ALLEGATO II
L'allegato XV del regolamento (UE) n. 142/2011 è così modificato:
|
1) |
i capi da 1 a 3(F) sono sostituiti dai seguenti: «CAPO 1 Certificato sanitario Per la spedizione/il transito (2) nell'Unione europea di proteine animali trasformate diverse da quelle derivate da insetti d'allevamento, non destinate al consumo umano, inclusi prodotti e miscele contenenti tali proteine, esclusi gli alimenti per animali da compagnia  Testo di immagine
Testo di immagine
PAESE Certificato veterinario per l'esportazione nell'UE Parte I: informazioni relative alla partita spedita I.1. Speditore Nome Indirizzo Tel. I.2. N. di riferimento del certificato I.2.a. I.3. Autorità centrale competente I.4. Autorità locale competente I.5. Destinatario Nome Indirizzo Codice postale Tel. I.6. Persona responsabile della partita nell'UE Nome Indirizzo Codice postale Tel. I.7. Paese di origine Codice ISO I.8. Regione di origine Codice I.9. Paese di destinazione Codice ISO I.10. Regione di destinazione Codice I.11. Luogo di origine Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo I.12. Luogo di destinazione Deposito doganale Nome N. di riconoscimento Indirizzo Codice postale I.13. Luogo di carico I.14. Data di partenza I.15. Mezzo di trasporto Aereo Nave Vagone ferroviario Veicolo stradale Altro Identificazione Riferimento documentale I.16. PIF di entrata nell'UE I.17.  Testo di immagine
Testo di immagine
I.18. Descrizione della merce I.19. Codice del prodotto (codice SA) I.20. Quantità I.21. Temperatura del prodotto Ambiente Refrigerato Congelato I.22. Numero di colli I.23. Numero del sigillo/contenitore I.24. Tipo di imballaggio I.25. Merce certificata per Alimentazione animale Uso tecnico Produzione di alimenti per animali da compagnia I.26. Per transito attraverso l'UE verso un paese terzo Paese terzo Codice ISO I.27. Per l'importazione/l'ammissione nell'UE I.28. Identificazione della merce Numero di riconoscimento degli stabilimenti Specie (nome scientifico) Natura della merce Impianto di fabbricazione Peso netto Numero del lotto  Testo di immagine
Testo di immagine
PAESE Proteine animali trasformate, diverse da quelle derivate da insetti d'allevamento, non destinate al consumo umano, inclusi prodotti e miscele contenenti tali proteine, esclusi gli alimenti per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Il sottoscritto, veterinario ufficiale, dichiara di aver preso atto del regolamento (CE) n. 1069/2009 del Parlamento europeo e del Consiglio (1a), in particolare dell'articolo 10, e del regolamento (UE) n. 142/2011 della Commissione (1b), in particolare dell'allegato X, capo II, sezione 1, e dell'allegato XIV, capo I, e certifica quanto segue: II.1. le proteine animali trasformate o i prodotti sopra descritti contengono esclusivamente proteine animali trasformate non destinate al consumo umano che: a) sono state preparate e immagazzinate in uno stabilimento o in un impianto riconosciuto e controllato dall'autorità competente in conformità dell'articolo 24 del regolamento (CE) n. 1069/2009, e b) sono state preparate esclusivamente con i seguenti sottoprodotti di origine animale: (2) [- carcasse e parti di animali macellati oppure, nel caso della selvaggina, corpi o parti di animali uccisi idonei al consumo umano in conformità della normativa dell'Unione, ma non destinati al consumo umano per motivi commerciali;] (2) e/o [- carcasse e parti seguenti derivanti da animali macellati in un macello e ritenuti atti alla macellazione per il consumo umano dopo un'ispezione ante mortem o corpi e parti seguenti di animali da selvaggina uccisi per il consumo umano nel rispetto della normativa dell'Unione: i) carcasse o corpi e parti di animali dichiarati non idonei al consumo umano conformemente alla normativa dell'Unione, ma che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali; ii) teste di pollame; iii) pelli, inclusi ritagli e frammenti, corna e zampe, incluse le falangi e le ossa carpiche e metacarpiche e le ossa tarsiche e metatarsiche; iv) setole di suini; v) piume;] (2) e/o [- sangue di animali che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso il sangue, ottenuto da animali macellati in un macello dopo essere stati considerati atti alla macellazione per il consumo umano in seguito a un'ispezione ante mortem conformemente alla normativa dell'Unione;] (2) e/o [- sottoprodotti di origine animale derivanti dalla fabbricazione di prodotti destinati al consumo umano, compresi i ciccioli, le ossa sgrassate e i fanghi da centrifuga o da separatore risultanti dalla lavorazione del latte;] (2) e/o [- prodotti di origine animale, o prodotti alimentari contenenti prodotti di origine animale, i quali non sono più destinati al consumo umano per motivi commerciali o a causa di problemi di fabbricazione o difetti di condizionamento o altri difetti che non determinano rischi per la salute pubblica o animale;] (2) e/o [- sangue, placenta, lana, piume, peli, corna, frammenti di zoccoli e latte crudo derivanti da animali vivi che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso tali prodotti;] (2) e/o [- animali acquatici e parti di tali animali, eccetto i mammiferi marini, che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali;] (2) e/o [- sottoprodotti di animali acquatici provenienti da stabilimenti o impianti che fabbricano prodotti destinati al consumo umano;] Parte II Certificazione  Testo di immagine
Testo di immagine
PAESE Proteine animali trasformate, diverse da quelle derivate da insetti d'allevamento, non destinate al consumo umano, inclusi prodotti e miscele contenenti tali proteine, esclusi gli alimenti per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) e/o [- i materiali seguenti provenienti da animali che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso tali materiali: i) conchiglie e carapaci di crostacei e molluschi con tessuti molli o carni; ii) i seguenti prodotti derivati da animali terrestri: — sottoprodotti dei centri di incubazione; — uova; — sottoprodotti delle uova, compresi i gusci d'uovo; iii) pulcini di un giorno abbattuti per motivi commerciali;] (2) e/o [- invertebrati acquatici e terrestri, diversi dalle specie patogene per l'uomo o per gli animali e diversi dagli insetti;] (2) e/o [- animali e loro parti degli ordini Rodentia e Lagomorpha, eccetto i materiali di categoria 1 di cui all'articolo 8, lettera a), punti iii), iv) e v), e di categoria 2 di cui all'articolo 9, lettere da a) a g) del regolamento (CE) n. 1069/2009;] e c) sono state sottoposte ai seguenti metodi di trasformazione: (2) [trattamento termico che innalza la temperatura al centro della massa a oltre 133 °C, per almeno 20 minuti senza interruzione, ad una pressione (assoluta) di almeno 3 bar prodotta mediante vapore saturo, con una dimensione delle particelle prima della trasformazione non superiore a 50 mm;] (2) o [nel caso di proteine ricavate da animali non appartenenti alla specie dei mammiferi e diverse dalla farina di pesce, il metodo di trasformazione 1-2-3-4-5-7 (indicare il metodo di trasformazione) di cui all'allegato IV, capo III, del regolamento (UE) n. 142/2011;] (2) o [nel caso della farina di pesce, il metodo di trasformazione 1-2-3-4-5-7 (indicare il metodo di trasformazione) di cui all'allegato IV, capo III, del regolamento (UE) n. 142/2011;] (2) o [nel caso del sangue suino, il metodo di trasformazione 1-2-3-4-5-7 (indicare il metodo di trasformazione) di cui all'allegato IV, capo III, del regolamento (UE) n. 142/2011, dove in caso di ricorso al metodo 7 è stato applicato un trattamento termico che ha portato la temperatura ad almeno 80 °C in tutta la massa;] II.2. le proteine animali trasformate o i prodotti sopra descritti sono stati sottoposti, immediatamente prima della spedizione, ad un esame per campionatura aleatoria in esito al quale l'autorità competente li ha dichiarati conformi alle seguenti condizioni (3) Salmonella: assenza in 25 g: n = 5, c = 0, m = 0, M = 0 Enterobatteriacee: n = 5, c = 2, m = 10, M = 300 in 1 g; II.3. il prodotto è stato trattato con tutte le precauzioni atte ad evitare la ricontaminazione da parte di agenti patogeni dopo il trattamento; II.4. il prodotto finale: (2) [è stato imballato in sacchi nuovi o sterilizzati,]  Testo di immagine
Testo di immagine
PAESE Proteine animali trasformate, diverse da quelle derivate da insetti d'allevamento, non destinate al consumo umano, inclusi prodotti e miscele contenenti tali proteine, esclusi gli alimenti per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) o [è stato trasportato alla rinfusa in contenitori o in altri mezzi di trasporto, accuratamente puliti e disinfettati prima dell'uso,] recanti un'etichetta con l'indicazione NON DESTINATI AL CONSUMO UMANO"; II.5. il prodotto finale è stato immagazzinato in depositi chiusi; (2) [II.6. le proteine animali trasformate o i prodotti sopra descritti contengono o sono ottenuti da sottoprodotti di origine animale derivati da ruminanti e: (2) [provengono da un paese o da una regione classificati come aventi un rischio trascurabile di BSE conformemente alla decisione 2007/453/CE e nei quali non si siano verificati casi indigeni di BSE, e]] (2) o [provengono da un paese o da una regione classificati come aventi un rischio trascurabile di BSE conformemente alla decisione 2007/453/CE e nei quali si è verificato un caso indigeno di BSE, e i sottoprodotti di origine animale o i prodotti derivati sono stati ottenuti da animali nati dopo la data in cui nel paese o nella regione è stato effettivamente applicato il divieto di somministrazione ai ruminanti di farine di carne e ossa e ciccioli, quali definiti nel codice sanitario per gli animali terrestri dell'OIE, ottenuti da ruminanti, e] (2) [sono ottenuti da ruminanti diversi da bovini, ovini o caprini.] (2) o [sono ottenuti da bovini, ovini o caprini e non contengono né sono ottenuti da: (2) [materiali ricavati da bovini, ovini e caprini diversi da quelli derivati da animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]] (2) o [a) materiale specifico a rischio di cui all'allegato V, punto 1, del regolamento (CE) n. 999/2001 del Parlamento europeo e del Consiglio (4); b) carni separate meccanicamente ottenute da ossa di bovini, ovini o caprini, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE della Commissione (5) e in cui non si sono verificati casi indigeni di BSE, c) sottoprodotti di origine animale o prodotti derivati ottenuti da bovini, ovini o caprini che sono stati abbattuti, previo stordimento, mediante lacerazione del tessuto nervoso centrale per mezzo di uno stilo inserito nella cavità cranica, o tramite iniezione di gas nella cavità cranica, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o in una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]]] II.7. le proteine animali trasformate o i prodotti sopra descritti: (2) [non contengono latte o prodotti a base di latte di origine ovina o caprina o non sono destinati all'alimentazione degli animali d'allevamento diversi dagli animali da pelliccia.] (2) o [contengono latte o prodotti a base di latte di origine ovina o caprina e sono destinati all'alimentazione degli animali d'allevamento diversi dagli animali da pelliccia, e il latte o i prodotti a base di latte: a) sono ottenuti da ovini e caprini che sono rimasti continuativamente dalla nascita in un paese in cui sono soddisfatte le seguenti condizioni: i) la scrapie classica è soggetta a obbligo di notifica;  Testo di immagine
Testo di immagine
PAESE Proteine animali trasformate, diverse da quelle derivate da insetti d'allevamento, non destinate al consumo umano, inclusi prodotti e miscele contenenti tali proteine, esclusi gli alimenti per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. ii) esiste un sistema di sensibilizzazione, sorveglianza e monitoraggio per la scrapie classica; iii) alle aziende di ovini o caprini si applicano restrizioni ufficiali in presenza di un sospetto di TSE o della conferma della scrapie classica; iv) gli ovini e i caprini colpiti da scrapie classica sono abbattuti e distrutti; v) la somministrazione agli ovini e ai caprini di farine di carne e ossa o di ciccioli, quali definiti nel codice sanitario per gli animali terrestri dell'organizzazione mondiale per la salute animale (OIE), ricavati da ruminanti è vietata e il divieto è effettivamente applicato in tutto il paese da almeno sette anni; b) provengono da aziende che non sono soggette ad alcuna restrizione ufficiale a causa di un sospetto di TSE; c) provengono da aziende nelle quali, da almeno sette anni, non viene diagnosticato alcun caso di scrapie classica o nelle quali, a seguito della conferma di un caso di scrapie classica: (2) [tutti gli ovini e i caprini dell'azienda sono stati abbattuti e distrutti o macellati, fatta eccezione per i montoni da riproduzione del genotipo ARR/ARR, per le pecore da riproduzione portatrici di almeno un allele ARR e nessun allele VRQ e per gli altri ovini portatori di almeno un allele ARR;] (2) o [tutti gli animali nei quali la scrapie classica è stata confermata sono stati abbattuti e distrutti e l'azienda è stata sottoposta per almeno due anni dalla data di conferma dell'ultimo caso di scrapie classica a una sorveglianza intensificata delle TSE, compresa l'esecuzione di un test con esito negativo per individuare la presenza di TSE conformemente ai metodi di laboratorio di cui dell'allegato X, capitolo C, punto 3.2, del regolamento (CE) n. 999/2001 su tutti i seguenti animali di età superiore ai 18 mesi, esclusi gli ovini del genotipo ARR/ARR: — animali macellati per il consumo umano; e — animali morti o abbattuti nell'azienda, ma non abbattuti nel quadro di una campagna di eradicazione della malattia.]] II.8. le proteine animali trasformate o i prodotti sopra descritti contengono o sono ottenuti da sottoprodotti di origine animale ricavati da non ruminanti e, conformemente alla dichiarazione dello speditore di cui alla casella I.1, (2) [non sono destinati alla produzione di mangimi per animali d'allevamento diversi dagli animali da pelliccia.] (2) (6) o [sono destinati alla produzione di mangimi per animali d'allevamento non ruminanti diversi dagli animali da pelliccia e lo speditore si impegna a garantire che al posto d'ispezione frontaliero di entrata saranno forniti i risultati delle analisi effettuate conformemente ai metodi di cui all'allegato VI del regolamento (CE) n. 152/2009 della Commissione(7).] Note Parte I: — Casella I.6.: persona responsabile della partita nell'Unione europea: da compilare soltanto se si tratta di un certificato per merce in transito nell'Unione europea; la casella può essere compilata se il certificato riguarda una merce da importare nell'Unione europea. — Casella I.12.: luogo di destinazione: casella da compilare solo se si tratta di un certificato per merce in transito. i prodotti in transito possono essere immagazzinati unicamente in zone franche, depositi franchi e depositi doganali. — Casella I.15.: numero di immatricolazione (vagoni ferroviari o container e autocarri), numero del volo (aeromobili) o nome (navi); queste informazioni devono essere aggiornate in caso di scarico e nuovo carico.  Testo di immagine
Testo di immagine
PAESE Proteine animali trasformate, diverse da quelle derivate da insetti d'allevamento, non destinate al consumo umano, inclusi prodotti e miscele contenenti tali proteine, esclusi gli alimenti per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. — Casella I.19.: utilizzare il codice SA appropriato: 05.05, 05.06, 05.07, 05.11, 23.01 o 23.09. — Casella I.25.: uso tecnico: qualsiasi uso diverso dall'alimentazione di animali d'allevamento diversi dagli animali da pelliccia e dalla produzione o fabbricazione di alimenti per animali da compagnia. — Caselle I.26. e I.27.: compilare a seconda che si tratti di un certificato di transito o d'importazione. — Casella I.28.: specie: scegliere fra: Aves, Ruminantia, Suidae, Mammalia diversi da Ruminantia e Suidae, Pesca, Mollusca, Crustacea, invertebrati diversi da Mollusca e Crustacea. Nel caso di pesci di allevamento, specificarne il nome scientifico. Parte II (1a) GU L 300 del 14.11.2009, pag. 1. (1b) GU L 54 del 26.2.2011, pag. 1. (2) Cancellare le voci non pertinenti. (3) Dove: n = numero di campioni da esaminare; m = valore soglia per quanto riguarda il numero dei batteri; il risultato è considerato soddisfacente se tutti i campioni hanno un numero di batteri inferiore o uguale a m; M = valore massimo per quanto riguarda il numero dei batteri; il risultato è considerato insoddisfacente se uno o più campioni hanno un numero di batteri uguale o superiore a M; e c = numero di campioni la cui carica batterica può essere compresa fra m e M; il campione è ancora considerato accettabile se la carica batterica degli altri campioni è uguale o inferiore a m. (4) GU L 147 del 31.5.2001, pag. 1. (5) GU L 172 del 30.6.2007, pag. 84. (6) La persona responsabile della partita di cui alla casella I.6. deve garantire che, se le proteine animali trasformate o i prodotti descritti nel presente certificato sanitario sono destinati alla produzione di mangimi per animali d'allevamento non ruminanti diversi dagli animali da pelliccia, la partita deve essere analizzata secondo i metodi di cui all'allegato VI del regolamento (CE) n. 152/2009, al fine di verificare l'assenza di costituenti di origine animale non autorizzati. Le informazioni sui risultati di tali analisi devono essere allegate al presente certificato sanitario al momento della presentazione della partita presso un posto d'ispezione frontaliero dell'UE. (7) GU L 54 del 26.2.2009, pag. 1. — Il colore della firma e del timbro dev'essere diverso da quello del testo stampato. — Osservazione per il responsabile della partita nell'Unione europea: il presente certificato è ad uso esclusivamente veterinario e deve accompagnare la partita fino al posto d'ispezione frontaliero. Veterinario ufficiale/Ispettore ufficiale Nome e cognome (in stampatello): Titolo e qualifica: Data: Firma: Timbro: CAPO 1 bis Certificato sanitario Per la spedizione/il transito (2) nell'Unione europea di proteine animali trasformate derivate da insetti d'allevamento non destinate al consumo umano, inclusi prodotti e miscele contenenti tali proteine, esclusi gli alimenti per animali da compagnia  Testo di immagine
Testo di immagine
PAESE Certificato veterinario per l'esportazione nell'UE Parte I: informazioni relative alla partita spedita I.1. Speditore Nome Indirizzo Tel. I.2. N. di riferimento del certificato I.2.a. I.3. Autorità centrale competente I.4. Autorità locale competente I.5. Destinatario Nome Indirizzo Codice postale Tel. I.6. Persona responsabile della partita nell'UE Nome Indirizzo Codice postale Tel. I.7. Paese di origine Codice ISO I.8. Regione di origine Codice I.9. Paese di destinazione Codice ISO I.10. Regione di destinazione Codice I.11. Luogo di origine Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo I.12. Luogo di destinazione Deposito doganale Nome N. di riconoscimento Indirizzo Codice postale I.13. Luogo di carico I.14. Data di partenza I.15. Mezzo di trasporto Aereo Nave Vagone ferroviario Veicolo stradale Altro Identificazione Riferimento documentale I.16. PIF di entrata nell'UE I.17. I.18. Descrizione della merce I.19. Codice del prodotto (codice SA) I.20. Quantità I.21. Temperatura del prodotto Ambiente Refrigerato Congelato I.22. Numero di colli I.23. Numero del sigillo/contenitore I.24. Tipo di imballaggio  Testo di immagine
Testo di immagine
I.25. Merce certificata per Alimentazione animale Uso tecnico Produzione di alimenti per animali da compagnia I.26. Per transito attraverso l'UE verso un paese terzo Paese terzo Codice ISO I.27. Per l'importazione/l'ammissione nell'UE I.28. Identificazione della merce Numero di riconoscimento degli stabilimenti Specie (nome scientifico) Natura della merce Impianto di fabbricazione Peso netto Numero del lotto  Testo di immagine
Testo di immagine
PAESE Proteine animali trasformate derivate da insetti d'allevamento non destinate al consumo umano, inclusi prodotti e miscele contenenti tali proteine, esclusi gli alimenti per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Il sottoscritto, veterinario ufficiale, dichiara di aver preso atto del regolamento (CE) n. 1069/2009 del Parlamento europeo e del Consiglio (1a), in particolare dell'articolo 10, e del regolamento (UE) n. 142/2011 della Commissione (1b), in particolare dell'allegato X, capo II, sezione 1, e dell'allegato XIV, capo I, e certifica quanto segue: II.1. le proteine animali trasformate derivate da insetti d'allevamento o i prodotti sopra descritti contengono esclusivamente proteine animali trasformate non destinate al consumo umano che: a) sono state preparate e immagazzinate in uno stabilimento o in un impianto riconosciuto e controllato dall'autorità competente in conformità dell'articolo 24 del regolamento (CE) n. 1069/2009, e b) sono state preparate esclusivamente a partire da insetti d'allevamento delle specie seguenti: (2) [- mosca soldato nera (Hermetia illucens);] (2) e/o [- mosca comune (Musca domestica);] (2) e/o [- tenebrione mugnaio (Tenebrio molitor);] (2) e/o [- alfitobio (Alphitobius diaperinus);] (2) e/o [- grillo domestico (Acheta domesticus);] (2) e/o [- grillo tropicale (Gryllodes sigillatus);] (2) e/o [- grillo silente (Gryllus assimilis).] e c) sono state trasformate mediante il metodo [1]-[2]-[3]-[4]-[5]-[7] (2) di cui all'allegato IV, capo III, del regolamento (UE) n. 142/2011; e d) il substrato per l'alimentazione degli insetti d'allevamento può contenere solo prodotti di origine non animale o i seguenti prodotti di origine animale ottenuti da materiali di categoria (3): — farine di pesce, — prodotti sanguigni da non ruminanti, — fosfato dicalcico e fosfato tricalcico di origine animale, — proteine idrolizzate derivate da non ruminanti, — proteine idrolizzate derivate da pelli di ruminanti, — gelatina e collagene derivati da non ruminanti, — uova e prodotti a base di uova, — latte, prodotti a base di latte, prodotti derivati dal latte e colostro, — miele, — grassi fusi; Parte II Certificazione  Testo di immagine
Testo di immagine
PAESE Proteine animali trasformate derivate da insetti d'allevamento non destinate al consumo umano, inclusi prodotti e miscele contenenti tali proteine, esclusi gli alimenti per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. e e) il substrato per l'alimentazione degli insetti e gli insetti o le loro larve non sono stati in contatto con materiali di origine animale diversi da quelli di cui alla lettera d) e il substrato non conteneva stallatico, rifiuti di cucina e ristorazione o altri rifiuti. II.2. le proteine animali trasformate o i prodotti sopra descritti sono stati sottoposti, immediatamente prima della spedizione, ad un esame per campionatura aleatoria in esito al quale l'autorità competente li ha dichiarati conformi alle seguenti condizioni (3) Salmonella: assenza in 25 g: n = 5, c = 0, m = 0, M = 0 Enterobatteriacee: n = 5, c = 2, m = 10, M = 300 in 1 g; II.3. il prodotto è stato trattato con tutte le precauzioni atte ad evitare la ricontaminazione da parte di agenti patogeni dopo il trattamento; II.4. il prodotto finale: (2) [è stato imballato in sacchi nuovi o sterilizzati,] (2) o [è stato trasportato alla rinfusa in contenitori o in altri mezzi di trasporto, accuratamente puliti e disinfettati prima dell'uso,] recanti un'etichetta con l'indicazione "NON DESTINATO AL CONSUMO UMANO/PROTEINE TRASFORMATE DI INSETTI – DA NON UTILIZZARE NEI MANGIMI PER ANIMALI D'ALLEVAMENTO, AD ECCEZIONE DEGLI ANIMALI D'ACQUACOLTURA E DEGLI ANIMALI DA PELLICCIA"; II.5. il prodotto finale è stato immagazzinato in depositi chiusi; (2) [II.6. le proteine animali trasformate o il prodotto sopra descritti contengono o sono ottenuti da sottoprodotti di origine animale ricavati da ruminanti e: (2) [provengono da un paese o da una regione classificati come aventi un rischio trascurabile di BSE conformemente alla decisione 2007/453/CE e nei quali non si siano verificati casi indigeni di BSE, e]] (2) o [provengono da un paese o da una regione classificati come aventi un rischio trascurabile di BSE conformemente alla decisione 2007/453/CE e nei quali si è verificato un caso indigeno di BSE, e i sottoprodotti di origine animale o i prodotti derivati sono stati ottenuti da animali nati dopo la data in cui il divieto di somministrazione ai ruminanti di farine di carne e ossa e ciccioli, quali definiti nel codice sanitario per gli animali terrestri dell'OIE, ottenuti da ruminanti è stato effettivamente applicato nel paese o nella regione, e]] (2) [sono ottenuti da ruminanti diversi da bovini, ovini o caprini.]] (2) o [sono ottenuti da bovini, ovini o caprini e non contengono né sono ottenuti da: (2) [materiali ricavati da bovini, ovini e caprini diversi da quelli derivati da animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]] (2) o [a) materiale specifico a rischio di cui all'allegato V, punto 1, del regolamento (CE) n. 999/2001 del Parlamento europeo e del Consiglio (4); b) carni separate meccanicamente ottenute da ossa di bovini, ovini o caprini, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE della Commissione (5) e in cui non si sono verificati casi indigeni di BSE,  Testo di immagine
Testo di immagine
PAESE Proteine animali trasformate derivate da insetti d'allevamento non destinate al consumo umano, inclusi prodotti e miscele contenenti tali proteine, esclusi gli alimenti per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. c) sottoprodotti di origine animale o prodotti derivati ottenuti da bovini, ovini o caprini che sono stati abbattuti, previo stordimento, mediante lacerazione del tessuto nervoso centrale per mezzo di uno stilo inserito nella cavità cranica, o tramite iniezione di gas nella cavità cranica, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o in una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]]] II.7. le proteine animali trasformate o i prodotti sopra descritti: (2) [non contengono latte o prodotti a base di latte di origine ovina o caprina o non sono destinati all'alimentazione degli animali d'allevamento diversi dagli animali da pelliccia.] (2) o [contengono latte o prodotti a base di latte di origine ovina o caprina e sono destinati all'alimentazione degli animali d'allevamento diversi dagli animali da pelliccia, e il latte o i prodotti a base di latte: a) sono ottenuti da ovini e caprini che sono rimasti continuativamente dalla nascita in un paese in cui sono soddisfatte le seguenti condizioni: i) la scrapie classica è soggetta a obbligo di notifica; ii) esiste un sistema di sensibilizzazione, sorveglianza e monitoraggio per la scrapie classica; iii) alle aziende di ovini o caprini si applicano restrizioni ufficiali in presenza di un sospetto di TSE o della conferma della scrapie classica; iv) gli ovini e i caprini colpiti da scrapie classica sono abbattuti e distrutti; v) la somministrazione agli ovini e ai caprini di farine di carne e ossa o di ciccioli, quali definiti nel codice sanitario per gli animali terrestri dell'organizzazione mondiale per la salute animale (OIE), ricavati da ruminanti è vietata e il divieto è effettivamente applicato in tutto il paese da almeno sette anni; b) provengono da aziende che non sono soggette ad alcuna restrizione ufficiale a causa di un sospetto di TSE; c) provengono da aziende nelle quali, da almeno sette anni, non viene diagnosticato alcun caso di scrapie classica o nelle quali, a seguito della conferma di un caso di scrapie classica: (2) [tutti gli ovini e i caprini dell'azienda sono stati abbattuti e distrutti o macellati, fatta eccezione per i montoni da riproduzione del genotipo ARR/ARR, per le pecore da riproduzione portatrici di almeno un allele ARR e nessun allele VRQ e per gli altri ovini portatori di almeno un allele ARR;] (2) o [tutti gli animali nei quali la scrapie classica è stata confermata sono stati abbattuti e distrutti e l'azienda è stata sottoposta per almeno due anni dalla data di conferma dell'ultimo caso di scrapie classica a una sorveglianza intensificata delle TSE, compresa l'esecuzione di un test con esito negativo per individuare la presenza di TSE conformemente ai metodi di laboratorio di cui dell'allegato X, capitolo C, punto 3.2, del regolamento (CE) n. 999/2001 su tutti i seguenti animali di età superiore ai 18 mesi, esclusi gli ovini del genotipo ARR/ARR: — animali macellati per il consumo umano; e — animali morti o abbattuti nell'azienda, ma non abbattuti nel quadro di una campagna di eradicazione della malattia.]] II.8. [le proteine animali trasformate o i prodotti sopra descritti contengono o sono ottenuti da sottoprodotti di origine animale ricavati da non ruminanti e, conformemente alla dichiarazione dello speditore di cui alla casella I.1,  Testo di immagine
Testo di immagine
PAESE Proteine animali trasformate derivate da insetti d'allevamento non destinate al consumo umano, inclusi prodotti e miscele contenenti tali proteine, esclusi gli alimenti per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) [non sono destinati alla produzione di mangimi per animali d'allevamento diversi dagli animali da pelliccia.] (2) (6) o [sono destinati alla produzione di mangimi per animali d'allevamento non ruminanti diversi dagli animali da pelliccia e lo speditore si impegna a garantire che al posto d'ispezione frontaliero di entrata nell'Unione europea saranno forniti i risultati delle analisi effettuate conformemente ai metodi di cui all'allegato VI del regolamento (CE) n. 152/2009 della Commissione (7).] Note Parte I: — Casella I.6.: persona responsabile della partita nell'Unione europea: da compilare soltanto se si tratta di un certificato per merce in transito nell'Unione europea; la casella può essere compilata se il certificato riguarda una merce da importare nell'Unione europea. — Casella I.12.: luogo di destinazione: da compilare soltanto se si tratta di un certificato per merce in transito; i prodotti in transito possono essere immagazzinati unicamente in zone franche, depositi franchi e depositi doganali. — Casella I.15.: numero di immatricolazione (vagoni ferroviari o container e autocarri), numero del volo (aeromobili) o nome (navi); queste informazioni devono essere aggiornate in caso di scarico e nuovo carico. — Casella I.19.: utilizzare il codice SA appropriato: 05.11, 23.01 o 23.09. — Casella I.25.: uso tecnico: qualsiasi uso diverso dall'alimentazione di animali d'allevamento diversi dagli animali da pelliccia e dalla produzione o fabbricazione di alimenti per animali da compagnia. — Caselle I.26. e I.27.: compilare a seconda che si tratti di un certificato di transito o d'importazione. — Casella I.28.: specie: insetti, specificare il nome scientifico. Parte II (1a) GU L 300 del 14.11.2009, pag. 1. (1b) GU L 54 del 26.2.2011, pag. 1. (2) Cancellare le voci non pertinenti. (3) Dove: n = numero di campioni da esaminare; m = valore soglia per quanto riguarda il numero dei batteri; il risultato è considerato soddisfacente se tutti i campioni hanno un numero di batteri inferiore o uguale a m; M = valore massimo per quanto riguarda il numero dei batteri; il risultato è considerato insoddisfacente se uno o più campioni hanno un numero di batteri uguale o superiore a M; e c = numero di campioni la cui carica batterica può essere compresa fra m e M; il campione è ancora considerato accettabile se la carica batterica degli altri campioni è uguale o inferiore a m. (4) GU L 147 del 31.5.2001, pag. 1. (5) GU L 172 del 30.6.2007, pag. 84.  Testo di immagine
Testo di immagine
PAESE Proteine animali trasformate derivate da insetti d'allevamento non destinate al consumo umano, inclusi prodotti e miscele contenenti tali proteine, esclusi gli alimenti per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (6) La persona responsabile della partita di cui alla casella I.6. deve garantire che, se le proteine animali trasformate o i prodotti descritti nel presente certificato sanitario sono destinati alla produzione di mangimi per animali d'allevamento non ruminanti diversi dagli animali da pelliccia, la partita deve essere analizzata secondo i metodi di cui all'allegato VI del regolamento (CE) n. 152/2009, al fine di verificare l'assenza di costituenti di origine animale non autorizzati. Le informazioni sui risultati di tali analisi devono essere allegate al presente certificato sanitario al momento della presentazione della partita presso un posto d'ispezione frontaliero dell'UE. (7) GU L 54 del 26.2.2009, pag. 1. — Il colore della firma e del timbro dev'essere diverso da quello del testo stampato. — Osservazione per il responsabile della partita nell'Unione europea: il presente certificato è ad uso esclusivamente veterinario e deve accompagnare la partita fino al posto d'ispezione frontaliero. Veterinario ufficiale/Ispettore ufficiale Nome e cognome (in stampatello): Titolo e qualifica: Data: Firma: Timbro: CAPO 2(A) Certificato sanitario Per la spedizione o il transito (2) nell'Unione europea di latte, prodotti a base di latte e prodotti derivati dal latte non destinati al consumo umano  Testo di immagine
Testo di immagine
PAESE Certificato veterinario per l'esportazione nell'UE Parte I: informazioni relative alla partita spedita I.1. Speditore Nome Indirizzo Tel. I.2. N. di riferimento del certificato I.2.a. I.3. Autorità centrale competente I.4. Autorità locale competente I.5. Destinatario Nome Indirizzo Codice postale Tel. I.6. Persona responsabile della partita nell'UE Nome Indirizzo Codice postale Tel. I.7. Paese di origine Codice ISO I.8. Regione di origine Codice I.9. Paese di destinazione Codice ISO I.10. Regione di destinazione Codice I.11. Luogo di origine Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo I.12. Luogo di destinazione Deposito doganale Nome N. di riconoscimento Indirizzo Codice postale I.13. Luogo di carico I.14. Data di partenza I.15. Mezzo di trasporto Aereo Nave Vagone ferroviario Veicolo stradale Altro Identificazione Riferimento documentale I.16. PIF di entrata nell'UE I.17. Numero/i CITES I.18. Descrizione della merce I.19. Codice del prodotto (codice SA) I.20. Quantità I.21. Temperatura del prodotto Ambiente Refrigerato Congelato I.22. Numero di colli I.23. Numero del sigillo/contenitore I.24. Tipo di imballaggio  Testo di immagine
Testo di immagine
I.25. Merce certificata per Alimentazione animale Trasformazione suppl. Produzione di alimenti per animali da compagnia Uso tecnico I.26. Per transito attraverso l'UE verso un paese terzo Paese terzo Codice ISO I.27. Per l'importazione/l'ammissione nell'UE I.28. Identificazione della merce Numero di riconoscimento degli stabilimenti Specie (nome scientifico) Impianto di fabbricazione Peso netto Numero del lotto  Testo di immagine
Testo di immagine
PAESE Latte, prodotti a base di latte e prodotti derivati dal latte non destinati al consumo umano II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Il sottoscritto, veterinario ufficiale, dichiara di aver preso atto del regolamento (CE) n. 1069/2009 del Parlamento europeo e del Consiglio (1a), in particolare dell'articolo 10 e del regolamento (UE) n. 142/2011 della Commissione (1b), in particolare dell'allegato X, capo II, sezione 4, e dell'allegato XIV, capo I, e certifica che il latte (2), i prodotti a base di latte (2) e i prodotti derivati dal latte (2) di cui alla casella I.28. rispettano le seguenti condizioni: II.1. sono stati prodotti e ottenuti in (inserire il nome del paese esporta-tore) (3), (inserire il nome della regione) (3), figurante nell'elenco dell'allegato II, parte I, del regolamento (UE) n. 605/2010 della Commissione (4), indenne da afta epizootica e da peste bovina nei 12 mesi immediatamente precedenti l'esportazione e che non ha praticato la vaccinazione contro la peste bovina durante tale periodo; II.2. sono stati prodotti a partire da latte crudo proveniente da animali che, al momento della mungitura, non presentavano segni clinici di malattie trasmissibili all'uomo o agli animali attraverso il latte e che sono rimasti, per almeno 30 giorni prima della produzione, in aziende non soggette a restrizioni ufficiali a causa di afta epizootica o di peste bovina; II.3. si tratta di latte o prodotti a base di latte che: (2) [hanno subito uno dei trattamenti o una combinazione dei trattamenti descritti al punto II.4;] (2) o [contengono siero destinato all'alimentazione di animali di specie suscettibili di contrarre l'afta epizootica; il siero è stato raccolto da latte sottoposto a uno dei trattamenti descritti al punto II.4 e: (2) [il siero è stato raccolto almeno 16 ore dopo la cagliatura e presenta un pH inferiore a 6;] (2) (5) o [il siero è stato prodotto almeno 21 giorni prima della spedizione e, durante tale periodo, nessun caso di afta epizootica è stato individuato nel paese esportatore;] (2) (5) o [il siero è stato prodotto il …/…/… e questa data, tenuto conto della durata del viaggio prevista, è anteriore di almeno 21 giorni alla data di presentazione della partita presso un posto d'ispezione frontaliero dell'Unione europea;]] II.4. sono stati sottoposti a uno dei seguenti trattamenti: (2) [una pastorizzazione rapida ad elevata temperatura, vale a dire 72 °C durante almeno 15 secondi, o una pastorizzazione equivalente sufficiente perché il test della fosfatasi nel latte bovino dia esito negativo, in aggiunta a: (2) [una seconda pastorizzazione rapida ad elevata temperatura, vale a dire 72 °C durante almeno 15 secondi, ovvero una pastorizzazione equivalente sufficiente perché il test della fosfatasi nel latte bovino dia esito negativo;] (2) o [un procedimento di essiccazione successivo seguito, nel caso del latte destinato all'alimentazione animale, da un ulteriore trattamento termico ad almeno 72 °C;] (2) o [un ulteriore procedimento mediante il quale il pH è abbassato e mantenuto per almeno un'ora a un livello inferiore a 6;] (2) (5) o [la condizione che il latte o il prodotto a base di latte sia stato prodotto almeno 21 giorni prima della spedizione e, durante tale periodo, nessun caso di afta epizootica sia stato individuato nel paese esportatore;] (2) (5) o [la condizione che il latte o il prodotto a base di latte sia stato prodotto il …/…/… (inserire la data) e questa data, tenuto conto della durata del viaggio prevista, sia anteriore di almeno 21 giorni alla data di presentazione della partita presso un posto d'ispezione frontaliero dell'Unione europea;] (2) o [sterilizzazione almeno al livello F03;]] Parte II Certificazione  Testo di immagine
Testo di immagine
PAESE Latte, prodotti a base di latte e prodotti derivati dal latte non destinati al consumo umano II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) o [un trattamento a temperatura ultra elevata a 132 °C per almeno un secondo, in aggiunta a: (2) [un procedimento di essiccazione successivo seguito, nel caso del latte destinato all'alimentazione animale, da un ulteriore trattamento termico ad almeno 72 °C;] (2) o [un ulteriore procedimento mediante il quale il pH è abbassato e mantenuto per almeno un'ora a un livello inferiore a 6;] (2) (5) o [la condizione che il latte o il prodotto a base di latte sia stato prodotto almeno 21 giorni prima della spedizione e, durante tale periodo, nessun caso di afta epizootica sia stato individuato nel paese esportatore;] (2) (5) o [la condizione che il latte o il prodotto a base di latte sia stato prodotto il …/…/… (inserire la data) e questa data, tenuto conto della durata del viaggio prevista, sia anteriore di almeno 21 giorni alla data di presentazione della partita presso un posto d'ispezione frontaliero dell'Unione europea;]] II.5. sono state prese tutte le precauzioni atte ad evitare la contaminazione del latte/dei prodotti a base di latte dopo la trasformazione; II.6. il latte/i prodotti a base di latte/i prodotti derivati dal latte sono stati imballati: (2) [in contenitori nuovi;] (2) o [in veicoli o contenitori per il trasporto alla rinfusa, disinfettati prima del carico con un prodotto approvato dall'autorità competente;] e i contenitori sono contrassegnati in modo da indicare la natura del latte/dei prodotti a base di latte/dei prodotti derivati dal latte e recano etichette indicanti che il prodotto è un materiale di categoria 3 non destinato al consumo umano; II.7. il latte, i prodotti a base di latte e i prodotti derivati dal latte di cui sopra: (2) [non contengono latte o prodotti a base di latte di origine ovina o caprina o non sono destinati all'alimentazione degli animali d'allevamento diversi dagli animali da pelliccia.] (2) o [contengono latte o prodotti a base di latte di origine ovina o caprina e sono destinati all'alimentazione degli animali d'allevamento diversi dagli animali da pelliccia, e il latte o i prodotti a base di latte: a) sono ottenuti da ovini e caprini che sono rimasti continuativamente dalla nascita in un paese in cui sono soddisfatte le seguenti condizioni: i) la scrapie classica è soggetta a obbligo di notifica; ii) esiste un sistema di sensibilizzazione, sorveglianza e monitoraggio per la scrapie classica; iii) alle aziende di ovini o caprini si applicano restrizioni ufficiali in presenza di un sospetto di TSE o della conferma della scrapie classica; iv) gli ovini e i caprini colpiti da scrapie classica sono abbattuti e distrutti; v) la somministrazione agli ovini e ai caprini di farine di carne e ossa o di ciccioli, quali definiti nel codice sanitario per gli animali terrestri dell'organizzazione mondiale per la salute animale (OIE), ricavati da ruminanti è vietata e il divieto è effettivamente applicato in tutto il paese da almeno sette anni; b) provengono da aziende che non sono soggette ad alcuna restrizione ufficiale a causa di un sospetto di TSE;  Testo di immagine
Testo di immagine
PAESE Latte, prodotti a base di latte e prodotti derivati dal latte non destinati al consumo umano II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. c) provengono da aziende nelle quali, da almeno sette anni, non viene diagnosticato alcun caso di scrapie classica o nelle quali, a seguito della conferma di un caso di scrapie classica: (2) [tutti gli ovini e i caprini dell'azienda sono stati abbattuti e distrutti o macellati, fatta eccezione per i montoni da riproduzione del genotipo ARR/ARR, per le pecore da riproduzione portatrici di almeno un allele ARR e nessun allele VRQ e per gli altri ovini portatori di almeno un allele ARR;] (2) o [tutti gli animali nei quali la scrapie classica è stata confermata sono stati abbattuti e distrutti e l'azienda è stata sottoposta per almeno due anni dalla data di conferma dell'ultimo caso di scrapie classica a una sorveglianza intensificata delle TSE, compresa l'esecuzione di un test con esito negativo per individuare la presenza di TSE conformemente ai metodi di laboratorio di cui dell'allegato X, capitolo C, punto 3.2, del regolamento (CE) n. 999/2001(6) su tutti i seguenti animali di età superiore ai 18 mesi, esclusi gli ovini del genotipo ARR/ARR: — animali macellati per il consumo umano; e — animali morti o abbattuti nell'azienda, ma non abbattuti nel quadro di una campagna di eradicazione della malattia.]] Note Parte I: — Casella I.6.: persona responsabile del carico nell'Unione europea: da compilare soltanto se si tratta di un certificato per merce in transito nell'Unione europea; la casella può essere compilata se il certificato riguarda una merce da importare nell'Unione europea. — Casella I.12.: luogo di destinazione: casella da compilare solo se si tratta di un certificato per merce in transito. — Casella I.15.: indicare il numero di immatricolazione (vagoni ferroviari o container e autocarri), il numero del volo (aeromobili) o il nome (navi). In caso di scarico e nuovo carico, lo speditore deve informare il posto d'ispezione frontaliero dell'Unione europea. — Casella I.19.: utilizzare il codice appropriato del sistema armonizzato (SA) dell'Organizzazione mondiale delle dogane: 04.01, 04.02, 04.03, 04.04, 23.09.10, 23.09.90, 35.01, 35.02 o 35.04. — Casella I.23.: nel caso di contenitori per il trasporto di merci alla rinfusa, indicare il numero del contenitore e il numero del sigillo (se pertinente). — Casella I.25.: uso tecnico: qualsiasi uso diverso dall'alimentazione di animali d'allevamento diversi dagli animali da pelliccia e dalla produzione o fabbricazione di alimenti per animali da compagnia. — Caselle I.26. e I.27.: compilare a seconda che si tratti di un certificato di transito o d'importazione. — Casella I.28.: "impianto di fabbricazione": numero di registrazione dello stabilimento di trattamento o di trasformazione. Parte II (1a) GU L 300 del 14.11.2009, pag. 1. (1b) GU L 54 del 26.2.2011, pag. 1.  Testo di immagine
Testo di immagine
PAESE Latte, prodotti a base di latte e prodotti derivati dal latte non destinati al consumo umano II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) Cancellare le voci non pertinenti. (3) Da indicare se l'autorizzazione all'importazione o al transito nell'Unione europea riguarda solo alcune regioni del paese terzo interessato. (4) GU L 175 del 10.7.2010, pag. 1. (5) Questa condizione si applica solo ai paesi terzi elencati nell'allegato I, colonna "A", del regolamento (UE) n. 605/2010. (6) GU L 147 del 31.5.2001, pag. 1. — Il colore della firma e del timbro dev'essere diverso da quello del testo stampato. — Osservazione per il responsabile della partita nell'Unione europea: il presente certificato è ad uso esclusivamente veterinario e deve accompagnare la partita fino al posto d'ispezione frontaliero. Veterinario ufficiale/Ispettore ufficiale Nome e cognome (in stampatello): Titolo e qualifica: Data: Firma: Timbro: CAPO 2(B) Certificato sanitario Per la spedizione o il transito (2) nell'Unione europea di colostro e prodotti a base di colostro di bovini non destinati al consumo umano  Testo di immagine
Testo di immagine
PAESE Certificato veterinario per l'esportazione nell'UE Parte I: informazioni relative alla partita spedita I.1. Speditore Nome Indirizzo Tel. I.2. N. di riferimento del certificato I.2.a. I.3. Autorità centrale competente I.4. Autorità locale competente I.5. Destinatario Nome Indirizzo Codice postale Tel. I.6. Persona responsabile della partita nell'UE Nome Indirizzo Codice postale Tel. I.7. Paese di origine Codice ISO I.8. Regione di origine Codice I.9. Paese di destinazione Codice ISO I.10. Regione di destinazione Codice I.11. Luogo di origine Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo I.12. Luogo di destinazione Deposito doganale Nome N. di riconoscimento Indirizzo Codice postale I.13. Luogo di carico I.14. Data di partenza I.15. Mezzo di trasporto Aereo Nave Vagone ferroviario Veicolo stradale Altro Identificazione Riferimento documentale I.16. PIF di entrata nell'UE I.17. Numero/i CITES I.18. Descrizione della merce I.19. Codice del prodotto (codice SA) I.20. Quantità I.21. Temperatura del prodotto Ambiente Refrigerato Congelato I.22. Numero di colli I.23. Numero del sigillo/contenitore I.24. Tipo di imballaggio  Testo di immagine
Testo di immagine
I.25. Merce certificata per Alimentazione animale Trasformazione suppl. Produzione di alimenti per animali da compagnia Uso tecnico I.26. Per transito attraverso l'UE verso un paese terzo Paese terzo Codice ISO I.27. Per l'importazione/l'ammissione nell'UE I.28. Identificazione della merce Numero di riconoscimento degli stabilimenti Specie (nome scientifico) Impianto di fabbricazione Peso netto Numero del lotto  Testo di immagine
Testo di immagine
PAESE Colostro e prodotti a base di colostro di bovini non destinati al consumo umano II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Il sottoscritto, veterinario ufficiale, dichiara di aver preso atto del regolamento (CE) n. 1069/2009 del Parlamento europeo e del Consiglio(1a), in particolare dell'articolo 10 e del regolamento (UE) n. 142/2011 della Commissione(1b), in particolare dell'allegato X, capo II, sezione 4, e dell'allegato XIV, capo I, e certifica che il colostro(2) o i prodotti a base di colostro(2) di cui alla casella I.28. rispettano le seguenti condizioni: II.1. sono stati prodotti e ottenuti in (inserire il nome del paese esportatore)(3), (inserire il nome della regione)(3), figurante nell'elenco dell'allegato I del regolamento (UE) n. 605/2010 della Commissione(4), indenne da afta epizootica e da peste bovina nei 12 mesi immediatamente precedenti l'esportazione e che non ha praticato la vaccinazione contro la peste bovina durante tale periodo; II.2. sono stati prodotti a partire da colostro proveniente da animali che, al momento della mungitura, non presentavano segni clinici di malattie trasmissibili all'uomo o agli animali attraverso il colostro e che sono rimasti, per almeno 30 giorni prima della data di produzione, in aziende non soggette a restrizioni ufficiali a causa di afta epizootica o di peste bovina; II.3. si tratta di colostro o prodotti a base di colostro di origine bovina, che sono stati sottoposti ad una pastorizzazione rapida ad elevata temperatura, vale a dire 72 °C durante almeno 15 secondi, o ad una pastorizzazione equivalente sufficiente perché il test della fosfatasi nel colostro bovino dia esito negativo, in aggiunta a: (2) (5) [la condizione che il colostro o i prodotti a base di colostro siano stati prodotti almeno 21 giorni prima della spedizione e, durante tale periodo, nessun caso di afta epizootica sia stato individuato nel paese esportatore,] (2) (5) o [la condizione che il colostro o i prodotti a base di colostro siano stati prodotti il …/…/… (inserire la data) e questa data, tenuto conto della durata del viaggio prevista, sia anteriore di almeno 21 giorni alla data di presentazione della partita presso un posto d'ispezione frontaliera dell'Unione europea,] e sono stati ottenuti da bovini sottoposti regolarmente a visite veterinarie per accertare che provengano da aziende in cui tutti gli allevamenti di bovini: (2) (5) [sono riconosciuti ufficialmente indenni da tubercolosi e brucellos i(6),] (2) (5) o [non sono sottoposti a nessuna riserva in forza della legislazione nazionale del paese terzo di origine sull'eradicazione della tubercolosi e della brucellosi,] e (2) (5) [sono riconosciuti ufficialmente indenni dalla leucosi bovina enzootica (6),] (2) (5) o [sono inclusi in un sistema ufficiale per il controllo della leucosi bovina enzootica e in cui non sono stati rilevati indizi, clinici o di laboratorio, della presenza di questa malattia nel corso dei due anni precedenti,]] II.4. sono state prese tutte le precauzioni atte ad evitare la contaminazione del colostro/dei prodotti a base di colostro dopo la trasformazione; II.5. il colostro/prodotto a base di colostro è stato confezionato: (2) [in contenitori nuovi,] (2) o [in veicoli o contenitori per il trasporto alla rinfusa, disinfettati prima del carico con un prodotto approvato dall'autorità competente,] e i contenitori sono contrassegnati in modo da indicare la natura del colostro o dei prodotti a base di colostro e recano etichette indicanti che il prodotto è un materiale di categoria 3 non destinato al consumo umano; II.6. il colostro/prodotto a base di colostro non contiene latte o prodotti a base di latte di origine ovina o caprina. Note Parte I: — Casella I.6.: persona responsabile del carico nell'Unione europea: da compilare soltanto se si tratta di un certificato per merce in transito nell'Unione europea; la casella può essere compilata se il certificato riguarda una merce da importare nell'Unione europea. Parte II Certificazione  Testo di immagine
Testo di immagine
PAESE Colostro e prodotti a base di colostro di bovini non destinati al consumo umano II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. — Casella I.12.: luogo di destinazione: casella da compilare solo se si tratta di un certificato per merce in transito. — Casella I.15.: indicare il numero di immatricolazione (vagoni ferroviari o container e autocarri), il numero del volo (aeromobili) o il nome (navi). In caso di scarico e nuovo carico nell'Unione europea, lo speditore deve informare il posto d'ispezione frontaliero dell'UE. — Casella I.19.: utilizzare il codice appropriato del sistema armonizzato (SA) dell'Organizzazione mondiale delle dogane: 04.04.90, 23.09.10, 23.09.90, 35.01, 35.02 o 35.04. — Casella I.23.: nel caso di contenitori per il trasporto di merci alla rinfusa, indicare il numero del contenitore e il numero del sigillo (se pertinente). — Casella I.25.: uso tecnico: qualsiasi uso diverso dall'alimentazione di animali d'allevamento diversi dagli animali da pelliccia e dalla produzione o fabbricazione di alimenti per animali da compagnia. — Caselle I.26. e I.27.: compilare a seconda che si tratti di un certificato di transito o d'importazione. — Casella I.28.: "impianto di fabbricazione": numero di registrazione dello stabilimento di trattamento o di trasformazione. Parte II (1a) GU L 300 del 14.11.2009, pag. 1. (1b) GU L 54 del 26.2.2011, pag. 1. (2) Cancellare le voci non pertinenti. (3) Da indicare se l'autorizzazione a importare nell'Unione europea riguarda solo alcune regioni del paese terzo interessato. (4) GU L 175 del 10.7.2010, pag. 1. (5) Questa condizione si applica solo ai paesi terzi autorizzati figuranti nell'allegato I, colonna "A", del regolamento (UE) n. 605/2010 della Commissione (GU L 175 del 10.7.2010, pag. 1). (6) Allevamento ufficialmente indenne da tubercolosi e brucellosi conformemente all'allegato A della direttiva 64/432/CEE del Consiglio (GU L 121 del 29.7.1964, pag. 1977/64); e allevamento ufficialmente indenne da leucosi bovina enzootica conformemente all'allegato D, capitolo I, di detta direttiva. — La firma e il timbro devono essere di colore diverso da quello dei caratteri di stampa. — Nota per l'importatore: il presente certificato è ad uso esclusivamente veterinario e deve accompagnare la partita fino al posto d'ispezione frontaliero dell'Unione europea. Veterinario ufficiale/Ispettore ufficiale Nome e cognome (in stampatello): Titolo e qualifica: Data: Firma: Timbro: CAPO 3(A) Certificato sanitario Per la spedizione/il transito (2) nell'Unione europea di alimenti in conserva per animali da compagnia  Testo di immagine
Testo di immagine
PAESE Certificato veterinario per l'esportazione nell'UE Parte I: informazioni relative alla partita spedita I.1. Speditore Nome Indirizzo Tel. I.2. N. di riferimento del certificato I.2.a. I.3. Autorità centrale competente I.4. Autorità locale competente I.5. Destinatario Nome Indirizzo Codice postale Tel. I.6. Persona responsabile della partita nell'UE Nome Indirizzo Codice postale Tel. I.7. Paese di origine Codice ISO I.8. Regione di origine Codice I.9. Paese di destinazione Codice ISO I.10. Regione di destinazione Codice I.11. Luogo di origine Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo I.12. Luogo di destinazione Deposito doganale Nome N. di riconoscimento Indirizzo Codice postale I.13. Luogo di carico I.14. Data di partenza I.15. Mezzo di trasporto Aereo Nave Vagone ferroviario Veicolo stradale Altro Identificazione Riferimento documentale I.16. PIF di entrata nell'UE I.17. I.18. Descrizione della merce I.19. Codice del prodotto (codice SA) 23.09 I.20. Quantità I.21. Temperatura del prodotto Ambiente Refrigerato Congelato I.22. Numero di colli I.23. Numero del sigillo/contenitore I.24. Tipo di imballaggio  Testo di immagine
Testo di immagine
I.25. Merce certificata per Alimentazione per animali da compagnia Uso tecnico I.26. Per transito attraverso l'UE verso un paese terzo Paese terzo Codice ISO I.27. Per l'importazione/l'ammissione nell'UE I.28. Identificazione della merce Numero di riconoscimento degli stabilimenti Specie (nome scientifico) Impianto di fabbricazione Peso netto Numero del lotto  Testo di immagine
Testo di immagine
PAESE Alimenti in conserva per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Il sottoscritto, veterinario ufficiale, dichiara di aver preso atto del regolamento (CE) n. 1069/2009 del Parlamento europeo e del Consiglio (1a), in particolare degli articoli 8 e 10, e del regolamento (UE) n. 142/2011 della Commissione (1b), in particolare dell'allegato XIII, capo II, e dell'allegato XIV, capo II, e certifica che gli alimenti per animali da compagnia sopraindicati: II.1. sono stati preparati e immagazzinati in uno stabilimento o in un impianto riconosciuto e controllato dall'autorità competente in conformità dell'articolo 24 del regolamento (CE) n. 1069/2009; II.2. sono stati preparati esclusivamente con i seguenti sottoprodotti di origine animale: (2) [- carcasse e parti di animali macellati oppure, nel caso della selvaggina, corpi o parti di animali uccisi idonei al consumo umano in conformità della normativa dell'Unione, ma non destinati al consumo umano per motivi commerciali;] (2) e/o [- carcasse e parti seguenti derivanti da animali macellati in un macello e ritenuti atti alla macellazione per il consumo umano dopo un'ispezione ante mortem o corpi e parti seguenti di animali da selvaggina uccisi per il consumo umano nel rispetto della normativa dell'Unione: i) carcasse o corpi e parti di animali dichiarati non idonei al consumo umano conformemente alla normativa dell'Unione, ma che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali; ii) teste di pollame; iii) pelli, inclusi ritagli e frammenti, corna e zampe, incluse le falangi e le ossa carpiche e metacarpiche e le ossa tarsiche e metatarsiche; iv) setole di suini; v) piume;] (2) e/o [- sottoprodotti di origine animale di pollame e lagomorfi macellati nell'azienda agricola conformemente all'articolo 1, paragrafo 3, lettera d), del regolamento (CE) n. 853/2004 del Parlamento europeo e del Consiglio (2a), che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali] (2) e/o [- sangue di animali che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso il sangue, ottenuto da animali macellati in un macello dopo essere stati considerati atti alla macellazione per il consumo umano in seguito a un'ispezione ante mortem conformemente alla normativa dell'Unione;] (2) e/o [- sottoprodotti di origine animale derivanti dalla fabbricazione di prodotti destinati al consumo umano, compresi i ciccioli, le ossa sgrassate e i fanghi da centrifuga o da separatore risultanti dalla lavorazione del latte;] (2) e/o [- prodotti di origine animale, o prodotti alimentari contenenti prodotti di origine animale, i quali non sono più destinati al consumo umano per motivi commerciali o a causa di problemi di fabbricazione o difetti di condizionamento o altri difetti che non determinano rischi per la salute pubblica o animale;] (2) e/o [- alimenti per animali da compagnia e mangimi di origine animale o mangimi contenenti sottoprodotti di origine animale o prodotti derivati, non più destinati all'uso nei mangimi per motivi commerciali o a causa di problemi di fabbricazione o difetti di confezionamento o altri difetti che non determinano rischi per la salute pubblica o animale;] (2) e/o [- sangue, placenta, lana, piume, peli, corna, frammenti di zoccoli e latte crudo derivanti da animali vivi che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso tali prodotti;] (2) e/o [- animali acquatici e parti di tali animali, eccetto i mammiferi marini, che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali;] (2) e/o [- sottoprodotti di animali acquatici provenienti da stabilimenti o impianti che fabbricano prodotti destinati al consumo umano;] Parte II Certificazione  Testo di immagine
Testo di immagine
PAESE Alimenti in conserva per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) e/o [- i materiali seguenti provenienti da animali che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso tali materiali: i) conchiglie e carapaci di crostacei e molluschi con tessuti molli o carni; ii) i seguenti prodotti derivati da animali terrestri: — sottoprodotti dei centri di incubazione; — uova; — sottoprodotti delle uova, compresi i gusci d'uovo; iii) pulcini di un giorno abbattuti per motivi commerciali;] (2) e/o [- sottoprodotti di origine animale ottenuti da invertebrati acquatici e terrestri diversi dalle specie patogene per l'uomo o per gli animali;] (2) e/o [- animali e loro parti degli ordini Rodentia e Lagomorpha, eccetto i materiali di categoria 1 di cui all'articolo 8, lettera a), punti iii), iv) e v), e di categoria 2 di cui all'articolo 9, lettere da a) a g), del regolamento (CE) n. 1069/2009;] (2) e/o [- materiali ottenuti da animali che sono stati trattati con talune sostanze vietate dalla direttiva 96/22/CE del Consiglio (2b), la cui importazione è consentita in applicazione dell'articolo 35, lettera a), punto ii), del regolamento (CE) n. 1069/2009;] II.3. sono stati sottoposti a trattamento termico in contenitori ermeticamente chiusi almeno fino al raggiungimento del valore Fc = 3; II.4. sono stati analizzati, sulla base di almeno cinque campioni aleatoriamente prelevati da ciascun lotto trasformato, applicando un metodo diagnostico di laboratorio atto ad accertare che l'intera partita sia stata sottoposta ad un trattamento termico adeguato e conforme a quanto previsto al punto II.3.; II.5. sono stati trattati con tutte le precauzioni atte ad evitare la contaminazione da parte di agenti patogeni dopo il trattamento. (2) [II.6. gli alimenti per animali da compagnia sopraindicati (2) [sono ottenuti da ruminanti diversi da bovini, ovini o caprini.] (2) o [sono ottenuti da bovini, ovini o caprini e non contengono né sono ottenuti da: (2) [materiali ricavati da bovini, ovini e caprini diversi da quelli derivati da animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]] (2) o [a) materiale specifico a rischio di cui all'allegato V, punto 1, del regolamento (CE) n. 999/2001 del Parlamento europeo e del Consiglio (3); b) carni separate meccanicamente ottenute da ossa di bovini, ovini o caprini, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE della Commissione (4) e in cui non si sono verificati casi indigeni di BSE, c) sottoprodotti di origine animale o prodotti derivati ottenuti da bovini, ovini o caprini che sono stati abbattuti, previo stordimento, mediante lacerazione del tessuto nervoso centrale per mezzo di uno stilo inserito nella cavità cranica, o tramite iniezione di gas nella cavità cranica, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o in una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]]]  Testo di immagine
Testo di immagine
PAESE Alimenti in conserva per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Note Parte I: — Casella I.6.: persona responsabile della partita nell'Unione europea: da compilare soltanto se si tratta di un certificato per merce in transito nell'Unione europea; la casella può essere compilata se il certificato riguarda una merce da importare nell'Unione europea. — Casella I.12.: luogo di destinazione: casella da compilare solo se si tratta di un certificato per merce in transito. i prodotti in transito possono essere immagazzinati unicamente in zone franche, depositi franchi e depositi doganali. — Casella I.15.: numero di immatricolazione (vagoni ferroviari o container e autocarri), numero del volo (aeromobili) o nome (navi); queste informazioni devono essere aggiornate in caso di scarico e nuovo carico nell'Unione europea. — Casella I.23.: nel caso di contenitori per il trasporto di merci alla rinfusa, indicare il numero del contenitore e il numero del sigillo (se pertinente). — Casella I.25.: uso tecnico: qualsiasi uso diverso dall'alimentazione di animali d'allevamento diversi dagli animali da pelliccia e dalla produzione o fabbricazione di alimenti per animali da compagnia. — Caselle I.26. e I.27.: compilare a seconda che si tratti di un certificato di transito o d'importazione. — Casella I.28.: specie: scegliere fra: Aves, Ruminantia, Suidae, Mammalia diversi da Ruminantia e Suidae, Pesca, Mollusca, Crustacea, invertebrati diversi da Mollusca e Crustacea. Parte II (1a) GU L 300 del 14.11.2009, pag. 1. (1b) GU L 54 del 26.2.2011, pag. 1. (2) Cancellare le voci non pertinenti. (2a) GU L 139 del 30.4.2004, pag. 55. (2b) GU L 125 del 23.5.1996, pag. 3. (3) GU L 147 del 31.5.2001, pag. 1. (4) GU L 172 del 30.6.2007, pag. 84. — Il colore della firma e del timbro dev'essere diverso da quello del testo stampato. — Osservazione per il responsabile della partita nell'Unione europea: il presente certificato è ad uso esclusivamente veterinario e deve accompagnare la partita fino al posto d'ispezione frontaliero. Veterinario ufficiale/Ispettore ufficiale Nome e cognome (in stampatello): Titolo e qualifica: Data: Firma: Timbro: CAPO 3(B) Certificato sanitario Per la spedizione o il transito (2) nell'Unione europea di alimenti trasformati per animali da compagnia diversi dagli alimenti in conserva per animali da compagnia  Testo di immagine
Testo di immagine
PAESE Certificato veterinario per l'esportazione nell'UE Parte I: informazioni relative alla partita spedita I.1. Speditore Nome Indirizzo Tel. I.2. N. di riferimento del certificato I.2.a. I.3. Autorità centrale competente I.4. Autorità locale competente I.5. Destinatario Nome Indirizzo Codice postale Tel. I.6. Persona responsabile della partita nell'UE Nome Indirizzo Codice postale Tel. I.7. Paese di origine Codice ISO I.8. Regione di origine Codice I.9. Paese di destinazione Codice ISO I.10. Regione di destinazione Codice I.11. Luogo di origine Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo I.12. Luogo di destinazione Deposito doganale Nome N. di riconoscimento Indirizzo Codice postale I.13. Luogo di carico I.14. Data di partenza I.15. Mezzo di trasporto Aereo Nave Vagone ferroviario Veicolo stradale Altro Identificazione Riferimento documentale I.16. PIF di entrata nell'UE I.17. I.18. Descrizione della merce I.19. Codice del prodotto (codice SA) I.20. Quantità I.21. Temperatura del prodotto Ambiente Refrigerato Congelato I.22. Numero di colli I.23. Numero del sigillo/contenitore I.24. Tipo di imballaggio  Testo di immagine
Testo di immagine
I.25. Merce certificata per Alimentazione per animali da compagnia Uso tecnico I.26. Per transito attraverso l'UE verso un paese terzo Paese terzo Codice ISO I.27. Per l'importazione/l'ammissione nell'UE I.28. Identificazione della merce Numero di riconoscimento degli stabilimenti Specie (nome scientifico) Impianto di fabbricazione Peso netto Numero del lotto  Testo di immagine
Testo di immagine
PAESE Alimenti trasformati per animali da compagnia diversi dagli alimenti in conserva per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Il sottoscritto, veterinario ufficiale, dichiara di aver preso atto del regolamento (CE) n. 1069/2009 del Parlamento europeo e del Consiglio (1a), in particolare degli articoli 8 e 10, e del regolamento (UE) n. 142/2011 della Commissione (1b), in particolare dell'allegato XIII, capo II, e dell'allegato XIV, capo II, e certifica che gli alimenti per animali da compagnia sopraindicati: II.1. sono stati preparati e immagazzinati in un impianto riconosciuto e controllato dall'autorità competente in conformità dell'articolo 24 del regolamento (CE) n. 1069/2009; II.2. sono stati preparati esclusivamente con i seguenti sottoprodotti di origine animale: (2) [- carcasse e parti di animali macellati oppure, nel caso della selvaggina, corpi o parti di animali uccisi idonei al consumo umano in conformità della normativa dell'Unione, ma non destinati al consumo umano per motivi commerciali;] (2) e/o [- carcasse e parti seguenti derivanti da animali macellati in un macello e ritenuti atti alla macellazione per il consumo umano dopo un'ispezione ante mortem o corpi e parti seguenti di animali da selvaggina uccisi per il consumo umano nel rispetto della normativa dell'Unione: i) carcasse o corpi e parti di animali dichiarati non idonei al consumo umano conformemente alla normativa dell'Unione, ma che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali; ii) teste di pollame; iii) pelli, inclusi ritagli e frammenti, corna e zampe, incluse le falangi e le ossa carpiche e metacarpiche e le ossa tarsiche e metatarsiche; iv) setole di suini; v) piume;] (2) e/o [- sottoprodotti di origine animale di pollame e lagomorfi macellati nell'azienda agricola conformemente all'articolo 1, paragrafo 3, lettera d), del regolamento (CE) n. 853/2004 del Parlamento europeo e del Consiglio (2a), che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali] (2) e/o [- sangue di animali che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso il sangue, ottenuto da animali macellati in un macello dopo essere stati considerati atti alla macellazione per il consumo umano in seguito a un'ispezione ante mortem conformemente alla normativa dell'Unione;] (2) e/o [- sottoprodotti di origine animale derivanti dalla fabbricazione di prodotti destinati al consumo umano, compresi i ciccioli, le ossa sgrassate e i fanghi da centrifuga o da separatore risultanti dalla lavorazione del latte;] (2) e/o [- prodotti di origine animale, o prodotti alimentari contenenti prodotti di origine animale, i quali non sono più destinati al consumo umano per motivi commerciali o a causa di problemi di fabbricazione o difetti di condizionamento o altri difetti che non determinano rischi per la salute pubblica o animale;] (2) e/o [- alimenti per animali da compagnia e mangimi di origine animale o mangimi contenenti sottoprodotti di origine animale o prodotti derivati, non più destinati all'uso nei mangimi per motivi commerciali o a causa di problemi di fabbricazione o difetti di confezionamento o altri difetti che non determinano rischi per la salute pubblica o degli animali;] (2) e/o [- sangue, placenta, lana, piume, peli, corna, frammenti di zoccoli e latte crudo derivanti da animali vivi che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso tali prodotti;] (2) e/o [- animali acquatici e parti di tali animali, eccetto i mammiferi marini, che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali;] Parte II Certificazione  Testo di immagine
Testo di immagine
PAESE Alimenti trasformati per animali da compagnia diversi dagli alimenti in conserva per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) e/o [- sottoprodotti di animali acquatici provenienti da stabilimenti o impianti che fabbricano prodotti destinati al consumo umano;] (2) e/o [- i materiali seguenti provenienti da animali che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso tali materiali: i) conchiglie e carapaci di crostacei e molluschi con tessuti molli o carni; ii) i seguenti prodotti derivati da animali terrestri: — sottoprodotti dei centri di incubazione; — uova; — sottoprodotti delle uova, compresi i gusci d'uovo; iii) pulcini di un giorno abbattuti per motivi commerciali;] (2) e/o [- sottoprodotti di origine animale ottenuti da invertebrati acquatici e terrestri diversi dalle specie patogene per l'uomo o per gli animali;] (2) e/o [- animali e loro parti degli ordini Rodentia e Lagomorpha, eccetto i materiali di categoria 1 di cui all'articolo 8, lettera a), punti iii), iv) e v), e di categoria 2 di cui all'articolo 9, lettere da a) a g), del regolamento (CE) n. 1069/2009;] (2) e/o [- materiali ottenuti da animali che sono stati trattati con talune sostanze vietate dalla direttiva 96/22/CE del Consiglio (2b), la cui importazione è consentita in applicazione dell'articolo 35, lettera a), punto ii), del regolamento (CE) n. 1069/2009;] II.3. (2) [sono stati sottoposti ad un trattamento termico nel corso del quale tutta la massa ha raggiunto una temperatura di almeno 90 °C;] (2) o [sono stati prodotti, per quanto riguarda gli ingredienti d'origine animale, utilizzando esclusivamente prodotti che: a) nel caso di sottoprodotti di origine animale e prodotti derivati di carne o prodotti a base di carne, sono stati sottoposti ad un trattamento termico in cui tutta la massa ha raggiunto una temperatura di almeno 90 °C; b) nel caso del latte e dei prodotti a base di latte, i) se provengono da paesi terzi o da parti di paesi terzi indicati nell'allegato I, colonna B, del regolamento (UE) n. 605/2010 della Commissione (3), sono stati sottoposti a un trattamento di pastorizzazione sufficiente a produrre un esito negativo al test della fosfatasi; ii) se hanno un pH ridotto a meno di 6 e provengono da paesi terzi o da parti di paesi terzi indicati nell'allegato I, colonna C, del regolamento (UE) n. 605/2010, sono stati sottoposti preventivamente a un trattamento di pastorizzazione sufficiente a produrre un esito negativo al test della fosfatasi; iii) se provengono da paesi terzi o da parti di paesi terzi indicati nell'allegato I, colonna C, del regolamento (UE) n. 605/2010, sono stati sottoposti a un processo di sterilizzazione o a un duplice trattamento termico in cui ciascun trattamento è stato sufficiente a produrre un esito negativo al test della fosfatasi; iv) se provengono da paesi terzi o da parti di paesi terzi indicati nell'allegato I, colonna C, del regolamento (UE) n. 605/2010, in cui vi sia stato un focolaio di afta epizootica negli ultimi 12 mesi o in cui negli ultimi 12 mesi sia stata praticata una vaccinazione contro l'afta epizootica, sono stati sottoposti: — a un processo di sterilizzazione mediante il quale è stato raggiunto un valore Fc pari o superiore a 3, o — a un trattamento termico iniziale con effetto termico almeno pari a quello ottenuto col processo di pastorizzazione ad almeno 72 °C per almeno 15 secondi e sufficiente affinché il test della fosfatasi dia esito negativo, seguito da:  Testo di immagine
Testo di immagine
PAESE Alimenti trasformati per animali da compagnia diversi dagli alimenti in conserva per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. — un secondo trattamento termico con un effetto termico pari almeno a quello ottenuto con il trattamento termico iniziale e sufficiente a determinare una reazione negativa alla prova della fosfatasi, seguito, nel caso del latte disidratato o dei prodotti a base di latte disidratato, da un processo di essiccazione; o — un processo di acidificazione mediante il quale il pH è stato mantenuto a un livello inferiore a 6 per almeno un'ora; c) nel caso della gelatina, è stata prodotta con un processo in cui il materiale non trasformato di categoria 3 deve essere sottoposto a un trattamento acido o alcalino, seguito da uno o più risciacqui, con un successivo adeguamento del pH e una successiva estrazione mediante riscaldamento, ripetuta se necessario e seguita da una purificazione tramite filtrazione e sterilizzazione; d) nel caso delle proteine idrolizzate, sono state prodotte mediante un processo comprendente misure atte a minimizzare la contaminazione delle materie prime di categoria 3 e, in caso di proteine idrolizzate interamente o parzialmente derivate da pelli di ruminanti, sono state prodotte in un impianto di trasformazione destinato esclusivamente alla produzione di proteine idrolizzate, utilizzando unicamente materiali con un peso molecolare inferiore a 10 000 Dalton e un processo comprendente la preparazione delle materie prime di categoria 3 mediante trattamento in salamoia, calcinazione e lavaggio intensivo, seguiti da: i) esposizione dei materiali a un pH superiore a 11 per più di tre ore a una temperatura superiore a 80 °C e successivamente da un trattamento termico a una temperatura di oltre 140 °C per 30 minuti a una pressione superiore a 3,6 bar; o ii) esposizione del materiale a un pH compreso tra 1 e 2 e poi a un pH superiore a 11, seguita da un trattamento termico a una temperatura di 140 °C per 30 minuti a una pressione di 3 bar; e) nel caso di prodotti a base di uova, sono stati sottoposti a uno dei metodi di trasformazione da 1 a 5 o al metodo 7 di cui all'allegato IV, capo III, del regolamento (UE) n. 142/2011; o sono stati trattati conformemente all'allegato III, sezione X, capitolo II, del regolamento (CE) n. 853/2004; f) nel caso del collagene, è stato sottoposto a un processo in cui il materiale non trasformato di categoria 3 deve essere sottoposto a un trattamento comprendente il lavaggio, l'adeguamento del pH con l'utilizzo di acidi o alcali seguito da uno o più risciacqui, filtraggio ed estrusione; l'uso di conservanti diversi da quelli consentiti dalla normativa dell'Unione è vietato; g) nel caso di prodotti sanguigni, sono stati prodotti utilizzando uno dei metodi di trasformazione da 1 a 5 o il metodo 7, di cui all'allegato IV, capo III, del regolamento (UE) n. 142/2011; h) nel caso delle proteine animali trasformate derivanti da mammiferi, sono state sottoposte ad uno dei metodi di trasformazione da 1 a 5 o al metodo 7 e, nel caso del sangue di suini, a uno dei metodi di trasformazione da 1 a 5 o al metodo 7, a condizione che nel metodo 7 sia stato applicato un trattamento termico in cui tutta la massa ha raggiunto una temperatura minima di 80 °C; i) nel caso delle proteine trasformate non derivanti da mammiferi, ad esclusione delle farine di pesce, sono state sottoposte ad uno dei metodi di trasformazione da 1 a 5 o al metodo 7 di cui all'allegato IV, capo III, del regolamento (UE) n. 142/2011; j) nel caso della farina di pesce, è stata sottoposta a uno qualsiasi dei metodi di trasformazione da 1 a 7 di cui all'allegato IV, capo III, del regolamento (UE) n. 142/2011 o a un metodo e a parametri tali da garantire che il prodotto sia conforme alle norme microbiologiche per i prodotti derivati stabilite nell'allegato X, capo I, del regolamento (UE) n. 142/2011; k) nel caso di grassi fusi, compresi gli oli di pesce, sono stati sottoposti ad uno dei metodi di trasformazione da 1 a 5 o al metodo 7 (e al metodo 6 nel caso dell'olio di pesce), di cui all'allegato IV, capo III, del regolamento (UE) n. 142/2011 o sono stati prodotti conformemente all'allegato III, sezione XII, capitolo II, del regolamento (CE) n. 853/2004; i grassi fusi provenienti da ruminanti devono essere purificati in modo che il livello massimo del totale di impurità insolubili rimanenti non superi lo 0,15 % del peso;  Testo di immagine
Testo di immagine
PAESE Alimenti trasformati per animali da compagnia diversi dagli alimenti in conserva per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. l) nel caso del fosfato bicalcico, è stato prodotto con un processo che i) prevede che tutto il materiale osseo di categoria 3 sia finemente triturato, sgrassato con acqua calda e trattato con acido cloridrico diluito (con una concentrazione minima del 4 % e un pH inferiore a 1,5) per almeno due giorni; ii) in seguito alla procedura di cui al punto i), prevede un trattamento con calce del liquido fosforico ottenuto, risultante nella formazione di un precipitato di fosfato bicalcico con pH compreso tra 4 e 7; e iii) prevede infine che il precipitato di fosfato bicalcico sia essiccato con aria avente una temperatura d'ingresso compresa tra 65 °C e 325 °C e una temperatura di uscita compresa tra 30 °C e 65 °C; m) nel caso del fosfato tricalcico, è stato prodotto con un processo che prevede che: i) tutto il materiale osseo di categoria 3 sia finemente triturato e sgrassato con un getto contrario di acqua calda (frammenti ossei di dimensioni inferiori a 14 mm); ii) i frammenti siano sottoposti a una cottura continua a vapore a 145 °C per 30 minuti a 4 bar; iii) il brodo di proteine venga separato dall'idrossiapatite (fosfato tricalcico) mediante centrifugazione; e iv) il fosfato tricalcico sia granulato dopo l'essiccazione in un letto fluido con aria a 200 °C; n) nel caso di interiora aromatizzanti, sono state prodotte secondo un metodo di trattamento e secondo parametri che garantiscano che il prodotto sia conforme alle norme microbiologiche di cui al punto II.4.] (2) o [sono stati sottoposti a un trattamento come l'essiccazione o la fermentazione, autorizzato dall'autorità competente;] (2) o [nel caso di invertebrati acquatici e terrestri diversi dalle specie patogene per l'uomo o per gli animali, sono stati sottoposti a un trattamento autorizzato dall'autorità competente, che garantisca che gli alimenti per animali da compagnia non comportino rischi inaccettabili per la salute pubblica e animale;] II.4. sono stati analizzati sulla base di almeno cinque campioni aleatoriamente prelevati da ciascun lotto trasformato durante o dopo il magazzinaggio nell'impianto di trasformazione e sono conformi alle seguenti condizioni (4): Salmonella: assenza in 25 g: n = 5, c = 0, m = 0, M = 0, Enterobatteriacee: n = 5, c = 2, m = 10, M = 300 in 1 g; II.5. sono stati trattati con tutte le precauzioni necessarie per evitare la contaminazione con agenti patogeni dopo il trattamento; II.6. sono stati confezionati in imballaggi nuovi, su cui è applicata un'etichetta con la dicitura "NON DESTINATO AL CONSUMO UMANO", a meno che gli alimenti per animali da compagnia non siano spediti in imballaggi pronti per la vendita su cui è indicato chiaramente che il contenuto è destinato unicamente all'alimentazione di animali da compagnia; (2) [II.7. gli alimenti per animali da compagnia sopraindicati (2) [sono ottenuti da ruminanti diversi da bovini, ovini o caprini.] (2) o [sono ottenuti da bovini, ovini o caprini e non contengono né sono ottenuti da: (2) [materiali ricavati da bovini, ovini e caprini diversi da quelli derivati da animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]] (2) o [a) materiale specifico a rischio di cui all'allegato V, punto 1, del regolamento (CE) n. 999/2001 del Parlamento europeo e del Consiglio (5);  Testo di immagine
Testo di immagine
PAESE Alimenti trasformati per animali da compagnia diversi dagli alimenti in conserva per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. b) carni separate meccanicamente ottenute da ossa di bovini, ovini o caprini, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE della Commissione (6) e in cui non si sono verificati casi indigeni di BSE, c) sottoprodotti di origine animale o prodotti derivati ottenuti da bovini, ovini o caprini che sono stati abbattuti, previo stordimento, mediante lacerazione del tessuto nervoso centrale per mezzo di uno stilo inserito nella cavità cranica, o tramite iniezione di gas nella cavità cranica, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o in una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]]] Note Parte I: — Casella I.6.: persona responsabile della partita nell'Unione europea: da compilare soltanto se si tratta di un certificato per merce in transito nell'Unione europea; la casella può essere compilata se il certificato riguarda una merce da importare nell'Unione europea. — Casella I.12.: luogo di destinazione: da compilare soltanto se si tratta di un certificato per merce in transito; i prodotti in transito possono essere immagazzinati unicamente in zone franche, depositi franchi e depositi doganali. — Casella I.15.: indicare il numero di immatricolazione (vagoni ferroviari o container e autocarri), il numero del volo (aeromobili) o il nome (navi). In caso di scarico e nuovo carico, lo speditore deve informare il posto d'ispezione frontaliero di entrata nell'Unione europea. — Casella I.19.: utilizzare il codice appropriato del sistema armonizzato (SA) delle seguenti voci: 04.01, 04.02, 04.03, 04.04, 04.08, 05.04, 05.05, 05.06, 05.11, 15.01, 15.02, 15.03, 15.04, 23.01, 23.09, 28.35.25, 28.35.26, 35.01, 35.02, 35.03 o 35.04. — Casella I.23.: nel caso di contenitori per il trasporto di merci alla rinfusa, indicare il numero del contenitore e il numero del sigillo (se pertinente). — Casella I.25.: uso tecnico: qualsiasi uso diverso dall'alimentazione di animali d'allevamento diversi dagli animali da pelliccia e dalla produzione o fabbricazione di alimenti per animali da compagnia. — Caselle I.26. e I.27.: compilare a seconda che si tratti di un certificato di transito o d'importazione. — Casella I.28.: specie: scegliere fra: Aves, Ruminantia, Suidae, Mammalia diversi da Ruminantia e Suidae, Pesca, Mollusca, Crustacea, invertebrati diversi da Mollusca e Crustacea. Parte II (1a) GU L 300 del 14.11.2009, pag. 1. (1b) GU L 54 del 26.2.2011, pag. 1. (2) Cancellare le voci non pertinenti. (2a) GU L 139 del 30.4.2004, pag. 55. (2b) GU L 125 del 23.5.1996, pag. 3. (3) GU L 175 del 10.7.2010, pag. 1.  Testo di immagine
Testo di immagine
PAESE Alimenti trasformati per animali da compagnia diversi dagli alimenti in conserva per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (4) Dove: n = numero di campioni da esaminare; m = valore soglia per quanto riguarda il numero dei batteri; il risultato è considerato soddisfacente se tutti i campioni hanno un numero di batteri inferiore o uguale a m; M = valore massimo per quanto riguarda il numero dei batteri; il risultato è considerato insoddisfacente se uno o più campioni hanno un numero di batteri uguale o superiore a M; e c = numero di campioni la cui carica batterica può essere compresa fra m e M; il campione è ancora considerato accettabile se la carica batterica degli altri campioni è uguale o inferiore a m. (5) GU L 147 del 31.5.2001, pag. 1. (6) GU L 172 del 30.6.2007, pag. 84. — Il colore della firma e del timbro dev'essere diverso da quello del testo stampato. — Osservazione per il responsabile della partita nell'Unione europea: il presente certificato è ad uso esclusivamente veterinario e deve accompagnare la partita fino al posto d'ispezione frontaliero di entrata nell'Unione europea. Veterinario ufficiale/Ispettore ufficiale Nome e cognome (in stampatello): Titolo e qualifica: Data: Firma: Timbro: CAPO 3(C) Certificato sanitario Per articoli da masticare per animali da compagnia destinati alla spedizione/al transito (2) nell'Unione europea  Testo di immagine
Testo di immagine
PAESE Certificato veterinario per l'esportazione nell'UE Parte I: informazioni relative alla partita spedita I.1. Speditore Nome Indirizzo Tel. I.2. N. di riferimento del certificato I.2.a. I.3. Autorità centrale competente I.4. Autorità locale competente I.5. Destinatario Nome Indirizzo Codice postale Tel. I.6. Persona responsabile della partita nell'UE Nome Indirizzo Codice postale Tel. I.7. Paese di origine Codice ISO I.8. Regione di origine Codice I.9. Paese di destinazione Codice ISO I.10. Regione di destinazione Codice I.11. Luogo di origine Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo I.12. Luogo di destinazione Deposito doganale Nome N. di riconoscimento Indirizzo Codice postale I.13. Luogo di carico I.14. Data di partenza I.15. Mezzo di trasporto Aereo Nave Vagone ferroviario Veicolo stradale Altro Identificazione Riferimento documentale I.16. PIF di entrata nell'UE I.17. I.18. Descrizione della merce I.19. Codice del prodotto (codice SA) I.20. Quantità I.21. Temperatura del prodotto Ambiente Refrigerato Congelato I.22. Numero di colli I.23. Numero del sigillo/contenitore I.24. Tipo di imballaggio  Testo di immagine
Testo di immagine
I.25. Merce certificata per Alimentazione per animali da compagnia Uso tecnico I.26. Per transito attraverso l'UE verso un paese terzo Paese terzo Codice ISO I.27. Per l'importazione/l'ammissione nell'UE I.28. Identificazione della merce Numero di riconoscimento degli stabilimenti Specie (nome scientifico) Impianto di fabbricazione Peso netto Numero del lotto  Testo di immagine
Testo di immagine
PAESE Articoli da masticare per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Il sottoscritto, veterinario ufficiale, dichiara di aver preso atto del regolamento (CE) n. 1069/2009 del Parlamento europeo e del Consiglio (1a), in particolare dell'articolo 10, e del regolamento (UE) n. 142/2011 della Commissi-one (1b), in particolare dell'allegato XIII, capo II, e dell'allegato XIV, capo II, e certifica che gli articoli da masticare per animali da compagnia di cui sopra: II.1. sono stati preparati esclusivamente con i seguenti sottoprodotti di origine animale: (2) [- carcasse e parti di animali macellati oppure, nel caso della selvaggina, corpi o parti di animali uccisi idonei al consumo umano in conformità della normativa dell'Unione, ma non destinati al consumo umano per motivi commerciali;] (2) e/o [- carcasse e parti seguenti derivanti da animali macellati in un macello e ritenuti atti alla macellazione per il consumo umano dopo un'ispezione ante mortem o corpi e parti seguenti di animali da selvaggina uccisi per il consumo umano nel rispetto della normativa dell'Unione: i) carcasse o corpi e parti di animali dichiarati non idonei al consumo umano conformemente alla normativa dell'Unione, ma che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali; ii) teste di pollame; iii) pelli, inclusi ritagli e frammenti, corna e zampe, incluse le falangi e le ossa carpiche e metacarpiche e le ossa tarsiche e metatarsiche; iv) setole di suini; v) piume;] (2) e/o [- sangue di animali che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso il sangue, ottenuto da animali macellati in un macello dopo essere stati considerati atti alla macellazione per il consumo umano in seguito a un'ispezione ante mortem conformemente alla normativa dell'Unione;] (2) e/o [- sottoprodotti di origine animale derivanti dalla fabbricazione di prodotti destinati al consumo umano, compresi i ciccioli, le ossa sgrassate e i fanghi da centrifuga o da separatore risultanti dalla lavorazione del latte;] (2) e/o [- animali acquatici e parti di tali animali, eccetto i mammiferi marini, che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali;] (2) e/o [- sottoprodotti di animali acquatici provenienti da stabilimenti o impianti che fabbricano prodotti destinati al consumo umano;] (2) e/o [- materiali ottenuti da animali che sono stati trattati con talune sostanze vietate dalla direttiva 96/22/CE del Consiglio(2b), la cui importazione è consentita in applicazione dell'articolo 35, lettera a), punto ii), del regolamento (CE) n. 1069/2009;] II.2. sono stati: (2) [nel caso di articoli da masticare ottenuti da pelli di ungulati o da pesci, ad un trattamento termico sufficiente a distruggere gli organismi patogeni (compresa la salmonella); e gli articoli da masticare sono secchi]; (2) e/o [nel caso di articoli da masticare ottenuti da sottoprodotti di origine animale diversi dalle pelli di ungulati o da pesci, ad un trattamento termico nel corso del quale la temperatura di tutta la massa ha raggiunto almeno 90 °C;] II.3. sono stati analizzati sulla base di almeno cinque campioni aleatoriamente prelevati da ciascun lotto trasformato durante o dopo il magazzinaggio nell'impianto di trasformazione e sono risultati conformi alle seguenti condizioni (3): Salmonella: assenza in 25 g: n = 5, c = 0, m = 0, M = 0, Enterobatteriacee: n = 5, c = 2, m = 10, M = 300 in 1 g; Parte II Certificazione  Testo di immagine
Testo di immagine
PAESE Articoli da masticare per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. II.4. sono stati trattati con tutte le precauzioni atte ad evitare la contaminazione da parte di agenti patogeni dopo il trattamento; II.5. sono stati confezionati in imballaggi nuovi; (2) [II.6. gli articoli da masticare sopraindicati (2) [sono ottenuti da ruminanti diversi da bovini, ovini o caprini.]] (2) o [sono ottenuti da bovini, ovini o caprini e non contengono né sono ottenuti da: (2) [materiali ricavati da bovini, ovini e caprini diversi da quelli derivati da animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]] (2) o [a) materiale specifico a rischio di cui all'allegato V, punto 1, del regolamento (CE) n. 999/2001 del Parlamento europeo e del Consiglio (4); b) carni separate meccanicamente ottenute da ossa di bovini, ovini o caprini, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE della Commissione (5) e in cui non si sono verificati casi indigeni di BSE, c) sottoprodotti di origine animale o prodotti derivati ottenuti da bovini, ovini o caprini che sono stati abbattuti, previo stordimento, mediante lacerazione del tessuto nervoso centrale per mezzo di uno stilo inserito nella cavità cranica, o tramite iniezione di gas nella cavità cranica, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o in una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]]] Note Parte I: — Casella I.6.: persona responsabile della partita nell'Unione europea: da compilare soltanto se si tratta di un certificato per merce in transito; la casella può essere compilata se il certificato riguarda una merce da importare nell'Unione europea. — Casella I.12.: luogo di destinazione: da compilare soltanto se si tratta di un certificato per merce in transito; i prodotti in transito possono essere immagazzinati unicamente in zone franche, depositi franchi e depositi doganali. — Casella I.15.: numero di immatricolazione (vagoni ferroviari o container e autocarri), numero del volo (aeromobili) o nome (navi); queste informazioni devono essere aggiornate in caso di scarico e nuovo carico nell'Unione europea. — Casella I.19.: 05.11, 23.09, 41.01 o 42.05. — Casella I.23.: nel caso di contenitori per il trasporto di merci alla rinfusa, indicare il numero del contenitore e il numero del sigillo (se pertinente). — Casella I.25.: uso tecnico: qualsiasi uso diverso dall'alimentazione di animali d'allevamento diversi dagli animali da pelliccia e dalla produzione o fabbricazione di alimenti per animali da compagnia. — Caselle I.26. e I.27.: compilare a seconda che si tratti di un certificato di transito o d'importazione. — Casella I.28.: specie: scegliere fra: Aves, Ruminantia, Suidae, Mammalia diversi da Ruminantia e Suidae, Pesca, Mollusca, Crustacea, invertebrati diversi da Mollusca e Crustacea. Parte II (1a) GU L 300 del 14.11.2009, pag. 1. (1b) GU L 54 del 26.2.2011, pag. 1.  Testo di immagine
Testo di immagine
PAESE Articoli da masticare per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) Cancellare le voci non pertinenti. (2a) GU L 125 del 23.5.1996, pag. 3. (3) Dove: — n = numero di campioni da esaminare; — m = valore soglia per quanto riguarda il numero dei batteri; il risultato è considerato soddisfacente se tutti i campioni hanno un numero di batteri inferiore o uguale a m; — M = valore massimo per quanto riguarda il numero dei batteri; il risultato è considerato insoddisfacente se uno o più campioni hanno un numero di batteri uguale o superiore a M; e — c = numero di campioni la cui carica batterica può essere compresa fra m e M; il campione è ancora considerato accettabile se la carica batterica degli altri campioni è uguale o inferiore a m. (4) GU L 147 del 31.5.2001, pag. 1. (5) GU L 172 del 30.6.2007, pag. 84. — Il colore della firma e del timbro dev'essere diverso da quello del testo stampato. — Osservazione per il responsabile della partita nell'Unione europea: il presente certificato è ad uso esclusivamente veterinario e deve accompagnare la partita fino al posto d'ispezione frontaliero di entrata nell'Unione europea. Veterinario ufficiale/Ispettore ufficiale Nome e cognome (in stampatello): Titolo e qualifica: Data: Firma: Timbro: CAPO 3(D) Certificato sanitario Per la spedizione/il transito (2) nell'Unione europea di alimenti greggi per animali da compagnia destinati alla vendita diretta o di sottoprodotti di origine animale per l'alimentazione degli animali da pelliccia  Testo di immagine
Testo di immagine
PAESE Certificato veterinario per l'esportazione nell'UE Parte I: informazioni relative alla partita spedita I.1. Speditore Nome Indirizzo Tel. I.2. N. di riferimento del certificato I.2.a. I.3. Autorità centrale competente I.4. Autorità locale competente I.5. Destinatario Nome Indirizzo Codice postale Tel. I.6. Persona responsabile della partita nell'UE Nome Indirizzo Codice postale Tel. I.7. Paese di origine Codice ISO I.8. Regione di origine Codice I.9. Paese di destinazione Codice ISO I.10. Regione di destinazione Codice I.11. Luogo di origine Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo I.12. Luogo di destinazione Deposito doganale Nome N. di riconoscimento Indirizzo Codice postale I.13. Luogo di carico I.14. Data di partenza I.15. Mezzo di trasporto Aereo Nave Vagone ferroviario Veicolo stradale Altro Identificazione Riferimento documentale I.16. PIF di entrata nell'UE I.17. I.18. Descrizione della merce I.19. Codice del prodotto (codice SA) I.20. Quantità I.21. Temperatura del prodotto Ambiente Refrigerato Congelato I.22. Numero di colli I.23. Numero del sigillo/contenitore I.24. Tipo di imballaggio  Testo di immagine
Testo di immagine
I.25. Merce certificata per Alimentazione per animali da compagnia Uso tecnico I.26. Per transito attraverso l'UE verso un paese terzo Paese terzo Codice ISO I.27. Per l'importazione/l'ammissione nell'UE I.28. Identificazione della merce Numero di riconoscimento degli stabilimenti Specie (nome scientifico) Natura della merce Impianto di fabbricazione Peso netto Numero del lotto  Testo di immagine
Testo di immagine
PAESE Alimenti greggi per animali da compagnia destinati alla vendita diretta o sottoprodotti di origine animale per l'alimentazione di animali da pelliccia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Il sottoscritto, veterinario ufficiale, dichiara di aver preso atto del regolamento (CE) n. 1069/2009 del Parlamento europeo e del Consiglio (1a), in particolare dell'articolo 10, e del regolamento (UE) n. 142/2011 della Commissione (1b), in particolare dell'allegato XIII, capo II, e dell'allegato XIV, capo II, e certifica che gli alimenti greggi per animali da compagnia o i sottoprodotti di origine animale di cui sopra: II.1. costituiti da sottoprodotti di origine animale che soddisfano le condizioni sanitarie di seguito indicate; II.2. sono costituiti da sottoprodotti di origine animale: a) derivati da carni che soddisfano le pertinenti condizioni sanitarie e di polizia sanitaria previste dai seguenti atti: — regolamento (UE) n. 206/2010 (3) della Commissione, purché gli animali dai quali è stata ottenuta la carne provengano dai paesi terzi, dai loro territori o dalle parti di territori (codice ISO per il paese o codici per i territori o loro parti) elencati in tale regolamento; — e/o regolamento (CE) n. 798/2008 della Commissione (4), purché gli animali dai quali è stata ottenuta la carne provengano dai paesi terzi, dai loro territori o dalle parti di territori (codice ISO per il paese o codici per i territori o loro parti) elencati in tale regolamento, nei quali, durante gli ultimi 12 mesi, non è stato registrato nessun caso di malattia di Newcastle, né di influenza aviaria; — e/o regolamento (CE) n. 119/2009 della Commissione (5), purché gli animali dai quali è stata ottenuta la carne provengano dai paesi terzi, dai loro territori o da parti di territori (codice ISO per il paese o codici per i territori o loro parti) elencati in tale regolamento, nei quali, durante gli ultimi 12 mesi, non è stato registrato nessun caso di afta epizootica, peste bovina, peste suina classica, peste suina africana, malattia vescicolare dei suini, malattia di Newcastle e influenza aviaria e nei quali, durante lo stesso periodo, non sono state effettuate vaccinazioni (solo se si tratta di specie suscettibili di contrarre tali malattie); b) derivati da animali che nel macello sono stati sottoposti a ispezione sanitaria ante mortem nelle 24 ore precedenti la macellazione, senza che venisse rilevata la presenza delle pertinenti malattie di cui ai regolamenti citati alla lettera a); e c) derivati da animali che nel macello, prima e durante la macellazione o l'abbattimento, sono stati trattati conformemente alle disposizioni pertinenti della normativa dell'Unione e sono state osservate prescrizioni almeno equivalenti a quelle di cui ai capi II e III del regolamento (CE) n. 1099/2009 del Consiglio (6); o d) nel caso di alimenti per animali da pelliccia derivati da animali acquatici che soddisfano le relative condizioni sanitarie e di polizia sanitaria stabilite nella decisione 2006/766/CE della Commissione (7), provengono da paesi o loro territori … (codice ISO del paese) elencati nell'allegato II di detta decisione; II.3.1. sono costituiti solo dai seguenti sottoprodotti di origine animale: a) carcasse e parti di animali macellati oppure, nel caso della selvaggina, corpi o parti di animali uccisi dichiarati idonei al consumo umano in conformità della normativa dell'Unione finché non sono stati irreversibilmente dichiarati sottoprodotti di origine animale per motivi commerciali; b) parti di animali macellati dichiarate non idonee al consumo umano ma che non presentano sintomi di malattie trasmissibili all'uomo o agli animali e provenienti da carcasse non idonee al consumo umano in virtù della normativa dell'Unione; II.3.2. nel caso di alimenti per animali da pelliccia, oltre al punto II.3.1. sono costituiti anche dai seguenti sottoprodotti di origine animale: (2) [- sottoprodotti di origine animale di pollame e lagomorfi macellati nell'azienda agricola conformemente all'articolo 1, paragrafo 3, lettera d), del regolamento (CE) n. 853/2004 del Parlamento europeo e del Consiglio (2a), che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali;] (2) e/o [- sangue di animali che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso il sangue, ottenuto da animali macellati in un macello dopo essere stati considerati atti alla macellazione per il consumo umano in seguito a un'ispezione ante mortem conformemente alla normativa dell'Unione;] (2) e/o [- sottoprodotti di origine animale derivanti dalla fabbricazione di prodotti destinati al consumo umano, compresi i ciccioli, le ossa sgrassate e i fanghi da centrifuga o da separatore risultanti dalla lavorazione del latte;] Parte II Certificazione  Testo di immagine
Testo di immagine
PAESE Alimenti greggi per animali da compagnia destinati alla vendita diretta o sottoprodotti di origine animale per l'alimentazione di animali da pelliccia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) e/o [- prodotti di origine animale, o prodotti alimentari contenenti prodotti di origine animale, i quali non sono più destinati al consumo umano per motivi commerciali o a causa di problemi di fabbricazione o difetti di condizionamento o altri difetti che non determinano rischi per la salute pubblica o degli animali;] (2) e/o [- alimenti per animali da compagnia e mangimi di origine animale o mangimi contenenti sottoprodotti di origine animale o prodotti derivati, non più destinati all'uso nei mangimi per motivi commerciali o a causa di problemi di fabbricazione o difetti di confezionamento o altri difetti che non determinano rischi per la salute pubblica o degli animali;] (2) e/o [- sangue, placenta, lana, piume, peli, corna, frammenti di zoccoli e latte crudo derivanti da animali vivi che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso tali prodotti;] (2) e/o [- animali acquatici e parti di tali animali, eccetto i mammiferi marini, che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali;] (2) e/o [- sottoprodotti di animali acquatici provenienti da stabilimenti o impianti che fabbricano prodotti destinati al consumo umano;] (2) e/o [- i materiali seguenti provenienti da animali che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso tali materiali: i) conchiglie e carapaci di crostacei e molluschi con tessuti molli o carni; ii) i seguenti prodotti derivati da animali terrestri: — sottoprodotti dei centri di incubazione; — uova; — sottoprodotti delle uova, compresi i gusci d'uovo; iii) pulcini di un giorno abbattuti per motivi commerciali;] (2) e/o [- sottoprodotti di origine animale ottenuti da invertebrati acquatici e terrestri diversi dalle specie patogene per l'uomo o per gli animali;] (2) e/o [- animali e loro parti degli ordini Rodentia e Lagomorpha, eccetto i materiali di categoria 1 di cui all'articolo 8, lettera a), punti iii), iv) e v), e di categoria 2 di cui all'articolo 9, lettere da a) a g), del regolamento (CE) n. 1069/2009;] II.4. sono stati ottenuti e preparati senza essere entrati in contatto con altro materiale non conforme alle condizioni di cui al regolamento (CE) n. 1069/2009 e sono stati manipolati in modo da evitare la contaminazione da parte di agenti patogeni; II.5. sono stati confezionati in un imballaggio finale recante la dicitura "ALIMENTI GREGGI PER ANIMALI DA COMPAGNIA – NON DESTINATI AL CONSUMO UMANO" o "SOTTOPRODOTTI DI ORIGINE ANIMALE PER L'ALIMENTAZIONE DI ANIMALI DA PELLICCIA – NON DESTINATI AL CONSUMO UMANO" e poi posti in scatole/contenitori a tenuta stagna ed ufficialmente sigillati o in un imballaggio nuovo a tenuta stagna ed in scatole/contenitori ufficialmente sigillati recanti la dicitura "ALIMENTI GREGGI PER ANIMALI DA COMPAGNIA – NON DESTINATI AL CONSUMO UMANO" o "SOTTOPRODOTTI DI ORIGINE ANIMALE PER L'ALIMENTAZIONE DI ANIMALI DA PELLICCIA – NON DESTINATI AL CONSUMO UMANO" ed il nome e l'indirizzo dello stabilimento di destinazione; II.6. nel caso degli alimenti greggi per animali da compagnia: a) sono stati preparati e immagazzinati in un impianto riconosciuto e controllato dall'autorità competente in conformità dell'articolo 24 del regolamento (CE) n. 1069/2009 e b) sono stati esaminati sulla base di almeno cinque campioni aleatoriamente prelevati da ciascun lotto durante il magazzinaggio (prima della spedizione) e soddisfano le seguenti condizioni (8):  Testo di immagine
Testo di immagine
PAESE Alimenti greggi per animali da compagnia destinati alla vendita diretta o sottoprodotti di origine animale per l'alimentazione di animali da pelliccia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Salmonella: assenza in 25 g: n = 5, c = 0, m = 0, M = 0, Enterobatteriacee: n = 5, c = 2, m = 10, M = 5 000 in 1 grammo; (2) [II.7. [gli alimenti per animali da compagnia o i sottoprodotti di origine animale per l'alimentazione di animali da pelliccia sopra descritti contengono o sono ottenuti da sottoprodotti di origine animale ricavati da ruminanti e: (2) [provengono da un paese o da una regione classificati come aventi un rischio trascurabile di BSE conformemente alla decisione 2007/453/CE e nei quali non si siano verificati casi indigeni di BSE, e]] (2) o [provengono da un paese o da una regione classificati come aventi un rischio trascurabile di BSE conformemente alla decisione 2007/453/CE e nei quali si è verificato un caso indigeno di BSE, e i sottoprodotti di origine animale o i prodotti derivati sono stati ottenuti da animali nati dopo la data in cui il divieto di somministrazione ai ruminanti di farine di carne e ossa e ciccioli, quali definiti nel codice sanitario per gli animali terrestri dell'OIE, ottenuti da ruminanti è stato effettivamente applicato nel paese o nella regione, e]] (2) [sono ottenuti da ruminanti diversi da bovini, ovini o caprini.]] (2) o [sono ottenuti da bovini, ovini o caprini e non contengono né sono ottenuti da: (2) [materiali ricavati da bovini, ovini e caprini diversi da quelli derivati da animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]] (2) o [a) materiale specifico a rischio di cui all'allegato V, punto 1, del regolamento (CE) n. 999/2001 del Parlamento europeo e del Consiglio (9); b) carni separate meccanicamente ottenute da ossa di bovini, ovini o caprini, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE della Commissione (10) e in cui non si sono verificati casi indigeni di BSE, c) sottoprodotti di origine animale o prodotti derivati ottenuti da bovini, ovini o caprini che sono stati abbattuti, previo stordimento, mediante lacerazione del tessuto nervoso centrale per mezzo di uno stilo inserito nella cavità cranica, o tramite iniezione di gas nella cavità cranica, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o in una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]]] Note Parte I: — Casella I.6.: persona responsabile della partita nell'Unione europea: da compilare soltanto se si tratta di un certificato per merce in transito nell'Unione europea; la casella può essere compilata se il certificato riguarda una merce da importare nell'Unione europea. — Casella I.12.: luogo di destinazione: casella da compilare solo se si tratta di un certificato per merce in transito. i prodotti in transito possono essere immagazzinati unicamente in zone franche, depositi franchi e depositi doganali. — Casella I.15.: indicare il numero di immatricolazione (vagoni ferroviari o container e autocarri), il numero del volo (aeromobili) o il nome (navi). In caso di scarico e nuovo carico, lo speditore deve informare il posto d'ispezione frontaliero di entrata nell'Unione europea. — Casella I.19.: utilizzare il codice appropriato del sistema armonizzato (SA) delle seguenti voci: 04.08, 05.06, 05.08, 05.11, 23.01 o 23.09. — Casella I.23.: nel caso di contenitori per il trasporto di merci alla rinfusa, indicare il numero del contenitore e il numero del sigillo (se pertinente). — Casella I.25.: uso tecnico: qualsiasi uso diverso dall'alimentazione di animali d'allevamento diversi dagli animali da pelliccia e dalla produzione o fabbricazione di alimenti per animali da compagnia. — Caselle I.26. e I.27.: compilare a seconda che si tratti di un certificato di transito o d'importazione.  Testo di immagine
Testo di immagine
PAESE Alimenti greggi per animali da compagnia destinati alla vendita diretta o sottoprodotti di origine animale per l'alimentazione di animali da pelliccia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. — Casella I.28.: natura della merce: indicare alimenti greggi per animali da compagnia o sottoprodotti di origine animale. Nel caso di materie prime per la fabbricazione di alimenti greggi per animali da compagnia indicare il nome scientifico delle specie. Nel caso di materie prime per la fabbricazione di alimenti per animali da pelliccia, scegliere tra: Aves, Ruminantia, Suidae, Mammalia diversi da Ruminantia e Suidae, Pesca, Mollusca, Crustacea, invertebrati diversi da Mollusca e Crustacea. Parte II (1a) GU L 300 del 14.11.2009, pag. 1. (1b) GU L 54 del 26.2.2011, pag. 1. (2) Cancellare le voci non pertinenti. (2a) GU L 139 del 30.4.2004, pag. 55. (3) GU L 73 del 20.3.2010, pag. 1. (4) GU L 226 del 23.8.2008, pag. 1. (5) GU L 39 del 10.2.2009, pag. 12. (6) GU L 303 del 18.11.2009, pag. 1. (7) GU L 320 del 18.11.2006, pag. 53. (8) Dove: n = numero di campioni da esaminare; m = valore soglia per quanto riguarda il numero dei batteri; il risultato è considerato soddisfacente se tutti i campioni hanno un numero di batteri inferiore o uguale a m; M = valore massimo per quanto riguarda il numero dei batteri; il risultato è considerato insoddisfacente se uno o più campioni hanno un numero di batteri uguale o superiore a M; e c = numero di campioni la cui carica batterica può essere compresa fra m e M; il campione è ancora considerato accettabile se la carica batterica degli altri campioni è uguale o inferiore a m. (9) GU L 147 del 31.5.2001, pag. 1. (10) GU L 172 del 30.6.2007, pag. 84. — Il colore della firma e del timbro dev'essere diverso da quello del testo stampato. — Osservazione per il responsabile della partita nell'Unione europea: il presente certificato è ad uso esclusivamente veterinario e deve accompagnare la partita fino al posto d'ispezione frontaliero dell'Unione europea. Veterinario ufficiale/Ispettore ufficiale Nome e cognome (in stampatello): Titolo e qualifica: Data: Firma: Timbro: CAPO 3(E) Certificato sanitario Per la spedizione/il transito (2) nell'Unione europea di interiora aromatizzanti destinate alla fabbricazione di alimenti per animali da compagnia  Testo di immagine
Testo di immagine
PAESE Certificato veterinario per l'esportazione nell'UE Parte I: informazioni relative alla partita spedita I.1. Speditore Nome Indirizzo Tel. I.2. N. di riferimento del certificato I.2.a. I.3. Autorità centrale competente I.4. Autorità locale competente I.5. Destinatario Nome Indirizzo Codice postale Tel. I.6. Persona responsabile della partita nell'UE Nome Indirizzo Codice postale Tel. I.7. Paese di origine Codice ISO I.8. Regione di origine Codice I.9. Paese di destinazione Codice ISO I.10. Regione di destinazione Codice I.11. Luogo di origine Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo I.12. Luogo di destinazione Deposito doganale Nome N. di riconoscimento Indirizzo Codice postale I.13. Luogo di carico I.14. Data di partenza I.15. Mezzo di trasporto Aereo Nave Vagone ferroviario Veicolo stradale Altro Identificazione Riferimento documentale I.16. PIF di entrata nell'UE I.17. I.18. Descrizione della merce I.19. Codice del prodotto (codice SA) I.20. Quantità I.21. Temperatura del prodotto Ambiente Refrigerato Congelato I.22. Numero di colli I.23. Numero del sigillo/contenitore I.24. Tipo di imballaggio  Testo di immagine
Testo di immagine
I.25. Merce certificata per Alimentazione per animali da compagnia Uso tecnico I.26. Per transito attraverso l'UE verso un paese terzo Paese terzo Codice ISO I.27. Per l'importazione/l'ammissione nell'UE I.28. Identificazione della merce Numero di riconoscimento degli stabilimenti Specie (nome scientifico) Natura della merce Impianto di fabbricazione Peso netto Numero del lotto  Testo di immagine
Testo di immagine
PAESE Interiora aromatizzanti destinate alla fabbricazione di alimenti per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Il sottoscritto, veterinario ufficiale, dichiara di aver preso atto del regolamento (CE) n. 1069/2009 del Parlamento europeo e del Consiglio (1a), in particolare degli articoli 8 e 10, e del regolamento (UE) n. 142/2011 della Commissione (1b), in particolare dell'allegato XIII, capo III, e dell'allegato XIV, capo II, e certifica che le interiora aromatizzanti di cui sopra: II.1. sono costituite da sottoprodotti di origine animale che soddisfano le condizioni sanitarie di seguito indicate; II.2. sono state preparate esclusivamente con i seguenti sottoprodotti di origine animale: (2) [- carcasse e parti di animali macellati oppure, nel caso della selvaggina, corpi o parti di animali uccisi idonei al consumo umano in conformità della normativa dell'Unione, ma non destinati al consumo umano per motivi commerciali;] (2) e/o [- carcasse e parti seguenti derivanti da animali macellati in un macello e ritenuti atti alla macellazione per il consumo umano dopo un'ispezione ante mortem o corpi e parti seguenti di animali da selvaggina uccisi per il consumo umano nel rispetto della normativa dell'Unione: i) carcasse o corpi e parti di animali dichiarati non idonei al consumo umano conformemente alla normativa dell'Unione, ma che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali; ii) teste di pollame; iii) pelli, inclusi ritagli e frammenti, corna e zampe, incluse le falangi e le ossa carpiche e metacarpiche e le ossa tarsiche e metatarsiche; iv) setole di suini; v) piume;] (2) e/o [- sangue di animali che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso il sangue, ottenuto da animali macellati in un macello dopo essere stati considerati atti alla macellazione per il consumo umano in seguito a un'ispezione ante mortem conformemente alla normativa dell'Unione;] (2) e/o [- sottoprodotti di origine animale derivanti dalla fabbricazione di prodotti destinati al consumo umano, compresi i ciccioli, le ossa sgrassate e i fanghi da centrifuga o da separatore risultanti dalla lavorazione del latte; ] (2) e/o [- prodotti di origine animale, o prodotti alimentari contenenti prodotti di origine animale, i quali non sono più destinati al consumo umano per motivi commerciali o a causa di problemi di fabbricazione o difetti di condizionamento o altri difetti che non determinano rischi per la salute pubblica o animale;] (2) e/o [- alimenti per animali da compagnia e mangimi di origine animale o mangimi contenenti sottoprodotti di origine animale o prodotti derivati, non più destinati all'uso nei mangimi per motivi commerciali o a causa di problemi di fabbricazione o difetti di confezionamento o altri difetti che non determinano rischi per la salute pubblica o degli animali;] (2) e/o [- sangue, placenta, lana, piume, peli, corna, frammenti di zoccoli e latte crudo derivanti da animali vivi che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso tali prodotti;] (2) e/o [- animali acquatici e parti di tali animali, eccetto i mammiferi marini, che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali;] (2) e/o [- sottoprodotti di animali acquatici provenienti da stabilimenti o impianti che fabbricano prodotti destinati al consumo umano;] (2) e/o [- i materiali seguenti provenienti da animali che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso tali materiali: i) conchiglie e carapaci di crostacei e molluschi con tessuti molli o carni; Parte II Certificazione  Testo di immagine
Testo di immagine
PAESE Interiora aromatizzanti destinate alla fabbricazione di alimenti per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. ii) i seguenti prodotti derivati da animali terrestri: – sottoprodotti dei centri di incubazione; – uova; – sottoprodotti delle uova, compresi i gusci d'uovo; iii) pulcini di un giorno abbattuti per motivi commerciali;] (2) e/o [- sottoprodotti di origine animale ottenuti da invertebrati acquatici e terrestri diversi dalle specie patogene per l'uomo o per gli animali;] (2) e/o [- animali e loro parti degli ordini Rodentia e Lagomorpha, eccetto i materiali di categoria 1 di cui all'articolo 8, lettera a), punti iii), iv) e v), e di categoria 2 di cui all'articolo 9, lettere da a) a g), del regolamento (CE) n. 1069/2009;] (2) e/o [- materiali ottenuti da animali che sono stati trattati con talune sostanze vietate dalla direttiva 96/22/CE del Consiglio (2b), la cui importazione è consentita in applicazione dell'articolo 35, lettera a), punto ii), del regolamento (CE) n. 1069/2009;] II.3. sono state sottoposte, conformemente all'allegato XIII, capo III, del regolamento (UE) n. 142/2011, ad un procedimento di trasformazione diretto a distruggere gli agenti patogeni; II.4. sono state analizzate sulla base di almeno cinque campioni aleatoriamente prelevati da ciascun lotto trasformato durante o dopo il magazzinaggio nell'impianto di trasformazione e sono conformi alle seguenti condizioni (3): Salmonella: assenza in 25 g: n = 5, c = 0, m = 0, M = 0, Enterobatteriacee: n = 5, c = 2, m = 10, M = 300 in 1 g; II.5. il prodotto finale è stato: (2) [imballato in sacchi nuovi o sterilizzati,] (2) o [trasportato alla rinfusa in contenitori o in altri mezzi di trasporto, accuratamente puliti e sterilizzati con un disinfettante approvato dall'autorità competente prima dell'uso,] e recanti un'etichetta con l'indicazione "NON DESTINATO AL CONSUMO UMANO"; II.6. il prodotto finale è stato immagazzinato in depositi chiusi; II.7. il prodotto è stato trattato con tutte le precauzioni atte ad evitare la contaminazione da parte di agenti patogeni successivamente al trattamento; (2) [II.8. le interiora aromatizzanti di cui sopra (2) [sono ottenute da ruminanti diversi da bovini, ovini o caprini.]] (2) o [sono ottenute da bovini, ovini o caprini e non contengono né sono ottenuti da: (2) [materiali ricavati da bovini, ovini e caprini diversi da quelli derivati da animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]] (2) o [a) materiale specifico a rischio di cui all'allegato V, punto 1, del regolamento (CE) n. 999/2001 del Parlamento europeo e del Consiglio (4); b) carni separate meccanicamente ottenute da ossa di bovini, ovini o caprini, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE della Commissione (5) e in cui non si sono verificati casi indigeni di BSE, c) sottoprodotti di origine animale o prodotti derivati ottenuti da bovini, ovini o caprini che sono stati abbattuti, previo stordimento, mediante lacerazione del tessuto nervoso centrale per mezzo di uno stilo inserito nella cavità cranica, o tramite iniezione di gas nella cavità cranica, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o in una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]]]  Testo di immagine
Testo di immagine
PAESE Interiora aromatizzanti destinate alla fabbricazione di alimenti per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Note Parte I: — Casella I.6.: persona responsabile della partita nell'Unione europea: da compilare soltanto se si tratta di un certificato per merce in transito nell'Unione europea; la casella può essere compilata se il certificato riguarda una merce da importare nell'Unione europea. — Casella I.12.: luogo di destinazione: casella da compilare solo se si tratta di un certificato per merce in transito. i prodotti in transito possono essere immagazzinati unicamente in zone franche, depositi franchi e depositi doganali. — Casella I.15.: numero di immatricolazione (vagoni ferroviari o container e autocarri), numero del volo (aeromobili) o nome (navi); queste informazioni devono essere aggiornate in caso di scarico e nuovo carico nell'Unione europea. — Casella I.19.: utilizzare il codice SA appropriato: 05.04, 05.06, 05.11 o 23.09. — Casella I.23.: nel caso di contenitori per il trasporto di merci alla rinfusa, indicare il numero del contenitore e il numero del sigillo (se pertinente). — Casella I.25.: uso tecnico: qualsiasi uso diverso dall'alimentazione di animali d'allevamento diversi dagli animali da pelliccia e dalla produzione o fabbricazione di alimenti per animali da compagnia. — Caselle I.26. e I.27.: compilare a seconda che si tratti di un certificato di transito o d'importazione. — Casella I.28.: — specie: scegliere fra: Aves, Ruminantia, Suidae, Mammalia diversi da Ruminantia e Suidae, Pesca, Mollusca, Crustacea, invertebrati diversi da Mollusca e Crustacea. — definire le interiora aromatizzanti. Parte II (1a) GU L 300 del 14.11.2009, pag. 1. (1b) GU L 54 del 26.2.2011, pag. 1. (2) Cancellare le voci non pertinenti. (2a) GU L 125 del 23.5.1996, pag. 3. (3) Dove: n = numero di campioni da esaminare; m = valore soglia per quanto riguarda il numero dei batteri; il risultato è considerato soddisfacente se tutti i campioni hanno un numero di batteri inferiore o uguale a m; M = valore massimo per quanto riguarda il numero dei batteri; il risultato è considerato insoddisfacente se uno o più campioni hanno un numero di batteri uguale o superiore a M; e c = numero di campioni la cui carica batterica può essere compresa fra m e M; il campione è ancora considerato accettabile se la carica batterica degli altri campioni è uguale o inferiore a m. (4) GU L 147 del 31.5.2001, pag. 1. (5) GU L 172 del 30.6.2007, pag. 84. — Il colore della firma e del timbro dev'essere diverso da quello del testo stampato. — Osservazione per il responsabile della partita nell'Unione europea: il presente certificato è ad uso esclusivamente veterinario e deve accompagnare la partita fino al posto d'ispezione frontaliero. Veterinario ufficiale/Ispettore ufficiale Nome e cognome (in stampatello): Titolo e qualifica: Data: Firma: Timbro: CAPO 3(F) Certificato sanitario Per la spedizione/il transito (2) nell'Unione europea di sottoprodotti di origine animale (3) destinati alla fabbricazione di alimenti per animali da compagnia  Testo di immagine
Testo di immagine
PAESE Certificato veterinario per l'esportazione nell'UE Parte I: informazioni relative alla partita spedita I.1. Speditore Nome Indirizzo Tel. I.2. N. di riferimento del certificato I.2.a. I.3. Autorità centrale competente I.4. Autorità locale competente I.5. Destinatario Nome Indirizzo Codice postale Tel. I.6. Persona responsabile della partita nell'UE Nome Indirizzo Codice postale Tel. I.7. Paese di origine Codice ISO I.8. Regione di origine Codice I.9. Paese di destinazione Codice ISO I.10. Regione di destinazione Codice I.11. Luogo di origine Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo I.12. Luogo di destinazione Deposito doganale Nome N. di riconoscimento Indirizzo Codice postale I.13. Luogo di carico I.14. Data di partenza I.15. Mezzo di trasporto Aereo Nave Vagone ferroviario Veicolo stradale Altro Identificazione Riferimento documentale I.16. PIF di entrata nell'UE I.17. I.18. Descrizione della merce I.19. Codice del prodotto (codice SA) I.20. Quantità I.21. Temperatura del prodotto Ambiente Refrigerato Congelato I.22. Numero di colli I.23. Numero del sigillo/contenitore I.24. Tipo di imballaggio  Testo di immagine
Testo di immagine
I.25. Merce certificata per Produzione di alimenti per animali da compagnia Trasformazione suppl. Uso tecnico I.26. Per transito attraverso l'UE verso un paese terzo Paese terzo Codice ISO I.27. Per l'importazione/l'ammissione nell'UE I.28. Identificazione della merce Numero di riconoscimento degli stabilimenti Specie (nome scientifico) Natura della merce Impianto di fabbricazione Numero di colli Peso netto Numero del lotto  Testo di immagine
Testo di immagine
PAESE Sottoprodotti di origine animale destinati alla fabbricazione di alimenti per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Il sottoscritto, veterinario ufficiale, dichiara di aver preso atto del regolamento (CE) n. 1069/2009 del Parlamento europeo e del Consiglio (1a) e del regolamento (UE) n. 142/2011 della Commissione (1b), in particolare dell'allegato XIV, capo II, e certifica che i sottoprodotti di origine animale sopra descritti: II.1.1. sono costituiti da sottoprodotti di origine animale che soddisfano le condizioni sanitarie di seguito indicate; II.1.2. sono stati ottenuti nel territorio di: (1c) da animali: (2) [a) rimasti in tale territorio fin dalla nascita o almeno durante gli ultimi tre mesi prima della macellazione o produzione;] (2) o [b) selvatici abbattuti in tale territorio (1d);] (2) o [c) derivati da roditori, lagomorfi, animali acquatici o terrestri o invertebrati acquatici;] II.1.3. sono stati ottenuti o prodotti a partire da animali: (2) [a) provenienti da un'azienda: i) nella quale non vi sono stati casi/focolai delle malattie seguenti alle quali gli animali sono sensibili: peste bovina, malattia vescicolare dei suini, malattia di Newcastle o influenza aviaria ad alta patogenicità durante i 30 giorni precedenti, né casi/epidemie di peste suina classica o africana durante i 40 giorni precedenti; tenendo presente che durante i 30 giorni precedenti non vi devono essere stati casi/focolai neanche nelle aziende situate in un raggio di 10 km attorno all'azienda interessata; e ii) nella quale non vi sono stati casi/focolai di afta epizootica durante i 60 giorni precedenti, tenendo presente che durante i 30 giorni precedenti non vi devono essere stati casi/focolai neanche nelle aziende situate in un raggio di 25 km attorno all'azienda interessata; e b) che: i) non sono stati abbattuti per eradicare una epizoozia; ii) sono rimasti nell'azienda d'origine per almeno 40 giorni prima dell'invio alla macellazione e sono stati trasportati direttamente al macello senza entrare in contatto con altri animali che non soddisfacessero le stesse condizioni sanitarie; iii) nel macello sono stati sottoposti a ispezione sanitaria ante mortem nelle 24 ore precedenti la macellazione, senza che venisse rilevata la presenza delle pertinenti malattie di cui sopra; e iv) nel macello, prima e durante la macellazione o l'abbattimento, sono stati trattati conformemente alle disposizioni pertinenti della normativa dell'Unione e sono state osservate prescrizioni almeno equivalenti a quelle di cui ai capi II e III del regolamento (CE) n. 1099/2009 del Consiglio (4)] (2) o [a) selvatici catturati e abbattuti in una zona: i) nella quale, nel raggio di 25 km, non vi sono stati casi/focolai delle malattie seguenti alle quali gli animali sono sensibili: afta epizootica, peste bovina, malattia di Newcastle o influenza aviaria ad alta patogenicità nei 30 giorni precedenti, né di peste suina classica o peste suina africana nei 40 giorni precedenti; e ii) che dista almeno 20 km da un paese o da una parte del territorio di un paese non autorizzati ad esportare nell'Unione europea materiali derivati da pollame durante i 30 giorni precedenti o materiali derivati da suini durante i 40 giorni precedenti; e b) i quali entro 12 ore dall'abbattimento sono stati trasportati per esservi sottoposti a refrigerazione a un centro di raccolta e immediatamente dopo a uno stabilimento di lavorazione della selvaggina o direttamente a uno stabilimento di lavorazione della selvaggina;] Parte II Certificazione  Testo di immagine
Testo di immagine
PAESE Sottoprodotti di origine animale destinati alla fabbricazione di alimenti per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. II.1.4. sono stati ottenuti in uno stabilimento attorno al quale, in un raggio di 10 km, non vi sono stati casi/epidemie delle pertinenti malattie di cui al punto II.1.3. durante i 30 giorni precedenti oppure, in caso di malattia, la preparazione di materie prime da esportare nell'Unione europea è stata autorizzata soltanto dopo la rimozione di tutta la carne e la pulizia e disinfezione totali dello stabilimento sotto il controllo di un veterinario ufficiale; II.1.5. sono stati ottenuti e preparati senza che siano entrati in contatto con materiali non conformi alle condizioni sopra indicate e sono stati manipolati in modo da evitare la contaminazione da parte di agenti patogeni; II.1.6. sono stati confezionati in imballaggi nuovi a tenuta stagna e in contenitori ufficialmente sigillati recanti la dicitura "MATERIE PRIME DESTINATE UNICAMENTE ALLA FABBRICAZIONE DI ALIMENTI PER ANIMALI DA COMPAGNIA" e il nome e l'indirizzo dello stabilimento di destinazione nell'Unione europea; II.1.7. sono costituiti solo dai seguenti sottoprodotti di origine animale: (2) [- carcasse e parti di animali macellati oppure, nel caso della selvaggina, corpi o parti di animali uccisi dichiarati idonei al consumo umano in conformità della normativa dell'Unione finché non sono stati irreversibilmente dichiarati sottoprodotti di origine animale per motivi commerciali;] (2) e/o [- carcasse e parti seguenti derivanti da animali macellati in un macello e ritenuti atti alla macellazione per il consumo umano dopo un'ispezione ante mortem o corpi e parti seguenti di animali da selvaggina uccisi per il consumo umano nel rispetto della normativa dell'Unione: i) carcasse o corpi e parti di animali dichiarati non idonei al consumo umano conformemente alla normativa dell'Unione, ma che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali; ii) teste di pollame; iii) pelli, inclusi ritagli e frammenti, corna e zampe, incluse le falangi e le ossa carpiche e metacarpiche e le ossa tarsiche e metatarsiche; iv) setole di suini; v) piume;] (2) e/o [- sottoprodotti di origine animale derivanti dalla fabbricazione di prodotti destinati al consumo umano, compresi i ciccioli, le ossa sgrassate e i fanghi da centrifuga o da separatore risultanti dalla lavorazione del latte;] (2) e/o [- prodotti di origine animale, o prodotti alimentari contenenti prodotti di origine animale, i quali non sono più destinati al consumo umano per motivi commerciali o a causa di problemi di fabbricazione o difetti di condizionamento o altri difetti che non determinano rischi per la salute pubblica o animale;] (2) e/o [- animali acquatici e parti di tali animali, eccetto i mammiferi marini, che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali;] (2) e/o [- sottoprodotti di animali acquatici provenienti da stabilimenti o impianti che fabbricano prodotti destinati al consumo umano;] (2) e/o [- i materiali seguenti provenienti da animali che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso tali materiali: i) conchiglie e carapaci di crostacei e molluschi con tessuti molli o carni; ii) i seguenti prodotti derivati da animali terrestri: — sottoprodotti dei centri di incubazione; — uova; — sottoprodotti delle uova, compresi i gusci d'uovo;  Testo di immagine
Testo di immagine
PAESE Sottoprodotti di origine animale destinati alla fabbricazione di alimenti per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. iii) pulcini di un giorno abbattuti per motivi commerciali;] (2) e/o [- sottoprodotti di origine animale ottenuti da invertebrati acquatici e terrestri diversi dalle specie patogene per l'uomo o per gli animali;] (2) e/o [- animali e loro parti degli ordini Rodentia e Lagomorpha, eccetto i materiali di categoria 1 di cui all'articolo 8, lettera a), punti iii), iv) e v), e di categoria 2 di cui all'articolo 9, lettere da a) a g), del regolamento (CE) n. 1069/2009;] (2) e/o [- materiali ottenuti da animali che sono stati trattati con talune sostanze vietate dalla direttiva 96/22/CE del Consiglio (4a), la cui importazione è consentita in applicazione dell'articolo 35, lettera a), punto ii), del regolamento (CE) n. 1069/2009;] II.1.8. sono stati surgelati nell'impianto d'origine o sono stati conservati conformemente alla normativa dell'Unione europea in una maniera che ne impedisca il deterioramento tra la spedizione e la consegna all'impianto di destinazione nell'Unione europea o durante il transito nell'UE; II.1.9. nel caso in cui si tratti di materie prime per la produzione di alimenti per animali da compagnia derivate da animali trattati con talune sostanze vietate dalla direttiva 96/22/CE, la cui importazione è però consentita in conformità dell'articolo 35, lettera a), punto ii), del regolamento (CE) n. 1069/2009: a) sono state contrassegnate nel paese terzo, prima di entrare nel territorio dell'Unione europea, mediante una croce di carbone liquefatto o di carbone attivo apposta su ogni lato esterno di ciascun blocco congelato oppure, se le materie prime sono trasportate in pallet non divisi in singole partite durante il trasporto all'impianto di produzione di mangimi per animali da compagnia di destinazione nell'Unione europea o durante il transito nell'UE, su ogni lato esterno di ciascun pallet, in modo che la marcatura copra almeno il 70 % della lunghezza diagonale del lato del blocco congelato e sia larga almeno 10 cm; b) se si tratta di materie prime non congelate, esse sono state contrassegnate nel paese terzo, prima di entrare nel territorio dell'Unione europea, mediante applicazione di carbone liquefatto o in polvere in modo che il carbone sia chiaramente visibile sul materiale; e c) ove i sottoprodotti di origine animale siano costituiti da materie prime trattate nel modo sopra indicato e da altre materie prime non trattate, tutte le materie prime sono state contrassegnate secondo quanto previsto dalle precedenti lettere a) e b). (2) (5) [II.2. Prescrizioni specifiche (2) (6) [II.2.1. I sottoprodotti di origine animale che costituiscono la presente partita provengono da animali che sono stati tenuti nel territorio indicato al punto (II.1.2), nel quale i bovini domestici sono regolarmente sottoposti a programmi di vaccinazione contro l'afta epizootica ufficialmente controllati.] (2) (7) [II.2.2. I sottoprodotti di origine animale della presente partita sono ottenuti soltanto da frattaglie rifilate di ruminanti domestici, maturate ad una temperatura ambiente superiore a + 2 °C per almeno tre ore o, nel caso di muscoli masseteri di bovini e di carni disossate di animali domestici, per almeno 24 ore.]] (2) [II.3. i sottoprodotti di origine animale per la produzione di alimenti per animali da compagnia contengono o sono ottenuti da sottoprodotti di origine animale ricavati da ruminanti e: (2) [provengono da un paese o da una regione classificati come aventi un rischio trascurabile di BSE conformemente alla decisione 2007/453/CE e nei quali non si siano verificati casi indigeni di BSE, e]] (2) o [provengono da un paese o da una regione classificati come aventi un rischio trascurabile di BSE conformemente alla decisione 2007/453/CE e nei quali si è verificato un caso indigeno di BSE, e i sottoprodotti di origine animale o i prodotti derivati sono stati ottenuti da animali nati dopo la data in cui il divieto di somministrazione ai ruminanti di farine di carne e ossa e ciccioli, quali definiti nel codice sanitario per gli animali terrestri dell'OIE, ottenuti da ruminanti è stato effettivamente applicato nel paese o nella regione, e]] (2) [sono ottenuti da ruminanti diversi da bovini, ovini o caprini.]  Testo di immagine
Testo di immagine
PAESE Sottoprodotti di origine animale destinati alla fabbricazione di alimenti per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) o [sono ottenuti da bovini, ovini o caprini e non contengono né sono ottenuti da: (2) [materiali ricavati da bovini, ovini e caprini diversi da quelli derivati da animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]]] (2) o [a) materiale specifico a rischio di cui all'allegato V, punto 1, del regolamento (CE) n. 999/2001 del Parlamento europeo e del Consiglio (8); b) carni separate meccanicamente ottenute da ossa di bovini, ovini o caprini, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE della Commissione (9) e in cui non si sono verificati casi indigeni di BSE, c) sottoprodotti di origine animale o prodotti derivati ottenuti da bovini, ovini o caprini che sono stati abbattuti, previo stordimento, mediante lacerazione del tessuto nervoso centrale per mezzo di uno stilo inserito nella cavità cranica, o tramite iniezione di gas nella cavità cranica, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o in una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]]]] Note Parte I: — Casella I.6.: persona responsabile della partita nell'Unione europea: da compilare soltanto se si tratta di un certificato per merce in transito; la casella può essere compilata se il certificato riguarda una merce da importare nell'Unione europea. — Casella I.12.: luogo di destinazione: da compilare soltanto se si tratta di un certificato per merce in transito; i prodotti in transito possono essere immagazzinati unicamente in zone franche, depositi franchi e depositi doganali. — Casella I.15.: numero di immatricolazione (vagoni ferroviari o container e autocarri), numero del volo (aeromobili) o nome (navi); queste informazioni devono essere aggiornate in caso di scarico e nuovo carico nell'Unione europea. — Casella I.19.: utilizzare il codice SA appropriato: 05.04, 05.06, 05.07, 05.11.91 o 05.11.99, 23.01, 41.01. — Casella I.23.: nel caso di contenitori per il trasporto di merci alla rinfusa, indicare il numero del contenitore e il numero del sigillo (se pertinente). — Casella I.25.: uso tecnico: qualsiasi uso diverso dall'alimentazione di animali d'allevamento diversi dagli animali da pelliccia e dalla produzione o fabbricazione di alimenti per animali da compagnia. — Caselle I.26. e I.27.: compilare a seconda che si tratti di un certificato di transito o d'importazione. — Casella I.28.: — specie: scegliere fra: Aves, Ruminantia, Suidae, Mammalia diversi da Ruminantia e Suidae, Pesca, Mollusca, Crustacea, invertebrati diversi da Mollusca e Crustacea; — impianto di fabbricazione: indicare il numero di controllo veterinario dello stabilimento riconosciuto. Parte II: (1a) GU L 300 del 14.11.2009, pag. 1. (1b) GU L 54 del 26.2.2011, pag. 1.  Testo di immagine
Testo di immagine
PAESE Sottoprodotti di origine animale destinati alla fabbricazione di alimenti per animali da compagnia II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (1c) Il nome e il codice ISO del paese esportatore indicati: — all'allegato II, parte 1 del regolamento (UE) n. 206/2010; — all'allegato I, parte 1, del regolamento (CE) n. 798/2008, e — all'allegato I, parte 1, del regolamento (CE) n. 119/2009. Va inoltre inserito il codice ISO di regionalizzazione di cui agli allegati succitati (se pertinente e per le specie interessate). (1d) Riguarda solo i paesi in provenienza dai quali è autorizzata l'importazione nell'Unione europea di carni di selvaggina delle stesse specie animali destinate al consumo umano. (2) Cancellare le voci non pertinenti. (3) Esclusi sangue greggio, latte crudo, pelli, zoccoli, corna, setole di suini e piume (per l'importazione di questi prodotti si vedano i pertinenti certificati specifici nell'allegato). (4) GU L 303 del 18.11.2009, pag. 1. (4a) GU L 125 del 23.5.1996, pag. 3. (5) Garanzie supplementari da fornire quando il materiale di ruminanti domestici proviene dal territorio di un paese o di una parte di un paese sudamericano o sudafricano a partire dal quale possono essere esportate nell'Unione europea soltanto le carni fresche maturate e disossate di ruminanti domestici destinate al consumo umano. Sono inoltre permessi i muscoli masseteri di bovini, incisi conformemente all'allegato I, sezione IV, capo 1, parte B 1, del regolamento (CE) n. 854/2004 del Parlamento europeo e del Consiglio (GU L 139 del 30.4.2004, pag. 206). (6) Soltanto per certi paesi sudamericani. (7) Soltanto per certi paesi sudamericani e sudafricani. (8) GU L 147 del 31.5.2001, pag. 1. (9) GU L 172 del 30.6.2007, pag. 84. — Il colore della firma e del timbro dev'essere diverso da quello del testo stampato. — Osservazione per il responsabile della partita nell'Unione europea: il presente certificato è ad uso esclusivamente veterinario e deve accompagnare la partita fino al posto d'ispezione frontaliero dell'Unione europea. Veterinario ufficiale/Ispettore ufficiale Nome e cognome (in stampatello): Titolo e qualifica: Data: Firma: Timbro: |
|
2) |
i capi da 4(B) a 4(D) sono sostituiti dai seguenti: «CAPO 4(B) Certificato sanitario Per la spedizione o il transito (2) nell'Unione europea di prodotti sanguigni non destinati al consumo umano che potrebbero essere utilizzati come materie prime per mangimi  Testo di immagine
Testo di immagine
PAESE Certificato veterinario per l'esportazione nell'UE Parte I: informazioni relative alla partita spedita I.1. Speditore Nome Indirizzo Tel. I.2. N. di riferimento del certificato I.2.a. I.3. Autorità centrale competente I.4. Autorità locale competente I.5. Destinatario Nome Indirizzo Codice postale Tel. I.6. Persona responsabile della partita nell'UE Nome Indirizzo Codice postale Tel. I.7. Paese di origine Codice ISO I.8. Regione di origine Codice I.9. Paese di destinazione Codice ISO I.10. Regione di destinazione Codice I.11. Luogo di origine Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo I.12. Luogo di destinazione Deposito doganale Nome N. di riconoscimento Indirizzo Codice postale I.13. Luogo di carico I.14. Data di partenza I.15. Mezzo di trasporto Aereo Nave Vagone ferroviario Veicolo stradale Altro Identificazione Riferimento documentale I.16. PIF di entrata nell'UE I.17. I.18. Descrizione della merce I.19. Codice del prodotto (codice SA) I.20. Quantità I.21. Temperatura del prodotto Ambiente Refrigerato Congelato I.22. Numero di colli I.23. Numero del sigillo/contenitore I.24. Tipo di imballaggio 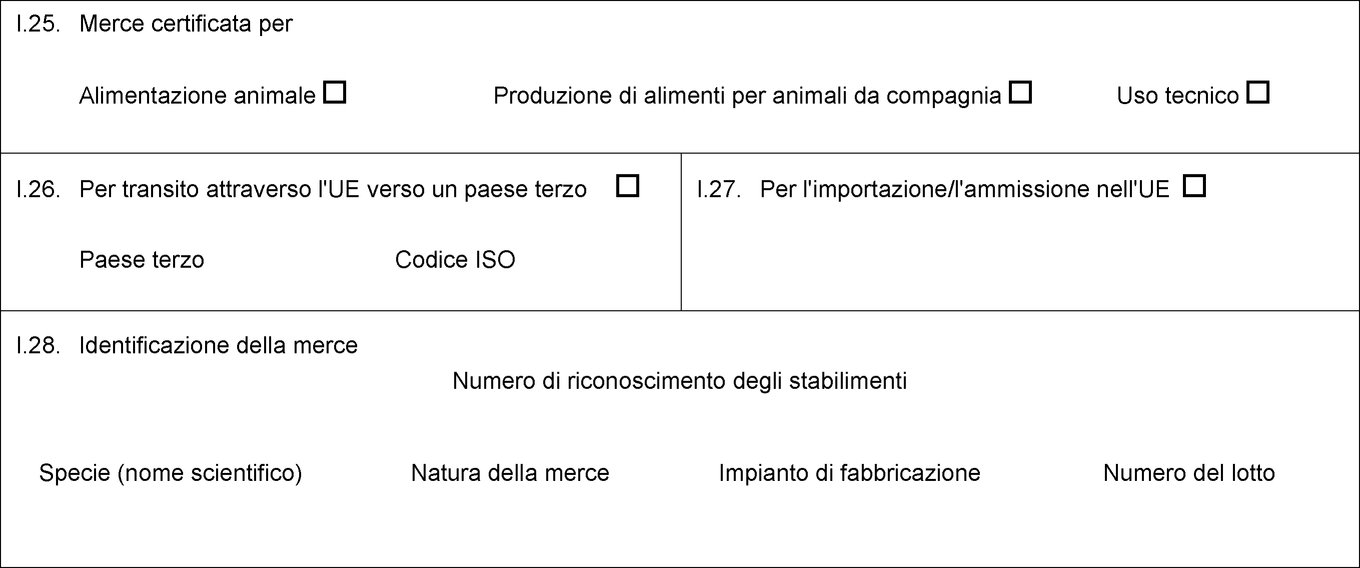 Testo di immagine
Testo di immagine
I.25. Merce certificata per Alimentazione animale Produzione di alimenti per animali da compagnia Uso tecnico I.26. Per transito attraverso l'UE verso un paese terzo Paese terzo Codice ISO I.27. Per l'importazione/l'ammissione nell'UE I.28. Identificazione della merce Numero di riconoscimento degli stabilimenti Specie (nome scientifico) Natura della merce Impianto di fabbricazione Numero del lotto  Testo di immagine
Testo di immagine
PAESE Prodotti sanguigni non destinati al consumo umano che potrebbero essere utilizzati come materie prime per mangimi II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Il sottoscritto, veterinario ufficiale, dichiara di aver preso atto del regolamento (CE) n. 1069/2009 del Parlamento europeo e del Consiglio (1a) e del regolamento (UE) n. 142/2011 della Commissione (1b) e certifica che i prodotti sanguigni di cui sopra: II.1. soddisfano le prescrizioni sanitarie di seguito indicate; II.2. sono esclusivamente prodotti sanguigni non destinati al consumo umano; II.3. sono stati preparati e immagazzinati in un impianto riconosciuto e controllato dall'autorità competente in conformità dell'articolo 24 del regolamento (CE) n. 1069/2009; II.4. sono stati preparati esclusivamente con i seguenti sottoprodotti di origine animale: (2) [sangue di animali macellati, idoneo al consumo umano in conformità della normativa dell'Unione europea, ma non destinato al consumo umano per motivi commerciali;] (2) e/o [sangue di animali macellati, dichiarato non idoneo al consumo umano in conformità della normativa dell'Unione, ma che non presentava segni di malattie trasmissibili all'uomo o agli animali e proveniente da carcasse di animali macellati in un macello considerati idonei al consumo umano in seguito a un'ispezione ante mortem conformemente alla normativa dell'Unione;] II.5. allo scopo di inattivare gli agenti patogeni, sono stati sottoposti (2) [al metodo di trasformazione (3) di cui all'allegato IV, capo III, del regolamento (UE) n. 142/2011;] (2) o [ad un metodo e a parametri che garantiscano la conformità del prodotto alle norme microbiologiche fissate nell'allegato X, capo I, del regolamento (UE) n. 142/2011;] (2) o [in caso di prodotti sanguigni, compresi sangue e plasma sanguigno di origine suina essiccati a spruzzo, destinati all'alimentazione di animali della specie suina, ad un trattamento termico a una temperatura minima di 80 °C in tutte le loro parti e il sangue e il plasma sanguigno essiccati presentano un tenore di umidità non superiore all'8 % con un'attività dell'acqua (aw) inferiore a 0,60.] II.6. il prodotto finale è stato: (2) [imballato in sacchi nuovi o sterilizzati;] (2) o [trasportato alla rinfusa in contenitori o in altri mezzi di trasporto, accuratamente puliti e sterilizzati con un disinfettante approvato dall'autorità competente prima dell'uso,] e recanti un'etichetta con l'indicazione "NON DESTINATO AL CONSUMO UMANO"; II.7. il prodotto finale è stato immagazzinato in depositi chiusi; II.8. il prodotto è stato trattato con tutte le precauzioni atte ad evitare la contaminazione da parte di agenti patogeni successivamente al trattamento; (2) e [in caso di prodotti sanguigni, compresi sangue e plasma sanguigno di origine suina essiccati a spruzzo destinati all'alimentazione di animali della specie suina, è stato immagazzinato in un luogo asciutto a temperatura ambiente per almeno 6 settimane.] II.9. sono stati esaminati prima della spedizione dall'autorità competente, con il prelievo durante o al termine del magazzinaggio di un campione aleatorio, che è risultato conforme alle seguenti condizioni (4): Salmonella: assenza in 25 g: n = 5, c = 0, m = 0, M = 0, Enterobatteriacee: n = 5, c = 2, m = 10, M = 300 in 1 grammo; Parte II Certificazione  Testo di immagine
Testo di immagine
PAESE Prodotti sanguigni non destinati al consumo umano che potrebbero essere utilizzati come materie prime per mangimi II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) [II.10. i prodotti sanguigni di cui sopra (2) [sono ottenuti da ruminanti diversi da bovini, ovini o caprini.]] (2) o [sono ottenuti da bovini, ovini o caprini e non contengono né sono ottenuti da: (2) [materiali ricavati da bovini, ovini e caprini diversi da quelli derivati da animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]] (2) o [a) materiale specifico a rischio di cui all'allegato V, punto 1, del regolamento (CE) n. 999/2001 del Parlamento europeo e del Consiglio (5); b) carni separate meccanicamente ottenute da ossa di bovini, ovini o caprini, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE della Commissione (6) e in cui non si sono verificati casi indigeni di BSE, c) sottoprodotti di origine animale o prodotti derivati ottenuti da bovini, ovini o caprini che sono stati abbattuti, previo stordimento, mediante lacerazione del tessuto nervoso centrale per mezzo di uno stilo inserito nella cavità cranica, o tramite iniezione di gas nella cavità cranica, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o in una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]]] II.11. i prodotti sanguigni di cui sopra: (2) [non contengono latte o prodotti a base di latte di origine ovina o caprina o non sono destinati all'alimentazione degli animali d'allevamento diversi dagli animali da pelliccia.] (2) o [contengono latte o prodotti a base di latte di origine ovina o caprina e sono destinati all'alimentazione degli animali d'allevamento diversi dagli animali da pelliccia, che: a) sono ottenuti da ovini e caprini che sono rimasti continuativamente dalla nascita in un paese in cui sono soddisfatte le seguenti condizioni: i) la scrapie classica è soggetta a obbligo di notifica; ii) esiste un sistema di sensibilizzazione, sorveglianza e monitoraggio per la scrapie classica; iii) alle aziende di ovini o caprini si applicano restrizioni ufficiali in presenza di un sospetto di TSE o della conferma della scrapie classica; iv) gli ovini e i caprini colpiti da scrapie classica sono abbattuti e distrutti; v) la somministrazione agli ovini e ai caprini di farine di carne e ossa o di ciccioli, quali definiti nel codice sanitario per gli animali terrestri dell'organizzazione mondiale per la salute animale (OIE), ricavati da ruminanti è vietata e il divieto è effettivamente applicato in tutto il paese da almeno sette anni; b) provengono da aziende che non sono soggette ad alcuna restrizione ufficiale a causa di un sospetto di TSE; c) provengono da aziende nelle quali, da almeno sette anni, non viene diagnosticato alcun caso di scrapie classica o nelle quali, a seguito della conferma di un caso di scrapie classica:  Testo di immagine
Testo di immagine
PAESE Prodotti sanguigni non destinati al consumo umano che potrebbero essere utilizzati come materie prime per mangimi II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) [tutti gli ovini e i caprini dell'azienda sono stati abbattuti e distrutti o macellati, fatta eccezione per i montoni da riproduzione del genotipo ARR/ARR, per le pecore da riproduzione portatrici di almeno un allele ARR e nessun allele VRQ e per gli altri ovini portatori di almeno un allele ARR;] (2) o [tutti gli animali nei quali la scrapie classica è stata confermata sono stati abbattuti e distrutti e l'azienda è stata sottoposta per almeno due anni dalla data di conferma dell'ultimo caso di scrapie classica a una sorveglianza intensificata delle TSE, compresa l'esecuzione di un test con esito negativo per individuare la presenza di TSE conformemente ai metodi di laboratorio di cui dell'allegato X, capitolo C, punto 3.2, del regolamento (CE) n. 999/2001 su tutti i seguenti animali di età superiore ai 18 mesi, esclusi gli ovini del genotipo ARR/ARR: — animali macellati per il consumo umano; e — animali morti o abbattuti nell'azienda, ma non abbattuti nel quadro di una campagna di eradicazione della malattia.]] II.12. i prodotti sanguigni sopra descritti contengono o sono ottenuti da sottoprodotti di origine animale ricavati da non ruminanti e, conformemente alla dichiarazione dello speditore di cui alla casella I.1, (2) [non sono destinati alla produzione di mangimi per animali d'allevamento diversi dagli animali da pelliccia.] (2) (7) o [sono destinati alla produzione di mangimi per animali d'allevamento non ruminanti diversi dagli animali da pelliccia e lo speditore si impegna a garantire che al posto d'ispezione frontaliero di entrata saranno forniti i risultati delle analisi effettuate conformemente ai metodi di cui all'allegato VI del regolamento (CE) n. 152/2009 della Commissione (8).] Note Parte I: — Casella I.6.: persona responsabile della partita nell'Unione europea: da compilare soltanto se si tratta di un certificato per merce in transito nell'Unione europea; la casella può essere compilata se il certificato riguarda una merce da importare nell'Unione europea. — Casella I.12.: luogo di destinazione: da compilare soltanto se si tratta di un certificato per merce in transito; i prodotti in transito possono essere immagazzinati unicamente in zone franche, depositi franchi e depositi doganali. — Casella I.15.: numero di immatricolazione (vagoni ferroviari o container e autocarri), numero del volo (aeromobili) o nome (navi); queste informazioni debbono essere aggiornate in caso di scarico e nuovo carico nell'Unione europea. — Casella I.19.: utilizzare il codice SA appropriato: 05.11.91, 05.11.99, 35.02 o 35.04. — Casella I.23.: nel caso di contenitori per il trasporto di merci alla rinfusa, indicare il numero del contenitore e il numero del sigillo (se pertinente). — Casella I.25.: uso tecnico: qualsiasi uso diverso dall'alimentazione di animali d'allevamento diversi dagli animali da pelliccia e dalla produzione o fabbricazione di alimenti per animali da compagnia. — Caselle I.26. e I.27.: compilare a seconda che si tratti di un certificato di transito o d'importazione. — Casella I.28.: specie: scegliere fra: Aves, Ruminantia, Suidae, Mammalia diversi da Ruminantia o Suidae, Pesca, Reptilia.  Testo di immagine
Testo di immagine
PAESE Prodotti sanguigni non destinati al consumo umano che potrebbero essere utilizzati come materie prime per mangimi II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Parte II (1a) GU L 300 del 14.11.2009, pag. 1. (1b) GU L 54 del 26.2.2011, pag. 1. (2) Cancellare le voci non pertinenti. (3) Indicare, a seconda del caso, un metodo da 1 a 5 o il metodo 7. (4) Dove: n = numero di campioni da esaminare; m = valore soglia per quanto riguarda il numero dei batteri; il risultato è considerato soddisfacente se tutti i campioni hanno un numero di batteri inferiore o uguale a m; M = valore massimo per quanto riguarda il numero dei batteri; il risultato è considerato insoddisfacente se uno o più campioni hanno un numero di batteri uguale o superiore a M; e c = numero di campioni la cui carica batterica può essere compresa fra m e M; il campione è ancora considerato accettabile se la carica batterica degli altri campioni è uguale o inferiore a m. (5) GU L 147 del 31.5.2001, pag. 1. (6) GU L 172 del 30.6.2007, pag. 84. (7) La persona responsabile della partita di cui alla casella I.6. deve garantire che, se i prodotti sanguigni descritti nel presente certificato sanitario sono destinati alla produzione di mangimi per animali d'allevamento non ruminanti diversi dagli animali da pelliccia, la partita deve essere analizzata secondo i metodi di cui all'allegato VI del regolamento (CE) n. 152/2009, al fine di verificare l'assenza di costituenti di origine animale non autorizzati. Le informazioni sui risultati di tali analisi devono essere allegate al presente certificato sanitario al momento della presentazione della partita presso un posto d'ispezione frontaliero dell'Unione europea. (8) GU L 54 del 26.2.2009, pag. 1. — Il colore della firma e del timbro dev'essere diverso da quello del testo stampato. — Osservazione per il responsabile della partita nell'Unione europea: il presente certificato è ad uso esclusivamente veterinario e deve accompagnare la partita fino al posto d'ispezione frontaliero del punto d'ingresso nell'Unione europea. Veterinario ufficiale/Ispettore ufficiale Nome e cognome (in stampatello): Titolo e qualifica: Data: Firma: Timbro: CAPO 4(C) Certificato sanitario Per la spedizione o il transito (2) nell'Unione europea di prodotti sanguigni non trattati, esclusi quelli derivati da equidi, destinati alla fabbricazione di prodotti derivati per usi esterni alla catena degli alimenti per animali d'allevamento  Testo di immagine
Testo di immagine
PAESE Certificato veterinario per l'esportazione nell'UE Parte I: informazioni relative alla partita spedita I.1. Speditore Nome Indirizzo Tel. I.2. N. di riferimento del certificato I.2.a. I.3. Autorità centrale competente I.4. Autorità locale competente I.5. Destinatario Nome Indirizzo Codice postale Tel. I.6. Persona responsabile della partita nell'UE Nome Indirizzo Codice postale Tel. I.7. Paese di origine Codice ISO I.8. Regione di origine Codice I.9. Paese di destinazione Codice ISO I.10. Regione di destinazione Codice I.11. Luogo di origine Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo I.12. Luogo di destinazione Deposito doganale Nome N. di riconoscimento Indirizzo Codice postale I.13. Luogo di carico I.14. Data di partenza I.15. Mezzo di trasporto Aereo Nave Vagone ferroviario Veicolo stradale Altro Identificazione Riferimento documentale I.16. PIF di entrata nell'UE I.17. I.18. Descrizione della merce I.19. Codice del prodotto (codice SA) I.20. Quantità I.21. Temperatura del prodotto Ambiente Refrigerato Congelato I.22. Numero di colli I.23. Numero del sigillo/contenitore I.24. Tipo di imballaggio  Testo di immagine
Testo di immagine
I.25. Merce certificata per Uso tecnico I.26. Per transito attraverso l'UE verso un paese terzo Paese terzo Codice ISO I.27. Per l'importazione/l'ammissione nell'UE I.28. Identificazione della merce Numero di riconoscimento degli stabilimenti Specie (nome scientifico) Impianto di fabbricazione Numero del lotto  Testo di immagine
Testo di immagine
PAESE Prodotti sanguigni non trattati, esclusi quelli derivati da equidi, destinati alla fabbricazione di prodotti derivati per usi esterni alla catena degli alimenti per animali d'allevamento II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Il sottoscritto, veterinario ufficiale, dichiara di aver preso atto del regolamento (CE) n. 1069/2009 del Parlamento europeo e del Consiglio (1a), in particolare dell'articolo 8, lettere c) e d), e dell'articolo 10, nonché del regolamento (UE) n. 142/2011 della Commissione (1b), in particolare dell'allegato XIV, capo II, e certifica che: II.1. i prodotti sanguigni sopraindicati sono costituiti da prodotti sanguigni che soddisfano le condizioni sanitarie di seguito indicate; II.2. sono costituiti esclusivamente da prodotti sanguigni non destinati al consumo umano o animale; II.3. sono stati preparati e immagazzinati in un impianto controllato dall'autorità competente o nello stabilimento di prelievo, esclusivamente con i seguenti sottoprodotti di origine animale: (2) [- sangue di animali macellati idoneo al consumo umano in conformità della normativa dell'Unione europea, ma non destinato al consumo umano per motivi commerciali;] (2) e/o [- sangue di animali macellati dichiarato non idoneo al consumo umano in conformità della normativa dell'Unione, ma che non presentava segni di malattie trasmissibili all'uomo o agli animali, proveniente da carcasse di animali macellati in un macello e considerati idonei al consumo umano in seguito a un'ispezione ante mortem conformemente alla normativa dell'Unione;] (2) e/o [- sangue di animali macellati che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali, ottenuto da animali macellati in un macello dopo essere stati considerati idonei al consumo umano in seguito a un'ispezione ante mortem conformemente alla normativa dell'Unione;] (2) e/o [- sangue e prodotti sanguigni ottenuti dalla fabbricazione di prodotti destinati al consumo umano;] (2) e/o [- sangue e prodotti sanguigni provenienti da animali vivi che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso tali prodotti;] (2) e/o [- sottoprodotti di origine animale ottenuti da animali che sono stati sottoposti a trattamenti illeciti ai sensi dell'articolo 1, paragrafo 2, lettera d), della direttiva 96/22/CE del Consiglio (2a) o dell'articolo 2, lettera b), della direttiva 96/23/CE del Consiglio (2b);] (2) e/o [- sottoprodotti di origine animale contenenti residui di altre sostanze e di agenti contaminanti per l'ambiente elencati nell'allegato I, categoria B, punto 3, della direttiva 96/23/CE, se tali residui superano il livello consentito dalla normativa dell'Unione o, in assenza di tale normativa, dalla normativa nazionale;] II.4. il sangue con cui tali prodotti sono stati fabbricati è stato prelevato in macelli riconosciuti in conformità della normativa dell'Unione, in macelli riconosciuti e controllati dall'autorità competente del paese del prelievo o da animali vivi in impianti riconosciuti e controllati dall'autorità competente del paese del prelievo; (2) [II.5. nel caso di prodotti sanguigni ottenuti da animali appartenenti agli ordini Artiodactyla, Perissodactyla e Proboscidea, o da incroci tra le specie di tali taxa, il sangue è stato raccolto in un paese o una regione in cui non si registrano casi di peste bovina, peste dei piccoli ruminanti e febbre della Valle del Rift da almeno 12 mesi e in cui non vengono effettuate vaccinazioni contro tali malattie da almeno 12 mesi; e (2) [in paesi terzi, loro territori o parti [inserire il codice ISO per il paese o codici (3) per i territori o loro parti] in cui non vengono registrati casi di afta epizootica da almeno 12 mesi e in cui non vengono effettuate vaccinazioni contro tale malattia da almeno 12 mesi, e] (2) o [in paesi terzi, loro territori o parti [inserire il codice ISO per il paese o codici (3) per i territori o loro parti] in cui non vengono registrati casi di afta epizootica da almeno 12 mesi e in cui i ruminanti domestici sono vengono sottoposti a programmi di vaccinazione contro tale malattia ufficialmente controllati da almeno 12 mesi (4), e]] Parte II Certificazione  Testo di immagine
Testo di immagine
PAESE Prodotti sanguigni non trattati, esclusi quelli derivati da equidi, destinati alla fabbricazione di prodotti derivati per usi esterni alla catena degli alimenti per animali d'allevamento II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) [II.5.1. nel caso di animali non appartenenti né alla famiglia Suidae né alla famiglia Tayassuidae, in paesi terzi o regioni in cui: (2) [non vengono registrati casi di stomatite vescicolare o di febbre catarrale degli ovini (2) (compresa la presenza di animali sieropositivi) da almeno 12 mesi e non vengono effettuate vaccinazioni contro tali malattie da almeno 12 mesi;] (2) o [sono presenti (4) animali sieropositivi per la stomatite vescicolare e la febbre catarrale degli ovini (2);]] (2) [II.5.2. nel caso di Suidae e Tayassuidae, in paesi terzi o regioni in cui non vengono registrati casi di malattia vescicolare dei suini, peste suina classica e peste suina africana da almeno 12 mesi e non vengono effettuate vaccinazioni contro tali malattie da almeno 12 mesi nelle specie suscettibili di contrarre tali malattie e: (2) [non vengono registrati casi di stomatite vescicolare (compresa la presenza di animali sieropositivi) da almeno 12 mesi e non vengono effettuate vaccinazioni contro tale malattia da almeno 12 mesi;]] (2) o [sono presenti (4) animali sieropositivi per la stomatite vescicolare;]]] (2) [II.6. nel caso di prodotti sanguigni derivati da pollame o altre specie aviarie, gli animali e i prodotti provengono dal territorio del paese o della regione con il codice (5) indenne dalla malattia di Newcastle e dall'influenza aviaria ad alta patogenicità, secondo la definizione del Codice sanitario per gli animali terrestri dell'OIE, in cui non vengono effettuate vaccinazioni contro l'influenza aviaria da almeno 12 mesi, in cui gli animali da cui i prodotti sono stati ottenuti non sono stati vaccinati contro la malattia di Newcastle con vaccini ottenuti da un ceppo madre del virus della malattia di Newcastle che presenta una patogenicità superiore rispetto ai ceppi lentogeni dello stesso virus;] II.7. i prodotti sono stati: (2) [imballati in bottiglie o sacchi nuovi o sterilizzati,] (2) o [trasportati alla rinfusa in contenitori o in altri mezzi di trasporto, accuratamente puliti e sterilizzati con un disinfettante approvato dall'autorità competente prima dell'uso,] l'imballaggio esterno o i contenitori recano un'etichetta con la dicitura "NON DESTINATO AL CONSUMO UMANO O ANIMALE"; II.8. i prodotti sono stati immagazzinati in depositi chiusi; II.9. sono state prese tutte le precauzioni necessarie per evitare la contaminazione dei prodotti con agenti patogeni durante il trasporto; (2) [II.10. i prodotti sanguigni non trattati di cui sopra (2) [sono ottenuti da ruminanti diversi da bovini, ovini o caprini.]] (2) o [sono ottenuti da bovini, ovini o caprini e non contengono né sono ottenuti da: (2) [materiali ricavati da bovini, ovini e caprini diversi da quelli derivati da animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]] (2) o [a) materiale specifico a rischio di cui all'allegato V, punto 1, del regolamento (CE) n. 999/2001 del Parlamento europeo e del Consiglio (6); b) carni separate meccanicamente ottenute da ossa di bovini, ovini o caprini, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE della Commissione (7) e in cui non si sono verificati casi indigeni di BSE,  Testo di immagine
Testo di immagine
PAESE Prodotti sanguigni non trattati, esclusi quelli derivati da equidi, destinati alla fabbricazione di prodotti derivati per usi esterni alla catena degli alimenti per animali d'allevamento II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. c) sottoprodotti di origine animale o prodotti derivati ottenuti da bovini, ovini o caprini che sono stati abbattuti, previo stordimento, mediante lacerazione del tessuto nervoso centrale per mezzo di uno stilo inserito nella cavità cranica, o tramite iniezione di gas nella cavità cranica, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o in una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]]] Note Parte I: — Casella I.6.: persona responsabile della partita nell'Unione europea: da compilare soltanto se si tratta di un certificato per merce in transito nell'Unione europea; la casella può essere compilata se il certificato riguarda una merce da importare nell'Unione europea. — Caselle I.11. e I.12.: numero di riconoscimento: numero di registrazione dello stabilimento o dell'impianto, assegnato dall'autorità competente. — Casella I.12.: luogo di destinazione: da compilare soltanto se si tratta di un certificato per merce in transito; i prodotti in transito possono essere immagazzinati unicamente in zone franche, depositi franchi e depositi doganali. — Casella I.15.: indicare il numero di immatricolazione (vagoni ferroviari o container e autocarri), il numero del volo (aeromobili) o il nome (navi). In caso di scarico e nuovo carico nell'Unione europea, lo speditore deve informare il posto d'ispezione frontaliero del punto d'ingresso nell'Unione europea. — Casella I.19.: utilizzare il codice appropriato del sistema armonizzato (SA) delle seguenti voci: 05.11, 30.02 o 35.02. — Casella I.23.: nel caso di contenitori per il trasporto di merci alla rinfusa, indicare il numero del contenitore e il numero del sigillo (se pertinente). — Casella I.25.: uso tecnico: qualsiasi uso diverso dall'alimentazione di animali d'allevamento diversi dagli animali da pelliccia e dalla produzione o fabbricazione di alimenti per animali da compagnia. — Caselle I.26. e I.27.: compilare a seconda che si tratti di un certificato di transito o d'importazione. — Casella I.28.: specie: scegliere fra: Aves, Ruminantia, Suidae, Mammalia diversi da Ruminantia o Suidae, Pesca, Reptilia. Parte II (1a) GU L 300 del 14.11.2009, pag. 1. (1b) GU L 54 del 26.2.2011, pag. 1. (2) Cancellare le voci non pertinenti. (2a) GU L 125 del 23.5.1996, pag. 3. (2b) GU L 125 del 23.5.1996, pag. 10. (3) Codice del territorio quale figurante nell'allegato II, parte 1, del regolamento (UE) n. 206/2010 (GU L 73 del 20.3.2010, pag. 1). (4) In questo caso, dopo i controlli veterinari a norma della direttiva 97/78/CE (GU L 24 del 30.1.1998, pag. 9) e in conformità delle disposizioni di cui all'articolo 8, paragrafo 4, della stessa direttiva, i prodotti sono trasportati direttamente allo stabilimento nel luogo di destinazione.  Testo di immagine
Testo di immagine
PAESE Prodotti sanguigni non trattati, esclusi quelli derivati da equidi, destinati alla fabbricazione di prodotti derivati per usi esterni alla catena degli alimenti per animali d'allevamento II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (5) Codice del territorio quale figurante nell'allegato I, parte 1, del regolamento (CE) n. 798/2008 della Commissione (GU L 226 del 23.8.2008, pag. 1). (6) GU L 147 del 31.5.2001, pag. 1. (7) GU L 172 del 30.6.2007, pag. 84. — Il colore della firma e del timbro dev'essere diverso da quello del testo stampato. — Osservazione per il responsabile della partita nell'Unione europea: il presente certificato è ad uso esclusivamente veterinario e deve accompagnare la partita fino al posto d'ispezione frontaliero del punto d'ingresso nell'Unione europea. Veterinario ufficiale/Ispettore ufficiale Nome e cognome (in stampatello): Titolo e qualifica: Data: Firma: Timbro: CAPO 4(D) Certificato sanitario Per la spedizione o il transito (2) nell'Unione europea di prodotti sanguigni trattati, esclusi quelli derivati da equidi, destinati alla fabbricazione di prodotti derivati per usi esterni alla catena degli alimenti per animali d'allevamento  Testo di immagine
Testo di immagine
PAESE Certificato veterinario per l'esportazione nell'UE Parte I: informazioni relative alla partita spedita I.1. Speditore Nome Indirizzo Tel. I.2. N. di riferimento del certificato I.2.a. I.3. Autorità centrale competente I.4. Autorità locale competente I.5. Destinatario Nome Indirizzo Codice postale Tel. I.6. Persona responsabile della partita nell'UE Nome Indirizzo Codice postale Tel. I.7. Paese di origine Codice ISO I.8. Regione di origine Codice I.9. Paese di destinazione Codice ISO I.10. Regione di destinazione Codice I.11. Luogo di origine Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo I.12. Luogo di destinazione Deposito doganale Nome N. di riconoscimento Indirizzo Codice postale I.13. Luogo di carico I.14. Data di partenza I.15. Mezzo di trasporto Aereo Nave Vagone ferroviario Veicolo stradale Altro Identificazione Riferimento documentale I.16. PIF di entrata nell'UE I.17. I.18. Descrizione della merce I.19. Codice del prodotto (codice SA) I.20. Quantità I.21. Temperatura del prodotto Ambiente Refrigerato Congelato I.22. Numero di colli I.23. Numero del sigillo/contenitore I.24. Tipo di imballaggio 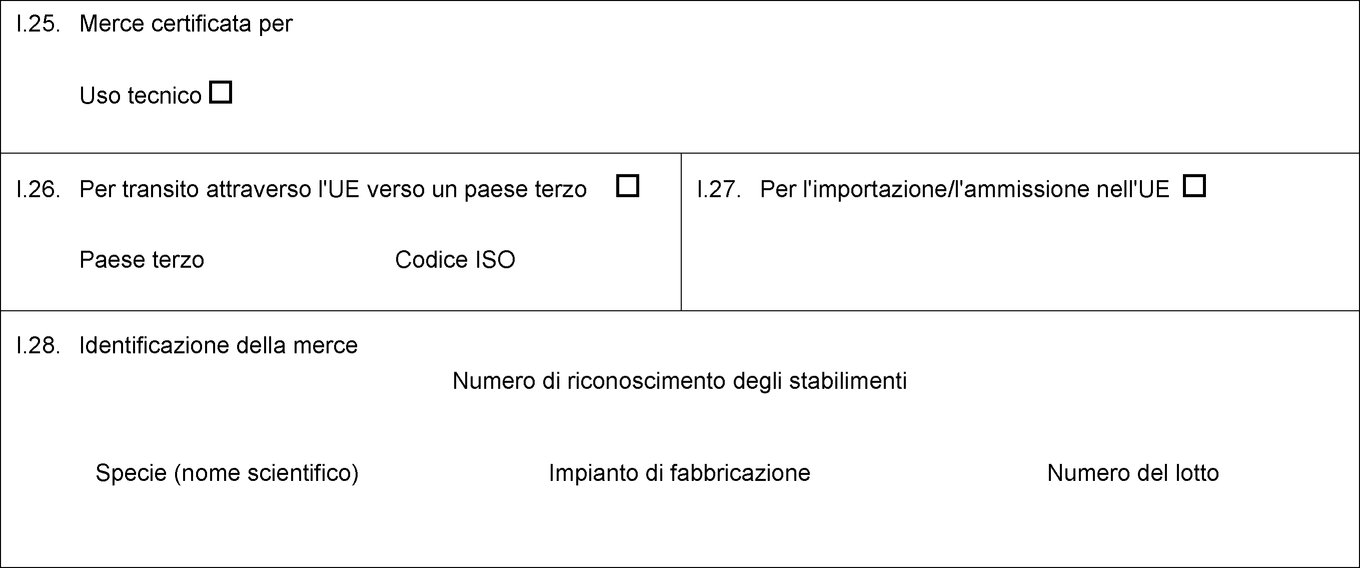 Testo di immagine
Testo di immagine
I.25. Merce certificata per Uso tecnico I.26. Per transito attraverso l'UE verso un paese terzo Paese terzo Codice ISO I.27. Per l'importazione/l'ammissione nell'UE I.28. Identificazione della merce Numero di riconoscimento degli stabilimenti Specie (nome scientifico) Impianto di fabbricazione Numero del lotto  Testo di immagine
Testo di immagine
PAESE Prodotti sanguigni trattati, esclusi quelli derivati da equidi, destinati alla fabbricazione di prodotti derivati per usi esterni alla catena degli alimenti per animali d'allevamento II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Il sottoscritto, veterinario ufficiale, dichiara di aver preso atto del regolamento (CE) n. 1069/2009 del Parlamento europeo e del Consiglio (1a), in particolare dell'articolo 8, lettere c) e d), e dell'articolo 10, nonché del regolamento (UE) n. 142/2011 della Commissione (1b), in particolare dell'allegato XIV, capo II, e certifica che: II.1. i prodotti sanguigni sopraindicati sono costituiti da prodotti sanguigni che soddisfano le condizioni di seguito indicate; II.2. sono costituiti esclusivamente da prodotti sanguigni non destinati al consumo umano o animale; II.3. sono stati preparati e immagazzinati in un impianto controllato dall'autorità competente, esclusivamente con i seguenti sottoprodotti di origine animale: (2) [- sangue di animali macellati idoneo al consumo umano in conformità della normativa dell'Unione europea, ma non destinato al consumo umano per motivi commerciali;] (2) e/o [- sangue di animali macellati dichiarato non idoneo al consumo umano in conformità della normativa dell'Unione, ma che non presentava segni di malattie trasmissibili all'uomo o agli animali, proveniente da carcasse di animali macellati in un macello e considerati idonei al consumo umano in seguito a un'ispezione ante mortem conformemente alla normativa dell'Unione;] (2) e/o [- sangue di animali macellati che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali, ottenuto da animali macellati in un macello dopo essere stati considerati idonei al consumo umano in seguito a un'ispezione ante mortem conformemente alla normativa dell'Unione;] (2) e/o [- sangue e prodotti sanguigni provenienti da animali vivi che non presentavano segni clinici di malattie trasmissibili all'uomo o agli animali attraverso tali prodotti;] (2) e/o [- sangue e prodotti sanguigni ottenuti dalla fabbricazione di prodotti destinati al consumo umano;] (2) e/o [- sottoprodotti di origine animale ottenuti da animali che sono stati sottoposti a trattamenti illeciti ai sensi dell'articolo 1, paragrafo 2, lettera d), della direttiva 96/22/CE del Consiglio (2a) o dell'articolo 2, lettera b), della direttiva 96/23/CE del Consiglio (2b);] (2) e/o [- sottoprodotti di origine animale contenenti residui di altre sostanze e di agenti contaminanti per l'ambiente elencati nell'allegato I, categoria B, punto 3, della direttiva 96/23/CE, se tali residui superano i livelli consentiti dalla normativa dell'Unione o, in assenza di tale normativa, dalla normativa nazionale;] II.4. il sangue con cui tali prodotti sono stati fabbricati è stato prelevato in macelli riconosciuti in conformità della normativa dell'Unione, in macelli riconosciuti e controllati dall'autorità competente del paese del prelievo o da animali vivi in impianti riconosciuti e controllati dall'autorità competente del paese del prelievo. (2) [II.5. Nel caso di prodotti sanguigni derivati da Artiodactyla, Perissodactyla e Proboscidea o dai loro incroci, esclusi Suidae e Tayassuidae, i prodotti sono stati sottoposti a uno dei seguenti trattamenti, che garantisce l'assenza di agenti patogeni causa di afta epizootica, stomatite vescicolare, peste bovina, peste dei piccoli ruminanti, febbre della Valle del Rift e febbre catarrale degli ovini: (2) [trattamento termico a una temperatura di 65 °C per almeno tre ore, seguito da una verifica dell'efficacia;] (2) e/o [irradiazione a 25 kGy con raggi gamma, seguita da una verifica dell'efficacia;] (2) e/o [modifica del pH in pH 5 per due ore, seguita da una verifica dell'efficacia;] (2) e/o [trattamento termico a una temperatura almeno di 80 °C in tutta la massa, seguito da una verifica dell'efficacia.]] Parte II Certificazione  Testo di immagine
Testo di immagine
PAESE Prodotti sanguigni trattati, esclusi quelli derivati da equidi, destinati alla fabbricazione di prodotti derivati per usi esterni alla catena degli alimenti per animali d'allevamento II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) [II.6. I prodotti sanguigni ottenuti da animali appartenenti alle famiglie Suidae, Tayassuidae, da pollame e altre specie aviarie sono stati sottoposti a uno dei seguenti trattamenti che garantisce l'assenza degli agenti patogeni che causano le seguenti malattie: afta epizootica, stomatite vescicolare, malattia vescicolare dei suini, peste suina classica, peste suina africana, malattia di Newcastle e influenza aviaria ad alta patogenicità, secondo la specie: (2) [trattamento termico a una temperatura di 65 °C per almeno tre ore, seguito da una verifica dell'efficacia;] (2) e/o [irradiazione a 25 kGy con raggi gamma, seguita da una verifica dell'efficacia;] (2) e/o [trattamento termico a una temperatura di almeno 80 °C per gli animali appartenenti alle famiglie Suidae/Tayassuidae (2) e almeno di 70 °C per il pollame e altre specie aviarie (2) in tutta la massa del prodotto, seguito da una verifica dell'efficacia]]. (2) [II.7. Nel caso dei prodotti sanguigni derivati da specie diverse da quelle indicate ai punti II.5. o II.6., i prodotti sono stati sottoposti al seguente trattamento (specificare): ] II.8. i prodotti sono stati: (2) [imballati in bottiglie o sacchi nuovi o sterilizzati,] (2) o [trasportati alla rinfusa in contenitori o in altri mezzi di trasporto, accuratamente puliti e sterilizzati con un disinfettante approvato dall'autorità competente prima dell'uso;] e l'imballaggio esterno o i contenitori recano un'etichetta con la dicitura "NON DESTINATO AL CONSUMO UMANO O ANIMALE"; II.9. i prodotti sono stati immagazzinati in depositi chiusi; II.10. sono state prese tutte le precauzioni necessarie per evitare la contaminazione dei prodotti con agenti patogeni dopo il trattamento; (2) [II.11. I prodotti sanguigni trattati di cui sopra (2) [sono ottenuti da ruminanti diversi da bovini, ovini o caprini.]] (2) o [sono ottenuti da bovini, ovini o caprini e non contengono né sono ottenuti da: (2) [materiali ricavati da bovini, ovini e caprini diversi da quelli derivati da animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]] (2) o [a) materiale specifico a rischio di cui all'allegato V, punto 1, del regolamento (CE) n. 999/2001 del Parlamento europeo e del Consiglio (3); b) carni separate meccanicamente ottenute da ossa di bovini, ovini o caprini, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE della Commissione (4) e in cui non si sono verificati casi indigeni di BSE, c) sottoprodotti di origine animale o prodotti derivati ottenuti da bovini, ovini o caprini che sono stati abbattuti, previo stordimento, mediante lacerazione del tessuto nervoso centrale per mezzo di uno stilo inserito nella cavità cranica, o tramite iniezione di gas nella cavità cranica, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o in una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]]]  Testo di immagine
Testo di immagine
PAESE Prodotti sanguigni trattati, esclusi quelli derivati da equidi, destinati alla fabbricazione di prodotti derivati per usi esterni alla catena degli alimenti per animali d'allevamento II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Note Parte I: — Casella I.6.: persona responsabile della partita nell'Unione europea: da compilare soltanto se si tratta di un certificato per merce in transito nell'Unione europea; la casella può essere compilata se il certificato riguarda una merce da importare nell'Unione europea. — Caselle I.11. e I.12.: numero di riconoscimento: numero di registrazione dello stabilimento o dell'impianto, assegnato dall'autorità competente. — Casella I.12.: luogo di destinazione: da compilare soltanto se si tratta di un certificato per merce in transito; i prodotti in transito possono essere immagazzinati unicamente in zone franche, depositi franchi e depositi doganali. — Casella I.15.: indicare il numero di immatricolazione (vagoni ferroviari o container e autocarri), il numero del volo (aeromobili) o il nome (navi). In caso di scarico e nuovo carico nell'Unione europea, lo speditore deve informare il posto d'ispezione frontaliero di entrata nell'Unione europea. — Casella I.19.: utilizzare il codice appropriato del sistema armonizzato (SA) delle seguenti voci: 05.11, 30.02, 35.02 o 35.04. — Casella I.23.: nel caso di contenitori per il trasporto di merci alla rinfusa, indicare il numero del contenitore e il numero del sigillo (se pertinente). — Casella I.25.: uso tecnico: qualsiasi uso diverso dall'alimentazione di animali d'allevamento diversi dagli animali da pelliccia e dalla produzione o fabbricazione di alimenti per animali da compagnia. — Caselle I.26. e I.27.: compilare a seconda che si tratti di un certificato di transito o d'importazione. — Casella I.28.: in caso di specie: scegliere fra: Aves, Ruminantia, Suidae, Mammalia diversi da Ruminantia o Suidae, Pesca, Reptilia. Parte II (1a) GU L 300 del 14.11.2009, pag. 1. (1b) GU L 54 del 26.2.2011, pag. 1. (2) Cancellare le voci non pertinenti. (2a) GU L 125 del 23.5.1996, pag. 3. (2b) GU L 125 del 23.5.1996, pag. 10. (3) GU L 147 del 31.5.2001, pag. 1. (4) GU L 172 del 30.6.2007, pag. 84. — Il colore della firma e del timbro dev'essere diverso da quello del testo stampato. — Osservazione per il responsabile della partita nell'Unione europea: il presente certificato è ad uso esclusivamente veterinario e deve accompagnare la partita fino al posto d'ispezione frontaliero dell'Unione europea. Veterinario ufficiale/Ispettore ufficiale Nome e cognome (in stampatello): Titolo e qualifica: Data: Firma: Timbro: |
|
3) |
il capo 6(B) è sostituito dal seguente: «CAPO 6(B) Certificato sanitario Per la spedizione/il transito nell'Unione europea (2) di trofei di caccia di uccelli e ungulati costituiti da parti anatomiche intere che non hanno subito alcun trattamento 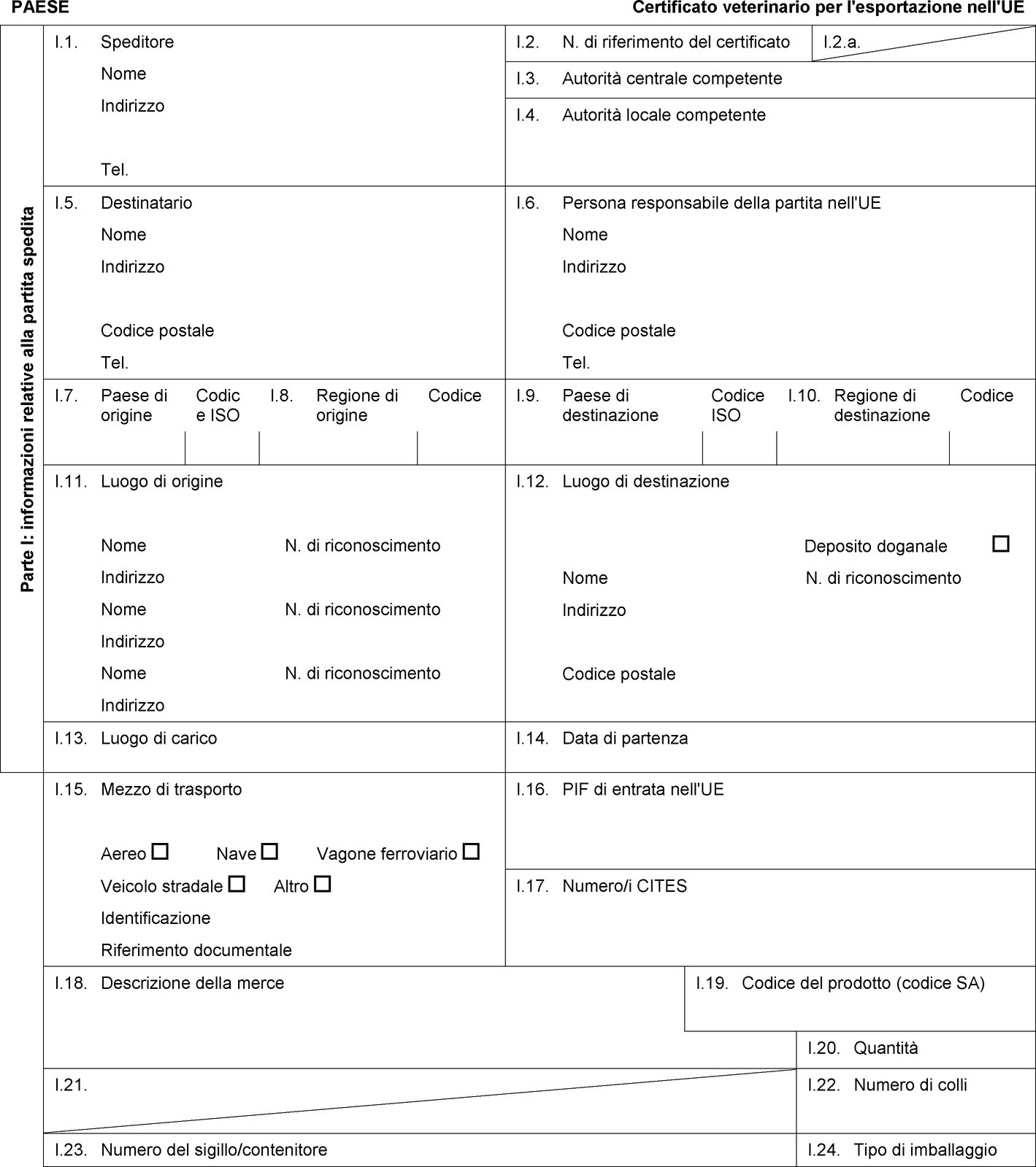 Testo di immagine
Testo di immagine
PAESE Certificato veterinario per l'esportazione nell'UE Parte I: informazioni relative alla partita spedita I.1. Speditore Nome Indirizzo Tel. I.2. N. di riferimento del certificato I.2.a. I.3. Autorità centrale competente I.4. Autorità locale competente I.5. Destinatario Nome Indirizzo Codice postale Tel. I.6. Persona responsabile della partita nell'UE Nome Indirizzo Codice postale Tel. I.7. Paese di origine Codice ISO I.8. Regione di origine Codice I.9. Paese di destinazione Codice ISO I.10. Regione di destinazione Codice I.11. Luogo di origine Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo I.12. Luogo di destinazione Deposito doganale Nome N. di riconoscimento Indirizzo Codice postale I.13. Luogo di carico I.14. Data di partenza I.15. Mezzo di trasporto Aereo Nave Vagone ferroviario Veicolo stradale Altro Identificazione Riferimento documentale I.16. PIF di entrata nell'UE I.17. Numero/i CITES I.18. Descrizione della merce I.19. Codice del prodotto (codice SA) I.20. Quantità I.21. I.22. Numero di colli I.23. Numero del sigillo/contenitore I.24. Tipo di imballaggio  Testo di immagine
Testo di immagine
I.25. Merce certificata per Uso tecnico I.26. Per transito attraverso l'UE verso un paese terzo Paese terzo Codice ISO I.27. Per l'importazione/l'ammissione nell'UE I.28. Identificazione della merce Specie (nome scientifico) Numero di colli  Testo di immagine
Testo di immagine
PAESE Trofei di caccia o altre preparazioni di uccelli e ungulati costituiti da parti anatomiche intere che non hanno subito alcun trattamento II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Il sottoscritto, veterinario ufficiale, dichiara di aver preso atto del regolamento (CE) n. 1069/2009 del Parlamento europeo e del Consiglio(1a) e del regolamento (UE) n. 142/2011 della Commissione(1b), in particolare dell'allegato XIV, capo II, e certifica che i trofei di caccia sopra descritti: (2) [II.1. per quanto riguarda i trofei di caccia e altre preparazioni di artiodattili diversi dai suini: a) da 12 mesi (regione) è indenne da afta epizootica e da peste bovina e durante lo stesso periodo non vi è stata praticata alcuna vaccinazione contro tali malattie; e b) i trofei di caccia e altre preparazioni sopra descritti: i) sono stati ottenuti da animali abbattuti nel territorio della suddetta regione, in provenienza dalla quale sono autorizzate le esportazioni nell'Unione europea di carni fresche delle specie domestiche sensibili corrispondenti e la quale negli ultimi 60 giorni non è stata soggetta a restrizioni di polizia sanitaria dovute a focolai di malattie della selvaggina; e ii) sono stati ottenuti da animali abbattuti ad almeno 20 km di distanza dalla frontiera di un altro paese terzo o di una sua parte in provenienza dai quali non sono autorizzate le esportazioni nell'Unione europea di trofei di caccia non trattati di artiodattili diversi dai suini;] (2) o [II.1. per quanto riguarda i trofei di caccia o altre preparazioni di suini selvatici: a) da 12 mesi (regione) è indenne da peste suina classica, peste suina africana, malattia vescicolare dei suini, afta epizootica e encefalomielite suina da enterovirus (malattia di Teschen) e durante lo stesso periodo non vi è stata praticata alcuna vaccinazione contro tali malattie; e b) i trofei di caccia o altre preparazioni sopra descritti: i) sono stati ottenuti da animali abbattuti nel suddetto territorio, in provenienza del quale sono autorizzate le esportazioni nell'Unione europea di carni fresche delle specie domestiche sensibili corrispondenti e il quale negli ultimi 60 giorni non è stato soggetto a restrizioni di polizia sanitaria dovute a focolai di malattie dei suini; e ii) sono stati ottenuti da animali abbattuti ad almeno 20 km di distanza dalla frontiera di un altro paese terzo o di una sua parte in provenienza dai quali non sono autorizzate le esportazioni nell'Unione europea di trofei di caccia non trattati di suini sel (2) o [II.1. per quanto riguarda i trofei di caccia o altre preparazioni di solipedi, i trofei di caccia o altre preparazioni sopra descritti sono stati ottenuti da solipedi selvatici abbattuti nel territorio del suddetto paese esportatore;] (2) o [II.1. per quanto riguarda i trofei di caccia o altre preparazioni di selvaggina da penna: a) (regione) è indenne dall'influenza aviaria ad alta patogenicità e dalla malattia di Newcastle; e b) i trofei di caccia o altre preparazioni sopra descritti sono stati ottenuti da selvaggina da penna uccisa nella suddetta regione, la quale nei 30 giorni precedenti non è stata soggetta a restrizioni di polizia sanitaria dovute a focolai di malattie della selvaggina da penna;] II.2. i trofei di caccia o altre preparazioni sopra descritti sono stati confezionati, senza essere stati a contatto con altri prodotti di origine animale che li potessero contaminare, in imballaggi singoli, trasparenti e chiusi in modo da evitare contaminazioni successive. Parte II Certificazione  Testo di immagine
Testo di immagine
PAESE Trofei di caccia o altre preparazioni di uccelli e ungulati costituiti da parti anatomiche intere che non hanno subito alcun trattamento II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) [II.3. I trofei di caccia o altre preparazioni sopra descritti: (2) [sono ottenuti da ruminanti diversi da bovini, ovini o caprini.]] (2) o [sono ottenuti da bovini, ovini o caprini e non contengono né sono ottenuti da: (2) [materiali ricavati da bovini, ovini e caprini diversi da quelli derivati da animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]] (2) o [a) materiale specifico a rischio di cui all'allegato V, punto 1, del regolamento (CE) n. 999/2001 del Parlamento europeo e del Consiglio (3); b) carni separate meccanicamente ottenute da ossa di bovini, ovini o caprini, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE della Commissione (4) e in cui non si sono verificati casi indigeni di BSE, c) sottoprodotti di origine animale o prodotti derivati ottenuti da bovini, ovini o caprini che sono stati abbattuti, previo stordimento, mediante lacerazione del tessuto nervoso centrale per mezzo di uno stilo inserito nella cavità cranica, o tramite iniezione di gas nella cavità cranica, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o in una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]]] Note Parte I: — Casella I.6.: persona responsabile della partita nell'Unione europea: da compilare soltanto se si tratta di un certificato per merce in transito nell'Unione europea; la casella può essere compilata se il certificato riguarda una merce da importare nell'Unione europea. — Caselle I.11. e I.12.: numero di riconoscimento: numero di registrazione dello stabilimento o dell'impianto, assegnato dall'autorità competente. — Casella I.12.: luogo di destinazione: casella da compilare solo se si tratta di un certificato per merce in transito. i prodotti in transito possono essere immagazzinati unicamente in zone franche, depositi franchi e depositi doganali. — Casella I.15.: numero di immatricolazione (vagoni ferroviari o container e autocarri), numero del volo (aeromobili) o nome (navi); queste informazioni devono essere aggiornate in caso di scarico e nuovo carico nell'Unione europea. — Casella I.19.: utilizzare il codice SA appropriato: 05.05, 05.06, 05.07, 05.11, 96.01 o 97.05. — Casella I.23.: nel caso di contenitori per il trasporto di merci alla rinfusa, indicare il numero del contenitore e il numero del sigillo (se pertinente). — Casella I.25.: uso tecnico: ogni uso diverso dal consumo animale. — Caselle I.26. e I.27.: compilare a seconda che si tratti di un certificato di transito o d'importazione. — Casella I.28.: specie: scegliere fra: Aves, Equidae, Tapiridae, Rhinoceritidae, Antilocaparidae, Bovidae, Camelidae, Cervidae, Giraffidae, Hippopotamindae, Moschidae, Suidae, Tayassuidae, Tragulidae e Elephantidae.  Testo di immagine
Testo di immagine
PAESE Trofei di caccia o altre preparazioni di uccelli e ungulati costituiti da parti anatomiche intere che non hanno subito alcun trattamento II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Parte II (1a) GU L 300 del 14.11.2009, pag. 1. (1b) GU L 54 del 26.2.2011, pag. 1. (2) Cancellare le voci non pertinenti. (3) GU L 147 del 31.5.2001, pag. 1. (4) GU L 172 del 30.6.2007, pag. 84. — Il colore della firma e del timbro dev'essere diverso da quello del testo stampato. — Osservazione per il responsabile della partita nell'Unione europea: il presente certificato è ad uso esclusivamente veterinario e deve accompagnare la partita fino al posto d'ispezione frontaliero del punto d'ingresso nell'Unione europea. Veterinario ufficiale/Ispettore ufficiale Nome e cognome (in stampatello): Titolo e qualifica: Data: Firma: Timbro: |
|
4) |
il capo 8 è sostituito dal seguente: «CAPO 8 Certificato sanitario Per la spedizione o il transito (2) nell'Unione europea di sottoprodotti di origine animale destinati a usi esterni alla catena degli alimenti per animali o da utilizzare come campioni commerciali (2)  Testo di immagine
Testo di immagine
PAESE Certificato veterinario per l'esportazione nell'UE Parte I: informazioni relative alla partita spedita I.1. Speditore Nome Indirizzo Tel. I.2. N. di riferimento del certificato I.2.a. I.3. Autorità centrale competente I.4. Autorità locale competente I.5. Destinatario Nome Indirizzo Codice postale Tel. I.6. Persona responsabile della partita nell'UE Nome Indirizzo Codice postale Tel. I.7. Paese di origine Codice ISO I.8. Regione di origine Codice I.9. Paese di destinazione Codice ISO I.10. Regione di destinazione Codice I.11. Luogo di origine Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo I.12. Luogo di destinazione Deposito doganale Nome N. di riconoscimento Indirizzo Codice postale I.13. Luogo di carico I.14. Data di partenza I.15. Mezzo di trasporto Aereo Nave Vagone ferroviario Veicolo stradale Altro Identificazione Riferimento documentale I.16. PIF di entrata nell'UE I.17. I.18. Descrizione della merce I.19. Codice del prodotto (codice SA) I.20. Quantità I.21. Temperatura del prodotto Ambiente Refrigerato Congelato I.22. Numero di colli I.23. Numero del sigillo/contenitore I.24. Tipo di imballaggio  Testo di immagine
Testo di immagine
I.25. Merce certificata per Uso tecnico I.26. Per transito attraverso l'UE verso un paese terzo Paese terzo Codice ISO I.27. Per l'importazione/l'ammissione nell'UE I.28. Identificazione della merce Numero di riconoscimento degli stabilimenti Specie (nome scientifico) Natura della merce Impianto di fabbricazione Numero di colli Peso netto Numero del lotto  Testo di immagine
Testo di immagine
PAESE Sottoprodotti di origine animale destinati ad usi esterni alla catena dei mangimi o da utilizzare come campioni commerciali (2) II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Il sottoscritto, veterinario ufficiale, dichiara di aver preso atto del regolamento (CE) n. 1069/2009 del Parlamento europeo e del Consiglio (1a) e del regolamento (UE) n. 142/2011 della Commissione (1b), in particolare dell'allegato XIV, capo II, e certifica che i sottoprodotti di origine animale sopra descritti: (2) [sono campioni commerciali costituiti da sottoprodotti di origine animale destinati a studi o analisi particolari di cui alla definizione di campioni commerciali all'allegato I, punto 39, del regolamento (UE) n. 142/2011 della Commissione, recanti l'etichetta "CAMPIONE COMMERCIALE NON DESTINATO AL CONSUMO UMANO".] (2) o [sono conformi alle prescrizioni sanitarie di cui al punto II.1.]; II.1. I sottoprodotti di origine animale di cui sopra II.1.1. sono stati: (2) [a) ottenuti da materiali importati da un paese terzo, un suo territorio o una sua parte (3) autorizzati ad esportare carni fresche nell'Unione europea;] (2) e/o [b) ottenuti nel paese terzo esportatore, in un suo territorio o in una sua parte (3) da animali i) che sono rimasti dalla nascita o almeno negli ultimi tre mesi prima della macellazione in tale paese terzo, suo territorio o sua parte autorizzati a esportare carni fresche nell'Unione europea; e/o ii) selvatici abbattuti in tale paese terzo, suo territorio o sua parte (4);] (2) e/o [c) derivati da uova, latte, roditori, lagomorfi o animali acquatici o terrestri o invertebrati acquatici;] (2) [II.1.2. nel caso di materiali diversi da quelli ottenuti da uova, latte, roditori, lagomorfi, grasso di lana, animali acquatici o terrestri o invertebrati acquatici o pellicce non trasformate, i materiali sono stati ottenuti da animali: (2) [a) provenienti da un'azienda: i) nella quale non vi sono stati casi/focolai delle malattie seguenti alle quali gli animali sono sensibili: peste bovina, malattia vescicolare dei suini, malattia di Newcastle o influenza aviaria ad alta patogenicità durante i 30 giorni precedenti, né casi/epidemie di peste suina classica o africana durante i 40 giorni precedenti; tenendo presente che durante i 30 giorni precedenti non vi devono essere stati casi/focolai neanche nelle aziende situate in un raggio di 10 km attorno all'azienda interessata; e ii) nella quale non vi sono stati casi/focolai di afta epizootica durante i 60 giorni precedenti, tenendo presente che durante i 30 giorni precedenti non vi devono essere stati casi/focolai neanche nelle aziende situate in un raggio di 25 km attorno all'azienda interessata; e b) che: i) non sono stati abbattuti per eradicare una epizoozia; ii) sono rimasti nell'azienda d'origine per un periodo di almeno 40 giorni prima dell'invio alla macellazione e sono stati trasportati direttamente al macello senza entrare in contatto con altri animali che non soddisfacessero le stesse condizioni sanitarie; iii) nel macello sono stati sottoposti a ispezione sanitaria ante mortem nelle 24 ore precedenti la macellazione, senza che venisse rilevata la presenza delle pertinenti malattie di cui sopra; e iv) nel macello, prima e durante la macellazione o l'abbattimento, sono stati trattati conformemente alle disposizioni pertinenti della normativa dell'Unione e sono state osservate prescrizioni almeno equivalenti a quelle di cui ai capi II e III del regolamento (CE) n. 1099/2009 del Consiglio (5)] Parte II Certificazione  Testo di immagine
Testo di immagine
PAESE Sottoprodotti di origine animale destinati ad usi esterni alla catena dei mangimi o da utilizzare come campioni commerciali (2) II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) o [a) selvatici catturati e abbattuti in una zona: i) nella quale, nel raggio di 25 km, non vi sono stati casi/focolai delle malattie seguenti alle quali gli animali sono sensibili: afta epizootica, peste bovina, malattia di Newcastle o influenza aviaria ad alta patogenicità nei 30 giorni precedenti, né di peste suina classica o peste suina africana nei 40 giorni precedenti; e ii) la quale dista oltre 20 km dalla frontiera di un altro territorio appartenente ad un paese o ad una parte di un paese non autorizzati a tale data ad esportare nell'Unione europea tale materiale; e b) i quali entro le 12 ore successive all'abbattimento sono stati trasportati per esservi sottoposti a refrigerazione a un centro di raccolta e immediatamente dopo a uno stabilimento per il trattamento della selvaggina, oppure direttamente a uno stabilimento per il trattamento della selvaggina;]] (2) [II.1.3. nel caso di materiali non derivati da pesci o invertebrati catturati in natura, i materiali sono stati ottenuti in uno stabilimento attorno al quale, in un raggio di 10 km, non vi sono stati casi/focolai delle pertinenti malattie di cui al punto II.1.2. durante i 30 giorni precedenti oppure, se ci sono stati casi/focolai di dette malattie, la preparazione di materie prime da esportare nell'Unione europea è stata autorizzata soltanto dopo la rimozione di tutta la carne e la pulizia e disinfezione totali dello stabilimento sotto il controllo di un veterinario ufficiale;] II.1.4. sono stati ottenuti e preparati senza che siano entrati in contatto con materiali non conformi alle condizioni sopra indicate e sono stati manipolati in modo da evitare la contaminazione da parte di agenti patogeni; II.1.5. sono stati imballati in imballaggi nuovi a tenuta stagna o in imballaggi puliti e disinfettati prima dell'uso oppure, nel caso di partite non spedite in colli postali, in contenitori sigillati dall'autorità competente, recanti l'etichetta "SOTTOPRODOTTI DI ORIGINE ANIMALE DESTINATI UNICAMENTE ALLA FABBRICAZIONE DI PRODOTTI DERIVATI PER USI ESTERNI ALLA CATENA DEI MANGIMI" nonché il nome e l'indirizzo dello stabilimento di destinazione nell'Unione europea; II.1.6. sono costituiti solo dai seguenti sottoprodotti di origine animale: (2) [- carcasse e parti di animali macellati oppure, nel caso della selvaggina, corpi o parti di animali uccisi dichiarati idonei al consumo umano in conformità della normativa dell'Unione finché non sono stati irreversibilmente dichiarati sottoprodotti di origine animale per motivi commerciali;] (2) e/o [- carcasse e parti seguenti derivanti da animali macellati in un macello e ritenuti atti alla macellazione per il consumo umano dopo un'ispezione ante mortem o corpi e parti seguenti di animali da selvaggina uccisi per il consumo umano nel rispetto della normativa dell'Unione: i) carcasse o corpi e parti di animali respinti in quanto non idonei al consumo umano in virtù della normativa dell'Unione, ma che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali; ii) teste di pollame; iii) pelli, inclusi ritagli e frammenti, corna e zampe, incluse le falangi e le ossa carpiche e metacarpiche e le ossa tarsiche e metatarsiche; iv) setole di suini; v) piume;] (2) e/o [- sottoprodotti di origine animale di pollame e lagomorfi macellati nell'azienda agricola conformemente all'articolo 1, paragrafo 3, lettera d), del regolamento (CE) n. 853/2004 del Parlamento europeo e del Consiglio (2a), che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali;] (2) e/o [- sangue di animali che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso il sangue, ottenuto da animali macellati in un macello dopo essere stati considerati atti alla macellazione per il consumo umano in seguito a un'ispezione ante mortem conformemente alla normativa dell'Unione;]  Testo di immagine
Testo di immagine
PAESE Sottoprodotti di origine animale destinati ad usi esterni alla catena dei mangimi o da utilizzare come campioni commerciali (2) II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) e/o [- sottoprodotti di origine animale derivanti dalla fabbricazione di prodotti destinati al consumo umano, compresi i ciccioli, le ossa sgrassate e i fanghi da centrifuga o da separatore risultanti dalla lavorazione del latte;] (2) e/o [- prodotti di origine animale, o prodotti alimentari contenenti prodotti di origine animale, i quali non sono più destinati al consumo umano per motivi commerciali o a causa di problemi di fabbricazione o difetti di condizionamento o altri difetti che non determinano rischi per la salute pubblica o degli animali;] (2) e/o [- alimenti per animali da compagnia e mangimi di origine animale o mangimi contenenti sottoprodotti di origine animale o prodotti derivati, non più destinati all'uso nei mangimi per motivi commerciali o a causa di problemi di fabbricazione o difetti di confezionamento o altri difetti che non determinano rischi per la salute pubblica o degli animali;] (2) e/o [- sangue, placenta, lana, piume, peli, corna, frammenti di zoccoli e latte crudo derivanti da animali vivi che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso tali prodotti;] (2) e/o [- animali acquatici e parti di tali animali, eccetto i mammiferi marini, che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali;] (2) e/o [- sottoprodotti di animali acquatici provenienti da stabilimenti o impianti che fabbricano prodotti destinati al consumo umano;] (2) e/o [- i materiali seguenti provenienti da animali che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso tali materiali: i) conchiglie e carapaci di crostacei e molluschi con tessuti molli o carni; ii) i seguenti prodotti derivati da animali terrestri: — sottoprodotti dei centri di incubazione; — uova; — sottoprodotti delle uova, compresi i gusci d'uovo; iii) pulcini di un giorno abbattuti per motivi commerciali;] (2) e/o [- sottoprodotti di origine animale ottenuti da invertebrati acquatici e terrestri diversi dalle specie patogene per l'uomo o per gli animali;] (2) e/o [- animali e loro parti, degli ordini Rodentia e Lagomorpha, eccetto i materiali di categoria 1 di cui all'articolo 8, lettera a), punti iii), iv) e v), e di categoria 2 di cui all'articolo 9, lettere da a) a g), del regolamento (CE) n. 1069/2009;] (2) e/o [- pellicce provenienti da animali morti che non presentavano segni clinici di malattie trasmissibili all'uomo o agli animali attraverso tali prodotti;] II.1.7. sono stati surgelati nell'impianto d'origine o sono stati conservati conformemente alla normativa dell'Unione europea in una maniera che ne impedisca il deterioramento tra il momento della spedizione e il momento della consegna all'impianto di destinazione. (2) (6) [II.1.8. (2) (7) [II.1.8.1. I sottoprodotti di origine animale della presente partita provengono da animali che sono stati ottenuti nel territorio indicato al punto II.1.1, nel quale i bovini domestici sono regolarmente sottoposti a programmi di vaccinazione contro l'afta epizootica ufficialmente controllati.]]  Testo di immagine
Testo di immagine
PAESE Sottoprodotti di origine animale destinati ad usi esterni alla catena dei mangimi o da utilizzare come campioni commerciali (2) II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) (8) e/o [II.1.8.2. I sottoprodotti di origine animale della presente partita sono stati costituiti da frattaglie o da carni disossate.]] (2) [II.1.9. i sottoprodotti di origine animale di cui sopra (2) [sono ottenuti da ruminanti diversi da bovini, ovini o caprini.]] (2) o [sono ottenuti da bovini, ovini o caprini e non contengono né sono ottenuti da: (2) [materiali ricavati da bovini, ovini e caprini diversi da quelli derivati da animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]] (2) o [a) materiale specifico a rischio di cui all'allegato V, punto 1, del regolamento (CE) n. 999/2001 del Parlamento europeo e del Consiglio (9); b) carni separate meccanicamente ottenute da ossa di bovini, ovini o caprini, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE della Commissione (10) e in cui non si sono verificati casi indigeni di BSE, c) sottoprodotti di origine animale o prodotti derivati ottenuti da bovini, ovini o caprini che sono stati abbattuti, previo stordimento, mediante lacerazione del tessuto nervoso centrale per mezzo di uno stilo inserito nella cavità cranica, o tramite iniezione di gas nella cavità cranica, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o in una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]]] II.1.10. i sottoprodotti di origine animale di cui sopra: (2) [non contengono latte o prodotti a base di latte di origine ovina o caprina o non sono destinati all'alimentazione degli animali d'allevamento diversi dagli animali da pelliccia.] (2) o [contengono latte o prodotti a base di latte di origine ovina o caprina e sono destinati all'alimentazione degli animali d'allevamento diversi dagli animali da pelliccia, e il latte o i prodotti a base di latte: a) sono ottenuti da ovini e caprini che sono rimasti continuativamente dalla nascita in un paese in cui sono soddisfatte le seguenti condizioni: i) la scrapie classica è soggetta a obbligo di notifica; ii) esiste un sistema di sensibilizzazione, sorveglianza e monitoraggio per la scrapie classica; iii) alle aziende di ovini o caprini si applicano restrizioni ufficiali in presenza di un sospetto di TSE o della conferma della scrapie classica; iv) gli ovini e i caprini colpiti da scrapie classica sono abbattuti e distrutti; v) la somministrazione agli ovini e ai caprini di farine di carne e ossa o di ciccioli, quali definiti nel codice sanitario per gli animali terrestri dell'organizzazione mondiale per la salute animale (OIE), ricavati da ruminanti è vietata e il divieto è effettivamente applicato in tutto il paese da almeno sette anni; b) provengono da aziende che non sono soggette ad alcuna restrizione ufficiale a causa di un sospetto di TSE; c) provengono da aziende nelle quali, nei sette anni precedenti, non è stato diagnosticato alcun caso di scrapie classica o nelle quali, a seguito della conferma di un caso di scrapie classica:  Testo di immagine
Testo di immagine
PAESE Sottoprodotti di origine animale destinati ad usi esterni alla catena dei mangimi o da utilizzare come campioni commerciali (2) II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) [tutti gli ovini e i caprini dell'azienda sono stati abbattuti e distrutti o macellati, fatta eccezione per i montoni da riproduzione del genotipo ARR/ARR, per le pecore da riproduzione portatrici di almeno un allele ARR e nessun allele VRQ e per gli altri ovini portatori di almeno un allele ARR;] (2) o [tutti gli animali nei quali la scrapie classica è stata confermata sono stati abbattuti e distrutti e l'azienda è stata sottoposta per almeno due anni dalla data di conferma dell'ultimo caso di scrapie classica a una sorveglianza intensificata delle TSE, compresa l'esecuzione di un test con esito negativo per individuare la presenza di TSE conformemente ai metodi di laboratorio di cui dell'allegato X, capitolo C, punto 3.2, del regolamento (CE) n. 999/2001 su tutti i seguenti animali di età superiore ai 18 mesi, esclusi gli ovini del genotipo ARR/ARR: — animali macellati per il consumo umano; e — animali morti o abbattuti nell'azienda, ma non abbattuti nel quadro di una campagna di eradicazione della malattia.]]. Note Parte I: — Casella I.6.: persona responsabile della partita nell'Unione europea: da compilare soltanto se si tratta di un certificato per merce in transito nell'Unione europea; la casella può essere compilata se il certificato riguarda una merce da importare nell'Unione europea. — Casella I.11.: nel caso di partite di campioni commerciali o destinati ad analisi: indicare unicamente il nome e l'indirizzo dello stabilimento. — Caselle I.11. e I.12.: numero di riconoscimento: numero di registrazione dello stabilimento o dell'impianto, assegnato dall'autorità competente. — Casella I.12.: luogo di destinazione: la casella va compilata: — per i prodotti destinati alla fabbricazione di prodotti derivati per usi esterni alla catena dei mangimi: solo se si tratta di un certificato per merce in transito; i prodotti in transito possono essere immagazzinati unicamente in zone franche, depositi franchi e depositi doganali; — per i prodotti per campioni commerciali o destinati ad analisi: l'impianto nell'Unione europea indicato nell'autorizzazione dell'autorità competente, se opportuno. — Casella I.15.: indicare il numero di immatricolazione (vagoni ferroviari o container e autocarri), il numero del volo (aeromobili) o il nome (navi). In caso di scarico e nuovo carico nell'Unione europea, lo speditore deve informare il posto d'ispezione frontaliero del punto d'ingresso nell'Unione europea. — Casella I.19.: utilizzare il codice appropriato del sistema armonizzato (SA) delle seguenti voci: 04.01, 04.02, 04.03, 04.04, 04.08, 05.05, 05.06, 05.07, 05.11.91, 05.11.99, 23.01 o 30.01. — Casella I.23.: nel caso di contenitori per il trasporto di merci alla rinfusa, indicare il numero del contenitore e il numero del sigillo (se pertinente). — Casella I.25.: uso tecnico: qualsiasi uso diverso dall'alimentazione di animali d'allevamento diversi dagli animali da pelliccia e dalla produzione o fabbricazione di alimenti per animali da compagnia. — Casella I.25.: ai fini del presente certificato, "uso tecnico" comprende anche l'uso come campione commerciale. — Caselle I.26. e I.27.: eccetto per i campioni commerciali, che non sono inviati in transito, compilare a seconda che si tratti di un certificato per transito o per importazione. — Casella I.28.: — per i prodotti destinati alla fabbricazione di prodotti derivati per usi esterni alla catena dei mangimi: impianto di fabbricazione: indicare il numero di controllo veterinario dello stabilimento riconosciuto; — per i prodotti destinati ad analisi e studi tecnologici particolari: l'impianto nell'Unione europea indicato nell'autorizzazione dell'autorità competente, se opportuno; — specie: scegliere fra: Aves, Ruminantia, Suidae, Mammalia diversi da Ruminantia e Suidae, Pesca, Mollusca, Crustacea, invertebrati diversi da Mollusca e Crustacea.  Testo di immagine
Testo di immagine
PAESE Sottoprodotti di origine animale destinati ad usi esterni alla catena dei mangimi o da utilizzare come campioni commerciali(2) II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Parte II (1a) GU L 300 del 14.11.2009, pag. 1. (1b) GU L 54 del 26.2.2011, pag. 1. (2) Cancellare le voci non pertinenti. (2a) GU L 139 del 30.4.2004, pag. 55. (3) Il nome e il codice ISO del paese esportatore indicati: — allegato II, parte 1, del regolamento (UE) n. 206/2010 della Commissione (GU L 73 del 20.3.2010, pag. 1). — allegato I del regolamento (CE) n. 798/2008 della Commissione (GU L 226 del 23.8.2008, pag. 1). — allegato I del regolamento (CE) n. 119/2009 della Commissione (GU L 39 del 10.2.2009, pag. 12). Qualora applicabile, va inoltre inserito il codice ISO dei territori e delle loro parti di cui agli allegati dei regolamenti (UE) n. 206/2010, (CE) n. 798/2008 e (CE) n. 119/2009 di cui alla presente nota (se pertinente per le specie interessate). (4) Riguarda solo i paesi in provenienza dai quali è autorizzata l'importazione nell'Unione europea di carni di selvaggina delle stesse specie animali destinate al consumo umano. (5) GU L 303 del 18.11.2009, pag. 1. (6) Garanzie supplementari da fornire quando il materiale di ruminanti domestici proviene dal territorio di un paese o di una parte di un paese sudamericano o sudafricano a partire dal quale possono essere esportate nell'Unione europea soltanto le carni fresche maturate e disossate di ruminanti domestici destinate al consumo umano. Sono inoltre permessi i muscoli masseteri di bovini, incisi conformemente alle prescrizioni di cui all'allegato I, sezione IV, capo 1, parte B 1, del regolamento (CE) n. 854/2004 del Parlamento europeo e del Consiglio (GU L 139 del 30.4.2004, pag. 206). (7) Soltanto per certi paesi sudamericani. (8) Soltanto per certi paesi sudamericani e sudafricani. (9) GU L 147 del 31.5.2001, pag. 1. (10) GU L 172 del 30.6.2007, pag. 84. — Il colore della firma e del timbro dev'essere diverso da quello del testo stampato. — Osservazione per il responsabile della partita nell'Unione europea: il presente certificato è ad uso esclusivamente veterinario e deve accompagnare la partita fino al posto d'ispezione frontaliero del punto d'ingresso nell'Unione europea. Veterinario ufficiale/Ispettore ufficiale Nome e cognome (in stampatello): Titolo e qualifica: Data: Firma: Timbro: |
|
5) |
i capi 10(A), 10(B), 11 e 12 sono sostituiti dai seguenti: «CAPO 10(A) Certificato sanitario Per la spedizione/il transito (2) nell'Unione europea di grassi fusi non destinati al consumo umano da utilizzare come materie prime per mangimi  Testo di immagine
Testo di immagine
PAESE Certificato veterinario per l'esportazione nell'UE Parte I: informazioni relative alla partita spedita I.1. Speditore Nome Indirizzo Tel. I.2. N. di riferimento del certificato I.2.a. I.3. Autorità centrale competente I.4. Autorità locale competente I.5. Destinatario Nome Indirizzo Codice postale Tel. I.6. Persona responsabile della partita nell'UE Nome Indirizzo Codice postale Tel. I.7. Paese di origine Codice ISO I.8. Regione di origine Codice I.9. Paese di destinazione Codice ISO I.10. Regione di destinazione Codice I.11. Luogo di origine Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo I.12. Luogo di destinazione Deposito doganale Nome N. di riconoscimento Indirizzo Codice postale I.13. Luogo di carico I.14. Data di partenza I.15. Mezzo di trasporto Aereo Nave Vagone ferroviario Veicolo stradale Altro Identificazione Riferimento documentale I.16. PIF di entrata nell'UE I.17. I.18. Descrizione della merce I.19. Codice del prodotto (codice SA) I.20. Quantità I.21. Temperatura del prodotto Ambiente Refrigerato Congelato I.22. Numero di colli I.23. Numero del sigillo/contenitore I.24. Tipo di imballaggio  Testo di immagine
Testo di immagine
I.25. Merce certificata per Alimentazione animale Produzione di alimenti per animali da compagnia Uso tecnico I.26. Per transito attraverso l'UE verso un paese terzo Paese terzo Codice ISO I.27. Per l'importazione/l'ammissione nell'UE I.28. Identificazione della merce Numero di riconoscimento degli stabilimenti Specie (nome scientifico) Natura della merce Impianto di fabbricazione Numero di colli Peso netto Numero del lotto  Testo di immagine
Testo di immagine
PAESE Grassi fusi non destinati al consumo umano da utilizzare come materie prime per mangimi II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Il sottoscritto, veterinario ufficiale, dichiara di aver preso atto del regolamento (CE) n. 1069/2009 del Parlamento europeo e del Consiglio (1a), in particolare dell'articolo 10, nonché del regolamento (UE) n. 142/2011 della Commissione (1b), in particolare dell'allegato XIV, capo II, e certifica che i grassi fusi di cui sopra: II.1. soddisfano le condizioni sanitarie di seguito indicate; II.2. non sono destinati al consumo umano; II.3. sono stati preparati e immagazzinati in un impianto riconosciuto e controllato dall'autorità competente in conformità dell'articolo 24 del regolamento (CE) n. 1069/2009 oppure conformemente all'articolo 4, paragrafo 2, del regolamento (CE) n. 853/2004 del Parlamento europeo e del Consiglio (3) al fine di distruggere gli agenti patogeni; II.4. sono stati preparati esclusivamente con i seguenti sottoprodotti di origine animale: (2) [- carcasse e parti di animali macellati oppure, nel caso della selvaggina, corpi o parti di animali uccisi idonei al consumo umano in conformità della normativa dell'Unione, ma non destinati al consumo umano per motivi commerciali;] (2) e/o [- carcasse e parti seguenti derivanti da animali macellati in un macello e ritenuti atti alla macellazione per il consumo umano dopo un'ispezione ante mortem o corpi e parti seguenti di animali da selvaggina uccisi per il consumo umano nel rispetto della normativa dell'Unione: i) carcasse o corpi e parti di animali dichiarati non idonei al consumo umano conformemente alla normativa dell'Unione, ma che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali; ii) teste di pollame; iii) pelli, inclusi ritagli e frammenti, corna e zampe, incluse le falangi e le ossa carpiche e metacarpiche e le ossa tarsiche e metatarsiche; iv) setole di suini; v) piume;] (2) e/o [- sangue di animali che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso il sangue, ottenuto da animali macellati in un macello dopo essere stati considerati atti alla macellazione per il consumo umano in seguito a un'ispezione ante mortem conformemente alla normativa dell'Unione;] (2) e/o [- sottoprodotti di origine animale derivanti dalla fabbricazione di prodotti destinati al consumo umano, compresi i ciccioli, le ossa sgrassate e i fanghi da centrifuga o da separatore risultanti dalla lavorazione del latte;] (2) e/o [- prodotti di origine animale, o prodotti alimentari contenenti prodotti di origine animale, i quali non sono più destinati al consumo umano per motivi commerciali o a causa di problemi di fabbricazione o difetti di condizionamento o altri difetti che non determinano rischi per la salute pubblica o animale;] (2) e/o [- alimenti per animali da compagnia e mangimi di origine animale o mangimi contenenti sottoprodotti di origine animale o prodotti derivati, non più destinati all'uso nei mangimi per motivi commerciali o a causa di problemi di fabbricazione o difetti di confezionamento o altri difetti che non determinano rischi per la salute pubblica o degli animali;] (2) e/o [- sangue, placenta, lana, piume, peli, corna, frammenti di zoccoli e latte crudo derivanti da animali vivi che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso tali prodotti;] Parte II Certificazione  Testo di immagine
Testo di immagine
PAESE Grassi fusi non destinati al consumo umano da utilizzare come materie prime per mangimi II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) e/o [- animali acquatici e parti di tali animali, eccetto i mammiferi marini, che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali;] (2) e/o [- sottoprodotti di animali acquatici provenienti da stabilimenti o impianti che fabbricano prodotti destinati al consumo umano;] (2) e/o [- i materiali seguenti provenienti da animali che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso tali materiali: i) conchiglie e carapaci di crostacei e molluschi con tessuti molli o carni; ii) i seguenti prodotti derivati da animali terrestri: — sottoprodotti dei centri di incubazione; — uova; — sottoprodotti delle uova, compresi i gusci d'uovo; iii) pulcini di un giorno abbattuti per motivi commerciali;] II.5. (2) [- se si tratta di materiali di origine suina, provengono da un paese o da una parte del territorio di un paese indenne da afta epizootica negli ultimi 24 mesi e indenne da peste suina classica e peste suina africana negli ultimi 12 mesi;] (2) e/o [- se si tratta di materiali di origine avicola, provengono da un paese o da una parte del territorio di un paese indenne dalla malattia di Newcastle e dall'influenza aviaria negli ultimi 6 mesi;] (2) e/o [- se si tratta di materiali ricavati da ruminanti, provengono da un paese o da una parte del territorio di un paese indenne da afta epizootica negli ultimi 24 mesi e indenne da peste bovina negli ultimi 12 mesi;] (2) e/o [- ove nel pertinente periodo di cui al punto II.5. vi sia stato un focolaio di una delle malattie di cui al punto II.5., e ove siano ottenuti da specie sensibili, i grassi fusi sono stati sottoposti a un trattamento termico ad almeno 70 °C per 30 minuti o ad almeno 90 °C per almeno 15 minuti, e sono stati registrati e conservati i dati relativi ai punti critici di controllo in modo che il proprietario, l'operatore o il loro rappresentante e, eventualmente, l'autorità competente possano monitorare il funzionamento dell'impianto. I dati devono includere la dimensione delle particelle, la temperatura critica e, se opportuno, il tempo assoluto, l'andamento della pressione, la frequenza di ricarica di materie prime e la frequenza di riciclo dei grassi.] II.6. se si tratta di grassi fusi ottenuti da ruminanti, essi sono stati purificati in modo tale che il tenore massimo di impurità insolubili residue totali non superi lo 0,15 % in peso; II.7. i grassi fusi: a) sono stati sottoposti a trasformazione conformemente all'allegato X, capo II, sezione 3 del regolamento (UE) n. 142/2011, oppure ad un trattamento di cui all'allegato III, sezione XII, del regolamento (CE) n. 853/2004, al fine di distruggere gli agenti patogeni; e (2) [b) sono imballati in contenitori nuovi o in contenitori che sono stati puliti e, se necessario, disinfettati onde evitare la contaminazione e che sono stati trattati con tutte le precauzioni atte ad evitarne la contaminazione;] (2) o [b) se si prevede di trasportare i grassi alla rinfusa, occorre che i tubi, le pompe, le cisterne e qualsiasi altro contenitore o camion cisterna per merci sfuse, usati per il trasporto del prodotto dall'impianto di produzione direttamente sulla nave, in cisterne a terra o agli impianti, siano stati ispezionati dall'autorità competente prima dell'uso e siano risultati puliti;] e recanti un'etichetta con l'indicazione "NON DESTINATO AL CONSUMO UMANO";  Testo di immagine
Testo di immagine
PAESE Grassi fusi non destinati al consumo umano da utilizzare come materie prime per mangimi II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) [II.8. i grassi fusi di cui sopra (2) [sono ottenuti da ruminanti diversi da bovini, ovini o caprini.]] (2) o [sono ottenuti da bovini, ovini o caprini e non contengono né sono ottenuti da: (2) [materiali ricavati da bovini, ovini e caprini diversi da quelli derivati da animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]] (2) o [a) materiale specifico a rischio di cui all'allegato V, punto 1, del regolamento (CE) n. 999/2001 del Parlamento europeo e del Consiglio (4); b) carni separate meccanicamente ottenute da ossa di bovini, ovini o caprini, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE della Commissione (5) e in cui non si sono verificati casi indigeni di BSE, c) sottoprodotti di origine animale o prodotti derivati ottenuti da bovini, ovini o caprini che sono stati abbattuti, previo stordimento, mediante lacerazione del tessuto nervoso centrale per mezzo di uno stilo inserito nella cavità cranica, o tramite iniezione di gas nella cavità cranica, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o in una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]]] II.9. i grassi fusi di cui sopra: (2) [non contengono latte o prodotti a base di latte di origine ovina o caprina o non sono destinati all'alimentazione degli animali d'allevamento diversi dagli animali da pelliccia.] (2) o [contengono latte o prodotti a base di latte di origine ovina o caprina e sono destinati all'alimentazione degli animali d'allevamento diversi dagli animali da pelliccia, e il latte o i prodotti a base di latte: a) sono ottenuti da ovini e caprini che sono rimasti continuativamente dalla nascita in un paese in cui sono soddisfatte le seguenti condizioni: i) la scrapie classica è soggetta a obbligo di notifica; ii) esiste un sistema di sensibilizzazione, sorveglianza e monitoraggio per la scrapie classica; iii) alle aziende di ovini o caprini si applicano restrizioni ufficiali in presenza di un sospetto di TSE o della conferma della scrapie classica; iv) gli ovini e i caprini colpiti da scrapie classica sono abbattuti e distrutti; v) la somministrazione agli ovini e ai caprini di farine di carne e ossa o di ciccioli, quali definiti nel codice sanitario per gli animali terrestri dell'organizzazione mondiale per la salute animale (OIE), ricavati da ruminanti è vietata e il divieto è effettivamente applicato in tutto il paese da almeno sette anni; b) provengono da aziende che non sono soggette ad alcuna restrizione ufficiale a causa di un sospetto di TSE; c) provengono da aziende nelle quali, nei sette anni precedenti, non è stato diagnosticato alcun caso di scrapie classica o nelle quali, a seguito della conferma di un caso di scrapie classica:  Testo di immagine
Testo di immagine
PAESE Grassi fusi non destinati al consumo umano da utilizzare come materie prime per mangimi II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) [tutti gli ovini e i caprini dell'azienda sono stati abbattuti e distrutti o macellati, fatta eccezione per i montoni da riproduzione del genotipo ARR/ARR, per le pecore da riproduzione portatrici di almeno un allele ARR e nessun allele VRQ e per gli altri ovini portatori di almeno un allele ARR;] (2) o [tutti gli animali nei quali la scrapie classica è stata confermata sono stati abbattuti e distrutti e l'azienda è stata sottoposta per almeno due anni dalla data di conferma dell'ultimo caso di scrapie classica a una sorveglianza intensificata delle TSE, compresa l'esecuzione di un test con esito negativo per individuare la presenza di TSE conformemente ai metodi di laboratorio di cui dell'allegato X, capitolo C, punto 3.2, del regolamento (CE) n. 999/2001 su tutti i seguenti animali di età superiore ai 18 mesi, esclusi gli ovini del genotipo ARR/ARR: — animali macellati per il consumo umano; e — animali morti o abbattuti nell'azienda, ma non abbattuti nel quadro di una campagna di eradicazione della malattia.]] Note Parte I: — Casella I.6.: persona responsabile della partita nell'Unione europea: da compilare soltanto se si tratta di un certificato per merce in transito nell'Unione europea; la casella può essere compilata se il certificato riguarda una merce da importare nell'Unione europea. — Casella I.12.: luogo di destinazione: da compilare soltanto se si tratta di un certificato per merce in transito; i prodotti in transito possono essere immagazzinati unicamente in zone franche, depositi franchi e depositi doganali. — Casella I.15.: numero di immatricolazione (vagoni ferroviari o container e autocarri), numero del volo (aeromobili) o nome (navi); queste informazioni debbono essere aggiornate in caso di scarico e nuovo carico nell'Unione europea. — Casella I.19.: utilizzare il codice SA appropriato: 04.05, 15.01, 15.02, 15.03, 15.04, 15.05, 15.06, 15.16.10 o 15.18. — Casella I.23.: nel caso di contenitori per il trasporto di merci alla rinfusa, indicare il numero del contenitore e il numero del sigillo (se pertinente). — Casella I.25.: uso tecnico: qualsiasi uso diverso dall'alimentazione di animali d'allevamento diversi dagli animali da pelliccia o degli animali da compagnia e dalla produzione o fabbricazione di alimenti per animali da compagnia. — Caselle I.26. e I.27.: compilare a seconda che si tratti di un certificato di transito o d'importazione. — Casella I.28.: — specie: scegliere fra: Ruminantia, diversa da Ruminantia — impianto di fabbricazione: numero di registrazione dello stabilimento di trattamento/trasformazione. Parte II (1a) GU L 300 del 14.11.2009, pag. 1. (1b) GU L 54 del 26.2.2011, pag. 1. (2) Cancellare le voci non pertinenti. (3) GU L 139 del 30.4.2004, pag. 55.  Testo di immagine
Testo di immagine
PAESE Grassi fusi non destinati al consumo umano da utilizzare come materie prime per mangimi II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (4) GU L 147 del 31.5.2001, pag. 1. (5) GU L 172 del 30.6.2007, pag. 84. — Il colore della firma e del timbro dev'essere diverso da quello del testo stampato. — Osservazione per il responsabile della partita nell'Unione europea: il presente certificato è ad uso esclusivamente veterinario e deve accompagnare la partita fino al posto d'ispezione frontaliero dell'Unione europea. Veterinario ufficiale/Ispettore ufficiale Nome e cognome (in stampatello): Titolo e qualifica: Data: Firma: Timbro: CAPO 10(B) Certificato sanitario Per la spedizione o il transito (2) nell'Unione europea di grassi fusi non destinati al consumo umano, da utilizzare per determinati usi esterni alla catena degli alimenti per animali  Testo di immagine
Testo di immagine
PAESE Certificato veterinario per l'esportazione nell'UE Parte I: informazioni relative alla partita spedita I.1. Speditore Nome Indirizzo Tel. I.2. N. di riferimento del certificato I.2.a. I.3. Autorità centrale competente I.4. Autorità locale competente I.5. Destinatario Nome Indirizzo Codice postale Tel. I.6. Persona responsabile della partita nell'UE Nome Indirizzo Codice postale Tel. I.7. Paese di origine Codice ISO I.8. Regione di origine Codice I.9. Paese di destinazione Codice ISO I.10. Regione di destinazione Codice I.11. Luogo di origine Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo I.12. Luogo di destinazione Deposito doganale Nome N. di riconoscimento Indirizzo Codice postale I.13. Luogo di carico I.14. Data di partenza I.15. Mezzo di trasporto Aereo Nave Vagone ferroviario Veicolo stradale Altro Identificazione Riferimento documentale I.16. PIF di entrata nell'UE I.17. I.18. Descrizione della merce I.19. Codice del prodotto (codice SA) I.20. Quantità I.21. Temperatura del prodotto Ambiente Refrigerato Congelato I.22. Numero di colli I.23. Numero del sigillo/contenitore I.24. Tipo di imballaggio  Testo di immagine
Testo di immagine
I.25. Merce certificata per Uso tecnico I.26. Per transito attraverso l'UE verso un paese terzo Paese terzo Codice ISO I.27. Per l'importazione/l'ammissione nell'UE I.28. Identificazione della merce Numero di riconoscimento degli stabilimenti Specie(nome scientifico) Impianto di fabbricazione Numero di colli Peso netto Numero del lotto  Testo di immagine
Testo di immagine
PAESE Grassi fusi non destinati al consumo umano per determinati usi esterni alla catena degli alimenti per animali II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Il sottoscritto, veterinario ufficiale, dichiara di aver preso atto del regolamento (CE) n. 1069/2009 del Parlamento europeo e del Consiglio (1a), in particolare degli articoli 8, 9 e 10, nonché del regolamento (UE) n. 142/2011 della Commissione (1b), in particolare dell'allegato XIV, capo II, e certifica che i grassi fusi di cui sopra: II.1. sono costituiti da grassi fusi non destinati al consumo umano che soddisfano le condizioni sanitarie di seguito indicate; II.2. sono stati preparati esclusivamente con i seguenti sottoprodotti di origine animale: (2) [II.2.1. nel caso di materiali destinati alla produzione di combustibili rinnovabili di cui all'allegato IV, capo IV, sezione 2, lettera L, del regolamento (UE) n. 142/2011, di biodiesel o di prodotti oleochimici, con i sottoprodotti di origine animale di cui agli articoli 8, 9 e 10 del regolamento (CE) n. 1069/2009;] (2) [II.2.2. nel caso di materiali destinati alla produzione di combustibili rinnovabili di cui all'allegato IV, capo IV, sezione 2, lettera J, del regolamento (UE) n. 142/2011, i materiali sono stati ottenuti esclusivamente dai sottoprodotti di origine animale di cui agli articoli 9 e 10 del regolamento (CE) n. 1069/2009;] (2) [II.2.3. nel caso di materiali non destinati all'uso in prodotti cosmetici, farmaceutici o dispositivi medici, i materiali sono stati ottenuti esclusivamente da: (2) [- sottoprodotti di origine animale contenenti residui di sostanze o di agenti inquinanti autorizzati che superano i livelli consentiti di cui all'articolo 15, paragrafo 3, della direttiva 96/23/CE del Consiglio(2a);] (2) e/o [- prodotti di origine animale dichiarati non idonei al consumo umano a causa della presenza di corpi estranei in tali prodotti;] (2) e/o [- animali e parti di animali, diversi da quelli indicati negli articoli 8 e 10 del regolamento (CE) n. 1069/2009, morti per cause diverse dalla macellazione o dall'abbattimento per il consumo umano, compresi gli animali abbattuti per motivi di controllo delle malattie;] (2) e/o [- carcasse e parti di animali macellati oppure, nel caso della selvaggina, corpi o parti di animali uccisi, idonei al consumo umano in conformità della normativa dell'Unione, ma non destinati al consumo umano per motivi commerciali;] (2) e/o [- carcasse e parti seguenti derivanti da animali macellati in un macello e ritenuti atti alla macellazione per il consumo umano dopo un'ispezione ante mortem o corpi e parti seguenti di animali da selvaggina uccisi per il consumo umano nel rispetto della normativa dell'Unione: i) carcasse o corpi e parti di animali respinti in quanto non idonei al consumo umano in virtù della normativa dell'Unione, ma che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali; ii) teste di pollame; iii) pelli, inclusi ritagli e frammenti, corna e zampe, incluse le falangi e le ossa carpiche e metacarpiche e le ossa tarsiche e metatarsiche; iv) setole di suini; v) piume;] (2) e/o [- sangue di animali che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso il sangue, ottenuto da animali macellati in un macello dopo essere stati considerati atti alla macellazione per il consumo umano in seguito a un'ispezione ante mortem conformemente alla normativa dell'Unione;] (2) e/o [- sottoprodotti di origine animale derivanti dalla fabbricazione di prodotti destinati al consumo umano, compresi i ciccioli, le ossa sgrassate e i fanghi da centrifuga o da separatore risultanti dalla lavorazione del latte;] Parte II Certificazione  Testo di immagine
Testo di immagine
PAESE Grassi fusi non destinati al consumo umano per determinati usi esterni alla catena degli alimenti per animali II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) e/o [- prodotti di origine animale, o prodotti alimentari contenenti prodotti di origine animale, i quali non sono più destinati al consumo umano per motivi commerciali o a causa di problemi di fabbricazione o difetti di condizionamento o altri difetti che non determinano rischi per la salute pubblica o degli animali;] (2) e/o [- alimenti per animali da compagnia e mangimi di origine animale o mangimi contenenti sottoprodotti di origine animale o prodotti derivati, non più destinati all'uso nei mangimi per motivi commerciali o a causa di problemi di fabbricazione o difetti di confezionamento o altri difetti che non comportano rischi per la salute pubblica o degli animali;] (2) e/o [- sangue, placenta, lana, piume, peli, corna, frammenti di zoccoli e latte crudo derivanti da animali vivi che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso tali prodotti;] (2) e/o [- animali acquatici e parti di tali animali, eccetto i mammiferi marini, che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali;] (2) e/o [- sottoprodotti di animali acquatici provenienti da stabilimenti o impianti che fabbricano prodotti destinati al consumo umano;] (2) e/o [- i materiali seguenti provenienti da animali che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso tali materiali: i) conchiglie e carapaci di crostacei e molluschi con tessuti molli o carni; ii) i seguenti prodotti derivati da animali terrestri: — sottoprodotti dei centri di incubazione; — uova; — sottoprodotti delle uova, compresi i gusci d'uovo; iii) pulcini di un giorno abbattuti per motivi commerciali;] (2) e/o [- invertebrati acquatici e terrestri, diversi dalle specie patogene per l'uomo o per gli animali;] (2) e/o [- animali e loro parti degli ordini Rodentia e Lagomorpha, eccetto i materiali di categoria 1 di cui all'articolo 8, lettera a), punti iii), iv) e v), e di categoria 2 di cui all'articolo 9, lettere da a) a g), del regolamento (CE) n. 1069/2009;] (2) e/o [- pelli, zoccoli, piume, lana, corna, peli e pellicce ottenuti da animali morti che non presentavano segni di malattie trasmissibili all'uomo o agli animali attraverso tali prodotti;] (2) e/o [- tessuto adiposo di animali che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso tale materiale, ottenuto da animali macellati in un macello e ritenuti atti alla macellazione per il consumo umano in seguito a un esame ante mortem nel rispetto della normativa dell'Unione;]] (2) [II.2.4. nel caso di materiali destinati a fini diversi dalla produzione di fertilizzanti organici o ammendanti, prodotti cosmetici, prodotti farmaceutici o dispositivi medici: (2) [- materiale specifico a rischio ai sensi dell'articolo 3, paragrafo 1, lettera g), del regolamento (CE) n. 999/2001 del Parlamento europeo e del Consiglio (2b);] (2) e/o [- corpi interi o parti di animali morti contenenti materiale specifico a rischio ai sensi dell'articolo 3, paragrafo 1, lettera g), del regolamento (CE) n. 999/2001 al momento dello smaltimento;] (2) e/o [- sottoprodotti di origine animale ottenuti da animali che sono stati sottoposti a trattamenti illeciti ai sensi dell'articolo 1, paragrafo 2, lettera d), della direttiva 96/22/CE del Consiglio(2c) o dell'articolo 2, lettera b), della direttiva 96/23/CE del Consiglio;]  Testo di immagine
Testo di immagine
PAESE Grassi fusi non destinati al consumo umano per determinati usi esterni alla catena degli alimenti per animali II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) e/o [- sottoprodotti di origine animale contenenti residui di altre sostanze e di agenti contaminanti per l'ambiente elencati nell'allegato I, categoria B, punto 3, della direttiva 96/23/CE, se tali residui superano i livelli consentiti dalla normativa dell'Unione o, in assenza di tale normativa, dalla normativa dello Stato membro d'importazione;]] II.3. i grassi fusi: a) sono stati sottoposti a un processo di trasformazione secondo il metodo (indicare il metodo di trasformazione) conformemente all'allegato IV, capo III, del regolamento (UE) n. 142/2011, al fine di distruggere gli agenti patogeni, b) sono stati marcati, prima della spedizione nell'Unione europea, con trieptanoato di glicerina (GTH) in modo da raggiungere una concentrazione omogenea minima di almeno 250 mg di GTH per chilogrammo di grasso, c) nel caso di grassi fusi ottenuti da ruminanti, le impurità insolubili eccedenti lo 0,15 % in peso sono state rimosse, d) sono stati trasportati in condizioni atte a prevenirne la contaminazione, e e) recano un'etichetta sull'imballaggio o sul contenitore con la dicitura "NON DESTINATO AL CONSUMO UMANO O ANIMALE"; (2) [II.4. nel caso di materiali destinati alla produzione di fertilizzanti organici, prodotti cosmetici o farmaceutici, dispositivi medici o ammendanti, i grassi fusi sopra descritti (2) [sono ottenuti da ruminanti diversi da bovini, ovini o caprini.] (2) o [sono ottenuti da bovini, ovini o caprini e non contengono né sono ottenuti da: (2) [materiali ricavati da bovini, ovini e caprini diversi da quelli derivati da animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.] (2) o [a) materiale specifico a rischio di cui all'allegato V, punto 1, del regolamento (CE) n. 999/2001 del Parlamento europeo e del Consiglio (3); b) carni separate meccanicamente ottenute da ossa di bovini, ovini o caprini, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE della Commissione (4) e in cui non si sono verificati casi indigeni di BSE, c) sottoprodotti di origine animale o prodotti derivati ottenuti da bovini, ovini o caprini che sono stati abbattuti, previo stordimento, mediante lacerazione del tessuto nervoso centrale per mezzo di uno stilo inserito nella cavità cranica, o tramite iniezione di gas nella cavità cranica, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o in una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]]] Note Parte I: — Casella I.6.: persona responsabile della partita nell'Unione europea: da compilare soltanto se si tratta di un certificato per merce in transito nell'Unione europea; la casella può essere compilata se il certificato riguarda una merce da importare nell'Unione europea. — Caselle I.11. e I.12.: numero di riconoscimento: numero di registrazione dello stabilimento o dell'impianto, assegnato dall'autorità competente.  Testo di immagine
Testo di immagine
PAESE Grassi fusi non destinati al consumo umano per determinati usi esterni alla catena degli alimenti per animali II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. — Casella I.12.: luogo di destinazione: da compilare soltanto se si tratta di un certificato per merce in transito; i prodotti in transito possono essere immagazzinati unicamente in zone franche, depositi franchi e depositi doganali. — Casella I.15.: indicare il numero di immatricolazione (vagoni ferroviari o container e autocarri), il numero del volo (aeromobili) o il nome (navi). In caso di scarico e nuovo carico nell'Unione europea, lo speditore deve informare il posto d'ispezione frontaliero del punto d'ingresso nell'Unione europea. — Casella I.19.: utilizzare il codice appropriato del sistema armonizzato (SA) delle seguenti voci: 04.05, 15.01, 15.02, 15.03, 15.04, 15.05, 15.06, 15.16 o 15.18. — Casella I.23.: nel caso di contenitori per il trasporto di merci alla rinfusa, indicare il numero del contenitore e il numero del sigillo (se pertinente). — Casella I.25.: uso tecnico: qualsiasi uso diverso dall'alimentazione di animali d'allevamento diversi dagli animali da pelliccia o degli animali da compagnia e dalla produzione o fabbricazione di alimenti per animali da compagnia. — Caselle I.26. e I.27.: compilare a seconda che si tratti di un certificato di transito o d'importazione. — Casella I.28.: specie: scegliere fra: Ruminantia, diversa da Ruminantia impianto di fabbricazione: numero di registrazione dello stabilimento di trattamento/trasformazione. Parte II (1a) GU L 300 del 14.11.2009, pag. 1. (1b) GU L 54 del 26.2.2011, pag. 1. (2) Cancellare le voci non pertinenti. (2a) GU L 125 del 23.5.1996, pag. 10. (2b) GU L 147 del 31.5.2001, pag. 1. (2c) GU L 125 del 23.5.1996, pag. 3. (3) GU L 147 del 31.5.2001, pag. 1. (4) GU L 172 del 30.6.2007, pag. 84. — Il colore della firma e del timbro dev'essere diverso da quello del testo stampato. — Osservazione per il responsabile della partita nell'Unione europea: il presente certificato è ad uso esclusivamente veterinario e deve accompagnare la partita fino al posto d'ispezione frontaliero del punto d'ingresso nell'Unione europea. Veterinario ufficiale/Ispettore ufficiale Nome e cognome (in stampatello): Titolo e qualifica: Data: Firma: Timbro: CAPO 11 Certificato sanitario Per la spedizione o il transito (2) nell'Unione europea di gelatina e collagene non destinati al consumo umano da utilizzare come materia prima per mangimi o a scopi esterni alla catena dei mangimi  Testo di immagine
Testo di immagine
PAESE Certificato veterinario per l'esportazione nell'UE Parte I: informazioni relative alla partita spedita I.1. Speditore Nome Indirizzo Tel. I.2. N. di riferimento del certificato I.2.a. I.3. Autorità centrale competente I.4. Autorità locale competente I.5. Destinatario Nome Indirizzo Codice postale Tel. I.6. Persona responsabile della partita nell'UE Nome Indirizzo Codice postale Tel. I.7. Paese di origine Codice ISO I.8. Regione di origine Codice I.9. Paese di destinazione Codice ISO I.10. Regione di destinazione Codice I.11. Luogo di origine Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo I.12. Luogo di destinazione Deposito doganale Nome N. di riconoscimento Indirizzo Codice postale I.13. Luogo di carico I.14. Data di partenza I.15. Mezzo di trasporto Aereo Nave Vagone ferroviario Veicolo stradale Altro Identificazione Riferimento documentale I.16. PIF di entrata nell'UE I.17. I.18. Descrizione della merce I.19. Codice del prodotto (codice SA) I.20. Quantità I.21. Temperatura del prodotto Ambiente Refrigerato Congelato I.22. Numero di colli I.23. Numero del sigillo/contenitore I.24. Tipo di imballaggio  Testo di immagine
Testo di immagine
I.25. Merce certificata per Alimentazione animale Produzione di alimenti per animali da compagnia Uso tecnico I.26. Per transito attraverso l'UE verso un paese terzo Paese terzo Codice ISO I.27. Per l'importazione/l'ammissione nell'UE I.28. Identificazione della merce Numero di riconoscimento degli stabilimenti Specie (nome scientifico) Impianto di fabbricazione Numero di colli Peso netto Numero del lotto  Testo di immagine
Testo di immagine
PAESE Gelatina e collagene non destinati al consumo umano da utilizzare come materie prime per mangimi o a scopi esterni alla catena dei mangimi II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Il sottoscritto, veterinario ufficiale, dichiara di aver preso atto del regolamento (CE) n. 1069/2009 del Parlamento europeo e del Consiglio(1a) in particolare dell'articolo 10, nonché del regolamento (UE) n. 142/2011 della Commissione(1b), in particolare dell'allegato XIV, capo I, e certifica che la gelatina/il collagene (2) sopraindicati: II.1. sono costituiti da gelatina/collagene (2) che soddisfano le condizioni sanitarie di seguito indicate; II.2. sono costituiti esclusivamente da gelatina/collagene (2) non destinati al consumo umano; II.3. sono stati preparati e immagazzinati in un impianto riconosciuto e controllato dall'autorità competente in conformità dell'articolo 24 del regolamento (CE) n. 1069/2009, al fine di distruggere gli agenti patogeni; II.4. sono stati preparati esclusivamente con i seguenti sottoprodotti di origine animale: (2) [- carcasse e parti di animali macellati oppure, nel caso della selvaggina, corpi o parti di animali uccisi idonei al consumo umano in conformità della normativa dell'Unione, ma non destinati al consumo umano per motivi commerciali;] (2) e/o [- carcasse e parti seguenti derivanti da animali macellati in un macello e ritenuti atti alla macellazione per il consumo umano dopo un'ispezione ante mortem o corpi e parti seguenti di animali da selvaggina uccisi per il consumo umano nel rispetto della normativa dell'Unione: i) carcasse o corpi e parti di animali dichiarati non idonei al consumo umano conformemente alla normativa dell'Unione, ma che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali; ii) teste di pollame; iii) pelli, inclusi ritagli e frammenti, corna e zampe, incluse le falangi e le ossa carpiche e metacarpiche e le ossa tarsiche e metatarsiche; iv) setole di suini; v) piume;] (2) e/o [- sottoprodotti di origine animale derivanti dalla fabbricazione di prodotti destinati al consumo umano, compresi i ciccioli, le ossa sgrassate e i fanghi da centrifuga o da separatore risultanti dalla lavorazione del latte;] (2) e/o [- prodotti di origine animale, o prodotti alimentari contenenti prodotti di origine animale, i quali non sono più destinati al consumo umano per motivi commerciali o a causa di problemi di fabbricazione o difetti di condizionamento o altri difetti che non determinano rischi per la salute pubblica o degli animali;] (2) e/o [- alimenti per animali da compagnia e mangimi di origine animale o mangimi contenenti sottoprodotti di origine animale o prodotti derivati, non più destinati all'uso nei mangimi per motivi commerciali o a causa di problemi di fabbricazione o difetti di confezionamento o altri difetti che non determinano rischi per la salute pubblica o degli animali;] (2) e/o [- animali acquatici e parti di tali animali, eccetto i mammiferi marini, che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali;] (2) e/o [- sottoprodotti di animali acquatici provenienti da stabilimenti o impianti che fabbricano prodotti destinati al consumo umano;] II.5. la gelatina/il collagene (2): a) sono stati confezionati, imballati, immagazzinati e trasportati in condizioni igieniche soddisfacenti; in particolare, il confezionamento e l'imballaggio sono stati effettuati in appositi locali, utilizzando soltanto conservanti consentiti dalla normativa dell'Unione. Parte II Certificazione  Testo di immagine
Testo di immagine
PAESE Gelatina e collagene non destinati al consumo umano da utilizzare come materie prime per mangimi o a scopi esterni alla catena dei mangimi II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Le confezioni e gli imballaggi contenenti la gelatina/il collagene (2) di cui sopra recano la dicitura "GELATINA/COLLAGENE ADATTI ALL'ALIMENTAZIONE DEGLI ANIMALI"; e (2) [b) nel caso della gelatina, è stata prodotta mediante un processo in cui il materiale non trasformato di categoria 3 deve essere sottoposto a un trattamento acido o alcalino, seguito da uno o più risciacqui, con un adeguamento del pH e un'estrazione mediante riscaldamento, ripetuta una o più volte, seguiti da una purificazione tramite filtrazione e sterilizzazione, al fine di distruggere gli agenti patogeni;] (2) o [b) nel caso del collagene, è stato prodotto mediante un processo in cui il materiale non trasformato di categoria 3 deve essere sottoposto a un trattamento comprendente il lavaggio, l'adeguamento del pH mediante acido o alcali, seguiti da uno o più risciacqui, dal filtraggio e dall'estrusione, al fine di distruggere gli agenti patogeni;] (2) [II.6. nel caso di gelatina/collagene(2) ottenuti da materiali diversi da pelli (2) [sono ottenuti da ruminanti diversi da bovini, ovini o caprini.]] (2) o [sono ottenuti da bovini, ovini o caprini e non contengono né sono ottenuti da: (2) [materiali ricavati da bovini, ovini e caprini diversi da quelli derivati da animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]] (2) o [a) materiale specifico a rischio di cui all'allegato V, punto 1, del regolamento (CE) n. 999/2001 del Parlamento europeo e del Consiglio (3); b) carni separate meccanicamente ottenute da ossa di bovini, ovini o caprini, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE della Commissione (4) e in cui non si sono verificati casi indigeni di BSE, c) sottoprodotti di origine animale o prodotti derivati ottenuti da bovini, ovini o caprini che sono stati abbattuti, previo stordimento, mediante lacerazione del tessuto nervoso centrale per mezzo di uno stilo inserito nella cavità cranica, o tramite iniezione di gas nella cavità cranica, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o in una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]]] II.7. nel caso di gelatina/collagene (2) ottenuti da materiali diversi da pelli di cui sopra: (2) [non contengono latte o prodotti a base di latte di origine ovina o caprina o non sono destinati all'alimentazione degli animali d'allevamento diversi dagli animali da pelliccia.] (2) o [contengono latte o prodotti a base di latte di origine ovina o caprina e sono destinati all'alimentazione degli animali d'allevamento diversi dagli animali da pelliccia, e il latte o i prodotti a base di latte: a) sono ottenuti da ovini e caprini che sono rimasti continuativamente dalla nascita in un paese in cui sono soddisfatte le seguenti condizioni: i) la scrapie classica è soggetta a obbligo di notifica; ii) esiste un sistema di sensibilizzazione, sorveglianza e monitoraggio per la scrapie classica; iii) alle aziende di ovini o caprini si applicano restrizioni ufficiali in presenza di un sospetto di TSE o della conferma della scrapie classica;  Testo di immagine
Testo di immagine
PAESE Gelatina e collagene non destinati al consumo umano da utilizzare come materie prime per mangimi o a scopi esterni alla catena dei mangimi II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. iv) gli ovini e i caprini colpiti da scrapie classica sono abbattuti e distrutti; v) la somministrazione agli ovini e ai caprini di farine di carne e ossa o di ciccioli, quali definiti nel codice sanitario per gli animali terrestri dell'organizzazione mondiale per la salute animale (OIE), ricavati da ruminanti è vietata e il divieto è effettivamente applicato in tutto il paese da almeno sette anni; b) provengono da aziende che non sono soggette ad alcuna restrizione ufficiale a causa di un sospetto di TSE; c) provengono da aziende nelle quali, nei sette anni precedenti, non è stato diagnosticato alcun caso di scrapie classica o nelle quali, a seguito della conferma di un caso di scrapie classica: (2) [tutti gli ovini e i caprini dell'azienda sono stati abbattuti e distrutti o macellati, fatta eccezione per i montoni da riproduzione del genotipo ARR/ARR, per le pecore da riproduzione portatrici di almeno un allele ARR e nessun allele VRQ e per gli altri ovini portatori di almeno un allele ARR;] (2) o [tutti gli animali nei quali la scrapie classica è stata confermata sono stati abbattuti e distrutti e l'azienda è stata sottoposta per almeno due anni dalla data di conferma dell'ultimo caso di scrapie classica a una sorveglianza intensificata delle TSE, compresa l'esecuzione di un test con esito negativo per individuare la presenza di TSE conformemente ai metodi di laboratorio di cui dell'allegato X, capitolo C, punto 3.2, del regolamento (CE) n. 999/2001 su tutti i seguenti animali di età superiore ai 18 mesi, esclusi gli ovini del genotipo ARR/ARR: — animali macellati per il consumo umano; e — animali morti o abbattuti nell'azienda, ma non abbattuti nel quadro di una campagna di eradicazione della malattia.]] Note Parte I: — Casella I.6.: persona responsabile della partita nell'Unione europea: da compilare soltanto se si tratta di un certificato per merce in transito nell'Unione europea; la casella può essere compilata se il certificato riguarda una merce da importare nell'Unione europea. — Casella I.12.: luogo di destinazione: casella da compilare solo se si tratta di un certificato per merce in transito. i prodotti in transito possono essere immagazzinati unicamente in zone franche, depositi franchi e depositi doganali. — Casella I.15.: indicare il numero di immatricolazione (vagoni ferroviari o container e autocarri), il numero del volo (aeromobili) o il nome (navi). In caso di scarico e nuovo carico nell'Unione europea, lo speditore deve informare il posto d'ispezione frontaliero del punto d'ingresso nell'Unione europea. — Casella I.19.: utilizzare il codice appropriato del sistema armonizzato (SA) delle seguenti voci: 35.03 o 35.04. — Casella I.23.: nel caso di contenitori per il trasporto di merci alla rinfusa, indicare il numero del contenitore e il numero del sigillo (se pertinente). — Casella I.25.: uso tecnico: qualsiasi uso diverso dall'alimentazione di animali d'allevamento diversi dagli animali da pelliccia e dalla produzione o fabbricazione di alimenti per animali da compagnia. — Caselle I.26. e I.27.: compilare a seconda che si tratti di un certificato di transito o d'importazione. — Casella I.28.: specie: scegliere fra: Aves, Ruminantia, Suidae, Mammalia diversi da Ruminantia o Suidae, Pesca.  Testo di immagine
Testo di immagine
PAESE Gelatina e collagene non destinati al consumo umano da utilizzare come materie prime per mangimi o a scopi esterni alla catena dei mangimi II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Parte II (1a) GU L 300 del 14.11.2009, pag. 1. (1b) GU L 54 del 26.2.2011, pag. 1. (2) Cancellare le voci non pertinenti. (3) GU L 147 del 31.5.2001, pag. 1. (4) GU L 172 del 30.6.2007, pag. 84. — Il colore della firma e del timbro dev'essere diverso da quello del testo stampato. — Osservazione per il responsabile della partita nell'Unione europea: il presente certificato è ad uso esclusivamente veterinario; l'originale deve accompagnare la partita fino al posto d'ispezione frontaliero. Veterinario ufficiale/Ispettore ufficiale Nome e cognome (in stampatello): Titolo e qualifica: Data: Firma: Timbro: CAPO 12 Certificato sanitario Per la spedizione/il transito nell'Unione europea (2) di proteine idrolizzate, fosfato bicalcico e fosfato tricalcico non destinati al consumo umano, da utilizzare come materia prima per mangimi o a scopi esterni alla catena dei mangimi  Testo di immagine
Testo di immagine
PAESE Certificato veterinario per l'esportazione nell'UE Parte I: informazioni relative alla partita spedita I.1. Speditore Nome Indirizzo Tel. I.2. N. di riferimento del certificato I.2.a. I.3. Autorità centrale competente I.4. Autorità locale competente I.5. Destinatario Nome Indirizzo Codice postale Tel. I.6. Persona responsabile della partita nell'UE Nome Indirizzo Codice postale Tel. I.7. Paese di origine Codice ISO I.8. Regione di origine Codice I.9. Paese di destinazione Codice ISO I.10. Regione di destinazione Codice I.11. Luogo di origine Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo I.12. Luogo di destinazione Deposito doganale Nome N. di riconoscimento Indirizzo Codice postale I.13. Luogo di carico I.14. Data di partenza I.15. Mezzo di trasporto Aereo Nave Vagone ferroviario Veicolo stradale Altro Identificazione Riferimento documentale I.16. PIF di entrata nell'UE I.17. I.18. Descrizione della merce I.19. Codice del prodotto (codice SA) I.20. Quantità I.21. Temperatura del prodotto Ambiente Refrigerato Congelato I.22. Numero di colli I.23. Numero del sigillo/contenitore I.24. Tipo di imballaggio  Testo di immagine
Testo di immagine
I.25. Merce certificata per Alimentazione animale Produzione di alimenti per animali da compagnia Uso tecnico I.26. Per transito attraverso l'UE verso un paese terzo Paese terzo Codice ISO I.27. Per l'importazione/l'ammissione nell'UE I.28. Identificazione della merce Numero di riconoscimento degli stabilimenti Specie (nome scientifico) Natura della merce Impianto di fabbricazione Numero di colli Peso netto Numero del lotto  Testo di immagine
Testo di immagine
PAESE Proteine idrolizzate, fosfato bicalcico e fosfato tricalcico non destinati al consumo umano, da utilizzare come materie prime per mangimi o a scopi esterni alla catena dei mangimi II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Il sottoscritto, veterinario ufficiale, dichiara di aver preso atto del regolamento (CE) n. 1069/2009 del Parlamento europeo e del Consiglio (1a), in particolare dell'articolo 10, nonché del regolamento (UE) n. 142/2011 della Commissione (1b), in particolare dell'allegato XIV, capo I, e certifica che le proteine idrolizzate/il fosfato bicalcico/il fosfato tricalcico (2) sopraindicati: II.1. sono costituiti da proteine idrolizzate/fosfato bicalcico/fosfato tricalcico (2) che soddisfano le condizioni sanitarie di seguito indicate; II.2. sono costituiti esclusivamente da proteine idrolizzate/fosfato bicalcico/fosfato tricalcico (2) non destinati al consumo umano; II.3. sono stati preparati e immagazzinati in un impianto riconosciuto e controllato dall'autorità competente in conformità dell'articolo 24 del regolamento (CE) n. 1069/2009, al fine di distruggere gli agenti patogeni; II.4. sono stati preparati esclusivamente con i seguenti sottoprodotti di origine animale: (2) [nel caso di fosfato bicalcico ottenuto da ossa sgrassate, carcasse e parti di animali macellati oppure, nel caso della selvaggina, corpi o parti di animali uccisi idonei al consumo umano in conformità della normativa dell'Unione, ma non destinati al consumo umano per motivi commerciali;] (2) o [se si tratta di altri materiali: (2) [- carcasse e parti di animali macellati oppure, nel caso della selvaggina, corpi o parti di animali uccisi idonei al consumo umano in conformità della normativa dell'Unione, ma non destinati al consumo umano per motivi commerciali;]] (2) e/o [- carcasse e parti seguenti derivanti da animali macellati in un macello e ritenuti atti alla macellazione per il consumo umano dopo un'ispezione ante mortem o corpi e parti seguenti di animali da selvaggina uccisi per il consumo umano nel rispetto della normativa dell'Unione: i) carcasse o corpi e parti di animali dichiarati non idonei al consumo umano conformemente alla normativa dell'Unione, ma che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali; ii) teste di pollame; iii) pelli, inclusi ritagli e frammenti, corna e zampe, incluse le falangi e le ossa carpiche e metacarpiche e le ossa tarsiche e metatarsiche; iv) setole di suini; v) piume;]] (2) e/o [- sangue di animali che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso il sangue, ottenuto da animali macellati in un macello dopo essere stati considerati atti alla macellazione per il consumo umano in seguito a un'ispezione ante mortem conformemente alla normativa dell'Unione;]] (2) e/o [- sottoprodotti di origine animale derivanti dalla fabbricazione di prodotti destinati al consumo umano, compresi i ciccioli, le ossa sgrassate e i fanghi da centrifuga o da separatore risultanti dalla lavorazione del latte;]] (2) e/o [- prodotti di origine animale, o prodotti alimentari contenenti prodotti di origine animale, i quali non sono più destinati al consumo umano per motivi commerciali o a causa di problemi di fabbricazione o difetti di condizionamento o altri difetti che non determinano rischi per la salute pubblica o degli animali;]] Parte II Certificazione  Testo di immagine
Testo di immagine
PAESE Proteine idrolizzate, fosfato bicalcico e fosfato tricalcico non destinati al consumo umano, da utilizzare come materie prime per mangimi o a scopi esterni alla catena dei mangimi II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) e/o [- alimenti per animali da compagnia e mangimi di origine animale o mangimi contenenti sottoprodotti di origine animale o prodotti derivati, non più destinati all'uso nei mangimi per motivi commerciali o a causa di problemi di fabbricazione o difetti di confezionamento o altri difetti che non determinano rischi per la salute pubblica o degli animali;]] (2) e/o [- sangue, placenta, lana, piume, peli, corna, frammenti di zoccoli e latte crudo derivanti da animali vivi che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso tali prodotti;]] (2) e/o [- animali acquatici e parti di tali animali, eccetto i mammiferi marini, che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali;]] (2) e/o [- sottoprodotti di animali acquatici provenienti da stabilimenti o impianti che fabbricano prodotti destinati al consumo umano;]] (2) e/o [- i materiali seguenti provenienti da animali che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso tali materiali: i) conchiglie e carapaci di crostacei e molluschi con tessuti molli o carni; ii) i seguenti prodotti derivati da animali terrestri: — sottoprodotti dei centri di incubazione; — uova; — sottoprodotti delle uova, compresi i gusci d'uovo; iii) pulcini di un giorno abbattuti per motivi commerciali;]] II.5. le proteine idrolizzate/il fosfato bicalcico/il fosfato tricalcico (2) di cui sopra: a) sono stati confezionati ed imballati in imballaggi recanti la dicitura "NON DESTINATI AL CONSUMO UMANO" e sono stati conservati e trasportati in condizioni igieniche soddisfacenti. In particolare, il confezionamento e l'imballaggio hanno avuto luogo in appositi locali e sono stati utilizzati soltanto conservanti consentiti dalla normativa dell'Unione; e (2) [b) se si tratta di proteine idrolizzate, esse sono state prodotte mediante un processo che comprende misure atte a minimizzare i rischi di contaminazione delle materie prime di categoria 3. Se si tratta di proteine idrolizzate interamente o parzialmente derivate da pelli di ruminanti, tali proteine sono state prodotte in un impianto di trasformazione adibito alla sola produzione di proteine idrolizzate, utilizzando un processo che comprenda la preparazione delle materie prime di categoria 3 mediante salatura in salamoia, calcinazione e lavaggio intensivo seguita: i) dall'esposizione dei materiali a un pH superiore a 11 per più di 3 ore ad una temperatura superiore a 80 °C e successivamente da un trattamento termico ad una temperatura di oltre 140 °C per 30 minuti a una pressione superiore a 3,6 bar; o ii) dall'esposizione dei materiali a un pH compreso tra 1 e 2, poi a un pH superiore a 11, seguita da un trattamento termico ad una superiore a 140 °C per 30 minuti a una pressione di 3 bar.] (2) o [b) nel caso del fosfato bicalcico, è stato prodotto con un processo che: i) prevede che tutto il materiale osseo di categoria 3 sia finemente triturato, sgrassato con acqua calda e trattato con acido cloridrico diluito (con una concentrazione minima del 4 % e un pH inferiore a 1,5) per almeno due giorni, ii) comporta poi un trattamento con calce del liquido fosforico ottenuto che porta alla formazione di un precipitato di fosfato bicalcico con pH compreso tra 4 e 7, e  Testo di immagine
Testo di immagine
PAESE Proteine idrolizzate, fosfato bicalcico e fosfato tricalcico non destinati al consumo umano, da utilizzare come materie prime per mangimi o a scopi esterni alla catena dei mangimi II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. iii) prevede infine che tale precipitato sia essiccato con aria avente una temperatura d'ingresso compresa tra 65 °C e 325 °C e una temperatura di uscita compresa fra 30 °C e 65 °C.] (2) o [b) nel caso del fosfato tricalcico, è stato prodotto mediante un processo atto a garantire che: i) tutto il materiale osseo di categoria 3 sia finemente triturato e sgrassato con un getto contrario di acqua calda (frammenti ossei di dimensioni inferiori a 14 mm), ii) i frammenti vengano sottoposti a cottura continua a vapore a 145 °C per 30 minuti a 4 bar, iii) il brodo di proteine venga separato dall'idrossiapatite (fosfato tricalcico) mediante centrifugazione, e iv) il fosfato tricalcico venga granulato dopo essere stato essiccato in un letto fluido con aria a 200 °C.] (2) [II.6. le proteine idrolizzate/il fosfato bicalcico/il fosfato tricalcico (2) di cui sopra: (2) [sono ottenuti da ruminanti diversi da bovini, ovini o caprini.]] (2) o [sono ottenuti da bovini, ovini o caprini e non contengono né sono ottenuti da: (2) [materiali ricavati da bovini, ovini e caprini diversi da quelli derivati da animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]] (2) o [a) materiale specifico a rischio di cui all'allegato V, punto 1, del regolamento (CE) n. 999/2001 del Parlamento europeo e del Consiglio (3); b) carni separate meccanicamente ottenute da ossa di bovini, ovini o caprini, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE della Commissione (4) e in cui non si sono verificati casi indigeni di BSE, c) sottoprodotti di origine animale o prodotti derivati ottenuti da bovini, ovini o caprini che sono stati abbattuti, previo stordimento, mediante lacerazione del tessuto nervoso centrale per mezzo di uno stilo inserito nella cavità cranica, o tramite iniezione di gas nella cavità cranica, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o in una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]]] II.7. le proteine idrolizzate/il fosfato bicalcico/il fosfato tricalcico (2) di cui sopra: (2) [non contengono latte o prodotti a base di latte di origine ovina o caprina o non sono destinati all'alimentazione degli animali d'allevamento diversi dagli animali da pelliccia.] (2) o [contengono latte o prodotti a base di latte di origine ovina o caprina e sono destinati all'alimentazione degli animali d'allevamento diversi dagli animali da pelliccia, e il latte o i prodotti a base di latte: a) sono ottenuti da ovini e caprini che sono rimasti continuativamente dalla nascita in un paese in cui sono soddisfatte le seguenti condizioni: i) la scrapie classica è soggetta a obbligo di notifica; ii) esiste un sistema di sensibilizzazione, sorveglianza e monitoraggio per la scrapie classica; iii) alle aziende di ovini o caprini si applicano restrizioni ufficiali in presenza di un sospetto di TSE o della conferma della scrapie classica;  Testo di immagine
Testo di immagine
PAESE Proteine idrolizzate, fosfato bicalcico e fosfato tricalcico non destinati al consumo umano, da utilizzare come materie prime per mangimi o a scopi esterni alla catena dei mangimi II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. iv) gli ovini e i caprini colpiti da scrapie classica sono abbattuti e distrutti; v) la somministrazione agli ovini e ai caprini di farine di carne e ossa o di ciccioli, quali definiti nel codice sanitario per gli animali terrestri dell'organizzazione mondiale per la salute animale (OIE), ricavati da ruminanti è vietata e il divieto è effettivamente applicato in tutto il paese da almeno sette anni; b) provengono da aziende che non sono soggette ad alcuna restrizione ufficiale a causa di un sospetto di TSE; c) provengono da aziende nelle quali, nei sette anni precedenti, non è stato diagnosticato alcun caso di scrapie classica o nelle quali, a seguito della conferma di un caso di scrapie classica: (2) [tutti gli ovini e i caprini dell'azienda sono stati abbattuti e distrutti o macellati, fatta eccezione per i montoni da riproduzione del genotipo ARR/ARR, per le pecore da riproduzione portatrici di almeno un allele ARR e nessun allele VRQ e per gli altri ovini portatori di almeno un allele ARR;] (2) o [tutti gli animali nei quali la scrapie classica è stata confermata sono stati abbattuti e distrutti e l'azienda è stata sottoposta per almeno due anni dalla data di conferma dell'ultimo caso di scrapie classica a una sorveglianza intensificata delle TSE, compresa l'esecuzione di un test con esito negativo per individuare la presenza di TSE conformemente ai metodi di laboratorio di cui dell'allegato X, capitolo C, punto 3.2, del regolamento (CE) n. 999/2001 su tutti i seguenti animali di età superiore ai 18 mesi, esclusi gli ovini del genotipo ARR/ARR: — animali macellati per il consumo umano; e — animali morti o abbattuti nell'azienda, ma non abbattuti nel quadro di una campagna di eradicazione della malattia.]] Note Parte I: — Casella I.6.: persona responsabile della partita nell'Unione europea: da compilare soltanto se si tratta di un certificato per merce in transito nell'Unione europea; la casella può essere compilata se il certificato riguarda una merce da importare nell'Unione europea. — Casella I.12.: luogo di destinazione: da compilare soltanto se si tratta di un certificato per merce in transito; i prodotti in transito possono essere immagazzinati unicamente in zone franche, depositi franchi e depositi doganali. — Casella I.15.: numero di immatricolazione (vagoni ferroviari o container e autocarri), numero del volo (aeromobili) o nome (navi); informazioni da fornire in caso di scarico e nuovo carico. — Casella I.19.: utilizzare il codice SA appropriato: 05.08, 28.35.25, 28.35.26, 29.22, 35.02, 35.03 o 35.04. — Casella I.23.: nel caso di contenitori per il trasporto di merci alla rinfusa, indicare il numero del contenitore e il numero del sigillo (se pertinente). — Casella I.25.: uso tecnico: qualsiasi uso diverso dall'alimentazione di animali d'allevamento diversi dagli animali da pelliccia e dalla produzione o fabbricazione di alimenti per animali da compagnia. — Caselle I.26. e I.27.: compilare a seconda che si tratti di un certificato di transito o d'importazione. — Casella I.28.: — specie: scegliere fra: Aves, Ruminantia, Suidae, Mammalia diversi da Ruminantia e Suidae, Pesca, Mollusca, Crustacea, invertebrati diversi da Mollusca e Crustacea;  Testo di immagine
Testo di immagine
PAESE Proteine idrolizzate, fosfato bicalcico e fosfato tricalcico non destinati al consumo umano, da utilizzare come materie prime per mangimi o a scopi esterni alla catena dei mangimi II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. — natura della merce: specificare se proteine idrolizzate, fosfato bicalcico o fosfato tricalcico; — impianto di fabbricazione: numero di registrazione dello stabilimento di trattamento/trasformazione. Parte II (1a) GU L 300 del 14.11.2009, pag. 1. (1b) GU L 54 del 26.2.2011, pag. 1. (2) Cancellare le voci non pertinenti. (3) GU L 147 del 31.5.2001, pag. 1. (4) GU L 94 dell'1.4.2006, pag. 28. — Il colore della firma e del timbro dev'essere diverso da quello del testo stampato. — Osservazione per il responsabile della partita nell'Unione europea: il presente certificato è ad uso esclusivamente veterinario e deve accompagnare la partita fino al posto d'ispezione frontaliero del punto d'ingresso nell'Unione europea. Veterinario ufficiale/Ispettore ufficiale Nome e cognome (in stampatello): Titolo e qualifica: Data: Firma: Timbro: |
|
6) |
il capo 18 è sostituito dal seguente: «CAPO 18 Certificato sanitario Per la spedizione o il transito nell'Unione europea (2) di corna e prodotti a base di corna, esclusa la farina di corna, e zoccoli e prodotti a base di zoccoli, esclusa la farina di zoccoli, destinati alla produzione di fertilizzanti organici o ammendanti  Testo di immagine
Testo di immagine
PAESE Certificato veterinario per l'esportazione nell'UE Parte I: informazioni relative alla partita spedita I.1. Speditore Nome Indirizzo Tel. I.2. N. di riferimento del certificato I.2.a. I.3. Autorità centrale competente I.4. Autorità locale competente I.5. Destinatario Nome Indirizzo Codice postale Tel. I.6. Persona responsabile della partita nell'UE Nome Indirizzo Codice postale Tel. I.7. Paese di origine Codice ISO I.8. Regione di origine Codice I.9. Paese di destinazione Codice ISO I.10. Regione di destinazione Codice I.11. Luogo di origine Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo I.12. Luogo di destinazione Deposito doganale Nome N. di riconoscimento Indirizzo Codice postale I.13. Luogo di carico I.14. Data di partenza I.15. Mezzo di trasporto Aereo Nave Vagone ferroviario Veicolo stradale Altro Identificazione Riferimento documentale I.16. PIF di entrata nell'UE I.17. Numero/i CITES I.18. Descrizione della merce I.19. Codice del prodotto (codice SA) 05.07 I.20. Quantità I.21. Temperatura del prodotto Ambiente Refrigerato Congelato I.22. Numero di colli I.23. Numero del sigillo/contenitore I.24. Tipo di imballaggio  Testo di immagine
Testo di immagine
I.25. Merce certificata per Trasformazione suppl. Uso tecnico I.26. Per transito attraverso l'UE verso un paese terzo Paese terzo Codice ISO I.27. Per l'importazione/l'ammissione nell'UE I.28. Identificazione della merce Numero di riconoscimento degli stabilimenti Specie (nome scientifico) Impianto di fabbricazione Peso netto Numero del lotto  Testo di immagine
Testo di immagine
PAESE Corna e prodotti a base di corna, esclusa la farina di corna, e zoccoli e prodotti a base di zoccoli, esclusa la farina di zoccoli, destinati alla produzione di fertilizzanti organici o ammendanti II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Il sottoscritto, veterinario ufficiale, dichiara di aver preso atto del regolamento (CE) n. 1069/2009 del Parlamento europeo e del Consiglio (1a) e del regolamento (UE) n. 142/2011 della Commissione (1b), in particolare dell'allegato II, capo XIV, e certifica che le corna e i prodotti a base di corna, esclusa la farina di corna, e gli zoccoli e i prodotti a base di zoccoli, esclusa la farina di zoccoli (2), di cui sopra: II.1. sono stati ottenuti da animali (2) [macellati in un macello dopo aver subito un'ispezione ante mortem e considerati, in esito a tale ispezione, atti alla macellazione in vista del consumo umano;] (2) o [che non presentavano segni clinici di malattie trasmissibili mediante tale prodotto all'uomo o agli animali;] II.2. le corna, i prodotti a base di corna, gli zoccoli e i prodotti a base di zoccoli devono essere stati sottoposti ad un trattamento termico per almeno un'ora ad una temperatura al centro della massa di almeno 80 °C; II.3. le corna sono state asportate dal cranio con un metodo che consente di lasciare intatta la cavità cranica; II.4. in ogni fase di trasformazione, magazzinaggio o trasporto devono essere state prese tutte le precauzioni atte ad evitare la contaminazione incrociata. II.5. le corna e i prodotti a base di corna, esclusa la farina di corna, e gli zoccoli e i prodotti a base di zoccoli, esclusa la farina di zoccoli, sono stati imballati: (2) [in contenitori o imballaggi nuovi;] (2) o [in veicoli o contenitori per il trasporto alla rinfusa, disinfettati prima del carico con un prodotto approvato dall'autorità competente;] e l'imballaggio o i contenitori sono contrassegnati in modo da indicare il tipo di sottoprodotto di origine animale (3) e recano etichette con la dicitura "NON DESTINATO AL CONSUMO UMANO E ANIMALE" nonché il nome e l'indirizzo dello stabilimento di destinazione. (2) [II.6. Le corna e i prodotti a base di corna, esclusa la farina di corna, e gli zoccoli e i prodotti a base di zoccoli, esclusa la farina di zoccoli di cui sopra (2) [sono ottenuti da ruminanti diversi da bovini, ovini o caprini.]] (2) o [sono ottenuti da bovini, ovini o caprini e non contengono né sono ottenuti da: (2) [materiali ricavati da bovini, ovini e caprini diversi da quelli derivati da animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.] (2) o [a) materiale specifico a rischio di cui all'allegato V, punto 1, del regolamento (CE) n. 999/2001 del Parlamento europeo e del Consiglio (4); b) carni separate meccanicamente ottenute da ossa di bovini, ovini o caprini, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE della Commissione (5) e in cui non si sono verificati casi indigeni di BSE, c) sottoprodotti di origine animale o prodotti derivati ottenuti da bovini, ovini o caprini che sono stati abbattuti, previo stordimento, mediante lacerazione del tessuto nervoso centrale per mezzo di uno stilo inserito nella cavità cranica, o tramite iniezione di gas nella cavità cranica, salvo nel caso di animali nati, allevati continuativamente e macellati in un paese o in una regione classificati come aventi un rischio di BSE trascurabile conformemente alla decisione 2007/453/CE.]]] Parte II Certificazione  Testo di immagine
Testo di immagine
PAESE Corna e prodotti a base di corna, esclusa la farina di corna, e zoccoli e prodotti a base di zoccoli, esclusa la farina di zoccoli, destinati alla produzione di fertilizzanti organici o ammendanti II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. Note Parte I: — Casella I.6.: persona responsabile della partita nell'Unione europea: da compilare soltanto se si tratta di un certificato per merce in transito nell'Unione europea; la casella può essere compilata se il certificato riguarda una merce da importare nell'Unione europea. — Caselle I.11. e I.12.: numero di riconoscimento: numero di registrazione dello stabilimento o dell'impianto, assegnato dall'autorità competente. — Casella I.12.: luogo di destinazione: da compilare soltanto se si tratta di un certificato per merce in transito; i prodotti in transito devono essere immagazzinati unicamente in zone franche, depositi franchi e depositi doganali. — Casella I.15.: numero di immatricolazione (vagoni ferroviari o container e autocarri), numero del volo (aeromobili) o nome (navi); queste informazioni devono essere aggiornate in caso di scarico e nuovo carico nell'Unione europea. — Casella I.23.: nel caso di contenitori per il trasporto di merci alla rinfusa, indicare il numero del contenitore e il numero del sigillo (se pertinente). — Casella I.25.: uso tecnico: ogni uso diverso dal consumo animale. — Caselle I.26. e I.27.: compilare a seconda che si tratti di un certificato di transito o d'importazione. — Casella I.28.: natura della merce. Parte II (1a) GU L 300 del 14.11.2009, pag. 1. (1b) GU L 54 del 26.2.2011, pag. 1. (2) Cancellare le voci non pertinenti. (3) Tipo di prodotto: corna, prodotti a base di corna, zoccoli, prodotti a base di zoccoli. (4) GU L 147 del 31.5.2001, pag. 1. (5) GU L 172 del 30.6.2007, pag. 84. — Il colore della firma e del timbro dev'essere diverso da quello del testo stampato. — Osservazione per il responsabile della partita nell'Unione europea: il presente certificato è ad uso esclusivamente veterinario e deve accompagnare la partita fino al posto d'ispezione frontaliero del punto d'ingresso nell'Unione europea. Veterinario ufficiale/Ispettore ufficiale Nome e cognome (in stampatello): Titolo e qualifica: Data: Firma: Timbro: |
|
7) |
il capo 20 è sostituito dal seguente: «CAPO 20 Modello di dichiarazione Dichiarazione relativa all'importazione da paesi terzi e al transito (2) nell'Unione europea di prodotti intermedi da utilizzare nella fabbricazione di medicinali, medicinali veterinari, dispositivi medici per scopi medici e veterinari, dispositivi medici impiantabili attivi, dispositivi medico-diagnostici in vitro per scopi medici e veterinari, reagenti di laboratorio e prodotti cosmetici  Testo di immagine
Testo di immagine
PAESE Certificato veterinario per l'esportazione nell'UE Parte I: informazioni relative alla partita spedita I.1. Speditore Nome Indirizzo Tel. I.2. N. di riferimento del certificato I.2.a. I.3. Autorità centrale competente I.4. Autorità locale competente I.5. Destinatario Nome Indirizzo Codice postale Tel. I.6. Persona responsabile della partita nell'UE Nome Indirizzo Codice postale Tel. I.7. Paese di origine Codice ISO I.8. Regione di origine Codice I.9. Paese di destinazione Codice ISO I.10. Regione di destinazione Codice I.11. Luogo di origine Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo Nome N. di riconoscimento Indirizzo I.12. Luogo di destinazione Deposito doganale Nome N. di riconoscimento Indirizzo Codice postale I.13. Luogo di carico I.14. Data di partenza I.15. Mezzo di trasporto Aereo Nave Vagone ferroviario Veicolo stradale Altro Identificazione Riferimento documentale I.16. PIF di entrata nell'UE I.17. I.18. Descrizione della merce I.19. Codice del prodotto (codice SA) I.20. Quantità I.21. Temperatura del prodotto Ambiente Refrigerato Congelato I.22. Numero di colli I.23. Numero del sigillo/contenitore I.24. Tipo di imballaggio  Testo di immagine
Testo di immagine
I.25. Merce certificata per Uso tecnico I.26. Per transito attraverso l'UE verso un paese terzo Paese terzo Codice ISO I.27. Per l'importazione/l'ammissione nell'UE I.28. Identificazione della merce Numero di riconoscimento degli stabilimenti Specie (nome scientifico) Impianto di fabbricazione Peso netto Numero del lotto  Testo di immagine
Testo di immagine
PAESE Prodotti intermedi da utilizzare nella fabbricazione di medicinali, medicinali veterinari, dispositivi medici per scopi medici e veterinari, dispositivi medici impiantabili attivi, dispositivi medico-diagnostici in vitro per scopi medici e veterinari, reagenti di laboratorio e prodotti cosmetici II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. DICHIARAZIONE Il sottoscritto dichiara che il prodotto intermedio di cui sopra è destinato ad essere importato da lui stesso o fatto transitare nell'Unione e risponde alla definizione di prodotto intermedio di cui all'allegato I, punto 35, del regolamento (UE) n. 142/2011 della Commissione (1a), e in particolare che: 1) è destinato alla fabbricazione di: (2) [- medicinali,] (2) e/o [- medicinali veterinari,] (2) e/o [- dispositivi medici per scopi medici e veterinari,] (2) e/o [- dispositivi medici impiantabili attivi,] (2) e/o [- dispositivi medico-diagnostici in vitro per scopi medici e veterinari,] (2) e/o [- reagenti di laboratorio,] (2) e/o [- prodotti cosmetici;] 2) le fasi di progettazione, trasformazione e fabbricazione sono state eseguite in modo da qualificare il materiale direttamente o quale componente di un prodotto destinato a tale scopo, eccetto per il fatto che, al fine di essere idoneo all'immissione sul mercato o alla messa in servizio quale medicinale, medicinale veterinario, dispositivo medico per scopi medici o veterinari, dispositivo medico impiantabile attivo, dispositivo medico-diagnostico in vitro per scopi medici o veterinari o prodotto cosmetico secondo la normativa dell'Unione (1b) applicabile a detti prodotti o quale reagente di laboratorio, richiede ulteriore fabbricazione o trasformazione, ad esempio miscelazione, rivestimento, assemblaggio o imballaggio; 3) è stato ottenuto da: (2) [- materiali che possono derivare da animali sottoposti a trattamenti illeciti come definiti all'articolo 1, paragrafo 2, lettera d), della direttiva 96/22/CE del Consiglio (2a) o all'articolo 2, lettera b), della direttiva 96/23/CE del Consiglio (2b);] (2) e/o [- carcasse e parti di animali macellati oppure, nel caso della selvaggina, corpi o parti di animali uccisi idonei al consumo umano in conformità della normativa dell'Unione, ma non destinati al consumo umano per motivi commerciali;] (2) e/o [- carcasse e parti seguenti derivanti da animali macellati in un macello e ritenuti atti alla macellazione per il consumo umano dopo un'ispezione ante mortem o corpi e parti seguenti di animali da selvaggina uccisi per il consumo umano nel rispetto della normativa dell'Unione: i) carcasse o corpi e parti di animali dichiarati non idonei al consumo umano conformemente alla normativa dell'Unione, ma che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali; ii) teste di pollame; iii) pelli, inclusi ritagli e frammenti, corna e zampe, incluse le falangi e le ossa carpiche e metacarpiche e le ossa tarsiche e metatarsiche, di animali diversi dai ruminanti; iv) setole di suini; v) piume;] Parte II Certificazione  Testo di immagine
Testo di immagine
PAESE Prodotti intermedi da utilizzare nella fabbricazione di medicinali, medicinali veterinari, dispositivi medici per scopi medici e veterinari, dispositivi medici impiantabili attivi, dispositivi medico-diagnostici in vitro per scopi medici e veterinari, reagenti di laboratorio e prodotti cosmetici II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) e/o [- sangue di animali che non presentavano segni clinici di malattie trasmissibili all'uomo o agli animali attraverso il sangue, ottenuto da animali diversi dai ruminanti macellati in un macello dopo essere stati ritenuti atti alla macellazione per il consumo umano in seguito a un'ispezione ante mortem nel rispetto della normativa dell'Unione;] (2) e/o [- sottoprodotti di origine animale derivanti dalla fabbricazione di prodotti destinati al consumo umano, compresi i ciccioli, le ossa sgrassate e i fanghi da centrifuga o da separatore risultanti dalla lavorazione del latte;] (2) e/o [- prodotti di origine animale, o prodotti alimentari contenenti prodotti di origine animale, i quali non sono più destinati al consumo umano per motivi commerciali o a causa di problemi di fabbricazione o difetti di condizionamento o altri difetti che non determinano rischi per la salute pubblica o animale;] (2) e/o [- alimenti per animali da compagnia e mangimi di origine animale o mangimi contenenti sottoprodotti di origine animale o prodotti derivati, non più destinati all'uso nei mangimi per motivi commerciali o a causa di problemi di fabbricazione o difetti di confezionamento o altri difetti che non determinano rischi per la salute pubblica o degli animali;] (2) e/o [- sangue, placenta, lana, piume, peli, corna, frammenti di zoccoli e latte crudo derivanti da animali vivi che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso tali prodotti;] (2) e/o [- animali acquatici e parti di tali animali, eccetto i mammiferi marini, che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali;] (2) e/o [- sottoprodotti di animali acquatici provenienti da stabilimenti o impianti che fabbricano prodotti destinati al consumo umano;] (2) e/o [- i materiali seguenti provenienti da animali che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali attraverso tali materiali: i) conchiglie e carapaci di crostacei e molluschi con tessuti molli o carni; ii) i seguenti prodotti derivati da animali terrestri: — sottoprodotti dei centri di incubazione; — uova; — sottoprodotti delle uova, compresi i gusci d'uovo; iii) pulcini di un giorno abbattuti per motivi commerciali;] (2) e/o [- sottoprodotti di origine animale ottenuti da invertebrati acquatici e terrestri diversi dalle specie patogene per l'uomo o per gli animali;] (2) e/o [- animali e loro parti degli ordini Rodentia e Lagomorpha, eccetto i materiali di categoria 1 di cui all'articolo 8, lettera a), punti iii), iv) e v), e di categoria 2 di cui all'articolo 9, lettere da a) a g), del regolamento (CE) n. 1069/2009;] (2) e/o [- prodotti ottenuti o generati da: — animali acquatici e parti di tali animali, eccetto i mammiferi marini, che non presentavano sintomi di malattie trasmissibili all'uomo o agli animali; — invertebrati acquatici o terrestri diversi dalle specie patogene per l'uomo o per gli animali; — animali e loro parti degli ordini Rodentia e Lagomorpha, eccetto i materiali di categoria 1 di cui all'articolo 8, lettera a), punti iii), iv) e v), e di categoria 2 di cui all'articolo 9, lettere da a) a g) del regolamento (CE) n. 1069/2009;]  Testo di immagine
Testo di immagine
PAESE Prodotti intermedi da utilizzare nella fabbricazione di medicinali, medicinali veterinari, dispositivi medici per scopi medici e veterinari, dispositivi medici impiantabili attivi, dispositivi medico-diagnostici in vitro per scopi medici e veterinari, reagenti di laboratorio e prodotti cosmetici II. Informazioni sanitarie II.a. N. di riferimento del certificato II.b. (2) e/o [- animali e parti di animali, diversi da quelli di cui all'articolo 8 o all'articolo 10 del regolamento (CE)n. 1069/2009, i) che non sono stati macellati o abbattuti per il consumo umano, inclusi gli animali abbattuti a fini di controllo delle malattie; ii) feti; iii) ovociti, embrioni e sperma non destinati alla riproduzione; e iv) pollame morto nell'uovo;] (2) e/o [- sottoprodotti di origine animale che non sono materiali di categoria 1 e 3;] 4) sul suo imballaggio esterno figura l'etichetta "DESTINATO UNICAMENTE A MEDICINALI/MEDICINALI VETERINARI/DISPOSITIVI MEDICI PER SCOPI MEDICI E VETERINARI/DISPOSITIVI MEDICI IMPIANTABILI ATTIVI/DISPOSITIVI MEDICO-DIAGNOSTICI IN VITRO PER SCOPI MEDICI E VETERINARI/REAGENTI DI LABORATORIO/PRODOTTI COSMETICI" e non è destinato ad altri usi in nessun momento all'interno dell'Unione europea; 5) la partita è trasportata direttamente al luogo di destinazione nell'Unione europea, come indicato al punto I.12. della presente dichiarazione, ossia: (2) [ad uno stabilimento o impianto di fabbricazione di medicinali, medicinali veterinari, dispositivi medici per scopi medici e veterinari, dispositivi medici impiantabili attivi, dispositivi medico-diagnostici in vitro per scopi medici e veterinari, reagenti di laboratorio o prodotti cosmetici, registrato a norma dell'articolo 23 del regolamento (CE) n. 1069/2009], (2) o [ad uno stabilimento o impianto riconosciuto a norma dell'articolo 24, paragrafo 1, lettera i), del regolamento (CE) n. 1069/2009, dal quale saranno solo spediti ad uno stabilimento o impianto indicato al trattino precedente di questo punto.] Note — Casella I.19.: utilizzare il codice appropriato del sistema armonizzato (SA) conformemente alla decisione 2007/275/CE della Commissione, del 17 aprile 2007, relativa agli elenchi di animali e prodotti da sottoporre a controlli presso i posti d'ispezione frontalieri a norma delle direttive del Consiglio 91/496/CEE e 97/78/CE (GU L 116 del 4.5.2007, pag. 9). — Casella I.25.: uso tecnico: ogni uso diverso dal consumo animale. (1a) GU L 54 del 26.2.2011, pag. 1. (1b) Direttiva 2001/82/CE del Parlamento europeo e del Consiglio, del 6 novembre 2001, recante un codice comunitario relativo ai medicinali veterinari (GU L 311 del 28.11.2001, pag. 1), direttiva 2001/83/CE del Parlamento europeo e del Consiglio, del 6 novembre 2001, recante un codice comunitario relativo ai medicinali per uso umano (GU L 311 del 28.11.2001, pag. 67), direttiva 93/42/CEE del Consiglio, del 14 giugno 1993, concernente i dispositivi medici (GU L 169 del 12.7.1993, pag. 1) e direttiva 98/79/CE del Parlamento europeo e del Consiglio, del 27 ottobre 1998, relativa ai dispositivi medico-diagnostici in vitro (GU L 331 del 7.12.1998, pag. 1), regolamento (CE) n. 1223/2009 del Parlamento europeo e del Consiglio, del 30 novembre 2009, sui prodotti cosmetici (GU L 342 del 22.12.2009, pag. 59), a seconda del caso. (2) Cancellare le voci non pertinenti. (2a) GU L 125 del 23.5.1996, pag. 3. (2b) GU L 125 del 23.5.1996, pag. 10. Importatore Nome e cognome (in stampatello): Indirizzo: Data: Firma: |