ALLEGATO I
UNGULATI
PARTE 1
Elenco di paesi terzi, territori o loro parti (1)
|
Codice ISO e nome del paese terzo |
Codice del territorio |
Descrizione del paese terzo, del territorio o di parte dei medesimi |
Certificato veterinario |
Condizioni specifiche |
|||||||
|
Modelli |
GS |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
||||||
|
CA – Canada |
CA-0 |
Tutto il paese |
POR-X |
|
IVb IX |
||||||
|
CA-1 |
Tutto il paese eccetto la regione della valle di Okanagan nella Columbia Britannica, delimitata come segue:
|
BOV-X, OVI-X, OVI-Y RUM (2) |
A |
||||||||
|
CH – Svizzera |
CH-0 |
Tutto il paese |
|
|
|||||||
|
CL – Cile |
CL-0 |
Tutto il paese |
BOV-X, OVI-X, RUM |
|
|
||||||
|
POR-X, SUI |
B |
|
|||||||||
|
GL – Groenlandia |
GL-0 |
Tutto il paese |
OVI-X, RUM |
|
V |
||||||
|
HR – Croazia |
HR-0 |
Tutto il paese |
BOV-X, BOV-Y, RUM, OVI-X, OVI-Y |
|
|
||||||
|
IS – Islanda |
IS-0 |
Tutto il paese |
BOV-X, BOV-Y RUM, OVI-X, OVI-Y |
|
|
||||||
|
POR-X, POR-Y |
B |
||||||||||
|
ME – Montenegro |
ME-0 |
Tutto il paese |
|
|
I |
||||||
|
MK – Ex Repubblica iugoslava di Macedonia (4) |
MK-0 |
Tutto il paese |
|
|
I |
||||||
|
NZ – Nuova Zelanda |
NZ-0 |
Tutto il paese |
BOV-X, BOV-Y, RUM, POR-X, POR-Y OVI-X, OVI-Y |
|
III V |
||||||
|
PM – Saint Pierre e Miquelon |
PM-0 |
Tutto il paese |
BOV-X, BOV-Y, RUM, OVI-X, OVI-Y CAM |
|
|
||||||
|
RS – Serbia (5) |
RS-0 |
Tutto il paese |
|
|
I |
||||||
Condizioni specifiche (cfr. le note di ciascun certificato)
|
«I» |
: |
per il transito attraverso il territorio di un paese terzo – su autocarri sigillati con un sigillo numerato progressivamente – di animali vivi destinati alla macellazione immediata o di bovini vivi da ingrasso provenienti da uno Stato membro e destinati a un altro Stato membro. Il numero di sigillo deve essere indicato sul certificato sanitario rilasciato in conformità al modello di cui all'allegato F della direttiva 64/432/CEE (6) per quanto concerne i bovini vivi destinati alla macellazione e all'ingrasso e in conformità al modello I dell'allegato E della direttiva 91/68/CEE (7) per quanto concerne gli ovini e i caprini destinati alla macellazione. Inoltre il sigillo deve essere intatto all'arrivo al posto di ispezione frontaliero designato, attraverso il quale avviene l'introduzione nell'Unione, e il numero di sigillo deve essere registrato nel sistema informatico veterinario integrato dell'Unione (TRACES). Al punto di uscita dall'Unione, prima del transito attraverso uno o più paesi terzi, il certificato deve essere timbrato dall'autorità veterinaria competente con la seguente dicitura: «SOLO PER IL TRANSITO TRA VARIE PARTI DELL'UNIONE EUROPEA ATTRAVERSO L'EX REPUBBLICA IUGOSLAVA DI MACEDONIA/IL MONTENEGRO/LA SERBIA (8) (9)». I bovini da ingrasso devono essere trasportati direttamente all'azienda di destinazione designata dall'autorità veterinaria competente di destinazione. Tali animali non devono lasciare l'azienda, salvo per la macellazione immediata. |
|
«II» |
: |
territorio riconosciuto ufficialmente indenne da tubercolosi ai fini dell'esportazione nell'Unione di animali vivi certificati secondo il modello di certificato BOV-X. |
|
«III» |
: |
territorio riconosciuto ufficialmente indenne da brucellosi ai fini dell'esportazione nell'Unione di animali vivi certificati secondo il modello di certificato BOV-X. |
|
«IVa» |
: |
territorio riconosciuto ufficialmente indenne da leucosi bovina enzootica ai fini dell'esportazione nell'Unione di animali vivi certificati secondo il modello di certificato BOV-X. |
|
«IVb» |
: |
territorio con aziende autorizzate, riconosciute ufficialmente indenni da leucosi bovina enzootica ai fini dell'esportazione nell'Unione di animali vivi certificati secondo il modello di certificato BOV-X. |
|
«V» |
: |
territorio riconosciuto ufficialmente indenne da brucellosi ai fini dell'esportazione nell'Unione di animali vivi certificati secondo il modello di certificato OVI-X. |
|
«VI» |
: |
limitazioni geografiche. |
|
«VII» |
: |
territorio riconosciuto ufficialmente indenne da tubercolosi ai fini dell'esportazione nell'Unione di animali vivi certificati secondo il modello di certificato RUM. |
|
«VIII» |
: |
territorio riconosciuto ufficialmente indenne da brucellosi ai fini dell'esportazione nell'Unione di animali vivi certificati secondo il modello di certificato RUM. |
|
«IX» |
: |
territorio riconosciuto ufficialmente indenne dalla malattia di Aujeszky ai fini dell'esportazione nell'Unione di animali vivi certificati secondo il modello di certificato POR-X. |
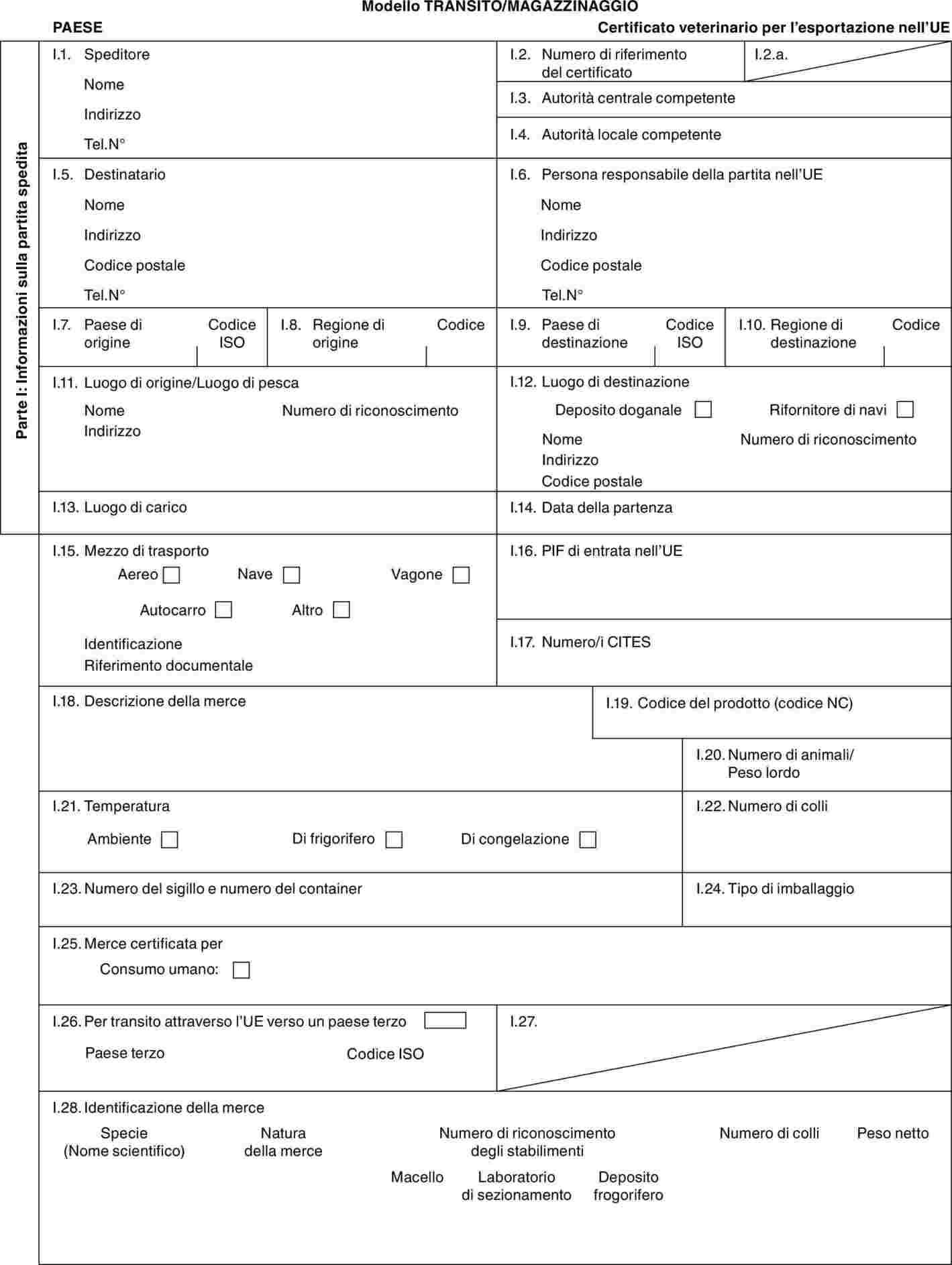
PARTE 2
Modelli di certificati veterinari
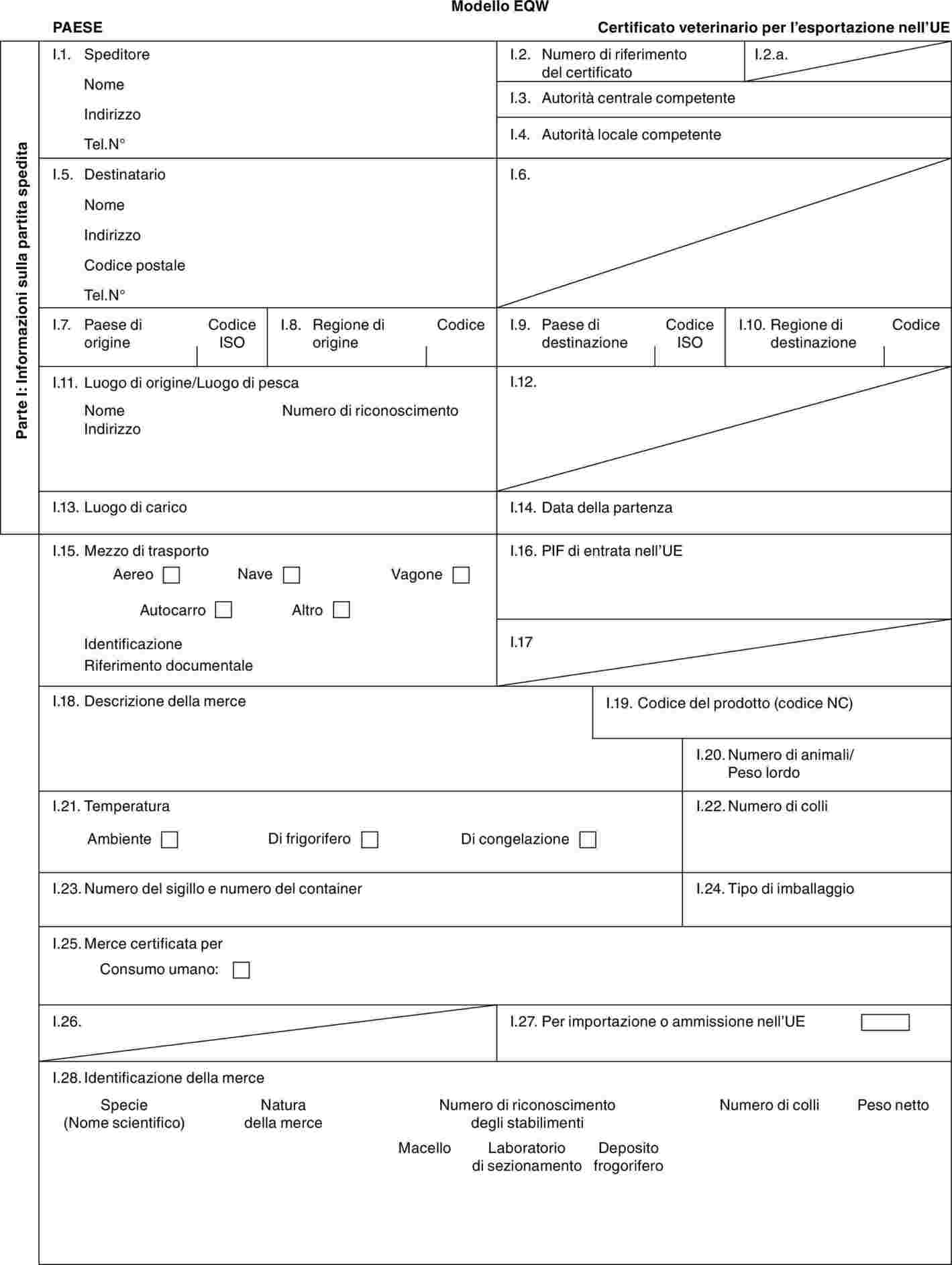
Modelli:
|
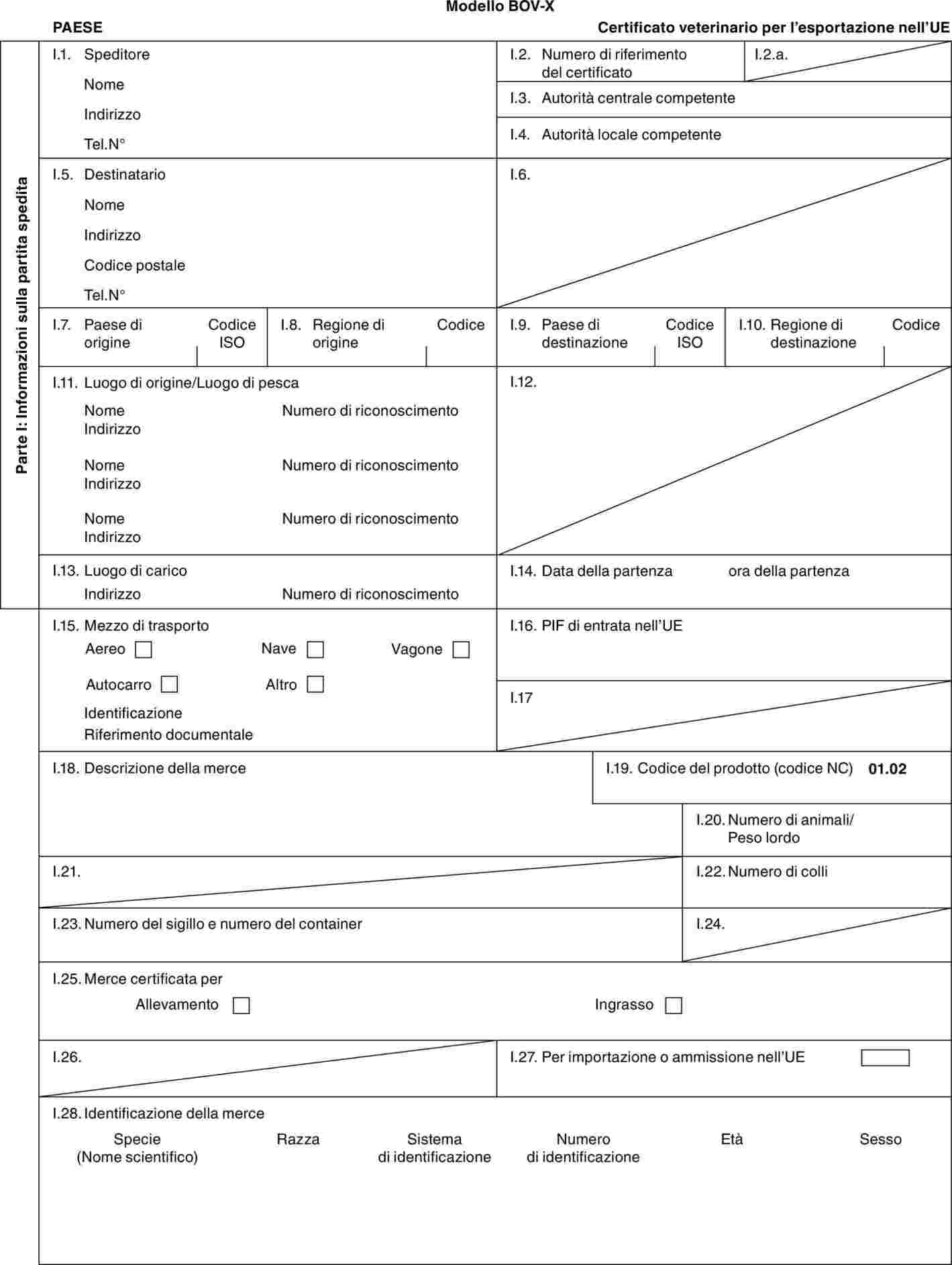
«BOV-X» |
: |
modello di certificato veterinario per i bovini domestici (incluse le specie Bubalus e Bison e loro incroci) destinati all'allevamento e/o alla produzione dopo l'importazione. |
|
«BOV-Y» |
: |
modello di certificato veterinario per i bovini domestici (incluse le specie Bubalus e Bison e loro incroci) destinati alla macellazione immediata dopo l'importazione. |
|
«OVI-X» |
: |
modello di certificato veterinario per gli ovini (Ovis aries) e i caprini (Capra hircus) domestici destinati all'allevamento e/o alla produzione dopo l'importazione. |
|
«OVI-Y» |
: |
modello di certificato veterinario per gli ovini (Ovis aries) e i caprini (Capra hircus) domestici destinati alla macellazione immediata dopo l'importazione. |
|
«POR-X» |
: |
modello di certificato veterinario per i suini domestici (Sus scrofa) destinati all'allevamento e/o alla produzione dopo l'importazione. |
|
«POR-Y» |
: |
modello di certificato veterinario per i suini domestici (Sus scrofa) destinati alla macellazione immediata dopo l'importazione. |
|
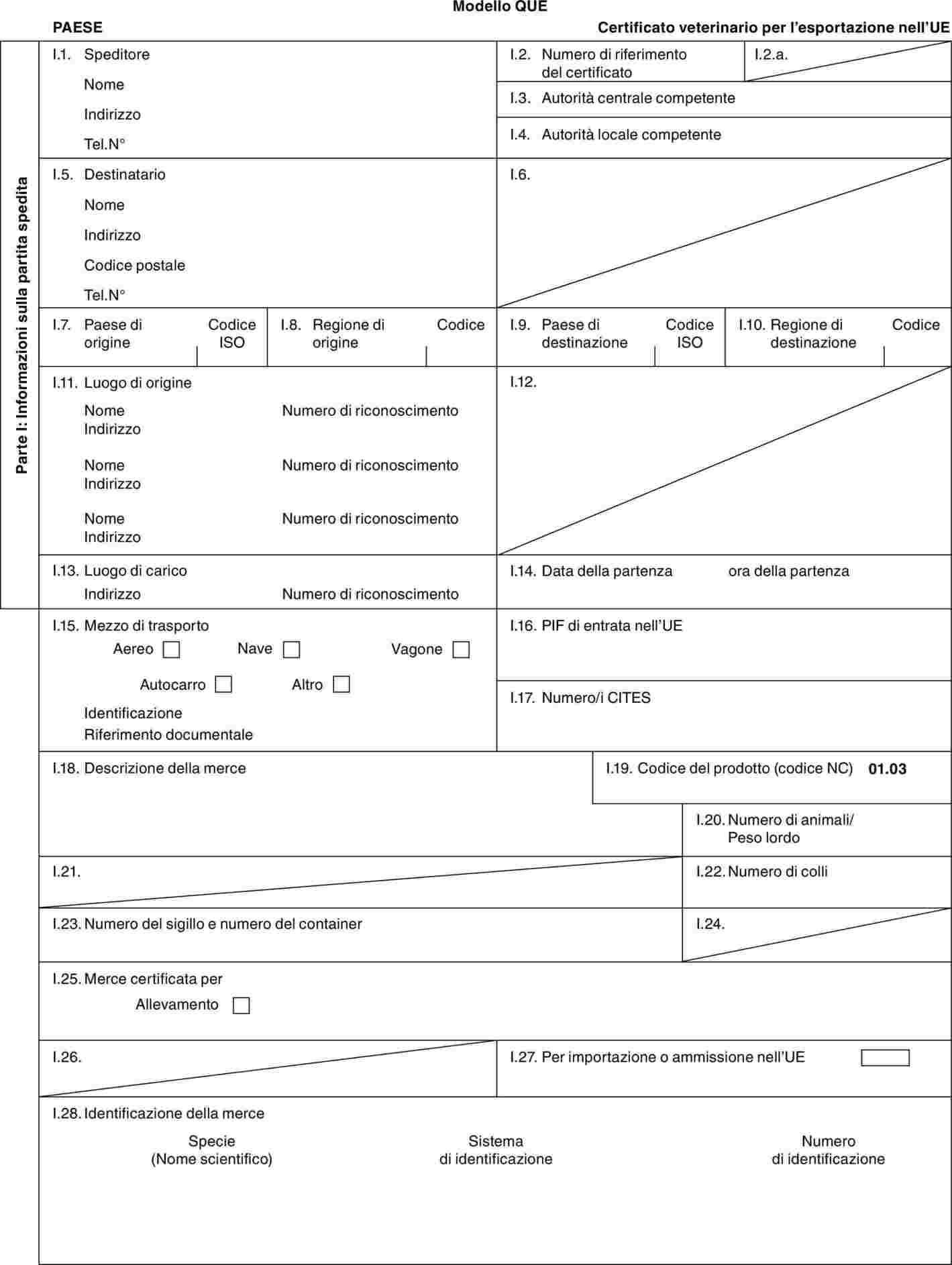
«RUM» |
: |
modello di certificato veterinario per gli animali dell'ordine degli artiodattili [esclusi i bovini (ivi comprese le specie Bubalus e Bison e loro incroci), l'Ovis aries, la Capra hircus, i suidi e i taiassuidi], e delle famiglie dei rinocerontidi e degli elefantidi. |
|
«SUI» |
: |
modello di certificato veterinario per i suidi, i taiassuidi e i tapiridi non domestici. |
|
«CAM» |
: |
Modello di attestato specifico per gli animali importati da Saint Pierre e Miquelon alle condizioni di cui all'allegato I, parte 7. |
GS (garanzie supplementari):
|
«A» |
: |
garanzie relative ai test per la febbre catarrale degli ovini e la malattia emorragica epizootica praticati su animali certificati conformemente ai modelli BOV-X (punto II.2.8 B), OVI-X (punto II.2.6 D) e RUM (punto II.2.6). |
|
«B» |
: |
garanzie relative ai test per la malattia vescicolare dei suini e la peste suina classica praticati su animali certificati conformemente ai modelli POR-X (punto II.2.4 B) e SUI (punto II.2.4 B). |
|
«C» |
: |
garanzie relative ai test per la brucellosi praticati su animali certificati conformemente ai modelli POR-X (punto II.2.4 C) e SUI (punto II.2.4 C). |


















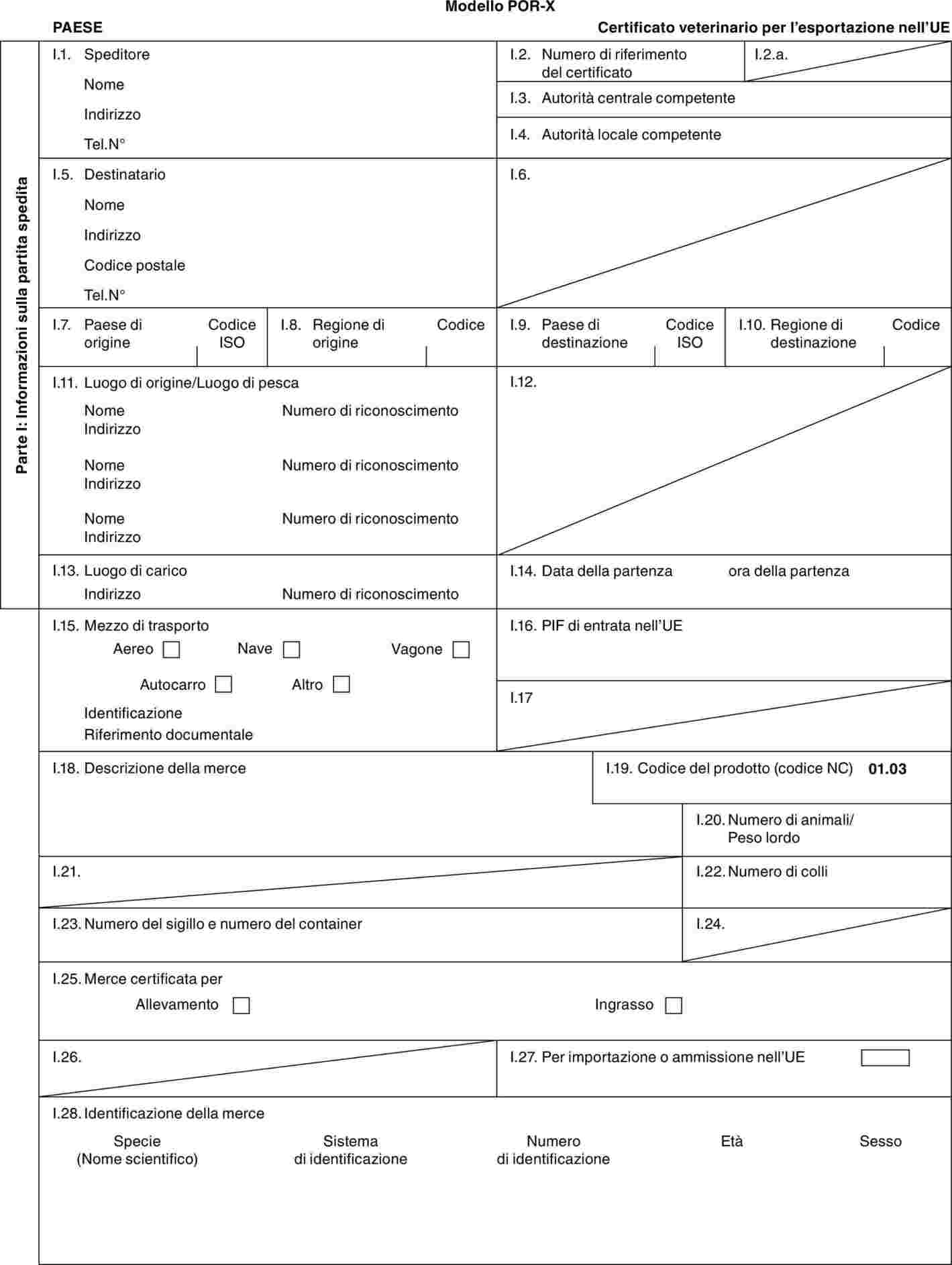



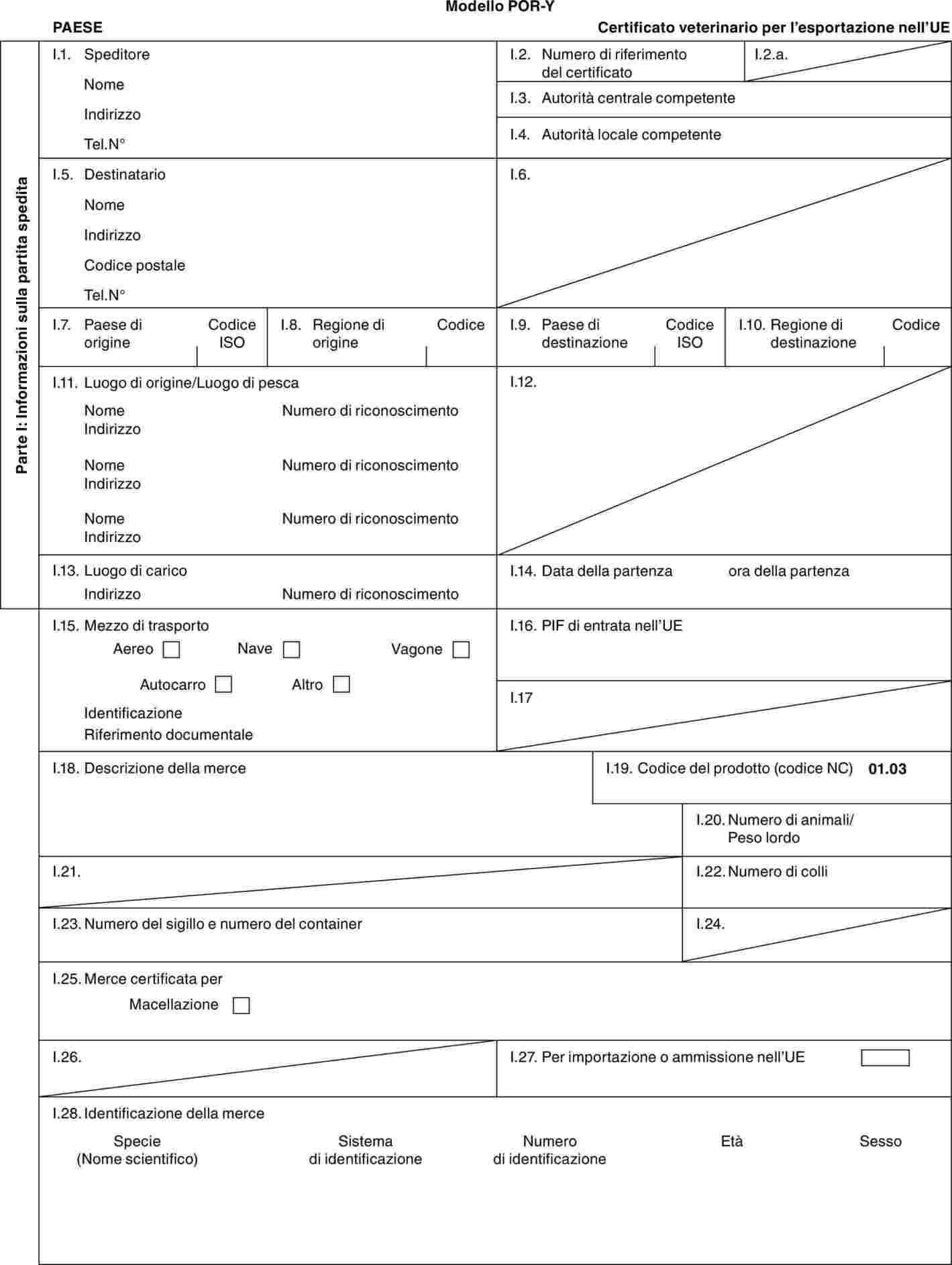
















PARTE 3
Addendum relativo al trasporto marittimo di animali
(da compilare e allegare al certificato veterinario se il trasporto fino alla frontiera dell'Unione comprende, anche limitatamente a una parte del viaggio, un tragitto via nave)
|
Dichiarazione del comandante della nave |
|
|
Il sottoscritto, comandante della nave (nome …), dichiara che gli animali di cui al certificato veterinario allegato n. … sono rimasti a bordo della nave durante il viaggio da … in … (paese esportatore) a … nell'Unione e che la nave non ha fatto scalo in alcun luogo al di fuori di … (paese esportatore) durante il viaggio verso l'Unione salvo che a: … (porti di scalo lungo la rotta). Inoltre, nel corso del viaggio gli animali non sono stati in contatto con altri animali di qualifica sanitaria inferiore presenti a bordo. Fatto a …, il … |
|
|
(Porto di arrivo) |
(Data di arrivo) |
|
(Timbro) |
(Firma del comandante) |
|
(Cognome e nome, qualifica – in stampatello) |
|
PARTE 4
Addendum relativo al trasporto aereo di animali
(da compilare e allegare al certificato veterinario se il trasporto fino alla frontiera dell'Unione comprende, anche limitatamente a una parte del viaggio, un tragitto aereo)
|
Dichiarazione del capitano dell'aeromobile |
|
|
Il sottoscritto, capitano dell'aeromobile (nome …), dichiara che la cassa o il contenitore e l'area adiacente la cassa o il contenitore che ospitano gli animali di cui all'allegato certificato veterinario n. … sono stati irrorati con insetticida prima della partenza. Fatto a …, il … |
|
|
(Aeroporto di partenza) |
(Data di partenza) |
|
(Timbro) |
(Firma del capitano) |
|
(Cognome e nome, qualifica – in stampatello) |
|
PARTE 5
Condizioni relative al riconoscimento dei centri di raccolta (di cui all'articolo 4)
Ai fini del riconoscimento i centri di raccolta devono soddisfare le condizioni seguenti.
|
I. |
Devono essere sottoposti alla supervisione di un veterinario ufficiale. |
|
II. |
Devono essere situati al centro di un'area del diametro di almeno 20 km all'interno della quale, stando alle risultanze ufficiali, non sia stato riscontrato alcun caso di afta epizootica almeno nei 30 giorni precedenti il loro utilizzo come centri di raccolta riconosciuti. |
|
III. |
Prima di ciascun utilizzo come centri di raccolta riconosciuti, devono essere puliti e disinfettati con un disinfettante ufficialmente autorizzato nel paese esportatore, di comprovata efficacia ai fini della lotta all'afta epizootica. |
|
IV. |
Tenuto conto del numero di animali che possono accogliere, devono disporre:
|
|
V. |
Quando in attività, i centri devono disporre di un numero di veterinari sufficiente allo svolgimento di tutti i compiti descritti nella parte 5. |
|
VI. |
Devono ammettere solo animali identificati individualmente in modo da garantire la tracciabilità. A tal fine, all'arrivo degli animali, il proprietario o il responsabile del centro deve verificare che essi siano adeguatamente identificati e accompagnati dai documenti o certificati sanitari previsti per le specie o categorie in questione. Il proprietario o il responsabile del centro deve inoltre inserire in un registro o in una banca dati i seguenti dati, da conservare per un minimo di tre anni: il nome del proprietario, l'origine degli animali, la data di ingresso e di uscita, il numero di identificazione degli animali o il numero di registrazione dell'allevamento di origine e dell'azienda di destinazione, il numero di registrazione del vettore e il numero di targa dell'autocarro con cui è effettuata la consegna o la raccolta degli animali presso il centro. |
|
VII. |
Tutti gli animali che transitano per un centro di raccolta riconosciuto devono soddisfare le condizioni sanitarie stabilite per l'introduzione nell'Unione della categoria di animali interessata. |
|
VIII. |
Gli animali destinati a essere introdotti nell'Unione che transitano per un centro di raccolta devono, entro sei giorni dall'arrivo presso il centro medesimo, essere caricati e spediti direttamente alla frontiera del paese esportatore:
|
|
IX. |
Qualora le condizioni per l'esportazione di animali nell'Unione prescrivano l'espletamento di un esame entro un determinato periodo di tempo prima del carico, tale periodo deve includere la sosta degli animali successiva al loro arrivo nel centro riconosciuto, fino a un massimo di sei giorni. |
|
X. |
Il paese esportatore deve designare i centri riconosciuti per gli animali da allevamento e da produzione e quelli riconosciuti per gli animali da macello e deve notificare alla Commissione e alle autorità centrali competenti degli Stati membri i nomi e gli indirizzi di tali centri. Le informazioni devono essere regolarmente aggiornate. |
|
XI. |
Il paese terzo esportatore determina le modalità del controllo ufficiale sui centri di raccolta riconosciuti e garantisce l'effettività di tale controllo. |
|
XII. |
I centri di raccolta riconosciuti devono essere ispezionati regolarmente dall'autorità competente del paese terzo in modo da verificare la sussistenza delle condizioni di cui ai punti da I a XI che ne hanno consentito il riconoscimento. Se le ispezioni dimostrano che le condizioni non sono più soddisfatte, il riconoscimento del centro deve essere sospeso. Il riconoscimento può essere ripristinato solo ove l'autorità competente del paese terzo abbia la certezza che il centro soddisfa appieno le condizioni di cui ai punti da I a XI. |
PARTE 6
Protocolli per la standardizzazione dei materiali e delle procedure di analisi
(di cui all'articolo 5)
Tubercolosi (TBL)
L'intradermotubercolinizzazione unica con tubercolina bovina deve essere effettuata conformemente all'allegato B della direttiva 64/432/CEE. Nel caso dei suidi, l'intradermotubercolinizzazione unica con tubercolina aviaria deve essere effettuata conformemente all'allegato B della direttiva 64/432/CEE, salvo il fatto che l'inoculazione va praticata nella pelle floscia alla base dell'orecchio.
Brucellosi (Brucella abortus) (BRL)
I test di sieroagglutinazione e di fissazione del complemento, la prova all'antigene di brucella tamponato e il saggio di immunoassorbimento enzimatico (ELISA) devono essere effettuati conformemente all'allegato C della direttiva 64/432/CEE.
Brucellosi (Brucella melitensis) (BRL)
Gli esami devono essere effettuati conformemente all'allegato C della direttiva 91/68/CEE.
Leucosi bovina enzootica (EBL)
L'immunodiffusione in gel di agar e il saggio di immunoassorbimento enzimatico (ELISA) devono essere effettuati conformemente all'allegato D, capitolo II, paragrafi A e C, della direttiva 64/432/CEE.
Febbre catarrale degli ovini (BTG)
Il saggio ELISA blocking o competitivo deve essere effettuato secondo il metodo descritto qui di seguito.
Il saggio ELISA competitivo con l'anticorpo monoclonale 3-17-A3 serve a individuare gli anticorpi nei confronti di tutti i sierotipi noti del virus della febbre catarrale degli ovini (BTV).
Il principio su cui si basa il saggio consiste nell'interruzione della reazione tra l'antigene del virus della febbre catarrale degli ovini (antigene BTV) e un anticorpo monoclonale gruppo-specifico (3-17-A3) mediante aggiunta del siero da esaminare. Gli anticorpi anti-BTV presenti nel siero da esaminare bloccano la reattività dell'anticorpo monoclonale (Mab) e determinano una riduzione della colorazione prevista dopo l'aggiunta di anticorpi anti-topo marcati da enzima e di cromogeno/substrato. I sieri possono essere saggiati con una sola diluizione di 1:5 (saggio puntuale - appendice 1) o essere titolati (titolazione del siero - appendice 2) con diluizioni in serie fino al punto finale. Possono essere considerati positivi i campioni con valori di inibizione superiori al 50 %.
Materiali e reagenti
|
1. |
Piastre da microtitolazione ELISA adeguate. |
|
2. |
Antigene: fornito sotto forma di estratto di cellule concentrato, preparato secondo il metodo descritto di seguito e conservato a una temperatura di –20 °C o –70 °C. |
|
3. |
Tampone bloccante: tampone fosfato salino (PBS) contenente 0,3 % di siero bovino adulto BTV-negativo e 0,1 % (v/v) di Tween-20 (fornito come sciroppo di poliossietilen-sorbitan-monolaurato) in PBS. |
|
4. |
Anticorpo monoclonale: 3-17-A3 (sotto forma di supernatante di coltura tissutale di ibridoma) diretto contro il polipeptide VP7 gruppo-specifico, conservato a –20 °C o liofilizzato e diluito a una diluzione di 1:100 con tampone bloccante prima dell'uso. |
|
5. |
Coniugato: globulina di coniglio anti-topo (adsorbita ed eluita), coniugata con perossidasi di rafano e conservata al buio a 4 °C. |
|
6. |
Cromogeno e substrato: ortofenilendiammina (cromogeno OPD) a una concentrazione finale di 0,4 mg/ml in acqua distillata sterile. Perossido di idrogeno (substrato al 30 % p/v), allo 0,05 % v/v aggiunto immediatamente prima dell'uso (5 μl H2 O2 per 10 ml OPD). (Maneggiare l'OPD con cautela, indossare guanti di gomma, sospetto mutageno). |
|
7. |
Acido solforico 1 molare: 26,6 ml di acido aggiunti a 473,4 ml di acqua distillata. (Attenzione: aggiungere sempre l'acido all'acqua, mai l'acqua all'acido). |
|
8. |
Agitatore orbitale. |
|
9. |
Lettore di piastre ELISA (il test può essere letto visivamente). |
Struttura del test
Cc: controllo del coniugato (assenza di siero e di anticorpo monoclonale); C++: controllo del siero fortemente positivo; C+: controllo del siero debolmente positivo; C-: controllo del siero negativo; Cm: controllo dell'anticorpo monoclonale (assenza di siero).
APPENDICE 1
Struttura del test con una sola diluizione di 1:5 (40 sieri/piastra)
|
|
Controlli |
Sieri da esaminare |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
|
A |
Cc |
C- |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
B |
Cc |
C- |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
C |
C++ |
C++ |
|
|
|
|
|
|
|
|
|
|
|
D |
C++ |
C++ |
|
|
|
|
|
|
|
|
|
|
|
E |
C+ |
C+ |
|
|
|
|
|
|
|
|
|
|
|
F |
C+ |
C+ |
|
|
|
|
|
|
|
|
|
|
|
G |
Cm |
Cm |
|
|
|
|
|
|
|
|
|
40 |
|
H |
Cm |
Cm |
|
|
|
|
|
|
|
|
|
40 |
APPENDICE 2
Struttura del test con titolazione del siero (10 sieri/piastra)
|
|
Controlli |
Sieri da esaminare |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
|
A |
Cc |
C- |
1:5 |
|
|
|
|
|
|
|
|
1:5 |
|
B |
Cc |
C- |
1:10 |
|
|
|
|
|
|
|
|
1:10 |
|
C |
C++ |
C++ |
1:20 |
|
|
|
|
|
|
|
|
1:20 |
|
D |
C++ |
C++ |
1:40 |
|
|
|
|
|
|
|
|
1:40 |
|
E |
C+ |
C+ |
1:80 |
|
|
|
|
|
|
|
|
1:80 |
|
F |
C+ |
C+ |
1:160 |
|
|
|
|
|
|
|
|
1:160 |
|
G |
Cm |
Cm |
1:320 |
|
|
|
|
|
|
|
|
1:320 |
|
H |
Cm |
Cm |
1:640 |
|
|
|
|
|
|
|
|
1:640 |
Protocollo di riferimento
|
Controllo del coniugato (Cc) |
: |
i pozzetti 1A e 1B rappresentano un controllo (bianco) costituito da antigene BTV e coniugato. Essi possono essere usati come bianco per il lettore ELISA. |
|
Controllo del Mab (Cm) |
: |
le colonne 1 e 2 e le righe G e H rappresentano il controllo dell'anticorpo monoclonale e contengono l'antigene BTV, l'anticorpo monoclonale e il coniugato. Questi pozzetti rappresentano la massima intensità di colore. La media delle letture di densità ottica effettuate su questa serie di controllo rappresenta il valore di inibizione pari allo 0 %. |
|
Controllo positivo (C++, C+) |
: |
colonne 1 e 2, righe C-D-E-F. Questi pozzetti contengono l'antigene BTV, l'antisiero BTV (rispettivamente) fortemente e debolmente positivo, il Mab e il coniugato. |
|
Controllo negativo (C-) |
: |
i pozzetti 2A e 2B rappresentano il controllo negativo e contengono l'antigene BTV, l'antisiero BTV negativo, il Mab e il coniugato. |
|
Sieri da esaminare |
: |
per indagini sierologiche su vasta scala e lo screening rapido, i sieri possono essere analizzati a una sola diluizione di 1:5 (appendice 1). In alternativa si possono analizzare 10 sieri nell'intervallo di diluizione compreso tra 1:5 e 1:640 (appendice 2): ciò fornisce una qualche indicazione sul titolo dell'anticorpo nei sieri da esaminare. |
Procedimento
|
1. |
Diluire l'antigene BTV alla concentrazione pretitolata in PBS, sottoporre a breve sonicazione per disperdere il virus aggregato (in assenza di sonicatore, pipettare vigorosamente) e aggiungere 50 µl in tutti i pozzetti della piastra ELISA. Dare leggeri colpi ai bordi della piastra per disperdere l'antigene. |
|
2. |
Incubare a 37 °C per 60 minuti su agitatore orbitale. Lavare le piastre tre volte, immergendole e vuotando i pozzetti con PBS non sterile e asciugare su carta assorbente. |
|
3. |
Pozzetti di controllo: aggiungere 100 μl di tampone bloccante ai pozzetti Cc. Aggiungere 50 µl di siero di controllo positivo e negativo, a una diluizione di 1:5 (10 µl di siero + 40 µl di tampone bloccante), rispettivamente ai pozzetti C-, C+ e C++. Aggiungere 50 μl di tampone bloccante ai pozzetti di controllo del Mab. Metodo della titolazione puntuale: aggiungere una diluizione 1:5 di ogni campione di siero a un tampone bloccante nei pozzetti in duplicato delle colonne da 3 a 12 (10 μl di siero +40 μl di tampone bloccante), oppure metodo della titolazione del siero: preparare una serie di diluizioni doppie di ogni campione di siero (da 1:5 a 1:640) in tampone bloccante per otto pozzetti delle colonne singole da 3 a 12. |
|
4. |
Immediatamente dopo l'aggiunta dei sieri da esaminare, diluire il Mab in tampone bloccante alla diluizione di 1:100 e aggiungere 50 µl a tutti i pozzetti della piastra, eccettuato il controllo (bianco). |
|
5. |
Incubare a 37 °C per 60 minuti su agitatore orbitale. Lavare tre volte con PBS e asciugare con carta assorbente. |
|
6. |
Diluire il concentrato di coniglio anti-topo a 1:5 000 in tampone bloccante e aggiungere 50 µl a tutti i pozzetti della piastra. |
|
7. |
Incubare a 37 °C per 60 minuti su agitatore orbitale. Lavare tre volte con PBS e asciugare con carta assorbente. |
|
8. |
Scongelare il dicloridrato di ortofenilendiammina (OPD) e, immediatamente prima dell'uso, aggiungere 5 μl di perossido di idrogeno al 30 % a ogni aliquota di 10 ml di OPD. Aggiungere 50 μl a tutti i pozzetti della piastra. Lasciar sviluppare il colore per circa 10 minuti e arrestare la reazione con acido solforico 1 M (50 μl per pozzetto). Il colore dovrebbe svilupparsi nei pozzetti di controllo del Mab e nei pozzetti contenenti siero senza anticorpi anti-BTV. |
|
9. |
Esaminare e leggere le piastre visivamente oppure facendo uso di un lettore spettrofotometrico. |
Analisi dei risultati
Usando un programma informatico, stampare i valori di densità ottica (DO) e di inibizione percentuale (IP) dei sieri da esaminare e dei sieri di controllo a partire dal valore medio registrato nei pozzetti di controllo dell'antigene. I dati espressi in valori DO e IP servono a stabilire se il test si colloca entro limiti accettabili. I limiti di controllo superiori (UCL – upper control limits) e inferiori (LCL – lower control limits) del controllo del Mab (antigene più Mab in assenza di siero da esaminare) si situano tra i valori di densità ottica 1,4 e 0,4. Devono essere escluse le piastre che non rispettano i suddetti criteri.
Se non si dispone di un programma informatico, stampare i valori DO usando la stampante ELISA. Calcolare il valore medio DO per i pozzetti di controllo dell'antigene, che equivale al valore al 100 %. Determinare il valore DO al 50 % e calcolare manualmente la positività e negatività di ciascun campione.
Valore di inibizione percentuale (IP) = 100 – (DO di ciascun campione di controllo/DO media del Cm) × 100.
I pozzetti di siero di controllo negativo in duplicato e i pozzetti del bianco in duplicato devono registrare valori IP compresi rispettivamente tra +25 % e –25 % e tra +95 % e + 105 %. Il fatto che i valori non si situino entro questi limiti non significa che la piastra debba essere scartata, ma che si sta sviluppando un colore di fondo. I sieri di controllo fortemente e debolmente positivi devono registrare valori IP compresi rispettivamente tra +81 % e + 100 % e tra +51 % e +80 %.
La soglia diagnostica per i sieri da esaminare è del 50 % (IP 50 % o DO 50 %). I campioni che registrano valori IP > 50 % sono interpretati come negativi. I campioni che registrano valori IP al di sopra e al di sotto della soglia per i pozzetti in duplicato sono da considerare dubbi e possono essere nuovamente analizzati con il metodo puntuale e/o mediante titolazione. Anche i campioni positivi possono essere titolati per valutare il grado di positività.
Lettura visiva: i campioni positivi e negativi sono facilmente distinguibili a occhio nudo; i campioni debolmente positivi o fortemente negativi possono essere di più difficile interpretazione a occhio nudo.
Preparazione dell'antigene BTV per il saggio ELISA
|
1. |
Lavare tre volte 40-60 «Roux» di cellule confluenti BHK-21 con terreno di Eagle senza siero e infettare con sierotipo 1 del virus della febbre catarrale degli ovini in terreno di Eagle senza siero. |
|
2. |
Incubare a 37 °C e verificare quotidianamente l'effetto citopatico (CPE). |
|
3. |
Quando il CPE è osservato nel 90-100 % dello strato cellulare di ciascuna Roux, raccogliere il virus scuotendo dalle pareti eventuali cellule ancora adese. |
|
4. |
Centrifugare a 2 000-3 000 giri al minuto per ottenere un pellet di cellule. |
|
5. |
Eliminare il supernatante e risospendere le cellule in circa 30 ml di PBS contenente l'1 % di «Sarkosyl» e 2 ml di fenil-metil-sulfonil-fluoruro (tampone di lisi). Se le cellule formano un gel, è possibile aggiungere un'ulteriore aliquota di tampone di lisi per ridurre questo effetto. (Attenzione: il fenil-metil-sulfonil-fluoruro è pericoloso: maneggiare con estrema cautela.) |
|
6. |
Disgregare le cellule per 60 secondi con una sonda a ultrasuoni a una ampiezza di 30 micron. |
|
7. |
Centrifugare a 10 000 giri al minuto per 10 minuti. |
|
8. |
Conservare il supernatante a +4 °C e risospendere il pellet di cellule residuo in 10-20 ml di tampone di lisi. |
|
9. |
Sottoporre a sonicazione e chiarificazione per tre volte, conservando ogni volta il supernatante. |
|
10. |
Raccogliere i supernatanti e centrifugare a 24 000 giri al minuto (100,000 g) per 120 minuti a +4 °C su un cuscinetto di 5 ml di saccarosio al 40 % (p/v in PBS) usando centrifughe Beckman da 30 ml e un rotore SW 28. |
|
11. |
Eliminare il supernatante, asciugare le provette e risospendere il pellet in PBS mediante sonicazione. Conservare l'antigene in aliquote a –20 °C. |
Titolazione dell'antigene BTV per il saggio ELISA
L'antigene BTV per il saggio ELISA viene titolato mediante ELISA indiretto. Diluizioni doppie di antigene vengono titolate rispetto a una diluizione costante (1:100) di anticorpo monoclonale 3-17-A3. Il protocollo è il seguente:
|
1. |
Titolare una diluizione 1:20 dell'antigene BTV in PBS su tutta la piastra da microtitolazione in una serie di diluizioni doppie (50 µl/pozzetto) usando una pipetta multicanale. |
|
2. |
Incubare per un'ora alla temperatura di 37 °C su agitatore orbitale. |
|
3. |
Lavare le piastre tre volte con PBS. |
|
4. |
Aggiungere 50 µl di anticorpo monoclonale 3-17-A3 (diluito a 1:100) in ciascun pozzetto della piastra da microtitolazione. |
|
5. |
Incubare per un'ora alla temperatura di 37 °C su agitatore orbitale. |
|
6. |
Lavare le piastre tre volte con PBS. |
|
7. |
Aggiungere in ciascun pozzetto della piastra di micro titolazione 50 μl di globulina di coniglio anti-topo coniugata con perossidasi di rafano, diluita a una concentrazione ottimale pretitolata. |
|
8. |
Incubare per un'ora alla temperatura di 37 °C su agitatore orbitale. |
|
9. |
Aggiungere substrato e cromogeno come precedentemente descritto. Arrestare la reazione dopo 10 minuti aggiungendo acido solforico 1 M (50 μl/pozzetto). |
Nel saggio competitivo l'anticorpo monoclonale deve essere in eccesso; per questo viene scelta una diluizione di antigene compresa nella curva di titolazione (non nella zona piatta) tale da dare approssimativamente una densità ottica di 0,8 dopo 10 minuti.
L'immunodiffusione in gel di agar deve essere effettuata secondo il seguente protocollo:
Antigene
L'antigene precipitante viene preparato in un qualsiasi sistema di coltura cellulare capace di sostenere la moltiplicazione rapida di un ceppo di riferimento del virus della febbre catarrale degli ovini. Si raccomandano le cellule BHK oppure VERO. L'antigene è presente nel fluido supernatante alla fine dello sviluppo del virus, ma per essere efficace deve essere concentrato da 50 a 100 volte. Tale concentrazione può essere ottenuta con qualsiasi metodo normalmente applicabile alle proteine; il virus dell'antigene può essere inattivato mediante aggiunta di beta-propiolattone allo 0,3 % (v/v).
Siero di controllo a positività nota
Impiegando l'antigene e il siero di riferimento internazionale si produce un siero standard nazionale. Questo viene standardizzato in misura ottimale rispetto al siero di riferimento internazionale, liofilizzato e usato in ciascun test come siero di controllo positivo.
Siero da esaminare
|
Procedimento |
: |
Versare agarosio all'1 %, preparato in tampone borato o barbital sodico, a pH 8,5-9,0, in una scatola di Petri in modo da ottenere uno spessore minimo di 3,0 mm di agarosio. Praticare nell'agar 7 pozzetti esenti da umidità, ciascuno del diametro di 5,0 mm., secondo il seguente schema: un pozzetto centrale e sei pozzetti disposti in cerchio attorno ad esso, a una distanza di 3 cm dal centro. Riempire il pozzetto centrale con l'antigene standard. Riempire i pozzetti periferici 2, 4 e 6 con il siero a positività nota, e i pozzetti 1, 3 e 5 con i sieri da esaminare. Porre in incubazione per 72 ore a temperatura ambiente in camera umida chiusa. |
|
Interpretazione |
: |
Il campione di siero è positivo se forma una linea di precipitazione specifica con l'antigene e una linea identica a quella del siero di controllo. Un campione di siero è negativo se non forma una linea specifica con l'antigene e se non modifica il raggio di curvatura della linea del siero di controllo. La scatole di Petri devono essere esaminate in illuminazione indiretta contro sfondo scuro. |
Malattia emorragica epizootica (EHD)
L'immunodiffusione in gel di agar deve essere effettuata secondo il seguente protocollo.
Antigene
L'antigene precipitante viene preparato in un qualsiasi sistema di coltura cellulare capace di sostenere la moltiplicazione rapida del o dei sierotipi opportuni del virus della malattia emorragica epizootica. Si raccomandano le cellule BHK oppure VERO. L'antigene è presente nel fluido supernatante alla fine dello sviluppo del virus, ma per essere efficace deve essere concentrato da 50 a 100 volte. Tale concentrazione può essere ottenuta con qualsiasi metodo normalmente applicabile alle proteine; il virus dell'antigene può essere inattivato mediante aggiunta di beta-propiolattone allo 0,3 % (v/v).
Siero di controllo a positività nota
Impiegando l'antigene e il siero di riferimento internazionale si produce un siero standard nazionale. Questo viene standardizzato in misura ottimale rispetto al siero di riferimento internazionale, liofilizzato e usato in ciascun test come siero di controllo positivo.
Siero da esaminare
|
Procedimento |
: |
Versare agarosio all'1 %, preparato in tampone borato o barbital sodico, a pH 8,5-9,0, in una scatola di Petri in modo da ottenere uno spessore minimo di 3,0 mm di agarosio. Praticare nell'agar 7 pozzetti esenti da umidità, ciascuno del diametro di 5,0 mm., secondo il seguente schema: un pozzetto centrale e sei pozzetti disposti in cerchio attorno ad esso, a una distanza di 3 cm dal centro. Riempire il pozzetto centrale con l'antigene standard. Riempire i pozzetti periferici 2, 4 e 6 con il siero a positività nota, e i pozzetti 1, 3 e 5 con i sieri da esaminare. Porre in incubazione per 72 ore a temperatura ambiente in camera umida chiusa. |
|
Interpretazione |
: |
Il campione di siero è positivo se forma una linea di precipitazione specifica con l'antigene e una linea identica a quella del siero di controllo. Un campione di siero è negativo se non forma una linea specifica con l'antigene e se non modifica il raggio di curvatura della linea del siero di controllo. La scatole di Petri devono essere esaminate in illuminazione indiretta contro sfondo scuro. |
Rinotracheite bovina infettiva (IBR)/vulvovaginite pustolosa infettiva (IPV)
A) La sieroneutralizzazione deve essere effettuata secondo il seguente protocollo.
|
Siero |
: |
Prima dell'uso tutti i sieri vengono inattivati termicamente a 56 °C per 30 minuti. |
|
Procedimento |
: |
la neutralizzazione a virus costante e siero variabile su piastre da microtitolazione impiega cellule MDBK o altre cellule recettive. Va utilizzato il ceppo di riferimento del virus (Colorado, Oxford od altro) a 100 TCID50/0,025 ml; i campioni di siero inattivato non diluito sono miscelati con un volume uguale (0,025 ml) di sospensione virale. Prima di aggiungere le cellule MDBK, incubare le miscele virus/siero per 24 ore a 37 °C nelle piastre da microtitolazione. Impiegare le cellule a una concentrazione in grado di formare un monostrato completo dopo 24 ore. |
|
Controlli |
: |
i) Saggio di infettività del virus; ii) controlli di tossicità del siero; iii) controlli su colture cellulari non inoculate; iv) antisieri di riferimento. |
|
Interpretazione |
: |
I risultati del test neutralizzazione e il titolo del virus impiegato nel test devono essere registrati dopo 3-6 giorni di incubazione a 37 °C. I titoli del siero sono considerati negativi in assenza di neutralizzazione alla diluizione 1:2 (siero non diluito). |
B) Qualsiasi altro test riconosciuto a norma della decisione 2004/558/CE (10).
Afta epizootica (FMD)
A) Il prelievo dei campioni esofagei/faringei e le analisi devono essere effettuati secondo il seguente protocollo.
|
Reagenti |
: |
Prima del campionamento preparare il terreno di trasporto. Versare un volume di 2 ml in un numero di contenitori corrispondente a quello degli animali su cui va effettuato il prelievo del campione. I contenitori utilizzati debbono resistere al congelamento in CO2 solida o in azoto liquido. I campioni vengono ottenuti usando un apposito raccoglitore (a coppa) di espettorato o «probang». Per prelevare il campione, il probang viene fatto passare attraverso la bocca sul dorso della lingua fino alla parte prossimale dell'esofago. Si cerca di raschiare l'epitelio superficiale della parte alta dell'esofago e del faringe facendo movimenti in direzione laterale e dorsale. Il probang va quindi retratto, preferibilmente dopo che l'animale ha deglutito. La tazza dovrà essere piena e contenere una miscela di muco, saliva, liquido esofageo e detriti cellulari. È necessario assicurarsi che ciascun campione contenga materiale cellulare visibile. Devono essere evitate manovre brusche che provochino sanguinamento. I campioni prelevati da alcuni animali potrebbero essere gravemente contaminati da contenuto ruminale. Questi campioni devono essere scartati e si deve sciacquare la bocca dell'animale con acqua o preferibilmente con soluzione fisiologica prima di ripetere il prelievo. |
|
Trattamento dei campioni |
: |
Ciascun campione raccolto nel probang subisce un esame qualitativo e 2 ml di questo materiale vengono aggiunti a un volume equivalente di terreno di trasporto in un contenitore resistente al congelamento. I contenitori vengono chiusi ermeticamente, sigillati, disinfettati ed etichettati. I campioni vengono tenuti al fresco (+4 °C) ed esaminati entro 3-4 ore oppure conservati in ghiaccio secco (–69 °C) o azoto liquido e mantenuti congelati fino al momento dell'esame. Tra un animale e l'altro il probang viene disinfettato e lavato per tre volte con acqua pulita. |
|
Ricerca del virus FMD |
: |
I campioni vengono inoculati in colture di cellule primarie di tiroide bovina usando almeno 3 provette per campione. È possibile usare altre cellule recettive, ad esempio cellule primarie renali di suini e bovini, ma è necessario tener presente che per alcuni ceppi di virus FMD esse sono meno sensibili. Le provette vengono incubate a 37 °C in un apparecchio rotante ed esaminate quotidianamente per 48 ore per individuare l'eventuale presenza di un effetto citopatico (CPE). In assenza di effetto citopatico, viene eseguito un passaggio cieco in nuove colture e si ripete nuovamente l'esame per 48 ore. La specificità di qualsiasi CPE deve essere confermata. |
Terreni di trasporto consigliati
|
1. |
Tampone fosfato 0,08 M a pH 7,2, contenente lo 0,01 % di sieroalbumina bovina, lo 0,002 % di rosso fenolo e antibiotici. |
|
2. |
Terreno di coltura tissutale (ad esempio MEM di Eagle) contenente tampone HEPES 0,04 M, lo 0,01 % di sieroalbumina bovina e antibiotici, a pH 7,2. |
|
3. |
Gli antibiotici da aggiungere al terreno di trasporto (per ml finale) possono essere i seguenti: penicillina 1 000 UI, solfato di neomicina 100 UI, solfato di polimixina B 50 UI, micostatina 100 UI. |
B) Il test di neutralizzazione virale deve essere eseguito secondo il seguente protocollo.
|
Reagenti |
: |
Preparare l'antigene del virus dell'FMD in colture cellulari oppure su lingua di bovino e conservarlo a una temperatura non superiore a –70 °C oppure a –20 °C previa aggiunta di glicerolo al 50 %. Questo è l'antigene di riserva. In queste condizioni l'FMDV è stabile e il titolo varia di poco per alcuni mesi. |
|
Procedimento |
: |
Il test viene eseguito in piastre da microtitolazione a fondo piatto per colture tissutali utilizzando cellule recettive quali le IB-RS-2, le BHK-21 o cellule renali di vitello. I sieri da sottoporre al test vengono posti in un terreno di coltura cellulare senza siero a una diluizione di 1:4 con l'aggiunta di 100 UI/ml di neomicina o altro antibiotico idoneo. I sieri vengono inattivati a 56 °C per 30 minuti e vengono utilizzate aliquote di 0,05 ml per preparare una doppia serie di piastre da microtitolazione facendo uso di anse di diluizione da 0,05 ml. A ciascun pozzetto viene quindi aggiunto virus pretitolato diluito anch'esso in terreno di coltura senza siero e contenente 100 TCID50/0,05 ml. Dopo l'incubazione a 37 °C per un'ora per consentire la neutralizzazione, vengono aggiunti in ciascun pozzetto 0,05 ml di sospensione cellulare (0,5-1,0 × 106 cellule per ml) in terreno di coltura cellulare contenente siero senza anticorpi anti-FMD e le piastre vengono sigillate. Le piastre vengono incubate a 37 °C. I monostrati sono, di norma, confluenti entro 24 ore. Di solito il CPE è sufficientemente avanzato a 48 ore per una lettura del test al microscopio. A questo punto è possibile eseguire una lettura finale al microscopio, oppure le piastre possono essere fissate e colorate per la lettura macroscopica, ad esempio facendo uso di soluzione fisiologica di formolo al 10 % e blu di metilene allo 0,05 %. |
|
Controlli |
: |
In ciascun test i controlli comprendono antisiero omologo a titolo noto, un controllo cellulare, un controllo di sierotossicità, un controllo del terreno e una titolazione del virus da cui si calcola il quantitativo virale effettivo nel test. |
|
Interpretazione |
: |
I pozzetti con evidenze di effetto citopatico vengono considerati infetti e i titoli di neutralizzazione vengono espressi come il reciproco della diluizione finale del siero presente nelle miscele siero/virus con punto finale al 50 % calcolato con il metodo di Spearman-Karber. (Karber, G., 1931, Archiv für Experimentelle Pathologie und Pharmakologie 162, pag. 480). I test vengono considerati validi se il quantitativo virale effettivo usato per pozzetto nel test è compreso tra 101,5 e 102,5 TCID50 e se il titolo del siero di riferimento non supera il doppio di quello atteso, desunto dalle titolazioni precedenti. Se i controlli sono al di fuori di questi limiti, gli esami vengono ripetuti. Un titolo al punto finale pari o inferiore a 1:11 è interpretato come negativo. |
C) La ricerca e quantificazione dell'anticorpo con il saggio ELISA devono essere effettuate secondo il seguente protocollo.
|
Reagenti |
: |
Antisieri di coniglio per l'antigene 146S di 7 tipi di virus dell'afta epizootica (FMDV) usati a una concentrazione ottimale predeterminata in tampone carbonato/bicarbonato, a pH 9,6. Gli antigeni vengono preparati da ceppi selezionati di virus coltivati su monostrati di cellule BHK-21. I supernatanti non purificati vengono usati e pretitolati secondo il protocollo, ma senza siero, in modo da ottenere una diluizione che, dopo l'aggiunta di un volume eguale di PBST (tampone fosfato salino contenente lo 0,05 % di Tween-20 e indicatore rosso fenolo), darebbe una lettura di densità ottica compresa tra 1,2 e 1,5. I virus possono essere usati inattivati. Il PBST viene usato come diluente. Gli antisieri di porcellini d'India vengono preparati inoculando a porcellini d'India l'antigene 146S di ciascun sierotipo. Una concentrazione ottimale predeterminata viene preparata nel PBST contenente siero bovino normale al 10 % e siero di coniglio normale al 5 %. L'immunoglobulina di coniglio anti-porcellino d'India coniugata con perossidasi di rafano viene usata a una concentrazione ottimale predeterminata in PBST contenente siero bovino normale al 10 % e siero di coniglio normale al 5 %. I sieri da esaminare vengono diluiti in PBST. |
Procedimento
|
1. |
Le piastre ELISA vengono coperte con 50 µl di sieri antivirali di coniglio, per una notte, in una camera umida, a temperatura ambiente. |
|
2. |
In piastre a pozzetti multipli con fondo a U (piastre portanti) vengono preparati 50 microlitri di una doppia serie, in duplicato, di ciascun siero da analizzare cominciando da una diluizione 1:4. In ciascun pozzetto vengono aggiunti 50 microlitri di una dose costante di antigene e le miscele vengono lasciate per tutta la notte a 4 °C. L'aggiunta di antigene riduce la diluizione del siero iniziale a 1:8. |
|
3. |
Le piastre ELISA vengono lavate 5 volte con PBST. |
|
4. |
50 microlitri di miscele siero/antigene vengono quindi trasferiti dalle piastre portanti alle piastre ELISA coperte di siero di coniglio e incubate a 37 °C per un'ora su agitatore rotante. |
|
5. |
Dopo il lavaggio, 50 µl di antisiero di porcellino d'India per l'antigene usato al punto 4 vengono aggiunti a ciascun pozzetto. Le piastre vengono incubate a 37 °C per un'ora su agitatore rotante. |
|
6. |
Le piastre vengono lavate e in ciascun pozzetto vengono aggiunti 50 µl di immunoglobulina di coniglio anti-porcellino d'India coniugata con perossidasi di rafano. Le piastre vengono incubate a 37 °C per un'ora su agitatore rotante. |
|
7. |
Le piastre vengono lavate e a ciascun pozzetto vengono aggiunti 50 µl di ortofenilendiammina contenente H2O2 allo 0,05 % (30 %) p/v. |
|
8. |
La reazione viene arrestata dopo 15 minuti con H2SO4 1,25 M. |
Le piastre vengono lette spettrofotometricamente a 492 nm su un lettore ELISA collegato a un microcomputer.
|
Controlli |
: |
Per ciascun antigene usato, 40 pozzetti non contengono siero, bensì antigene diluito in PBST. Una doppia serie, in duplicato, di diluizioni di antisiero bovino omologo di riferimento. Una doppia serie, in duplicato, di diluizioni di siero bovino, negativo. |
|
Interpretazione |
: |
I titoli anticorpali vengono espressi come la diluizione finale del campione di siero che dà il 50 % del valore medio della densità ottica registrata nei pozzetti di controllo del virus nei quali il siero da analizzare è assente. I titoli superiori a 1:40 vengono considerati positivi. |
|
Riferimenti |
: |
Hamblin C, Barnett ITR and Hedger RS (1986) «A new enzyme-linked immunosorbent assay (ELISA) for the detection of antibodies against foot-and-mouth disease virus. I. Development and method of ELISA.»Journal of Immunological Methods, 93, pagg. 115-121.11. |
Malattia di Aujeszky (AJD)
A) La sieroneutralizzazione deve essere effettuata secondo il seguente protocollo.
|
Siero |
: |
Prima dell'uso tutti i sieri vengono inattivati termicamente a 56 °C per 30 minuti. |
|
Procedimento |
: |
La neutralizzazione a virus costante e siero variabile su piastre da microtitolazione impiega sistemi cellulari VERO o altri sistemi cellulari sensibili. Il virus della malattia di Aujeszky è impiegato a 100 TCID50/0,025 ml; i campioni di siero inattivato non diluito sono miscelati con un volume uguale (0,025 ml) di sospensione virale. Prima di aggiungere le opportune cellule, le miscele virus/siero sono incubate per 2 ore a 37 °C nelle piastre da microtitolazione. Le cellule sono impiegate a una concentrazione in grado di formare un monostrato completo dopo 24 ore. |
|
Controlli |
: |
i) Saggio di infettività del virus; ii) controlli di tossicità del siero; iii) controlli su colture cellulari non inoculate; iv) antisieri di riferimento. |
|
Interpretazione |
: |
I risultati del test di neutralizzazione e il titolo del virus impiegato nell'esame sono registrati dopo 3-7 giorni di incubazione a 37 °C. I sieri con titolo inferiore a 1:2 (siero non diluito) vengono considerati negativi. |
B) Qualsiasi altro test riconosciuto a norma della decisione 2008/185/CE (11).
Gastroenterite trasmissibile (TGE)
La sieroneutralizzazione deve essere effettuata secondo il seguente protocollo.
|
Siero |
: |
Prima dell'uso tutti i sieri vengono inattivati termicamente a 56 °C per 30 minuti. |
|
Procedimento |
: |
La neutralizzazione a virus costante e siero variabile su piastre da microtitolazione impiega cellule A72 (tumore del cane) o altri sistemi cellulari sensibili. Il virus della TGE deve essere impiegato a 100 TCID50/0,025 ml; i campioni di siero inattivato non diluito sono miscelati con un volume uguale (0,025 ml) di sospensione virale. Le miscele virus/siero sono incubate per 30-60 minuti a 37 °C nelle piastre da microtitolazione prima dell'aggiunta delle cellule opportune. Le cellule sono impiegate a una concentrazione in grado di formare un monostrato completo dopo 24 ore. Ogni cellula riceve 0,1 ml di sospensione cellulare. |
|
Controlli |
: |
i) Saggio di infettività del virus; ii) controlli di tossicità del siero; iii) controlli su colture cellulari non inoculate; iv) antisieri di riferimento. |
|
Interpretazione |
: |
I risultati del test di neutralizzazione e il titolo del virus impiegato nel test sono registrati dopo 3-5 giorni di incubazione a 37 °C. I sieri con titoli inferiori a 1:2 (diluizione finale) sono da considerarsi negativi. Se i campioni di siero non diluiti sono tossici per le colture tissutali, essi possono essere diluiti a 1:2 prima di essere usati nel test. Ciò equivale a una diluizione finale del siero di 1:4. In questo caso, i sieri con titoli inferiori a 1:4 (diluizione finale) sono da considerarsi negativi. |
Malattia vescicolare dei suini (SVD)
Gli esami per la malattia vescicolare dei suini (SVD) vengono effettuati conformemente alla decisione 2000/428/CE (12).
Peste suina classica (CSF)
Gli esami per la peste suina classica (CSF) vengono effettuati conformemente alla decisione 2002/106/CE (13).
Gli esami per la CSF devono essere eseguiti seguendo gli orientamenti di cui al capitolo pertinente del Manual of Diagnostic Tests and Vaccines for Terrestrial Animals (Manuale dei test diagnostici e dei vaccini per gli animali terrestri) dell'OIE.
La sensibilità e la specificità della prova sierologica per la CSF devono essere valutate presso un laboratorio nazionale che applica un sistema di garanzia della qualità. Gli esami utilizzati devono essere in grado di riconoscere una serie di sieri di riferimento debolmente e fortemente positivi e consentire l'identificazione di anticorpi nella fase iniziale della malattia e nella fase di convalescenza.
PARTE 7
Condizioni di polizia sanitaria relative all'importazione e alla quarantena degli animali importati a Saint Pierre e Miquelon meno di sei mesi prima della loro introduzione nell'Unione
(di cui all'articolo 6)
Specie animali interessate
|
Unità tassonomica |
||
|
ORDINE |
FAMIGLIA |
GENERE E SPECIE |
|
Artiodattili |
Camelidi |
Camelus spp., Lama spp., Vicugna spp. |
CAPO 1
Soggiorno e quarantena
1. Gli animali importati a Saint Pierre e Miquelon devono soggiornare in una stazione di quarantena autorizzata per almeno 60 giorni prima di essere spediti ai fini della loro introduzione nell'Unione. Gli esami prescritti per le singole specie possono richiedere un'estensione di questo periodo. Gli animali devono soddisfare inoltre le seguenti condizioni:
|
a) |
sebbene nella stazione di quarantena possano essere ammesse partite separate, una volta accolti nella stazione di quarantena tutti gli animali appartenenti alla stessa specie devono essere considerati come un unico gruppo ed essere individuati come tali. Per l'intero gruppo il periodo di quarantena decorre dal momento dell'ingresso dell'ultimo animale nell'impianto di quarantena; |
|
b) |
all'interno della stazione di quarantena, ogni specifico gruppo di animali deve essere tenuto in isolamento e non deve avere contatti diretti o indiretti con altri animali, compresi quelli di altre partite eventualmente presenti. Ogni partita deve essere tenuta nella stazione di quarantena riconosciuta ed essere al riparo da insetti vettori; |
|
c) |
se, durante il periodo di quarantena, l'isolamento viene interrotto e un gruppo di animali entra in contatto con altri animali, deve iniziare un nuovo periodo di quarantena della stessa durata di quello inizialmente contemplato all'entrata nella stazione di quarantena; |
|
d) |
gli animali destinati a essere introdotti nell'Unione che transitano per la stazione di quarantena devono essere caricati e spediti direttamente nell'Unione:
|
2. Le strutture di quarantena devono soddisfare almeno i requisiti minimi di cui all'allegato B della direttiva 91/496/CEE (14), nonché le seguenti condizioni:
|
a) |
devono essere sottoposte alla supervisione di un veterinario ufficiale; |
|
b) |
devono essere situate al centro di un'area di almeno 20 km di diametro all'interno della quale, stando alle risultanze ufficiali, non sia stato riscontrato alcun caso di afta epizootica almeno nei 30 giorni precedenti il loro utilizzo come stazione di quarantena; |
|
c) |
prima di essere adibite a stazione di quarantena, devono essere pulite e disinfettate con un disinfettante ufficialmente autorizzato a Saint Pierre e Miquelon, di comprovata efficacia ai fini della lotta contro le malattie di cui al capo II; |
|
d) |
tenuto conto del numero di animali che possono accogliere, devono disporre:
|
|
e) |
quando in attività, devono disporre di un numero di veterinari sufficiente allo svolgimento di tutti i compiti; |
|
f) |
devono ammettere solo animali identificati individualmente in modo da garantire la tracciabilità. A tal fine, all'arrivo degli animali, il proprietario o il responsabile della stazione di quarantena deve verificare che essi siano adeguatamente identificati e accompagnati dai certificati sanitari previsti per le specie e categorie in questione. Il proprietario o il responsabile della stazione di quarantena deve inoltre inserire in un registro o in una banca dati i seguenti dati, da conservare per un minimo di tre anni: il nome del proprietario, l'origine degli animali che compongono la partita, la data di ingresso e di uscita di tali animali, il numero di identificazione degli animali che compongono la partita e il luogo di destinazione; |
|
g) |
l'autorità competente deve stabilire la procedura di controllo ufficiale della stazione di quarantena e garantirne l'effettività del controllo. Nell'ambito della supervisione, sono previste ispezioni regolari volte a determinare il perdurare delle condizioni che hanno consentito il riconoscimento. In caso di inadempienze e di sospensione del riconoscimento, quest'ultimo può essere ripristinato solo ove l'autorità competente abbia la certezza che la struttura di quarantena soddisfa pienamente tutte le condizioni di cui alle lettere da a) a g). |
CAPO 2
Test zoosanitari
1. REQUISITI GENERALI
Gli animali devono essere sottoposti ai seguenti test da effettuare su campioni ematici prelevati, salvo diversa indicazione, non prima che siano trascorsi 21 giorni dall'inizio del periodo di isolamento.
Gli esami di laboratorio devono essere eseguiti in un laboratorio riconosciuto nell'Unione e al certificato sanitario devono essere allegati i documenti attestanti gli esami di laboratorio e i relativi risultati, le vaccinazioni e i trattamenti praticati.
Al fine di ridurre al minimo gli interventi sugli animali, i prelievi, i test e le eventuali vaccinazioni devono essere nella misura del possibile raggruppati nel rispetto degli intervalli di tempo minimi imposti dai protocolli di cui alla parte 2 del presente capo.
2. REQUISITI SPECIFICI
2.1 CAMELIDI
2.1.1 Tubercolosi
|
a) |
Test da impiegare: test comparativo di intradermoreazione con PPD (derivato proteico purificato) bovina e aviaria ottenuta secondo le norme per la produzione delle tubercoline bovine e aviarie di cui all'allegato B, punto 2.1.2, della direttiva 64/432/CEE. Il test deve essere eseguito nella regione ascellare (dietro la spalla) secondo la tecnica di cui all'allegato B, punto 2.2.4, della direttiva 64/432/CEE. |
|
b) |
Calendario di esecuzione dei test: il test deve essere eseguito entro due giorni dall'arrivo degli animali nella stazione di quarantena e a distanza di 42 giorni dal primo test. |
|
c) |
Interpretazione dei test La reazione è da considerarsi:
|
|
d) |
Misure successive ai test Se il test di intradermoreazione alla PPD bovina dà esito positivo in un animale, tale animale deve essere allontanato dal gruppo e gli altri animali devono essere nuovamente sottoposti al test a distanza di almeno 42 giorni dall'esecuzione del primo test risultato positivo; il nuovo test va considerato come il primo dei due di cui alla lettera b). Se il test dà esito positivo in più di un animale, l'intero gruppo non è ammesso all'esportazione nell'Unione. Se il test dà esito dubbio in uno o più animali dello stesso gruppo, l'intero gruppo deve essere nuovamente sottoposto al test a distanza di 42 giorni dall'esecuzione del primo test risultato positivo e il nuovo test va considerato il primo dei due di cui alla lettera b). |
2.1.2 Brucellosi
|
a) |
Test da impiegare
|
|
b) |
Calendario di esecuzione dei test: il test deve essere eseguito una prima volta entro due giorni dall'arrivo degli animali nella stazione di quarantena e a distanza di 42 giorni dal primo test. |
|
c) |
Interpretazione dei test La reazione ai test è da considerarsi positiva se corrisponde alla definizione di cui all'allegato C della direttiva 64/432/CEE. |
|
d) |
Misure successive ai test Gli animali risultati positivi a uno dei test devono essere allontanati dal gruppo e il resto degli animali deve essere nuovamente sottoposto al test a distanza di almeno 42 giorni dall'esecuzione del primo test positivo; il nuovo test va considerato come il primo dei due di cui alla lettera b). È consentita l'introduzione nell'Unione unicamente degli animali risultati negativi a due test consecutivi eseguiti secondo quanto descritto alla lettera b). |
2.1.3 Febbre catarrale degli ovini e malattia emorragica epizootica (EHD)
|
a) |
Test da impiegare: immunodiffusione in gel di agar quale descritta nell'allegato I, parte 6, del regolamento (UE) n. 206/2010 (SANCO/4787/2009). In caso di reazione positiva, gli animali devono essere sottoposti a saggio ELISA competitivo quale descritto nell'allegato I, parte 6, del regolamento (UE) n. 206/2010 (SANCO/4787/2009) per distinguere le due malattie. |
|
b) |
Calendario di esecuzione dei test Gli animali devono risultare negativi a due test, eseguiti il primo entro due giorni dall'arrivo nella stazione di quarantena e il secondo a distanza di almeno 21 giorni dal primo. |
|
c) |
Misure successive ai test
|
2.1.4 Afta epizootica (FMD)
|
a) |
Test da impiegare: test diagnostici (probang e sierologici) con le tecniche ELISA e di neutralizzazione del virus eseguiti secondo i protocolli di cui all'allegato I, parte 6, del regolamento (UE) n. 206/2010 (SANCO/4787/2009). |
|
b) |
Calendario di esecuzione dei test: gli animali devono risultare negativi a due test, eseguiti il primo entro due giorni dall'arrivo nella stazione di quarantena e il secondo a distanza di almeno 42 giorni dal primo. |
|
c) |
Misure successive ai test: se un solo animale risulta positivo al virus FMD, nessuno degli animali presenti nella stazione di quarantena è considerato idoneo a essere introdotto nell'Unione. Nota: l'eventuale presenza di anticorpi nei confronti delle proteine strutturali e non strutturali del virus FMD è considerata come l'indicazione di una pregressa infezione da FMD, indipendentemente dallo stato vaccinale degli animali. |
2.1.5 Peste bovina
|
a) |
Test da impiegare: il test prescelto è il saggio ELISA competitivo, quale descritto nell'ultima edizione del Manual of Diagnostic Tests and Vaccines for Terrestrial Animals (Manuale dei test diagnostici e dei vaccini per gli animali terrestri) dell'OIE, trattandosi del test prescritto per gli scambi internazionali. È inoltre consentito l'impiego della sieroneutralizzazione o di altri test riconosciuti, secondo i protocolli descritti nelle sezioni pertinenti del manuale dell'OIE. |
|
b) |
Calendario di esecuzione dei test: gli animali devono essere sottoposti a due test, eseguiti il primo entro due giorni dall'arrivo nella stazione di quarantena e il secondo a distanza di almeno 42 giorni dal primo. |
|
c) |
Misure successive ai test: se un solo animale risulta positivo al virus della peste bovina, nessuno degli animali presenti nella stazione di quarantena è considerato idoneo a essere introdotto nell'Unione. |
2.1.6 Stomatite vescicolosa
|
a) |
Test da impiegare: saggio ELISA, test di neutralizzazione virale o altro test riconosciuto, secondo i protocolli descritti nelle sezioni pertinenti del manuale dell'OIE. |
|
b) |
Calendario di esecuzione dei test: gli animali devono essere sottoposti a due test, eseguiti il primo entro due giorni dall'arrivo nella stazione di quarantena e il secondo a distanza di almeno 42 giorni dal primo. |
|
c) |
Misure successive ai test: se un solo animale risulta positivo al virus della stomatite vescicolosa, nessuno degli animali presenti nella stazione di quarantena è considerato idoneo a essere introdotto nell'Unione. |
2.1.7 Febbre della Rift Valley
|
a) |
Test da impiegare: saggio ELISA, test di neutralizzazione virale o altro test riconosciuto, secondo i protocolli descritti nelle sezioni pertinenti del manuale dell'OIE. |
|
b) |
Calendario di esecuzione dei test: gli animali devono essere sottoposti a due test, eseguiti il primo entro due giorni dall'arrivo nella stazione di quarantena e il secondo a distanza di almeno 42 giorni dal primo. |
|
c) |
Misure successive ai test: se un solo animale risulta essere stato esposto all'agente causale della febbre della Rift Valley, nessuno degli animali presenti nella stazione di quarantena è considerato idoneo a essere introdotto nell'Unione. |
2.1.8 Dermatite nodulare contagiosa
|
a) |
Test da impiegare: il test sierologico ELISA, test di neutralizzazione virale o altro test riconosciuto, secondo i protocolli descritti nelle sezioni pertinenti del manuale dell'OIE. |
|
b) |
Calendario di esecuzione dei test: gli animali devono essere sottoposti a due test, eseguiti il primo entro due giorni dall'arrivo nella stazione di quarantena e il secondo a distanza di almeno 42 giorni dal primo. |
|
c) |
Misure successive ai test: se un solo animale risulta essere stato esposto alla dermatite nodulare contagiosa, nessuno degli animali presenti nella stazione di quarantena è considerato idoneo a essere introdotto nell'Unione. |
2.1.9 Febbre emorragica di Crimea-Congo
|
a) |
Test da impiegare: saggio ELISA, test di neutralizzazione virale, test di immunofluorescenza o altro test ammesso. |
|
b) |
Calendario di esecuzione dei test: gli animali devono essere sottoposti a due test, eseguiti il primo entro due giorni dall'arrivo nella stazione di quarantena e il secondo a distanza di almeno 42 giorni dal primo. |
|
c) |
Misure successive ai test: se un solo animale risulta essere stato esposto all'agente causale della febbre emorragica di Crimea-Congo, nessuno degli animali presenti nella stazione di quarantena è considerato idoneo a essere introdotto nell'Unione. |
2.1.10 Surra [Trypanosoma evansi (T. evansi)]
|
a) |
Test da impiegare: la presenza dell'agente parassitario può essere evidenziata in campioni ematici concentrati, secondo i protocolli descritti nelle sezioni pertinenti del manuale dell'OIE. |
|
b) |
Calendario di esecuzione dei test: gli animali devono essere sottoposti a due test, eseguiti il primo entro due giorni dall'arrivo nella stazione di quarantena e il secondo a distanza di almeno 42 giorni dal primo. |
|
c) |
Misure successive ai test: non è considerato idoneo a essere introdotto nell'Unione ogni animale di una partita nel quale sia evidenziata la presenza del Trypanosoma evansi. Gli altri animali del gruppo devono essere sottoposti a trattamento antiparassitario interno ed esterno con agenti di comprovata efficacia nei confronti del Trypanosoma evansi. |
2.1.11 Febbre catarrale maligna
|
a) |
Test da impiegare: ricerca del DNA virale con identificazione mediante immunofluorescenza o immunocitochimica, secondo i protocolli descritti nelle sezioni pertinenti del manuale dell'OIE. |
|
b) |
Calendario di esecuzione dei test: gli animali devono essere sottoposti a due test, eseguiti il primo entro due giorni dall'arrivo nella stazione di quarantena e il secondo a distanza di almeno 42 giorni dal primo. |
|
c) |
Misure successive ai test: se un solo animale risulta essere stato esposto alla febbre catarrale maligna, nessuno degli animali presenti nella stazione di quarantena è considerato idoneo a essere introdotto nell'Unione. |
2.1.12 Rabbia
Vaccinazione: la vaccinazione contro la rabbia può essere praticata ove richiesta dallo Stato membro di destinazione. L'animale deve essere quindi sottoposto a un prelievo ematico e a una prova di sieroneutralizzazione per la ricerca di anticorpi.
2.1.13 Leucosi bovina enzootica [solo nel caso di animali destinati a uno Stato membro o una regione ufficialmente indenni dalla leucosi bovina enzootica, di cui all'articolo 2, paragrafo 2, lettera k), della direttiva 64/432/CEE].
|
a) |
Test da impiegare: immunodiffusione in gel di Agar (AGID) o saggio ELISA blocking, secondo i protocolli descritti nelle sezioni pertinenti dell'ultima edizione del manuale dell'OIE. |
|
b) |
Calendario di esecuzione dei test: gli animali devono essere sottoposti a due test, eseguiti il primo entro due giorni dall'arrivo nella stazione di quarantena e il secondo a distanza di almeno 42 giorni dal primo. |
|
c) |
Misure successive ai test: gli animali risultati positivi al test di cui alla lettera a) devono essere allontanati dal gruppo di animali nella stazione di quarantena e gli altri animali devono essere nuovamente sottoposti a test a distanza di almeno 21 giorni dall'esecuzione del primo test positivo; il nuovo test va considerato come il primo dei due di cui alla lettera b). Sono considerati idonei a essere introdotti nell'Unione unicamente gli animali risultati negativi a due test consecutivi eseguiti secondo quanto descritto alla lettera b). |
(1) Fatte salve le condizioni specifiche in materia di certificazione contemplate da eventuali accordi pertinenti tra l'Unione e i paesi terzi.
(2) Esclusivamente per animali vivi non appartenenti a specie di cervidi.
(3) Certificati conformi all'accordo tra la Comunità europea e la Confederazione svizzera sul commercio di prodotti agricoli (GU L 114 del 30.4.2002, pag. 132).
(4) Ex Repubblica iugoslava di Macedonia: la denominazione definitiva del paese verrà concordata a conclusione dei negoziati attualmente in corso alle Nazioni Unite.
(5) Escluso il Kosovo, posto attualmente sotto amministrazione internazionale ai sensi della risoluzione 1 244 del Consiglio di sicurezza delle Nazioni Unite del 10 giugno 1999.
(6) GU 121 del 29.7.1964, pag. 1977/64.
(7) GU L 46 del 19.2.1991, pag. 19.
(8) Cancellare il paese non pertinente.
(9) La Serbia non comprende il Kosovo, posto attualmente sotto amministrazione internazionale ai sensi della risoluzione 1244 del Consiglio di sicurezza delle Nazioni Unite del 10 giugno 1999.
(10) GU L 249 del 23.7.2004, pag. 20.
(11) GU L 59 del 4.3.2008, pag. 19.
(12) GU L 167 del 7.7.2000, pag. 22.