|
31.5.2008
|
IT
|
Gazzetta ufficiale dell’Unione europea
|
L 142/1
|
REGOLAMENTO (CE) N. 440/2008 DELLA COMMISSIONE
del 30 maggio 2008
che istituisce dei metodi di prova ai sensi del regolamento (CE) n. 1907/2006 del Parlamento europeo e del Consiglio concernente la registrazione, la valutazione, l'autorizzazione e la restrizione delle sostanze chimiche (REACH)
(Testo rilevante ai fini del SEE)
LA COMMISSIONE DELLE COMUNITÀ EUROPEE,
visto il trattato che istituisce la Comunità europea,
visto il regolamento (CE) n. 1907/2006 del Parlamento europeo e del Consiglio, del 18 dicembre 2006, concernente la registrazione, la valutazione, l'autorizzazione e la restrizione delle sostanze chimiche (REACH), che istituisce un'Agenzia europea per le sostanze chimiche, che modifica la direttiva 1999/45/CE e abroga il regolamento (CEE) n. 793/93 del Consiglio e il regolamento (CE) n. 1488/94 della Commissione, nonché la direttiva 76/769/CEE del Consiglio e le direttive della Commissione 91/155/CEE, 93/67/CEE, 93/105/CE e 2000/21/CE (1) e, in particolare, l'articolo 13, paragrafo 3, del medesimo,
considerando quanto segue:
|
(1)
|
A norma del regolamento (CE) n. 1907/2006, ai fini dello svolgimento di test sulle sostanze occorre adottare metodi di prova a livello comunitario qualora tali test siano finalizzati ad acquisire informazioni sulle proprietà intrinseche delle sostanze.
|
|
(2)
|
La direttiva 67/548/CEE del Consiglio, del 27 giugno 1967, concernente il ravvicinamento delle disposizioni legislative, regolamentari e amministrative relative alla classificazione, all'imballaggio e all'etichettatura delle sostanze pericolose (2) istituiva, all'allegato V, i metodi per determinare le proprietà fisico-chimiche, la tossicità e l'ecotossicità delle sostanze e dei preparati. L'allegato V della direttiva 67/548/CEE è stato soppresso dalla direttiva 2006/121/CE del Parlamento europeo e del Consiglio a decorrere dal 1o giugno 2008.
|
|
(3)
|
I metodi di prova contenuti nell'allegato V della direttiva 67/548/CEE devono essere integrati nel presente regolamento.
|
|
(4)
|
Questo regolamento non esclude l'uso di altri metodi di prova, a condizione che il loro uso sia conforme all'articolo 13, paragrafo 3, del regolamento (CE) n. 1907/2006.
|
|
(5)
|
Nella concezione dei metodi di prova occorre tener conto dei principi finalizzati a rimpiazzare, ridurre e raffinare le tecniche per l'uso degli animali nelle procedure, in particolare quando diventano disponibili opportuni metodi convalidati per sostituire, ridurre o raffinare la sperimentazione sugli animali.
|
|
(6)
|
Le disposizioni di cui al presente regolamento sono conformi al parere del comitato istituito dall'articolo 133 del regolamento (CE) n. 1907/2006,
|
HA ADOTTATO IL PRESENTE REGOLAMENTO:
Articolo 1
I metodi di prova applicabili ai fini del regolamento (CE) n. 1907/2006 sono definiti nell'allegato al presente regolamento.
Articolo 2
La Commissione riesamina, ove opportuno, i metodi di prova contenuti nel presente regolamento al fine di sostituire, ridurre o raffinare i test sugli animali vertebrati.
Articolo 3
I riferimenti all'allegato V della direttiva 67/548/CEE si intendono fatti al presente regolamento.
Articolo 4
Il presente regolamento entra in vigore il giorno successivo alla pubblicazione nella Gazzetta ufficiale dell'Unione europea.
Esso si applica a decorrere dal 1o giugno 2008.
Fatto a Bruxelles, il 30 maggio 2008.
Per la Commissione
Stavros DIMAS
Membro della Commissione
(1) GU L 396 del 30.12.2006, pag. 1, rettifica nella GU L 136 del 29.5.2007, pag. 3.
(2) GU 196 del 16.8.1967, pag. 1. Direttiva modificata da ultimo dalla direttiva 2006/121/CE del Parlamento europeo e del Consiglio, rettifica nella GU L 136 del 29.5.2007, pag. 281, (GU L 396 del 30.12.2006, pag. 850) [da aggiornare con i riferimenti corretti al momento della pubblicazione del 30o adeguamento al progresso tecnico].
ALLEGATO
PARTE A: METODI PER LA DETERMINAZIONE DELLE PROPRIETÀ FISICO-CHIMICHE
INDICE
|
A.1.
|
TEMPERATURA DI FUSIONE/CONGELAMENTO |
|
A.2.
|
TEMPERATURA DI EBOLLIZIONE |
|
A.5.
|
TENSIONE SUPERFICIALE |
|
A.8.
|
COEFFICIENTE DI RIPARTIZIONE |
|
A.9.
|
PUNTO D'INFIAMMABILITÀ |
|
A.10.
|
INFIAMMABILITÀ (SOLIDI) |
|
A.ll
|
INFIAMMABILITÀ (GAS) |
|
A.12
|
INFIAMMABILITÀ (CONTATTO CON L'ACQUA) |
|
A.13
|
PROPRIETÀ PIROFORICHE DI SOLIDI E LIQUIDI |
|
A.15
|
TEMPERATURA DI AUTOACCENSIONE (LIQUIDI E GAS) |
|
A.16
|
TEMPERATURA DI AUTOACCENSIONE RELATIVA DEI SOLIDI |
|
A.17
|
PROPRIETÀ OSSIDANTI (SOLIDI) |
|
A.18.
|
PESO MOLECOLARE MEDIO NUMERICO E DISTRIBUZIONE DEL PESO MOLECOLARE DI POLIMERI |
|
A.19.
|
CONTENUTO DI FRAZIONI A BASSO PESO MOLECOLARE IN POLIMERI |
|
A.20.
|
COMPORTAMENTO DI SOLUZIONE/ESTRAZIONE DEI POLIMERI IN ACQUA |
|
A.21.
|
PROPRIETÀ COMBURENTI (LIQUIDI) |
A.1. TEMPERATURA DI FUSIONE/CONGELAMENTO
1. METODO
La maggior parte dei metodi descritti si basano sulle linee direttrici OCSE (1). I principi fondamentali sono riportati nei riferimenti (2) e (3).
1.1. INTRODUZIONE
I metodi e le apparecchiature qui illustrati si applicano alla determinazione della temperatura di fusione di sostanze senza alcuna limitazione rispetto al loro grado di purezza.
La scelta del metodo più idoneo dipende dalla natura delle sostanze in esame. Di conseguenza, il fattore limitante sarà inerente ai fatto che la sostanza sia facilmente, difficilmente o per nulla polverizzabile.
Per alcune sostanze, la determinazione della temperatura di congelamento o di solidificazione risulta più appropriata e pertanto in questo metodo sono state incluse anche le norme per queste determinazioni.
Dove, a motivo delle particolari proprietà della sostanza, non sia possibile misurare in modo adatto alcuni dei parametri suddetti, può essere appropriato un punto di scorrimento.
1.2. DEFINIZIONI ED UNITÀ
La temperatura di fusione è definita come la temperatura alla quale si verifica la transizione di fase dallo stato solido allo stato liquido a pressione atmosferica, e questa temperatura nel caso ideale corrisponde alla temperatura di congelamento.
Poiché per molte sostanze la transizione di fase si verifica in un intervallo di temperatura ampio, questo viene spesso descritto come intervallo di fusione.
Conversione delle unità (da K a oC):
t = T - 273,15
|
t
|
:
|
temperatura Celsius, gradi Celsius ( oC)
|
|
T
|
:
|
temperatura termodinamica, kelvin (K)
|
1.3. SOSTANZE DI RIFERIMENTO
Non è necessario utilizzare sostanze di riferimento ogni volta che si esamina una nuova sostanza. Esse devono principalmente venire impiegate per controllare periodicamente i risultati ottenuti col metodo e per permettere confronti con i risultati ottenuti con altri metodi.
Alcune sostanze di riferimento sono elencate nel riferimento bibliografico (4).
1.4. PRINCIPIO DEL METODO
Si determina la temperatura (o l’intervallo di temperatura) della transizione di fase dallo stato solido allo stato liquido o dallo stato liquido allo stato solido. In pratica si determina la temperatura di fusione/congelamento incipiente e di fusione/congelamento finale curante il riscaldamento/raffreddamento di un campione della sostanza in esame a pressione atmosferica. Sona descritti 5 metodi, e precisamente il metodo del capillare, il metodo degli elementi riscaldanti, la determinazione del punto di congelamento, i metodi di analisi termica e la determinazione del punto di scorrimento (come è stata sviluppata per gli olii di origine petrolifera).
In alcuni casi, può essere conveniente misurare la temperatura di congelamento invece della temperatura di fusione.
1.4.1. Metodo del capillare
1.4.1.1. Apparecchi per la determinazione del punto di fusione tramite bagno liquido
Una piccola quantità della sostanza finemente macinata viene introdotta in un tubo capillare e compattata fortemente. Il tubo viene riscaldato, insieme ad un termometro, e l'aumento di temperatura viene regolato in modo che sia inferiore a circa 1 K/min durante la fusione propriamente detta. Si determinano quindi le temperature iniziale e finale di fusione.
1.4.1.2. Apparecchi per la determinazione del punto di fusione a blocco metallico
Si procede come indicato al punto 1.4.1.1, salvo il fatto che i tubo capillare ed il termometro sono collocati in un blocco di metallo riscaldante, attraverso alcuni fori del quale è possibile la loro osservazione.
1.4.1.3. Determinazione tramite fotocellula
Il campione contenuto nel tubo capillare viene riscaldato automaticamente in un cilindro metallico. Attraverso un foro praticato nel cilindro un raggio luminoso viene convogliato sulla sostanza e raggiunge poi una fotocellula accuratamente tarata. Per la maggior parte delle sostanze le proprietà ottiche si modificano durante la fusione, passando dall'opacità alla trasparenza. L'intensità della luce che raggiunge la fotocellula aumenta fino ad inviare un segnale di arresto all'indicatore numerico di un termometro a resistenza di platino collocato nella camera di riscaldamento. Questo metodo non è adatto per alcune sostanze fortemente colorate.
1.4.2. Elementi riscaldanti
1.4.2.1. Banco riscaldante di Kofler
Il banco riscaldante di Kofler fa uso di due corpi metallici di diversa conducibilità termica, riscaldati elettricamente; la sbarra è progettata in modo tale che per tutta la sua lunghezza il gradiente di temperatura è virtualmente costante. La temperatura dell'elemento riscaldante può variare da 283 K a 573 K; essa viene letta su un apposito strumento costituito da un cursore provvisto di indice e di linguetta specificamente realizzati per ogni banco. Per determinare una temperatura di fusione, la sostanza viene distribuita in uno strato sottile direttamente sulla superficie dell'elemento riscaldante. In pochi secondi appare una linea di separazione netta tra la fase solida e quella liquida. La temperatura corrispondente a questa linea di separazione viene letta facendovi coincidere l'indice dello strumento.
1.4.2.2. Microscopio di fusione
Numerosi sono gli elementi riscaldanti forniti di microscopio utilizzati per la determinazione del punto di fusione con quantità molto piccole di materiale. Nella maggioranza di questi strumenti, la temperatura viene determinata mediante una termocoppia sensibile, ma talvolta si usano anche termometri a mercurio. La versione tipica di un apparecchio per la determinazione del punto di fusione ad elemento riscaldante con microscopio è dotata di una camera di riscaldamento contenerne una piastra metallica sopra la quale si pone il campione, distribuito su un vetrino. Al centro della piastra metallica si trova un foro che permette il passaggio della luce proveniente dallo specchio di illuminazione del microscopio. Durante la misura la camera viene chiusa da una piastra di vetro in modo da escludere l'aria dalla zona del campione.
Il riscaldamento del campione è regolato da un reostato. Per misure di grande precisione e nel caso di sostanze otticamente anisotrope, si può utilizzare luce polarizzata.
1.4.2.3. Metodo del menisco
Questo metodo è specifico per le poliammidi.
Si determina visivamente la temperatura alla quale si verifica lo spostamento di un menisco di olio siliconico compreso tra un elemento riscaldante e un copri-oggetti sostenuto dal campione di poliammide in esame.
1.4.3 Metodo per determinare la temperatura di congelamento
Il campione viene posto in una provetta speciale e inserito in un apparecchio per la determinazione della temperatura di congelamento. Il campione viene agitato con delicatezza e continuità durante il raffreddamentoe la temperatura viene misurata ad intervalli adatti. Non appena la temperatura si mantiene costante per qualche lettura, si registra tale temperatura (corretta per l'errore termometrico) come temperatura di congelamento.
Si deve evitare un sovraraffreddamento mantenendo l'equilibrio tra le fasi solida e liquida.
1.4.4. Analisi termica
1.4.4.1. Analisi termica differenziale (ATD)
Questa tecnica registra la differenza di temperatura tra la sostanza e un materiale di riferimento in funzione della temperatura stessa mentre la sostanza e il materiale di riferimento sono sottoposti allo stesso programma controllato di temperatura. Quando il campione subisce una transizione che implica una variazione di entalpia, tale variazione è indicata da una deviazione endotermica (fusione) o esotermica (congelamento) dalla linea di base del tracciato della temperatura.
1.4.4.2. Calorimetria differenziale a scansione (CDS)
Questa tecnica registra la differenza tra l'energia introdotta in una sostanza e quella introdotta in un materiale di riferimento, in funzione della temperatura, mentre la sostanza e il materiale di riferimento sono sottoposti allo stesso programma controllato di temperatura. Questa energia è l'energia necessaria per mantenere nulla la differenza di temperatura tra la sostanza e il materiale di riferimento. Quando il campione subisce una transizione che implica una variazione di entalpia, tale variazione è indicata da una deviazione endotermica (fusione) o esotermica (congelamento) dalla linea di base del tracciato del flusso termico.
1.4.5. Punto di scorrimento
Questo metodo è stato sviluppato per l'uso con gli olii di origine petrolifera ed è adatto per l'uso con sostanze oleose aventi una bassa temperatura di fusione.
Dopo un riscaldamento preliminare, il campione viene raffreddato ad una velocità specifica mentre, ad intervalli di 3 K, se ne esaminano le caratteristiche di scorrimento. La temperatura più bassa alla quale si osserva un movimento della sostanza viene registrata come punto di scorrimento.
1.5. CRITERI DI QUALITÀ
L'applicabilità e l'accuratezza dei vari metodi impiegati per la determinazione della temperatura di fusione/intervallo di fusione sono indicate nella seguente tabella.
TABELLA: APPLICABILITÀ DEI METODI
A. Metodi con impiego di capillare
|
Metodo di misura
|
Sostanze polverizzabili
|
Sostanze difficilmente polverizzabili
|
Intervallo di temperatura
|
Accuratezza stimata (1)
|
Norme esistenti
|
|
Apparecchi per il punto di fusione a bagno liquido
|
Sì
|
Soltanto per alcune
|
Da 273 a 573 K
|
±0,3 K
|
JIS K 0064
|
|
Apparecchi per il punto di fusione con blocco metallico
|
Sì
|
Soltanto per alcune
|
Da 293 a > 573 K
|
±0,5 K
|
ISO 1218 (E)
|
|
Determinazione con fotocellula
|
Sì
|
Svariate, con uso di accessori
|
Da 253 a 573 K
|
±0,5 K
|
|
B. Metodi con impiego di elementi riscaldanti e metodi di congelamento
|
Metodo di misura
|
Sostanze polverizzabili
|
Sostanze difficilmente polverizzabili
|
Intervallo di temperatura
|
Accuratezza stimata (2)
|
Norme esistenti
|
|
Banco riscaldante di Kofler
|
Sì
|
No
|
Da 283 a > 573 K
|
±1,0 K
|
ANSI/ASTM D 345176
|
|
Microscopio di fusione
|
Sì
|
Soltanto per alcune
|
Da 273 a > 573 K
|
±0,5 K
|
DIN 53736
|
|
Metodo del menisco
|
No
|
Specifico per le poliammidi
|
Da 293 a > 573 K
|
±0,5 K
|
ISO 1218 (E)
|
|
Metodo del punto di congelamento
|
Sì
|
Sì
|
Da 223 a 573 K
|
±0,5 K
|
per esempio BS 4695
|
C. Analisi termica
|
Metodo di misura
|
Sostanze polverizzabili
|
Sostarne difficilmente polverizzabili
|
Intervallo di temperatura
|
Accuratezza stimata (3)
|
Norme esistenti
|
|
Analisi termica differenziale
|
Sì
|
Sì
|
Da 173 a 1 273 K
|
Fino a 600 K ±0,5 K Fino a 1 273 K ±2,0 K
|
ASTM E 53776
|
|
Calorimetria differenziate a scansione
|
Sì
|
Sì
|
Da 173 a 1 273 K
|
Fino a 600 K ±0,5 K Fino a 1 273 K ±2,0 K
|
ASTM E 53776
|
D. Punto di scorrimento
|
Metodo di misura
|
Sostanze polverizzabili
|
Sostanze difficilmente polverizzabili
|
Intervallo di temperatura
|
Accuratezza stimata (4)
|
Norme esistenti
|
|
Punto di scorrimento
|
Per olii di origine petrolifera e sostanze oleose
|
Per olii di origine petrolifera e sostanze oleose
|
Da 223 a 323 K
|
±0,3 K
|
ASTM D 9766
|
1.6. DESCRIZIONE DEI METODI
Le procedure relative a quasi tutti i metodi di determinazione sono state descritte in varie norme internazionali nazionali (vedi appendice 1).
1.6.1. Metodi con tubo capillare
Quando vengono sottoposte ad un lento aumento di temperatura, sostanze finemente polverizzate mostrano solitamente gli stadi di fusione mostrati in figura 1.
figura 1.

Durante la determinazione della temperatura di fusione viene registrata la temperatura all'inizio delia fusione e nello stadio finale.
1.6.1.1. Apparecchi per il punto di fusione a bagno liquido
La figura 2 presenta un tipo di apparecchio normalizzato, realizzato in vetro, per la temperatura di fusione (JIS K0064): tutte le quote sono date in mm.
Figura 2

Bagno liquido:
Si deve scegliere un liquido adatto. La scelta del liquido dipende dalla temperatura di fusione da determinare, per esempio paraffina liquida per temperature di fusione non superiori a 473 K, olio di silicone per temperature di fusione non maggiori di 573 K.
Per temperature di fusione superiori a 523 K, si può usare una miscela costituita da 3 parti di acido solforico e 2 parti di solfato di potassio (rapporto in peso). Se si usa una miscela di questo tipo occorre prendere opportune precauzioni.
Termometro:
Vanno impiegati soltanto termometri che soddisfano le prescrizioni delle norme ASTM E 1-71, DIN 12770, JIS K 8001, o di norme equivalenti.
ASTM E 1671, DIN 12770, JIS K 8001.
Modalità operative:
La sostanza secca va polverizzata finemente in un mortaio e posta in un tubo capillare, chiuso per fusione ad una estremità, in modo che, dopo assestamento nella maniera più compatta possibile, l'altezza del riempimento sia di 3 mm circa. Per ottenere un assestamento uniforme del campione, il tubo capillare deve essere lasciato cadere attraverso una canna di vetro su un vetro da orologio da un'altezza di circa 700 mm.
Il capillare riempito viene posto nel bagno in modo tale che la parte centrale del bulbo del termometro a mercurio sia in contatto con il tubo capillare nella zona dove è collocato il campione. Il tubo capillare viene di solito introdotto nell'apparecchio a temperatura inferiore di circa 10 K a quella della temperatura di fusione.
Il bagno liquido viene riscaldato in modo che l'aumento di temperatura corrisponda a circa 3 K/min. Il liquido va mantenuto sotto agitazione. A circa 10 K al di sotto della temperatura prevista di fusione, la velocità di incremento della temperatura va regolata ad un massimo di 1 K/min.
Calcolo:
La temperatura fusione si calcola con la formula seguente:
T = TD + 0,00016 (TD - TE)n
dove:
|
T
|
=
|
temperatura di fusione corretta, in K,
|
|
TD
|
=
|
temperatura letta sul termometro D, in K,
|
|
TE
|
=
|
temperatura letta sul termometro E, in K,
|
|
n
|
=
|
numero di graduazioni della colonnina di mercurio sul termometro D sulla parte di stelo emergente.
|
1.6.1.2. Apparecchi per la temperatura di fusione con blocco metallico
Apparecchiatura:
La strumentazione consiste in:
|
—
|
un blocco cilindrico di metallo, la cui parte superiore è cava e forma una camera (vedi figura 3);
|
|
—
|
un tappo metallico provvisto di due o più fori per permettere l'inserimento dei tubi capillari nel blocco metallico;
|
|
—
|
un sistema di riscaldamento per il blocco metallico realizzato, per esempio, tramite una resistenza elettrica incorporata nel blocco;
|
|
—
|
un reostato per la regolazione della potenza applicata, se si fa uso del riscaldamento elettrico;
|
|
—
|
quattro finestre di vetro resistente al calore sulle pareti laterali della camera, disposte diametralmente ad angolo retto l'una rispetto all'altra. Di fronte ad una di esse è montato un oculare per l'osservazione del capillare. Le altre tre finestre vengono usate per illuminare l'interno per mezzo di lampade;
|
|
—
|
un capillare di vetro resistente al calore chiuso ad una estremità (vedi punto 1.6.1.1).
|
Termometro :
Vedi norme citate al punto 1.6.1.1. Possono utilizzarsi anche strumenti di misura termoelettrici di analoga accuratezza.
Figura 3

1.6.1.3. Determinazione tramite fotocellula
Apparecchiatura e modalità operative:
La strumentazione consiste in una camera metallica con un sistema automatico di riscaldamento. Si riempiono tre capillari secondo le indicazioni del punto 1.6.1.1 e si pongono nella camera.
Per la taratura dell'apparecchio sono disponibili diverse velocità di incremento lineare della temperatura e l'aumento di temperatura opportuno viene regolato elettricamente su una velocità costante e lineare preselezionata. La temperatura effettiva nel forno e la temperatura della sostanza nei tubi capillari sono indicare da registratori.
1.6.2. Elementi riscaldanti
1.6.2.1. Banco riscaldante di Kofler
Vedi appendice.
1.6.2.2. Microscopio di fusione
Vedi appendice.
1.6.2.3. Metodo del menisco (per poliammidi)
Vedi appendice.
La velocità di riscaldamento nella zona di passaggio attraverso la temperatura di fusione deve essere inferiore a 1 K/min.
1.6.3. Metodi per la determinazione della temperatura di congelamento
Vedi appendice.
1.6.4. Analisi termica
1.6.4.1. Analisi termica differenziale
Vedi appendice.
1.6.4.2. Calorimetria differenziale a scansione
Vedi appendice.
1.6.5. Determinazione del punto di scorrimento
Vedi appendice.
2. DATI
In alcuni casi si rende necessaria una correzione della lettura termometrica.
3. RELAZIONE
La relazione sulla prova deve, se possibile, includere le seguenti informazioni:
|
—
|
descrizione precisa della sostanza (identità e impurezze) ed eventuale stadio preliminare di purificazione;
|
|
—
|
stima dell'accuratezza.
|
Come temperatura di fusione viene riportata la media di almeno due misure che cadano nel campo di accuratezza stimata (vedi tabelle).
Se la differenza tra la temperatura all'inizio e allo stadio finale della fusione ricade nei limiti di accuratezza del metodo, si prende come punto di fusione la temperatura dello stadio finale della fusione; altrimenti vengono riportate ambedue le temperature.
Se la sostanza si decompone o sublima prima del raggiungimento della temperatura di fusione, si riporterà la temperatura alla quale si osserva l'effetto.
Devono essere riportate tutte le informazioni e osservazioni utili per l'interpretazione dei risultati, in particolare per quanto riguarda le impurezze e lo stato fisico della sostanza.
4. BIBLIOGRAFIA
|
(1)
|
OECD, Paris, 1981, Test Guideline 102, Decision of the Council C(81) 30 final.
|
|
(2)
|
IUPAC, B. Le Neindre, B. Vodar, eds. Experimental thermodynamics, Butterworths, London 1975, vol. II, 803-834.
|
|
(3)
|
R. Weissberger ed.: Technique of organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Interscience Publ., New York, 1959, vol. I, Part I, Chapter VII.
|
|
(4)
|
IUPAC, Physicochemical measurements: Catalogue of reference materials, from national laboratories, Pure and applied chemistry, 1976, vol, 48, 505-515.
|
Appendice
Per ulteriori particolari tecnici, si possono consultare ad esempio le seguenti norme:
1. Metodi basati sull'impiego di capillari
1.1. Apparecchi per la determinazione del punto di fusione a bagno liquido
|
ASTM E 324-69
|
Standard test method for relative initial and final melting points and the melting range of organic chemicals
|
|
BS 4634
|
Method for the determination of melting point and/or melting range
|
|
DIN 53181
|
Bestimmung des Schmelzintervalles von Harzen nach Kapillarverfahren
|
|
JIS K 00-64
|
Testing methods for melting point of chemical products
|
1.2. Apparecchi per la determinazione della temperatura di fusione a blocco di metallo
|
DIN 53736
|
Visuelle Bestimmung der Schmelztemperatur von teilkristallinen Kunststoffen
|
|
ISO 1218 (E)
|
Plastics — polyarnides — determination of «melting point»
|
2. Apparecchi ed elementi riscaldanti
2.1. Banco riscaldante di Kofler
|
ANSI/ASTM D 3451-76
|
Standard recommended practices for testing; polymeric powder coatings
|
2.2. Microscopio di fusione
|
DIN 53736
|
Visuelle Bestimmung der Schmelztemperatur von teilkristallinen Kunststoffen
|
2.3. Metodo del menisco (poliammidi)
|
ISO 1218 (E)
|
Plastics — polyarnides — determination of «melting point»
|
|
ANSI/ASTM D2133-66
|
Standard specification for acetal resin injection; moulding and extrusion materials
|
|
NF T 51-050
|
Résines de polyamides. Détermination du «point de fusion». Méthode du ménisque
|
3. Metodi per la determinazione della temperatura di congelamento
|
BS 4633
|
Method for the determination of crystallizing point
|
|
BS 4695
|
Method for determination of melting point of petroleum wax (Cooling Curve)
|
|
DIN 51421
|
Bestimmung des Gefrierpunktes von Flugkraftstoffen, Ottokraftstoffen und Motorenbenzolen
|
|
ISO 2207
|
Cires de pétrole: détermination de la température de figeage
|
|
DIN 53175
|
Bestimmung des Erstarrungspunktes von Fettsauren
|
|
NF T 60-114
|
Point de fusion des paraffines
|
|
NF T 20-051
|
Méthode de détermination du point de cristalisation (point de congélation)
|
|
ISO 1392
|
Method for the determination of the freezing point
|
4. Analisi termica
4.1. Analisi termica differenziale
|
ASTM E 537-76
|
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis
|
|
ASTM E 473-85
|
Standard definitions of terms relating to thermal analysis
|
|
ASTM E 472-86
|
Standard practice for reporting thermoanalytical data
|
|
DIN 51005
|
Thermische Analyse, Begriffe
|
4.2. Calorimetria differenziale a scansione
|
ASTM E 537-76
|
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis
|
|
ASTM E 473-85
|
Standard definitions of terms relating to thermal analysis
|
|
ASTM E 472-86
|
Standard practice for reporting thermoanalytical data
|
|
DIN 51005
|
Thermische Analyse, Begriffe
|
5. Determinazione del punto di scorrimento
|
NBN 52014
|
Echantillonnage et analyse des produits du pétrole: Point de trouble et point d'écoulement limite — Monstememing en ontleding van aardolieproducten: Troebelingspunt en vloeipunt
|
|
ASTM D 97-66
|
Standard test method for pour point of petroleum oils
|
|
ISO 3016
|
Petroleum oils — Determination of pour point.
|
A.2. TEMPERATURA DI EBOLLIZIONE
1. METODO
La maggior parte dei metodi descritti sono basati sulle linee direttrici OCSE (1). I principi fondamentali sono riportati nei riferimenti (2) e (3).
1.1. INTRODUZIONE
I metodi e le apparecchiature qui illustrati possono essere applicati a sostanze liquide e a bassa temperatura di fusione, purché queste non siano soggette a reazioni chimiche al di sotto della temperatura di ebollizione (per esempio: autoossidazione, trasposizione, degradazione, ecc.). I metodi possono essere applicati a sostanze liquide sia pure che impure.
Si dà particolare risalto ai metodi che utilizzano la determinazione tramite fotocellula e l'analisi termica perché questi metodi permettono la determinazione sia della temperatura di fusione che della temperatura di ebollizione. Inoltre, le misure possono essere eseguite in automatico.
Il «metodo dinamico» ha il vantaggio di poter essere applicato anche alla determinazione della tensione di vapore e di non richiedere la correzione della temperatura di ebollizione per riferirla alla pressione normale (101,325 kPa) dal momento che la pressione normale può essere regolata durante la misura mediante un manostato.
Osservazioni:
L'influenza delle impurezze sulla determinazione della temperatura di ebollizione dipende in notevole misura dalla natura delle impurezze. Quando il campione contiene impurezze volatili che possono alterare i risultati, la sostanza può venire purificata.
1.2. DEFINIZIONI E UNITÀ
La temperatura di ebollizione normale è definita come la temperatura alla quale la tensione di vapore di un liquido è di 101,325 kPa.
Se la temperatura di ebollizione non viene misurata alla pressione atmosferica normale, la dipendenza della tensione di vapore dalla temperatura può essere descritta mediante l'equazione di Clausius-Clapeyron:
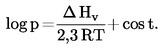
dove:
|
p
|
=
|
tensione di vapore della sostanza in Pascal,
|
|
Δ Hv
|
=
|
calore di evaporazione in J mol-1,
|
|
R
|
=
|
costante universale dei gas = 8,314 J mol-1 K-1,
|
|
T
|
=
|
temperatura termodinamica in K.
|
La temperatura di ebollizione è riferita alla pressione ambiente al momento della misura.
Fattori di conversione
Pressione (unità: kPa)
|
100 kPa
|
=
|
1 bar = 0,1 MPa
(«bar» è ancora ammissibile, ma non raccomandato).
|
|
133 Pa
|
=
|
1 mm Hg = 1 Torr
(le unità «mm Hg» e «Torr» non sono permesse).
|
|
1 atm
|
=
|
atmosfera standard = 101 325 Pa
(l'unità «atm» non è permessa).
|
Temperatura (unità: K)
t = T - 273,15
|
t
|
:
|
temperatura Celsius, gradi Celsius ( oC)
|
|
T
|
:
|
temperatura termodinamica, Kelvin (K)
|
1.3. SOSTANZE DI RIFERIMENTO
Non è necessario utilizzare sostanze di riferimento in tutti i casi in cui si esamina una nuova sostanza. Esse servono principalmente per controllare periodicamente l'accuratezza del metodo e per permettere un confronto coi risultati ottenuti con altri metodi.
Alcune sostanze di riferimento sono elencate nei metodi riportati in appendice.
1.4. PRINCIPIO DEI METODI
Cinque metodi per la determinazione della temperatura di ebollizione (intervallo di ebollizione) sono basati sulla misura della temperatura di ebollizione, altri due sono basati sull'analisi termica.
1.4.1. Determinazione tramite ebulliometro
Gli ebulliometri sono stati originariamente concepiti per la determinazione del peso molecolare tramite l'innalzamento della temperatura di ebollizione, ma si prestano anche per accurate misure della temperatura di ebollizione. Una apparecchiatura molto semplice è descritta nella norma ASTM D 1120-72 (vedi appendice). Con questo strumento il liquido viene riscaldato fino all'ebollizione in condizioni di equilibrio a pressione atmosferica.
1.4.2. Metodo dinamico
Questo metodo implica la misura della temperatura di ricondensazione del vapore mediante un appropriato termometro nella zona di riflusso durante l'ebollizione. Questo metodo permette di variare la pressione.
1.4.3. Metodo della distillazione per la temperatura di ebollizione
Il metodo si basa sulla distillazione del liquido e sulla misura della temperatura di ricondensazione del vapore con determinazione della quantità di distillato.
1.4.4. Metodo di Siwoloboff
Il campione viene riscaldato in una provetta immersa a sua volta nel liquido di un bagno riscaldante. Nella provetta contenente il campione viene introdotto un capillare, chiuso per fusione ad un estremo e contenente una bollicina d'aria nella parte inferiore.
1.4.5. Determinazione tramite fotocellula
Si impiega il metodo Siwoloboff, applicando tuttavia la misura fotoelettrica della fase di emissione delle bollicine.
1.4.6. Analisi termica differenziale
Questa tecnica registra la differenza di temperatura tra la sostanza e un materiale di riferimento, in funzione della temperatura, mentre la sostanza e il materiale di riferimento sono sottoposti allo stesso programma controllato di variazione della temperatura. Quando il campione subisce una transizione che implica una variazione di entalpia, tale variazione è indicata da un allontanamento endotermico (ebollizione) dalla linea di base nella registrazione della temperatura.
1.4.7. Calorimetria differenziale a scansione
Questa tecnica registra la differenza di energia introdotta in una sostanza e in un materiale di riferimento in funzione della temperatura mentre la sostanza e il materiale di riferimento vengono sottoposti allo stesso programma controllato di variazione della temperatura. Questa energia è l'energia necessaria per mantenere a zero la differenza di temperatura tra la sostanza e il materiale di riferimento. Quando il campione subisce una transizione che implica una variazione di entalpia, tale variazione è indicata da un allontanamento endotermico (ebollizione) dalla linea di base della registrazione del flusso di calore.
1.5. CRITERI DI QUALITÀ
La tabella 1 riporta l'applicabilità e l'accuratezza dei vari metodi utilizzati per la determinazione della temperatura di ebollizione/intervallo di ebollizione.
Tabella 1
Confronto dei metodi
|
Metodo di misura
|
Accuratezza stimata
|
Norme esistenti
|
|
Ebulliometro
|
±1,4 K (fino a 373 K) (5)
(6)
±2,5 K (fino a 600 K) (5)
(6)
|
ASTM D 1120-72 (5)
|
|
Metodo dinamico
|
±0,5 K (fino a 600 K) (6)
|
|
|
Processo di distillazione (intervallo di ebollizione)
|
±0,5 k (fino a 600 K)
|
ISO/R 918, DIN 53171, BS 4591/71
|
|
Metodo di Siwoloboff
|
± 2 K (fino a 600 K) (6)
|
|
|
Rivelazione mediante fotocellula
|
±0,3 K (a 373 K) (6)
|
|
|
Analisi termica differenziale
|
±0,5 K (fino a 600 K)
±2,0 K (fino a 1 273 K)
|
ASTM E 537-76
|
|
Calorimetria differenziale a scansione
|
±0,5 K (fino a 600 K)
±2,0 K (fino a 1 273 K)
|
ASTM E 537-76
|
1.6. DESCRIZIONE DEI METODI
I procedimenti relativi ad alcuni dei metodi citati sono descritti in varie norme internazionali e nazionali (vedi appendice).
1.6.1. Ebulliometro
Vedi appendice.
1.6.2. Metodo dinamico
Vedi metodo A.4. per la determinazione della tensione di vapore.
Si assume come temperatura di ebollizione quella misurata in corrispondenza di una pressione di 101,325 kPa.
1.6.3. Metodo della distillazione (intervallo di ebollizione)
Vedi appendice.
1.6.4. Metodo di Siwoloboff
Il campione viene riscaldato in una apparecchiatura per il punto di fusione in una provetta di diametro approssimato di 5 mm (figura 1).
La figura 1 presenta un tipo di apparecchiatura standardizzata per la determinazione della temperatura di fusione e di ebollizione (JIS K 0064) (realizzata in vetro; tutte le quote sono in mm).
Figura 1

Nella provetta viene posto un tubo capillare (capillare di ebollizione) fuso a circa 1 cm dall'estremità inferiore. Il livello di riempimento della sostanza in esame deve essere tale che la parte fusa del capillare si trovi al di sotto della superficie del liquido. La provetta contenente il capillare di ebollizione può essere assicurata al termometro con un elastico oppure fissata tramite un sostegno laterale (vedi figura 2).
|
Figura 2
Principio secondo Siwoloboff
|
Figura 3
Principio modificato
|
|

|
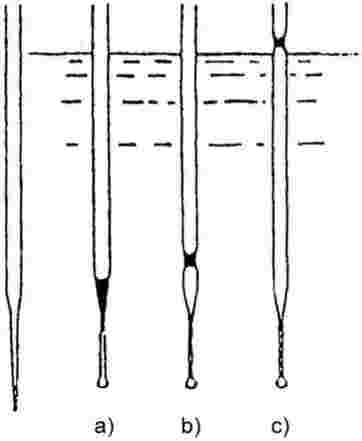
|
Il liquido per il bagno va scelto in funzione della temperatura di ebollizione. Per temperature fino a 573 K si può impiegare olio di silicone. La paraffina liquida può essere impiegata solo fino a 473 K. Il riscaldamento del bagno liquido deve essere regolato in modo che l'incremento di temperatura sia inizialmente di circa 3 K/min. Il liquido del bagno va tenuto in agitazione. A circa 10 K al di sotto della temperatura di ebollizione prevista, il riscaldamento va diminuito in maniera da ridurre la velocità di aumento della temperatura a meno di 1 K/min. In prossimità della temperatura di ebollizione, dal capillare in ebollizione incominciano a emergere rapidamente delle bollicine.
La temperatura di ebollizione è la temperatura alla quale, per raffreddamento temporaneo, la serie di bollicine s'arresta e il fluido inizia improvvisamente a risalire nel capillare. La corrispondente lettura termometrica rappresenta la temperatura di ebollizione della sostanza.
Secondo il principio modificato (vedi figura 3) la temperatura di ebollizione viene determinata in un capillare per la temperatura di fusione. Questo viene sfinato per circa 2 cm (a) e con esso si aspira una piccola quantità del campione. L'estremità aperta della parte sfinata viene chiusa alla fiamma in modo da far restare una bollicina d'aria in vicinanza della punta. Durante il riscaldamento nell'apparecchio per la temperatura di fusione (b) la bolla d'aria si dilata. La temperatura di ebollizione corrisponde alla temperatura alla quale il menisco superiore della sostanza raggiunge il livello della superficie del bagno liquido (c).
1.6.5. Determinazione tramite fotocellula
Il campione viene riscaldato in un tubicino capillare all'interno di un blocco metallico riscaldante.
Tramite opportune aperture sul blocco, un raggio di luce viene fatto passare attraverso la sostanza e colpisce una fotocellula accuratamente tarata.
Durante l'aumento della temperatura del campione, dal capillare di ebollizione emergono bollicine d'aria isolate. Quando viene raggiunta la temperatura di ebollizione, il numero di bollicine aumenta enormemente. Ciò fa variare l'intensità della luce misurata dalla fotocellula, inviando un segnale di arresto all'indice di un termometro a resistenza di platino collocato nel blocco.
Questo metodo risulta particolarmente vantaggioso poiché permette determinazioni al di sotto della temperatura ambiente fino a 253,15 K (- 20 oC) senza modifiche dell'apparecchiatura. È semplicemente necessario porre lo strumento in un bagno di raffreddamento.
1.6.6. Analisi termica
1.6.6.1. Analisi termica differenziale
Vedi appendice
1.6.6.2. Calorimetria differenziale a scansione
Vedi appendice
2. DATI
Per piccole deviazioni dalla pressione normale (max. ± 5 kPa), le temperature di ebollizione vengono normalizzate a Tn mediante la seguente equazione numerica di Sidney-Young:
Tn = T + (fT × Δ p)
dove:
|
Δ p
|
=
|
(101,325 — p) [notare il segno],
|
|
p
|
=
|
valore misurato della pressione, in kPa,
|
|
fT
|
=
|
coefficiente di correzione della temperatura di ebollizione con la pressione, in K/kPa,
|
|
T
|
=
|
valore misurato della temperatura, in K,
|
|
Tn
|
=
|
temperatura di ebollizione corretta a pressione normale, in K.
|
Per molte sostanze i coefficienti di correzione della temperatura fT e le equazioni per il calcolo approssimativo sono indicati nelle norme internazionali e nazionali prima citate.
A titolo di esempio, il metodo DIN 53171 cita i seguenti coefficienti approssimativi per i solventi contenuti nelle vernici:
Tabella 2
Coefficienti di correzione della temperatura fT
|
Temperatura T in K
|
Coefficiente di correzione fT (K/kPa
|
|
323,15
|
0,26
|
|
348,15
|
0,28
|
|
373,15
|
0,31
|
|
398,15
|
0,33
|
|
423,15
|
0,35
|
|
448,15
|
0,37
|
|
473,15
|
0,39
|
|
498,15
|
0,41
|
|
523,15
|
0,44
|
|
548,15
|
0,45
|
|
573,15
|
0,47
|
3. RELAZIONE
La relazione sulla prova deve, se possibile, includere le seguenti informazioni:
|
—
|
descrizione precisa della sostanza (identità e impurezze) e dell'eventuale stadio preliminare di purificazione;
|
|
—
|
una stima dell'accuratezza.
|
Come temperatura di ebollizione viene riportata la media di almeno due misure che ricadano nel campo dell'accuratezza stimata (vedi tabella 1).
Devono essere riportate le temperature di ebollizione misurate e la loro media, e le pressioni alle quali sono state effettuate le misure devono essere riportate in kPa. La pressione deve preferibilmente essere prossima alla normale pressione atmosferica.
Vanno fornite tutte le informazioni e osservazioni utili per l'interpretazione dei risultati, in particolare per quanto riguarda le impurezze e lo stato fisico della sostanza.
4. BIBLIOGRAFIA
|
(1)
|
OCDE, Paris, 1981, Test Guideline 103, Decision of the Council C(81) 30 final.
|
|
(2)
|
IUPAC, B. le Neindre, B. Vodar, eds. Experimental thermodynamics, Butterworths, London 1975, vol. II.
|
|
(3)
|
R. Weissberger ed.: Technique of organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Interscience Publ., New York, 1959, vol. I, Part I, Chapter VIII.
|
Appendice
Per ulteriori particolari tecnici, si possono ad esempio consultare le seguenti norme:
1. Ebulliometro
|
ASTM D 1120-72
|
Standard test method for boiling point of engine anti-freezes
|
2. Metodo della distillazione (intervallo di ebollizione)
|
ISO/R 918
|
Test Method for Distillation (Distillation Yield and Distillation Range)
|
|
BS 4349/68
|
Method for determination of distillation of petroleum products
|
|
BS 4591/71
|
Method for the determination of distillation characteristics
|
|
DIN 53171
|
Lösungsmittel für Anstrichstoffe, Bestimmung des Siedeverlaufes
|
|
NF T 20-608
|
Distillation: détermination du rendement et de l'intervalle de distillation
|
3. Analisi termica differenziale e calorimetria differenziale a scansione
|
ASTM E 537-76
|
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis
|
|
ASTM E 473-85
|
Standard definitions of terms relating to thermal analysis
|
|
ASTM E 472-86
|
Standard practice for reporting thermoanalytical data
|
|
DIN 51005
|
Thermische Analyse: Begriffe
|
A.3. DENSITÀ RELATIVA
1. METODO
I metodi descritti si basano sulle linee direttrici (OCSE) (1). I principi fondamentali sono riportati nel riferimento (2).
1.1. INTRODUZIONE
I metodi qui illustrati si applicano alle sostanze solide e liquide senza alcuna limitazione rispetto al loro grado di purezza. I vari metodi da utilizzare sono elencati nella tabella 1.
1.2. DEFINIZIONI ED UNITÀ
La densità relativa, D20
4, di solidi o liquidi è il rapporto tra la massa di un determinato volume della sostanza in esame, misurata a 20 oC, e la massa di un ugual volume di acqua, misurata a 4 oC. La densità relativa è una grandezza adimensionale.
La densità, ρ, di una sostanza è il rapporto tra una determinata massa m e il volume corrispondente v.
In unità SI la densità, ρ, viene espressa in kg/m3.
1.3. SOSTANZE DI RIFERIMENTO (1) (3)
Non è necessario utilizzare sostanze di riferimento in rutti i casi in cui si esamina una nuova sostanza. Esse servono principalmente per controllare periodicamente l'accuratezza del metodo e per permettere un confronto con risultati ottenuti con altri metodi.
1.4. PRINCIPIO DEI METODI
Si utilizzano quattro classi di metodi.
1.4.1. Metodi per galleggiamento
1.4.1.1. Idrometro (per sostanze liquide)
Determinazioni rapide e sufficientemente accurate della densità possono essere eseguite per mezzo di idrometri galleggianti, che permettono di dedurre la densità di un liquido dal grado di immersione desunto da una scala graduata.
1.4.1.2. Bilancia idrostatica (per sostanze solide e liquide)
La differenza tra il peso di un campione in aria e quello in un liquido adatto (per esempio acqua) può essere utilizzata per determinare la densità.
Nel caso dei solidi, la densità cosi misurata va considerata valida solo per il particolare campione in esame. Per la determinazione della densità dei liquidi, un corpo di volume V noto viene pesato prima in aria e poi nel liquido stesso.
1.4.1.3. Metodo ad immersione di sfera (per sostanze liquide) (4)
In questo metodo la densità di un liquido viene determinata in base alla differenza tra i valori ottenuti pesando il liquido prima e dopo l'immersione di una sfera di volume noto nel liquido stesso.
1.4.2. Metodi picnometrici
Per solidi o liquidi possono impiegarsi picnometri di varia forma e di volume noto. La densità si calcola in base alla differenza di peso tra il picnometro pieno e quello vuoto ed in base al suo volume noto.
1.4.3. Picnometro di comparizione ad aria (per solidi)
La densità di un solido di forma qualsiasi può essere determinata a temperatura ambiente con il picnometro di comparazione a gas. Il volume di una sostanza viene misurato in aria o in un gas inerte all'interno di un cilindro tarato di volume variabile. Per il calcolo della densità va effettuata una misura di massa successivamente a quella di volume.
1.4.4. Densimetro oscillante (5) (6) (7)
La densità di un liquido può essere determinata per mezzo di un densimetro oscillante. Un oscillatore meccanico costruito a forma di un tubo a U viene fatto vibrare alla frequenza di risonanza dell'oscillatore, che dipende dalla sua massa. L'introduzione di un campione modifica! a frequenza di risonanza dell'oscillatore. L'apparecchio deve essere calibrato mediante due sostanze liquide di densità nota. Tali sostanze vanno preferibilmente selezionate in modo da coprire l'intervallo di densità in cui si effettuano le misure.
1.5. CRITERI DI QUALITÀ
L'applicabilità dei vari metodi impiegati per la determinazione della densità relativa è indicata nella tabella.
1.6. DESCRIZIONE DEI METODI
Nell'appendice sono riportate a titolo di esempio alcune delle norme da consultare per ulteriori dettagli tecnici.
Le prove vanno eseguite a 20 oC effettuando almeno due misure.
2. DATI
Vedi norme
3. RELAZIONE
La relazione sulla prova deve, se possibile, includere le seguenti informazioni:
|
—
|
descrizione precisa della sostanza (identità e impurezze) e dell'eventuale stadio preliminare di purificazione;
|
La densità relativa  deve essere indicata secondo quanto prescritto al punto 1.2., insieme allo stato fisico della sostanza esaminata.
deve essere indicata secondo quanto prescritto al punto 1.2., insieme allo stato fisico della sostanza esaminata.
Vanno fomite tutte le informazioni ed osservazioni utili per l'interpretazione dei risultati, in modo particolare per quel che riguarda le impurezze e lo stato fisico della sostanza.
Tabella
Applicabilità dei metodi
|
Metodi di misura
|
Densità
|
Viscosità dinamica massima possibile
|
Norme esistenti
|
|
solidi
|
liquidi
|
|
|
|
sì
|
5 Pa s
|
ISO 387,
ISO 649-2,
NF T 20-050
|
|
1.4.1.2.
|
bilancia idrostatica
|
|
|
|
|
|
|
|
sì
|
|
|
ISO 1183 (A)
|
|
|
|
sì
|
5 Pa s
|
ISO 901 e 758
|
|
1.4.1.3.
|
metodo della sfera immersa
|
|
|
sì
|
20 Pa s
|
DIN 53217
|
|
|
|
|
|
ISO 3507
|
|
|
sì
|
|
|
ISO 1183 (B),
NF T 20-053
|
|
|
|
sì
|
500 Pa s
|
ISO 758
|
|
1.4.3.
|
picnometro di comparazione ad aria
|
|
sì
|
|
|
DIN 55990 parte 3,
DIN 53243
|
|
1.4.4.
|
densimetro oscillante
|
|
|
sì
|
5 Pa s
|
|
4. BIBLIOGRAFIA
|
(1)
|
OECD, Paris, 1981, Test Guideline 109, Decision of the Council C(81) 30 final.
|
|
(2)
|
R. Weissberger ed., Technique of Organic Chemistry. Physical Methods of Organic Chemistry, 3rd ed., Chapter IV, Interscience Publ., New York, 1959, vol. I, Part 1.
|
|
(3)
|
IUPAC, Recommended reference materials for realization of physico-chemical properties, Pure and applied chemistry, 1976, vol. 48, 508.
|
|
(4)
|
Wagenbreth, H., Die Tauchkugel zur Bestimmung der Dichte von Flüssigkeiten, Technisches Messen tm, 1979, vol. 11, 427-430.
|
|
(5)
|
Leopold, H., Die digitale Messung von Flüssigkeiten, Elektronik, 1970, vol. 19, 297-302.
|
|
(6)
|
Baumgarten, D., Füllmengenkontrolle bei vorgepackten Erzeugnissen — Verfahren zur Dichtebestimmung bei flüssigen Produkten und ihre praktische Anwendung, Die Pharmazeutische Industrie, 1975, vol. 37, 717-726.
|
|
(7)
|
Riemann, J., Der Einsatz der digitalen Dichtemessung im Brauereilaboratorium, Brauwissenschaft, 1976, vol. 9, 253—255.
|
Appendice
Per ulteriori particolari tecnici, possono essere consultate, a titolo d'esempio, le seguenti norme:
1. Metodi per galleggiamento
1.1. Idrometro
|
DIN 12790, ISO 387
|
Hydrometer; general instructions
|
|
DIN 12791
|
Part I: Density hydrometers: construction, adjustment and use
Part II: Density hydrometers: standardized sizes, designation
Part III: Use and test
|
|
ISO 649-2
|
Laboratory glassware: density hydrometers for general purpose
|
|
NF T 20-050
|
Chemical products for industrial use. Determination of density of liquids — Areometric method
|
|
DIN 12793
|
Laboratory glassware: range find hydrometers
|
1.2. Bilancia idrostatica
Per sostanze solide
|
ISO 1183
|
Method A: Methods for determining the density and relative density of plastics excluding cellular plastics
|
|
NF T 20-049
|
Chemical products for industrial use — Determination of the density of solids other than powders and cellular products — Hydrostatic balance method
|
|
ASTM-D-792
|
Specific gravity and density of plastics by displacement
|
|
DIN 53479
|
Testing of plastics and elastomers; determination of density
|
Per sostanze liquide
|
ISO 901
|
ISO 758
|
|
DIN 51757
|
Testing of mineral oils and related materials; determination of density
|
|
ASTM D 941-55, ASTM D 1296-67 and ASTM D 1481-62
|
|
ASTM D 1298
|
Density, specific gravity or API gravity of crude petroleum and liquid petroleum products by hydrometer method
|
|
BS 4714
|
Density, specific gravity or API gravity of crude petroleum and liquid petroleum products by hydrometer method
|
1.3. Metodo della sfera immersa
|
DIN 53217
|
Testing of paints, varnishes and similar coating materials; determination of density; immersed body method
|
2. Metodi picnometrici
2.1. Per sostanze liquide
|
ISO 3507
|
Pycnometers
|
|
ISO 758
|
Liquid chemical products; determination of density at 20 oC
|
|
DIN 12797
|
Gay-Lussac pycnometer (for non-volatile liquids which are not too viscous)
|
|
DIN 12798
|
Lipkin pycnometer (for liquids with a kinematìc viscosity of less than 100,10-6 m2 s-1 at 15 oC)
|
|
DIN 12800
|
Sprengel pycnometer (for liquids as DIN 12798)
|
|
DIN 12801
|
Reischauer pycnometer (for liquids with a kinematic viscosity of less than 100,10-6 m2 s-1 at 20 oC, applicable in particular also to hydrocarbons and aqueous solutions as well as to liquids with higher vapour pressure, approximately 1 bar at 90 oC)
|
|
DIN 12806
|
Hubbard pycnometer (for viscous liquids of all types which do not have a too high vapour pressure, in particular also for paints, varnishes and bitumen)
|
|
DIN 12807
|
Bingham pycnometer (for liquids, as in DIN 12801)
|
|
DIN 12808
|
Jaulmes pycnometer (in particular for ethanol-water mixture)
|
|
DIN 12809
|
Pycnometer with ground-in thermometer and capillary side tube (for liquids which are not too viscous)
|
|
DIN 53217
|
Testing of paints, varnishes and similar products; determination of density by pycnometer
|
|
DIN 51757
|
Point 7: Testing of mineral oils and related materials; determination of density
|
|
ASTM D 297
|
Section 15: Rubber products — chemical analysis
|
|
ASTM D 2111
|
Method C: Halogenated organic compounds
|
|
BS 4699
|
Method for determination of specific gravity and density of petroleum products (graduated bicapillary pycnometer method)
|
|
BS 5903
|
Method for determination of relative density and density of petroleum products by the capillary-stoppered pycnometer method
|
|
NF T 20-053
|
Chemical products for industrial use — Determination of density of solids in powder and liquids — Pycnometric method
|
2.2. Per sostanze solide
|
ISO 1183
|
Method B: Methods for determining the density and relative density of plastics excluding cellular plastics.
|
|
NT T 20-053
|
Chemical products for industrial use — Determination of density of solids in powder and liquids — Pycnometric method
|
|
DIN 19683
|
Determination of the density of soils
|
3. Picnometro di comparazione ad aria
|
DIN 55990
|
Part 3: Prüfung von Anstrichstoffen und ähnlichen Beschichtungsstoffen; Pulverlack; Bestimmung der Dichte
|
|
DIN 53243
|
Anstrichstoffe; Chlorhaltige Polymere; Prüfung
|
A.4. TENSIONE DI VAPORE
1. METODO
La maggior parte dei metodi descritti sono basati sulle linee direttrici OCSE (1). I principi fondamentali sono presentati nei riferimenti (2) e (3).
1.1. INTRODUZIONE
Per eseguire questa prova è utile avere informazioni preliminari sulla struttura, la temperatura di fusione e la temperatura di ebollizione della sostanza.
Non esiste un procedimento unico che sia applicabile a tutto l'intervallo dei valori di tensione di vapore. Si raccomanda pertanto di usare più di un metodo per la misura di tensione di vapore da < 10-4 Pa a 105 Pa.
Le impurezze influiscono normalmente sulla tensione di vapore, e in una misura che dipende ampiamente dal tipo di impurezza.
Nel caso in cui nel campione siano presenti impurezze volatili che potrebbero influire sul risultato, la sostanza può venire purificata. Può anche essere opportuno indicare la tensione di vapore del materiale tecnico.
Alcuni dei metodi qui descritti utilizzano apparecchiature con parti metalliche; di ciò si deve tenere conto quando si analizzano sostanze corrosive.
1.2. DEFINIZIONI ED UNITÀ
La tensione di vapore di una sostanza è definita come la pressione di saturazione al di sopra di un solido o di un liquido. All'equilibrio termodinamico, la tensione di vapore di una sostanza pura è funzione della sola temperatura.
L'unità SI di pressione da utilizzare è il Pascal (Pa).
Altre unità impiegate in passato sono elencate qui di seguito con i relativi fattori di conversione:
|
1 Torr (= 1 mm Hg)
|
= 1,333 × 102 Pa
|
|
1 atmosfera
|
= 1,013 × 105 Pa
|
|
1 bar
|
= 105 Pa
|
L'unità SI di temperatura è il grado Kelvin (K).
La costante universale dei gas R è 8,314 J mol-1 K-1.
La dipendenza della tensione di vapore dalla temperatura è descritta dalla equazione di Clausius-Clapeyron:
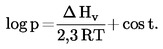
dove:
|
p
|
=
|
tensione di vapore della sostanza in Pascal
|
|
Δ Hv
|
=
|
calore di evaporazione in J mol -1
|
|
R
|
=
|
costante universale dei gas = 8,314 J mol-1 K-1
|
|
T
|
=
|
temperatura termodinamica in K
|
1.3. SOSTANZE DI RIFERIMENTO
Non è necessario utilizzare sostanze di riferimento in tutti i casi in cui si esamina una nuova sostanza. Esse servono principalmente per controllare periodicamente l'accuratezza del metodo e per permettere un confronto con i risultati ottenuti con altri metodi.
1.4. PRINCIPIO DEL METODO
Per la determinazione della tensione di vapore si propongono sette metodi, che possono essere applicati a diversi intervalli della tensione di vapore. Per ciascun metodo, la tensione di vapore viene determinata a varie temperature. In un intervallo di temperatura limitato, il logaritmo della tensione di vapore di una sostanza pura è funzione lineare del reciproco della temperatura.
1.4.1. Metodo dinamico
Il metodo dinamico prevede la misura della temperatura di ebollizione corrispondente ad una determinata pressione.
Intervallo di valori raccomandato:
da 103 a 105 Pa.
Questo metodo è stato raccomandato anche per la determinazione della temperatura di ebollizione normale, ed a questo fine esso è utilizzabile fino a 600 K.
1.4.2. Metodo statico
Tramite il processo statico si determina la tensione di vapore che si stabilisce ad una determinata temperatura in un sistema chiuso in equilibrio termodinamico. Questo metodo si presta per sostanze solide e liquide ad una o più fasi.
Intervallo di valori raccomandato:
da 10 Pa fino a 105 Pa.
Questo metodo può venire utilizzato anche nel campo da 1 a 10 Pa purché si proceda con attenzione.
1.4.3. Isoteniscopio
Questo metodo standardizzato è a sua volta un procedimento statico, ma non è generalmente utilizzabile per sistemi a più componenti. Ulteriori dettagli sono reperibili nel metodo ASTM D-2879-86.
Intervallo di valori raccomandato:
da 100 Pa a 105 Pa.
1.4.4. Metodo di effusione: bilancia a tensione di vapore
Si determina la quantità di sostanza che, nell'unità di tempo, abbandona una cella attraverso un'apertura di dimensioni note e sotto condizioni di vuoto in modo che il ritorno della sostanza nella cella sia trascurabile (per esempio, tramite determinazione dell'impulso trasmesso ad una bilancia sensibile da un getto di vapore, oppure misurando la perdita di peso).
Intervallo di valori raccomandato:
da 10-3 Pa a 1 Pa.
1.4.5. Metodo di effusione: per perdita di peso o per cattura del vaporizzato
Il metodo è basato sulla stima della massa della sostanza in esame che esce nell'unità di tempo da una cella di Knudsen (4) in forma di vapore, attraverso un micro-orificio, in condizioni di vuoto spinto. La massa di vapore effusa può essere ottenuta o determinando la perdita di massa della cella o condensando il vapore a bassa temperatura e determinando la quantità di sostanza volatilizzata mediante l'uso dell'analisi cromatografica. La tensione di vapore viene calcolata applicando la relazione di Hertz-Knudsen.
Intervallo di valori raccomandato:
da 10-3 a 1 Pa.
1.4.6. Metodo di saturazione del gas
Una corrente di gas di trasporto inerte viene fatta passare sopra alla sostanza in modo tale che detto gas si saturi del vapore della sostanza stessa. La quantità di materiale trasportata da una quantità nota di gas di trasporto può essere misurata o mediante raccolta in una trappola adatta o mediante una tecnica analitica a flusso continuo. Questo valore viene poi usato per calcolare la tensione di vapore ad una data temperatura.
Intervallo di valori raccomandato:
da 10-4 a 1 Pa.
Questo metodo può venire usato anche nel campo da 1 a 10 Pa purché si proceda con attenzione.
1.4.7. Rotore
Nel manometro a rotore, l'elemento di misura effettivo è una pallina d'acciaio sospesa in un campo magnetico, che ruota ad alta velocità. La pressione del gas viene ricavata dal rallentamento della pallina d'acciaio, che dipende dalla pressione.
Intervallo di valori raccomandato:
10-4 a 0,5 Pa.
1.5. CRITERI DI QUALITÀ
Si confrontano i vari metodi per la determinazione della tensione di vapore per quanto riguarda la loro applicabilità, ripetibilità, riproducibilità, intervallo di misura e standard esistenti. Il confronto è riportato nella seguente tabella.
Tabella
Criteri di qualità
|
Metodo di misura
|
Sostanze
|
Ripetibilità stimata (7)
|
Riproducibilità stimata (7)
|
Intervallo raccomandato
|
Norme esistenti
|
|
solide
|
liquide
|
|
|
basso-fondenti
|
sì
|
fino al 25 %
|
fino al 25 %
|
da 103 Pa a 2 × 103 Pa
|
—
|
|
|
|
|
1-5 %
|
1-5 %
|
da 2 × 103 Pa a 105 Pa
|
—
|
|
|
sì
|
sì
|
5-10 %
|
5-10 %
|
da 10 Pa a 105 Pa (8)
|
NFT 20-048 (5)
|
|
|
sì
|
sì
|
5-10 %
|
5-10 %
|
da 102 Pa a 105 Pa
|
ASTM-D
2879-86
|
|
1.4.4.
|
Metodo di effusione: bilancia a tensione di vapore
|
|
sì
|
sì
|
5-20 %
|
fino al 50 %
|
da 10-3 Pa a 1 Pa
|
NFT
20-047 (6)
|
|
1.4.5.
|
Metodo di effusione: perdita di peso
|
|
sì
|
sì
|
10-30 %
|
—
|
da 10-3 Pa a 1 Pa
|
—
|
|
1.4.6.
|
Metodo di saturazione del gas
|
|
sì
|
sì
|
10-30 %
|
fino al 50 %
|
da 10-4 Pa a 1 Pa (8)
|
—
|
|
|
sì
|
sì
|
10-20 %
|
—
|
da 10-4 Pa a 0,5 Pa
|
—
|
1.6. DESCRIZIONE DEI METODI
1.6.1. Misura dinamica
1.6.1.1. Apparecchiatura
L'apparecchio di misura consiste generalmente in un recipiente per l'ebollizione provvisto di un refrigerante in vetro o metallo (vedi figura 1), strumenti per misurare la temperatura e apparecchi per regolare e misurare la pressione. Un tipico apparecchio di misura è realizzato, come mostra la figura, in vetro resistente al calore ed è composto di 5 parti:
Il tubo grande, parzialmente a doppia parete, consiste in un giunto smerigliato a camicia, un recipiente di raffreddamento ed un ingresso.
Il cilindro di vetro, provvisto di pompa Cottrell, è montato sulla sezione di ebollizione del tubo ed è fornito di una superficie scabra di frammenti di vetro per evitare la formazione di grosse bolle durante il processo di ebollizione.
La temperatura viene misurata con un adatto sensore di temperatura (per esempio un termometro a resistenza, una termocoppia incamiciata) immerso nell'apparecchiatura fino al punto di misurazione (figura 1, numero 5) attraverso un passaggio adatto (per esempio un giunto smerigliato maschio).
Devono essere realizzati i necessari collegamenti con l'apparecchiatura di regolazione e misura della flessione.
Il bulbo, che agisce da polmone, è collegato allo strumento di misura mediante un tubo capillare.
Il recipiente di ebollizione è riscaldato mediante un elemento riscaldante (per esempio un riscaldatore a cartuccia) inserito dal basso nell'apparecchiatura di vetro. La corrente di riscaldamento richiesta viene fissata e regolata tramite una termocoppia.
Il vuoto necessario tra 102 Pa e approssimativamente 105 Pa viene prodotto mediante una pompa a vuoto.
Per dosare l'aria o l'azoto per la regolazione della pressione (campo di misura approssimativamente 102-105 Pa) e per la ventilazione si usa una valvola adatta.
La pressione viene misurata con un manometro.
1.6.1.2. Procedimento di misura
La tensione di vapore viene misurata determinando la temperatura di ebollizione del campione a varie pressioni prestabilite approssimativamente tra 103 e 105 Pa. Una temperatura constante a pressione costante indica che è stata raggiunta la temperatura di ebollizione. Questo metodo non è adatto per la determinazione nel caso di sostanze che fanno schiuma.
La sostanza viene posta in un porta campioni pulito ed asciutto. Con solidi non in forma di polvere si possono incontrare dei problemi, ma questi possono talvolta essere risolti riscaldando la camicia di raffreddamento. Dopo che il recipiente è stato riempito, l'apparecchiatura viene sigillata in corrispondenza della flangia e la sostanza viene degassata. Viene poi impostata la pressione minima desiderata e si accende il riscaldamento. Nello stesso tempo, il sensore di temperatura è collegato ad un registratore.
L'equilibrio è raggiunto quando viene registrata una temperatura di ebollizione costante a pressione costante. Bisogna porre una particolare cura per evitare una formazione di grosse bolle durante l'ebollizione. Inoltre, sul refrigerante deve avvenire una condensazione completa. Quando si determina la tensione di vapore di solidi basso-fondenti, bisogna porre attenzione ad evitare il bloccaggio del condensatore.
Dopo aver registrato il punto di equilibrio così raggiunto, si regola la pressione su un valore più elevato. Questa procedura va ripetuta fino a raggiungere una pressione di 105 Pa (per un totale da 5 a 10 punti di misura). A titolo di controllo, la determinazione dei punti di equilibrio deve essere ripetuta a pressioni decrescenti.
1.6.2. Misura statica
1.6.2.1. Apparecchiatura
L'apparecchiatura comprende un contenitore per il campione, un sistema di riscaldamento e raffreddamento per regolare la temperatura del campione e per misurare la temperatura. L'apparecchio comprende anche strumenti per impostare e misurare la pressione. Le figure 2a e 2b illustrano i principi fondamentali implicati.
La camera del campione (figura 2a) è collegata da una parte con un'adatta valvola per alto vuoto e dall'altra con un tubo ad U contenente un opportuno fluido manometrico. Una estremità del tubo ad U è collegata con la pompa da vuoto, la bombola dell'azoto o la valvola di ventilazione, ed un manometro.
Al posto del tubo ad U si può usare un manometro con indicatore di pressione (figura 2b).
Allo scopo di regolare la temperatura del campione, il recipiente del campione, insieme con la valvola e il tubo ad U o il manometro, viene posto in un bagno mantenuto ad una temperatura costante ±0,2 K. Le misure di temperatura vengono effettuate sulla parete esterna del recipiente contenente il campione o nel recipiente stesso.
Per evacuare l'apparecchio si utilizza una pompa da vuoto a monte della quale vi è una trappola refrigerante.
Nel metodo 2a, la tensione di vapore della sostanza viene misurata indirettamente utilizzando un indicatore di zero. Questo tiene conto del fatto che la densità del fluido nel tubo ad U risulta alterata se la temperatura cambia in maniera consistente.
Come indicatori di zero per il tubo ad U, sono adatti secondo il campo di pressioni e il comportamento chimico della sostanza in esame, i seguenti fluidi: fluidi siliconici, ftalati. La sostanza in esame non deve sciogliersi in maniera apprezzabile o reagire con il fluido del tubo ad U.
Per il manometro può venire usato il mercurio nel campo dalla normale pressione atmosferica fino a 102 Pa, mentre per l'uso tra 102 Pa e 10 Pa sono adatti i fluidi siliconici e gli ftalati. I manometri capacitivi a membrana riscaldabile possono essere usati anche al di sotto di 10-1 Pa. Esistono anche altri manometri che possono essere usati al di sotto di 102 Pa.
1.6.2.2. Procedimento di misura
Prima della misura, tutti i componenti dell'apparecchio mostrato in figura 2 devono essere puliti e asciugati accuratamente.
Per il metodo 2a, riempire il tubo ad U con il liquido scelto, che deve essere degassato a temperatura elevata prima di procedere alla lettura.
La sostanza in esame viene posta nell'apparecchio, che viene poi chiuso, e la temperatura viene ridotta in modo sufficiente per il degassaggio. La temperatura deve essere sufficientemente bassa per assicurare che l'aria sia aspirata fuori ma — nel caso di sistema a componenti multipli — non deve alterare la composizione del materiale. Se richiesto, l'equilibrio può essere raggiunto più rapidamente mediante agitazione.
Il campione può essere sovrarraffreddato, per esempio con azoto liquido (attenzione: condensazione dell'aria, fluido di pompaggio) o con una miscela di etanolo e ghiaccio secco. Per misure a bassa temperatura, usare un bagno con regolazione della temperatura collegato ad un ultracriostato.
Con la valvola sopra al recipiente del campione aperta, si applica il vuoto per qualche minuto per rimuovere l'aria. La valvola viene poi chiusa e la temperatura del campione viene ridotta al livello minimo desiderato. Se necessario, l'operazione di degassaggio deve essere ripetuta più volte.
Quando il campione viene riscaldato, la tensione di vapore aumenta. Ciò altera l'equilibrio del fluido nel tubo ad U. Per compensare questo effetto, lasciare entrare azoto o aria nell'apparecchio attraverso una valvola fino a che il fluido indicatore di pressione è nuovamente a zero. La pressione richiesta a questo scopo può essere letta da un manometro di precisione a temperatura ambiente. Questa pressione corrisponde alla tensione di vapore della sostanza a quella particolare temperatura di misura.
Il metodo 2b è simile, ma la tensione di vapore viene letta direttamente.
La dipendenza dalla temperatura della tensione di vapore viene determinata ad intervalli adeguatamente piccoli (approssimativamente da 5 a 10 punti di misura in totale) fino al valore massimo desiderato. Le letture a bassa temperatura devono essere ripetute per verifica.
Se i valori ottenuti dalla ripetizione delle letture non coincidono con la curva ottenuta per la temperatura crescente, la ragione può essere una delle seguenti:
|
1.
|
Il campione contiene ancora aria (per esempio materiali ad elevata viscosità) o sostanze basso-bollenti, che vengono liberate durante il riscaldamento e possono essere rimosse mediante applicazione di vuoto dopo ulteriore sovrarraffreddamento.
|
|
2.
|
La temperatura di raffreddamento non è sufficientemente bassa. In questo caso si usa come agente refrigerante azoto liquido.
Se vale il caso 1 o 2, le misure devono essere ripetute.
|
|
3.
|
La sostanza subisce una reazione chimica nel campo di temperature studiato (per esempio decomposizione, polimerizzazione).
|
1.6.3. Isoteniscopio
Una descrizione completa del metodo è reperibile in letteratura (7). Il principio dell'apparecchio di misura è illustrato nella figura 3. Analogamente al metodo statico descritto al punto 1.6.2, l'isoteniscopio si presta all'esame di solidi e liquidi.
Nel caso dei liquidi, la sostanza in esame serve essa stessa da fluido nel manometro ausiliario. Una quantità di liquido sufficiente per riempire il bulbo e il gambo corto della sezione del manometro viene introdotta nell'isoteniscopio. L'isoteniscopio viene poi collegato ad un sistema di vuoto; l'isoteniscopio viene evacuato e poi riempito con azoto. L'evacuazione e la bonifica del sistema vengono ripetute due volte per rimuovere l'ossigeno residuo. L'isoteniscopio riempito viene posto in posizione orizzontale in modo che il campione si sparga in uno strato sottile nel bulbo del campione e nella sezione manometrica (parte ad U). La pressione del sistema viene ridotta a 133 Pa e il campione viene riscaldato delicatamente fino a quando incomincia a bollire (rimozione dei gas fissi disciolti). L'isoteniscopio viene poi sistemato in modo che il campione ritorni nel bulbo e nel gambo corto del manometro, di modo che siano ambedue completamente riempiti di liquido. La pressione viene mantenuta allo stesso livello usato per il degassaggio; la punta stirata del bulbo porta campione viene riscaldata con una fiamma piccola fino a che i vapori del campione liberati si espandono in modo sufficiente per spostare parte del campione dalla parte superiore del bulbo e del braccio manometrico nella sezione manometrica dell'isoteniscopio, creando uno spazio riempito di vapore ed esente da azoto.
L'isoteniscopio viene posto in un bagno a temperatura costante e la pressione dell'azoto viene regolata fino a quando coincide con la pressione del campione. L'equilibrio della pressione è indicato dalla sezione manometrica dell'isoteniscopio.
All'equilibrio, la tensione di vapore dell'azoto è uguale alla tensione di vapore della sostanza. Nel caso di solidi, si usano i liquidi manometrici elencati in 1.6.2.1, secondo il campo di pressioni e di temperature. Il liquido manometrico degassato viene introdotto in una boccia sul braccio lungo dell'isoteniscopio. Il solido in esame viene poi posto nel bulbo e degassato a temperatura elevata. Dopo di ciò si inclina l'isoteniscopio in modo che il fluido manometrico possa defluire nel tubo ad U. La misura della tensione di vapore in funzione della temperatura viene effettuata come indicato al punto 1.6.2.
1.6.4. Metodo di effusione: bilancia a tensione di vapore
1.6.4.1. Apparecchiatura
In letteratura (1) sono descritte varie versioni dell'apparecchiatura. L'apparecchiatura qui descritta illustra il principio generale implicato (figura 4). La figura 4 mostra i componenti principali dell'apparecchiatura, che comprendono un contenitore d'acciaio inossidabile o vetro per alto vuoto, strumenti per produrre e misurare il vuoto e componenti incorporati per misurare la tensione di vapore su una bilancia. Nell'apparecchio sono incorporati i seguenti componenti:
|
—
|
Un forno evaporatore provvisto di flangia e ingresso rotativo. Il forno evaporatore è un recipiente cilindrico, fatto per esempio di rame o di lega chimicamente resistente con buona conducibilità termica. Può essere usato anche un recipiente di vetro con parete di rame. Il forno ha un diametro approssimativo di 3-5 cm e un'altezza di 2-5 cm e presenta da 1 a 3 aperture di differenti dimensioni per la corrente di vapore.
|
|
—
|
Il forno è riscaldato o mediante una piastra riscaldante sottostante o mediante una spirale riscaldante avvolta intorno. Per impedire la dissipazione di calore verso la piastra di base, il riscaldatore è attaccato alla piastra di base mediante un metallo di bassa conducibilità termica (nichel-argento o acciaio al cromo-nichel), per esempio un tubo di nichel-argento collegato ad un ingresso rotativo se si usa un forno con più aperture. Questa disposizione ha il vantaggio di permettere l'introduzione di una barra di rame. Ciò permette di effettuare il raffreddamento dall'esterno utilizzando un bagno di raffreddamento.
Se il coperchio del forno di rame presenta tre aperture di differenti diametri, a 90 o una rispetto all'altra, è possibile coprire vari intervalli di tensione di vapore all'interno dell'intervallo di misura globale (diametri delle aperture compresi approssimativamente tra 0,30 e 4,50 mm). Le aperture più grandi vengono usate per le basse tensioni di vapore, e viceversa. Ruotando il forno, si può selezionare l'apertura desiderata o una posizione intermedia per la corrente di vapore (apertura del forno — schermo — piatto della bilancia) liberando la corrente molecolare o deviandola, attraverso l'apertura del forno, sul piatto della bilancia. Allo scopo di misurare la temperatura della sostanza, in un punto opportuno si posiziona una termocoppia o un termometro a resistenza.
|
|
—
|
Al di sopra dello schermo vi è il piatto di una microbilancia di alta sensibilità (vedi avanti). Il piatto della bilancia ha un diametro approssimativo di 30 mm. Un materiale adatto è alluminio placcato d'oro.
|
|
—
|
Il piatto della bilancia è circondato da una cassetta di refrigerazione cilindrica di ottone o rame. Secondo il tipo di bilancia, essa presenta aperture per il giogo della bilancia e un'apertura nello schermo per la corrente molecolare, e deve garantire una condensazione completa del vapore sul piatto della bilancia. La dissipazione del calore verso l'esterno è assicurata, per esempio, mediante una barra di rame collegata alla cassetta di refrigerazione. La barra passa attraverso la piastra di base ed è isolata termicamente da essa, per esempio, con un tubo di acciaio al cromo-nichel. La barra è immersa in una bottiglia di Dewar contenente azoto liquido posta sotto la piastra di base, oppure azoto liquido viene fatto circolare attraverso la barra. La cassetta di refrigerazione viene così mantenuta a circa — 120 oC. Il piatto della bilancia è raffreddato esclusivamente per irraggiamento ed è soddisfacente per il campo di pressioni in esame (raffreddare approssimativamente per 1 ora prima dell'inizio della misura).
|
|
—
|
La bilancia viene posizionata sopra alla cassetta di refrigerazione. Bilance adatte sono, per esempio, una microbilancia elettronica a 2 bracci di alta sensibilità (8) o uno strumento a spirale mobile di elevata sensibilità (vedi linee direttrici OCSE 104, edizione 12.5.1981).
|
|
—
|
La piastra di base contiene anche connessioni elettriche per termocoppie (o termometri a resistenza) e serpentine di riscaldamento.
|
|
—
|
Nel recipiente viene prodotto il vuoto usando una pompa per vuoto parziale o una pompa per alto vuoto (vuoto richiesto: circa da 1 a 2.10-3 Pa, ottenuto dopo 2 ore di pompaggio). La pressione viene regolata con un adatto manometro a ionizzazione.
|
1.6.4.2. Procedimento di misura
Il recipiente viene riempito con la sostanza in esame e il coperchio viene chiuso. Lo schermo e la cassetta di refrigerazione vengono portati sopra al forno. L'apparecchiatura viene chiusa e le pompe a vuoto vengono accese. La pressione finale prima di iniziare le misure deve essere di circa 10-4 Pa. Il raffreddamento della cassetta di refrigerazione parte da 10-2 Pa.
Dopo aver raggiunto il vuoto richiesto, partire con la serie di taratura alla temperatura più bassa richiesta. Si seleziona l'apertura corrispondente del coperchio, e la corrente di vapore passa attraverso lo schermo direttamente sopra all'apertura e colpisce il piatto della bilancia raffreddato. Il piatto della bilancia deve essere sufficientemente grande per assicurare che l'intera corrente guidata dallo schermo lo colpisca. La quantità di moto della corrente di vapore agisce da forza contro il piatto della bilancia e le molecole condensano sulla sua superficie raffreddata.
La quantità di moto e la condensazione simultanea producono un segnale sul registratore. La valutazione dei segnali fornisce due elementi di informazione:
|
1.
|
Nell'apparecchiatura qui descritta la tensione di vapore è determinata direttamente dalla quantità di moto sul piatto della bilancia [a questo scopo non è necessario conoscere il peso molecolare (2)]. Nella valutazione delle letture, bisogna tenere conto dei fattori geometrici, come l'apertura del forno e l'angolo della corrente molecolare.
|
|
2.
|
Contemporaneamente si può misurare la massa del condensato e calcolare da ciò la velocità di evaporazione. La tensione di vapore può essere calcolata anche dalla velocità di evaporazione e dal peso molecolare utilizzando l'equazione di Hertz (2)
|

dove:
|
G
|
=
|
velocità di evaporazione (kg s-1 m-2)
|
|
M
|
=
|
massa molare (g mol-1)
|
|
T
|
=
|
temperatura (K)
|
|
R
|
=
|
costante universale dei gas (J mol-1 K-1)
|
|
p
|
=
|
tensione di vapore (Pa)
|
Dopo aver raggiunto il vuoto necessario, si inizia la serie delle misure alla temperatura di misurazione minima desiderata.
Per ulteriori misure, la temperatura viene aumentata per piccoli incrementi fino a che si raggiunge il massimo valore desiderato della temperatura. Il campione viene poi nuovamente raffreddato e si può registrare una seconda curva della tensione di vapore. Se la seconda prova non conferma i risultati della prima prova, può darsi che la sostanza si decomponga nell'intervallo di temperature oggetto delle misure.
1.6.5. Metodo di effusione: per perdita di peso
1.6.5.1. Apparecchiatura
L'apparecchiatura di effusione è costituita dai seguenti componenti fondamentali:
|
—
|
un serbatoio che può essere termostatato ed evacuato e nel quale sono posizionate le celle di effusione;
|
|
—
|
una pompa per alto vuoto (per esempio una pompa a diffusione o una pompa turbomolecolare) con vacuometro;
|
|
—
|
una trappola, in cui si usa azoto liquefatto o ghiaccio secco.
|
In figura 5 è mostrato un esempio di un recipiente da vuoto in alluminio, riscaldato elettricamente, con 4 celle di effusione in acciaio inossidabile. Il foglio d'acciaio inossidabile dello spessore di circa 0,3 mm presenta un orificio di effusione da 0,2 mm a 1,0 mm di diametro ed è collegato alla cella di effusione mediante un coperchio a vite.
1.6.5.2. Procedimento di misura
La sostanza di riferimento e la sostanza in esame sono introdotte nella cella di effusione, il diaframma metallico con l'orificio viene fissato mediante il coperchio a vite e la cella viene pesata con un'approssimazione di 0,1 mg. La cella viene poi posta nell'apparecchio termostatato, che viene poi evacuato a meno di 1/10 della tensione prevista. Ad intervalli di tempo definiti, che variano da 5 a 30 ore, si introduce aria nell'apparecchio e si determina la perdita di massa della cella di effusione ripesandola.
Allo scopo di assicurare che i risultati non siano influenzati da impurezze volatili, la cella viene ripesata ad intervalli di tempo definiti per controllare che la velocità di evaporazione sia costante su almeno due intervalli di tempo.
La tensione di vapore p nella cella di effusione è data da:

dove:
|
p
|
=
|
tensione di vapore (Pa)
|
|
m
|
=
|
massa della sostanza che lascia la cella nel tempo t (kg)
|
|
t
|
=
|
tempo (S)
|
|
A
|
=
|
area del foro (m2)
|
|
K
|
=
|
fattore di correzione
|
|
R
|
=
|
costante universale dei gas (J mol-1 K-1)
|
|
T
|
=
|
temperatura (K)
|
|
M
|
=
|
massa molecolare (kg mol-l)
|
Il fattore di correzione K dipende dal rapporto tra la lunghezza e il raggio dell'orificio cilindrico:
|
rapporto
|
0,1
|
0,2
|
0,6
|
1,0
|
2,0
|
|
K:
|
0,952
|
0,909
|
0,771
|
0,672
|
0,514
|
L'equazione vista sopra può essere scritta nella forma:
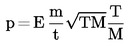
dove  è la costante di effusione della cella.
è la costante di effusione della cella.
Questa costante di effusione della cella E può essere determinata mediante sostanze di riferimento (2,9), usando la seguente equazione:

dove:
|
p(r)
|
=
|
tensione di vapore della sostanza di riferimento (Pa)
|
|
M(r)
|
=
|
massa molecolare della sostanza di riferimento (kg.mol-1)
|
1.6.6. Metodo della saturazione del gas
1.6.6.1. Apparecchiatura
Un apparecchio tipico usato per eseguire questa prova comprende un certo numero di componenti presentati in figura 6a e descritti nel seguito (1).
Gas inerte:
Il gas di trasporto non deve reagire chimicamente con la sostanza in esame. A tale scopo è in genere sufficiente l'azoto, ma talvolta possono essere necessari altri gas (10). Il gas impiegato deve essere secco (vedi figura 6a, riferimento 4: sensore dell'umidità relativa).
Controllo del flusso:
Per assicurare un flusso costante e regolabile del gas attraverso la colonna del saturatore va impiegato un adatto sistema di controllo.
Condensatori di raccolta del vapore:
I condensatori da impiegare dipendono dalle caratteristiche del particolare campione e dal metodo di analisi prescelto. Il vapore deve essere condensato quantitativamente ed in una forma che ne consenta la successiva analisi. Per talune sostanze saranno adatti condensatori contenenti liquidi, quali l'esano od il glicol etilenico. Per altre sostanze possono essere impiegati assorbenti solidi.
In alternativa alla condensazione dei vapori e successiva analisi, si possono usare tecniche analitiche a flusso continuo, come la cromatografia, per determinare quantitativamente la quantità di materiale trasportato da una quantità nota di gas di trasporto. Inoltre, si può misurare la perdita di massa del campione.
Scambiatore di calore:
Per misure a temperature diverse, può essere necessario includere nell'apparecchiatura uno scambiatore di calore.
Colonna di saturazione:
La sostanza in esame, sotto forma di soluzione, viene depositata su di un adatto supporto inerte. Il supporto così ricoperto viene introdotto nella colonna di saturazione, le cui dimensioni cosi come la velocità di flusso del gas di trasporto devono essere tali da assicurare una completa saturazione di quest'ultimo. La colonna di saturazione va termostatata. Per misure al di sopra di temperatura ambiente, la zona compresa tra la colonna del saturatore ed i dispositivi di condensazione del vapore deve essere riscaldata in modo da evitare la condensazione della sostanza in esame.
Al fine di ridurre il trasporto di massa per diffusione, a valle della colonna di saturazione si può disporre un capillare (figura 6b).
1.6.6.2. Procedimento di misura
Preparazione della colonna di saturazione:
Una soluzione della sostanza in esame in un solvente altamente volatile viene aggiunta ad un'adeguata quantità di supporto. Si deve impiegare una sufficiente quantità di sostanza per mantenere la saturazione per tutta la durata della prova. Si evapora completamente il solvente, in aria o mediante un evaporatore rotante, e si introduce nella colonna di saturazione il materiale ben miscelato. Dopo aver regolato il termostato, si fa passare azoto secco attraverso l'apparecchio.
Misura:
I condensatori o i rivelatori a flusso continuo sono collegati alla linea di efflusso della colonna e si registra il tempo. La portata viene controllata all'inizio e ad intervalli regolari durante l'esperimento usando un misuratore a bolle (o in continuo con un flussimetro di massa).
Si deve misurare la pressione all'uscita verso il saturatore. Ciò può essere fatto:
|
a)
|
includendo un manometro tra il saturatore e i condensatori (questa soluzione può non essere soddisfacente in quanto aumenta lo spazio morto e la superficie di adsorbimento);
|
|
b)
|
determinando la caduta di pressione attraverso il particolare sistema di condensazione impiegato in funzione della velocità di flusso, eseguendo una determinazione a parte (questo metodo può essere non molto soddisfacente per i condensatori a liquido).
|
Il tempo richiesto per raccogliere la quantità di sostanza in esame necessaria per i differenti metodi d'analisi viene determinato in prove preliminari o stimato per calcolo. In alternativa alla raccolta della sostanza per l'ulteriore analisi, si può usare una tecnica analitica quantitativa a flusso continuo (per esempio la cromatografia). Prima di calcolare la tensione di vapore ad una data temperatura, vanno eseguite prove preliminari per stabilire la velocità di flusso massima ancora capace di saturare completamente il gas di trasporto con il vapore della sostanza. Ciò viene assicurato se il gas di trasporto passa attraverso la colonna di saturazione tanto lentamente che una velocità ancora minore non conduce alla misura di una tensione di vapore superiore.
Il metodo analitico specifico (per esempio gascromatografia o gravimetria) verrà scelto in funzione della sostanza in esame.
Si determina la quantità di sostanza trasportata da un volume noto di gas di trasporto.
1.6.6.3. Calcolo della tensione di vapore
La tensione di vapore è calcolata in base alla densità di vapore (W/V), mediante i'equazione:
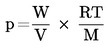
dove:
|
p
|
=
|
tensione di vapore (Pa)
|
|
W
|
=
|
massa di sostanza in esame evaporata (g)
|
|
V
|
=
|
volume di gas saturato (m3)
|
|
R
|
=
|
costante universale molare dei gas (J mol-1 K-1)
|
|
T
|
=
|
temperatura (K)
|
|
M
|
=
|
massa molare della sostanza in esame (g mol-1)
|
I volumi misurati vanno corretti per tenere conto delle differenze di temperatura e di pressione tra il flussimetro e la colonna di saturazione termostatata. Se il flussimetro si trova a valle del condensatore del vapore, possono essere necessarie correzioni che tengano conto degli eventuali prodotti di evaporazione provenienti da esso (1).
1.6.7. Rotore (8, 11, 13)
1.6.7.1. Apparecchiatura
La tecnica del rotore può venire messa in atto usando un viscosimetro a rotore come mostrato in figura 8. Un disegno schematico della disposizione sperimentale è mostrato in figura 7.
L'apparecchio di misura è costituito tipicamente da una testa di misurazione a rotore posta in un recipiente termostatato (regolato con l'approssimazione di 0,1 oC). Il contenitore del campione viene posto in un recipiente termostatato (regolato con un'approssimazione di 0,01 oC), e tutte le parti dell'apparecchiatura vengono tenute ad una temperatura più elevata del contenitore del campione per impedire la condensazione. Un dispositivo di pompa ad alto vuoto viene collegato al sistema mediante valvole per alto vuoto.
La testina di misurazione a rotore è costituita da una pallina d'acciaio (diametro da 4 a 5 mm) disposta in un tubo. La pallina è sospesa e stabilizzata in un campo magnetico, generalmente con l'uso di una combinazione di magneti permanenti e bobine di controllo.
La palla viene fatta ruotare da campi rotanti prodotti dalle bobine. Bobine di trasduzione, che misurano la leggera magnetizzazione laterale sempre presente della pallina, permettono di misurare la sua velocità di rotazione.
1.6.7.2. Procedimento dì misura
Quando la pallina ha raggiunto una determinata velocità di rotazione v(o) (di solito circa 400 giri al secondo), si interrompe la fornitura di energia ed avviene una decelerazione dovuta all'attrito col gas.
La riduzione della velocità di rotazione viene misurata in funzione del tempo. Poiché l'attrito provocato dalla sospensione magnetica è trascurabile in confronto con l'attrito gassoso, la pressione del gas p è data da:
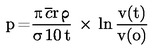
dove:
|

|
=
|
velocità media delle molecole del gas
|
|
r
|
=
|
raggio della pallina
|
|
ρ
|
=
|
densità di massa della pallina
|
|
σ
|
=
|
coefficiente di trasferimento tangenziale della quantità di moto (σ = 1 per una superficie sferica ideale della pallina)
|
|
t
|
=
|
tempo
|
|
v(t)
|
=
|
velocità di rotazione dopo il tempo t
|
|
v(o)
|
=
|
velocità di rotazione iniziale
|
Questa equazione può anche essere scritta nella forma:
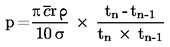
dove tn, tn_] sono i tempi occorrenti per un determinato numero N di rotazioni. Questi intervalli di tempo tn e tn-1 si succedono uno all'altro, e si ha tn > tn-1.
La velocità media delle molecole di gas Ec è data da:

dove:
|
T
|
=
|
temperatura (K)
|
|
R
|
=
|
costante molare universale dei gas
|
|
M
|
=
|
massa molare
|
2. DATI
La tensione di vapore misurata mediante uno qualunque dei metodi precedenti deve essere determinata per almeno due temperature. Tre o più temperature diverse nell'intervallo da 0 a 50 oC sarebbero preferibili per verificare la linearità della curva di tensione di vapore.
3. RELAZIONE
La relazione sulla prova deve, se possibile, includere le seguenti informazioni:
|
—
|
descrizione precisa della sostanza (identità e impurezze) ed eventuale stadio preliminare di purificazione;
|
|
—
|
almeno due valori di tensione di vapore e di temperatura; preferibilmente nel campo da 0 a 50 oC;
|
|
—
|
una curva di log p contro 1/T;
|
|
—
|
una stima della tensione di vapore a 20 o 25 oC.
|
Qualora si osservi una transizione (cambiamento di stato, decomposizione), saranno fornite le informazioni seguenti:
|
—
|
la natura del cambiamento;
|
|
—
|
la temperatura a cui il cambiamento si verifica sotto la pressione atmosferica;
|
|
—
|
la tensione di vapore a 10 oC e a 20 oC al di sotto della temperatura di transizione, nonché a 10 oC e a 20 oC al di sopra di tale temperatura (a meno che la transizione non consista in un passaggio dallo stato solido allo stato gassoso).
|
Devono essere riportate tutte le informazioni e osservazioni significative per l'interpretazione dei risultati, in particolare per quanto riguarda le impurezze e lo stato fisico della sostanza.
4. BIBLIOGRAFIA
|
(1)
|
OECD, Paris, 1981, Test Guideline 104, Decision of the Council C(81) 30 final.
|
|
(2)
|
Ambrose, D. B. Le Neindre, B. Vodar, (Eds): Experimental Thermodynamics, Butterworths, London, 1975, vol. II.
|
|
(3)
|
R. Weissberger ed.: Technique of Organic Chemistry. Physical Methods of Organic Chemistry, 3rd ed. Chapter IX, Interscience Publ., New York, 1959, Vol. I, Part I.
|
|
(4)
|
Knudsen, M. Ann. Phys. Lpz., 1909, vol. 29, 1979; 1911, vol. 34, 593.
|
|
(5)
|
NF T 20-048 AFNOR (Sept. 85). Chemical products for industrial use — Determination of vapour pressure of solids and liquids within range from 10-1 to 105 Pa — Static method.
|
|
(6)
|
NF T 20-047 AFNOR (Sept. 85). Chemical products for industrial use — Determination of vapour pressure of solids and liquids within range from 10-3 to 1 Pa — Vapour pressure balance method.
|
|
(7)
|
ASTM D 2879-86, Standard test method for vapour pressure-temperature relationship and initial decomposition temperature of liquids by isoteniscope.
|
|
(8)
|
G. Messer, P. Röhl. G. Grosse and W. Jitschin. J. Vac. Sci. Technol. (A), 1987. vol. 5 (4), 2440.
|
|
(9)
|
Ambrose, D.; Lawrenson, I.J.; Sprake, C.H.S. J. Chem. Thermodynamics 1975, vol. 7, 1173.
|
|
(10)
|
B.F. Rordorf. Thermochimica Acta, 1985, vol. 85, 435.
|
|
(11)
|
G. Comsa, J.K. Fremerey and B. Lindenau. J. Vac. Sci. Technol., 1980, vol. 17 (2), 642.
|
|
(12)
|
G. Reich, J. Vac. Sci. Technol., 1982, vol. 20 (4), 1148.
|
|
(13)
|
J.K. Fremerey, J. Vac. Sci. Technol. (A), 1985, vol. 3 (3), 1715.
|
Appendice 1
Metodo di stima
INTRODUZIONE
I valori calcolati della tensione di vapore possono essere utilizzati:
|
—
|
per decidere quale dei metodi sperimentali sia appropriato;
|
|
—
|
per fornire un valore di stima o un valore limite nei casi in cui il metodo sperimentale non possa esser applicato per ragioni tecniche (incluso il caso in cui la tensione di vapore sia molto bassa);
|
|
—
|
per aiutare ad identificare i casi nei quali è giustificato omettere la misura sperimentale perché la tensione di vapore è probabile che sia < 10-5 Pa a temperatura ambiente.
|
METODO DI STIMA
La tensione di vapore dei liquidi e solidi può essere stimata mediante l'uso della correlazione di Watson modificata (a). L'unico dato sperimentale richiesto è il punto di ebollizione normale. Questo metodo è applicato sull'intervallo di pressioni da 105 Pa a 10-5 Pa.
Informazioni più precise sul metodo sono fornite nello «Handbook of Chemical Property Estimation Methods» (b).
PROCEDURA DI CALCOLO
Secondo (b), la tensione di vapore viene calcolata come segue:

dove:
T= temperatura di interesse
Tb= punto di ebollizione normale
Pvp= tensione di vapore alla temperatura T
Δ Hvb= calore di vaporizzazione
Δ Zb,= fattore di compressibilità (stimato in 0,97)
m= fattore empirico che dipende dallo stato fisico alla temperatura di interesse
inoltre
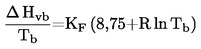
dove Kp è un fattore empirico che tiene conto della polarità della sostanza. Per diversi tipi di composto, i fattori Kp sono elencati nel riferimento (b).
Molto spesso, sono disponibili dei dati nei quali è fornito un punto di ebollizione a pressione ridotta. In tale caso, secondo (b), la tensione di vapore si calcola come segue:

dove T1 è il punto di ebollizione alla pressione ridotta P1.
RELAZIONE
Quando si usa il metodo della stima, la relazione deve includere una documentazione completa del calcolo.
BIBLIOGRAFIA
|
(a)
|
K.M. Watson, Ind. Eng. Chem., 1943, vol. 35, 398.
|
|
(b)
|
W.J. Lyman, W.F. Reehl, D.H. Rosenblatt. Handbook of Chemical Property Estimation Methods, McGraw-Hill, 1982.
|
Appendice 2
Figura 1
Apparecchio per la determinazione della curva di tensione di vapore mediante il metodo dinamico
Figura 2a
Apparecchio per la determinazione della curva della tensione di vapore secondo il metodo statico (con l'uso di un manometro con tubo ad U)

Figura 2b
Apparecchio per la determinazione della curva della tensione di vapore secondo il metodo statico (con l'uso di un indicatore di pressione)

Figura 3
Isoteniscopio (rif. bibl. 7)

Figura 4
Apparecchio per la determinazione della curva della tensione di vapore secondo il metodo della bilancia a tensione di vapore

Figura 5
Esempio di apparecchio per l'evaporazione a bassa pressione mediante il metodo di effusione, con una cella di effusione del volume di 8 cm3
Figura 6a
Esempio di sistema di flusso per la determinazione della tensione di vapore mediante il metodo della saturazione gassosa
Figura 6b
Esempio di sistema per la determinazione della tensione di vapore mediante il metodo della saturazione di gas, con un capillare disposto a valle della camera di saturazione

Figura 7
Esempio della disposizione sperimentale per il metodo del rotore
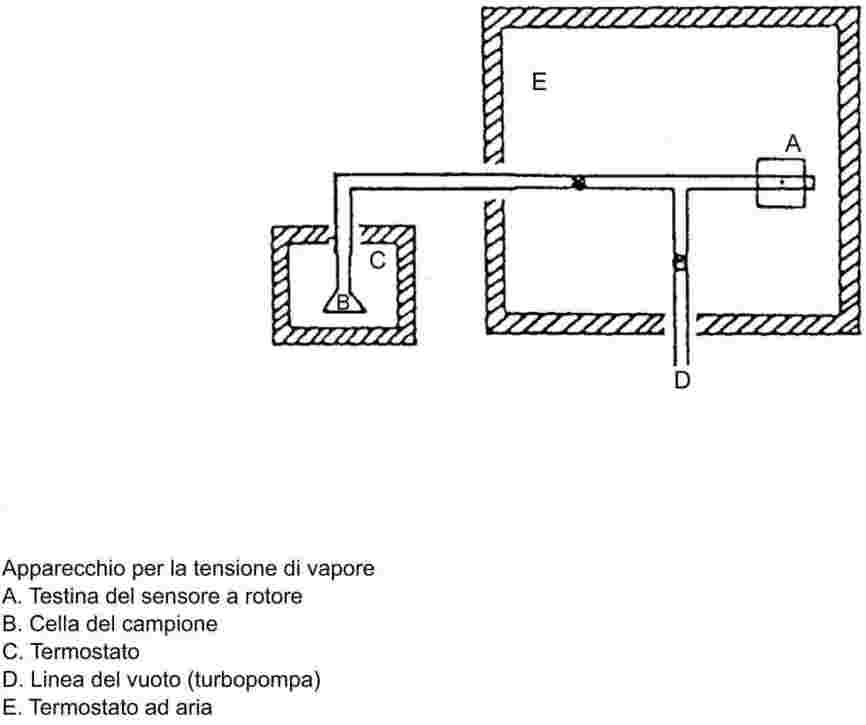
Figura 8
Esempio di testina di misurazione a rotore

A.5. TENSIONE SUPERFICIALE
1. METODO
I metodi descritti si basano sulle linee direttrici OCSE (1) I principi fondamentali sono presentati nel riferimento (2).
1.1. INTRODUZIONE
I metodi qui illustrati si applicano alla misura della tensione superficiale di soluzioni acquose.
Prima di effettuare le prove, è utile disporre di dati preliminari su alcune caratteristiche della sostanza in esame, quali la solubilità in acqua, la struttura, il comportamento all’idrolisi e la concentrazione critica per la formazione di micelle.
I metodi qui illustrati si applicano alla maggior parte delle sostanze chimiche senza alcuna limitazione rispetto al loro grado di purezza.
La misura della tensione superficiale col metodo del tensiometro ad anello può essere effettuata soltanto su soluzioni acquose con viscosità dinamica inferiore a 200 mPa s circa.
1.2. DEFINIZIONI ED UNITÀ
Per tensione superficiale si intende l'entalpia libera superficiale per unità di area.
La tensione superficiale si misura in:
N/m (unità SI) oppure in
mN/m (sottomultipli della unità SI);
1 N/m = 103 dine/cm,
1 mN/m = 1 dine/cm nel vecchio sistema cgs.
1.3. SOSTANZE DI RIFERIMENTO
Non è necessario utilizzare sostanze di riferimento ogni volta che si esamina una nuova sostanza. Esse servono principalmente per controllare periodicamente l'attendibilità del metodo e per permettere il confronto dei risultati ottenuti con altri metodi.
Nei riferimenti bibliografici (1) e (3) sono citate varie sostanze di riferimento in grado di coprire un ampio campo di valori della tensione superficiale.
1.4. PRINCIPIO DEI METODI
I metodi si basano sulla misura della massima forza che è necessario esercitare in senso verticale ad una staffa o ad un anello a contatto con la superficie del liquido in esame posto in un recipiente di misura affinché detto liquido si distacchi dalla superficie stessa, ovvero ad una lamina che abbia un bordo a contatto con la superficie suddetta per sollevare la pellicola che si è formata.
Le sostanze che sono solubili in acqua ad una concentrazione di almeno 1 mg/l sono esaminate in soluzione acquosa ad un'unica concentrazione.
1.5. CRITERI DI QUALITÀ
I metodi descritti permettono misure più precise di quanto possa essere necessario per valutazioni di ordine ambientale.
1.6. DESCRIZIONE DEI METODI
Si prepara una soluzione della sostanza in acqua distillata. La concentrazione di questa soluzione dovrebbe essere il 90 % del valore corrispondente alla concentrazione di saturazione della sostanza in acqua; quando questa concentrazione supera 1 g/l, si usa per la prova una concentrazione di 1 g/l. Non è necessario eseguire il saggio su sostanze con una solubilità in acqua minore di 1 mg/1.
1.6.1. Metodo della lamina
Vedi ISO 304 e NF T 73-060 (Tensioattivi — Determinazione della tensione superficiale attraverso il sollevamento di pellicole liquide).
1.6.2. Metodo della staffa
Vedi ISO 304 e NF T 73-060 (Tensioattivi — Determinazione della tensione superficiale attraverso il sollevamento di pellicole liquide).
1.6.3. Metodo dell'anello
Vedi ISO 304 e NF T 73-060 (Tensioattivi — Determinazione della tensione superficiale attraverso il sollevamento di pellicole liquide).
1.6.4. Metodo armonizzato dell'anello secondo l'OCSE
1.6.4.1. Apparecchiatura
I tensiometri reperibili in commercio risultano adeguati a questo tipo di misura. Essi consistono delle parti seguenti:
|
—
|
tavolo mobile per il campione,
|
|
—
|
sistema di misurazione della forza,
|
|
—
|
elemento di misura (anello),
|
1.6.4.1.1. Tavolo mobile per il campione
Il tavolo mobile per il campione viene usato come piano d'appoggio per il recipiente di misura termostatato contenente la soluzione in esame. Detto tavolo è montato su di un sostegno assieme al sistema di misurazione della forza.
1.6.4.1.2. Sistema di misurazione della forza
Il sistema di misurazione della forza (vedi la figura) è collocato al di sopra del tavolo che sostiene il campione. L'errore nella misura della forza non deve essere maggiore di ± 10-6N, corrispondente ad un limite d'errore di ±0,1 mg in unità di massa. Nella maggioranza dei casi, la scala di misura dei tensiometri reperibili in commercio è tarata in mN/m, in modo che la tensione superficiale possa essere direttamente letta in mN/m con una incertezza di 0,1 mN/m.
1.6.4.1.3. Elemento di misura (anello)
L'anello è generalmente costituito da un filo di platino-iridio di circa 0,4 mm di spessore ed avente una circonferenza media di 60 mm. L'anello è sospeso orizzontalmente ad uno stelo metallico e ad una forcella di supporto in filo metallico che costituiscono il collegamento con il sistema di misurazione della forza (vedi la figura).
Figura
Elemento di misura
(Tutte le quote sono in mm)

1.6.4.1.4. Recipiente di misura
Il recipiente di misura contenente la soluzione in esame deve essere in vetro e permettere la termostatazione. Esso deve essere progettato in modo che, durante la misura, la temperatura della soluzione liquida in esame e della fase gassosa sovrastante la sua superficie rimanga costante e che il campione non possa evaporare. Sono accettabili recipienti cilindrici in vetro di diametro interno non inferiore a 45 mm.
1.6.4.2. Preparazione dell'apparecchiatura
1.6.4.2.1. Pulizia
I recipienti di vetro devono essere accuratamente puliti. Se necessario, essi vanno lavati con miscela solfo-cromica bollente, poi con acido fosforico sciropposo (dall'83 al 98 % in peso di H3PO4), abbondantemente risciacquati con acqua di rubinetto, lavati con acqua bidistillata fino a reazione neutra ed infine asciugati o risciacquati con parte del campione liquido in esame.
L'anello deve essere innanzitutto abbondantemente risciacquato con acqua per eliminare ogni sostanza idrosolubile, poi immerso per breve tempo nella miscela solfo-cromica, lavato con acqua bidistillata fino a reazione neutra ed infine riscaldato brevemente su una fiamma a metanolo.
Nota:
Eventuali sostanze contaminanti che non possano essere disciolte o distrutte dalla miscela solfo-cromica o dall'acido fosforico, come ad esempio siliconi, vanno eliminate mediante un opportuno solvente organico.
1.6.4.2.2. Taratura dell'apparecchio
La convalida dell'apparecchiatura consiste nel controllo del punto di zero e nella regolazione dello strumento in modo che esso permetta determinazioni attendibili in mN/ra.
Montaggio:
La base dell'apparecchio deve essere posta perfettamente in piano, per esempio utilizzando una livella a bolla d'aria e regolando le apposite viti di livellamento.
Azzeramento dell'apparecchio:
Dopo aver montato l'anello sull'apparecchio e prima di immergerlo nel liquido, il tensiometro deve essere azzerato, controllando inoltre il parallelismo dell'anello con la superficie della soluzione. A tale scopo la superficie della soluzione può essere usata come uno specchio.
Taratura:
La taratura può essere effettuata tramite uno dei due procedimenti seguenti:
|
a)
|
per mezzo di una massa: il procedimento si basa sull'impiego di cavalieri di massa nota compresa tra 0,1 e 1,0 g, da collocare sull'anello. Il fattore di calibrazione Φa, per il quale tutte le letture dell'apparecchio devono essere moltiplicate, va determinato con la seguente equazione (1):
|

|
(1)
|
dove:
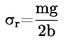 (mN/m) (mN/m)
|
m
|
=
|
massa del cavaliere (in g),
|
|
g
|
=
|
accelerazione di gravità (981 cm.s-2 al livello del mare),
|
|
b
|
=
|
circonferenza dell'anello (in cm),
|
|
σa
|
=
|
lettura al tensiometro dopo collocamento del cavaliere sull'anello (in mN/m);
|
|
|
b)
|
per mezzo dell'acqua: il procedimento si basa sull'impiego di acqua pura, la cui tensione superficiale è nota; per esempio, a 23 oC essa è di 72,3 mN/m. Questo metodo è più rapido della taratura con pesi, ma comporta sempre il rischio che la tensione superficiale dell'acqua risulti alterata a causa della contaminazione con tensioattivi in traccia.
Il fattore di taratura Φb, per il quale tutte le letture dell'apparecchio devono essere moltiplicate, va determinato con la seguente equazione (2):
|

|
(2)
|
dove:
|
σo
|
=
|
valore riportato in letteratura per la tensione superficiale dell'acqua (in mN/m),
|
|
σg
|
=
|
valore misurato della tensione superficiale dell'acqua (in mN/m) entrambi riferiti alla stessa temperatura.
|
|
1.6.4.3. Preparazione dei campioni
Vanno preparate soluzioni acquose delle sostanze da esaminare alle concentrazioni richieste ed in assenza di alcun corpo di fondo.
La soluzione deve essere mantenuta a temperatura costante (±0,5 oC). Poiché la tensione superficiale di una soluzione nel recipiente di misura varia con il tempo, devono essere effettuate più misure a distanza l'una dall'altra, in modo da poter tracciare un grafico rappresentante le variazioni della tensione superficiale in funzione del tempo. Lo stato di equilibrio si considera raggiunto quando non si riscontrano più variazioni.
La polvere e la contaminazione gassosa ad opera di altre sostanze interferiscono con le misure. Queste devono pertanto essere effettuate sotto una copertura di protezione.
1.6.5. Condizioni sperimentali
Le misure vanno eseguite a 20 oC circa con variazioni non superiori a ±0,5 oC.
1.6.6. Esecuzione della prova
Le soluzioni da sottoporre a misura devono essere trasferite nel recipiente di misura accuratamente pulito, avendo cura di evitare la formazione di schiuma, e successivamente il recipiente di misura va collocato sul tavolo dell'apparecchio di prova. Il piano dei tavolo va alzato insieme ai recipiente fino ad immergere l'anello sotto la superficie della soluzione in esame. Il piano del tavolo va poi abbassato gradualmente ed uniformemente (ad una velocità di circa 0,5 cm/min), in modo da staccare l'anello dalla superficie, fino a raggiungere il massimo della forza. Lo strato liquido attaccato all'anello non deve separarsi da esso. Al termine della misura, l'anello va nuovamente immerso sorto la superficie della soluzione ed il procedimento ripetuto finché si ottenga un valore costante della tensione superficiale. In ciascuna determinazione va registrato il tempo trascorso dal trasferimento della soluzione nel recipiente di misura. Le letture devono essere effettuate in corrispondenza dello sforzo massimo necessario per distaccare l'anello dalla superficie del liquido.
2. DATI
Per calcolare la tensione superficiale, il valore in mN/m letto sull'apparecchio va innanzitutto moltiplicato per il fattore di calibrazione Φa o Φb, (secondo il procedimento di taratura adottato). Si otterrà così un valore approssimativo, che deve essere a sua volta opportunamente corretto.
Harkins e Jordan (4) hanno determinato alcuni fattori di correzione empirici per i valori della tensione superficiale misurata col metodo dell'anello, i quali dipendono dalle dimensioni dell'anello, dalla densità del liquido e dalla sua tensione superficiale.
Poiché la determinazione del fattore di correzione con le tabelle di Harkins e Jordan per ciascuna singola misura di tensione superficiale risulta troppo laboriosa, per le soluzioni acquose può applicarsi un metodo semplificato, consistente nel desumere la tensione superficiale corretta direttamente dalla tabella qui di seguito riportata (per valori compresi tra quelli tabulati si può ricorrere all'interpolazione).
Tabella
Correzione dei valori sperimentali della tensione superficiale
Valida soltanto per soluzioni acquose con p = 1 g/cm3
|
R
|
= 9,55 mm (raggio medio dell'anello).
|
|
r
|
= 0,185 mm (spessore medio del filo metallico).
|
|
Valore sperimentale (mN/m)
|
Valore corretto (mN/m)
|
|
Taratura con pesi (vedi punto 1.6.4.2.2, lettera a)
|
Taratura con acqua (vedi punto 1.6.4.2.2, lettera b)
|
|
20
|
16,9
|
18,1
|
|
22
|
18,7
|
20,1
|
|
24
|
20,6
|
22,1
|
|
26
|
22,4
|
24,1
|
|
28
|
24,3
|
26,1
|
|
30
|
26,2
|
28,1
|
|
32
|
28,1
|
30,1
|
|
34
|
29,9
|
32,1
|
|
36
|
31,8
|
34,1
|
|
38
|
33,7
|
36,1
|
|
40
|
35,6
|
38,2
|
|
42
|
37,6
|
40,3
|
|
44
|
39,5
|
42,3
|
|
46
|
41,4
|
44,4
|
|
48
|
43,4
|
46,5
|
|
50
|
45,3
|
48,6
|
|
52
|
47,3
|
50,7
|
|
54
|
49,3
|
52,8
|
|
56
|
51,2
|
54,9
|
|
58
|
53,2
|
57,0
|
|
60
|
55,2
|
59,1
|
|
62
|
57,2
|
61,3
|
|
64
|
59,2
|
63,4
|
|
66
|
61,2
|
65,5
|
|
68
|
63,2
|
67,7
|
|
70
|
65,2
|
69,9
|
|
72
|
67,2
|
72,0
|
|
74
|
69,2
|
—
|
|
76
|
71,2
|
—
|
|
78
|
73,2
|
—
|
Questa tabella è stata compilata sulla base della correzione secondo Harkins e Jordan, in modo analogo alla norma DIN 53914 per l'acqua e le soluzioni acquose (densità p = 1 g/cm3) e per anelli reperibili in commercio aventi dimensioni di R = 9,55 mm (raggio medio dell'anello) e r = 0,185 mm (spessore del filo metallico). La tabella fornisce i valori corretti per le misure di tensione superficiale effettuate dopo taratura con pesi o con acqua.
In alternativa, la tensione superficiale può essere calcolata senza taratura preliminare ricorrendo alla formula seguente:

dove:
|
F
|
=
|
forza misurata al dinamometro al punto di rottura della pellicola,
|
|
R
|
=
|
raggio dell'anello,
|
|
f
|
=
|
fattore di correzione (1).
|
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
La relazione di prova deve, se possibile, includere le seguenti informazioni:
|
—
|
tipo d'acqua o soluzione impiegata;
|
|
—
|
descrizione precisa della sostanza (identità e impurezze);
|
|
—
|
risultati delle misure: tensione superficiale (lettura), indicando sia le singole letture e la loro media che la media corretta (tenendo conto del fattore specifico dell'apparecchio e della tabella di correzione);
|
|
—
|
concentrazione della soluzione;
|
|
—
|
temperatura di esecuzione delle prove;
|
|
—
|
età della soluzione impiegata; in particolare il tempo trascorso tra la preparazione della soluzione e le misure;
|
|
—
|
descrizione della variazione della tensione superficiale col tempo dopo il trasferimento della soluzione nel recipiente di misura;
|
|
—
|
tutte le informazioni e osservazioni utili per l'interpretazione dei risultati, in particolare per quanto riguarda le impurezze e lo stato fisico della sostanza.
|
3.2. INTERPRETAZIONE DEI RISULTATI
Considerando che l'acqua distillata ha una tensione superficiale di 72,75 mN/m a 20 oC, le sostanze che presentano una tensione superficiale minore di 60 mN/m nelle condizioni di misura previste da questo metodo devono essere considerate come materiali tensioattivi.
4. BIBLIOGRAFIA
|
(1)
|
OECD, Paris, 1981, Test Guideline 115, Decision of the Council C(81) 30 final.
|
|
(2)
|
R. Weissberger ed., Technique of Organic Chemistry, Chapter XIV, Physical Methods of Organic Chemistry, 3rd ed., Interscience Publ., New York, 1959, Vol. I, Part I.
|
|
(3)
|
Pure Appl. Chem., 1976, vol. 48, 511.
|
|
(4)
|
Harkins, W.D., Jordan, H.F., J. Amer. Chem. Soc, 1930, vol. 52, 1751.
|
A.6. IDROSOLUBILITÀ
1. METODO
I metodi descritti sono basati sulle linee direttrici OCSE (1).
1.1. INTRODUZIONE
Per l'esecuzione della prova in oggetto è utile disporre di informazioni preliminari sulla formula di struttura, la tensione di vapore, la costante di dissociazione e l'idrolisi (in funzione del pH) della sostanza in esame.
Non esiste un procedimento unico che sia applicabile a tutto l'intervallo delle possibili solubilità in acqua.
I due metodi di prova descritti nel seguito coprono l'intera gamma della solubilità, ma non sono applicabili a sostanze volatili:
|
—
|
il primo si applica a sostanze essenzialmente pure, scarsamente solubili (< 10-2 g/l) e stabili in acqua, e viene definito «metodo della eluizione su colonna»;
|
|
—
|
il secondo si applica a sostanze essenzialmente pure con solubilità più elevata (>10–2 g/l) e stabili in acqua, e viene definito «metodo del matraccio».
|
La solubilità in acqua della sostanza esaminata può essere considerevolmente alterata dalla presenza di impurezze.
1.2. DEFINIZIONI ED UNITÀ
La solubilità in acqua di una sostanza è definita come la concentrazione di saturazione della sostanza in acqua ad una determinata temperatura. La solubilità in acqua è espressa in unità di massa per volume di soluzione. L'unità SI è il kg/m3 (si può anche far uso del g/l).
1.3. SOSTANZE DI RIFERIMENTO
Non è necessario utilizzare sostanze di riferimento ogni volta che si esamina una nuova sostanza. Esse servono principalmente per controllare periodicamente l'attendibilità del metodo e per permettere il confronto con risultati ottenuti mediante altri metodi.
1.4. PRINCIPIO DEL METODO
Tramite una semplice prova preliminare si stabilisce la quantità approssimativa del campione ed il tempo necessario per raggiungere la concentrazione di saturazione.
1.4.1. Metodo dell'eluizione su colonna
Questo metodo si basa sull'eluizione con acqua della sostanza in esame da una microcolonna riempita con materiale di supporto inerte, come perline di vetro o sabbia, con un eccesso della sostanza stessa. La solubilità in acqua viene valutata quando la concentrazione della sostanza nell'eluato è costante. Ciò si deduce dal fatto che la concentrazione in funzione del tempo raggiunge un valore costante.
1.4.2. Metodo del matraccio
In questo metodo la sostanza (polverizzata, se solida) è disciolta in acqua ad una temperatura leggermente superiore a quella del saggio. Quando si raggiunge la saturazione, la miscela viene raffreddata e mantenuta alla temperatura della determinazione, agitando per tutto il tempo necessario a raggiungere l'equilibrio. In alternativa, la misura può essere eseguita direttamente alla temperatura di prova se, mediante un appropriato campionamento, si può essere sicuri di avere raggiunto l'equilibrio di saturazione. Successivamente, si determina mediante un opportuno metodo analitico la concentrazione della massa della sostanza nella soluzione acquosa, quest'ultima non deve contenere particelle indisciolte.
1.5. CRITERI DI QUALITÀ
1.5.1. Ripetibilità
Per il metodo dell'eluizione su colonna, si può ottenere una ripetibilità inferiore al 30 %; per il metodo del matraccio essa dovrebbe essere inferiore al 15 %.
1.5.2. Rivelabiltà
La rivelabilità dipende dal metodo d'analisi; si possono comunque effettuare determinazioni della concentrazione di massa fino a 10 –6 g/l.
1.6. DESCRIZIONE DEL METODO
1.6.1. Condizioni di determinazione
La prova deve essere eseguita preferibilmente a 20 oC ±0,5 oC. Se si presume che ci sia una dipendenza della solubilità anche dalla temperatura (> 3 % per oC), la prova deve essere eseguita ad altre due temperature di almeno 10 oC al di sopra e al di sotto di quella scelta inizialmente. In questo caso il controllo della temperatura deve rientrare in ±0,1 oC. La temperatura prescelta deve essere mantenuta costante in tutti i componenti importanti della strumentazione.
1.6.2. Prova preliminare
In un cilindro graduato da 10 ml, chiuso con tappo di vetro e contenente all'incirca 0,1 g del campione (le sostanze solide devono essere polverizzate), vengono versati volumi crescenti di acqua distillata a temperatura ambiente, secondo le indicazioni riportate nella seguente tabella:
|
0,1 g solubili in «x» ml di acqua
|
0,1
|
0,5
|
1
|
2
|
10
|
100
|
> 100
|
|
Solubilità approssimativa (g/l)
|
> 1 000
|
1 000-200
|
200-100
|
100-50
|
50-10
|
10-1
|
< 1
|
Dopo ciascuna aggiunta delle quantità d'acqua indicate, la miscela viene vigorosamente agitata per 10 minuti e controllata visualmente per accertare la presenza di particelle non disciolte del campione. Se, dopo l'aggiunta di 10 ml d'acqua, il campione, o parte di esso, rimane indisciolto, l'esperimento deve essere ripetuto in un cilindro graduato da 100 ml con volumi d'acqua maggiori. Per solubilità inferiori, il tempo necessario per sciogliere la sostanza può essere considerevolmente più lungo (si devono prevedere almeno 24 ore). La solubilità approssimativa è indicata nella tabella in corrispondenza del volume d'acqua aggiunto per ottenere la dissoluzione completa del campione. Se la sostanza è ancora manifestamente insolubile, occorre attendere più di 24 ore (fino ad un massimo di 96 ore), oppure si deve effettuare un'ulteriore diluizione per accertarsi se debba essere usato il metodo dell'eluizione su colonna o il metodo del matraccio.
1.6.3. Metodo dell'eluizione su colonna
1.6.3.1. Materiale di supporto, solvente ed eluente
II materiale di supporto per il metodo dell'eluizione su colonna deve essere inerte. Possibili materiali adatti allo scopo sono perline di vetro e sabbia. Per distribuire la sostanza in esame sul materiale di supporto, va utilizzato un opportuno solvente volatile di purezza analitica. Come eluente va utilizzata acqua bidistillata ottenuta tramite apparecchi in vetro od in quarzo.
Nota:
Non deve utilizzarsi acqua proveniente direttamente da scambiatore di ioni di natura organica.
1.6.3.2. Caricamento del supporto
Si pesano circa 600 mg del materiale di supporto, che si trasferiscono poi in un pallone a base tonda da 50 ml.
Si scioglie nel solvente prescelto una quantità pesata opportuna della sostanza da esaminare. Una quantità appropriata di questa soluzione viene aggiunta al materiale di supporto. Il solvente deve essere completamente evaporato, ad esempio in un evaporatore rotante. In caso contrario non si raggiunge la saturazione con acqua del supporto a causa degli effetti di ripartizione sulla superficie del materiale di supporto.
Il caricamento del materiale di supporto può causare problemi (risultati erronei) se la sostanza di prova si deposita sotto forma di olio o di una differente fase cristallina. Il problema deve essere esaminato sperimentalmente e i dettagli riportati nella relazione.
Il materiale di supporto così caricato viene lasciato a bagno approssimativamente per 2 ore in circa 5 ml di acqua, e quindi la sospensione viene introdotta nella microcolonna. In alternativa, si può versare il materiale di supporto già ricoperto della sostanza ed essiccato nella microcolonna previamente riempita d'acqua e quindi lasciare il tutto ad equilibrarsi per circa 2 ore.
Procedimento di determinazione
L'eluizione della sostanza dal materiale di supporto può essere eseguita in due modi diversi:
|
—
|
con una pompa di circolazione (si veda la figura 1),
|
|
—
|
con un recipiente di livellamento (si veda la figura 4).
|
1.6.3.3. Metodo dell'eluizione su colonna con pompa di circolazione
Apparecchiatura
La rappresentazione schematica di un sistema convenzionale è riportata nella figura 1. La figura 2 presenta una microcolonna di adatte caratteristiche, che peraltro può avere altre misure, purché vengano rispettati i criteri di riproducibilità e sensibilità. La colonna deve comprendere uno spazio di testa pari ad almeno cinque volte il volume del letto d'acqua ed essere in grado di contenere un minimo di cinque campioni. In alternativa, le dimensioni possono anche essere ridotte qualora si impieghi un solvente di riempimento per sostituire i primi cinque volumi del letto d'acqua, scartati perché contenenti impurezze.
La colonna deve essere collegata ad una pompa di circolazione capace di assicurare una portata di circa 25 ml/h. La pompa è collegata mediante giunti in politetrafluoroetilene (PTFE) e/o in vetro. La colonna e la pompa, dopo il montaggio, devono permettere il campionamento dell'effluente e l'equilibrazione dello spazio di testa a pressione atmosferica. Il materiale della colonna è sostenuto da un batuffolo di lana di vetro (5 mm), che serve anche da filtro per le particelle. La pompa di circolazione può essere ad esempio una pompa peristaltica od una pompa a membrana (si deve fare attenzione affinché non ci sia contaminazione e/o adsorbimento da parte del materiale del tubo).
Procedimento di misura
Si avvia il flusso attraverso la colonna. Si raccomanda di usare una portata di approssimativamente 25 ml/h (che corrisponde a 10 volumi del letto per ora per la colonna descritta). Si devono scartare almeno i primi cinque volumi per allontanare le impurezze solubili in acqua. Successivamente si lascia funzionare la pompa di circolazione fino al raggiungimento dell'equilibrio; ciò viene accertato sulla base di cinque campioni successivi, le concentrazioni dei quali non differiscono più del ± 30 % con distribuzione casuale. Questi campioni devono essere distanziati l'uno dall'altro da intervalli di tempo corrispondenti al passaggio di almeno dieci volte il volume del letto di eluente.
1.6.3.4. Metodo dell'eluizione su colonna con recipiente di livellamento
Apparecchiatura (si vedano le figure 3 e 4):
Recipiente di livellamento: il collegamento con il recipiente di livellamento si realizza tramite un giunto di vetro smerigliato, connesso con un tubo in teflon. Si raccomanda una velocità di flusso di circa 25 ml/h. Frazioni eluite consecutivamente vanno prelevate ed analizzate con il metodo prescelto.
Procedimento di misura
Per determinare la solubilità in acqua si utilizzano le frazioni eluite nella fase centrale, dove le concentrazioni devono risultare costanti (± 30 %) in almeno cinque frazioni consecutive.
In ambedue i casi (sia che si usi una pompa di circolazione sia che si usi un vaso di livellamento), si deve eseguire una seconda prova con una velocità di flusso uguale alla metà di quella della prima prova. Se i risultati delle due prove concordano, la determinazione è soddisfacente. Se si misura una solubilità manifestamente superiore alla portata minore, il dimezzamento della velocità di flusso va proseguito finché due prove successive non forniscano lo stesso valore della solubilità.
In entrambi i casi (utilizzando una pompa di circolazione od un recipiente di livellamento), l'eventuale presenza di materia colloidale va controllata tramite l'effetto Tyndall (diffusione della luce). La presenza di tali particelle toglie validità ai risultati e pertanto si deve ripetere la determinazione migliorando l'azione filtrante della colonna.
Va registrato il pH di ogni campione. Deve essere eseguita una seconda prova alla stessa temperatura.
1.6.4. Metodo del matraccio
1.6.4.1. Apparecchiatura
Per il metodo del matraccio è necessario il seguente materiale:
|
—
|
normale strumentazione e vetreria di laboratorio,
|
|
—
|
un apparecchio adatto per l'agitazione delle soluzioni a temperatura costante e controllata,
|
|
—
|
una centrifuga (preferibilmente con termostato), se necessaria quando siano presenti emulsioni, e
|
|
—
|
apparecchiatura per determinazioni analitiche.
|
1.6.4.2. Procedimento di misura
La quantità di materiale necessario per saturare il volume di acqua viene valutata in base alla prova preliminare. Il volume di acqua necessario dipenderà dal metodo analitico e dall'intervallo di solubilità. Una quantità di materiale pari a cinque volte quella determinata in conformità a quanto detto sopra viene pesata direttamente in tre recipienti di vetro (per esempio, provette da centrifuga, beute) provvisti di tappi di vetro. A ciascun recipiente viene aggiunto il volume prescelto di acqua e quindi i recipienti vengono chiusi ermeticamente. Questi sono poi agitati a 30 oC si deve utilizzare un apparecchio di agitazione o di mescolamento che funzioni a temperatura costante, per esempio un agitatore magnetico in bagno d'acqua termostato). Dopo un giorno, uno dei recipienti viene prelevato e riequilibrato per 24 ore alla temperatura della determinazione, con agitazione intermittente. Il contenuto del recipiente viene poi centrifugato alla temperatura di prova, e si misura con un opportuno metodo analitico ia concentrazione del composto nella fase acquosa limpida. Gli altri due recipienti vengono trattati in modo analogo dopo una equilibrazione iniziale a 30 oC per due e tre giorni, rispettivamente. Se i valori di concentrazione concordano, nei limiti richiesti per la riproducibilità, almeno per i due ultimi campioni, la prova è positiva. Se invece i dati relativi ai recipienti 1, 2 e 3 mostrano una tendenza verso valori crescenti, l'intera prova deve essere ripetuta utilizzando tempi di equilibrazione più lunghi.
Il procedimento di misura può anche venire eseguito senza preincubazione a 30 oC. Allo scopo di stimare la velocità con cui si stabilisce l'equilibrio di saturazione, si prelevano dei campioni fino a che il tempo di agitazione non influisce più sulla concentrazione della soluzione di prova.
Va riportato il pH di ciascun campione.
1.6.5. Analisi
Per queste determinazioni va preferito un metodo analitico specifico per la sostanza in esame, poiché piccole quantità di impurezze solubili possono causare forti errori nella misura della solubilità. Esempi di tali metodi sono la gascromatografia, la cromatografia liquida, procedimenti di titolazione, procedimenti fotometrici, procedimenti voltammetrici.
2. DATI
2.1. METODO DELL'ELUIZIONE SU COLONNA
Per ciascuna prova si deve calcolare il valore medio di almeno cinque campioni consecutivi, prelevati in corrispondenza della fase di costanza di saturazione, nonché la deviazione standard. I risultati devono essere presentati in unità di massa per volume di soluzione.
Le medie calcolate su due prove con l'utilizzo di portate differenti vengono confrontate e devono presentare una ripetibilità inferiore al 30 %.
2.2. METODO DEL MATRACCIO
Si devono riportare i singoli risultati per ciascuno dei tre matracci e i risultati giudicati costanti (ripetibilità entro il 15 %) devono essere mediati e presentati in unità di massa per volume di soluzione. Ciò può richiedere la conversione delle unità di massa in unità di volume, utilizzando la densità quando la solubilità sia molto elevata (> 100 g/l).
3. RELAZIONE
3.1. METODO DELLA ELUIZIONE SU COLONNA
La relazione sulla prova deve, se possibile, includere le seguenti informazioni:
|
—
|
i risultati della prova preliminare,
|
|
—
|
la descrizione precisa della sostanza (identità e impurezze),
|
|
—
|
le concentrazioni, flussi e pH individuali di ciascun campione
|
|
—
|
le medie e le deviazioni standard di almeno cinque campioni nella zona di saturazione costante per ciascuna prova,
|
|
—
|
la media delle due prove successive accettabili,
|
|
—
|
la temperatura dell'acqua durante il processo di saturazione,
|
|
—
|
il metodo di analisi utilizzato,
|
|
—
|
la natura del materiale di supporto utilizzato,
|
|
—
|
il procedimento di carica del materiale di supporto,
|
|
—
|
il solvente utilizzato,
|
|
—
|
l'indicazione di eventuale instabilità chimica della sostanza durante la prova e il metodo utilizzato,
|
|
—
|
tutte le informazioni attinenti all'interpretazione dei risultati, in particolare per quanto riguarda le impurezze e lo stato fisico della sostanza.
|
3.2. METODO DEL MATRACCIO
La relazione sulla prova deve, se possibile, includere le seguenti informazioni:
|
—
|
i risultati della prova preliminare,
|
|
—
|
la descrizione precisa della sostanza (identità ed impurezze),
|
|
—
|
le singole determinazioni analitiche e la media nel caso in cui più di un valore sia stato determinato per ciascun matraccio,
|
|
—
|
il pH di ciascun campione,
|
|
—
|
la media dei valori per i diversi matracci, i cui risultati siano concordanti,
|
|
—
|
la temperatura di determinazione,
|
|
—
|
il metodo analitico utilizzato,
|
|
—
|
l'indicazione di eventuale instabilità chimica della sostanza durante la prova e il metodo utilizzato,
|
|
—
|
tutte le informazioni attinenti all'interpretazione dei risultati, in particolare per quanto riguarda le impurezze e lo stato fisico della sostanza.
|
4. BIBLIOGRAFIA
|
(1)
|
OECD, Paris, 1981, Test Guideline 105, Decision of the Council C(81) 30 final.
|
|
(2)
|
NF T 20-045 (AFNOR) (September 85). Chemical products for industrial use — Determination of water solubility of solids and liquids with low solubility — Column elution method.
|
|
(3)
|
NF T 20-046 (AFNOR) (September 85). Chemical products for industrial use — Determination of water solubility of solids and liquids with high solubility — Flask method.
|
Appendice
Figura 1
Metodo dell'eluizione su colonna con pompa di circolazione
Figura 2
Microcolonna tipica
(tutte le quote sono in mm)

Figura 3
Microcolonna tipica
(tutte le quote sono in mm)
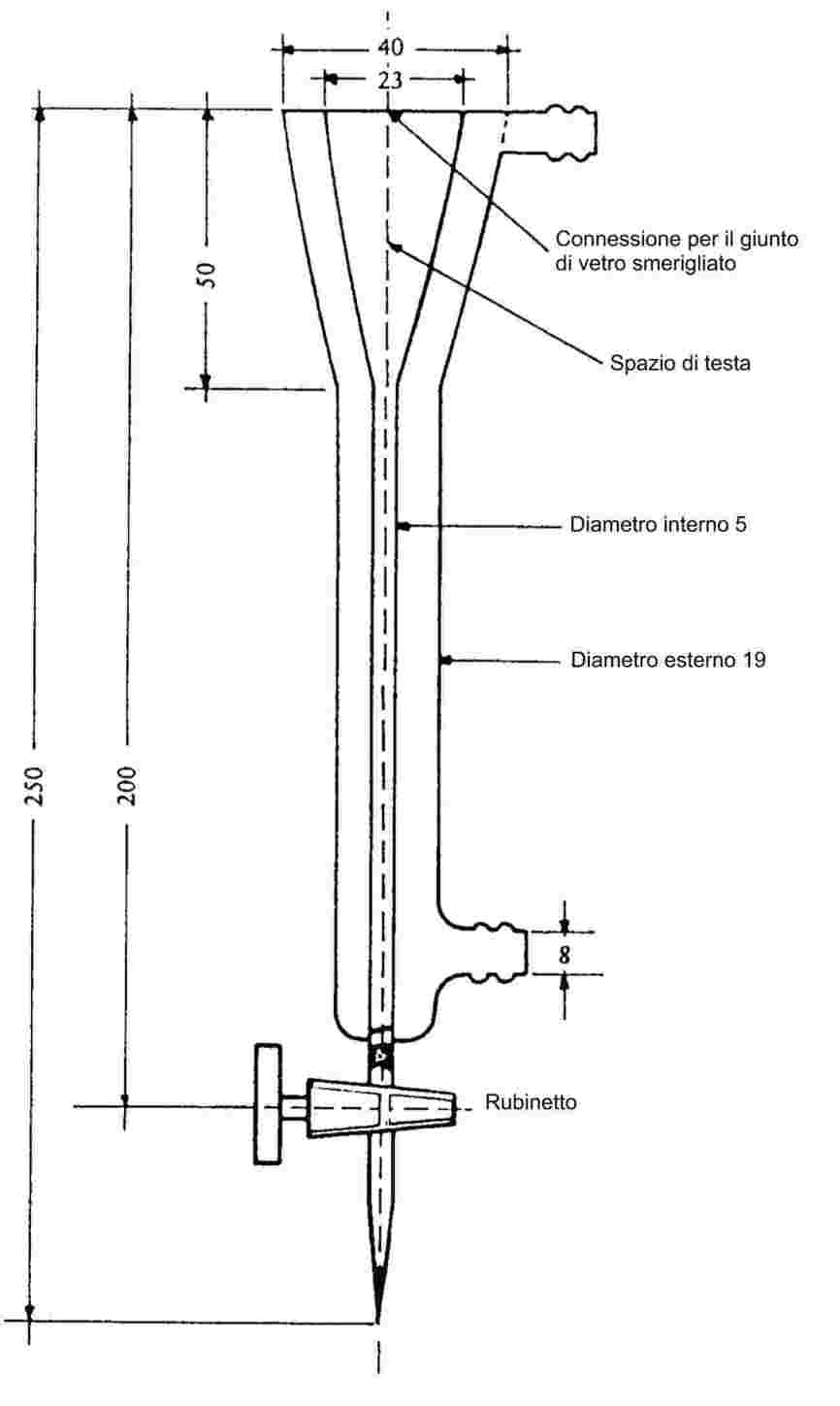
Figura 4
Metodo dell'eluizione su colonna con recipiente di livellamento

A.8. COEFFICIENTE DI RIPARTIZIONE
1. METODO
Il metodo del «dibattimento in pallone» descritto è basato sulle linee direttrici OCSE (1).
1.1. INTRODUZIONE
Per eseguire questa prova è utile disporre di informazioni preliminari sulla formula di struttura, la costante di dissociazione, la solubilità in acqua, l'idrolisi, la solubilità in n-ottanolo e la tensione superficiale della sostanza.
La misura sulle sostanze ionizzabili deve essere eseguita solo nella loro forma non ionizzata (acido libero o base libera), prodotta mediante l'uso di un tampone appropriato con un pH di almeno una unità inferiore (acido libero) o superiore (base libera) al pK.
Questo metodo di prova include due procedure separate — il metodo dell'agitazione in pallone e la cromatografia liquida ad alte prestazioni (HPLC). Il primo può essere applicato quando il valore di log Poa (per le definizioni si veda più avanti) ricade nel campo da — 2 a 4 e il secondo nel campo da 0 a 6. Prima di eseguire una delle due procedure sperimentali, si deve ricavare una stima preliminare del coefficiente di ripartizione.
Il metodo del dibattimento in pallone vale solo per sostanze essenzialmente pure, solubili in acqua e in n-ottanolo. Non è applicabile a materiali tensioattivi (per i quali si deve fornire un valore calcolato o una stima basata sulle solubilità individuali in n-ottanolo e in acqua).
Il metodo HPLC non è applicabile ad acidi e basi forti, complessi metallici, materiali tensioattivi o sostanze che reagiscono con l'eluente. Per questi materiali, si deve fornire un valore calcolato o una stima basata sulle solubilità individuali in n-ottanolo e acqua.
Il metodo HPLC è meno sensibile alla presenza di impurezze nei composto in esame che non il metodo dell'agitazione in pallone. Tuttavia, in alcuni casi, le impurezze possono rendere difficile l'interpretazione dei risultati perché l'assegnazione dei picchi diventa incerta. Per le miscele che forniscono una banda non risolta, si devono indicare i limiti inferiore e superiore di log P,
1.2. DEFINIZIONI ED UNITÀ
Il coefficiente di ripartizione (P) si definisce come il rapporto tra le concentrazioni all'equilibrio (Ci) di una sostanza disciolta in un sistema costituito da due solventi pressoché immiscibili. Nel caso del n-ottanolo e dell'acqua:
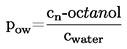
Il coefficiente di ripartizione (P) è pertanto il quoziente di due concentrazioni e viene generalmente espresso sotto forma del suo logaritmo decimale (log P).
1.3. SOSTANZE DI RIFERIMENTO
Metodo del dibattimento in pallone
Non è necessario utilizzare sostanze di riferimento ogni volta che si esamina una nuova sostanza. Esse servono principalmente per controllare periodicamente l'attendibilità del metodo e per permettere il confronto con risultati ottenuti mediante altri metodi.
Metodo HPLC
Allo scopo di correlare i dati di un composto misurati per HPLC con il suo P, si deve tracciare un grafico di taratura di log P contro i dati cromatografici utilizzando almeno 6 punti di riferimento. Sta all'utilizzatore selezionare le sostanze di riferimento appropriate. Se possibile, almeno un composto di riferimento deve avere un Poa al di sopra di quello della sostanza in esame e un altro un Poa al di sotto di quello della sostanza in esame. Per valori di log P minori di 4, la taratura può essere basata su dati ottenuti mediante il metodo del dibattimento in pallone. Per valori di log P maggiori di 4, la taratura può essere basata su valori di letteratura convalidati, purché siano in accordo con i valori calcolati. Per una migliore accuratezza, è preferibile scegliere composti di riferimento strutturalmente simili alla sostanza in esame.
Sono disponibili elenchi estesi di valori di log Poa per molti gruppi di composti chimici (2) (3). Se non sono disponibili dati di coefficienti di ripartizione di composti strutturalmente simili, si può allora usare una taratura più generale basata su altri composti di riferimento.
In appendice 2 è fornito un elenco di sostanze di riferimento raccomandate e dei loro valori di Poa.
1.4. PRINCIPIO DEL METODO
1.4.1. Metodo del dibattimento in pallone
Per determinare il coefficiente di ripartizione è necessario raggiungere l'equilibrio tra tutti i componenti che interagiscono nel sistema, e si devono determinare le concentrazioni delle sostanze disciolte nelle due fasi. Un esame della letteratura sull'argomento indica che si possono utilizzare varie tecniche per risolvere questo problema, cioè l'accurata miscelazione delle due fasi seguita dalla loro separazione per poter determinare la concentrazione all'equilibrio della sostanza in esame.
1.4.2. Metodo HPLC
La misura viene eseguita su colonne analitiche impaccate con una fase solida disponibile in commercio contenente idrocarburi a catena lunga (ad esempio C8, C18) chimicamente legati su silice. I prodotti chimici iniettati su una colonna si muovono lungo di essa a velocità differenti a causa del differente grado di ripartizione tra la fase mobile e la fase stazionaria idrocarbonica. Miscele di composti chimici vengono eluite nell'ordine della loro idrofobicità, dove i composti chimici solubili in acqua sono eluiti per primi e i composti chimici liposolubili per ultimi, in proporzione al loro coefficiente di ripartizione idrocarburo-acqua. Questo permette di stabilire la relazione esistente tra il tempo di ritenzione su tale colonna (a fase inversa) e il coefficiente di ripartizione n-ottanolo/acqua. Il coefficiente di ripartizione viene dedotto dal fattore di capacità k, fornito dall'espressione:
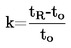
in cui tr = tempo di ritenzione della sostanza in esame e to = tempo medio richiesto perché una molecola di solvente passi attraverso la colonna (tempo morto).
Non sono richiesti metodi analitici quantitativi, ed è necessaria solo la determinazione dei tempi di eluizione.
1.5. CRITERI DI QUALITÀ
1.5.1. Ripetibilità
Metodo del dibattimento in pallone
Per assicurare l'accuratezza del coefficiente di ripartizione, vanno eseguite determinazioni in doppio in tre diverse condizioni sperimentali, così da poter variare la quantità della sostanza considerata nonché il rapporto tra i volumi dei solventi. I valori determinati per il coefficiente di ripartizione, espressi come logaritmi decimali, devono essere compresi in un intervallo di ±0,3 unità logaritmiche.
Metodo HPLC
Al fine di aumentare la validità della misura, si devono eseguire determinazioni in doppio. I valori di log P derivati dalle singole misure devono essere compresi in un intervallo di ±0,1 unità logaritmiche.
1.5.2. Sensibilità
Metodo del dibattimento in pallone
L'intervallo di misura del metodo è definito dal limite di rivelabilità del procedimento analitico. Questo deve essere sufficiente per permettere la valutazione dei valori di log Poa nel campo da — 2 a 4 (occasionalmente, quando si verificano le opportune condizioni, questo intervallo può essere esteso ad un log Poa fino a 5) quando la concentrazione del soluto in una delle due fasi non è superiore a 0,01 mol/l.
Metodo HPLC
Il metodo HPLC permette di stimare i coefficienti di ripartizione nel campo di log Poa da 0 a 6.
Normalmente, il coefficiente di ripartizione di un composto può essere stimato entro ± 1 unità logaritmica del valore ottenibile con il metodo del dibattimento in pallone. In letteratura è possibile trovare correlazioni tipiche (4) (5) (6) (7) (8). Un'accuratezza più elevata si può in genere ottenere con grafici di correlazione basati su composti di riferimento di struttura simile (9).
1.5.3. Specificità
Metodo del dibattimento in pallone
La legge di ripartizione di Nernst si applica esclusivamente a soluzioni diluite a temperatura, pressione e pH costanti. Essa è rigorosamente valida solo per una sostanza pura dispersa tra due solventi puri. Qualora in una delle due fasi, od in ambedue, siano presenti più soluti diversi, ciò può alterare i risultati.
La dissociazione o l'associazione delle molecole disciolte portano a deviazioni dalla legge di ripartizione di Nernst. Tali deviazioni sono evidenziate dal fatto che il coefficiente di ripartizione varia in funzione della concentrazione della soluzione.
Dati gli equilibri multipli che hanno luogo, questo metodo non può essere applicato a composti ionizzabili senza ricorrere ad opportuni fattori di correzione. Per tali composti si deve prendere in considerazione l'uso di soluzioni tampone invece di acqua; il pH del tampone deve differire di almeno un'unità di pH dal pKa della sostanza, tenendo presente la significatività di questo pH per l'ambiente.
1.6. DESCRIZIONE DEL METODO
1.6.1. Stima preliminare del coefficiente di ripartizione
II coefficiente di ripartizione viene stimato preferibilmente utilizzando un metodo di calcolo (si veda l'appendice 1), o, dove appropriato, dal rapporto delle solubilità della sostanza in esame nei solventi puri (10).
1.6.2. Metodo del dibattimento in pallone
1.6.2.1. Preparazione
n-ottanolo: la determinazione del coefficiente di ripartizione deve essere eseguita con reattivi per analisi di elevata purezza.
Acqua: va impiegata acqua distillata o bidistillata in apparecchi di vetro o quarzo. Per i composti ionizzabili, si devono usare soluzioni tampone al posto dell'acqua, se giustificato.
Nota:
Non si deve usare acqua prelevata direttamente da uno scambiatore di ioni.
1.6.2.1.1. Presaturazione dei solventi
Prima di determinare il coefficiente di ripartizione, le fasi del sistema di solventi devono essere mutuamente saturate mediante agitazione alla temperatura della determinazione. Per far ciò è vantaggioso agitare per 24 ore con un agitatore meccanico due grandi bottiglie di riserva contenenti rispettivamente n-ottanolo ed acqua, entrambi di grande purezza, addizionati ciascuno di una adeguata quantità dell'altro solvente, e poi lasciate riposare abbastanza a lungo da consentire la separazione delle fasi ed il raggiungimento dello stato di saturazione.
1.6.2.1.2. Preparazione per la determinazione
L'intero volume del sistema bifasico deve riempire quasi completamente il recipiente di misura. Ciò permetterà di evitare le perdite di materiale per volatilizzazione. I rapporti in volume e le quantità delle sostanze da impiegare devono essere stabilite tenendo conto:
|
—
|
della valutazione preliminare del coefficiente di ripartizione (si veda sopra),
|
|
—
|
della quantità minima di sostanza da esaminare per il procedimento analitico,
|
|
—
|
della limitazione della concentrazione ad un massimo di 0,01 mol/l per ognuna delle due fasi.
|
Si eseguono tre determinazioni. Nella prima, si usa il rapporto in volume calcolato di n-ottanolo ad acqua; nella seconda, questo rapporto viene diviso per due; e nella terza questo rapporto viene moltiplicato per due (ad esempio 1:1, 1:2, 2:1).
1.6.2.1.3. Sostanza da esaminare
Si prepara una soluzione di riserva in n-ottanolo presaturato con acqua. La concentrazione di questa soluzione di riserva deve essere determinata con precisione prima di impiegarla nella determinazione del coefficiente di ripartizione. Questa soluzione deve essere conservata in condizioni che assicurino la sua stabilità.
1.6.2.2. Condizioni sperimentali
La temperatura della determinazione deve essere mantenuta costante (± 1 oC) ed essere compresa nell'intervallo 20-25 oC.
1.6.2.3. Procedimento di misura
1.6.2.3.1. Raggiungimento dell'equilibrio di ripartizione
Per ciascuna condizione sperimentale si devono preparare in doppio i recipienti contenenti la quantità richiesta dei due solventi, esattamente misurata, insieme all'opportuna quantità della soluzione di riserva.
Le fasi in n-ottanolo devono essere misurate in volume. I recipienti per la determinazione devono essere collocati in un opportuno agitatore o essere agitati manualmente. Un metodo raccomandato è quello di fare ruotare rapidamente di 180o la provetta da centrifuga intorno al suo asse trasversale in modo che l'eventuale aria intrappolata risalga attraverso le due fasi. L'esperienza ha mostrato che 50 rotazioni così effettuate sono in generale sufficienti per raggiungere l'equilibrio di ripartizione. Per sicurezza sono raccomandate 100 rotazioni in 5 minuti.
1.6.2.3.2. Separazioni delle fasi
Quando è necessario, allo scopo di separare le fasi si deve effettuare una centrifugazione della miscela. Ciò dovrebbe essere fatto mediante una centrifuga da laboratorio mantenuta a temperatura ambiente o, se si usa una centrifuga non termostatata, le provette da centrifuga devono essere riequilibrate alla temperatura di determinazione per almeno 1 ora prima dell'analisi.
1.6.2.4. Analisi
Per la determinazione del coefficiente di ripartizione è necessario misurare la concentrazione della sostanza in esame in ambedue le fasi. Ciò può essere fatto prelevando un'aliquota di entrambe le fasi da ciascuna provetta per ciascuna condizione sperimentale ed analizzando ciascuna aliquota mediante il procedimento prescelto. La quantità totale delle sostanze presenti in ambedue le fasi deve essere calcolata e confrontata con la quantità della sostanza inizialmente introdotta.
Il prelievo di un campione della fase acquosa va eseguito con un procedimento che renda minimo il rischio di inclusione di tracce di n-ottanolo; a tal fine si può impiegare una siringa in vetro con ago asportabile. All'inizio, la siringa deve essere parzialmente riempita d'aria. L'aria deve essere espulsa cautamente mentre si inserisce l'ago attraverso lo strato di ottanolo. Si aspira nella siringa un adeguato volume di fase acquosa. Si toglie rapidamente la siringa dalla soluzione e si rimuove l'ago. Il contenuto della siringa può quindi essere impiegato come campione della fase acquosa. La concentrazione nelle due fasi separate va determinata preferibilmente attraverso un metodo specifico per la sostanza. Esempi di determinazioni chimico-fisiche che possono essere adatte sono i seguenti:
|
—
|
cromatografia liquida ad alte prestazioni.
|
1.6.3. Metodo HPLC
1.6.3.1. Preparazione
Apparecchiatura
È necessario un cromatografo liquido equipaggiato con pompa esente da pulsazioni e con un adatto dispositivo di rivelazione. Si raccomanda di usare una valvola di iniezione con serbatoi di iniezione. La presenza di gruppi polari nella fase stazionaria può peggiorare gravemente le prestazioni della colonna HPLC. Pertanto, le fasi stazionarie devono contenere una percentuale minima di gruppi polari (11). Si possono usare riempimenti commerciali a fase inversa a microparticelle o colonne preimpaccate. Si può posizionare una colonna di protezione tra il sistema di iniezione e la colonna analitica.
Fase mobile
Per preparare il solvente di eluizione si usano metanolo per HPLC e acqua per HPLC e il solvente viene degassato prima dell'uso. Si deve ricorrere all'eluizione isocratica. Si devono usare rapporti metanolo/acqua con un contenuto minimo d'acqua del 25 %. Normalmente, una miscela metanolo/acqua 3:1 (v/v) è soddisfacente per eluire composti con log P 6 in un'ora ad una portata di 1 ml/min. Per composti con log P elevato, può essere necessario abbreviare il tempo di eluizione (e quello dei composti di riferimento) diminuendo la polarità della fase mobile oppure la lunghezza della colonna.
Sostanze con solubilità molto bassa in n-ottanolo tendono a fornire dei valori anormalmente bassi di log Poa con il metodo HPLC; i picchi di tali composti accompagnano talvolta il fronte del solvente. Ciò è probabilmente dovuto al fatto che il processo di ripartizione è troppo lento perché raggiunga l'equilibrio nel tempo normalmente richiesto da una separazione mediante HPLC. Una diminuzione del flusso e/o una diminuzione del rapporto metanolo/acqua può essere efficace per arrivare ad un valore affidabile.
Il composto in esame e i composti di riferimento devono essere solubili nella fase mobile in concentrazioni sufficienti per permetterne la rivelazione. Solo in casi eccezionali si possono usare degli additivi con la miscela metanolo-acqua perché questi modificano le proprietà della colonna. Per i cromatografi con additivi, è obbligatorio usare una colonna separata dello stesso tipo. Se la miscela metanolo/acqua non è appropriata, si possono usare altre miscele solvente organico/acqua, ad esempio etanolo/acqua o acetonitrile/acqua.
Il pH dell'eluente è critico per i composti ionizzabili. Esso deve rientrare nel campo operativo di pH della colonna, che di solito è compreso tra 2 e 8. Si raccomanda di tamponare la soluzione. Occorre aver cura di evitare la precipitazione di sali e il deterioramento della colonna che si verificano con alcune miscele di fase organica/tampone. Le misure mediante HPLC con fasi stazionarie a base di silice al di sopra di pH 8 non sono consigliabili perché l'uso di una fase mobile alcalina può provocare un rapido scadimento delle prestazioni della colonna.
Soluti
I composti di riferimento devono essere i più puri disponibili. I composti da usare a scopo di prova o di taratura devono, se possibile, essere disciolti nella fase mobile.
Condizioni sperimentali
La temperatura durante le misure non deve variare di oltre ± 2 K.
1.6.3.2. Misure
Calcolo del tempo morto to
Il tempo morto to può venire determinato usando o una serie omologa di sostanze (ad esempio n-alchilmetilchetoni) o composti organici non trattenuti (ad esempio tiourea o formammide). Per il calcolo del tempo morto to mediante l'uso di una serie omologa, si inietta una successione di almeno 7 elementi di una serie omologa e si determinano i rispettivi tempi di ritenzione. I tempi di ritenzione grezzi tr(nc +1) sono riportati in grafico in funzione di tr(nc), determinano la intercetta a e il coefficiente angolare b della equazione di regressione:
tr(nc +1) = a + b tr(nc)
(nc = numero di atomi di carbonio). Il tempo morto o è rappresentato allora da:
t0 = a/(1 - b)
Grafico di taratura
La fase successiva consiste nella costruzione di un tracciato di correlazione di log k contro log P per appropriati composti di riferimento. Nella pratica, si effettua la determinazione su un gruppo di 5-10 composti standard di riferimento, il cui log P cade nei dintorni dell'intervallo previsto, iniettandoli simultaneamente ed effettuando preferibilmente la determinazione con un registratore integratore collegato al sistema di rivelazione. I logaritmi dei fattori di capacità corrispondenti, log k, vengono calcolati e riportati sul tracciato in funzione del log P determinato mediante il metodo del dibattimento in pallone. La taratura viene eseguita a intervalli regolari ed almeno una volta al giorno, in modo da tenere conto di possibili variazioni delle prestazioni della colonna.
Determinazioni del fattore di capacità della sostanza in esame
La sostanza in esame viene iniettata nella più piccola quantità possibile di fase mobile. Viene determinato il tempo di ritenzione (in doppio) e questo permette il calcolo del fattore di capacità k. Dal grafico di correlazione dei composti di riferimento, si può interpolare il coefficiente di ripartizione della sostanza in esame. Per coefficienti di ripartizione sia molto bassi che molto elevati è necessario ricorrere alla estrapolazione. In tali casi bisogna porre particolare attenzione ai limiti di validità della retta di regressione.
2. DATI
Metodo del dibattimento in pallone
L'affidabilità dei valori di P determinati può essere controllata confrontando le medie delle determinazioni in doppio con la media globale.
3. RELAZIONE
La relazione di prova deve, se possibile, includere le seguenti informazioni:
|
—
|
indicazione precisa della sostanza (identità e impurezze),
|
|
—
|
quando i metodi non siano applicabili (ad esempio materiale tensioattivo), deve essere fornito un valore calcolato o una stima basata sulle singole solubilità in n-ottanolo e acqua,
|
|
—
|
ogni informazione e osservazione significativa per l'interpretazione dei risultati, in particolare per quanto riguarda le impurezze e lo stato fisico della sostanza.
|
Per il metodo del dibattito in pallone:
|
—
|
il risultato dell'eventuale stima preliminare,
|
|
—
|
la temperatura di determinazione,
|
|
—
|
i dati sui procedimenti analitici impiegati per determinare le concentrazioni,
|
|
—
|
il tempo e la velocità di centrifugazione, se quest'ultima è stata applicata,
|
|
—
|
le concentrazioni misurate in ambedue le fasi per ciascuna determinazione (ciò significa che dovrà essere riportato un totale di 12 concentrazioni),
|
|
—
|
il peso della sostanza in esame, il volume di ciascuna fase impiegata in ciascun recipiente di prova e la quantità totale calcolata della sostanza in esame presente in ciascuna fase dopo equilibrazione,
|
|
—
|
i valori calcolati per il coefficiente di ripartizione (P), e le medie per ciascuna serie di condizioni sperimentali, nonché la media per tutte le determinazioni. Se esiste il sospetto di una dipendenza dalla concentrazione del coefficiente di ripartizione, ciò va menzionato nella relazione,
|
|
—
|
la deviazione standard dei singoli valori di P rispetto alla loro media,
|
|
—
|
il valore medio di P risultante da tutte le determinazioni deve pure essere espresso come logaritmo (base 10),
|
|
—
|
il valore teorico calcolato per Poa quando esso è stato determinato o quando il valore misurato è > 104,
|
|
—
|
il pH dell'acqua impiegata e della fase acquosa durante l'esperimento,
|
|
—
|
se vengono usati dei tamponi, giustificazione del loro uso al posto dell'acqua, composizione, concentrazione, e pH dei tamponi, pH della fase acquosa prima e dopo l'esperimento.
|
Per il metodo HPLC:
|
—
|
il risultato dell'eventuale stima preliminare,
|
|
—
|
sostanze in esame e di riferimento e loro purezza,
|
|
—
|
intervallo di temperatura delle determinazioni,
|
|
—
|
pH al quale vengono effettuate le determinazioni,
|
|
—
|
dettagli relativi alla colonna analitica e di protezione, alla fase mobile e al dispositivo di rivelazione,
|
|
—
|
dati di ritenzione e valori di log P desunti dalla letteratura per i composti di riferimento usati nella taratura,
|
|
—
|
dettagli della curva di regressione risultante (log k contro log P),
|
|
—
|
dati di ritenzione media e valore interpolato di log P per il composto in esame,
|
|
—
|
descrizione dell'apparecchiatura e delle condizioni operative,
|
|
—
|
quantità delle sostanze in esame e di riferimento introdotte nella colonna,
|
|
—
|
tempo morto e metodo secondo il quale questo è stato misurato.
|
4. BIBLIOGRAFIA
|
(1)
|
OECD, Paris, 1981, Test Guideline 107, Decision of the Council C(81) 30 final.
|
|
(2)
|
C. Hansch and A.J. Leo, Substiruent Constants for Correlation Analysis in Chemistry and Biology, John Wiley, New York, 1979.
|
|
(3)
|
Log P and Parameter Database, A tool for the quantitative prediction of bioactivity (C. Hansch, chairman; A.J. Leo, dir.) — Available from Pomona College Medical Chemistry Project, 1982, Pomona College, Claremont, California 91711.
|
|
(4)
|
L. Renberg, G. Sundström and K. Sundh-Nygärd, Chemosphere, 1981, vol. 80, 683.
|
|
(5)
|
H. Ellgehausen, C. D'Hondt and R. Fuerer, Pestic. Sci., 1981, vol. 12, 219.
|
|
(6)
|
B. McDuffie, Chemosphere, 1981, vol. 10, 73.
|
|
(7)
|
W.E. Hammers et al., J. Chromatogr, 1982, vol. 247, 1.
|
|
(8)
|
J.E. Haky and A.M. Young, J. Liquid, Chromat., 1984, vol. 7, 675.
|
|
(9)
|
S. Fujisawa and E. Masuhara, J. Biomed. Mat. Res., 1981, vol. 15, 787.
|
|
(10)
|
O. Jubermann, Verteilen und Extrahieren, in Methoden der Organischen Chemie (Houbenm Weyl), Allgemeine Laboratoriumpraxis (edited by E. Muller), Georg Thieme Verlag, Stuttgart, 1958, Band I/l, 223—339.
|
|
(11)
|
R.F. Rekker and H.M. de Kort, Euro. J. Med. Chem., 1979, vol. 14, 479.
|
|
(12)
|
A. Leo, C. Hansch and D. Elkins, Partition coefficients and their uses. Chem. Rev., 1971, vol. 71, 525.
|
|
(13)
|
R.F. Rekker, The Hydrophobic Fragmental Constant, Elsevier, Amsterdam, 1977.
|
|
(14)
|
NF T 20-043 AFNOR (1985). Chemical products for industrial use — Determination of partition coefficient — Flask shaking method.
|
|
(15)
|
C.V. Eadsforth and P. Moser, Chemosphere, 1983, vol. 12, 1459.
|
|
(16)
|
A. Leo, C. Hansch and D. Elkins, Chem. Rev., 1971, vol. 71, 525.
|
|
(17)
|
C. Hansch, A. Leo, S.H. Unger, K.H. Kim, D. Nikaitani and E.J. Lien, J. Med. Chem., 1973, vol. 16, 1207.
|
|
(18)
|
W.B. Neely, D.R. Branson and G.E. Blau, Environ, Sci, Technol., 1974, vol. 8, 1113.
|
|
(19)
|
D.S. Brown and E.W. Flagg, J. Environ. Qual., 1981, vol. 10, 382.
|
|
(20)
|
J.K. Seydel and K.J. Schaper, Chemische Struktur und biologische Aktivität von Wirkstoffen, Verlag Chemie, Weinheim, New York, 1979.
|
|
(21)
|
R. Franke, Theoretical Drug Design Methods, Elsevier, Amsterdam, 1984.
|
|
(22)
|
Y.C. Martin, Quantitative Drug Design, Marcel Dekker, New York, Basel, 1978.
|
|
(23)
|
N.S. Nirrlees, S.J. Noulton, C.T. Murphy, P.J. Taylor; J. Med. Chem., 1976, vol. 19, 615.
|
Appendice 1
Metodi di calcolo/stima
INTRODUZIONE
Un'introduzione generale ai metodi di calcolo, dati ed esempi si trova nello Handbook of Chemical Property Estimation Methods (a).
I valori calcolati di Poa possono essere usati:
|
—
|
per decidere quale dei metodi sperimentati sia appropriato (intervallo del metodo di dibattimento in pallone: log Poa da — 2 a 4, intervallo del metodo in HPLC: log Poa da 0 a 6),
|
|
—
|
per scegliere le condizioni sperimentali appropriate (ad esempio, sostanze di riferimento per i procedimenti HPLC, rapporto in volume n-ottanolo/acqua per il metodo del dibattimento in pallone),
|
|
—
|
come verifica interna di laboratorio per possibili errori sperimentali,
|
|
—
|
per ottenere una stima di Poa nei casi in cui i metodi sperimentali non possano essere applicati per ragioni tecniche.
|
METODO DI STIMA
Stima preliminare del coefficiente di ripartizione
Il valore del coefficiente di ripartizione può essere stimato mediante l'uso delle solubilità della sostanza in esame nei solventi puri: a tale scopo:

METODI DI CALCOLO
Principio dei metodi di calcolo
Tutti i metodi di calcolo sono basati sulla frammentazione formale della molecola in sottostrutture adatte per le quali sono noti incrementi di log Poa affidabili. Il log Poa della molecola intera viene poi calcolato come somma dei valori corrispondenti dei suoi frammenti più la somma di termini di correzione per le interazioni intramolecolari.
Sono disponibili elenchi delle costanti di frammentazione e dei termini di correzione (b) (c) (d) (e). Alcuni di questi vengono regolarmente aggiornati (b).
Criteri di qualità
In generale, l'affidabilità del metodo di calcolo diminuisce al crescere della complessità del composto in esame. Nel caso di molecole semplici di basso peso molecolare e con uno o due gruppi funzionali, ci si può attendere una deviazione da 0,1 a 0,3 unità di log Poa tra i risultati dei metodi di frammentazione e il valore misurato. Nel caso di molecole più complesse, il margine d'errore può essere più grande. Questo dipenderà dall’affidabilità e disponibilità delle costanti dei frammenti, nonché dalla capacità di riconoscere le interazioni intramolecolari (ad esempio i legami idrogeno) e dall'uso corretto dei termini di correzione (problema di non difficile soluzione utilizzando un elaboratore di calcolo e il programma CLOGP-3) (b). Nel caso di composti che si ionizzano, è importante considerare correttamente la carica e il grado di ionizzazione.
Procedure di calcolo
Metodo del π di Hansch
La costante del sostituente idrofobo originale, π, introdotta da Fujita et al. (f) è definita come:
πx = log Poa (PhX) - log Poa (PhH)
dove Poa (PhX) è il coefficiente di ripartizione di un derivato aromatico e Poa (PhH) quello del composto capostipite
(e.g. πCl = log Poa (C6H5Cl) - log Poa (C6H6) = 2,84 - 2,13 = 0,71).
Secondo la sua definizione, il metodo del π può essere applicato principalmente per la sostituzione aromatica. Valori di π per un gran numero di sostituenti sono stati tabulati in (b) (c) (d). Essi vengono usati per il calcolo di log Poa di molecole o sottostrutture aromatiche.
Metodo di Rekker
Secondo Rekker (g), il valore di log Poa viene calcolato come segue:

dove f, rappresenta la costante dei differenti frammenti molecolari e a, la frequenza con cui essi si presentano nella molecola in esame. I termini di correzione possono essere espressi come multiplo intero di una costante singola Cm (la cosiddetta «costante magica»). Le costanti di frammento fi e Cm sono state ricavate da un elenco di 1 054 valori sperimentali di Poa (825 composti) utilizzando l'analisi di regressione multipla (c) (h). La determinazione dei termini di interazione viene eseguita secondo regole fisse descritte in letteratura (e) (h) (i).
Metodo di Hansch-Leo
Secondo Hansch e Leo (c), il valore di log Poa si calcola dalla relazione:

in cui fi, rappresenta la costante per differenti frammenti molecolari, Fj il termine di correzione e ai, bj le corrispondenti frequenze con cui essi si presentano. Una serie di valori di frammenti costituiti da atomi e gruppi e una serie di termini di correzione Fj (i cosiddetti «fattori») sono stati determinati per approssimazioni successive derivandoli da valori sperimentali di Poa. I termini di correzione sono stati ordinati in varie classi (a) (c). E relativamente complicato e lungo tener conto di tutte le regole e dei termini di correzione. Sono stati sviluppati a tale scopo dei pacchetti di programma (b).
Metodo combinato
Il calcolo del log Poa di molecole complesse può venire migliorato considerevolmente se la molecola viene divisa in strutture più semplici per le quali sono disponibili valori affidabili di log Poa ottenuti o da tabelle (b) (c) o da proprie misure. Tali frammenti (ad esempio sostanze eterocidiche, antrachinoni, azobenzene) possono poi venire combinati con i valori di π di Hansch o con le costanti di frammento di Rekker o Leo.
Osservazioni
|
i)
|
I metodi di calcolo possono essere applicati a composti parzialmente o completamente ionizzati solo quando è possibile tener conto dei necessari fattori di correzione.
|
|
ii)
|
Se si può assumere che vi siano dei legami idrogeno intramolecolari, i corrispondenti termini di correzione (approssimativamente da +0,6 a +1,0 unità di log Poa) devono venire aggiunti (a). Indicazioni della presenza di tali legami si possono ottenere da modelli tridimensionali o da dati spettroscopici della molecola.
|
|
iii)
|
Se sono possibili varie forme tautomere, sì deve assumere come base di calcolo la forma più probabile.
|
|
iv)
|
È opportuno seguire con attenzione le revisioni degli elenchi delle costanti di frammento.
|
Relazione
Quando si utilizzano metodi di calcolo/stima, la relazione deve, se possibile, includere le seguenti informazioni:
|
—
|
descrizione della sostanza (miscela, impurezze, e così via),
|
|
—
|
indicazione di ogni possibile legame idrogeno intramolecolare, dissociazione, carica e altri effetti insoliti (ad esempio tautomeria),
|
|
—
|
descrizione del metodo di calcolo,
|
|
—
|
identificazione o fornitura della base di dati,
|
|
—
|
peculiarità della scelta dei frammenti,
|
|
—
|
documentazione completa del calcolo.
|
BIBLIOGRAFIA
|
(a)
|
W.J. Lyman, W.F. Reehl and D.H. Rosenblatt (ed.), Handbook of Chemical Property Estimation Methods, McGraw-Hill, New York, 1983.
|
|
(b)
|
Pomona College, Medicinal Chemistry Project, Claremont, California 91711, USA, Log P Database and Med. Chem. Software (Program CLOGP-3).
|
|
(c)
|
C. Hansch, A.J. Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology, John Wiley, New York, 1979.
|
|
(d)
|
A. Leo, C. Hansch, D. Elkins, Chem. Rev., 1971, vol. 71, 525.
|
|
(e)
|
R.F. Rekker, H.M. de Kort, Eur. J. Med. Chem. — Chill. Ther., 1979, vol. 14, 479.
|
|
(f)
|
T. Fujita, J. Iwasa and C. Hansch, J. Amer. Chem. Soc., 1964, vol. 86, 5175.
|
|
(g)
|
R.F. Rekker, The Hydrophobic Fragmental Constant, Pharmacochemistry Library, vol. 1, Elsevier, New York, 1977.
|
|
(h)
|
C.V. Eadsforth, P. Moser, Chemosphere, 1983, vol. 12, 1459.
|
|
(i)
|
R.A. Scherrer, ACS — American Chemical Society, Washington D.C., 1984, Symposium Series 255, p. 225.
|
Appendice 2
Sostanze di riferimento raccomandate per il metodo HPLC
|
N.
|
Sostanza di riferimento
|
log Poa
|
pKa
|
|
1
|
2-butanone
|
0,3
|
|
|
2
|
4-acetilpiridina
|
0,5
|
|
|
3
|
anilina
|
0,9
|
|
|
4
|
acetanilide
|
1,0
|
|
|
5
|
alcool benzilico
|
1,1
|
|
|
6
|
p-metossifenolo
|
1,3
|
pKa = 10,26
|
|
7
|
acido fenossiacetico
|
1,4
|
pKa = 3,12
|
|
8
|
fenolo
|
1,5
|
pKa = 9,92
|
|
9
|
2,4-dinitrofenolo
|
1,5
|
pKa = 3,96
|
|
10
|
benzonitrile
|
1,6
|
|
|
11
|
fenilacetonitrile
|
1,6
|
|
|
12
|
alcool 4-metilbenzilico
|
1,6
|
|
|
13
|
acetofenone
|
1,7
|
|
|
14
|
2-nitrofenolo
|
1,8
|
pKa = 7,17
|
|
15
|
acido 3-nitrobenzoico
|
1,8
|
pKa = 3,47
|
|
16
|
4-cloroanilina
|
1,8
|
pKa = 4,15
|
|
17
|
nitrobenzene
|
1,9
|
|
|
18
|
alcool cinnamico
|
1,9
|
|
|
19
|
acido benzoico
|
1,9
|
pKa = 4,19
|
|
20
|
p-cresolo
|
1,9
|
pKa = 10,17
|
|
21
|
acido cinnamico
|
2,1
|
pKa = 3,89 cis 4,44 trans
|
|
22
|
anisolo
|
2,1
|
|
|
23
|
metilbenzoato
|
2,1
|
|
|
24
|
benzene
|
2,1
|
|
|
25
|
acido 3-metilbenzoico
|
2,4
|
pKa = 4,27
|
|
26
|
4-clorofenolo
|
2,4
|
pKa = 9,1
|
|
27
|
tricloroetilene
|
2,4
|
|
|
28
|
atrazina
|
2,6
|
|
|
29
|
etilbenzoato
|
2,6
|
|
|
30
|
2,6-diclorobenzonitrile
|
2,6
|
|
|
31
|
acido 3-clorobenzoico
|
2,7
|
pKa = 3,82
|
|
32
|
toluene
|
2,7
|
|
|
33
|
1-naftolo
|
2,7
|
pKa = 9,34
|
|
34
|
2,3-didoroanilina
|
2,8
|
|
|
35
|
clorobenzene
|
2,8
|
|
|
36
|
allilfenil etere
|
2,9
|
|
|
37
|
bromobenzene
|
3,0
|
|
|
38
|
etilbenzene
|
3,2
|
|
|
39
|
benzofenone
|
3,2
|
|
|
40
|
4-fenilfenolo
|
3,2
|
pKa = 9,54
|
|
41
|
timolo
|
3,3
|
|
|
42
|
1,4-diclorobenzene
|
3,4
|
|
|
43
|
difenilammina
|
3,4
|
pKa = 0,79
|
|
44
|
naftalene
|
3,6
|
|
|
45
|
fenilbenzoato
|
3,6
|
|
|
46
|
isopropilbenzene
|
3,7
|
|
|
47
|
2,4,6-triclorofenolo
|
3,7
|
pKa = 6
|
|
48
|
bifenile
|
4,0
|
|
|
49
|
benzilbenzoato
|
4,0
|
|
|
50
|
2,4-dinitro-6-sec.butilfenolo
|
4,1
|
|
|
51
|
1,2,4-triclorobenzene
|
4,2
|
|
|
52
|
acido dodecanoico
|
4,2
|
|
|
53
|
difeniletere
|
4,2
|
|
|
54
|
n-burilbenzene
|
4,5
|
|
|
55
|
fenantrene
|
4,5
|
|
|
56
|
fluorantene
|
4,7
|
|
|
57
|
dibenzile
|
4,8
|
|
|
58
|
2,6-difenilpiridina
|
4,9
|
|
|
59
|
trifenilammina
|
5,7
|
|
|
60
|
DDT
|
6,2
|
|
|
Altre sostanze di riferimento di basso Poa
|
|
1
|
acido nicotinico
|
-0,07
|
|
A.9. PUNTO D'INFIAMMABILITÀ
1. METODO
1.1. INTRODUZIONE
Prima di procedere all'esecuzione della prova sarà utile disporre di informazioni preliminari sulla infiammabilità della sostanza. Il metodo è applicabile a sostanze liquide i cui vapori possono infiammarsi mediante sorgenti di accensione. I metodi sperimentali elencati in questo testo sono affidabili solo per gli intervalli del punto di infiammabilità specificati nei singoli metodi.
Quando si sceglie il metodo da usare, bisogna considerare la possibilità di reazioni chimiche tra la sostanza e il porta campioni.
1.2. DEFINIZIONI E UNITÀ
Il punto di infiammabilità è la temperatura più bassa, corretta alla pressione di 101,325 kPa, alla quale un liquido sviluppa vapori, nelle condizioni definite nel metodo sperimentale, in quantità tali da produrre una miscela vapore/aria infiammabile nel recipiente di prova.
unità: oC
t = T - 273,15
(t in oC e T in K)
1.3. SOSTANZE DI RIFERIMENTO
Non è necessario utilizzare sostanze di riferimento ogni volta che si esamina una nuova sostanza. Esse servono principalmente per controllare periodicamente la precisione del metodo e per permettere il confronto con risultati ottenuti mediante altri metodi.
1.4. PRINCIPIO DEL METODO
La sostanza viene posta in un recipiente di prova e riscaldata o raffreddata alla temperatura sperimentale secondo la procedura descritta nei singoli metodi sperimentali. Vengono eseguite delle prove di accensione allo scopo di accertare se il campione si infiamma o non si infiamma alla temperatura di prova.
1.5. CRITERI DI QUALITÀ
1.5.1. Ripetibilità
La ripetibilità varia secondo l'intervallo del punto di infiammabilità e secondo il metodo sperimentale usato; massimo 2 oC.
1.5.2. Sensibilità
La sensibilità dipende dal metodo sperimentale applicato.
1.5.3. Specificità
La specificità di alcuni metodi sperimentali è limitata a particolari intervalli di punto di infiammabilità e dipende dalle caratteristiche delle sostanze (come ad esempio una elevata viscosità).
1.6. DESCRIZIONE DEL METODO
1.6.1. Preparazioni
Un campione della sostanza in esame viene posto in un apparecchio di prova in conformità a quanto indicato nei punti 1.6.3.1 e/o 1.6.3.2.
Per ragioni di sicurezza, si raccomanda di usare un metodo che utilizzi un campione di piccole dimensioni, circa 2 cm3, per le sostanze di elevato contenuto energetico o tossiche.
1.6.2. Condizioni di prova
L'apparecchio, nei limiti in cui ciò sia in linea con le esigenze di sicurezza, deve essere collocato lontano da correnti d'aria.
1.6.3. Esecuzione della prova
1.6.3.1. Metodo dell'equilibrio
Vedi norme ISO 1516, ISO 3680, ISO 1523 e ISO 3679.
1.6.3.2. Metodo basato sul non equilibrio
Apparecchio di Abel:
Vedi norme BS 2000, parte 170, NF M07-011 e NF T66-009.
Apparecchio di Abel-Pensky:
Vedi norme EN 57, DIN 51755 — parte 1 — (per temperature comprese tra 5 oC e 65 oC) e DIN 51755 — parte 2 — (per temperature al di sotto di 5 oC), NF M07-036
Apparecchio di Tag:
Vedi norma ASTM D 56.
Apparecchio di Pensky-Martens:
Vedi norme ISO 2719, EN 11, DIN 51758, ASTM D 93, BS 2000-34 e NF M 07-019.
Osservazioni:
Quando il punto di infiammabilità, determinato mediante un metodo non di equilibrio scelto tra quelli elencati al punto 1.6.3.2, risulta essere pari a 0 ± 2 oC, 21 ± 2 oC, o 55 ± 2 oC, occorre confermarlo con un metodo all'equilibrio, utilizzando la stessa apparecchiatura.
Ai fini della notifica possono applicarsi solo i metodi che forniscono la temperatura del punto di infiammabilità.
Per determinare il punto di infiammabilità di liquidi viscosi (vernici, gomme e prodotti analoghi) contenenti solventi, possono impiegarsi soltanto apparecchiature e metodi di prova adatti alla determinazione del punto di infiammabilità di liquidi viscosi.
Vedi norme ISO 3679, ISO 3680, ISO 1523 e DIN 53213, parte 1.
3. RELAZIONE
La relazione di prova deve, se possibile, includere le seguenti informazioni:
|
—
|
la descrizione precisa della sostanza (identità e impurezze presenti),
|
|
—
|
l'indicazione del metodo impiegato e di eventuali deviazioni da esso,
|
|
—
|
i risultati e tutte le osservazioni aggiuntive utili ai fini dell'interpretazione dei risultati.
|
4. BIBLIOGRAFIA
Nessuna.
A.10. INFIAMMABILITÀ (SOLIDI)
1. METODO
1.1. INTRODUZIONE
Prima di effettuare la prova sarà utile disporre di informazioni preliminari sulle eventuali proprietà esplosive della sostanza.
La presente prova dovrebbe essere applicata esclusivamente a sostanze in polvere, granulari e pastose.
Evitando di considerare tutte le sostanze capaci di infiammarsi e limitandosi soltanto a quelle che bruciano rapidamente o il cui comportamento alla combustione presenta particolari pericoli di qualsiasi genere, si considerano come facilmente infiammabili soltanto le sostanze la cui velocità di combustione supera un certo valore limite.
Può essere particolarmente pericoloso se l'incandescenza si propaga lungo una polvere metallica a motivo della difficoltà di estinguere l'incendio. Le polveri metalliche sono da considerarsi facilmente infiammabili se sostengono la diffusione dell'incandescenza attraverso la massa entro un tempo specificato.
1.2. DEFINIZIONE E UNITÀ
La velocità di combustione è espressa in secondi.
1.3. COMPOSTI DI RIFERIMENTO
Non specificati.
1.4. PRINCIPIO DEL METODO
La sostanza viene sagomata in una striscia continua o in una miccia di polvere della lunghezza di circa 250 mm e si esegue una prova preliminare orientativa per determinare se, all'accensione mediante una fiamma gassosa, si verifica la propagazione per combustione con fiamma o senza fiamma. Se entro un tempo specificato si verifica la propagazione su 200 mm della massa di campione, allora si esegue un programma completo di prova per determinare la velocità di combustione.
1.5. CRITERI DI QUALITÀ
Non definiti.
1.6. DESCRIZIONE DEL METODO
1.6.1. Prova preliminare orientativa
La sostanza viene sagomata in una striscia continua o in una miccia di polvere per una lunghezza di circa 250 mm per 20 mm di larghezza per 10 mm di altezza su una lastra di base non combustibile, non porosa e di bassa conducibilità termica. Ad una estremità della miccia in polvere si applica una fiamma di alta temperatura generata da un bruciatore a gas (diametro minimo 5 mm) fino a che la polvere si accende oppure per un massimo di 2 minuti (5 minuti per polveri di metalli o leghe metalliche). Ciò che deve essere osservato è se la combustione si propaghi per 200 mm della miccia entro un tempo di prova di 4 minuti (o 40 minuti per polveri metalliche). Se la sostanza non si accende e non propaga la combustione bruciando con fiamma o senza fiamma su 200 mm della miccia di polvere entro 4 minuti (o 40 minuti) nel periodo di prova, allora la sostanza non è da considerarsi come facilmente infiammabile e non sono richieste ulteriori prove. Se la sostanza propaga la combustione per un tratto di 200 mm della miccia di polvere in meno di 4 minuti o in meno di 40 minuti per le polveri metalliche, si deve eseguire il procedimento descritto di seguito (punto 1.6.2. e successivi).
1.6.2. Prova della velocità di combustione
1.6.2.1. Preparazione
Le sostanze in polvere o granulari vengono introdotte in modo sfuso in uno stampo della lunghezza di 250 mm con sezione trasversale triangolare ed altezza interna di 10 mm e larghezza di 20 mm. Su ambedue i lati dello stampo, in senso longitudinale, sono montate due lastrine di metallo, con la funzione di limiti laterali; esse devono sporgere di 2 mm oltre il bordo superiore della sezione triangolare (vedi figura). Lo stampo viene poi lasciato cadere per tre volte su una superficie solida, dall'altezza di 2 cm. Se necessario, lo stampo viene nuovamente riempito. I limiti laterali vengono poi rimossi e la sostanza in eccesso viene asportata. Sopra allo stampo si pone una piastra non combustibile, non porosa e con una bassa conducibilità termica che funge da piastra di base, si rovescia l'apparecchio e si rimuove lo stampo.
Le sostanze pastose sono sparse su una piastra di base non combustibile, non porosa e di bassa conducibilità termica in forma di un cordone della lunghezza di 250 mm con una sezione trasversale di circa 1 cm2.
1.6.2.2. Condizioni sperimentali
Nel caso di una sostanza sensibile all'umidità, la prova deve essere effettuata con la massima rapidità possibile subito dopo aver tolto la sostanza stessa dal recipiente.
1.6.2.3. Esecuzione della prova
Disporre il campione nella corrente di una cappa per l'aspirazione dei fumi.
La velocità dell'aria deve essere sufficiente per impedire ai fumi di sfuggire verso il laboratorio e non deve venire modificata durante la prova. L'apparecchio deve essere schermato dalla corrente d'aria.
Per accendere l'ammasso ad una estremità, si utilizza una fiamma calda di un bruciatore a gas (diametro minimo 5 mm). Quando l'ammasso è bruciato per un tratto di 80 mm, si misura la velocità di combustione sui successivi 100 mm.
L'esperimento viene eseguito sei volte usando ogni volta una piastra pulita e fredda, salvo che si osservi prima un risultato positivo.
2. DATI
Il tempo di combustione risultante dalla prova preliminare orientativa (1.6.1) e il minimo tempo di combustione su un massimo di sei prove (1.6.2.3) sono i dati utili ai fini della valutazione.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
La relazione di prova deve, se possibile, includere le seguenti informazioni:
|
—
|
l'indicazione esatta della sostanza (identificazione e impurezze),
|
|
—
|
una descrizione della sostanza esaminata e dei suo stato fisico, incluso il contenuto di umidità,
|
|
—
|
i risultati della prova preliminare orientativa e della prova della velocità di combustione, se eseguita,
|
|
—
|
tutte le osservazioni aggiuntive significative ai fini dell'interpretazione dei risultati.
|
3.2. INTERPRETAZIONE DEI RISULTATI
Le sostanze in polvere, granulari o pastose sono da considerarsi facilmente infiammabili se il tempo di combustione in una qualunque delle prove eseguite secondo la procedura sperimentale descritta al punto 1.6.2. è minore di 45 secondi. Le polveri di metalli o leghe metalliche sono considerate facilmente infiammabili quando sono suscettibili di accensione e la fiamma o la zona di reazione si propaga sull'intero campione in 10 minuti o meno.
4. BIBLIOGRAFIA
|
(1)
|
NF T 20-042 (September 85). Chemical products for industrial use. Determination of the flammability of solids.
|
Appendice
Figura
Stampo e accessori per la preparazione del campione
(Tutte le dimensioni sono espresse in mm)

A.11. INFIAMMABILITÀ (GAS)
1. METODO
1.1. INTRODUZIONE
Questo metodo permette di determinare se gas miscelati con aria a temperatura ambiente (circa 20 oC) e pressione atmosferica sono infiammabili e, in tale caso, in quale intervallo di concentrazioni. Miscele a concentrazioni crescenti del gas in esame con l'aria vengono esposte a una scintilla elettrica e si osserva se ha luogo l'accensione.
1.2. DEFINIZIONE E UNITÀ
L'intervallo d'infiammabilità è l'intervallo di concentrazione compreso fra il limite minimo e il limite massimo di esplosione. I limiti minimo e massimo di esplosione sono quei limiti di concentrazione del gas infiammabile in miscela con l'aria ai quali non si verifica la propagazione della fiamma.
1.3. SOSTANZE DI RIFERIMENTO
Non specificate
1.4. PRINCIPIO DEL METODO
La concentrazione del gas nell'aria viene aumentata gradualmente e ad ogni livello di concentrazione la miscela viene esposta ad una scintilla elettrica.
1.5. CRITERI DI QUALITÀ
Non stabiliti
1.6. DESCRIZIONE DEL METODO
1.6.1. Apparecchiatura
Il recipiente di prova è costituito da un cilindro verticale di vetro con un diametro interno di almeno 50 mm ed un’altezza di 300 mm. Gli elettrodi di accensione, separati da una distanza di 3-5 mm, sono collocati 60 mm al di sopra del fondo del cilindro. Il cilindro è provvisto di un'apertura per lo sfogo della pressione. L'apparecchio deve essere schermato in modo da limitare gli eventuali danni dovuti ad esplosione.
Come fonte di accensione si impiega una scintilla ad induzione permanente della durata di 0,5 s, generata da un trasformatore ad alto voltaggio con una tensione di uscita compresa fra 10 e 15 kV (potenza massima di entrata: 300 W). Un esempio di un apparecchio adatto è descritto nel riferimento bibliografico (2).
1.6.2. Condizioni sperimentali
La prova deve essere eseguita a temperatura ambiente (circa 20 oC).
1.6.3. Esecuzione della prova
Usando pompe dosatrici, si introduce nel cilindro di vetro una miscela gas/aria di concentrazione nota. Si fa passare una scintilla attraverso la miscela e si osserva se si stacca o no dalla fonte di accensione una fiamma che si propaga indipendentemente. La concentrazione del gas viene variata per incrementi dell'1 % in volume fino a quando si verifica l'accensione sopra descritta.
Se la struttura chimica del gas indica che esso non dovrebbe essere infiammabile e si può calcolare la composizione della miscela stechiometrica con aria, si effettua allora la prova solo su miscele nell'intervallo dal 10 % al di sotto della composizione stechiometrica al 10 % al di sopra di questa composizione in incrementi dell'1 %.
2. DATI
La propagazione della fiamma è l'unico fenomeno significativo per la determinazione di questa proprietà.
3. RELAZIONE
La relazione di prova deve, se possibile, includere le seguenti informazioni:
|
—
|
la descrizione esatta della sostanza (identità e impurezze presenti),
|
|
—
|
la descrizione dell'apparecchiatura utilizzata con l'indicazione delle dimensioni,
|
|
—
|
la temperatura alla quale la prova è stata eseguita,
|
|
—
|
le diverse concentrazioni impiegate e i risultati ottenuti,
|
|
—
|
il risultato della prova: gas non infiammabile o gas facilmente infiammabile,
|
|
—
|
se si conclude che il gas non è infiammabile, si deve allora dichiarare l'intervallo di concentrazioni nel quale esso è stato provato in incrementi dell'1 %;
|
|
—
|
tutte le informazioni e osservazioni significative per l'interpretazione dei risultati.
|
4. BIBLIOGRAFIA
|
(1)
|
NF T 20-041 (September 85). Chemical products for industrial use. Determination of the flammability of gases.
|
|
(2)
|
W. Berthoid, D. Conrad, T. Grewer, H. Grosse-Wortmann, T. Redeker und H. Schacke «Entwicklung einer Standard-Apparatur zur Messung von Explosionsgrenzen». Chem.-Ing.-Tech. 1984, vol. 56, 2, 126-127.
|
A.12. INFIAMMABILITÀ (CONTATTO CON L'ACQUA)
1. METODO
1.1. INTRODUZIONE
Questo metodo sperimentale può essere usato per determinare se la reazione di una sostanza con acqua o aria umida porta allo sviluppo di quantità pericolose di gas che possono essere facilmente infiammabili.
Il metodo è applicabile alle sostanze solide e liquide. Questo metodo non è applicabile a sostanze che si infiammano spontaneamente a contatto con l'aria.
1.2. DEFINIZIONI E UNITÀ
Facilmente infiammabili: sostanze che, a contatto con l'acqua o con l'aria umida, sviluppano gas facilmente infiammabili in quantità pericolose ad una velocità minima di 1 l/kg per ora.
1.3. PRINCIPIO DEL METODO
La sostanza viene saggiata secondo il procedimento per gradi descritto nel seguito; se ad uno qualsiasi dei livelli si verifica l'accensione, non è necessario proseguire nella prova. Se è noto che la sostanza non reagisce violentemente con l'acqua, procedere allora al livello 4 (1.3.4).
1.3.1. Livello 1
La sostanza in esame viene versata in un recipiente contenente acqua distillata a 20 oC e si osserva se il gas sviluppato si infiamma o meno.
1.3.2. Livello 2
La sostanza in esame viene posta su un foglio di carta da filtro galleggiante sulla superficie di un recipiente contenente acqua distillata a 20 oC e si osserva se il gas sviluppato si infiamma o meno. La carta da filtro ha semplicemente la funzione di evitare la dispersione della sostanza in acqua, aumentando così le possibilità di accensione.
1.3.3. Livello 3
La sostanza in esame viene disposta in forma approssimativamente cilindrica di circa 2 cm di altezza e 3 cm di diametro. Si aggiungono alcune gocce di acqua e si osserva se il gas sviluppato si infiamma.
1.3.4. Livello 4
La sostanza in esame viene mescolata con acqua distillata a 20 oC e si misura la velocità di sviluppo del gas per un periodo di 7 ore ad intervalli di un'ora. Se la velocità di formazione del gas non è costante, o è ancora in aumento dopo 7 ore, si deve prolungare il tempo di misurazione fino ad un massimo di 5 giorni. La prova può essere sospesa in qualsiasi momento se la velocità di sviluppo del gas supera 1 l/kg per ora.
1.4. SOSTANZA DI RIFERIMENTO
Non specificata.
1.5. CRITERI DI QUALITÀ
Non stabiliti.
1.6. DESCRIZIONE DEI METODI
1.6.1. Livello 1
1.6.1.1. Condizioni di prova
La prova va eseguita a temperatura ambiente (circa 20 oC).
1.6.1.2. Esecuzione della prova
Una piccola quantità (2 mm circa di diametro; della sostanza da esaminare viene posta in un recipiente contenente acqua distillata. Si deve osservare: i) se si ha sviluppo di gas; ii) se si verifica l'accensione del gas. Se si verifica l'accensione del gas, non sono necessarie ulteriori prove, poiché la sostanza deve essere considerata pericolosa.
1.6.2. Livello 2
1.6.2.1. Apparecchiatura
Un foglio di carta da filtro viene fatto galleggiare sulla superficie di acqua distillata contenuta in un qualsiasi recipiente idoneo, ad esempio una capsula da evaporazione del diametro di 100 mm.
1.6.2.2. Condizioni di prova
La prova va eseguita a temperatura ambiente (circa 20 oC).
1.6.2.3. Esecuzione della prova
Una piccola quantità della sostanza in esame (2 mm circa di diametro) viene posta al centro del foglio di carta da filtro. Si deve osservare: i) se si ha sviluppo di gas; ii) se si verifica l'accensione del gas. Se si verifica l'accensione del gas, non sono necessarie ulteriori prove, poiché la sostanza deve essere considerata pericolosa.
1.6.3. Livello 3
1.6.3.1. Condizioni di prova
La prova deve essere eseguita a temperatura ambiente.
1.6.3.2. Esecuzione della prova
La sostanza da esaminare viene disposta in forma approssimativamente cilindrica di circa 2 cm d'altezza e 3 cm di diametro, con una leggera concavità sulla cima. Si aggiungono alcune gocce di acqua e si osserva: i) se si ha sviluppo di gas; ii) se si verifica l'accensione del gas. Se si verifica l'accensione del gas, non sono necessarie ulteriori prove, poiché la sostanza deve essere considerata pericolosa.
1.6.4. Livello 4
1.6.4.1. Apparecchiatura
L'apparecchiatura viene montata come mostrato in figura.
1.6.4.2. Condizioni di prova
Controllare il contenitore della sostanza da esaminare per accertare l'eventuale presenza di polveri al di sotto di 500 μm (dimensioni delle particelle). Se il contenuto in polvere supera l'1 % (p/p) del totale, o se il campione è friabile, tutta la sostanza deve essere ridotta in polvere prima della prova, per tener conto della riduzione di formato delle particelle durante l'immagazzinamento e la manipolazione; in caso contrario, la sostanza deve essere saggiata così come ricevuta. La prova deve essere eseguita a temperatura ambiente (circa 20 oC) e a pressione atmosferica.
1.6.4.3. Esecuzione della prova
Si introducono da 10 a 20 ml d'acqua nel contagocce dell'apparecchiatura e 10 g di sostanza nella beuta. Il volume del gas sviluppato può essere misurato mediante qualsiasi mezzo opportuno. L'imbuto del contagocce viene aperto per immettere l'acqua nella beuta e si avvia un cronometro. Lo sviluppo del gas viene misurato ogni ora per un periodo di 7 ore. Se durante questo periodo lo sviluppo del gas è irregolare o se, al termine di questo periodo, la velocità di sviluppo del gas è in aumento, le misure devono essere continuate fino a 5 giorni. Se in qualunque momento durante la misura la velocità di sviluppo del gas è superiore a 1 l/kg per ora, la prova può essere interrotta. La prova va eseguita in triplo.
Se l'identità chimica del gas è sconosciuta, il gas deve essere analizzato. Quando il gas contiene componenti facilmente infiammabili e non si sa se l'intera miscela sia facilmente infiammabile, si deve preparare e saggiare secondo il metodo A.11 una miscela avente la stessa composizione.
2. DATI
La sostanza viene considerata pericolosa se:
|
—
|
a qualsiasi livello della procedura sperimentale si verifica l'accensione spontanea,
o
|
|
—
|
avviene uno sviluppo di gas infiammabile ad una velocità maggiore dì 1 l/kg della sostanza per ora.
|
3. RELAZIONE
La relazione di prova deve, se possibile, includere le seguenti informazioni:
|
—
|
l'indicazione precisa della sostanza (identificazione e impurezze),
|
|
—
|
dettagli dell'eventuale preparazione iniziale della sostanza in esame,
|
|
—
|
i risultati delle prove (livelli 1, 2, 3 e 4),
|
|
—
|
l'identità chimica del gas sviluppato,
|
|
—
|
la velocità di sviluppo del gas se viene eseguito il livello 4 (1.6.4),
|
|
—
|
ogni ulteriore osservazione significativa ai fini dell'interpretazione dei risultati.
|
4. BIBLIOGRAFIA
|
(1)
|
Recommendations on the Transport of Dangerous Goods, test and criteria, 1990, United Nations, New York.
|
|
(2)
|
NF T 20-040 (September 85). Chemical products for industrial use. Determination of the flammability of gases formed by the hydrolysis of solid and liquid products.
|
Appendice
Figura
Apparecchiatura

A.13. PROPRIETÀ PIROFORICHE DI SOLIDI E LIQUIDI
1. METODO
1.1. INTRODUZIONE
La procedura sperimentale può essere applicata a sostanze solide o liquide che, in piccole quantità, si accendano spontaneamente poco tempo dopo essere venute in contatto con l'aria a temperatura ambiente (circa 20 oC).
Questo metodo di prova non considera le sostanze che devono essere esposte all'aria per ore o giorni a temperatura ambiente o a temperature elevate prima che si verifichi l'accensione.
1.2. DEFINIZIONI E UNITÀ
Si considera che una sostanza presenti proprietà piroforiche se si accende o carbonizza nelle condizioni descritte in 1.6.
Può anche essere necessario controllare l'autoinfiammabilità dei liquidi usando il metodo A.15 (Temperatura di autoaccensione liquidi e gas).
1.3. SOSTANZE DI RIFERIMENTO
Non specificate.
1.4. PRINCIPIO DEL METODO
La sostanza solida o liquida viene aggiunta ad un veicolo inerte e portata in contatto con aria a temperatura ambiente per un periodo di 5 minuti. Se le sostanze liquide non si accendono, esse vengono assorbite su carta da filtro ed esposte all'aria a temperatura ambiente (circa 20 oC) per 5 minuti. Se un solido o un liquido si infiammano, o se un liquido provoca l'accensione o la carbonizzazione della carta da filtro, la sostanza è considerata piroforica.
1.5. CRITERIO DI QUALITÀ
Ripetibilità: per motivi di sicurezza, un singolo risultato positivo è sufficiente perché la sostanza sia considerata piroforica.
1.6. DESCRIZIONE DEL METODO DI PROVA
1.6.1. Apparecchiatura
Una capsula di porcellana del diametro di circa 10 cm viene riempita con farina di diatomee per un'altezza di circa 5 mm a temperatura ambiente (circa 20 oC).
Nota:
La farina di diatomee, o qualsiasi altra sostanza inerte paragonabile facilmente reperibile, sarà considerata rappresentativa di un suolo su cui può riversarsi, in caso di incidente, la sostanza in esame.
Per l'analisi di liquidi che non si accendono a contatto con l'aria quando siano in contatto con un veicolo inerte, è necessaria carta da filtro asciutta.
1.6.2. Esecuzione della prova
a) Solidi in polvere
Da 1 a 2 cm3 della sostanza in polvere da esaminare vengono versati da un'altezza di circa 1 m su una superficie non combustibile e si osserva se la sostanza si infiamma durante la caduta o entro 5 minuti dopo la caduta.
La prova viene eseguita fino a quando si verifica l'accensione, per un massimo di 6 volte.
b) Liquidi
Circa 5 cm3 del liquido in esame vengono versati nella capsula di porcellana preparata e si osserva se la sostanza si infiamma entro 5 minuti.
Se nelle 6 prove non si verifica accensione, eseguire la prova seguente:
un campione da 0,5 ml viene applicato mediante siringa su una carta da filtro dentellata e si osserva se avviene l'accensione o la carbonizzazione della carta da filtro entro 5 minuti dall'aggiunta del liquido. La prova viene eseguita fino a quando si verifica l'accensione o la carbonizzazione, per un massimo di tre volte.
2. DATI
2.1. TRATTAMENTO DEI RISULTATI
La prova può essere interrotta non appena si verifichi un risultato positivo in una qualunque delle prove.
2.2. VALUTAZIONE
Se la sostanza si accende entro 5 minuti da quando viene aggiunta ad un veicolo inerte ed esposta all'aria, oppure se una sostanza liquida carbonizza o provoca l'accensione di una carta da filtro entro 5 minuti da quando è stata aggiunta ed esposta all'aria, tale sostanza viene considerata piroforica.
3. RELAZIONE
La relazione di prova deve, se possibile, includere le seguenti informazioni:
|
—
|
l'indicazione precisa della sostanza (identificazione e impurezze),
|
|
—
|
i risultati delle prove,
|
|
—
|
ogni ulteriore osservazione significativa ai fini dell'interpretazione dei risultati.
|
4. BIBLIOGRAFIA
|
(1)
|
NF T 20-039 (September 85). Chemical products for industrial use. Determination of the spontaneous flammability of solids and liquids.
|
|
(2)
|
Recommendations on the Transport of Dangerous Goods, Test and criteria, 1990, United Nations, New York.
|
A.14. PROPRIETÀ ESPLOSIVE
1. METODO
1.1. INTRODUZIONE
Il metodo fornisce uno schema di prove per determinare se una sostanza solida o pastosa presenti un pericolo di esplosione quando viene sottoposta all'effetto di una fiamma (sensibilità termica) o ad urti o sfregamenti (sensibilità agli stimoli meccanici) e se una sostanza liquida presenti un pericolo di esplosione quando viene sottoposta all'effetto di una fiamma o di un urto.
Il metodo comprende tre parti:
|
a)
|
una prova di sensibilità termica (1);
|
|
b)
|
una prova di sensibilità meccanica relativa agli urti (1);
|
|
c)
|
una prova di sensibilità meccanica relativa allo sfregamento (1).
|
Il metodo fornisce dei dati per valutare la probabilità che certe sollecitazioni comuni possano dar luogo ad una esplosione. Il metodo non è previsto per stabilire se una sostanza sia in grado di esplodere in qualsiasi condizione.
Il metodo è appropriato per determinare se una sostanza presenti un pericolo di esplosione (sensibilità termica e meccanica) nelle particolari condizioni specificate nella direttiva. Questo metodo è basato su un certo numero di tipi di apparecchi ampiamente usati a livello internazionale (1) e che danno normalmente dei risultati significativi. Si riconosce che il metodo non è definitivo. Apparecchi alternativi a quelli specificati possono essere usati purché siano internazionalmente riconosciuti e i risultati possano adeguatamente venire correlati con quelli ricavabili dall'apparecchio specificato.
Non è necessario eseguire le prove quando le informazioni termodinamiche disponibili (ad esempio il calore di formazione, calore di decomposizione) e/o l'assenza di certi gruppi reattivi (2) nella formula di struttura permettano di stabilire al di là di ogni ragionevole dubbio che la sostanza non è soggetta a rapida decomposizione con sviluppo di gas o liberazione di calore (cioè che il materiale non presenta alcun rischio di esplosione). Per i liquidi non è richiesto un saggio di sensibilità allo sfregamento.
1.2. DEFINIZIONI E UNITÀ
Esplosivi:
Sostanze che possono esplodere sotto l'effetto di una fiamma o che sono sensibili agli urti o all'attrito nell'apparecchiatura specificata (o che presentano una sensibilità meccanica maggiore dell’1,3-dinitrobenzene in un apparecchio alternativo).
1.3. SOSTANZE DI RIFERIMENTO
1,3-dinitrobenzene tecnico cristallino passante un setaccio da 0,5 mm per il metodo dello sfregamento e dell'urto.
Peridro-1,3,5-trinitro-1,3,5-triazina (RDX, esogeno, ciclonite — CAS 121-82-4), ricristallizzata da cicloesanone acquoso, setacciata a umido attraverso un setaccio da 250 μm e trattenuta su un setaccio da 150 μm, essiccata a 103 ± 2 oC (per 4 ore) per la seconda serie di prove di sfregamento e urto.
1.4. PRINCIPIO DEL METODO
Per stabilire le condizioni di sicurezza per l'esecuzione delle tre prove di sensibilità sono necessarie delle prove preliminari.
1.4.1. Prove di sicurezza di manipolazione (3)
Per ragioni di sicurezza, prima di eseguire le prove principali campioni molto piccoli (circa 10 mg) della sostanza vengono sottoposti a riscaldamento senza restrizioni fisiche in una fiamma gassosa, ad urti in qualunque tipo di apparecchio adatto e allo sfregamento con l'impiego di un mazzuolo contro un incudine o qualsiasi altro tipo di macchina che produca attrito. Obiettivo della prova è di stabilire se la sostanza sia sensibile ed esplosiva in misura tale che le prove di sensibilità prescritte, in particolare quella della sensibilità termica, debbano essere eseguite con precauzioni particolari per evitare danni all'operatore.
1.4.2. Sensibilità termica
Il metodo prevede di riscaldare la sostanza in un tubo d'acciaio chiuso con piastre forate di differente diametro del foro per determinare se la sostanza tenda ad esplodere nelle condizioni di intensa sollecitazione termica e delimitazione spaziale definita.
1.4.3. Sensibilità meccanica (urti)
Il metodo prevede di sottoporre la sostanza all'urto di una massa specificata lasciata cadere da un'altezza specificata.
1.4.4. Sensibilità meccanica (sfregamento)
Il metodo prevede di sottoporre le sostanze solide o pastose ad attrito tra superfici standard in condizioni specificate di carico e movimento relativo.
1.5. CRITERI DI QUALITÀ
Non stabiliti.
1.6. DESCRIZIONE DEL METODO
1.6.1. Sensibilità termica (effetto di una fiamma)
1.6.1.1. Apparecchiatura
L'apparecchiatura è costituita da un tubo d'acciaio non riutilizzabile con il suo dispositivo di chiusura riutilizzabile (figura 1), installato in un dispositivo di riscaldamento e protezione. Ciascun tubo è ottenuto per imbutitura da una lamiera d'acciaio (vedi appendice) e presenta un diametro interno di 24 mm, una lunghezza di 75 mm e uno spessore delle pareti di 0,5 mm. I tubi sono flangiati all'estremità aperta per permetterne la chiusura mediante la piastra forata. Questa è costituita da una piastra forata resistente alle alte pressioni, dotata di un foro centrale, saldamente fissata ad un tubo con un giunto a vite a due parti (dado e collare filettato). Il dado e il collare filettato sono in acciaio al cromo-manganese (vedi appendice) che non genera scintille fino a 800 oC. Le piastre forate hanno uno spessore di 6 mm, sono in acciaio resistente al calore (vedi appendice) e sono disponibili con aperture di vario diametro.
1.6.1.2. Condizioni di prova
Normalmente la sostanza viene controllata cosi come fornita, benché in certi casi, ad esempio se è pressata, colata o altrimenti condensata, possa essere necessario triturarla prima di esaminarla.
Per i solidi, la massa di materiale da usarsi in ciascuna prova viene determinata secondo un procedimento a secco in due stadi. Un tubo tarato viene riempito con 9 cm3 di sostanza e la sostanza viene compattata con una forza di 80 N applicata alla sezione trasversale totale del tubo. Per ragioni di sicurezza o nei casi in cui la forma fisica del campione possa essere modificata per compressione, si possono usare differenti procedure di riempimento; ad esempio, se la sostanza è molto sensibile all'attrito la pigiatura non è appropriata. Se il materiale è comprimibile, se ne aggiunge dell'altro e lo si pigia fino a che il tubo è riempito fino a 55 mm dal bordo. Si determina la massa totale usata per riempire il tubo fino al livello di 55 mm e se ne aggiungono due ulteriori aliquote, pigiata ciascuna con una forza di 80 N. Poi, secondo le necessità, si aggiunge ulteriore materiale pigiandolo oppure lo si toglie per lasciare il rubo riempito fino a 15 mm dal bordo. Si esegue una seconda prova a secco partendo con una quantità pigiata pari a un terzo della massa totale trovata nella prima prova a secco. Si aggiungono altre due di queste aliquote pigiandole a 80 N e il livello della sostanza nel tubo viene regolato a 15 mm dal bordo mediante l'aggiunta o la sottrazione di materiale secondo le necessità. La quantità di solido usata in ciascuna prova è quella determinata nella seconda prova a secco; il riempimento viene eseguito in tre quantità uguali, compresse ciascuna a 9 cm3 con la forza necessaria, qualunque essa sia. (Ciò può essere facilitato mediante l'uso di anelli distanziatori.)
I liquidi e i gel sono caricati nel tubo fino ad un'altezza di 60 mm ponendo particolare attenzione con i gel per impedire la formazione di vuoti. Il collare filettato viene fatto scivolare sul tubo dal basso, si inserisce l'appropriato piatto forato e si serra il dado dopo aver applicato un po' di lubrificante a base di disolfuro di molibdeno. È essenziale controllare che non vi sia sostanza intrappolata tra la flangia e la piastra né nella filettatura.
Per il riscaldamento si utilizza propano prelevato da una bombola industriale dotata di regolatore di pressione (60-70 mbar), passandolo attraverso un manometro e distribuendolo in modo uniforme (come indicato dall'osservazione visiva delle fiamme uscenti dai bruciatori) a 4 bruciatori mediante un collettore. I bruciatori sono disposti intorno alla camera di prova come mostrato in figura 1. I quattro bruciatori hanno un consumo totale di circa 3,2 litri di propano al minuto. È possibile usare gas combustibili e bruciatori alternativi, ma la velocità di riscaldamento deve essere quella specificata in figura 3. Per tutte le apparecchiature, si deve controllare periodicamente la velocità di riscaldamento con l'uso di tubi riempiti di dibutilftalato, come indicato in figura 3.
1.6.1.3. Esecuzione delle prove
Ciascuna prova viene eseguita fino a quando il tubo si frammenta o è stato riscaldato per 5 minuti. Una prova che dia come risultato la frammentazione del tubo in tre o più pezzi, che in alcuni casi possono essere collegati uno all'altro da sottili strisce di metallo come è illustrato in figura 2, viene valutata come esplosione. Se una prova dà come risultato un minor numero di frammenti o nessuna frammentazione, si considera che non abbia dato luogo ad esplosione.
Si esegue inizialmente una serie di tre prove con una piastra con orificio da 6,0 mm di diametro e, se non si ottengono esplosioni, si esegue una seconda serie di tre prove con una piastra avente un orificio del diametro di 2,0 mm. Se avviene un'esplosione durante una delle serie di prova non sono necessarie prove ulteriori.
1.6.1.4. Valutazione
II risultato della prova è considerato positivo se si verifica un'esplosione in una delle serie di prove sopra descritte.
1.6.2. Sensibilità meccanica (urti)
1.6.2.1. Apparecchiatura (figura 4)
Le parti essenziali di una tipica apparecchiatura a martello cadente sono un blocco d'acciaio fuso con base, incudine, colonna, guide, pesi cadenti, dispositivo di rilascio e porta campione. L'incudine d'acciaio da 100 mm di diametro per 70 mm di altezza è avvitata su un blocco d'acciaio da 230 mm di lunghezza per 250 mm di larghezza per 200 mm d'altezza con una base fusa da 450 mm di lunghezza per 450 mm di larghezza per 60 mm d'altezza. Sul retro del blocco d'acciaio è avvitato un sostegno nel quale è fissata una colonna in tubo d'acciaio trafilato senza saldatura. Quattro viti ancorano l'apparecchio ad un blocco massiccio di cemento da 60 × 60 × 60 cm in modo che le guide siano assolutamente verticali e il peso cadente possa cadere liberamente. Per l'uso sono disponibili pesi di acciaio massiccio da 5 e 10 kg. La testa di impatto dei pesi è di acciaio temprato da 60 a 63 HRC e presenta un diametro minimo di 25 mm.
Il campione da esaminare viene posto in un dispositivo per prove d'urto costituito da due cilindri massicci d'acciaio coassiali e sovrapposti in un cilindro cavo d'acciaio che funge da guida. I cilindri d'acciaio massiccio devono avere un diametro di 10 (-0,003, -0,005) mm e un'altezza di 10 mm e superfici levigate, spigoli arrotondati (raggio di curvatura 0,5 mm) e una durezza HRC da 58 a 65. Il cilindro cavo deve avere un diametro esterno di 16 mm, un foro levigato di 10 (+0,005, +0,010) mm e un'altezza di 13 mm. Il dispositivo per le prove d'urto è montato su un'incudine intermedia d'acciaio (diametro 26 mm, altezza 26 mm) e centrato mediante un anello con fori di sfogo dei fumi.
1.6.2.2. Condizioni sperimentali
Il volume del campione dovrebbe essere di 40 mm3, o un volume adatto per eventuali apparecchi alternativi. Le sostanze solide dovrebbero essere provate allo stato secco e preparate come segue:
|
a)
|
le sostanze in polvere sono setacciate (maglie da 0,5 mm); per le prove si usa tutto il materiale passato attraverso il setaccio;
|
|
b)
|
le sostanze pressate, fuse o altrimenti condensate vengono rotte in pezzettini e setacciate. Per le prove si usa la frazione di setacciatura compresa tra 0,5 e 1 mm di diametro, e questa deve essere rappresentativa della sostanza originale.
|
Le sostanze che si presentano normalmente sotto forma di pasta dovrebbero essere saggiate per quanto possibile alla stato secco o comunque dopo aver rimosso la maggior quantità possibile di diluente.
1.6.2.3. Esecuzione delle prove
Si esegue una serie di 6 prove lasciando cadere la massa di 10 kg da 0,40 m (40 J). Se durante le sei prove a 40 J si ottiene un'esplosione, si deve eseguire una serie ulteriore di 6 prove lasciando cadere una massa di 5 kg da 0,15 m (7,5 J). In altri apparecchi, il campione viene confrontato con la sostanza di riferimento scelta usando una procedura di provata validità (ad esempio tecnica «su e giù», ecc.).
1.6.2.4. Valutazione
Il risultato della prova viene considerato positivo se si verifica un'esplosione (l'accensione violenta e/o un colpo sono equivalenti a un'esplosione) almeno una volta in qualsiasi delle prove con l'apparecchio per prove d'urto specificato oppure se il campione è più sensibile dello 1,3-dinitrobenzene o della RDX in una prova d'urto alternativa.
1.6.3. Sensibilità meccanica (attrito)
1.6.3.1. Apparecchiatura (figura 5)
L'apparecchiatura per le prove d'attrito è costituita da una piastra di base d'acciaio fuso sulla quale è montato il dispositivo di sfregamento, costituito da una barra fissa di porcellana con una piastra mobile di porcellana. La piastra di porcellana è tenuta in una slitta che corre su due guide. La slitta è collegata ad un motore elettrico mediante un'asta di collegamento, un eccentrico e una trasmissione adatta perché la piastra di porcellana venga spostata, una sola volta, avanti e indietro sotto la barra di porcellana per un tratto di 10 mm. La barra di porcellana può essere sottoposta ad un carico per esempio di 120 o 360 newton.
Le piastre di porcellana piatte sono fatte di porcellana tecnica bianca (ruvidità da 9 a 32 μm) e hanno le seguenti dimensioni: 25 mm di lunghezza × 25 mm di larghezza × 5 mm di altezza. La barra cilindrica di porcellana è fatta anch'essa di porcellana bianca tecnica ed ha una lunghezza di 15 mm, un diametro di 10 mm e superfici terminali sferiche irruvidite con un raggio di curvatura di 10 mm.
1.6.3.2. Condizioni sperimentali
Il volume del campione dovrebbe essere di 10 mm3 o un volume adatto ad eventuale apparecchio alternativo.
Le sostanze solide sono controllate allo stato secco e preparate come segue:
|
a)
|
le sostanze in polvere sono setacciate (maglie da 0,5 mm); per la prova si utilizza tutto il materiale passato attraverso il setaccio;
|
|
b)
|
le sostanze pressate, fuse o altrimenti condensate vengono rotte in pezzettini e setacciate. La frazione di setacciatura < 0,5 mm viene usata per le prove.
|
Le sostanze che si presentano normalmente sotto forma di pasta devono essere provate per quanto possibile allo stato secco. Se la sostanza non può essere preparata allo stato secco, la pasta (dopo rimozione della maggior quantità possibile di diluente) viene provata in forma di una pellicola da 0,5 mm di spessore, 2 mm di larghezza e 10 mm di lunghezza preparata con un attrezzo opportuno.
1.6.3.3. Esecuzione delle prove
La base di porcellana viene portata sul campione in esame e si applica il peso. Durante l'esecuzione della prova, la struttura spugnosa superficiale della piastra di porcellana deve giacere trasversalmente rispetto alla direzione di movimento. Bisogna fare attenzione che la barra sia appoggiata sul campione, che vi sia una quantità sufficiente di materiale in esame sotto alla barra e inoltre che la piastra si muova correttamente sotto la barra. Per le sostanze pastose si usa un calibro dello spessore di 0,5 mm con una fessura da 2 × 10 mm per applicare la sostanza alla piastra. La piastra di porcellana deve muoversi 10 mm avanti e indietro sotto alla barra di porcellana in un tempo di 0,44 secondi. Ciascuna parte della superficie della piastra e della barra deve essere usata una sola volta; le due estremità di ciascuna barra serviranno per due prove e le due superfici di una piastra serviranno ciascuna per tre prove.
Si esegue una serie di sei prove con un carico di 360 N. Se in queste sei prove si ottiene un evento positivo, si deve eseguire un'ulteriore serie di sei prove con un carico di 120 N. In altri apparecchi, il campione viene confrontato con la sostanza di riferimento scelta usando una procedura di provata validità (ad esempio tecnica «su e giù», ecc.).
1.6.3.4. Valutazione
Il risultato della prova viene considerato positivo se si verifica un'esplosione (crepitio e/o una accensione violenta o una fiammata sono equivalenti ad un'esplosione) almeno una volta in una qualunque delle prove con l'apparecchio di attrito specificato o se soddisfa i criteri equivalenti in una prova di attrito alternativa.
2. DATI
In linea di principio, si considera che una sostanza presenti un pericolo di esplosione ai sensi della direttiva se si ottiene un risultato positivo nella prova di sensibilità termica, agli urti o all'attrito.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
La relazione di prova deve, se possibile, includere le seguenti informazioni:
|
—
|
identità, composizione, purezza, umidità e così via della sostanza esaminata,
|
|
—
|
la forma fisica del campione e se esso sia o no stato macinato, triturato e/o setacciato,
|
|
—
|
osservazioni effettuate durante le prove di sensibilità termica (ad esempio massa del campione, numero di frammenti),
|
|
—
|
osservazioni eseguite durante le prove di sensibilità meccanica (ad esempio la formazione di quantità considerevoli di fumo o la decomposizione completa senza accensione violenta, fiamme, scintille, crepitii, ecc.),
|
|
—
|
risultati di ciascun tipo di prova,
|
|
—
|
se è stato usato un apparecchio alternativo, bisogna fornire una giustificazione scientifica e una prova della correlazione tra i risultati ottenuti con l'apparecchio specificato e quelli ottenuti con l'apparecchio equivalente,
|
|
—
|
qualsiasi commento utile, come riferimenti a prove con prodotti simili, che possono essere significativi per una corretta interpretazione dei risultati,
|
|
—
|
tutte le osservazioni addizionali significative per l'interpretazione dei risultati.
|
3.2. INTERPRETAZIONE E VALUTAZIONE DEI RISULTATI
La relazione di prova deve citare gli eventuali risultati considerati falsi, anormali o non rappresentativi. Se qualcuno dei risultati deve essere scartato, deve essere fornita una spiegazione e i risultati di prove alternative o complementari. I risultati anormali, salvo che essi possano venire spiegati, devono essere accettati con i valori sperimentali e usati per classificare conformemente la sostanza.
4. BIBLIOGRAFIA
|
(1)
|
Recommendations on the Transport of Dangerous Goods: Tests and criteria, 1990, United Nations, New York.
|
|
(2)
|
Bretherick, L., Handbook of Reactive Chemical Hazards, 4th edition, Butterworths, London, ISBN 0-750-60103-5, 1990.
|
|
(3)
|
Koenen, H., Ide, K.H. and Swart, K.H., Explosivstoffe, 1961, vol. 3, 6-13 and 30-42.
|
|
(4)
|
NF T 20-038 (September 85). Chemical products for industrial use — Determination of explosion risk.
|
Appendice
Esempi di specifiche dei materiali per la prova di sensibilità termica (vedi DIN 1623)
|
(1)
|
Tubo: specifica materiali numero 1.0336.505 g
|
|
(2)
|
Piastra forata: specifica materiali numero 1.4873
|
|
(3)
|
Collare filettato e dado: specifica materiali numero 1.3817
|
Figura 1
Apparecchio per la prova della sensibilità termica
(quote espresse in millimetri)
Figura 2
Prova di sensibilità termica
(esempi di frammentazione)
Figura 3
Taratura della velocità di riscaldamento per la prova di sensibilità termica
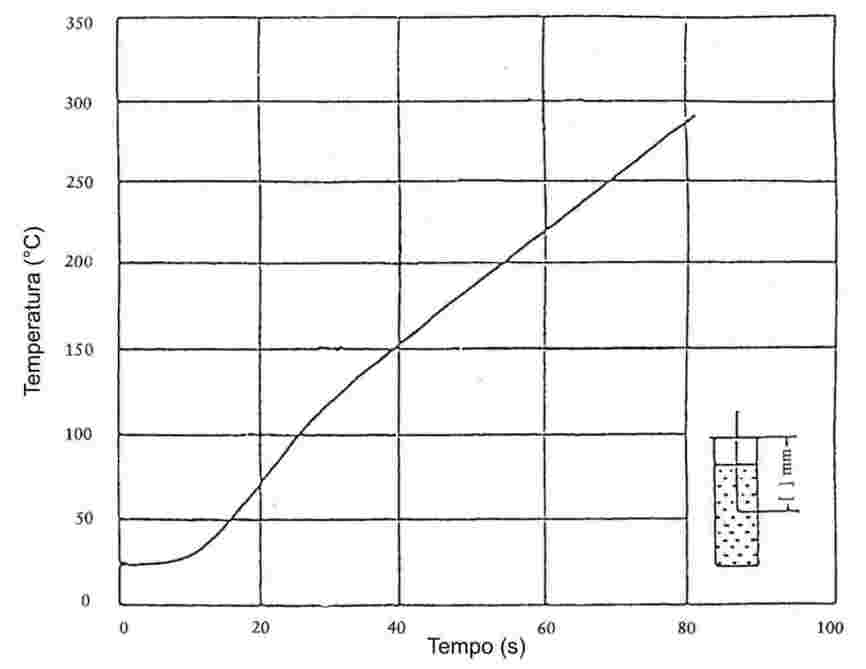
Curva temperatura/tempo ottenuta riscaldando dibutilftalato (27 cm3 in un tubo chiuso (piastra forata da 1,5 mm) con propano ad una portata di 3,2 litri al minuto. La temperatura viene misurata con una termocoppia cromel/alumel con guaina d'acciaio inossidabile del diametro di 1 mm disposta centralmente 43 mm al di sotto del bordo del tubo. La velocità di riscaldamento tra 135 oC e 285 oC deve essere compresa tra 185 e 215 K/min.
Figura 4
Apparecchio per le prove d'urto
(quote espresse in millimetri)
Figura 4
(segue)
Figura 5
Apparecchio per la sensibilità all'attrito

A.15. TEMPERATURA DI AUTOACCENSIONE (LIQUIDI E GAS)
1. METODO
1.1. INTRODUZIONE
A questa prova non devono essere sottoposte le sostanze esplosive e le sostanze che si accendono spontaneamente a contatto con l'aria a temperatura ambiente. La procedura d'esame è applicabile a gas, liquidi e vapori che in presenza dell'aria possono essere infiammati da una superficie calda.
La temperatura di autoaccensione può essere ridotta considerevolmente dalla presenza di impurezze catalitiche, dal materiale della superficie o da un maggiore volume del recipiente di prova.
1.2. DEFINIZIONI E UNITÀ
Il grado di autoinfiammabilità è espresso in termini di temperature di autoaccensione. La temperatura di autoaccensione è la temperatura minima alla quale la sostanza in esame si infiamma quando sia miscelata con aria nelle condizioni definite nel metodo di prova.
1.3. SOSTANZE DI RIFERIMENTO
Le sostanze di riferimento sono citate nelle norme (vedi 1.6.3). Queste sostanze servono principalmente per verificare periodicamente la precisione del metodo e per permettere il confronto coi risultati ottenuti mediante altri metodi.
1.4. PRINCIPIO DEL METODO
Il metodo determina la temperatura minima della superficie interna di un recipiente chiuso che da luogo all'accensione di un gas, vapore o liquido iniettato nel recipiente chiuso.
1.5. CRITERI DI QUALITÀ
La ripetibilità varia secondo l'intervallo delle temperature di autoaccensione e il metodo di prova usato.
La sensibilità e la specificità dipendono dal metodo di prova utilizzato.
1.6. DESCRIZIONE DEL METODO
1.6.1. Apparecchiatura
L'apparecchiatura è descritta nel metodo di cui al punto 1.6.3.
1.6.2. Condizioni di prova
Un campione della sostanza in esame viene saggiato in conformità al metodo di cui al punto 1.6.3.
1.6.3. Esecuzione della prova
Vedi IEC 79-4, DIN 51794, ASTM-E 659-78, BS 4056, NF T 20-037.
2. DATI
Registrare la temperatura di prova, la pressione atmosferica, la quantità di campione usato e l'intervallo di tempo dopo il quale si verifica l'accensione.
3. RELAZIONE
La relazione di prova deve, se possibile, includere le seguenti informazioni:
|
—
|
l'indicazione precisa della sostanza (identificazione e impurezze),
|
|
—
|
la quantità di campione usato, la pressione atmosferica,
|
|
—
|
l'apparecchiatura usata,
|
|
—
|
i risultati delle misure (temperature di prova, risultati relativi all'accensione, e corrispondenti ritardi temporali),
|
|
—
|
tutte le osservazioni aggiuntive significative per l'interpretazione dei risultati.
|
4. BIBLIOGRAFIA
Nessuna.
A.16. TEMPERATURA DI AUTOACCENSIONE RELATIVA DEI SOLIDI
1. METODO
1.1. INTRODUZIONE
Non devono essere sottoposte a questa prova le sostanze esplosive e le sostanze che si infiammano spontaneamente a contatto con l'aria a temperatura ambiente.
Lo scopo della prova è di fornire informazioni preliminari sull'autoinfiammabilità di sostanze solide a temperature elevate.
Se il calore sviluppato dalla reazione della sostanza con l'ossigeno o dalla sua decomposizione esotermica non viene ceduto con sufficiente rapidità all'ambiente circostante, si ha un autoriscaldamento che porta all'autoaccensione. L'autoaccensione si verifica quindi quando la velocità di produzione di calore supera quella della sua dispersione.
Il procedimento è utile come saggio preliminare per le sostanze solide. Data la complessità dei processi di accensione e di combustione dei solidi, la temperatura di autoaccensione determinata con questo metodo deve essere utilizzata soltanto a scopo di confronto.
1.2. DEFINIZIONI E UNITÀ
La temperatura di autoaccensione ottenuta secondo il presente metodo è la minima temperatura, espressa in oC, alla quale un dato volume di una sostanza si infiamma in determinate condizioni.
1.3. SOSTANZE DI RIFERIMENTO
Nessuna.
1.4. PRINCIPIO DEL METODO
In un forno a temperatura ambiente viene posto un certo volume della sostanza da esaminare; si registra la curva temperatura/tempo relativa alle condizioni esistenti al centro del campione mentre la temperatura del forno viene aumentata fino a 400 oC o fino al punto di fusione, se inferiore, ad una velocità di 0,5 oC/min. Ai fini di questa prova, la temperatura del forno alla quale la temperatura del campione raggiunge i 400 oC per autoriscaldamento è detta temperatura di autoaccensione.
1.5. CRITERI DI QUALITÀ
Nessuno.
1.6. DESCRIZIONE DEL METODO
1.6.1. Apparecchiatura
1.6.1.1. Forno
Forno da laboratorio a temperatura programmata (volume circa 2 litri) con circolazione d'aria naturale e sfogo per esplosioni. Per evitare un rischio potenziale di esplosione, si deve impedire che eventuali gas di decomposizione vengano in contatto con gli elementi riscaldanti elettrici.
1.6.1.2. Cubo di rete metallica
Ritagliare un pezzo di rete d'acciaio inossidabile con luce di 0,045 mm secondo il modello della figura 1. Piegare la rete e fissarla con filo metallico in forma di cubi con la faccia superiore aperta.
1.6.1.3. Termocoppie
Termocoppie adatte.
1.6.1.4. Registratore
Qualsiasi registratore a due canali tarato da 0 a 600 oC o tensione corrispondente.
1.6.2. Condizioni di prova
Le sostanze vengono sottoposte a prova nella forma in cui vengono ricevute.
1.6.3. Esecuzione della prova
Il cubo viene riempito con la sostanza da esaminare e battuto leggermente, aggiungendo ulteriore sostanza fino a quando è completamente pieno. Il cubo viene poi sospeso al centro del forno a temperatura ambiente. Una termocoppia viene posta al centro del cubo e l'altra tra il cubo e la parete del forno per registrare la temperatura del forno.
Le temperature del forno e del campione vengono registrate in continuo mentre la temperatura del forno viene aumentata fino a 400 oC o fino al punto di fusione, se inferiore, ad una velocità di 0,5 oC/min.
Quando la sostanza si infiamma, la temperatura del campione presenterà un aumento brusco della temperatura al di sopra di quella del forno.
2. DATI
Rilevante ai fini della valutazione è la temperatura del forno alla quale la temperatura del campione raggiunge i 400 oC per autoriscaldamento (vedi figura 2).
3. RELAZIONE
La relazione di prova deve, se possibile, includere le seguenti informazioni:
|
—
|
descrizione della sostanza in esame,
|
|
—
|
risultati delle misure, inclusa la curva temperatura/tempo,
|
|
—
|
tutte le osservazioni aggiuntive significative per l'interpretazione dei risultati.
|
4. BIBLIOGRAFIA
|
(1)
|
NF T 20-036 (September 85). Chemical products for industrial use. Determination of the relative temperature of the spontaneous flammability of solids.
|
Figura 1
Sviluppo di un cubo di prova da 20 mm

Figura 2
Curva tipica temperatura/tempo

A.17. PROPRIETÀ OSSIDANTI (SOLIDI)
1. METODO
1.1. INTRODUZIONE
È utile avere informazioni preliminari sulle potenziali proprietà esplosive della sostanza prima di effettuare la prova.
Questa prova non si applica ai liquidi e ai gas, alle sostanze esplosive o altamente infiammabili, e ai perossidi organici.
Non occorre eseguire questa prova quando l'esame delle formule di struttura stabilisce, al di là di ogni ragionevole dubbio, che la sostanza non è suscettibile di reagire esotermicamente con materiale combustibile.
Per appurare se la prova debba essere condotta con precauzioni particolari, è opportuno effettuare un test preliminare.
1.2. DEFINIZIONI ED UNITÀ
Tempo di combustione: tempo di reazione, in secondi, riferito allo spostamento della zona di reazione lungo il cumulo, seguendo la procedura descritta nel punto 1.6.
Velocità di combustione: espressa in mm/s.
Velocità di combustione massima: il valore più elevato della velocità di combustione ottenuto con miscele contenenti dal 10 % al 90 %, in peso, di ossidante.
1.3. SOSTANZA DI RIFERIMENTO
Per la prova e per la prova preliminare si usa il nitrato di bario (grado analitico) come sostanza di riferimento.
La miscela di riferimento è costituita da una miscela di nitrato di bario e di polvere di cellulosa, preparata secondo il punto 1.6, che presenta la massima velocità di combustione (di solito una miscela con il 60 % in peso di nitrato di bario).
1.4. PRINCIPIO DEL METODO
Per sicurezza si esegue una prova preliminare. Quando la prova preliminare indica chiaramente che la sostanza in esame presenta proprietà ossidanti, non sono necessarie prove ulteriori. Quando ciò non si verifica, la sostanza deve essere sottoposta alla prova completa.
Nella prova completa, la sostanza da esaminare e una sostanza combustibile definita vengono miscelate in vari rapporti. Si formano altrettanti cumuli con le varie miscele e si procede all'accensione di un'estremità di ognuno di essi. La velocità massima determinata viene poi confrontata con la velocità massima di combustione di una miscela di riferimento.
1.5. CRITERI DI QUALITÀ
Qualsiasi metodo di macinazione e mescolamento è valido a condizione che la differenza fra le velocità massime di combustione in ciascuna delle 6 prove non differisca dal valore della media aritmetica di oltre il 10 %.
1.6. DESCRIZIONE DEL METODO
1.6.1. Preparazione
1.6.1.1. Sostanza in esame
Ridurre il campione da esaminare ad una granulometria < 0,125 mm usando la seguente procedura: setacciare la sostanza di prova, macinare la frazione rimanente, ripetere la procedura fino a quando tutta la porzione di prova è passata dal setaccio.
Per la macinatura e la setacciatura si può usare qualsiasi apparecchio che soddisfi i criteri di qualità.
Prima di preparare la miscela, la sostanza viene essiccata a 105 oC fino a peso costante. Se la temperatura di decomposizione della sostanza da esaminare è inferiore a 105 oC, la sostanza deve essere essiccata ad una temperatura opportunamente inferiore.
1.6.1.2. Sostanza combustibile.
Come sostanza combustibile si usa la cellulosa in polvere del tipo impiegato per la cromatografia a strato sortile o in colonna. È risultato idoneo un tipo di cellulosa con fibre di lunghezza compresa per l'85 % tra 0,020 mm e 0,075 mm. La polvere di cellulosa viene fatta passare attraverso un setaccio a maglia da 0,125 mm. Per tutta la prova deve essere usata la stessa partita di cellulosa.
Prima di preparare la miscela, la cellulosa in polvere deve essere essiccata a 105 oC fino a peso costante.
Se nella prova preliminare si usa farina di legno, preparare farina di legno dolce raccogliendo la porzione che passa attraverso un setaccio da 1,6 mm, miscelare accuratamente e poi essiccare a 105 oC per 4 ore in uno strato di spessore non superiore a 25 mm. Raffreddare e conservare in un contenitore a tenuta d'aria riempito il più possibile fino a quando serva, preferibilmente entro 24 ore dall'essiccazione.
1.6.1.3. Fonte di ignizione
Come fonte di ignizione si dovrebbe usare una fiamma calda di un bruciatore a gas (diametro minimo 5 mm). Se si usa un'altra fonte di ignizione (ad esempio quando si effettua la prova in atmosfera inerte), devono essere riportate la descrizione e la giustificazione.
1.6.2. Esecuzione della prova
Nota:
Le miscele di ossidanti con cellulosa o farina di legno devono essere trattate come potenzialmente esplosive e maneggiate con la dovuta attenzione.
1.6.2.1. Prova preliminare
La sostanza essiccata viene accuratamente miscelata con cellulosa o farina di legno essiccata nel rapporto 2 parti di sostanza in esame/1 parte di cellulosa o farina di legno (in peso) e la miscela viene ammucchiata in forma di un piccolo cono con un diametro di base di 3,5 cm × 2,5 d'altezza, riempiendo, senza compattazione, un recipiente di forma conica, (ad esempio un imbuto da laboratorio con il gambo tappato).
Il mucchietto viene posto su una piastra di base fredda, non combustibile, non porosa e di bassa conducibilità termica. La prova deve essere eseguita sotto cappa di aspirazione dei fumi come indicato al punto 1.6.2.2.
La sorgente di ignizione viene posta in contatto con il cono, e si osservano e registrano il vigore e la durata della reazione risultante.
La sostanza deve essere considerata ossidante se la reazione è vigorosa.
Nei casi in cui il risultato sia dubbio, è necessario completare l'intera sequenza di prova descritta di seguito.
1.6.2.2. Prova sequenziale
Preparare miscele ossidante/cellulosa contenenti dal 10 al 90 % in peso di ossidante in incrementi del 10 %. Per i casi limite, usare miscele ossidante/cellulosa intermedie per ottenere con maggior precisione la massima velocità di combustione.
Il mucchietto viene formato mediante uno stampo di metallo, che presenta una lunghezza di 250 mm e una sezione trasversale triangolare con altezza interna di 10 mm e larghezza interna di 20 mm. Su ambedue i lati dello stampo, nella direzione longitudinale, sono montate due lastre metalliche come limitazioni laterali che sporgono di 2 mm sopra al bordo superiore della sezione triangolare (figura). Questo dispositivo viene riempito con un leggero eccesso di miscela. Dopo aver lasciato cadere una volta lo stampo da un'altezza di 2 cm su una superficie solida, la sostanza in eccesso rimanente viene rimossa con un foglio disposto obliquamente. Le delimitazioni laterali vengono rimosse e la polvere rimanente viene lisciata con l'uso di un rullo. Sopra allo stampo si pone poi una piastra di base non combustibile, non porosa, e di bassa conducibilità termica, l'apparecchio viene invertito e lo stampo rimosso.
Disporre il mucchietto nella corrente d'aria in una cappa.
La velocità dell'aria deve essere sufficiente per impedire ai fumi di propagarsi nel laboratorio e non deve venire variata durante la prova. Intorno all'apparecchio deve essere montato uno schermo per la corrente.
Data l'igroscopicità della cellulosa e di alcune sostanze da esaminare, la prova deve essere eseguita più velocemente possibile.
Accendere un'estremità del cumulo toccandolo con la fiamma.
Misurare il tempo di reazione su una distanza di 200 mm dopo che la zona di reazione si è propagata per una distanza iniziale di 30 mm.
La prova viene eseguita con la sostanza di riferimento e almeno una volta con ciascuna miscela di sostanze di prova e cellulosa della serie.
Se si trova che la velocità massima di combustione è significativamente maggiore di quella della miscela di riferimento, la prova può essere interrotta. Altrimenti la prova deve essere ripetuta 5 volte per ciascuna delle 3 miscele che danno la velocità di combustione più elevata.
Se si sospetta che il risultato sia un falso positivo, ripetere la prova usando una sostanza inerte con granulometria simile, come farina fossile, al posto della cellulosa. In alternativa, la miscela sostanza in esame/cellulosa che presenta la velocità di combustione più elevata deve essere ricontrollata in atmosfera inerte (contenuto d'ossigeno < 2 % v/v).
2. DATI
Per ragioni di sicurezza, deve essere considerato come caratteristica della proprietà ossidante della sostanza in prova il valore massimo della velocità di combustione e non il valore medio.
Ai fini della valutazione si prende in considerazione il più alto valore della velocità di combustione rilevato su una serie di 6 prove su una determinata miscela.
Riportare in grafico il valore più elevato di velocità di combustione per ciascuna miscela contro la concentrazione dell'ossidante. Ricavare dal grafico la velocità massima di combustione.
I sei valori di velocità di combustione misurati in una prova effettuata sulla miscela che presenta la più elevata velocità di combustione non devono differire dalla loro media aritmetica per oltre il 10 %; altrimenti deve essere migliorato il metodo di macinatura e miscelazione.
Confrontare la velocità di combustione massima ottenuta con la massima velocità di combustione della miscela di riferimento (vedi 1.3.).
Se le prove vengono condotte in atmosfera inerte, la velocità di reazione massima viene confrontata con quella della miscela di riferimento in atmosfera inerte.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
La relazione di prova deve, se possibile, includere le seguenti informazioni:
|
—
|
l'identità, composizione, purezza, umidità ecc. della sostanza esaminata,
|
|
—
|
eventuali trattamenti del campione in esame (per esempio macinatura, essiccazione, ecc.),
|
|
—
|
la fonte di ignizione usata nelle prove,
|
|
—
|
i risultati delle misure,
|
|
—
|
la modalità di reazione (per esempio fiammata superficiale, combustione attraverso l'intera massa, eventuali informazioni relative ai prodotti di combustione, ecc),
|
|
—
|
ogni osservazione aggiuntiva significativa per l'interpretazione dei risultati, inclusa una descrizione del vigore (la miscela arde, produce scintille, esala fumi, brucia senza fiamma, ecc.) e la durata approssimata prodotta nella prova preliminare di sicurezza/vagliatura per la sostanza in esame e la sostanza di riferimento,
|
|
—
|
i risultati delle prove eventuali con sostanze inerti,
|
|
—
|
i risultati delle prove eventuali in atmosfera inerte.
|
3.2. INTERPRETAZIONE DEI RISULTATI
Una sostanza è considerata come ossidante quando:
|
a)
|
nella prova preliminare c'è una reazione vigorosa;
|
|
b)
|
nella prova, la velocità massima di combustione delle miscele analizzate è maggiore o uguale alla velocità di combustione della miscela di cellulosa e di nitrato di bario.
|
Al fine di evitare un falso positivo, i risultati ottenuti nella prova della sostanza miscelata con un materiale inerte e/o sotto atmosfera inerte devono essere tenuti in considerazione nell'interpretazione dei risultati.
4. BIBLIOGRAFIA
|
(1)
|
NF T 20-035 (September 85). Chemical products for industrial use. Determination of the oxidizing properties of solids.
|
Appendice
Figura
Stampo e accessori per la preparazione del campione
(Tutte le dimensioni sono espresse in mm)

A.18. PESO MOLECOLARE MEDIO NUMERICO E DISTRIBUZIONE DEL PESO MOLECOLARE DI POLIMERI
1. METODO
Il presente metodo cromatografico a permeazione di gel corrisponde al metodo OCSE TG 118 (1996). I principi fondamentali e ulteriori informazioni tecniche sono riportati nel riferimento bibliografico (1).
1.1. INTRODUZIONE
Data la varietà delle proprietà dei polimeri, è impossibile descrivere un singolo metodo che definisca con precisione condizioni di separazione e di valutazione tali da coprire tutte le particolarità e specificità che si incontrano nella separazione di polimeri. In particolare, sistemi di polimeri complessi spesso non sono adatti alla cromatografia a permeazione di gel (GPC). Quando non si può ricorrere alla GPC, il peso molecolare può venire determinato mediante altri metodi (vedi allegato). In tali casi, fornire ampi dettagli e la motivazione del metodo usato.
Il metodo descritto è basato sulla norma DIN 55672 (1), nella quale si trovano informazioni dettagliate su come eseguire gli esperimenti e valutare i dati. Nel caso siano necessarie modifiche delle condizioni sperimentali, queste modifiche devono essere motivate. Si possono usare altre norme purché fornite con riferimenti completi. Il metodo descritto ricorre a campioni di polistirene di polidispersità nota per la taratura e può richiedere modifiche per adeguarlo a certi polimeri, per esempio polimeri solubili in acqua e ramificati a catena lunga.
1.2. DEFINIZIONE E UNITÀ
Il peso molecolare medio numerico Mn e il peso molecolare medio ponderale Mw vengono determinati con le seguenti equazioni.
in cui
Hi è il livello del segnale del rivelatore relativo alla linea di base per il volume di ritenzione Vi,
Mi è il peso molecolare della frazione di polimero in corrispondenza del volume di ritenzione Vi, e
n è il numero di punti.
L'ampiezza della distribuzione del peso molecolare, che è una misura della dispersità del sistema, è data dal rapporto Mw/Mn.
1.3. SOSTANZE DI RIFERIMENTO
Poiché la GPC è un metodo relativo, è necessaria una taratura. A questo scopo vengono di norma utilizzati standard di polistirene a struttura lineare con pesi molecolari medi Mn e Mw noti e distribuzione nota del peso molecolare. La curva di taratura può venire usata nella determinazione del peso molecolare del campione sconosciuto solo se le condizioni scelte per la separazione del campione e degli standard sono identiche.
Una determinata relazione tra il peso molecolare e il volume di eluizione è valida solo nelle specìfiche condizioni del particolare esperimento. Queste condizioni includono soprattutto la temperatura, il solvente (o miscele di solventi), le condizioni cromatografiche e la colonna e il sistema di colonne di separazione.
I pesi molecolari del campione determinati in questo modo sono valori relativi e sono descritti come «pesi molecolari equivalenti in polistirene». Questo significa che, secondo le differenze strutturali e chimiche tra il campione e gli standard, i pesi molecolari possono deviare dai valori assoluti in misura più o meno grande. Se si usano altri standard, per esempio polietilenglicole, polietilenossido, poli-metil-metacrilato, acido poliacrilico, indicarne la ragione.
1.4. PRINCIPIO DEL METODO DI ANALISI
Utilizzando la GPC, si possono determinare sia la distribuzione del peso molecolare del campione che i pesi molecolari medi (Mn, Mw). La GPC è un particolare tipo di cromatografia liquida in cui il campione viene separato in base ai volumi idrodinamici dei singoli costituenti (2).
La separazione viene effettuata mentre il campione passa attraverso una colonna riempita di un materiale poroso, tipicamente un gel organico. Le molecole piccole possono penetrare nei pori, mentre le molecole grandi ne sono escluse. Il percorso delle molecole grandi è pertanto più breve e queste vengono eluite per prime. Le molecole di medie dimensioni penetrano in alcuni dei pori e vengono eluite più tardi. Le molecole più piccole, con un raggio idrodinamico più piccolo dei pori del gel, possono penetrare in tutti i pori. Queste vengono eluite per ultime.
In una situazione ideale, la separazione è determinata unicamente dalla dimensione delle specie molecolari, ma in pratica è difficile evitare l'interferenza di almeno qualche effetto di assorbimento. Un riempimento disuniforme della colonna e volumi morti possono peggiorare la situazione (2).
La rivelazione viene effettuata per esempio mediante l'indice di diffrazione o l'assorbimento nell'UV e fornisce una curva di distribuzione semplice. Tuttavia, per attribuire valori effettivi di peso molecolare alla curva, è necessario tarare la colonna facendo passare attraverso di essa polimeri di peso molecolare noto, possibilmente anche di struttura approssimativamente simile, per esempio vari standard di polistirene. Tipicamente si ottiene una curva gaussiana, talvolta distorta con una piccola coda verso il lato dei pesi molecolari bassi, in cui l'asse verticale indica la quantità in peso delle specie di vario peso molecolare eluite e l'asse orizzontale indica il logaritmo del peso molecolare.
1.5. CRITERI DI QUALITÀ
La ripetibilità (deviazione standard relativa — Relative Standard Deviation: RSD) de! volume di eluizione dovrebbe essere migliore dello 0,3 %. Se un cromatogramma viene valutato in funzione del tempo e non corrisponde al criterio succitato, la ripetibilità di analisi richiesta deve essere garantita mediante correzione attraverso uno standard interno (1). Le polidispersità dipendono dal peso molecolare degli standard. Nel caso degli standard di polistirene valori tipici sono:
|
Mp < 2 000
|
Mw/Mn < 1,20
|
|
2 000 < Mp < 106
|
Mw/Mn < 1,05
|
|
Mp > 106
|
Mw/Mn < 1,20
|
(Mp è il peso molecolare dello standard in corrispondenza del massimo del picco)
1.6. DESCRIZIONE DEL METODO DI ANALISI
1.6.1. Preparazione delle soluzioni di polistirene standard
Gli standard di polistirene vengono sciolti mediante accurata miscelazione nell'eluente scelto. Nella preparazione delle soluzioni tener conto delle raccomandazioni del produttore.
La scelta delle concentrazioni degli standard dipende da vari fattori, per esempio il volume di iniezione, la viscosità della soluzione e la sensibilità del rivelatore analitico. Il volume massimo di iniezione deve essere adeguato alla lunghezza della colonna allo scopo di evitare un sovraccarico. Volumi di iniezione tipici per separazioni analitiche con la GPC su una colonna da 30 cm × 7,8 mm sono normalmente compresi tra 40 e 100 μl. Sono possibili volumi più elevati, ma non devono superare i 250 μl. Il rapporto ottimale tra il volume di iniezione e la concentrazione va determinato prima dell'effettiva taratura della colonna.
1.6.2. Preparazione della soluzione campione
In linea di principio, per la preparazione delle soluzioni campione valgono gli stessi requisiti. Il campione viene sciolto in un solvente adatto, per esempio, tetraidrofurano (THF), mediante un accurato sbattimento. In nessun caso deve essere sciolto utilizzando un bagno ad ultrasuoni. Se necessario, la soluzione campione viene purificata su un filtro a membrana con dimensione dei pori compresa tra 0,2 e 2 μm.
Nella relazione finale deve essere registrata l'eventuale presenza di particelle indisciolte perché queste possono essere dovute a specie di peso molecolare elevato. Usare un metodo appropriato per determinare la percentuale in peso delle particelle indisciolte. Utilizzare le soluzioni entro 24 ore.
1.6.3. Apparecchiature
|
—
|
serbatoio del solvente,
|
|
—
|
degasatore (se del caso),
|
|
—
|
ammortizzatore di pulsazioni (se del caso),
|
|
—
|
colonne per cromatografia,
|
|
—
|
flussimetro (se del caso),
|
|
—
|
registratore-elaboratore dati,
|
Assicurarsi che il sistema GPC sia inerte rispetto ai solventi utilizzati (p. es. mediante l'uso di capillari d'acciaio se come solvente si usa il THF).
1.6.4. Sistema di iniezione e di erogazione del solvente
Caricare nella colonna un volume definito della soluzione campione utilizzando un autocampionatore oppure manualmente in una zona nettamente definita. Nel caso di una operazione manuale, se lo stantuffo della siringa viene tirato o spinto troppo rapidamente la distribuzione dei pesi molecolari osservata può variare. Nei limiti del possibile il sistema di erogazione del solvente deve essere esente da pulsazioni e l'ideale sarebbe che vi fosse incorporato un attenuatore delle pulsazioni. La portata è dell'ordine di 1 ml/min.
1.6.5. Colonna
Secondo il campione, il polimero viene caratterizzato utilizzando una colonna semplice o più colonne collegate in serie. In commercio sono disponibili vari materiali porosi per colonne con proprietà (p. es. dimensione dei pori, limiti di esclusione) definite. La scelta del gel di separazione o della lunghezza della colonna dipende sia dalle proprietà del campione (volumi idrodinamici, distribuzione dei pesi molecolari) che dalle specifiche condizioni di separazione come il solvente, la temperatura e la portata (1) (2) (3).
1.6.6. Piatti teorici
La colonna o la combinazione di colonne utilizzata per la separazione deve essere caratterizzata mediante il numero di piatti teorici. Questo, nel caso venga utilizzato il THF come solvente di eluizione, implica di caricare una soluzione di etilbenzene o altro adatto soluto apolare su una colonna di lunghezza nota. Il numero di piatti teorici è dato dall'equazione seguente:
|

|
o
|
|
in cui
|
N è
|
=
|
il numero di piatti teorici
|
|
Vc è
|
=
|
il volume di eluizione al massimo del picco
|
|
W è
|
=
|
la larghezza del picco alla linea di base
|
|
W1/2 è
|
=
|
la larghezza del picco a mezza altezza.
|
1.6.7. Efficienza di separazione
Oltre al numero di piatti teorici, che è una quantità che determina l'ampiezza della banda, è importante anche l'efficienza di separazione, che è determinata dalla rapidità della curva di taratura. L'efficienza di separazione di una colonna si ottiene dalla seguente relazione:
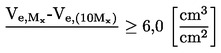
in cui
|
Ve.Mx è
|
=
|
il volume di eluizione per polistirene di peso molecolare Mx
|
|
Ve(10Mx)
|
=
|
è il volume di eluizione per polistirene di peso molecolare dieci volte maggiore.
|
La risoluzione del sistema è definita in generale come segue:

in cui,
|
Ve1, Ve2
|
=
|
sono i volumi di eluizione dei due standard di polistirene al massimo del picco
|
|
W1, W2
|
=
|
sono le larghezze del picco alla linea di base
|
|
M1, M2,
|
=
|
sono i pesi molecolari al massimo del picco (dovrebbero differire di un fattore 10)
|
Il valore di R del sistema di colonne deve essere maggiore di 1,7 (4).
1.6.8. Solventi
Tutti i solventi devono essere di purezza elevata (per il THF si utilizza una purezza del 99,5 %). Il serbatoio del solvente (se necessario sotto atmosfera di gas inerte) deve essere sufficientemente grande per la taratura della colonna e per l'analisi di parecchi campioni. Degasare il solvente prima di trasportarlo alla colonna mediante la pompa.
1.6.9. Controllo della temperatura
La temperatura dei componenti interni critici (ansa di iniezione, colonne, rivelatore e tubature) deve essere costante e coerente con il solvente scelto.
1.6.10. Rivelatore
La funzione del rivelatore è di registrare quantitativamente la concentrazione del campione eluito dalla colonna. Per evitare un inutile allargamento dei picchi, il volume della cuvetta della celia del rivelatore deve essere il più piccolo possibile. Salvo per rivelatori a diffrazione della luce e rivelatori di viscosità, questo volume non deve superare i 10 μl. Il metodo di solito utilizzato per la rivelazione è la rifrattometria differenziale. Tuttavia, se richiesto dalle proprietà specifiche del campione o del solvente di eluizione, si possono utilizzare altri tipi di rivelatori, per esempio UV/VIS, IR, rivelatori viscosimetrici, ecc.
2. DATI E RELAZIONE
2.1. DATI
Fare riferimento alla norma DIN (1) per i criteri di valutazione dettagliati e per i requisiti di raccolta ed elaborazione dei dati.
Per ciascun campione eseguire due esperimenti indipendenti, che dovranno venire analizzati singolarmente.
Per ogni misura si devono ottenere i valori di Mn, Mw, Mw/Mn e Mp . È necessario indicare esplicitamente che i valori misurati sono valori relativi equivalenti al peso molecolare dello standard usato.
Dopo la determinazione dei volumi di ritenzione o dei tempi di ritenzione (possibilmente corretti usando uno standard interno), i valori di log Mp (Mp sono i massimi dei picchi dello standard di taratura) vengono riportati contro una delle suddette quantità. Per ogni decade di peso molecolare sono necessari almeno due punti di taratura e per la curva totale sono richiesti almeno cinque punti di misura, che devono coprire il peso molecolare stimato del campione. L'estremità della curva di taratura corrispondente al basso peso molecolare è definita da n-esilbenzene o altro soluto apolare adatto. I pesi molecolari medi numerico e ponderale vengono in generale determinati mediante sistemi elettronici di elaborazione dati sulla base delle formule riportate nella sezione 1.2. Se si utilizza una digitalizzazione manuale, si può consultare il metodo ASTM D 3536-91 (3).
La curva di distribuzione deve essere fornita come tabella o come figura (frequenza differenziale o sommatoria delle percentuali contro log M). Nella rappresentazione grafica, una decade di peso molecolare deve avere normalmente una larghezza di circa 4 cm e il massimo del picco deve avere un'altezza di circa 8 cm. Nel caso di curve di distribuzione integrali la differenza in ordinata tra lo 0 e il 100 % deve essere di circa 10 cm.
2.2. RELAZIONE D'ANALISI
La relazione d'analisi deve includere le seguenti informazioni:
2.2.1. Sostanza in esame:
|
—
|
informazioni disponibili sulla sostanza in esame (identità, additivi, impurezze),
|
|
—
|
descrizione del trattamento del campione, osservazioni, problemi.
|
2.2.2. Strumentazione:
|
—
|
serbatoio dell'eluente, gas inerte, degasaggio dell'eluente, composizione dell'eluente, impurezze,
|
|
—
|
pompa, attenuatore di pulsazioni, sistema di iniezione,
|
|
—
|
colonne di separazione (fabbricante, tutte le informazioni sulle caratteristiche delle colonne, come dimensione dei pori, tipo di materiale di separazione ecc, numero, lunghezza e ordine delle colonne usate),
|
|
—
|
numero di piatti teorici della colonna (o combinazione di colonne), efficienza di separazione (risoluzione del sistema),
|
|
—
|
informazioni sulla simmetria dei picchi,
|
|
—
|
temperatura della colonna, tipo di controllo della temperatura,
|
|
—
|
rivelatore (principio di misurazione, tipo, volume della cuvetta),
|
|
—
|
flussimetro se usato (produttore, principio di misurazione),
|
|
—
|
sistema di registrazione ed elaborazione dati (hardware e software).
|
2.2.3. Taratura del sistema:
|
—
|
descrizione dettagliata del metodo usato per costruire la curva di taratura,
|
|
—
|
informazioni sui criteri di qualità per questo metodo (p. es. coefficiente di correlazione, varianza ecc),
|
|
—
|
informazioni su tutte le estrapolazioni, ipotesi e approssimazioni fatte durante la procedura sperimentale e durante la valutazione e l'elaborazione dei dati,
|
|
—
|
tutte le misure usate per costruire la curva di taratura devono essere documentate in una tabella includente le seguenti informazioni per ciascun punto di taratura:
|
—
|
produttore del campione,
|
|
—
|
valori caratteristici degli standard Mp , Mn , Mw , Mw/Mn , forniti dal produttore o ricavati da misure successive, insieme con dettagli relativi al metodo di determinazione,
|
|
—
|
volume di iniezione e concentrazione di iniezione,
|
|
—
|
valore di Mp usato per la taratura,
|
|
—
|
volume di eluizione o tempo di ritenzione corretto misurato in corrispondenza del massimo dei picchi,
|
|
—
|
Mp calcolato al massimo del picco,
|
|
—
|
errore percentuale dell' Mp calcolato e del valore di taratura.
|
|
2.2.4. Valutazione:
|
—
|
valutazione su base temporale: metodi usati per garantire la riproducibilità richiesta (metodo di correzione, standard interno ecc),
|
|
—
|
indicazione se la valutazione sia stata effettuata sulla base del volume di eluizione o del tempo di ritenzione,
|
|
—
|
informazioni riguardo ai limiti della valutazione se un picco non viene analizzato completamente,
|
|
—
|
descrizione dei metodi di lisciatura, se usati,
|
|
—
|
procedure di preparazione e pretrattamento del campione,
|
|
—
|
presenza di eventuali particelle indisciolte,
|
|
—
|
volume dì iniezione (μl) e concentrazione di iniezione (mg/ml),
|
|
—
|
osservazioni indicanti effetti che portano a deviazioni dal profilo GPC ideale,
|
|
—
|
descrizione dettagliata di tutte le modifiche applicate alle procedure di analisi,
|
|
—
|
dettagli sugli intervalli di errore,
|
|
—
|
qualsiasi altra informazione e osservazione utile all'interpretazione dei risultati.
|
3. BIBLIOGRAFIA
|
(1)
|
DIN 55672 (1995). Gelpermeationschromatographie (GPC) mit Tetrahydrofuran (THF) als Elution-smittel, Teil 1.
|
|
(2)
|
Yau, W.W., Kirkland, J.J., and Bly. D.,D,. eds, (1979). Modern Size Exclusion Liquid Chromatography, J. Wiley and Sons.
|
|
(3)
|
ASTM D 3536-91, (1991). Standard Test Method for Molecular Weight Averages and Molecular Weight Distribution by Liquid Exclusion Chromatography (Gel Permeation Chromatography-GPC). American Society for Testing and Materials, Philadelphia, Pennsylvania.
|
|
(4)
|
ASTM D 5296-92, (1992). Standard Test Method for Molecular Weight Averages and Molecular Weight Distribution of Polystyrene by High Performance Size-Exclusion Chromatography. American Society for Testing and Materials, Philadelphia, Pennsylvania.
|
Allegato
Esempi di altri metodi per la determinazione del peso molecolare medio numerico (MN) di polimeri
La cromatografia a permeazione di gel (GPC) è il metodo preferito per la determinazione di Mn, in particolare quando sia disponibile una serie di standard la cui struttura è confrontabile con quella del polimero. Tuttavia, nel caso vi siano difficoltà pratiche per usare la GPC o si preveda già che la sostanza non rispetti un criterio normativo di Mn (che richiede conferma), sono disponibili metodi alternativi come:
1. Uso di proprietà colligative
|
1.1.
|
Ebullioscopia/crioscopia:
prevede la misura dell'innalzamento del punto di ebollizione (ebullioscopia) o dell'abbassamento del punto di congelamento (crioscopia) dì un solvente quando si aggiunge un polimero. Il metodo è basato sul fatto che l'effetto del polimero disciolto sul punto di ebollizione/congelamento del liquido dipende dal peso molecolare del polimero (1) (2).
Applicabilità: Mn < 20 000.
|
|
1.2.
|
Abbassamento della tensione di vapore:
prevede la misura della tensione di vapore di un dato liquido di riferimento prima e dopo l'aggiunta di quantità note di polimero (1) (2).
Applicabilità: Mn < 20 000 (in teoria; in pratica però di valore limitato).
|
|
1.3.
|
Qsometria su membrana:
è basata sul principio dell'osmosi, cioè della tendenza naturale delle molecole di solvente a passare attraverso una membrana semipermeabile da una soluzione diluita verso una soluzione concentrata fino a raggiungere l'equilibrio. Nel saggio, la soluzione diluita è a concentrazione zero, mentre la soluzione concentrata contiene il polimero. L'effetto di aspirazione del solvente attraverso la membrana dà luogo ad un differenziale di pressione che dipende dalla concentrazione e dal peso molecolare del polimero (1) (3) (4).
Applicabilità: Mn compreso tra 20 000 — 200 000.
|
|
1.4.
|
Osmometria in fase vapore:
prevede il confronto della velocità di evaporazione di un aerosol del solvente puro con almeno tre aerosol contenenti il polimero a varie concentrazioni (1) (2) (4).
Applicabilità: Mn < 20 000.
|
2. Analisi dei gruppi terminali
Per usare questo metodo è necessario conoscere sia la struttura complessiva del polimero che la natura dei gruppi terminali delle catene (che devono poter essere distinti dallo scheletro principale per esempio mediante NMR o titolazione/derivatizzazione). La determinazione della concentrazione molecolare dei gruppi terminali presenti sul polimero può portare ad un valore del peso molecolare (7) (8) (9).
Applicabilità: Mn fino a 50 000 (con affidabilità decrescente).
3. Bibliografia
|
(1)
|
Billmeyer, F.W. Jr., (1984). Textbook of Polymer Science, 3rd Edn, John Wiley, New York.
|
|
(2)
|
Glover, CA, (1975). Absolute Colligative Property Methods. Chapter 4. In: Polymer Molecular Weights, Part I, P.E. Slade, Jr. ed., Marcel Dekker, New York.
|
|
(3)
|
ASTM D 3750-79, (1979). Standard Practice for Determination of Number-Average Molecular Weight of Polymers by Membrane Osmometry. American Society for Testing and Materials, Philadelphia, Pennsylvania.
|
|
(4)
|
Coll, H. (1989), Membrane Osmometry. In: Determination of Molecular Weight, A.R. Cooper ed., J. Wiley and Sons, pag. 25-52.
|
|
(5)
|
ASTM 3592-77, (1977). Standard Recommended Practice for Determination of Molecular Weight by Vapour Pressure, American Society for Testing and Materials, Philadelphia, Pennsylvania.
|
|
(6)
|
Morris, C.E.M., (1989), Vapour Pressure Osmometry. In: Determination of Molecular Weight, A.R. Cooper ed., John Wiley and Sons.
|
|
(7)
|
Schröder, E. Muller, G., and Arndt, K-F., (1989). Polymer Characterisation, Cari Hanser Verlag, Munich.
|
|
(8)
|
Garmon, R.G. (1975). End-Group Determinations, Chapter 3. In: Polymer Molecular Weights, Part I, P.E. Slade, Jr. ed, Marcel Dekker, New York.
|
|
(9)
|
Amiya, S, et al. (1990). Pure and Applied Chemistry, 62, 2139-2146.
|
A.19. CONTENUTO DI FRAZIONI A BASSO PESO MOLECOLARE IN POLIMERI
1. METODO
Questo metodo cromatografico a permeazione di gel corrisponde al metodo OCSE TG 119 (1996). I principi fondamentali e ulteriori informazioni tecniche sono presentati nei riferimenti bibliografici.
1.1. INTRODUZIONE
Data la varietà delle proprietà dei polimeri, è impossibile descrivere un singolo metodo che definisca con precisione condizioni di separazione e di valutazione tali da coprire tutte le particolarità e specificità che si incontrano nella separazione di polimeri. In particolare, sistemi di polimeri complessi spesso non sono adatti alla cromatografia a permeazione di gel (GPC). Quando non si può ricorrere alla GPC, il peso molecolare può venire determinato mediante altri metodi (vedi allegato). In tali casi, fornire ampi dettagli e la motivazione del metodo usato.
Il metodo descritto è basato sulla norma DIN 55672 (1), che contiene informazioni dettagliate su come eseguire gli esperimenti e valutare i dati. Nel caso siano necessarie modifiche delle condizioni sperimentali, queste modifiche devono essere motivate. Si possono usare altre norme purché fornite con riferimenti completi. Il metodo descritto ricorre a campioni di polistirene di polidispersità nota per la taratura e può richiedere modifiche per adeguarlo a certi polimeri, per esempio polimeri solubili in acqua e ramificati a catena lunga.
1.2. DEFINIZIONI E UNITÀ
Un basso peso molecolare è definito arbitrariamente come un peso molecolare inferiore a 1 000 dalton.
Il peso molecolare medio numerico Mn e il peso molecolare medio ponderale Mw vengono determinati con le seguenti equazioni:
in cui
|
Hi
|
=
|
è il livello del segnale del rivelatore relativo alla linea di base per il volume di ritenzione Vi
|
|
Mi
|
=
|
è il peso molecolare della frazione di polimero in corrispondenza del volume di ritenzione Vi e n è il numero di punti.
|
L' ampiezza della distribuzione del peso molecolare, che è una misura della dispersità del sistema, è data dal rapporto Mw/Mn .
1.3. SOSTANZE DI RIFERIMENTO
Poiché la GPC è un metodo relativo, è necessaria una taratura. A questo scopo vengono di norma utilizzati standard di polistirene a struttura lineare con pesi molecolari medi Mn e Mw noti e distribuzione nota del peso molecolare. La curva di taratura può venire usata nella determinazione del peso molecolare del campione sconosciuto solo se le condizioni scelte per la separazione del campione e degli standard sono identiche.
Una determinata relazione tra il peso molecolare e il volume di eluizione è valida solo nelle specifiche condizioni del particolare esperimento. Queste condizioni includono soprattutto la temperatura, il solvente (o miscele di solventi), le condizioni cromatografiche e la colonna e il sistema di colonne di separazione.
I pesi molecolari del campione determinati in questo modo sono valori relativi e sono descritti come «pesi molecolari equivalenti in polistirene». Questo significa che, secondo le differenze strutturali e chimiche tra il campione e gli standard, i pesi molecolari possono deviare dai valori assoluti in misura più o meno grande. Se si usano altri standard, per esempio polietilenglicole, polietilenossido, poli-metil-metacrilato, acido poliacrilico, indicarne la ragione.
1.4. PRINCIPIO DEL METODO DI ANALISI
Utilizzando la GPC, si possono determinare sia la distribuzione del peso molecolare del campione che i pesi molecolari medi (Mn, Mw). La GPC è un particolare tipo di cromatografia liquida in cui il campione viene separato in base ai volumi idrodinamici dei singoli costituenti (2).
La separazione viene effettuata mentre il campione passa attraverso una colonna riempita di un materiale poroso, tipicamente un gel organico. Le molecole piccole possono penetrare nei pori, mentre le molecole grandi ne sono escluse. Il percorso delle molecole grandi è pertanto più breve e queste vengono eluite per prime. Le molecole di medie dimensioni penetrano in alcuni dei pori e vengono eluite più tardi. Le molecole più piccole, con un raggio ìdrodinamico più piccolo dei pori del gel, possono penetrare in tutti i pori. Queste vengono eluite per ultime.
In una situazione ideale, la separazione è determinata unicamente dalla dimensione delle specie molecolari, ma in pratica è difficile evitare l'interferenza di almeno qualche effetto di assorbimento. Un riempimento disuniforme della colonna e volumi morti possono peggiorare la situazione (2).
La rivelazione viene effettuata per esempio mediante l'indice di diffrazione o l'assorbimento nell'UV e fornisce una curva di distribuzione semplice. Tuttavia, per attribuire valori effettivi di peso molecolare alla curva, è necessario tarare la colonna facendo passare attraverso di essa polimeri di peso molecolare noto, possibilmente anche di struttura approssimativamente simile, per esempio vari standard di polistirene. Tipicamente si ottiene una curva gaussiana, talvolta distorta con una piccola coda verso il lato dei pesi molecolari bassi, in cui l'asse verticale indica la quantità in peso delle specie di vario peso molecolare eluite, e l'asse orizzontale ìndica il logaritmo del peso molecolare.
Il contenuto di sostanze a basso peso molecolare si ricava da questa curva. Il calcolo può essere accurato solo se le specie di basso peso molecolare hanno una risposta, riferita alla massa, equivalente al polimero nel suo complesso.
1.5. CRITERI DI QUALITÀ
La ripetibilità (deviazione standard relativa — Relative Standard Deviation: RSD) del volume di eluizione dovrebbe essere migliore dello 0,3 %. Se un cromatogramma viene valutato in funzione del tempo e non corrisponde al criterio succitato, la ripetibilità di analisi richiesta deve essere garantita mediante correzione attraverso uno standard interno (1). Le polidispersità dipendono dal peso molecolare degli standard. Nel caso degli standard di polistirene valori tipici sono:
|
Mp < 2 000
|
Mw/Mn < 1,20
|
|
2 000 < Mp < 106
|
Mw/Mn < 1,05
|
|
Mp > 106
|
Mw/Mn < 1,20
|
(Mp is the molecular weight of the standard at the peak maximum)
1.6. DESCRIZIONE DEL METODO DI ANALISI
1.6.1. Preparazione delle soluzioni di polistirene standard
Gli standard di polistirene vengono sciolti mediante accurata miscelazione nell'eluente scelto. Nella preparazione delle soluzioni tener conto delle raccomandazioni del produttore.
La scelta delle concentrazioni degli standard dipende da vari fattori, per esempio il volume di iniezione, la viscosità della soluzione e la sensibilità del rivelatore analitico. Il volume massimo di iniezione deve essere adeguato alla lunghezza della colonna allo scopo di evitare un sovraccarico. Volumi di iniezione tipici per separazioni analitiche con la GPC su una colonna da 30 cm × 7,8 mm sono normalmente compresi tra 40 e 100 μl. Sono possibili volumi più elevati, ma non devono superare i 250 μl.. Il rapporto ottimale tra il volume di iniezione e la concentrazione deve essere determinato prima dell'effettiva taratura della colonna.
1.6.2. Preparazione della soluzione campione
In linea di principio, per la preparazione delle soluzioni campione valgono gli stessi requisiti. Il campione viene sciolto accuratamente in un solvente adatto, per esempio tetraidrofurano (THF), per sbattimento. In nessun caso deve essere sciolto utilizzando un bagno ad ultrasuoni. Se necessario, la soluzione campione viene purificata su un filtro a membrana con dimensione dei pori compresa tra 0,2 e 2 μm.
Nella relazione finale deve essere registrata l'eventuale presenza di particelle indisciolte perché queste possono essere dovute a specie di peso molecolare elevato. Usare un metodo appropriato per determinare la percentuale in peso delle particelle indisciolte. Utilizzare le soluzioni entro 24 ore.
1.6.3. Correzione dell'errore dovuto a impurezze e additivi
É di solito necessaria una correzione del contenuto di specie M < 1 000 che tenga conto del contributo di componenti specifici non polimerici presenti (p. es. impurezze e/o additivi), salvo che il contenuto misurato sia già < 1 %. Questo si ottiene mediante l'analisi diretta della soluzione di polimero o dell'eluato della GPC.
Se, dopo il passaggio attraverso la colonna, l'eluato è troppo diluito per un'ulteriore analisi, occorre concentrarlo. Può essere necessario evaporare l'eluato a secchezza e scioglierlo di nuovo. La concentrazione dell'eluato deve essere condotta in condizioni tali da garantire che non si abbiano cambiamenti nell'eluato. Il trattamento dell'eluato dopo lo stadio di GPC dipende dal metodo analitico usato per la determinazione quantitativa.
1.6.4. Apparecchiature
L'apparecchiatura GPC comprende i seguenti componenti:
|
—
|
serbatoio del solvente,
|
|
—
|
degasatore (se del caso),
|
|
—
|
ammortizzatore di pulsazioni (se del caso),
|
|
—
|
colonne per cromatografia,
|
|
—
|
flussimetro (se del caso),
|
|
—
|
registratore-elaboratore dati,
|
Assicurarsi che il sistema GPC sia inerte rispetto ai solventi utilizzati (p. es. mediante l'uso di capillari d'acciaio se come solvente si usa il THF).
1.6.5. Sistema di iniezione e di erogazione del solvente
Caricare nella colonna un volume definito della soluzione campione utilizzando un autocampionatore oppure manualmente in una zona nettamente definita. Nel caso di una operazione manuale; se lo stantuffo della siringa viene tirato o spinto troppo rapidamente, la distribuzione dei pesi molecolari osservata può variare. Nei limiti del possibile il sistema di erogazione del solvente deve essere esente da pulsazioni e l'ideale sarebbe che vi fosse incorporato un attenuatore delle pulsazioni. La portata è dell ordine di 1 ml/min.
1.6.6. Colonna
Secondo il campione, il polimero viene caratterizzato utilizzando una colonna semplice o più colonne collegate in serie. In commercio sono disponibili vari materiali porosi per colonne con proprietà (p. es. dimensione dei pori, limiti di esclusione) definite. La scelta del gel di separazione o della lunghezza della colonna dipende sia dalle proprietà del campione (volumi idrodinamici, distribuzione dei pesi molecolari) che dalle specifiche condizioni di separazione come il solvente, la temperatura e la portata (1) (2) (3).
1.6.7. Piatti teorici
La colonna o la combinazione di colonne utilizzata per la separazione deve essere caratterizzata dal numero di piatti teorici. Questo, nel caso venga utilizzato il THF come solvente di eluizione, implica di caricare una soluzione di etilbenzene o altro adatto soluto apolare su una colonna di lunghezza nota. Il numero di piatti teorici è dato dall'equazione seguente:
|

|
o
|

|
in cui,
|
N è
|
=
|
il numero di piatti teorici
|
|
Ve è
|
=
|
il volume di eluizione al massimo del picco
|
|
W è
|
=
|
la larghezza del picco alla linea di base
|
|
W1/2 è
|
=
|
la larghezza del picco a mezza altezza
|
1.6.8. Efficienza di separazione
Oltre al numero di piatti teorici, che è una quantità che determina l'ampiezza della banda, è importante anche l'efficienza di separazione, che è determinata dalla ripidità della curva di taratura. L'efficienza di separazione di una colonna si ottiene dalla seguente relazione:
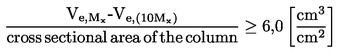
in cui
|
VeMx è
|
=
|
il volume di eluizione per polistirene di peso molecolare Mx
|
|
Ve,(10Mu) è
|
=
|
il volume di eluizione per polistirene di peso molecolare dieci volte maggiore.
|
La risoluzione del sistema è definita in generale come segue:

in cui,
|
Ve1, Ve2
|
=
|
sono i volumi di eluizione dei due standard di polistirene al massimo del picco
|
|
W1, W2
|
=
|
sono le larghezze del picco alla linea di base
|
|
M1, M2
|
=
|
sono i pesci molecolari al massimo del picco (dovrebbero differire di un fattore 10).
|
Il valore di R per il sistema di colonne deve essere maggiore di 1,7 (4).
1.6.9. Solventi
Tutti i solventi devono essere di purezza elevata (per il THF si usa una purezza del 99,5 %). Il serbatoio del solvente (se necessario sotto atmosfera di gas inerte) deve essere sufficientemente grande per la taratura della colonna e per l'analisi di parecchi campioni. Degasare il solvente prima di trasportarlo alla colonna mediante la pompa.
1.6.10. Controllo della temperatura
La temperatura dei componenti interni critici (ansa di iniezione, colonne, rivelatore e tubature) deve essere costante e coerente con il solvente scelto.
1.6.11. Rivelatore
La funzione del rivelatore è di registrare quantitativamente la concentrazione del campione eluito dalla colonna. Per evitare un inutile allargamento dei picchi, il volume della cuvetta della cella del rivelatore deve essere il più piccolo possibile. Salvo per rivelatori a diffrazione della luce e rivelatori a viscosità, questo volume non deve superare i 10 μl. Il metodo di solito utilizzato per la rivelazione è la rifrattometria differenziale. Tuttavia, se richiesto dalle proprietà specifiche del campione o del solvente di eluizione, si possono utilizzare altri tipi di rivelatori, per esempio UV/VIS, IR, rivelatori viscosimetrici ecc.
2. DATI E RELAZIONE
2.1. DATI
Fare riferimento alla norma DIN (1) per i criteri di valutazione dettagliati e per i requisiti di raccolta ed elaborazione dei dati.
Per ciascun campione eseguire due esperimenti indipendenti, che dovranno venire analizzati singolarmente. In ogni caso è essenziale determinare i dati anche sui bianchi trattati nelle stesse condizioni del campione.
È necessario indicare esplicitamente che i valori misurati sono valori relativi equivalenti al peso molecolare dello standard usato.
Dopo la determinazione dei volumi di ritenzione o dei tempi di ritenzione (possibilmente corretti usando uno standard interno), i valori di log Mp (Mp sono i massimi dei picchi dello standard di taratura) vengono riportati contro una delle suddette quantità. Per ogni decade di peso molecolare sono necessari almeno due punti di taratura e per la curva totale sono richiesti almeno cinque punti di misura, che devono coprire il peso molecolare stimato del campione. L'estremità della curva di taratura corrispondente al basso peso molecolare è definita da n-esilbenzene o altro soluto apolare adatto. Si determina la porzione della curva corrispondente a pesi molecolari inferiori a 1 000 e, se necessario, la si corregge per compensare impurezze e additivi. In genere le curve di eluzione vengono valutate con sistemi elettronici di elaborazione. Se si utilizza una digitalizzazione manuale, si può consultare il metodo ASTM D 3536-91 (3).
Se eventuali polimeri insolubili vengono trattenuti sulla colonna, è probabile che il loro peso molecolare sia più elevato di quello della frazione solubile, e non considerandolo si sovrastimerebbe il contenuto di sostanze di basso peso molecolare. Nell'allegato sono fornite indicazioni per la correzione del contenuto di sostanze a basso peso molecolare per tener conto del polimero insolubile.
La curva di distribuzione deve essere fornita come tabella o come figura (frequenza differenziale o sommatoria delle percentuali contro log M). Nella rappresentazione grafica, una decade di peso molecolare deve avere normalmente una larghezza di circa 4 cm e il massimo del picco deve avere un'altezza di circa 8 cm. Nel caso di curve di distribuzione integrali la differenza in ordinata tra lo 0 e il 100 % deve essere di circa 10 cm.
2.2. RELAZIONE D'ANALISI
La relazione d'analisi deve includere le seguenti informazioni:
2.2.1. Sostanza in esame
|
—
|
informazioni disponibili sulla sostanza in esame (identità, additivi, impurezze),
|
|
—
|
descrizione del trattamento del campione, osservazioni, problemi.
|
2.2.2. Strumentazione
|
—
|
serbatoio dell'eluente, gas inerte, degasaggio dell'eluente, composizione dell'eluente, impurezze,
|
|
—
|
pompa, attenuatore di pulsazioni, sistema di iniezione,
|
|
—
|
colonne di separazione (fabbricante, tutte le informazioni sulle caratteristiche delle colonne, come dimensione dei pori, tipo di materiale di separazione ecc, numero, lunghezza e ordine delle colonne usate),
|
|
—
|
numero di piatti teorici della colonna (o combinazione di colonne), efficienza di separazione (risoluzione del sistema),
|
|
—
|
informazioni sulla simmetria dei picchi,
|
|
—
|
temperatura della colonna, tipo di controllo della temperatura,
|
|
—
|
rivelatore (principio di misurazione, tipo, volume della cuvetta),
|
|
—
|
flussimetro se usato (produttore, principio di misurazione),
|
|
—
|
sistema di registrazione ed elaborazione dati (hardware e software).
|
2.2.3. Taratura del sistema
|
—
|
descrizione dettagliata del metodo usato per costruire la curva di taratura,
|
|
—
|
informazioni sui criteri di qualità per questo metodo (coefficiente di correlazione, varianza ecc),
|
|
—
|
informazioni su tutte le estrapolazioni, ipotesi e approssimazioni fatte durante la procedura sperimentale e durante la valutazione e l'elaborazione dei dati,
|
|
—
|
tutte le misure usate per costruire la curva di taratura devono essere documentate in una tabella includente le seguenti informazioni per ciascun punto di taratura:
|
—
|
produttore del campione,
|
|
—
|
valori caratteristici degli standard Mp , Mn , Mw , Mw/Mn, forniti dal produttore o ricavati da misure successive, insieme con dettagli relativi al metodo di determinazione,
|
|
—
|
volume di iniezione e concentrazione di iniezione,
|
|
—
|
valore di Mp usato per la taratura,
|
|
—
|
volume di eluizione o tempo di ritenzione corretto misurato in corrispondenza del massimo dei picchi,
|
|
—
|
Mp calcolato al massimo del picco,
|
|
—
|
errore percentuale dell'Mp calcolato e del valore di taratura.
|
|
2.2.4. Informazioni sul contenuto di polimero a basso peso molecolare
|
—
|
descrizione dei metodi usati nell'analisi e del modo in cui sono stati condotti gli esperimenti,
|
|
—
|
informazioni sul contenuto percentuale (p/p) di specie di basso peso molecolare riferito al campione totale;
|
|
—
|
informazioni sulle impurezze, gli additivi e altre specie non polimeriche in percentuale in peso riferita al campione totale.
|
2.2.5. Valutazione
|
—
|
valutazione su base temporale: metodi usati per garantire la riproducibilità richiesta (metodo di correzione, standard interno ecc),
|
|
—
|
indicazione se la valutazione sia stata effettuata sulla base del volume di eluizione o del tempo di ritenzione,
|
|
—
|
informazioni riguardo ai limiti della valutazione se un picco non viene analizzato completamente,
|
|
—
|
descrizione dei metodi di lisciatura, se usati,
|
|
—
|
procedure di preparazione e pretrattamento del campione,
|
|
—
|
presenza di eventuali particelle indisciolte,
|
|
—
|
volume di iniezione (μl) e concentrazione di iniezione (mg/ml),
|
|
—
|
osservazioni indicanti effetti che portano a deviazioni dal profilo GPC ideale,
|
|
—
|
descrizione dettagliata di tutte le modifiche applicate alle procedure di analisi,
|
|
—
|
dettagli sugli intervalli di errore,
|
|
—
|
qualsiasi altra informazione e osservazione utile all'interpretazione dei risultati.
|
3. BIBLIOGRAFIA
|
(1)
|
DIN 55672 (1995). Geldpermeationschromatographie (GPC) mit Tetrahydrofuran (THF) als Elutionsmittel, Teil 1.
|
|
(2)
|
Yau, W.W., Kirkland, J.J., and Bly, D.D. eds. (1979). Modern Size Exclusion Liquid Chromatography, J.Wiley and Sons.
|
|
(3)
|
ASTM D 3536-91, (1991). Standard Test method for Molecular Weight Averages and Molecular Weight Distribution by Liquid Exclusion Chromatography (Gel Permeation Chromatography-GPC). American Society for Testing and Materials, Philadelphia, Pennsylvania.
|
|
(4)
|
ASTM D 5296-92, (1992). Standard Test method for Molecular Weight Averages and Molecular Weight Distribution of Polystyrene by High Performance Size-Exclusion Chromatography. American Society for Testing and Materials, Philadelphia, Pennsylvania.
|
Allegato
Indicazioni per la correzione del contenuto di specie di basso peso molecolare in funzione della presenza di polimero insolubile
Quando in un campione è presente polimero insolubile, si verifica una perdita di massa durante l'analisi GPC. Il polimero insolubile viene trattenuto in modo irreversibile sulla colonna o sul filtro del campione, mentre la porzione solubile del campione passa attraverso la colonna. Se l'incremento dell'indice di rifrazione (dn/dc) del polimero può essere stimato o misurato, si può stimare la massa di campione persa sulla colonna. In tal caso si effettua una correzione usando una taratura esterna con materiali standard di concentrazione nota e dn/dc noto per tarare la risposta del rifrattometro. Nel seguente esempio si usa uno standard di poli(metilmetacrilato) (pMMA).
Nella taratura esterna per l'analisi di polimeri acrilici, si analizza uno standard di pMMA di concentrazione nota in tetraidrofurano mediante GPC e i dati risultanti vengono usati per trovare la costante del rifrattometro secondo l'equazione:
K = R/(C × V × dn/dc)
in cui:
|
K
|
=
|
è la costante del rifrattometro (in microvolt secondi/ml),
|
|
R
|
=
|
è la risposta dello standard di pMMA (in microvolt/secondi),
|
|
C
|
=
|
è la concentrazione dello standard di pMMA (in mg/ml),
|
|
V
|
=
|
è il volume di iniezione (in ml) e dn/dc è l'incremento di indice di rifrazione per il pMMA in tetraidrofurano (in ml/mg).
|
I seguenti sono dati tipici di uno standard di pMMA:
|
R
|
=
|
2 937 891
|
|
C
|
=
|
1,07 mg/ml
|
|
V
|
=
|
0,1 ml
|
|
dn/dc
|
=
|
9 × 10-5 ml/mg.
|
II valore di K risultante, 3,05 × 1011 viene poi utilizzato per calcolare la risposta teorica del rivelatore se il 100 % del polimero iniettato fosse stato eluito attraverso il rivelatore.
A.20. COMPORTAMENTO DI SOLUZIONE/ESTRAZIONE DEI POLIMERI IN ACQUA
1. METODO
II metodo descritto corrisponde alla versione riveduta del metodo OCSE TG 120 (1997). Ulteriori informazioni tecniche sono fornite nel riferimento bibliografico (1).
1.1. INTRODUZIONE
Per certuni polimeri, come i polimeri in emulsione, può essere necessario un lavoro di preparazione iniziale prima di poter utilizzare il metodo qui presentato. Il metodo non può essere applicato a polimeri liquidi e a polimeri che reagiscono con l'acqua nelle condizioni del saggio.
Quando il metodo non è pratico o è impossibile da applicare, il comportamento di soluzione/estrazione può essere studiato mediante altri metodi. In tal caso,. fornire dettagli completi e la motivazione del metodo usato.
1.2. SOSTANZE DI RIFERIMENTO
Nessuna.
1.3. PRINCIPI DEL METODO DI SAGGIO
II comportamento di soluzione/estrazione di polimeri in un ambiente acquoso viene determinato con il metodo del pallone (cfr. A.6. Solubilità in acqua, metodo del pallone) con le modifiche descritte nel seguito.
1.4. CRITERI DI QUALITÀ
Nessuno.
1.5. DESCRIZIONE DEL METODO DI SAGGIO
1.5.1. Apparecchiatura
Per il metodo occorre la seguente apparecchiatura:
|
—
|
dispositivo di triturazione, per esempio un macinino, per la produzione di particelle di dimensioni note,
|
|
—
|
apparecchiature di scuotimento con possibilità di controllo della temperatura,
|
|
—
|
sistema di filtrazione su membrana,
|
|
—
|
apparecchiature analitiche appropriate,
|
|
—
|
setacci standardizzati.
|
1.5.2. Preparazione del campione
Un campione rappresentativo deve innanzitutto venire ridotto ad una dimensione granulometrica compresa tra 0,125 e 0,25 mm con l'utilizzo di appropriati setacci. Può essere richiesto un raffreddamento ai fini della stabilità del campione o per la macinazione. Materiali di natura gommosa possono venire tritati alla temperatura dell'azoto liquido (1).
Se non è possibile ottenere la frazione di dimensione granulometrica richiesta, ridurre il più possibile le dimensioni delle particelle e indicare il risultato nella relazione. Nella relazione è necessario indicare come è stato conservato il campione tritato prima dell'analisi.
1.5.3. Procedura
Tre campioni da 10 g della sostanza in analisi vengono pesati in tre recipienti dotati di tappi di vetro e in ciascun recipiente si aggiungono 1 000 ml di acqua. Se ia manipolazione di una quantità di 10 g di polimero si dimostra irrealizzabile, utilizzare la massima quantità manipolabile e regolare in proporzione il volume d'acqua.
I recipienti vengono tappati ermeticamente ed agitati a 20 oC. Usare un dispositivo di agitazione in grado di funzionare a temperatura costante. Dopo un periodo di 24 ore, il contenuto di ciascun recipiente viene centrifugato o filtrato e si determina la concentrazione del polimero nella fase acquosa limpida mediante un adatto metodo analitico. Se non sono disponibili metodi analitici adatti per la fase acquosa, si può stimare la solubilità/estrattività totale del peso secco del residuo trattenuto sul filtro o del precipitato centrifugato.
Di solito è necessario distinguere quantitativamente le impurezze e gli additivi, da una parte, dalle specie di basso peso molecolare, dall'altra parte. Nel caso di una determinazione gravimetrica, è importante anche eseguire una prova in bianco senza sostanza in esame per tener conto di residui dovuti alla procedura sperimentale.
Il comportamento di soluzione/estrazione di polimeri in acqua a 37 oC a pH 2 e pH 9 può venire determinato come descritto per l'esperimento a 20 oC. Questi pH si possono ottenere mediante l'aggiunta di adatti tamponi o di acidi o basi appropriate, come acido cloridrico, acido acetico, idrossido di sodio o di potassio per analisi o NH3.
Secondo il metodo di analisi usato, si devono eseguire una o due prove. Quando sono disponibili metodi sufficientemente specifici per determinare il componente polimerico mediante l'analisi diretta della fase acquosa, dovrebbe essere sufficiente una prova eseguita come descritto sopra. Se invece tali metodi non sono disponibili e la determinazione del comportamento di soluzione/estrazione del polimero è limitata all'analisi indiretta mediante la sola determinazione del carbonio organico totale (TOC) contenuto nell'estratto acquoso, si dovrebbe eseguire una prova addizionale. Anche questa prova addizionale deve essere eseguita in triplo utilizzando campioni di polimero dieci volte più piccoli e le stesse quantità di acqua usate nella prima prova.
1.5.4. Analisi
1.5.4.1. Saggio condotto con una sola dimensione del campione
Se disponibili, usare metodi per l'analisi diretta dei componenti polimerici nella fase acquosa. In alternativa, si può prendere in considerazione anche un'analisi indiretta dei componenti de! polimero disciolti/estratti mediante determinazione del contenuto totale di parti solubili e correzione per tener conto dei componenti non specifici del polimero.
Per determinare le specie polimeriche totali è possibile effettuare l'analisi della fase acquosa: o
mediante un metodo di sufficiente sensibilità, per esempio:
|
—
|
TOC mediante digestione con persolfato o dicromato a dare CO2, e stima mediante IR o analisi chimica,
|
|
—
|
spettrometria di assorbimento atomico (AAS) o il suo equivalente emissione a plasma accoppiato induttivamente (ICP) per polimeri contenenti silicio o metalli,
|
|
—
|
assorbimento UV o spettrofluorimetria per i polimeri acrilici,
|
|
—
|
LC-MS per campioni di basso peso molecolare,
|
oppure mediante evaporazione a secchezza sotto vuoto dell'estratto acquoso e analisi spettroscopica (IR, UV, ecc.) o AAS/ICP del residuo.
Se l'analisi della fase acquosa tal quale non è praticabile, l'estratto acquoso dovrebbe venire estratto con un solvente organico immiscibile con l'acqua, per esempio un idrocarburo clorurato. Il solvente viene poi evaporato e il residuo viene analizzato come sopra per determinare il contenuto di polimero di cui sopra. I componenti di questo residuo identificati come impurezza o additivo devono venire sottratti per determinare così il grado di soluzione/estrazione del polimero stesso.
Quando tali sostanze sono presenti in quantità relativamente grandi, può essere necessario sottoporre il residuo per esempio ad un'analisi HPLC o GC per distinguere le impurezze dal monomero e dalle specie derivate dal monomero presenti, in modo che sia possibile determinare il reale contenuto di queste ultime.
In alcuni casi può essere sufficiente una semplice evaporazione a secchezza del solvente seguita dalla pesata del residuo secco.
1.5.4.2. Prova condotta con due differenti dimensioni del campione
Si determina il TOC su tutti gli estratti acquosi.
Eseguire una determinazione gravimetrica sulla parte indisciolta/non estratta del campione. Se, dopo centrifugazione o filtrazione del contenuto di ciascun recipiente, rimangono residui di polimero attaccati alla parete del recipiente, risciacquarlo con il filtrato fino a rimuoverne tutti i residui visibili, dopo di che il filtrato viene di nuovo centrifugato o filtrato. I residui che rimangono sul filtro o nella provetta da centrifuga vengono essiccati a 40 oC sotto vuoto e pesati. Continuare l'essiccazione fino a peso costante.
2. DATI
2.1. PROVA CONDOTTA CON UNA SOLA DIMENSIONE DEL CAMPIONE
Indicare i singoli risultati di ciascuno dei tre palloni e valori medi, in unità di massa per volume della soluzione (tipicamente mg/1) o di massa per massa del campione di polimero (tipicamente mg/g). Indicare anche la perdita di peso del campione (calcolata come peso del soluto diviso per il peso del campione iniziale). Si dovrebbero calcolare le deviazioni standard relative (RSD). Indicare i singoli valori per la sostanza totale (polimero più additivi essenziali ecc.) e per il solo polimero (cioè dopo aver sottratto il contributo di tali additivi).
2.2. PROVA CONDOTTA CON DUE DIFFERENTI DIMENSIONI DEL CAMPIONE
Fornire i singoli valori di TOC degli estratti acquosi dei due esperimenti in triplo e il valore medio di ciascun esperimento in unità di massa per volume della soluzione (tipicamente mg C/g), nonché in unità di massa per peso del campione iniziale (tipicamente mg C/g).
Se non vi sono differenze tra i risultati ai rapporti campione/acqua alto e basso, questo può indicare che effettivamente sono stati estratti tutti i componenti estraibili. In tal caso normalmente non sarà necessaria l'analisi diretta.
Indicare i singoli pesi dei residui espressi in percentuale del peso iniziale dei campioni. Per ogni esperimento calcolare le medie. Le differenze tra 100 e le percentuali trovate rappresentano le percentuali di materiale solubile ed estraibile contenuto nel campione originario.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
La relazione sul saggio deve includere le informazioni seguenti:
3.1.1. Sostanza esaminata:
|
—
|
informazioni disponibili sulla sostanza esaminata (identità, additivi, impurezze, contenuto di specie di basso peso molecolare).
|
3.1.2. Condizioni sperimentali:
|
—
|
descrizione delle procedure usate e delle condizioni sperimentali,
|
|
—
|
descrizione dei metodi analitici e di rivelazione.
|
3.1.3. Risultati:
|
—
|
risultati di solubilità/estraibilità in mg/l; valori singoli e valori medi delle prove di estrazione nelle varie soluzioni, scomposti in contenuto di polimero e impurezze, additivi ecc.,
|
|
—
|
risultati di solubilità/estraibilità in mg/g di polimero,
|
|
—
|
valori di TOC per gli estratti acquosi, peso del soluto e percentuali calcolate, se misurati,
|
|
—
|
pH di ciascun campione,
|
|
—
|
informazioni riguardo ai valori del bianco,
|
|
—
|
se necessario, indicazioni sulla instabilità chimica della sostanza in esame sia durante il processo di saggio che durante il processo analitico,
|
|
—
|
tutte le informazioni ritenute importanti per l'interpretazione dei risultati.
|
4. BIBLIOGRAFIA
|
(1)
|
DIN 53733 (1976). Zerkleinerung von Kunststofferzeugnissen fùr Priifzwecke.
|
A.21. PROPRIETÀ COMBURENTI (LIQUIDI)
1. METODO
1.1. INTRODUZIONE
Il presente metodo di test è disegnato per misurare il potenziale che una sostanza liquida ha di aumentare la velocità o l'intensità di combustione di una sostanza combustibile, o di formare con una sostanza combustibile una miscela capace di autoaccensione, quando le due sostanze vengono perfettamente miscelate. Il metodo si basa sul test ONU per i liquidi comburenti (1) ed è equivalente ad esso. Poiché tuttavia il presente metodo A.21 deve fondamentalmente soddisfare i requisiti del regolamento 1907/2006, esso può limitarsi a richiedere solo un confronto con un'unica sostanza di riferimento. L'analisi e il confronto con altre sostanze di riferimento possono risultare necessari quando occorre utilizzare i risultati del test per altri scopi. (9)
Non occorre eseguire questo test quando l'esame della formula di struttura conferma oltre ogni ragionevole dubbio che la sostanza non è in grado di reagire esotermicamente con un materiale combustibile.
Prima di eseguire il test è utile possedere informazioni preliminari su eventuali potenziali proprietà esplosive della sostanza.
Il test non è applicabile a solidi, gas, sostanze esplosive o altamente infiammabili, né a perossidi organici.
L'esecuzione di questo test può essere evitata qualora la sostanza in esame sia già stata analizzata con il test ONU sui liquidi comburenti (1).
1.2 DEFINIZIONI E UNITÀ
Per tempo medio di aumento della pressione si intende la media dei tempi misurati perché una miscela in esame produca un aumento della pressione da 690 kPa a 2 070 kPa in autoclave.
1.3 SOSTANZA DI RIFERIMENTO
Come sostanza di riferimento si utilizza acido nitrico acquoso al 65 % (p/p) (grado analitico) (10).
A scelta, se lo sperimentatore prevede che i risultati di questo test possano alla fine essere impiegati per altri scopi (9), può risultare appropriato eseguire il test anche con altre sostanze di riferimento. (11)
1.4 PRINCIPIO DEL METODO UTILIZZATO
Il liquido da sottoporre a test viene miscelato con cellulosa fibrosa in rapporto 1:1 (per massa) e introdotto in un recipiente a pressione. Se durante la miscelatura o il riempimento si verifica un'accensione spontanea non occorre proseguire il test.
Se non si verifica un'accensione spontanea il test va eseguito interamente. Dopo aver riscaldato la miscela in un recipiente a pressione si misura il tempo medio di aumento della pressione da 690 kPa a 2 070 kPa in autoclave, infine si confronta il risultato con il tempo medio di aumento della pressione rilevato per la miscela 1:1 della/e sostanza/e di riferimento con cellulosa.
1.5 CRITERI DI QUALITÀ
In una serie di cinque prove eseguite su un'unica sostanza i risultati non devono differire di oltre il 30 % dalla media aritmetica; in caso contrario vanno scartati. Se ciò dovesse succedere, occorre provvedere a migliorare la procedura di miscelazione e di riempimento prima di ripetere il test.
1.6 DESCRIZIONE DEL METODO
1.6.1 Preparazione
1.6.1.1 Sostanza combustibile
Come materiale combustibile viene impiegata cellulosa essiccata fibrosa con fibre di lunghezza compresa fra 50 e 250 μm e diametro medio di 25 μm (12). L'essiccazione avviene a peso costante formando uno strato di spessore non superiore a 25 mm, ad una temperatura di 105 oC per un periodo di 4 ore. La sostanza viene dunque conservata in un essiccatore in presenza di un essiccante nella fase di raffreddamento e comunque fino al momento del suo utilizzo. Il tenore di acqua della cellulosa essiccata deve essere inferiore allo 0,5 % della massa secca (13), eventualmente, se necessario, prolungando il tempo di essiccazione (14). Per tutto il test va utilizzato un unico lotto di cellulosa.
1.6.1.2 Apparecchiatura
1.6.1.2.1 Recipiente a pressione
Si utilizza un recipiente a pressione formato da un cilindro di acciaio lungo 89 mm e avente un diametro esterno di 60 mm (vedi figura 1). Sui lati opposti occorre lavorare due superfici piane (che riducono la sezione trasversale del recipiente a 50 mm) per facilitare la presa mentre si preparano la spina di accensione e il tappo-sfiatatoio. Il recipiente, che ha un diametro interno di 20 mm, presenta alle due estremità una smussatura interna per una profondità di 19 mm ed è filettato in modo da accomodare filettature British Standard Pipe (BSP) da 1" o l'equivalente metrico. Un limitatore di pressione, formato da un braccio laterale, è avvitato sul lato curvo del recipiente a pressione a 35 mm da una delle estremità e a 90o rispetto alle superfici piane lavorate. L'incavo per il limitatore è perforato per una profondità di 12 mm e filettato in modo da accomodare il filo del BSP da 1/2" (o l'equivalente metrico) all'estremità del braccio laterale. Se necessario si inserisce un sigillo di materiale inerte per assicurare la tenuta stagna contro la fuoriuscita di gas. Il braccio laterale si estende per 55 mm oltre il corpo del recipiente a pressione e presenta un foro di 6 mm. L'estremità del braccio laterale è smussata e filettata in modo da accomodare un trasduttore di pressione del tipo a membrana. È possibile utilizzare qualunque tipo di misuratore di pressione, a condizione che non sia sensibile alla temperatura dei gas o ai prodotti della decomposizione e che sia in grado di rilevare l'aumento di pressione tra 690 e 2 070 kPa in meno di 5 millisecondi.
L'estremità del recipiente a pressione più lontana dal braccio laterale è chiusa con la spina di accensione provvista di due elettrodi, uno isolato dal corpo della spina e l'altro collegato a massa. L'altra estremità del recipiente a pressione è chiusa da un disco di rottura (pressione di scoppio di circa 2 200 kPa) mantenuto in sede con un tappo di ritenuta provvisto di un'apertura di 20 mm. Se necessario la spina di accensione può essere dotata di un sigillo di materiale inerte per assicurare la tenuta stagna contro la fuoriuscita di gas. Una base appoggio (figura 2) mantiene l'assemblato nella posizione corretta durante l'utilizzo. In genere si ricorre ad una piastra di base in acciaio dolce di 235 mm x 184 mm × 6 mm provvista di un profilato cavo di 185 mm di lunghezza a sezione quadra di dimensioni di 70 mm x 70 mm × 4 mm.
Da ciascuno dei lati opposti di un'estremità del profilato viene tagliata una sezione, in modo da formare una struttura a due gambe con i lati piatti sormontata da un tratto di profilato a sezione intatta della lunghezza di 86 mm. Le estremità di questi lati piatti sono tagliate ad angolo di 60o in orizzontale e sono saldate alla piastra di base. In un lato dell'estremità superiore della sezione della base viene eseguita una scanalatura di 22 mm di larghezza × 46 mm di profondità tale che, quando l'assemblato del recipiente a pressione viene calato dal lato dell'estremità della spina di accensione nel supporto del profilato squadrato, il braccio laterale possa inserirsi nella scanalatura. Un pezzo di acciaio largo 30 mm e spesso 6 mm viene saldato al lato inferiore interno della sezione quadra per fungere da distanziatore. Due viti a testa piatta da 7 mm inserite nella faccia opposta servono a mantenere fisso in posizione il recipiente a pressione. Due strisce d'acciaio larghe 12 mm e spesse 6 mm, saldate alle parti laterali lungo la base della sezione quadra, sostengono il recipiente a pressione dal di sotto.
1.6.1.2.2 Sistema di accensione
Il sistema di accensione è formato da un filo in Ni/Cr lungo 25 cm con diametro di 0,6 mm e resistenza di 3,85 ohm/m. Mediante un'asta del diametro di 5 mm, il filo è arrotolato a formare una bobina ed è collegato agli elettrodi della spina di accensione. La bobina deve avere una delle configurazioni mostrate nella figura 3. La distanza fra il fondo del recipiente e la parte inferiore della bobina di accensione deve essere preferibilmente di 20 mm. Se gli elettrodi non sono regolabili, le estremità del filo di accensione fra la bobina e il fondo del recipiente vanno isolate con una guaina in ceramica. Il filo è riscaldato da un alimentatore a corrente continua di almeno 10 A.
1.6.2 Esecuzione del test
(15)
L'apparecchiatura, assemblata con il trasduttore di pressione e il sistema di riscaldamento ma senza il disco di rottura posizionato, viene appoggiata con il lato della spina di accensione verso il basso. In un bicchiere di vetro si mescolano 2,5 g del liquido da esaminare con 2,5 g di cellulosa essiccata, utilizzando un agitatore in vetro (16). Per sicurezza, quando si miscelano le due sostanze occorre inserire uno schermo di protezione fra l'operatore e la miscela. Se la miscela si incendia durante il mescolamento o il riempimento, non occorre proseguire il test. La miscela va versata nel recipiente a pressione in piccole quantità, tamburellando sul contenitore e facendo in modo che essa si concentri intorno alla bobina di accensione e sia perfettamente a contatto con essa. È importante che durante questo processo di impaccamento la bobina non venga deformata per evitare risultati sfalsati (17). Il disco di rottura viene messo in posizione e il tappo di ritenuta viene avvitato saldamente. Il recipiente carico viene trasferito sulla base di appoggio per l'accensione, con il disco di rottura in alto e il tutto viene sistemato in un apposito armadio aspirato corazzato da laboratorio o in una camera di scoppio. L'alimentatore viene collegato ai terminali esterni della spina di accensione e impostato su 10 A. Il tempo fra l'inizio della miscelazione e l'accensione dell'alimentatore non deve superare i 10 minuti.
Il segnale prodotto dal trasduttore di pressione viene registrato mediante sistema apposito che consenta sia la valutazione dei dati, sia la generazione di un registro permanente del profilo tempo-pressione ottenuto (ad esempio un registratore di segnali transitori unito a un registratore su carta). La miscela viene scaldata fino a rottura del disco o finché siano trascorsi almeno 60 s. Se la rottura del disco non si verifica, occorre lasciare raffreddare la miscela prima di smontare con cautela l'apparecchiatura, prendendo precauzioni per tenere conto dell'eventuale pressurizzazione. In totale vengono eseguite cinque prove con la sostanza in esame e la/le sostanza/e di riferimento. Si rileva e registra il tempo impiegato dalla pressione per aumentare da 690 kPa a 2 070 kPa in autoclave. Infine si calcola il tempo medio di aumento della pressione.
In alcuni casi le sostanze possono generare un aumento di pressione eccessivamente alto o basso dovuto a reazioni chimiche che non caratterizzano le proprietà comburenti della sostanza in questione. In tali casi può essere necessario ripetere il test con una sostanza inerte, come la diatomite (terra a diatomee), in luogo della cellulosa, allo scopo di chiarire la natura della reazione.
2. DATI
Tempi di aumento della pressione sia per la sostanza in esame che per la/le sostanze di riferimento. Tempi di aumento della pressione per la sostanza inerte eventualmente utilizzata.
2.1 TRATTAMENTO DEI RISULTATI
Si calcolano i tempi medi di aumento della pressione, sia per la sostanza in esame che per la/le sostanze di riferimento.
Si calcola il tempo medio di aumento della pressione per la sostanza inerte eventualmente utilizzata. La tabella 1 mostra alcuni esempi di risultati.
preparata fresca per ciascun test.
Tabella 1
Esempi di risultati
(18)
|
Sostanza (19)
|
Tempo medio di aumento della pressione per una miscela 1:1 con cellulosa
(ms)
|
|
Dicromato di ammonio, soluzione acquosa satura
|
20 800
|
|
Nitrato di calcio, soluzione acquosa satura
|
6 700
|
|
Nitrato di ferro, soluzione acquosa satura
|
4 133
|
|
Perclorato di litio, soluzione acquosa satura
|
1 686
|
|
Perclorato di magnesio, soluzione acquosa satura
|
777
|
|
Nitrato di nickel, soluzione acquosa satura
|
6 250
|
|
Acido nitrico, 65 %
|
4 767 (20)
|
|
Acido perclorico, 50 %
|
121 (20)
|
|
Acido perclorico, 55 %
|
59
|
|
Nitrato di potassio, soluzione acquosa al 30 %
|
26 690
|
|
Nitrato di argento, soluzione acquosa satura
|
(21)
|
|
Clorato di sodio, soluzione acquosa al 40 %
|
2 555 (20)
|
|
Nitrato di sodio, soluzione acquosa al 45 %
|
4 133
|
|
Sostanza inerte
|
|
|
Acqua:cellulosa
|
(21)
|
3. RELAZIONE
3.1 RELAZIONE SULL'ESECUZIONE DEL TEST
La relazione deve contenere le seguenti informazioni:
|
—
|
identità, composizione, purezza, ecc. della sostanza di prova,
|
|
—
|
concentrazione della sostanza di prova,
|
|
—
|
procedura di essiccazione della cellulosa,
|
|
—
|
contenuto di acqua della cellulosa,
|
|
—
|
risultati delle misurazioni,
|
|
—
|
risultati degli eventuali test con sostanza inerte,
|
|
—
|
tempi medi calcolati di aumento della pressione,
|
|
—
|
eventuali deviazioni dal metodo descritto e motivazioni,
|
|
—
|
qualunque informazione od osservazione rilevante per l'interpretazione dei risultati.
|
3.2 INTERPRETAZIONE DEI RISULTATI (22)
I risultati del test devono essere valutati in base ai seguenti criteri:
|
a)
|
eventuale accensione spontanea della miscela formata dalla sostanza di prova e dalla cellulosa;
|
|
b)
|
confronto del tempo medio impiegato dalla pressione per aumentare da 690 kPa a 2 070 kPa con quello della/e sostanza/e di riferimento.
|
Una sostanza liquida è considerata comburente quando:
|
a)
|
una miscela 1:1, per massa, di sostanza e cellulosa prende fuoco spontaneamente; oppure
|
|
b)
|
una miscela 1:1, per massa, di sostanza e cellulosa presenta un tempo medio di aumento della pressione inferiore o uguale al tempo medio di aumento della pressione di una miscela 1:1, per massa, di acido nitrico acquoso al 65 % (p/p) e cellulosa.
|
Allo scopo di evitare un risultato falso positivo, in sede di interpretazione dei risultati occorre, se necessario, tenere conto anche dei risultati ottenuti testando la sostanza con un materiale inerte.
4. BIBLIOGRAFIA
|
(1)
|
Recommendations on the Transport of Dangerous Goods, Manual of Tests and Criteria. 3rd revised edition. UN Publication No: ST/SG/AC.10/11/Rev. 3, 1999, page 342. Test O.2: Test for oxidizing liquids.
|
Figura 1
Recipiente a pressione

Figura 2
Base d'appoggio
Figura 3
Sistema di accensione
Nota: entrambe queste configurazioni possono essere utilizzate.
(1) In funzione del tipo di strumento e del grado di purezza della sostanza.
(2) In funzione del tipo di strumento e del grado di purezza della sostanza.
(3) In funzione del tipo di strumento e del grado di purezza della sostanza
(4) In funzione del tipo di strumento e del grado di purezza della sostanza.
(5) Questo livello di accuratezza è valido soltanto nel caso di una strumentazione semplice, come ad esempio quella descritta nella norma ASTM D 1120-72; esso può essere migliorato con ebulliometri più perfezionati.
(6) Valida solo per sostanze pure. L'uso in altre circostanze deve essere giustificato.
(7) Dipendente dal grado di purezza.
(8) Questi metodi possono essere usati anche nel campo da 1 a 10 Pa a condizione di operare con attenzione.
(9) Come, per esempio, nell'ambito della normativa ONU sui trasporti.
(10) L'acido va titolato prima del test per confermarne la concentrazione.
(11) Ad es.: nello studio di cui alla voce bibliografica 1 vengono usati acido perclorico al 50 % (p/p) e clorato di sodio al 40 % (p/p).
(12) Ad es. Whatman Column Chromatographic Cellulose Powder CF 11, numero catalogo 4021 050.
(13) Confermato (ad esempio) con titolazione di Karl-Fisher.
(14) In alternativa è possibile ottenere questo livello di umidità mediante (ad esempio) riscaldamento a 105 oC sotto vuoto per 24 h.
(15) Le miscele di ossidanti con cellulosa vanno trattate come potenzialmente esplosive e maneggiate con la dovuta cautela.
(16) In pratica occorre preparare una miscela 1:1 di liquido da esaminare e cellulosa in una quantità superiore a quella necessaria per il test e poi trasferirne 5 ±0,1 g nel recipiente a pressione. La miscela deve essere preparata fresca per ciascun test.
(17) In particolare occorre evitare il contatto fra le spire adiacenti della bobina.
(18) Vedi voce bibliografica (1) per la classificazione in base al regime di trasporto ONU.
(19) Le soluzioni sature vanno preparate a 20 oC.
(20) Valore medio da studi comparativi interlaboratorio.
(21) Pressione massima di 2 070 kPa non raggiunta.
(22) Vedi voce bibliografica 1 per l'interpretazione dei risultati in base alla normativa ONU sui trasporti con varie sostanze di riferimento.
PARTE B: METODI PER LA DETERMINAZIONE DELLA TOSSICITÀ E DEGLI ALTRI EFFETTI SULLA SALUTE
INDICE
INTRODUZIONE GENERALE
|
B.1 bis.
|
TOSSICITÀ ORALE ACUTA — METODO A DOSE FISSA |
|
B.1 ter.
|
TOSSICITÀ ACUTA PER VIA ORALE — METODO DELLA CLASSE DI TOSSICITÀ ACUTA |
|
B.2.
|
TOSSICITÀ ACUTA PER INALAZIONE |
|
B.3.
|
TOSSICITÀ ACUTA PER VIA CUTANEA |
|
B.4.
|
TOSSICITÀ ACUTA: IRRITAZIONE/CORROSIONE CUTANEA |
|
B.5.
|
TOSSICITÀ ACUTA: IRRITAZIONE/CORROSIONE OCULARE |
|
B.6.
|
SENSIBILIZZAZIONE CUTANEA |
|
B.7.
|
TOSSICITÀ A DOSE RIPETUTA (28 GIORNI) PER VIA ORALE |
|
B.8.
|
TOSSICITÀ A DOSE RIPETUTA (28 GIORNI) PER INALAZIONE |
|
B.9.
|
TOSSICITÀ A DOSE RIPETUTA (28 GIORNI) PER VIA CUTANEA |
|
B.10.
|
MUTAGENICITÀ — TEST IN VITRO DI ABERRAZIONE CROMOSOMICA NEI MAMMIFERI |
|
B.11.
|
MUTAGENICITÀ — TEST IN VIVO DI ABERRAZIONE CROMOSOMICA SUL MIDOLLO OSSEO DI MAMMIFERI |
|
B.12.
|
MUTAGENICITÀ — TEST IN VIVO SUI MICRONUCLEI NEGLI ERITROCITI DI MAMMIFERO |
|
B.13/14.
|
MUTAGENICITÀ — TEST DI REVERSIONE SU BATTERI |
|
B.15.
|
SAGGIO DI MUTAGENESI E PRESCREENING DI CANCEROGENESI MUTAZIONE GENICA: SACCHAROMYCES CEREVISIAE
|
|
B.16.
|
RICOMBINAZIONE MITOTICA: SACCHAROMYCES CEREVISIAE
|
|
B.17.
|
MUTAGENICITÀ — TEST IN VITRO DI MUTAZIONE GENICA SU CELLULE DI MAMMIFERO |
|
B.18.
|
DANNO E RIPARAZIONE DEL DNA: SINTESI NON PROGRAMMATA DEL DNA — CELLULE DI MAMMIFERO IN VITRO
|
|
B.19.
|
SAGGIO DEGLI SCAMBI TRA CROMATIDI FRATELLI IN VITRO
|
|
B.20.
|
SAGGIO DEI LETALI RECESSIVI LEGATI AL SESSO: DROSOPHILA MELANOGASTER
|
|
B.21.
|
SAGGIO IN VITRO DI TRASFORMAZIONE DI CELLULE DI MAMMIFERO |
|
B.22.
|
SAGGIO DEI LETALI DOMINANTI NEI RODITORI |
|
B.23.
|
TEST DI ABERRAZIONE CROMOSOMICA SUGLI SPERMATOGONI DI MAMMIFERO |
|
B.24.
|
SAGGIO DELLE MACCHIE (SPOT TEST): TOPI |
|
B.25.
|
TRASLOCAZIONI EREDITABILI: TOPO |
|
B26.
|
TEST DI TOSSICITÀ ORALE SUBCRONICA STUDIO DELLA TOSSICITÀ ORALE CON SOMMINISTRAZIONE RIPETUTA DI DOSI PER 90 GIORNI SUI RODITORI |
|
B.27.
|
TEST DI TOSSICITÀ ORALE SUBCRONICA STUDIO DELLA TOSSICITÀ ORALE CON SOMMINISTRAZIONE RIPETUTA DI DOSI PER 90 GIORNI SUI NON RODITORI |
|
B.28
|
SAGGIO DI TOSSICITÀ CUTANEA SUBCRONICA SAGGIO CON SOMMINISTRAZIONE CUTANEA RIPETUTA DI DOSI PER 90 GIORNI USANDO SPECIE DI RODITORI |
|
B.29
|
SAGGIO DI TOSSICITÀ SUBCRONICA INALATORIA SAGGIO CON SOMMINISTRAZIONE INALATORIA RIPETUTA DI DOSI PER 90 GIORNI USANDO SPECIE DI RODITORI |
|
B.30
|
SAGGIO DI TOSSICITÀ CRONICA |
|
B.31.
|
STUDIO DI TOSSICITÀ PRENATALE |
|
B.32
|
SAGGIO DI CANCEROGENESI |
|
B.33
|
SAGGIO COMBINATO DI TOSSICITÀ CRONICA/CANCEROGENESI |
|
B.34.
|
SAGGIO DI TOSSICITÀ SULLA RIPRODUZIONE: UNA GENERAZIONE |
|
B.35.
|
STUDIO DI TOSSICITÀ RIPRODUTTIVA A DUE GENERAZIONI |
|
B.37.
|
NEUROTOSSICITÀ RITARDATA DI SOSTANZE ORGANOFOSFORICHE DOPO ESPOSIZIONE ACUTA |
|
B.38.
|
NEUROTOSSICITÀ RITARDATA DI SOSTANZE ORGANOFOSFORICHE: STUDIO CON SOMMINISTAZIONE RIPETUTA PER 28 GIORNI |
|
B.39.
|
TEST IN VIVO DI SINTESI NON PROGRAMMATA DI DNA (UDS) SU CELLULE EPATICHE DI MAMMIFERO |
|
B.40.
|
CORROSIONE CUTANEA IN VITRO: TEST DI RESISTENZA ELETTRICA TRANSCUTANEA (TER) |
|
B.40bis.
|
CORROSIONE CUTANEA IN VITRO: TEST SU MODELLI DI PELLE UMANA |
|
B.41.
|
SAGGIO DI FOTOTOSSICITÀ IN VITRO 3T3 NRU |
|
B.42.
|
SENSIBILIZZAZIONE CUTANEA: LOCAL LYMPH NODE ASSAY |
|
B.43.
|
STUDI DI NEUROTOSSICITÀ NEI RODITORI |
|
B.44.
|
ASSORBIMENTO CUTANEO: METODO IN VIVO
|
|
B.45.
|
ASSORBIMENTO CUTANEO: METODO IN VITRO
|
INTRODUZIONE GENERALE
A. CARATTERIZZAZIONE DELLA SOSTANZA IN ESAME
Prima dell'inizio di qualsiasi studio di tossicità occorre conoscere la composizione della sostanza in esame, incluse le impurità principali e le proprietà fisico-chimiche pertinenti, compresa la stabilità.
Le proprietà fisico-chimiche della sostanza in esame forniscono informazioni importanti per la scelta della via di somministrazione, per la progettazione dei vari studi e per il trattamento e la conservazione della sostanza in esame.
L'elaborazione di un metodo analitico per la determinazione qualitativa e quantitativa della sostanza in esame (comprese, se possibile, le principali impurità) nel mezzo di dosaggio e nel materiale biologico deve precedere l'inizio dello studio.
Tutte le informazioni relative all'identificazione, alle proprietà fisico-chimiche, alla purezza e al comportamento della sostanza devono essere riportate nella relazione del saggio.
B. CURA DEGLI ANIMALI
Nei saggi di tossicità è indispensabile esercitare un rigoroso controllo delle condizioni ambientali e utilizzare tecniche adeguate per la cura degli animali.
(i) Condizioni di alloggiamento
Le condizioni ambientali nei locali o nei recinti degli animali da laboratorio devono essere appropriate per le specie sperimentali. Per ratti, topi e porcellini d'India è indicata una temperatura ambiente di 22 oC ±3 oC con un'umidità relativa del 30-70 %. Per i conigli, la temperatura deve essere di 20 ± 3 oC con un'umidità relativa del 30-70 %.
Talune tecniche sperimentali sono particolarmente sensibili agli effetti della temperatura e, in tali casi, la descrizione del metodo di saggio comprende indicazioni precise sulle condizioni adeguate. In tutti gli studi di tossicità, la temperatura e l'umidità devono essere controllate, registrate e riportate nella relazione finale dello studio.
L'illuminazione deve essere artificiale ed alternare 12 ore di luce e 12 ore di oscurità. Le condizioni di illuminazione devono essere dettagliatamente registrate e riportate nella relazione finale dello studio.
Salvo nel caso in cui venga diversamente specificato nel metodo, gli animali dovranno essere alloggiati in gabbie individuali o contenenti piccoli gruppi dello stesso sesso. In questo caso il numero degli animali non dovrà essere superiore a cinque.
Nelle relazioni sugli esperimenti effettuati su animali dovranno essere indicati il tipo di gabbie utilizzate e il numero di animali alloggiati in ogni gabbia sia durante l'esposizione alla sostanza chimica che durante tutto il periodo successivo di osservazione.
(ii) Condizioni di alimentazione
La dieta deve soddisfare tutte le esigenze nutrizionali della specie utilizzata per il saggio. Qualora le sostanze in esame vengano somministrate agli animali nella loro dieta, il valore nutrizionale degli alimenti potrebbe essere ridotto per effetto dell'interazione tra la sostanza ed un costituente dietetico. Nell'interpretazione dei risultati dei saggi si dovrà tener conto di questa possibilità. Gli animali potranno essere nutriti con diete convenzionali da laboratorio ed abbeverati con acqua a sazietà. La scelta della dieta potrà essere condizionata dalla necessità di garantire un apporto adeguato della sostanza in esame, qualora essa venga somministrata con gli alimenti.
I contaminanti dietetici suscettibili di influenzare la tossicità non dovrebbero essere presenti in condizioni tali da causare interferenze.
C. METODI ALTERNATIVI
L'Unione europea è impegnata a sviluppare e collaudare tecniche alternative che consentano di ottenere lo stesso livello di informazioni degli attuali esperimenti su animali, riducendo tuttavia il numero di animali utilizzati e le sofferenze ad essi inflitte o evitando del tutto il ricorso agli animali.
Non appena perfezionati, tali metodi dovranno costituire, ove possibile, la scelta d'elezione per gli studi miranti alla caratterizzazione dei rischi e alla conseguente classificazione ed etichettatura delle sostanze in funzione dei rischi intrinseci.
D. VALUTAZIONE E INTERPRETAZIONE
Nella valutazione ed interpretazione dei saggi occorre tener conto dei limiti entro i quali i risultati di studi su animali e in vitro possono essere estrapolati direttamente all'uomo; laddove si abbia evidenza di effetti avversi per l'uomo, questa potrà essere utilizzata per confermare i risultati sperimentali.
E. RIFERIMENTI BIBLIOGRAFICI
La maggior parte di detti metodi è stata messa a punto nell'ambito del programma per la definizione di linee guida elaborato dall'OCSE in materia di saggi. Essi dovranno essere applicati in conformità con i principi delle buone pratiche di laboratorio allo scopo di garantire il più possibile il «reciproco riconoscimento dei dati».
Ulteriori informazioni sono reperibili nei riferimenti citati nelle linee guida dell'OCSE e nell'ampia letteratura esistente in materia.
B.1. bis. TOSSICITÀ ORALE ACUTA — METODO A DOSE FISSA
1. METODO
Questo metodo di prova è equivalente al metodo OCSE TG 420 (2001)
1.1. INTRODUZIONE
I metodi tradizionali di valutazione della tossicità acuta utilizzano come endpoint la morte degli animali. Nel 1984, la British Toxicology Society ha proposto un nuovo metodo, basato sulla somministrazione di una serie di dosi fisse (1), che invece di utilizzare come endpoint la morte degli animali prevede l'osservazione di segni evidenti di tossicità in seguito alla somministrazione di una dose facente parte di una serie prestabilita. In seguito a studi di validazione in vivo eseguiti nel Regno Unito (2) e a livello internazionale (3), il procedimento è stato adottato come metodo di prova nel 1992. Successivamente, le proprietà statistiche del metodo a dose fissa sono state oggetto di valutazione in una serie di studi basati sull'impiego di modelli matematici (4)(5)(6). Sia gli studi in vivo sia quelli di modellizzazione hanno dimostrato che il procedimento è riproducibile, utilizza un minor numero di animali provocando meno sofferenze rispetto ai metodi tradizionali, e permette di classificare le sostanze in maniera analoga agli altri metodi di prova della tossicità acuta.
Per indicazioni sulla scelta del metodo di prova più adatto per un determinato scopo, si rimanda alle linee guida OCSE sui test di tossicità orale acuta (7), che contengono ulteriori informazioni sull'esecuzione e sull'interpretazione del metodo di prova B.1 bis.
Il metodo prevede che nello studio principale si utilizzino solo dosi a moderata tossicità, evitando di somministrare dosi che possano avere un effetto letale. Inoltre non è necessario somministrare dosi che provocano notoriamente dolore e sofferenze gravi per effetto dell'azione corrosiva o fortemente irritante. Gli animali moribondi o che manifestano dolore evidente o segni di sofferenza grave e persistente devono essere sottoposti a eutanasia e ai fini dell'interpretazione dei risultati devono essere assimilati agli animali morti durante lo svolgimento del test. I criteri da applicare per decidere la soppressione degli animali moribondi o in stato di grave sofferenza sono oggetto di specifiche linee guida, che indicano anche come riconoscere i segni di morte prevedibile o imminente (8).
Il metodo fornisce informazioni sulla pericolosità della sostanza esaminata, permettendone la classificazione secondo il GHS (Global Harmonized System), sistema armonizzato su scala mondiale per la classificazione delle sostanze chimiche che causano tossicità acuta (9).
Prima di effettuare lo studio, il laboratorio che esegue il test deve consultare tutte le informazioni disponibili sulla sostanza di prova, tra cui l'identità e la struttura chimica, le proprietà chimico-fisiche, i risultati di eventuali altri test di tossicità in vitro o in vivo eseguiti sulla sostanza, i dati tossicologici su sostanze strutturalmente affini, l'impiego o gli impieghi previsti. Queste informazioni sono necessarie per provare a tutti i soggetti interessati l'adeguatezza del test per la protezione della salute umana e servono a scegliere la giusta dose iniziale.
1.2. DEFINIZIONI
Tossicità orale acuta: effetti avversi che si verificano in seguito alla somministrazione orale di una singola dose o di più dosi di una sostanza nell’arco di 24 ore.
Morte tardiva: termine usato per indicare che l’animale non muore né appare moribondo nelle 48 ore successive alla somministrazione, ma muore successivamente, durante il periodo di osservazione di 14 giorni.
Dose: quantità di sostanza somministrata. Viene espressa in peso della sostanza di prova per unità di peso dell’animale sottoposto al test (ad es. mg/kg).
Tossicità manifesta: termine generale che indica la presenza di chiari segni di tossicità in seguito alla somministrazione della sostanza di prova [per alcuni esempi, cfr. (3)], tali da far prevedere alla dose fissa immediatamente superiore manifestazioni di dolore intenso e segni persistenti di grave sofferenza, uno stato di agonia [i criteri che definiscono tale stato sono illustrati nelle linee guida OCSE citate in bibliografia al n. (8)] o la morte della maggior parte degli animali.
GHS (Globally Harmonized System): sistema armonizzato globale per la classificazione delle sostanze e delle miscele chimiche. Si tratta di un'iniziativa congiunta dell'OCSE (salute umana e ambiente), del Comitato di esperti delle Nazioni Unite sul trasporto delle merci pericolose (proprietà fisico-chimiche) e dell'Organizzazione internazionale del lavoro (comunicazione del rischio), coordinata dal programma IOMC per la gestione ottimale delle sostanze chimiche (Inter-organization programme for the sound management of chemicals).
Morte imminente: stato in cui si prevede l'agonia o la morte dell'animale prima della successiva osservazione in programma. Per i roditori tra i segni indicativi di morte imminente figurano le convulsioni, la posizione laterale o prona e il tremore [per maggiori indicazioni, cfr. le linee guida OCSE citate in bibliografia al n. (8)].
DL
50
(dose letale 50): la singola dose di sostanza, determinata statisticamente, capace di provocare la morte del 50 % degli animali a cui viene somministrata per via orale. Il valore della DL
50
viene espresso in peso della sostanza di prova per unità di peso dell'animale usato per il saggio (mg/kg).
Dose limite: dose corrispondente al limite superiore fissato per il test (2 000 o 5 000 mg/kg).
Stato di agonia: fase in cui l'animale è moribondo o non è in grado di sopravvivere, nemmeno se sottoposto a trattamento [per maggiori indicazioni, cfr. le linee guida OCSE citate in bibliografia al n.(8)].
Morte prevedibile: presenza di segni clinici, come ad esempio l'incapacità di raggiungere il cibo o l'acqua, che indicano che l'animale morirà prima della conclusione programmata dell'esperimento [per maggiori indicazioni, cfr. le linee guida OCSE citate in bibliografia al n. (8)].
1.3. PRINCIPIO DEL METODO DI PROVA
La sostanza viene somministrata a gruppi di animali dello stesso sesso seguendo un procedimento articolato in più fasi successive che prevede la somministrazione di dosi fisse di 5, 50, 300 e 2 000 mg/kg (in casi eccezionali può essere prevista una dose fissa aggiuntiva di 5 000 mg/kg: cfr. punto 1.6.2). Il livello di dose iniziale è scelto sulla base di uno studio di osservazione, ed è la dose alla quale si prevede che si manifestino alcuni segni di tossicità, senza tuttavia causare effetti tossici gravi o la morte degli animali. I segni clinici e le condizioni associate a dolore, sofferenza e morte imminente sono descritti in apposite linee guida OCSE (8). A seconda della presenza o dell'assenza di segni di tossicità o mortalità, la sostanza in esame può essere somministrata ad altri gruppi di animali a dosi superiori o inferiori. La procedura prosegue fino a quando viene identificata la dose che causa tossicità manifesta o la morte di un solo animale o fino alla somministrazione della dose più elevata, se non vengono riscontrati effetti, mentre viene immediatamente interrotta se si verificano decessi alla dose più bassa.
1.4. DESCRIZIONE DEL METODO DI PROVA
1.4.1. Scelta delle specie animale
È preferibile utilizzare il ratto, ma è possibile ricorrere anche ad altre specie di roditori. Normalmente vengono utilizzati animali di sesso femminile (7), perché la letteratura esistente sui test convenzionali DL50 indica che, pur non essendovi grandi differenze di sensibilità tra i due sessi, nei casi in cui sono state osservate differenze in genere le femmine sono risultate leggermente più sensibili (10). Tuttavia se le informazioni disponibili sulle proprietà tossicologiche o tossicocinetiche di sostanze chimiche strutturalmente affini indicano la probabilità che i maschi siano più sensibili delle femmine, si devono utilizzare animali di sesso maschile. In quest'ultimo caso, occorre fornire un'adeguata giustificazione.
Si devono utilizzare animali adulti giovani e sani, appartenenti a ceppi comunemente usati in laboratorio. Le femmine devono essere nullipare e non gravide. All'inizio del trattamento ciascun animale deve avere un'età compresa tra 8 e 12 settimane ed un peso del ± 20 % del peso medio degli animali a cui è già stata somministrata la sostanza.
1.4.2. Condizioni di stabulazione e di alimentazione
La temperatura dello stabulario deve essere di 22 oC (± 3 oC). L'umidità relativa deve essere preferibilmente del 50-60 %; in ogni caso non deve essere inferiore al 30 % e possibilmente non superiore al 70 %, tranne durante la pulizia dei locali. L'illuminazione deve essere artificiale, alternando 12 ore di luce e 12 ore di oscurità. Per l'alimentazione si possono utilizzare diete convenzionali da laboratorio con acqua ad libitum. Nelle gabbie, gli animali possono essere raggruppati in funzione della dose somministrata, ma il numero di animali per gabbia non deve impedire la corretta osservazione di ciascun esemplare.
1.4.3. Preparazione degli animali
Gli animali sono scelti in modo casuale, marchiati per consentire l'individuazione dei singoli esemplari e tenuti nelle gabbie per almeno 5 giorni prima dell'inizio del trattamento, in modo da consentirne l'acclimatazione alle condizioni di laboratorio.
1.4.4. Preparazione delle dosi
In genere la sostanza di prova va somministrata a volume costante per tutte le dosi, variando la concentrazione del preparato da somministrare. Tuttavia, se il test viene eseguito su prodotti o miscele allo stato liquido, ai fini della valutazione del rischio può essere opportuno usare la sostanza non diluita, cioè a concentrazione costante; alcune autorità di regolamentazione impongono obbligatoriamente l'uso della sostanza non diluita. In ogni caso, non deve essere superato il volume massimo della dose somministrabile. Il volume massimo di liquido somministrabile in una sola volta dipende dalla taglia dell'animale, e nei roditori non deve di norma superare 1 ml/100 g di peso corporeo, tranne nel caso delle soluzioni acquose, per le quali si possono prevedere 2 ml/100 g di peso corporeo. Quanto alla formulazione del preparato da somministrare, si raccomanda di usare ove possibile una soluzione/sospensione/emulsione acquosa, seguita in ordine di preferenza da una soluzione/sospensione/emulsione in olio (per esempio olio di mais) e infine da una soluzione in altri veicoli. Per i veicoli diversi dall'acqua devono essere note le caratteristiche tossiche. Le dosi devono essere preparate poco prima della somministrazione, tranne nel caso in cui la stabilità del preparato nell'arco del periodo di utilizzo sia nota e ritenuta accettabile.
1.5. PROCEDIMENTO
1.5.1. Somministrazione delle dosi
La sostanza da esaminare viene somministrata in un'unica dose mediante sonda gastrica o apposita cannula per intubazione. Nel remoto caso in cui non sia possibile somministrare l'intera quantità in un'unica dose, ques'ultima può essere frazionata e somministrata in un arco di tempo non superiore a 24 ore.
Prima della somministrazione della sostanza gli animali devono essere tenuti a digiuno (ad esempio, l'alimentazione, a esclusione dell'acqua, deve essere sospesa a partire dalla sera precedente per i ratti e per 3-4 ore nei topi). Dopo il periodo di digiuno, si pesano gli animali e si somministra la sostanza da esaminare. A somministrazione avvenuta, l'alimentazione può essere sospesa per altre 3-4 ore nei ratti o 1-2 ore nei topi. Qualora la dose venga frazionata e somministrata nell'arco di un certo periodo di tempo, a seconda della durata del periodo di somministrazione può essere necessario alimentare e abbeverare gli animali.
1.5.2. Studio di osservazione
Lo scopo dello studio di osservazione è di consentire la scelta della giusta dose iniziale per lo studio principale. La sostanza in esame viene somministrata in maniera sequenziale a singoli animali, secondo il diagramma di flusso riportato nell'allegato 1. Lo studio di osservazione si conclude quando è possibile decidere la dose iniziale da utilizzare nello studio principale (o se la dose fissa più bassa provoca la morte di un animale).
La dose iniziale da utilizzare nello studio di osservazione, scelta tra i livelli di dose fissi di 5, 50, 300 e 2 000 mg/kg, è la dose che si prevede possa provocare tossicità manifesta sulla base, ove possibile, di dati in vivo e in vitro relativi alla stessa sostanza chimica e a sostanze di struttura affine. In mancanza di questi dati, si utilizza una dose iniziale di 300 mg/kg.
Tra le somministrazioni a ciascun animale devono trascorrere almeno 24 ore. Tutti gli animali devono essere tenuti in osservazione per almeno 14 giorni.
In casi eccezionali, e solo se giustificato da specifiche esigenze normative, può essere previsto un ulteriore livello di dose fisso pari a 5 000 mg/kg (cfr. allegato 3). Per il benessere degli animali, si sconsiglia di effettuare sperimentazioni su animali alla dose stabilita per la categoria GHS 5 (2 000-5 000 mg/kg); l'utilizzo di questa dose va preso in considerazione solo se vi è una probabilità elevata che i risultati del test abbiano rilevanza diretta per la tutela della salute umana o animale o per la protezione dell'ambiente.
Se la somministrazione della dose fissa più bassa (5 mg/kg) provoca la morte dell'animale nel corso dello studio di osservazione, la procedura normale prevede l'interruzione dello studio e l'assegnazione della sostanza alla categoria GHS 1 (cfr. allegato 1). Tuttavia, qualora sia necessaria un'ulteriore conferma della classificazione, può essere utilizzata la seguente procedura supplementare facoltativa: la sostanza viene somministrata a un secondo animale alla dose di 5 mg/kg; se questo secondo animale muore, viene confermata la classificazione nella categoria GHS 1 e lo studio viene immediatamente interrotto; se invece sopravvive, la sostanza viene somministrata alla dose di 5 mg/kg a non più di altri tre animali. A causa dell'elevato rischio di mortalità, per proteggere gli animali la sostanza esaminata deve essere somministrata in maniera sequenziale. L'intervallo di tempo tra le somministrazioni ai diversi animali deve essere sufficiente ad accertare che l'animale trattato in precedenza riesca a sopravvivere. Se si verifica un secondo decesso, la sequenza deve essere immediatamente interrotta e la sostanza non deve essere somministrata ad altri animali. Dal momento che il verificarsi di un secondo decesso (indipendentemente dal numero di animali a cui è già stata somministrata la sostanza al momento dell'interruzione) rientra nel risultato A (2 o più decessi), si applica la regola di classificazione di cui all'allegato 2 alla dose fissa di 5 mg/kg (categoria 1 se vi sono 2 o più morti o categoria 2 se c'è un'unica morte). L'allegato 4 riporta la classificazione prevista dal sistema UE in attesa dell'applicazione del nuovo sistema GHS.
1.5.3. Studio principale
1.5.3.1. Numero di animali e livelli di dose
I diagrammi di flusso di cui all'allegato 2 illustrano le tappe da seguire dopo la somministrazione del livello di dose iniziale. Vi sono tre possibilità: interrompere il test e assegnare la sostanza alla classe di rischio appropriata; effettuare il test a una dose fissa superiore; effettuare il test a una dose fissa inferiore. Tuttavia, per salvaguardare gli animali, se un livello di dose ha causato la morte di un animale durante lo studio di osservazione, questo livello non deve più essere utilizzato nello studio principale (cfr. allegato 2). L'esperienza indica che dopo la somministrazione del livello di dose iniziale in genere è possibile classificare la sostanza senza bisogno di effettuare ulteriori test.
Per ciascun livello di dose, normalmente si usano in tutto cinque animali dello stesso sesso: l'animale a cui nello studio di osservazione è stato somministrato lo stesso livello di dose, più altri quattro animali (tranne nel caso remoto in cui un livello di dose utilizzato nello studio principale non sia stato incluso nello studio di osservazione).
L'intervallo di tempo tra le somministrazioni dei vari livelli di dose ai diversi animali viene determinato in funzione della comparsa, della durata e della gravità dei segni di tossicità, avendo cura di procedere alla somministrazione della dose successiva solo una volta accertata la sopravvivenza degli animali trattati precedentemente. Si consiglia di far trascorrere, se necessario, 3 o 4 giorni tra le somministrazioni per consentire l'osservazione di eventuali segni di tossicità tardiva. L'intervallo di tempo può essere modificato secondo necessità, ad esempio in caso di risposte non convincenti.
Quando si prevede di utilizzare una dose fissa superiore di 5 000 mg/kg, è necessario attenersi alla procedura descritta nell'allegato 3 (cfr. anche punto 1.6.2).
1.5.3.2. Saggio limite
Il saggio limite viene utilizzato principalmente quando lo sperimentatore dispone di informazioni che indicano che la sostanza in esame non è probabilmente tossica, cioè causa tossicità solo in dosi superiori alle dosi limite previste per legge. Le informazioni sulla tossicità della sostanza in esame possono essere ricavate da test su composti, miscele o prodotti simili, tenendo conto dell'identità e della percentuale dei componenti dei quali è nota la rilevanza tossicologica. Se le informazioni sulla tossicità della sostanza sono scarse o nulle o si prevede che la sostanza in esame sia tossica occorre eseguire lo studio principale.
Ai fini delle presenti linee-guida, per il saggio limite si utilizza, seguendo il procedimento normale, una dose iniziale di 2 000 mg/kg (o in casi eccezionali 5 000 mg/kg) nello studio di osservazione, quindi si somministra la stessa dose ad altri quattro animali.
1.6. OSSERVAZIONI
Dopo la somministrazione, gli animali sono esaminati individualmente almeno una volta nei primi 30 minuti, quindi periodicamente nelle prime 24 ore, prestando particolare attenzione alle prime 4 ore, e successivamente una volta al giorno per 14 giorni, a meno che non muoiano o non sia necessario ritirarli dallo studio e sottoporli a eutanasia per risparmiare loro sofferenze eccessive. Tuttavia, la durata del periodo di osservazione non è tassativa, ma va stabilita in funzione della natura delle reazioni tossiche, del momento della loro comparsa e dei tempi di recupero e può quindi essere prolungata in caso di necessità. Un parametro importante è rappresentato dal momento della comparsa e della scomparsa dei segni di tossicità, soprattutto se questi ultimi tendono ad apparire tardivamente (11). Tutte le osservazioni devono essere sistematicamente registrate su schede individuali per ogni animale.
Qualora gli animali presentino segni persistenti di tossicità sono necessarie ulteriori osservazioni, che devono riguardare le modificazioni della cute e del pelo, degli occhi e delle mucose, del sistema respiratorio e circolatorio, del sistema nervoso autonomo e centrale, dell'attività somatomotoria e del comportamento. Particolare attenzione deve essere rivolta all'osservazione di tremori, convulsioni, salivazione, diarrea, letargia, sonno e coma. Si devono tenere in considerazione i principi e i criteri riassunti nelle linee guida OCSE citate in bibliografia al punto (8). Gli animali agonizzanti o che manifestano dolore intenso o segni di sofferenza grave e persistente devono essere sottoposti a eutanasia. Nel caso di animali sottoposti a eutanasia o rinvenuti morti, occorre registrare con la massima precisione possibile il momento del decesso.
1.6.1. Peso corporeo
1 singoli animali devono essere pesati poco prima della somministrazione della sostanza di prova e in seguito almeno una volta alla settimana. Occorre calcolare e registrare le variazioni ponderali. Al termine del test, gli animali sopravvissuti devono essere pesati prima di essere sottoposti a eutanasia.
1.6.2. Esame patologico
Tutti gli animali utilizzati (compresi quelli che muoiono nel corso del test e quelli che sono ritirati dallo studio per risparmiare loro eccessive sofferenze) devono essere sottoposti a necroscopia macroscopica. Per ogni animale devono essere registrate tutte le modificazioni patologiche di rilievo. Per gli animali sopravvissuti almeno 24 ore, può essere opportuno l'esame microscopico degli organi recanti alterazioni patologiche evidenti, che potrebbe fornire indicazioni utili.
2. DATI
Occorre fornire risultati individuali per ciascun animale. Tutti i dati devono essere riassunti in una tabella nella quale devono essere indicati per ciascun gruppo sottoposto al test il numero di animali utilizzati, il numero di animali che hanno manifestato segni di tossicità, il numero di animali rinvenuti morti durante il test o sottoposti a eutanasia, il momento del decesso di ciascun animale, la descrizione degli effetti tossici, il loro decorso e l'eventuale reversibilità e i risultati della necroscopia.
3. PRESENTAZIONE DEI DATI
3.1. RAPPORTO DI PROVA
Il rapporto di prova deve contenere le seguenti informazioni, a seconda dei casi:
|
|
Sostanza di prova:
|
—
|
natura fisica, purezza e (se pertinenti) proprietà fisico-chimiche (compresa 1'isomerizzazione),
|
|
—
|
dati identificativi, compreso il numero CAS.
|
|
|
|
Veicolo (se pertinente):
|
—
|
motivazione della scelta del veicolo utilizzato, se diverso dall'acqua.
|
|
|
|
Animali da esperimento:
|
—
|
specie/ceppo utilizzato,
|
|
—
|
condizioni microbiologiche degli animali, qualora siano note,
|
|
—
|
numero, età e sesso degli animali (compresa l'eventuale giustificazione dell'uso di esemplari maschi anziché femmine),
|
|
—
|
provenienza, condizioni di stabulazione, dieta ecc.
|
|
|
|
Condizioni del test:
|
—
|
informazioni dettagliate sulla formulazione della sostanza di prova, comprese informazioni sullo stato fisico del preparato somministrato,
|
|
—
|
modalità di somministrazione della sostanza di prova, compreso il volume delle dosi e l'orario di somministrazione,
|
|
—
|
informazioni dettagliate sulla qualità del cibo e dell'acqua (compresi tipo di dieta/provenienza degli alimenti, provenienza dell'acqua),
|
|
—
|
motivazione della scelta della dose iniziale.
|
|
|
|
Risultati:
|
—
|
tabella con risposta e livello di dose per ciascun animale (animali che manifestano segni di tossicità, mortalità compresa; natura, gravità e durata degli effetti),
|
|
—
|
tabella del peso corporeo e delle variazioni ponderali,
|
|
—
|
peso dei singoli animali nel giorno della somministrazione, e in seguito ad intervalli di una settimana e al momento della morte o del sacrificio,
|
|
—
|
data e ora della morte, se questa avviene prima del sacrificio programmato,
|
|
—
|
momento della comparsa dei segni di tossicità, decorso ed eventuale reversibilità per ciascun animale,
|
|
—
|
referto necroscopico e referto istopatologico per ciascun animale, se disponibili.
|
|
|
|
Discussione e interpretazione dei risultati.
|
4. RIFERIMENTI BIBLIOGRAFICI
|
(1)
|
British Toxicology Society Working Party on Toxicity (1984). Special report: a new approach to the classification of substances and preparations on the basis of their acute toxicity. Human Toxicol., 3, 85-92.
|
|
(2)
|
Van den Heuvel, M.J., Dayan, A.D. and Shillaker, R.O. (1987). Evaluation of the BTS approach to the testing of substances and preparations for their acute toxicity. Human Toxicol., 62, 79-291.
|
|
(3)
|
Van den Heuvel, M.J., Clark, D.G., Fielder, R.J., Koundakjian, P.P., Oliver, G.J.A., Pelling, D., Tomlinson, N.J. and Walker, A.P. (1990). The international validation of a fixed-dose procedure as an alternative to the classical LD50 test. Fd. Chem. Toxicol. 28, 469-482.
|
|
(4)
|
Whitehead, A. and Curnow, R.N. (1992). Statistical evaluation of the fixed-dose procedure. Fd. Chem. Toxicol., 30, 313-324.
|
|
(5)
|
Stallard, N. and Whitehead, A. (1995). Reducing numbers in the fixed-dose procedure. Human Exptl. Toxicol. 14, 315-323. Human Exptl. Toxicol.
|
|
(6)
|
Stallard, N., Whitehead, A. and Ridgeway, P. (2002). Statistical evaluation ofthe revised fixed dose procedure. Hum. Exp. Toxicol., 21, 183-196.
|
|
(7)
|
OECD (2001). Guidance Document on Acute Oral Toxicity Testing. Environmental Health and Safety Monograph Series on Testing and Assessment N. 24. Paris
|
|
(8)
|
OECD (2000). Guidance Document on the Recognition, Assessment and Use ofClinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Monograph Series on Testing and Assessment N. 19.
|
|
(9)
|
OECD (1998). Harmonised Integrated Hazard Classification for Human Health and Environmental Effects of Chemical Substances, Approvato alla 28a riunione congiunta del Chemicals Committee e del Working Party on Chemicals nel novembre 1998, parte 2, pag. 11 [http://webnet1.oecd.org/oecd/pages/home/displaygeneral/0,3380,EN-documents-521-14-no-24-no- 0,FF.html].
|
|
(10)
|
Lipnick, R.L., Cotruvo, J.A., Hill, R.N., Bruce, R.D., Stitzel, K.A., Walker, A.P., Chu, I., Goddard, M., Segal, L., Springer, J.A. and Myers, R.C. (1995). Comparison of the Up-and-Down, Conventional LD50, and Fixed-Dose Acute Toxicity Procedures. Fd. Chem. Toxicol. 33, 223-231.
|
|
(11)
|
Chan P.K and A.W. Hayes (1994) Cap. 16 Acute Toxicity and Eye Irritation, in A.W. Hayes (a cura di), Principles and Methods of Toxicology, terza edizione, Raven Press, Ltd. New York, USA.
|
ALLEGATO 1:
DIAGRAMMA DI FLUSSO DELLO STUDIO DI OSSERVAZIONE


ALLEGATO 2:
DIAGRAMMA DI FLUSSO DELLO STUDIO PRINCIPALE

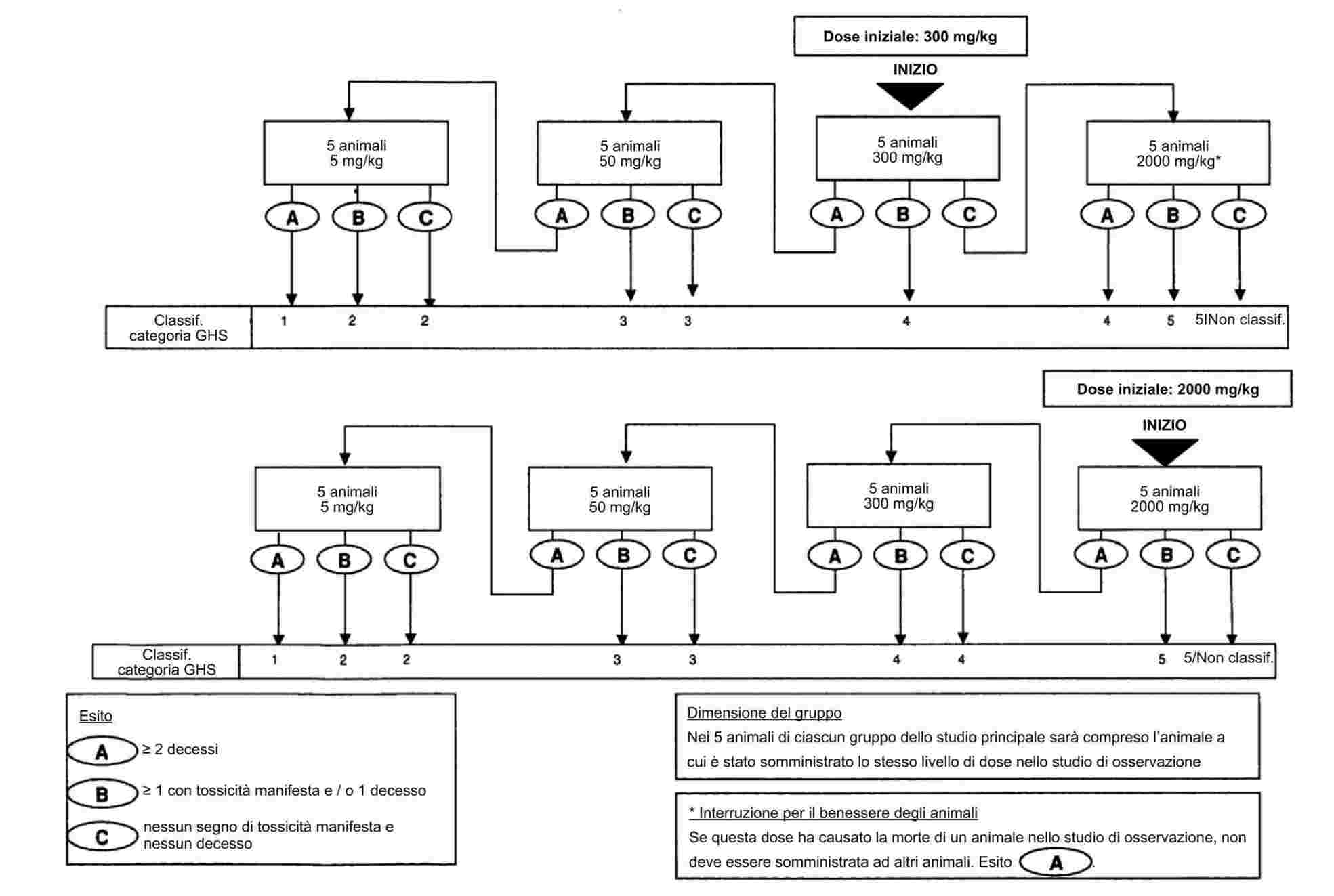
Allegato 3
CRITERI PER LA CLASSIFICAZIONE DI SOSTANZE CON VALORI PREVISTI DI LD50 SUPERIORI A 2 000 MG/KG PER LE QUALI NON È NECESSARIO ESEGUIRE IL TEST DI TOSSICITÀ
I criteri relativi alla categoria di rischio 5 servono a consentire l'identificazione di sostanze che presentano un rischio di tossicità acuta relativamente basso ma che in determinate circostanze possono rappresentare un pericolo per popolazioni vulnerabili. Si tratta di sostanze per le quali è prevista una DL50 orale o cutanea compresa fra 2 000 e 5 000 mg/kg o dosi equivalenti per altre vie di somministrazione. Una sostanza può essere classificata nella categoria di rischio definita da: 2 000 mg/kg < DL50 < 5 000 mg/kg (categoria 5 nel GHS) nei seguenti casi:
|
a)
|
se uno qualsiasi degli schemi di cui all'allegato 2 porta a inserire tale sostanza in questa categoria, sulla base delle incidenze di mortalità;
|
|
b)
|
se sono già disponibili prove attendibili che indicano che la DL50 si situa nell'intervallo di valori della categoria 5 o se altri studi su animali o sugli effetti tossici nell'uomo indicano un rischio di tossicità acuta per la salute umana;
|
|
c)
|
per estrapolazione, stima o misurazione di dati se non è giustificata l'assegnazione ad una classe di rischio superiore, e se:
|
—
|
sono disponibili informazioni attendibili che indicano effetti tossici significativi nell'uomo, o
|
|
—
|
si osserva mortalità nei test eseguiti fino ai valori della categoria 4 per via orale, o
|
|
—
|
i pareri degli esperti confermano segni clinici significativi di tossicità nei test eseguiti fino ai valori della categoria 4, a esclusione di diarrea, piloerezione o aspetto non tolettato, o
|
|
—
|
i pareri degli esperti confermano l'esistenza di informazioni attendibili, ricavate dagli altri studi su animali, che indicano potenziali effetti acuti significativi.
|
|
ESECUZIONE DEL TEST A DOSI SUPERIORI A 2 000 MG/KG
In casi eccezionali, e solo se specifiche esigenze normative lo giustificano, può essere previsto un ulteriore livello di dose fisso superiore pari a 5 000 mg/kg. Al fine di proteggere gli animali, si sconsiglia di utilizzare la dose di 5 000 mg/kg, che va presa in considerazione solo nel caso in cui sia molto probabile che i risultati del test abbiano rilevanza diretta per la protezione della salute degli animali o degli esseri umani.
Studio di osservazione
Ai criteri decisionali che regolano la procedura sequenziale di cui all'allegato 1 viene aggiunto un livello di dose di 5 000 mg/kg. Di conseguenza, quando nello studio di osservazione si utilizza una dose iniziale di 5 000 mg/kg, in caso di esito A (decesso) si effettua il test su un secondo animale a 2 000 mg/kg; in caso di esito B o C (tossicità manifesta o nessun segno di tossicità) si può scegliere la dose di 5 000 mg/kg come dose iniziale per lo studio principale. Analogamente, se si utilizza una dose iniziale diversa da 5 000 mg/kg, in caso di esito B o C a 2 000 mg/kg si procede con la dose di 5 000 mg/kg; a tale dose, in caso di esito A si utilizza la dose di 2 000 mg/kg come dose iniziale per lo studio principale; in caso di esito B o C si utilizza la dose di 5 000 mg/kg
Studio principale
Ai criteri decisionali che regolano la procedura sequenziale di cui all'allegato 2 viene aggiunto un livello di dose di 5 000 mg/kg. Di conseguenza, quando nello studio principale si utilizza una dose iniziale di 5 000 mg/kg, in caso di esito A (≥ 2 decessi) è necessario effettuare il test su un secondo gruppo a 2 000 mg/kg; in caso di esito B (tossicità evidente e/o ≤ 1 decesso) o C (nessun segno di tossicità) la sostanza non viene classificata nel sistema GHS. Analogamente, se si utilizza una dose iniziale diversa da 5 000 mg/kg, in caso di esito C a 2 000 mg/kg si procede con la dose di 5 000 mg/kg; a tale dose, in caso di esito A la sostanza è assegnata alla categoria 5 GHS, in caso di esito B o C la sostanza non è classificata.
Allegato 4
METODO DI PROVA B.1 bis
Guida alla classificazione transitoria UE in attesa dell'effettiva attuazione del sistema di classificazione armonizzato su scala mondiale (GHS) [cfr. riferimento bibliografico n. (8)]
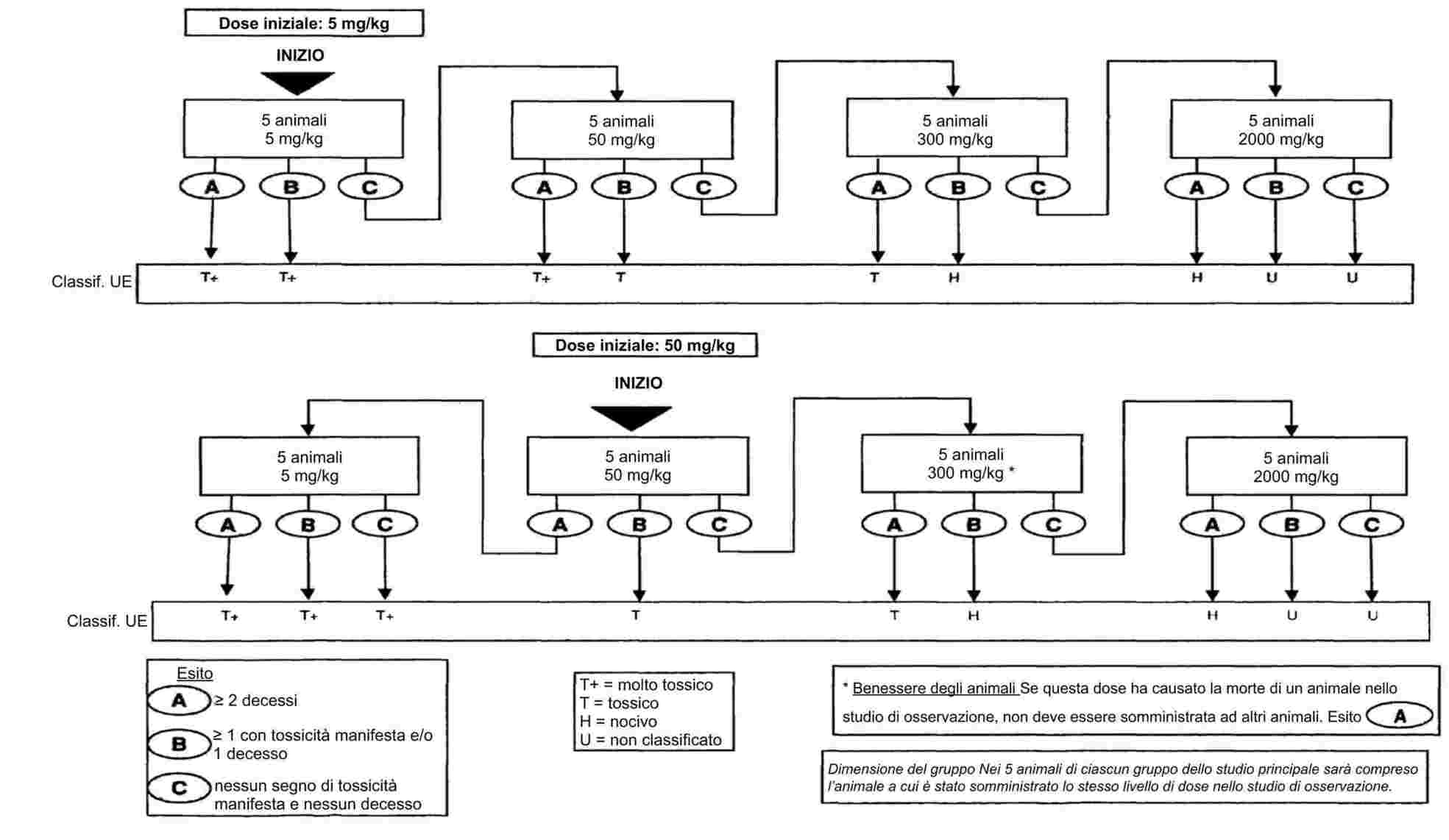

B.1ter. TOSSICITÀ ACUTA PER VIA ORALE — METODO DELLA CLASSE DI TOSSICITÀ ACUTA
1. METODO
Questo metodo di saggio è equivalente al metodo OCSE TG 423 (2001).
1.1 INTRODUZIONE
Il metodo della classe di tossicità acuta (1) qui descritto è un procedimento articolato in più fasi successive che prevede l'uso di 3 animali dello stesso sesso in ogni fase. In media, per valutare la tossicità acuta di una sostanza sono necessarie 2-4 fasi, in funzione del numero di animali morti e/o moribondi. Il procedimento è riproducibile, utilizza un numero molto limitato di animali e permette di classificare le sostanze in maniera analoga agli altri metodi di determinazione della tossicità acuta. Il metodo della classe di tossicità acuta si basa su valutazioni biometriche (2)(3)(4)(5) e utilizza dosi fisse, opportunamente separate, per consentire la classificazione della sostanza ai fini dell'assegnazione a una particolare categoria e della valutazione dei rischi. Il metodo, adottato nel 1996, è stato ampiamente convalidato in vivo mediante dati sulla DL50 ricavati dalla letteratura esistente, sia a livello nazionale (6) che a livello internazionale (7).
Per indicazioni sulla scelta del metodo di prova più adatto per scopi specifici, si rimanda al documento orientativo sui saggi di tossicità acuta per via orale dell'OCSE (8). Tale documento contiene anche ulteriori informazioni sull'applicazione e sull'interpretazione del metodo di saggio B.1 ter.
Non è necessario somministrare le sostanze da esaminare in dosi che provocano notoriamente dolore e sofferenze gravi per effetto delle proprietà corrosive o fortemente irritanti delle sostanze stesse. Ai fini dell'interpretazione dei risultati del saggio, gli animali moribondi o che manifestano segni evidenti di dolore o di sofferenza grave e persistente devono essere sottoposti a eutanasia e assimilati agli animali morti spontaneamente nel corso dell'esperimento. I criteri da applicare per decidere in merito al sacrificio degli animali moribondi o in stato di grave sofferenza sono oggetto di uno specifico documento orientativo, che riporta anche indicazioni su come riconoscere i segni di morte prevedibile o imminente (9).
Il metodo utilizza dosi prestabilite e i risultati che se ne ricavano permettono di classificare la sostanza esaminata conformemente al sistema armonizzato su scala mondiale (GHS) per la classificazione delle sostanze chimiche che causano tossicità acuta (10).
In linea di principio, il metodo non ha lo scopo di determinare una DL50 precisa, ma consente di stabilire range di esposizione verosimilmente letali: la morte di una certa percentuale di animali, infatti, costituisce ancora l'endpoint principale di questo saggio. Il metodo consente di determinare un valore di DL50 solo quando almeno due dosi provocano una mortalità superiore allo 0 % e inferiore al 100 %. L'uso di dosi prestabilite, indipendentemente dalla sostanza in esame, e la classificazione esplicitamente legata al numero di animali osservati in diversi stati favoriscono la congruenza e la ripetibilità dei dati presentati dai vari laboratori.
Il laboratorio che esegue il saggio deve consultare tutte le informazioni disponibili sulla sostanza in esame prima di effettuare lo studio. Tali informazioni devono riguardare quantomeno l'identità e la struttura chimica; le proprietà chimico-fisiche; i risultati di eventuali altri saggi di tossicità in vitro o in vivo eseguiti sulla sostanza; i dati tossicologici su sostanze di struttura affine; l'impiego o gli impieghi previsti. Queste informazioni sono necessarie per provare a tutti i soggetti interessati la rilevanza del saggio per la protezione della salute degli esseri umani, e sono utili per la scelta della dose iniziale più appropriata.
1.2 DEFINIZIONI
Tossicità acuta per via orale: effetti avversi che si verificano in seguito alla somministrazione orale di una singola dose di una sostanza o di più dosi nell'arco di 24 ore.
Morte tardiva: termine usato per indicare che l'animale non muore né appare moribondo nelle 48 ore successive alla somministrazione, ma muore successivamente nei 14 giorni del periodo di osservazione.
Dose: quantità di sostanza somministrata. Viene espressa in peso per unità di peso dell'animale usato per il saggio (p. es. mg/kg).
GHS: sistema armonizzato su scala mondiale per la classificazione delle sostanze chimiche e dei relativi miscugli. Si tratta di un'iniziativa congiunta dell'OCSE (salute degli esseri umani e ambiente), del Comitato di esperti delle Nazioni Unite sul trasporto delle sostanze pericolose (proprietà fisico-chimiche) e dell'ILO (comunicazione dei rischi), coordinata dal programma inter-organizzazioni per una gestione responsabile delle sostanze chimiche (IOMC).
Morte imminente: stato in cui si prevede che l'animale sarà moribondo o morto prima della successiva osservazione in programma. Nei roditori, tra i segni indicativi di morte imminente sono compresi convulsioni, posizione laterale o prona e tremore [per maggiori indicazioni, vedi il documento orientativo sugli endpoint non crudeli (9)].
DL
50
(dose letale mediana): la singola dose di sostanza, determinata statisticamente, che si prevede causi la morte del 50 % degli animali a cui viene somministrata per via orale. Il valore della DL50 viene espresso in peso per unità di peso dell'animale usato per il saggio (mg/kg).
Dose limite: dose corrispondente al limite superiore fissato per il saggio (2 000 o 5 000 mg/kg).
Moribondo: che sta morendo o non è in grado di sopravvivere, nemmeno se sottoposto a trattamento [per maggiori indicazioni, vedi il documento orientativo sugli endpoint non crudeli (9)].
Morte prevedibile: presenza di segni clinici, ad esempio incapacità di raggiungere il cibo o l'acqua, che indicano che l'animale morirà prima della conclusione programmata dell'esperimento [per maggiori indicazioni, vedi il documento orientativo sugli endpoint non crudeli (9)].
1.3 PRINCIPIO DEL METODO DI SAGGIO
Il metodo prevede l'applicazione di un procedimento articolato in fasi successive che richiede l'uso di un numero minimo di animali in ciascuna fase e permette di ricavare informazioni sufficienti per la classificazione della tossicità acuta della sostanza in esame. La sostanza viene somministrata per via orale a un gruppo di animali da laboratorio in una delle dosi prestabilite. Il saggio viene effettuato seguendo un procedimento in fasi successive; in ciascuna fase vengono utilizzati tre animali dello stesso sesso (normalmente femmine). In funzione della presenza o assenza di mortalità riferibile alla sostanza in esame tra gli animali trattati, per ciascuna fase si possono avere tre esiti diversi:
|
—
|
interruzione del saggio
|
|
—
|
somministrazione della sostanza ad altri tre animali, alla stessa dose
|
|
—
|
somministrazione della sostanza ad altri tre animali al livello di dose immediatamente superiore o inferiore.
|
Lo schema dettagliato del procedimento è riportato nell'allegato 1. Il metodo consente di valutare la sostanza allo scopo di assegnarla a una delle classi di tossicità definite da valori discriminanti fissi di DL50.
1.4 DESCRIZIONE DEL METODO
1.4.1 Scelta delle specie di animali
La specie di roditori da preferirsi è rappresentata dal ratto, ma è possibile utilizzare anche altre specie di roditori. Normalmente vengono utilizzati animali di sesso femminile (9), perché la letteratura esistente circa i saggi convenzionali sulla DL50 indica che, pur non essendovi grandi differenze di sensibilità tra i due sessi, nei casi in cui sono state osservate differenze in genere le femmine sono risultate leggermente più sensibili (11). Peraltro, se le informazioni disponibili sulle proprietà tossicologiche o tossicocinetiche di sostanze chimiche di struttura affine indicano che i maschi sono verosimilmente più sensibili delle femmine, si devono usare animali di sesso maschile. Qualora vengano usati animali di sesso maschile, se ne deve fornire un'adeguata motivazione.
Si devono utilizzare animali adulti giovani e sani appartenenti a ceppi comunemente usati in laboratorio. Le femmine devono essere nullipare e non gravide. Ciascun animale, all'inizio del trattamento, deve essere di età compresa fra 8 e 12 settimane e di peso del ± 20 % del peso medio di eventuali animali a cui è stata precedentemente somministrata la sostanza in esame.
1.4.2 Condizioni di stabulazione e di alimentazione
La temperatura dello stabulario deve essere di 22 oC (± 3 oC). L'umidità relativa deve essere preferibilmente del 50-60 %; in ogni caso deve essere non inferiore al 30 % e possibilmente non superiore al 70 %, tranne durante la pulizia dei locali. L'illuminazione deve essere artificiale e alternare 12 ore di luce e 12 ore di oscurità. Per l'alimentazione si possono utilizzare diete convenzionali da laboratorio con acqua ad libitum. Nelle gabbie, gli animali possono essere raggruppati in funzione della dose, ma il numero di animali per gabbia non deve essere tale da impedire la corretta osservazione di ciascun esemplare.
1.4.3 Preparazione degli animali
Gli animali devono essere scelti in modo casuale, marchiati per consentire l'individuazione dei singoli esemplari e tenuti nelle gabbie per almeno 5 giorni prima dell'inizio del trattamento, in modo da consentirne l'acclimatazione alle condizioni di laboratorio.
1.4.4 Preparazione delle dosi
In genere le somministrazioni delle sostanze in esame devono avere un volume costante per tutte le dosi oggetto del saggio; a questo scopo, si varia la concentrazione del preparato da somministrare. Tuttavia, se il saggio viene eseguito su prodotti o miscugli che si presentano in forma liquida, ai fini della successiva valutazione del rischio può essere opportuno usare la sostanza non diluita, cioè a concentrazione costante; peraltro, l'uso della sostanza non diluita è prescritto da alcune autorità di regolamentazione. In ogni caso, non si deve superare il volume massimo somministrabile. Il volume massimo di liquido somministrabile in una sola volta dipende dalla taglia dell'animale. Nei roditori, di norma non deve superare 1 ml/100 g di peso corporeo tranne nel caso delle soluzioni acquose, per le quali si possono prevedere 2 ml/100 g di peso corporeo. Quanto alla formulazione del preparato da somministrare, si raccomanda di usare ove possibile una soluzione/sospensione/emulsione acquosa oppure, in ordine di preferenza, una soluzione/sospensione/emulsione in olio (per esempio olio di mais) o una soluzione in altri veicoli. Nel caso in cui si utilizzino veicoli diversi dall'acqua, devono essere note le caratteristiche di tossicità degli stessi. Le dosi devono essere preparate poco prima della somministrazione, tranne nel caso in cui la stabilità del preparato nell'arco del periodo di utilizzo sia nota e si sia dimostrata accettabile.
1.5 PROCEDIMENTO
1.5.1 Somministrazione delle dosi
La sostanza da saggiare viene somministrata in un'unica dose mediante sonda gastrica o idonea cannula per intubazione. Nel caso infrequente in cui non sia possibile somministrare l'intera quantità in un'unica dose, si può procedere al frazionamento della stessa e alla somministrazione delle varie frazioni nell'arco di un periodo non superiore a 24 ore.
Gli animali devono essere tenuti a digiuno prima della somministrazione della sostanza (p. es. l'alimentazione, a esclusione dell'acqua, deve essere sospesa a partire dalla sera precedente nei ratti e per 3-4 ore nei topi). Dopo il periodo di digiuno, si pesano gli animali e si somministra la sostanza da esaminare. A somministrazione avvenuta, il cibo può essere sospeso per altre 3-4 ore nei ratti o 1-2 ore nei topi. Qualora la dose venga frazionata e somministrata nell'arco di un certo periodo di tempo, può essere necessario alimentare e abbeverare gli animali in misura adeguata alla durata del periodo di somministrazione.
1.5.2 Numero di animali e livelli di dose
Si utilizzano tre animali in ciascuna fase. La dose iniziale viene scelta fra quattro livelli fissi: 5, 50, 300 e 2 000 mg/kg di peso corporeo. Il livello di dose iniziale deve essere quello che con maggior probabilità provoca la morte di una parte degli animali trattati. I diagrammi di flusso dell'allegato 1 illustrano il procedimento da seguire per ciascuna delle dosi iniziali, mentre l'allegato 4 riporta indicazioni sulla classificazione secondo il sistema UE in attesa dell'applicazione del nuovo sistema GHS.
Qualora, alla luce delle informazioni disponibili, la mortalità risulti improbabile al livello di dose iniziale più elevato (2 000 mg/kg di peso corporeo), si deve fare ricorso a un saggio limite. In mancanza di informazioni su una sostanza da esaminare, per il benessere degli animali si raccomanda di utilizzare la dose iniziale di 300 mg/kg di peso corporeo.
L'intervallo di tempo tra il trattamento dei diversi gruppi viene determinato in funzione dell'esordio, della durata e della gravità dei segni di tossicità, avendo cura di procedere al trattamento degli animali alla dose successiva solo una volta accertata la sopravvivenza degli animali trattati precedentemente.
In casi eccezionali, e solo se specifiche esigenze normative lo giustificano, può essere previsto un ulteriore livello di dose fisso superiore pari a 5 000 mg/kg (vedi allegato 2). Per il benessere degli animali, si sconsiglia di effettuare sperimentazioni su animali alle dosi stabilite per la categoria GHS 5 (2 000-5 000 mg/kg); l'utilizzo di tali dosi è da prevedere solo se vi è una probabilità elevata che i risultati del saggio abbiano rilevanza diretta per la tutela della salute degli animali o dell'uomo o per la salvaguardia dell'ambiente.
1.5.3 Saggio limite
Il saggio limite viene utilizzato principalmente quando lo sperimentatore dispone di informazioni che indicano che la sostanza in esame è verosimilmente non tossica, cioè causa tossicità solo in dosi superiori alle dosi limite previste per legge. Le informazioni sulla tossicità della sostanza in esame possono essere ricavate da conoscenze su composti, miscugli o prodotti simili esaminati, tenendo conto dell'identità e della percentuale dei componenti dei quali è nota la rilevanza tossicologica. Nel caso in cui le informazioni sulla tossicità della sostanza siano scarse o nulle, o in cui ci si attenda che la sostanza in esame sia tossica, il saggio principale deve essere eseguito.
Il saggio limite si effettua con un unico livello di dose di 2 000 mg/kg di peso corporeo su sei animali (tre animali per fase). In casi eccezionali, si può utilizzare un unico livello di dose di 5 000 mg/kg su tre animali (vedi allegato 2). Se si osservano decessi riferibili alla sostanza in esame, può essere necessario eseguire un altro saggio al livello di dose immediatamente inferiore.
1.6 OSSERVAZIONE
Dopo la somministrazione, gli animali sono esaminati individualmente almeno una volta nei primi 30 minuti, quindi periodicamente nelle prime 24 ore, ponendo particolare attenzione nelle prime 4 ore, e successivamente una volta al giorno per 14 giorni in tutto, tranne nel caso in cui sia necessario ritirarli dallo studio e sottoporli a eutanasia per motivi legati al loro benessere, o nel caso in cui vengano rinvenuti morti. Tuttavia, la durata dell'osservazione non è tassativa, e va stabilita in funzione delle reazioni tossiche, del momento della loro insorgenza e della durata del periodo di recupero; se necessario, quindi, è possibile prolungarla. Un parametro importante è rappresentato dal momento della comparsa e della scomparsa dei segni di tossicità, soprattutto se negli animali è rilevabile una tendenza a manifestare segni di tossicità tardiva (12). Tutte le osservazioni devono essere sistematicamente registrate su schede individuali per ogni animale.
Ulteriori osservazioni sono necessarie qualora gli animali presentino segni persistenti di tossicità. Dette osservazioni devono comprendere le modificazioni della cute e del pelo, degli occhi e delle mucose, del sistema respiratorio e circolatorio, del sistema nervoso autonomo e centrale, dell'attività e del comportamento somatomotori. Particolare attenzione deve essere rivolta all'osservazione di tremori, convulsioni, salivazione, diarrea, letargia, sonno e coma. Si devono tenere in considerazione i principi e i criteri riassunti nel documento orientativo sugli endpoint non crudeli (9). Gli animali moribondi o che manifestano dolore intenso o segni di sofferenza grave e persistente devono essere sottoposti a eutanasia. Nel caso di animali sottoposti a eutanasia o rinvenuti morti, il momento del decesso deve essere registrato con la massima precisione possibile.
1.6.1 Peso corporeo
I singoli animali devono essere pesati poco prima della somministrazione della sostanza da saggiare e in seguito almeno una volta alla settimana. Le variazioni ponderali devono essere calcolate e registrate. Al termine del saggio, gli animali sopravvissuti devono essere pesati e sottoposti a eutanasia.
1.6.2 Esame patologico
Tutti gli animali utilizzati (compresi quelli che muoiono nel corso del saggio e quelli che sono ritirati dallo studio per motivi legati al loro benessere) devono essere sottoposti a necroscopia macroscopica. Per ogni animale devono essere registrate tutte le modificazioni patologiche di rilievo. Per gli animali sopravvissuti almeno 24 ore, l'esame microscopico degli organi recanti alterazioni patologiche evidenti potrebbe fornire indicazioni utili ed essere quindi opportuno.
2. DATI
Devono essere forniti dati individuali su ciascun animale. Inoltre, tutti i dati devono essere riassunti in una tabella indicante, per ogni gruppo del saggio, il numero di animali utilizzati, il numero di animali che hanno manifestato segni di tossicità, il numero di animali rinvenuti morti durante il saggio o sottoposti a eutanasia, il momento del decesso di ciascun animale, la descrizione degli effetti tossici con indicazioni sul decorso e sulla reversibilità, e i risultati della necroscopia.
3. RELAZIONE
3.1 Relazione sul saggio
La relazione sul saggio deve contenere le seguenti informazioni, a seconda dei casi:
|
|
Sostanza in esame:
|
—
|
natura fisica, purezza e, se del caso, proprietà fisico-chimiche (compresa l'isomerizzazione);
|
|
—
|
dati identificativi, compreso il numero CAS.
|
|
|
|
Veicolo (se del caso):
|
—
|
motivazione della scelta del veicolo utilizzato, se diverso dall'acqua.
|
|
|
|
Animali da esperimento:
|
—
|
specie/ceppo utilizzato;
|
|
—
|
condizioni microbiologiche degli animali, qualora siano note;
|
|
—
|
numero, età e sesso degli animali (compresa, se del caso, la motivazione dell'uso di esemplari maschi anziché femmine);
|
|
—
|
provenienza, condizioni di stabulazione, dieta, ecc.;
|
|
|
|
Condizioni sperimentali:
|
—
|
informazioni dettagliate sulla formulazione della sostanza in esame, comprese informazioni sulla forma fisica del preparato somministrato;
|
|
—
|
modalità precise di somministrazione della sostanza in esame, compresi volumi e orari delle somministrazioni;
|
|
—
|
informazioni dettagliate sulla qualità del cibo e dell'acqua (compresi tipo di dieta/provenienza, provenienza dell'acqua);
|
|
—
|
motivazione della scelta della dose iniziale.
|
|
|
|
Risultati:
|
—
|
tabella con risposta e livello di dose per ciascun animale (vale a dire animali che manifestano segni di tossicità, mortalità compresa; natura, gravità e durata degli effetti);
|
|
—
|
tabella del peso corporeo e delle relative modificazioni;
|
|
—
|
peso dei singoli animali il giorno della somministrazione, quindi a intervalli di una settimana, e infine al momento della morte o del sacrificio;
|
|
—
|
data e ora della morte, se questa avviene prima del sacrificio programmato;
|
|
—
|
momento della comparsa dei segni di tossicità, loro decorso ed eventuale reversibilità, per ciascun animale;
|
|
—
|
reperti necroscopici ed eventuali reperti istopatologici per ciascun animale.
|
|
|
|
Discussione e interpretazione dei risultati.
|
4. RIFERIMENTI BIBLIOGRAFICI
|
(1)
|
Roll R., Höfer-Bosse Th. And Kayser D. (1986). New Perspectives in Acute Toxicity Testing of Chemicals. Toxicol. Lett., Suppl. 31, 86
|
|
(2)
|
Roll R., Riebschläger M., Mischke U. and Kayser D. (1989). Neue Wege zur Bestimmung der akuten Toxizität von Chemikalien. Bundesgesundheitsblatt 32, 336-341.
|
|
(3)
|
Diener W., Sichha L., Mischke U., Kayser D. and Schlede E. (1994). The Biometric Evaluation of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 68, 559-610
|
|
(4)
|
Diener W., Mischke U., Kayser D. and Schlede E. (1995). The Biometric Evaluation of the OECD Modified Version of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 69, 729-734.
|
|
(5)
|
Diener W., and Schlede E. (1999) Acute Toxicity Class Methods: Alterations to LD/LC50 Tests. ALTEX 16, 129-134
|
|
(6)
|
Schlede E., Mischke U., Roll R. and Kayser D. (1992). A National Validation Study of the Acute-Toxic-Class Method — An Alternative to the LD50 Test. Arch. Toxicol. 66,455-470.
|
|
(7)
|
Schlede E., Mischke U., Diener W. and Kayser D. (1994). The International Validation Study of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 69,659-670.
|
|
(8)
|
OECD (2001) Guidance Document on Acute Oral Toxicity Testing. Environmental Health and Safety Monograph Series on Testing and Assessment N. 24. Paris.
|
|
(9)
|
OECD (2000) Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Monograph Series on Testing and Assessment N 19.
|
|
(10)
|
OECD (1998) Harmonized Integrated Hazard Classification System For Human Health And Environmental Effects Of Chemical Substances as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals in November 1998, Part 2, p. 11 [http://webnet1.oecd.org/oecd/pages/home/displaygeneral/0,3380,EN-documents-521-14-no-24-no-0,FF.html].
|
|
(11)
|
Lipnick R L, Cotruvo, J A, Hill R N, Bruce R D, Stitzel K A, Walker A P, Chu I; Goddard M, Segal L, Springer J A and Myers R C (1995) Comparison of the Up-and Down, Conventional LD50, and Fixed Dose Acute Toxicity Procedures. Fd. Chem. Toxicol 33, 223-231.
|
|
(12)
|
Chan P.K. and A.W. Hayes. (1994). Chap. 16. Acute Toxicity and Eye Irritancy. Principles and Methods of Toxicology. Third Edition. A.W. Hayes, Editor. Raven Press, Ltd., New York, USA.
|
Allegato 1
PROCEDIMENTO DA SEGUIRE PER CIASCUNA DELLE DOSI INIZIALI
OSSERVAZIONI GENERALI
Il procedimento da seguire per ciascuna dose iniziale è indicato nei diagrammi di questo allegato.
|
—
|
Allegato 1a: dose iniziale 5 mg/kg di peso corporeo
|
|
—
|
Allegato 1b: dose iniziale 50 mg/kg di peso corporeo
|
|
—
|
Allegato 1c: dose iniziale 300 mg/kg di peso corporeo
|
|
—
|
Allegato 1d: dose iniziale 2 000 mg/kg di peso corporeo
|
Il procedimento segue le frecce indicate, in funzione del numero di animali sottoposti a eutanasia o morti spontaneamente.
Allegato 1 A
PROCEDIMENTO CON DOSE INIZIALE DI 5 MG/KG DI PESO CORPOREO

Allegato 1 B
PROCEDIMENTO CON DOSE INIZIALE DI 50 MG/KG DI PESO CORPOREO

Allegato 1 C
PROCEDIMENTO CON DOSE INIZIALE DI 300 MG/KG DI PESO CORPOREO

Allegato 1 D
PROCEDIMENTO CON DOSE INIZIALE DI 2 000 MG/KG DI PESO CORPOREO

Allegato 2
CRITERI PER LA CLASSIFICAZIONE DI SOSTANZE CON VALORI DI DL50 ATTESI SUPERIORI A 2 000 MG/KG SENZA BISOGNO DI ESEGUIRE UN SAGGIO DI TOSSICITÀ
I criteri relativi alla categoria di rischio 5 hanno lo scopo di consentire l'identificazione di sostanze che presentano un rischio di tossicità acuta relativamente basso ma che, in determinate situazioni, possono rappresentare un pericolo per popolazioni vulnerabili. Si tratta di sostanze che si prevede abbiano una DL50 orale o cutanea compresa fra 2 000 e 5 000 mg/kg o dosi equivalenti per altre vie di somministrazione. Una sostanza può essere classificata nella categoria di rischio definita da: 2 000 mg/kg < DL50 < 5 000 mg/kg (categoria 5 nel GHS) nei casi seguenti:
|
a)
|
se uno qualsiasi degli schemi di cui all'allegato 1a-1d porta a inserire tale sostanza in questa categoria, sulla base delle incidenze di mortalità;
|
|
b)
|
se sono già disponibili dati obiettivi attendibili che indicano che la DL50 si situa nell'intervallo di valori della categoria 5, o se altri studi su animali o effetti tossici nell'uomo indicano un rischio di tossicità acuta per l'uomo;
|
|
c)
|
per estrapolazione, stima o misurazione di dati se non è giustificata l'assegnazione a una classe di rischio maggiore, e se
|
—
|
sono disponibili informazioni attendibili che indicano effetti tossici significativi nell'uomo, o
|
|
—
|
si osserva mortalità nei saggi eseguiti fino ai valori della categoria 4 per via orale, o
|
|
—
|
valutazioni di esperti confermano segni clinici significativi di tossicità nei saggi eseguiti fino ai valori della categoria 4, a esclusione di diarrea, piloerezione o aspetto non tolettato, o
|
|
—
|
valutazioni di esperti confermano informazioni attendibili, ricavate dagli altri studi su animali, che indicano potenziali effetti acuti significativi.
|
|
ESECUZIONE DEL SAGGIO A DOSI SUPERIORI A 2 000 MG/KG
Data la necessità di tutelare il benessere degli animali, si sconsiglia di utilizzare la dose prevista per la categoria 5 (5 000 mg/kg); l'utilizzo di tale dose è da prevedere solo nel caso in cui sia molto probabile che i risultati del saggio abbiano rilevanza diretta per la protezione della salute degli esseri umani o degli animali (10). Non devono essere effettuati ulteriori saggi a livelli di dose superiori.
Quando è necessario effettuare un saggio di tossicità alla dose di 5 000 mg/kg, tale saggio deve essere eseguito in una sola fase (e quindi su tre animali). Se il primo animale a cui viene somministrata la sostanza muore, si procede somministrando la sostanza a 2 000 mg/kg, così come indicato nei diagrammi di flusso dell'allegato 1. Se il primo animale sopravvive, la sostanza viene somministrata alla stessa dose ad altri due animali. Se solo uno dei tre animali muore, si ritiene che il valore di DL50 sia superiore a 5 000 mg/kg. Se due animali muoiono, si procede somministrando la sostanza a 2 000 mg/kg.
Allegato 3
METODO DI SAGGIO B.1 ter: indicazioni sulla classificazione secondo lo schema UE nel periodo di transizione in attesa della piena applicazione del sistema di classificazione armonizzato su scala mondiale (GHS) [ricavate dalla voce bibliografica (8)]

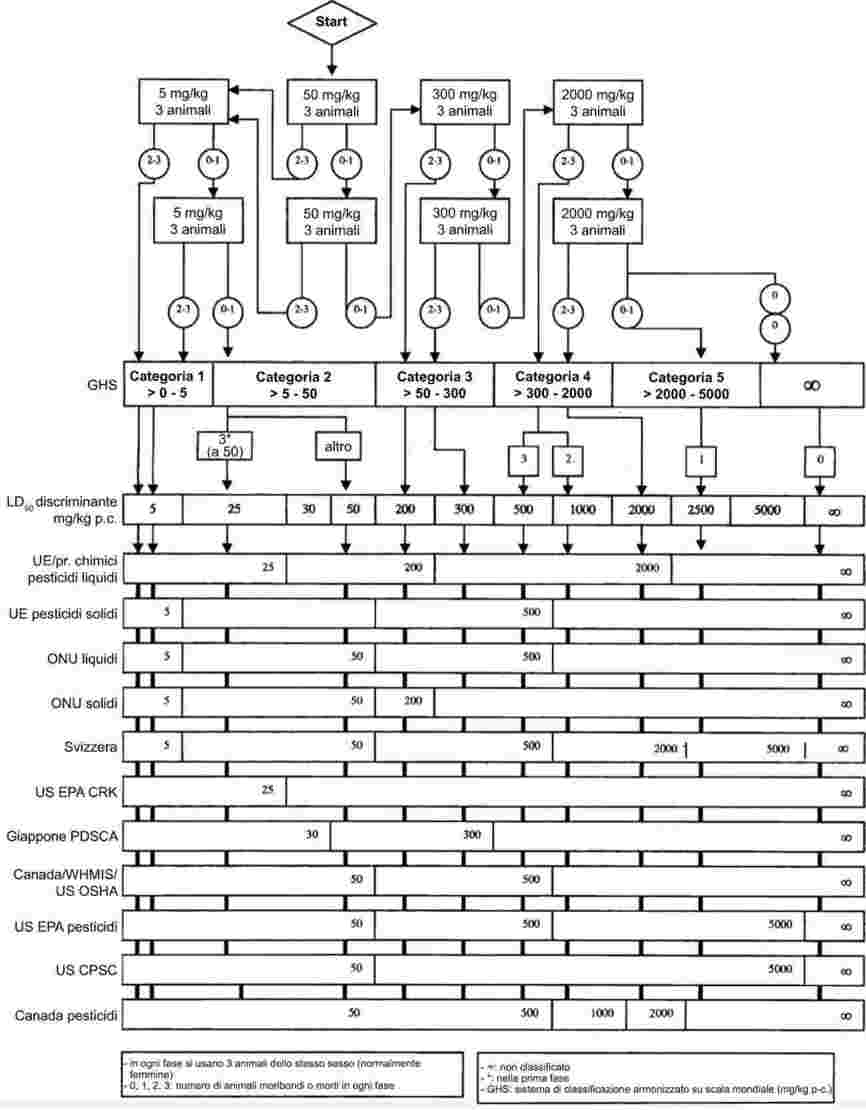

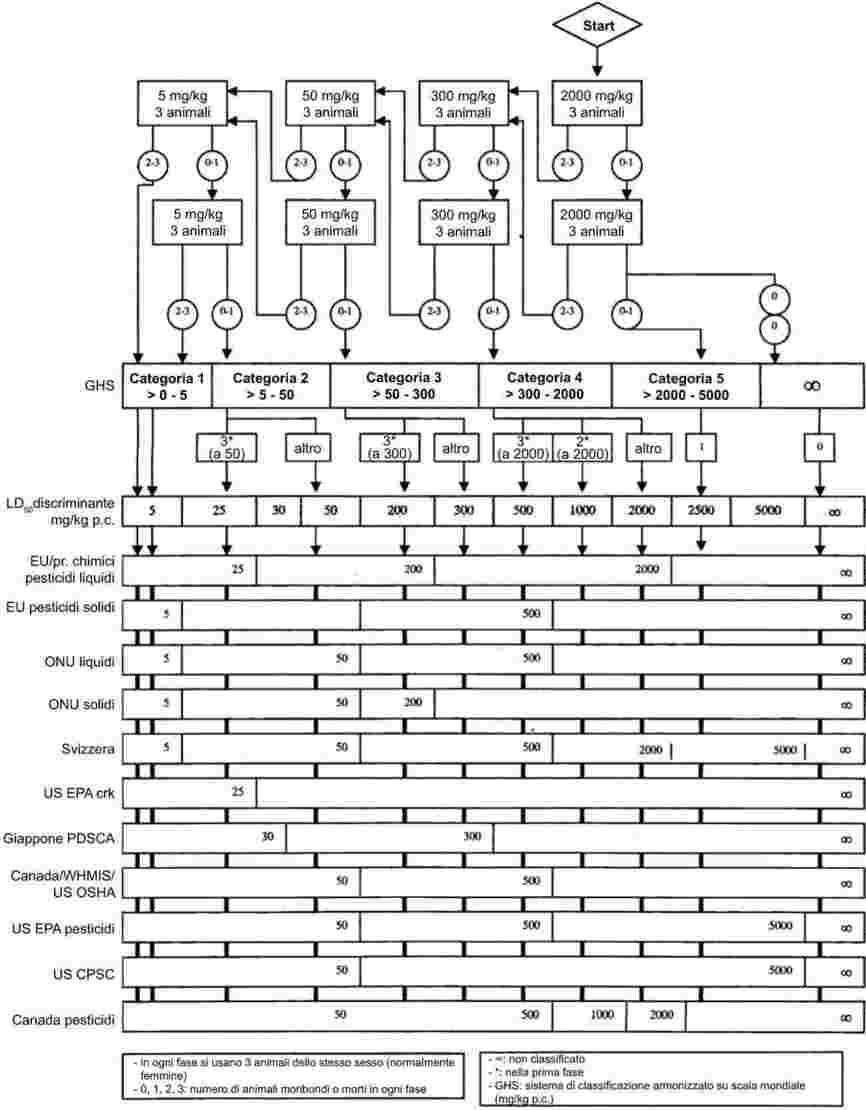
B.2. TOSSICITÀ ACUTA PER INALAZIONE
1. METODO
1.1. INTRODUZIONE
È utile avere informazioni preliminari sulla distribuzione della dimensione delle particelle, la tensione di vapore, il punto di fusione, punto di ebollizione, il punto di infiammabilità e l'esplosività (se del caso) della sostanza.
Si veda anche introduzione generale, parte B (A).
1.2. DEFINIZIONI
Vedi introduzione generale, parte B (B).
1.3. SOSTANZE DI RIFERIMENTO
Nessuna.
1.4. PRINCIPIO DEL METODO DI SAGGIO
Diversi gruppi di animali da esperimento sono esposti a concentrazioni graduate della sostanza in esame per un determinato periodo di tempo (una concentrazione per gruppo). Si procede poi all'osservazione degli effetti e degli eventi letali. Gli animali che muoiono durante l'esperimento sono sottoposti a necroscopia e quelli che sopravvivono sono sottoposti a necroscopia alla fine dell'esperimento.
Può essere necessario sopprimere umanamente gli animali che mostrano segni gravi e persistenti di sofferenza e di dolore. Non è necessario eseguire la somministrazione di dosi delle sostanze in esame in una maniera che può provocare dolore e sofferenza marcate a motivo di proprietà corrosive o gravemente irritanti.
1.5. CRITERI DI QUALITÀ
Nessuno.
1.6. DESCRIZIONE DEL METODO DI SAGGIO
1.6.1. Preparazioni
Prima del saggio gli animali sono tenuti nelle condizioni di stabulazione e di alimentazione dell'esperimento per un periodo di almeno 5 giorni. Prima del saggio gli animali, che dovranno essere giovani adulti e sani sono scelti con metodo casuale e assegnati ai gruppi necessari per il saggio. Non è necessario sottoporre gli animali a una esposizione simulata, a meno che ciò non sia richiesto dal tipo di dispositivo utilizzato per l'esposizione.
Le sostanze di prova solide possono richiedere una micronizzazione allo scopo di ottenere particelle di dimensione appropriata.
Ove necessario, alla sostanza in esame può essere aggiunto un veicolo idoneo per facilitare una concentrazione appropriata della sostanza in esame nell'atmosfera e, in tal caso, deve essere utilizzato un gruppo di controllo per il veicolo. Se per facilitare il dosaggio si impiega un veicolo o altri additivi, questi non dovrebbero produrre effetti tossici. Se appropriato, possono essere utilizzati dati storici.
1.6.2. Condizioni per il saggio
1.6.2.1. Animali da esperimento
Salvo controindicazioni, il ratto è la specie d'elezione. Si dovrebbero utilizzare ceppi di laboratorio comunemente usati. Per ciascun sesso, all'inizio del saggio la variazione ponderale degli animali utilizzati non dovrebbe superare del ± 20 % il valore medio.
1.6.2.2. Numero e sesso
Per ogni livello di concentrazione vengono utilizzati almeno dieci roditori (5 di sesso femminile e 5 di sesso maschile). Le femmine dovrebbero essere nullipare e non gravide.
Nota: nei saggi di tossicità acuta con animali di ordine superiore ai roditori, si dovrebbe prendere in considerazione l'uso di un numero minore di animali. Le dosi devono essere accuratamente scelte e si deve fare ogni sforzo possibile per non superare dosi moderatamente tossiche. In tali prove si dovrebbe evitare la somministrazione di dosi letali della sostanza in esame.
1.6.2.3. Concentrazioni di esposizione
Queste dovranno essere in numero sufficiente, almeno tre, e opportunamente intervallate, onde produrre nei gruppi trattati una graduazione di effetti tossici e di mortalità. I risultati dovrebbero essere sufficienti per fornire una curva mortalità-concentrazione e, quando possibile, permettere un'accettabile determinazione della CL50.
1.6.2.4. Saggio limite
Se un'esposizione di 5 animali maschi e di 5 animali femmine da esperimento per 4 ore a 20 mg/l di un gas o 5 mg/l di un aerosol o di una sostanza particellata (o, se ciò non è possibile, a causa di proprietà fisiche o chimiche, comprese quelle esplosive della sostanza in esame, alla concentrazione massima raggiungibile) non provoca entro 14 giorni mortalità legata al composto in esame, si può considerare che non sono necessarie ulteriori prove.
1.6.2.5. Tempo di esposizione
Il periodo di esposizione dovrà essere di 4 ore.
1.6.2.6. Attrezzatura
Gli animali dovranno essere sottoposti all'esperimento con dispositivi per l'inalazione appositamente progettati per consentire un flusso d'aria dinamico di almeno 12 ricambi d'aria all'ora, per assicurare un adeguato contenuto di ossigeno e un'atmosfera di esposizione distribuita uniformemente. Qualora sia usata una camera, essa dovrà essere progettata in modo da evitare l'affollamento degli animali da esperimento e al tempo stesso rendere massima l'esposizione alla sostanza in esame mediante inalazione. Come regola generale, onde garantire la stabilità dell'atmosfera nella camera, il «volume» complessivo degli animali del saggio non dovrebbe superare il 5 % di quello della camera di saggio. Si può ricorrere ad una esposizione oro-nasale, della sola testa o di tutto il corpo in camera singola; le prime due modalità di esposizione aiuteranno a rendere minimo l'assorbimento delle sostanze attraverso altre vie.
1.6.2.7. Periodo di osservazione
Il periodo di osservazione dovrebbe essere di almeno 14 giorni. Tuttavia la durata dell'osservazione non dovrebbe essere fissata rigidamente. Essa dovrebbe essere determinata dalla natura delle reazioni tossiche, dalla velocità del loro insorgere e dalla durata del periodo di recupero; essa può, quindi, essere estesa se considerato necessario. Il momento in cui si manifestano e scompaiono i sintomi di tossicità e quello nel quale interviene il decesso, sono importanti, soprattutto quando la sostanza tenda a causare mortalità ritardata.
1.6.3. Procedimento
Gli animali sono pesati poco prima dell'esposizione e quindi esposti alla concentrazione di saggio nell'apposito dispositivo, per un periodo di 4 ore, dopo aver effettuato l'equilibramento della concentrazione nella camera di inalazione. Il tempo di equilibramento dovrebbe essere breve. Il saggio dovrebbe essere effettuato ad una temperatura di 22 oC ± 3 oC. Da un punto di vista ottimale l'umidità relativa dovrebbe essere mantenuta tra il 30 e il 70 % ma, in taluni casi (ad esempio, prove di aerosol), ciò può non essere realizzabile. Mantenendo una pressione leggermente negativa all'interno della camera (≥ 5 mm di acqua) si impedirà un trafilamento della sostanza in esame nell'area circostante. Durante l'esposizione, la somministrazione di cibo e acqua deve essere sospesa. Si devono usare sistemi adatti per la generazione e il controllo dell'atmosfera d'esame. Il sistema dovrà assicurare che condizioni di esposizione stabili vengano realizzate il più rapidamente possibile. La camera deve essere progettata e fatta funzionare in modo da mantenere una distribuzione omogenea dell'atmosfera sperimentale all'interno della camera.
Si dovranno misurare o controllare:
|
(a)
|
la velocità del flusso d'aria (in continuo).
|
|
(b)
|
la concentrazione effettiva della sostanza in esame misurata nella zona di respirazione almeno tre volte durante l'esposizione (alcune atmosfere, per esempio aerosoli ad alta concentrazione, possono richiedere un controllo più frequente). Durante il periodo di esposizione, la concentrazione non dovrebbe variare più del ± 15 % del valore medio. Tuttavia nel caso di alcuni aerosol questo livello di regolazione può non essere realizzabile, e in tal caso è accettabile un intervallo più ampio. Per gli aerosol, si deve eseguire con la frequenza necessaria (almeno una volta per gruppo di prova) l'analisi della dimensione delle particelle.
|
|
(c)
|
temperatura e umidità, in continuo se possibile.
|
Durante e dopo l'esposizione, si procede all'effettuazione e alla registrazione sistematica delle osservazioni effettuate; registrazioni individuali dovranno essere tenute per ciascun animale. Durante il primo giorno le osservazioni dovrebbero essere frequenti. Un attento esame clinico dovrà essere effettuato almeno una volta al giorno per cinque giorni per settimana. Altre osservazioni dovranno essere effettuate quotidianamente con azioni appropriate per minimizzare la perdita di animali da studiare, ad esempio necroscopia e refrigerazione degli animali trovati morti e isolamento o sacrificio degli animali deboli e moribondi.
Le osservazioni dovrebbero comprendere le alterazioni della cute e del pelo, degli occhi, delle membrane mucose e del sistema respiratorio, circolatorio, nervoso autonomo e centrale, dell'attività somatomotoria e del comportamento dell'animale. Particolare attenzione dovrebbe essere rivolta all'osservazione del comportamento respiratorio, di tremori, convulsioni, salivazione, diarrea, letargia, sonno e coma. Il momento in cui sopraggiunge il decesso dell'animale dovrà essere registrato con la massima precisione possibile. I valori ponderali degli animali dovranno essere determinati settimanalmente dopo l'esposizione e al momento del decesso.
Gli animali che muoiono durante il saggio e quelli che sopravvivono a conclusione dello stesso sono sottoposti a necroscopia con particolare riferimento alle alterazioni del tratto respiratorio superiore e inferiore. Si dovranno registrare tutti i cambiamenti patologici macroscopici. Ove del caso, i tessuti dovrebbero essere prelevati per l'esame istopatologico.
2. DATI
I dati dovranno essere riassunti in una tabella indicante per ogni gruppo di saggio il numero di animali all'inizio del saggio, il momento del decesso di ciascun animale, il numero di animali che presentano altri sintomi di tossicità, la descrizione degli effetti tossici e i risultati della necroscopia. Le variazioni ponderali devono essere calcolate e registrate quando la sopravvivenza sia superiore ad un giorno. Gli animali che sono soppressi per motivi umanitari in conseguenza di sofferenze e dolore dovuti al composto sono registrati come morti dovute al composto. La CL50 dovrà essere determinata con un metodo riconosciuto. La valutazione dei dati dovrà comprendere il rapporto, se esistente, tra l'esposizione degli animali alla sostanza in esame e l'incidenza e gravità di tutte le alterazioni incluse quelle comportamentali e cliniche, le lesioni macroscopiche, le variazione del peso corporeo, la mortalità e qualsiasi altro effetto tossico.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
La relazione di prova deve, se possibile, includere le seguenti informazioni:
|
—
|
specie, ceppo, origine degli animali, condizioni ambientali, dieta ecc.;
|
|
—
|
condizioni del saggio: descrizione dell'apparecchiatura usata per l'esposizione, incluso il modello, il tipo, le dimensioni, la sorgente d'aria, il sistema per la generazione degli aerosol, il metodo di condizionamento dell'aria e il metodo di alloggiamento degli animali nella camera di prova quando questa venga usata. Si dovrà descrivere anche l'apparecchiatura per la misura della temperatura, dell'umidità e della concentrazione di aerosol e della distribuzione delle dimensioni delle particelle di aerosol.
|
Dati sull'esposizione:
Questi dati dovranno essere raccolti in tabelle e presentati con i valori medi e con una misura di variabilità (ad esempio, deviazione standard) e dovranno, se possibile, includere:
|
(a)
|
velocità del flusso d'aria attraverso l'apparecchiatura di inalazione,
|
|
(b)
|
temperatura e umidità dell'aria,
|
|
(c)
|
concentrazioni nominali (quantitativo totale della sostanza in esame introdotta nel dispositivo per l'inalazione diviso per il volume d'aria);
|
|
(d)
|
natura dell'eventuale veicolo, se usato;
|
|
(e)
|
concentrazioni effettive nella zona di respirazione;
|
|
(f)
|
il diametro aerodinamico mediano in massa (DAMM) e la deviazione standard geometrica (DSG);
|
|
(g)
|
periodo di equilibratura;
|
|
(h)
|
periodo di esposizione;
|
—
|
tabulazione dei dati di risposta per sesso e per livello di esposizione (cioè il numero di animali morti o sacrificati durante la prova; il numero di animali che presentano sintomi di tossicità; numero di animali esposti);
|
|
—
|
momento della morte durante o dopo l'esposizione, ragioni e criteri usati per la eutanasia di animali;
|
|
—
|
CL50 per ciascun sesso determinata alla fine del periodo di osservazione (specificando il metodo di calcolo);
|
|
—
|
intervallo di confidenza statistica del 95 % per la CL50 (quando questo possa venire fornito);
|
|
—
|
curve dose-mortalità e relativo coefficiente angolare (se il metodo di determinazione lo permette);
|
|
—
|
risultati dell'esame necroscopico;
|
|
—
|
qualsiasi risultato istopatologico;
|
|
—
|
discussione dei risultati (particolare attenzione deve essere dedicata all'effetto che la eutanasia di animali durante la prova può avere sul valore calcolato della CL50);
|
|
—
|
interpretazione dei risultati.
|
|
3.2. VALUTAZIONE E INTERPRETAZIONE
Vedi introduzione generale, parte B (punto D).
4. BIBLIOGRAFIA
Vedi introduzione generale, parte B (punto E).
B.3. TOSSICITÀ ACUTA PER VIA CUTANEA
1. METODO
1.1. INTRODUZIONE
Vedi introduzione generale, parte B (punto A).
1.2. DEFINIZIONI
Vedi introduzione generale, parte B (punto B).
1.3. SOSTANZE DI RIFERIMENTO
Nessuna.
1.4. PRINCIPIO DEL METODO DI SAGGIO
La sostanza in esame viene applicata a livelli di dose graduati, un livello di dose per gruppo, sulla cute di vari gruppi di animali di saggio. Si procede poi all'osservazione degli effetti e degli eventi letali. Gli animali morti o sacrificati durante il saggio sono sottoposti a necroscopia e i sopravvissuti lo sono a conclusione del saggio.
Può essere necessario sottoporre a eutanasia gli animali che mostrano segni gravi e persistenti di sofferenza e di dolore; non bisogna eseguire la somministrazione di dosi delle sostanze in esame in una maniera che notoriamente provoca dolore e sofferenza marcate a motivo delle proprietà corrosive o gravemente irritanti.
1.5. CRITERI DI QUALITÀ
Nessuno.
1.6. DESCRIZIONE DEL METODO ADOTTATO PER IL SAGGIO
1.6.1. Preparazioni
Per almeno cinque giorni prima dell'esperimento, gli animali sono tenuti nelle gabbie usate per il saggio nelle stesse condizioni di stabulazione e di alimentazione dell'esperimento. Prima del saggio, gli animali che dovranno essere giovani adulti e sani, sono scelti con metodo casuale e assegnati ai gruppi sperimentali. Circa 24 ore prima del saggio, si effettua il taglio o la rasatura del pelo nella parte dorsale del corpo della cavia. Durante le operazioni di taglio o rasatura, si deve badare a non ledere la cute dell'animale per evitarne l'abrasione che potrebbe alterarne la permeabilità. Si dovrà preparare almeno il 10 % della superficie corporea per l'applicazione della sostanza in esame. Le sostanze solide, che potranno essere eventualmente ridotte in polvere, dovrebbero essere inumidite con acqua o, se necessario, con un veicolo adatto ad assicurare un buon contatto con la cute. Se viene utilizzato un veicolo, si dovrà tener conto dell'influenza dello stesso sulla penetrazione cutanea della sostanza in esame. Le sostanze liquide generalmente vengono saggiate senza diluizione.
1.6.2. Condizioni del saggio
1.6.2.1. Animali da esperimento
Possono essere utilizzati ratti o conigli adulti. Si possono utilizzare altre specie animali, ma il loro uso dovrebbe essere giustificato. Dovrebbero essere utilizzati ceppi di laboratorio comunemente usati. Per ciascun sesso, all'inizio della prova l'intervallo di variazione del peso degli animali utilizzati non dovrebbe essere superiore a ± 20 % del valore medio.
1.6.2.2. Numero e sesso
Per ciascun saggio vengono usati almeno 5 animali a ciascun livello di dosaggio. Essi dovrebbero essere tutti dello stesso sesso. Se si usano femmine, dovrebbero esse nullipare e non gravide. Nel caso siano disponibili informazioni che dimostrano che un sesso è nettamente più sensibile, si dovrebbero usare animali di questo sesso.
Nota: nei saggi di tossicità acuta con animali di ordine superiore ai roditori, si dovrà prendere in considerazione l'uso di un numero minore di animali. Le dosi devono essere accuratamente scelte e si deve fare ogni sforzo possibile per non superare dosi moderatamente tossiche. In tali prove si dovrebbe evitare la somministrazione di dosi letali della sostanza in esame.
1.6.2.3. Livelli di dosaggio
Questi dovranno essere in numero sufficiente, almeno 3, e adeguatamente intervallati per produrre uno spettro di effetti tossici e di tassi di mortalità. Nel decidere i dosaggi occorre tener presente qualsiasi effetto irritante o corrosivo. I dati dovrebbero essere sufficienti per ottenere una curva dose-risposta e, quando possibile, permettere una determinazione accettabile della DL50.
1.6.2.4. Saggio limite
Si può eseguire un saggio limite ad un livello di dosaggio di almeno 2 000 mg/kg peso corporeo su un gruppo di 5 animali maschi e 5 femmine usando le procedure sopra descritte. Se si produce una mortalità dovuta al composto, può essere necessario considerare uno studio completo.
1.6.2.5. Periodo di osservazione
Il periodo di osservazione dovrebbe essere almeno di 14 giorni. Tuttavia tale durata non è tassativa. Essa dovrebbe dipendere dalla natura delle reazioni tossiche, dalla velocità della loro insorgenza e dalla lunghezza del periodo di guarigione; se necessario, quindi, essa potrà essere prolungata. Il momento in cui compaiono e spariscono i sintomi di tossicità, la loro durata e il momento in cui interviene il decesso, sono importanti soprattutto nel caso in cui la sostanza tenda a causare mortalità ritardata.
1.6.3. Procedimento
Ogni gabbia deve contenere un solo animale. La sostanza in esame dovrà essere applicata uniformemente su una superficie pari a circa il 10 % della superficie corporea totale. Per le sostanze altamente tossiche, la superficie può essere inferiore, ma dovrà essere ricoperta da uno strato per quanto possibile sottile e uniforme.
Durante il periodo di esposizione di 24 ore, le sostanze in esame dovranno essere tenute a contatto diretto della cute mediante una garza porosa e un cerotto non irritante. La parte su cui viene applicata la sostanza dovrebbe essere ulteriormente coperta in modo opportuno per tenere ferma la garza e la sostanza in esame e assicurare che gli animali non ingeriscano la sostanza stessa. Dispositivi per la limitazione dei movimenti possono essere usati per impedire agli animali di ingerire la sostanza in esame, ma l'immobilizzazione completa non è consigliabile.
Alla fine del periodo di esposizione si dovrà rimuovere la sostanza residua utilizzando acqua, se possibile, o altri prodotti idonei per la pulizia della pelle.
Le osservazioni dovranno essere registrate sistematicamente non appena fatte, badando a tenere separati i dati per ciascun animale. Durante il primo giorno le osservazioni dovranno essere frequenti. Un attento esame clinico dovrà essere effettuato almeno una volta al giorno per 5 giorni per settimana. Le altre osservazioni dovrebbero essere effettuate quotidianamente, agendo appropriatamente per minimizzare la perdita di animali da studiare, ad esempio necroscopia o refrigerazione degli animali trovati morti e isolamento o sacrificio degli animali deboli o moribondi.
Le osservazioni dovrebbero tener conto delle alterazioni riscontrate nel pelo, nella cute trattata, negli occhi e nelle membrane mucose e anche nel sistema respiratorio, circolatorio, nel sistema nervoso autonomo e centrale, nell'attività somatomotoria e nel comportamento dell'animale. Particolare attenzione dovrebbe essere rivolta all'osservazione di tremori, convulsioni, salivazione, diarrea, letargia, sonno e coma. Il momento in cui sopraggiunge il decesso deve essere registrato con la massima precisione possibile. Gli animali che muoiono durante il saggio e quelli che sopravvivono alla fine del saggio sono sottoposti a necroscopia. Tutte le variazioni patologiche macroscopiche dovranno essere registrate. Ove del caso, dovrebbero essere prelevati tessuti per l'esame istopatologico.
Valutazione della tossicità nell'altro sesso
Dopo il completamento dello studio su un sesso, si somministra almeno un intervallo di dose ad un gruppo di 5 animali dell'altro sesso per controllare che gli animali di questo sesso non siano nettamente più sensibili alla sostanza in esame. In circostanze particolari può essere giustificato l'uso di un minor numero di animali. Nel caso in cui siano disponibili informazioni adeguate che dimostrano che gli animali del sesso controllato sono nettamente più sensibili, si può fare a meno di effettuare la prova su animali dell'altro sesso.
2. DATI
I risultati dovranno essere riassunti in forma tabellare indicante per ogni singolo gruppo di saggio il numero di animali presenti all'inizio del saggio, il momento del decesso di ciascun animale, il numero di animali che presentano altri segni di tossicità, la descrizione degli effetti tossici e i risultati della necroscopia. Il peso di ciascun animale dovrà essere determinato e registrato poco prima dell'applicazione della sostanza, poi settimanalmente e al momento del decesso; le variazioni ponderali dovranno essere calcolate e registrate quando la sopravvivenza sia superiore a un giorno. Gli animali che vengono sottoposti ad eutanasia in conseguenza di sofferenza e dolore dovuti al composto vengono registrati come morti in conseguenza del composto. La DL50 può essere determinata con un metodo riconosciuto.
La valutazione dei dati dovrebbe includere il rapporto, se esistente, tra l'esposizione degli animali alla sostanza in esame e l'incidenza e gravità di tutte le alterazioni, incluse quelle comportamentali e cliniche, le lesioni macroscopiche, le variazioni del peso corporeo, la mortalità e qualsiasi altro effetto tossico.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
La relazione di prova deve, se possibile, includere le seguenti informazioni:
|
—
|
specie, ceppo, origine degli animali, condizioni ambientali, dieta, ecc.;
|
|
—
|
condizioni sperimentali (inclusa la tecnica di pulizia della cute e il tipo di medicazione; occlusiva o non occlusiva);
|
|
—
|
livelli di dosaggio (col veicolo, se usato, e concentrazione);
|
|
—
|
sesso degli animali sottoposti a somministrazione;
|
|
—
|
tabulato dei dati di risposta per dose e livello di dosaggio (cioè il numero di animali morti o sacrificati durante la prova; numero di animali che presentano sintomi di tossicità; numero di animali esposti);
|
|
—
|
tempo intercorso tra la somministrazione della sostanza e la morte, ragioni e criteri usati per la eutanasia di animali;
|
|
—
|
valore della DL50 per il sesso sottoposto ad uno studio completo, determinato dopo 14 giorni, specificando il metodo di determinazione;
|
|
—
|
intervallo di confidenza statistica del 95 % per la DL50 (se può essere fornito);
|
|
—
|
curva dose-mortalità e relativo coefficiente angolare (se il metodo di determinazione lo consente);
|
|
—
|
risultati necroscopici;
|
|
—
|
qualsiasi altro reperto istopatologico;
|
|
—
|
risultati di eventuali saggi sull'altro sesso;
|
|
—
|
discussione dei risultati (occorre dedicare una particolare attenzione all'effetto che la eutanasia di animali durante la prova può avere sul valore calcolato della DL50);
|
|
—
|
interpretazione dei risultati.
|
3.2. VALUTAZIONE E INTERPRETAZIONE
Vedi introduzione generale, parte B (punto D).
4. BIBLIOGRAFIA
Vedi introduzione generale, parte B (punto E).
B.4. TOSSICITÀ ACUTA: IRRITAZIONE/CORROSIONE CUTANEA
1. METODO
Questo metodo corrisponde al TG 404 (2002) dell'OCSE.
1.1 INTRODUZIONE
Nella preparazione di questo metodo aggiornato è stata dedicata particolare attenzione ai miglioramenti possibili in relazione al benessere degli animali e alla valutazione di tutte le informazioni disponibili sulla sostanza in esame, per evitare prove non necessarie sugli animali da laboratorio. Il metodo comprende la raccomandazione di eseguire, prima di effettuare il saggio in vivo descritto per la corrosione/irritazione, un'analisi dell'importanza delle prove (weight-of-the-evidence analysis) sui dati pertinenti esistenti. Qualora i dati disponibili fossero insufficienti, si raccomanda di svilupparli mediante l'applicazione di saggi sequenziali (1). La strategia di saggio raccomandata comprende l'esecuzione di saggi in vitro validati ed accettati ed è descritta nell'Allegato al presente metodo. Nel saggio iniziale in vivo si raccomanda inoltre di applicare, ove opportuno, all'animale i tre cerotti per il saggio da contatto uno dopo l'altro, anziché simultaneamente.
Nell'interesse sia dell'accuratezza scientifica, sia del benessere degli animali, non bisogna prendere in considerazione i saggi in vivo finché non siano stati valutati, in un'analisi dell'importanza delle prove, tutti i dati disponibili pertinenti circa la potenziale corrosività/irritazione cutanea della sostanza. Tali dati devono comprendere prove derivanti da studi esistenti su soggetti umani e/o animali da laboratorio, prove di corrosività/irritazione di una o più sostanze strutturalmente correlate o miscele di tali sostanze, dati dimostranti l'elevata acidità o alcalinità della sostanza (2)(3), nonché i risultati di test in vitro o ex vivo validati ed accettati (4)(5)(5a). Questa analisi deve ridurre la necessità di eseguire test in vivo della corrosività/irritazione delle sostanze per le quali esistono già prove sufficienti derivanti da altri studi in relazione a questi due fattori.
Nell'Allegato al presente metodo è inclusa e consigliata una strategia a tappe, che prevede l'esecuzione di saggi validati in vitro o ex vivo per la corrosione/irritazione. Tale strategia è stata sviluppata e raccomandata all'unanimità dai partecipanti a un workshop dell'OCSE (6), ed è stata adottata come strategia raccomandata di test nel GHS (Globally Harmonised System for the Classification of Chemical Substances) (Sistema globale armonizzato per la classificazione delle sostanze chimiche) (7). Si raccomanda di adottare la strategia prima di passare ai saggi in vivo. Nel caso di nuove sostanze, si raccomanda di adottare un approccio graduale per sviluppare dati scientificamente validi sulla corrosività/irritazione della sostanza. Se per le sostanze esistenti i dati sulla corrosione/irritazione cutanea sono insufficienti, si può usare tale strategia per ottenere i dati mancanti. È necessario giustificare l'uso di una strategia o procedura di saggio differente, nonché l'eventuale decisione di non usare un approccio di saggio graduale.
Se non è possibile determinare la corrosività o il potere irritante usando un'analisi dell'importanza delle prove, coerente con la strategia di saggi sequenziali, va preso in considerazione un saggio in vivo (cfr. Allegato).
1.2 DEFINIZIONI
Irritazione cutanea: produzione di danni reversibili alla pelle in seguito all'applicazione di una sostanza in esame per un massimo di 4 ore.
Corrosione cutanea: produzione di danni irreversibili alla pelle; in particolare, necrosi visibile attraverso l'epidermide e all'interno del derma, in seguito all'applicazione della sostanza in esame per un massimo di quattro ore. Le reazioni corrosive sono caratterizzate da ulcere, emorragie, escare sanguinanti e, alla fine dell'osservazione, il giorno 14, da alterazione del colore dovuta a pallore della cute, zone di completa alopecia e cicatrici. Per valutare le lesioni dubbie effettuare eventualmente un esame istopatologico.
1.3 PRINCIPIO DEL METODO DI SAGGIO
La sostanza in esame è applicata in un'unica dose sulla pelle della cavia; le zone di pelle non trattate dell'animale servono da controllo. A intervalli specificati si valuta e si attribuisce un punteggio al grado di irritazione/corrosione, che va ulteriormente descritto per fornire una valutazione completa degli effetti. La durata dello studio deve essere sufficiente a valutare la reversibilità o irreversibilità degli effetti osservati.
Gli animali che presentano segni prolungati di grave sofferenza e/o dolore, in qualsiasi fase del saggio, vanno soppressi con metodi non cruenti e la sostanza va valutata di conseguenza. Cfr. bibliografia per i criteri da seguire nel decidere di sopprimere gli animali moribondi o che soffrono gravemente (8).
1.4 DESCRIZIONE DEL METODO DI SAGGIO
1.4.1 Preparazione per il saggio in vivo
1.4.1.1 Selezione delle specie
L'animale da laboratorio di elezione è il coniglio albino; usare giovani adulti sani. Giustificare l'eventuale uso di altre specie.
1.4.1.2 Preparazione degli animali
All'incirca 24 ore prima del saggio occorre rasare il pelo nella zona dorsale del tronco degli animali evitando di scorticare la pelle. Usare solo animali la cui pelle è sana e intatta.
Alcuni ceppi di coniglio presentano zone di pelo più denso che sono più evidenti in alcuni periodi dell'anno. Tali aree di crescita densa del pelo non vanno usate come punti per il saggio.
1.4.1.3 Condizioni di alloggio e alimentazione
Gli animali vanno posti in gabbie singole. La temperatura del locale deve essere di 20 oC (± o3 C) per i conigli. L'umidità relativa deve raggiungere almeno il 30 % e preferibilmente non superare il 70 %, tranne che nel corso delle pulizie degli ambienti, ma occorre puntare a un valore del 50-60 %. L'illuminazione deve essere artificiale, con una sequenza di 12 ore di luce e 12 di oscurità. Per l'alimentazione, attenersi alle diete convenzionali da laboratorio con una quantità illimitata di acqua potabile.
1.4.2 Procedura
1.4.2.1 Applicazione della sostanza in esame
La sostanza in esame va applicata su una zona ridotta (circa 6 cm2) di pelle e coperta con una garza fissata con un cerotto non irritante. Nei casi in cui non è possibile l'applicazione diretta (ad es. liquidi e alcune paste), la sostanza in esame va prima applicata sulla garza, che poi è a sua volta applicata sulla pelle. La garza va mantenuta a contatto con la pelle, ma allentata, mediante una fasciatura semiocclusiva, per tutta la durata del periodo di esposizione. Se la sostanza in esame è applicata sulla garza, essa va appoggiata sulla pelle in modo che la sostanza sia bene a contatto e si distribuisca uniformemente. Occorre impedire che l'animale abbia accesso alla garza e ingerisca o inali la sostanza in esame.
Le sostanze sperimentali liquide si usano generalmente non diluite. Per l'esame dei solidi (che possono essere ridotti in polvere, se ritenuto necessario) la sostanza in esame va inumidita con la minor quantità d'acqua (o, ove necessario, di un altro eccipiente adeguato) sufficiente ad assicurare un buon contatto con la pelle. Se si impiegano eccipienti diversi dall'acqua, la potenziale influenza dell'eccipiente sull'irritazione della pelle da parte della sostanza in esame deve essere minima o nulla.
Al termine del periodo di esposizione, che è normalmente di 4 ore, la sostanza in esame residua va rimossa, ove possibile, usando acqua o un solvente adeguato senza alterare la risposta da essa provocata e l'integrità dell'epidermide.
1.4.2.2 Livello di dosi
Sul punto prescelto per il saggio va applicata una dose di 0,5 ml di liquido o 0,5 g di solido o pasta.
1.4.2.3 Saggio iniziale (Saggio di irritazione/corrosione cutanea in vivo su un solo animale)
Si raccomanda caldamente di eseguire inizialmente il saggio in vivo usando un solo animale, soprattutto quando si sospetta che la sostanza sia potenzialmente corrosiva, in conformità alla strategia dei saggi sequenziali (cfr. Allegato 1).
Quando una sostanza è stata giudicata corrosiva sulla base di un'analisi dell'importanza delle prove, non è necessario eseguire ulteriori saggi su animali. Per la maggior parte delle sostanze sospettate di essere corrosive, non è normalmente necessario eseguire ulteriori saggi in vivo. Tuttavia, nei casi in cui si ritiene giustificato ottenere altri dati, in quanto le prove sono insufficienti, è possibile effettuare saggi limitati su animali secondo l'approccio seguente: all'animale si applicano un massimo di tre cerotti con garza per il saggio da contatto, in sequenza. Il primo cerotto è tolto dopo tre minuti. Se non si osservano reazioni cutanee gravi, si applica un secondo cerotto, che è rimosso dopo un'ora. Se le osservazioni in questa fase indicano che è possibile estendere l'esposizione a quattro ore, senza causare sofferenze, si applica un terzo cerotto, che è rimosso dopo quattro ore, e si valuta la reazione.
Se dopo una qualsiasi delle tre esposizioni in sequenza si osserva un effetto corrosivo, il saggio va immediatamente interrotto. Se dopo la rimozione dell'ultimo cerotto non si osserva alcun effetto corrosivo, si mantiene l'animale sotto osservazione per 14 giorni, a meno che la corrosione non si manifesti più precocemente.
Nei casi in cui non si prevede che la sostanza in esame produca corrosione, ma che possa essere irritante, applicare un unico cerotto a un solo animale per quattro ore.
1.4.2.4 Saggio di conferma (saggio di irritazione cutanea in vivo con ulteriori animali)
Se nel saggio iniziale non si osservano effetti corrosivi, confermare la reazione irritante o negativa su due altri animali al massimo, ciascuno con un cerotto, per un periodo di esposizione di quattro ore. Se nel saggio iniziale si osserva un effetto irritante, il saggio di conferma può essere condotto in maniera sequenziale, oppure esponendo contemporaneamente due altri animali. Nel caso eccezionale in cui non sia eseguito il saggio iniziale, è possibile trattare due o tre animali con un solo cerotto, che è poi asportato dopo quattro ore. Quando si usano due animali, se entrambi evidenziano la stessa reazione, non sono necessari altri saggi, altrimenti si sottopone al saggio anche il terzo animale. È possibile che siano necessari altri animali per valutare le reazioni dubbie.
1.4.2.5 Periodo di osservazione
La durata del periodo di osservazione deve essere sufficiente a valutare completamente la reversibilità degli effetti osservati. Interrompere però l'esperimento in qualsiasi momento se l'animale mostra segni continui di dolore o sofferenza gravi. Per determinare la reversibilità degli effetti, gli animali vanno osservati per un massimo di 14 giorni dopo la rimozione dei cerotti. In caso di reversibilità prima dei 14 giorni, interrompere subito l'esperimento.
1.4.2.6 Osservazioni cliniche e classificazione delle reazioni cutanee
Esaminare tutti gli animali per vedere se presentano segni di eritema e di edema e valutare le reazioni a 60 minuti e successivamente a 24, 48 e 72 ore dopo la rimozione del cerotto. Per il saggio iniziale su un solo animale, esaminare subito la zona prescelta per il saggio dopo la rimozione del cerotto. Le reazioni cutanee sono classificate e registrate in base ai gradi indicati nella tabella allegata. Se la pelle presenta una lesione che non può essere identificata come irritazione o corrosione a 72 ore, può essere necessario proseguire le osservazioni fino al giorno 14, per determinare la reversibilità degli effetti. Oltre alle osservazioni dell'irritazione, descrivere e documentare tutti gli effetti tossici locali, come la perdita del grasso cutaneo, ed eventuali effetti sistemici negativi (ad es. effetti sui segni clinici di tossicità e sul peso corporeo). Per chiarire le reazioni dubbie, valutare l'opportunità di eseguire un esame istopatologico.
La classificazione delle reazioni cutanee è necessariamente soggettiva. Per favorirne l'armonizzazione e per assistere i laboratori e le persone che eseguono il saggio e interpretano le osservazioni, istruire adeguatamente il personale sul sistema di punteggio usato (cfr. tabella più avanti). Potrebbe essere utile una guida illustrata per la classificazione dell'irritazione cutanea e di altre lesioni (9).
2. DATI
2.1 PRESENTAZIONE DEI RISULTATI
I risultati dello studio vanno riassunti sotto forma di tabella nella relazione finale sul saggio e devono coprire tutte le voci elencate al punto 3.1.
2.2 VALUTAZIONE DEI RISULTATI
Valutare il grado di irritazione cutanea insieme alla natura e alla gravità delle lesioni, nonché alla loro reversibilità o irreversibilità. Le reazioni individuali non rappresentano uno standard assoluto per le proprietà irritanti di un materiale, in quanto si valutano anche altri effetti del materiale in esame. I risultati individuali vanno invece considerati come valori di riferimento e devono essere valutati insieme a tutte le altre osservazioni emerse dallo studio.
Nella valutazione delle reazioni irritanti è necessario considerare la reversibilità delle lesioni cutanee. Quando reazioni quali alopecia (zona limitata), ipercheratosi, iperplasia e desquamazione persistono fino alla fine del periodo di osservazione di 14 giorni, la sostanza in esame va considerata irritante.
3. RAPPORTO
3.1 RAPPORTO SUL SAGGIO
Il rapporto deve contenere le seguenti informazioni:
|
|
Giustificazione del saggio in vivo: analisi dell'importanza delle prove di dati pre-esistenti, compresi i risultati della strategia dei saggi sequenziali:
|
—
|
descrizione dei dati pertinenti disponibili da saggi precedenti;
|
|
—
|
dati ricavati in ciascuna fase della strategia dei saggi;
|
|
—
|
descrizione dei saggi in vitro eseguiti, con i dettagli delle procedure, i risultati ottenuti con le sostanze in esame/di riferimento;
|
|
—
|
analisi dell'importanza delle prove per l'esecuzione dello studio in vivo.
|
|
|
|
Sostanza in esame:
|
—
|
dati di identificazione (ad es. numero CAS, origine, purezza, impurità note, numero di lotto);
|
|
—
|
natura fisica e proprietà fisico-chimiche (ad es. pH, volatilità, solubilità, stabilità);
|
|
—
|
se si tratta di una miscela, composizione e percentuali relative dei componenti.
|
|
|
|
Eccipiente:
|
—
|
identificazione, concentrazione (ove pertinente), volume usato;
|
|
—
|
giustificazione della scelta dell'eccipiente.
|
|
|
|
Cavie:
|
—
|
specie/ceppo usato, motivazione per l'uso di animali diversi dal coniglio albino;
|
|
—
|
numero di animali di ciascun sesso;
|
|
—
|
peso di ciascun singolo animale all'inizio e alla conclusione del saggio;
|
|
—
|
età all'inizio dello studio;
|
|
—
|
origine, condizioni di alloggio, dieta, ecc.
|
|
|
|
Condizioni del saggio:
|
—
|
tecnica di preparazione del punto di applicazione del cerotto;
|
|
—
|
dettagli relativi al materiale del cerotto e alla tecnica di applicazione del cerotto;
|
|
—
|
dettagli relativi a preparazione, applicazione e rimozione della sostanza in esame.
|
|
|
|
Risultati:
|
—
|
tabulazione dei punteggi delle reazioni di irritazione/corrosione per ciascun animale in tutti i momenti di misurazione;
|
|
—
|
descrizione di tutte le lesioni osservate;
|
|
—
|
descrizione della natura e del grado di irritazione o corrosione osservate e degli eventuali reperti istopatologici;
|
|
—
|
descrizione di altri effetti negativi locali (ad es. perdita del grasso cutaneo) e sistemici oltre all'irritazione e alla corrosione cutanea.
|
|
|
|
Discussione dei risultati
|
4. BIBLIOGRAFIA
|
(1)
|
Barratt, M.D., Castell, J.V., Chamberlain, M., Combes, R.D., Dearden, J.C., Fentem, J.H., Gerner, I., Giuliani, A., Gray, T.J.B., Livingston, D.J., Provan, W.M., Rutten, F.A.J.J.L., Verhaar, H.J.M., Zbinden, P. (1995) The Integrated Use of Alternative Approaches for Predicting Toxic Hazard. ECVAM Workshop Report 8. ATLA 23,410-429.
|
|
(2)
|
Young, J.R., How, M.J., Walker, A.P., Worth W.M.H. (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicol. In Vitro, 2, 19-26.
|
|
(3)
|
Worth, A.P., Fentem, J.H., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Liebsch, M. (1998) Evaluation of the proposed OECD Testing Strategy for skin corrosion. ATLA 26, 709-720.
|
|
(4)
|
ECETOC (1990) Monograph No. 15, «Skin Irritation», European Chemical Industry, Ecology and Toxicology Centre, Brussels.
|
|
(5)
|
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhutter, H.G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, pp. 483-524.
|
|
(5a)
|
Metodo di prova B.40 Corrosione cutanea.
|
|
(6)
|
OECD (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22-24 January 1996. (http://www1.oecd.org/ehs/test/background.htm).
|
|
(7)
|
OECD (1998) Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998. (http://www1.oecd.org/ehs/Class/HCL6.htm).
|
|
(8)
|
OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. OECD Environmental Health and Safety Publications. Series on Testing and Assessment No. 19. (http://www1.oecd.org/ehs/test/monos.htm).
|
|
(9)
|
EPA (1990). Atlas of Dermal Lesions, (20T-2004). United States Environmental Protection Agency, Office of Pesticides and Toxic Substances, Washington, DC, August 1990.
[Available from OECD Secretariat upon request].
|
Tabella I
CLASSIFICAZIONE DELLE REAZIONI CUTANEE
Eritema e formazione di escara
|
Assenza di eritema
|
0
|
|
Eritema molto lieve (appena percettibile)
|
1
|
|
Eritema ben definito
|
2
|
|
Eritema da moderato a grave
|
3
|
|
Eritema grave (rosso vivo) fino alla formazione di escara che impedisce la classificazione dell'eritema
|
4
|
Massimo possibile: 4
Formazione di edema
|
Assenza di edema
|
0
|
|
Edema molto lieve (appena percettibile)
|
1
|
|
Edema lieve (bordi dell'area ben definiti dal gonfiore)
|
2
|
|
Edema moderato (area sollevata di circa 1 mm)
|
3
|
|
Edema grave (area sollevata di oltre 1 mm ed estesa oltre la zona di esposizione)
|
4
|
Massimo possibile: 4
Per chiarire le reazioni dubbie è possibile eseguire un esame istopatologico.
Allegato
Strategia dei saggi sequenziali per l'irritazione e la corrosione cutanee
CONSIDERAZIONI GENERALI
Nell'interesse dell'accuratezza scientifica e del benessere degli animali, è importante evitare l'uso non necessario di animali e ridurre al minimo i saggi atti a provocare reazioni gravi. Valutare tutte le informazioni relative alla potenziale irritazione/corrosività cutanea di una sostanza prima di prendere in considerazione i saggi in vivo. È possibile che esistano già prove sufficienti per classificare il potenziale di irritazione o corrosione cutanea di una sostanza in esame, senza bisogno di effettuare saggi su animali da laboratorio. L'analisi dell'importanza delle prove e una strategia dei saggi sequenziali ridurranno al minimo la necessità di eseguire saggi in vivo, soprattutto se è probabile che la sostanza provochi reazioni gravi.
Si raccomanda l'uso di un'analisi dell'importanza delle prove per valutare le informazioni esistenti sul potenziale di irritazione e corrosione cutanea delle sostanze e determinare se occorre eseguire altri studi, diversi da quelli cutanei in vivo, per caratterizzare meglio tale potenziale. Qualora tali studi fossero necessari, si raccomanda di usare la strategia dei saggi sequenziali per sviluppare i dati sperimentali pertinenti. Per le sostanze senza una documentazione sperimentale, usare la strategia dei saggi sequenziali per sviluppare i dati necessari al fine di valutarne il potenziale di corrosività/irritazione cutanea. La strategia dei saggi descritta nel presente allegato è stata sviluppata nel corso di un workshop dell'OCSE (1), ed è stata successivamente confermata ed ampliata nello Harmonised Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances (Sistema di classificazione armonizzato integrato dei rischi per la salute umana e gli effetti ambientali delle sostanze chimiche), come approvato alla 28a riunione congiunta del comitato sulle sostanze chimiche e dal gruppo di lavoro sulle sostanze chimiche nel novembre 1998 (2).
Questa strategia dei saggi sequenziali non è parte integrante del metodo di prova B.4., ma esprime l'approccio raccomandato per determinare le caratteristiche di irritazione/corrosione cutanea. Tale approccio rappresenta sia la migliore prassi che un punto di riferimento etico per l'esecuzione di saggi in vivo sull'irritazione/corrosione cutanea. Il metodo di prova fornisce indicazioni su come eseguire il saggio in vivo e riassume i fattori da valutare prima di prendere in considerazione tale saggio. La strategia dei saggi sequenziali fornisce un approccio per valutare i dati esistenti sulle caratteristiche di irritazione/corrosione cutanea delle sostanze e un approccio graduale per lo sviluppo di dati pertinenti sulle sostanze sulle quali sono necessari ulteriori studi o che non sono mai state oggetto di studio. Essa raccomanda inoltre l'esecuzione di saggi validati ed accettati in vitro o ex vivo di irritazione/corrosione cutanea in circostanze specifiche.
DESCRIZIONE DELLA STRATEGIA DI VALUTAZIONE E SAGGI
Prima di effettuare saggi nell'ambito della strategia dei saggi sequenziali (Figura), occorre valutare tutte le informazioni disponibili, per determinare l'effettiva necessità di saggi cutanei in vivo. Sebbene sia possibile trarre significative informazioni dalla valutazione di singoli parametri (ad es. pH estremo), è necessario valutare la totalità delle informazioni esistenti. Nel prendere una decisione sull'importanza delle prove vanno valutati tutti i dati pertinenti sugli effetti della sostanza in questione e dei suoi analoghi strutturali e occorre giustificare tale decisione. Dare soprattutto importanza ai dati esistenti sulla sostanza riguardo a persone e animali, seguiti dal risultato dei saggi in vitro o ex vivo. Ove possibile, vanno evitati gli studi in vivo delle sostanze corrosive. I fattori considerati nella strategia di saggio sono:
Valutazione dei dati esistenti su soggetti umani e animali (Fase 1). Considerare innanzi tutto i dati esistenti sulle persone (studi clinici e occupazionali, relazioni di casi, e/o dati relativi a saggi su animali, ad es. da studi di tossicità da esposizione cutanea singola o ripetuta) in quanto forniscono informazioni direttamente correlate agli effetti sulla pelle. Non occorre sottoporre a saggi in vivo le sostanze notoriamente irritanti o corrosive, nonché quelle che hanno dimostrato inequivocabilmente di non essere corrosive e di non avere potere irritante.
Analisi delle relazioni struttura/attività (SAR) (Fase 2). Si devono considerare i risultati dei saggi di sostanze chimiche strutturalmente correlate, ove disponibili. Quando sono disponibili dati su persone e/o animali riguardo a sostanze strutturalmente correlate o miscele di tali sostanze sufficienti a indicarne il potenziale di corrosione/irritazione cutanea, si può presumere che la sostanza in esame produrrà le stesse reazioni. In questi casi non è probabilmente necessario saggiare la sostanza. Dati negativi derivanti da studi di sostanze strutturalmente correlate o miscele di tali sostanze non costituiscono una prova sufficiente di non corrosività/non potere irritante di una sostanza nell'ambito della strategia dei saggi sequenziali. Per identificare il potenziale di corrosione e irritazione cutanea usare approcci SAR validati ed accettati.
Proprietà fisico-chimiche e reattività chimica (Fase 3). Le sostanze che presentano un pH estremo, come ad es. ≤ 2,0 o ≥ 11,5, possono avere forti effetti locali. Se il pH estremo costituisce la base per l'identificazione di una sostanza come corrosiva per la pelle, si può prendere in considerazione anche il suo rapporto acido/alcalino (capacità tampone) (3)(4). Se la capacità tampone suggerisce che una sostanza può non essere corrosiva per la pelle, è necessario effettuare ulteriori saggi a conferma di questo dato, di preferenza un saggio in vitro o ex vivo validato ed accettato (cfr. fasi 5 e 6).
Tossicità cutanea (Fase 4). Se una sostanza chimica è risultata molto tossica per via cutanea, non è probabilmente praticabile uno studio di irritazione/corrosione cutanea in vivo, poiché la quantità di sostanza in esame normalmente applicata potrebbe superare la dose altamente tossica e, di conseguenza, provocare la morte o grave sofferenza degli animali. Inoltre, se sono già stati eseguiti studi di tossicità cutanea su conigli albini fino al livello limite di dose di 2 000 mg/kg di peso corporeo o superiori, e non è stata osservata irritazione o corrosione cutanea, diventano superflui ulteriori saggi per l'irritazione/corrosione cutanea. Quando si valuta la tossicità cutanea acuta in studi eseguiti in precedenza occorre tenere presenti numerose considerazioni. Per esempio, le informazioni riferite sulle lesioni cutanee possono essere incomplete. È possibile che i saggi e le osservazioni siano stati eseguiti su una specie diversa dal coniglio, e la sensibilità della reazione delle varie specie può essere molto diversa. Inoltre, è possibile che la forma della sostanza in esame applicata agli animali non fosse adeguata per la valutazione dell'irritazione/corrosione cutanea (ad es. diluizione delle sostanze per i saggi della tossicità cutanea) (5). Tuttavia, nel caso di studi di tossicità cutanea ben concepiti e ben condotti sui conigli, i risultati negativi possono essere considerati una prova sufficiente che la sostanza non è corrosiva o irritante.
Risultati dei saggi in vitro o ex vivo (Fasi 5 e 6). Non occorre sperimentare sugli animali le sostanze che hanno dimostrato di avere proprietà corrosive o gravemente irritanti in un saggio in vitro o ex vivo (6)(7) concepito per la valutazione di questi effetti specifici. Si può presumere che tali sostanze produrranno effetti analogamente gravi anche in vivo.
Saggio in vivo nei conigli (Fasi 7 e 8). Qualora in base all'analisi dell'importanza delle prove si arrivasse alla decisione di eseguire un saggio in vivo, esso deve cominciare con un saggio iniziale su un solo animale. Se i risultati di tale saggio indicano che la sostanza è corrosiva per la pelle, non si devono effettuare altri saggi. Se invece il saggio iniziale non rivela un effetto corrosivo, la reazione irritante o negativa va confermata usando al massimo due altri animali per un periodo di esposizione di quattro ore. Se il saggio iniziale rivela un effetto irritante, il saggio di conferma può essere condotto in maniera sequenziale, oppure esponendo contemporaneamente i due animali aggiuntivi.
BIBLIOGRAFIA
|
(1)
|
OECD (1996). Test Guidelines Programme: Final Report on the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held on Solna, Sweden, 22-24 January 1996 (http://www1.oecd.org/ehs/tests/background/htm).
|
|
(2)
|
OECD (1998). Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www1.oecd.org/ehs/Class/HCL6.htm).
|
|
(3)
|
Worth, A.P., Fentem J.H., Balls M., Botham P.A., Curren R.D., Earl L.K., Esdaile D.J., Liebsch M. (1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26, 709-720.
|
|
(4)
|
Young, J.R., How, M.J., Walker, A.P., Worth, W.M.H. (1988). Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substances, Without Testing on Animals. Toxic In Vitro, 2 (1) pp 19-26.
|
|
(5)
|
Patil, S.M., Patrick, E., Maibach, H.I. (1996) Animal, Human, and In Vitro Test Methods for Predicting Skin Irritation, in: Francis N. Marzulli and Howard I. Maibach (editors): Dermatotoxicology. Fifth Edition ISBN 1-56032-356-6, Chapter 31,411-436.
|
|
(6)
|
Metodo di prova B.40.
|
|
(7)
|
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhutter, H.G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, pp. 483-524.
|
Figura
STRATEGIA DI TEST E VALUTAZIONE DELL'IRRITAZIONE/CORROSIONE CUTANEA

B.5. TOSSICITÀ ACUTA: IRRITAZIONE/CORROSIONE OCULARE
1. METODO
Questo metodo corrisponde al TG 405 (2002) dell'OCSE.
1.1 INTRODUZIONE
Nella preparazione di questo metodo aggiornato è stata dedicata particolare attenzione ai possibili miglioramenti, mediante la valutazione di tutte le informazioni disponibili circa la sostanza in esame, per evitare prove non necessarie sugli animali da laboratorio e tener conto del benessere degli animali. Questo metodo include la raccomandazione, prima di effettuare il saggio in vivo descritto per l'irritazione/corrosione oculare acuta, di una analisi accurata dei dati disponibili e pertinenti (weight-of-the-evidence analysis) (1) sui dati pertinenti esistenti. Qualora i dati disponibili fossero insufficienti, si raccomanda di ottenerli mediante l'applicazione di saggi sequenziali (2)(3). La strategia di saggio raccomandata comprende l'esecuzione di saggio in vitro validati ed accettati ed è descritta nell'Allegato al metodo. Inoltre, si raccomanda l'uso di un saggio di irritazione/corrosione cutanea in vivo per prevedere la corrosione oculare prima di considerare un saggio oculare in vivo.
Nell'interesse dell'accuratezza scientifica e del benessere degli animali, non bisogna prendere in considerazione i saggi in vivo finché non siano stati valutati, considerando l'importanza delle prove, tutti i dati disponibili pertinenti circa la potenziale corrosività/irritazione oculare della sostanza. Tali dati devono comprendere prove derivanti da studi esistenti su soggetti umani e/o animali da laboratorio, prove di corrosività/irritazione di una o più sostanze strutturalmente correlate o miscele di tali sostanze, dati dimostranti l'elevata acidità o alcalinità della sostanza (4)(5), nonché i risultati di saggi in vitro o ex vivo validati ed accettati per la corrosione e l'irritazione cutanea (6)(6a). Gli studi possono essere stati condotti prima di un'analisi dell'importanza delle prove, o in conseguenza di essa.
Per alcune sostanze, un'analisi di questo tipo può indicare la necessità di studi in vivo del potenziale di corrosione/irritazione oculare. In tutti questi casi, prima di considerare l'uso del saggio oculare in vivo, va preferibilmente condotto uno studio sugli effetti cutanei in vivo della sostanza, e valutate in base al metodo B.4 (7). L'applicazione di un'analisi dell'importanza delle prove e la strategia dei saggi sequenziali dovrebbe ridurre la necessità di eseguire saggi in vivo della corrosività/irritazione delle sostanze per le quali esistano già prove sufficienti derivanti da altri studi. Qualora non sia possibile determinare il potenziale di corrosione o irritazione oculare usando la strategia dei saggi sequenziali, anche dopo l'esecuzione di uno studio in vivo della corrosione e dell'irritazione della cute, si può effettuare un saggio in vivo della corrosione/irritazione oculare.
Nell'Allegato al presente metodo di prova è inclusa la strategia dei saggi sequenziali da preferirsi, che prevede l'esecuzione di saggi validati in vitro o ex vivo per la corrosione/irritazione. Tale strategia è stata sviluppata e raccomandata all'unanimità dai partecipanti a un workshop dell'OCSE (8), ed è stata adottata come strategia raccomandata di saggio nel GHS (Globally Harmonised System for the Classification of Chemical Substances) (Sistema globale armonizzato per la classificazione delle sostanze chimiche) (9). Si raccomanda di seguire questa strategia prima di passare al saggio in vivo. Per le nuove sostanze, si raccomanda di adottare una strategia a «tappesaggio» (stepwise), per sviluppare dati scientificamente validi sulla corrosività/irritazione della sostanza. Se per le sostanze esistenti i dati sulla corrosione/irritazione oculare e cutanea sono insufficienti, si può usare tale strategia per recuperare i dati mancanti. È necessario giustificare l'uso di una strategia o procedura di saggio differente, nonché l'eventuale decisione di non usare un approccio di saggio «per gradi.»
1.2 DEFINIZIONI
Irritazione oculare: produzione di alterazioni nell'occhio in seguito all'applicazione della sostanza in esame sulla superficie anteriore dell'occhio, completamente reversibili entro 21 giorni dall'applicazione.
Corrosione oculare: produzione di lesioni del tessuto oculare o di un grave deterioramento fisico della vista, in seguito all'applicazione della sostanza in esame sulla superficie anteriore dell'occhio, non completamente reversibili entro 21 giorni dall'applicazione.
1.3 PRINCIPIO DEL METODO DI SAGGIO
La sostanza in esame è applicata in un'unica dose su uno degli occhi dell'animale sperimentale; l'occhio non trattato serve da controllo. Il grado di irritazione/corrosione è valutato dando un punteggio alle lesioni di congiuntiva, cornea e iride, a intervalli di tempo specifici. Sono descritti anche altri effetti sull'occhio ed effetti negativi sistemici, con l'obiettivo di fornire una valutazione completa degli effetti. La durata dello studio deve essere sufficiente a valutare la reversibilità o irreversibilità degli effetti.
Gli animali che presentano segni prolungati di grave sofferenza e/o dolore, in qualsiasi fase del saggio, vanno soppressi con metodi non cruenti e la sostanza va valutata di conseguenza. Cfr. bibliografia per i criteri da seguire nel decidere l'eutanasia di animali moribondi o che soffrono gravemente (10).
1.4 DESCRIZIONE DEL METODO DI SAGGIO
1.4.1 Preparazione per il saggio in vivo
1.4.1.1 Selezione delle specie
L'animale da laboratorio di elezione è il coniglio albino, del quale vanno utilizzati giovani adulti sani. Giustificare l'eventuale uso di altri ceppi o specie.
1.4.1.2 Preparazione degli animali
Entro 24 ore dall'inizio del saggio è necessario esaminare entrambi gli occhi di ciascun animale sperimentale provvisoriamente selezionato per il saggio. Non vanno utilizzati animali che presentino irritazione oculare, difetti degli occhi o preesistenti lesioni corneali.
1.4.1.3 Condizioni di alloggio e alimentazione
Gli animali vanno posti in gabbie singole. La temperatura del locale deve essere di 20 oC (± 3 oC) per i conigli. Sebbene l'umidità relativa debba raggiungere almeno il 30 % e preferibilmente non superare il 70 %, tranne che nel corso delle pulizie degli ambienti, occorre puntare a un valore del 50-60 %. L'illuminazione deve essere artificiale, con una sequenza di 12 ore di luce e 12 di oscurità. Per l'alimentazione, attenersi alle diete convenzionali da laboratorio con una quantità illimitata di acqua potabile.
1.4.2 Procedura
1.4.2.1 Applicazione della sostanza in esame
La sostanza in esame va posta nel sacco congiuntivale di un occhio di ciascun animale, dopo aver allontanato delicatamente la palpebra inferiore dal bulbo. Le palpebre vanno poi tenute unite con delicatezza per circa un secondo, per evitare la fuoriuscita del materiale. L'altro occhio, che non viene trattato, serve da controllo.
1.4.2.2 Irrigazione
Gli occhi degli animali sperimentali non vanno lavati per almeno 24 ore dopo l'instillazione della sostanza in esame, tranne nel caso di saggio di sostanze solide (cfr. punto 1.4.2.3.2), e nel caso di effetti corrosivi o irritanti immediati. Dopo 24 ore è possibile effettuare un lavaggio, se lo si considera necessario.
Non si raccomanda l'uso di un gruppo satellite di animali per studiare l'influenza del lavaggio oculare, a meno che ciò non risulti scientificamente giustificato. Qualora sia necessario un gruppo satellite, vanno usati due conigli. Le condizioni del lavaggio vanno documentate accuratamente: momento del lavaggio, composizione e temperatura della soluzione di lavaggio, durata, volume e velocità di applicazione.
1.4.2.3 Livello di dosi
1.4.2.3.1 Saggio di liquidi
Per saggiare i liquidi usare una dose di 0,1 ml. Non usare spray per instillare la sostanza direttamente nell'occhio; lo spray liquido va spruzzato e raccolto in un contenitore prima di instillarne 0,1 ml nell'occhio.
1.4.2.3.2 Saggio di solidi
Nel saggio di sostanze solide, paste e sostanze particellari, la quantità impiegata deve avere un volume di 0,1 ml o un peso non superiore a 100 mg. Il materiale in esame va ridotto in polvere fine. Prima della misurazione del volume, il materiale solido va delicatamente compattato, ad esempio picchiettando sul contenitore per la misurazione. Se la sostanza in esame solida non è stata rimossa dall'occhio dell'animale da meccanismi fisiologici, al primo tempo di osservazione un'ora dopo il trattamento, si può sciacquare l'occhio con soluzione salina o acqua distillata.
1.4.2.3.3 Saggio di aerosol
Si raccomanda di raccogliere tutti gli spray e gli aerosol prima dell'instillazione nell'occhio. L'unica eccezione riguarda le sostanze in contenitori pressurizzati per aerosol, che non possono essere raccolte a causa della vaporizzazione. In questi casi l'occhio va tenuto aperto e la sostanza va somministrata nell'occhio con un unico spruzzo di circa un secondo, da una distanza di 10 cm, direttamente davanti all'occhio. La distanza può variare a seconda della pressione dello spray e del suo contenuto. Evitare di danneggiare l'occhio con la pressione dello spray. In alcuni casi può essere necessario valutare il potenziale di danno «meccanico» all'occhio dovuto alla forza dello spray.
È possibile ottenere una stima della dose di un aerosol simulando il saggio come segue: spruzzare la sostanza attraverso un'apertura delle dimensioni dell'occhio di un coniglio posta esattamente di fronte ad un foglio di carta. L'aumento di peso della carta viene usato quindi per approssimare la quantità spruzzata nell'occhio. Per le sostanze volatili, la dose può essere stimata pesando un contenitore ricevente prima e dopo la rimozione del materiale in esame.
1.4.2.4 Saggio iniziale (saggio di irritazione/corrosione oculare in vivo su un solo animale)
Come descritto nella strategia dei saggi sequenziali (cfr. Allegato 1), si raccomanda caldamente di eseguire inizialmente il saggio in vivo usando un solo animale.
Se con la procedura descritta, i risultati di tale saggio indicano che la sostanza è corrosiva o gravemente irritante per l'occhio, non eseguire altri saggi di irritazione oculare.
1.4.2.5 Anestetici locali
È possibile applicare anestetici locali, valutandone la necessità caso per caso. Se l'analisi dell'importanza delle prove indica che la sostanza può provocare dolore, e se il saggio iniziale dimostra che si verificherà una reazione dolorosa, prima dell'instillazione della sostanza in esame si può applicare un anestetico locale. Il tipo, la concentrazione e la dose dell'anestetico locale vanno attentamente selezionati in modo da assicurare che il suo uso non modifichi la reazione alla sostanza in esame. Anche l'occhio di controllo va anestetizzato analogamente.
1.4.2.6 Saggio di conferma (saggio di irritazione oculare in vivo con animali supplementari)
Se nel saggio iniziale non si osservano effetti corrosivi, confermare la reazione irritante o negativa su un massimo di altri due animali. Se nel saggio iniziale è stato osservato un effetto fortemente irritante che indica un possibile effetto grave (irreversibile) si raccomanda di eseguire il saggio di conferma in maniera sequenziale su un solo animale per volta, anziché esporre contemporaneamente i due animali. Se il secondo animale rivela effetti corrosivi o gravemente irritanti, interrompere il saggio. È possibile che siano necessari altri animali per confermare le reazioni irritanti deboli o moderate.
1.4.2.7 Periodo di osservazione
La durata del periodo di osservazione deve essere sufficiente a valutare completamente l'entità e la reversibilità degli effetti osservati. Interrompere però l'esperimento in qualsiasi momento se l'animale mostra segni continui di dolore o sofferenza gravi (9). Per determinare la reversibilità degli effetti, gli animali vanno osservati di norma per 21 giorni successivamente alla somministrazione della sostanza in esame. In caso di reversibilità prima dei 21 giorni, interrompere subito l'esperimento.
1.4.2.7.1 Osservazioni cliniche e classificazione delle reazioni oculari
Gli occhi vanno esaminati a 1, 24, 48 e 72 ore dopo l'applicazione della sostanza in esame. Gli animali devono essere sottoposti a saggio per il tempo minimo necessario per ottenere informazioni definitive. Gli animali che presentano grave dolore o sofferenza vanno soppressi al più presto con metodi non cruenti e la sostanza va valutata di conseguenza. Sopprimere con metodi non cruenti gli animali che, dopo l'instillazione, presentano le seguenti lesioni oculari: perforazione corneale o ulcerazione corneale di rilievo, compreso stafiloma; sangue nella camera anteriore dell'occhio; opacità corneale di grado 4 che persista per 48 ore; assenza di riflesso pupillare alla luce (risposta dell'iride di grado 2) che persista per 72 ore; ulcerazione della membrana congiuntivale; necrosi della congiuntiva o della membrana nittitante; distacco epidermico. Tali lesioni sono infatti generalmente irreversibili.
Gli animali che non sviluppano lesioni oculari possono essere soppressi non prima di 3 giorni dopo l'instillazione. Gli animali con lesioni lievi o moderate vanno tenuti sotto osservazione fino alla scomparsa delle lesioni, oppure per 21 giorni, momento in cui lo studio si conclude. Effettuare le osservazioni nei giorni 7,14 e 21, con l'obiettivo di determinare lo stato delle lesioni e la loro reversibilità o irreversibilità.
In occasione di ciascun esame, registrare i gradi della reazione oculare (congiuntiva, cornea e iride) (Tabella I). Annotare anche qualsiasi altra lesione dell'occhio (ad es. panno corneale, macchie) e qualsiasi effetto sistemico negativo.
L'esame delle reazioni può essere facilitato usando una lente binoculare, una lampada manuale a fessura, un biomicroscopio o altro dispositivo idoneo. Dopo aver registrato le osservazioni a 24 ore, è possibile esaminare ulteriormente gli occhi con l'ausilio di fluoresceina.
La classificazione delle reazioni oculari è necessariamente soggettiva. Per favorirne l'armonizzazione e per assistere i laboratori e le persone che eseguono e interpretano le osservazioni, istruire adeguatamente il personale sul sistema di punteggio utilizzato.
2. DATI
2.2 VALUTAZIONE DEI RISULTATI
Valutare i punteggi dell'irritazione oculare insieme alla natura e alla gravità delle lesioni, nonché alla loro reversibilità o irreversibilità. I punteggi individuali non rappresentano uno standard assoluto per le proprietà irritanti di un materiale, in quanto si valutano anche altri effetti del materiale in esame. I punteggi individuali vanno invece considerati come valori di riferimento e hanno significato solo se corredati da una descrizione e una valutazione complete di tutte le osservazioni.
3. RAPPORTO
3.1 RAPPORTO DI PROVA
Il rapporto deve contenere le seguenti informazioni:
|
|
Motivazione per il saggio in vivo: analisi dei dati relativi a saggi precedenti, compresi i risultati della strategia dei saggi sequenziali
|
—
|
descrizione dei dati pertinenti disponibili da saggi precedenti;
|
|
—
|
dati ricavati in ciascuna fase della strategia di saggio;
|
|
—
|
descrizione dei saggi in vitro eseguiti, con i dettagli delle procedure, i risultati ottenuti con le sostanze in esame/di riferimento;
|
|
—
|
descrizione dello studio di irritazione/corrosione cutanea in vivo eseguito, con i risultati ottenuti;
|
|
—
|
analisi dell'importanza delle prove per l'esecuzione dello studio in vivo
|
|
|
|
Sostanza in esame:
|
—
|
dati di identificazione (ad es. numero CAS, origine, purezza, impurità note, numero di lotto);
|
|
—
|
natura fisica e proprietà fisico-chimiche (ad es. pH, volatilità, solubilità, stabilità, reattività con l’acqua);
|
|
—
|
se si tratta di una miscela, composizione e percentuali relative dei componenti;
|
|
—
|
se si usa un anestetico locale, identificazione, purezza, tipo, dose e potenziale interazione con la sostanza in esame.
|
|
|
|
Eccipiente:
|
—
|
identificazione, concentrazione (ove pertinente), volume usato;
|
|
—
|
giustificazione della scelta dell'eccipiente.
|
|
|
|
Animali sperimentali:
|
—
|
specie/ceppo usato, motivazione dell'uso di animali diversi dal coniglio albino;
|
|
—
|
età di ciascun animale all'inizio dello studio;
|
|
—
|
numero di animali di ciascun sesso nei gruppi sperimentali e di controllo (ove necessario);
|
|
—
|
peso di ciascun singolo animale all'inizio e alla conclusione del saggio;
|
|
—
|
origine, condizioni di alloggio, dieta, ecc.
|
|
|
|
Risultati:
|
—
|
descrizione del metodo usato per assegnare un punteggio all'irritazione in ciascun momento di osservazione (ad es. lampada manuale a fessura, biomicroscopio, fluoresceina);
|
|
—
|
tabella dei dati relativi alla reazione irritante/corrosiva per ciascun animale e in ciascun momento di osservazione fino alla fine del saggio
|
|
—
|
descrizione del grado e della natura dell'irritazione o della corrosione osservata;
|
|
—
|
descrizione di qualsiasi altra lesione osservata nell'occhio (ad es. vascolarizzazione, formazione di panno oculare, aderenze, macchie);
|
|
—
|
descrizione degli eventuali effetti negativi non oculari locali e sistemici e degli eventuali reperti istopatologici.
|
|
|
|
Discussione dei risultati.
|
3.2 INTERPRETAZIONE DEI RISULTATI
L'estrapolazione dei risultati degli studi sull'irritazione oculare negli animali da laboratorio agli esseri umani ha un valore solo limitato. In molti casi, il coniglio albino è più sensibile dell'uomo alle sostanze irritanti o corrosive per l'occhio.
È necessario interpretare con attenzione i dati per escludere l'irritazione dovuta a infezione secondaria.
4. BIBLIOGRAFIA
|
(1)
|
Barratt, M.D., Castell, J.V., Chamberlain, M., Combes, R.D., Dearden, J.C., Fentem, J.H., Gerner, I., Giuliani, A., Gray, T.J.B., Livingston, D.J., Provan, W.M., Rutten, F.A.J.J.L., Verhaar, H.J.M., Zbinden, P. (1995) The Integrated Use of Alternative Approaches for Predicting Toxic Hazard. ECVAM Workshop Report 8. ATLA 23, 410-429.
|
|
(2)
|
de Silva, O., Cottin, M., Dami, N., Roguet, R., Catroux, P., Toufic, A., Sicard, C., Dossou, K.G., Gerner, I., Schlede, E., Spielmann, H., Gupta, K.C., Hill, R.N. (1997) Evaluation of Eye Irritation Potential: Statistical Analysis and Tier Testing Strategies. Food Chem. Toxicol 35, 159-164.
|
|
(3)
|
Worth A.P. and Fentem J.H. (1999) A general approach for evaluating stepwise testing strategies ATLA 27, 161-177.
|
|
(4)
|
Young, J.R., How, M.J., Walker, A.P., Worth W.M.H. (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicol. In Vitro, 2, 19-26.
|
|
(5)
|
Neun, D.J. (1993) Effects of Alkalinity on the Eye Irritation Potential of Solutions Prepared at a Single pH. J. Toxicol. Cut. Ocular Toxicol. 12, 227-231.
|
|
(6)
|
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Edsaile, D.J., Holzhutter, H.G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, pp. 483-524.
|
|
(6a)
|
Metodo di prova B.40 Corrosione cutanea.
|
|
(7)
|
Metodo di prova B.4. Tossicità acuta: irritazione/corrosione cutanea.
|
|
(8)
|
OECD (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22-24 January 1996 (http://www.oecd.org/ehs/test/background.htm).
|
|
(9)
|
OECD (1998) Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www.oecd.org/ehs/Class/HCL6.htm).
|
|
(10)
|
OECD (2000) Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. OECD Environmental Health and Safety Publications. Series on Testing and Assessment No. 19 (http://www.oecd.org/ehs/test/monos.htm).
|
Tabella I
CLASSIFICAZIONE DELLE LESIONI OCULARI
Cornea
Opacità: grado di densità (le misure vanno prese dalle zone più dense) (1)
|
Assenza di ulcerazione e opacità
|
0
|
|
Zone di opacità sparse o diffuse (diverse dal lieve appannamento della normale lucentezza); dettagli dell'iride visibili chiaramente
|
1
|
|
Zone traslucide facilmente individuabili; dettagli dell'iride lievemente offuscati
|
2
|
|
Zona madreperlacea; nessun dettaglio visibile dell'iride; dimensioni della pupilla appena distinguibili
|
3
|
|
Cornea opaca; iride non distinguibile attraverso l'opacità
|
4
|
Massimo possibile: 4
NOTE
Iride
|
Normale
|
0
|
|
Rughe notevolmente approfondite, congestione, edema, moderata iperemia circumcorneale; oppure iniezione; iride reattiva alla luce (una reazione lenta è considerata positiva)
|
1
|
|
Emorragia, distruzione macroscopica, oppure assenza di reazione alla luce
|
2
|
Massimo possibile: 2
Congiuntive
Rossore (relativo alla congiuntiva palpebrale e bulbare; escluse cornea e iride)
|
Normale
|
0
|
|
Alcuni vasi sanguigni iperemici (iniettati)
|
1
|
|
Colore cremisi diffuso; singoli vasi non facilmente distinguibili
|
2
|
|
Rosso acceso diffuso
|
3
|
Massimo possibile: 3
Chemosi
Edema (relativo alle palpebre e/o alle membrane nittitanti)
|
Normale
|
0
|
|
Edema appena superiore alla norma
|
1
|
|
Edema evidente, con parziale eversione delle palpebre
|
2
|
|
Edema, con palpebre semichiuse
|
3
|
|
Edema, con palpebre più che semichiuse
|
4
|
Massimo possibile: 4
Allegato
Strategia dei saggi sequenziali per l'irritazione e la corrosione oculari
CONSIDERAZIONI
Nell'interesse dell'accuratezza scientifica e del benessere degli animali, è importante evitare l'uso non necessario di animali e ridurre al minimo i saggi atti a provocare reazioni gravi. Valutare tutte le informazioni relative alla potenziale irritazione/corrosività oculare di una sostanza prima di prendere in considerazione i saggi in vivo. È possibile che esistano già prove sufficienti per classificare il potenziale di irritazione o corrosione oculare di una sostanza in esame, senza bisogno di effettuare saggi su animali da laboratorio. L'analisi dell'importanza delle prove e l'uso di una strategia dei saggi sequenziali ridurranno al minimo la necessità di eseguire saggi in vivo, soprattutto se è probabile che la sostanza provochi reazioni gravi.
Si raccomanda di svolgere un'analisi dell'importanza delle prove per valutare le informazioni esistenti sul potenziale di irritazione e corrosione oculare delle sostanze e determinare la necessità di altri studi, diversi da quelli in vivo sugli occhi, per meglio caratterizzare tale potenziale. Qualora tali studi fossero necessari, si raccomanda di applicare la strategia dei saggi sequenziali per sviluppare i dati sperimentali pertinenti. Per le sostanze senza una documentazione sperimentale, usare la strategia dei saggi sequenziali per sviluppare i dati necessari al fine di valutarne la corrosività/irritazione oculare. La strategia dei saggi descritta nel presente Allegato è stata sviluppata nel corso di un workshop dell'OCSE (1) e successivamente confermata ed ampliata nello Harmonised Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances (Sistema di classificazione armonizzato integrato dei rischi per la salute umana e gli effetti ambientali delle sostanze chimiche), come approvato alla 28a riunione congiunta del comitato sulle sostanze chimiche e dal gruppo di lavoro sulle sostanze chimiche nel novembre 1998 (2).
Questa strategia di saggio non è parte integrante del metodo di prova B.5, ma esprime l'approccio raccomandato per la determinazione delle proprietà di irritazione/corrosione oculare. Tale approccio rappresenta sia la migliore prassi che un punto di riferimento etico per l'esecuzione di saggi in vivo sull'irritazione/corrosione oculare. Il metodo di prova fornisce indicazioni su come eseguire il saggio in vivo e riassume i fattori da valutare prima di prendere in considerazione tale saggio. La strategia dei saggi sequenziali fornisce un metodo di analisi dell'importanza delle prove per la valutazione dei dati esistenti sulle proprietà di irritazione/corrosione oculare delle sostanze e un approccio graduale per lo sviluppo di dati pertinenti sulle sostanze sulle quali sono necessari ulteriori studi o che non sono mai state oggetto di studio. La strategia prevede dapprima l'esecuzione di saggi validati ed accettati in vitro o ex vivo e successivamente di studi di irritazione/corrosione cutanea in base al metodo di prova B.4 in circostanze specifiche (3)(4).
DESCRIZIONE DELLA STRATEGIA DI SAGGIO «PER GRADI»
Prima di effettuare saggi nell'ambito della strategia dei saggi sequenziali (Figura), valutare tutte le informazioni disponibili, per determinare l'effettiva necessità di saggi oculari in vivo. Sebbene sia possibile trarre significative informazioni dalla valutazione di singoli parametri (ad es. pH estremo), è necessario valutare la totalità delle informazioni esistenti. Nel prendere una decisione sull'importanza delle prove valutare tutti i dati pertinenti sugli effetti della sostanza in questione e dei suoi analoghi strutturali e giustificare tale decisione. Dare soprattutto importanza ai dati esistenti sulla sostanza riguardo a persone e animali, seguiti dal risultato dei saggi in vitro o ex vivo. Ove possibile, evitare gli studi in vivo delle sostanze corrosive. I fattori considerati nella strategia di saggio sono:
Valutazione dei dati esistenti su soggetti umani e animali (Fase 1). Considerare innanzitutto i dati esistenti sulle persone (studi clinici e occupazionali, relazioni di casi, e/o dati relativi a saggi su animali in studi sugli occhi), in quanto forniscono informazioni direttamente correlate agli effetti sugli occhi. Successivamente valutare i dati disponibili di studi su soggetti umani e/o animali sulla corrosione/irritazione cutanea. Non instillare negli occhi degli animali sostanze notoriamente corrosive o gravemente irritanti per l'occhio né sostanze che mostrano effetti corrosivi o irritanti sulla pelle; tali sostanze vanno considerate corrosive e/o irritanti anche per gli occhi. Non saggiare in vivo sugli occhi sostanze che in precedenti studi oculari hanno presentato prove sufficienti di non essere corrosive e di non avere potere irritante.
Analisi delle relazioni struttura/attività (SAR) (Fase 2). Prendere in considerazione i risultati dei saggi di sostanze chimiche strutturalmente correlate, ove disponibili. Quando sono disponibili dati su persone e/o animali riguardo a sostanze strutturalmente correlate o miscele di tali sostanze sufficienti a indicarne il potenziale di corrosione/irritazione oculare, si può presumere che la sostanza in esame provocherà le stesse reazioni. In questi casi non è probabilmente necessario saggiare la sostanza. Dati negativi derivanti da studi di sostanze strutturalmente correlate o miscele di tali sostanze non costituiscono una prova sufficiente di non corrosività/non potere irritante di una sostanza nell'ambito della strategia dei saggi sequenziali. Per identificare il potenziale di corrosione e irritazione sia per gli effetti oculari che per quelli cutanei usare approcci SAR validati ed accettati.
Proprietà fisicochimiche e reattività chimica (Fase 3). Le sostanze che presentano un pH estremo, come ad es. ≤ 2,0 o ≥ 11,5, possono avere forti effetti locali. Se il pH estremo costituisce la base per identificare una sostanza come corrosiva o irritante per gli occhi, si può prendere in considerazione anche il suo rapporto acido/alcalino (capacità tampone) (5)(6). Se la capacità tampone suggerisce che una sostanza può non essere corrosiva per l'occhio, è necessario effettuare ulteriori saggi a conferma di questo dato, di preferenza un saggio in vitro o ex vivo validato ed accettato (cfr. punto Fasi 5 e 6).
Considerazione di altre informazioni esistenti (Fase 4). Valutare in questa fase tutte le informazioni disponibili sulla tossicità sistemica per via cutanea. Considerare anche la tossicità cutanea acuta della sostanza in esame. Se essa si è dimostrata molto tossica per via cutanea, può non essere necessario saggiarla sull'occhio. Sebbene non vi sia necessariamente un rapporto fra la tossicità cutanea acuta e l'irritazione/corrosione oculare, si può presumere che se una sostanza è molto tossica per via cutanea, presenterà anche elevata tossicità quando viene instillata nell'occhio. Questi dati possono essere valutati anche fra le fasi 2 e 3.
Risultati dei saggi in vitro o ex vivo (Fasi 5 e 6). Non occorre sperimentare sugli animali le sostanze che hanno dimostrato di avere proprietà corrosive o gravemente irritanti in un saggio in vitro o ex vivo (7)(8) che è stato validato ed accettato per la valutazione specifica della corrosività/irritazione oculare o cutanea. Si può presumere che tali sostanze produrranno effetti analogamente gravi anche in vivo. Qualora non siano disponibili saggi in vitro/ex vivo validati ed accettati, si salteranno le Fasi 5 e 6 e si procederà direttamente alla Fase 7.
Valutazione del potere irritante o della corrosività cutanea in vivo della sostanza (Fase 7). Quando le prove esistenti non sono sufficienti ad effettuare un'analisi dell'importanza delle prove conclusiva della potenziale irritazione/corrosività oculare di una sostanza, sulla base dei dati degli studi sopra elencati, occorre valutare per prima cosa il potenziale di irritazione/corrosione cutanea in vivo, usando il metodo di prova B.4 (4) e il suo Allegato (9). Qualora si dimostri che la sostanza provoca corrosione o grave irritazione cutanea, essa va considerata un irritante oculare corrosivo, a meno che altre informazioni non vadano a sostegno di una conclusione alternativa. Pertanto, non è necessario eseguire un saggio oculare in vivo. Se la sostanza non è corrosiva o gravemente irritante per la pelle, va eseguito un saggio oculare in vivo.
Saggio in vivo nei conigli (Fasi 8 e 9). Gli studi oculari in vivo devono cominciare con un saggio iniziale su un solo animale. Se i risultati di questo saggio indicano che la sostanza è gravemente irritante o corrosiva per gli occhi, non si devono effettuare altri saggi. Se invece il saggio non rivela effetti corrosivi o gravemente irritanti, si esegue un saggio di conferma con altri due animali.
BIBLIOGRAFIA
|
(1)
|
OECD (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22-24 January 1996 (http://www1.oecd.org/ehs/test/background.htm).
|
|
(2)
|
OECD (1998) Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www1.oecd.org/ehs/Class/HCL6.htm).
|
|
(3)
|
Worth, A.P. and Fentem J.H. (1999). A General Approach for Evaluating Stepwise Testing Strategies. ATLA 27, 161-177.
|
|
(4)
|
Metodo di prova B.4. Tossicità acuta: irritazione/corrosione cutanea.
|
|
(5)
|
Young, J.R., How, M.J., Walker, A.P., Worth W.M.H. (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicol. In Vitro, 2, 19-26.
|
|
(6)
|
Neun, D.J. (1993) Effects of Alkalinity on the Eye Irritation Potential of Solutions Prepared at a Single pH. J. Toxicol. Cut. Ocular Toxicol. 12, 227-231.
|
|
(7)
|
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Edsail, D.J., Holzhutter, H.G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, pp. 483-524.
|
|
(8)
|
Metodo di prova B.40 Corrosione cutanea.
|
|
(9)
|
Allegato al metodo di prova B.4: Una strategia dei saggi sequenziali per l'irritazione e la corrosione cutanee.
|
Figura
STRATEGIA DI SAGGIO E VALUTAZIONE DELL'IRRITAZIONE/CORROSIONE OCULARE


B.6 SENSIBILIZZAZIONE CUTANEA
1. METODO
1.1. INTRODUZIONE
Note:
La sensibilità dei saggi e la loro efficacia nell'individuazione di potenziali sensibilizzatori della cute umana costituiscono parametri importanti in un sistema di classificazione della tossicità per la tutela della salute pubblica.
Non esiste un unico metodo sperimentale atto a identificare correttamente tutte le sostanze dotate di un potenziale sensibilizzante per la cute umana e quindi sistematicamente applicabile.
Nella scelta del metodo occorre tener conto di fattori quali le caratteristiche fisiche di una sostanza, compresa la sua capacità di penetrazione cutanea.
Sono stati elaborati due tipi di saggio su porcellini d'India: il saggio con utilizzo di adiuvanti, nel quale uno stato allergico viene potenziato sciogliendo o sospendendo la sostanza in esame in adiuvante completo di Freund (ACF), e il saggio senza utilizzo di adiuvante.
I saggi con utilizzo di adiuvante offrono generalmente un più elevato grado di precisione nell'individuare un potenziale di sensibilizzazione cutanea nell'uomo rispetto ai metodi che non prevedono l'uso dell'adiuvante completo di Freund. Essi sono pertanto preferibili.
Il «Guinea-Pig Maximisation Test» (GPMT) è un test con utilizzo di adiuvante ampiamente usato. Malgrado esistano diversi altri metodi per identificare il potenziale di sensibilizzazione cutanea di una sostanza, il GPMT è considerato il metodo con adiuvante d'elezione.
Per molte classi di sostanze chimiche, i saggi senza utilizzo di adiuvante (fra cui il più diffuso è quello di Buehler) sono considerati meno sensibili.
In alcuni casi il saggio di Buehler, che prevede un'applicazione topica della sostanza, può risultare preferibile all'iniezione intradermica utilizzata nel Guinea-Pig Maximisation Test. Qualora si opti per il saggio di Buehler, si dovrà fornire una giustificazione scientifica.
Il Guinea-Pig Maximisation Test (GPMT) e il saggio di Buehler sono descritti nel presente metodo. È possibile il ricorso ad altri metodi, purché siano debitamente convalidati e venga fornita una giustificazione scientifica.
In caso di risultato positivo di un saggio di screening riconosciuto, la sostanza in esame può essere considerata un potenziale sensibilizzante e non è necessario condurre un ulteriore test GPMT. Tuttavia in caso di risultato negativo del saggio di screening è necessario condurre un test GPMT attenendosi alla procedura descritta nel presente metodo di saggio.
Vedi anche introduzione generale, parte B.
1.2. DEFINIZIONI
Sensibilizzazione cutanea: (dermatite allergica da contatto) è una reazione cutanea a una sostanza mediata da fattori immunologici. Nell'uomo la reazione può essere caratterizzata da prurito, eritema, edema, papule, vescicole, bolle o da una combinazione di queste manifestazioni. In altre specie le reazioni possono differire e limitarsi alla comparsa di eritemi e di edemi.
Esposizione di induzione: esposizione sperimentale di un soggetto alla sostanza in esame al fine di indurre uno stato di ipersensibilità.
Periodo di induzione: periodo della durata minima di una settimana, successivo all'esposizione di induzione, entro il quale può manifestarsi uno stato di ipersensibilità.
Esposizione di provocazione: in un soggetto già trattato, esposizione sperimentale alla sostanza in esame, effettuata successivamente al periodo di induzione al fine di accertare se il soggetto sviluppa una reazione di ipersensibilità.
1.3 SOSTANZE DI RIFERIMENTO
La sensibilità e l'attendibilità della tecnica sperimentale utilizzata devono essere verificate ogni sei mesi utilizzando sostanze notoriamente dotate di proprietà di sensibilizzazione cutanea di grado leggero-medio.
In un saggio eseguito correttamente, per sensibilizzanti di tipo leggero-medio si dovrebbe avere una risposta pari ad almeno il 30 % con il metodo con adiuvanti e ad almeno il 15 % con il metodo senza adiuvanti.
Si farà preferibilmente ricorso alle seguenti sostanze:
|
Numero CAS-
|
Numero EINECS-
|
Denominazione EINECS
|
Denominazione corrente
|
|
101-86-0
|
202-983-3
|
α-esilcinnamaldeide
|
α-esilcinnamaldeide
|
|
149-30-4
|
205-736-8
|
benzothiazol-2-tiolo (mercapto-benzothiaziolo)
|
kaptax
|
|
94-09-7
|
202-303-5
|
benzocaina
|
norcaina
|
Qualora le circostanze lo giustifichino, potranno essere utilizzate altre sostanze di controllo conformi ai criteri suelencati.
1.4. PRINCIPIO DEL METODO DI SAGGIO
In un primo tempo gli animali vengono esposti alla sostanza da saggiare con iniezioni intradermiche e/o applicazione epidermica (esposizione di induzione). Dopo un periodo di riposo di 10-14 giorni (periodo di induzione), in cui si può sviluppare una risposta immunitaria, essi vengono esposti alla dose di provocazione. L'estensione e la gravità della reazione cutanea all'esposizione di provocazione vengono confrontate con la reazione sviluppata dagli animali di controllo trattati con un placebo nella fase di induzione e sottoposti all'esposizione di provocazione.
1.5. DESCRIZIONE DEI METODI DI SAGGIO
Se lo si ritiene necessario, si procederà alla rimozione della sostanza da saggiare utilizzando acqua o un solvente appropriato, in modo da non alterare la reazione in corso, né intaccare l'integrità dell'epidermide.
1.5.1. Guinea-Pig Maximistlion Test (GMPT)
1.5.1.1. Preparazioni
Porcellini d'India albini, giovani e sani, vengono acclimatati alle condizioni di laboratorio per almeno 5 giorni prima dell'inizio del saggio. Prima dell'esperimento, gli animali vengono suddivisi in modo casuale ed assegnati al gruppo da trattare o al gruppo di controllo. In funzione del metodo di saggio utilizzato, il pelo verrà tagliato, rasato o rimosso con una sostanza depilatoria, avendo cura di non danneggiare la cute. Gli animali vengono pesati all'inizio e alla fine del saggio.
1.5.1.2. Condizioni sperimentali
1.5.1.2.1. Animali da esperimento
Si utilizzano porcellini d'India albini di ceppi comunemente usati in laboratorio.
1.5.1.2.2. Numero e sesso
Si utilizzano animali di sesso maschile e/o femminile. Le femmine dovranno essere nullipare e non gravide.
Il gruppo sottoposto a trattamento deve essere composto da almeno 10 animali, il gruppo di controllo da un minimo di 5. Qualora il primo gruppo comprenda meno di 20 esemplari ed il secondo meno di 10 e non sia possibile concludere che la sostanza in esame è un sensibilizzante, si consiglia di proseguire lo studio fino a disporre di almeno 20 animali trattati e 10 di controllo.
1.5.1.2.3. Livelli di dosaggio
La concentrazione della sostanza in esame utilizzata per ogni esposizione di induzione deve essere ben tollerata a livello sistemico e corrispondere alla dose massima suscettibile di produrre un'irritazione cutanea di grado leggero-medio. La concentrazione utilizzata per l'esposizione di provocazione deve corrispondere alla dose massima che non cagioni irritazione. Se necessario, la concentrazione appropriata può essere determinata con uno studio pilota condotto su due o tre animali. A questo scopo è preferibile utilizzare animali trattati con l'adiuvante completo di Freund.
1.5.1.3. Procedimento
1.5.1.3.1. Induzione
Giorno 0 — gruppo trattato
Nella regione della spalla, debitamente depilata, si praticano tre serie di due iniezioni intradermiche da 0,1 ml ciascuna. Le due iniezioni di ciascuna serie devono essere praticate l'una a sinistra e l'altra a destra della linea mediana.
Iniezione 1: miscela 1:1 (v/v) ACF/acqua o soluzione salina fisiologica
Iniezione 2: la sostanza in esame in un veicolo adatto alla concentrazione selezionata
Iniezione 3: la sostanza in esame alla concentrazione desiderata, formulata in una miscela 1:1 (v/v) ACF/acqua o soluzione salina fisiologica.
Nell'iniezione 3, le sostanze idrosolubili vengono disciolte nella fase acquosa prima di essere miscelate con l'ACF. Le sostanze liposolubili o insolubili vengono messe in sospensione nell'ACF prima di essere combinate con la fase acquosa. La concentrazione finale della sostanza in esame deve essere uguale a quella utilizzata nell'iniezione 2.
Le iniezioni 1 e 2 vengono praticate l'una accanto all'altra e quanto più possibile in prossimità della testa, mentre la 3 è praticata verso la parte caudale della zone d'esame.
Giorno 0 — gruppo di controllo
Tre serie di due iniezioni intradermiche, ciascuna del volume di 0,1 ml, sono praticate negli stessi punti scelti per gli animali trattati.
Iniezione 1: miscela 1:1 (v/v) ACF/acqua o soluzione salina fisiologica
Iniezione 2: il veicolo non diluito
Iniezione 3: formulazione 50 % p/v del veicolo in una miscela 1:1 (v/v) ACF/acqua o soluzione salina fisiologica.
Giorno 5-7 — gruppo trattato e gruppo di controllo
Circa 24 ore prima dell'applicazione topica di induzione, se la sostanza non è un irritante cutaneo, l'area di prova, debitamente tosata e/o rasata, viene trattata con 0,5 ml di laurilsoliato di sodio al 10 % in vaselina, al fine di provocare un'irritazione locale.
Giorno 6-8 — gruppo trattato
L'area di prova viene nuovamente depilata. Una carta da filtro (2 × 4 cm), impregnata della sostanza in esame incorporata in un veicolo adatto, viene applicata sull'area di prova e tenuta in contatto con la cute per 48 ore mediante una medicazione occlusiva. La scelta del veicolo deve essere motivata. Le sostanze solide vengono ridotte in polvere e incorporate in un veicolo adatto. I liquidi, se del caso, possono essere applicati direttamente.
Giorno 6-8 — gruppo di controllo
L'area di prova viene nuovamente depilata. Il solo veicolo viene applicato con le stesse modalità sull'area di prova e tenuto a contatto per 48 ore mediante una medicazione occlusiva.
1.5.1.3.2. Provocazione (challenge)
Giorno 20-22 — gruppo trattato e gruppo di controllo
Si rimuove il pelo dai fianchi degli animali trattati e degli animali di controllo. Su un fianco si applica una garza o una compressa impregnata della sostanza in esame e, se opportuno, sull'altro si applica una garza o una compressa impregnata del solo veicolo. Le compresse vengono tenute a contatto con la cute per 24 ore mediante una medicazione occlusiva.
1.5.1.3.3. Osservazione e valutazione: gruppo trattato e gruppo di controllo
|
—
|
circa 21 ore dopo la rimozione della compressa, la zona sottoposta a «challenge» viene pulita e tosata e/o rasata e depilata, se necessario;
|
|
—
|
circa 3 ore più tardi (approssimativamente 48 ore dall'inizio dell'applicazione di provocazione) la reazione cutanea viene esaminata e classificata in base alla scala di valutazione riportata in appendice;
|
|
—
|
circa 24 ore dopo detto esame si procede a una seconda osservazione (72 ore) e a una nuova classificazione delle reazioni cutanee.
|
È consigliabile procedere ad una lettura cieca nei due gruppi di animali.
Qualora sia necessario chiarire i risultati ottenuti nel primo «challenge», una seconda esposizione di provocazione, ove del caso con un nuovo gruppo di controllo, potrà essere effettuata a circa una settimana di distanza dalla prima. Il nuovo «challenge» potrà essere realizzato anche sul gruppo di controllo iniziale.
Tutte le reazioni cutanee e qualsiasi risultato insolito, comprese le reazioni sistemiche, derivanti dall'esposizione di induzione e di provocazione, dovranno essere osservate e classificate in base alla scala di valutazione di Magnusson/Kligman (vedi appendice). Per chiarire eventuali reazioni dubbie si potrà far ricorso ad altre tecniche, quali l'esame istopatologico o la misurazione dello spessore delle pieghe cutanee.
1.5.2. Saggio di Buehler
1.5.2.1. Preparazioni
Porcellini d'India albini, giovani e sani, vengono acclimatati alle condizioni di laboratorio per almeno 5 giorni prima dell'inizio del saggio. Prima dell'esperimento, gli animali vengono suddivisi in modo casuale ed assegnati al gruppo da trattare o al gruppo di controllo. In funzione del metodo di saggio utilizzato, il pelo verrà tagliato, rasato o rimosso con una sostanza depilatoria, avendo cura di non danneggiare la cute. Gli animali vengono pesati all' inizio e alla fine del saggio.
1.5.2.2. Condizioni sperimentali
1.5.2.2.1. Animali da esperimento
Si utilizzano porcellini d'India albini di ceppi comunemente usati in laboratorio.
1.5.2.2.2. Numero e sesso
Si utilizzano animali di sesso maschile e/o femminile. Le femmine dovranno essere nullipare e non gravide.
Il gruppo sottoposto a trattamento deve essere composto da almeno 20 animali, il gruppo di controllo da un minimo di 10.
1.5.2.2.3. Livelli di dosaggio
La concentrazione della sostanza in esame utilizzata per ogni esposizione di induzione deve corrispondere alla dose massima suscettibile di produrre un'irritazione cutanea moderata e non eccessiva. La concentrazione utilizzata per l'esposizione di provocazione deve corrispondere alla dose massima che non cagioni irritazione. Se necessario, la concentrazione appropriata può essere determinata con uno studio pilota condotto su due o tre animali.
Nel caso di sostanze idrosolubili, l'acqua o una soluzione diluita non irritante di surfactante rappresentano il veicolo più appropriato. Per le altre sostanze si preferiranno una miscela di etanolo all'80 % ed acqua per la fase di induzione e dell'acetone per la fase di provocazione.
1.5.2.3. Procedimento
1.5.2.3.1. Induzione
Giorno 0 — gruppo trattato
Gli animali vengono tosati su un fianco. La compressa utilizzata per il saggio viene impregnata della sostanza in esame incorporata in un veicolo idoneo (la scelta del veicolo deve essere motivata; se del caso, le sostanze liquide possono essere applicate non diluite).
La compressa viene applicata sull'area di prova e tenuta a contatto con la pelle per sei ore mediante un cerotto occlusivo e una fasciatura adeguata.
La medicazione deve essere occlusiva. Si potrà ricorrere a un tampone d'ovatta, rotondo o quadrato e di circa 4-6 cm2. Per garantire l'occlusione, è opportuno limitare la libertà di movimento degli animali con un sistema adeguato. Se si utilizza una fasciatura, possono essere necessarie esposizioni supplementari.
Giorno 0 — gruppo di controllo
Gli animali vengono tosati su un fianco. Il solo veicolo viene applicato con modalità analoghe a quelle utilizzate per il gruppo trattato. La compressa viene tenuta a contatto con la pelle per sei ore mediante un cerotto occlusivo e una fasciatura adeguata. Se si dimostra che non è necessario disporre di un gruppo di controllo cui sia stato somministrato un placebo, si potrà utilizzare un gruppo di controllo non sottoposto a tale trattamento.
Giorni 6-8 e 13-15 — gruppo trattato e gruppo di controllo
Si esegue la stessa applicazione del giorno 0 sulla medesima area di prova (rasata, se necessario) sulla stesso fianco il giorno 6-8 e nuovamente il giorno 13-15.
1.5.2.3.2. Provocazione (challenge)
Giorno 27-29 — gruppo trattato e gruppo di controllo
Il fianco non trattato degli animali trattati e degli animali di controllo viene tosato. Si procede quindi all'applicazione di un cerotto occlusivo o di una compressa contenente un'adeguata quantità della sostanza in esame, alla massima concentrazione non irritante, sulla parte posteriore del fianco non trattato in entrambi i gruppi di animali.
Se necessario, si applica inoltre un cerotto occlusivo o una compressa contenente il solo veicolo sulla parte anteriore del fianco non trattato di entrambi i gruppi di animali. Il cerotto o la compressa vengono tenuti a contatto con la pelle per 6 ore mediante un'adeguata medicazione.
1.5.2.3.3. Osservazione e valutazione
|
—
|
Circa 21 ore dopo la rimozione del cerotto, la zona sottoposta a «challenge» viene depilata;
|
|
—
|
circa tre ore più tardi (approssimativamente 30 ore dopo l'applicazione di provocazione) le reazioni cutanee vengono esaminate e classificate in base alla scala di valutazione riportata in appendice;
|
|
—
|
circa 24 ore dopo detto esame (approssimativamente 54 ore dopo l'applicazione di provocazione) si procede a una seconda osservazione e a una nuova classificazione delle reazioni cutanee.
|
È consigliabile procedere ad una lettura cieca nei due gruppi di animali.
Qualora sia necessario chiarire ulteriormente i risultati ottenuti nel primo «challenge», una seconda esposizione di provocazione, ove del caso con un nuovo gruppo di controllo, potrà essere effettuata a circa una settimana di distanza dalla prima. Il nuovo «challenge» potrà essere realizzato anche sul gruppo di controllo iniziale.
Tutte le reazioni cutanee e qualsiasi risultato insolito, comprese le reazioni sistemiche, derivanti dall'esposizione di induzione e di provocazione, dovranno essere osservate e classificate in base alla scala di valutazione di Magnusson/Kligman (vedi appendice). Per chiarire eventuali reazioni dubbie si potrà far ricorso ad altre tecniche, quali l'esame istopatologico o la misurazione dello spessore delle pieghe cutanee.
2. DATI (GPMT E SAGGIO DI BUEHLER)
I dati saranno riassunti in forma tabulare, indicando, per ogni animale, le reazioni cutanee rilevate nel corso di ogni osservazione.
3. RELAZIONE (GPMT E SAGGIO DI BUEHLER)
Se il saggio sul porcellino d'India è preceduto da una prova preliminare, si avrà cura di fornirne la descrizione o il riferimento [per es. Local Lymph Node Assay (LLNA), Mouse Ear Swelling Test (MEST)], compreso il procedimento particolareggiato, insieme ai risultati ottenuti con le sostanze da saggiare e le sostanze di riferimento.
Relazione sul saggio (GPMT E SAGGIO DI BUEHLER)
La relazione sul saggio deve, se possibile, includere le seguenti informazioni:
|
|
Animali da esperimento
|
—
|
ceppo di porcellino d'India utilizzato;
|
|
—
|
numero, età e sesso degli animali;
|
|
—
|
origine, condizioni di alloggiamento, dieta, ecc;
|
|
—
|
peso di ogni singola cavia all'inizio dell'esperimento.
|
|
|
|
Condizioni sperimentali:
|
—
|
tecnica di preparazione dell'area di applicazione della compressa;
|
|
—
|
materiali utilizzati e tecnica di preparazione e di applicazione della compressa;
|
|
—
|
risultato dello studio pilota e conclusioni relative alle concentrazioni di induzione e di provocazione da utilizzare nel saggio;
|
|
—
|
modalità di preparazione, applicazione e rimozione della sostanza in esame;
|
|
—
|
motivazione della scelta del veicolo;
|
|
—
|
concentratzioni del veicolo e della sostanza utilizzate per le esposizioni di induzione e di provocazione, nonché quantità totale di sostanza applicata per l'induzione e la provocazione.
|
|
|
|
Risultati:
|
—
|
un riepilogo dei risultati dell'ultimo controllo di sensibilità e attendibilità (vedi 1.3), comprese le informazioni sulla sostanza, la concentrazione e il veicolo utilizzato;
|
|
—
|
tutte le osservazioni effettuate su ogni singolo animale, compreso il sistema di classificazione;
|
|
—
|
la descrizione della natura e dell'entità degli effetti osservati;
|
|
—
|
tutti i reperti dell'esame istopatologico.
|
|
|
|
Discussione dei risultati.
|
4. RIFERIMENTI
Il presente metodo corrisponde al metodo OCSE TG 406.
Appendice
TABELLA:
scala di Magnusson/Kligman per la classificazione delle reazioni al saggio di provocazione cutanea
0 = assenza di modificazioni visibili
1 = eritema localizzato o a distribuzione irregolare
2 = eritema modesto e confluente
3 = eritema intenso associato a tumefazione
B.7 TOSSICITÀ A DOSE RIPETUTA (28 GIORNI) PER VIA ORALE
1. METODO
1.1. INTRODUZIONE
Vedi introduzione generale, parte B.
1.2. DEFINIZIONI
Vedi introduzione generale, parte B.
1.3. PRINCIPIO DEL METODO DI SAGGIO
La sostanza in esame viene somministrata in dosi giornaliere graduate ad alcuni gruppi di animali da esperimento, un livello di dose per gruppo, per un periodo di 28 giorni. Durante il periodo di somministrazione gli animali vengono giornalmente esaminati al fine di rilevare eventuali segni di tossicità. Gli animali deceduti o soppressi durante l'esperimento vengono sottoposti a necroscopia. Al termine del saggio gli animali superstiti vengono soppressi e sottoposti a necroscopia.
Il presente metodo attribuisce particolare importanza agli effetti neurologici in quanto parametro specifico di valutazione e comporta la necessità di un'accurata osservazione clinica degli animali per ottenere il maggior numero possibile di informazioni. Tale metodo è finalizzato all'individuazione di sostanze chimiche dotate di un potenziale neurotossico, che potranno successivamente richiedere indagini più approfondite al riguardo. Esso può inoltre fornire indicazioni sugli effetti immunologici e sulla tossicità per l'apparato riproduttivo.
1.4. DESCRIZIONE DEL METODO DI SAGGIO
1.4.1. Preparazioni
Animali adulti, giovani e sani, vengono suddivisi in modo casuale e assegnati a gruppi da trattare e a gruppi di controllo. Le gabbie dovranno essere sistemate in modo da ridurre al minimo eventuali effetti dovuti alla loro collocazione. Gli animali vengono identificati individualmente e tenuti nelle loro gabbie per un periodo di almeno 5 giorni prima dell'inizio del saggio, in modo da potersi acclimatare alle condizioni di laboratorio.
La sostanza in esame viene somministrata a mezzo di sonda gastrica, con gli alimenti e con l'acqua. La modalità di somministrazione orale viene scelta in funzione della finalità dello studio e delle proprietà fisico-chimiche della sostanza.
Se necessario, la sostanza in esame viene disciolta o messa in sospensione in un veicolo adeguato. Ove possibile, si preferirà una soluzione/sospensione acquosa, o, come seconda alternativa, una soluzione/emulsione in olio (per esempio olio di mais), o ancora, infine, una soluzione in altri veicoli. Per i veicoli non acquosi, dovranno esserne note le caratteristiche di tossicità. È opportuno determinare la stabilità della sostanza in esame nel veicolo.
1.4.2. Condizioni sperimentali
1.4.2.1. Animali da esperimento
Il ratto è la specie d'elezione, ma sono ammesse anche altre specie di roditori. Si utilizzeranno animali adulti, giovani e sani, di ceppi comunemente usati in laboratorio. Le femmine dovranno essere nullipare e non gravide. La somministrazione dovrà iniziare prima possibile al termine dello svezzamento, e comunque non oltre la nona settimana di vita.
All'inizio dello studio, la variazione di peso degli animali dovrà essere minima e non essere superiore al ± 20 per cento del peso medio per ogni sesso.
Qualora, prima di uno studio a lungo termine, si effettui uno studio preliminare con somministrazione orale ripetuta, si utilizzeranno di preferenza in entrambi ammali provenienti dallo stesso ceppo e aventi la medesima origine.
1.4.2.2. Numero e sesso
Per ciascun livello di dosaggio dovranno essere utilizzati almeno 10 animali (cinque femmine e 5 maschi). Se il protocollo sperimentale prevede la soppressione di animali nel corso dello studio, il numero totale dovrà essere aumentato in ragione del numero di animali che si prevede di sacrificare.
Inoltre, un gruppo satellite di 10 animali (cinque per sesso) potrà essere trattato alla dose massima per 28 giorni e tenuto in osservazione nei 14 giorni successivi al fine di valutare la reversibilità, la persistenza o la comparsa tardiva di effetti tossici. È altresi previsto l'utilizzo di un gruppo satellite di 10 animali di controllo (cinque animali per sesso).
1.4.2.3. Livelli di dosaggio
Si utilizzano generalmente almeno tre gruppi da trattare e un gruppo di controllo. Quest'ultimo, fatta eccezione per la somministrazione della sostanza in esame, dovrà essere trattato in modo identico ai gruppi sottoposti a trattamento. Qualora la sostanza da saggiare venga incorporata in un veicolo, al gruppo di controllo verrà somministrato il medesimo veicolo nel volume massimo utilizzato.
Se, in base alla valutazione di altri dati, sussistono motivi per ritenere che un dosaggio di 1 000 mg/kg pc/d non dovrebbe produrre effetti, è possibile eseguire un saggio limite. In mancanza di dati al riguardo, potrà essere effettuato uno studio finalizzato alla determinazione di un range entro il quale selezionare le dosi da somministrare.
I livelli di dosaggio dovranno essere selezionati tenendo conto di tutti i dati esistenti sulla tossicità e le caratteristiche (tossico-)cinetiche della sostanza da saggiare o di sostanze affini. Il livello massimo di dosaggio dovrà essere tale da indurre effetti tossici senza tuttavia cagionare la morte o sofferenze gravi. Sarà inoltre definita una serie decrescente di dosaggi al fine di individuare eventuali risposte a dosi determinate e dimostrare l'assenza di effetti avversi al dosaggio minimo (NOAEL, no-observed-adverse effects). Per la determinazione dei livelli decrescenti di dosaggio risulta spesso ottimale applicare un fattore di divisione compreso tra due e quattro; è comunque preferibile aggiungere un quarto gruppo di studio piuttosto che avere uno scarto eccessivo (superiore ad un fattore 10) tra una dose e l'altra.
Se la sostanza è somministrata con gli alimenti o con l'acqua, è importante verificare che le quantità di sostanza necessarie non alterino il bilancio idrico o nutrizionale. Se la sostanza in esame è somministrata con la dieta, si può utilizzare sia una concentrazione dietetica (ppm), sia un livello di dosaggio costante in funzione del peso degli animali, avendo cura di specificare quale sia l'alternativa prescelta. Se la sostanza è somministrata tramite sonda gastrica, la dose deve essere somministrata ogni giorno alla stessa ora e modificata in modo da mantenere un dosaggio costante in funzione del peso dell'animale.
Qualora, prima di uno studio a lungo termine, si effettui uno studio preliminare con somministrazione orale ripetuta, la dieta degli animali dovrà essere identica in entrambi.
1.4.2.4. Saggio limite
Qualora un saggio, effettuato in conformità con il metodo descritto, con un livello di dosaggio di almeno 1 000 mg/kg di peso corporeo/giorno o, in caso di somministrazione con gli alimenti o l'acqua, ad una concentrazione equivalente (in funzione del peso corporeo), non produca effetti tossici evidenti e se i dati relativi a sostanze di struttura affine non sono suggestivi di tossicità, può non essere necessario eseguire uno studio completo utilizzando tre dosaggi. Il saggio limite è giustificato, salvo nel caso in cui l'esposizione umana comporti la necessità di utilizzare un più elevato livello di dosaggio.
1.4.2.5. Periodo di osservazione
Il periodo di osservazione ha una durata di 28 giorni. Gli animali del gruppo satellite selezionati per effettuare ulteriori osservazioni dovranno essere esaminati per almeno altri 14 giorni senza alcun trattamento al fine di individuare l'insorgenza, la persistenza o la scomparsa tardiva degli effetti tossici.
1.4.3. Procedimento
La sostanza in esame viene somministrata agli animali giornalmente, sette giorni su sette, per un periodo di 28 giorni. La scelta di somministrare la sostanza cinque giorni alla settimana deve essere opportunamente motivata. Se effettuata mediante intubazione, la somministrazione avverrà in una singola dose mediante sonda gastrica o apposita cannula. Il volume massimo di liquido somministrabile in una sola volta dipende dalla taglia dell'animale. Esso non dovrebbe superare 1 ml/100 g di peso corporeo, eccetto nel caso di soluzioni acquose, dove sono ammessi 2 ml/100 g di peso corporeo. Salvo nel caso di sostanze irritanti o corrosive, suscettibili di produrre effetti esacerbati a concentrazioni più elevate, la variabilità del volume di saggio dovrà essere ridotta al minimo ritoccando la concentrazione, in modo da mantenere un volume costante per qualsiasi livello di dosaggio.
1.4.3.1. Osservazioni generali
Osservazioni cliniche generali devono essere effettuate almeno una volta al giorno, preferibilmente alla stessa ora e tenendo conto del periodo probabile di massima intensità degli effetti dopo la somministrazione. Si registreranno informazioni concernenti le condizioni di salute degli animali. Almeno due volte al giorno, tutti gli animali vengono esaminati al fine di determinare la morbilità e la mortalità. Gli animali moribondi o recanti segni di grave sofferenza o dolore saranno immediatamente esclusi dallo studio, sottoposti ad eutanasia e a necroscopia.
Prima dell’esposizione iniziale (per consentire un confronto sullo stesso soggetto) e almeno una volta alla settimana successivamente tutti gli animali vengono sottoposti ad osservazioni cliniche particolareggiate. A tale scopo gli animali vengono tolti dalle gabbie, collocati in un recinto standard ed esaminati di preferenza sempre alla stessa ora. Le osservazioni vengono accuratamente registrate, possibilmente utilizzando sistemi di punteggio esplicitamente definiti dal laboratorio che esegue il saggio. Si avrà cura di ridurre al minimo le variazioni delle condizioni sperimentali e le osservazioni saranno condotte di preferenza da persone che non siano al corrente del trattamento. Si terrà conto, tra l'altro, di tutte le alterazioni della cute, del pelo, degli occhi, delle membrane mucose, della comparsa di secrezioni ed escrezioni e dell'attività del sistema nervoso autonomo (per es. lacrimazione, piloerezione, ampiezza pupillare, ritmo respiratorio insolito). Verranno inoltre registrate le modifiche osservate nel comportamento, nella postura e nella risposta alla manipolazione, come pure la presenza di movimenti clonici o tonici, stereotipi (per es. tolettatura eccessiva, continuo girare in tondo) o comportamenti insoliti (per es. automutilazione, marcia a ritroso).
Nella quarta settimana di esposizione si procede alla valutazione della reattività sensoriale a diversi tipi di stimolo (p. es. uditivi, visivi e propriocettivi), della forza di prensione e dell'attività motoria. Ulteriori dettagli sui metodi utilizzabili sono riportati in letteratura (vedi introduzione generale, parte B).
Le osservazioni funzionali previste per la quarta settimana di esposizione possono essere evitate nel caso di uno studio preliminare ad un successivo studio subcronico (90 giorni). In questa eventualità, le osservazioni funzionali saranno incluse nello studio complementare. D'altro canto, le informazioni ricavate possono essere utili nella determinazione dei livelli di dosaggio per un successivo studio subcronico.
In via eccezionale, le osservazioni funzionali potranno essere evitate anche per i gruppi che presentino segni di tossicità suscettibili di interferire in modo significativo con i risultati delle prove funzionali.
1.4.3.2. Peso corporeo e consumo di cibo e di acqua
Tutti gli animali devono essere pesati almeno una volta alla settimana. Il consumo di cibo e di acqua viene determinato con scadenza almeno settimanale. Se la sostanza in esame viene somministrata con l'acqua, anche il consumo di acqua deve essere misurato almeno una volta alla settimana.
1.4.3.3. Ematologia
Al termine del periodo di prova si effettueranno i seguenti controlli ematologici: ematocrito, concentrazione dell'emoglobina, conteggio degli eritrociti, conteggio dei leucociti totali e formula leucocitaria, conteggio delle piastrine e determinazione del tempo/potenziale di coagulazione.
I campioni di sangue devono essere prelevati in un sito determinato immediatamente prima o durante la soppressione degli animali e conservati in condizioni adeguate.
1.4.3.4. Biochimica clinica
Esami biochimico-clinici finalizzati allo studio dei principali effetti tossici sui tessuti ed in particolare sui reni e sul fegato dovranno essere effettuati sui campioni di sangue prelevati da tutti gli animali immediatamente prima o durante la loro soppressione (eccetto gli animali trovati moribondi e/o soppressi nel corso del saggio). È preferibile che gli animali vengano tenuti a digiuno dalla sera precedente il prelievo di sangue (2). Le analisi sul plasma o sul siero comprenderanno il sodio, il potassio, il glucosio, il colesterolo totale, l'urea, la creatinina, le proteine totali e l'albumina, almeno due enzimi indicatori degli effetti epatocellulari (come l'alanina aminotransferasi, l'aspartato aminotransferasi, la fosfatasi alcalina, la gamma-glutamil transpeptidasi e la sorbitol deidrogenasi). Determinazioni di altri enzimi (di origine epatica o altro) e degli acidi biliari possono talvolta fornire indicazioni utili.
I seguenti esami delle urine possono essere facoltativamente effettuati nell'ultima settimana dello studio utilizzando un volume d'urina raccolto ad orari fissi: aspetto, volume, osmolalità o densità relativa, pH, albumina, glucosio e sangue-eritrociti.
Sono inoltre raccomandati studi sui marker serici delle lesioni tissutali generali. Altre determinazioni dovranno essere eseguite qualora si abbia motivo di ritenere o di sospettare che le proprietà della sostanza in esame possano alterare i profili metabolici riguardanti il calcio, il fosfato, i trigliceridi a digiuno, gli ormoni specifici, la metemoglobina e la colinesterasi. Tali parametri dovranno essere determinati per certe classi di sostanze o determinati composti specifici.
Nel complesso è opportuno adottare un approccio flessibile, che tenga conto della specie utilizzata e degli effetti osservati e/o previsti della sostanza in esame.
Se i dati storici di base risultano inadeguati, è opportuno determinare i parametri ematologici e biochimico-chimici prima dell'inizio del saggio.
1.4.3.5. Necroscopia macroscopica
Tutti gli animali dello studio dovranno essere sottoposti ad una necroscopia completa, comprendente un accurato esame della superficie esterna del corpo, di tutti gli orifizi, della cavità cranica, toracica e addominale e del loro contenuto. Il fegato, i reni, le ghiandole surrenali, i testicoli, gli epididimi, il timo, la milza, il cervello e il cuore di tutti gli animali saranno opportunamente sezionati e pesati quanto più rapidamente possibile onde evitarne la disidratazione.
I seguenti tessuti dovranno essere conservati nel mezzo di fissazione più adeguato in funzione del tipo di tessuto e degli esami istopatologici previsti: tutti i tessuti recanti lesioni macroscopiche, encefalo (le regioni rappresentative comprendono cervello, cervelletto e ponte), midollo spinale, stomaco, intestino tenue e crasso (comprese le placche di Peyer), fegato, reni, ghiandole surrenali, milza, cuore, timo, tiroide, trachea e polmoni (conservati con insufflazione di un fissativo e successiva immersione), gonadi, organi genitali accessori (per es. utero, prostata), vescica, linfonodi (preferibilmente un linfonodo sulla via di somministrazione e un linfonodo distante da essa, in modo da coprire gli effetti sistemici), nervi periferici (nervo sciatico o nervo tibiale), possibilmente in stretta prossimità del muscolo, e una sezione del midollo osseo (o, in alternativa, un preparato fresco di midollo osseo aspirato). In base all'esito dell'esame clinico e ad altri risultati può risultare opportuno esaminare altri tessuti. Dovranno inoltre essere conservati tutti gli organi ritenuti organi bersaglio potenziali in funzione delle proprietà note della sostanza in esame.
1.4.3.6. Esame istopatologico
Un esame istopatologico completo sarà effettuato sugli organi e i tessuti conservati di tutti gli animali del gruppo di controllo e del gruppo trattato con dosaggio elevato. Detto esame sarà esteso agli animali degli altri gruppi di dosaggio qualora nel gruppo a dosaggio elevato vengano osservate alterazioni indotte dalla sostanza.
Si procederà all'esame di tutte le lesioni macroscopiche.
Nel caso si utilizzi un gruppo satellite, un esame istopatologico dovrà essere eseguito sui tessuti e gli organi per i quali siano stati osservati effetti nei gruppi trattati.
2. DATI
Dovranno essere forniti i dati individuali di ciascun animale. Inoltre, tutti i dati dovranno essere riassunti in una tabella indicante, per ogni gruppo, il numero di animali all'inizio del saggio, il numero di animali rinvenuti morti durante il saggio o sottoposti ad eutanasia nonché il momento del decesso o della soppressione di ciascun animale, il numero di animali recanti segni di tossicità, una descrizione degli effetti tossici con indicazione del momento della comparsa, della durata e della gravità di detti effetti, il numero di animali che presentano lesioni, il tipo di lesione e la percentuale di animali per ogni tipo di lesione.
Se possibile, i risultati numerici devono essere valutati sulla base di un metodo statistico adeguato e generalmente riconosciuto. I metodi statistici devono essere selezionati durante la fase di progettazione dello studio.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
La relazione sul saggio deve, se possibile, includere le seguenti informazioni:
|
|
Animali da esperimento:
|
—
|
specie/ceppo utilizzati;
|
|
—
|
numero, età e sesso degli animali;
|
|
—
|
origine, condizioni di alloggiamento, dieta ecc;
|
|
—
|
peso di ciascun animale determinato all'inizio del saggio, con cadenza settimanale nel periodo successivo e al termine del saggio.
|
|
|
|
Condizioni sperimentali:
|
—
|
motivazione della scelta del veicolo utilizzato, se diverso dall'acqua;
|
|
—
|
motivazione della scelta del livello di dosaggio;
|
|
—
|
informazioni dettagliate sulla formulazione della sostanza e sulla preparazione della dieta, concentrazione ottenuta, stabilità e omogeneità della preparazione;
|
|
—
|
modalità precise di somministrazione della sostanza in esame;
|
|
—
|
se del caso, conversione della concentrazione della sostanza somministrata con gli alimenti o con l'acqua (ppm) in dose effettiva (mg/kg di peso corporeo/giorno);
|
|
—
|
informazioni dettagliate sulla qualità del cibo e dell'acqua.
|
|
|
|
Risultati:
|
—
|
peso corporeo/modificazioni del peso corporeo;
|
|
—
|
consumo di cibo e, se del caso, consumo di acqua;
|
|
—
|
dati concernenti la risposta tossica per sesso e per dose, compresi i segni di tossicità;
|
|
—
|
natura, gravità e durata degli effetti clinici osservati (ed eventuale reversibilità);
|
|
—
|
valutazione dell'attività sensoriale, della forza di prensione e dell'attività motoria;
|
|
—
|
esami ematologici e relativi valori di riferimento;
|
|
—
|
esami biochimico-clinici e relativi valori di riferimento;
|
|
—
|
peso corporeo al momento della soppressione degli animali e peso degli organi;
|
|
—
|
esito dell'esame necroscopico;
|
|
—
|
una descrizione particolareggiata di tutti i reperti istopatologici;
|
|
—
|
dati relativi all'assorbimento, se disponibili;
|
|
—
|
ove del caso, elaborazione statistica dei risultati.
|
|
|
|
Discussione dei risultati.
|
4. RIFERIMENTI
Il presente metodo corrisponde al metodo OCSE TG 407.
B.8. TOSSICITÀ A DOSE RIPETUTA (28 GIORNI) PER INALAZIONE
1. METODO
1.1. INTRODUZIONE
È utile avere informazioni preliminari sulla distribuzione delle dimensioni delle particelle, la tensione di vapore, il punto di fusione, il punto di ebollizione, il punto di infiammabilità e la esplosività (se del caso) della sostanza.
Vedi anche introduzione generale, parte B (punto A).
1.2. DEFINIZIONI
Vedi introduzione generale, parte B (punto B).
1.3. SOSTANZE DI RIFERIMENTO
Nessuna.
1.4. PRINCIPIO DEL METODO DI SAGGIO
Diversi gruppi di animali da esperimento sono esposti quotidianamente per un periodo determinato a concentrazioni graduate della sostanza in esame; si utilizza una concentrazione per gruppo, somministrata per 28 giorni. Se si fa uso di un veicolo per ottenere una concentrazione appropriata della sostanza in esame nell'atmosfera, si dovrà prevedere anche un gruppo di animali di controllo trattati con il veicolo. Durante il periodo di trattamento, gli animali vengono esaminati quotidianamente per rilevare i sintomi di tossicità. Gli animali che muoiono durante il saggio e quelli che sopravvivono sono sottoposti a necroscopia alla fine del saggio.
1.5. CRITERI DI QUALITÀ
Nessuno.
1.6. DESCRIZIONE DEL METODO DI SAGGIO
1.6.1. Preparazioni
Per almeno 5 giorni prima dell'esperimento gli animali sono mantenuti nelle stesse condizioni di stabulazione e di alimentazione dell'esperimento. Prima del saggio, gli animali, che dovranno essere giovani e sani, sono scelti con metodo casuale e assegnati ai vari gruppi previsti. Se necessario, alla sostanza in esame può essere aggiunto un veicolo idoneo per facilitare la generazione di una concentrazione appropriata della sostanza in esame nell'atmosfera. Se per facilitare il dosaggio si utilizza un veicolo o altri additivi, questi dovranno non produrre effetti tossici. Se appropriato, possono essere utilizzati i dati storici.
1.6.2. Condizioni per il saggio
1.6.2.1. Animali da esperimento
Salvo controindicazione, il ratto è la specie d'elezione. Si dovranno utilizzare animali giovani e sani da ceppi di laboratorio comunemente usati.
All'inizio dello studio, l'intervallo di variazione ponderale degli animali usati non dovrebbe superare ± 20 % del valore medio.
1.6.2.2. Numero e sesso
Per ogni gruppo in esame dovranno essere utilizzati almeno 10 animali (5 di sesso maschile e 5 di sesso femminile). Le femmine dovrebbero essere nullipare e non gravide. Ove siano programmati sacrifici intermedi, il numero degli animali dovrà essere aumentato per includere quello degli animali da sacrificare prima del termine della prova. Inoltre, un gruppo satellite di 10 animali (5 animali per sesso) può essere sottoposto al trattamento con il livello superiore di dosaggio per 28 giorni ed esaminato, nei seguenti 14 giorni, per quanto riguarda la reversibilità o la persistenza o l'insorgenza ritardata degli effetti tossici. Inoltre si userà, in tale caso, un gruppo satellite pure di 10 animali di controllo (5 animali per sesso).
1.6.2.3. Concentrazioni di esposizione
Sono richieste almeno tre concentrazioni con un controllo, oppure, se viene utilizzato un veicolo, un controllo del veicolo (corrispondente alla massima concentrazione del veicolo). Gli animali del gruppo di controllo dovranno essere trattati in modo identico agli animali dei gruppi trattati, ad eccezione del trattamento con la sostanza in esame. La massima concentrazione dovrebbe produrre effetti tossici, ma senza causare mortalità, o almeno causando una mortalità molto bassa. La concentrazione più bassa non dovrebbe causare alcun sintomo di tossicità. Nei casi in cui sia possibile stimare l'esposizione umana prevista, il livello di dosaggio più basso dovrebbe superare questo livello. Dal punto di vista ottimale la concentrazione intermedia dovrebbe produrre effetti tossici minimi. Nel caso in cui siano utilizzate più concentrazioni intermedie, queste dovrebbero essere intervallate in modo tale da produrre una graduazione di effetti tossici. Nei gruppi esposti alle concentrazioni bassa e intermedia e nei controlli, l'incidenza dei decessi dovrebbe essere bassa al fine di consentire una valutazione significativa dei risultati.
1.6.2.4. Tempo di esposizione
La durata dell'esposizione giornaliera dovrà essere di 6 ore. Tuttavia, per esigenze specifiche, si possono utilizzare esposizioni di diversa durata.
1.6.2.5. Apparecchiature
Gli animali dovranno essere esposti al composto in dispositivi per l'inalazione appositamente progettati per consentire un flusso dinamico dell'aria di almeno 12 ricambi l'ora per garantire un adeguato contenuto di ossigeno e un'atmosfera uniformemente distribuita. Qualora sia usata una camera, essa deve essere progettata in modo da minimizzare l'affollamento degli animali da esperimento e al tempo stesso rendere massima l'esposizione mediante inalazione alla sostanza in esame. Come regola generale per garantire la stabilità dell'atmosfera della camera, il «volume» complessivo degli animali di saggio non dovrebbe superare il 5 % di quello della camera di saggio. Si può ricorrere ad una esposizione oro-nasale, della sola testa, oppure di tutto il corpo in camera individuale; le prime due modalità d'esposizione renderanno minima l'assunzione delle sostanze attraverso altre vie.
1.6.2.6. Periodo di osservazione
Durante l'intero trattamento e il periodo di recupero, gli animali dovranno essere esaminati quotidianamente per rilevare i segni di tossicità. Il momento del decesso e il momento in cui si manifestano e scompaiono i sintomi di tossicità dovranno essere registrati.
1.6.3. Procedimento
Gli animali vengono esposti giornalmente alla sostanza in esame per 5-7 giorni alla settimana per un periodo di 28 giorni. Gli animali di ogni gruppo satellite, previsto per proseguire le osservazioni, dovranno essere tenuti per altri 14 giorni, senza alcun trattamento, al fine di rilevare la scomparsa oppure la persistenza degli effetti tossici. L'esperimento dovrà essere effettuato ad una temperatura di 22 oC ± 3 oC.
Dal punto di vista ottimale, l'umidità relativa dovrà essere mantenuta tra il 30 e il 70 % ma, in taluni casi (ad esempio prove di alcuni aerosol), ciò può non essere realizzabile. Mantenendo una leggera pressione negativa all'interno della camera (≤ 5 mm d'acqua) si impedirà il trafilamento della sostanza in esame nell'area circostante. Durante l'esposizione, la somministrazione di cibo e acqua dovrebbe essere sospesa.
Dovrà essere realizzato un sistema dinamico d'inalazione con un adeguato sistema analitico di controllo della concentrazione. Si raccomanda di effettuare un esperimento di prova per stabilire le concentrazioni idonee di esposizione. La velocità di flusso dell'aria dovrà essere regolata in modo da rendere uniformi le condizioni nella camera di esposizione. Il sistema dovrebbe consentire di raggiungere al più presto possibile le condizioni d'esposizione stabili.
Dovranno essere misurati o controllati:
|
(a)
|
la velocità del flusso d'aria (in continuo);
|
|
(b)
|
la concentrazione effettiva della sostanza in esame nella zona di respirazione. Durante il periodo giornaliero di esposizione, la concentrazione non dovrà variare oltre il ± 15 % del valore medio. Tuttavia, nel caso di alcuni aerosol, questo livello di controllo potrebbe non essere realizzabile, e sarebbe quindi accettabile un intervallo più ampio. Per tutta la durata dello studio, le concentrazioni dovranno essere mantenute per quanto possibile costanti da un giorno all'altro. Per gli aerosol, si dovrà eseguire almeno un'analisi delle dimensioni di particelle per gruppo di prova e per settimana.
|
|
(c)
|
Temperatura e umidità, in continuo se possibile.
|
Durante e dopo l'esposizione si procede all'effettuazione e alla registrazione sistematica delle osservazioni; registri individuali dovranno essere mantenuti per ciascun animale. Tutti gli animali dovranno essere esaminati giornalmente e dovranno essere registrati i sintomi di tossicità, compresi il momento del loro insorgere, il loro grado e la loro durata. Le osservazioni effettuate dovrebbero comprendere le alterazioni della cute e del pelo, degli occhi, delle membrane mucose e dei sistemi respiratorio, circolatorio, nervoso autonomo e centrale, dell'attività somatomotoria e del comportamento dell'animale, La misura del peso degli animali dovrà essere effettuata ogni settimana. Si raccomanda, inoltre, che anche il consumo di alimento sia misurato ogni settimana. L'osservazione regolare degli animali è necessaria per minimizzare la perdita di animali da studiare causata da cannibalismo, autolisi dei tessuti o errata collocazione. Al termine dello studio, gli animali sopravvissuti, esclusi quelli del gruppo satellite, vengono sottoposti ad esame necroscopico. Gli animali moribondi e gli animali in stato di grave sofferenza o dolore dovrebbero essere rimossi appena notati, soppressi umanamente e sottoposti a necroscopia.
Al termine del saggio tutti gli animali, compresi quelli di controllo, saranno sottoposti ai seguenti esami:
|
i)
|
ematologia, comprendente almeno l'ematocrito, la concentrazione di emoglobina, la conta degli eritrociti, la conta totale e differenziale dei leucociti e una misura del potenziale di coagulazione;
|
|
ii)
|
biochimica clinica del sangue, comprendente almeno un parametro della funzionalità epatica e renale nel siero: alanina aminotransferasi (prima conosciuta come glutammico-piruvico transaminasi), aspartato aminotransferasi (prima conosciuta come glutammico-ossalacetico transaminasi), azoto ureico, albumina, creatinina ematica, bilirubina totale e proteine seriche totali.
|
Altre determinazioni che possono risultare necessarie per una adeguata valutazione tossicologica comprendono il calcio, il fosforo, il cloruro, il sodio, il potassio, il glucosio a digiuno, l'analisi dei lipidi, gli ormoni, l'equilibrio acido/base, la metaemoglobina, l'attività colinesterasica.
Ove necessario, si possono effettuare altre analisi biochimico-cliniche per estendere l'indagine degli effetti osservati.
1.6.3.1. Necroscopia
Tutti gli animali usati nello studio dovrebbero esser sottoposti a necroscopia completa. Per evitare la disidratazione, almeno il fegato, i reni, le ghiandole surrenali, i polmoni e i testicoli dovrebbero essere pesati a umido appena possibile dopo la dissezione. Organi e tessuti (il tratto respiratorio, fegato, reni, milza, testicoli, ghiandole surrenali, cuore e qualsiasi organo presentante lesioni macroscopiche o variazioni delle dimensioni) dovrebbero essere conservati in un materiale idoneo per un eventuale futuro esame istopatologico. I polmoni dovrebbero essere asportati intatti, pesati e trattati con un fissatore idoneo ad assicurare che la struttura dei polmoni venga mantenuta.
1.6.3.2. Esame istopatologico
Gli organi e i tessuti degli animali del gruppo trattato con la concentrazione più elevata e del gruppo di controllo dovranno essere sottoposti ad esame istologico. Gli organi e i tessuti che presentano alterazioni attribuibili alla sostanza in esame, somministrata al più alto livello di dosaggio, dovranno essere esaminati in tutti i gruppi trattati con i dosaggi inferiori. Gli animali di ogni gruppo satellite dovranno essere sottoposti ad esame istologico, in particolare per gli organi e i tessuti che risultano colpiti da effetti tossici negli altri gruppi trattati.
2. DATI
I risultati dovranno essere riassunti sotto forma tabellare indicante, per ogni gruppo trattato, il numero di animali all'inizio e il numero di animali che presentano ciascun tipo di lesione.
Tutti i risultati osservati dovrebbero essere valutati secondo un adeguato metodo statistico. Può essere utilizzato qualsiasi metodo statistico riconosciuto.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
La relazione di prova deve, se possibile, includere le seguenti informazioni:
|
—
|
specie, ceppo, origine degli animali, condizioni ambientali, dieta, ecc.;
|
|
—
|
condizioni del saggio:
Descrizione dell'apparecchiatura di esposizione, incluso il disegno, tipo, dimensioni, la fonte d'aria, il sistema per la formazione degli aerosol, il metodo di condizionamento dell'aria, il trattamento dell'aria di scarico e il metodo di stabulazione degli animali in una camera sperimentale, quando questa venga usata. Dovrebbe essere fornita una descrizione della strumentazione usata per misurare la temperatura, l'umidità e, se del caso, la stabilità delle concentrazioni di aerosol o la distribuzione delle dimensioni delle particelle.
Dati relativi all'esposizione:
Essi dovrebbero essere tabulati e presentati con valori medi e con una misura della variabilità (ad esempio deviazione standard) e dovrebbero includere:
|
a)
|
velocità del flusso d'aria attraverso l'apparecchiatura di inalazione;
|
|
b)
|
temperatura e umidità dell'aria;
|
|
c)
|
concentrazioni nominali (quantitativo globale della sostanza in esame introdotta nel dispositivo di inalazione diviso per il volume dell'aria);
|
|
d)
|
tipo di veicolo, se usato;
|
|
e)
|
concentrazioni effettive nella zona di respirazione;
|
|
f)
|
diametro aerodinamico mediano in massa (DAMM) e deviazione standard geometrica (DSG);
|
|
|
—
|
dati relativi agli effetti tossici per sesso e per concentrazione;
|
|
—
|
momento del decesso durante lo studio, o se gli animali sono sopravvissuti sino al suo termine;
|
|
—
|
descrizione di effetti tossici o altri effetti; livello senza effetti;
|
|
—
|
momento in cui è stato rilevato ciascun sintomo anormale e suo decorso;
|
|
—
|
dati relativi al consumo di alimento e al peso corporeo;
|
|
—
|
analisi ematologiche effettuate e loro risultati;
|
|
—
|
analisi biochimiche-cliniche effettuate e loro risultati;
|
|
—
|
risultati della necroscopia;
|
|
—
|
descrizione dettagliata di tutti i risultati istopatologici;
|
|
—
|
elaborazione statistica dei risultati, ove possibile;
|
|
—
|
discussione dei risultati;
|
|
—
|
interpretazione dei risultati.
|
3.2. VALUTAZIONE E INTERPRETAZIONE
Vedi introduzione generale, parte B (punto D).
4. BIBLIOGRAFIA
Vedi introduzione generale, parte B (punto E)
B.9. TOSSICITÀ A DOSE RIPETUTA (28 GIORNI) PER VIA CUTANEA
1. METODO
1.1. INTRODUZIONE
Vedi introduzione generale, parte B (punto A).
1.2. DEFINIZIONI
Vedi introduzione generale, parte B (punto B).
1.3. SOSTANZA DI RIFERIMENTO
Nessuna.
1.4. PRINCIPIO DEL METODO DI SAGGIO
La sostanza in esame è applicata ogni giorno sulla pelle di alcuni gruppi di animali da esperimento, in dosi graduate, un livello di dose per gruppo, per un periodo di 28 giorni. Durante il periodo di applicazione, gli animali vengono osservati quotidianamente per rilevare i sintomi di tossicità. Si sottopongono a necroscopia gli animali morti durante la prova e al termine del saggio vengono sottoposti a necroscopia gli animali sopravvissuti.
1.5. CRITERI DI QUALITÀ
Nessuno.
1.6. DESCRIZIONE DEL METODO DI SAGGIO
1.6.1. Preparazioni
Per un periodo di almeno 5 giorni prima della prova gli animali sono mantenuti nelle stesse condizioni di stabulazione e di alimentazione del saggio. Prima del saggio gli animali, che dovranno essere giovani e sani, sono scelti con metodo casuale e assegnati ai gruppi previsti per il trattamento e per il controllo. Poco prima dell'esperimento si effettua il taglio del pelo nella parte dorsale del corpo degli animali. Si può procedere alla rasatura, ma essa dovrebbe essere effettuata circa 24 ore prima dell'esperimento. Di norma è necessario ripetere il taglio o la rasatura a intervalli di circa una settimana. Durante il taglio o la rasatura si dovrà badare a non ledere la cute dell'animale. Per l'applicazione della sostanza in esame, si dovrebbe preparare almeno il 10 % della superficie corporea. Nel determinare l'entità dell'area da preparare e le dimensioni della copertura è opportuno tenere presente il peso dell'animale. Le sostanze solide, che possono essere ridotte in polvere se appropriato, dovranno essere inumidite sufficientemente con acqua o, se necessario, con un veicolo adatto ad assicurare un buon contatto con la pelle. In generale le sostanze liquide sono saggiate in forma non diluita. Dal punto di vista ottimale, applicazioni quotidiane vengono effettuate sulla base di 5-7 giorni per settimana.
1.6.2. Condizioni per il saggio
1.6.2.1. Animali per l'esperimento
Possono essere utilizzati ratti adulti, conigli o porcellini d'India. Si possono utilizzare altre specie animali, ma il loro uso dovrà essere giustificato.
All'inizio dello studio l'intervallo di variazione di peso degli animali non dovrebbe superare ± 20 % del valore medio
1.6.2.2. Numero e sesso
Per ciascun livello di dosaggio dovrebbero essere utilizzati almeno 10 animali (5 di sesso femminile e 5 di sesso maschile) con cute sana. Le femmine dovrebbero essere nullipare e non gravide. Qualora siano stati programmati sacrifici intermedi di alcuni animali, il numero degli animali dovrà essere aumentato per includere quello degli animali da sacrificare prima del termine della prova. Inoltre, un altro gruppo (gruppo satellite) di 10 animali (5 animali per sesso) può essere sottoposto al trattamento con il livello massimo di dosaggio per 28 giorni e tenuto in osservazione per 14 giorni dopo il trattamento per rilevare la reversibilità, la persistenza o l'insorgenza ritardata degli effetti tossici. Inoltre si utilizzerà in tale caso pure un gruppo satellite di 10 animali di controllo (5 animali per sesso).
1.6.2.3. Livelli di dosaggio
Sono richiesti almeno 3 livelli di dosaggio, almeno 6 ore al giorno, con un gruppo di controllo oppure, nel caso venga usato un veicolo, con un gruppo di controllo del veicolo. L'applicazione della sostanza in esame dovrebbe essere effettuata ogni giorno alla stessa ora e modificata ad intervalli (settimanali e bisettimanali) al fine di mantenere un livello di dosaggio costante in funzione del peso dell'animale. Gli animali del gruppo di controllo dovranno essere trattati in modo identico agli animali del saggio, ad eccezione che per l'applicazione delle sostanze da saggiare. Se, per facilitare il dosaggio, viene utilizzato un veicolo, al gruppo di controllo dovrà essere somministrato il veicolo allo stesso modo che ai gruppi trattati e nella stessa quantità somministrata al gruppo con il dosaggio più elevato. Il livello di dosaggio più elevato della sostanza in esame dovrebbe causare effetti tossici ma senza causare mortalità oppure causando una mortalità molto limitata. Il livello di dosaggio più basso non dovrebbe provocare alcun sintomo di tossicità. Nei casi in cui vi sia una stima utilizzabile dell'esposizione umana, il livello di dosaggio più basso dovrebbe superarla. Dal punto di vista ottimale, il livello intermedio dovrebbe provocare effetti tossici osservabili minimi. Nei casi in cui siano usati più livelli di dosaggio intermedi, essi dovrebbero essere intervallati al fine di causare una graduazione di effetti tossici. Nei gruppi a livello di dosaggio basso e medio e di controllo, l'incidenza dei decessi dovrebbe essere bassa per consentire una valutazione significativa dei risultati.
Se l'applicazione della sostanza in esame dovesse causare una grave irritazione della cute, sarà opportuno ridurne le concentrazioni, e ciò può causare una diminuzione oppure l'assenza degli altri effetti tossici al livello di dosaggio più elevato. Inoltre, se la cute à stata gravemente danneggiata, può essere necessario interrompere il saggio e iniziarne uno nuovo a concentrazioni più basse.
1.6.2.4. Saggio limite
Qualora un saggio preliminare, effettuato con un livello di dosaggio di 1 000 mg/kg di peso corporeo, oppure con una dose superiore in relazione all'eventuale esposizione umana, se nota, non causi effetti tossici, ulteriori saggi possono essere considerati non necessari.
1.6.2.5. Periodo di osservazione
Gli animali da esperimento dovrebbero essere esaminati quotidianamente al fine di rilevare i segni della tossicità. Il momento del decesso e quello in cui appaiono e scompaiono i sintomi di tossicità dovrebbero essere registrati.
1.6.3. Procedimento
Ogni gabbia dovrebbe contenere un solo animale. Da un punto di vista ottimale, la sostanza in esame viene applicata agli animali 7 giorni la settimana per un periodo di 28 giorni. Gli animali di ogni eventuale gruppo satellite previsto per proseguire le osservazioni dovrebbero essere tenuti per altri 14 giorni, senza subire trattamenti, al fine di rilevare l'eventuale guarigione o la persistenza degli effetti tossici, La durata dell'esposizione dovrebbe essere almeno di 6 ore/giorno.
La sostanza in esame dovrebbe essere applicata uniformemente su un'area pari a circa il 10 % della superficie corporea totale. Per le sostanze altamente tossiche, la superficie coperta può essere inferiore, ma la maggior parte dell'area trattata dovrebbe essere ricoperta da uno strato per quanto possibile sottile e uniforme.
Durante il periodo di esposizione, la sostanza in esame viene tenuta a contatto della cute mediante una garza porosa e un cerotto non irritante. La parte su cui viene applicata la sostanza dovrà essere ulteriormente coperta in modo opportuno per tenere ferma la garza e la sostanza in esame e affinché gli animali non possano ingerire la sostanza stessa. Dispositivi per la limitazione dei movimenti possono essere utilizzati per impedire agli animali di ingerire la sostanza in esame, ma non è consigliabile l'immobilizzazione completa dell'animale. Come alternativa si può usare un «dispositivo protettivo a collare».
Alla fine del periodo di esposizione, la sostanza residua dovrà essere rimossa utilizzando acqua, se possibile, o altri prodotti idonei per la pulizia della pelle.
Tutti gli animali dovranno essere esaminati quotidianamente e dovranno essere registrati i segni di tossicità, inclusi il momento dell'insorgenza, il loro grado e durata. Le osservazioni dovrebbero includere le alterazioni della cute e del pelo, degli occhi e delle membrane mucose, e anche dei sistemi respiratorio, circolatorio, nervoso autonomo e centrale, dell'attività somatomotoria e del comportamento dell'animale. La misura del peso degli animali dovrà essere effettuata ogni settimana. Si raccomanda, inoltre, che il consumo sia anche misurato ogni settimana. L'esame periodico degli animali è necessario per impedire la perdita degli animali dello studio, dovuta a cause come cannibalismo, autolisi dei tessuti o errata collocazione. Al termine del saggio, tutti gli animali sopravvissuti, ad eccezione del gruppo satellite, sono sottoposti a necroscopia. Gli animali moribondi e gli animali in condizioni di grave sofferenza o dolore dovranno essere rimossi appena notati, soppressi umanamente e sottoposti a necroscopia.
Al termine del saggio tutti gli animali, compresi quelli di controllo, saranno sottoposti ai seguenti esami:
|
i)
|
ematologia, comprendente almeno l'ematocrito, la concentrazione di emoglobina, la conta degli eritrociti, la conta totale e differenziale dei leucociti e una misura del potenziale di coagulazione;
|
|
ii)
|
biochimica clinica del sangue, comprendente almeno un parametro della funzionalità epatica e renale nel siero: alanina aminotransferasi (prima conosciuta come glutammico-piruvico transaminasi), aspartato aminotransferasi (prima conosciuta come glutammico-ossalacetico transaminasi), azoto ureico, albumina, creatinina ematica, bilirubina totale e proteine seriche totali.
|
Altre determinazioni, che possono risultare necessarie per un'adeguata valutazione tossicologica, comprendono il calcio, il fosforo, il cloruro, il sodio, il potassio, il glucosio a digiuno, l'analisi dei lipidi, gli ormoni, l'equilibrio acido/base, la metaemoglobina, l'attività colinesterasica.
Per estendere l'indagine degli effetti osservati, se necessario, si possono utilizzare ulteriori esami biochimico-clinici.
1.6.4. Necroscopia
Tutti gli animali dello studio dovranno essere sottoposti a necroscopia completa. Per evitare la disidratazione, il fegato, i reni, le ghiandole surrenali e i testicoli dovrebbero essere pesati umidi al più presto possibile dopo la dissezione. Gli organi e i tessuti, cioè la cute normale e trattata, il fegato, i reni, la milza, i testicoli, le ghiandole surrenali, il cuore e gli organi bersaglio (cioè gli organi che presentano lesioni macroscopiche o variazioni di dimensioni) dovranno essere conservati in un mezzo adatto per l'eventuale futuro esame istopatologico.
1.6.5. Esame istopatologico
Gli organi e i tessuti degli animali del gruppo ad alto dosaggio e del gruppo di controllo opportunamente preservati dovranno essere sottoposti ad esame istologico. Gli organi e i tessuti che presentano lesioni attribuibili alla sostanza in esame somministrata al dosaggio più elevato dovranno essere esaminati anche per i gruppi a dosaggio inferiore. Gli animali dell'eventuale gruppo satellite dovranno essere sottoposti ad esame istologico, in particolare per gli organi e i tessuti che risultano colpiti da effetti tossici negli altri gruppi trattati.
2. DATI
I risultati dovranno essere riassunti in una tabella indicante, per ogni gruppo trattato, il numero di animali all'inizio del saggio e il numero di animali che mostra ciascun tipo di lesione.
Tutti i risultati osservati dovranno essere valutati con un adeguato metodo statistico. Può essere utilizzato qualsiasi metodo statistico riconosciuto.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
La relazione di prova deve, se possibile, includere le seguenti informazioni:
|
—
|
dati sugli animali (specie, ceppo, origine, condizioni ambientali, dieta, ecc.);
|
|
—
|
condizioni di prova (incluso il tipo di medicazione: occlusiva o non occlusiva);
|
|
—
|
livello di dosaggio (incluso il veicolo, se usato) e concentrazioni;
|
|
—
|
livello senza effetti, dove possibile;
|
|
—
|
effetti tossici per sesso e dosaggio;
|
|
—
|
il momento del decesso durante il saggio, oppure se gli animali sono sopravvissuti sino al termine;
|
|
—
|
effetti tossici o altri effetti;
|
|
—
|
momento dell'osservazione di ciascun sintomo anomalo e suo successivo decorso;
|
|
—
|
dati relativi al consumo di alimenti e al peso corporeo;
|
|
—
|
esami ematologici effettuati e loro risultati;
|
|
—
|
esami biochimico-clinici effettuati e loro risultati;
|
|
—
|
risultati della necroscopia;
|
|
—
|
descrizione dettagliata di tutti i risultati istopatologici;
|
|
—
|
elaborazione statistica dei risultati, ove possibile;
|
|
—
|
discussione dei risultati;
|
|
—
|
interpretazione dei risultati.
|
3.2. VALUTAZIONE E INTERPRETAZIONE
Vedi introduzione generale, parte B (punto D).
4. BIBLIOGRAFIA
Vedi introduzione generale, parte B (punto E)
B.10. MUTAGENICITÀ — TEST IN VITRO DI ABERRAZIONE CROMOSOMICA NEI MAMMIFERI
1. METODO
Il metodo è ripreso dal metodo OECD TG 473, In Vitro Mammalian Chromosome Aberration Test (1997).
1.1. INTRODUZIONE
Il saggio in vitro di aberrazione cromosomica è destinato ad identificare gli agenti che causano aberrazioni cromosomiche strutturali in una coltura di cellule di mammifero (1) (2) (3). Le aberrazioni strutturali possono essere di due tipi: cromosomiche o cromatidiche. La maggior parte dei mutageni chimici induce aberrazioni cromatidiche, benché si verifichino anche aberrazioni cromosomiche. Un aumento della poliploidia può indicare che una sostanza chimica ha la capacità di indurre aberrazioni numeriche. Questo metodo tuttavia non è inteso a misurare le aberrazioni numeriche e non viene usato di norma per tale scopo. Le mutazioni cromosomiche e i fenomeni ad esse correlati sono causa di molte malattie genetiche umane e vi sono prove concrete che mutazioni cromosomiche e fenomeni ad esse correlati, che causano alterazioni degli oncogeni e dei geni soppressori dei tumori nelle cellule somatiche, sono implicati nella comparsa delle neoplasie umane come in quelle sperimentalmente indotte negli animali da laboratorio.
Nei test in vitro sulle aberrazioni cromosomiche si possono usare colture di linee cellulari stabilizzate, ceppi cellulari o colture cellulari primarie. Le cellule sono scelte in funzione della capacità di crescita in coltura, della stabilità del cariotipo, del numero e della diversità dei cromosomi e della frequenza di aberrazioni cromosomiche spontanee.
I test in vitro richiedono in generale l'uso di una fonte esogena di attivazione metabolica. Tale sistema di attivazione metabolica non può simulare perfettamente le condizioni in vivo nel mammifero. Si evitino accuratamente condizioni che porterebbero a risultati positivi che non riflettono una mutagenicità intrinseca ma che possono avere origine da cambiamenti di pH o dell'osmolalità o da livelli elevati di citotossicità (4) (5).
Questi test sono utilizzati per individuare potenziali mutageni e cancerogeni per i mammiferi. Molti composti che risultano positivi al test sono cancerogeni per i mammiferi; tuttavia la correlazione tra il test e la cancerogenicità non è assoluta: dipende dalla classe chimica e vi sono sempre più elementi che inducono a ritenere che esistono cancerogeni non rivelati da questi test, perché sembrano agire attraverso meccanismi diversi dal danno diretto al DNA.
Cfr. anche Introduzione generale parte B.
1.2. DEFINIZIONI
Aberrazione cromatidica: danno cromosomico strutturale che si manifesta nella rottura di un singolo cromatide o nella rottura e ricongiunzione di cromatidi.
Aberrazione cromosomica: alterazione cromosomica strutturale, che si manifesta nella rottura, o nella rottura e ricongiunzione, di entrambi i cromatidi in uno stesso punto.
Endoriduplicazione: processo nel quale, dopo una fase S di replicazione del DNA, il nucleo non inizia la mitosi ma inizia una nuova fase S. Ne risultano cromosomi con 4, 8, 16, ... cromatidi.
Gap: lesione acromatica, di ampiezza inferiore a un cromatide, con minimo disallineamento dei cromatidi.
Coefficiente mitotico: numero delle cellule in metafase diviso per il numero totale di cellule della popolazione: costituisce un'indicazione del grado di proliferazione della popolazione cellulare.
Aberrazione numerica: variazione del numero di cromosomi rispetto al numero diploide caraneristico della specie.
Poliploidia: numero di cromosomi multiplo superiore a due del numero aploide (cioè 3n, 4n ecc.).
Aberrazione strutturale: alterazione della struttura cromosomica visibile all'esame microscopico dello stadio di metafase, che si presenta con delezioni, perdita di segmenti, scambi intercromosomici e intracromosomici.
1.3. PRINCIPIO DEL METODO DI SAGGIO
L'azione della sostanza in esame è saggiata sulle colture cellulari, con e senza attivazione metabolica. Dopo l'esposizione alla sostanza in esame, le colture cellulari sono trattate, a determinati intervalli, con un inibitore della metafase (per esempio Colcemid® o colchicina), raccolte, sottoposte a un processo di colorazione e le cellule in metafase sono esaminate al microscopio per determinare la presenza di aberrazioni cromosomiche.
1.4. DESCRIZIONE DEL METODO
1.4.1. Preparazioni
1.4.1.1. Cellule
Si possono usare varie linee cellulari, ceppi o colture cellulari primarie, fra cui cellule umane (per esempio fibroblasti del criceto cinese, linfociti del sangue periferico umano o di altri mammiferi).
1.4.1.2. Terreni e condizioni di coltura
Si usino terreni di coltura e condizioni di incubazione (recipienti per coltura, concentraazione di CO2, temperatura e umidità) adeguati alle colture. Si controlli periodicamente la stabilità del numero modale dei cromosomi e l'assenza di contaminazione da micoplasma nelle linee cellulari stabilizzate e nei ceppi; non si usino ceppi contaminati. Dovrebbero essere note la durata normale del ciclo cellulare e le condizioni di coltura utilizzate.
1.4.1.3. Preparazione delle colture
Linee cellulari stabilizzate e ceppi: le cellule provenienti da colture primarie vengono inoculate in un terreno di coltura ad una densità tale da impedire che le colture raggiungano la confluenza prima della raccolta, e incubate a 37 oC.
Linfociti: sangue intero trattato con un anticoagulante (per esempio eparina) o linfociti isolati, prelevati da soggetti sani, sono posti in un terreno di coltura contenente un mitogeno (per esempio fitoemoagglutinina) e incubati a 37 oC.
1.4.1.4. Attivazione metabolica
Le cellule dovrebbero essere esposte alla sostanza in esame sia in presenza che in assenza di un adeguato sistema di attivazione metabolica. Il sistema più comunemente usato è una frazione post-mitocondriale integrata di cofattori (S9) ricavata dal fegato di roditori trattati con induttori enzimatici, per esempio: Aroclor 1254 (6) (7) (8) (9), o con un combinazione di fenobarbitone e/3-naftoflavone (10) (11) (12).
La frazione post-mitocondriale viene di solito usata a concentrazioni comprese tra 1 e 10 % v/v nel terreno di coltura. Le condizioni del sistema di attivazione metabolica dipendono dalla classe chimica della sostanza in esame. In alcuni casi può essere opportuno utilizzare varie concentrazioni della frazione post-mitocondriale.
Vari nuovi procedimenti, tra cui la creazione di linee cellulari modificate mediante ingegneria genetica che esprimono enzimi attivatori specifici, possono fornire il potenziale di attivazione endogena. La scelta delle linee cellulari deve essere scientificamente motivata (per esempio in funzione dell'importanza dell'isoenzima del citocromo P450 nel metabolismo della sostanza in esame).
1.4.1.5. Sostanza in esame/Preparazione
Le sostanze solide devono essere poste in soluzione o in sospensione in adeguati solventi o mezzi disperdenti e, se necessario, diluite prima del trattamento delle cellule. Le sostanze liquide possono essere aggiunte direttamente alla coltura o diluite prima del trattamento. Si usino preparati recenti della sostanza, salvo qualora siano disponibili dati sulla sua stabilità che dimostrino che la conservazione è accettabile.
1.4.2. Condizioni di esperimento
1.4.2.1. Solvente/mezzo disperdente
Il solvente/mezzo disperdente non deve reagire chimicamente con la sostanza in esame e deve essere compatibile con la sopravvivenza delle cellule e con l'azione di S9, L'uso di solventi/mezzi disperdenti poco noti è ammesso solo se suffragato da dati che ne provino la compatibilità. Si raccomanda di prendere in primo luogo in considerazione, se possibile, l'uso di un solvente/mezzo disperdente acquoso. Nell'esame di sostanze instabili in acqua, si usi un solvente organico anidro. L'acqua può essere rimossa mediante un setaccio molecolare.
1.4.2.2. Concentrazioni di esposizione
Fra i criteri da considerare nel determinare la concentrazione massima si citano la citotossicità, la solubilità nel sistema di prova e le variazioni di pH o di osmolalità.
La citotossicità deve essere determinata con e senza attivazione metabolica nel test principale, sulla base di un'indicatore adeguato dell'integrità e della moltiplicazione cellulare, come il grado di confluenza, il conteggio delle cellule vitali o il coefficiente mitotico. Può essere utile determinare la citotossicità e la solubilità in un esperimento preliminare.
Si usino almeno tre concentrazioni analizzagli. In caso di sostanze citotossiche, le concentrazioni devono andare dalla tossicità massima ad una tossicità assente o modica; le concentrazioni devono cioè essere di norma separate al massimo da un fattore compreso tra 2 e v 10. Al momento della raccolta la concentrazione più elevata deve presentare una riduzione significativa (superiore al 50 %) del grado di confluenza, del numero delle cellule o del coefficiente mitotico. Il coefficiente mitotico è solo una misura indiretta di effetti citotossici/citostatici e dipende dal tempo trascorso dopo il trattamento. È tuttavia accettabile per colture in sospensione, per le quali altre misure della tossicità possono essere complesse e poco pratiche. Dati relativi alla cinetica cellulare, per esempio il tempo medio di moltiplicazione, possono fornire informazioni supplementari. Il tempo medio di moltiplicazione tuttavia è una media generale, che non sempre rivela l'esistenza di sottopopolazioni con ritardi di crescita, e anche piccoli aumenti di esso possono essere associati ad un ritardo sostanziale del tempo di comparsa delle aberrazioni.
Per sostanze a basso grado di citotossicità la concentrazione massima di prova dovrebbe essere pari a 5 ul/ml, 5 mg/ml o 0,01 M (si scelga il valore più basso).
Per sostanze difficilmente solubili e non tossiche a concentrazioni inferiori al limite di solubilità, la dose massima dovrebbe essere una concentrazione superiore al limite di solubilità nel terreno di coltura, al termine del trattamento. In alcuni casi (per esempio quando si verifica tossicità solo a concentrazioni superiori alla concentrazione minima insolubile) è opportuno eseguire prove a più di una concentrazione, con precipitazione visibile. Può essere utile valutare la solubilità all'inizio e al termine del trattamento, perché questa può variare nel corso dell'esposizione durante il saggio, per la presenza di cellule, S9, siero ecc. L'insolubilità può essere rilevata ad occhio nudo. Il precipitato non deve interferire con la valutazione.
1.4.2.3. Controlli negativi e positivi
Ogni test dovrà comprendere controlli positivi e negativi (solvente o mezzo disperdente) trattati in parallelo, con e senza attivazione metabolica. Quando si usa l'attivazione metabolica, la sostanza usata per i controlli positivi deve esigere attivazione per dare una risposta mutagenica.
Come controllo positivo si utilizzi un clastogeno noto, a livelli ai quali ci si attende un aumento riproducibile e individuabile rispetto ai valori normali, che dimostri la sensibilità del test.
La concentrazione del controllo positivo deve essere tale che gli effetti siano chiari ma non rivelino immediatamente al lettore l'identità dei vetrini codificati. Esempi di sostanze di controllo positive:
|
Condizione di attivazione metabolica
|
Sostanza
|
N. CAS
|
N. Einecs
|
|
Assenza di attivazione metabolica esogena
|
Metansolfonato di metile
|
66-27-3
|
200-625-0
|
|
Metansolfonato di etile
|
62-50-0
|
200-536-7
|
|
Etilnitrosourea
|
759-73-9
|
212-072-2
|
|
Mitomicina C
|
50-07-7
|
212-072-2
|
|
4-Nitrochinolina-N-ossido
|
56-57-5
|
200-281-1
|
|
Presenza di attivazione metabolica esogena
|
Benzo[a]pirene
|
50-32-8
|
200-028-5
|
|
Ciclofosfammide
Ciclofosfammide monoidrato
|
50-18-0
6055-19-2
|
200-015-4
|
Si possono usare altre adeguate sostanze per i controlli positivi. Si usino, se disponibili, sostanze di una classe chimica correlata.
Si effettuino anche controlli negativi, con solvente o mezzo disperdente usati da soli sul terreno di coltura; i controlli vanno trattati come le colture di trattamento, per ogni fase di raccolta. Si proceda inoltre a controlli non trattati, salvo che dati precedenti provino che il solvente scelto non induce effetti nocivi o mutageni.
1.4.3. Procedura
1.4.3.1. Trattamento con la sostanza in esame
Le cellule in proliferazione sono trattate con la sostanza in esame in presenza e in assenza di un sistema di attivazione metabolica. 11 trattamento dei linfociti deve iniziare circa 48 ore dopo la stimolazione mitogenica.
|
1.4.3.2.
|
Dovrebbero essere usate di norma colture in doppio per ogni concentrazione, anche per le colture di controllo con solo solvente. Se esistono precedenti dati che provano che le variazioni tra colture in doppio sono minime (13) (14), si può accettare l'uso di una sola coltura per concentrazione.
1 test con sostanze gassose o volatili devono essere condotti con metodi adeguati, per esempio in recipienti di coltura ermetici (15) (16)
|
1.4.3.3. Raccolta delle colture
Nel primo esperimento si espongano le cellule alla sostanza in esame, sia con che senza attivazione metabolica, per 3-6 ore e si proceda al campionamento quando sia trascorso un periodo equivalente a circa una volta e mezza la durata del ciclo cellulare normale dall'inizio del trattamento (12). Se i risultati sono negativi, sia con che senza attivazione, si esegua un ulteriore esperimento senza attivazione, con trattamento continuo fino al campionamento, dopo un periodo equivalente a circa una volta e mezzo la durata del ciclo cellulare normale. Alcune sostanze chimiche possono essere individuate più facilmente con tempi di trattamento/campionamento superiori a una volta e mezzo la durata del ciclo cellulare. I risultati negativi nei testi con attivazione metabolica devono essere confermati caso per caso. Se non si ritiene necessaria la conferma dei risultati negativi, se ne fornisca la motivazione.
1.4.3.4. Preparazione dei cromosomi
Le colture cellulari sono trattate con Colcemid8 o colchicina, di norma per un periodo variabile da una a tre ore prima della raccolta. Ogni coltura cellulare viene raccolta e trattata separatamente per la preparazione dei cromosomi. La preparazione dei cromosomi comprende il trattamento ipotonico delle cellule, il fissaggio e la colorazione.
1.4.3.5. Analisi
Tutti i vetrini, compresi quelli dei controlli positivi e negativi, devono essere codificati individualmente prima dell'esame al microscopio. Poiché le procedure di fissaggio provocano spesso la rottura di una parte delle cellule in metafase, con perdita di cromosomi, le cellule classificate devono contenere un numero di centromeri pari al numero modale ± 2 per tutti i tipi di cellule. Per ogni concentrazione e per ogni controllo si devono valutare almeno 200 cellule in metafase ben distribuite e adeguatamente suddivise, se possibile tra le prove in doppio. Tale numero può essere ridotto quando si osserva un gran numero di aberrazioni.
Anche se il test è destinato a rivelare aberrazioni cromosomiche strutturali, è importante registrare eventuali casi di poliploidia e di endoriduplicazione.
2. RISULTATI
2.1. TRATTAMENTO DEI RISULTATI
L'unità sperimentale è la cellula; pertanto si deve valutare la percentuale di cellule che presentano una o più aberrazioni cromosomiche strutturali. Per le colture sperimentali e per le colture di controllo si indichino i vari tipi di aberrazioni cromosomiche strutturali, con numero e frequenza. I gap vanno registrati separatamente e indicati nella relazione, ma non vanno inclusi nella frequenza totale delle aberrazioni.
Si riportino anche le misure di citotossicità condotte in parallelo per tutte le colture trattate e i controlli negativi nei principali test di aberrazione.
1 dati saranno presentati separatamente per le singole colture e riassunti in tabelle.
Non è necessario verificare le risposte positive inequivocabili. I risultati ambigui devono essere chiariti mediante prove ulteriori, preferibilmente modificando le condizioni di esperimento. La necessità di confermare i risultati negativi è stata discussa al punto 1.4.3.3. Nei test successivi si dovrebbero modificare i parametri di studio, per estendere la gamma delle condizioni valutate. Fra i parametri di studio modificabili si citano l'intervallo fra i livelli di concentrazione e le condizioni di attivazione metabolica.
2.2. VALUTAZIONE E INTERPRETAZIONE DEI RISULTATI
Vari criteri permettono di determinare se un risultato è positivo, per esempio un aumento correlato alla concentrazione o un aumento riproducibile del numero di cellule che presentano aberrazioni cromosomiche. Si consideri in primo luogo la rilevanza dei risultati dal punto di vista biologico. Si possono usare metodi statistici come ausilio nella valutazione dei risultati sperimentali (3) (13). ma la significatività statistica non dovrebbe essere l'unico fattore determinante di una risposta positiva.
Un aumento del numero di cellule poliploidi può significare che la sostanza in esame è in grado di inibire processi miratici e di indurre aberrazioni numeriche nei cromosomi. Un aumento del numero di cellule con cromosomi endoriduplicati può indicare che la sostanza in esame è in grado di inibire il ciclo cellulare (17) (18).
Una sostanza che fornisca risultati non corrispondenti ai criteri di cui sopra è considerata non mutagena in questo test.
La maggior parte degli esperimenti fornirà indubbiamente risultati palesemente positivi o negativi, ma in alcuni casi i dati ottenuti non consentiranno di formulare un giudizio definitivo sull'azione della sostanza in esame. 1 risultati possono rimanere ambigui nonostante l'esperimento venga ripetuto più volte.
Risultati positivi del saggio di aberrazione cromosomica in vitro indicano che la sostanza in esame induce aberrazioni cromosomiche strutturali in colture di cellule somatiche di mammifero. Risultati negativi indicano che, nelle condizioni di test, la sostanza in esame non induce aberrazioni cromosomiche in colture di cellule somatiche di mammifero.
3. RELAZIONE
RELAZIONE SUL SAGGIO
La relazione sul saggio dovrà contenere le seguenti informazioni:
|
|
Solvente/mezzo disperdente:
|
—
|
motivazione della scelta del mezzo disperdente,
|
|
—
|
solubilità e stabilità della sostanza in esame nel solvente/mezzo disperdente, se nota.
|
|
|
|
Cellule:
|
—
|
tipo e origine delle cellule,
|
|
—
|
caratteristiche del cariotipo e idoneità del tipo di cellula usato,
|
|
—
|
assenza di micoplasma, se del caso,
|
|
—
|
informazioni sulla durata del ciclo cellulare,
|
|
—
|
sesso dei donatori di sangue, sangue intero o linfociti isolati, mitogeno usato,
|
|
—
|
eventuale numero di passaggi in coltura, se del caso,
|
|
—
|
metodi usati per la conservazione della coltura cellulare, se del caso,
|
|
—
|
numero modale dei cromosomi.
|
|
|
|
Condizioni di esperimento:
|
—
|
natura e concentrazione dell'inibitore della metafase, durata di esposizione delle cellule,
|
|
—
|
criteri di selezione delle concentrazioni e del numero di colture, per esempio dati sulla citotossicità e sui limiti di solubilità, se disponibili,
|
|
—
|
composizione del terreno di coltura, concentrazione di CO2 se del caso,
|
|
—
|
concentrazione della sostanza in esame.
|
|
—
|
volume del mezzo disperdente e della sostanza in esame aggiunti,
|
|
—
|
temperatura di incubazione,
|
|
—
|
durata del trattamento,
|
|
—
|
densità delle cellule al momento dell'inoculazione, se del caso,
|
|
—
|
tipo e composizione del sistema di attivazione metabolica, compresi i criteri di accettabilità.
|
|
—
|
controlli positivi e negativi,
|
|
—
|
metodi di preparazione dei vetrini,
|
|
—
|
criteri di conteggio delle aberrazioni,
|
|
—
|
numero di metafasi analizzate,
|
|
—
|
metodi di misura della tossicità,
|
|
—
|
criteri in base ai quali i risultati sono giudicati positivi, negativi o ambigui.
|
|
|
|
Risultati:
|
—
|
indizi di tossicità, per esempio grado di confluenza, dati sul ciclo cellulare, conta delle cellule, coefficiente mitotico,
|
|
—
|
segni di precipitazione,
|
|
—
|
dati sul pH e sull'osmolalità del terreno di trattamento, se determinati,
|
|
—
|
definizione delle aberrazioni, compresi i salti,
|
|
—
|
numero di cellule con aberrazioni cromosomiche e tipi di aberrazioni, indicati separatamente per ciascuna coltura trattata e di controllo,
|
|
—
|
eventuali cambiamenti di ploidia,
|
|
—
|
relazione dose-risposta, se possibile,
|
|
—
|
eventuali analisi statistiche,
|
|
—
|
dati sui controlli negativi (solvente/mezzo disperdente) e positivi paralleli,
|
|
—
|
precedenti dati sui controlli negativi (solvente/mezzo disperdente) e positivi, con variazioni, medie e deviazioni standard.
|
|
|
|
Discussione dei risultati.
|
4. BIBLIOGRAFIA
|
(1)
|
Evans, H. J. (1976), Cytological Methods for Detecting Chemical Mutagens, in: Chemical mutagens, Principles and Methods for their Detection, Voi. 4, Hollaender, A. (ed) Plenum Press, New York and London, pp. 1-29.
|
|
(2)
|
lshidate, M. Jr. and Sofuni, T. (1985), The In Vitro Chromosomal Aberration Test Using Chinese Ham ster Lung (CHL) Fibroblast Cells in Culture, in: Progress in Mutation Research, Voi. 5. Ashby, J. et al., (eds) Elsevier Science Publishers, Amsterdam-New York-Oxford. pp. 427-432.
|
|
(3)
|
Galloway, S. M., Armstrong, M. J., Reuben, C, Colman, S., Brown, B., Camion, C, Blooin, A. D., Nakamura, F., Ahmed, M, Duk, S., Rimpo, J., Margolin, G. H., Resnick, M. A., Andersen, G. and Zeiger, E. (1978), Chromosome aberration and sister chromatic exchanges in Chinese hamster ovary cells: Evaluation of 108 chemicals, Environs. Moke. Mutagen 10 (suppl. 10), pp. 1-175.
|
|
(4)
|
Scott, D., Galloway, S. M., Marshall, R. R., lshidate, M. Jr., Brusick, D., Ashby, J. and Myhr, B. C. (1991), Genotoxicity under Extreme Culture Conditions. A report from ICPEMC Task Group 9, Mutation Res., 25.7 pp. 147-204.
|
|
(5)
|
Morita, T., Nagaki, T., Fukuda, 1. and Okumura, K. (1992), Clastogenicity of low pH to Various Cultured Mammalian Cells, Mutation Res., 268, pp. 297-305.
|
|
(6)
|
Ames, B. N., McCann, J. and Yamasaki, E. (1975), Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian Microsome Mutagenicity Test, Mutation Res., 31, pp. 347-364.
|
|
(7)
|
Maron, D. M. and Ames, B. N. (1983), Revised Methods for thè Salmonella Mutagenicity Test, Mutation Res.. 113, pp. 173-215.
|
|
(8)
|
Natarajan, A. T., Tares, A. D., van Buul, P. P. W., Meijers, M. and de Vogel, N. (1976), Cytogenetic Effects of Mutagen/Carcinogens after Activation in a Microsomal System In Vitro, J. Induction of Chro mosome Aberrations and Sister Chromatid Exchange by Diethylnitrosamine (DEN) and Dimethylnitro- samine (DMN) in CHO Cells in the Presence of Rat-Liver Microsomes, Mutation Res., 37, pp. 83-90.
|
|
(9)
|
Matsuoka, A., Hayashi, M. and Ishidate, M. Jr. (1979), Chromosomal Aberration Tests on 29 Chemicals Combined with S9 Mix In Vitro, Mutation Res., 66, pp. 277-290.
|
|
(10)
|
Elliot, B. M., Combes, R. D., Elcombe, C. R., Gatehouse, D. G., Gibson, G. G., Mackay, J. M. and Wolf, R. C. (1992), Report of UK environmental Mutagen Society Working Party. Alternatives to Aroclar 1254-induced S9 in In Vitro Genotoxicity Assays, Mutagenesis, 7, pp. 175-177.
|
|
(11)
|
Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T. (1976), A Safe Substitute for Polvchlorinated Biphenyls as an Inducer of Metabolic Activation Systems, in: de Serres, E. J., Fouts, J. R., Berid, J. R. and Philpot, R. M. (eds). In Vitro Metabolic Activation in Mutagenesis Testing, Elsevier. North-Holland, pp. 85-88.
|
|
(12)
|
Galloway, S. M., Aardema, M. J., Ishidate, M. Jr., Iven, J. L, Kirkland, D. J., Morita. T., Mosesso, P., Sofuni, T. (1994), Report from Working Group on in In Vitro Tests for Chromosomal Aberrations, Mutation Res., 312, pp. 241-261.
|
|
(13)
|
Richardson, C, Williams, D. A., Allen, J. A., Amphlett, G., Chanter, D. O. and Phillips, B. (1989), Analy sis of Data from In Vitro Cytogenetic Assays, in: Statistical Evaluation of Mutagenicity Test Data, Kirkland, D. J., (ed) Cambridge University Press, Cambridge, pp. 141-154.
|
|
(14)
|
Soper, K. A. and Galloway, S. M. (1994), Replicate Flasks are not Necessary for In Vitro Chromosome Aberration Assays in CHO Cells, Mutation Res., 312, pp. 139-149.
|
|
(15)
|
Krahn, D. F., Barsky, F. C. and McCooey, K. T. (1982), CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids, in: Tice, R. R., Costa, D. L., Schaich, K. M. (eds), Genotoxic Effects o/Airborne Agents, New York, Plenum, pp. 91-103.
|
|
(16)
|
Zamora, P. 0., Benson, J. M., Li, A. P. and Brooks, A. L. (1983), Evaluation of an Exposure System Using Cells Grown on Collagen Gels for Detecting Highly Volatile Mutagens in the CHO/HGPRT Mutation Assay, Environmental Mutagenesis, 5, pp. 795-801.
|
|
(17)
|
Locke-Huhle, C. (1983), Endoreduplication in Chinese hamster cells during alpha-radiation induced G2 arrest, Mutation Res., 119, pp. 403-413.
|
|
(18)
|
Huang, Y., Change, C. and Trosko, j. E. (1983), Aphidicolin-induced endoreduplication in Chinese hamster cells, Cancer Res., 43, pp. 1362-1364...
|
«B.11. MUTAGENICITA — TEST IN VIVO DI ABERRAZIONE CROMOSOMICA SUL MIDOLLO OSSEO DI MAMMIFERI
1. METODO
Il metodo è ripreso dal metodo OECD TG 475, Mammalian Bone Marrow Chromosome Aberration Test (1997).
1.1. INTRODUZIONE
I testi di aberrazione cromosomica in vivo nei mammiferi sono destinati ad individuare aberrazioni cromosomiche strutturali indotte dalla sostanza in esame nelle cellule del midollo osseo di animali, di solito roditori (1) (2) (3) (4). Le aberrazioni cromosomiche strutturali possono essere di due tipi: cromosomiche o cromatidiche. Un aumento della poliploidia può significare che una sostanza chimica è in grado di indurre aberrazioni numeriche. La maggior parte dei mutageni chimici induce aberrazioni cromatidiche, ma si verificano anche aberrazioni cromosomiche. Le mutazioni cromosomiche e i fenomeni ad esse correlati sono causa di molte malattie genetiche umane e vi sono prove concrete che mutazioni cromosomiche e fenomeni ad esse correlati, che causano alterazioni degli oncogeni e dei geni soppressori di tumori, sono implicati nella comparsa delle neoplasie umane e di quelle sperimentalmente indotte negli animali da laboratorio.
Per i test si usano solitamente roditori. Il midollo osseo è il tessuto bersaglio, in quanto è altamente vascolarizzato e contiene una popolazione di cellule a ciclo rapido, che possono essere agevolmente isolate e trattate. Altre specie e altri tessuti bersaglio non sono oggetto della presente metodica.
Il test di aberrazione cromosomica è particolarmente idoneo a valutare il rischio mutagenico, in quanto per mette di considerare fattori del metabolismo in vivo, aspetti farmacocinetici e processi di riparazione del DNA, che peraltro possono variare in funzione della specie e del tipo di tessuto. Un test in vivo è utile anche per verificare l'effetto mutageno rivelato da un test in vitro.
Se è evidente che la sostanza in esame, o un metabolita reattivo, non raggiungono il tessuto bersaglio, il test non è idoneo.
Cfr. anche Introduzione generale parte B.
1.2. DEFINIZIONI
Aberrazione cromatica: danno strutturale dei cromosomi che si manifesta nella rottura di un singolo cromatide o nella rottura e ricongiunzione di cromatidi.
Aberrazione cromosomica: alterazione cromosomica strutturale, che si manifesta nella rottura, o nella rottura e ricongiunzione, di entrambi i cromatidi in uno stesso punto.
Endoriduplicazione: processo nel quale, dopo una fase S di replicazione del DNA, il nucleo non inizia la mitosi ma inizia una nuova fase S. Ne risultano cromosomi con 4, 8, 16, ... cromatidi.
Gap: lesione acromatica, di ampiezza inferiore a un cromatide, con minimo disallineamento dei cromatidi.
Coefficiente mitotico: numero delle cellule in metafase diviso per il numero totale di cellule della popolazione: costituisce un'indicazione del grado di proliferazione della popolazione cellulare.
Aberrazione numerica: variazione del numero di cromosomi rispetto al numero diploide caraneristico della specie.
Poliploidia: numero di cromosomi multiplo superiore a due del numero aploide (cioè 3n, 4n, ecc).
Aberrazione strutturale: alterazione della struttura cromosomica visibile all'esame microscopico dello stadio di metafase, che si presenta con perdita di segmenti, riordinamenti intercromosomici e intracromosomici.
1.3. PRINCIPIO DEL METODO DI SAGGIO
Gli animali sono esposti alle sostanze in esame per una via adeguata e vengono quindi sacrificati a tempo debito, dopo somministrazione di un inibitore della metafase (per esempio colchicina o Colcemid05). Sono poi approntate e sottoposte a un processo di colorazione le preparazioni cromosomiche delle cellule di midollo osseo, e se ne analizzano le cellule in metafase per determinare le aberrazioni cromosomiche.
1.4. DESCRIZIONE DEL METODO
1.4.1. Preparazioni
1.4.1.1. Scelta delle specie animali
Ratti, topi e criceti cinesi sono gli animali più comunemente usati, ma si può usare qualsiasi specie adeguata di mammifero. Si scelgano individui adulti, giovani e in buona salute, provenienti da ceppi di animali da laboratorio. All'inizio dello studio le variazioni di peso tra gli animali devono essere minime e non superare il ±20 % del peso medio per sesso.
1.4.1.2. Condizioni di stabulazione e alimentazione
Valgono le condizioni generali citate nell'Introduzione generale alla parte B; l'umidità ideale è pari al 50-60 %.
1.4.1.3. Preparazione degli animali
Gli animali adulti, sani e giovani sono suddivisi a caso in gruppi di controllo e di trattamento. Le gabbie devono essere disposte in modo da minimizzare eventuali effetti dovuti alla posizione. Gli animali vanno identificati inequivocabilmente e acclimatati alle condizioni di laboratorio per almeno cinque giorni.
1.4.1.4. Preparazione delle dosi
Le sostanze solide devono essere poste in soluzione o in sospensione in adeguati solventi o mezzi disperdenti e, se necessario, diluite prima del trattamento degli animali. Le sostanze liquide possono essere somministrate direttamente o diluite prima del trattamento. Si usino preparati recenti della sostanza, salvo qualora siano disponibili dati sulla sua stabilità che dimostrino che la conservazione è ammissibile.
1.4.2. Condizioni di esperimento
1.4.2.1. Solvente/mezzo disperdente
11 solvente/mezzo disperdente non deve produrre effetti tossici alle dosi usate e non deve reagire chimicamente con la sostanza in esame. L'uso di solventi/mezzi disperdenti poco noti è ammesso solo se suffragato da dati che ne provino la compatibilita. Si raccomanda di prendere in primo luogo in considerazione, se possibile, l'uso di un solvente/mezzo disperdente acquoso.
1.4.2.2. Controlli
Ogni test dovrà comprendere controlli positivi e negativi (solvente/mezzo disperdente), trattati in parallelo per ciascun sesso. Gli animali dei gruppi dovranno essere trattati in modo identico, salvo per la somministrazione della sostanza in esame,
I controlli positivi dovrebbero indurre aberrazioni strutturali in vivo a livelli di esposizione ai quali è previsto un aumento rilevabile rispetto alla media. Le dosi dei controlli positivi devono essere scelte in modo che gli effetti siano chiari ma non rivelino immediatamente al lettore l'identità dei vetrini codificati. E ammissibile che le sostanze per i controlli positivi siano somministrate per una via diversa dalla sostanza in esame ed e sufficiente un solo prelievo per campione. È anche ammissibile l'uso per i controlli positivi di sostanze di una classe chimica correlata, se ne esistono. Fra gli esempi di sostanze per i controlli positivi si citano:
|
Sostanza
|
N. CAS
|
N. Einecs
|
|
Metansolfonato di etile
|
62-50-0
|
200-536-7
|
|
Etilnitrosourea
|
759-73-9
|
212-072-2
|
|
Mitomicina C
|
50-07-7
|
200-008-6
|
|
Ciclofosfammide
Ciclofosfammide monoidrato
|
50-18-0
6055-19-2
|
200-015-4
|
|
Trietilenmelammina
|
51-18-3
|
200-083-5
|
In ogni fase del campionamento si proceda a controlli negativi, cui sia somministrato solo il solvente o il mezzo disperdente, senza altre differenze di trattamento, salvo che dati precedenti dimostrino che la variabilità intraspecifica e la frequenza di cellule con aberrazioni cromosomiche sono accettabili. Se per i controlli negativi si procede ad un solo campionamento, il momento più adeguato è quello del primo prelievo. Si ricorra anche a controlli negativi non trattati, salvo che dati precedenti dimostrino che il solvente/mezzo disperdente scelto non induce effetti nocivi o mutageni.
1.5. PROCEDURA
1.5.1. Numero e sesso degli animali
Ogni gruppo trattato e ogni gruppo di controllo deve essere composto di almeno 5 animali analizzabili per sesso. Se al momento della sperimentazione sono disponibili dati relativi a sperimentazioni sulla stessa specie, con la medesima via di esposizione, che dimostrano che non vi sono sostanziali differenze di tossicità tra i sessi, sarà sufficiente effettuare i test su un solo sesso. Qualora l'esposizione umana alle sostanze chimiche sia specifica per un sesso, come per esempio nel caso di alcuni prodotti farmaceutici, i test devono essere eseguiti su animali di tale sesso.
1.5.2. Protocollo di trattamento
Le sostanze in esame sono somministrate di preferenza in un'unica dose. Possono essere somministrate anche in dosi frazionate, per esempio in due dosi nello stesso giorno, a distanza di qualche ora al massimo, per agevolare la somministrazione, trattandosi di dosi di volume elevato. Se si usa una posologia diversa, se ne fornisca la motivazione scientifica.
Dopo il trattamento si proceda al prelievo dei campioni in due momenti diversi dello stesso giorno. Per i roditori il primo prelievo dopo il trattamento è effettuato quando sia trascorso un periodo equivalente ad una volta e mezza la durata del ciclo cellulare (che è di norma di 12-18 ore). Poiché il tempo necessario affinché la sostanza in esame sia assorbita e metabolizzata e produca effetti sulla cinetica del ciclo cellulare può influire sul momento ottimale per l'individuazione delle aberrazioni cromosomiche, si raccomanda di prelevare un altro campione 24 ore dopo. Se il protocollo di trattamento è più lungo di un giorno, si proceda ad un unico campionamento quando sia trascorso un periodo equivalente ad una volta e mezza la durata normale del ciclo cellulare dopo l'ultima somministrazione.
Prima di sacrificare gli animali si inietti per via interperitoneale una dose adeguata di un inibitore della meta-fase (per esempio Colcemid® o colchicina). Gi animali saranno quindi sacrificati dopo un adeguato lasso di tempo: 3-5 ore circa per i topi, 4-5 ore circa per i criceti cinesi. Si prelevino quindi le necessarie cellule del midollo osseo e si rilevino le aberrazioni cromosomiche.
1.5.3. Dosi
Se si procede a uno studio per individuare l'intervallo di dosi, non essendo disponibili dati utili in materia, questo va eseguito nello stesso laboratorio, sulla stessa specie, ceppo e sesso, con il medesimo protocollo usato nel test principale (5). In caso di tossicità si usino per la prima fase di campionamento tre dosi diverse, che vadano dalla tossicità massima ad una tossicità assente o modica. Per il campionamento successivo si usi solo la dose massima. La dose massima è definita come dose che produce segni di tossicità tali che livelli più elevati, con la stessa posologia, sarebbero presumibilmente letali. Sostanze con azione biologica specifica, a dosi basse non tossiche (come ormoni e mitogeni) possono costituire eccezione rispetto ai criteri di definizione della dose e vanno valutate caso per caso. La dose massima può essere definita anche come dose che produce qualche segno di tossicità nel midollo osseo (per esempio una riduzione del coefficiente mitotico superiore al 50 %).
1.5.4. Saggio con dose limite
Se la somministrazione di una quantità di sostanza pari ad almeno 2 000 mg per kg di peso corporeo in dose unica o in due dosi nello stesso giorno non produce effetti tossici rilevabili, e se non vi sono ragioni di sospettare un'azione genotossica sulla base di dati relativi a sostanze strutturalmente correlate, si può considerare che non è necessario procedere alla sperimentazione completa con tre dosi diverse. Per studi di maggiore durata la dose limite è pari a 2 000 mg/kg di peso corporeo al giorno, da somministrare per 14 giorni al massimo; è pari a 1 000 mg/kg di peso corporeo al giorno per un trattamento più lungo. Sulla base della esposizione umana prevista per la sostanza in esame, può essere necessario usare una dose più elevata nel test con dose limite.
1.5.5. Somministrazione
La sostanza in esame viene di solito somministrata con sonda gastrica o cannula di intubazione, oppure mediante iniezione intraperitoneale. Possono essere accettate altre vie se esiste una valida ragione. Il volume massimo di liquido somministrabile in un'unica volta con sonda gastrica o con iniezione dipende dalle dimensioni dell'animale da laboratorio; non deve superare i 2 ml/100 g di peso corporeo. L'uso di volumi più elevati deve essere motivato. Salvo per sostanze irritanti o corrosive, che di norma riveleranno effetti esacerbati a concentrazioni più elevate, le variazioni di volume devono essere minimizzate, regolando la concentrazione in modo da garantire un volume costante a tutte le dosi.
1.5.6. Preparazione dei cromosomi
Non appena l'animale è stato sacrificato, si prelevi il midollo osseo, lo si esponga ad una soluzione ipotonica e lo si fissi. Le cellule siano poi poste su vetrini e sottoposte a un processo di colorazione.
1.5.7. Analisi
Si determini il coefficiente mitotico come misura della citotossicità in almeno 1 000 cellule per animale, in tutti gli animali trattati (compresi i controlli positivi) e nei controlli negativi, non trattati.
Per ogni animale si analizzino almeno 100 cellule. Tale numero può essere ridotto qualora si rilevi un alto numero di aberrazioni. Tutti i vetrini, compresi quelli dei controlli positivi e negativi, devono essere codificati indipendentemente prima dell'esame al microscopio. Poiché le procedure di preparazione dei vetrini causano spesso la rottura di un parte delle cellule in metafase, con perdita di cromosomi, le cellule trattate devono contenere un numero di centromeri pari a 2n ± 2.
2. RISULTATI
2.1. TRATTAMENTO DEI RISULTATI
I dati relativi ai singoli animali vanno presentati in forma di tabelle. L'unità sperimentale è l'animale. Per ciascun animale si indichi il numero di cellule analizzate e si valuti il numero di aberrazioni per cellula e la percentuale di cellule con una o più aberrazioni cromosomiche strutturali. Per i gruppi di trattamento e di controllo si elenchino i vari tipi di aberrazioni cromosomiche strutturali, il loro numero e la loro frequenza. I gap devono essere registrati separatamente e indicati nella relazione, ma non inclusi nella frequenza totale delle aberrazioni. Se non c'è un'evidente differenza di risposta tra i sessi, i dati relativi ai due sessi possono essere combinati nell'analisi statistica.
2.2. VALUTAZIONE E INTERPRETAZIONE DEI RISULTATI
Vari criteri permettono di determinare se un risultato è positivo, per esempio un aumento del numero relativo di cellule che presentano aberrazioni cromosomiche, correlato alla dose somministrata, o un palese aumento del numero di cellule con aberrazioni nei campioni, prelevati alla stessa fase di campionamento e provenienti da un gruppo cui è stata somministrata la stessa dose della sostanza in esame. Si consideri per prima cosa la rilevanza dei risultati dal punto di vista biologico. Si possono usare metodi statistici come ausilio nella valutazione dei risultati sperimentali (6), ma la significatività statistica non dovrebbe essere l'unico fattore determinante di una risposta positiva. Eventuali risultati ambigui possono essere chiariti mediante test ulteriori, preferibilmente in condizioni sperimentali modificate.
Un aumento del numero di cellule poliploidi può significare che la sostanza in esame è in grado di indurre aberrazioni numeriche nei cromosomi. Un aumento del numero di cellule che presentano endoriduplicazione può significare che la sostanza in esame è in grado di inibire il ciclo cellulare (7) (8).
Una sostanza che fornisca risultati non corrispondenti ai criteri di cui sopra è considerata non mutagena in questo test.
La maggior parte degli esperimenti fornirà indubbiamente risultati chiaramente positivi o negativi ma occasionalmente i dati ottenuti non consentiranno di formulare un giudizio definitivo sull'azione della sostanza in esame. I risultati possono rimanere ambigui nonostante l'esperimento venga ripetuto più volte.
Risultati positivi del saggio di aberrazione cromosomica in vivo indicano che una sostanza induce aberrazioni cromosomiche nel midollo osseo della specie usata per i test. Risultati negativi indicano che nelle condizioni di test la sostanza in esame non induce aberrazioni cromosomiche nel midollo osseo della specie usata per i test.
Si vaglino le probabilità che la sostanza in esame o i suoi metaboliti entrino in circolo o specificamente raggiungano il tessuto bersaglio (tossicità sistemica).
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
La relazione sul saggio dovrà contenere le seguenti informazioni:
|
|
Solvente/mezzo disperdente:
|
—
|
motivazione della scelta del mezzo disperdente,
|
|
—
|
solubilità e stabilità della sostanza in esame nel solvente/mezzo disperdente, se nota.
|
|
|
|
Animali da laboratorio:
|
—
|
numero, età e sesso degli animali,
|
|
—
|
provenienza, condizioni di stabulazione, dieta, ecc,
|
|
—
|
peso dei singoli animali all'inizio degli esperimenti, con range, valore medio e deviazione standard per ciascun gruppo.
|
|
|
|
Condizioni di esperimento:
|
—
|
controlli positivi e negativi (mezzo disperdente/solvente),
|
|
—
|
risultati dello studio per individuare l'intervallo di dosi, se effettuato.,
|
|
—
|
criteri di selezione delle dosi,
|
|
—
|
illustrazione particolareggiata della preparazione della sostanza in esame,
|
|
—
|
illustrazione particolareggiata della somministrazione della sostanza in esame,
|
|
—
|
metodi di misura della tossicità,
|
|
—
|
criteri di selezione della via di somministrazione,
|
|
—
|
metodi usati per verificare che la sostanza in esame sia entrata in circolo o abbia raggiunto il tessuto bersaglio, se del caso,
|
|
—
|
conversione della concentrazione (ppm) della sostanza in esame nel cibo o nell'acqua potabile nella dose effettiva (mg/kg di peso corporeo/giorno), se del caso,
|
|
—
|
dettagli relativi alla qualità del cibo e dell'acqua,
|
|
—
|
descrizione dettagliata dei protocolli di trattamento e di campionamento,
|
|
—
|
natura e concentrazione dell'inibitore della metafase, durata del trattamento,
|
|
—
|
metodi di preparazione dei vetrini,
|
|
—
|
criteri di conteggio delle aberrazioni,
|
|
—
|
numero di cellule analizzate per animale,
|
|
—
|
criteri in base ai quali i risultati sono giudicati positivi, negativi o ambigui.
|
|
|
|
Risultati:
|
—
|
tipo e numero delle aberrazioni, indicati separatamente per ciascun animale,
|
|
—
|
numero totale delle aberrazioni per gruppo, con medie e deviazioni standard,
|
|
—
|
numero di cellule che presentano aberrazioni per gruppo, con medie e deviazioni standard,
|
|
—
|
eventuali cambiamenti del numero cromosomico,
|
|
—
|
relazione dose-risposta, se possibile,
|
|
—
|
eventuali analisi statistiche,
|
|
—
|
dati sui controlli negativi paralleli,
|
|
—
|
dati sui controlli negativi precedenti, con range, medie e deviazioni standard,
|
|
—
|
dati sui controlli positivi paralleli.
|
|
|
|
Discussione dei risultati.
|
4. BIBLIOGRAFIA
|
(1)
|
Adler, I. D. (1984), Cytogenetic Tests in Mammals, in: Mutagenicity Testing: a Practical Approach, S. Venitt and J. M. Parry (eds.). 1RL Press, Oxford, Washington D. C., 275-306.
|
|
(2)
|
Preston, R. J,, Dean, B. J., Galloway, S., Holden, H,, McFee, A. F. and Shelby, M. (1987), Mammalian In Vivo Cytogenetic Assays: Analysis of Chromosome Aberrations in Bone Marrow Cells, Mutation Res., 189, 157-165.
|
|
(3)
|
Richold, M., Chandly, A., Ashby, J., Gatehouse D. G., Bootman, J. and Henderson, L. (1990), In Vivo Cytogenetic Assays, in: D. J. Kirkland, (ed.), Basic Mutagenicity Tests, UKEMS Recommended Procedures. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing Report. Part 1 revised, Cambridge University Press, Cambridge, New Cork, Port Chester, Melbourne, Sydney, pp. 115-141.
|
|
(4)
|
Tice, R. R, Hayashi, M., MacGregor, J. T., Anderson, D., Blakey, D. H., Holden, H. E., Kirch-Volders, M., Oleson Jr., F. B., Paccierotti, F., Preston R. J., Romagna F., Shimada, H., Sutou, S. and Vannier, B. (1994), Report from the Working Group on the In Vivo Mammalian Bone Marrow Chromosomal Aberration Test, Mutation Res., 312, pp. 305-312.
|
|
(5)
|
Fielder, R. J., Alleen, J. A., Boobis, A. R., Botham, P. A., Doe, J., Esdaile, D.]., Gatehouse, D. G., Hodson-Walker, G., Morton, D. B., Kirkland, D. J. and Richold, M. (1992), Report of British Toxicology Society/UK, Environmental Mutagen Society Working Group: Dose setting in In Vivo Mutagenicity Assays, Mutagenesis. 7, pp. 313-319.
|
|
(6)
|
Lovell, D. P., Anderson, D., Albanese, R., Amphlett, G. E., Clare, G., Ferguson, R., Richold, M., Papworth, D. G. and Savage, J. R. K. (1989), Statistical Analysis of In Vivo Cytogenetic Assays, in: UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report Part III. Statistical Evaluation of Mutagenicity Test Data, D. J. Kirkland, (ed.) Cambridge University Press, Cambridge, pp. 184-232.
|
|
(7)
|
Locke-Huhle, C. (1983), Endoreduplication in Chinese hamster cells during alpha-radiation-induced G2 arrest, Mutation Res. 119, pp. 403-413.
|
|
(8)
|
Huang, Y., Change, C. and Trosko, J. E. (1983), Aphidicolin-induced endoreduplication in Chinese hamster cells, Cancer Res., 43, pp. 1363-1364.
|
B.12. MUTAGENICITÀ — TEST IN VIVO SUI MICRONUCLEI NEGLI ERITROCITI DI MAMMIFERO
1. METODO
Il metodo è ripreso dal metodo OECD TG 474, Mammalian Erythrocyte Micronucleus Test (1997).
1.1. INTRODUZIONE
Il test in vivo sui micronuclei dei mammiferi è usato per individuare i danni indotti dalla sostanza in esame ai cromosomi o all'apparato mitotico degli eritroblasti; si effettua analizzando gli eritrociti provenienti dal midollo osseo e/o dalle cellule del sangue periferico di animali, di norma roditori.
È destinato a identificare sostanze che provocano danni citogenetici, che si manifestano nella formazione di micronuclei contenenti frammenti di cromosomi o cromosomi interi.
Quando da un eritroblasto del midollo osseo si sviluppa un eritrocita policromatico, il nucleo principale viene espulso; i micronuclei formatisi possono rimanere nel citoplasma che non contiene più il nucleo principale, cosa che rende più agevole la visualizzazione dei micronuclei. L'aumento della frequenza di eritrociti policromatici contenenti micronuclei negli animali trattati è un'indicazione di danno cromosomico indotto.
In questo test si usa solitamente il midollo osseo di roditori: il midollo osseo è il tessuto in cui sono prodotti gli eritrociti policromatici. Il conteggio degli eritrociti immaturi (policromatici) contenenti micronuclei nel sangue periferico è ugualmente accettabile nelle specie in cui è stata provata l'incapacità della milza di svolgere la funzione emocatecretica sugli eritrociti contenenti micronuclei o che sia risultata particolarmente sensibile per l'individuazione di agenti che provocano aberrazioni cromosomiche strutturali o numeriche. Per distinguere i micronuclei si possono usare vari criteri, tra cui la presenza o l'assenza del cinetocore, o del centromero, nei micronuclei. L'elemento conclusivo è la frequenza degli eritrociti immaturi (policromatici) contenenti micronuclei. Quando gli animali vengono trattati in continuo per quattro settimane o più, come elemento conclusivo si può usare anche la percentuale di eritrociti maturi (ortocromatici) del sangue periferico che contengono micronuclei.
L'esame dei micronuclei dei mammiferi in vivo è particolarmente idoneo a valutare il rischio mutagenico, in quanto permette di prendere in considerazione elementi del metabolismo, della farmacocinetica e dei processi di riparazione del DNA in vivo, anche se questi possono variare in funzione della specie, dei tessuti e dell'effetto genetico indagato. 1 test in vivo sono utili anche ad approfondire gli studi di un effetto mutagenico rilevato in vitro.
Qualora risulti che la sostanza in esame, o un suo metabolita reattivo, non raggiungono il tessuto bersaglio, il test non è adeguato.
Cfr. anche Introduzione generale, parte B.
1.2. DEFINIZIONI
Centromero (cinetocoro): regione/i di un cromosoma sede di attacco del fuso durante la divisione cellulare, che permette il corretto movimento dei cromosomi figli verso i poli delle cellule figlie.
Micronuclei: piccoli nuclei sovrannumerari, separati dal nucleo principale delle cellule, prodotti durante la telofase della mitosi (meiosi) da frammenti residui di cromosomi o da cromosomi interi.
Eritrocita ortocromatico: eritrocita maturo in cui mancano i ribosomi, che può essere distinto dagli eritrociti policromatici immaturi mediante coloranti selettivi per i ribosomi.
Eritrocita policromatico: eritrocita immaturo, in uno stadio di sviluppo intermedio, che contiene ancora ribosomi e che pertanto può essere distinto dagli eritrociti ortocromatici maturi mediante coloranti selettivi per i ribosomi.
1.3. PRINCIPIO DEL METODO DI SAGGIO
Gli animali sono esposti alla sostanza in esame tramite una via adeguata. Se si utilizza il midollo osseo, gli animali sono sacrificati a tempo debito dopo il trattamento; il midollo osseo viene quindi prelevato, preparato e colorato (1) (2) (3) (4) (5) (6) (7). Se si utilizza sangue periferico, questo viene raccolto a tempo debito dopo il trattamento, si preparano quindi gli strisci e si colorano (4) (8) (9) (10). Per i test eseguiti con sangue periferico l'intervallo fra l'ultima esposizione della sostanza e la raccolta delle cellule dovrebbe essere minimo. Si individuano quindi i micronuclei nei preparati.
1.4. DESCRIZIONE DEL METODO
1.4.1. Preparazioni
1.4.1.1. Scelta delle specie animali
Se si usa il midollo osseo si raccomanda di servirsi di topi o ratti, benché si possa usare qualsiasi specie adeguata di mammifero. Se si usa il sangue periferico si raccomanda di servirsi di topi, ma si può utilizzare qualsiasi specie adeguata di mammifero, purché sia una specie in cui la milza non espleta la funzione emocateretica sugli eritrociti micronucleati e che si è rivelata sufficientemente sensibile per l'individuazione degli agenti che causano aberrazioni cromosomiche strutturali o numeriche. Si scelgano individui giovani e in buona salute provenienti da ceppi di animali da laboratorio. All'inizio dell'esperimento le variazioni di peso fra gli animali devono essere minime: non possono superare il 20 % del peso medio per sesso.
1.4.1.2. Condizioni di stabulazione e alimentazione
Valgono le condizioni generali citate nell'Introduzione generale alla parte B: l'umidità ideale è pari al 50-60 %.
1.4.1.3. Preparazione degli animali
Gli animali adulti, sani e giovani vengono suddivisi a caso in gruppi di controllo e di trattamento. Le gabbie devono essere disposte in modo da minimizzare eventuali effetti dovuti alla posizione. Gli animali vanno identificati inequivocabilmente e acclimatati alle condizioni di laboratorio per almeno cinque giorni.
1.4.1.4. Sostanza in esame/Preparazione
Le sostanze solide devono essere poste in soluzione o in sospensione in adeguati solventi o mezzi disperdenti e, se necessario, diluite prima del trattamento degli animali. Le sostanze liquide possono essere aggiunte direttamente alla coltura o diluite prima del trattamento. Si usino preparati recenti della sostanza, salvo qualora siano disponibili dati sulla sua stabilità che dimostrino che la conservazione è ammissibile.
1.4.2. Condizioni di esperimento
1.4.2.1. Solvente/mezzo disperdente
Il solvente/mezzo disperdente non deve produrre effetti tossici alle dosi usate e non deve reagire chimicamente con la sostanza in esame. L'uso di solventi/mezzi disperdenti poco noti è ammesso solo se suffragato da dati che ne provino la compatibilità. Si raccomanda di prendere in primo luogo in considerazione, se possibile, l'uso di un solvente/mezzo disperdente acquoso.
1.4.2.2. Controlli
Ogni test dovrà comprendere controlli positivi e negativi (solvente/mezzo disperdente), trattati in parallelo per ciascun sesso. Gli animali dei due gruppi dovranno essere trattati in modo identico, salvo per la somministrazione della sostanza in esame.
I controlli positivi dovrebbero produrre micronuclei in vivo a livelli di esposizione che provocano un aumento rilevabile rispetto alla media. Le dosi dei controlli positivi devono essere scelte in modo che gli effetti siano chiari ma non rivelino immediatamente al lettore l'identità dei vetrini codificati. È ammissibile che le sostanze per i controlli positivi siano somministrate per una via diversa dalla sostanza in esame ed è sufficiente un solo prelievo per campione. È anche ammissibile l'uso per i controlli positivi di sostanze di una classe chimica correlata, se ne esistono. Fra gli esempi di sostanze per i controlli positivi si citano:
|
Sostanza
|
N: CAS
|
N. Einecs
|
|
Metansolfonato di etile
|
62-50-0
|
200-536-7
|
|
N-ethil-N-nitrosourea
|
759-73-9
|
212-072-2
|
|
Mitomicina C
|
50-07-7
|
200-008-6
|
|
Ciclofosfammide
Ciclofosfammide monoidrato
|
50-18-0
6055-19-2
|
200-015-4
|
|
Trietilenmelammina
|
51-18-3
|
200-083-5
|
In ogni fase del campionamento si proceda a controlli negativi, cui sia somministrato solo il solvente o il mezzo disperdente, senza altre differenze di trattamento, salvo che dai dati precedenti risulti che la variabilità intraspecifica e la frequenza di cellule con micronuclei sono accettabili. Se per i controlli negativi si procede ad un solo campionamento, lo si effettui al momento del primo prelievo. Si ricorra anche a controlli negativi non trattati, salvo che dati precedenti dimostrino che il solvente/mezzo disperdente scelto non induce effetti nocivi o mutageni.
Se si usa sangue periferico come controllo negativo parallelo è ammissibile anche un campione prelevato prima del trattamento, solo però negli studi brevi sul sangue periferico (che vanno per esempio da 1 a 3 somministrazioni), qualora i dati ottenuti rientrino nel range previsto in letteratura.
1.5. PROCEDURA
1.5.1. Numero e sesso degli animali
Ogni gruppo trattato e ogni gruppo di controllo deve essere composto di almeno 5 animali analizzabili per sesso (11). Se al momento della sperimentazione sono disponibili dati relativi a sperimentazioni sulla stessa specie e con la medesima via di esposizione, che dimostrano che non vi sono sostanziali differenze di tossicità tra i sessi, sarà sufficiente effettuare i test su un unico sesso. Qualora l'esposizione umana alle sostanze chimiche sia specifica per un sesso, come per esempio nel caso di alcuni prodotti farmaceutici, i test devono essere eseguiti su animali di tale sesso.
1.5.2. Protocollo di trattamento
Non si può raccomandare un protocollo standard (cioè 1, 2 o più somministrazioni a intervalli di 24 ore). I campioni ottenuti dopo somministrazione protratta sono accettabili purché sia comprovato un effetto positivo o, per uno studio negativo, ne sia stata dimostrata la tossicità o sia stata usata la dose limite, continuando la somministrazione fino al prelievo dei campioni. La sostanza in esame può essere somministrata anche in dosi frazionate, per esempio a due riprese nello stesso giorno, a intervalli non superiori a qualche ora, per agevolarne la somministrazione, trattandosi di un prodotto di grande volume.
Il test può essere eseguito in due modi:
|
(a)
|
la sostanza è somministrata agli animali in un'unica dose. Sono prelevati campioni di midollo osseo almeno due volte, ad adeguati intervalli, la prima volta almeno 24 ore dopo il trattamento, l'ultima non dopo 48 ore. Se il prelievo è effettuato meno di 24 ore dopo la somministrazione se ne fornisca la ragione. I campioni di sangue periferico vanno prelevati almeno due volte, ad adeguati intervalli, la prima volta almeno 36 ore dopo la somministrazione, l'ultima non dopo 72 ore. Quando in una delle fasi si abbia una risposta positiva non è necessario procedere ad altri prelievi;
|
|
(b)
|
se si procede a due o più somministrazioni giornaliere (per esempio due o più somministrazioni ad intervalli di 24 ore), i campioni vanno prelevati un'unica volta, fra le 18 e le 24 ore dopo l'ultima somministrazione per il midollo osseo e tra le 36 e le 48 ore dopo l'ultima somministrazione per il sangue periferico (12).
|
Se del caso, possono essere effettuati ulteriori campionamenti.
1.5.3. Dosi
Se si procede a uno studio per individuare l'intervallo di dosi, non essendo disponibili dati utili in materia, questo va eseguito nello stesso laboratorio, sulla stessa specie, ceppo e sesso, con il medesimo protocollo usato nel test principale (13). In caso di tossicità si usino per la prima fase di campionamento tre dosi diverse, che vanno dalla tossicità massima ad una tossicità assente o modica. Per il campionamento successivo si usi solo la dose massima. La dose massima è definita come dose che produce segni di tossicità tali che livelli più elevati, con la stessa posologia, sarebbero presumibilmente letali. Sostanze con azione biologica specifica, non tossiche a dosi basse (come ormoni e mitogeni) possono costituire un'eccezione rispetto ai criteri di definizione della dose e vanno valutate caso per caso. La dose massima può essere definita anche come dose che produce qualche segno di tossicità nel midollo osseo (per esempio una riduzione della percentuale di eritrociti immaturi nel midollo osseo o nel sangue periferico).
1.5.4. Test con dose limite
Se la somministrazione di una quantità di sostanza pari ad almeno 2 000 mg per kg di peso corporeo in dose unica o in due dosi nello stesso giorno non produce effetti tossici rilevabili, e se non vi sono ragioni di sospettare un'azione genotossica sulla base di dati relativi a sostanze strutturalmente correlate, si può considerare che non è necessario procedere alla sperimentazione completa con tre dosi diverse. Per studi di maggiore durata la dose limite è pari a 2 000 mg/kg di peso corporeo al giorno, da somministrare per 14 giorni al massimo; per un trattamento più lungo è pari a 1 000 mg/kg di peso corporeo al giorno. Sulla base della esposizione umana prevista per la sostanza in esame, può essere necessario usare una dose più elevata nel test con dose limite.
1.5.5. Somministrazione
La sostanza in esame viene di solito somministrata con sonda gastrica o cannula di intubazione, oppure mediante iniezione intraperitoneale. Possono essere accettate altre vie se esiste una valida ragione. Il volume massimo di liquido somministrabile in una volta con sonda gastrica o con iniezione dipende dalle dimensioni dell'animale da laboratorio; non deve superare i 2 ml/100 g di peso corporeo. L'uso di volumi più elevati deve essere motivato. Salvo per sostanze irritanti o corrosive, che di norma riveleranno effetti esacerbati a concentrazioni più elevate, le variazioni di volume devono essere minimizzate, regolando la concentrazione in modo da garantire un volume costante a tutte le dosi.
1.5.6. Preparazione di midollo osseo/sangue
Le cellule del midollo osseo vengono di solito prelevate dal femore o dalla tibia immediatamente dopo che l'animale è stato sacrificato. Le cellule sono prelevate, preparate e sottoposte a un processo di colorazione con metodi di accertata validità. Il sangue periferico è prelevato dalla vena caudale o da altro vaso sanguigno adeguato. Le cellule ematiche vengono immediatamente sottoposte a un processo di colorazione in condizioni sopravitali (8) (9) (10), oppure si preparano strisci che sono poi colorati. L'uso di un colorante specifico per il DNA [per esempio arancio acridina (14) o Hoechst 33258 più pironina-Y (15)] può eliminare alcuni degli artefatti dovuti all'uso di un colorante non specifico per il DNA. Ciò non esclude l'uso di coloranti convenzionali (per esempio Giemsa). Si possono usare anche altri sistemi [per esempio colonne di cellulosa per la rimozione delle cellule nucleate (16)], se ne è provata l'efficacia per la preparazione dei micronuclei in laboratorio.
1.5.7. Analisi
La percentuale degli eritrociti immaturi rispetto al totale (immaturi + maturi) viene determinata per ciascun animale contando in tutto almeno 200 eritrociti per il midollo osseo e 1 000 per il sangue periferico (17). Tutti i vetrini, compresi i controlli positivi e negativi, devono essere codificati indipendentemente prima dell'esame al microscopio. Si esaminino almeno 2 000 eritrociti immaturi per animale per determinare la frequenza degli eritrociti immaturi micronucleati. Informazioni ulteriori si possono ottenere dal conteggio dei micronuclei negli eritrociti maturi. Nell'analisi dei vetrini, la proporzione degli eritrociti immaturi sugli eritrociti totali non deve essere inferiore al 20 % del valore dei controlli. Quando gli animali sono trattati in continuo per 4 settimane o più, si può anche determinare la frequenza degli eritrociti con micronuclei su almeno 2 000 eritrociti maturi per animale. In alternativa alle tecniche manuali, si possono accettare sistemi di analisi automatica (analisi dell'immagine e citometria a flusso continuo su cellule in sospensione), se adeguatamente motivati e di provata efficacia.
2. DATI
2.1. TRATTAMENTO DEI RISULTATI
I dati relativi a ciascun animale vanno presentati sotto forma di tabella. L'unità sperimentale è l'animale. Il numero degli eritrociti immaturi e degli di eritrociti immaturi con micronuclei, nonché la percentuale degli eritrociti immaturi, devono essere elencati separatamente per ciascun animale. Quando gli animali sono trattati in continuo per 4 settimane o più, si forniscano anche i dati relativi agli eritrociti maturi, se sono stati rilevati. Si indichi per ciascun animale la percentuale degli eritrociti immaturi sul totale e, se ritenuta utile, la percentuale degli eritrociti micronucleati. Se non c'è un'evidente differenza di risposta tra i sessi, i dati dei due sessi possono essere combinati nell'analisi statistica.
2.2. VALUTAZIONE E INTERPRETAZIONE DEI RISULTATI
Vari criteri permettono di determinare se un risultato è positivo, per esempio un aumento correlato alla dose somministrata del numero di cellule contenenti micronuclei, o un evidente aumento del numero di cellule contenenti micronuclei nei campioni prelevati alla medesima fase di campionamento e provenienti da un gruppo cui è stata somministrata la stessa dose. Si consideri per prima cosa la rilevanza dei risultati dal punto di vista biologico. Si possono usare metodi statistici come ausilio nella valutazione dei risultati sperimentali (18) (19), ma la significatività statistica non dovrebbe essere l'unico fattore determinante di una risposta positiva. Eventuali risultati ambigui possono essere chiariti mediante test ulteriori, preferibilmente in condizioni sperimentali modificate.
Una sostanza che fornisca risultati non corrispondenti ai criteri di cui sopra è considerata non mutagena in questo test.
La maggior parte degli esperimenti fornirà indubbiamente risultati chiaramente positivi o negativi ma occasionalmente i dati ottenuti non consentiranno di formulare un giudizio definitivo sull'azione della sostanza in esame. I risultati possono rimanere ambigui nonostante l'esperimento venga ripetuto più volte.
Risultati positivi del saggio significano che la sostanza induce la formazione di micronuclei, che sono il risultato di un danno cromosomico o di un danno all'apparato mitotico negli eritroblasti della specie in esame. Risultati negativi indicano che, nelle condizioni di esperimento, la sostanza in esame non produce micronuclei negli eritrociti immaturi della specie in esame.
Si vagli la possibilità che la sostanza in esame o i suoi metaboliti entrino in circolo o raggiungano specifica-mente il tessuto bersaglio (tossicità sistemica).
3. RELAZIONE
RELAZIONE SUL SAGGIO
La relazione deve comprendere le seguenti informazioni:
|
|
Solvente/mezzo disperdente:
|
—
|
motivazione della scelta del mezzo disperdente,
|
|
—
|
solubilità e stabilità della sostanza in esame nel solvente/mezzo disperdente, se noto.
|
|
|
|
Animali da laboratorio:
|
—
|
numero, età e sesso degli animali,
|
|
—
|
provenienza, condizioni di stabulazione, dieta, ecc.,
|
|
—
|
peso dei singoli animali all'inizio degli esperimenti, con range, valore medio e deviazione standard per ciascun gruppo.
|
|
|
|
Condizioni di esperimento:
|
—
|
controlli positivi e negativi (mezzo disperdente/solvente),
|
|
—
|
risultati dello studio per individuare l'intervallo di dosi, se effettuato,
|
|
—
|
criteri di selezione delle dosi,
|
|
—
|
illustrazione particolareggiata della preparazione della sostanza in esame,
|
|
—
|
illustrazione particolareggiata della somministrazione della sostanza in esame,
|
|
—
|
criteri di selezione della via di somministrazione,
|
|
—
|
metodi usati per verificare che la sostanza in esame sia entrata in circolo o abbia raggiunto il tessuto ber saglio, se del caso,
|
|
—
|
conversione della concentrazione (ppm) della sostanza in esame nel cibo o nell'acqua potabile nella dose effettiva (mg/kg di peso corporeo/giorno), se del caso,
|
|
—
|
dettagli relativi alla qualità del cibo e dell'acqua,
|
|
—
|
descrizione dettagliata dei protocolli di trattamento e campionamento,
|
|
—
|
metodi di preparazione dei vetrini,
|
|
—
|
metodi di misura della tossicità,
|
|
—
|
criteri di conteggio degli eritrociti immaturi contenenti micronuclei,
|
|
—
|
numero di cellule analizzate per animale,
|
|
—
|
criteri in base a cui i risultati sono giudicati positivi, negativi o ambigui.
|
|
|
|
Risultati:
|
—
|
proporzione degli eritrociti immaturi sugli eritrociti totali,
|
|
—
|
numero di eritrociti immaturi contenenti micronuclei per animale,
|
|
—
|
media ± deviazione standard degli eritrociti immaturi contenenti micronuclei per gruppo,
|
|
—
|
relazione dose-risposta, se possibile,
|
|
—
|
analisi statistiche e metodi applicati,
|
|
—
|
controlli negativi paralleli e in letteratura,
|
|
—
|
controlli positivi paralleli.
|
|
|
|
— Discussione dei risultati.
|
4. BIBLIOGRAFIA
|
(1)
|
Heddle, J. A. (1973), A Rapid In Vivo Test for Chromosomal Damage, Mutation Res., 18, pp. 187-190.
|
|
(2)
|
Schmid, W. (1975), The Micronucleus Test, Mutation Res., 31, pp. 9-15.
|
|
(3)
|
Heddle, J. A., Salamone, M. F., Hite, M., Kirkhart, B., Mavournin, K., MacGregor, J. G. and Newell, G. W. (1983), The Induction of Micronuclei as a Measure of Genotoxicity, Mutation Res. 123, pp. 61-118.
|
|
(4)
|
Mavournin, K. H., Blakey, D. H., Cimino, M. C, Salamone, M. F. and Heddle, J. A. (1990), The In Vivo Micronucleus Assay in Mammalian Bone Marrow and Peripheral Blood. A report of the U.S. Environmental Protection Agency Gene-Tox Program, Mutation Res., 239, pp. 29-80.
|
|
(5)
|
MacGregor, J. T., Schlegel, R., Choy, W. N., and Wehr, C. M. (1983), Micronuclei in Circulating Erythrocytes: A Rapid Screen for Chromosomal Damage During Routine Toxicity Testing in Mice, in: Developments in Science and Practice of Toxicology, ed. A. W. Hayes, R. C. Schnell and T. S. Miya, Elsevier, Amster dam, pp., 555-558.
|
|
(6)
|
MacGregor, J. T., Heddle, J. A., Hite, M., Margolin, G. H., Ramel, C, Salamone, M. F., Tice, R. R. and Wild, D. (1987), Guidelines for the Conduct of Micronucleus Assays in Mammalian Bone Marrow Erythrocytes, Mutation Res., 189, pp. 103-112.
|
|
(7)
|
MacGregor, J. T., Wehr, C. M., Henika, P. R., and Shelby, M. E. (1990), The in vivo Erythrocyte Micronu cleus Test: Measurement at Steady State Increases Assay Efficiency and Permits Integration with Toxicity Studies, Fund. Appl. Toxicol. 14, pp. 513-522.
|
|
(8)
|
Hayashi, M., Morita, T., Kodama, Y., Sofuni, T. and Ishidate, M. Jr. (1990), The Micronucleus Assay with Mouse Peripheral Blood Reticulocytes Using Acridine Orange-Coated Slides, Mutation Res., 245. pp. 245-249.
|
|
(9)
|
The Collaborative Study Group for thè Micronucleus Test (1992). Micronucleus Test with Mouse Peri pheral Blood Erythrocytes by Acridine Orange Supravital Staining: The Summary Report of the 5th Col laborative Study by CSGMT/JEMMS, MMS, Mutation Res., 278, pp. 83-98.
|
|
(10)
|
The Collaborative Study Group for the Micronucleus Test (CSGMT/JEMMS, MMS: The Mammalian Mutagenesis Study Group of the Environmental Mutagen Society of Japan) (1995). Protocol recommended for the short-terni mouse peripheral blood micronucleus test, Mutagenesis, 10, pp. 153-159.
|
|
(11)
|
Hayashi, M., Tice, R. R., MacGregor, J. T., Anderson, D., Blackey, D. H., Kirsch-Volders, M., Oleson, Jr. F. B., Pacchicrotti, F., Romagna, F., Shimada, H., Sutou, S. and Vannier, B. (1994), In Vivo, Rodent Ery- throcyte Micronucleus Assay, Mutation Res., 312, pp. 293-304.
|
|
(12)
|
Higashikuni, N. and Sutou, S, (1995), An optimal, generalised sampling time of 30 ± 6 h after double dosing in the mouse peripheral blood micronucleus test, Mutagenesis, 10, pp. 313-319.
|
|
(13)
|
Fielder, R.)., Allen, J. A., Boobis, A. R., Botham, P. A., Doe,]., Esdaile, D. J., Gatehouse, D. G., Hodson- Walker, G., Morton, D. B., Kirkland, D. J. and Rochold, M. (1992), Report of British Toxicology Society/UK Environmental Mutagen Society Working Group: Dose Setting in In Vivo Mutagenicity Assays, Mutagenesis, 7, pp. 313-319.
|
|
(14)
|
Hayashi, M., Sofuni, T. and Ishidate, M. Jr. (1983), An Application of Acridine Orange Fluorescent Staining to the Micronucleus Test, Mutation Res., 120, pp. 241-247.
|
|
(15)
|
MacGregor, J. T., Wehr, C. M. and Langlois, R. G. (1983), A Simple Fluorescent Staining Procedure for Micronuclei and RNA in Erythrocytes Using Hoechst 33258 and Pyronin Y, Mutation Res., 120, pp, 269-275.
|
|
(16)
|
Romagna, F. and Staniforth, C. D. (1989), The automated bone marrow micronucleus test, Mutation Res., 213, pp. 91-104.
|
|
(17)
|
Gollapudi, B. and McFadden, L. G. (1995), Sample size for the estimation of polychromatic to normochromatic erythrocyte ratio in the bone marrow micronucleus test, Mutation Res., 347, pp. 97-99.
|
|
(18)
|
Richold, M., Ashby, J., Bootman, J., Chandley, A., Gatehouse, D. G. and Henderson, L. (1990), In Vivo Cytogenetics Assay, in: D. J. Kirkland (ed.), Basic Mutagenicity tests. UKEMS Recommended Procedures,
UK.EMS Sub-Committee on Guidelines for Mutagenicity Testing. Report, Part I, revised, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 115-141.
|
|
(19)
|
Lovell, D. P., Anderson, D., Albanese, R., Amphlett, G. E., Clare, G., Ferguson, R., Richold, M., Pap- worth, D. G. and Savage, J. R. K. (1989), Statistical Analysis of In Vivo Cytogenetic Assays, in: D. J. Kir- kland (ed.), .Statistical Evaluation of Mutagenicity Test Data. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report, Part III, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 184-232.»
|
«B.13/14. MUTAGENICITÀ — TEST DI REVERSIONE SU BATTERI
1. METODO
Il metodo è ripreso dal metodo OECD TG 471 Bacterial Reverse Mutation Test (1997).
1.1. INTRODUZIONE
I1 saggio di retromutazione su batteri utilizza ceppi di Salmonella typhimurium e Escherichia coli auxotrofi nei confronti di un amminoacido per identificare mutazioni puntiformi che implicano sostituzione, addizione o delezione di una o più paia di basi del DNA (1) (2) (3). Il principio su cui è basato questo saggio è la sua capacità di rivelare, nei ceppi sperimentali, retromutazioni che ripristinano la capacità funzionale dei batteri di sintetizzare un amminoacido essenziale. I batteri retromutanti sono individuati in base alia capacità di crescere in assenza dell'amminoacido di cui ha invece bisogno il ceppo sperimentale progenitore.
Le mutazioni puntiformi sono causa di molte malattie genetiche umane e vi sono prove concrete che mutazioni puntiformi in oncogeni e geni soppresori dei tumori di cellule somatiche sono implicate nella comparsa delle neoplasie umane come in quelle sperimentalmente indotte negli animali da laboratorio. Il saggio di retro-mutazione batterica è rapido, poco costoso e relativamente facile da eseguire. Molti ceppi sperimentali presentano caratteristiche che le rendono più sensibili per l'identificazione di mutazioni, in particolare sequenze di DNA sensibili nei siti di reversione, maggior permeabilità cellulare per le grandi molecole e assenza dei sistemi di riparazione del DNA, o rafforzamento dei sistemi soggetti a errore. La specificità dei ceppi sperimentali può fornire informazioni utili sul tipo di mutazioni indotte da agenti genotossici. Per i testi di retromutazione batterica esiste una vastissima base dati, che contiene i risultati per una grande varietà di strutture e sono stati sviluppati metodi ormai classici per l'analisi chimica di prodotti con proprietà chimico-fisiche diverse, compresi i composti volatili.
Vedi anche introduzione generale parte B.
1.2. DEFINIZIONI
Un test di reversione in Salmonella typhimurium o Escherichia coli rivela in un ceppo auxotrofo, che necessita l'apporto di un amminoacido (rispettivamente istidina o triptofano), una mutazione che lo trasforma in un ceppo che non necessita l'apporto dell'amminoacido.
Mutageni che provocano la sostituzione di coppie di basi sono agenti che provocano un cambiamento di basi nel DNA. In un test di reversione questo cambiamento può verificarsi nel sito della mutazione originale o in un altro sito del genoma batterico.
Mutageni che provocano la mutazione della fase di lettura sono agenti che provocano l'inserzione o la delezione di una o più basi nel DNA, modificando cosi la fase di lettura nell'RNA.
1.3. CONSIDERAZIONI INIZIALI
Nel saggio di reversione batterica si usano cellule procariote, che differiscono dalle cellule dei mammiferi in fattori come l'assorbimento, il metabolismo, la struttura cromosomica e i meccanismi di riparazione del DNA. I test in vitro richiedono in genere una fonte esogena di attivazione metabolica, i sistemi di attivazione metabolica in vitro non sono in grado di simulare perfettamente le condizioni in vivo nei mammiferi. Il test, pertanto, non fornisce informazioni dirette sul potenziale mutageno e cancerogeno di una sostanza nei mammiferi.
Il saggio di reversione batterica è comunemente impiegato come prima tappa per individuare l'azione genotossica e, in particolare, la capacità di indurre mutazioni puntiformi. Numerosi dati dimostrano che molte sostanze chimiche che risultano positive a questo saggio presentano attività mutagena anche in altri test. Vi sono esempi di agenti mutageni che non sono rivelati da questo test; le ragioni di questi insuccessi possono essere ricondotte alla natura specifica della mutazione, a differenze di attivazione metabolica o a differenze di biodisponibilità. D'altra parte, i fattori che aumentano la sensibilità del test possono indurre a sopravvalutare l'azione mutagena.
Il test di retromutazione batterica può non essere adatto per la valutazione di alcune classi di sostanze chimiche, per esempio i composti fortemente battericidi (come alcuni antibiotici) e quelli di cui si suppone (o si sa) che interferiscano specificamente con il sistema di moltiplicazione cellulare nei mammiferi (per esempio, alcuni inibitori delle topoisomerasi e alcuni analoghi di nucleosidi). In tali casi possono essere più adeguati test su mammiferi.
Molti composti che risultano positivi al test sono cancerogeni nei mammiferi, tuttavia la correlazione non è assoluta: dipende dalla classe chimica. Inoltre vi sono cancerogeni che non sono rivelati da questo saggio, perché agiscono con meccanismi diversi, non genotossici, o con meccanismi assenti nelle cellule batteriche.
1.4. PRINCIPIO DEL METODO DI SAGGIO
Le cellule batteriche in sospensione sono esposte alla sostanza in esame in presenza e in assenza di un sistema esogeno di attivazione metabolica. Nel metodo di incorporazione su piastra, tali sospensioni sono miscelate con un agar di copertura e piastrate immediatamente su terreno minimo. Nel metodo di preincubazione, il composto di trattamento è posto in incubazione, mescolato ad un agar di copertura, poi piastrato su terreno minimo. In entrambe le tecniche, dopo due o tre giorni di incubazione si contano le colonie revertanti e se ne confronta il numero con quello delle colonie revertanti spontanee su piastre di controllo esposte al solo solvente.
Per i test di reversione batterica sono state descritte varie procedure. Quelle più comunemente usate sono: il metodo di incorporazione su piastra (1) (2) (3) (4), il metodo di preincubazione (2) (3) (5) (6) (7) (8), il metodo di fluttuazione (9) (10) e il metodo di sospensione (11). Sono state descritte modifiche per i test su gas o vapori (12).
Le procedure descritte riguardano principalmente i metodi di incorporazione su piastra e di preincubazione. Sono entrambi ammissibili per l'esecuzione di esperimenti con e senza attivazione metabolica. Per alcune sostanze è più efficace il metodo di preincubazione. Si tratta di sostanze appartenenti alle classi chimiche che includono le nitrosammine alifatiche a catena corta, i metalli bivalenti, a aldeidi, i coloranti azoici e i composti diazoici, gli alcaloidi pirollizidinici, i composti allilici e i nitrocomposti (3). È noto anche che alcune classi di mutageni non sono sempre identificabili con procedure standard come il metodo di incorporazione su piastra o il metodo di preincubazione. Devono essere considerate “casi speciali” e si raccomanda vivamente di usare altri metodi di rilevazione. Sono stati identificati i seguenti “casi speciali” (con esempi di possibili metodi di rilevazione): coloranti azoici e composti diazoici (3) (5) (6) (13), gas e sostanze chimiche volatili (12) (14) (15) (16) e glicosidi (17) (18). Le deviazioni dalla procedura standard devono essere scientificamente motivate.
1.5. DESCRIZIONE DEL METODO
1.5.1. Preparazioni
1.5.1.1. Butteri
Si lascino sviluppare le colture fresche di batteri fino alla fase esponenziale tardiva o alla fase stazionaria precoce (approssimativamente 109 cellule per ml). Non si usino colture in fase stazionaria tardiva. E essenziale che le colture usate nell'esperimento contengano un titolo elevato di batteri vitali. Il titolo può essere provato sulla base di dati di controllo precedenti sulle curve di crescita, oppure, nei singoli saggi, determinando il numero di cellule vitali mediante un test di piastramento.
La temperatura di incubazione raccomandata è di 37 oC.
Si usino almeno cinque ceppi di batteri, tra cui quattro ceppi di S. typhimurium (TA 1535; TA 1537 o TA97a o TA97; TA98; e TA100) la cui affidabilità è provata e che forniscono risposte riproducibili. I ceppi di S. typhimurium contengono paia di basi GC sul sito di reversione primario ed è noto che non permettono di identificare alcuni mutageni ossidanti, agenti che provocano cross-linking e idrazine. Tali sostanze possono essere individuate con ceppi di E. coli YVP2 o da S. typhimurium TA102 (19) che hanno una coppia di basi AT sul sito di reversione primaria. La combinazione di ceppi raccomandata è pertanto:
|
—
|
S. typhimurium TA1535, e
|
|
—
|
S. typhimurium TA1537 o TA97 o TA97a, e
|
|
—
|
S. typhimurium TA100, e
|
|
—
|
E. coli WP2 uvrA. o E. coli WP2 uvtA (pKM101), o S. typhimurium Ta102.
|
Al fine di rilevare mutageni che provocano cross-linking, può essere preferibile includere TA102 o aggiungere un ceppo di E. coli con sistema di riparazione del DNA privo di errore [per esempio, E. coli WP2 o E. Coli WP2 (pKM101)]
Si usino metodi di provata validità per la preparazione delle colture primarie, la verifica dei marcatori e la conservazione. La necessità dell'amminioacido in supplemento nutritivo per la crescita deve essere dimostrata per ciascuna delle colture congelate (istidina per ceppi di S. typhimurium, e triptofano per ceppi di E. coli). Si controllino anche altre caratteristiche fenotipiche, e cioè: la presenza o l'assenza di plasmidi R [resistenza all'ampicillina nei ceppi TA98, TA100 e TA97a o TA97, WP2 uvtA e WP2 uvrA (pKM101), e resistenza a ampicillina + tetraciclina nel ceppo TA102], se del caso; la presenza di mutazioni caratteristiche (cioè la mutazione rfa in S. typhimurium attraverso la sensibilità al cristalvioletto e la mutazione uvtA in E. coli o la mutazione uvtB in S. typhimurium, attraverso la sensibilità all'ultravioletto) (2) (3). I ceppi devono produrre un certo numero di colonie retromutanti spontanee per piastra, situato entro il range di frequenze rapportato ai valori precedenti ottenuti nel laboratorio e, possibilmente, ai valori del range riportati in letteratura.
1.5.1.2. Terreno di coltura
Si usi una minima quantità di agar adeguato (per esempio contenente una minima quantità di terreno E di Vogel-Bonner e glucosio) e un agar di copertura contenente istidina e biotina o triptofano, tale da permettere un certo numero di divisioni cellulari (1) (2) (9).
1.5.1.3. Attivazione metabolica
i batteri dovrebbero essere esposti alla sostanza in esame sia in presenza che in assenza di un adeguato sistema di attivazione metabolica. Il sistema più comunemente usato è una frazione post-mitocondriale integrata di cofattore (S9), prelevata dal fegato di roditori trattati con induttori enzimatici come Aroclor 1254 (1) (2), o una combinazione di fenobarbitone e β-naftoflavone (18) (20) (21). La frazione post-mitocondriale viene usata di solito a concentrazioni comprese fra 5 e 30 % v/v nel composto S9. La scelta e le condizione di un sistema di attivazione metabolica dipendono dalla classe chimica della sostanza in esame. In alcuni casi può essere opportuno utilizzare più di una concentrazione della frazione post-mitocondriale. Per coloranti azoici e composti diazoici, può essere più adeguato un sistema di attivazione metabolica riduttivo (6) (13).
1.5.1.4. Sostanza in esame/Preparazione
Le sostanze solide devono essere poste in soluzione o in sospensione in adeguati solventi o mezzi disperdenti e, se necessario, diluite prima del trattamento dei batteri. Le sostanze liquide possono essere aggiunte diretta-mente alla coltura o diluite prima del trattamento. Si usino preparati recenti della sostanza, salvo qualora siano disponibili dati sulla sua stabilità, che dimostrino che la conservazione è accettabile.
Il solvente/mezzo disperdente non deve reagire chimicamente con la sostanza in esame e deve essere compatibile con la sopravvivenza dei batteri e con l'attività di S9 (22). L'uso di solventi/mezzi disperdenti poco noti è ammesso solo se suffragato da dati che ne provino la compatibilità. Si raccomanda di prendere in primo luogo in considerazione, se possibile, l'uso di un solvente/mezzo disperdente acquoso. Se si procede all'esame di sostanze instabili in acqua, si usino solventi organici anidri.
1.5.2. Condizioni di esperimento
1.5.2.1. Ceppi sottoposti a test (vedi 1.5.1.1)
1.5.2.2. Concentrazione di esposizione
l criteri da considerare per determinare la quantità massima di sostanza da usare sono la citotossicità e la solubilità nel composto di trattamento finale.
Può essere utile determinare la tossicità e l'insolubilità in un esperimento preliminare. La citotossicità può essere rivelata da una riduzione del numero di colonie revertanti, dalla comparsa di una crescita anormale del fondo, o dal grado di sopravvivenza delle colture trattate. La citotossicità di una sostanza può risultare alterata in presenza di sistemi di attivazione metabolica. L'insolubilità è dimostrata dalla presenza di un precipitato nel composto finale, visibile ad occhio nudo nelle condizioni di esperimento effettive.
La concentrazione massima raccomandata per sostanze non citotossiche solubili è di 5 mg/piastra o 5 μl/piastra. Per sostanze non citotossiche insolubili a 5 mg/piastra o 5 pi/piastra, una o più concentrazioni devono essere insolubili nelle ultime miscele di trattamento. Le sostanze citotossiche a concentrazione inferiori a 5 mg/piastra o 5 μl/piastra devono essere saggiate fino ad una concentrazione citotossica. Il precipitato non deve interferire con la valutazione dei risultati.
Si usino almeno cinque diverse concentrazioni analizzabili della sostanza in esame, ad intervalli approssimativamente semilogaritmici (cioè 10) per i primi esperimenti. Per l'analisi della relazione concentrazione-rispo-sta, può essere necessario ridurre gli intervalli. Nella valutazione di sostanze che contengono quantità sostanziali di impurezza potenzialmente mutagene si possono prendere in considerazione concentrazioni superiori a 5 mg/piastra o 5 (il/piastra.
1.5.2.3. Controlli negativi e positivi
Ogni test dovrà comportare controlli positivi e negativi (solvente o mezzo disperdente) paralleli, con e senza attivazione metabolica. Per i controlli positivi, si scelgano concentrazioni che dimostrino la validità di ogni test.
Quando si usa un sistema di attivazione metabolica, le sostanze per i controlli positivi di riferimento devono essere scelte in funzione del tipo di ceppo batterico.
Le seguenti sostanze sono esempi di controlli positivi adatti per saggi con attivazione metabolica:
|
Denominazione
|
Numero CAS
|
Numero Einecs
|
|
9,10-dimetilanthracene
|
781-43-1
|
212-308-4
|
|
7,1 2-dimetilbenz[a]antracene
|
57-97-6
|
200-359-5
|
|
3enzo[a]pirene
|
50-32-8
|
200-028-5
|
|
2-amminoantracene
|
613-13-8
|
210-330-9
|
|
ciclofosfammide
|
50-18-0
|
|
|
ciclofosfammide monoidrato
|
6055-19-2
|
200-015-4
|
Le seguente sostanza è un controllo positivo adatto per il metodo di attivazione metabolica riduttiva:
|
Denominazione
|
Numero CAS
|
Numero Einecs
|
|
Congo Red
|
573-58-0
|
209-358-4
|
Il 2-amminoantracene non dovrebbe essere usato come unico indicatore dell'efficacia del composto S9. Se si usa il 2-amminoantracene, si caratterizzi ogni lotto di S9 anche con un mutageno che richiede attivazione metabolica da parte di enzimi microsomiali, per esempio benzo[a]pirene. dimetilbenzantracene.
Le seguenti sostanze sono esempi di controlli positivi a specificità di ceppo per esperimenti eseguiti senza sistema di attivazione metabolica esogeno:
|
Denominazione
|
Numero CAS
|
Numero Einecs
|
Ceppo
|
|
sodio azide
|
26628-22-8
|
247-852-1
|
TA 1535 e TA 100
|
|
2-nitrofluorene
|
607-57-8
|
210-138-5
|
TA 98
|
|
9-amminoacridina
|
90-45-9
|
201-995-6
|
TA 1537, TA 97 e TA 97a
|
|
1CR 191
|
17070-45-0
|
241-129-4
|
TA 1537, TA 97 e TA 97a
|
|
idroperossido di cumene
|
80-15-9
|
201-254-7
|
TA 102
|
|
mitomicina C
|
50-07-7
|
200-008-6
|
WP2uvrA e TA 102
|
|
N-ethil-N-nitro-N-nitrosoguanidina
|
70-25-7
|
200-730-1
|
WP2, WP2uvrA e-WP2uvrA(pKM101)
|
|
4-nitrochinolina-l-ossido
|
56-57-5
|
200-281-1
|
WP2. WP2uvrA e-WP2uvrA(pKM101)
|
|
furilfurammide (AF2)
|
3688-53-7
|
|
ceppi contenenti plasmidi
|
Si possono usare altre adeguate sostanze di riferimento per i controlli positivi. Si usino, se disponibili, sostanze di una classe chimica correlata.
Si effettuino anche controlli negativi, usando solo il solvente o il mezzo disperdente sul terreno di coltura: i controlli vanno trattati come le colture che contengono la sostanza oggetto del test. Si proceda inoltre a controlli non trattati, salvo che esistano precedenti dati di controllo che dimostrano che il solvente scelto non induce effetti nocivi o mutageni.
1.5.3. Procedura
Per il metodo di incorporazione su piastra (1) (2) (3) (4), senza attivazione metabolica, di norma si mescolano 0,05 ml o 0,1 ml della soluzione, 0,1 ml di coltura batterica fresca (contenente approssimativamente 108 cellule vitali) e 0,5 ml di tampone sterile con 2,0 ml di agar di copertura. Per i test con attivazione metabolica, si mescolano di norma 0,5 ml del composto di attivazione metabolica contenente una quantità adeguata di frazione post-mitocondriale (dal 5 al 30 % v/v) von l'agar di copertura (2,0 ml), i batteri e la sostanza in esame o la soluzione. Il contenuto di ciascuna provetta viene mescolato e piastrato su terreno minimo (agar). Prima dell'incubazione si lascia solidificare l'agar di copertura.
Per il metodo di preincubazione (2) (3) (5) (6), la sostanza in esame/soluzione è preincubata con il ceppo batterico (contenente approssimativamente 108 cellule vitali) e con un tampone sterile o con il sistema di attivazione metabolica (0,5 ml), di norma per 20 minuti o più, a 30-37 oC: è quindi mescolata all'agar di copertura e piastrata su terreno minimo (agar). Di norma si mescolano 0,05 o 0,1 ml di sostanza in esame/soluzione, 0,1 ml di batteri e 0,5 ml di composto S9 o di tampone sterile con 2,0 ml di agar di copertura. Durante la preincubazione le provette vanno aerate con un agitatore.
Per una valida stima della variazione, si usino piastre in triplo a ciascuna dose. L'uso di piastre in doppio è accettabile se scientificamente motivato. La perdita occasionale di una piastra non invalida necessariamente il test.
I test con sostanze gassose o volatili devono essere condotti con metodi adeguati, per esempio in recipienti ermetici (12) (14) (15) (16).
1.5.4. Incubazione
Tutte le piastre di un esperimento devono essere poste in incubazione a 37 oC per 48-72 ore; si rilevi quindi il numero di colonie revertanti per piastra.
2. RISULTATI
2.1. TRATTAMENTO DEI RISULTATI
I dati devono essere presentati come numero di colonie revertanti per piastra. Si fornisca anche il numero di colonie revertanti sulle piastre dei controlli negativi (controllo trattato con solo solvente e controllo non trattato, se effettuato) e positivi. Per la sostanza in esame e per i controlli, positivi e negativi (non trattati o con solo solvente), si indichino le cifre per le singole piastre, il numero medio di colonie revertanti per piastra e la deviazione standard.
In caso di risposta inequivocabilmente positiva non sono necessarie verifiche. I risultati ambigui devono essere chiariti mediante prove ulteriori, preferibilmente in condizioni di esperimento modificate. I riusultati negativi devono essere confermati caso per caso. Se non si ritiene necessaria la conferma dei risultati negativi, se ne indichino le ragioni. Nei test successivi si dovrebbero modificare i parametri di studio per estendere la gamma delle condizioni in esame. Fra i parametri modificabili si citano l'intervallo tra le concentrazioni, il metodo di trattamento (incorporazione su piastra o preincubazione in ambiente liquido) e le condizioni di attivazione metabolica.
2.2. VALUTAZIONE E INTERPRETAZIONE DEI RISULTATI
Vari criteri permettono di determinare se un risultato è positivo, per esempio un aumento, correlato con la concentrazione, per tutte le concentrazioni sottoposte a esame e/o un aumento riproducibile, ad una o più concentrazioni, del numero di colonie revertanti per piastra per almeno un ceppo, con o senza sistema di attivazione metabolica (23). Si consideri in primo luogo la rilevanza dei risultati dal punto di vista biologico. Si possono usare metodi statistici come ausilio nella valutazione dei risultati sperimentali (24), ma la significatività statistica non dovrebbe essere l'unico fattore determinante di una risposta positiva.
Una sostanza che fornisca risultati non corrispondenti ai criteri di cui sopra è considerata non mutagena in questo test.
La maggior parte degli esperimenti fornirà indubbiamente risultati palesemente positivi o negativi, ma in alcuni casi i dati ottenuti non consentiranno di formulare un giudizio definitivo sull'azione della sostanza in esame. I risultati possono rimanere ambigui, nonostante l'esperimento venga ripetuto più volte.
Risultati positivi del saggio di retromutazione batterica dimostrano che la sostanza induce mutazioni puntiformi per sostituzioni di basi o mutazione della fase di lettura nel genoma di Salmonella typhimurium o Escherichia coli. Risultati negativi indicano che, nelle condizioni di test, la sostanza in esame non induce mutazioni nella specie sottoposta al test.
3. RELAZIONE
RELAZIONE SUL SAGGIO
La relazione dovrà contenere le seguenti informazioni:
|
|
Solvente/mezzo disperdente:
|
—
|
motivazione della scelta del solvente/mezzo disperdente;
|
|
—
|
solubilità e stabilità della sostanza in esame nel solvente/mezzo disperdente, se nota.
|
|
|
|
Ceppi:
|
—
|
numero per cellule per coltura:
|
|
—
|
caratteristiche dei ceppi.
|
|
|
|
Condizioni di esperimento:
|
—
|
quantità della sostanza in esame per piastra (mg/piastra o (μl/piastra/e criteri di selezione della concentrazione e del numero di piastre per concentrazione;
|
|
—
|
tipo e composizione del sistema di attivazione metabolica, criteri di accettabilità;
|
|
—
|
procedura di trattamento.
|
|
|
|
Risultati:
|
—
|
segni di precipitazione,
|
|
—
|
conteggi per le singole piastre,
|
|
—
|
numero medio di colonie revertanti per piastra e deviazione standard,
|
|
—
|
relazione dose-risposta, se possibile,
|
|
—
|
eventuali analisi statistiche,
|
|
—
|
dati sui controlli paralleli negativi (solvente/mezzo disperdente) e positivi, con intervalli, medie e devia zioni standard,
|
|
—
|
dati sui controlli negativi (solvente/mezzo disperdente) e positivi precedenti, con intervalli, medie e devia zioni standard.
|
|
|
|
Discussione dei risultati
|
4. BIBLIOGRAFIA
|
(1)
|
Ames, B. N., McCann, J. and Yamasaki E. (1975), Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian-Microsome Mutagenicity Test, Mutation Res., 31, pp. 347-364.
|
|
(2)
|
Maron, D. M. and Ames, B. N. (1983), Revised Methods for the Salmonella Mutagenicity Test, Mutation
Res., 113, pp. 173-215.
|
|
(3)
|
Gatehouse, D., Haworth, S., Cebula, T., Gocke, E., Kier, L., Matsushima, T., Melcion, C., Nohmi, T., Venitt, S. and Zeiger, E. (1994), Recommendations for the Performance of Bacterial Mutation Assays, Mutatimi Res., 312, pp. 217-233.
|
|
(4)
|
Kier, L. D., Brusick, D. J., Auletta, A. E., Von Halle, E. S., Brown, M. M., Simmon, V. F., Dunkel, V., McCann, J., Mortelmans, K., Privai, M.. Rao, T. K. and Ray V. (1986), The Salmonella typhimurium/Mam- malian Microsomal Assay: A Report of the U.S. Environmental Protection Agency Gene-Tox Program, Mutation Res., 168, pp. 69-240.
|
|
(5)
|
Yahagi, T., Degawa, M., Seino, Y.Y., Matsushima, T., Nagao, M., Sugimura, T. and Hashimoto, Y. (1975), Mutagenicity of Carcinogen Azo Dyes and their Derivatives, Cancer Letters, 1, pp. 91-96.
|
|
(6)
|
Matsushima, M., Sugimura, T., Nagao, M., Yahagi, T., Shirai, A. and Sawamura, M. (1980), Factors Modulating Mutagenicity Microbial Tests, in: Short-term Test Systems for Detecting Carcinogens, ed. Norpoth K. H. and Garner, R. C, Springer, Berlin-Heidelberg-New York, pp. 273-285.
|
|
(7)
|
Gatehouse, D. G., Rowland, 1. R., Wilcox, P., Callender, R. D. and Foster R. (1980), Bacterial Mutation Assays, in: Basic Mutagenicity Tests: UKEMS Part 1 Revised , ed. D.]. Kirkland, Cambridge University Press, pp. 13-61.
|
|
(8)
|
Aeschacher, H. U., Wolleb, U. and Porchet, L. (1987), Liquid Preincubation Mutagenicity Test for Foods, J. Food Safety, 8, pp. 167-177.
|
|
(9)
|
Green, M. H. L., Muriel, W. J. and Bridges, B. A. (1976), Use of a simplified fluctuation test to detect low levels of mutagens, Mutations Res., 38, pp. 33-42.
|
|
(10)
|
Hubbard, S. A., Green, M. H. L., Gatehouse, D. and]. W. Bridges (1984), The Fluctuation Test in Bacte- ria, in: Handbook of Mutagenicity Test Procedures , 2nd Edition, ed. Kilbey, B. }., Legator, M., Nichols, W. and Ramel, C, Elsevier, Amsterdam-New York-Oxford, pp. 141-161.
|
|
(11)
|
Thompson, E. D. and Melampy, P. J. (1981), An Examination of the Quantitative Suspension Assay for Mutagenesis with Strains of Salmonella typhimurium, Environmental Mutagenesis. 3, pp. 453-465.
|
|
(12)
|
Araki, A., Noguchi, T., Kato, F. and T. Matsushima (1994), lmproved Method for Mutagenicity Testing of Gaseous Compounds by Using a Gas Sampling Bag, Mutation Res., 307, pp. 335-344.
|
|
(13)
|
Privai, M. J., Bell, S. J., Mitchell, V. D., Reipert, M. D. and Vaughan, V. L. (1984), Mutagenicity of Benzidine and Benzidine-Congener Dyes and Selected Monoazo Dyes in a Modified Salmonella Assay, Mutation Res., 136, pp. 3347.
|
|
(14)
|
Zeiger, E., Anderson B. E., Haworth, S., Lawlor, T. and Mortelmans, K. (1992), Salmonella Mutagenicity Tests. V. Results from the Testing of 311 Chemicals, Environ. Mol. Mutagen., 19, pp. 2-141.
|
|
(15)
|
Simmon, V., Kauhanen K. and Tardiff, R. G. (1977), Mutagenic Activity of Chemicals Identified in Drinking Water, in Progress in Genetic Toxicology, D. Scott, B. Bridges and F. Sobels (eds.) Elsevier, Amsterdam, pp. 249-258.
|
|
(16)
|
Hughes, T. J., Simmons, D. M., Monteith, I. G. and Claxton, L. D. (1987), Vaporisation Technique to Measure Mutagenic Activity of Volatile Organic Chemicals in the Ames/Salmonella Assay, Environmental
Mutagenesis, 9, pp. 421-441.
|
|
(17)
|
Matsushima, T., Matsumoto, A., Shirai, M., Sawamura, M. and Sugimura T. (1979), Mutagenicity of the Naturally Occurring Carcinogen Cycasin and Synthetic Methylazoxy Methane Conjugates in Salomonella
typhimurium, Cancer Res., 39, pp. 3780-3782.
|
|
(18)
|
Tamura, G., Gold, C, Ferro-Luzzi, A. and Ames, B. N. (1980), Fecalase: A Model for Activation of Die- tary Glycosides to Mutagens by Intestinal Flora, Proc. Natl. Acad. Sci. USA, 77, pp. 4961-4965.
|
|
(19)
|
Wilcox, P., Naidoo, A., Wedd, D. J. and Gatehouse, D. G. (1990), Comparison of Salmonella typhimurium TA 102 with Escherichia coli WP2 Tester strains, Mutagenesis, 5, pp. 285-291.
|
|
(20)
|
Matsushima, T., Sawamura, M., Hara, K. and Sugimura T. (1976), A Safe Substitute for Polychlorinated Biphenyls as an Inducer or Metabolic Activation Systems, in: In Vitro Metabolic Activation in Mutagenesis
Testing, eds. F. J. de Serres et al. Elsevier, North Holland, pp. 85-88.
|
|
(21)
|
Elliot, B. M., Combes, R. D., Elcombe, C. R., Tatehouse, D. G., Gibson, G. G., Mackay,]. M. and Wolf, R. C. (1992), Alternatives to Aroclor 1254-induced S9 in in vitro Genotoxicity Assays, Mutagenesis, 7, pp. 175-177.
|
|
(22)
|
Maron, D., Katzenellenbogen, J. and Ames, B. N. (1981), Compatibility of Organic Solvents with the Salmonella/Microsome Test, Mutation Res., 88, pp. 343-350.
|
|
(23)
|
Claxton, L. D., Allen)., Auletta, A., Mortelmans, K., Nestmann, E. and Zeiger, E. (1987), Guide for the Salmonella typhimurium/Mammalian Microsome Tests for Bacterial Mutagenicity, Mutation Res., 189, pp. 83 — 91.
|
|
(24)
|
Mahon, G. A. T., Green, M. H. L., Middleton, B., Mitchell, I., Robinson, W. D. and Tweats, D. J. (1989), Analysis of Data from Microbial Colony Assays, in: UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Part (II. Statistica! livaluation of Mutagenicity Test Data, ed. Kirkland, D. J., Cambridge University Press, pp. 28-65.»
|
B.15 SAGGIO DI MUTAGENESI E PRESCREENING DI CANCEROGENESI MUTAZIONE GENICA: SACCHAROMYCES CEREVISIAE
1. METODO
1.1. INTRODUZIONE
Vedi introduzione generale, parte B.
1.2. DEFINIZIONI
Vedi introduzione generale, parte B.
1.3. SOSTANZE DI RIFERIMENTO
Nessuna.
1.4. PRINCIPI DEL METODO DI SAGGIO
Per misurare l'induzione di mutazioni geniche indotte da agenti chimici, con e senza attivazione metabolica, può essere fatto uso di una varietà di ceppi aploidi e diploidi del lievito Saccharomyces cerevisiae.
Sono stati utilizzati sistemi di mutazione in avanti in ceppi aploidi, come la misura della mutazione da mutanti rossi, richiedenti adenina (ade-I, ade-2), a doppi mutanti bianchi richiedenti adenina; e sistemi selettivi come l'induzione della resistenza alla canavanina.
Il sistema di retromutazione più largamente convalidato comporta l'uso del ceppo aploide XV 185-14C che porta le mutazioni di tipo «senza senso» (ochre) ade 2-1, arg 4-17, lys 1-1 e trp 5-48, le quali possono essere revertite da mutageni che inducono sostituzioni di base nel sito specifico o mutazioni che sopprimono «ochre». Il ceppo XV 185-14C porta altresi il marcatore his 1-7, mutazione di tipo «senso sbagliato» revertita principalmente da mutazioni nel secondo sito, e il marcatore hom 3-10 che viene revertito da mutageni che inducono mutazioni del tipo «inserzione-delezione».
Fra i ceppi diploidi del S. cerevisiae il solo largamente convalidato è il ceppo D7, omozigote per ilv 1-92.
1.5. CRITERI QUALITATIVI
Nessuno.
1.6. DESCRIZIONE DEL METODO DI SAGGIO
Preparati
È opportuno preparare le soluzioni delle sostanze in esame e dei composti di controllo o di riferimento, servendosi di un veicolo appropriato, al momento dell'effettuazione del test. Con i composti organici non solubili in acqua si devono usare soluzioni di solventi organici quali l'etanolo, l'acetone e il dimetilsolfossido (DMSO) a non più del 2 % in volume (v/v). La concentrazione finale del solvente non dovrebbe influenzare in modo significativo la vitalità cellulare e le caratteristiche di crescita.
Attivazione metabolica
Le cellule vanno esposte alle sostanze in esame sia in presenza che in assenza di un sistema appropriato di attivazione metabolica esogena.
Il sistema più comunemente usato è una frazione postmitocondriale integrata con cofattori, ottenuta dai fegati di roditori pretrattati con agenti che inducono enzimi. Per l'attivazione metabolica può essere appropriato anche l'uso di altre specie, di altri tessuti, di altre frazioni postmitocondriali o di altri procedimenti.
Condizioni di effettuazione del saggio
Ceppi
I ceppi più largamente usati negli studi sulle mutazioni geniche sono il ceppo aploide XV 185-14C e il ceppo diploide D
7. Possono essere appropriati anche altri ceppi.
Terreni di coltura
Per la determinazione della sopravvivenza delle cellule e del numero dei mutanti è fatto uso di terreni di coltura appropriati.
Uso di controlli negativi e positivi
È opportuno procedere in parallelo a controlli positivi, non trattati e con il solo solvente. Per ciascun evento genetico specifico vanno usate appropriate sostanze di controllo positivo.
Concentrazioni
Occorre far uso di almeno 5 concentrazioni adeguatamente intervallate della sostanza in esame. Per le sostanze tossiche la concentrazione più elevata usata nel test non deve ridurre la sopravvivenza a meno del 5-10 %. Le sostanze relativamente insolubili in acqua vanno saggiate fino al loro limite di solubilità secondo procedimenti appropriati. Per le sostanze non tossiche completamente solubili in acqua la concentrazione massima va determinata caso per caso.
Condizioni di incubazione
Le piastre vengono incubate per 4-7 giorni a temperatura da 28o a 30 oC nell'oscurità.
Frequenze delle mutazioni spontanee
È opportuno usare subcolture con frequenze delle mutazioni spontanee entro i limiti accettati come normali.
Numero delle repliche
Per la determinazione dei prototrofi che si inducono per mutazione genica e della sopravvivenza cellulare è opportuno fare uso di almeno tre piastre di replica per concentrazione. Nel caso di esperimenti nei quali si usino marcatori a bassa frequenza di mutazione, quali hom 3-10, per poter ottenere dati aventi rilevanza statistica è necessario aumentare il numero delle piastre.
Procedimento
Il trattamento dei ceppi di S. cerevisiae viene normalmente effettuato secondo un procedimento di test in sospensione liquida con impiego di cellule quiescenti o in crescita. Gli esperimenti iniziali dovrebbero essere condotti su cellule in crescita. Si espongono alla sostanza in esame per una durata fino a 18 ore a temperatura da 28o a 37 oC e in agitazione 1-5 X 1O7 cellule/mi; in casi opportuni, nel corso del trattamento si aggiunge una quantità adeguata di un sistema di attivazione metabolica. Al termine del trattamento si procede alla centrifugazione ed al lavaggio delle cellule ed alla loro semina su un terreno di coltura appropriato. Dopo incubazione si analizzano le piastre per la determinazione della sopravvivenza e dell'induzione della mutazione genica. Se il primo esperimento è negativo il secondo esperimento dovrebbe essere condotto su cellule quiescenti; se il primo esperimento è positivo, viene confermato in un appropriato esperimento indipendente.
2. DATI
1 dati devono essere presentati in forma di tabelle, con indicazione del numero delle colonie contate, del numero di mutanti, della sopravvivenza e della frequenza dei mutanti. Tutti i risultati devono essere confermati in un esperimento indipendente. I dati devono essere stabiliti secondo metodi statistici appropriati.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
Nella relazione sul saggio devono figurare, se possibile:
|
—
|
condizioni di effettuazione del test: cellule in fase stazionaria o in crescita, composizione dei terreni, temperatura e durata dell'incubazione, sistemi di attivazione metabolica,
|
|
—
|
condizioni del trattamento: livelli di esposizione, procedimento e durata del trattamento, temperatura di trattamento, controlli positivi e negativi,
|
|
—
|
numero delle colonie contate, numero di mutanti, sopravvivenza e frequenza dei mutanti, relazione dose/risposta se disponibile, valutazione statistica dei dati,
|
|
—
|
discussione dei risultati,
|
|
—
|
interpretazione dei risultati.
|
3.2. VALUTAZIONE ED INTERPRETAZIONE
Vedi introduzione generale, parte B.
4. RIFERIMENTI
Vedi introduzione generale, parte B.
B.16 RICOMBINAZIONE MITOTICA: SACCHAROMYCES CEREVISIAE
1. METODO
1.1. INTRODUZIONE
Vedi introduzione generale, parte B.
1.2. DEFINIZIONI
Vedi introduzione generale, parte B.
1.3. SOSTANZE DI RIFERIMENTO
Nessuna.
1.4. PRINCIPI DEL METODO DI SAGGIO
La ricombinazione mitotica in Saccharomyces cerevisiae può essere rilevata fra geni (o in linea più generale fra un gene e il suo centromero) e all'interno dei geni. La prima delle due eventualità è denominata crossing-over mitotico e genera prodotti reciproci, mentre la seconda eventualità è per lo più non reciproca ed è denominata conversione genica. Il crossing-over viene generalmente determinato mediante la produzione di colonie o settori recessivi omozigoti in un ceppo eterozigote, mentre la conversione genica viene determinata attraverso la produzione di revertanti prototrofici in un ceppo auxotrofico eteroallelomorfo portante due diversi alleli del medesimo gene. I ceppi più comunemente usati per la rilevazione della conversione genica mitotica sono i ceppi D4 (eteroallelomorfo irí ade 2 e trp5),D7 (eteroallelomorfo in trp 5),BZ34 (eteroallelomorfo in arg 4)e JDl (eteroallelomorfo in his 4 e trp 5). Il crossing-over mitotico producente settori omozigoti di colore rosso e rosa può essere determinato nel ceppo D5 o in D7 (che misura anche la conversione genica mitotica e la retromutazione in ilv 1-92), essendo entrambi i ceppi eteroallelomorfi per alleli complementanti di ade 2.
1.5. CRITERI QUALITATIVI
Nessuno.
1.6. DESCRIZIONE DEL METODO DI SAGGIO
Preparazioni
È opportuno preparare le soluzioni della sostanza in esame e dei composti di controllo o di riferimento, facendo uso di un solvente appropriato, al momento di procedere all'effettuazione del test. Con i composti organici non solubili in acqua è opportuno usare solventi organici come l'etanolo, l'acetone e il dimetilsolfossido (DMSO) a non più del 2 % (v/v). La concentrazione finale del solvente non dovrebbe alterare significativamente la vitalità cellulare e le caratteristiche di crescita.
Attivazione metabolica
Le cellule devono essere esposte alle sostanze in esame sia in presenza che in assenza di un sistema appropriato di attivazione metabolica esogena. Il sistema più comunemente usato è una frazione postmitocondriale supplementare con cofattori e ottenuta dai fegati di roditori pretrattati con agenti che inducono enzimi. Per l'attivazione metabolica può essere appropriato anche l'impiego di altre specie, di altri tessuti, di altre frazioni postmitocondriali o di altri procedimenti.
Condizioni sperimentali
Ceppi
I ceppi più frequentemente usati sono i ceppi diploidi D4, D5, D7, e JD1. Può essere appropriato anche l'impiego di altri ceppi.
Terreni di coltura
Per la determinazione della sopravvivenza e della frequenza della ricombinazione mitotica si devono usare terreni di coltura appropriati.
Uso di controlli negativi e positivi
È opportuno effettuare in parallelo controlli positivi, controlli non trattati o trattati con solo solvente. Per ciascun tipo specifico di ricombinazione devono essere usate le appropriate sostanze di controllo positivo.
Concentrazioni
È opportuno fare uso di almeno cinque concentrazioni della sostanza in esame adeguatamente intervallate. Tra i fattori da prendere in considerazione vi sono la citotossicità e la solubilità. La concentrazione più bassa non deve produrre alcun effetto sulla vitalità cellulare. Per le sostanze tossiche, la più alta concentrazione saggiata non deve ridurre la sopravvivenza a meno del 5-10 %. Le sostanze relativamente insolubili in acqua devono essere saggiate fino al loro limite di solubilità secondo procedimenti appropriati. Per le sostanze non tossiche altamente solubili in acqua la concentrazione massima del test va determinata caso per caso.
Le cellule possono essere esposte alle sostanze in esame in fase stazionaria o in fase di crescita per periodi fino a 18 ore. Nel caso di tempi di trattamento prolungati occorre tuttavia accertare mediante esame microscopico che nelle culture non vi sia formazione di spore, la cui presenza invaliderebbe il test.
Condizióni di incubazione
Le piastre vengono incubate nell'oscurità per 4-7 giorni a temperatura da 28 o a 30 oC. Le piastre usate per l'analisi dei settori omozigoti di colore rosso e roseo derivanti dal crossing-over mitotico vanno tuttavia tenute in frigorifero (4 oC) per un altro ciclo di uno o due giorni prima dell'analisi, per dare tempo allo sviluppo del pigmento nelle colonie ricombinanti.
Frequenze della ricombinazione mitotica spontanea
È opportuno usare subcolture con frequenze di ricombinazione mitotica spontanea entro i limiti accettati come normali.
Numero delle repliche
Per la determinazione dei prototrofi prodotti dalla conversione genica mitotica e per quella della sopravvivenza è opportuno fare uso di un minimo di tre piastre di replica per concentrazione. Nella determinazione della omozigosi recessiva derivante dal crossing-over mitotico il numero delle piastre va aumentato in modo da ottenere un numero adeguato di colonie.
Procedimento
Il trattamento dei ceppi di S. cerevisiae viene normalmente effettuato in un procedimento di test in sospensione liquida con cellule in fase stazionaria o in fase di crescita. Esperimenti iniziali dovrebbero essere condotti su cellule in fase di crescita. Si espongono alla sostanza in esame per una durata fino a 18 ore a temperatura da 28 o a 37 oC con scuotimento 1-5 × 107 cellule/mi; nel corso del trattamento, nei casi opportuni si aggiunge una quantità adeguata di un sistema di attivazione metabolica. Al termine del trattamento si procede alla centrifugazione ed al lavaggio delle cellule ed alla loro semina su un terreno di coltura appropriato. Dopo l'incubazione si analizzano le piastre per la determinazione della sopravvivenza e dell'induzione della ricombinazione mitotica.
Se il primo esperimento è negativo il secondo dovrebbe essere eseguito su cellule quiescenti; se il primo esperimento è positivo, il secondo viene confermato in un esperimento indipendente appropriato.
2. DATI
I dati devono essere presentati in forma di tabelle, con indicazione del numero dei ricombinanti, della sopravvivenza e della frequenza dei ricombinanti.
Tutti i risultati devono essere confermati in un esperimento indipendente.
I dati vanno stabiliti per valutazione secondo metodi statistici appropriati.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
Nella relazione sul saggio devono figurare, se possibile;
|
—
|
condizioni di effettuazione del test: cellule in fase stazionaria o di crescita, composizione dei terreni, temperatura e durata dell'incubazione, sistemi di attivazione metabolica,
|
|
—
|
condizioni del trattamento: concentrazione di esposizione, procedimento e durata del trattamento, tempera tura di trattamento, controlli positivi e negativi,
|
|
—
|
numero di colonie contate, numero dei ricombinanti, frequenza della sopravvivenza e della ricombinazione, relazione dose/risposta se possibile, valutazione statistica dei dati,
|
|
—
|
discussione dei risultati,
|
|
—
|
interpretazione dei risultati.
|
3.2. VALUTAZIONE ED INTERPRETAZIONE
Vedi introduzione generale, parte B.
4. RIFERIMENTI
Vedi introduzione generale, parte B.
«B.17. MUTAGENICITÀ — TEST IN VITRO DI MUTAZIONE GENICA SU CELLULE DI MAMMIFERO
1. METODO
Il metodo è ripreso dal metodo OECD TG 476, In Vitro Mammalian Cell Gene Mutation Test (1997).
1.1. INTRODUZIONE
Il test in vitro di mutazione genica su cellule di mammifero permette di identificare mutazioni geniche indotte da sostanze chimiche. Fra le linee cellulari adeguate si citano le cellule di linfoma di topo L5178Y, le linee CHO, CHO-AS52 e V79 di cellule di criceto cinese, le cellule linfoblastoidi umane TK6 (1). In queste linee cellulari di norma si misurano le mutazioni sui loci della timidina chinasi (TK) e dell'ipoxantina-guanina fosfori-bosil trasferasi (HPRT) e su un transgene della xantina-guanina fosforibosil trasferasi (XPRT). 1 saggi di mutazione TK, HPRT e XPRT rivelano varie categorie di fenomeni genetici. La posizione autosomica di TK e XPRT può permettere di individuare effetti genetici (per esempio grandi delezioni) non individuati sul locus HPRT dei cromosomi X (2) (3) (4) (5) (6).
Nel test in vitro di mutazione genica su cellule di mammifero si possono usare colture di linee cellulari stabilizzate o ceppi cellulari. Le cellule sono scelte in base alla capacità di crescita in coltura e alla stabilità della frequenza di mutazioni spontanee.
I saggi in vitro richiedono in generale l'uso di una fonte esogena di attivazione metabolica. Tale sistema di attivazione metabolica non può simulare perfettamente le condizioni in vivo nel mammifero. Si evitino condi zioni che porterebbero a risultati che non riflettono una mutagenicità intrinseca. Risultati positivi che non riflettono una mutagenicità intrinseca possono avere origine da cambiamenti di pH e di osmolalità o da ele vati livelli di citotossicità (7).
II saggio è usato per individuare potenziali mutageni e cancerogeni per i mammiferi. Molti composti positivi a questo test sono cancerogeni per i mammiferi, tuttavia la correlazione non è assoluta, ma dipende dalla classe chimica: vi sono sempre più elementi che inducono a ritenere che esistono cancerogeni che non sono rivelati da questi test perché sembrano agire attraverso altri meccanismi, non genotossici.
Cfr. anche Introduzione generale parte B.
1.2. DEFINIZIONI
Mutazione “in avanti”: una mutazione genica in cui dal tipo parentale alla forma mutante si ha alterazione o perdita dell'attività enzimatica o della funzione della proteina codificata.
Mutageni che provocano la sostituzione di coppie di basi: sostanze che provocano la sostituzione di una o più coppie di basi del DNA.
Mutageni che provocano la mutazione della fase di lettura: Sostanze che provocano l'inserzione o la delezione di una o più coppie di basi nella molecola di DNA.
Tempo di espressione fenotipica: il periodo durante il quale i prodotti genici inalterati scompaiono dalle cellule recentemente mutate.
Frequenza dei mutanti: numero di cellule mutanti diviso per il numero di cellule vitali.
Crescita totale relativa: aumento del numero di cellule nel tempo, in confronto con una popolazione di cellule di controllo: si calcola moltiplicando la crescita in sospensione rispetto al controllo negativo per l'efficienza di clonazione del controllo negativo.
Crescita relativa in sospensione: aumento del numero di cellule nel corso del periodo di espressione rispetto al controllo negativo.
Vitalità: l'efficienza di clonazione delle cellule trattate al momento del piastramento in condizioni selettive dopo il periodo di espressione.
Sopravvivenza: l'efficienza di clonazione delle cellule trattate al momento del piastramento, al termine del trattamento; il tasso di sopravvivenza viene espresso di solito in relazione alla sopravvivenza della popolazione di cellule di controllo.
1.3. PRINCIPIO DEL METODO DI SAGGIO
Le cellule carenti di timidina chinasi (TK) a causa della mutazione TK+/- —> TK-/- sono resistenti agli effetti citotossici dell'analogo pirimidinico trifluorotimidina (TFT). Le cellule capaci di produrre la timidina chinasi sono sensibili alla TFT, che provoca l'inibizione del metabolismo cellulare e arresta la divisione cellulare. Di conseguenza, le cellule mutanti sono in grado di proliferare in presenza di TFT, mentre le cellule normali, che contengono timidina chinasi, non lo sono. Analogamente le cellule carenti di HPRT o XPRT sono selezionate in base alla resistenza alla 6-tioguanina (TG) o alla 8-azaguanina (AG). Le proprietà della sostanza in esame devono essere studiate accuratamente quando in uno dei test di mutazione genica su cellule di mammifero si sperimenta un analogo di una base o un composto correlato all'agente selettivo. Per esempio, è necessario controllare la sospetta tossicità selettiva della sostanza in esame nei confronti di cellule mutanti e non mutanti. Quando sono sottoposte a test sostanze chimiche strutturalmente correlate all'agente selettivo (8). deve quindi essere confermata l'efficacia del sistema o dell'agente selettivo.
Le cellule in sospensione o in coltura monostrato sono esposte alla sostanza in esame, con e senza attivazione metabolica, per un tempo adeguato, poi reinoculate per determinare la citotossicità e permettere l'espressione fenotipica prima della selezione dei mutanti (9) (10) (11) (12) (13). La citotossicità è determinata di norma misurando l'efficacia relativa di clonazione (sopravvivenza) o la crescita totale relativa delle colture dopo il trattamento. Le colture trattate sono mantenute nel terreno di coltura per un periodo sufficiente, specifico per ciascun locus e tipo cellulare, per permettere l'espressione fenotipica ottimale delle mutazioni indotte. La frequenza di mutanti è determinata mediante inseminazione di un numero noto di cellule in terreno contenente l'agente selettivo, per rilevare le cellule mutanti, e in terreno non contenente l'agente selettivo, per determinare l'efficacia di clonazione (vitalità). Dopo un adeguato periodo di incubazione le colonie sono contate. La frequenza dei mutanti è costituita dal rapporto tra il numero di colonie mutanti nel terreno selettivo e in quello non selettivo.
1.4. DESCRIZIONE DEL METODO
1.4.1. Preparazioni
1.4.1.1. Cellule
I tipi di cellule adatti sono molti, per esempio i subcloni delle cellule L5178Y, CHO, CHO-AS52, V79 o TK6. Le cellule usate per questo test devono essere notoriamente sensibili ai mutageni chimici e presentare elevata efficienza di clonazione e frequenza stabile delle mutazioni spontanee. Si controlli che non siano contaminate da micoplasma: non si usino i ceppi contaminati.
Il test deve essere impostato in modo da avere sensibilità ed efficacia predeterminate. Il numero di cellule, di colture e di concentrazioni della sostanza in esame deve riflettere tali parametri predefiniti (14). Ad ogni sta dio del test il numero minimo di cellule vitali che sopravvivono al trattamento deve essere basato sulla fre quenza delle mutazioni spontanee. Come regola generale si può usare un numero di cellule pari almeno al decuplo dell'inverso della frequenza di mutazioni spontanee. Si raccomanda comunque di utilizzare almeno 106 cellule. Dovrebbero essere disponibili risultati di precedenti esperienze sul sistema cellulare, che indichino che le prestazioni del test sono costanti.
1.4.1.2. Terreni e condizioni di coltura
Si usino adeguati terreni di coltura e condizioni di incubazione (recipienti di coltura, temperatura, concentrazione di CO2, e umidità). I terreni devono essere scelti in funzione dei sistemi selettivi e del tipo di cellule. E particolarmente importante che le condizioni di coltura siano scelte in modo da garantire la crescita ottimale delle cellule durante il periodo di espressione e la capacità di formare colonie da parte delle cellule mutanti e non mutanti.
1.4.1.3. Preparazione delle colture
Le cellule provenienti da colture primarie sono inoculate in un terreno di coltura e incubate a 37 oC. Prima di iniziare il test può rivelarsi necessario asportare dalle colture eventuali cellule mutanti preesistenti.
1.4.1.4. Attivazione metabolica
Le cellule dovrebbero essere esposte alla sostanza in esame sia in presenza che in assenza di un adeguato sistema di attivazione metabolica. Il sistema più comunemente usato è una frazione post-mitocondriale integrata di cofattore (S9), ricavata dal fegato di roditori trattati con induttori enzimatici come Aroclor 1254 (15) (16) (17) (18), o una combinazione di fenobarbitone e β-naftoflavone (19) (20).
La frazione post-mitocondriale è di solito usata a concentrazioni finali dell'1-10 % v/v nel terreno di coltura. La scelta e le condizioni di un sistema di attivazione metabolica dipendono dalla classe chimica della sostanza in esame. In alcuni casi può essere opportuno utilizzare più di una concentrazione della frazione post-mito-condriale.
Vari nuovi procedimenti, tra cui la creazione mediante ingegneria genetica di linee cellulari che esprimono enzimi attivatori specifici, possono fornire le risorse potenziali per l'attivazione endogena. La scelta delle linee cellulari deve essere scientificamente motivata (per esempio dall'importanza dell'isoenzima del citocromo P450 per il metabolismo della sostanza in esame).
1.4.1.5. Sostanza in esame/Preparazione
Le sostanze solide devono essere poste in soluzione o in sospensione in adeguati solventi o mezzi disperdenti e, se necessario, diluite prima del trattamento delle cellule. Le sostanze liquide possono essere aggiunte diretta-mente alla coltura o diluite prima del trattamento. Si usino preparati recenti della sostanza, salvo qualora siano disponibili dati sulla sua stabilità che dimostrino che la conservazione è accettabile.
1.4.2. Condizioni di esperimento
1.4.2.1. Solvente/mezzo disperdente
11 solvente/mezzo disperdente non deve reagire chimicamente con la sostanza in esame e deve essere compatibile con la sopravvivenza delle cellule e con l'azione di S9. L'uso di solventi/mezzi disperdenti poco noti è ammesso solo se suffragato da dati che ne provino la compatibilita. Si raccomanda di prendere in primo luogo in considerazione, se possibile, l'uso di un solvente/mezzo disperdente acquoso. Nell'esame di sostanze instabili in acqua, si usi un solvente organico anidro. L'acqua può essere rimossa mediante un setaccio molecolare.
1.4.2.2. Concentrazioni di esposizione
Fra i criteri da considerare nel determinare la concentrazione massima si citano la citotossicità, la solubilità nel sistema di prova e le variazioni di pH o di osmolalità.
La citotossicità deve essere determinata con e senza attivazione metabolica nel test principale, sulla base di un indicatore adeguato dell'integrità e della moltiplicazione cellulare, come l'efficacia relativa di clonazione (tasso di sopravvivenza) o la crescita totale relativa. Può essere utile determinare la citotossicità e la solubilità in un esperimento preliminare.
Si usino almeno quattro concentrazioni analizzabili. In caso di sostanza citotossica, le concentrazioni devono andare dalla tossicità massima ad una tossicità assente o modica; in altri termini, di norma le concentrazioni devono essere separate al massimo da un fattore compreso tra 2 e 10. Se la concentrazione massima è basata sulla citotossicità, il tasso di sopravvivenza relativa (efficacia relativa di clonazione) o la crescita totale relativa dovrebbero essere pari al 10-20 % circa (e in ogni caso non inferiori al 10 %). Per sostanze a basso grado di citotossicità, la concentrazione massima di prova dovrebbe essere pari a 5 μl/ml, 5 mg/ml o 0,01 M (si scelga il valore più basso).
Le sostanze difficilmente solubili devono essere sottoposte a test nelle condizioni di coltura fino al limite di solubilità e oltre. L'eventuale insolubilità va provata nel terreno finale in cui sono trattate le cellule. Può essere utile valutare la solubilità all'inizio e alla fine del trattamento, in quanto essa può modificarsi nel corso del- l'esperimento a causa della presenza di cellule, S9, siero, ecc. L'insolubilità è rilevabile ad occhio nudo. Il precipitato non deve interferire con la valutazione.
1.4.2.3. Controlli
Ogni test dovrà comprendere controlli positivi e negativi (solvente o mezzo disperdente) trattati in parallelo, con e senza attivazione metabolica. Quando si usa l'attivazione metabolica, la sostanza usata per i controlli positivi deve esigere attivazione per dare una risposta mutagenica.
Fra gli esempi di sostanze per i controlli positivi si citano:
|
Condizione di attivazione metabolica
|
Locus
|
Sostanza
|
Numero CAS
|
Numero EINECS
|
|
Assenza di attivazione metabolica esogena
|
HPRT
|
Metansolfonato di etile
|
62-50-0
|
200-536-7
|
|
Etilnitrosourea
|
759-73-9
|
212-072-2
|
|
TK (colonie piccole e grandi)
|
Metansolfonato di metile
|
66-27-3
|
200-625-0
|
|
XPRT
|
Metansolfonato d'etile
|
62-50-0
|
200-536-7
|
|
Etilnitrosourea
|
759-73-9
|
212-072-2
|
|
Presenza di attivazione metabolica esogena
|
HPRT
|
3-Metilcolantrene
|
56-49-5
|
200-276-4
|
|
N-Nitrosodimentilammina
|
62-75-9
|
200-549-8
|
|
7,12-Dimetilbenzantracene
|
57-97-6
|
200-359-5
|
|
TK (colonie piccole e grandi)
|
Ciclofosfammide
|
50-18-0
|
200-015-4
|
|
Ciclofosfammide monoidrato
|
6055-19-2
|
|
|
Benzo[a]pirene
|
50-32-8
|
200-028-5
|
|
3-Metilcolantrene
|
56-49-5
|
200-276-5
|
|
XPRT
|
N-Nitrosodimetilammina (per livelli elevati di S-9)
|
62-75-9
|
200-549-8
|
|
Benzo[a]pirene
|
50-32-8
|
200-028-5
|
Si possono usare altre sostanze adeguate per i controlli positivi, per esempio, la 5-bromo 2'-deossiuridina (CAS n. 59-14-3, EINECS n. 200-415-9) se il laboratorio dispone di una base dati su tale sostanza, desunti da precedenti esperimenti. Per i controlli positivi si usino, se possibile, sostanze chimiche di una classe chimica correlata alla sostanza saggiata.
Si effettuino anche controlli negativi, con solvente o mezzo disperdente usato da solo sul terreno di coltura; i controlli vanno trattati come le colture che contengono la sostanza sottoposta al test. Si proceda inoltre a controlli non trattati, salvo che precedenti esperimenti dimostrino che il solvente scelto non induce effetti nocivi o mutageni.
1.4.3. Procedura
1.4.3.1. Trattamento con la sostanza in esame
Le cellule in proliferazione sono esposte alla sostanza in esame con e senza attivazione metabolica. L'esposizione deve protrarsi per un periodo adeguato (si considera che di norma tre-sei ore danno buoni risultati). Il tempo di esposizione può corrispondere a uno o più cicli cellulari.
Si possono usare colture in doppio o in singolo per ciascuna delle concentrazioni. Quando si usano colture singole, il numero di concentrazioni deve essere aumentato, per garantire un adeguato numero di colture per l'analisi (per esempio, almeno 8 concentrazioni analizzabili). Le colture dei controlli negativi (solvente) devono essere in doppio.
1 test con sostanze gassose o volatili devono essere condotti con metodi adeguati, per esempio in recipienti di coltura ermetici (21) (22).
1.4.3.2. Misura del tasso di sopravvivenza, della vitalità e della frequenza delle mutazioni
Al termine del periodo di esposizione, le cellule sono lavate e messe in coltura per determinare la sopravvivenza e permettere l'espressione del fenotipo mutante. La misura della citotossicità mediante determinazione dell'efficacia relativa di clonazione (sopravvivenza) o della crescita totale relativa delle colture inizia di solito dopo il periodo di trattamento.
A ciascun locus corrisponde un determinato tempo minimo, necessario per permettere l'espressione subottimale del fenotipo dei mutanti neoindotti (HPRT e XPRT richiedono almeno 6-8 giorni, e TK almeno 2 giorni). Le cellule sono coltivate in terreno con e senza agenti selettivi per determinare rispettivamente il numero di mutanti e l'efficacia di clonazione. La vitalità (usata per il calcolo della frequenza di mutanti) si misura al termine del tempo di espressione, piastrando le colture in terreno non selettivo.
Se la sostanza in esame è positiva a test su L5178Y TK+/-, la dimensione delle colonie deve essere rilevata almeno su una delle colture trattate (quella con la concentrazione positiva più alta) e sui controlli negativi e positivi. Se la sostanza in esame è negativa al test su L5178Y TK+/-, la dimensione va rilevata sui controlli negativi e positivi. Anche negli studi condotti su TK6TK+/-, si può rilevare la dimensione delle colonie mutanti.
2. DATI
2.1. TRATTAMENTO DEI RISULTATI
I dati devono comprendere la determinazione di citotossicità e di vitalità, il conteggio delle colonie e la fre quenza dei mutanti nelle colture trattate e di controllo. In caso di risposta positiva al test su L5178Y TK+/-, si contino le colonie, distinguendo fra piccole e grandi, almeno per una concentrazione della sostanza in esame (concentrazione positiva massima) e per i controlli negativi e positivi. La natura molecolare e citogenetica dei due tipi di mutanti (quelli che producono colonie grandi e quelli che producono colonie piccole) è stata stu diata particolareggiatamente (23) (24). Nel saggio TK+/-, le colonie sono recensite sulla base del criterio della crescita: normale (colonie grandi) e lenta (colonie piccole) (25). Le cellule mutanti che hanno subito altera zioni genetiche più gravi hanno tempi di duplicazione più lunghi e formano di conseguenza colonie piccole.
II danno può andare dalla perdita dell'intero gene ad aberrazioni cromosomiche che si manifestano nel cario tipo. La presenza di mutanti che producono colonie piccole è stata messa in relazione con sostanze chimiche che causano aberrazioni cromosomiche rilevanti (26). Le cellule mutanti che hanno subito alterazioni meno gravi crescono a velocità simile a quella delle cellule parentali, formando colonie grandi.
Si indichi il tasso di sopravvivenza (efficacia relativa di clonazione) o la crescita totale relativa. La frequenza dei mutanti deve essere espressa come rapporto fra il numero delle cellule mutanti e quello delle cellule sopravvisute.
Si presentino i dati relativi alle singole colture. Tutti i dati inoltre vanno riassunti in una tabella. Non è necessario verificare una risposta palesemente positiva. 1 risultati ambigui devono essere chiariti mediante prove ulteriori, preferibilmente in condizioni di esperimento modificate. I risultati negativi devono essere confermati caso per caso. Se non si considera necessaria la conferma di risultati negativi, se ne fornisca la ragione. Se si procede a test ulteriori in caso di risultati ambigui o negativi, si dovrebbero modificare i parametri di studio, per ampliare la gamma delle condizioni valutate. Fra i parametri di studio modificabili si citano l'intervallo tra le dosi saggiate e le condizioni di attivazione metabolica.
2.2. VALUTAZIONE E INTERPRETAZIONE DEI RISULTATI
Vari criteri permettono di determinare se un risultato è positivo, per esempio un aumento correlato alla dose o un aumento riproducibile della frequenza dei mutanti. Si consideri per prima cosa la rilevanza biologica dei risultati. Si possono usare metodi statistici come ausilio nella valutazione dei risultati sperimentali, ma la significatività statistica non dovrebbe essere l'unico fattore determinante di una risposta positiva.
Una sostanza che fornisca risultati non corrispondenti ai criteri di cui sopra è considerata non mutagena in questo test.
La maggior parte degli esperimenti fornirà indubbiamente risultati chiaramente positivi o negativi, ma occasionalmente i dati ottenuti non consentiranno di formulare un giudizio definitivo sull'azione della sostanza in esame. I risultati possono rimanere ambigui, nonostante l'esperimento venga ripetuto più volte.
Risultati positivi del saggio in vitro di mutazione genica su cellule di mammifero indicano che la sostanza in esame induce mutazioni geniche nelle cellule di mammifero utilizzate nelle colture. Una riproducibile correlazione fra l'entità della risposta positiva e la dose è maggiormente significativa. Risultati negativi significano che nelle condizioni del test la sostanza in esame non induce mutazioni geniche nelle cellule di mammifero usate nella coltura.
3. RELAZIONE
RELAZIONE SUL SAGGIO
La relazione sul saggio dovrà contenere le seguenti informazioni:
|
|
Solvente/mezzo disperdente:
|
—
|
motivazione della scelta del mezzo disperdente:
|
|
—
|
solubilità e stabilità della sostanza in esame nel solvente/mezzo disperdente, se nota;
|
|
|
|
Cellule:
|
—
|
tipo e origine delle cellule;
|
|
—
|
numero di colture cellulari;
|
|
—
|
eventuale numero di passaggi in coltura, se del caso;
|
|
—
|
metodi usati per la conservazione della cultura cellulare, se del caso;
|
|
|
|
Condizioni di esperimento:
|
—
|
criteri di selezione delle concentrazioni e del numero di colture, per esempio i dati relativi alla citotossicità e ai limiti di solubilità, se disponibili;
|
|
—
|
composizione del terreno, concentrazione di CO2;
|
|
—
|
concentrazione della sostanza in esame;
|
|
—
|
volume del mezzo disperdente e della sostanza in esame aggiunto;
|
|
—
|
temperatura di incubazione;
|
|
—
|
durata del trattamento;
|
|
—
|
densità delle cellule durante il trattamento;
|
|
—
|
tipo e composizione del sistema di attivazione metabolica, compresi i criteri di accettabilità;
|
|
—
|
controlli positivi e negativi;
|
|
—
|
durata del periodo di espressione (con numero di cellule inseminate, subcolture e protocolli di alimenta zione, se del caso):
|
|
—
|
criteri in base ai quali i risultati sono considerati positivi, negativi o ambigui;
|
|
—
|
metodi usati per contare il numero di cellule vitali e mutanti;
|
|
—
|
definizione delle colonie considerate, per dimensione e tipo (compresi i criteri in base a cui le colonie sono considerate “piccole” o “grandi”, se del caso).
|
|
|
|
Risultati:
|
—
|
segni di precipitazione;
|
|
—
|
dati sul pH e l'osmolalità durante l'esposizione alla sostanza in esame, se determinati;
|
|
—
|
dimensioni delle colonie, se registrate almeno per i controlli negativi e positivi;
|
|
—
|
idoneità del laboratorio a individuare mutanti in colonie piccole con il sistema L5178Y TK+/-, se del caso;
|
|
—
|
relazione dose-risposta, se possibile;
|
|
—
|
eventuali analisi statistiche;
|
|
—
|
dati sui controlli negativi (solvente/mezzo disperdente) e positivi paralleli;
|
|
—
|
dati sui precedenti controlli negativi (solvente/mezzo disperdente) e positivi, con ranges, medie e devia zioni standard;
|
|
|
|
Discussione dei risultati.
|
4. BIBLIOGRAFIA
|
(1)
|
Moore, M.M., DeMarini, D. M., DeSerres, F. J. and Tindall, K. R. (eds.) (1987), Banbury Report 28: Mammalian Cell Mutagenesis, Cold Spring Harbor Laboratory, New York.
|
|
(2)
|
Chu, E. H. Y. and Malling, H. V. (1968), Mammalian Cell Genetics. II. Chemical Induction of Specific Locus Mutations in Chinese Hamster Cells In Vitro, Proc. Natl. Acad. Sci. USA, 61, pp. 1306-1312.
|
|
(3)
|
Liber, H. L. and Thilly, W. G. (1982), Mutation Assay at the Thymidine Kinase Locus in Diploid Human Lymphoblasts, Mutation Res., 94, pp. 467-485.
|
|
(4)
|
Moore, M. M., Harington-Brock, K.. Doerr, C. L. and Dearfield, K. L. (1989), Differential Mutant Quantitation at the Mouse Lymphoma TK and CHO HGPRT Loci, Mutagenesis. 4, pp. 394-403.
|
|
(5)
|
Aaron, C. S. and Stankowski, Jr. L. F. (1989), Comparison of the AS52/XPRT and the CHO/HPRT Assays: Evaluation of Six Drug Candidates, Mutation Res., 223, pp. 121-128.
|
|
(6)
|
Aaron, C. S., Bolcsfoldi, G., Glatt, H. R., Moore, M., Nishi, Y., Stankowski, Jr. L. F., Theiss, J. and Thompson, E. (1994), Mammalian Cell Gene Mutation Assays Working Group Report. Report of the International Workshop on Standardisation of Genotoxicity Test Procedures. Mutation Res., 312, pp. 235-239.
|
|
(7)
|
Scott, D., Galloway, S. M., Marshall, R. R., Ishidate, M., Brusick, D., Ashby, J. and Myhr, B. C. (1991). Genotoxicity Under Extreme Culture Conditions. A report from 1CPEMC Task Group 9, Mutation Res.,
257, pp. 147-204.
|
|
(8)
|
Clive, D., McCuen, R., Spector, J. F. S., Piper, C. and Mavournin, K. H. (198 3), Specific Gene Mutations in L5178Y Cells in Culture. A Report of the U. S. Environmental Protection Agency Gene-Tox Program, Mutation Res., 115, pp. 225-251.
|
|
(9)
|
Li, A. P., Gupta, R. S., Heflich, R. H. and Wasson, J. S. (1988), A Review and Analysis of the Chinese Hamster Ovary/Hypoxanthine Guanine Phosphoribosyl Transferase System to Determine the Mutageni-city of Chemical Agents: A Report of Phase III of the U. S. Environment Protection Agency Gene-Tox Program. Mutation Res., 196, pp. 17-36.
|
|
(10)
|
Li, A. P., Carver, J. H., Choy, W. N., Hsie, A. W., Gupta, R. S., Loveday, K. S., O'Neill, J. ?.. Riddle, J. C, Stankowski, L. F. Jr. and Yang, L. L. (1987), A Guide for the Performance of the Chinese Hamster Ovary Cell/Hypoxanthine-Cuanine Phosphoribosyl Transferase Gene Mutation Assay, Mutation Res., 189, pp. 135-141.
|
|
(11)
|
Liber, H. L, Yandell, D. W. and Little,]. B. (1989), A Comparison of Mutation Induction at the TK and HPRT Loci in Human Lymphoblastoid Cells: Quantitative Differences are Due to an Additional Class of Mutations at the Autosomal TK Locus, Mutation Res., 216, pp. 9-17.
|
|
(12)
|
Stankowski, L. F. Jr., Tindall, K. R. and Hsie, A. W. (1986), Quantitative and Molecular Analyses of Ethyl Methanosulphonate — and ICR 191-Induced Molecular Analyses of Ethyl Methanosulphonate — and ICR 191-lnduced Mutation in AS52 Cells, Mutation Res., 160, pp. 133-147.
|
|
(13)
|
Turner, N. T., Batson, A. G. and Clive, D. (1984), Procedures for the L5178Y/TK+/- — TK+/- Mouse Lymphoma Cell Mutagenicity Assay, in: Kilbey, B. J. et al (eds.) Handbook of Mutagenicity Test Procedures, Elsevier Science Publishers, New York, pp. 239-268.
|
|
(14)
|
Arlett, C. F., Smith, D. M., Clarke, G. M., Green, M. H. L, Cole,)., McGregor, D. B. and Asquith,]. C. (1989), Mammalian Cell Gene Mutation Assays Based upon Colony Formation, in: Statistica! Evaluation
of Mutagenicity Test Data, Kirkland D. J., ed., Cambridge University Press, pp. 66-101.
|
|
(15)
|
Abbondandolo, A., Bonatti, S., Corti, G., Fiorio, R., Loprieno, N. and Mazzaccaro, A. (1977), Induction of 6-Thioguanine-Resistant Mutants in V79 Chinese Hamster Cells by Mouse-Liver Microsome-Activated Dimethylnitrosamine, Mutation Res., 46, pp. 365-373.
|
|
(16)
|
Ames, B. N., McCann, J. and Yamasaki, E. (1975), Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian-Microsome Mutagenicity Test, Mutation Res., 31, pp. 347-364.
|
|
(17)
|
Clive, D., Johnson, K. O., Spector, J. F. S., Batson, A. G. and Brown M. M. M. (1979), Validation and Characterisation of the L5178Y/TK+/- Mouse Lymphoma Mutagen Assay System, Mutat Res., 59, pp. 61-108.
|
|
(18)
|
Maron, D. M. and Ames, B. N. (1983), Revised Methods for the Salmonella Mutagenicity Test, Mutation
Res., 113, pp. 173-215.
|
|
(19)
|
Elliott, B. M., Combes, R. D., Elcome, C. R., Gatehouse, D. G., Gibson, G. G., Mackay, J. M. and Wolf, R. C. (1992), Alternatives to Aroclor 1254-Induced S9 in In Vitro Genotoxicity Assays, Mutagenesis, 7, pp. 175-177.
|
|
(20)
|
Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T. (1976), A Safe Substitute for Polychlorinated Biphenyls as an Inducer of Metabolic Activation Systems, in In Vitro Metabolic Activation in Mutagenesis
Testing, de Serres, F. J., Fouts,]. R., Bend,). R. and Philpot. R. M. (eds.) Elsevier, North-Holland, pp. 85-88.
|
|
(21)
|
Krahn, D. F., Barsky, F. C. and McCooey, K. T. (1982), CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids, In: Tice, R. R., Costa, D. L., Schaich, K. M. (eds.), Genotoxic Effects of Airbome
Agents, New York, Plenum, pp. 91-103.
|
|
(22)
|
Zamora, P. O., Benson, J. M., Li, A. P. and Brooks, A. L. (1983), Evaluation of an Exposure System Using Cells Grown on Collagen Gels for Detecting Highly Volatile Mutagens in the CHO/HGPRT Muta- tion Assay, Environmental Mutagenesis, 5, pp. 795-801.
|
|
(23)
|
Applegate, M. L, Moore, M. M., Broder, C. B., Burrell, A. and Hozier, J. C. (1990), Molecular Dissection of Mutations at the Heterozygous Thymidine Kinase Locus in Mouse Lymphoma Cells, Proc. Natl. Acad.
Sci. USA, 87, pp. 51-55.
|
|
(24)
|
Moore, M. M., Clive, D., Hozier, J. C. Howard, B. E., Batson, A. G., Turner, N. T. and Sawyer, J. (1985), Analysis of Trifluorothymidine-Resistant (TFT1) and Mutants of L51 78Y/TK+/- Mouse Lymphoma Cells, Mutation Res. 151, pp. 161-174.
|
|
(25)
|
Yandell, D. W., Dryja, T. P. and Little, J. B. (1990), Molecular Genetic Analysis of Recessive Mutations at a Heterozygous Autosomal Locus in Human Cells, Mutation Res., 229, pp. 89-102.
|
|
(26)
|
Moore, M. M. and Doerr, C. L. (1990), Comparison of Chromosome Aberration Frequency and Small- Colony TK-Deficient Mutant Frequency in L5178Y/TK+/- — 3.7.2C Mouse Lymphoma Cells, Mutagenesis 5, pp. 609-614.»
|
B.18 DANNO E RIPARAZIONE DEL DNA: SINTESI NON PROGRAMMATA DEL DNA — CELLULE DI MAMMIFERO IN VITRO
1. METODO
1.1. INTRODUZIONE
Vedi introduzione generale, parte B.
1.2. DEFINIZIONI
Vedi introduzione generale, parte B.
1.3. SOSTANZE DI RIFERIMENTO
Nessuna.
1.4. PRINCIPI DEL METODO DI SAGGIO
Il test della sintesi non programmata del DNA — Unscheduled DNA Syntesis (UDS) — misura la sintesi di riparazione del DNA dopo l'escissione e la rimozione di un tratto di DNA contenente la zona del danno indotto da agenti chimici e fisici. Il test si basa sull'incorparazione di timidina marcata con tritio (3H-TdR) nel DNA di cellule di mammiferi che non si trovano nella fase S del ciclo cellulare. L'assunzione di 3H-TdR può essere determinata per autoradiografia oppure mediante conteggio per scintillazione in fase liquida — liquid scintillation counting (LSC) — del DNA dalle cellule trattate. Le cellule di mammiferi in coltura, salvo nel caso che si faccia uso di epatociti primari di topo, vengono trattate con l'agente all'esame con e senza un sistema di attivazione metabolica esogena. La UDS può essere misurata anche in sistemi in vivo.
1.5. CRITERI QUALITATIVI
Nessuno.
1.6. DESCRIZIONE DEL METODO DI SAGGIO
Preparazioni
Le sostanze in esame e quelle di controllo o di riferimento vanno preparate in terreno di crescita ovvero disciolte o poste in sospensione in veicoli appropriati e poi ancora diluite in terreno di crescita prima di essere utilizzate per il test. La concentrazione finale del veicolo non deve produrre alcun effetto sulla vitalità delle cellule.
Nel test possono essere utilizzate colture primarie di epatociti di ratto, di linfociti umani o di linee cellulari stabilizzate (ad esempio fibroblasti diploidi umani).
È opportuno esporre le cellule alla sostanza in esame sia in presenza che in assenza di un sistema appropriato di attivazione metabolica.
Condizioni sperimentali
Numero di colture
Sono necessarie almeno due colture di cellule per l'autoradiografia e sei colture (o meno, se giustificato scientificamente) per le determinazioni LSC e UDS per ogni punto sperimentale.
Uso di controlli negativi e positivi
È opportuno includere in ciascun esperimento controlli simultanei positivi e negativi (non trattati e/o del solo veicolo), con e senza attivazione metabolica.
Esempi di controlli positivi per il test su epatociti di ratto sono il 7,12-DMBA (7,12-dimetilbenzatracene) e il 2-AAF (2-acetilaminofluorene). Nel caso delle linee cellulari stabilizzate un esempio di controllo positivo sia per le determinazioni autoradiografiche che per le determinazioni LSC effettuate senza attivazione metabolica è la 4-NQO (4-nitrochinolina-N-ossido); la N-dimetilnitrosamina è a sua volta un esempio di composto per controllo positivo quando sia fatto uso di sistemi di attivazione metabolica.
Concentrazioni
È opportuno fare uso di concentrazioni multiple della sostanza in esame in una gamma adeguata ai fini della determinazione della risposta. La concentrazione più elevata deve dar luogo a qualche effetto citotossico. I composti relativamente insolubili in acqua vanno saggiati fino al loro limite di solubilità. Per le sostanze non tossiche altamente solubili in acqua la concentrazione massima della sostanza in esame va determinata caso per caso.
Cellule
Per il mantenimento delle colture è opportuno fare uso di terreni di crescita, di concentrazioni di CO2 e di condizioni di temperatura e di umidità appropriate. Le linee cellulari stabilizzate devono essere controllate periodicamente per escludere la presenza di contaminazione da micoplasma.
Attivazione metabolica
Con le colture primarie di epatociti non si fa uso di sistemi di attivazione metabolica. Le* linee cellulari stabilizzate ed i linfociti vengono esposti alla sostanza in esame sia in presenza che in assenza di un sistema appropriato di attivazione metabolica.
Procedimento
Preparazione delle colture
La linee cellulari stabilizzate vengono generate da coltura stock (ad esempio per tripsinizzazione o mediante separazione per scuotimento), seminate in recipienti di coltura a densità appropriata ed incubate a 37 oC.
Colture a breve termine di epatociti di ratto vengono preparate dando modo a epatociti dissociati di fresco in un terreno appropriato di attaccarsi alla superficie di crescita.
Le colture di linfociti umani vengono preparate secondo tecniche appropriate.
Trattamento delle colture con la sostanza in esame
Epatociti primari di ratto
Gli epatociti di ratto isolati di fresco vengono trattati con la sostanza in esame in un terreno contenente 3H-TdR per una durata appropriata. Al termine del periodo di trattamento le cellule vanno tolte mediante filtraggio dal terreno, risciacquate, fissate ed essiccate. I vetrini vanno immersi in emulsione autoradiografica (alternativamente si possono usare pellicole adatte), esposti, sviluppati, colorati ed enumerati.
Linee cellulari stabilizzate e linfociti
Tecniche autoradiografiche: Le colture di cellule vengono esposte alla sostanza in esame per una durata appropriata e successivamente trattate con 3H-TdR. La durata sarà determinata dalla natura della sostanza, dall'attività del sistema metabolizzante e dal tipo delle cellule. Per rilevare il valore massimo di UDS, è opportuno aggiungere 3H-TdR contemporaneamente alla sostanza all'esame, ovvero entro pochi minuti dall'esposizione alla sostanza stessa. La scelta fra i suddetti due procedimenti sarà fatta in relazione alla possibilità di interazioni fra la sostanza all'esame e 3H-TdR. Al fine di poter distinguere fra UDS e la replicazione semi-conservativa di DNA si può inibire quest'ultima, ad esempio facendo uso di un terreno deficiente di arginina, a basso contenuto di siero o con idrossiurea nel mezzo di coltura.
Misure LSC di UDS: Prima del trattamento con la sostanza in esame è opportuno bloccare nel modo che si è descritto sopra l'entrata delle cellule nella fase S. Le cellule vengono poi esposte alla sostanza in esame nel modo che si è descritto per l'autoradiografia. Al termine del periodo di incubazione si estrae il DNA dalle cellule e si determinano il contenuto totale di DNA e la misura della incorporazione di 3H-TdR.
Occorre rilevare che quando si fa uso delle tecniche sopra descritte di linfociti umani, la soppressione della replicazione semi-conservativa di DNA non è necessaria in colture non stimolate.
Analisi
Determinazioni autoradiografiche
Nella determinazione di UDS nelle cellule in coltura non si contano i nuclei in fase S. È opportuno contare almeno 50 cellule per concentrazione. Le lastrine vanno codificate prima del conteggio, È opportuno contare su ciascuna piastrina diversi campi a caso interamente separati tra loro. Per la determinazione della quantità di incorporazione di 3H-J-TdR nel citoplasma è bene contare nel citoplasma di ciascuna cellula conteggiata tre aree delle dimensioni del nucleo.
Determinazioni LSC
Nelle determinazioni LSC UDS occorre fare uso di un numero adeguato di colture per ogni concentrazione e per i controlli.
Tutti i risultati dovrebbero essere confermati in un esperimento indipendente.
2. DATI
I dati devono essere presentati in forma di tabelle.
2.1. DETERMINAZIONI AUTORADIOGRAFICHE
Della entità dell'incorporazione di 3H-TdR nel citoplasma e del numero dei granuli osservati nel nucleo delle cellule va presa nota separatamente.
Per descrivere la distribuzione dell'entità dell'incorporazione di 3H-TdR nel citoplasma e del numero dei granuli per nucleo può essere fatto riferimento alla media, alla mediana ed al modo.
2.2. DETERMINAZIONI LSC
Per le determinazioni LSC, l'incorporazione di 3H-TdR va indicata in termini di dpm/μg di DNA. Il valore medio di dpm/μg di DNA con la deviazione standard può essere usato per descrivere la distribuzione della incorporazione.
I dati devono essere valutati secondo metodi statistici appropriati.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
Nella relazione sul saggio devono figurare, se possibile:
|
—
|
cellule usate, densità e numero dei passagi al momento del trattamento, numero delle colture di cellule,
|
|
—
|
metodi usati per il mantenimento delle colture di cellule, con indicazione del terreno, della temperatura e della concentrazione di CO2,
|
|
—
|
sostanza in esame, veicolo, concentrazioni e ragioni della scelta delle concentrazioni usate nella determinazione,
|
|
—
|
dettagli riguardanti i sistemi di attivazione metabolica,
|
|
—
|
programmi di trattamento,
|
|
—
|
controlli positivi e negativi,
|
|
—
|
tecnica autoradiografica usata,
|
|
—
|
procedimenti usati per bloccare l'entrata delle cellule nella fase S,
|
|
—
|
procedimenti usati per l'estrazione di DNA e per la determinazione del contenuto totale di DNA nelle determinazioni LSC,
|
|
—
|
relazione dose-risposta se del caso,
|
|
—
|
valutazione statistica,
|
|
—
|
discussione dei risultati,
|
|
—
|
interpretazione dei risultati.
|
3.2. VALUTAZIONE ED INTERPRETAZIONE
Vedi introduzione generale, parte B.
4. RIFERIMENTI
Vedi introduzione generale, parte B.
B.19 SAGGIO DEGLI SCAMBI TRA CROMATIDI FRATELLI IN VITRO
1. METODO
1.1. INTRODUZIONE
Vedi introduzione generale, parte B.
1.2. DEFINIZIONI
Vedi introduzione generale, parte B.
1.3. SOSTANZE DI RIFERIMENTO
Nessuna.
1.4. PRINCIPI DEL METODO DI SAGGIO
Quello degli scambi tra cromatidi fratelli — Sister chromatid exchange (SEC) — è un test a breve termine per la rilevazione degli scambi reciproci di DNA fra due cromatidi fratelli di un cromosoma in duplicazione. Gli SCE rappresentano l'interscambio di prodotti della replicazione di DNA in corrispondenza di loci apparentemente omologhi. Il processo di scambio comporta presumibilmente la rottura e la riunione di DNA, ma sulla sua base molecolare non si conosce in realtà molto. La rilevazione degli SCE richiede qualche mezzo per marcare in modo differenziale i cromatidi fratelli, e questo può essere ottenuto mediante incorporazione di bromodeossiurtdina (BrdU) nel DNA cromosomico per due cicli cellulari.
Colture in vitro di cellule di mammiferi vengono esposte alla sostanza in esame con e senza un sistema esogeno di attivazione metabolica dei mammiferi, se appropriato, e poste in coltura per due cicli di replicazione in terreno contenente BrdU. Dopo un trattamento con un inibitore del fuso (ad esempio la colchicina) per accumulare cellule in uno stadio di mitosi di tipo metafasico (c-metafase), le cellule vengono raccolte e si procede alle preparazioni cromosomiche.
1.5. CRITERI QUALITATIVI
Nessuno.
1.6. DESCRIZIONE DEL METODO DI SAGGIO
Preparazioni
|
—
|
Nel saggio si possono usare colture primarie (linfociti umani) o linee cellulari stabilizzate (ad esempio cellule di ovario di hamster cinese). Le linee cellulari devono essere controllate per escludere la presenza di contaminazione da Mycoplasma.
|
|
—
|
Vanno usati terreni di coltura e condizioni di incubazione (temperatura, recipienti di coltura, concentrazione di CO2 ed umidità) appropriati.
|
|
—
|
Le sostanze in esame possono essere preparate in terreni di coltura ovvero disciolte o poste in sospensione in veicoli appropriati prima del trattamento delle cellule. La concentrazione finale dei veicoli nei sistemi di coltura non deve influire in maniera significativa sulla vitalità o sul tasso di crescita delle cellule, ed è parallelamente opportuno verificare la frequenza degli SCE per mezzo di un controllo con solvente.
|
|
—
|
E opportuno esporre le cellule alla sostanza in esame sia in presenza che in assenza di un sistema esogeno di attivazione metabolica di mammiferi. Alternativamente, ove si faccia uso di tipi di cellule con attività metabolica endogena, l'intensità e la natura dell'attività devono essere appropriate per la classe chimica sottoposta all'esame.
|
Condizioni sperimentali
Numero di colture
Per ciascun punto sperimentale dovrebbero essere usate colture almeno in duplicato.
Uso di controlli positivi e negativi
È opportuno includere in ciascun esperimento dei controlli positivi, facendo uso sia di un composto ad azione diretta che di un composto richiedente attivazione metabolica, ed è opportuno anche effettuare un controllo del veicolo.
Quali esempi di sostanze che si prestano ad essere usate come controlli positivi si possono citare:
|
—
|
come composto ad azione diretta:
|
|
—
|
come composto ad azione indiretta:
|
Se del caso, può essere incluso nell'esperimento un controllo positivo supplementare della medesima classe chimica della sostanza in esame.
Concentrazioni
È opportuno fare uso di almeno tre concentrazioni adeguatamente intervallate della sostanza in esame. La concentrazione più elevata deve dar luogo ad un effetto tossico significativo, ma deve ancora consentire il verificarsi di una replicazione adeguata delle cellule. Le sostanze relativamente insolubili in acqua vanno saggiate fino al loro limite di solubilità secondo procedimenti appropriati. Per le sostanze non tossiche altamente solubili in acqua la concentrazione massima della sostanza in esame va determinata caso per caso.
Procedimento
Preparazione delle colture
Linee cellulari stabilizzate vengono generate da colture stock (ad esempio per tripsinizzazione o mediante distacco per scuotimento), seminate in recipienti di coltura a densità appropriata ed incubate a 37 oC. Nel caso di coltura monostrato, il numero delle cellule per ogni recipiente di coltura va regolato in modo che le colture non siano confluenti in misura molto maggiore del 50 % al momento della raccolta. Alternativamente, le cellule possono essere usate in forma di coltura in sospensione. Le colture di linfociti umani sono ottenute da sangue eparinizzato secondo tecniche appropriate ed incubate a 37 oC.
Trattamento
Vengono esposte alla sostanza in esame per una durata adeguata cellule in uno stadio di crescita esponenziale; nella maggior parte dei casi può essere efficace una durata da una a due ore, ma la durata del trattamento può in taluni casi essere prolungata fino a due cicli cellulari completi. Le cellule non aventi una sufficiente attività metabolica endogena vanno esposte alla sostanza in esame sia in presenza che in assenza di un sistema appropriato di attivazione metabolica. Al termine del periodo di esposizione le cellule vengono lavate da ogni traccia della sostanza in esame e coltivate per due cicli di replicazione in presenza di BrdU. In un procedimento alternativo si possono esporre le cellule contemporaneamente alla sostanza in esame e al BrdU per la durata completa di coltura di due cicli cellulari.
Le colture di linfociti umani vengono trattate mentre si trovano in condizione semisincrona.
Le cellule vengono analizzate alle loro seconda divisione dopo il trattamento, per assicurarsi che siano state esposte alla sostanza negli stadi più sensibili del ciclo cellulare. Tutte le colture alle quali si aggiunge BrdU, vanno manipolate nell'oscurità o in luce attenuata di lampade ad incandescenza fino al momento della raccolta delle cellule, allo scopo di ridurre per quanto possibile la fotolisi del DNA contenente BrdU.
Raccolta delle cellule
Le colture di cellule vengono trattate con un inibitore del fuso (ad esempio colchicina) da 1 a 4 ore prima della raccolta. Ciascuna coltura viene raccolta e trattata separatamente per la preparazione dei cromosomi.
Preparazione e colorazione dei cromosomi
I preparati di cromosomi vengono ottenuti secondo le tecniche citogenetiche correnti. La colorazione dei vetrini per l'evidenziazione degli SCE può essere effettuata secondo diverse tecniche (ad esempio con il metodo della fluorescenza più Giemsa).
Analisi
Il numero di cellule analizzate deve essere basato sulla frequenza spontanea di controllo degli SCE. Normalmente si analizzano per gli SCE almeno 25 metafasi ben spaziate per coltura. I vetrini vengono codificati prima dell'analisi. Nei linfociti umani si analizzano soltanto metafasi contenenti 46 centromeri. Nelle linee cellulari stabilizzate si analizzano a loro volta soltanto metafasi contenenti ± 2 centromeri del numero modale. E opportuno indicare se il salto di marcatura a livello del centromero viene o non viene conteggiato come SCE. I risultati dovrebbero essere confermati in un esperimento indipendente.
2. DATI
I dati devono essere presentati in forma di tabelle. Il numero degli SCE per metafase e il numero degli SCE per cromosoma vanno indicati separatamente per tutte le colture trattate e quelle di controllo.
I dati devono essere definiti secondo metodi statistici appropriati.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
Nella relazione sul saggio devono figurare, se possibile:
|
—
|
cellule usate, metodi di mantenimento della coltura cellulare,
|
|
—
|
condizioni sperimentali: composizione dei mezzi, concentrazione di CO2, concentrazione della sostanza all'esame, veicolo usato, temperatura di incubazione, tempo di trattamento, inibitore del fuso usato, sua concentrazione e durata del trattamento connesso, tipo di sistema di attivazione di mammiferi usato, controlli positivi e negativi,
|
|
—
|
numero di colture di cellule per punto sperimentale,
|
|
—
|
dettagli della tecnica usata per la preparazione delle lastrine,
|
|
—
|
numero delle metafasi analizzate (indicazione separata dei dati per ciascuna coltura),
|
|
—
|
numero medio di SCE per cellula e per cromosoma (indicazione separata dei dati per ciascuna coltura),
|
|
—
|
criteri per il riscontro degli SCE,
|
|
—
|
criteri di selezione delle dosi,
|
|
—
|
relazione dose/risposta se del caso,
|
|
—
|
valutazione statistica,
|
|
—
|
discussione dei risultati,
|
|
—
|
interpretazione dei risultati.
|
3.2. VALUTAZIONE ED INTERPRETAZIONE
Vedi introduzione generale, parte B.
4. RIFERIMENTI
Vedi introduzione generale, parte B.
B.20 SAGGIO DEI LETALI RECESSIVI LEGATI AL SESSO: DROSOPHILA MELANOGASTER
1. METODO
1.1. INTRODUZIONE
Vedi introduzione generale, parte B.
1.2. DEFINIZIONI
Vedi introduzione generale, parte B.
1.3. SOSTANZE DI RIFERIMENTO
Nessuna.
1.4. PRINCIPI DEL METODO DI SAGGIO
Il saggio dei letali recessivi legati al sesso — sex-linked recessive lethal (SLRL) — nel quale è fatto uso della Drosophila melanogaster, permette di rilevare l'induzione sia di mutazioni puntiformi che di piccole delezioni nella linea germinale dell'insetto. Si tratta di un saggio capace di rivelare mutazioni in circa 800 loci sul cromosoma X; questa cifra rappresenta circa l'80 % di tutti i loci del cromosoma X; quest'ultimo rappresenta a sua volta circa un quinto dell'intero genoma aploide.
Le mutazioni nel cromosoma X nella D. melanogaster sono espresse fenotipicamente nei maschi portanti il gene mutante. Quando la mutazione è letale nella condizione emizigote, la sua presenza si desume dall'assenza di una delle due classi di discendenza maschile che sono normalmente prodotte da una femmina eterozigote. Il saggio SLRL si basa sulla disponibilità di cromosomi specificamente marcati.
1.5. CRITERI QUALITATIVI
Nessuno.
1.6. DESCRIZIONE DEL METODO DI SAGGIO
Preparazioni
Ceppi
Possono essere usati maschi di un ceppo ben definito di tipo selvatico e femmine del ceppo Muller-5. Possono altresi essere usati altri ceppi di femmine marcate in modo appropriato con cromosomi X multipli invertiti.
Sostanza in esame
Le sostanze in esame vanno disciolte in acqua. Le sostanze non solubili in acqua possono essere disciolte o poste in sospensione in solventi appropriati (ad esempio una miscela di etanolo e Tween-60 o 80), e successivamente diluite in acqua o in soluzione salina prima della somministrazione. E opportuno evitare quale solvente il dimetilsol-fossido (DMSO).
Numero di animali
Il saggio va programmato con una sensibilità ed una potenza predeterminati. Sul numero di cromosomi trattati che devono essere analizzati influirà fortemente la frequenza delle mutazioni spontanee osservata nel controllo appropriato.
Vie di somministrazione
L'esposizione può essere orale, per iniezione o per esposizione a gas o a vapori. La somministrazione della sostanza in esame può essere fatta in forma di soluzione zuccherina. Se necessario, le sostanze possono essere disciolte in soluzione di NaCl allo 0,7 % ed iniettate nel torace o nell'addome.
Uso di controlli negativi e positivi
È opportuno includere nell'esperimento controlli negativi (del solvente) e positivi. Ove tuttavia siano disponibili appropriati dati storici di controllo del laboratorio, non sono necessari controlli concomitanti.
Concentrazioni
È opportuno fare uso di tre concentrazioni. Per una valutazione preliminare può essere fatto uso di una sola concentrazione della sostanza in esame, che può essere quella massima tollerata o quella che dà luogo ad una qualche indicazione di tossicità. Per le sostanze non tossiche è opportuno adottare l'esposizione alla concentrazione massima praticabile.
Procedimento
Maschi di tipo selvatico (di età da 3 a 5 giorni) vengono trattati con la sostanza in esame e accoppiati individualmente con un numero maggiore di femmine vergini dello stock Muller-5 o di altro stock marcato in maniera appropriata (con cromosomi X multipli invertiti). Le femmine vengono sostituite con vergini fresche ogni due, tre giorni cosi da coprire l'intero ciclo delle cellule germinali. Sulla prole di dette femmine viene effettuata l'analisi degli effetti letali corrispondenti agli effetti sullo sperma maturo, sugli spermatidi di stadio medio o avanzato, sugli spermatidi precoci, sugli spermaticiti e sugli spermatogoni al momento del trattamento.
Le femmine eterozigoti F1, degli incroci di cui sopra sono fatte accoppiare individualmente (ossia in ragione di una femmina per bottiglietta) con i loro fratelli. Nella generazione F2 si procede su ciascuna coltura all'analisi dell'assenza di maschi del tipo selvatico. Se da una femmina F1 appare essere derivata una coltura portante un letale nel cromosoma X dei genitori (ossia se non si osservano maschi con il cromosoma trattato) si devono mettere alla prova figlie di quella femmina con il medesimo genotipo per stabilire se la letalità si ripete nella generazione successiva.
2. DATI
I dati devono essere disposti in forma di tabelle con indicazione del numero dei cromosomi X saggiati, del numero dei maschi non fertili e del numero dei cromosomi letali per ciascuna concentrazione di esposizione e per ciascun periodo di accoppiamento per i singoli maschi trattati. Deve essere riportato per ciascun maschio il numero degli aggregati di differenti dimensioni, I risultati del test devono essere confermati in un esperimento a parte.
Per la valutazione del saggio dei letali recessivi legati al sesso deve essere fatto uso di metodi statistici appropriati. L'agglomerazione di letali recessivi aventi origine da un medesimo maschio dev'essere considerata e valutata secondo criteri statistici appropriati.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
Nella relazione sul saggio devono figurare, se possibile:
|
—
|
stock: stock o ceppi di Drosophila usati, età degli insetti, numero dei maschi trattati, numero dei maschi sterili, numero di colture F2 costituite, numero di colture F2 senza progenie, numero di cromosomi portanti un letale individuati per ciascuno stadio delle cellule germinali,
|
|
—
|
criteri per la definizione delle dimensioni dei gruppi trattati,
|
|
—
|
condizioni di effettuazione del saggio: descrizione dettagliata dei programmi di trattamento e di campionatura, livelli di esposizione, dati della tossicità, controlli negativi (del solvente) e positivi, se del caso,
|
|
—
|
criteri per il riscontro delle mutazioni letali,
|
|
—
|
relazione esposizione/effetto se del caso,
|
|
—
|
valutazione statistica,
|
|
—
|
discussione dei risultati,
|
|
—
|
interpretazione dei risultati.
|
3.2. VALUTAZIONE ED INTERPRETAZIONE
Vedi introduzione generale, parte B.
4. RIFERIMENTI
Vedi introduzione generale, parte B.
B.21 SAGGIO IN VITRO DI TRASFORMAZIONE DI CELLULE DI MAMMIFERO
1. METODO
1.1. INTRODUZIONE
Vedi introduzione generale, parte B.
1.2. DEFINIZIONI
Vedi introduzione generale, parte B.
1.3. SOSTANZE DI RIFERIMENTO
Nessuna.
1.4. PRINCIPI DEL METODO DI SAGGIO
Per la rilevazione di cambiamenti fenotipici in vitro indotti da sostanze chimiche associate con una trasformazione maligna in vivo può essere fatto uso di sistemi di coltura di cellule di mammiferi. Fra le cellule più largamente usate figurano le cellule C3H10T1/2, 3T3, SHE, le cellule di ratto Fisher; i saggi si fondano su cambiamenti della morfologia cellulare, sulla formazione di foci e sulla perdita della dipendenza da ancoraggio in agar semisolido. Esistono anche altri sistemi meno largamente usati i quali mettono in luce altri tipi di cambiamenti fisiologici o morfologici nelle cellule successivamente all'esposizione a sostanze chimiche carcinogene. Nessuno degli eventi finali dei test in vitro ha un legame meccanicistico accertato con il cancro. Alcuni fra i saggi sono in grado di evidenziare agenti promotori dei tumori. La citotossicità può essere determinata attraverso la misura dell'effetto della sostanza in esame sulla capacità di formazione di colonie (efficienza di clonaggio) o sul tasso di crescita delle colture. La misurazione della citotossicità ha lo scopo di stabilire se l'esposizione alla sostanza in esame abbia avuto carattere rilevante dal punto di vista tossicologico, ma non può essere usata per calcolare la frequenza della trasformazione in tutti i saggi poiché alcuni di essi possono comportare un'incubazione prolungata e/o un ripiastramento delle cellule.
1.5. CRITERI QUALITATIVI
Nessuno.
1.6. DESCRIZIONE DEL METODO DI SAGGIO
Preparazioni
Cellule
È disponibile tutta una varietà di linee cellulari o di cellule primarie, in relazione al saggio di trasformazione che si intende effettuare. Il ricercatore deve accertarsi che nel saggio che si sta effettuando le cellule presentino dopo esposizione a carcinogeni noti l'appropriato cambiamento fenotipico, e che il saggio nel suo laboratorio sia di provata e documentata validità e attendibilità.
Terreni di coltura
Devono essere usati terreni di coltura e condizioni sperimentali appropriati per il saggio di trasformazione che si effettua.
Sostanza in esame
Le sostanze in esame possono essere preparate in mezzi di coltura ovvero disciolte o poste in sospensione in veicoli appropriati, prima del trattamento delle cellule. La concentrazione finale del veicolo nel sistema di coltura non deve influire sulla vitalità o sul tasso di crescita delle cellule né sull'incidenza della trasformazione.
Attivazione metabolica
Le cellule vanno esposte alla sostanza in esame sia in presenza che in assenza di un sistema esogeno di attivazione metabolica dei mammiferi. Alternativamente, quando sia fatto uso di tipi di cellule che possiedono un'attività metabolica endogena deve essere accertato che la natura dell'attività stessa sia appropriata per la classe chimica sottoposta all'esame.
Condizioni sperimentali
Uso di controlli positivi e negativi
È opportuno includere in ciascun esperimento dei controlli positivi, con impiego sia di un composto ad azione diretta che di un composto richiedente attivazione metabolica; è altresì opportuno fare uso di un controllo negativo (del solvente).
Quali esempi di sostanze che si prestano ad essere usate come controlli positivi si possono citare:
|
—
|
sostanze ad azione diretta:
|
|
—
|
composti richiedenti un'attivazione metabolica:
|
—
|
4-dimetilaminoazobenzene,
|
|
—
|
7,12-dimetilbenzantracene.
|
|
Se del caso, è opportuno includere un controllo positivo supplementare della medesima classe chimica del composto in esame.
Concentrazioni
È opportuno usare varie concentrazioni della sostanza in esame. Dette concentrazioni devono dar luogo ad un effetto tossico correlato con la concentrazione, nel senso che la concentrazione più elevata produce un livello ridotto di sopravvivenza, mentre alla concentrazione più bassa la sopravvivenza è approssimativamente dello stesso ordine che nel controllo negativo. Le sostanze relativamente insolubili in acqua vanno saggiate fino al loro limite di solubilità secondo procedure appropriate. Per le sostanze non tossiche altamente solubili in acqua la concentrazione massima della sostanza va determinata caso per caso.
Procedimento
L'esposizione delle cellule deve avere una durata appropriata in relazione al sistema di saggio adottato, e questo, quando l'esposizione è prolungata, può comportare un ridosaggio con cambio del mezzo e, se necessario, con miscela di attivazione metabolica fresca. Le cellule non aventi un'attività metabolica endogena sufficiente vanno esposte alla sostanza in esame sia in presenza che in assenza di un sistema di attivazione metabolica appropriato. Al termine del periodo di esposizione le cellule vengono lavate da ogni traccia della sostanza in esame e coltivate in condizioni appropriate per la comparsa del fenotipo trasformato che si sta studiando, e viene infine determinata l'incidenza della trasformazione. Tutti i risultati devono essere confermati in un esperimento indipendente.
2. DATI
I dati vanno presentati in forma di tabella e possono assumere forme diverse a seconda del tipo di determinazione effettuato, ad esempio numero di foci o di colonie per piastre, piastre positive o numero delle cellule trasformate. La sopravvivenza va espressa quale percentuale dei livelli di controllo, e la frequenza della trasformazione sotto forma del numero di trasformanti in relazione al numero dei sopravvissuti. I dati devono essere valutati secondo metodi statistici appropriati.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
Nella relazione sul saggio devono figurare, se possibile:
|
—
|
tipo di cellule usato, numero delle colture cellulari, metodi di mantenimento delle colture,
|
|
—
|
condizioni di effettuazione del saggio, concentrazione della sostanza in esame, veicolo usato, temperatura di incubazione, durata dell'incubazione, durata e frequenza del trattamento, densità delle cellule durante il trattamento, tipo di sistema di attivazione metabolica esogena usato, controlli positivi e negativi, specificazione del fenotipo studiato, sistema selettivo usato (se del caso), criteri per la scelta delle dosi,
|
|
—
|
metodo seguito per l'enumerazione delle cellule vitali e delle cellule trasformate,
|
|
—
|
valutazione statistica,
|
|
—
|
discussione dei risultati,
|
|
—
|
interpretazione dei risultati.
|
3.2. VALUTAZIONE ED INTERPRETAZIONE
Vedi introduzione generale, parte B.
4. RIFERIMENTI
Vedi introduzione generale, parte B.
B.22 SAGGIO DEI LETALI DOMINANTI NEI RODITORI
1. METODO
1.1. INTRODUZIONE
Vedi introduzione generale, parte B.
1.2. DEFINIZIONI
Vedi introduzione generale, parte B.
1.3. SOSTANZE DI RIFERIMENTO
Nessuna.
1.4. PRINCIPI DEL METODO DI SAGGIO
Gli effetti dei letali dominanti provocano la morte dell'embrione o del feto. L'induzione di letali dominanti per effetto dell'esposizione ad una sostanza chimica indica che la sostanza in causa ha attaccato il tessuto germinale della specie all'esame. E generalmente ammesso che i letali dominanti sono dovuti a un danno cromosomico (anomalie strutturali e numeriche). La morte dell'embrione in femmine trattate può altresì essere il risultato di effetti tossici.
Come criterio generale si espongono animali maschi al composto in esame e si accoppiano i medesimi con femmine vergini non trattate. I diversi stadi delle cellule germinali possono essere saggiati separatamente mediante l'osservanza di intervalli in successione negli accoppiamenti. L'aumento degli impianti morti per femmina nel gruppo trattato in confronto con gli impianti morti per femmina nel gruppo di controllo rispecchia la perdita successiva all'impianto. La perdita anteriore all'impianto può essere stimata sulla base di conteggi dei corpi lutei oppure attraverso il raffronto del totale degli impianti per femmina nel gruppo trattato e in quello di controllo. L'effetto letale dominante complessivo è rappresentato dalla somma della perdita anteriore e successiva all'impianto. Il calcolo dell'effetto letale dominante complessivo si basa sul raffronto fra gli impianti vivi per femmina nel gruppo trattato e gli impianti vivi per femmina nel gruppo di controllo. Una riduzione del numero di impianti a determinati intervalli può essere il risultato dell'uccisione di cellule (vale a dire, di spermatociti e/o di spermagoni).
1.5. CRITERI QUALITATIVI
Nessuno.
1.6. DESCRIZIONE DEL METODO DI SAGGIO
Preparazioni
In tutti i casi in cui ciò sia possibile, le sostanze in esame vanno disciolte o poste in sospensione in soluzione salina isotonica. Le sostanze non solubili in acqua possono essere disciolte o sospese in solventi appropriati. Il solvente usato non deve né interferire con la sostanza in esame né produrre effetti tossici. È opportuno fare uso di preparazioni fresche della sostanza in esame.
Condizioni sperimentali
Vie di somministrazione
Il composto in esame va in generale somministrato una sola volta. Sulla base di informazioni tossicologiche può essere adottato un programma di trattamento ripetuto. Le vie di somministrazione correnti sono l'intubazione orale e l'iniezione intraperitoneale. Possono altresì essere appropriate altre vie di somministrazione.
Animali da esperimento
Quali specie da sottoporre al saggio sono raccomandati i ratti o i topi. Animali sani nella piena maturità sessuale vengono randomizzati ed assegnati al gruppo per il trattamento e al gruppo di controllo.
Numero e sesso
Occorre fare uso di un numero adeguato di maschi trattati in modo da tener conto della variazione spontanea del carattere biologico di cui si effettua la valutazione. Il numero scelto deve essere basato sulla sensibilità di rilevazione e sul valore di significatività determinati in precedenza. Ad esempio, in un esperimento tipico, il numero dei maschi per ciascun gruppo/dose deve essere sufficiente per dare da 30 a 50 femmine gravide per ogni intervallo di accoppiamento.
Uso di controlli negativi e positivi
È opportuno in linea generale includere in ciascun esperimento dei controlli simultanei positivi e negativi (del veicolo). Quando siano disponibili risultati accettabili di controlli positivi relativi ad esperimenti effettuati di recente nel medesimo laboratorio, al posto di un controllo positivo simultaneo può essere fatto uso di detti risultati. Le sostanze per i controlli positivi vanno usate a dosi opportunamente basse (ad esempio MMS, intraperitoneale, a 10 mg/kg) allo scopo di dimostrare la sensibilità del saggio.
Livelli delle dosi
Di norma va fatto uso di tre livelli di dosaggio. La dose più alta deve produrre segni di tossicità o di riduzione della fertilità negli animali trattati. In taluni casi può essere sufficiente un solo livello elevato di dosaggio.
Saggio del limite
Le sostanze non tossiche vanno saggiate a 5 g/kg con una sola somministrazione o a 1 g/kg/giorno con somministrazione ripetuta.
Procedimento
Sono possibili vari schemi di trattamento. Il tipo di trattamento più largamente usato è quello della somministrazione singola della sostanza in esame. Possono essere applicati anche altri schemi di trattamento.
I singoli maschi vengono accoppiati in successione con una o due femmine vergini non trattate ad intervalli appropriati dopo il trattamento. Le femmine vanno lasciate con i maschi almeno per la durata di un ciclo di estro o fino a che sia avvenuto l'accoppiamento, da determinare in base alla presenza di sperma nella vagina o di un tappo vaginale.
II numero degli accoppiamenti successivi al trattamento è determinato in base al programma di trattamento e deve essere tale che vengano esaminati dopo il trattamento tutti gli stadi delle cellule germinali.
Le femmine vengono sacrificate nella seconda metà del periodo di gravidanza, e si procede all'esame del contenuto uterino per la determinazione del numero degli impianti morti e viventi. Si possono anche esaminare le ovaie per determinare il numero dei corpi lutei.
2. DATI
I dati devono essere disposti in forma di tabelle con indicazione del numero dei maschi, del numero delle femmine gravide e del numero delle femmine non gravide. I risultati di ciascun accoppiamento, con indicazione dell'identità dei singoli soggetti maschi e femmine, vanno riportati individualmente. Per ciascuna femmina va indicata la settimana di accoppiamento, e per i maschi il livello di dosaggio, nonché rispettivamente le frequenze degli impianti vivi e degli impianti morti.
Il calcolo dell'effetto complessivo letale dominante si basa sul raffronto fra gli impianti vivi per femmina nel gruppo sottoposto al saggio e gli impianti vivi per femmina nel gruppo di controllo. Il rapporto' fra gli impianti morti e quelli vivi del gruppo trattato posto a raffronto con il rapporto corrispondente del gruppo di controllo viene analizzato ai fini dell'indicazione della perdita successiva all'impianto.
Se i dati sono registrati come morti precoci e morti tardive, ciò deve risultare dalle tabelle. Se la perdita anteriore all'impiantazione è stimata, ne deve essere dato ragguaglio. La perdita anteriore all'impianto può essere calcolata come discrepanza fra il numero dei corpi lutei e il numero degli impianti, ovvero come riduzione del numero medio di impianti per utero in confronto con gli accoppiamenti di controllo.
I dati vengono valutati secondo metodi statistici appropriati.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
Nella relazione sul saggio devono figurare, se possibile:
|
—
|
specie, ceppo, età e peso degli animali usati, numero degli animali dell'uno e dell'altro sesso nei gruppi sottoposti al saggio e nei gruppi di controllo,
|
|
—
|
sostanza in esame, solvente, livelli di dosaggio saggiati e ragioni della scelta delle dosi, controlli negativi e positivi, dati della tossicità,
|
|
—
|
via e durata dell'esposizione,
|
|
—
|
ordine degli accoppiamenti,
|
|
—
|
metodo usato per stabilire l'avvenuto accoppiamento,
|
|
—
|
criteri per l'analisi dei letali dominanti,
|
|
—
|
relazione dose/risposta, se del caso,
|
|
—
|
valutazione statistica,
|
|
—
|
discussione dei risultati,
|
|
—
|
interpretazione dei risultati.
|
3.2. VALUTAZIONE ED INTERPRETAZIONE
Vedi introduzione generale, parte B.
4. RIFERIMENTI
Vedi introduzione generale, parte B.
B.23. TEST DI ABERRAZIONE CROMOSOMICA SUGLI SPERMATOGONI DI MAMMIFERO
1. METODO
Il metodo è ripreso dal metodo OECD TG 483. Mammalian Spermatogonial Chromosome Aberration Test (1997).
1.1. INTRODUZIONE
Il saggio in vivo di aberrazione cromosomica su spermatogoni di mammifero è destinato ad identificare sostanze che causano aberrazioni cromosomiche strutturali nelle cellule spermatogoniche di mammifero (1) (2) (3) (4) (5). Le aberrazioni strutturali possono essere di due tipi, cromosomiche o cromatidiche. La maggior parte dei mutageni chimici induce aberrazioni del tipo cromatidico, ma si verificano anche aberrazioni di tipo cromosomico. Il metodo non è destinato a misurare le aberrazioni numeriche e di norma non è usato a tal fine. Le mutazioni cromosomiche ed i fenomeni ad esse correlati sono causa di numerose malattie genetiche umane.
Questo saggio misura fenomeni cromosomici negli spermatogoni e pertanto dovrebbe permettere di prevedere l'induzione di mutazioni ereditabili nelle cellule germinali.
Per tale saggio si usano di norma roditori. Si tratta di test citogenetici in vivo, che rivelano aberrazioni cromo-somiche nelle mitosi degli spermatogoni. Altre cellule bersaglio non sono oggetto del presente saggio.
Per rilevare aberrazioni di tipo cromatidico in cellule spermatogoniche, è necessario esaminare la prima divisione cellulare mitotica dopo il trattamento, prima che tali aberrazioni scompaiano nelle successive divisioni cellulari. L'analisi dei cromosomi allo stadio della meiosi, per individuare aberrazioni cromosomiche allo stadio della diacinesi-metafase I, quando le cellule trattate diventano spermatociti, può fornire ulteriori informazioni sugli spermatogoni trattati.
Questo saggio in vivo è inteso a verificare se i mutageni delle cellule somatiche siano attivi anche nelle cellule germinali. Inoltre il saggio sugli spermatogoni è idoneo a valutare il rischio di mutagenicità in quanto permette di tener conto di fattori di metabolismo in vivo, di farmacocinetica e di processi di riparazione del DNA.
I testicoli contengono varie generazioni di spermatogoni, che presentano sensibilità diverse al trattamento chi mico. Le aberrazioni individuate rappresentano pertanto una risposta globale delle popolazioni di spermato- goni trattati, tra cui predominano le cellule spermatogoniche differenziate, più numerose. Le varie generazioni di spermatogoni sono o non sono esposte alla circolazione generale in funzione della posizione all'interno del testicolo, a causa della barriera fisica e fisiologica costituita dalle cellule di Sertoli e dalla barriera ematotestico lare.
Il test non è idoneo se è evidente che la sostanza in esame o un metabolita reattivo non raggiungono il tes suto bersaglio.
Cfr. anche Introduzione generale, pane B.
1.2. DEFINIZIONI
Aberrazione di tipo cromatidico: alterazione cromosomica strutturale che si manifesta nella rottura di un singolo cromatide o nella rottura e ricongiunzione di cromatidi.
Aberrazione di tipo cromosomico: alterazione cromosomica strutturale che si manifesta nella rottura, o nella rottura e ricongiunzione, di entrambi i cromatidi in uno stesso punto.
Gap: lesione acromatica di ampiezza inferiore a un cromatide, con minimo disallineamento dei cromatidi.
Aberrazione numerica: variazione del numero di cromosomi rispetto al numero diploide caratteristico della specie.
Poliploidia: numero di cromosomi multiplo superiore a due del numero aploide (cioè 3n, 4n ecc).
Aberrazione strutturale: alterazione della struttura cromosomica visibile all'esame microscopico dello stadio di metafase della divisione cellulare, che si presenta con delezioni, riordinamenti intercromosomici e intracro-mosomici.
1.3. PRINCIPIO DEL METODO DI SAGGIO
Gli animali sono esposti alle sostanze in esame tramite una via di esposizione adeguata e sono quindi sacrificati a tempo debito, dopo somministrazione di un inibitore della metafase (p.es. colchicina o Colcemid®). Sono poi approntate e sottoposte a un processo di colorazione preparazioni cromosomiche provenienti dalle cellule germinali, e se ne analizzano le cellule in metafase per determinare le aberrazioni cromosomiche.
1.4. DESCRIZIONE DEL METODO
1.4.1. Preparazioni
1.4.1.1. Scelta delle specie animali
Criceti cinesi e topi maschi sono gli animali più comunemente usati, ma si possono usare maschi di altre specie di mammiferi. Si scelgano individui adulti, giovani e in buona salute, provenienti da ceppi di animali da laboratorio. All'inizio dello studio la variazione di peso tra gli animali deve essere minima e non superare ± 20 % del peso medio.
1.4.1.2. Condizioni di stabulazione e alimentazione
Valgono le condizioni generali citate nell'Introduzione generale alla parte B; l'umidità ideale è pari al 50-60 %.
1.4.1.3. Preparazione degli animali
Gli animali adulti, sani e giovani vengono suddivisi a caso in gruppi di controllo e di trattamento. Le gabbie devono essere disposte in modo da minimizzare eventuali effetti dovuti alla posizione. Gli animali vanno identificati inequivocabilmente e acclimatati alle condizioni di laboratorio per almeno cinque giorni.
1.4.1.4. Preparazione delle dosi
Le sostanze solide devono essere poste in soluzione o in sospensione in adeguati solventi o mezzi disperdenti e, se necessario, diluite prima del trattamento delle cellule. Le sostanze liquide possono essere aggiunte diretta-mente alla coltura o diluite prima del trattamento. Si usino preparati recenti della sostanza, salvo qualora siano disponibili dati sulla sua stabilità che dimostrino che la conservazione è ammissibile.
1.4.2. Condizioni di esperimento
1.4.2.1. Solvente/mezzo disperdente
11 solvente/mezzo disperdente non deve produrre effetti tossici alle dosi usate e non deve reagire chimicamente con la sostanza in esame. L'uso di solventi/mezzi disperdenti poco noti è ammesso solo se suffragato da dati che ne provino la compatibilità. Si raccomanda di prendere in primo luogo in considerazione, se possibile, l'uso di un solvente/mezzo disperdente acquoso.
1.4.2.2. Controlli
Ogni test dovrà comprendere controlli positivi e negativi (solvente/mezzo disperdente). Gli animali dei vari gruppi dovranno essere trattati in modo identico, salvo per la somministrazione della sostanza in esame.
I controlli positivi dovrebbero produrre aberrazioni strutturali in vivo negli spermatogoni a livelli di esposizione ai quali è previsto un aumento rilevabile rispetto alla media.
Le dosi dei controlli positivi devono essere scelte in modo che gli effetti siano chiari ma non rivelino immediatamente al lettore l'identità dei vetrini codificati. È ammissibile che le sostanze per i controlli positivi siano somministrate per una via diversa dalla sostanza in esame e che il campionamento venga effettuato una sola volta, È anche ammissibile l'uso per i controlli positivi di sostanze di una classe chimica correlata, se ne esistono. Fra gli esempi di sostanze per i controlli positivi si citano:
|
Sostanza
|
N. CAS
|
N. Einecs
|
|
Ciclofosfammide
Ciclofosfammide monoidrato
|
50-18-0
6055-19-2
|
200-015-4
|
|
Cicloesilammina
|
108-91-8
|
203-629-0
|
|
Mitomicina C
|
50-07-7
|
200-008-6
|
|
Acrilammide monomerica
|
79-06-1
|
201-173-7
|
|
Trietilenmelammina
|
51-18-3
|
200-083-5
|
In ogni fase del campionamento si proceda a controlli negativi, cui sia somministrato solo il solvente o il mezzo disperdente, senza altre differenze di trattamento, salvo che dati precedenti dimostrino che la variabilità intraspecifica e la frequenza di cellule con aberrazioni cromosomiche sono accettabili. Si ricorra anche controlli negativi non trattati, salvo che risultati di test precedenti o dati citati in letteratura dimostrino che il solvente/mezzo disperdente scelto non induce effetti nocivi o mutageni.
1.5. PROCEDURA
1.5.1. Numero degli animali
Ogni gruppo trattato e ogni gruppo di controllo deve essere composto di almeno 5 maschi analizzabili.
1.5.2. Protocollo di trattamento
Le sostanze in esame sono somministrate di preferenza in un'unica volta, o in due volte. Possono essere somministrate anche in dosi frazionate, ad esempio in due volte nello stesso giorno, a distanza di qualche ora al massimo, per agevolare la somministrazione, trattandosi di un prodotto di grande volume. Se si usa una posologia diversa, se ne fornisca la motivazione scientifica.
Dopo il trattamento si proceda al prelievo di due campioni nel gruppo cui è stata somministrata la dose massima. Poiché la cinetica del ciclo cellulare può essere influenzata dalla sostanza in esame, si effettuino un campionamento precoce e uno tardivo, rispettivamente 24 e 48 ore dopo il trattamento. Per dosi diverse dalla dose massima è opportuno procedere al prelievo 24 ore dopo il trattamento, o dopo un periodo pari a 1,5 volte la durata del ciclo cellulare, salvo sia noto che un campionamento in un momento diverso è più idoneo a identificare l'effetto ricercato (6).
Si possono effettuare ulteriori prelievi. Ad esempio, per sostanze chimiche che possono indurre perdita di cromosomi o che possono esercitare effetti indipendenti dalla fase S, può essere opportuno effettuare un campionamento più precoce (1).
L'opportunità di un protocollo di trattamento ripetuto deve essere valutata caso per caso. Dopo un protocollo ripetuto gli animali devono essere sacrificati 24 ore (1,5 volte la durata del ciclo cellulare) dopo l'ultima somministrazione. Si possono usare fasi di campionamento addizionali, se opportuno.
Prima di sacrificare gli animali si inietti per via interperitoneale una dose adeguata di un inibitore della mitosi (ad esempio Colcemid® o colchicina). Gi animali saranno quindi sacrificati dopo un adeguato lasso di tempo. Per i topi si tratterà di circa 3-5 ore; per i criceti cinesi di circa 4-5 ore.
1.5.3. Dosi
Se si procede a uno studio per individuare l'intervallo di dosi, non essendo disponibili dati utili in materia, questo va eseguito nello stesso laboratorio, sulla stessa specie e ceppo, con il medesimo protocollo usato nel test principale (7). In caso di tossicità si usino per la prima fase di campionamento tre dosi diverse, che vadano dalla tossicità massima ad una tossicità assente o modica. Per il campionamento successivo si usi solo la dose massima. La dose massima è definita come dose che produce segni di tossicità tali che livelli più elevati, con la stessa posologia, sarebbero presumibilmente letali.
Sostanze con azione biologica specifica, a dosi basse non tossiche (come ormoni e mitogeni) possono costituire eccezione rispetto ai criteri di definizione della dose e vanno valutate caso per caso. La dose massima può essere definita anche come dose che produce qualche segno di tossicità negli spermatogoni (ad esempio una riduzione del coefficiente mitotico alla prima e alla seconda metafase meiotica; tale diminuzione non dovrebbe essere superiore al 50 %).
1.5.4. Test con dose limite
Se la somministrazione di una quantità di sostanza pari ad almeno 2 000 mg/kg di peso corporeo in dose unica o in due dosi nello stesso giorno non produce effetti tossici rilevabili, e se non vi sono ragioni di sospettare un'azione genotossica sulla base di dati relativi a sostanze strutturalmente correlate, si può considerare che non è necessario procedere alla sperimentazione completa con tre dosi diverse. Sulla base dell’esposizione umana prevista per la sostanza in esame, può essere necessario usare una dose più elevata nel test con dose limite.
1.5.5. Somministrazione
La sostanza in esame viene di solito somministrata con sonda gastrica o cannula di intubazione, oppure mediante iniezione intraperitoneale. Possono essere accettate altre vie se esiste una valida ragione. Il volume massimo di liquido somministrabile in una sola volta con sonda gastrica o con iniezione dipende dalle dimensioni dell'animale da laboratorio; non deve superare i 2 ml/100 g di peso corporeo. L'uso di volumi più elevati deve essere motivato. Salvo per sostanze irritanti o corrosive, che di norma riveleranno effetti esacerbati a concentrazioni più elevate, le variazioni di volume devono essere minimizzate, regolando la concentrazione in modo da garantire un volume costante a tutte le dosi.
1.5.6. Preparazione dei cromosomi
Le sospensioni cellulari ottenute da uno o da entrambi i testicoli immediatamente dopo che l'animale è stato sacrificato sono esposte ad una soluzione ipotonica e fissate. Le cellule sono poi spalmate su vetrini e sottoposte a un processo di colorazione.
1.5.7. Analisi
Per ogni animale si analizzino almeno 100 cellule in metafase correttamente spalmate (cioè almeno 500 metafasi per gruppo). Tale numero può essere ridotto se si osservano numerose aberrazioni. Tutti i vetrini, compresi quelli dei controlli positivi e negativi, devono essere codificati indipendentemente prima dell'esame al microscopio. Poiché le procedure di fissaggio dei vetrini causano spesso la rottura di una parte delle cellule in metafase con perdita di cromosomi, le cellule esaminate devono contenere un numero di centromeri pari a 2n ± 2.
2. RISULTATI
2.1. TRATTAMENTO DEI RISULTATI
I dati relativi ai singoli animali vanno presentati in forma di tabelle. L'unità sperimentale è l'animale. Per ciascun animale si valuti la percentuale di cellule con aberrazioni cromosomiche strutturali e il numero di aberrazioni per cellula. I vari tipi di aberrazioni cromosomiche strutturali, il loro numero e la loro frequenza devono essere indicati per i gruppi di trattamento e di controllo. I gap devono essere registrati separatamente e indicati nella relazione, ma non vanno di norma inclusi nella frequenza totale delle aberrazioni.
Se si osservano tanto mitosi che meiosi, al fine di stabilire un eventuale effetto citotossico si determini il rapporto fra le mitosi degli spermatogoni e la prima e seconda metafase meiotica per tutti gli animali trattati e per i controlli negativi, su un campione totale di 100 cellule in divisione per animale. Se si osservano solo mitosi, si determini il coefficiente mitotico in almeno 1 000 cellule per animale.
2.2. VALUTAZIONE E INTERPRETAZIONE DEI RISULTATI
Vari criteri permettono di determinare se un risultato è positivo, ad esempio un aumento del numero relativo di cellule che presentano aberrazioni cromosomiche, correlato alla dose somministrata, o un palese aumento del numero di cellule con aberrazioni nei campioni, prelevati alla stessa fase di campionamento e provenienti da un gruppo cui è stata somministrata la stessa dose della sostanza in esame. Si consideri per prima cosa la rilevanza dei risultati dal punto di vista biologico. Si possono usare metodi statistici come ausilio nella valutazione dei risultati sperimentali (8), ma la significatività statistica non dovrebbe essere l'unico fattore determinante di una risposta positiva. Eventuali risultati ambigui possono essere chiariti mediante test ulteriori, preferibilmente in condizioni di esperimento modificate.
Una sostanza che fornisca risultati non corrispondenti ai criteri di cui sopra è considerata non mutagena in questo test.
La maggior parte degli esperimenti fornirà indubbiamente risultati chiaramente positivi o negativi ma occasionalmente i dati ottenuti non consentiranno di formulare un giudizio definitivo sull'azione della sostanza in esame. I risultati possono rimanere ambigui nonostante l'esperimento venga ripetuto più volte.
Risultati positivi del saggio in vivo di aberrazione cromosomica negli spermatogoni indicano che una sostanza induce aberrazioni cromosomiche nelle cellule germinali della specie sottoposta a test. Risultati negativi indicano che nelle condizioni del test la sostanza in esame non induce aberrazioni cromosomiche nelle cellule germinali della specie sottoposta a test.
Si vaglino le probabilità che la sostanza in esame o i suoi metaboliti raggiungano specificamente il tessuto bersaglio.
3. RELAZIONE
RELAZIONE SUL SAGGIO
La relazione sul saggio deve contenere le seguenti informazioni:
|
|
Solvente/mezzo disperdente:
|
—
|
motivazione della scelta del mezzo disperdente,
|
|
—
|
solubilità e stabilità della sostanza in esame nel solvente/mezzo disperdente, se note.
|
|
|
|
Animali da laboratorio:
|
—
|
numero ed età degli animali,
|
|
—
|
provenienza, condizioni di stabulazione, dieta, ecc.,
|
|
—
|
peso dei singoli animali all'inizio del test, con intervallo, media e deviazione standard per ciascun gruppo.
|
|
|
|
Condizioni di esperimento:
|
—
|
risultati dello studio per individuare l'intervallo di dosi, se effettuato,
|
|
—
|
criteri di selezione delle dosi,
|
|
—
|
criteri di selezione della via di somministrazione,
|
|
—
|
illustrazione particolareggiata della preparazione della sostanza in esame,
|
|
—
|
illustrazione particolareggiata della somministrazione della sostanza in esame,
|
|
—
|
criteri di determinazione del momento del sacrificio,
|
|
—
|
conversione della concentrazione (ppm) della sostanza in esame nel cibo o nell'acqua potabile nella dose di cellule analizzate per animale,
|
|
—
|
effettiva (mg/kg di peso corporeo/giorno), se del caso,
|
|
—
|
dettagli relativi alla qualità del cibo e dell'acqua,
|
|
—
|
descrizione dettagliata dei protocolli di trattamento e campionamento,
|
|
—
|
metodi di misura della tossicità,
|
|
—
|
natura e concentrazione dell'inibitore della mitosi, durata del trattamento,
|
|
—
|
metodi di preparazione dei vetrini,
|
|
—
|
criteri di conteggio delle aberrazioni,
|
|
—
|
numero criteri in base ai quali i risultati sono giudicati positivi, negativi o ambigui.
|
|
|
|
Risultati:
|
—
|
tasso di mitosi degli spermatogoni in rapporto alla prima e seconda metafase meiotica,
|
|
—
|
tipo e numero delle aberrazioni, indicati separatamente per ciascun animale,
|
|
—
|
numero totale delle aberrazioni per gruppo,
|
|
—
|
numero di cellule con aberrazioni per gruppo,
|
|
—
|
relazione dose-risposta, se possibile,
|
|
—
|
eventuali analisi statistiche,
|
|
—
|
dati sui controlli negativi paralleli,
|
|
—
|
dati sui precedenti controlli negativi con intervalli, inedie e deviazioni standard,
|
|
—
|
dati sui controlli positivi paralleli,
|
|
—
|
eventuali cambiamenti di ploidia.
|
|
|
|
Discussione dei risultati.
|
4. BIBLIOGRAFIA
|
(1)
|
Adler, I.D. (1986), Clastogenic Potential in Mouse Spermatogonia of Chemical Mutagens Related to their Cell-Cycle Specifications, in: Genetic Toxicology of Environmental Chemicals, Part B: Genetic Effects and Applied Mutagenesis, Ramel, C., Lambert B., and Magnusson, J. (eds.) Liss, New York. pp. 477-484.
|
|
(2)
|
Adler, I.D. (1984), Cytogenic tests in Mammals, in: Mutagenicity Testing: a Practical Approach, ed. S. Venitt and J. M. Parry, IRL Press, Oxford, Washington DC, pp. 275-306.
|
|
(3)
|
Evans, E.P., Breckon, G. and Ford, C.E., (1964), An Air-drying Method for Meiotic Preparations from Mammalian Testes, Cytogenetics and Cell Genetics, 3, pp. 289-294.
|
|
(4)
|
Richold, M., Ashby, J., Chandley, A., Gatehouse, D.G. and Henderson L. (1990), In Vìvo Cytogenetic Assays, in: D. J. Kirkland (ed.), Basic Mutagenicily Tests, UKEMS Recommended Procedures. UKEMS Subcommittee on Guidelines far Mutagenicity Testìng. Report. Part I revised, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 115-141.
|
|
(5)
|
Yamamoto, K. and Kikuchi, Y. (1978), A New Method for Preparation of Mammalian Spermatogonial Chromosomes, Mutation Res., 52, pp. 207-209.
|
|
(6)
|
Adler, I.D., Shelby, M.D., Bootman, J., Favor, J., Generoso, W., Pacchierotti, F., Shibuya, T. and Tanaka, N. (1994), International Workshop on Standardisation of Genotoxicity Test Procedures. Summary Report of the Working Group on Mammalian Germ Cell Tests, Mutation Res., 312, pp. 313-318.
|
|
(7)
|
Fielder, R.J., Allen, J.A., Boobis, A.R., Botham, P.A., Doe, J., Esdaile, D.J., Gatehouse, D.G., Hodson-Walker, G., Morton, D.B., Kirkland D.J. and Richold, M. (1992), Report of British Toxicology Society/UK Environmental Mutagen Society Working Group: Dose setting in In Vivo Mutagenicity Assays, Mutagenesis, 7, pp. 313-319.
|
|
(8)
|
Lovell, D.P., Anderson, D., Albanese, R., Amphlett, G.E., Clare, G., Ferguson, R., Richold, M., Papworth, D.G. and Savage,].R.K. (1989), Statistical Analysis of In Vivo Cytogenetic Assays, in: D.J. Kirkland (ed.), Statistical Evaluation of Mutagenicity Test Data. UKEMS Subcommittee on Guidelines far Mutagenicity Testing, report, Part III, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 184-232.
|
B.24 SAGGIO DELLE MACCHIE (SPOT TEST): TOPI
1. METODO
1.1. INTRODUZIONE
Vedi introduzione generale, parte B.
1.2. DEFINIZIONI
Vedi introduzione generale, parte B.
1.3. SOSTANZE DI RIFERIMENTO
Nessuna.
1.4. PRINCIPI DEL METODO DI SAGGIO
Quello qui considerato è un saggio in vivo nei topi, nel quale vengono esposti alle sostanze chimiche degli embrioni in corso di sviluppo. Le cellule-bersaglio negli embrioni in corso di sviluppo sono i melanoblasti e i geni-bersaglio sono quelli che governano la pigmentazione del pelame dell'animale. Gli embrioni in corso di sviluppo sono eterozigoti per una serie di detti geni della colorazione del mantello. Una mutazione nell'allele dominante di un gene di questo tipo in un melanoblasto, o la sua perdita (tramite diversi eventi genetici) ha come risultato l'espressione del fenotipo recessivo nelle sue cellule discendenti, costituita da una macchia di colore cambiato nel mantello del topo risultante. Si riporta quindi il numero della prole con dette macchie o mutazioni, e se ne raffronta la frequenza con quella riscontrata nella prole risultante da embrioni trattati soltanto con il solvente. Il saggio delle macchie (spot test) nei topi rivela presunte mutazioni somatiche nelle cellule fetali.
1.5. CRITERI QUALITATIVI
Nessuno.
1.6. DESCRIZIONE DEL METODO DI SAGGIO
Preparazioni
Quando ciò è possibile, le sostanze in esame vengono disciolte o poste in sospensione in soluzione salina isotonica. Le sostanze non solubili in acqua vengono disciolte o poste in sospensione in solventi appropriati. Il solvente usato non deve interferire con la sostanza in esame né produrre effetti tossici. È opportuno usare preparazioni fresche della sostanza in esame.
Animali da esperimento
Si accoppiano topi del ceppo T (nonagouti, a/a; chinchilla, pink eye, cchp/c hp; brown, b/b; dilute, short ear, d se/d se; piebald spotting, s/s) con il ceppo HT (pallid, nonagouti, brachypody, pa a bp/pa a bp; leaden fuzzy, ln fz/ln fz; pearl pe/pe) o con C57 BL (nonagouti, a/a). Possono essere usati anche altri incroci appropriati, ad esempio fra NMRI (nonagouti, a/a; albino, c/c) e DBA (nonagouti, a/a; brown, b/b; dilute d/d), a condizione che producano prole nonagouti.
Numero e sesso
Viene trattato un numero di femmine gravide sufficiente per ottenere un numero appropriato di prole sopravvivente per ciascun livello di dosaggio usato. Le dimensioni appropriate del campione sono determinate dal numero delle macchie osservate nei topi trattati e dalla scala dei dati di controllo. Un risultato negativo è accettabile soltanto quando si siano riscontrati almeno 300 figli di femmine trattate con la dose più alta.
Controlli positivi e negativi
È opportuno che siano disponibili dati di controllo simultanei ottenuti su topi trattati soltanto con il solvente (controlli negativi). Eventuali dati storici di controllo del medesimo laboratorio possono essere messi insieme con i dati di controllo nuovi in modo da accrescere la sensibilità del saggio, a condizione che essi siano omogenei. Se non si rileva alcuna mutagenicità per la sostanza in esame, dovrebbero essere disponibili dati di controllo positivo ottenuti di recente nel medesimo laboratorio in seguito a trattamento con una sostanza della quale sono noti gli effetti di mutagenicità con questo saggio.
Vie di somministrazione
Le vie abituali di somministrazione sono l'intubazione orale e l'iniezione intraperitoneale delle femmine gravide. Nei casi in cui ciò possa essere appropriato, si fa uso anche del trattamento per inalazione o di altre vie di somministrazione.
Livelli di dose
Si fa uso di almeno due livelli di dose, con uno dei livelli che dà luogo a segni di tossicità o ad una riduzione delle proporzioni della figliata. Per le sostanze non tossiche è opportuno ricorrere all'esposizione alla dose massima praticabile.
Procedimento
Viene di norma praticato un unico trattamento nel giorno 8, 9 o 10 di gravidanza, contando come giorno 1 quello in cui si è osservato per la prima volta il tappo vaginale. Detti giorni corrispondono a 7,25, 8,25 e 9,25 giorni dopo il concepimento. Possono essere praticati trattamenti successivi nel corso di detti giorni.
Analisi
La prole viene codificata e nel periodo fra tre o quattro settimane dopo la nascita si effettua su di essa l'analisi delle macchie pigmentale. Si distinguono tre categorie di macchie:
|
a)
|
macchie bianche a distanza fino a 5 mm dalla linea ventrale mediana, che si presume derivino dall'uccisione di cellule (WMVS);
|
|
b)
|
macchie gialle di tipo aguti, associate con le mammelle, gli organi genitali, le zone della gola, delle ascelle e dell'inguine e la parte mediana della fronte, che si presume derivino da difettoso differenziamento (MDS);
|
|
c)
|
macchie pigmentate e bianche distribuite in disordine sul manto, che si presume derivino da mutazioni somatiche (RS).
|
Devono essere osservate tutte e tre le categorie, ma ha rilevanza genetica soltanto l'ultima, RS. Eventuali problemi per quel che riguarda la distinzione fra MDS e RS possono essere risolti mediante microscopia fluorescente di peli presi come campione.
Va presa nota di evidenti anomalie morfologiche grossolane della prole.
2. DATI
I dati vengono presentati sotto forma del numero totale dei discendenti esaminati e del numero dei discendenti che hanno una o più macchie da mutazione somatica presunta. I dati relativi ai trattamenti ed al controllo negativo vengono posti a raffronto secondo metodi statistici appropriati. I dati sono anche presentati su base per prole.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
Nella relazione sul saggio devono figurare, se possibile:
|
—
|
ceppi usati nell'incrocio,
|
|
—
|
numero di femmine gravide nei gruppi trattati e nei gruppi di controllo,
|
|
—
|
dimensioni medie delle figliate nei gruppi trattati ed in quelli di controllo alla nascita ed allo svezzamento,
|
|
—
|
livelli di dose della sostanza in esame,
|
|
—
|
giorno di gravidanza al quale è stato praticato il trattamento,
|
|
—
|
vie di somministrazione del trattamento,
|
|
—
|
numero complessivo dei discendenti esaminati, e numero dei discendenti con WMVS, MDS e RS nei gruppi trattati e in quelli di controllo,
|
|
—
|
anomalie morfologiche grossolane,
|
|
—
|
relazione dose/risposte di RS quando ciò sia possibile,
|
|
—
|
valutazione statistica,
|
|
—
|
discussione dei risultati,
|
|
—
|
interpretazione dei risultati.
|
3.2. VALUTAZIONE ED INTERPRETAZIONE
Vedi introduzione generale, parte B.
4. RIFERIMENTI
Vedi introduzione generale, parte B.
B.25 TRASLOCAZIONI EREDITABILI: TOPO
1. METODO
1.1. INTRODUZIONE
Vedi introduzione generale, parte B.
1.2. DEFINIZIONI
Vedi introduzione generale, parte B.
1.3. SOSTANZE DI RIFERIMENTO
Nessuna.
1.4. PRINCIPI DEL METODO DI SAGGIO
I1 saggio delle traslocazioni ereditabili nel topo rivela cambiamenti strutturali e numerici dei cromosomi nelle cellule germinali di mammiferi quali sono recuperate nella progenie della prima generazione. I tipi di mutazioni cromosomiche sono delle traslocazioni reciproche e, Se è compresa progenie femminile, la perdita del cromosoma X. I portatori di traslocazione e le femmine XO presentano fertilità ridotta e di ciò è fatto uso per la selezione di progenie F1, per l'analisi citogenetica. Taluni tipi di traslocazioni (autosoma-X e tipo c-t) provocano sterilità completa, Le traslocazioni sono citogeneticamente osservabili in cellule meiotiche alla diacinesi della metafase I di individui di sesso maschile, che sono o maschi F1, o figli di femmine F1. Le femmine XO sono identificate citogeneticamente dalla presenza di 39 cromosomi soltanto nelle mitosi del midollo osseo.
1.5. CRITERI QUALITATIVI
Nessuno.
1.6. DESCRIZIONE DEL METODO DI SAGGIO
Preparazioni
Le sostanze chimiche in esame vengono disciolte in soluzione salina isoconica. Se insolubili esse vengono disciolte o poste in sospensione in solventi appropriati. È fatto uso di soluzioni della sostanza in esame preparate di fresco. Se si fa uso di un solvente per facilitare il dosaggio, esso non deve interferire con il composto in esame né dar luogo ad effetti tossici.
Vie di somministrazione
Le vie di somministrazione sono solitamente l'intubazione orale o l'iniezione intraperitoneale. Possono essere appropriate altre vie di somministrazione.
Animali da esperimento
Per la facilità della riproduzione e della verifica citologica, gli esperimenti in questione vengono effettuati sui topi. Non è necessario alcun ceppo di topi specifico. Tuttavia, nell'effettuazione di prove riguardanti la fertilità è opportuno che le dimensioni medie della figliata del ceppo usato siano di più di 8 neonati e siano inoltre relativamente costanti.
Sono usati animali sani sessualmente maturi.
Numero di animali
Il numero degli animali occorrenti dipende dalla frequenza delle traslocazioni spontanee, e dal tasso minimo di induzione necessario per un risultato positivo.
Il saggio si effettua normalmente mediante analisi della progenie maschile F1. E opportuno esaminare almeno 500 capi di progenie maschile F1 per ciascun gruppo/dose. Se si include progenie femminile F1, occorrono 300 maschi e 300 femmine.
Uso di controlli negativi e positivi
Dovrebbero essere disponibili dati adeguati di controllo, derivati da controlli simultanei o storici. Qualora siano disponibili dati accettabili di controllo positivo da esperimenti condotti di recente nello stesso laboratorio, questi risultati possono essere usati in luogo del controllo positivo simultaneo.
Livelli di dose
Si sperimenta un solo livello di dose, ossia solitamente la dose più alta associata con la produzione dei minimi effetti tossici, ma senza che sia influenzato il comportamento riproduttivo o la sopravvivenza. Per stabilire una relazione dose/risposta sono necessarie due dosi supplementari più basse. Per le sostanze non tossiche è opportuno adottare un'esposizione alla dose massima praticabile.
Procedimento
Trattamento e accoppiamento
Sono possibili due schemi di trattamento. Nello schema più largamente usato è praticata un'unica somministrazione della sostanza in esame. Si può tuttavia procedere anche all'applicazione della sostanza in esame 7 giorni per settimana per 35 giorni. Il numero degli accoppiamenti successivi al trattamento è determinato dal programma di trattamento adottato, e deve essere stabilito in modo che siano considerati tutti gli stadi delle cellule germinali trattate. Al termine del periodo di accoppiamento, le femmine vengono tenute in gabbie individuali. Quando le femmine partoriscono, si prende nota della data, del numero e del sesso della progenie. Tutta la progenie maschile viene svezzata, mentre tutta la progenie femminile viene scartata, salvo nel caso che la si includa nell'esperimento.
Controllo della eterozigosi di traslocazione
È praticato l'uno o l'altro di due metodi possibili:
|
—
|
analisi della fertilità della progenie F1 e successiva verifica degli eventuali portatori di traslocazione mediante analisi citogenetica,
|
|
—
|
analisi citogenetica di tutta la progenie maschile F1 senza selezione preliminare mediante analisi della fertilità.
|
|
a)
|
Analisi della fertilità
La diminuzione della fertilità di un individuo F1 può essere stabilita attraverso l'osservazione delle dimensioni della figliata e/o dell'analisi del contenuto uterino delle femmine accoppiate.
Devono essere stabiliti dei criteri specifici per la determinazione della fertilità normale e della fertilità diminuita nel ceppo di topi usato.
Osservazione dell'entità delle figliate: i maschi F1 da sottoporre al saggio vengono posti in gabbia individualmente con femmine del medesimo esperimento o della colonia. Le gabbie vengono ispezionate giornalmente a partire da 18 giorni dopo l'accoppiamento. Viene presa nota alla nascita dell'entità della figliata e del sesso dalla progenie F2 e le figliate vengono successivamente scartate. Se si sottopone al saggio la progenie femminile F1, si tiene la progenie F2 di piccole figliate per un'ulteriore sperimentazione. Le portatrici femmine di traslocazioni sono verificate mediante analisi citogenetica di una traslocazione in uno qualsiasi dei loro discendenti maschi. Le femmine XO si riconoscono dal cambiamento del rapporto fra i sessi nella loro progenie (maschi/femmine da 1:1 a 1:2). In un procedimento in serie si escludono gli animali F1 normali da sperimentazioni ulteriori se la prima figliata F2 raggiunge o supera un valore normale predeterminato, altrimenti si osserva una seconda o una terza figliata F2.
Gli animali F1 che non possono essere classificati come normali dopo l'osservazione di un numero di figliate F2 fino a tre vengono saggiati ulteriormente mediante l'analisi del contenuto uterino delle femmine con essi accoppiate, oppure sono direttamente sottoposti all'analisi citogenetica.
Analisi del contenuto uterino: la diminuzione dell'entità delle figliate nei portatori di traslocazioni è dovuta a morte dell'embrione, e di conseguenza un numero elevato di impianti morti è indicativo della presenza di una traslocazione nell'animale all'esame. I maschi F1 da sottoporre al saggio vengono accoppiati con due, tre femmine ciascuno. Il concepimento viene determinato mediante ispezione giornaliera per l'osservazione di tappi vaginali fra le 8 e le 10 antimeridiane. Le femmine vengono uccise da 14 a 16 giorni dopo e viene presa nota degli impianti sia vivi che morti nei loro uteri.
|
|
b)
|
Analisi citogenetica
Si allestiscono preparati di testicoli con la tecnica dell'essiccazione in aria. I portatori di traslocazioni sono identificati in base alla presenza di configurazioni multivalenti alla diacinesi di metafasi I degli spermatociti primari. L'osservazione di almeno due cellule con associazione multivalente costituisce la prova occorrente che l'animale sottoposto al saggio è un portatore di traslocazione.
Se non si è proceduto ad alcuna selezione nell'allevamento, sono esaminati citogeneticamente tutti i maschi F1. Deve essere riscontrato al microscopio un minimo di 25 diacinesi metafasi I per maschio. Per i maschi F1 con testicoli piccoli e con degradazione meiotica prima della diacinesi e per le femmine F1 sospette di XO è necessario l'esame delle metafasi mitotiche, degli spermatogoni o del midollo osseo. La presenza di un cromosoma insolitamente lungo e/o corto in ognuna di 10 cellule è il segno di una traslocazione particolare sterile del maschio (tipo c-t). Talune traslocazioni di autosoma X che provocano la sterilità del maschio possono essere identificate soltanto raggruppando l'analisi dei cromosomi mitotici. La presenza di 39 cromosomi nella totalità di 10 mitosi è il segno di una condizione di XO in una femmina.
|
2. DATI
I dati sono presentati in forma di tabelle.
Sono riportati l'entità media delle figliate e il rapporto fra i sessi dagli accoppiamenti dei genitori alla nascita e allo svezzamento per ciascun intervallo di accoppiamento.
Per la valutazione della fertilità degli animali F1 sono presentate le entità medie delle figliate di tutti gli accoppiamenti normali e le entità delle figliate singole dei portatori di traslocazioni F1. Per l'analisi del contenuto uterino è dato ragguaglio del numero medio degli impianti vivi e morti degli accoppiamenti normali e del numero individuale degli impianti vivi e morti per ciascun accoppiamento di portatori di traslocazione F1.
Per l'analisi citogenetica della diacinesi metafase I sono elencati per ciascun portatore di traslocazione il numero di tipi di configurazioni multivalenti ed il numero totale delle cellule.
Per gli individui F1 sterili sono riportati il numero totale degli accoppiamenti e la durata del periodo di accoppiamento. Sono forniti i pesi dei testicoli e dettagli delle analisi citogenetiche.
Per le femmine XO sono riportati l'entità media delle figliate, il rapporto fra i sessi della progenie F2 e i risultati dell'analisi citogenetica.
Se possibile i portatori di traslocazioni vengono preselezionati per mezzo di analisi della fertilità; le tabelle devono in tal caso recare l'indicazione del numero di soggetti così selezionati che sono risultati eterozigoti di traslocazione confermati.
Sono parimenti riportati i dati dei controlli negativi e degli esperimenti di controllo positivo.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
Nella relazione sul saggio devono figurare, se possibile:
|
—
|
ceppo dei topi, età degli animali, pesi degli animali trattati,
|
|
—
|
numero di animali genitori dell'uno e dell'altro sesso nei gruppi sottoposti al saggio e nei gruppi di controllo,
|
|
—
|
condizioni di effettuazione del saggio, descrizione particolareggiata del trattamento, livelli di dosaggio, solventi, programmi di accoppiamento,
|
|
—
|
numero e sesso dei piccoli nati per femmina, numero e sesso dei piccoli allevati per l'analisi della traslocazione,
|
|
—
|
tempo e criteri dell'analisi della traslocazione,
|
|
—
|
numero e descrizione particolareggiata dei portatori di traslocazioni ivi compresi i dati riguardanti la procreazione e i dati sul contenuto uterino, se del caso,
|
|
—
|
procedimenti citogenetici e dettagli delle analisi microscopiche, di preferenza con illustrazioni,
|
|
—
|
valutazione statistica,
|
|
—
|
discussione dei risultati,
|
|
—
|
interpretazione dei risultati.
|
3.2. VALUTAZIONE ED INTERPRETAZIONE
Vedi introduzione generale, parte B.
4. RIFERIMENTI
Vedi introduzione generale, parte B.
B.26 TEST DI TOSSICITÀ ORALE SUBCRONICA — STUDIO DELLA TOSSICITÀ ORALE CON SOMMINISTRAZIONE RIPETUTA DI DOSI PER 90 GIORNI SUI RODITORI
1. METODO
Questo metodo di tossicità subcronica corrisponde al TG 408 (1998) dell'OCSE.
1.1. INTRODUZIONE
Nella valutazione e nel giudizio delle caratteristiche tossiche di una sostanza chimica è possibile determinare la tossicità orale subcronica con dosi ripetute dopo aver ottenuto dati preliminari sulla tossicità mediante test di tossicità acuta o con dosi ripetute per 28 giorni. Lo studio di 90 giorni fornisce informazioni sui possibili rischi per la salute che potrebbero derivare dall'esposizione ripetuta per un periodo di tempo prolungato che copre la maturazione post-svezzamento e la crescita, fino all'età adulta. Con questo studio si otterranno dati sui principali effetti tossici, sugli organi bersaglio e sulla possibilità di accumulo, mediante i quali si potrà stimare il livello di esposizione al quale non si osservano effetti avversi, che può essere utilizzato per scegliere i livelli delle dosi per gli studi cronici e per definire i criteri di sicurezza relativi all'esposizione di soggetti umani.
Il metodo pone ulteriore enfasi sugli endpoint neurologici e fornisce un'indicazione degli effetti immunologia e riproduttivi. Si sottolinea inoltre la necessità di sottoporre gli animali ad attente osservazioni cliniche, allo scopo di ottenere il maggior numero possibile di informazioni. Il presente studio dovrebbe permettere l'identificazione di sostanze chimiche che abbiano la capacità potenziale di provocare effetti neurotossici, o sul sistema immunologico) o sugli organi della riproduzione che potrebbero richiedere ulteriori indagini approfondite.
Cfr. anche introduzione generale, parte B.
1.2. DEFINIZIONI
Dose: quantità della sostanza di prova somministrata. La dose si esprime in termini di peso (g, mg) o di peso della sostanza in esame per unità di peso dell'animale sperimentale (ad esempio mg/kg), oppure in termini di concentrazioni dietetiche costanti (ppm).
Dosaggio: termine generico che comprende la dose, la frequenza e la durata della somministrazione.
NOAEL: abbreviazione di «no observed adverse effect level» (livello al quale non si osservano effetti dannosi): il più alto livello di dose a cui non si osservano effetti avversi correlati al trattamento.
1.3. PRINCIPIO DEL METODO UTILIZZATO
Ogni giorno, per un periodo di 90 giorni, si somministra per via orale la sostanza in esame in dosi crescenti a vari gruppi di animali da esperimento, laddove ad ogni gruppo corrisponde un determinato livello di dose. Durante il periodo di somministrazione si tengono gli animali sotto attenta osservazione per individuare eventuali segni di tossicità. Gli animali che muoiono o vengono sacrificati durante il test sono sottoposti a esame necroscopico e, a conclusione del test, anche gli animali sopravvissuti vengono sacrificati e sottoposti a esame necroscopico.
1.4. DESCRIZIONE DEL METODO UTILIZZATO
1.4.1. Preparazione degli animali
Si utilizzano solo animali sani che siano stati acclimatati alle condizioni di laboratorio per almeno 5 giorni e non siano stati sottoposti a precedenti procedure sperimentali. Gli animali in esame vanno caratterizzati per specie, ceppo, origine, sesso, peso e/o età. L'assegnazione degli animali al gruppo di controllo e di trattamento avviene mediante randomizzazione. Le gabbie vanno disposte in modo da ridurre al minimo eventuali effetti dovuti alla collocazione. A ogni animale deve essere assegnato un numero di identificazione esclusivo.
1.4.2. Preparazione delle dosi
La sostanza di prova viene somministrata mediante sonda gastrica, oppure con la dieta o l'acqua di abbeveraggio. Il metodo di somministrazione orale dipende dallo scopo dello studio e dalle caratteristiche fisico-chimiche del materiale da esaminare.
Se necessario, la sostanza di prova viene disciolta o posta in sospensione in un veicolo adeguato. Dove possibile, si raccomanda di prendere anzitutto in considerazione la possibilità di utilizzare una soluzione/sospensione acquosa, indi una soluzione/emulsione in olio (ad esempio olio di mais) e infine una soluzione in altri veicoli. Se si usano veicoli diversi dall'acqua è necessario conoscerne le caratteristiche tossiche. Occorre inoltre determinare la stabilità della sostanza di prova nelle condizioni di somministrazione.
1.4.3. Condizioni di esecuzione del test
1.4.3.1. Animali sperimentali
La specie di elezione è il ratto, sebbene si possano utilizzare anche altre specie di roditori, come il topo. È bene usare ceppi di animali giovani adulti sani comunemente utilizzati in laboratorio. Le femmine devono essere nullipare e non gravide. La somministrazione dovrebbe iniziare al più presto possibile dopo lo svezzamento e comunque prima che gli animali abbiano raggiunto le nove settimane di vita. All'inizio dello studio la variazione di peso degli animali deve essere minima e non superare il ± 20 % del peso medio per ciascun sesso. Per gli studi preliminari a studi della tossicità cronica a lungo termine, è necessario usare animali dello stesso ceppo e provenienti dalla stessa origine in entrambi gli studi.
1.4.3.2. Numero e sesso
Per ciascun livello di dose vanno usati almeno 20 animali (dieci femmine e dicci maschi). Qualora si preveda di sacrificare a intervalli intermedi alcuni animali, il numero iniziale va aumentato del numero di animali che si prevede di sacrificare prima del completamento dello studio. In base alle precedenti conoscenze sulla sostanza chimica o su una sostanza analoga, occorre valutare la possibilità di includere un ulteriore gruppo satellite di dieci animali (cinque per sesso) nel gruppo di controllo e in quello trattato col livello di dose più elevato, allo scopo di osservare, dopo il periodo di trattamento, la reversibilità o la persistenza di eventuali effetti tossici. La durata di tale periodo post-trattamento va stabilita adeguatamente tenendo conto degli effetti osservati.
1.4.3.3. Livelli di dose
Occorre utilizzare almeno tre livelli di dose e un controllo concomitante, tranne quando si esegue un test limite (cfr. 1.4.3.4). 1 livelli di dose possono essere basati sui risultati di precedenti studi con dosi ripetute o di definizione del range e devono tenere conto dei dati tossicologici e tossicocinetici esistenti relativi alla sostanza in esame o a materiali analoghi. A meno che non sia limitato dalla natura fisico-chimica o dagli effetti biologici della sostanza in esame, il livello di dose più elevato va scelto con l'obiettivo di indurre tossicità, senza provocare il decesso o gravi sofferenze agli animali. Occorre scegliere una sequenza decrescente dei livelli di dose per poter eventualmente dimostrare la correlazione dosaggio/risposta e un NOAEL al livello di dose più basso. In genere, per definire i livelli decrescenti di dose si consiglia l'impiego di intervalli multipli di un numero compreso fra due e quattro e, spesso, l'aggiunta di un quarto gruppo sperimentale è preferibile all'uso di intervalli molto ampi (ad esempio, più di un fattore di circa 6-10) fra i dosaggi.
Il gruppo di controllo deve essere non trattato oppure, se per somministrare la sostanza di prova si impiega un veicolo, trattato solo con il veicolo. Salvo il trattamento con la sostanza in esame, gli animali del gruppo di controllo vanno manipolati esattamente come quelli dei gruppi sperimentali. Se si utilizza un veicolo, il gruppo di controllo deve riceverne il volume più elevato somministrato. Se la sostanza di prova viene somministrata con la dieta e concorre a ridurre l'assunzione di cibo da parte degli animali, per distinguere fra la riduzione dovuta a questo fatto e quella determinata dalle alterazioni tossicologiche può essere utile un gruppo di controllo pair-fed.
Occorre tenere conto delle seguenti caratteristiche del veicolo e di eventuali altri additivi: effetti su assorbimento, distribuzione, metabolismo o ritenzione della sostanza di prova; effetti sulle proprietà chimiche della sostanza di prova che potrebbero alterarne le caratteristiche tossiche; effetti sui consumo di cibo o di acqua o sulle condizioni nutrizionali degli animali.
1.4.3.4. Test limite
Se impiegando la procedura descritta per il presente studio, un test a un livello di dose equivalente ad almeno 1 000 mg/kg di peso corporeo/die non produce effetti avversi e se, sulla base dei dati relativi a sostanze strutturalmente affini non si prevede tossicità, ci si può esimere dal condurre uno studio completo con tre livelli di dose. Il test limite non si applica quando l'esposizione di soggetti umani indica la necessità di utilizzare un livello di dose più elevato.
1.5. PROCEDURA
1.5.1. Somministrazione delle dosi
Le dosi della sostanza in esame devono essere somministrate quotidianamente, sette giorni alla settimana, per 90 giorni. Occorre giustificare la scelta di eventuali altri regimi di dosaggio (ad esempio cinque giorni alla settimana). Se si utilizza una sonda gastrica o una cannula per intubazione, la somministrazione deve avvenire in dose unica. Il volume massimo di liquido somministrabile ogni volta dipende dalle dimensioni dell'animale sperimentale, ma non deve superare 1 ml/100 g di peso corporeo, tranne in caso di soluzioni acquose per le quali si possono usare 2 ml/100 g di peso corporeo. Ad eccezione delle sostanze irritanti o corrosive, che in genere producono effetti più forti a concentrazioni più elevate, occorre ridurre al minimo la variabilità del volume da somministrare regolando! a concentrazione in modo da mantenere il volume costante a tutti i livelli di dose.
Per le sostanze somministrate con la dieta o l'acqua di abbeveraggio è importante impedire che la quantità della sostanza in esame interferisca con la normale alimentazione o il normale bilancio dei liquidi. Quando la sostanza in esame viene somministrata nella dieta si possono usare sia una concentrazione dietetica costante (ppm), sia un livello di dose costante in termini di peso corporeo dell'animale ed occorre motivare l'opzione scelta. Se si utilizza invece l'alimentazione forzata con sonda gastrica, la dose va somministrata ogni giorno più o meno alla stessa ora, regolandola adeguatamente per mantenere la dose a un livello costante rispetto al peso corporeo dell'animale. Se lo studio sul periodo di 90 giorni è preliminare ad uno studio sulla tossicità cronica a lungo termine, occorre utilizzare una dieta simile in entrambi.
1.5.2. Osservazioni
Il periodo di osservazione deve essere di almeno 90 giorni. Gli animali del gruppo satellite destinato a osservazioni di follow-up non vanno trattati per un periodo adeguato, allo scopo di individuare la persistenza o la remissione degli effetti tossici.
Le osservazioni cliniche vanno effettuate almeno una volta al giorno, preferibilmente alla/e stessa/e ora/e, tenendo conto del periodo di picco degli effetti previsti dopo la somministrazione. Occorre registrare le condizioni cliniche degli animali. Per identificare segni di morbilità e mortalità tutti gli animali vanno osservati almeno due volte al giorno, in genere all'inizio e alla fine della giornata.
Tutti gli animali vanno sottoposti a dettagliate osservazioni cliniche almeno una volta prima della prima esposizione (per consentire il confronto all'interno dei gruppi di soggetti) e, successivamente, una volta alla settimana. Le osservazioni vanno eseguite fuori dalla gabbia di stabulazione, preferibilmente in un ambiente standard e sempre all'incirca allo stesso orario. Occorre registrare con cura le osservazioni, preferibilmente usando sistemi di punteggio statistico definiti appositamente dal laboratorio che esegue l'esperimento. Occorre adottare ogni misura per ridurre al minimo le variazioni delle condizioni di osservazione. I segni da osservare sono almeno i seguenti: cambiamenti a livello cutaneo, del pelo, degli occhi e delle mucose, presenza di secrezioni ed escrezioni e attività neurovegetativa (ad esempio lacrimazione, piloerezione, reazioni pupillari, alterazioni della respirazione). Vanno inoltre registrati cambiamenti dell'andatura, della postura e della risposta alla manipolazione, nonché la presenza di movimenti tonici o clonici, stereotipie (ad esempio tendenza a pulirsi eccessivamente, a girare in cerchio) e comportamenti insoliti (ad esempio automutilazione, deambulazione a ritroso) (1).
Prima della somministrazione della sostanza in esame e a conclusione dello studio occorre eseguire un esame oftalmologico, mediante un oftalmoscopio o analogo dispositivo idoneo, preferibilmente su tutti gli animali o comunque almeno sul gruppo a cui viene somministrata la dose più elevata e sui controlli. Se si riscontrano alterazioni degli occhi è necessario esaminare tutti gli animali.
Verso la fine del periodo di esposizione e comunque non prima dell’11a settimana si valutano i seguenti parametri: reattività sensoriale a stimoli di vario tipo (1) (ad esempio stimoli uditivi, visivi e propriocettivi) (2), (3), (4), forza di presa (5) e attività motoria (6). Ulteriori particolari sulle procedure ammesse si trovano nei rispettivi riferimenti bibliografici, ma sono comunque accettabili procedure alternative.
Le osservazioni funzionali da effettuare verso la fine dello studio possono essere omesse se sono disponibili dati a questo riguardo derivati da altri studi e se le osservazioni cliniche quotidiane non hanno rivelato deficit funzionali.
Eccezionalmente è possibile omettere le osservazioni funzionali anche per i gruppi che evidenzino comunque segni di tossicità tale da interferire in modo significativo con l'esecuzione dei test di funzionalità.
1.5.2.1. Peso corporeo e assunzione di cibo/acqua
Tutti gli animali vanno pesati almeno una volta alla settimana. La misurazione del consumo di cibo va eseguita almeno con cadenza settimanale. Se la sostanza in esame viene somministrata con l'acqua di abbeveraggio, anche il consumo di acqua va misurato almeno a cadenza settimanale. È utile tener conto del consumo di acqua anche negli studi con somministrazione mediante dieta o sonda gastrica perché potrebbe risultare alterato.
l.5.2.2. Ematologia e biochimica clinica
Occorre prelevare campioni di sangue da un sito specifico e conservarli, se opportuno, in condizioni adeguate. Alla fine del test si raccolgono campioni di sangue subito prima o nel corso della procedura di soppressione degli animali.
I seguenti esami ematologici vanno eseguiti sui campioni prelevati alla fine e nel corso del test: ematocrito, concentrazione di emoglobina, conta degli eritrociti, conta totale e differenziale dei leucociti, conta delle piastrine e misurazione del potenziale di coagulazione (tempo).
Le determinazioni di biochimica clinica per lo studio degli effetti tossici gravi sui tessuti e, più specificatamente, degli effetti su reni e fegato, vanno condotte su campioni di sangue prelevati da ciascun animale subito prima o nel corso della procedura di soppressione degli animali (salvo gli esemplari moribondi e/o sacrificati nel frattempo). Analogamente agli esami ematologici, si possono raccogliere campioni di sangue a intervalli intermedi per eseguire test di biochimica clinica. Si raccomanda di lasciare gli animali a digiuno la notte precedente la raccolta dei campioni (3). Le determinazioni, nel plasma o nel siero, devono comprendere sodio, potassio, glucosio, colesterolo totale, urea, azoto ureico, creatinina, proteine totali e albumina, ed almeno tre enzimi indicativi degli effetti epatocellulari (ad esempio alanina aminotransferasi, aspartato aminotransferasi, fosfatasi alcalina, gamma-glutamil-transpeptidasi e deidrogenasi del sorbitolo). Possono essere aggiunte anche misurazioni di altri enzimi (epatici o di altra origine) e degli acidi biliari, che in alcune circostanze possono fornire utili informazioni.
A scelta, nel corso dell'ultima settimana di studio, è possibile eseguire le seguenti analisi delle urine, raccolte in tempi prestabiliti: aspetto, volume, osmolalità o densità relativa, pH, proteine, glucosio e sangue/cellule ematiche.
È inoltre necessario considerare la possibilità di condurre studi sui marker sierologici dei danni generici ai tessuti. Altre determinazioni da eseguire se le proprietà note della sostanza possono, o si sospetta che possano, influire sui profili metabolici sono calcio, fosforo, trigliceridi a digiuno, ormoni specifici, metaemoglobina e colinesterasi. Queste determinazioni vanno effettuate per alcune classi di sostanze chimiche oppure caso per caso.
Nel complesso è necessario adottare un approccio flessibile in funzione delle specie e dell'effetto osservato e/o previsto relativo ad una data sostanza.
Non disponendo di sufficienti dati pregressi occorre valutare se sia necessario determinare le variabili ematologiche e di biochimica clinica prima della somministrazione: in generale non è raccomandabile che tali dati siano generati prima del trattamento (7).
1.5.2.3. Necroscopia macroscopica
Tutti gli animali dello studio vanno sottoposti a completa e dettagliata necroscopia macroscopica che comprende un attento esame della superficie esterna del corpo, di tutti gli orifizi e delle cavità cranica, toracica e addominale e del loro contenuto. Fegato, reni, ghiandole surrenali, testicoli, epididimi, utero, ovaie, timo, milza, cervello e cuore di tutti gli animali (tranne quelli trovati moribondi e/o sacrificati nel frattempo) vanno opportunamente liberati da eventuali tessuti aderenti e pesati umidi immediatamente dopo la dissezione, per evitare l'essiccamento.
I seguenti tessuti vanno conservati nel mezzo di fissazione più adatto, sia per il tipo di tessuto, sia per il successivo esame istopatologico che si intende effettuare: tutte le lesioni macroscopiche, cervello (porzioni rappresentative comprendenti cervello, cervelletto, bulbo e/o ponte), midollo spinale (a tre livelli: cervicale, mediotoracico e lombare), ghiandola pituitaria, tiroide, paratiroide, timo, esofago, ghiandole salivari, stomaco, intestino tenue e crasso (comprese le placche di Peyer), fegato, pancreas, reni, ghiandole surrenali, milza, cuore, trachea e polmoni (conservati con dilatazione e poi immersione in fissativo), aorta, gonadi, utero, annessi, ghiandola mammaria delle femmine, prostata, vescica, cistifellea (topo), linfonodi (preferibilmente un linfonodo interessato dalla via di somministrazione e un altro distante dalla via di somministrazione per coprire gli effetti sistemici), un nervo periferico (sciatico o tibiale) preferibilmente in prossimità del muscolo, una sezione di midollo osseo (e/o un aspirato di midollo osseo fresco), cute e occhi (se gli esami oftalmologici hanno evidenziato alterazioni). I reperti clinici e di altro tipo possono evidenziare la necessità di esaminare altri tessuti. Vanno inoltre conservati tutti gli organi considerati organi bersaglio in base alle proprietà note della sostanza in esame.
1.5.2.4. Esame istopatologico
Gli organi e i tessuti conservati di tutti gli animali del gruppo di controllo e del gruppo che riceve la dose più elevata vanno sottoposti a esame istopatologico completo. Si procede a questi esami anche sugli animali degli altri gruppi se nel gruppo a cui viene somministrata la dose più elevata si osservano alterazioni correlate al trattamento.
Vanno esaminate tutte le lesioni macroscopiche.
Quando si utilizza un gruppo satellite l'esame istopatologico va eseguito sui tessuti e sugli organi per i quali sono stati osservati effetti nei gruppi trattati.
2. DATI E RELAZIONE
2.1. DATI
I dati devono essere forniti separatamente per ogni soggetto. Inoltre, tutti i dati vanno riassunti sotto forma di tabelle che indichino per ogni gruppo sperimentale il numero di animali presenti all'inizio della prova, il numero di animali trovati morti durante il test o sacrificati per motivi umanitari e il momento di tutti i decessi o soppressioni, il numero di animali che presentano segni di tossicità, una descrizione dei segni di tossicità osservati, quali momento dell'esordio, durata e gravita di tutti gli effetti tossici, il numero di animali che presentano lesioni, il tipo di lesioni e la percentuale di animali rapportata al tipo di lesione.
I risultati numerici vanno valutati mediante un metodo statistico adeguato e generalmente accettabile. I metodi statistici e i dati da analizzare vanno scelti già in sede di determinazione del disegno sperimentale.
2.2. RELAZIONE SUL TEST
La relazione sul test deve contenere le seguenti informazioni:
2.2.1. Sostanza di prova:
|
—
|
natura fisica, purezza e proprietà fisico-chimiche,
|
|
—
|
veicolo (se utilizzato): motivazione per la scelta del veicolo, se diverso dall'acqua.
|
2.2.2. Specie di prova:
|
—
|
numero, età e sesso degli animali,
|
|
—
|
origine, condizioni di stabulazione, dieta, ecc.,
|
|
—
|
peso dei singoli animali all'inizio del test.
|
2.2.3. Condizioni di esecuzione del test:
|
—
|
motivo della scelta del livello di dose,
|
|
—
|
dettagli sulla formulazione della sostanza in esame/preparazione dietetica, sulla concentrazione ottenuta, sulla stabilità e l'omogeneità della preparazione,
|
|
—
|
dettagli sulla somministrazione della sostanza in esame,
|
|
—
|
dosi effettive (mg/kg di peso corporeo/die) e fattore di conversione dalla concentrazione della sostanza di prova nella dieta/acqua di abbeveraggio (ppm) alla dose effettiva, se del caso,
|
|
—
|
particolari sulla qualità del cibo e dell'acqua.
|
2.2.4. Risultati:
|
—
|
peso corporeo e cambiamenti del peso corporeo,
|
|
—
|
assunzione di cibo ed eventualmente di acqua,
|
|
—
|
dati sulla risposta tossica per sesso e livello di dose, compresi i segni di tossicità,
|
|
—
|
natura, gravità e durata delle osservazioni cliniche (reversibili o meno),
|
|
—
|
risultati dell'esame oftalmologico,
|
|
—
|
valutazioni di attività sensoriale, forza di presa e attività motoria (se disponibili),
|
|
—
|
test ematologici con i relativi valori basali,
|
|
—
|
test biochimici clinici con i relativi valori basali,
|
|
—
|
peso corporeo terminale, peso degli organi e rapporti tra peso degli organi e peso corporeo,
|
|
—
|
risultati della necroscopia,
|
|
—
|
descrizione dettagliata di tutti i reperti istopatologici,
|
|
—
|
dati sull'assorbimento, se disponibili,
|
|
—
|
elaborazione statistica dei risultati, se del caso.
|
Discussione dei risultati.
Conclusioni.
3. BIBLIOGRAFIA
|
(1)
|
IPCS (1986). Principles and Methods for the Assessment of Neurotoxicity Associated with Exposure to.Chemicals, Environmental Health Criteria Document No. 60.
|
|
(2)
|
Tupper, D.E., Wallace, R.B. (1980). Utility of the Neurologie Examination in Rats. Acta Neurobiol. Exp.,.40, pp. 999-1003.
|
|
(3)
|
Gad, S.C. (1982). A Neuromuscular Screen for Use in Industrial Toxicology. J. Toxicol. Environ. Health, 9, pp. 691-704.
|
|
(4)
|
Moser, V.C., Mc Daniel, K.M., Phillips, P.M. (1991). Rat Strain and Stock Comparisons Using a.Functional Observational Battery: Baseline Values and Effects of Amitraz. Toxicol. Appl. Pharmacol.,.108, pp. 267-283.
|
|
(5)
|
Meyer O.A., Tilson H.A., Byrd W.C., Riley M.T. (1979). A Method for the Routine Assessment of Fore-and Hind-limb grip Strength of Rats and Mice. Neurobehav. Toxivol., 1. pp. 233-236.
|
|
(6)
|
Crofton K.M., Howard J.L., Moser V.C., Gill M.W., Reiter L.W., Tilson H.A., MacPhail R.C. (1991). Interlaboratory Comparison of Motor Activity Experiments: Implication for Neurotoxicological Assessments. Neurotoxicol. Teratol., 13, pp. 599-609.
|
|
(7)
|
Weingand K., Brown G., Hall R. et al. (1996). Harmonisation of Animal Clinic Pathology Testing in.Toxicity and Safety Studies, Fundam. & Appl. Toxicol., 29, pp. 198-201.
|
B.27. TEST DI TOSSICITÀ ORALE SUBCRONICA — STUDIO DELLA TOSSICITÀ ORALE CON SOMMINISTRAZIONE RIPETUTA DI DOSI PER 90 GIORNI SUI NON RODITORI
1. METODO
Questo metodo di tossicità orale subcronica corrisponde al TG 409 (1998) dell'OCSE.
1.1. INTRODUZIONE
Nella valutazione e nel giudizio delle caratteristiche tossiche di una sostanza chimica è possibile determinare la tossicità orale subcronica con dosi ripetute dopo aver ottenuto dati preliminari sulla tossicità mediante test di tossicità acuta o con dosi ripetute per 28 giorni. Lo studio di 90 giorni fornisce informazioni sui possibili rischi per la salute che potrebbero derivare dall'esposizione ripetuta in un periodo di rapida crescita, fino alla giovane età adulta. Con questo studio si otterranno dati sui principali effetti tossici, sugli organi bersaglio e sulla possibilità di accumulo, mediante i quali si potrà stimare il livello di esposizione al quale non si osservano effetti avversi che può essere utilizzato per scegliere i livelli delle dosi per gli studi cronici e per definire i criteri di sicurezza relativi all'esposizione di soggetti umani.
Il metodo di test consente di identificare gli effetti avversi dell'esposizione a sostanze chimiche in specie di non roditori e va usato solo:
|
—
|
nei casi in cui gli effetti osservati in altri studi indichino la necessità di procedere ad un chiarimento o ad una caratterizzazione in un secondo test su specie di non roditori, oppure
|
|
—
|
nei casi in cui gli studi tossicocinetici indichino che sia meglio utilizzare una particolare specie di non roditori, oppure
|
|
—
|
nei casi in cui altri motivi specifici giustifichino l'uso di una specie di non roditori.
|
Cfr. anche introduzione generale, parte B.
1.2. DEFINIZIONI
Dose: quantità della sostanza di prova somministrata. La dose si esprime in termini di peso (g, mg) o di peso della sostanza in esame per unità di peso dell'animale sperimentale (ad esempio mg/kg), oppure in termini di concentrazioni dietetiche costanti (ppm).
Dosaggio: termine generico che comprende la dose, la frequenza e la durata della somministrazione.
NOAEL: abbreviazione di «no observed adverse effect level» (livello al quale non si osservano effetti dannosi): il più alto livello di dose a cui non si osservano effetti avversi correlati al trattamento.
1.3. PRINCIPIO DEL METODO UTILIZZATO
Ogni giorno, per un periodo di 90 giorni, si somministra per via orale la sostanza in esame in dosi crescenti a vari gruppi di animali da esperimento, laddove ad ogni gruppo corrisponde un determinato livello di dose. Durante il periodo di somministrazione si tengono gli animali sotto attenta osservazione per individuare eventuali segni di tossicità. Gli animali che muoiono o vengono sacrificati durante il test sono sottoposti a esame necroscopico e, a conclusione del test, anche gli animali sopravvissuti vengono sacrificati e sottoposti a esame necroscopico.
1.4. DESCRIZIONE DEL METODO UTILIZZATO
1.4.1. Selezione delle specie di animali
La specie di non roditori comunemente utilizzata è il cane, preferibilmente di razza definita: spesso si utilizza la razza beagle, è possibile utilizzare anche altre specie, come il maiale, il mini-pig ed altri. Si raccomanda di non utilizzare primati, la cui scelta va motivata. Si utilizzano animali giovani e sani e, nel caso del cane, la somministrazione deve iniziare preferibilmente a 4-6 mesi e comunque entro il 9° mese di vita. Per gli studi preliminari a studi della tossicità cronica a lungo termine, è necessario usare la stessa specie o la stessa razza in entrambi gli studi.
1.4.2. Preparazione degli animali
Si utilizzano solo animali sani e giovani che siano stati acclimatati alle condizioni di laboratorio e non siano stati sottoposti a precedenti procedure sperimentali. La durata dell'acclimatazione dipende dalla specie selezionata per il test e dalla sua origine. Si raccomanda un periodo di almeno 5 giorni per cani o maiali di una colonia residente allevati a scopo sperimentale, e di almeno 2 settimane per gli stessi animali provenienti da fonti esterne. Gli animali sperimentali vanno caratterizzati per specie, ceppo, origine, sesso, peso e/o età. L'assegnazione degli animali al gruppo di controllo e di trattamento avviene mediante randomizzazione. Le gabbie vanno disposte in modo da ridurre al minimo eventuali effetti dovuti alla loro collocazione. A ogni animale deve essere assegnato un numero di identificazione esclusivo.
1.4.3. Preparazione delle dosi
La sostanza in esame può essere somministrata nella dieta o nell'acqua di abbeveraggio, mediante sonda gastrica o in capsule. Il metodo di somministrazione orale dipende dallo scopo dello studio e dalle caratteristiche fisico-chimiche del materiale in esame.
Se necessario, la sostanza di prova viene disciolta o posta in sospensione in un veicolo adeguato. Dove possibile, si raccomanda di prendere anzitutto in considerazione la possibilità di utilizzare una soluzione/sospensione acquosa, indi una soluzione/emulsione in olio (ad esempio olio di mais) e infine una soluzione in altri veicoli. Se si usano veicoli diversi dall'acqua è necessario conoscerne le caratteristiche tossiche. Occorre determinare inoltre la stabilità della sostanza di prova nelle condizioni di somministrazione.
l.5. PROCEDURA
1.5.1. Numero e sesso degli animali
Per ciascun livello di dose vanno usati almeno otto animali (quattro femmine e quattro maschi). Qualora si preveda di sacrificare a intervalli intermedi alcuni animali, il numero va aumentato del numero di animali che si prevede di sacrificare prima del completamento dello studio. Il numero di animali al termine dello studio deve essere tale da consentire di effettuare una valutazione significativa degli effetti tossici. In base alle precedenti conoscenze sulla sostanza chimica o su una sostanza analoga, occorre valutare la possibilità di includere un ulteriore gruppo satellite di otto animali (quattro per sesso) nel gruppo di controllo e in quello trattato col livello di dose più elevato, allo scopo di osservare, dopo il periodo di trattamento, la reversibilità o la persistenza di eventuali effetti tossici. La durata di tale periodo post-trattamento va stabilita adeguatamente tenendo conto degli effetti osservati.
1.5.2. Dosaggio
Occorre utilizzare almeno tre livelli di dose e un controllo concomitante, tranne quando si esegue un test limite (cfr. 1.5.3). I livelli di dose possono essere basati sui risultati di precedenti studi con dosi ripetute o di definizione del rango e devono tenere conto dei dati tossicologici e tossicocinetici esistenti disponibili relativi al composto in esame o a materiali analoghi. A meno che non sia limitato dalla natura fisico-chimica o dagli effetti biologici della sostanza in esame, il livello di dose più elevato va scelto con l'obiettivo di indurre tossicità, senza provocare il decesso o arrecare gravi sofferenze. Occorre scegliere una sequenza decrescente dei livelli di dose per poter eventualmente dimostrare la correlazione dosaggio/risposta e un NOAEL al livello di dose più basso. In genere, per definire i livelli decrescenti di dose è ottimale l'impiego di intervalli multipli di un numero compreso fra due e quattro e, spesso, l'aggiunta di un quarto gruppo sperimentale è preferibile all'uso di intervalli molto ampi (ad esempio, più di un fattore di circa 6-10) fra i dosaggi.
Il gruppo di controllo deve essere non trattato oppure, se per somministrare la sostanza di prova si impiega un veicolo, trattato solo con il veicolo. Salvo il trattamento con la sostanza in esame, gli animali del gruppo di controllo vanno manipolati esattamente come quelli dei gruppi sperimentali. Se si utilizza un veicolo, il gruppo di controllo deve riceverne il volume più elevato somministrato. Se la sostanza di prova viene somministrata con la dieta e concorre a ridurre l'assunzione di cibo da parte degli animali, per distinguere fra la riduzione dovuta a questo fatto e quella determinata dalle alterazioni tossicologiche può essere utile un gruppo di controllo pair-fed.
Occorre tenere conto delle seguenti caratteristiche del veicolo e di eventuali altri additivi: effetti su assorbimento, distribuzione, metabolismo o ritenzione della sostanza di prova; effetti sulle proprietà chimiche della sostanza di prova che potrebbero alterarne le caratteristiche tossiche; effetti sul consumo di cibo o di acqua o sulle condizioni nutrizionali degli animali.
1.5.3. Test limite
Se, impiegando la procedura descritta per il presente studio, un test a un livello di dose equivalente ad almeno 1 000 mg/kg di peso corporeo/die non produce effetti avversi e se, sulla base dei dati relativi a sostanze strutturalmente affini, non si prevede tossicità, ci si può esimere dal condurre uno studio completo con tre livelli di dose. Il test limite non si applica quando l'esposizione di soggetti umani indica la necessità di utilizzare un livello di dose più elevato.
1.3.4. Somministrazione delle dosi
Le dosi della sostanza in esame devono essere amministrate quotidianamente, sette giorni alla settimana, per 90 giorni. Occorre giustificare la scelta di eventuali altri regimi di dosaggio (ad esempio cinque giorni alla settimana). Se si utilizza una sonda gastrica o una cannula per intubazione, la somministrazione deve avvenire in dose unica. Il volume massimo di liquido somministrabile ogni volta dipende dalle dimensioni dell'animale sperimentale e di norma va mantenuto al minimo possibile. Ad eccezione delle sostanze irritanti o corrosive, che in genere producono effetti più forti a concentrazioni più elevate, occorre ridurre al minimo la variabilità del volume da somministrare regolando la concentrazione in modo da mantenere il volume costante a tutti i livelli di dose.
Per le sostanze somministrate con la dieta o l'acqua di abbeveraggio è importante impedire che le quantità della sostanza in esame interferiscano con la normale alimentazione o il normale bilancio dei liquidi. Quando la sostanza in esame viene somministrata nella dieta si possono usare sia una concentrazione dietetica costante (ppm), sia un livello di dose costante in termini di peso corporeo dell'animale ed occorre motivare l'opzione scelta. Se si utilizza invece l'alimentazione forzata mediante sonda gastrica o se si somministrano capsule, la dose va somministrata ogni giorno più o meno alla stessa ora, regolandola adeguatamente per mantenere la dose a un livello costante rispetto al peso corporeo dell'animale. Se lo studio sul periodo di 90 giorni è preliminare ad uno studio sulla tossicità cronica a lungo termine, occorre utilizzare una dieta simile in entrambi.
1.5.5. Osservazioni
Il periodo di osservazione deve essere di almeno 90 giorni. Gli animali del gruppo satellite destinato a osservazioni di follow-up non vanno trattati per un periodo adeguato, allo scopo di individuare la persistenza o la remissione degli effetti tossici.
Le osservazioni cliniche vanno effettuate almeno una volta al giorno, preferibilmente alla/e stessa/e ora/e, tenendo conto del periodo di picco degli effetti previsti dopo la somministrazione. Occorre registrare le condizioni cliniche degli animali. Per identificare segni di morbilità e mortalità tutti gli animali vanno osservati almeno due volte al giorno, in genere all'inizio e alla fine della giornata.
Tutti gli animali vanno sottoposti a dettagliate osservazioni cliniche almeno una volta prima della prima esposizione (per consentire il confronto all'interno dei gruppi di soggetti) e, successivamente, una volta alla settimana. Le osservazioni vanno eseguite, se fattibile, fuori dalla gabbia di stabulazione, preferibilmente in un ambiente standard e sempre all'inarca allo stesso orario. Occorre adottare ogni misura per ridurre al minimo le variazioni delle condizioni di osservazione. I segni di tossicità, compresi il momento dell'esordio, il grado e la durata, vanno accuratamente registrati. I segni da osservare sono almeno i seguenti: cambiamenti a livello cutaneo, del pelo, degli occhi e delle mucose, presenza di secrezioni ed escrezioni e attività neurovegetativa (ad esempio lacrimazione, piloerezione, reazioni pupillari, alterazioni della respirazione). Vanno inoltre registrati cambiamenti dell'andatura, della postura e della risposta alla manipolazione, nonché la presenza di movimenti tonici o clonici, stereotipie (ad esempio tendenza a pulirsi eccessivamente, a girare in cerchio) e qualsiasi comportamento insolito.
Prima della somministrazione della sostanza in esame e a conclusione dello studio occorre eseguire un esame oftalmologico, mediante un oftalmoscopio o analogo dispositivo idoneo, preferibilmente su tutti gli animali o comunque almeno sul gruppo a cui viene somministrata la dose più elevata e sui controlli. Se si riscontrano alterazioni degli occhi correlate al trattamento è necessario esaminare tutti gli animali.
1.5.5.1. Peso corporeo e assunzione di cibo/acqua
Tutti gli animali vanno pesati almeno una volta alla settimana. La misurazione del consumo di cibo va eseguita almeno con cadenza settimanale. Se la sostanza in esame viene somministrata con l'acqua di abbeveraggio, anche il consumo di acqua va misurato almeno con cadenza settimanale. È utile tener conto del consumo di acqua anche negli studi con somministrazione mediante dieta o sonda gastrica perché potrebbe risultare alterato.
1.5.5.2. Ematologia e biochimica clinica
Occorre prelevare campioni di sangue da un sito specifico e conservarli, se opportuno, in condizioni adeguate. Alla fine del test si raccolgono campioni di sangue subito prima o nel corso della procedura di soppressione degli animali.
Gli esami ematologici, compresi ematocrito, concentrazione di emoglobina, conta degli eritrociti, conta totale e differenziale dei leucociti, conta delle piastrine e una misurazione del potenziale di coagulazione scelta tra tempo dì coagulazione, tempo di protrombina o tempo di tromboplastina, vanno eseguiti all'inizio dello studio e successivamente a intervalli mensili o a metà del periodo di test e infine alla conclusione del test.
Le determinazioni biochimiche cliniche per lo studio degli effetti tossici gravi sui tessuti e, specificamente, gli effetti su reni e fegato, vanno condotte su campioni di sangue prelevati da tutti gli animali all'inizio dello studio, poi a intervalli mensili o a metà del test, e infine a conclusione del periodo di test. Gli elementi da valutare sono l'equilibrio elettrolitico, il metabolismo dei carboidrati e la funzionalità epatica e renale. La scelta di test specifici sarà influenzata dalle osservazioni sulla modalità di azione della sostanza di prova. Prima della raccolta dei campioni di sangue, gli animali vanno lasciati a digiuno per un periodo adeguato alla specie. Si consiglia di determinare calcio, fosforo, cloruro, sodio, potassio, glucosio a digiuno, alanina aminotransferasi, aspartato aminotransferasi, ornitindecarbossilasi, gamma-glutamil-transpeptidasi, azoto ureico, albumina, creatininemia, bilirubina totale e proteine sieriche totali.
L'analisi delle urine va effettuata almeno all'inizio dello studio e successivamente a metà e alla conclusione, raccogliendo le urine in tempi prestabiliti. Le determinazioni da effettuare comprendono aspetto, volume, osmolalità o densità relativa, pH, proteine, glucosio e sangue/cellule ematiche. Se necessario, per ampliare lo studio dell'effetto o degli effetti osservato/i è possibile impiegare ulteriori parametri.
È inoltre necessario considerare la possibilità di condurre studi sui marker dei danni generici ai tessuti. Altre determinazioni che possono rendersi necessario per un'adeguata valutazione tossicologica comprendono le analisi dei lipidi, degli ormoni, equilibrio acidi/basi, metaemoglobina e inibizione della colinesterasi. Se necessario, per ampliare lo studio degli effetti osservati è possibile effettuare ulteriori esami biochimici clinici. Queste determinazioni vanno effettuate per alcune classi di sostanze chimiche oppure caso per caso.
Nel complesso è necessario adottare un approccio flessibile, in funzione delle specie e dell'effetto osservato e/o previsto relativo ad una data sostanza.
1.5.5.3. Necroscopia macroscopica
Tutti gli animali dello studio vanno sottoposti a completa e dettagliata necroscopia macroscopica che comprende un attento esame della superficie esterna del corpo, di tutti gli orifizi e delle cavità cranica, toracica e addominale e del loro contenuto. Fegato (compresa la cistifellea), reni, ghiandole surrenali, testicoli, epididimi, ovaie, utero, tiroide (con paratiroidi), timo, milza, cervello e cuore di tutti gli animali (tranne quelli trovati moribondi e/o sacrificati nel frattempo) vanno opportunamente liberati da eventuali tessuti aderenti e pesati umidi immediatamente dopo la dissezione, per evitare l'essiccamento.
I seguenti tessuti vanno conservati nel mezzo di fissazione più adatto, sia per il tipo di tessuto, sia per il successivo esame istopatologico che si intende effettuare: tutte le lesioni macroscopiche, cervello (porzioni rappresentative comprendenti cervello, cervelletto, bulbo e/o ponte), midollo spinale (a tre livelli: cervicale, mediotoracico e lombare), ghiandola pituitaria, occhi, tiroide, paratiroide, timo, esofago, ghiandole salivari, stomaco, intestino tenue e crasso (comprese le placche di Peyer), fegato, cistifellea, pancreas, reni, ghiandole surrenali, milza, cuore, trachea e polmoni, aorta, gonadi, utero, annessi, ghiandola mammaria delle femmine, prostata, vescica, linfonodi (preferibilmente un linfonodo interessato dalla via di somministrazione e un altro distante dalla via di somministrazione per coprire gli effetti sistemici), un nervo periferico (sciatico o tibiale) preferibilmente in prossimità del muscolo, una sezione di midollo osseo (e/o un aspirato di midollo osseo fresco) e cute. I reperti clinici e di altro tipo possono evidenziare la necessità di esaminare altri tessuti. Vanno inoltre conservati tutti gli organi considerati organi bersaglio in base alle proprietà note della sostanza in esame.
1.5.5.4. Esame istopatologico
Vanno sottoposti a esame istopatologico completo gli organi e i tessuti conservati di almeno tutti gli animali del gruppo di controllo e del gruppo che riceve la dose più elevata. Si procede a questo esame anche sugli animali degli altri gruppi qualora nel gruppo a cui viene somministrata la dose più elevata si osservano alterazioni correlate al trattamento.
Vanno esaminate tutte le lesioni macroscopiche.
Quando si utilizza un gruppo satellite l'esame istopatologico va eseguito sui tessuti e sugli organi per i quali sono stati osservati effetti nei gruppi trattati.
2. DATI E RELAZIONE
2.1. DATI
I dati devono essere forniti separatamente per ogni soggetto. Inoltre, tutti i dati vanno riassunti sotto forma di tabelle che indichino per ogni gruppo sperimentale il numero di animali presenti all'inizio della prova, il numero di animali trovati morti durante il test o sacrificati per motivi umanitari e il momento di tutti i decessi/soppressioni, il numero di animali che presentano segni di tossicità, una descrizione dei segni di tossicità osservati, quali momento dell'esordio, durata e gravità di tutti gli effetti tossici, il numero di animali che presentano lesioni, il tipo di lesioni e la percentuale di animali rapportata al tipo di lesione.
I risultati numerici vanno valutati mediante un metodo statistico adeguato e generalmente accettabile. I metodi statistici e i dati da analizzare vanno scelti già in sede di determinazione del disegno sperimentale.
2.2. RELAZIONE SUL TEST
La relazione sul test deve contenere le seguenti informazioni:
2.2.1. Sostanza di prova:
|
—
|
natura fisica, purezza e proprietà fisico-chimiche,
|
|
—
|
veicolo (se utilizzato): motivazione per la scelta del veicolo, se diverso dall'acqua.
|
2.2.2. Specie di prova:
|
—
|
numero, età e sesso degli animali,
|
|
—
|
origine, condizioni di stabulazione, dieta, ecc.,
|
|
—
|
peso dei singoli animali all'inizio del test.
|
2.2.3. Condizioni di esecuzione del test:
|
—
|
motivo della scelta del livello di dose,
|
|
—
|
dettagli sulla formulazione della sostanza in esame/preparazione dietetica, sulla concentrazione ottenuta, sulla stabilità e l'omogeneità della preparazione,
|
|
—
|
dettagli sulla somministrazione della sostanza in esame,
|
|
—
|
dosi effettive (mg/kg di peso corporeo/die) e fattore di conversione dalla concentrazione della sostanza di prova nella dieta/acqua di abbeveraggio (ppm) alla dose effettiva, se del caso,
|
|
—
|
particolari sulla qualità del cibo e dell'acqua.
|
2.2.4. Risultati:
|
—
|
peso corporeo/cambiamenti del peso corporeo,
|
|
—
|
assunzione di cibo, ed eventualmente di acqua,
|
|
—
|
dati sulla risposta tossica per sesso e livello di dose, compresi segni di tossicità,
|
|
—
|
natura, gravità e durata delle osservazioni cliniche (reversibili o meno),
|
|
—
|
test ematologici con i relativi valori basali,
|
|
—
|
test biochimici cimici con i relativi valori basali,
|
|
—
|
peso corporeo terminale, peso degli organi e rapporti tra peso degli organi e peso corporeo,
|
|
—
|
risultati della necroscopia,
|
|
—
|
descrizione dettagliata di tutti i reperti istopatologici,
|
|
—
|
dati sull'assorbimento, se disponibili,
|
|
—
|
elaborazione statistica dei risultati, se del caso.
|
Discussione dei risultati.
Conclusioni.
B.28 SAGGIO DI TOSSICITÀ CUTANEA SUBCRONICA SAGGIO CON SOMMINISTRAZIONE CUTANEA RIPETUTA DI DOSI PER 90 GIORNI USANDO SPECIE DI RODITORI
1. METODO
1.1. INTRODUZIONE
Vedi introduzione generale, parte B.
1.2. DEFINIZIONI
Vedi introduzione generale, parte B.
1.3. SOSTANZE DI RIFERIMENTO
Nessuna.
1.4. PRINCIPI DEL METODO DI SAGGIO
La sostanza sperimentale viene applicata quotidianamente alle cute in dosi scalari a vari gruppi di animali da esperimento, una dose per gruppo per un periodo di 90 giorni. Durante il periodo di somministrazione, gli animali vengono giornalmente sottoposti ad osservazione per individuare segni di tossicità. Gli animali che muoiono durante il saggio vengono sottoposti a necroscopia, ed alla conclusione della prova anche gli animali superstiti vengono sottoposti a necroscopia.
1.5. CRITERI QUALITATIVI
Nessuno.
1.6. DESCRIZIONE DEL METODO DI SAGGIO
Preparazioni
Gli animali sono tenuti nelle condizioni sperimentali di alloggiamento ed alimentazione per almeno 5 giorni prima dell'inizio del saggio. Prima dell'esperimento, gli animali giovani e sani vengono mischiati con metodo casuale ed assegnati ai gruppi di trattamento e di controllo. Poco prima dell'inizio dell'esperimento gli animali da trattare vengono tosati nella zona dorsale del tronco. Si può usare la rasatura, ma questa dovrebbe essere effettuata circa 24 ore prima del saggio. La tosatura o la rasatura usualmente deve essere ripetuta ad intervalli approssimativamente settimanali. Durante la tosatura o la rasatura del pelo, occorre fare attenzione a non scorticare la pelle. La superficie corporea da trattare per l'applicazione della sostanza in esame non dovrebbe essere inferiore al 10 % del totale. Il peso dell'animale dovrebbe essere preso in considerazione quando si decidono le dimensioni delle superficie da liberare dal pelo e dalla copertura. Quando si saggiano solidi, che possono essere polverizzati se del caso, la sostanza in esame dovrebbe essere umidificata sufficientemente con l'acqua o, se necessario, con un veicolo adatto per assicurare un buon contatto con la pelle. Le sostanze in esame liquide sono in genere usate non diluite. L'applicazione quotidiana si estenderà da 5 a 7 giorni per settimana.
Condizioni sperimentali
Animali da esperimento
Si possono utilizzare esemplari adulti di ratto, coniglio o cavia. Altre specie possono essere utilizzate, ma il loro uso richiede una giustificazione. All'inizio del saggio, la gamma di variazione del peso dovrebbe essere ± 20 % del peso medio. Quando uno studio di tossicità subcronica cutanea viene condotto come preliminare ad uno studio a lungo termine, in entrambi gli studi si dovrebbe usare la stessa specie e lo stesso ceppo.
Numero e sesso
Per ciascun livello di dose si dovrebbero utilizzare almeno 20 animali (10 maschi e 10 femmine) con pelle sana. Le femmine dovrebbero essere nullipare e non gravide. Se si prevede di sacrificare ad intervalli alcuni animali, il numero totale dovrebbe essere aumentato del numero di animali che si prevede di sacrificare prima del completamento dello studio. Inoltre, un gruppo satellite di 20 animali (10 animali per sesso) può essere trattato con il livello di dose elevato per 90 giorni e sottoposto ad osservazione per l'individuazione della reversibilità, della persistenza o dell'insorgenza ritardata di effetti tossici per 28 giorni dopo il trattamento.
Livelli di dose
Almeno tre livelli di dose con un controllo o un controllo del veicolo, se si utilizza un veicolo, sono richiesti. Il periodo di esposizione dovrebbe essere di almeno 6 ore al giorno. L'applicazione della sostanza in esame dovrebbe essere eseguita ogni giorno alla stessa ora e la quantità di sostanza applicata dovrebbe essere aggiustata a intervalli (settimanali o bisettimanali) per mantenere un livello costante di dose in termini di peso corporeo dell'animale. Eccezion fatta per il trattamento con la sostanza in esame, gli animali nel gruppo di controllo dovrebbero essere trattati in modo identico ai soggetti dei gruppi trattati. Quando per facilitare il dosaggio si usa un veicolo, il gruppo di controllo del veicolo dovrebbe essere sottoposto a dosaggio come i gruppi trattati, e ricevere la stessa quantità che riceve il gruppo a livello di dose più elevata. Il livello di dose più elevato dovrebbe provocare effetti tossici ma produrre pochi o nessun decesso. Il livello di dose più basso non dovrebbe produrre effetti tossici. Quando esista una valutazione utile di esposizione umana, il livello più basso dovrebbe superare questo valore. Idealmente, il livello di dose intermedio dovrebbe produrre effetti tossici osservabili minimi. Se viene usata più di una dose intermedia, i livelli di dose dovrebbero essere intervallati per produrre una graduazione degli effetti tossici. Nei gruppi trattati con livello di dose basso, intermedio e nei controlli, l'incidenza delle morti dovrà essere bassa e tale da permettere una valutazione significativa dei risultati.
Se l'applicazione della sostanza in esame produce irritazioni gravi della pelle, le concentrazioni dovrebbero essere ridotte e ciò può provocare una riduzione, o l'assenza, di altri effetti tossici al livello di dose elevato. Sela pelle è stata gravemente danneggiata, può rendersi necessaria l'interruzione dello studio, Si procederà quindi a un nuovo studio con concentrazione più basse.
Saggio limite
Se uno studio preliminare con livello di dose di 1 000 mg/kg o un livello di dose più elevato in relazione a una possibile esposizione umana, quando questa sia nota, non produce effetti tossici, ulteriori prove possono non essere considerate necessarie.
Periodo di osservazione
Gli animali da esperimento dovrebbero essere osservati quotidianamente per individuare eventuali segni di tossicità. Il tempo della morte e quello dell'insorgenza o della scomparsa dei segni di tossicità dovrebbero essere registrati.
Procedimento
Gli animali dovrebbero essere ingabbiati individualmente e sottoposti a trattamento con la sostanza in esame, idealmente 7 giorni per settimana, per un periodo di 90 giorni.
Gli animali appartenenti a ciascun gruppo satellite previsto per ulteriori osservazioni dovrebbero essere mantenuti ancora per 28 giorni per individuare i sintomi di guarigione oppure di persistenza degli effetti tossici. Il tempo di esposizione dovrebbe essere 6 ore/giorno.
La sostanza in esame dovrebbe essere applicata uniformemente su un'area che è approssimativamente il 10 % della superficie corporea totale. Con sostanze molto tossiche, la superficie coperta può essere inferiore, ma deve comunque essere coperta da uno strato più uniforme e più sottile possibile.
Durante l'esposizione, la sostanza in esame viene tenuta a contatto con la pelle da una fascia porosa di garza e da un nastro non irritante. La superfìcie cutanea su cui è applicata la sostanza dovrebbe essere coperta opportunamente in modo da trattenere la fascia e la sostanza in esame, per evitare un'eventuale ingestione da parte degli animali della sostanza in esame. Si può ricorrere a mezzi per limitare i movimenti dell'animale, ma l'immobilizzazione completa non è un metodo raccomandato.
Alla fine del periodo di esposizione, la sostanza in esame residua dovrebbe essere rimossa, ove possibile, con l'uso di acqua o con qualche altro metodo appropriato per pulire la pelle.
Tutti gli animali dovrebbero essere quotidianamente sottoposti a osservazione e si dovrebbe registrare i segni di tossicità, incluso il tempo d'insorgenza, l'intensità e la durata. Le osservazioni collaterali dovrebbero includere i cambiamenti della cute e del pelo, degli occhi e delle mucose, nonché del sistema nervoso centrale e autonomo, del sistema respiratorio e circolatorio, dell'attività somatomotoria e del quadro comportamentale. Si dovrebbe procedere settimanalmente alla misura del consumo alimentare e alla pesatura degli animali. L'osservazione regolare degli animali è necessaria per assicurarsi che gli stessi non siano persi a causa di cannibalismo, autolisi dei tessuti o smarrimento. Alla fine del periodo di studio tutti gli animali sopravvissuti dei gruppi di trattamento non satelliti sono sottoposti a necroscopia. Gli animali moribondi dovrebbero essere rimossi e sottoposti a necroscopia.
I seguenti esami vengono effettuati abitualmente per tutti gli animali, compresi i controlli:
|
a)
|
l'esame oftalmoscopico, eseguito con un oftalmoscopio o attrezzatura analoga, dovrebbe essere effettuato prima della somministrazione della sostanza sperimentale e alla conclusione dello studio, preferibilmente su tutti gli animali, o perlomeno su quelli a cui vengono somministrati il dosaggio elevato, e infine al gruppo di controllo. Se vengono individuati cambiamenti negli occhi, tutti gli animali dovrebbero essere esaminati;
|
|
b)
|
alla fine del periodo di saggio, si dovrebbero effettuare le seguenti analisi: ematologia, incluso ematocrito, concentrazione di emoglobina degli eritrociti, conteggio totale e differenziale dei leucociti, misurazione del potenziale di coagulazione, quale il tempo di coagulazione, il tempo di protrombina, il tempo di tromboplastina o il conteggio delle piastrine;
|
|
c)
|
la determinazione della biochimica clinica sul sangue dovrebbe essere effettuata alla fine del periodo di saggio. Le aree di studio, ritenute opportune per tutti gli studi sono: equilibrio degli elettroliti, metabolismo dei carboidrati, funzione epatica e renale. La selezione di prove specifiche sarà determinata dalle osservazioni sul modo di azione della sostanza. Si suggerisce di determinare: calcio, fosforo, cloruro, sodio, potassio, glucosio a digiuno (con periodo di digiuno appropriato alla specie), glutamminico-piruvica transaminasi serica (4), glutammico-ossalacetico transaminasi serica (5), ornitina decarbossilasi, gamma glutammil transpeptidase, azoto ureico, albumina, creatinina ematica, bilirubina totale e proteine totali del siero. Altre determinazioni che possono rendersi necessarie per una valutazione tossicologica adeguata, includono: analisi dei lipidi, ormoni, equilibrio acido/base, metaemoglobina, attività della colinesterasi. Determinazioni biochimiche supplementari possono essere usate, se necessarie, per estendere la ricerca di effetti osservati;
|
|
d)
|
l'analisi delle urine non è richiesta routinariamente, ma solo quando vi sia una indicazione basata sulla tossicità prevista o osservata.
|
Se i dati storici di base sono insufficienti, prima di iniziare il dosaggio si dovrebbe prendere in considerazione la determinazione dei parametri ematologici e di biochimica clinica.
Necroscopia macroscopica
Tutti gli animali dovrebbero essere sottoposti a necroscopia macroscopica completa, che include l'esame della superficie esterna del corpo, di tutti gli orifizi e delle cavità cranica, toracica e addominale e dei loro contenuti. Il fegato, i reni, le ghiandole surrenali e i testicoli devono essere pesati umidi, appena possibile dopo la dissezione, per evitare l'essiccamento. I seguenti organi e tessuti dovrebbero essere conservati in mezzo adatto per possibili esami istopatologici futuri: tutte le lesioni macroscopiche; cervello — comprese sezioni di midollo/ponte, corteccia cerebellare e corteccia cerebrale, pituitaria, tiroide/paratiroide, qualsiasi tessuto timico, (trachea), polmoni, cuore, aorta, ghiandole salivari, fegato, milza, reni, ghiandole surrenali, pancreas, gonadi, utero, organi genitali accessori, cistifellea (se esiste), esofago, stomaco, duodeno, digiuno, ileo, intestino cieco, colon, retto, vescica urinaria, linfonodi rappresentativi, (ghiandole mammarie femminili), (muscolatura della coscia), nervo periferico (occhi), (sterno con midollo osseo), (femore — compresa superficie articolare), (midollo spinale a tre livelli — cervicale, emitoracico e lombare) e (ghiandole lacrimali esorbitali). I tessuti citati tra parentesi devono essere esaminati solo se presentano sintomi di tossicità o se vi siano indicazioni che sono l'organo bersaglio coinvolto.
Esame istopatologico
|
a)
|
L'esame istopatologico completo dovrebbe essere effettuato sulla cute normale e sulla cute trattata, e sugli organi e tessuti degli animali nel gruppo trattato con dosaggio elevato e nel gruppo di controllo;
|
|
b)
|
tutte le lesioni macroscopiche dovrebbero essere esaminate;
|
|
c)
|
gli organi bersaglio dovrebbero essere esaminati anche nei gruppi trattati con altre dosi;
|
|
d)
|
quando si usano i ratti, si dovrebbe eseguire l'esame istopatologico dei polmoni degli animali dei gruppi trattati con dosaggi bassi e intermedi per l'individuazione di infezioni poiché ciò fornisce una valutazione appropriata dello stato di salute degli animali. Ulteriori esami istopatologici di routine possono non essere richiesti per gli animali di questi gruppi, ma devono sempre essere effettuati sugli organi che presentano lesioni nel gruppo trattato con dosi elevate;
|
|
e)
|
quando si fa uso di un gruppo satellite, si dovrebbe eseguire l'esame istopatologico dei tessuti e degli organi che presentano lesioni in altri gruppi trattati.
|
2. DATI
I dati dovrebbero essere riassunti sotto forma di tabelle, indicando per ogni gruppo sperimentale il numero di animali all'inizio del saggio, il numero di animali che presentano lesioni, il tipo di lesioni e la percentuale degli animali che presentano ciascun tipo di lesione. I risultati dovrebbero essere valutati con un metodo statistico appropriato. Qualsiasi metodo statistico riconosciuto può essere utilizzato.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
Nella relazione sul saggio devono figurare, se possibile:
|
—
|
specie, ceppo, origine, condizioni ambientali, dieta,
|
|
—
|
condizione sperimentali,
|
|
—
|
livello di dose (veicolo compreso, se utilizzato) e concentrazioni,
|
|
—
|
dati sulla risposta tossica per sesso e per dose,
|
|
—
|
livello senza effetto, quando possibile,
|
|
—
|
tempo della morte (durante l'esperimento) oppure specificare se gli animali sono sopravvissuti fino alla conclusione della prova,
|
|
—
|
descrizione degli effetti tossici o di altri effetti,
|
|
—
|
tempo di osservazione di ogni segno anormale e successivo decorso,
|
|
—
|
dati di alimentazione e sul peso corporeo,
|
|
—
|
risultati oftalmologici,
|
|
—
|
analisi ematologiche usate e risultati completi,
|
|
—
|
analisi di biochimica clinica usati e risultati completi (compresi i risultati dell'analisi delle urine),
|
|
—
|
risultati della necroscopia,
|
|
—
|
descrizione particolareggiata di tutti di risultati istopatologici,
|
|
—
|
elaborazione statistica dei risultati, quando possibile,
|
|
—
|
discussione dei risultati,
|
|
—
|
interpretazione dei risultati.
|
3.2. VALUTAZIONE ED INTERPRETAZIONE
Vedi introduzione generale, parte B.
4. RIFERIMENTI
Vedi introduzione generale, parte B.
B.29 SAGGIO DI TOSSICITÀ SUBCRONICA INALATORIA SAGGIO CON SOMMINISTRAZIONE INALATORIA RIPETUTA DI DOSI PER 90 GIORNI USANDO SPECIE DI RODITORI
1. METODO
1.1. INTRODUZIONE
Vedi introduzione generale, parte B.
1.2. DEFINIZIONI
Vedi introduzione generale, parte B.
1.3. SOSTANZE DI RIFERIMENTO
Nessuna.
1.4. PRINCIPI DEL METODO DI SAGGIO
Diversi gruppi di animali da esperimento sono esposti quotidianamente per un periodo definito alla sostanza in esame in concentrazioni graduate, utilizzando una concentrazione per gruppo, per un periodo di 90 giorni. Quando si utilizza un veicolo per contribuire a generare una concentrazione appropriata della sostanza in esame nell'atmosfera, si dovrebbe utilizzare un gruppo di controllo per il veicolo. Durante il periodo di somministrazione, gli animali vengono giornalmente sottoposti ad osservazione per individuare segni di tossicità. Gli animali che muoiono durante il saggio sono sottoposti a necroscopia; alla conclusione del saggio anche gli animali superstiti vengono sottoposti a necroscopia.
1.5. CRITERI QUALITATIVI
Nessuno.
1.6. DESCRIZIONE DEL METODO DI SAGGIO
Preparazioni
Gli animali sono tenuti nelle condizioni di alloggiamento e di alimentazione sperimentali per almeno cinque giorni prima dell'inizio della prova. Prima del saggio, animali giovani e sani sono mischiati con metodo casuale ed assegnati ai gruppi di trattamento e di controllo. Se necessario, un veicolo adatto può essere aggiunto alla sostanza in esame per contribuire a generare una concentrazione appropriata della sostanza nell'atmosfera. Se un veicolo o altri additivi vengono utilizzati per facilitare il dosaggio, essi dovrebbero essere noti per non produrre effetti tossici. Se del caso, i dati storici possono essere usati.
Condizioni sperimentali
Animali sperimentali
A meno che vi siano controindicazioni, la specie preferita è il ratto. Si dovrebbero usare animali sani giovani di ceppi comunemente usati in laboratorio. All'inizio dello studio la gamma di variazione del peso degli animali usati non dovrebbe essere superiore al ± 20 % del peso medio. Quando venga intrapreso uno studio subcronico per inalazione come preliminare ad uno studio a lungo termine, in entrambi gli studi si dovrebbe usare la stessa specie e stesso ceppo.
Numero e sesso
Per ciascuna concentrazione di esposizione si dovrebbero utilizzare almeno 20 animali (10 femmine e 10 maschi). Le femmine dovrebbero essere nullipare e non gravide. Se si prevede di sacrificare ad intervalli alcuni animali il numero dovrebbe essere aumentato del numero di animali che si prevede di sacrificare prima del completamento dello studio. Inoltre, un gruppo satellite di 20 animali (10 animali per sesso) può essere trattato con il livello di dose elevato per 90 giorni e sottoposto ad osservazione per l'individuazione della reversibilità, della persistenza o dell'insorgenza ritardata di effetti tossici per 28 giorni dopo il trattamento.
Concentrazione di esposizione
Sono richieste almeno tre concentrazioni, con un controllo o un controllo del veicolo (che corrisponde alla concentrazione del veicolo al livello più elevato) se si utilizza un veicolo. Eccezion fatta per il trattamento con la sostanza in esame, gli animali nel gruppo di controllo dovrebbero essere trattati in modo identico agli animali dei gruppi. La concentrazione più elevata dovrebbe provocare effetti tossici ma nessuna o poche morti. Quando esista una valutazione utile dell'esposizione umana, la concentrazione più bassa dovrebbe superare detto valore. Idealmente la concentrazione media dovrebbe produrre effetti tossici osservabili minimi. Se viene usata più di una concentrazione intermedia le concentrazioni dovrebbero essere intervallate per produrre una graduazione di effetti tossici. Nei gruppi trattati con concentrazioni basse ed intermedie e nei controlli, l'incidenza delle morti dovrebbe essere bassa per permettere una valutazione significativa dei risultati.
Tempo di esposizione
La durata dell'esposizione quotidiana dovrebbe essere di 6 ore, dopo la stabilizzazione delle concentrazione delle camere di inalazione. Altri tempi di esposizione possono essere usati per esigenze specifiche.
Attrezzatura
Gli esperimenti sugli animali dovrebbero essere effettuati in apparecchiatura per inalazione progettata per sostenere una corrente dinamica d'aria con almeno 12 cambiamenti d'aria l'ora, per assicurare un tenore di ossigeno adeguato e un'atmosfera di esposizione a distribuzione uniforme. Quando si usa una camera di inalazione la progettazione dovrebbe essere tale da evitare l'affollamento degli animali e di aumentare al massimo la loro esposizione per inalazione alla sostanza in esame. Di massima, per assicurare la stabilità dell'atmosfera della camera, il «volume» totale degli animali di saggio non dovrebbe superare il 5 % del volume della camera di prova. Si può usare il sistema di esposizione oro-nasale, della testa soltanto o del corpo intero; i primi due sistemi ridurranno al massimo l'assorbimento da altre vie.
Periodo di osservazione
Gli animali sperimentali dovrebbero quotidianamente essere sottoposti ad osservazione per individuare i segni di tossicità durante l'interno periodo di trattamento e di recupero. Si dovrebbe registrare anche il tempo della morte e quello dell'insorgenza o della scomparsa dei segni di tossicità.
Procedimento
Gli animali vengono esposti alla sostanza in esame 5-7 giorni per settimana, per un periodo di 90 giorni. Gli animali appartenenti ai gruppi satelliti previsti per ulteriori osservazioni dovrebbero essere tenuti ancora per 28 giorni senza trattamento per individuare la guarigione o la persistenza degli effetti tossici. La temperatura durante la prova dovrebbe essere mantenuta a 22 oC (± 3 oC). Idealmente, l'umidità relativa dovrà essere mantenuta tra il 30 % ed il 70 %, ma in certi casi (ad esempio, saggi di aerosol) ciò potrebbe non essere possibile. Il cibo e l'acqua non dovrebbero essere somministrati durante l'esposizione.
Si dovrebbe usare un sistema dinamico con un idoneo sistema di controllo analitico della concentrazione. Per stabilire le opportune concentrazioni di esposizione si raccomanda di effettuare una prova. Il flusso d'aria dovrebbe essere regolato in modo da garantire che le condizioni nella camera d'esposizione siano omogenee. Il sistema dovrebbe garantire che condizioni stabili di esposizione siano realizzate il più rapidamente possibile.
Si dovrebbero misurare e controllare:
|
a)
|
la velocità della corrente d'aria (in continuo);
|
|
b)
|
la concentrazione reale della sostanza in esame misurata nella zona di respirazione.. Durante il periodo di esposizione quotidiana, la concentrazione non dovrebbe subire variazioni più del ± 15 % del valore medio. Tuttavia, nel caso delle polveri e degli aerosol questo livello di controllo potrebbe non essere realizzabile e un più vasto intervallo sarebbe quindi accettabile. Durante tutto il periodo dello studio la concentrazione giornaliera dovrebbe essere tenuta costante nei limiti del possibile. Durante la messa a punto del sistema di generazione si dovrebbe eseguire l'analisi delle dimensioni e delle particelle per stabilire la stabilità delle concentrazioni di aerosol. Durante l'esposizione, le analisi dovrebbero essere effettuate con la necessaria frequenza per determinare l'uniformità di distribuzione delle dimensioni delle particelle;
|
|
c)
|
temperatura ed umidità;
|
|
d)
|
durante e dopo l'esposizione le osservazioni sono effettuate e registrate sistematicamente; per ogni animale si dovrebbero tenere registri individuali. Tutti gli animali dovrebbero essere osservati quotidianamente e si dovrebbero registrare i segni di tossicità, incluso il tempo di insorgenza, il grado e la durata. Le osservazioni collaterali dovrebbero includere i cambiamenti della cute e del pelo, degli occhi e delle mucose nonché del sistema nervoso centrale ed autonomo, di quello respiratorio e circolatorio, dell'attività somatomotoria e del quadro comportamentale. Si dovrebbe procedere settimanalmente alla misura del consumo alimentare ed alla pesatura degli animali. L'osservazione regolare degli animali è necessaria per assicurare che gli stessi non siano persi per lo studio a causa di cannibalismo, autolisi dei tessuti o smarrimento. Alla fine del periodo di studio tutti gli animali sopravvissuti sono sottoposti a necroscopia. Gli animali moribondi dovrebbero essere rimossi e sottoposti a necroscopia, quando notati.
|
I seguenti esami vengono effettuati abitualmente per tutti gli animali, compresi i controlli:
|
a)
|
l'esame oftalmoscopico, eseguito con un oftalmoscopio o idonea attrezzatura analoga, dovrebbe essere effettuato prima dell'esposizione alla sostanza in esame e alla conclusione dello studio, preferibilmente su tutti gli animali o perlomeno su quelli cui viene somministrato il dosaggio elevato e al gruppo di controllo. Se vengono individuati cambiamenti agli occhi tutti gli animali dovrebbero essere esaminati;
|
|
b)
|
alla fine del periodo di saggio, si dovrebbero effettuare le seguenti analisi: ematologia, incluso ematocrito, concentrazione di emoglobina, conteggio degli eritrociti, conteggio totale e differenziale dei leucociti, misura del potenziale di coagulazione, quale il tempo di coagulazione, il tempo di protrombina, il tempo di tromboplastina o conteggio delle piastrine;
|
|
c)
|
la determinazione della biochimica clinica sul sangue dovrebbe essere effettuata alla fine del periodo di saggio. Le aree di saggio che sono considerate opportune per tutti gli studi sono: equilibrio degli elettroliti, metabolismo dei carboidrati, funzione epatica e renale. La selezione delle prove specifiche sarà determinata dalle osservazioni sul modo di azione della sostanza. Si suggerisce di determinare: calcio, fosforo, cloruro, sodio, potassio, glucosio a digiuno (con periodo di digiuno appropriato alla specie), glutamminico-piruvico transaminasi serica (4), glutammino-ossalacetico transaminasi serica (5), ornitina decarbossilasi, gamma glutammil transpeptidase, azoto ureico, albumina, creatinina nel sangue, bilirubina totale e misurazione delle proteine totali del siero. Altre determinazioni che possono rendersi necessarie per una valutazione tossicologica adeguata, includono: analisi dei lipidi, ormoni, equilibrio acido/base, metaemoglobina, attività della colinesterasi. Determinazione biochimiche supplementari possono essere usate, se necessario, per estendere la ricerca sugli effetti osservati;
|
|
d)
|
l'analisi delle urine non è richiesta routinariamente, ma solo quando vi siano indicazioni basate sulla tossicità prevista o osservata.
|
Se i dati storici di base sono insufficienti, prima di iniziare il dosaggio si dovrebbe prendere in considerazione la determinazione dei parametri ematologici e di biochimica clinica.
Necroscopia macroscopica
Tutti gli animali dovrebbero essere sottoposti a necroscopia macroscopica completa, che include l'esame della superficie esterna del corpo, di tutti gli orifizi e delle cavità cranica, toracica e addominale e dei loro contenuti. Il fegato, i reni, le ghiandole surrenali e i testicoli dovranno essere pesati umidi, appena possibile dopo la dissezione, per evitare l'essiccamento. I seguenti organi e tessuti dovrebbero essere conservati in mezzo adatto per possibili esami istopatologici futuri: tutte le lesioni generali, polmoni — che dovrebbero essere rimossi intatti, pesati e trattati con un fissativo adatto per garantire che la struttura polmonare rimanga intatta (la perfusione con fissativo è considerata un procedimento efficace), tessuti rinofaringei, cervello — comprese sezioni di midollo/ponte, corteccia cerebellare e corteccia cerebrale, pituitaria, tiroide/paratiroide, qualsiasi tessuto timico, trachea e polmoni, cuore, aorta, ghiandole salivari, milza, fegato, reni, ghiandole surrenali, pancreas, gonadi, utero, (organi genitali accessori), (pelle), cistifellea (se presente), esofago, stomaco, duodeno, digiuno, ileo, intestino cieco, colon, retto, vescica urinaria, linfonodi rappresentativi, (ghiandole mammarie femminili), (muscolatura della coscia), nervo periferico (occhi), sterno con midollo osseo, (femore — compresa superficie articolare), (midollo spinale a tre livelli — cervicale, emitoracico e lombare), e (ghiandole lacrimali esorbitali). I tessuti citati tra parentesi devono essere esaminati solo se presentano segni di tossicità o se vi siano indicazioni che sono l'organo bersaglio coinvolto.
Esame istopatologico
|
a)
|
L'esame istopatologico completo dovrebbe essere effettuato sulle vie respiratorie e su altri organi e tessuti di tutti gli animali nel gruppo trattato con dosaggio elevato e nel gruppo di controllo;
|
|
b)
|
tutte le lesioni macroscopiche dovrebbero essere esaminate;
|
|
c)
|
gli organi bersaglio in gruppi trattati con altre dosi dovrebbero essere esaminati;
|
|
d)
|
i polmoni degli animali nei gruppi trattati con dosaggio basso ed intermedio dovrebbero essere sottoposti ad esame istopatologico per l'individuazione di infezioni, poiché ciò fornisce una valutazione appropriata dello stato di salute degli animali. Ulteriori esami istopatologici di routine possono non essere richiesti per gli animali di questi gruppi, ma devono sempre essere effettuati sugli organi che presentano lesioni nel gruppo trattato con dose elevata;
|
|
e)
|
quando si fa uso di gruppo satellite, si dovrebbe eseguire l'esame istopatologico degli stessi tessuti e degli organi che presentano effetti in altri gruppi trattati.
|
2. DATI
I dati dovrebbero essere riassunti sono forma di tabelle, indicando per ogni gruppo di saggio il numero di animali all'inizio del saggio, il numero degli animali che presentano lesioni, i tipi di lesione e la percentuale degli animali che presenta ciascun tipo di lesioni. I risultati dovrebbero essere valutati con un metodo statistico idoneo. Qualsiasi metodo statistico riconosciuto può essere utilizzato.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
Nella relazione sul saggio devono figurare, se possibile:
|
—
|
specie, ceppo, origine, condizioni ambientali, dieta,
|
|
—
|
condizioni sperimentali:
descrizione dell'apparecchiatura di esposizione inclusi progettazione, tipo, dimensioni, generatore dell'aria, sistema di generazione delle particelle e degli aerosol, metodo di condizionamento dell'aria, trattamento dell'aria di scarico e metodo di alloggiamento degli animali in una camera di saggio, quando questa sia usata. L'attrezzatura per la misura della temperatura, dell'umidità e, se del caso, della stabilità delle concentrazioni di aerosol o delle dimensioni delle particelle dovrebbe essere descritta.
Dati di esposizione: i dati dovrebbero essere tabulati presentati con valori medi e una misura della variabilità (ad esempio deviazione standard) e dovrebbero includere:
|
a)
|
velocità del flusso dell'aria attraverso l'attrezzatura per l'inalazione;
|
|
b)
|
temperatura ed umidità dell'aria;
|
|
c)
|
concentrazioni nominali (quantità totale della sostanza in esame immessa nell'apparecchiatura per l'inalazione, divisa per il volume dell'aria);
|
|
d)
|
natura del veicolo, se usato;
|
|
e)
|
concentrazione reali nella zona di respirazione;
|
|
f)
|
dimensioni delle particelle mediane (se del caso),
|
|
|
—
|
dati sulla risposta tossica per sesso e per concentrazione,
|
|
—
|
livello senza effetto, quando possibile,
|
|
—
|
tempo della morte (durante l'esperimento) oppure specificare se gli animali sono sopravvissuti fino alle conclusione della prova,
|
|
—
|
descrizione degli effetti tossici o di altri effetti,
|
|
—
|
tempo di osservazione di ogni segno anomalo e successivo decorso,
|
|
—
|
dati di alimentazione sul peso corporeo,
|
|
—
|
risultati oftalmologici,
|
|
—
|
prove ematologiche usate e risultati completi,
|
|
—
|
prove di biochimica clinica usate e risultati (compresi i risultati dell'analisi delle urine),
|
|
—
|
risultati della necroscopia,
|
|
—
|
descrizione particolareggiata di tutti i risultati istopatologici,
|
|
—
|
elaborazione statistica dei risultati, quando possibile,
|
|
—
|
discussione dei risultati,
|
|
—
|
interpretazione dei risultati.
|
3.2. VALUTAZIONE ED INTERPRETAZIONE
Vedi introduzione generale, parte B.
4. RIFERIMENTI
Vedi introduzione generale, parte B.
B.30 SAGGIO DI TOSSICITÀ CRONICA
1. METODO
1.1. INTRODUZIONE
Vedi introduzione generale, parte B.
1.2. DEFINIZIONI
Vedi introduzione generale, parte B.
1.3. SOSTANZE DÌ RIFERIMENTO
Nessuna.
1.4. PRINCIPIO DEL METODO DI SAGGIO
La sostanza in esame è somministrata normalmente 7 giorni per settimana, per una via opportuna, a diversi gruppi di animali sperimentali, una dose per gruppo, per la maggior parte della loro durata di vita. Durante e dopo l'esposizione alla sostanza in esame, gli animali sperimentali sono sottoposti ad osservazione quotidianamente per individuare segni di tossicità.
1.5. CRITERI QUALITATIVI
Nessuno.
1.6. DESCRIZIONE DEL METODO DI SAGGIO
Preparazioni
Gli animali sono tenuti nelle condizioni di alloggiamento e nutrizione sperimentali per almeno 5 giorni prima dell'inizio del saggio. Prima dell'esperimento, gli animali giovani e sani vengono mescolati con metodo casuale ed assegnati a gruppi di trattamento e di controllo.
Condizioni di saggio
Animali da laboratorio
La specie preferita è il ratto.
Sulla base dei risultati di studi precedentemente effettuati, altre specie (roditori o non roditori) possono essere utilizzate. Si dovrebbero usare i ceppi di laboratorio generalmente utilizzati di giovani animali sani ed il dosaggio dovrebbe iniziare non appena possibile dopo lo svezzamento.
All'inizio dello studio, la variazione di peso negli animali usati non dovrebbe superare il ± 20 % del valore medio. Quando venga intrapreso uno studio di tossicità subcronica orale come preliminare ad uno studio a lungo termine, si dovrebbe usare la stessa specie e lo stesso ceppo in entrambi gli studi.
Numero e sesso
Per ciascun livello di dose si dovrebbero utilizzare, per i roditori, almeno 40 animali (20 maschi e 20 femmine) e un gruppo di controllo parallelo. Le femmine dovrebbero essere nullipare e non gravide. Se si prevede di sacrificare alcuni animali, il loro numero dovrà essere aumentato del numero di animali che si prevede di sacrificare prima del completamento dello studio.
Per i non roditori un numero inferiore di animali, almeno 4 per sesso e per gruppo, è accettabile.
Livelli di dose e frequenza dell'esposizione
Si dovrebbero utilizzare almeno tre livelli di dose oltre al gruppo di controllo. Il livello di dose più elevato dovrebbe provocare sintomi precisi di tossicità senza causare eccessiva mortalità.
Il livello di dose più basso non dovrebbe produrre alcuna evidenza di tossicità.
La dose (le dosi) intermedia(e) dovrebbe(ro) essere fissata(e) in un intervallo intermedio tra le dosi elevate e quelle basse.
Nella scelta dei livelli di dose si dovrebbe tener conto dei dati ottenuti da precedenti saggi e studi di tossicità.
Normalmente, la frequenza dell'esposizione è quotidiana. Se la sostanza chimica viene somministrata in acqua potabile o mescolata nella dieta, essa dovrebbe essere continuamente disponibile.
Controlli
Si dovrebbe usare un gruppo di controllo parallelo identico sotto tutti i punti di vista ai gruppi esposti, eccezion fatta per l'esposizione alla sostanza in esame.
In circostanze specifiche, come in studi di inalazione che richiedono l'uso di aerosol o di un emulsionante ad attività biologica non caratterizzata in studi orali, si dovrebbe usare anche un gruppo di controllo negativo parallelo. In gruppo di controllo negativo riceve lo stesso trattamento degli altri gruppi di animali sperimentali, eccettuato il fatto che gli animali non sono esposti alla sostanza sperimentale né ad alcun veicolo.
Vie di somministrazione
Le due vie principali di somministrazione sono quella orale e quella inalatoria. La scelta della via di somministrazione dipende dalle caratteristiche fisiche e chimiche della sostanza in esame e della via probabile di esposizione dell'uomo.
L'uso della via cutanea presenta considerevoli problemi pratici. La tossicità sistematica cronica derivante dall'assorbimento percutaneo può essere arguita normalmente dai risultati dell'altra prova orale e dalla conoscenza dell'entità dell'assorbimento percutaneo derivata dalle prove di tossicità percutanea.
Studi orali
Ove la sostanza in esame sia assorbita dal tratto gastrointestinale, e se la via orale è una via di esposizione degli esseri umani, la via orale di somministrazione è quella preferita, a meno che non vi siano controindicazioni. Gli animali possono ricevere la sostanza in esame nella loro dieta, sciolta in acqua potabile, o in capsula. Idealmente, dovrebbe essere usato un dosaggio giornaliero, sette giorni per settimana, perché un dosaggio di cinque giorni/settimana potrebbe provocare un recupero o una tossicità da privazione nel periodo di mancato dosaggio, influenzando così il risultato e la valutazione successiva. Tuttavia, sulla base principalmente di considerazioni pratiche, il dosaggio su una base di cinque giorni/settimana è considerato accettabile.
Studi di inalazione
Poiché gli studi sull'inalazione offrono problemi tecnici di maggior complessità delle altre vie di somministrazione, vengono qui fornite indicazioni più particolareggiate su questo modo di somministrazione. Dovrebbe essere notato che l'installazione endotracheale può costituire un'alternativa valida in situazioni specifiche.
Le esposizioni a lungo termine sono di solito modellate sull’esposizione umana prevista, che prevede per gli animali un'esposizione quotidiana di 6 ore dopo equilibrazione delle concentrazioni nella camera, per 5 giorni/settimana (esposizione intermittente), o su un'esposizione ambientale possibile, con 22-24 ore di esposizione/giorno, 7 giorni/settimana (esposizione continua), con circa un'ora/giorno per nutrire gli animali allo stesso orario e per la manutenzione della camera.
In entrambi i casi, gli animali sono di solito esposti a concentrazioni fisse delle sostanze in esame. Una differenza importante da considerare tra l'esposizione intermittente e quella continua è che, con la prima, vi è un periodo di 17-18 ore in cui gli animali possono riprendersi dagli effetti di ogni esposizione quotidiana, e un periodo di recupero ancora più lungo durante i fine settimana.
La scelta dell'esposizione intermittente o continua dipende dagli obiettivi dello studio e dall'esposizione umana che deve essere simulata. Tuttavia, certe difficoltà tecniche devono essere considerate. Ad esempio, i vantaggi dell'esposizione continua per simulare le condizioni ambientali possono essere controbilanciati dalla necessità di nutrire e abbeverare gli animali durante l'esposizione, o di disporre di aerosol di tipo più complicato (e affidabile) e di sistemi di generazione di vapore e di controllo.
Camere di esposizione
Gli animali dovrebbero essere sottoposti a sperimentazione in camere di inalazione progettate per sostenere un flusso dinamico con almeno 12 cambiamenti d'aria/ora, per assicurare un tenore di ossigeno adeguato e un'atmosfera di esposizione uniforme. Le camere di esposizione e di controllo dovrebbero essere identiche nella costruzione e nella progettazione, per poter assicurare condizioni di esposizione comparabili sotto tutti gli aspetti, eccezion fatta per l'esposizione alle sostanze in esame. Nella camera viene generalmente mantenuta una leggera depressione per impedire la fuoriuscita delle sostanze in esame nella zona circostante. Nelle camere si dovrebbe ridurre al minimo l'affollamento degli animali. Come regola generale, al fine di assicurare la stabilità dell'atmosfera della camera, il «volume» totale degli animali di saggio non dovrebbe superare il 5 % del volume della camera.
Si dovrebbero eseguire le misure o i controlli sottoelencati:
|
i)
|
Flusso dell'aria: la velocità del flusso d'aria attraverso la camera dovrebbe essere controllata preferibilmente in modo continuo.
|
|
ii)
|
Concentrazione: durante il periodo di esposizione quotidiana, la concentrazione della sostanza in esame non dovrebbe variare di più o meno il 15 % del valore medio.
|
|
iii)
|
Temperatura ed umidità: per i roditori la temperatura dovrebbe essere mantenuta sui 22 oC (± 2 oC), e l'umidità all'interno della camera al 30-70 %, eccetto quando l'acqua è usata per mantenere in sospensione la sostanza di prova nell'atmosfera della camera. Preferibilmente entrambe dovrebbero essere controllate in continuo.
|
|
iv)
|
Misura delle dimensioni delle particelle: la distribuzione delle dimensioni delle particelle dovrebbe essere determinata sulle atmosfere di camere che contengano aerosol liquidi o solidi. Le particelle contenute negli aerosol dovrebbero avere dimensioni tali da essere inalabili dall'animale da laboratorio usato. I campioni di atmosfera dovrebbero essere prelevati a livello della zona di respirazione degli animali. Il campione d'aria dovrebbe essere rappresentativo della distribuzione delle particelle a cui gli animali sono esposti e dovrebbe rappresentare, su una base gravimetrica, tutto l'aerosol sospeso anche quando gran parte di esso non è respirabile. Le analisi della grandezza delle particelle dovrebbero essere effettuate spesso durante la messa a punto del sistema di generazione per assicurare la stabilità dell'aerosol e, in seguito, quando si ritenga necessario, durante le esposizioni, per determinare in modo adeguato l'uniformità della distribuzione delle particelle a cui gli animali sono stati esposti.
|
Durata dello studio
La durata del periodo di somministrazione dovrebbe essere di almeno 12 mesi.
Procedimento
Osservazioni
Un accurato esame clinico dovrebbe essere eseguito almeno quotidianamente. Oltre alle osservazioni supplementari, si dovrebbero adottare le misure appropriate per ridurre al massimo la perdita di animali, ad esempio necroscopia o refrigerazione degli animali trovati morti e isolamento o sacrificio degli animali deboli o moribondi. Si dovrebbero eseguire accurate osservazioni per individuare l'insorgere e la progressione di tutti gli effetti tossici e per ridurre al massimo le perdite dovute a malattia, ad autolisi, o a cannibalismo.
I segni clinici, comprese le alterazioni oculari e neurologiche nonché la mortalità, dovrebbero essere registrati per tutti gli animali. Si dovrebbero registrare il tempo di insorgenza e la progressione delle condizioni tossiche, compresi i tumori sospetti.
Una registrazione individuale del peso corporeo di tutti gli animali dovrebbe essere effettuata una volta per settimana, durante le prime 13 settimane del periodo di saggio ed almeno una volta ogni 4 settimane in seguito. La quantità di cibo ingerita dovrebbe essere determinata settimanalmente durante le prime 13 settimane dello studio, e poi a intervalli di circa tre mesi, a meno che lo stato di salute o le variazioni del peso corporeo non impongano altre soluzioni.
Esame ematologico
L'esame ematologico (ad esempio: contenuto di emoglobina, volume delle cellule ammassate, eritrociti totali, leucociti totali, piastrine, o altre misure di potenziale di coagulazione) dovrebbe essere eseguito dopo 3 mesi, 6 mesi e quindi a intervalli di circa 6 mesi, ed alla conclusione dello studio, su campioni di sangue raccolti da tutti i non roditori e da 10 ratti per sesso di tutti i gruppi. Se possibile, questi prelievi dovrebbero essere effettuati ogni volta sugli stessi ratti. Inoltre, si dovrebbe raccogliere un campione prima dell'esperimento dai non roditori.
Se le osservazioni cliniche indicano un deterioramento nella salute degli animali durante lo studio, si dovrebbe eseguire un conteggio differenziale ematico dei suddetti animali.
Un conteggio differenziale ematico viene eseguito sui campioni provenienti dagli animali del gruppo a dosaggio più elevato e dai controlli. I conteggi differenziali ematici sono eseguiti per il gruppo seguente (o i gruppi seguenti) trattato con dosaggio inferiore, soltanto se vi sono discordanze importanti tra il gruppo trattato con dosaggio più elevato ed i controlli, o se vi sono indicazioni derivanti dai risultati dall'esame patologico.
Analisi delle urine
Per l'analisi si dovrebbero prelevare campioni di urina da tutti i non roditori e da 10 ratti per sesso di tutti i gruppi, se possibile dagli stessi ratti ed agli stessi intervalli dell'esame ematologico. Le seguenti determinazioni dovrebbero essere effettuate o sui singoli animali o su una miscela dei campioni per sesso e per gruppo di roditori:
|
—
|
aspetto: volume e densità per i singoli animali,
|
|
—
|
proteine, glucosio, chetoni, sangue occulto (semiquantitativamente),
|
|
—
|
microscopia del sedimento (semiquantitativamente).
|
Chimica clinica
Approssimativamente a intervalli di 6 mesi, ed alla conclusione del saggio, si prelevano campioni di sangue per le determinazioni di chimica clinica da tutti i non roditori e da 10 ratti/sesso di tutti i gruppi, se possibile dagli stessi ratti a ogni intervallo. Inoltre si dovrebbe prelevare un campione prima dell'esperimento dai non roditori. Da questi campioni viene preparato il plasma e vengono eseguite le seguenti analisi:
|
—
|
concentrazione delle proteine totali,
|
|
—
|
concentrazione dell'albumina,
|
|
—
|
saggio di funzionalità epatica (quali attività fosfatasi alcalina, glutammico-piruvico transaminasi (4) e transaminasi glutammico-ossalacetica (5), glutammil transpeptidasi, ornitina decarbossilasi),
|
|
—
|
metabolismo dei carboidrati, quali glucosio ematico a digiuno,
|
|
—
|
saggi di funzionalità renale, quali azoto ureico ematico.
|
Necroscopia macroscopica
È necessario un esame necroscopico completo di tutti gli animali, compresi quelli morti durante l'esperimento o uccisi perché moribondi. Prima del sacrificio da tutti gli animali si dovrebbero prelevare campioni di sangue per i conteggi differenziali ematici. Tutte le lesioni macroscopiche visibili, i tumori o le lesioni sospette quali tumori dovrebbero essere conservate. Si dovrebbe cercare di correlare le osservazioni macroscopiche con i risultati degli esami microscopici.
Tutti gli organi e i tessuti dovrebbero essere conservati per l'esame istopatologico. Questo di solito riguarda i seguenti organi e tessuti: cervello (6) (midollo/ponte, corteccia cerebellare, corteccia cerebrale), pituitaria, tiroide (compresa paratiroide), timo, polmoni (trachea compresa), cuore, aorta, ghiandole salivarie, fegato (6), milza, reni (6), ghiandole surrenali (6), esofago, stomaco, duodeno, digiuno, ileo, intestino cieco, colon, retto, utero, vescica urinaria, linfonodi, pancreas, gonadi (6), organi genitali accessori, ghiandole mammarie femminili, pelle, muscolatura, nervo periferico, midollo spinale (cervicale, toracico, lombare), sterno con midollo osseo e femore (articolazione compresa) e occhi. L'insufflazione dei polmoni e della vescica urinaria con un fissativo è il modo ottimale di conservare questi tessuti; l'insufflazione dei polmoni negli studi di inalazione è essenziale per eseguire un esame istopatologico appropriato. Negli studi speciali, quali quelli di inalazione, si studieranno l'intero tratto respiratorio compreso naso, faringe e laringe.
Se si eseguono altri esami clinici, le informazioni ottenute da questi dovranno essere disponibili prima dell'esame microscopico, perché esse possono fornire indicazioni significative al patologo.
Istopatologia
Tutte le alterazioni visibili, in particolare i tumori ed altre lesioni che si verificano in qualsiasi organo, dovrebbero essere esaminati microscopicamente. Inoltre si raccomandano le seguenti procedure:
|
a)
|
esame microscopico di tutti gli organi e tessuti conservati, con descrizione completa di tutte le lesioni riscontrate in:
|
1)
|
tutti gli animali che sono morti durante lo studio; e
|
|
2)
|
tutti quelli dei gruppi trattati con la dose elevata e controlli. Questi organi, prelevati da 10 animali per sesso e per gruppo per i roditori e da tutti i non roditori, più tiroide (con paratiroide) per tutti i non roditori, dovrebbero essere pesati;
|
|
|
b)
|
gli organi o i tessuti che mostrano anomalie causate, o possibilmente causate dalla sostanza in esame, vengono esaminati anche negli animali appartenenti ai gruppi trattati con le dosi più basse;
|
|
c)
|
se il risultato dell'esperimento evidenzia una riduzione sostanziale della longevità normale degli animali o induzione di effetti in grado di influire sulla risposta tossica, gli animali del gruppo trattato con livello di dose immediatamente inferiore dovrebbero essere esaminati come sopra descritto;
|
|
d)
|
informazioni sull'incidenza di lesioni normalmente riscontrate nel ceppo degli animali usati, nelle stesse condizioni di laboratorio ossia i dati storici dei controlli sono indispensabili per valutare correttamente l'importanza dei mutamenti osservati negli animali trattati.
|
2. DATI
I dati dovrebbero essere riassunti sotto forma di tabelle, indicando per ogni gruppo di saggio il numero di animali all'inizio del saggio, il numero degli animali che presenta lesioni e la percentuale degli animali che presenta ciascun tipo di lesione. I risultati dovrebbero essere valutati con un metodo statistico idoneo. Qualsiasi metodo statistico riconosciuto può essere utilizzato.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
Nella relazione sul saggio devono figurare, se possibile:
|
—
|
specie, ceppo, origine, condizioni ambientali, dieta,
|
|
—
|
condizioni sperimentali.
Descrizione dell'apparecchiatura per l'esposizione, inclusi:
progettazione, tipo, dimensioni, fonte dell'aria, sistema per generare particelle e aerosol, metodo di condizionamento dell'aria, trattamento dell'aria di scarico e metodo di alloggiamento degli animali in una camera di saggio, quando questa è utilizzata. L'attrezzatura per misurare la temperatura, l'umidità e, se del caso, la stabilità di concentrazione degli aerosol o la dimensione delle particelle dovrebbe essere descritta.
Dati di esposizione:
dovrebbero essere presentati in forma tabulare con i valori medi e una misura della variabilità (ad esempio: deviazione standard) e dovrebbero includere:
|
a)
|
portate dell'aria attraverso l'attrezzatura di inalazione;
|
|
b)
|
temperatura ed umidità dell'aria;
|
|
c)
|
concentrazioni nominali (quantità totale della sostanza in esame immessa nell'attrezzatura di inalazione divisa per il volume dell'aria);
|
|
d)
|
natura del veicolo, se usato;
|
|
e)
|
concentrazioni reali nella zona sperimentale di respirazione;
|
|
f)
|
dimensioni delle particelle medianti (se del caso);
|
|
|
—
|
livelli di dose (incluso il veicolo, se usato) e le concentrazioni,
|
|
—
|
dati relativi agli effetti tossici per sesso e dose,
|
|
—
|
tempo di eventi letali durante lo studio o se gli animali erano vivi al completamento del saggio,
|
|
—
|
descrizione degli effetti tossici e di altri effetti,
|
|
—
|
registrazione della data di osservazione di ogni sintomo anomalo e successivo decorso,
|
|
—
|
dati di alimentazione e di peso corporeo,
|
|
—
|
risultati oftalmologici,
|
|
—
|
prove ematologiche usate e risultati completi,
|
|
—
|
saggi di biochimica clinica usati e risultati completi (compresi i risultati dell'analisi delle urine),
|
|
—
|
risultati della necroscopia,
|
|
—
|
descrizione particolareggiata di tutti i risultati istopatologici,
|
|
—
|
elaborazione statistica dei risultati, quando possibile,
|
|
—
|
discussione dei risultati,
|
|
—
|
interpretazione dei risultati.
|
3.2. VALUTAZIONE ED INTERPRETAZIONE
Vedi introduzione generale, parte B.
4. RIFERIMENTI
Vedi introduzione generale, parte B.
B.31. STUDIO DI TOSSICITÀ PRENATALE
1. METODO
Questo metodo corrisponde al TG 414 (2001) dell'OCSE.
1.1. INTRODUZIONE
Questo metodo di test della tossicità prenatale è disegnato per fornire informazioni generiche riguardanti gli effetti dell'esposizione prenatale a determinate sostanze sia su femmine gravide che sull'organismo che si sta sviluppando nell'utero. Il test può comprendere la valutazione degli effetti sulla madre e delle cause della morte o di anomalie fisiche strutturali o alterazioni della crescita del feto. I deficit funzionali, per quanto costituiscano una parte importante dello sviluppo, non sono parte integrante del presente metodo e possono essere valutati in uno studio separato o come segmento aggiuntivo a questo studio, usando il metodo di test della neurotossicità nella fase di sviluppo. Per ottenere dati sull'analisi dei deficit funzionali e di altri effetti postnatali si rimanda, a seconda dei casi, al metodo di test per lo studio della tossicità sulla riproduzione in due generazioni o a quello sulla neurotossicità in fase di sviluppo.
Questo metodo di test può richiedere un adattamento particolare in alcuni casi, ad esempio in funzione delle conoscenze specifiche circa le proprietà fisico-chimiche o tossicologiche della sostanza di saggio. Tale adattamento è accettabile laddove, in base ad opportuni riscontri scientifici, risulti utile ai fini della raccolta di dati più specifici. In questo caso tali prove scientifiche vanno attentamente documentate nella relazione sullo studio.
1.2. DEFINIZIONI
Tossicologia prenatale: studio degli effetti negativi sull'organismo che si sta sviluppando che possono derivare dall'esposizione prima del concepimento, durante lo sviluppo prenatale o successivamente alla nascita fino al momento della maturazione sessuale. Le manifestazioni principali della tossicità sullo sviluppo comprendono 1) morte dell'organismo; 2) anomalia strutturale; 3) alterazione della crescita; e 4) deficit funzionali. L'espressione «tossicologia prenatale» ha soppiantato il termine «teratologia», utilizzato in passato.
Effetto negativo: qualsiasi alterazione rispetto al valore basale correlata al trattamento che riduca la capacità di un organismo di sopravvivere, riprodursi o adattarsi all'ambiente. Per quanto concerne la tossicologia prenatale, nel senso più ampio tale termine comprende qualunque effetto che interferisca con il normale sviluppo del concepito, sia prima che dopo la nascita.
Alterazione della crescita: alterazione di un organo o del peso corporeo o delle dimensioni della prole.
Alterazioni (anomalie): alterazioni strutturali dello sviluppo, comprendenti sia malformazioni che variazioni (28).
Malformazione/anomalia grave: modifica strutturale considerata dannosa per l'animale (può anche essere letale) e solitamente rara.
Variazione/anomalia non grave: modifica strutturale considerata scarsamente o per nulla dannosa per l'animale; può essere transitoria e può comparire con relativa frequenza nella popolazione di controllo.
Concepito: l'insieme dei derivati di un ovulo fertilizzato a qualsiasi stadio di sviluppo, dalla fecondazione fino alla nascita, comprendente le membrane extraembrionali nonché l'embrione o il feto.
Impianto (annidamento): attecchimento della blastocisti sul rivestimento epiteliale dell'utero, compresi la sua penetrazione attraverso l'epitelio uterino e il suo annidamento nell'endometrio.
Embrione: lo stadio precoce o di sviluppo di qualsiasi organismo, in particolare il prodotto in via di sviluppo della fecondazione di un uovo, dal momento in cui si individua l'asse longitudinale fino alla comparsa di tutte le strutture principali.
Embriotossicità: insieme di caratteristiche dannose per la struttura anatomica di un embrione, per il suo sviluppo, la crescita e/o la vitalità.
Feto: prodotto del concepimento nel periodo post-embrionale, prima della nascita.
Fetotossicità: insieme di caratteristiche dannose per la struttura anatomica di un feto, per il suo sviluppo, la crescita e/o la vitalità.
Aborto: espulsione prematura dall'utero dei prodotti del concepimento (ossia embrioni o feti non vitali).
Riassorbimento: un concepito che, dopo essersi impiantato nell'utero, muore e viene, o è stato, riassorbito.
Riassorbimento precoce: segni di avvenuto impianto in assenza di embrione o feto riconoscibili.
Riassorbimento tardivo: embrione o feto morto con alterazioni degenerative esterne.
NOAEL: abbreviazione di no-observed-adverse-effect level (livello al quale non si osservano effetti negativi) che indica la dose o il livello di esposizione massimi ai quali non si osservano effetti negativi correlati al trattamento.
1.3. SOSTANZA DI RIFERIMENTO
Nessuna.
1.4. PRINCIPIO DEL TEST
Di norma la sostanza di saggio viene somministrata a femmine gravide di animali da laboratorio come minimo dal momento dell'impianto fino al giorno precedente la soppressione programmata, che deve avvenire quanto più in prossimità della normale data del parto, senza tuttavia rischiare di perdere utili dati a causa di un parto prematuro. Il metodo di test non è inteso a esaminare esclusivamente il periodo dell'organogenesi (cioè i giorni 5-15 nei roditori, e i giorni 6-18 nei conigli), bensì anche gli effetti antecedenti all'impianto, se di pertinenza, lungo tutto il periodo di gestazione fino al giorno precedente l'isterotomia con taglio cesareo. Poco prima dell'intervento le femmine vengono soppresse, il contenuto dell'utero viene esaminato e i feti vengono valutati alla ricerca di anomalie visibili esteriormente e di alterazioni dei tessuti molli e dello scheletro.
1.5. DESCRIZIONE DEL METODO DI TEST
1.5.1. Selezione delle specie animali
Si raccomanda di effettuare il test sulle specie più adeguate e di utilizzare le specie e i ceppi da laboratorio solitamente impiegati per i test di tossicità prenatale. La specie di roditori di elezione è il ratto, mentre tra i non roditori si preferirà il coniglio. In caso di utilizzo di un'altra specie è necessario motivarne la scelta.
1.5.2. Condizioni di stabulazione e alimentazione
La temperatura dello stabulario deve essere di 22 oC (± 3o) per i roditori e 18 oC (± 3o) per i conigli. Sebbene l'umidità relativa debba raggiungere almeno il 30 % e preferibilmente non superare il 70 %, tranne che nel corso delle pulizie degli ambienti, occorre puntare a un valore del 50-60 %. L'illuminazione deve essere artificiale, con una sequenza di 12 ore di luce e 12 di oscurità. Per quanto concerne l'alimentazione si possono usare le diete convenzionali da laboratorio con una quantità illimitata di acqua potabile.
Le procedure di accoppiamento vanno effettuate in gabbie adeguate allo scopo. Sebbene sia preferibile alloggiare singolarmente gli animali accoppiati, è accettabile anche che vengano alloggiati in piccoli gruppi nella stessa gabbia.
1.5.3. Preparazione degli animali
Si utilizzano animali sani, che siano stati acclimatati alle condizioni di laboratorio per almeno 5 giorni e non siano stati precedentemente sottoposti ad altre procedure sperimentali. Gli animali sottoposti al test vanno caratterizzati per quanto concerne specie, ceppo, provenienza, sesso, peso e/o età. Gli animali di tutti i gruppi del test devono essere, per quanto praticamente possibile, di età e peso uniformi. Per ciascun livello di dose vanno usate giovani femmine adulte nullipare. Le femmine vanno fatte accoppiare con maschi della stessa specie e dello stesso ceppo, evitando l'accoppiamento fra consanguinei della stessa generazione. Nei roditori il giorno 0 di gestazione è il giorno in cui si osserva un tappo vaginale e/o la presenza di spermatozoi; nei conigli il giorno 0 è in genere il giorno del coito o dell'inseminazione artificiale, qualora venga utilizzata questa tecnica. Le femmine accoppiate vanno assegnate a random ai gruppi di controllo e di trattamento. Le gabbie vanno sistemate in modo da ridurre al minimo i possibili effetti dovuti alla loro posizione nell'ambiente. A ciascun animale va assegnato un numero identificativo unico. Se le femmine vengono fatte accoppiare in lotti, gli individui di ciascun lotto vanno equamente distribuiti nei vari gruppi. Analogamente, le femmine fecondate dallo stesso maschio vanno equamente distribuite tra i vari gruppi.
1.6. PROCEDURA
1.6.1. Numero e sesso degli animali
Ciascun gruppo di trattamento e di controllo deve contenere un numero sufficiente di femmine da fornire all'incirca 20 femmine con siti di impianto all'autopsia. Gruppi con meno di 16 femmine che presentano siti di impianto potrebbero risultare inadeguati. La mortalità delle femmine gravide non invalida necessariamente lo studio, a condizione che non superi il 10 % circa.
1.6.2. Preparazione delle dosi
Qualora per facilitare il dosaggio si impiegasse un veicolo o un altro additivo, occorre tenere conto delle seguenti caratteristiche: effetti su assorbimento, distribuzione, metabolismo e ritenzione o escrezione della sostanza di saggio; effetti sulle proprietà chimiche della sostanza di saggio che possono alterarne le caratteristiche tossiche; effetti sul consumo di cibo o di acqua o sulle condizioni nutrizionali degli animali. Il veicolo non deve avere effetti tossici sullo sviluppo, né influire sulla riproduzione.
1.6.3. Dosaggio
Di norma la sostanza di saggio va somministrata quotidianamente dal momento dell'impianto (ad esempio il giorno 5 dopo l'accoppiamento) fino al giorno precedente l'isterotomia. Se studi preliminari, ove disponibili, non indicano un alto potenziale di perdita preimpianto, il trattamento può comprendere l'intero periodo di gestazione, dall'accoppiamento fino al giorno precedente la soppressione. È noto che la manipolazione inadeguata delle femmine gravide o la loro esposizione a stress può provocare la perdita del feto o dell'embrione. Per evitare aborti dovuti a fattori non correlati al trattamento occorre maneggiare le femmine gravide solo se strettamente necessario, proteggendole da stress causati da fattori esterni (ad esempio il rumore).
Si somministrano almeno tre diversi livelli di dose e un controllo corrispondente. Gli animali sani vanno assegnati per randomizzazione ai gruppi di controllo e di trattamento. I livelli di dose vanno distanziati in modo che gli effetti tossici siano graduali. A meno che la natura fisico-chimica o le proprietà biologiche della sostanza di saggio non impongano limiti in tal senso, il livello della dose più elevata va scelto con l'obiettivo di indurre un determinato grado di tossicità sullo sviluppo dei feti e/o di tossicità materna (segni clinici oppure riduzione del peso corporeo), senza tuttavia provocarne il decesso o arrecare loro gravi sofferenze. Almeno un livello intermedio di dose deve produrre effetti tossici minimi osservabili. Il livello della dose minima non deve produrre segni di tossicità né nella madre, né nel feto. I livelli di dose devono essere selezionati in sequenza decrescente allo scopo di dimostrare la correlazione tra il dosaggio e la risposta e determinare il NOAEL. Per fissare le dosi a livelli decrescenti è utile utilizzare fattori compresi tra due e quattro; spesso è preferibile aggiungere un quarto gruppo di trattamento piuttosto che utilizzare intervalli molto distanziati (ad esempio un fattore superiore a 10) fra i dosaggi. Sebbene l'obiettivo sia determinare il NOAEL nelle femmine gravide, sono ritenuti comunque validi anche gli studi che non stabiliscono tale livello (1).
I livelli di dose vanno selezionati tenendo conto di eventuali dati esistenti sulla tossicità, oltre alle informazioni sul metabolismo e sulla tossicocinetica della sostanza di saggio o di sostanze ad essa correlate. Tali dati contribuiscono altresì a dimostrare l'adeguatezza del regime di dosaggio.
Occorre utilizzare al contempo un gruppo di controllo che va sottoposto a trattamento simulato oppure, qualora si utilizzi un veicolo per somministrare la sostanza di saggio, un gruppo che va trattato col solo veicolo. La quantità della sostanza di saggio o del veicolo da somministrare a tutti i gruppi deve essere uguale. Gli animali di controllo devono essere manipolati esattamente come quelli sottoposti al test. La quantità del veicolo da somministrare ai gruppi di controllo deve essere equivalente a quella più elevata utilizzata (come nel gruppo di trattamento con dosaggio più basso).
1.6.4. Test limite
Se, a seguito di somministrazione orale di un unico livello di dose di almeno 1 000 mg/kg peso corporeo/die, usando le procedure descritte nel presente studio, non si osservano effetti tossici nelle femmine gravide o nella loro progenie e qualora, sulla base di dati esistenti (ad esempio relativi a sostanze stutturalmente simili e/o metabolicamente correlate) non si preveda alcun effetto, lo studio completo con tre livelli di dose può non essere considerato necessario. Il livello probabile di esposizione umana può suggerire la necessità di utilizzare un livello di dose orale più elevata nel test limite. Per altre vie di somministrazione (ad es. inalazione o applicazione cutanea) sono spesso le proprietà fisico-chimiche della sostanza di saggio a indicare e limitare il massimo livello di esposizione raggiungibile (ad esempio l'applicazione cutanea non deve provocare grave tossicità locale).
1.6.5. Somministrazione delle dosi
La sostanza di saggio o il veicolo vengono normalmente somministrati oralmente per intubazione. Volendo utilizzare un'altra via di somministrazione occorre motivare e argomentare tale scelta; in tal caso potrebbe essere necessario modificare opportunamente il protocollo sperimentale (2)(3)(4). La sostanza di saggio va somministrata ogni giorno all'incirca alla stessa ora.
La dose somministrata ai singoli animali deve normalmente essere basata sulla determinazione più recente del peso corporeo individuale. Occorre tuttavia prestare particolare attenzione nel regolare la dose durante l'ultimo periodo della gravidanza. Nel selezionare le dosi è utile ricorrere a dati disponibili per evitare il rischio di provocare una eccessiva tossicità materna. Comunque, gli animali in cui si dovessero osservare effetti di eccessiva tossicità vanno soppressi con metodi non cruenti. Se diverse femmine gravide mostrano segni di eccessiva tossicità, occorre prendere in considerazione l'opportunità di sopprimere l'intero gruppo corrispondente alla dose in questione. Quando la sostanza viene somministrata mediante sonda, va data di preferenza in un'unica dose mediante sondino gastrico od opportuna cannula da intubazione. Il massimo volume di liquido che può essere somministrato in un'unica volta dipende dalle dimensioni dell'animale. Il volume non deve superare 1 ml/100 g di peso corporeo, tranne nel caso delle soluzioni acquose che possono essere somministrate in quantità pari a 2 ml/100 g di peso corporeo. Se si utilizza olio di semi di mais come veicolo il volume non deve superare 0,4 ml/100 g di peso corporeo. La variabilità dei volumi somministrati va ridotta al minimo regolando le concentrazioni in modo da assicurare un volume costante in tutti i livelli di dose.
1.6.6. Osservazione delle femmine gravide
Le osservazioni cliniche vanno eseguite e registrate almeno una volta al giorno e preferibilmente alla stessa ora, tenendo conto della finestra di picco degli effetti previsti dopo la somministrazione. Si registrano le condizioni degli animali, compresi mortalità, agonia, alterazioni pertinenti del comportamento e qualunque segno di evidente tossicità.
1.6.7. Peso corporeo e consumo di cibo
Le femmine vanno pesate il giorno 0 della gestazione o comunque entro il giorno 3 della gestazione, nel caso si tratti di animali accoppiati in una data prestabilita forniti da un allevatore esterno, oltre che il primo giorno di somministrazione, almeno ogni 3 giorni durante il periodo di somministrazione e il giorno della soppressione.
Il consumo di cibo va registrato a intervalli di tre giorni, in coincidenza dei giorni in cui si determina il peso corporeo.
1.6.8. Esame autoptico
Le femmine vanno soppresse un giorno prima della data prevista del parto. Le femmine che presentano segni di aborto o parto prematuro prima della soppressione programmata vanno soppresse e sottoposte a esame macroscopico completo.
Al momento della soppressione o del decesso durante lo studio le femmine vanno esaminate macroscopicamente alla ricerca di eventuali anomalie strutturali o alterazioni patologiche. Per garantire la completa imparzialità nell'interpretazione dei dati è preferibile che la valutazione delle femmine durante l'isterotomia e le successive analisi dei feti siano effettuate senza conoscere il gruppo di trattamento.
1.6.9. Esame del contenuto uterino
Immediatamente dopo la soppressione o appena possibile dopo il decesso occorre asportare l'utero e accertare lo stato di gravidanza degli animali. Gli uteri che non risultino gravidi vanno ulteriormente esaminati (ad esempio con colorazione mediante solfuro di ammonio per i roditori e colorazione di Salewski o un metodo alternativo adeguato per i conigli) per confermare l'assenza di una gravidanza (5).
Si procede a pesatura degli uteri gravidi e del collo cervicale. Il peso degli uteri gravidi non va invece rilevato per gli animali trovati morti durante lo studio.
Nelle femmine gravide occorre determinare il numero di corpi lutei.
Il contenuto uterino va esaminato per determinare il numero di embrioni o feti, sia morti che vitali. Occorre descrivere il grado di riassorbimento allo scopo di stimare il momento relativo della morte del concepito (vedi sezione 1.2).
1.6.10. Esame dei feti
È necessario determinare sesso e peso corporeo di ciascun feto.
Ciascun feto va esaminato alla ricerca di alterazioni esteriori (6).
L'esame dei feti deve essere teso a individuare alterazioni scheletriche e dei tessuti molli (ad esempio, variazioni e malformazioni o anomalie) (7)(8)(9)(10)(11)(12)(13)(14)(15)(16)(17)(18)(19)(20)(21)(22)(23)(24). La classificazione delle alterazioni fetali in categorie è preferibile ma non indispensabile. Quando si effettua tale classificazione occorre specificare con chiarezza i criteri utilizzati per la definizione di ciascuna categoria. Particolare attenzione deve essere dedicata all'apparato riproduttore, che va esaminato alla ricerca di eventuali alterazioni dello sviluppo.
Per quanto concerne i roditori, circa la metà di ciascuna nidiata va preparata ed esaminata alla ricerca di alterazioni scheletriche. I restanti piccoli vanno preparati ed esaminati per l'analisi dei tessuti molli mediante sezionamento seriale secondo metodi adeguati o accettati oppure procedendo con cautela alla dissezione macroscopica dei tessuti.
Per quanto riguarda i non roditori, ad esempio i conigli, tutti i feti vanno sottoposti ad analisi sia dei tessuti molli che dello scheletro. I corpi di questi feti vanno esaminati mediante cauta dissezione alla ricerca di eventuali alterazioni dei tessuti molli, compresa, ove opportuno, la struttura cardiaca interna (25). Di metà dei feti esaminati in questo modo è necessario rimuovere la testa e trattarla per analizzare ulteriormente i tessuti molli (compresi occhi, cervello, cavità nasali e lingua) con metodi di sezionamento seriale standard (26) o un metodo altrettanto sensibile. I corpi di questi feti, nonché i restanti feti intatti, vanno trattati ed esaminati alla ricerca di alterazioni scheletriche, utilizzando gli stessi metodi descritti per i roditori.
2. DATI
2.1. TRATTAMENTO DEI RISULTATI
I dati vanno riportati individualmente per ciascuna femmina gravida e per la loro prole e riassunti sotto forma di tabella, evidenziando per ciascun gruppo sperimentale il numero di animali all'inizio del test, il numero di animali trovati morti durante il test o soppressi per motivi umanitari, il momento di eventuali decessi o soppressioni, il numero di femmine gravide, il numero di animali che mostrano segni di tossicità, una descrizione dei segni di tossicità osservati, ivi compresi il momento dell'insorgenza, la durata e la gravità di eventuali effetti tossici, i tipi di osservazioni embrio/fetali, nonché tutti i dati di rilievo riguardanti le figliate.
È necessario valutare i risultati numerici mediante un metodo statistico adeguato, usando la nidiata come unità di base per l'analisi dei dati. Occorre utilizzare un metodo statistico generalmente accettato; i metodi statistici vanno selezionati come parte del disegno sperimentale e devono essere giustificati. Occorre riportare anche i dati sugli animali che non sono sopravvissuti fino alla soppressione programmata, che peraltro possono essere inclusi nel calcolo delle medie del gruppo, se pertinenti. La pertinenza dei dati ottenuti da tali animali, e pertanto l'inclusione o l'esclusione dal calcolo delle medie del gruppo, va motivata e giudicata singolarmente.
2.2. VALUTAZIONE DEI RISULTATI
I risultati dello studio di tossicità sullo sviluppo prenatale vanno valutati in base agli effetti osservati. La valutazione deve includere le seguenti informazioni:
|
—
|
risultati dei test sulle femmine gravide e sui feti/embrioni, ivi compresa la valutazione del rapporto, o la sua assenza, fra l'esposizione degli animali alla sostanza di saggio e l'incidenza e la gravità di tutti gli effetti,
|
|
—
|
criteri applicati per l'eventuale suddivisione in categorie delle alterazioni fetali esteriori, a carico dei tessuti molli e dello scheletro,
|
|
—
|
se pertinenti, dati storici di controllo per una migliore interpretazione dei risultati dello studio,
|
|
—
|
numeri utilizzati per il calcolo delle percentuali o degli indici
|
|
—
|
adeguata analisi statistica dei reperti dello studio, se di pertinenza; dati sul metodo di analisi per consentire ad un revisore/esperto di statistica indipendente di rivalutare e ricostruire l'analisi.
|
In assenza di effetti tossici a conclusione di uno studio occorre prendere in considerazione l'opportunità di eseguire ulteriori indagini per determinare l'assorbimento e la biodisponibilità della sostanza di saggio.
2.3. INTERPRETAZIONE DEI RISULTATI
Uno studio della tossicità sullo sviluppo prenatale deve fornire informazioni sugli effetti dell'esposizione ripetuta ad una sostanza durante la gravidanza, sulle femmine gravide e sullo sviluppo intrauterino della prole. I risultati dello studio vanno interpretati insieme ai dati derivanti da studi subcronici, sulla riproduzione, di tossicocinetica e altri studi disponibili. Poiché l'enfasi viene posta sia sulla tossicità generale, in termini di tossicità materna, che sugli endpoint di tossicità sullo sviluppo, i risultati dello studio consentiranno in parte di discriminare fra gli effetti sullo sviluppo che si verificano in assenza di tossicità generale e quelli che sono indotti solo a livelli che risultano tossici anche per le madri (27).
3. RELAZIONE
3.1. RELAZIONE SULL'ESECUZIONE DEL TEST
La relazione deve contenere le seguenti informazioni specifiche:
|
|
Sostanza di saggio:
|
—
|
natura fìsica e, ove pertinenti, proprietà fisico-chimiche,
|
|
—
|
identificazione, compreso numero CAS se noto/stabilito,
|
|
|
|
Veicolo (se pertinente):
|
—
|
giustificazione per la scelta del veicolo, se diverso dall'acqua.
|
|
|
|
Animali sperimentali:
|
—
|
numero ed età degli animali,
|
|
—
|
origine, condizioni di stabulazione, dieta, ecc.,
|
|
—
|
peso individuale degli animali all'inizio del test.
|
|
|
|
Condizioni del test:
|
—
|
motivazione per la selezione del livello delle dosi,
|
|
—
|
dettagli sulla formulazione/preparazione della sostanza di saggio somministrata nella dieta, concentrazioni ottenute, stabilità e omogeneità della preparazione,
|
|
—
|
dettagli sulla somministrazione della sostanza di saggio,
|
|
—
|
conversione dalla concentrazione della sostanza di saggio in dieta/acqua potabile (ppm) alla dose vera e propria (mg/kg peso corporeo/die), se pertinente,
|
|
—
|
dettagli circa la qualità di cibo e acqua.
|
|
|
|
Dati sulla tossicità materna in funzione della dose (elenco non esaustivo):
|
—
|
numero di animali all'inizio del test, numero di animali sopravvissuti, numero di gravide e numero di femmine che hanno abortito, numero di femmine che hanno partorito precocemente,
|
|
—
|
giorno del decesso durante lo studio o indicazione del fatto che gli animali sono sopravvissuti fino alla soppressione programmata,
|
|
—
|
i dati sugli animali non sopravvissuti fino alla soppressione programmata vanno riportati ma non inclusi nelle analisi statistiche di confronto fra i gruppi,
|
|
—
|
giorno di osservazione di ciascun segno clinico anomalo e suo successivo decorso,
|
|
—
|
peso corporeo, modifica del peso corporeo e peso dell'utero gravido, compresa, facoltativamente, modifica del peso corporeo corretta in base al peso dell'utero gravido,
|
|
—
|
consumo di cibo ed eventualmente di acqua,
|
|
—
|
reperti autoptici, compreso il peso dell'utero,
|
|
—
|
valori di NOAEL in riferimento agli effetti sulle genitrici e sullo sviluppo.
|
|
|
|
Endpoint relativi allo sviluppo per ciascuna dose e nidiata (con impianti) ed inoltre:
|
—
|
numero di impianti, numero e percentuale di feti vivi e morti e di riassorbimenti,
|
|
—
|
numero e percentuale di perdite pre- e post-impianto.
|
|
|
|
Endpoint relativi allo sviluppo per ciascuna dose e figliata (con feti vivi) ed inoltre:
|
—
|
numero e percentuale di piccoli vivi,
|
|
—
|
peso corporeo fetale, preferibilmente per sesso e con i sessi combinati,
|
|
—
|
malformazioni esteriori, dei tessuti molli e scheletriche e altre alterazioni di rilievo,
|
|
—
|
criteri per la suddivisione in categorie, se pertinenti,
|
|
—
|
numero totale e percentuale di feti e nidiate con eventuali alterazioni esteriori, dei tessuti molli o scheletriche, oltre ai tipi e all'incidenza delle singole anomalie e di altre alterazioni rilevanti.
|
|
|
|
Discussione dei risultati.
|
4. BIBLIOGRAFIA
|
(1)
|
Kavlock R.J. et al. (1996) A Simulation Study of the Influence of Study Design on the Estimation of Benchmark Doses for Developmental Toxicity. Risk Analysis 16; 399-410.
|
|
(2)
|
Kimmel, C.A. and Francis, E.Z. (1990) Proceedings of the Workshop on the Acceptability and Interpretation of Dermal Developmental Toxicity Studies. Fundamental and Applied Toxicology 14; 386-398.
|
|
(3)
|
Wong, B.A., et al. (1997) Developing Specialized Inhalation Exposure Systems to Address Toxicological Problems. CIIT Activities 17; 1-8.
|
|
(4)
|
US Environmental Protection Agency (1985) Subpart E-Specific Organ/Tissue Toxicity, 40 CFR 798.4350: Inhalation Developmental Toxicity Study.
|
|
(5)
|
Salewski, E. (1964) Faerbermethode zum Makroskopischen Nachweis von Implantations Stellen am Uterusder Ratte. Naunyn-Schmeidebergs Archiv fur Pharmakologie und Experimentelle Pathologie 247:367.
|
|
(6)
|
Edwards, J.A. (1968) The external Development of the Rabbit and Rat Embryo. In Advances in Teratology. D.H.M. Woolam (ed.) Vol. 3. Academic Press, NY.
|
|
(7)
|
Inouye, M. (1976) Differential Staining of Cartilage and Bone in Fetal Mouse Skeleton by Alcian Blue and Alizarin Red S. Congenital Anomalies 16; 171-173.
|
|
(8)
|
Igarashi, E. et al. (1992) Frequency of Spontaneous Axial Skeletal Variations Detected by the Double Staining Techniquefor Ossified and Cartilaginous Skeleton in Rat Foetuses. Congenital Anomalies 32; :381-391.
|
|
(9)
|
Kimmel, C.A. et al. (1993) Skeletal Development Following Heat Exposure in the Rat. Teratology 47:229-242.
|
|
(10)
|
Marr, M.C. et al. (1988) Comparison of Single and Double Staining for Evaluation of Skeletal Development: The Effects of Ethylene Glycol (EG) in CD Rats. Teratology 37; 476.
|
|
(11)
|
Barrow, M.V. and Taylor, W.J. (1969) A Rapid Method for Detecting Malformations in Rat Foetuses. Journal of Morphology 127:291-306.
|
|
(12)
|
Fritz, H. (1974) Prenatal Ossification in Rabbits ss Indicative of Foetal Maturity. Teratology 11; 313-320.
|
|
(13)
|
Gibson, J.P. et al. (1966) Use of the Rabbit in Teratogenicity Studies. Toxicology and Applied Pharmacology 9; 398-408.
|
|
(14)
|
Kimmel, C.A. and Wilson, J.G. (1973) Skeletal Deviation in Rats: Malformations or Variations? Teratology 8; 309-316.
|
|
(15)
|
Marr, M.C. et al. (1992) Developmental Stages of the CD (Sprague-Dawley) Rat Skeleton after Maternal Exposure to Ethylene Glycol. Teratology 46; 169-181.
|
|
(16)
|
Monie, I.W. et al. (1965) Dissection Procedures for Rat Foetuses Permitting Alizarin Red Staining of Skeleton and Histological Study of Viscera. Supplement to Teratology Workshop Marmai, pp. 163-173.
|
|
(17)
|
Spark, C. and Dawson, A.B. (1928) The Order and Time of appearance of Centers of Ossification in the Fore and Hind Limbs of the Albino Rat, with Special Reference to the Possible Influence of the Sex Factor. American Journal of Anatomy 41; 411-445.
|
|
(18)
|
Staples, R.E. and Schnell, V.L. (1964) Refinements in Rapid Clearing Technique in the KOH- Alizarin Red S Method for Fetal Bone. Stain Technology 39; 61-63.
|
|
(19)
|
Strong, R.M. (1928) The Order Time and Rate of Ossification of the Albino Rat (Mus Norvegicus Albinus) Skeleton. American Journal of Anatomy 36; 313-355.
|
|
(20)
|
Stuckhardt, J.L. and Poppe, S.M. (1984) Fresh Visceral Examination of Rat and Rabbit Foetuses Used in Teratogenicity Testing. Teratogenesis, Carcinogenesis, andMutagenesis 4; 181-188.
|
|
(21)
|
Walker, D.G. and Wirtschafter, Z.T. (1957) The Genesis of the Rat Skeleton. Thomas, Springfield, IL.
|
|
(22)
|
Wilson, J.G. (1965) Embryological Considerations in Teratology. In Teratology: Principles and Techniques, Wilson J.G. and Warkany J. (eds.). University of Chicago, Chicago, IL, pp. 251-277.
|
|
(23)
|
Wilson, J.G. and Fraser, F.C. (eds). (1977) Handbook of' Teratology, Vol. 4. Plenum, NY.
|
|
(24)
|
Varnagy, L. (1980) Use of Recent Fetal Bone Staining Techniques in the Evaluation of Pesticide Teratogenicity. Acta Vet. Acad. Sci. Hung. 28; 233-239.
|
|
(25)
|
Staples, R.E. (1974) Detection of visceral Alterations in Mammalian Foetuses. Teratology 9; 37-38.
|
|
(26)
|
Van Julsingha, E.B. and C.G. Bennett (1977) A Dissecting Procedure for the Detection of Anomalies in the Rabbit Foetal Head. In: Methods in Prenatal Toxicology Neubert, D., Merker, H.J. and Kwasigroch, T.E. (eds.). University of Chicago, Chicago, IL, pp. 126-144.
|
|
(27)
|
US Environmental Protection Agency (1991) Guidelines for Developmental Toxicity Risk Assessment. Federal Register 56; 63798-63826.
|
|
(28)
|
Wise, D.L. et al. (1997) Terminology of Developmental Abnormalities in Common Laboratory Mammals (Version 1) Teratology 55; 249-292.
|
B.32. SAGGIO DI CANCEROGENESI
1. METODO
1.1. INTRODUZIONE
Vedi introduzione generale, parte B.
1.2. DEFINIZIONI
Vedi introduzione generale, parte B.
1.3. SOSTANZE DI RIFERIMENTO
Nessuna.
1.4. PRINCIPIO DEL METODO DI SAGGIO
La sostanza da saggiare è somministrata normalmente 7 giorni per settimana, tramite via appropriata, a diversi gruppi di animali sperimentali, una dose per gruppo, per la maggior parte della loro durata di vita. Durante e dopo l'esposizione alla sostanza, gli animali verranno sottoposti giornalmente ad osservazione per individuare i sintomi della tossicità, in particolare lo sviluppo dei tumori.
1.5. CRITERI QUALITATIVI
Nessuno.
1.6. DESCRIZIONE DEL METODO DI SAGGIO
Preparazioni
Gli animali sono tenuti nell'alloggio sperimentale e nutriti per almeno 5 giorni prima dell'inizio della prova. Prima dell'esperimento, gli animali giovani e sani vengono randomizzati ed assegnati a gruppi stabiliti.
Animali da laboratorio
La specie preferita è il ratto. Sulla base dei risultati di studi precedentemente intrapresi, altre specie (roditori o non roditori) possono essere utilizzate.
Sarà opportuno usare ceppi di giovani animali sani generalmente utilizzati in laboratorio e il dosaggio dovrà iniziare non appena possibile dopo lo svezzamento. All'inizio dello studio, la variazione di peso degli animali usati non dovrà superare più o meno 20 % del valore medio. Quando vengano intrapresi studi di subcronicità orale come preliminari ad uno studio a lungo termine, si dovranno usare le stesse specie in entrambi gli studi.
Numero e sesso
Si utilizzeranno animali di entrambi i sessi. La somministrazione del dosaggio ai roditori dovrà cominciare non appena possibile dopo lo svezzamento. Nel caso di roditori si utilizzeranno almeno 100 animali (50 maschi e 50 femmine) per ogni livello di dose e gruppo di controllo parallelo. Le femmine devono essere nullipare e non gravide. Se si prevede di sacrificare ad intervalli alcuni animali, il numero dovrà essere aumentato del numero di animali che si prevede di sacrificare prima del completamento dello studio.
Livelli di dose e frequenza dell'esposizione
Si dovranno usare almeno tre livelli di dose oltre a un gruppo di controllo parallelo. Il livello di dose più elevato dovrà essere tale da provocare sintomi di tossicità minimi, quali una leggera diminuzione dell'aumento del peso corporeo (meno di 10 %), senza alterare sostanzialmente la durata normale di vita per effetti diversi da quelli dei tumori.
La dose più bassa non dovrà interferire con la crescita, lo sviluppo, e la longevità normali dell'animale né produrre sintomi di tossicità, In generale, essa non dovrà essere inferiore al 10 % della dose più elevata.
La (le) dose(i) intermedia(e) dovrà essere stabilita mediamente tra le dosi elevate e quelle basse.
La scelta dei livelli di dose dovrà prendere in considerazione i dati delle prove e degli studi precedenti di tossicità.
Se il prodotto chimico è somministrato in acqua potabile o mescolato nella dieta, esso dovrà essere continuamente disponibile.
Controlli
Si userà il gruppo di controllo parallelo, che è identico sotto ogni aspetto ai gruppi esposti eccezion fatta per l'esposizione alla sostanza in esame.
In circostanze specifiche, quali ad esempio gli studi di inalazione comportanti impiego di aerosol o gli studi sulla tossicità orale che contemplano l'uso di un emulsionante ad attività biologica atipica, si utilizzerà un gruppo di controllo supplementare non esposto al veicolo.
Vie di somministrazione
Le tre vie principali di somministrazione sono: orale, cutanea e per inalazione. La scelta della via di somministrazione dipende dalle caratteristiche fisiche e chimiche della sostanza da saggiare e dalla via che caratterizza l'esposizione degli esseri umani.
Saggio per via orale
Se la sostanza da saggiare è assorbita dal tratto gastrointestinale, e se la via orale è una via di esposizione degli esseri umani, verrà preferita la via orale di somministrazione, a meno che non vi siano controindicazioni. Gli animali dovranno ricevere la sostanza da saggiare nella loro dieta, sciolta in acqua potabile, o in capsula.
Il dosaggio ideale dovrebbe essere un dosaggio quotidiano sulla base di sette giorni/settimana, perché il dosaggio di cinque giorni/settimana permette il recupero o la perdita di tossicità nel periodo di mancato dosaggio, influenzando così i risultati e la valutazione successiva. Tuttavia, principalmente sulla base di considerazioni pratiche, il dosaggio di cinque giorni/settimana è considerato accettabile.
Saggio per via cutanea
L'esposizione cutanea per spennellamento della pelle può essere scelta per simulare una via principale di esposizione umana e come sistema modello per induzione di lesioni cutanee.
Saggio per via inalatoria
Poiché gli esperimenti di inalazione presentano problemi tecnici di maggior complessità delle altre vie di somministrazione, si forniscono in questa sede indicazioni particolareggiate su questo modo di somministrazione. Da notare inoltre che l'installazione endotracheale può costituire un'alternativa valida in situazioni specifiche.
Le esposizioni a lungo termine sono di solito modellate sui tipi di esposizione umana e sottopongono gli animali ad un'esposizione quotidiana di 6 ore dopo livellamento delle concentrazioni della camera, per 5 giorni/settimana (esposizione intermittente) o, per un'esposizione ambientale possibile, con 22-24 ore di esposizione/giorno, 7 giorni/settimana (esposizione continua), con circa un'ora per nutrire gli animali in orari simili ogni giorno e per il mantenimento delle camere. In entrambi i casi, gli animali di solito sono esposti ad una concentrazione fissa di sostanza da saggiare. Una differenza notevole da considerare tra l'esposizione intermittente e quella continua è costituita dal fatto che con la prima vi è un periodo di 17-18 ore in cui gli animali possono riprendersi dagli effetti di ogni esposizione, e un periodo ancora più lungo di recupero a fine settimana.
La scelta dell'esposizione intermittente o continua dipende dagli obiettivi dello studio e dall'esposizione umana da simulare. Tuttavia, occorrerà considerare alcune difficoltà tecniche. Ad esempio, i vantaggi dell'esposizione continua per la simulazione delle condizioni ambientali possono essere compensati dalla necessità di abbeverare o nutrire gli animali durante l'esposizione, e dall'esigenza di usare aerosol più complicati (e affidabili), di generare il vapore e di usare tecniche di controllo.
Camere di esposizione
Gli animali dovranno essere sottoposti a prove in camere di inalazione progettate per sostenere un flusso dinamico di almeno 12 cambiamenti d'aria/ora, per assicurare un tenore di ossigeno adeguato e un'atmosfera ugualmente distribuita. Le camere di esposizione e di controllo dovranno avere costruzioni e progettazioni identiche per assicurare condizioni di esposizione comparabili sotto tutti gli aspetti, eccezion fatta per le esposizioni alle sostanze da saggiare. Una leggera pressione negativa dentro la camera viene generalmente mantenuta per impedire perdite della sostanza sperimentale nella zona circostante. Nelle camere si dovrà ridurre al massimo l'affollamento degli animali sperimentali. Come regola generale per assicurare la stabilità dell'atmosfera della camera, il «volume» totale degli animali sperimentali non dovrà superare il 5 % del volume della camera.
Si effettueranno le seguenti misurazioni o controlli:
|
i)
|
corrente d'aria: la portata d'aria attraverso la camera dovrà essere controllata preferibilmente in continuo;
|
|
ii)
|
concentrazione: durante il periodo di esposizione quotidiana, la concentrazione non dovrà variare di più del ± 15 % dal valore medio. Per la durata totale dello studio, le concentrazioni giornaliere dovranno essere tenute costanti nella misura del possibile;
|
|
iii)
|
temperatura ed umidità: per i roditori, la temperatura dovrà essere mantenuta a 22 oC (± 2 oC) e l'umidità all'interno della camera al 30-70 %, eccetto quando l'acqua è usata per mantenere in sospensione la sostanza sperimentale nell'atmosfera della camera. Entrambe dovranno essere controllate preferibilmente in continuo;
|
|
iv)
|
misurazioni delle dimensioni delle particelle: occorrerà effettuare una determinazione della distribuzione dimensionale delle particelle nell'atmosfera delle camere in cui si usino aerosol liquidi o solidi. Le particelle degli aerosol dovranno essere di dimensioni respirabili per gli animali sperimentali usati. I campioni delle atmosfere della camera saranno prelevati nell'area di respirazione degli animali. Il campione dell'aria sarà rappresentativo della distribuzione delle particelle a cui gli animali sono esposti e dovrà rappresentare, su una base gravimetrica, tutto l'aerosol sospeso anche quando gran parte dello stesso non è respirabile. Le analisi granulometriche dovranno essere effettuate di frequente durante la messa a punto del sistema di generazione per assicurare la stabilità dell'aerosol e, in seguito, durante le esposizioni, solo quando necessario, a seconda dei bisogni, per determinare l'uniformità di distribuzione delle particelle a cui gli animali sono stati esposti.
|
Durata dello studio
La durata di un test di cancerogenesi copre la parte principale della durata normale di vita degli animali sperimentali. La conclusione dello studio sarà dopo 18 mesi per i topi ed i criceti, e dopo 24 mesi per i ratti; tuttavia, per certi ceppi di animali con maggior longevità e tasso poco elevato di tumori spontanei, la conclusione dovrebbe essere dopo 24 mesi per i topi ed i criceti e dopo 30 mesi per i ratti. Alternativamente, la conclusione di un tale studio esteso è accettabile quando la percentuale di superstiti nel gruppo a livello di dose più basso o nel gruppo di controllo raggiunge il 25 %. Allo scopo di terminare lo studio in cui si manifesti una differenza evidente nella risposta, determinata dal sesso, ciascun sesso dovrà essere considerato come un esperimento distinto. Quando solo il gruppo a dose elevata muore prematuramente per ovvie ragioni di tossicità, questa ragione non deve determinare la conclusione dell'esperimento a meno che le manifestazioni tossiche non causino problemi negli altri gruppi. Perché un risultato sperimentale negativo sia accettabile, non più del 10 % di animali di qualsiasi gruppo deve essere perso a causa di autolisi, cannibalismo o altri problemi, e il tasso di sopravvivenza di tutti i gruppi non deve essere inferiore al 50 % a 18 mesi per i topi ed i criceti e a 24 mesi per i ratti.
Procedimento
Osservazioni
Le osservazioni parallele includeranno modificazioni della cute e del pelo, degli occhi e delle mucose nonché del sistema nervoso centrale ed autonomo, di quello respiratorio e circolatorio, dell'attività somatomotoria e del modello comportamentale.
L'osservazione regolare degli animali è necessaria per assicurarsi che gli stessi siano conservati il più possibile per lo studio e non persi a causa di cannibalismo, autolisi dei tessuti o smarrimento. Gli animali moribondi verranno rimossi e sottoposti a necroscopia.
Per tutti gli animali si annoteranno i sintomi clinici e la mortalità. Si dedicherà speciale attenzione all'insorgenza dei tumori; si registrerà la data di inizio, la posizione, le dimensioni, l'aspetto e la progressione di ogni tumore grossolanamente visibile o palpabile.
Si procederà settimanalmente alla misurazione del consumo alimentare (e del consumo dell'acqua quando la sostanza sperimentale è somministrata in acqua potabile) durante le prime 13 settimane dello studio e successivamente a intervalli di circa tre mesi a meno che i cambiamenti dello stato di salute o del peso corporeo non impongano altre soluzioni.
Il peso corporeo dovrà essere registrato individualmente per tutti gli animali una volta per settimana durante le prime 13 settimane del periodo di prova ed almeno una volta ogni 4 settimane in seguito.
Esami clinici
Ematologia
Se le osservazioni parallele evidenziano un deterioramento nella salute degli animali durante lo studio, si eseguirà un conteggio differenziale del sangue degli animali colpiti.
Dopo 12 mesi, 18 mesi e prima del sacrificio, si farà uno striscio del sangue di rutti gli animali. Un conteggio differenziale del sangue sarà eseguito sui campioni ottenuti dagli animali nel gruppo a dosaggio più elevato e nei controlli. Se i suddetti dati, e in particolare quelli ottenuti prima del sacrificio, o i dati dall'esame patologico ne indicano l'esigenza, si eseguirà il conteggio differenziale del sangue anche per il (i) gruppo(i) trattato(i) con dosaggio immediatamente inferiore.
Esame autoptico di base
L'esame autoptico di base completo dovrà essere eseguito su tutti gli animali, compresi quelli che sono morti durante l'esperimento e quelli moribondi. Si conserveranno tutti i tumori o le lesioni visibili o sospette.
I seguenti organi e tessuti dovranno essere conservati in mezzo adatto per esami istopatologici futuri possibili: tutte le lesioni generali, cervello — comprese sezioni di midollo/ponte, corteccia cerebellare e corteccia cerebrale, pituitaria, tiroide/paratiroide, qualsiasi tessuto timico, trachea e polmoni, cuore, aorta, ghiandole salivarie, milza, fegato, reni, ghiandole surrenali, pancreas, gonadi, utero, organi genitali accessori, pelle, esofago, stomaco, duodeno, digiuno, ileo, intestino cieco, colon, retto, vescica urinaria, linfonodi rappresentativi, ghiandole mammarie femminili, muscolatura della coscia, nervo periferico, sterno con midollo osseo, femore — compresa superficie articolare, midollo spinale a tre livelli — cervicale, mediotoracico e lombare, occhi e ghiandole lacrimali esorbitali.
Sebbene l'insufflazione dei polmoni e della vescica urinaria con un fissativo sia il modo ottimale di conservare questi tessuti, l'insufflazione dei polmoni negli studi di inalazione è un requisito necessario per l'esecuzione dell'esame istopatologico appropriato. Negli studi di inalazione, si conserverà tutto il tratto respiratorio, comprese le cavità nasali, le faringi e le laringi.
Esame istopatologico
|
a)
|
Esame istopatologico completo degli organi e dei tessuti di tutti gli animali che muoiono o vengono sacrificati durante la prova e di tutti gli animali nei gruppi trattati con dose elevata e nei controlli.
|
|
b)
|
Esame dei tumori o lesioni grossolane visibili o sospette in tutti i gruppi.
|
|
c)
|
Se nei gruppi trattati con dosaggio elevato e nei gruppi di controllo si riscontra una differenza significativa nell'incidenza di lesioni neoplastiche, si eseguirà l'esame istopatologico di quell'organo o tessuto specifico negli altri gruppi.
|
|
d)
|
Se il tasso di sopravvivenza nel gruppo trattato con dosi elevate è significativamente inferiore a quello del gruppo di controllo, il gruppo trattato con dosaggio immediatamente inferiore dovrà essere sottoposto ad esame completo.
|
|
e)
|
Se nel gruppo trattato con dosi elevate si riscontra induzione di tossicità o altri effetti che potrebbero influire sulla risposta neoplastica, si effettuerà un esame completo del gruppo trattato con il dosaggio immediatamente inferiore.
|
2. DATI
I dati dovranno essere riassunti sotto forma di tabella, indicando per ogni gruppo sperimentale il numero di animali all'inizio della prova, il numero di animali che presentano tumori scoperti durante l'esperimento, la data di individuazione ed il numero di animali in cui si sono riscontrati tumori dopo l'uccisione. I risultati debbono essere valutati con un metodo statistico idoneo. Qualsiasi metodo statistico riconosciuto può essere utilizzato.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
Nella relazione sul saggio devono figurare, se possibile:
|
—
|
specie, ceppo, origine, condizioni ambientali, dieta, ecc.,
|
|
—
|
condizioni sperimentali:
|
—
|
descrizione dell'apparecchiatura di esposizione, includente:
progettazione, tipo, dimensioni, fonte di aria, sistema per generare particelle ed aerosol, metodo di condizionamento dell'aria, trattamento dell'aria di scarico, metodo di alloggiamento degli animali in una camera sperimentale quando questo sistema venga utilizzato. Descrizione del dispositivo per misurare la temperatura, l'umidità e, se del caso, la stabilità delle concentrazioni di aerosol o le dimensioni delle particelle.
|
|
—
|
Dati di esposizione:
questi dovranno essere presentati in forma di tabelle con indicazione dei valori medi e una misura della variabilità (ad esempio: deviazione standard) e includeranno:
|
a)
|
portata dell'aria attraverso l'attrezzatura di inalazione;
|
|
b)
|
temperatura ed umidità dell'aria;
|
|
c)
|
concentrazioni nominali (quantità totale della sostanza sperimentale immessa nell'attrezzatura di inalazione divisa per il volume dell'aria);
|
|
d)
|
natura del veicolo, se usato;
|
|
e)
|
concentrazioni reali nella zona sperimentale di respirazione;
|
|
f)
|
dimensioni delle particelle medianti (se del caso):
|
|
|
|
—
|
livelli di dose (veicolo compreso, se utilizzato) e concentrazioni,
|
|
—
|
dati di incidenza del tumore secondo il sesso, la dose e il tipo di tumore,
|
|
—
|
registrazione della data della morte (durante l'esperimento) oppure specificare se gli animali sono sopravvissuti fino alla conclusione della prova,
|
|
—
|
dati sulla risposta tossica per sesso e per dose,
|
|
—
|
descrizione degli effetti tossici o di altri effetti,
|
|
—
|
registrazione della data di osservazione di ogni sintomo anomalo e del decorso successivo,
|
|
—
|
alimentazione e dati sul peso corporeo,
|
|
—
|
risultati dell'esame ematologico,
|
|
—
|
risultati dell'autopsia,
|
|
—
|
descrizione particolareggiata di tutti i risultati istopatologici,
|
|
—
|
elaborazione statistica dei risultati con descrizione dei metodi impiegati,
|
|
—
|
discussione dei risultati,
|
|
—
|
interpretazione dei risultati.
|
3.2. VALUTAZIONE ED INTERPRETAZIONE
Vedi introduzione generale, parte B.
4. RIFERIMENTI
Vedi introduzione generale, parte B.
B.33. SAGGIO COMBINATO DI TOSSICITÀ CRONICA/CANCEROGENESI
1. METODO
1.1. INTRODUZIONE
Vedi introduzione generale, parte B.
1.2. DEFINIZIONI
Vedi introduzione generale, parte B.
1.3. SOSTANZE DI RIFERIMENTO
Nessuna.
1.4. PRINCIPIO DEL METODO DI SAGGIO
L'obiettivo di un saggio combinato di tossicità cronica/cancerogenesi è quello di determinare gli effetti cronici e cancerogeni di una sostanza di una specie di mammifero in seguito a esposizione prolungata.
Per questo scopo, uno studio di cancerogenesi è integrato con almeno un gruppo satellite trattato e un gruppo satellite di controllo. La dose usata per il gruppo satellite a dose elevata può essere più alta di quella usata per il gruppo a dose elevata nello studio di cancerogenesi. Nello studio di cancerogenesi, gli animali sono esaminati per la tossicità in generale come pure per la risposta cancerogena. Gli animali nel gruppo satellite trattato sono esaminati per la tossicità in generale.
La sostanza in esame è somministrata normalmente 7 giorni per settimana, per una via di somministrazione appropriata, a diversi gruppi di animali da esperimento, una dose per gruppo, per la maggior parte della loro vita. Durante e dopo l'esposizione alla sostanza in esame, gli animali da esperimento vengono osservati ogni giorno per individuare i segni di tossicità e lo sviluppo di tumori.
1.5. CRITERI QUALITATIVI
Nessuno.
1.6. DESCRIZIONE DEL METODO DI SAGGIO
Gli animali sono tenuti nelle condizioni di alloggio e di alimentazione del saggio per almeno 5 giorni prima dell'inizio della prova. Prima dell'esperimento, gli animali giovani e sani vengono mescolati con metodo casuale ed assegnati a gruppi.
Animali da esperimento
La specie preferita è il ratto. Sulla base dei risultati di studi precedentemente svolti, altre specie (roditori o non roditori) possono essere utilizzate. Si dovrebbero usare i ceppi di animali giovani sani generalmente usati in laboratorio e il dosaggio dovrebbe cominiciare non appena possibile dopo lo svezzamento.
All'inizio dello studio, la variazione del peso degli animali usati non dovrebbe superare il ± 20 % del valore medio. Quando venga intrapreso uno studio subcronico orale come preliminare ad uno studio a lungo termine, si dovrebbe usare la stessa specie e lo stesso ceppo in entrambi gli studi.
Numero e sesso
Per i roditori si dovrebbero usare almeno 100 animali (50 maschi e 50 femmine) per ciascun livello di dose e un gruppo di controllo parallelo. Le femmine dovranno essere nullipare e non gravide. Se si prevedono sacrifici intermedi, il numero dovrebbe essere aumentato del numero di animali che si prevede di sacrificare prima del completamento dello studio.
Il(i) gruppo(i) satellite(i) trattato(i) per la valutazione di patologie diverse dai tumori dovrebbe essere composto da 20 animali di ciascun sesso, mentre il gruppo di controllo satellite dovrà contenere 10 animali di ciascun sesso.
Livelli di dose e frequenza di esposizione
Per gli scopi delle prove di cancerogenesi si dovrebbero usare almeno tre livelli di dose oltre ad un gruppo di controllo parallelo. Il livello di dose più elevato dovrebbe produrre sintomi minimi di tossicità, quale un leggero calo dell'aumento del peso corporeo (meno del 10 %), senza alterare sostanzialmente la durata normale di vita a causa di effetti diversi dai tumori.
Il livello di dose più basso non dovrebbe interferire con la crescita normale, lo sviluppo e la longevità dell'animale, né produrre alcuna indicazione di tossicità. Questa dose, in genere, non dovrebbe essere inferiore al 10 % della dose elevata.
La(e) dose(i) intermedia(e) dovrebbe(ro) essere fisata(e) in un intervallo medio compreso fra la dose elevata a quella bassa. La selezione dei livelli di dose dovrebbe tener conto dei dati derivati dai saggi e dagli studi di tossicità precedenti.
Per le finalità del saggio di tossicità cronica, nel saggio vengono inclusi gruppi trattati aggiuntivi e un gruppo di controllo satellite parallelo. La dose elevata per il trattamento degli animali del gruppo satellite dovrà essere tale da produrre evidenti segni di tossicità.
La frequenza dell'esposizione è normalmente quotidiana.
Se la sostanza chimica è somministrata nell'acqua da bere o mescolata nella dieta, queste dovrebbero essere continuamente disponibili.
Controlli
Si dovrebbe usare un gruppo parallelo, identico sotto tutti gli aspetti ai gruppi trattati, fatta eccezione per l'esposizione alla sostanza in esame.
In circostanze speciali, quali gli studi di inalazione comportanti l'uso di aerosol o di un emulsionante con attività biologica non caratterizzata mediante studi di tossicità orale, si dovrebbe utilizzare un gruppo di controllo complementare non esposto al veicolo.
Vie di somministrazione
Le tre vie principali di somministrazione sono: orale, cutanea e per inalazione. La scelta della via di somministrazione è funzione delle caratteristiche chimico-fisiche della sostanza in esame e della più probabile via di esposizione degli esseri umani.
Saggi per via orale
Quando la sostanza in esame è assorbita dal tratto gastrointestinale e l'ingestione è una via di esposizione per gli esseri umani, si preferisce la via orale di somministrazione a meno che vi siano controindicazioni. Gli animali possono ricevere la sostanza in esame nella loro dieta, sciolta nell'acqua potabile, o somministrata in capsula.
Idealmente, si dovrebbe usare un dosaggio quotidiano sulla base di sette giorni per settimana, perché il dosaggio di cinque giorni per settimana potrebbe permettere il recupero o una tossicità da privazione nel periodo di mancato dosaggio influenzando così i risultati e la valutazione successiva. Tuttavia, principalmente sulla base di considerazioni pratiche, un dosaggio sulla base di cinque giorni per settimana è considerato accettabile.
Saggi per via cutanea
L'esposizione cutanea con spennellatura della pelle può essere scelta per simulare una principale via di esposizione umana e come sistema modello per induzione di lesioni cutanee.
Saggi per via inalatoria
Poiché i saggi inalatori presentano problemi tecnici di maggior complessità delle altre vie di somministrazione, si forniscono in questa sede indicazioni più particolareggiate su questo modo di somministrazione. Da notare inoltre che l'instillazione endotracheale può costituire un'alternativa valida in situazioni specifiche.
Le esposizioni a lungo termine sono di solito modellate su esposizione umana prevista sottoponendo gli animali ad un'esposizione quotidiana di 6 ore dopo equilibrazione delle concentrazioni della camera, per 5 giorni/settimana (esposizione intermittente) o ad un'esposizione ambientale possibile, con 22-24 ore di esposizione/giorno, 7 giorni per settimana (esposizione continua), con circa un'ora per nutrire gli animali allo stesso orario e per la manutenzione della camera. In entrambi i casi, gli animali di solito sono esposti a concentrazioni fisse delle sostanze in esame. Una differenza notevole da considerare tra l'esposizione intermittente e quella continua è costituita dal fatto che con la prima vi è un periodo di 17-18 ore in cui gli animali possono riprendersi dagli effetti di ogni esposizione quotidiana, e un periodo ancora più lungo di ricupero durante i fine settimana.
La scelta dell'esposizione intermittente o continua dipende dagli obiettivi dello studio e dall'esposizione umana da simulare. Tuttavia, occorrerà considerare alcune difficoltà tecniche. Per esempio, i vantaggi dell'esposizione continua per la simulazione delle condizioni ambientali possono essere controbilanciati dalla necessità di abbeverare o nutrire gli animali durante l'esposizione, e dall'esigenza di usare aerosol più complicati (e affidabili) e di sistemi di generazione del vapore e di controllo.
Camere di esposizione
Gli animali dovrebbero essere sottoposti a sperimentazione in camere di inalazione progettate per sostenere un flusso dinamico di almeno 12 cambiamenti d'aria/ora, per assicurare un tenore di ossigeno adeguato e un'atmosfera di esposizione uniforme. Le camere di esposizione e di controllo dovrebbero essere identiche nella costruzione e progettazione per assicurare condizioni di esposizione comparabili sotto tutti gli aspetti, eccezion fatta per le esposizioni alle sostanze in esame. Una leggera depressione viene generalmente mantenuta dentro la camera per impedire perdite della sostanza in esame nella zona circostante. Nelle camere si dovrebbe ridurre al massimo l'affollamento degli animali di saggio. Come regola generale per assicurare la stabilità dell'atmosfera della camera, il «volume» totale degli animali di saggio non dovrebbe superare il 5 % del volume della camera.
Si dovrebbero effettuare le seguenti misurazioni o controlli:
|
i)
|
flusso dell'aria: la velocità del flusso dell'aria attraverso la camera dovrebbe essere controllata preferibilmente in modo continuo;
|
|
ii)
|
concentrazione: durante il periodo di esposizione quotidiana, la concentrazione non dovrebbe variare più del ± 15 % dal valore medio. Per la durata totale dello studio, le concentrazioni giornaliere dovranno essere tenute costanti nella misura del possibile;
|
|
iii)
|
temperatura ed umidità: per i roditori, la temperatura dovrà essere mantenuta a 22 oC (± 2 oC) e l'umidità all'interno della camera al 30-70 %, eccetto quando l'acqua è usata per mantenere in sospensione la sostanza sperimentale nell'atmosfera della camera. Entrambe dovrebbero essere controllate preferibilmente in continuo;
|
|
iv)
|
misura delle dimensioni delle particelle: la distribuzione delle dimensioni delle particelle dovrebbe essere determinata sulle atmosfere di camere che contengono aerosol liquidi o solidi. Le particelle contenute negli aerosol dovrebbero avere dimensioni tali da essere inalabili dall'animale da laboratorio usato. I campioni di atmosfera dovrebbero essere prelevati a livello della zona di respirazione degli animali. Il campione d'aria dovrebbe essere rappresentativo della distribuzione delle particelle a cui gli animali sono esposti e dovrebbe rappresentare, su una base gravimetrica, tutto l'aerosol sospeso anche quando gran parte di esso non è respirabile. Le analisi della grandezza delle particelle dovrebbero essere effettuate spesso durante la messa a punto del sistema di generazione per assicurare la stabilità dell'aerosol e, in seguito, quando si ritenga necessario, durante le esposizioni, per determinare in modo adeguato l'uniformità della distribuzione delle particelle a cui gli animali sono stati esposti.
|
Durata dello studio
La durata della parte del saggio relativa alla cancerogenesi comprende la maggior parte della vita normale degli animali di saggio. La conclusione del saggio dovrebbe essere a 18 mesi per i topi ed i criceti e dopo 24 mesi per i ratti; tuttavia, per certi ceppi di animali con maggior longevità e/o tasso poco elevato di tumori spontanei, la conclusione dovrebbe essere dopo 24 mesi per i topi ed i criceti e dopo 30 mesi per i ratti. Alternativamente, la conclusione di un tale studio esteso è accettabile quando la percentuale di superstiti nel gruppo a livello di dose più basso o nel gruppo di controllo raggiunge il 25 %. Quando si conclude uno studio in cui si manifesti una differenza evidente nella risposta determinata del sesso, ciascun sesso dovrebbe essere considerato separatamente. Quando solo il gruppo a dose elevata muore prematuramente per ovvie ragioni di tossicità, ciò non deve necessariamente determinare la conclusione dell'esperimento purché le manifestazioni tossiche non causino problemi negli altri gruppi. Perché un risultato sperimentale negativo sia accettabile, non più del 10 % di animali di qualsiasi gruppo può essere perso nell'esperimento a causa di autolisi, cannibalismo o altri problemi, e il tasso di sopravvivenza di tutti i gruppi non deve essere inferiore al 50 % a 18 mesi per i topi ed i criceti e a 24 mesi per i ratti.
I gruppi satelliti di 20 animali (per sesso) sottoposti a dosaggio e i 10 animali (per sesso) di controllo associati, usati per la prova di tossicità cronica, dovrebbero essere mantenuti ai fini dello studio per almeno 12 mesi. Questi animali dovrebbero essere destinati al sacrificio ai fini di un esame della patologia connessa con la sostanza sperimentale non complicata da mutamenti geriatrici.
Procedimento
Osservazioni
Quotidianamente si dovrebbero effettuare osservazioni cliniche che includeranno i mutamenti della cute e del pelo, degli occhi e delle membrane mucose nonché del sistema nervoso centrale ed autonomo, di quello respiratorio e circolatorio, dell'attività somatomotoria e del modello comportamentale.
Un esame clinico dovrebbe essere effettuato a intervalli appropriati sugli animali del(dei) gruppo(i) satellite(i) trattato(i).
Osservazioni regolari degli animali sono necessarie per assicurarsi, per quanto possibile, che gli stessi non siano persi dallo studio a cause quali cannibalismo, autolisi dei tessuti o smarrimento. Gli animali moribondi dovrebbero essere rimossi e sottoposti a necroscopia.
Per tutti gli animali si dovrebbero registrare i segni clinici, inclusi i mutamenti neurologici ed oculari nonché la mortalità. Si deve dedicare particolare attenzione allo sviluppo dei tumori; il momento di insorgenza e la progressione delle condizioni tossiche dovrebbero essere registrati.
Si dovrebbe procedere settimanalmente alla misurazione del consumo alimentare (e del consumo dell'acqua quando la sostanza in esame è somministrala in tale veicolo) durante le prime 13 settimane dello studio e poi a intervalli di circa tre mesi a meno che i mutamenti dello stato di salute o del peso corporeo non impongano altre soluzioni.
Il peso corporeo dovrebbe essere registrato individualmente per tutti gli animali una volta per settimana durante le prime 13 settimane del periodo di saggio ed almeno una volta ogni 4 settimane in seguito.
Esami clinici
Ematologia
L'esame ematologico (ad esempio: contenuto dell'emoglobina, volume delle cellule impaccate, globuli rossi totali, globuli bianchi totali, piastrine o altre misure del potenziale di coagulazione) dovrebbe essere eseguito dopo 3 mesi, 6 mesi ed approssimativamente a intervalli successivi di 6 mesi ed alla conclusione, sui campioni di sangue raccolti da 10 ratti per sesso di tutti i gruppi. Se possibile, i campioni dovrebbero essere prelevati dagli stessi ratti a ogni intervallo.
Se le osservazioni cliniche suggeriscono un peggioramento nella salute degli animali durante lo studio, si dovrebbe eseguire un conteggio differenziale ematico degli animali colpiti. Un conteggio differenziale ematico viene eseguito sui campioni provenienti dagli animali appartenenti al gruppo a più elevato dosaggio e nei controlli. 1 conteggi differenziali del sangue sono eseguiti sul(i) gruppo(i) a dosaggio inferiore immediatamente successivo soltanto se si riscontra una discrepanza notevole tra il gruppo a dosaggio più elevato ed i controlli, o se i risultati dell'esame patologico ne indicano l'esigenza.
Analisi delle urine
Si dovrebbero raccogliere per analisi i campioni di urina di 10 ratti per sesso per tutti i gruppi, se possibile agli stessi intervalli dell'esame ematologico. Le seguenti determinazioni dovrebbero essere fatte o a partire dai diversi animali o su un campione miscelato sesso/gruppo per i roditori:
|
—
|
aspetto: volume e densità per i singoli animali,
|
|
—
|
proteina, glucosio, chetoni, sangue occulto (semiquantitativamente),
|
|
—
|
microscopia del deposito (semiquantitativamente).
|
Chimica clinica
Approssimativamente a intervalli di 6 mesi, ed alla conclusione, si prelevano campioni di sangue per le misure di chimica clinica da tutti i non roditori e da 10 ratti per sesso di tutti i gruppi, se possibile dagli stessi ratti a ogni intervallo. Inoltre, si dovrebbe prelevare un campione prima del saggio dai non roditori. Il plasma viene preparato da questi campioni e vengono fatte le seguenti determinazioni:
|
—
|
concentrazione proteina totale,
|
|
—
|
concentrazione dell'albumina,
|
|
—
|
saggi di funzionalità epatica [come attività fosfatasi alcalina, glutammico-piruvico-transaminasi (4), glutammico-ossalacetico-transaminasi (5)] gamma-glutamil transpeptidasi, ornitina decarbossilasi,
|
|
—
|
metabolismo dei carboidrati, come glucosio ematico a digiuno,
|
|
—
|
saggi di funzionalità renale come azoto ureico.
|
Necroscopia macroscopica
Tutti gli animali dovrebbero essere sottoposti ad esame necroscopico completo, compresi quelli che sono morti durante l'esperimento a quelli sacrificati perché moribondi. Prima del sacrificio si dovrebbero prelevare campioni di sangue da tutti gli animali per i conteggi differenziali ematici. Si dovrebbero conservare tutte le lesioni e i tumori grossolanamente visibili o sospetti. Si dovrebbe cercare di correlare le osservazioni macroscopiche con i risultati microscopici.
Tutti gli organi e i tessuti dovrebbero essere conservati per l'esame istopatologico. Questo di solito riguarda i seguenti organi e tessuti: cervello (7) (midollo/ponte, corteccia cerebellare, corteccia cerebrale), pituitaria, tiroide (compresa paratiroide), timo, polmoni (trachea compresa), cuore, aorta, ghiandole salivari, fegato (7), milza, reni (7) ghiandole surrenali (7), esofago, stomaco, duodeno, digiuno, ileo, intestino cieco, colon, retto, utero, vescica urinaria, linfonodi, pancreas, gonadi (7), organi genitali accessori, ghiandole mammarie femminili, pelle, muscolatura, nervo periferico, midollo spinale (cervicale, toracico, lombare), sterno con midollo osseo e femore (articolazione compresa) e occhi.
Sebbene l'insufflazione dei polmoni e della vescica urinaria con un fissativo sia il modo ottimale di conservare questi tessuti, l'insufflazione dei polmoni negli studi di inalazione è un requisito essenziale per l'esame istopatologico appropriato. In studi speciali come quelli dell'inalazione, si dovrebbero studiare tutte le vie respiratorie, compreso naso, faringe e laringe.
Se si eseguono altri esami clinici, le informazioni ottenute con queste procedure dovrebbero essere rese disponibili prima dell'esame microscopico, perché possono fornire indicazioni significative al patologo.
Istopatologia
Per la parte di saggio riguardante la tossicità cronica
Esame particolareggiato da effettuarsi su tutti gli organi conservati di tutti gli animali appartenenti al gruppo satellite trattato con dose elevata e al gruppo di controllo. Quando si riscontra una patologia correlata con la sostanza in esame nel gruppo satellite trattato con dose elevata, gli organi-bersaglio di tutti gli altri animali in un qualsiasi altro gruppo satellite trattato dovrebbero essere sottoposti ad esame istologico completo e particolareggiato insieme con quelli dei gruppi trattati nella parte di cancerogenesi dello studio alla sua conclusione.
Per la parte di saggio riguardante la cancerogenesi:
|
a)
|
l'esame istopatologico completo dovrebbe essere effettuato sugli organi e tessuti di tutti gli animali che muoiono o che vengono uccisi durante la prova e di tutti gli animali dei gruppi trattati con dose elevata e del gruppo di controllo;
|
|
b)
|
tutti i tumori visibili macroscopicamente o le lesioni sospette di essere di origine tumorali, che si riscontrano in qualsiasi organo di tutti i gruppi di animali dovrebbero essere esaminati microscopicamente;
|
|
c)
|
se si riscontra una differenza significativa nell'incidenza delle lesioni neoplastiche nei gruppi di controllo e in quello trattato con dose elevata, si dovrebbe effettuare l'esame istopatologico su quel particolare organo o tessuto, negli altri gruppi;
|
|
d)
|
se la sopravvivenza nel gruppo trattato con dose elevata è significativamente inferiore a quella del gruppo di controllo, si dovrebbe effettuare un esame completo del gruppo trattato con il dosaggio immediatamente inferiore;
|
|
e)
|
quando si riscontra un'evidenza nel gruppo a dosaggio elevato di induzione di effetti tossici o altri effetti che potrebbero influire su una risposta neoplastica, si dovrebbe procedere ad un esame completo del gruppo trattato con il dosaggio immediatamente inferiore.
|
2. DATI
I dati dovrebbero essere riassunti sotto forma di tabella, indicando per ogni gruppo di saggio il numero di animali all'inizio della prova, il numero di animali che presentano tumori o effetti tossici riscontrati durante il saggio, il tempo di individuazione ed il numero di animali in cui sono stati individuati tumori dopo il sacrificio. I risultati dovrebbero essere valutati con un metodo statistico appropriato. Qualsiasi metodo statistico riconosciuto può essere utilizzato.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
Nella relazione sul saggio devono figurare, se possibile:
|
—
|
specie, ceppo, origine, condizioni ambientali, dieta, ecc.,
|
|
—
|
condizioni sperimentali:
|
—
|
descrizione dell'apparecchiatura di esposizione, includente:
progettazione, tipo, dimensioni, sorgente d'aria, sistema per generare particelle ed aerosol, metodo di condizionamento dell'aria, trattamento dell'aria di scarico, metodo di alloggiamento degli animali in una camera di saggio quando questa venga utilizzata. Il dispositivo per misurare la temperatura, l'umidità e, se del caso, la stabilità delle concentrazioni di aerosol o le dimensioni delle particelle,
|
|
—
|
dati di esposizione:
questi dovranno essere presentati in forma tabulare con indicazione dei valori medi e una misura della variabilità (ad esempio: deviazione standard) ed includere:
|
a)
|
velocità dei flussi dell'aria attraverso l'attrezzatura di inalazione;
|
|
b)
|
temperature ed umidità dell'aria;
|
|
c)
|
concentrazioni nominali (quantità totale della sostanza di saggio immessa nell'attrezzatura di inalazione divisa per il volume dell'aria);
|
|
d)
|
natura di veicolo, se usato;
|
|
e)
|
concentrazioni reali nella zona sperimentale di respirazione,
|
|
f)
|
dimensioni mediane delle particelle (se del caso),
|
|
|
|
—
|
livelli di dose (veicolo compreso, se utilizzato) e concentrazioni,
|
|
—
|
dati di incidenza dei tumori secondo il sesso, la dose e il tipo di tumore,
|
|
—
|
registrazione del tempo degli eventi letali (durante l'esperimento) oppure specificare se gli animali siano sopravvissuti fino alla conclusione del saggio, incluso gruppo satellite,
|
|
—
|
dati sulla risposta tossica per sesso e per dose,
|
|
—
|
descrizione degli effetti tossici o di altri effetti,
|
|
—
|
registrazione della data di osservazione di ogni sintomo anomalo e del decorso successivo,
|
|
—
|
risultati oftalmologici,
|
|
—
|
dati su alimentazione e peso corporeo,
|
|
—
|
risultati dell'esame ematologico,
|
|
—
|
risultati degli esami di biochimica clinica (inclusa qualsiasi analisi delle urine),
|
|
—
|
risultati dell'esame necroscopico,
|
|
—
|
descrizione particolareggiata di tutti i risultati istopatologici,
|
|
—
|
elaborazione statistica dei risultati con descrizione dei metodi impiegati,
|
|
—
|
discussione dei risultati,
|
|
—
|
interpretazione dei risultati.
|
3.2. VALUTAZIONE ED INTERPRETAZIONE
Vedi introduzione generale, parte B.
4. RIFERIMENTI
Vedi introduzione generale, parte B.
B.34. SAGGIO DI TOSSICITÀ SULLA RIPRODUZIONE: UNA GENERAZIONE
1. METODO
1.1. INTRODUZIONE
Vedi introduzione generale, parte B.
1.2. DEFINIZIONI
Vedi introduzione generale, parte B.
1.3. SOSTANZA DI RIFERIMENTO
Nessuna.
1.4. PRINCIPI DEL METODO DI SAGGIO
La sostanza sperimentale è somministrata in dosi graduate a diversi gruppi di animali maschi e femmine. I maschi dovrebbero essere sottoposti a dosaggio durante la crescita e per almeno un ciclo spermatogenico completo (approssimativamente 56 giorni per il topo e 70 giorni per il ratto) per provocare qualsiasi tipo di effetto avverso da parte della sostanza di saggio sulla spermatogenesi.
Le femmine della generazione P dovrebbero essere sottoposte a dosaggio per almeno due cicli estrali completi per suscitare qualsiasi tipo di effetto contrario della sostanza in esame sull'estro. Gli animali sono poi accoppiati. La sostanza in esame viene somministrata ad entrambi i sessi durante il periodo di accoppiamento ed in seguito soltanto alle femmine durante la gravidanza e per la durata del periodo di allattamento. Per la somministrazione della sostanza in esame per via inalatoria, il metodo richiederà modifiche.
1.5. CRITERI QUALITATIVI
Nessuno.
1.6. DESCRIZIONE DEL METODO DI SAGGIO
Preparazioni
Prima del saggio gli animali giovani e sani sono mescolati con metodo casuale ed assegnati ai gruppi trattati e di controllo. Gli animali sono tenuti nelle condizioni sperimentali di alloggiamento e nutrizione per almeno 5 giorni prima dell'inizio della prova. Si raccomanda di somministrare la sostanza in esame nella dieta o nell'acqua da bere. Sono accettabili anche altre vie di somministrazione. Il dosaggio per tutti gli animali dovrebbe essere fatto con lo stesso metodo durante l'appropriato periodo dell'esperimento. Se un veicolo od altri additivi sono utilizzati per facilitare il dosaggio, essi non dovranno notoriamente produrre effetti tossici. Il dosaggio dovrà essere fatto su una base di sette giorni per settimana.
Animali da esperimento
Scelta della specie
Il ratto o il topo sono le specie preferite. Si dovrebbero utilizzare animali sani, non sottoposti in precedenza a esperimenti. Non si dovrebbero utilizzare ceppi a bassa fecondità. Gli animali di saggio dovrebbero essere caratterizzati quanto alle specie, al ceppo, al sesso, al peso e all'età.
Per una valutazione adeguata della fertilità, si dovrebbero studiare sia i maschi sia le femmine. Tutti gli animali per il saggio e i controlli dovrebbero essere svezzati prima dell'inizio del dosaggio.
Numero e sesso
Ogni gruppo trattato e di controllo dovrebbe contenere un numero sufficiente di animali per avere circa 20 femmine incinte prossime a partorire o quasi al termine della gravidanza.
L'obiettivo è di avere sufficienti gravidanze e figliate per assicurare una valutazione significativa del potenziale della sostanza di influire negativamente sulla fertilità, sulla gravidanza e sul comportamento materno negli animali della generazione P, e sul lattante, sulla crescita e sullo sviluppo della figliata F, dal concepimento allo svezzamento.
Condizioni di saggio
Il cibo e l'acqua dovrebbero essere forniti ad libitum. Nell'imminenza del parto, le femmine incinte dovrebbero essere messe in gabbie separate o in gabbie apposite per il parto e possono essere rifornite di materiale per la costruzione della tana.
Livelli di dose
Si dovrebbero usare almeno tre gruppi di trattamento e un gruppo di controllo. Se si usa un veicolo per la somministrazione della sostanza in esame, il gruppo di controllo dovrebbe ricevere il veicolo al livello di dose più alto usato. Se una sostanza in esame provoca una riduzione dell'ingestione o dell'utilizzazione della dieta, si potrebbe considerare necessario l'uso di un gruppo di controllo parallelo. Idealmente, a meno che non sia limitato dalla natura fisico/chimica o dagli effetti biologici della sostanza in esame, il livello di dose più elevato dovrebbe indurre effetti tossici, ma non mortalità nei genitori P. La(e) dose(i) intermedia(e) dovrebbe indurre effetti tossici minimi attribuibili alla sostanza in esame e la dose più bassa non dovrebbe indurre alcun effetto osservabile sui genitori o sulla prole. Quando somministrato con sonda o in capsula, il dosaggio di ogni animale dovrebbe essere basato sul peso corporeo del singolo animale e regolato settimanalmente per tener conto dei cambiamenti del peso corporeo. Per le femmine gravide, i dosaggi possono essere basati sul peso corporeo nel giorno 0 o al 6° giorno di gravidanza.
Saggio limite
Nel caso di sostanze a bassa tossicità, se un livello di dose di almeno 1 000 mg/kg non produce evidenza di interferenza con la funzione riproduttiva, studi con altri livelli di dose possono essere considerati non necessari. Se uno studio preliminare con un livello di dose elevato, con evidenza precisa di tossicità materna, non evidenzia effetti avversi sulla fertilità, studi con altri livelli di dose possono essere considerati non necessari.
Svolgimento del saggio
Programmi sperimentali
Il dosaggio giornaliero dei genitori maschi P dovrebbe cominciare a circa cinque-nove settimane di età, dopo svezzamento e acclimatazione per almeno 5 giorni, Nei ratti, il dosaggio viene continuato per dieci settimane prima del periodo di accoppiamento (per i topi, otto settimane). I maschi dovrebbero essere sacrificati ed esaminati sia alla fine del periodo di accoppiamento oppure, alternativamente, essi possono essere mantenuti con la dieta sperimentale per la possibile produzione di una seconda figliata e dovrebbero essere sacrificati un po' prima della fine dello studio. Per le femmine genitrici P il dosaggio dovrebbe cominciare dopo almeno 5 giorni di acclimatazione e continuare per almeno due settimane prima dell'accoppiamento. Il dosaggio giornaliero delle femmine P dovrebbe continuare durante il periodo di accoppiamento di tre settimane, la gravidanza e fino allo svezzamento della prole F1. Si dovrebbe dare attenzione a modifiche del programma di dosaggio sulla base di altre informazioni disponibili sulla sostanza in esame, quali l'induzione del suo metabolismo o bioaccumulazione.
Procedura di accoppiamento
Negli studi degli effetti tossici sulla riproduzione si possono usare i seguenti sistemi di accoppiamento: 1:1 (un maschio e una femmina), oppure 1:2 (un maschio e due femmine).
Usando il sistema di accoppiamento 1:1 si dovrebbe mettere una femmina con lo stesso maschio finché la femmina non rimanga gravida o finché non siano trascorse tre settimane. Ogni mattina le femmine dovrebbero essere esaminate per la presenza di sperma o di tappi vaginali. Il giorno 0 di gravidanza è definito come il giorno in cui si trova un tappo vaginale oppure lo sperma.
Le coppie che non riescono ad accoppiarsi dovrebbero essere studiate per determinare la causa della sterilità apparente.
Questo può comportare procedure quali, ad esempio, quella di fornire opportunità supplementari di accoppiamento con altri maschi o femmine provati, esame microscopico degli organi riproduttori, e esame del ciclo estrale o della spermatogenesi.
Dimensioni della figliata
Gli animali sottoposti a dosaggio durante lo studio di fertilità vengono lasciati partorire normalmente ed allevare liberamente la prole fino alla fase di svezzamento.
Se si effettua una standardizzazione si suggerisce la seguente procedura. Tra il 1° ed il 4° giorno dopo la nascita, la dimensione di ogni figliata può essere regolata eliminando i piccoli in più, in modo da avere, nella misura del possibile, quattro maschi e quattro femmine per figliata.
Ogni volta che il numero di maschi o di femmine non permette di avere quattro animali di ogni sesso per figliata, è accettabile una regolazione parziale (ad esempio, cinque maschi e tre femmine). La standardizzazione non è applicabile alle figliate di meno di otto piccoli.
Osservazioni
Durante tutto il periodo di saggio, ogni animale dovrebbe essere sottoposto ad osservazione almeno una volta al giorno. Si dovrebbero registrare tutte le variazioni comportamentali pertinenti, i segni di parto difficile o prolungato, e tutti i sintomi di tossicità, compresa la mortalità. Nei periodi precedenti e durante l'accoppiamento, il consumo alimentare può essere misurato quotidianamente. Dopo il parto e durante l'allattamento, le misurazioni del consumo di alimento (e del consumo dell'acqua quando la sostanza sperimentale è somministrata in acqua potabile) dovrebbero essere effettuate nello stesso giorno della pesatura delle figliate. I maschi e le femmine P dovrebbero essere pesati nel primo giorno del dosaggio e in seguito settimanalmente. Queste osservazioni dovrebbero essere registrate individualmente per ogni animale adulto.
La durata della gestazione dovrebbe essere calcolata dal giorno 0 di gravidanza. Ogni figliata dovrebbe essere esaminata non appena possibile dopo il parto per stabilire il numero ed il sesso dei piccoli, dei nati morti, dei nati vivi e la presenza di grosse anomalie.
I piccoli morti e quelli sacrificati al 4° giorno dovrebbero essere conservati e studiati per la constatazione di possibili difetti. I piccoli vivi dovrebbero essere contati e le figliate pesate al mattino dopo la nascita, al 4° giorno e al 7° e settimanalmente fino alla conclusione dello studio, quando gli animali dovrebbero essere pesati individualmente.
Le anomalie fisiche o comportamentali osservate nei ceppi o nella prole dovrebbero essere registrate.
Patologia
Necroscopia
Al momento del sacrificio o della morte durante lo studio, gli animali della generazione P dovrebbero essere esaminati macroscopicamente per l'individuazione di tutte le anomalie strutturali o mutamenti patologici, prestando particolare attenzione agli organi del sistema riproduttivo. I piccoli morti o moribondi dovrebbero essere esaminati per individuare eventuali difetti.
Istopatologia
Le ovaie, l'utero, il collo dell'utero, la vagina, i testicoli, l'epididimo, le vescichette seminali, la prostata, la ghiandola della coagulazione, la ghiandola pituitaria e l'organo(i)-bersaglio di tutti gli animali P dovrebbero essere conservati per l'esame microscopico. Nel caso in cui questi organi non siano stati esaminati in altri studi con dosi multiple, essi dovrebbero essere esaminati microscopicamente in tutti gli animali dei gruppi trattati con dose elevata e di controllo e negli animali che muoiono durante l'esperimento, quando fattibile.
Gli organi di questi animali che mostrano anomalie dovrebbero quindi essere esaminati in tutti gli altri animali P. In questi casi, si dovrebbe eseguire l'esame microscopico di tutti i tessuti che mostrano alterazioni patologiche macroscopiche. Come suggerito per le procedure di accoppiamento, gli organi riproduttivi degli animali sospetti di sterilità possono essere sottoposti all'esame microscopico.
2. DATI
I dati possono essere riassunti sotto forma di tabella, indicando per ogni gruppo sperimentale il numero di animali all'inizio del saggio, il numero di maschi fertili, il numero di femmine incinte, i tipi di cambiamenti e la percentuale degli animali che mostrano ciascun tipo di cambiamento.
Quando possibile, i risultati numerici dovrebbero essere valutati con un metodo statistico idoneo. Qualsiasi metodo statistico generalmente riconosciuto può essere utilizzato.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
Nella relazione sul saggio devono figurare, se possibile:
|
—
|
dati sulla risposta tossica per sesso e per dose, compresa la fertilità, la gestazione normale e la vitalità,
|
|
—
|
tempo di morte durante lo studio o, se gli animali sono sopravvissuti fino al tempo previsto per il sacrificio, alla conclusione dello studio,
|
|
—
|
tabella indicante i pesi di ogni figliata, il peso medio dei piccoli ed i pesi individuali dei piccoli a termine,
|
|
—
|
effetti tossici o altri effetti sulla riproduzione, sulla prole, sulla crescita postnatale,
|
|
—
|
data di osservazione di ogni segno anomalo e decorso successivo,
|
|
—
|
dati sul peso corporeo degli animali P,
|
|
—
|
risultati della microscopia,
|
|
—
|
descrizione particolareggiata di tutti i risultati degli esami microscopici,
|
|
—
|
elaborazione statistica dei risultati, quando appropriata,
|
|
—
|
discussione dei risultati,
|
|
—
|
interpretazione dei risultati.
|
3.2. VALUTAZIONE ED INTERPRETAZIONE
Vedi introduzione generale, parte B.
4. RIFERIMENTI
Vedi introduzione generale, parte B.
B.35. STUDIO DI TOSSICITÀ RIPRODUTTIVA A DUE GENERAZIONI
1. METODO
Questo metodo corrisponde al TG 416 (2001) dell'OCSE.
1.1. INTRODUZIONE
Questo metodo di test della capacità riproduttiva a due generazioni è in grado di fornire dati generici riguardanti gli effetti di una sostanza sull'integrità e le prestazioni degli apparati riproduttori maschile e femminile, compresi funzione delle gonadi, ciclo estrale, comportamento nell'accoppiamento, concepimento, gestazione, parto, allattamento e svezzamento, nonché crescita e sviluppo della prole. Lo studio può inoltre fornire informazioni sugli effetti della sostanza circa la morbilità e la mortalità neonatale, nonché dati preliminari sulla tossicità a carico dello sviluppo prenatale e postnatale, e servire da guida per test successivi. Oltre a studiare la crescita e lo sviluppo della generazione F1, questo metodo di test è inteso a valutare l'integrità e le prestazioni degli apparati riproduttori maschile e femminile, nonché la crescita e lo sviluppo della generazione F2. Per ottenere ulteriori dati inerenti alla tossicità sullo sviluppo e ai deficit funzionali è possibile incorporare nel presente protocollo parti di altri studi attingendo eventualmente ai metodi per la tossicità e/o la neurotossicità in fase evolutiva; alternativamente gli stessi endpoint possono essere esaminati in studi separati, mediante adeguati metodi di test.
1.2. PRINCIPIO DEL TEST
La sostanza di saggio viene somministrata in dosi graduate a diversi gruppi di maschi e femmine. Ai maschi della generazione P la sostanza va somministrata durante la crescita e per almeno un ciclo completo di spermatogenesi (all'incirca 56 giorni nel topo e 70 giorni nel ratto) con l'obiettivo di provocare eventuali effetti avversi sulla spermatogenesi. Gli effetti sugli spermatozoi si rilevano in base a svariati parametri (tra cui la morfologia e la motilità degli spermatozoi) nonché mediante preparazione tissutale e dettagliato esame istopatologico. Nel caso siano disponibili dati sulla spermatogenesi provenienti da un precedente studio a dosi ripetute di durata sufficiente, come ad esempio uno studio di 90 giorni, non occorre includere nella valutazione i maschi della generazione P. Si raccomanda tuttavia di conservare campioni o registrazioni digitali degli spermatozoi della generazione P, per consentirne la valutazione in un momento successivo. Alle femmine della generazione P la sostanza va somministrata durante la crescita e per diversi cicli estrali completi con l'obiettivo di provocare eventuali effetti avversi sulla normalità del ciclo estrale. La sostanza di saggio viene somministrata agli animali della generazione parentale (P) durante l'accoppiamento, durante la gravidanza e per tutto lo svezzamento della loro prole della generazione F1. Allo svezzamento, si prosegue la somministrazione della sostanza da saggiare alla prole della generazione F1 durante la crescita e successivamente l'età adulta, l'accoppiamento e la produzione di una generazione F2, continuando fino allo svezzamento della generazione F2.
Tutti gli animali vanno sottoposti a osservazioni cliniche e valutazione anatomopatologica per individuare eventuali segni di tossicità, in particolare gli effetti sull'integrità e le prestazioni degli apparati riproduttori maschile e femminile e sulla crescita e sullo sviluppo della prole.
1.3. DESCRIZIONE DEL METODO
1.3.1. Selezione delle specie animali
La specie d'elezione per l'esecuzione del test è il ratto. In caso di utilizzo di altre specie, occorre giustificare tale scelta e apportare adeguate modifiche al protocollo. Non vanno usati ceppi a bassa fecondità o con nota elevata incidenza di difetti dello sviluppo. All'inizio dello studio la variazione ponderale degli animali utilizzati deve essere minima e non superare il 20 % del peso medio di ciascun sesso.
1.3.2. Condizioni di stabulazione e alimentazione
La temperatura nella stanza degli animali sperimentali deve essere di 22 oC (± 3o). Sebbene l'umidità relativa debba raggiungere almeno il 30 % e preferibilmente non superare il 70 %, tranne che nel corso delle pulizie della stanza, è bene puntare a un valore del 50-60 %. L'illuminazione deve essere artificiale, con una sequenza di 12 ore di luce e 12 di buio. Per quanto concerne l'alimentazione si possono usare le diete convenzionali da laboratorio con una quantità illimitata di acqua potabile. La scelta della dieta può essere influenzata dalla necessità di assicurare un'adeguata miscelazione della sostanza di saggio, quando somministrata con il presente metodo.
Gli animali possono essere alloggiati individualmente o in piccoli gruppi dello stesso sesso. Le procedure di accoppiamento vanno effettuate in gabbie adeguate per tale scopo. Dopo comprovata copulazione, le femmine accoppiate vanno isolate in gabbie da parto o maternità. Anche i ratti accoppiati possono essere tenuti in piccoli gruppi, ma vanno separati uno o due giorni prima del parto. Quando si avvicina il momento del parto occorre fornire agli animali materiali specifici adeguati per la costruzione del nido.
1.3.3. Preparazione degli animali
Devono essere utilizzati animali giovani sani, che siano stati acclimatati alle condizioni di laboratorio per almeno 5 giorni e non siano stati precedentemente sottoposti ad altre procedure sperimentali. Gli animali del test vanno caratterizzati per quanto concerne specie, ceppo, provenienza, sesso, peso e/o età. È necessario conoscere eventuali relazioni di consanguineità in modo da evitare l'accoppiamento tra individui fratelli. Gli animali vanno assegnati a random ai gruppi di controllo e di trattamento (si raccomanda la stratificazione per peso corporeo). Le gabbie vanno sistemate in modo da ridurre al minimo i possibili effetti dovuti alla loro posizione. A ciascun animale va assegnato un numero identificativo unico. Per la generazione P l'assegnazione del numero identificativo deve avvenire prima dell'inizio della somministrazione delle dosi. Per la generazione F1 l'assegnazione va fatta allo svezzamento degli animali selezionati per l'accoppiamento. È necessario conservare la registrazione indicante la nidiata di origine per tutti gli animali F1 selezionati. Inoltre, si raccomanda l'identificazione individuale dei piccoli non appena possibile dopo la nascita nel caso si preveda la pesatura individuale degli stessi o l'esecuzione di eventuali test funzionali.
All'inizio della somministrazione delle dosi gli animali della generazione parentale P devono avere 5-9 settimane di età. Gli animali di tutti i gruppi sperimentali devono essere, per quanto praticamente possibile, di età e peso uniformi.
1.4. PROCEDURA
1.4.1. Numero e sesso degli animali
Ciascun gruppo di trattamento e di controllo deve comprendere un numero sufficiente di animali da fornire idealmente non meno di 20 femmine gravide al parto o prossime al termine. Ciò può risultare impossibile in caso di somministrazione di sostanze che causano effetti indesiderati correlati al trattamento (ad esempio sterilità o eccessiva tossicità a dose elevata). L'obiettivo è di produrre un numero di gravidanze tale da assicurare un'analisi significativa del potenziale della sostanza in termini di effetti sulla fertilità, la gravidanza e il comportamento materno, oltre che la suzione, la crescita e lo sviluppo della prole F1, dal concepimento e fino alla maturità, per proseguire poi con gli effetti sullo sviluppo della prole della successiva generazione F2 fino allo svezzamento. Comunque, il mancato ottenimento del numero desiderato di femmine gravide (± 20) non invalida necessariamente lo studio e va valutato caso per caso.
1.4.2. Preparazione delle dosi
Si raccomanda di somministrare la sostanza di prova per via orale (assieme alla dieta o all'acqua potabile o mediante sonda gastrica), a meno che non si consideri più adeguata un'altra via di somministrazione (ad esempio cutanea o per inalazione).
Se necessario la sostanza di prova va disciolta o sospesa in un veicolo adeguato. Si raccomanda di prendere anzitutto in considerazione, ogni qualvolta possibile, l'uso di una soluzione/sospensione acquosa, e in seconda battuta quello di una soluzione/emulsione in olio (ad esempio olio di semi di mais) e infine la possibile soluzione in altri veicoli. Dei veicoli diversi dall'acqua devono essere note le caratteristiche tossiche. È necessario determinare la stabilità della sostanza di prova nel veicolo.
1.4.3. Dosaggio
Si utilizzano almeno tre livelli di dose e un controllo corrispondente. A meno che la natura fisico-chimica o gli effetti biologici della sostanza di prova non impongano limiti in tal senso, il livello della dose più elevata va scelto con l'obiettivo di indurre tossicità ma non provocare il decesso o gravi sofferenze. Di norma gli studi con un tasso di mortalità imprevista inferiore a circa il 10 % degli animali parentali P sono comunque accettabili. Per dimostrare eventuali effetti correlati al dosaggio e individuare il livello al quale non si osservano effetti avversi (NOAEL) occorre selezionare una sequenza decrescente di livelli di dose. In genere, per determinare i livelli decrescenti delle dosi risultano ottimali fattori compresi tra due e quattro e spesso è preferibile aggiungere un quarto gruppo di prova piuttosto che utilizzare intervalli molto ampi (ad esempio un fattore superiore a 10) fra i dosaggi. Per gli studi con somministrazione nella dieta, l'intervallo fra le dosi non deve superare un fattore di 3. I livelli delle dosi vanno selezionati tenendo conto di eventuali dati sulla tossicità già disponibili, e in particolar modo dei risultati di studi con dosi ripetute. Occorre inoltre tenere conto di eventuali informazioni già disponibili sul metabolismo e la cinetica della sostanza di prova o di sostanze correlate. Questi dati contribuiranno altresì a dimostrare l'adeguatezza del regime di dosaggio.
Il gruppo di controllo deve essere non trattato o trattato solo con il veicolo nel caso si utilizzi un veicolo per somministrare la sostanza di saggio. Tranne per la somministrazione della sostanza di saggio, gli animali del gruppo di controllo devono essere trattati in maniera identica ai soggetti del gruppo di trattamento. Se si utilizza un veicolo, il gruppo di controllo riceverà il veicolo al volume più elevato in uso nel test. Se una sostanza di prova viene somministrata mediante la dieta e causa una riduzione dell'apporto o dell'utilizzo degli alimenti, può diventare necessario l'impiego di un gruppo di controllo pair-fed. In alternativa è possibile usare i dati da studi controllati disegnati per valutare gli effetti della diminuzione del consumo di cibo sui parametri della riproduzione al posto di un gruppo di controllo pair-fed concomitante.
Occorre tenere conto delle seguenti caratteristiche del veicolo e di altri additivi: effetti sull'assorbimento, sulla distribuzione, sul metabolismo o sulla ritenzione della sostanza di prova; effetti sulle proprietà chimiche della sostanza di prova che potrebbero alterarne le caratteristiche tossiche; infine, effetti sul consumo di cibo o di acqua o sulle condizioni nutrizionali degli animali.
1.4.4. Test limite
Se uno studio orale a un livello di dose di almeno 1 000 mg/kg per peso corporeo/die o, per somministrazione tramite l'alimentazione o l'acqua potabile, a una percentuale equivalente nella dieta o nell'acqua potabile secondo le procedure descritte per questo studio non produce effetti tossici osservabili, sia negli animali parentali sia nella prole e se, sulla base di dati relativi a sostanze strutturalmente e/o metabolicamente correlate, non ci si attende tossicità, allora può non essere considerato necessario uno studio completo con livelli di dosi differenti. Si applica il test limite, tranne quando l'esposizione umana indica la necessità di utilizzare un livello di dose orale più elevato. Per altri tipi di somministrazione, quali l'inalazione o l'applicazione cutanea, sono spesso le proprietà fisico-chimiche della sostanza di saggio, come la solubilità, a indicare e limitare il livello massimo di esposizione raggiungibile.
1.4.5. Somministrazione delle dosi
Occorre somministrare la sostanza di prova agli animali per 7 giorni alla settimana, di preferenza per via orale (dieta, acqua potabile o sonda gastrica). In caso di utilizzo di un'altra via di somministrazione, occorre giustificare tale scelta ed eventualmente apportare modifiche adeguate al test. Tutti gli animali saranno trattati per la stessa via di somministrazione nel corso di un periodo sperimentale adeguato. Se la sostanza di saggio viene somministrata mediante sonda, deve trattarsi di una sonda gastrica. Il volume di liquidi somministrati in una volta non deve superare 1 ml/l00 g di peso corporeo (0,4 ml/100 g di peso corporeo è il massimo per l'olio di semi di mais), tranne che nel caso di soluzioni acquose in cui è consentito usare 2 ml/100 g. Ad eccezione delle sostanze irritanti o corrosive, che generalmente manifestano effetti esacerbati a concentrazioni più elevate, occorre ridurre al minimo la variabilità del volume di prova, regolando la concentrazione, in modo da assicurare un volume costante a tutti i livelli di dose. Negli studi con sonda gastrica normalmente i piccoli ricevono la sostanza solo indirettamente, attraverso il latte, finché non comincia il dosaggio diretto al momento dello svezzamento. Negli studi che prevedono la somministrazione nella dieta o nell'acqua potabile in genere i piccoli ricevono la sostanza di saggio anche direttamente quando cominciano ad alimentarsi da soli durante l'ultima settimana del periodo di allattamento.
Per quanto concerne le sostanze somministrate tramite il cibo o l'acqua potabile, è importante fare in modo che le quantità di sostanza di saggio impiegate non interferiscano con la normale alimentazione o il normale bilancio idrico. Se la sostanza di saggio viene somministrata con la dieta, è possibile usare una concentrazione alimentare costante (ppm) o un livello costante di dosi rispetto al peso corporeo degli animali; occorre specificare l'opzione utilizzata. Nel caso di sostanze somministrate mediante sonda gastrica, la dose va somministrata ogni giorno all'incirca negli stessi orari e regolata almeno settimanalmente per mantenere un livello costante delle dosi rispetto al peso corporeo degli animali. Nel regolare le dosi per la sonda gastrica in base al peso occorre tenere conto dei dati sulla distribuzione nella placenta.
1.4.6. Programma sperimentale
La somministrazione giornaliera delle dosi ai maschi e alle femmine della generazione parentale P deve iniziare a 5-9 settimane di età. La somministrazione giornaliera ai maschi e alle femmine F1 deve iniziare allo svezzamento; occorre ricordare che, in caso di somministrazione della sostanza di saggio tramite la dieta o l'acqua potabile, l'esposizione diretta dei piccoli F1 alla sostanza di saggio può avvenire già durante il periodo dell'allattamento. Per entrambi i sessi di entrambe le generazioni (P e F1) la somministrazione proseguirà per almeno 10 settimane prima del periodo di accoppiamento e andrà continuata, in entrambi i sessi, durante le 2 settimane del periodo di accoppiamento. I maschi vanno sacrificati con metodi non cruenti ed esaminati quando non sono più necessari per la valutazione degli effetti sulla riproduzione. Per quanto riguarda le femmine parentali P, il dosaggio va continuato per tutta la gravidanza e fino allo svezzamento della prole F1. Occorre eventualmente modificare il programma di somministrazione sulla base delle informazioni disponibili circa la sostanza di saggio, compresi dati già esistenti di tossicità, induzione del metabolismo o bioaccumulo. Di norma la dose somministrata a ciascun animale deve essere basata sulla più recente determinazione individuale del peso corporeo. Occorre tuttavia usare cautela nel regolare la dose durante l'ultimo periodo della gravidanza.
Il trattamento di maschi e femmine delle generazioni P e F1 va proseguito fino alla soppressione. Tutti i maschi e le femmine adulti P e F1 vanno sacrificati con metodi non cruenti quando non sono più necessari per la valutazione degli effetti sulla riproduzione. La prole F1 non selezionata per l'accoppiamento e tutta la prole F2 vanno sacrificate con metodi non cruenti dopo lo svezzamento.
1.4.7. Procedura di accoppiamento
1.4.7.1. Accoppiamento parentale (P)
Per ogni accoppiamento, ciascuna femmina viene posta insieme a un unico maschio dello stesso livello di dose (accoppiamento 1:1) finché non avviene la copulazione o finché non sono trascorse 2 settimane. Occorre esaminare ogni giorno le femmine alla ricerca di spermatozoi o tappi vaginali. Il giorno 0 della gravidanza è definito come il giorno in cui si rileva la presenza di un tappo vaginale o di spermatozoi. Nel caso l'accoppiamento non abbia successo, si può valutare la possibilità di far accoppiare le femmine con maschi di comprovata capacità riproduttiva dello stesso gruppo. Le coppie in cui è avvenuta la copulazione vanno identificate chiaramente in sede di registrazione dei dati. Occorre evitare l'accoppiamento fra consanguinei.
1.4.7.2. Accoppiamento della generazione F1
Per l'accoppiamento della prole F1 occorre selezionare, allo svezzamento, almeno un maschio e una femmina da ciascuna nidiata per farli accoppiare con altri piccoli dello stesso livello di dose, ma di una nidiata diversa, allo scopo di produrre la generazione F2. Se non si osservano differenze significative nel peso corporeo o nell'aspetto dei potenziali partner, la selezione dei piccoli da ciascuna nidiata va effettuata a random. Nel caso in cui si osservino differenze, vanno selezionati i migliori rappresentanti di ciascuna nidiata. Di prassi, il modo migliore per farlo è basarsi sul peso corporeo, sebbene l'aspetto possa risultare un parametro più adeguato. La prole F1 non va fatta accoppiare prima del raggiungimento della piena maturità sessuale.
Le coppie senza progenie vanno analizzate per determinare la causa apparente dell'infertilità. In tal caso può rendersi necessario ricorrere a determinate procedure, tra cui la ripetizione dell'accoppiamento con altri maschi o femmine di comprovata capacità riproduttiva, l'esame microscopico degli organi riproduttori e l'esame dei cicli estrali o della spermatogenesi.
1.4.7.3. Secondo accoppiamento
Qualora si riscontri una deviazione dalla norma nel numero di esemplari di una nidiata correlabile al trattamento o qualora si osservino effetti inusitati nel corso del primo accoppiamento, si raccomanda di far accoppiare una seconda volta gli adulti delle generazioni P o F1 per produrre una seconda nidiata. Per le femmine o i maschi che non hanno prodotto piccoli è consigliabile il riaccoppiamento con riproduttori comprovati del sesso opposto. Se si ritiene necessaria la produzione di una seconda nidiata da parte di una delle generazioni, gli animali vanno fatti riaccoppiare all'incirca una settimana dopo lo svezzamento della nidiata precedente.
1.4.7.4 Dimensioni della nidiata
Occorre permettere agli animali di figliare normalmente e di allevare la prole fino allo svezzamento. La standardizzazione del numero di individui delle nidiate è facoltativa. Nel caso venga eseguita, occorre descrivere in modo particolareggiato il metodo utilizzato.
1.5. OSSERVAZIONI
1.5.1. Osservazioni cliniche
Occorre eseguire ogni giorno osservazioni cliniche generali e, nel caso di somministrazione mediante sonda gastrica, tale esame va programmato tenendo conto del previsto periodo di picco degli effetti dopo la somministrazione. Sono da registrare i cambiamenti del comportamento, i segni di parto difficoltoso o prolungato e tutti i segni di tossicità. È necessario eseguire un ulteriore esame più dettagliato su ciascun animale a intervalli almeno settimanali, ad esempio da svolgersi in occasione di una pesatura dell'animale. Due volte al giorno, o eventualmente una volta al giorno durante il fine settimana, occorre valutare tutti gli animali in relazione alla morbilità e alla mortalità.
1.5.2. Peso corporeo e consumo di cibo/acqua degli animali parentali
Gli animali delle generazioni parentali (P e F1) vanno pesati il primo giorno della somministrazione e, successivamente, a cadenza almeno settimanale. Le femmine parentali (P e F1) vanno pesate almeno nei giorni 0, 7, 14 e 20 o 21 di gestazione, nonché durante l'allattamento negli stessi giorni di pesatura dei cuccioli e nel giorno della soppressione degli animali. Queste osservazioni vanno riportate singolarmente per ciascun animale adulto. Durante il periodo precedente all'accoppiamento e quello di gestazione il consumo di cibo va registrato con cadenza almeno settimanale. Se la sostanza di saggio viene somministrata nell'acqua, il consumo di acqua va registrato con cadenza almeno settimanale.
1.5.3. Ciclo estrale
La lunghezza e la normalità del ciclo estrale vanno valutate nelle femmine P e F1 mediante striscio vaginale prima dell'accoppiamento, nonché facoltativamente durante l'accoppiamento, finché l'accoppiamento non risulti avvenuto. Durante il prelievo delle cellule vaginali/cervicali occorre prestare attenzione a non arrecare disturbo alla mucosa per evitare un'eventuale induzione di pseudogravidanza (1).
1.5.4. Parametri relativi agli spermatozoi
Al momento della soppressione occorre registrare il peso di testicoli ed epididimi di tutti i maschi P e F1, riservando un esemplare di ciascun organo per l'esame istopatologico (vedi sezioni 1.5.7 e 1.5.8.1). In una subserie di almeno dieci maschi di ciascun gruppo di maschi delle generazioni P e F1, i testicoli e gli epididimi restanti sono da utilizzare rispettivamente per la conta degli spermatidi resistenti all'omogeneizzazione e delle riserve di spermatozoi nella coda dell'epididimo. Per la stessa subserie di maschi occorre raccogliere gli spermatozoi dalla coda dell'epididimo o dal vaso deferente allo scopo di valutarne la motilità e la morfologia. Se si osservano effetti correlati al trattamento o se da altri studi emergono prove di possibili effetti sulla spermatogenesi, la valutazione degli spermatozoi va eseguita su tutti i maschi di ciascun gruppo; diversamente, è possibile limitare la conta ai maschi P e F1 di controllo e del gruppo di trattamento alla dose più elevata.
È necessario contare il numero totale degli spermatidi testicolari resistenti all'omogeneizzazione e degli spermatozoi della coda dell'epididimo (2)(3). Le riserve caudali di spermatozoi possono essere calcolate in base alla concentrazione e al volume degli spermatozoi nella sospensione usata per eseguire le valutazioni qualitative e in base al numero di spermatozoi rinvenuti mediante successiva triturazione e/o omogeneizzazione del restante tessuto caudale. La conta va eseguita sulla subserie selezionata di maschi di tutti i gruppi di dosaggio immediatamente dopo la soppressione degli animali, a meno che non si eseguano registrazioni video o digitali o salvo in caso di congelamento degli esemplari per esame successivo. In questi casi è possibile analizzare anzitutto i controlli e il gruppo alla dose più elevata. Se non si rilevano effetti correlati al trattamento (ad esempio effetti sulla conta, sulla motilità o sulla morfologia degli spermatozoi) non occorre procedere all'analisi degli altri gruppi. Se nel gruppo che ha ricevuto la dose più elevata si osservano effetti correlati al trattamento, è necessario analizzare anche i gruppi delle dosi inferiori.
La motilità degli spermatozoi dell'epididimo (o del vaso deferente) va valutata o videoregistrata immediatamente dopo aver sacrificato gli animali. Occorre recuperare gli spermatozoi riducendo al minimo il danno e diluirli, per l'analisi della motilità, usando metodi accettabili (4). La percentuale di spermatozoi progressivamente mobili va determinata soggettivamente od oggettivamente. Se si esegue l'analisi computerizzata del movimento (5)(6)(7)(8)(9)(10) il calcolo della mobilità progressiva si basa su soglie definite dall'utente per la velocità media sul percorso e l'avanzamento in linea retta o indice lineare. Se si esegue una videoregistrazione dei campioni (11) o le immagini vengono registrate in altro modo al momento dell'autopsia, è sufficiente procedere solo all'analisi dei maschi P e F1 di controllo e della dose più elevata, a meno che non si osservino effetti correlati al trattamento; in tal caso vanno esaminati anche i gruppi delle dosi inferiori. In assenza di immagini video o digitali, vanno analizzati mediante autopsia tutti i campioni di tutti i gruppi di trattamento.
È necessario eseguire una valutazione morfologica di un campione di spermatozoi dell'epididimo (o del vaso deferente). Gli spermatozoi (ad esempio 200) vanno esaminati come preparazioni fisse e umide (12) e classificati come normali o anomali. Esempi di anomalie morfologiche degli spermatozoi sono fusione, teste isolate e malformazioni di testa e/o coda. La valutazione va eseguita sulla subserie selezionata dei maschi di ciascun gruppo di dose subito dopo la soppressione degli animali o, in caso di registrazioni video o digitali, in un secondo momento. Gli strisci, una volta fissati, possono anch'essi essere letti in un momento successivo. In questi casi è possibile analizzare anzitutto i controlli e il gruppo della dose più elevata. Se non si rilevano effetti correlati al trattamento (ad esempio effetti sulla morfologia degli spermatozoi) non occorre procedere all'analisi degli altri gruppi. Se nel gruppo della dose più elevata si osservano effetti correlati al trattamento, è necessario analizzare anche i gruppi delle dosi inferiori.
Qualora uno o più parametri di valutazione degli spermatozoi di cui sopra siano già stati esaminati nell'ambito di uno studio sulla tossicità sistemica della durata di almeno 90 giorni, non occorre ripeterli nello studio su due generazioni. Si raccomanda, tuttavia, di conservare campioni o registrazioni digitali degli spermatozoi della generazione P per consentire un'eventuale valutazione successiva.
1.5.5. Prole
Ciascuna nidiata va esaminata non appena possibile dopo il parto (giorno di allattamento 0) per stabilire il numero e il sesso dei piccoli, distinguere gli individui nati morti da quelli nati vivi e individuare eventuali anomalie macroscopiche. I piccoli trovati morti il giorno 0 dovrebbero, se non sono in stato di decomposizione, essere esaminati alla ricerca di possibili difetti e della causa del decesso e preparati per la conservazione. I piccoli vivi dovrebbero essere contati e pesati individualmente alla nascita (giorno di allattamento 0) o il giorno 1, e successivamente ad intervalli regolari, ad esempio nei giorni 4, 7, 14 e 21 dell'allattamento. È importante registrare eventuali anomalie fisiche o comportamentali osservate nelle madri o nella prole.
Lo sviluppo fisico della prole va registrato soprattutto in termini di aumento del peso corporeo. Altri parametri fisici (ad esempio l'apertura di orecchie e occhi, l'eruzione dei denti, la crescita del pelo) possono fornire informazioni supplementari, ma è preferibile valutare questo tipo di dati alla luce di quelli sulla maturazione sessuale (ad esempio età e peso corporeo all'apertura vaginale o alla separazione balano-prepuziale) (13). Si raccomanda di eseguire indagini sulla funzionalità in generale (ad esempio attività motoria, funzioni sensoriali, ontogenesi dei riflessi) della prole F1 prima e/o dopo lo svezzamento, in particolare per le funzioni correlate alla maturazione sessuale, se tali indagini non sono comprese in studi separati. Degli animali F1 svezzati e selezionati per l'accoppiamento occorre determinare l'età al momento dell'apertura vaginale e della separazione prepuziale. La distanza anogenitale va misurata al giorno 0 dalla nascita nei piccoli F2, se ciò risulta indicato per la presenza di alterazioni nel rapporto tra i due sessi o nei tempi di maturazione sessuale della generazione F1.
Le osservazioni sulla funzionalità possono essere omesse nei gruppi che rivelano altri chiari segni di effetti negativi (ad esempio un rallentamento significativo dell'aumento ponderale, ecc.). Se effettuate, le indagini sulla funzionalità non devono riguardare i piccoli selezionati per l'accoppiamento.
1.5.6. Esame autoptico macroscopico
Al momento della soppressione o dell'eventuale decesso di esemplari nel corso dello studio è necessario eseguire un esame autoptico macroscopico per determinare eventuali anomalie strutturali o alterazioni patologiche su tutti gli animali parentali (P e F1), tutti i piccoli con anomalie visibili o segni clinici, oltre che su un piccolo di ciascun sesso di ogni nidiata selezionato a random, sia della generazione F1 che della F2. Occorre prestare particolare attenzione agli organi dell'apparato riproduttore. I piccoli moribondi che vengono sacrificati con modalità non cruente e i piccoli deceduti, quando non in stato di decomposizione, vanno esaminati alla ricerca di possibili difetti e/o della causa del decesso e successivamente conservati.
Occorre esaminare l'utero di tutte le femmine primipare, evitando di compromettere l'esame istopatologico, per determinare la presenza e il numero dei siti di impianto.
1.5.7. Peso degli organi
Al momento della soppressione occorre determinare il peso corporeo e il peso dei seguenti organi di tutti gli animali delle generazioni parentali P e F1 (gli organi pari vanno pesati individualmente):
|
—
|
testicoli, epididimi (totali e coda),
|
|
—
|
vescicole seminali con ghiandole della coagulazione e i relativi liquidi oltre che la prostata (come un'unica unità),
|
|
—
|
cervello, fegato, reni, milza, ghiandole pituitaria, tiroide e surrenali e organi bersaglio noti.
|
Al momento della soppressione dei piccoli F1 e F2 selezionati per l'esame autoptico si procede alla determinazione del peso corporeo raggiunto alla fine dell'esperimento (vedi sezione 1.5.6). Di ciascun piccolo, di entrambi i sessi da ciascuna nidiata selezionato a random, alla pesatura dei seguenti organi: cervello, milza e timo.
I risultati dell'autopsia macroscopica e della pesatura degli organi vanno valutati, quando possibile, in rapporto alle osservazioni fatte in altri studi con dose ripetuta.
1.5.8. Istopatologia
1.5.8.1. Animali parentali
I seguenti organi e tessuti degli animali delle generazioni parentali (P e F1), o loro campioni rappresentativi, devono essere fissati e conservati in un mezzo adeguato per l'esame istopatologico:
|
—
|
vagina, utero con cervice e ovaie (conservati in un fissativo appropriato),
|
|
—
|
un testicolo (conservato in soluzione di Bouin o in un fissativo analogo), un epididimo, vescicole seminali, prostata e ghiandola della coagulazione,
|
|
—
|
organi bersaglio precedentemente identificati di tutti gli animali P e F1 selezionati per l'accoppiamento.
|
L'esame istopatologico completo degli organi e dei tessuti conservati sopra elencati va eseguito su tutti gli animali P e F1 della dose elevata e di controllo selezionati per l'accoppiamento. L'esame delle ovaie degli animali P è facoltativo. Gli organi che evidenziano alterazioni correlate al trattamento vanno esaminati anche nei gruppi alla dose bassa ed intermedia, allo scopo di contribuire alla determinazione del NOAEL. Inoltre, vanno sottoposti ad esame istopatologico gli organi della riproduzione degli animali dei gruppi di trattamento alla dose bassa ed intermedia nei quali si sospetta una riduzione della fertilità (ad esempio gli esemplari che non si sono accoppiati, che non hanno concepito, che non hanno generato o che non hanno partorito prole sana, o nei quali si sono osservati effetti sul ciclo estrale o sul numero, sulla motilità o sulla morfologia degli spermatozoi). Devono essere esaminate tutte le lesioni macroscopiche, quali atrofie e tumori.
L'esame istopatologico dettagliato dei testicoli (trattati ad esempio mediante fissativo di Bouin, inclusi in paraffina e preparati in sezioni trasversali di 4-5 μm di spessore) va effettuato allo scopo di identificare eventuali effetti correlati al trattamento, quali ritenzione di spermatidi, mancanza di strati o tipi di cellule germinali, formazione di cellule giganti polinucleate o spostamento delle cellule spermatogeniche nel lume (14). L'esame degli epididimi intatti deve comprendere testa, corpo e coda e può essere eseguito mediante valutazione di una sezione longitudinale. Occorre valutare la presenza di infiltrazioni leucocitarie, alterazioni della prevalenza dei tipi cellulari, tipi cellulari aberranti e fagocitosi degli spermatozoi nell'epididimo. Per l'esame degli organi della riproduzione maschili può essere impiegata la colorazione con PAS ed ematossilina.
Dopo l'allattamento l'ovaio deve contenere follicoli primordiali e in crescita, oltre ai grandi corpi lutei della lattazione. L'esame istopatologico deve individuare un deterioramento qualitativo della popolazione di follicoli primordiali. Nelle femmine F1 occorre effettuare un'analisi quantitativa dei follicoli primordiali; il numero di animali, la selezione delle sezioni ovariche e le dimensioni dei campioni devono essere statisticamente adeguati alla procedura di analisi applicata. L'esame deve comprendere la conta del numero dei follicoli primordiali che può essere combinata con i follicoli piccoli in crescita per il confronto delle ovaie tra soggetti trattati e i controlli (15)(16)(17)(18)(19).
1.5.8.2. Animali svezzati
I tessuti e gli organi bersaglio che presentano evidenti irregolarità nei piccoli con anomalie esterne o segni clinici, oltre a quelli di un individuo di ciascun sesso di ogni nidiata scelto a random, sia della generazione F1 che della F2, che non sono stati selezionati per l'accoppiamento, devono essere fissati e conservati in mezzo adeguato per l'esame istopatologico. Occorre effettuare una caratterizzazione istopatologica completa del tessuto conservato con particolare attenzione per gli organi dell'apparato riproduttore.
2. DATI
2.1. TRATTAMENTO DEI RISULTATI
I dati vanno riportati individualmente e riassunti sotto forma di tabella, evidenziando per ciascun gruppo sperimentale e ciascuna generazione il numero di animali presenti all'inizio del test, il numero di animali trovati morti durante il test o soppressi per motivi umanitari, il momento di eventuali decessi o soppressioni con metodi non cruenti, il numero di animali fertili, il numero di femmine gravide, il numero di animali che mostrano segni di tossicità, una descrizione dei segni di tossicità osservati, ivi compresi il momento dell'insorgenza, la durata e la gravità degli effetti tossici, i tipi di osservazione sugli animali parentali e sulla prole, i tipi di alterazioni istopatologiche, nonché tutti i dati di rilievo riguardanti le nidiate.
È necessario valutare i risultati numerici mediante un metodo statistico adeguato e generalmente accettato; i metodi statistici vanno selezionati come parte del disegno sperimentale e devono essere giustificati. Per l'analisi dei dati possono risultare utili i modelli statistici dose-risposta. La relazione deve comprendere sufficienti informazioni sul metodo di analisi e sul programma software utilizzati, di modo che un revisore o un esperto di statistica indipendente possa rivalutare e ricostruire l'analisi.
2.2. VALUTAZIONE DEI RISULTATI
I risultati del presente studio di tossicità riproduttiva a due generazioni vanno valutati in base agli effetti osservati, ai reperti delle autopsie e all'esame microscopico. La valutazione deve includere il rapporto, o la sua assenza, fra la dose della sostanza di saggio e la presenza o assenza, incidenza e gravità delle anomalie, comprese eventuali lesioni macroscopiche, gli organi bersaglio identificati, le conseguenze sulla fertilità, le anomalie cliniche, la capacità riproduttiva, gli effetti sulla generazione successiva, le alterazioni del peso corporeo, gli effetti sulla mortalità ed eventuali altri effetti tossici. Nella valutazione dei risultati del test occorre tenere conto delle proprietà fisico-chimiche della sostanza di saggio e, quando disponibili, dei dati sulla sua tossicocinetica.
Un test di tossicità riproduttiva adeguatamente condotto deve fornire una stima soddisfacente del livello di dose al quale non si osservano effetti e consentire di capire gli effetti negativi sulla riproduzione, sul parto, sull'allattamento, sullo sviluppo postnatale, sulla crescita e sullo sviluppo sessuale.
2.3. INTERPRETAZIONE DEI RISULTATI
Uno studio di tossicità riproduttiva a due generazioni deve fornire informazioni sugli effetti dovuti all'esposizione ripetuta ad una sostanza durante tutte le fasi del ciclo riproduttivo. In particolare, un simile studio fornisce informazioni sui parametri relativi alla riproduzione e sullo sviluppo, la crescita, la maturazione e la sopravvivenza della prole. I risultati dello studio vanno interpretati insieme ai dati ottenuti con studi subcronici, sullo sviluppo prenatale, di tossicocinetica e altri studi disponibili. I risultati di questo studio possono essere impiegati per valutare la necessità di sottoporre a ulteriori test una determinata sostanza chimica. L'estrapolazione all'uomo dei risultati dello studio è valida solo limitatamente. Tali risultati si prestano piuttosto per trarre informazioni sui livelli di dose ai quali non si rilevano effetti e sui livelli di esposizione accettabile per l'uomo (20)(21)(22)(23).
3. RELAZIONE
3.1. RELAZIONE SULL'ESECUZIONE DEL TEST
La relazione deve contenere le seguenti informazioni:
|
|
sostanza di saggio:
|
—
|
natura fisica e, se pertinenti, proprietà fisico-chimiche,
|
|
|
|
Veicolo (se pertinente):
|
—
|
giustificazione per la scelta del veicolo, se diverso dall'acqua.
|
|
|
|
Animali sperimentali:
|
—
|
numero, età e sesso degli animali,
|
|
—
|
origine, condizioni di alloggio, dieta, materiali per la lettiera, ecc.,
|
|
—
|
peso individuale degli animali all'inizio del test.
|
|
|
|
Condizioni del test:
|
—
|
motivazione per la selezione del livello delle dosi,
|
|
—
|
dettagli sulla formulazione/preparazione della sostanza di saggio somministrata nella dieta, concentrazioni ottenute,
|
|
—
|
stabilità e omogeneità della preparazione,
|
|
—
|
dettagli sulla somministrazione della sostanza di saggio,
|
|
—
|
conversione dalla concentrazione della sostanza di saggio in dieta/acqua potabile (ppm) alla dose ottenuta (mg/kg peso corporeo/die), se pertinente,
|
|
—
|
dettagli circa la qualità di cibo e acqua.
|
|
|
|
Risultati:
|
—
|
consumo di cibo e di acqua (se disponibile), efficienza di trasformazione alimentare (incremento ponderale per grammo di cibo assunto), consumo della sostanza di saggio per gli animali P e F1, tranne che per il periodo di coabitazione e per almeno l'ultimo terzo dell'allattamento,
|
|
—
|
dati sull'assorbimento (se disponibili),
|
|
—
|
dati sul peso corporeo per gli animali P e F1 selezionati per l'accoppiamento,
|
|
—
|
dati sul peso corporeo degli individui singoli e delle intere nidiate,
|
|
—
|
peso corporeo al momento della soppressione degli animali e dati sul peso assoluto e relativo degli organi negli animali parentali,
|
|
—
|
natura, gravità e durata dei segni clinici (reversibili o meno),
|
|
—
|
momento del decesso durante lo studio o indicazione degli animali sopravvissuti fino alla conclusione del test,
|
|
—
|
dati sulla risposta tossica per sesso e dose, ivi compresi gli indici di accoppiamento, fertilità, gestazione, nascita, vitalità e allattamento; la relazione deve indicare i numeri utilizzati per calcolare questi indici,
|
|
—
|
effetti tossici o di altro tipo sulla riproduzione, sulla prole, sulla crescita postnatale, ecc.,
|
|
—
|
reperti delle autopsie,
|
|
—
|
descrizione dettagliata di tutti i reperti istopatologici,
|
|
—
|
numero di femmine P e F1 con cicli normali e lunghezza dei cicli,
|
|
—
|
numero totale degli spermatozoi nella coda dell'epididimo, percentuale di spermatozoi progressivamente mobili, percentuale di spermatozoi morfologicamente normali e percentuale di spermatozoi con ciascuna delle anomalie identificate,
|
|
—
|
tempo di maturazione per l'accoppiamento, compreso il numero di giorni fino all'accoppiamento,
|
|
—
|
durata della gestazione,
|
|
—
|
numero di impianti, corpi lutei, numero di esemplari per nidiata,
|
|
—
|
numero di nati vivi e di perdite post-impianto,
|
|
—
|
numero di piccoli con anomalie evidenti; numero di esemplari più piccoli del normale (se determinato),
|
|
—
|
dati sui punti di repere fisici nei piccoli e altri dati sullo sviluppo postnatale; i punti di repere fisici valutati vanno giustificati,
|
|
—
|
dati sulla funzionalità in piccoli e adulti, per quanto pertinenti,
|
|
—
|
trattamento statistico dei risultati, se pertinente.
|
|
|
|
Discussione dei risultati.
|
|
|
Conclusioni, compresi i valori NOAEL per gli effetti sulle madri e sulla prole.
|
4. BIBLIOGRAFIA
|
(1)
|
Sadleir, R.M.F.S. (1979). Cycles and Seasons, In: Reproductions in Mammals: I. Germ Cells and Fertilization, C.R. Auston and R.V. Short (eds.), Cambridge, New York.
|
|
(2)
|
Gray, L.E. et al., (1989). A Dose-Response Analysis of Methoxychlor-Induced Alterations of Reproductive Development and Function in the Rat. Fundamental and Applied Toxicology 12:92-108.
|
|
(3)
|
Robb, G.W. et al., (1978). Daily Sperm Production and Epididymal Sperm Reserves of Pubertal and Adult Rats. Journal of Reproduction and Fertility 54:103-107.
|
|
(4)
|
Klinefelter, G.R. et al., (1991). The Method of Sperm Collection Significantly Influences Sperm Motion Parameters Following Ethane Dimethanesulfonate Administration in the Rat. Reproductive Toxicology 5:39 44.
|
|
(5)
|
Seed, J. et al. (1996). Methods for Assessing Sperm Motility, Morphology, and Counts in the Rat, Rabbit, and Dog: a Consensus Report. Reproductive Toxicology 10(3):237-244.
|
|
(6)
|
Chapin, R.E. et al., (1992).Methods for Assessing Rat Sperm Motility. Reproductive Toxicology 6:267-273.
|
|
(7)
|
Klinefelter, G.R. et al., (1992). Direct Effects of Ethane Dimethanesulphonate on Epididymal Function in Adult Rats: an In Vitro Demonstration. Journal of Andrology 13:409-421.
|
|
(8)
|
Slott, V.L. et al., (1991). Rat Sperm Motility Analysis: Methodologic Considerations. Reproductive Toxicology 5:449-458.
|
|
(9)
|
Slott, V.L. and Perreault, S.D., (1993). Computer-Assisted Sperm Analysis of Rodent Epididymal Sperm Motility Using the Hamilton-Thorn Motility Analyzer. In: Methods in Toxicology, Part A., Academic, Orlando, Florida. pp. 319-333.
|
|
(10)
|
Toth, G.P. et al. (1989). The Automated Analysis of Rat Sperm Motility Following Subchronic Epichlorhydrin Administration: Methodologic and Statistical Considerations. Journal of Andrology 10:401-415.
|
|
(11)
|
Working, P.K. and M. Hurtt, (1987). Computerized Videomicrographic Analysis of Rat Sperm Motility. Journal of Andrology 8:330-337.
|
|
(12)
|
Linder, R.E. et al., (1992). Endpoints of Spermatoxicity in the Rat After Short Duration Exposures to Fourteen Reproductive Toxicants. Reproductive Toxicology 6:491-505.
|
|
(13)
|
Korenbrot, C.C. et al., (1977). Preputial Separation as an External Sign of Pubertal Development in the Male Rat. Biological Reproduction 17:298-303.
|
|
(14)
|
Russell, L.D. et al., (1990). Histological and Histopathological Evaluation of the Testis, Cache River Press, Clearwater, Florida.
|
|
(15)
|
Heindel, J.J. and R.E. Chapin, (eds.) (1993). Part B. Female Reproductive Systems, Methods in Toxicology, Academic, Orlando, Florida.
|
|
(16)
|
Heindel, J.J. et al., (1989) Histological Assessment of Ovarian Follicle Number in Mice As a Screen of Ovarian Toxicity. In: Growth Factors and the Ovary, A.N. Hirshfield (ed.), Plenum, New York, pp. 421-426.
|
|
(17)
|
Manson, J.M. and Y.J. Kang, (1989). Test Methods for Assessing Female Reproductive and Developmental Toxicology. In: Principles and Methods of Toxicology, A.W. Hayes (ed.), Raven, New York.
|
|
(18)
|
Smith, B.J. et al,. (1991). Comparison of Random and Serial Sections in Assessment of Ovarian Toxicity. Reproductive Toxicology 5:379-383.
|
|
(19)
|
Heindel, J.J. (1999). Oocyte Quantitation and Ovarian Histology. In: An Evaluation and Interpretation of Reproductive Endpoints for Human Health Risk Assessment, G. Daston,. and C.A. Kimmel, (eds.), ILSI Press, Washington, DC.
|
|
(20)
|
Thomas, J. A. (1991). Toxic Responses of the Reproductive System. In: Casarett and Doull's Toxicology, M.O. Amdur, J. Doull, and C.D. Klaassen (eds.), Pergamon, New York.
|
|
(21)
|
Zenick, H.s and E.D. Clegg, (1989). Assessment of Male Reproductive Toxicity: A Risk Assessment Approach. In: Principles and Methods of Toxicology, A.W. Hayes (ed.), Raven Press, New York.
|
|
(22)
|
Palmer, A.K. (1981). In: Developmental Toxicology, Kimmel, C.A. and J. Buelke-Sam (eds.), Raven Press, New York.
|
|
(23)
|
Palmer, A.K. (1978). In Handbook of Teratology, Vol. 4, J.G. Wilson and F.C. Fraser (eds.), Plenum Press, New York.
|
B.36. TOSSICOCINETICA
1. METODO
1.1. INTRODUZIONE
Vedi introduzione generale, parte B.
1.2. DEFINIZIONI
Vedi introduzione generale, parte B.
1.3. SOSTANZE DI RIFERIMENTO
Nessuna.
1.4. PRINCIPI DEL METODO DI SAGGIO
Si somministra la sostanza in esame per una via appropriata. In relazione agli obiettivi dello studio, la sostanza può essere somministrata, in dose singola o in dosi ripetute nel corso di periodi di tempo definiti, a uno o più gruppi di animali da esperimento. Successivamente, in relazione al tipo di studio effettuato, si determinano la sostanza e/o i suoi metaboliti nei fluidi corporei e nei tessuti e/o negli escreti.
Gli studi possono essere effettuati con forme «non marcate» o «marcate» delle sostanze in esame. Quando è fatto uso di un marcatore, è opportuno che esso sia collocato nella sostanza in maniera tale da fornire la maggior quantità possibile di informazioni sul destino del composto.
1.5. CRITERI QUALITATIVI
Nessuno.
1.6. DESCRIZIONE DEL METODO DI SAGGIO
Preparazioni
Si acclimatano alle condizioni del laboratorio per almeno cinque giorni prima dei saggio animali adulti sani e giovani. Prima del saggio gli animali vengono mischiati con metodo casuale ed assegnati ai gruppi destinati ai trattamenti. In situazioni speciali possono essere usati animali molto giovani, femmine gravide o pretrattati.
Condizioni sperimentali
Animali da esperimento
Gli studi tossicocinetici possono essere effettuati su una o più specie animali appropriate, e dovrebbero tenere conto delle specie usate o che si pensa di usare per altri studi tossicologici sulla medesima sostanza in esame. Quando in un saggio si fa uso di ratti, la variazione del peso corporeo non dovrebbe essere maggiore del ± 20 % del peso medio.
Numero e sesso
Per gli studi di assorbimento e di escrezione sarebbe opportuno che in ciascun gruppo di dose vi siano inizialmente quattro animali. Una preferenza per l'uno o l'altro sesso non è imperativa, ma in determinate circostanze può essere necessario studiare entrambi i sessi. Se vi sono differenze di risposta secondo i sessi, quattro individui per sesso dovrebbero essere sottoposti al saggio. Nel caso di studi su animali diversi dai roditori può essere usato un numero minore di individui. Quando si studia la distribuzione nei tessuti, la grandezza del gruppo iniziale dovrebbe tenere conto sia del numero degli animali da sacrificare in ciascuna fase che del numero delle fasi da considerare.
Negli studi del metabolismo le dimensioni del gruppo sono in relazione con le esigenze specifiche dello studio. Per gli studi con dosi multiple e in fasi multiple, le dimensioni del gruppo dovrebbero tenere conto del numero sia delle fasi che dei sacrifici in programma, e in ogni caso il gruppo non deve comprendre meno di due animali. Le dimensioni del gruppo dovrebbero essere sufficienti per fornire una caratterizzazione accettabile dell'assorbimento, del plateau e della deplezione (a seconda del caso considerato) della sostanza in esame e/o dei suoi metaboliti.
Livelli di dosaggio
Nel caso della somministrazione in un'unica dose almeno due livelli di dosaggio dovrebbero essere usati. Vi dovrebbero essere una dose bassa, alla quale non si osservano effetti tossici, e una dose elevata, alla quale vi possono essere cambiamenti dei parametri tossicocinetici o si manifestano effetti tossici.
Nel caso della somministrazione di dosi ripetute la dose bassa è normalmente sufficiente, ma in determinate circostanze può essere necessaria anche una dose alta.
Vie di somministrazione
Gli studi tossicocinetici dovrebbero essere effettuati facendo uso della stessa via e, se del caso, dello stesso veicolo usato, o che si pensa dì usare negli altri studi di tossicità. La sostanza in esame è normalmente somministrata per via orale mediante sonda gastrica o nella dieta, o è applicata alla cute, o somministrata per inalazione per periodi di tempo definiti a gruppi di animali da esperimento. Per la determinazione dell'assorbimento relativo per altre vie può essere utile la somministrazione della sostanza in esame per via endovenosa. Entro breve tempo della somministrazione endovenosa di una sostanza è inoltre possibile ottenere utili informazioni sul suo profilo di distribuzione.
Si dovrebbe tener presente la possibilità di un'interferenza fra il veicolo e la sostanza in esame. Si dovrebbe fare attenzione alle differenze di assorbimento fra la somministrazione delle sostanza in esame per sonda gastrica e rispettivamente nell'alimentazione, ed all'esigenza di una determinazione precisa della dose, specialmente quando la sostanza in esame viene somministrata con la dieta.
Periodo di osservazione
Tutti gli animali dovrebbero essere osservati quotidianamente, e dovrebbe essere presa nota di tutti i segni di tossicità e degli altri elementi clinici rilevanti, ivi compresi il momento dell'insorgenza, il grado e la durata.
Procedimento
Dopo la pesatura degli animali di saggio si somministra per una via appropriata la sostanza in esame. Se lo si considera importante, gli animali possono essere tenuti a digiuno prima della somministrazione della sostanza in esame.
Assorbimento
La velocità e l'entità dell'assorbimento della sostanza somministrata possono essere valutate secondo diversi metodi, con o senza gruppi di riferimento (8), ad esempio:
|
—
|
attraverso la determinazione della quantità della sostanza in esame e/o dei suoi metaboliti negli escreti, quali l'urina, la bile, le feci e l'aria inspirata, e della quantità che rimane nella carcassa,
|
|
—
|
attraverso il raffronto della risposta biologica (ad esempio negli studi della tossicità acuta) fra i gruppi sottoposti al saggio e i gruppi di controllo e/o di riferimento,
|
|
—
|
attraverso il raffronto della quantità di sostanza e/o di metabolita escreta per via renale nei gruppi sottoposti al saggio e in gruppi di riferimento,
|
|
—
|
attraverso la determinazione dell'area al di sotto della curva del livello plasmatico in funzione del tempo della sostanza in esame e/o dei suoi metaboliti, e attraverso il raffronto con i dati di un gruppo di riferimento.
|
Distribuzione
Sono attualmente disponibili due procedure che possono essere usate insieme o separatamente per le analisi dei profili di distribuzione:
|
—
|
un'utile informazione qualitativa si ottiene facendo uso di tecniche autoradiografiche su tutto il corpo,
|
|
—
|
un'informazione quantitativa si ottiene sacrificando gli animali a intervalli diversi dopo l'esposizione e determinando la concentrazione e la quantità della sostanza in esame e/o dei suoi metaboliti nei tessuti e negli organi.
|
Escrezione
Negli studi di escrezione si raccolgono l'urina, le feci e l'aria espirata e, in determinate circostanze, la bile. La quantità della sostanza in esame e/o dei suoi metaboliti dovrebbe essere misurata in detti escreti ad intervalli diversi dopo l'esposizione, fino a che sia stato escreto intorno al 95 % della dose somministrata, ovvero per sette giorni, secondo la condizione che si verifica per prima.
In casi speciali può essere necessario considerare l'escrezione della sostanza in esame nel latte degli animali da esperimento che allattano i piccoli.
Metabolismo
Per determinare l'estensione e il profilo del metabolismo si dovrebbero analizzare campioni biologici secondo tecniche appropriate. Se vi è la necessità di dare risposta a quesiti derivanti da studi tossicologici precedenti si dovrebbero chiarire le strutture dei metaboliti e proporre vie metaboliche appropriate. Per ottenere informazioni sulle vie metaboliche può essere proficuo effettuare studi in vitro.
Ulteriori informazioni sulle relazioni fra il metabolismo e la tossicità possono essere ottenute da studi biochimici, quali la determinazione degli effetti sui sistemi di enzimi metabolizzanti, sulla deplezione dei composti sulfidrilici endogeni non proteici e sull'unione della sostanza con macromolecole.
2. DATI
In relazione al tipo di studio effettuato i dati dovrebbero essere riassunti in forma di tabella integrata se del caso da rappresentazioni grafiche. Per ciascun gruppo di saggio dovrebbero essere poste in evidenza, in tutti i casi in cui ciò è possibile, le variazioni medie e statistiche delle misurazioni in relazione al tempo, al dosaggio, ai tessuti e agli organi. L'entità dell'assorbimento e la quantità e la velocità dell'escrezione dovrebbero essere determinate con metodi appropriati. Quando si effettuano studi del metabolismo, la struttura dei metaboliti identificati dovrebbe essere data e le possibili vie metaboliche presentate.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
Nella relazione sul saggio devono figurare, se possibile:
|
—
|
specie, ceppo, provenienza, condizioni ambientali, dieta,
|
|
—
|
caratterizzazione di eventuali materiali marcati,
|
|
—
|
livelli di dosaggio e intervalli usati,
|
|
—
|
via o vie di somministrazione ed ogni veicolo usato,
|
|
—
|
effetti tossici ed altri effetti osservati,
|
|
—
|
metodi per la determinazione della sostanza in esame e/o dei suoi metaboliti nei campioni biologici, ivi compresa l'aria espirata,
|
|
—
|
presentazione in forma tabulare delle misurazioni per sesso, dose regime, tempo, tessuti ed organi,
|
|
—
|
presentazione dell'entità dell'assorbimento e dell'escrezione nel tempo,
|
|
—
|
metodi per la caratterizzazione e l'identificazione di metaboliti nei campioni biologici,
|
|
—
|
metodi per le misurazioni biochimiche concernenti il metabolismo,
|
|
—
|
vie proposte per il metabolismo,
|
|
—
|
discussione dei risultati,
|
|
—
|
interpretazione dei risultati.
|
3.2. VALUTAZIONE E INTERPRETAZIONE
Vedi introduzione generale, parte B.
4. RIFERIMENTI
Vedi introduzione generale, parte B.
B.37. NEUROTOSSICITÀ RITARDATA DI SOSTANZE ORGANOFOSFORICHE DOPO ESPOSIZIONE ACUTA
1. METODO
1.1. INTRODUZIONE
Per la valutazione degli effetti tossici delle sostanze è importante tener conto della facoltà di talune classi di sostanze di indurre effetti neurotossici specifici che potrebbero non essere messi in luce da altri studi di tossicità. Alcune sostanze organofosforiche, che hanno evidenziato una neurotossicità ritardata, dovrebbero essere oggetto di una valutazione in questo senso.
Saggi preliminari in vitro consentono di identificare le sostanze suscettibili di indurre una polineuropatia ritardata; tuttavia risultati di studi in vitro non garantiscono l'assenza di neurotossicità della sostanza saggiata.
Vedi introduzione generale, parte B.
1.2. DEFINIZIONI
Le sostanze organofosforiche comprendono esteri, tioesteri o anidridi organofosforici neutri degli acidi organofosforico, organofosfonico o organofosforamidico o dei corrispondenti acidi fosforotioico, fosfonotioico o fosforotioamidico, o altre sostanze suscettibili di indurre gli effetti neurotossici ritardati talvolta osservati in questa classe di sostanze.
La neurotossicità ritardata è una sindrome associata ad atassia prolungata a comparsa tardiva, ad assonopatie distali del midollo spinale e dei nervi periferici e ad un'inibizione e un invecchiamento dell'esterasi suggestiva di neuropatia (NTE, neuropathy target esterase) nei tessuti nervosi.
1.3. SOSTANZE DI RIFERIMENTO
Una sostanza di riferimento può essere sagggiata in un gruppo di controllo positivo al fine di dimostrare che, nelle condizioni sperimentali utilizzate, la reazione delle specie esaminate non ha subito variazioni significative.
Una sostanza neurotossica di comune utilizzo è il tri-o-tolil fosfato [CAS 78-30-8, E1NECS 201-103-5, nomenclatura CAS: acido fosforico, tris (2-metilfenil)estere], noto anche come tris-o-cresilfosfato.
1.4. PRINCIPIO DEL METODO DI SAGGIO
La sostanza in esame viene somministrata per via orale in un'unica dose a galline eventualmente protette contro effetti colinergici acuti. Gli animali vengono tenuti in osservazione per 21 giorni al fine di individuare eventuali anomalie del comportamento, atassia e paralisi. A 24 e 48 ore di distanza dalla somministrazione vengono effettuate analisi biochimiche, e in particolare l'inibizione della NTE, su galline selezionate da ciascun gruppo secondo un criterio di casualità. Ventun giorni dopo l'esposizione si sopprimono gli animali superstiti e si procede all'esame istopatologico di determinati tessuti nervosi.
1.5. DESCRIZIONE DEL METODO DI SAGGIO
1.5.1. Preparazioni
Galline adulte, giovani e sane, che non presentino affezioni virali e non siano trattate con farmaci suscettibili di alterare i risultati del saggio, nonché esenti da turbe della deambulazione, vengono assegnate in modo casuale a gruppi da trattare e di controllo e acclimatate alle condizioni di laboratorio per almeno 5 giorni prima dell'inizio del saggio.
Le gabbie o i recinti saranno sufficientemente ampi affinché gli animali possano muoversi liberamente ed essere facilmente osservati durante la deambulazione.
Di norma la sostanza in esame viene somministrata per via orale tramite sonda gastrica, capsule di gelatina o un metodo analogo. Le sostanze liquide possono essere somministrate non diluite o disciolte in un veicolo appropriato, quale l'olio di mais. Se possibile, si avrà cura di sciogliere le sostanze solide, in quanto dosi elevate di tali sostanze in capsule di gelatina possono non essere completamente assorbite. Per i veicoli non acquosi, le caratteristiche di tossicità del veicolo dovranno essere note o, in caso contrario, determinate prima del saggio.
1.5.2. Condizioni sperimentali
1.5.2.1. Animali da esperimento
Si utilizzeranno di preferenza galline domestiche ovaiole (Gallus gallus domesticus), giovani e adulte, di età compresa tra 8 e 12 mesi, appartenenti a razze e a ceppi di taglia standard. Gli animali saranno allevati in condizioni che ne garantiscano la libertà di movimento.
1.5.2.2. Numero e sesso
Oltre al gruppo da trattare, si utilizzeranno un gruppo di controllo positivo ed uno con somministrazione del solo veicolo. Quest'ultimo sarà trattato in modo identico al primo, tranne per il fatto che agli animali non verrà somministrata la sostanza in esame.
Ogni gruppo dovrà comprendere un numero sufficiente di animali, in modo che almeno sei esemplari possano essere soppressi per effettuare le analisi biochimiche (tre a 24 ore e tre a 48 ore di distanza dalla somministrazione) ed altri sei possano sopravvivere per i 21 giorni del periodo di osservazione.
Il gruppo di controllo positivo può essere attuale o appartenere a studi recentemente effettuati. Esso comprenderà almeno sei animali trattati con una sostanza neurotossica nota ad effetto ritardato, tre dei quali saranno destinati alle analisi biochimiche e tre all'osservazione. È opportuno procedere ad un aggiornamento periodico dei dati storici. Nuovi dati di controllo positivo dovranno essere elaborati ogniqualvolta venga modificato un elemento essenziale del saggio (quale il ceppo, il tipo di alimentazione o le condizioni di alloggiamento degli animali).
1.5.2.3. Livelli di dosaggio
Per la determinazione del livello di dosaggio da utilizzare nello studio principale si procederà ad uno studio preliminare su un numero adeguato di animali suddivisi in gruppi trattati con diversi livelli di dosaggio. Per una corretta definizione di detto parametro sono generalmente necessari in questa fase preliminare, un certo numero di decessi. Tuttavia, al fine di evitare decessi cagionati da effetti colinergici acuti, si potrà fare ricorso ad atropina o ad un altro agente protettivo che non sia suscettibile di interferire con eventuali reazioni neurotossiche ritardate. Esistono diversi metodi per la determinazione della dose massima non letale di una sostanza (vedi metodo B.l bis). Anche i dati di precedenti studi su galline o altre informazioni tossicologiche possono essere utili a questo scopo.
Il livello di dosaggio da utilizzare nello studio principale deve essere il più elevato possibile tenendo conto dei risultati ottenuti nello studio preliminare per la determinazione del dosaggio e del limite massimo di 2 000 mg/kg peso corporeo. Indipendentemente dal tasso di mortalità, è indispensabile che un numero sufficiente di animali sopravviva per l'esecuzione delle analisi biochimiche (sei) e dell'esame istologico del ventunesimo giorno (sei). Per evitare decessi cagionati da effetti colinergici acuti, si potranno somministrare atropina o un analogo agente protettivo che non sia suscettibile di interferire con eventuali reazioni neurotossiche ritardate.
1.5.2.4. Saggio limite
Qualora un saggio, effettuato in conformità con il metodo descritto, con un livello di dosaggio di almeno 2 000 mg/kg di peso corporeo/giorno, non produca effetti tossici evidenti e se i dati relativi a sostanze di struttura affine non sono suggestivi di tossicità, può non essere necessario somministrare un dosaggio superiore. Il saggio limite è giustificato, salvo nel caso in cui l'esposizione umana comporti la necessità di utilizzare un più elevato livello di dosaggio.
1.5.2.5. Periodo di osservazione
Il periodo di osservazione avrà una durata di 21 giorni.
1.5.3. Procedimento
Dopo aver trattato gli animali con un agente protettivo atto a prevenire effetti colinergici acuti potenzialmente letali, si somministra la sostanza in esame in una singola dose.
1.5.3.1. Osservazioni generali
II periodo di osservazione inizia subito dopo l'esposizione alla sostanza. Tutte le galline saranno accuratamente esaminate diverse volte per i primi 2 giorni e almeno quotidianamente a partire dal terzo fino alla soppressione degli animali, prevista per il ventunesimo giorno. Si registreranno tutti i segni di tossicità, nonché il momento della comparsa, la natura, la gravità e la durata di qualsiasi anomalia del comportamento. Per l'atassia si utilizzerà un sistema di classificazione comprendente un minimo di quatro livelli; si registreranno altresì i casi di paralisi. Almeno due volte alla settimana le galline selezionate per l'osservazione dovranno essere tolte dalle gabbie o sottoposte ad attività motoria forzata (ad esempio salire le scale) al fine di agevolare l'osservazione degli effetti tossici minimi. Gli animali moribondi o recanti segni gravi e persistenti di sofferenza dovranno essere immediatamente sottoposti ad eutanasia e ad esame necroscopico.
1.5.3.2. Peso corporeo
Tutte le galline saranno pesate poco prima della somministrazione della sostanza e almeno una volta alla settimana successivamente.
1.5.3.3. Biochimica
Pochi giorni dopo l'esposizione si sopprimeranno sei galline scelte in modo casuale da ciascuno dei gruppi trattati e di controllo negativo e tre appartenenti al gruppo di controllo positivo (se realizzato). Il cervello e il midollo spinale lombare saranno quindi preparati e analizzati per identificare un'eventuale attività di inibizione della NTE. Inoltre può essere utile effettuare la stessa analisi su tessuti del nervo sciatico. Generalmente si sopprimono tre animali per il gruppo di controllo e per ciascuno dei gruppi trattati a distanza di 24 ore ed altri tre a distanza di 48 ore, mentre le tre galline del gruppo di controllo positivo vengono soppresse dopo 24 ore. Qualora l'osservazione dei segni clinici di intossicazione (spesso valutabili in funzione della comparsa di effetti colinergici) suggerisca che l’eliminazione della sostanza tossica avviene molto lentamente, può essere preferibile effettuare altri due prelievi tissutali da tre animali nel periodo compreso tra 24 e non oltre 72 ore dopo la somministrazione.
Se del caso, è possibile effettuare su tali tessuti analisi dell'acetilcolinesterasi (AChE). Tuttavia si può avere una riattivazione spontanea dell'AChE in vivo, il che potrebbe indurre a sottovalutare il potenziale di inibizione dell'AChE di una sostanza.
1.5.3.4. Necroscopia macroscopica
L'esame necroscopico di tutti gli animali (sia di quelli soppressi come da programma che di quelli sottoposti ad eutanasia) dovrà comprendere l'osservazione dell'aspetto del cervello e del midollo spinale.
1.5.3.5. Esame istopatologico
I tessuti nervosi degli animali sopravvissuti al periodo di osservazione e non utilizzati per gli studi biochimici saranno sottoposti ad esame microscopico. Essi saranno fissati in situ con tecniche di perfusione. I prelievi tissutali saranno effettuati su cervelietto (piano longitudinale medio), midollo allungato, midollo spinale e nervi periferici. Il midollo spinale sarà prelevato dal tratto cervicale superiore, dal terzo toracico centrale e dal tratto lombosacrale. Si preleveranno inoltre tessuti dal segmento distale del nervo tibiale e delle sue ramificazioni verso il muscolo gastrocnemio e dal nervo sciatico. I tessuti saranno colorati con appositi coloranti specifici per la mielina e gli assoni.
2. DATI
Di norma, se i risultati ottenuti per i parametri di valutazione adottati nel presente metodo (biochimica, istopatologia e osservazione del comportamento) sono negativi, non è necessario eseguire ulteriori saggi di neurotossicità ritardata. Risultati equivoci o non conclusivi possono invece richiedere un approfondimento.
Dovranno essere forniti i dati individuali di ciascun animale. Inoltre, tutti i dati dovranno essere riassunti in una tabella indicante, per ogni gruppo, il numero di animali all'inizio del saggio, il numero di animali recanti lesioni, alterazioni del comportamento o effetti biochimici, la natura e la gravità di detti effetti o lesioni e la percentuale di animali per ogni tipo di effetto o lesione e per ogni livello di gravità.
I risultati del presente studio dovranno essere valutati in termini di incidenza, gravità e correlazione tra effetti comportamentali, biochimici e istopatologici e qualsiasi altro effetto osservato nei gruppi trattati e di controllo.
I risultati numerici dovranno essere elaborati sulla base di metodi statistici appropriati e generalmente riconosciuti. I metodi statistici saranno selezionati durante la fase di progettazione dello studio.
3. RELAZIONE
RELAZIONE SUL SAGGIO
La relazione sul saggio deve, se possibile, includere le seguenti informazioni.
|
|
Animali da esperimento:
|
—
|
numero e età degli animali,
|
|
—
|
origine, condizioni di allogiamento, ecc.,
|
|
—
|
peso di ciascun animale all'inizio del saggio.
|
|
|
|
Condizioni sperimentali:
|
—
|
modalità precise di preparazione della sostanza in esame, stabilità e omogeneità, ove del caso,
|
|
—
|
motivazione della scelta del veicolo,
|
|
—
|
modalità precise di somministrazione della sostanza in esame,
|
|
—
|
caratteristiche della qualità del cibo e dell'acqua,
|
|
—
|
motivazione della scelta del dosaggio,
|
|
—
|
dosi somministrate, caratteristiche del veicolo, volume e forma fisica della sostanza somministrata,
|
|
—
|
tipo di agente protettivo e caratteristiche di somministrazione, ove del caso.
|
|
|
|
Risultati:
|
—
|
dati relativi al peso corporeo,
|
|
—
|
dati relativi alla reazione tossica per ciascun gruppo, compresa la mortalità,
|
|
—
|
natura, gravità e durata degli effetti clinici osservati (ed eventuale reversibilità),
|
|
—
|
descrizione particolareggiata delle analisi biochimiche e relativi risultati,
|
|
—
|
risultati dell'esame necroscopico,
|
|
—
|
descrizione particolareggiata di tutti i reperti istopatologici,
|
|
—
|
elaborazione statistica dei risultati, ove del caso.
|
|
|
|
Discussione dei risultati.
|
4. RIFERIMENTI
Il presente metodo corrisponde al metodo OCSE TG 418.
B.38. NEUROTOSSICITÀ RITARDATA DI SOSTANZE ORGANOFOSFORICHE STUDIO CON SOMMINISTRAZIONE RIPETUTA PER 28 GIORNI
1. METODO
1.1. INTRODUZIONE
Per la valutazione degli effetti tossici delle sostanze è importante tener conto della facoltà di talune classi di sostanze di indurre effetti neurotossici specifici che potrebbero non essere messi in luce da altri studi di tossicità. Alcune sostanze organofosforiche, che hanno evidenziato una neurotossicità ritardata, dovrebbero essere oggetto di una valutazione in questo senso.
Saggi preliminari in vitro consentono di identificare le sostanze suscettibili di indurre una polineuropatia ritardata; tuttavia risultati negativi di studi in vitro non garantiscono l'assenza di neurotossicità della sostanza saggiata.
Il presente saggio di neurotossicità ritardata su 28 giorni fornisce informazioni sui rischi che l'esposizione ripetuta per un periodo limitato di tempo può comportare per la salute. Esso consente di trarre indicazioni sulla correlazione dose-risposta e di valutare il NOAEL applicabile per la determinazione di criteri di sicurezza per l'esposizione.
Vedi anche introduzione generale, parte B.
1.2. DEFINIZIONI
Le sostanze organofosforiche comprendono esteri, tioesteri o anidridi organofosforici neutri degli acidi organofosforico, organofosfonico o organofosforamidico o dei corrispondenti acidi fosforotioico, fosfonotioico o fosforotioamidico, o altre sostanze suscettibili di indurre gli effetti neurotossici ritardati talvolta osservati in questa classe di sostanze.
La neurolossicità ritardata è una sindrome associata ad atassia prolungata a comparsa tardiva, ad assonopatie distali del midollo spinale e dei nervi periferici e ad un'inibizione e un invecchiamento dell'esterasi suggestiva di neuropatia (NTE, neuropathy target esterase) nei tessuti nervosi.
1.3. PRINCIPIO DEL METODO DI SAGGIO
La sostanza in esame viene quotidianamente somministrata per via orale a galline domestiche per un periodo di 28 giorni. Gli animali vengono esaminati almeno una volta al giorno al fine di individuare eventuali anomalie del comportamento, atassia e paralisi fino a 14 giorni dopo l'ultima somministrazione. Analisi biochimiche, e in particolare l'inibizione della NTE, vengono di norma eseguite 24 e 48 ore dopo l'ultima esposizione su galline selezionate da ciascun gruppo secondo un criterio di casualità. Due settimane dopo l'ultima somministrazione si sopprimono gli animali superstiti e si procede all'esame istopatologico di determinati tessuti nervosi.
1.4. DESCRIZIONE DEL METODO DI SAGGIO
1.4.1. Preparazioni
Galline adulte, giovani e sane, che non presentino affezioni virali e non siano trattate con farmaci suscettibili di alterare i risultati del saggio, nonché esenti da turbe della deambulazione, vengono assegnate in modo casuale a gruppi da trattare e di controllo e acclimatate alle condizioni di laboratorio per almeno 5 giorni prima dell'inizio del saggio.
La gabbie o i recinti saranno sufficientemente ampi affinché gli animali possano muoversi liberamente ed essere facilmente osservati durante la deambulazione.
La sostanza viene somministrata giornalmente, sette giorni su sette, preferibilmente tramite sonda gastrica o capsule di gelatina. Le sostanze liquide possono essere somministrate non diluite o disciolte in un veicolo appropriato, quale l'olio di mais. Se possibile, si avrà cura di sciogliere le sostanze solide, in quanto dosi elevate di tali sostanze in capsule di gelatina possono non essere completamente assorbite. Per i veicoli non acquosi, le caratteristiche di tossicità del veicolo dovranno essere note o, in caso contrario, determinate prima del saggio.
1.4.2. Condizioni sperimentali
1.4.2.1. Animali da esperimento
Si utilizzeranno di preferenza galline domestiche ovaiole (Gallus gallus domesticus), giovani e adulte, di età compresa tra 8 e 12 mesi, appartenenti a razze e a ceppi di taglia standard. Gli animali saranno allevati in condizioni che ne garantiscano la libertà di movimento.
1.4.2.2. Numero e sesso
Si utilizzano di norma almeno tre gruppi da trattare ed uno di controllo con somministrazione del solo veicolo. Quest'ultimo sarà trattato in modo identico ai primi, tranne per il fatto che agli animali non verrà somministrata la sostanza in esame.
Ogni gruppo dovrà comprendere un numero sufficiente di animali, in modo che almeno sei esemplari possano essere soppressi per effettuare le analisi biochimiche (tre a 24 e tre a 48 ore di distanza dall'ultima somministrazione) ed altri sei possano sopravvivere per i 14 giorni del periodo di osservazione.
1.4.2.3. Livelli di dosaggio
I livelli di dosaggio dovranno essere selezionati tenendo conto dei risultati del saggio di neurotossicità ritardata dopo esposizione acuta e di tutti i dati di tossicità o di tossicocinetica esistenti per la sostanza in esame. Il livello massimo di dosaggio dovrà essere tale da indurre effetti tossici, preferibilmente effetti neurotossici ritardati, senza tuttavia cagionare la morte o sofferenze gravi. Sarà inoltre definita una serie descrescente di dosaggi al fine di individuare eventuali risposte a dosi determinate e dimostrare l'assenza di effetti avversi al dosaggio minimo.
1.4.2.4. Saggio limite
Qualora un saggio, effettuato in conformità con il metodo descritto, con un livello di dosaggio di almeno 1 000 mg/kg di peso corporeo/giorno, non produca effetti tossici evidenti e se i dati relativi a sostanze di struttura affine non sono suggestivi di tossicità, può non essere necessario somministrare un dosaggio superiore. Il saggio limite giustificato, salvo nel caso in cui l'esposizione umana comporti la necessità di utilizzare un più elevato livello di dosaggio.
1.4.2.5. Periodo di osservazione
Tutti gli animali saranno esaminati almeno quotidianamente durante il periodo di esposizione e nei 14 giorni successivi, salvo nel caso in cui sia previsto un esame necroscopico.
1.4.3. Procedimento
La sostanza in esame viene somministrata sette giorni su sette per un periodo di 28 giorni.
1.4.3.1. Osservazioni generali
Il periodo di osservazione inizia subito dopo l'esposizione alla sostanza. Tutte le galline saranno accuratamente esaminate almeno una volta al giorno per i 28 giorni del trattamento e i 14 giorni successivi, fino al momento della loro soppressione. Si registreranno futi i segni di tossicità, specificandone il momento della comparsa, la natura, la gravità e la durata. Le osservazioni riguarderanno, tra l'altro, eventuali anomalie comportamentali. Per l'atassia si utilizzerà un sistema di classificazione comprendente un minimo di quattro livelli; si registreranno altresì i casi di paralisi. Almeno due volte alla settimana le galline selezionate per l'osservazione dovranno essere tolte dalle gabbie e sottoposte ad attività motoria forzata (ad esempio salire le scale) al fine di agevolare l'osservazione degli effetti tossici minimi. Gli animali moribondi o recanti segni gravi e persistenti di sofferenza dovranno essere immediatamente sottoposti ad eutanasia e ad esame necroscopico.
1.4.3.2. Peso corporeo
Tutte le galline saranno pesate poco prima della somministrazione della sostanza e almeno una volta alla settimana successivamente.
1.4.3.3. Biochimica
Pochi giorni dopo l'ultima esposizione si sopprimeranno sei galline scelte in modo casuale da ciascuno dei gruppi trattati e dal gruppo di controllo con somministrazione del solo veicolo. Il cervello e il midollo spinale lombare saranno quindi preparati e analizzati per identificare un'eventuale attività di inibizione della NTE. Inoltre può essere utile effettuare la stessa analisi su tessuti del nervo sciatico. Generalmente si sopprimono tre animali per il gruppo di controllo e per ciascuno dei gruppi trattati dopo 24 ore ed altri tre dopo 48 ore dall'ultima somministrazione. Qualora ciò risulti preferibile in base ai risultati dello studio con esposizione acuta o di altri studi (ad esempio di tossicocinetica), si potranno modificare i tempi previsti per la soppresisone degli animali. Tale scelta dovrà essere tuttavia scientificamente motivata.
Se del caso, è possibile effettuare su tali tessuti analisi dell'acetilcolinesterasi (AChE). Tuttavia si può avere una riattivazione spontanea dell'AChE in vivo, il che potrebbe indurre a sottovalutare il potenziale di inibizione dell'AChE di una sostanza.
1.4.3.4. Necroscopia macroscopica
L'esame necroscopico di tutti gli animali (sia di quelli soppressi come da programma che di quelli sottoposti ad eutanasia) dovrà comprendere l'osservazione dell'aspetto del cervello e del midollo spinale.
1.4.3.5. Esame istopatologico
I tessuti nervosi degli animali sopravvissuti al periodo di osservazione e non utilizzati per gli studi biochimici saranno sottoposti ad esame microscopico. Essi saranno fissati in situ con tecniche di perfusione. I prelievi tissutali saranno effettuati su cervelletto (piano longitudinale medio), midollo allungato, midollo spinale e nervi periferici. Il midollo spinale sarà prelevato dal tratto cervicale superiore, dal terzo toracico centrale e dal tratto lombosacrale. Si preleveranno inoltre tessuti dal segmento distale del nervo tibiale e delle sue ramificazioni verso il muscolo gastrocnemio e dal nervo sciatico. I tessuti saranno colorati con apposti coloranti specifici per la mielina e gli assoni. L'esame microscopico sarà dapprima effettuato su tessuti conservati di tutti gli animali del gruppo di controllo e di quello trattato con il livello massimo di dosaggio. Qualora in questo gruppo si riscontrino effetti, si procederà all'esame microscopico di tessuti prelevati da animali appartenenti agli altri due gruppi (rispettivamente con somministrazione del dosaggio intermedio e del dosaggio minimo).
2. DATI
Di norma, se i risultati ottenuti per i parametri di valutazione adottati nel presente metodo (biochimica, istopatologia e osservazione del comportamento) sono negativi, non è necessario eseguire ulteriori saggi di neurotossicità ritardata. Risultati equivoci o non conclusivi possono invece richiedere un approfondimento.
Dovranno essere forniti i dati individuali di ciascun animale. Inoltre, tutti i dati dovranno essere riassunti in una tabella indicante, per ogni gruppo, il numero di animali all'inizio del saggio, il numero di animali recanti lesioni, alterazioni del comportamento o effetti biochimici, la natura e la gravita di detti effetti o lesioni e la percentuale di animali per ogni tipo di effetto o lesione e per ogni livello di gravità.
I risultati del presente studio dovranno essere valutati in termini di incidenza, gravità e correlazione tra effetti comportamentali, biochimici e istopatologici e qualsiasi altro effetto osservato nei gruppi trattati e di controllo.
I risultati numerici dovranno essere elaborati sulla base di metodi statistici appropriati e generalmente riconosciuti. I metodi statistici saranno selezionati durante la fase di progettazione dello studio.
3. RELAZIONE
RELAZIONE SUL SAGGIO
La relazione sul saggio deve, se possibile, includere le seguenti informazioni.
|
|
Animali da esperimento:
|
—
|
numero e età degli animali,
|
|
—
|
origine, condizioni di alloggiamento, ecc.,
|
|
—
|
peso di ciascun animale all'inizio del saggio.
|
|
|
|
Condizioni sperimentali:
|
—
|
modalità precise di preparazione della sostanza in esame, stabilità e omogeneità, ove del caso,
|
|
—
|
motivazione della scelta del veicolo,
|
|
—
|
modalità precise di somministrazione della sostanza in esame,
|
|
—
|
caratteristiche della qualità del cibo e dell'acqua,
|
|
—
|
motivazione della scelta del dosaggio,
|
|
—
|
dosi somministrate, caratteristiche del veicolo, volume e forma fisica della sostanza somministrata,
|
|
—
|
qualora le analisi biochimiche vengano effettuate in tempi diversi da quelli previsti (24 e 48 h), motivazione di tale scelta.
|
|
|
|
Risultati:
|
—
|
dati relativi al peso corporeo,
|
|
—
|
dati relativi alla reazione tossica per ciascun livello di dosaggio, compresa la mortalità,
|
|
—
|
livello di esposizione massimo per il quale non siano stati osservati effetti avversi (NOAEL),
|
|
—
|
natura, gravità e durata degli effetti clinici osservati (ed eventuale reversibilità),
|
|
—
|
descrizione particolareggiata delle analisi biochimiche e relativi risultati,
|
|
—
|
risultati dell'esame necroscopico,
|
|
—
|
descrizione particolareggiata di tutti i reperti istopatologici,
|
|
—
|
elaborazione statistica dei risultati, ove del caso.
|
|
|
|
Discussione dei risultati.
|
4. RIFERIMENTI
Il presente metodo corrisponde al metodo OCSE TG 419.
B.39. TEST IN VIVO DI SINTESI NON PROGRAMMATA DI DNA (UDS) SU CELLULE EPATICHE DI MAMMIFERO
1. METODO
Il metodo è ripreso dal metodo OECD TG 486, (UDS) Test with Mammalian Liver Cells In Vivo (1997).
1.1. INTRODUZIONE
Il saggio in vivo della sintesi non programmata di DNA (Unscheduled DNA Synthesis — UDS) su cellule epatiche di mammifero è destinato ad identificare le sostanze che inducono la riparazione del DNA nelle cellule epatiche degli animali trattati [cfr. (1) (2) (3) (4)].
Questo test in vivo fornisce un metodo per studiare gli effetti genotossici di sostanze chimiche sul fegato. L'effetto misurato è indice di danno al DNA e successiva riparazione nelle cellule epatiche. Il fegato è di norma la sede principale del metabolismo delle sostanze assorbite. Rappresenta pertanto il sito idoneo per misurare in vivo il danno al DNA.
Questo saggio non è idoneo se è evidente che la sostanza in esame non raggiunge il tessuto bersaglio.
La sintesi non programmata dì DNA (UDS) è misurata determinando l'assorbimento di nucleosidi marcati nelle cellule in cui non è in corso una sintesi programmata (fase S) del DNA. La tecnica più comunemente usata è la determinazione mediante autoradiografia dell'assorbimento di timidina marcata con tritio (3H-TdR). Per il test UDS in vivo si usa di preferenza il fegato di ratto. Si possono usare anche altri tessuti, ma non sono oggetto del presente metodo.
L'individuazione di una risposta UDS dipende dal numero di basi del DNA escisse e sostituite nel sito danneggiato. Il saggio di UDS pertanto è particolarmente valido per individuare la riparazione di sequenze lunghe (da 20 a 30 basi) indotta dalla sostanza. È molto meno sensibile invece trattandosi di rilevare la riparazione di sequenze corte (1-3 basi). Fenomeni di mutagenesi possono inoltre risultare da mancata riparazione o riparazione difettosa di lesioni del DNA o da errata replicazione. Il grado di risposta di UDS non fornisce alcuna indicazione sulla fedeltà del meccanismo di riparazione. Inoltre un agente mutageno può reagire con il DNA senza che il danno prodotto al DNA sia riparato con un processo di riparazione per escissione. L'impossibilità di ottenere con il saggio UDS informazioni specifiche sull'attività mutagena è compensata dalla sua potenziale sensibilità, in quanto viene misurato nell'intero genoma.
Cfr. anche introduzione generale parte B.
1.2. DEFINIZIONI
Cellule in riparazione: cellule in cui il numero di grani nucleari netti (NNG) è superiore ad un valore prestabilito, che il laboratorio che effettua il saggio deve motivare.
Grani nucleari netti (NNG): misura quantitativa in autoradiografìa dell'attività di UDS delle cellule, calcolata sottraendo il numero medio di grani citoplasmici in aree citoplasmiche equivalenti al nucleo (CG) dal numero di grani nucleari (NG): NNG = NG-CG. I NNG sono conteggiati per le singole cellule, poi sommati per le cellule di una coltura, di colture in parallelo, ecc.
Sintesi non programmata di DNA (UDS): sintesi di riparazione del DNA dopo escissione e rimozione di un tratto di DNA che contiene una regione danneggiata per effetto di sostanze chimiche o agenti fisici.
1.3. PRINCIPIO DEL METODO DI SAGGIO
Il saggio UDS in vivo su cellule epatiche di mammifero permette di individuare la sintesi di riparazione del DNA dopo escissione e rimozione di un tratto di DNA contenente una regione che presenta un danno indotto da sostanze chimiche o agenti fisici. Il test è di solito basato sull'incorporazione di 3H-TdR nel DNA di cellule epatiche che presentano una bassa frequenza di cellule nella fase S del ciclo cellulare. La captazione di 3H-TdR è solitamente determinata mediante autoradiografia, non essendo tale tecnica soggetta ad interferenze da parte delle cellule nella fase S, a differenza, ad esempio, del conteggio per scintillazione in fase liquida.
1.4. DESCRIZIONE DEL METODO
1.4.1. Preparazioni
1.4.1.1. Scelta delle specie ammali
Il ratto è la specie più comunemente usata, ma si può usare qualsiasi specie di mammifero adatta. Si scelgano individui adulti, giovani e in buona salute, provenienti da ceppi di animali da laboratorio. All'inizio dello studio la variazione di peso tra gli animali deve essere minima e non superare ± 20 % del peso medio per sesso.
1.4.1.2. Condizioni dì stabulazione e alimentazione
Valgono le condizioni generali citate nell'Introduzione generale alla parte B; l'umidità ideale è pari al 50-60 %.
1.4.1.3. Preparazione degli animali
Gli animali adulti, sani e giovani vengono suddivisi a caso in gruppi di controllo e di trattamento. Le gabbie devono essere disposte in modo da minimizzare eventuali effetti dovuti alla posizione. Gli animali vanno identificati inequivocabilmente e acclimatati alle condizioni di laboratorio per almeno cinque giorni.
1.4.1.4. Sostanze in esame/preparazione
Le sostanze solide devono essere poste in soluzione o in sospensione in adeguati solventi o mezzi disperdenti e, se necessario, diluite prima di essere somministrate agli animali. Le sostanze liquide possono essere somministrate direttamente o diluite prima del trattamento. Si usino preparati recenti della sostanza, salvo qualora siano disponibili dati sulla sua stabilità che dimostrino che la conservazione è ammissibile.
1.4.2. Condizioni di esperimento
1.4.2.1. Solvente/mezzo disperdente
Il solvente/mezzo disperdente non deve produrre effetti tossici alle dosi usate e non deve reagire chimicamente con la sostanza in esame. L'uso di solventi/mezzi disperdenti poco noti è ammesso solo se suffragato da dati che ne provino la compatibilita. Si raccomanda di prendere in primo luogo in considerazione, se possibile, l'uso di un solvente/mezzo disperdente acquoso.
1.4.2.2. Controlli
Ogni parte dell'esperimento condotta separatamente dovrà comprendere controlli positivi e negativi (solvente/mezzo disperdente). Gli animali dei vari gruppi dovranno essere trattati in modo identico, salvo per la somministrazione della sostanza in esame.
I controlli positivi devono essere effettuati con sostanze che producono UDS in vivo a livelli di esposizione ai quali è previsto un aumento rilevabile rispetto alla media. I controlli positivi che richiedono un'attivazione metabolica devono essere usati a dosi che provochino una risposta moderata (4). Le dosi dei controlli positivi devono essere scelte in modo che gli effetti siano chiari ma non rivelino immediatamente al lettore d'identità dei vetrini codificati. Fra gli esempi di sostanze per i controlli positivi si citano:
|
Fasi di campionamento
|
Sostanza
|
N. CAS
|
N. Einecs
|
|
Fasi di campionamento precoci (2-4 ore)
|
N-Nitrosodimetilammina
|
62-75-9
|
200-249-8
|
|
Fasi di campionamento tardive (12-16 ore)
|
N-2-Fluorenilacetammide (2-AAF)
|
53-96-3
|
200-188-6
|
Sono ammesse altre sostanze adeguate per i controlli positivi. Il controllo positivo può essere somministrato per una via diversa rispetto alla sostanza in esame.
1.5. PROCEDURA
1.5.1. Numero e sesso degli animali
Si usi un numero di animali adeguato, per tener conto delle normali variazioni biologiche di risposta al saggio. Ogni gruppo dovrebbe comprendere almeno 3 animali analizzabili. Qualora esista una base di dati precedenti significativa, sono sufficienti 1 o 2 animali per i gruppi di controllo negativo e positivo.
Se al momento dello studio sono disponibili dati relativi a studi sulla stessa specie, nei quali è stata usata la stessa via di esposizione, che dimostrano che non vi sono sostanziali differenze di tossicità tra i sessi, sarà sufficiente effettuare il test su un singolo sesso, preferibilmente sui maschi. Se l'esposizione umana a sostanze chimiche è specifica per un sesso, ad esempio nel caso di alcuni prodotti farmaceutici, il test deve essere eseguito su animali di tale sesso.
1.5.2. Protocollo di trattamento
Le sostanze in esame vengono in generale somministrate in un'unica volta.
1.5.3. Dosi
Di norma si usano almeno due dosi. La dose massima è definita come dose che produce segni di tossicità tali che livelli più elevati, con la stessa posologia, sarebbero presumibilmente letali. In linea di principio la dose inferiore dovrebbe andare dal 50 % al 25 % della dose massima.
Sostanze con azione biologica specifica, a dosi basse non tossiche (come ormoni e mitogeni) possono costituire eccezione rispetto ai criteri di definizione della dose e vanno valutate caso per caso. Se si procede a uno studio per individuare l'intervallo di dosi, non essendo disponibili dati utili in materia, questo va eseguito nello stesso laboratorio, sulla stessa specie e ceppo, con il medesimo protocollo usato nel test principale.
La dose massima può anche essere definita come dose che produce qualche segno di epatotossicità (ad esempio nuclei picnotici).
1.5.4. Saggio con dose limite
Se la somministrazione di una dose di almeno 2 000 mg/kg di peso corporeo in una singola presa o in due prese lo stesso giorno non produce effetti tossici rilevabili, e se non c'è ragione di sospettare genotossicità sulla base di dati relativi a sostanze strutturalmente correlate, può essere superfluo uno studio completo. Sulla base dell’esposizione umana prevista per la sostanza in esame, può essere necessario usare una dose più elevata nel test con dose limite.
1.5.5. Somministrazione delle dosi
La sostanza in esame viene di solito somministrata con sonda gastrica o cannula di intubazione, oppure mediante iniezione intraperitoneale. Possono essere accettate altre vie se esiste una valida ragione. La via intraperitoneale non è però raccomandata, in quanto potrebbe esporre il fegato alla sostanza in esame direttamente, e non attraverso il sistema circolatorio. Il volume massimo di liquido somministrabile in una volta con sonda gastrica o con iniezione dipende dalle dimensioni dell'animale da laboratorio; non deve superare i 2 ml/100 g di peso corporeo. L'uso di volumi più elevati deve essere motivato. Salvo per sostanze irritanti o corrosive, che di norma riveleranno effetti esacerbati a concentrazioni più elevate, le variazioni di volume devono essere minimizzate, regolando la concentrazione in modo da garantire un volume costante a tutte le dosi.
1.5.6. Preparazione delle cellule epatiche
Di norma le cellule epatiche sono prelevate da animali trattati e preparate 12-16 ore dopo la somministrazione. In genere è necessario un altro prelievo dopo un periodo più breve (di norma da 2 a 4 ore dopo il trattamento), salvo che a 12-16 ore si abbia una risposta positiva chiara. Si possono comunque usare fasi di campionamento diverse se motivate sulla base di dati tossicocinetici.
Le colture a breve termine di cellule epatiche di mammifero sono di solito costituite mediante perfusione del fegato in situ con collagenasi, lasciando poi le cellule epatiche appena dissociate aderire ad una superficie idonea. Le cellule epatiche dei controlli negativi dovrebbero avere una vitalità (5) almeno del 50 %.
1.5.7. Determinazione dell’UDS
Le cellule epatiche di mammifero appena isolate sono poste in incubazione, di norma su terreno contenente 3H-TdR, per un periodo adeguato, ad esempio da 3 a 8 ore. Al termine dell'incubazione, si rimuova il terreno dalle cellule, che possono poi essere incubate con terreno contenente un eccesso di timidina non marcata, per ridurre la radioattività non incorporata («cold chase»). Le cellule vengono poi risciacquate, fissate ed essiccate. Per tempi di incubazione più prolungati, la «cold chase» può essere superflua. I vetrini sono immersi in emulsione autoradiografica, esposti al buio (ad esempio refrigerati per 7-14 giorni), sviluppati, colorati; si contano quindi i grani d'argento. Per ogni animale si preparano due o tre vetrini.
1.5.8. Analisi
I preparati su vetrino devono contenere cellule di morfologia normale in numero sufficiente per permettere una valutazione probante dell'UDS. I preparati sono esaminati al microscopio alla ricerca di segni evidenti di citotossicìtà (ad esempio picnosi, livelli ridotti di radiomarcatura).
Si codifichino i vetrini prima del conteggio dei grani. Di norma si analizzano 100 cellule per animale, su almeno due vetrini. L'analisi di un numero inferiore a 100 cellule per animale deve essere motivato. Nel conteggio dei grani non si tiene conto dei nuclei in fase S, ma si può registrare la percentuale delle cellule in fase S.
Il grado di incorporazione della 3H-TdR nel nucleo e nel citoplasma di cellule morfologicamente normali, messo in evidenza dal deposito di granuli di argento, deve essere determinato mediante metodi adeguati.
Il numero dei grani è determinato sui nuclei (grani nucleari, NG) e su aree del citoplasma equivalenti al nucleo (grani citoplasmici, CG). Il numero dei CG è determinato prendendo in considerazione l'area più densamente marcata del citoplasma, oppure in base alla media di due o più regioni citoplasmiche adiacenti al nucleo, scelte casualmente. Si possono usare altri metodi di conteggio (ad esempio il conteggio delle cellule complete) se motivabili (6).
2. RISULTATI
2.1. TRATTAMENTO DEI RISULTATI
Si forniscano i dati relativi ai singoli vetrini e ai singoli animali. Inoltre tutti i dati devono essere riassunti in tabelle. Il numero dei grani nucleari netti (NNG) va determinato per ciascuna cellula, per ciascun animale e per ciascuna dose e fase di prelievo sottraendo il numero dei CG dal numero dei NG. Se si contano le «cellule in riparazione», i criteri di definizione delle «cellule in riparazione» devono essere motivati e basati sui dati di controlli negativi precedenti o paralleli. I risultati numerici possono essere valutati mediante metodi statistici. Gli eventuali test statistici devono essere scelti e motivati prima di condurre lo studio.
2.2. VALUTAZIONE E INTERPRETAZIONE DEI RISULTATI
Esempi di criteri che permettono di concludere che la risposta è positiva o negativa:
|
risposta positiva
|
i)
|
valori di NNG superiori ad una soglia prestabilita, motivata sulla base di dati di laboratorio precedenti; o
|
|
|
ii)
|
valori di NNG significativamente maggiori rispetto al controllo parallelo;
|
|
risposta negativa
|
i)
|
valori di NNG uguali o inferiori alla soglia dei controlli precedenti; o
|
|
|
ii)
|
valori di NNG non significativamente maggiori rispetto al controllo parallelo.
|
Si consideri per prima cosa la rilevanza dei risultati dal punto di vista biologico; si tenga conto di parametri quali le variazioni intraspecifìche, la relazione dose-risposta e la citotossicità. Si possono usare metodi statistici come ausilio nella valutazione dei risultati sperimentali, ma la significatività statistica non dovrebbe essere l'unico attore determinante di una risposta positiva.
La maggior parte degli esperimenti fornirà indubbiamente risultati chiaramente positivi o negativi ma occasionalmente i dati ottenuti non consentiranno di formulare un giudizio definitivo sull'azione della sostanza in esame. I risultati possono rimanere ambigui nonostante l'esperimento venga ripetuto più volte.
Risultati positivi del saggio in vivo su cellule epatiche di mammifero indicano che la sostanza in esame induce nel DNA di cellule epatiche di mammifero in vivo un danno che può essere riparato in vitro mediante sintesi non programmata del DNA. Risultati negativi indicano che, nelle condizioni di esperimento, la sostanza in esame non induce nel DNA danni rilevabili mediante questo saggio.
Si vagli la probabilità che la sostanza in esame o i suoi metaboliti entrino in circolo o raggiungano specificamente il tessuto bersaglio (tossicità sistemica).
3. RELAZIONE
RELAZIONE SUL SAGGIO
La relazione sul saggio dovrà contenere le seguenti informazioni.
|
|
Solvente/mezzo disperdente:
|
—
|
motivazione della scelta del mezzo disperdente,
|
|
—
|
solubilità e stabilità della sostanza in esame nel solvente/mezzo disperdente, se nota.
|
|
|
|
Animali da laboratorio:
|
—
|
numero, età e sesso degli animali,
|
|
—
|
provenienza, condizioni di stabulazione, dieta, ecc.,
|
|
—
|
peso dei singoli animali all'inizio del test, con range, media e deviazione standard per ciascun gruppo.
|
|
|
|
Condizioni di esperimento:
|
—
|
controlli positivi e negativi mezzo disperdente/solvente,
|
|
—
|
risultati dello studio per individuare l'intervallo di dosi, se effettuato,
|
|
—
|
criteri di selezione delle dosi,
|
|
—
|
illustrazione paiticolareggiata della preparazione della sostanza in esame,
|
|
—
|
illustrazione particolareggiata della somministrazione della sostanza in esame,
|
|
—
|
criteri di selezione della via di somministrazione,
|
|
—
|
metodi usati per verificare che la sostanza in esame sia entrata in circolo o abbia raggiunto il tessuto bersaglio, se del caso,
|
|
—
|
conversione della concentrazione (ppm) della sostanza in esame nel cibo o nell'acqua potabile nella dose effettiva (mg/kg di peso corporeo/giorno), se del caso,
|
|
—
|
dettagli relativi alla qualità del cibo e dell'acqua,
|
|
—
|
descrizione dettagliata dei protocolli di trattamento e campionamento,
|
|
—
|
metodi di misura della tossicità,
|
|
—
|
metodo di preparazione e di coltura delle cellule epatiche,
|
|
—
|
tecnica autoradiografica usata,
|
|
—
|
numero di vetrini preparati e numero di cellule analizzate,
|
|
—
|
criteri di valutazione,
|
|
—
|
criteri in base ai quali i risultati sono giudicati positivi, negativi o ambigui.
|
|
|
|
Risultati:
|
—
|
valori medi dei grani nucleari, dei grani citoplasmici, e dei grani nucleari netti per vetrino, per animale e per gruppo,
|
|
—
|
relazione dose-risposta, se possibile,
|
|
—
|
eventuali analisi statistiche,
|
|
—
|
dati sui controlli negativi (solvente/mezzo disperdente) e positivi paralleli,
|
|
—
|
dati sui precedenti controlli negativi (solvente/mezzo disperdente) con intervalli, medie e deviazioni standard,
|
|
—
|
numero di «cellule in riparazione», se determinato,
|
|
—
|
numero di cellule in fase S, se determinato,
|
|
—
|
vitalità delle cellule.
|
|
|
|
Discussione dei risultati.
|
4. BIBLIOGRAFIA
|
(1)
|
Ashby, J., Lefevre, P.A., Burlinson, B. and Penman, M.G. (1985), An Assessment of the in Vivo Rat Hepatocyte DNA Repair Assay, Mutation Res., 156, pp. 1-18.
|
|
(2)
|
Butterworth, B.E., Ashby, J., Bermudez, E., Casciano, D., Mirsalis, J., Probst G. and Williams, G. (1987), A Protocol and Guide for the In Vivo Rat Hepatocyte DNA-Repair Assay, Mutation Res., 189, pp. 123-133.
|
|
(3)
|
Kennelly, J.C, Waters, R., Ashby, J., Lefevre, P.A., Burlinson B., Benford, D. J., Dean, S.W. and Mitchell I. de G. (1993), In Vivo Rat Liver UDS Assay. In: Kirkland D.J. and Fox M, (eds.), Supplementary Mutagenicily Tests: UKEM Recommended Procedures. UKEMS Subcommittee on Guidlines for Mulagenicity Testing Report. Part II revised, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 52-77.
|
|
(4)
|
Madie, S., Dean, S.W., Andrae, U., Brambilla, G., Burlinson, B., Doolittle, D.J., Furihata, C, Hertner, T., McQueen, C.A. and Mori, H. (1993), Recommendations for the Performance of UDS Tests In Vitro and In Vivo, Mutations Res., 312, pp. 263-285.
|
|
(5)
|
Fautz, R., Hussain, B., Efstathiou, E. and Hechenberger-Freudl, C. (1993), Assessment of the Relation Between the Initital Viability and the Attachment of Freshly Isolateci Rat Hepatocytes Used for the In Vivo/In Vitro DNA Repair Assay (UDS), Mutation Res., 291, pp. 21-27.
|
|
(6)
|
Mirsalis, J.C, Tyson, C.K. and Butterworth, B.E. (1982), Detection of Genotoxic Carcinogens in the In Vivo/In Vitro Hepatocyte DNA Repair Assay, Environ Mutagen, 4, pp. 553-562.
|
B.40. CORROSIONE CUTANEA IN VITRO: TEST DI RESISTENZA ELETTRICA TRANSCUTANEA (TER)
1. METODO
Questo metodo corrisponde alle linee guida OCSE TG 430 (2004).
1.1. INTRODUZIONE
Per corrosione cutanea si intende il manifestarsi di lesioni irreversibili sulla pelle dopo l'applicazione della sostanza che si intende testare (come definita dal Globally Harmonised System for the Classification and Labelling of Chemical Substances and Mixtures (GHS)(1). Il presente metodo prevede una procedura per la valutazione della corrosività che non è condotta su animali vivi.
Tipicamente, la valutazione della corrosività cutanea è effettuata su cavie (2). Gli aspetti connessi al dolore ed alla sofferenza inflitti agli animali ai fini del test di corrosività sono stati affrontati in occasione della revisione del metodo di prova B.4, che consente di determinare la corrosione cutanea tramite metodi alternativi in vitro, evitando la sofferenza degli animali.
Il primo passo verso la definizione di test alternativi atti a studiare la corrosività cutanea a fini regolamentari è stato la realizzazione di studi di prevalidazione (3). Successivamente è stato realizzato (6)(7)(8) uno studio di validazione formale dei metodi in vitro di valutazione della corrosione cutanea (4)(5). I risultati di questi studi e di altri documenti pubblicati hanno permesso di stabilire che i seguenti test potevano essere utilizzati per valutare la corrosività cutanea in vivo (9)(10)(11): il test eseguito su modelli di pelle umana (cfr. il metodo di prova B.40 bis) e il test di resistenza elettrica transcutanea (TER, il presente metodo).
I risultati di uno studio di validazione e di altri studi pubblicati indicano che il test di resistenza elettrica (TER) condotto sui ratti (12)(13) è in grado di discriminare in modo affidabile, tra le sostanze conosciute, quelle che sono corrosive e non corrosive per la pelle (5)(9).
Il test descritto nel presente metodo permette di identificare le sostanze e i composti chimici corrosivi. Permette inoltre l'identificazione delle sostanze e dei composti non corrosivi se sostenuto da molte prove basate su altre informazioni esistenti (ad esempio, pH, relazioni struttura/attività, dati relativi agli esseri umani e/o agli animali) (1)(2)(11)(14). Non fornisce informazioni pertinenti sull'irritazione cutanea, né permette la sottocategorizzazione delle sostanze corrosive conformemente al sistema armonizzato universale di classificazione (GHS) (1).
Per una valutazione completa degli effetti cutanei locali dopo una singola esposizione della cute, si raccomanda di applicare la strategia di test sequenziale allegata al metodo di prova B.4 (2) e descritta nel sistema armonizzato universale (1). Detta strategia sperimentale comporta la realizzazione di test in vitro volti a determinare la corrosione cutanea (come descritta nel presente metodo) e l'irritazione cutanea prima di prevedere la conduzione di test su animali vivi.
1.2. DEFINIZIONI
Corrosione cutanea in vivo: è il manifestarsi di lesioni irreversibili della pelle, vale a dire, necrosi visibile dell'epidermide e del derma, a seguito dell'applicazione della sostanza di prova per non più di quattro ore. Le reazioni corrosive sono caratterizzate da ulcere, emorragie, escare sanguinanti e, alla fine dell'osservazione, il giorno 14, da alterazione del colore dovuta a pallore della cute, zone di completa alopecia e cicatrici. Per valutare le lesioni dubbie effettuare eventualmente un esame istopatologico.
Resistenza elettrica transcutanea (TER): misurazione dell'impedenza elettrica della pelle, come valore di resistenza espressa in kΩ (kilo-ohm). Si tratta di un metodo al contempo semplice ed affidabile per valutare la funzione di barriera tramite la registrazione del passaggio di ioni attraverso la pelle per mezzo di un ponte di Wheatstone.
1.3. SOSTANZE CHIMICHE DI RIFERIMENTO
Tabella 1
Sostanze chimiche di riferimento
|
Denominazione
|
N. Einecs
|
N. CAS
|
|
|
1,2-diaminopropano
|
201-155-9
|
78-90-0
|
Fortemente corrosivo
|
|
Acido acrilico
|
201-177-9
|
79-10-7
|
Fortemente corrosivo
|
|
2-tert-butilfenolo
|
201-807-2
|
88-18-6
|
Corrosivo
|
|
Idrossido di potassio (10 %)
|
215-181-3
|
1310-58-3
|
Corrosivo
|
|
Acido solforico (10 %)
|
231-639-5
|
7664-93-9
|
Corrosivo
|
|
Acido ottanoico (caprilico)
|
204-677-5
|
124-07-02
|
Corrosivo
|
|
4-amino-1,2,4-triazolo
|
209-533-5
|
584-13-4
|
Non corrosivo
|
|
Eugenol
|
202-589-1
|
97-53-0
|
Non corrosivo
|
|
Fenetil bromuro
|
203-130-8
|
103-63-9
|
Non corrosivo
|
|
Tetracloroetilene
|
204-825-9
|
27-18-4
|
Non corrosivo
|
|
Acido isostearico
|
250-178-0
|
30399-84-9
|
Non corrosivo
|
|
4-(metiltio)-benzaldeide
|
222-365-7
|
3446-89-7
|
Non corrosivo
|
La maggior parte delle sostanze chimiche sopra elencate proviene dall'elenco delle sostanze chimiche selezionate per lo studio di validazione internazionale di ECVAM (4). Detta selezione si basa sui criteri seguenti:
|
i)
|
ugual numero di sostanze corrosive e non corrosive;
|
|
ii)
|
sostanze disponibili in commercio, rappresentanti la maggior parte delle classi chimiche pertinenti;
|
|
iii)
|
l'inclusione di sostanze fortemente corrosive e meno corrosive ai fini della discriminazione in base al potere corrosivo;
|
|
iv)
|
selezione di sostanze chimiche che possono essere trattate in laboratorio senza presentare altri rischi gravi oltre alla corrosività.
|
1.4. PRINCIPIO DEL METODO
La sostanza di prova è applicata per non più di 24 ore sulla superficie epidermica di dischi di tessuto cutaneo in un sistema di test a due compartimenti nel quale i dischi di tessuto cutaneo fungono da separatori tra i compartimenti. I dischi di tessuto cutaneo sono prelevati da ratti di 28-30 giorni, soppressi con metodi non cruenti. Le materie corrosive sono individuate in base alla loro capacità di comportare una perdita dell'integrità dello strato corneo normale e della funzione di barriera, che si misura come riduzione della TER al di sotto di un livello soglia (12). Per la TER dei ratti, un valore limite di 5 kΩ è stato scelto sulla base di molti dati relativi ad un elevato numero di sostanze chimiche per le quali la maggior parte dei valori era nettamente superiore (spesso > 10 kΩ), o nettamente inferiore (spesso < 3 kΩ) a tale valore (12). In generale, le sostanze che non sono corrosive per gli animali ma che sono irritanti o non irritanti non comportano una riduzione della TER al di sotto di tale valore limite. Inoltre, l'utilizzo di altre preparazioni cutanee o di altre attrezzature può alterare il valore limite, rendendo necessaria in tal caso una validazione supplementare.
La procedura sperimentale include una sequenza relativa alla fissazione del colorante al fine di confermare i risultati positivi del TER con valori attorno a 5 kΩ. Tale sequenza determina se l'aumento della permeabilità ionica è dovuto alla distruzione fisica dello strato corneo. È stato dimostrato che il metodo TER su pelle di ratto permetteva di predire la corrosività in vivo nel coniglio valutato con il metodo di prova B.4 (2). Giova osservare che il test in vivo sul coniglio è estremamente conservativo per quanto riguarda la corrosività cutanea e l'irritazione cutanea rispetto al test sul tessuto cutaneo umano (15).
1.5. DESCRIZIONE DEL METODO
1.5.1. Animali
I ratti sono la specie di elezione, giacché la sensibilità della loro pelle alle sostanze chimiche utilizzate nel test è stata già dimostrata (10). L'età (al momento in cui la cute è prelevata) ed il ceppo del ratto sono particolarmente importanti perché si deve essere sicuri che i follicoli piliferi siano in fase d'inattività, prima dell'inizio della crescita dei peli adulti.
I peli della zona dorsale e laterale di giovani ratti maschi o femmine di circa 22 giorni (Wistar o ceppo comparabile) sono rimossi con cura per mezzo di piccole forbici. Gli animali sono successivamente lavati con cura mediante pezze bagnate e la zona rimossa è immersa in una soluzione antibiotica (contenente, ad esempio, streptomicina, penicillina, cloramfenicolo e amfotericina a concentrazioni efficaci per inibire la crescita batterica). Gli animali sono nuovamente lavati con antibiotici il terzo o il quarto giorno dopo il primo lavaggio e sottoposti al test entro 3 giorni dal secondo lavaggio, quando lo strato corneo si è rimesso dalla rimozione dei peli.
1.5.2. Preparazione dei dischi di tessuto cutaneo
Gli animali sono uccisi in modo non cruento quando hanno 28-30 giorni. La pelle dorso-laterale di ciascun animale è successivamente rimossa ed accuratamente liberata da qualsiasi eccesso di grasso sottocutaneo. Vengono rimossi dischi di tessuto cutaneo del diametro di circa 20 mm. Il tessuto cutaneo potrà essere conservato prima dell'utilizzo dei dischi se i dati dei controlli positivi e negativi risultano equivalenti a quelli ottenuti sul tessuto cutaneo fresco.
Ciascun disco di tessuto cutaneo è posto su una delle estremità di un tubo di politetrafluoroetilene (PTFE), con la superficie epidermica a contatto con il tubo. Dopo aver fissato il disco all'estremità del tubo con un anello di tenuta toroidale in gomma, si elimina la parte eccedentaria del tessuto. Le dimensioni del tubo e del giunto toroidale sono indicate nella figura 2. L'anello toroidale di gomma viene quindi fissato con cura all'estremità del tubo per mezzo di vaselina. Il tubo è posizionato con una pinza a molla all'interno in un cilindro contenente una soluzione di 154 mM di MgSO4 (figura 1). Il disco cutaneo deve essere interamente sommerso nella soluzione di MgSO4. È possibile ottenere fino a 10-15 dischi di tessuto cutaneo dalla pelle di un solo ratto.
Prima di cominciare le prove, misurare la resistenza elettrica di due dischi cutanei per controllare la qualità della pelle di ciascun animale. I due dischi devono dare valori di resistenza superiori a 10 kΩ affinché gli altri dischi possano essere utilizzati per il test. Se il valore di resistenza è inferiore a 10 kΩ, gli altri dischi della stessa cute devono essere eliminati.
1.5.3. Applicazione delle sostanze di prova e delle sostanze di controllo
Controlli positivi e negativi concorrenti devono essere utilizzati per ciascuno studio in modo da garantire un'adeguata prestazione del metodo di prova. Devono essere utilizzati dischi di tessuto cutaneo provenienti da un unico animale. Le sostanze proposte per i controlli positivi e negativi sono, rispettivamente, l'acido cloridrico 10 M e l'acqua distillata.
La sostanza di prova liquida (150 μL) è applicata uniformemente sulla superficie epidermica all'interno del tubo. Per il test di sostanze solide, si applica in modo uniforme sul disco di tessuto cutaneo una quantità sufficiente di sostanza in modo da coprire la totalità della superficie dell'epidermide. Dopo avere aggiunto l'acqua deionizzata (150 μL) sulla sostanza solida, agitare delicatamente il tubo. Per ottenere il massimo contatto con la pelle, può risultare necessario riscaldare i solidi a 30 oC per sciogliere o rammollire la sostanza di prova o macinarli per ottenere grani o polveri.
Tre dischi di pelle sono utilizzati per ciascuna sostanza di prova e di controllo. La sostanza di prova è applicata per 24 ore a 20-23 oC, quindi rimossa con un getto d'acqua corrente a 30 oC fino alla sua completa rimozione.
1.5.4. Misurazione della TER
L'impedenza cutanea è determinata misurando la TER per mezzo di un ponte Wheatstone a basso voltaggio e corrente alternata (13). Le specificazioni generali del ponte sono una tensione operativa di 1-3 V, una corrente alternata sinusoidale o rettangolare di 50-1 000 Hz ed un intervallo di misurazione di almeno 0,1-30 kΩ. Il ponte utilizzato nello studio di validazione misura l'induttanza, la capacitanza e la resistenza fino a valori di 2 000 H, 2 000 μF e 2 MΩ, rispettivamente, a frequenze di 100 Hz o 1 kHz, utilizzando valori in serie o paralleli. Ai fini della TER, le misurazioni dei test di corrosività sono registrate in resistenza ad una frequenza di 100 Hz utilizzando valori in serie. Prima di misurare la resistenza elettrica, la tensione di superficie della pelle è ridotta aggiungendo un volume di etanolo al 70 % sufficiente a coprire l'epidermide. Dopo alcuni secondi, l'etanolo è rimosso dal tubo ed il tessuto è idratato con l'aggiunta di 3 mL di soluzione di MgSO4 (154 mM). Gli elettrodi del ponte di misurazione sono posizionati su entrambi i lati del disco cutaneo per misurare la resistenza in kΩ/disco di tessuto cutaneo (figura 1). Le dimensioni degli elettrodi e la lunghezza dell'elettrodo esposto al di sotto dei morsetti a coccodrillo sono indicate nella figura 2. Il morsetto attaccato all'elettrodo interno è posto sulla parte superiore del tubo durante la misurazione della resistenza, affinché la lunghezza dell'elettrodo immerso nella soluzione di MgSO4 resti costante. L'elettrodo esterno è posizionato all'interno del cilindro in modo tale da posarsi sul fondo dello stesso. La distanza tra la pinza a molla e la parte inferiore del tubo deve rimanere costante (figura 2), poiché tale distanza influenza il valore di resistenza che si ottiene. Di conseguenza, la distanza tra l'elettrodo interno ed il disco di tessuto cutaneo deve essere costante e minima (1-2 mm).
Se la misurazione della resistenza dà un valore superiore a 20 kΩ, ciò può essere dovuto ad un residuo della sostanza di prova che copre la superficie epidermica del disco di tessuto cutaneo. Un tentativo di rimozione della sostanza può essere effettuato, ad esempio, turando ermeticamente il tubo con il pollice inguantato ed agitandolo per 10 secondi circa; la soluzione di MgSO4 viene così completamente rimossa e la misurazione della resistenza è ripetuta con una nuova soluzione di MgSO4.
Le proprietà e le dimensioni dell'apparecchiatura e la procedura sperimentale utilizzate possono influenzare i valori della TER che si ottengono. La soglia di corrosività è stata fissata a 5 kΩ sulla base di dati ottenuti con l'apparecchiatura e la procedura sperimentale specifiche descritte nel presente metodo. Possono essere applicati diversi valori limite e di controllo nel caso in cui le condizioni sperimentali siano alterate o sia utilizzata una diversa attrezzatura. Pertanto, si raccomanda di calibrare la metodologia ed i valori limite di resistenza provando una serie di sostanze standard di riferimento scelte fra le sostanze chimiche utilizzate nello studio di validazione (4)(5) o fra classi di sostanze chimiche simili a quelle studiate. Un elenco di idonee sostanze chimiche di riferimento è proposto nella tabella 1.
1.5.5. Metodi di fissazione del colorante
L'esposizione ad alcune sostanze non corrosive può comportare una diminuzione della resistenza al di sotto del valore soglia di 5 kΩ e permettere il passaggio di ioni attraverso lo strato corneo riducendo in tal modo la resistenza elettrica (5). Ad esempio, le sostanze organiche neutre e le sostanze tensioattive (compresi detergenti, emulsionanti ed altri agenti di superficie) può eliminare i lipidi della cute rendendo in tal modo la barriera più permeabile agli ioni. Di conseguenza, se i valori della TER delle sostanze di prova sono inferiori o all'incirca di 5 kΩ in mancanza di lesioni visive, si deve effettuare una valutazione della penetrazione del colorante sui tessuti di controllo ed i tessuti trattati per determinare se i valori della TER ottenuti sono il risultato della maggiore permeabilità della cute o della corrosione cutanea (3)(5). In caso di corrosione cutanea con danno dello strato corneo, il colorante sulforodamina B, quando applicato sulla pelle, penetra rapidamente e colora il tessuto sottostante. Questo colorante è stabile con un'ampia gamma di sostanze chimiche e non è influenzato dal procedimento di estrazione descritto di seguito.
1.5.5.1. Applicazione ed eliminazione del colorante sulforodamina B
Al termine della valutazione della TER, il solfato di magnesio è rimosso dal tubo ed il tessuto cutaneo è esaminato con cura in cerca di lesioni manifeste. Se non ci sono importanti lesioni manifeste, 150 μL di una diluizione al 10 % (p/v) di colorante sulforodamina B (rosso acido 52; n. Einecs 222-529-8; n. CAS 3520-42-1) in acqua distillata sono applicati sulla superficie epidermica di ogni disco di tessuto cutaneo per 2 ore. Questi dischi di tessuto vengono successivamente lavati con un getto d'acqua corrente a temperatura ambiente per circa 10 secondi in modo da eliminare il colorante eccedentario/non fissato. Ciascun disco di tessuto cutaneo è rimosso attentamente dal tubo e messo in una fiala (ad esempio, una fiala a scintillazione in vetro di 20 mL) contenente acqua deionizzata (8 mL). Agitare delicatamente le fiale per 5 minuti fino ad eliminare qualsiasi eccesso di colorante non fissato. Dopo aver ripetuto la procedura di risciacquo, i dischi di tessuto cutaneo sono rimossi e inseriti in fiale contenenti 5 ml di sodio dodecil solfato (SDS) al 30 % (p/v) in acqua distillata, quindi incubati per una notte a 60 oC.
In seguito all'incubazione, ciascun disco di tessuto cutaneo è rimosso e scartato e la soluzione restante è centrifugata per 8 minuti a 21 oC (forza centrifuga relativa ~175 × g). Un campione di 1 mL di supernatante è in seguito diluito in rapporto 1:5 (v/v) (cioè 1 mL + 4 mL) con SDS al 30 % (p/v) in acqua distillata. La densità ottica (OD) della soluzione è misurata a 565 nm.
1.5.5.2. Calcolo del tasso di colorante
Il tasso di sulforodamina B in ciascun disco è calcolato sulla base dei valori di OD (5) (coefficiente di estinzione molare della sulforodamina B a 565 nm = 8,7 × 104; peso molecolare = 580). Il tenore di colorante è determinato per ciascun disco di tessuto cutaneo per mezzo di un’idonea curva di taratura. Un tenore medio è quindi calcolato per le prove ripetute.
2. DATI
I valori di resistenza (kΩ) e, eventualmente, i valori di tasso medio del colorante (μg/disco), per la sostanza di prova ed i controlli positivi e negativi sono presentati sotto forma di tabella (dati relativi ai singoli test e medie ± D.S.), compresi i dati dei test ripetuti/replicati ed i valori medi ed individuali.
2.1. INTERPRETAZIONE DEI RISULTATI
I valori medi della TER sono accettati se i valori dei controlli positivi e negativi effettuati in parallelo si situano entro gli intervalli accettabili di valori per il metodo utilizzato nel laboratorio di prova. Gli intervalli accettabili di resistenza per la metodologia e l'apparecchiatura descritte sono indicati nella tabella seguente:
|
Controllo
|
Sostanza
|
Intervallo di resistenza (kΩ)
|
|
Positivo
|
10 M acido cloridrico
|
0,5-1,0
|
|
Negativo
|
Acqua distillata
|
10-25
|
I valori medi della fissazione del colorante sono accettati a condizione che i valori dei controlli effettuati in parallelo si situino entro gli intervalli accettabili per il metodo. Gli intervalli accettabili di tasso colorante per le sostanze di controllo proposte per la metodologia e l'apparecchiatura descritte sono i seguenti:
|
Controllo
|
Sostanza
|
Intervallo di tasso di colorante (μg/disco)
|
|
Positivo
|
10 M acido cloridrico
|
40-100
|
|
Negativo
|
Acqua distillata
|
15-35
|
La sostanza di prova è considerata non corrosiva per la pelle:
|
i)
|
se il valore medio della TER ottenuto per la sostanza di prova è superiore a 5 k; o
|
|
ii)
|
se il valore medio della TER è inferiore o uguale a 5 kΩ; e se
|
—
|
il disco di tessuto cutaneo non presenta alcuna lesione manifesta, e
|
|
—
|
il tasso medio di colorante del disco è nettamente inferiore a quello del controllo positivo di 10 M HCl realizzato in parallelo.
|
|
La sostanza di prova è considerata corrosiva per la pelle:
|
i)
|
se il valore medio della TER è inferiore o uguale a 5 kΩ e se il disco di tessuto cutaneo presenta lesioni manifeste; o
|
|
ii)
|
se il valore medio della TER è inferiore o uguale a 5 kΩ, e se
|
—
|
il disco di tessuto cutaneo non presenta alcuna lesione manifesta, ma soltanto
|
|
—
|
il tasso medio di colorante del disco è maggiore o uguale a quello del controllo positivo di 10 M HCl realizzato in parallelo.
|
|
3. RELAZIONE SULL'ESECUZIONE DEL SAGGIO
3.1. RAPPORTO DI PROVA
Il rapporto di prova deve contenere le informazioni seguenti.
|
|
Sostanze di prova e sostanze di controllo:
|
—
|
denominazioni chimiche, quali i nomi IUPAC o CAS ed il numero CAS, se conosciuti,
|
|
—
|
purezza e composizione della sostanza o della preparazione (in percentuale ponderale), natura fisica,
|
|
—
|
proprietà fisico-chimiche pertinenti per la realizzazione dello studio, quali la natura fisica, il pH, la stabilità e la solubilità nell'acqua,
|
|
—
|
trattamento delle sostanze di prova/di controllo prima del test, se necessario (ad esempio, riscaldamento, frantumazione);
|
|
—
|
stabilità, se conosciuta.
|
|
|
|
Cavie:
|
—
|
ceppo e sesso utilizzati,
|
|
—
|
età degli animali in caso d'utilizzo come animali donatori,
|
|
—
|
origine, condizione d'alloggio, alimentazione, ecc.,
|
|
—
|
dettagli sulla preparazione della pelle.
|
|
|
|
Condizioni di prova:
|
—
|
curve di taratura dell'apparecchiatura di test,
|
|
—
|
curve di taratura delle prestazioni del test di fissazione del colorante,
|
|
—
|
dettagli sulla procedura sperimentale utilizzata per le misurazioni della TER,
|
|
—
|
dettagli sulla procedura sperimentale utilizzata per la valutazione della fissazione del colorante, se del caso,
|
|
—
|
descrizione di qualsiasi modifica delle procedure sperimentali;
|
|
—
|
descrizione dei criteri di valutazione utilizzati.
|
|
|
|
Risultati:
|
—
|
presentazione sotto forma di tabella dei dati derivati dal test della TER e dal test di fissazione del colorante (se del caso) per i singoli animali e singoli campioni di pelle,
|
|
—
|
descrizione di tutti gli effetti osservati.
|
|
|
|
Discussione dei risultati.
|
4. BIBLIOGRAFIA
|
(1)
|
OCSE (2001) Harmonised Integrated Classification System for Human Health and Environmental Hazards of Chemical Substances and Mixtures. OECD Series on Testing and Assessment Number 33. ENV/JM/MONO(2001)6, Paris. http://www.olis.oecd.org/olis/2001doc.nsf/LinkTo/env-jm-mono(2001)6.
|
|
(2)
|
Testing Method B.4. Acute Toxicity: Dermal Irritation/Corrosion.
|
|
(3)
|
Botham, P.A., Chamberlain, M., Barratt, M.D., Curren, R.D., Esdaile, D.J., Gardner, J.R., Gordon, V.C., Hildebrand, B., Lewis, R.W., Liebsch, M., Logemann, P., Osborne, R., Ponec, M., Regnier, J.F., Steiling, W., Walker, A.P., and Balls, M. (1995). A prevalidation study on in vitro skin corrosivity testing. The report and recommendations of ECVAM Workshop 6. ATLA 23, 219-255.
|
|
(4)
|
Barratt, M.D., Brantom, P.G., Fentem, J.H., Gerner, I., Walker, A.P., and Worth, A.P. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 1. Selection and distribution of the test chemicals. Toxic. in Vitro 12, 471-482.
|
|
(5)
|
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhütter, H.-G., e Liebsch, M. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxic. in Vitro 12, 483-524.
|
|
(6)
|
OCSE (1996). Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods, 62 pp.
|
|
(7)
|
Balls, M., Blaauboer, B.J., Fentem. J.H., Bruner. L., Combes, R.D., Ekwall, B., Fielder. R.J., Guillouzo, A., Lewis, R.W., Lovell, D.P., Reinhardt, C.A., Repetto, G., Sladowski. D., Spielmann, H., e Zucco, F. (1995). Practical aspects of the validation of toxicity test procedures. The report and recommendations of ECVAM workshops. ATLA 23, 129-147.
|
|
(8)
|
ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (1997). Validation and Regulatory Acceptance of Toxicological Test Methods. NIH Publication No. NIH Publication No. 97-3981. National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/docs/guidelines/validate.pdf
|
|
(9)
|
ECVAM (1998). ECVAM News & Views. ATLA 26, 275-280.
|
|
(10)
|
ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (2002). ICCVAM evaluation of EpiDermTM, EPISKINTM (EPI-200), and the Rat Skin Transcutaneous Electrical Resistance (TER) assay: In Vitro test methods for assessing dermal corrosivity potential of chemicals. NIH Publication No. NIH Publication No. 02-4502. National Toxicology Program Interagency Center for the Evaluation of Alternative Toxicological Methods, National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/methods/epiddocs/epis_brd.pdf.
|
|
(11)
|
OECD (2002) Extended Expert Consultation Meeting on The In Vitro Skin Corrosion Test Guideline Proposal, Berlin, 1st - 2nd November 2001, Secretariat's Final Summary Report, 27th March 2002, OECD ENV/EHS, available upon request from the Secretariat.
|
|
(12)
|
Oliver, G.J.A., Pemberton, M.A., and Rhodes, C. (1986). An in vitro skin corrosivity test-modificationsand validation. Fd. Chem. Toxicol. 24, 507-512.
|
|
(13)
|
Botham, P.A., Hall, T.J., Dennett, R., McCall, J.C., Basketter, D.A., Whittle, E., Cheeseman, M., Esdaile, D.J., and Gardner, J. (1992). The skin corrosivity test in vitro: results of an interlaboratory trial. Toxic. in Vitro 6, 191-194.
|
|
(14)
|
Worth AP, Fentem JH, Balls M, Botham PA, Curren RD, Earl LK, Esdaile DJ, Liebsch M (1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26: 709-720.
|
|
(15)
|
Basketter, D.A., Chamberlain, M., Griffiths, H.A., Rowson, M., Whittle, E., York, M. (1997). The classification of skin irritants by human patch test. Fd. Chem. Toxicol. 35, 845-852.
|
|
(16)
|
Oliver G.J.A, Pemberton M.A and Rhodes C. (1988). An In Vitro model for identifying skin- corrosive chemicals. I. Initial Validation. Toxic. in Vitro. 2, 7-17.
|
Figura 1
Attrezzatura per il test di resistenza elettrica transcutanea (TER) su tessuti cutanei di ratto

Figura 2
Dimensioni del tubo in polietrafluoroetilene (PTFE), del cilindro contenitore e degli elettrodi utilizzati
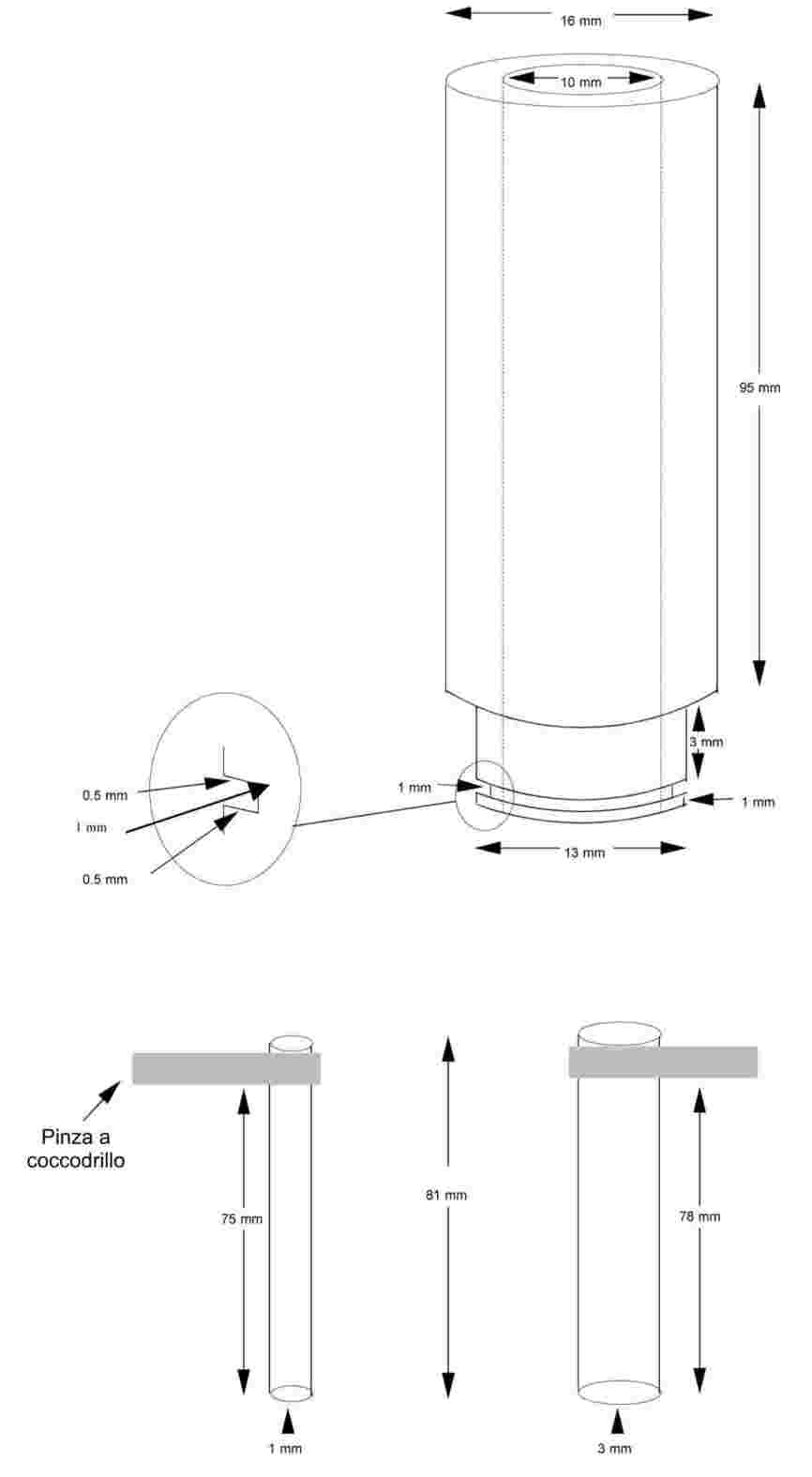
Fattori critici dell'attrezzatura sopra descritta:
|
—
|
diametro interno del tubo PTFE,
|
|
—
|
lunghezza degli elettrodi relativi al tubo PTFE e al cilindro contenitore, di modo che il disco di tessuto cutaneo non è in contatto con gli elettrodi e che una lunghezza standard dell'elettrodo sia in contatto con la soluzione MgSO4,
|
|
—
|
la quantità della soluzione MgSO4 nel cilindro contenitore dovrebbe essere tale che la profondità del liquido, relativo al livello nel tubo PFTE, appaia come indicato nella figura 1,
|
|
—
|
il disco di tessuto cutaneo deve essere fissato accuratamente al tubo PFTE, di modo che la resistenza elettrica sia una misura reale delle proprietà del tessuto cutaneo.
|
B.40 BIS. CORROSIONE CUTANEA IN VITRO: TEST SU MODELLI DI PELLE UMANA
1. METODO
Il presente metodo corrisponde alle linee guida OCSE TG 431 (2004).
1.1. INTRODUZIONE
Per corrosione cutanea si intende il manifestarsi di lesioni irreversibili sulla pelle dopo l'applicazione della sostanza che si intende testare (come definita dal Globally Harmonised System for the Classification and Labelling of Chemical Substances and Mixtures (GHS)(1). Il presente metodo non prevede l'utilizzo di animali vivi o di tessuti animali ai fini della valutazione della corrosività cutanea.
Tipicamente, la valutazione della corrosività cutanea è effettuata su cavie (2). Gli aspetti connessi al dolore ed alla sofferenza inflitti agli animali ai fini del test di corrosività sono stati affrontati in occasione della revisione del metodo di prova B.4, che consente di determinare la corrosione cutanea tramite metodi alternativi in vitro, evitando la sofferenza degli animali.
Il primo passo verso la definizione di test alternativi atti a studiare la corrosività cutanea a fini regolamentari è stato la realizzazione di studi di prevalidazione (3). Successivamente è stato realizzato (6)(7)(8) uno studio di validazione formale dei metodi in vitro di valutazione della corrosione cutanea (4)(5). I risultati di questi studi e di altri documenti pubblicati (9) hanno permesso di stabilire che i seguenti test potevano essere utilizzati per valutare la corrosività cutanea in vivo (10)(1 1)(12)(13): il test eseguito su modelli di pelle umana (cfr. il presente metodo) e il test di resistenza elettrica transcutanea (TER, il metodo di prova B.40).
I risultati degli studi di validazione indicano che i test basati sui modelli di pelle umana (3)(4)(5)(9) sono in grado di discriminare in modo affidabile, tra le sostanze conosciute, quelle che sono corrosive e non corrosive per la pelle. Il presente metodo di prova è altresì in grado di fornire un'indicazione sulla distinzione fra le sostanze che presentano un diverso grado di corrosività.
Il test descritto nel presente metodo permette di identificare le sostanze e i composti chimici corrosivi. Permette inoltre l'identificazione delle sostanze e dei composti non corrosivi se sostenuto da molte prove basate su altre informazioni esistenti (ad esempio, pH, relazioni struttura/attività, dati relativi agli esseri umani e/o agli animali) (1)(2)(13)(14). In generale, non fornisce adeguate informazioni sull'irritazione cutanea, né permette la sottocategorizzazione delle sostanze corrosive conformemente al sistema armonizzato universale di classificazione (GHS) (1).
Ai fini di una completa valutazione degli effetti cutanei locali dopo una singola esposizione della cute, si raccomanda di applicare la strategia di test sequenziale indicata nell'allegato al metodo di prova B.4 (2) e descritta nel sistema armonizzato universale (GHS)(1). Detta strategia sperimentale comporta la realizzazione di test in vitro volti a determinare la corrosione cutanea (come descritta nel presente metodo) e l'irritazione cutanea prima di prevedere la conduzione di test su animali vivi.
1.2. DEFINIZIONI
Corrosione cutanea in vivo: è il manifestarsi di lesioni irreversibili della pelle, vale a dire, necrosi visibile dell'epidermide e del derma, a seguito dell'applicazione della sostanza di prova per non più di quattro ore. Le reazioni corrosive sono caratterizzate da ulcere, emorragie, escare sanguinanti e, alla fine dell'osservazione, il giorno 14, da alterazione del colore dovuta a pallore della cute, zone di completa alopecia e cicatrici. Per valutare le lesioni dubbie effettuare eventualmente un esame istopatologico.
Vitalità cellulare: parametro che misura l'attività totale di una popolazione di cellule (ad esempio, capacità delle deidrogenasi mitocondriali cellulari di ridurre il colorante vitale MTT), che, in funzione del parametro misurato e del tipo di test utilizzato, corrisponde al numero totale e/o alla vitalità delle cellule.
1.3. SOSTANZE CHIMICHE DI RIFERIMENTO
Tabella 1
Sostanze chimiche di riferimento
|
Denominazione
|
N. Einecs
|
N. CAS
|
|
|
1,2-diaminopropano
|
201-155-9
|
78-90-0
|
Fortemente corrosivo
|
|
Acido acrilico
|
201-177-9
|
79-10-7
|
Fortemente corrosivo
|
|
2-tert-butilfenolo
|
201-807-2
|
88-18-6
|
Corrosivo
|
|
Idrossido di potassio (10 %)
|
215-181-3
|
1310-58-3
|
Corrosivo
|
|
Acido solforico (10 %)
|
231-639-5
|
7664-93-9
|
Corrosivo
|
|
Acido ottanoico (caprilico)
|
204-677-5
|
124-07-02
|
Corrosivo
|
|
4-amino-1,2,4-triazolo
|
209-533-5
|
584-13-4
|
Non corrosivo
|
|
Eugenol
|
202-589-1
|
97-53-0
|
Non corrosivo
|
|
Fenetil bromuro
|
203-130-8
|
103-63-9
|
Non corrosivo
|
|
Tetracloroetilene
|
204-825-9
|
27-18-4
|
Non corrosivo
|
|
Acido isostearico
|
250-178-0
|
30399-84-9
|
Non corrosivo
|
|
4-(metiltio)-benzaldeide
|
222-365-7
|
3446-89-7
|
Non corrosivo
|
La maggior parte delle sostanze chimiche sopra elencate proviene dall'elenco delle sostanze chimiche selezionate per lo studio di validazione internazionale di ECVAM (4). Detta selezione si basa sui criteri seguenti:
|
i)
|
ugual numero di sostanze corrosive e non corrosive;
|
|
ii)
|
sostanze disponibili in commercio, rappresentanti la maggior parte delle classi chimiche pertinenti;
|
|
iii)
|
l'inclusione di sostanze fortemente corrosive e meno corrosive ai fini della discriminazione in base al potere corrosivo;
|
|
iv)
|
selezione di sostanze chimiche che possono essere trattate in laboratorio senza presentare altri rischi gravi oltre alla corrosività.
|
1.4. PRINCIPIO DEL METODO
La sostanza di prova è applicata localmente su un modello tridimensionale di pelle umana che comprende almeno un'epidermide ricostituita con uno strato corneo funzionale. Le sostanze corrosive sono individuate in base alla loro attitudine a ridurre la vitalità cellulare [determinata, ad esempio, tramite test di riduzione del MTT (15)] al di sotto di valori limite definiti per periodi di esposizione determinati. Il principio del test si basa sull'ipotesi secondo la quale le sostanze chimiche corrosive sono capaci di penetrare nello strato corneo per diffusione o erosione e sono citotossiche per gli strati cellulari sottostanti.
1.4.1. Procedura
1.4.1.1. Modelli di pelle umana
I modelli di pelle umana possono essere costruiti, acquistati in commercio (ad esempio, i modelli EpiDermTM ed EPISKINTM) (16)(17)(18)(19) oppure sviluppati o costruiti nel laboratorio di prova (20)(21). Com'è generalmente riconosciuto, l'utilizzo di pelle umana forma l'oggetto di considerazioni etiche ed è subordinato a condizioni nazionali ed internazionali. Qualsiasi nuovo modello deve essere validato (almeno nella misura descritta al punto 1.4.1.1.2). I modelli di pelle umana utilizzati nel presente test devono soddisfare i criteri seguenti.
1.4.1.1.1 Condizioni generali dei modelli:
Per costruire l'epitelio devono essere utilizzati cheratinociti d'origine umana. Devono essere presenti molteplici strati di cellule epiteliali vitali sotto lo strato corneo funzionale. Il modello di pelle umana può anche avere uno strato stromale. Lo strato corneo deve presentare una molteplicità di strati con il necessario profilo lipidico per produrre una barriera funzionale solida capace di resistere alla penetrazione rapida dei marcatori citotossici. Le proprietà di contenimento del modello devono impedire il passaggio delle sostanze dallo strato corneo verso i tessuti vitali. Il passaggio delle sostanze chimiche da testare dallo strato corneo potrebbe infatti dare origine a modelli di esposizione cutanea non validi. Il modello di pelle umana non deve essere stato contaminato da batteri (tra cui micoplasmi) né da funghi.
1.4.1.1.2 Condizioni funzionali dei modelli:
La vitalità è generalmente quantificata tramite MTT o altri coloranti vitali che hanno subito una conversione metabolica. In questo caso, la densità ottica (DO) del colorante estratto (solubilizzato) dal tessuto di controllo negativo deve essere almeno 20 volte superiore alla DO del solo solvente di estrazione [per maggiori dettagli, si rimanda al riferimento (22)]. Il tessuto di controllo negativo deve essere stabile in cultura (cioè fornire misure di vitalità simili) nel corso del periodo di esposizione. Lo strato corneo deve essere sufficientemente solido per resistere alla penetrazione rapida di alcuni marcatori citotossici (ad esempio, Triton X-100 all'1 %). Tale proprietà può essere valutata calcolando il tempo di esposizione necessaria per ridurre la vitalità cellulare del 50 % (ET50) (ad esempio, per i modelli EpiDermTM ed EPISKINTM, tale tempo è inferiore a 2 ore). Il tessuto deve dimostrare una riproducibilità dei risultati nel tempo e preferibilmente tra laboratori. Deve inoltre permettere di prevedere il potenziale corrosivo delle sostanze chimiche di riferimento (cfr. tabella 1) quando utilizzate nel metodo di prova selezionato.
1.4.1.2. Applicazione delle sostanze di prova e delle sostanze di controllo
Due tessuti replicati sono utilizzati per ciascun trattamento (tempo di esposizione), compresi i controlli. Per le sostanze liquide, deve essere applicata una quantità della sostanza di prova sufficiente a coprire la superficie cutanea in modo uniforme (almeno 25 μL/cm2). Per le sostanze solide, occorre applicare in modo uniforme una quantità della sostanza di prova sufficiente a coprire la pelle; essa deve successivamente essere inumidita con acqua deionizzata o distillata al fine di garantire un buon contatto con la pelle. Se necessario, le sostanze solide devono essere ridotte in polvere prima della loro applicazione. Il metodo d'applicazione deve essere adatto alla sostanza di prova (cfr., ad esempio, il riferimento 5). Al termine del periodo di esposizione, la sostanza di prova deve essere tolta con cura dalla superficie cutanea con idoneo tampone o NaCl allo 0,9 %.
Controlli positivi e negativi concorrenti devono essere utilizzati per ciascuno studio in modo da garantire un'adeguata prestazione del metodo di prova. Le sostanze proposte ai fini dei controlli positivi sono l'acido acetico ghiacciato o 8N KOH. Le sostanze proposte per i controlli negativi sono NaCl allo 0,9 % o l'acqua.
1.4.1.3. Misurazioni della vitalità cellulare
Solo metodi quantitativi validati possono essere utilizzati per misurare la vitalità cellulare. La misurazione della vitalità deve inoltre essere compatibile con l'utilizzo in un modello tridimensionale di tessuto. Il legame non specifico dei coloranti non deve interferire con la misurazione della vitalità. L'utilizzo di coloranti che si legano alle proteine o che non subiscono conversioni metaboliche (ad esempio, il rosso neutro) non risulta pertanto adeguato. Il metodo più spesso utilizzato è la riduzione del MTT (3- (4,5-dimetiltiazol-2-yl)-2,5-difeniltetrazolio bromide; Tiazolil blue: numero Einecs 206-069-5, numero CAS 298-93-1), di cui si è constatata l'esattezza e la riproducibilità dei risultati (5), ma è anche possibile utilizzare altri metodi. Il campione di pelle è inserito in una soluzione MTT alla concentrazione adeguata (ad esempio, 0,3-1/ml) e ad una temperatura di incubazione adeguata per 3 ore. Il precipitato blu formazan è successivamente estratto con solvente (isopropanolo) e la concentrazione di formazan è misurata determinando la DO ad una lunghezza d'onda compresa tra 540 e 595 nm.
L'azione chimica prodotta dalla sostanza di prova sul colorante vitale può imitare quella del metabolismo cellulare, il che può condurre ad una stima sbagliata della vitalità. È stato dimostrato che ciò avviene in particolare quando la sostanza di prova non è stata rimossa completamente dalla pelle con risciacquo (9). Se la sostanza di prova agisce direttamente sul colorante vitale, devono essere utilizzati controlli supplementari per individuare e correggere qualsiasi interferenza delle sostanze di prova con la misurazione della vitalità (9)(23).
2. DATI
Per ciascun tessuto, i valori della DO, le percentuali calcolate della vitalità cellulare per la sostanza di prova ed i controlli positivi e negativi sono presentati sotto forma di tabella, compresi i dati delle prove ripetute ed i valori medi ed individuali.
2.1. INTERPRETAZIONE DEI RISULTATI
I valori della DO ottenuti per ciascun campione di prova possono essere utilizzati per calcolare una percentuale di vitalità rispetto al controllo negativo, il cui valore è fissato arbitrariamente al 100 %. Il valore limite della percentuale di vitalità cellulare in base al quale si stabilisce la distinzione tra sostanze corrosive e sostanze non corrosive (o tra diverse classi di sostanze corrosive) o le procedure statistiche utilizzate per analizzare i risultati e individuare le sostanze corrosive devono essere chiaramente definite e documentate, nonché dimostrarsi idonee. In generale, questi valori limite sono stabiliti nel corso dell'ottimizzazione del test, testati in una fase di prevalidazione e confermati da uno studio di validazione. Ad esempio, la previsione di corrosività associata al modello EpiDermTM è la seguente (9):
La sostanza di prova è considerata corrosiva per la pelle:
|
i)
|
se la vitalità dopo 3 minuti d'esposizione è inferiore al 50 %; o
|
|
ii)
|
se la vitalità dopo 3 minuti d'esposizione è superiore o uguale al 50 %, ma è inferiore al 15 % dopo 1 ora di esposizione.
|
La sostanza di prova è considerata non corrosiva per la pelle:
|
i)
|
se la vitalità dopo 3 minuti di esposizione è superiore o uguale al 50 %, e la vitalità dopo un'ora di esposizione è superiore o uguale al 15 %.
|
3. RELAZIONE SULL'ESECUZIONE DELLA PROVA
3.1. RAPPORTO DI PROVA
Il rapporto sul test deve contenere le informazioni seguenti:
|
|
Sostanze di prova e sostanze di controllo:
|
—
|
denominazioni chimiche, quali le denominazioni IUPAC o CAS ed il numero CAS, se conosciuti;
|
|
—
|
purezza e composizione della sostanza o della preparazione (in percentuale ponderale);
|
|
—
|
proprietà fisico-chimiche pertinenti per la realizzazione dello studio, quali la natura fisica, il pH, la stabilità e la solubilità in acqua;
|
|
—
|
trattamento delle sostanze di prova/di controllo prima del test, se del caso (ad esempio, riscaldamento, frantumazione);
|
|
—
|
stabilità, se conosciuta.
|
|
|
|
Giustificazione del modello di pelle umana e del metodo utilizzato.
|
|
|
Condizioni di prova:
|
—
|
sistema cellulare utilizzato;
|
|
—
|
informazioni sulla taratura dell'attrezzatura di misurazione utilizzata per misurare la vitalità cellulare (spettrofotometro, ad esempio);
|
|
—
|
informazioni complete sul modello di pelle utilizzato e sulla sua vitalità
|
|
—
|
dettagli sulla procedura sperimentale utilizzata;
|
|
—
|
dosi utilizzate per il test;
|
|
—
|
descrizione di qualsiasi modifica delle procedure sperimentali;
|
|
—
|
riferimenti a dati storici del modello;
|
|
—
|
descrizione dei criteri di valutazione utilizzati.
|
|
|
|
Risultati:
|
—
|
presentazione sotto forma di tabella dei dati tratti dai campioni di prova individuali;
|
|
—
|
descrizione di altri effetti osservati.
|
|
|
|
Discussione dei risultati.
|
4. BIBLIOGRAFIA
|
1.
|
OCSE (2001) Harmonised Integrated Classification System for Human Health and Environmental Hazards of Chemical Substances and Mixtures. OECD Series on Testing and Assessment Number 33. ENV/JM/MONO(2001)6, Paris. http://www.olis.oecd.org/olis/2001 doc.nsf/LinkTo/env-jm-mono(2001)6.
|
|
2.
|
Metodo di prova B.4. Acute Toxicity: Dermal Irritation/Corrosion.
|
|
3.
|
Botham, P.A., Chamberlain, M., Barratt, M.D., Curren, R.D., Esdaile, D.J., Gardner, J.R., Gordon, V.C., Hildebrand, B., Lewis, R.W., Liebsch, M., Logemann, P., Osborne, R., Ponec, M., Regnier, J.F., Steiling, W., Walker, A.P., e Balls, M. (1995). A prevalidation study on in vitro skin corrosivity testing. The report recommendations of ECVAM Workshop 6 ATLA 23, 219-255.
|
|
4.
|
Barratt, M.D., Brantom, P.G., Fentem, J.H., Gerner, I., Walker, A.P., and Worth, A.P. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 1. Selection and distribution of the test chemicals. Toxic. In Vitro 12, 471-482.
|
|
5.
|
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhutter, H.G. and Liebsch, M. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxic. In Vitro 12, 483-524.
|
|
6.
|
OCSE (1996). Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods, 62 pp.
|
|
7.
|
Balls, M., Blaauboer, B.J., Fentem, J.H., Bruner, L., Combes, R.D., Ekwall, B., Fielder, R.J., Guillouzo, A., Lewis, R.W., Lovell, D.P., Reinhardt, C.A., Repetto, G., Sladowski, D., Spielmann, H., e Zucco, F. (1995). Practical aspects of the validation of toxicity test procedures. Test report and recommendations of ECVAM workshops. ATLA 23, 129-147.
|
|
8.
|
ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (1997). Validation and Regulatory Acceptance of Toxicological Test Methods. NIH Publication No. NIH Publication No. 97-3981. National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/docs/guidelines/validate.pdf.
|
|
9.
|
Liebsch, M., Traue, D., Barrabas, C., Spielmann, H., Uphill, P., Wilkins, S., McPherson, J.P., Wiemann, C., Kaufmann, T., Remmele, M. and Holzhutter, H.G. (2000). The ECVAM prevalidation study on the use of EpiDerm for skin Corrosivity testing. ATLA 28, pp.371-401.
|
|
10.
|
ECVAM (1998). ECVAM News & Views. ATLA 26, 275-280.
|
|
11.
|
ECVAM (2000). ECVAM News & Views. ATLA 28, 365-67.
|
|
12.
|
ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (2002). ICCVAM evaluation of EpiDermTM, EPISKINTM (EPI-200), and the Rat Skin Transcutaneous Electrical Resistance (TER) assay: In Vitro test methods for assessing dermal corrosivity potential of chemicals. NIH Publication No. NIH Publication No. 02-4502. National Toxicology Program Interagency Center for the Evaluation of Alternative Toxicological Methods, National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/methods/epiddocs/epis_brd.pdf.
|
|
13.
|
OECD (2002) Extended Expert Consultation Meeting on The In Vitro Skin Corrosion Test Guideline Proposal, Berlin, 1st - 2nd November 2001, Secretariat's Final Summary Report, 27th March 2002, OECD ENV/EHS, available upon request from the Secretariat
|
|
14.
|
Worth AP, Fentem JH, Balls M, Botham PA, Curren RD, Earl LK, Esdaile DJ, Liebsch M (1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26: 709-720.
|
|
15.
|
Mosmann, T. (1983). Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J.Immunol. Meth. 65, 55-63.
|
|
16.
|
Cannon, C.L., Neal, P.J., Southee, J.A., Kubilus, J., and Klausner, M., 1994. New epidermal model for dermal irritancy testing. Toxic. In Vitro 8, 889-891.
|
|
17.
|
Ponec, M., Boelsma, E., Weerheim, A., Mulder, A., Boutwstra, J., and Mommaas, M., 2000. Lipid and ultrastructural characterization of reconstructed skin models. International Journal of Pharmaceutics. 203, 211-225.
|
|
18.
|
Tinois E, Gaetani Q, Gayraud B, Dupont D, Rougier A, Pouradier DX (1994). The Episkin model: Successful reconstruction of human epidermis in vitro. In In vitro Skin Toxicology. Edited by A Rougier, AM Goldberg and HI Maibach: 133-140
|
|
19.
|
Tinois E, Tiollier J, Gaucherand M, Dumas H, Tardy M, Thivolet J (1991). In vitro and post -transplantation differentiation of human keratinocytes grown on the human type IV collagen film of a bilayered dermal substitute. Experimental Cell Research 193: 310-319
|
|
20.
|
Parentau, N.L., Bilbo, P., Molte, C.J., Mason, V.S., and Rosenberg, H. (1992). The organotypic culture of human skin keratinocytes and fibroblasts to achieve form and function. Cytotechnology 9, 163-171.
|
|
21.
|
Wilkins, L.M., Watson, S.R., Prosky, S.J., Meunier, S.F., Parentau, N.L. (1994). Development of a bilayered living skin construct for clinical applications. Biotechnology and Bioengineering 43/8, 747-756.
|
|
22.
|
Marshall, N.J., Goodwin, C.J., Holt, S.J. (1995). A critical assessment of the use of microculture tetrazolium assays to measure cell growth and function. Growth Regulation 5, 69-84.
|
|
23.
|
Fentem, J.H., Briggs, D., Chesne', C., Elliot, G.R., Harbell, J.W., Heylings, J.R., Portes, P., Rouget, R., and van de Sandt, J.J.M., and Botham, P.A. (2001). A prevalidation study on in vitro tests for acute skin irritation: results and evaluation by the Management Team. Toxic. InVItro 15, 57-93.
|
B.41. SAGGIO DI FOTOTOSSICITÀ IN VITRO 3T3 NRU
1. METODO
Questo metodo corrisponde alle linee guida OCSE TG 432 (2004).
1.1. INTRODUZIONE
Per fototossicità si intende la risposta tossica che si manifesta dopo esposizione del corpo ad una sostanza chimica e che è indotta o accentuata (ma presente a dosaggi inferiori) dopo successiva esposizione alla luce, o che è indotta da irradiazione della cute dopo somministrazione sistemica di una sostanza chimica.
Il saggio di fototossicità in vitro 3T3 NRU consente di identificare il potenziale fototossico di una sostanza di prova indotto dalla sostanza chimica eccitata dopo esposizione alla luce. Il saggio determina la fotocitotossicità in base alla relativa riduzione della vitalità delle cellule esposte alla sostanza chimica in presenza di luce rispetto alla mancata esposizione alla luce. Le sostanze individuate da questo saggio sono verosimilmente fototossiche in vivo, dopo applicazione sistemica e distribuzione sulla cute o altra applicazione topica.
È noto che molti tipi di sostanze chimiche inducono effetti fototossici (1)(2)(3)(4). La caratteristica che le accomuna è la capacità di assorbire l'energia luminosa nello spettro della luce solare. In base alla prima legge della fotochimica (legge di Grotthaus-Draper), la reazione fotochimica richiede un assorbimento sufficiente di quanti di luce. Pertanto, prima di prendere in esame l'eventualità di un saggio biologico, occorre determinare lo spettro di assorbimento UV/visibile della sostanza di prova secondo le linee guida dell'OCSE dal titolo OECD Test Guideline 101. Secondo alcuni, se il coefficiente di estinzione/assorbimento molare è inferiore a 10 litri × mol-1 × cm-1 è improbabile che la sostanza chimica sia fotoreattiva. In quel caso non è necessario sottoporre la sostanza al saggio di fototossicità in vitro 3T3 NRU o ad altri saggi biologici per determinarne gli effetti fotochimici indesiderati (1)(5). Cfr. anche l'allegato I.
Recentemente sono state valutate l'affidabilità e la pertinenza del saggio di fototossicità in vitro 3T3 NRU (6)(7)(8)(9). È stato dimostrato che il saggio di fototossicità in vitro 3T3 NRU consente di prevedere gli effetti fototossici acuti negli animali e nelle persone in vivo. Il saggio non è concepito per prevedere altri effetti indesiderati che potrebbero derivare dall'azione combinata di una sostanza chimica e della luce, come ad esempio la fotogenotossicità, la fotoallergia e la fotocancerogenicità né permette di valutare la potenza fototossica. Il saggio non è nemmeno studiato per determinare i meccanismi indiretti della fototossicità, gli effetti dei metaboliti della sostanza di prova o gli effetti delle miscele di sostanze.
Mentre in genere è richiesto l'utilizzo di sistemi metabolizzanti per tutti i saggi in vitro utilizzati per determinare il potenziale genotossico e cancerogeno, finora nel caso della fototossicologia si contano solo rari esempi dove è richiesta la trasformazione metabolica affinché la sostanza chimica agisca come fototossina in vivo o in vitro. Non si ritiene pertanto necessario né giustificato dal punto di vista scientifico che il presente saggio sia eseguito con un sistema di attivazione metabolica.
1.2. DEFINIZIONI
Irradianza: l'intensità della luce ultravioletta (UV) o visibile incidente su una superficie, misurata in W/m2 o in mW/cm2.
Dose di luce: la quantità (= intensità × tempo) di radiazione ultravioletta (UV) o visibile incidente su una superficie, espressa in joule (= W × s) per area di superficie, ad esempio J/m2 o J/cm2.
Bande di lunghezza d'onda della luce UV: i valori raccomandati dalla CIE (Commission Internationale de l'Éclairage) sono: UVA (315-400 nm), UVB (280-315 nm) e UVC (100-280 nm). Sono in uso, inoltre, altri valori: spesso la distinzione fra UVB e UVA viene posta a 320 nm e gli UVA possono essere suddivisi in UV-A1 e UV-A2, con una distinzione posta a circa 340 nm.
Vitalità cellulare: parametro che misura l'attività totale di una popolazione di cellule (ad esempio l'assunzione del colorante vitale rosso neutro nei lisosomi cellulari) che, in funzione dell’«endpoint» misurato e del tipo di saggio impiegato, è correlato al numero totale e/o alla vitalità delle cellule.
Vitalità cellulare relativa: vitalità cellulare espressa in relazione a controlli negativi (solvente) effettuati nel corso del saggio (+ Irr o - Irr) senza trattamento con la sostanza chimica di prova.
PIF
(Photo Irritation Factor —
Fattore di fotoirritazione): fattore ottenuto comparando due concentrazioni di pari citotossicità (IC50) della sostanza chimica di prova in assenza (- Irr) e in presenza (+ Irr) di una irradiazione non citotossica con raggi UVA/luce visibile.
IC
50: concentrazione della sostanza di prova alla quale la vitalità cellulare è ridotta del 50 %.
MPE
(Mean Photo Effect —
Foto-effetto medio): misura derivata dall'analisi matematica delle curve di concentrazione-risposta ottenute in assenza (- Irr) e in presenza (+ Irr) di una irradiazione non citotossica con UVA/luce visibile.
Fototossicità: risposta tossica acuta che si manifesta dopo esposizione primaria della cute ad alcune sostanze chimiche e successiva esposizione alla luce, o che è indotta analogamente da irradiazione della cute dopo somministrazione sistemica di una sostanza chimica.
1.3. PRINCIPIO DEL METODO
Il saggio di fototossicità in vitro 3T3 NRU è basato sul confronto della citotossicità di una sostanza chimica sottoposta al saggio con e senza esposizione a una dose non citotossica di luce solare simulata. In questo saggio la citotossicità viene espressa come riduzione, dipendente dalla concentrazione, dell'assunzione del colorante vitale rosso neutro 24 ore dopo il trattamento con la sostanza chimica di prova e l'irradiazione (10). Il rosso neutro (Neutral Red, NR) è un colorante cationico debole che penetra rapidamente nelle membrane cellulari per non-diffusione e si accumula a livello intracellulare nei lisosomi. Le alterazioni della superficie della membrana sensibile del lisosoma causano una fragilità del lisosoma e altri cambiamenti che diventano progressivamente irreversibili. Tali cambiamenti dovuti all'azione degli xenobiotici riducono l'assunzione e il legame dell'NR. È dunque possibile fare la distinzione tra cellule vitali, cellule danneggiate e cellule morte, che è alla base di questo saggio.
Le cellule Balb/c 3T3 vengono mantenute in coltura per 24 ore per permettere la formazione di monostrati. Quindi, per ogni sostanza chimica di prova, vengono preincubate due piastre a 96 pozzetti con otto diverse concentrazioni della sostanza chimica per 1 ora. Una delle due piastre viene successivamente esposta alla massima dose non citotossica di luce, mentre l'altra piastra viene mantenuta al buio. In entrambe le piastre, il mezzo di trattamento viene successivamente sostituito con il mezzo di coltura e, dopo altre 24 ore di incubazione, si determina la vitalità cellulare tramite assunzione del rosso neutro (Neutral Red Uptake, NRU). Per ognuna delle otto concentrazioni di prova viene dunque calcolata la vitalità cellulare, espressa come percentuale dei controlli non trattati (solvente). Per prevedere il potenziale fototossico vengono confrontate le risposte alla concentrazione ottenute in presenza e in assenza di irradiazione, generalmente al livello IC50, cioè alla concentrazione che inibisce la vitalità cellulare del 50 % rispetto ai controlli non trattati.
1.4. DESCRIZIONE DEL METODO
1.4.1 Preparazioni
1.4.1.1 Cellule
Nello studio di validazione è stata usata una linea cellulare permanente di fibroblasti di topo — Balb/c 3T3, clone 31 — proveniente dall'American Type Culture Collection (ATCC), Manassas, VA, USA, o dalla European Collection of Cell Cultures (ECACC) di Salisbury, Wiltshire, Regno Unito. Si raccomanda di acquisire le cellule da una banca di cellule qualificata. È possibile utilizzare anche altre cellule o linee cellulari applicando lo stesso protocollo se le condizioni della coltura vengono adattate alle esigenze specifiche delle cellule; in quel caso è tuttavia necessario dimostrare l'equivalenza.
È necessario verificare con regolarità che le cellule non siano contaminate da micoplasmi e utilizzarle solo se non vi è contaminazione (11).
È importante verificare periodicamente la sensibilità delle cellule Balb/c 3T3 agli UV secondo la procedura di controllo della qualità descritta in questo metodo. Poiché la sensibilità delle cellule agli UVA può aumentare con il numero di passaggi, vanno impiegate cellule Balb/c 3T3 del numero più basso ottenibile di passaggi, preferibilmente inferiore a 100 (cfr. punto 1.4.2.2.2 e allegato II).
1.4.1.2. Condizioni dei mezzi e della coltura
Per il passaggio di routine delle cellule e durante il saggio è necessario utilizzare mezzi di coltura e condizioni di incubazione adeguati: ad esempio, nel caso delle cellule Balb/c 3T3, il DMEM (Dulbecco's Modified Eagle's Medium) integrato con 10 % di siero di vitello neonato, 4 mM di glutammina, penicillina (100 IU) e streptomicina (100 μg/mL), nonché incubazione umidificata a 37 oC, al 5-7,5 % di CO2 in funzione del tampone (cfr. punto 1.4.1.4, secondo paragrafo). È particolarmente importante che le condizioni della coltura cellulare assicurino un tempo di ciclo cellulare compreso nel normale range storico delle cellule o della linea cellulare utilizzate.
1.4.1.3 Preparazione delle colture
Le cellule ottenute da colture madre congelate vengono seminate nel terreno di coltura alla densità adeguata e poste in sottocoltura almeno una volta prima di essere utilizzate per il saggio di fototossicità in vitro 3T3 NRU.
Per il saggio di fototossicità occorre seminare le cellule nel terreno di coltura ad una densità tale che impedisca alle colture di raggiungere la confluenza prima della fine del saggio, cioè quando viene determinata la vitalità cellulare 48 ore dopo la semina. Per le cellule Balb/c 3T3 coltivate in piastre a 96 pozzetti la densità raccomandata è di 1 × 104 cellule per pozzetto.
Per ogni sostanza chimica di prova si seminano cellule in maniera identica in due diverse piastre a 96 pozzetti, che vengono poi sottoposte simultaneamente all'intero protocollo in condizioni colturali identiche, salvo il periodo di tempo in cui una delle piastre viene irradiata (+ Irr) mentre l'altra viene tenuta al buio (- Irr).
1.4.1.4 Preparazione della sostanza chimica di prova
Le sostanze chimiche di prova devono essere preparate di fresco immediatamente prima dell'uso, a meno che non siano disponibili dati che ne dimostrino la stabilità di conservazione. Si raccomanda che tutte le manipolazioni chimiche e il trattamento iniziale delle cellule avvengano in condizioni di luce tali da evitare la fotoattivazione o la degradazione della sostanza di prova prima dell'irradiazione.
Le sostanze chimiche di prova vanno dissolte in soluzioni saline tampone, come la soluzione isotonica di Earl (EBSS) o altre soluzioni tampone in equilibrio fisiologico che, per evitare interferenze durante l'irradiazione, devono essere prive di componenti proteiche e fotoassorbenti (ad esempio colori indicatori di pH e vitamine). Poiché durante l'irradiazione le cellule sono mantenute per circa 50 minuti al di fuori dell'incubatore al CO2, è necessario fare in modo di evitare l'alcalizzazione. Se vengono impiegati tamponi deboli come l'EBSS, è necessario incubare le cellule al 7,5 % di CO2; se invece le cellule sono incubate al 5 % di CO2 è necessario selezionare un tampone più forte.
Le sostanze chimiche di prova che presentano una scarsa solubilità in acqua devono essere disciolte in solventi adeguati. Gli eventuali solventi utilizzati devono essere presenti a un volume costante in tutte le colture, e cioè sia nei controlli negativi che in tutte le concentrazioni della sostanza chimica di prova; a tali concentrazioni non devono essere citotossici. Le concentrazioni della sostanza chimica di prova devono essere tali da evitare precipitati o soluzioni torbide.
I solventi raccomandati sono il dimetilsolfossido (DMSO) e l'etanolo (ETOH). Possono essere adatti anche altri solventi a bassa citotossicità. Prima dell'uso è necessario valutare attentamente le proprietà specifiche di tutti i solventi utilizzati, quali la reazione con la sostanza chimica di prova, l'estinzione dell'effetto fototossico, le proprietà di cattura dei radicali e/o la stabilità chimica nel solvente.
Se necessario, si può procedere a miscelazione tramite vortex e/o sonicazione e/o riscaldamento alle temperature opportune per favorire la solubilizzazione, a condizione che non ci siano conseguenze sulla stabilità della sostanza di prova.
1.4.1.5 Condizioni di irradiazione
1.4.1.5.1 Fonte di luce
La scelta di una fonte di luce e di filtri adeguati è il fattore più importante ai fini di un corretto saggio della fototossicità. Le radiazioni UVA e la luce visibile si associano generalmente a fotosensibilizzazione in vivo (3) (12), mentre i raggi UVB sono in genere meno rilevanti ma fortemente citotossici; la citotossicità aumenta di 1 000 volte quando la lunghezza d'onda passa da 313 a 280 nm (13). Per scegliere una fonte luminosa adeguata valgono, tra l'altro, i seguenti criteri essenziali: la fonte di luce deve emettere lunghezze d'onda assorbite dalla sostanza chimica di prova (spettro di assorbimento) e la dose di luce (ottenibile in tempi di esposizione ragionevoli) deve essere sufficiente per individuare le sostanze con caratteristiche fotocitotossiche note. Inoltre, le lunghezze d'onda e le dosi utilizzate non devono essere eccessivamente nocive per il sistema sottoposto a prova, ad esempio per quanto riguarda l'emissione di calore (spettro dell'infrarosso).
La fonte di luce artificiale ottimale si ottiene simulando la luce solare con simulatori solari. La distribuzione della potenza di irradiazione dei simulatori solari con filtri deve essere la più vicina possibile a quella della luce solare esterna indicata in (14). Nei simulatori solari si usano sia gli archi allo xeno che gli archi al mercurio e ad alogenuri metallici (drogati) (15). Questi ultimi presentano il vantaggio di emettere meno calore e di essere meno costosi, ma la simulazione della luce solare che offrono è inferiore a quella garantita dagli archi allo xeno. Poiché tutti i simulatori solari emettono quantità significative di UVB, vanno muniti di filtri adeguati per attenuare le lunghezze d'onda UVB altamente citotossiche. Poiché i materiali plastici delle colture cellulari contengono stabilizzatori UV, lo spettro deve essere misurato utilizzando lo stesso tipo di coperchio della piastra a 96 pozzetti impiegato per il saggio. Indipendentemente dalle misure adottate per attenuare parti dello spettro con filtri o con gli effetti filtranti inevitabili dell'apparecchiatura, lo spettro registrato al di sotto dei filtri non deve discostarsi dalla luce solare esterna standardizzata (14). Un esempio della distribuzione spettrale dell'irradianza del simulatore solare con filtro impiegato nello studio di validazione del saggio di fototossicità in vitro 3T3 NRU 1 figura in (8)(16). Cfr. anche allegato II, figura 1.
1.4.1.5.2 Dosimetria
Prima di effettuare il saggio di fototossicità occorre controllare regolarmente l'intensità della luce (irradianza) mediante opportuno misuratore UV a banda larga. L'intensità deve essere misurata utilizzando lo stesso tipo di coperchio della piastra a 96 pozzetti impiegato per il saggio. Il misuratore UV deve essere calibrato in funzione della fonte. È necessario controllare la funzionalità del misuratore UV e, a tale scopo, si raccomanda di impiegare un secondo misuratore UV di riferimento, dello stesso tipo e con identica calibrazione. L'ideale sarebbe che, a intervalli di tempo più lunghi, con uno spettroradiometro si misurasse l'irradianza spettrale della fonte di luce filtrata e si controllasse la calibrazione del misuratore UV a banda larga.
È stato dimostrato che una dose di 5 J/cm2 (nelle lunghezze d'onda UVA) non è citotossica per le cellule Balb/c 3T3 ed è sufficientemente potente per eccitare le sostanze chimiche e indurre reazioni di fototossicità (6) (17): a titolo di esempio, per ottenere una dose di 5 J/cm2 entro 50 minuti, l'irradianza deve essere regolata a 1,7 mW/cm2 (cfr. allegato II, figura 2). Se si utilizza un'altra linea cellulare o una diversa fonte luminosa, potrebbe essere necessario adattare la dose irradiata in modo tale che non sia nociva per le cellule e che sia comunque sufficiente per eccitare le fototossine standard. Il tempo di esposizione alla luce si calcola come segue:
|

|
(1 J = 1 Wsec)
|
1.4.2 Condizioni di prova
1.4.2.1 Concentrazioni della sostanza di prova
I range (o intervalli) di concentrazione di una sostanza chimica sottoposta al saggio in presenza (+ Irr) e in assenza (- Irr) di luce vanno determinati in modo adeguato con esperimenti espressamente effettuati a tale scopo. Può essere utile valutare la solubilità nel momento iniziale e dopo 60 minuti (o dopo qualsiasi altro periodo di trattamento utilizzato), perché la solubilità può variare nel tempo o nel corso dell'esposizione. Per evitare di indurre tossicità a causa di condizioni inadeguate delle colture o in presenza di sostanze chimiche altamente acide o alcaline, il pH delle colture cellulari alle quali è aggiunta la sostanza chimica di prova deve essere compreso tra 6,5 e 7,8.
La concentrazione massima della sostanza chimica di prova deve rientrare nelle condizioni fisiologiche di prova (occorre ad esempio evitare stress osmotico e del pH). In funzione della sostanza di prova prescelta può essere necessario prendere in considerazione altre proprietà fisico-chimiche tra i fattori che limitano la concentrazione massima di prova. Per le sostanze relativamente insolubili che non sono tossiche a concentrazioni massime fino al punto di saturazione è necessario testare la concentrazione massima raggiungibile. In generale è preferibile evitare la precipitazione della sostanza di prova a qualsiasi concentrazione. La concentrazione massima di una sostanza di prova non deve superare i 1 000 μg/mL e l'osmolalità non deve superare 10 mmolari. È necessario utilizzare diluizioni in serie geometrica con 8 concentrazioni della sostanza di prova (con un fattore di diluizione costante) (cfr. punto 2.1, secondo paragrafo).
Se sono disponibili dati (ricavati da esperimenti preliminari per determinare il range di concentrazione o range finding) che dimostrano che la sostanza chimica non è citotossica fino al limite di concentrazione nell'esperimento in assenza di luce (- Irr), ma è altamente citotossica se irradiata (+ Irr), per garantire un'adeguata qualità dei dati gli intervalli di concentrazione da scegliere per l'esperimento (+ Irr) possono essere diversi da quelli utilizzati nel saggio (- Irr).
1.4.2.2 Controlli
1.4.2.2.1 Sensibilità delle cellule alle radiazioni, determinazione dei dati storici
Le cellule devono essere controllate con regolarità (ogni cinque passaggi) per accertarne la sensibilità alla fonte luminosa valutando la loro vitalità dopo l'esposizione a dosi crescenti di radiazioni. Nella valutazione devono essere applicate varie dosi di radiazioni luminose, fino a livelli molto superiori a quelli applicati nel saggio di fototossicità 3T3 NRU. Le dosi in questione sono quantificate più facilmente misurando lo spettro UV della fonte luminosa. Le cellule sono seminate alla stessa densità utilizzata nel saggio di fototossicità in vitro 3T3 NRU e irradiate il giorno successivo; il giorno ancora successivo si determina la vitalità cellulare misurando l'assunzione del rosso neutro (NRU). Si deve poter dimostrare che la dose non-citotossica massima che ne risulta [ad esempio, nello studio di validazione: 5 J/cm2 (UVA)] è sufficiente per classificare correttamente le sostanze chimiche di riferimento (tabella 1).
1.4.2.2.2 Sensibilità alle radiazioni, verifica del saggio in corso
Il saggio risponde ai criteri di qualità se i controlli negativi/solvente con irradiazione dimostrano una vitalità superiore all'80 % rispetto ai controlli negativi/solvente senza irradiazione.
1.4.2.2.3 Vitalità associata ai controlli a base di solvente
La densità ottica assoluta (OD540 NRU) del rosso neutro derivata dai controlli in solvente indica se le 1 × 104 cellule seminate in ogni pozzetto sono cresciute con un tempo di raddoppiamento normale durante i due giorni della prova. Il saggio soddisfa i criteri di accettazione se la OD540 NRU media dei controlli non trattati è ≥ 0,4 (cioè circa 20 volte l'assorbanza di fondo del solvente).
1.4.2.2.4 Controllo positivo
Contemporaneamente al saggio di fototossicità in vitro 3T3 NRU, si saggia una sostanza chimica notoriamente fototossica. Si raccomanda l'uso di clorpromazina (CPZ). Per la CPZ saggiata con il protocollo standard nel saggio di fototossicità in vitro 3T3 NRU sono stati definiti i seguenti criteri di accettazione: CPZ irradiata (+ Irr): IC50 = da 0,1 a 2,0 μg/ml; CPZ non irradiata (- Irr): IC50 = da 7,0 a 90,0 μg/ml. Il PIF deve essere superiore a 6. È necessario monitorare le prestazioni dei controlli positivi nel tempo.
Come controlli positivi concomitanti, al posto della CPZ possono essere impiegate altre sostanze chimiche notoriamente fototossiche, corrispondenti alla classe chimica o alle caratteristiche di solubilità della sostanza chimica di prova.
1.4.3 Procedura di prova (6)(7)(8)(16)(17)
1.4.3.1 Primo giorno
Versare 100 μL di terreno di coltura nei pozzetti periferici di una piastra per microtitolazione di coltura tissutale da 96 pozzetti (= bianchi). Nei restanti pozzetti versare 100 μL di una sospensione cellulare di 1 × 105 cellule/mL (= 1 × 104 cellule/pozzetto). Per ciascuna serie di concentrazioni delle singole sostanze di prova e per i controlli in solvente e i controlli positivi preparare due piastre.
Incubare le cellule per 24 ore (cfr. punto 1.4.1.2) finché formano un monostrato semiconfluente. Questo periodo di incubazione tiene conto del recupero e dell'aderenza delle cellule, nonché della crescita esponenziale.
1.4.3.2 Secondo giorno
Dopo l'incubazione, far decantare il terreno di coltura separandolo dalle cellule e lavare con cura con 150 μL della soluzione tamponata usata per l'incubazione chimica. Aggiungere 100 μL del tampone contenente la concentrazione corretta della sostanza chimica di prova o del solvente (controllo in solvente). Utilizzare 8 diverse concentrazioni della sostanza chimica di prova. Incubare le cellule con la sostanza chimica di prova al buio per 60 minuti (cfr. punti 1.4.1.2 e 1.4.1.4, secondo paragrafo).
Delle due piastre preparate per ogni serie di concentrazioni della sostanza di prova e dei controlli, una è scelta, in genere a caso, per determinare la citotossicità (- Irr) (la piastra di controllo) e una (la piastra di trattamento) per determinare la fotocitotossicità (+ Irr).
Per eseguire la parte + Irr del saggio, irradiare le cellule a temperatura ambiente per 50 minuti attraverso il coperchio della piastra a 96 pozzetti con la dose massima di radiazione non citotossica (cfr. anche allegato II). Mantenere le piastre non irradiate (- Irr) a temperatura ambiente in una scatola al buio per 50 minuti (= tempo di esposizione alla luce).
Far decantare la soluzione di prova e lavare con cura due volte con 150 μL della soluzione tamponata usata per l'incubazione e non contenente materiale di prova. Sostituire il tampone con terreno di coltura e incubare (cfr. punto 1.4.1.2) per una notte (18-22 ore).
1.4.3.3 Terzo giorno
1.4.3.3.1 Esame al microscopio
Esaminare le cellule con un microscopio a contrasto di fase per verificare la crescita, la morfologia e l'integrità del monostrato. Registrare gli eventuali cambiamenti morfologici delle cellule e gli effetti sulla crescita cellulare.
1.4.3.3.2 Saggio di assunzione del rosso neutro (NRU)
Lavare le cellule con 150 μL di tampone preriscaldato. Eliminare la soluzione di lavaggio con lievi colpetti. Aggiungere 100 μl di rosso neutro (3-amino-7-dimetilamino-2-metilfenazina cloridrato, numero Einecs 209-035-8; numero CAS 553-24-2; C.I. 50040) a 50 μg/ml nel terreno di coltura senza siero (16) e incubare per 3 ore secondo la procedura descritta al punto 1.4.1.2. Dopo l'incubazione, rimuovere il terreno al rosso neutro e lavare le cellule con 150 μL di tampone. Far decantare ed eliminare il tampone con materiale assorbente o per centrifugazione.
Aggiungere esattamente 150 μL di soluzione di estinzione del rosso neutro (49 parti di acqua + 50 parti di etanolo + 1 parte di acido acetico preparati di fresco).
Scuotere con attenzione la piastra di microtitolazione con un agitatore per 10 minuti fino ad estrazione del rosso neutro dalle cellule e formazione di una soluzione omogenea.
Misurare la densità ottica dell'estratto di rosso neutro a 540 nm con uno spettrofotometro, utilizzando i bianchi come riferimento. Salvare i dati nel formato elettronico più opportuno per le analisi successive.
2. DATI
2.1. QUALITÀ E QUANTITÀ DEI DATI
I dati devono permettere un'analisi significativa della concentrazione-risposta ottenuta in presenza e in assenza di irradiazione e, se possibile, la concentrazione della sostanza di prova alla quale la vitalità cellulare è ridotta al 50 % (IC50). Se si rileva citotossicità, è necessario fissare sia il range di concentrazione che l'intervallo tra le singole concentrazioni in modo da adattare una curva ai dati sperimentali.
Per i casi evidentemente positivi e negativi (cfr. punto 2.3, primo paragrafo) è sufficiente procedere all'esperimento principale, sostenuto da uno o più esperimenti preliminari di definizione dei range delle dosi.
I risultati dubbi, borderline o non chiari devono essere definiti con altre prove (cfr. anche punto 2.4, secondo paragrafo). In tal caso si deve prendere in considerazione l'eventualità di modificare le condizioni dell'esperimento; tra le condizioni che possono essere modificate vi sono il range o l'intervallo tra le concentrazioni, il tempo di pre-incubazione e il tempo di esposizione all'irradiazione. Per le sostanze chimiche instabili in acqua può essere indicato un tempo di esposizione più breve.
2.2. TRATTAMENTO DEI DATI
Per poter valutare i dati è possibile calcolare il PIF (fattore di fotoirritazione) o l'MPE (foto-effetto medio).
Per il calcolo delle misure di fototossicità (cfr. sotto) la serie di valori dose-risposta discreti deve essere approssimata con un'adeguata curva continua dose-risposta (modello). L'adattamento della curva ai dati è in genere effettuato con il metodo di regressione non lineare (18). Per valutare come la variabilità dei dati incida sulla curva adattata si raccomando l'uso di un metodo bootstrap.
Il PIF è calcolato con la seguente formula:
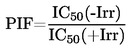
Se non è possibile calcolare l'IC50 in presenza o in assenza di luce, non si può determinare il PIF per il materiale di prova. L'MPE si basa sulla comparazione delle curve complete di concentrazione-risposta (19) ed è definito come la media ponderata di una serie rappresentativa di valori di foto-effetto.

Il valore PEC alla concentrazione C è definito come il prodotto dell'effetto di risposta REC per l'effetto alla dose DEC, cioè PEC = REC × DEC. L'effetto di risposta REC è uguale alla differenza tra le risposte osservate in assenza e in presenza di luce, cioè REC = RC (- Irr) - RC (+ Irr). L'effetto rispetto alla dose è dato da:

dove C* è la concentrazione di equivalenza, cioè la concentrazione alla quale la risposta + Irr è uguale alla risposta - Irr alla concentrazione C. Se non è possibile determinare C* perché i valori di risposta della curva + Irr sono sistematicamente superiori o inferiori a RC(- Irr) l'effetto rispetto alla dose è fissato a 1. I fattori di ponderazione wi sono dati dal valore di risposta più alto, cioè wi = MAX {Ri (+ Irr), Ri (- Irr)}. La griglia di concentrazione Ci è scelta in modo tale che lo stesso numero di punti rientri in ciascuno degli intervalli di concentrazione definiti dai valori di concentrazione utilizzati nell'esperimento. Il calcolo dell'MPE è limitato al valore massimo di concentrazione al quale almeno una delle due curve mostra ancora un valore di risposta pari ad almeno il 10 %. Se questa concentrazione massima è superiore alla concentrazione più elevata utilizzata nell'esperimento + Irr, la parte residua della curva + Irr è fissata al valore di risposta «0». Se il valore MPE è superiore ad un valore discriminante adeguatamente scelto (MPEC = 0,15) la sostanza è classificata come fototossica.
Un pacchetto software per il calcolo del PIF e dell'MPE è disponibile al sito indicato in bibliografia (20).
2.3. INTERPRETAZIONE DEI RISULTATI
In base allo studio di validazione (8), una sostanza di prova con un PIF < 2 o un MPE < 0,1 è indice di assenza di fototossicità. Un PIF > 2 e < 5 o un MPE > 0,1 e < 0,15 è indice di una probabile fototossicità e un PIF > 5 o un MPE > 0,15 predice fototossicità.
Per i laboratori che svolgono questo saggio per la prima volta i materiali di riferimento indicati nella tabella 1 devono essere testati prima delle sostanze di prova per verificarne le caratteristiche fototossiche. I valori del PIF o dell'MPE devono essere prossimi a quelli indicati nella tabella 1.
Tabella 1
|
Denominazione chimica
|
N. Einecs
|
N. CAS
|
PIF
|
MPE
|
Picco di assorbimento
|
Solvente (9)
|
|
Amiodarone HCL
|
243-293-2
|
[19774-82-4]
|
> 3,25
|
0,27-0,54
|
242 nm
300 nm
(spalla)
|
etanolo
|
|
Cloropromazina HCL
|
200-701-3
|
[69-09-0]
|
> 14,4
|
0,33-0,63
|
309 nm
|
etanolo
|
|
Norfloxacin
|
274-614-4
|
[70458-96-7]
|
> 71,6
|
0,34-0,90
|
316 nm
|
acetonitrile
|
|
Antracene
|
204-371-1
|
[120-12-7]
|
> 18,5
|
0,19-0,81
|
356 nm
|
acetonitrile
|
|
Protoporfirina IX, Disodio
|
256-815-9
|
[50865-01-5]
|
> 45,3
|
0,54-0,74
|
402 nm
|
etanolo
|
|
L-Istidina
|
|
[7006-35-1]
|
nessun PIF
|
0,05-0,10
|
211 nm
|
acqua
|
|
Esaclorofene
|
200-733-8
|
[70-30-4]
|
1,1-1,7
|
0,00-0,05
|
299 nm
317 nm
(spalla)
|
etanolo
|
|
Laurilsolfato di sodio
|
205-788-1
|
[151-21-3]
|
1,0-1,9
|
0,00-0,05
|
Nessun assorbimento
|
acqua
|
2.4. INTERPRETAZIONE DEI DATI
Se vengono rilevati effetti fototossici solo al valore massimo di concentrazione utilizzato nel saggio (in particolare per le sostanze di prova solubili in acqua) può essere necessario tener conto di altri elementi per la valutazione del rischio. Tali fattori possono includere dati sull'assorbimento cutaneo e l'accumulo della sostanza nella cute oppure dati ricavati da altre prove, ad esempio saggi in vitro della sostanza sulla cute umana o animale o modelli di cute.
Se non si rileva fototossicità (+ Irr e - Irr) e se la scarsa solubilità ha limitato le concentrazioni da testare, si può mettere in questione la compatibilità della sostanza di prova con il saggio e si deve considerare la possibilità di effettuare un saggio di conferma, ad esempio utilizzando un modello diverso.
3. RELAZIONE SULL'ESECUZIONE DEL SAGGIO
RAPPORTO DI PROVA
Il rapporto di prova deve contenere almeno le seguenti informazioni:
|
|
Sostanza chimica di prova:
|
—
|
dati di identificazione, denominazione generica e numeri IUPAC e CAS, se noti;
|
|
—
|
caratteristiche fisiche e purezza;
|
|
—
|
proprietà fisico-chimiche rilevanti per l'esecuzione dello studio;
|
|
—
|
spettro di assorbimento UV/visibile;
|
|
—
|
stabilità e fotostabilità, se note.
|
|
|
|
Solvente:
|
—
|
motivazione della scelta del solvente;
|
|
—
|
solubilità della sostanza chimica di prova nel solvente;
|
|
—
|
percentuale di solvente presente nel terreno di trattamento.
|
|
|
|
Cellule:
|
—
|
numero di passaggi delle cellule, se noto;
|
|
—
|
sensibilità delle cellule alle radiazioni, determinata con gli strumenti di irradiazione usati nel saggio di fototossicità in vitro 3T3 NRU.
|
|
|
|
Condizioni di prova (1); incubazione prima e dopo il trattamento:
|
—
|
tipo e composizione del terreno di coltura;
|
|
—
|
condizioni di incubazione (concentrazione di CO2, temperatura, umidità);
|
|
—
|
durata dell'incubazione (pre-trattamento, post-trattamento).
|
|
|
|
Condizioni di prova (2); trattamento con la sostanza chimica:
|
—
|
criteri di scelta delle concentrazioni della sostanza chimica di prova usata sia in presenza che in assenza di irradiazione;
|
|
—
|
in caso di solubilità limitata della sostanza chimica di prova e assenza di citotossicità, motivi della scelta della concentrazione più elevata;
|
|
—
|
tipo e composizione del terreno di trattamento (soluzione tampone salina);
|
|
—
|
durata del trattamento chimico.
|
|
|
|
Condizioni di prova (3); irradiazione:
|
—
|
motivo della scelta della fonte di luce utilizzata nel saggio;
|
|
—
|
fabbricante e tipo di fonte luminosa e radiometro;
|
|
—
|
caratteristiche di irradianza spettrale della fonte di luce;
|
|
—
|
caratteristiche di trasmissione/assorbimento del/i filtro/i usato/i;
|
|
—
|
caratteristiche del radiometro e particolari sulla sua calibrazione;
|
|
—
|
distanza della fonte di luce dal sistema di prova;
|
|
—
|
irradianza UVA a tale distanza, espressa in mW/cm2;
|
|
—
|
durata dell'esposizione alla luce UV/visibile;
|
|
—
|
dose UVA (irradianza × tempo), espressa in J/cm2;
|
|
—
|
temperatura delle colture cellulari durante l'irradiazione e delle colture cellulari mantenute al buio.
|
|
|
|
Condizioni di prova (4); prova vitalità in rosso neutro:
|
—
|
composizione del terreno per il trattamento al rosso neutro;
|
|
—
|
durata dell'incubazione nel rosso neutro;
|
|
—
|
condizioni di incubazione (concentrazione di CO2, temperatura, umidità);
|
|
—
|
condizioni di estrazione del rosso neutro (agente di estrazione, durata);
|
|
—
|
lunghezza d'onda usata per la lettura spettrofotometrica della densità ottica del rosso neutro;
|
|
—
|
seconda lunghezza d'onda (riferimento), se utilizzata;
|
|
—
|
contenuto del bianco spettrofotometrico, se utilizzato.
|
|
|
|
Risultati:
|
—
|
vitalità cellulare ottenuta a ciascuna concentrazione della sostanza chimica di prova, espressa in vitalità percentuale media dei concomitanti controlli in solvente;
|
|
—
|
curve concentrazione-risposta (concentrazione della sostanza chimica di prova rispetto a vitalità cellulare relativa), ottenute negli esperimenti simultanei + Irr e - Irr;
|
|
—
|
analisi dei dati delle curve concentrazione-risposta: se possibile, computo/calcolo dell'IC50 (+ Irr) e dell'IC50 (- Irr);
|
|
—
|
confronto delle due curve concentrazione-risposta ottenute in presenza e in assenza di irradiazione, tramite calcolo del PIF o dell'MPE;
|
|
—
|
criteri di accettazione del saggio; controllo simultaneo in solvente:
|
|
—
|
vitalità assoluta (densità ottica dell'estratto di rosso neutro) delle cellule irradiate e non irradiate;
|
|
—
|
dati storici del controllo negativo e con solvente; deviazione media e standard;
|
|
—
|
criteri di accettazione del saggio; controllo positivo simultaneo:
|
|
—
|
IC50 (+ Irr) e IC50 (- Irr) e PIF/PME della sostanza chimica del controllo positivo:
|
|
—
|
dati storici riguardanti la sostanza chimica del controllo positivo: IC50 (+ Irr) e IC50 (- Irr) e PIF/PME; deviazione media e standard.
|
|
|
|
Discussione dei risultati.
|
4. BIBLIOGRAFIA
|
1.
|
Lovell W.W. (1993), «A scheme for in vitro screening of substances for photoallergenic potential», Toxic. In Vitro, 7:, pagg. 95-102.
|
|
2.
|
Santamaria, L. e Prino, G. (1972), «List of the photodynamic substances», in Research Progress in Organic, Biological and Medicinal Chemistry, Vol. 3, parte 1, North Holland Publishing Co. Amsterdam, pagg. XI-XXXV.
|
|
3.
|
Spielmann, H., Lovell, W.W., Hölzle, E., Johnson, B.E., Maurer, T., Miranda, M.A., Pape, W.J.W., Sapora, O. e Sladowski, D. (1994), «In vitro phototoxicity testing: The report and recommendations of ECVAM Workshop 2», ATLA, 22, pagg. 314-348.
|
|
4.
|
Spikes, J.D. (1989), «Photosensitization» in The science of Photobiology, a cura di K.C. Smith, Plenum Press, New York, seconda edizione, pagg. 79-110.
|
|
5.
|
OCSE (1997), «Guidance Document On Direct Phototransformation Of Chemicals In Water», Environmental Health and Safety Publications, Series on Testing and Assessment N. 7, Environment Directorate, Parigi.
|
|
6.
|
Spielmann, H., Balls, M., Döring, B., Holzhütter, H.G., Kalweit, S., Klecak, G., L'Eplattenier, H., Liebsch, M., Lovell, W.W., Maurer, T., Moldenhauer. F. Moore. L., Pape, W., Pfannbecker, U., Potthast, J., De Silva, O., Steiling, W. e Willshaw, A. (1994), «EEC/COLIPA project on in vitro phototoxicity testing: First results obtained with a Balb/c 3T3 cell phototoxicity assay», Toxi.c In Vitro, 8, pagg. 793-796.
|
|
7.
|
Anon (1998), «Statement on the scientific validity of the 3T3 NRU PT test (an in vitro test for phototoxicity)», Commissione europea, Centro comune di ricerca: ECVAM e DGXI/E/2, 3 novembre 1997, ATLA, 26, pagg. 7-8.
|
|
8.
|
Spielmann, H., Balls, M., Dupuis, J., Pape, W.J.W., Pechovitch, G,. De Silva, O., Holzhütter, H.G., Clothier, R., Desolle, P., Gerberick, F., Liebsch, M., Lovell, W.W., Maurer, T., Pfannenbecker, U., Potthast, J. M., Csato, M., Sladowski, D., Steiling, W. e Brantom, P. (1998), «The international EU/COLIPA In vitro phototoxicity validation study: results of phase II (blind trial), part 1: the 3T3 NRU phototoxicity test», Toxic. In Vitro 12, pagg. 305-327.
|
|
9.
|
OCSE (2002), Riunione estesa di consultazione di esperti su The In Vitro 3T3 NRU Phototoxicity Test Guideline Proposal, Berlino, 30-31 ottobre 2001, Relazione sintetica finale del Segretariato OCSE, 15 marzo 2002, OCSE ENV/EHS, disponibile presso il Segretariato, su richiesta.
|
|
10.
|
Borenfreund, E. e Puerner, J.A. (1985), «Toxicity determination in vitro by morphological alterations and neutral red absorption», Toxicology Lett., 24, pagg. 119-124.
|
|
11.
|
Hay, R.J. (1988), «The seed stock concept and quality control for cell lines», Analytical Biochemistry, 171, pagg. 225-237.
|
|
12.
|
Lambert L.A, Warner W.G. e Kornhauser A. (1996), «Animal models for phototoxicity testing» in Dermatotoxicology, a cura di F.N. Marzulli e H.I. Maibach, Taylor & Francis, Washington DC, quinta edizione, pagg. 515-530.
|
|
13.
|
Tyrrell R.M., Pidoux M. (1987), «Action spectra for human skin cells: estimates of the relative cytotoxicity of the middle ultraviolet, near ultraviolet and violet regions of sunlight on epidermal keratinocytes», Cancer Res., 47, pagg. 1825-1829.
|
|
14.
|
ISO 10977 (1993), Photography — Processed photographic colour films and paper prints — Methodsfor measuring image stability.
|
|
15.
|
CIE (1993), Sunscreen Testing (UV.B) TECHNICAL REPORT, n. 90, Vienna, ISBN 3 900 734 275.
|
|
16.
|
ZEBET/ECVAM/COLIPA — Standard Operating Procedure: In Vitro 3T3 NRU Phototoxicity Test, versione finale, 7 settembre 1998, 18 pagg.
|
|
17.
|
Spielmann, H., Balls, M., Dupuis, J., Pape, W.J.W., De Silva, O., Holzhütter, H.G., Gerberick, F., Liebsch, M., Lovell, W.W. e Pfannenbecker, U. (1998), «A study on UV filter chemicals from Annex VII of the European Union Directive 76/768/EEC, in the in vitro 3T3 NRU phototoxicity test», ATLA 26, pagg. 679-708.
|
|
18.
|
Holzhütter, H.G. e Quedenau, J. (1995), «Mathematical modeling of cellular responses to external signals», J. Biol. Systems 3, pagg. 127-138.
|
|
19.
|
Holzhütter, H.G. (1997), «A general measure of in vitro phototoxicity derived from pairs of dose-response curves and its use for predicting the in vivo phototoxicity of chemicals», ATLA, 25, pagg. 445-462.
|
|
20.
|
http://www.oecd.org/document/55/0,2340,en_2649_34377_2349687_1_1_1_1,00.html
|
Allegato 1
Ruolo del saggio 3T3 NRU PT in un approccio sequenziale ai saggi di fototossicità delle sostanze chimiche

Allegato 2
Figura 1
Distribuzione spettrale della potenza di un simulatore solare con filtro

(cfr. punto 1.4.1.5, secondo paragrafo)
La figura 1 presenta un esempio di una distribuzione spettrale di potenza accettabile di un simulatore solare con filtro. È derivato dal simulatore ad alogenuri metallici (drogati) utilizzato nel trial di validazione del saggio 3T3 NRU PT (6)(8)(17). La figura mostra l'effetto di due diversi filtri e l'effetto filtrante aggiuntivo dato dal coperchio della piastra di coltura cellulare a 96 pozzetti. Il filtro H2 è stato utilizzato solo con sistemi di saggio in grado di tollerare un quantitativo superiore di UVB (saggio su un modello di cute e test di fotoemolisi degli eritrociti). Nel saggio 3T3 NRU-PT è stato usato il filtro H1. La figura mostra che l'effetto filtrante aggiuntivo dato dal coperchio della piastra si osserva principalmente nello spettro UVB, ma lascia ancora radiazioni UVB sufficienti nello spettro di irradiazione da eccitare le sostanze chimiche che in genere assorbono i raggi UVB, come l'amiodarone (cfr. tabella 1).
Figura 2
Sensibilità all'irradiazione delle cellule Balb/c 3T3 (nelle lunghezze d'onda UVA)
Vitalità cellulare ( % assunzione del rosso neutro dei controlli al buio)

(cfr. punti 1.4.1.5.2, secondo paragrafo, 1.4.2.2.1, 1.4.2.2.2)
Sensibilità delle cellule Balb/c 3T3 all'irradiazione con il simulatore solare utilizzato nel trial di validazione del saggio di fototossicità 3T3 NRU, misurata nelle lunghezze d'onda UVA. La figura illustra i risultati ottenuti nello studio di pre-validazione in 7 laboratori diversi (1). Le due curve con i simboli in chiaro sono state ottenute con cellule vecchie (numero elevato di passaggi), che sono state sostituite da nuove popolazioni di cellule; le curve con i simboli scuri mostrano che le cellule presentano una tolleranza accettabile all'irradiazione.
Da questi dati è stata ricavata la più elevata dose di irradiazione non-citotossica pari a 5 J/cm2 (linea tratteggiata verticale. La linea tratteggiata orizzontale indica anche l'effetto di irradiazione massimo accettabile fornito al punto 1.4.2.2.
B.42. SENSIBILIZZAZIONE CUTANEA: LOCAL LYMPH NODE ASSAY
1. METODO
Questo saggio corrisponde al TG 429 (2002) dell'OCSE
1.1 INTRODUZIONE
Il Local Lymph Node Assay (LLNA) è stato validato ed accettato a sufficienza da giustificarne l'adozione come nuovo Metodo (1)(2)(3). Si tratta del secondo metodo per valutare il potenziale di sensibilizzazione cutanea delle sostanze chimiche sugli animali. L'altro metodo (B.6) utilizza i saggi sui porcellini d'India e in particolare il guinea pig maximisation test (test di massimizzazione sui porcellini d'India) e il saggio di Buehler (4).
L'LLNA costituisce un metodo alternativo da usarsi per identificare le sostanze chimiche che provocano sensibilizzazione cutanea e per confermare che le sostanze chimiche non hanno un potenziale significativo di sensibilizzazione cutanea. Ciò non significa necessariamente che l'LLNA vada usato in tutti i casi in sostituzione del test sui porcellini d'India, ma piuttosto che il saggio ha gli stessi meriti e può essere utilizzato in alternativa, poiché i risultati positivi e negativi ottenuti con questo metodo non richiedono generalmente un'ulteriore conferma.
L'LLNA presenta alcuni vantaggi per ciò che concerne sia il progresso scientifico che il benessere degli animali. Esso studia la fase di induzione della sensibilizzazione cutanea e fornisce dati quantitativi che consentono la valutazione della risposta alla dose. I particolari della validazione dell'LLNA e una rassegna del lavoro ad essa associato sono stati pubblicati (5)(6)(7)(8). Inoltre, occorre sottolineare che i sensibilizzanti lievi/moderati, raccomandati come sostanze di controllo positive adeguate per i saggi sui porcellini d'India, sono idonei anche per l'uso con l'LLNA (6)(8)(9).
L'LLNA è un metodo in vivo e, di conseguenza, non elimina l'impiego di animali nella valutazione dell'attività sensibilizzante da contatto. Esso ha però il potenziale di ridurre il numero di animali necessari a tale scopo. Inoltre, l'LLNA rappresenta un significativo miglioramento del modo in cui vengono usati gli animali per gli studi sulla sensibilizzazione da contatto. L'LLNA è basato sull'attenta valutazione delle manifestazioni immunologiche stimolate dalle sostanze chimiche durante la fase di induzione della sensibilizzazione. Diversamente dai saggi sui porcellini d'India, l'LLNA non richiede la stimolazione di reazioni di ipersensibilità cutanea indotte da provocazione. Inoltre, l'LLNA non richiede l'uso di un adiuvante, come invece è il caso del saggio di massimizzazione sui porcellini d'India. Per questo motivo, l'LLNA riduce la sofferenza degli animali. Nonostante i vantaggi dell'LLNA rispetto ai tradizionali saggi sui porcellini d'India, occorre riconoscere che esistono alcune limitazioni che possono rendere necessario l'impiego dei saggi tradizionali (ad es., risposte falsi negativi nell'LLNA con alcuni metalli, risposte falsi positivi con alcuni irritanti cutanei) (10).
Vedi anche Introduzione, parte B.
1.2 PRINCIPIO DEL METODO
Il principio fondamentale che sta alla base dell'LLNA è che i sensibilizzanti inducono una proliferazione primaria dei linfociti nel linfonodo responsabile del drenaggio della zona di applicazione della sostanza chimica. Tale proliferazione è proporzionale alla dose applicata (e alla potenza dell'allergene) e costituisce un semplice mezzo per ottenere una misurazione quantitativa oggettiva della sensibilizzazione. L'LLNA valuta tale proliferazione come rapporto dose-risposta in cui la proliferazione osservata nei gruppi sperimentali viene confrontata con quella nei controlli trattati con il veicolo. Occorre determinare il rapporto fra la proliferazione nei gruppi trattati e quella dei controlli trattati con il solo veicolo, definito Indice di Stimolazione, che deve essere almeno di tre prima che una sostanza sperimentale possa essere ulteriormente valutata come potenziale sensibilizzante cutaneo. I metodi qui descritti si basano sull'uso della marcatura radioattiva per misurare la proliferazione delle cellule. È possibile però impiegare anche altri criteri per la valutazione della proliferazione, sempre che vi siano una giustificazione e un adeguato sostegno scientifico, comprese citazioni complete e la descrizione della metodologia.
1.3 DESCRIZIONE DEL METODO
1.3.1 Preparazioni
1.3.1.1 Condizioni di alloggio e alimentazione
Gli animali vanno posti in gabbie singole. La temperatura dello stabulario deve essere di 22 oC (± 3 oC). Sebbene l'umidità relativa debba raggiungere almeno il 30 % e preferibilmente non superare il 70 %, tranne che nel corso delle pulizie degli ambienti, occorre puntare a un valore del 50-60 %. L'illuminazione deve essere artificiale, con una sequenza di 12 ore di luce e 12 d'oscurità. Per quanto concerne l'alimentazione, si possono usare le diete convenzionali da laboratorio con una quantità illimitata d'acqua potabile.
1.3.1.2 Preparazione degli animali
Gli animali vanno selezionati in maniera randomizzata, marcati per consentire l'identificazione individuale (ma non mediante marchi per orecchio), e tenuti nelle loro gabbie per almeno 5 giorni prima dell'inizio del dosaggio, per permetterne l'acclimatazione alle condizioni di laboratorio. Prima dell'inizio del trattamento, tutti gli animali vanno esaminati per accertare che non presentino lesioni cutanee visibili.
1.3.2 Condizioni del saggio
1.3.2.1 Animali sperimentali
La specie di elezione per questo saggio è il topo. Vanno usate femmine di topo, giovani adulte, del ceppo CBA/Ca o CBA/J, nullipare e non gravide. All'inizio dello studio, gli animali devono avere un'età compresa fra 8 e 12 settimane e la variazione ponderale degli animali deve essere minima e non superare il 20 % del peso medio. È possibile utilizzare altri ceppi ed esemplari di sesso maschile quando vengano prodotti dati sufficienti a dimostrare che nella risposta all'LLNA non esistono differenze significative specifiche per il ceppo e/o il genere.
1.3.2.2 Controllo dell'affidabilità
Per dimostrare che il saggio è stato eseguito in modo adeguato e che il laboratorio ha competenza nel condurre il saggio con successo, si utilizzano controlli positivi. Il controllo positivo dovrebbe produrre una risposta positiva all'LLNA a un livello di esposizione che si ritiene provochi un aumento dell'indice di stimolazione (SI) > 3 rispetto al gruppo di controllo negativo. La dose per il controllo positivo va scelta in modo che l'induzione sia definita ma non eccessiva. Le sostanze di elezione sono l'esilcinnamaldeide (CAS 101-86-0, Einecs 202-983-3) e il mercaptobenzotiazolo (CAS 149-30-4, Einecs 205-736-8). Possono verificarsi occasioni in cui, con adeguata giustificazione, è possibile usare altre sostanze di controllo che rispondano ai criteri di cui sopra. Mentre normalmente ciascun saggio può richiedere un gruppo di controllo positivo, possono esservi delle situazioni in cui i laboratori sperimentali hanno a disposizione dati pregressi su controlli positivi per dimostrare la coerenza di una risposta soddisfacente per un periodo di sei mesi o superiore. In tali situazioni può essere appropriato eseguire saggi meno frequenti con controlli positivi a intervalli non superiori a 6 mesi. Sebbene la sostanza di controllo positiva vada sottoposta a saggi nel veicolo che è noto per la sua capacità di provocare una risposta coerente (ad es. acetone: olio di oliva), è possibile che si verifichino alcune situazioni normative nelle quali sarà necessario eseguire il saggio anche in un veicolo non standard (formulazione clinicamente/chimicamente pertinente). In tale situazione, è necessario sottoporre a saggio la possibile interazione di un controllo positivo con tale veicolo non convenzionale.
1.3.2.3 Numero di animali, livelli di dose e scelta del veicolo.
Ogni gruppo di saggi comprende almeno quattro animali, sui quali si saggiano almeno tre concentrazioni della sostanza sperimentale, più un gruppo di controllo negativo trattato solo con il veicolo per la sostanza sperimentale e, ove pertinente, un controllo positivo. Nei casi in cui sia necessario raccogliere dati su animali singoli, si utilizzano almeno cinque animali per gruppo. Salvo il trattamento con la sostanza in esame, gli animali del gruppo di controllo vanno manipolati esattamente come quelli dei gruppi sperimentali.
La selezione della dose e del veicolo vanno basate sulle raccomandazioni contenute nella voce bibliografica (1). Le dosi vanno selezionate fra le concentrazioni 100 %, 50 %, 25 %, 10 %, 5 %, 2,5 %, 1 %, 0,5 % ecc. Ove disponibili, occorre tenere conto dei dati esistenti circa la tossicità acuta e l'irritazione cutanea, nel selezionare le tre concentrazioni consecutive, in modo che la concentrazione più elevata massimizzi l'esposizione, evitando al contempo la tossicità sistemica e l'eccessiva irritazione cutanea locale (2)(11).
Il veicolo va selezionato con l'obiettivo di massimizzare le concentrazioni sperimentali e la solubilità producendo al contempo una soluzione/sospensione adatta all'applicazione della sostanza di prova. In ordine di preferenza, i veicoli raccomandati sono acetone/olio di oliva (4:1 v/v), dimetilformammide, metiletilchetone, glicole propilenico e dimetilsulfossido (2)(10), ma è possibile utilizzarne anche altri, fornendo una sufficiente motivazione scientifica. In alcune situazioni può rendersi necessario l'uso di un solvente clinicamente pertinente o la formulazione nella quale la sostanza sperimentale è posta in commercio, come controllo ulteriore. Occorre prestare particolare cura per assicurare che i materiali idrofili vengano incorporati in un sistema veicolare che inumidisce la pelle e non scorre via immediatamente. Vanno pertanto evitati i veicoli completamente acquosi.
1.3.3 Procedura
1.3.3.1 Protocollo sperimentale
Il protocollo sperimentale del saggio è il seguente:
|
|
Giorno 1:
Identificare e registrare il peso di ciascun animale singolarmente. Cominciare l'applicazione di 25 μl della diluizione appropriata della sostanza sperimentale, del solo veicolo o del controllo positivo (pertinente), sulla parte posteriore di entrambe le orecchie.
|
|
|
Giorni 2 e 3:
Ripetere la procedura di applicazione eseguita il giorno 1.
|
|
|
Giorni 4 e 5:
Nessun trattamento.
|
|
|
Giorno 6:
Registrare il peso di ciascun animale. Iniettare 250 μl di soluzione salina tampone fosfato (PBS) contenente 20 μCi (7.4e + 8 Bq) di 3H-metil timidina a tutti i topi trattati e di controllo, attraverso la vena caudale. In alternativa, iniettare 250 μL di PBS contenente 2 μCi (7.4e + 7 Bq) di 125I-iododeossiuridina e 10-5 M fluorodeossiuridina a tutti i topi, attraverso la vena caudale.
Cinque ore dopo, gli animali vanno soppressi. I linfonodi auricolari drenanti di entrambe le orecchie vengono asportati e posti in soluzione salina tampone fosfato raggruppati per gruppo sperimentale (sistema del gruppo di trattamento), oppure per ciascun animale separatamente (sistema del singolo animale). I particolari e i diagrammi relativi all'identificazione e alla dissezione dei linfonodi si trovano nell'Allegato I della voce bibliografica 10.
|
1.3.3.2 Preparazione delle sospensioni cellulari
Mediante delicata disaggregazione meccanica attraverso una rete di acciaio inossidabile con maglie da 200 μm si prepara una singola sospensione cellulare di cellule linfonodali, provenienti dai gruppi di trattamento oppure bilateralmente da singoli individui. Le cellule linfonodali vanno lavate due volte con abbondante PBS e precipitate con acido tricloroacetico al 5 % (TCA) a 4 oC per 18 ore (1). I granuli vanno poi rimessi in sospensione in 1 ml di TCA e quindi trasferiti in fiale di scintillazione contenenti 10 ml di liquido di scintillazione per il conteggio del 3H, oppure trasferiti direttamente in tubi per conteggio gamma per il conteggio dello 125I.
1.3.3.3 Determinazione della proliferazione delle cellule (radioattività incorporata)
L'incorporazione di 3H-metil timidina viene misurata mediante conteggio a β-scintillazione, in disintegrazioni per minuto (DPM). L'incorporazione di 125I-iododeossiuridina viene misurata mediante conteggio dello 125I ed espressa, ugualmente, in DPM. A seconda dell'approccio usato, l'incorporazione verrà espressa in DPM/gruppo di trattamento (sistema del gruppo di trattamento) o DPM/animale (sistema del singolo animale).
1.3.3.4 Osservazioni
1.3.3.4.1 Osservazioni cliniche
Gli animali vanno osservati attentamente una volta al giorno per individuare eventuali segni clinici di irritazione locale nel punto di applicazione o di tossicità sistemica. Tutte le osservazioni vanno registrate sistematicamente e riportate singolarmente per ciascun animale.
1.3.3.4.2 Peso corporeo
Come illustrato nella sezione 1.3.3.1, all'inizio del saggio e al momento della soppressione programmata degli animali, occorre misurare il peso dei singoli esemplari.
1.3.4 Calcolo dei risultati
I risultati vengono espressi mediante l'indice di stimolazione (SI). Se si applica il sistema del gruppo di trattamento, l'SI si ottiene dividendo l'incorporazione radioattiva per ciascun gruppo di trattamento per l'incorporazione del gruppo di controllo trattato con veicolo; si ottiene così un SI medio. Quando si utilizza l'approccio a singolo animale, l'SI si ottiene dividendo i valori medi delle DPM per animale calcolate per ogni gruppo di trattamento compreso il gruppo di controllo positivo, per le medie delle DPM per animale calcolate per il gruppo di controllo trattato solo con il veicolo. Quindi l'SI medio per i controlli trattati con solo veicolo è 1.
L'uso dell'approccio a singolo animale per calcolare l'SI consentirà di eseguire un'analisi statistica dei dati. Nella scelta di un metodo adeguato di analisi statistica, lo sperimentatore deve essere consapevole di possibili ineguaglianze delle varianze e di altri problemi correlati che possono richiedere una trasformazione dei dati o un'analisi statistica non parametrica. Un approccio adeguato per interpretare i dati consiste nel valutare tutti i dati singoli dei soggetti trattati e dei controlli trattati con veicolo, e nel ricavare da essi la curva dose-risposta più adeguata, tenendo conto dei limiti fiduciali (8)(12)(13). Lo sperimentatore deve però prestare attenzione a possibili risposte «aberranti» per singoli animali all'interno di un gruppo che possano richiedere l'uso di una misura alternativa della risposta (ad es. del valore mediano anziché della media) o l'eliminazione dell'osservazione aberrante.
Il processo decisionale rispetto a una risposta positiva prevede un indice di stimolazione ≥ 3 unito alla considerazione della dose-risposta e, ove pertinente, della significatività statistica (3)(6)(8)(12)(14).
Qualora fosse necessario chiarire i risultati ottenuti, occorre prendere in considerazione diverse proprietà della sostanza sperimentale, in particolare se ha un rapporto strutturale con noti sensibilizzanti cutanei, se causa eccessiva irritazione cutanea, nonché la natura della risposta alla dose rilevata. Queste e altre considerazioni sono illustrate nei dettagli in altra sede (7).
2. DATI
I dati vanno riassunti sotto forma di tabella, evidenziando i valori medi e individuali delle disintegrazioni per minuto (DPM) e gli indici di stimolazione per ciascun gruppo di dose (compreso quello di controllo con veicolo).
3. RELAZIONE
3.1 RELAZIONE SULL'ESECUZIONE DEL SAGGIO
La relazione deve contenere le seguenti informazioni:
|
|
Sostanza di prova:
|
—
|
dati di identificazione (ad es. numero CAS, se disponibile; origine; purezza; impurezze note; numero di lotto);
|
|
—
|
natura fisica e proprietà fisico-chimiche (ad es. volatilità, stabilità, solubilità);
|
|
—
|
se si tratta di una miscela, composizione e percentuali relative dei componenti.
|
|
|
|
Veicolo:
|
—
|
dati di identificazione [purezza; concentrazione (ove pertinente); volume usato];
|
|
—
|
giustificazione per la scelta del veicolo.
|
|
|
|
Animali sperimentali:
|
—
|
condizioni microbiologiche degli animali, se note;
|
|
—
|
numero, età e sesso degli animali;
|
|
—
|
origine degli animali, condizioni di alloggio, dieta, ecc.
|
|
|
|
Condizioni del saggio:
|
—
|
dettagli relativi alla preparazione e all'applicazione della sostanza di prova;
|
|
—
|
giustificazione per la scelta delle dosi, compresi i risultati dello studio di definizione dell'intervallo di concentrazioni, se eseguito; concentrazioni del veicolo e della sostanza e quantità totale di sostanza applicata;
|
|
—
|
dettagli sulla qualità del cibo e dell'acqua (compresi tipo/origine della dieta, origine dell'acqua).
|
|
|
|
Controllo dell'affidabilità:
|
—
|
riassunto dei risultati del più recente controllo dell'affidabilità, comprese informazioni sulla sostanza, la concentrazione e il veicolo usati;
|
|
—
|
dati sui controlli positivi e negativi, contemporanei e/o storici, per il laboratorio di prova.
|
|
|
|
Risultati:
|
—
|
peso dei singoli animali all'inizio dell'applicazione delle dosi e alla soppressione programmata;
|
|
—
|
tabella dei valori di DPM medi (sistema del gruppo di trattamento) o individuali (sistema del singolo animale) come pure l'intervallo dei valori per entrambi i sistemi e degli indici di stimolazione per ciascun gruppo di dose (compreso quello di controllo con solo veicolo);
|
|
—
|
analisi statistica ove pertinente;
|
|
—
|
momento dell'insorgenza e decorso degli eventuali segni di tossicità, compresa l'irritazione cutanea nel punto di applicazione della somministrazione, per ciascun animale.
|
|
|
|
Discussione dei risultati:
|
—
|
Breve commento sui risultati, sull'analisi dose-risposta e sulle analisi statistiche, ove pertinenti, con una conclusione sulla necessità o meno di considerare la sostanza di prova un sensibilizzante cutaneo.
|
|
4. BIBLIOGRAFIA
|
(1)
|
Kimber, I. and Basketter, D.A. (1992). The murine local lymph node assay; collaborative studies and new directions: A commentary. Food and Chemical Toxicology 30, 165-169.
|
|
(2)
|
Kimber, I, Derman, R.J., Scholes E.W, and Basketter, D.A. (1994). The local lymph node assay: developments and applications. Toxicology, 93, 13-31.
|
|
(3)
|
Kimber, I., Hilton, J., Dearman, R.J., Gerberick, G.F., Ryan, C.A., Basketter, D.A., Lea, L., House, R.V., Ladies, G.S., Loveless, S.E., Hastings, K.L. (1998). Assessment of the skin sensitisation potential of topical medicaments using the local lymph node assay: An interlaboratory exercise. Journal of Toxicology and Environmental Health, 53, 563-79.
|
|
(5)
|
Chamberlain, M. and Basketter, D.A. (1996). The local lymph node assay: status of validation. Food and Chemical Toxicology, 34, 999-1002.
|
|
(6)
|
Basketter, D.A., Gerberick, G.F., Kimber, I. and Loveless, S.E (1996). The local lymph node assay- A viable alternative to currently accepted skin sensitisation tests. Food and Chemical Toxicology, 34, 985-997.
|
|
(7)
|
Basketter, D.A., Gerberick, G.F. and Kimber, I. (1998). Strategies for identifying false positive responses in predictive sensitisation tests. Food and Chemical Toxicology. 36, 327-33.
|
|
(8)
|
Van Och, F.M.M, Slob, W., De Jong, W.H., Vandebriel, R.J., Van Loveren, H. (2000). A quantitative method for assessing the sensitising potency of low molecular weight chemicals using a local lymph node assay: employement of a regression method that includes determination of uncertainty margins. Toxicology, 146, 49-59.
|
|
(9)
|
Dearman, R.J., Hilton, J., Evans, P., Harvey, P., Basketter, D.A. and Kimber, I. (1998). Temporal stability of local lymph node assay responses to hexyl cinnamic aldehyde. Journal of Applied Toxicology, 18,281-4.
|
|
(10)
|
National Institute of Environmental Health Sciences (1999). The Murine Local Lymph Node Assay: A Test Method for Assessing the Allergic Contact Dermatitis Potential of Chemicals/Compounds: The Results of an Independent Peer Review Evaluation Coordinated by the Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program Center for the Evaluation of Alternative Toxicological Methods (NICETAM). NIH Publication No: 99-4494, Research Triangle Park, N.C. (http://iccvam.niehs.nih.gov).
|
|
(11)
|
Metodo di prova B.4.
|
|
(12)
|
Basketter, D.A., Selbie, E., Scholes, E.W. Lees, D. Kimber, I. and Botham, P.A. (1993) Results with OECD recommended positive control sensitisers in the maximisation, Buehler and local lymph node assays. Food and Chemical Toxicology, 31, 63-67.
|
|
(13)
|
Basketter D.A., Lea L.J., Dickens A., Briggs D., Pate I., Dearman R.J., Kimber I. (1999). A comparison of statistical approaches to the derivation of EC3 values from local lymph node assay dose responses. J. Appl. Toxicology, 19, 261-266.
|
|
(14)
|
Basketter DA, Blaikie L, Derman RJ, Kimber I, Ryan CA, Gerberick GF, Harvey P, Evans P, White IR and Rycroft RTG (2000). Use of local lymph node assay for the estimation of relative contact allergenic potency. Contact Dermatitis 42, 344-48.
|
B.43. STUDI DI NEUROTOSSICITÀ NEI RODITORI
1. METODO
Questo metodo di saggio è equivalente al metodo OCSE TG 424 (1997).
Il suo scopo è permettere di ricavare le informazioni necessarie per confermare o caratterizzare in modo più accurato la potenziale neurotossicità di sostanze chimiche in animali adulti. Può essere abbinato a metodi esistenti utilizzati per studi di tossicità per dose ripetuta, oppure essere utilizzato in uno studio a sé stante. Per la concezione di studi basati sul suo utilizzo, si raccomanda di consultare il documento orientativo OCSE sulle strategie e sui metodi di sperimentazione riguardanti la neurotossicità (1), in particolare nel caso in cui siano previste modifiche delle osservazioni e dei procedimenti raccomandati per l'uso routinario di questo metodo. Tale documento, infatti, è stato elaborato allo scopo di facilitare la scelta di altri procedimenti da utilizzare in casi specifici.
La valutazione della neurotossicità sullo sviluppo non rientra nell'oggetto di questo metodo.
1.1 INTRODUZIONE
Per la valutazione delle caratteristiche tossiche delle sostanze chimiche, è importante prendere in considerazione la loro capacità potenziale di causare effetti neurotossici. Il metodo utilizzato per i saggi di tossicità sistemica per dose ripetuta prevede già osservazioni intese a individuare una potenziale neurotossicità. Il metodo oggetto del presente documento può essere utilizzato per disegnare uno studio che consenta di ricavare maggiori informazioni o di confermare gli effetti neurotossici osservati negli studi di tossicità sistemica per dose ripetuta. Tuttavia, per talune classi di sostanze chimiche, di cui è nota la potenziale neurotossicità, può essere opportuno utilizzare questo metodo anche in assenza di indicazioni di una potenziale neurotossicità emerse da studi di tossicità sistemica per dose ripetuta. Depongono a favore di questo approccio, ad esempio:
|
—
|
l'osservazione di segni neurologici o lesioni neuropatologiche in studi di tossicità diversi dagli studi di tossicità per dose ripetuta, oppure
|
|
—
|
l'affinità strutturale o altre informazioni che indicano una correlazione tra tali sostanze e neurotossici noti.
|
L'uso di questo metodo può essere opportuno anche in altri casi; per maggiori indicazioni a questo riguardo, si rimanda alla voce bibliografica (1).
Nell'elaborazione di questo metodo, si è posta particolare attenzione alla possibilità di un suo adattamento a necessità specifiche di conferma della specifica neurotossicità istopatologica e comportamentale di una sostanza chimica, nonché di caratterizzazione e quantificazione delle risposte neurotossiche.
In passato, si faceva coincidere la neurotossicità con la neuropatia, che comporta lesioni neuropatologiche o disfunzioni neurologiche quali convulsioni, paralisi o tremore. La neuropatia è indubbiamente una manifestazione importante di neurotossicità, ma oggi appare evidente che vi sono molti altri segni di tossicità per il sistema nervoso centrale (p. es. la perdita della coordinazione motoria, i deficit sensoriali, le disfunzioni dell'apprendimento e della memoria) che possono non emergere negli studi sulla neuropatia o in altri tipi di studi.
Questo metodo per la conduzione di studi di neurotossicità ha lo scopo di consentire l'individuazione di effetti neurocomportamentali e neuropatologici di rilievo nei roditori adulti. Gli effetti comportamentali, anche in assenza di modificazioni morfologiche, possono essere indicativi di un effetto avverso sull'organismo; viceversa, non tutte le modificazioni comportamentali sono riconducibili in modo specifico al sistema nervoso centrale. Per questo motivo, tutte le modificazioni osservate devono essere valutate insieme a dati correlati di tipo istopatologico, ematologico o biochimico, nonché a dati riguardanti altri tipi di tossicità sistemica. Ai fini della caratterizzazione e quantificazione delle risposte neurotossiche, questo metodo prevede tra l'altro specifici esami istopatologici e comportamentali che possono essere ulteriormente supportati da indagini elettrofisiologiche e/o biochimiche (1)(2)(3)(4).
I neurotossici possono agire su diversi target del sistema nervoso e con svariati meccanismi. Dato che non esiste un unico insieme di test che permetta di valutare in modo approfondito e completo il potenziale neurotossico di ogni sostanza, può essere necessario ricorrere ad altri test in vivo o in vitro specifici per il tipo di neurotossicità osservata o attesa.
Questo metodo di saggio può essere anche usato, insieme alle indicazioni riportate nel documento orientativo OCSE sulle strategie e sui metodi di sperimentazione riguardanti la neurotossicità (1), per disegnare studi che permettano di caratterizzare in modo più accurato la quantificazione dose-risposta o migliorarne la sensibilità in modo da poter stimare meglio il NOAEL (livello in corrispondenza del quale non si osservano effetti avversi) o documentare rischi noti o sospetti associati alla sostanza chimica. Ad esempio, può essere utilizzato per disegnati studi intesi a identificare e valutare il meccanismo o i meccanismi di neurotossicità, oppure a integrare i dati già disponibili ricavati da procedure di base per l'osservazione degli effetti neurocomportamentali o neuropatologici. Non è necessario che tali studi producano gli stessi dati che si ricaverebbero applicando i procedimenti standard raccomandati in questo metodo, se tali dati sono già disponibili e non sono ritenuti necessari per l'interpretazione dei risultati dello studio.
Questo studio di neurotossicità, usato da solo o in abbinamento ad altri studi, permette di ricavare informazioni utili per:
|
—
|
stabilire se la sostanza chimica esaminata provoca effetti permanenti o reversibili sul sistema nervoso;
|
|
—
|
caratterizzare con maggior precisione le alterazioni del sistema nervoso associate all'esposizione alla sostanza chimica, e comprendere il meccanismo alla base di tali alterazioni;
|
|
—
|
determinare le relazioni dose-risposta e tempo-risposta al fine di stimare un livello in corrispondenza del quale non si osservano effetti avversi (a sua volta utilizzabile per stabilire criteri di sicurezza per la sostanza chimica in questione).
|
Questo metodo di saggio prevede la somministrazione orale della sostanza da esaminare. In talune circostanze può essere preferibile usare altre vie di somministrazione (ad esempio cutanea o per inalazione); in tal caso può essere necessaria una modifica dei procedimenti raccomandati. La via di somministrazione deve essere scelta in funzione del profilo di esposizione negli esseri umani e delle informazioni disponibili sulle caratteristiche tossicologiche o cinetiche.
1.2 DEFINIZIONI
Effetto avverso: alterazione rispetto alle condizioni di base, riferibile al trattamento somministrato, che riduce la capacità di un organismo di sopravvivere, riprodursi o adattarsi all'ambiente.
Dose: quantità di sostanza somministrata. Viene espressa in peso (g, mg), oppure in peso per unità di peso dell'animale usato per il saggio (p. es. mg/kg), oppure concentrazione costante nella dieta (ppm).
Dosaggio: termine generale che indica la dose, la frequenza e la durata della somministrazione.
Neurotossicità: modificazione avversa che si produce nella struttura o nella funzione del sistema nervoso centrale in seguito all'esposizione a un agente chimico, biologico o fisico.
Neurotossico: agente chimico, biologico o fisico potenzialmente in grado di causare neurotossicità.
NOAEL: abbreviazione dell'inglese no observed adverse effect level; designa il livello di dose massimo in corrispondenza del quale non si osservano effetti avversi correlati al trattamento.
1.3 PRINCIPIO DEL METODO DI SAGGIO
La sostanza chimica in esame viene somministrata per via orale in un range di dosi a diversi gruppi di roditori da laboratorio. Normalmente sono necessarie dosi ripetute, e il regime di somministrazione può essere di 28 giorni, subcronico (90 giorni) o cronico (1 anno o più). I procedimenti indicati in questo metodo sono utilizzabili anche per studi di neurotossicità acuta. Il saggio eseguito sugli animali ha lo scopo di consentire l'individuazione o la caratterizzazione di anomalie del comportamento e/o neurologiche. In ciascun periodo di osservazione viene valutata una serie di comportamenti che potrebbero essere influenzati dai neurotossici. Al termine del saggio, all'interno di ciascun gruppo un sottogruppo di animali di ciascun sesso viene sottoposto a perfusione in situ e prelievo di tessuti del cervello, del midollo spinale e dei nervi periferici, destinati a un successivo esame.
Nel caso di studi a sé stanti condotti per determinare la neurotossicità di una sostanza o per caratterizzarne gli effetti neurotossici, gli animali di ciascun gruppo non utilizzati per la perfusione e il successivo esame istopatologico (vedi tabella 1) possono essere utilizzati per specifici esami neurocomportamentali, neuropatologici, neurochimici o elettrofisiologici allo scopo di completare i dati ricavati dagli esami standard previsti da questo metodo (1). Questi esami supplementari possono essere particolarmente utili qualora osservazioni empiriche o gli effetti attesi indichino che l'azione neurotossica della sostanza in esame si esercita su un tipo specifico di bersaglio. Altrimenti, gli animali rimanenti possono essere utilizzati per valutazioni analoghe a quelle previste da questo metodo nell'ambito di studi di tossicità per dose ripetuta nei roditori.
Quando gli esami previsti da questo metodo sono abbinati a esami previsti da altri metodi, è necessario disporre di un numero sufficiente di animali per poter eseguire le osservazioni richieste da entrambi gli studi.
1.4 DESCRIZIONE DEL METODO
1.4.1 Scelta della specie di animali
La specie di roditori da preferirsi è rappresentata dal ratto, ma è possibile utilizzare anche altre specie di roditori, fornendone adeguata motivazione. Gli animali utilizzati devono essere adulti giovani e sani appartenenti a ceppi comunemente usati in laboratorio. Le femmine devono essere nullipare e non gravide. Di norma, la somministrazione deve iniziare quanto prima possibile dopo il divezzamento, preferibilmente prima che gli animali abbiano raggiunto le sei settimane di età e in ogni caso prima che abbiano raggiunto le nove settimane di età. Tuttavia, quando questo studio viene eseguito in abbinamento ad altri studi, può essere necessario un aggiustamento del criterio relativo all'età degli animali. All'inizio dello studio, il peso degli animali deve essere del ± 20 % del peso medio per ciascun sesso. Quando uno studio per dose ripetuta di breve durata serve da studio preliminare per uno studio a lungo termine, nei due studi devono essere utilizzati animali dello stesso ceppo e della stessa provenienza.
1.4.2 Condizioni di stabulazione e di alimentazione
La temperatura dello stabulario deve essere di 22 oC (± 3 oC). L'umidità relativa deve essere preferibilmente del 50-60 %; in ogni caso deve essere non inferiore al 30 % e possibilmente non superiore al 70 %, tranne durante la pulizia dei locali. L'illuminazione deve essere artificiale e alternare 12 ore di luce e 12 ore di oscurità. I rumori forti intermittenti devono essere ridotti al minimo. Per l'alimentazione, si possono utilizzare diete convenzionali da laboratorio con acqua ad libitum. La scelta della dieta può essere influenzata dalla necessità di garantire un'adeguata miscelazione della sostanza in esame, allorché essa viene somministrata con questo metodo. Gli animali devono essere alloggiati in gabbie individuali o contenenti piccoli gruppi dello stesso sesso.
1.4.3 Preparazione degli animali
L'assegnazione al gruppo di trattamento e al gruppo di controllo viene effettuata in modo casuale scegliendo animali giovani e sani. Le gabbie devono essere sistemate in modo da ridurre al minimo eventuali effetti dovuti alla loro collocazione. Gli animali devono essere identificati in modo univoco e tenuti nelle gabbie per almeno 5 giorni prima dell'inizio dello studio, in modo da consentirne l'acclimatazione alle condizioni di laboratorio.
1.4.4 Via di somministrazione e preparazione delle dosi
Questo metodo prevede espressamente la somministrazione orale della sostanza da esaminare. La somministrazione può essere effettuata per via intragastrica, con gli alimenti, nell'acqua di bevanda o mediante capsule. Si possono utilizzare anche altre vie di somministrazione (ad es. cutanea o per inalazione), ma in questo caso può essere necessario modificare i procedimenti raccomandati. La via di somministrazione deve essere scelta in funzione del profilo di esposizione degli esseri umani e delle informazioni disponibili sulle caratteristiche tossicologiche o cinetiche. Si devono comunque indicare i motivi della scelta della via di somministrazione e le conseguenti modifiche dei procedimenti previsti da questo metodo.
Se necessario, la sostanza da esaminare può essere disciolta o sospesa in un veicolo adatto. Ove possibile, si raccomanda di utilizzare una soluzione/sospensione acquosa, oppure, come seconda alternativa, una soluzione/sospensione in olio (per esempio olio di mais), o infine una soluzione/sospensione in altri veicoli. Le caratteristiche di tossicità del veicolo devono essere note. È opportuno inoltre verificare le seguenti caratteristiche del veicolo: effetti del veicolo sull'assorbimento, sulla distribuzione, sul metabolismo o sulla ritenzione della sostanza in esame che potrebbero alterare le caratteristiche tossiche di tale sostanza; ed effetti sul consumo di cibo o di acqua o sullo stato nutrizionale degli animali.
1.5 PROCEDIMENTI
1.5.1 Numero e sesso degli animali
Quando lo studio viene condotto come studio a sé stante, ciascun gruppo di trattamento e di controllo deve essere composto almeno da 20 animali (10 femmine e 10 maschi) ai fini della valutazione delle osservazioni cliniche e funzionali dettagliate. Al termine dello studio, almeno cinque maschi e cinque femmine, scelti tra questi 10 maschi e 10 femmine, devono essere sottoposti a perfusione in situ e a esame neuroistopatologico dettagliato. Nei casi in cui solo un numero limitato di animali all'interno di un determinato gruppo di trattamento venga sottoposto a osservazione per rilevare segni di effetti neurotossici, è opportuno includere tali animali tra quelli scelti per la perfusione. Quando lo studio viene condotto in abbinamento a uno studio di tossicità per dose ripetuta, si deve prevedere l'utilizzo di un numero di animali sufficiente per gli obiettivi di entrambi gli studi. Nella tabella 1 è riportato, per varie combinazioni di studi, il numero minimo di animali da utilizzare per ciascun gruppo. Se sono previsti sacrifici intermedi nel corso dello studio, o gruppi di recupero per l'osservazione della reversibilità, della persistenza o della comparsa tardiva di effetti tossici dopo il trattamento, oppure se sono previste osservazioni supplementari, il numero di animali deve essere opportunamente aumentato affinché sia disponibile il numero di animali necessario per l'osservazione e l'esame istopatologico.
1.5.2 Gruppi di trattamento e gruppo di controllo
In genere si devono utilizzare almeno tre gruppi di trattamento a dosi diverse e un gruppo di controllo; tuttavia, se la valutazione di altri dati porta a prevedere l'assenza di effetti a una dose ripetuta di 1 000 mg/kg di peso corporeo/giorno, può essere eseguito un saggio limite. Per stabilire le dosi da utilizzare, in mancanza di dati adeguati si può effettuare uno studio preliminare di tipo range finding. Fatta eccezione per la somministrazione della sostanza da esaminare, gli animali del gruppo di controllo devono essere trattati in modo identico agli esemplari del gruppo di controllo. Qualora la sostanza da saggiare venga incorporata in un veicolo, al gruppo di controllo verrà somministrato il medesimo veicolo nel volume massimo utilizzato.
1.5.3 Controllo di attendibilità
Il laboratorio che esegue lo studio deve presentare dati che dimostrino la capacità dello stesso di eseguire lo studio, nonché la sensibilità dei procedimenti utilizzati. Tali dati devono provare la capacità di individuare e quantificare, nel modo più opportuno, modificazioni dei diversi endpoint di cui è raccomandata l'osservazione, quali segni autonomici, reattività sensoriale, forza di prensione e attività motoria. Per informazioni su sostanze chimiche che causano vari tipi di risposte neurotossiche e che possono essere utilizzate come sostanze di controllo positivo si rimanda alle voci bibliografiche da (2) a (9). È ammesso l'uso di dati storici, che si raccomanda di aggiornare periodicamente, a condizione che siano identici gli aspetti essenziali dei procedimenti sperimentali. Nuovi dati che dimostrino che i procedimenti continuano a essere sensibili devono essere elaborati ogniqualvolta venga modificato un elemento essenziale del saggio o dei procedimenti.
1.5.4 Scelta della dose
I livelli di dose devono essere scelti tenendo conto di tutti i dati esistenti sulla tossicità e sulle caratteristiche cinetiche della sostanza da esaminare o di sostanze affini. Il livello di dose più elevato deve essere tale da indurre effetti neurotossici o chiari effetti tossici sistemici. Deve essere inoltre definita una serie decrescente di livelli di dose al fine di individuare un'eventuale risposta dose-correlata e l'assenza di effetti avversi osservati al livello di dose più basso (NOAEL). In linea di massima, i livelli di dose devono essere tali da consentire di distinguere gli effetti tossici primari sul sistema nervoso dagli effetti legati alla tossicità sistemica. Per la determinazione dei livelli di dose decrescenti risulta spesso ottimale applicare un fattore di divisione compreso tra due e tre; è comunque preferibile aggiungere un quarto gruppo di studio piuttosto che avere uno scarto eccessivo (ad esempio superiore a un fattore 10) tra un dosaggio e l'altro. Se esistono stime attendibili sull'esposizione umana prevista, se ne deve tenere conto.
1.5.5 Saggio limite
Se uno studio effettuato conformemente al metodo descritto con un livello di dose di almeno 1 000 mg/kg di peso corporeo/giorno non produce effetti neurotossici osservabili e se i dati relativi a composti di struttura affine non sono suggestivi di tossicità, può non essere necessario eseguire uno studio completo con tre livelli di dose. In funzione dell'esposizione umana prevista può essere opportuno utilizzare un livello di dose orale più elevato nel saggio limite. Per altri tipi di somministrazione, ad esempio per inalazione o applicazione cutanea, il livello massimo di esposizione realizzabile dipende in molti casi dalle proprietà fisico-chimiche della sostanza da esaminare. La dose da utilizzare in un saggio limite per uno studio di neurotossicità acuta per via orale deve essere di almeno 2 000 mg/kg.
1.5.6 Somministrazione delle dosi
La sostanza viene somministrata agli animali giornalmente, sette giorni su sette, per un periodo di almeno 28 giorni. La scelta di somministrare la sostanza cinque giorni alla settimana o per un periodo più breve deve essere opportunamente motivata. Se viene effettuata per via intragastrica, la somministrazione deve avvenire in dose singola mediante sonda gastrica o idonea cannula per intubazione. Il volume massimo di liquido somministrabile in una volta sola dipende dalla taglia dell'animale, ma non deve superare 1 ml/100 g di peso corporeo tranne nel caso delle soluzioni acquose, per le quali si possono prevedere fino a 2 ml/100 g di peso corporeo. Salvo nel caso di sostanze irritanti o corrosive, i cui effetti di norma tendono a esacerbarsi con l'aumentare della concentrazione, la variabilità del volume somministrato deve essere ridotta al minimo variando la concentrazione, in modo da mantenere un volume costante per tutti i livelli di dose.
Se la sostanza in esame è somministrata con la dieta o con l'acqua, è importante verificare che le quantità da utilizzare non alterino il normale bilancio idrico o nutrizionale. Se la sostanza è somministrata con la dieta, si può utilizzare una concentrazione costante nella dieta (ppm) o un livello di dose costante in funzione del peso degli animali, avendo cura di specificare quale sia l'alternativa prescelta. Se la sostanza è somministrata per via intragastrica, la dose deve essere somministrata ogni giorno alla stessa ora e all'occorrenza modificata per mantenere costante il livello di dose rispetto al peso dell'animale. Qualora, prima di uno studio a lungo termine, si effettui uno studio preliminare per dose ripetuta, la dieta degli animali deve essere identica nei due studi. Per gli studi acuti, nel caso in cui non sia possibile effettuare la somministrazione in un'unica dose, si può procedere al frazionamento della stessa e alla somministrazione delle varie frazioni nell'arco di un periodo non superiore a 24 ore.
1.6 OSSERVAZIONE
1.6.1 Frequenza delle osservazioni e degli esami
Negli studi per dose ripetuta, il periodo di osservazione deve coprire il periodo della somministrazione. Negli studi acuti, l'osservazione deve estendersi ai 14 giorni successivi al trattamento. Nel caso degli animali dei gruppi satellite, per i quali è previsto un periodo post-trattamento senza esposizione, l'osservazione deve comprendere anche questo periodo.
Le osservazioni devono essere effettuate con frequenza tale da assicurare la massima probabilità che vengano individuate le anomalie comportamentali e/o neurologiche. Le osservazioni devono essere effettuate preferibilmente ogni giorno alla stessa ora, tenendo conto del periodo probabile di massima intensità degli effetti dopo la somministrazione. La frequenza delle osservazioni cliniche e degli esami funzionali è riassunta nella tabella 2. Se in base ai dati cinetici o di altro tipo ricavati in precedenza appare necessario effettuare le osservazioni o gli esami funzionali in momenti diversi rispetto a quelli previsti o variare i periodi post-osservazione, deve essere elaborato un programma alternativo che consenta di ricavare quante più informazioni possibile. Queste variazioni devono essere adeguatamente motivate.
1.6.1.1 Osservazione delle condizioni generali di salute e della mortalità/morbilità
Tutti gli animali devono essere esaminati attentamente almeno una volta al giorno per verificare le condizioni di salute e almeno due volte al giorno per determinare la morbilità e la mortalità.
1.6.1.2 Osservazioni cliniche dettagliate
Osservazioni cliniche dettagliate devono essere eseguite su tutti gli animali scelti a questo scopo (vedi tabella 1) una volta prima dell'esposizione iniziale (per consentire un confronto sullo stesso soggetto) e successivamente a diversi intervalli, in funzione della durata dello studio (vedi tabella 2). Nel caso degli animali dei gruppi satellite di recupero, le osservazioni cliniche dettagliate devono essere eseguite al termine del periodo di recupero. Le osservazioni cliniche dettagliate devono essere eseguite fuori dalle gabbie, collocando gli animali in un recinto standard. Le osservazioni devono essere accuratamente registrate, possibilmente utilizzando sistemi di punteggio che comprendano criteri o scale di punteggi esplicitamente definiti dal laboratorio che esegue il saggio per ciascuna delle misurazioni effettuate. Le variazioni delle condizioni sperimentali devono essere minime (non legate sistematicamente al trattamento) e le osservazioni devono essere condotte da osservatori preparati non a conoscenza del trattamento somministrato.
Si raccomanda di eseguire le osservazioni in modo strutturato, così da applicare sistematicamente criteri ben definiti (compresa la definizione del range normale) a ciascun animale in ciascuna osservazione. Il range normale deve essere adeguatamente documentato. Tutti i segni osservati devono essere registrati. Ogniqualvolta ciò sia possibile, deve essere registrata anche l'entità dei segni osservati. Le osservazioni cliniche devono riguardare, tra l'altro, tutte le alterazioni della cute, del pelo, degli occhi e delle mucose, la comparsa di secrezioni ed escrezioni e l'attività autonomica (ad es. lacrimazione, piloerezione, ampiezza pupillare, ritmo respiratorio insolito e/o respirazione attraverso la bocca, anomalie nella minzione o nella defecazione, e variazione di colore dell'urina).
Deve essere registrata anche ogni risposta inusuale riguardante la posizione del corpo, il livello di attività (ad es. maggiore o minore esplorazione del recinto standard) e la coordinazione dei movimenti. Devono essere inoltre registrate le modificazioni dell'andatura (ad es. andatura anserina, atassia), della postura (ad es. gobba) e della reattività alla manipolazione, al posizionamento o ad altri stimoli ambientali, come pure la presenza di movimenti clonici o tonici, convulsioni o tremori, stereotipi (ad es. tolettatura eccessiva, movimenti inusuali della testa, continuo girare in tondo) o comportamenti insoliti (ad es. tendenza a mordere o tendenza eccessiva a leccarsi, automutilazione, marcia a ritroso, vocalizzazione) o aggressivi.
1.6.1.3 Esami funzionali
Analogamente alle osservazioni cliniche dettagliate, anche gli esami funzionali devono essere eseguiti una volta prima dell'esposizione e successivamente a intervalli frequenti in tutti gli animali scelti a questo scopo (vedi tabella 1). La frequenza degli esami funzionali dipende anche dalla durata dello studio (vedi tabella 2). Oltre che agli intervalli indicati nella tabella 2, nei gruppi satellite di recupero devono essere effettuate osservazioni funzionali anche quanto più vicino possibile al sacrificio finale. Tra gli esami funzionali dev'essere compresa la valutazione della reattività sensoriale a stimoli di diverso tipo [ad es. stimoli uditivi, visivi e propriocettivi (5)(6)(7)], della forza di prensione (8) e dell'attività motoria (9). L'attività motoria deve essere misurata con un dispositivo automatizzato in grado di rilevare sia un aumento che una diminuzione della stessa. Se si utilizza un altro sistema, questo deve essere quantitativo e presentare sensibilità e affidabilità dimostrate. Ciascun dispositivo deve essere collaudato per garantire l'affidabilità nel tempo e l'omogeneità delle sue caratteristiche rispetto a quelle degli altri dispositivi. Ulteriori indicazioni sui procedimenti utilizzabili sono contenute nelle voci bibliografiche citate. Se non esistono dati (ad es. struttura-attività, dati epidemiologici, altri studi tossicologici) che indicano i potenziali effetti neurotossici, è opportuno prevedere l'esecuzione di esami più specifici sulla funzione sensoriale e motoria o sull'apprendimento e sulla memoria per valutare in maggior dettaglio questi possibili effetti. Per ulteriori informazioni sugli esami più specifici e sul loro impiego, si rimanda alla voce bibliografica (1).
In via eccezionale, gli animali che presentano segni di tossicità tali da interferire in modo significativo con gli esami funzionali possono essere esclusi da tali esami, fornendone opportuna motivazione.
1.6.2 Peso corporeo e consumo di cibo/acqua
Negli studi di durata fino a 90 giorni, tutti gli animali devono essere pesati almeno una volta alla settimana e almeno settimanalmente deve essere determinato il loro consumo di cibo (o di acqua, nel caso in cui la sostanza in esame venga somministrata con l'acqua). Negli studi a lungo termine, tutti gli animali devono essere pesati almeno una volta alla settimana nelle prime 13 settimane e successivamente almeno una volta ogni quattro settimane. Il consumo di cibo (o di acqua, nel caso in cui la sostanza in esame venga somministrata con l'acqua) deve essere misurato almeno una volta alla settimana nelle prime 13 settimane e successivamente a intervalli di circa tre mesi, sempreché non appaia opportuno modificare tale frequenza alla luce dello stato di salute degli animali o di variazioni del loro peso corporeo.
1.6.3 Esame oftalmologico
Per studi di durata superiore a 28 giorni deve essere effettuato un esame oftalmologico, utilizzando un oftalmoscopio o uno strumento equivalente adatto, prima della somministrazione della sostanza in esame e al termine dello studio, preferibilmente su tutti gli animali e in ogni caso almeno sugli animali del gruppo di trattamento a dose elevata e del gruppo di controllo. In presenza di modificazioni degli occhi o di segni clinici che ne indichino l'opportunità, l'esame deve essere effettuato su tutti gli animali. Negli studi a lungo termine, l'esame oftalmologico deve essere effettuato anche alla tredicesima settimana. Gli esami oftalmologici non sono necessari se i relativi dati possono essere ricavati da altri studi di durata e con livelli di dose simili.
1.6.4 Esami ematologici e biochimici clinici
Quando lo studio di neurotossicità viene effettuato in abbinamento a uno studio di tossicità sistemica per dose ripetuta, devono essere eseguiti gli esami ematologici e biochimici-clinici previsti dal metodo dello studio di tossicità sistemica. Il prelievo dei campioni deve avvenire in modo da ridurre al minimo i potenziali effetti neurocomportamentali.
1.6.5 Esame istopatologico
L'esame neuropatologico deve integrare e ampliare le osservazioni effettuate nella fase in vivo dello studio. A tal fine, si deve procedere alla fissazione in situ dei tessuti di almeno 5 animali/sesso/gruppo (vedi tabella 1 e il seguente paragrafo), utilizzando tecniche di perfusione e fissazione generalmente accettate [vedi voce bibliografica (3), capitolo 5 e voce bibliografica (4), capitolo 50]. Tutte le modificazioni macroscopiche osservabili devono essere registrate. Se lo studio è eseguito come studio a sé stante per la valutazione della neurotossicità o la caratterizzazione degli effetti neurotossici, gli animali rimanenti possono essere utilizzati per specifici esami neurocomportamentali (10)(11), neuropatologici (10)(11)(12)(13), neurochimici (10)(11)(14)(15) o elettrofisiologici (10)(11)(16)(17) a integrazione dei test e degli esami qui descritti, o sottoposti anch'essi a esame istopatologico. Questi esami supplementari sono particolarmente utili quando, in base a osservazioni empiriche o agli effetti attesi, si prevede un tipo specifico di neurotossicità o un target specifico (2)(3). In alternativa, gli animali rimanenti possono essere anch'essi utilizzati per le valutazioni patologiche di routine descritte nel metodo relativo agli studi per dose ripetuta.
Tutti i campioni di tessuti, inclusi in paraffina, devono essere colorati con un procedimento di colorazione generale, ad esempio con ematossilina-eosina, quindi sottoposti a esame microscopico. Se si osservano o si sospettano segni di neuropatia periferica, si deve procedere all'esame di campioni di tessuti di nervi periferici inclusi in plastica. In base ai segni clinici, può essere opportuno estendere l'esame ad altri siti o utilizzare procedure di colorazione speciali. Per indicazioni sugli ulteriori siti da esaminare si rimanda alle voci bibliografiche (3)(4). Può essere utile anche utilizzare opportuni coloranti speciali per provare tipi specifici di modificazioni patologiche (18).
Sezioni rappresentative del sistema nervoso centrale e del sistema nervoso periferico devono essere sottoposte a esame istologico [vedi voce bibliografica (3), capitolo 5 e voce bibliografica (4), capitolo 50]. Di norma, i prelievi tissutali devono essere effettuati almeno su: prosencefalo, area centrale del cervello, compresa una sezione che attraversi l'ippocampo, mesencefalo, cervelletto, ponte, midollo allungato, occhio con nervo ottico e retina, midollo spinale a livello dei rigonfiamenti cervicale e lombare, gangli della radice dorsale, fibre della radice dorsale e ventrale, nervo sciatico prossimale, nervo tibiale prossimale (a livello del ginocchio) e ramificazioni del nervo tibiale a livello dei muscoli del polpaccio. Per il midollo spinale e i nervi periferici, le sezioni devono essere sia trasversali che longitudinali. Deve essere osservata la vascolarizzazione del sistema nervoso. Deve essere esaminato anche un campione di muscolo scheletrico, in particolare dei muscoli del polpaccio. Particolare attenzione deve essere rivolta a punti del SNC e SNP con strutture e modelli cellulari e delle fibre notoriamente molto sensibili all'azione dei neurotossici.
Indicazioni sulle alterazioni neuropatologiche tipiche indotte dall'esposizione a tossici sono contenute nelle voci bibliografiche (3)(4). Si raccomanda di sottoporre i campioni tissutali a un esame articolato in più fasi. Innanzitutto, si devono confrontare sezioni di tessuti prelevati da esemplari del gruppo trattato con dose elevata a sezioni di tessuti prelevati da esemplari del gruppo di controllo. Se non vengono osservate alterazioni neuropatologiche, non sono necessarie ulteriori analisi. Se invece vengono osservate alterazioni neuropatologiche nel gruppo trattato con dose elevata, si procede assegnando un numero di codice ed esaminando sequenzialmente campioni di ciascuno dei tessuti potenzialmente interessati prelevati da esemplari dei gruppi trattati con dose intermedia e con dose bassa.
Se all'esame qualitativo vengono riscontrate alterazioni neuropatologiche, deve essere effettuato un secondo esame su tutte le regioni del sistema nervoso che manifestano tali alterazioni. Dopo aver assegnato un codice a tutte le sezioni prelevate da ciascuna delle regioni potenzialmente interessate in tutti i gruppi trattati, si fanno esaminare le sezioni in modo casuale da persone all'oscuro del significato dei codici e si registrano la frequenza e la gravità di ciascuna lesione. Terminata la classificazione di tutte le regioni di tutti i gruppi trattati, si apre il codice e si procede all'analisi statistica per valutare le relazioni dose-risposta, avendo cura inoltre di descrivere esempi dei diversi livelli di gravità di ciascuna lesione.
I reperti neuropatologici devono essere valutati nel contesto delle osservazioni e misurazioni comportamentali, come pure di altri dati ricavati da studi precedenti o contemporanei sulla tossicità sistemica della sostanza in esame.
2. DATI
2.1 ELABORAZIONE DEI RISULTATI
Devono essere forniti dati individuali su ciascun animale. Inoltre, tutti i dati devono essere riassunti in una tabella indicante, per ogni gruppo di trattamento o di controllo, il numero di animali all'inizio del saggio, il numero di animali rinvenuti morti durante il saggio o sottoposti a eutanasia, nonché il momento del decesso di ciascun animale morto spontaneamente o sottoposto a eutanasia, il numero di animali che hanno manifestato segni di tossicità, una descrizione dei segni di tossicità osservati con indicazione del momento di insorgenza, della durata, del tipo e della gravità degli effetti tossici, il numero di animali che hanno manifestato lesioni, con indicazione del tipo e della gravità delle lesioni.
2.2 VALUTAZIONE E INTERPRETAZIONE DEI RISULTATI
I risultati dello studio devono essere valutati in termini di incidenza, gravità e correlazione tra effetti neurocomportamentali e neuropatologici (compresi gli effetti neurochimici o elettrofisiologici, nonché gli effetti riscontrati con gli eventuali esami supplementari effettuati) e qualsiasi altro effetto avverso osservato. Se possibile, i risultati numerici devono essere valutati sulla base di un metodo statistico appropriato e comunemente accettato. I metodi statistici devono essere selezionati durante la fase di progettazione dello studio.
3. PRESENTAZIONE DEI DATI
3.1. RELAZIONE SUL SAGGIO
La relazione sul saggio deve includere le seguenti informazioni:
|
|
Sostanza in esame:
|
—
|
natura fisica (compresi isomerismo, purezza e proprietà fisico-chimiche);
|
|
|
|
Veicolo (se del caso):
|
—
|
motivazione della scelta del veicolo.
|
|
|
|
Animali da laboratorio:
|
—
|
specie/ceppo impiegati;
|
|
—
|
numero, età e sesso degli animali;
|
|
—
|
provenienza, condizioni di stabulazione, acclimatazione, dieta, ecc.;
|
|
—
|
peso di ciascun animale all'inizio del saggio.
|
|
|
|
Condizioni sperimentali:
|
—
|
informazioni dettagliate sulla formulazione della sostanza in esame/preparazione della dieta, sulla concentrazione utilizzata, sulla stabilità e sull'omogeneità del preparato;
|
|
—
|
dosi somministrate, caratteristiche del veicolo, volume e forma fisica del preparato somministrato;
|
|
—
|
modalità precise di somministrazione della sostanza in esame;
|
|
—
|
motivazione della scelta dei livelli di dose;
|
|
—
|
motivazione della scelta della via e della durata di esposizione;
|
|
—
|
se del caso, conversione della concentrazione della sostanza nella dieta o nell'acqua (ppm) in dose effettiva (mg/kg di peso corporeo/giorno);
|
|
—
|
informazioni dettagliate sulla qualità degli alimenti e dell'acqua.
|
|
|
|
Osservazione e procedimenti del saggio:
|
—
|
informazioni dettagliate sull'assegnazione degli animali di ciascun gruppo ai sottogruppi destinati alla perfusione;
|
|
—
|
informazioni dettagliate sui sistemi di punteggio utilizzati, compresi criteri e scale di punteggio impiegati per ciascuna misurazione effettuata nel corso delle osservazioni cliniche dettagliate;
|
|
—
|
informazioni dettagliate sugli esami funzionali per la valutazione della reattività sensoriale a stimoli di diverso tipo (p. es. uditivi, visivi e propriocettivi), della forza di prensione, dell'attività motoria (comprese indicazioni particolareggiate sui dispositivi automatizzati impiegati per rilevare l'attività); altri esami eseguiti;
|
|
—
|
informazioni dettagliate sugli esami oftalmologici e, se del caso, sugli esami ematologici e sugli esami di biochimica clinica con i rispettivi valori di riferimento;
|
|
—
|
informazioni dettagliate su specifici esami neurocomportamentali, neuropatologici, neurochimici o elettrofisiologici.
|
|
|
|
Risultati:
|
—
|
peso corporeo e relative modificazioni, compreso il peso corporeo al momento del sacrificio;
|
|
—
|
consumo di cibo e consumo d'acqua, se del caso;
|
|
—
|
dati sulla risposta tossica per sesso e per livello di dose, compresi i segni di tossicità o mortalità;
|
|
—
|
natura, gravità e durata (momento di insorgenza e successivo decorso) degli effetti clinici osservati (sia reversibili che non reversibili);
|
|
—
|
descrizione dettagliata di tutti i risultati degli esami funzionali;
|
|
—
|
descrizione dettagliata dei risultati di tutti gli eventuali esami neurocomportamentali, neuropatologici e neurochimici o elettrofisiologici;
|
|
—
|
eventuali dati sull'assorbimento e sul metabolismo;
|
|
—
|
elaborazione statistica dei risultati, se del caso.
|
|
|
|
Discussione dei risultati:
|
—
|
informazioni sulla relazione dose-risposta;
|
|
—
|
relazione tra eventuali altri effetti tossici e la conclusione sul potenziale neurotossico della sostanza chimica in esame;
|
|
|
|
Conclusioni:
|
—
|
viene incoraggiata l'inclusione di una indicazione specifica della neurotossicità complessiva della sostanza chimica esaminata.
|
|
4. RIFERIMENTI BIBLIOGRAFICI
|
(1)
|
OECD Guidance Document on Neurotoxicity Testing Strategies and Test Methods. OCSE, Parigi. In preparazione.
|
|
(2)
|
Test Guideline for a Developmental Neurotoxicity Study, OECD Guidelines for the Testing of Chemicals. In preparazione.
|
|
(3)
|
World Health Organisation (WHO) (1986). Environmental Health Criteria document 60: Principles and Methods for the Assessment of Neurotoxicity associated with Exposure to Chemicals.
|
|
(4)
|
Spencer P.S., Schaumburg H.H. (1980). Experimental and Clinical Neurotoxicology. A cura di Spencer, P.S. e Schaumburg, H.H., Williams e Wilkins, Baltimora/Londra.
|
|
(5)
|
Tupper D.E., Wallace R.B. (1980). Utility of the Neurological Examination in Rats. Acta Neurobiol. Exp., 40, 999-1003.
|
|
(6)
|
Gad, S.C. (1982). A Neuromuscular Screen for Use in Industrial Toxicology. J. Toxicol. Environ. Health, 9, 691-704.
|
|
(7)
|
Moser V.C., McDaniel K.M., Phillips P.M. (1991). Rat Strain and Stock Comparisons Using a Functional Observational Battery: Baseline Values and Effects of amitraz. Toxic. Appl. Pharmacol., 108, 267-283.
|
|
(8)
|
Meyer O.A., Tilson H.A., Byrd W.C., Riley M.T. (1979). A Method for the Routine Assessment of Fore- and Hind- limb Grip Strength of Rats and Mice. Neurobehav. Toxicol., 1, 233-236.
|
|
(9)
|
Crofton K.M., Haward J.L., Moser V.C., Gill M.W., Reirer L.W., Tilson H.A., MacPhail R.C. (1991) Interlaboratory Comparison of Motor Activity Experiments: Implication for Neurotoxicological Assessments. Neurotoxicol. Teratol., 13, 599-609.
|
|
(10)
|
Tilson H.A., Mitchell C.L. (a cura di). (1992). Neurotoxicology Target Organ Toxicology Series. Raven Press, New York.
|
|
(11)
|
Chang L.W. (a cura di). (1995). Principles of Neurotoxicology. Marcel Dekker, New York.
|
|
(12)
|
Broxup B. (1991). Neuropathology as a screen for Neurotoxicity Assessment. J. Amer. Coll. Toxicol., 10, 689-695.
|
|
(13)
|
Moser V.C., Anthony D.C., Sette W.F., MacPhail R.C. (1992). Comparison of Subchronic Neurotoxicity of 2-Hydroxyethyl Acrylate and Acrylamide in Rats. Fund. Appl.Toxicol., 18, 343-352.
|
|
(14)
|
O'Callaghan J.P. (1988). Neurotypic and Gliotypic Proteins as Biochemical Markers of Neurotoxicity. Eurotoxicol. Teratol., 10, 445-452.
|
|
(15)
|
O'Callaghan J.P., Miller D.B. (1988). Acute Exposure of the Neonatal Rat to Triethyltin Results in Persistent Changes in Neurotypic and Gliotypic Proteins. J. Pharmacol. Exp. Ther., 244, 368-378.
|
|
(16)
|
Fox. D.A., Lowndes H.E., Birkamper G.G. (1982). Electrophysiological Techniques in Neurotoxicology. In: Nervous System Toxicology. A cura di Mitchell C.L. Raven Press, New York, pagg. 299-335.
|
|
(17)
|
Johnson B.L. (1980). Electrophysiological Methods in neurotoxicity Testing. In: Experimental and Clinical Neurotoxicology. A cura di Spencer, P.S., Schaumburg, H.H., Williams and Wilkins Co., Baltimora/Londra, pagg. 726-742.
|
|
(18)
|
Bancroft J.D., Steven A. (1990). Theory and Pratice of Histological Techniques. Capitolo 17, Neuropathological Techniques. A cura di Lowe, James e Cox, Gordon. Churchill Livingstone.
|
Tabella 1
Numero minimo di animali necessari per ciascun gruppo per uno studio di neurotossicità a sé stante o abbinato ad altri studi
|
|
STUDIO DI NEUROTOSSICITÀ ESEGUITO COME:
|
|
Studio a sé stante
|
Studio abbinato a uno studio su 28 giorni
|
Studio abbinato a uno studio su 90 giorni
|
Studio abbinato a uno studio di tossicità cronica
|
|
Numero totale di animali per gruppo
|
10 maschi e 10 femmine
|
10 maschi e 10 femmine
|
15 maschi e 15 femmine
|
25 maschi e 25 femmine
|
|
Numero di animali scelti per gli esami funzionali, comprese le osservazioni cliniche dettagliate
|
10 maschi e 10 femmine
|
10 maschi e 10 femmine
|
10 maschi e 10 femmine
|
10 maschi e 10 femmine
|
|
Numero di animali scelti per la perfusione in situ e l'esame neuroistopatologico
|
5 maschi e 5 femmine
|
5 maschi e 5 femmine
|
5 maschi e 5 femmine
|
5 maschi e 5 femmine
|
|
Numero di animali scelti per le osservazioni sulla tossicità per dose ripetuta/subcronica/cronica, gli esami ematologici, di biochimica clinica, istopatologici, ecc. conformemente alle indicazioni delle rispettive linee guida
|
|
5 maschi e 5 femmine
|
10 maschi (10) e 10 femmine (10)
|
20 maschi (10) e 20 femmine (10)
|
|
Eventuali osservazioni supplementari
|
5 maschi e 5 femmine
|
|
|
|
Tabella 2
Frequenza dell'osservazione clinica e degli esami funzionali
|
Tipo di ossservazioni
|
Durata dello studio
|
|
Acuto
|
28 giorni
|
90 giorni
|
Cronico
|
|
In tutti gli animali
|
Condizioni di salute generali
|
una volta al giorno
|
una volta al giorno
|
una volta al giorno
|
una volta al giorno
|
|
Mortalità/morbilità
|
due volte al giorno
|
due volte al giorno
|
due volte al giorno
|
due volte al giorno
|
|
Negli animali scelti per le osservazioni funzionali
|
Osservazioni cliniche dettagliate
|
|
—
|
prima dell'esposizione iniziale
|
|
—
|
entro 8 ore dalla somministrazione nel momento di massimo effetto previsto
|
|
—
|
il 7 e 14 giorno dopo la somministrazione
|
|
|
—
|
prima dell'esposizione iniziale
|
|
—
|
successivamente una volta alla settimana
|
|
|
—
|
prima dell'esposizione iniziale
|
|
—
|
una volta durante la prima o seconda settimana di esposizione
|
|
—
|
successivamente una volta al mese
|
|
|
—
|
prima dell'esposizione iniziale
|
|
—
|
una volta alla fine del primo mese di esposizione
|
|
—
|
successivamente ogni tre mesi
|
|
|
Esami funzionali
|
|
—
|
prima dell'esposizione iniziale
|
|
—
|
entro 8 ore dalla somministrazione nel momento di massimo effetto previsto
|
|
—
|
il 7o e 14o giorno dopo la somministrazione
|
|
|
—
|
prima dell'esposizione iniziale
|
|
—
|
durante la quarta settimana di trattamento il più vicino possibile alla fine del periodo di esposizione
|
|
|
—
|
prima dell'esposizione iniziale
|
|
—
|
una volta durante la prima o seconda settimana di esposizione
|
|
—
|
successivamente una volta al mese
|
|
|
—
|
prima dell'esposizione iniziale
|
|
—
|
una volta alla fine del primo mese di esposizione
|
|
—
|
successivamente ogni tre mesi
|
|
B.44. ASSORBIMENTO CUTANEO: METODO IN VIVO
1. METODO
Il presente metodo corrisponde alle linee guida OCSE TG 427 (2004).
1.1 INTRODUZIONE
L'esposizione a molte sostanze chimiche avviene principalmente attraverso la pelle, ma la maggior parte degli studi tossicologici eseguiti su animali da laboratorio ricorre alla somministrazione orale. Lo studio dell'assorbimento percutaneo in vivo presentato in queste linee guida fornisce il collegamento necessario per estrapolare, da studi basati sulla somministrazione orale, dati utili per la valutazione dell'innocuità in caso di esposizione cutanea.
Prima di entrare in circolazione, una sostanza deve attraversare molti strati cellulari cutanei. Lo strato cineticamente determinante per la maggior parte delle sostanze è lo strato corneo, costituito da cellule morte. La permeabilità percutanea dipende sia dalla lipofilia della sostanza chimica che dallo spessore dello strato esterno dell'epidermide, nonché da fattori quali il peso molecolare e la concentrazione della sostanza. Generalmente, la pelle dei ratti e dei conigli è più permeabile di quella dell'uomo, mentre la permeabilità cutanea delle cavie e delle scimmie è più simile a quella umana. I metodi di misurazione dell'assorbimento percutaneo possono essere suddivisi in due categorie: metodi in vivo e metodi in vitro. Il metodo in vivo permette di ottenere buone informazioni sull'assorbimento cutaneo in varie specie animali di laboratorio. Più recentemente sono stati sviluppati i metodi in vitro, basati sul trasporto attraverso un campione di pelle umana o animale, di spessore totale o parziale, verso un serbatoio di fluidi.
Il metodo in vitro è descritto in un altro metodo di prova (1). Ai fini della scelta del metodo più idoneo per una determinata situazione, si raccomanda di consultare il documento dell'OCSE Guidance Document for the Conduct of Skin Absorption Studies (2), che contiene maggiori informazioni sull'idoneità dei metodi in vivo e in vitro.
Il metodo in vivo descritto nel presente documento permette di determinare la penetrazione della sostanza di prova attraverso la pelle fino al compartimento sistemico. Questa tecnica è ampiamente utilizzata da molti anni (3) (4) (5) (6) (7). Benché in molti casi sia possibile ricorrere a studi sull'assorbimento percutaneo in vitro, potrebbero esservi situazioni in cui soltanto uno studio in vivo permette di ottenere i dati necessari.
Il metodo in vivo presenta diversi vantaggi: utilizza un sistema intatto dal punto di vista fisiologico e metabolico, fa ricorso ad una specie comunemente utilizzata negli studi sulla tossicità e può essere adattato in modo da poter essere impiegato su altre specie. Gli svantaggi sono il ricorso ad animali vivi, la necessità di utilizzare sostanze radiomarcate per poter ottenere risultati affidabili, le difficoltà connesse alla determinazione della fase iniziale di assorbimento e le differenze di permeabilità tra la pelle della specie generalmente utilizzata (il ratto) e la pelle umana. La pelle degli animali è generalmente più permeabile, cosicché si rischia di sovrastimare l'assorbimento percutaneo umano (6)(8)(9). Le sostanze caustiche/corrosive non devono essere testate su animali vivi.
1.2 DEFINIZIONI
Dose non assorbita: la dose presente nell'acqua di risciacquo dell'epidermide dopo esposizione e sul bendaggio non occlusivo, ivi comprese le dosi che evaporano dalla pelle durante l'esposizione.
Dose assorbita (in vivo): comprende i residui presenti nell'urina, nell'acqua di risciacquo delle gabbie, negli escrementi, nell'aria espirata (se misurata), nel sangue, nei tessuti (se raccolti) e nella carcassa restante dopo il prelievo della pelle nel punto di applicazione della sostanza.
Dose assorbibile: dose presente sulla o nella pelle dopo il lavaggio.
1.3 PRINCIPIO DEL METODO
La sostanza di prova, preferibilmente radiomarcata, è applicata sulla pelle rasata degli animali in una o più concentrazioni idonee, sotto forma di preparazione rappresentativa delle preparazioni in uso. La preparazione di prova è lasciata a contatto con la pelle per un determinato periodo di tempo, ed è coperta con idoneo bendaggio (non occlusivo, semi-occlusivo o occlusivo) per evitarne l'ingestione. Al termine del periodo di esposizione, il bendaggio è rimosso e la pelle è pulita con un apposito prodotto detergente. Il bendaggio e il materiale utilizzato per la pulizia sono conservati per essere poi analizzati ed è applicato un nuovo bendaggio. Prima, durante e dopo il periodo di esposizione, gli animali sono collocati in gabbie metaboliche individuali e gli escrementi e l'aria espirata nelle diverse fasi sono raccolti ai fini della successiva analisi. Si può evitare di raccogliere l'aria espirata se i dati disponibili sono sufficienti a concludere che la formazione di metaboliti radioattivi è scarsa o assente. Ciascuno studio prevede generalmente l'esposizione di più gruppi di animali alla preparazione di prova. Gli animali di uno dei gruppi sono soppressi alla fine del periodo di esposizione. Gli animali degli altri gruppi sono soppressi successivamente, a intervalli prestabiliti. Al termine del periodo di campionamento, gli animali restanti vengono soppressi, il loro sangue viene raccolto per essere poi analizzato, la zona di pelle su cui era stata applicata la sostanza viene prelevata ai fini della successiva analisi e la carcassa viene esaminata per individuare l'eventuale presenza di materia non escreta. Si procede quindi all'analisi dei campioni con metodi adeguati e alla stima del grado di assorbimento percutaneo (6) (8) (9).
1.4 DESCRIZIONE DEL METODO
1.4.1 Scelta della specie animale
Il ratto è la specie più frequentemente utilizzata, ma possono essere utilizzati anche ceppi glabri e specie che presentano tassi di assorbimento cutaneo più vicini a quelli umani (3) (6) (7) (8) (9). Di preferenza sono impiegati giovani animali adulti sani dello stesso sesso (maschi, ove non espressamente indicato), appartenenti ai ceppi di laboratorio generalmente utilizzati. All'inizio dello studio, la variazione di peso degli animali utilizzati non può superare ± 20 % del peso medio. A titolo di esempio, sono adatti i ratti maschi di peso compreso tra 200 e 250 g, specialmente quelli il cui peso è situato nella metà superiore di tale intervallo.
1.4.2 Numero e sesso degli animali
Per ciascuna preparazione di prova e ciascuna fase di soppressione programmata deve essere utilizzato un gruppo di almeno quattro animali dello stesso sesso. Ciascun gruppo di animali è soppresso a intervalli di tempo differenti, ad esempio alla fine del periodo di esposizione (in genere, 6 o 24 ore) e in momenti successivi (ad esempio, dopo 48 e 72 ore). Se i dati disponibili indicano differenze sostanziali a livello della tossicità cutanea tra maschi e femmine, sarà selezionato il sesso più sensibile. In assenza di dati di questo tipo, si potrà utilizzare indifferentemente l'uno o l'altro sesso.
1.4.3 Condizioni di stabulazione e di alimentazione
La temperatura dello stabulario deve essere di 22 oC (± 3 oC). L'umidità relativa deve essere preferibilmente del 50-60 %; in ogni caso deve essere non inferiore al 30 % e possibilmente non superiore al 70 %, tranne durante la pulizia del laboratorio. L'illuminazione deve essere artificiale, con un'alternanza di 12 ore di luce e 12 ore di buio. Per l'alimentazione, si possono utilizzare diete convenzionali da laboratorio, con cibo liberamente disponibile e acqua potabile in quantità illimitata. Durante lo studio e preferibilmente anche durante il periodo di acclimatazione, gli animali sono alloggiati in gabbie metaboliche individuali. Poiché la fuoriuscita accidentale di cibo e di acqua rischia di compromettere i risultati, sarà necessario ridurre al minimo la probabilità che tale evento si verifichi.
1.4.4 Preparazione degli animali
Gli animali sono contrassegnati in modo da poter essere identificati e lasciati nella loro gabbia per almeno cinque giorni prima dell'inizio dello studio, onde permetterne l'acclimatazione alle condizioni del laboratorio.
Al termine del periodo di acclimatazione e circa 24 ore prima della somministrazione della sostanza di prova, si rasa una zona di pelle nella regione delle spalle e del dorso di ciascun animale. Poiché la capacità di penetrazione della pelle danneggiata è diversa da quella della pelle intatta, si deve aver cura di non procurare abrasioni cutanee. Dopo la rasatura e circa 24 ore prima dell'applicazione della sostanza di prova sulla pelle (cfr. sezione 1.4.7), la superficie cutanea è lavata con acetone per rimuovere il sebo. Non è opportuno lavare ulteriormente la pelle con acqua saponata, poiché i residui di sapone rischiano di favorire l'assorbimento della sostanza di prova. La zona di applicazione deve essere abbastanza grande (preferibilmente almeno 10 cm2) da consentire un calcolo affidabile della quantità di sostanza chimica di prova assorbita per cm2 di pelle. Una zona di tali dimensioni può essere facilmente individuata in ratti di peso compreso fra 200 e 250 g. Dopo la preparazione, gli animali sono collocati nuovamente nelle gabbie metaboliche.
1.4.5 Sostanza di prova
La sostanza di prova è la sostanza di cui si intendono studiare le caratteristiche di penetrazione. Preferibilmente tale sostanza deve essere radiomarcata.
1.4.6 Preparazione della sostanza di prova
La preparazione della sostanza di prova (ad esempio, materiale puro, diluito o formulato contenente la sostanza di prova e applicato sulla pelle) deve essere la stessa a cui possono essere esposti gli esseri umani o le altre specie potenzialmente interessate, o un adeguato sostituto. Qualsiasi variazione dalla preparazione d'uso deve essere giustificata. Ove necessario, la sostanza di prova è disciolta o sospesa in un veicolo adeguato. Per veicoli diversi dall'acqua, devono essere note le caratteristiche di assorbimento e l'interazione potenziale con la sostanza di prova.
1.4.7 Applicazione sulla pelle
Si delimita sulla superficie cutanea una zona di applicazione di dimensioni prestabilite. Successivamente si applica su questa zona, in maniera uniforme, una quantità nota della preparazione di prova. Normalmente la quantità applicata deve simulare l'esposizione umana potenziale (generalmente 1-5 mg/cm2 per i solidi e fino a 10 μl/cm2 per i liquidi). L'utilizzo di altre quantità deve essere giustificato in base alle condizioni di uso previste, agli obiettivi dello studio o alle caratteristiche fisiche della preparazione di prova. Dopo l'applicazione, la zona di pelle trattata deve essere protetta in modo che l'animale non possa effettuare la tolettatura. La figura 1 mostra un esempio di dispositivo tipicamente utilizzato a tal fine. Normalmente la zona di pelle su cui è effettuata l'applicazione è protetta con un bendaggio non occlusivo (ad es. garza di nylon permeabile). Tuttavia, in caso di applicazioni illimitate occorre un bendaggio occlusivo. Qualora il saggio riguardi sostanze semivolatili, se l'evaporazione provoca una riduzione inaccettabile del tasso di recupero della sostanza di prova (cfr. anche la prima parte del punto 1.4.10) è necessario raccogliere la sostanza evaporata in un filtro a carbone che copra il dispositivo di applicazione (cfr. figura 1). È importante che il dispositivo utilizzato non danneggi la pelle e non assorba il preparato di prova né reagisca con esso. Gli animali sono poi nuovamente collocati nelle gabbie metaboliche individuali per la raccolta degli escrementi.
1.4.8 Durata dell'esposizione e campionamento
La durata dell'esposizione è l'intervallo di tempo tra l'applicazione e la rimozione del preparato di prova mediante lavaggio della pelle. Il periodo di esposizione utilizzato (normalmente 6 o 24 ore) deve essere scelto in funzione della probabile durata dell'esposizione umana. Dopo il periodo di esposizione, gli animali sono tenuti nelle gabbie metaboliche fino alla loro soppressione programmata e sono sottoposti ad osservazione periodica per l'intera durata del saggio, onde rilevare eventuali segni di tossicità o reazioni anomale. Al termine del periodo di esposizione la pelle trattata deve essere esaminata al fine di rilevare segni visibili di irritazione.
Le gabbie metaboliche devono consentire la raccolta separata dell'urina e delle feci durante tutto lo studio, nonché la raccolta del biossido di carbonio 14C e dei composti volatili del carbonio 14C, che devono essere analizzati qualora siano prodotti in quantità significativa (> 5 %). L'urina, le feci e i fluidi trattenuti (ad es. il biossido di carbonio 14C e i composti volatili del carbonio 14C) devono essere raccolti individualmente per ciascun gruppo in ciascun intervallo di campionamento. Se i dati disponibili sono sufficienti a concludere che la formazione di metaboliti radioattivi volatili è scarsa o assente, è possibile utilizzare gabbie aperte.
Gli escrementi sono raccolti durante il periodo di esposizione e fino a 24 ore dopo il contatto iniziale con la pelle, e in seguito con cadenza giornaliera fino alla fine dell'esperimento. Se normalmente sono sufficienti tre intervalli di raccolta degli escrementi, potrebbe essere opportuno prevedere intervalli di tempo supplementari o più pertinenti per lo studio, a seconda della finalità alla quale è destinata la preparazione di prova o dei dati cinetici esistenti.
Al termine del periodo di esposizione il dispositivo di protezione è rimosso da ogni animale e conservato ai fini della successiva analisi. La pelle trattata deve essere lavata almeno 3 volte con un prodotto detergente, utilizzando appositi tamponi. Occorre fare attenzione per evitare di contaminare altre parti del corpo. Il prodotto detergente deve essere rappresentativo delle normali pratiche igieniche (ad es. una soluzione acquosa di sapone). Infine, la pelle deve essere asciugata. Tutti i tamponi e i residui del lavaggio devono essere conservati per essere poi analizzati. Agli animali appartenenti ai gruppi da sottoporre ad ulteriori osservazioni viene applicato un nuovo bendaggio prima del ritorno nelle gabbie individuali.
1.4.9 Procedure finali
I singoli animali di ciascun gruppo sono soppressi al momento previsto e il loro sangue è raccolto e analizzato. Il bendaggio o dispositivo di protezione è rimosso e analizzato. La pelle del punto di applicazione e una zona simile di pelle rasata non trattata sono prelevate da ciascun animale e analizzate separatamente. La pelle del punto di applicazione può essere frazionata per separare lo strato corneo dall'epidermide sottostante e ottenere in tal modo maggiori informazioni sulla distribuzione della sostanza di prova. La determinazione di tale distribuzione in un periodo di tempo predefinito dopo il periodo di esposizione dovrebbe fornire alcune indicazioni sul destino della sostanza di prova eventualmente presente nello strato corneo. Per facilitare il frazionamento della pelle (dopo il lavaggio finale e la soppressione dell'animale) viene rimosso il bendaggio protettivo. La pelle del punto di applicazione, insieme ad un'areola di pelle circostante, è asportata dal ratto e fissata su una tavola. Con una leggera pressione, viene applicata sulla pelle una striscia di nastro adesivo, che viene poi rimossa insieme a parte dello strato corneo. Successivamente sono applicate altre strisce di nastro adesivo fino al momento in cui, essendo stato rimosso tutto lo strato corneo, il nastro cessa di aderire alla superficie della pelle. Tutte le strisce di adesivo utilizzate per lo stesso animale possono essere messe insieme in un unico recipiente, nel quale viene aggiunta una sostanza per la digestione dei tessuti, al fine di solubilizzare lo strato corneo. Tutti i tessuti potenzialmente interessati possono essere asportati e sottoposti a misurazione separata prima di analizzare il resto della carcassa per stabilire la dose assorbita da quest'ultima. Le carcasse dei singoli animali devono essere conservate ai fini della successiva analisi. Normalmente è sufficiente l'analisi del contenuto totale. Gli organi potenzialmente interessati possono essere asportati per essere analizzati individualmente (se indicato da altri studi). L'urina presente nella vescica al momento della soppressione è aggiunta all'urina raccolta in precedenza. Dopo la raccolta degli escrementi presenti nelle gabbie metaboliche al momento della soppressione programmata, le gabbie e i sistemi di raccolta devono essere lavati con un solvente adeguato. Occorre inoltre analizzare gli altri materiali potenzialmente contaminati.
1.4.10 Analisi
In tutti gli studi si deve ottenere un tasso di recupero adeguato (l'obiettivo deve essere una media di 100 ± 10 % della radioattività). L'eventuale scostamento da questi valori deve essere giustificato. La quantità di dose somministrata presente in ciascun campione deve essere analizzata mediante procedure opportunamente convalidate.
Le analisi statistiche devono prevedere la misurazione della varianza tra le diverse repliche di ciascuna applicazione.
2. DATI
Per determinare la presenza della sostanza di prova e/o di metaboliti per ciascun animale e a ciascun tempo di campionamento occorre effettuare le misurazioni di seguito indicate. Oltre ad essere presentati individualmente, i dati devono essere raggruppati in funzione dei tempi di campionamento e devono essere riportati sotto forma di medie.
|
—
|
quantità associata ai dispositivi di protezione;
|
|
—
|
quantità che può essere rimossa dalla pelle;
|
|
—
|
quantità presente sulla o nella pelle e non eliminabile con il lavaggio;
|
|
—
|
quantità presente nel campione di sangue;
|
|
—
|
quantità presente negli escrementi e nell'aria espirata (eventualmente);
|
|
—
|
quantità esistente nella carcassa e negli organi eventualmente asportati in vista di un'analisi individuale.
|
La quantità della sostanza di prova e/o dei metaboliti presenti negli escrementi, nell'aria espirata, nel sangue e nella carcassa permetterà di determinare la quantità totale assorbita in ogni intervallo di tempo. Potrà inoltre essere calcolata la quantità di sostanza chimica di prova assorbita per cm2 di pelle esposta nel corso del periodo di esposizione.
3. RELAZIONE SULL'ESECUZIONE DELLA PROVA
3.1 RAPPORTO DI PROVA
Il rapporto di prova deve contenere i dati richiesti dal protocollo, in particolare la giustificazione del sistema utilizzato, nonché le seguenti informazioni:
|
|
Sostanza di prova:
|
—
|
dati identificativi [ad es. numero CAS, se disponibile; purezza (purezza radiochimica); impurità note; numero di lotto];
|
|
—
|
natura fisica, proprietà fisicochimiche (ad es. pH, volatilità, solubilità, stabilità, peso molecolare e coefficiente di ripartizione — log POW).
|
|
|
|
Preparazione della sostanza di prova:
|
—
|
formulazione e giustificazione dell'utilizzo;
|
|
—
|
informazioni dettagliate riguardanti la preparazione della sostanza di prova, la quantità applicata, la concentrazione raggiunta, il veicolo impiegato, la stabilità e l'omogeneità.
|
|
|
|
Animali da laboratorio:
|
—
|
specie/ceppo utilizzato;
|
|
—
|
numero, età e sesso degli animali;
|
|
—
|
provenienza, condizioni di stabulazione, dieta, ecc.;
|
|
—
|
peso dei singoli animali all'inizio dell'esperimento.
|
|
|
|
Condizioni di prova:
|
—
|
modalità di somministrazione della preparazione di prova (punto di applicazione, metodi di determinazione, bendaggio occlusivo/non occlusivo, volume, estrazione, rilevazione);
|
|
—
|
informazioni dettagliate sulla qualità del cibo e dell'acqua.
|
|
|
|
Risultati:
|
—
|
eventuali segni di tossicità;
|
|
—
|
tabella dei valori di assorbimento (espressi sotto forma di tasso, quantità o percentuale);
|
|
—
|
recuperi totali del saggio;
|
|
—
|
interpretazione dei risultati, comparazione con i dati eventualmente esistenti sull'assorbimento percutaneo del composto di prova.
|
|
|
|
Discussione dei risultati.
|
4. BIBLIOGRAFIA
|
1.
|
Metodo di prova B.45. Assorbimento cutaneo: In vitro Method.
|
|
2.
|
OCSE (2002). Guidance Document for the Conduct of Skin Absorption Studies. OCSE, Parigi.
|
|
3.
|
ECETOC (1993) Percutaneous Absorption. European Centre for Ecotoxicology and Toxicology of Chemicals, Monograph No. 20.
|
|
4.
|
Zendzian RP (1989) Skin Penetration Method suggested for Environmental Protection Agency Requirements. J. Am. Coll. Toxicol. 8(5), 829-835.
|
|
5.
|
Kemppainen BW, Reifenrath WG (1990) Methods for skin absorption. CRC Press Boca Raton, FL, USA.
|
|
6.
|
EPA (1992) Dermal Exposure Assessment: Principles and Applications. Exposure Assessment Group, Office of Health and Environmental Assessment.
|
|
7.
|
EPA (1998) Health Effects Test Guidelines, OPPTS 870-7600, Dermal Penetration. Office of Prevention, Pedsticides and Toxic Substances.
|
|
8.
|
Bronaugh RL, Wester RC, Bucks D, Maibach HI and Sarason R (1990) In vivo percutaneous absorption of fragrance ingredients in reshus monkeys and humans. Fd. Chem. Toxic. 28, 369-373.
|
|
9.
|
Feldman RJ and Maibach HI (1970) Absorption of some organic compounds through the skin in man. J. Invest Dermatol. 54, 399-404.
|
Figura 1
Esempio di dispositivo generalmente utilizzato per delimitare e proteggere il punto di applicazione cutanea durante gli studi di assorbimento percutaneo in vivo

B.45. ASSORBIMENTO CUTANEO: METODO IN VITRO
1. METODO
Il metodo di seguito descritto corrisponde alle linee guida dell'OCSE TG 428 (2004).
1.1. INTRODUZIONE
Questo metodo è stato elaborato per ottenere informazioni sull'assorbimento di una sostanza di prova applicata su un campione di pelle asportata. Può essere associato al metodo di assorbimento cutaneo in vivo (1), o essere eseguito da solo. Si raccomanda di consultare il documento orientativo dell'OCSE sullo svolgimento di studi concernenti l'assorbimento cutaneo [OECD Guidance Document for the Conduct of Skin Absorption Studies (2)] per l'elaborazione di studi che si basano su questo metodo. Tale documento è stato elaborato per agevolare la selezione di procedure in vitro adeguate, da utilizzare in circostanze specifiche al fine di garantire l'affidabilità dei risultati ottenuti con tale metodo.
I metodi per la misurazione dell'assorbimento cutaneo e della diffusione cutanea possono essere divisi in due categorie: in vivo e in vitro. I metodi in vivo per la valutazione dell'assorbimento cutaneo sono di uso comune e forniscono informazioni di carattere farmacocinetico per una serie di specie animali. In un altro metodo di prova (1) viene descritto un metodo in vivo. I metodi in vitro sono anche utilizzati da molti anni per misurare l'assorbimento cutaneo. Sebbene non siano stati eseguiti studi di validazione ufficiale dei metodi in vitro di cui al presente metodo, gli esperti dell'OCSE hanno convenuto nel 1999 che esistevano dati sufficienti a sostegno del metodo in vitro (3). Ulteriori informazioni in questo senso, in particolare un numero importante di confronti diretti tra i metodi in vitro e in vivo, sono contenuti nel documento orientativo (2). Varie monografie trattano questo tema e forniscono informazioni dettagliate sull'uso del metodo in vitro (4)(5)(6)(7)(8)(9)(10)(11)(12). I metodi in vitro misurano la diffusione di sostanze chimiche nella pelle e attraverso la pelle verso un serbatoio di fluidi e possono servirsi di campioni di pelle non vitale per misurare unicamente la diffusione, o campioni di pelle appena asportati e che evidenziano un'attività metabolica, per misurare contemporaneamente la diffusione e il metabolismo cutaneo. Questi metodi sono utilizzati, in particolare, per confrontare la somministrazione cutanea e transcutanea di varie formulazioni di sostanze chimiche e possono fornire modelli utili per la valutazione dell'assorbimento transcutaneo nell'essere umano.
Tale metodo in vitro potrebbe non essere applicabile in tutte le situazioni e a tutte le classi di sostanze chimiche. Può essere utilizzato per una valutazione qualitativa iniziale della penetrazione cutanea. In alcuni casi potrebbe essere necessario completare detta valutazione con dati in vivo. È opportuno consultare il documento orientativo (2) per l'individuazione di altre situazioni in cui l'uso del metodo in vitro può rivelarsi opportuno. I riferimenti bibliografici (3) contengono informazioni dettagliate complementari che risulteranno utili ai fini della scelta del metodo.
Questo documento presenta i principi generali per la misura dell'assorbimento e della diffusione cutanee della sostanza di prova utilizzando pelle asportata. Si possono utilizzare campioni di pelle di molte specie di mammiferi diversi, esseri umani compresi. Le proprietà di permeabilità della pelle sono mantenute dopo l'asportazione dal corpo in quanto la principale barriera di diffusione è lo strato corneo non vitale; non è stato rilevato alcun trasporto transcutaneo attivo di sostanze chimiche. La pelle ha evidenziato la capacità di metabolizzare alcune sostanze chimiche durante l'assorbimento transcutaneo (6), ma questo processo non è limitativo della velocità in termini di dosi effettivamente assorbite, sebbene possa condizionare la natura del materiale che entra nella circolazione sanguigna.
1.2. DEFINIZIONI
Dose non assorbita: la dose presente nell'acqua di risciacquo dell'epidermide dopo l'esposizione e sulla copertura non occlusiva, ivi comprese le dosi che evaporano dalla pelle durante l'esposizione.
Dosa assorbita (in vitro): massa della sostanza di prova che raggiunge il fluido recettore o la circolazione sistemica entro un determinato periodo.
Dose assorbibile (in vitro): dose presente sulla o nella pelle dopo il lavaggio.
1.3. PRINCIPIO DEL METODO
La sostanza di prova, che può essere radiomarcata, viene applicata sulla superficie di un campione di pelle che separa le due camere di una cella di diffusione. La sostanza chimica viene lasciata sulla pelle per un periodo determinato in condizioni specifiche prima di essere eliminata con un'adeguata procedura di pulitura. Il fluido recettore è campionato in vari momenti durante l'esperimento e analizzato per stabilire la presenza della sostanza di prova e/o di metaboliti.
Qualora vengano utilizzati sistemi metabolicamente attivi, i metaboliti della sostanza di prova possono essere analizzati ricorrendo a metodi adeguati. Alla fine dell'esperimento, la distribuzione della sostanza di prova e i suoi metaboliti sono quantificati, se opportuno.
Nelle condizioni adeguate, descritte nel presente metodo e nel documento orientativo (2), l'assorbimento di una sostanza di prova in un periodo determinato viene misurata analizzando il fluido recettore e il campione di pelle trattato. La sostanza di prova che rimane nella pelle deve essere considerata assorbita, a meno che non si riesca a dimostrare che l'assorbimento può essere determinato anche solo dai valori del fluido recettore. L'analisi degli altri componenti (materiale eliminato dalla pelle mediante risciacquo che rimane negli strati cutanei) consente di procedere a ulteriori valutazioni dei dati, quali l'eliminazione totale della sostanza di prova e la percentuale di recupero.
Al fine di dimostrare le prestazioni e l'affidabilità del sistema nel laboratorio che esegue la prova, sarebbe opportuno disporre dei risultati ottenuti con dei prodotti chimici di riferimento pertinenti, conformemente alla letteratura pubblicata sul metodo in questione. Questo requisito potrebbe essere soddisfatto testando una sostanza di riferimento adeguata (di preferenza una sostanza con affinità per ambienti lipidici simili alla sostanza di prova) contemporaneamente alla sostanza di prova o fornendo dati storici pertinenti per una serie di sostanze di riferimento con affinità per ambienti lipidici diversi (ad esempio, caffeina, acido benzoico e testosterone).
1.4. DESCRIZIONE DEL METODO
1.4.1 Cella di diffusione
Una cella di diffusione è costituita da una camera «donatrice» e una camera «recettrice» in mezzo alle quali viene posto il campione di pelle (alla fig. 1 è riportato un modello standard). La cella di diffusione deve avere una buona tenuta intorno alla pelle, consentire un agevole campionamento e un'adeguata miscela della soluzione recettrice in contatto con la faccia inferiore della pelle, permettere un controllo adeguato della temperatura della cella e del suo contenuto. Si possono utilizzare celle di diffusione statiche e a flusso (flow-through). Di norma le camere donatrici sono lasciate aperte al momento dell'esposizione ad una dose finita di un preparato di prova. Tuttavia, per applicazioni infinite e in alcuni casi di dosaggi finiti, le camere donatrici possono essere chiuse.
1.4.2. Fluido recettore
Si utilizzerà di preferenza un fluido recettore fisiologicamente adeguato, anche se è consentito l'uso di altri fluidi qualora il loro uso sia giustificato. Occorrerà fornire la composizione esatta del fluido recettore. Occorrerà dimostrare l'adeguata solubilità della sostanza di prova nel fluido recettore in modo che quest'ultimo non ostacoli l'assorbimento. Inoltre, il fluido recettore non deve intaccare l'integrità del campione di pelle. In un sistema a flusso la velocità di flusso non deve ostacolare la diffusione della sostanza di prova nel fluido recettore. In un sistema a cella statica, il fluido dovrebbe essere continuamente agitato e regolarmente campionato. Per lo studio del metabolismo il fluido recettore deve consentire la vitalità del campione di pelle per l'intera durata dell'esperimento.
1.4.3 Preparati di pelle
Potranno essere utilizzati campioni di pelle di origine umana e animale. È noto che l'utilizzo di pelle umana è oggetto di considerazioni etiche e soggetto a condizioni nazionali ed internazionali. Di preferenza si utilizzeranno campioni di pelle vitale, ma l'uso di campioni non vitali è consentito a condizione di poter dimostrare l'integrità della pelle. Possono essere utilizzate membrane epidermiche (separate mediante processi enzimatici, termici o chimici) o campioni di pelle di spessore parziale (di solito tra 200 e 400 μm) preparati con un dermatomo. I campioni di pelle a spessore totale sono consentiti, ma dovrebbero essere evitati spessori eccessivi (superiori a circa 1 mm), a meno che non siano specificatamente richiesti per determinare la sostanza chimica di prova negli strati epidermici. Occorre giustificare la scelta della specie, del sito anatomico e della tecnica di preparazione. Sono richiesti dati accettabili risultanti da almeno quattro repliche per preparato di prova.
1.4.4 Integrità del preparato
Il campione di pelle deve essere adeguatamente preparato. Eventuali manipolazioni inadeguate possono danneggiare lo strato corneo, pertanto è opportuno verificare l'integrità della pelle preparata. Per lo studio del metabolismo la pelle appena asportata dovrebbe essere utilizzata il più rapidamente possibile e in condizioni che consentano di mantenere l'attività metabolica. A titolo orientativo, la pelle appena asportata dovrebbe essere utilizzata nell'arco di 24 ore, ma il periodo di conservazione consentito potrebbe variare in funzione del sistema enzimatico che interviene nella metabolizzazione e delle temperature di stoccaggio (13). Qualora i campioni di pelle siano stati conservati prima dell'utilizzazione, occorrerebbe dimostrare che la funzione di barriera è stata mantenuta.
1.4.5 Sostanza di prova
La sostanza di prova è il prodotto di cui si intende studiare le caratteristiche di penetrazione. Preferibilmente detta sostanza sarà radiomarcata.
1.4.6 Preparazione della sostanza di prova
La preparazione della sostanza di prova (ad esempio, materiale puro, diluito o formulato contenente la sostanza di prova applicata sulla pelle) dovrebbe essere identica (o un sostituto adeguato) a quella cui gli esseri umani o le altre specie potenzialmente interessate possono essere esposti. Qualsiasi variazione dalla preparazione d'uso deve essere giustificata.
1.4.7 Concentrazioni e formulazioni delle sostanze di prova
In linea di massima si utilizzano più concentrazioni della sostanza di prova in modo da coprire i valori più elevati della potenziale esposizione umana. Analogamente, si potrebbero analizzare una serie di formulazioni tipo.
1.4.8 Applicazione sulla pelle
Nelle condizioni normali di esposizione umana alle sostanze chimiche, in linea di massima si riscontrano dosi finite. Sarà pertanto opportuno utilizzare un'applicazione che imiti le condizioni dell'esposizione umana, di solito pari a 1-5 mg/cm2 di pelle per un solido e 10 μl/cm2 per i liquidi. La quantità dovrebbe dipendere dalle condizioni di utilizzo previste, dagli obiettivi del saggio e dalle caratteristiche fisiche del preparato di prova. Ad esempio, le applicazioni sull'epidermide possono essere infinite dove si applicano importanti volumi per unità di superficie.
1.4.9 Temperatura
La temperatura condiziona la diffusione passiva delle sostanze chimiche (e pertanto il loro assorbimento cutaneo). La cella di diffusione e la pelle devono essere mantenute ad una temperatura costante vicina alla temperatura normale della pelle (32 ± 1 oC). I vari modelli di cella richiederanno temperature diverse per il bagnomaria e il blocco riscaldante in modo da garantire il rispetto della norma fisiologica del recettore/della pelle. L'umidità sarà preferibilmente compresa tra 30 e 70 %.
1.4.10 Durata dell'esposizione e del campionamento
Il campione di pelle può essere esposto al preparato di prova per l'intera durata del saggio o per periodi più brevi (ad esempio per simulare un tipo specifico di esposizione). Il lavaggio della pelle per eliminare l'eccesso di sostanza di prova dove essere eseguito con un agente di pulizia adeguato e l'acqua di risciacquo deve essere raccolta per essere analizzata. La procedura di eliminazione del preparato di prova dipenderà delle condizioni di uso previste e deve essere giustificata. Di norma è necessario un periodo di campionamento di 24 ore per ottenere l'adeguata caratterizzazione del profilo di assorbimento. Dal momento che l'integrità della pelle può cominciare a deteriorarsi dopo 24 ore, i periodi di campionamento non dovrebbero mai superare le 24 ore. Per le sostanze di prova che penetrano rapidamente nella pelle, il problema non si pone, ma per quelle che penetrano più lentamente possono essere necessari tempi più lunghi. La frequenza di campionamento del fluido recettore dovrebbe consentire di procedere alla rappresentazione grafica del profilo di assorbimento della sostanza di prova.
1.4.11 Procedure finali
Tutti i componenti del sistema di prova devono essere analizzati ed occorre determinare il tasso di recupero. Ciò riguarda la camera donatrice, l'acqua di risciacquo dell'epidermide, il preparato di pelle, il fluido recettore o la camera recettrice. In alcuni casi la pelle può essere frazionata nell'area esposta della pelle e nell'area della pelle sotto il bordo della cella e in frazioni di strato corneo, epidermide e derma per eseguire analisi separate.
1.4.12 Analisi
In tutti gli studi si dovrebbe ottenere un tasso di recupero sufficiente (l'obiettivo deve essere una media di 100 ± 10 % della radioattività, gli eventuali scartamenti da questi valori devono essere giustificati). La quantità di sostanza di prova nel fluido recettore, nel preparato di pelle, nelle acque di lavaggio dell'epidermide e nell'acqua di risciacquo dell'apparecchio devono essere analizzate con una tecnica adeguata.
2. DATI
Occorre fornire l'analisi del fluido recettore, la distribuzione della sostanza di prova nel sistema e il profilo d'assorbimento nel corso del tempo. In condizioni di esposizione a dosi finite, è necessario calcolare la quantità eliminata dalla pelle con il risciacquo, la quantità assimilata dalla pelle (e dai vari strati cutanei, se sono analizzati) e la quantità presente nel fluido recettore (tasso, quantità o percentuale della dose applicata). L'assorbimento cutaneo può a volte essere espresso unicamente utilizzando i dati relativi al fluido recettore. Tuttavia, quando la sostanza di prova rimane nella pelle alla fine dello studio, può essere necessario includerla nella quantità totale assorbita [cfr. paragrafo 66 nel riferimento bibliografico (3)]. In condizioni di esposizione a dosi infinite, i dati possono consentire di calcolare una costante di permeabilità (Kp). In tal caso, la percentuale assorbita è irrilevante.
3. RELAZIONE SULL'ESECUZIONE DEL SAGGIO
3.1. RAPPORTO DI PROVA
Il rapporto di prova deve contenere i requisiti stabiliti nel protocollo, in particolare la giustificazione del sistema utilizzato, nonché le seguenti informazioni:
|
|
Sostanza di prova:
|
—
|
natura fisica, proprietà fisicochimiche (almeno il peso molecolare e il coefficiente di ripartizione - log POW), purezza (purezza radiochimica);
|
|
—
|
dati di identificazione (ad es. numero del lotto);
|
|
—
|
solubilità nel fluido recettore.
|
|
|
|
Preparazione della sostanza di prova:
|
—
|
formulazione e giustificazione dell'utilizzo;
|
|
|
|
Condizioni di prova:
|
—
|
origini e sito della pelle, metodo di preparazione, condizioni di stoccaggio prima dell'uso, eventuali pretrattamenti (pulizia, trattamenti antibiotici ecc.), misure dell'integrità della pelle, stato metabolico, giustificazione dell'uso;
|
|
—
|
modello di cella, composizione del fluido recettore, velocità di flusso del fluido recettore o intervalli e procedure di campionamento;
|
|
—
|
informazioni sull'applicazione del preparato di prova e quantificazione della dose applicata;
|
|
—
|
durata dell'esposizione;
|
|
—
|
informazioni sull'eliminazione del preparato di prova dalla pelle (ad es. risciacquo della pelle);
|
|
—
|
informazioni sull'analisi della pelle e le tecniche di frazionamento eventualmente utilizzate per dimostrare la distribuzione cutanea;
|
|
—
|
procedure di lavaggio della cella e dell'apparecchiatura;
|
|
—
|
metodi di saggio, tecniche di estrazione, limiti di rilevazione e validazione del metodo analitico.
|
|
|
|
Risultati:
|
—
|
recuperi totali del saggio (dose applicata = liquido di lavaggio della pelle + pelle + fluido recettore + liquido di lavaggio della cella);
|
|
—
|
tabella dei tassi di recupero in ciascun compartimento della cella;
|
|
—
|
profilo di assorbimento;
|
|
—
|
tabella dei valori di assorbimento (espressi sotto forma di tasso, quantità o percentuale).
|
|
|
|
Discussione dei risultati.
|
4. BIBLIOGRAFIA
|
1.
|
Metodo B.44. Assorbimento cutaneo: metodo in vivo.
|
|
2.
|
OECD (2002). Guidance Document for the Conduct of Skin Absorption Studies. OCSE, Parigi.
|
|
3.
|
OCSE (2000). Report of the Meeting of the OECD Extended Steering Committee for Percutaneous Absorption Testing, Annex 1 to ENV/JM/TG(2000)5. OCSE, Parigi.
|
|
4.
|
Kemppainen BW and Reifenrath WG. (1990). Methods for skin absorption. CRC Press, Boca Raton.
|
|
5.
|
Bronaugh RL and Collier, SW.(1991). Protocol for In vitro Percutaneous Absorption Studies, in In vitro Percutaneous Absorption: Principles, Fundamentals and Applications, RL Bronaugh and HI Maibach, Eds., CRC Press, Boca Raton, pagg. 237-241.
|
|
6.
|
Bronaugh RL and Maibach HI. (1991). In vitro Percutaneous Absorption: Principles, Fundamentals and Applications. CRC Press, Boca Raton.
|
|
7.
|
European Centre for Ecotoxicology and Toxicology of Chemicals (1993). Monografia n. 20, Percutaneous Absorption, ECETOC, Bruxelles.
|
|
8.
|
Diembeck W, Beck H, Benech-Kieffer F, Courtellemont P, Dupuis J, Lovell W, Paye M, Spengler J, Steiling W (1999). Test Guidelines for In Vitro Assessment of Dermal Absorption and Percutaneous Penetration of Cosmetic Ingredients, Fd Chem Tox, 37, 191-205.
|
|
9.
|
Recommended Protocol for In vitro Percutaneous Absorption Rate Studies (1996). US Federal Register, Vol. 61, No. 65.
|
|
10.
|
Howes D, Guy R, Hadgraft J, Heylings JR et al. (1996). Methods for assessing Percutaneous absorption. ECVAM Workshop Report ATLA 24, 81 R10.
|
|
11.
|
Schaefer H and Redelmeier TE. (1996). Skin barrier: principles of percutaneous absorption. Karger, Basilea.
|
|
12.
|
Roberts MS and Walters KA. (1998). Dermal absorption and toxicity assessment. Marcel Dekker, New York..
|
|
13.
|
Jewell, C., Heylings, JR., Clowes, HM. And Williams, FM. (2000). Percutaneous absorption and metabolism of dinitrochlorobenzene in vitro. Arch Toxicol 74: 356-365.
|
Figura 1
Esempio di un modello tipo di cella di diffusione statica concepita per studiare l'assorbimento transcutaneo in vitro

(1) Indicare l'area di opacità corneale
(2) Per un certo numero di analisi nel siero e nel plasma, ed in particolare per la determinazione del glucosio, è preferibile che gli animali siano a digiuno dalla sera precedente. In caso contrario, infatti, si ha una maggiore variabilità nei risultati, cosa che può dissimulare gli effetti meno evidenti e ostacolare l'interpretazione. D'altro canto, però, il digiuno può modificare il metabolismo generale degli animali e, soprattutto negli studi sull'alimentazione, perturbare l'esposizione giornaliera alla sostanza in esame. Se si opta per il digiuno, gli esami biochimico-clinici dovranno essere effettuati dopo le osservazioni funzionali della quarta settimana.
(3) Per svariate misurazioni del siero e del plasma, e soprattutto per il glucosio, sarebbe preferibile mantenere il digiuno per tutta la notte. Il motivo principale è che l'aumento della variabilità dovuto inevitabilmente al mancato digiuno tenderebbe a mascherare effetti meno evidenti rendendo più difficile l'interpretazione. D'altro lato, però, il digiuno notturno può interferire con il metabolismo generale degli animali e, soprattutto negli studi sull'alimentazione, può incidere sull'esposizione quotidiana alla sostanza in esame. Se si adotta il digiuno notturno le osservazioni biochimiche cliniche vanno eseguite dopo le osservazioni funzionali.
(4) Ora nota come alanina-aminotransferasi serica.
(5) Ora nota come appartato-aminotransferasi serica.
(6) Questi organi, prelevati da 10 animali per sesso e per gruppo per i roditori e da tutti i non roditori, più tiroide (con paratiroidi) per tutti i non roditori, dovrebbero essere pesati.
(7) Questi organi, provenienti da 10 animali per sesso e per gruppo (per i roditori) dovrebbero essere pesati.
(8) In questo metodo un gruppo di riferimento è un gruppo nel quale la sostanza in esame è somministrata per un'altra via che permette la disponibilità completa della dose.
(9) Solvente impiegato per misurare l'assorbimento.
(10)
|
†
|
Compresi cinque animali scelti per gli esami funzionali e le osservazioni cliniche dettagliate nello studio di neurotossicità.
|
PARTE C: METODI PER LA DETERMINAZIONE DELL'ECOTOSSICITÀ
INDICE
|
C.1.
|
TOSSICITÀ ACUTA PER I PESCI |
|
C.2.
|
SAGGIO DI IMMOBILIZZAZIONE ACUTA IN DAPHNIA SP
|
|
C.3.
|
SAGGIO DI INIBIZIONE DELLA CRESCITA DELLE ALGHE |
|
C.4.
|
BIODEGRADAZIONE Determinazione della «pronta» (ready) biodegradabilità |
|
PARTE I.
|
CONSIDERAZIONI GENERALI |
|
PARTE II.
|
SAGGIO DI RIMOZIONE LENTA DEL DOC (Metodo C.4-A) |
|
PARTE III.
|
SAGGIO DI SCREENING OCSE MODIFICATO (Metodo C.4-B) |
|
PARTE IV.
|
SAGGIO DI SVILUPPO DEL CO2 (Metodo C.4-C) |
|
PARTE V.
|
SAGGIO RESPIROMETRICO MANOMETRICO (Metodo C.4-D) |
|
Parte VI.
|
SAGGIO DELLA BOTTIGLIA CHIUSA (Metodo C.4-E) |
|
PARTE VII.
|
SAGGIO M.I.T.I. (Metodo C.4-F) |
|
C.5.
|
DEGRADAZIONE — DOMANDA BIOCHIMICA DI OSSIGENO (BOD) |
|
C.6.
|
DEGRADAZIONE — DOMANDA CHIMICA DI OSSIGENO (COD) |
|
C.7.
|
DEGRADAZIONE — DEGRADAZIONE ABIOTICA: IDROLISI IN FUNZIONE DEL PH |
|
C.8.
|
TOSSICITÀ PER I LOMBRICHI |
|
C.9.
|
BIODEGRADAZIONE — ZAHN — WELLENS TEST |
|
C.10.
|
BIODEGRADAZIONE — SAGGIO DI SIMULAZIONE CON FANGHI ATTIVI |
|
C.11.
|
BIODEGRADAZIONE — FANGHI ATTIVI: SAGGIO DI INIBIZIONE DELLA RESPIRAZIONE |
|
C.12.
|
BIODEGRADAZIONE — SAGGIO SCAS MODIFICATO |
|
C.13.
|
BIOCONCENTRAZIONE: SAGGIO SUI PESCI, METODO A FLUSSO CONTINUO |
|
C.14.
|
TEST SULLA CRESCITA DEI PESCI GIOVANI |
|
C.15.
|
PESCI, PROVA DI TOSSICITÀ A BREVE TERMINE SUGLI STADI DI EMBRIONI E DI LARVA CON SACCO VITELLINO |
|
C.16.
|
API MELLIFERE — TEST DI TOSSICITÀ ORALE ACUTA |
|
C.17.
|
API MELLIFERE — TEST DI TOSSICITÀ ACUTA PER CONTATTO |
|
C.18.
|
ADSORBIMENTO/DESORBIMENTO: METODO DISCONTINUO ALL'EQUILIBRIO |
|
C.19.
|
STIMA DEL COEFFICIENTE DI ADSORBIMENTO (KOC) SUL TERRENO E SUI FANGHI DI ACQUE DA SCARICO MEDIANTE CROMATOGRAFIA LIQUIDA AD ALTA PRESTAZIONE (HPLC) |
|
C.20.
|
PROVA DI RIPRODUZIONE CON DAPHNIA MAGNA
|
|
C.21.
|
MICRORGANISMI DEL SUOLO: TEST DI TRASFORMAZIONE DELL'AZOTO |
|
C.22.
|
MICRORGANISMI DEL SUOLO: TEST DI TRASFORMAZIONE DEL CARBONIO |
|
C.23.
|
TRASFORMAZIONE AEROBICA E ANAEROBICA NEL SUOLO |
|
C.24.
|
TRASFORMAZIONE AEROBICA E ANAEROBICA NEI SISTEMI SEDIMENTOSI ACQUATICI |
C.1. TOSSICITÀ ACUTA PER I PESCI
1. METODO
1.1. INTRODUZIONE
Lo scopo di questo saggio è di determinare la tossicità letale acuta di una sostanza nei confronti di pesci in acqua dolce. Per poter scegliere il metodo di saggio (statico, semistatico o a flusso continuo) più idoneo a garantire che le concentrazioni della sostanza in esame si mantengano soddisfacentemente costanti per tutta la durata del saggio, è desiderabile disporre, per quanto possibile, di dati concernenti la solubilità in acqua, la tensione di vapore, la stabilità chimica, le costanti di dissociazione e la biodegradabilità della sostanza in esame.
Sia per la programmazione della prova che per l'interpretazione dei risultati si dovrebbero tenere in considerazione anche altre informazioni (per esempio formula di struttura, grado di purezza, natura e percentuale delle impurezze significative, presenza e quantità di additivi e coefficiente di ripartizione n-ottanolo/acqua).
1.2. DEFINIZIONE E UNITÀ
La tossicità acuta è l'effetto avverso osservabile indotto in un organismo entro un breve tempo (giorni) di esposizione ad una data sostanza. Nel presente saggio, la tossicità acuta viene espressa come concentrazione letale media (CL50), che è la concentrazione di una sostanza nell'acqua capace di uccidere il 50 % di un gruppo di pesci entro un periodo continuo di esposizione, la cui durata deve essere precisata.
Tutte le concentrazioni delle sostanze in esame sono espressi in peso/volume (mg/l). Esse possono anche venire espresse in peso/peso (mg.kg-1).
1.3. SOSTANZE DI RIFERIMENTO
Per dimostrare che, nelle condizioni sperimentali di laboratorio, la risposta della specie usata per il saggio non è variata in modo significativo, può essere saggiata una sostanza di riferimento.
Per il presente saggio non vengono specificate sostanze di riferimento.
1.4. PRINCIPIO DEL METODO DI SAGGIO
Si può eseguire un saggio limite a 100 mg per litro allo scopo di dimostrare che la CL50 è maggiore di questa concentrazione.
I pesci sono esposti alla sostanza (alle sostanze) in esame, aggiunta all'acqua in varie concentrazioni, per un periodo di 96 ore. Le mortalità vengono registrate almeno ad intervalli di 24 ore, quando possibile, per ciascun tempo di osservazione si calcola la concentrazione (CL50) alla quale muore il 50 % dei pesci.
1.5. CRITERI DI QUALITÀ
I criteri di qualità dovranno essere applicati sia per il saggio limite che per il metodo di saggio completo.
La mortalità negli animali di controllo usati non deve essere superiore al 10 % (o un pesce se se ne usano meno di 10) ai termine della prova.
La concentrazione dell'ossigeno deve rimanere per tutta la prova al di sopra del 60 % del valore di saturazione dell'aria.
La concentrazione della sostanza in esame deve essere mantenuta entro l'80 % della concentrazione iniziale per tutta la durata della prova.
Per sostanze che si sciolgono facilmente nel mezzo di saggio producendo soluzioni stabili, cioè quelle che non presentano un grado significativo di volatilizzazione, degradazione, idrolisi o assorbimento, la concentrazione iniziale può essere presa equivalente alla concentrazione nominale. Deve essere fornita la documentazione che la concentrazione si è mantenuta costante per tutta la durata del saggio e che sono stati soddisfatti i criteri di qualità.
Per sostanze che sono:
|
i)
|
scarsamente solubili nel mezzo di saggio; o
|
|
ii)
|
in grado di formare emulsioni o dispersioni stabili; o
|
|
iii)
|
non stabili in soluzione acquosa;
|
come concentrazione iniziale si dovrà prendere la concentrazione misurata in soluzione (o, se non è possibile tecnicamente, misurata nella colonna d'acqua) all'inizio della prova. La concentrazione sarà determinata dopo un periodo di equilibrazione, ma prima dell'introduzione dei pesci di prova.
In ciascuno di questi casi, ulteriori misure devono essere effettuate durante il saggio per confermare che la concentrazione di esposizione effettiva o i criteri di qualità sono stati rispettati.
Il pH non dovrebbe variare più di una unità.
1.6. DESCRIZIONE DEL METODO DI SAGGIO
Tre diversi procedimenti possono essere usati.
Prova statica:
Prova di tossicità su pesci nel corso della quale non ha luogo alcun flusso della soluzione di saggio (le soluzioni non vengono cambiate per tutta la durata della prova).
Prova semistatica:
Prova senza alcun flusso della soluzione ma nella quale le soluzioni di saggio vengono rinnovate ad intervalli regolari e prolungati (ad esempio 24 ore).
Prova a flusso continuo:
Prova di tossicità nella quale l'acqua è rinnovata costantemente nelle vasche di saggio e la sostanza in esame viene trasportata insieme all'acqua usata per rinnovare l'ambiente del saggio.
1.6.1. Reattivi
1.6.1.1. Soluzioni delle sostanze da esaminare
Si preparano soluzioni di riserva alla concentrazione richiesta, sciogliendo la sostanza in acqua deionizzata o comunque rispondente alle caratteristiche descritte al punto 1.6.1.2.
Le concentrazioni di prova scelte vengono preparate per diluizione della soluzione di riserva. Se si saggiano concentrazioni elevate, la sostanza può essere disciolta direttamente nell'acqua di diluizione.
Le sostanze devono normalmente essere saggiate solo fino al limite di solubilità. Per alcune sostanze (per esempio sostanze che hanno una scarsa solubilità in acqua o un elevato Pow, o quelle che formano dispersioni stabili piuttosto che soluzioni vere in acqua), è accettabile preparare un livello di concentrazione al di sopra del limite di solubilità della sostanza per garantire di raggiungere la massima concentrazione solubile/stabile. È importante tuttavia che questa concentrazione non disturbi altrimenti il sistema di saggio (per esempio una pellicola della sostanza sulla superficie dell'acqua che impedisca l'ossigenazione dell'acqua, ecc.).
Si può ricorrere a dispersione ultrasonica, solventi organici, emulsionanti o disperdenti come aiuto per preparare le soluzioni concentrate di riserva delle sostanze di scarsa solubilità in acqua o per disperdere queste sostanze nell'ambiente di prova. Quando si utilizzano tali sostanze ausiliarie, tutte le concentrazioni da saggiare dovrebbero contenere la stessa quantità di sostanza ausiliaria, e pesci di controllo addizionali dovrebbero essere esposti alla stessa concentrazione della sostanza ausiliaria usata nella serie di concentrazioni da saggiare. La concentrazione di tali sostanze ausiliarie deve essere minimizzata, e in nessun caso deve superare i 100 mg per litro nell'ambiente di prova.
La prova dovrebbe essere effettuata senza aggiustamento del pH. Se esiste evidenza di variazioni pronunciate del pH, si consiglia di ripetere la prova procedendo all'opportuna regolazione del pH e riportando i risultati. In questo caso, il valore del pH della soluzione di riserva dovrebbe essere aggiustato a quello dell'acqua di diluizione, a meno che non esistano specifiche ragioni per agire diversamente. A tal fine sono da preferirsi HCl ed NaOH. Questa regolazione del pH dovrebbe essere effettuata in modo che la concentrazione della sostanza in esame nella soluzione di riserva non cambi in modo significativo. Qualora la regolazione dovesse provocare reazioni chimiche o la precipitazione fisica del composto in esame, ciò dovrebbe essere riportato.
1.6.1.2. Acqua di stabulazione e di diluizione
Si possono impiegare acqua potabile (non contaminata da concentrazioni potenzialmente pericolose di cloro, metalli pesanti od altre sostanze), acqua naturale di buona qualità od acqua ricostituita (cfr. Appendice 1). Sono da preferirsi acque con una durezza totale compresa tra 10 e 250 mg/l (come CaCO3) e con pH fra 6,0 e 8,5.
1.6.2. Attrezzatura
Tutte le attrezzature devono essere costruite in materiale chimicamente inerte.
|
—
|
sistema di diluizione automatico (per le prove a flusso continuo),
|
|
—
|
misuratore di ossigeno,
|
|
—
|
apparecchiatura per la determinazione della durezza dell'acqua,
|
|
—
|
apparecchiatura adeguata per il controllo della temperatura,
|
1.6.3. Pesci per il saggio
I pesci devono essere in buona salute e non presentare evidenti malformazioni.
Le specie usate devono essere scelte sulla base di criteri pratici, come la loro facile disponibilità per tutto l'anno, la facilità di mantenimento, la idoneità per il saggio, sensibilità relativa e qualsiasi fattore economico, biologico o ecologico avente qualche rilevanza. Nella scelta della specie di pesce si deve tenere presente anche la necessità di poter confrontare i dati ottenuti e l'armonizzazione internazionale esistente (riferimento 1).
Un elenco di specie ittiche che sono raccomandate per l'esecuzione di questo saggio è presentato in Appendice 2. Le specie preferite sono il danio zebrato e la trota.
1.6.3.1. Stabulazione
I pesci dovrebbero provenire di preferenza da un singolo gruppo con lunghezza ed età simili. Essi devono essere mantenuti per almeno 12 giorni nelle seguenti condizioni:
densità degli animali:
appropriata al sistema (riciclo o flusso continuo) e alla specie di pesce;
acqua:
vedi punto 1.6.1.2;
illuminazione:
fotoperiodo da 12 a 16 ore al giorno;
concentrazione dell'ossigeno disciolto:
almeno 1'80 % del valore di saturazione dell'aria;
alimentazione:
tre volte alla settimana o quotidianamente con sospensione 24 ore prima dell'inizio della prova.
1.6.3.2. Mortalità
Dopo un periodo di adattamento di 48 ore, si procede a registrare la mortalità e si applicano i seguenti criteri:
|
—
|
mortalità superiore al 10 % della popolazione in sette giorni:
l'intera partita viene respinta,
|
|
—
|
mortalità tra il 5 e il 10 % della popolazione:
il periodo di adattamento prosegue per altri sette giorni.
Se non si verificano ulteriori mortalità, la partita è accettabile, in caso contrario essa deve essere respinta,
|
|
—
|
mortalità inferiore al 5 % della popolazione:
la partita è accettabile.
|
1.6.4. Adattamento
Prima dell'impiego, tutti i pesci debbono essere posti per almeno sette giorni in acqua della qualità e temperatura da impiegare per il saggio.
1.6.5. Procedimento del saggio
Al saggio definitivo si può far precedere una prova orientativa allo scopo di ottenere informazioni per definire l'intervallo di concentrazioni da impiegare.
In aggiunta alla serie di concentrazioni da saggiare, si esegue anche una esposizione di controllo senza la sostanza in esame e, se pertinente, una esposizione di controllo contenente la sostanza ausiliaria.
A seconda delle proprietà fisiche e chimiche del composto in esame, si deve scegliere una prova statica, semistatica o a flusso continuo, secondo quanto più appropriato per soddisfare i criteri di qualità.
I pesci vengono esposti alla sostanza nel modo indicato di seguito:
|
—
|
numero di animali: almeno 7 per concentrazione,
|
|
—
|
vasche: di capacità opportuna secondo il carico raccomandato,
|
|
—
|
densità dei pesci: per i saggi statici e semistatici si raccomanda un carico di biomassa massimo di 1,0 g/l; per i sistemi a flusso continuo può essere accettabile un carico più elevato,
|
|
—
|
concentrazioni di saggio: almeno cinque concentrazioni, differenti per un fattore costante non superiore a 2,2, e che, nel limite del possibile, coprano l'intervallo di mortalità dallo 0 al 100 %,
|
|
—
|
acqua: vedi punto 1.6.1.2,
|
|
—
|
illuminazione: fotoperiodo quotidiano: da 12 a 16 ore al giorno,
|
|
—
|
temperatura: appropriata alla specie (vedi appendice 2) ma con variazioni entro ± 1 oC per ciascuna prova,
|
|
—
|
concentrazione dell'ossigeno disciolto: non meno del 60 % del valore di saturazione dell'aria alla temperatura prescelta,
|
|
—
|
alimentazione: nessuna.
|
I pesci sono esaminati dopo le prime 2-4 ore ed almeno a intervalli di 24 ore. Essi sono considerati morti se toccando il peduncolo caudale non si ha alcuna reazione e non sono visibili movimenti respiratori. I pesci morti sono allontanati al momento in cui vengono osservati e le mortalità devono essere registrate. Va presa nota delle anormalità visibili (come la perdita di equilibrio, cambiamento di comportamento alla natazione, funzione respiratoria, pigmentazione, ecc.).
Il pH, l'ossigeno disciolto e la temperatura devono essere misurati quotidianamente.
Saggio limite
Usando le procedure descritte in questo metodo di saggio, si può eseguire un saggio limite a 100 mg per litro allo scopo di dimostrare che la CL50 è più elevata di questa concentrazione.
Se la natura della sostanza è tale che non si possa raggiungere una concentrazione di 100 mg per litro nel mezzo di saggio, il saggio limite deve essere eseguito ad una concentrazione uguale alla solubilità della sostanza (o alla concentrazione massima formante una dispersione stabile) nell'ambiente usato (vedi anche 1.6.1.1.).
Il saggio limite deve essere eseguito usando da 7 a 10 pesci, con lo stesso numero nel saggio (nei saggi) di controllo. (La teoria binomiale stabilisce che quando si utilizzano 10 pesci con mortalità 0, c'è il 99,9 % di confidenza che la CL50 sia maggiore della concentrazione usata nel saggio limite. Con 7, 8 0 9 pesci l'assenza di mortalità assicura una confidenza di almeno il 99 % che la CL50 sia maggiore della concentrazione usata).
Se si verifica mortalità, occorre eseguire uno studio completo. Se si osservano effetti sub-letali, questi devono essere registrati.
2. DATI E VALUTAZIONE
Per ciascun periodo in cui sono registrate osservazioni (24, 48, 72 e 96 ore) riportare su carta logaritmico-pro-babilistica la mortalità percentuale per ciascun periodo di esposizione raccomandato in funzione della concentrazione.
Dove è possibile, e per ciascun tempo di osservazione, si dovrebbero stimare la CL50 e i limiti di confidenza statistica (p = 0,05) con l'uso di procedure standard; questi valori devono essere arrotondati ad una (o al massimo due) cifre significative (esempi di arrotondamento a due cifre: 170 per 173,5; 0,13 per 0,127; 1,2 per 1,21).
Nei casi in cui il coefficiente angolare della curva di concentrazione/risposta percentuale è troppo alto per permettere il calcolo della CL50, è sufficiente una stima grafica di questo valore.
Quando due concentrazioni consecutive in un rapporto di 2,2 danno solo 0 e 100 % di mortalità, questi due valori sono sufficienti per indicare l'intervallo in cui cade la CL50.
Qualora si osservasse che la stabilità o l'omogeneità della sostanza in esame non può essere mantenuta, tale fatto dovrebbe essere indicato nella relazione e l'interpretazione dei risultati dovrebbe essere fatta con prudenza.
3. RELAZIONE
La relazione sulla prova deve, se possibile, includere le seguenti informazioni:
|
—
|
informazioni sul pesce impiegato per la prova (nome scientifico, ceppo, fornitore, eventuali pretrattamenti, grandezza e numero impiegato a ciascuna concentrazione di saggio),
|
|
—
|
fonte dell'acqua di diluizione e principali caratteristiche chimiche (pH, durezza, temperatura),
|
|
—
|
nel caso di una sostanza di scarsa solubilità in acqua, il metodo di preparazione della soluzione concentrata di riserva e della soluzione di saggio,
|
|
—
|
concentrazione di eventuali sostanze ausiliarie,
|
|
—
|
elenco delle concentrazioni usate e qualsiasi informazione disponibile relativa alla stabilità, alle concentrazioni della sostanza chimica provata nella soluzione di saggio,
|
|
—
|
se si eseguono analisi chimiche, metodi usati e risultati ottenuti,
|
|
—
|
risultati dell'eventuale saggio limite,
|
|
—
|
ragioni della scelta e dettagli del procedimento usato nel saggio (per esempio statico, semistatico, tasso di dosaggio, portata nel caso di flusso continuo, eventuale aereazione, densità dei pesci, ecc.),
|
|
—
|
descrizione dell'apparecchiatura sperimentale,
|
|
—
|
regime di illuminazione,
|
|
—
|
concentrazione dell'ossigeno disciolto, pH e temperatura delle soluzioni di saggio ogni 24 ore,
|
|
—
|
evidenze del fatto che sono stati soddisfatti i criteri di qualità,
|
|
—
|
una tabella che presenti la mortalità cumulativa a ciascuna concentrazione e nel controllo (e controllo con la sostanza ausiliaria, se richiesto) a ciascuno dei tempi di osservazione raccomandati,
|
|
—
|
grafico della curva di concentrazione/risposta percentuale al termine del saggio,
|
|
—
|
se possibile, i valori di CL50 a ciascuno dei tempi di osservazione raccomandati (con limiti di confidenza statistica al 95 %),
|
|
—
|
procedure statistiche usate per determinare i valori della CL50,
|
|
—
|
se si usa una sostanza di riferimento, risultati ottenuti,
|
|
—
|
concentrazione di saggio massima che non ha causato mortalità nel periodo di saggio,
|
|
—
|
concentrazione di saggio minima che ha provocato il 100 % di mortalità nel periodo del saggio.
|
4. BIBLIOGRAFIA
|
(1)
|
OECD, Paris, 1981, Test Guideline 203, Decision of the Council C(81) 30 final and updates.
|
|
(2)
|
AFNOR — Determination of the acute toxicity of a substance to Brachydanio rerio — Static and Flow Through methods — NFT 90-303 June 1985.
|
|
(3)
|
AFNOR — Determination of the acute toxicity of a substance to Salmo gairdneri — Static and Flow Through methods — NFT 90-305 June 1985.
|
|
(4)
|
ISO 7346/1,/2 and/3 — Water Quality — Determination of the acute lethal toxicity of substances to a fresh water fìsh (Brachydanio rerio Hamilton-Buchanan — Teleostei, Cyprinidae). Part 1: Static method. Part 2: Semi-static method. Part 3: Flow-through method.
|
|
(5)
|
Eidgenössisches Department des Innern, Schweiz: Richtlinien für Probenahme und Normung von Wasseruntersuchungsmethoden — Part II 1974.
|
|
(6)
|
DIN Tesrverfahren mit Wasserorganismen, 38 412 (L1) und L (15).
|
|
(7)
|
JIS K 0102, Acute toxicity test for fish.
|
|
(8)
|
NEN 6506 — Water — Bepaling van de akute toxiciteit met behulp van Poecilia recticulata — 1980.
|
|
(9)
|
Environmental Protection Agency, Methods for the acute toxicity tests with fish, macroinvertebrates and amphibians. The Committee on Methods for Toxicity tests with Aquatic Organisms, Ecological Research Series EPA-660-75-009, 1975.
|
|
(10)
|
Environmental Protection Agency, Environmental monitoring and support laboratory, Office of Rese arch and Development, EPA-600/4-78-012, January 1978.
|
|
(11)
|
Environmental Protection Agency, Toxic Substance Control, Part IV, 16 March 1979.
|
|
(12)
|
Standard methods for the examination of water and wastewater, 14th edition, APHA-AWWA-WPCF, 1975.
|
|
(13)
|
Commission of che European Coramunities, Inter-Laboratory test programme concerning the study of the ecotoxicity of a chemical substance with respect to the fish. EEC Study D.8368, 22 March 1979.
|
|
(14)
|
Verfahrensvorschlag des Umweltbundesamtes rum akuten Fisch-test. Rudolph, P. und Boje, R. Okoto- xikologie, Grundlagen für die ökotoxikologische Bewertung von Umweltchemikalien nach dem Chemi- kaliengesetz, ecomed 1986.
|
|
(15)
|
Litchfield, J.T. and Wilcoxon, F., A simplified method for evaluating dose effects experiments, J. Pharm, Exp. Therap., 1949, vol. 96, 99.
|
|
(16)
|
Finney, D.J. Statistical Methods in Biological Assay. Griffin, Weycombe, U.K., 1978.
|
|
(17)
|
Sprague, J.B. Measurement of pollutant toxicity to fish. I Bioassay methods for acute toxicity. Water Res. 1969, vol. 3, 793-821.
|
|
(18)
|
Sprague, J.B. Measurement of pollutant toxicity to fish. II Utilising and applying bioassay results. Water Res. 1970, vol. 4, 3-32.
|
|
(19)
|
Stephan, C.E. Methods for calculating an LC50. In Aquatic Toxicology and Hazard Evaluation (edited by F.I. Mayer and J.L. Hamelinck). American Society for Testing and Materials. ASTM STP 634, 1977, 65-84.
|
|
(20)
|
Stephan, C.E., Busch, K.A., Smith, R., Burke, J. and Andrews, R.W. A computer program for calculating an LC50. US EPA.
|
Appendice 1
Acqua ricostituita
Esempio di acqua di diluizione appropriata
Tutti i prodotti chimici devono avere purezza analitica.
Dovrebbe essere impiegata acqua distillata di buona qualità oppure acqua deionizzata, di conduttività, inferiore a 5 μScm-1
L'apparecchio per la distillazione dell'acqua non deve contenere parti in rame.
Soluzioni di riserva
|
CaCl2. 2H2O (calcio cloruro diidrato):
Sciogliere e portare ad un litro con acqua.
|
11,76 g
|
|
MgSO4. 7H2O (magnesio solfato eptaidrato):
Sciogliere e portare ad un litro con acqua.
|
4,93 g
|
|
NaHCO3 (sodio bicarbonato):
Sciogliere e portare ad un litro con acqua.
|
2,59 g
|
|
KCl (potassio cloruro):
Sciogliere e portare ad un litro con acqua.
|
0,23 g
|
Acqua di diluizione ricostituita
Mescolare 25 ml di ciascuna delle quattro soluzioni di riserva e portare ad un litro con acqua.
Aerare finchè la concentrazione dell'ossigeno disciolto uguagli il valore di saturazione per l'aria.
Il pH dovrebbe essere di 7,8 ± 0,2.
Se necessario regolare il pH mediante aggiunte di NaOH (sodio idrossido) o HCl (acido cloridrico).
L'acqua di diluizione così preparata viene lasciata da parte per circa 12 ore e non richiede alcuna ulteriore aerazione.
La somma degli ioni Ca e Mg in questa soluzione è di 2,5 mmol/l. II rapporto degli ioni Ca e Mg è di 4:1 e quello degli ioni Na e K è di 10:1. L'alcalinità totale di questa soluzione è 0,8 mmol/1.
Eventuali deviazioni nel modo di preparare l'acqua di diluizione non devono modificarne la composizione e le proprietà.
Appendice 2
Specie di pesci raccomandate per il saggio
|
Specie raccomandate
|
Intervallo di temperatura raccomandato per il saggio ( oC)
|
Lunghezza totale racommandata per gli animali da saggio (cm)
|
|
Brachydanio reno (Teleostei, Cyprinidae) (Hamilton-Buchanan) Danio Zebrato
|
20 a 24
|
3,0 ± 0,5
|
|
Pimephales promelas (Teleostei, Cyprinidae) (Rafinesque) Fathead minnow
|
20 a 24
|
5,0 ± 2,0
|
|
Cyprinus carpio (Teleostei, Cyprinidae) (Linnaeus 1758) Carpe commune
|
20 a 24
|
6,0 ± 2,0
|
|
Oryzias latipes (Teleostei, Poeciliiae Cyprinodonti-dae) (Tomminck et Schlegel 1850) Red Killifish
|
20 a 24
|
3,0 ± 1,0
|
|
Poecilia reticulata (Teleostei, Poeciliidae) (Peters 1859) Guppy
|
20 a 24
|
3,0 ± 1,0
|
|
Lepomis macrochirus (Teleostei, Centrarchidae) (Rafinesque Linnaeus 1758) Bluegill
|
20 a 24
|
5,0 ± 2,0
|
|
Onchorhynchus mykiss (Teleostei, Salmonidae) (Walbaum 1988) Trota iridea
|
12 a 17
|
6,0 ± 2,0
|
|
Leuciscus idus (Teleostei, Cyprinidae) (Linnaeus 1758) Golden orfe
|
20 a 24
|
6,0 ± 2,0
|
Raccolta
I pesci suelencati sono allevabili facilmente e/o sono largamente disponibili per tutto l'anno. Possono riprodursi e essere mantenuti sia in stabilimenti di acquicoltura sia in laboratorio, sotto condizioni di controllo delle malattie e dei parassiti, in modo che gli animali di saggio saranno sani e geneticamente controllati. Questi pesci sono disponibili in molte parti del mondo.
Appendice 3
Esempio di curva concentrazione/percento di mortalità
Esempio di determinazione della CL50 usando carta log-probit.

C.2. SAGGIO DI IMMOBILIZZAZIONE ACUTA IN DAPHNIA SP.
1. METODO
Il presente metodo di prova di immobilizzazione acuta corrisponde a quello descritto nelle linee guida dell'OCSE TG 202 (2004).
1.1. INTRODUZIONE
Il presente metodo descrive un saggio di tossicità acuta finalizzato a determinare gli effetti di una sostanza chimica sulle dafnie. Per quanto possibile sono stati utilizzati i metodi di prova esistenti (1)(2)(3).
1.2. DEFINIZIONI
Ai fini del presente metodo si applicano le seguenti definizioni:
|
|
EC
50: concentrazione stimata che immobilizza il 50 % delle dafnie entro un periodo di esposizione prestabilito. Se si applica una definizione diversa, è necessario indicarlo con i relativi riferimenti bibliografici.
|
|
|
Immobilizzazione: sono considerati immobili gli animali che, dopo lieve agitazione del contenitore usato per il saggio, non sono in grado di nuotare entro 15 secondi (anche se possono ancora muovere le antenne).
|
1.3. PRINCIPIO DEL METODO
Le giovani dafnie, di età inferiore a 24 ore all'inizio del saggio, sono esposte alla sostanza di prova ad un certo range di concentrazione per 48 ore. L'immobilizzazione viene registrata dopo 24 ore e dopo 48 ore e comparata ai valori di controllo. I risultati sono successivamente analizzati per calcolare la EC50 a 48 ore (cfr. definizioni al punto 1.2.). La determinazione della EC50 a 24 ore è facoltativa.
1.4. INFORMAZIONI SULLA SOSTANZA DI PROVA
È necessario conoscere la solubilità in acqua e la pressione di vapore della sostanza di prova e deve essere disponibile un metodo analitico affidabile per quantificare la sostanza nelle soluzioni di prova con una efficienza di recupero e un limite di rilevamento noti. Tra le informazioni utili di cui disporre figurano la formula di struttura, la purezza della sostanza, la stabilità in acqua o alla luce, Pow e i risultati di un saggio di biodegradabilità con metodo ready (cfr. metodo C.4).
Nota: orientamenti per testare sostanze con caratteristiche fisico-chimiche che rendono difficoltosa l'esecuzione del saggio sono contenuti in (4).
1.5. SOSTANZE DI RIFERIMENTO
Una sostanza di riferimento può essere sottoposta a prova per determinarne l'EC50 al fine di garantire che le condizioni di prova sono affidabili. A tal fine si raccomanda l'utilizzo di tossicanti utilizzati in prove interlaboratorio (ring test) (1)(5) (1). La o le prove con una sostanza di riferimento devono essere condotte preferibilmente una volta al mese e almeno due volte l'anno.
1.6. CRITERI DI QUALITÀ
Ai fini della validità del saggio devono applicarsi i seguenti criteri:
|
—
|
nei controlli, compreso il controllo contenente l'agente di solubilizzazione, l'immobilizzazione nelle dafnie non deve superare il 10 %,
|
|
—
|
la concentrazione dell'ossigeno disciolto nei contenitori usati nel saggio e nei controlli deve essere ≥ 3 mg/l alla fine del saggio.
|
Nota: per il primo criterio, non più del 10 % delle dafnie di controllo deve presentare immobilizzazione o altri segni di disturbo o stress quali scolorazione o comportamento anomalo come il fatto di rimanere bloccate alla superficie dell'acqua.
1.7. DESCRIZIONE DEL METODO
1.7.1. Apparecchiature
I contenitori e gli altri apparecchi destinati ad entrare in contatto con le soluzioni di prova devono essere interamente di vetro o di altro materiale chimicamente inerte. I contenitori saranno in genere provette o bicchieri di vetro; prima di ogni uso devono essere puliti secondo le normali procedure di laboratorio. I contenitori utilizzati nelle prove devono essere coperti in maniera non ermetica per ridurre la perdita d'acqua per evaporazione ed evitare che penetri polvere nelle soluzioni. Le sostanze volatili devono essere testate in contenitori chiusi e completamente riempiti, abbastanza grandi da evitare che l'ossigeno raggiunga un livello troppo scarso o tale da avere un effetto limitante (cfr. punto 1.6 e punto 1.8.3, primo paragrafo).
Oltre ai contenitori saranno utilizzate alcune o tutte le apparecchiature indicate di seguito: misuratore di ossigeno (con microelettrodo o altro apparecchio adatto per la misurazione dell'ossigeno disciolto in campioni di piccolo volume); pH-metro; apparecchiatura adeguata per il controllo della temperatura; apparecchiatura per determinare la concentrazione di carbonio organico totale (TOC); apparecchiatura per determinare la domanda chimica di ossigeno (COD); apparecchiatura per la determinazione della durezza dell'acqua, ecc.
1.7.2. Organismo sottoposto al saggio
Daphnia magna Straus è la specie sperimentale preferita, anche se è possibile ricorrere ad altre specie (ad esempio Daphnia pulex). All'inizio del saggio gli animali devono avere meno di 24 ore di vita; per ridurre la variabilità è fortemente consigliabile non utilizzare progenie provenienti dalla prima nidiata. Devono provenire da una popolazione sana (senza segni di stress quali un alto tasso di mortalità, presenza di maschi e formazione di efippi, ritardo nella produzione della prima nidiata, scolorazione ecc.). Tutti gli organismi utilizzati per una prova particolare devono provenire da colture derivanti dalla stessa popolazione di dafnie. Gli animali della popolazione vanno mantenuti in condizioni colturali (luce, temperatura, mezzo) simili a quelle che verranno utilizzate nel saggio. Se il mezzo di coltura delle dafnie da usare nel saggio è diverso da quello utilizzato di routine per la coltura delle dafnie, è buona prassi prevedere un periodo di acclimatazione prima del saggio. A tal fine le dafnie parentali devono essere mantenute in acqua di diluizione alla temperatura di prova per almeno 48 ore prima dell'inizio del saggio.
1.7.3. Acqua di allevamento e di diluizione
È possibile utilizzare come acqua di allevamento e acqua di diluizione acqua naturale (di superficie o freatica), acqua ricostituita o acqua di rubinetto non clorata se le dafnie sopravvivono per la durata della coltura, dell'acclimatazione e della prova senza manifestare segni di stress. Le acque che presentano le caratteristiche chimiche indicate all'allegato I riferite ad un'acqua di diluizione accettabile sono considerate adatte come acque da utilizzare per il saggio. Per tutta la durata del saggio l'acqua deve mantenere una qualità costante. L'acqua ricostituita può essere ottenuta aggiungendo ad acqua deionizzata o distillata specifiche quantità di reagenti di grado analitico riconosciuto. Esempi di acqua ricostituita sono indicati in (1)(6) e all'allegato II. Per saggiare sostanze contenenti metalli non utilizzare mezzi contenenti agenti chelanti noti, come l'M4 e l'M7 indicati all'allegato II. Il pH deve essere compreso tra 6 e 9. Per la Daphnia magna si raccomanda una durezza compresa tra 140 e 250 mg/l (come CaCO3), mentre per altre specie di Daphnia può essere più opportuna una durezza inferiore. L'acqua di diluizione deve essere aerata prima di utilizzarla nel saggio per consentire alla concentrazione di ossigeno disciolto di raggiungere la saturazione.
Se si utilizza acqua naturale, i parametri relativi alla qualità devono essere misurati almeno due volte all'anno oppure ogni volta si sospetti che tali caratteristiche possano essersi modificate sensibilmente (cfr. paragrafo precedente e allegato I). È inoltre necessario misurare i metalli pesanti (ad esempio Cu, Pb, Zn, Hg, Cd, Ni). Se si utilizza acqua di rubinetto non clorata, è preferibile procedere ad un'analisi giornaliera del cloro. Se l'acqua di diluizione proviene da una sorgente di acqua di superficie o da una sorgente freatica, è necessario misurare la conduttività e il carbonio organico totale (TOC) oppure la domanda chimica di ossigeno (COD).
1.7.4. Soluzioni di prova
Le soluzioni di prova delle concentrazioni scelte sono in genere preparate diluendo una soluzione madre. Le soluzioni madre devono essere preferibilmente preparate mediante dissoluzione della sostanza di prova nell'acqua di diluizione. Per quanto possibile evitare l'impiego di solventi, emulsionanti o agenti di dispersione; in alcuni casi, tuttavia, può essere necessario usare questi composti per ottenere una soluzione madre della concentrazione corretta. Per ottenere indicazioni sull'impiego dei solventi, emulsionanti e agenti di dispersione adeguati, consultare il testo (4). In ogni caso, la sostanza di prova contenuta nelle soluzioni di prova non deve superare il limite di solubilità nell'acqua di diluizione.
Il saggio deve essere effettuato senza regolazione del pH. Se quest'ultimo non rimane nell'intervallo 6-9 si consiglia di ripetere il saggio regolando il pH della soluzione madre in base a quello dell'acqua di diluizione prima di aggiungere la sostanza di prova. La regolazione del pH deve essere effettuata in modo tale che la concentrazione della soluzione madre non vari in modo significativo e che non si producano reazioni chimiche o precipitazione della sostanza di prova. A tal fine sono da preferirsi l'HCl e l'NaOH.
1.8. PROCEDURA
1.8.1. Condizioni di esposizione
1.8.1.1. Gruppi di prova e controlli
Riempire i contenitori usati nel saggio con la quantità corretta di acqua di diluizione e soluzioni della sostanza di prova. Il rapporto tra volume di aria/volume di acqua all'interno del contenitore deve essere uguale per il gruppo di prova e il gruppo di controllo. Le dafnie sono successivamente collocate nei contenitori di prova. Per ciascuna concentrazione di prova e per i controlli devono essere utilizzati almeno 20 animali, preferibilmente suddivisi in quattro gruppi di cinque. Per ciascun animale sono necessari almeno 2 ml di soluzione di prova (cioè un volume di 10 ml per cinque dafnie per contenitore di prova). Il saggio può essere effettuato con un sistema di rinnovo semi-statico o con un sistema dinamico quando la concentrazione della sostanza di prova non è stabile.
Oltre alla serie di trattamento è necessario procedere a una serie di controlli con acqua di diluizione e, se opportuno, a una serie di controlli con agente solubilizzante.
1.8.1.2. Concentrazioni di prova
Si può procedere a una prova per determinare il range di concentrazione per il saggio definitivo, a meno di non disporre già di informazioni sulla tossicità della sostanza di prova. A tal fine le dafnie sono esposte a una serie di concentrazioni della sostanza di prova molto intervallate tra loro. Cinque dafnie devono essere sottoposte a ciascuna concentrazione di prova per 48 ore al massimo e non sono necessarie ripetizioni. Il periodo di esposizione può essere ridotto (ad esempio a 24 ore o meno) se è possibile ottenere i dati necessari per determinare il range di concentrazione in meno tempo.
Devono essere utilizzate almeno cinque concentrazioni di prova in una serie geometrica con un rapporto geometrico preferibilmente non superiore a 2,2. Se vengono utilizzate meno di cinque concentrazioni è necessario motivare la scelta. La concentrazione più elevata testata deve preferibilmente produrre l'immobilizzazione totale (100 %), mentre la concentrazione più bassa non deve, di preferenza, causare alcun effetto osservabile.
1.8.1.3. Condizioni di incubazione
La temperatura deve essere compresa tra 18 oC e 22 oC e per ogni singolo saggio deve mantenersi costante con uno scarto di ± 1 oC. È consigliabile effettuare un ciclo di 16 ore di luce e un ciclo di 8 ore di buio. Si può anche procedere all'incubazione nell'oscurità totale, in particolare se le sostanze di prova sono instabili alla luce.
Durante il saggio i contenitori non devono essere aerati. Il saggio non richiede la regolazione del pH. Durante il saggio le dafnie non devono essere alimentate.
1.8.1.4. Durata
Il saggio dura 48 ore.
1.8.2. Osservazioni
Ciascun contenitore utilizzato per il saggio deve essere controllato per verificare l'immobilizzazione delle dafnie dopo 24 e dopo 48 ore dall'inizio del saggio (cfr. definizioni al punto 1.2). Oltre all'immobilità è necessario riferire su qualsiasi comportamento o aspetto anomali.
1.8.3. Misurazioni analitiche
L'ossigeno disciolto e il pH sono misurati all'inizio e alla fine del saggio nel/nei controllo/i e alla concentrazione più elevata della sostanza di prova. La concentrazione dell'ossigeno disciolto nei controlli deve rispettare il criterio di validità (cfr. punto 1.6). Il pH non deve in genere variare di oltre 1,5 unità in ciascun saggio effettuato. La temperatura viene in genere rilevata nei contenitori di controllo o nell'aria ambiente e dev'essere preferibilmente registrata in maniera continua durante il saggio o comunque almeno all'inizio e alla fine del saggio.
La concentrazione della sostanza di prova deve essere misurata almeno alla concentrazione di prova massima e minima, all'inizio e alla fine del saggio (4). I risultati devono basarsi sulle concentrazioni misurate. Tuttavia, se vi sono dati in grado di dimostrare che per tutta la durata del saggio la concentrazione della sostanza di prova si è mantenuta in maniera soddisfacente entro ± 20 % della concentrazione nominale o della concentrazione iniziale rilevata, i risultati possono anche basarsi sui valori nominali o sui valori iniziali misurati.
1.9. SAGGIO LIMITE
Usando le procedure descritte in questo metodo di prova, si può eseguire un saggio limite a 100 mg/l della sostanza di prova oppure fino al limite di solubilità di quest'ultima nel terreno utilizzato per il saggio (se è inferiore) allo scopo di dimostrare che la EC50 si colloca al di sopra di questa concentrazione. Il saggio limite deve essere eseguito usando 20 dafnie (preferibilmente suddivise in 4 gruppi di cinque), con un ugual numero nel gruppo (nei gruppi) di controllo. Se si verifica immobilizzazione, si deve eseguire uno studio completo. Ogni comportamento anomalo rilevato deve essere registrato.
2. DATI
I dati devono essere riassunti sotto forma di tabelle; per ogni gruppo di trattamento e gruppo di controllo devono essere indicati il numero di dafnie utilizzate e il grado di immobilizzazione rilevato ad ogni osservazione. Le percentuali di dafnie immobilizzate dopo 24 ore e dopo 48 ore devono essere rappresentate graficamente rispetto alle concentrazioni di prova. I dati devono essere analizzati con gli opportuni metodi statistici (come analisi probit ecc.) per calcolare l'andamento delle curve e la EC50 con limiti di affidabilità del 95 % (p = 0,05) (7) (8).
Se non è possibile applicare ai dati ottenuti i metodi standard di calcolo della EC50, come valore approssimativo per la EC50 devono essere utilizzate la concentrazione massima che non causa immobilizzazione e la concentrazione minima che causa l'immobilità totale (100 %) (il valore è dato dalla media geometrica di queste due concentrazioni).
3. RELAZIONE SULL'ESECUZIONE DEL SAGGIO
3.1. RAPPORTO DI PROVA
Il rapporto di prova deve includere le seguenti informazioni:
Sostanza di prova:
|
—
|
natura fisica e caratteristiche fisico-chimiche,
|
|
—
|
dati che ne consentano l'identificazione chimica, compresa la purezza.
|
Specie sottoposte al saggio:
|
—
|
origine e specie di Daphnia, fornitore (se noto) e condizioni di coltura utilizzate (inclusa la fonte, il tipo e la quantità di alimento e la frequenza di alimentazione).
|
Condizioni di prova:
|
—
|
descrizione dei contenitori utilizzati per il saggio: tipo di contenitori, volume della soluzione, numero di dafnie per contenitore, numero di contenitori di prova (ripetizioni) per concentrazione,
|
|
—
|
metodi di preparazione della soluzione madre e della soluzione di prova, compreso l'eventuale impiego di solventi o agenti di dispersione, concentrazioni utilizzate,
|
|
—
|
informazioni sull'acqua di diluizione: provenienza e caratteristiche di qualità dell'acqua (pH, durezza, rapporto Ca/Mg, rapporto Na/K, alcalinità, conduttività ecc.); composizione dell'acqua ricostituita, se utilizzata,
|
|
—
|
condizioni di incubazione: temperatura, intensità luminosa e periodicità dell'esposizione alla luce, ossigeno disciolto, pH, ecc.
|
Risultati:
|
—
|
numero e percentuale di dafnie immobilizzate o che hanno mostrato effetti negativi (compreso un comportamento anomalo) nei gruppi di controllo e in ciascun gruppo di trattamento, per ogni tempo di osservazione e descrizione del tipo di effetti osservati,
|
|
—
|
risultati e data del saggio eseguito con la sostanza di riferimento, se disponibili,
|
|
—
|
concentrazioni nominali di prova e risultato di tutte le analisi effettuate per determinare la concentrazione della sostanza di prova nei contenitori utilizzati nel saggio; devono essere indicati anche l'efficienza di recupero del metodo e il limite di determinazione,
|
|
—
|
tutte le misurazioni fisico-chimiche di temperatura, pH e ossigeno disciolto svolte durante il saggio,
|
|
—
|
EC50 a 48 ore per l'immobilizzazione con intervalli di affidabilità e grafici del modello adattato utilizzato per il calcolo, andamento delle curve dose-risposta ed errore standard; procedimenti statistici utilizzati per determinare la EC50 (questi stessi dati devono essere riportati anche per l'immobilizzazione a 24 ore, se misurati),
|
|
—
|
spiegazione delle eventuali deviazioni rispetto al metodo di prova, con indicazione dell'eventuale incidenza della deviazione sui risultati ottenuti nel saggio.
|
4. BIBLIOGRAFIA
|
1.
|
ISO 6341. (1996), Water quality — Determination of the inhibition of the mobility of Daphnia magna Straus (Cladocera, Crustacea) — Acute toxicity test, terza edizione, 1996.
|
|
2.
|
EPA OPPTS 850.1010 (1996), Ecological Effects Test Guidelines — Aquatic Invertebrate Acute Toxicity Test, Freshwater Daphnids.
|
|
3.
|
Environment Canada (1996), Biological test method. Acute Lethality Test Using Daphnia spp. EPS 1/RM/11, Environment Canada, Ottawa, Ontario, Canada.
|
|
4.
|
Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, OECD Environmental Health and Safety Publication. Series on Testing and Assessment, No. 23, Parigi 2000.
|
|
5.
|
Commissione delle Comunità europee, Studio D8369 (1979), Inter-laboratory Test Programme concerning the study of the ecotoxicity of a chemical substance with respect to Daphnia.
|
|
6.
|
OECD Guidelines for the Testing of Chemicals. Guideline 211: Daphnia magna Reproduction Test, adottato nel settembre 1998.
|
|
7.
|
Stephan C.E. (1977), Methods for calculating an LC50, in Aquatic Toxicology and Hazard Evaluation (a cura di F.I. Mayer e J.L. Hamelink), ASTM STP 634 — American Society for Testing and Materials, pagg. 65-84.
|
|
8.
|
Finney D.J. (1978), Statistical Methods in Biological Assay, terza edizione, Londra, Griffin, Weycombe, UK.
|
ALLEGATO 1
ALCUNE CARATTERISTICHE CHIMICHE RIFERITE AD UN'ACQUA DI DILUIZIONE DI QUALITÀ ACCETTABILE
|
Sostanza
|
Concentrazione
|
|
Particolato
|
< 20 mg/l
|
|
Carbonio organico totale
|
< 2 mg/l
|
|
Ammoniaca non ionizzata
|
< 1 μg/l
|
|
Cloro residuo
|
< 10 μg/l
|
|
Pesticidi organofosforici totali
|
< 50 ng/l
|
|
Pesticidi organoclorati totali più difenili policlorurati
|
< 50 ng/l
|
|
Cloro organico totale
|
< 25 ng/l
|
ALLEGATO 2
ESEMPI DI ACQUA RICOSTITUITA RITENUTA ADEGUATA PER IL SAGGIO
Acqua per il saggio ISO (1)
|
Soluzione madre (singola sostanza)
|
Per preparare l'acqua ricostituita, aggiungere i seguenti volumi di soluzione madre in 1 litro d'acqua (2)
|
|
Sostanza
|
Quantità aggiunta in 1 litro d'acqua (2)
|
|
Cloruro di calcio
CaCl2, 2H2O
|
11,76 g
|
25 ml
|
|
Solfato di magnesio
MgSO4, 7H2O
|
4,93 g
|
25 ml
|
|
Bicarbonato di sodio
NaHCO3
|
2,59 g
|
25 ml
|
|
Cloruro di potassio
KCl
|
0,23 g
|
25 ml
|
Mezzo Elendt M7 ed M4
Acclimatazione al mezzo Elendt M4 ed M7
Alcuni laboratori hanno riscontrato difficoltà a trasferire direttamente la Daphnia ai mezzi di coltura M4 ed M7. Qualche risultato è stato invece ottenuto con un'acclimatazione graduale, cioè trasferendo la Daphnia dal proprio mezzo ad un mezzo Elendt al 30 %, poi al 60 % e infine ad un mezzo Elendt al 100 %. I periodi di acclimatazione possono avere anche una durata di un mese.
Preparazione
Elementi in tracce
Preparare innanzitutto distinte soluzioni madre (I) dei singoli elementi in tracce in acqua di purezza adeguata, ad esempio acqua non ionizzata, acqua distillata o sottoposta a trattamento di osmosi inversa. Da queste soluzioni (I) preparare una seconda soluzione madre unica (II) contenente tutti gli elementi in tracce (soluzione combinata), cioè:
|
Soluzione(i) madre I (unica sostanza)
|
Quantità aggiunta all'acqua (mg/l)
|
Concentrazione (riferita al mezzo M4)
|
Per preparare la soluzione madre combinata II aggiungere i seguenti quantitativi di soluzione I all'acqua (ml/l)
|
|
M4
|
M7
|
|
H3BO3
|
57 190
|
20 000 volte
|
1,0
|
0,25
|
|
MnCl2.4H2O
|
7 210
|
20 000 volte
|
1,0
|
0,25
|
|
LiCl
|
6 120
|
20 000 volte
|
1,0
|
0,25
|
|
RbCl
|
1 420
|
20 000 volte
|
1,0
|
0,25
|
|
SrCl2.6H2O
|
3 040
|
20 000 volte
|
1,0
|
0,25
|
|
NaBr
|
320
|
20 000 volte
|
1,0
|
0,25
|
|
Na2 MoO4.2H2O
|
1 230
|
20 000 volte
|
1,0
|
0,25
|
|
CuCl2.2H2O
|
335
|
20 000 volte
|
1,0
|
0,25
|
|
ZnCl2
|
260
|
20 000 volte
|
1,0
|
1,0
|
|
CoCl2.6H2O
|
200
|
20 000 volte
|
1,0
|
1,0
|
|
KI
|
65
|
20 000 volte
|
1,0
|
1,0
|
|
Na2SeO3
|
43,8
|
20 000 volte
|
1,0
|
1,0
|
|
NH4VO3
|
11,5
|
20 000 volte
|
1,0
|
1,0
|
|
Na2EDTA.2H2O
|
5 000
|
2 000 volte
|
—
|
—
|
|
FeSO4.7H2O
|
1 991
|
2 000 volte
|
—
|
—
|
|
Le soluzioni Na 2 EDTA ed FeSO4 sono preparate individualmente, mescolate e messe immediatamente in autoclave.
|
|
Il risultato è:
|
|
2 l Fe-EDTA solutione
|
|
1 000 volte
|
20,0
|
5,0
|
Mezzi di coltura M4 edM7
I mezzi di coltura M4 ed M7 sono preparati con la soluzione madre II, macronutrienti e vitamine come indicato nella tabella:
|
|
Quantità aggiunta all'acqua (mg/l)
|
Concentrazione (riferita al mezzo M4)
|
Quantitativo di soluzione II aggiunto per preparare il mezzo di coltura (ml/l)
|
|
M4
|
M7
|
|
Soluzione madre II (elementi in tracce combinati)
|
|
20 volte
|
50
|
50
|
|
Soluzioni madre con macronutrienti (unica sostanza)
|
|
|
|
|
|
CaCl2 — 2H2O
|
293 800
|
1 000 volte
|
1,0
|
1,0
|
|
MgSO4 — 7H2O
|
246 600
|
2 000 volte
|
0,5
|
0,5
|
|
KCl
|
58 000
|
10 000 volte
|
0,1
|
0,1
|
|
NaHCO3
|
64 800
|
1 000 volte
|
1,0
|
1,0
|
|
Na2 SiO3 — 9H2O
|
50 000
|
5 000 volte
|
0,2
|
0,2
|
|
NaNO3
|
2 740
|
10 000 volte
|
0,1
|
0,1
|
|
KH2PO4
|
1 430
|
10 000 volte
|
0,1
|
0,1
|
|
K2HPO4
|
1 840
|
10 000 volte
|
0,1
|
0,1
|
|
Soluzione madre di vitamine combinate
|
—
|
10 000 volte
|
0,1
|
0,1
|
|
La soluzione madre di vitamine combinate viene preparata aggiungendo le 3 vitamine indicate di seguitoin un litro d'acqua:
|
|
Tiamina cloridrato
|
750
|
10 000 volte
|
|
|
|
Cianocobalamina (B12)
|
10
|
10 000 volte
|
|
|
|
Biotina
|
7,5
|
10 000 volte
|
|
|
La soluzione di vitamine combinate è conservata in congelatore in piccole aliquote. Le vitamine vengono aggiunte al mezzo di coltura poco prima dell'utilizzo.
|
N.B.
|
:
|
Per evitare la precipitazione di sali durante la preparazione del mezzo di coltura completo, aggiungere le aliquote di soluzioni madre a circa 500-800 ml di acqua non ionizzata e poi riempire fino a raggiungere il litro.
|
|
N.B.
|
:
|
La prima pubblicazione riguardante il mezzo M4 si trova in Elendt, B. P. (1990), Selenium deficiency in crustacea; an ultrastructual approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, pagg. 25-33.
|
C.3. SAGGIO DI INIBIZIONE DELLA CRESCITA DELLE ALGHE
1. METODO
1.1. INTRODUZIONE
Lo scopo di questo saggio è di determinare gli effetti di una sostanza sulla crescita di una specie di alga verde unicellulare. Con saggi relativamente brevi (72 ore) si possono valutare gli effetti su varie generazioni. Questo metodo può essere adattato all'uso di parecchie specie di alghe unicellulari, nel qual caso nella relazione sul saggio deve essere fornita una descrizione del metodo usato.
Questo metodo viene applicato con particolare facilità a sostanze solubili in acqua che, nelle condizioni del saggio, hanno buone probabilità di rimanere nell'acqua.
Il metodo può essere usato per sostanze che non interferiscano direttamente con la misura della crescita delle alghe.
Prima di iniziare il saggio è desiderabile disporre, per quanto è possibile, di informazioni concernenti la solubilità in acqua, la tensione di vapore, la stabilità chimica, le costanti di dissociazione e la biodegradabilità della sostanza in esame.
Sia per la programmazione della prova che per l'interpretazìone dei risultati si dovrebbero tenere in considerazione anche altre informazioni (per esempio formula di struttura, grado di purezza, natura e percentuale delle impurezze significative, presenza e quantità di additivi e coefficiente di ripartizione n-ottanolo/acqua).
1.2. DEFINIZIONI E UNITÀ
Densità delle cellule: numero di cellule per millilitro;
Crescita: aumento della densità delle cellule lungo il periodo sperimentale;
Tasso di crescita: aumento di densità delle cellule per unità di tempo;
CE50: in questo metodo, la concentrazione della sostanza in esame che provoca una riduzione del 50 % della crescita (CbE50) o del tasso di crescita (CrE50) rispetto al controllo;
NOEC (concentrazione senza effetti osservabili): in questo metodo, la maggiore concentrazione sperimentata alla quale non si osserva alcuna inibizione significativa della crescita rispetto al controllo.
Tutte le concentrazioni delle sostanze in esame sono espresse in peso/volume (mg/l). Esse possono anche venire espresse in peso/peso (mg.kg-1).
1.3. SOSTANZE DI RIFERIMENTO
Per dimostrare che, nelle condizioni sperimentali di laboratorio, la sensibilità della risposta della specie usata per il saggio non è variata in modo significativo, può essere saggiata una sostanza di riferimento.
Se si usa una sostanza di riferimento, i risultati ottenuti devono essere presentati nella relazione sul saggio. Come sostanza di riferimento si può usare dicromato di potassio, ma il suo colore può interferire con la qualità della luce e la sua intensità disponibile per le cellule e inoltre con le determinazioni spertrofotometriche, nel caso vangano usate. Il dicromato di potassio è stato usato in un saggio interlaboratorio internazionale (vedi riferimento (3) e appendice 2).
1.4. PRINCIPIO DEL METODO DI SAGGIO
Si può eseguire un saggio limite a 100 mg per litro della sostanza in esame allo scopo di dimostrare che la CE50 si pone al di sopra di questa concentrazione.
Colture in crescita esponenziale di alghe verdi selezionate sono esposte a varie concentrazioni della sostanza in esame su varie generazioni in condizioni definite.
Le soluzioni di prova sono incubate per un periodo di 72 ore, durante cui la densità delle cellule in ciascuna viene misurata almeno ogni 24 ore. Si determina l'inibizione della crescita rispetto ad una coltura di controllo.
1.5. CRITERI DI QUALITÀ
I criteri di qualità valgono sia per il saggio limite che per il metodo di saggio completo.
La densità delle cellule nelle colture di controllo deve aumentare di un fattore di almeno 16 entro 3 giorni.
La concentrazione della sostanza in esame deve essere mantenuta in modo da non scendere al di sotto dell'80 % della concentrazione iniziale per tutta la durata della prova.
Per le sostanze che si sciolgono facilmente nel mezzo liquido del saggio e che forniscono soluzioni stabili, ossia che non presentano in grado significativo volatilizzazione, degradazione, idrolisi o adsorbimento, la concentrazione iniziale può essere considerata come equivalente alla concentrazione nominale. Deve essere fornita la prova che la concentrazione si è mantenuta costante per tutta la durata del saggio e che sono stati soddisfatti i criteri di qualità.
Per le sostanze che sono:
|
(i)
|
scarsamente solubili nel mezzo liquido del saggio, o
|
|
(ii)
|
in grado di formare emulsioni o dispersioni stabili, o
|
|
(iii)
|
non stabili in soluzione acquosa,
|
come concentrazione iniziale si assume la concentrazione misurata all'inizio del saggio. La concentrazione deve essere determinata dopo un periodo concesso per il raggiungimento dell'equilibrio.
In ciascuno di questi casi, ulteriori misure devono essere effettuate durante il saggio per confermare la concentrazione di esposizione effettiva o i criteri di qualità sono stati rispettati.
È certo che quantità significative della sostanza in esame saranno incorporate nella biomassa delle alghe nel periodo di esecuzione del saggio. Pertanto, allo scopo di dimostrare la conformità coi criteri di qualità visti sopra, si deve prendere in considerazione sia la sostanza incorporata nella biomassa algale che la sostanza in soluzione (o, se ciò non è tecnicamente possibile, misurata nella colonna d'acqua). Tuttavia, poichè la determinazione della concentrazione di sostanza nella biomassa delle alghe può presentare dei problemi tecnici significativi, il rispetto dei criteri dì qualità può essere dimostrato eseguendo una prova in un recipiente alla concentrazione massima della sostanza ma senza alghe e misurando la concentrazione in soluzione (o, se ciò non è tecnicamente possìbile nella colonna d'acqua) all'inizio e al termine del periodo di prova.
1.6. DESCRIZIONE DEL PROCEDIMENTO SPERIMENTALE
1.6.1. Reagenti
1.6.1.1. Soluzioni di sostanze in esame
Soluzioni di riserva opportunamente concentrate vengono preparate sciogliendo la sostanza in acqua deionizzata o in acqua secondo il punto 1.6.1.2.
Si preparano le concentrazioni scelte per il saggio. Aggiungendone adatte aliquote a precolture di alghe (vedi appendice 1).
Normalmente le sostanze devono essere sottoposte al saggio solo fino al limite di solubilità. Per alcune sostanze (per esempio sostanze che hanno una scarsa solubilità in acqua o un elevato Poa, o quelle che formano dispersioni stabili piuttosto che soluzioni vere in acqua), è accettabile includere nel saggio una concentrazione che superi il limite di solubilità della sostanza al fine di garantire di raggiungere la massima concentrazione solubile/stabile. È importante tuttavia che questa concentrazione non disturbi altrimenti il sistema di saggio (per esempio una pellicola della sostanza sulla superficie dell'acqua che impedisca l'ossigenazione dell'acqua, ecc.).
Si può ricorrere alla dispersione ultrasonica, solventi organici, emulsionanti o disperdenti come aiuto per preparare le soluzioni concentrate di riserva delle sostanze di scarsa solubilità in acqua o per disperdere queste sostanze nel mezzo liquido del saggio. Quando si utilizzano tali sostanze ausiliari, tutte le concentrazioni di saggio devono contenere la stessa quantità di sostanza ausiliare, e devono essere esposte colture di controllo aggiuntive alla stessa concentrazione della sostanza ausiliare usata nella serie di prove del saggio. La concentrazione di tali ausiliari deve essere minimizzata, e in nessun caso deve superare i 100 mg per litro nel mezzo liquido del saggio.
La prova deve essere effettuata senza regolazione del pH. Se quest'ultimo presentasse notevoli variazioni, si consiglia di ripetere la prova procedendo all'opportuna regolazione del pH e riportando i risultati. In questo caso, il valore del pH della soluzione di riserva deve essere portato al valore di quello dell'acqua di diluizione, a meno che non esistano specifiche ragioni per agire diversamente. A tal fine sono da preferirsi HCl ed NaOH. Questa regolazione del pH dovrebbe essere effettuata in modo che la concentrazione della sostanza in esame nella soluzione di riserva non cambi in modo significativo. Qualora la regolazione dovesse provocare reazioni chimiche o la precipitazione fisica del composto in esame, ciò andrebbe riferito.
1.6.1.2. Terreno di coltura del saggio
L'acqua deve essere acqua distillata di buona qualità o acqua deionizzata con una conducibilità minore di 5 μS.cm-1. L'apparecchio per la distillazione dell'acqua non deve contenere parti in rame.
Si raccomanda il seguente terreno di coltura.
Si preparano quattro soluzioni madri secondo la tabella seguente. Le soluzioni madri sono sterilizzate per filtrazione su membrana oppure in autoclave e conservate al buio a 4 oC. La soluzione madre numero 4 deve essere sterilizzata esclusivamente per filtrazione su membrana. Queste soluzioni madri vanno diluite per ottenere le concentrazioni finali di nutrienti nelle soluzioni sperimentali del saggio.
|
Nutriente
|
Concentrazione nella soluzione madre
|
Concentrazione finale nella soluzione da usare nel saggio
|
|
Solution di riserva 1: macro-nutrienti
|
|
NH4Cl
|
1,5 g/l
|
15 mg/l
|
|
MgCl2.6H2O
|
1,2 g/l
|
12 mg/l
|
|
CaCl2.2H2O
|
1,8 g/l
|
18 mg/l
|
|
MgSO4.7H2O
|
1,5 g/l
|
15 mg/l
|
|
KH2 PO4
|
0,16 g/l
|
1,6 mg/l
|
|
Soluzione di riserva 2 Fe-EDTA
|
|
FeCl3.6H2O
|
80 mg/l
|
0,08 mg/l
|
|
Na2EDTA.2H2O
|
100 mg/l
|
0,1 mg/l
|
|
Soluzione di riserva 3 oligoclementi
|
|
H3BO3
|
185 mg/l
|
0,185 mg/l
|
|
MnCl2.4H2O
|
415 mg/l
|
0,415 mg/l
|
|
ZnCl2
|
3 mg/l
|
3 × 10-3mg/l
|
|
CoCl2.6H2O
|
1,5 mg/I
|
1,5 × 10-3 mg/l
|
|
CuCl2.2H2O
|
0,01 mg/l
|
10-5 mg/l
|
|
Na2MoO4.2H2O
|
7 mg/l
|
7 × 10-3 mg/l
|
|
Soluzione di riserva 4: NaHCO3
|
|
NaHCO3
|
50 g/l
|
50 mg/l
|
Il pH del terreno di coltura, messo in equilibrio con l'aria, è approssimativamente 8.
1.6.2. Apparecchiatura
|
—
|
normale attrezzatura di laboratorio,
|
|
—
|
beute per il saggio di volume adatto (per esempio, quando il volume della soluzione sperimentale è di 100 ml occorrono beute da 250 ml). Tutte le beute devono essere identiche in quanto a materiale e dimensioni
|
|
—
|
attrezzatura per le colture: cabina o camera in cui è possibile mantenere con una precisione di ± 2 oC una temperatura nel campo tra 21 e 25 oC e fornire una illuminazione uniforme continua nel campo spettrale da 400 a 700 nm. Se le alghe nelle colture di controllo hanno raggiunto i tassi di crescita raccomandati, si può assumere che le condizioni di crescita, inclusa l'intensità luminosa, siano state adeguate,
si raccomanda di usare, al livello medio delle soluzioni sperimentali, un'intensità luminosa nel campo da 60 a 120 μE.m-2.s-1 (da 35 a 70 × 1018 fotoni.m-2.s-1) quando si effettui la misura nel campo da 400 a 700 nm utilizzando un idoneo sensore. Per gli strumenti di misura della luce calibrati in lux, è accettabile un intervallo equivalente tra 6 000 e 10 000 lux,
l'intensità luminosa occorrente può essere ottenuta usando da 4 a 7 lampade a fluorescenza da 30 W del tipo bianco universale (temperatura di colore approssimativamente 4 300 K), poste ad una distanza di 0,35 m dalla coltura di alghe,
|
|
—
|
le misure della densità delle cellule devono essere effettuate utilizzando un metodo di conta diretto delle cellule viventi, per esempio un microscopio con camere di conteggio. Tuttavia, si possono usare altri metodi (fotometria, torbidimetria) se sono sufficientemente sensibili e se si riscontra una sufficientemente buona correlazione con la densità delle cellule.
|
1.6.3. Organismi per il saggio
Si consiglia di usare specie di alghe verdi a rapida crescita adatte per la coltura e l'esecuzione del saggio. Sono preferite le seguenti specie:
|
—
|
Selenastrum capricornutum, per esempio ATCC 22662 o CCAP 278/4,
|
|
—
|
Scenedesrnus subspicatus, per esempio 86.81 SAG,
|
Nota:
|
ATCC
|
=
|
Raccolta Americana di Colture Tipo (U.S.A.)
|
|
CCAP
|
=
|
Centro per la Coltura di Alghe e Protozoi (G.B.)
|
|
SAG
|
=
|
Raccolta di Colture Algali (Göttingen, R.F.G.)
|
Se si usano altre specie, la relazione deve indicarne il ceppo.
1.6.4. Procedimento sperimentale
Si determina l'intervallo di concentrazioni nel quale è facile che si verifichino degli effetti sulla base di risultati ottenuti da esperimenti di selezione dell'intervallo.
Le due misure di crescita (biomassa e tasso di crescita) possono dare come risultato misure molto disparate dell'inibizione della crescita; entrambe le misure devono essere usate nella prova di individuazione del campo per assicurare che la progressione geometrica delle concentrazioni permetta una stima sia della CbE50 sia della CrE50.
Densità iniziale delle cellule
Si raccomanda di regolare la densità iniziale delle cellule nelle colture sperimentali ad approssimativamente 104 cellule/ml per Selenastrum capricornutum e Scenedesmus subspicatus. Quando si utilizzano altre specie, la biomassa dovrebbe essere confrontabile.
Concentrazioni della sostanza in esame
Per il saggio, si preparano almeno 5 concentrazioni in serie geometrica con un rapporto tra ogni concentrazione e quella immediatamente successiva non superiore a 2,2. La più bassa concentrazione sperimentata non dovrebbe permettere di osservare effetti sulla crescita delle alghe. La più elevata concentrazione sperimentata dovrebbe inibire la crescita di almeno il 50 % rispetto al controllo o, preferibilmente, arrestare completamente la crescita.
Repliche e controlli
Lo schema sperimentale deve comprendere tre repliche per ogni concentrazìone. Sono previsti tre controlli senza sostanza in esame e, se del caso, altri tre controlli contenenti la sostanza ausiliare. Se giustificato, lo schema sperimentale può venire modificato per aumentare il numero di concentrazioni e ridurre il numero di repliche per concentrazione.
Esecuzione del saggio
Le colture del saggio contenenti le concentrazioni desiderate di sostanza in esame e la quantità desiderata di inoculo algale vengono preparate aggiungendo aliquote di soluzioni di riserva della sostanza in esame a quantità adatte di precolture algali (vedi appendice 1).
Le beute di coltura vengono agitate e disposte nell'apparecchiatura di coltura. Le cellule algali vengono mantenute in sospensione mediante sbattimento, mescolamento o gorgogliamento d'aria allo scopo di faciltare lo scambio gassoso e di ridurre le variazioni di pH nelle soluzioni del saggio. Le colture devono essere mantenute ad una temperatura con variazione ammissibile di ± 2 oC nell'intervallo da 21 a 25 oC.
La densità delle cellule in ciascuna beuta viene determinata almeno 24, 48 e 72 ore dopo l'inizio del saggio. Nei casi in cui si utilizza una misura della densità delle cellule diversa del metodo di conteggio diretto, si usa il terreno di coltura algale filtrato contenente la concentrazione appropriata della sostanza chimica in esame per fissare il bianco.
Il pH viene misurato all'inizio del saggio e dopo 72 ore.
Normalmente durante il saggio il pH delle colture di controllo non deve variare più di 1,5 unità.
Saggio con sostanze volatili
Fino ad oggi non esiste un metodo accettato in modo generale per saggiare sostanze volatili. Quando è noto che una sostanza ha la tendenza a evaporare, si può far uso nel saggio di beute chiuse con la parte vuota superiore aumentata. Nel calcolare lo spazio vuoto superiore delle beute chiuse occorre tenere in considerazione la possibilità di una scarsità di CO2. Sono state proposte delle modifiche a questo metodo. [Vedi riferimento (4)].
Si dovrebbe tentare di determinare la quantità di sostanza che rimane in soluzione, e si consiglia comunque una estrema cautela nell'interpretazione dei risultati dei saggi con sostanze volatili eseguiti con l'uso di sistemi chiusi.
Saggio limite
Utilizzando i procedimenti descritti nel presente metodo, si può eseguire un saggio limite a 100 mg per litro allo scopo di dimostrare che la CE50 si trova al di sopra di questa concentrazione.
Se a causa della natura della sostanza non fosse possibile raggiungere una concentrazione di 100 mg per litro nell'acqua usata per il saggio, il saggio limite dovrebbe essere eseguito ad una concentrazione corrispondente alla solubilità della sostanza (o alla concentrazione massima in cui si forma una dispersione stabile) nel terreno di coltura usato (vedi anche punto 1.6.1.1.).
Il saggio limite deve essere eseguito almeno in tre repliche, anche per il controllo. Nel saggio limite devono essere usate ambedue le misure della crescita (biomassa e velocità di crescita).
Qualora in un saggio limite si riscontrasse una diminuzione media del 25 % o più nella biomassa o nel tasso di crescita rispetto il controllo, si dovrebbe eseguire un saggio completo.
2. DATI E VALUTAZIONE
La densità delle cellule misurata nelle colture sperimentali e nelle colture di controllo viene tabulata insieme con la concentrazione della sostanza in esame e dei tempi di effettuazione delle misure. Per ciascuna concentrazione della sostanza in esame e i controlli il valore medio della densità delle cellule va graficamente riportato in funzione del tempo (0-72 h) in modo da poter costruire delle curve di crescita.
Per determinare la relazione concentrazione/effetto, si ricorre a due metodi descritti qui di seguito. Alcune sostanze possono stimolare la crescita a basse concentrazioni. Devono essere presi in considerazione solamente i dati che indicano un'inibizione compresa tra lo 0 e il 100 %.
2.1. CONFRONTO DELLE AREE SOTTO LE CURVE DI CRESCITA
L'area compresa tra una determinata curva di crescita e la linea orizzontale N = No può essere calcolata secondo la formula:
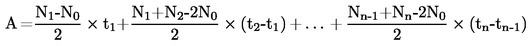
in cui
|
A
|
=
|
area,
|
|
N0
|
=
|
numero di cellule/mi al momento t0
(inizio del saggio),
|
|
N1
|
=
|
numero di cellule/mi determinato a t1,
|
|
Nn
|
=
|
numero di cellule/mi determinato al tempo tn,
|
|
t1
|
=
|
tempo di effettuazione della prima misura dopo l'inizio del saggio,
|
|
tn
|
=
|
tempo di effettuazione della ennesima misura .dopo l'inizio del saggio,
|
|
n
|
=
|
numero di misure effettuate dopo l'inizio del saggio.
|
L'inibizione percentuale della crescita cellulare relativa a ciascuna concentrazione della sostanza in esame (IA) viene calcolata secondo la formula:

in cui
|
Ac
|
=
|
area compresa tra la curva di crescita del controllo e la linea orizzontale N = No.
|
|
At
|
=
|
area compresa tra la curva di crescita alla concentrazione t e la linea orizzontale N = No.
|
|
I valori di IA
|
=
|
sono riportati su carta semi-logaritmica o su carta probit semi-logaritmica corrispondentemente alle rispettive concentrazioni. Se vengono tracciati su carta probit, i punti vengono interpolati con una linea retta tracciata a occhio oppure ricavata mediante calcolo di regressione.
|
La CE50 viene stimata dalla linea di regressione leggendo la concentrazione equivalente al 50 % di inibizione (IA = 50 %). Per identificare in modo univoco questo valore in relazione a questo metodo di calcolo, si propone di usare il simbolo CbE50. È essenziale che la CbE50 sia indicata con il periodo di esposizione pertinente, per esempio CbE50 (0-72h).
2.2. CONFRONTO DEI TASSI DI CRESCITA
Il tasso medio specifico di crescita (μ) per colture in crescita esponenziale può essere calcolato come

dove t0 è il tempo all'inizio del saggio.
In alternativa, il tasso medio specifico di crescita può essere derivato dal coefficiente angolare della linea di regressione in un grafico ove In N appare in funzione del tempo.
L'inibizione percentuale del tasso specifico di crescita a ciascuna concentrazione della sostanza in esame (Iμt) viene calcolata secondo la formula:

in cui
|
μc
|
=
|
tasso medio specifico di crescita della coltura di controllo
|
|
μt
|
=
|
tasso medio specifico di crescita per la concentrazione del saggio t
|
La riduzione percentuale del tasso medio specifico di crescita a ciascuna concentrazione della sostanza in esame calcolata sulla base del confronto con il valore del controllo va graficamente riportata in corrispondenza del logaritmo della concentrazione. La CE50 può essere direttamente ricavata dal grafico che ne risulta. Per indicare in modo univoco la CE50 ottenuta mediante questo metodo si propone di usare il simbolo C1L50. Si deve indicare il tempo di effettuazione della misura, per esempio se il valore riguarda i tempi 0 e 72 ore, il simbolo diventa CrE50 (0-72 h).
Nota: il tasso dì crescita specifico è un termine logaritmico, e piccole variazioni del tasso di crescita possono portare a grandi variazioni della biomassa. I valori di CbE e di CrE non possono pertanto essere confrontati numericamente.
2.3. CALCOLO DELLA NOEC
La concentrazione senza effetti osservati è determinata mediante un'adatta procedura statistica per il confronto multicampione (per esempio analisi della varianza e test di Dunnett), utilizzando i valori delle repliche (prese individualmente) appartenenti alle aree che si trovano sorto le curve di crescita A (vedi punto 2.1) oppure i tassi specifico di crescita μ (vedi punto 2.2).
3. RELAZIONE
La relazione sul saggio deve, se possibile, includere le seguenti informazioni:
|
—
|
sostanze in esame: dati di identificazione chimica,
|
|
—
|
organismi sperimentali: origine, coltura di laboratorio, numero del ceppo, metodo di coltura,
|
|
—
|
condizioni sperimentali:
|
—
|
data di inizio e fine del saggio e sua durata,
|
|
—
|
composizione del terreno di coltura,
|
|
—
|
apparecchiatura per le colture,
|
|
—
|
pH delle soluzioni all'inizio e alla prova del saggio (se si osservano deviazioni del pH superiori a 1,5 unità si devono fornire delle spiegazioni),
|
|
—
|
veicolo e metodo usato per solubilizzare la sostanza in esame e concentrazioni del veicolo nelle soluzioni del saggio,
|
|
—
|
intensità e qualità dell'illuminazione,
|
|
—
|
concentrazioni provate (misurate o nominali);
|
|
|
—
|
risultati:
|
—
|
densità delle cellule per ciascuna beuta corrispondente ad ogni singola misurazione, e metodo usato per la misura della densità delle cellule,
|
|
—
|
valori medi di densità delle cellule,
|
|
—
|
rappresentazione grafica della relazione tra concentrazione ed effetto,
|
|
—
|
valori di CE e metodo di calcolo,
|
|
—
|
altri effetti osservati.
|
|
4. BIBLIOGRAFIA
|
(1)
|
OECD, Paris, 1981, Test Guideline 201, Decision of the Council C(81) 30 Final.
|
|
(2)
|
Umweltbundesamt, Berlin, 1984, Verfahrensvorschlag «Hemmung der Zellvermehrung bei der Grünalge Scenedesmus subspicatus», in: Rudolph/Boje: Okotoxikologie, ecomed, Landsberg, 1986.
|
|
(3)
|
ISO 8692 — Water quality — Fresh water algal growth inhibition test with Scenedesmus subspicatus and Selenastrum capricornutum.
|
|
(4)
|
S. Galassi and M. Vigni — Chemosphere, 1981, vol. 10, 1123-1126.
|
Appendice 1
Esempio di un procedimento per coltura di alghe
Osservazioni generali
La preparazione di colture sulla base del seguente procedimento ha per scopo di ottenere colture algali per saggi di tossicità.
Si devono usare metodi adatti per assicurare che le colture algali non siano infette da batteri (ISO 4833). Sono desiderabili infatti colture axeniche, e sono essenziali colture unialgali.
Tutte le operazioni devono essere eseguite in condizioni sterili allo scopo di evitare una contaminazione con batteri e altre alghe. Le culture contaminate devono essere scartate.
Procedimenti per l'ottenimento di colture algali
Preparazione di soluzioni di nutrienti (terreni di coltura):
Il terreno di coltura può essere preparato diluendo soluzioni di riserva concentrate di elementi nutritivi. Per un terreno solido, si aggiunge lo 0,8 % di agar. Il terreno usato deve essere sterile. La sterilizzazione in autoclave può portare ad una perdita di NH3.
Coltura di riserva:
Le colture di riserva (colture madri) sono piccole colture algali che vengono trasferite con regolarità su terreno di coltura fresco per fungere da materiale di partenza per il saggio. Nel caso in cui le colture non vengano usate con regolarità, esse vanno strisciate su pezzi di agar inclinati entro provette. Questi vengono trasferiti su terreno fresco almeno una volta ogni due mesi.
Le colture di riserva vengono fatte crescere in beute contenenti il terreno appropriato (volume circa 100 ml). Quando le alghe vengono incubate a 20 oC con illuminazione continua, è necessario un trasferimento settimanale.
Durante il trasferimento, una certa quantità di coltura «vecchia» viene trasferita con pipette sterili in una beuta di terreno di coltura fresco e la quantità deve essere tale che, nel caso delle specie di crescita veloce, la concentrazione iniziale sia circa 100 volte minore di quella della coltura vecchia.
Il tasso di crescita di una specie può essere determinato dalla curva di crescita. Se questa è nota, è possibile stimare la densità alla quale la coltura deve essere trasferita ad un terreno di coltura nuovo. Ciò deve essere fatto prima che la coltura raggiunga la fase di mortalità.
Precoltura:
La precoltura serve a fornire il quantitativo di alghe adatto per l'inoculo delle colture del saggio. La precoltura viene incubata nelle condizioni del saggio e usata quando è ancora in crescita esponenziale, normalmente dopo un periodo di incubazione di circa 3 giorni. Quando le colture algali contengono cellule deformate o anomale, devono essere scartate.
Appendice 2
Il protocollo «ISO 8692 — Water quality — Fresh water algal growth inhibition test with Scenedesmus subspicatus and Selenastrum capricornutum» riporta i seguenti risultati ottenuti in un saggio interlaboratorio che ha interessato 16 laboratori e nel quale è stato saggiato il dicromato di potassio:
|
|
Media (mg/l)
|
Intervallo (mg/l)
|
|
ErC50 (0-72 h)
|
0,84
|
0,60-1,03
|
|
EbC50 (0-72 h)
|
0,53
|
0,20-0,75
|
C.4. BIODEGRADAZIONE DETERMINAZIONE DELLA «PRONTA» (READY) BIODEGRADABILITÀ
PARTE I. CONSIDERAZIONI GENERALI
1.1. INTRODUZIONE
Vengono descritti sei metodi d'analisi che permettono di valutare la pronta biodegradabilità di composti chimici in un mezzo acquoso in condizioni aerobiche:
|
a)
|
Carbonio organico disciolto (DOC) — rimozione lenta (Metodo C.4-A)
|
|
b)
|
«Screening» OCSE modificato — rimozione lenta del DOC (Metodo C.4-B)
|
|
c)
|
Sviluppo di biossido di carbonio (CO2) — Saggio di Sturm modificato) (Metodo C.4-C)
|
|
d)
|
Respirometria manometrica (Metodo C.4-E)
|
|
e)
|
Bottiglia chiusa (Metodo C.4-E)
|
|
f)
|
MITI (Ministero del Commercio Internazionale e dell'Industria — Giappone) (Metodo C.4-F)
|
Nella Parte I del metodo sono date indicazioni di carattere generale nonchè considerazioni comuni per tutti sei i saggi. Gli aspetti specifici dei metodi sono presentati nelle parti da II a VII. Gli allegati contengono definizioni, formule e materiale operativo.
Un saggio di confronto interlaboratori OCSE, effettuato nel 1988, ha mostrato che i metodi forniscono dei risultati coerenti. Tuttavia, secondo le caratteristiche fisiche della sostanza da saggiare, si può preferire l'uno o l'altro metodo.
1.2. SCELTA DEL METODO PIÙ APPROPRIATO
Allo scopo di scegliere il metodo più appropriato, è essenziale disporre di informazioni sulla solubilità, sulla tensione di vapore e sulle caratteristiche di adsorbimento del composto chimico. Dovrebbe essere nota la struttura chimica o la formula bruta per calcolare i valori teorici e/o per controllare i valori dei parametri significativi, per esempio ThOD, ThCO2, DOC, TOD, COD, misurati (si vedano gli allegati I e II).
I composti chimici da esaminare che sono solubili in acqua, ad una concentrazione di almeno 100 mg/l, possono essere valutati con tutti i metodi, a condizione che non siano volatili e non diano luogo a fenomeni di adsorbimento. Nella tabella n. 1 vengono riportati metodi idonei per quei composti chimici, volatili o adsorbibili, scarsamente solubili in acqua. Nell'allegato IH è descritto come si possono trattare i composti chimici scarsamente solubili in acqua e quelli volatili. Composti chimici moderatamente volatili possono essere controllati mediante il metodo di rimozione lenta del DOC se nei contenitori di prova si dispone di uno spazio gassoso sufficiente (che dovrebbe opportunamente tappato). In questo caso, è necessario eseguire anche un controllo abiotico per tener conto di eventuali perdite per fenomeni fisici.
Tabella 1
Applicabilità dei metodi di saggio
|
Saggio
|
Metodo analitico
|
Idoneità del metodo per sostanze:
|
|
scars. solub.
|
volatili
|
adsorbibili
|
|
Rimozione lenta DOC
|
Carbonio organico disciolto
|
—
|
—
|
+/–
|
|
Rimozione lenta OCSE modificato
|
Carbonio organico disciolto
|
—
|
—
|
+/–
|
|
Sviluppo CO2
|
Respìrometria: sviluppo CO2
|
+
|
—
|
+
|
|
Respirometria manometrica
|
Respirometria manometrica: consumo d'ossigeno
|
+
|
+/–
|
+
|
|
Bottiglia chiusa
|
Respirometria: ossigeno disciolto
|
+/–
|
+
|
+
|
|
MITI
|
Respirometria: consumo d'ossigeno
|
+
|
+/–
|
+
|
Per interpretare i risultati ottenuti, in particolare quando i valori di biodegradabilità sono bassi o marginali, è necessario acquisire ulteriori informazioni riguardo alla purezza e alle proporzioni relative dei componenti principali del materiale da saggiare.
Informazioni sulla tossicità del composto chimico da saggiare, nei confronti dei batteri (vedi allegato IV), possono essere molto utili per una scelta mirata della concentrazione da sottoporre a saggio e per una corretta interpretazione dei bassi valori di biodegradazione.
1.3. SOSTANZE DI RIFERIMENTO
Allo scopo di verificare la procedura, si controllano prodotti chimici di riferimento che rispettano i criteri di pronta biodegradabilità installando un pallone apportuno in parallelo come parte delle normali prove sperimentali.
Composti chimici adatti sono anilina (distillata di fresco), acetato di sodio e benzoato di sodio. Questi prodotti chimici di riferimento si degradano tutti in questi metodi anche quando non si aggiunga deliberatamente inoculo.
È stato suggerito che si dovrebbe cercare un prodotto chimico di riferimento che sia facilmente biodegradabile, ma che richieda l'aggiunta di un inoculo, anche nel saggio della bottiglia chiusa. È stato proposto l'idrogenoftalato di potassio, ma mancano le prove per accettare questa sostanza come sostanza di riferimento.
Nei saggi respirometrici, i composti contenenti azoto possono influire sull'assorbimento di ossigeno a causa della nitrificazione (si vedano gli allegati II e V).
1.4. PRINCIPIO DEI METODI DI SAGGIO
Una soluzione, o sospensione, della sostanza in esame in un mezzo minerale viene inoculata e incubata in condizioni aerobiche al buio o a luce diffusa. La quantità di DOC introdotta nella soluzione con l'inoculo dovrebbe essere quanto più bassa possibile in paragone alla quantità di DOC dovuta alla sostanza in esame. Per valutare l'attività endogena dell'inoculo, si eseguono, in parallelo, dei saggi in bianco con l'inoculo ma senza sostanze in esame, in quanto l'attività endogena delle cellule, in presenza della sostanza, non si concilia esattamente con quella del controllo. Un saggio con una sostanza di riferimento viene eseguito in parallelo per valutare l'efficacia della procedura.
In generale, la degradazione viene seguita mediante la determinazione di parametri significativi, come DOC, produzione di CO2 e consumo dell'ossigeno. Le misure vengono effettuate ad intervalli sufficientemente frequenti per permettere l'identificazione della biodegradazione dall'inizio alla fine. Con respirometri automatici, la misurazione è continua. Il DOC viene misurato in aggiunta ad un altro parametro, di solito all'inìzio e al termine della prova. Si può anche utilizzare un'analisi chimica specifica per valutare la degradazione primaria della sostanza in esame e per determinare la concentrazione delle eventuali sostanze intermedie formate (questa analisi è obbligatoria nel saggio MITI).
Normalmente la prova dura 28 giorni. Tuttavia è possibile terminare il saggio prima dei 28 giorni, per esempio appena la curva della degradazione biologica ha raggiunto un livello stazionario per almeno tre determinazioni. Le prove possono anche essere prolungate oltre i 28 giorni quando la curva mostra che la biodegradazione è iniziata ma che non si è ancora raggiunto lo stato stazionario al 28° giorno.
1.5. CRITERIO DI QUALITÀ
1.5.1. Riproducibilità
A causa della natura della biodegradazione e delle popolazioni batteriche miste usate come inoculi, le determinazioni devono essere eseguite almeno in doppio.
È esperienza comune che quanto più grande è la concentrazione di microorganismi aggiunti inizialmente al mezzo colturale, tanto minori saranno le variazioni tra le repliche. Prove di intercalibrazione tra laboratori hanno mostrato che vi possono essere grandi variazioni tra i risultati ottenuti da differenti laboratori, ma normalmente si ottiene un buon accordo con composti chimici di riferimento facilmente biodegradabili.
1.5.2. Validità del saggio
Il saggio viene considerato valido se la differenza tra i valori estremi delle prove in multiplo di rimozione del composto chimico in esame al «plateau», alla fine del saggio o alla fine della fase di crescita (rime window) di 10 giorni, è minore del 20 % e se la degradazione percentuale della sostanza di riferimento ha raggiunto il livello corrispondente alla «pronta» biodegradabilità in 14 giorni. Se non si verifica una di queste condizioni, la prova deve venire ripetuta. Data la rigorosità dei metodi, bassi valori non significano necessariamente che la sostanza in esame non sia biodegradabile nell'ambiente, ma che sarà necessario ulteriore lavoro per definire la biodegradabilità.
Se in un saggio di tossicità, contenente sia la sostanza in esame che un composto chimico di riferimento, in 14 giorni si verifica una degradazione inferiore al 35 % (in base al DOC) o minore del 25 % (in base a ThOD o ThCO2), si deve supporre che i composti chimici in esame siano inibitorì (si veda anche l'allegato IV). Le prove dovrebbero essere ripetute, possibilmente con l'uso di una concentrazione minore di sostanza chimica in esame e/o una concentrazione più elevata di inoculo, ma non superiore a 30 mg per litro di solido.
1.6. PROCEDURE GENERALI E PREPARAZIONI
Le condizioni generali che valgono per le prove sono riassunte in Tabella 2. Le apparecchiature e le altre condizioni sperimentali valide per un particolare tipo di saggio sono descritte più avanti al paragrafo «saggio specifico».
Tabella 2
Condizioni sperimentali
|
Saggio
|
Rimozione lenta DOC
|
Sviluppo CO2
|
Respirometria manometrica
|
Screenig OCSE tnodif.
|
Bottiglia chiuasa
|
MITI (I)
|
|
Concentrazione della sostanza in esame
|
|
|
|
|
|
|
|
in mg/L
|
|
|
100
|
|
2-10
|
100
|
|
mg DOC/L
|
10-40
|
10-20
|
|
10-40
|
|
|
|
mg ThOD/L
|
|
|
50-100
|
|
5-10
|
|
|
Concentrazione dell'inoculo (in cellule/L, approssimata)
|
≤ 30 mg/l SS
o ≤ 100 ml effluente/L
(107-108)
|
0,5 ml effluente secondario/l
(105)
|
≤ 5 ml di effluente/L
(104-106)
|
30 mg/l SS
(107-108)
|
|
Concentrazione di elementi nel mezzo minerale (in mg/l):
|
|
|
|
|
|
|
|
P
|
116
|
11,6
|
29
|
|
N
|
1,3
|
0,13
|
1,3
|
|
Na
|
86
|
8,6
|
17,2
|
|
K
|
122
|
12,2
|
36,5
|
|
Mg
|
2,2
|
2,2
|
6,6
|
|
Ca
|
9,9
|
9,9
|
29,7
|
|
Fe
|
0,05-0,1
|
0,05-0,1
|
0,15
|
|
pH
|
7,4±0,2
|
preferibilmente 7,0
|
|
Temperatura
|
22 ± 2 oC
|
25 ± 1 oC
|
|
DOC
|
=
|
carbonio organico disciolto
|
|
|
ThoD
|
=
|
domanda teorica ossigeno
|
|
|
1.6.1. Acqua di diluizione
L'acqua deionizzata o distillata, esente da concentrazioni inibitrici di sostanze tossiche (per esempio ioni Cu+
+), è usata come solvente. Essa deve contenere non oltre il 10 % del carbonio organico introdotto mediante il materiale in esame. L'elevata purezza dell'acqua per il saggio è necessaria per eliminare valori di bianco elevati. La contaminazione può essere dovuta a impurezze intrinseche, all'impiego di resine a scambio ionico o a materiale lisato proveniente da batteri e alghe. Per ciascuna serie di saggi usare una sola partita d'acqua, controllata preventivamente mediante analisi DOC. Detto controllo non è necessario per il saggio della bottiglia chiusa, perchè il consumo dì ossigeno da parte dei microorganismi dell'acqua sia basso.
1.6.2. Soluzioni «stock» dei sali minerali
Per preparare le soluzioni per il saggio, devono essere preventivamente preparate delle soluzioni «stock» di appropriata concentrazione dei sali minerali. Possono essere usate le seguenti soluzioni «stock» (con differenti fattori di diluizione) per i metodi: rimozione lenta DOC, screening OCSE modificato, sviluppo di CO2, respirometria manometrica, saggio della bottiglia chiusa.
I fattori di diluizione e, per il saggio MITI, la preparazione specifica del mezzo minerale sono indicati nei saggi specifici.
Soluzioni «stock»:
Preparare le seguenti soluzioni «stock» utilizzando reagenti puri per analisi.
|
(a)
|
Diidrogenoortofosfato monopotassico, KH2PO4
|
8,50 g
|
|
Monoidrogenoortofosfato dipotassico, K2HPO4
|
21,75 g
|
|
Monoidrogenoortofosfato disodico diidrato Na2HPO4. 2 H2O
|
33,40 g
|
|
Cloruro d'ammonio, NH4Cl
|
0,50 g
|
|
Sciogliere in acqua e portare a 1 litroll pH della soluzione deve essere 7,4
|
|
|
(b)
|
Cloruro di calcio anidro, CaCl2
|
27,50 g
|
|
O cloruro di calcio diidrato, CaCl2- 2 H2O
|
36,40 g
|
|
Sciogliere in acqua e portare a 1 litro
|
|
|
(c)
|
Solfato di magnesio eptaidrato, MgSO4. 7 H2O
|
22,50 g
|
|
Sciogliere in acqua e portare a 1 litro
|
|
|
(d)
|
Cloruro di ferro (III) esaidrato, FeCl3. 6 H2O
|
0,25 g
|
|
Sciogliere in acqua e portare a 1 litro.
|
|
Nota: allo scopo dì evitare di dover preparare questa soluzione immediatamente prima dell'uso, aggiungere una goccia di HCl concentrato o 0,4 g di acido etilendiamminotetra-acetico sale disodico (EDTA) per litro.
1.6.3. Soluzioni «stock» di composti chimici
Per esempio, sciogliere da 1 a 10 g, a seconda della sostanza chimica da saggiare o di riferimento in acqua deionizzata e portare a 1 litro quando la solubilità sia superiore a 1 g/l. Altrimenti, preparare soluzioni «stock» del mezzo minerale, oppure aggiungere la sostanza chimica direttamente al mezzo minerale. Per la solubilizza-zione dì composti chimici poco solubili, si veda l'allegato III, ma nel saggio MITI (Metodo C.4-F), non si devono usare nè solventi nè emulsionanti.
1.6.4. Inoculi
L'inoculo può essere ottenuto da varie fonti: fango attivo, acque di scarico (non clorate), acque superficiali e terreni, oppure da una miscela di questi. Per i saggi di rimozione lenta del DOC, sviluppo di CO2 e respirometria manometrica, se si usa fango attivo esso dovrebbe essere prelevato da un impianto di trattamento 0 da una unità su scala di laboratorio che riceva principalmente scarichi domestici. Si è visto che gli inoculi provenienti da altre fonti danno luogo ad una dispersione maggiore dei risultati. Per lo screening OCSE modificato e per il saggio della bottiglia chiusa occorre un inoculo più diluito senza fiocchi di fango; la fonte preferita è un effluente secondario di un impianto di trattamento delle acque di rifiuto domestiche o una rispettiva unità su scala di laboratorio. Per il saggio MITI l'inoculo viene ricavato da una miscela di fanghi di diversa provenienza ed è descritto nel paragrafo di questo saggio specifico.
1.6.4.1. Inoculo da fanghi attivi
Raccogliere un campione di fango attivo fresco dal serbatoio di aereazione di un impianto di trattamento o da una unità pilota di laboratorio per il trattamento delle acque di scarico che tratti prevalentemente acque di origine domestica. Rimuovere, se necessario, le particelle grossolane mediante filtrazione attraverso un setaccio fine, e quindi mantenere il fango in condizioni aerobiche.
In alternativa, decantare o centrifugare (per esempio a 1 100 g per 10 minuti) dopo la rimozione di eventuali particelle grossolane. Scartare il surnatante. Il fango può essere lavato nel mezzo minerale. Sospendere il fango concentrato in mezzo minerale per ottenere una concentrazione di 3-5 g di solidi sospesi/l e aereare fino a quando è necessario.
Il fango dovrebbe essere prelevato da un impianto convenzionale ben funzionante. Se il fango è stato preso da un impianto ad alta potenzialità o si ritiene contenga inibitori dovrebbe essere lavato. Decantare o centrifugare il fango risospeso dopo accurata miscelazione, scartare il surnatante e risospendere il fango lavato in un volume ulteriore di terreno minerale. Ripetere questa procedura fino a quando il fango può essere considerato esente da eccesso di substrato e da inibitori.
Dopo avere ottenuto la completa risospensione, con fango non trattato, prelevare un'aliquota prima dell'uso per la determinazione del peso secco dei solidi sospensi.
Un'ulteriore alternativa è quella di omogeneizzare il fango attivo (3-5 g di solidi sospesi/l). Trattare il fango in un miscelatore meccanico per due minuti a velocità media. Decantare il fango miscelato per 30 minuti, o più a lungo se necessario, e utilizzare il liquido sovrastante per l'uso come inoculo nel rapporto di 10 ml/l nel mezzo minerale.
1.6.4.2. Altre fonti di inoculo
Esso può essere ottenuto da un effluente secondario di un impianto di trattamento o da una unità pilota di laboratorio che riceve prevalentemente scarichi domestici. Raccogliere un campione fresco e mantenerlo in condizioni aerobiche durante il trasporto. Lasciare decantare per 1 ora o filtrare con carta da filtro grossolana e mantenere l'effluente decantato o il filtrato in condizioni aerobiche fino a quando è necessario. Si possono usare fino a 100 ml di questo tipo di inoculo per litro di mezzo minerale.
Una fonte alternativa per l'inoculo è l'acqua superficiale. In questo caso, raccogliere un'idonea quantità di campione acqua superficiale, per esempio acqua di fiume, di lago, e mantenerla in condizioni aerobiche fino a quando è necessario. Se è il caso, concentrare l'inoculo mediante filtrazione o centrifugazione.
1.6.5. Precondizionamento degli inoculi
Gli inoculi possono essere precondizionati alle condizioni sperimentali, ma non preadattati al composto chimico in esame. Il precondizionamento consiste nell'aereare fango attivo nel mezzo minerale o effluente secondario per 5-7 giorni alla temperatura di prova. Il precondizionamento migliora tavolta la precisione dei metodi sperimentali riducendo i valori del bianco. Sì ritiene non necessario precondizionare l'inoculo nel metodo MITI.
1.6.6. Controlli abiotici
Quando è necessario, controllare la possibile degradazione abiotica della sostanza in esame determinando la rimozione di DOC, l'assorbimento di ossigeno o lo sviluppo di biossido di carbonio in controlli sterili che non contengono inoculo. La sterilizzazione può essere fatta mediante filtrazione attraverso una membrana (0,2-0,45 micrometri), mediante l'aggiunta di una sostanza tossica di idonea concentrazione. Se viene usata una membrana filtrante, prelevare i campioni in modo asettico per mantenerli sterili. A meno che l'adsorbimento della sostanza chimica saggiata non sia risultato precedentemente assente, i saggi che misurano la biodegradazione come rimozione del DOC (carbonio organico disciolto), specialmente con inoculi a fanghi attivi, dovrebbero includere un controllo abiotico con inoculo tossico.
1.6.7. Numero di contenitori usati in un saggio tipo
Il numero di contenitori usati in una prova tipo è descritto nei rispettivi metodi di ciascun saggio.
Possono essere usati i seguenti tipi di contenitori:
|
—
|
sospensione: contenente la sostanza per il saggio e l'inoculo
|
|
—
|
bianco: contenente solo l'inoculo
|
|
—
|
controllo: contenente la sostanza di riferimento e l'inoculo
|
|
—
|
controllo abiotico sterile: contenente la sostanza per il saggio sterile (vedi 1.6.6.)
|
|
—
|
controllo dell'adsorbimento: contenente la sostanza per il saggio, l'inoculo e l'agente sterilizzante
|
|
—
|
controllo della tossicità: contenente la sostanza per il saggio, la sostanza di riferimento e l'inoculo
|
Le determinazioni nella sospensione in esame e nel bianco dovrebbero essere fatti in parallelo. È consigliabile effettuare le determinazioni in parallelo negli altri contenitori al meglio.
Tuttavia ciò non sempre è possibile. Assicurarsi che vengano prelevati un numero sufficiente di campioni o vengano effettuate un numero sufficiente di letture per permettere di valutare la rimozione percentuale nell'arco di 10 giorni.
1.7. DATI E VALUTAZIONE
Nel calcolo della degradazione percentuale (Dt), si utilizzano i valori medi delle misure in doppio del parametro significativo nei recipienti di prova e nel bianco dell'inoculo. Le formule sono rappresentate nei paragrafi relativi ai saggi specifici. L'andamento della degradazione viene illustrato graficamente e con l'indicazione della fase di crescita (time window) di 10 giorni. Calcolare e riportare la rimozione percentuale ottenuta al termine della fase di crescita (time window) di 10 giorni e il valore raggiunto nella fase di stabilizzazione o al termine della prova, a seconda dei casi.
Nelle prove respirometriche, i composti che contengono azoto possono influire sul consumo di ossigeno a causa della nitrificazione (si vedano gli allegati II e V).
1.7.1. Misura della degradazione mediante determinazione del DOC
La percentuale di degradazione nel tempo (Dt) dovrebbe essere calcolata separatamente nei recipienti contenenti la sostanza da esaminare usando i valori medi della misura in doppio del DOC perché il saggio possa avere significato. Ciò può essere calcolato usando la seguente equazione:

dove:
|
Dt
|
=
|
degradazione % al tempo t,
|
|
Co
|
=
|
concentrazione iniziale media di DOC nel mezzo di coltura inoculato contenente la sostanza in esame (mg DOC/1),
|
|
Ct
|
=
|
concentrazione media di DOC nel mezzo di coltura inoculato contenente la sostanza in esame al tempo t (mg DOC/1),
|
|
Cbo
|
=
|
concentrazione media iniziale di DOC ne! bianco del mezzo minerale inoculato (mg DOC/l),
|
|
Cbt
|
=
|
concentrazione media di DOC nel bianco del mezzo minerale inoculato al tempo t (mg DOC/l).
|
Tutte le concentrazioni sono misurate sperimentalmente.
1.7.2. Misura della degradazione mediante analisi specifica
Quando sono disponibili dati analitici specifici, calcolare la degradazione biologica primaria dalla relazione:

dove:
|
Dt
|
=
|
degradazione % al tempo t, normalmente 28 giorni,
|
|
Sa
|
=
|
quantità residua di sostanza in esame nel terreno inoculato al termine della prova (mg),
|
|
Sb
|
=
|
quantità residua di sostanza in esame nella prova in bianco con acqua/mezzo minerale a cui è stata aggiunta solo la sostanza in esame (mg).
|
1.7.3. Degradazione abiotica
Se è usato un controllo abiotico sterile, calcolare la percentuale di degradazione abiotica usando:

dove
|
Cs(0)
|
=
|
concentrazione del DOC nel controllo sterile al giorno 0,
|
|
Cs(t)
|
=
|
concentrazione del DOC nel controllo sterile al giorno t.
|
1.8. RELAZIONE
La relazione del saggio deve, se possibile, contenere le seguenti informazioni:
|
—
|
sostanze chimiche sperimentali di riferimento, e loro purezza,
|
|
—
|
inoculo: natura e località del campionamento, concentrazione ed eventuale trattamento di precondizionamento,
|
|
—
|
proporzione e natura degli effluenti industriali presenti nelle acque di scarico, se note,
|
|
—
|
tempi di conduzione del saggio e temperatura,
|
|
—
|
nel caso di sostanze chimiche scarsamente solubili, il tipo di trattamento adottato,
|
|
—
|
metodo di saggio applicato; dovrebbero essere fornite ragioni scientifiche e una spiegazione per eventuali modifiche alla procedura,
|
|
—
|
registrazione dei dati,
|
|
—
|
dovrebbero essere indicati eventuali fenomeni di inibizione osservati,
|
|
—
|
eventuale degradazione abiotica osservata,
|
|
—
|
dati analitici chimici specifici, se disponibili,
|
|
—
|
dati analitici sugli intermedi, se disponibili,
|
|
—
|
grafico della degradazione percentuale in funzione del tempo per le sostanze in esame e per quelle di riferimento; la fase di latenza, la fase di degradazione, la fase di crescita (rime window) di 10 giorni e la pendenza devono essere indicate chiaramente (allegato I). Se il saggio ha rispettato il criterio di validità, per il grafico può essere usata la media della percentuale di degradazione dei recipienti contenenti la sostanza da esaminare,
|
|
—
|
la rimozione percentuale dopo la fase di crescita (time window) di 10 giorni, nonché. La stabilizzazione o il termine della prova.
|
PARTE II. SAGGIO DI RIMOZIONE LENTA DEL DOC (Metodo C.4-A)
II.1. PRINCIPIO DEL METODO
Un volume misurato del mezzo minerale inoculato, contenente una concentrazione nota della sostanza in esame (10-40 mg DOC/l) come unica fonte nominale di carbonio organico, viene aereato al buio o in luce diffusa a 22 ± 2 oC.
La degradazione viene seguita mediante analisi del DOC a intervalli regolari in un arco di tempo di oltre 28 giorni. Il grado di biodegradazione viene calcolato esprimendo la concentrazione di DOC rimossa (corretta del bianco di controllo dell'inoculo) in percento di concentrazione presente inizialmente. Il grado di degradazione biologica primaria può anche essere calcolato da una analisi chimica supplementare effettuata all'inizio e al termine dell'incubazione.
II.2. DESCRIZIONE DEL METODO
II.2.1. Apparecchiatura
|
a)
|
Beute, per esempio, da 250 ml a 2 litri, secondo il volume necessario per l'analisi DOC;
|
|
b)
|
tavola di agitazione — in grado di accogliere le beute, con controllo automatico della temperatura oppure disposta in un ambiente a temperatura costante — e di potenza tale da mantenere le condizioni aerobiche in tutte le beute;
|
|
c)
|
apparecchio di filtrazione con membrane adatte;
|
|
e)
|
apparecchio per determinare l'ossigeno disciolto;
|
II.2.2. Preparazione del mezzo minerale
Per la preparazione delle soluzioni concentrate vedi 1.6.2.
Miscelare 10 ml di soluzione (a) con 800 ml di acqua di diluizione, aggiungere 1 ml di soluzioni da (b) a (d) e portare a 1 litro con acqua di diluizione.
II.2.3. Preparazione e precondizionamemo dell'inoculo
L'inoculo può essere ottenuto da varie fonti: fango attivo, acque di scarico, acque superficiali e terreni, oppure da una miscela di questi.
Vedi I.6.4., 1.6.4.1., 1.6.4.2. e 1.6.5.
II.2.4. Preparazione delle beute
Introdurre, per esempio, porzioni da 800 ml di mezzo minerale in beute da 2 litri e aggiungere volumi sufficienti di soluzioni concentrate delle sostanze in esame e di riferimento a beute separate in modo da ottenere una concentrazione di sostanza chimica equivalente a 10-40 mg DOC/1. Controllare il valore del pH e correggerlo, se necessario, a pH = 7,4. Inoculare i palloni con fango attivo o altra fonte di inoculo (vedi I.6.4.), in modo da ottenere una concentrazione finale non superiore a 30 mg di solidi sospesi/l. Preparare inoltre controlli di inoculo in mezzo minerale senza il composto chimico in esame nè quello di riferimento.
Se necessario, usare un recipiente per controllare il possibile effetto inibitore della sostanza chimica in esame inoculando una soluzione contenente, nel mezzo minerale, concentrazioni confrontabili della sostanza chimica in esame e di quella di riferimento.
Inoltre, se richiesto, preparare un'ulteriore beuta sterile per controllare se la sostanza chimica in esame venga degradata abioticamente utilizzando una soluzione non inoculata della sostanza chimica (vedi 1.6,6.).
In aggiunta, se si sospetta che la sostanza chimica in esame sia adsorbita in modo significativo sul vetro, sul fango etc., effettuare una valutazione preliminare per determinare il grado probabile di adsorbimento e quindi l'idoneità del saggio per il composto chimico (vedi Tabella 1). Preparazione di un recipiente contenente la sostanza da esaminare, l'inoculo e l'agente sterilizzante.
Portare i volumi in tutte le beute a 11 con mezzo minerale, e, dopo miscelazione, prelevare un campione da ciascuna beuta per determinare la concentrazione iniziale di DOC (vedi allegato II.4). Coprire le aperture delle beute, per esempio, con un foglio di alluminio, in modo da permettere uno scambio libero di aria tra la beuta e l'atmosfera circostante. Inserire poi i contenitori nella tavola di agitazione e avviare il saggio.
II.2.5. Numero di contenitori usati in un saggio tipo
Recipiente 1 e 2: sospensione
Recipiente 3 e 4: bianco con inoculo
Recipiente 5: controllo
preferibilmente se è necessario:
Recipiente 6: controllo abiotico sterile
Recipiente 7: controllo per l'adsorbimento
Recipiente 8: controllo per la tossicità
Vedi I.6.7.
II.2.6. Esecuzione del saggio
Durante l'esecuzione del saggio, determinare la concentrazione di DOC in ciascuna beuta, in doppio, a intervalli di tempo noti, in modo sufficientemente regolare per poter determinare il momento di inizio della fase di crescita (time window) di 10 giorni e la rimozione percentuale al termine della fase dì crescita (time window) di 10 giorni. Prelevare solo il volume minimo necessario di sospensione di prova per ciascuna determinazione.
Prima del campionamento, compensare le perdite per evaporazione dalle beute mediante l'aggiunta di acqua di diluizione (I.6.1) nella quantità richiesta, se necessario. Miscelare il mezzo di coltura accuratamente prima di prelevare un campione e assicurarsi che il materiale eventualmente aderente alle pareti dei recipienti sia disciolto o sospeso prima del campionamento. Filtrare su membrana o centrifugare (vedi allegato II.4) immediatamente dopo aver prelevato il campione. Analizzare i campioni filtrati e centrifugati lo stesso giorno, altrimenti conservarli a 2-4 oC per un massimo di 48 ore o al di sotto di - 18 oC per un periodo più lungo.
II.3. DATI E RELAZIONE
II.3.1. Modalità di esposizione dei risultati
Calcolare la degradazione percentuale al tempo t come indicato al punto I.7.1. (determinazione del DOC) e (analisi specifica) punto I.7.2. facoltativa.
Trascrivere tutti i risultati su moduli predisposti.
II.3.2. Validità dei risultati
Vedi I.5.2.
II.3.3. RELAZIONE
Vedi 1.8.
II.4. MODULARIO
Nel seguito è presentato un esempio di modulo predisposto.
SAGGIO DI RIMOZIONE LENTA DEL DOC
|
2.
|
DATA DI INIZIO DEL SAGGIO
|
3. SOSTANZA CHIMICA IN ESAME
Nome: ...
Concentrazione della soluzione stock: ... mg/l come sostanza
Concentrazione iniziale nel mezzo, t0: ... mg/l come sostanza
4. INOCULO
Fonte: ...
Trattamento applicato: ...
Eventuale precondizionamento: ...
Concentrazione dei solidi sospesi nella miscela di reazione: ... mg/l
5. DETERMINAZIONI DEL CARBONIO
Analizzatore di carbonio: ...
|
|
Beuta N.
|
|
DOC dopo n giorni (mg/L)
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
Sostanza chemica in esame più inoculo
|
1
|
a1
|
|
|
|
|
|
|
a2
|
|
|
|
|
|
|
a, media
Ca(t)
|
|
|
|
|
|
|
2
|
b1
|
|
|
|
|
|
|
b2
|
|
|
|
|
|
|
b, media
Cb(t)
|
|
|
|
|
|
|
Bianco dell'inoculo senza sostanza chemica in esame
|
3
|
C1
|
|
|
|
|
|
|
C2
|
|
|
|
|
|
|
C, media Cc(t)
|
|
|
|
|
|
|
4
|
d1
|
|
|
|
|
|
|
d2
|
|
|
|
|
|
|
d, media
Cd(t)
|
|
|
|
|
|
|

|
|
|
|
|
|
6. VALUTAZIONE DEI DATI GREZZI
|
Beuta Nr
|
|
% degradazione dopo in giorni
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
1
|

|
0
|
|
|
|
|
|
2
|

|
0
|
|
|
|
|
|
Media (3)
|

|
0
|
|
|
|
|
Nota: formule simili possono essere usate per i controlli della sostanza chimica di riferimento e di tossicità.
7. CONTROLLO ABIOTICO (facoltativo)
|
|
Tempo (in giorni)
|
|
0
|
t
|
|
DOC conc. in (mg/L) nel controllo sterile
|
Cs(o)
|
Cs(t)
|

8. ANALISI SPECIFICA DEL COMPOSTO CHIMICO (facoltativa)
|
|
quantità residua della sostanza chimica alla fine del saggio
|
% di degradazione primaria
|
|
Controllo sterile
|
Sb
|
|
|
Saggio del mezzo inoculato
|
Sa
|

|
PARTE III. SAGGIO DI SCREENING OCSE MODIFICATO (Metodo C.4-B)
III.l. PRINCIPIO DEL METODO
Un volume noto di mezzo minerale contenente una concentrazione nota della sostanza in esame (10-40 mg DOC/1) come unica fonte nominale di carbonio organico viene inoculato con 0,5 ml di effluente per litro di mezzo minerale. La miscela viene aerata al buio o in luce diffusa a 22 ± 2 oC.
La degradazione viene seguita mediante analisi del DOC a intervalli regolari in un arco di tempo di 28 giorni. Il grado di biodegradazione viene calcolato esprimendo la concentrazione dì DOC rimossa (corretta del bianco di controllo dell'inoculo) in percento della concentrazione presente inizialmente. Il grado di degradazione biologica primaria può anche essere calcolato mediante analisi chimica supplementare effettuata all'inizio e al termine dell'incubazione.
III.2. DESCRIZIONE DEL METODO
III.2.1. Apparecchiatura
|
a)
|
Beute, per esempio da 250 ml a 2 litri, secondo il volume necessario per l'analisi del DOC;
|
|
b)
|
tavola di agitazione — in grado di accogliere le beute, con controllo automatico della temperatura oppure disposta in un ambiente a temperatura costante — e di potenza sufficiente a mantenere le condizioni aerobiche in tutte le beute;
|
|
c)
|
apparecchio di filtrazione con membrane adatte;
|
|
e)
|
apparecchio per determinare l'ossigeno disciolto;
|
III.2.2. Preparazione del mezzo minerale
Per la preparazione delle soluzioni concentrate vedi I.6.2.
Miscelare 10 ml di soluzione (a) con 800 ml di acqua di diluizione, aggiungere 1 ml di soluzioni da (b) a (d) e portare a 1 litro con acqua di diluizione.
In questo metodo si utilizzano solo 0,5 ml di effluente/litro come inoculo e pertanto può essere necessario integrare il terreno con oligoelementi e fattori di crescita aggiungendo 1 ml per ciascuna delle seguenti soluzioni per litro di terreno finale.
Soluzione di oligoelementi:
|
Solfato di manganese tetraidrato, MnSO4. 4H2O
|
39,9 mg
|
|
Acido borico, H3BO3
|
57,2 mg
|
|
Solfato di zinco eptaidrato, ZnSO4. 7H2O
|
42,8 mg
|
|
Eptamolibdato d'ammonio, (NH4)6 MO7O24
|
34,7 mg
|
|
Chelato di Fe (FeCl3 acido etilendiammino-tetraacetico)
|
100,0 mg
|
|
Sciogliere in un matraccio e portare a 1 000 ml con acqua di diluizione.
|
|
|
Soluzione di vitamine:
|
|
|
Estratto di lievito
|
15,0 mg
|
Sciogliere l'estratto di lievito in 100 ml di acqua e sterilizzare attraverso una membrana da 0,2 micron, preparare la soluzione al momento dell'uso.
III.2.3. Preparazione e precondizionamento dell'inoculo
L'inoculo è ottenuto da un effluente secondario di un impianto di trattamento o da un'unità pilota di laboratorio alimentata prevalentemente da scarichi domestici.
È usato in ragione di 0,5 ml/l di mezzo minerale. Vedi I.6.4.2. e I.6.5.
III.2.4. Preparazione dei contenitori
Introdurre, per esempio, porzioni da 800 ml di mezzo minerale in beute da 2 litri e aggiungere volumi sufficienti di soluzioni stock delle sostanze in esame e di riferimento a beute separate in modo da ottenere una concentrazione di sostanza chimica equivalente a 10-40 mg DOC/l. Controllare il valore del pH e correggerlo, se necessario, a pH = 7,4. Inoculare le beute con effluente di acque di scarico (0,5 ml/litro) (vedi I.6.4.2.). Preparare inoltre controlli dell'inoculo nel mezzo minerale senza le sostanze chimiche in esame e di riferimento.
Se necessario, usare un recipiente per controllare il possibile effetto inibitore della sostanza chimica in esame inoculando una soluzione contenente, nel mezzo minerale, concentrazioni confrontabili della sostanza chimica in esame e di quella di riferimento.
Inoltre, se richiesto, preparare un'ulteriore beuta sterile per controllare se la sostanza chimica in esame venga degradata abioticamente utilizzando una soluzione non inoculata della sostanza chimica (vedi I.6.6.).
In aggiunta, se si sospetta che la sostanza chimica in esame sia adsorbita in modo significativo sul vetro, sul fango ecc, effettuare una valutazione preliminare per determinare il grado probabile di adsorbimento e quindi l'idoneità del saggio per il composto chimico (vedi Tabella 1). Preparazione di un recipiente contenente la sostanza da esaminare, l'inoculo e l'agente sterilizzante.
Portare i volumi in tutte le beute a 1 l con mezzo minerale, e, dopo miscelazione, prelevare un campione da ciascuna beuta per determinare la concentrazione iniziale di DOC (vedi allegato II.4). Coprire le aperture delle beute, per esempio con un foglio di alluminio, in modo da permettere uno scambio libero di aria tra la beuta e l'atmosfera circostante. Inserire poi i recipienti nella tavola di agitazione e avviare il saggio.
III.2.5. Numero di contenitori usati in una prova tipo
Recipiente 1 e 2: sospensione
Recipiente 3 e 4: bianco con inoculo
Recipiente 5: controllo
preferibilmente se è necessario:
Recipiente 6: controllo abiotico sterile
Recipiente 7: controllo per l'adsorbimento
Recipiente 8: controllo per la tossicità
Vedi 1.6.7.
III.2.6. Esecuzione del saggio
Durante l'esecuzione del saggio, determinare la concentrazione di DOC in ciascuna beuta, in doppio, a intervalli di tempo noti, in modo sufficientemente regolare per poter determinare il momento di inizio della fase di crescita (time window) di 10 giorni e la rimozione percentuale al termine della fase di crescita (time window) di 10 giorni. Prelevare solo il volume mìnimo necessario dì sospensione di prova per ciascuna determinazione.
Prima del campionamento, compensare le perdite per evaporazione dalle beute mediante l'aggiunta di acqua di diluizione (I.6.1), se necessario, nella quantità richiesta. Miscelare il mezzo di coltura accuratamente prima di prelevare un campione e assicurarsi che il materiale eventualmente aderente alle pareti dei recipienti sia disciolto o sospeso prima del campionamento. Filtrare su membrana o centrifugare (vedi allegato II.4) immediatamente dopo aver prelevato il campione. Analizzare i campioni filtrati e centrifugati lo stesso giorno, altrimenti conservarli a 2-4 oC per un massimo di 48 ore o al di sotto di - 18 oC per un periodo più lungo.
III.3. DATI E RELAZIONE
III.3.1. Trattamento dei risultati
Calcolare la degradazione percentuale al tempo t come indicato al punto I.7.1. (determinazione del DOC) e, facoltativamente, al punto I.7.2. (analisi specifica).
Trascrivere tutti i risultati su moduli predisposti.
III.3.2. Validità dei risultati
Vedi I.5.2.
III.3.3. RELAZIONE
Vedi I.8.
III.4. MODULARIO
Nel seguito è presentato un esempio di modulo.
SAGGIO DI RIMOZIONE LENTA DEL DOC SCREENING OCSE MODIFICATO
|
2.
|
DATA DI INIZIO DEL SAGGIO
|
3. SOSTANZA IN ESAME
Nome: ...
Concentrazione della soluzione stock: ... mg/l come sostanza
Concentrazione iniziale nel mezzo, to: ... mg/l come sostanza
4. INOCULO
Fonte: ...
Trattamento applicato: ... mg/l
Eventuale precondizionamento: ...
Concentrazione dei solidi sospesi nella miscela di reazione: ... mg/l
5. DETERMINAZIONI DEL CARBONIO
Analizzatore di carbonio: ...
|
|
Beuta N.
|
|
DOC dopo n giorni (mg/l)
|
|
0
|
n1
|
n2
|
n3
|
n4
|
|
Sostanza chimica in esame più inoculo
|
1
|
a1
|
|
|
|
|
|
|
a2
|
|
|
|
|
|
|
a, media
Ca(t)
|
|
|
|
|
|
|
2
|
b1
|
|
|
|
|
|
|
b2
|
|
|
|
|
|
|
b, media
Cb(t)
|
|
|
|
|
|
|
Bianco dell'inoculo senza sostanza chimica in esame
|
3
|
c1
|
|
|
|
|
|
|
c2
|
|
|
|
|
|
|
c, media Cc(t)
|
|
|
|
|
|
|
4
|
d1
|
|
|
|
|
|
|
d2
|
|
|
|
|
|
|
d, media
Cd(t)
|
|
|
|
|
|
|
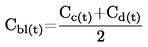
|
|
|
|
|
|
6. VALUTAZIONE DEI DATI GREZZI
|
Beuta n.
|
|
% degradazione dopo n giorni
|
|
0
|
n1
|
n2
|
n3
|
n4
|
|
1
|

|
0
|
|
|
|
|
|
2
|
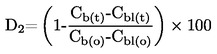
|
0
|
|
|
|
|
|
Media (4)
|

|
0
|
|
|
|
|
Nota: formule simili possono essere usate per i controlli della sostanza chimica di riferimento e di tossicità.
7. CONTROLLO ABIOTICO (facoltativo)
|
|
Tempo (in giorni)
|
|
0
|
t
|
|
DOC conc. in mg/L nel controllo sterile
|
Cs(o)
|
Cs(t)
|

8. ANALISI SPECIFICA DEL COMPOSTO CHIMICO (facoltativa)
|
|
quantità residua della sostanza chimica alla fine del saggio
|
% di degradazione primaria
|
|
Controllo sterile
|
Sb
|
|
|
Saggio del mezzo inoculato
|
Sa
|

|
PARTE IV. SAGGIO DI SVILUPPO DEL CO2 (Metodo C.4-C)
IV.1. PRINCIPIO DEL METODO
Un volume misurato di mezzo minerale inoculato contenente una concentrazione nota della sostanza chimica in esame (10-20 mg DOC o TOC/l) come unica fonte nominale di carbonio organico, viene aerato mediante il passaggio di aria esente da biossido di carbonio ad una portata controllata, al buio o a luce diffusa. La degradazione viene seguita per 28 giorni determinando il biossido di carbonio prodotto, che viene assorbito su idrossido di bario o di sodio e che viene misurato per titolazione dell'idrossido di bario residuo o come carbonio inorganico. La quantità di biossido di carbonio prodotta dalla sostanza chimica in esame (corretta, per tener conto di quella derivante dal bianco dell'inoculo) viene espressa come percentuale di ThCO2. Il grado di degradazione biologica può anche essere calcolato da un'analisi DOC supplementare effettuata all'inizio e al termine dell'incubazione.
IV.2. DESCRIZIONE DEL METODO
IV.2.1. Apparecchiatura
|
a)
|
Palloni, 2-5 litri, dotati ciascuno di un tubo di aerazione che giunge quasi al fondo del recipiente e di una uscita;
|
|
b)
|
agitatori magnetici quando la valutazione viene effettuata su sostanze chimiche scarsamente solubili;
|
|
c)
|
bottiglie per l'assorbimento di gas;
|
|
d)
|
dispositivo per controllare e misurare il flusso d'aria;
|
|
e)
|
apparecchio per la rimozione del biossido di carbonio per la preparazione d'aria esente da biossido di carbonio; in alternativa, una miscela di ossigeno esente da CO2 e azoto esente da CO2 prelevata da bombole di gas nelle proporzioni corrette (20 % O2:80 % N2);
|
|
f)
|
dispositivo per la determinazione del biossido di carbonio, o per titolazione o mediante qualche tipo di analizzatore del carbonio inorganico;
|
|
g)
|
dispositivo di filtrazione su membrana (facoltativo);
|
|
h)
|
analizzatore del DOC (facoltativo).
|
IV.2.2. Preparazione del mezzo minerale
Per la preparazione delle soluzioni concentrate vedi I.6.2.
Miscelare 10 ml di soluzione (a) con 800 ml di acqua di diluizione, aggiungere 1 ml di soluzioni da (b) a (d) e portare a 1 litro con acqua di diluizione.
IV.2.3. Preparazione e precondizionamento dell'inoculo
L'inoculo può essere ottenuto da varie fonti: fango attivo, acque di scarico, acque superficiali e terreni, oppure da una miscela di questi.
Vedi I.6.4., I.6.4.1., I.6.4.2. e I.6.5.
IV.2.4. Preparazione dei contenitori
Per esempio, i seguenti volumi e pesi indicano i valori per palloni da 5 litri contenenti 3 litri di sospensione. Se si utilizzano volumi più piccoli, modificare proporzionatamente i valori, ma assicurarsi che il biossido di carbonio formato possa venire misurato con accuratezza.
In ciascun pallone da 5 litri introdurre 2 400 ml di mezzo minerale. Aggiungere un volume appropriato del fango attivo preparato (vedi I.6.4.1. e I.6.5.) in modo da ottenere una concentrazione di solidi sospesi non maggiore di 30 mg/l nei 3 litri finali di miscela inoculata. In alternativa, diluire per prima cosa il fango preparato in modo da ottenere una sospensione a 500-1 000 mg/l nel mezzo minerale prima di aggiungerne un'aliquota al contenuto del pallone da 5 litri per realizzare una concentrazione di 30 mg/l; questo assicura una maggior precisione. È possibile usare altre fonti di inoculo (vedi I.6.4.2.).
Aerare queste miscele inoculate con aria esente da CO2 per una notte in modo da bonificare il sistema dal biossido di carbonio.
Aggiungere il materiale in esame e la sostanza di riferimento, separatamente, come volumi noti delle soluzioni concentrate ai palloni in multiplo, in modo da ottenere concentrazioni, fornite dalle sostanze chimiche aggiunte, da 10 a 20 mg di DOC o TOC/l; lasciare alcuni palloni senza aggiunta di sostanze chimiche come controlli dell'inoculo. Aggiungere le sostanze chimiche in esame, scarsamente solubili, direttamente nei palloni in una percentuale in peso o in volume, oppure trattarle come descritto nell'allegato III.
Se richiesto, usare un pallone per controllare il possibile effetto inibitore della soluzione chimica in esame aggiungendo le sostanze chimiche in esame e di riferimento alle stesse concentrazioni alle quali sono presenti negli altri palloni.
Inoltre, se richiesto, utilizzare un pallone sterile per controllare se la sostanza chimica in esame venga degradata abioticamente, utilizzando una soluzione non inoculata della sostanza chimica (vedi I.6.6.). Sterilizzare mediante l'aggiunta di una sostanza tossica ad una idonea concentrazione.
Portare i volumi delle sospensioni in tutti i palloni a 3 l mediante l'aggiunta del mezzo minerale preventivamente aerato con aria esente da CO2. In alternativa, si possono prelevare dei campioni per l'analisi del DOC (vedi allegato II.4.) e/o per l'analisi specifica. Collegare le bottiglie di assorbimento alle uscite dell'aria dei palloni.
Se si utilizza idrossido di bario, collegare tre bottiglie di assorbimento, contenenti ciascuna 100 ml di soluzione 0,0125 M di idrossido di bario, in serie con ciascun pallone da 5 l. La soluzione deve essere esente da solfati e carbonati precipitati e la sua concentrazione deve essere determinata immediatamente prima dell'uso. Se si utilizza idrossido di sodio, collegare due recipienti di cattura, dove il secondo agisce da controllo per verificare che tutto il biossido di carbonio è stato assorbito nel primo. Sono adatte bottiglie di assorbimento con chiusure per bottiglie da siero. Aggiungere 200 ml di idrossido di sodio 0,05 M a ciascuna bottiglia, quantità sufficiente per assorbire la quantità totale di biossido di carbonio sviluppata quando la sostanza chimica in esame è completamente degradata. La soluzione di idrossido di sodio, anche quando è stata preparata di fresco, conterrà tracce di carbonati; questo valore viene corretto sottraendo il carbonato contenuto nel bianco.
IV.2.5. Numero di palloni usati in un saggio tipo
Recipiente 1 e 2: sospensione
Recipiente 3 e 4: bianco con inoculo
Recipiente 5: controllo
preferibilmente se è necessario:
Recipiente 6: controllo abiotico sterile
Recipiente 7: controllo per la tossicità
Vedi I.6.7.
IV.2.6. Esecuzione del saggio
Iniziare la prova facendo gorgogliare aria esente da CO2 attraverso le sospensioni ad una portata di 30-100 ml/min. Prelevare periodicamente dei campioni dal contenitore che assorbe il biossido di carbonio per l'analisi del contenuto di CO2. Durante i primi 10 giorni si raccomanda di effettuare l'analisi ogni due o tre giorni, poi ogni cinque giorni fino al ventottesimo giorno in modo da poter identificare la fase di crescita (time window) di 10 giorni.
Al ventottesimo giorno, prelevare dei campioni (facoltativamente) per l'analisi del DOC e/o l'analisi specifica, misurare il pH delle sospensioni e aggiungere 1 ml di acido cloridrico concentrato a ciascun contenitore; aerare i contenitori per una notte per scacciare il biossido di carbonio presente nelle, sospensioni in esame. Al giorno ventinovesimo eseguire l'ultima analisi del biossido di carbonio sviluppato.
Nei giorni di misura del CO2, scollegare l'assorbitore dell'idrossido di bario più vicino al pallone e titolare la soluzione di idrossido con HCl 0,05 M utilizzando fenolftaleina come indicatore. Spostare gli assorbitori rimanenti di un posto verso il pallone e porre un nuovo assorbitore contenente 100 ml di idrossido di bario 0,0125 M fresco all'estremità più lontana della serie. Effettuare le titolazioni quando necessario, per esempio quando si vede una sostanziale precipitazione nella prima trappola e prima che sia evidente una precipitazione nella seconda, oppure almeno ogni settimana. In alternativa, con NaOH come assorbente, prelevare con una siringa una piccola aliquota di campione (secondo le caratteristiche dell'analizzatore di carbonio usato) della soluzione di idrossido di sodio nell'assorbitore più vicino al pallone. Iniettare il campione nella parte per il carbonio inorganico dell'analizzatore di carbonio ed effettuare direttamente l'analisi del biossido di carbonio sviluppato.
Analizzare il contenuto della seconda trappola solo al termine del saggio per correggere eventuali trascinamenti di biossido di carbonio.
IV.3. DATI E RELAZIONE
IV.3.1. Modalità di esposizione dei risultati
La quantità di CO2 catturata nell'assorbitore al momento della titolazione è data da:
mg CO2 = (100 × CB-0,5 × V × CA) ×l44
in cui:
|
V
|
=
|
volume di HCl utilizzato per la titolazione dei 100 ml nell'assorbitore (ml),
|
|
CB
|
=
|
concentrazione della soluzione di idrossido di bario (M),
|
|
CA
|
=
|
concentrazione della soluzione di acido cloridrico (M),
|
se CB è 0,0125 MeCA è 0,05 M, la titolazione per 100 ml di idrossido di bario è 50 ml e il peso di CO2 è dato da:

Così, in questo caso, il fattore di conversione del volume di HCl titolato in mg di CO2 prodotta è 1,1.
Calcolare i pesi di CO2 prodotto dall'inoculo da solo e dall'inoculo più la sostanza chimica in esame utilizzando i rispettivi valori di titolazione; la differenza è il peso di CO2 prodotto dalla sostanza chimica in esame da sola.
Per esempio, se l'inoculo da solo fornisce una titolazione di 48 ml e l'inoculo più sostanza chimica in esame fornisce 45 ml.
CO2 dall'inoculo = 1,1 × (50 - 48) = 2,2 mg
CO2 dall'inoculo più sostanza chimicain esame= 1,1 × (50 - 45) = 5,5 mg
e così il peso di CO2 prodotto dalla sostanza chimica in esame è 3,3 mg.
La degradazione biologica percentuale si calcola da:

o,
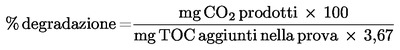
dove 3,67 è il fattore di conversione (44/12) da carbonio a biossido di carbonio.
Ricavare la degradazione percentuale dopo ogni intervallo di tempo aggiungendo la percentuale dei valori di ThCO2 calcolati per ciascuno dei giorni in cui è stata misurata fino a quel momento.
Per gli assorbitori all'idrossido di sodio, calcolare la quantità di biossido di carbonio prodotto, espressa come 1C (mg), moltiplicando la concentrazione di IC nell'assorbente per il volume dell'assorbente.
Calcolare la degradazione percentuale dalla:

Calcolare il grado di rimozione del DOC (facoltativo) come descritto al punto 1.7. Registrare questi risultati, e tutti gli altri, sui registri forniti.
IV.3.2. Validità dei risultati
Il contenuto di carbonio inorganico nella sospensione della sostanza chimica in esame nel mezzo minerale all'inizio della prova deve essere minore del 5 % del carbonio totale e lo sviluppo totale di CO2 nel bianco dell'inoculo al termine della prova non dovrebbe normalmente superare i 40 mg/l di terreno. Se si ottengono valori maggiori di 70 mg CO2/l, si dovrebbero esaminare criticamente i dati e la tecnica sperimentale.
Vedi anche I.5.2.
IV.3.3. Relazione
Vedi I.8.
IV.4. MODULARIO
Nel seguito è presentato un esempio di modulo predisposto.
SAGGIO DI SVILUPPO DEL BIOSSIDO DI CARBONIO
|
2.
|
DATA DI INIZIO DEL SAGGIO
|
3. SOSTANZA IN ESAME
Nome: ...
Concentrazione della soluzione stock: ... mg/l come sostanza
Concentrazione iniziale nel mezzo: ... mg/l come sostanza
C totale aggiunto al contenitore: ... mg C
ThCO2: ... mg CO2
4. INOCULO
Fonte: ...
Trattamento effettuato: ...
Eventuale precondizionamento: ...
Concentrazione dei solidi sospesi nella miscela di reazione: ... mg/l
5. PRODUZIONE DI BIOSSIDO DI CARBONIO E DEGRADABILITÀ
Metodo: Ba(OH)2/NaOH/altro: ...
|
Tempo
(giorno)
|
CO2 formato
prova (mg)
|
CO2 formato
bianca (mg)
|
CO2 formato
kumulativo (mg)
|
% ThCO2
cumulativo 
|
|
1
2
|
media
|
3
4
|
media
|
1
|
2
|
1
|
2
|
media
|
|
0
|
|
|
|
|
|
|
|
|
|
|
n1
|
|
|
|
|
|
|
|
|
|
|
n2
|
|
|
|
|
|
|
|
|
|
|
n3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
28
|
|
|
|
|
|
|
|
|
|
Nota: formati simili possono essere usati per i controlli della sostanza chimica di riferimento e di tossicità.
6. ANALISI DEL CARBONIO (facoltativa)
Analizzatore di carbonio:
|
Tempo (giorno)
|
Bianco mg/l
|
Sostanza chimica in esame mg/l
|
|
0
|
Cb(o)
|
Co
|
|
28 (5)
|
Cb(t)
|
Ct
|

7. DEGRADAZIONE ABIOTICA (facoltativa)

PARTE V. SAGGIO RESPIROMETRICO MANOMETRICO (Metodo C.4-D)
V. 1. PRINCIPIO DEL METODO
Un volume misurato di mezzo minerale inoculato, contenente una concentrazione nota della sostanza chimica in esame (100 mg/l della sostanza chimica in esame in modo da fornire almeno 50-100 mg ThOD/1) come unica fonte nominale di carbonio organico, viene tenuto sotto agitazione in un contenitore chiuso a temperatura costante (± 1 oC o meno) per un tempo fino a 28 giorni. Il consumo di ossigeno viene determinato o misurando la quantità di ossigeno (prodotto elettroliticamente) necessario per mantenere costante il volume di gas nel contenitore del respirometro, oppure dalla variazione di volume o di pressione (o da una combinazione delle due variazioni) nell'apparecchiatura. Il biossido di carbonio sviluppato viene assorbito in una soluzione di idrossido di potassio o un altro assorbente adatto. La quantità di ossigeno consumata dalla sostanza chimica in esame (corretta del consumo del bianco dell'inoculo, controllato in parallelo) viene espressa in percentuale di ThOD o COD. In alternativa, la degradazione primaria può anche essere calcolata mediante analisi specifica supplementare fatta all'inizio e alla fine dell'incubazione e la degradazione ultima mediante analisi del DOC.
V.2. DESCRIZIONE DEL METODO
V.2.1. Apparecchiatura
|
b)
|
sistema di regolazione della temperatura che mantenga ± 1 oC, o miglio;
|
|
c)
|
dispositivo di filtrazione su membrana (facoltativo);
|
|
d)
|
analizzatore di carbonio (facoltativo).
|
V.2.2. Preparazione del mezzo minerale
Per la preparazione delle soluzioni concentrate vedi I.6.2.
Miscelare 10 ml di soluzione (a) con 800 ml di acqua di diluizione, aggiungere 1 ml di soluzioni da (b) a (d) e portare a 1 litro con acqua di diluizione.
V.2.3. Preparazione e precondizionamento dell'inoculo
L'inoculo può essere ottenuto da varie fonti: fango attivo, acque di scarico, acque superficiali e terreni, oppure da una miscela di questi.
Vedi I.6.4., 1.6.4.1., I.6.4.2. e I.6.5.
V.2.4. Preparazione dei contenitori
Preparare separatamente le soluzioni delle sostanze chimiche in esame e di riferimento nel mezzo minerale, normalmente equivalenti ad una concentrazione di 100 mg di sostanza chimica/1 (che forniscono almeno 50-100 mg ThOD/1) utilizzando le soluzioni concentrate (stock).
Calcolare la ThOD sulla base della formazione di sali di ammonio, salvo che si preveda una nitrificazione, nel qual caso il calcolo dovrebbe essere basato sulla formazione di nitrati (vedi allegato H.2.).
Determinare i valori di pH e, se necessario, regolare a pH = 7,4±0,2.
Sostanze scarsamente solubili dovrebbero essere aggiunte in una fase più avanzata (vedi nel seguito).
Se si deve determinare la tossicità della sostanza chimica in esame, preparare una ulteriore soluzione nel mezzo minerale contenente sia la sostanza chimica in esame che quella di riferimento alle stesse concentrazioni delle singole soluzioni.
Se è richiesta una misura dell'assorbimento chimico-fisico dell'ossigeno, preparare una soluzione sterile della sostanza chimica in esame ad una concentrazione, normalmente, di 100 mg ThOD/1 mediante aggiunta di una idonea sostanza tossica (vedi I.6,6.).
Introdurre il volume richiesto di soluzione delle sostanze chimiche rispettivamente in esame e di riferimento, in contenitori almeno in doppio. Aggiungere ad ulteriori contenitori il mezzo minerale da solo (per i controlli dell'inoculo) e, se richiesto, la soluzione mista della sostanza chimica di prova/riferimento e la soluzione sterile.
Se la sostanza chimica in esame è scarsamente solubile, aggiungerla direttamente a questo stadio, in ragione del peso o del volume, oppure trattarla come descrino nell'allegato III. Nel comparto di assorbimento della CO2, aggiungere idrossido di potassio, pastiglie di calce sodata o altro assorbente.
V.2.5. Numero di contenitori usati in un saggio tipo
Recipiente 1 e 2: sospensione
Recipiente 3 e 4: bianco con inoculo
Recipiente 5: controllo
preferibilmente se è necessario:
Recipiente 6: controllo sterile
Recipiente 7: controllo per la tossicità
Vedi I.6.7.
V.2.6. Esecuzione del saggio
Aspettare che i contenitori abbiano raggiunto la temperatura desiderata, inoculare i recipienti appropriati con fango attivo preparato o altra fonte di inoculo in modo da ottenere una concentrazione di solidi sospesi non superiore a 30 mg/l. Montare l'apparecchiatura, avviare l'agitatore e controllare la tenuta nei confronti dell'aria, e iniziare la misura del consumo di ossigeno. Di solito non sono richieste ulteriori attenzioni a parte quella di effettuare le necessarie letture e i controlli giornalieri per verificare che vengano mantenute la temperatura corretta ed una adeguata agitazione.
Calcolare il consumo di ossigeno con letture effettuate ad intervalli regolari e frequenti, utilizzando i metodi forniti dal fabbricante dell'apparecchiatura. Al termine dell'incubazione, normalmente 28 giorni, misurare il pH del contenuto dei contenitori, sopratutto se il consumo di ossigeno è basso o maggiore della ThODNH4 (vedi composti contenenti azoto).
Se necessario, prelevare campioni dai contenitori del respirometro, all'inizio e alla fine, per l'analisi del DOC o per l'analisi chimica specifica (vedi allegato II.4.). Al momento del prelievo iniziale, assicurarsi che il volume della sospensione in esame che rimane nel contenitore sia noto. Quando l'ossigeno viene consumato da una sostanza in esame contenente azoto, determinare l'aumento della concentrazione dei nitriti e dei nitrati durante i 28 giorni e calcolare la correzione per l'ossigeno consumato mediante nitrificazione (allegato V).
V.3. DATI E RELAZIONE
V.3.1. Modalità di esposizione dei risultati
Dividere il consumo di ossigeno (mg) da parte della sostanza chimica in esame dopo un tempo stabilito (corretto del controllo del bianco di inoculo dopo lo stesso tempo) per il peso della sostanza chimica in esame usata. Questo fornisce il BOD espresso come mg di ossigeno/mg di sostanza chimica in esame, cioè

= mg O2 per mg di sostanza chimica in esame.
Calcolare la percentuale di degradazione biologica con una delle seguenti relazioni:

o
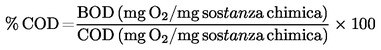
Si dovrebbe notare che questi due metodi non forniscono necessariamente lo stesso valore; dei due è preferibile usare il primo.
Per le sostanze in esame che contengono azoto, utilizzare il valore appropriato di ThOD (NH4 o NO3) secondo quanto è noto o ci si aspetta per quanto riguarda il verificarsi della nitrificazione (allegato II.2). Se viceversa si verifica una nitrificazione non completa, effettuare una correzione che tenga conto dell'ossigeno consumato dalla nitrificazione in base alle variazioni di concentrazione dei nitriti e dei nitrati (allegato V).
Quando si effettuano determinazioni facoltative del carbonio organico e/o di una sostanza chimica specifica, calcolare la degradazione percentuale come descritto al punto I.7.
V.3.2. Validità dei risultati
Il consumo di ossigeno da parte del bianco dell'inoculo è normalmente di 20-30 mg O2/l e non dovrebbe essere maggiore di 60 mg/l in 28 giorni. Valori più elevati di 60 mg/l richiedono un esame critico dei dati e delle tecniche sperimentali. Se il valore del pH è al di fuori del campo 6-8,5 ed il consumo di ossigeno da parte della sostanza chimica in esame è minore del 60 %, si dovrebbe ripetere la prova con una minore concentrazione della sostanza chimica in esame.
Vedi anche I.5.2.
V.3.3. Relazione
Vedi I.8.
V.4. MODULARIO
Nel seguito è presentato un esempio di modulo predisposto.
SAGGIO RESPIROMETRICO MANOMETRICO
|
2.
|
DATA DI INIZIO DEL SAGGIO
|
3. SOSTANZA IN ESAME
Nome: ...
Concentrazione della soluzione stock: ... mg/l
Concentrazione iniziale nel mezzo, Co: ... mg/l
Volume nel recipiente di saggio (V): ... ml
ThOD o COD: ... mg O2/mg sostanza saggiata (NH4, NO3)
4. INOCULO
Fonte: ...
Trattamento effettuato: ...
Eventuale precondizionamento: ...
Concentrazione dei solidi sospesi nella miscela di reazione: ... mg/l
5. CONSUMO DI OSSIGENO: BIODEGRADABILITÀ
|
|
Tempo (giorni)
|
|
0
|
|
7
|
|
14
|
|
|
21
|
|
|
28
|
|
|
O2 cons. (mg) sostanza chimica in esame
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a, media
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O2 cons. (mg) bianco
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
b, media
|
|
|
|
|
|
|
|
|
|
|
|
|
|
BOD (mg) corretto
|
(a1 — bm)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(a2 — bm)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
BOD per mg di sostanza chimica in esame
|

|
|
|
|
|
|
|
|
|
|
|
|
|
|
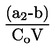
|
|
|
|
|
|
|
|
|
|
|
|
|
|
% degradazione
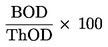
|
D1 (a1)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
D2 (a2)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Media (6)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V = Volume del mezzo nel contenitore d'esame
|
Nota: formule simili possono essere usate per i controlli della sostanza chimica di riferimento e per i controlli di tossicità.
6. CORREZIONE PER LA NITRIFICAZIONE (vedi allegato V)
|
Giorno
|
0
|
28
|
Differenza
|
|
(i)
|
Concentrazione nitrati (mg N/l)
|
|
|
|
(N)
|
|
(ii)
|
Ossigeno equivalente (4,57 × N × V) (mg)
|
|
—
|
—
|
|
|
(iii)
|
Concentrazione nitriti (mg N/l)
|
|
|
|
(N)
|
|
(iv)
|
Ossigeno equivalente (3,43 × N × V) (mg)
|
|
—
|
—
|
|
|
(ii + iv)
|
Ossigeno equivalente totale
|
|
—
|
—
|
|
7. ANALISI DEL CARBONIO (facoltativa)
Analizzatore di carbonio: ...
|
Tempo (giorno)
|
Bianco mg/l
|
Sostanza chimica in esame mg/l
|
|
0
|
Cb(o)
|
Co
|
|
28 (7)
|
Cb(t)
|
Ct
|

8. SOSTANZA CHIMICA SPECIFICA (facoltativa)
|
Sb
|
=
|
concentrazione nel controllo chimico-fisico (sterile) al ventottesimo giorno.
|
|
Sa
|
=
|
concentrazione nel pallone inoculato al ventottesimo giorno.
|

9. DEGRADAZIONE ABIOTICA (facoltativa)
|
a
|
=
|
consumo di ossigeno nei contenitori sterili dopo 28 giorni, (mg).
|
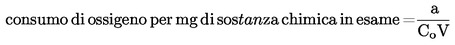
(vedi sezioni 1 e 3)

PARTE VI. SAGGIO DELLA BOTTIGLIA CHIUSA (Metodo C.4-E)
VI.l. PRINCIPIO DEL METODO SPERIMENTALE
La soluzione della sostanza chimica in esame nel mezzo minerale, di solito a 2-5 mg/l, viene inoculata con un numero relativamente piccolo di microorganismi provenienti da una popolazione mista e mantenuti in bottiglie chiuse, completamente piene, al buio a temperatura costante. La degradazione viene seguita mediante l'analisi dell'ossigeno disciolto su un arco di tempo di 28 giorni. La quantità di ossigeno consumata dalla sostanza chimica in esame, corretta per tener conto del bianco dell'inoculo controllato in parallelo, è espressa in percentuale di ThOD o COD.
VI.2. DESCRIZIONE DEL METODO
VI.2.1. Apparecchiatura
|
a)
|
Bottiglie per BOD, con tappi di vetro, per esempio da 250-300 ml;
|
|
b)
|
bagno d'acqua o incubatore per mantenere le bottiglie a temperatura costante (± 1 oC o meglio) con l'esclusione di luce;
|
|
c)
|
bottiglie di vetro grandi (2-5 l) per la preparazione dei terreni e per il riempimento delle bottiglie per BOD:
|
|
d)
|
elettrodo a ossigeno e misuratore, o apparecchiatura e reagenti per la titolazione di Winkler.
|
VI.2.2. Preparazione del mezzo minerale
Per la preparazione della soluzione concentrata, vedi I.6.2.
Miscelare 1 ml di soluzioni da (a) a (d) e portare a 1 l con acqua di diluizione.
VI.2.3. Preparazione dell'inoculo
L'inoculo è normalmente proveniente da un effluente secondario di un impianto di trattamento o da una unità pilota di laboratorio alimentata prevalentemente da scarichi domestici. In alternativa una sorgente d'inoculo è un'acqua superficiale. Normalmente si usa da una goccia (0,05 ml) a 5 ml di filtrato per litro di mezzo minerale; è utile eseguire delle prove sperimentali per valutare il volume ottimale per un dato effluente (vedi I.6.4.2 e I.6.5.).
VI.2.4. Preparazione dei contenitori
Aerare fortemente il mezzo minerale per almeno 20 minuti. Eseguire ogni serie di esperimenti con mezzo minerale ottenuto dalla stessa partita. In generale, il mezzo è pronto per l'uso dopo essere stato a riposo per 20 ore alla temperatura di prova. Determinare la concentrazione dell'ossigeno disciolto a scopo di controllo; il valore dovrebbe essere di circa 9 mg/l a 20 oC. Eseguire tutte le operazioni di trasferimento e di riempimento del terreno saturato con aria evitando la formazione di bolle, per esempio mediante l'uso di sifoni.
Preparare gruppi paralleli di bottiglie per BOD per la determinazione delle sostanze chimiche di prova e di riferimento in serie sperimentali simultanee. Preparare un numero sufficiente di bottiglie per BOD, includendo i bianchi dell'inoculo, per permettere di fare delle misure almeno in doppio del consumo di ossigeno agli intervalli di prova desiderati, per esempio dopo 0, 7, 14, 21 e 28 giorni. Per assicurarsi di poter identificare la fase di crescita di 10 giorni (time window), possono essere necessarie un maggior numero di bottiglie.
Aggiungere mezzo minerale completamente aerato a bottiglie grandi in modo che esse siano riempite per circa un terzo. Aggiungere poi una quantità sufficiente delle soluzioni concentrate della sostanza chimica in esame e della sostanza chimica di riferimento a bottiglie grandi separate in quantità tale che la concentrazione finale delle sostanze chimiche sia normalmente non superiore a 10 mg/l. Non aggiungere sostanze chimiche al terreno di controllo del bianco contenuto in una ulteriore bottiglia grande.
Allo scopo di garantire che l'attività dell'inoculo non sia contenuta, la concentrazione dell'ossigeno disciolto non deve scendere al di sotto di 0,5 mg/l nelle bottiglie per BOD. Questo limita la concentrazione della sostanza chimica in esame a circa 2 mg/l. Tuttavia, per composti scarsamente degradabili e per quelli con un basso ThOD, si possono usare 5-10 mg/l. In alcuni casi, è consigliabile eseguire prove su serie in parallelo della sostanza chimica a due differenti concentrazioni, per esempio 2 e 5 mg/l. Normalmente, si calcola il ThOD sulla base della formazione di sali d'ammonio ma, se è prevista la nitrificazione, si calcola sulla base della formazione di nitrato (ThODNO3: vedi allegato II.2). Tuttavia, se si verifica una nitrificazione non completa, si effettua una correzione tenendo conto delle variazioni di concentrazione di nitrito e nitrato determinate mediante analisi (vedi allegato V).
Se si deve studiare la tossicità della sostanza chimica in esame (nel caso per esempio sia stato trovato preventivamente un basso valore di biodegradabilità), è necessaria un'altra serie di bottiglie.
Preparare un'altra bottiglia grande, che deve contenere mezzo minerale aerato (fino a circa un terzo del suo volume) più la sostanza chimica in esame e la sostanza chimica di riferimento alle concentrazioni finali normalmente uguali a quelle usate nelle altre bottiglie grandi.
Inoculare le soluzioni contenute nelle bottiglie grandi con effluente secondario (da una goccia, o circa 0,05 ml, a 5 ml/l) o con un'altra fonte, come acqua di fiume (vedi I.6.4.2.). Infine, portare a volume le soluzioni con mezzo minerale aerato utilizzando un tubo flessibile che arrivi fino al fondo della bottiglia per realizzare una adeguata miscelazione.
VI.2.5. Numero di contenitori usati in un saggio tipo
In una prova tipica si usano le seguenti bottiglie:
|
—
|
almeno 10 contenenti la sostanza chimica in esame e l'inoculo (sospensione in esame),
|
|
—
|
almeno 10 contenenti solo l'inoculo (bianco dell'inoculo),
|
|
—
|
almeno 10 contenenti la sostanza chimica di riferimento e l'inoculo (controllo),
|
|
—
|
e, quando sia necessario, 6 bottiglie contenenti la sostanza chimica in esame, la sostanza chimica di riferimento e l'inoculo (controllo di tossicità). Tuttavia, per poter essere sicuri di riuscire a identificare la fase di crescita (time window) di 10 giorni, sarà necessario un numero di bottiglie circa doppio.
|
VI.2.6. Esecuzione dei saggio
Dosare immediatamente ciascuna soluzione preparata nel rispettivo gruppo di bottiglie per BOD mediante un tubo flessibile prelevandola dal quarto inferiore (non dal fondo) dell'opportuna bottiglia grande in modo che tutte le bottiglie per BOD siano completamente riempite. Battere delicatamente per rimuovere eventuali bolle d'aria. Analizzare immediatamente le bottiglie al tempo zero per determinare l'ossigeno disciolto mediante il metodo di Winkler o il metodo all'elettrodo. Il contenuto delle bottiglie può venire conservato per un'analisi successiva mediante il metodo di Winkler aggiungendo solfato di manganese (II) e idrossido di sodio (il primo reagente di Winkler). Conservare le bottiglie, accuratamente tappate, contenenti l'ossigeno fissato in forma di ossido di manganese (III) idrato marrone, al buio a 10-20 oC per non oltre 24 ore prima di procedere con le fasi rimanenti del metodo di Winkler. Tappare le bottiglie in multiplo rimanenti assicurandosi che non siano intrappolate bolle d'aria, e incubare a 20 oC al buio. Ciascuna serie deve essere accompagnata da una serie parallela completa per la determinazione del bianco del mezzo inoculato. Prelevare bottiglie almeno in doppio di tutte le serie per l'analisi dell'ossigeno disciolto ad intervalli di tempo (almeno settimanali) durante i 28 giorni di incubazione.
I campioni settimanali dovrebbero permettere la valutazione della rimozione percentuale in una fase di crescita di 14 giorni, mentre un campionamento ogni 3-4 giorni dovrebbe permettere di identificare la fase di crescita di 10 giorni, il che richiederà un numero di bottiglie circa doppio.
Per sostanze in esame contenenti azoto, si devono apportare delle correzioni per il consumo dell'ossigeno che si verifica nell'eventuale nitrificazione. A questo scopo, usare il metodo dell'elettrodo a O2 per la determinazione della concentrazione di ossigeno disciolto e prelevare poi un campione dalla bottiglia per BOD per analizzare nitriti e nitrati. Dall'aumento di concentrazione dei nitriti e dei nitrati, calcolare l'ossigeno consumato (vedi allegato V).
VI.3. DATI E RELAZIONE
VI.3.1. Modalità di esposizione dei risultati
Calcolare per prima cosa il BOD dopo ciascun periodo di tempo sottraendo il consumo di ossigeno (mg O2/l) del bianco dell'inoculo da quello presentato dalla sostanza chimica in esame. Dividere questo consumo corretto per la concentrazione (mg/l) della sostanza chimica in esame per ottenere il BOD specifico come mg di ossigeno per mg di sostanza chimica in esame. Calcolare la biodegradabilità percentuale dividendo il BOD specifico per il ThOD specifico (calcolato secondo l'allegato II.2) o per il COD (determinato mediante analisi, vedi allegato II.3), come segue:

= mg O2 per mg di sostanza chimica in esame

o

Si noti che questi due metodi non forniscono necessariamente lo stesso valore; è preferibile usare il primo dei due.
Per le sostanze in esame che contengono azoto, utilizzare il valore appropriato di ThOD (NH4 o NO3) secondo quanto è noto o ci si aspetta per quanto riguarda il verificarsi della nitrificazione (allegato II.2). Se si verifica la nitrificazione ma non è completa, calcolare una correzione per tener conto dell'ossigeno consumato dalla nitrificazione in base alle variazioni di concentrazione dei nitriti e dei nitrati (allegato V).
VI.3.2. Validità dei risultati
Il consumo di ossigeno nel bianco dell'inoculo non dovrebbe superare 1,5 mg di ossigeno disciolto/1 dopo 28 giorni. Valori più elevati di questo richiedono un esame delle tecniche sperimentali. La concentrazione residua di ossigeno nelle bottiglie di prova non dovrebbe scendere al di sotto di 0,5 mg/l dopo questo tempo. Livelli di ossigeno cosi bassi sono validi solo se il metodo usato per la determinazione dell'ossigeno disciolto è in grado di misurare accuratamente livelli cosi bassi.
Vedi anche I.5.2.
VI.3.3. Relazione
Vedi I.8.
VI.4. MODULARIO
Nel seguito è presentato un esempio di modulo predisposto.
SAGGIO DELLA BOTTIGLIA CHIUSA
|
2.
|
DATA DI INIZIO DEL SAGGIO
|
3. SOSTANZA IN ESAME
Nome: ...
Concentrazione della soluzione stock: ... mg/l
Concentrazione iniziale nella bottiglia: ... mg/l
ThOD o COD: .. mg O2/mg sostanza saggiata
4. INOCULO
Fonte: ...
Trattamento effettuato: ...
Eventuale precondizionamento: ...
Concentrazione nella miscela di reazione: ... mg/l
5. DETERMINAZIONE DEL DO
Metodo: Winkler/elettrodo
Analisi dei contenitori
|
Tempo di incubazione (d)
|
DO (mg/l)
|
|
0
|
n1
|
n2
|
|
|
Bianco (senza sostanza chimica)
|
1
|
C1
|
|
|
|
|
|
2
|
C2
|
|
|
|
|
|
Media
|

|
|
|
|
|
|
Sostanza chimica in esame
|
1
|
a1
|
|
|
|
|
|
|
2
|
a2
|
|
|
|
|
|
Media
|

|
|
|
|
|
Nota: formule simili possono essere usate per i controlli della sostanza chimica di riferimento e per i controlli di tossicità.
6. CORREZIONE PER LA NITRIFICAZIONE (vedi allegato V)
|
Tempo di incubazione (d)
|
0
|
n1
|
n2
|
n3
|
|
(i)
|
Concentrazione nitrati (mg N/l)
|
|
|
|
|
|
|
(ii)
|
Variazione della concentrazione dei nitrati (mg N/l)
|
|
—
|
|
|
|
|
(iii)
|
Ossigeno equivalente (mg/l)
|
|
—
|
|
|
|
|
(iv)
|
Concentrazione nitriti (mg N/l)
|
|
|
|
|
|
|
(v)
|
Variazione della concentrazione dei nitriti (mg N/l)
|
|
—
|
|
|
|
|
(vi)
|
Ossigeno equivalente (mg/l)
|
|
—
|
|
|
|
|
(iii + vi)
|
Ossigeno equivalente totale (mg/l)
|
|
—
|
|
|
|
7. CONSUMO DI DO: % DEGRADAZIONE
|
|
Abbattimento dopo n giorni (mg/l)
|
|
n1
|
n2
|
n3
|
|
|
Recipiente 1: (mto - mtx) - (mbo - mbx)
|
|
|
|
|
|
Recipiente 2: (mto - mtx) - (mbo - mbx)
|
|
|
|
|
|
Recipiente 1:
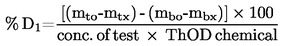
|
|
|
|
|
|
Recipiente 2:
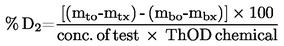
|
|
|
|
|
| % D mean (8)=
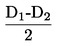
|
|
|
|
|
|
mto
|
=
|
valore nel recipiente di saggio al tempo 0
|
|
mtx
|
=
|
valore nel recipiente di saggio al tempo x
|
|
mbo
|
=
|
valore medio del bianco al tempo 0
|
|
mbx
|
=
|
valore medio del bianco al tempo x
|
Applicare anche la correzione per la nitrificazione da iii + vi della sezione 6.
8. CONSUMI DI DO DEL BIANCO
Consumo di ossigeno da parte del bianco: (mbo - mb28) mg/l. Questo consumo è importante per la validità del saggio. Non deve essere inferiore a 1,5 mg/l.
PARTE VII. SAGGIO MITI (Metodo C.4-F)
VII.1. PRINCIPIO DEL METODO
Il consumo di ossigeno da parte di una soluzione o sospensione agitata della sostanza chimica in esame in un mezzo minerale inoculato con microorganismi non adattati, coltivati in modo speciale, viene misurato in modo automatico in un arco di tempo di 28 giorni in un respirometro tenuto in ambiente chiuso al buio a 25 ± 1 oC. Il biossido di carbonio sviluppato viene assorbito mediante calce sodata. La biodegradabilità è espressa come percentuale di ossigeno consumato (corretta del consumo del bianco) rispetto all'assorbimento teorico (ThOD). La percentuale di biodegradanbilità primaria viene inoltre calcolata mediante una analisi chimica specifica supplementare effettuata all'inizio e al termine dell'incubazione e, possibilmente, mediante analisi del DOC.
VII.2. DESCRIZIONE DEL METODO
VII.2.1. Apparecchiatura
|
a)
|
Misuratore elettrolitico automatico di BOD o respirometro equipaggiato normalmente con 6 bottiglie da 300 ml ciascuna munite di contenitori per l'assorbimento del CO2;
|
|
b)
|
camera e/o bagno d'acqua a temperatura costante a 25 oC ± 1 oC o meglio;
|
|
c)
|
dispositivo di filtrazione su membrana (facoltativo);
|
|
d)
|
analizzatore di carbonio (facoltativo).
|
VII.2.2. Preparazione del mezzo minerale
Preparare le seguenti soluzioni concentrate (stock) utilizzando reattivi puri per analisi e acqua (I.6.1.)-
|
(a)
|
Diidrogenoortofosfato monopotassico, KH2PO4
|
8,50 g
|
|
Monoidrogenoortofosfato dipotassico, K2HPO4
|
21,75 g
|
|
Monoidrogenoortofosfato disodico dodecaidrato Na2HP04.12 H2O
|
44,60 g
|
|
Cloruro d'ammonio, NH4Cl
|
1,70 g
|
|
Sciogliere in acqua e portare a 1 litro
|
|
|
Il pH della soluzione deve essere 7,2
|
|
|
(b)
|
Solfato di magnesio eptaidrato, MgSO4.7 H2O
|
22,50 g
|
|
Sciogliere in acqua e portare a 1 litro
|
|
|
(c)
|
Cloruro di calcio anidro, CaCl2
|
27,50 g
|
|
Sciogliere in acqua e portare a 1 litro
|
|
|
(d)
|
Cloruro di ferro (III) esaidrato, FeCl3.6 H2O
|
0,25 g
|
|
Sciogliere in acqua e portare a 1 litro.
|
|
Prelevare 3 ml di ciascuna soluzione (a), (b), (c) e (d) e portare a 1 litro.
VII.2.3. Preparazione dell'inoculo
Raccogliere campioni freschi provenienti da almeno 10 località, principalmente da aree nelle quali vengono usati e scaricati vari prodotti chimici. Raccogliere da località come impianti di trattamento degli scarichi di fognatura, trattamento delle acque di scarico industriali, fiumi, laghi, mari, campioni da 1 litro di fango, terreno superficiale, acqua e così via e miscelare accuratamente insieme. Dopo avere rimosso la sostanza galleggiante e aver lasciato il resto a riposo, regolare il surnatante a pH 7 ± 1 con idrossido di sodio o acido fosforico.
Utilizzare un volume appropriato del surnatante filtrato per riempire un recipiente a fango attivo del tipo riempi e preleva e aerare il liquido per circa 23 ore e mezzo. Trenta minuti dopo avere arrestato l'aerazione, scartare circa un terzo del volume totale di surnatante e aggiungere un volume uguale di una soluzione (pH = 7) contenente lo 0,1 % rispettivamente di glucosio, peptone e ortofosfato monopotassico al materiale decantato e ricominciare l'aereazione. Ripetere questa procedura una volta al giorno. L'unità del fango deve essere fatta funzionare secondo la buona pratica di laboratorio: gli effluenti dovrebbero essere limpidi, la temperatura dovrebbe mantenersi a 25 ± 2 oC, il pH dovrebbe essere 7 ± 1, il fango ben decantato, una sufficiente aereazione per mantenere la miscela aerobica per tutto il tempo, devono essere presenti protozoi e l'attività del fango deve essere verificata contro una sostanza di riferimento almeno ogni tre mesi. Non usare il fango come inoculo prima di almeno un mese di funzionamento, ma nemmeno dopo più di quattro mesi. Prelevare, quindi, campioni da almeno 10 località ad intervalli regolari, una volta ogni tre mesi.
Allo scopo di mantenere il fango fresco e quello vecchio alla stessa attività, miscelare il surnatante filtrato di un fango attivo in uso con un volume uguale del surnatante filtrato di una miscela raccolta di fresco da 10 fonti e coltivare il liquido combinato come visto sopra. Prelevare il fango da usarsi come inoculo 18-24 ore dopo che l'unità è stata alimentata.
VII.2.4. Preparazione dei contenitori
Preparare i seguenti sei palloni:
n. 1: sostanza chimica in esame in acqua di diluizione a 100 mg/l
n. 2, 3 e 4: sostanza chimica in esame nel mezzo minerale a 100 mg/l
n. 5: sostanza chimica di riferimento (per esempio anilina) nel mezzo minerale a 100 mg/l
n. 6: mezzo minerale da solo
Aggiungere le sostanze chimiche scarsamente solubili direttamente, in ragione del peso o del volume, o trattarle come descritto nell'allegato III, salvo il fatto che non si devono usare né solventi né agenti emulsionanti. Aggiungere l'assorbente del CO2 in tutti i contenitori in speciali recipienti appositamente previsti. Regolare il pH nei contenitori n. 2, 3 e 4 a 7,0.
VII.2.5. Esecuzione del saggio
Inoculare i palloni n. 2, 3 e 4 (sospensioni in esame), n. 5 (controllo dell'attività) e n. 6 (bianco dell'inoculo) con un piccolo volume dell'inoculo fino ad una concentrazione di 30 mg/l di solidi sospesi. Non si aggiunge inoculo nel contenitore n. 1, che serve da controllo abiotico. Montare l'apparecchiatura, controllare che sia a tenuta d'aria, avviare gli agitatori e iniziare la misura dell'assorbimento di ossigeno in condizioni di buio. Controllare giornalmente la temperatura, l'agitatore e il registratore del consumo di ossigeno coulometrico e annotare tutte le eventuali variazioni di colore del contenuto dei contenitori. Leggere il consumo di ossigeno per i sei palloni mediante un idoneo metodo, per esempio direttamente dal registratore scrivente a sei punti, che produce una curva di BOD. Al termine dell'incubazione, normalmente 28 giorni, misurare il pH del contenuto nei contenitori e determinare la concentrazione della sostanza chimica in esame residua e di tutti gli eventuali intermedi e, nel caso di sostanze solubili in acqua, la concentrazione di DOC (allegato II.4). Porre una cura particolare nel caso di sostanze chimiche volatili. Se si prevede la nitrificazione, determinare, se possibile, la concentrazione di nitrati e nitriti.
VII.3. DATI E RELAZIONE
VII.3.1. Modalità di esposizione dei risultati
Dividere il consumo di ossigeno (mg) da parte della sostanza chimica in esame dopo un tempo stabilito (corretto del controllo del bianco di inoculo dopo lo stesso tempo) per il peso della sostanza chimica in esame usata. Questo fornisce il BOD espresso come mg di ossigeno/mg di sostanza chimica in esame, cioè

= mg O2 per mg di sostanza chimica in esame
La biodegradazione percentuale si ottiene poi da:

Per le miscele, calcolare il ThOD dall'analisi elementare, come per i composti semplici. Utilizzare il valore appropriato di ThOD (ThODNH4 o ThODNO3) a secondo che la nitrificazione sia assente o completa (allegato II.2). Se, tuttavia, si verifica la nitrificazione ma non è completa, calcolare la correzione, che tenga conto dell'ossigeno consumato per nitrificazione, dalle variazioni di concentrazione di nitriti e nitrati (allegato V).
Calcolare la biodegradazione primaria percentuale dalla perdita del composto chimico (progenitore) specifico (vedi I.7,2.).
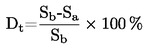
Se c'è stata una perdita di sostanza chimica in esame nel contenitore n. 1 che misura la rimozione chimico-fisica, riportare questa nella relazione e usare la concentrazione della sostanza chimica in esame (Sb) dopo 28 giorni in questo pallone per calcolare la biodegradazione percentuale.
Quando si effettuano misure (facoltative) di DOC, calcolare la biodegradazione finale percentuale da:
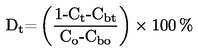
come descritto al punto I.7.1. Se c'è stata una perdita di DOC nel pallone n. 1, che misura la rimozione chimico-fisica, utilizzare la concentrazione di DOC in questo pallone per calcolare la biodegradazione percentuale.
Registrare tutti i risultati sui moduli allegati.
VII.3.2. Validità dei risultati
Il consumo di ossigeno da parte del bianco dell'inoculo è normalmente di 20-30 mg O2/l e non dovrebbe essere maggiore di 60 mg/l in 28 giorni. Valori più elevati di 60 mg/l richiedono un esame critico dei dati e delle tecniche sperimentali. Se il valore del pH è al di fuori del campo 6-8,5 e il consumo di ossigeno da parte della sostanza chimica in esame è minore del 60 %, si dovrebbe ripetere la prova con una minore concentrazione della sostanza chimica in esame.
Vedi anche I.5.2.
Se la degradazione percentuale dell'anilina, calcolata dal consumo di ossigeno, non supera il 40 % dopo 7 giorni e il 65 % dopo 14 giorni, la prova viene considerata non valida.
VII.3.3. Relazione
Vedi I.8.
VII.4. MODULARIO
Nel seguito è presentato un esempio di modulo predisposto.
SAGGIO MITI (I)
|
2.
|
DATA DI INIZIO DEL SAGGIO
|
3. SOSTANZA IN ESAME
Nome: ...
Concentrazione della soluzione stock: ... mg/l come sostanza
Concentrazione iniziale nel mezzo, Co: ... mg/l come sostanza
Volume della miscela di reazione, V: ... ml
ThOD: ... mg O2/l
4. INOCULO
Località di campionamento del fango:
Concentrazione dei solidi sospesi nel fango attivo dopo acclimatazione con liquido fognario sintetico = ... mg/l
Volume di fango attivo per litro di mezzo finale = ... ml
Concentrazione del fango nel mezzo finale = ... mg/l
5. CONSUMO DI OSSIGENO: BIODEGRADABILITÀ
Tipo di respirometro usato: ...
|
|
Tempo (giorni)
|
|
0
|
7
|
14
|
21
|
28
|
|
O2 cons. (mg) sostanza chimica in esame
|
a1
|
|
|
|
|
|
|
a2
|
|
|
|
|
|
|
a3
|
|
|
|
|
|
|
O2 cons. (mg) bianco
|
b
|
|
|
|
|
|
|
O2 cons. (mg) corretto
|
(a1 - b1)
(a1 - b1)
(a1 - b1)
|
|
|
|
|
|
|
BOD per mg di sostanza chimica in esame
|

|
Conten. 1
|
|
|
|
|
|
|
Conten. 2
|
|
|
|
|
|
|
Conten. 3
|
|
|
|
|
|
|
% degradazione

|
|
1
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
media (9)
|
|
|
|
|
|
Nota: formule simili possono essere usate per i controlli della sostanza chimica di riferimento e per i controlli di tossicità.
6. ANALISI DEL CARBONIO (facoltativa)
Analizzatore di carbonio: ...
|
Contenitore
|
DOC
|
% DOC rimosso
|
Media
|
|
Misurato
|
Corretto
|
|
Acqua + sost. in esame
|
a
|
|
|
|
—
|
—
|
|
Fango + sost. in esame
|
b1
|
|
b1 - c
|
|
|
|
|
Fango + sost. in esame
|
b2
|
|
b2 - C
|
|
|
|
|
Fango + sost. in esame
|
b3
|
|
b3 - c
|
|
|
|
|
Controllo del bianco
|
c
|
|
—
|
|
—
|
—
|
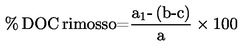
7. DATI ANALITICI DELLA SOSTANZA CHIMICA SPECIFICA
|
|
Quantità residua della sostanza chimica in esame al termine della prova
|
% degradazione
|
|
prova in bianco con acqua
|
Sb
|
|
|
mezzo inoculato
|
Sa1
|
|
|
Sa2
|
|
|
Sa3
|
|

Calcolare la degradazione % per i contenitori a1, a2 e a3 rispettivamente.
8. NOTE
Se disponibile, allegare la curva del BOD in funzione del tempo.
ALLEGATO I
ABBREVIAZIONI E DEFINIZIONI
|
DO
|
:
|
Ossigeno disciolto (mg/1); è la concentrazione di ossigeno disciolto in un campione acquoso.
|
|
BOD
|
:
|
Domanda biochimica di ossigeno (g); è la quantità di ossigeno consumato dai microorganismi nella metabolizzazione di un composto in esame; espressa anche come grammi di ossigeno consumato per grammo di composto in esame (vedi metodo C.5).
|
|
COD
|
:
|
Domanda chimica di ossigeno (g); è la quantità di ossigeno consumata durante l'ossidazione di un composto in esame con dicromato acido caldo: fornisce una misura della quantità di materia ossidabile presente; espressa anche come grammi di ossigeno consumati per grammo di sostanza in esame (vedi metodo C.6).
|
|
DOC
|
:
|
Carbonio organico disciolto; è il carbonio organico presente in soluzione o che passa attraverso un filtro da 0,45 micrometri o che rimane nel surnatante dopo centrifugazione a 40 000 m/s2 (±4 000 g) per 15 minuti.
|
|
ThOD
|
:
|
Domanda teorica di ossigeno (mg); è la quantità totale di ossigeno richiesta per ossidare completamente una sostanza chimica; viene calcolata dalla formula molecolare (vedi allegato II.2) ed è espressa anche come mg di ossigeno richiesti per mg di sostanza in esame.
|
|
ThCO2
|
:
|
Biossido di carbonio teorico (mg); è la quantità di biossido di carbonio prodotto calcolato dal contenuto di carbonio noto o misurato della sostanza in esame quando sia stata completamente mineralizzata; espresso anche come mg di biossido di carbonio sviluppati per mg di sostanza in esame.
|
|
TOC
|
:
|
Carbonio organico totale di un campione; è la somma del carbonio organico in soluzione e in sospensione.
|
|
IC
|
:
|
Carbonio inorganico.
|
|
TC
|
:
|
Carbonio totale; è la somma del carbonio organico e di quello inorganico presenti in un campione.
|
Biodegradazione primaria:
è l'alterazione della struttura chimica di una sostanza provocata da un'azione biologica, che dà come risultato la perdita delle proprietà specifiche di quella sostanza.
Biodegradazione ultima (aerobica):
è il livello di degradazione realizzato quando la sostanza in esame è completamente utilizzata da microorganismi, con il risultato della produzione di biossido di carbonio, acqua, sali minerali e nuovi costituenti cellulari microbici (biomassa).
Prontamente biodegradabile:
una classificazione arbitraria di sostanze chimiche che hanno superato certe prove specifiche di selezione riguardo alla biodegradabilità ultima; queste prove sono cosi rigorose che si suppone che tali composti si degraderanno biologicamente in modo rapido e completo in ambienti acquosi in condizioni aerobiche.
Intrinsecamente biodegradabile:
una classificazione di sostanze chimiche per le quali vi è una dimostrazione inequivocabile di biodegradazione (primaria o ultima) in qualsiasi riconosciuto saggio di biodegradabilità.
Trattabilità:
è la capacità di composti di essere rimossi durante il trattamento biologico di acque di scarico senza influire in modo dannoso sul funzionamento normale dei processi di trattamento. In generale, i composti prontamente biodegradabili possono essere trattaci, ma non tutti i composti intrinsecamente biodegradabili lo sono. Possono funzionare anche processi abiotici.
Tempo di latenza:
è il tempo che passa dall'inoculazione in un saggio di rimozione lenta a quando la degradazione percentuale è aumentata fino ad almeno il 10 %. Il tempo di latenza è spesso notevolmente variabile e scarsamente riproducibile.
Tempo di degradazione:
è il tempo che passa dal termine del tempo di latenza al momento in cui si raggiunge il 90 % o il massimo livello di degradazione.
Finestra di 10 giorni:
sono i 10 giorni che seguono immediatamente il raggiungimento del 10 % di degradazione.
ALLEGATO II
CALCOLO E DETERMINAZIONE DEI PARAMETRI SIGNIFICATIVI
Secondo il metodo scelto, saranno richiesti certi parametri somma. La sezione che segue descrive come ricavare questi valori. L'uso di questi parametri è descritto nei metodi specifici.
1. Contenuto di carbonio
Il contenuto di carbonio viene calcolato dalla composizione elementare nota oppure viene determinato mediante analisi elementare della sostanza in esame.
2. Domanda teorica di ossigeno (ThOD)
La domanda teorica di ossigeno (ThOD) può essere calcolata se è nota la composizione elementare, oppure se questa viene determinata mediante analisi elementare. Per il composto:
CcHhClclNnNanaOoPpSs
senza nitrificazione, si ha
 mg/mg
mg/mg
oppure, con nitrificazione,
 mg/mg
mg/mg
3. Domanda chimica di ossigeno (COD)
La domanda chimica di ossigeno (COD) viene determinata secondo il metodo C.6.
4. Carbonio organico disciolto (DOC)
Il carbonio organico disciolto (DOC) è per definizione il carbonio organico di qualsiasi sostanza chimica o miscela in acqua che passa attraverso un filtro da 0,45 micrometri.
Campioni estratti dal recipiente di prova vengono prelevati e filtrati immediatamente nell'apparecchiatura di filtrazione utilizzando un appropriato filtro a membrana. I primi 20 ml (quantità che può essere ridotta quando si usino filtri piccoli) del filtrato vengono scartati. Per l'analisi del carbonio si trattengono volumi di 10-20 ml, o minori, nel caso vengano iniettati (il volume dipende dalla quantità richiesta dall'analizzatore del carbonio). La concentrazione di DOC viene determinata mediante un analizzatore di carbonio organico che è in grado di misurare accuratamente una concentrazione di carbonio equivalente o minore del 10 % della concentrazione iniziale di DOC usata nella prova.
Campioni filtrati che non possono essere analizzati lo stesso giorno di lavoro possono essere conservati in frigorifero a 2-4 °C per 48 ore o al di sotto di - 18 °C per periodi più lunghi.
Note:
I filtri a membrana sono spesso impregnati di tensioattivi per la idrofilizzazione. Così i filtri possono contenere fino a parecchi mg di carbonio organico solubile che interferirebbe nelle determinazioni di biodegradabilità. I tensioattivi e altri composti organici solubili vengono rimossi dai filtri bollendoli in acqua deionizzata per tre periodi di 1 ora ciascuno. I filtri possono poi venire conservati in acqua per una settimana. Se si utilizzano cartucce filtranti a perdere, ciascuna partita deve essere controllata per confermare che non liberi carbonio organico solubile.
Secondo il tipo di filtro a membrana, la sostanza chimica in esame può essere trattenuta per adsorbimento. Pertanto può essere consigliabile assicurarsi che la sostanza chimica in esame non venga trattenuta dal filtro.
Una centrifugazione a 40 000 m/s2 (4 000 g) per 15 minuti può venire usata al posto della filtrazione per differenziare tra TOC e DOC. Il metodo non è affidabile a una concentrazione iniziale < 10 mg DOC/l perché o non vengono rimossi tutti i batteri, oppure viene ridisciolto carbonio come parte del plasma batterico.
BIBLIOGRAFIA
|
—
|
Standard Methods for the Examination of Water and Wastewater, 12th, ed. Am. Pub. Hlth. Ass., Am. Wat. Poll. Control Fed., Oxygen Demand, 1965, P 65.
|
|
—
|
Wagner, R., Von Wasser, 1976, Vol. 46, 139.
|
|
—
|
DIN-Entwurf 38 409 Teil 41 — Deutsche Einheitsverfahren zur Wasser-, Abwasser- und Schlammuntersuchung, Summarische Wirkungs- und Stoffkenngröβen (Gruppe H). Bestimmung des Chemischen Sauerstoffbedarfs (CSB) (H 41), Normenausschuβ Wasserwesen (NAW) in DIN Deutsches Institut für Normung e.V.
|
|
—
|
Gerike, P. The biodegradability testing of poorly water soluble compounds. Chemosphere, 1984, Vol. 13 (1), 169.
|
ALLEGATO III
VALUTAZIONE DELLA BIODEGRADABILITÀ DI SOSTANZE SCARSAMENTE SOLUBILI
Nei saggi di biodegradabilità con sostanze scarsamente solubili, si dovrebbe prestare una particolare attenzione agli aspetti seguenti:
Mentre i liquidi omogenei raramente creano problemi di campionamento, si raccomanda di omogenizzare i materiali solidi mediante mezzi appropriati per evitare errori dovuti alla disomogenità. Un'attenzione particolare deve essere adoperata quando occorrono campioni rappresentativi di pochi mg prelevati da miscele di prodotti chimici o sostanze con grandi quantità di impurezze.
Durante le prove si possono usare varie forme di agitazione. Bisogna porre attenzione ad applicare semplicemente una agitazione sufficiente per mantenere in dispersione la sostanza chimica e ad evitare un surriscaldamento, eccessiva formazione di schiuma e eccessive forze di taglio.
Si può usare un emulsionante che fornisca una dispersione stabile della sostanza chimica. Esso non dovrebbe essere tossico per i batteri e non dovrebbe essere biodegradato né provocare schiuma nelle condizioni sperimentali.
Gli stessi criteri valgono per i solventi e gli emulsionanti.
Non è raccomandabile usare carriers solidi per le sostanze in esame solide, ma essi possono essere adatti per le sostanze oleose.
Quando si utilizzano sostanze ausiliarie, come emulsionanti, solventi e veicoli, si dovrebbe eseguire una prova in bianco contenente la sostanza ausiliaria.
Per studiare la biodegradabilità di composti scarsamente solubili si può usare uno qualunque dei tre saggi respirometrici CO2, BOD, MITI.
BIBLIOGRAFIA
|
—
|
de Morsier, A. et al. Biodegradation tests for poorly soluble compounds Chemosphere, 1987, Vol. 16, 833.
|
|
—
|
Gerike, P. The Biodegradabily testing of poorly water soluble compounds. Chemosphere, 1984, Vol. 13, 169.
|
ALLEGATO IV
VALUTAZIONE DELLA BIODEGRADABILITÀ DI SOSTANZE CHIMICHE DI SOSPETTA TOSSICITÀ PER L'INOCULO
Quando una sostanza chimica viene sottoposta ad un saggio di pronta biodegradabilità e risulta non biodegradabile, si raccomanda di eseguire la procedura seguente se si vuole distinguere tra inibizione e inerzia (Reynolds et al., 1987).
Si devono usare inoculi simili o identici per i saggi di tossicità e degradazione biologica.
Per valutare la tossicità di sostanze chimiche studiate in saggi di pronta biodegradabilità, sembra appropriata l'applicazione di uno dei metodi, o una loro combinazione, di inibizione del tasso di respirazione del fango (saggio di inibizione della respirazione del fango attivo — direttiva 88/302/CEE), BOD e/o inibizione della crescita.
Se si deve evitare l'inibizione dovuta a tossicità, si suggerisce di usare nelle prove di pronta biodegradabilità una concentrazione della sostanza in esame minore di 1/10 dei valori di EC50 (o minore dei valori di EC20) ottenuti nelle prove di tossicità. I composti con un valore di Ec50 maggiore di 300 mg/l è improbabile che abbiano effetti tossici nelle prove di pronta biodegradabilità.
I valori di EC50 minori di 20 mg/l è probabile che pongano seri problemi per la successiva esecuzione delle prove. Si devono impiegare concentrazioni di prova basse, che richiedono l'uso del saggio rigoroso e sensibile della bottiglia chiusa oppure l'uso di materiale marcato 14C. In alternativa, un inoculo acclimatato può permettere di usare concentrazioni più elevate della sostanza in esame. In questo ultimo caso, tuttavia, si perde lo specifico criterio di pronta biodegradabilità.
BIBLIOGRAFIA
Reynolds, L. et al. Evaluation of the toxicity of substances to be assessed for biodegradability. Chemosphere, 1987, Vol. 16, 2259.
ALLEGATO V
CORREZIONE DELL'ASSORBIMENTO DI OSSIGENO PER INTERFERENZA DOVUTA A NITRIFICAZIONE
Errori dovuti al fatto di non considerare la nitrificazione, nella valutazione del consumo di ossigeno nella biodegradabilità di sostanze in esame che non contengono azoto, sono marginali (minori del 5 %), anche se si verifica, in modo irregolare, l'ossidazione dell'azoto ammoniacale nel mezzo, tra i recipienti di prova e i recipienti del bianco. Invece, per le sostanze di prova, che contengono azoto, possono verificarsi gravi errori.
Se si è avuta nitrificazione ma questa non è completa, il consumo di ossigeno osservato, nella miscela di reazione, può essere corretto tenendo conto della quantità di ossigeno utilizzata nell'ossidazione dell'ammonio a nitrito e nitrato, se si determinano le variazioni di concentrazione dei nitriti e dei nitrati durante l'incubazione, tenendo conto delle equazioni seguenti:
|
2 NH4Cl + 3 O2 = 2 HNO2 + 2 HCl + 2 H2O
|
(1)
|
|
2 HNO2 + O2 = 2 HNO3
|
(2)
|
|
Complessivamente:
|
|
|
2 NH4Cl + 4 O2 = 2 HNO3 + 2 HCl + 2 H2O
|
(3)
|
Dall'equazione (1) risulta che l'ossigeno consumato da 28 g d'azoto, contenuti nel cloruro d'ammonio (NH4Cl) ossidato a nitrito è pari a 96 g, il che corrisponde ad un fattore di 3,43 (96/28). Nello stesso modo dall'equazione (3) l'assorbimento di ossigeno da parte di 28 g di azoto, ossidati a nitrato, è di 128 g, il che corrisponde ad un fattore di 4,57 (128/28).
Poichè le reazioni avvengono in sequenza, in quanto sono eseguite da specie batteriche distinte e differenti, è possibile che la concentrazione di nitrito aumenti o diminuisca; in quest'ultimo caso si formerà una concentrazione equivalente di nitrato. Così, l'ossigeno consumato nella formazione di nitrato è 4,57 moltiplicato per l'aumento di concentrazione del nitrato, mentre l'ossigeno associato alla formazione di nitrito è 3,43 moltiplicato per l'aumento di concentrazione del nitrito o per la diminuzione della sua concentrazione; la perdita di ossigeno è -3,43 moltiplicato per la diminuzione di concentrazione.
Cioè:
|
O2 consumato nella formazione di nitrato = 4,57 × aumento di concentrazione dei N-nitrati
|
(4)
|
|
e
|
|
|
O2 consumato nella formazione di nitrito = 3,43 × aumento della concentrazione di N-nitrito
|
(5)
|
|
e
|
|
|
O2 perso nella sparizione dei nitriti = -3,43 × diminuzione della concentrazione di N-nitriti
|
(6)
|
|
Di modo chel'assorbimento di O2 dovuto alla nitrificazione = ±3,43 × variazione della concentrazione di N-nitrito +4,57 × aumento della concentrazione di N-nitrato
|
(7)
|
|
e così l'assorbimento di O2 dovuto all'ossidazione del C = assorbimento osservato totale - assorbimento dovuto alla nitrificazione
|
(8)
|
In alternativa, se si determina solo l'N totale ossidato, l'assorbimento di ossigeno dovuto alla nitrificazione può essere assunto, in prima approssimazione, pari a 4,57 × aumento di N ossidato.
Il valore corretto per il consumo di ossigeno dovuto all'ossidazione di C viene poi confrontato con il ThOD NH4, come calcolato nell'allegato II.
C.5. DEGRADAZIONE — DOMANDA BIOCHIMICA DI OSSIGENO (BOD)
1. METODO
1.1. INTRODUZIONE
Il presente metodo serve a misurare la domanda biochimica di ossigeno (BOD) delle sostanze organiche solide e liquide.
I dati ottenuti con questa prova riguardano i composti idrosolubili; è tuttavia possibile, almeno in linea di principio, esaminare anche i composti volatili e quelli poco solubili in acqua.
Il metodo può essere applicato soltanto a sostanze organiche che non esercitano azione inibitoria sui batteri alla concentrazione impiegata per le prove. Se la sostanza non è solubile, per ottenere una buona dispersione potrà essere necessario ricorrere a speciali accorgimenti, come l'impiego di ultrasuoni.
Informazioni preliminari in merito alla tossicità del composto chimico possono risultare utili per interpretare i valori più bassi e per scegliere adeguate concentrazioni per la prova.
1.2. DEFINIZIONI ED UNITÀ
Si definisce BOD la quantità di ossigeno che un determinato quantitativo della sostanza in esame richiede, in determinate condizioni, per consentire il verificarsi del processo di ossidazione biochimica.
I risultati vengono espressi in g di BOD per g di sostanza esaminata.
1.3. SOSTANZE DI RIFERIMENTO
È consigliabile impiegare una sostanza di riferimento adatta per verificare l'attività dell'inoculo.
1.4. PRINCIPIO DEL METODO
Una quantità predeterminata della sostanza in esame, disciolta o dispersa in un mezzo idoneo ben aerato, viene inoculata con opportuni microorganismi e posta in incubazione al buio, a temperatura ambiente determinata e costante.
Il BOD viene determinato dalla differenza del contenuto di ossigeno disciolto all'inizio e alla fine del saggio. La durata del saggio deve essere almeno di 5 giorni e non più di 28 giorni.
Deve essere effettuata in parallelo una prova in bianco, su un sistema analogo, ma non contenente la sostanza in esame.
1.5. CRITERI DI QUALITÀ
La determinazione del BOD non può essere ritenuta una valida determinazione della biodegradabilità di una sostanza. Il presente metodo può essere considerato unicamente come un saggio orientativo.
1.6. DESCRIZIONE DEL METODO
Si prepara preliminarmente una soluzione od una dispersione della sostanza da esaminare, per ottenere una concentrazione di BOD compatibile con il metodo impiegato. Si determina successivamente il BOD seguendo un qualunque metodo nazionale o internazionale normalizzato.
2. DATI E VALUTAZIONE
Il BOD ottenuto nella soluzione preliminare viene calcolato conformemente al metodo normalizzato prescelto e convertito in grammi di BOD per grammo di sostanza esaminata.
3. RELAZIONE
Va precisato il metodo impiegato.
La domanda biochimica di ossigeno deve risultare dalla media di almeno tre misurazioni valide.
Va indicata ogni informazione ed ogni osservazione utile per l'interpretazione del saggio, soprattutto per quanto riguarda le impurezze, lo stato fisico, gli effetti tossici, la composizione intrinseca della sostanza ed ogni altro elemento tale da influenzarne i risultati.
Nella relazione va indicato l'eventuale impiego di un additivo mirante a impedire la nitrificazione biologica.
4. BIBLIOGRAFIA
Elenco di metodi normalizzati, quali ad esempio:
|
|
NF T 90-103: Determination of the biochemical oxygen demand
|
|
|
NBN 407: Biochemical oxygen demand
|
|
|
NEN 3235 5.4: Bepaling van het biochemisch zuurstofverbruik (BZV)
|
|
|
The determination of biochemical oxygen demand, 1981, Methods for the examination of water and associated materials, HMSO, London.
|
|
|
ISO 5815: Determination of biochemical oxygen demand after n days.
|
C.6. DEGRADAZIONE — DOMANDA CHIMICA DI OSSIGENO (COD)
1. METODO
1.1. INTRODUZIONE
Il presente metodo è destinato alla determinazione della domanda chimica di ossigeno (COD) delle sostanze organiche solide o liquide, secondo una tecnica normalizzata ed arbitraria, in condizioni di laboratorio prefissate.
Per effettuare la prova ed interpretarne i risultati sarà utile disporre di dati sulla formula chimica della sostanza (ad esempio: sali alogenati, sali ferrosi di composti organici, composti organoclorurati).
1.2. DEFINIZIONI ED UNITÀ
La richiesta chimica di ossigeno è una misura dell'ossidabilità di una sostanza, espressa come equivalente in ossigeno di un reattivo ossidante consumato dalla sostanza in condizioni di laboratorio prestabilite.
Il risultato si esprime in g COD/g sostanza in esame.
1.3. SOSTANZE DI RIFERIMENTO
Nell'esame di nuovi prodotti non è necessario impiegare costantemente sostanze di riferimento. Queste dovrebbero servire essenzialmente a calibrare saltuariamente il metodo e fornire la possibilità di confrontare i risultati con quelli ottenuti applicando un altro metodo.
1.4. PRINCIPIO DEL METODO
Una quantità prestabilita della sostanza da esaminare, disciolta o dispersa in acqua, viene ossidata con potassio dicromato in ambiente fortemente acido per H2SO4, impiegando solfato d'argento come catalizzatore e facendo bollire a ricadere per due ore. La quantità residua di dicromato viene determinata titolando con solfato di ferro (II) e ammonio standardizzato.
Nel caso delle sostanze contenenti cloro, si aggiunge solfato di mercurio (10) per ridurre l'interferenza dei cloruri.
1.5. CRITERI DI QUALITÀ
Data l'arbitrarietà di determinazione del metodo, il COD è un «indicatore di ossidabilità» e come tale viene usato come un metodo pratico per determinare la sostanza organica.
Nella prova possono interferire i cloruri; anche riducenti o ossidanti inorganici possono interferire con la determinazione del COD.
Alcuni composti ciclici e molte sostanze volatili (per esempio acidi grassi inferiori) non vengono ossidati completamente da questo saggio.
1.6. DESCRIZIONE DEL METODO
Si prepara una soluzione o una dispersione della sostanza da saggiare, in modo da ottenere una domanda chimica di ossigeno compresa tra 250 e 600 mg/l di COD.
Osservazioni
Nel caso di sostanze scarsamente solubili o non disperdibili, si può pesare una quantità di sostanza, finemente polverizzata od allo stato liquido, corrispondente a 5 mg di COD, e si colloca nell'apparecchio sperimentale con acqua.
La domanda chimica di ossigeno (COD) viene spesso determinata, specialmente nel caso di sostanze scarsamente solubili, secondo una variante al metodo, cioè in un sistema chiuso con un equalizzatore di pressione (H. Kelkenberg, 1975). Con questa variante, è spesso possibile riuscire a quantificare composti che si determinano solo con difficoltà con il metodo convenzionale, per esempio acido acetico. Anche questo metodo fallisce tuttavia nel caso della piridina. Se si aumenta la concentrazione del dicromato di potassio descritta nel riferimento (1), fino a 0,25 N (0,0416 M), la pesata diretta di 5-10 mg di sostanza viene facilitata, e ciò è essenziale per la determinazione del COD di sostanze scarsamente solubili in acqua (rif. 2).
Altrimenti, il COD viene poi determinato seguendo un qualunque metodo nazionale o internazionale normalizzato.
2. DATI E VALUTAZIONI
Il COD del recipiente sperimentale viene calcolato secondo il metodo normalizzato prescelto e trasformato in grammi di COD per grammi della sostanza in esame.
3. RELAZIONE
Nella relazione deve essere indicato il metodo di riferimento.
Il COD deve risultare dalla media di almeno tre misure. Devono essere riferiti tutti i dati e le osservazioni significative per l'interpretazione dei valori ottenuti: ciò vale particolarmente per le impurezze, lo stato fisico e le proprietà della sostanza (se note), qualora possano influire sui risultati.
Va altresì riferito l'eventuale impiego di solfato mercurico per minimizzare l'interferenza dei cloruri.
4. BIBLIOGRAFIA
|
(1)
|
Kelkenberg, H.Z. von Wasser und Abwasserforschung, 1975, vol. 8, 146.
|
|
(2)
|
Gerike, P. The biodegradability testing of poorly water soluble compound;. Chemosphere, 1984, vol. 13, 169.
Elenco dei metodi standardizzati, ad esempio:
|
|
NBN T 91-201 Determinaition of the chemical oxygen demand.
|
|
|
ISBN 0 11 7512494 Chemical oxygen demand (dichromate value) of polluted and waste waters.
|
|
|
NF T 90-101 Determination of the chemical oxygen demand.
|
|
|
DS 217 = water analyis Determination of the chemical oxygen demand.
|
|
|
DIN 38409-H-41 Determination of the chemical oxygen demand (COD) within the range above 15 mg per litre.
|
|
|
NEN 3235 5.3 Bepaling van het chemisch zuurstofverbruik.
|
|
|
ISO 6060 Water quality: chemical oxygen demand dichromate methods.
|
|
C.7. DEGRADAZIONE — DEGRADAZIONE ABIOTICA: IDROLISI IN FUNZIONE DEL PH
1. METODO
Il metodo di seguito descritto è equivalente alle linee guida OCSE TG 111 (2004).
1.1. INTRODUZIONE
Le sostanze chimiche possono penetrare nelle acque superficiali per immissione diretta, dispersione di sostanze nebulizzate, scorrimento, drenaggio, smaltimento dei rifiuti, tramite gli effluenti industriali, domestici o agricoli o per deposizione atmosferica, e in acqua possono subire trasformazioni mediante processi chimici (ad es. idrolisi, ossidazione), fotochimici e/o microbici. Le presenti linee guida descrivono un metodo di prova di laboratorio per valutare la trasformazione idrolitica abiotica delle sostanze chimiche nei sistemi acquatici ai valori di pH normalmente riscontrabili nell'ambiente (pH 4-9) e sono basate su linee guida già esistenti (1)(2)(3)(4)(5)(6)(7).
Scopo degli esperimenti è determinare: i) la velocità di idrolisi della sostanza di prova in funzione del pH, e ii) l'identità o la natura e la velocità di formazione e degradazione dei prodotti dell'idrolisi ai quali gli organismi possono essere esposti. Tali esperimenti possono risultare necessari per le sostanze chimiche immesse direttamente in acqua o in grado di penetrare nell'ambiente attraverso le altre vie sopra indicate.
1.2. DEFINIZIONI E UNITÀ DI MISURA
Cfr. allegato 2.
1.3. APPLICABILITÀ DEL METODO
Il metodo è applicabile a tutte le sostanze chimiche (marcate o non marcate) per le quali sia disponibile un metodo analitico di sufficiente accuratezza e sensibilità; è applicabile a composti leggermente volatili o non volatili sufficientemente solubili in acqua, ma non a sostanze chimiche che presentano elevata volatilità in acqua (ad es. fumiganti o solventi organici) e che non possono pertanto essere mantenute in soluzione nelle condizioni sperimentali del presente saggio. L'esecuzione del saggio potrebbe risultare difficile con sostanze scarsamente solubili in acqua (8).
1.4. PRINCIPIO DEL METODO
Soluzioni tampone acquose sterili con differenti valori di pH (4, 7 e 9) sono trattate con la sostanza di prova e incubate al buio in condizioni controllate di laboratorio (a temperature costanti). Ad opportuni intervalli di tempo, le soluzioni tampone sono analizzate per identificare e quantificare la sostanza di prova e i prodotti dell'idrolisi. L'uso di sostanze di prova marcate (ad es. 14C) facilita la determinazione del bilancio di massa.
Questo metodo di prova è concepito secondo uno schema articolato in più fasi (o livelli), illustrato e descritto nell'allegato 1. Ogni fase è avviata sulla base dei risultati della fase precedente.
1.5. INFORMAZIONI SULLA SOSTANZA DI PROVA
Per misurare la velocità di idrolisi è possibile utilizzare sostanze di prova marcate o non marcate. Generalmente per studiare il meccanismo di idrolisi e per determinare il bilancio di massa si preferisce utilizzare materiale marcato; tuttavia, in casi particolari, la marcatura può non essere affatto necessaria. Si raccomanda la marcatura con 14C, ma possono risultare utili anche altri isotopi, quali 13C, 15N, 3H. Nei limiti del possibile, la marcatura va posizionata nella parte o nelle parti più stabili della molecola. Se per esempio la sostanza di prova contiene un anello, la marcatura va effettuata su questo anello; se la sostanza di prova contiene due o più anelli potrebbero essere necessari studi separati per valutare il destino di ciascun anello marcato e ottenere informazioni adeguate sulla formazione dei prodotti dell'idrolisi. La sostanza di prova deve avere una purezza minima del 95 %.
Prima di eseguire il saggio di idrolisi è necessario disporre delle seguenti informazioni sulla sostanza di prova:
|
a)
|
solubilità in acqua [metodo di prova A.6];
|
|
b)
|
solubilità in solventi organici;
|
|
c)
|
pressione di vapore [metodo di prova A.4] e/o costante della legge di Henry;
|
|
d)
|
coefficiente di ripartizione n-ottanolo/acqua [metodo di prova A. 8];
|
|
e)
|
costante di dissociazione (pKa) [linee guida OCSE 112] (9);
|
|
f)
|
tasso di fototrasformazione diretta o indiretta in acqua, a seconda dei casi.
|
Occorre disporre di metodi analitici per la quantificazione della sostanza di prova e, se necessario, per l'identificazione e la quantificazione dei prodotti dell'idrolisi in soluzioni acquose (cfr. anche punto 1.7.2).
1.6. SOSTANZE DI RIFERIMENTO
Ove possibile, occorre utilizzare sostanze di riferimento per l'identificazione e la quantificazione dei prodotti dell'idrolisi mediante metodi spettroscopici e cromatografici o altri metodi di sensibilità adeguata.
1.7. CRITERI DI QUALITÀ
1.7.1. Recuperi
L'analisi delle soluzioni tampone (almeno in duplicato) o dei loro estratti subito dopo l'aggiunta della sostanza di prova fornisce una prima indicazione della ripetibilità del metodo analitico e dell'uniformità della procedura di applicazione della sostanza. Nelle ultime fasi degli esperimenti i recuperi sono dati dai rispettivi bilanci di massa (in caso di utilizzo di sostanze marcate). Sia per le sostanze marcate che per le sostanze non marcate i recuperi devono essere compresi tra il 90 % e il 110 % (7). Qualora sia tecnicamente difficile raggiungere questo intervallo, si considera accettabile un recupero del 70 % per le sostanze non marcate, ma in tal caso occorre fornire una giustificazione.
1.7.2. Ripetibilità e sensibilità del metodo analitico
La ripetibilità del(i) metodo(i) analitico(i) utilizzato(i) per quantificare la sostanza di prova e i prodotti dell'idrolisi può essere verificata mediante analisi in duplicato delle stesse soluzioni tampone (o dei loro estratti) dopo la formazione di una quantità di prodotti dell'idrolisi sufficiente a permetterne la quantificazione.
Il metodo analitico deve essere sufficientemente sensibile da consentire di quantificare concentrazioni della sostanza di prova uguali o inferiori al 10 % della concentrazione iniziale. All'occorrenza i metodi analitici devono essere anche sufficientemente sensibili da consentire di quantificare qualsiasi prodotto dell'idrolisi che rappresenti almeno il 10 % della dose applicata (in qualsiasi fase del saggio) fino al 25 % o meno della sua concentrazione massima.
1.7.3. Intervalli di confidenza dei dati cinetici dell'idrolisi
Occorre calcolare e indicare gli intervalli di confidenza di tutti i coefficienti di regressione, delle costanti di velocità, dei tempi di dimezzamento e di tutti gli altri parametri cinetici (ad es. DT50).
1.8. DESCRIZIONE DEL METODO
1.8.1. Attrezzature e apparecchiature
Il saggio deve essere realizzato in recipienti di vetro (ad es. provette, piccoli matracci), al buio e in condizioni sterili, se necessario, a meno che dalle informazioni preliminari (quali ad esempio il coefficiente di ripartizione n-ottanolo/acqua) non risulti che la sostanza di prova può aderire al vetro. In tal caso, può essere necessario prendere in considerazione l'uso di materiali alternativi come il teflon. Per ovviare al problema dell'aderenza al vetro è possibile ricorrere ad uno o più dei seguenti metodi:
|
—
|
determinazione della massa della sostanza di prova e dei prodotti dell'idrolisi assorbiti dal recipiente di prova;
|
|
—
|
uso di un bagno ad ultrasuoni;
|
|
—
|
lavaggio con solvente di tutti i recipienti in vetro in ciascun intervallo di campionamento;
|
|
—
|
uso di prodotti formulati;
|
|
—
|
uso di una maggiore quantità di cosolvente per aggiungere la sostanza di prova al sistema. In caso di utilizzo di un cosolvente, quest'ultimo non deve idrolizzare la sostanza di prova.
|
Sono normalmente necessari bagnomaria agitanti a temperatura controllata o incubatori termostatici per l'incubazione delle varie soluzioni di prova.
È necessaria la normale attrezzatura da laboratorio e in particolare:
|
—
|
strumenti analitici e in particolare apparecchi per gascromatografia (GC), cromatografia liquida ad alta risoluzione (HPLC), cromatografia su strato sottile (TLC), compresi gli opportuni sistemi di rilevazione per l'analisi delle sostanze radiomarcate e non marcate, o per il metodo della diluizione isotopica inversa;
|
|
—
|
strumenti di identificazione, quali ad esempio spettrometria di massa (MS), gascromatografia con spettrometria di massa (GC-MS), cromatografia liquida ad alta risoluzione con spettrometria di massa (HPLC-MS), risonanza magnetica nucleare (NMR), ecc.;
|
|
—
|
contatore a scintillazione liquida;
|
|
—
|
imbuti separatori per estrazione liquido-liquido;
|
|
—
|
strumenti per la concentrazione delle soluzioni e degli estratti (ad es. evaporatore rotante);
|
|
—
|
dispositivi per il controllo della temperatura (ad es. bagnomaria).
|
I reagenti chimici utilizzati comprendono ad esempio:
|
—
|
solventi organici di grado analitico quali l'esano, il diclorometano, ecc.;
|
|
—
|
liquido di scintillazione;
|
|
—
|
soluzioni tampone (per una descrizione più dettagliata cfr. punto 1.8.3).
|
Tutti i recipienti di vetro, l'acqua di grado reagente e le soluzioni tampone da utilizzare nei saggi di idrolisi devono essere sterilizzati.
1.8.2. Applicazione della sostanza di prova
La sostanza di prova deve essere applicata in soluzione acquosa nelle varie soluzioni tampone (cfr. allegato 3). Per permettere un'adeguata dissoluzione è consentito, se necessario, l'uso di piccole quantità di solventi miscibili in acqua (ad es. acetonitrile, acetone, etanolo) per l'applicazione e la distribuzione della sostanza di prova, che tuttavia non devono di norma superare l'1 % v/v. L'uso di una concentrazione più elevata di solventi (ad es. in caso di sostanze poco solubili) è ammesso solo se è possibile dimostrare che il solvente non ha alcun effetto sull'idrolisi delle sostanze di prova.
Si sconsiglia di utilizzare regolarmente prodotti formulati, in quanto non si può escludere che gli ingredienti della formulazione interferiscano con il processo di idrolisi. L'impiego di materiale formulato può tuttavia rappresentare un'alternativa adeguata nel caso di sostanze di prova scarsamente idrosolubili o caratterizzate da aderenza al vetro (cfr. punto 1.8.1).
Occorre utilizzare un'unica concentrazione della sostanza di prova, che non deve essere superiore a 0,01 M o alla metà della concentrazione di saturazione (cfr. allegato 1).
1.8.3. Soluzioni tampone
Il saggio di idrolisi deve essere eseguito a valori di pH 4, 7 e 9. A tal fine occorre preparare soluzioni tampone utilizzando acqua e sostanze chimiche di grado reagente. Nell'allegato 3 sono indicati alcuni utili esempi di sistemi tampone. Occorre notare che il sistema tampone utilizzato può influenzare il grado di idrolisi; in tal caso occorre utilizzare un altro sistema tampone (11).
Il pH di ciascuna soluzione tampone va verificato con un pH-metro tarato ad una precisione di almeno 0,1 alla temperatura richiesta.
1.8.4. Condizioni di prova
1.8.4.1. Temperatura
Gli esperimenti di idrolisi devono essere effettuati a temperature costanti. A fini di estrapolazione è importante mantenere la variazione della temperatura entro ±0,5 oC.
Se il comportamento idrolitico della sostanza di prova è sconosciuto, occorre eseguire un saggio preliminare (fase 1) ad una temperatura di 50 oC. I saggi cinetici di livello superiore devono essere eseguiti ad almeno tre temperature (compreso il saggio a 50 oC) a meno che il saggio di primo livello non abbia dimostrato la stabilità idrolitica della sostanza di prova. Si suggerisce un intervallo di temperature compreso tra 10 oC e 70 oC (preferibilmente con almeno una temperatura inferiore a 25 oC), che deve includere la temperatura di riferimento di 25 oC e la maggior parte delle temperature registrate sul campo.
1.8.4.2. Illuminazione e ossigeno
Tutti i saggi di idrolisi devono essere realizzati utilizzando metodi atti ad evitare effetti fotolitici. Occorre prendere tutte le misure opportune per evitare la formazione di ossigeno (ad esempio facendo gorgogliare elio, azoto o argon per 5 minuti prima di preparare la soluzione).
1.8.4.3. Durata del saggio
Il saggio preliminare deve essere eseguito per 5 giorni mentre i saggi di livello superiore devono essere eseguiti fino a quando non è idrolizzato il 90 % della sostanza di prova o per 30 giorni, a seconda dell'ipotesi che si verifica per prima.
1.8.5. Esecuzione del saggio
1.8.5.1. Saggio preliminare (fase 1)
Il saggio preliminare è eseguito a 50 ±0,5 oC e a valori di pH 4,0, 7,0 e 9,0. Se dopo 5 giorni l'idrolisi è inferiore al 10 % (t0,525 oC > 1 anno), la sostanza di prova è considerata idroliticamente stabile e non è necessario eseguire altri saggi. Se la sostanza di prova è notoriamente instabile a temperature rappresentative di quelle ambientali (12), non è necessario eseguire il saggio preliminare. Il metodo analitico deve essere sufficientemente preciso e sensibile da consentire di rilevare una riduzione del 10 % della concentrazione iniziale.
1.8.5.2. Idrolisi di sostanze instabili (fase 2)
Il saggio di livello superiore (avanzato) deve essere eseguito ai valori di pH ai quali la sostanza di prova è risultata instabile nel saggio preliminare. Le soluzioni tampone della sostanza di prova devono essere termostatizzate alle temperature selezionate. Per verificare se il comportamento cinetico è di primo ordine, ogni soluzione deve essere analizzata ad intervalli di tempo che permettano di ottenere almeno sei valori adeguatamente distanziati compresi in linea di principio tra il 10 % e il 90 % di idrolisi della sostanza di prova. Occorre prelevare singole repliche dei campioni (almeno due repliche contenute in recipienti di reazione separati) e analizzare il loro contenuto in ciascuno dei sei tempi di campionamento (per un minimo di dodici valori). Il ricorso ad un unico campione globale da cui prelevare singole aliquote della soluzione di prova in ciascun intervallo di campionamento si considera inadeguato, in quanto non consente l'analisi della variabilità dei dati e può comportare problemi di contaminazione della soluzione di prova. Al termine del saggio di livello superiore (ossia al raggiungimento del 90 % di idrolisi o trascorsi 30 giorni) occorre eseguire saggi di conferma della sterilità. Tuttavia, nel caso in cui non si osservi alcuna degradazione (ossia trasformazione), tali saggi non sono considerati necessari.
1.8.5.3. Identificazione dei prodotti dell'idrolisi (fase 3)
Occorre identificare con appositi metodi analitici tutti i principali prodotti dell'idrolisi, ossia almeno quelli che rappresentano una percentuale uguale o superiore al 10 % della dose applicata.
1.8.5.4. Saggi facoltativi
Per sostanze di prova idroliticamente instabili può essere necessario eseguire ulteriori saggi a valori di pH diversi da 4, 7 e 9. Ad esempio, a fini fisiologici può essere necessario effettuare un saggio in condizioni di maggiore acidità (ad es. pH 1,2) ad un'unica temperatura rilevante dal punto di vista fisiologico (37 oC).
2. DATI
La quantità di sostanza di prova e, se necessario, dei prodotti dell'idrolisi, deve essere espressa in percentuale della concentrazione iniziale applicata ed eventualmente in mg/L per ciascun intervallo di campionamento e per ogni pH e temperatura di prova. Nel caso in cui sia stata utilizzata una sostanza marcata occorre inoltre indicare il bilancio di massa, espresso in percentuale della concentrazione iniziale applicata.
Occorre fornire una rappresentazione grafica dei logaritmi delle concentrazioni della sostanza di prova in funzione del tempo e identificare i principali prodotti dell'idrolisi, ossia almeno quelli che rappresentano una percentuale uguale o superiore al 10 % della dose applicata. I logaritmi delle concentrazioni di tali prodotti devono essere rappresentati graficamente nella stessa maniera della sostanza madre per evidenziare i tassi di formazione e distruzione.
2.1. TRATTAMENTO DEI RISULTATI
È possibile calcolare in modo più preciso il tempo di dimezzamento o i valori del DT50 utilizzando adeguati modelli cinetici. Occorre indicare il tempo di dimezzamento e/o i valori del DT50 (compresi i limiti di confidenza) per ciascun pH e ciascuna temperatura, insieme ad una descrizione del modello utilizzato, dell'ordine cinetico e del coefficiente di determinazione (r2). Se necessario, i calcoli devono essere applicati anche ai prodotti dell'idrolisi.
Nel caso di studi sulla velocità di reazione effettuati a diverse temperature, le costanti di velocità di pseudo-primo ordine (kobs) dell'idrolisi devono essere descritte in funzione della temperatura. Il calcolo deve basarsi sulla scomposizione di kobs in costanti di velocità dell'idrolisi in catalisi acida, neutra e in catalisi basica (rispettivamente kH, kneutral, e kOH) e sull'equazione di Arrhenius:

dove Ai e Bi sono le costanti di regressione, rispettivamente dall'intercetta e dalla pendenza, delle rette di best fit ottenute dalla regressione lineare di ln ki rispetto all'inverso della temperatura assoluta espressa in Kelvin (T). Applicando le relazioni di Arrhenius all'idrolisi catalizzata da acidi, neutra e catalizzata da basi, è possibile calcolare le costanti di velocità di pseudo-primo ordine, e di conseguenza i tempi di dimezzamento relativi ad altre temperature per le quali non è possibile una determinazione sperimentale diretta della costante di velocità (10).
2.2. VALUTAZIONE E INTERPRETAZIONE DEI RISULTATI
La maggior parte delle reazioni di idrolisi segue un'apparente cinetica di primo ordine e quindi i tempi di dimezzamento sono indipendenti dalla concentrazione (cfr. equazione 4 nell'allegato 2). Ciò consente generalmente di applicare alle condizioni ambientali (concentrazioni ≤ 10-6 M) i risultati di laboratorio determinati a concentrazioni tra 10-2 e 10-3 M (10). Mabey e Mill (11) hanno indicato diversi esempi di buona corrispondenza tra la velocità di idrolisi di varie sostanze chimiche misurata in acque pure e in acque naturali, a condizione che siano stati misurati sia il pH che la temperatura.
3. RELAZIONE SULL'ESECUZIONE DEL SAGGIO
3.1. RAPPORTO DI PROVA
Il rapporto di prova deve contenere almeno le seguenti informazioni:
Sostanza di prova:
|
—
|
denominazione comune, nome chimico, numero CAS, formula di struttura (se si utilizza materiale radiomercato occorre indicare la posizione della marcatura) e relative proprietà fisico-chimiche (cfr. punto 1.5);
|
|
—
|
purezza (impurità) della sostanza di prova;
|
|
—
|
purezza radiochimica della sostanza marcata e attività molare (nei casi opportuni).
|
Soluzioni tampone:
|
—
|
date e dettagli della preparazione;
|
|
—
|
tamponi e acqua utilizzati;
|
|
—
|
molarità e pH delle soluzioni tampone.
|
Condizioni di prova:
|
—
|
date di esecuzione degli esperimenti;
|
|
—
|
quantità di sostanza di prova applicata;
|
|
—
|
metodo e solventi (tipo e quantità) utilizzati per l'applicazione della sostanza di prova;
|
|
—
|
volume delle soluzioni tampone trattate con la sostanza di prova incubate;
|
|
—
|
descrizione del sistema di incubazione utilizzato;
|
|
—
|
pH e temperatura durante l'esperimento;
|
|
—
|
tempi di campionamento;
|
|
—
|
metodo(i) di estrazione;
|
|
—
|
metodi utilizzati per la quantificazione e l'identificazione della sostanza di prova e dei prodotti della relativa idrolisi nelle soluzioni tampone;
|
|
—
|
numero di repliche dei campioni.
|
Risultati:
|
—
|
ripetibilità e sensibilità dei metodi di analisi utilizzati;
|
|
—
|
recuperi (al punto 1.7.1 sono indicati i valori percentuali necessari per la validità dello studio);
|
|
—
|
dati e medie delle repliche dei campioni, sotto forma di tabelle;
|
|
—
|
bilancio di massa nel corso e al termine degli studi (in caso di utilizzo di sostanze di prova marcate);
|
|
—
|
risultati del saggio preliminare;
|
|
—
|
discussione e interpretazione dei risultati;
|
|
—
|
tutti i dati e i valori originari.
|
Le seguenti informazioni sono necessarie soltanto quando si determina la velocità di idrolisi:
|
—
|
rappresentazione grafica delle concentrazioni delle sostanze di prova (ed eventualmente dei prodotti dell'idrolisi) in funzione del tempo per ciascun pH e ciascuna temperatura;
|
|
—
|
tabelle dei risultati dell'equazione di Arrhenius per una temperatura di 20 oC/25 oC, specificando il pH, la costante di velocità [h-1 o g-1], il tempo di dimezzamento o il DT50, le temperature [espresse in oC], compresi i limiti di confidenza e i coefficienti di correlazione (r2) o altre informazioni analoghe;
|
|
—
|
meccanismo di idrolisi proposto.
|
4. BIBLIOGRAFIA
|
(1)
|
OCSE (1981). Hydrolysis as a Function of pH. OECD Guideline for Testing of Chemicals Nr. 111, adottata il 12 maggio 1981.
|
|
(2)
|
US-Environmental Protection Agency (1982). 40 CFR 796.3500, Hydrolysis as a Function of pH at 25 oC. Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
|
|
(3)
|
Agriculture Canada (1987). Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada.
|
|
(4)
|
Direttiva 95/36/CE della Commissione, del 14 luglio 1995, che modifica la direttiva 91/414/CEE del Consiglio relativa all’immissione in commercio dei prodotti fitosanitari. Allegato V: destino e comportamento nell'ambiente.
|
|
(5)
|
Dutch Commission for Registration of Pesticides (1991). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air.
|
|
(6)
|
BBA (1980). Merkblatt Nr. 55, Teil I und II: Prüfung des Verhaltens von Pflanzenbehandlungsmitteln im Wasser (ottobre 1980).
|
|
(7)
|
SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides (a cura di Mark R. Lynch).
|
|
(8)
|
OCSE (2000). Guidance document on aquatic toxicity testing of difficult substances and mixtures, OECD Environmental Health and Safety Publications Series on Testing and Assessment Nr. 23.
|
|
(9)
|
OCSE (1993). Guidelines for the Testing of Chemicals. Parigi. OCSE (1994 — 2000): Addenda 6-11 to Guidelines for the Testing of Chemicals.
|
|
(10)
|
Nelson, H., Laskowski D., Thermes S. e Hendley P. (1997) Recommended changes in pesticide fate study guidelines for improving input to computer models (versione scritta della relazione presentata alla 14a riunione annuale della Society of Environmental Toxicology and Chemistry, Dallas, novembre 1993).
|
|
(11)
|
Mabey, W., Mill, T. (1978). Critical review of hydrolysis of organic compounds in water under environmental conditions, J. Phys. Chem. Ref. Data 7, 383-415.
|
ALLEGATO 1
Schema delle fasi del saggio di idrolisi
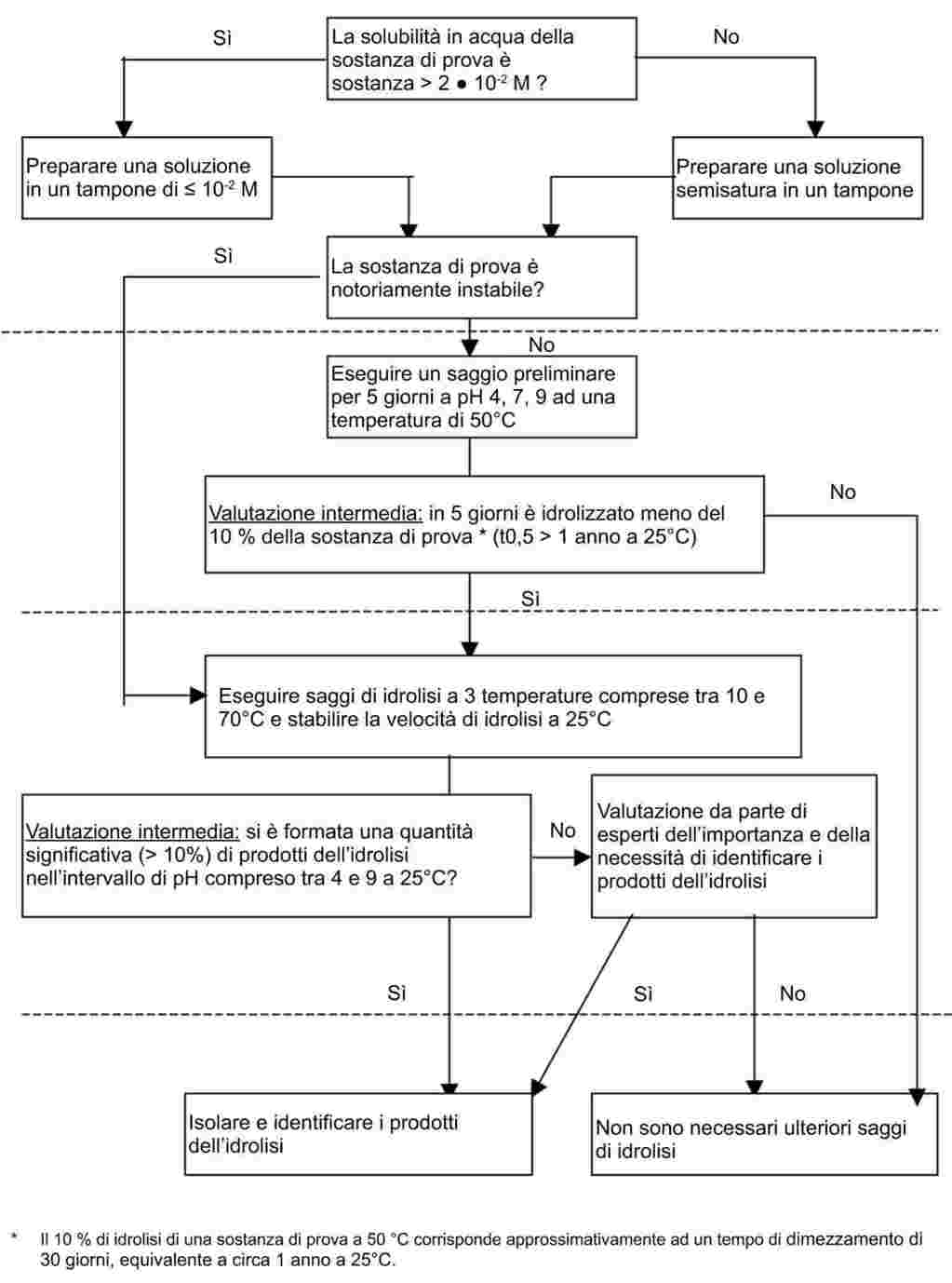
ALLEGATO 2
Definizioni e unità di misura
Le unità di misura del sistema internazionale (SI) dovrebbero essere utilizzate in ogni caso.
Sostanza di prova: qualsiasi sostanza (sia il composto originale che i relativi prodotti di trasformazione).
Prodotti di trasformazione: tutte le sostanze derivanti da reazioni di trasformazione biotica o abiotica della sostanza di prova.
Prodotti dell'idrolisi: tutte le sostanze derivanti da reazioni di trasformazione idrolitica della sostanza di prova.
Idrolisi: reazione di una sostanza RX con l'acqua, con scambio netto del gruppo X con OH al centro della reazione:
La velocità di riduzione della concentrazione di RX in questo processo semplificato è data da:
|
velocità = k [H2O] [RX]
|
reazione di secondo ordine
|
|
o
|
|
velocità = k [RX]
|
reazione di primo ordine
|
a seconda dello stadio cineticamente determinante. Poiché l'acqua è presente in forte eccesso rispetto alla sostanza di prova, questo tipo di reazione è normalmente descritto come «reazione di pseudo-primo ordine», e la costante di velocità osservata è data dalla relazione
e può essere ricavata dall'espressione
|

ln

|
[3]
|
dove
t= tempo
e Co, Ct= concentrazioni di RX al tempo 0 e al tempo t.
Le unità di questa costante hanno dimensioni di (tempo)-1 e il tempo di dimezzamento (tempo necessario per ottenere una reazione del 50 % di RX) è dato da
|

|
[4]
|
Tempo di dimezzamento: (t0,5) è il tempo necessario per l'idrolisi del 50 % della sostanza di prova quando la reazione può essere descritta mediante una cinetica di primo ordine; è indipendente dalla concentrazione.
DT
50
(Disappearance Time 50): tempo entro cui la concentrazione della sostanza di prova si riduce del 50 %; è diverso dal tempo di dimezzamento t0,5 quando la reazione non segue una cinetica di primo ordine.
Stima di k a diverse temperature
Se sono note le costanti di velocità per due temperature, è possibile calcolare le costanti di velocità ad altre temperature utilizzando l'equazione di Arrhenius:
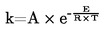 o
o 
La rappresentazione grafica di ln k rispetto ad 1/T è una linea retta con pendenza -E/R
in cui:
|
k
|
=
|
costante di velocità misurata a diverse temperature
|
|
E
|
=
|
energia di attivazione [kJ/mol]
|
|
T
|
=
|
temperatura assoluta [K]
|
|
R
|
=
|
costante universale dei gas [8,314 J/mol.K]
|
L'energia di attivazione è stata calcolata mediante analisi di regressione o tramite la seguente equazione:
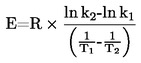
in cui: T2 > T1.
ALLEGATO 3
Sistemi tampone
A. CLARK E LUBS:
Miscele tampone di CLARK e LUBS
(13)
|
Composizione
|
pH
|
|
0,2 N HCl e 0,2 N KCl a 20 oC
|
|
47,5 ml HCl + 25 ml KCl dil. a 100 ml
|
1,0
|
|
32,25 ml HCl + 25 ml KCl dil. a 100 ml
|
1,2
|
|
20,75 ml HCl + 25 ml KCl dil. a 100 ml
|
1,4
|
|
13,15 ml HCl + 25 ml KCl dil. a 100 ml
|
1,6
|
|
8,3 ml HCl + 25 ml KCl dil. a 100 ml
|
1,8
|
|
5,3 ml HCl + 25 ml KCl dil. a 100 ml
|
2,0
|
|
3,35 ml HCl + 25 ml KCl dil. a 100 ml
|
2,2
|
|
0,1 M ftalato acido di potassio + 0,1 N HCl a 20 oC
|
|
46,70 ml 0,1 N HCl + 50 ml ftalato acido a 100 ml
|
2,2
|
|
39,60 ml 0,1 N HCl + 50 ml ftalato acido a 100 ml
|
2,4
|
|
32,95 ml 0,1 N HCl + 50 ml ftalato acido a 100 ml
|
2,6
|
|
26,42 ml 0,1 N HCl + 50 ml ftalato acido a 100 ml
|
2,8
|
|
20,32 ml 0,1 N HCl + 50 ml ftalato acido a 100 ml
|
3,0
|
|
14,70 ml 0,1 N HCl + 50 ml ftalato acido a 100 ml
|
3,2
|
|
9,90 ml 0,1 N HCl + 50 ml ftalato acido a 100 ml
|
3,4
|
|
5,97 ml 0,1 N HCl + 50 ml ftalato acido a 100 ml
|
3,6
|
|
2,63 ml 0,1 N HCl + 50 ml ftalato acido a 100 ml
|
3,8
|
|
0,1 M ftalato acido di potassio + 0,1 N NaOH a 20 oC
|
|
0,40 ml 0,1 N NaOH + 50 ml ftalato acido a 100 ml
|
4,0
|
|
3,70 ml 0,1 N NaOH + 50 ml ftalato acido a 100 ml
|
4,2
|
|
7,50 ml 0,1 N NaOH + 50 ml ftalato acido a 100 ml
|
4,4
|
|
12,15 ml 0,1 N NaOH + 50 ml ftalato acido a 100 ml
|
4,6
|
|
17,70 ml 0,1 N NaOH + 50 ml ftalato acido a 100 ml
|
4,8
|
|
23,85 ml 0,1 N NaOH + 50 ml ftalato acido a 100 ml
|
5,0
|
|
29,95 ml 0,1 N NaOH + 50 ml ftalato acido a 100 ml
|
5,2
|
|
35,45 ml 0,1 N NaOH + 50 ml ftalato acido a 100 ml
|
5,4
|
|
39,85 ml 0,1 N NaOH + 50 ml ftalato acido a 100 ml
|
5,6
|
|
43,00 ml 0,1 N NaOH + 50 ml ftalato acido a 100 ml
|
5,8
|
|
45,45 ml 0,1 N NaOH + 50 ml ftalato acido a 100 ml
|
6,0
|
Miscele tampone di CLARK e LUBS (segue)
|
0,1 M fosfato monopotassico + 0,1 N NaOH a 20 oC
|
|
5,70 ml 0,1 N NaOH + 50 ml fosfato a 100 ml
|
6,0
|
|
8,60 ml 0,1 N NaOH + 50 ml fosfato a 100 ml
|
6,2
|
|
12,60 ml 0,1 N NaOH + 50 ml fosfato a 100 ml
|
6,4
|
|
17,80 ml 0,1 N NaOH + 50 ml fosfato a 100 ml
|
6,6
|
|
23,45 ml 0,1 N NaOH + 50 ml fosfato a 100 ml
|
6,8
|
|
29,63 ml 0,1 N NaOH + 50 ml fosfato a 100 ml
|
7,0
|
|
35,00 ml 0,1 N NaOH + 50 ml fosfato a 100 ml
|
7,2
|
|
39,50 ml 0,1 N NaOH + 50 ml fosfato a 100 ml
|
7,4
|
|
42,80 ml 0,1 N NaOH + 50 ml fosfato a 100 ml
|
7,6
|
|
45,20 ml 0,1 N NaOH + 50 ml fosfato a 100 ml
|
7,8
|
|
46,80 ml 0,1 N NaOH + 50 ml fosfato a 100 ml
|
8,0
|
|
0,1 M H3B03 in 0,1 M KCl + 0,1 N NaOH a 20 oC
|
|
2,61 ml 0,1 N NaOH + 50 ml acido borico a 100 ml
|
7,8
|
|
3,97 ml 0,1 N NaOH + 50 ml acido borico a 100 ml
|
8,0
|
|
5,90 ml 0,1 N NaOH + 50 ml acido borico a 100 ml
|
8,2
|
|
8,50 ml 0,1 N NaOH + 50 ml acido borico a 100 ml
|
8,4
|
|
12,00 ml 0,1 N NaOH + 50 ml acido borico a 100 ml
|
8,6
|
|
16,30 ml 0,1 N NaOH + 50 ml acido borico a 100 ml
|
8,8
|
|
21,30 ml 0,1 N NaOH + 50 ml acido borico a 100 ml
|
9,0
|
|
26,70 ml 0,1 N NaOH + 50 ml acido borico a 100 ml
|
9,2
|
|
32,00 ml 0,1 N NaOH + 50 ml acido borico a 100 ml
|
9,4
|
|
36,85 ml 0,1 N NaOH + 50 ml acido borico a 100 ml
|
9,6
|
|
40,80 ml 0,1 N NaOH + 50 ml acido borico a 100 ml
|
9,8
|
|
43,90 ml 0,1 N NaOH + 50 ml acido borico a 100 ml
|
10,0
|
B. KOLTHOFF E VLEESCHHOUWER:
Tamponi citrato di KOLTHOFF e VLEESCHHOUWER
|
Composizione
|
pH
|
|
0,1 M citrato monopotassico e 0,1 N HCl a 18 oC
(14)
|
|
49,7 ml 0,1 N HCl + 50 ml citrato a 100 ml
|
2,2
|
|
43,4 ml 0,1 N HCl + 50 ml citrato a 100 ml
|
2,4
|
|
36,8 ml 0,1 N HCl + 50 ml citrato a 100 ml
|
2,6
|
|
30,2 ml 0,1 N HCl + 50 ml citrato a 100 ml
|
2,8
|
|
23,6 ml 0,1 N HCl + 50 ml citrato a 100 ml
|
3,0
|
|
17,2 ml 0,1 N HCl + 50 ml citrato a 100 ml
|
3,2
|
|
10,7 ml 0,1 N HCl + 50 ml citrato a 100 ml
|
3,4
|
|
4,2 ml 0,1 N HCl + 50 ml citrato a 100 ml
|
3,6
|
|
0,1 M citrato monopotassico e 0,1 N NaOH a 18 oC
(14)
|
|
2,0 ml 0,1 N NaOH + 50 ml citrato a 100 ml
|
3,8
|
|
9,0 ml 0,1 N NaOH + 50 ml citrato a 100 ml
|
4,0
|
|
16,3 ml 0,1 N NaOH + 50 ml citrato a 100 ml
|
4,2
|
|
23,7 ml 0,1 N NaOH + 50 ml citrato a 100 ml
|
4,4
|
|
31,5 ml 0,1 NNaOH + 50 ml citrato a 100 ml
|
4,6
|
|
39,2 ml 0,1 N NaOH + 50 ml citrato a 100 ml
|
4,8
|
|
46,7 ml 0,1 N NaOH + 50 ml citrato a 100 ml
|
5,0
|
|
54,2 ml 0,1 N NaOH + 50 ml citrato a 100 ml
|
5,2
|
|
61,0 ml 0,1 N NaOH + 50 ml citrato a 100 ml
|
5,4
|
|
68,0 ml 0,1 N NaOH + 50 ml citrato a 100 ml
|
5,6
|
|
74,4 ml 0,1 N NaOH + 50 ml citrato a 100 ml
|
5,8
|
|
81,2 ml 0,1 N NaOH + 50 ml citrato a 100 ml
|
6,0
|
C. SÖRENSEN:
Miscele di borati di SÖRENSEN
|
Composizione
|
Sörensen
18 oC
|
Walbum, pH a
|
|
ml di borace
|
ml di HCl/NaOH
|
10 oC
|
40 oC
|
70 oC
|
|
0,05 M borace + 0,1 NHCl
|
|
5,25
|
4,75
|
7,62
|
7,64
|
7,55
|
7,47
|
|
5,50
|
4,50
|
7,94
|
7,98
|
7,86
|
7,76
|
|
5,75
|
4,25
|
8,14
|
8,17
|
8,06
|
7,95
|
|
6,00
|
4,00
|
8,29
|
8,32
|
8,19
|
8,08
|
|
6,50
|
3,50
|
8,51
|
8,54
|
8,40
|
8,28
|
|
7,00
|
3,00
|
8,08
|
8,72
|
8,56
|
8,40
|
|
7,50
|
2,50
|
8,80
|
8,84
|
8,67
|
8,50
|
|
8,00
|
2,00
|
8,91
|
8,96
|
8,77
|
8,59
|
|
8,50
|
1,50
|
9,01
|
9,06
|
8,86
|
8,67
|
|
9,00
|
1,00
|
9,09
|
9,14
|
8,94
|
8,74
|
|
9,50
|
0,50
|
9,17
|
9,22
|
9,01
|
8,80
|
|
10,00
|
0,00
|
9,24
|
9,30
|
9,08
|
8,86
|
|
0,05 M borace + 0,1 N NaOH
|
|
10,0
|
0,0
|
9,24
|
9,30
|
9,08
|
8,86
|
|
9,0
|
1,0
|
9,36
|
9,42
|
9,18
|
8,94
|
|
8,0
|
2,0
|
9,50
|
9,57
|
9,30
|
9,02
|
|
7,0
|
3,0
|
9,68
|
9,76
|
9,44
|
9,12
|
|
6,0
|
4,0
|
9,97
|
10,06
|
9,67
|
9,28
|
Miscele di fosfati di SÖRENSEN
|
Composizione
|
pH
|
|
0,0667 M fosfato monopotassico + 0,0667 M fosfato disodico a 20 oC
|
|
99,2 ml KH2PO4 + 0,8 ml Na2HPO4
|
5,0
|
|
98,4 ml KH2PO4 + 1,6 ml Na2HPO4
|
5,2
|
|
97,3 ml KH2PO4 + 2,7 ml Na2HPO4
|
5,4
|
|
95,5 ml KH2PO4 + 4,5 ml Na2HPO4
|
5,6
|
|
92,8 ml KH2PO4 + 7,2 ml Na2HPO4
|
5,8
|
|
88,9 ml KH2PO4 + 11,1 ml Na2HPO4
|
6,0
|
|
83,0 ml KH2PO4 + 17,0 ml Na2HPO4
|
6,2
|
|
75,4 ml KH2PO4 + 24,6 ml Na2HPO4
|
6,4
|
|
65,3 ml KH2PO4 + 34,7 ml Na2HPO4
|
6,6
|
|
53,4 ml KH2PO4 + 46,6 ml Na2HPO4
|
6,8
|
|
41,3 ml KH2PO4 + 58,7 ml Na2HPO4
|
7,0
|
|
29,6 ml KH2PO4 + 70,4 ml Na2HPO4
|
7,2
|
|
19,7 ml KH2PO4 + 80,3 ml Na2HPO4
|
7,4
|
|
12,8 ml KH2PO4 + 87,2 ml Na2HPO4
|
7,6
|
|
7,4 ml KH2PO4 + 92,6 ml Na2HPO4
|
7,8
|
|
3,7 ml KH2PO4 + 96,3 ml Na2HPO4
|
8,0
|
C.8 TOSSICITÀ PER I LOMBRICHI
SAGGIO SU TERRENO ARTIFICIALE
1. METODO
1.1. INTRODUZIONE
In questo saggio di laboratorio la sostanza in esame viene aggiunta ad un terreno artificiale dove si pongono i lombrichi per quattordici giorni. Dopo tale periodo (facoltativamente dopo sette giorni) si esamina l'effetto letale della sostanza sui lombrichi. Il saggio fornisce un metodo di valutazione, a termine relativamente breve, dell'effetto sui lombrichi di sostanze chimiche assunte per via cutanea e alimentare.
1.2. DEFINIZIONI E UNITÀ
LC50 : concentrazione di una sostanza capace di uccidere il 50 % degli animali in esame entro il periodo del saggio.
1.3. Sostanza di riferimento
Una sostanza di riferimento viene usata periodicamente per dimostrare che la sensibilità del sistema (di saggio) non è cambiata in modo significativo.
Come sostanza di riferimento si raccomanda cloroacetammide di grado analitico.
1.4. Principio del saggio
Il terreno è un elemento variabile; si usa pertanto, per questo saggio, un terreno fertile artificiale definito accuratamente. Lombrichi adulti della specie Eisenia foetida (vedi nota in appendice) vengono tenuti in un determinato terreno artificiale, trattato con diverse concentrazioni della sostanza in esame. Quattordici giorni (facoltativamente sette giorni) dopo l'inizio della prova, si sparge il contenuto dei recipienti su un vassoio e per ciascuna concentrazione si contano i lombrichi sopravvissuti.
1.5. CRITERI DI QUALITÀ
Il saggio è programmato in modo da essere il più possibile riproducibile per quanto concerne il substrato e gli organismi in esame. Alla fine del saggio, la mortalità fra gli animali di controllo non deve superare il 10 %, altrimenti la prova non è valida.
1.6. DESCRIZIONE DEL METODO
1.6.1. Materiali
1.6.1.1. Substrato per il saggio
Come substrato di base per il saggio si usa un ben determinato terreno artificiale.
|
a)
|
Substrato di base (percentuali espresse in peso secco)
|
—
|
10 % di torba di stagno (con pH più vicino possibile a 5,5-6,0, priva di residui visibili di piante e finemente macinata);
|
|
—
|
20 % di argilla caolinica preferibilmente con più del 50 % di caolinite;
|
|
—
|
circa 69 % di sabbia quarzosa industriale (sabbia a grana prevalentemente fine con oltre il 50 % dei granuli di dimensioni comprese fra 0,05 e 0,2 mm). Qualora la sostanza in esame non possa essere sufficientemente dispersa in acqua, per ogni recipiente (di saggio) andrebbero messi da parte 10 g di tale sabbia da mescolare successivamente con la sostanza stessa;
|
|
—
|
circa 1 % di carbonato di calcio (CaCO3) in polvere, chimicamente puro, aggiunto per portare il pH a 6,0 ±0,5,
|
|
|
b)
|
Substrato per il saggio
Il substrato per il saggio contiene i! substrato di base, la sostanza in esame e acqua deionizzata.
Il contenuto in acqua è circa dal 25 al 42 % del peso secco del substrato di base. Il contenuto in acqua del substrato si determina per essiccamento di un campione fino a peso costante, a 105 oC. II criterio base è che il terreno artificiale deve essere addizionato con acqua fino al punto in cui non vi sia acqua stagnante. Nel mescolare si dovrebbe fare attenzione ad ottenere una distribuzione uniforme della sostanza in esame e del substrato. Il procedimento seguito per addizionare la sostanza in esame al substrato deve essere riportato.
|
|
c)
|
Substrato di controllo
Il substrato di controllo contiene il substrato di base e l'acqua. Se si usa un additivo, un ulteriore controllo dovrebbe contenere la stessa quantità di additivo.
|
1.6.1.2. Recipienti per il saggio
Recipienti di vetro della capacità di circa un litro (adeguatamente coperti con coperchi di plastica, piatti o con una pellicola di plastica muniti di fori di ventilazione) vengono riempiti, sia per il saggio che per il controllo, con una quantità di substrato umido equivalente a 500 g di peso secco di substrato.
1.6.2. Condizioni della prova
I recipienti dovrebbero essere tenuti in camere climatizzate a 20 oC (± 2 oC) ed illuminate in continuazione. L'intensità luminosa dovrebbe essere compressa fra 400 e 800 lux.
La durata della prova è di quattordici giorni, ma è facoltativo fare una prima determinazione della mortalità a sette giorni dall'inizio del saggio.
1.6.3. Procedimento del saggio
Concentrazioni del saggio
Le concentrazioni della sostanza in esame sono espresse in peso della sostanza per peso secco del substrato di base (mg/kg):
Saggio orientativo
L'intervallo delle concentrazioni che causano una mortalità variabile fra lo 0 ed il 100 % può essere determinato con un saggio orientativo che fornisca informazioni sull'intervallo di concentrazioni da impiegare nel saggio definitivo.
Si dovrebbe esaminare la sostanza alle seguenti concentrazioni: 1 000, 100, 10, 1, 0,1 mg di sostanza/kg di substrato in esame (peso secco).
Se si deve effettuare un saggio definitivo completo, per ogni prova orientativa e per il controllo non trattato, potrebbe essere sufficiente un gruppo di dieci lombrichi per ciascuna concentrazione.
Saggio definitivo
I risultati del saggio orientativo vengono impiegati per scegliere almeno 5 concentrazioni in serie geometrica, che causino una mortalità variabile fra lo 0 ed il 100 % e che differiscano fra loro per un fattore costante non superiore a 1,8.
Con questa serie di concentrazioni, il saggio dovrebbe consentire una stima la più precisa possibile del valore della LC50 e dei suoi limiti di confidenza.
Nella prova definitiva si usano almeno quattro gruppi di saggio per concentrazione e quattro per controlli non trattati, ciascuno con dieci lombrichi. I risultati ottenuti con questi gruppi saggiati in replicato vengono espressi con il valore medio e con la deviazione standard relativa.
Quando due concentrazioni consecutive, nel rapporto 1,8, danno una mortalità pari allo 0 ed al 100 %, questi due valori sono sufficienti ad indicare l'intervallo entro il quale è compresa la LC50.
Miscela del substrato di base per il saggio e della sostanza in esame
Se possibile, il substrato per il saggio dovrebbe essere preparato senza alcun additivo che non sia acqua. Subito prima dell'inizio del saggio, si mescola con il substrato di base, oppure vi si sparge sopra uniformemente, con uno spruzzatore da cromatografia o dispositivo similare, un'emulsione o dispersione in acqua deionizzata o in altro solvente della sostanza da esaminare.
Se insolubile in acqua, la sostanza in esame può essere disciolta nel minor volume possibile di un idoneo solvente organico (per esempio esano, acetone, cloroformio).
Per solubilizzare, disperdere o emulsionare la sostanza in esame, si possono impiegare soltanto agenti che volatilizzano rapidamente. Prima dell'uso occorre ventilare il substrato per il saggio. Si deve aggiungere una quantità di acqua pari a quella evaporata. Il controllo dovrebbe contenere la stessa quantità di tutti gli additivi.
Se la sostanza in esame non è solubile, disperdibile o emulsionabile in solventi organici, 10 g di una miscela costituita da sabbia fine quarzosa e dalla quantità di sostanza in esame necessaria per trattare 500 g di peso secco di terreno artificiale, vengono mescolate con 490 g di peso secco del substrato per il saggio.
Per ciascun gruppo di saggio, si riempie ogni recipiente di vetro con una quantità di substrato umido equivalente a 500 g di peso secco, e sulla superficie del substrato si collocano 10 lombrichi precedentemente condizionati per 24 ore in un simile substrato umido e quindi lavati rapidamente ed asciugati dell'acqua in eccesso per assorbimento su carta da filtro.
I recipienti vengono coperti con coperchi, piatti o pellicole di plastica perforati per impedire l'essiccamento del substrato e sono mantenuti nelle condizioni sperimentali per quattordici giorni.
Le valutazioni andrebbero effettuate quattordici giorni (facoltativamente sette giorni) dopo l'inizio del saggio. Si sparge il substrato su un piatto di vetro o di acciaio inossidabile. Si esaminano i lombrichi e si determina il numero di quelli sopravvissuti. I lombrichi sono considerati morti se non reagiscono ad un leggero stimolo meccanico sull'estremità anteriore.
Se l'esame è effettuato dopo sette giorni, il recipiente è riempito di nuovo con lo stesso substrato ed i lombrichi sopravvissuti vengono collocati sulla sua superficie.
1.6.4. Organismi per il saggio
Gli organismi per il saggio dovrebbero essere individui adulti di Eisenia foetida (vedi la nota dell'allegato) (di almeno due mesi con clitella) del peso umido di 300-600 mg. (Per il metodo di allevamento vedi allegato).
2. DATI
2.1. TRATTAMENTO E VALUTAZIONE DEI RISULTATI
Si riportano le concentrazioni della sostanza esaminata con le rispettive percentuali di lombrichi morti.
Quando i dati sono affidabili si dovrebbero determinare il valore della LC50 e i limiti di confidenza (P = 0,05) utilizzando metodi standard (Litchfield e Wilcoxon, 1949 o un metodo equivalente). Il valore della LC50 dovrebbe essere espresso in mg di sostanza in esame per kg di substrato per il saggio (peso secco).
Nei casi in cui la pendenza della curva di concentrazione sia troppo elevata per consentire il calcolo della LC50, è sufficiente una stima grafica di tale valore.
Quando due concentrazioni consecutive, nel rapporto di 1,8, danno mortalità pari allo 0 % ed al 100 %, questi due valori sono sufficienti per indicare l'intervallo entro il quale è situata la LC50.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
Nella relazione sul saggio devono figurare, se possibile:
|
—
|
la dichiarazione che la prova è stata eseguita conformemente ai criteri di qualità sopra riportati,
|
|
—
|
il saggio effettuato (saggio orientativo e/o saggio definitivo),
|
|
—
|
l'esatta descrizione delle condizioni in cui è stato effettuato il saggio o la dichiarazione che il saggio è stato condotto conformemente al metodo; qualsiasi modifica del procedimento deve essere riportata,
|
|
—
|
l'esatta descrizione del procedimento seguito per mescolare la sostanza in esame con il substrato di base,
|
|
—
|
informazioni sugli organismi impiegati per il saggio (specie, età, media ed intervallo di variazione del peso, condizioni di mantenimento e di allevamento fornitore),
|
|
—
|
il metodo seguito per la determinazione della LC50,
|
|
—
|
i risultati del saggio comprensivi di tutti i dati utilizzati,
|
|
—
|
la descrizione dei sintomi e dei cambiamenti osservati nel comportamento degli organismi per il saggio,
|
|
—
|
la mortalità nei controlli,
|
|
—
|
la LC50 oppure la più elevata concentrazione saggiata che non provoca mortalità e la più bassa concentrazione saggiata che provoca il 100 % di mortalità, a quattordici giorni (facoltativamente a sette giorni) dopo l'inizio della prova,
|
|
—
|
il grafico della curva concentrazione/risposta,
|
|
—
|
i risultati ottenuti con la sostanza di riferimento, specificando se siano stati ottenuti in associazione con il saggio in questione o da precedenti saggi di controllo di qualità.
|
4. BIBLIOGRAFIA
|
(1)
|
OCSE, Parigi 1981, Linea Guida 207, decisione C(81) 30 def. del Consiglio.
|
|
(2)
|
Edwards, C. A. e Lofty, 1977, Biology of Earthworms, Londra: Chapman and Hall, 331 pagine.
|
|
(3)
|
Bouche, M. B., 1972, Lombriciens de Frante, Ecologie et Systématique, Institut National de la Recherche Agronomique, 671 pagine.
|
|
(4)
|
Litchfield, J. T. e Wilcoxon, F., A simplified method of evaluating dose-effect experiments. ]. Pharm. Exp. Therap., vol. 96, pagine 99.
|
|
(5)
|
Commissione delle Comunità europee 1983, Development of a standardized laboratory method for assessing the toxicity of chemical substances to earthworms. Report EUR 8714 EN.
|
|
(6)
|
Umweltbundesamt/Biologische Bundesanstalt für Land- und Forstwirtschaft, Berlino 1984, Verfahrensvorschlag «Toxizitätstest am Regenwurm Eisenia foetida in künstlichem Boden», in: Rudolph/Boje: Ökotoxikologie, ecomed, Landsberg, 1986.
|
Appendice
Allevamento e mantenimento dei lombrichi prima del saggio
Per l'allevamento si pongono gli animali, da 30 a 50 lombrichi adulti, in una scatola di allevamento con substrato fresco e si rimuovono dopo 14 giorni. Questi animali possono essere utilizzati per ulteriori gruppi di allevamento. I lombrichi nati dalle zooteche vengono impiegati per i saggi quando sono maturi (nelle condizioni prescritte, dopo 2-3 mesi).
Condizioni di allevamento e mantenimento
|
Camera climatizzata
|
:
|
temperatura di 20 oC (± 2 oC), di preferenza illuminata ininterrottamente (intensità da 400 a 800 lux).
|
|
Scatole di allevamento
|
:
|
idonei contenitori poco profondi del volume da 10 a 20 litri.
|
|
Substrato
|
:
|
Eisenia foetida può essere allevata in diversi escrementi animali. Come terreno per l'allevamento si raccomanda l'uso di una miscela costituita dal 50 % in volume di torba e dal 50 % di sterco di mucca o di cavallo. Il terreno dovrebbe avere un pH di circa 6-7 (corretto con carbonato di calcio) ed una bassa conduttività ionica (meno di 6 mmhos o 0,5 % di concentrazione salina).
Il substrato dovrebbe essere umido ma non troppo bagnato.
Oltre al metodo sopra esposto si possono impiegare con buoni risultati anche altri procedimenti.
|
Nota: Esistono due varietà di Eisenia foetida che alcuni tassonomi hanno separato in specie (Bouché, 1972). Queste sono morfologicamente simili ma una, la Eisenia foetida foetida, ha delle tipiche strisce o fasce trasversali sui segmenti mentre l'altra, la Eisenia foetida andrei, ne è priva ed ha un colore rossiccio screziato. Ove possibile si dovrebbe usare la Eisenia foetida andrei. Se è disponibile la metodologia necessaria, si possono usare altre specie.
C.9 BIODEGRADAZIONE
ZAHN-WELLENS TEST
1. METODO
1.1. INTRODUZIONE
Il metodo è destinato a valutare la potenziale biodegradabilità ultima (15) delle sostanze organiche idrosolubili e non volatili: esposte a concentrazioni relativamente elevate di microorganismi nel corso di un saggio statico.
Può verificarsi un assorbimento chimico-fisico della sostanza in esame sui solidi sospesi; di ciò si dovrà tener conto nell'interpretare i risultati (vedi punto 3.2),
Le sostanze da studiare vengono impiegate a concentrazioni corrispondenti a valori del DOC compresi fra 50 e 400 mg/l o a valori del COD compresi fra 100 e 1 000 mg/l (DOC = carbonio organico disciolto; COD = domanda chimica di ossigeno). Dette concentrazioni, relativamente elevate, hanno il vantaggio dell'attendibilità analitica. I composti dotati di proprietà tossiche possono ritardare o inibire il processo di degradazione.
In questo metodo, la misura della concentrazione del carbonio organico disciolto o la richiesta chimica di ossigeno vengono impiegate per valutare la biodegradazione ultima della sostanza in esame.
L'impiego simultaneo di un metodo di analisi specifico può permettere di valutare la biodegradazione primaria della sostanza (modifica della struttura chimica della sostanza in esame).
Il metodo può essere applicato soltanto all'esame di quelle sostanze organiche le quali, alle concentrazioni impiegate per la prova:
|
—
|
sono solubili in acqua nelle condizioni sperimentali;
|
|
—
|
hanno una tensione di vapore trascurabile nelle condizioni sperimentali;
|
|
—
|
non esercitano effetti inibitori sui batteri;
|
|
—
|
sono assorbite soltanto in misura limitata nel sistema sperimentale;
|
|
—
|
non vanno perdute per effetto della formazione di schiume nella soluzione in esame.
|
La disponibilità di dati sulle proporzioni relative dei principali componenti del materiale da esaminare sarà utile per interpretare i risultati, particolarmente nei casi in cui i risultati sono bassi o trascurabili.
Per poter interpretare i risultati più bassi e per poter scegliere le opportune concentrazioni sperimentali sarà altresì utile disporre di dati sulla tossicità della sostanza nei confronti dei microorganismi.
1.2. DEFINIZIONI ED UNITÀ
Il livello di degradazione raggiunto alla fine dell'esperimento, denominato «biodegradabilità nel Zahn-Wellens Test», è dato dall'espressione:

|
DT
|
=
|
biodegradazione ( %) al tempo T
|
|
CA
|
=
|
valori del DOC (o del COD) della miscela in esame, espressi in mg/l e misurati tre ore dopo l'inizio della prova (DOC = carbonio organico disciolto, COD = domanda chimica di ossigeno)
|
|
CT
|
=
|
valori del DOC o del COD nella miscela in esame al momento del prelievo (mg/l)
|
|
CB
|
=
|
valori del DOC o del COD relativi al «bianco» al momento del prelievo (mg/l)
|
|
CBA
|
=
|
valori del DOC o del COD del «bianco», misurati tre ore dopo l'inizio della prova (mg/l)
|
L'entità della degradazione dev'essere arrotondata all'unità percentuale.
La degradazione percentuale si esprime come eliminazione percentuale del DOC (o del COD) della sostanza sperimentata.
La differenza tra il valore misurato dopo tre ore e il valore calcolato, o preferibilmente misurato inizialmente, può fornire informazioni utili in merito all'eliminazione della sostanza (vedi punto 3.2: «Interpretazione dei risultati»).
1.3. SOSTANZE DI RIFERIMENTO
In taluni casi, quando vengono studiate sostanze nuove, può essere utile l'impiego di sostanze di riferimento. Tuttavia, non possono ancora essere raccomandate specifiche sostanze di riferimento.
1.4. PRINCIPIO DEL METODO
In un recipiente di vetro da 1 a 4 litri, provvisto di agitatore e aereatore, vengono introdotti contemporaneamente il fango attivo, le sostanze nutritive minerali e il materiale da esaminare, quale unica fonte di carbonio, in soluzione acquosa. La miscela viene agitata ed aereata alla temperatura di 20-25 oC, sotto illuminazione diffusa o in camera oscura, per la durata massima di 28 giorni. Il processo di degradazione viene seguito mediante determinazione dei valori del COD o del DOC nella soluzione filtrata, eseguita giornalmente o comunque ad intervalli appropriati e regolari. Il rapporto fra il DOC (o il COD) eliminato dopo ciascun intervallo ed il valore a tre ore dall'inizio viene espresso come biodegradazione percentuale e serve per misurare l'entità della degradazione in quel momento. Diagrammando tale valore in funzione del tempo si costruisce la curva di biodegradazione.
Impiegando un metodo analitico specifico è possibile misurare le variazioni di concentrazione della sostanza in esame dovute alla biodegradazione (biodegradabilità primaria).
1.5. CRITERI DI QUALITÀ
Prove d'intercalibrazione tra laboratori hanno dimostrato che la riproducibilità di questo metodo è soddisfacente.
La sensibilità del metodo è determinata principalmente dalla variabilità del «bianco» e, in misura minore, dalla precisione con cui è possibile determinare il carbonio organico disciolto e la quantità del composto da esaminare contenuto nel mezzo.
1.6 DESCRIZIONE DEL METODO
1.6.1. Preparazioni
1.6.1.1. Reattivi
Acqua per il saggio: acqua potabile a contenuto di carbonio organico inferiore a 5 mg/l. La concentrazione globale degli ioni calcio e magnesio non deve superare 2,7 mmol/l; in caso contrario sarà necessaria un'opportuna diluizione con acqua deionizzata o distillata
|
Acido solforico, p.a.,
|
50 g/l
|
|
Soluzione di idrossido di sodio, p.a.,
|
40 g/l
|
|
Soluzione nutritiva minerale: sciogliere in 1 litro d'acqua deionizzata:
|
|
|
cloruroammonico, NH4Cl, p.a.
|
38,5 g
|
|
ortofosfato monosodico diidrato NaH3PO4.2H2O, p.a.
|
33,4 g,
|
|
ortofosfato monopotassico, KH2PO4, p.a.
|
8,5 g,
|
|
ortofosfato dipotassico, K2HPO4. p.a.
|
21,75 g.
|
La miscela serve contemporaneamente da sostanza nutritiva e da tampone.
1.6.1.2. Apparecchiatura
Recipienti cilindrici di vetro, del volume da 1 a 4 litri
Dispositivo di agitazione. L'agitatore vero e proprio, di vetro o metallo, dev'essere sostenuto da un albero adatto e deve girare a 5-10 cm circa dal fondo del recipiente. Si può anche impiegare un agitatore magnetico, con barretta da 7 a 10 cm di lunghezza
Tubo di vetro, del diametro interno di 2-4 mm, per l'introduzione dell'aria. L'apertura del tubo deve trovarsi a 1 cm circa sopra il fondo del recipiente
Centrifuga (3 550 giri circa)
pH-metro
Misuratore dell'ossigeno disciolto
Filtri di carta
Apparecchiatura per filtrazione su membrana
Filtri a membrana, porosità 0,45 μm. I filtri a membrana sono adatti solo a condizione che non cedano carbonio organico e non assorbano la sostanza durante la filtrazione
Apparecchiatura analitica per la determinazione del contenuto in carbonio organico e della domanda chimica di ossigeno
1.6.1.3. Preparazione dell'inoculo
Lavare il fango attivo proveniente da un impianto di trattamento biologico centrifugando o lasciando sedimentare ripetutamente con l'acqua per il saggio (vedi sopra).
I! fango attivo deve trovarsi in idonee condizioni. Esso può essere prelevato da un impianto di trattamento di acque di scarico in buone condizioni di funzionamento. Per ottenere il maggior numero possibile di specie o ceppi differenti di batteri è preferibile mescolare gli inoculi provenienti da varie fonti (per esempio: vari impianti di trattamento, estratti di suoli, acque di fiume, ecc). La miscela deve essere trattata come descritto sopra.
Per controllare l'attività del fango attivo vedi oltre il paragrafo «Controllo funzionale».
1.6.1.4. Preparazione delle soluzioni da esaminare
Nel recipiente per il saggio, introdurre 500 ml dell'acqua per il saggio, insieme alla soluzione nutritiva minerale in quantità pari a 2,5 ml/l e al fango attivo in quantità corrisponderne a 0,2-1,0 g/l di materiale secco nella miscela finale. Aggiungere la soluzione madre della sostanza da esaminare in quantità tale da ottenere un DOC da 50 a 400 mg/l nella miscela finale. I corrispondenti valori del COD saranno da 100 a 1 000 mg/l. Portare con l'acqua di cui sopra al volume totale da 1 a 4 litri. Il volume totale da scegliere dipende dal numero dei campioni da prelevare per le determinazioni del DOC o del COD, nonché dai volumi necessari per il procedimento analitico.
Normalmente, un volume di 2 litri può essere considerato soddisfacente. Per ciascuna serie di saggi va preparato almeno un recipiente di controllo (bianco): esso deve contenere soltanto il fango attivo e la soluzione nutritiva minerale portata allo stesso volume totale dei recipienti per il saggio.
1.6.2. Esecuzione del saggio
Si agita il contenuto dei recipienti per il saggio con agitatori magnetici od a spirale, sotto illuminazione diffusa o in camera oscura e alla temperatura di 20-25 oC. L'aerazione dev'essere ottenuta insufflando aria compressa purificata facendola passare attraverso un tampone di cotone e, se necessario, una bottiglia di lavaggio. Si farà in modo che il fango non si depositi e che la concentrazione dell'ossigeno non scenda al di sotto di 2 mg/l.
Il valore del pH deve essere controllato ad intervalli regolari (ad esempio quotidianamente) e regolato se necessario sul valore di 7-8.
Le perdite dovute all'evaporazione andranno compensate immediatamente prima di ogni prelievo aggiungendo acqua deionizzata o distillata nelle quantità richieste. Sarà particolarmente utile segnare il livello del liquido sul recipiente prima di avviare la prova. Dopo ogni campionamento (in assenza di aerazione e agitazione} si apporranno nuovi contrassegni. I primi campioni dovranno sempre essere prelevati tre ore dopo l'inizio della prova per verificare se ha luogo un assorbimento del materiale in esame da parte del fango attivo.
L'eliminazione della sostanza in esame dev'essere seguita mediante determinazioni del DOC e del COD, effettuate quotidianamente o ad intervalli comunque regolari. I campioni prelevati dal recipiente di saggio e dal «bianco» devono essere filtrati su carta accuratamente lavata. I primi 5 ml del filtrato della soluzione devono essere scartati. I fanghi difficilmente filtrabili possono essere eliminati in precedenza centrifugando per 10 minuti. Le determinazioni del COD e del DOC devono essere effettuate almeno in doppio. L'esperimento deve proseguire per la durata di 28 giorni.
Nota: I campioni che rimangono torbidi devono essere filtrati attraverso filtri a membrana, Questi ultimi non devono cedere od assorbire materiale organico.
Controllo funzionale del fango attivo
In parallelo a ciascuna serie di esperimenti, deve essere saggiata una sostanza nota, destinata a controllare la capacità funzionale del fango attivo. A questo scopo si è mostrato utile il glicoldietilenico.
Adattamento
Qualora si eseguano analisi ad intervalli relativamente brevi (ad esempio quotidianamente}, l'adattamento può essere chiaramente controllato dalla curva di degradazione (vedi figura 2). Il saggio, pertanto, non deve essere avviato immediatamente prima dell'interruzione di fine settimana.
Qualora l'adattamento si verifichi verso la fine del periodo di saggio, il saggio stesso può essere prolungato fino al momento in cui la degradazione è terminata.
Nota: Se è necessaria una conoscenza più vasta del comportamento dei fanghi adattati, lo stesso fango attivo deve essere posto nuovamente a contatto con lo stesso materiale di prova, procedendo come segue:
arrestare l'agitatore e l'aeratore e lasciar sedimentare il fango attivo; eliminare il surnatante, riempire fino a 2 litri con acqua per il saggio, agitare per 15 minuti e lasciare nuovamente sedimentare; eliminare nuovamente il surnatante e impiegare il fango rimanente per ripetere il saggio con gli stessi materiali conformemente a quanto indicato ai precedenti punti 1.6.1.4 e 1.6.2. Il fango attivo può essere isolato anche per centrifugazione anziché per sedimentazione.
Il fango adattato può essere mescolato con fango fresco, fino ad una quantità totale di 0,2-1 g di sostanza secca per litro.
Mezzi analitici
Normalmente i campioni vengono filtrati attraverso un filtro di carta accuratamente lavato (per il lavaggio, impiegare acqua deionizzata).
I campioni che restano torbidi devono essere filtrati con filtri a membrana (0,45 μm).
La concentrazione del DOC dev'essere determinata in doppio sul campione filtrato (scartando i primi 5 ml) con apparecchiatura per la determinazione del TOC. Se il filtrato non può essere analizzato lo stesso giorno, esso va conservato in frigorifero fino al giorno successivo. Una conservazione più lunga non è da raccomandarsi:
La concentrazione del COD va determinata sul campione filtrato con il procedimento analitico descritto nel riferimento bibliografico (2).
2. DATI E VALUTAZIONE
Le concentrazioni del DOC e del COD devono essere determinate almeno in doppio in ogni campione secondo quanto indicato al punto 1.6.2. La degradazione al momento T viene calcolata mediante la formula riportata (insieme alle definizioni) al punto 1.2.
La misura della degradazione dev'essere arrotondata all'unità percentuale. L'entità della degradazione raggiunta alla fine dell'esperimento viene definita come «biodegradabilità secondo Zahn-Wellens»
Nota: Qualora la degradazione completa venga raggiunta prima che il tempo necessario per il saggio sia terminato e questo risultato sia confermato da una seconda analisi effettuata il giorno successivo, il saggio può essere considerato concluso.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
Nella relazione sul saggio devono figurare, se possibile:
|
—
|
la concentrazione iniziale della sostanza,
|
|
—
|
tutte le altre informazioni e risultati sperimentali concernenti la sostanza esaminata, la sostanza di riferimento (se impiegata) e il «bianco»,
|
|
—
|
la concentrazione dopo tre ore,
|
|
—
|
la curva di biodegradazione con la relativa descrizione,
|
|
—
|
la data e la località di prelievo dei microorganismi usati per l’esperimento, lo stato di adattamento, la concentrazione impiegata, ecc.
|
|
—
|
le giustificazioni scientifiche per qualsiasi modifica apportata al procedimento sperimentale.
|
3.2. INTERPRETAZIONE DEI RISULTATI
La rimozione del DOC (o del COD) che si verifica gradualmente entro giorni o settimane indica che la sostanza in esame sta subendo biodegradazione.
In taluni casi può comunque entrare in gioco l'assorbimento chimico-fisico, denotato dal fatto che la scomparsa si verifica in modo completo o parziale fin dall'inizio, entro le prime tre ore e che la differenza di risposta tra i surnatanti del controllo e del saggio rimane a livelli inaspettatamente bassi.
Se si vuole distinguere fra la biodegradazione (o biodegradazione parziale) e l'assorbimento, sono necessari ulteriori saggi.
Ciò può essere fatto in numerosi modi, ma il metodo più convincente consiste nell'impiegare il surnatante quale inoculo in una prova del dossier di base (preferibilmente un saggio respirometrico).
Le sostanze che, nel corso di questo saggio, mostrano un'elevata eliminazione del DOC (o del COD) non dovuta ad assorbimento devono essere considerate potenzialmente biodegradabili. Una rimozione parziale, non dovuta ad assorbimento indica che il prodotto chimico è soggetto almeno in parte alla biodegradazione. Una rimozione bassa o nulla del DOC (o del COD) può essere dovuta all'inibizione dei microorganismi da parte delle sostanze in esame: ciò può anche essere rivelato dalla lisi e dalla perdita di fango, accompagnata dalla formazione di surnatanti torbidi. In questo caso il saggio deve essere ripetuto impiegando la sostanza in esame a concentrazione minore.
L'impiego di un metodo di analisi specifico per la sostanza in esame o della sostanza marcata con 14C può consentire una maggiore sensibilità. Nel caso di composto marcato al 14C, il recupero di 14CO2 confermerà che la biodegradazione è avvenuta.
Quando i risultati sono espressi in termini di biodegradazione primaria, dovrà essere fornita, possibilmente, una spiegazione della modifica di struttura chimica che conduce alla diminuzione di risposta della sostanza in esame.
Si deve dimostrare la validità del metodo analitico e fornire la risposta ottenuta sul «bianco».
4. BIBLIOGRAFIA
|
(1)
|
OCSE, Parigi 1981, Linea Guida 302 B, decisione C(81) 30 def. del Consiglio.
|
Appendice
ESEMPIO DI VALUTAZ1ONE
|
Composto organico:
|
acido 4-etossibenzoico
|
|
Conccntrazione teorica della sostanza:
|
600 mg/l
|
|
DOC teorico:
|
390 mg/l
|
|
Inoculo
|
Impianto di trattamento delle acque fognarie di
|
|
Concentrazione
|
1 g di sostanza secca
|
|
Stato di adattamento
|
non adattato
|
|
Analisi:
|
determinazione DOC
|
|
Quantità del campione
|
3 ml
|
|
Sostanza di controllo
|
glicoldietilenico
|
|
Tossicità del composto
|
nessun effetto tossico al di sotto di 1 000 mg/l
(metodo utilizzato: saggio in tubi di fermentazione)
|
|
Tempi di analisi
|
Sostanza di riferimento
|
Sostanza in esame
|
|
Bianco
DOC (16)
mg/1
|
DOC (16)
mg/l
|
DOC netto
mg/1
|
Degradazione
%
|
DOC (16)
mg/l
|
DOC netto
mg/l
|
Degradazione
%
|
|
0
|
—
|
—
|
300,0
|
—
|
—
|
390,0
|
—
|
|
3 ore
|
4,0
|
298,0
|
294,0
|
2
|
371,6
|
367,6
|
6
|
|
1 giorno
|
6,1
|
288,3
|
282,2
|
6
|
373,3
|
367,2
|
6
|
|
2 giorni
|
5,0
|
281,2
|
276,2
|
8
|
360,0
|
355,0
|
9
|
|
5 giorni
|
6,3
|
270,5
|
264,2
|
12
|
193,8
|
187,5
|
52
|
|
6 giorni
|
7,4
|
253,3
|
245,9
|
18
|
143,9
|
136,5
|
65
|
|
7 giorni
|
11,3
|
212,5
|
201,2
|
33
|
104,5
|
93,2
|
76
|
|
8 giorni
|
7,8
|
142,5
|
134,7
|
55
|
58,9
|
51,1
|
87
|
|
9 giorni
|
7,0
|
35,0
|
28,0
|
91
|
18,1
|
11,1
|
97
|
|
10 giorni
|
18,0
|
37,0
|
19,0
|
94
|
20,0
|
2,0
|
99
|
Figura 1
Esempio di curve di biodegradazione

Figura2
Esempio di adattamento dei fanghi
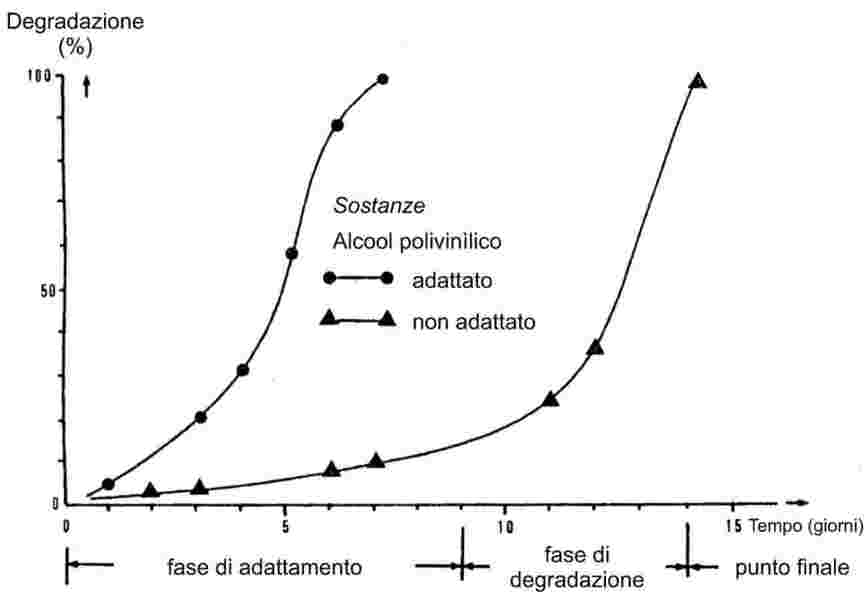
C.10 BIODEGRADAZIONE
SAGGIO DI SIMULAZIONE CON FANGHI ATTIVI
1. METODO
1.1. INTRODUZIONE
1.1.1. Osservazioni generali
Il metodo può essere applicato esclusivamente a quelle sostanze organiche che, alle concentrazioni impiegate per il saggio:
|
—
|
sono solubili in acqua nella misura necessaria per la preparazione delle soluzioni per il saggio,
|
|
—
|
hanno, nelle condizioni del saggio, una tensione di vapore trascurabile,
|
|
—
|
non esercitano effetti inibitori sui batteri.
|
La disponibilità di dati sulle proporzioni relative dei principali componenti del prodotto da esaminare sarà utile per interpretare i risultati ottenuti, in particolare in quei casi in cui i valori trovati sono bassi o non significativi.
È auspicabile poter disporre di dati sulla tossicità della sostanza nei confronti dei microorganismi per l'interpretazione di eventuali bassi valori e per la scelta delle concentrazioni sperimentali appropriate,
1.1.2. Determinazione della biodegradabilità ultima (analisi DOC/COD)
(17)
Scopo del metodo è la determinazione della biodegradabilità ultima mediante misura della rimozione della sostanza e di qualsiasi metabolita in un impianto modello a fanghi attivi, ad una concentrazione > 12 mg DOC/l (o a circa 40 mg COD/1). Sembrano ottimali 20 mg DOC/l (DOC = carbonio organico disciolto/litro; COD = domanda chimica di ossigeno).
Si deve determinare il contenuto di carbonio organico (o la domanda chimica di ossigeno) del materiale in esame,
1.1.3. Determinazione della biodegradabilità primaria (analisi specifica)
Scopo del metodo è la determinazione della biodegradabilità primaria di una sostanza in un impianto pilota a fanghi attivi, a una concentrazione di circa 20 mg/l, con l'impiego di un metodo analitico specifico (se il metodo analitico e la tossicità della sostanza lo consentono, si può usare una concentrazione più bassa o più elevata). Questo consente la valutazione della biodegradabilità primaria della sostanza (modifica della struttura chimica della sostanza in esame).
Il metodo non è destinato alla determinazione della mineralizzazione della sostanza esaminata.
Per la determinazione della sostanzia esaminata occorre disporre di un metodo analitico adeguato.
1.2. DEFINIZIONI E UNITÀ
1.2.1. Analisi DOC/COD
Il grado di rimozione della sostanza è dato da:
|

|
[1(a)]
|
dove:
|
DR
|
=
|
grado di rimozione percentuale del DOC (o del COD) relativo alla sostanza in esame entro il tempo medio di ritenzione fissato
|
|
T
|
=
|
concentrazione della sostanza in esame nell'affluente in mg DOC/litro (o mg COD/litro)
|
|
E
|
=
|
concentrazione del DOC (o del COD) nell'effluente dell'unità per il saggio in mg DOC/litro (o mg COD/litro)
|
|
EO
|
=
|
concentrazione dei DOC (o del COD) nell'effluente dell'unità per il «bianco» in mg DOC/litro (o mg COD/litro)
|
La degradazione si definisce come la rimozione percentuale di DOC (o di COD), ne! tempo di ritenzione fissato, relativo alla sostanza in esame.
1.2.2. Analisi specifica
L'eliminazione percentuale della sostanza esaminata dalla fase acquosa (RW), nel tempo medio di ritenzione fissato, si ricava da:
|
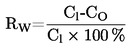
|
[1b)]
|
dove:
|
C1
|
=
|
concentrazione della sostanza nell'affluente dell'unità per il saggio (mg di sostanza/litro, determinata con l'analisi specifica)
|
|
CO
|
=
|
concentrazione della sostanza nell'effluente dell'unità per il saggio (mg di sostanza/litro, determinata con l'analisi specifica)
|
1.3. SOSTANZE DI RIFERIMENTO
In alcuni casi, quando si esamina una nuova sostanza, possono essere utili delle sostanze di riferimento; ciò nonostante, non è attualmente possibile indicare sostanze di riferimento specifiche.
1.4. PRINCIPIO DEL METODO
Per la determinazione della biodegradabilità ultima si fanno funzionare in parallelo due unità pilota a fanghi attivi (saggio di conferma dell'OCSE o unità a vaso poroso). La sostanza in esame viene addizionata all'affluente (liquame sintetico o domestico) di una delle unità, mentre l'altra riceve soltanto liquame. Per la determinazione della biodegradazione primaria con l'analisi specifica dell'affluente e dell'effluente si impiega soltanto una unità.
Si misurano le concentrazioni di DOC (o di COD) negli effluenti, oppure si determinano con l'analisi specifica le concentrazioni della sostanza.
Il DOC dovuto alla sostanza in esame non viene misurato ma soltanto specificato.
Quando si effettuano le misurazioni del DOC (e del COD), si assume che la differenza fra le concentrazioni medie degli effluenti del saggio e del controllo sia dovuta alla sostanza in esame non degradata.
Quando vengono effettuate analisi specifiche è possibile misurare la variazione della concentrazione della sostanza in esame (biodegradazione primaria).
Si possono fare funzionare le unità seguendo il «sistema delle unità accoppiate», con il procedimento della transinoculazione.
1.5. CRITERI DI QUALITÀ
La concentrazione di partenza della sostanza dipende dal tipo di analisi effettuata e dalle sue limitazioni.
1.6. DESCRIZIONE DEL METODO
1.6.1. Preparazione
1.6.1.1. Apparecchiatura
A parte il caso delle analisi specifiche, è necessaria una coppia di unità dello stesso tipo. Possono essere impiegati due sistemi:
Saggio di conferma OCSE
L'apparecchiatura (allegato 1) è costituita da un serbatoio (A) per il liquame sintetico, da una pompa di dosaggio (B), da una vasca di aerazione (C), da un sedimentatore (D), una pompa ad aria compressa (E) per riciclare i fanghi attivi e una vasca (F) per raccogliere l'effluente trattato.
I serbatoi (A) e (F) devono essere di vetro o di idoneo materiale plastico, e della capacità di almeno 24 litri. La pompa (B) alimenta con un flusso costante di liquame sintetico la vasca di aerazione; si può impiegare qualsiasi sistema idoneo purché sia in grado di assicurare il flusso e la concentrazione di alimentazione.
Durante il normale funzionamento, l'altezza del sedimentatore (D) è fissata in modo che il volume della soluzione chiarificata contenuto nella vasca di aerazione sia di tre litri. Un diffusore di materiale sinterizzato (G) è sospeso nel recipiente (C) al vertice del cono. La quantità di aria insufflata attraverso l'aeratore può essere determinata con un flussometro. La pompa ad aria compressa (E) è regolata in modo che il fango attivo sia riciclato con continuità e regolarità dal sedimentatore al recipiente di aerazione (C).
«Vaso poroso»
Il vaso poroso è realizzato con fogli di polietilene poroso (spessore 2 mm, dimensione massima dei pori 95 μm), a forma cilindrica del diametro di 14 cm e con una base conica a 45 o (figure 1 e 2 dell'allegato II). Il vaso poroso è contenuto in un recipiente impermeabile di plastica idonea del diametro di 15 cm, con una luce sulla parte cilindrica ad una altezza di 17,2 cm che determina il volume (tre litri) del vaso. Nella parte superiore del recipiente interno si trova un anello rigido di sostegno in plastica idonea in modo da avere un'intercapedine di efflusso di 0,5 cm fra il recipiente interno e quello esterno.
I vasi porosi possono essere montati sul fondo di un bagnomaria controllato termostaticamente. Alla base del recipiente interno, dove sono collocati idonei diffusori, si ha un'alimentazione di aria.
I recipienti (A) ed (E) debbono essere di vetro o di plastica idonea ed avere una capacità di almeno 24 litri. La pompa (B) alimenta, con un flusso costante di liquame sintetico, il recipiente di aerazione; si può impiegare qualsiasi sistema atto ad assicurare il flusso e la concentrazione di alimentazione.
Sono necessari dei vasi porosi interni di riserva per sostituire quelli che possono ostruirsi durante l'uso; i vasi ostruiti vengono puliti mediante immersione per 24 ore in una soluzione di ipoclorito seguita da un lavaggio accurato con acqua di rubinetto.
1.6.1.2. Filtrazione
Apparecchiatura per filtrazione su membrana e membrane filtranti con pori da 0,45 μm. Le membrane filtranti sono adatte soltanto se non cedono carbonio organico e non assorbono la sostanza durante la filtrazione.
1.6.1.3. Liquame
Si possono impiegare sia un'idonea alimentazione sintetica, sia liquame domestico.
Esempio di alimentazione sintetica
Sciogliere in un litro di acqua di rubinetto i seguenti composti:
|
Peptone:
|
160 mg
|
|
Estratto di carne:
|
110 mg
|
|
Urea:
|
30 mg
|
|
NaCl:
|
7 mg
|
|
CaCl2 2H2O:
|
4 mg
|
|
MgSO4 7H2O:
|
2 mg
|
|
K2HPO4:
|
28 mg
|
Liquame domestico
Dovrebbe essere raccolto fresco ogni giorno dallo stramazzo della vasca di sedimentazione primaria di un impianto che tratta in prevalenza liquami domestici.
1.6.1.4. Soluzione madre della sostanza in esame
Si dovrebbe preparare una soluzione della sostanza in esame, ad esempio all'1 %, da aggiungere nell'unità di prova. È necessario fissare la concentrazione della sostanza in modo tale che si conosca il volume necessario per ottenere la concentrazione di prova da addizionare al liquame o direttamente nell'unità per mezzo di una seconda pompa.
1.6.1.5. Inoculo
Osservazione: Usando liquami domestici, sarebbe superfluo l'impiego di un inoculo a bassa concentrazione batterica, ma si possono usare fanghi attivi.
Possono essere usati svariati inoculi, se ne danno tre esempi adatti:
|
a)
|
Inoculo da effluente secondario
Si dovrebbe ricavare l'inoculo da un effluente secondario di buona qualità raccolto da un impianto che tratta in prevalenza liquami domestici. Nel periodo compreso fra il campionamento e l'impiego, l'effluente deve essere tenuto in condizioni aerobie. Per preparare l'inoculo, si filtra il campione su filtro a elevata porosità, scartando i primi 200 ml, Il filtrato è mantenuto in condizioni aerobie sino al momento dell'uso. L'inoculo deve essere impiegato il giorno stesso del prelievo. Per l'inoculazione occorre impiegarne almeno 3 ml.
|
|
b)
|
Inoculo composito
Inoculo da un effluente secondario:
vedi descrizione precedente.
Inoculo da terreno:
si sospendono 100 grammi di terreno (fertile, non sterile) in 1 000 ml di acqua potabile esente da cloro (terreni con un contenuto eccessivo di argilla, sabbia o humus non sono adatti). Dopo agitazione, si lascia riposare la sospensione per 30 minuti. Si filtra il surnatante su carta a elevata porosità, scartando i primi 200 ml. Si sottopone immediatamente il filtrato ad aerazione prolungandola fino al momento dell'uso. L'inoculo deve essere utilizzato il giorno stesso del prelievo.
Inoculo da acque superficiali:
un altro inoculo parziale può ottenersi da acque superficiali semiputride (mesosaprobiche). Si filtra il campione su carta ad elevata porosità, scartando i primi 200 ml. Si mantiene in condizioni aerobie fino al momento dell'impiego. L'inoculo va utilizzato il giorno stesso del prelievo.
Si mettono insieme i volumi dei tre campioni parziali di inoculo, si mescolano bene e si preleva dal miscuglio ottenuto l'inoculo finale. Per l'inoculazione occorre che esso sia di almeno 3 ml.
|
|
c)
|
Inoculo da un fango attivo
Si può usare come inoculo un volume (non più di tre litri) di fango attivo (contenuto in solidi sospesi fino a 2,5 g/l) prelevato dalla vasca di aerazione di un impianto che tratta prevalentemente liquami domestici.
|
1.6.2. Procedimento
II saggio viene eseguito a temperatura ambiente; questa dovrebbe essere mantenuta fra 18 e 25 oC.
Se è il caso, il saggio può essere condotto a una temperatura più bassa (fino a 10 oC): se la sostanza viene degradata, allora non occorrono, di solito, altre operazioni. In caso contrario il saggio deve essere condotto ad una temperatura costante compresa fra 18 e 25 oC.
1.6.2.1. Periodo di avviamento: formazione/stabilizzazione del fango delle unità
Il periodo di formazione/stabilizzazione del fango è il periodo necessario perché la concentrazione dei solidi sospesi del fango attivo ed il funzionamento delle unità pervengano allo stato di regime nelle condizioni operative volute.
Il periodo di avviamento è quello che va dall'istante in cui la sostanza in esame è aggiunta per la prima volta fino all'istante in cui la sua rimozione si stabilizza (valore relativamente costante). Questo periodo non deve superare le sei settimane.
Il periodo di valutazione è di tre settimane a partire dall'istante in cui la rimozione della sostanza in esame raggiunge un valore relativamente costante che è di solito elevato. Per tutte le sostanze che, nelle prime sei settimane, mostrano una degradazione limitata o nulla, si prendono, come periodo di valutazione, le successive tre settimane.
All'inizio si riempie la (le) unità necessaria(e) per una prova con l'inoculo mescolato con l'affluente.
Si mettono allora in funzione l'aeratore [nel caso della unità del saggio di conferma OCSE la pompa ad aria compressa (E)] ed il meccanismo di dosaggio (B).
L'affluente, privo della sostanza da esaminare, deve attraversare il recipiente di aerazione (C) alla velocità di 1 l/h oppure 0,5 l/h; ciò comporta un tempo medio di ritenzione di tre o di sei ore.
La velocità di aerazione dovrebbe essere regolata in modo che il contenuto del recipiente (C) sia manenuto costantemente in sospensione ed il volume di ossigeno disciolto sia di almeno 2 mg/l.
Va evitata, con mezzi adeguati, la formazione di schiuma. Non si devono usare agenti antischiumogeni che inibiscano il fango attivo.
Il fango accumulatosi nella parte superiore del recipiente di aerazione (C) [per le unità del saggio di conferma OCSE alla base del recipiente di sedimentazione (D) e nel circuito di circolazione] deve essere riportato nella soluzione chiarificata almeno una volta al giorno con l'uso di una spazzola o di qualche altro mezzo appropriato.
Quando il fango ha difficoltà a sedimentare, se ne può aumentare la densità aggiungendo delle porzioni di 2 ml di una soluzione al 5 % di cloruro ferrico e ripetendo l'operazione quando necessario.
Si raccoglie l'effluente nel recipiente (E o F) per 20-24 ore e si preleva un campione dopo un'accurata miscelazione. Il recipiente (E o F) deve essere pulito molto bene.
Per poter determinare e controllare l'efficienza del processo, si misurano almeno due volte alla settimana la domanda chimica di ossigeno (COD) o il carbonio organico disciolto (DOC) del filtrato dell'effluente raccoltosi, come pure del filtrato dell'affluente (usando una membrana con pori di 0,45 μm e scartando i primi 20 ml circa di filtrato).
La riduzione del COD o DOC dovrebbe annullarsi quando siottiene una degradazione giornaliera abbastanza regolare.
Due volte alla settimana si dovrebbe determinare la quantità (in g/l) di sostanza secca del fango attivo nel recipiente di aerazione. Le unità possono funzionare in due modi: o due volte per settimana si determina la quantità di sostanza secca presente nel fango attivo e se essa supera i 2,5 g/l si deve togliere quella in eccesso; oppure si eliminano giornalmente da ciascun vaso 500 ml di soluzione mista per avere un tempo di ritenzione medio del fango di 6 giorni.
Quando i parametri misurati e calcolati [efficienza del processo (nella rimozione COD o DOC), concentrazione del fango, capacità di sedimentazione del fango, torbidità degli effluenti, ecc.] delle due unità sono sufficientemente stazionati, la sostanza in esame può essere introdotta nell'affluente di una delle unità, secondo il punto 1.6.2.2.
In alternativa, la sostanza in esame può essere introdotta all'inizio del periodo di formazione del fango, specialmente quando come inoculo si aggiunge fango.
1.6.2.2. Procedimento
Si mantengono le condizioni di funzionamento del periodo di avviamento e si aggiunge all'affluente dell'unità di prova una quantità sufficiente (circa l'1 %) di soluzione madre del prodotto in esame, in modo da ottenere nel liquame la concentrazione voluta del prodotto (circa 10-20 mg DOC/l o 40 mg COD/l). Ciò si può effettuare o miscelando giornalmente ii liquame con la soluzione madre, oppure con un sistema separato di pompaggio. Detta concentrazione può essere raggiunta progressivamente. Se non si hanno effetti tossici della sostanza in esame sul fango attivo, possono essere provate anche concentrazioni più elevate.
L'unità in bianco è alimentata soltanto con l'affluente senza aggiunta di sostanze. Per l'analisi si prendono adeguate quantità di effluenti e si filtrano con filtri a membrana (0,45 μm) scartando i primi 20 ml (circa) di filtrato.
I campioni filtrati devono essere analizzati il giorno stesso, in caso contrario vanno opportunamente conservati, per esempio mediante l'aggiunta di 0,05 ml di una soluzione all'1 % di cloruro mercurico (HgCl2) per ogni 10 ml di campione filtrato, oppure mantenendoli alla temperatura da 2 a 4 oC per 24 ore al massimo, oppure al di sotto di 18
o
C per periodi più lunghi.
Il periodo di sperimentazione, a partire dall'aggiunta della sostanza in esame, non dovrebbe superare le sei settimane ed il periodo di valutazione dovrebbe durare almeno tre settimane; per il calcolo del risultato finale dovrebbero potersi effettuare da 14 a 20 determinazioni.
Processo a unità accoppiate
L'accoppiamento delle unità si ottiene scambiando, una volta al giorno, fra le due unità, 1,5 litri di soluzione chiarificata (fango incluso) proveniente dalle vasche di aerazione del fango attivo. Nel caso di prodotti in esame fortemente assorbenti, si prelevano dalle vasche di sedimentazione 1,5 litri del solo liquido surnatante e si versano nella vasca di fango attivo dell'altra unità.
1.6.2.3. Analisi
Per seguire il comportamento della sostanza si possono effettuare due tipi di analisi:
DOC e COD
Le concentrazioni di DOC sono determinate in doppio con l'analizzatore di carbonio e quelle di COD (assieme o in alternativa) col sistema indicato nel riferimento bibliografico (2).
Analisi specifica
Le concentrazioni delia sostanza esaminata si determinano con un metodo analitico idoneo. Se possibile, si dovrebbe effettuare una determinazione specifica della sostanza assorbita sul fango.
2. DATI E VALUTAZIONE
2.1. PROCESSO AD UNITÀ ACCOPPIATE
Quando si impiega il «processo ad unità accoppiate», il grado giornaliero di rimozione DR viene calcolato come indicato al punto 1.2.1.
Il valore DR viene quindi corretto in DRc, per tener conto del trasferimento di sostanza dovuto al procedimento di transinoculazione, mediante l'equazione (2) e l'equazione (3) per tempi medi di ritenzione rispettivamente di tre e di sei ore.
|

|
[2]
|
|
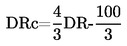
|
[3]
|
Si calcola la media della serie di valori di DRc ed inoltre la deviazione standard con l'equazione [4]
|
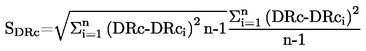
|
[4]
|
dove:
|
SDRc
|
=
|
deviazione standard della serie di valori di DRc
|
|

c |
=
|
media dei valori di DRc
|
|
n
|
=
|
numero di determinazioni
|
Si eliminano i valori anomali della serie di DRc secondo un opportuno procedimento statistico, ad esempio Nalimov (6), con un livello di probabilità del 95 % e si ricalcolano la media e la deviazione standard della serie di DRc priva di valori anomali (outliers).
Si calcola quindi il risultato finale con l'equazione (5):
|

|
[5]
|
dove:
|
tn-1 ;a
|
=
|
valore tabulato di t per n coppie di valori di E ed Eo e l'intervallo fiduciario P (P = 1 - α) è stimato al 95 % (1)
|
Il risultato viene espresso come media con limiti di tolleranza al 95 %, relativa deviazione standard e numero di dati della serie DRc priva di «outliers» e numero di valori anormali, ad esempio:
|
DRc
|
=
|
98,6±2,3 % della rimozione del DOC
|
|
s
|
=
|
4,65 % della rimozione del DOC
|
|
n
|
=
|
18
|
|
x
|
=
|
numero degli «outliers»
|
2.2. PROCESSO AD UNITÀ NON ACCOPPIATE
II funzionamento delle unita può essere vcrificato come segue:

Questa rimozione giornaliera può essere riportata in grafico per evidenziare eventuali andamenti, per esempio, verso l'acclimatazione.
2.2.1. Determinazioni attraverso il COD/DOC
Il grado giornaliero di rimozione DR è calcolato come indicato al punto 1.2.1.
Si calcola la media della serie di valori DR ed inoltre la sua deviazione standard con l'equazione:
|
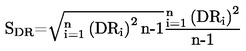
|
[6]
|
dove:
|
SDR
|
=
|
deviazione standard della serie di valori di DRi
|
|
|
=
|
media dei valori DRi
|
|
n
|
=
|
numero delle determinazioni
|
Si eliminano gli «outliers» delia serie di DR secondo un opportuno procedimento statistico, ad esempio Nalimov (6), con un livello di probabilità del 95 % e si ricalcolano la media e la deviazione standard della serie di DR così epurata.
Il risultato finale è quindi calcolato con l'equazione:
|

|
[7]
|
dove:
|
tn - 1α
|
=
|
valore tabulato di t per n coppie di valori di E ed Eo e l'intervallo fiduciario P (P = 1 - α) dove P è stimato al 95 %(1).
|
Come risultato vengono presi la media, con limiti di tolleranza ad un livello di probabilità del 95 %, la relativa deviazione standard, il numero di dati della serie DR epurata ed il numero di valore anomali, ad esempio:
|
DR
|
=
|
(98,6±2,3 %) della rimozione del DOC
|
|
s
|
=
|
4,65 % della rimozione del DOC
|
|
n
|
=
|
18
|
|
x
|
=
|
numero di «outliers».
|
2.2.2. Determinazione attraverso l'analisi specifica
La percentuale di eliminazione della sostanza in esame dalla fase acquosa (Rw) è calcolata come indicato al punto 1.2.2.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
Nella relazione sul saggio devono figurare, se possibile:
|
—
|
la scheda fornita nell'appendice 3, che mostra le condizioni operative del saggio,
|
|
—
|
l'apparecchiatura scelta (prova di conferma OCSE o vaso poroso),
|
|
—
|
il procedimento scelto: unità accoppiate o meno,
|
|
—
|
il liquame impiegato: sintetico o domestico (nel caso di liquame domestico, data e provenienza del campione),
|
|
—
|
tipo di inoculo, con data e provenienza del campione,
|
|
—
|
una descrizione de! metodo analitico, se sono state effettuate analisi specifiche,
|
|
—
|
grafico della rimozione di COD o DOC in funzione del tempo, comprensivo dei periodi di avviamento e di valutazione,
|
|
—
|
recupero analitico della sostanza in esame come COD o DOC nella soluzione madre,
|
|
—
|
nel caso siano state effettuate analisi specifiche, grafico della rimozione percentuale della sostanza esaminata dalla fase acquosa in funzione del tempo (periodo di avviamento e di valutazione),
|
|
—
|
la rimozione media di DOC, COD o della sostanza in esame e la deviazione standard sono calcolate dai risultati del periodo di valutazione, cioè quando si ha una rimozione stazionaria della sostanza in esame o un periodo di funzionamento a regime,
|
|
—
|
grafico della concentrazione del fango attivo in funzione del tempo,
|
|
—
|
osservazioni riguardanti il fango attivo (scarto di fanghi in eccesso, presenza di rigonfiamenti, FeCl3, ecc.),
|
|
—
|
concentrazione della sostanza usata nel saggio,
|
|
—
|
tutti i risultati relativi all'analisi fatta sul fango,
|
|
—
|
tutti i dati ed i risultati sperimentali relativi alla sostanza in esame e a quella di riferimento, se impiegata,
|
|
—
|
motivazioni scientifiche per eventuali modifiche nel procedimento.
|
3.2. INTERPRELAZIONE DEI RISULTATI
Una bassa rimozione della sostanza esaminata dalla fase acquosa può essere dovuta all'inibizione dei microorganismi da parte della sostanza in esame. Ciò può anche essere evidenziato da lisi e perdita di fango, che produce un surnatante torbido e da un abbassamento dell'efficienza di rimozione COD (o DOC) dell'impianto pilota.
A volte può svolgere un ruolo l'assorbimento fisico-chimico. Le differenze fra l'azione biologica sulla molecola e l'assorbimento chimico-fisico possono essere rivelati da un'analisi condotta sul fango dopo un adeguato desorbimento,
Se si deve fare la distinzione fra biodegradazione (o parziale biodegradazione) ed assorbimento, sono necessarie ulteriori prove.
Ciò si può effettuare in diversi modi, ma il più convincente è usare il surnatante come inoculo in un saggio del dossier di base (preferibilmente un saggio respirometrico).
Se si osservano elevate rimozioni DOC o COD, ciò è dovuto alla biodegradazione, mentre a basse rimozioni la biodegradazione non si può distinguere dall'eliminazione. Ad esempio, se un composto solubile manifesta una elevata costante di assorbimento del 98 % ed il tasso di eliminazione giornaliero del surplus di fango è del 10 %, è possibile un'eliminazione sino al 40 %; con un tasso di eliminazione del surplus di fango del 30 %, l'eliminazione dovuta all'assorbimento ed alla rimozione attraverso il surplus di fango può arrivare fino al 65 % (4).
Quando si effettuano analisi specifiche, occorrerebbe fare attenzione alla relazione fra la struttura della sostanza e l'analisi'specifica impiegata. In questo caso il fenomeno osservato non può essere interpretato come una mineralizzazione della sostanza.
4. BIBLIOGRAFIA
|
(1)
|
OCSE, Parigi 1981, Linea Guida 303 A, decisione C(81) 30 def, del Consiglio.
|
|
(3)
|
Painter, H. A., King, E. F., WRC Porous-Potmethod for assessing biodegradability. Technical ReportTR70, giugno 1978, Water Research Center, Regno Unito.
|
|
(4)
|
Wierich, P., Gerike, P., «The fate of soluble, recalcitrant, and adsorbing compounds in activated sludge plants», Ecotoxicology and Environmental Safety, Vol. 5, n. 2, giugno 1981, pagine da 161 a 171.
|
|
(6)
|
Streuli, H., «Fehlerhafte Interpretation und Anwendung von Ausrcissertests, insbesondere bei Ringversuchen zur Uberprfüng analytischcr-chemischer Untersuchungsmcthoden», Fesemus-Zeitschrift für Analytische Chemie, 303 (1980) pagine da 406 a 408.
|
Appendice 1
Figura 1
Figura 2

Appendice 2
Figura 1
Attrezzatura per la determinazione della biodegradabilità

Figura 2
Dettagli del recipiente di aerazione a vaso poroso di 3 litri

Appendice 3
Condizioni operative per la prova di simulazione con fanghi attivi
Controllo in ciascun gruppo
Attrezzatura
|
di conferma OCSE
|
|
|
vaso poroso
|
|
Funzionamento
|
singola unità
|
|
|
unità accoppiate
|
|
|
unità non accoppiate
|
|
Transinoculazione
|
nessuna
|
|
|
fango attivo
|
|
|
surnatante
|
|
Tempo medio di ritensione
Base nutritiva
|
liquame domestico
|
|
|
liquame sintetico
|
|
Inoculo
|
effluente secondario
|
|
|
coposito
|
|
|
fango attivo
|
|
Addizione del materiale da esaminare
|
dall'avviamento
|
|
|
addizione graduale
|
|
|
a formazione del fango avvenuta
|
|
Analisi
C.11. BIODEGRADAZIONE
FANGHI ATTIVI: SAGGIO DI INIBIZIONE DELLA RESPIRAZIONE
1. METODO
1.1. INTRODUZIONE
Con il metodo qui descritto si valuta l'effetto della sostanza in esame sui microorganismi misurando la velocità di respirazione in determinate condizioni alla presenza di diverse concentrazioni della sostanza stessa.
Il metodo ha lo scopo di fornire un procedimento rapido di «screening» per l'identificazione delle sostanze che possono avere effetti nocivi sugli impianti di trattamento batterico aerobio e per indicare le concentrazioni della sostanza in esame, che non provocano effetti inibitori, da usare nei saggi di biodegradabilità.
Si può fare precedere la prova definitiva da una prova orientativa che consenta di avere delle informazioni sull'intervallo di concentrazioni da usare nel saggio.
Nel programma del saggio vengono inclusi due controlli senza la sostanza da esaminare, da utilizzare uno all'inizio e l'altro alla fine della serie di saggi. Ciascun gruppo di fanghi attivi dovrebbe essere anche controllato con una sostanza di riferimento.
Il presente metodo si applica più facilmente a quelle sostanze che grazie alla loro idrosolubilità ed alla loro bassa volatilità, permangano prevalentemente in acqua.
Per le sostanze che hanno invece una limitata solubilità nei mezzi di trattamento, può non essere possibile determinare la EC50.
Quando la sostanza in esame ha tendenza a disaccoppiare la fosforilazione ossidativa, i risultati basati sull'assunzione di ossigeno possono condurre ad errate conclusioni.
Per eseguire il saggio è utile disporre delle seguenti informazioni:
|
—
|
grado di purezza della sostanza in esame.
|
Raccomandazione
I fanghi attivi possono contenere organismi potenzialmente patogeni e dovrebbero perciò essere maneggiati con cautela.
1.2. DEFINIZIONI E UNITÀ
La velocità di respirazione è il consumo di ossigeno da parte di microrganismi del fango aerobio di acque reflue ed è espresso generalmente in mg di O2 per mg di fango per ora.
Per calcolare l'effetto inibitorio della sostanza in esame ad una data concentrazione, la velocità di respirazione si esprime come percentuale della media delle velocità di respirazione dei due controlli:
dove:
|
Rs
|
=
|
velocità di consumo di ossigeno alla concentrazione saggiata della sostanza in esame
|
|
Rc
1
|
=
|
velocità di consumo di ossigeno nel controllo 1,
|
|
Rc2
|
=
|
velocità di consumo di ossigeno nel controllo 2.
|
Ec50 è, in questo metodo, la concentrazione della sostanza in esame alla quale la velocità di respirazione risulta pari al 50 % di quella rilevata nel controllo nelle condizioni qui descritte.
1.3. SOSTANZE DI RIFERIMENTO
Per controllare che la sensibilità del fango sia normale si raccomanda di usare come sostanza di riferimento il 3,5-diclorofenolo, noto come inibitore della respirazione, e di sottoporlo a determinazione della EC50 in ciascun gruppo di fanghi attivi.
1.4. PRINCIPIO DEL METODO
La velocità di respirazione di un fango attivo, alimentato con una quantità standard di liquame sintetico, è misurato dopo un tempo di contatto di 30 minuti o/e di 3 ore. Si misura anche la velocità di respirazione dello stesso fango attivo in presenza di diverse concentrazioni della sostanza in esame in condizioni per il resto identiche. L'effetto inibitorio della sostanza in esame ad una data concentrazione è espresso come percentuale delle velocità medie di respirazione dei due controlli. Dalle determinazioni a diverse concentrazioni si calcola un valore della Ec50.
1.5. CRITERI DI QUALITÀ
I risultati del saggio sono validi se:
|
—
|
le velocità di respirazione dei controlli differiscono entro il 15 %,
|
|
—
|
la EC50 (30 minuti e/o 3 ore) del 3,5-diclorofenolo cade nell'intervallo accettato compreso fra 5 e 30 mg/l.
|
1.6. DESCRIZIONE DEL METODO
1.6.1. Reagenti
1.6.1.1. Soluzioni della sostanza in esame
Le soluzioni della sostanza in esame vengono preparate all'inizio dello studio impiegando una soluzione madre. Se si segue il procedimento di cui sotto, è opportuno che la concentrazione della soluzione madre sia di 0,5 g/l.
1.6.1.2. Soluzione della sostanza di riferimento
Si può preparare ad esempio una soluzione di 5,5-diclorofenolo sciogliendo 0,5 g di 3,5 diclorofenolo in 10 ml di NaOH lM, diluendo quindi con acqua distillata sino a circa 30 ml, addizionando (mentre si agita) H2SO40,5M sino al punto di precipitazione incipiente — occorreranno circa 8 ml di H2SO40,5M — e diluendo infine la miscela con acqua distillata sino al volume di 1 litro. Il pH dovrebbe allora avere un valore compreso fra 7 e 8.
1.6.1.3. Liquame sintetico
Una alimentazione di liquame sintetico si ottiene sciogliendo in un litro di acqua le seguenti sostanze nelle quantità precisate:
|
—
|
11 g di estratto di carne,
|
Nota 1: Questo liquame sintetico è 100 volte più concentrato di quello descritto in OECD Technical Report, «Metodo proposto per la determinazione della biodegradabilità dei tensioattivi impiegati nei detersivi sintetici» (11 giugno 1976), con l'aggiunta di fosfato acido di potassio.
Nota 2: La soluzione preparata, se non viene utilizzata subito, dovrà essere conservata ai buio a temperature comprese tra 0 oC e 4 oC per non oltre una settimana, in condizioni tali da non subire alterazioni nella composizione. Inoltre, prima della conservazione la soluzione potrà essere sterilizzata oppure si potranno aggiungere il peptone e l'estratto di carne solo poco prima di effettuare l'analisi. Prima dell'uso la soluzione dovrà essere agitata ed il suo pH dovrà essere corretto.
1.6.2. Apparecchiatura
Apparecchiatura di misurazione: non è importante che l'apparecchio abbia una forma precisa. Comunque, la bottiglia di misurazione dovrebbe essere completamente piena e la sonda dovrebbe aderire ermeticamente al collo.
È necessaria la normale dotazione di laboratorio ed in particolare:
|
—
|
apparecchio di misurazione,
|
|
—
|
elettrodo per pH e relativa apparecchiatura di misurazione,
|
1.6.3. Preparazione dell'inoculo
Come inoculo batterico per il saggio si impiega fango attivo proveniente da un impianto di trattamento di liquami prevalentemente domestici.
Se necessario, al ritorno in laboratorio, si possono rimuovere le particelle grossolane mediante sedimentazione per un breve periodo ad esempio per 15 minuti, e, quindi, decantare, per l'uso, lo strato superficiale contenente le particelle solide più piccole, In alternativa il fango può essere miscelato per pochi secondi con un agitatore.
Inoltre, ove si presume la presenza di materiali inibenti, il fango dovrebbe essere lavato con acqua di rubinetto o con soluzione isotonica. Dopo centrifugazione si decanta il surnatante (questo procedimento si ripete per tre volte).
Una piccola quantità di fango umido viene pesata, essiccata e ripesata. In questo modo si può calcolare la quantità di fango umido da sospendere in acqua per ottenere un fango attivo con una quantità di solidi sospesi nel liquido chiarificato compresa tra 2 e 4 g/l. Questa quantità dà una concentrazione compresa tra 0,8 e 1,6 g/l nel mezzo utilizzato per il saggio, se si segue la procedura raccomandata più sotto.
Se il fango non può essere utilizzato il giorno stesso del prelievo, ad ogni litro del fango attivo preparato come sopra si aggiungono 50 ml di liquame sintetico; il fango viene quindi aerato per tutta la notte a 20 oC ± 2 oC). L'aerazione viene mantenuta anche durante la giornata in attesa dell'uso prima del quale si controlla e, se necessario, si tampona il pH fra 6 e 8. I solidi sospesi nel liquido chiarificato si dovrebbero determinare come descritto nel precedente paragrafo.
Se si deve impiegare lo stesso gruppo di fanghi nei giorni successivi (quattro giorni al massimo), alla fine di ogni giornata di lavoro occorrerà aggiungere altri 50 ml di liquame sintetico, per litro di fango.
1.6.4. Esecuzione del saggio
|
Durata/tempo di contatto:
|
30 minuti e/o 3 ore, sotto aerazione
|
|
Acqua:
|
acqua potabile (se necessario declorata)
|
|
Alimentazione di aria:
|
aria pulita, esente da oli; flusso da 0,5 a 1 l/min
|
|
Apparecchiatura di misurazione:
|
bottiglia a fondo piatto del tipo della bottiglia per la determinazione del BOD
|
|
Ossimetro:
|
idoneo elettrodo ad ossigeno con registratore
|
|
Soluzione nutritiva:
|
liquame sintetico (vedi sopra)
|
|
Sostanza in esame:
|
la soluzione in esame è preparata in concomitanza all'inizio del saggio
|
|
Sostanza di riferimento:
|
ad esempio 3,5-diclorofenolo (almeno tre concentrazioni)
|
|
Controlli:
|
campioni inoculati esenti dalla sostanza in esame
|
|
Temperatura:
|
20 oC ± 2 oC.
|
Si descrive in seguito un procedimento sperimentale che può essere seguito sia per la sostanza in esame che per quella di riferimento durante il periodo di contatto di tre ore.
Occorrono diversi recipienti (ad esempio becher da 1 litro).
Si dovrebbe impiegare una serie di almeno cinque concentrazioni che differiscano tra di loro di un fattore costante di preferenza non superiore a 3,2.
Al tempo «0», si portano 16 ml di liquame sintetico a 300 ml con acqua. Si aggiungono 200 ml di inoculo batterico e si versa la miscela totale (500 ml) in un primo recipiente (primo controllo C1).
I recipienti in esame dovrebbero essere aerati continuativamente in modo da impedire che il livello di O2 disciolto scenda al di sotto di 2,5 ml/l ed in modo che, subito prima di misurare la velocità di respirazione, la concentrazione di O2 sia almeno uguale a 6,5 mg/l.
Al tempo «15 minuti» (15 minuti è un intervallo arbitrario ma adeguato) si ripete la stessa operazione salvo che 100 ml della soluzione madre della sostanza in esame vengono aggiunti ai 16 ml di liquame sintetico prima di addizionare l'acqua sino a 300 ml e l'inoculo batterico sino al volume di 500 ml. Questa miscela viene quindi versata in un secondo recipiente ed aerata come sopra. Si ripete questo procedimento ad intervalli di 15 minuti con differenti volumi della soluzione madre della sostanza in esame, in modo da disporre di una serie di recipienti contenenti diverse concentrazioni della sostanza in esame. Infine si prepara un secondo controllo (C2).
Dopo tre ore si determina il pH e si versa un'aliquota ben miscelata del contenuto del primo recipiente nell'apparecchio di misurazione e si misura la velocità di respirazione per un tempo fino a 10 minuti.
Questa determinazione viene ripetuta sul contenuto di ciascun recipiente ad intervalli di 15 minuti, in modo che il tempo di contatto per ogni recipiente sia di tre ore.
La sostanza di riferimento viene saggiata nello stesso modo su ciascun gruppo di inoculi batterici.
Quando si devono effettuare misurazioni dopo 30 minuti di contatto, occorre un procedimento diverso (ad esempio con più di un ossimetro).
Se si richiede la misura del consumo di ossigeno, si preparano altre bottiglie contenenti la sostanza in esame, il liquame sintetico ed acqua ma non fango attivo. Il consumo di ossigeno si misura e registra dopo un periodo di aerazione di 30 minuti e/o 3 ore (tempo di contatto).
2. DATI E VALUTAZIONE
La velocità di respirazione si calcola dal tracciato del registratore nell'intervallo che va da circa 2,5 a 6,5 mg O2/l, oppure, se la velocità di respirazione è bassa, per un periodo di 10 minuti. Il tratto di curva di respirazione in cui si misura la velocità di respirazione dovrebbe essere lineare.
Se le velocità di respirazione dei due controlli differiscono tra loro di più del 15 % o se la EC50 (30 minuti e/o 3 ore) della sostanza di riferimento non cade nell'intervallo ammesso (da 5 a 30 mg/l per il 3,5-diclorofenolo), la prova non è valida e deve essere ripetuta.
Per ogni concentrazione in esame si calcola la percentuale di inibizione (vedi paragrafo 1.2). Quest'ultima viene riportata in grafico, su carta log-normale (o log-probability), in funzione della concentrazione e si ricava un valore di EC50.
Usando procedimenti standard si possono determinare i limiti di confidenza al 95 % per i valori della EC50.
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
Nella relazione sul saggio devono figurare, se possibile:
|
—
|
sostanza in esame: dati di identificazione chimica,
|
|
—
|
sistema di saggio: origine, concentrazione ed eventuali trattamenti preliminari del fango attivo,
|
|
—
|
condizioni del saggio:
|
—
|
pH della miscela in esame prima di determinare la respirazione,
|
|
—
|
sostanza di riferimento e relativa EC50 misurata,
|
|
—
|
eventuale assunzione abiotica di ossigeno,
|
|
|
—
|
risultati:
|
—
|
curva di inibizione e metodo per il calcolo della EC50,
|
|
—
|
EC50 e, se possibile, limiti di confidenza al 95 %, EC20 ed EC10,
|
|
—
|
tutte le osservazioni e le eventuali deviazioni dal presente metodo che potrebbero aver condizionato il risultato.
|
|
3.2. INTERPRETAZIONE DEI DATI
Dal momento che le complesse interazioni che si hanno nell'ambiente non possono essere fedelmente riprodotte in un saggio di laboratorio, il valore della EC50 dovrebbe essere considerato semplicemente come una indicazione della probabile tossicità della sostanza in esame per il fango attivo usato nel trattamento dei liquami o per i microorganismi delle acque reflue. Inoltre, le sostanze in esame aventi effetto inibitorio sull'ossidazione dell'ammoniaca possono anche causare curve di inibizione atipiche. Di conseguenza cali curve dovranno essere interpretate con cautela.
4. BIBLIOGRAFIA
|
(1)
|
International Standard ISO/8192-1986.
|
|
(2)
|
Broecker, B. e Zahn, R., Water Research 11, 1977, pagina 165.
|
|
(3)
|
Brown, D., Hitz, H. R. e Schaefer, L., Chemosphere 10, 1981, pagina 245.
|
|
(4)
|
ETAD (Ecological and Toxicological Association of Dyestuffs Manufacturing Industries), Recommended Method n. 103, descritto anche in:
|
|
(5)
|
Robra, B., Wasser/Abwasser 117, 1976, pagina 80.
|
|
(6)
|
Schefer, W., Textilveredelung 6, 1977, pagina 247.
|
|
(7)
|
OCSE, Parigi 1981, Linea Guida 209, decisione C(84) 30 def. del Consiglio.
|
C.12. BIODEGRADAZIONE
SAGGIO SCAS MODIFICATO
1. METODO
1.1. INTRODUZIONE
Scopo del metodo è quello di valutare la potenziale biodegradabilità ultima di sostanze organiche solubili in acqua e non volatili, esposte per un lungo periodo a concentrazioni relativamente elevate di microorganismi. La vitalità dei microorganismi viene mantenuta per tutto il periodo aggiungendo giornalmente liquami decantati. (Per l'intervallo di fine settimana, i liquami possono essere conservati a 4 oC. In alternativa si può usare il liquame sintetico del saggio di conferma OCSE.)
Nell'interpretazione dei risultati occorre tenere conto dell'eventuale assorbimento fisico-chimico della sostanza in esame sui solidi in sospensione (cfr. paragrafo 3.2).
A causa del lungo periodo di ritenzione della fase liquida (36 ore) e dell'aggiunta intermittente di nutrienti, la prova non riproduce le stesse condizioni che si hanno in un impianto per il trattamento dei liquami. I risultati ottenuti con diverse sostanze indicano che il sistema ha un elevato potenziale di biodegradazione.
Le condizioni sperimentali sono estremamente favorevoli alla selezione e/o all'adattamento di microorganismi capaci di degradare il composto in esame (si può seguire questo procedimento anche per produrre inoculi acclimatati da utilizzare in altri saggi).
Nel presente metodo la biodegradabilità ultima delle sostanze in esame viene determinata attraverso la misura della concentrazione del carbonio organico disciolto (DOC) (è preferibile determinare il DOC dopo acidificazione e depurazione anziché dalla differenza Ctotale — Cinorganico).
L'impiego simultaneo di un metodo analitico specifico consente di determinare la degradazione primaria della sostanza (modifica della struttura chimica della sostanza in esame).
Il metodo può essere applicato soltanto alle sostanze organiche che alle concentrazioni impiegate per il saggio:
|
—
|
sono solubili in acqua (almeno 20 mg/l di carbonio organico disciolto),
|
|
—
|
hanno una tensione di vapore trascurabile,
|
|
—
|
non esercitano effetti inibitori sui batteri,
|
|
—
|
non vengono assorbite in modo significativo dal sistema sperimentale,
|
|
—
|
non vengono sottratte alla soluzione in esame mediante formazione di schiume.
|
Occorre determinare il contenuto di carbonio organico della sostanza in esame.
Per l'interpretazione dei risultati ottenuti, in particolare nei casi in cui i valori siano bassi o trascurabili, sarà utile disporre di informazioni sulle proporzioni relative dei principali componenti della sostanza in esame.
Per l'interpretazione di eventuali valori bassi e per la scelta di una concentrazione adeguata al saggio, può essere utile disporre di informazioni sulla tossicità della sostanza per i microorganismi.
1.2. DEFINIZIONI E UNITÀ
|
CT
|
=
|
concentrazione della sostanza in esame espressa come carbonio organico presente o addizionato al liquame sedimentato all'inizio dei periodo di aerazione (mg/l)
|
|
Ct
|
=
|
concentrazione del carbonio organico disciolto rinvenuto nel surnatante del saggio alla fine del periodo di aerazione (mg/l)
|
|
Cc
|
=
|
concentrazione del carbonio organico disciolto rinvenuto nel surnatante del controllo alla fine del periodo di aerazione (mg/l)
|
Nel presente metodo la biodegradazione è definita come eliminazione del carbonio organico. La biodegradazione può essere espressa come:
|
1)
|
la rimozione percentuale DDa della sostanza aggiunta giornalmente:
|
|
[1]
|
dove:
|
Dda
|
=
|
degradazione/aggiunta giornaliera.
|
|
|
2)
|
la rimozione percentuale Dssd di sostanza rispetto a quella presente all'inizio di ogni giorno:
|

|
[2 (a)]
|
|

|
[2 (b)]
|
dove:
|
Dssd
|
=
|
degradazione/sostanza iniziale giornaliera.
|
Gli indici i e (i + 1) si riferiscono al giorno in cui si effettua la misurazione.
L'equazione 2(a) è consigliata se il DOC dell'effluente varia giornalmente mentre l'equazione 2(b) può essere usata quando il DOC dell'effluente rimane relativamente costante da un giorno all'altro.
|
1.3. SOSTANZE DI RIFERIMENTO
In alcuni casi quando si esamina una nuova sostanza, possono essere utili delle sostanze di riferimento; ciò nonostante non si propogono qui sostanze di riferimento specifiche.
Nell'appendice I vengono forniti dati relativi a numerosi composti analizzati in un saggio interlaboratorio soprattutto per consentire di tanto in tanto la calibrazione del metodo e per rendere possibile il confronto dei risultati quando se ne adotta un altro.
1.4. PRINCIPIO DEL METODO
I fanghi arrivi provenienti da un impianto di trattamento dei liquami vengono posti in una unità semicontinua per fanghi attivi (SCAS). Si aggiungono il composto in esame e liquame domestico sedimentato; si effettua l'aerazione della miscela per 23 ore. Quindi si interrompe l'aerazione, si lasciano decantare i fanghi e si rimouve il surnatante.
I fanghi che rimangono nella camera di aerazione vengono quindi mescolati con un'altra aliquota del composto in esame e del liquame, e si ripete il ciclo.
La biodegradazione si ricava determinando la quantità di carbonio organico disciolto nel surnatante. Tale valore viene confrontato con quello trovato nel surnatante del controllo contenente soltanto liquame decantato.
Se si utilizza un metodo analitico specifico si possono determinare le variazioni di concentrazione della sostanza in esame dovute alla biodegradazione (biodegradabilità primaria).
1.5. CRITERI DI QUALITÀ
La riproducibilità di questo metodo basato sulla rimozione di carbonio organico disciolto non è stata ancora dimostrata. (Se si prende in considerazione la biodegradazione primaria si ottengono dati molto precisi per sostanze che siano estesamente degradate.)
La sensibilità del metodo dipende soprattutto dalla variabilità del bianco ed in minor misura dalla precisione della determinazione del carbonio organico disciolto e dalla quantità del composto in esame presente nel liquido all'inizio di ogni ciclo.
1.6. DESCRIZIONE DEL METODO
1.6.1. Preparazioni
Per ciascuna sostanza in esame e per i controlli si collega un numero sufficiente di unità di aerazione pulite (in alternativa si può usare l'unità originale per il saggio SCAS da 1,5 litri) con i tubi di presa dell'aria (figura 1). L'aria compressa inviata nelle unità di saggio, purificata con un filtro di cotone grezzo, deve essere esente da carbonio organico e satura di acqua per ridurre le perdite per evaporazione.
Da un impianto di trattamento a fanghi attivi adibito prevalentemente a liquami domestici si preleva un campione di liquido chiarificato, contenente da 1 a 4 g/l di solidi sospesi. Per ciascuna unità di aerazione occorrono circa 150 ml di liquido chiarificato.
Si preparano con acqua distillata le soluzioni madri della sostanza in esame; di solito è richiesta una concentrazione di 400 mg/l di carbonio organico che, se non ha luogo biodegradazione, corrisponde ad una concentrazione di sostanza in esame pari a 20 mg/l di carbonio all'inizio di ogni ciclo di aerazione.
Se la tossicità per i microorganismi lo consente si possono avere concentrazioni più elevate.
Si misura la concentrazione di carbonio organico nelle soluzioni madri.
1.6.2. Condizioni del saggio
Il saggio va effettuato da 20 a 25 oC.
Si utilizza un'elevata concentrazione di microorganismi aerobici (da 1 a 4 g/l di solidi sospesi) ed il periodo di ritenzione effettivo è di 36 ore. In genere, otto ore dopo l'avvio di ciascun ciclo di aerazione, il carbonio organico contenuto nei liquami immessi è ampiamente ossidato. Dopo ha inizio la respirazione endogena del fango che si manterrà per tutto il rimanente periodo di aerazione, durante il quale il solo substrato disponibile è la sostanza in esame a meno che non venga anch'essa metabolizzata rapidamente. Questi fattori, unitamente alla reinoculazione giornaliera del sistema (cfr. paragrafo 1.4), nel caso in cui si usino come mezzo liquami domestici, crea condizioni estremamente favorevoli sia per l'acclimatazione, sia per ottenere elevati valori di biodegradazione.
1.6.3. Esecuzione del saggio
Si preleva un campione del liquido chiarificato da un idoneo impianto a fanghi attivi per il trattamento di liquami in prevalenza domestici oppure da un impianto di laboratorio e si mantiene in condizioni aerobiche sino all'impiego in laboratorio. Si riemie ciascuna unità di aerazione e l'unità di controllo con 150 ml (se si utilizza l'unità originale per il saggio SCAS, moltiplicare i volumi per 10) di liquido chiarificato e si avvia l'aerazione. Dopo 23 ore si interrompe l'aerazione e si lasciano decantare i fanghi per 45 minuti. Si apre, a turno, il rubinetto di ogni recipiente e si prelevano aliquote da 100 ml di surnatante. Si prepara, immediatamente prima dell'impiego, un campione di liquami domestici decantati e se ne aggiungono 100 ml al fango che rimane in ciascuna unità di aerazione. Si avvia nuovamente l'aerazione. A questo punto non si aggiunge la sostanza da esaminare e si alimentano giornalmente le unità con liquami domestici fino a quando si forma per decantazione un surnatante chiaro. In genere questa fase richiede al massimo due settimane e nel frattempo il carbonio organico disciolto nel surnatante raggiunge alla fine di ogni ciclo di aerazione un valore costante.
Terminata questa fase, i singoli fanghi sedimentati vengono mescolati tra loro e 50 ml di tale miscela vengono introdotti in ciascuna unità.
95 ml di liquame sedimentato e 5 ml di acqua vengono aggiunti all'unità di controllo, e 95 ml di liquame sedimentato più 5 ml della soluzione madre della sostanza in esame (400 mg/l) vengono aggiunti alle unità di saggio. Si riavvia l'aerazione e si protrae per 23 ore. Si lasciano quindi sedimentare i fanghi per 45 minuti, si preleva il surnatante e se ne analizza il contenuto di carbonio organico disciolto.
Le suddette operazioni di riempimento e di prelievo, vengono ripetute ogni giorno per tutta la durata del saggio.
Prima della sedimentazione può essere necessario pulire le pareti delle unità per evitare che si accumulino solidi al di sopra del livello del liquido. Per evitare contaminazioni incrociate si utilizza un raschiatore o una spazzola diversa per ciascuna unità.
Idealmente, il carbonio organico disciolto nei surnatanti dovrebbe essere determinato ogni giorno anche se si può consentire una minore frequenza delle analisi. Prima delle analisi i liquidi vengono filtrati mediante filtri a membrana con pori da 0,45 μm lavati oppure vengono centrifugati. Il filtri a membrana sono idonei se durante la filtrazione non liberano carbonio organico né assorbono la sostanza in esame. Nella centrifuga la temperatura del campione non deve superare i 40 gradi centrigradi.
La durata del saggio per i composti che mostrano una biodegradazione limitata o nulla non è fissata, ma l'esperienza suggerisce che la durata dovrebbe essere, in generale, di almeno 12 settimane, ma non più lunga di 26 settimane.
2. DATI E VALUTAZIONE
I valori del carbonio organico disciolto rilevati nei surnatanti delle unità di saggio e delle unità di controllo vengono riportati in grafico in funzione del tempo.
Con il procedere della biodegradazione i valori determinati nel saggio si avvicinano a quelli del controllo, Quando la differenza tra i due livelli si mantiene costante per oltre tre misurazioni consecutive, si esegue un numero di ulteriori misurazioni, tale da effettuare una elaborazione statistica dei dati e da calcolare la biodegradazione percentuale subita dalla sostanza in esame (Dda oppure Dssd, cfr. paragrafo 1.2).
3. RELAZIONE
3.1. RELAZIONE SUL SAGGIO
Nella relazione sul saggio devono figurare, se possibile:
|
—
|
tutte le informazioni sul tipo di liquame, sul tipo di unità usata e sui risultati sperimentali concernenti le sostanze esaminate, la sostanza di riferimento, se usata, ed il bianco,
|
|
—
|
la curva di rimozione, nonché descrizione e metodo di calcolo relativi (cfr. paragrafo 1.2),
|
|
—
|
date e luogo di prelievo dei fanghi attivi e del liquame, stato di adattamento, concentrazione, ecc.,
|
|
—
|
motivazioni scientifiche di eventuali modifiche del procedimento,
|
3.2. INTERPRETAZIONI DEI RISULTATI
Dato che le sostanze esaminate con il presente metodo non sono facilmente biodegradabili, qualsiasi rimozione del DOC imputabile esclusivamente alla biodegradazione avviene in genere gradualmente nel corso di giorni o settimane, ad eccezione di quei casi in cui avviene una improvvisa acclimatazione indicata da una brusca scomparsa che si verifica dopo alcune settimane.
In ogni caso l'assorbimento chimico-fisico può a volte giocare un ruolo importante; ciò si verifica quando all'inizio della prova si riscontra una parziale o completa rimozione del DOC aggiunto. Ciò che accade successivamente, dipende da fattori quali il grado di assorbimento e la concentrazione di solidi sospesi nell'effluente di scarico. Di solito la differenza tra concentrazione del DOC nel controllo e nei surnatanti del saggio aumenta gradualmente rispetto al basso valore iniziale e tale differenza si mantiene quindi al nuovo valore per il resto della prova a meno che non si verifichi l'acclimatazione.
Se si vuole distinguere nel grafico la biodegradazione (o la parziale biodegradazione) dall'assorbimento, sono necessari ulteriori saggi. Questi possono essere effettuati in diversi modi: il più convincente è quello di usare il surnatante o i fanghi come inoculo in un saggio del dossier di base (preferibilmente il saggio respirometrico).
Le sostanze che in questo saggio mostrano un'elevata rimozione del DOC, non dovuta ad assorbimento, devono essere considerate potenzialmente biodegradabili. Un'eliminazione parziale non dovuta ad assorbimento indica che la sostanza è almeno in parte biodegradabile.
Valori bassi o nulli di rimozione del DOC possono essere dovuti ad un effetto inibente della sostanza in esame sui microorganismi, il che può anche essere evidenziato da lisi o da riduzione dei fanghi con formazione di surnatanti torbidi. Il saggio deve essere ripetuto a concentrazione più bassa della sostanza in esame.
Il ricorso a un metodo analitico specifico o alla marcatura della sostanza in esame con il 14C può permettere una maggiore sensibilità. Nel caso di composti marcati con 14C lo sviluppo di 14CO2 confermerà che la biodegradazione ha avuto luogo.
Quando i risultati vengono presentati anche come biodegradazione primaria occorre dare, se possibile, una spiegazione del cambiamento di struttura chimica che causa la diminuzione di risposta della sostanza in esame.
Si deve dimostrare la validità del metodo analitico e riportare la risposta fornita dal bianco.
4. BIBLIOGRAFIA
|
(1)
|
OCSE, Parigi 1981, Linea Guida 302 A, decisione C(81) 30 def. del Consiglio.
|
Appendice 1
Saggio SCAS: Esempio di risultati
|
Sostanza
|
(mg/l)
|
Ct — Cc
(mg/l)
|
Biodegradazion* percentuale
Dda
|
Durata del saggio
(giorni)
|
|
4-acetil aminobenzen sulfonato
|
17,2
|
2,0
|
85
|
40
|
|
Tetrapropilene benzen sulfonato
|
17,3
|
8,4
|
51,4
|
40
|
|
4-nitrofenolo
|
16,9
|
0,8
|
95,3
|
40
|
|
Glicol dietilenico
|
16,5
|
0,2
|
98,8
|
40
|
|
Anilina
|
16,9
|
1,7
|
95,9
|
40
|
|
Ciclopentano tetra carbossilato
|
17,9
|
3,2
|
81,1
|
120
|
Appendice 2
Esempio di apparecchiatura per il saggio
Figura 2

C.13. BIOCONCENTRAZIONE: SAGGIO SUI PESCI, METODO A FLUSSO CONTINUO
1. METODO
Questo metodo di bioconcentrazione corrisponde al metodo OCSE TG 305 (1996).
1.1. INTRODUZIONE
Il presente metodo descrive una procedura per caratterizzare il potenziale di bioconcentrazione di una sostanza nei pesci in condizioni di flusso continuo. Benché i regimi di saggio a flusso continuo siano ampiamente preferibili, sono ammissibili regimi semistatici, purché soddisfatti i criteri di validità.
Il metodo fornisce dettagli sufficienti per eseguire il saggio concedendo una libertà adeguata per adattare l'impianto sperimentale alle particolari condizioni di laboratorio e alla variabilità delle caratteristiche delle sostanze analizzate. La sua validità è massima per composti chimici organici stabili con log Poa compreso tra 1,5 e 6,0 (1), ma è applicabile anche a sostanze superlipofile (log Poa> 6,0). La stima preliminare del fattore di bioconcentrazione (BCF), indicato talvolta con KB, per tali sostanze superlipofile sarà presumibilmente più elevata del fattore di bioconcentrazione allo stato stazionario (BCFSS) prevedibilmente ottenuto da esperimenti di laboratorio. Stime preliminari del fattore di bioconcentrazione per composti chimici organici con valori di log Poa fino a circa 9,0 si possono ricavare dall'equazione di Bintein at al (2). I parametri che caratterizzano il potenziale di bioconcentrazione includono la costante di velocità di assorbimento (kl), la costante di velocità di depurazione (k2) e il BCFSS.
L'analisi dei campioni di acqua e di pesce può risultare più facile se le sostanze in esame sono radiomarcate; e queste possono venire utilizzate per determinare se sia il caso di procedere all'identificazione e alla qualificazione dei prodotti di degradazione. Se si misurano i residui radioattivi totali (per esempio per combustione o solubilizzazione dei tessuti), il BCF risulta basato sul composto progenitore, eventuali metaboliti trattenuti e anche sul carbonio assimilato. I BCF basati sui residui radioattivi totali non sono pertanto confrontabili direttamente con un BCF ottenuto mediante analisi chimica specifica del solo composto progenitore.
Negli studi con radiomarcante si possono impiegare procedure di bonifica per determinare il BCF sulla base del composto progenitore, e se ritenuto necessario si possono caratterizzare i principali metaboliti. È anche possibile combinare uno studio di metabolismo nei pesci con uno studio di bioconcentrazione mediante l'analisi e l'identificazione dei residui nei tessuti.
1.2. DEFINIZIONI E UNITÀ
Bioconcentrazione/Bioaccumulo è l'aumento di concentrazione della sostanza in esame in o su un organismo (suoi tessuti specificati) rispetto alla concentrazione della sostanza in esame nell'ambiente circostante.
Il fattore di bioconcentrazione (BCF o KB) in qualsiasi momento durante la fase di assorbimento di questo saggio di accumulo è la concentrazione della sostanza in esame nel o sul pesce o suoi tessuti specificati [Cf in μg/g (ppm)] divisa per la concentrazione del composto chimico nell'ambiente circostante [Ca in μg/ml (ppm)].
Il fattore di bioconcentrazione allo stato stazionario (BCFSS o KB) non cambia in modo significativo su un periodo di tempo prolungato, la concentrazione della sostanza in esame nell'ambiente circostante essendo costante durante tale periodo di tempo.
Un livello costante o stato stazionario nel tracciato della sostanza in esame nei pesci (Cf) contro il tempo viene raggiunto quando la curva diventa parallela all' asse del tempo e tre analisi successive di Cf su campioni prelevati ad intervalli di almeno due giorni differiscono di non oltre il ± 20 % una dall'altra, e non vi sono differenze significative tra i tre periodi di campionamento. Quando si analizzano campioni raggruppati, sono necessarie almeno quattro analisi successive. Per il controllo di sostanze che vengono assorbite lentamente saranno più opportuni intervalli di sette giorni.
Fattori di bioconcentrazione calcolati direttamente dalle costanti di velocità cinetiche (k1/k2) sono definiti fattore di concentrazione cinetico, BCFk.
Il coefficiente di ripartizione ottanolo-acqua (Poa) è il rapporto della solubilità di un composto chimico in n-ottanolo su quella in acqua all'equilibrio (metodo A.8), espresso anche come Koa. Il logaritmo di Poa viene usato come indicazione del potenziale di bioconcentrazione di un composto chimico da parte di organismi acquatici.
La fase di esposizione o assorbimento è il tempo durante il quale i pesci sono esposti al composto chimico in esame.
La costante di velocità di assorbimento (k1) è il valore numerico che definisce la velocità di aumento della concentrazione della sostanza in esame nel o sul pesce di prova (o suoi tessuti specificati) quando il pesce viene esposto a tale composto chimico (k1 è espresso in giorni-1).
La fase post-esposizione o di depurazione (perdita) è il tempo, dopo il trasferimento del pesce di prova da un ambiente contenente la sostanza in esame ad un ambiente esente da tale sostanza, durante il quale viene studiata la depurazione (o perdita netta) della sostanza dal pesce di prova (o suo tessuto specificato).
La costante di velocità di depurazione (perdita) (k2) è il valore numerico che definisce la velocità di riduzione della concentrazione della sostanza in esame nel pesce di prova (o suoi tessuti specificati) dopo il trasferimento del pesce da un ambiente contenente la sostanza in esame ad un ambiente esente da tale sostanza (k2 è espresso in giorni-1).
1.3. PRINCIPIO DEL METODO DI SAGGIO
Il saggio è costituito da due fasi: la fase di esposizione (assorbimento) e di post-esposizione (depurazione). Durante la fase di assorbimento, gruppi separati di pesci di una stessa specie vengono esposti ad almeno due concentrazioni della sostanza in esame. Essi vengono poi trasferiti in un ambiente esente dalla sostanza in esame per la fase di depurazione. È sempre necessaria una fase di depurazione, salvo che l'assorbimento della sostanza durante la fase di assorbimento sia risultato insignificante (per esempio BCF minore di 10). La concentrazione della sostanza in esame nel o sul pesce (o suo tessuto specificato) viene seguita in tutte e due le fasi della prova. In aggiunta alle due concentrazioni di prova, un gruppo di pesci di controllo viene mantenuto in condizioni identiche, salvo per l'assenza della sostanza in esame, per confrontare possibili effetti dannosi osservati nel saggio di bioconcentrazione con un gruppo di controllo corrispondente e per ottenere concentrazioni di fondo della sostanza in esame.
La fase di assorbimento viene eseguita per 28 giorni salvo dimostrazione che l'equilibrio è stato raggiunto prima. Per una previsione della durata della fase di assorbimento e del tempo necessario per arrivare allo stato stazionario ci si può basare sull'equazione fornita nell'allegato 3. Viene poi iniziato il periodo di depurazione trasferendo il pesce in un altro contenitore pulito con lo stesso ambiente ma senza la sostanza in esame. Se possibile, il fattore di bioconcentrazione viene calcolato preferibilmente sia come rapporto (BCFSS) delle concentrazioni nel pesce (Cf) e nell'acqua (Ca) nello stato stazionario apparente che come fattore di bioconcentrazione cinetico, BCFk, che è il rapporto fra le costanti di velocità di assorbimento (k1) e di depurazione (k2) assumendo una cinetica di primo ordine. Se appare ovvio che la cinetica seguita non è di primo ordine, impiegare modelli più complessi (allegato 5).
Se lo stato stazionario non viene raggiunto entro 28 giorni, la fase di assorbimento deve essere prolungata fino al raggiungimento dello stato stazionario, con un limite massimo di 60 giorni, dopo di che si incomincia la fase di depurazione.
La costante di velocità di assorbimento, la costante di velocità di depurazione (perdita) (o le costanti nel caso di modelli più complessi), il fattore di bioconcentrazione e, se possibile, i limiti di confidenza di ciascuno di questi parametri vengono calcolati sulla base del modello che meglio descrive le concentrazioni misurate di sostanza in esame nel pesce e nell'acqua.
Il BCF è espresso in funzione del peso umido totale del pesce. Tuttavia, per scopi speciali, se il pesce è sufficientemente grande o può venire diviso in parti commestibili (filetto) e non commestibili (viscere), si possono usare tessuti od organi specificati (per esempio muscolo, fegato). Poiché per molte sostanze organiche esiste una chiara relazione tra il potenziale di bioconcentrazione e la lipofilia, esiste anche una relazione corrispondente tra il contenuto di liquidi nel pesce di prova e la bioconcentrazione osservata di tali sostanze. Pertanto, allo scopo di ridurre questa fonte di variabilità nei risultati sperimentali per le sostanze di elevata lipofilia (cioè con log Poa> 3), la bioconcentrazione dovrebbe essere espressa in relazione al contenuto di lipidi oltre che al peso corporeo totale.
Il contenuto di lipidi deve essere determinato possibilmente sullo stesso materiale biologico usato per determinare la concentrazione della sostanza in esame.
1.4. INFORMAZIONE SULLA SOSTANZA IN ESAME
Prima di eseguire la prova di bioconcentrazione si dovrebbero conoscere le seguenti informazioni sulla sostanza in esame:
|
—
|
coefficiente di ripartizione ottanolo-acqua Poa (indicato anche con Koa, determinato mediante HPLC in A.8)
|
|
—
|
fototrasformazione in acqua, determinata sotto irraggiamento solare o solare simulato e nelle condizioni di irraggiamento della prova di bioconcentrazione (3);
|
|
—
|
tensione superficiale (per sostanze per le quali non è possibile determinare il log Poa);
|
|
—
|
pronta biodegradabilità (se del caso).
|
Un'altra informazione richiesta è la tossicità nei confronti delle specie ittiche usate nel saggio, preferibilmente la CL50 asintotica (cioè indipendente dal tempo). Per la quantificazione della sostanza in esame nelle soluzioni di saggio e nel materiale biologico, oltre ai dettagli relativi alla preparazione e conservazione del campione è necessario disporre di un metodo analitico appropriato, di accuratezza, precisione e sensibilità note. Dovrebbe essere noto anche il limite di rivelazione analitica in acqua e nei tessuti del pesce della sostanza in esame. Quando per l'esame si utilizza una sostanza marcata con 1
4C è necessario conoscere la percentuale di radioattività associata ad impurezze.
1.5. VALIDITÀ DEL SAGGIO
Perché il saggio sia valido occorre rispettare le seguenti condizioni:
|
—
|
le variazioni di temperatura devono essere minori di ± 2 oC,
|
|
—
|
la concentrazione dell'ossigeno disciolto non deve scendere al di sotto del 60 % della saturazione,
|
|
—
|
la concentrazione della sostanza in esame nelle camere deve venire mantenuta entro ±20 % della media dei valori misurati durante la fase di assorbimento,
|
|
—
|
la mortalità o altri effetti dannosi o malattie sia nei pesci di controllo che in quelli trattati devono essere minori del 10 % al termine della prova. Quando la prova viene prolungata a varie settimane o mesi, il tasso di mortalità o altri effetti dannosi in tutte e due le serie di pesci deve essere minore del 5 % al mese e non superare il 30 % in totale.
|
1.6. COMPOSTI DI RIFERIMENTO
Per verificare la procedura sperimentale, laddove richiesto, può servire l'uso di composti di riferimento di potenziale di bioconcentrazione noto. Tuttavia per ora non è possibile raccomandare sostanze specifiche.
1.7. DESCRIZIONE DEL METODO DI SAGGIO
1.7.1. Apparecchiatura
Per tutte le parti dell'apparecchiatura, evitare accuratamente l'uso di materiali soggetti a dissoluzione, assorbimento o lisciviatura e che possano avere un effetto dannoso sul pesce. Si possono usare vasche rettangolari o cilindriche normali di materiale chimicamente inerte e di capacità adeguata al tasso di carico. Minimizzare l'uso di tubature in materia plastica flessibile. Usare di preferenza tubature di Teflon (R), acciaio inossidabile e/o vetro. L'esperienza ha dimostrato che per sostanze con elevati coefficienti di assorbimento come i piretroidi sintetici può essere necessario il vetro silanizzato. In queste situazioni le apparecchiature non possono venire riutilizzate.
1.7.2. Acqua
Nel saggio si usa in genere acqua naturale che dovrebbe essere prelevata da una fonte non contaminata e di qualità uniforme. L'acqua di diluizione deve essere di una qualità che permetta la sopravvivenza delle specie ittiche scelte per la durata del periodo di acclimatazione e del periodo di prova senza che mostrino alcun aspetto o comportamento anomalo. L'ideale sarebbe dimostrare che la specie in esame è in grado di sopravvivere, crescere e riprodursi nell'acqua di diluizione (per esempio in una coltura di laboratorio o in un saggio di tossicità su tutto il ciclo di vita). L'acqua deve essere caratterizzata almeno con il pH, la durezza, i solidi totali, il carbonio organico totale e di preferenza anche ammonio, nitriti e alcalinità nonché, per le specie marine, la salinità. I parametri importanti per il benessere ottimale dei pesci sono perfettamente noti, ma l'allegato 1 fornisce concentrazioni massima raccomandate per un certo numero di parametri per le acque dolci e marine usate nel saggio.
L'acqua dovrebbe essere di qualità costante per tutta la durata di un saggio. Il pH dovrebbe essere compreso tra 6,0 e 8,5, ma durante un dato saggio deve restare entro ±0,5 unità di pH. Per assicurarsi che l'acqua di diluizione non abbia influenze indesiderate sul risultato sperimentale (per esempio per complessazione della sostanza in esame) o influisca dannosamente sul pesce, prelevare di quando in quando dei campioni per l'analisi. La determinazione dei metalli pesanti (per esempio Cu, Pb, Zn, Hg, Cd, Ni), dei principali anioni e cationi (per esempio Ca, Mg, Na, K, Cl, SO4), dei pesticidi (per esempio pesticidi organofosforati totali e organoclorurati totali), del carbonio organico totale e dei solidi in sospensione deve essere effettuata per esempio ogni 3 mesi, ove si sappia che l'acqua di diluizione è di qualità relativamente costante. Se la qualità dell'acqua si è dimostrata costante per almeno un anno, le determinazioni possono essere effettuate con minore frequenza, a intervalli più lunghi (per esempio ogni sei mesi).
Il contenuto naturale di particelle in sospensione nonché il carbonio organico totale (TOC) nell'acqua di diluizione devono essere i più bassi possibili per evitare un assorbimento della sostanza in esame su materia organica che ne può ridurre la biodisponibilità (4). Il valore massimo accettabile è di 5 mg/l per i solidi sospesi (materia secca che non passa attraverso un filtro da 0,45 μm) e di 2 mg/l per il carbonio organico totale (vedi allegato 1). Se necessario, filtrare l'acqua prima dell'uso. Il contributo del pesce di prova al contenuto di carbonio organico nell'acqua (escrezioni) e quello dei residui alimentari deve essere il più basso possibile. Durante tutto il saggio, la concentrazione del carbonio organico nel recipiente di esecuzione del saggio non deve superare la concentrazione di carbonio organico derivata dalla sostanza in esame e dall'eventuale agente solubilizzante più di 10 mg/l (± 20 %).
1.7.3. Soluzioni di saggio
Preparare una soluzione madre («stock») della sostanza in esame a una concentrazione adatta. La soluzione madre deve essere preparata preferibilmente per semplice miscelazione o agitazione della sostanza in esame nell'acqua di diluizione. È preferibile non usare solventi o disperdenti (agenti solubilizzanti); può tuttavia essere opportuno in alcuni casi per produrre una soluzione madre di concentrazione adatta. Solventi che si possono usare sono etanolo, metanolo, etere monometilico del glicol etilenico, etere dimetilico del glicol etilenico, dimetilformammide e glicol trietilenico. Disperdenti utilizzabili sono Cremophor RH40, Tween 80, metilcellulosa 0,01 % e HCO-40. Prestare attenzione quando si usano agenti prontamente biodegradabili perché possono causare problemi di crescita batterica nelle prove a flusso continuo. La sostanza in esame può essere radiomarcata e dovrebbe avere la massima purezza (preferibilmente > 98 %).
Per le prove a flusso continuo occorre un sistema che eroghi e diluisca in continuo una soluzione madre della sostanza in esame (per esempio pompa dosatrice, diluitore proporzionale, sistema di saturazione) per fornire le concentrazioni di prova nelle camere di saggio. Il volume di ciascuna camera di saggio deve essere sostituito preferibilmente almeno cinque volte al giorno. La modalità a flusso continuo va preferita, ma laddove non sia possibile (per esempio quando ciò ha un'influenza dannosa sugli organismi in esame) si può utilizzare una tecnica semistatica, purché siano rispettati i criteri di validità. Le portate di soluzione madre e acqua di diluizione devono essere controllate 48 ore prima del saggio e poi almeno una volta al giorno durante il saggio. In questo controllo deve essere inclusa la determinazione della portata attraverso ciascuna camera di saggio e si deve garantire che questa vari non più del 20 % all'interno di ciascuna camera e tra una camera e l'altra.
1.7.4. Scelta delle specie
Criteri importanti nella scelta delle specie sono la disponibilità, la possibilità di ottenerle di dimensioni convenienti e di mantenerle in modo soddisfacente in laboratorio. Altri criteri per la scelta delle specie ittiche includono l'importanza ricreativa, commerciale ed ecologica nonché una sensibilità paragonabile, il fatto che essa sia stata già utilizzata con successo in passato, ecc.
Specie sperimentali raccomandate sono indicate nell'allegato 2. Si possono usare anche altre specie, ma può darsi che la procedura di saggio debba venire adattata per ottenere condizioni sperimentali idonee. In questo caso, la relazione deve indicare la ragione della scelta della specie e il metodo di saggio.
1.7.5. Stabulazione del pesce
Acclimatare la popolazione ittica di scorta per almeno due settimane in acqua alla temperatura di saggio e alimentarla con mangime dello stesso tipo usato durante il saggio in quantità sufficiente.
Dopo un periodo di ambientazione di 48 ore, si registra la mortalità e si applicano i seguenti criteri:
|
—
|
mortalità superiore al 10 % della popolazione in sette giorni: l'intera partita viene respinta,
|
|
—
|
mortalità tra il 5 % e il 10 % della popolazione in sette giorni: l'acclimatazione prosegue per altri sette giorni,
|
|
—
|
mortalità minore del 5 % della popolazione in sette giorni: la partita è accettabile — in caso di mortalità superiore al 5 % durante il secondo periodo di sette giorni l'intera partita viene respinta.
|
Assicurarsi che i pesci usati nelle prove non presentino malattie o anomalie osservabili. Scartare qualsiasi pesce ammalato. Nelle due settimane che precedono il saggio e durante il saggio i pesci non devono ricevere alcun trattamento per la cura di malattia.
1.8. ESECUZIONE DEL SAGGIO
1.8.1. Saggio preliminare
Può essere utile condurre un esperimento preliminare allo scopo di ottimizzare le condizioni sperimentali del test definitivo, per esempio la scelta delle concentrazioni della sostanza in esame e la durata delle fasi di assorbimento e di depurazione.
1.8.2. Condizioni di esposizione
1.8.2.1. Durata della fase di assorbimento
La durata prevedibile della fase di assorbimento si può ricavare dall'esperienza pratica (per esempio da uno studio precedente o da un composto chimico con accumulo simile) o da certe relazioni empiriche, conoscendo la solubilità in acqua o il coefficiente di ripartizione ottanolo/acqua della sostanza in esame (vedi allegato 3).
La fase di assorbimento deve durare 28 giorni, salvo dimostrazione che l'equilibrio è stato raggiunto prima. Se in 28 giorni non si raggiunge lo stato stazionario, prolungare la fase di assorbimento effettuando ulteriori misure, fino al raggiungimento dello stato stazionano, con un massimo di 60 giorni.
1.8.2.2. Durata della fase di depurazione
Un periodo pari a metà della durata della fase di assorbimento è solitamente sufficiente per una riduzione appropriata (per esempio del 95 %) del carico della sostanza nel corpo (vedi allegato 3 per una spiegazione della stima). Se il tempo necessario per raggiungere una perdita del 95 % è troppo lungo nella pratica, per esempio se supera il doppio della normale durata della fase di assorbimento (cioè oltre 56 giorni), si può utilizzare un periodo più breve (fino ad una riduzione della concentrazione della sostanza in esame al di sotto del 10 % della concentrazione nello stato stazionario). Tuttavia, per sostanze con caratteristiche di assorbimento e depurazione più complesse di quelle rappresentate da un modello ittico a compartimento singolo, che fornisce una cinetica di primo ordine, prevedere fasi di depurazione più lunghe per la determinazione delle costanti di velocità di perdita. Il periodo può tuttavia dipendere dal tempo durante il quale la concentrazione della sostanza in esame nel pesce rimane al di sopra del limite analitico di rivelazione.
1.8.2.3. Numero di pesci di prova
Scegliere il numero di pesci per ogni concentrazione di prova in modo tale che ad ogni campionamento siano disponibili almeno quattro pesci per campione. Se si richiede una potenza statistica più elevata, sarà necessario un maggior numero di pesci per campione.
Se si usano pesci adulti, indicare nella relazione se l'esperimento viene effettuato con maschi o femmine o ambedue. Se si utilizzano tutti e due i sessi, prima di incominciare l'esposizione documentare che le differenze di contenuto di lipidi tra i sessi non siano significative; può essere necessario raggruppare tutti i maschi e tutte le femmine.
In ogni saggio scegliere pesci di peso simile, tale che il più piccolo abbia un peso non inferiore a due terzi del più grande. I pesci dovrebbero essere tutti della stessa classe di età e provenire dalla stessa fonte. Poiché il peso e l'età di un pesce sembrano talvolta avere un effetto significativo sui valori di BCF (1), riportare accuratamente questi dettagli nella relazione. Si raccomanda di pesare un sottocampione dello stock di pesci prima del saggio per stimare il peso medio.
1.8.2.4. Carico
Usare rapporti acqua su pesce elevati per minimizzare la riduzione di Ca causata dall'aggiunta del pesce all'inizio del saggio e per evitare riduzioni della concentrazione di ossigeno disciolto. È importante che il carico sia appropriato per la specie usata nel saggio. In ogni caso si raccomanda normalmente un carico di 0,1-1,0 g di pesce (peso umido) per litro d'acqua per giorno. Si possono utilizzare carichi elevati se si dimostra che la concentrazione della sostanza in esame può venire mantenuta entro i limiti di ± 20 % del valore richiesto, e che la concentrazione dell'ossigeno disciolto non scende al di sotto del 60 % della saturazione.
Nella scelta di appropriati regimi di carico si deve tener conto dell'habitat normale della specie ittica. Per esempio, pesci che vivono sul fondo, a pari volume d'acqua, possono richiedere un acquario con area di fondo più grande rispetto alle specie ittiche pelagiche.
1.8.2.5. Alimentazione
Durante i periodi di acclimatazione e di saggio, mantenere i pesci ad un regime alimentare appropriato, avente un contenuto di lipidi e di proteine totali noto, in quantità sufficiente per tenerli in condizioni di buona salute e per mantenere il peso corporeo. Per tutto il periodo di acclimatazione e di prova somministrare ai pesci il cibo in una quantità approssimativamente dall'1 % al 2 % del peso corporeo al giorno; nella maggior parte delle specie ittiche questo regime mantiene la concentrazione dei lipidi ad un livello relativamente costante durante il saggio. La quantità di mangime deve venire ricalcolata, per esempio una volta alla settimana, per mantenere costanti il peso corporeo e il contenuto di lipidi. Per questo calcolo, si può stimare il peso dei pesci in ciascuna camera di saggio in base al peso del pesce campionato più recentemente nella stessa camera. Non pesare i pesci rimasti nella camera.
Cibo non consumato e feci vengono sifonati giornalmente dalle camere di saggio poco dopo la fornitura del cibo (da 30 minuti a 1 ora). Mantenere le camere più pulite possibile per tutto il saggio in modo che la concentrazione di materia organica rimanga più scarsa possibile perché la presenza di carbonio organico può limitare la biodisponibilità della sostanza in esame (1).
Poiché molti mangimi derivano da farina di pesce, analizzare il contenuto della sostanza in esame nel mangime. È desiderabile analizzare nel mangime anche il contenuto di pesticidi e metalli pesanti.
1.8.2.6. Luce e temperatura
Il fotoperiodo è normalmente da 12 a 16 ore e la temperatura (± 2 oC) dovrebbe essere appropriata per la specie di prova (cfr. allegato 2). Il tipo e le caratteristiche dell'illuminazione devono essere noti. Fare attenzione ad una possibile fototrasformazione della sostanza in esame nelle condizioni di irraggiamento dello studio. Usare un'illuminazione appropriata evitando l'esposizione del pesce a fotoprodotti non naturali. In alcuni casi può essere appropriato utilizzare un filtro per bloccare la radiazione UV al di sotto di 290 nm.
1.8.2.7. Concentrazioni di prova
I pesci vengono esposti in condizioni di flusso continuo ad almeno due concentrazioni della sostanza in esame in acqua. Normalmente la concentrazione più elevata (o massima) della sostanza in esame viene scelta intorno all'1 % della sua CL50 asintotica acuta e almeno dieci volte più elevata del suo limite di rivelazione in acqua mediante il metodo analitico usato.
La concentrazione di prova massima può venire determinata anche dividendo la CL50 acuta a 96 ore per un appropriato rapporto acuta/cronica (rapporti appropriati per alcuni composti chimici possono essere da circa 3 fino a 100). Se possibile, scegliere l'altra o le altre concentrazioni in modo che differiscano dalla suddetta di un fattore 10. Se ciò non è possibile perché il limite analitico urta con il criterio dell'1 % della CL50, si può usare un fattore minore di 10, altrimenti prendere in considerazione la marcatura con 14C della sostanza in esame. Non usare mai una concentrazione superiore alla solubilità della sostanza in esame.
Se si usa un agente solubilizzante, la sua concentrazione non dovrebbe essere superiore a 0,1 ml/l, e deve essere uguale in tutte le vasche di saggio. Il suo contributo, insieme con la sostanza in esame, al contenuto complessivo di carbonio organico nell'acqua usata per il saggio deve essere noto. Fare comunque il possibile per evitare l'uso di tali materiali.
1.8.2.8. Prove di controllo
Oltre alla serie dei saggi, eseguire una prova di controllo con l'acqua di diluizione o, se del caso, una prova con acqua contenente l'agente solubilizzante, posto che sia stato stabilito che l'agente non ha effetti sul pesce; altrimenti eseguire tutte e due le prove di controllo.
1.8.3. Frequenza delle misure della qualità dell'acqua
Durante il saggio, misurare in tutte le vasche ossigeno disciolto, TOC, pH e temperatura. La durezza totale e la salinità, se del caso, devono essere misurate nelle prove di controllo e in una vasca alla concentrazione massima. Come minimo, l'ossigeno disciolto e, se del caso, la salinità devono essere misurati tre volte — all'inizio, verso la metà e alla fine del periodo di assorbimento — e una volta alla settimana durante il periodo di depurazione. Il TOC deve essere misurato all'inizio del saggio (24 h e 48 h prima dell'inizio della fase di assorbimento) prima dell'aggiunta del pesce e almeno una volta la settimana durante le fasi di assorbimento e depurazione. La temperatura va misurata giornalmente, il pH all'inizio e al termine di ciascun periodo e la durezza una volta per ogni saggio. La temperatura dovrebbe preferibilmente essere controllata in continuo in almeno una vasca.
1.8.4. Campionamento e analisi dei pesci e dell'acqua
1.8.4.1. Programma di campionamento del pesce e dell'acqua
Per la determinazione della concentrazione della sostanza in esame, l'acqua delle camere di saggio viene campionata prima dell'aggiunta del pesce e durante le fasi di assorbimento e depurazione. Campionare l'acqua come minimo tutte le volte che viene campionato il pesce e prima della fornitura del mangime. Durante la fase di assorbimento, determinare le concentrazioni della sostanza in esame per verificare il rispetto dei criteri di validità.
I pesci vengono campionati almeno cinque volte durante la fase di assorbimento e almeno quattro volte durante la fase di depurazione. Poiché in qualche caso risulterà difficile calcolare una stima ragionevolmente precisa del BCF sulla base di questo numero di campioni, in particolare quando la cinetica di depurazione non è una semplice cinetica di primo ordine, è consigliabile prelevare campioni a frequenza più elevata in tutti e due i periodi (cfr. allegato 4). I campioni in più vengono conservati e analizzati solo se i risultati della prima serie di analisi si dimostrano inadeguati per il calcolo del BCF con la precisione desiderata.
L'allegato 4 presenta un esempio di un programma di campionamento accettabile. Se si usano altri valori di Poa per calcolare il tempo di esposizione necessario per un assorbimento del 95 %, si possono facilmente calcolare altri programmi.
Il campionamento viene continuato durante la fase di assorbimento fino a quando si stabilisce lo stato stazionario, con un limite massimo di 28 giorni. Se non si raggiunge lo stato stazionario in 28 giorni, il campionamento continua fino al raggiungimento dello stato stazionario, con un massimo di 60 giorni. Prima dell'inizio della fase di depurazione, i pesci vengono trasferiti in vasche pulite.
1.8.4.2. Campionamento e preparazione del campione
I campioni d'acqua per l'analisi vengono ottenuti per esempio mediante sifonatura attraverso tubature inerti da un punto centrale della camera di saggio. Poiché sembra che né la filtrazione né la centrifugazione separino sempre la frazione non-biodisponibile della sostanza in esame da quella biodisponibile (in particolare per composti chimici super-lipofili, cioè quelli con un log Poa > 5) (1) (5), i campioni non devono essere sottoposti a questi trattamenti.
Curare, invece, di mantenere le vasche più pulite possibile e controllare il contenuto di carbonio organico totale durante le fasi di assorbimento e depurazione.
Ad ogni campionamento rimuovere dalle camere di saggio un numero appropriato di pesci (normalmente almeno quattro). I pesci campionati vengono rapidamente risciacquati con acqua, «asciugati» per tamponamento, uccisi immediatamente con l'uso del metodo più appropriato e umano e poi pesati.
È preferibile analizzare il pesce e l'acqua immediatamente dopo il campionamento allo scopo di evitare degradazione o altre perdite e calcolare tassi approssimativi di assorbimento e depurazione nel corso del saggio. L'analisi immediata evita inoltre ritardi nella determinazione del raggiungimento di un livello costante.
In mancanza di analisi immediata, conservare i campioni mediante un metodo appropriato. Prima di iniziare lo studio procurarsi le informazioni sul metodo appropriato di conservazione per la particolare sostanza in esame — per esempio surgelazione, mantenimento a 4 oC, durata della conservazione, estrazione, ecc.
1.8.4.3. Qualità del metodo analitico
Poiché tutta la procedura è basata sostanzialmente sull'accuratezza, la precisione e la sensibilità del metodo analitico utilizzato per la sostanza in esame, controllare sperimentalmente che la precisione e la riproducibilità dell'analisi chimica, e che il recupero della sostanza in esame dall'acqua e dal pesce, siano soddisfacenti per quel particolare metodo. Inoltre, controllare che la sostanza in esame non sia rilevabile nell'acqua di diluizione usata.
Se necessario, correggere i valori di Ca e Cf ottenuti nel saggio per tener conto del livello di recupero e dei valori di fondo delle prove di controllo. Manipolare sempre i campioni di pesce e acqua in modo da minimizzare la contaminazione e le perdite (per esempio per assorbimento sul dispositivo di campionamento).
1.8.4.4. Analisi del campione di pesce
Se nel saggio vengono usati materiali radiomarcati, è possibile analizzare il radiomarcante totale (cioè progenitore e metaboliti), oppure i campioni possono venire depurati, così da poter analizzare il composto progenitore separatamente. Inoltre si possono caratterizzare i principali metaboliti allo stato stazionario, oppure al termine della fase di assorbimento se viene conclusa prima del raggiungimento dello stato stazionario. Se il BCF, in termini di residui radiomarcati totali, è ≥ 1 000 %, può essere consigliabile, e per alcune categorie di composti chimici come i pesticidi è fortemente raccomandato, identificare e quantificare i composti di degradazione che rappresentano ≥ 10 % dei residui totali nei tessuti del pesce allo stato stazionario. Se si identificano e quantificano i prodotti di degradazione che rappresentano ≥ 10 % dei residui radiomarcati totali nei tessuti del pesce, si raccomanda di identificarli e quantificarli anche nell'acqua di prova.
La concentrazione della sostanza in esame viene di solito determinata su ciascun singolo pesce pesato. Se ciò non è possibile, si possono raggruppare i campioni in occasione di ciascun campionamento, ma questo limita le procedure statistiche applicabili ai dati. Se si da importanza ad una specifica procedura statistica e alla sua potenza, nel saggio va incluso un numero di pesci adeguato per tener conto della procedura di raggruppamento e della potenza desiderate (6) (7).
Il BCF va espresso sia in funzione del peso umido totale che, per le sostanze fortemente lipofile, in funzione del contenuto di lipidi. Determinare se possibile il contenuto di lipidi nel pesce ad ogni campionamento. Per la determinazione del contenuto lipidico utilizzare metodi adatti (rif. 8 e 2 dell'allegato 3). Come metodo standard si può raccomandare la tecnica di estrazione con cloroformio/metanolo (9). I vari metodi non forniscono valori identici (10), per cui è importante indicare in dettaglio il metodo usato. Se possibile l'analisi dei lipidi deve essere effettuata sullo stesso estratto prodotto per l'analisi della sostanza in esame, perché i lipidi devono spesso venire rimossi dall'estratto prima di poterlo analizzare per via cromatografica. La differenza del contenuto di lipidi del pesce (in mg/kg di peso umido) tra l'inizio e il termine dell'esperimento non deve essere superiore a ± 25 %. Registrare anche i solidi percentuali del tessuto per poter convertire la concentrazione lipidica da base umida a base secca.
2. DATI
2.1. TRATTAMENTO DEI RISULTATI
La curva di assorbimento della sostanza in esame viene ottenuta riportando la sua concentrazione nel/sul pesce (o tessuti specificati) durante la fase di assorbimento contro il tempo su scale aritmetiche. Se la curva ha raggiunto un andamento costante, cioè è diventata approssimativamente asintotica all'asse del tempo, il BCFSS allo stato stazionario si calcola da:

Quando non si raggiunge lo stato stazionario si può calcolare un BCFSS di sufficiente precisione per una valutazione di rischio da uno «stato stazionario» all'80 % (1,6/k2 o al 95 % (3,0/k2 dell'equilibrio.
Determinare inoltre il fattore di concentrazione (BCFk) come rapporto k1/k2, cioè delle due costanti cinetiche di primo ordine. La costante di velocità di depurazione (k2) viene di solito determinata dalla curva di depurazione (cioè da una curva di riduzione della concentrazione della sostanza in esame nel pesce contro il tempo). La costante di velocità di assorbimento (K1) viene poi calcolata sulla base di k2 e di un valore di Cf che si ottiene dalla curva di assorbimento (vedi anche allegato 5). Il metodo preferito per l'ottenimento del BCFk e delle costanti di velocità k1 e k2 consiste nell'uso di metodi di stima parametrica non lineare su computer (11). Altrimenti, per calcolare k1 e k2 si possono usare metodi grafici. Se è evidente che la curva di depurazione non è di primo ordine, bisogna allora impiegare modelli più complessi (vedi bibliografia dell'allegato 3) con l'assistenza di un biostatistico.
2.2. INTERPRETAZIONE DEI RISULTATI
Se le concentrazioni misurate delle soluzioni di prova sono prossime al limite di rivelazione del metodo analitico, i risultati devono essere interpretati con cautela.
Curve di assorbimento e di perdita chiaramente definite sono un'indicazione di buona qualità dei dati di bioconcentrazione. La variazione delle costanti di assorbimento/depurazione tra le due concentrazioni di prova deve essere minore del 20 %. Se si osservano differenze significative nelle velocità di assorbimento/depurazione tra le due concentrazioni di prova applicate, registrarle e fornire una possibile spiegazione. In genere, il limite di confidenza di BCF ottenuti da studi ben impostati è vicino al ± 20 %.
3. RELAZIONE
La relazione sulla prova deve includere le seguenti informazioni:
3.1. SOSTANZA DI PROVA
|
—
|
natura fisica e, se del caso, proprietà chimico fisiche,
|
|
—
|
dati di identificazione chimica (incluso, se opportuno, il contenuto di carbonio organico),
|
|
—
|
se radiomarcata, la posizione precisa dell'atomo o degli atomi marcati e la percentuale di radioattività associata ad impurezze.
|
3.2. SPECIE USATA NEL SAGGIO
|
—
|
nome scientifico, ceppo, provenienza, eventuali pretrattamenti, acclimatazione, età, intervallo di dimensioni, ecc.
|
3.3. CONDIZIONI SPERIMENTALI
|
—
|
procedura di saggio usata (per esempio a flusso continuo o semistatica),
|
|
—
|
tipo e caratteristiche dell'illuminazione usata e fotoperiodo(i),
|
|
—
|
impostazione della prova (per esempio numero e dimensioni delle camere di saggio, tasso di sostituzione del volume d'acqua, molteplicità dei campioni, numero di pesci per campione, numero delle concentrazioni di prova, durata delle fasi di assorbimento e depurazione, frequenza di campionamento per i campioni di pesce e di acqua,
|
|
—
|
metodo di preparazione delle soluzioni madre e frequenza di rinnovo (se usato, indicare l'agente solubilizzante, la sua concentrazione e il suo contributo al contenuto di carbonio organico dell'acqua),
|
|
—
|
concentrazioni nominali nel saggio, medie dei valori misurati e loro deviazioni standard nelle vasche di saggio, e metodo mediante cui sono stati ottenuti questi valori,
|
|
—
|
fonte dell'acqua di diluizione, descrizione degli eventuali pretrattamenti, risultati di eventuali dimostrazioni della capacità del pesce di saggio di vivere nell'acqua, e caratteristiche dell'acqua: pH, durezza, temperatura, concentrazione di ossigeno disciolto, livelli residui di cloro (se misurati), carbonio organico totale, solidi sospesi, salinità dell'ambiente di prova (se del caso) ed eventuali altre misure effettuate,
|
|
—
|
qualità dell'acqua all'interno delle vasche di saggio, pH, durezza, TOC, temperatura e concentrazione dell'ossigeno disciolto,
|
|
—
|
informazioni dettagliate sull'alimentazione (per esempio tipo di mangime, fonte, composizione — se possibile almeno il tenore lipidico e proteico, quantità somministrata e frequenza),
|
|
—
|
informazioni sul trattamento dei campioni di pesce e d'acqua, inclusi dettagli di preparazione, conservazione, estrazione e procedure analitiche (e loro precisione) per la sostanza in esame e il contenuto di lipidi (se misurato).
|
3.4. RISULTATI
|
—
|
risultati di eventuali studi preliminari eseguiti,
|
|
—
|
mortalità dei pesci di controllo e dei pesci in ciascuna camera di esposizione ed eventuale, comportamento anomalo osservato,
|
|
—
|
contenuto di lipidi del pesce (se determinato durante l'esecuzione delle prove),
|
|
—
|
curve (con tutti i dati di misura) di assorbimento e di depurazione del composto chimico in esame nel pesce, tempo di raggiungimento dello stato stazionano,
|
|
—
|
Cf e Ca (con deviazione standard e intervallo, se del caso) per tutti i momenti di campionamento [Cf espresso in μg/g di peso umido (ppm) del corpo intero o dei suoi tessuti specificati, per esempio lipidi, e Ca in μg/ml (ppm)]. Valori di Ca per la serie di controllo (riportare anche il valore di fondo),
|
|
—
|
fattore di bioconcentrazione allo stato stazionario (BCFSS) e/o fattore di concentrazione cinetico (BCFk) e, se del caso, limiti di confidenza al 95 % per le costanti di velocità di assorbimento e depurazione (perdita) (tutte espresse in relazione al corpo intero e al contenuto totale di lipidi, se misurato, dell'animale o di suoi tessuti specificati), limiti di confidenza e deviazione standard (se disponibili) e metodi di calcolo o analisi dei dati per ciascuna concentrazione della sostanza in esame usata,
|
|
—
|
se vengono usate sostanze radio-marcate, e se richiesto, si può presentare l'accumulo di tutti i metaboliti rilevati,
|
|
—
|
qualsiasi cosa insolita riguardo al saggio, eventuali deviazioni da queste procedure e qualsiasi altra informazione pertinente.
|
Minimizzare i risultati come «non rilevato a questo limite di rivelazione» mediante lo sviluppo pre-test del metodo e l'imposizione sperimentale, perché tali risultati non possono venire utilizzati per i calcoli delle costanti di velocità.
4. BIBLIOGRAFIA
|
(1)
|
Connell D.W. (1988). Bioaccumulation behaviour of persistent chemicals with aquatic organisms. Rev. Environ. Contam. Toxicol. 102, pp 1 17-1.56.
|
|
(2)
|
Bintein S., Devillers J. and Karcher W. (1993). Nonlinear dependence of fish bioconcentration on n-octanol/'water partition coefficient. SAR and QSAR in Environmental Research, 1, 29-390.
|
|
(3)
|
OECD, Paris (1996). Direct Phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals. No. 3.
|
|
(4)
|
Kristensen P. (1991). Bioconcentration in fish: Comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate organic matter to the bioavailability of chemicals. Water Quality Institute, Denmark.
|
|
(5)
|
US EPA 822-R-94-002 (1994) Great Lake Water Quality Initiative Technical Support Doc. for the Procedure to Determine Bioaccumulation Factors. July 1994.
|
|
(6)
|
US FDA, (Food and Drug Administration) Revision. Pesticide analytical manual, 1, 5600 Fisher's Lane, Rockville, MD 20852, July 1975.
|
|
(7)
|
US EPA (1974). Section 5, A(l) Analysis of Human or Animai Adipose Tissue, in Analysis of Pesticide Residues in Human and Environmental Samples, Thompson J.F. (ed.) Research Triangle Park, N.C. 27711.
|
|
(8)
|
Compaan H. (1980) in «The determination of the possible effects of chemicals and wastes on the aquatic environment: degradation, toxicity, bioaccumulation», Ch. 2.3, Part II. Government Publishing Office, The Hague, The Netherlands.
|
|
(9)
|
Gardner et al, (1995) Limn. & Oceanogr. 30, 1099-1105.
|
|
(10)
|
Randall R.C., Lee H., Ozretich R.J., Lake J.L. and Pruell R.J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Envir. Toxicol. Chem. 10, pp 1431-1436.
|
|
(11)
|
CEC, Bioconcentration of chemical substances in fish: the flow-through method-Ring Test Programme, 1984-1985. Final report March 1987. Authors: P. Kristensen and N. Nyholm.
|
|
(12)
|
ASTM E-1022-84 (Reapproved 1988) Standard Practice for conducting Bioconcentration Tests with Fishes and Saltwater Bivalve Molluscs.
|
ALLEGATO 1
Caratteristiche chimiche di un'acqua di diluizione accettabile
|
|
Sostanza
|
Concentrazione limite
|
|
1
|
Solidi sospesi
|
5 mg/l
|
|
2
|
Carbonio organico totale
|
2 mg/l
|
|
3
|
Ammoniaca non ionizzata
|
1 μg/l
|
|
4
|
Cloro residuo
|
10 μg/l
|
|
5
|
Pesticidi organofosforati totali
|
50 μg/l
|
|
6
|
Pesticidi organoclorurati totali più bifenili policlorurati
|
50 μg/l
|
|
7
|
Cloro organico totale
|
25 μg/l
|
|
8
|
Alluminio
|
1 μg/l
|
|
9
|
Arsenico
|
1 μg/l
|
|
10
|
Cromo
|
1 μg/l
|
|
11
|
Cobalto
|
1 μg/l
|
|
12
|
Rame
|
1 μg/l
|
|
13
|
Ferro
|
1 μg/l
|
|
14
|
Piombo
|
1 μg/l
|
|
15
|
Nichel
|
1 μg/l
|
|
16
|
Zinco
|
1 μg/l
|
|
17
|
Cadmio
|
100 μg/l
|
|
18
|
Mercurio
|
100 μg/l
|
|
19
|
Argento
|
100 μg/l
|
ALLEGATO 2
Specie ittiche raccomandate per l'esecuzione del saggio
|
|
Specie raccomandata
|
Intervallo di temperatura raccomandato per la prova ( oC)
|
Lunghezza totale raccomandata dell' animale di prova (cm)
|
|
1
|
Danio rerio (18) (Teleostei, Cyprinidae) (Hamilton-Buchanan) Danio zebrato
|
20-25
|
3,0±0,5
|
|
2
|
Pimephales promelas (Teleostei, Cyprinidae) (Rafinesque) Fathead minnow
|
20-25
|
5,0±2,0
|
|
3
|
Cyprinus carpio (Teleostei, Cyprinidae) (Linnaeus) Carpa comune
|
20-25
|
5,0±3,0
|
|
4
|
Oryzias latipes (Teleostei, Poeciliidae) (Temminck e Schlegel) Ricefish
|
20-25
|
4,0±1,0
|
|
5
|
Poecilia reticulata (Teleostei, Poeciliidae) (Peters) Guppy
|
20-25
|
3,0±1,0
|
|
6
|
Lepomis macrochirus (Teleostei, Centrarchidae) (Rafinesque) Bluegill
|
20-25
|
5,0±2,0
|
|
7
|
Oncorhynchus mykiss (Teleostei, Salmonidae) (Walbaum) Trota iridea
|
13-17
|
8,0±4,0
|
|
8
|
Gasterosteus aculeatus (Teleostei, Gasterosteidae) (Linnaeus) Spinarello
|
18-20
|
3,0±1,0
|
Varie specie di estuario e marine sono in uso in differenti paesi, per esempio:
|
Corvina striata
|
Leiostomus xanthurus
|
|
Sheepshead minnow
|
Cyprinodon variegatus
|
|
Latterino
|
Menidia beryllina
|
|
Shiner perch
|
Cymatogaster aggregata
|
|
English sole
|
Parophrys vetulus
|
|
Staghorn sculpin
|
Leptocottus armatus
|
|
Spinarello
|
Gasterosteus aculeatus
|
|
Spigola
|
Dicentracus labrax
|
|
Alborella
|
Alburnus alburnus
|
Raccolta
I pesci d'acqua dolce suelencati sono facilmente allevabili e/o sono largamente disponibili per tutto l’anno, mentre la disponibilità delle specie marine e di estuario è parzialmente confinata ai rispettivi paesi. Possono riprodursi e venire allevati sia in stabilimenti di acquacoltura che in laboratorio, in condizioni di controllo delle malattie e dei parassiti, in modo che gli animali di saggio siano sani e geneticamente controllati. Questi pesci sono disponibili in molte parti del mondo.
ALLEGATO 3
Previsione della durata delle fasi di assorbimento e depurazione
1. Previsione della durata della fase di assorbimento
Prima di eseguire il saggio, si può ricavare una stima di k2 e quindi di una data percentuale del tempo occorrente per arrivare allo stato stazionario da relazioni empiriche tra k2 e il coefficiente di ripartizione n-ottanolo/acqua (Poa) o tra k2 e la solubilità in acqua (s).
Una stima di k2 (giorni-1) si può ottenere per esempio dalla seguente relazione empirica (1):
|
log10k2 = 0,414 log10(Poa) +1,47 (r2 = 0,95)
|
[equazione 1]
|
Per altre relazioni cfr. rif. (2).
Se il coefficiente di ripartizione (Poa) non è noto, si può ricavare una stima (3) conoscendo la solubilità in acqua della sostanza da utilizzare:
|
log10(Poa) = 0,862 log10(s) +0,710 (r2 = 0,994)
|
[equazione 2]
|
in cui
s = solubilità (moli/1): (n = 36)
Queste relazioni valgono solo per composti chimici con valori di Poa compresi tra 2 e 6,5 (4).
Il tempo necessario per raggiungere una certa percentuale dello stato stazionario si può ricavare, applicando il valore stimato di k2, dall'equazione cinetica generale che descrive l'assorbimento e la depurazione (cinetica di primo ordine):

o, se C è costante:
|
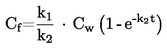
|
[equazione 3]
|
Approssimandosi allo stato stazionario, (t — ∞), l'equazione 3 può venire ridotta (5) (6) a:
 or Cf/Cw = k1/k2
= BCF
or Cf/Cw = k1/k2
= BCF
Cw è allora k1/k2 . un'approssimazione della concentrazione nel pesce allo «stato stazionario» (Cfs).
L'equazione 3 può venire riscritta come:
|

o
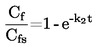
|
[equazione 4]
|
Applicando l'equazione 4, si può prevedere il tempo necessario per raggiungere una certa percentuale dello stato stazionario quando k2 sia stato pre-stimato con l'equazione 1 o 2.
Indicativamente, la durata statisticamente ottimale della fase di assorbimento per ottenere dati statisticamente accettabili (BCFK) è il periodo necessario perché la cura del logaritmo della concentrazione della sostanza in esame nel pesce contro il tempo, su scala lineare raggiunga il suo punto medio, o 1,6/k2, o 80 % dello stato stazionario, ma non più di 3,0/k2 o 95 % dello stato stazionario (7).
Il tempo necessario per raggiungere 1'80 % dello stato stazionario si ottiene da (equazione 4):
|
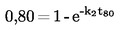
o
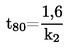
|
[equazione 5]
|
Similmente, il 95 % dello stato stazionario si ottiene da:
|

|
[equazione 6]
|
Per esempio, la durata dalla fase di assorbimento (as) per una sostanza in esame con log Poa = 4 sarà (utilizzando le equazioni 1, 5, 6):
|
log10k2 = -0,414.(4) + 1,47
|
k2 = 0,652 giorni-1
|
top = t80 = 1,6/0,652, cioè 2,45 giorni (59 ore)
o top = t95 = 3,0/0,652, cioè 4,60 giorni (110 ore)
Similmente, per una sostanza con s = 10-5 mol/l (log(s) = - 5,0), la durata dell'assorbimento sarà (utilizzando le equazioni 1, 2, 5, 6):
log10 (Poa) = -0,862 (-5,0) +0,710 = 5,02
log10k2 = -0,414 (5,02) +1,47
k2 = 0,246 giorni-1
top
= t80
=1,6/0,246, cioè 6,5 giorni (156 ore)
o top = t95 = 3,0/0,246, cioè 12,2 giorni (293 ore)
In alternativa, si può utilizzare l'espressione:
teq = 6,54 x 10-3 Poa + 55,31 (ore)
per calcolare il tempo necessario per raggiungere uno stato stazionario efficace (4).
2. Previsione della durata della fase di depurazione
Una previsione del tempo necessario per ridurre il carico sul corpo ad una certa percentuale della concentrazione iniziale si può ricavare anch'essa dall'equazione generale che descrive l'assorbimento e la depurazione (cinetica di primo ordine) (1) (8).
Per la fase di depurazione, si assume che Ca sia zero. L'equazione si può ridurre a:
 o
o 
dove Cf, o è la concentrazione all'inizio del periodo di depurazione. Una depurazione del 50 % verrà allora raggiunta al tempo (t50):
 o
o 
Similmente, una depurazione del 95 % verrà raggiunta a:

Se per il primo periodo si usa un assorbimento dell'80 % (1,6/k,) e nella fase di depurazione si usa una perdita del 95 % (3,0/k2), la fase di depurazione dura allora circa il doppio della fase di assorbimento.
È importante notare, tuttavia, che le stime sono basate sull'ipotesi che l'assorbimento e la depurazione seguano una cinetica di primo ordine. Se è ovvio che non viene seguita una cinetica di primo ordine, si devono impiegare modelli più complessi [per esempio rif (1)].
Bibliografia (dell'allegato 3)
|
(1)
|
Spacie A. and Hamelink J.L. (1982) Alternative models for describing the bioconcentration of organic in fish. Environ. Toxicol. and Chem. 1, pagine 309-320.
|
|
(2)
|
Kristensen P. (1991) Bioconcentration in fish: comparison of BCF's derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Danish Water Quality Institute.
|
|
(3)
|
Chiou C.T. and Schmedding D.W. (1982) Partitioning of organic compounds in octanol-water systems. Environ: Sci. Technol. 16 (1), pagine 4-10.
|
|
(4)
|
Hawker D.W. and Connell D.W. (1988) Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22 (6), pagine 701-707.
|
|
(5)
|
Branson D.R., Blau G.E., Alexander H.C. and Neely W.B. (1975) Transactions of the American Fisheries Society, 104 (4), pagine 785-792.
|
|
(6)
|
Ernst W. (1985) Accumulation in Aquatic organisms. In: Appraisal of tests to predict the environmental behaviour of chemicals. Ed. by Sheehman P., Korte F., Klein W. and Bourdeau P.H. Part 4.4, pagine 243-255. SCOPE, 1985, John Wiley & Sons Ltd, N.Y.
|
|
(7)
|
Reilly P.M., Bajramovic R., Blau G.E., Branson D.R. and Sauerhoff M.W. (1977) Guidelines for the optimal design of experiments to estimate parameters in first order kinetic models, Can. J. Chem. Eng, 55, pagine 614-622.
|
|
(8)
|
Könemann H. and Van Leeuwen K. (1980) Toxicokinetics in fish: Accumulation and Elimination of six Chlorobenzenes by Guppies. Chemosphere, 9, pagine 3-19.
|
ALLEGATO 4
Esempio teorico di un programma di campionamento per saggi di bioconcentrazione di sostanze con log Poa = 4
|
Campionamento del pesce
|
Programma di campionamento
|
Numero di campioni d'acqua
|
Numero di pesci per campione
|
|
Frequenza minima richiesta (giorni)
|
Campionamento addizionale
|
|
Fase di assorbimento
|
-1
0
|
|
2 (19)
2
|
immettere 45-80 pesci
|
|
1a
|
0,3
|
0,4
|
2
(2)
|
4
(4)
|
|
2a
|
0,6
|
0,9
|
2
(2)
|
4
(4)
|
|
3a
|
1,2
|
1,7
|
2
(2)
|
4
(4)
|
|
4a
|
2,4
|
3,3
|
2
(2)
|
4
(4)
|
|
5a
|
4,7
|
|
2
|
6
|
|
Fase di depurazione
|
|
|
|
Trasferire il pesce in acqua esente dal composto chimico in esame
|
|
6a
|
5,0
|
5,3
|
|
4
(4)
|
|
7a
|
5,9
|
7,0
|
|
4
(4)
|
|
8a
|
9,3
|
11,2
|
|
4
(4)
|
|
9a
|
14,0
|
17,5
|
|
6
(4)
|
|
I valori tra parentesi sono il numero di campioni (acqua, pesce) da prelevare se si esegue un campionamento addizionale.
|
Nota
|
:
|
La stima preliminare di k2 per log Pow = 4,0 è di 0,652 giorni-1. La durata totale dell’esperimento viene impostata su 3 × as = 3 × 4,6 giorni, cioè 14 giorni. Per la stima di «as» vedi allegato 3.
|
|
ALLEGATO 5
Differenziazione dei modelli
Si è supposto che la maggior parte dei dati di bioconcentrazione sia «ragionevolmente» ben descritta mediante un semplice modello a due compartimenti e due parametri, come indicato dalla curva rettilinea che approssima i punti delle concentrazioni nel pesce durante la fase di depurazione quando vengono tracciati su carta semilogaritmica (nel caso questi punti non possano essere descritti mediante una linea retta, impiegare modelli più complessi, cfr. per esempio Spacie and Hamelink, rif. 1 nell'allegato 3).
Metodo grafico per la determinazione della costante di velocità di depurazione (perdita) k2
Tracciare la concentrazione della sostanza in esame trovata in ciascun campione di pesce contro il tempo su carta semilogaritmica. Il coefficiente angolare della linea è k2.


Si noti che le deviazioni dalla linea retta possono indicare uno schema di depurazione più complesso di una cinetica di primo ordine. Per risolvere i tipi di depurazione che deviano dalla cinetica di primo ordine si può applicare un metodo grafico.
Metodo grafico per la determinazione della costante di velocità di assorbimento kt
Dato k2 calcolare k1 come segue:
|

|
[equazione 1]
|
Il valore di Cf viene letto dal punto centrale del tratto piatto della curva di assorbimento ottenuta dai dati tracciando log concentrazione contro il tempo (su scala aritmetica).
Metodo per il calcolo su computer delle costanti di velocità di assorbimento e depurazione (perdita)
Il mezzo preferito per ottenere il fattore di bioconcentrazione e le costanti di velocità k1 e k2 prevede l'uso di metodi di stima parametrica non lineare su computer. Questi programmi trovano i valori di k1 e k2 data una serie di dati sequenziali di concentrazione contro il tempo e il modello:
|

0 < t < tc
|
[equazione 2]
|
|

t > tc
|
[equazione 3]
|
in cui si ha te = tempo al termine della fase di assorbimento.
Questo approccio e stime della deviazione fornisce standard di k1 e k2.
Poiché k2 nella maggior parte dei casi può venire stimato con una precisione relativamente elevata dalla curva di depurazione, e poiché vi è una forte correlazione tra i due parametri, k1 e k2 se vengono stimati simultaneamente, e può essere conveniente calcolare per primo k2 dai soli dati di depurazione e successivamente k1 dai dati di assorbimento utilizzando una regressione non lineare.
C.14. TEST SULLA CRESCITA DEI PESCI GIOVANI
1. METODO
Questo metodo di test di tossicità sulla crescita corrisponde al TG 215 (2000) dell'OCSE.
1.1. INTRODUZIONE
L'obiettivo di questo test è valutare gli effetti dell'esposizione prolungata alle sostanze chimiche sulla crescita dei pesci giovani. Il test si basa su un metodo, sviluppato e sottoposto ad esercizi di intercalibrazione (ring test) (1) (3) all'interno dell'Unione europea, per valutare gli effetti delle sostanze chimiche sulla crescita di giovani di trota iridea (Oncorynchus mykiss) in condizioni di flusso continuo. È possibile utilizzare anche altre specie ben documentate. Per esempio, esistono esperienze di test sulla crescita con il danio zebrato (Danio rerio) (20) (2) (4) (5) e Oryzias latipes (6) (7) (8).
Cfr. anche Introduzione generale, parte C.
1.2. DEFINIZIONI
Minima concentrazione con effetto (Lowest Observed Effect Concentration, LOEC): è la più bassa concentrazione testata di una sostanza in esame alla quale si osserva un effetto significativo (p < 0,05) rispetto alla sostanza di controllo. Tuttavia, tutte le concentrazioni al di sopra della LOEC devono avere un effetto dannoso uguale o superiore a quelli osservati alla LOEC.
Massima concentrazione senza effetto (No Observed Effect Concentration, NOEC): concentrazione di prova immediatamente inferiore alla LOEC.
ECx
: in questo metodo di test è la concentrazione della sostanza in esame che provoca una variazione x % nel tasso di crescita dei pesci rispetto ai controlli.
Regime di carico: peso fresco dei pesci per volume di acqua.
Densità della popolazione: numero di pesci per volume di acqua.
Tasso di crescita specifico del singolo pesce: esprime il tasso di crescita di un individuo in base al suo peso iniziale.
Tasso di crescita specifico medio della vasca: esprime il tasso di crescita medio della popolazione di una vasca a una specifica concentrazione.
Tasso di crescita pseudo-specifico: esprime il tasso di crescita di un individuo rispetto al peso iniziale medio della popolazione della vasca.
1.3. PRINCIPIO DEL METODO DI TEST
I pesci giovani in fase di crescita esponenziale vengono pesati e collocati in contenitori di prova e quindi esposti a un intervallo di concentrazioni subletali della sostanza in esame disciolta in acqua, preferibilmente in condizioni di flusso continuo o, ove non sia possibile, in adeguate condizioni semistatiche (statiche con rinnovo del medium). La durata del test è di 28 giorni. I pesci sono alimentati quotidianamente. La razione di cibo è basata sul peso iniziale dei pesci e può essere ricalcolata dopo 14 giorni. Al termine del test, i pesci vengono nuovamente pesati. Gli effetti sui tassi di crescita vengono analizzati tramite un modello di regressione per stimare la concentrazione che causerebbe una variazione x % del tasso di crescita, cioè ECX (ad esempio EC10, EC20 o EC30). In alternativa, è possibile paragonare i dati con valori di controllo per determinare la minima concentrazione con effetto (LOEC) e di conseguenza la concentrazione senza effetto (NOEC).
1.4. INFORMAZIONI SULLA SOSTANZA IN ESAME
Dovrebbero essere disponibili i risultati di un test di tossicità acuta (cfr. metodo C.1) eseguito preferibilmente sulle stesse specie scelte per il presente test. Occorre pertanto che siano note la solubilità in acqua e la tensione di vapore della sostanza in esame e che sia disponibile un metodo analitico affidabile per la quantificazione della sostanza nelle soluzioni di prova, di cui devono essere noti e riportati i dati relativi all'accuratezza e al limite di rivelabilità.
Le informazioni utili comprendono: formula di struttura, purezza della sostanza, stabilità in acqua e alla luce, pKa, Pow- e risultati di un test di biodegradabilità immediata (cfr. metodo C.4).
1.5. VALIDITÀ DEL TEST
Perché il test sia valido devono realizzarsi le seguenti condizioni:
|
—
|
la mortalità del/i controllo/i non deve superare il 10 % alla fine del test,
|
|
—
|
il peso medio dei pesci di controllo deve essere aumentato a sufficienza da consentire di individuare la variazione minima del tasso di crescita considerata significativa. Un ring-test (3) ha dimostrato che, per la trota iridea, il peso medio dei pesci controlli deve essere aumentato, nei 28 giorni, di almeno la metà (50 %) del loro peso medio iniziale: ad esempio, peso iniziale:1 g/pesce (= 100 %), peso finale dopo 28 giorni: > 1,5 g/pesce (≥ 150 %),
|
|
—
|
la concentrazione dell'ossigeno disciolto deve essere rimasta almeno al 60 % del valore di saturazione in aria per tutta la durata del test,
|
|
—
|
la temperatura dell'acqua non deve mai differire di oltre ± 1 oC fra i diversi contenitori, né fra i vari giorni e dovrebbe essere mantenuta in un intervallo di 2 oC entro gli intervalli di temperatura specificati per la specie utilizzata (allegato 1).
|
1.6. DESCRIZIONE DEL METODO
1.6.1. Apparecchiatura
Normale attrezzatura da laboratorio e in particolare:
|
—
|
misuratori dell'ossigeno e del pH;
|
|
—
|
attrezzatura per la determinazione della durezza e dell'alcalinità dell'acqua;
|
|
—
|
apparecchiatura adeguata per il controllo della temperatura e preferibilmente per il monitoraggio continuo;
|
|
—
|
vasche in materiale chimicamente inerte e di capacità adeguata in relazione al carico e alla densità di popolazione raccomandati (cfr. sezione 1.8.5 e appendice 1);
|
|
—
|
bilancia sufficientemente precisa (precisione a ±0,5 %).
|
1.6.2. Acqua
Per il test si può utilizzare qualunque tipo di acqua in cui la specie in esame dimostra di sopravvivere a lungo termine e di crescere in modo adeguato. La qualità dell'acqua deve essere costante per tutta la durata del test. Il pH deve essere compreso entro 6,5 e 8,5, ma nel corso di un dato test deve essere compreso entro un intervallo di ±0,5 unità di pH. Si raccomanda una durezza superiore a 140 mg/l (come CaCO3). Per evitare effetti indesiderati dell'acqua di diluizione sui risultati del test (ad esempio per complessazione della sostanza in esame), ad intervalli si dovrebbero prelevare campioni e analizzarli. La misura dei metalli pesanti (ad esempio Cu, Pb, Zn, Hg, Cd e Ni), dei principali anioni e cationi (ad esempio Ca, Mg, Na, K, Cl e SO4), dei pesticidi (ad esempio pesticidi organofosforati totali e organoclorurati totali), del carbonio organico totale e dei solidi in sospensione va effettuata ad esempio ogni tre mesi, se l'acqua di diluizione è di qualità relativamente costante. Se la qualità dell'acqua è risultata costante per almeno un anno, le determinazioni possono essere effettuate con minore frequenza (ad esempio ogni sei mesi). Alcune caratteristiche chimiche di un'acqua di diluizione accettabile sono elencate nell'allegato 2.
1.6.3. Soluzioni di prova
Le soluzioni di prova alle concentrazioni scelte vanno preparate per diluizione di una soluzione madre.
La soluzione madre deve essere di preferenza preparata semplicemente miscelando o agitando la sostanza di prova nell'acqua di diluizione con mezzi meccanici (cioè agitazione o ultrasuoni). Per ottenere una concentrazione adeguata della soluzione madre si possono utilizzare colonne di saturazione (colonne di solubilità).
In alcuni casi può rendersi necessario l'utilizzo di solventi o disperdenti (agenti solubilizzanti) per ottenere una soluzione madre di adeguata concentrazione. A tale scopo si prestano, ad esempio, solventi quali acetone, eta-nolo, metanolo, dimetilsolfossido, dimetilformammide e glicole trietilenico o disperdenti quali Cremophor RH40. Tween 80, metilcellulosa 0,01 % e HCO-40. Quando si impiegano agenti a rapida biodegradabilità, come l'acetone, e/o altamente volatili è necessario procedere con cautela, poiché potrebbero causare problemi nelle prove a flusso continuo dovuti a sviluppo batterico Eventuali agenti solubilizzanti non devono avere effetti significativi sulla crescita dei pesci, né effetti negativi visibili sui giovani; come deve risultare da un controllo con solo solvente.
Per le prove a flusso continuo occorre un sistema che eroghi e diluisca in continuo una soluzione madre della sostanza in esame (ad esempio una pompa dosatrice, un diluitore proporzionale, un sistema di saturazione) per fornire alle camere di prova una serie di concentrazioni. Le portate di soluzione madre e acqua di diluizione dovrebbero essere controllate a intervalli, preferibilmente ogni giorno, e non devono variare di oltre il 10 % per tutta la durata del test. Un ring-test (3) ha dimostrato che, per la trota iridea, è accettabile una rimozione dell'acqua, durante il test, di 6 litri/g di pesce/die (cfr. sezione 1.8.2.2).
Per i test semistatici (con rinnovo), la frequenza di rinnovo del mezzo dipende dalla stabilità della sostanza in esame, ma si raccomanda di sostituire l'acqua quotidianamente. Se da test preliminari di stabilità (cfr. sezione 1.4) la concentrazione della sostanza in esame non risulta stabile (cioè è al di fuori dell' intervallo dell'80-120 % della concentrazione nominale o al di sotto dell'80 % della concentrazione iniziale misurata) durante l'intervallo di tempo tra due rinnovi dell'acqua, occorre prendere in considerazione l'uso di un test a flusso continuo.
1.6.4. Selezione della specie
La trota iridea (Oncorhynchus mykiss) è la specie raccomandata per questo test, in quanto la maggior parte dell'esperienza deriva da ring-test effettuati su questa specie (1) (3). È però possibile utilizzare altre specie ben documentate, ma in questo caso potrebbe essere necessario adattare la procedura sperimentale per fornire condizioni sperimentali adeguate. Ad esempio, sono state fatte esperienze anche con il danio zebrato (Danio rerio) (4) (5) e l'Oryzias latipes (6) (7) (8). In questo caso occorre motivare la scelta della specie e descrivere dettagliatamente il metodo sperimentale.
1.6.5. Mantenimento dei pesci
I pesci vanno selezionati da una popolazione di un solo stock, preferibilmente dalla stessa nidiata che sia stata mantenuta in condizioni di qualità dell'acqua e di illuminazione simili a quelle usate nel test per almeno due settimane prima della sperimentazione. Essi vanno alimentati con una razione minima quotidiana pari al 2 % del peso corporeo (razione quotidiana ideale = 4 % del peso corporeo) per tutto il periodo di mantenimento e durante il test.
Dopo un periodo di acclimatazione di 48 h si registra la mortalità e si applicano i seguenti criteri:
|
—
|
mortalità di oltre il 10 % della popolazione in sette giorni: respingere l'intero lotto,
|
|
—
|
mortalità fra il 5 % e il 10 % della popolazione: acclimatazione per altri sette giorni; se nel corso della seconda settimana la mortalità supera il 5 %, respingere l'intero lotto,
|
|
—
|
mortalità inferiore al 5 % della popolazione in sette giorni: accettare il lotto.
|
Durante le due settimane precedenti il test e durante il test ai pesci non vanno somministrate sostanze terapeutiche.
1.7. DISEGNO SPERIMENTALE
Il «disegno sperimentale» comprende la selezione del numero delle concentrazioni di prova, e dell'intervallo fra esse, il numero di vasche per ciascun livello di concentrazione e il numero di pesci per vasca. Idealmente, il disegno sperimentale dovrebbe essere scelto tenendo conto dei seguenti aspetti:
|
—
|
obiettivo dello studio;
|
|
—
|
metodo di analisi statistica che verrà impiegato;
|
|
—
|
disponibilità e costo delle risorse sperimentali.
|
Nel dichiarare l'obiettivo occorre possibilmente specificare il potere statistico a cui occorre rilevare una data differenza (ad esempio nel tasso di crescita) o, alternativamente, la precisione con cui occorre stimare la ECX (ad esempio con x = 10, 20 o 30, comunque di preferenza non meno di 10). In assenza di questi dati è impossibile dare indicazioni precise sulle dimensioni dello studio.
È importante riconoscere che un disegno che risulta ottimale (ovvero utilizza al meglio le risorse) per un dato metodo di analisi statistica non è necessariamente ottimale per un altro metodo. Il disegno raccomandato per la stima della LOEC/NOEC non sarebbe pertanto lo stesso raccomandato per l'analisi con la regressione.
Nella maggior parte dei casi l'analisi di regressione è preferibile all'analisi della varianza per i motivi discussi da Stephan e Rogers (9). Comunque, qualora non si trovi un modello di regressione adeguato (r2 < 0,9), si dovrebbe utilizzare la NOEC/LOEC.
1.7.1. Disegno per l'analisi con la regressione
Nel definire il disegno sperimentale di un test cui applicare l'analisi di regressione occorre considerare quanto segue:
|
—
|
la concentrazione con effetto (ad esempio EC10,20,30) e l'intervallo di concentrazioni a cui interessa l'effetto della sostanza in esame dovrebbero necessariamente essere compresi dalle concentrazioni incluse nel test. La precisione con cui si possono stimare le concentrazioni con effetto sarà maggiore quando la concentrazione con effetto è al centro dell'intervallo di concentrazioni da testare. Un test preliminare di ricerca dell'intervallo può risultare utile per selezionare le concentrazioni di prova più adeguate;
|
|
—
|
per consentire l'intervallo di un modello statistico soddisfacente il test dovrebbe comprendere almeno una vasca di controllo e cinque vasche ulteriori a concentrazioni diverse fra loro. Se del caso, quando si utilizza un agente solubilizzante, occorre predisporre un controllo contenente l'agente solubilizzante alla più alta concentrazione utilizzata, oltre alla serie prevista dal test (cfr. sezioni 1.8.3 e 1.8.4);
|
|
—
|
è possibile usare una serie geometrica adeguata allo scopo o una serie logaritmica (10) (cfr. allegato 3). E preferibile un intervallo logaritmico fra le concentrazioni sperimentali;
|
|
—
|
se sono disponibili più di sei vasche, le vasche in eccedenza dovrebbero essere utilizzate come repliche o distribuite per tutto il intervallo di concentrazioni per ridurre gli intervalli tra le concentrazioni. Entrambi i metodi sono ugualmente accettabili.
|
1.7.2. Disegno per la stima di una NOEC/LOEC mediante analisi della varianza (ANOVA)
È preferibile che vi siano vasche di replica per ciascuna concentrazione e l'analisi statistica dovrebbe essere fatta a livello di vasca (11). La mancanza di vasche di replica non consente di tener conto della variabilità fra le vasche al di là di quella dovuta ai singoli pesci. Tuttavia, l'esperienza (12) ha dimostrato che, nel caso esaminato, la variabilità fra le vasche era molto bassa rispetto alla variabilità all'interno della vasca (ovvero fra i pesci). Pertanto un'alternativa relativamente accettabile è quella di effettuare l'analisi statistica a livello dei singoli pesci.
Di norma si utilizzano almeno cinque concentrazioni sperimentali in una serie geometrica con un fattore preferibilmente non superiore a 3,2.
Generalmente, quando si eseguono test con repliche, il numero di vasche di replica nel controllo e pertanto il numero di pesci dovrebbe corrispondere al doppio del numero in ciascuna delle concentrazioni sperimentali, che dovrebbero essere di dimensioni uguali (13) (14) (15). Per contro, in mancanza di repliche il numero di pesci nel gruppo di controllo dovrebbe essere uguale a quello in ciascuna concentrazione sperimentale.
Se l'ANOVA deve essere basata sulle vasche invece che sui singoli pesci [cosa che comporterebbe la marcatura individuale dei pesci o l'uso dei tassi di crescita «pseudo» specifici (cfr. sezione 2.1.2)], il numero di vasche di replica deve essere sufficiente per consentire la determinazione della deviazione standard delle «vasche all'interno delle concentrazioni». Ciò significa che i gradi di libertà dell'errore nell'analisi della varianza sono almeno 5 (11). Replicando solo i controlli si rischia di influenzare la variabilità dell'errore poiché essa può aumentare con il valore medio del tasso di crescita in questione. Poiché è probabile che il tasso di crescita diminuisca con l'aumentare della concentrazione, ciò tenderà a portare a una sovrastima della variabilità.
1.8. PROCEDURA
1.8.1. Selezione e pesatura dei pesci da sottoporre al test
È importante ridurre a! minimo la differenza di peso tra i pesci all'inizio del test. L'appendice 1 fornisce gli intervalli adeguati di misura per le diverse specie raccomandate per questo test. Per l'intero lotto di pesci utilizzato nel test, la differenza di peso tra i singoli individui all'inizio del test dovrebbe essere idealmente mantenuta entro ± 10 % del peso medio aritmetico e, in ogni caso, non deve superare il 25 %. Si raccomanda di pesare un sottocampione di pesci prima del test per stimare il peso medio.
La popolazione dello stock non va nutrita per 24 ore prima dell'inizio del test. Successivamente, i pesci vanno scelti in maniera casuale. Utilizzando un anestetico generale [ad esempio con una soluzione acquosa di 100 mg/l di metilsolfonato di tricaina (MS 222) neutralizzato con l'aggiunta di due parti di bicarbonato di sodio per parte di MS 222], occorre pesare individualmente i pesci asciugati per tamponamento come peso fresco alla precisione indicata nell'allegato 1. I pesci con pesi entro il intervallo desiderato vanno tenuti e quindi distribuiti a caso tra le vasche sperimentali. È necessario registrare il peso fresco totale dei pesci in ciascuna vasca sperimentale. L'impiego di anestetici e la manipolazione dei pesci (compresi l'asciugatura e la pesatura) possono provocare stress e lesioni nei pesci giovani, in particolare nelle specie di piccola taglia. I pesci giovani vanno pertanto maneggiati con la massima cura per evitare di stressare e danneggiare gli animali sperimentali.
I pesci vanno nuovamente pesati il giorno 28 del test (cfr. sezione 1.8.6). Se tuttavia si ritiene necessario ricalcolare la razione di cibo, i pesci possono essere pesati anche il giorno 14 del test (cfr. sezione 1.8.2.3). Per determinare i cambiamenti di dimensione dei pesci, su cui basarsi per adeguare le razioni di cibo, si possono utilizzare metodi diversi come quello fotografico.
1.8.2. Condizioni di esposizione
1.8.2.1. Durata
La durata del test è di ≥ 28 giorni.
1.8.2.2. Regimi di carico e densità della popolazione
È importante che il regime di carico e la densità della popolazione siano adeguate per la specie usata nel test (cfr. allegato 1). Se la densità della popolazione è eccessivamente alta, si verificherà uno stress da sovraffollamento, con conseguente diminuzione dei tassi di crescita e, verosimilmente, sviluppo di malattie. Se è eccessivamente bassa, è possibile che si induca un comportamento territoriale passibile di influenzare anche la crescita degli individui. In ogni caso il regime di carico dovrebbe essere sufficientemente basso da consentire di mantenere, senza areazione, una concentrazione di ossigeno disciolto pari ad almeno il 60 % del valore di saturazione in aria. Un ring test (3) ha dimostrato che, per la trota iridea, è accettabile un regime di carico di 16 trote di 3-5 g in un volume di 40 litri. La frequenza raccomandata di rimozione dell'acqua durante il test è di 6 litri/g di pesce/die.
1.8.2.3. Alimentazione
I pesci vanno nutriti con cibo adatto (allegato 1) in quantità sufficiente da indurre un tasso di crescita accettabile. Occorre evitare la crescita microbica e l'intorbidimento dell'acqua. Per la trota iridea una quantità quotidiana pari al 4 % del peso corporeo dovrebbe soddisfare queste condizioni (3) (16) (17) (18). La razione quotidiana può essere suddivisa in due porzioni uguali e offerta ai pesci in due pasti al giorno, a distanza di almeno 5 ore l'uno dall'altro. La razione si basa sul peso totale iniziale dei pesci per ciascuna vasca sperimentale. Se i pesci vengono pesati anche il giorno 14. la razione viene ricalcolata. Nelle 24 ore precedenti alla pesatura i pesci non dovrebbero essere nutriti.
II cibo avanzato e il materiale fecale vanno rimossi dalle vasche sperimentali ogni giorno, pulendo con cura il fondo di ciascuna vasca con un aspiratore.
1.8.2.4. Luce e temperatura
Il fotoperiodo e la temperatura dell'acqua devono essere adatti alla specie utilizzata (allegato 1).
1.8.3. Concentrazioni sperimentali
Normalmente occorrono cinque concentrazioni della sostanza in esame, a prescindere dal disegno sperimentale scelto (cfr. sezione l.7.2). La conoscenza preliminare della tossicità della sostanza in esame (ad esempio mediante un test di tossicità acuta e/o uno studio di ricerca dell'intervallo di tossicità) dovrebbe essere d'aiuto nella selezione delle opportune concentrazioni sperimentali Se si utilizzano meno di cinque concentrazioni occorre spiegarne il motivo. La più alta concentrazione utilizzata nel test non deve superare il limite di solubilità in acqua della sostanza.
Se nella preparazione delle soluzioni madre si utilizza un agente solubilizzante, la sua concentrazione finale non deve superare 0,1 ml/l e, di preferenza, essere uguale in tutte le vasche (cfr. sezione 1.6.3). L'uso di tali materiali dovrebbe comunque essere evitato il più possibile.
1.8.4. Controlli
Il numero di controlli dell'acqua di diluizione dipende dal disegno sperimentale (cfr. sezioni 1.7-1.7.2). Se si utilizza un agente solubilizzante, il numero di controlli dell'agente solubilizzante deve corrispondere a quello dei controlli dell'acqua di diluizione.
1.8.5. Frequenza delle determinazioni analitiche e delle misure
Durante il test vanno determinate a intervalli regolari le concentrazioni della sostanza in esame (cfr. sotto).
Nei test a flusso continuo le portate del diluente e della soluzione madre della sostanza tossica dovrebbero essere controllati a intervalli, preferibilmente ogni giorno, e non dovrebbero variare di oltre il 10 % per tutta la durata del test. Quando si suppone che le concentrazioni della sostanza in esame siano entro ± 20 % dei valori nominali (cioè entro l'intervallo 80-120 %; cfr. sezioni 1.6.2 e 1.6.3), si raccomanda di analizzare, come minimo, la concentrazione minima e massima all'inizio del test e, successivamente, a intervalli settimanali. Per i test in cui non si ritiene che la concentrazione della sostanza in esame resti entro ± 20 % dei valori nominali (sulla base dei dati di stabilità relativi alla sostanza in esame), è necessario analizzare tutte le concentrazioni sperimentali, ma seguendo lo stesso regime.
Nei test semistatici (con rinnovo) in cui si suppone che la concentrazione della sostanza in esame resti entro ± 20 % dei valori nominali, si raccomanda di analizzare, come minimo, la concentrazione minima e massima appena preparate e subito prima del rinnovo, all'inizio dello studio e, successivamente, ogni settimana. Per i test in cui non si ritiene che la concentrazione della sostanza in esame resti entro ± 20 % dei valori nominali, si devono analizzare tutte le concentrazioni sperimentali seguendo lo stesso regime adottato per le sostanze più stabili.
Si raccomanda che i risultati siano basati sulle concentrazioni misurate. Se tuttavia vi sono prove che dimostrino che la concentrazione della sostanza in esame in soluzione è stata mantenuta in modo soddisfacente entro ± 20 % della concentrazione iniziale nominale o misurata per tutta la durata del test, allora i risultati possono essere basati sui valori nominali o misurati.
Qualora si rendesse necessario filtrare (ad esempio con pori di 0,45 μm) o centrifugare i campioni, la centrifugazione è la procedura raccomandata. Comunque, se il materiale da testare non assorbe ai filtri, può essere accettabile anche la filtrazione.
Durante il test l'ossigeno disciolto, il pH e la temperatura dovrebbero essere misurati in tutte le vasche sperimentali. La durezza totale, l'alcalinità e la salinità (se del caso) vanno misurate nei controlli e in una vasca alla concentrazione massima. L'ossigeno disciolto e, eventualmente la salinità, vanno misurati almeno tre volte (all'inizio, verso la metà e alla fine del test). Nei testi semistatici si raccomanda di misurare l'ossigeno disciolto con maggiore frequenza, preferibilmente prima e dopo ogni rinnovo dell'acqua o almeno una volta alla settimana. Il pH dovrebbe essere misurato all'inizio e alla fine di ogni rinnovo dell'acqua nei test semistatici e almeno una volta alla settimana nei test a flusso continuo. La durezza e l'alcalinità vanno misurate una sola volta per ciascun test. È auspicabile che la temperatura sia controllata continuamente in almeno in una vasca sperimentale.
1.8.6. Osservazioni
Peso: alla fine del test tutti i pesci sopravvissuti devono essere pesati come peso fresco dopo essere stati asciugati per tamponamento o in gruppo per ogni vasca sperimentale o singolarmente. La pesatura degli animali per vasca è preferibile a quella dei singoli individui, poiché evita di marcare i pesci uno per uno. Nel caso della misura individuale per la determinazione del tasso di crescita specifico di ogni singolo pesce, la tecnica di marcatura selezionata non deve causare stress agli animali (possono risultare adatte delle alternative alla marcatura per congelamento come ad esempio l'uso di una sottile lenza da pesca colorata).
I pesci dovrebbero essere esaminati ogni giorno durante il periodo di test ed eventuali anomalie esterne (quali emorragie, scoloramento) o comportamenti anomali dovrebbero essere registrati. Eventuali casi di mortalità vanno registrati e i pesci morti devono essere rimossi appena possibile. Questi non vanno sostituiti, in quanto il regime di carico e la densità della popolazione sono sufficienti per evitare effetti sulla crescita dovuti al cambiamento del numero di pesci per vasca. Sarà invece necessario adeguare la quantità di cibo somministrata.
2. DATI E RELAZIONE
2.1. TRATTAMENTO DEI RISULTATI
Si raccomanda di ricorrere ad uno statistico sia per la concezione del disegno sperimentale che per l'analisi statistica dei risultati del test, in quanto il metodo consente considerevoli variazioni, ad esempio nel numero di vasche e di concentrazioni di prova, nel numero dei pesci e così via. Viste le diverse opzioni di disegno sperimentale, in questa sede non si forniscono indicazioni specifiche sulle procedure statistiche.
Non vanno calcolati i tassi di crescita per le vasche in cui la mortalità supera il 10 %. Il tasso di mortalità dovrebbe però essere indicato per tutte le concentrazioni di prova.
Qualsiasi metodo venga utilizzato per l'analisi dei dati, il concetto centrale è il tasso di crescita specifico r fra il tempo t1 e il tempo t2. Esso può essere definito in vari modi, a seconda che i pesci siano marcati individualmente o meno, o che sia richiesta una media della vasca.



dove,
|
r1
|
=
|
tasso di crescita specifico del singolo pesce
|
|
r2
|
=
|
tasso di crescita specifico medio della vasca
|
|
r3
|
=
|
tasso di crescita «pseudo» specifico
|
|
w1, w2
|
=
|
pesi di un particolare pesce rispettivamente ai tempi t1 e t2
|
|
loge w1
|
=
|
logaritmo del peso di un singolo pesce all'inizio del periodo di studio
|
|
loge w2
|
=
|
logaritmo del peso di un singolo pesce alla fine del periodo di studio
|
|
logeW1
|
=
|
media dei logaritmi dei valori w1 per i pesci nella vasca all'inizio del periodo di studio
|
|
logeW2
|
=
|
media dei logaritmi dei valori w2 per i pesci nella vasca alla fine del periodo di studio
|
|
t1, t2
|
=
|
tempo (giorni) all'inizio e alla fine del periodo di studio
|
r1, r2, r3 possono essere calcolati per il periodo compreso fra i giorni 0 e 28 ed eventualmente (cioè quando è stata effettuata la misurazione al giorno 14) per i periodi fra i giorni 0 e 14 e 14 e 28.
2.1.1. Analisi dei risultati con la regressione (modello concentrazione-risposta)
Questo metodo di analisi trova una relazione matematica adeguata fra il tasso di crescita specifico e la concentrazione. e dunque consente la stima della «ECX», ovvero qualsiasi valore di EC richiesto. Con questo metodo non è necessario calcolare r per ogni singolo pesce (r1): l'analisi può invece essere basata sul valore di r medio per la vasca (r2). Quest'ultimo metodo è preferibile, nonché più adatto nel caso si utilizzino le specie più piccole.
I tassi di crescita specifici medi per la vasca (r2) dovrebbero essere riportati in grafico contro la concentrazione, allo scopo di esaminare la relazione concentrazione-risposta.
Per esprimere la relazione fra r2 e la concentrazione occorre scegliere un modello adatto e la sua scelta deve essere sostenuta da opportune considerazioni.
Se il numero dei pesci sopravvissuti varia di vasca in vasca, il processo di adattamento del modello ai punti sperimentali (fitting) che sia semplice o non lineare, dovrebbe essere pesato per tenere conto delle diverse dimensioni dei gruppi.
Il metodo di adattamento del modello deve permettere di ricavare una stima, ad esempio, della EC20 e della sua dispersione (errore standard o intervallo di confidenza). Il grafico del modello trovato va presentato in relazione ai dati in modo tale da mostrare l'adeguatezza dell'adattamento (fit) del modello (9) (19) (20) (21).
2.1.2. Analisi dei risultati per la stima della LOEC
Se il test prevedeva repliche a tutti i livelli di concentrazione, la stima della LOEC può essere basata su un'analisi della varianza (ANOVA) del tasso di crescita specifico medio della vasca (cfr. sezione 2.1), seguita da un metodo adeguato [ad esempio il test di Dunnett o di Williams (13) (14) (15) (22)] di confronto tra l'r media per ciascuna concentrazione con l'r media per i controlli, allo scopo di identificare la concentrazione più bassa alla quale tale differenza risulti significativa a un livello di probabilità dello 0,05. Se non vengono soddisfatte le assunzioni richieste per i metodi parametrici — distribuzione non normale (ad esempio al test di Shapiro-Wilk) o varianza eterogenea (al test di Bartlett) —, potrebbe essere necessario trasformare i dati per rendere omogenee le varianze prima di eseguire l'ANOVA oppure effettuare un'ANOVA ponderata.
Se il test non comprendeva repliche a ciascuna concentrazione, un'ANOVA basata sulle vasche non sarà sensibile o risulterà impossibile. In tal caso un compromesso accettabile è quello di basare l'ANOVA sul tasso di crescita «pseudo» specifico r3 dei singoli pesci.
L'r3 medio di ciascuna concentrazione sperimentale può quindi essere paragonato con l'r3 medio dei controlli. La LOEC può quindi essere identificata come in precedenza. Va detto che questo metodo non consente di tenere conto della variabilità fra le vasche, (né di salvaguardarsi da essa) ma solo di quella dovuta alla variabilità esistente fra i singoli pesci. Tuttavia, l'esperienza ha dimostrato (9) che la variabilità fra le vasche era molto piccola rispetto alla variabilità all'interno della vasca (cioè fra i pesci). Se nell'analisi non sono compresi i singoli pesci, occorre indicare il metodo di identificazione dei valori anomali e giustificarne l'utilizzo.
2.2. INTERPRETAZIONE DEI RISULTATI
I risultati vanno interpretati con cautela nel caso in cui nelle soluzioni di prova si misurino concentrazioni di sostanze tossiche a livelli vicini al limite di rivelabilità del metodo analitico o, nei test semistatici, quando la concentrazione della sostanza in esame prima del rinnovo risulta diminuita rispetto alla soluzione appena preparata.
2.3. RELAZIONE SUL TEST
La relazione sul test deve contenere le seguenti informazioni:
2.3.1. Sostanza in esame:
|
—
|
natura fisica e proprietà chimico-fisiche rilevanti,
|
|
—
|
dati chimici di identificazione, compresi purezza e metodo analitico per la quantificazione della sostanza in esame, se del caso.
|
2.3.2. Specie utilizzata:
|
—
|
nome scientifico, se possibile,
|
|
—
|
ceppo, dimensioni, fornitore, eventuali pretrattamenti, ecc.
|
2.3.3. Condizioni di esecuzione del test:
|
—
|
procedura sperimentale utilizzata (ad esempio semistatica con rinnovo, a flusso continuo, carico, densità della popolazione, ecc.),
|
|
—
|
disegno sperimentale (ad esempio numero di vasche, concentrazioni e repliche, numero di pesci per vasca),
|
|
—
|
metodo di preparazione delle soluzioni madre e frequenza di rinnovo (l'agente solubilizzante, se usato, va indicato insieme alla sua concentrazione),
|
|
—
|
concentrazioni sperimentali nominali, medie dei valori misurati e loro deviazioni standard nelle vasche sperimentali nonché metodo con cui sono state calcolate e dimostrazione che le misure si riferiscono alle concentrazioni della sostanza in esame in soluzione vera,
|
|
—
|
caratteristiche dell'acqua di diluizione: pH, durezza, alcalinità, temperatura, concentrazione di ossigeno disciolto, livelli di cloro residuo (se misurati), carbonio organico totale, solidi in sospensione, salinità del mezzo di prova (se misurata) ed eventuali altre misurazioni effettuate,
|
|
—
|
qualità dell'acqua nelle vasche sperimentali: pH, durezza, temperatura e concentrazione dell'ossigeno disciolto,
|
|
—
|
informazioni dettagliate sull'alimentazione (ad esempio tipo/i di cibo, origine, quantità somministrata e frequenza).
|
2.3.4. Risultati:
|
—
|
dimostrazione che i controlli soddisfino i criteri di validità per la sopravvivenza, nonché dati sulla eventuale mortalità in tutte le concentrazioni sperimentali,
|
|
—
|
tecniche di analisi statistica utilizzate, statistica basata sulle repliche o sui pesci, trattamento dei dati e giustificazione delle tecniche usate,
|
|
—
|
dati tabulati sui pesi individuali e medi dei pesci nei giorni 0,14 (se misurati) e 28, valori dei tassi di crescita medi per vasca o pseudo specifici (a seconda del caso) per i periodi da 0 a 28 giorni o eventualmente da 0 a 14 e da 14 a 28,
|
|
—
|
risultati dell'analisi statistica (analisi di regressione o ANOVA) preferibilmente mostrati in tabelle e grafici, nonché la LOEC (p = 0,05) e la NOEC o ECx con gli errori standard, se possibile, a seconda dei casi,
|
|
—
|
incidenza delle eventuali reazioni anomale da parte dei pesci e di eventuali effetti visibili indotti dalla sostanza in esame.
|
3. BIBLIOGRAFIA
|
(1)
|
Solbe J. F. de LG (1987). Environmental Effects of Chemicals (CFM 9350 SLD). Report on a UK Ring Test of a Method for Studying the Effects of Chemicals on the Growth Rate of Fish. WRc Report No PRD 1388-M/2.
|
|
(2)
|
Meyer, A., Bierman, C. H. and Orti, G. (1993). The phylogenetic position of the zebrafish (Danio rerio), a model System in developmental biology: an invitation to the comparative method. Proc. R. Soc. Lond. B. 252, pp. 231-236.
|
|
(3)
|
Ashley S., Mallett M. J. and Grandy N. J. (1990). EEC Ring Test of a Method for Determining the Effects of Chemicals on the Growth Rate of Fish. Final Report to the Commission of the European Communities. WRc Report No EEC 2600-M.
|
|
(4)
|
Crossland N. O. (198 5). A method to evaluate effects of toxic chemicals on fish growth. Chemosphere, 14. pp. 1855-1870.
|
|
(5)
|
Nagel R.. Bresh H., Caspers N., Hansen P. D., Market M, Munk R., Scholz N. and Höfte B. B. (1991). Effect of 3,4-dichloroaniline on the early life stages of the Zebrafish (Brachydanio reno): results of a comparative laboratory study. Ecotox. Environ. Safety, 21, pp. 157-164.
|
|
(6)
|
Yamamoto. Tokio. (1975). Series of stock cultures in biological field. Medaka (killifish) biology and strains. Keigaku Publish. Tokio. Japan.
|
|
(7)
|
Holcombe, G. \V., Benoit D. A., Hammermeister, D. E., Leonard, E. N. and Johnson, R. D. (1995). Acute and long-term effects of nine chemicals on the japanese medaka (Oryzias latipes). Arch. Environ. Conta. Toxicol. 28. pp. 287-297.
|
|
(8)
|
Benoit, D. A.. Holcombe, G. W. and Spehar. R. L. (1991). Guidelines for conducting early life toxicity tests with japanese medaka (Oryzias latipes). Ecological Research Series EPA-600/3-91-063. US Environmental Protection Agency, Duluth, Minnesota.
|
|
(9)
|
Stephan C. E. and Rogers J. W. (1985). Advantages of using regression analysis to calculate results of chronic toxicity tests. Aquatic Toxicology and Hazard Assessment: Eighth Symposium, ASTM STP 891, R. C. Bahner and D. J. Hansen, eds., American Society for Testing and Materials, Philadelphia, pp. 328-338.
|
|
(10)
|
Environment Canada (1992). Biological test method: toxicity tests using early life stages of salmonid fish (rainbow trout, coho salmon, or atlantic salmoni Conservation and Protection, Ontano, Report EPS l/RM/28, 81 pp.
|
|
(11)
|
Cox D. R. (1958). Planning of experiments. Wiley Edt.
|
|
(12)
|
Pack S. (1991). Statistical issues concerning the design of tests for determining the effects of chemicals on the growth rate of fish. Room Document 4, OECD Ad Hoc Meeting of Experts on Aquatic Toxicology, WRc Medmenham, UK, 10-12 December 1991.
|
|
(13)
|
Dunnett C. W. (1955). A Multiple Comparisons Procedure for Comparing Several Treatments with a Control, J. Amer. Statist. Assoc, 50, pp. 1096-1121.
|
|
(14)
|
Dunnett C. W. (1964). New tables for multiple comparisons with a control. Biometrics, 20, pp. 482-491.
|
|
(15)
|
Williams D. A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, pp. 103-117.
|
|
(16)
|
Johnston, W. L, Atkinson, J. L, Glanville N. T. (1994). A technique using sequential feedings of different coloured food to determine food intake by individual rainbow trout, Oncorhynchus mykiss: effect of feeding level. Aquaculture 120, pp. 123-133.
|
|
(17)
|
Quinton, J. C. and Blake. R. W. (1990). The effect of feed cycling and ration level on the compensatory growth response in rainbow trout, Oncorhvnchus mvkiss. Journal of Fish Biology, 37, pp. 33-41.
|
|
(18)
|
Post, G. (1987). Nutrition and Nutritional Diseases of Fish. Chapter IX in Testbook of Fish Health. T.F.H. Publications, Inc. Neptune City, New Jersey, USA. 288 pp.
|
|
(19)
|
Bruce, R. D. and Versteeg D. J. (1992). A statistical procedure for modelling continuous toxicity data, Environ. Toxicol. Chem. 11, pp. 1485-1494.
|
|
(20)
|
DeGraeve, G. M, Cooney, J. M., Pollock, T. L, Reichenbach, J. H., Dean, Marcus, M. D. and McIntyre, D. O. (1989). Precision of EPA seven-day fathead minnow larval survival and growth test; intra and interlaboratory study. Report EA-6189 (American Petroleum Institute Publication, No 4468). Electric Power Research Institute, Palo Alto, CA.
|
|
(21)
|
Norbert-King T. J. (1988). An interpolation estimate for chronic toxicity: the ICp approach. US Environmental Protection Agency. Environmental Research Lab., Duluth, Minnesota. Tech. Rep. No 05-88 of National Effluent Toxicity Assesment Center. Sept. 1988. 12 pp.
|
|
(22)
|
Williams D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, pp. 510-531.
|
ALLEGATO 1
SPECIE DI PESCI RACCOMANDATE PER IL TEST E CONDIZIONI SPERIMENTALI ADEGUATE
|
Specie
|
Intervallo di temperatura raccomandalo
( oC)
|
Fotoperiodo
(ore)
|
Intervallo raccomandato per il peso iniziale dei pesci
(g)
|
Precisione della misura richiesta
|
Regime di carico
(g/l)
|
Densità della popolazione
(per litro)
|
Cibo
|
Durata de! test
(giorni)
|
|
Specie raccomandate:
|
|
|
|
|
|
|
|
|
|
Oncorhynchus mykiss
Trota iridea
|
12,5-16,0
|
12-16
|
1-5
|
Ai 100 mg più vicini
|
1,2-2,0
|
4
|
Cibo secco commerciale per avan-notti di salmonidi
|
≥ 28
|
|
Altre specie ben documentate:
|
|
|
|
|
|
|
|
|
|
Danio rerio
Danio zebrato
|
21-25
|
12-16
|
0,050-0,100
|
All'1 mg più vicino
|
0,2-1,0
|
5-10
|
Cibo vivo (Brachionus Artemia)
|
≥ 28
|
|
Oryzias latipes
|
21-25
|
12-16
|
0,050-0,100
|
All'1 mg più vicino
|
0,2-1,0
|
5-20
|
Cibo vivo (Brachionus Anemia)
|
≥ 28
|
ALLEGATO 2
ALCUNE CARATTERISTICHE CHIMICHE DI UN'ACQUA DI DILUIZIONE ACCETTABILE
|
Sostanza
|
Concentrazioni
|
|
Particolato
|
< 20 mg/l
|
|
Carbonio organico totale
|
< 2 mg/l
|
|
Ammoniaca non ionizzata
|
< 1 μg/l
|
|
Cloro residuo
|
< 10 μg/l
|
|
Pesticidi organofosforati totali
|
< 50 μg/l
|
|
Pesticidi organoclorurati totali più difenili policlorurati
|
< 50 μg/l
|
|
Cloro organico totale
|
< 25 μg/l
|
APPENDICE 3
Serie logaritmiche di concentrazioni adatte per i test di tossicità (9)
|
Colonna (numero di concentrazioni fra 100 e 10 o fra 10 e 1 (21)
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
32
|
46
|
56
|
63
|
68
|
72
|
75
|
|
10
|
22
|
32
|
40
|
46
|
52
|
56
|
|
3,2
|
10
|
18
|
25
|
32
|
37
|
42
|
|
1,0
|
4,6
|
10
|
16
|
22
|
27
|
32
|
|
|
2,2
|
5,6
|
10
|
15
|
19
|
24
|
|
|
1,0
|
3,2
|
6,3
|
10
|
14
|
18
|
|
|
|
1,8
|
4,0
|
6,8
|
10
|
13
|
|
|
|
1,0
|
2,5
|
4,6
|
7,2
|
10
|
|
|
|
|
1,6
|
3,2
|
5,2
|
7,5
|
|
|
|
|
1,0
|
2,2
|
3,7
|
5,6
|
|
|
|
|
|
1,5
|
2,7
|
4,2
|
|
|
|
|
|
1,0
|
1,9
|
3,2
|
|
|
|
|
|
|
1,4
|
2,4
|
|
|
|
|
|
|
1,0
|
1,8
|
|
|
|
|
|
|
|
1,3
|
|
|
|
|
|
|
|
1,0
|
C.15. PESCI, PROVA DI TOSSICITÀ A BREVE TERMINE SUGLI STADI DI EMBRIONI E DI LARVA CON SACCO VITELLINO
1. METODO
Questo metodo di prova della tossicità a breve termine corrisponde al TG 212 (1998) dell'OCSE.
1.1. INTRODUZIONE
Questa prova di tossicità a breve termine sugli stadi di embrione e di larve con sacco vitellino di pesci è una prova a breve termine in cui vengono esposti i pesci negli stadi che vanno dall'uovo appena fertilizzato alla fine dello stadio di larve con sacco vitellino. La prova sugli embrioni e sulle larve con sacco vitellino non prevede alcun tipo di alimentazione e va pertanto conclusa mentre le larve con sacco vitellino sono ancora nutrite dal sacco vitellino.
L'obiettivo della prova è definire gli effetti letali e, limitatamente, subletali di sostanze chimiche sugli specifici stadi vitali e specie sottoposti alla prova. Questa prova è in grado di fornire informazioni utili in quanto: a) può fare da nesso fra le prove letali e subletali; b) può essere utilizzata come prova di screening in una «prova completa su stadi di vita precoci» per una prova di tossicità cronica e c) può essere usata per saggiare specie per le quali le tecniche di allevamento non sono sufficientemente avanzate per coprire il periodo di transizione dall'alimentazione endogena a quella esogena.
È necessario ricordare che, in generale, solo le prove che comprendono tutti gli stadi del ciclo vitale dei pesci sono in grado di fornire una stima accurata della tossicità cronica delle sostanze chimiche nei confronti dei pesci e che eventuali riduzioni dell'esposizione in funzione dei diversi stadi di vita possono diminuire la sensibilità della prova e quindi sottovalutare la tossicità cronica. Si ritiene pertanto che la prova sugli embrioni e su larve con sacco vitellino sia meno sensibile di una «prova completa su stadi di vita precoci», soprattutto rispetto a sostanze chimiche altamente lipofile (log POW > 4) e a sostanze chimiche con un meccanismo di azione tossica specifico. Comunque, si prevede che per sostanze chimiche con un modo di azione narcotico non specifico le differenze di sensibilità fra le due prove siano minori (1).
Prima della sua pubblicazione la presente prova sugli embrioni e su larve con sacco vitellino è stata per la maggior parte condotta sul pesce d'acqua dolce Danio rerio Hamilton-Buchanan (Teleostei, Cyprinidae — nome comune: danio zebrato). Per questo motivo l'appendice 1 contiene indicazioni più dettagliate sull'esecuzione della prova su questa specie, ma ciò non impedisce di utilizzare altre specie con le quali sono già state fatte esperienze (tabelle 1A e 1B).
1.2. DEFINIZIONI
Minima concentrazione con effetti significativi (Lowest observed effect concentration, LOEC): è la più bassa concentrazione saggiata di una sostanza di prova alla quale si osserva un effetto significativo (p < 0,05) rispetto al controllo. Tuttavia, tutte le concentrazioni al di sopra della LOEC devono avere un effetto dannoso uguale o superiore a quello osservato alla LOEC.
Massima concentrazione senza effetti significativi (No observed effect concentration, NOEC): è la concentrazione di prova immediatamente inferiore alle LOEC.
1.3. PRINCIPIO DELLA PROVA
Gli stadi di embrione e di larva con sacco vitellino vengono esposti a un intervallo di concentrazioni della sostanza di prova disciolta in acqua. Il protocollo consente di optare per una procedura semistatica o per una a flusso continuo in funzione della natura della sostanza in esame. La prova inizia con la collocazione delle uova fecondate in contenitori di prova e termina subito prima che il sacco vitellino di una qualsiasi delle larve in una delle camere di prova sia completamente assorbito, o prima che i controlli inizino a morire per mancanza di cibo. Gli effetti letali e subletali vengono valutati e confrontati con i valori relativi ai controlli allo scopo di determinare la minima concentrazione alla quale si osservano effetti significativi (LOEC) e di conseguenza la concentrazione senza effetti significativi (NOEC). In alternativa, è possibile valutare gli effetti tramite un modello di regressione per stimare la concentrazione capace di causare una determinata percentuale di effetto (cioè LC/ECx,, dove x è una % di effetto definita).
1.4. INFORMAZIONI SULLA SOSTANZA DI PROVA
Dovrebbero essere disponibili i risultati di una prova di tossicità acuta (cfr. metodo C.1) eseguita preferibilmente sulla stessa specie scelta per la presente prova. I risultati possono essere utili per scegliere un intervallo adeguato di concentrazioni di prova nella prova sugli stadi di vita precoci. Occorre conoscere i valori relativi alla solubilità in acqua (compresa la solubilità nell'acqua utilizzata per la prova) e alla tensione di vapore della sostanza di prova. Occorre inoltre disporre di un metodo analitico affidabile per la quantificazione della sostanza nelle soluzioni di prova, di cui devono essere noti e riportati i dati relativi all'accuratezza e al limite di rivelabilità.
Le informazioni sulla sostanza in esame utili per definire le condizioni di esecuzione della prova sono: formula di struttura, purezza della sostanza, fotostabilità, stabilità nelle condizioni di esecuzione della prova, pKa, POW. e risultati di una prova di biodegradabilità immediata (cfr. metodo C.4).
1.5. VALIDITÀ DELLA PROVA
Perché una prova sia valida devono realizzarsi le seguenti condizioni:
|
—
|
la sopravvivenza complessiva delle uova fecondate nei controlli e, se del caso, nei contenitori con solo solvente, deve essere superiore o uguale ai valori definiti nelle appendici 2 e 3,
|
|
—
|
la concentrazione dell'ossigeno disciolto deve essere compresa fra il 60 e il 100 % del valore di saturazione nell'aria per tutta la durata della prova,
|
|
—
|
la temperatura dell'acqua non deve mai differire di oltre ±1,5 oC fra le diverse camere di prova, né fra i vari giorni, e dovrebbe restare negli intervalli di temperatura indicata per le specie utilizzate nella prova (appendici 2 e 3).
|
1.6. DESCRIZIONE DEL METODO UTILIZZATO
1.6.1. Contenitori di prova
Si può utilizzare qualsiasi tipo di recipiente in vetro o in altro materiale chimicamente inerte. Le dimensioni dei recipienti devono essere proporzionate al regime di carico (cfr. sezione 1.7.1.2). Si raccomanda di randomizzare la collocazione delle camere di prova nella zona della prova. Se nel laboratorio sussistono effetti sistematici controllabili tramite separazione per blocchi, è preferibile utilizzare un disegno sperimentale a blocchi randomizzati in cui ciascun trattamento è presente in ciascun blocco, piuttosto che un disegno completamente randomizzato. Se si opta per il disegno sperimentale a blocchi, occorre tenerne conto anche in sede di analisi dei dati. Le camere di prova devono essere protette da eventuali disturbi.
1.6.2. Selezione della specie ittica
Le specie ittiche raccomandate sono elencate nella tabella 1A. Ciò non preclude l'uso di altre specie (cfr. esempi nella tabella 1B), ma in questo caso potrebbe essere necessario adattare la procedura sperimentale per ottenere adeguate condizioni di esecuzione della prova. In tal caso occorre spiegare i criteri di scelta delle specie e del metodo sperimentale.
1.6.3. Mantenimento dei pesci riproduttori
Per informazioni dettagliate su come mantenere i pesci riproduttori in condizioni soddisfacenti, si rimanda al TG 210 dell'OCSE (22) e ai riferimenti bibliografici (2) (3) (4) (5) (6).
1.6.4. Manipolazione di embrioni e larve
All'interno del contenitore principale gli embrioni e le larve possono essere esposti in recipienti più piccoli forniti di rete ai lati o alle estremità per consentire il flusso della soluzione di prova attraverso il recipiente. Si può indurre un flusso non turbolento in questi recipienti più piccoli sospendendoli a un braccio sistemato in modo che muova il recipiente verticalmente, mantenendo però sempre sommersi gli organismi: è possibile usare anche un sistema di flusso a sifone. Le uova fecondate dei pesci salmonidi possono essere sistemate su rastrelliere o reti con aperture sufficientemente grandi da permettere alle larve di cadere fuori dopo la schiusa delle uova. Per rimuovere gli embrioni e le larve nella prova semistatica con rinnovo quotidiano completo dell'acqua sono adatte pipette Pasteur (cfr. 1.6.6).
I contenitori, le griglie o le reti eventualmente utilizzati per tenere le uova all'interno della vasca principale vanno rimossi, in quanto ostacoli, dopo la schiusa delle larve (22): le reti vanno invece lasciate per evitare la fuga dei pesci. Dovendo trasferire le larve, queste non dovrebbero essere esposte all'aria e per rilasciare i pesci dai contenitori per le uova non si devono usare retini (questa precauzione può essere superflua per alcune specie meno delicate, come la carpa). Il trasferimento, i cui tempi dipendono dalla specie, non è sempre necessario. Per la tecnica semistatica si possono usare beaker o contenitori poco profondi e, se necessario, forniti di un divisorio a rete lievemente sopraelevato rispetto al fondo. Se il volume dei contenitori è sufficiente a soddisfare le richieste di carico (cfr. l.7.1.2) il trasferimento degli embrioni o delle larve può essere evitato.
1.6.5. Acqua
Per la prova si può utilizzare qualunque tipo di acqua conforme alle caratteristiche chimiche di un'acqua di diluizione accettabile, come descritta nell'appendice 4, e in cui la specie utilizzata nella prova dimostra una capacità di sopravvivenza dei controlli almeno pari a quella descritta nelle appendici 2 e 3. La qualità dell'acqua dovrebbe essere costante per tutta la durata della prova. Il pH dovrebbe rimanere entro un intervallo di ±0,5 unità di pH. Per escludere la possibilità di effetti indesiderati dell'acqua di diluizione sui risultati della prova (ad esempio per complessazione della sostanza in esame) o influenze negative sulla performance dei pesci riproduttori è utile prelevare di quando in quando alcuni campioni e analizzarli. La misura dei metalli pesanti (ad esempio Cu, Pb, Zn, Hg, Cd e Ni), dei principali anioni e cationi (ad esempio Ca, Mg, Na, K, Cl e SO4), dei pesticidi (ad esempio pesticidi organofosforati totali e organoclorurati totali), del carbonio organico totale e dei solidi sospesi va effettuata ad esempio ogni tre mesi, se l'acqua di diluizione è di qualità relativamente costante. Se la qualità dell'acqua si è dimostrata costante per almeno un anno, le titolazioni possono essere effettuate con minore frequenza (ad esempio ogni sei mesi),
1.6.6. Soluzioni di prova
Le soluzioni di prova alle concentrazioni scelte vanno preparate per diluizione di una soluzione madre.
La soluzione madre deve essere di preferenza preparata semplicemente miscelando o agitando la sostanza di prova nell'acqua di diluizione con mezzi meccanici (cioè agitazione e ultrasuoni). Per ottenere una concentrazione adeguata della soluzione madre si possono utilizzare colonne di saturazione (colonne di solubilità). Per quanto possibile va evitato l'utilizzo di solventi o disperdenti (agenti solubilizzanti); tuttavia, in alcuni casi tali composti possono essere necessari per ottenere una soluzione madre di concentrazione adeguata. A tale scopo si prestano ad esempio solventi quali acetone, etanolo, metanolo, dimetilformammide e glicole trietilenico o disperdenti quali Cremophor RH40, Tween 80, metilcellulosa 0,01 % e HCO-40. Quando si impiegano agenti a rapida biodegradabilità, come l'acetone, e/o altamente volatili è necessario procedere con cautela, poiché potrebbero causare problemi nelle prove a flusso continuo dovuti a sviluppo batterico. Qualora si utilizzi un agente solubilizzante questo non deve avere effetti significativi sulla sopravvivenza né effetti negativi visibili sui primi stadi di vita degli organismi come è dimostrato da un controllo con solo solvente. L'uso di questi materiali dovrebbe essere evitato il più possibile.
Per la tecnica semistatica è possibile seguire due diverse procedure di rinnovo dell'acqua: i) si preparano nuove soluzioni di prova in recipienti puliti e si trasferiscono delicatamente le uova e le larve sopravvissute nei nuovi recipienti utilizzando un piccolo volume di soluzione vecchia ed evitando l'esposizione all'aria, oppure ii) gli organismi della prova sono mantenuti nei recipienti mentre viene cambiata una parte (almeno tre quarti) dell'acqua. La frequenza di rinnovo del mezzo dipende dalla stabilità della sostanza di prova, ma si raccomanda di sostituire l'acqua quotidianamente. Se da prove preliminari di stabilità (cfr. sezione 1.4) la concentrazione della sostanza di prova non risulta stabile (cioè è al di fuori dell' intervallo dell'80-120 % della concentrazione nominale o al di sotto dell'80 % della concentrazione iniziale misurata) durante l'intervallo di tempo tra le operazioni di rinnovo dell'acqua, occorre prendere in considerazione l'opportunità di utilizzare una prova a flusso continuo, in ogni caso occorre evitare di sottoporre le larve a stress durante l'operazione di rinnovo dell'acqua.
Le prove a flusso continuo comportano l'uso di un sistema che eroghi e diluisca di continuo la soluzione madre della sostanza in esame (ad esempio pompa dosatrice, diluitore proporzionale, sistema di saturazione) per fornire alle camere di prova una serie di concentrazioni. Le portate di soluzione madre e acqua di diluizione dovrebbero essere controllate a intervalli, preferibilmente ogni giorno, e non presentare variazioni superiori al 10 % per tutta la durata della prova. Si considera adeguata una portata equivalente ad almeno cinque volte il volume della camera di prova ogni 24 ore (2).
1.7. PROCEDURA
In letteratura si trovano informazioni utili sull'esecuzione della prova di tossicità sugli stadi di embrione e di larve con sacco vitellino di pesci; alcuni riferimenti sono elencati nella bibliografia della presente prova (7) (8) (9).
1.7.1 Condizioni di esposizione
1.7.1.1. Durata
La prova dovrebbe avere inizio preferibilmente entro 30 minuti dalla fecondazione delle uova. Gli embrioni vanno immersi nella soluzione di prova prima o immediatamente dopo l'inizio dello stadio di segmentazione del blastodisco e, comunque, prima che inizi lo stadio di gastrula. Se le uova provengono da fornitori esterni può risultare impossibile iniziare la prova subito dopo la fecondazione. Poiché un ritardo nell'avvio della prova può influire fortemente sulla sua sensibilità, la prova dovrebbe iniziare entro 8 ore dalla fecondazione. Dato che le larve non vengono nutrite durante il periodo di esposizione, la prova dovrebbe terminare subito prima che il sacco vitellino di una qualsiasi delle larve in una delle camere di prova sia stato completamente assorbito, o prima che i controlli inizino a morire per mancanza di cibo. La durata della prova dipende dalla specie utilizzata. Le appendici 2 e 3 contengono alcune raccomandazioni al riguardo.
1.7.1.2. Carico
All'inizio della prova il numero di uova fecondate deve essere sufficiente a soddisfare le richieste dell'analisi statistica. Le uova dovrebbero essere distribuite a caso fra i trattamenti e per ogni concentrazione si dovrebbero usare almeno 30 uova fecondate, divise equamente (o il più equamente possibile, visto che con alcune specie può essere difficile ottenere lotti uguali) tra almeno tre repliche. Il regime di carico (biomassa per volume di soluzione di prova) deve essere abbastanza basso da consentire di mantenere senza aerazione una concentrazione di ossigeno disciolto pari ad almeno il 60 % del valore di saturazione nell'aria. Per la prova a flusso continuo è stato raccomandato un regime di carico non superiore a 0,5 g/l per 24 ore e non superiore a 5 g/l di soluzione in qualsiasi momento (2).
1.7.1.3. Luce e temperatura
Il fotoperiodo e la temperatura dell'acqua di prova devono essere adatti alla specie utilizzata (appendici 2 e 3). Per controllare la temperatura si può utilizzare un recipiente di prova aggiuntivo.
1.7.2. Concentrazioni della sostanza di prova
Di norma occorrono cinque concentrazioni della sostanza in esame che differiscano di un fattore costante non superiore a 3,2. Nella scelta dell'intervallo delle concentrazioni bisogna tenere conto della curva che pone in relazione la CL50 al periodo di esposizione nello studio della tossicità acuta. In alcune circostanze, ad esempio nelle prove limite, può essere appropriato impiegare meno di cinque concentrazioni a un intervallo di concentrazione più ristretto. Se si utilizzano meno di cinque concentrazioni occorre spiegarne il motivo. Non è necessario provare concentrazioni della sostanza superiori alla CL50 nelle 96 ore o a 100 mg/l, qualsiasi sia la più bassa. Le sostanze non dovrebbero essere provate a concentrazioni al di sopra del loro limite di solubilità nell'acqua di prova.
Se nella preparazione delle soluzioni di prova si utilizza un agente solubilizzante (cfr. sezione 1.6.6), la sua concentrazione finale nei recipienti di prova non dovrebbe superare 0,1 ml/l e dovrebbe essere uguale in tutti i recipienti.
1.7.3. Controlli
In aggiunta alle concentrazioni della sostanza in esame, dovrebbe essere allestito un controllo con l'acqua di diluizione (ripetendola in modo adeguato) ed eventualmente controllo con acqua contenente l'agente solubilizzante (ripetendola in modo adeguato), ambedue con un adeguato numero di repliche.
1.7.4. Frequenza delle determinazioni e delle misurazioni analitiche
Durante la prova vanno determinate a intervalli regolari le concentrazioni della sostanza di prova.
Nella prova semistatica in cui si prevede che la concentrazione della sostanza in esame si mantenga intorno a ± 20 % del valore nominale (ovvero entro un intervallo di 80-120 %; cfr. sezioni 1.4 e 1.6.6), si raccomanda, come minimo, di analizzare le concentrazioni minima e massima subito dopo la preparazione e immediatamente prima del rinnovo dell'acqua almeno tre volte a intervalli regolari nel corso della prova (le analisi vanno effettuate su un campione della stessa soluzione preparata di fresco e poi al momento di rinnovarla).
Quando si prevede che la concentrazione della sostanza in esame non si mantenga intorno a ± 20 % del valore nominale (in base ai dati sulla stabilità della sostanza), è necessario analizzare tutte le concentrazioni di prova, preparate di fresco e al momento di rinnovarle, ma seguendo lo stesso schema (cioè almeno tre volte a intervalli regolari nel corso della prova), è sufficiente determinare le concentrazioni della sostanza in esame prima di rinnovare la soluzione solo su una replica per ogni concentrazione. L'intervallo fra le determinazioni analitiche non deve superare i sette giorni. Si raccomanda che i risultati siano basati sulle concentrazioni misurate. Tuttavia se è possibile provare che durante tutta la prova la concentrazione della sostanza di prova nella soluzione è stata mantenuta in modo soddisfacente entro ± 20 % della concentrazione nominale o della concentrazione iniziale misurata, i risultati possono essere basati sui valori nominali o sui valori iniziali misurati.
Per le prove a flusso continuo è appropriato l'uso di un regime di campionamento simile a quello descritto per i le prove semistatiche (sebbene in questo caso non si effettui la misurazione delle soluzioni «vecchie»). Se però la durata della prova supera i sette giorni, può essere consigliabile aumentare il numero di campionamenti durante la prima settimana (ad esempio, tre serie di misurazioni) per assicurare che le concentrazioni di prova restino stabili.
Può essere necessario centrifugare o filtrare i campioni (ad esempio con filtro con pori di 0,45 μm). Poiché tuttavia né la centrifugazione né la filtrazione sembrano essere sempre in grado di separare la frazione non biodisponibile della sostanza in esame da quella biodisponibile, i campioni non devono necessariamente essere sottoposti a questi trattamenti.
Durante la prova in tutti i recipienti di prova dovrebbero essere misurati l'ossigeno disciolto, il pH e la temperatura. La durezza totale e la salinità (se del caso) vanno misurate nei controlli e in un recipiente alla concentrazione massima. L'ossigeno disciolto ed eventualmente la salinità vanno misurati almeno tre volte (all'inizio, verso la metà e alla fine della prova). Nella prova semistatica si raccomanda di misurare l'ossigeno disciolto con maggiore frequenza, preferibilmente prima e dopo ogni rinnovo dell'acqua o almeno una volta alla settimana. Il pH dovrebbe essere misurato all'inizio e alla fine di ogni rinnovo dell'acqua nella prova semistatica e almeno una volta alla settimana nella prova a flusso continuo. La durezza va misurata una sola volta per ciascuna prova. La temperatura dovrebbe essere misurata una volta al giorno e preferibilmente essere costantemente controllata almeno in un recipiente di prova.
1.7.5. Osservazioni
1.7.5.1. Stadio dello sviluppo embrionale
Lo stadio embrionale (stadio di gastrula) all'inizio dell'esposizione alla sostanza di prova va verificato nel modo più accurato possibile. Per far ciò si può utilizzare un campione rappresentativo di uova adeguatamente conservate e separate. Per la descrizione e l'illustrazione degli stadi embrionali si rimanda alla letteratura in materia (2) (5) (10) (11).
1.7.5.2. Schiusa e sopravvivenza
Almeno una volta al giorno occorre effettuare osservazioni sulla schiusa e la sopravvivenza e registrarne i dati. All'inizio della prova può essere consigliabile effettuare osservazioni più frequenti (ad esempio ogni 30 minuti durante le prime tre ore), poiché in alcuni casi i tempi di sopravvivenza possono avere maggiore importanza del solo numero di decessi (ad esempio in presenza di effetti tossici acuti). Gli embrioni e le larve morti vanno rimossi appena individuati in quanto possono decomporsi rapidamente. Nel rimuovere gli individui morti è necessario procedere con estrema cautela per non urtare o danneggiare le uova/larve vicine, che sono estremamente delicate e sensibili. I criteri per stabilire la morte variano a seconda dello stadio di vita:
|
—
|
per le uova: soprattutto nei primi stadi, marcata perdita di traslucidità e cambiamento di colorazione dovute a coagulazione e/o precipitazione delle proteine, con conseguente aspetto bianco opaco,
|
|
—
|
per gli embrioni: assenza di movimenti del corpo e/o assenza di battito cardiaco e/o di colorazione opaca nelle specie in cui gli embrioni sono normalmente traslucidi,
|
|
—
|
per le larve: immobilità e/o assenza di movimenti respiratori e/o assenza di battito cardiaco e/o colorazione bianca opaca del sistema nervoso centrale e/o mancanza di reazione agli stimoli meccanici.
|
1.7.5.3. Anomalie dell'aspetto
A intervalli adeguati, a seconda della durata della prova e della natura dell'anomalia descritta, vanno registrati il numero di larve che presentano anomalie morfologiche e/o della pigmentazione, e lo stadio di assorbimento del sacco vitellino. Va rilevato che la presenza di embrioni e larve anomali è un fenomeno naturale e nel/i controllo/i di alcune specie può raggiungere molti punti percentuali. Gli individui che presentano anomalie vanno rimossi dai recipienti solo dopo la loro morte.
1.7.5.4. Anomalie del comportamento
Le anomalie, quali iperventilazione. movimenti natatori scoordinati e inattività atipica, dovrebbero essere registrate a intervalli adeguati in funzione della durata della prova. Il rilevamento di tali effetti, per quanto difficili da quantificare, può facilitare l'interpretazione dei dati sulla mortalità, cioè fornire informazioni sul modo d'azione tossica della sostanza.
1.7.5.5. Lunghezza
Alla fine della prova si raccomanda di misurare la lunghezza degli individui, che può essere quella standard alla biforcazione della pinna caudale o quella totale. In caso di marcescenza della pinna caudale o erosione della pinna, si dovrebbe misurare la lunghezza standard. Generalmente, in una prova ben eseguita, il coefficiente di variazione della lunghezza tra le repliche dei controlli dovrebbe essere < 20 %.
1.7.5.6. Peso
Alla fine della prova si può procedere alla pesatura degli individui; i pesi a secco (24 ore a 60 oC sono preferibili ai pesi umidi (dopo asciugatura). Generalmente, in una prova ben eseguita, il coefficiente di variazione del peso tra le repliche dei controlli dovrebbe essere ≤ 20 %.
Al termine delle osservazioni alcuni o tutti i seguenti dati saranno disponibili per l'analisi statistica:
|
—
|
numero di larve sane alla fine della prova,
|
|
—
|
tempo all'inizio della schiusa e alla fine della schiusa (90 % di schiusa in ogni replica),
|
|
—
|
numero di larve che si schiudono ogni giorno,
|
|
—
|
lunghezza (e peso) degli animali sopravvissuti alla fine della prova,
|
|
—
|
numero delle larve deformi o di aspetto anomalo,
|
|
—
|
numero delle larve che presentano un comportamento anomalo.
|
2. DATI E RELAZIONE
2.1. TRATTAMENTO DEI RISULTATI
Si raccomanda di ricorrere a personale esperto di statistica sia per la concezione del disegno sperimentale che per l'analisi statistica dei risultati della prova, in quanto il metodo consente considerevoli variazioni nel disegno sperimentale, ad esempio nel numero di camere di prova e numero di concentrazioni di prova, nel numero iniziale di uova fecondate e nei parametri da misurare. Viste le diverse possibili opzioni di disegno sperimentale, in questa sede non si forniscono indicazioni specifiche sulle procedure statistiche.
Dovendo stimare i valori LOEC/NOEC sarà necessario analizzare le variazioni all'interno di ogni serie di repliche mediante l'analisi della varianza (ANOVA) o tabelle di contingenza. Per effettuare un confronto multiplo fra i risultati delle singole concentrazioni e quelli dei controlli, può essere utile il metodo di Dunnett (12) (13). Allo scopo sono disponibili anche altri metodi (14) (15). Occorre calcolare e riportare l'entità dell'effetto individuabile mediante ANOVA o altre procedure (vale a dire la potenza della prova). Va rilevato che non tutti i dati elencati nella sezione 1.7.5.6 sono adatti all'analisi statistica mediante ANOVA. Per esempio, la mortalità cumulativa e il numero delle larve sane alla fine della prova potrebbero essere analizzati con metodi dei probit.
Dovendo stimare i valori CL/CEX occorre adottare una curva/e adeguata/e (ad esempio la curva logistica) ai dati da analizzare mediante un metodo statistico come quello dei minimi quadrati o dei minimi quadrati non lineare. La/e curva/e dovrebbe/ro essere parametrizzata/e in modo da consentire di stimare direttamente la CL/CEX di interesse e il suo errore standard. Ciò faciliterà notevolmente il calcolo dei limiti di confidenza della CL/CEX. A meno che vi siano buoni motivi per preferire livelli fiduciali diversi dovrebbero essere riportati limiti di confidenza a due code ad un livello fiduciale del 95 %. La procedura di adattamento della curva dovrebbe preferibilmente consentire di valutare il significato della mancanza di adattamento (lack of fit). È possibile usare metodi grafici per l'adattamento delle curve. L'analisi di regressione è adatta a tutti i dati elencati nella sezione 1.7.5.6,
2.2. INTERPRETAZIONE DEI RISULTATI
I risultati vanno interpretati con cautela nel caso in cui nelle soluzioni di prova si misurino concentrazioni di sostanze tossiche a livelli vicini al limite di rivelabilità del metodo analitico. Occorre usare cautela anche nell'interpretazione dei risultati riferiti a concentrazioni al di sopra della solubilità in acqua della sostanza.
2.3. RELAZIONE SULLA PROVA
La relazione sulla prova deve contenere le seguenti informazioni:
2.3.1. Sostanza di prova:
|
—
|
natura fisica e proprietà fisico-chimiche rilevanti,
|
|
—
|
dati chimici di identificazione, compresi purezza e metodo analitico per la quantificazione della sostanza di prova, se del caso.
|
2.3.2. Specie utilizzata:
|
—
|
nome scientifico, ceppo, numero di pesci riproduttori (cioè quante femmine sono state usate per produrre il numero di uova necessarie per la prova), origine e metodo di raccolta delle uova fecondate e successiva manipolazione.
|
2.3.3. Condizioni di esecuzione della prova:
|
—
|
procedura di prova utilizzata (ad esempio semistatica o a flusso continuo, periodo di tempo dalla fecondazione all'inizio della prova, carico, ecc),
|
|
—
|
disegno sperimentale (ad esempio, numero di camere di prova e repliche, numero di embrioni per replica),
|
|
—
|
metodo di preparazione delle soluzioni madre e frequenza di rinnovo (l'agente solubilizzante, se usato, deve essere indicato insieme alla sua concentrazione),
|
|
—
|
concentrazioni nominali di prova, valori misurati, loro medie e deviazioni standard nei recipienti di prova e metodo con cui sono state ottenute e, se la sostanza è solubile in acqua a concentrazioni inferiori a quelle provate, va dimostrato che le misurazioni si riferiscono alle concentrazioni della sostanza di prova in soluzione,
|
|
—
|
caratteristiche dell'acqua di diluizione: pH, durezza, temperatura, concentrazione di ossigeno disciolto, livelli di cloro residuo (se misurati), carbonio organico totale, solidi sospesi, salinità del mezzo di prova (se misurato) ed eventuali altre misurazioni effettuate,
|
|
—
|
qualità dell'acqua nei recipienti di prova: pH, durezza, temperatura e concentrazione di ossigeno disciolto.
|
2.3.4. Risultati:
|
—
|
risultati di eventuali studi preliminari sulla stabilità della sostanza di prova,
|
|
—
|
dimostrazione che i controlli rispondono allo standard di accettabilità di sopravvivenza complessiva della specie in esame (appendici 2 e 3),
|
|
—
|
dati sulla mortalità/sopravvivenza agli stadi embrionale e larvale e mortalità/sopravvivenza complessiva,
|
|
—
|
giorni alla schiusa e numero di uova schiuse,
|
|
—
|
dati relativi alla lunghezza (e al peso),
|
|
—
|
incidenza e descrizione delle eventuali anomalie morfologiche,
|
|
—
|
incidenza e descrizione degli eventuali effetti sul comportamento,
|
|
—
|
analisi statistica e trattamento dei dati,
|
|
—
|
per le prove analizzate mediante ANOVA, minima concentrazione con effetti significativi (LOEC) con p = 0,05 e massima concentrazione senza effetti significativi (NOEC) per ogni risposta analizzata, compresa una descrizione delle procedure statistiche utilizzate e un'indicazione dell'entità dell'effetto che poteva essere individuato.
|
|
—
|
per le prove analizzate mediante tecniche di regressione. CL/CEX e intervalli di confidenza, nonché un grafico del modello adattato usato per i relativi calcoli,
|
|
—
|
spiegazione di eventuali deviazioni da questo metodo.
|
3. BIBLIOGRAFIA
|
(1)
|
Kristensen P. (1990). Evaluation of the Sensitivity of Short Term Fish Early Life Stage Tests in Relation to other FELS Test Methods. Final report to the Commission of the European Communities, 60 pp. June 1990.
|
|
(2)
|
ASTM (1988). Standard Guide for Conducting Early Life-Stage Toxicity Tests with Fishes. American Society for Testing and Materials. E 1241-88. 26 pp.
|
|
(3)
|
Brauhn J. L. and Schoettger R. A. (1975). Acquisition and Culture of Research Fish: Rainbow trout, Fathead minnows, Channel Catfish and Bluegills. p. 54, Ecological Research Series, EPA-660/3-75-011, Duluth, Minnesota.
|
|
(4)
|
Brungs W. A. and Jones B. R. (1977). Temperature Criteria for Freshwater Fish: Protocol and Procedures. p. 128, Ecological Research Series EPA-600/3-77-061, Duluth, Minnesota.
|
|
(5)
|
Laale H. W. (1977). The Biology and Use of the Zebrafish (Brachydanio rerio) in Fisheries Research. A Literature Review. J. Biol. 10, pp. 121-173.
|
|
(6)
|
Legault R. (19 58). A Technique for Controlling the Time of Daily Spawning and Collecting Eggs of the Zebrafish, Brachydanio rerio (Hamilton-Buchanan) Copeia, 4, pp. 328-330,
|
|
(7)
|
Dave G., Damgaard B., Grande M., Martelin J. E., Rosander B. and Viktor T. (1987). Ring Test of an Embryo-larval Toxicity Test with Zebrafish (Brachydanio rerio) Using Chromium and Zinc as Toxicants. Environmental Toxicology and Chemistry, 6, pp. 61-71.
|
|
(8)
|
Birge J. W., Black J. A. and Westerman A. G. (1985). Short-term Fish and Amphibian Embryo-larval Tests for Determining the Effects of Toxicant Stress on Early Life Stages and Estimating Chronic Values for Single Compounds and Complex Effluents. Environmental Toxicology and Chemistry 4, pp. 807-821.
|
|
(9)
|
Van Leeuwen C. J., Espeldoorn A. and Mol F. (1986). Aquatic Toxicological Aspects of Dithiocarbamates and Related Compounds. III. Embryolarval Studies with Rainbow Trout (Salmo gairdneri). J. Aquatic Toxicology, 9, pp. 129-145.
|
|
(10)
|
Kirchen R. V. and W. R. West (1969). Teleostean Development. Carolina Tips 32(4): 1-4. Carolina Biological Supply Company.
|
|
(11)
|
Kirchen R. V. and W. R. West (1976). The Japanese Medaka. Its care and Development. Carolina Biological Supply Company, North Carolina. 36 pp.
|
|
(12)
|
Dunnett C. W. (19 55). A Multiple Comparisons Procedure for Comparing Several Treatments with Control. J. Amer. Statist. Assoc, 50, pp. 1096-1121.
|
|
(13)
|
Dunnett C. W. (1964). New Tables for Multiple Comparisons with a Control. Biometrics, 20, pp. 482-491.
|
|
(14)
|
Mc Clave J. T., Sullivan J. H. and Pearson J.G. (1980). Statistical Analysis of Fish Chronic Toxicity Test Data. Proceedings of 4th Aquatic Toxicology Symposium, ASTM, Philadelphia.
|
|
(15)
|
Van Leeuwen C. J., Adema D. M. M. and Hermes J. (1990). Quantitative Structure-Activity Relationships for Fish Early Life Stage Toxicity. Aquatic Toxicology, 16, pp. 321-334.
|
|
(16)
|
Environment Canada. (1992). Toxicity Tests Using Early Life Stages of Salmonid Fish (Rainbow Trout, Coho Salmon or Atlantic Salmon). Biological Test Method Series. Report EPS 1/RM/28, December 1992, 81 pp.
|
|
(17)
|
Dave G. and Xiu R. (1991). Toxicity of Mercury, Nickel, Lead and Cobalt to Embryos and Larvae of Zebrafish. Brachydanio rerio. Arch, of Environmental Contamination and Toxicology, 21, pp. 126-134.
|
|
(18)
|
Meyer A., Bierman C. H. and Orti G. (1993). The phylogenetic position of the Zebrafish (Danio rerio), a model system in developmental biology — an invitation to the comperative methods. Proc. Royal Society of London. Series B, 252: pp. 231-236.
|
|
(19)
|
Ghillebaert F., Chaillou C. Deschamps F. and Roubaud P. (1995). Toxic Effects, at Three pH Levels, of Two Reference Molecules on Common Carp Embryo. Ecotoxicology and Environmental Safety 32, pp. 19-28,
|
|
(20)
|
US EPA, (1991). Guidelines for Culturing the Japanese Medaka, Oryzias latipes. EPA report EPA/600/3-91/064, Dec. 1991, EPA, Duluth.
|
|
(21)
|
US EPA, (1991). Guidelines for Conducting Early Life Stage Toxicity Tests with Japanese Medaka, (Orvzias latipes). EPA report EPA/600/3-91/063, Dec. 1991, EPA, Duluth.
|
|
(22)
|
De Graeve G. M., Cooney J. D., McIntyre D. O., Poccocic T. L, Reichenbach N. G., Dean J. H. and Marcus M. D. (1991). Validity in the performance of the seven-day Fathead minnow (Pimephales promelas) larval survival and growth test: an intra- and interlaboratory study. Environ. Tox. Chem. 10, pp. 1189-1203.
|
|
(23)
|
Calow P. (1993). Handbook of Ecotoxicology, Blackwells, Oxford. Vol. 1, Chapter 10: Methods for spawning, culturing and conducting toxicity tests with Early Life stages of Estuarine and Marine fish.
|
|
(24)
|
Balon E. K. (198 5). Early life history of fishes: New developmental, ecological and evolutionary perspectives, Junk Publ., Dordrecht, 280 pp.
|
|
(25)
|
Blaxter J. H. S. (1988). Pattern and variety in development, in: W. S. Hoar and D. J. Randall eds., Fish Physiology, Vol. XIA, Academic press, pp. 1-58.
|
TABELLA 1A
Specie di pesci raccomandate per la prova
|
ACQUA DOLCE
|
|
Oncorhynchus mykiss
Trota iridea (9) (16)
|
|
Danio rerio
Danio zebrato (7) (17) (18)
|
|
Cyprinus capilo
Carpa (8) (19)
|
|
Orvzias latipes
(20) (21)
|
|
Pimephales promelas
(8) (22)
|
TABELLA 1B
Esempi di altre specie ben documentate
|
Acqua dolce
|
Acqua salata
|
|
Carassius auratus
Carassio dorato (8)
|
Menidia peninsulare
Latterino menidia (23) (24) (25)
|
|
Lepomis macrochirus
(8)
|
Clupea harengu
Aringa (24) (25)
|
|
Gadus morhua
Merluzzo comune (24) (25)
|
|
Cyprinodon variegates
(23) (24) (25)
|
APPENDICE 1
GUIDA ALL'ESECUZIONE DI UNA PROVA DI TOSSICITÀ SUGLI EMBRIONI E SULLE LARVE CON SACCO VITELLINO DEL DANIO ZEBRATO (BRACHYDANIO RERIO)
INTRODUZIONE
Il danio zebrato proviene dalla costa di Coromandel, in India, dove vive in corsi d'acqua a corso rapido. Si tratta di un comune pesce da acquario della famiglia delle carpe e le informazioni sulla sua cura e sul suo allevamento si trovano nella normale bibliografia sui pesci tropicali. La sua biologia e il suo impiego nella ricerca ittica sono stati riesaminati da Laale (1).
Questo pesce, che supera raramente i 45 mm di lunghezza, ha il corpo di forma cilindrica, con 7-9 strisce orizzontali blu scuro argentate che arrivano alla pinna caudale e anale. Il dorso è verde oliva. I maschi sono più sottili delle femmine, le quali sono più argentate e presentano l'addome disteso, soprattutto prima della deposizione delle uova.
Gli esemplari adulti sono in grado di tollerare ampie fluttuazioni di temperatura, pH e durezza dell'acqua, ma per ottenere pesci sani che producano uova di buona qualità è necessario creare le condizioni ottimali.
Durante la deposizione delle uova, il maschio insegue e colpisce la femmina con la testa e feconda le uova appena espulse. Le uova, trasparenti e non adesive, cadono sul fondo, dove possono essere mangiate dai genitori. La deposizione delle uova viene influenzata dalla luce. Se la luce del mattino è adeguata, in genere il pesce depone le uova nelle prime ore dopo l'alba.
Ogni femmina può produrre lotti di parecchie centinaia di uova a intervalli settimanali.
CONDIZIONI DEI PESCI RIPRODUTTORI, RIPRODUZIONE E STADI DI VITA PRECOCI
Scegliere un numero adeguato di pesci sani e tenerli in un'acqua adatta (cfr. ad esempio l'appendice 4) per almeno 2 settimane prima della deposizione delle uova progettata. È necessario consentire al gruppo di pesci di riprodursi almeno una volta prima di produrre il lotto di uova da utilizzare nella prova. La densità dei pesci durante questo periodo non dovrebbe superare 1 grammo di pesce per litro. La sostituzione regolare dell'acqua o l'uso di sistemi di purificazione consente di mantenere una maggiore densità. La temperatura nelle di mantenimento dovrebbe essere mantenuta a 25 ± 2 oC. Il pesce deve avere una dieta varia che può essere costituita, per esempio, da mangime secco commerciale adatto, individui vivi appena schiusi di Artemia, chironomidi, Daphnia ed oligocheti (Enchytrraeidae).
Di seguito vengono descritte due procedure che, nella pratica, hanno consentito di ottenere un lotto sufficiente di uova sane e fecondate per effettuare la prova:
|
i)
|
In una vasca contenente 50 litri di acqua di diluizione vengono posti 8 femmine e 16 maschi, schermati dalla luce diretta e lasciati il più possibile indisturbati per almeno 48 ore. Nel pomeriggio precedente l'inizio della prova sul fondo dell'acquario viene posto un vassoio per la deposizione delle uova, costituita da un telaio di plexiglas o di altro materiale adatto alto 5-7 mm con una rete a maglia grossa di 2-5 mm fissata sul lato superiore e una rete a maglia fine di 10-30 μm sul fondo. Alla rete a maglia grossa sono attaccati numerosi «alberi di deposizione» formati da corde di nylon non ritorte. I pesci vengono lasciati nell'oscurità per 12 ore, dopo di che viene accesa una luce debole che darà inizio alla deposizione delle uova. Circa 2-4 ore dopo la deposizione delle uova si rimuove l'apposito vassoio e si raccolgono le uova. Il vassoio impedisce ai pesci di cibarsi delle uova e, allo stesso tempo, consente di raccoglierle facilmente. Il gruppo di pesci dovrebbe aver già deposto uova almeno una volta prima della deposizione di quelle destinate alla prova.
|
|
ii)
|
5-10 pesci maschi e femmine vengono mantenuti singolarmente per almeno 2 settimane prima della deposizione delle uova progettata. Dopo 5-10 giorni l'addome delle femmine apparirà disteso e saranno visibili le loro papille genitali. I maschi non hanno papille. Le uova vengono deposte in apposite vasche fornite di un falso fondo di rete (come descritto sopra). La vasca è riempita di acqua di diluizione, con una profondità di 5-10 cm al di sopra della rete. Il giorno prima della prevista deposizione si introducono nella vasca una femmina e due maschi. La temperatura dell'acqua viene progressivamente aumentata di un grado oltre la temperatura di acclimatazione. Si spegne la luce e si lascia la vasca il più possibile indisturbata. Il mattino seguente si accende una luce debole che darà inizio alla deposizione delle uova. Dopo 2-4 ore si rimuovono i pesci e si raccolgono le uova. Se sono necessarie più uova rispetto a quelle ottenibili da una sola femmina si possono allestire contemporaneamente più vasche di deposizione. Registrando il successo riproduttivo delle singole femmine prima della prova (numero e qualità delle uova deposte), è possibile selezionare per l'allevamento le femmine che presentano maggiore successo riproduttivo.
|
Le uova vanno trasferite nei recipienti di prova mediante tubi di vetro (diametro interno non inferiore a 4 mm), dotate di bulbo contagocce flessibile. La quantità di acqua raccolta con le uova nel trasferimento dovrebbe essere la minima possibile. Le uova sono più pesanti dell'acqua e colano fuori dal tubo. Occorre evitare che le uova (e le larve) vengano a contatto con l'aria. Alcuni campioni del/i lotto/i vanno esaminati al microscopio per verificare che i primi stadi dello sviluppo non presentino irregolarità. Non è consentito disinfettare le uova.
Il tasso di mortalità delle uova è massimo entro le prime 24 ore dalla fecondazione. Spesso, in questo periodo, si registra una mortalità che varia tra il 5 e il 40 %. Le uova degenerano se non sono fecondate o per difetti dello sviluppo. Sembra che la qualità delle uova dipenda dalla femmina; infatti, alcune femmine producono costantemente uova di buona qualità, altre non vi riescono mai. Anche la velocità di sviluppo e la percentuale di schiusa variano da un lotto all'altro. Le uova fecondate e le larve con sacco vitellino sopravvivono bene, generalmente per oltre il 90 %. A 25 oC le uova si schiudono 3-5 giorni dopo la fecondazione e il sacco vitellino viene assorbito all'incirca 13 giorni dopo la fecondazione.
Lo sviluppo embrionale è stato accuratamente descritto da Hisaoka e Battle (2). Grazie alla trasparenza delle uova e delle larve dopo la schiusa è possibile seguire lo sviluppo del pesce e osservare la presenza di eventuali malformazioni. Circa 4 ore dopo la deposizione è possibile distinguere le uova non fecondate da quelle fecondate (3). Per effettuare questo esame si pongono uova e larve in recipienti di prova di dimensioni ridotte e le si studiano al microscopio.
Le condizioni di esecuzione della prova che si applicano ai primi stadi di vita sono specificate nell'appendice 2. I valori ottimali del pH e della durezza dell'acqua di diluizione sono rispettivamente 7,8 e 250 mg CaCO3/l.
CALCOLI E STATISTICA
Si propone un approccio a due fasi. Anzitutto si analizzano statisticamente i dati sulla mortalità, sulle anomalie dello sviluppo e sul tempo di schiusa. Poi si valuta statisticamente la lunghezza del corpo, per le concentrazioni alle quali non sono stati rilevati effetti negativi per nessuno dei precedenti parametri. Si consiglia questo approccio in quanto la sostanza tossica può uccidere selettivamente i pesci più piccoli, ritardare il tempo di schiusa e indurre gravi malformazioni, influenzando così i valori relativi alla lunghezza. Inoltre il numero di pesci da misurare per ogni trattamento sarà all'incirca uguale, garantendo così la validità dei dati statistici.
DETERMINAZIONE DELLA CL50 E DELLA CE50
Si calcola la percentuale di uova e larve sopravvissute e la si corregge in base alla mortalità riscontrata nei controlli, mediante la formula di Abbot (4):
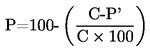
dove
|
P
|
=
|
% sopravvivenza corretta
|
|
P'
|
=
|
% sopravvivenza osservata nella concentrazione di prova
|
|
C
|
=
|
% sopravvivenza nel controllo
|
Se possibile, la CL50 viene determinata alla fine della prova mediante un metodo adeguato.
Per includere nel calcolo statistico della CE50 anche le anomalie morfologiche. si rimanda a Stephan (5).
STIMA DEI VALORI DI LOEC E NOEC
Uno degli obiettivi della prova sulle uova e sulle larve con sacco vitellino è paragonare le concentrazioni diverse da zero con il controllo, cioè determinare la LOEC. Occorre dunque utilizzare procedure di comparazione multipla (6) (7) (8) (9) (10).
BIBLIOGRAFIA
|
(1)
|
Laale H. W. (1977). The Biology and Use of the Zebrafish (Brachydanio rerio) in Fisheries Research. A Literature Review.). Fish Biol. 10. pp. 121-173.
|
|
(2)
|
Hisaoka K.K. and Battle H.I. (1958). The Normal Development Stages of the Zebrafish Brachydanio rerio (Hamilton-Buchanan) J. Morph., 102, 311 pp.
|
|
(3)
|
Nagel R. (1986). Untersuchungen zur Riproduktion beim Zebrabärbling (Brachydanio rerio Hamilton-Buchanan). Journal of Applied Ichthyology, 2, pp. 173-181.
|
|
(4)
|
Finney D.J. (1971). Probit Analysis, 3rd ed., Cambridge University Press, Great Britain, pp. 1-333.
|
|
(5)
|
Stephan C. E. (1982). Increasing the Usefulness of Acute Toxicity Tests. Aquatic Toxicology and Hazard Assessment: Fifth Conference, ASTM STP 766, J.G. Pearson, R.B. Foster and W.E. Bishop, Eds., American Society for Testing and Materials, pp. 69-81.
|
|
(6)
|
Dunnett C.W. (1955). A Multiple Comparisons Procedure for Comparing Several Treatments with a Control. J. Amer. Statist. Assoc, 50, pp. 1096-1121.
|
|
(7)
|
Dunnett C.W. (1964). New Tables for Multiple Comparisons with a Control. Biometrics, 20, pp. 482-491.
|
|
(8)
|
Williams D.A. (1971). A Test for Differences Between Treatment Means when Several Dose Levels are Compared with a Zero Dose Control. Biometrics, 27, pp. 103-117.
|
|
(9)
|
Williams D.A. (1972). The Comparison of Several Dose Levels with a Zero Dose Control. Biometrics 28, pp. 519-531.
|
|
(10)
|
Sokal R.R. and Rohlf F.J. (1981). Biometry, the Principles and Practice of Statistics in Biological Research, W. H. Freeman and Co., San Francisco.
|
APPENDICE 2
CONDIZIONI DI ESECUZIONE DELLA PROVA, DURATA E CRITERI DI SOPRAVVIVENZA PER LE SPECIE RACCOMANDATE
|
Specie
|
Temperatura
(oC)
|
Salinità
(0/0")
|
Fotoperiodo
(ore)
|
Durata degli stadi
(giorni)
|
Durata tipica della prova
|
Sopravvivenza del controllo
( % minima)
|
|
Embrioni
|
Larve con sacco vitellino
|
Successo alla schiusa
|
Post-schiusa
|
|
ACQUA DOLCE
|
|
Brachydanio rerio
Danio zebrato
|
25 ±1
|
—
|
12-16
|
3-5
|
8-10
|
Appena possibile dopo la fecondazione (inizio stadio di gastrula) fino a 5 giorni dopo la schiusa (8-10 giorni)
|
80
|
90
|
|
Oncorhynchus mykiss
Trota iridea
|
10 ± 1 (23)
12 ± 1 (24)
|
—
|
0 (25)
|
30-35
|
25-30
|
Appena possibile dopo la fecondazione (inizio stadio gastrula) fino a 20 giorni dopo la schiusa (50-55 giorni)
|
66
|
70
|
|
Carpa carpio
Carpa
|
21-25
|
—
|
12-16
|
5
|
> 4
|
Appena possibile dopo la fecondazione (inizio stadio gastrula) fino a 4 giorni dopo la schiusa (8-9 giorni)
|
80
|
75
|
|
Oryzias lalipes
|
24 ± 1 (23)
23 ± 1 (24)
|
—
|
12-16
|
8-11
|
4-8
|
Appena possibile dopo la fecondazione (inizio stadio gastrula) fino a 5 giorni dopo la schiusa (13-16 giorni)
|
80
|
80
|
|
Pimephales promelas
|
25 ± 2
|
—
|
16
|
4-5
|
5
|
Appena possibile dopo la fecondazione (inizio stadio gastrula) fino a 4 giorni dopo la schiusa (8-9 giorni)
|
60
|
70
|
APPENDICE 3
Condizioni di esecuzione della prova, durata e criter1 di sopravvivenza per altre specie ben documentate
|
Specie
|
Temperatura ( oC)
|
Salinità (0/00)
|
Fotoperiodo (ore)
|
Durata degli sudi (giorni)
|
Durata tipica della prova su embrioni e larve con sacco vitellino
|
Sopravvivenza dei controlli ( % minima)
|
|
|
|
|
|
Embrioni
|
Larve con sacco vitellino
|
Successo alla schiusa
|
Post-schiusa
|
|
ACQUA DOLCE
|
|
Carassius auratus
Carassio dorato
|
24 ± 1
|
—
|
—
|
3-4
|
> 4
|
Appena possibile dopo la fecondazione (inizio stadio gastrula) fino a 4 giorni dopo la schiusa (7 giorni)
|
—
|
80
|
|
Leopomis macrochirus
|
21 ± 1
|
—
|
16
|
3
|
> 4
|
Appena possibile dopo la fecondazione (inizio stadio gastrula) fino a 4 giorni dopo la schiusa (7 giorni)
|
—
|
75
|
|
ACQUA SALATA
|
|
Menida peninsulare
Latterino menidia
|
22-25
|
15-22
|
12
|
1,5
|
10
|
Appena possibile dopo la fecondazione (inizio stadio gastrula) fino a 5 giorni dopo la schiusa (6-7 giorni)
|
80
|
60
|
|
Clupea harengus
Aringa
|
10 ± 1
|
8-15
|
12
|
20-25
|
3-5
|
Appena possibile dopo la fecondazione (inizio stadio gastrula) fino a 3 giorni dopo la schiusa (23-27 giorni)
|
60
|
80
|
|
Gadus morhua
Merluzzo comune
|
5 ± 1
|
5-30
|
12
|
14-16
|
3-5
|
Appena possibile dopo la fecondazione (inizio stadio gastrula) fino a 3 giorni dopo la schiusa (18 giorni)
|
60
|
80
|
|
Cyprinodon variegatus
|
25 ± 1
|
15-30
|
12
|
—
|
—
|
Appena possibile dopo la fecondazione (inizio stadio gastrula) fino a 4-7 giorni dopo la schiusa (28 giorni)
|
> 75
|
80
|
APPENDICE 4
ALCUNE CARATTERISTICHE CHIMICHE DI UN'ACQUA DI DILUIZIONE ACCETTABILE
|
Sostanza
|
Concentrazioni
|
|
Particolato
|
< 20 mg/1
|
|
Carbonio organico totale
|
< 2 mg/1
|
|
Ammoniaca non ionizzata
|
< 1 μg/l
|
|
Cloro residuo
|
< 10 μg/1
|
|
Pesticidi organofosforati totali
|
< 50 ng/1
|
|
Pesticidi organoclorurati totali più difenili policlorurati
|
< 50 ng/1
|
|
Cloro organico totale
|
< 25 ng/1
|
C.16. API MELLIFERE — TEST DI TOSSICITÀ ORALE ACUTA
1. METODO
Questo metodo di test della tossicità acuta corrisponde al TG 213 (1998) dell'OCSE.
1.1. INTRODUZIONE
Questo test di tossicità è un metodo di laboratorio progettato per valutare la tossicità orale acuta dei fitofarmaci e di altre sostanze chimiche sulle api operaie adulte.
Per determinare e valutare le proprietà tossiche delle sostanze può rendersi necessario determinare la tossicità orale acuta sulle api, ad esempio in caso di probabile esposizione di api a una data sostanza. Il test di tossicità orale acuta viene eseguito per determinare la tossicità intrinseca dei pesticidi e di altre sostanze chimiche sulle api. In base ai risultati di tale test si valuta la necessità di effettuare analisi più approfondite. In particolare questo metodo può essere applicato per valutare i rischi che i pesticidi presentano per le api nell'ambito di un programma di test a più fasi che prevede in sequenza l'esecuzione di test in laboratorio, di esperimenti condotti parzialmente di semi-campo ed altri di campo (1). I pesticidi possono essere testati come principi attivi (p.a.) oppure come prodotti formulati.
Per verificare la sensibilità delle api e la precisione della procedura del test si utilizza una sostanza tossica standard.
1.2. DEFINIZIONI
Tossicità orale acuta: effetti avversi che si verificano entro un massimo di 96 ore dalla somministrazione orale di una dose singola della sostanza in esame.
Dose: quantità della sostanza di prova consumata, espressa in termini di massa (μg) della sostanza per animale sperimentale (μg/ape). Non è possibile calcolare la dose reale per ogni ape, in quanto le api vengono alimentate tutte insieme, ma si può fare una stima della dose media (sostanza consumata in totale/numero di api in una gabbia).
DL
50
(Dose Letale Mediana) orale: dose singola, calcolata statisticamente, di una sostanza in grado di provocare la morte del 50 % degli animali se somministrata per via orale. Il valore della DL50 si esprime in μg di sostanza di prova per ape. Nel caso dei pesticidi la sostanza di prova può essere un principio attivo (p.a.) o un prodotto formulato contenente uno o più principi attivi.
Mortalità: si registra la morte di un animale quando l'esemplare resta completamente immobile.
1.3. PRINCIPIO DEL METODO UTILIZZATO
Si espongono api operaie adulte (Apis mellifera) a un range di dosi della sostanza in esame dispersa in soluzioni di saccarosio. Successivamente si alimentano le api con la stessa dieta, senza la sostanza in esame. Per almeno 48 ore si registra quotidianamente la mortalità e la si confronta con i valori di controllo. Se il tasso di mortalità aumenta fra le 24 ore e le 48 ore mentre la mortalità dei controlli resta a livelli accettabili, ovvero ≤ 10 %,. il test deve essere protratto fino a un massimo di 96 ore. Si analizzano i risultati per calcolare la DL50 a 24 ore e 48 ore e. nel caso lo studio venga prolungato, a 72 ore e 96 ore.
1.4. VALIDITÀ DEL TEST
Perché un test sia valido devono realizzarsi le seguenti condizioni:
|
—
|
la mortalità media del numero totale dei controlli non deve superare il 10 % alla fine del test,
|
|
—
|
la DL50 della sostanza tossica standard corrisponde al range specificato.
|
1.5. DESCRIZIONE DEL METODO UTILIZZATO
1.5.1. Raccolta delle api
Si utilizzano giovani api operaie adulte della stessa razza, della stessa età, alimentate allo stesso modo ecc. Le api vanno prelevate da colonie con regina, devono essere adeguatamente nutrite e sane e, per quanto possibile, esenti da malattie con storia e condizioni fisioloeiche note. Possono essere raccolte la mattina del test o la sera prima e vanno tenute in condizioni sperimentali fino al giorno successivo. Si prestano a tale fine le api raccolte da telaini senza covata. È meglio evitare di raccogliere gli insetti all'inizio della primavera o alla fine dell'autunno, poiché in tali periodi il loro stato fisiologico è alterato. Dovendo eseguire i test all'inizio della primavera o alla fine dell'autunno, si possono tenere le api in un'incubatrice e allevarle per una settimana con polline raccolto dal favo e soluzione di saccarosio. Le api trattate con sostanze chimiche quali antibiotici, prodotti anti-Varroa ed altri non possono essere utilizzate nei test di tossicità prima di quattro settimane dalla fine dell'ultimo trattamento.
1.5.2. Condizioni di mantenimento e alimentazione
Si usano gabbie facili da pulire e ben ventilate di qualsiasi materiale adatto: acciaio inossidabile, reti di ferro, plastica o legno monouso. Il numero ideale è di dieci api per gabbia. Le dimensioni delle gabbie devono essere adeguate al numero di api per garantire uno spazio sufficiente.
Le api devono essere mantenute nell'oscurità in una stanza sperimentale a una temperatura di 25 ± 2 oC. L'umidità relativa (normalmente tra 50-70 %) va registrata durante tutto il test. Le procedure di manipolazione, compresi il trattamento e le osservazioni, possono essere condotte in presenza di luce (naturale). L'alimentazione è costituita da una soluzione di saccarosio in acqua ad una concentrazione finale di 500 g/l (50 % p/v). Dopo aver somministrato le dosi sperimentali, le api vanno alimentate per tutta la durata del test. Il sistema di alimentazione deve consentire di registrare l'assunzione di cibo per ogni gabbia (cfr. sezione 1.6.3.1). Come tale si può usare una pipetta di vetro (lunga 50 mm e larga 10 mm circa con l'estremità aperta ristretta a circa 2 mm di diametro).
1.5.3. Preparazione delle api
Le api raccolte vengono collocate per randomizzazione nelle gabbie, a loro volta poste in maniera randomizzata nella stanza sperimentale.
Prima di iniziare il test si possono lasciare le api a digiuno per un massimo di 2 ore. Si raccomanda di privare le api del cibo prima del trattamento in modo che all'inizio del test risultino tutte uguali per contenuto intestinale. Prima di cominciare il test occorre scartare le eventuali api moribonde e sostituirle con api sane.
1.5.4. Preparazione delle dosi
Se la sostanza di prova è un composto idromiscibile, la si può disperdere direttamente in una soluzione di saccarosio al 50 %. Per i prodotti tecnici e le sostanze a bassa idrosolubilità è possibile usare veicoli come i solventi organici, gli emulsionanti e i disperdenti scarsamente tossici per le api (quali acetone, dimetilformammide, dimetilsolfossido). La concentrazione del veicolo dipende dalla solubilità della sostanza di prova e deve essere uguale per tutte le concentrazioni testate. Generalmente, però, non si dovrebbe superare una concentrazione dell'1 %, che risulta essere la più appropriata.
Occorre preparare adeguate soluzioni di controllo; quando si utilizza un solvente o un disperdente per solubilizzare la sostanza vanno usati due gruppi di controllo separati: una soluzione in acqua e una soluzione di saccarosio con il solvente/veicolo alla concentrazione usata nelle soluzioni di dosaggio.
1.6. PROCEDURA
1.6.1. Gruppi sperimentali e gruppi di controllo
Il numero di dosi e di repliche testati deve soddisfare i requisiti statistici per la determinazione della DL50 con limiti di affidabilità del 95 %. Per il test sono di solito necessarie cinque dosi in serie geometriche, con un fattore non superiore a 2,2 e che coprano il range della DL50. È tuttavia necessario determinare il fattore di diluizione e il numero di concentrazioni per dosaggio, in relazione alla pendenza della curva di tossicità (dose/mortalità) e tenendo conto del metodo statistico scelto per l'analisi dei risultati. Un test di ricerca del range permette di scegliere le concentrazioni adeguate per dosaggio.
Con ogni concentrazione utilizzata vanno effettuate almeno 3 repliche, ognuna di dieci api. Oltre alle serie sperimentali è necessario analizzare almeno tre lotti di controllo, ognuno di dieci api. Occorrono 3 gruppi di controllo anche per i solventi/veicoli usati (cfr. sezione 1.5.4).
1.6.2. Sostanza tossica standard
Nelle serie sperimentali deve essere inclusa una sostanza tossica standard. Occorre selezionare almeno tre dosi che coprano il valore atteso di DL50. Per ciascuna dose si utilizzano almeno tre gabbie, ognuna contenente dieci api. La sostanza tossica di elezione è il dimetoato, per il quale la DL50 sulle 24 ore per somministrazione orale si colloca tra 0,10 e 0,35 μg p.a./ape (2). Tuttavia sono accettabili anche altre sostanze tossiche standard di cui occorre avere dati sufficienti per verificare la risposta attesa rispetto alla dose (ad esempio il parathion).
1.6.3. Esposizione
1.6.3.1. Somministrazione delle dosi
Ogni gruppo sperimentale di api deve ricevere 100-200 μl di soluzione di saccarosio/acqua al 50 % contenente la sostanza in esame alla concentrazione adeguata. Per i prodotti a bassa solubilità, bassa tossicità o bassa concentrazione nella formulazione è necessario aumentare il volume, in quanto vanno usate proporzioni maggiori nella soluzione di saccarosio. È necessario monitorare la quantità di cibo trattato consumato da ciascun gruppo. Una volta vuoto (in genere entro 3-4 ore), l'alimentatore va tolto dalla gabbia e sostituito con un altro contenente solo la soluzione di saccarosio. Le soluzioni di saccarosio vengono quindi somministrate ad libitum. Per alcune sostanze a concentrazioni elevate è possibile che le api rifiutino l'alimentazione trattata. Anche se le quantità consumate sono ridotte, dopo un massimo di 6 ore il cibo trattato non consumato va comunque sostituito con la soluzione di solo saccarosio. È necessario valutare la quantità di cibo trattato consumato (ad esempio con misurazione del peso/volume del cibo trattato rimanente).
1.6.3.2. Durata
Il test dovrebbe durare 48 ore dal momento della sostituzione della soluzione di prova con la soluzione di solo saccarosio. Se la mortalità continua ad aumentare di oltre il 10 % dopo le prime 24 ore, la durata del test va prolungata fino ad un massimo di 96 ore, sempre che la mortalità fra i controlli non superi il 10 %.
1.6.4. Osservazioni
La mortalità viene registrata 4 ore dopo l'inizio del test e in seguito dopo 24 ore e 48 ore dalla somministrazione della dose. In caso di prolungamento del periodo di osservazione occorre effettuare altre valutazioni a intervalli di 24 ore, fino a un massimo di 96 ore, sempre che la mortalità nei controlli non superi il 10 %.
E necessario stimare la quantità di cibo trattato consumato da ciascun gruppo. Il confronto fra la quantità consumata di cibo trattato e non trattato entro le 6 ore può fornire informazioni sulla gustosità della dieta trattata.
Vanno registrate tutte le anomalie del comportamento osservate durante il periodo di svolgimento del test.
1.6.5. Test limite
In alcuni casi (ad esempio quando si presume che la sostanza di prova sia poco tossica) si può eseguire un test limite utilizzando 100 μg p.a./ape per dimostrare che la DL50 è maggiore di tale valore. La procedura da seguire è la stessa, comprese le tre repliche per dose di prova, i controlli, la valutazione della quantità di cibo trattato consumato e l'uso della sostanza tossica standard. Se si verificano casi di mortalità occorre effettuare uno studio completo. Se si verificano effetti subletali, è necessario registrarli (cfr. sezione 1.6.4).
2. DATI E RELAZIONE
2.1. DATI
I dati vanno riassunti in una tabella che evidenzi il numero di api usate, la mortalità a ogni osservazione e il numero di api con comportamento anomalo per ogni gruppo di trattamento, di controllo e relativo alla sostanza tossica standard. Per analizzare i dati della mortalità occorrono metodi statistici adeguati (ad esempio analisi probit, media mobile, probabilità binomiale) (3) (4). Occorre tracciare curve dose-risposta per ogni tempo di osservazione raccomandato e calcolare le pendenze delle curve e le dosi letali mediane (DL50) con limiti di affidabilità al 95 %. Le correzioni per la mortalità fra i controlli possono essere effettuate con il metodo di Abbott (4) (5). Quando il cibo trattato non viene consumato completamente è necessario determinare la dose della sostanza in esame consumata da ciascun gruppo. La DL50 va espressa in μg di sostanza di prova per ape.
2.2. RELAZIONE SUL TEST
La relazione sul test deve contenere le seguenti informazioni:
2.2.1. Sostanza di prova:
|
—
|
natura fisica e proprietà fisico-chimiche rilevanti (ad esempio stabilità nell'acqua, tensione di vapore),
|
|
—
|
dati chimici di identificazione, compresi formula di struttura, purezza (per i pesticidi: identità e concentrazione del/i principio/i attivo/i).
|
2.2.2. Animali sperimentali:
|
—
|
nome scientifico della specie, razza, età approssimativa (in settimane), metodo e data di raccolta,
|
|
—
|
informazioni sulle colonie usate per la raccolta, compresi stato di salute, eventuali malattie degli esemplari adulti, eventuali pre-trattamenti, ecc.
|
2.2.3. Condizioni di esecuzione del test:
|
—
|
temperatura e umidità relativa della stanza sperimentale,
|
|
—
|
condizioni di alloggiamento, compresi tipo, dimensioni e materiale delle gabbie,
|
|
—
|
metodi di preparazione delle soluzioni madri e sperimentali (indicare eventuale solvente e relativa concentrazione),
|
|
—
|
disegno sperimentale, ad esempio numero delle concentrazioni della sostanza in esame utilizzata, numero dei controlli; per ciascuna concentrazione e ciascun controllo, numero di gabbie e numero di api per gabbia,
|
2.2.4. Risultati:
|
—
|
risultati dello studio preliminare di ricerca del range, se effettuato,
|
|
—
|
dati primari: mortalità per ciascuna dose testata in funzione dei diversi tempi di osservazione,
|
|
—
|
grafico delle curve dose-risposta alla fine del test,
|
|
—
|
valori della DL50 con limiti di affidabilità al 95 %, per i singoli tempi di osservazione raccomandati per la sostanza di prova e la sostanza tossica standard,
|
|
—
|
procedure statistiche usate per determinare la DL50,
|
|
—
|
mortalità fra i controlli,
|
|
—
|
altri effetti biologici osservati o misurati, quali comportamento anomalo delle api (compreso il rifiuto della dose sperimentale), quantità di cibo consumato nei gruppi trattati e non trattati,
|
|
—
|
eventuali deviazioni dalle procedure sperimentali qui descritte ed eventuali altre informazioni pertinenti.
|
3. BIBLIOGRAFIA
|
(1)
|
EPPO/Council of Europe (1993). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Products — Honeybees. EPPO Bulletin, Vol. 23, N.l, pp. 151-165. March 1993.
|
|
(2)
|
Gough, H.J., Mclndoe, E.C., Lewis, G.B. (1994). The use of dimethoate as a reference compound in laboratory acute toxicity tests on honeybees (Apis mellifera L.) 1981-1992. Journal of Apicultural Research, 22, pp. U9-125.
|
|
(3)
|
Litchfield, J.T. and Wilcoxon, F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, pp. 99-113.
|
|
(4)
|
Finney, D. J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New York.
|
|
(5)
|
Abbott, W. S. (1925). A method for computing the effectiveness of an insecticide. Jour. Econ. Entomol., 18, pp. 265-267.
|
C.17. API MELLIFERE — TEST DI TOSSICITÀ ACUTA PER CONTATTO
1. METODO
Questo metodo di test della tossicità acuta corrisponde al TG 214 (1998) dell'OCSE.
1.1. INTRODUZIONE
Questo test di tossicità è un metodo di laboratorio progettato per valutare la tossicità acuta per contatto dei fitofarmaci e di altre sostanze chimiche sulle api operaie adulte.
Per determinare e valutare le proprietà tossiche delle sostanze può rendersi necessario determinare la tossicità acuta per contatto nelle api, ad esempio in caso di probabile esposizione di api a una data sostanza. Il test di tossicità acuta per contatto viene eseguito per determinare la tossicità intrinseca dei pesticidi e di altre sostanze chimiche sulle api. In base ai risultati di tale test si valuta la necessità di effettuare analisi più approfondite. In particolare questo metodo può essere applicato per valutare i rischi che i pesticidi presentano per le api nell'ambito di un programma di test a più fasi che prevede in sequenza l'esecuzione di test in laboratorio, di esperimenti condotti di semi-campo ed altri di campo (1). I pesticidi possono essere testati come principi attivi (p.a.) oppure come prodotti formulati.
Per verificare la sensibilità delle api e la precisione della procedura del test si utilizza una sostanza tossica standard.
1.2. DEFINIZIONI
Tossicità acuta per contatto: effetti avversi che si verificano entro un massimo di 96 ore dall'applicazione topica di una dose singola di una sostanza.
Dose: quantità della sostanza di prova applicata. La dose si esprime in termini di massa (μg) della sostanza per animale sperimentale (μg/ape).
DL
50
(Dose Letale Mediana) per contatto: dose singola, calcolata statisticamente, di una sostanza in grado di provocare la morte del 50 % degli animali se somministrata per contatto. Il valore della DL50 si esprime in μg di sostanza di prova per ape. Nel caso dei pesticidi la sostanza di prova può essere un principio attivo (p.a.) o un prodotto formulato contenente uno o più principi attivi.
Mortalità: si registra la morte di un animale quando l'esemplare resta completamente immobile.
1.3. PRINCIPIO DEL METODO UTILIZZATO
Si espongono api operaie adulte (Apis mellifera) a un range di dosi della sostanza in esame disciolta in un veicolo adeguato, per applicazione diretta sul torace (goccioline). La durata del test è di 48 ore. Se il tasso di mortalità aumenta fra le 24 ore e le 48 ore mentre la mortalità dei controlli resta a livelli accettabili, ovvero ≤ 10 %, il test deve essere protratto fino a un massimo di 96 ore. La mortalità va registrata quotidianamente e confrontata con i valori di controllo. I risultati vengono analizzati per calcolare la DL50 a 24 ore e 48 ore e, nel caso lo studio sia prolungato, a 72 ore e 96 ore.
1.4. VALIDITÀ DEL TEST
Perché un test sia valido devono realizzarsi le seguenti condizioni:
|
—
|
la mortalità media del numero totale dei controlli non deve superare il 10 % alla fine del test,
|
|
—
|
la DL50 della sostanza tossica standard corrisponde al range specificato.
|
1.5. DESCRIZIONE DEL METODO UTILIZZATO
1.5.1. Raccolta delle api
Si utilizzano giovani api operaie adulte della stessa razza, della stessa età, alimentate allo stesso modo ecc. Le api vanno prelevate da colonie con regina, devono essere adeguatamente nutrite e sane e, per quanto possibile. esenti da malattie con storia e condizioni fisiologiche note. Possono essere raccolte la mattina del test o la sera prima e vanno tenute in condizioni sperimentali fino al giorno successivo. Si prestano a tale fine le api raccolte da telaini senza covata. È meglio evitare di raccogliere gli insetti all'inizio della primavera o alla fine dell'autunno, poiché in tali periodi il loro stato fisiologico è alterato. Dovendo eseguire i test all'inizio della primavera o alla fine dell'autunno, si possono tenere le api in un'incubatrice e allevarle per una settimana con polline raccolto dal favo e soluzione di saccarosio. Le api trattate con sostanze chimiche quali antibiotici, prodotti anti-Varroa ed altri non possono essere utilizzate nei test di tossicità prima di quattro settimane dalla fine dell'ultimo trattamento.
1.5.2. Condizioni di mantenimento e alimentazione
Si usano gabbie facili da pulire e ben ventilate di qualsiasi materiale adatto: acciaio inossidabile, reti di ferro, plastica, legno monouso, e così via. Le dimensioni delle gabbie devono essere adeguate al numero delle api per garantire uno spazio sufficiente. Si consiglia di mettere gruppi di dieci api per ogni gabbia.
Le api devono essere mantenute nell'oscurità in una stanza sperimentale a una temperatura di 25 ± 2 oC. L'umidità relativa (normalmente tra 50-70 %) va registrata durante tutto il test. Le procedure di manipolazione, compresi il trattamento e le osservazioni, possono essere condotte in presenza di luce (naturale). L'alimentazione, fornita per tutta la durata del test, è costituita da una soluzione di saccarosio in acqua ad una concentrazione finale di 500 g/l (50 % p/v) ed è somministrata tramite un alimentatore per api. Come tale si può usare una pipetta di vetro (lunga 50 mm e larga 10 mm circa con l'estremità aperta ristretta a circa 2 mm di diametro).
1.5.3. Preparazione delle api
Le api raccolte possono essere anestetizzate con anidride carbonica o azoto per l'applicazione della sostanza di prova. La quantità di anestetico e i tempi di esposizione devono essere minimi. Prima di cominciare il test occorre scartare le eventuali api moribonde e sostituirle con api sane.
1.5.4. Preparazione delle dosi
La sostanza di prova va applicata come soluzione in un veicolo, ad esempio un solvente organico o una soluzione acquosa con un agente umettante. Come solvente organico è preferibile l'acetone, ma si possono utilizzare, anche altri solventi organici {come la dimetilformammide e il dimetilsolfossido). Per i prodotti formulati dispersi in acqua e le sostanze organiche altamente polari non solubili in solventi organici può risultare più semplice applicare le soluzioni preparandole in una soluzione debole di un agente umettante comunemente in commercio (ad esempio Agral, Cittowett, Lubrol, Triton, Tween).
Occorre preparare adeguate soluzioni di controllo: quando si utilizza un solvente o un disperdente per solubilizzare la sostanza, vanno usati due gruppi di controllo separati: uno trattato con acqua e l'altro con il solvente/disperdente.
1.6. PROCEDURA
1.6.1. Gruppi sperimentali e gruppi di controllo
Il numero di dosi e di repliche testati deve soddisfare i requisiti statistici per la determinazione della DL50 con limiti di affidabilità del 95 %. Per il test sono di solito necessarie cinque dosi in serie geometriche, con un fattore non superiore a 2,2 e che coprano il range della DL5O. È tuttavia necessario determinare il numero di dosi, in relazione alla pendenza della curva di tossicità (dose/mortalità) e tenendo conto del metodo statistico scelto per l'analisi dei risultati. Un test di ricerca del range permette di scegliere le dosi adeguate.
Con ogni concentrazione utilizzata vanno effettuate almeno tre repliche, ognuna di dieci api.
Oltre alle serie sperimentali è necessario analizzare almeno tre lotti di controllo, ognuno di dieci api. Dovendo utilizzare un solvente organico o un agente umettante occorre aggiungere altri tre lotti di controllo, di dieci api ciascuno, per il solvente o l'agente umettante.
1.6.2. Sostanza tossica standard
Nelle serie sperimentali deve essere inclusa una sostanza tossica standard. Occorre selezionare almeno tre dosi che coprano il valore atteso di DL50. Per ciascuna dose si utilizzano almeno tre gabbie, ognuna contenente dieci api. La sostanza tossica di elezione è il dimetoato, per il quale la DL50 sulle 24 ore per contatto si colloca tra 0,10 e 0,30 μg p.a./ape (2). Tuttavia sono accettabili anche altre sostanze tossiche standard di cui occorre avere dati sufficienti per verificare la risposta attesa rispetto alla dose (ad esempio il parathion).
1.6.3. Esposizione
1.6.3.1. Somministrazione delle dosi
Le api vengono anestetizzate e trattate una per una con applicazione topica. L'assegnazione delle diverse dosi sperimentali e dei controlli è fatta per randomizzazione. Con un microapplicatore si applica 1 μl di soluzione contenente la sostanza di prova alla corretta concentrazione nella porzione dorsale del torace di ciascuna ape. Se si utilizza una quantità diversa, occorre precisarne le ragioni. Dopo l'applicazione le api vengono assegnate alle gabbie e alimentate con soluzioni di saccarosio.
1.6.3.2. Durata
Di preferenza, il test deve durare 48 ore. Se la mortalità aumenta di oltre il 10 % fra le 24 ore e le 48 ore, la durata del test va prolungata fino ad un massimo di 96 ore, sempre che la mortalità fra i controlli non superi il 10 %.
1.6.4. Osservazioni
La mortalità va registrata 4 ore dopo l'applicazione e, successivamente, alla ventiquattresima e quarantottesima ora. In caso di prolungamento del periodo di osservazione occorre effettuare altre valutazioni a intervalli di 24 ore, fino a un massimo di 96 ore, sempre che la mortalità fra i controlli non superi il 10 %.
E necessario registrare tutte le anomalie del comportamento osservate durante il test.
1.6.5. Test limite
In alcuni casi (ad esempio quando si presume che la sostanza di prova sia poco tossica) si può eseguire un test limite utilizzando 100 μg p.a./ape per dimostrare che la DL50 è maggiore di tale valore. La procedura da seguire è la stessa, comprese le tre repliche per dose di prova, i controlli e l'uso della sostanza tossica standard. Se si verificano casi di mortalità occorre effettuare uno studio completo. Se si verificano effetti subletali, è necessario registrarli (cfr. sezione 1.6.4).
2. DATI E RELAZIONE
2.1. DATI
I dati vanno riassunti in una tabella che evidenzi il numero di api usate, la mortalità a ogni osservazione e il numero di api con comportamento anomalo per ogni gruppo di trattamento, di controllo e relativo alla sostanza tossica standard. Per analizzare i dati della mortalità occorrono metodi statistici adeguati (ad esempio analisi probit, media mobile, probabilità binomiale) (3) (4). Occorre tracciare curve dose-risposta per ogni tempo di osservazione raccomandato {cioè 24 ore. 48 ore ed eventualmente 72 ore e 96 ore) e calcolare le pendenze delle curve e le dosi letali mediane (DL5O) con limiti di affidabilità al 95 %. Le correzioni per la mortalità fra i controlli possono essere effettuate con il metodo di Abbott (4) (5). La DL50 va espressa in μg di sostanza di prova per ape.
2.2. RELAZIONE SUL TEST
La relazione sul test deve contenere le seguenti informazioni:
2.2.1. Sostanza di prova:
|
—
|
natura fisica e proprietà fisico-chimiche (ad esempio stabilità nell'acqua, tensione di vapore).
|
|
—
|
dati chimici di identificazione, compresi formula di struttura, purezza (per i pesticidi: identità e concentrazione del/i principio/i attivo.i).
|
2.2.2. Animali sperimentali:
|
—
|
nome scientifico della specie, razza, età approssimativa (in settimane), metodo e data di raccolta,
|
|
—
|
informazioni sulle colonie usate per la raccolta, compresi stato di salute, eventuali malattie degli esemplari adulti, eventuali pre-trattamenti. ecc.
|
2.2.3. Condizioni di esecuzione del test:
|
—
|
temperatura e umidità relativa della stanza sperimentale,
|
|
—
|
condizioni di alloggiamento, compresi tipo, dimensioni e materiale delle gabbie,
|
|
—
|
metodi di somministrazione della sostanza di prova, ad esempio solvente veicolo usato, volume della soluzione di prova applicata, anestetici usati,
|
|
—
|
disegno sperimentale, ad esempio numero delle dosi sperimentali usate, numero dei controlli; per ciascuna dose e ciascun controllo, numero di gabbie e numero di api per gabbia,
|
2.2.4. Risultati:
|
—
|
risultati dello studio preliminare di ricerca del range, se effettuato,
|
|
—
|
dati primari: mortalità per ciascuna concentrazione testata in funzione dei diversi tempi di osservazione,
|
|
—
|
grafico delle curve dose-risposta alla fine del test,
|
|
—
|
valori della DL50 con limiti di affidabilità al 95 %, per i singoli tempi di osservazione raccomandati per la sostanza di prova e la sostanza tossica standard,
|
|
—
|
procedure statistiche usate per determinare la DL50,
|
|
—
|
mortalità fra i controlli,
|
|
—
|
altri effetti biologici osservati o misurati ed eventuali risposte anomale delle api,
|
|
—
|
eventuali deviazioni dalle procedure del metodo sperimentale qui descritte ed eventuali altre informazioni pertinenti.
|
3. BIBLIOGRAFIA
|
(1)
|
EPPO/Council of Europe (1993). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Products — Honeybees. EPPO bulletin, Vol. 23, N.l, pp. 151-165. March 1993.
|
|
(2)
|
Gough, H.J., Mclndoe, E.C, Lewis, G.B. (1994). The use of dimethoate as a reference compound in laboratory acute toxicity tests on honeybees (Apis mellifera L.), 1981-1992. Journal of Apicultural Research 22, pp. 119-125.
|
|
(3)
|
Litchfield,). T. and Wilcoxon, F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, pp. 99-113.
|
|
(4)
|
Finney, D. J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New York.
|
|
(5)
|
Abbott, W. S. (1925). A method for computing the effectiveness of an insecticide. Jour. Econ. Entomol. 18, pp. 265-267.
|
C.18. ADSORBIMENTO/DESORBIMENTO: METODO DISCONTINUO ALL'EQUILIBRIO
1. METODO
Il metodo discontinuo all'equilibrio qui descritto è una replica di: OECD TG 106 for the Determination of Soil Adsorption/Desorption, Using a Batch Equilibrium Method (2000).
1.1. INTRODUZIONE
Nell'elaborazione del presente metodo sono stati presi in conto i risultati di una sperimentazione circolare e di un workshop per la selezione dei terreni in vista della messa a punto di una prova di adsorbimento (1) (2) (3) (4), nonché le linee direttrici già esistenti sul piano nazionale (5) (6) (7) (8) (9) (10) (11).
Gli studi sull'adsorbimento/desorbimento sono utili per ottenere conoscenze essenziali in merito alla mobilità dei composti chimici e alla loro distribuzione nei comparti terreno, acqua ed aria della biosfera (12) (13) (14) (15) (16) (17) (18) (19) (20) (21). Queste conoscenze possono servire, per esempio, a prevedere o valutare la disponibilità di un prodotto chimico sotto vari aspetti: degradazione (22) (23); trasformazione ed assimilazione da parte degli organismi viventi (24); dilavamento attraverso il profilo del terreno (16) (18) (19) (21) (25) (26) (27) (28); volatilità a partire dal terreno (21) (29) (30); passaggio dalla superficie del terreno alle acque naturali (18) (31) (32). I dati sull'adsorbimento possono essere impiegati a fini di comparazione e di modellizzazione (19) (33) (34) (35).
La distribuzione di un prodotto chimico fra il terreno e le fasi acquose è un processo complicato, che dipende da svariati fattori: la natura chimica della sostanza (12) (36) (37) (38) (39) (40), le caratteristiche dei terreni (4) (12) (13) (14) (41) (42) (43) (44) (45) (46) (47) (48) (49) e i fattori climatici (precipitazioni, temperatura, luce solare, vento). I numerosi fenomeni e meccanismi coinvolti nel processo di adsorbimento di una sostanza chimica non possono essere definiti completamente attraverso un modello semplificato di laboratorio, sul tipo di quello qui proposto. Nondimeno, pur non permettendo di coprire tutti i casi che possono manifestarsi nella realtà, il presente tentativo fornisce informazioni utili sulla rilevanza ambientale dell'adsorbimento di una sostanza chimica.
Cfr. anche l'Introduzione generale.
1.2. CAMPO DI APPLICAZIONE
Il metodo è destinato a valutare il comportamento di una data sostanza sotto l'aspetto del suo adsorbimento/desorbimento nei vari tipi di terreno. Esso ha lo scopo di ricavare un valore del sorbimento che possa essere impiegato per prevedere la ripartizione della sostanza entro un'intera gamma di condizioni ambientali; a tale fine, per ciascun prodotto chimico considerato, si procede a determinare i coefficienti di adsorbimento all'equilibrio su vari tipi di terreno, in funzione delle caratteristiche del terreno stesso (ad esempio contenuto in carbonio organico, contenuto in argilla, struttura, pH). Per coprire nel modo più ampio possibile le interazioni di una data sostanza con i suoli, nelle condizioni in cui essi si presentano effettivamente in natura, è necessario impiegare vari tipi di terreno.
Ai fini del presente metodo, per adsorbimento s'intende il processo col quale un prodotto chimico si lega alla superficie dei terreni; non viene fatta differenza fra i vari processi di adsorbimento (adsorbimento chimico e fisico) ed altri processi, come la degradazione catalitica in superficie, l'adsorbimento in massa o le reazioni chi-miche. Non si è tenuto conto dell'adsorbimento che si verifica sulle particelle colloidali (diametro < 0,2 μm) generate dai terreni.
Per i vari tipi di terreno, si è ritenuto che i parametri di maggiore importanza dal punto di vista dell'adsorbimento siano il contenuto in carbonio organico (3) (4) (12) (13) (14) (41) (43) (44) (45) (46) (47) (48), il contenuto in argilla e la struttura del terreno (3) (4) (41) (42) (43) (44) (45) (46) (47) (48), e, per i composti ionizzabili, il pH (3) (4) (42). Si è tenuto altresì conto: della capacità effettiva di scambio cationico (CESC), del contenuto in ossidi amorfi di ferro e di alluminio, particolarmente per i terreni vulcanici e tropicali (4), e della superficie specifica (49).
Il metodo è destinato a valutare l'adsorbimento di un prodotto chimico su vari tipi di terreno, entro una gamma variabile di contenuti di carbonio organico e di argilla, di struttura e di pH del terreno. Esso consiste in tre momenti:
|
Primo momento:
|
studi preliminari destinati a determinare:
|
—
|
il rapporto terreno/soluzione,
|
|
—
|
il tempo di equilibrio per l'adsorbimento e la quantità della sostanza sotto esame che risulta adsorbita all'equilibrio,
|
|
—
|
l'adsorbimento della sostanza sotto esame alla superficie dei recipienti e la stabilità della sostanza sotto esame lungo tutta la durata dell'esperimento.
|
|
|
Secondo momento:
|
prova di selezione: l'adsorbimento viene studiato su cinque diversi tipi di terreno, attraverso la cinetica di adsorbimento a concentrazione singola e la successiva determinazione dei coefficienti di distribuzione Kd e Koc.
|
|
Terzo momento:
|
determinazione delle isoterme di adsorbimento di Freundlich, per determinare l'influenza della concentrazione sull'entità dell'adsorbimento nei terreni.
Studio di desorbimento attraverso la cinetica di desorbimento/isoterme di desorbimento di Freundlich (appendice 1).
|
1.3. DEFINIZIONI E UNITÀ
|
Simbolo
|
Definizione
|
Unità
|
|

|
percentuale di adsorbimento al tempo ti
|
%
|
|
Aeq
|
percentuale di adsorbimento all'equilibrio di adsorbimento
|
%
|
|

|
massa della sostanza sotto esame adsorbita sul terreno al tempo ti
|
μg
|
|

|
massa della sostanza sotto esame adsorbita sul terreno durante l'intervallo di tempo Ati
|
μg
|
|
|
massa della sostanza sotto esame adsorbita sul terreno all'equilibrio di adsorbimento
|
μg
|
|
m0
|
massa della sostanza sotto esame contenuta nella provetta, all'inizio della prova di adsorbimento
|
μg
|
|

|
massa della sostanza sotto esame misurata in un'aliquota (
) al tempo ti
|
μg
|
|
|
massa della sostanza nella soluzione all'equilibrio di adsorbimento
|
μg
|
|
msoil
|
quantità in massa della fase terreno, riferita al secco
|
g
|
|
cst
|
concentrazione di massa della soluzione di riserva della sostanza
|
μg cm-3
|
|
C0
|
concentrazione iniziale di massa della soluzione in esame a contatto col terreno
|
μg cm-3
|
|

|
concentrazione di massa della sostanza nella fase acquosa al tempo ti in cui l'analisi viene effettuata
|
μg cm-3
|
|
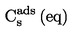
|
contenuto della sostanza adsorbita sul terreno all'equilibrio di adsorbimento
|
μg cm-1
|
|

|
concentrazione di massa della sostanza nella fase acquosa all'equilibrio di adsorbimento
|
μg cm-3
|
|
V0
|
volume iniziale della fase acquosa a contatto col terreno durante la prova di adsorbimento
|
cm3
|
|

|
volume dell'aliquota in cui viene misurata la sostanza sotto esame
|
cm3
|
|
Kd
|
coefficiente di distribuzione per l'adsorbimento
|
cm3 g-1
|
|
Koc
|
coefficiente di adsorbimento normalizzato per il carbonio organico
|
cm3 g-1
|
|
Kom
|
coefficiente di distribuzione normalizzato per la sostanza organica
|
cm3 g-1
|
|

|
coefficiente di adsorbimento secondo Freundlich
|
μg 1-1/n (cm3) 1/n g-1
|
|
l/n
|
esponente di Freundlich
|
|
|
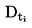
|
percentuale di desorbimento al tempo ti
|
%
|
|

|
percentuale di desorbimento durante l'intervallo di tempo Δti
|
%
|
|
Kdes
|
coefficiente apparente di desorbimento
|
cm3 g-1
|
|

|
coefficiente di desorbimento secondo Freundlich
|
μg 1-1/n (cm3) 1/n g-1
|
|
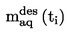
|
massa della sostanza sotto esame desorbita dal terreno al tempo ti
|
μg
|
|

|
massa della sostanza sotto esame desorbita dal terreno durante l'intervallo di tempo Δti
|
μg
|
|
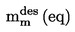
|
massa della sostanza determinata analiticamente nella fase acquosa all'equilibrio di desorbimento
|
μg
|
|

|
massa totale della sostanza sotto esame desorbita all'equilibrio di desorbimento
|
μg
|
|
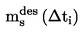
|
massa della sostanza che resta adsorbita nel terreno dopo l'intervallo di tempo Δti
|
μg
|
|

|
massa della sostanza residua dall'equilibrio di adsorbimento per effetto di una sostituzione incompleta del volume
|
μg
|
|
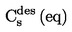
|
contenuto della sostanza sotto esame che rimane adsorbito sul terreno all'equilibrio di desorbimento
|
μg g-1
|
|

|
concentrazione di massa della sostanza sotto esame presente nella fase acquosa all'equilibrio di desorbimento
|
μg cm-3
|
|
VT
|
volume totale della fase acquosa a contatto col terreno durante l'esperimento sulla cinetica di desorbimento effettuato col metodo in serie
|
cm3
|
|
VR
|
volume del surnatante eliminato dalla provetta dopo il raggiungimento di un equilibrio di adsorbimento e sostituito dallo stesso volume in una soluzione 0,01 M CaCl2
|
cm3
|
|

|
volume dell'aliquota prelevata a fini analitici dal tempo (i), durante l'esperimento sulla cinetica di desorbimento effettuato col metodo in serie
|
cm3
|
|

|
volume della soluzione prelevata dalla provetta (i) per la misurazione della sostanza sotto esame, durante l'esperimento di cinetica di desorbimento (metodo in parallelo)
|
cm3
|
|
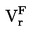
|
volume della soluzione prelevata dal tubo per la misura della sostanza sotto esame all'equilibrio di desorbimento
|
cm3
|
|
MB
|
bilancio di massa
|
%
|
|
mE
|
massa totale della sostanza sotto esame estratta in due stadi dal terreno e dalle pareti del recipiente
|
μg
|
|
Vrec
|
volume del surnatante recuperato dopo che è stato raggiunto l'equilibrio di adsorbimento
|
cm3
|
|
pow
|
coefficiente di ripartizione ottanolo/acqua
|
|
|
pKa
|
costante di dissociazione
|
|
|
Sw
|
solubilità in acqua
|
g l-1
|
1.4. PRINCIPIO DEL METODO
Volumi noti di soluzioni della sostanza sotto esame, non marcata o radiomarcata, a concentrazioni note in CaCl20,01 M, vengono aggiunti a campioni di terreno di peso secco noto, previamente equilibrati in CaCl20,01 M. La miscela viene agitata per un tempo adeguato. Le sospensioni di terreno vengono quindi separate per centrifugazione e facoltativa filtrazione, e si procede all'analisi della fase acquosa. La quantità di sostanza sotto esame adsorbita sul campione di terreno viene calcolata per differenza fra la quantità di sostanza sotto esame contenuta inizialmente nella soluzione e la quantità che rimane alla fine dell'esperimento (metodo indiretto).
Un altro metodo per determinare la quantità adsorbita della sostanza sotto esame è quello di analizzare direttamente il terreno (metodo diretto). Questo procedimento, che comporta un'estrazione per stadi successivi dei terreni mediante un appropriato solvente, è raccomandabile quando le differenze di concentrazione della soluzione della sostanza non possono essere determinate con precisione (casi possibili: adsorbimento della sostanza sotto esame sulla superficie dei recipienti nei quali ha luogo l'esperimento; instabilità della sostanza entro la durata dell'esperimento; adsorbimento debole, che dà luogo soltanto a piccole variazioni di concentrazione nella soluzione; adsorbimento energico, che conduce a basse concentrazioni non determinabili con esattezza). Se si impiega una sostanza radiomarcata, l'estrazione del terreno può essere evitata analizzando la fase terreno con la tecnica della combustione e successiva conta delle scintillazioni in fase liquida. Quest'ultima tecnica, peraltro, manca di specificità e non permette di distinguere i prodotti progenitori da quelli della trasformazione, e perciò dovrebbe essere riservata ai casi in cui il prodotto chimico sotto esame rimane stabile per tutta la durata dello studio.
1.5. INFORMAZIONI SULLA SOSTANZA SOTTO ESAME
I reattivi chimici debbono essere di purezza analitica. Si raccomanda l'impiego di sostanze non marcate, a composizione nota e preferibilmente di purezza non inferiore al 95 %, oppure di sostanze radiomarcate a composizione e radiopurezza note. Nel caso dei radiomarcatori a semivita breve si terrà conto della degradazione apportando adeguate correzioni.
Prima di eseguire una prova per l'adsorbimcnto-desorbimento, è necessario disporre dei seguenti dati relativi alla sostanza sotto esame:
|
a)
|
solubilità in acqua (A.6);
|
|
b)
|
tensione di vapore (A.4) e/o costante della legge di Henry;
|
|
c)
|
degradazione abiotica: idrolisi in funzione del pH (C.7);
|
|
d)
|
coefficiente di ripartizione (A.8);
|
|
e)
|
biodegrabilità rapida (C.4) o trasformazione aerobica ed anaerobica nel terreno;
|
|
f)
|
pKa delle sostanze ionizzabili;
|
|
g)
|
fotolisi diretta nell'acqua (cioè spettro di assorbimento UV-Vis nell'acqua, rendimento quantico) e fotodegradazione nel terreno.
|
1.6. APPLICABILITÀ
La prova può essere eseguita sulle sostanze chimiche per le quali si dispone di un metodo analitico sufficientemente preciso. La stabilità della sostanza sotto esame durante il tempo necessario per l'esecuzione della prova è un parametro importante, capace di influenzare l'attendibilità dei risultati, specialmente quando si applica il metodo indiretto. Pertanto, è necessario verificare detta stabilità attraverso uno studio preliminare; se nell'ordine di durata della prova si osserva una trasformazione, si raccomanda di eseguire lo studio principale analizzando tanto la fase terreno quanto la fase acquosa.
L'esecuzione di questa prova su sostanze a bassa solubilità in acqua (SW < 10-4 g l-1) e su sostanze a carica elevata può dar luogo a difficoltà, dovute al fatto che la concentrazione nella fase acquosa non può essere misurata analiticamente con sufficiente precisione. In questi casi debbono essere introdotti passaggi intermedi. Il modo di affrontare questi problemi è descritto dove di rilevanza nel presente documento.
Sperimentando su sostanze volatili, si avrà cura di evitare le perdite durante lo studio.
1.7. DESCRIZIONE DEL METODO
1.7.1. Apparecchiature e reattivi chimici
Normale apparecchiatura di laboratorio, e in particolare:
|
a)
|
provette o recipienti per eseguire l'esperimento. È importante che essi:
|
—
|
siano adattabili direttamente alla centrifuga, in modo da minimizzare le perdite per manipolazione o travaso,
|
|
—
|
siano costituiti da materiale inerte, tale cioè che l'adsorbimento della sostanza sotto esame sulla loro superficie sia minimo;
|
|
|
b)
|
agitatore od apparecchio equivalente, capace di mantenere il terreno in sospensione durante l'agitazione;
|
|
c)
|
centrifuga, di preferenza ad alta velocità (capace per esempio di produrre più di 3 000 g), a temperatura controllabile e che permetta di eliminare dalla soluzione acquosa le particelle di diametro superiore a 0,2 μm. Durante l'agitazione e la centrifugazione i contenitori dovranno essere mantenuti coperti, per evitare le perdite di liquido e quelle dovute alla volatilità; per rendere minimo l'adsorbimento sui coperchi, questi dovranno essere disattivati (ad esempio: coperchi a vite rivestiti di teflon);
|
|
d)
|
facoltativi: apparecchio da filtrazione; filtri con porosità da 0,2 μm, sterili, per uso unico. Si avrà particolare cura di scegliere il materiale filtrante in modo da evitare che esso possa provocare perdite della sostanza sotto esame; per le sostanze scarsamente solubili non è opportuno impiegare materiale filtrante organico;
|
|
e)
|
strumentazione analitica, adatta a misurare la concentrazione della sostanza sotto esame;
|
|
f)
|
stufa da laboratorio, capace di mantenere una temperatura compresa fra 103 oC e 110 oC.
|
1.7.2. Caratterizzazione e selezione dei terreni
I terreni debbono essere caratterizzati attraverso tre parametri, dai quali si ritiene dipendere principalmente la loro capacità di adsorbimento: carbonio organico, contenuto in argilla e struttura del terreno, pH. Come già indicato (cfr. «Campo di applicazione»), va peraltro presa in considerazione ogni altra caratteristica chimico-fisica dei terreni che possa avere effetti sull'adsorbimento/desorbimento di una particolare sostanza.
I metodi impiegati per la caratterizzazione sono molto importanti e possono avere un influsso significativo sui risultati. Si raccomanda pertanto di misurare il pH del terreno in una soluzione in CaCl20,01 M (cioè nella soluzione usata per la prova di adsorbimento/desorbimento), secondo il corrispondente metodo ISO (ISO-10390-1). Si raccomanda inoltre di determinare le altre proprietà rilevanti del terreno attraverso metodi standard (esempio manuale ISO di analisi dei terreni «Hanbook of Soil Analysis»); in questo modo, l'analisi dei dati sul sorbimento potrà basarsi su parametri dei terreni standardizzati globalmente. I riferimenti bibliografici (50-52) forniscono alcune indicazioni sui metodi standard disponibili per l'analisi e la caratterizzazione dei terreni. Per la taratura dei metodi di prova dei terreni, si raccomanda l'impiego di terreni di riferimento.
La tabella 1 fornisce indicazioni per la scelta dei terreni in vista degli esperimenti di adsorbimento/desorbimento. I sette terreni prescelti coprono i tipi di terreni che si incontrano nelle zone geografiche temperate. Quando le sostanze sotto prova sono ionizzabili, i terreni scelti debbono coprire una vasta gamma di pH, in modo da potersi valutare l'adsorbimento della sostanza nelle sue forme ionizzata e non ionizzata. Indicazioni sul numero di terreni diversi da impiegare nelle varie fasi della prova sono fornite al punto 1.9 («Esecuzione dell'esperimento»).
Se si preferiscono altri tipi di terreno, questi debbono essere caratterizzati dagli stessi parametri, e le loro proprietà debbono variare analogamente a quelle indicate nella tabella 1, anche se non corrispondono esattamente ai criteri.
Tabella 1
Guida per la selezione dei campioni di terreno per l'adsorbimento-desorbimento
|
Tipo di terreno
|
Campo di pH (in CaCl20,01 M)
|
Contenuto in carbonio organico
|
Contenuto in argilla ( %)
|
Composizione del terreno (26)
|
|
1
|
4,5-5,5
|
1,0-2,0
|
65-80
|
argilla
|
|
2
|
> 7,5
|
3,5-5,0
|
20-40
|
limo argilloso
|
|
3
|
5,5-7,0
|
1,5-3,0
|
15-25
|
limo sedimentario
|
|
4
|
4,0-5,5
|
3,0-4,0
|
15-30
|
limo
|
|
5
|
< 4,0-6,0 (27)
|
< 0,5-1,5 (27)
(28)
|
< 10-15 (27)
|
sabbia limacciosa
|
|
6
|
> 7,0
|
< 0,5-1,0 (27)
(28)
|
40-65
|
limo argilloso/argilla
|
|
7
|
< 4,5
|
> 10
|
< 10
|
sabbia/sabbia limacciosa
|
1.7.3. Raccolta e conservazione dei campioni di terreno
1.7.3.1. Raccolta
Per il campionamento non si raccomandano tecniche o strumenti specifici; la tecnica di campionamento dipende dalle finalità dello studio (53) (54) (55) (56) (57) (58).
Va tenuto presente quanto segue:
|
a)
|
è necessario disporre di informazioni particolareggiate sui precedenti della località dove ha luogo il prelievo, riguardanti il manto vegetale, i trattamenti con antiparassitari e/o fertilizzanti, gli ammendamenti biologici o la contaminazione accidentale, e le loro localizzazioni. Quanto alla descrizione del luogo di prelievo vanno seguite le raccomandazioni della norma ISO sul campionamento dei terreni (ISO 10381-6);
|
|
2)
|
il luogo di campionamento deve essere definito secondo il metodo UTM (Proiezione universale traversa di Mercatore/dato orizzontale europeo) od attraverso le sue coordinate geografiche; ciò permetterà di eseguire futuri prelievi dello stesso terreno e contribuirà a definire il terreno a norma dei vari sistemi di classifica impiegati nei vari paesi. Si raccoglierà esclusivamente l'orizzonte A fino a una profondità massima di 20 cm. Con particolare riguardo al terreno n. 7, se del terreno fa parte un orizzonte Oh, questo deve essere incluso nel campionamento.
|
I campioni di terreno debbono essere trasportati entro contenitori, ed in condizioni di temperatura, tali da impedire che le proprietà iniziali del terreno risultino significativamente alterate.
1.7.3.2. Conservazione
È da preferirsi l'impiego di terreni prelevati di recente. Soltanto quando ciò non fosse possibile si potranno utilizzare terreni conservati a temperatura ambiente, al secco e all'asciutto. Per la conservazione non si raccomandano particolari limiti di tempo, ma i terreni conservati per più di tre anni saranno rianalizzati prima dell'impiego, per verificarne il contenuto in carbonio organico, il pH e il CESC.
1.7.3.3. Manipolazione e preparazione dei campioni di terreno per la prova
I terreni debbono essere essiccati all'aria a temperatura ambiente (di preferenza fra 20 e 25 oC). La disgregazione deve essere effettuata applicando la minima forza possibile, in modo da non alterare sensibilmente la struttura originale del terreno. I terreni saranno setacciati fino a granulometria < 2 mm; seguendo le raccomandazioni della norma ISO sul campionamento dei terreni (ISO 10381-6). Si raccomanda un'accurata omogeneizzazione, in quanto essa giova alla riproducibilità dei risultati. Il contenuto di umidità di ciascun terreno viene determinato su tre aliquote, per riscaldamento a 105 oC fino a peso sensibilmente costante (12 ore circa). Per tutti i calcoli, la massa del terreno va riferita alla massa essiccata in stufa, cioè al peso del terreno corretto per il suo contenuto di umidità.
1.7.4. Preparazione della sostanza sotto esame per l'applicazione al terreno
La sostanza sotto esame viene sciolta in una soluzione 0,01 M di CaCl2 in acqua distillata o deionizzata; la soluzione di CaCl2 .impiegata come fase acquosa solvente serve a migliorare la centrifugabilità ed a rendere minimo lo scambio di cationi. La concentrazione della soluzione di riserva deve di preferenza superare di tre ordini di grandezza il limite di rivelazione del metodo analitico applicato: ciò salvaguarda l'esattezza delle misure effettuate secondo la metodologia qui descritta. La concentrazione della soluzione di riserva deve inoltre essere inferiore alla solubilità in acqua della sostanza sotto esame.
Di preferenza, la soluzione di riserva deve essere preparata estemporaneamente al momento dell'applicazione ai campioni di terreno ed essere mantenuta ben chiusa e al buio, alla temperatura di 4 oC. Il tempo di conservazione dipende dalla stabilità della sostanza sotto esame e dalla sua concentrazione nella soluzione.
Soltanto nel caso delle sostanze scarsamente solubili (Sw < 10-4 g l-1) può essere necessario ricorrere a un agente di solubilizzazione. Quest'ultimo: a) deve essere miscibile con l'acqua (ad esempio metanolo, acetonitrile); b) la sua concentrazione non deve superare l'1 % del volume totale della soluzione di riserva ed essere inferiore a quella della soluzione della sostanza sotto esame che verrà a contatto col terreno (di preferenza meno dello 0,1 %); c) non deve avere carattere di tensioattivo o dar luogo a reazioni solvolitiche con la sostanza chimica sotto esame. L'impiego di un agente di solubilizzazione deve essere menzionato e giustificato nella relazione.
Un'altra possibilità per le sostanze scarsamente solubili consiste nell'aggiunta intenzionale della sostanza sotto esame al sistema di prova: la sostanza sotto esame viene disciolta in un solvente organico, un'aliquota del quale viene aggiunta al sistema terreno (soluzione 0,01 M di CaCl2 in acqua distillata o deionizzata). Il contenuto del solvente organico nella fase acquosa deve essere mantenuto al più basso livello possibile, in modo da non superare lo 0,1 %. L'addizione intenzionale di una soluzione organica può compromettere la riproducibilità sotto l'aspetto del volume: essa introdurrebbe un ulteriore fattore di errore, in quanto le concentrazioni della sostanza sotto esame e del cosolvente non sarebbero le stesse in tutte le prove.
1.8. PREREQUISITI PER L'ESECUZIONE DELLA PROVA DI ADSORBIMENTO/DESORBIMENTO
1.8.1. Il metodo analitico
Fra i parametri chiave capaci di influenzare la precisione delle misure di sorbimento sono compresi la precisione dei metodi impiegati per analizzare la soluzione e la fase adsorbita, la stabilità e la purezza della sostanza da esaminare, il raggiungimento di un equilibrio di sorbimento, l'ordine di grandezza delle variazioni di concentrazione della soluzione, il rapporto terreno/soluzione e le variazioni di struttura del terreno durante i processi di equilibrazione (35) (59-62). Alcuni esempi, focalizzati sulla precisione, sono riportati nell'appendice 2.
L'attendibilità del metodo analitico nell'intervallo di concentrazioni che è verosimile incontrare durante la prova deve essere controllata. Lo sperimentatore deve essere libero di mettere a punto un metodo appropriato sotto gli aspetti dell'esattezza, della precisione, della riproducibilità, dei limiti di rivelazione e del recupero. La tecnica sperimentale appresso descritta costituisce una guida per l'esecuzione della prova.
Un adeguato volume (ad esempio 100 cm3) di CaCl20,01 M viene agitato per 4 ore insieme a un'adeguata massa (ad esempio 20 g) di terreno ad elevata capacità di adsorbimento, vale a dire ad elevato contenuto di carbonio organico e di argilla. Le masse e i volumi possono variare secondo le esigenze analitiche, ma un rapporto terreno/soluzione di 1 a 5 può rappresentare un punto di partenza adeguato. La miscela viene centrifugata, e la fase acquosa viene filtrata. A quest'ultima viene aggiunto un determinato volume della soluzione di riserva della sostanza sotto esame, in modo da ottenere una concentrazione nominale rientrante nel campo di concentrazioni che è verosimile incontrare durante la prova. Il volume non deve superare il 10 % del volume finale della fase acquosa, allo scopo di modificare il meno possibile la natura della soluzione di pre-equilibrazione. Si procede quindi all'analisi della soluzione.
Per tener conto delle sostanze artificiali impiegate nel metodo analitico e degli effetti matrice causati dal terreno va previsto un «bianco», consistente nel solo sistema terreno + soluzione di CaCl2, senza aggiunta della sostanza sotto esame.
Per le misure di sorbimento si possono impiegare la cromatografia gas-liquido (GLC), la cromatografia in fase liquida ad alta pressione (HPLC), la spettrometria (ad esempio GC/spettrometria di massa, HPLC/spettrometria di massa) e la conta delle scintillazioni in fase liquida (per le sostanze radiomarcate). Indipendentemente dalla sua natura, un metodo analitico può ritenersi adeguato se il recupero è compreso fra il 90 % e il 110 % del valore nominale. Per consentire l'identificazione e la quantificazione dopo la ripartizione, i limiti di rivelazione del metodo analitico dovrebbero essere almeno due ordini di grandezza al di sotto della concentrazione nominale.
Le caratteristiche e i limiti di rivelazione del metodo analitico utilizzato per eseguire gli studi sull'adsorbimento sono importanti per definire le condizioni sperimentali e l'intera esecuzione dell'esame. Il presente metodo segue uno schema sperimentale generale e fornisce raccomandazioni e linee direttrici in vista di soluzioni alternative laddove la metodica analitica e le disponibilità di laboratorio imponessero limitazioni.
1.8.2. Selezione dei rapporti ottimali terreno/soluzione
Negli studi sui fenomeni di sorbimento, la scelta dei rapporti terreno/soluzione dipende dal coefficiente di distribuzione Kd e dal grado relativo di adsorbimento desiderato. La variazione di concentrazione della sostanza in soluzione determina la precisione statistica della misura, la quale dipende dalla forma dell'equazione di adsorbimento e, per quanto riguarda la rivelazione della concentrazione della sostanza chimica in soluzione, dalle limitazioni della metodologia analitica applicata. Pertanto, nella pratica generale, è utile adottare un numero limitato di rapporti fissi, nei quali la percentuale adsorbita sia superiore al 20 % e, meglio ancora, al 50 % (62); al tempo stesso si avrà cura che la concentrazione della sostanza sotto esame nella fase acquosa rimanga sempre abbastanza alta da poter essere misurata con precisione. Ciò ha particolare importanza quando le percentuali di adsorbimento sono elevate.
Un modo conveniente per scegliere i rapporti terreno/acqua più appropriati comincia da una valutazione di Kd attraverso studi preliminari o secondo tecniche di valutazione che abbiano dato buona prova (appendice 3). Il rapporto appropriato può quindi essere scelto in base a un grafico del rapporto terreno/soluzione in funzione di Kd per determinate percentuali fisse di adsorbimento (fig. 1). Tale grafico è basato sul presupposto che l'equazione di adsorbimento sia lineare (29). La relazione applicabile si ottiene rielaborando l'equazione 4 del Kd nella forma dell’equazione 1:
|
|
(1)
|
ovvero, in forma logaritmica ed ammettendo che R = msoil/V0 e Aeq %/100 = 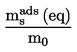 :
:
|
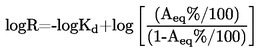
|
(2)
|

La figura 1 mostra i rapporti terreno/soluzione, espressi in funzione di Kd, per i vari livelli di adsorbimento. Ad esempio: per un rapporto terreno/soluzione di 1 a 5 e Kd = 20, l'adsorbimento dovrebbe essere dell'80 % circa. A parità di Kd, per ottenere un adsorbimento del 50 % andrebbe impiegato un rapporto di 1 a 25. Questa maniera di scegliere gli adeguati rapporti terreno/soluzione offre al ricercatore la flessibilità necessaria per rispondere alle esigenze sperimentali.
Le maggiori difficoltà s'incontrano quando la sostanza chimica viene adsorbita in misura molto elevata o molto bassa. Quando l'adsorbimento è basso, è raccomandabile adottare un rapporto terreno/soluzione di 1 a 1, anche se, per alcuni tipi di terreno ad elevato contenuto organico, può essere necessario ricorrere a rapporti più bassi, in modo da ottenere un impasto liquido. La metodologia analitica dovrà permettere di misurare piccole modifiche della concentrazione della soluzione; in caso contrario, le misure di adsorbimento saranno imprecise. D'altra parte, per valori molto elevati di Kd si può arrivare a rapporti terreno/soluzione di 1 a 100, per lasciare in soluzione una quantità significativa della sostanza chimica. Si avrà comunque cura di assicurare una buona miscelazione, e si lascerà al sistema un tempo adeguato per raggiungere l'equilibrio. Un'altra possibilità è quella di prevedere il valore di Kd applicando tecniche di valutazione fondate, ad esempio, sui valori di Pow (appendice 3). Ciò potrebbe rivelarsi utile, specialmente nel caso delle sostanze chimiche scarsamente adsorbite/polari, con Pow < 20, e di quelle lipofile/altamente sorbitive, con Pow > 104.
1.9. ESECUZIONE DELL'ESPERIMENTO
1.9.1. Condizioni sperimentali
Tutta la sperimentazione deve essere effettuata a temperatura ambiente, possibilmente costante, compresa fra 20 oC e 25 oC.
Le condizioni di centrifugazione debbono permettere di eliminare dalla soluzione le particelle oltre 0,2 μm. Questo valore rappresenta le dimensioni limite fra le particelle solide e quelle colloidali. L'appendice 4 offre una guida per determinare le condizioni di centrifugazione.
Se l'apparecchiatura di centrifugazione disponibile non garantisce l'eliminazione delle particelle sopra gli 0,2 μm, la centrifugazione può essere associata alla filtrazione attraverso filtri da 0,2 μm. Per evitare perdite della sostanza sotto esame, questi debbono essere composti di un appropriato materiale inerte. Va in ogni caso assicurato che durante la filtrazione non si verifichino perdite della sostanza sotto esame.
1.9.2. Primo momento: studio preliminare
Le ragioni di uno studio preliminare sono già state indicate al capitolo «Campo di applicazione». Lo schema sperimentale suggerito qui appresso costituisce una guida per la sua esecuzione.
1.9.2.1. Scelta dei rapporti ottimali terreno/soluzione
Si ricorre a due tipi di terreno e a tre rapporti terreno/soluzione (sei esperimenti). Un tipo di terreno ha un elevato contenuto in carbonio organico e un basso contenuto in argilla, e l'altro ha un basso contenuto in carbonio organico e un elevato contenuto in argilla. Si suggeriscono i seguenti rapporti:
|
—
|
50 g di terreno e 50 cm3 di soluzione acquosa della sostanza sotto esame (rapporto 1/1),
|
|
—
|
10 g di terreno e 50 cm3 di soluzione acquosa della sostanza sotto esame (rapporto 1/5),
|
|
—
|
2 g di terreno e 50 cm3 di soluzione acquosa della sostanza sotto esame (rapporto 1/25).
|
La quantità minima di terreno da impiegare dipende dalle disponibilità del laboratorio e dall'efficacia del metodo analitico applicato. Per ottenere risultati attendibili si raccomanda comunque di impiegare non meno di 1 g, e preferibilmente 2 g.
Per verificare se la sostanza sotto esame è stabile nella soluzione di CaCl2 e se eventualmente rimane adsorbita sulle pareti dei recipienti, si preparerà un campione di riferimento non contenente terreno, ma soltanto la sostanza in questione e la soluzione di CaCl20,01 M: esso verrà sottoposto esattamente alle stesse operazioni dei sistemi esaminati.
Per ogni terreno si preparerà un «bianco» contenente la stessa quantità di terreno e un volume totale di 50 cm3 di soluzione di CaCl20,01 M (senza la sostanza sotto esame), che verrà sottoposto alla stessa procedura sperimentale. Esso servirà da riferimento di base durante l'analisi, per rivelare se sono presenti sostanze capaci di interferire o se il terreno è contaminato.
Tutti gli esperimenti, compresi quelli sul campione di riferimento e sui «bianchi», verranno effettuati almeno in doppio. Il numero totale di campioni da preparare per lo studio va stabilito in funzione della metodologia da seguire.
I metodi per lo studio preliminare e per quello principale sono genericamente gli stessi: se del caso, gli eventuali discostamenti vanno menzionati.
I campioni di terreno essiccati all'aria vengono equilibrati mantenendoli sotto agitazione per 12 h (tutta la notte precedente l'esperimento) insieme a un volume minimo di 45 cm3 di CaCl20,01 M. Si aggiunge poi un certo volume della soluzione di riserva della sostanza sotto esame, fino a un totale di 50 cm3. Il volume di soluzione di riserva aggiunto: a) non deve eccedere il 10 % dei 50 cm3 di volume della fase acquosa, per alterare il meno possibile la natura della soluzione di pre-equilibrazione; b) deve condurre di preferenza a una concentrazione iniziale della sostanza sotto esame a contatto col terreno (Co) superiore di almeno due ordini di grandezza al limite di rivelazione del metodo analitico, per salvaguardare la capacità di eseguire misure esatte anche quando l'adsorbimento è forte (> 90 %) e determinare più tardi le isoterme di adsorbimento. Si raccomanda inoltre, se possibile, che la concentrazione iniziale (Co) della sostanza sotto esame non superi la metà del suo limite di solubilità.
Il seguente esempio indica il modo di calcolare la concentrazione della soluzione di riserva (Cst). Si parte dall'idea che il limite di rivelazione sia di 0,01 μg cm-3 e l'adsorbimento sia del 90 %: la concentrazione iniziale della sostanza sotto esame a contatto col suolo dovrebbe quindi essere preferibilmente uguale ad 1 μg cm-3 (due ordini di grandezza sopra il limite di rivelazione). Ammettendo che si sia aggiunto il massimo volume raccomandato della soluzione di riserva, cioè da 5 a 45 cm3 della soluzione di equilibrazione di CaCl20,01 M (= 10 % della soluzione di riserva rispetto a 50 cm3 di volume totale della fase acquosa), la concentrazione della soluzione di riserva dovrebbe essere di 10 μg cm-3, cioè superiore di tre ordini di grandezza al limite di rivelazione del metodo analitico.
Il pH della fase acquosa deve essere misurato prima e dopo il contatto col terreno, poiché esso ha una funzione importante nell'intero processo di adsorbimento, specialmente per le sostanze ionizzabili.
La miscela deve essere agitata finché sia raggiunto l'equilibrio di adsorbimento. Il tempo di equilibrio nei terreni è assai variabile, secondo la natura del prodotto chimico e del terreno: in generale è sufficiente un periodo di 24 h (77). Nello studio preliminare, i campioni possono essere prelevati sequenzialmente su un periodo di 48 h di miscelazione (ad esempio 4. 8, 24, 48 h). Comunque, i tempi di analisi debbono essere considerati con flessibilità, tenendo conto dei programmi di lavoro del laboratorio.
Per l'analisi della sostanza sotto esame nella soluzione acquosa è possibile scegliere fra: a) il metodo in parallelo: b) il metodo in serie. Si noti che, sebbene il metodo in parallelo sia più tedioso sul piano sperimentale, il trattamento matematico dei risultati ne risulta semplificato (appendice 5). La scelta della metodologia da seguire spetta comunque allo sperimentatore, il quale terrà conto delle disponibilità materiali e delle risorse del laboratorio.
|
a)
|
Metodo in parallelo: si preparano dei campioni con lo stesso rapporto terreno/soluzione, nel numero necessario per coprire gli intervalli di tempo ai quali si desidera studiare la cinetica di adsorbimento. Dopo centrifugazione e facoltativa filtrazione, la fase acquosa della prima provetta viene recuperata nel modo più completo possibile; si procede quindi alle misure dopo tempi adeguati (ad esempio dopo 4 h per la prima provetta, dopo 8 h per la seconda, dopo 24 h per la terza, ecc.).
|
|
b)
|
Metodo in serie: per ciascun rapporto terreno/soluzione si prepara soltanto un campione in doppio. A determinati intervalli di tempo, la miscela viene centrifugata per separare le fasi. In una piccola aliquota della fase acquosa si ricerca immediatamente la sostanza sotto esame; dopo di che, l'esperimento prosegue sulla miscela originale. Se la centrifugazione è stata seguita dalla filtrazione, il laboratorio deve avere la possibilità di eseguire la filtrazione di piccole aliquote acquose. Per non modificare in modo significativo il rapporto terreno/soluzione e far diminuire la massa del soluto disponibile per l'adsorbimento durante la prova, si raccomanda che il volume totale delle aliquote prelevate non superi l'1 % del volume totale della soluzione.
|
Per ciascun tempo ti si calcola la percentuale di adsorbimento  , sulla base della concentrazione nominale iniziale e della concentrazione misurata ai momenti ti del prelievo, previa correzione per il bianco. Per valutare se la piattaforma di equilibrio è stata raggiunta, si riportano graficamente i valori di
, sulla base della concentrazione nominale iniziale e della concentrazione misurata ai momenti ti del prelievo, previa correzione per il bianco. Per valutare se la piattaforma di equilibrio è stata raggiunta, si riportano graficamente i valori di  in funzione del tempo (cfr. appendice 5, fig. 1) (30). Si calcola inoltre il valore di Kd all'equilibrio. Sulla base del valore di Kd ed utilizzando la fig.l si scelgono gli appropriati rapporti terreno/soluzione, in modo che l'adsorbimento percentuale risulti superiore al 20 % e, di preferenza, al 50 % (61). Tutte le equazioni applicabili e i principi per il tracciamento del grafico sono indicati al capitolo sulla presentazione dei dati e la relazione, nonché nell'appendice 5.
in funzione del tempo (cfr. appendice 5, fig. 1) (30). Si calcola inoltre il valore di Kd all'equilibrio. Sulla base del valore di Kd ed utilizzando la fig.l si scelgono gli appropriati rapporti terreno/soluzione, in modo che l'adsorbimento percentuale risulti superiore al 20 % e, di preferenza, al 50 % (61). Tutte le equazioni applicabili e i principi per il tracciamento del grafico sono indicati al capitolo sulla presentazione dei dati e la relazione, nonché nell'appendice 5.
1.9.2.2. Determinazione del tempo di equilibrazione all'adsorbimento e della quantità di sostanza sotto esame adsorbita all'equilibrio
Come già detto, i grafici di  o di
o di  in funzione del tempo permettono di stabilire se l'equilibrio all'adsorbimento è stato raggiunto e di valutare la quantità di sostanza sotto esame adsorbita all'equilibrio. Le figure 1 e 2 nell'appendice 5 mostrano alcuni esempi di tali grafici. Il tempo di equilibrio è quello necessario perché il sistema raggiunga una piattaforma.
in funzione del tempo permettono di stabilire se l'equilibrio all'adsorbimento è stato raggiunto e di valutare la quantità di sostanza sotto esame adsorbita all'equilibrio. Le figure 1 e 2 nell'appendice 5 mostrano alcuni esempi di tali grafici. Il tempo di equilibrio è quello necessario perché il sistema raggiunga una piattaforma.
Se con un dato terreno non si raggiunge una piattaforma ma si ha un incremento continuo, la causa andrebbe cercata in certi fattori di complicanza, quali la biodegradazione o la diffusione lenta. La biodegradazione può essere evidenziata ripetendo l'esperimento su un campione di terreno sterilizzato. Se nemmeno in questo modo si raggiunge una piattaforma, lo sperimentatore dovrebbe esaminare l'eventualità che nei suoi specifici studi possano essere coinvolti altri fenomeni, e modificare adeguatamente le condizioni sperimentali (temperatura, tempi di agitazione, rapporti terreno/soluzione). Inoltre, spetta a lui decidere se proseguire il lavoro malgrado l'eventuale impossibilità di raggiungere un equilibrio.
1.9.2.3. Adsorbimento alla superficie dei recipienti e stabilità della sostanza sotto esame
Alcuni dati sulla stabilità della sostanza sotto esame e sul suo adsorbimento alla superficie dei recipienti possono essere ricavati analizzando i campioni di riferimento. Se si osserva una deplezione superiore all'errore standard implicito nel metodo analitico, si potrebbe pensare a una degradazione abiotica e/o ad un adsorbimento alla superficie del recipiente. Una distinzione fra questi due fenomeni può essere fatta lavando a fondo le pareti del recipiente con un volume noto di un opportuno solvente ed analizzando il liquido di lavaggio per ricercarvi la sostanza sotto esame. Se non si osserva alcun adsorbimento alla superficie dei recipienti, la deplezione evidenzia l'instabilità abiotica della sostanza sotto esame. Se si constata un adsorbimento, è necessario utilizzare recipienti in altro materiale. In ogni modo, i dati sull'adsorbimento così ottenuti non possono essere estrapolati direttamente all'esperimento terreno/soluzione, poiché la presenza del terreno influisce sull'adsorbimento.
Ulteriori informazioni sulla stabilità della sostanza sotto esame possono essere ricavate da un bilancio della massa progenitrice nel tempo. In altre parole, bisogna analizzare la fase acquosa, gli estratti del terreno e le pareti dei recipienti per ricercarvi la sostanza sotto esame. La differenza fra la massa della sostanza sotto esame aggiunta e la somma delle masse della sostanza sotto esame nella fase acquosa, negli estratti di terreno e nelle pareti dei recipienti corrisponde alla massa degradata c/o volatilizzata e/o non estratta. Per un corretto bilancio di massa, l'equilibrio di adsorbimento dovrebbe essere stato raggiunto durante l'esperimento.
Il bilancio di massa dev'essere eseguito tanto sui terreni quanto per un rapporto terreno/soluzione per ogni terreno che all'equilibrio dia luogo a una deplezione superiore al 20 % e preferibilmente al 50 %. Quando l'esperimento per la ricerca dei rapporti viene completato con l'analisi dell'ultimo campione della fase acquosa dopo 48 h, le fasi debbono essere separate per centrifugazione e facoltativa filtrazione. La fase acquosa dev'esere recuperata nella maggior quantità possibile, aggiungendo poi al terreno un solvente di estrazione adatto (coefficiente di estrazione non inferiore al 95 %) per estrarne la sostanza sotto esame. Si raccomanda di eseguire non meno di due estrazioni successive. Si determina poi la quantità di sostanza sotto esame negli estratti del terreno e dei recipienti e si calcola il bilancio di massa (equazione 10, «Dati e relazione»). Se essa è inferiore al 9 %, la sostanza sotto esame viene considerata instabile nella scala di tempo dell'esperimento. Gli studi vanno comunque proseguiti, tenendo conto dell'instabilità della sostanza sotto esame: in questo caso si raccomanda di esaminare ambedue le fasi nello studio principale.
1.9.2.4. Secondo momento — Cinetica di adsorbimento per una data concentrazione della sostanza sotto esame
Si impiegano cinque terreni, scelti dalla tabella 1. Può convenire includere fra di essi qualcuno di quelli impiegati nello studio preliminare (al limite, tutti}. In questo caso, le operazioni del secondo momento non vanno ripetute sui terreni impiegati nello studio preliminare.
Il tempo di equilibrio, il rapporto terreno/soluzione, il peso di campione di terreno, il volume della fase acquosa a contatto col terreno e la concentrazione della sostanza sotto esame nella soluzione debbono essere scelti sulla base dei risultati degli studi preliminari. Di preferenza, l'analisi deve essere eseguita dopo circa 2, 4, 6, 8 e possibilmente anche 10 e 24 ore di contatto; il tempo di agitazione può essere portato fino a un massimo di 48 h nel caso che una sostanza chimica richieda tempi di equilibrio più lunghi rispetto ai risultati della ricerca del campo di rapporti. In ogni modo, i tempi di analisi debbono essere considerati con flessibilità.
Ogni esperimento (un terreno ed una soluzione) deve essere fatto almeno in doppio, per poter valutare la varianza dei risultati. Per ogni esperimento va previsto un bianco, consistente nel terreno e nella soluzione di CaCl20,01 M, senza aggiunta della sostanza sotto esame, di peso e volume rispettivamente identici a quelli dell'esperimento. A titolo di salvaguardia contro gli imprevisti, si sottoporrà alla stessa procedura sperimentale un campione di controllo contenente soltanto la sostanza sotto esame nella soluzione di CaCl20,01 M (senza aggiunta di terreno).
L'adsorbimento percentuale va calcolato per ogni attimo  e/o intervallo di tempo
e/o intervallo di tempo 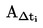 (secondo necessità), e riportato in funzione del tempo. Vanno altresì calcolati il coefficiente di distribuzione Kd all'equilibrio e il coefficiente di adsorbimento normalizzato per il carbonio organico Koc (per i composti chimici organici non polari).
(secondo necessità), e riportato in funzione del tempo. Vanno altresì calcolati il coefficiente di distribuzione Kd all'equilibrio e il coefficiente di adsorbimento normalizzato per il carbonio organico Koc (per i composti chimici organici non polari).
Risultati degli esperimenti sulla cinetica di adsorbimento
Il valore lineare Kd è generalmente abbastanza preciso da poter descrivere il comportamento relativo al sorbimento nei terreni (35) (78) e rappresenta un'espressione della mobilità intrinseca dei prodotti chimici nel terreno. Ad esempio: sul piano generale, i prodotti chimici con Kd < 1 cm3 g-1 sono considerati qualitativamente mobili. McCall et al. hanno inoltre messo a punto uno schema di classifica della mobilità basato sul valore di Koc (16). Esistono infine schemi di classifica in funzione del dilavamento, basati su una relazione fra Koc e DT-50 (31) (32) (79).
Da studi sull'analisi degli errori (61) risulta altresì che, partendo da una diminuzione della concentrazione della fase acquosa, non è possibile valutare con precisione i valori di Kd inferiori a 0,3 cm3 g-1, neppure quando si applica il rapporto terreno/soluzione più favorevole dal punto di vista della precisione, cioè quello di 1:1. In questo caso si raccomanda di analizzare ambedue le fasi (terreno e soluzione).
Quanto alle osservazioni di cui sopra, si raccomanda di proseguire gli studi del comportamento all'adsorbimento di un prodotto chimico nel terreno e della sua mobilità potenziale, determinando le isoterme di adsorbimento secondo Freundlich, per tutti i sistemi per i quali il valore di Kd può essere determinato con esattezza, applicando il protocollo sperimentale descritto nel presente metodo. Una determinazione accurata è possibile se il valore ottenuto moltiplicando Kd per il rapporto terreno/soluzione è superiore a 0,3, quando le misure si basano sulla diminuzione di concentrazione nella fase acquosa (metodo indiretto), oppure a 0,1, quando vengono analizzate ambedue le fasi (metodo diretto) (61).
1.9.2.5 Terzo momento — Isoterme di adsorbimento e cinetica di desorbimento/isoterme di desorbimento
1.9.2.5.1. Isoterme di adsorbimento
Si impiegano cinque concentrazioni della sostanza sotto esame, tali da coprire preferibilmente due ordini di grandezza: per la scelta di queste concentrazioni vanno prese in conto la solubilità in acqua e le concentrazioni all'equilibrio acquoso che ne risultano. Lo stesso rapporto terreno/soluzione per ogni terreno deve essere mantenuto per tutta la durata dello studio. La prova di adsorbimento viene eseguita come sopra descritto, con la sola differenza che la fase acquosa viene analizzata una sola volta, al momento necessario per raggiungere l'equilibrio. come determinato al secondo momento. Si determinano le concentrazioni all'equilibrio nella soluzione e si calcola la quantità adsorbita partendo dalla deplezione della sostanza sotto esame nella soluzione, oppure col metodo diretto. La massa adsorbita, riferita all'unità di massa di terreno, viene poi riportata graficamente, in funzione della concentrazione all'equilibrio della sostanza sotto esame (cfr. «Dati e relazione»).
Risultati della sperimentazione per le isoterme di adsorbimento
Fra i modelli matematici per l'adsorbimento proposti fino ad oggi, le isoterme di Freundlich sono quelle più frequentemente utilizzate per descrivere i procedimenti di adsorbimento. Dati più particolareggiati sull'interpretazione e l'importanza dei modelli di adsorbimento sono reperibili in letteratura (41) (45) (80) (81) (82).
NB: va tenuto presente che, per varie sostanze, un confronto fra i valori di KF (coefficienti di adsorbimento secondo Freundlich) è possibile soltanto se tali valori sono espressi nelle stesse unità (83).
1.9.2.5.2. Cinetica di desorbimento
Questo esperimento ha lo scopo di stabilire se una sostanza chimica viene adsorbita reversibilmente o irreversibilmente dal terreno. Questo dato è importante, poiché i processi di desorbimento hanno anch'essi una funzione rilevante nel comportamento di un composto chimico nelle condizioni effettive sul terreno. Inoltre, i dati di desorbimento contribuiscono utilmente alla modellizzazione computerizzata del dilavamento ed alla simulazione della scomparsa della sostanza dilavata. Se si vuole studiare il desorbimento, si raccomanda di eseguire lo studio appresso descritto su ciascun sistema per il quale è stato possibile determinare con accuratezza il valore di Kd nel precedente studio sulla cinetica di adsorbimento.
Analogamente alla cinetica di adsorbimento, per studiare la cinetica di desorbimento esistono due possibilità: a) il metodo in parallelo; b) il metodo in serie. La scelta della metodologia da seguire è lasciata allo sperimentatore, che dovrà considerare le disponibilità strumentali e le risorse del laboratorio.
|
a)
|
Metodo in parallelo: per ciascun terreno scelto per lo studio sul desorbimento si preparano dei campioni con lo stesso rapporto terreno/soluzione, nel numero necessario per coprire gli intervalli di tempo ai quali si desidera studiare la cinetica di desorbimento. Di preferenza, vanno impiegati gli stessi intervalli di tempo utilizzati per la cinetica di adsorbimento; tuttavia, il tempo totale può essere esteso secondo necessità, in modo che il sistema possa raggiungere l'equilibrio di desorbimento. Per ogni esperimento (un terreno, una soluzione) si esegue un bianco. Esso consiste nel terreno e nella soluzione 0,01 M di CaCl2, senza la sostanza sotto esame, nonché di un peso e un volume rispettivamente identici a quelli dell'esperimento. Quale termine di riferimento s'impiega la sostanza sotto esame nella soluzione 0,01 M di CaCl, (senza terreno), che viene sottoposta alla stessa procedura sperimentale. Tutte le miscele del terreno con la soluzione vengono agitate fino a raggiungimento dell'equilibrio di adsorbimento (come in precedenza al secondo momento). Le due fasi vengono quindi separate per centrifugazione, e la fase acquosa viene allontanata nella maggior misura possibile. Il volume della soluzione allontanata viene sostituito da un volume uguale di 0,01 M CaCl2, senza la sostanza sotto esame, e le nuove miscele vengono nuovamente agitate. La fase acquosa della prima provetta viene recuperata nel modo più completo possibile e viene misurata, ad esempio, dopo 2 h, quella della seconda provetta dopo 4 h, quella della terza dopo 6 h, ecc. finché sia raggiunto l'equilibrio di desorbimento.
|
|
b)
|
Metodo in serie: dopo l'esperimento sulla cinetica di adsorbimento, la miscela viene centrifugata e la fase acquosa viene eliminata nella maggior misura possibile. Il volume di soluzione eliminato viene sostituito da un uguale volume di CaCl20,01 M, senza la sostanza sotto esame. La nuova miscela viene agitata fino a raggiungere l'equilibrio di desorbimento. Durante questo periodo di tempo, ad intervalli di tempo definiti, la miscela viene centrifugata per separare le fasi. La sostanza sotto esame viene ricercata immediatamente in una piccola aliquota della fase acquosa; l'esperimento prosegue quindi con la miscela originale. Il volume delle singole aliquote deve essere inferiore all'1 % del volume totale. Si aggiunge alla miscela la stessa quantità di soluzione fresca di CaCl20,01 M, in modo da mantenere il rapporto terreno/soluzione e si prosegue l'agitazione fino al successivo intervallo di tempo.
|
Il desorbimento percentuale viene calcolato ad ogni momento  e/o intervallo tempo
e/o intervallo tempo  , secondo le esigenze dello studio, e riportato graficamente in funzione del tempo. Si calcola anche il coefficiente di desorbimento Kdes all'equilibrio. Tutte le equazioni applicabili sono riportate al capitolo «Presentazione dei dati e relazione», nonché nell'appendice 5.
, secondo le esigenze dello studio, e riportato graficamente in funzione del tempo. Si calcola anche il coefficiente di desorbimento Kdes all'equilibrio. Tutte le equazioni applicabili sono riportate al capitolo «Presentazione dei dati e relazione», nonché nell'appendice 5.
Risultati dell'esperimento sulla cinetica di desorbimento
I grafici comuni del desorbimento percentuale  e dell'adsorbimento percentuale
e dell'adsorbimento percentuale  in funzione del tempo permettono di valutare la reversibilità dei processi di adsorbimento. Se l'equilibrio di desorbimento viene raggiunto entro un tempo che può essere anche doppio del tempo ottenuto per l'equilibrio di adsorbimento, e il desorbimento totale risulta superiore al 75 % della quantità adsorbita, l'adsorbimento è considerato reversibile.
in funzione del tempo permettono di valutare la reversibilità dei processi di adsorbimento. Se l'equilibrio di desorbimento viene raggiunto entro un tempo che può essere anche doppio del tempo ottenuto per l'equilibrio di adsorbimento, e il desorbimento totale risulta superiore al 75 % della quantità adsorbita, l'adsorbimento è considerato reversibile.
1.9.2.5.3. Isoterme di desorbimento
Le isoterme di desorbimento secondo Freundlich sono determinate sui terreni impiegati nell'esperimento sulle isoterme di adsorbimento. La prova di desorbimento viene eseguita come descritto al capitolo «Cinetica di desorbimento» con la sola differenza che la fase acquosa viene analizzata soltanto una volta, all'equilibrio di desorbimento. Si procede poi al calcolo della quantità di sostanza sotto esame desorbita. La quantità di sostanza sotto esame che resta adsorbita sul terreno all'equilibrio di desorbimento viene riportata graficamente in funzione delle concentrazioni di equilibrio della sostanza sotto esame in soluzione (cfr. «Presentazione dei dati e relazione» ed appendice 5).
2. PRESENTAZIONE DEI DATI E RELAZIONE
I dati analitici vanno presentati in forma tabulare (cfr. appendice 6). Vanno indicate le misure singole e le medie calcolate. Debbono essere fornite le rappresentazioni grafiche delle isoterme di adsorbimento. I calcoli vanno eseguiti come appresso indicato.
Ai fini della prova, il peso di 1 cm3 di soluzione acquosa è considerato uguale a 1 g. Il rapporto terreno/soluzione può essere espresso in unità peso/peso o peso/volume con la stessa cifra.
2.1. ADSORBIMENTO
L'adsorbimento ( ) si definisce come percentuale della sostanza sotto esame adsorbita dal terreno, riferita alla quantità presente all'inizio della prova, nelle condizioni sperimentali. Se la sostanza sotto prova è stabile e non viene adsorbita significativamente sulle pareti del recipiente,
) si definisce come percentuale della sostanza sotto esame adsorbita dal terreno, riferita alla quantità presente all'inizio della prova, nelle condizioni sperimentali. Se la sostanza sotto prova è stabile e non viene adsorbita significativamente sulle pareti del recipiente,  può essere calcolato a ciascun momento ti, con l'equazione:
può essere calcolato a ciascun momento ti, con l'equazione:
|

|
(3)
|
dove:
|
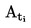
|
=
|
percentuale di adsorbimento al momento ti ( %);
|
|

|
=
|
massa della sostanza sotto esame adsorbita sul terreno al momento ti (μg);
|
|
m0
|
=
|
massa della sostanza sotto esame nella provetta, all'inizio della prova (μg).
|
Informazioni particolareggiate sul modo di calcolare la percentuale di adsorbimento  per i metodi in serie e in parallelo sono fornite nell'appendice 5.
per i metodi in serie e in parallelo sono fornite nell'appendice 5.
Il coefficiente di distribuzione Kd è il rapporto fra il contenuto della sostanza nella fase terreno e la concentrazione di massa della sostanza della soluzione acquosa, nelle condizioni sperimentali, al momento in cui viene raggiunto l'equilibrio di adsorbimento.
|
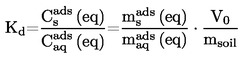
(cm3 g-1) |
(4)
|
dove:
|
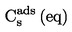
|
=
|
contenuto della sostanza adsorbita sul terreno all'equilibrio di adsorbimento (ug g-1);
|
|

|
=
|
concentrazione di massa della sostanza nella fase acquosa all'equilibrio di adsorbimento (μg cm-3). Questa concentrazione viene determinata analiticamente tenendo conto dei valori indicati dai bianchi;
|
|
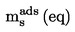
|
=
|
massa della sostanza adsorbita sul terreno all'equilibrio di adsorbimento (μg);
|
|

|
=
|
massa della sostanza in soluzione all'equilibrio di adsorbimento (μg);
|
|
msoil
|
=
|
quantità della fase terreno, espressa come massa secca di terreno (g);
|
|
V0
|
=
|
volume iniziale della fase acquosa a contatto col terreno (cm3).
|
La relazione fra Aeq e Kd è data dall'espressione:
|

(cm3 g-1) |
(5)
|
dove:
|
Aeq
|
=
|
percentuale di adsorbimento all'equilibrio di adsorbimento, %.
|
Il coefficiente normalizzato di adsorbimento del carbonio organico Koc collega il coefficiente di distribuzione Kd al contenuto di carbonio organico del campione di terreno:
|

(cm3 g-1) |
(6)
|
dove:
|
% OC
|
=
|
percentuale di carbonio organico nel campione di terreno (g g-1).
|
Il coefficiente Koc rappresenta un valore singolo che caratterizza la ripartizione, principalmente delle sostanze chimiche organiche non polari, fra il carbonio organico contenuto nel terreno o nel sedimento e l'acqua. L'adsorbimento di queste sostanze chimiche è in relazione col contenuto organico del solido sorbente (7); quindi, i valori di Koc dipendono dalle specifiche caratteristiche delle frazioni umiche che differiscono considerevolmente per la loro capacità di sorbimento a causa delle differenze di genesi, di provenienza ecc.
2.1.1. Isoterme di adsorbimento
L'equazione delle isoterme di adsorbimento secondo Freundlich collega la quantità della sostanza sotto esame adsorbita con la concentrazione della sostanza sotto esame in soluzione all'equilibrio (equazione 8).
I dati sono trattati come descritto alla voce «Adsorbimento», e per ciascuna provetta si calcola il contenuto della sostanza sotto esame adsorbita sul terreno dopo la prova di adsorbimento [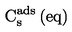 (eq), altrove indicato come x/m]. Si parte dall'idea che l'equilibrio sia stato raggiunto e che
(eq), altrove indicato come x/m]. Si parte dall'idea che l'equilibrio sia stato raggiunto e che 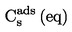 (eq) rappresenti il valore all'equilibrio:
(eq) rappresenti il valore all'equilibrio:
|
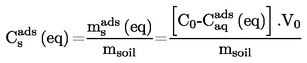
(μg g-1) |
(7)
|
L'equazione di adsorbimento secondo Freundlich è data dall'espressione:
|

(μg g-1) |
(8)
|
oppure, in forma lineare, da:
|

|
(9)
|
dove:
|

|
=
|
coefficiente di adsorbimento secondo Freundlich. Le sue dimensioni sono cm3 g-1 soltanto se 1/n = 1: in tutti gli altri casi, nelle dimensioni di  [μg1-1/n (cm3)1/n g-1) è introdotto il coefficiente angolare 1/n; [μg1-1/n (cm3)1/n g-1) è introdotto il coefficiente angolare 1/n;
|
|
n
|
=
|
costante di regressione; 1/n è generalmente compreso fra 0,7 e 1,0. Ciò sta a indicare che spesso i dati relativi al sorbimento si discostano leggermente dalla linearità.
|
Si tracciano i grafici delle equazioni (8) e (9), e si calcolano i valori di  e di 1/n attraverso l'analisi di regressione applicando la (9). Si calcola inoltre il coefficiente di correlazione r2 dell'equazione logaritmica. Un esempio dei due grafici è presentato nella figura 2.
e di 1/n attraverso l'analisi di regressione applicando la (9). Si calcola inoltre il coefficiente di correlazione r2 dell'equazione logaritmica. Un esempio dei due grafici è presentato nella figura 2.
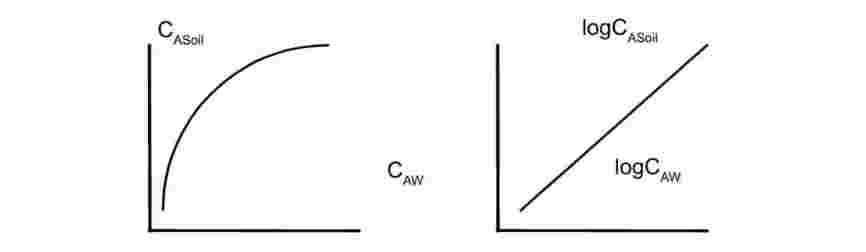
2.1.2. Bilancio di massa
Come bilancio di massa (MB) si definisce la percentuale di sostanza che può essere recuperata analiticamente dopo una prova di adsorbimento, espressa in funzione della quantità nominale di sostanza all'inizio della prova.
Il trattamento dei dati sarà diverso se il solvente è completamente miscibile con l'acqua. Nel caso del solvente miscibile con l'acqua, per determinare la quantità di sostanza recuperata per estrazione del solvente si potranno trattare i dati al modo descritto sotto la voce «Desorbimento». Se il solvente è meno miscibile con acqua, si dovrà procedere alla determinazione della quantità recuperata.
Il bilancio di massa MB per l'adsorbimento viene calcolato come appresso indicato: si ammette che il termine (mE) corrisponda alla somma delle masse dei prodotti chimici sotto prova estratte dal terreno o dalla superficie del recipiente con un solvente organico:
|

|
(10)
|
dove:
|
MB
|
=
|
bilancio di massa ( %)
|
|
mE
|
=
|
massa totale della sostanza sotto prova, estratta dal terreno e dalle pareti del recipiente in due stadi (μg)
|
|
C0
|
=
|
concentrazione iniziale di massa della soluzione sotto prova a contatto col terreno (μg/cm3)
|
|
Vrec
|
=
|
volume del surnatante recuperato dopo l'equilibrio di adsorbimento (cm-3).
|
2.2. DESORBIMENTO
Il desorbimento (D) si definisce come percentuale della sostanza sotto esame che viene desorbita, riferita alla quantità di sostanza precedentemente adsorbita, nelle condizioni sperimentali:
|
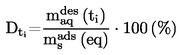
|
(11)
|
dove:
|

|
=
|
percentuale di desorbimento al momento ti ( %)
|
|

|
=
|
massa della sostanza sotto esame desorbita dal terreno al momento ti (μg)
|
|
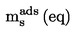
|
=
|
massa della sostanza sotto esame adsorbita sul terreno all'equilibrio di adsorbimento (μg).
|
Informazioni particolareggiate sul modo di calcolare la percentuale di desorbimento  per i metodi in parallelo e in serie figurano nell'appendice 5.
per i metodi in parallelo e in serie figurano nell'appendice 5.
Il coefficiente apparente di desorbimento (Kdes), nelle condizioni sperimentali, è il rapporto fra il contenuto della sostanza che rimane nella fase terreno e la concentrazione di massa della sostanza desorbita nella soluzione acquosa, al momento in cui l'equilibrio di desorbimento è raggiunto:
|
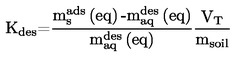
(cm3 g-1) |
(12)
|
dove:
|
Kdes
|
=
|
coefficiente di desorbimento cm3 g-1)
|
|

|
=
|
massa totale della sostanza sotto esame desorbita dal terreno all'equilibrio di desorbimento (μg)
|
|
VT
|
=
|
volume totale della fase acquosa a contatto col terreno durante la prova di cinetica del desorbimento (cm3).
|
Una guida per calcolare il  (eq) figura nell'appendice 5 sotto l'intestazione «Desorbimento».
(eq) figura nell'appendice 5 sotto l'intestazione «Desorbimento».
Osservazioni:
Se la precedente prova di adsorbimento era stata eseguita col metodo in parallelo, il volume VT nell'equazione 12 viene considerato uguale a V0.
2.2.1. Isoterme di desorbimento
L'equazione delle isoterme di desorbimento secondo Freundlich collega il contenuto della sostanza sotto esame che rimane adsorbita al terreno alla concentrazione della sostanza sotto esame nella soluzione, all'equilibrio di desorbimento (equazione 16).
Per ogni provetta, il contenuto della sostanza che rimane adsorbita al terreno all'equilibrio di desorbimento viene calcolata come segue:
|
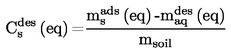
(µg g-1) |
(13)
|
 si definisce come:
si definisce come:
|

(μg) |
(14)
|
dove:
|
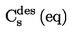
|
=
|
contenuto della sostanza sotto esame che rimane adsorbito sul terreno all'equilibrio di desorbimento (μg g-1)
|
|

|
=
|
massa di sostanza determinata analiticamente nella fase acquosa all'equilibrio di desorbimento (μg)
|
|

|
=
|
massa della sostanza sotto esame residuata dall'equilibrio di adsorbimento a causa dell'incompleta sostituzione del volume (μg)
|
|

|
=
|
massa della sostanza della soluzione all'equilibrio di adsorbimento (μg)
|
|

|
(15)
|
|

|
=
|
volume della soluzione prelevata dalla provetta per la misura della sostanza sotto esame, all'equilibrio di desorbimento (cm3)
|
|
VR
|
=
|
volume del surnatante allontanato dalla provetta dopo il raggiungimento dell'equilibrio all'adsorbimento e sostituito dallo stesso volume di soluzione 0,01 M CaCl2 (cm3).
|
L'equazione di desorbimento secondo Freundlich è data dalla (16):
|

(μg g-1) |
(16)
|
oppure, in forma lineare:
|

|
(17)
|
dove:
|

|
=
|
coefficiente di desorbimento secondo Freundlich
|
|
n
|
=
|
costante di regressione
|
|

|
=
|
concentrazione di massa della sostanza nella fase acquosa all'equilibrio di desorbimento (μg cm-3).
|
Le equazioni (16) e (17) possono essere rappresentate graficamente, e i valori di  e 1/n vengono calcolati per analisi di regressione con l'equazione 17.
e 1/n vengono calcolati per analisi di regressione con l'equazione 17.
Osservazioni:
Se l'esponente l/n di adsorbimento o desorbimento secondo Freundlich è uguale a 1, le costanti di legame di adsorbimento o desorbimento secondo Freundlich (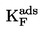 e
e  ) saranno rispettivamente uguali alle costanti di equilibrio all'adsorbimento o al desorbimento (Kd e Kdes), e il grafico di Cs in funzione di Caq sarà lineare. Se gli esponenti sono diversi da 1, i grafici di Q in funzione di Caq non saranno lineari, e le costanti di adsorbimento e desorbimento varieranno con le isoterme.
) saranno rispettivamente uguali alle costanti di equilibrio all'adsorbimento o al desorbimento (Kd e Kdes), e il grafico di Cs in funzione di Caq sarà lineare. Se gli esponenti sono diversi da 1, i grafici di Q in funzione di Caq non saranno lineari, e le costanti di adsorbimento e desorbimento varieranno con le isoterme.
2.2.2. Relazione
La relazione deve comprendere i seguenti dati:
|
—
|
Identificazione completa dei campioni di terreno utilizzati, comprendenti:
|
|
—
|
coordinate geografiche della località (latitudine, longitudine),
|
|
—
|
data di prelievo del campione,
|
|
—
|
schema d'impiego (esempio: terreno agrario, foresta, ecc),
|
|
—
|
profondità del prelievo,
|
|
—
|
contenuto in sabbia/torba/argilla,
|
|
—
|
valore del pH (come CaCl20,01 M),
|
|
—
|
contenuto in carbonio organico,
|
|
—
|
contenuto in sostanza organica,
|
|
—
|
capacità di scambio canonico (mmol/kg),
|
|
—
|
tutte le informazioni relative alla raccolta e alla conservazione dei campioni di suolo,
|
|
—
|
dove del caso, tutte le informazioni rilevanti ai fini dell'interpretazione dell'adsorbimento/desorbimento della sostanza sotto esame,
|
|
—
|
riferimento ai metodi impiegati per la determinazione di ciascun parametro,
|
|
—
|
informazioni sulla sostanza sotto esame, come del caso,
|
|
—
|
temperatura della sperimentazione,
|
|
—
|
condizioni di centrifugazione,
|
|
—
|
procedimento analitico impiegato per analizzare la sostanza sotto esame,
|
|
—
|
giustificazione per l'impiego di qualsiasi agente solubilizzante per la preparazione della soluzione di riserva della sostanza sotto esame,
|
|
—
|
spiegazione delle correzioni apportate ai calcoli, se del caso,
|
|
—
|
dati secondo il formulario dell'appendice 6 e presentazioni grafiche,
|
|
—
|
tutte le informazioni e osservazioni che possono essere utili per interpretare i risultati delle prove.
|
3. RIFERIMENTI
|
(1)
|
Kukowski H. and Brümmer G., (1987). Investigations on the Adsorption and Desorption of Selected Chemicals in Soils. UBA Report 106 02045, Part II.
|
|
(2)
|
Fränzle O., Kuhnt G. and Vetter L., (1987). Selection of Representative Soils in the EC-Territory. UBA Report 106 02045, Part I.
|
|
(3)
|
Kuhnt G. and Muntau H. (Eds.) EURO-Soils: Identification, Collection, Treatment, Characterisation. Special Publication No 1.94.60, Joint Research Centre. European Commission, ISPRA, December 1994.
|
|
(4)
|
OECD Test Guidelines Programme, Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italy, 18-20 January 1995 (June 1995).
|
|
(5)
|
US Environment Protection Agency: Pesticide Assessment Guidelines. Subdivision N, Chemistry: Environmental Fate, Series 163-1, Leaching and Adsorption/Desorption Studies, Addendum 6 on Data Reporting, 54O/O9-8S-O96. Date: 1/19SS.
|
|
(6)
|
US Environment Protection Agency: Prevention, Pesticides and Toxic Substances, OPPTS Harmonized Test Guidelines, Series 835-rate, Transport and Transformation Test Guidelines, OPPTS No: 835.1220 Sediment and Soil Adsorption/Desorption Isotherm. EPA No: 712-C-96-048 April 1996.
|
|
(7)
|
ASTM Standards, E 1195-85, Standard Test Method for Determining a Sorption Constant (KOC) for an Organic Chemical in Soil and Sediments.
|
|
(8)
|
Agriculture Canada: Environmental Chemistry and Fate. Guidelines for registration of pesticides in Canada, 15 July 1987.
|
|
(9)
|
Netherlands Commission Registration Pesticides (1995); Application for registration of a pesticide. Section G. Behaviour of the product and its metabolites in soil, water and air.
|
|
(10)
|
Danish National Agency of Environmental Protection (October 1988): Criteria for registration of pesticides as especially dangerous to health or especially harmful to the environment.
|
|
(11)
|
BBA (1990). Guidelines for the Official Testing of Plant Protection Products, Biological Research Centre for Agriculture and Forestry, Braunschweig, Germany.
|
|
(12)
|
Calvet R., (1989), «Evaluation of adsorption coefficients and the prediction of the mobilities of pesticides in soils», in Methodological Aspects of the Study of Pesticide Behaviour in Soil (ed. P. Jamet), INRA, Paris, (Review).
|
|
(13)
|
Calvet R., (1980), «Adsorption-Desorption Phenomena» in Interactions between herbicides and the soil. (R.J. Hance ed.), Academic Press, London, pp. 83-122.
|
|
(14)
|
Hasset J.J., and Banwart W.L, (1989), «The sorption of nonpolar organics by soils and sediments» in Reactions and Movement of Organic Chemicals in Soils. Soil Science Society of America (S.S.S.A), Special Publication no. 22, pp. 31-44.
|
|
(15)
|
van Genuchten M.Th., Davidson J.M., and Wierenga P.J., (1974), «An evaluation of kinetic and equilibrium equations for the prediction of pesticide movement through porous media». Soil Sci. Soc. Am. Proc, Vol. 38(1), pp. 29-35.
|
|
(16)
|
McCall P.J., Laskowski D.A., Swann R.L, and Dishburger H.J., (1981), «Measurement of sorption coefficients of organic chemicals and their use, in environmental fate analysis», in Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington DC.
|
|
(17)
|
Lambert S.M, Porter P.E., and Schieferrstein R.H., (1965), «Movement and sorption of chemicals applied to the soil». Weeds, 13, pp. 185-190.
|
|
(18)
|
Rhodes R.C, Belasco I.J., and Pease H.L., (1970) «Determination of mobility and adsorption of agrochemicals in soils». J.Agric.Food Chem., 18, pp. 524-528.
|
|
(19)
|
Russell M.H., (1995), «Recommended approaches to assess pesticide mobility in soil» in Environmental Behavior of Agrochemicals (ed. T. R. Roberts and P. C. Kearney). John Wiley & Sons Ltd.
|
|
(20)
|
Esser H.O., Hemingway R.J.. Klein W., Sharp D.B., Vonk J.W. and Holland P.T., (1988), «Recommended approach to the evaluation of the environmental behavior of pesticides», IUPAC Reports on Pesticides (24). Pure Appl. Chem., 60, pp. 901-932.
|
|
(21)
|
Guth J.A., Burkhard N., and D.O. Eberle, (1976), «Experimental models for studying the persistence of pesticides in soils». Proc. BCPC Symposium: Persistence of Insecticides and Herbicides, pp. 137-157, BCPC, Surrey, UK.
|
|
(22)
|
Furminge C.G.L, and Osgerby J.M., (1967), «Persistence of herbicides in soil» 175. J. Sci. Fd Agric, IS, pp. 269-273.
|
|
(23)
|
Burkhard N., and Guth J.A., (1981), «Chemical hydrolysis of 2-Chloro-4.6-bis(alkylamino)-l,3,5-triazine herbicides and their breakdown in soil under the influence of adsorption». Pestic. Sci. 12, pp. 45-52.
|
|
(24)
|
Guth J.A., Gerber H.R., and Schlaepfer T., (1977), «Effect of adsorption, movement and persistence on the biological availability of soil-applied pesticides». Proc. Br. Crop Prot. Conf., 3, pp. 961-971.
|
|
(25)
|
Osgerby J.M, (1973), «Process affecting herbicide action in soil». Pestic. Sci., 4. pp. 247-258.
|
|
(26)
|
Guth J.A., (1972), «Adsorptions- und Einwascheverhalten von Pflanzenschutzmitteln in Böden». Schr. Reihe Ver. Wass. -Boden-Lufthyg. Berlin-Dahlem. Heft 37, pp. 143-154.
|
|
(27)
|
Hamaker J.W., (1975). «The interpretation of soil leaching experiments», in Environmental Dynamics of Pesticides (eds R. Haque and V.H. Freed), pp. 135-172, Plenum Press, NY.
|
|
(28)
|
Helling C.S., (1971). «Pesticide mobility in soils». Soil Sci. Soc. Amer. Proc, 35, pp. 732-210.
|
|
(29)
|
Hamaker J.W. (1972). «Diffusion and volatilization» in Organic chemicals in the soil environment (C.A.I. Goring and J. W. Hamaker eds), Vol. I. pp. 49-143.
|
|
(30)
|
Burkhard N. and Guth J.A.. (1981), «Rate of volatilisation of pesticides from soil surfaces; Comparison of calculated results with those determined in a laboratory model system». Pestic. Sci. 12, pp. 37-44.
|
|
(31)
|
Cohen S.Z., Creeger S.M., Carsel R.F., and Enfield C.G., (1984), «Potential pesticide contamination of groundwater from agricultural uses», in Treatment and Disposal of Pesticide Wastes, pp. 297-325, Acs Symp. Ser. 259, American Chemical Society, Washington, DC.
|
|
(32)
|
Gustafson D.I., (1989), «Groundwater ubiquity score: a simple method for assessing pesticide leachability». J. Environ. Toxic. Chem., 8(4), pp. 339-357.
|
|
(33)
|
Leistra M, and Dekkers W.A., (1976). «Computed effects of adsorption kinetics on pesticide movement in soils». J. of Soil Sci., 28, pp. 340-3 50.
|
|
(34)
|
Bromilov R.H., and Leistra M., (1980), «Measured and simulated behavior of aldicarb and its oxidation products in fallow soils». Pest. Sci., 11, pp. 389-395.
|
|
(35)
|
Green R.E., and Karickoff S.W., (1990), «Sorption estimates for modeling», in Pesticides in the Soil Environment: Process, Impacts and Modeling (ed. H.H. Cheng). Soil Sci. Soc. Am., Book Series no. 2, pp. 80-101.
|
|
(36)
|
Lambert S.M., (1967), «Functional relationship between sorption in soil and chemical structure». J. Agri. Food Chem., 15, pp. 572-576.
|
|
(37)
|
Hance R.J., (1969), «An empirical relationship between chemical structure and the sorption of some herbicides by soils». J. Agri. Food Chem., 17, pp. 667-668.
|
|
(38)
|
Briggs G.G. (1969), «Molecular structure of herbicides and their sorption by soils». Nature, 223, 1288.
|
|
(39)
|
Briggs G.G. (1981). «Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficients, water solubilities, bioconcentration factors, and the parachor».). Agric. Food Chem., 29, pp. 1050-1059.
|
|
(40)
|
Sabljic A., (1984), «Predictions of the nature and strength of soil sorption of organic polutance by molecular topology». J. Agric. Food Chem., 32, pp. 243-246.
|
|
(41)
|
Bailey G.W., and White J.L, (1970), «Factors influencing the adsorption, desorption, and movement of pesticides in soil». Residue Rev., 32, pp. 29-92.
|
|
(42)
|
Bailey G.W., J.L. White and Y. Rothberg., (1968), «Adsorption of organic herbicides by montomorillonite: Role of pH and chemical character of adsorbate». Soil Sci. Soc. Amer. Proc. 32: pp. 222-234.
|
|
(43)
|
Karickhoff S.W., (1981), «Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils». Chemosphere 10, pp. 833-846.
|
|
(44)
|
Paya-Perez A., Riaz M. and Larsen B., (1989), «Soil Sorption of 6 Chlorobenzenes and 20 PCB Congeners». Environ. Toxicol. Safety 21, pp. 1-17.
|
|
(45)
|
Hamaker J.W., and Thompson J.M., (1972), «Adsorption in organic chemicals» in Organic Chemicals in the Soil Environment (Goring C. A. I. and Hamaker J. W., eds), Vol I and II, Marcel Dekker, Inc., New York, NY, 1972, pp. 49-143.
|
|
(46)
|
Deli J., and Warren G.F., 1971, «Adsorption, desorption and leaching of diphenamid in soils». Weed Sci. 19: pp. 67-69.
|
|
(47)
|
Chu-Huang Wu, Buehring N., Davinson J.M. and Santelmann, (1975), «Napropamide Adsorption, desorption and Movement in soils». Weed Science, Vol. 23, pp. 454-457.
|
|
(48)
|
Haues M.H.B., Stacey M., and Thompson J.M., (1968), «Adsorption of s-triazine herbicides by soil organic preparations» in Isotopes and Radiation in Soil Organic Studies, p.75, International. Atomic Energy Agency, Vienna.
|
|
(49)
|
Pionke H.B., and Deangelis R.J. (1980), «Methods for distributing pesticide loss in field run-off between the solution and adsorbed phase». CREAMS, in A Field Scale Model for Chemicals, Run-off and Erosion from Agricultural Management Systems. Chapter 19. Vol. III: Supporting Documentation, USDA Conservation Research report.
|
|
(50)
|
ISO Standard Compendium Environment: Soil Quality — General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition (1994).
|
|
(51)
|
Scheffer F. and Schachtschabel. Lehrbuch der Bodenkunde. F. Enke Verlag. Stuttgart (1982), 11th edition.
|
|
(52)
|
Black, Evans D. D., White J. L.. Ensminger L. E., and Clark F. E., eds. «Methods of Soil Analysis», Vol 1 and 2, American Society of Agronomy, Madison, Wl, 1982.
|
|
(53)
|
ISO/DIS 10381-1 Soil Quality — Sampling — Part 1: Guidance on the design of sampling programmes.
|
|
(54)
|
ISO/DIS 10381-2 Soil Quality — Sampling — Part 2: Guidance on sampling techniques.
|
|
(55)
|
ISO/DIS 10381-3 Soil Quality — Sampling — Part 3: Guidance on safety of sampling.
|
|
(56)
|
ISO/DIS 10381-4 Soil Quality — Sampling — Part 4: Guidance on the investigation of natural and cultivated soils.
|
|
(57)
|
ISO/DIS 10381-5 Soil Quality — Sampling — Part 5: Guidance on the investigation of soil contamination of urban and industrial sites.
|
|
(58)
|
ISO 10381-6, 1993: Soil Quality — Sampling — Part 6: Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory.
|
|
(59)
|
Green R.E., and Yamane V.K., (1970), «Precision in pesticide adsorption measurements». Soil Sci. Am. Proc, 34, pp. 353-354.
|
|
(60)
|
Grover R., and Hance R. J. (1970), «Effect of ratio of soil to water on adsorption of linuron and atrazine». Soil Sci., pp. 109-138.
|
|
(61)
|
Boesten, J.J.T.I, «Influence of soil/liquid ratio on the experimental error of sorption coefficients in pesticide/soil system». Pest. Sci. 1990, 30, pp. 31-41.
|
|
(62)
|
Boesten, J.J.T.I. «Influence of soil/liquid ratio on the experimental error of sorption coefficients in relation to OECD guideline 106». Proceedings of 5th international workshop on environmental behaviour of pesticides and regulatory aspects, Brussels, 26-29 April 1994.
|
|
(63)
|
Bastide J., Cantier J.M., et Coste C, (1980), «Comportement de substances herbicides dans le sol en fonction de leur structure chimique». Weed Res. 21, pp. 227-231.
|
|
(64)
|
Brown D.S., and Flagg E.W., (1981), «Empirical prediction of organic pollutants sorption in natural sediments». J. Environ.Qual., 10(3), pp. 382-386.
|
|
(65)
|
Chiou C.T., Porter P.E., and Schmedding D.W., (1983), «Partition equilibria of non-ionic organic compounds between soil organic matter and water». Environ. Sci. Technol., 17(4), pp. 227-231.
|
|
(66)
|
Gerstl Z., and Mingelgrin U., (1984), «Sorption of organic substances by soils and sediments». J. Environm. Sci. Health, B19 (3), pp. 297-312.
|
|
(67)
|
Vowles P.D., and Mantoura R.F.C, (1987), «Sediment-water partition coefficient and HPLC retention factors of aromatic hydrocarbons». Chemosphere, 16(1), pp. 109-116.
|
|
(68)
|
Lyman W.J. , Reehl W.F.and Rosenblatt D.H. (1990). Handbook of Chemical Property Estimation Methods. Environmental Behaviour of Organic Compounds. American Chemical Society, Washington DC.
|
|
(69)
|
Keniga E.E., and Goring, C.A.I. (1980). «Relationship between water solubility, soil sorption, octanol-water partitioning and concentration of chemicals in the biota» in Aquatic Toxicology (eds J.G. Eaton, et al.), pp.78-115, ASTM STP 707, Philadelphia.
|
|
(70)
|
Chiou C.T., Peters L.J., and Freed V.H., (1979), «A physical concept of soil-water equilibria for non-ionic organic compounds». Science, Vol. 206, pp. S31-832.
|
|
(71)
|
Hassett J.J., Banwart W.I., Wood S.G., and Means J.C, (1981), «Sorption of/-Naphtol: implications concerning the limits of hydrophobic sorption». Soil Sci. Soc. Am. J. 45, pp. 38-42.
|
|
(72)
|
Karickhoff S.W., (1981), «Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils». Chemosphere, Vol. 10(8), pp. 833-S46.
|
|
(73)
|
Moreale A., van Bladel R., (1981), «Adsorption de 13 herbicides et insecticides par le sol. Relation solubilité-reactivité». Revue de 1'Agric. 34 (4). pp. 319-322.
|
|
(74)
|
Muller M., Kordel W. (1996), «Comparison of screening methods for the determination/estimation of adsorption coefficients on soil». Chemosphere, 32(12), pp. 2493-2504.
|
|
(75)
|
Kordel W., Kotthoff G., Muller M. (1995). «HPLC — screening method for the determination of the adsorption coefficient on soil — results of a ring test». Chemosphere 30 (7), pp. 1373-1384.
|
|
(76)
|
Kördel W., Stutte J., Kotthoff G. (1993), «HPLC — screening method for the determination of the adsorption coefficient on soil — comparison of different stationary phases». Chemosphere 27 (12), pp. 2341-2352.
|
|
(77)
|
Hance, R.J., (1967), «The Speed of Attainment of Sorption Equilibria in Some Systems Involving Herbicides». Weed Research, Vol. 7, pp. 29-36.
|
|
(78)
|
Koskinen W.C, and Harper S.S., (1990), «The retention processes: mechanisms» in Pesticides in the Soil Environment: Processes, Impacts and Modelling (ed. H. H. Cheng). Soil Sci. Soc. Am. Book Series, No. 2, Madison, Wisconsin.
|
|
(79)
|
Cohen S.Z., Creeger S.M., Carsel R.F., and Enfield C.G. (1984), «Potential pesticide contamination of groundwater from agricultural uses», in Treatment and Disposal of Pesticide Wastes, pp. 297-325, ACS Symp. Ser. 259, American Chemical Society, Washington, DC.
|
|
(80)
|
Giles C.H., (1970), «Interpretation and use of sorption isotherms» in Sorption and Transport Processes in Soils. S.C.I. Monograph No. 37, pp. 14-32.
|
|
(81)
|
Giles, C.H.; McEwan J.H.: Nakhwa, S.N. and Smith, D, (1960), «Studies in adsorption: XI. A system of classification of solution adsorption isotherms and its use in the diagnosis of adsorption mechanisms and in measurements of pesticides surface areas of soils». J. Chem. Soc, pp. 3973-93.
|
|
(82)
|
Calvet R., Terce M., and Arvien J.C, (1980), «Adsorption des pesticides par les sols et leurs constituants: 3. Caractéristiques générales de l'adsorption». Ann. Agron. 31: pp. 239-251.
|
|
(83)
|
Bedbur E., (1996), «Anomalies in the Freundlich equation», Proc. COST 66 Workshop, Pesticides in soil and the environment, 13-15 May 1996, Stratford-upon-Avon, UK.
|
|
(84)
|
Guth, J. A., (1985), «Adsorption/desorption», in Joint International Symposium, Physicochemical Properties and their Role in Environmental Hazard Assessment, July 1-3, Canterbury, UK.
|
|
(85)
|
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26:305 (1962).
|
APPENDICE 1
Schema di sperimentazione

APPENDICE 2
INFLUENZA DELLA PRECISIONE DEL METODO ANALITICO E DEL CAMBIAMENTO DI CONCENTRAZIONE SULLA PRECISIONE DEI RISULTATI RELATIVI ALL'ADSORBIMENTO
La seguente tabella (84) mostra chiaramente che, quando la differenza fra la massa iniziale (m0 = 110 μg) e la massa all'equilibrio (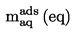 = 100 μg) della sostanza sotto esame nella soluzione è assai piccola, un errore del 5 % nella misura della concentrazione all'equilibrio conduce a un errore del 50 % nel calcolo della sostanza adsorbita nel terreno (
= 100 μg) della sostanza sotto esame nella soluzione è assai piccola, un errore del 5 % nella misura della concentrazione all'equilibrio conduce a un errore del 50 % nel calcolo della sostanza adsorbita nel terreno ( ) e del 52,4 % nel calcolo del Kd.
) e del 52,4 % nel calcolo del Kd.
|
Quantità di terreno
|
msoil
|
= 10 g
|
|
Volume di soluzione
|
Vo
|
= 100 cm3
|
|
|
FOR-L_2008142IT.01044401.notes.0187.xml.jpg (μg)
|
FOR-L_2008142IT.01044401.notes.0188.xml.jpg (μg cm-3)
|
R
|
FOR-L_2008142IT.01044401.notes.0189.xml.jpg (μg)
|
FOR-L_2008142IT.01044401.notes.0190.xml.jpg (μg g-1)
|
R‡
|
Kd*
|
R‡
|
|
|
PER A = 9 %
|
|
m0 = 110 μg or C0=1,100 μg/cm3
|
100
|
1,000
|
valore vero
|
10
|
1,00
|
valore vero
|
1
|
|
|
101
|
1,010
|
1 %
|
9
|
0,90
|
10 %
|
0,891
|
10,9 %
|
|
105
|
1,050
|
5 %
|
5
|
0,50
|
50 %
|
0,476
|
52,4 %
|
|
109
|
1,090
|
9 %
|
1
|
0,10
|
90 %
|
0,092
|
90,8 %
|
|
|
PER A = 55 %
|
|
m0= 110 μg or C0=1,100 μg/cm3
|
50,0
|
0,500
|
valore vero
|
60,0
|
6,00
|
valore vero
|
12,00
|
|
|
50,5
|
0,505
|
1 %
|
59,5
|
5,95
|
0,8 %
|
11,78
|
1,8 %
|
|
52,5
|
0,525
|
5 %
|
57,5
|
5,75
|
4,0 %
|
10,95
|
8,8 %
|
|
55,0
|
0,550
|
10 %
|
55,0
|
5,50
|
8,3 %
|
10,00
|
16,7 %
|
|
|
PER A = 99 %
|
|
m0 = 110 μg or C0=1,100 μg/cm3
|
1,100
|
0,011
|
valore vero
|
108,9
|
10,89
|
valore vero
|
990
|
|
|
1,111
|
0,01111
|
1 %
|
108,889
|
10,8889
|
0,01 %
|
980
|
1,0 %
|
|
1,155
|
0,01155
|
5 %
|
108,845
|
10,8845
|
0,05 %
|
942
|
4,8 %
|
|
1,21
|
0,0121
|
10 %
|
108,790
|
10,8790
|
0,10 %
|
899
|
9,2 %
|
Dove:
|

|
=
|

|
|
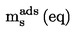
|
=
|
massa della sostanza sotto esame nella fase terreno all'equilibrio, μg
|
|
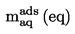
|
=
|
massa della sostanza sotto esame nella fase acquosa all'equilibrio, μg
|
|
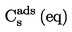
|
=
|
contenuto della sostanza sotto esame nella fase terreno all'equilibrio, μg g-1
|
|
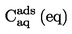
|
=
|
concentrazione in massa della sostanza sotto esame nella fase acquosa all'equilibrio, μg cm-3
|
|
R
|
=
|
errore analitico nella determinazione di 
|
|
R‡
|
=
|
errore calcolato dovuto all'errore analitico R.
|
APPENDICE 3
TECNICHE DI VALUTAZIONE PER Kd
|
1.
|
Le tecniche di valutazione consentono di prevedere i valori di Kd basandosi, ad esempio, sulle correlazioni con i valori di POW (12) (39) (63-68), sui dati relativi alla solubilità in acqua (12) (19) (21) (39) (68-73), o su quelli relativi alla polarità ricavati applicando la HPLC in fase invertita (74-76). Come mostrato nelle tabelle 1 e 2, queste equazioni permettono di calcolare i valori di Koc o di Kom, dai quali si ricava indirettamente il valore di Kd attraverso le equazioni:
|
|
2.
|
Queste correlazioni si fondano essenzialmente su due supposizioni: 1) la principale influenza sull'adsorbimento di una sostanza viene esercitata dalla sostanza organica contenuta nel terreno; 2) le interazioni che si manifestano hanno principalmente un carattere non polare. Di conseguenza, tali correlazioni: 1) non possono essere applicate alle sostanze polari, o possono esserlo soltanto in misura limitata; 2) non possono essere applicate nei casi in cui il contenuto in sostanza organica del terreno è molto basso (12). Inoltre, sebbene si siano trovate correlazioni soddisfacenti fra i valori di POW e l'adsorbimento (19), lo stesso non può dirsi per le relazioni fra la solubilità in acqua e la misura dell'adsorbimento (19) (21); gli studi effettuati fino ad oggi hanno dato esiti assai contraddittori.
|
|
3.
|
Nelle tabelle 1 e 2 sono indicati rispettivamente alcuni esempi di correlazione fra il coefficiente di adsorbimento e il coefficiente di ripartizione ottanolo-acqua, nonché alcuni dati relativi alla solubilità in acqua.
Tabella 1
Esempi di correlazione fra il coefficiente di distribuzione all'adsorbimento e il coefficiente di ripartizione ottanolo-acqua [per ulteriori esempi cfr. (12) (68)]
|
Sostanza
|
Correlazioni
|
Autori
|
|
Uree sostituite
|
log Kom = 0,69 + 0,52 log Pow
|
Briggs (1981) (39)
|
|
Chloroganici aromatici
|
log Koc = -0,779 + 0,904 log Pow
|
Chiou et al. (1983) (65)
|
|
Antiparassitari diversi
|
log Kom = 4,4 + 0,72 log Pow
|
Gerstl e Mingelgrin (1984) (66)
|
|
Idrocarburi aromatici
|
log Koc = -2,53 + 1,15 log Pow
|
Vowles e Mantoura (1987) (67)
|
Tabella 2
Esempi di correlazione fra il coefficiente di distribuzione all'adsorbimento e la solubilità in acqua [per ulteriori esempi cfr. (68) (69)].
|
Sostanza
|
Correlazioni
|
Autori
|
|
Antiparassitari diversi
|
log Kom = 3,8 - 0,561 log Sw
|
Gerstl e Mingelgrin (1984) (66)
|
|
Sostanze alifatiche e aromatiche clorurate
|
log K0m = (4,040 +/- 0,038) -(0,557 +/- 0,012) log Sw
|
Chiou et al. (1979) (70)
|
|
a-naftolo
|
log Koc = 4,273 - 0,686 log Sw
|
Hasset et al. (1981) (71)
|
|
Sostanze cicliche, alifatiche e aromatiche
|
log Koc = -1,405 - 0,921 log Sw-0,00953 (mp-25)
|
Karickhoff (1981) (72)
|
|
Composti vari
|
log Kom = 2,75 - 0,45 log Sw
|
Moreale van Blade (1982) (73)
|
|
APPENDICE 4
CALCOLI PER LA DEFINIZIONE DELLE CONDIZIONI DI CENTRIFUGAZIONE
|
1.
|
Il tempo di centrifugazione è dato dalla formula seguente, basata sul presupposto che le particelle siano sferiche e nella quale,
|

|
(1)
|
per semplificare, tutti i parametri sono espressi in unità non appartenenti al SI (g, cm).
dove:
|
ω
|
=
|
velocità angolare (=2 π rpm/60), rad s-1
|
|
rpm
|
=
|
giri al minuto
|
|
η
|
=
|
viscosità della soluzione (g s-1 cm-1)
|
|
rp
|
=
|
raggio delle particelle (cm)
|
|
ρs
|
=
|
densità del terreno (g cm-3)
|
|
ρaq
|
=
|
densità della soluzione (g cm-3)
|
|
Rt
|
=
|
distanza dal centro del rotore della centrifuga alla sommità della soluzione nella provetta da centrifuga (cm)
|
|
Rb
|
=
|
distanza dal centro del rotore della centrifuga al fondo della provetta da centrifuga, cm
|
|
Rb-Rt
|
=
|
lunghezza della miscela terreno/soluzione della provetta da centrifuga, cm.
|
In pratica, per assicurare la separazione completa si usa generalmente raddoppiare i tempi calcolati.
|
|
2.
|
L'equazione 1 può essere ulteriormente semplificata ammettendo che la viscosità (η) e la densità (ρaq) della soluzione siano uguali alla viscosità e alla densità dell'acqua a 25 oC; ne deriva che η = 8,95 × 10-3 g s-1 cm-1 e ρaq = 1,0 g cm-3.
Il tempo di centrifugazione si ricava quindi dall'equazione (2):
|

|
(2)
|
|
|
3.
|
Dall'equazione 2 risulta chiaro che, per stabilire le condizioni di centrifugazione (tempo e velocità) da applicare per ottenere la separazione delle particelle di una data grandezza (nel nostro caso, quelle da 0,1 μm di raggio), i parametri importanti sono due: a) la densità del terreno; b) l'«altezza» (Rb-Rt) della miscela contenuta nella provetta da centrifuga, cioè la distanza che una particella di terreno deve percorrere dalla sommità della soluzione al fondo della provetta. Ovviamente, a parità del volume di contenuto, tale altezza dipenderà dal quadrato del raggio della provetta.
|
|
4.
|
Nella figura 1 è rappresentato il modo di variare del tempo di centrifugazione (t) in funzione della velocità di centrifugazione (rpm), secondo le diverse densità del terreno (ρs) (Fig. 1a) e secondo la diversa altezza della miscela nelle provette (Fig. 1b). Dalla Fig. 1a risulta ovvia l'influenza della densità del terreno: ad esempio, per una centrifugazione classica a 3000, il tempo di centrifugazione è di 240 min per una densità di 1,2 g cm3 ma scende a 50 min per una densità di 2,0 g cm3. Analogamente, dalla Figura 1b si vede che, per una centrifugazione classica a 3000 rpm il tempo di centrifugazione è dell'ordine di 50 min. quando l'altezza della miscela è di 10 cm, ma scende a soli 7 min. per un'altezza di 1 cm. È comunque importante trovare un compromesso ottimale fra le condizioni di centrifugazione, che richiedono la minor altezza possibile, e la facilità di manipolazione da parte dello sperimentatore al momento di separare le fasi dopo la centrifugazione.
|
|
5.
|
Nello stabilire le condizioni sperimentali per la separazione delle fasi terreno/soluzione non va altresì trascurata la possibile esistenza di una terza «pseudofase», costituita dai colloidi. Le particelle colloidali, di diametro inferiore a 0,2 μm, possono avere un effetto importante sull'intero meccanismo di adsorbimento di una data sostanza in una sospensione di terreno. Quando la centrifugazione viene eseguita al modo sopra descritto, i colloidi restano nella fase acquosa e vengono analizzati insieme a quest'ultima, e i dati relativi ai loro effetti vanno perduti.
Se il laboratorio che esegue l'analisi è dotato di strumenti per l'ultracentrifugazione o l'ultrafiltrazione, l'adsorbimento/desorbimento di una sostanza nel terreno può essere studiato più a fondo, per approfondire la maniera in cui la sostanza sotto esame viene adsorbita dai colloidi. In questo caso, per separare le tre fasi (terreno, colloidi, soluzione) si dovrebbe procedere a un'ultracentrifugazione a 60 000 rpm o un'ultrafiltrazione su filtri con pori da 100 000 dalton. La sostanza sotto esame va ricercata in tutte e tre le fasi, perciò il protocollo di sperimentazione dovrebbe essere modificato di conseguenza.
|
Fig. 1a
Fig. 1b

APPENDICE 5
CALCOLO DELL'ADSORBIMENTO A ( %) E DEL DESORBIMENTO D ( %)
Lo schema cronologico del procedimento è il seguente:

Per tutti i calcoli si parte dal presupposto che la sostanza sotto esame sia stabile e non rimanga significativamente adsorbita sulle pareti del recipiente.
ADSORBIMENTO A (A %)
a) Metodo in parallelo
La percentuale di adsorbimento è calcolata per ciascuna provetta (i) a ciascun attimo (ti), secondo l'equazione:
I termini di quest'equazione possono essere calcolati come segue:
|
m0 = C0 · V0 (μg)
|
(2)
|
|
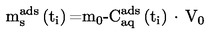
(μg) |
(3)
|
dove:
|

|
=
|
percentuale di adsorbimento ( %) all'attimo ti
|
|

|
=
|
massa della sostanza sotto esame sul terreno all'attimo ti in cui viene eseguita l'analisi (μg)
|
|
m0
|
=
|
massa della sostanza sotto esame nella provetta, all'inizio della prova (μg)
|
|
C0
|
=
|
concentrazione di massa iniziale della soluzione sotto esame a contatto col terreno (μg cm-3)
|
|

|
=
|
concentrazione di massa della sostanza nella fase acquosa all'attimo ti in cui l'analisi viene effettuata (μg cm-3); questa concentrazione viene determinata analiticamente tenendo conto dei valori forniti dai «bianchi»
|
|
V0
|
=
|
volume iniziale della soluzione di prova a contatto col terreno (cm3).
|
I valori della percentuale di adsorbimento  o
o  vengono riportati graficamente in funzione del tempo, e si determina il tempo dopo il quale viene raggiunto l'equilibrio di sorbimento. Esempi di questi grafici sono riportati rispettivamente nella fig. 1 e fig. 2.
vengono riportati graficamente in funzione del tempo, e si determina il tempo dopo il quale viene raggiunto l'equilibrio di sorbimento. Esempi di questi grafici sono riportati rispettivamente nella fig. 1 e fig. 2.


b) Metodo in serie
Nelle equazioni che seguono si è tenuto conto del fatto che la procedura di adsorbimento viene eseguito attraverso misure della sostanza sotto esame su piccole aliquote della fase acquosa, eseguite a specifici intervalli di tempo.
|
—
|
Durante ciascun intervallo di tempo, la quantità di sostanza adsorbita dal terreno si calcola come segue:
|
—
|
per il primo intervallo di tempo Δt1 = t1 - t0
|
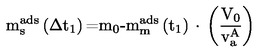
|
(4)
|
|
|
—
|
per il secondo intervallo di tempo Δt2 = t2 - t1
|

|
(5)
|
|
|
—
|
per il terzo intervallo di tempo Δt3 = t3 - t2
|

|
(6)
|
|
|
—
|
per l'ennesimo intervallo di tempo Δtn = tn- tn - 1
|

|
(7)
|
|
|
|
—
|
La percentuale di adsorbimento ad ogni intervallo di tempo 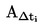 , si calcola con l'equazione seguente: , si calcola con l'equazione seguente:
mentre la percentuale di adsorbimento  a un dato attimo ti si ricava con l'equazione: a un dato attimo ti si ricava con l'equazione:
Si riportano graficamente i valori dell'adsorbimento  o o  (secondo le necessità dello studio) in funzione del tempo, e si determina il tempo dopo il quale si raggiunge l'equilibrio di sorbimento. (secondo le necessità dello studio) in funzione del tempo, e si determina il tempo dopo il quale si raggiunge l'equilibrio di sorbimento.
|
|
—
|
Al tempo di equilibrio teq:
|
—
|
la massa della sostanza sotto esame adsorbita sul terreno è:
|
|
—
|
la massa della sostanza sotto esame nella soluzione è:
|
|
—
|
la percentuale di adsorbimento all'equilibrio è:
|
|
I parametri sopra impiegati sono definiti come segue:
|
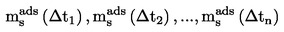
|
=
|
massa di sostanza adsorbita sul terreno, rispettivamente durante gli intervalli di tempo Δt1, Δt2,..., Δtn (μg);
|
|
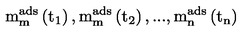
|
=
|
massa della sostanza misurata in un'aliquota  rispettivamente agli attimi t1, t2,,..., tn (μg); rispettivamente agli attimi t1, t2,,..., tn (μg);
|
|
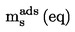
|
=
|
massa della sostanza adsorbita sul terreno all'equilibrio di adsorbimento (μg);
|
|
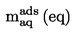
|
=
|
massa della sostanza nella soluzione all'equilibrio di adsorbimento (μg);
|
|

|
=
|
volume dell'aliquota nella quale viene misurata la sostanza in esame (cm3);
|
|
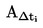
|
=
|
percentuale di adsorbimento corrispondente all'intervallo di tempo Δt1 (%);
|
|

|
=
|
percentuale di adsorbimento all'equilibrio (%).
|
DESORBIMENTO D(%)
Quale tempo iniziale t0 dell'esperimento di cinetica del desorbimento si considera il momento in cui il massimo volume recuperato della soluzione della sostanza sotto esame (dopo che è stato raggiunto l'equilibrio di adsorbimento) è sostituito da un uguale volume di soluzione di CaCl2 M.
a) Metodo in parallelo
All'attimo ti, si misura la massa della sostanza sotto esame nella fase acquosa prelevata dalla provetta i  e si calcola la massa desorbita con l'equazione:
e si calcola la massa desorbita con l'equazione:
|

|
(13)
|
All'equilibrio di desorbimento è ti = teq, e pertanto è  =
=  .
.
La massa della sostanza sotto esame desorbita durante l'intervallo di tempo (Δti) è data dall'equazione:
|

|
(14)
|
La percentuale di desorbimento si calcola:
all'attimo ti, con l'equazione:
|
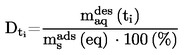
|
(15)
|
durante l'intervallo di tempo (Δt1) con l'equazione:
|

|
(16)
|
dove:
|

|
=
|
percentuale di desorbimento all'attimo ti (%)
|
|
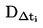
|
=
|
percentuale di desorbimento corrispondente all'intervallo di tempo Δt1 (%)
|
|

|
=
|
massa della sostanza sotto esame desorbita all'attimo t1, (μg)
|
|
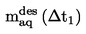
|
=
|
massa della sostanza sotto esame desorbita durante l'intervallo di tempo Δti (μg)
|
|

|
=
|
massa della sostanza sotto esame misurata analiticamente all'attimo t1 nel volume 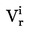 ,di soluzione prelevata per l'analisi (μg) ,di soluzione prelevata per l'analisi (μg)
|
|

|
=
|
massa della sostanza sotto esame rimasta all'equilibrio di adsorbimento per effetto dell'incompleta sostituzione del volume (μg)
|
|

|
(17)
|
|

|
=
|
massa della sostanza sotto esame nella soluzione all'equilibrio ed adsorbimento (μg)
|
|
VR
|
=
|
volume del surnatante eliminato dal tubo dopo che è stato raggiunto l'equilibrio di adsorbimento in sostituzione dello stesso volume di soluzione 0,01 M CaCl2 soluzione (cm3)
|
|
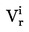
|
=
|
volume della soluzione prelevata dalla provetta (i) per la misura della sostanza sotto esame, nell'esperimento di cinetica di desorbimento (cm3).
|
Si riportano graficamente i valori del desorbimento  o
o  (secondo le necessità dello studio) in funzione del tempo, e si determina il tempo dopo il quale si raggiunge l'equilibrio di desorbimento.
(secondo le necessità dello studio) in funzione del tempo, e si determina il tempo dopo il quale si raggiunge l'equilibrio di desorbimento.
b) Metodo in serie
Le seguenti equazioni tengono conto del fatto che il precedente processo di adsorbimento era stato effettuato misurando la sostanza sotto esame in piccole aliquote  della fase acquosa (cfr. punto 14.9., «1.9. Esecuzione dell'esperimento», metodo in serie). Si ammette quanto segue: a) il volume del surnatante allontanato dal tubo dopo l'esperimento sulla cinetica di adsorbimento è sostituito dallo stesso volume (VR) di soluzione 0,01 M di CaCl2; b) il volume totale di fase acquosa a contatto col terreno (VT) durante l'esperimento di cinetica di desorbimento rimane costante ed è espresso dall'equazione:
della fase acquosa (cfr. punto 14.9., «1.9. Esecuzione dell'esperimento», metodo in serie). Si ammette quanto segue: a) il volume del surnatante allontanato dal tubo dopo l'esperimento sulla cinetica di adsorbimento è sostituito dallo stesso volume (VR) di soluzione 0,01 M di CaCl2; b) il volume totale di fase acquosa a contatto col terreno (VT) durante l'esperimento di cinetica di desorbimento rimane costante ed è espresso dall'equazione:
|
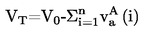
|
(18)
|
All'attimo ti:
|
—
|
si misura la massa della sostanza sotto esame in una piccola aliquota  e si calcola la massa desorbita con l'equazione: e si calcola la massa desorbita con l'equazione:
|
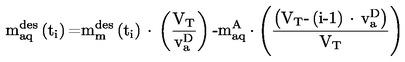
|
(19)
|
|
|
—
|
all'equilibrio di desorbimento è ti = teq e pertanto è  = =  . .
|
|
—
|
si calcola la percentuale di desorbimento  con la seguente equazione: con la seguente equazione:
|

|
(20)
|
|
Per l'intervallo di tempo (Δti):
la quantità di sostanza desorbita durante ciascun intervallo di tempo si calcola come segue:
|
—
|
per il primo intervallo di tempo, Δt1 = t1 - t0
|

and
|
(21)
|
|
|
—
|
per il secondo intervallo di tempo Δt2 = t2 - t1
|
 and and

|
(22)
|
|
|
—
|
per l'ennesimo intervallo di tempo, Δtn = tn - tn-1
|
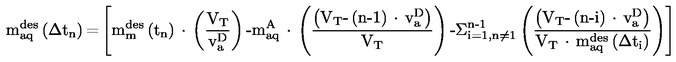 and and
|
(23)
|
|
In conclusione, la percentuale  , di desorbimento per ciascun intervallo di tempo si calcola con l'equazione
, di desorbimento per ciascun intervallo di tempo si calcola con l'equazione
|
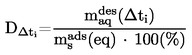
|
(24)
|
dove la percentuale di desorbimento 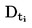 all'attimo ti è data dall'equazione:
all'attimo ti è data dall'equazione:
|
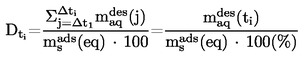
|
(25)
|
dove i parametri sopra impiegati sono definiti come segue:
|
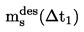
,

,... ,

|
=
|
massa della sostanza che rimane rispettivamente adsorbita sul terreno dopo gli intervalli di tempo Δt1, Δt2,..., Δtn (μg)
|
|

,

,... ,

|
=
|
massa della sostanza di prova rispettivamente desorbita durante gli intervalli di tempo Δt1, Δt2,..., Δtn (μg)
|
|
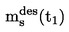
,
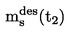
,... ,

|
=
|
massa della sostanza rispettivamente misurata in un'aliquota ai momenti  t1,t2,..., tn(μg) t1,t2,..., tn(μg)
|
|
VT
|
=
|
volume totale della fase acquosa a contatto col terreno durante l'esperimento di cinetica di desorbimento effettuato col metodo in serie (cm3);
|
|

|
=
|
massa della sostanza sotto esame rimasta dopo l'equilibrio di adsorbimento per effetto della sostituzione incompleta del volume, (μg)
|
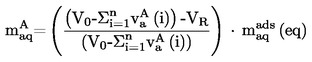
|
(26)
|
|
|
VR
|
=
|
volume del surnatante allontanato dalla provetta dopo il raggiungimento dell'equilibrio di adsorbimento e sostituita dallo stesso volume di soluzione 0,01 M di CaCl2 (cm3);
|
|

|
=
|
volume dell'aliquota prelevata a fini analitici dalla provetta i), durante l'esperimento di cinetica di desorbimento effettuato col metodo in serie (cm3)
|

|
(27)
|
|
APPENDICE 6
ADSORBIMENTO-DESORBIMENTO NEI SUOLI: FORMULARI DI PRESENTAZIONE DEI RISULTATI
Sostanza esaminata:
Suolo esaminato:
Contenuto in sostanza secca del suolo (105 oC, 12 h): … %
Temperatura: … oC
Idoneità del metodo analitico
|
Suolo pesato
|
g
|
|
|
Suolo: massa secca
|
g
|
|
|
Volume di soluzione CaC12
|
cm3
|
|
|
Concentrazione nominale soluzione finale
|
μg cm-3
|
|
|
Concentrazione analitica soluzione finale
|
μg cm-3
|
|
Principio del metodo analitico impiegato:
Taratura del metodo analitico:
Sostanza esaminata:
Suolo esaminato:
Contenuto in sostanza secca del suolo (105 oC, 12 h): … %
Temperatura: … oC
|
Metodologia analitica seguita:
|
Indiretta
|
|
In parallelo
|
|
In serie
|
|
|
|
Diretta
|
|
|
|
|
|
Prova di adsorbimento: campioni esaminati
|
|
Simbolo
|
Unità
|
Tempo di equilibrazione
|
Tempo di equilibrazione
|
Tempo di equilibrazione
|
Tempo di equilibrazione
|
|
N. della provetta
|
|
|
|
|
|
|
|
|
|
|
|
Suolo pesato
|
—
|
g
|
|
|
|
|
|
|
|
|
|
Suolo: massa secca
|
msoil
|
g
|
|
|
|
|
|
|
|
|
|
Volume d'acqua nel suolo pesato (calcolato)
|
VWS
|
cm3
|
|
|
|
|
|
|
|
|
|
Volume di soluzione 0,01 M CaCl2 per equilibrare il suolo
|
|
cm3
|
|
|
|
|
|
|
|
|
|
Volume della soluzione di riserva
|
|
cm3
|
|
|
|
|
|
|
|
|
|
Volume totale della fase acquosa a contatto col suolo
|
V0
|
cm3
|
|
|
|
|
|
|
|
|
|
Concentrazione iniziale della soluzione di prova
|
C0
|
μg cm-3
|
|
|
|
|
|
|
|
|
|
Massa della sostanza in esame all'inizio della prova
|
m
0
|
μg
|
|
|
|
|
|
|
|
|
|
Dopo agitazione e centrifugazione
|
|
METODO INDIRETTO
|
|
Metodo parallelo
|
|
Concentrazione sostanza in esame fase acquosa (compresa correzione del bianco)
|

|
μg cm-3
|
|
|
|
|
|
|
|
|
|
Metodo in serie
|
|
Massa di sostanza in esame misurata nell'aliquota Va
A
|

|
μg
|
|
|
|
|
|
|
|
|
|
METODO DIRETTO
|
|
Massa della sostanza in esame adsorbita nel suolo
|

|
μg
|
|
|
|
|
|
|
|
|
|
Concentrazione dell'adsorbimento
|
|
Adsorbimento
|
|
%
|
|
|
|
|
|
|
|
|
|
|

|
%
|
|
|
|
|
|
|
|
|
|
Media
|
|
|
|
|
|
|
|
Coefficiente di adsorbimento
|
Kd
|
cm3 g-1
|
|
|
|
|
|
|
|
|
|
Media
|
|
|
|
|
|
|
|
Adsorbimento
|
Koc
|
cm3 g-1
|
|
|
|
|
|
|
|
|
|
Media
|
|
|
|
|
|
|
Sostanza esaminata:
Suolo esaminato:
Contenuto in sostanza secca del suolo (105 oC, 12 h): … %
Temperatura: … oC
Prova di adsorbimento: bianchi e controllo
|
|
Simbolo
|
Unità
|
Bianco
|
Bianco
|
Controllo
|
|
Provetta N.
|
|
|
|
|
|
|
|
|
|
Suoli pesati
|
|
g
|
|
|
|
|
0
|
0
|
|
Quantità d'acqua nel suolo pesato (calcolata)
|
|
cm3
|
|
|
|
|
—
|
—
|
|
Volume di soluzione 0,01 M CaCl2 aggiunta
|
|
cm3
|
|
|
|
|
|
|
|
Volume della soluzione di riserva della sostanza in esame aggiunta
|
|
cm3
|
0
|
0
|
|
|
|
|
|
Volume totale della fase acquosa (calcolata)
|
|
cm3
|
|
|
|
|
—
|
—
|
|
Concentrazione iniziale della sostanza in esame della fase acquosa
|
|
μg cm-3
|
|
|
|
|
|
|
|
Dopo agitazione e centrifugazione
|
|
Concentrazione nella fase acquosa
|
|
μg cm-3
|
|
|
|
|
|
|
Osservazione: aggiungere colonne se necessario.
Sostanza esaminata:
Suolo esaminato:
Contenuto in sostanza secca del suolo (105 oC, 12 h): … %
Temperatura: oC
Bilancio di massa
|
|
Simbolo
|
Unità
|
|
|
|
|
|
Provetta n.
|
|
|
|
|
|
|
|
Suolo pesato
|
—
|
g
|
|
|
|
|
|
Suolo: massa secca
|
msoil
|
g
|
|
|
|
|
|
Volume d'acqua nel suolo pesato (calcolato)
|
VWS
|
ml
|
|
|
|
|
|
Volume di soluzione 0,01 M CaCl2 per equilibrare il suolo
|
|
ml
|
|
|
|
|
|
Volume della soluzione di riserva
|
|
cm3
|
|
|
|
|
|
Volume totale della fase acquosa a contatto col suolo
|
V0
|
cm3
|
|
|
|
|
|
Concentrazione iniziale della soluzione in esame
|
C0
|
μg cm-3
|
|
|
|
|
|
Tempo di equilibrazione
|
—
|
h
|
|
|
|
|
|
Dopo agitazione e centrifugazione
|
|
Concentrazione della sostanza in esame. Fase acquosa all'equilibrio di adsorbimento, compresa la correzione per il bianco
|
|
μg cm-3
|
|
|
|
|
|
Tempo di equilibrazione
|
teq
|
h
|
|
|
|
|
|
la diluizione con solvente
|
|
Volume eliminato di fase acquosa
|
Vrec
|
cm3
|
|
|
|
|
|
Volume aggiunto di solvente
|
ΔV
|
cm3
|
|
|
|
|
|
la estrazione col solvente
|
|
Segnale analizzato nel solvente
|
SE1
|
var.
|
|
|
|
|
|
Concentrazione della sostanza in esame nel solvente
|
CE1
|
μg cm-3
|
|
|
|
|
|
Massa della sostanza estratta dal suolo e dalle pareti del recipiente
|
mE1
|
μg
|
|
|
|
|
|
2a diluizione col solvente
|
|
Volume di solvente eliminato
|
ΔVs
|
cm3
|
|
|
|
|
|
Volume di solvente aggiunto
|
ΔV’
|
cm3
|
|
|
|
|
|
2a estrazione col solvente
|
|
Segnale analizzato nella fase solvente
|
SE2
|
var.
|
|
|
|
|
|
Concentrazione della sostanza in esame nel solvente
|
CE2
|
μg cm-3
|
|
|
|
|
|
Massa della sostanza estratta dal suolo e dalle pareti del recipiente
|
mE2
|
μg
|
|
|
|
|
|
Massa totale della sostanza in esame estratta in due fasi
|
mE
|
μg
|
|
|
|
|
|
Bilancio di massa
|
MB
|
%
|
|
|
|
|
Sostanza esaminata:
Suolo esaminato:
Contenuto in sostanza secca del suolo (105 oC, 12 h): … %
Temperatura: …oC
Isoterme di adsorbimento
|
|
Simbolo
|
Unità
|
|
|
|
|
|
|
|
|
|
Provetta n.
|
|
|
|
|
|
|
|
|
|
|
|
Suolo pesato
|
—
|
g
|
|
|
|
|
|
|
|
|
|
Suolo: massa secca
|
E
|
g
|
|
|
|
|
|
|
|
|
|
Volume dell'acqua nel suolo pesato (calcolato)
|
VWS
|
cm3
|
|
|
|
|
|
|
|
|
|
Volume di soluzione di 0,01 CaCl2 M necessaria per equilibrare il suolo
|
|
cm3
|
|
|
|
|
|
|
|
|
|
Volume di soluzione di riserva aggiunto
|
|
cm3
|
|
|
|
|
|
|
|
|
|
Volume totale di fase acquosa a contatto col suolo (calcolato)
|
V0
|
cm3
|
|
|
|
|
|
|
|
|
|
Soluzione della concentrazione
|
C0
|
μg cm-3
|
|
|
|
|
|
|
|
|
|
Tempo di equilibrio
|
—
|
h
|
|
|
|
|
|
|
|
|
|
Dopo agitazione e centrifugazione
|
|
Concentrazione della sostanza nella fase acquosa, compresa la correzione per il bianco
|

|
μg cm-3
|
|
|
|
|
|
|
|
|
|
Temperatura
|
|
oC
|
|
|
|
|
|
|
|
|
|
Massa adsorbita per unità di suolo
|

|
μg g-1
|
|
|
|
|
|
|
|
|
Analisi di regressione:
valore di KF
ads:
valore di 1/n:
coefficiente di regressione r2:
Sostanza esaminata:
Suolo esaminato:
Contenuto in sostanza secca del suolo (105 oC, 12 h): … %
Temperatura: … oC
|
Metodologia analitica seguita:
|
Indiretta
|
|
Parallel
|
|
In serie
|
|
Prova di desorbimento
|
|
Simbolo
|
Unità
|
Intervallo di tempo
|
Intervallo di tempo
|
Intervallo di tempo
|
Intervallo di tempo
|
|
N. della provetta proveniente dallo stadio di adsorbimento
|
|
|
|
|
|
|
|
Massa della sostanza adsorbita sul suolo all'equilibrio di adsorbimento
|

|
μg
|
|
|
|
|
|
Volume di fase acquosa eliminato e sostituito da 0,01 M CaCl2
|
VR
|
cm3
|
|
|
|
|
|
Volume totale di fase acquosa a contatto col suolo
|
PM
|
V0
|
cm3
|
|
|
|
|
|
SM
|
vT
|
cm3
|
|
|
|
|
|
Massa della sostanza in esame rimasta dopo l'equilibrio di adsorbimento per effetto della sostituzione incompleta del volume
|

|
μg
|
|
|
|
|
|
Cinetica di desorbimento
|
|
Massa misurata di sostanza desorbita dal suolo al momento ti
|

|
μg
|
|
|
|
|
|
Volume della soluzione prelevata dalla provetta (i) per la misura della sostanza in esame
|
PM
|
Vf
i
|
cm3
|
|
|
|
|
|
SM
|
Va
D
|
cm3
|
|
|
|
|
|
Massa della sostanza desorbita dal suolo al momento ti (calcolata)
|

|
μg
|
|
|
|
|
|
Massa della sostanza desorbita dal suolo durante l'intervallo di tempo Δti (calcolata)
|
|
μg
|
|
|
|
|
|
Percentuale di desorbimento
|
|
Desorbimento al tempo ti
|
Dti
|
%
|
|
|
|
|
|
Desorbimento nell'intervallo di tempo di Δti
|

|
%
|
|
|
|
|
|
Coefficiente di desorbimento apparente
|
Kdes
|
|
|
|
|
|
PM: Metodo in parallelo.
SM: Metodo in serie.
C.19. STIMA DEL COEFFICIENTE DI ADSORBIMENTO (kOC) SUL TERRENO E SUI FANGHI DI ACQUE DA SCARICO MEDIANTE CROMATOGRAFIA LIQUIDA AD ALTA PRESTAZIONE (HPLC)
1. METODO
Il metodo qui descritto corrisponde al TG121 (2001) dell'OCSE.
1.1 INTRODUZIONE
Le caratteristiche di adsorbimento delle sostanze presenti nei terreni o nei fanghi di acque da scarico possono essere descritte con parametri determinati per via sperimentale tramite il metodo di prova C.18. Un parametro importante è il coefficiente di adsorbimento, definito come il rapporto tra la concentrazione di una sostanza nel suolo/fango e la concentrazione della sostanza stessa nella fase acquosa all'equilibrio di adsorbimento. Il coefficiente di adsorbimento Koc normalizzato al contenuto di carbonio organico del terreno è un buon indicatore della capacità a formare legami di una sostanza chimica alla componente organica del suolo e dei fanghi di acque da scarico e permette di fare confronti tra diverse sostanze chimiche. Questo parametro può essere stimato mediante correlazioni con la solubilità in acqua e con il coefficiente di ripartizione ottanolo-acqua (1) (2) (3) (4) (5) (6) (7).
Il metodo sperimentale descritto in questo test consente di stimare il coefficiente di adsorbimento Koc nel suolo e nei fanghi di acque da scarico mediante cromatografia liquida ad alta prestazione (HPLC) (8). L'affidabilità dei valori stimati con questo metodo è superiore a quella ottenuta tramite QSAR. (relazione quantitativa struttura-attività) (9). Trattandosi di un metodo di stima, non può sostituire completamente gli esperimenti di equilihrio in batch usati nel metodo di prova 18. Tuttavia, stimare il valore Koc può essere utile nella scelta dei parametri più appropriati per gli studi di adsorbimento-desorbimento secondo il metodo di prova C.18 e a tal fine si calcola il valore Kd (coefficiente di distribuzione) o Kf (coefficiente di adsorbimento di Freundlich) in base all'equazione 3 (cfr. punto 1.2).
1.2. DEFINIZIONI
K
d
: si definisce coefficiente di distribuzione il rapporto tra le concentrazioni all'equilibrio C di una sostanza in esame disciolta in un sistema a due fasi composto da un mezzo adsorbente (terreno o fanghi di acque da scarico) e una fase acquosa; è un valore adimensionale quando le concentrazioni in entrambe le fasi sono espresse in termini di peso/peso. Se la concentrazione nella fase acquosa è indicata in termini di peso/volume, il valore sarà espresso in unità ml g-1. Il valore di Kd può variare in base alle proprietà di adsorbimento e col variare della concentrazione.
|

|
(1)
|
dove:
|
Csuolo
|
=
|
concentrazione della sostanza in esame nel terreno all'equilibrio (μg· g-1)
|
|
Cfango
|
=
|
concentrazione della sostanza in esame nel fango all'equilibrio (μg· g-1)
|
|
Caq
|
=
|
concentrazione della sostanza in esame nella fase acquosa all'equilibrio (μg· g-1, μg· ml-1),
|
Kf
: il coefficiente di adsorbimento di Freundlich è definito come la concentrazione della sostanza in esame nel suolo o nei fanghi di acque da scarico (x/m) quando la concentrazione all'equilibrio nella fase acquosa Caq è uguale a uno; le unità si riferiscono a μg· g-1 di sostanza adsorbente. Il valore può variare in base alle proprietà adsorbenti.
|
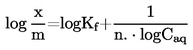
|
(2)
|
dove:
|
x/m
|
=
|
quantità (in μg) di sostanza in esame x adsorbita a contatto con una quantità (in g) di sostanza adsorbente m all'equilibrio
|
|
l/n
|
=
|
pendenza dell'isoterma di adsorbimento di Freundlich
|
|
Caq
|
=
|
concentrazione della sostanza in esame nella fase acquosa all'equilibrio (μg · ml-1)
|
At
Koc
: il coefficiente di distribuzione (Kd) o il coefficiente di adsorbimento di Freundlich (Kf) normalizzati al contenuto di carbonio organico (foc) della sostanza adsorbente; specialmente per le sostanze chimiche non ionizzate fornisce un'indicazione approssimativa dell'entità di adsorbimento tra una sostanza e il mezzo adsorbente e consente di effettuare confronti tra diverse sostanze chimiche. A seconda delle dimensioni di Kd e Kf, Koc può essere un valore adimensionale o essere espresso in μg· g-1 di sostanza organica.
|
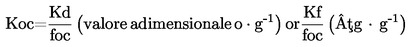
|
(3)
|
La relazione tra Koc e Kd non è sempre lineare, pertanto i valori di Koc possono variare da terreno a terreno, anche se la loro variabilità è notevolmente minore rispetto i valori di Kd o di Kf.
Il coefficiente di adsorbimento (Koc) viene ricavato dal fattore di capacità (k') usando un diagramma di taratura log k'/log Koc dei composti di riferimento selezionati.
|
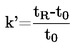
|
(4)
|
dove:
|
tR
|
=
|
tempo di ritenzione in HPLC del test e della sostanza di riferimento (minuti)
|
|
t0
|
=
|
tempo morto in HPLC (minuti) (cfr. punto 1.8.2).
|
Pow: il coefficiente di ripartizione ottanolo-acqua è definito come il rapporto tra le concentrazioni di una sostanza disciolta in n-ottanolo e quella disciolta in acqua; si tratta di una valore adimensionale
|

|
(5)
|
1.3. SOSTANZE DI RIFERIMENTO
Prima di applicare il metodo è opportuno conoscere la formula di struttura, la purezza e la costante di dissociazione (se la sostanza è ionizzabile). Sono utili anche informazioni sulla solubilità in acqua e in solventi organici, sul coefficiente di ripartizione ottanolo-acqua e sulle caratteristiche di idrolisi.
Per stabilire una correlazione tra i tempi di ritenzione in HPLC che riguardano la sostanza in esame con il suo coefficiente di adsorbimento Koc occorre costruire un grafico di taratura log Koc/log k' che comprenda almeno sei punti di riferimento, di cui almeno uno al di sopra e uno al di sotto del valore previsto per la sostanza in esame. L'accuratezza del metodo può essere migliorata in modo significativo utilizzando sostanze di riferimento che presentino affinità strutturali con la sostanza in esame. Se tali dati non sono disponibili, la selezione delle sostanze di taratura è affidata al giudizio dell'operatore. In tal caso è consigliabile scegliere una serie più generale di sostanze strutturalmente eterogenee. Le sostanze e i valori di Koc che possono essere utilizzati per i fanghi di acque da scarico e per il terreno sono elencati, rispettivamente, nella tabella 1 e nella tabella 3 dell'appendice. La scelta di altre sostanze di riferimento va motivata.
1.4. PRINCIPIO DEL METODO UTILIZZATO
L'HPLC viene eseguita con colonne analitiche impaccate con una fase solida commerciale di cianopropile contenente gruppi lipofili e polari. Si utilizza inoltre una fase stazionaria moderatamente polare su una matrice di silice:
|
— O— Si
|
— CH2 — CH2 — CH2
|
— CN
|
|
silice
|
spaziatore non polare
|
gruppo polare
|
Il principio del metodo è analogo al metodo di prova A.8 (coefficiente di ripartizione, metodo per HPLC). Durante il passaggio nella colonna insieme alla fase mobile la sostanza in esame interagisce con la fase stazionaria. La ripartizione tra la fase mobile e la fase stazionaria provoca un rallentamento della sostanza in esame. La doppia composizione della fase stazionaria, che ha gruppi polari e non polari, consente l'interazione tra i gruppi polari e non polari di una molecola in maniera analoga a quanto avviene per le sostanze organiche nelle matrici di terreno o di fango. Ciò permette di stabilire una relazione tra il tempo di ritenzione in colonna ed il coefficiente di adsorbimento sulla sostanza organica.
Il pH influenza in maniera significativa le caratteristiche di adsorbimento, specie per le sostanze polari. Nei terreni agricoli o nei collettori degli impianti di trattamento dei fanghi di acque da scarico il pH varia normalmente tra 5,5 e 7,5. Per le sostanze ionizzabili, nei casi in cui almeno il 10 % del composto in esame verrà dissociato nel range di pH compreso tra 5,5 e 7,5, occorre eseguire due test, uno sulla forma ionizzata e l'altro sulla forma non ionizzata, utilizzando soluzioni tampone adeguate.
Poiché la relazione tra il tempo di ritenzione nella colonna per HPLC e il coefficiente di adsorbimento è il solo criterio impiegato per la stima, non è necessario ricorrere a metodi analitici quantitativi, ma basta solo la determinazione del tempo di ritenzione. Avendo a disposizione un gruppo adeguato di sostanze di riferimento e potendo applicare condizioni sperimentali standard, il metodo offre una tecnica rapida ed efficiente per stimare il coefficiente di adsorbimento Koc.
1.5. APPLICABILITÀ DEL TEST
Il metodo per HPLC è applicabile a sostanze chimiche (marcate o non marcate) per cui è disponibile un sistema di rilevazione adeguato (ad esempio spettrofotometro o rilevatore di radioattività) e che siano sufficientemente stabili per tutta la durata dell'esperimento. Può rivelarsi particolarmente utile per sostanze chimiche difficili da studiare con altri sistemi sperimentali (ad esempio sostanze volatili, sostanze non solubili in acqua ad una concentrazione analiticamente misurabile, sostanze con elevata affinità verso la superficie dei sistemi di incubazione). Il metodo è applicabile a miscele che danno bande di eluizione non risolte. In tal caso è opportuno determinare il limite superiore e inferiore del valore log Koc dei composti della miscela di prova.
Le impurezze possono talvolta interferire con l'interpretazione dei risultati HPLC, ma ciò non ha rilievo particolare purché la sostanza in esame possa essere chiaramente identificata e separata dalle impurezze.
Il metodo è convalidato per le sostanze elencate nella tabella 1 dell'appendice ed è stato anche applicato ad una serie di sostanze delle seguenti classi chimiche:
|
—
|
ammine aromatiche (ad esempio trifluralin, 4-cloroanilina, 3,5-dinitroanilina, 4-metilanilina, N-metilanilina, 1-naftilammina),
|
|
—
|
esteri degli acidi carbossilici aromatici (ad esempio estere metilico dell'acido benzoico, estere etilico dell'acido 3,5-dinitrobenzoico),
|
|
—
|
idrocarburi aromatici (ad esempio toluene, xilene, etilbenzene, nitrobenzene),
|
|
—
|
esteri dell'acido arilossifenossipropionico (ad esempi diclofop-metile, fenoxaprop-etile, fenoxaprop-P-etile),
|
|
—
|
fungicidi a base di benzimidazolo e imidazolo (ad esempio carbendazim, fuberidazole, triazoxide),
|
|
—
|
ammidi degli acidi carbossilici (ad esempio 2-clorobenzammide, N,N-dimetilbenzammide, 3,5-dinitrobenzammide, N-metilbenzammide, 2-nitrobenzammide, 3-nitrobenzammide),
|
|
—
|
idrocarburi clorurati (ad esempio endosulfan, DDT, esaclorobenzene, quintozene, 1,2,3-triclorobenzene),
|
|
—
|
insetticidi organofosforati (ad esempio azinfos-metile, disulfoton. fenamifos. isofenfos. pirazofos, sulprofos, triazofos).
|
|
—
|
fenoli (ad esempio fenolo. 2-nitrofenolo, 4-nitrofenolo, pentaclorofenolo. 2,4,6-triclorofenolo, I-naftolo),
|
|
—
|
derivati della fenilurea (ad esempio isoproturon, monolinuron, pencicuron).
|
|
—
|
coloranti di pigmentazione (ad esempio Giallo Acido 219, Blu Basico 41. Rosso Diretto 81),
|
|
—
|
idrocarburi poliaromatici (ad esempio acenaftene, naftalene),
|
|
—
|
erbicidi a base di 1,3,5-triazina (ad esempio prometryn, propazina, simazina, terbutrin),
|
|
—
|
derivati del triazolo (ad esempio tebuconazolo, triadimefon, tradimenol, triapenthenol).
|
Il metodo non è applicabile a sostanze che reagiscono con l'eluente o con la fase stazionaria, né a sostanze che interagiscono in maniera specifica con i componenti inorganici (ad esempio formazione di cluster complessi con i minerali delle argille). Il metodo potrebbe non funzionare per le sostanze tensioattive, i composti inorganici e le basi e gli acidi organici moderati e forti. Sono determinabili i valori di log Koc compresi tra 1,5 e5,0. Le sostanze ionizzabili devono essere testate usando una fase mobile tamponata, ma occorre procedere con la massima cura per evitare la precipitazione di componenti del tampone o della sostanza in esame.
1.6. CRITERI QUALITATIVI
1.6.1. Accuratezza
Normalmente la stima del coefficiente di adsorbimento può raggiungere una precisione di ±0,5 unità logaritmiche del valore determinato con il metodo di equilibrio in batch (cfr. la tabella 1 nell'appendice). Si può ottenere una maggior accuratezza utilizzando come riferimento sostanze strutturalmente analoghe alla sostanza in esame.
1.6.2. Ripetibilità
Le determinazioni devono essere eseguite almeno due volte. I valori di log Koc ricavati dalle singole misurazioni dovrebbero essere compresi entro un range di 0,25 unità logaritmiche.
1.6.3. Riproducibilità
L'esperienza finora acquisita nell'applicazione del metodo ne conferma la validità. Da uno studio di validazione del metodo per HPLC usando 48 sostanze (in prevalenza pesticidi), per le quali erano disponibili dati affidabili relativi al Koc sul terreno, è risultato un coefficiente di correlazione di R = 0,95 (10) (11).
Per migliorare e validare il metodo è stato effettuato un test a cui hanno partecipato 11 laboratori (12). I risultati sono riportati nella tabella 2 dell'appendice.
1.7. DESCRIZIONE DEL METODO UTILIZZATO
1.7.1. Stima preliminare del coefficiente di adsorbimento
Il coefficiente di ripartizione ottanolo-acqua Pow (= Kow) e, entro certi limiti, la solubilità in acqua, possono servire da indicatori dell'entità dell'adsorbimento, soprattutto per le sostanze non ionizzate, e quindi essere utilizzati per l'identificazione preliminare del range. Sono state pubblicate una serie di utili correlazioni per diversi gruppi di sostanze chimiche (1) (2) (3) (4) (5) (6) (7).
1.7.2. Apparecchiatura
E richiesto un apparecchio per cromatografia liquida dotato di pompa pulse-free e di un sistema di rilevazione adeguato. Si raccomanda l'utilizzo di una valvola di iniezione con loop. Occorre utilizzare resine legate a cianopropile, comunemente disponibili in commercio, su una base di silice (ad esempio Hypersil e Zorbax CN). Tra il sistema di iniezione e la colonna analitica è possibile inserire una precolonna dello stesso materiale. L'efficienza di separazione della colonna può variare in modo significativo a seconda della casa produttrice. Si tenga presente che, indicativamente, la colonna deve raggiungere i seguenti fattori di capacità k': log k' > 0,0 per log Koc = 3,0 e log k' > 0,4 per log Koc = 2,0 con una fase mobile metanolo/acqua 55/45 %.
1.7.3. Fasi mobili
A seguito di test effettuati su diverse fasi mobili. si raccomandano le due seguenti:
|
—
|
metanolo/acqua (55/45 % v/v),
|
|
—
|
metanolo/soluzione tampone citrato 0,01 M a pH 6,0 (55/45 % v/v).
|
Il solvente di eluizione viene preparato con metanolo per HPLC e acqua distillata o tampone citrato. Prima dell'uso la miscela viene sottoposta a degasaggio. Si consiglia di optare per l'eluizione isocratica. Nel caso le miscele metanolo/acqua non siano adeguate, è possibile provare altre miscele di solvente organico/acqua, come miscele di etanolo/acqua o acetonitrile/acqua. Per i composti ionizzabili si raccomanda l'uso di soluzioni tampone allo scopo di stabilizzare il pH. È importante osservare tutte le precauzioni necessarie per evitare la precipitazione di sali e il deterioramento della colonna, che si possono verificare con alcune miscele di fase organica/soluzione tampone.
Non è consentito l'uso di additivi quali ad esempio i reagenti ione pair che possono modificare le proprietà di adsorbimento della fase stazionaria. Tali modifiche possono essere irreversibili. Per questo motivo è necessario che gli esperimenti che prevedono l'uso di additivi vengano condotti su colonne separate.
1.7.4. Soluti
Le sostanze in esame e di riferimento devono essere sciolte nella fase mobile.
1.8. ESECUZIONE DEL TEST
1.8.1. Condizioni
È bene registrare la temperatura durante le misurazioni. Si raccomanda in modo particolare l'uso di un comparto colonne a temperatura controllata per garantire condizioni costanti durante i cicli di esecuzione della taratura, delle corse e delle misurazioni sulla sostanza in esame.
1.8.2. Determinazione del tempo morto to
Il tempo morto to può essere determinato con due metodi diversi (cfr. anche il punto 1.2).
1.8.2.1. Determinazione del tempo morto to mediante serie omologa
È comprovato che con questa procedura i valori di to sono affidabili e standardizzati. Per maggiori dettagli, consultare il metodo di prova A.8: coefficiente di ripartizione (n-ottanolo/acqua), metodo per HPLC.
1.8.2.2. Determinazione del tempo morto to mediante sostanze inerti non trattenute dalla colonna
Questa tecnica si basa sull'iniezione di formammide, urea o nitrato di sodio. Le misurazioni devono essere eseguite almeno due volte.
1.8.3. Determinazione dei tempi di ritenzione tR
Selezionare le sostanze di riferimento secondo le modalità descritte nel punto 1.3. Queste sostanze sono iniettabili sotto forma di miscela standard, purché esista una conferma che il tempo di ritenzione di ciascuno standard di riferimento non sia influenzato dalla presenza degli altri. Effettuare la taratura a intervalli regolari almeno due volte al giorno, in modo da considerare eventuali variazioni impreviste nelle prestazioni della colonna. È buona prassi eseguire le iniezioni di taratura prima e dopo le iniezioni della sostanza in esame per escludere eventuali derive dei tempi di ritenzione. Iniettare le singole sostanze in esame nella minor quantità possibile (per evitare un sovraccarico della colonna) e determinare i relativi tempi di ritenzione.
Per aumentare l'affidabilità delle misurazioni, ripetere le determinazioni almeno due volte. I valori di log Koc ricavati dalle singole misurazioni dovrebbero essere compresi entro un range di 0,25 unità logaritmiche.
1.8.4. Valutazione
I fattori di capacità k' vengono ricavati dal tempo morto to e dai tempi di ritenzione tR delle sostanze di riferimento selezionate secondo l'equazione 4 (cfr. il punto 1.2). Successivamente si costruisce un grafico log k'/log Koc ottenuti dagli esperimenti di equilibrio in batch riportati nelle tabelle 1 e 3 dell'appendice. Servendosi di questo grafico, si utilizza il valore di log k' della sostanza in esame per determinare il rispettivo valore di log Koc (interpolazione). Se i risultati mostrano che log Kuc della sostanza in esame esce dal range di taratura, occorre ripetere il test usando altre sostanze di riferimento più appropriate.
2. DATI E RELAZIONE
La relazione deve contenere le seguenti informazioni:
|
—
|
identità della sostanza in esame e delle sostanze di riferimento, relativa purezza e valori pKa. per composti ionizzabili,
|
|
—
|
descrizione della strumentazione e delle condizioni operative, ad esempio tipo e dimensioni della colonna (e precolonna) analitica, mezzi di rivelazione, fase mobile (rapporto dei componenti e pH), intervallo di temperatura durante le misurazioni,
|
|
—
|
tempo morto e relativo metodo di determinazione,
|
|
—
|
quantità delle sostanze in esame e di riferimento introdotte nella colonna,
|
|
—
|
tempi di ritenzione dei composti di riferimento usati per la taratura,
|
|
—
|
dettagli sulla retta di regressione approssimata (log k' in rapporto a log Koc) e rappresentazione grafica della retta di regressione,
|
|
—
|
dati sui tempi medi di ritenzione e valore stimato di d log Koc riferito al composto in esame,
|
3. BIBLIOGRAFIA
|
(1)
|
W.J. Lyman, W.F. Reehl. D.H. Rosenblatt (ed). (1990). Handbook of chemical property estimation methods, Chap. 4, McGraw-Hill, New York.
|
|
(2)
|
J. Hodson, N.A. Williams (1988). The estimation of the adsorption coefficient (Koc) for soils by HPLC. Chemosphere, 17, 1 67.
|
|
(3)
|
G.G. Briggs (1981). Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficients, water solubilities, bioconcentration factors, and the parachor. J. Agric. Food Chem., 29, pp. 1050-1059.
|
|
(4)
|
C.T. Chiou, P.E. Porter, D.W. Schmedding (1983). Partition equilibria of nonionic organic compounds between soil organic matter and water. Environ. Sci. Technol., 17, pp. 227-231.
|
|
(5)
|
Z. Gerstl, U. Mingelgrin (1984). Sorption of organic substances by soils and sediment. J. Environm. Sci. Health, B19, pp. 297-312.
|
|
(6)
|
C.T. Chiou, L.J. Peters, V.H. Freed (1979). A physical concept of soil water equilibria for non-ionic organic compounds, Science, 106, pp. 831-832.
|
|
(7)
|
S.W. Karickhoff (1981). Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils. Chemosphere, 10, pp. 833-846.
|
|
(8)
|
W. Kördel, D. Hennecke, M. Herrmann (1997). Application of the HPLC-screening method for the determination of the adsorption coefficient on sewage sludges. Chemosphere, 35(1/2), pp. 121-128.
|
|
(9)
|
M. Mueller, W. Kördel (1996). Comparison of screening methods for the estimation of adsorption coefficients on soil. Chemosphere, 32(12), pp. 2493-2504.
|
|
(10)
|
W. Kördel, J. Stutte, G. Kotthoff (1993). HPLC-screening method for the determination of the adsorption coefficient in soil-comparison of different stationary phases, Chemosphere, 27(12), pp. 2341-2352.
|
|
(11)
|
B. von Oepen, W. Kördel, W. Klein (1991). Sorption of nonpolar and polar compounds to soils: Processes, measurements and experience with the applicability of the modified OECD Guideline 106, Chemosphere, 22, pp. 285-304.
|
|
(12)
|
W. Kördel, G. Kotthoff, J. Müller (1995). HPLC-screening method for the determination of the adsorption coefficient on soil-results of a ring test. Chemosphere, 30(7), pp. 1373-1384.
|
APPENDICE
Tabella 1
Confronto tra i valori di Koc per i terreni e i fanghi di acque da scarico e i valori calcolati con il metodo di screening per HPLC (34)
(35)
|
Sostanza
|
N.CAS
|
Log Koc fanghi di acque da scarico
|
Log Ko HPLC
|
Δ
|
Log Koc terreni
|
Log Koc HPLC
|
Δ
|
|
Atrazina
|
1912-24-9
|
1,66
|
2,14
|
0,48
|
1,81
|
2,20
|
0,39
|
|
Linuron
|
330-55-2
|
2,43
|
2,96
|
0,53
|
2,59
|
2,89
|
0,30
|
|
Fention
|
55-38-9
|
3,75
|
3,58
|
0,17
|
3,31
|
3,40
|
0,09
|
|
Monuron
|
150-68-5
|
1,46
|
2,21
|
0,75
|
1,99
|
2,26
|
0,27
|
|
Fenantrene
|
85-01-8
|
4,35
|
3,72
|
0,63
|
4,09
|
3,52
|
0,57
|
|
Acido benzoico fenilestere
|
93-99-2
|
3,26
|
3,03
|
0,23
|
2,87
|
2,94
|
0,07
|
|
Benzammide
|
55-21-0
|
1,60
|
1,00
|
0,60
|
1,26
|
1,25
|
0,01
|
|
4-nitrobenzammide
|
619-80-7
|
1,52
|
1,49
|
0,03
|
1,93
|
1,66
|
0,27
|
|
Acetanilide
|
103-84-4
|
1,52
|
1,53
|
0,01
|
1,26
|
1,69
|
0,08
|
|
Anilina
|
62-53-3
|
1,74
|
1,47
|
0,27
|
2,07
|
1,64
|
0,43
|
|
2,5-dicloroanilina
|
95-82-9
|
2,45
|
2,59
|
0,14
|
2,55
|
2,58
|
0,03
|
Tabella 2
Risultati di un test comparativo fra laboratori (11 laboratori partecipanti) eseguito per migliorare e validare il metodo per HPLC (36)
|
Sostanza
|
N.CAS
|
Log KOc:
|
Koc
|
Log Koc
|
|
[OCSE 106]
|
[Metodo HPLC]
|
|
Atrazina
|
1912-24-9
|
1,81
|
78 ± 16
|
1,89
|
|
Monuron
|
150-68-5
|
1,99
|
100 ± 8
|
2,00
|
|
Triapenthenol
|
776O8-8S-3
|
2,37
|
292 ± 58
|
2,47
|
|
Linuron
|
330-55-2
|
2,59
|
465 ± 62
|
2,67
|
|
Fention
|
55-38-9
|
3,31
|
2062 ± 648
|
3,31
|
Tabella 3
Sostanze di riferimento raccomandate per il metodo di screening per HPLC in base ai dati sull'adsorbimento del suolo
|
Sostanza di riferimento
|
N.CAS
|
Valori medi di log Koc ottenuti dall'equilibrio in batch
|
Numero di dati relativi a Koc
|
Log S.D.
|
Fonte
|
|
Acetanilide
|
103-84-4
|
1,25
|
4
|
0,48
|
(37)
|
|
Fenolo
|
108-95-2
|
1,32
|
4
|
0,70
|
(37)
|
|
2-nitrobenzammide
|
610-15-1
|
1,45
|
3
|
0,90
|
(38)
|
|
N, N-dimetilbenzammide
|
611-74-5
|
1,52
|
2
|
0,45
|
(37)
|
|
4-metilbenzammide
|
619-55-6
|
1,78
|
3
|
1,76
|
(37)
|
|
Benzoato di metile
|
93-58-3
|
1,80
|
4
|
1,08
|
(37)
|
|
Atrazina
|
1912-24-9
|
1,81
|
3
|
1,08
|
(39)
|
|
Isoproturon
|
34123-59-6
|
1,86
|
5
|
1,53
|
(39)
|
|
3-nitrobenzammide
|
645-09-0
|
1,95
|
3
|
1,31
|
(38)
|
|
Anilina
|
62-53-3
|
2,07
|
4
|
1,73
|
(37)
|
|
3,5-dinitrobenzammide
|
121-81-3
|
2,31
|
3
|
1,27
|
(38)
|
|
Carbendazim
|
10605-21-7
|
2,35
|
3
|
1,37
|
(39)
|
|
Triadimenol
|
55219-65-3
|
2,40
|
3
|
1,85
|
(39)
|
|
Triazoxide
|
72459-58-6
|
2,44
|
3
|
1,66
|
(39)
|
|
Triazofos
|
24017-47-8
|
2,55
|
3
|
1,78
|
(39)
|
|
Linuron
|
330-55-2
|
2,59
|
3
|
1,97
|
(39)
|
|
Naftalene
|
91-20-3
|
2,75
|
4
|
2,20
|
(37)
|
|
Endosulfan-diolo
|
2157-19-9
|
3,02
|
5
|
2,29
|
(39)
|
|
Metiocarb
|
2032-65-7
|
3,10
|
4
|
2,39
|
(39)
|
|
Giallo Acido 219
|
63405-85-6
|
3,16
|
4
|
2,83
|
(37)
|
|
1,2,3-triclorobenzene
|
87-61-6
|
3,16
|
4
|
1,40
|
(37)
|
|
γ-HCH
|
58-89-9
|
3,23
|
5
|
2,94
|
(37)
|
|
Fention
|
55-38-9
|
3,31
|
3
|
2,49
|
(39)
|
|
Rosso Diretto 81
|
2610-11-9
|
3,43
|
4
|
2,68
|
(37)
|
|
Pirazofos
|
13457-18-6
|
3,65
|
3
|
2,70
|
(39)
|
|
α-Endosulfan
|
959-98-8
|
4,09
|
5
|
3,74
|
(39)
|
|
Diclofop-metile
|
51338-27-3
|
4,20
|
3
|
3,77
|
(39)
|
|
Fenantrene
|
85-01-8
|
4,09
|
4
|
3,83
|
(37)
|
|
Blu Basico 41 (miscela)
|
26S50-47-5
12270-l 3-2
|
4,89
|
4
|
4,46
|
(37)
|
|
DDT
|
50-29-3
|
5,63
|
1
|
—
|
(38)
|
C.20. PROVA DI RIPRODUZIONE CON DAPHNIA MAGNA
1. METODO
Questo metodo di test della tossicità per la riproduzione corrisponde al TG 211 (1998) dell'OCSE.
1.1. INTRODUZIONE
Il principale obiettivo del test è valutare l'effetto delle sostanze chimiche sulla capacità riproduttiva di Daphnia magna.
1.2. DEFINIZIONI E UNITÀ
Animali riproduttori: femmine di Daphnia presenti all'inizio del test la cui capacità riproduttiva è oggetto dello studio.
Prole: piccoli di Daphnia prodotti dagli animali riproduttori nel corso del test.
Minima concentrazione con effetti significativi (Lowest Observed Effect Concentration, LOEC): concentrazione più bassa testata della sostanza alla quale si osserva un effetto statisticamente significativo (p < 0,05) sulla riproduzione e sulla mortalità parentale rispetto ai controlli, entro un periodo di esposizione definito. Tuttavia, tutte le concentrazioni al di sopra della LOEC devono avere un effetto dannoso uguale o superiore a quelli osservati alla LOEC. Se non è possibile soddisfare queste due condizioni, è necessario fornire una spiegazione esauriente sulle modalità di scelta della LOEC {e di conseguenza della NOEC).
Massima concentrazione senza effetti significativi (No Observed Effect Concentration, NOEC): concentrazione di prova immediatamente inferiore alla LOEC che, se confrontata con i controlli, non ha un effetto statisticamente significativo (p < 0,05), entro un periodo di esposizione definito.
ECx
: concentrazione della sostanza di prova disciolta in acqua che provoca una percentuale x di riduzione della capacità riproduttiva di Daphnia magna entro un determinato periodo di esposizione.
Tasso intrinseco di accrescimento: misura della crescita della popolazione che integra la capacità riproduttiva e la mortalità specifica in base all'età (20) (21) (22). Nelle popolazioni in equilibrio dinamico è uguale a zero. Per le popolazioni in crescita è positivo, mentre per quelle in diminuzione è negativo. Ovviamente, quest'ultimo tasso non è sostenibile e, alla fine, porta all'estinzione.
Limite di rivelabilità: concentrazione minima che può essere individuata ma non quantificata.
Limite di determinazione: concentrazione minima misurabile quantitativamente.
Mortalità: si considerano morti gli animali che, entro 15 secondi dopo lieve agitazione del contenitore usato per il test, restano immobili, cioè non sono in grado di nuotare, o nei quali non si osserva alcun movimento delle appendici o della parte posteriore dell'addome. (Nel caso si usi un'altra definizione, essa deve essere indicata insieme al relativo riferimento bibliografico).
1.3. PRINCIPIO DEL METODO DI PROVA
Giovani femmine di Daphnia (animali riproduttori), di età inferiore alle 24 ore al momento dell'inizio del test, vengono esposte alla sostanza di prova aggiunta ad acqua a un intervallo di concentrazioni diverse. La durata del test è di 21 giorni. Alla fine del test si valuta il numero totale di piccoli vivi prodotti da ciascun animale riproduttore vivo alla fine del test. Ciò significa che la prole nata da adulti che muoiono durante il test viene esclusa dai calcoli. La capacità riproduttiva degli animali parentali può essere espressa in altri modi (ad esempio, con il numero dei piccoli vivi prodotti giornalmente da ciascun animale a partire dal primo giorno di comparsa della prole) ma questi dati dovrebbero essere riportati solo ad integrazione del numero totale di piccoli prodotti da ciascun genitore vivo alla fine del test. La capacità riproduttiva degli animali esposti alla sostanza di prova viene confrontata con quella del/i controllo/i allo scopo di determinare la concentrazione più bassa alla quale si osservano effetti (LOEC) e quindi la concentrazione a cui non si osservano effetti (NOEC). Inoltre, e per quanto possibile, si analizzano i dati mediante un modello di regressione allo scopo di calcolare la concentrazione che causerebbe una riduzione percentuale x della capacità riproduttiva (cioè CE50, CE20 o CE10).
Deve essere inoltre riportata la sopravvivenza degli animali riproduttori e il tempo intercorso fino alla produzione della prima schiusa, è possibile esaminare anche altri effetti correlati alla sostanza su parametri quali la crescita (ad esempio la lunghezza) e il tasso intrinseco di accrescimento.
1.4. INFORMAZIONI SULLA SOSTANZA DI PROVA
Dovrebbero essere disponibili i risultati di un test di tossicità acuta (cfr. metodo C.2, parte I) effettuato sulla Daphnia magna. Tali risultati possono essere utili per selezionare un intervallo di concentrazione adeguato da utilizzare nei test sulla riproduzione. Dovrebbero essere noti la solubilità in acqua e la tensione di vapore della sostanza di prova e dovrebbe essere disponibile un metodo analitico affidabile per quantificare la sostanza nelle soluzioni di prova con la relativa efficienza di recupero e limite di determinazione.
Le informazioni sulla sostanza in esame utili per definire le condizioni di esecuzione del test sono: formula di struttura, purezza della sostanza, fotostabilità, stabilità nelle condizioni di esecuzione del test, pKa, Pow e risultati del test di biodegradabilità immediata (cfr. metodo C.4).
1.5. VALIDITÀ DEL TEST
Perché il test sia valido, il/i controllo/i dovrebbe/ro soddisfare i seguenti criteri di prestazione:
|
—
|
la mortalità degli animali riproduttori (femmine di Daphnia) non deve superare il 20 % alla fine del test,
|
|
—
|
il numero medio dei piccoli vivi prodotti da ciascun animale riproduttore sopravvissuto alla fine del test deve essere > 60.
|
1.6. DESCRIZIONE DEL METODO DI PROVA
1.6.1. Apparecchiatura
I recipienti di prova e le altre apparecchiature destinate a entrare in contatto con le soluzioni della prova devono essere interamente di vetro o di altro materiale chimicamente inerte. Di norma si utilizzano beaker di vetro come recipienti di prova.
Occorrono inoltre alcuni (o tutti) dei seguenti strumenti:
|
—
|
misuratore di ossigeno (con microelettrodo o altro apparecchio adatto per la misurazione dell'ossigeno disciolto in campioni di volume ridotto),
|
|
—
|
adeguata apparecchiatura per il controllo della temperatura,
|
|
—
|
apparecchiatura per la determinazione della durezza dell'acqua,
|
|
—
|
apparecchiatura per la determinazione della concentrazione dei carbonio organico totale (TOC) nell'acqua o per la determinazione della domanda chimica di ossigeno (COD),
|
|
—
|
adeguata apparecchiatura per il controllo del regime di illuminazione e la misurazione dell'intensità della luce.
|
1.6.2. Organismi da utilizzare nella prova
La specie da utilizzare nel test è la Daphnia magna Straus. È possibile usare altre specie di dafnie, purché soddisfino adeguatamente i criteri di validità (il criterio di validità relativo alla capacità riproduttiva nei controlli deve essere calibrato sulla specie di dafnia). Nel caso si utilizzino altre specie di dafnie, occorre identificarle con precisione e motivare la scelta.
Di preferenza il clone dovrebbe essere stato identificato tramite determinazione del genotipo. La ricerca (1) ha dimostrato che le prestazioni riproduttive del Clone A (proveniente dall'IRCHA, in Francia) (3), allevato nelle condizioni descritte nel presente metodo, soddisfa costantemente il criterio di validità di una media di ≥ 60 di piccoli per animale riproduttore sopravvissuto. Sono comunque accettabili altri cloni, purché si dimostri che la coltura di Daphnia soddisfa i criteri di validità del test.
All'inizio del test gli animali devono avere meno di 24 ore di vita e non devono provenire dalla prima nidiata. Devono provenire da un allevamento sano (senza segni di stress quali un alto tasso di mortalità, presenza di maschi e formazione di efippi. ritardo nella produzione della prima nidiata, scolorazione ecc). Gli animali riproduttori vanno mantenuti in condizioni di allevamento (luce, temperatura, mezzo, alimentazione e numero di animali per unità di volume) simili a quelle che verranno utilizzate nella prova. Se il mezzo di coltura delle dafnie da usare nel test è diverso da quello utilizzato di routine per la coltura delle dafnie, è buona prassi prevedere un periodo di acclimatazione prima del test, normalmente di tre settimane (cioè una generazione) per evitare di sottoporre a stress gli animali destinati alla riproduzione.
1.6.3. Mezzo di prova
Si raccomanda di usare per questa prova un mezzo completamente definito per evitare l'uso di additivi (ad esempio alghe, estratto di terra, e così via), che sono difficili da caratterizzare, e dunque aumentare la possibilità di standardizzazione fra vari laboratori. I mezzi M4 (4) e M7 di Elendt (cfr. appendice 1) si sono rivelati adatti a questo scopo. Sono comunque accettabili altri mezzi [ad esempio (5) (6)], purché si dimostri che le prestazioni della coltura di Daphnia soddisfano i criteri di validità del test.
Se si impiegano mezzi contenenti additivi non ben definiti, occorre descriverli in dettaglio aggiungendo nella relazione informazioni sulla loro composizione, con particolare riferimento al contenuto di carbonio, che potrebbe influire sulla dieta. Si raccomanda di determinare il carbonio organico totale (TOC) e/o la domanda chimica di ossigeno (COD) della preparazione madre dell'additivo organico e di effettuare una stima del contributo dato al TOC/COD del mezzo di prova. Si raccomanda che i livelli di TOC nel mezzo (cioè prima dell'aggiunta delle alghe) siano inferiori a 2 mg/l (7).
Quando si provano sostanze contenenti metalli è importante tener conto del fatto che le proprietà del mezzo di prova (ad esempio la durezza e la capacità di chelazione) possono influire sulla tossicità della sostanza in esame. Per questo motivo è consigliabile avere un mezzo completamente definito. Attualmente però gli unici mezzi di questo tipo noti per essere adatti all' allevamento a lungo termine di Daphnia magna sono l'M4 e l'M7 di Elendt. Entrambi i mezzi contengono l'agente chelante EDTA. La ricerca ha dimostrato (2) che la «tossicità apparente» del cadmio è generalmente inferiore quando il test sulla riproduzione viene eseguito nei mezzi M4 e M7 invece che in mezzi non contenenti EDTA. I mezzi M4 e M7 non sono pertanto raccomandati per il test di sostanze contenenti metalli; occorre inoltre evitare anche altri mezzi che contengono agenti chelanti. Per le sostanze contenenti metalli può essere consigliabile utilizzare un mezzo alternativo come, ad esempio, l'acqua dolce dura ricostituita secondo le indicazioni dell'ASTM (7), che non contiene EDTA, con l'aggiunta di estratto di alghe marine (8). Questa combinazione di acqua dolce dura ricostituita ed estratto di alghe marine è adatta anche per l'allevamento a lungo termine e la sperimentazione con Daphnia magna (2), sebbene anch'essa eserciti un'azione lievemente chelante a causa del componente organico presente nell'estratto di alghe marine aggiunto.
All'inizio e nel corso del test la concentrazione dell'ossigeno disciolto deve essere superiore a 3 mg/l. Il pH dovrebbe restare nel range 6-9 senza di norma variare di oltre 1,5 unità nell'ambito di un test. Si raccomanda una durezza superiore a 140 mg/l (come CaCO3). I test eseguiti con un valore pari o superiore a questo livello hanno dimostrato che le prestazioni riproduttive sono conformi ai criteri di validità (9) (10).
1.6.4. Soluzioni di prova
Le soluzioni di prova alle concentrazioni scelte vanno in genere preparate per diluizione di una soluzione madre. Le soluzioni madre dovrebbero preferibilmente essere preparate solubilizzando la sostanza nel mezzo di prova.
Per produrre una soluzione madre alla concentrazione adeguata, talvolta è necessario aggiungere solventi organici o disperdenti, ma l'uso di queste sostanze dovrebbe essere evitato per quanto possibile. Alcuni solventi adatti sono ad esempio l'acetone, l'etanolo, il metanolo, la dimetilformammide e il glicole trietilenico. Alcuni disperdenti adatti sono ad esempio il Cremophor RH40, la metilcellulosa 0,01 % e l'HCO-40. In ogni caso nelle soluzioni di prova la sostanza da saggiare non deve eccedere il limite di solubilità nel mezzo di prova.
Solventi: servono per produrre una soluzione madre che possa essere dosata con precisione nell'acqua. Alla concentrazione di solvente raccomandata nel mezzo di prova finale (< 0,1 ml/l) i solventi sopra elencati non sono tossici e non aumentano la solubilità in acqua delle sostanze.
Disperdenti: possono facilitare il dosaggio preciso e la dispersione. Alla concentrazione raccomandata nel mezzo di prova finale (≤ 0,1 ml/l) i disperdenti sopra elencati non sono tossici e non aumentano la solubilità in acqua delle sostanze.
1.7. DISEGNO SPERIMENTALE
Occorre randomizzare l'assegnazione dei trattamenti ai recipienti di prova e tutte le successive manipolazioni. In caso contrario si potrebbero venficare «bias» che potrebbero essere interpretate come un effetto della concentrazione. In particolare, se le unità sperimentali vengono manipolate in ordine di trattamento o di concentrazione, non si può escludere che alcuni effetti collegati al tempo (ad esempio la stanchezza dell'operatore o un altro errore) possono produrre effetti maggiori alle concentrazioni più alte. Inoltre, se si ritiene possibile una alterazione dei risultati del test a causa delle condizioni sperimentali iniziali o ambientali (ad esempio la posizione delle vasche nel laboratorio), si può ricorrere al frazionamento del test in blocchi.
1.8. PROCEDURA
1.8.1 Condizioni di esposizione
1.8.1.1. Durata
La durata del test è di 21 giorni.
1.8.1.2. Carico
Gli esemplari riproduttori vengono mantenuti individualmente, uno per ciascun recipiente di prova, con 50-100 ml di mezzo in ogni recipiente.
Talvolta, per soddisfare i requisiti della procedura analitica usata per determinare la concentrazione della sostanza in esame, occorre utilizzare un volume maggiore, sebbene sia consentito il raggruppamento delle repliche per l'analisi chimica. Nel caso si utilizzino volumi superiori a 100 ml, potrebbe essere necessario aumentare la razione fornita alle dafnie per assicurare un'adeguata disponibilità del cibo e il rispetto dei criteri di validità. Per i test a flusso continuo è possibile prendere in considerazione, per motivi tecnici, disegni sperimentali alternativi (ad esempio quattro gruppi di 10 animali in una soluzione di prova più abbondante); qualunque modifica del disegno sperimentale deve essere descritta nella relazione.
1.8.1.3. Numero di animali
Per i test semistatici occorrono almeno 10 animali, mantenuti singolarmente, per ogni concentrazione di prova e almeno 10 animali, mantenuti singolarmente nella serie di controllo.
E stato dimostrato che per i test a flusso continuo è adeguato utilizzare 40 animali suddivisi in quattro gruppi di 10 per ciascuna concentrazione di prova (1). È possibile utilizzare un numero inferiore di organismi sperimentali, ma si raccomanda comunque di utilizzare un minimo di 20 animali per concentrazione, divisi in due o più repliche con un numero uguale di animali (ad esempio quattro repliche con cinque dafnidi ciascuna). Si noti che per i test nei quali gli animali sono tenuti in gruppi, se gli animali riproduttori muoiono, non è possibile esprimere la capacità riproduttiva in termini di numero totale di piccoli vivi prodotti da ciascun animale riproduttore vivo alla fine del test. In questi casi la capacità riproduttiva dovrebbe essere espressa come «numero totale di piccoli vivi prodotti per (pro)genitore presente all'inizio del test».
1.8.1.4. Alimentazione
Nei test semistatici è preferibile nutrire gli animali ogni giorno, e comunque almeno tre volte alla settimana (in concomitanza con la sostituzione del mezzo). Se non si osserva questo modello di alimentazione, (per esempio nei saggi a flusso continuo) occorre segnalarlo nella relazione.
Durante la prova la dieta degli animali riproduttori dovrebbe consistere preferibilmente in alghe unicellulari vive di una o più delle seguenti specie: Chlorella sp., Selenastrum capricornutum [ora Pseudokirchneriella subcapitata (11)] e Scenedesmus subspicatus. La dieta deve essere basata sulla quantità di carbonio organico (C) fornita a ciascun animale riproduttore. Ricerche (12) hanno dimostrato che per ottenere il numero di piccoli di Daphnia magna necessari per soddisfare i criteri di validità sono sufficienti razioni comprese fra 0,1 e 0,2 mg C/Daphnia/die. È possibile somministrare la razione in maniera costante per tutto il periodo del test oppure una razione inferiore all'inizio della prova del test ed una razione più alta durante la prova, tenendo conto della crescita degli animali riproduttori. In questo caso la razione deve comunque restare sempre nel range raccomandato di 0,1-0,2 mg C/Daphnia/die.
Se per comodità (visto che la misurazione del tenore di carbonio richiede molto tempo) si utilizzano altri parametri di misurazione, quali la conta delle cellule algali o l'assorbanza della luce, per somministrare la razione necessaria, ogni laboratorio deve elaborare un proprio nomogramma che correli il parametro di misurazione scelto al contenuto di carbonio della coltura di alghe (cfr. appendice 2 per l'elaborazione del nomogramma). I nomogrammi vanno controllati almeno una volta all'anno e con maggiore frequenza in caso di modifica delle condizioni di coltura delle alghe. È stato dimostrato che l'assorbanza della luce è un parametro alternativo al contenuto di carbonio migliore rispetto al numero di cellule (13).
Occorre alimentare le dafnie con una sospensione concentrata di alghe per ridurre al minimo il volume del mezzo di coltura algale trasferito nei recipienti di prova. La concentrazione delle alghe avviene per centrifugazione con successiva risospensione in acqua distillata, acqua deionizzata o mezzo di allevamento delle dafnie.
1.8.1.5. Luce
16 ore di luce a un'intensità non superiore a 15-20 μE.m-2 s-1.
1.8.1.6. Temperatura
La temperatura dei mezzi di prova dovrebbe rimanere tra i 18 e i 22 oC e possibilmente non variare di oltre 2 oC in ogni test, restando comunque entro i suddetti limiti (ad esempio 18-20, 19-21 o 20-22 oC). Per controllare la temperatura si può utilizzare un recipiente di prova aggiuntivo.
1.8.1.7. Aerazione
I recipienti di prova non devono essere aerati durante il test.
1.8.2. Concentrazioni di prova
In genere si dovrebbero provare almeno cinque concentrazioni di prova, disposte in serie geometriche e separate da un fattore preferibilmente non superiore a 3,2; per ogni concentrazione si dovrebbe allestire un numero adeguato di repliche (cfr. punto 1.8.1.3). Se si utilizzano meno di cinque concentrazioni occorre indicare il motivo. Le sostanze non vanno provate al di sopra del loro limite di solubilità nel mezzo di prova.
Nel definire l'intervallo delle concentrazioni è necessario tenere conto dei seguenti elementi:
|
i)
|
se l'obiettivo è ottenere la LOEC/NOEC, la concentrazione minima deve essere sufficientemente bassa affinché la fecondità, a tale concentrazione, non sia significativamente inferiore rispetto a quella del controllo. In caso contrario il test andrà ripetuto con una concentrazione minima più bassa;
|
|
ii)
|
se l'obiettivo è ottenere la LOEC/NOEC, la concentrazione massima deve essere sufficientemente alta affinché la fecondità, a tale concentrazione, sia significativamente inferiore rispetto a quella del controllo. In caso contrario il test andrà ripetuto con una concentrazione massima più elevata;
|
|
iii)
|
se si stima la CEX per gli effetti sulla riproduzione, è consigliabile usare un numero sufficiente di concentrazioni tale da consentire di definire la CEX con un livello di confidenza adeguato. Se si stima la CE50 per gli effetti sulla riproduzione, è consigliabile che la massima concentrazione di prova sia maggiore della CE50 calcolata. Diversamente, sebbene sia comunque possibile calcolare la CE50, l'intervallo fiduciale per la CE50 sarà molto ampio e potrebbe non essere possibile valutare in modo soddisfacente l'adeguatezza del modello adattato;
|
|
iv)
|
è preferibile che l'intervallo delle concentrazioni di prova non comprenda concentrazioni con un effetto statisticamente significativo sulla sopravvivenza degli adulti, in quanto ciò trasformerebbe la natura della prova da una semplice prova sulla riproduzione a una prova combinata su riproduzione e mortalità, che richiederebbe un'analisi statistica molto più complessa.
|
Le informazioni disponibili sulla tossicità della sostanza di prova (ad esempio risultati di prove di tossicità acuta e/o di studi di definizione dell'intervallo di concentrazione) dovrebbero essere di aiuto nella scelta delle concentrazioni di prova appropriate.
Se per facilitare la preparazione delle soluzioni di prova si utilizza un solvente o un disperdente (cfr. punto 1.6.4), la sua concentrazione finale nei recipienti di prova non dovrebbe superare 0,1 ml/l e dovrebbe essere uguale in tutti i recipienti.
1.8.3. Controlli
In aggiunta alle concentrazioni con la sostanza di prova, dovrebbe essere allestita una serie di controllo con il mezzo di prova ed eventualmente una serie di controllo contenente il solvente o il disperdente. La concentrazione dell'eventuale solvente o disperdente deve essere identica a quella usata nei recipienti contenenti la sostanza di prova. Anche per i controlli dovrebbe essere usato un numero adeguato di repliche (cfr. punto 1.8.1.3),
Generalmente, in un test ben condotto, il coefficiente di variazione del numero medio di piccoli vivi prodotti da ciascun animale riproduttore nel/i controllo/i dovrebbe essere ≤ 25 %; il coefficiente di variazione dovrebbe essere riportato per le prove dove gli animali riproduttori sono mantenuti individualmente.
1.8.4. Rinnovo del mezzo di prova
La frequenza con cui il mezzo viene rinnovato dipende dalla stabilità della sostanza di prova, ma dovrebbe essere almeno tre volte alla settimana. Se da prove preliminari sulla stabilità (cfr. punto 1.4) la concentrazione della sostanza di prova non risulta stabile (cioè è al di fuori del range dell'80-120 % della concentrazione nominale o al di sotto dell'80 %, della concentrazione iniziale misurata) durante il periodo massimo di rinnovo (tre giorni), si consiglia di rinnovare il mezzo con maggiore frequenza oppure di eseguire una prova a flusso continuo.
Quando si rinnova il mezzo nelle prove semistatiche si prepara una seconda serie di recipienti dove vengono trasferiti gli animali riproduttori mediante, ad esempio, una pipetta di vetro di diametro adeguato. Il volume del mezzo trasferito con le dafnie dovrebbe essere il più piccolo possibile.
1.8.5. Osservazioni
I risultati delle osservazioni fatte durante il test vanno registrati su apposite schede di raccolta dei dati (cfr. appendici 3 e 4). Dovendo fornire i dati di altre misurazioni (cfr. punti 1.3 e 1.8.8) possono essere richieste ulteriori osservazioni.
1.8.6. Prole
La prole prodotta da ciascun animale riproduttore dovrebbe essere di preferenza tolta dal recipiente e contata ogni giorno a partire dalla comparsa della prima schiusa, per impedire che consumi cibo destinato all'adulto. Ai fini del metodo qui descritto è necessario contare solo il numero di piccoli vivi, ma è consigliabile registrare anche la presenza di uova abortite o piccoli morti.
1.8.7. Mortalità
La mortalità fra gli animali riproduttori va rilevata di preferenza quotidianamente, almeno ad ogni conta dei piccoli.
1.8.8. Altri parametri
Sebbene questo metodo sia fondamentalmente inteso a valutare gli effetti sulla riproduzione, è possibile che altri effetti siano sufficientemente quantificati da permettere un'analisi statistica. La misura della crescita è molto auspicabile in quanto fornisce informazioni su possibili effetti subletali, che potrebbero essere più utili della sola misura della riproduzione; si raccomanda di misurare la lunghezza degli animali riproduttori (lunghezza del corpo esclusa la spina posteriore del carapace) alla fine del test. Altri parametri che possono essere misurati o calcolati sono: il periodo intercorso fino alla produzione della prima schiusa (e delle schiuse successive), il numero e le dimensioni delle schiuse per animale, il numero delle schiuse abortite, la presenza di maschi o efippi e il tasso intrinseco di aumento della popolazione.
1.8.9. Frequenza delle determinazioni e delle misurazioni analitiche
Concentrazione dell'ossigeno, temperatura, durezza e pH dovrebbero essere misurati almeno una volta alla settimana, nei mezzi freschi e vecchi, nel/i controllo/i e nella concentrazione massima della sostanza in esame.
Durante la prova le concentrazioni della sostanza di prova vanno determinate a intervalli regolari.
Nei test semistatici in cui si prevede che la concentrazione della sostanza in esame resti intorno a ± 20 % del valore nominale (e cioè entro l'intervallo dell'80-120 %; cfr. punti 1.4. e 1.8.4), si raccomanda di analizzare almeno le concentrazioni minima e massima di prova subito dopo la loro preparazione e in occasione di un rinnovo del mezzo nel corso della prima settimana del test (le analisi vanno effettuate su un campione della stessa soluzione, preparata di fresco e al momento di rinnovarla). Queste determinazioni vanno poi ripetute a intervalli almeno settimanali.
Per i test in cui non si prevede che la concentrazione della sostanza in esame resti entro ± 20 % del valore nominale, è necessario analizzare tutte le concentrazioni di prova, appena preparate e al momento di rinnovarle. Tuttavia, per i test in cui la concentrazione iniziale misurata della sostanza di prova non è entro ± 20 % del valore nominale, ma si può fornire prova che le concentrazioni iniziali sono ripetibili e stabili (cioè entro un range dell'80-120 % delle concentrazioni iniziali), nella seconda e terza settimana del test le determinazioni chimiche possono limitarsi alle concentrazioni massima e minima. In tutti i casi la determinazione delle concentrazioni della sostanza in esame prima del rinnovo può limitarsi ad un unico recipiente per ciascuna concentrazione.
Per i test a flusso continuo è appropriato l'uso di un regime di campionamento simile a quello descritto per i test semistatici (sebbene in questo caso non ci sia la misurazione delle soluzioni «vecchie»). Può essere però consigliabile aumentare il numero di campionamenti durante la prima settimana (ad esempio, tre serie di misurazioni;) per accertare la stabilità delle concentrazioni di prova. In questi tipi di prova dovrebbe essere controllato quotidianamente il tasso di flusso del diluente e della sostanza di prova.
Potendo dimostrare che durante tutto il test la concentrazione della sostanza di prova in soluzione è stata mantenuta in modo soddisfacente entro ± 20 % della concentrazione nominale o della concentrazione iniziale misurata, i risultati possono essere basati sui valori nominali o sui valori iniziali misurati. Se la deviazione dalla concentrazione iniziale nominale o misurata è maggiore di ± 20 %, i risultati vanno espressi come media ponderata nel tempo (cfr. appendice 5).
2. DATI E RELAZIONE
2.1. ELABORAZIONE DEI RISULTATI
Scopo di questo test è determinare l'effetto della sostanza di prova sul numero complessivo di piccoli vivi prodotti da ciascun animale riproduttore vivo alla fine del test. Occorre calcolare il numero complessivo di piccoli per animale riproduttore per ciascun recipiente di prova (replica). Se in una replica qualsiasi l'animale riproduttore muore durante il test o si rivela essere un maschio, questa replica viene esclusa dall'analisi. L'analisi si baserà quindi su un numero ridotto di repliche.
Per stimare la LOEC e quindi la NOEC per gli effetti della sostanza chimica sulla capacità riproduttiva è necessario calcolare la capacità riproduttiva media nelle varie repliche di ciascuna concentrazione, nonché la deviazione standard residua di dati comuni («pooled»), utilizzando l'analisi della varianza (ANOVA). La media di ogni concentrazione deve poi essere confrontata con la media dei controlli mediante un metodo adeguato di comparazione multipla. Possono essere utilizzati i test di Dunnett o di Williams (14) (15) (16) (17). E necessario controllare se la assunzione di omogeneità della varianza dell'ANOVA è fondata. Si raccomanda di fare questo controllo graficamente piuttosto che con un test formale della significatività (18); una possibile alternativa è il test di Bartlett. Se la assunzione non è fondata, bisogna valutare se trasformare i dati per omogeneizzare le varianze prima di eseguire l'ANOVA, o se eseguire una ANOVA ponderata. Occorre calcolare e riferire nella relazione l'entità dell'effetto misurabile tramite ANOVA (ovvero la più piccola differenza significativa).
Per la stima della concentrazione che causerebbe una riduzione del 50 % della capacità riproduttiva (CE50) è necessario approssimare ai dati una curva adeguata, come la curva logistica, utilizzando un metodo statistico come quello dei minimi quadrati. È possibile parametrizzare la curva in modo da poter stimare direttamente la CE50 e il suo errore standard. Ciò faciliterebbe notevolmente il calcolo dei limiti fiduciali della CE50. A meno che vi siano buoni motivi per preferire limiti fiduciali diversi, vanno utilizzati i limiti di confidenza inferiore e superiore (probabilità del 95 %). La procedura di approssimazione deve fornire, di preferenza, uno strumento per valutare il significato della mancanza di approssimazione. Lo si può fare graficamente o dividendo la somma residua dei quadrati in componenti di mancanza di adattamento e «componenti d'errore puro» ed eseguendo un test della significatività per la mancanza di adattamento. Poiché generalmente i trattamenti che danno alta fecondità tendono ad avere una varianza maggiore nel numero dei piccoli prodotti rispetto ai trattamenti che danno bassa fecondità, si potrebbe eventualmente ponderare i valori osservati per rispecchiare le diverse varianze nei diversi gruppi di trattamento [cfr. riferimento (18) per ulteriori dettagli].
Nell'analisi dei dati ottenuti nel «ring test» finale (2) è stata approssimata una curva logistica mediante il seguente modello, sebbene si possano usare altri modelli adeguati:

dove:
|
Y
|
=
|
numero totale dei piccoli per animale riproduttore vivo alla fine del test (calcolato per ciascun recipiente)
|
|
x
|
=
|
concentrazione della sostanza
|
|
c
|
=
|
numero previsto di piccoli se x = 0
|
|
x0
|
=
|
CE50 della popolazione
|
|
b
|
=
|
parametro della pendenza.
|
Questo modello dovrebbe essere adeguato in molte situazioni diverse, ma esistono senz'altro test per i quali non è adatto. È dunque necessario controllarne la validità come suggerito sopra. In alcuni casi può prestarsi meglio un modello di ormesi in cui concentrazioni basse danno effetti più severi (19).
È possibile calcolare anche altre concentrazioni efficaci, come la CE10 o la CE20, anche se può essere preferibile utilizzare una parametrizzazione diversa del modello rispetto a quella usata per la stima della CE50.
2.2. RELAZIONE SUL TEST
La relazione sul test deve contenere:
2.2.1 Sostanza di prova:
|
—
|
natura fisica e proprietà fisico-chimiche pertinenti,
|
|
—
|
dati di identificazione chimica, compresa la purezza.
|
2.2.2. Specie di prova:
|
—
|
clone (se è stato tipizzato geneticamente), fornitore o fonte (se nota) e condizioni di utilizzate. Se si usa una specie diversa dalla Daphnia magna, è necessario precisarlo nella relazione e giustificare i motivi di questa scelta.
|
2.2.3. Condizioni di esecuzione della prova:
|
—
|
procedura usata (ad esempio semistatica o a flusso continuo, volume, carico espresso in numero di Daphnia per litro),
|
|
—
|
fotoperiodo e intensità della luce,
|
|
—
|
disegno sperimentale (ad esempio, numero di repliche, numero di animali riproduttori per replica),
|
|
—
|
particolari sul mezzo di allevamento utilizzato,
|
|
—
|
eventuali aggiunte di materiale organico, inclusa composizione, fonte, metodo di preparazione, TOC/COD delle preparazioni madri, stima del TOC/COD risultante nel mezzo di prova,
|
|
—
|
informazioni dettagliate sull'alimentazione, comprese la quantità (in mg C/Daphnia/die) e il programma (ad esempio tipo di alimento/i, compresi il nome della specie di alghe e, se noti, il ceppo e le condizioni di coltura),
|
|
—
|
metodo di preparazione delle soluzioni madri e frequenza di rinnovo (deve essere specificato il tipo e la concentrazione del solvente o disperdente, se usati).
|
2.2.4. Risultati:
|
—
|
risultati di eventuali studi preliminari sulla stabilità della sostanza di prova,
|
|
—
|
concentrazioni di prova nominali e risultati di tutte le analisi per determinare la concentrazione della sostanza nei recipienti di prova (cfr. esempi di schede di raccolta dati nell'appendice 4): vanno riportati nella relazione anche l'efficienza di recupero del metodo e il limite di determinazione,
|
|
—
|
qualità dell'acqua nei recipienti di prova (pH, temperatura e concentrazione dell'ossigeno disciolto, e, dove possibile, anche TOC e/o COD e durezza) (cfr. esempio di scheda di raccolta dati nell'appendice 3),
|
|
—
|
numero totale di piccoli vivi per ciascun animale riproduttore (cfr. esempio di scheda di raccolta dati nell'appendice 3),
|
|
—
|
numero di decessi fra gli animali riproduttori e giorno in cui sono avvenuti (cfr. esempio di scheda di raccolta dati nell'appendice 3),
|
|
—
|
coefficiente di variazione per la fecondità dei controlli (basato sul numero totale di piccoli vivi per animale riproduttore vivo alla fine del test),
|
|
—
|
diagramma del numero totale di piccoli vivi per animale riproduttore vivo (per ogni replica) alla fine del test sulla concentrazione della sostanza in esame,
|
|
—
|
concentrazione più bassa alla quale si osservano effetti (LOEC) sulla riproduzione, comprese una descrizione delle procedure statistiche usate e un'indicazione dell'entità dell'effetto che poteva essere rilevato e concentrazione più alta alla quale non si osservano effetti (NOEC) sulla riproduzione: se del caso, va indicata anche la LOEC/NOEC relativa alla mortalità degli animali riproduttori,
|
|
—
|
se del caso, CEX per la riproduzione e intervalli di confidenza, nonché un grafico del modello approssimato usato per il suo calcolo, la pendenza della curva dose-risposta e il suo errore standard.
|
|
—
|
altri effetti biologici osservati o misure effettuate: riferire qualsiasi altro effetto biologico osservato o misurato (ad esempio, crescita degli animai: riproduttori) comprese le motivazioni adeguate.
|
|
—
|
spiegazione di eventuali deviazioni dal metodo di prova.
|
3. BIBLIOGRAFIA
|
(1)
|
OECD Test Guideline Programme, Report of the Workshop on the Daphnia magna Pilot Ring Test, Sheffield University, UK, 20-21 March 1993.
|
|
(2)
|
OECD Environmental Health and Safety Publications. Series on Testing and Assessment No. 6. Report of the Final Ring Test of the Daphnia magna Reproduction Test Paris. 1997.
|
|
(3)
|
Baird D.J., Barber J., Bradley M.C, Soares A.M.V.M. and Calow P. (1991). A comparative study of genotype sensitivity to acute toxic stress using clones of Daphnia magna Strauss. Ecotoxicology and Environmental Safety, 21, pp. 257-265.
|
|
(4)
|
Elendt B.P., (1990). Selenium deficiency in Crustacea; An ultrastructural approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, pp. 25-33.
|
|
(5)
|
EPA (1993). Methods for Measuring the Acute Toxicity of Effluents and Receiving Waters to Freshwater and Marine Organisms. (Fourth ed.). EPA/600/4-90/027F. C. I. Weber (ed), USEPA, Cincinnati, Ohio.
|
|
(6)
|
Vigano E., (1991) Suitability of commercially available spring waters as standard medium for culturing Daphnia magna. Bull. Environ. Contam. Toxicol., 47, pp. 775-782.
|
|
(7)
|
ASTM (1988). Standard Guide for Conducting Acute Toxicity Tests with Fishes, Macroinvcrtebrates and Amphibians. E729-88a. American Society for Testing and Materials, Philadelphia P.A. 20 pp.
|
|
(8)
|
Baird D.J., Soares A.M.V.M., Girling A., Barber J., Bradley M.C. and Calow P. (1989). The long terra maintenance of Daphnia magna Straus for use in ecotoxicological tests; problems and prospects. In: Proceedings of the 1st European Conference on Ecotoxicology. Copenhagen 1988 (H.Løkke, H. Tyle & F. Bro-Rasmussen, Eds.), pp. 144-148.
|
|
(9)
|
Parkhurst B.R., Forte J.L. and Wright G.P. (1981). Reproducibility of a life-cycle toxicity test with Daphnia magna. Bull. Environ. Contam. and Toxicol., 26, pp. 1-8.
|
|
(10)
|
Cowgill U.M. and Milazzo D.P. (1990) The sensitivity of two cladocerans to water quality variables: salinity and hardness. Arch. Hydrobiol., 120(2), pp. 185-196.
|
|
(11)
|
Korshikov (1990). Pseudokirchneriella subcapitata Hindak, F-1990. Biologice Prace, 36, 209.
|
|
(12)
|
Sims I.R., Watson S. and Holmes D. (1993). Toward a standard Daphnia juvenile production test. Environmental Toxicology and Chemistry, 12, pp. 2053-2058.
|
|
(13)
|
Sims I. (1993). Measuring the growth of phytoplankton: the relationship between total organic carbon with three commonly used parameters of algal growth. Arch. Hydrobiol., 128, pp. 459-466.
|
|
(14)
|
Dunnett C. W., (1955). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc, 50, pp. 1096-1121.
|
|
(15)
|
Dunnett C.W., (1964). New tables for multiple comparisons with a control. Biometrics, 20, pp. 482-491.
|
|
(16)
|
Williams D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, pp. 103-117.
|
|
(17)
|
Williams D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics, 28, pp. 510-531.
|
|
(18)
|
Draper N.R. and Smith H. (1981). Applied Regression Analysis, second edition, Wiley, N.Y.
|
|
(19)
|
Brain P. and Cousens R. (1989). An equation to describe dose responses where there is stimulation of growth at low doses. Weed Research, 29, pp. 93-96.
|
|
(20)
|
Wilson E.O. and Bossert, W.H. (1971). A Primer of Population Biology. Sinauer Associates Inc. Publishers.
|
|
(21)
|
Poole R.W. (1974). An Introduction to quantitative Ecology. McGraw-Hill Series in Population Biology, New York, pp. 532.
|
|
(22)
|
Meyer J.S., Ingersoll C.G., McDonald L.L. and Boyce M S. (1986). Estimating uncertainty in population growth rates: Jackknife vs bootstrap techniques. Ecology, 67, pp. 1156-1166.
|
APPENDICE 1
PREPARAZIONE DEI MEZZI M7 E M4 DI ELENDT TOTALMENTE DEFINITI
Acclimatazione ai mezzi M7 e M4 di Elendt
Alcuni laboratori hanno avuto difficoltà nel trasferire direttamente le daphnie nei mezzi M4 (1) e M7. Per contro, con l'acclimatazione graduale, cioè lo spostamento dal mezzo originario a un mezzo Elendt al 30 %, poi al 60 % e infine al 100 % si sono avuti risultati soddisfacenti. Potrebbe essere necessario prevedere periodi di acclimatazione persino di un mese.
PREPARAZIONE
Oligoelementi
Inizialmente si preparano soluzioni madri distinte (I) dei singoli oligoelementi in acqua di adeguata purezza, ad esempio deionizzata, distillata o sottoposta a osmosi inversa. Da queste diverse soluzioni madre (I) si prepara una seconda soluzione madre singola (II) che contiene tutti gli oligoelementi (soluzione combinata), e cioè:
|
Soluzioni madre I
(sostanza singola)
|
Quantità aggiunta
(mg/l)
|
Concentrazione (in relazione al mezzo M4)
(volte)
|
Per preparare la soluzione madre combinata II aggiungere la seguente quantità di soluzione madre I ad acqua
(ml/l)
|
|
M 4
|
M 7
|
|
H3BO3
|
57 190
|
20 000
|
1,0
|
0,25
|
|
MnCl2 * 4 H2O
|
7 210
|
20 000
|
1,0
|
0,25
|
|
LiCl
|
6 120
|
20 000
|
1,0
|
0,25
|
|
RbCl
|
1 420
|
20 000
|
1,0
|
0,25
|
|
SrCl2 * 6 H2O
|
3 040
|
20 000
|
1,0
|
0,25
|
|
NaBr
|
320
|
20 000
|
1,0
|
0,25
|
|
Na2MoO4 * 2 H2O
|
1 260
|
20 000
|
1,0
|
0,25
|
|
CuCl2 * 2 H2O
|
335
|
20 000
|
1,0
|
0,25
|
|
ZnCl2
|
260
|
20 000
|
1,0
|
1,0
|
|
CoCl2 * 6 H2O
|
200
|
20 000
|
1,0
|
1,0
|
|
Kl
|
65
|
20 000
|
1,0
|
1,0
|
|
Na2SeO3
|
43,8
|
20 000
|
1,0
|
1,0
|
|
NH4VO3
|
11,5
|
20 000
|
1,0
|
1,0
|
|
Na2EDTA * 2 H2O
|
5 000
|
2 000
|
—
|
—
|
|
FeSO4 * 7 H2O
|
1 991
|
2 000
|
—
|
—
|
|
Sia la soluzione Na2EDTA che la FeSO4 vengono preparate singolarmente, versate insieme e inserite immediatamente nell'autoclave. Con ciò si ottiene:
|
|
21 soluzione Fe-EDTA
|
|
1 000
|
20,0
|
5,0
|
Mezzi M4 e M7
I mezzi M4 e M7 si preparano usando la soluzione madre II, i macronutrienti e le vitamine, nel modo seguente:
|
|
Quantità aggiunta ad acqua
(mg/l)
|
Concentrazione (rispetto al mezzo M4)
(volte)
|
Quantità di soluzione madre aggiunta per preparare il mezzo
ml/l
|
|
M 4
|
M 7
|
|
Soluzione madre II oligoelementi combinati
|
|
20
|
50
|
50
|
|
Soluzioni madri con macrocostituenti (singola sostanza)
|
|
CaCl2 * 2 H20
|
293 800
|
1 000
|
1,0
|
1,0
|
|
MgSO4 * 7 H20
|
246 600
|
2 000
|
0,5
|
0,5
|
|
KC1
|
58 000
|
10 000
|
0,1
|
0,1
|
|
NaHCO3
|
64 800
|
1 000
|
1,0
|
1,0
|
|
Na2SiO3 * 9 H20
|
50 000
|
5 000
|
0,2
|
0,2
|
|
NaNO3
|
2 740
|
10 000
|
0,1
|
0,1
|
|
KH2PO4
|
1 430
|
10 000
|
0,1
|
0,1
|
|
K2HPO4
|
1 840
|
10 000
|
0,1
|
0,1
|
|
Soluzione madre combinata di vitamine
|
—
|
10 000
|
0,1
|
0,1
|
|
La soluzione madre combinata di vitamine si prepara aggiungendo le 3 vitamine a 1 litro di acqua, come segue:
|
|
Cloridrato di tiammina
|
750
|
10 000
|
—
|
—
|
|
Cianocobalamina (Bl2)
|
10
|
10 000
|
—
|
—
|
|
Biotina
|
7,5
|
10 000
|
—
|
—
|
|
La soluzione madre combinata di vitamine si conserva congelata in piccole aliquote Le vitamine si aggiungono ai mezzi poco prima dell'uso.
|
Note:
|
Per evitare la precipitazione dei sali durante la preparazione dei mezzi completi, aggiungere le aliquote delle soluzioni madre a circa 500-800 ml di acqua deionizzata e poi portare a 1 litro.
|
|
|
Il primo studio pubblicato sul mezzo M4 si trova in Elendt, B.P. (1990). Selenium deficiency in crustacea; an ultrastructural approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, pp. 25-33.
|
|
APPENDICE 2
ANALISI DEL CARBONIO ORGANICO TOTALE (TOC) E PRODUZIONE DI UN NOMOGRAMMA PER IL CONTENUTO DI TOC DELL'ALIMENTO ALGALE
È riconosciuto che il contenuto di carbonio dell'alimento algale non viene di norma misurato direttamente, bensì mediante correlazioni (cioè nomogrammi) con misure sostitutive quali il numero di cellule algali o l'assorbanza della luce.
Il TOC dovrebbe essere misurato per ossidazione ad alta temperatura piuttosto che mediante UV o metodi con persolfati. (Cfr.: The Instrumental Determination of Total Organic Carbon, Total Oxygen Demand and Related Determinands 1979, HMSO 1980; 49 High Holborn, London WC1V 6HB).
Per la produzione del nomogramma, le alghe vanno separate dal mezzo di crescita mediante centrifugazione, seguita da risospensione in acqua distillata. Occorre misurare il parametro surrogato e la concentrazione del TOC in ciascun campione in triplicato. Vanno analizzati i bianchi di acqua distillata e la loro concentrazione di TOC viene dedotta dalla concentrazione del TOC nel campione di alghe.
Il nomogramma deve essere lineare nell'intervallo richiesto di concentrazioni del carbonio. Di seguito sono riportati alcuni esempi.
NB: Non usare questi nomogrammi per effettuare conversioni; è essenziale che ogni laboratorio prepari il suo nomogramma..


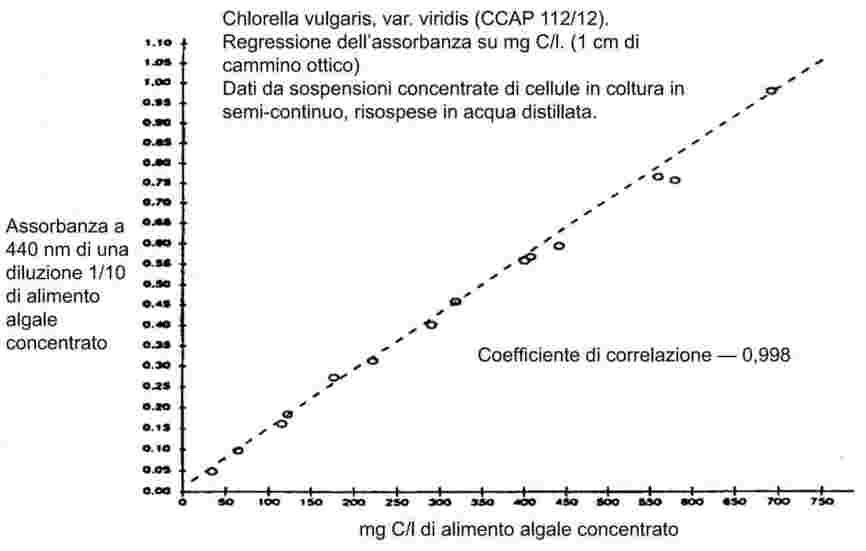
APPENDICE 3
ESEMPIO DI SCHEDA PER LA RACCOLTA DI DATI SUL RINNOVO DEL MEZZO, IL MONITORAGGIO FISICO/CHIMICO, L'ALIMENTAZIONE, LA RIPRODUZIONE DELLE DAPHNIA E LA MORTALITÀ DEGLI ADULTI
|
Esperimento n.:
|
Inizio raccolta dati:
|
Clone:
|
Mezzo:
|
Tipo di cibo:
|
Sostanza di prova;
|
Concentrazione nominale:
|
|
Giorno
|
0
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
13
|
14
|
15
|
16
|
17
|
18
|
19
|
20
|
21
|
|
|
|
Rinnovo del mezzo (spuntare)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PH (40)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
nuovo
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
vecchio
|
|
|
O2 mg/l (40)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
nuovo
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
vecchio
|
|
|
Temperatura ( oC) (40)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
nuovo
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
vecchio
|
|
|
Somministrazione del cibo (spuntare)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N. di piccoli vivi (41)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Totale
|
|
Recipiente 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Totale
|
|
|
Mortalità cumulativa adulti (42)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
APPENDICE 4
ESEMPIO DI SCHEDA PER LA REGISTRAZIONE DEI RISULTATI DELLE ANALISI CHIMICHE
a) Concentrazioni misurate
|
Concentrazioni nominali
|
Campione settimana 1
|
Campione settimana 2
|
Campione settimana 3
|
|
Fresco
|
Vecchio
|
Fresco
|
Vecchio
|
Fresco
|
Vecchio
|
|
|
|
|
|
|
|
|
b) Concentrazioni misurate come percentuale del valore nominale
|
Concentrazioni nominali
|
Campione settimana 1
|
Campione settimana 2
|
Campione settimana 3
|
|
Fresco
|
Vecchio
|
Fresco
|
Vecchio
|
Fresco
|
Vecchio
|
|
|
|
|
|
|
|
|
APPENDICE 5
CALCOLO DI UNA MEDIA PONDERATA NEL TEMPO
Media ponderata nel tempo
Dato che la concentrazione della sostanza di prova può diminuire nel periodo fra i rinnovi del mezzo è necessario considerare quale concentrazione vada scelta come rappresentativa dell' intervallo di concentrazioni a cui sono state esposte le dafnie riproduttrici. La selezione deve basarsi su considerazioni biologiche oltre che statistiche. Per esempio, se si ritiene che la riproduzione venga influenzata soprattutto dalla concentrazione picco, si deve utilizzare la concentrazione massima. Se invece si ritiene più importante l'effetto accumulato o a più lungo termine della sostanza tossica, allora risulta più pertinente una concentrazione media. In questo caso una media adeguata è la concentrazione media ponderata nel tempo, in quanto tiene conto della variazione della concentrazione istantanea nel corso del tempo.
Figura 1:
Esempio di media ponderata nel tempo

La Figura 1 mostra un esempio di test (semplificato) della durata di sette giorni con rinnovo del mezzo nei giorni 0, 2 e 4.
|
—
|
La linea sottile a zig-zag rappresenta la concentrazione in qualsiasi momento nel tempo. Si suppone che la caduta di concentrazione segua un processo di decadimento esponenziale.
|
|
—
|
I sei quadratini rappresentano le concentrazioni osservate misurate all'inizio e alla fine di ciascun periodo di rinnovo.
|
|
—
|
La linea retta spessa indica la posizione della media ponderata nel tempo.
|
La media ponderata nel tempo viene calcolata in modo che l'area ad essa sottostante sia uguale all'area sotto la curva della concentrazione. Il calcolo per l'esempio in figura è illustrato nella tabella 1.
Tabella 1:
Calcolo della media ponderata nel tempo
|
Rinnovo n.
|
Giorni
|
Conc0
|
Conc1
|
Ln(Conc0)
|
Ln(Conc1)
|
Area
|
|
1
|
2
|
10,000
|
4,493
|
2,303
|
1,503
|
13,767
|
|
2
|
2
|
11,000
|
6,037
|
2,398
|
1,798
|
16,544
|
|
3
|
3
|
10,000
|
4,066
|
2,303
|
1,403
|
19,781
|
|
Giorni totali: 7
|
Area totale
|
50,091
|
|
Media ponderata/t
|
7,156
|
|
«Giorni» è il numero di giorni nel periodo di rinnovo.
«Conc0» è la concentrazione misurata all'inizio di ciascun periodo di rinnovo.
«Conc1» è la concentrazione misurata alla fine di ciascun periodo di rinnovo.
«Ln(Conc0)» è il logaritmo naturale di Conc0.
«Ln(Conc1)» è il logaritmo naturale di Conc1.
«Area» è l'area sotto la curva esponenziale per ciascun periodo di rinnovamento. Viene calcolata nel modo seguente:

|
La media ponderata nel tempo («media ponderata/t») è l'«Area totale» divisa per i «Giorni totali».
Ovviamente per il test di riproduzione con Daphnia la tabella andrebbe prolungata fino a coprire 21 giorni.
È chiaro che quando le osservazioni vengono effettuate solo all'inizio e alla fine di ciascun periodo di rinnovamento non è possibile confermare che il processo di decadimento è effettivamente esponenziale. Una curva diversa produrrebbe un calcolo diverso per l'Arca. È tuttavia plausibile che il processo di decadimento sia esponenziale e questa è probabilmente la curva migliore da usare in assenza di altre informazioni.
E però necessario procedere con cautela se l'analisi chimica non rileva alcuna sostanza alla fine del periodo di rinnovo. A meno che non sia possibile stimare la rapidità con cui la sostanza è scomparsa dalla soluzione, è impossibile ottenere un'area sotto la curva che sia realistica, e pertanto è impossibile ottenere una ragionevole media ponderata nel tempo.
C.21. MICRORGANISMI DEL SUOLO: TEST DI TRASFORMAZIONE DELL'AZOTO
1. METODO
Questo metodo di prova corrisponde al TG 216 (2000) dell'OCSE.
1.1 INTRODUZIONE
Qui di seguito è descritto un metodo di laboratorio messo a punto per studiare gli effetti a lungo termine delle sostanze chimiche, dopo un'unica esposizione, sull'attività di trasformazione dell'azoto ad opera dei microrganismi del suolo. Il test si basa principalmente sulle raccomandazioni dell'Organizzazione europea e mediterranea per la protezione delle piante (1), ma tiene conto anche delle linee guida formulate dal Centro federale tedesco di ricerca biologica per l'agricoltura e la silvicoltura (Biologische Bundesanstalt für Land und Forstwirtschaft) (2), dall'Agenzia per la protezione dell'ambiente degli Stati Uniti (Environmental Protection Agency) (3), dal SETAC (4) e dall'Organizzazione internazionale di normalizzazione (ISO) (5). Il numero ed il tipo di suoli da utilizzare nel test sono stati concordati in occasione di un workshop dell'OCSE sulla selezione dei suoli e dei sedimenti, svoltosi a Belgirate nel 1995 (6). Le raccomandazioni riguardanti il prelievo, la manipolazione e lo stoccaggio dei campioni di suolo si basano su linee guida ISO (7) e sulle raccomandazioni formulate dal workshop di Belgirate. Per accertare e valutare le caratteristiche tossiche delle sostanze di prova può essere necessario determinarne gli effetti sull'attività microbica del suolo, ad esempio quando occorre disporre di dati sui potenziali effetti collaterali dei prodotti fitosanitari sulla microflora del suolo o quando si prevede un'esposizione dei microrganismi del suolo ad altri tipi di sostanze chimiche. Il test di trasformazione dell'azoto viene effettuato per determinare gli effetti di queste sostanze chimiche sulla microflora del suolo. Qualora siano testati prodotti agrochimici (ad es. fitosanitari, fertilizzanti, prodotti chimici per la silvicoltura), oltre al test di trasformazione dell'azoto si effettua anche il test di trasformazione del carbonio. Per le altre sostanze chimiche è invece sufficiente il test di trasformazione dell'azoto. Tuttavia se i valori CE50 riscontrati per queste sostanze nel test di trasformazione dell'azoto corrispondono a quelli degli inibitori della nitrificazione disponibili in commercio (ad es. nitrapirina), per ottenere maggiori informazioni può essere effettuato anche il test di trasformazione del carbonio.
I suoli sono costituiti da miscele eterogenee e complesse di componenti viventi e non viventi. I microrganismi svolgono un ruolo importante nella decomposizione e nella trasformazione della materia organica in suolo fertile, contribuendo in maniera differente a seconda delle specie ai vari aspetti della fertilizzazione. Eventuali interferenze con questi processi biochimici rischiano a lungo termine di influenzare il ciclo delle sostanze nutritive e di alterare la fertilità del suolo. La trasformazione del carbonio e dell'azoto avviene in tutti i suoli fertili; anche se le comunità microbiche responsabili di questi processi variano a seconda del tipo di suolo, le vie di trasformazione sono sostanzialmente le stesse.
Il metodo di prova di seguito descritto è stato concepito per individuare gli effetti nocivi a lungo termine di una sostanza sul processo di trasformazione dell’azoto nei suoli aerobici superficiali, ma consente anche di stimarne gli effetti sulla trasformazione del carbonio ad opera della microflora del suolo. La formazione di nitrati avviene in seguito alla degradazione del legame carbonio-azoto; di conseguenza, qualora nei campioni di suolo trattato ed in quelli di controllo si riscontrino gli stessi tassi di produzione di nitrati, è molto probabile che le principali vie di degradazione del carbonio siano intatte e funzionali. Il substrato scelto per il test (farina di erba medica in polvere) presenta un buon rapporto carbonio/azoto (compreso normalmente tra 12:1 e 16:1). Per questo motivo durante il test la carenza di carbonio è ridotta e le comunità microbiche eventualmente danneggiate da una sostanza chimica possono ristabilirsi entro 100 giorni.
I test su cui si basa questo metodo di prova sono stati originariamente concepiti per sostanze di cui è possibile stimare la quantità che penetra nel suolo. È il caso, ad esempio, dei prodotti fitosanitari, la cui dose di applicazione nel terreno è conosciuta. Per i prodotti agrochimici è sufficiente utilizzare due concentrazioni di prova, corrispondenti alla dose di applicazione prevista o stimata; tali prodotti possono essere testati come ingredienti attivi (i.a.) o come prodotti formulati. Tuttavia, cambiando sia la quantità della sostanza di prova applicata al suolo sia le modalità di valutazione dei dati il test può essere utilizzato non soltanto per i prodotti agrochimici ma anche per altre sostanze chimiche di cui non si conosca la quantità che penetra nel suolo; in questo caso è possibile determinare gli effetti sulla trasformazione dell'azoto di una serie di concentrazioni. I dati ottenuti sono utilizzati per costruire una curva dose-risposta e calcolare i valori CEx, dove x è la percentuale di effetto.
1.2 DEFINIZIONI
Trasformazione dell'azoto: degradazione ad opera dei microrganismi di materia organica contenente azoto attraverso il processo di ammonificazione e nitrificazione, con formazione del relativo prodotto finale inorganico, il nitrato.
CE
x
(concentrazione efficace): concentrazione della sostanza di prova nel suolo che determina un'inibizione dell'x per cento nella trasformazione dell'azoto in nitrato.
CE
50
(concentrazione efficace media): concentrazione della sostanza di prova nel suolo che determina un'inibizione del 50 % nella trasformazione dell'azoto in nitrato.
1.3 SOSTANZE DI RIFERIMENTO
Nessuna.
1.4 PRINCIPIO DEL METODO DI PROVA
Dopo essere stato setacciato il suolo viene ammendato con farine vegetali in polvere ed una parte viene trattata con la sostanza di prova mentre un'altra parte non viene sottoposta ad alcun trattamento (controllo). Se il test è effettuato su prodotti agrochimici, si raccomanda di utilizzare almeno due concentrazioni di prova, scelte in relazione alla massima concentrazione prevista nel terreno. Dopo 0, 7, 14 e 28 giorni di incubazione si utilizza un solvente adeguato per estrarre i campioni trattati e i campioni controllo e si determinano le quantità di nitrati presenti negli estratti. La velocità di formazione dei nitrati nei campioni trattati viene comparata con quella dei campioni di controllo, calcolando la percentuale di scarto tra campione trattato e campione controllo. Tutti i test durano almeno 28 giorni. Se al ventottesimo giorno le differenze tra i campioni di suolo trattati e non trattati sono uguali o superiori al 25 % le misurazioni continuano fino ad un massimo di 100 giorni. Se il test è effettuato su prodotti non agrochimici ai campioni di suolo viene aggiunta la sostanza di prova in diverse concentrazioni e dopo 28 giorni di incubazione vengono misurate le quantità di nitrati formate nei campioni trattati ed in quelli di controllo. I risultati dei test effettuati con concentrazioni multiple sono analizzati mediante un modello di regressione ed infine vengono calcolati i valori CEx (CE50, CE25 e/o CE10. Cfr. in proposito le definizioni).
1.5 VALIDITÀ DEL TEST
Le analisi dei risultati del test sui prodotti agrochimici si basano su differenze relativamente modeste (valore medio ± 25 %) tra le concentrazioni di nitrati presenti nei campioni controllo e in quelli trattati, e dunque la presenza di forti variazioni tra i campioni controllo può portare a falsi risultati. Pertanto la variazione tra le diverse repliche dei campioni controllo deve essere inferiore a ± 15 %.
1.6 DESCRIZIONE DEL METODO DI PROVA
1.6.1 Apparecchiatura
Per il test sono utilizzati contenitori di materiale chimicamente inerte, di capacità adeguata al metodo di incubazione del suolo utilizzato (ad es. in un campione globale o in una serie di sottocampioni: cfr. paragrafo 1.7.1.2). Occorre adottare le precauzioni necessarie per ridurre al minimo l'evaporazione di acqua e consentire lo scambio di gas durante il test (ad es. i contenitori utilizzati per il test possono essere coperti con un foglio di polietilene perforato). Per i test su sostanze volatili devono essere utilizzati contenitori a chiusura ermetica e a tenuta di gas, di dimensioni tali che il campione di suolo occupi all'incirca un quarto del volume.
Si utilizza attrezzatura da laboratorio di uso comune tra cui:
|
—
|
agitatore: agitatore meccanico o dispositivo equivalente;
|
|
—
|
centrifuga (3 000 g) o sistema filtrante (con carta da filtro priva di nitrati);
|
|
—
|
strumento di sensibilità e riproducibilità adeguata per l'analisi dei nitrati.
|
1.6.2 Selezione e numero di suoli
Si utilizza un unico suolo, per il quale si raccomandano le seguenti caratteristiche:
|
—
|
contenuto in sabbia: non inferiore al 50 % e non superiore al 75 %;
|
|
—
|
contenuto di carbonio organico: 0,5-1,5 %;
|
|
—
|
deve essere misurata la biomassa microbica (8)(9): il contenuto di carbonio di quest'ultima deve corrispondere almeno all'1 % del carbonio organico totale del suolo.
|
Nella maggior parte dei casi un suolo con queste caratteristiche rappresenta l'ipotesi più sfavorevole, in quanto l'adsorbimento della sostanza chimica di prova è minimo, mentre la disponibilità per la microflora è massima e dunque in genere non è necessario effettuare il test con altri suoli. Tuttavia in alcune circostanze, ad esempio quando si prevede un uso prevalente della sostanza di prova su particolari tipi di suolo, (ad es. suoli forestali acidi) o per sostanze chimiche con carica elettrostatica, può essere necessario utilizzare un suolo aggiuntivo.
1.6.3 Prelievo e stoccaggio dei campioni di suolo
1.6.3.1 Prelievo
Devono essere disponibili informazioni dettagliate sulla storia del sito di campionamento, tra cui l'esatta ubicazione, il tipo di copertura vegetale, le date dei trattamenti con prodotti fitosanitari e con fertilizzanti organici o inorganici, l'eventuale applicazione di materiali biologici ed i casi di contaminazione accidentale. Il sito scelto per il prelievo del suolo deve consentire cicli molto lunghi; sono perciò adatti i pascoli permanenti, i terreni destinati a colture cerealicole annuali (ad eccezione del granturco) o da sovescio a semina fitta. Il sito di campionamento scelto non deve essere stato sottoposto a trattamenti con prodotti fitosanitari da almeno un anno e da almeno sei mesi non devono essere stati applicati fertilizzanti organici. L'uso di fertilizzanti minerali è ammesso solo se richiesto dal tipo di coltura in atto ed in questo caso il prelievo di campioni di suolo deve essere effettuato almeno tre mesi dopo l'applicazione del fertilizzante. Bisogna evitare di utilizzare suoli trattati con fertilizzanti di cui siano noti gli effetti biocidi (ad es. calciocianammide).
Il prelievo di campioni non deve avvenire durante o subito dopo lunghi periodi (> 30 giorni) di siccità o di saturazione idrica del terreno. Nei suoli arati i campioni devono essere prelevati ad una profondità compresa tra 0 e 20 cm. Nei suoli a prato o a pascolo o in altri suoli che non vengono arati per lunghi periodi (almeno un ciclo vegetativo) la profondità massima di campionamento può essere leggermente superiore a 20 cm (ad es. fino a 25 cm).
I campioni devono essere trasportati in contenitori adeguati e in condizioni di temperatura tali da garantire che le proprietà iniziali del suolo non vengano alterate in maniera significativa.
1.6.3.2 Stoccaggio
È preferibile utilizzare suoli appena prelevati dal terreno. Qualora non si possa evitare lo stoccaggio in laboratorio, i suoli possono essere conservati al buio ad una temperatura di 4 ± 2 oC per un massimo di tre mesi. Durante lo stoccaggio deve essere assicurato il mantenimento in condizioni aerobiche. Se i suoli vengono prelevati da zone in cui gelano per almeno tre mesi l'anno, si può prendere in considerazione lo stoccaggio per sei mesi ad una temperatura compresa tra - 18 oC e - 22 oC. Prima di ogni esperimento viene misurata la biomassa microbica dei suoli: il carbonio presente nella biomassa deve essere pari almeno all'1 % del contenuto di carbonio organico totale nel suolo (cfr. paragrafo 1.6.2).
1.6.4 Manipolazione e preparazione del suolo
1.6.4.1 Pre-incubazione
Se il suolo è stato stoccato (cfr. paragrafo 1.6.3.2), si raccomanda la pre-incubazione per un periodo compreso tra 2 e 28 giorni. Durante la pre-incubazione la temperatura e il contenuto di umidità del suolo devono essere analoghi a quelli del test (cfr. paragrafi 1.6.4.2 e 1.7.1.3).
1.6.4.2 Caratteristiche fisico-chimiche
Dopo la rimozione manuale di particelle di grandi dimensioni (ad es. sassi, parti di piante, ecc.) il suolo viene setacciato ad umido, evitando l'eccessiva essiccazione, in modo tale che la dimensione dei granuli sia inferiore o uguale a 2 mm. Il contenuto di umidità del campione di suolo deve essere regolato con acqua distillata o deionizzata ad un valore compreso tra il 40 % ed il 60 % della capacità massima di ritenzione idrica.
1.6.4.3 Ammendamento con substrato organico
Il suolo deve essere ammendato con idoneo substrato organico, ad es. farina di erba medica verde in polvere (componente principale: Medicago sativa) con un rapporto carbonio-azoto (C/N) compreso tra 12:1 e 16:1. Si raccomanda una proporzione di 5 g di erba medica per ogni chilogrammo di terreno (peso secco).
1.6.5 Preparazione della sostanza di prova per l'applicazione al suolo
Normalmente la sostanza di prova è applicata utilizzando un vettore, che può essere l'acqua (per le sostanze idrosolubili) o un solido inerte come la sabbia di quarzo fine (diametro: 0,1-0,5 mm). Si deve evitare l'uso di vettori liquidi diversi dall'acqua (ad es. solventi organici come l'acetone o il cloroformio) in quanto possono danneggiare la microflora. Se il vettore utilizzato è la sabbia, quest'ultima può essere rivestita con la sostanza di prova, disciolta o posta in sospensione in un solvente adeguato. In questi casi il solvente deve essere eliminato per evaporazione prima della miscelazione con il suolo. Per consentire una distribuzione ottimale della sostanza di prova nel suolo, si raccomanda una proporzione di 10 g di sabbia per ogni chilogrammo di suolo (peso secco). I campioni controllo sono trattati esclusivamente con una quantità equivalente di acqua e/o di sabbia di quarzo.
Se il test viene effettuato su sostanze chimiche volatili, occorre per quanto possibile evitare dispersioni durante il trattamento e cercare di assicurare una distribuzione omogenea nel suolo (ad es. la sostanza di prova deve essere iniettata in diversi punti del suolo).
1.6.6 Concentrazioni di prova
Se il test è effettuato su prodotti agrochimici, devono essere utilizzate almeno due concentrazioni. La concentrazione più bassa deve corrispondere almeno alla quantità massima che si prevede possa effettivamente penetrare nel suolo, mentre la concentrazione più elevata deve essere un multiplo della concentrazione più bassa. Le concentrazioni della sostanza di prova aggiunte al suolo sono calcolate supponendo un'incorporazione uniforme ad una profondità di 5 cm ed una densità apparente del suolo di 1,5 g/cm3. Per i prodotti agrochimici applicati direttamente al suolo o per le sostanze chimiche di cui si può prevedere la quantità che penetra nel suolo, le concentrazioni di prova raccomandate sono la massima concentrazione ambientale prevista (PEC) ed il suo quintuplo. Le sostanze per le quali si prevedono più applicazioni al suolo nel corso di una stagione devono essere testate a concentrazioni calcolate moltiplicando la PEC per il numero massimo di applicazioni previste. Tuttavia la più alta concentrazione testata non deve superare il decuplo della dose massima di applicazione. Se invece il test è effettuato su altri tipi di sostanze chimiche, si utilizza una serie geometrica di almeno cinque concentrazioni. Il range delle concentrazioni testate deve essere tale da consentire di determinare i valori CEx.
1.7 ESECUZIONE DEL TEST
1.7.1 Condizioni di esposizione
1.7.1.1 Trattamento e controllo
Qualora il test sia condotto su prodotti agrochimici, il suolo viene suddiviso in tre porzioni di uguale peso. Due di esse sono miscelate con il vettore contenente la sostanza chimica, mentre la terza è miscelata soltanto con il vettore, senza aggiunta di alcuna sostanza (campione controllo). Si raccomanda di utilizzare almeno tre repliche sia per i campioni di suolo trattato, sia per quelli di controllo. Nei test su altri tipi di sostanze chimiche il suolo viene suddiviso in sei porzioni di uguale peso. Cinque campioni vengono miscelati con il vettore contenente la sostanza di prova, mentre il sesto è miscelato unicamente con il vettore, senza aggiungere la sostanza chimica. Si raccomanda di utilizzare almeno tre repliche sia per i campioni di suolo trattato sia per quelli di controllo. Bisogna cercare di assicurare una distribuzione omogenea della sostanza di prova nei campioni di suolo trattati. Durante la miscelazione occorre evitare di compattare o agglomerare il suolo.
1.7.1.2 Incubazione dei campioni
L'incubazione dei campioni di suolo può essere effettuata in due modi: utilizzando un campione globale di suolo trattato ed uno di suolo non trattato o invece una serie di sottocampioni elementari e di uguali dimensioni di suolo trattato e di suolo non trattato. Tuttavia per le sostanze volatili il test deve necessariamente essere effettuato utilizzando una serie di sottocampioni. Se si opta per l'incubazione in un campione globale occorre preparare grandi quantità sia di suolo trattato sia di suolo non trattato e, durante il test, procedere secondo necessità al prelievo dei vari sottocampioni da analizzare. La quantità inizialmente preparata per il trattamento e per i controlli dipende dalla dimensione dei sottocampioni, dal numero di repliche utilizzate per l'analisi e dal numero massimo di tempi di campionamento previsti. I suoli incubati in un campione globale devono essere accuratamente mescolati prima di procedere al prelievo di sottocampioni. Se invece i suoli sono incubati in una serie di sottocampioni, il suolo trattato e quello non trattato vengono suddivisi nel numero di sottocampioni necessario, e questi ultimi vengono utilizzati a seconda del bisogno. Negli esperimenti in cui si possono prevedere più di due tempi di campionamento deve essere preparato un numero sufficiente di sottocampioni per tener conto di tutte le repliche e di tutti i tempi di campionamento. Per il test devono essere incubate in condizioni aerobiche almeno tre repliche di campioni di suolo (cfr. paragrafo 1.7.1.1.) Durante tutti i test devono essere utilizzati appositi contenitori con uno spazio di testa sufficiente ad evitare che si sviluppino condizioni anaerobiche. Se il test è effettuato su sostanze volatili, il metodo da impiegare è necessariamente quello dei sottocampioni.
1.7.1.3 Condizioni e durata del test
Il test viene eseguito al buio ad una temperatura ambiente di 20 ± 2 oC. Durante il test il contenuto di umidità dei campioni deve essere mantenuto tra il 40 % ed il 60 % della capacità massima di ritenzione idrica del suolo (cfr. paragrafo 1.6.4.2), con un margine di variazione di ± 5 %. Se necessario può essere aggiunta acqua distillata e deionizzata.
La durata minima dei test è di 28 giorni. Se il test è effettuato su prodotti agrochimici, i tassi di formazione di nitrati nei campioni trattati vengono comparati con quelli riscontrati nei campioni controllo. Se al ventottesimo giorno la differenza è superiore al 25 %, il test prosegue fino al raggiungimento di una differenza uguale o inferiore al 25 % o per un massimo di 100 giorni. Per le sostanze diverse dai prodotti agrochimici il test termina dopo 28 giorni. Al ventottesimo giorno vengono determinate le quantità di nitrati nei campioni trattati e nei campioni controllo e calcolati i valori CEx.
1.7.2 Campionamento e analisi dei suoli
1.7.2.1 Programma di campionamento
Se il test è condotto su prodotti agrochimici occorre analizzare i campioni di suolo per misurare la quantità di nitrati nei giorni 0, 7, 14 e 28. Qualora la durata del test debba essere prolungata, le successive misurazioni vengono effettuate ad intervalli di 14 giorni a partire dal ventottesimo giorno.
Se il test è condotto su sostanze diverse dai prodotti agrochimici, si utilizzano almeno cinque concentrazioni di prova e l'analisi dei nitrati sui campioni di suolo viene effettuata all'inizio (giorno 0) e alla fine del periodo di esposizione (giorno 28). Se necessario si può ricorrere ad una misurazione intermedia, ad esempio il giorno 7. I dati ottenuti il ventottesimo giorno sono utilizzati per determinare il valore CEx per la sostanza chimica. Eventualmente i dati ottenuti dai campioni controllo il giorno 0 possono essere utilizzati come misura della quantità iniziale di nitrati nel suolo.
1.7.2.2 Analisi dei campioni di suolo
Ad ogni campionamento viene determinata la quantità di nitrati formata in ciascuna replica dei campioni trattati e dei campioni controllo. I nitrati vengono estratti dal suolo agitando i campioni con idoneo solvente di estrazione, ad es. una soluzione 0,1 M di cloruro di potassio. Si raccomanda di utilizzare 5 ml di soluzione KCl per grammo di suolo (peso secco equivalente). Per ottimizzare l'estrazione il campione di suolo e la soluzione di estrazione non devono occupare più della metà del volume del contenitore. La miscela viene agitata a 150 giri al minuto per 60 minuti e poi centrifugata o filtrata; vengono quindi analizzate le fasi liquide per misurare i nitrati. Gli estratti liquidi privi di particelle possono essere stoccati prima dell'analisi ad una temperatura di - 20 ± 5 oC per un massimo di sei mesi.
2. DATI
2.1 TRATTAMENTO DEI RISULTATI
Se il test è effettuato su prodotti agrochimici si registra la quantità di nitrati formata in ciascun campione replicato di suolo, e i valori medi di tutti i campioni replicati devono essere riportati in una tabella. I tassi di trasformazione dell'azoto devono essere analizzati con metodi statistici adeguati e comunemente accettati (ad es. F-test, soglia di significatività del 5 %). La quantità di nitrati è espressa in mg/kg di suolo (peso secco)/die. Il tasso di formazione di nitrati riscontrato in ciascun campione trattato viene comparato con quello del campione controllo e viene calcolato lo scarto percentuale tra i due campioni.
Se il test è effettuato su altre sostanze chimiche, viene determinata la quantità di nitrati formata in ciascun campione replicato e viene costruita una curva dose-risposta per stimare i valori CEx. La quantità di nitrati ottenuta dopo 28 giorni nei campioni trattati, espressa in mg di nitrati/kg di suolo (peso secco), viene comparata con quella riscontrata nei campioni controllo. I risultati vengono utilizzati per calcolare i valori percentuali di inibizione per ogni concentrazione di prova. Su un grafico si riportano le percentuali ottenute in funzione delle concentrazioni e con metodi statistici vengono calcolati i valori CEx. Con procedure standard vengono determinati anche gli intervalli di confidenza (p = 0,95) dei valori CEx(10)(11)(12).
Le sostanze di prova che contengono elevate quantità di azoto possono contribuire alla quantità di nitrati che si forma nel corso del test. Se queste sostanze sono testate a concentrazioni elevate (come avviene ad es. per le sostanze chimiche per cui si prevedono applicazioni ripetute) il test deve prevedere adeguati controlli, ad esempio aggiungendo al suolo la sostanza di prova ma non la farina vegetale. I risultati dei controlli devono essere presi in considerazione nel calcolo dei valori CEx.
2.2 INTERPRETAZIONE DEI RISULTATI
Nella valutazione dei risultati dei test sui prodotti agrochimici, se in un qualsiasi campionamento effettuato dopo il ventottesimo giorno la differenza tra i tassi di formazione dei nitrati nel campione di suolo trattato con la concentrazione più bassa (cioè la massima concentrazione prevista) e nel campione controllo è uguale o inferiore al 25 %, si può ritenere che la sostanza testata non produce effetti a lungo termine sulla trasformazione dell'azoto nel suolo. Per la valutazione dei risultati dei test su sostanze diverse dai prodotti agrochimici si utilizzano i valori CE50, CE25 e/o CE10.
3. RELAZIONE
La relazione sull'esecuzione del test deve contenere le seguenti informazioni:
|
|
Completa identificazione del suolo utilizzato comprendente:
|
—
|
coordinate geografiche del sito (latitudine, longitudine);
|
|
—
|
informazioni sulla storia del sito (tipo di copertura vegetale, trattamenti con prodotti fitosanitari, trattamenti con fertilizzanti, casi di contaminazione accidentale, ecc.);
|
|
—
|
destinazione (ad es. suolo agricolo, forestale, ecc.);
|
|
—
|
profondità del campionamento (cm);
|
|
—
|
contenuto in sabbia/limo/argilla ( % peso secco);
|
|
—
|
contenuto di carbonio organico ( % peso secco);
|
|
—
|
contenuto di azoto ( % peso secco);
|
|
—
|
concentrazione iniziale di nitrati (mg di nitrati/kg peso secco);
|
|
—
|
capacità di scambio cationico (mmol/kg);
|
|
—
|
biomassa microbica (in termini di percentuale del carbonio organico totale);
|
|
—
|
indicazione dei metodi utilizzati per la determinazione di ciascun parametro;
|
|
—
|
tutte le informazioni relative al prelievo e allo stoccaggio dei campioni di suolo;
|
|
—
|
informazioni dettagliate sulla eventuale pre-incubazione del suolo.
|
|
|
|
Sostanza di prova:
|
—
|
natura fisica e (se pertinenti) proprietà fisico-chimiche;
|
|
—
|
dati di identificazione chimica (se pertinenti), compresa la formula strutturale, la purezza (per i prodotti fitosanitari, la percentuale di ingrediente attivo), il contenuto di azoto.
|
|
|
|
Substrato:
|
—
|
composizione (farina di erba medica, farina di erba medica verde);
|
|
—
|
contenuto di carbonio e di azoto ( % peso secco);
|
|
—
|
dimensione delle maglie del setaccio (mm).
|
|
|
|
Condizioni del test:
|
—
|
informazioni dettagliate sull'ammendamento del suolo con substrato organico;
|
|
—
|
numero di concentrazioni della sostanza chimica di prova utilizzata e, ove opportuno, giustificazione delle concentrazioni scelte;
|
|
—
|
informazioni dettagliate sulle modalità di applicazione al suolo della sostanza di prova;
|
|
—
|
temperatura di incubazione;
|
|
—
|
contenuto di umidità del suolo all'inizio e nel corso del test;
|
|
—
|
metodo di incubazione del suolo (campione globale o serie di sottocampioni);
|
|
—
|
numero di repliche dei campioni;
|
|
—
|
tempi di campionamento;
|
|
—
|
metodi utilizzati per l'estrazione dei nitrati dal suolo.
|
|
|
|
Risultati:
|
—
|
procedure analitiche e strumenti utilizzati per l'analisi dei nitrati;
|
|
—
|
tabelle dei risultati, con i valori singoli ed i valori medi della misurazione dei nitrati;
|
|
—
|
variazioni tra le differenti repliche dei campioni trattati e dei campioni controllo;
|
|
—
|
giustificazioni delle eventuali correzioni apportate ai calcoli;
|
|
—
|
scarto percentuale tra i tassi di formazione dei nitrati per ciascun campionamento o, se opportuno, valore CE50 con un intervallo di confidenza del 95 %, altri valori CEx (CE25 o CE10) con i rispettivi intervalli di confidenza e grafico della curva dose-risposta;
|
|
—
|
trattamento statistico dei risultati;
|
|
—
|
altre informazioni e osservazioni utili per l'interpretazione dei risultati.
|
|
4. BIBLIOGRAFIA
|
(1)
|
EPPO (1994). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Chemicals. Chapter 7: Soil Microflora. EPPO Bulletin 24: 1-16, 1994.
|
|
(2)
|
BBA (1990). Effects on the Activity of the Soil Microflora. BBA Guidelines for the Official Testing of Plant Protection Products, VI, 1-1 (2nd eds., 1990).
|
|
(3)
|
EPA (1987). Soil Microbial Community Toxicity Test. EPA 40 CFR Part 797.3700. Toxic Substances Control Act Test Guidelines; Proposed rule. September 28, 1987.
|
|
(4)
|
SETAC-Europe (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides, Ed. M.R. Lynch, Pub. SETAC-Europe, Brussels.
|
|
(5)
|
ISO/DIS 14238 (1995). Soil Quality — Determination of Nitrogen Mineralisation and Nitrification in Soils and the Influence of Chemicals on these Processes. Technical Committee ISO/TC 190/SC 4: Soil Quality — Biological Methods.
|
|
(6)
|
OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italy, 18-20 January 1995.
|
|
(7)
|
ISO 10381-6 (1993). Soil quality — Sampling. Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory.
|
|
(8)
|
ISO 14240-1 (1997). Soil quality — Determination of soil microbial biomass — Part 1: Substrate-induced respiration method.
|
|
(9)
|
ISO 14240-2 (1997). Soil quality — Determination of soil microbial biomass — Part 2: Fumigationextraction method.
|
|
(10)
|
Litchfield, J.T. e Wilcoxon F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, 99-113.
|
|
(11)
|
Finney, D.J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New-York.
|
|
(12)
|
Finney, D.J. (1978). Statistical Methods in biological Assay. Griffin, Weycombe, UK.
|
C.22. MICRORGANISMI DEL SUOLO: TEST DI TRASFORMAZIONE DEL CARBONIO
1. METODO
Questo metodo di prova corrisponde al TG 217 (2000) dell'OCSE.
1.1 INTRODUZIONE
Qui di seguito è descritto un metodo di laboratorio messo a punto per studiare i potenziali effetti a lungo termine di un'unica esposizione a prodotti fitosanitari e possibilmente ad altre sostanze chimiche sull'attività di trasformazione del carbonio ad opera dei microrganismi del suolo. Il test si basa principalmente sulle raccomandazioni dell'Organizzazione europea e mediterranea per la protezione delle piante (1), ma tiene conto anche delle linee guida formulate dal Centro federale tedesco di ricerca biologica per l'agricoltura e la silvicoltura (Biologische Bundesanstalt für Land und Forstwirtschaft) (2), dall'Agenzia per la protezione dell'ambiente degli Stati Uniti (Environmental Protection Agency) (3), e dal SETAC (4). Il numero ed il tipo di suoli da utilizzare nel test sono stati concordati in occasione di un workshop dell'OCSE sulla selezione dei suoli e dei sedimenti, svoltosi a Belgirate nel 1995 (5). Le raccomandazioni riguardanti il prelievo, la manipolazione e lo stoccaggio dei campioni di suolo si basano su linee guida ISO (6) e sulle raccomandazioni formulate dal workshop di Belgirate.
Per accertare e valutare le caratteristiche tossiche delle sostanze di prova può essere necessario determinarne gli effetti sull'attività microbica del suolo, ad esempio quando occorre disporre di dati sui potenziali effetti collaterali dei prodotti fitosanitari sulla microflora del suolo o quando si prevede un'esposizione dei microrganismi del suolo ad altri tipi di sostanze chimiche. Il test di trasformazione del carbonio viene effettuato per determinare gli effetti di tali sostanze chimiche sulla microflora del suolo. Qualora siano testati prodotti agrochimici (ad es. fitosanitari, fertilizzanti, prodotti chimici per la silvicoltura), oltre al test di trasformazione dell'azoto si effettua anche il test di trasformazione del carbonio. Per le altre sostanze chimiche è invece sufficiente il test di trasformazione dell'azoto. Tuttavia se i valori CE50 riscontrati per queste sostanze nel test di trasformazione dell'azoto corrispondono a quelli degli inibitori della nitrificazione disponibili in commercio (ad es. nitrapirina), per ottenere maggiori informazioni può essere effettuato anche il test di trasformazione del carbonio.
I suoli sono costituiti da miscele eterogenee e complesse di componenti viventi e non viventi. I microrganismi svolgono un ruolo importante nella decomposizione e nella trasformazione della materia organica in suolo fertile, contribuendo in maniera differente a seconda delle specie ai vari aspetti della fertilizzazione. Eventuali interferenze con questi processi biochimici rischiano a lungo termine di influenzare il ciclo delle sostanze nutritive e di alterare la fertilità del suolo. La trasformazione del carbonio e dell'azoto avviene in tutti i suoli fertili; anche se le comunità microbiche responsabili di questi processi variano a seconda del tipo di suolo, le vie di trasformazione sono sostanzialmente le stesse.
Il metodo di prova di seguito descritto è stato concepito per individuare gli effetti nocivi a lungo termine di una data sostanza sul processo di trasformazione del carbonio nei suoli aerobici superficiali. Il test è sensibile alle variazioni di dimensione e di attività delle comunità microbiche responsabili della trasformazione del carbonio in quanto sottopone tali comunità sia ad uno stress chimico che ad una carenza di carbonio. Viene utilizzato un suolo sabbioso con un basso contenuto di materia organica, che viene trattato con la sostanza di prova ed incubato in condizioni che consentono un rapido metabolismo microbico. In tali condizioni, le fonti di carbonio prontamente disponibile nel suolo si esauriscono rapidamente. Ciò provoca una carenza di carbonio, che da un lato provoca la morte delle cellule microbiche e dall'altro induce dormienza e/o sporulazione. Se il test prosegue per più di 28 giorni, la somma di queste reazioni può essere misurata nei campioni controllo (costituiti da suolo non trattato) come perdita progressiva di biomassa microbica metabolicamente attiva (7). Se nelle condizioni di esecuzione del test la biomassa del suolo sottoposto a stress da carenza di carbonio subisce la presenza di una sostanza chimica, è possibile che essa non riesca a tornare allo stesso livello del campione controllo, per cui si può dedurre che le perturbazioni provocate dalla sostanza di prova in un qualsiasi momento del test spesso dureranno fino alla fine del test.
I test su cui si basa questo metodo di prova sono stati originariamente concepiti per sostanze di cui è possibile stimare la quantità che penetra nel suolo. È il caso, ad esempio, dei prodotti fitosanitari, la cui dose di applicazione nel terreno è conosciuta. Per i prodotti agrochimici è sufficiente utilizzare due concentrazioni di prova, corrispondenti alla dose di applicazione prevista o stimata; tali prodotti possono essere testati come ingredienti attivi (i.a.) o come prodotti formulati. Tuttavia il test non si limita alle sostanze chimiche le cui concentrazioni ambientali siano prevedibili; cambiando sia la quantità della sostanza di prova applicata al suolo sia le modalità di valutazione dei dati il test può infatti essere utilizzato anche per altre sostanze chimiche, di cui non si conosca la quantità che penetra nel suolo; in questo caso è possibile determinare gli effetti sulla trasformazione del carbonio di una serie di concentrazioni. I dati ottenuti sono utilizzati per costruire una curva dose-risposta e calcolare i valori CEx, dove x è la percentuale di effetto.
1.2 DEFINIZIONI
Trasformazione del carbonio: degradazione ad opera dei microrganismi di materia organica, con formazione di un prodotto finale inorganico, l'anidride carbonica.
CE
x
(concentrazione efficace): concentrazione della sostanza di prova nel suolo che determina un'inibizione dell'x per cento nella trasformazione del carbonio in anidride carbonica.
CE
50
(concentrazione efficace media): concentrazione della sostanza di prova nel suolo che determina un'inibizione del 50 % nella trasformazione del carbonio in anidride carbonica.
1.3 SOSTANZE DI RIFERIMENTO
Nessuna.
1.4 PRINCIPIO DEL METODO DI PROVA
Dopo la setacciatura, una parte del suolo viene trattata con la sostanza di prova mentre un'altra parte non è sottoposta ad alcun trattamento (controllo). Se il test è effettuato su prodotti agrochimici si raccomanda di utilizzare almeno due concentrazioni di prova, scelte in relazione alla massima concentrazione prevista nel terreno. Dopo 0, 7, 14 e 28 giorni di incubazione, i campioni di suolo trattati con la sostanza di prova e i campioni controllo sono miscelati con glucosio e per 12 ore consecutive vengono misurati i tassi di respirazione indotta dal glucosio, espressi in termini di anidride carbonica emessa (mg di anidride carbonica/kg di suolo peso secco/ora) o di ossigeno consumato (mg di ossigeno/kg di suolo/ora). Il tasso di respirazione medio dei campioni di suolo trattato viene comparato con quello dei campioni controllo e viene calcolata la percentuale di scarto del campione trattato rispetto al campione controllo. Tutti i test durano almeno 28 giorni. Se al ventottesimo giorno le differenze tra i campioni trattati e non trattati sono uguali o superiori al 25 %, le misurazioni continuano ad intervalli di 14 giorni fino ad un massimo di 100 giorni. Se il test è effettuato su prodotti non agrochimici, ai campioni di suolo viene aggiunta la sostanza di prova in diverse concentrazioni e dopo 28 giorni vengono misurati i tassi di respirazione indotta dal glucosio (cioè la media delle quantità di anidride carbonica prodotta o di ossigeno consumato). I risultati dei test effettuati con una serie di concentrazioni sono analizzati mediante un modello di regressione; infine vengono calcolati i valori CEx (CE50, CE25 e/o CE10. Cfr. in proposito le definizioni).
1.5 VALIDITÀ DEL TEST
Le analisi dei risultati del test sui prodotti agrochimici si basano su differenze relativamente modeste (valore medio ± 25 %) tra l'anidride carbonica emessa o l'ossigeno consumato nei (o dai) campioni di suolo trattato e nei controlli, e dunque la presenza di forti variazioni tra i campioni controllo può portare a falsi risultati. Pertanto la variazione tra le diverse repliche dei campioni controllo deve essere inferiore a ± 15 %.
1.6 DESCRIZIONE DEL METODO DI PROVA
1.6.1 Apparecchiatura
Per il test sono utilizzati contenitori di materiale chimicamente inerte, di capacità adeguata al metodo di incubazione del suolo utilizzato (ad es. in un campione globale o in una serie di campioni singoli: cfr. paragrafo 1.7.1.2). Occorre adottare le precauzioni necessarie per ridurre al minimo l'evaporazione di acqua e consentire lo scambio di gas durante il test (ad es. i contenitori utilizzati per il test possono essere coperti con un foglio di polietilene perforato). Per i test su sostanze volatili, devono essere utilizzati contenitori a chiusura ermetica e a tenuta di gas, di dimensioni tali che il campione di suolo occupi all'incirca un quarto del volume.
Per determinare i tassi di respirazione indotta dal glucosio sono necessari sistemi di incubazione e strumenti per la misurazione della produzione di anidride carbonica o del consumo di ossigeno. La letteratura scientifica citata in bibliografia riporta alcuni esempi di sistemi e strumenti utilizzabili [cfr. (8) (9) (10) (11)].
1.6.2 Selezione e numero di suoli
Si utilizza un unico suolo, per il quale si raccomandano le seguenti caratteristiche:
|
—
|
contenuto in sabbia: non inferiore al 50 % e non superiore al 75 %;
|
|
—
|
contenuto di carbonio organico: 0,5-1,5 %;
|
|
—
|
deve essere misurata la biomassa microbica (12)(13), il cui contenuto di carbonio deve corrispondere almeno all'1 % del carbonio organico totale del suolo.
|
Nella maggior parte dei casi un suolo con queste caratteristiche rappresenta l'ipotesi più sfavorevole, in quanto l'adsorbimento della sostanza chimica di prova è minimo, mentre la disponibilità per la microflora è massima e dunque in genere non è necessario effettuare il test con altri suoli. Tuttavia in alcune circostanze, ad esempio quando si prevede un uso prevalente della sostanza di prova su particolari tipi di suolo (ad es. i suoli forestali acidi) o per sostanze chimiche con carica elettrostatica, può essere necessario utilizzare un suolo aggiuntivo.
1.6.3 Prelievo e stoccaggio dei campioni di suolo
1.6.3.1 Prelievo
Devono essere disponibili informazioni dettagliate sulla storia del sito di campionamento, tra cui l'esatta ubicazione, il tipo di copertura vegetale, le date dei trattamenti con prodotti fitosanitari e con fertilizzanti organici o inorganici, l'eventuale applicazione di materiali biologici ed i casi di contaminazione accidentale. Il sito scelto per il prelievo del suolo deve consentire cicli molto lunghi; sono perciò adatti i pascoli permanenti, i terreni destinati a colture cerealicole annuali (ad eccezione del granturco) o da sovescio a semina fitta. Il sito di campionamento scelto non deve essere stato sottoposto a trattamenti con prodotti fitosanitari da almeno un anno e da almeno sei mesi non devono essere stati applicati fertilizzanti organici. L'uso di fertilizzanti minerali è ammesso solo se richiesto dal tipo di coltura in atto ed in questo caso il prelievo di campioni di suolo deve essere effettuato almeno tre mesi dopo l'applicazione del fertilizzante. Bisogna evitare di utilizzare suoli trattati con fertilizzanti di cui siano noti gli effetti biocidi (ad es. calciocianammide).
Il prelievo di campioni non deve avvenire durante o subito dopo lunghi periodi (> 30 giorni) di siccità o di saturazione idrica del terreno. Nei suoli arati i campioni devono essere prelevati ad una profondità compresa tra 0 e 20 cm. Nei suoli a prato o a pascolo o in altri suoli che non vengono arati per lunghi periodi (almeno un ciclo vegetativo) la profondità massima di campionamento può essere leggermente superiore a 20 cm (ad es. fino a 25 cm). I campioni devono essere trasportati in contenitori adeguati e in condizioni di temperatura tali da garantire che le proprietà iniziali del suolo non vengano alterate in maniera significativa.
1.6.3.2 Stoccaggio
È preferibile l'uso di suoli appena prelevati dal terreno. Qualora non si possa evitare lo stoccaggio in laboratorio, i suoli possono essere conservati al buio ad una temperatura di 4 ± 2 oC per un massimo di tre mesi. Durante lo stoccaggio deve essere assicurato il mantenimento in condizioni aerobiche. Se i suoli vengono prelevati da zone in cui gelano per almeno tre mesi l'anno, si può prendere in considerazione lo stoccaggio per sei mesi ad una temperatura compresa tra - 18 oC e - 22 oC. Prima di ogni esperimento viene misurata la biomassa microbica dei suoli: il carbonio presente nella biomassa deve essere pari almeno all'1 % del contenuto di carbonio organico totale nel suolo (cfr. paragrafo 1.6.2).
1.6.4 Manipolazione e preparazione del suolo
1.6.4.1 Pre-incubazione
Se il suolo è stato stoccato (cfr. paragrafi 1.6.4.2 e 1.7.1.3), si raccomanda la pre-incubazione per un periodo compreso tra 2 e 28 giorni. Durante la pre-incubazione la temperatura e il contenuto di umidità del suolo devono essere analoghi a quelli del test (cfr. paragrafi 1.6.4.2 e 1.7.1.3).
1.6.4.2 Caratteristiche fisico-chimiche
Dopo la rimozione manuale di particelle di grandi dimensioni (ad es. sassi, parti di piante, ecc.) il suolo viene setacciato ad umido, evitando l'eccessiva essiccazione, in modo tale che la dimensione dei granuli sia inferiore o uguale a 2 mm. Il contenuto di umidità del campione di suolo deve essere regolato con acqua distillata o deionizzata ad un valore compreso tra il 40 % ed il 60 % della capacità massima di ritenzione idrica.
1.6.5 Preparazione della sostanza di prova per l'applicazione al suolo
Normalmente la sostanza di prova è applicata utilizzando un vettore, che può essere l'acqua (per le sostanze idrosolubili) o un solido inerte come la sabbia di quarzo fine (diametro: 0,1-0,5 mm). Si deve evitare l'uso di vettori liquidi diversi dall'acqua (ad es. solventi organici come l'acetone o il cloroformio) in quanto possono danneggiare la microflora. Se il vettore utilizzato è la sabbia, quest'ultima può essere rivestita con la sostanza di prova, disciolta o posta in sospensione in un solvente adeguato. In questi casi il solvente deve essere eliminato per evaporazione prima della miscelazione con il suolo. Per consentire una distribuzione ottimale della sostanza di prova nel suolo, si raccomanda una proporzione di 10 g di sabbia per ogni chilogrammo di suolo (peso secco). I campioni controllo sono trattati esclusivamente con la quantità equivalente di acqua e/o di sabbia di quarzo.
Se il test viene effettuato su sostanze chimiche volatili, occorre per quanto possibile evitare dispersioni durante il trattamento e cercare di assicurare una distribuzione omogenea nel suolo (ad es. la sostanza di prova deve essere iniettata in diversi punti del suolo).
1.6.6 Concentrazioni di prova
Se il test è effettuato su prodotti agrochimici o su altre sostanze chimiche le cui concentrazioni ambientali siano prevedibili, devono essere utilizzate almeno due concentrazioni di prova. La concentrazione più bassa deve corrispondere almeno alla quantità massima che si prevede possa effettivamente penetrare nel suolo, mentre la concentrazione più elevata deve essere un multiplo della concentrazione più bassa. Le concentrazioni della sostanza di prova aggiunte al suolo sono calcolate supponendo un'incorporazione uniforme ad una profondità di 5 cm ed una densità apparente del suolo di 1,5 g/cm3. Per i prodotti agrochimici applicati direttamente al suolo o per le sostanze chimiche di cui si può prevedere la quantità che penetra nel suolo, le concentrazioni di prova raccomandate sono la massima concentrazione ambientale prevista (PEC) ed il suo quintuplo. Le sostanze per le quali si prevedono più applicazioni al suolo nel corso di una stagione devono essere testate a concentrazioni calcolate moltiplicando la PEC per il numero massimo di applicazioni previste. Tuttavia la più alta concentrazione testata non deve superare il decuplo della dose massima di applicazione.
Se invece il test è effettuato su altri tipi di sostanze chimiche, si utilizza una serie geometrica di almeno cinque concentrazioni. Il range delle concentrazioni testate deve essere tale da consentire di determinare i valori CEx.
1.7 ESECUZIONE DEL TEST
1.7.1 Condizioni di esposizione
1.7.1.1 Trattamento e controllo
Qualora il test sia condotto su prodotti agrochimici, il suolo viene suddiviso in tre porzioni di uguale peso. Due di esse sono miscelate con il vettore contenente la sostanza chimica, mentre la terza è miscelata soltanto con il vettore, senza aggiunta della sostanza (campione controllo). Si raccomanda di utilizzare almeno tre repliche sia per i campioni di suolo trattato sia per quelli di controllo. Nei test su altri tipi di sostanze chimiche il suolo viene suddiviso in sei porzioni di uguale peso. Cinque campioni vengono miscelati con il vettore contenente la sostanza di prova, mentre il sesto è miscelato unicamente con il vettore, senza aggiungere la sostanza chimica. Si raccomanda di utilizzare almeno tre repliche sia per i campioni di suolo trattato sia per quelli di controllo. Bisogna cercare di assicurare una distribuzione omogenea della sostanza di prova nei campioni di suolo trattati. Durante la miscelazione, bisogna evitare di compattare o di agglomerare il suolo.
1.7.1.2 Incubazione dei campioni
L'incubazione dei campioni di suolo può essere effettuata in due modi: utilizzando un campione globale di suolo trattato ed uno di suolo non trattato o invece una serie di sottocampioni elementari e di uguali dimensioni di suolo trattato e di suolo non trattato. Tuttavia per le sostanze volatili il test deve necessariamente essere effettuato utilizzando una serie di sottocampioni. Se si opta per l'incubazione in un campione globale, occorre preparare grandi quantità sia di suolo trattato sia di suolo non trattato e, durante il test, procedere secondo necessità al prelievo dei vari sottocampioni da analizzare. La quantità inizialmente preparata per il trattamento e i controlli dipende dalla dimensione dei sottocampioni, dal numero di repliche utilizzate per l'analisi e dal numero massimo di tempi di campionamento previsti. I suoli incubati in un campione globale devono essere accuratamente mescolati prima di procedere al prelievo di sottocampioni. Se invece i suoli sono incubati in una serie di sottocampioni, il suolo trattato e quello non trattato vengono suddivisi nel numero di sottocampioni necessario, e questi ultimi vengono utilizzati a seconda del bisogno. Negli esperimenti in cui si possono prevedere più di due tempi di campionamento deve essere preparato un numero sufficiente di sottocampioni per tener conto di tutte le repliche e di tutti i tempi di campionamento. Per il test devono essere incubate in condizioni aerobiche almeno tre repliche di campioni di suolo (cfr. paragrafo 1.7.1.1.) Durante tutti i test devono essere utilizzati appositi contenitori con uno spazio di testa sufficiente ad evitare che si sviluppino condizioni anaerobiche. Se il test è effettuato su sostanze volatili, il metodo da impiegare è necessariamente quello dei sottocampioni.
1.7.1. Condizioni e durata del test
Il test viene eseguito al buio ad una temperatura ambiente di 20 ± 2 oC. Durante il test il contenuto di umidità dei campioni deve essere mantenuto tra il 40 % ed il 60 % della capacità massima di ritenzione idrica del suolo (cfr. paragrafo 1.6.4.2), con un margine di variazione di ± 5 %. Se necessario può essere aggiunta acqua distillata e deionizzata.
La durata minima dei test è di 28 giorni. Se il test è effettuato su prodotti agrochimici, viene comparata la quantità di anidride carbonica emessa o di ossigeno consumato nei campioni trattati e nei controlli. Se al ventottesimo giorno la differenza è superiore al 25 %, il test prosegue fino al raggiungimento di una differenza uguale o inferiore al 25 % o per un massimo di 100 giorni. Per le sostanze diverse dai prodotti agrochimici il test termina dopo 28 giorni. Al ventottesimo giorno viene determinata la quantità di anidride carbonica emessa o di ossigeno consumato nei campioni trattati e in quelli di controllo e vengono calcolati i valori CEx.
1.7.2 Campionamento e analisi dei suoli
1.7.2.1 Programma di campionamento
Se il test è condotto su prodotti agrochimici occorre analizzare i campioni di suolo per misurare i tassi di respirazione indotta dal glucosio nei giorni 0, 7, 14 e 28. Qualora la durata del test debba essere prolungata, le successive misurazioni vengono effettuate ad intervalli di 14 giorni a partire dal ventottesimo giorno.
Se il test è condotto su sostanze diverse dai prodotti agrochimici, si utilizzano almeno cinque concentrazioni di prova e l'analisi dei tassi di respirazione indotta dal glucosio viene effettuata all'inizio (giorno 0) e alla fine del periodo di esposizione (giorno 28). Se necessario si può ricorrere ad una misurazione intermedia, ad esempio il giorno 7. I dati ottenuti il ventottesimo giorno sono utilizzati per determinare il valore CEx per la sostanza chimica. Eventualmente i dati ottenuti dai campioni controllo il giorno 0 possono essere utilizzati come misura della quantità iniziale di biomassa microbica metabolicamente attiva nel suolo (12).
1.7.2.2 Misura dei tassi di respirazione indotta dal glucosio
Ad ogni campionamento viene determinato il tasso di respirazione indotta dal glucosio in ciascuna replica dei campioni trattati e dei campioni controllo. I campioni di suolo vengono miscelati con una quantità di glucosio sufficiente a provocare una reazione respiratoria massima immediata. La quantità di glucosio necessaria per provocare una reazione respiratoria massima in un dato suolo può essere determinata in un test preliminare con una serie di concentrazioni della sostanza (14). Tuttavia, nel caso di suoli sabbiosi con un contenuto di carbonio organico compreso tra lo 0,5 e l'1,5 %, in genere è sufficiente una quantità di glucosio compresa tra 2 000 e 4 000 mg per chilogrammo di suolo (peso secco). Il glucosio può essere ridotto in polvere con sabbia di quarzo fine [10 g di sabbia/kg di suolo (peso secco)] e miscelato con il suolo in modo tale da assicurarne una distribuzione omogenea.
I campioni di suolo arricchiti con glucosio vengono incubati a 20 ± 2 oC in un apparecchio che consenta di misurare i tassi di respirazione in modo continuo, ogni ora, oppure ogni due ore (cfr. paragrafo 1.6.1). Per 12 ore consecutive vengono misurati l'anidride carbonica emessa o l'ossigeno consumato. Le misurazioni devono iniziare quanto prima, cioè entro 1-2 ore dall'aggiunta del glucosio. Dopo aver misurato la quantità totale di anidride carbonica emessa o di ossigeno consumato nel corso delle 12 ore, vengono determinati i tassi medi di respirazione.
2. DATI
2.1 TRATTAMENTO DEI RISULTATI
Se il test è effettuato su prodotti agrochimici si registra la quantità di anidride carbonica emessa o di ossigeno consumato da ciascun campione replicato di suolo e si riportano in una tabella i valori medi di tutti i campioni replicati. I risultati devono essere analizzati con metodi statistici adeguati e comunemente accettati (ad es. F-test, soglia di significatività del 5 %). I tassi di respirazione indotta dal glucosio sono espressi in mg di anidride carbonica/kg di suolo (peso secco)/ora o in mg di ossigeno/suolo (peso secco)/ora. Il tasso medio di produzione di anidride carbonica o il tasso medio di consumo di ossigeno riscontrato in ciascun campione trattato viene comparato con quello del campione controllo e viene calcolato lo scarto percentuale fra i due campioni.
Se il test è effettuato su altre sostanze chimiche, viene determinata la quantità di anidride carbonica emessa o di ossigeno consumato da ciascun campione replicato e viene costruita una curva dose-risposta per stimare i valori CEx. I tassi di respirazione indotta dal glucosio riscontrati dopo 28 giorni nei campioni trattati [espressi in mg di anidride carbonica/kg di suolo (peso secco)/ora o in mg di ossigeno/suolo (peso secco)/ora] sono comparati con quelli dei campioni controllo. I risultati vengono utilizzati per calcolare i valori percentuali di inibizione per ogni concentrazione di prova. Su un grafico si riportano le percentuali ottenute in funzione delle concentrazioni e con metodi statistici vengono calcolati i valori CEx. Con procedure standard vengono determinati anche gli intervalli di confidenza (p = 0,95) dei valori CEx (15)(16)(17).
2.2 INTERPRETAZIONE DEI RISULTATI
Nella valutazione dei risultati dei test sui prodotti agrochimici, se in un qualsiasi campionamento effettuato dopo il ventottesimo giorno la differenza tra i tassi di respirazione nel campione di suolo trattato con la concentrazione più bassa (cioè la massima concentrazione prevista) e nel campione controllo è uguale o inferiore al 25 %, si può ritenere che la sostanza testata non produce effetti a lungo termine sulla trasformazione del carbonio nel suolo. Per la valutazione dei risultati dei test su sostanze diverse dai prodotti agrochimici si utilizzano i valori CE50, CE25 e/o CE10.
3. RELAZIONE
RELAZIONE SULL'ESECUZIONE DEL TEST
La relazione sull'esecuzione del test deve contenere le seguenti informazioni:
|
|
Completa identificazione del suolo utilizzato comprendente:
|
—
|
coordinate geografiche del sito (latitudine, longitudine);
|
|
—
|
informazioni sulla storia del sito (tipo di copertura vegetale, trattamenti con prodotti fitosanitari, trattamenti con fertilizzanti, casi di contaminazione accidentale, ecc.);
|
|
—
|
destinazione (ad es. suolo agricolo, forestale, ecc.);
|
|
—
|
profondità del campionamento (cm);
|
|
—
|
contenuto in sabbia/limo/argilla ( % peso secco);
|
|
—
|
contenuto di carbonio organico ( % peso secco);
|
|
—
|
contenuto di azoto ( % peso secco);
|
|
—
|
capacità di scambio cationico (mmol/kg);
|
|
—
|
biomassa microbica iniziale (in termini di percentuale del carbonio organico totale);
|
|
—
|
indicazione dei metodi utilizzati per la determinazione di ciascun parametro;
|
|
—
|
tutte le informazioni relative al prelievo e allo stoccaggio dei campioni di suolo;
|
|
—
|
informazioni dettagliate sulla eventuale pre-incubazione del suolo.
|
|
|
|
Sostanza di prova:
|
—
|
natura fisica e (se pertinenti) proprietà fisico-chimiche;
|
|
—
|
dati di identificazione chimica (se pertinenti), compresa la formula strutturale, la purezza (per i prodotti fitosanitari, la percentuale di ingrediente attivo), il contenuto di azoto.
|
|
|
|
Condizioni del test:
|
—
|
informazioni dettagliate sull'ammendamento del suolo con substrato organico;
|
|
—
|
numero di concentrazioni della sostanza chimica di prova utilizzata e, ove opportuno, giustificazione delle concentrazioni scelte;
|
|
—
|
informazioni dettagliate sulle modalità di applicazione al suolo della sostanza di prova;
|
|
—
|
temperatura di incubazione;
|
|
—
|
contenuto di umidità del suolo all'inizio e nel corso del test;
|
|
—
|
metodo di incubazione del suolo utilizzato (campione globale o serie di sottocampioni);
|
|
—
|
numero di repliche dei campioni;
|
|
—
|
tempi di campionamento.
|
|
|
|
Risultati:
|
—
|
metodo e strumenti utilizzati per misurare i tassi di respirazione;
|
|
—
|
tabelle dei risultati, con i valori singoli e i valori medi delle quantità di anidride carbonica o di ossigeno;
|
|
—
|
variazioni tra le differenti repliche dei campioni trattati e dei campioni controllo;
|
|
—
|
giustificazioni delle eventuali correzioni apportate ai calcoli;
|
|
—
|
scarto percentuale tra i tassi di respirazione indotta dal glucosio registrati in ciascun campionamento o, se del caso, valore CE50 con un intervallo di confidenza del 95 %, altri valori CEx (CE25 o CE10) con i rispettivi intervalli di confidenza e grafico della curva dose-risposta;
|
|
—
|
trattamento statistico dei risultati, ove opportuno;
|
|
—
|
altre informazioni e osservazioni utili per l'interpretazione dei risultati.
|
|
4. BIBLIOGRAFIA
|
(1)
|
EPPO (1994). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Chemicals. Chapter 7: Soil Microflora. EPPO Bulletin 24: 1-16, 1994.
|
|
(2)
|
BBA (1990). Effects on the Activity of the Soil Microflora. BBA Guidelines for the Official Testing of Plant Protection Products, VI, 1-1 (2ndeds., 1990).
|
|
(3)
|
EPA (1987). Soil Microbial Community Toxicity Test. EPA 40 CFR Part 797.3700. Toxic Substances Control Act Test Guidelines; Proposed rule. September 28, 1987.
|
|
(4)
|
SETAC-Europe (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides, Ed. M.R. Lynch, Pub. SETAC-Europe, Brussels.
|
|
(5)
|
OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italy, 18-20 January 1995.
|
|
(6)
|
ISO 10381-6 (1993). Soil quality — Sampling. Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory.
|
|
(7)
|
Anderson, J.P.E. (1987). Handling and Storage of Soils for Pesticide Experiments, in «Pesticide Effects on Soil Microflora». Eds. L. Somerville and M.P. Greaves, Chap. 3: 45-60.
|
|
(8)
|
Anderson, J.P.E. (1982). Soil Respiration, in «Methods of Soil Analysis — Part 2: Chemical and Microbiological Properties». Agronomy Monograph No 9. Eds. A.L. Page, R.H. Miller and D.R. Keeney. 41:831-871.
|
|
(9)
|
ISO 11266-1. (1993). Soil Quality — Guidance on Laboratory Tests for Biodegradation in Soil: Part 1. Aerobic Conditions.
|
|
(10)
|
ISO 14239 (1997E). Soil Quality — Laboratory incubation systems for measuring the mineralization of organic chemicals in soil under aerobic conditions.
|
|
(11)
|
Heinemeyer O., Insam, H., Kaiser, E.A, Walenzik, G. (1989). Soil microbial biomass and respiration measurements; an automated technique based on infrared gas analyses. Plant and Soil, 116: 77-81.
|
|
(12)
|
ISO 14240-1 (1997). Soil quality — Determination of soil microbial biomass — Part 1: Substrate-induced respiration method.
|
|
(13)
|
ISO 14240-2 (1997). Soil quality — Determination of soil microbial biomass — Part 2: Fumigationextraction method.
|
|
(14)
|
Malkomes, H.-P. (1986). Einfluß von Glukosemenge auf die Reaktion der Kurzzeit-Atmung im Boden Gegenüber Pflanzenschutzmitteln, Dargestellt am Beispiel eines Herbizide. Nachrichtenbl. Deut. Pflanzenschutzd., Braunschweig, 38:113-120.
|
|
(15)
|
Litchfield, J.T. — Wilcoxon, F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol, and Exper. Ther., 96, 99-113.
|
|
(16)
|
Finney, D.J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New-York.
|
|
(17)
|
Finney D.J. (1978). Statistical Methods in biological Assay. Griffin, Weycombe, UK.
|
C.23. TRASFORMAZIONE AEROBICA E ANAEROBICA NEL SUOLO
1. METODO
Questo metodo corrisponde al TG 307 (2002) dell'OCSE.
1.1 INTRODUZIONE
Il presente metodo di test è basato sulle linee guida esistenti (1)(2)(3)(4)(5)(6)(7)(8)(9). Il metodo descritto è progettato per determinare la trasformazione aerobica ed anaerobica delle sostanze chimiche nel suolo. Gli esperimenti eseguiti hanno l'obiettivo di determinare: i) la velocità di trasformazione della sostanza di prova e ii) la natura e la velocità di formazione e di diminuzione dei prodotti di trasformazione ai quali possono essere esposti piante ed organismi del suolo. Tali studi sono necessari per le sostanze chimiche che vengono applicate direttamente sul suolo o che abbiano probabilità di raggiungere l'ambiente del suolo. I risultati di questi studi di laboratorio possono essere utilizzati anche per sviluppare protocolli di campionamento e di analisi per studi correlati sul campo.
Per la valutazione delle vie di trasformazione sono in genere sufficienti gli studi aerobici ed anaerobici con un solo tipo di suolo (8)(10)(11). I tassi di trasformazione vanno determinati in almeno altri tre suoli (8)(10).
Un workshop dell'OCSE sulla selezione dei suoli e dei sedimenti, tenutosi a Belgirate nel 1995 (10), ha definito, in particolare, il numero e i tipi di suoli da usarsi in questo test. I tipi di suoli esaminati devono essere rappresentativi delle condizioni ambientali in cui la sostanza verrà usata o rilasciata. Per esempio, le sostanze chimiche che potrebbero essere rilasciate in climi subtropicali e tropicali vanno testate utilizzando Ferrasols o Nitosols (sistema FAO). Il workshop ha inoltre espresso raccomandazioni circa la raccolta, la manipolazione e la conservazione dei campioni, sulla base delle linee guida ISO (15). Questo metodo prevede anche l'uso di suoli per risaia.
1.2 DEFINIZIONI
Sostanza di prova: qualsiasi sostanza, sia un composto progenitore che i relativi prodotti di trasformazione.
Prodotti di trasformazione: tutte le sostanze derivanti da reazioni di trasformazione biotica o abiotica della sostanza di prova, compresi CO2 e i prodotti che si trovano in residui non estraibili.
Residui non estraibili: i «residui non estraibili» sono sostanze nel suolo, nelle piante o negli animali, che dopo estrazione persistono nella matrice sotto forma di sostanza progenitrice o dei suoi metaboliti o prodotti di trasformazione. Il metodo di estrazione non deve alterare in modo considerevole le sostanze stesse o la struttura della matrice. La natura del legame può essere in parte chiarita mediante metodi di estrazione che alterano la matrice e sofisticate tecniche analitiche. Fino ad oggi, ad esempio, in questo modo sono stati identificati i legami ionici covalenti e di assorbimento/adsorbimento, oltre alle catture. In generale, la formazione di residui non estraibili riduce significativamente la bioaccessibilità e la biodisponibilità (12) [modificato da IUPAC 1984 (13)].
Trasformazione aerobica: reazioni che hanno luogo in presenza di ossigeno molecolare (14).
Trasformazione anaerobica: reazioni che hanno luogo in assenza di ossigeno molecolare (14).
Suolo: miscela di costituenti chimici organici e inorganici (questi ultimi contengono sostanze ad elevato contenuto di carbonio e azoto e di elevato peso molecolare), contenente organismi vitali di piccole dimensioni (soprattutto microrganismi). Il suolo può essere manipolato in due stati:
|
a)
|
indisturbato, come si è sviluppato nel tempo, in strati caratteristici di diversi tipi di suolo;
|
|
b)
|
disturbato, come si trova generalmente nei campi arabili o come si riscontra quando ne vengono prelevati campioni mediante scavo, che vengono utilizzati in questo metodo di test (14).
|
Mineralizzazione: completa degradazione di un composto organico in CO2 e H2O in condizioni aerobiche, e in CH4, CO2 e H2O in condizioni anaerobiche. Nel contesto del presente metodo di test, quando si utilizza una sostanza marcata al 14C, per mineralizzazione si intende una prolungata degradazione durante la quale un atomo di carbonio marcato viene ossidato con rilascio della corretta quantità di 14CO2 (14).
Tempo di dimezzamento: t
0,5, è il tempo necessario per una trasformazione del 50 % di una sostanza di prova, quando la trasformazione può essere descritta mediante cinetica di primo ordine; è indipendente dalla concentrazione.
DT
50
(Tempo di scomparsa 50): tempo entro cui la concentrazione della sostanza di prova si riduce del 50 %; è diverso dal tempo di dimezzamento t0,5 quando la trasformazione non segue la cinetica di primo ordine.
DT
75
(Tempo di scomparsa 75): tempo entro cui la concentrazione della sostanza di prova si riduce del 75 %.
DT90 (Tempo di scomparsa 90): tempo entro cui la concentrazione della sostanza di prova si riduce del 90 %.
1.3 SOSTANZE DI RIFERIMENTO
Per la caratterizzazione e/o l'identificazione dei prodotti di trasformazione mediante metodi spettroscopici e cromatografici si utilizzano sostanze di riferimento.
1.4 APPLICABILITÀ DEL TEST
Il metodo è applicabile a tutte le sostanze chimiche (non marcate o radiomarcate) per le quali è disponibile un metodo analitico sufficientemente accurato e sensibile. È applicabile a sostanze lievemente volatili, non volatili, idrosolubili e non idrosolubili. Il test non va applicato a sostanze chimiche altamente volatili dal suolo (ad es. fumiganti, solventi organici) che non possono essere tenute all'interno del suolo nelle condizioni sperimentali necessarie per questo test.
1.5 INFORMAZIONI SULLA SOSTANZA DI PROVA
Per misurare la velocità di trasformazione è possibile usare una sostanza di prova non marcata o marcata. Il materiale marcato è necessario per lo studio della via di trasformazione e per definire un bilancio di massa. Si raccomanda la marcatura con 14C, sebbene possa essere utile anche l'uso di altri isotopi, quali 13C, 15N, 3H, 32P. Per quanto possibile, la marcatura va applicata alla parte o alle parti più stabili della molecola (43). La purezza della sostanza di prova deve essere almeno del 95 %.
Prima di eseguire un test sulla trasformazione aerobica ed anaerobica nel suolo, devono essere disponibili le seguenti informazioni sulla sostanza di prova:
|
a)
|
solubilità in acqua (Metodo A.6)
|
|
b)
|
solubilità in solventi organici;
|
|
c)
|
tensione di vapore (Metodo A.4) e costante della legge di Henry;
|
|
d)
|
coefficiente di ripartizione n-ottanolo/acqua (Metodo A. 8);
|
|
e)
|
stabilità chimica al buio (idrolisi) (Metodo C.7);
|
|
f)
|
pKa se una molecola è soggetta a protonazione o deprotonazione (Linee guida OCSE 112) (16).
|
Altre informazioni utili possono essere costituite da dati sulla tossicità della sostanza di prova per i microrganismi del suolo (Metodi di test C.21 e C.22) (16).
Dovrebbero essere disponibili metodi analitici (compresi metodi per l'estrazione e di depurazione) per la quantificazione e l'identificazione della sostanza di prova e dei suoi prodotti di trasformazione.
1.6 PRINCIPIO DEL METODO DI PROVA
I campioni di suolo vengono trattati con la sostanza di prova e incubati al buio in contenitori per biometria o in sistemi a flusso continuo in condizioni controllate di laboratorio (a temperatura e umidità costante del suolo). Dopo adeguati intervalli di tempo, i campioni di suolo vanno estratti e analizzati alla ricerca della sostanza progenitrice e dei prodotti di trasformazione. Mediante adeguati dispositivi di assorbimento vengono raccolti anche i prodotti volatili e sottoposti ad analisi. Impiegando materiale 14C-marcato è possibile misurare i tassi di mineralizzazione della sostanza di prova intercettando il 14CO2 evoluto e determinare un bilancio di massa, compresa la formazione di residui non estraibili.
1.7 CRITERI DI QUALITÀ
1.7.1 Recupero
L'estrazione e l'analisi di campioni di suolo almeno duplicati, immediatamente dopo l'aggiunta della sostanza di prova, forniscono una prima indicazione della ripetibilità del metodo analitico e dell'uniformità della procedura di applicazione per la sostanza di prova. Le percentuali di recupero per le fasi successive degli esperimenti sono determinate dai rispettivi bilanci di massa e dovrebbero essere comprese tra 90 % e 110 % per le sostanze chimiche marcate (8) e tra 70 % e 110 % per le sostanze chimiche non marcate (3).
1.7.2 Ripetibilità e sensibilità del metodo di analisi
La ripetibilità del metodo di analisi (esclusa l'efficienza di estrazione iniziale) per quantificare la sostanza di prova e i prodotti di trasformazione può essere controllata duplicando l'analisi dello stesso estratto di suolo, incubato sufficientemente a lungo perché si formino prodotti di trasformazione.
Il limite di rivelabilità del metodo di analisi per la sostanza di prova e per i prodotti di trasformazione deve essere di almeno 0,01 mg kg-1 di suolo (come sostanza di prova) o dell'1 % della dose applicata (scegliere il dato inferiore). Il limite di quantificazione va anch'esso specificato.
1.7.3 Accuratezza dei dati sulla trasformazione
L'analisi di regressione delle concentrazioni della sostanza di prova in funzione del tempo fornisce dati adeguati circa l'affidabilità della curva di trasformazione e consente di calcolare gli intervalli di confidenza per i tempi di dimezzamento (in caso di cinetica di pseudo primo ordine) o i valori DT50 e, se del caso, DT75 e DT90.
1.8 DESCRIZIONE DEL METODO DI PROVA
1.8.1 Apparecchiature e reagenti chimici
I sistemi di incubazione sono costituiti da sistemi statici chiusi o adeguati sistemi a flusso continuo (7)(17). Le figure 1 e 2 mostrano rispettivamente esempi di apparecchi di flusso adatti all'incubazione del suolo e contenitori per biometria. Entrambi i tipi di sistemi di incubazione presentano vantaggi e limiti (7)(17).
È necessario disporre di un'attrezzatura standard da laboratorio, e in particolare:
|
—
|
strumentazione analitica quale apparecchi per GLC, HPLC, TLC, compresi adeguati sistemi di rilevazione per l'analisi di sostanze radiomarcate e non radiomarcate, o il metodo di diluizione isotopica inversa;
|
|
—
|
strumenti di identificazione (ad esempio: MS, GC-MS, HPLC-MS, RMN, ecc.);
|
|
—
|
rivelatore a scintillazione a liquido;
|
|
—
|
ossidatore per la combustione del materiale radioattivo;
|
|
—
|
apparecchio per l'estrazione (per esempio tubi da centrifuga per l'estrazione a freddo ed estrattore di Soxhlet per l'estrazione continua sotto riflusso);
|
|
—
|
strumentazione per la concentrazione di soluzioni ed estratti (ad es. evaporatore a rotazione);
|
|
—
|
apparecchio per miscelatura meccanica (ad es. impastatrice, miscelatore a rotazione).
|
I reagenti chimici usati sono, ad esempio:
|
—
|
NaOH, grado analitico, 2 mol· dm-3, o un'altra base adeguata (ad es. KOH, etanolammina);
|
|
—
|
H2SO4, grado analitico, 0,05 mol· dm-3;
|
|
—
|
glicole etilenico, grado analitico;
|
|
—
|
materiali assorbenti solidi, quali calce sodata e tappi in poliuretano;
|
|
—
|
solventi organici, grado analitico, quali acetone, metanolo, ecc.;
|
|
—
|
liquido per scintillazione.
|
1.8.2 Applicazione della sostanza di prova
Per introdurre e distribuire la sostanza di prova nel suolo la si può sciogliere in acqua (distillata o deionizzata) o, se necessario, in minime quantità di acetone o di altri solventi organici (6) nei quali la sostanza di prova sia sufficientemente solubile e stabile. La quantità di solvente scelto non deve però esercitare un'influenza significativa sull'attività microbica del suolo (vedi sezioni 1.5 e 1.9.2-1.9.3). Va evitato l'impiego di solventi che inibiscono l'attività microbica, quali il cloroformio, il diclorometano e altri solventi alogenati.
La sostanza di prova può essere aggiunta anche in forma solida, ad es. mista a sabbia quarzosa (6) o in un piccolo sottocampione del suolo sperimentale che sia stato asciugato all'aria e sterilizzato. Se la sostanza di prova viene aggiunta con l'ausilio di un solvente, occorre permettere al solvente di evaporare prima di aggiungere il sottocampione arricchito al campione di suolo originale non sterile.
Per le sostanze chimiche generiche, che entrano nel suolo soprattutto attraverso i fanghi delle acque di scarico e le pratiche agricole, la sostanza di prova va prima aggiunta al fango, che viene poi introdotto nel campione di suolo (vedi sezioni 1.9.2 e 1.9.3).
Di norma non si consiglia l'impiego di prodotti formulati, che possono però costituire una valida alternativa, ad esempio, per le sostanze di prova scarsamente solubili.
1.8.3 Suoli
1.8.3.1 Selezione del suolo
Per determinare la via di trasformazione è possibile usare un suolo rappresentativo; è consigliabile impiegare un limo sabbioso, un limo fangoso, un limo glaciale o una sabbia limosa [secondo la classificazione FAO e USDA (18)] con un pH di 5,5-8,0, un contenuto di carbonio organico dello 0,5-2,5 % e una biomassa microbica pari ad almeno l'1 % del carbonio organico totale (10).
Per gli studi dei tassi di trasformazione occorre usare almeno tre suoli aggiuntivi che rappresentino una gamma di suoli attinenti. I suoli devono differire tra loro in quanto a contenuto di carbonio organico, pH, contenuto di argilla e biomassa microbica (10).
Tutti i suoli devono essere caratterizzati per lo meno per quanto concerne struttura ( % di sabbia, % di limo, % di argilla) [secondo la classificazione FAO e USDA (18)], pH, capacità di scambio dei cationi, carbonio organico, peso specifico apparente, caratteristiche di ritenzione idrica (44) e biomassa microbica (solo per gli studi aerobici). Per l'interpretazione dei risultati possono essere utili ulteriori informazioni sulle proprietà del suolo. Per determinare le caratteristiche del suolo è possibile usare i metodi raccomandati nelle voci bibliografiche (19)(20)(21)(22)(23). La biomassa microbica va determinata utilizzando il metodo della respirazione indotta dal substrato (25)(26) o metodi alternativi (20).
1.8.3.2 Raccolta, manipolazione e conservazione dei suoli
Occorre fornire possibilmente informazioni dettagliate circa la storia del sito da cui è stato raccolto il suolo per il test. Tali dettagli comprendono il luogo esatto, la copertura vegetale, i trattamenti con sostanze chimiche, i trattamenti con fertilizzanti organici e inorganici, l'aggiunta di materiali biologici e altri tipi di contaminazione. I suoli trattati con la sostanza di prova o con i suoi analoghi strutturali nei precedenti quattro anni non vanno usati per gli studi sulla trasformazione (10)(15).
Il suolo deve essere raccolto di fresco sul campo (dall'orizzonte A o dallo strato superficiale di 20 cm) ad un tasso di umidità tale da facilitarne la setacciatura. Per suoli diversi da quelli provenienti dalle risaie, occorre evitare la raccolta di campioni durante o immediatamente dopo lunghi periodi (> 30 giorni) di siccità, gelo o inondazione (14). I campioni vanno trasportati in modo da ridurre al minimo l'alterazione del tasso di umidità del suolo e vanno tenuti al buio ma, per quanto possibile, con libero passaggio dell'aria. A tale scopo risulta generalmente adeguata una busta di polietilene con l'apertura allentata.
Il suolo deve essere trattato appena possibile dopo il campionamento. Occorre asportare la vegetazione, la fauna di maggiori dimensioni e le pietre, prima di passare il suolo attraverso un setaccio di 2 mm che rimuova le pietre, la fauna e i detriti delle piante di piccole dimensioni. Occorre evitare di essiccare e rompere eccessivamente il suolo prima della setacciatura (15).
Quando in inverno il campionamento sul campo risulta difficoltoso (suolo gelato o coperto da strati di neve), il campione può essere prelevato da un lotto di suolo conservato in serra sotto copertura vegetale (ad es. erba o miscugli erba-trifoglio). Sono di gran lunga preferibili gli studi con suoli appena raccolti dal campo, ma dovendo conservare il suolo raccolto e trattato prima di poter avviare lo studio, le condizioni di conservazione devono essere adeguate e limitate nel tempo (4 ± 2 oC per un massimo di tre mesi) per mantenere l'attività microbica (45). Istruzioni dettagliate circa la raccolta, la manipolazione e la conservazione dei suoli da usarsi per gli esperimenti di biotrasformazione sono reperibili in (8)(10)(15)(26)(27).
Prima che il suolo trattato venga usato per questo test, deve essere pre-incubato per consentire la germinazione e la rimozione dei semi, e per ristabilire l'equilibrio del metabolismo microbico successivamente al passaggio dalle condizioni di campionamento o conservazione alle condizioni di incubazione. Generalmente è ritenuto adeguato un periodo di pre-incubazione di 2-28 giorni in cui ci si avvicina alle condizioni di temperatura e umidità del test vero e proprio (15). Il tempo di conservazione e di pre-incubazione non deve superare complessivamente i tre mesi.
1.9 ESECUZIONE DEL TEST
1.9.1 Condizioni
1.9.1.1 Temperatura
Durante tutto il periodo del test, i suoli vanno incubati al buio a una temperatura costante rappresentativa delle condizioni climatiche del luogo in cui verranno usati o rilasciati. Una temperatura di 20 ± 2 oC è consigliata per tutte le sostanze sperimentali che possono raggiungere il suolo in climi temperati. La temperatura va monitorata.
Per le sostanze chimiche applicate o rilasciate in climi più freddi (ad es. nei paesi settentrionali, durante il periodo autunnale o invernale), occorre incubare anche altri campioni di suolo a una temperatura inferiore (ad es. 10 ± 2 oC).
1.9.1.2 Tenore di umidità
Per i test di trasformazione in condizioni aerobiche, il tenore di umidità del suolo (46) deve essere regolato e mantenuto a un pF compreso fra 2,0 e 2,5 (3). Il tenore di umidità del suolo si esprime come massa di acqua per massa di suolo secco e va controllato regolarmente (ad es. a intervalli di 2 settimane) mediante pesatura dei contenitori di incubazione; eventuali perdite di acqua vanno compensate con un'aggiunta di acqua (preferibilmente acqua corrente filtrata in condizioni sterili). Nel fare questo occorre prestare attenzione in modo da prevenire o ridurre al minimo le perdite di sostanza di prova e/o dei prodotti di trasformazione per volatilizzazione e/o fotodegradazione.
Per i test di trasformazione in condizioni anaerobiche e in risaia, il suolo va saturato di acqua mediante inondazione.
1.9.1.3 Condizioni aerobiche di incubazione
Nei sistemi a flusso continuo le condizioni aerobiche sono mantenute mediante afflusso intermittente o ventilazione continua con aria umidificata. Nei contenitori per studi biometrici, lo scambio dell'aria viene mantenuto per diffusione.
1.9.1.4 Condizioni aerobiche sterili
Per ottenere informazioni sulla rilevanza della trasformazione abiotica di una sostanza di prova, i campioni di suolo possono essere sterilizzati (per i metodi di sterilizzazione, cfr. i riferimenti bibliografici 16 e 29), trattati con sostanza di prova sterile (ad es. aggiunta di soluzione attraverso un filtro sterile) e aerati con aria sterile umidificata come descritto nella sezione 1.9.1.3. Per i terreni da risaia, suolo e acqua vanno sterilizzati e l'incubazione va effettuata come descritto nella sezione 1.9.1.6.
1.9.1.5 Condizioni anaerobiche di incubazione
Per ottenere e mantenere condizioni anaerobiche, il suolo trattato con la sostanza di prova e incubato in condizioni aerobiche per 30 giorni o un tempo di dimezzamento o DT50 (il tempo più breve) viene successivamente impregnato d'acqua (strato di acqua di 1-3 cm) e il sistema di incubazione viene sommerso con un gas inerte (ad es. azoto o argon) (47). Il sistema di prova deve consentire di effettuare anche misurazioni ad es. del pH, della concentrazione di ossigeno e del potenziale di ossidoriduzione e comprendere dispositivi di cattura dei prodotti volatili. Il sistema a biometro deve essere chiuso in modo da evitare l'ingresso di aria per diffusione.
1.9.1.6 Condizioni di incubazione in risaia
Per studiare la trasformazione nei suoli allagati da risaia, il suolo viene allagato con uno strato di acqua di circa 1-5 cm e la sostanza di prova viene applicata alla fase acquosa (9). Si raccomanda che il suolo sia profondo almeno 5 cm. Il sistema è ventilato con aria in condizioni aerobiche. pH, concentrazione di ossigeno e potenziale di ossidoriduzione dello strato acquoso vanno monitorati e indicati nella relazione. Prima di iniziare gli studi sulla trasformazione il suolo va tenuto in pre-incubazione per almeno due settimane (cfr. sezione 1.8.3.2).
1.9.1.7 Durata del test
Gli studi sulla velocità e la via di trasmissione non dovrebbero di norma superare i 120 giorni (48) (3)(6)(8), poiché, superato questo lasso di tempo, è molto probabile che in un sistema artificiale di laboratorio, isolato dalla naturale ricostituzione, si verifichi una riduzione dell'attività microbica. Se necessario, per caratterizzare la diminuzione della sostanza di prova e la formazione e la diminuzione dei principali prodotti di trasformazione, è possibile continuare gli studi per periodi più lunghi (ad es. 6 o 12 mesi) (8). In caso di prolungamento dei tempi di incubazione occorre dare motivazione nella relazione, aggiungendo i dati delle misurazioni della biomassa durante e alla fine dei periodi di incubazione.
1.9.2 Esecuzione del test
In ciascun contenitore per incubazione si sistemano circa 50-200 g di suolo (peso a secco) (cfr. figure 1 e 2 nell'allegato 3), che viene trattato con la sostanza di prova utilizzando uno dei metodi descritti nella sezione 1.8.2. Se si impiegano solventi organici per l'applicazione della sostanza di prova, è necessario eliminarli dal suolo per evaporazione. Il suolo va poi miscelato accuratamente con una spatola e/o scuotendo il contenitore. Se si conduce lo studio in condizioni di risaia, occorre miscelare accuratamente acqua e suolo dopo l'applicazione della sostanza di prova. Allo scopo di controllare la distribuzione uniforme della sostanza di prova, questa va ricercata analizzando piccole quantità (ad es. 1 g) dei suoli trattati. Per un metodo alternativo, cfr. sotto.
Il tasso di concentrazione delle sostanze per il trattamento deve corrispondere al tasso più elevato di applicazione di un prodotto fitosanitario indicato nelle istruzioni per l'uso e con incorporazione uniforme a una profondità adeguata nel terreno del campo (ad es. strato superficiale di 10 cm (49) di suolo). Per esempio, per le sostanze chimiche da applicare sul fogliame o sul suolo senza incorporazione, la profondità corretta per calcolare quanta sostanza chimica occorre aggiungere a ciascun contenitore è 2,5 cm. Per le sostanze chimiche da incorporare nel suolo, la profondità corretta è la profondità di incorporazione specificata nelle istruzioni per l'uso. Per le sostanze chimiche generiche, il tasso di applicazione va calcolato sulla base della via di somministrazione più rilevante; per esempio, quando la principale via di somministrazione nel suolo sono i fanghi di acque reflue, la sostanza chimica va dosata nel fango ad una concentrazione che rispecchi il normale carico di fanghi nei suoli agricoli. Se tale concentrazione non è sufficientemente elevata per identificare i principali prodotti di trasformazione, può essere utile l'incubazione di campioni di suolo separati con tenore più elevato, ma è importante evitare di eccedere nelle quantità per non avere reazioni che influiscono sulle funzioni microbiche (cfr. sezioni 1.5 e 1.8.2).
In alternativa è possibile trattare con la sostanza di prova un lotto più esteso (ad es. di 1-2 kg), accuratamente mescolato in un miscelatore adeguato e poi diviso in porzioni più piccole di 50-200 g nei contenitori per l'incubazione (per esempio usando inquartatori di campioni). Allo scopo di controllare la distribuzione uniforme della sostanza di prova, questa va ricercata analizzando piccole quantità (ad es. 1 g) del lotto di suolo trattato. Una procedura di questo tipo è preferibile, in quanto consente una distribuzione più uniforme della sostanza di prova nel suolo.
Anche i campioni di suolo non trattati vengono incubati nelle stesse condizioni (aerobiche) dei campioni trattati con la sostanza di prova. Tali campioni sono usati per le misurazioni della biomassa durante e alla fine degli studi.
Quando la sostanza di prova viene applicata al suolo disciolta in uno o più solventi organici, occorre incubare anche campioni di suolo trattati con la stessa quantità di solvente/i mantenendo le stesse condizioni (aerobiche) utilizzate per i campioni trattati con la sostanza di prova. I campioni trattati vengono usati per le misurazioni della biomassa all'inizio, durante e alla fine degli studi per controllare gli eventuali effetti del/i solvente/i sulla biomassa microbica.
I contenitori con il suolo trattato vengono collegati al sistema a flusso continuo descritto nella figura 1 o chiusi con la colonna di assorbimento di cui alla figura 2 (cfr. allegato 3).
1.9.3 Campionamento e misurazione
I contenitori doppi per l'incubazione vengono rimossi ad opportuni intervalli di tempo per estrarre i campioni di suolo con solventi appropriati di diversa polarità che vengono poi analizzati alla ricerca della sostanza di prova e/o di prodotti di trasformazione. Uno studio ben disegnato prevede un numero sufficiente di contenitori per consentire di sacrificare due contenitori durante ciascun campionamento. Inoltre, le soluzioni di assorbimento o i materiali solidi di assorbimento vengono rimossi a vari intervalli di tempo (intervalli di 7 giorni durante il primo mese e, successivamente, a intervalli di 17 giorni) durante e alla fine dell'incubazione di ciascun campione e analizzati alla ricerca di prodotti volatili. Oltre a un campione di suolo prelevato subito dopo l'applicazione (campione del giorno 0) occorre prevedere almeno altri 5 momenti di campionamento. Gli intervalli di tempo vanno scelti in modo da poter stabilire una costante di diminuzione della sostanza di prova e costanti di formazione e diminuzione dei prodotti di trasformazione (ad es. giorni 0, 1, 3, 7; settimane 2, 3; mesi 1, 2, 3, ecc.).
Quando si utilizza una sostanza di prova 14C-marcata, la radioattività non estraibile verrà quantificata per combustione e per ogni intervallo di campionamento verrà calcolato un bilancio di massa.
Nel caso di incubazione anaerobica e in risaia, le fasi di suolo e d'acqua vengono analizzate insieme per ricercare la sostanza di prova e i prodotti di trasformazione, oppure separate per filtrazione o centrifugazione prima dell'estrazione e dell'analisi.
1.9.4 Test opzionali
Studi aerobici, non sterili, ad altre temperature e diverse concentrazioni di umidità del suolo possono risultare utili per stimare gli effetti della temperatura e dell'umidità del suolo sulla velocità di trasformazione di una sostanza di prova e/o dei suoi prodotti di trasformazione nel suolo.
È possibile tentare un'ulteriore caratterizzazione della radioattività non estraibile usando, ad esempio, l'estrazione fluida supercritica.
2. DATI
2.1 TRATTAMENTO DEI RISULTATI
Le quantità delle sostanza di prova, dei prodotti di trasformazione e delle sostanze volatili (solo in %) e non estraibili vanno indicate come % della concentrazione iniziale applicata e, ove pertinente, in mg· kg-1 di suolo (in base al peso secco del suolo) per ciascun intervallo di campionamento. È necessario indicare in percentuale l'equilibrio di massa della concentrazione iniziale applicata per ciascun intervallo di campionamento. La presentazione grafica delle concentrazioni della sostanza di prova in funzione del tempo consentirà una stima del suo tempo di dimezzamento o DT50 di trasformazione. È inoltre necessario identificare i principali prodotti di trasformazione, rappresentandone graficamente le concentrazioni in funzione del tempo per evidenziarne la velocità di formazione e di diminuzione. Per principale prodotto di trasformazione si intende qualsiasi prodotto che rappresenti ≥ 10 % della dose applicata in qualsiasi momento nel corso dello studio.
I prodotti volatili intrappolati forniscono una certa indicazione del potenziale di volatilità di una sostanza di prova e dei suoi prodotti di trasformazione dal suolo.
È possibile calcolare in modo più accurato i tempi di dimezzamento o i valori DT50 e, se pertinente, i valori DT75 e DT90 utilizzando adeguati modelli cinetici. Il tempo di dimezzamento e i valori DT50 vanno riportati nella relazione insieme alla descrizione del modello usato, dell'ordine della cinetica e del coefficiente di determinazione (r2). Si preferisce la cinetica di primo ordine, a meno che r2 < 0,7. Se del caso, i calcoli vanno applicati anche ai principali prodotti di trasformazione. Nei riferimenti bibliografici da 31 a 35 sono descritti esempi di modelli adeguati.
Nel caso di studi sulla velocità eseguiti a diverse temperature, le velocità di trasformazione vanno descritte come funzione della temperatura all'interno della gamma di temperature sperimentali, usando il rapporto di Arrhenius della formula:
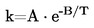 or
or  ,
,
dove ln A e B sono costanti di regressione, rispettivamente, dall'intercetta e dalla pendenza di una retta best fit generata dalla regressione lineare di ln k rispetto a 1/T, k è la velocità costante alla temperatura T e T è la temperatura in Kelvin. Occorre prestare attenzione alla gamma limitata di temperature in cui il rapporto di Arrhenius sarà valido nel caso la trasformazione sia governata dall'azione microbica.
2.2 VALUTAZIONE E INTERPRETAZIONE DEI RISULTATI
Sebbene gli studi vengano eseguiti in un sistema artificiale di laboratorio, i risultati consentiranno di stimare la velocità di trasformazione della sostanza di prova, oltre che il tasso di formazione e diminuzione dei prodotti di trasformazione in condizioni paragonabili a quelle di campo (36)(37).
Lo studio della via di trasformazione di una sostanza di prova fornisce informazioni sul modo in cui la sostanza applicata viene modificata strutturalmente nel suolo da reazioni chimiche e microbiche.
3. RELAZIONE
RELAZIONE SULL'ESECUZIONE DEL TEST
La relazione sull'esecuzione del test deve contenere le seguenti informazioni specifiche:
|
|
Sostanza di prova:
|
—
|
denominazione comune, nome chimico, numero CAS, formula di struttura [indicante la(e) posizione(i) della(e) marcatura(e) quando si utilizza materiale radiomercato] e proprietà fisico-chimiche pertinenti (cfr. sezione 1.5);
|
|
—
|
purezza (impurità) della sostanza di prova;
|
|
—
|
purezza radiochimica della sostanza chimica marcata e attività specifica (ove pertinente).
|
|
|
|
Sostanze di riferimento:
|
—
|
nome chimico e struttura delle sostanze di riferimento usate per la caratterizzazione e/o l'identificazione dei prodotti di trasformazione.
|
|
|
|
Suoli sperimentali:
|
—
|
particolari riguardanti il sito di raccolta;
|
|
—
|
data e procedura di campionamento dei suoli;
|
|
—
|
proprietà dei suoli, quali pH, contenuto di carbonio organico, tessitura ( % sabbia, % limo, % argilla), capacità di scambio dei cationi, peso specifico apparente, caratteristiche di ritenzione idrica e biomassa microbica;
|
|
—
|
durata della conservazione del suolo e condizioni di conservazione (se pertinente).
|
|
|
|
Condizioni del test:
|
—
|
date di esecuzione degli studi;
|
|
—
|
quantità di sostanza di prova applicata;
|
|
—
|
solventi usati e metodo di applicazione per la sostanza di prova;
|
|
—
|
peso del suolo trattato inizialmente e campionato a ciascun intervallo per essere analizzato;
|
|
—
|
descrizione del sistema di incubazione;
|
|
—
|
tassi di flusso dell'aria (solo per i sistemi a flusso continuo);
|
|
—
|
temperatura dell'ambiente sperimentale;
|
|
—
|
tasso di umidità del suolo durante l'incubazione;
|
|
—
|
biomassa microbica all'inizio, durante e alla fine degli studi aerobici;
|
|
—
|
pH, concentrazione di ossigeno e potenziale di ossidoriduzione all'inizio, durante e alla fine degli studi anaerobici e in risaia;
|
|
—
|
metodo/i di estrazione;
|
|
—
|
metodi per la quantificazione e l'identificazione della sostanza di prova e dei principali prodotti di trasformazione nel suolo e nei materiali di assorbimento;
|
|
—
|
numero di replicati e numero di controlli.
|
|
|
|
Risultati:
|
—
|
risultato della determinazione dell'attività microbica;
|
|
—
|
ripetibilità e sensibilità dei metodi analitici usati;
|
|
—
|
tassi di recupero (i valori % per uno studio valido sono indicati nella sezione 1.7.1);
|
|
—
|
tabelle dei risultati espressi in % della dose iniziale applicata e, ove pertinente, in mg· kg-1 di suolo (base di peso secco);
|
|
—
|
bilancio di massa durante e alla fine degli studi;
|
|
—
|
caratterizzazione della radioattività o dei residui non estraibili nel suolo;
|
|
—
|
quantificazione del CO2 e di altre sostanze volatili rilasciate;
|
|
—
|
grafici delle concentrazioni nel suolo in funzione del tempo riferiti alla sostanza di prova e, ove pertinente, ai principali prodotti di trasformazione;
|
|
—
|
tempo di dimezzamento o DT50, DT75 e DT90 della sostanza di prova e, ove pertinente, dei principali prodotti di trasformazione, compresi gli intervalli di confidenza;
|
|
—
|
stima della velocità di degradazione abiotica in condizioni sterili;
|
|
—
|
una valutazione della cinetica di trasformazione per la sostanza di prova e, ove pertinente, per i principali prodotti di trasformazione;
|
|
—
|
vie di trasformazione proposte, ove pertinente;
|
|
—
|
discussione e interpretazione dei risultati;
|
|
—
|
dati originali (cioè cromatogrammi campione, calcoli campione dei tassi di trasformazione e metodi usati per identificare i prodotti di trasformazione).
|
|
4. BIBLIOGRAFIA
|
(1)
|
US- Environmental Protection Agency (1982). Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
|
|
(2)
|
Agriculture Canada (1987). Environmental Chemistry and Fate. Guidelines for registration of pesticides in Canada.
|
|
(3)
|
Unione europea (UE) (1995). Direttiva 95/36/CE della Commissione, del 14 luglio 1995, che modifica la direttiva 91/414/CEE del Consiglio relativa all'immissione in commercio dei prodotti fitosanitari. Allegato II, parte A ed allegato III, parte A: Destino e comportamento nell'ambiente.
|
|
(4)
|
Dutch Commission for Registration of Pesticides (1995). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air.
|
|
(5)
|
BBA (1986). Richtlinie für die amtliche Prüfung von Pflanzenschutzmitteln, Teil IV, 4-1. Verbleib von Pflanzenschutzmitteln im Boden — Abbau, Umwandlung und Metabolismus.
|
|
(6)
|
ISO/DIS 11266-1 (1994). Soil Quality — Guidance on laboratory tests for biodegradation of organic chemicals in soil — Part 1: Aerobic conditions.
|
|
(7)
|
ISO 14239 (1997). Soil Quality — Laboratory incubation systems for measuring the mineralization of organic chemicals in soil under aerobic conditions.
|
|
(8)
|
SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed.
|
|
(9)
|
MAFF — Japan 2000 — Draft Guidelines for transformation studies of pesticides in soil — Aerobic metabolism study in soil under paddy field conditions (flooded).
|
|
(10)
|
OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italy, 18-20 January 1995.
|
|
(11)
|
Guth, J.A. (1980). The study of transformations. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, 123-157.
|
|
(12)
|
DFG: Pesticide Bound Residues in Soil. Wiley — VCH (1998).
|
|
(13)
|
T.R. Roberts: Non-extractable pesticide residue in soils and plants. Pure Appl. Chem. 56, 945-956 (IUPAC 1984)
|
|
(14)
|
OECD Test Guideline 304 A: Inherent Biodegradability in Soil (adopted 12 May 1981)
|
|
(15)
|
ISO 10381-6 (1993). Soil Quality — Sampling — Part 6: Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory.
|
|
(16)
|
Allegato V della direttiva 67/548/CEE.
|
|
(17)
|
Guth, J.A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry. D.H. Hutson, T.R. Roberts, Eds. J. Wiley & Sons. Vol 1, 85-114.
|
|
(18)
|
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26:305 (1962).
|
|
(19)
|
Methods of Soil Analysis (1986). Part 1, Physical and Mineralogical Methods. A. Klute, Ed. Agronomy Series No 9, 2nd Edition.
|
|
(20)
|
Methods of Soil Analysis (1982). Part 2, Chemical and Microbiological Properties. A.L. Page, R.H. Miller and D.R. Kelney, Eds. Agronomy Series No 9, 2nd Edition.
|
|
(21)
|
ISO Standard Compendium Environment (1994). Soil Quality — General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition.
|
|
(22)
|
Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt, Main.
|
|
(23)
|
Scheffer, F., Schachtschabel, P. (1975). Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart.
|
|
(24)
|
Anderson, J.P.E., Domsch, K.H. (1978) A physiological method for the quantitative measurement of microbial biomass in soils. Soil Biol. Biochem. 10, 215-221.
|
|
(25)
|
ISO 14240-1 and 2 (1997). Soil Quality — Determination of soil microbial biomass — Part 1: Substrate-induced respiration method. Part 2: fumigation-extraction method.
|
|
(26)
|
Anderson, J.P.E. (1987). Handling and storage of soils for pesticide experiments. In Pesticide Effects on Soil Microflora. L. Somerville, M.P. Greaves, Eds. Taylor & Francis, 45-60.
|
|
(27)
|
Kato, Yasuhiro. (1998). Mechanism of pesticide transformation in the environment: Aerobic and biotransformation of pesticides in aqueous environment. Proceedings of the 16th Symposium on Environmental Science of Pesticide, 105-120.
|
|
(28)
|
Keuken O., Anderson J.P.E. (1996). Influence of storage on biochemical processes in soil. In Pesticides, Soil Microbiology and Soil Quality, 59-63 (SETAC-Europe).
|
|
(29)
|
Stenberg B., Johansson M., Pell M., Sjödahl-Svensson K., Stenström J., Torstensson L. (1996). Effect of freeze and cold storage of soil on microbial activities and biomass. In Pesticides, Soil Microbiology and Soil Quality, 68-69 (SETAC-Europe).
|
|
(30)
|
Gennari, M., Negre, M., Ambrosoli, R. (1987). Effects of ethylene oxide on soil microbial content and some chemical characteristics. Plant and Soil 102, 197-200.
|
|
(31)
|
Anderson, J.P.E. (1975). Einfluss von Temperatur und Feuchte auf Verdampfung, Abbau und Festlegung von Diallat im Boden. Z. PflKrankh Pflschutz, Sonderheft VII, 141-146.
|
|
(32)
|
Hamaker, J.W. (1976). The application of mathematical modelling to the soil persistence and accumulation of pesticides. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides, 181-199.
|
|
(33)
|
Goring, C.A.I., Laskowski, D.A., Hamaker, J.W., Meikle, R.W. (1975). Principles of pesticide degradation in soil. In «Environmental Dynamics of Pesticides». R. Haque and V.H. Freed, Eds., 135-172.
|
|
(34)
|
Timme, G., Frehse, H., Laska, V. (1986). Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues. II. Pflanzenschutz — Nachrichten Bayer 39, 188-204.
|
|
(35)
|
Timme, G., Frehse, H. (1980). Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues. I. Pflanzenschutz — Nachrichten Bayer 33,47-60.
|
|
(36)
|
Gustafson D.I., Holden L.R. (1990). Non-linear pesticide dissipation in soil; a new model based on spatial variability. Environm. Sci. Technol. 24,1032-1041.
|
|
(37)
|
Hurle K., Walker A. (1980). Persistence and its prediction. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, 83-122.
|
ALLEGATO 1
TENSIONE DELL'ACQUA, CAPACITÀ DI CAMPO (FC) E CAPACITÀ DI RITENUTA IDRICA (WHC) (50)
|
Altezza della colonna d'acqua
[cm]
|
pF (51)
|
bar (52)
|
Note
|
|
107
|
7
|
104
|
Suolo secco
|
|
1,6 · 104
|
4,2
|
16
|
Punto di appassimento
|
|
104
|
4
|
10
|
|
|
103
|
3
|
1
|
|
|
6· 102
|
2,8
|
0,6
|
|
|
3,3 · 102
|
2,5
|
0,33 (53)
|
Gamma della capacità di campo (54) imazione)
|
|
102
|
2
|
0,1
|
|
60
|
1,8
|
0,06
|
|
33
|
1,5
|
0,033
|
|
10
|
1
|
0,01
|
WHC (approssimazione)
|
|
1
|
0
|
0,001
|
Suolo saturato d'acqua
|
La tensione dell'acqua si misura in cm di colonna d'acqua o in bar. A motivo dell'ampia gamma di tensione di aspirazione viene espressa semplicemente come valore pF, che è equivalente al logaritmo di cm di colonna d'acqua.
La capacità di campo si definisce come la quantità d'acqua che può essere conservata contro la gravità da parte di un suolo naturale 2 giorni dopo un periodo di pioggia prolungato o dopo irrigazione sufficiente. Viene determinata in suolo indisturbato in situ nel campo. La misurazione, pertanto, non è applicabile ai campioni di suolo disturbati di laboratorio. I valori FC determinati in suoli disturbati possono presentare notevoli varianze sistematiche.
La capacità di ritenuta idrica (WHC) si definisce in laboratorio con suolo indisturbato e disturbato saturando una colonna di suolo con acqua per trasporto capillare. È particolarmente utile per i suoli disturbati e può essere fino al 30 % superiore alla capacità di campo (1). Inoltre, sperimentalmente è più semplice da determinare rispetto ai valori affidabili diFC.
Note
ALLEGATO 2
CONTENUTO DI UMIDITÀ DEL SUOLO (g di acqua per 100 g di suolo secco) DI VARI TIPI DI SUOLO DA DIVERSI PAESI
|
|
|
Contenuto di umidità del suolo a
|
|
Tipo di suolo
|
Paese
|
|
|
|
WHC (55)
|
pF = 1,8
|
pF = 2,5
|
|
Sabbia
|
Germania
|
28,7
|
8,8
|
3,9
|
|
Sabbia limosa
|
Germania
|
50,4
|
17,9
|
12,1
|
|
Sabbia limosa
|
Svizzera
|
44,0
|
35,3
|
9,2
|
|
Limo fangoso
|
Svizzera
|
72,8
|
56,6
|
28,4
|
|
Limo argilloso
|
Brasile
|
69,7
|
38,4
|
27,3
|
|
Limo argilloso
|
Giappone
|
74,4
|
57,8
|
31,4
|
|
Limo sabbioso
|
Giappone
|
82,4
|
59,2
|
36,0
|
|
Limo fangoso
|
USA
|
47,2
|
33,2
|
18,8
|
|
Limo sabbioso
|
USA
|
40,4
|
25,2
|
13,3
|
ALLEGATO 3
Figura 1
Esempio di apparecchio a flusso continuo per studiare la trasformazione delle sostanze chimiche nel suolo
(56)
(57)

Figura 2
Esempio di contenitori per sistemi a biometro per studiare la trasformazione delle sostanze chimiche nel suolo
(58)

C.24. TRASFORMAZIONE AEROBICA E ANAEROBICA NEI SISTEMI SEDIMENTOSI ACQUATICI
1. METODO
Questo metodo di prova corrisponde al TG 308 (2002) dell'OCSE.
1.1 INTRODUZIONE
Le sostanze chimiche possono penetrare nelle acque superficiali, basse o profonde, per applicazione diretta, deriva di sostanze nebulizzate, deflusso, drenaggio, smaltimento di rifiuti, effluenti industriali, domestici o agricoli e deposizione atmosferica. Questo metodo di prova descrive un metodo di laboratorio per determinare la trasformazione aerobica e anaerobica di sostanze chimiche organiche nei sistemi sedimentosi acquatici. Esso si basa su linee guida esistenti (1)(2)(3)(4)(5)(6). Un gruppo di lavoro OCSE sulla selezione dei suoli e dei sedimenti, tenuto a Belgirate nel 1995 (7), ha definito, in particolare, il numero e il tipo di sedimenti da usare per questo test e ha formulato alcune raccomandazioni sulla raccolta, la manipolazione e la conservazione di campioni di sedimento, sulla base di norme ISO (8). Questi studi sono necessari per esaminare le sostanze chimiche che sono direttamente introdotte nell'acqua o che hanno la possibilità di raggiungere l'ambiente acquatico tramite le vie sopra menzionate.
I sistemi sedimentosi acquatici naturali hanno speso condizioni aerobiche nella fase acquosa superiore. Lo strato superficiale del sedimento può essere aerobico o anaerobico, mentre il sedimento più profondo è solitamente anaerobico. Per tenere conto di tutte queste possibilità, il presente documento descrive prove sia aerobiche, sia anaerobiche. La prova aerobica simula una colonna d'acqua aerobica sopra uno strato di sedimento aerobico sotto il quale si trova un gradiente anaerobico. La prova anaerobica simula un sistema acqua-sedimento completamente anaerobico. Vi sono altri metodi utilizzabili in circostanze nelle quali occorre scostarsi significativamente da queste raccomandazioni, per esempio impiegando nuclei di sedimento intatti o sedimenti che potrebbero essere stati esposti alla sostanza di prova (9).
1.2 DEFINIZIONI
In tutti i casi vanno applicate le unità del sistema internazionale (SI).
Sostanza di prova: qualsiasi sostanza, sia un composto progenitore che i relativi prodotti di trasformazione.
Prodotti di trasformazione: tutte le sostanze derivate da reazioni di trasformazione biotica o abiotica della sostanza di prova, compresi CO2 e i residui non estraibili.
Residui non estraibili: composti presenti nel suolo, nelle piante o negli animali, che dopo estrazione persistono nella matrice sotto forma di sostanza progenitrice o di uno o più dei suoi metaboliti. Il metodo di estrazione non deve alterare in modo considerevole i composti stessi o la struttura della matrice. La natura del legame può essere chiarita, in parte, mediante metodi di estrazione che alterano la matrice e sofisticate tecniche analitiche. Finora, ad esempio, sono stati individuati in questo modo legami ionici covalenti e di assorbimento/adsorbimento, come pure le catture. In generale, la formazione di residui non estraibili riduce la bioaccessibilità e la biodisponibilità in maniera significativa (10) [modificato da IUPAC 1984 (11)].
Trasformazione aerobica: (ossidante): reazioni che si verificano in presenza di ossigeno molecolare (12).
Trasformazione anaerobica: (riducente): reazioni che si verificano in assenza di ossigeno molecolare (12).
Acque naturali: acque superficiali ottenute da laghi, fiumi, ruscelli, ecc.
Sedimento: miscela di costituenti chimici inorganici e organici, questi ultimi contenenti composti ad elevato contenuto di carbonio e azoto e di elevata massa molecolare. Viene depositato dall'acqua naturale con cui forma un'interfaccia.
Mineralizzazione: degradazione completa di un composto organico in CO2 e H2O in condizioni aerobiche, e in CH4, CO2 e H2O in condizioni anaerobiche. Nel contesto del presente metodo di prova, quando viene impiegato un composto radiomarcato, la mineralizzazione rappresenta la degradazione di una molecola, durante la quale un atomo di carbonio marcato viene ossidato o ridotto in maniera quantitativa, con rilascio della quantità appropriata di 14CO2 o 14CH4, a seconda dei casi.
Tempo di dimezzamento: t0,5: il tempo occorrente per la trasformazione del 50 % di una sostanza di prova, quando la trasformazione può essere descritta mediante cinetica di primo ordine; essa è indipendente dalla concentrazione iniziale.
DT
50
(Tempo di scomparsa 50): tempo entro cui la concentrazione iniziale della sostanza di prova viene ridotta del 50 %.
DT
75
(Tempo di scomparsa 75): tempo entro cui la concentrazione iniziale della sostanza di prova viene ridotta del 75 %.
DT90 (Tempo di scomparsa 90): tempo entro cui la concentrazione iniziale della sostanza di prova viene ridotta del 90 %.
1.3 SOSTANZE DI RIFERIMENTO
Per identificare e determinare quantitativamente i prodotti di trasformazione mediante metodi spettroscopici e cromatografici vengono utilizzate sostanze di riferimento.
1.4 INFORMAZIONI SULLA SOSTANZA DI PROVA
Per misurare la velocità di trasformazione è possibile utilizzare una sostanza di prova non marcata o marcata con isotopo, ma si preferisce il materiale marcato. Il materiale marcato è essenziale per lo studio delle vie di trasformazione e per determinare il bilancio di massa. È consigliata la marcatura con 14C, ma possono anche rivelarsi utili altri isotopi, quali 13C, 15N, 3H, 32P. La marcatura va posizionata nei limiti del possibile nella parte o nelle parti più stabili della molecola (59). La purezza chimica e/o radiochimica della sostanza di prova deve essere almeno pari al 95 %.
Prima di eseguire la prova devono essere disponibili le seguenti informazioni sulla sostanza di prova:
|
a)
|
solubilità in acqua (Metodo A.6);
|
|
b)
|
solubilità in solventi organici;
|
|
c)
|
pressione di vapore (Metodo A.4) e costante della legge di Henry;
|
|
d)
|
coefficiente di ripartizione n-ottanolo/acqua (Metodo A.8);
|
|
e)
|
coefficiente di adsorbimento (Kd, Kf o Koc, a seconda dei casi) (Metodo C.18);
|
|
f)
|
idrolisi (Metodo C.7);
|
|
g)
|
costante di dissociazione (pKa) [linee guida OCSE 112] (13);
|
|
h)
|
struttura chimica della sostanza di prova ed eventuale posizione della marcatura isotopica.
|
Nota. Va indicata la temperatura alla quale vengono effettuate queste misurazioni.
Altre informazioni utili possono comprendere i dati sulla tossicità della sostanza di prova nei confronti di microrganismi, i dati sulla biodegradabilità rapida e/o intrinseca, e i dati sulla trasformazione aerobica e anaerobica nel suolo.
Dovrebbero essere disponibili metodi analitici (compresi i metodi di estrazione e depurazione) per l'identificazione e la determinazione quantitativa della sostanza di prova e dei suoi prodotti di trasformazione nell'acqua e nel sedimento (vedi sezione 1.7.2).
1.5 PRINCIPIO DEL METODO DI PROVA
Il metodo descritto in questo test utilizza un sistema sedimentoso acquatico aerobico e uno anaerobico (vedi allegato 1) che consente:
|
i)
|
la misurazione della velocità di trasformazione della sostanza di prova in un sistema acqua-sedimento;
|
|
ii)
|
la misurazione della velocità di trasformazione della sostanza di prova nel sedimento,
|
|
iii)
|
la misurazione della velocità di mineralizzazione della sostanza di prova e/o dei suoi prodotti di trasformazione (quando viene usata una sostanza di prova marcata con 14C),
|
|
iv)
|
l'identificazione e la determinazione quantitativa dei prodotti di trasformazione della fase acquosa e di quella sedimentosa, compreso il bilancio di massa (quando viene usata una sostanza di prova marcata),
|
|
v)
|
la misurazione della distribuzione della sostanza di prova e dei suoi prodotti di trasformazione tra le due fasi durante il periodo di incubazione al buio (per evitare ad esempio la fioritura delle alghe) a temperatura costante. I tempi di dimezzamento e i valori di DT50, DT75 e DT90 vengono determinati quando i dati lo dovessero consigliare, ma non vanno estrapolati di molto oltre l'intervallo sperimentale (vedi sezione 1.2).
|
Per ciascuno degli studi aerobico e anaerobico occorrono almeno due sedimenti con le rispettive acque (7). In determinati casi occorre però utilizzare più di due sedimenti acquatici, ad esempio nel caso di una sostanza chimica che può essere presente in ambienti di acqua dolce e/o in ambienti marini.
1.6 APPLICABILITÀ DEL TEST
Il metodo è generalmente applicabile alle sostanze chimiche (marcate o non marcate) per le quali è noto un metodo analitico sufficientemente accurato e sensibile. Esso è applicabile a composti leggermente volatili, non volatili, idrosolubili o scarsamente idrosolubili. Il test non va applicato a sostanze chimiche che presentano elevata volatilità in acqua (ad esempio fumiganti, solventi organici), che non possono pertanto essere tenute in acqua e/o nel sedimento nelle condizioni sperimentali del presente test.
Il metodo è stato applicato finora per studiare la trasformazione di sostanze chimiche in acque dolci e sedimenti, ma in linea di principio può anche essere applicato a sistemi estuariali o marini. Esso non è invece idoneo alla simulazione delle condizioni di acqua corrente (ad esempio nei fiumi) o di mare aperto.
1.7 CRITERI DI QUALITÀ
1.7.1 Recupero
L'estrazione e l'analisi di campioni di acqua e sedimento, perlomeno in duplicato, subito dopo l'aggiunta della sostanza di prova, forniscono una prima indicazione della ripetibilità del metodo analitico e dell'uniformità della procedura di applicazione per la sostanza di prova. Le percentuali di recupero per gli stadi successivi degli esperimenti sono basate sui rispettivi bilanci di massa (quando viene usato materiale marcato) e dovrebbero essere comprese tra 90 % e 110 % per le sostanze chimiche marcate (6) e tra 70 % e 110 % per le sostanze chimiche non marcate.
1.7.2 Ripetibilità e sensibilità del metodo analitico
La ripetibilità del metodo analitico (esclusa l'efficienza dell'estrazione iniziale) utilizzato per quantificare la sostanza di prova e i prodotti di trasformazione può essere controllata mediante un'analisi in duplicato dello stesso estratto dei campioni di acqua o sedimento, incubati sufficientemente a lungo per consentire la formazione di prodotti di trasformazione.
Il limite di rivelabilità del metodo analitico per la sostanza di prova e i prodotti di trasformazione deve essere pari ad almeno 0,01 mg· kg-1 in acqua o sedimento (come sostanza di prova) o all'1 % della quantità iniziale applicata a un sistema di prova, se minore del precedente. Va anche specificato il limite di quantificazione.
1.7.3 Accuratezza dei dati sulla trasformazione
L'analisi di regressione delle concentrazioni della sostanza di prova in funzione del tempo fornisce dati adeguati sull'accuratezza della curva di trasformazione e consente di calcolare gli intervalli di confidenza per i tempi di dimezzamento (in caso di cinetica del pseudo primo ordine) o i valori di DT50 e, se del caso, DT75 e DT90.
1.8 DESCRIZIONE DEL METODO
1.8.1 Sistema di prova e attrezzatura
Lo studio va eseguito in contenitori di vetro (ad esempio bottiglie, provette da centrifuga) salvo quando dati preliminari (quali il coefficiente di ripartizione n-ottanolo-acqua, i dati di assorbimento/adsorbimento, ecc.) indicano che la sostanza di prova può aderire al vetro, nel qual caso potrebbe essere necessario prendere in considerazione un materiale alternativo (ad esempio teflon). Se è noto che la sostanza di prova aderisce al vetro, può essere possibile ovviare al problema mediante uno o più dei metodi seguenti:
|
—
|
determinazione della massa della sostanza di prova e dei prodotti di trasformazione assorbiti sul vetro;
|
|
—
|
lavaggio con solvente di tutta la vetreria al termine della prova;
|
|
—
|
impiego di prodotti formulati (vedi anche sezione 1.9.2);
|
|
—
|
uso di una quantità maggiore di cosolvente per l'aggiunta della sostanza di prova al sistema; l'eventuale cosolvente impiegato deve essere tale da non sottoporre a solvolisi la sostanza di prova.
|
Gli allegati 2 e 3 riportano esempi di attrezzature di prova tipiche, ossia, rispettivamente, a flusso continuo e con sistema a biometro (14). Altri sistemi ad incubazione utili sono descritti nel riferimento bibliografico 15. L'attrezzatura sperimentale deve essere progettata in modo tale da consentire lo scambio di aria o azoto e la cattura dei prodotti volatili. Le sue dimensioni devono essere tali da soddisfare i requisiti del test (vedi sezione 1.9.1). La ventilazione può essere garantita mediante un leggero gorgogliamento o mediante il passaggio di aria o azoto sopra la superficie dell'acqua. In quest'ultimo caso può essere consigliabile agitare leggermente l'acqua dall'alto, per migliorare la distribuzione dell'ossigeno o dell'azoto nell'acqua. Non va impiegata aria priva di CO2 che potrebbe portare all'aumento del pH dell'acqua. In entrambi i casi è bene evitare se possibile di disturbare il sedimento. Le prove su sostanze chimiche leggermente volatili vanno effettuate in un sistema a biometro con leggera agitazione della superficie dell'acqua. Si possono anche usare recipienti chiusi con uno spazio di testa di aria atmosferica o azoto e fiale interne per la cattura dei prodotti volatili (16). Nella prova aerobica il gas contenuto nello spazio di testa va scambiato ad intervalli regolari per compensare il consumo di ossigeno ad opera della biomassa.
Come trappole idonee per la cattura di prodotti di trasformazione volatili si possono impiegare, senza però alcuna limitazione, soluzioni da 1 mol· dm-3 di idrossido di potassio o idrossido di sodio per l'anidride carbonica (60), e glicole etilenico, etanolammina o paraffina al 2 % in xilene per i composti organici. Le sostanze volatili formate in condizioni anaerobiche, quali metano, possono essere raccolte per esempio mediante setacci molecolari. Tali sostanze possono ad esempio essere bruciate per produrre CO2 facendo passare il gas attraverso un tubo in quarzo riempito con CuO alla temperatura di 900 oC e catturando la CO2 formata in un assorbitore contenente un alcale (17).
È necessaria una strumentazione da laboratorio per l'analisi chimica della sostanza di prova e dei prodotti di trasformazione [ad esempio cromatografia gas liquido (GLC), cromatografia liquida ad alta risoluzione (HPLC), cromatografia su strato sottile (TLC), spettroscopia di massa (MS), gas cromatografia-spettroscopia di massa (GC-MS), cromatografia liquida-spettrometria di massa (LC-MS), risonanza magnetica nucleare (NMR), ecc.], ivi compresi i sistemi di rilevamento per le sostanze chimiche radiomarcate o non marcate, a seconda dei casi. Quando si usa materiale radiomarcato occorrono inoltre un contatore a scintillazione a liquido e un ossidatore a combustione (per la combustione dei campioni di sedimento prima dell'analisi della radioattività).
Servono inoltre altre normali attrezzature da laboratorio per misurazioni fisico-chimiche e biologiche (vedi la tabella 1, sezione 1.8.2.2), vetreria, sostanze chimiche e reagenti, secondo necessità.
1.8.2 Selezione e numero dei sedimenti acquatici
I siti di campionamento vanno selezionati in funzione delle finalità del test in ogni situazione sperimentale. Ai fini della selezione dei siti di campionamento occorre prendere in considerazione tutti gli eventuali apporti agricoli, industriali e domestici verificatisi nella zona interessata e nelle acque a monte. Non vanno impiegati sedimenti che sono stati contaminati con la sostanza di prova o con i suoi analoghi strutturali nel corso dei precedenti 4 anni.
1.8.2.1 Selezione del sedimento
Per gli studi aerobici vengono normalmente usati due sedimenti (7). I due sedimenti selezionati dovrebbero essere diversi in quanto a contenuto di carbonio organico e tessitura. Uno dei sedimenti dovrebbe avere contenuto elevato di carbonio organico (2,5-7,5 %) e tessitura fine, mentre l'altro sedimento dovrebbe avere basso contenuto di carbonio organico (0,5-2,5 %) e tessitura grossa. La differenza tra i contenuti di carbonio organico deve essere normalmente pari almeno al 2 %. Per «tessitura fine» si intende un contenuto di [argilla + limo] (61) > 50 %, e per «tessitura grossa» un contenuto di [argilla + limo] < 50 %. Di norma la differenza di contenuto di [argilla + limo] dei due sedimenti deve essere almeno pari al 20 %. Nei casi in cui la sostanza chimica potrebbe anche raggiungere le acque marine è necessario che almeno uno dei sistemi acqua-sedimento abbia origine marina.
Per lo studio strettamente anaerobico vanno prelevati due campioni di sedimento (comprese le rispettive acque) da zone anaerobiche dei corpi d'acqua superficiali (7). Entrambe le fasi sedimentose e acquose vanno maneggiate e trasportate con cura in ambiente privo di ossigeno.
Potrebbero esserci altri fattori importanti nella scelta dei sedimenti, che vanno presi in considerazione caso per caso. L'intervallo di pH dei sedimenti, ad esempio, assumerebbe notevole importanza qualora la trasformazione e/o l'assorbimento della sostanza chimica oggetto della prova dipendessero dal pH. La dipendenza dal pH dell'assorbimento potrebbe riflettersi nel pKa della sostanza di prova.
1.8.2.2 Caratterizzazione dei campioni acqua-sedimento
Nella tabella seguente sono riassunti i parametri principali da misurare e documentare (con riferimento al metodo utilizzato) sia per l'acqua, sia per il sedimento, con indicazione delle fasi del test in cui tali parametri vanno determinati. Per ulteriori informazioni sui metodi per la determinazione di questi parametri si rimanda ai riferimenti bibliografici (18)(19)(20)(21).
Potrebbe inoltre essere necessario misurare e documentare altri parametri, a seconda dei casi [ad esempio, per acqua dolce: particelle, alcalinità, durezza, conduttività, NO3/PO4 (rapporto e valori singoli); per i sedimenti: capacità di scambio cationico, capacità di trattenimento dell'acqua, carbonato, azoto e fosforo totali; per sistemi marini: salinità]. Per valutare le condizioni di ossido-riduzione potrebbe inoltre rivelarsi utile l'analisi di nitrato, solfato, ferro biodisponibile ed eventualmente altri accettori elettronici nell'acqua e nei sedimenti, soprattutto in relazione alla trasformazione anaerobica.
Rilevamento dei parametri per la caratterizzazione dei campioni acqua-sedimento (7)(22)(23)
|
Parametro
|
Fase del test
|
|
campionatura sul campo
|
post-manipolazione
|
inizio dell'acclimatazione
|
inizio della prova
|
durante la prova
|
termine della prova
|
|
Acqua
|
|
Origine/fonte
|
x
|
|
|
|
|
|
|
Temperatura
|
x
|
|
|
|
|
|
|
pH
|
x
|
|
x
|
x
|
x
|
x
|
|
TOC
|
|
|
x
|
x
|
|
x
|
|
Concentrazione di O2
(62)
|
x
|
|
x
|
x
|
x
|
x
|
|
Potenziale Redox (62)
|
|
|
x
|
x
|
x
|
x
|
|
Sedimento
|
|
Origine/fonte
|
x
|
|
|
|
|
|
|
Profondità dello strato
|
x
|
|
|
|
|
|
|
pH
|
|
x
|
x
|
x
|
x
|
x
|
|
Distribuzione della dimensione delle particelle
|
|
x
|
|
|
|
|
|
TOC
|
|
x
|
x
|
x
|
|
x
|
|
Biomassa microbica (63)
|
|
x
|
|
x
|
|
x
|
|
Potenziale Redox (62)
|
Osservazione (colore/odore)
|
|
x
|
x
|
x
|
x
|
1.8.3 Raccolta, manipolazione e conservazione
1.8.3.1 Raccolta
Per la campionatura del sedimento va utilizzata la bozza di linea guida ISO sulla campionatura dei sedimenti depositati sul fondo (8). I campioni di sedimento vanno prelevati dall'intero strato superiore del sedimento, avente spessore di 5-10 cm. Le relative acque vanno raccolte nello stesso sito o ubicazione da cui viene prelevato il sedimento e nello stesso istante. Per gli studi anaerobici il prelievo e il trasporto del sedimento e dell'acqua relativa vanno effettuati in assenza di ossigeno (28) (vedi sezione 1.8.2.1). Alcuni dispositivi di campionatura sono descritti in bibliografia (8)(23).
1.8.3.2 Manipolazione
Il sedimento viene dapprima separato dall'acqua per filtrazione e poi setacciato a umido con un setaccio da 2 mm impiegando un eccesso di acqua locale, che viene poi gettata. Successivamente si mescolano quantità note di sedimenti e acqua nei rapporti desiderati (vedi sezione 1.9.1) utilizzando palloni di incubazione, le quali vengono poi preparate per il periodo di acclimatazione (vedi sezione 1.8.4). Per lo studio anaerobico tutte le operazioni di manipolazione vanno effettuate in assenza di ossigeno (29)(30)(31)(32)(33).
1.8.3.3 Conservazione
Si raccomanda vivamente di utilizzare sedimento e acqua campionati di fresco, ma se vi fossero necessità di conservazione occorre setacciare il sedimento e l'acqua come sopra descritto e conservarli insieme, coperti da uno strato d'acqua di 6-10 cm, al buio, a 4 ± 2 oC4 per un massimo di 4 settimane (7)(8)(23). I campioni da utilizzare per gli studi aerobici vanno conservati all'aria (ad esempio in contenitori aperti), mentre per gli studi anaerobici occorre eliminare la presenza di ossigeno. I campioni non vanno congelati e il sedimento non va lasciato asciugare durante il trasporto e la conservazione.
1.8.4 Preparazione dei campioni di sedimento/acqua per il test
Prima dell'aggiunta della sostanza di prova occorre prevedere un periodo di acclimatazione, ponendo ciascun campione di sedimento/acqua nel recipiente di incubazione che verrà poi utilizzato per il test principale; l'acclimatazione va eseguita esattamente nelle stesse condizioni dell'incubazione di prova (vedi sezione 1.9.1). Il periodo di acclimatazione serve per raggiungere sufficiente stabilità nel sistema, valutata in base al pH, alla concentrazione di ossigeno nell'acqua, al potenziale redox di sedimento e acqua e alla separazione macroscopica delle fasi. Il periodo di acclimatazione è di norma compreso tra una e due settimane e comunque non supera le quattro settimane. I risultati delle determinazioni effettuate durante questo periodo vanno documentati.
1.9 ESECUZIONE DEL TEST
1.9.1 Condizioni
Il test va effettuato nell'attrezzatura di incubazione (vedi sezione 1.8.1) con rapporto volumetrico acqua/sedimento compreso tra 3:1 e 4:1 e strato del sedimento di 2,5 cm (±0,5 cm) (64). Per ogni recipiente di incubazione si raccomanda una quantità minima di sedimento pari a 50 g (peso secco).
Il test va condotto al buio, a temperatura costante compresa tra 10 e 30 oC. La temperatura ideale è 20 ± 2 oC. In casi particolari può essere necessario eseguire un test anche a temperatura inferiore (ad esempio 10 oC), in funzione dei dati che si vogliono raccogliere. La temperatura d'incubazione va sottoposta a monitoraggio e documentata.
1.9.2 Trattamento e applicazione della sostanza di prova
Viene utilizzata una sola concentrazione di prova della sostanza chimica (65). Per le sostanze fitosanitarie applicate direttamente ai corpi d'acqua, la dose massima riportata sull'etichetta rappresenta il tasso di applicazione massimo calcolato sulla base dell'area superficiale dell'acqua nel recipiente di prova. In tutti gli altri casi la concentrazione da utilizzare va basata su previsioni derivate dalle emissioni ambientali. La concentrazione delle sostanze di prova applicate va studiata con cura al fine di caratterizzare la via di trasformazione, nonché la formazione e la diminuzione dei prodotti di trasformazione. Può essere necessario applicare dosi più elevate (ad esempio 10 volte maggiori) in situazioni in cui le concentrazioni delle sostanze di prova sono vicine ai limiti di rilevamento all'inizio della prova, e/o nei casi in cui alcuni importanti prodotti di trasformazione non potrebbero venire facilmente determinati se presenti in quantità pari al 10 % del tasso di applicazione della sostanza di prova. Se però vengono impiegate concentrazioni di prova più elevate, queste non devono avere significativi effetti avversi sull'attività microbica del sistema acqua-sedimento. Al fine di ottenere una concentrazione costante della sostanza di prova in recipienti di dimensione diversa, va presa in considerazione l'opportunità di modificare la quantità del materiale applicato sulla base della profondità della colonna d'acqua nel recipiente rispetto alla profondità dell'acqua sul campo (presunta pari a 100 cm, ma possono essere usate altre profondità). Un esempio di calcolo è riportato nell'allegato 4.
Nel caso ideale la sostanza di prova va applicata alla fase acquosa del sistema di prova sotto forma di soluzione acquosa. È ammesso, nei casi in cui ciò sia inevitabile, l'uso di piccole quantità di solventi miscibili in acqua (ad es. acetone, etanolo) per l'applicazione e la distribuzione della sostanza di prova, senza tuttavia superare l'1 % v/v ed evitando in ogni caso il rischio di produrre effetti avversi sull'attività microbica del sistema di prova. La soluzione acquosa della sostanza di prova va preparata con cautela; per garantire un'omogeneità completa può rivelarsi utile l'impiego di colonne di generazione e di premiscelazione. Dopo l'aggiunta della soluzione acquosa al sistema di prova si raccomanda di miscelare leggermente la fase acquosa, disturbando il meno possibile il sedimento.
L'uso di prodotti formulati non è consigliato in condizioni normali, perché gli ingredienti della formulazione possono influire sulla distribuzione della sostanza di prova e/o dei prodotti di trasformazione tra le fasi acquosa e sedimentosa. Nel caso di sostanze di prova scarsamente idrosolubili l'impiego di materiale formulato può rappresentare però un'alternativa appropriata.
Il numero di recipienti di incubazione dipende dal numero dei tempi di campionatura (vedi sezione 1.9.3). Il numero dei sistemi di prova deve essere sufficiente a consentire il sacrificio di due sistemi per ciascun tempo di campionatura. Se si impiegano unità di controllo per ciascun sistema sedimentoso acquatico, esse non vanno trattate con la sostanza di prova. Le unità di controllo possono essere usate per determinare la biomassa microbica del sedimento e il carbonio organico totale di acqua e sedimento al termine dello studio. Due unità di controllo (cioè un'unità di controllo per ciascun sedimento acquatico) possono essere utilizzate per monitorare i parametri richiesti nel sedimento e nell'acqua durante il periodo di acclimatazione (vedi tabella in sezione 1.8.2.2). Vanno incluse due unità di controllo aggiuntive nel caso in cui la sostanza di prova venga applicata mediante un solvente in modo da poter misurare gli effetti avversi sull'attività microbica del sistema di prova.
1.9.3 Durata del test e campionatura
La durata dell'esperimento non deve normalmente eccedere 100 giorni (6) e dovrebbe continuare fino alla determinazione delle vie di degradazione e delle caratteristiche di distribuzione acqua/sedimento, oppure fino alla dissipazione del 90 % della sostanza di prova a seguito di trasformazione e/o volatilizzazione. I tempi di campionatura devono essere almeno sei (tempo zero compreso), ricorrendo opzionalmente ad uno studio preliminare (vedi sezione 1.9.4) per determinare un regime di campionatura appropriato e la durata del test, salvo quando esistano dati sufficienti sulla sostanza di prova ottenuti da studi precedenti. Per sostanze di prova idrofobiche potrebbero rivelarsi necessari punti di campionatura aggiuntivi durante il periodo iniziale dello studio, allo scopo di determinare la velocità di distribuzione tra le fasi acquosa e sedimentosa.
In corrispondenza dei tempi di campionatura accuratamente selezionati si rimuovono i recipienti di incubazione interi (in duplicato) da sottoporre all'analisi. Il sedimento e l'acqua soprastante vengono analizzati separatamente (66). L'acqua superficiale va rimossa con attenzione, disturbando il meno possibile il sedimento. L'estrazione e la caratterizzazione della sostanza di prova e dei prodotti di trasformazione devono rispettare le procedure analitiche del caso. Va rimosso con attenzione l'eventuale materiale adsorbito nei recipienti di incubazione o nei tubi di interconnessione utilizzati per catturare le sostanze volatili.
1.9.4 Prova preliminare opzionale
Se la durata e il regime di campionatura non possono essere stimati sulla base di altri studi effettuati sulla sostanza di prova, può essere utile svolgere una prova preliminare opzionale, che va in tal caso effettuata alle stesse condizioni di prova proposte per lo studio definitivo. Le condizioni sperimentali e i risultati dell'eventuale prova preliminare vanno documentati brevemente.
1.9.5 Misurazioni e analisi
È necessario misurare e riportare la concentrazione della sostanza di prova e dei prodotti di trasformazione nell'acqua e nel sedimento in corrispondenza di ciascun tempo di campionatura (espressa come concentrazione e come percentuale della sostanza applicata). In via generale, per ciascun tempo di campionatura vanno identificati i prodotti di trasformazione rilevati a ≥ 10 % della radioattività applicata al sistema totale acqua-sedimento, a meno che vi siano motivi ragionevoli che consiglino altrimenti. Va inoltre presa in considerazione l'opportunità di identificare i prodotti di trasformazione le cui concentrazioni aumentano in modo continuativo durante lo studio, pur non eccedendo i limiti sopra riportati, poiché tale aumento può essere indicativo di persistenza. Questi aspetti vanno affrontati caso per caso, motivando nella relazione le soluzioni adottate.
I risultati ottenuti dai sistemi per la cattura di gas e sostanze volatili (CO2 e altri, cioè sostanze organiche volatili) vanno riportati per ciascun tempo di campionatura. Le velocità di mineralizzazione vanno anch'esse riportate. I residui non estraibili (legati) nel sedimento vanno riportati per ciascun punto di campionatura.
2. DATI
2.1 TRATTAMENTO DEI RISULTATI
Per ciascun tempo di campionatura si calcolano il bilancio di massa totale o il recupero (vedi sezione 1.7.1) della radioattività aggiunta. I risultati vanno espressi come percentuale della radioattività aggiunta. La distribuzione della radioattività tra acqua e sedimento va espressa come concentrazione e in percentuale, per ciascun tempo di campionatura.
Il tempo di dimezzamento, il DT50 ed eventualmente il DT75 e il DT90 della sostanza di prova vanno calcolati con i rispettivi intervalli di confidenza (vedi sezione 1.7.3). I dati sulla velocità di dissipazione della sostanza di prova nell'acqua e nel sedimento possono essere ricavati mediante opportuni strumenti di valutazione. Essi possono comprendere l'applicazione di cinetiche dello pseudo primo ordine, tecniche empiriche di interpolazione con curve che applicano soluzioni grafiche o numeriche, e valutazioni più complesse, tra cui modelli a compartimento singolo o multiplo. Per maggiori dettagli si rimanda alle rispettive pubblicazioni (35)(36)(37).
Tutte le tecniche hanno punti forti e punti deboli e possono variare notevolmente in quanto a complessità. L'ipotesi di una cinetica del primo ordine può semplificare eccessivamente i processi di degradazione e distribuzione, ma in determinati casi essa consente di disporre di un valore (la costante di velocità o il tempo di dimezzamento) che può essere compreso facilmente ed è utile nei modelli di simulazione e nei calcoli di previsione delle concentrazioni ambientali. Le soluzioni empiriche o le trasformazioni lineari possono fornire interpolazioni più aderenti e consentire pertanto una stima migliore dei tempi di dimezzamento, del DT50 ed eventualmente dei DT75 e DT90. L'uso delle costanti così derivate è però limitato. I modelli a compartimento possono dare luogo a diverse costanti utili ai fini della valutazione dei rischi, per descrivere la velocità di degradazione in compartimenti diversi e la distribuzione delle sostanze chimiche. Essi vanno inoltre utilizzati per stimare le costanti di velocità per la formazione e la degradazione dei prodotti di trasformazione principali. In tutti i casi il metodo prescelto va motivato e lo sperimentatore deve dimostrare graficamente e/o statisticamente la bontà dell'interpolazione.
3. RELAZIONE
3.1 RELAZIONE SULL'ESECUZIONE DEL TEST
La relazione deve comprendere le seguenti informazioni:
|
|
Sostanza di prova:
|
—
|
denominazione comune, nome chimico, numero CAS, formula di struttura (indicante la posizione della marcatura o delle marcature quando si utilizzano materiali radiomarcati) e proprietà fisicochimiche rilevanti;
|
|
—
|
purezza (impurità) della sostanza di prova;
|
|
—
|
purezza radiochimica della sostanza chimica marcata e attività molare (nei casi opportuni).
|
|
|
|
Sostanze di riferimento:
|
—
|
nome chimico e struttura delle sostanze di riferimento utilizzate per la caratterizzazione e/o l'identificazione dei prodotti di trasformazione.
|
|
|
|
Sedimenti e acque di prova:
|
—
|
ubicazione e descrizione dei siti di campionatura dei sedimenti acquatici, precisando se possibile i casi di contaminazione che si sono verificati;
|
|
—
|
tutte le informazioni riguardanti il prelievo, l'eventuale conservazione e l'acclimatazione dei sistemi acqua-sedimento;
|
|
—
|
caratteristiche dei campioni acqua-sedimento come riportato nella tabella in sezione 1.8.2.2.
|
|
|
|
Condizioni del test:
|
—
|
sistema di prova utilizzato (ad esempio flusso, biometro, modalità di ventilazione, metodo di agitazione, volume d'acqua, massa del sedimento, spessore degli strati acquoso e sedimentoso, dimensione dei recipienti di prova, ecc.);
|
|
—
|
applicazione della sostanza di prova al sistema di prova: concentrazione di prova utilizzata, numero dei replicati e dei controlli, modalità di applicazione della sostanza di prova (ad esempio eventuale uso di solvente), ecc.;
|
|
—
|
temperatura di incubazione;
|
|
—
|
metodi di estrazione e relative efficienze, oltre ai metodi analitici e ai limiti di rivelabilità;
|
|
—
|
metodi di caratterizzazione/identificazione dei prodotti di trasformazione;
|
|
—
|
deviazioni dai protocolli di prova o dalle condizioni di prova durante lo studio.
|
|
|
|
Risultati:
|
—
|
dati grezzi delle analisi rappresentative (tutti i dati grezzi vanno conservati nell'archivio GLP);
|
|
—
|
ripetibilità e sensibilità dei metodi analitici utilizzati;
|
|
—
|
tassi di recupero (i valori percentuali per la validità dello studio sono riportati nella sezione 1.7.1);
|
|
—
|
tabelle dei risultati, espressi come percentuale della dose applicata e in mg· kg-1 in acqua, sedimento e sistema totale (percentuale soltanto) per la sostanza di prova e, se appropriato, per i prodotti di trasformazione e la radioattività non estraibile;
|
|
—
|
bilancio di massa durante gli studi e al termine degli studi;
|
|
—
|
rappresentazione grafica della trasformazione nelle frazioni acquosa e sedimentosa e nel sistema totale (mineralizzazione compresa);
|
|
—
|
velocità di mineralizzazione;
|
|
—
|
tempo di dimezzamento, DT50 ed eventualmente DT75 e DT90 della sostanza di prova e, se del caso, per i principali prodotti di trasformazione, compresi gli intervalli di confidenza in acqua, nel sedimento e nel sistema totale;
|
|
—
|
valutazione delle cinetiche di trasformazione della sostanza di prova e, se del caso, dei principali prodotti di trasformazione;
|
|
—
|
via di trasformazione proposta, se del caso;
|
|
—
|
discussione dei risultati.
|
|
4. BIBLIOGRAFIA
|
(1)
|
BBA-Guidelines for the examination of plant protectors in the registration process. (1990). Part IV, Section 5-1: Degradability and fate of plant protectors in the water/sediment system. Germany.
|
|
(2)
|
Commission for registration of pesticides: Application for registration of a pesticide. (1991). Part G. Behaviour of the product and its metabolites in soil, water and air, Section G.2.1 (a). The Netherlands.
|
|
(3)
|
MAFF Pesticides Safety Directorate. (1992). Preliminary guideline for the conduct of biodegradability tests on pesticides in natural sediment/water systems. Ref No SC 9046. United-Kingdom.
|
|
(4)
|
Agriculture Canada: Environmental chemistry and fate. (1987). Guidelines for registration of pesticides in Canada. Aquatic (Laboratory) — Anaerobic and aerobic. Canada. pp 35-37.
|
|
(5)
|
US-EPA: Pesticide assessment guidelines, Subdivision N. Chemistry: Environmental fate (1982). Section 162-3, Anaerobic aquatic metabolism.
|
|
(6)
|
SETAC-Europe publication. (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides. Ed. Dr Mark R. Lynch. SETAC-Europe, Brussels.
|
|
(7)
|
OECD Test Guidelines Programme. (1995). Final Report of the OECD Workshop on Selection of Soils/sediments, Belgirate, Italy, 18-20 January 1995.
|
|
(8)
|
ISO/DIS 5667-12. (1994). Water quality — Sampling — Part 12: Guidance on sampling of bottom sediments.
|
|
(9)
|
US-EPA (1998a). Sediment/water microcosm biodegradation test. Harmonised Test Guidelines (OPPTS 835.3180). EPA 712-C-98-080.
|
|
(10)
|
DFG: Pesticide Bound Residues in Soil. Wiley-VCH (1998).
|
|
(11)
|
T.R. Roberts: Non-extractable pesticide residues in soils and plants. Pure Appl. Chem. 56, 945-956 (IUPAC 1984).
|
|
(12)
|
OECD Test Guideline 304A: Inherent Biodegradability in Soil (adopted 12 May 1981).
|
|
(13)
|
OECD (1993): Guidelines for Testing of Chemicals. Paris. OECD (1994-2000): Addenda 6-11 to Guidelines for the Testing of Chemicals.
|
|
(14)
|
Scholz, K., Fritz R., Anderson C. and Spiteller M. (1988) Degradation of pesticides in an aquatic model ecosystem. BCPC — Pests and Diseases, 3B-4, 149-158.
|
|
(15)
|
Guth, J.A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry (D.H. Hutson, T.R. Roberts, Eds.), Vol. 1, 85-114. J. Wiley & Sons.
|
|
(16)
|
Madsen, T., Kristensen, P. (1997). Effects of bacterial inoculation and non-ionic surfactants on degradation of polycyclic aromatic hydrocarbons in soil. Environ. Toxicol. Chem. 16, 631-637.
|
|
(17)
|
Steber, J., Wierich, P. (1987). The anaerobic degradation of detergent range fatty alcohol ethoxylates. Studies with 14C-labelled model surfactants. Water Research 21, 661-667.
|
|
(18)
|
Black, C.A. (1965). Methods of Soil Analysis. Agronomy Monograph No. 9. American Society of Agronomy, Madison.
|
|
(19)
|
APHA (1989). Standard Methods for Examination of Water and Wastewater (17th edition). American Public Health Association, American Water Works Association and Water Pollution Control Federation, Washington D.C.
|
|
(20)
|
Rowell, D.L. (1994). Soil Science Methods and Applications. Longman.
|
|
(21)
|
Light, T.S. (1972). Standard solution for redox potential measurements. Anal. Chemistry 44, 1038-1039.
|
|
(22)
|
SETAC-Europe publication (1991). Guidance document on testing procedures for pesticides in freshwater mesocosms. From the Workshop «A Meeting of Experts on Guidelines for Static Field Mesocosms Tests», 3-4 July 1991.
|
|
(23)
|
SETAC-Europe publication. (1993). Guidance document on sediment toxicity tests and bioassays for freshwater and marine environments. From the Workshop On Sediment Toxicity Assessment (WOSTA), 8-10 November 1993. Eds.: I.R. Hill, P. Matthiessen and F. Heimbach.
|
|
(24)
|
Vink, J.P.M., van der Zee, S.E.A.T.M. (1997). Pesticide biotransformation in surface waters: multivariate analyses of environmental factors at field sites. Water Research 31, 2858-2868.
|
|
(25)
|
Vink, J.P.M., Schraa, G., van der Zee, S.E.A.T.M. (1999). Nutrient effects on microbial transformation of pesticides in nitrifying waters. Environ. Toxicol, 329-338.
|
|
(26)
|
Anderson, T.H., Domsch, K.H. (1985). Maintenance carbon requirements of actively-metabolising microbial populations under in-situ conditions. Soil Biol. Biochem. 17, 197-203.
|
|
(27)
|
ISO-14240-2. (1997). Soil quality — Determination of soil microbial biomass — Part 2: Fumigation-extraction method.
|
|
(28)
|
Beelen, P. Van and F. Van Keulen. (1990), The Kinetics of the Degradation of Chloroform and Benzene in Anaerobic Sediment from the River Rhine. Hydrobiol. Bull. 24 (1), 13-21.
|
|
(29)
|
Shelton, D.R. and Tiedje, J.M. (1984). General method for determining anaerobic biodegradation potential. App. Environ. Microbiol. 47, 850-857.
|
|
(30)
|
Birch, R.R., Biver, C., Campagna, R., Gledhill, W.E., Pagga, U., Steber, J., Reust, H. and Bontinck, W.J. (1989). Screening of chemicals for anaerobic biodegradation. Chemosphere 19, 1527-1550.
|
|
(31)
|
Pagga, U. and Beimborn, D.B. (1993). Anaerobic biodegradation tests for organic compounds. Chemoshpere 27, 1499-1509.
|
|
(32)
|
Nuck, B.A. and Federle, T.W. (1986). A batch test for assessing the mineralisation of 14C-radiolabelled compounds under realistic anaerobic conditions. Environ. Sci. Technol. 30, 3597-3603.
|
|
(33)
|
US-EPA (1998b). Anaerobic biodegradability of organic chemicals. Harmonised Test Guidelines (OPPTS 835.3400). EPA 712-C-98-090.
|
|
(34)
|
Sijm, Haller and Schrap (1997). Influence of storage on sediment characteristics and drying sediment on sorption coefficients of organic contaminants. Bulletin Environ. Contam. Toxicol. 58, 961-968.
|
|
(35)
|
Timme, G., Frehse H. and Laska V. (1986) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues II. Pflanzenschutz — Nachrichten Bayer, 39, 187-203.
|
|
(36)
|
Timme, G., Frehse, H. (1980) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues I. Pflanzenschutz — Nachrichten Bayer, 33, 47-60.
|
|
(37)
|
Carlton, R.R. and Allen, R. (1994). The use of a compartment model for evaluating the fate of pesticides in sediment/water systems. Brighton Crop Protection Conference — Pest and Diseases, pp 1349-1354.
|
ALLEGATO 1
LINEE GUIDA SUI SISTEMI DI PROVA AEROBICI E ANAEROBICI
Sistema di prova aerobico
Il sistema di prova aerobico descritto in questo metodo di prova consiste di uno strato di acqua aerobico (concentrazioni di ossigeno tipiche comprese tra 7 e 10 mg· l-1) e uno strato sedimentoso aerobico in superficie e anaerobico sotto la superficie [potenziali redox (Eh) medi tipici nella zona anaerobica del sedimento compresi tra - 80 e - 190 mV]. Dell'aria inumidita viene fatta passare sopra la superficie dell'acqua in ciascuna unità di incubazione per mantenere una quantità sufficiente di ossigeno nello spazio di testa.
Sistema di prova anaerobico
Per il sistema di prova anaerobico la procedura di prova è sostanzialmente uguale a quella delineata per il sistema aerobico, con la differenza che viene fatto passare dell'azoto inumidito sopra la superficie dell'acqua in ciascuna unità di incubazione per mantenere uno spazio di testa di azoto. Il sedimento e l'acqua vengono considerati anaerobici se il potenziale redox (Eh) è minore di - 100 mV.
Nella prova anaerobica la valutazione della mineralizzazione comprende la misurazione dell'anidride carbonica e del metano prodotti.
ALLEGATO 2
ESEMPIO DI UN ATTREZZATURA A FLUSSO CONTINUO

ALLEGATO 3
ESEMPIO DI UN'ATTREZZATURA A BIOMETRO

ALLEGATO 4
ESEMPIO DI CALCOLO PER LA DOSE DI APPLICAZIONE NEI RECIPIENTI DI PROVA
|
Diametro interno del cilindro:
|
= 8 cm
|
|
Profondità della colonna d'acqua, sedimento escluso:
|
= 12 cm
|
|
Area di superficie: 3,142 × 42
|
= 50,3 cm2
|
|
Tasso di applicazione: 500 g di sostanza di prova/ha corrispondente a 5 μg/cm2
|
|
|
Totale μg: 5 × 50,3
|
= 251,5 μg
|
|
Regolazione della quantità in relazione ad una profondità di 100 cm:
12 × 251,5 ÷ 100
|
= 30,18 μg
|
|
Volume della colonna d'acqua: 50,3 × 12
|
= 603 ml
|
|
Concentrazione in acqua: 30,18 ÷ 603
|
= 0,050 μg/ml oppure 50 μg/l
|
(1) I risultati di queste prove interlaboratorio e una rettifica tecnica alla norma tecnica ISO 6341 danno una EC50 — 24 h del dicromato di potassio (K2Cr2O7) nell'intervallo 0,6 mg/l-1,7mg/l.
(2) Acqua di purezza adeguata, ad esempio acqua non ionizzata, acqua distillata o sottoposta a trattamento di osmosi inversa con una conduttività preferibilmente inferiore o uguale a 10 μS.cm-1.
(3) D1 e D2 non dovrebbero essere mediati se c'è notevole differenza tra loro.
(4) D1 e D2 non dovrebbero essere mediati se c'è notevole differenza tra loro.
(5) 0 al termine dell'incubazione
(6) D1: e D2 non dovrebbero essere mediati se c'è notevole differenza tra loro.
(7) o al termine dell'incubazione
(8) Non prendere il valore medio se c'è una notevole differenza tra due dati replicati.
(9) Non prendere il valore medio se c'è una notevole differenza tra due dati replicati.
(10) Dopo l'uso, le soluzioni contenenti sali di mercurio devono essere tranate in modo da evitare la diffusione di mercurio nell'ambiente.
(11) Mabey e Mill raccomandano l'utilizzo di tamponi borati o acetati anziché di tamponi fosfati (11).
(12) Tali informazioni possono provenire da altre fonti: può trattarsi ad esempio di dati sull'idrolisi di composti strutturalmente affini ricavati dalla letteratura scientifica o di dati ottenuti da altri saggi preliminari semiquantitativi di idrolisi eseguiti sulla sostanza di prova ad uno stadio precedente di sviluppo.
(13) I valori del pH riportati in queste tabelle sono stati calcolati a partire da misure del potenziale, utilizzando le equazioni standard di Sörensen (1909). I valori effettivi del pH sono superiori di 0,04 unità rispetto ai valori indicati nelle tabelle.
(14) Aggiungere qualche piccolo cristallo di timolo o altra sostanza simile per prevenire la formazione di muffe.
(15) I termini «ultima» e «primaria», riferiti alla biodegradazione, sono traduzioni dei termini inglesi «ultimate» e «primary», rispettivamente.
(16) Valore medio di tre determinazioni.
(17) I termini «ultima» e «primaria», riferiti alla biodegradazione, sono traduzioni dei termini inglesi «ultimate» e «primary», rispettivamente.
(18) Meyer A., Orti G. (1993) Proc. Rovai Society of London, Series B., Vol.252, p. 231.
(19) Campionare l'acqua dopo l’erogazione di almeno tre «volumi di camera».
I valori tra parentesi sono il numero di campioni (acqua, pesce) da prelevare se si esegue un campionamento addizionale.
|
Nota
|
:
|
La stima preliminare di k2 per log Pow = 4,0 è di 0,652 giorni-1. La durata totale dell’esperimento viene impostata su 3 × as = 3 × 4,6 giorni, cioè 14 giorni. Per la stima di «as» vedi allegato 3.
|
(20) Meyer, A., Bierman, C.H. and Orti, G. (1993). The phylogenetic position of the zebrafish (Danio rerio), a model system in developmental biology: an invitation to the comparative method. Proc. R. Soc. Lond. B. 252, 231-236.
(21) Da ciascuna colonna è possibile scegliere una serie di cinque (o più) concentrazioni .successive. I punti intermedi fra le concentrazioni nella colonna (x) si trovano nella colonna (2x + 1). I valori elencati possono rappresentare le concentrazioni espresse come percentuale per volume o peso (mg/1 o ug/1). I valori possono essere moltiplicati o divisi per qualsiasi potenza di 10 a seconda del caso. È possibile usare la colonna 1 in caso di notevoli incertezze sul livello di tossicità.
(22) OECD, Paris. 1992. Test Guideline 210, Fish. Early-life Stage Toxicity Test.
(23) Per gli embrioni.
(24) Per le larve.
(25) Buio per embrioni e larve fino a una settimana dopo la schiusa, tranne per le ispezioni. Poi luce debole per tutta la prova.
(26) Secondo il sistema FAO e quello US (85).
(27) Le rispettive variabili debbono mostrare di preferenza valori rientranti nel campo indicato. Se tuttavia risultasse difficile trovare materiali appropriati, sono accettabili valori inferiori al minimo indicato.
(28) I terreni contenenti meno dello 0,3 % di carbonio organico possono perturbare la correlazione fra il contenuto organico e l'adsorbimento. Si raccomanda perciò l'impiego di terreni a contenuto di carbonio organico non inferiore allo 0,3 %.
(29) 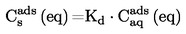
(30) Per valutare se la piattaforma di equilibro è stala raggiunta si potrebbero impiegare arche i grafici della concentrazione della sostanza sotto esame nella fase acquosa ( ) in funzione del tempo (cfr. appendice 5, fig. 2).
) in funzione del tempo (cfr. appendice 5, fig. 2).
(31) DT-50: tempo di degradazione per il 50 % della sostanza sotto esame.
(32) Equazione applicabile tanto al metodo diretto quanto al metodo indiretto. Tutte le altre equazioni sono applicabili esclusivamente al metodo indiretto.
(33) Equazione applicabili tanto al metodo diretto quanto al metodo indiretto. Tutte le altre equazioni sono applicabili esclusivamente al metodo indiretto.
(34) W. Kördel, D. Hennecke, M. Herrmann (1997). Application of the HPLC-screening method for the determination of the adsorption coefficient on sewage sludges. Chemosphere, 35(1/2), pp. 121-128.
(35) W. Kördel, D. Hennecke, C. Franke (1997). Determination of the adsorption-coefficients of organic substances on sewage sludges Chemosphere, 3 5 (1/2), pp. 107-119.
(36) W. Kördel, G, Kotthoff, J. Müller (1995). HPLC screening method for the determination of the adsorption coefficient on soil-results of a ring test. Chemosphere, 30(7), pp. 1373-1384.
(37) W. Kördel, J. Müller (1994). Bestimmung des Adsorptionskoeffizienten, organischer Chemikalien mit der HPLC. UBA R & D Report No. 106 01044 (1994).
(38) B.V. Oeper, W. Kördel, W. Klein. (1991). Chemosphere, 21 pp. 285-304.
(39) Dati fomiti dalle industrie.
(40) Indicare quale recipiente è stato usato per l’esperimento.
(41) Registrare la mortalità di qualsiasi animale adulto inserendo la lettera «M» nella casella corrispondente.
(42) Registrare le schiuse abortite inserendo la sigla «AB» nella casella corrispondente.
(43) Per esempio, se la sostanza di prova contiene un solo anello, è necessario marcare tale anello; se la sostanza contiene due anelli o più, possono risultare necessari studi separati per valutare il destino di ciascun anello marcato e per ottenere informazioni adeguate sulla formazione dei prodotti di trasformazione.
(44) La caratteristica della ritenzione idrica di un suolo può essere misurata come capacità di campo, come capacità idrica di ritenuta o come tensione di aspirazione dell'acqua (pF). Per le spiegazioni, cfr. l'allegato 1. Nella relazione è necessario riferire se le caratteristiche di ritenzione idrica e il peso specifico apparente dei suoli sono stati determinati in campioni di campi indisturbati o in campioni disturbati (lavorati)
(45) I risultati di recenti ricerche indicano che i suoli delle zone temperate possono essere conservati anche a - 20 oC per oltre tre mesi (28)(29) senza perdita significativa dell'attività microbica.
(46) Per areare e nutrire adeguatamente la microflora del suolo, il suolo non deve essere né troppo umido né troppo secco. I tenori di umidità raccomandati per una crescita microbica ottimale sono compresi fra il 40 e il 60 % della capacità idrica di ritenuta e fra 0,1 e 0,33 bar (6). Quest'ultima gamma di valori equivale a una gamma pF di 2,0-2,5. Nell'allegato 2 sono indicati i tenori di umidità tipici di vari tipi di suoli.
(47) Le condizioni aerobiche sono dominanti nei suoli superficiali e anche negli strati sotto la superficie, come dimostrato dal progetto di ricerca sponsorizzato dall'UE [K. Takagi et al. (1992). Microbial diversity and activity in subsoils: Methods, field site, seasonal variation in subsoil temperatures and oxygen contents. Proc. Internat. Symp. Environm. Aspects Pesticides Microbiol., 270-277, 17-21 August 1992, Sigtuna, Sweden]. Condizioni anaerobiche possono verificarsi solo occasionalmente durante l'inondazione dei suoli dopo forti piogge o quando le risaie vengono sommerse.
(48) Gli studi aerobici possono essere conclusi molto prima di 120 giorni, a condizione che al momento della conclusione siano state raggiunte con certezza la via definitiva di trasformazione e la massima mineralizzazione. È possibile concludere il test dopo 120 giorni o quando almeno il 90 % della sostanza di prova è trasformata, ma solo se si è formato almeno il 5 % di CO2.
(49) Calcolo della concentrazione iniziale su una base d'area usando la seguente equazione:

|
Csoil
|
=
|
concentrazione iniziale nel suolo [mg· kg]
|
|
A
|
=
|
tasso di applicazione [kg· ha-1]; l = spessore dello strato di suolo nel campo [m]; d = peso specifico apparente secco del suolo [kg· m-3].
|
Di massima, con un tasso di applicazione di 1 kg· ha-1 si ottiene una concentrazione nel suolo di circa 1 mg· kg-1 in uno strato di 10 cm (presupponendo un peso specifico apparente di 1 g· cm-3).
(50) Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt, Main.
(51) pF = log di cm di colonna d'acqua.
(52) 1 bar = 105 Pa.
(53) Corrisponde a un contenuto idrico approssimativo del 10 % in sabbia, 35 % in limo e 45 % in argilla.
(54) La capacità di campo non è costante ma varia con il tipo di suolo fra pF 1,5 e 2,5.
(55) Capacità di ritenuta idrica.
(56) Guth, J.A. (1980). The study of transformations. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, 123-157.
(57) Guth, J.A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry. D.H. Hutson, T.R. Roberts, Eds. J. Wiley & Sons. Vol 1, 85-114.
(58) Anderson, J.P.E. (1975). Einfluss von Temperatur und Feuchte auf Verdampfung, Abbau und Festlegung von Diallat im Boden. Z. PflKrankh Pflschutz, Sonderheft VII, 141-146.
(59) Se, per esempio, la sostanza contiene un anello, la marcatura va effettuata su questo anello; se la sostanza di prova contiene due o più anelli, potrebbero rilevarsi necessari più studi per determinare il destino di ciascun anello marcato e per ottenere informazioni adeguate sulla formazione dei prodotti di trasformazione.
(60) Poiché queste soluzioni di assorbimento alcaline assorbono anche l'anidride carbonica proveniente dall'aria di ventilazione e quella prodotta per respirazione negli esperimenti aerobici, esse vanno cambiate ad intervalli regolari per evitarne la saturazione con conseguente perdita di capacità assorbente.
(61) [Argilla + limo] è la frazione inorganica del sedimento con particelle di dimensione < 50 μm.
(62) Studi recenti hanno mostrato che le misurazioni delle concentrazioni dell'ossigeno in acqua e dei potenziali redox non hanno valore meccanicistico né predittivo sulla crescita e lo sviluppo di popolazioni microbiche in acque superficiali (24)(25). La determinazione della domanda biochimica d'ossigeno (BOD, in corrispondenza della campionatura sul campo, dell'inizio e del termine della prova) e delle concentrazioni dei micro/macro nutrienti Ca, Mg e Mn (all'inizio e alla fine della prova) in acqua, nonché la misurazione dell'N totale e del P totale nei sedimenti (in corrispondenza della campionatura sul campo e al termine della prova) possono rivelarsi più adatte per l'interpretazione e la valutazione delle velocità e delle vie di biotrasformazione aerobica.
(63) Metodo della velocità di respirazione microbica (26), metodo di fumigazione (27) o conteggi in piastra (ad esempio batteri, attinomiceti, funghi e colonie totali) per gli studi aerobici; velocità di metanogenesi per gli studi anaerobici.
(64) Alcuni studi recenti hanno dimostrato che la conservazione a 4 oC può comportare una diminuzione del contenuto in carbonio organico del sedimento, che potrebbe forse portare alla diminuzione dell'attività microbica (34).
(65) Per sostanze chimiche che raggiungono le acque superficiali per vie d'ingresso diverse, comportanti concentrazioni significativamente diverse, potrebbero rivelarsi utili prove con una seconda concentrazione, a condizione che la concentrazione inferiore possa essere analizzata con accuratezza sufficiente.
(66) In casi in cui può verificarsi facilmente una rapida riossidazione dei prodotti di trasformazione anaerobici occorre mantenere le condizioni anaerobiche durante tutta la campionatura e l'analisi.



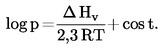

 deve essere indicata secondo quanto prescritto al punto 1.2., insieme allo stato fisico della sostanza esaminata.
deve essere indicata secondo quanto prescritto al punto 1.2., insieme allo stato fisico della sostanza esaminata.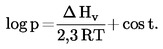


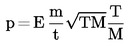
 è la costante di effusione della cella.
è la costante di effusione della cella.
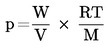
![]()
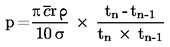


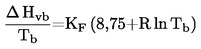
































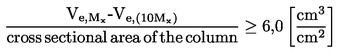








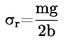 (mN/m)
(mN/m)
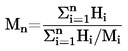


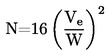
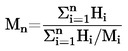































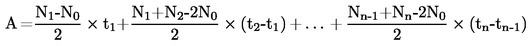

























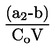
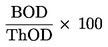


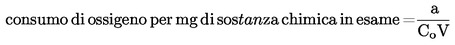




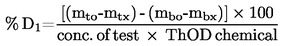
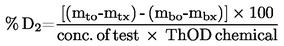
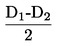


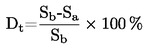
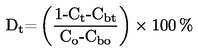


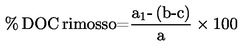

 mg/mg
mg/mg mg/mg
mg/mg





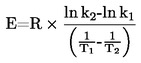




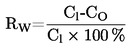

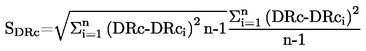



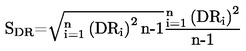
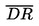





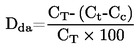


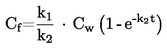
 or
or 
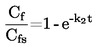
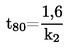

 o
o 
 o
o 









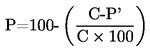



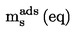

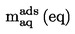

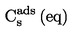


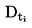


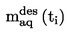

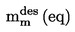

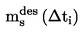

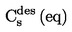


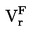
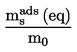 :
: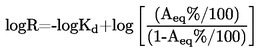

 , sulla base della concentrazione nominale iniziale e della concentrazione misurata ai momenti t
, sulla base della concentrazione nominale iniziale e della concentrazione misurata ai momenti t in funzione del tempo (cfr. appendice 5, fig. 1)
in funzione del tempo (cfr. appendice 5, fig. 1) o di
o di  in funzione del tempo permettono di stabilire se l'equilibrio all'adsorbimento è stato raggiunto e di valutare la quantità di sostanza sotto esame adsorbita all'equilibrio. Le figure 1 e 2 nell'appendice 5 mostrano alcuni esempi di tali grafici. Il tempo di equilibrio è quello necessario perché il sistema raggiunga una piattaforma.
in funzione del tempo permettono di stabilire se l'equilibrio all'adsorbimento è stato raggiunto e di valutare la quantità di sostanza sotto esame adsorbita all'equilibrio. Le figure 1 e 2 nell'appendice 5 mostrano alcuni esempi di tali grafici. Il tempo di equilibrio è quello necessario perché il sistema raggiunga una piattaforma. e/o intervallo di tempo
e/o intervallo di tempo  (secondo necessità), e riportato in funzione del tempo. Vanno altresì calcolati il coefficiente di distribuzione K
(secondo necessità), e riportato in funzione del tempo. Vanno altresì calcolati il coefficiente di distribuzione K e/o intervallo tempo
e/o intervallo tempo  , secondo le esigenze dello studio, e riportato graficamente in funzione del tempo. Si calcola anche il coefficiente di desorbimento Kd
, secondo le esigenze dello studio, e riportato graficamente in funzione del tempo. Si calcola anche il coefficiente di desorbimento Kd e dell'adsorbimento percentuale
e dell'adsorbimento percentuale  in funzione del tempo permettono di valutare la reversibilità dei processi di adsorbimento. Se l'equilibrio di desorbimento viene raggiunto entro un tempo che può essere anche doppio del tempo ottenuto per l'equilibrio di adsorbimento, e il desorbimento totale risulta superiore al 75 % della quantità adsorbita, l'adsorbimento è considerato reversibile.
in funzione del tempo permettono di valutare la reversibilità dei processi di adsorbimento. Se l'equilibrio di desorbimento viene raggiunto entro un tempo che può essere anche doppio del tempo ottenuto per l'equilibrio di adsorbimento, e il desorbimento totale risulta superiore al 75 % della quantità adsorbita, l'adsorbimento è considerato reversibile. ) si definisce come percentuale della sostanza sotto esame adsorbita dal terreno, riferita alla quantità presente all'inizio della prova, nelle condizioni sperimentali. Se la sostanza sotto prova è stabile e non viene adsorbita significativamente sulle pareti del recipiente,
) si definisce come percentuale della sostanza sotto esame adsorbita dal terreno, riferita alla quantità presente all'inizio della prova, nelle condizioni sperimentali. Se la sostanza sotto prova è stabile e non viene adsorbita significativamente sulle pareti del recipiente,  può essere calcolato a ciascun momento t
può essere calcolato a ciascun momento t

 per i metodi in serie e in parallelo sono fornite nell'appendice 5.
per i metodi in serie e in parallelo sono fornite nell'appendice 5.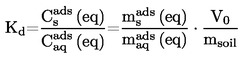
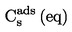

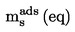



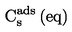 (eq), altrove indicato come x/m]. Si parte dall'idea che l'equilibrio sia stato raggiunto e che
(eq), altrove indicato come x/m]. Si parte dall'idea che l'equilibrio sia stato raggiunto e che 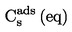 (eq) rappresenti il valore all'equilibrio:
(eq) rappresenti il valore all'equilibrio: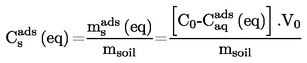



 [μg
[μg e di 1/n attraverso l'analisi di regressione applicando la (9). Si calcola inoltre il coefficiente di correlazione r
e di 1/n attraverso l'analisi di regressione applicando la (9). Si calcola inoltre il coefficiente di correlazione r

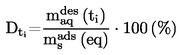


 per i metodi in parallelo e in serie figurano nell'appendice 5.
per i metodi in parallelo e in serie figurano nell'appendice 5.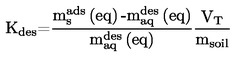

 (eq) figura nell'appendice 5 sotto l'intestazione «Desorbimento».
(eq) figura nell'appendice 5 sotto l'intestazione «Desorbimento».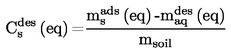
 si definisce come:
si definisce come:
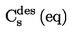









 e 1/n vengono calcolati per analisi di regressione con l'equazione 17.
e 1/n vengono calcolati per analisi di regressione con l'equazione 17.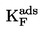 e
e  ) saranno rispettivamente uguali alle costanti di equilibrio all'adsorbimento o al desorbimento (K
) saranno rispettivamente uguali alle costanti di equilibrio all'adsorbimento o al desorbimento (K
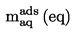 = 100 μg) della sostanza sotto esame nella soluzione è assai piccola, un errore del 5 % nella misura della concentrazione all'equilibrio conduce a un errore del 50 % nel calcolo della sostanza adsorbita nel terreno (
= 100 μg) della sostanza sotto esame nella soluzione è assai piccola, un errore del 5 % nella misura della concentrazione all'equilibrio conduce a un errore del 50 % nel calcolo della sostanza adsorbita nel terreno ( ) e del 52,4 % nel calcolo del K
) e del 52,4 % nel calcolo del K

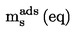
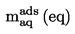
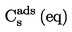
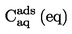

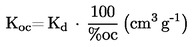






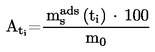
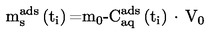



 o
o  vengono riportati graficamente in funzione del tempo, e si determina il tempo dopo il quale viene raggiunto l'equilibrio di sorbimento. Esempi di questi grafici sono riportati rispettivamente nella fig. 1 e fig. 2.
vengono riportati graficamente in funzione del tempo, e si determina il tempo dopo il quale viene raggiunto l'equilibrio di sorbimento. Esempi di questi grafici sono riportati rispettivamente nella fig. 1 e fig. 2.

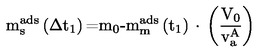



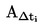 , si calcola con l'equazione seguente:
, si calcola con l'equazione seguente:
 a un dato attimo t
a un dato attimo t
 o
o  (secondo le necessità dello studio) in funzione del tempo, e si determina il tempo dopo il quale si raggiunge l'equilibrio di sorbimento.
(secondo le necessità dello studio) in funzione del tempo, e si determina il tempo dopo il quale si raggiunge l'equilibrio di sorbimento.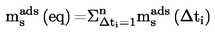


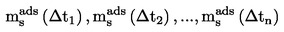
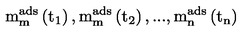
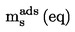
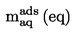
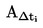

 e si calcola la massa desorbita con l'equazione:
e si calcola la massa desorbita con l'equazione:
 =
=  .
.
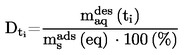


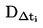

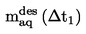

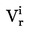 ,di soluzione prelevata per l'analisi (μg)
,di soluzione prelevata per l'analisi (μg)


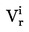
 o
o  (secondo le necessità dello studio) in funzione del tempo, e si determina il tempo dopo il quale si raggiunge l'equilibrio di desorbimento.
(secondo le necessità dello studio) in funzione del tempo, e si determina il tempo dopo il quale si raggiunge l'equilibrio di desorbimento. della fase acquosa (cfr. punto 14.9., «1.9. Esecuzione dell'esperimento», metodo in serie). Si ammette quanto segue: a) il volume del surnatante allontanato dal tubo dopo l'esperimento sulla cinetica di adsorbimento è sostituito dallo stesso volume (V
della fase acquosa (cfr. punto 14.9., «1.9. Esecuzione dell'esperimento», metodo in serie). Si ammette quanto segue: a) il volume del surnatante allontanato dal tubo dopo l'esperimento sulla cinetica di adsorbimento è sostituito dallo stesso volume (V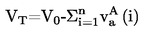
 e si calcola la massa desorbita con l'equazione:
e si calcola la massa desorbita con l'equazione: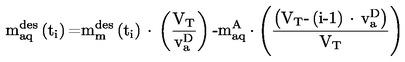
 =
=  .
. con la seguente equazione:
con la seguente equazione:

 and
and
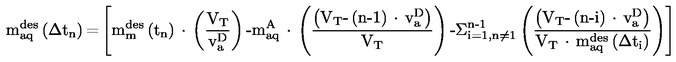 and
and
 , di desorbimento per ciascun intervallo di tempo si calcola con l'equazione
, di desorbimento per ciascun intervallo di tempo si calcola con l'equazione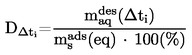
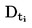 all'attimo t
all'attimo t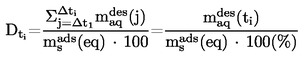
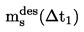





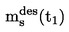
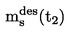

 t
t
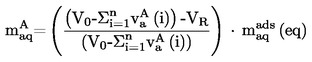














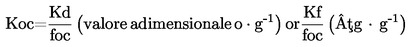
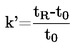







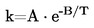 or
or  ,
,