EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 02017R0735-20170428
Consolidated text: A Bizottság (EU) 2017/735 rendelete ( 2017. február 14. ) a vegyi anyagok regisztrálásáról, értékeléséről, engedélyezéséről és korlátozásáról (REACH) szóló 1907/2006/EK európai parlamenti és tanácsi rendelet értelmében alkalmazandó vizsgálati módszerek megállapításáról szóló 440/2008/EK rendelet mellékletének a műszaki fejlődéshez való hozzáigazítás céljából történő módosításáról (EGT-vonatkozású szöveg)
A Bizottság (EU) 2017/735 rendelete ( 2017. február 14. ) a vegyi anyagok regisztrálásáról, értékeléséről, engedélyezéséről és korlátozásáról (REACH) szóló 1907/2006/EK európai parlamenti és tanácsi rendelet értelmében alkalmazandó vizsgálati módszerek megállapításáról szóló 440/2008/EK rendelet mellékletének a műszaki fejlődéshez való hozzáigazítás céljából történő módosításáról (EGT-vonatkozású szöveg)
 In force
In force
02017R0735 — HU — 28.04.2017 — 000.001
Ez a dokumentum kizárólag tájékoztató jellegű és nem vált ki joghatást. Az EU intézményei semmiféle felelősséget nem vállalnak a tartalmáért. A jogi aktusoknak – ideértve azok bevezető hivatkozásait és preambulumbekezdéseit is – az Európai Unió Hivatalos Lapjában közzétett és az EUR-Lex portálon megtalálható változatai tekintendők hitelesnek. Az említett hivatalos szövegváltozatok közvetlenül elérhetők az ebben a dokumentumban elhelyezett linkeken keresztül
|
A BIZOTTSÁG (EU) 2017/735 RENDELETE (2017. február 14.) ►C1 a vegyi anyagok regisztrálásáról, értékeléséről, engedélyezéséről és korlátozásáról (REACH) szóló 1907/2006/EK európai parlamenti és tanácsi rendelet értelmében alkalmazandó vizsgálati módszerek megállapításáról szóló 440/2008/EK rendelet mellékletének a műszaki fejlődéshez való hozzáigazítás céljából történő módosításáról ◄ (HL L 112, 2017.4.28., 1. o) |
Helyesbítette:
A BIZOTTSÁG (EU) 2017/735 RENDELETE
(2017. február 14.)
a vegyi anyagok regisztrálásáról, értékeléséről, engedélyezéséről és korlátozásáról (REACH) szóló 1907/2006/EK európai parlamenti és tanácsi rendelet értelmében alkalmazandó vizsgálati módszerek megállapításáról szóló 440/2008/EK rendelet mellékletének a műszaki fejlődéshez való hozzáigazítás céljából történő módosításáról
(EGT-vonatkozású szöveg)
1. cikk
A 440/2008/EK rendelet melléklete e rendelet mellékletének megfelelően módosul.
2. cikk
Ez a rendelet az Európai Unió Hivatalos Lapjában való kihirdetését követő huszadik napon lép hatályba.
Ez a rendelet teljes egészében kötelező és közvetlenül alkalmazandó valamennyi tagállamban.
MELLÉKLET
A 440/2008/EK rendelet melléklete a következőképpen módosul:
(1) Az A. rész a következő fejezettel egészül ki:
„A.25. DISSZOCIÁCIÓS ÁLLANDÓK A VÍZBEN (TITRÁLÁSI MÓDSZER – SPEKTROFOTOMETRIÁS MÓDSZER – KONDUKTOMETRIÁS MÓDSZER)
BEVEZETÉS
Ez a vizsgálati módszer egyenértékű az OECD 112. vizsgálati iránymutatásában (1981) leírt módszerrel.
Előfeltételek
— Megfelelő analitikai módszer
— Vízoldékonyság
Tájékoztató jellegű információk
— Szerkezeti képlet
— Elektromos vezetőképesség a konduktometriás módszer esetében
Minősítő állítások
— Valamennyi vizsgálati módszer végrehajtható tiszta vagy kereskedelmi tisztaságú anyagokon. A szennyeződések által az eredményekre kifejtett lehetséges hatásokat figyelembe kell venni.
— A titrálási módszer nem alkalmas az alacsony vízoldékonyságú anyagok esetében (lásd alább a Vizsgálati oldatok címsor alatt).
— A spektrofotometriás módszer csak azokra az anyagokra alkalmazandó, amelyeknek észrevehetően eltér az UV/VIS abszorpciós spektruma a disszociált és a nem disszociált forma esetében. Ez a módszer alkalmas lehet az alacsony vízoldékonyságú anyagok és a nem sav–bázis disszociációk, például a komplexképződés esetében.
— Az Onsager-egyenlet érvényességi körébe tartozó esetekben a konduktometriás módszer még viszonylag alacsony koncentráció mellett, sőt nem sav–bázis egyensúly eseteiben is alkalmazható.
Standard dokumentumok
Ez a vizsgálati módszer a »Szakirodalom« című szakaszban felsorolt hivatkozásokban megadott módszereken és a »Preliminary Draft Guidance for Premanufacture Notification EPA« című, 1978. augusztus 18-i kiadványon alapul.
MÓDSZER – BEVEZETÉS A VIZSGÁLATBA, A VIZSGÁLAT CÉLJA, ALKALMAZÁSI KÖRE, RELEVANCIÁJA, ALKALMAZÁSA ÉS KORLÁTAI
Valamely anyag vízben történő disszociációja jelentőséggel bír a környezetre kifejtett hatásának értékelése során. A vízben történő disszociáció határozza meg az anyag formáját, amely viszont meghatározza a viselkedését és a szállítását. Befolyásolhatja a vegyi anyag talajon vagy üledéken történő adszorpcióját és a biológiai sejtekbe irányuló abszorpcióját.
Fogalommeghatározások és mértékegységek
A disszociáció a két vagy több, esetenként ionos kémiai anyaggá történő reverzibilis bomlás. A folyamatot általában a következő képlet jelöli:
RX ⇌ R ++ X –
a reakcióra irányadó koncentrációs egyensúlyi állandó pedig a következő:

Például abban a sajátos esetben, ha az R hidrogén (az anyag sav), az állandó:
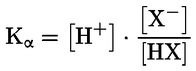
vagy
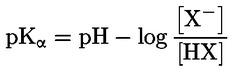
Referenciaanyagok
Az alábbi referenciaanyagokat az új anyagok vizsgálata során nem kell minden esetben alkalmazni. Elsősorban azért vannak megadva, hogy időnként el lehessen végezni a módszer kalibrálását, valamint azért, hogy másik módszer alkalmazása esetén lehetőséget nyújtsanak az eredmények összehasonlítására.
|
|
pKa (1) |
Hőmérséklet °C-ban |
|
p-nitrofenol |
7,15 |
25 (1) |
|
Benzoesav |
4,12 |
20 |
|
p-klóranilin |
3,93 |
20 |
|
(1) 20 °C hőmérséklethez nem áll rendelkezésre érték, de feltételezhető, hogy a mérési eredmények variabilitása nagyobb mértékű, mint a várható hőmérséklet-függőség. |
||
Célszerű lenne több pK-értékkel rendelkező anyag alkalmazása, ahogyan az alább „A módszer elve” című részben szerepel. Ilyen anyag lehetne a következő:
|
Citromsav |
pKa (8) |
Hőmérséklet °C-ban |
|
|
1) 3,14 |
20 |
|
|
2) 4,77 |
20 |
|
|
3) 6,39 |
20 |
A vizsgálati módszer elve
Az ismertetett kémiai folyamat általában csak kismértékben hőmérsékletfüggő a környezeti szempontból releváns hőmérséklet-tartományban. A disszociációs állandó meghatározása szükségessé teszi a vegyi anyag disszociált és nem disszociált formája koncentrációjának mérését. A fenti „Fogalommeghatározások és mértékegységek” című részben szereplő disszociációs reakció sztöchiometriájának ismerete alapján a megfelelő állandó meghatározható. Az e vizsgálati módszerben ismertetett konkrét esetben az anyag savként vagy bázisként viselkedik, és a disszociációs állandó meghatározása a legmegfelelőbben az anyag ionizált és nem ionizált formája relatív koncentrációjának és az oldat pH-értékének meghatározásával történik. A szóban forgó kifejezések közötti kapcsolatot a fenti „Fogalommeghatározások és mértékegységek” című részben szereplő pKa értékhez tartozó egyenlet adja meg. Egyes anyagok esetében egynél több disszociációs állandó van és hasonló egyenletek állíthatók fel. Az itt ismertetett módszerek közül néhány a nem sav–bázis disszociációra is alkalmazható.
Minőségi kritériumok
Megismételhetőség
A disszociációs állandó mérését legalább három alkalommal meg kell ismételni, és az értékeknek ± 0,1 log egységen belül kell elhelyezkedniük.
A VIZSGÁLATI ELJÁRÁSOK LEÍRÁSA
A pKa érték meghatározásának két alapvető megközelítése van. Az egyik az anyag ismert mennyiségének – szükség szerint – standard savval vagy bázissal történő titrálását, a másik az ionizált és a nem ionizált forma relatív koncentrációjának és pH-függőségének meghatározását foglalja magában.
Előkészületek
Az említett elveken alapuló módszerek titrálási, spektrofotometriás és konduktometriás eljárásként sorolhatók be.
Vizsgálati oldatok
A titrálási módszer és a konduktometriás módszer esetében a vegyi anyagot desztillált vízben kell feloldani. A spektrofotometriás módszer és más módszerek esetében pufferoldatok használatosak. A vizsgálati anyag koncentrációja nem haladhatja meg a 0,01 M, illetve a telítettségi koncentráció fele közül az alacsonyabb értéket, és az oldatok elkészítésekor az anyag legtisztább rendelkezésre álló formáját kell alkalmazni. Ha az anyag csak alig oldható, a fent feltüntetett koncentrációkhoz történő hozzáadását megelőzően feloldható kis mennyiségű, vízzel elegyedő oldószerben.
Az oldatokat Tyndall-sugár segítségével meg kell vizsgálni abból a szempontból, hogy előfordulnak-e bennük emulziók, különösen akkor, ha társoldószert használtak az oldékonyság javítására. Pufferoldatok használata esetén a puffer koncentrációja nem haladhatja meg a 0,05 M-t.
Vizsgálati körülmények
Hőmérséklet
A hőmérsékletet legalább ± 1 °C-ra kell szabályozni. A meghatározást lehetőleg 20 °C-on kell elvégezni.
Ha jelentős hőmérséklet-függőség gyanúja merül fel, a meghatározást legalább két másik hőmérsékleten is el kell végezni. A hőmérsékletközöknek ebben az esetben 10 °C-nak, a hőmérséklet-szabályozásnak pedig ± 0,1 °C-nak kell lennie.
Elemzések
A módszert a vizsgált anyag jellege határozza meg. A módszernek kellően érzékenynek kell lennie ahhoz, hogy lehetővé tegye a különböző kémiai anyagok meghatározását a vizsgálati oldat egyes koncentrációinál.
A vizsgálat végrehajtása
Titrálási módszer
A vizsgálati oldat meghatározása – szükség szerint – a standard bázikus vagy savas oldattal történő titrálással történik, melynek során a pH-értéket a titrálószer minden egyes hozzáadása után megmérik. Az egyenértékpont elérése előtt legalább 10 további hozzáadást kell végezni. Az egyensúly megfelelően gyors elérése esetén regisztráló potenciométer használható. Ehhez a módszerhez az anyag teljes mennyiségét és koncentrációját is pontosan ismerni kell. A szén-dioxid kizárása érdekében óvintézkedéseket kell tenni. Az eljárás, az óvintézkedések és a számítás részletei standard vizsgálatokban, például az (1), (2), (3), (4) hivatkozásban szerepelnek.
Spektrofotometriás módszer
Megállapítanak egy olyan hullámhosszot, ahol az anyag ionizált és nem ionizált formájának észrevehetően eltérő az extinkciós együtthatója. Az UV/VIS abszorpciós spektrumot állandó koncentrációjú oldatokból határozzák meg olyan pH-feltételek mellett, amelyeknél az anyag lényegében nem ionizált és amelyeknél teljesen ionizált, továbbá több köztes pH-érték mellett. Ez elvégezhető úgy, hogy további koncentrált savat (bázist) adnak hozzá egy, az anyagot egy többkomponensű pufferben tartalmazó, viszonylag nagy mennyiségű, kezdetben magas (alacsony) pH-értékű ((5) hivatkozás) oldathoz, vagy oly módon, hogy az anyagot például vízben, metanolban tartalmazó, ugyanolyan mennyiségű törzsoldatot adnak állandó mennyiségű, a kívánt pH-tartományt lefedő különféle pufferoldatokhoz. A kiválasztott hullámhosszon mért pH- és abszorbancia-érték alapján elegendő számú értéket kell kiszámítani a pKa értékhez legalább öt olyan pH-értéken alapuló adatok segítségével, amelyeknél az anyag legalább 10 százalékban, de 90 százaléknál kisebb mértékben ionizált. A kísérletek további részletezése és a számítási módszer az (1) hivatkozásban szerepel.
Konduktometriás módszer
Az anyagot tartalmazó, megközelítőleg 0,1 M koncentrációjú oldat vezetőképességét vezetőképes vízben, egy alacsony, ismert cellaállandójú cella segítségével megmérik. Ezen oldat több, pontosan elkészített hígításának vezetőképességét is megmérik. A koncentrációt minden egyes alkalommal megfelezik, és a sorozatnak a koncentráció tekintetében legalább egy nagyságrend-terjedelmet le kell fednie. Végtelen hígításnál a vezetőképesség határát nátriumsóval és extrapolálással végzett hasonló kísérlettel kell megállapítani. A disszociációfok ezt követően az egyes oldatok vezetőképessége alapján az Onsager-egyenlet segítségével számítható ki, és így az Ostwald-féle hígítási törvény segítségével a disszociációs állandó a következőképpen kapható meg: K = α2C/(1 – α), ahol C a mol/literben kifejezett koncentráció, α pedig a disszociált frakció. A CO2 kizárása érdekében óvintézkedéseket kell tenni. A kísérletek további részletezése és a számítási módszer a standard szövegekben, valamint az (1), (6) és (7) hivatkozásban szerepel.
ADATOK ÉS JEGYZŐKÖNYVEZÉS
Az eredmények feldolgozása
Titrálási módszer
A pKa értéket a titrálási görbe 10 mért pontjához ki kell számítani. Az ilyen pKa értékek átlagát és szórását ki kell számítani. A módszernek tartalmaznia kell a standard bázis vagy sav mennyiségéhez viszonyított pH görbéjét, valamint táblázatos bemutatását.
Spektrofotometriás módszerek
Az egyes spektrumok esetén kapott abszorbancia- és pH-értékeket táblázatba kell foglalni. A pKa-ra legalább öt értéket kell kiszámítani a közbenső spektrumok adatpontjaiból, és ezen eredmények átlagát és szórását is meg kell határozni.
Konduktometriás módszer
Az ekvivalens vezetőképességet (Λ) minden egyes savkoncentrációhoz, továbbá egy savegyenérték és 0,98 egyenérték karbonátmentes nátrium-hidroxid keverékének minden egyes koncentrációjához ki kell számítani. A sav túlsúlyban van, hogy megelőzhető legyen a hidrolízis miatti OH– túlsúly. Az 1/Λ-t Ö_C függvényében kell ábrázolni, és a só Λo értéke a nulla koncentrációra történő extrapolációval megtalálható.
A sav Λo értéke a H+ és a Na+ szakirodalmi értékei segítségével számítható ki. A pKa minden egyes koncentráció esetén az α = Λi /Λo és a Ka = α2C/(1 – α) képletből számítható ki. A Ka-ra jobb értékek kaphatók a mobilitásra és az aktivitásra tekintettel történő korrekcióval. A pKa értékek átlagát és szórását ki kell számítani.
Vizsgálati jegyzőkönyv
Valamennyi nyers adatot és pKa értéket, valamint a számítási módszert (az (1) hivatkozásban javasoltak szerint lehetőleg táblázatos formában) be kell mutatni, csakúgy, mint a fent ismertetett statisztikai paramétereket. A titrálási módszerek esetében részletezni kell a titrálószerek standardizálását.
A spektrofotometriás módszer esetében minden spektrumot be kell mutatni. A konduktometriás módszer esetében a cellaállandó meghatározásának részleteit dokumentálni kell. Az alkalmazott eljárásra, az analitikai módszerekre és bármely felhasznált puffer jellegére vonatkozó információkat meg kell adni.
A vizsgálati hőmérséklet(ek)et dokumentálni kell.
SZAKIRODALOM
(1) Albert, A. & Sergeant, E.P.: Ionization Constants of Acids and Bases, Wiley, Inc., New York, 1962.
(2) Nelson, N.H. & Faust, S.D.: Acidic dissociation constants of selected aquatic herbicides, Env. Sci. Tech. 3, II, pp. 1186-1188 (1969).
(3) ASTM D 1293 – Annual ASTM Standards, Philadelphia, 1974.
(4) Standard Method 242. APHA/AWWA/WPCF, Standard Methods for the Examination of Water and Waste Water, 14th Edition, American Public Health Association, Washington, D.C., 1976.
(5) Clark, J. & Cunliffe, A.E.: Rapid spectrophotometric measurement of ionisation constants in aqueous solution. Chem. Ind. (London) 281, (March 1973).
(6) ASTM D 1125 – Annual ASTM Standards, Philadelphia, 1974.
(7) Standard Method 205 – APHA/AWWA/NPCF (lásd fent (4)).
(8) Handbook of Chemistry and Physics, 60th ed. CRC-Press, Boca Raton, Florida, 33431 (1980).”
(2) A B. részben a B.5. fejezet helyébe a következő szöveg lép:
„B.5. AKUT SZEMIRRITÁCIÓ/SZEMKORRÓZIÓ
BEVEZETÉS
Ez a vizsgálati módszer egyenértékű az OECD 405. vizsgálati iránymutatásában (2012) leírt módszerrel. A vegyi anyagok vizsgálatára vonatkozó OECD-iránymutatás rendszeres időközönként felülvizsgálat tárgyát képezi annak biztosítása érdekében, hogy tükrözze a rendelkezésre álló legjobb tudományos ismereteket. E vizsgálati iránymutatás korábbi felülvizsgálatai során különleges figyelmet fordítottak a vizsgálati vegyi anyagra vonatkozó összes információ értékelésével történő lehetséges javításokra, hogy elkerülhető legyen a laboratóriumi állatokon történő szükségtelen kísérletezés, és ezáltal tiszteletben lehessen tartani az állatjóléti szempontokat. A(z 1981-ben elfogadott és 1987-ben, 2002-ben és 2012-ben frissített) 405. vizsgálati iránymutatásban szerepel az az ajánlás, hogy az akut szemirritáció/szemkorrózió vizsgálatára előírt in vivo vizsgálat elvégzése előtt el kell végezni a rendelkezésre álló adatok bizonyító erejének elemzését (1). Ha nem áll rendelkezésre elegendő adat, azok mennyiségét ajánlott lépcsőzetes vizsgálatok alkalmazásával növelni (2) (3). A vizsgálati stratégia részét képezi validált és elfogadott in vitro vizsgálatok végzése, amelyek e vizsgálati módszer kiegészítésében kerülnek ismertetésre. A vegyi anyagok regisztrálásáról, értékeléséről, engedélyezéséről és korlátozásáról (REACH) szóló 1907/2006/EK rendelet ( 1 ) alkalmazásában integrált vizsgálati stratégia is szerepel a vonatkozó ECHA-iránymutatásban (21). Állatkísérletek csak akkor végezhetők, ha a rendelkezésre álló alternatív módszerek figyelembevételét, valamint a megfelelőnek ítélt módszerek alkalmazását követően megállapítást nyert a szükségességük. E frissített vizsgálati módszer szövegezésekor vannak olyan esetek, amikor e vizsgálati módszer alkalmazása továbbra is szükséges, vagy azt egyes szabályozási keretek előírják.
A legutóbbi frissítés elsősorban a fájdalomcsillapítók és az érzéstelenítők használatára összpontosított, azonban nem befolyásolta a vizsgálati iránymutatás alapvető koncepcióját és felépítését. Az ICCVAM ( 2 ) és egy független nemzetközi szakértői értékelő testület felülvizsgálta a helyi fájdalomcsillapítók, a szisztémás hatású érzéstelenítők és a kíméletes végpontok rutinszerű alkalmazásának hasznosságát és korlátozásait a szemirritáció in vivo biztonsági vizsgálata során (12). A felülvizsgálat megállapította, hogy a helyi fájdalomcsillapítók és a szisztémás hatású érzéstelenítők alkalmazásával a vizsgálat kimenetelének befolyásolása nélkül kiküszöbölhető a fájdalom és a szorongás nagy része vagy egésze, és azt javasolta, hogy ezeket az anyagokat mindig használják. Ez a vizsgálati módszer figyelembe veszi ezt a felülvizsgálatot. A helyi fájdalomcsillapítókat, a szisztémás hatású érzéstelenítőket és a kíméletes végpontokat rutinszerűen kell alkalmazni az akut szemirritáció és -korrózió in vivo vizsgálata során. Az alkalmazásuk alóli kivételeket meg kell indokolni. Az e módszer keretében ismertetett pontosítások lényegesen csökkenteni fogják, illetve kiküszöbölik az állatok fájdalmát és szorongását a legtöbb olyan vizsgálati helyzetben, amelyben az in vivo szembiztonsági vizsgálat továbbra is szükséges.
A kiegyensúlyozott előzetes fájdalomcsillapításnak magában kell foglalnia i. egy helyi fájdalomcsillapítóval (például proparakainnal vagy tetrakainnal) és egy szisztémás hatású érzéstelenítővel (például buprenorfinnal) végzett rutinszerű előkezelést, ii. (például buprenorfinnal és meloxicammal kiváltott) szisztémás fájdalomcsillapítás rutinszerű utókezelési ütemtervét, iii. az állatoknál esetlegesen jelentkező fájdalom és/vagy szorongás klinikai tüneteinek tervezett megfigyelését, nyomon követését és rögzítését, továbbá iv. valamennyi szemlézió jellegének, súlyosságának és alakulásának tervezett megfigyelését, nyomon követését és rögzítését. További részletek az alábbiakban ismertetett frissített eljárásokban találhatók. A vizsgálat zavarásának elkerülése érdekében a vizsgálati vegyi anyag beadását követően további helyi fájdalomcsillapítók vagy érzéstelenítők nem alkalmazhatók. Gyulladásgátló hatású fájdalomcsillapítók (például meloxicam) nem alkalmazhatók helyileg, és a szisztémásan alkalmazott dózisok nem zavarhatják a szemre gyakorolt hatásokat.
A fogalommeghatározások a vizsgálati módszer függelékében szerepelnek.
KIINDULÁSI MEGFONTOLÁSOK
A tudományos ésszerűség és az állatok kímélete érdekében nem szabad in vivo vizsgálatokat végezni mindaddig, amíg a vegyi anyag potenciális szemkorróziós/szemirritáló hatására vonatkozó összes rendelkezésre álló adatra vonatkozóan el nem végezték az adatok bizonyító erejének elemzését. Ilyen adatok az embereken és/vagy laboratóriumi állatokon elvégzett vizsgálatok eredményei, egy vagy több, szerkezetileg rokon anyag vagy keverékeik szemkorróziós/szemirritáló hatásaival kapcsolatos bizonyítékok, a vegyi anyag nagymértékű savasságát vagy lúgosságát igazoló adatok (4) (5), valamint a bőrkorrózióra és szemkorrózióra/-irritációra irányuló validált és elfogadott in vitro vagy ex vivo vizsgálatokból kapott eredmények (6) (13) (14) (15) (16) (17). Előfordulhat, hogy a vizsgálatokat már az adatok bizonyító erejének elemzése előtt elvégezték, vagy éppen annak eredményeként végzik el.
Bizonyos vegyi anyagok esetében az ilyen elemzés annak szükségességét jelezheti, hogy el kell végezni a vegyi anyag szemkorróziós/szemirritációs potenciáljának in vivo vizsgálatát. Minden ilyen esetben az in vivo szemvizsgálat alkalmazásának tervbevétele előtt először lehetőleg a vegyi anyag in vitro és/vagy in vivo bőrkorróziós hatásainak vizsgálatát kell elvégezni, és azt a B.4. vizsgálati módszeren belüli lépcsőzetes vizsgálati stratégiának (7) vagy az ECHA-iránymutatásban ismertetett integrált vizsgálati stratégiának (21) megfelelően kell kiértékelni.
A lépcsőzetes vizsgálati stratégia, amely magában foglalja validált in vitro vagy ex vivo szemkorróziós/szemirritációs vizsgálatok elvégzését is, e vizsgálati módszer kiegészítésében és – a REACH alkalmazásában – az ECHA-iránymutatásban (21) kerül ismertetésre. Az in vivo vizsgálatok elvégzése előtt ilyen vizsgálati stratégia követése javasolt. Új vegyi anyagok esetében lépcsőzetes vizsgálati megközelítés javasolt a vegyi anyag korróziós/irritáló hatásaira vonatkozó, tudományos szempontból megfelelő adatok gyűjtésére. Ismert vegyi anyagok esetében, ha nem áll rendelkezésre elegendő adat a bőrkorróziós/bőrirritáló és szemkorróziós/szemirritáló hatásokról, e stratégia alkalmazásával pótolhatók a hiányzó adatok. Megfelelően meg kell indokolni, ha ettől eltérő vizsgálati stratégiát vagy eljárást alkalmaznak, vagy ha úgy döntenek, hogy nem használják a lépcsőzetes vizsgálati megközelítést.
AZ IN VIVO VIZSGÁLAT ELVE
Szisztémás hatású fájdalomcsillapítóval történő előkezelést és megfelelő helyi érzéstelenítők alkalmazását követően a vizsgálandó vegyi anyagot egyetlen dózisban kell alkalmazni a kísérleti állat egyik szemén; a nem kezelt szem szolgál kontrollként. A szemirritáció/szemkorrózió mértékét meghatározott időközönként a kötőhártya, a szaruhártya és a szivárványhártya lézióinak pontozásával kell kiértékelni. A hatások teljes kiértékelése érdekében részletesen ismertetni kell a szemre gyakorolt egyéb hatásokat és a káros szisztémás hatásokat is. A vizsgálat időtartamának elég hosszúnak kell lennie ahhoz, hogy meg lehessen határozni a hatások visszafordíthatóságát vagy visszafordíthatatlanságát.
A vizsgálat bármely fázisában súlyos szorongás és/vagy fájdalom vagy az e vizsgálati módszerben (lásd a 26. pontot) ismertetett kíméletes végpontoknak megfelelő léziók jeleit mutató állatokat humánus módon el kell pusztítani, és a vegyi anyagot ennek megfelelően kell értékelni. Az elhullás közelében lévő és súlyosan szenvedő állatok humánus módon történő elpusztításáról szóló döntéssel kapcsolatos kritériumok OECD-iránymutatás (8) tárgyát képezik.
AZ IN VIVO VIZSGÁLAT ELŐKÉSZÍTÉSE
A fajok kiválasztása
A preferált laboratóriumi állatfaj az albínó nyúl, és egészséges, fiatal, ivarérett állatokat kell alkalmazni. Más törzsek vagy fajok alkalmazását megfelelően meg kell indokolni.
Az állatok előkészítése
A vizsgálat megkezdése előtti 24 órában a vizsgálatra ideiglenesen kiválasztott kísérleti állat mindkét szemét meg kell vizsgálni. Szemirritációt, szemhibákat vagy korábban szerzett szaruhártya-sérülést mutató állatokat nem szabad használni.
Tartási és etetési körülmények
Az állatokat egyenként kell elhelyezni. Nyulak esetében a kísérleti állatok tartására szolgáló helyiség hőmérsékletének 20 °C (± 3 °C)-nak kell lennie. Bár a helyiség relatív páratartalmának legalább 30 %-nak kell lennie, illetve a takarítás időtartamától eltekintve lehetőleg ne haladja meg a 70 %-ot; a célérték az 50–60 %. A világítás legyen mesterséges; 12 órás világos és 12 órás sötét periódusok váltsák egymást. A túlzott fényerősség kerülendő. Az etetéshez standard laboratóriumi takarmány alkalmazható, korlátlan mennyiségű ivóvíz biztosítása mellett.
VIZSGÁLATI ELJÁRÁS
Helyi érzéstelenítők és szisztémás hatású fájdalomcsillapítók alkalmazása
A szembiztonsági vizsgálatok során jelentkező fájdalom és szorongás elkerülése, illetve minimálisra csökkentése érdekében az alábbi eljárások javasoltak. Más, helyettesítő eljárások is választhatók, amennyiben bizonyítottan ugyanolyan hatékonyan vagy hatékonyabban biztosítják a fájdalom és a szorongás elkerülését vagy enyhítését.
— A vizsgálati vegyi anyag alkalmazása előtt hatvan perccel szubkután injekcióval 0,01 mg/kg buprenorfint kell beadni a szisztémás fájdalomcsillapítás terápiás szintjének biztosítása érdekében. A szisztémásan beadott buprenorfin és más hasonló, szisztémásan beadott ópiumtartalmú fájdalomcsillapítók esetében nem ismert, illetve nem várható, hogy megváltoztatják a szemreakciókat (12).
— A vizsgálati vegyi anyag alkalmazása előtt öt perccel mindkét szemre egy vagy két csepp helyi érzéstelenítőt (pl. 0,5 % proparakain-hidrokloridot vagy 0,5 % tetrakain-hidrokloridot) kell alkalmazni. A vizsgálat esetleges zavarásának elkerülése érdekében tartósítószert nem tartalmazó helyi érzéstelenítő javasolt. A vizsgálati vegyi anyaggal nem, de helyi érzéstelenítővel kezelt állatok szeme szolgál kontrollként. Ha a vizsgálati vegyi anyag előreláthatólag jelentős fájdalmat és szorongást okoz, azt szokásosan nem szabad in vivo vizsgálni. Kétség felmerülése vagy a vizsgálat szükségessége esetén azonban mérlegelni kell a helyi érzéstelenítőnek a vizsgálati vegyi anyag alkalmazása előtti ötperces időközönkénti további alkalmazását. A felhasználóknak tisztában kell lenniük azzal, hogy a helyi érzéstelenítők többszöri alkalmazása kismértékben növelheti a vegyi anyagok okozta léziók súlyosságát és/vagy az e léziók megszűnéséhez szükséges időt.
— A vizsgálati vegyi anyag alkalmazása után nyolc órával szubkután injekcióval 0,01 mg/kg buprenorfint és 0,5 mg/kg meloxicamot kell beadni a szisztémás fájdalomcsillapítás terápiás szintjének fenntartása érdekében. Bár nincsenek arra utaló adatok, hogy a meloxicam napi egyszeri szubkután beadása gyulladásgátló hatást fejtene ki a szemre, a vizsgálat esetleges zavarásának elkerülése érdekében meloxicam a vizsgálati vegyi anyag alkalmazása után legalább 8 óráig nem adható be (12).
— A vizsgálati vegyi anyag alkalmazása utáni első 8 órás kezelést követően 12 óránként szubkután injekcióval 0,01 mg/kg buprenorfint, ezzel együtt 24 óránként szubkután injekcióval 0,5 mg/kg meloxicamot kell beadni, amíg a szemléziók be nem gyógyulnak, továbbá fájdalom és szorongás klinikai tünetei nem jelentkeznek. Rendelkezésre állnak olyan retard fájdalomcsillapító készítmények, amelyek használatát mérlegelni lehet a fájdalomcsillapító beadása gyakoriságának csökkentése érdekében.
— A vizsgálati vegyi anyag alkalmazása után azonnal »mentő« fájdalomcsillapítást kell végezni, ha az előzetes fájdalomcsillapítás és a helyi érzéstelenítés nem megfelelő. Ha a vizsgálat során az állatok fájdalom és szorongás jeleit mutatják, a szubkután injekcióval 12 óránként beadott 0,01 mg/kg helyett szubkután injekcióval 0,03 mg/kg »mentő« buprenorfin-dózist kell azonnal beadni, és ezt szükség esetén 8 óránként meg kell ismételni. A »mentő« buprenorfin-dózissal együtt 24 óránként, szubkután injekcióval 0,5 mg/kg meloxicamot kell beadni, amely azonban a vizsgálati vegyi anyag alkalmazása után legalább 8 órán át nem adható be.
A vizsgálati vegyi anyag alkalmazása
A vizsgálati vegyi anyagot az alsó szemhéj óvatos elhúzása után az állat egyik szemének kötőhártyazsákjába kell bejuttatni. Ezt követően körülbelül egy másodpercig óvatosan össze kell fogni a szemhéjakat, hogy az anyag ki ne essen vagy ki ne folyjon. A másik, nem kezelt szem kontrollként szolgál.
Öblögetés
A kísérleti állatok szemét a vizsgálati vegyi anyag becseppentése után legalább 24 órán át nem szabad kimosni, kivéve szilárd anyagok alkalmazása esetén (lásd a 18. pontot), illetve ha azonnali korróziós vagy irritáló hatások tapasztalhatók. Ha szükségesnek tűnik, 24 óra múlva ki lehet mosni az állatok szemét.
Nem javasolt kísérőcsoport alkalmazása a mosás hatásának vizsgálatára, kivéve, ha az tudományosan indokolt. Ha kísérőcsoport szükséges, akkor ehhez két nyulat kell használni. A mosás körülményeit, pl. a mosás időpontját, a mosóoldat összetételét és hőmérsékletét, a mosás időtartamát és sebességét, valamint az alkalmazott térfogatot részletesen dokumentálni kell.
Dózisszintek
(1) Folyadékok vizsgálata
Folyadékok vizsgálata esetén 0,1 ml-es dózist kell alkalmazni. Pumpás spray-ket nem szabad a vegyi anyag közvetlenül a szembe való permetezésére használni. A spray-t ki kell fújni, és tartalmát egy edényben össze kell gyűjteni, mielőtt 0,1 ml-t az állat szemébe cseppentenének.
(2) Szilárd anyagok vizsgálata
Szilárd anyagok, masszák és szemcsés vegyi anyagok vizsgálata esetén az alkalmazott mennyiségnek 0,1 ml térfogatúnak kell lennie, illetve tömege nem haladhatja meg a 100 mg-ot. A vizsgálati vegyi anyagot finom porrá kell őrölni. Térfogatmérés előtt óvatosan össze kell tömöríteni, pl. a mérőedény megkocogtatásával. Amennyiben az első megfigyelési időpontban, azaz a kezelés után 1 órával azt tapasztalják, hogy a szilárd vizsgálati vegyi anyagot a fiziológiai mechanizmusok nem távolították el a kísérleti állat szeméből, a szemet sóoldattal vagy desztillált vízzel ki lehet öblögetni.
(3) Aeroszolok vizsgálata
A szembe cseppentés előtt ajánlatos minden pumpás spray tartalmát és aeroszolt összegyűjteni. Az egyetlen kivételt ez alól a túlnyomásos aeroszolos flakonokban lévő vegyi anyagok képezik, amelyeket a párolgás miatt nem lehet összegyűjteni. Ilyen esetekben az állat szemét nyitva kell tartani, és a vizsgálati vegyi anyagot úgy kell a szembe juttatni, hogy a flakont 10 cm távolságban közvetlenül a szem előtt tartva és körülbelül egy másodpercig működtetve egyszer belefújnak az állat szemébe. A spray nyomásától és tartalmától függően a távolság ettől eltérő is lehet. Vigyázni kell arra, hogy a spray nyomása ne okozzon szemkárosodást. Megfelelő esetekben szükség lehet a spray ereje okozta »mechanikai« szemkárosodás lehetőségének figyelembevételére.
Az aeroszol dózisa a vizsgálat következő módon végzett szimulációjával becsülhető meg: a vegyi anyagot mérőpapírra kell permetezni egy olyan, közvetlenül a papír elé helyezett nyíláson keresztül, amelynek mérete megegyezik a nyúl szemének méretével. A szembe permetezett mennyiség közelítő becslésére a papír tömegének növekedése használatos. Illékony vegyi anyagok esetében a dózist úgy lehet megbecsülni, hogy a vizsgálati vegyi anyag eltávolítása előtt és után is megmérik a befogadó edény tömegét.
Kiindulási vizsgálat (egy állat alkalmazásával végzett in vivo szemirritációs/szemkorróziós vizsgálat)
Kifejezetten javasolt, hogy az in vivo vizsgálatra először egy állat alkalmazásával kerüljön sor (lásd e vizsgálati módszer kiegészítését: Lépcsőzetes vizsgálati stratégia szemirritáció és szemkorróziós hatás vizsgálatához). A megfigyeléseknek lehetővé kell tenniük a súlyosság és a visszafordíthatóság meghatározását, mielőtt egy második állaton végzett megerősítő vizsgálatra kerülne sor.
Ha e vizsgálat eredményei szerint az ismertetett eljárás alkalmazásával a vegyi anyag korróziós hatású vagy súlyosan irritálja a szemet, nem szabad további szemirritációs vizsgálatokat végezni.
Megerősítő vizsgálat (további állatok alkalmazásával végzett in vivo szemirritációs vizsgálat)
Ha a kiindulási vizsgálat során nem figyelhető meg korróziós vagy súlyos irritáló hatás, legfeljebb további két állat alkalmazásával ellenőrizni kell az irritációs vagy negatív válaszreakciókat. Ha a kiindulási vizsgálat során irritációs válasz tapasztalható, a megerősítő vizsgálatot ajánlatos lépcsőzetesen, egyszerre egy állaton elvégezni a két további állat egyszerre történő expozíciója helyett. Ha a második állat korróziós vagy súlyos irritáló hatásokat mutat, a vizsgálatot nem szabad folytatni. Ha a második állat eredményei elegendőek a veszélyességi osztály meghatározásához, akkor további vizsgálatokat nem szabad folytatni.
Megfigyelési időszak
A megfigyelési időszak hosszát úgy kell megválasztani, hogy elegendő legyen a megfigyelt hatások mértékének és visszafordíthatóságának teljes kiértékelésére. A kísérletet azonban azonnal be kell fejezni, ha az állat súlyos fájdalom vagy szorongás jeleit mutatja (8). A hatások visszafordíthatóságának meghatározásához az állatokat általában a vizsgálati vegyi anyag alkalmazása után 21 napig kell megfigyelni. Ha a visszafordíthatóság a 21 napos időszak vége előtt bebizonyosodik, a kísérletet ekkor be kell fejezni.
Klinikai megfigyelések és a szemreakciók értékelése
A szemeket érintően a vizsgálati vegyi anyag alkalmazása után egy órával átfogó értékelést kell végezni arra nézve, hogy előfordulnak-e szemléziók vagy sem; ezt napi szintű értékelések követik. Az állatokat az első három napon naponta többször ki kell értékelni annak biztosítása érdekében, hogy a vizsgálat befejezésére vonatkozó döntések meghozatalára időben sor kerüljön. A kísérleti állatokon a vizsgálat teljes időtartama alatt legalább naponta kétszer, minimum 6 órás intervallumokkal, vagy szükség esetén gyakrabban kell rutinszerű értékelést végezni a fájdalom és/vagy szorongás klinikai tünetei szempontjából (pl. a szem többszöri tapogatása vagy dörzsölése, túlzott pislogás, túlzott könnyezés) (9) (10) (11). Az állatokat i. megfelelően meg kell vizsgálni abból a szempontból, hogy van-e fájdalomra vagy szorongásra utaló bizonyíték, annak érdekében, hogy megalapozott döntéseket lehessen hozni a fájdalomcsillapító-adagolás növelésének szükségességéről, valamint ii. abból a szempontból, hogy van-e megállapított kíméletes végpontokra utaló bizonyíték, annak érdekében, hogy megalapozott döntéseket lehessen hozni arról, hogy helyénvaló-e az állatokon humánus módon eutanáziát végrehajtani, továbbá biztosítani lehessen, hogy e döntések meghozatalára időben sor kerüljön. Fluoreszcein festést rutinszerűen kell alkalmazni, és megfelelőnek ítélt esetben a szemkárosodás kimutatására és mérése szolgáló segédeszközként, valamint a humánus eutanázia tekintetében megállapított végpont-kritériumok teljesülésének értékelésére réslámpás biomikroszkópot kell használni (pl. szaruhártya-fekélyesedés fennállása esetén megvizsgálva a sérülés mélységét). A megfigyelt léziókról készült digitális fényképek gyűjthetők referenciaként, valamint a szemkárosodási mérték tartós rögzítésének biztosítása érdekében. Ha már megvan a döntő információ, az állatokat nem szabad a szükségesnél hosszabb ideig a kísérletben tartani. A súlyos fájdalmat vagy szorongást mutató állatokat haladéktalanul és humánus módon el kell pusztítani, és a vegyi anyagot ennek megfelelően kell értékelni.
A becseppentés után az alábbi szemléziókat mutató állatokat humánus módon el kell pusztítani (a léziók fokozatait lásd az 1. táblázatban): szaruhártya-perforálódás vagy jelentős mértékű szaruhártya-fekélyesedés, ezen belül staphyloma (a szaruhártya rendellenes kidomborodása); vér jelenléte a szem elülső szemzugában; negyedfokú szaruhártya-homály; a fényreflex 72 órán át tartó hiánya (másodfokú szivárványhártya-válaszreakció); a kötőhártya fekélyesedése; a kötőhártyában vagy a pislogóhártyában jelentkező szövetelhalás; vagy leválás. Erre azért van szükség, mert az ilyen léziók általában nem visszafordíthatók. Javasolt továbbá, hogy a vizsgálatoknak a tervezett 21 napos megfigyelési időszak vége előtti befejezéséhez az alábbi szemléziókat használják kíméletes végpontokként. Ezek a léziók súlyosan irritáló vagy korróziós hatású sérülések, valamint olyan sérülések előrejelzésének minősülnek, amelyek várhatóan nem fordulnak vissza teljesen a 21 napos megfigyelési időszak végéig: a sérülés súlyos mélysége (pl. a stroma felületi rétegein túlra kiterjedő szaruhártya-fekélyesedés), a szaruhártyaszél 50 %-osnál nagyobb mértékű rongálódása (ahogyan azt az alsó szemhéj szöveteinek elfehéredése bizonyítja), valamint súlyos szemfertőzés (gennyes váladék). A következők kombinációja: a szaruhártya felületének vaszkularizációja (azaz pannus); a fluoreszceinnel megfestett terület a naponta végzett értékelés alapján az idő múlásával nem csökken; és/vagy a vizsgálati vegyi anyag alkalmazása után öt nappal elmarad az újrahámosodás, szintén a vizsgálat korai befejezésére vonatkozó klinikai döntést potenciálisan befolyásoló, hasznos kritériumnak minősül. E megállapítások azonban önmagukban nem elegendőek a vizsgálat korai befejezésére vonatkozó döntés indokolásához. A szemre gyakorolt súlyos hatások meghatározását követően laboratóriumi állatokat kezelő állatorvossal vagy ilyen állatokra szakosodott állatorvossal, illetve a klinikai léziók azonosítására képesítéssel rendelkező személyzettel kell konzultálni annak meghatározására szolgáló klinikai vizsgálat érdekében, hogy e hatások kombinációja indokolja-e a vizsgálat korai befejezését. A vizsgálati vegyi anyag alkalmazása után 1, 24, 48 és 72 óra elteltével meg kell mérni és rögzíteni kell a szemreakciókat (kötőhártya-, szaruhártya- és szivárványhártya-reakciók) (1. táblázat). A szemléziókat nem mutató állatokat legkorábban a becseppentés után 3 nappal lehet elpusztítani. A nem súlyos szemléziókat mutató állatokat legalább addig megfigyelés alatt kell tartani, amíg a léziók meg nem szűnnek, vagy legfeljebb 21 napig, amikor a vizsgálat befejeződik. A léziók állapotának és visszafordíthatóságának vagy visszafordíthatatlanságának meghatározása érdekében legalább az 1., a 24. a 48., a 72. órában, a 7., a 14. és a 21. napon kell megfigyelést végezni, és azt dokumentálni kell. Gyakrabban kell megfigyeléseket végezni, ha az szükséges annak meghatározásához, hogy a kísérleti állaton humánus megfontolásból eutanáziát kell-e végrehajtani, vagy negatív eredmények miatt el kell-e azokat távolítani a vizsgálatból.
A szemléziók mértékét (1. táblázat) minden egyes vizsgálatkor fel kell jegyezni. A szem bármely egyéb lézióját (pl. pannus, elszíneződés, elülső szemzug elváltozásai) vagy a káros szisztémás hatásokat szintén dokumentálni kell.
A reakciók vizsgálatát megkönnyítheti egy binokuláris kézi nagyító, egy kézi réslámpa, egy biomikroszkóp vagy bármely más megfelelő eszköz alkalmazása. A 24 óra után tett megfigyelések rögzítését követően a szemek még fluoreszcein segítségével is megvizsgálhatók.
A szemreakciók értékelése elkerülhetetlenül szubjektív. A szemreakciók értékelésének harmonizálása és a vizsgáló laboratóriumok, illetve a megfigyelésekben és azok értékelésében részt vevők segítése érdekében a megfigyeléseket végző személyzetet megfelelően ki kell képezni az alkalmazott értékelési rendszer használatára.
ADATOK ÉS JEGYZŐKÖNYVEZÉS
Az eredmények értékelése
A szemirritációs pontszámokat a léziók jellegével és súlyosságával, illetve visszafordíthatóságukkal vagy visszafordíthatatlanságukkal összefüggésben kell meghatározni. Az egyes pontszámok nem jelentenek abszolút normát a vegyi anyagok irritációs tulajdonságai tekintetében, mivel a vizsgálati vegyi anyag egyéb hatásai is értékelés tárgyát képezik. Az egyes pontszámokat ehelyett referenciaértékeknek kell tekinteni, amelyeknek csak akkor van jelentőségük, ha az összes megfigyelés ismertetése és értékelése alátámasztja ezeket.
Vizsgálati jegyzőkönyv
A Vizsgálati jegyzőkönyvnek a következőket kell tartalmaznia:
Az in vivo vizsgálatok indokolása: a korábban rendelkezésre álló vizsgálati adatok, ezen belül a lépcsőzetes vizsgálati stratégia során nyert adatok bizonyító erejének elemzése:
— a korábbi vizsgálatokból rendelkezésre álló, vonatkozó adatok ismertetése;
— a vizsgálati stratégia egyes szakaszaiban nyert adatok;
— az elvégzett in vitro vizsgálatok, ezen belül az eljárások, illetve a vizsgálati/referenciaanyagokkal kapott eredmények részleteinek ismertetése;
— az elvégzett in vivo bőrirritációs/bőrkorróziós vizsgálatok és a kapott eredmények ismertetése;
— az adatok bizonyító erejének elemzése az in vivo vizsgálat elvégzéséhez.
Vizsgálati vegyi anyag:
— azonosító adatok (pl. kémiai név, és a CAS-szám, amennyiben rendelkezésre áll; tisztaság; ismert szennyeződések; forrás; tételszám);
— fizikai megjelenés és fizikai-kémiai tulajdonságok (pl. pH, illékonyság, oldhatóság, stabilitás, vízzel való reakcióképesség);
— keverék esetén azonosítandók a komponensek, többek között közlendők az azokat alkotó anyagok azonosító adatai (pl. kémiai név és a CAS-szám, amennyiben rendelkezésre áll) és a koncentrációjuk;
— az alkalmazott dózisok.
Vivőanyag:
— név, (adott esetben) koncentráció, alkalmazott térfogat;
— a vivőanyag megválasztásának indoklása.
Kísérleti állatok:
— az alkalmazott faj/törzs, adott esetben az albínó nyúltól eltérő faj alkalmazásának indoklása;
— az egyes állatok életkora a vizsgálat kezdetén;
— az állatok száma ivaronként a vizsgálati és kontrollcsoportokban (ha szükséges);
— az egyes állatok testtömege a vizsgálat előtt és végén;
— származás, tartási körülmények, takarmány stb.
Érzéstelenítők és fájdalomcsillapítók
— a helyi érzéstelenítők és a szisztémás hatású fájdalomcsillapítók beadásának dózisai és időpontjai;
— helyi érzéstelenítő alkalmazása esetén a szer neve, tisztasága, típusa, valamint a vizsgálati vegyi anyaggal való esetleges kölcsönhatása.
Eredmények:
— az irritáció értékelésére az egyes megfigyelési időpontokban alkalmazott módszer (pl. kézi réslámpa, biomikroszkóp, fluoreszcein) ismertetése;
— az irritációs/korróziós válaszreakció-adatok táblázatos megjelenítése mindegyik állatra vonatkozóan mindegyik megfigyelési időpontban egészen az állatoknak a vizsgálatból való kivételéig;
— a megfigyelt irritáció vagy korrózió jellegének és mértékének leíró jellegű ismertetése,
— a szemben megfigyelt bármely egyéb lézió (pl. vaszkularizáció, pannusképződés, összetapadások, elszíneződés) ismertetése;
— a szemen kívül jelentkező káros lokális és szisztémás hatások ismertetése, a fájdalom és a szorongás klinikai tüneteinek rögzítése, digitális fényképek, valamint adott esetben a kórszövettani eredmények ismertetése.
Az eredmények tárgyalása
Az eredmények kiértékelése
A laboratóriumi állatokon végzett szemirritációs vizsgálatok eredményeinek emberre extrapolálása csak korlátozott érvényességű. Az albínó nyúl sok esetben érzékenyebb a szemirritáló vagy -korróziós anyagokra, mint az ember.
Ügyelni kell arra, hogy az adatok kiértékelése során kizárják a másodlagos fertőzés eredményeként jelentkező irritációt.
SZAKIRODALOM
(1) Barratt, M.D., et al. (1995), The Integrated Use of Alternative Approaches for Predicting Toxic Hazard, ECVAM Workshop Report 8, ATLA 23, 410–429.
(2) de Silva, O., et al. (1997), Evaluation of Eye Irritation Potential: Statistical Analysis and Tier Testing Strategies, Food Chem. Toxicol 35, 159–164.
(3) Worth A.P. and Fentem J.H. (1999), A general approach for evaluating stepwise testing strategies ATLA 27, 161-177.
(4) Young, J.R., et al. (1988), Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals, Toxicol. In Vitro, 2, 19–26.
(5) Neun, D.J. (1993), Effects of Alkalinity on the Eye Irritation Potential of Solutions Prepared at a Single pH, J. Toxicol. Cut. Ocular Toxicol. 12, 227–231.
(6) Fentem, J.H., et al. (1998), The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team, Toxicology in vitro 12, pp. 483–524.
(7) E melléklet B.4., Akut bőrirritáció/bőrkorrózió című fejezete.
(8) OECD (2000), Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. OECD Environmental Health and Safety Publications, Series on Testing and Assessment No. 19. (http://www.oecd.org/ehs/test/monos.htm).
(9) Wright EM, Marcella KL, Woodson JF. (1985), Animal pain: evaluation and control, Lab Animal, May/June, 20–36.
(10) National Research Council (NRC) (2008), Recognition and Alleviation of Distress in Laboratory Animals, Washington, DC: The National Academies Press.
(11) National Research Council (NRC) (2009), Recognition and Alleviation of Pain in Laboratory Animals, Washington, DC: The National Academies Press.
(12) ICCVAM (2010), ICCVAM Test Method Evaluation Report: Recommendations for Routine Use of Topical Anesthetics, Systemic Analgesics, and Humane Endpoints to Avoid or Minimize Pain and Distress in Ocular Safety Testing, NIH Publication No. 10-7514, Research Triangle Park, NC, USA: National Institute of Environmental Health Sciences.
http://iccvam.niehs.nih.gov/methods/ocutox/OcuAnest- TMER.htm
(13) E melléklet B.40., In vitro bőrkorrózió: transzkután elektromos rezisztencia vizsgálat (TER) című fejezete.
(14) E melléklet B.40A., In vitro bőrkorrózió: emberi bőrmodellen végzett vizsgálat című fejezete.
(15) OECD (2006), Test No. 435: In vitro Membrane Barrier Test Method for Skin corrosion, OECD Guidelines for the Testing of Chemicals, Section 4, OECD Paris.
(16) E melléklet B.47., Szarvasmarha-szaruhártya opacitásának és permeabilitásának mérésén alapuló vizsgálati módszer i. a súlyos szemkárosodást okozó vegyi anyagok és ii. a szemirritáció vagy a súlyos szemkárosodás tekintetében besorolást nem igénylő vegyi anyagok azonosítására című fejezete.
(17) E melléklet B.48., Izolált csirkeszem vizsgálatán alapuló vizsgálati módszer i. a súlyos szemkárosodást okozó vegyi anyagok és ii. a szemirritáció vagy a súlyos szemkárosodás tekintetében besorolást nem igénylő vegyi anyagok azonosítására című fejezete.
(18) U.S. EPA (2003), Label Review Manual: 3rd Edition, EPA737-B-96-001, Washington, DC: U.S., Environmental Protection Agency.
(19) UN (2011), Globally Harmonized System of Classification and Labelling of Chemicals (GHS), Fourth revised edition, New York & Geneva: United Nations Publications.
(20) EK (2008), Az Európai Parlament és a Tanács 2008. december 16-i 1272/2008/EK rendelete az anyagok és keverékek osztályozásáról, címkézéséről és csomagolásáról, a 67/548/EGK és az 1999/45/EK irányelv módosításáról és hatályon kívül helyezéséről, valamint az 1907/2006/EK rendelet módosításáról. (HL L 353., 2008.12.31., 1. o.)
(21) ECHA Guidance on information requirements and chemical safety assessment, Chapter R.7a: Endpoint specific guidance.
http://echa.europa.eu/documents/10162/13632/information_requirements_r7a_en.pdf
1. táblázat
A szemléziók osztályozása
|
Szaruhártya |
Fokozat |
|
Homályosság: a homályosság mértéke (az érték megállapításához a legsűrűbb területet kell venni) (1) |
|
|
Nem észlelhető fekélyesedés vagy homályosság |
0 |
|
Szórványos vagy diffúz homályos területek (a megszokott csillogás enyhe tompulásán kívül), a szivárványhártya részletei tisztán láthatók |
1 |
|
Könnyen kivehető áttetsző terület; a szivárványhártya részletei kissé elhomályosodottak |
2 |
|
Gyöngyházfényű terület; a szivárványhártya semmilyen részlete nem látható; a pupilla mérete alig észlelhető |
3 |
|
Nem átlátszó szaruhártya; a szivárványhártya egyáltalán nem látható |
4 |
|
Lehetséges maximum: 4 |
|
|
Szivárványhártya |
|
|
Normális |
0 |
|
Észrevehetően mélyebb redők, vérbőség, duzzanat, mérsékelt vérbőség a szaruhártya körül; vagy belövelltség; a szivárványhártya fényre reagál (a lassú reakció is pozitív) |
1 |
|
Vérzés, nagymérvű roncsolódás, vagy nem reagál a fényre |
2 |
|
Lehetséges maximum: 2 |
|
|
Kötőhártya |
|
|
Vörösödés (a szemhéjak és a szemgolyó kötőhártyájára vonatkozik; kivéve a szaruhártyát és a szivárványhártyát) |
|
|
Normális |
0 |
|
Egyes vérerek vérteltek (belövelltek) |
1 |
|
Diffúz, bíborvörös szín; az egyes vérerek nehezen kivehetők |
2 |
|
Diffúz erőteljes vörös |
3 |
|
Lehetséges maximum: 3 |
|
|
Kötőhártya-vizenyő (chemosis) |
|
|
Duzzanat (a szemhéjak és/vagy a pislogóhártyák esetében) |
|
|
Normális |
0 |
|
A normálisnál kissé duzzadtabb |
1 |
|
Nyilvánvaló duzzanat, a szemhéjak részleges kifordulásával |
2 |
|
Duzzanat, nagyjából félig zárt szemhéjakkal |
3 |
|
Duzzanat, és a szemhéjak több mint félig zárva vannak |
4 |
|
Lehetséges maximum: 4 |
|
|
(*1) A szaruhártya homályos területének nagyságát fel kell jegyezni |
|
Függelék
FOGALOMMEGHATÁROZÁSOK
Sav-/alkálitartalék : savas készítmények esetében a nátrium-hidroxid meghatározott pH kialakításához szükséges, a készítmény 100 grammjára vetített (grammban kifejezett) mennyisége. Lúgos készítmények esetében a nátrium-hidroxid meghatározott pH kialakításához szükséges, a készítmény 100 grammjára vetített, grammban kifejezett kénsav mennyiségével egyenértékű (grammban kifejezett) mennyisége (Young et al. 1988).
Vegyi anyag : anyag vagy keverék.
Szemirritációt nem okozó anyag : a szemirritációt okozó anyagok EPA szerinti I., II. vagy III., a GHS szerinti 1., 2., 2A. vagy 2B., illetve az EU szerinti 1. vagy 2. kategóriájába nem tartozó anyag (17) (18) (19).
Szemkorróziót okozó anyag : a) a szemben visszafordíthatatlan szövetkárosodást okozó anyag; b) a GHS szerinti 1., az EPA szerinti I., illetve az EU szerinti 1. kategóriába besorolt, szemirritációt okozó vegyi anyag (17) (18) (19).
Szemirritációt okozó anyag : a) olyan vegyi anyag, amely visszafordítható elváltozást okoz a szemben; b) az EPA szerinti II. vagy III., a GHS szerinti 2., 2A. vagy 2B, illetve az EU szerinti 2. kategóriába besorolt, szemirritációt okozó vegyi anyag (17) (18) (19).
Súlyos szemirritációt okozó anyag : a) olyan vegyi anyag, amely 21 napon belül meg nem szűnő szövetkárosodást vagy a fizikai látóképesség súlyos romlását okozza; b) a GHS szerinti 1., az EPA szerinti I. vagy az EU szerinti 1. kategóriába besorolt, szemirritációt okozó anyag (17) (18) (19).
Vizsgálati vegyi anyag : bármely, e vizsgálati módszer alkalmazásával vizsgált anyag vagy keverék.
Lépcsőzetes megközelítés : olyan lépcsőzetes vizsgálati stratégia, amelynek keretében a vizsgálati vegyi anyagra vonatkozó valamennyi információt meghatározott sorrendben áttekintik, és az egyes szinteken az adatok bizonyító erejének elemzésével meghatározzák, hogy a következő szintre való továbblépés előtt a veszélyességi osztályozásra vonatkozó döntéshez elegendő információ áll-e rendelkezésre. Ha a vizsgálati vegyi anyag irritatív hatása a rendelkezésre álló információk alapján megállapítható, további vizsgálatra nincs szükség. Ha a vizsgálati vegyi anyag irritatív hatása a rendelkezésre álló információk alapján nem állapítható meg, több lépcsőben egymás után állatkísérleteket kell végezni mindaddig, amíg az egyértelmű besorolás meg nem állapítható.
Az adatok bizonyító erejének mérlegelése (mérlegelési folyamata) : Az egyes adatok alapján nem feltétlenül nyilvánvaló következtetést megalapozó, az összegyűjtött információkra vonatkozó érvek és ellenérvek alkalmazása.
A B.5. VIZSGÁLATI MÓDSZER KIEGÉSZÍTÉSE ( 3 )
LÉPCSŐZETES VIZSGÁLATI STRATÉGIA SZEMIRRITÁCIÓ ÉS SZEMKORRÓZIÓS HATÁS VIZSGÁLATÁHOZ
Általános megfontolások
A tudományos ésszerűség és az állatok kímélete érdekében fontos, hogy elkerülhető legyen az állatokkal való szükségtelen kísérletezés, illetve minimálisra lehessen csökkenteni azoknak a vizsgálatoknak a számát, amelyek valószínűleg súlyos válaszreakciókat váltanak ki a kísérleti állatokban. Az in vivo vizsgálatok fontolóra vétele előtt minden, a vegyi anyag potenciális szemirritáló/szemkorróziós hatásával összefüggő információt ki kell értékelni. Előfordulhat, hogy már elegendő bizonyíték létezik a vizsgálati vegyi anyag szemirritációs vagy szemkorróziós potenciál szempontjából történő besorolására anélkül, hogy laboratóriumi állatokon kísérleteket kellene végezni. Az adatok bizonyító erejének elemzésével és a lépcsőzetes vizsgálati stratégia alkalmazásával tehát minimálisra csökkenthető az in vivo vizsgálatok szükségszerűsége, különösen, ha a vegyi anyag valószínűsíthetően súlyos reakciókat okoz.
A vegyi anyagok szemirritáló és szemkorróziós hatásával kapcsolatban rendelkezésre álló információk értékelésre javasolt elvégezni az adatok bizonyító erejének elemzését annak meghatározása érdekében, hogy az in vivo szemvizsgálatokon kívül szükség van-e egyéb vizsgálatokra az irritáló/korróziós potenciál jellemzéséhez. Ha további vizsgálatokra van szükség, a vonatkozó kísérleti adatok összegyűjtéséhez a lépcsőzetes vizsgálati stratégiát javasolt alkalmazni. Az olyan anyagok esetében, amelyeket korábban nem vizsgáltak, az anyag szemkorróziós/szemirritációs potenciáljának értékeléséhez szükséges adatsor előállításához a lépcsőzetes vizsgálati stratégiát kell alkalmazni. Az e kiegészítésben ismertetett kiindulási vizsgálati stratégiát egy OECD-munkaértekezleten (1) dolgozták ki, majd később a vegyi anyagok humán egészségügyi és környezeti hatásainak osztályozására szolgáló harmonizált integrált veszélyosztályozási rendszer keretében 1998 novemberében a Vegyi Anyag Bizottság és a Vegyi Anyag Munkacsoport 28. együttes ülésén jóváhagyták és kibővítették (2), és azt 2011-ben egy OECD-szakértői csoport naprakésszé tette.
Bár ez a vizsgálati stratégia nem képezi a B5. vizsgálati módszer szerves részét, kifejezésre juttatja a szemirritációs/szemkorróziós tulajdonságok meghatározására ajánlott megközelítést. Ez a megközelítés jelenti a bevált gyakorlatot, és etikai szempontból is irányadó az in vivo szemirritációs/szemkorróziós vizsgálatokhoz. A vizsgálati módszer útmutatást ad az in vivo vizsgálatok elvégzéséhez, és összefoglalja azokat a tényezőket, amelyekre az ilyen vizsgálatok mérlegelése előtt ki kell térni. A lépcsőzetes vizsgálati stratégia az adatok bizonyító erején alapuló megközelítést biztosít a vegyi anyagok szemirritációs/szemkorróziós tulajdonságaival kapcsolatos meglévő adatok értékeléséhez, valamint lépcsőzetes megközelítést biztosít azon vegyi anyagok vonatkozó adatainak összegyűjtéséhez, amelyekhez további vizsgálatokra van szükség, vagy amelyeket korábban egyáltalán nem vizsgáltak. A stratégia magában foglalja továbbá, hogy először validált és elfogadott in vitro vagy ex vivo vizsgálatokat kell végezni, majd meghatározott körülmények mellett a B.4. vizsgálati módszerrel további vizsgálatokat (3) (4) kell lefolytatni.
A lépcsőzetes vizsgalati stratégia ismertetése
A vizsgálatoknak a lépcsőzetes vizsgálati stratégia (ábra) keretében történő elvégzése előtt minden rendelkezésre álló információt ki kell értékelni annak meghatározása érdekében, hogy szükség van-e in vivo szemvizsgálatokra. Bár egy-egy paraméter (pl. szélsőséges pH-érték) vizsgálatából is jelentős mennyiségű információ nyerhető ki, az összes rendelkezésre álló információt figyelembe kell venni. A kérdéses vegyi anyag vagy szerkezeti analógjai hatásaival kapcsolatos összes vonatkozó adatot értékelni kell az adatok bizonyító erejéről való döntés meghozatalakor, és meg is kell indokolni ezt a döntést. Elsődleges hangsúlyt kell fektetni a vegyi anyaggal kapcsolatban rendelkezésre álló humán és állatkísérletek adataira, ezt követően az in vitro vagy ex vivo vizsgálatok eredményére. Lehetőség szerint kerülni kell korróziós hatású vegyi anyagok in vivo vizsgálatát. A vizsgálati stratégia során figyelembe veendő tényezők többek között a következők:
Validált és nemzetközileg elfogadott módszerekből nyert, humán és/vagy állatokra vonatkozó és/vagy in vitro adatok (1. lépés).
Először is a rendelkezésre álló humán adatokat, pl. klinikai vagy munkaegészségügyi vizsgálatokat, valamint esettanulmányokat és/vagy állatokon végzett szemvizsgálatok adatait és/vagy a szemirritációra/szemkorrózióra vonatkozó, validált és nemzetközileg elfogadott módszerekből nyert, in vitro adatokat kell kiértékelni, mivel ezek a szemre gyakorolt hatásokkal közvetlenül összefüggő információkat szolgáltatnak. Ezt követően a rendelkezésre álló bőrkorróziós/bőrirritációs humán és/vagy állatkísérletek adatait és/vagy a bőrkorrózióra vonatkozó, validált és nemzetközileg elfogadott módszerek alapján rendelkezésre álló adatokat kell kiértékelni. Az ismerten szemkorróziós hatású vagy súlyosan szemirritáló vegyi anyagokat nem szabad állatok szemébe cseppenteni, ahogyan a bőrkorróziós és a súlyosan bőrirritáló hatású vegyi anyagokat sem; az ilyen vegyi anyagokat úgy kell tekinteni, hogy egyúttal szemkorróziós és/vagy szemirritáló hatásúak is. Nem szabad in vivo szemvizsgálatokat végezni olyan vegyi anyagokkal sem, amelyek esetében korábbi szemvizsgálatok alapján elegendő bizonyíték van az ilyen hatások hiányára.
A szerkezet-aktivitási összefüggések (SAR) elemzése (2. lépés).
Meg kell fontolni szerkezetileg rokon anyagok vizsgálatának eredményeit, ha rendelkezésre állnak ilyen eredmények. Ha a szerkezetileg rokon anyagokkal vagy keverékeikkel kapcsolatban elegendő olyan humán és/vagy állatkísérleti adat áll rendelkezésre, amely valószínűsíti a szemkorróziós/szemirritációs potenciált, feltételezhető, hogy a vizsgálati vegyi anyag ugyanilyen válaszreakciókat vált ki. Ilyen esetekben a vegyi anyagot nem feltétlenül kell megvizsgálni. A lépcsőzetes vizsgálati stratégia értelmében a szerkezetileg rokon anyagok vagy keverékeik vizsgálatából származó negatív adatok nem jelentenek elegendő bizonyítékot arra, hogy a vegyi anyag nem korróziós hatású vagy nem irritáló. A bőrre és a szemre gyakorolt hatások vonatkozásában is validált és elfogadott SAR-megközelítéseket kell alkalmazni a korróziós és irritáló potenciál meghatározására.
Fizikai-kémiai tulajdonságok és kémiai reakcióképesség (3. lépés).
A szélsőséges pH-értékű, például ≤2,0 vagy ≥11,5 kémhatású vegyi anyagok erőteljes lokális hatást gyakorolhatnak. Ha a szélsőséges pH-érték az alapja annak, hogy egy vegyi anyagot szemkorróziós vagy szemirritáló hatásúnak minősítsenek, akkor figyelembe lehet venni az anyag sav-/alkálitartalékát (pufferkapacitását) is (5)(6)(7). Ha a pufferkapacitás alapján valószínűsíthető, hogy a vegyi anyag nem lehet szemkorróziós hatású (azaz szélsőséges pH-értékű és alacsony sav-/alkálitartalékkal rendelkező vegyi anyag), akkor ennek megerősítésére további vizsgálatokat kell végezni, lehetőleg validált és elfogadott in vitro vagy ex vivo vizsgálatok alkalmazásával (lásd a 10. pontot).
Más meglévő információk fontolóra vétele (4. lépés)
Ebben a fázisban a dermális alkalmazás esetén jelentkező szisztémás toxicitással kapcsolatban rendelkezésre álló összes információt ki kell értékelni. A vizsgálati vegyi anyag akut dermális toxicitását is fontolóra kell venni. Ha kimutatható, hogy a vizsgálati vegyi anyag dermális alkalmazás esetén erősen mérgező, előfordulhat, hogy nem kell a szemben megvizsgálni. Bár nem feltétlenül van összefüggés az akut dermális toxicitás és a szemirritáció/szemkorrózió között, fel kell tételezni, hogy ha egy szer dermálisan alkalmazva erősen mérgező, a szembe cseppentve is erősen mérgező lesz. Az ilyen adatokat a 2. és a 3. lépés között is figyelembe lehet venni.
A vegyi anyag bőrkorróziós hatásának értékelése, ha ezt szabályozási célból is előírják (5. lépés).
Először a bőrkorróziós és a súlyos irritációs potenciált kell értékelni a B.4. vizsgálati módszernek (4) és az azt kísérő kiegészítésnek (8) megfelelően, melynek során ki kell térni többek között a validált és nemzetközileg elfogadott in vitro bőrkorróziós vizsgálati módszerek alkalmazására (9) (10) (11). Ha kimutatható, hogy a vegyi anyag bőrkorróziót vagy súlyos bőrirritációt okoz, szemkorróziós vagy súlyosan szemirritáló hatású vegyi anyagnak is tekinthető. Ezért további vizsgálatra nem lenne szükség. Ha a vegyi anyag nem bőrkorróziós vagy nem súlyosan bőrirritáló hatású, in vitro vagy ex vivo szemvizsgálatot kell végezni.
In vitro vagy ex vivo vizsgálatok eredményei (6. lépés).
Nem kell állatokon kísérletezni olyan vegyi anyagokkal, amelyek validált és kimondottan a szem vagy a bőr korróziójának/irritációjának értékelésére nemzetközileg elfogadott módszerekkel végzett in vitro vagy ex vivo vizsgálatokban (12) (13) korróziós vagy súlyos irritáló hatást mutattak. Feltételezhető, hogy az ilyen vegyi anyagok in vivo is hasonlóan súlyos hatásokat váltanak ki. Ha nem állnak rendelkezésre validált és elfogadott in vitro/ex vivo vizsgálatok, át kell ugrani a 6. lépést és közvetlenül a 7. lépésre kell áttérni.
Nyulakon végzett in vivo vizsgálat (7. és 8. lépés).
Az in vivo szemvizsgálatokat egyetlen állatot alkalmazó kiindulási vizsgálattal kell kezdeni. Ha ennek eredményei szerint a vegyi anyag súlyosan szemirritáló vagy szemkorróziós hatású, nem szabad további vizsgálatokat végezni. Ha a kiindulási vizsgálat nem mutat ki semmilyen korróziós vagy súlyosan irritáló hatást, két további állat alkalmazásával megerősítő vizsgálatot kell végezni. A megerősítő vizsgálat eredményeitől függően további vizsgálatokra lehet szükség. [lásd a B.5. vizsgálati módszert]
VONATKOZÓ VIZSGÁLATI ÉS KIÉRTÉKELÉSI STRATÉGIA SZEMIRRITÁCIÓ, ILLETVE SZEMKORRÓZIÓS HATÁS VIZSGÁLATÁHOZ
|
|
Tevékenység |
Eredmény |
Következtetés |
|
1 |
Szemre gyakorolt hatásokat kimutató, rendelkezésre álló humán és/vagy állatkísérleti adatok és/vagy validált és nemzetközileg elfogadott módszerek in vitro adatai |
Súlyos szemkárosodás |
Apikális végpont; szemkorróziós hatásúnak kell tekinteni. Nincs szükség vizsgálatokra. |
|
Szemirritáló hatású |
Apikális végpont; szemirritáló hatásúnak kell tekinteni. Nincs szükség vizsgálatokra. |
||
|
Nem szemkorróziós, illetve nem szemirritáló hatású |
Apikális végpont; nem szemkorróziós és nem szemirritáló hatásúnak kell tekinteni. Nincs szükség vizsgálatokra. |
||
|
Bőrkorróziós hatásokat kimutató, rendelkezésre álló humán és/vagy állatkísérleti adatok és/vagy validált és nemzetközileg elfogadott módszerek in vitro adatai |
Bőrkorróziós hatású |
Szemkorróziós hatást kell feltételezni. Nincs szükség vizsgálatokra. |
|
|
Súlyos bőrirritáló hatásokat kimutató, rendelkezésre álló humán és/vagy állatkísérleti adatok és/vagy validált és nemzetközileg elfogadott módszerek in vitro adatai |
Súlyosan bőrirritáló |
Szemirritáló hatást kell feltételezni. Nincs szükség vizsgálatokra. |
|
|
↓ |
|
|
|
|
nem áll rendelkezésre információ, illetve a rendelkezésre álló információk nem meggyőzőek |
|
|
|
|
↓ |
|
|
|
|
2 |
SAR-értékelést kell végezni a szemkorrózióra / szemirritációra vonatkozóan |
Súlyos szemkárosodást jelez előre |
Szemkorróziós hatást kell feltételezni. Nincs szükség vizsgálatokra. |
|
Szemirritációt jelez előre |
Szemirritáló hatást kell feltételezni. Nincs szükség vizsgálatokra. |
||
|
SAR-értékelést kell mérlegelni a bőrkorrózióra vonatkozóan |
Bőrkorróziót jelez előre |
Szemkorróziós hatást kell feltételezni. Nincs szükség vizsgálatokra. |
|
|
↓ |
|
|
|
|
Nem lehet előrejelzést tenni, vagy az előrejelzések nem meggyőzőek vagy negatívak |
|
|
|
|
↓ |
|
|
|
|
3 |
Meg kell mérni a pH-t (adott esetben figyelembe kell venni a pufferkapacitást is) |
pH ≤ 2 vagy ≥ 11,5 (nagy pufferkapacitással, amennyiben lényeges) |
Szemkorróziós hatást kell feltételezni. Nincs szükség vizsgálatokra. |
|
↓ |
|
|
|
|
2 < pH < 11,5, vagy pH ≤ 2,0 vagy pH ≥ 11,5 alacsony vagy nulla pufferkapacitással, amennyiben lényeges |
|
|
|
|
↓ |
|
|
|
|
4 |
Figyelembe kell venni a dermális alkalmazás esetén fellépő szisztémás toxicitásra vonatkozó adatokat |
Erősen mérgező olyan koncentrációknál, amelyeket a szemben vizsgálnának. |
A vegyi anyag túlzottan mérgező ahhoz, hogy vizsgálni lehessen. Nincs szükség vizsgálatokra. |
|
↓ |
|
|
|
|
Nem áll rendelkezésre ilyen információ, vagy a vegyi anyag nem erősen mérgező |
|
|
|
|
↓ |
|
|
|
|
5 |
A bőrkorróziós potenciál e melléklet B.4. fejezetében található vizsgálati stratégiának megfelelően, kísérleti úton történő értékelése, ha szabályozási célra is szükséges |
Korróziós hatás vagy súlyos irritációs hatás |
Szemkorróziós hatásúnak kell feltételezni. Nincs szükség további vizsgálatokra. |
|
↓ |
|
|
|
|
A vegyi anyag nem bőrkorróziós hatású vagy nem súlyosan bőrirritáló |
|
|
|
|
↓ |
|
|
|
|
6 |
Validált in vitro vagy ex vivo szemkorróziós vizsgálato(k) elvégzése |
Korróziós hatás vagy súlyos irritációs válasz |
Szemkorróziós hatásúnak vagy súlyosan szemirritálónak kell feltételezni, amennyiben az elvégzett vizsgálat alkalmazható a korróziós hatású, illetve súlyosan irritáló vegyi anyagok azonosítására, és amennyiben a vegyi anyag a vizsgálat alkalmazási körébe tartozik. Nincs szükség további vizsgálatokra. |
|
Irritációs hatás |
Szemirritálónak kell feltételezni, amennyiben az elvégzett vizsgálat(ok) alkalmazható(k) a korróziós hatású, a súlyosan irritáló és az irritáló vegyi anyagok megfelelő azonosítására, és amennyiben a vegyi anyag a vizsgálat(ok) alkalmazási körébe tartozik. Nincs szükség további vizsgálatokra. |
||
|
Nincs irritációs hatás |
Nem szemirritálónak kell feltételezni, amennyiben az elvégzett vizsgálat(ok) alkalmazható(k) a nem irritáló vegyi anyagok megfelelő azonosítására, e vegyi anyagoknak a szemirritáló, súlyosan szemirritáló vagy szemkorróziós hatású vegyi anyagoktól való megfelelő megkülönböztetésére, és amennyiben a vegyi anyag a vizsgálat(ok) alkalmazási körébe tartozik. Nincs szükség további vizsgálatokra. |
||
|
↓ |
|
|
|
|
A validált és elfogadott in vitro vagy ex vivo szemvizsgálat(ok) nem alkalmazható(k) következtetés levonására |
|
|
|
|
↓ |
|
|
|
|
7 |
Egyetlen nyúlon el kell végezni a kiindulási in vivo szemvizsgálatot. |
Súlyos szemkárosodás |
Szemkorróziós hatásúnak kell tekinteni. Nincs szükség további vizsgálatokra. |
|
↓ |
|
|
|
|
Nincs súlyos károsodás vagy nincs válaszreakció |
|
|
|
|
↓ |
|
|
|
|
8 |
Egy vagy két további állaton el kell végezni a megerősítő vizsgálatot. |
Korróziós vagy irritáló hatású |
Szemkorróziós vagy szemirritáló hatásúnak kell tekinteni. Nincs szükség további vizsgálatokra. |
|
Nem korróziós vagy irritáló hatású |
Nem szemkorróziós és nem szemirritáló hatásúnak kell tekinteni. Nincs szükség további vizsgálatokra. |
SZAKIRODALOM
(1) OECD (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22 – 24 January 1996 (http://www.oecd.org/ehs/test/background.htm).
(2) OECD (1998) Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www.oecd.org/ehs/Class/HCL6.htm).
(3) Worth, A.P. and Fentem J.H. (1999). A General Approach for Evaluating Stepwise Testing Strategies. ATLA 27, 161–177.
(4) E melléklet B.4., Akut bőrirritáció/bőrkorrózió című fejezete.
(5) Young, J.R., How, M.J., Walker, A.P., Worth W.M.H. (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicol. In Vitro, 2, 19 – 26.
(6) Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Edsail, D.J., Holzhutter, H.G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in vitro 12, pp. 483 – 524.
(7) Neun, D.J. (1993) Effects of Alkalinity on the Eye Irritation Potential of Solutions Prepared at a Single pH. J. Toxicol. Cut. Ocular Toxicol. 12, 227 – 231.
(8) E melléklet B.4. fejezetének kiegészítése: Lépcsőzetes vizsgálati stratégia bőrirritációhoz és bőrkorrózióhoz
(9) E melléklet B.40., In vitro bőrkorrózió: transzkután elektromos rezisztencia vizsgálat (TER) című fejezete.
(10) E melléklet B.40a., In vitro bőrkorrózió: Emberi bőrmodellen végzett vizsgálat című fejezete.
(11) OECD (2006), Test No. 435: In vitro Membrane Barrier Test Method for Skin corrosion, OECD Guidelines for the Testing of Chemicals, Section 4, OECD Paris.
(12) E melléklet B.47., Szarvasmarha-szaruhártya opacitásának és permeabilitásának mérésén alapuló vizsgálati módszer i. a súlyos szemkárosodást okozó vegyi anyagok és ii. a szemirritáció vagy a súlyos szemkárosodás tekintetében besorolást nem igénylő vegyi anyagok azonosítására című fejezete.
(13) E melléklet B.48., Izolált csirkeszem vizsgálatán alapuló vizsgálati módszer i. a súlyos szemkárosodást okozó vegyi anyagok és ii. a szemirritáció vagy a súlyos szemkárosodás tekintetében besorolást nem igénylő vegyi anyagok azonosítására című fejezete.”
(3) A B. részben a B.10. fejezet helyébe a következő szöveg lép:
„B.10. Kromoszóma-rendellenességek in vitro vizsgálata emlősökön
BEVEZETÉS
Ez a vizsgálati módszer egyenértékű az OECD 473. vizsgálati iránymutatásában (2016) leírt módszerrel. E vizsgálati módszer a genetikai toxikológiai vizsgálati módszerek sorozatának részét képezi. Kidolgozásra került egy, a genetikai toxikológiai vizsgálatokról tömör tájékoztatást nyújtó, a vizsgálati iránymutatások közelmúltbeli változásait áttekintő OECD-dokumentum (1).
A kromoszóma-rendellenességek in vitro vizsgálatának célja a tenyésztett emlősállatsejtekben szerkezeti kromoszóma-rendellenességeket okozó vegyi anyagok azonosítása (2) (3) (4). A szerkezeti rendellenességek kétféle típusúak lehetnek: kromoszóma vagy kromatid típusú rendellenességek. Poliploidia (többek között endoreduplikáció) felléphet a kromoszóma-rendellenességek in vitro vizsgálata során. Míg az aneugének kiválthatnak poliploidiát, a poliploidia önmagában nem jelez aneugén potenciált, egyszerűen sejtcikluszavarra vagy citotoxicitásra (5) utalhat. E vizsgálatnak nem az aneuploidia mérése a célja. Az aneuploidia kimutatására in vitro mikronukleusz-vizsgálat (6) lenne ajánlott.
A kromoszóma-rendellenesség in vitro vizsgálata során emberek vagy rágcsálók megállapodott sejtvonalaiból származó tenyészetek vagy primer sejtkultúrák alkalmazhatók. A felhasznált sejteket a tenyészetben való növekedési képesség, a kariotípus stabilitása (többek között a kromoszómaszám) és a kromoszóma-rendellenességek spontán gyakorisága alapján kell kiválasztani (7). A rendelkezésre álló adatok jelenleg nem teszik lehetővé határozott ajánlások megfogalmazását, azonban arra utalnak, hogy a kémiai veszélyek értékelése során fontos figyelembe venni a vizsgálat céljára kiválasztott sejtek p53 státuszát, genetikai (kariotípus-) stabilitását, DNS-reparációs képességét és eredetét (rágcsáló-, illetve emberi sejtek). E vizsgálati módszer alkalmazóinak tehát érdemes figyelembe venniük a sejtek szóban forgó és egyéb tulajdonságainak a sejtvonalak teljesítményére kifejtett hatását a kromoszóma-rendellenességek indukálásának kimutatása során, mivel a tudomány fejlődik ezen a területen.
A használt fogalmak meghatározását az 1. függelék tartalmazza.
KIINDULÁSI MEGFONTOLÁSOK ÉS KORLÁTOK
Az in vitro végrehajtott vizsgálatok rendszerint szükségessé teszik a metabolikus aktiválás valamilyen exogén forrásának használatát, kivéve, ha a sejtek metabolizálják a vizsgálati vegyi anyagokat. Az exogén metabolikus aktivációs rendszer nem utánozza teljes egészében az in vivo körülményeket. Ügyelni kell arra, hogy ne álljanak elő olyan körülmények, amelyek hamis pozitív eredményekhez – például nem a vizsgálati vegyi anyagok és a kromoszómák közvetlen kölcsönhatása okozta kromoszóma-károsodáshoz – vezethetnek; ilyen körülmény többek között a pH-érték vagy az ozmolalitás változása (8) (9) (10), a közeg összetevőivel való kölcsönhatás (11) (12) vagy a túlzott mértékű citotoxicitás (13) (14) (15) (16).
Ez a vizsgálati módszer azon kromoszóma-rendellenességek kimutatására használatos, amelyek klasztogén hatásokból fakadhatnak. A kromoszóma-rendellenességek indukálását metafázisban lévő sejtek segítségével kell elemezni. Így elengedhetetlen, hogy a sejtek a kezelt és a nem kezelt tenyészetekben is elérjék a mitózist. A mesterséges nanoanyagok esetében e vizsgálati módszer egyedi adaptálására lehet szükség, amelyet azonban ez a vizsgálati módszer nem ismertet.
A vizsgálati módszer tervezett szabályozási célt szolgáló adatgenerálás érdekében, keveréken történő alkalmazása előtt meg kell vizsgálni, hogy az megfelelő eredményeket biztosíthat-e erre a célra, és ha igen, miért. Ilyen megfontolások nem szükségesek, ha létezik a keverék vizsgálatára vonatkozó szabályozási követelmény.
A VIZSGÁLAT ELVE
Az emberből vagy más emlősből származó sejttenyészeteket exogén metabolikus aktiválási forrással vagy anélkül is kezelni kell a vizsgálati vegyi anyaggal, kivéve megfelelő metabolizáló képességű sejtek használata esetén (lásd a 13. pontot). A sejttenyészetek vizsgálati vegyi anyagnak való expozíciója megkezdését követően a sejteket megfelelő, előre meghatározott időközönként metafázis-blokkoló szerrel (például kolcemiddel vagy kolchicinnel) kell kezelni, majd az összegyűjtött, megfestett és metafázisban lévő sejteket mikroszkóp segítségével elemezni kell a kromatid típusú és kromoszóma típusú rendellenesség vizsgálata érdekében.
A MÓDSZER LEÍRÁSA
Előkészületek
Sejtek
Különféle sejtvonalak (például kínaihörcsög-petefészek CHO), kínaihörcsögtüdő V79-es sejtvonal, kínaihörcsögtüdő (CHL)/IU, TK6-os sejtvonal) vagy primer sejtkultúrák, többek között ember vagy más emlős perifériás limfocitái használhatók (7). A használt sejtvonalaknak tudományosan indokoltnak kell lenniük. Primer sejtek használatakor állatjóléti okok miatt meg kell fontolni emberi eredetű primer sejtek használatát – amennyiben megvalósítható –, és azokból a humán etikai elveknek és a vonatkozó szabályozásoknak megfelelően kell mintát venni. Az emberi perifériás limfocitákat olyan fiatal (kb. 18–35 éves), nem dohányzó egyénektől kell venni, akik ismert betegséggel nem rendelkeznek, illetve a közelmúltban genotoxikus szereknek (például vegyi anyagoknak, ionizáló sugárzásnak) nem voltak kitéve olyan mértékben, amely fokozná a kromoszóma-rendellenességek háttérbeli előfordulását. Ez biztosítaná, hogy a kromoszóma-rendellenességek háttérbeli előfordulása alacsony és egységes legyen. A kromoszóma-rendellenességek alapesetbeli előfordulása az életkor előrehaladtával nő, és ez a tendencia a nőknél jellemzőbb, mint a férfiaknál (17) (18). Amennyiben több donortól származó sejteket együtt használnak fel, akkor a donorok számát meg kell adni. Igazolni kell, hogy a sejtek a vizsgálati vegyi anyaggal való kezelés kezdetétől a sejtekből történő mintavételig osztódtak. A sejttenyészeteket exponenciális sejtnövekedési fázisban (sejtvonalakban) kell tartani vagy osztódásra kell késztetni (primer limfocita-tenyészetek) a sejteknek a sejtciklus különböző szakaszaiban történő expozíciója érdekében, mivel a sejtfázisoknak a vizsgálati vegyi anyagokra való érzékenysége nem feltétlenül lehet ismert. Azok a primer sejtek, amelyeket az osztódás érdekében mitogén szerekkel kell stimulálni, a vizsgálati vegyi anyagnak való expozíció során általában már nem szinkronizáltak (például az emberi limfociták 48 órás mitogén stimulációt követően). Szinkronizált sejtek használata nem javasolt a kezelés során, indokolt esetben azonban elfogadható.
Tenyészközegek és tenyésztési körülmények
A tenyészetek fenntartására megfelelő tenyészközeget és inkubációs feltételeket (tenyésztőedények, megfelelő esetben 5 %-os CO2-koncentrációjú párás légkör, 37 °C-os inkubációs hőmérséklet) kell alkalmazni. A sejtvonalakat rutinszerűen ellenőrizni kell a modális kromoszómaszám stabilitása és a mikoplazma-fertőzés hiánya szempontjából (7) (19), és a sejtek nem használhatók fel, ha fertőzöttek, vagy ha a modális kromoszómaszám megváltozott. A vizsgálólaboratóriumban használt sejtvonalak, illetve primer sejtkultúrák rendes sejtciklusidejét meg kell állapítani, és annak összhangban kell lennie a közzétett sejtjellemzőkkel (20).
A tenyészetek előkészítése
Sejtvonalak: a sejteket törzstenyészetekből fel kell szaporítani, majd tenyészközegbe kell leoltani olyan sejtszámmal, hogy a sejtek a szuszpenziókban vagy a monolayer tenyészetekben továbbra is exponenciálisan növekedjenek a begyűjtés idejéig (a monolayer tenyészetekben növő sejtek esetében például kerülendő a konfluencia).
Limfociták: alvadásgátlóval (például heparinnal) kezelt teljes vért vagy szeparált limfocitákat kell tenyészteni (például emberi limfociták esetében 48 óráig) mitogén szer [emberi limfociták esetében például phytohaemagglutinin (PHA)] jelenlétében, annak érdekében, hogy a vizsgálati vegyi anyagnak való expozíció előtt sejtosztódást váltsanak ki.
Metabolikus aktiválás
A nem megfelelő endogén metabolikus képességű sejtek használata esetén exogén metabolikus aktivációs rendszereket kell alkalmazni. Amennyiben az ettől való eltérés nem indokolt, az alapértelmezetten ajánlott, legáltalánosabban használt rendszer a rágcsálók (általában patkányok) enziminduktorral (ilyen például az Aroclor 1254 (21) (22) (23) vagy fenobarbitál és ß-naftoflavon kombinációjával (24) (25) (26) (27) (28) (29)) kezelt májából preparált, kofaktor-kiegészítésű posztmitokondriális frakció (S9). Ez utóbbi kombináció nem ütközik a környezetben tartósan megmaradó szerves szennyező anyagokról szóló stockholmi egyezménnyel (30), és kiderült róla, hogy olyan hatékony, mint az Aroclor 1254 a vegyes funkciójú oxidáz indukálásához (24) (25) (26) (28). Az S9 frakció jellemzően 1–2 térfogatszázalék koncentrációban használatos, de a végső vizsgálati közegben 10 térfogatszázalékra növelhető. A mitotikus indexet csökkentő termékek, különösen a kalcium-komplexáló termékek (31) használata kerülendő a kezelés során. Az alkalmazott exogén metabolikus aktivációs rendszer vagy metabolikus induktor típusának és koncentrációjának megválasztását befolyásolhatja a vizsgált anyagok osztálya.
A vizsgálati vegyi anyag előkészítése
A szilárd halmazállapotú vizsgálati vegyi anyagokat a sejtek kezelése előtt megfelelő oldószerben elő kell készíteni, és szükség esetén hígítani kell (lásd a 23. pontot). A folyékony halmazállapotú vizsgálati vegyi anyagok közvetlenül hozzáadhatók a vizsgálati rendszerhez és/vagy hígíthatók a vizsgálati rendszer kezelése előtt. A gáz halmazállapotú vagy illékony vizsgálati vegyi anyagokat a standard protokollok megfelelő módosításával, például légmentesen lezárt tenyésztőedényekben történő kezeléssel kell vizsgálni (32) (33) (34). A vizsgálati vegyi anyagot tartalmazó készítményeket pontosan a kezelés előtt kell előállítani, kivéve, ha a stabilitásra vonatkozó adatok a tárolás elfogadhatóságát bizonyítják.
Vizsgálati körülmények
Oldószerek
Az oldószert oly módon kell kiválasztani, hogy optimalizálja a vegyi anyag oldhatóságát, ugyanakkor ne befolyásolja hátrányosan a vizsgálat lebonyolítását, vagyis ne változtassa meg a sejtek növekedését, ne érintse a vizsgálati vegyi anyag integritását, ne lépjen reakcióba a tenyésztőedényekkel, és ne károsítsa a metabolikus aktivációs rendszert. Amennyiben lehetséges, először valamilyen vizes oldószer (vagy tenyészközeg) használatát érdemes megfontolni. Jól bevált oldószer például a víz vagy a dimetil-szulfoxid. A végleges kezelési közegben a szerves oldószerek általában nem haladhatják meg az 1 térfogatszázalékot, a vizes oldószerek (sós lé vagy víz) pedig a 10 térfogatszázalékot. Ha nem jól bevált szerves oldószereket (például etanolt vagy acetont) használnak, a használatukat a vizsgálati vegyi anyaggal és a vizsgálati rendszerrel való összeegyeztethetőségükre utaló, valamint azt jelző adatokkal kell alátámasztani, hogy a használt koncentrációnál nem genotoxikusak. Alátámasztó adatok hiányában fontos nem kezelt kontrollok (lásd az 1. függeléket) alkalmazása annak bizonyítására, hogy a kiválasztott oldószer nem vált ki ártalmas vagy klasztogén hatást.
A sejtproliferáció és a citotoxicitás mérése, valamint a kezelési koncentrációk kiválasztása
A vizsgálati vegyi anyag legmagasabb koncentrációjának meghatározása során kerülendő az olyan koncentráció, amely hamis pozitív válaszreakciókat válthat ki, ilyen a túlzott citotoxicitást okozó koncentráció (lásd a 22. pontot), a tenyésztőközegben való kicsapódást okozó koncentráció (lásd a 23. pontot), illetve a pH vagy az ozmolalitás jelentős változását okozó koncentráció (lásd az 5. pontot). Ha a vizsgálati vegyi anyag a hozzáadásakor jelentős változást okoz a tenyészközeg pH-jában, a pH a kezelésre szolgáló végleges tenyészközeg pufferelésével kiigazítható, hogy elkerülhetők legyenek a hamis pozitív eredmények és megfelelő tenyésztési feltételeket lehessen fenntartani.
Mérni kell a sejtproliferációt annak biztosítása érdekében, hogy a vizsgálat során elegendő számú kezelt sejt elérje a mitózist, és hogy a kezelésekre megfelelő szintű citotoxicitás mellett kerüljön sor (lásd a 18. és a 22. pontot). A citotoxicitást a fő kísérletben metabolikus aktiválással és anélkül is meg kell határozni a sejtelhalás és a sejtnövekedés megfelelő mutatóinak használatával. Bár egy kiindulási vizsgálat során hasznos lehet a citotoxicitás értékelése a fő kísérletben alkalmazandó koncentrációk jobb meghatározásához, a kiindulási vizsgálat nem kötelező. Végrehajtása esetén nem helyettesítheti a citotoxicitás fő kísérlet során történő mérését.
A relatív populációduplázódás (RPD) vagy a sejtszám relatív növekedése (RICC) megfelelő módszer a citotoxicitás citogenetikai vizsgálatok során történő értékelésére (13) (15) (35) (36) (55) (a képletekért lásd a 2. függeléket). Hosszú távú kezelés és a kezelés kezdetétől számított 1,5 normál sejtciklusidőn túli mintavétel esetén (azaz összesen 3 sejtciklusidőnél hosszabb idő elteltével) az RPD alulbecsülheti a citotoxicitást (37). Ilyen körülmények között az RICC jobb mértékegység lehet, illetve a citotoxicitás 1,5 normál sejtciklusidő utáni, RPD alkalmazásával történő értékelése hasznos becslést ad.
Ami a primer sejtkultúrákban lévő limfocitákat illeti, bár a mitotikus index (MI) a citotoxikus /citosztatikus hatások mérésére szolgál, azt befolyásolja, hogy a kezelés után mikor mérik, továbbá a használt mitogén és a sejtciklus esetleges megszakadása. Az MI azonban azért elfogadható, mert a citotoxicitás egyéb mérése nehézkes és kivitelezhetetlen lehet, és nem feltétlenül vonatkozik a PHA-stimulációra válaszreakcióként szaporodó limfociták célpopulációjára.
Bár a sejtvonalak esetében az RPD és az RICC, valamint a primer limfocita-tenyészet esetében az MI az ajánlott citotoxicitási paraméter, más mutatók (például a sejtintegritás, az apoptózis, a nekrózis, a sejtciklus) további hasznos információval szolgálhatnak.
Az elfogadhatósági kritériumokat (megfelelő citotoxicitás, sejtszám stb.) teljesítő, (az oldószeres és a pozitív kontrollokat nem tartalmazó) legalább három vizsgálati koncentrációt kell értékelni. A sejtek típusától (limfocita-sejtvonalak vagy primer limfocita-tenyészetek) függetlenül, minden egyes vizsgált koncentrációnál párhuzamos vagy szimpla kezelt tenyészetek használhatók. Bár két párhuzamos tenyészet használata ajánlatos, a szimpla tenyészetek is elfogadhatóak, amennyiben a szimpla vagy a párhuzamos tenyészetek esetében megegyezik az összességében értékelt sejtek száma. A szimpla tenyészetek használata különösen releváns, ha több mint három koncentráció értékelésére kerül sor (lásd a 31. pontot). A független párhuzamos tenyészetekben adott koncentráció mellett kapott eredmények összevonhatók az adatelemzéshez (38). Az alacsony citotoxicitást vagy a citotoxicitás hiányát mutató vizsgálati vegyi anyagok esetében rendszerint megközelítőleg kétszeres-háromszoros koncentrációs intervallumok helyénvalóak. Citotoxicitás fellépése esetén a vizsgálati koncentrációknak le kell fedniük a 22. pontban ismertetett, citotoxicitást okozó koncentrációtól azokig a koncentrációkig terjedő tartományt, ahol mérsékelt vagy alacsony a citotoxicitás, illetve nem jelentkezik citotoxicitás. Számos vizsgálati vegyi anyagnak meredek a koncentráció-válasz görbéje, és annak érdekében, hogy alacsony és mérsékelt citotoxicitásnál adatokat lehessen nyerni, vagy részletesen meg lehessen vizsgálni a dózis-válasz összefüggést, egymáshoz közelebbi koncentrációkat és/vagy háromnál több koncentrációt (szimpla tenyészeteket vagy párhuzamos tenyészeteket) kell használni, különösen olyan helyzetekben, ahol megismételt kísérlet szükséges (lásd a 47. pontot).
Ha a legmagasabb koncentráció a citotoxicitáson alapul, a legmagasabb koncentrációval 55 ± 5 %-os citotoxicitást kell megcélozni a citotoxicitás ajánlott paramétereinek alkalmazásával (azaz a sejtvonalak RICC és RPD mutatójának, illetve a primer limfocita-tenyészetek esetében az MI mutatónak a párhuzamos negatív kontroll 45 ± 5 %-ára csökkenésével). Az 55 ± 5 %-os citotoxicitási tartománynak csak a magasabb részén megtalálható pozitív eredmények értelmezése során körültekintően kell eljárni (13).
A legalacsonyabb oldhatatlan koncentrációnál alacsonyabb koncentrációk mellett nem citotoxikus, kevéssé oldható vegyi anyagok esetében a legmagasabb analizált koncentrációnak a vizsgálati vegyi anyaggal történő kezelés végén szemmel vagy inverz mikroszkóp segítségével látható zavarosságot vagy kicsapódást kell okoznia. Még abban az esetben is, ha citotoxicitás a legalacsonyabb oldhatatlan koncentráció felett jön létre, ajánlatos egyetlen egy, zavarosságot vagy látható kicsapódást okozó koncentrációt vizsgálni, mivel a kicsapódás fals hatásokat eredményezhet. A kicsapódást okozó koncentrációnál ügyelni kell annak biztosítására, hogy a kicsapódás ne zavarja a vizsgálat lebonyolítását (például a megfestést vagy az értékelést). Hasznos lehet a tenyészközegben való oldhatóság meghatározása a kísérlet előtt.
Ha nem figyelhető meg kicsapódás vagy korlátozó citotoxicitás, a legmagasabb vizsgálati koncentrációnak 10 mM-nek, 2 mg/ml-nek vagy 2 μl/ml-nek kell megfelelnie, melyek közül a legalacsonyabb a mérvadó (39) (40) (41). Ha a vizsgálati vegyi anyag nem meghatározott összetételű, például ismeretlen szerkezetű vagy változó összetételű, összetett reakcióban keletkezett vagy biológiai eredetű anyag (UVCB) (42), környezeti extraktum stb., előfordulhat, hogy kellő citotoxicitás hiányában a legmagasabb koncentrációnak magasabbnak (például 5 mg/ml-nek) kell lennie ahhoz, hogy növekedjen az egyes összetevők koncentrációja. Megjegyzendő azonban, hogy ezek a követelmények eltérőek lehetnek a humán gyógyszerek esetében (43).
Kontrollok
Minden begyűjtés alkalmával párhuzamos negatív kontrollokat kell használni (lásd a 15. pontot), amelyeknél csak oldószert alkalmaznak a kezelt közegben, és a kezelésük ugyanolyan módon történik, mint a kezelt tenyészeteké.
Párhuzamos pozitív kontrollok szükségesek annak igazolására, hogy a laboratórium képes az alkalmazott vizsgálati protokoll feltételei mellett klasztogének azonosítására, valamint adott esetben az exogén metabolikus aktivációs rendszer eredményességének igazolása érdekében. Pozitív kontrollokra vonatkozó példák az alábbi 1. táblázatban találhatók. Indokolt esetben pozitív kontrollként alternatív vegyi anyagok használhatók. Mivel az emlőssejtek genetikai toxicitás szempontjából végzett in vitro vizsgálatai kellően szabványosítottak, a pozitív kontrollok használata a metabolikus aktiválást igénylő klasztogénekre korlátozódhat. Amennyiben erre a nem aktivált vizsgálattal egyidejűleg, azonos időtartamú kezelés mellett kerül sor, ezen egyetlen pozitív kontroll válaszreakciója a metabolikus aktivációs rendszer aktivitását és a vizsgálati rendszer reagálóképességét is bizonyítani fogja. A(z S9 nélküli) hosszú távú kezelésnek azonban kell, hogy legyen saját pozitív kontrollja, mivel a kezelés időtartama eltér a metabolikus aktiválás alkalmazása mellett végzett vizsgálatétól. Mindegyik pozitív kontrollt egy vagy több olyan koncentrációban kell alkalmazni, amely a háttérértékekben reprodukálható és kimutatható növekedést okoz, hogy bizonyítani lehessen a vizsgálati rendszer érzékenységét (azaz a hatások egyértelműek, de az értékelést végző személy nem tudja beazonosítani azonnal a kódolt tárgylemezt), és a választ nem veszélyeztetheti a vizsgálati módszerben meghatározott határértékeket meghaladó citotoxicitás.
1. táblázat
A laboratóriumok jártasságának értékeléséhez és a pozitív kontrollok kiválasztásához ajánlott referenciaanyagok.
|
Kategória |
Vegyi anyag |
CASRN |
|
1. Metabolikus aktiválás nélkül is aktív klasztogének |
||
|
|
Metil-metánszulfonát |
66-27-3 |
|
|
Mitomicin-C |
50-07-7 |
|
|
4-Nitro-kinolin-N-oxid |
56-57-5 |
|
|
Citozin-arabinozid |
147-94-4 |
|
2. Metabolikus aktiválást igénylő klasztogének |
||
|
|
Benzo(a)pirén |
50-32-8 |
|
|
Ciklofoszfamid |
50-18-0 |
ELJÁRÁS
Kezelés a vizsgálati vegyi anyaggal
A proliferáló sejteket metabolikus aktivációs rendszer jelenlétében és hiányában kezelik a vizsgálati vegyi anyaggal.
Tenyészetbegyűjtési idő
A negatív eredmény megállapításához szükséges alapos értékeléshez mindhárom alábbi kísérleti körülményt meg kell teremteni, metabolikus aktiválással és anélkül végzett rövid távú kezeléssel, valamint metabolikus aktiválás nélküli hosszú távú kezeléssel (lásd a 43., 44. és 45. pontot):
— a sejteket metabolikus aktiválás nélkül 3–6 órára ki kell tenni a vizsgálati vegyi anyag hatásának, és azokból a kezelés megkezdése után kb. 1,5 normál sejtciklusidőnek megfelelő időpontban mintát kell venni (18),
— a sejteket metabolikus aktiválással 3–6 órára ki kell tenni a vizsgálati vegyi anyag hatásának, és azokból a kezelés megkezdése után kb. 1,5 normál sejtciklusidőnek megfelelő időpontban mintát kell venni (18),
— a sejteket a kezelés megkezdése után kb. 1,5 normál sejtciklusidőnek megfelelő időpontban történő mintavételig metabolikus aktiválás nélkül folyamatosan ki kell tenni a vizsgálati vegyi anyagnak. Előfordulhat, hogy bizonyos vegyi anyagok (például a nukleozidanalógok) könnyebben észlelhetők 1,5 normál sejtciklusidőnél hosszabb kezelési/mintavételi idő alkalmazása esetén (24).
Abban az esetben, ha a fenti kísérleti körülmények pozitív válaszreakciót eredményeznek, a többi kezelési eljárás vizsgálata nem feltétlenül szükséges.
Kromoszómapreparálás
A sejttenyészeteket a begyűjtésük előtt rendszerint 1–3 órán át kolcemiddel vagy kolchicinnel kell kezelni. Minden sejttenyészetet külön kell begyűjteni és feldolgozni a kromoszómapreparátumok készítéséhez. A kromoszómapreparátumok készítése a sejtek hipotóniás kezelését, fixálását és megfestését foglalja magában. A monolayer tenyészetekben a 3–6 órás kezelés végén mitotikus sejtek (ismertetőjegyük, hogy alakjuk kerek, és leválnak a felszínről) lehetnek jelen. Mivel ezek a mitotikus sejtek könnyen leválnak, a vizsgálati vegyi anyagot tartalmazó közeg eltávolításakor elveszhetnek. Ha bizonyíték van arra, hogy a mitotikus sejtek száma a kontrollokéhoz képest jelentősen megnő, valószínűsíthető mitotikus leállást jelezve, a sejteket centrifugálással be kell gyűjteni és vissza kell tenni a tenyészetekbe, annak elkerülése érdekében, hogy a begyűjtéskor elvesszenek a mitózisban lévő sejtek, valamint azok a sejtek, amelyeknél kromoszóma-rendellenesség kockázata áll fenn.
Elemzés
A kromoszóma-rendellenességek vizsgálatára irányuló mikroszkópos elemzés előtt minden tárgylemezt, a pozitív és negatív kontrollokét is ideértve, önálló kódolással kell ellátni. Mivel gyakori, hogy a fixálási eljárások bizonyos arányban olyan metafázisban lévő sejteket eredményeznek, amelyek kromoszómkat veszítettek, ezért az értékelt sejteknek a modális kromoszómaszám ± 2-vel egyenlő számú centromérát kell tartalmazniuk.
Koncentrációnként legalább 300, jól szétterült metafázist kell értékelni és ellenőrizni annak megállapításához, hogy valamely vizsgálati vegyo anyag egyértelműen negatív (lásd a 45. pontot). Párhuzamos tenyészetek használata esetén a 300 sejtet egyenlő mértékben kell elosztani a párhuzamosok között. Koncentrációnként egy tenyészet alkalmazása esetén (lásd a 21. pontot) legalább 300, jól szétterült metafázist kell értékelni ebben az egy tenyészetben. 300 sejt értékelésének az az előnye, hogy fokozza a vizsgálat statisztikai erejét, és ráadásul a nulla értékek megfigyelése ritkán (várhatóan mindössze 5 %-os gyakorisággal) fog előfordulni (44). Az értékelt metafázisok száma csökkenthető, ha sok kromoszóma-rendellenességgel rendelkező sejt figyelhető meg és a vizsgálati vegyi anyag egyértelműen pozitívnak minősül.
Az egy vagy több szerkezeti kromoszóma-rendellenességgel rendelkező sejteket a gapek figyelembevételével és figyelmen kívül hagyásával is értékelni kell. A törések és a gapek (45), (46) irodalom szerinti fogalommeghatározása az 1. függelékben található. A kromatid és a kromoszóma típusú rendellenességeket külön-külön kell feljegyezni és altípusonként (törések, kicserélődések) kell besorolni. A laboratóriumban alkalmazott eljárásoknak biztosítaniuk kell, hogy a kromoszóma-rendellenességeket jól képzett értékelők elemezzék, és adott esetben szakértők értékeljék.
Bár a vizsgálat célja a szerkezeti kromoszóma-rendellenességek kimutatása, fontos a poliploidia és az endoreduplikáció gyakoriságának feljegyzése, amennyiben ezek láthatók (lásd a (2) pontot).
A laboratórium jártassága
A laboratóriumoknak a vizsgálat rutinszerű alkalmazása előtti elegendő tapasztalat igazolása érdekében kísérletsorozatot kell végrehajtaniuk referenciaként szolgáló, más-más mechanizmusú pozitív vegyi anyagokkal, továbbá (különböző oldószerek/vivőanyagok segítségével) különféle negatív kontrollokkal. E pozitív és negatív kontrollok válaszreakcióinak összhangban kell lenniük a szakirodalommal. Ez nem vonatkozik azokra a laboratóriumokra, amelyek tapasztalattal rendelkeznek, azaz amelyeknek a rendelkezésére áll a 37. pontban meghatározott történeti adatbázis.
A pozitív kontrollként szolgáló, kiválasztott vegyi anyagokat (lásd a 26. pont 1. táblázatát) metabolikus aktiválás nélkül végzett rövid és hosszú kezeléssel, továbbá metabolikus aktiválás jelenlétében végzett rövid kezeléssel is meg kell vizsgálni a laboratórium klasztogén hatású vegyi anyagok kimutatásában, valamint a metabolikus aktiváló rendszer eredményességének meghatározásában való jártasságának bizonyítása érdekében. A vizsgálati rendszer érzékenységének és dinamikus tartományának bizonyítása érdekében a kiválasztott vegyi anyagok koncentrációtartományát úgy kell megválasztani, hogy reprodukálható és koncentrációval összefüggő növekedést biztosítson a háttérértékekhez viszonyítva.
Történeti kontrolladatok
A laboratóriumnak meg kell állapítania a következőket:
— a pozitív kontrollok történeti tartománya és eloszlása,
— a negatív (nem kezelt, oldószeres) kontrollok történeti tartománya és eloszlása.
A negatív kontrollok történeti eloszlásához kapcsolódó első adatgyűjtés során a párhuzamos negatív kontrolloknak összhangban kell lenniük a kontrollokra vonatkozóan közzétett adatokkal, amennyiben léteznek. Amint több kísérleti adat adódik a kontrollok eloszlásához, a párhuzamos negatív kontrolloknak ideális esetben az eloszlás 95 %-os ellenőrzési határértékén belül kell lenniük (44) (47). A laboratórium negatív kontrollokat tartalmazó történeti adatbázisát első lépésként legalább 10 kísérlettel kell kiépíteni, de az adatbázisnak lehetőség szerint legalább 20, összehasonlítható kísérleti körülmények között végzett kísérletet kell tartalmaznia. A laboratóriumoknak minőségellenőrzési módszereket, például ellenőrzési diagramokat (C-diagramokat vagy X-bar diagramokat (48)) kell alkalmazniuk annak meghatározására, hogy a pozitív és a negatív kontrollokra vonatkozó adataik mennyire változóak, valamint annak bizonyítására, hogy náluk a módszertan »ellenőrzés alatt« áll (44). A történeti adatok összeállításának és felhasználásának módjára (azaz az adatok történeti adatokhoz számításának és azok közül való kizárásának kritériumaira, valamint egy adott kísérlet elfogadhatósági kritériumaira) vonatkozó további ajánlások megtalálhatók a szakirodalomban (47).
A kísérleti protokoll bármely módosítását meg kell vizsgálni abból a szempontból, hogy összhangban van-e a laboratórium meglévő történeti kontrolladatbázisaival. Jelentősebb következetlenségek fennállása esetén új történeti kontrolladatbázist kell létrehozni.
A negatív kontrollokra vonatkozó adatok az egy tenyészetből vagy párhuzamos tenyészetek összességéből származó, kromoszóma-rendellenességekkel rendelkező sejtek előfordulását mutatják, ahogyan az a 21. pontban szerepel. A párhuzamos negatív kontrolloknak ideális esetben a laboratórium negatív kontrollokat tartalmazó történeti adatbázisa szerinti eloszlás 95 %-os ellenőrzési határértékén belül kell lenniük (44) (47). Amennyiben a párhuzamos negatív kontrollokra vonatkozó adatok a 95 %-os ellenőrzési határértéken kívül esnek, akkor számíthatók be a kontrollok történeti eloszlásába, amennyiben ezek az adatok nem szélsőségesen kiugró értékek, továbbá bizonyíték van arra, hogy a vizsgálati rendszer »ellenőrzés alatt áll« (lásd a 37. pontot), valamint arra, hogy nem áll fenn szakmai vagy emberi mulasztás.
ADATOK ÉS JEGYZŐKÖNYVEZÉS
Az eredmények ismertetése
Az egy vagy több szerkezeti kromoszóma-rendellenességgel rendelkező sejtek százalékos arányát értékelni kell. Az altípusonként (törések, kicserélődések) besorolt, kromatid és kromoszóma típusú rendellenességeket külön-külön kell felsorolni, megadva a számukat és a gyakoriságukat a kísérleti és a kontrolltenyészetek esetében. A gapeket külön-külön kell feljegyezni és jelenteni, de azokat nem kell beleszámolni a rendellenességek összgyakoriságba. A poliploidia és/vagy az endoreduplikált sejtek százalékos arányát észlelés esetén a jelentésbe kell foglalni.
A citotoxicitás egyidejű mérését a rendellenességek megállapítására irányuló fő kísérlet(ek)ben minden kezelt, negatív és pozitív kontrolltenyészet esetében fel kell jegyezni.
Az egyes tenyészetekhez tartozó adatokat meg kell adni. Ezenkívül minden adatot táblázat formájában kell összefoglalni.
Elfogadhatósági kritériumok
Egy-egy vizsgálat elfogadása az alábbi kritériumokon alapul:
— A párhuzamos negatív kontroll a 39. pont szerint belefoglalható a laboratórium negatív kontrollokat tartalmazó történeti adatbázisába.
— A párhuzamos pozitív kontrolloknak (lásd a 26. pontot) a pozitív kontrollokat tartalmazó történeti adatbázisban generált válaszokkal összeegyeztethető válaszokat, valamint a párhuzamos negatív kontrollhoz viszonyítva statisztikailag szignifikáns növekedést kell előidézniük.
— Az oldószeres kontrollban teljesülniük kell a sejtproliferáció kritériumainak (17. és 18. pont).
— Mindhárom kísérleti körülmény vizsgálatára sor került, kivéve, ha az egyik pozitív eredményeket hozott (lásd a 28. pontot).
— Megfelelő számú sejt és koncentráció elemezhető (31. és 21. pont).
— A legmagasabb koncentráció kiválasztására vonatkozó kritériumok összhangban vannak a 22., 23. és 24. pontban ismertetett legmagasabb koncentrációkkal.
Az eredmények értékelése és értelmezése
Amennyiben valamennyi elfogadhatósági kritérium teljesül, a vizsgálati vegyi anyag egyértelműen pozitívnak minősül, ha a vizsgált kísérleti körülmények bármelyikében (lásd a 28. pontot):
a) legalább az egyik vizsgálati koncentráció statisztikailag szignifikáns növekedést mutat a párhuzamos negatív kontrollhoz viszonyítva,
b) a megfelelő trendpróbával történő értékelés arra utal, hogy a növekedés a dózissal összefügg,
c) az eredmények bármelyike a történeti negatív kontrolladatok eloszlásán (például Poisson-eloszlású 95 %-os ellenőrzési határértékeken; lásd a 39. pontot) kívül esik.
Mindezen kritériumok teljesülése esetén úgy tekintendő, hogy a vizsgálati vegyi anyag ebben a vizsgálati rendszerben kromoszóma-rendellenességeket képes előidézni a tenyésztett emlőssejtekben. A legmegfelelőbb statisztikai módszerekre vonatkozó ajánlások megtalálhatók a szakirodalomban (49) (50) (51).
Amennyiben valamennyi elfogadhatósági kritérium teljesül, a vizsgálati vegyi anyag egyértelműen negatívnak minősül, ha valamennyi vizsgált kísérleti körülmény mellett (lásd a 28. pontot):
a) a vizsgálati koncentrációk egyike sem mutat statisztikailag szignifikáns növekedést a párhuzamos negatív kontrollhoz viszonyítva,
b) a megfelelő trendpróbával végzett értékelés nem mutat koncentrációval összefüggő növekedést,
c) valamennyi eredmény a történeti negatív kontrolladatok eloszlásán (például Poisson-eloszlású 95 %-os ellenőrzési határértékeken; lásd a 39. pontot) belül van.
Ezt követően úgy tekintendő, hogy a vizsgálati vegyi anyag ebben a vizsgálati rendszerben nem képes kromoszóma-rendellenességeket előidézni a tenyésztett emlőssejtekben.
Az egyértelműen pozitív vagy negatív válasz igazolása nem követelmény.
Amennyiben a reakció nem egyértelműen negatív és nem is egyértelműen pozitív, ahogyan az a fentiekben szerepel, illetve egy adott eredmény biológiai relevanciája megállapításának segítése érdekében az adatokat szakértői véleménnyel és/vagy további vizsgálatokkal kell értékelni. Hasznos lehet további sejtek értékelése (adott esetben) vagy – megismételt kísérlet lehetőleg módosított kísérleti körülmények (például a koncentrációk távolsága, más (S9-es koncentráció vagy S9 eredetű) metabolikus aktiválási feltételek) melletti – elvégzése.
Ritka esetekben, még további vizsgálatok után is, az adatkészlet eleve kizárja a pozitív vagy negatív eredményekre vonatkozó következtetést, és ezért az lesz a következtetés, hogy a vizsgálati vegyi anyagra adott reakció kétértelmű.
A poliploid sejtek számának növekedése azt jelezheti, hogy a vizsgálati vegyi anyag potenciálisan gátolhatja a mitotikus folyamatokat és számszerű kromoszóma-rendellenességet idézhet elő (52). Az endoreduplikált kromoszómákkal rendelkező sejtek számának növekedése azt jelezheti, hogy a vizsgálati vegyi anyag potenciálisan gátolhatja a sejtciklus végbemenetelét (53) (54) (lásd a 2. pontot). Ezért a poliploid sejtek és az endoreduplikált kromoszómákkal rendelkező sejtek előfordulását külön-külön kell feljegyezni.
Vizsgálati jegyzőkönyv
A Vizsgálati jegyzőkönyvnek a következőket kell tartalmaznia:
Vizsgálati vegyi anyag:
— eredet, tételszám, felhasználási határidő, ha rendelkezésre áll;
— a vizsgálati vegyi anyag stabilitása, ha ismert;
— a vizsgálati vegyi anyag oldhatósága és stabilitása az oldószerben, ha ismert;
— adott esetben a pH-érték, az ozmolalitás és a kicsapódás mérése abban a tenyészközegben, amelyhez a vizsgálati vegyi anyagot hozzáadták.
Egy összetevőből álló anyag:
— fizikai megjelenés, vízoldékonyság és a további releváns fizikai-kémiai tulajdonságok;
— kémiai azonosítás, például IUPAC- vagy CAS-név, CAS-szám, SMILES- vagy InChI-kód, szerkezeti képlet, tisztaság, adott esetben és amennyiben a gyakorlatban megvalósítható, a szennyeződések kémiai azonossága stb.
Több összetevőből álló anyag, UVCB-k és keverékek:
— amennyiben lehetséges, az összetevők kémiai azonosítója (lásd fent), mennyiségi előfordulása és releváns fizikai-kémiai tulajdonságai jellemzik.
Oldószer:
— az oldószer kiválasztásának indoklása;
— az oldószernek a végleges tenyészközegen belüli aránya szintén feltüntetendő.
Sejtek:
— a sejtek típusa és eredete;
— a felhasznált sejttípus kariotípus jellemzői és alkalmassága;
— sejtvonalak esetében a mikoplazma hiánya;
— sejtvonalak esetében a sejtciklus hosszúságára, a megkettőződési időre vagy a proliferációs indexre vonatkozó információk;
— a vérdonorok ivara, életkora, valamint a donorra, a teljes vérre vagy az elkülönített limfocitákra, a használt mitogénre vonatkozó bármely releváns információ;
— sejtvonalak esetében a passzálások száma, ha rendelkezésre áll;
— sejtvonalak esetében a sejttenyészetek fenntartásának módszerei;
— sejtvonalak esetében a modális kromoszómaszám.
Vizsgálati körülmények:
— a metafázis-blokkoló vegyi anyag megnevezése, koncentrációja és a sejtek expozíciójának időtartama;
— a vizsgálati vegyi anyag koncentrációja a tenyészközegen belüli végleges koncentrációjaként kifejezve (például μg, mg/a tenyészközeg mL-e vagy mM-ja);
— a koncentrációk kiválasztásának és a tenyészetek számának indoklása, beleértve például a citotoxicitási adatokat és az oldhatóságra vonatkozó korlátokat;
— a közeg összetétele, CO2-koncentráció, amennyiben alkalmazandó, nedvességtartalom;
— a tenyészközeghez adott oldószer és vizsgálati vegyi anyag koncentrációja (és/vagy térfogata);
— inkubációs hőmérséklet;
— inkubációs idő;
— a kezelés időtartama;
— a kezelés utáni begyűjtés időpontja;
— adott esetben a sejtszám a leoltáskor;
— a metabolikus aktivációs rendszer típusa és összetétele (az S9 eredete, az S9 keverék elkészítési módszerei, az S9 keverék és az S9 koncentrációja vagy térfogata a végleges tenyészközegben, az S9 minőségellenőrzése);
— pozitív és negatív kontrollként szolgáló vegyi anyagok, végleges koncentráció az egyes kezelési körülmények esetén;
— az alkalmazott tárgylemez-preparálási módszer és festési technika;
— a vizsgálatok elfogadhatósági kritériumai;
— a rendellenességek értékelésének kritériumai;
— az elemzett metafázisok száma;
— a citotoxicitás mérésére alkalmazott módszerek;
— a citotoxicitás és az alkalmazott módszer szempontjából lényeges kiegészítő információk;
— azok a kritériumok, amelyek meghatározzák, hogy a vizsgálatok pozitívnak, negatívnak vagy többféleképpen értelmezhetőnek tekintendők-e;
— a pH-érték, az ozmolalitás és a kicsapódás meghatározására alkalmazott módszerek.
Eredmények:
— sejtvonalak alkalmazásakor az egyes tenyészetek esetében kezelt sejtek száma és begyűjtött sejtek száma;
— a citotoxicitás mérése, például RPD, RICC, MI, egyéb megfigyelések, ha vannak ilyenek;
— sejtvonalak esetében a sejtciklus hosszúságára, a megkettőződési időre vagy a proliferációs indexre vonatkozó információk;
— a kicsapódás jelei és a meghatározás időpontja;
— a rendellenességek, többek között a gapek meghatározása;
— az értékelt sejtek száma, a kromoszóma-rendellenességeket mutató sejtek száma és a kromoszóma-rendellenességek típusa, minden egyes kezelt és kontrolltenyészet esetében külön-külön megadva, a gapek figyelembevételével és figyelmen kívül hagyásával;
— a ploidia változásai (poliploid sejtek és endoreduplikált kromoszómákkal rendelkező sejtek, külön-külön megadva), ha láthatóak;
— amennyiben lehetséges, a koncentráció-válasz összefüggés;
— a párhuzamos negatív (oldószeres) és pozitív kontrollokra vonatkozó adatok (koncentrációk és oldószerek);
— történeti negatív (oldószeres) és pozitív kontrollokra vonatkozó adatok, a tartományok, az átlagok, a szórás, valamint az eloszlás esetében a 95 %-os ellenőrzési határértékek megadásával, továbbá az adatok száma;
— statisztikai elemzések, p-értékek, ha vannak.
Az eredmények tárgyalása.
Következtetések.
SZAKIRODALOM
(1) OECD (2016). Overview of the set of OECD Genetic Toxicology Test Guidelines and updates performed in 2014-2015. ENV Publications. Series on Testing and Assessment, No. 234, OECD, Paris.
(2) Evans, H.J. (1976), “Cytological Methods for Detecting Chemical Mutagens”, in Chemical Mutagens, Principles and Methods for their Detection, Vol. 4, Hollaender, A. (ed.), Plenum Press, New York and London, pp. 1-29
(3) Ishidate, M. Jr., T. Sofuni (1985), “The in vitro Chromosomal Aberration Test Using Chinese Hamster Lung (CHL) Fibroblast Cells in Culture” in Progress in Mutation Research, Vol. 5, Ashby, J. et al. (eds.), Elsevier Science Publishers, Amsterdam-New York- Oxford, pp. 427-432.
(4) Galloway, S.M. et al. (1987), Chromosomal aberration and sister chromatid exchanges in Chinese hamster ovary cells: Evaluation of 108 chemicals, Environmental and Molecular Mutagenesis, Vol. 10/suppl. 10, pp. 1-175.
(5) Muehlbauer, P.A. et al. (2008), “Improving dose selection and identification of aneugens in the in vitro chromosome aberration test by integration of flow cytometry-based methods”, Environmental and Molecular Mutagenesis, Vol. 49/4, pp. 318-327.
(6) E melléklet B.49., In vitro celluláris mikronukleusz-vizsgálat emlősökön című fejezete.
(7) ILSI paper (draft), Lorge, E., M. Moore, J. Clements, M. O Donovan, F. Darroudi, M. Honma, A. Czich, J van Benthem, S. Galloway, V. Thybaud, B. Gollapudi, M. Aardema, J. Kim, D.J. Kirkland, Recommendations for good cell culture practices in genotoxicity testing.
(8) Scott, D. et al. (1991), Genotoxicity under Extreme Culture Conditions. A report from ICPEMC Task Group 9, Mutation Research/Reviews in Genetic Toxicology, Vol. 257/2, pp. 147-204.
(9) Morita, T. et al. (1992), Clastogenicity of Low pH to Various Cultured Mammalian Cells, Mutation Research/Genetic Toxicology and Environmental Mutagenesis, Vol. 268/2, pp. 297-305.
(10) Brusick, D. (1986), Genotoxic effects in cultured mammalian cells produced by low pH treatment conditions and increased ion concentrations, Environmental and Molecular Mutagenesis, Vol. 8/6, pp. 789-886.
(11) Long, L.H. et al. (2007), Different cytotoxic and clastogenic effects of epigallocatechin gallate in various cell-culture media due to variable rates of its oxidation in the culture medium, Mutation Research/Genetic Toxicology and Environmental Mutagenesis, Vol. 634/1-2, pp. 177-183.
(12) Nesslany, F. et al. (2008), Characterization of the Genotoxicity of Nitrilotriacetic Acid, Environmental and Molecular Mutagenesis, Vol. 49/6, pp. 439-452.
(13) Galloway, S. (2000), Cytotoxicity and chromosome aberrations in vitro: Experience in industry and the case for an upper limit on toxicity in the aberration assay, Environmental and Molecular Mutagenesis, Vol. 35/3, pp. 191-201.
(14) Kirkland, D. et al. (2005), Evaluation of the ability of a battery of three in vitro genotoxicity tests to discriminate rodent carcinogens and non-carcinogens. I: Sensitivity, specificity and relative predictivity, Mutation Research/Genetic Toxicology and Environmental Mutagenesis, Vol. 584/1-2, pp. 1–256.
(15) Greenwood, S. et al. (2004), Population doubling: a simple and more accurate estimation of cell growth suppression in the in vitro assay for chromosomal aberrations that reduces irrelevant positive results, Environmental and Molecular Mutagenesis, Vol. 43/1, pp. 36–44.
(16) Hilliard, C.A. et al. (1998), Chromosome aberrations in vitro related to cytotoxicity of nonmutagenic chemicals and metabolic poisons, Environmental and Molecular Mutagenesis, Vol. 31/4, pp. 316–326.
(17) Hedner K. et al. (1982), Sister chromatid exchanges and structural chromosomal aberrations in relation to age and sex, Human Genetics, Vol. 62, pp. 305-309.
(18) Ramsey M.J. et al. (1995), The effects of age and lifestyle factors on the accumulation of cytogenetic damage as measured by chromosome painting, Mutation Research, Vol. 338, pp. 95-106.
(19) Coecke S. et al. (2005), Guidance on Good Cell Culture Practice. A Report of the Second ECVAM Task Force on Good Cell Culture Practice, ATLA, Vol. 33/3, pp. 261-287.
(20) Henderson, L. et al. (1997), Industrial Genotoxicology Group collaborative trial to investigate cell cycle parameters in human lymphocyte cytogenetics studies, Mutagenesis, Vol.12/3, pp.163-167.
(21) Ames, B.N., J. McCann, E. Yamasaki (1975), Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian Microsome Mutagenicity Test, Mutation Research/Environmental Mutagenesis and Related Subjects, Vol. 31/6, pp. 347-363.
(22) Maron, D.M., B.N. Ames (1983), Revised Methods for the Salmonella Mutagenicity Test, Mutation Research/Environmental Mutagenesis and Related Subjects, Vol. 113/3-4, pp. 173-215.
(23) Natarajan, A.T. et al. (1976), Cytogenetic Effects of Mutagens/Carcinogens after Activation in a Microsomal System In Vitro, I. Induction of Chromosomal Aberrations and Sister Chromatid Exchanges by Diethylnitrosamine (DEN) and Dimethylnitrosamine (DMN) in CHO Cells in the Presence of Rat-Liver Microsomes, Mutation Research, Vol. 37/1, pp. 83-90.
(24) Matsuoka, A., M. Hayashi, M. Jr. Ishidate (1979), Chromosomal Aberration Tests on 29 Chemicals Combined with S9 Mix in vitro, Mutation Research/Genetic Toxicology, Vol. 66/3, pp. 277-290.
(25) Ong, T.-m. et al. (1980), Differential effects of cytochrome P450-inducers on promutagen activation capabilities and enzymatic activities of S-9 from rat liver, Journal of Environmental Pathology and Toxicology, Vol. 4/1, pp. 55-65.
(26) Elliot, B.M. et al. (1992), Report of UK Environmental Mutagen Society Working Party. Alternatives to Aroclor 1254-induced S9 in in vitro Genotoxicity Assays, Mutagenesis, Vol. 7/3, pp. 175-177.
(27) Matsushima, T. et al. (1976), “A Safe Substitute for Polychlorinated Biphenyls as an Inducer of Metabolic Activation Systems”, in In Vitro Metabolic Activation in Mutagenesis Testing, de Serres, F.J. et al. (eds.), Elsevier, North-Holland, pp. 85-88.
(28) Galloway, S.M. et al. (1994). Report from Working Group on in vitro Tests for Chromosomal Aberrations, Mutation Research/Environmental Mutagenesis and Related Subjects, Vol. 312/3, pp. 241-261.
(29) Johnson, T.E., D.R. Umbenhauer, S.M. Galloway (1996), Human liver S-9 metabolic activation: proficiency in cytogenetic assays and comparison with phenobarbital/beta-naphthoflavone or Aroclor 1254 induced rat S-9, Environmental and Molecular Mutagenesis, Vol. 28/1, pp. 51-59.
(30) UNEP (2001), Stockholm Convention on Persistent Organic Pollutants, United Nations Environment Programme (UNEP). Elérhető a következő internetcímen: http://www.pops.int/.
(31) Tucker, J.D., M.L. Christensen (1987), Effects of anticoagulants upon sister-chromatid exchanges, cell-cycle kinetics, and mitotic index in human peripheral lymphocytes, Mutation Research, Vol. 190/3, pp. 225-8.
(32) Krahn, D.F., F.C. Barsky, K.T. McCooey (1982), “CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids”, in Genotoxic Effects of Airborne Agents, Tice, R.R., D.L. Costa, K.M. Schaich (eds.), Plenum, New York, pp. 91-103.
(33) Zamora, P.O. et al. (1983), Evaluation of an Exposure System Using Cells Grown on Collagen Gels for Detecting Highly Volatile Mutagens in the CHO/HGPRT Mutation Assay, Environmental and Molecular Mutagenesis, Vol. 5/6, pp. 795-801.
(34) Asakura, M. et al. (2008), An improved system for exposure of cultured mammalian cells to gaseous compounds in the chromosomal aberration assay, Mutation Research, Vol. 652/2, pp. 122-130.
(35) Lorge, E. et al. (2008), Comparison of different methods for an accurate assessment of cytotoxicity in the in vitro micronucleus test. I. Theoretical aspects, Mutation Research/Genetic Toxicology and Environmental Mutagenesis, Vol. 655/1-2, pp. 1-3.
(36) Galloway, S. et al. (2011), Workshop summary: Top concentration for in vitro mammalian cell genotoxicity assays; and Report from working group on toxicity measures and top concentration for in vitro cytogenetics assays (chromosome aberrations and micronucleus), Mutation Research/Genetic Toxicology and Environmental Mutagenesis, Vol. 723/2, pp. 77-83.
(37) Honma, M. (2011), Cytotoxicity measurement in in vitro chromosome aberration test and micronucleus test, Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, Vol. 724/1-2, pp. 86-87.
(38) Richardson, C. et al. (1989), Analysis of Data from In Vitro Cytogenetic Assays. In: Statistical Evaluation of Mutagenicity Test Data, Kirkland, D.J. (ed.) Cambridge University Press, Cambridge, pp. 141-154.
(39) OECD (2014), Document supporting the WNT decision to implement revised criteria for the selection of the top concentration in the in vitro mammalian cell assays on genotoxicity (Test Guidelines 473, 476 and 487) ENV/JM/TG(2014)17. Kérésre beszerezhető.
(40) Morita, T., M. Honma, K. Morikawa (2012), Effect of reducing the top concentration used in the in vitro chromosomal aberration test in CHL cells on the evaluation of industrial chemical genotoxicity, Mutation Research/Genetic Toxicology and Environmental Mutagenesis, Vol. 741/1-2, pp. 32-56.
(41) Brookmire, L., J.J. Chen, D.D. Levy (2013), Evaluation of the Highest Concentrations Used in the In Vitro Chromosome Aberrations Assay, Environmental and Molecular Muagenesis, Vol. 54/1, pp. 36-43.
(42) EPA, Office of Chemical Safety and Pollution Prevention (2011), Chemical Substances of Unknown or Variable Composition, Complex Reaction Products and Biological Materials: UVCB Substances, http://www.epa.gov/opptintr/newchems/pubs/uvcb.txt.
(43) USFDA (2012), International Conference on Harmonisation (ICH) Guidance S2 (R1) on Genotoxicity Testing and Data Interpretation for Pharmaceuticals Intended For Human Use. Elérhető a következő internetcímen: https://federalregister.gov/a/2012-13774.
(44) OECD (2014), “Statistical analysis supporting the revision of the genotoxicity Test Guidelines, OECD Environment, Health and Safety Publications (EHS)”, Series on Testing and Assessment, No. 198, OECD Publishing, Paris.
(45) ISCN (2013), An International System for Human Cytogenetic Nomenclature, Schaffer, L.G., J. MacGowan-Gordon, M. Schmid (eds.), Karger Publishers Inc., Connecticut.
(46) Scott, D. et al. (1990), “Metaphase chromosome aberration assays in vitro”, in Basic Mutagenicity Tests: UKEMS Recommended Procedures, Kirkland, D.J. (ed.), Cambridge University Press, Cambridge, pp. 62-86.
(47) Hayashi, M. et al. (2011), Compilation and use of genetic toxicity historical control Data, Mutation Research, Vol. 723/2, pp. 87-90.
(48) Ryan, T. P. (2000), Statistical Methods for Quality Improvement, 2nd Edition, John Wiley and Sons, New York.
(49) Fleiss, J. L., B. Levin, M.C. Paik (2003), Statistical Methods for Rates and Proportions, 3rd ed., John Wiley & Sons, New York.
(50) Galloway, S.M. et al. (1987), Chromosome aberration and sister chromatid exchanges in Chinese hamster ovary cells: Evaluation of 108 chemicals, Environmental and Molecular Mutagenesis, Vol. 10/suppl. 10, pp. 1-175.
(51) Richardson, C. et al. (1989), “Analysis of Data from In Vitro Cytogenetic Assays”, in Statistical Evaluation of Mutagenicity Test Data, Kirkland, D.J. (ed.), Cambridge University Press, Cambridge, pp. 141-154.
(52) Warr, T.J., E.M. Parry, J.M. Parry (1993), A comparison of two in vitro mammalian cell cytogenetic assays for the detection of mitotic aneuploidy using 10 known or suspected aneugens, Mutation Research, Vol. 287/1, pp. 29-46.
(53) Locke-Huhle, C. (1983), Endoreduplication in Chinese hamster cells during alpha-radiation induced G2 arrest, Mutation Research, Vol. 119/3, pp. 403-413.
(54) Huang, Y., C. Change, J.E. Trosko (1983), Aphidicolin – induced endoreduplication in Chinese hamster cells, Cancer Research, Vol. 43/3, pp. 1362-1364.
(55) Soper, K.A., S.M. Galloway (1994), Cytotoxicity measurement in in vitro chromosome aberration test and micronucleus test, Mutation Research, Vol. 312, pp. 139-149.
1. függelék
FOGALOMMEGHATÁROZÁSOK
Aneuploidia : a normális diploid (vagy haploid) kromoszómaszámtól egyetlen kromoszómával vagy egynél több, szám feletti kromoszómával, de nem teljes kromoszómakészlettel (kromoszómakészletekkel) (poliploidia) való bármely eltérés.
Apoptózis : programozott sejthalál olyan lépések során keresztül, amelyek a sejt membránhoz kötött részecskékre történő szétesését eredményezik; a részecskék ezután fagocitózissal vagy sejtfelszínről történő leválással kerülnek eltávolításra.
Sejtproliferáció : a sejtek számának növekedése mitotikus sejtosztódással.
Vegyi anyag : anyag vagy keverék.
Kromatidtörés : egyetlen kromatid megszakadása, amit az egyik kromatid egyértelmű átrendeződése jelez.
Kromatid gap : egyetlen kromatid meg nem festődő régiója (akromatikus sérülése), ahol minimális a kromatid átrendeződése.
Kromatid típusú rendellenesség : olyan szerkezeti kromoszómakárosodás, amely a különálló kromatidok törésében vagy a kromatidok közötti törésben és újraegyesülésben nyilvánul meg.
Kromoszóma típusú rendellenesség : olyan szerkezeti kromoszómakárosodás, amely a két kromatid azonos helyén történt törésében, vagy törésében és újraegyesülésében nyilvánul meg.
Klasztogén : bármely olyan vegyi anyag, amely sejtek vagy eukarióta szervezetek populációjában szerkezeti kromoszóma-rendellenességeket okoz.
Koncentrációk : a vizsgálati vegyi anyagnak a tenyészközegen belüli végleges koncentrációira utalnak.
Citotoxicitás : az e vizsgálati módszerbe tartozó, sejtvonalak segítségével végzett vizsgálatok esetében a citotoxicitás a kezelt sejtek relatív populációduplázódásában (RPD) vagy a számuk relatív növekedésében (RICC) bekövetkezett csökkenés a negatív kontrollhoz viszonyítva (lásd a 17. pontot és a 2. függeléket). Az e vizsgálati módszerbe tartozó, primer limfocita-tenyészetek segítségével végzett vizsgálatok esetében a citotoxicitás a kezelt sejtek mitotikus indexének (MI) csökkenése a negatív kontrollhoz viszonyítva (lásd a 18. pontot és a 2. függeléket).
Endoreduplikáció : az a folyamat, amely során valamely DNS-replikáció S fázisát követően a sejtmag nem lép be a mitózis fázisába, hanem egy másik S fázist indít. Az eredmény 4, 8, 16, … kromatiddal rendelkező kromoszómák létrejötte.
Genotoxikus : olyan általános kifejezés, amely magában foglalja a DNS- vagy kromoszómakárosodás valamennyi típusát, köztük a töréseket, a deléciókat, az adduktok képződését, a nukleotidok módosulását és kapcsolódását, az átrendeződéseket, a génmutációkat, a kromoszóma-rendellenességeket és az aneuploidiát. A genotoxikus hatás nem minden típusa eredményez mutációkat vagy stabil kromoszómakárosodást.
Mitotikus index (MI) : a metafázisban lévő sejtek és a sejtpopuláció összes sejtjének aránya; e populáció proliferációja mértékének jelzése.
Mitózis : a sejtmag osztódása, amely általában profázisra, prometafázisra, metafázisra, anafázisra és telofázisra osztható fel.
Mutagén : örökletes elváltozást idéz elő a génekben lévő DNS-bázispár szekvenciában/szekvenciákban vagy a kromoszómák szerkezetében (kromoszóma-rendellenességek).
Számszerű rendellenesség : a kromoszómák számának eltérése a felhasznált sejtekre jellemző normál számértéktől.
Poliploidia : ellentétben a csak egyetlen kromoszómát vagy bizonyos kromoszómákat érintő számszerű rendellenességekkel (aneuploidia), teljes kromoszómakészlet(ek) sejtekben és organizmusokban jelentkező számszerű rendellenessége.
p53 státusz : A p53 fehérje vesz részt a sejtciklus-szabályozásban, az apoptózisban és a DNS-reparációban. Azoknak a sejteknek, amelyeknél hiányzik funkcionális p53 fehérje, nem képesek apoptózis útján vagy a DNS-károsodásra reagáló p53 funkciókkal összefüggő egyéb mechanizmusok útján (például DNS-reparáció kiváltásával) leállítani a sejtciklust vagy eltávolítani a károsodott sejteket, elméletileg hajlamosabbnak kell lenniük génmutációkra vagy kromoszóma-rendellenességekre.
A sejtszám relatív növekedése (RICC) : a kémiai expozíciónak kitett tenyészetekben tapasztalható sejtszámnövekedés a nem kezelt tenyészetekben tapasztalható növekedéshez viszonyítva; százalékos arányként kifejezett viszonyszám.
Relatív populációduplázódás (RPD) : a populációduplázódások számának növekedése a kémiai expozíciónak kitett tenyészetekben, a nem kezelt tenyészetekben tapasztalható növekedéshez viszonyítva; százalékos arányként kifejezett viszonyszám.
S9 májfrakció : 9 000 g centrifugálás utáni májhomogenátum felülúszója, azaz a nyers májextraktum.
S9 keverék : az S9 májfrakció és a metabolikus enzimaktivitáshoz szükséges kofaktorok keveréke.
Oldószeres kontroll : a csak a vizsgálati vegyi anyag feloldására használatos oldószert befogadó kontrolltenyészetek meghatározására szolgáló általános kifejezés.
Szerkezeti rendellenesség : a sejtosztódás metafázisának mikroszkopikus vizsgálata során – deléciókként és fragmensekként, kromoszómán belüli vagy a kromoszómák közötti átrendeződésként – észlelhető változás a kromoszóma szerkezetében.
Vizsgálati vegyi anyag : bármely, e vizsgálati módszer alkalmazásával vizsgált anyag vagy keverék.
Nem kezelt kontrollok : nem kezelt (azaz sem a vizsgálati vegyi anyaggal, sem oldószerrel nem kezelt), de a vizsgálati vegyi anyagot befogadó tenyészetekkel párhuzamosan, azonos módon feldolgozott tenyészetek.
2. függelék
A CITOTOXICITÁS ÉRTÉKELÉSÉRE SZOLGÁLÓ KÉPLETEK
Mitotikus index (MI):

A sejtszám relatív növekedése (RICC) vagy a relatív populációduplázódás (RPD) ajánlott, mivel mindkét módszer figyelembe veszi az osztódott sejtpopuláció arányát.


ahol:
Populációduplázódás = [log (kezelés utáni sejtszám ÷ kiindulási sejtszám)] ÷ log 2
Például 53 %-os RICC vagy RPD 47 %-os citotoxicitást/citosztázist jelez, az MI segítségével mért 55 %-os citotoxicitás/citosztázis pedig azt jelenti, hogy a tényleges MI a kontroll 45 %-a.
A kezelés előtti sejtszámot minden esetben meg kell mérni, és annak meg kell egyeznie a kezelt és a negatív kontrolltenyészetek esetében.
Míg az RCC (azaz a kezelt tenyészeteken belüli sejtszám és a kontrolltenyészeteken belüli sejtszám hányadosa) a múltban citotoxicitási paraméterként volt használatos, a továbbiakban már nem javasolt, mivel alulbecsülheti a citotoxicitást.
A negatív kontrolltenyészetekben a populációduplázódásnak összeegyeztethetőnek kell lennie azzal a követelménnyel, hogy a sejtekből a kezelés után körülbelül 1,5 normál sejtciklusidőnek megfelelő időpontban kell mintát venni, valamint a mitotikus indexnek kellően magasnak kell lennie ahhoz, hogy elegendő számú, mitózisban lévő sejtet lehessen kapni és megbízhatóan ki lehessen számítani egy 50 %-os csökkenést.
”
(4) A B. részben a B.11. fejezet helyébe a következő szöveg lép:
„B.11. Kromoszóma-rendellenességek vizsgálata emlősök csontvelőjében
BEVEZETÉS
Ez a vizsgálati módszer egyenértékű az OECD 475. vizsgálati iránymutatásában (2016) leírt módszerrel. E vizsgálati módszer a genetikai toxikológiai vizsgálati módszerek sorozatának részét képezi. Kidolgozásra került egy, a genetikai toxikológiai vizsgálatokról tömör tájékoztatást nyújtó, a vizsgálati iránymutatások közelmúltbeli változásait áttekintő OECD-dokumentum (1).
A kromoszóma-rendellenességeknek az emlősök csontvelőjében végzett in vivo vizsgálata azért különösen releváns a genotoxicitás értékelése szempontjából, mert az in vivo metabolizmus tényezői, a farmakokinetikai és a DNS-reparációs folyamatok – bár fajonként változhatnak – aktívak és hozzájárulnak a reakciókhoz. Az in vivo vizsgálat valamely in vitro rendszer által kimutatott genotoxicitás további vizsgálatához is hasznos.
A kromoszóma-rendellenességek emlősökön végzett in vivo vizsgálata a vizsgálati vegyi anyag által az állatok – rendszerint rágcsálók – csontvelősejtjeiben előidézett szerkezeti kromoszóma-rendellenességek kimutatására használatos (2), (3), (4), (5). A szerkezeti kromoszóma-rendellenességek kétféle típusúak lehetnek: kromoszóma vagy kromatid típusú rendellenességek. Bár a genotoxikus vegyi anyagok többsége által előidézett rendellenességek többsége kromatid típusú, kromoszóma típusú rendellenességek is előfordulnak. A kromoszómakárosodás és az ehhez kapcsolódó események számos emberi genetikai betegséget okoznak, és érdemi bizonyíték van arra, hogy amikor ezek a léziók és a kapcsolódó események az onkogénekben és a tumorszuppresszor génekben okoznak elváltozásokat, szerepet játszanak az emberekben és a kísérleti rendszerekben kialakuló rákban. Poliploidia (többek között endoreduplikáció) felléphet a kromoszóma-rendellenességek in vivo vizsgálata során. A poliploidia fokozódása azonban önmagában nem jelez aneugén potenciált, egyszerűen sejtcikluszavarra vagy citotoxicitásra utalhat. E vizsgálatnak nem az aneuploidia mérése a célja. Az in vivo emlős eritrocita mikronukleusz-vizsgálat (e melléklet B.12. fejezete) vagy az emlősökön végzett in vitro celluláris mikronukleusz-vizsgálat (e melléklet B.49. fejezete) lenne az aneuploidia kimutatására ajánlott in vivo, illetve in vitro vizsgálat.
A használt fogalmak meghatározását az 1. függelék tartalmazza.
KIINDULÁSI MEGFONTOLÁSOK
E vizsgálatban rendszerint rágcsálók használatosak, de egyes esetekben – amennyiben tudományosan indokolt – más fajok is megfelelőek lehetnek. E vizsgálatban a csontvelő a célszövet, mivel egy gazdagon vaszkularizált szövet, és olyan gyorsan szaporodó sejtek populációját tartalmazza, amelyek könnyen izolálhatók és preparálhatók. Patkányoktól és egerektől eltérő fajok használatának tudományos indokolását közölni kell a jelentésben. Rágcsálóktól eltérő fajok használata esetén a csontvelő kromoszóma-rendellenességének mérését ajánlatos integrálni egy másik megfelelő toxicitásvizsgálatba.
Ha létezik arra vonatkozó bizonyíték, hogy a vizsgálati vegyi anyag(ok), vagy annak (azoknak) a metabolitja(i) nem éri(k) el a célszövetet, e vizsgálat alkalmazása nem feltétlenül megfelelő.
A vizsgálati módszer tervezett szabályozási célt szolgáló adatgenerálás érdekében, keveréken történő alkalmazása előtt meg kell vizsgálni, hogy az megfelelő eredményeket biztosíthat-e erre a célra, és ha igen, miért. Ilyen megfontolások nem szükségesek, ha létezik a keverék vizsgálatára vonatkozó szabályozási követelmény.
A VIZSGÁLATI MÓDSZER ELVE
Az állatokat a megfelelő expozíciós úton kell kitenni a vizsgálati vegyi anyagnak, majd a kezelés után megfelelő időpontban humánus módon eutanáziát kell azokon végrehajtani. Az eutanázia előtt az állatokat metafázis-blokkoló szerrel (például kolchicinnel vagy kolcemiddel) kell kezelni. Ezután kromoszóma-preparálást kell végezni a csontvelősejtekből és azokat meg kell festeni, majd elemezni kell a metafázisban lévő sejteket kromoszóma-rendellenességek megállapítása céljából.
A LABORATÓRIUM JÁRTASSÁGÁNAK IGAZOLÁSA
A jártasság vizsgálata
A laboratóriumoknak a vizsgálat rutinszerű alkalmazása előtti, a vizsgálat lefolytatásával kapcsolatos elegendő tapasztalat igazolása érdekében bizonyítottan képesnek kell lenniük a közzétett (például (6) irodalom), a kromoszóma-rendellenességek gyakoriságára vonatkozó adatok alapján várható eredmények reprodukálására legalább két, pozitív kontrollként szolgáló – például az 1. táblázatban felsorolt – vegyi anyaggal (ideértve az alacsony dózisban adagolt pozitív kontrollok által kiváltott gyenge reakciókat is) és kompatibilis vivőanyagos/oldószeres kontrollokkal (lásd a 22. pontot). E kísérletek során olyan dózisokat kell alkalmazni, amelyek reprodukálható és dózissal összefüggő növekedést biztosítanak, továbbá bizonyítják a vizsgálati rendszer érzékenységét és dinamikus tartományát az érintett szövetben (a csontvelőben), a laboratóriumon belül alkalmazandó értékelési módszer használatával. Ez a követelmény nem vonatkozik azokra a laboratóriumokra, amelyek tapasztalattal rendelkeznek, azaz amelyeknek a rendelkezésére áll 10–14. pontban meghatározott történeti adatbázis.
Történeti kontrolladatok
A jártassági vizsgálatok során a laboratóriumnak meg kell állapítania a következőket:
— a pozitív kontrollok történeti tartománya és eloszlása, valamint
— a negatív kontrollok történeti tartománya és eloszlása.
A negatív kontrollok történeti eloszlásához kapcsolódó első adatgyűjtés során a párhuzamos negatív kontrolloknak összhangban kell lenniük a kontrollokra vonatkozóan közzétett adatokkal, amennyiben léteznek. Amint több kísérleti adat adódik a kontrollok történeti eloszlásához, a párhuzamos negatív kontrolloknak ideális esetben az eloszlás 95 %-os ellenőrzési határértékén belül kell lenniük. A laboratórium negatív kontrollokat tartalmazó történeti adatbázisának statisztikailag megbízhatónak kell lennie annak garantálása érdekében, hogy a laboratórium képes legyen ellenőrizni a negatív kontrollra vonatkozó adatok eloszlását. A szakirodalom szerint legalább 10 kísérletre lehet szükség, de az adatbázisnak lehetőség szerint legalább 20, összehasonlítható kísérleti körülmények között végzett kísérletet kell tartalmaznia. A laboratóriumoknak minőségellenőrzési módszereket, például ellenőrzési diagramokat (C-diagramokat vagy X-bar diagramokat (7)) kell alkalmazniuk annak meghatározására, hogy a pozitív és a negatív kontrollokra vonatkozó adataik mennyire változóak, valamint annak bizonyítására, hogy náluk a módszertan »ellenőrzés alatt« áll. A történeti adatok összeállításának és felhasználásának módjára (azaz az adatok történeti adatokhoz számításának és azok közül való kizárásának kritériumaira, valamint egy adott kísérlet elfogadhatósági kritériumaira) vonatkozó további ajánlások megtalálhatók a szakirodalomban (8).
Amennyiben a laboratórium nem végez elegendő számú kísérletet a negatív kontrollok statisztikailag megbízható eloszlásának megállapítására (lásd a 11. pontot) a (9. pontban ismertetett) jártassági vizsgálatok során, elfogadható, hogy az eloszlást az első rutinszerű vizsgálatok során határozzák meg. Ennek a megközelítésnek a (8) hivatkozásban foglalt ajánlásokat kell követnie, és az e kísérletek során kapott negatív kontrolleredményeknek továbbra is összhangban kell lenniük a negatív kontrollokra vonatkozóan közzétett adatokkal.
A kísérleti protokoll bármely módosítását meg kell vizsgálni abból a szempontból, hogy milyen hatást gyakorol a létrejött adatoknak a laboratórium meglévő történeti kontrolladatbázisával való összhangjára. Csak jelentősebb következetlenségek fennállása esetén kell új történeti kontrolladatbázist létrehozni, amennyiben szakértői vélemény megállapítja az adatok korábbi eloszlástól való eltérését (lásd a 11. pontot). Az újbóli létrehozás során nem feltétlenül van szükség negatív kontrollokat tartalmazó teljes adatbázisra egy tényleges vizsgálat lebonyolításához, amennyiben a laboratórium bizonyítani tudja, hogy a párhuzamos negatív kontrolljainak értékei továbbra is összhangban lesznek a korábbi adatbázisával vagy a kapcsolódó, közzétett adatokkal.
A negatív kontrollokra vonatkozó adatok a (gapeken kívüli) szerkezeti kromoszóma-rendellenességek egyes állatokban történő előfordulását mutatják. A párhuzamos negatív kontrolloknak ideális esetben a laboratórium negatív kontrollokat tartalmazó történeti adatbázisa szerinti eloszlás 95 %-os ellenőrzési határértékén belül kell lenniük. Amennyiben a párhuzamos negatív kontrollokra vonatkozó adatok a 95 %-os ellenőrzési határértéken kívül esnek, akkor számíthatók be a kontrollok történeti eloszlásába, amennyiben ezek az adatok nem szélsőségesen kiugró értékek, továbbá bizonyíték van arra, hogy a vizsgálati rendszer »ellenőrzés alatt áll« (lásd a 11. pontot), valamint arra, hogy nem áll fenn szakmai vagy emberi mulasztás.
A MÓDSZER LEÍRÁSA
Előkészületek
Az állatfaj kiválasztása
Egészséges, fiatal, ivarérett, általánosan használt laboratóriumi állattörzsekből származó állatokat kell alkalmazni. A patkányok általánosan használtak, bár az egerek is megfelelőek lehetnek. Bármely egyéb megfelelő emlősfaj használható, ha a jelentésben szerepel tudományos indokolás.
Az állatok tartásának és etetésének körülményei
Rágcsálók esetében a kísérleti helyiség hőmérsékletének 22 °C (±3 °C)-nak kell lennie. Bár ideális esetben a helyiség relatív páratartalmának 50–60 %-nak kell lennie, legyen legalább 40 %, illetve a takarítás időtartamától eltekintve lehetőleg ne haladja meg a 70 %-ot. A világítás legyen mesterséges; 12 órás világos és 12 órás sötét periódusok váltsák egymást. Az etetéshez standard laboratóriumi takarmány alkalmazható, korlátlan mennyiségű ivóvíz biztosítása mellett. A takarmány megválasztását a vizsgálati vegyi anyaggal való megfelelő keveredés szükségessége is befolyásolhatja, ha a vizsgálati vegyi anyag beadása ilyen módon történik. Ha agresszív viselkedés nem várható, a rágcsálókat azonos ivarú és azonos kezelt csoporthoz tartozó kis csoportokban, lehetőleg szilárd aljú, megfelelő környezetgazdagítással ellátott ketrecekben kell tartani (ketrecenként legfeljebb öt egyed tartható). Az állatok kizárólag tudományosan indokolt esetben tarthatók egyenként.
Az állatok előkészítése
Szokásosan egészséges, fiatal, ivarérett állatokat kell alkalmazni (rágcsálók esetén ideális esetben a kezelés kezdetén 6–10 hetes állatokat, bár valamivel idősebb állatok is elfogadhatóak), és azokat véletlenszerűen kontroll- és kezelt csoportokba kell osztani. Az egyes állatokat humánus, minimálisan invazív módszerrel (például gyűrűzéssel, címkézéssel, mikrocsip beültetésével vagy biometrikus azonosítással, de a fül vagy a lábujj kilyukasztása nélkül) egyedi azonosítóval kell ellátni, és legalább öt napig szoktatni kell a laboratóriumi körülményekhez. A ketreceket úgy kell elrendezni, hogy minimálisak legyenek a ketrec elhelyezéséből adódó esetleges hatások. A pozitív kontrollal és a vizsgálati vegyi anyaggal való keresztszennyeződés kerülendő. A vizsgálat kezdetén az állatok tömege közötti eltérésnek minimálisnak kell lennie és nem haladhatja meg az ivaronkénti átlag ± 20 %-át.
A dózisok előkészítése
Az állatoknak történő adagolás előtt a szilárd halmazállapotú vizsgálati vegyi anyagokat fel kell oldani vagy szuszpendálni kell megfelelő oldószerekben vagy vivőanyagokban, vagy bele kell keverni a takarmányba vagy az ivóvízbe. A folyékony vizsgálati vegyi anyagok közvetlenül adagolhatók vagy az adagolás előtt hígíthatók. Belélegzéses expozíció esetén a vizsgálati vegyi anyagok fizikai-kémiai tulajdonságaiktól függően gáz, gőz vagy szilárd/folyadék aeroszol formában adagolhatók. A vizsgálati vegyi anyagból mindig friss készítményeket kell alkalmazni, kivéve akkor, ha a stabilitási adatok bizonyítják a tárolás elfogadhatóságát és meghatározzák a megfelelő tárolási feltételeket.
Oldószer/Vivőanyag
Az oldószer/vivőanyag nem okozhat toxikus hatásokat az alkalmazott dózisok mellett, és nem alkalmazható olyan oldószer/vivőanyag, amelyről feltehető, hogy kémiai reakcióba fog lépni a vizsgálati vegyi anyagokkal. Jól ismert oldószerektől eltérő oldószerek/vivőanyagok alkalmazása esetén azok használatát alá kell támasztani a kompatibilitásukat jelző referenciaadatokkal. Amennyiben lehetséges, először valamilyen vizes oldószer/vivőanyag használatát ajánlatos megfontolni. Általánosan használt, kompatibilis oldószer/vivőanyag például többek között a víz, a fiziológiás sóoldat, a metilcellulóz oldat, a karboximetil-cellulóz-nátriumsó oldat, az olívaolaj és a kukoricaolaj. Azt igazoló történeti vagy közzétett adatok hiányában, hogy a választott atipikus oldószer/vivőanyag nem idéz elő szerkezeti rendellenességet vagy más ártalmas hatást, kiindulási vizsgálatot kell lebonyolítani az oldószeres/vivőanyagos kontroll elfogadhatóságának megállapítása érdekében.
Kontrollok
Pozitív kontrollok
Általában minden vizsgálat során alkalmazni kell olyan állatcsoportot, amelyet pozitív kontrollként szolgáló vegyi anyaggal kezeltek. Ettől el lehet tekinteni, ha a vizsgálólaboratórium bizonyítja a vizsgálat lebonyolításában való jártasságát és megállapítja a pozitív kontrollok történeti tartományát. Párhuzamos pozitív kontrollcsoport hiányában minden egyes kísérletben értékelési kontrollokat (fixált és megfestetlen tárgylemezeket) kell alkalmazni. Ezek oly módon kaphatók meg, hogy a vizsgálat értékelésébe beszámítanak a vizsgálat lebonyolítása szerinti laboratóriumban rendszeres időközönként (például 6–18 hónaponként) – például a jártasság vizsgálata során, vagy szükség esetén azt követően rendszeresen – pozitív kontrollokkal végzett különálló kísérlettel létrejött és tárolt megfelelő referenciamintákat.
A pozitív kontrollként szolgáló vegyi anyagoknak megbízható módon ki kell váltaniuk a szerkezeti kromoszóma-rendellenességekkel rendelkező sejtek spontán szinthez képest kimutathatóan gyakoribbá válását. A pozitív kontrollok dózisát úgy kell megválasztani, hogy a hatások egyértelműek legyenek, de az értékelő ne tudja beazonosítani azonnal a kódolt mintákat. Elfogadható, hogy a pozitív kontroll beadása a vizsgálati vegyi anyagétól eltérő módon, más kezelési ütemtervvel történjen, és hogy mintavételre csak egyetlen időpontban kerüljön sor. Ezen túlmenően, adott esetben megfontolható a vegyi anyagokkal azonos kémiai osztályba tartozó pozitív kontrollok használata. A pozitív kontrollként szolgáló vegyi anyagokra az 1. táblázat tartalmaz példákat.
1. táblázat
Példák pozitív kontrollként szolgáló vegyi anyagokra
|
Vegyi anyag |
CASRN |
|
Etil-metánszulfonát |
62-50-0 |
|
Metil-metánszulfonát |
66-27-3 |
|
N-etil-N-nitrozo-karbamid |
759-73-9 |
|
Mitomicin-C |
50-07-7 |
|
Ciklofoszfamid monohidrát |
50-18-0 (6055-19-2) |
|
Trietilén-melamin |
51-18-3 |
Negatív kontrollok
A negatív kontrollcsoport állatait minden mintavételi időpontban figyelembe kell venni, és azokat egyébként a kezelt csoportokkal azonos bánásmódban kell részesíteni, kivéve, hogy nem kapnak kezelést a vizsgálati vegyi anyaggal. Ha a vizsgálati vegyi anyag beadása során oldószert/vivőanyagot alkalmaznak, a kontrollcsoportnak meg kell kapnia ezt az oldószert/vivőanyagot. Ha azonban a vizsgálólaboratórium történeti adatai azt igazolják, hogy a negatív kontrollból származó, kromoszóma-rendellenességeket mutató sejtek állatok közötti sokfélesége és gyakorisága állandó minden mintavételi időpontban, a negatív kontrollokból elegendő lehet csak egyetlen mintavétel is. Amennyiben a negatív kontrollokhoz egyetlen mintavételt alkalmaznak, azt a vizsgálat során alkalmazott első mintavételi időpontban kell elvégezni.
ELJÁRÁS
Az állatok száma és ivara
A mikronukleusz-válasz általában hasonló a hím- és a nőivarú állatok körében (9), és ez várhatóan érvényes lesz a szerkezeti kromoszóma-rendellenességekre is; ezért a vizsgálatok többségét bármelyik ivarnál el lehet végezni. A hímek és a nőstények közötti lényeges eltéréseket (például a szisztémás toxicitás, a metabolizmus, a biológiai hasznosíthatóság, a csontvelő-toxicitás stb. többek között dózisbehatároló vizsgálattal megállapított eltéréseit) bizonyító adatok mindkét ivar használatát ösztönöznék. Ebben az esetben helyénvaló lehet mindkét ivarnál vizsgálatot végezni, például ismételt dózisú toxicitási vizsgálat keretében. Mindkét ivar használata esetén helyénvaló lehet a faktoriális kísérlettervezés alkalmazása. Az e kísérlettervezés segítségével végzendő adatelemzés részletei a 2. függelékben találhatók.
A vizsgálat megkezdésekor a csoportok méretét úgy kell megállapítani, hogy csoportonként legalább öt azonos ivarú – illetve mindkét ivar használata esetén mindkét ivarból öt – elemezhető állat legyen. Amennyiben a vegyi anyagoknak való emberi expozíció szexspecifikus lehet, mint például egyes gyógyszerek esetében, a vizsgálatot a megfelelő ivarú állatokkal kell elvégezni. Útmutatás az állatok maximális számára vonatkozó tipikus követelményhez: a három dóziscsoporttal és egy párhuzamos negatív kontrollcsoporttal, továbbá egy pozitív kontrollcsoporttal (melyek mindegyike öt, egy ivarhoz tartozó állatból áll) két mintavételi időpontban végzett csontvelővizsgálathoz 45 állatra lenne szükség.
Dózisszintek
Ha előzetes dózisbehatároló vizsgálatra kerül sor amiatt, hogy már nem állnak rendelkezésre megfelelő adatok a dózisok kiválasztásának segítéséhez, azt ugyanazon laboratóriumban, ugyanazon fajok, törzsek, ivarok és kezelési eljárások alkalmazásával kell végrehajtani, mint amelyek a fő vizsgálatban alkalmazandóak (10). A vizsgálatnak a maximális tolerálható dózis (MTD) meghatározására kell irányulnia, amely anélkül, hogy vizsgálatkorlátozó toxicitást mutatna, a legmagasabb tolerált dózis a vizsgálati időszak tartamához viszonyítva (például testtömeg-csökkenést vagy vérképző rendszeri citotoxicitást vált ki), de elhullást, illetve humánus eutanáziát igénylő, bizonyított fájdalmat, szenvedést vagy szorongást nem idéz elő (11).
A legmagasabb dózis a csontvelőben toxicitásra utaló jeleket kiváltó dózisként is meghatározható.
Azok a vegyi anyagok, amelyek a toxikokinetikai tulajdonságok telítődését mutatják, vagy olyan detoxifikációs folyamatokat idéznek elő, amelyek hosszú távú kezelés után az expozíció csökkenéséhez vezethetnek, kivételek lehetnek a dózisbeállítási kritériumok alól, és azokat eseti alapon kell értékelni.
Annak érdekében, hogy dózis-válasz adatokat lehessen szerezni, a teljes vizsgálatnak egy negatív kontrollcsoportot, valamint legalább három dózisszintet kell tartalmaznia, ahol a dózisszintek közötti szorzótényező általában 2, de legfeljebb 4. Ha a vizsgálati vegyi anyag nem okoz toxicitást a dózisbehatároló vizsgálatban vagy meglévő adatok alapján, egyetlen beadás esetén a legmagasabb dózisnak 2 000 mg/testtömegkilogrammnak kell lennie. Ha azonban a vizsgálati vegyi anyag toxicitást okoz, az MTD-nek a beadott legmagasabb dózisnak kell lennie, és a használt dózisszintek lehetőleg fedjék le a maximálistól az alacsony mértékű toxicitást okozó vagy toxicitást egyáltalán nem okozó dózisig terjedő tartományt. Ha a célszövet (csontvelő) toxicitása valamennyi vizsgált dózisszintnél megfigyelhető, érdemes nem toxikus dózisoknál további vizsgálatot végezni. A mennyiségi dózis-válasz adatok teljesebb körű jellemzését célzó vizsgálatok további dóziscsoportokat tehetnek szükségessé. Ezek a határértékek a vizsgálati vegyi anyagok bizonyos, külön követelmények hatálya alá tartozó típusai (például a humán gyógyszerek) esetében változóak lehetnek.
Határérték-vizsgálat
Ha a dózisbehatároló kísérletek vagy a rokon állattörzsekből származó meglévő adatok azt jelzik, hogy a legalább a határdózist tartalmazó (az alábbiakban ismertetett) kezelési eljárás semmilyen megfigyelhető toxikus hatást nem vált ki, (többek között nem váltja ki a csontvelősejtek proliferációjának visszaesését vagy a célszövet citotoxicitásának más bizonyítékát), és ha nem várható genotoxicitás az in vitro genotoxicitási vizsgálatok alapján vagy a szerkezetileg rokon anyagokra vonatkozó adatok alapján, akkor nem feltétlenül tekintendő szükségesnek három dózis használatával végrehajtott teljes vizsgálat, amennyiben bizonyítást nyert, hogy a vizsgálati vegyi anyag(ok) eléri(k) a célszövetet (a csontvelőt). Ilyen esetekben a határdózisnál alkalmazott egyetlen dózisszint elegendő lehet. 14 napot meghaladó beadási időszak esetén a határdózis 1 000 mg/testtömeg kg/nap. A legfeljebb 14 napig tartó beadási időszak esetén a határdózis 2 000 mg/testtömeg kg/nap.
A dózisok beadása
Az emberi expozíció várható útját figyelembe kell venni a vizsgálat tervezése során. Ezért az egyéb expozíciós utak (például takarmány, ivóvíz, helyi szubkután, intravénás, orális (gyomorszondával), inhalációs, intratracheális vagy implantáció) is kiválaszthatók indokoltként. Az utat mindenesetre úgy kell kiválasztani, hogy biztosítsa a célszövet(ek) megfelelő expozícióját. A hasüregbe adott injekció nem ajánlott, mivel az nem tervezett emberi expozíciós út, és kizárólag tudományos indokolással alkalmazható. Ha a vizsgálati vegyi anyagot a takarmányba vagy ivóvízbe keverik, különösen egyszeri adagolás esetén ügyelni kell arra, hogy a táplálék és a víz fogyasztása és a mintavétel közötti idő elegendő legyen a hatások kimutathatóságához (lásd a 33–34. pontot). A gyomorszondán át vagy injekcióval egyszerre beadható maximális folyadékmennyiség a kísérleti állat méretétől függ. A térfogata rendszerint nem haladhatja meg az 1 ml/100 testtömeggramm mennyiséget, kivéve vizes oldatok esetén, amelyeknél legfeljebb 2 ml/100 testtömeggramm használható. Ennél nagyobb mennyiségek használatát meg kell indokolni. A magasabb koncentrációértékeknél rendszerint fokozottabb hatást kiváltó irritatív vagy maró vizsgálati vegyi anyagok kivételével, a koncentráció megfelelő beállításával minimálisra kell csökkenteni a vizsgálati vegyi anyag mennyiségének eltéréseit, hogy valamennyi dózisszinten a testtömeghez viszonyítva konstans mennyiséget lehessen beadni a kísérleti állatoknak.
A kezelés ütemterve
A vizsgálati vegyi anyag beadása rendszerint egyszeri dózissal történik, nagy mennyiségű anyag beadásának megkönnyítése érdekében azonban kettéosztott dózissal is beadható (például ugyanazon a napon két vagy több alkalommal, legfeljebb 2–3 órás időközzel). Ilyen körülmények között, vagy amikor a vizsgálati vegyi anyag beadása inhaláció útján történik, a mintavétel időpontját az utolsó dózis beadásának vagy az expozíció végének időpontja alapján kell ütemezni.
Ehhez a vizsgálathoz kevés adat áll rendelkezésre az ismételt dózisú protokoll megfelelőségére vonatkozóan. Olyan körülmények között azonban, amikor érdemes kiegészíteni ezt a vizsgálatot ismételt dózisú toxicitási vizsgálattal, ügyelni kell a károsodott kromoszómájú mikotikus sejtek toxikus dózisoknál esetlegesen előforduló elveszítésének elkerülésére. Ez a kiegészítés elfogadható, amikor a legmagasabb dózis meghaladja a határdózist vagy megegyezik azzal (lásd a 29. pontot), és egy dóziscsoport a kezelési időszak során mindvégig megkapja a határdózist. A mikronukleusz-vizsgálat (a B.12. vizsgálati módszer) a kromoszóma-rendellenességek esetén első választásnak minősülő in vivo vizsgálatnak tekintendő, ha más vizsgálatokkal való integráció célszerű.
A csontvelőből két külön időpontban kell mintát venni az egyszeri dózissal végzett kezeléseket követően. Rágcsálók esetében az első mintavételi időköznek 1,5 normál sejtciklusidőhöz szükséges időnek kell lennie (ez utóbbi rendszerint a kezelési időszak utáni 12–18 órát jelenti). Mivel a vizsgálati vegyi anyag(ok) felvételéhez és anyagcseréjéhez szükséges idő, valamint annak a sejtciklus-kinetikára gyakorolt hatása befolyásolhatja a kromoszóma-rendellenesség kimutatásának optimális időpontját, az első mintavételi időpont után 24 órával ajánlott egy későbbi mintavétel. Az első mintavételi időpontban minden dóziscsoportot kezelni kell, és azokból elemzés céljára mintát kell gyűjteni, a későbbi mintavételi időpont(ok)ban azonban csak a legmagasabb dózist kell beadni. Ha tudományos indokolás alapján egy napnál hosszabb adagolási eljárást alkalmaznak, a mintavételt általában az utolsó kezelést követő legfeljebb kb. 1,5 normál sejtciklusidő elteltekor kell elvégezni.
A kezelést követően és a mintavétel előtt az állatokba hasüregbe adva megfelelő dózisú metafázis-blokkoló szert (például kolcemidet vagy kolchicint) kell befecskendezni, és ezt követően megfelelő idő elteltével mintát kell venni. Egerek esetében ez a megfelelő idő körülbelül 3–5 óra, patkányok esetében pedig 2–5 óra. A sejteket ki kell nyerni a csontvelőből, meg kell duzzasztani, fixálni kell és meg kell festeni, majd elemezni kell azokat a kromoszóma-rendellenességek szempontjából (12).
Megfigyelések
A kísérleti állatok esetében általános klinikai megfigyeléseket kell tenni, és a klinikai tüneteket legalább naponta egyszer, lehetőleg minden nap ugyanazon időpont(ok)ban rögzíteni kell, továbbá figyelembe kell venni az adagolást követően várható hatások érvényesülésének csúcsidőszakát. Az adagolási időszakban naponta legalább kétszer meg kell vizsgálni az összes állatot megbetegedés és elhullás szempontjából. Minden állat tömegét le kell mérni a vizsgálat megkezdésekor, az ismételt dózisú vizsgálatok esetén hetente legalább egyszer, valamint az állatok leölésekor. A legalább egy hétig tartó vizsgálatok során a felvett táplálék mennyiségét legalább heti rendszerességgel le kell mérni. Amennyiben a vizsgálati vegyi anyag beadására az ivóvízzel együtt kerül sor, a vízfogyasztást minden vízcsere alkalmával és legalább hetente le kell mérni. A túlzott toxicitás nem halálos jeleit mutató állatokon a vizsgálati időszak befejeződése előtt humánus módon eutanáziát kell végrehajtani (11).
A célszövet expozíciója
Amennyiben indokolt, és amennyiben más expozíciós adatok nem léteznek (lásd a 44. pontot), megfelelő időpont(ok)ban vérmintát kell venni annak érdekében, hogy a vizsgálati vegyi anyagok plazmában lévő szintjét meg lehessen vizsgálni annak bizonyítása céljából, hogy a csontvelő expozíciója megtörtént.
Csontvelő- és kromoszóma-preparátumok
Közvetlenül a humánus módon végrehajtott eutanáziát követően az állatok combcsontjából vagy sípcsontjából csontvelősejteket kell venni, azokat hipotonizálni, majd fixálni kell. A metafázisban lévő sejteket tárgylemezeken szét kell teríteni és bevált módszerek segítségével meg kell festeni (lásd a (3) és a (12) hivatkozást).
Elemzés
Az elemzés előtt minden tárgylemezt, a pozitív és negatív kontrollokét is ideértve, önálló kódolással kell ellátni, és azokat véletlenszerűen kell elrendezni, hogy az értékelést végző személy ne ismerje a kezelés körülményeit.
Minden kezelt állat (a pozitív kontrollállatokat is ideértve), továbbá a nem kezelt, vagy a vivőanyaggal/oldószerrel kezelt negatív kontrollba beosztott minden állat esetében állatonként legalább 1 000 sejtben meg kell határozni a mitiotikus indexet a citotoxicitás mérőszámaként.
Minden egyes állat esetében legalább 200 metafázist kell elemezni a szerkezeti kromoszóma-rendellenességek szempontjából, a gapek figyelembevételével és figyelmen kívül hagyásával is (6). Ha azonban a negatív kontrollokat tartalmazó történeti adatbázis szerint a szerkezeti kromoszóma-rendellenességek gyakoriságának átlagos háttérértéke 1 %-nál kevesebb a vizsgálólaboratóriumban, meg kell fontolni további sejtek értékelését. A kromatid és a kromoszóma típusú rendellenességeket külön-külön kell feljegyezni és altípusonként (törések, kicserélődések) kell besorolni. A laboratóriumban alkalmazott eljárásoknak biztosítaniuk kell, hogy a kromoszóma-rendellenességeket jól képzett értékelők elemezzék, és adott esetben szakértők értékeljék. Elismerve, hogy a tárgylemezek előkészítésére szolgáló eljárások következtében gyakran megszakad a metafázisok bizonyos aránya, ami kromoszómaveszteséggel jár, a kiértékelt sejteknek ezért legalább 2n±2 számú centromérát kell tartalmazniuk, ahol n az adott faj esetében a haploid kromoszómaszám.
ADATOK ÉS JEGYZŐKÖNYVEZÉS
Az eredmények feldolgozása
Az egyes állatok adatait táblázat formájában kell megadni. Minden egyes állat esetében értékelni kell a mitotikus indexet, a kiértékelt, metafázisban lévő sejtek számát, a metafázisban lévő sejtenkénti rendellenességek számát és a szerkezeti kromoszóma-rendellenessége(ke)t mutató sejtek százalékos arányát. Fel kell sorolni a szerkezeti kromoszóma-rendellenességek különböző típusait a számukkal és gyakoriságukkal együtt, kezelt és kontrollcsoportonként. A gapeket, valamint a poliploid sejteket és az endoreduplikált kromoszómákkal rendelkező sejteket külön-külön kell feljegyezni. A gapek gyakoriságát a jelentésbe kell foglalni, de általában nem kell szerepeltetni az összes szerkezeti rendellenesség gyakoriságának elemzésében. Ha nincs bizonyíték arra, hogy a két ivar másként reagál, az adatok statisztikai elemzés céljából összevonhatók. Az állati toxicitásra és a klinikai tünetekre vonatkozó adatokat szintén a jelentésbe kell foglalni.
Elfogadhatósági kritériumok
Az alábbi kritériumok határozzák meg a vizsgálat elfogadhatóságát:
a) A párhuzamos negatív kontrollok adatai bevihetők a laboratórium negatív kontrollokat tartalmazó történeti adatbázisába (lásd a 11–14. pontot).
b) A párhuzamos pozitív kontrolloknak vagy értékelési kontrolloknak a pozitív kontrollokat tartalmazó történeti adatbázisban generált válaszokkal összeegyeztethető válaszokat, valamint a párhuzamos negatív kontrollhoz viszonyítva statisztikailag szignifikáns növekedést kell előidézniük (lásd a 20–21. pontot).
c) A megfelelő számú dózis és sejt elemzésére sor került.
d) A legmagasabb dózis kiválasztására vonatkozó kritériumok összhangban vannak a 25-28. pontban ismertetett kritériumokkal.
Az eredmények értékelése és értelmezése
Amennyiben valamennyi elfogadhatósági kritérium teljesül, a vizsgálati vegyi anyag egyértelműen pozitívnak minősül, ha:
a) legalább az egyik kezelt csoport statisztikailag szignifikáns növekedést mutat a (gapeken kívüli) szerkezeti kromoszóma-rendellenességekkel rendelkező sejtek gyakoriságában a párhuzamos negatív kontrollhoz viszonyítva,
b) a megfelelő trendpróbával történő értékelés arra utal, hogy a növekedés a dózissal összefügg, legalább egy mintavételi időpontban; és
c) ezen eredmények bármelyike a történeti negatív kontrolladatok eloszlásán (például Poisson-eloszlású 95 %-os ellenőrzési határértékeken) kívül esik.
Ha egy adott mintavételi időpontban csak a legmagasabb dózis vizsgálatára kerül sor, a vizsgálati vegyi anyag egyértelműen pozitívnak minősül, ha statisztikailag szignifikáns növekedés tapasztalható a párhuzamos negatív kontrollhoz viszonyítva, és az eredmények a történeti negatív kontrolladatok eloszlásán (például Poisson-eloszlású 95 %-os ellenőrzési határértékeken) kívül esnek. A megfelelő statisztikai módszerekre vonatkozó ajánlások megtalálhatók a szakirodalomban (13). Dózis-válasz elemzéskor legalább három kezelt dóziscsoportot kell elemezni. A statisztikai vizsgálatoknak az állatot kell kísérleti egységként alkalmazniuk. A kromoszóma-rendellenességek vizsgálatának pozitív eredményei arra utalnak, hogy egy vizsgálati vegyi anyag szerkezeti kromoszóma-rendellenességeket idéz elő a vizsgált faj csontvelőjében.
Amennyiben valamennyi elfogadhatósági kritérium teljesül, a vizsgálati vegyi anyag egyértelműen negatívnak minősül, ha valamennyi vizsgált kísérleti körülmény esetén:
a) a kezelt csoportok egyike sem mutat statisztikailag szignifikáns növekedést a (gapeken kívüli) szerkezeti kromoszóma-rendellenességek gyakorisága tekintetében a párhuzamos negatív kontrollhoz viszonyítva,
b) a megfelelő trendpróbával történő értékelés arra utal, hogy egyetlen mintavételi időpontban sincs dózissal összefüggő növekedés,
c) valamennyi eredmény a történeti negatív kontrolladatok eloszlásán (például Poisson-eloszlású 95 %-os ellenőrzési határértékeken) belül van, valamint
d) a csontvelő vizsgálati vegyi anyag(ok)nak való expozíciója megtörtént.
A legmegfelelőbb statisztikai módszerekre vonatkozó ajánlások megtalálhatók a szakirodalomban (13). A csontvelő vizsgálati vegyi anyag(ok)nak való expozíciójára vonatkozó bizonyíték lehet többek között a mitotikus index csökkenése vagy a vizsgálati vegyi anyag(ok) plazmában vagy vérben való előfordulásának mérése. Intravénás beadás esetén az expozícióra vonatkozó bizonyíték nem szükséges. Alternatív esetben az azonos expozíciós út és azonos faj alkalmazásával végzett független vizsgálat során kapott ADME-adatok használhatók a csontvelő-expozíció bizonyítására. A negatív eredmények azt jelzik, hogy a vizsgálati körülmények mellett a vizsgálati vegyi anyag nem idéz elő szerkezeti kromoszóma-rendellenességeket a vizsgált fajok csontvelőjében.
Az egyértelműen pozitív vagy egyértelműen negatív válasz igazolása nem követelmény.
Olyan esetekben, ha a válasz nem egyértelműen negatív és nem is egyértelműen pozitív, illetve egy adott eredmény (például kismértékű vagy határesethez közelítő növekedés) biológiai relevanciája megállapításának segítése érdekében az adatokat szakértői véleménnyel és/vagy a már lefolytatott kísérletek további vizsgálataival kell értékelni. Egyes esetekben hasznos lehet több sejt elemzése vagy módosított kísérleti körülmények mellett megismételt kísérlet végrehajtása.
Ritka esetekben, még további vizsgálatok után is, az adatok eleve kizárják azt a következtetést, hogy a vizsgálati vegyi anyag pozitív vagy negatív eredményeket hoz, ezért a végkövetkeztetés szerint a vizsgálat kétértelmű lesz.
A poliploid sejteknek és az endoreduplikált metafázisú sejteknek az összes metafázis közötti gyakoriságát külön-külön kell feljegyezni. A poliploid/endoreduplikált sejtek számának növekedése azt jelezheti, hogy a vizsgálati vegyi anyag potenciálisan gátolhatja a mitotikus folyamatokat vagy a sejtciklus előrehaladását (lásd a 3. pontot).
Vizsgálati jegyzőkönyv
A Vizsgálati jegyzőkönyvnek a következőket kell tartalmaznia:
Összegzés
Vizsgálati vegyi anyag:
— eredet, tételszám, felhasználási határidő, ha rendelkezésre áll;
— a vizsgálati vegyi anyag stabilitása, ha ismert;
Egy összetevőből álló anyag:
— fizikai megjelenés, vízoldékonyság és a további releváns fizikai-kémiai tulajdonságok;
— kémiai azonosítás, például IUPAC- vagy CAS-név, CAS-szám, SMILES- vagy InChI-kód, szerkezeti képlet, tisztaság, adott esetben és amennyiben a gyakorlatban megvalósítható, a szennyeződések kémiai azonossága stb.
Több összetevőből álló anyag, UVCB-k és keverékek:
— amennyiben lehetséges, az összetevők kémiai azonosítója (lásd fent), mennyiségi előfordulása és releváns fizikai-kémiai tulajdonságai jellemzik.
A vizsgálati vegyi anyag előkészítése:
— a vivőanyag megválasztásának indoklása;
— a vizsgálati vegyi anyag oldhatósága és stabilitása az oldószerben/vivőanyagban, ha ismert;
— a takarmány-, ivóvíz- vagy inhalációs készítmények előkészítése;
— a készítmények analitikai meghatározásai (pl. stabilitás, homogenitás, névleges koncentráció), ha végeznek ilyen meghatározásokat.
Kísérleti állatok:
— a felhasznált faj/törzs és a felhasználásuk indokolása;
— az állatok száma, kora és ivara;
— az állatok származása, tartási körülmények, takarmány stb.;
— az állatok egyedi azonosítására szolgáló módszerek;
— rövid távú vizsgálatok esetében: az egyes állatok tömege a vizsgálat kezdetén és végén; egy hétnél hosszabb vizsgálatok esetében: az egyes állatok testtömege a vizsgálat során és a táplálékfelvételük. A testtömegtartományt, az átlagot és a szórást minden egyes csoportnál meg kell adni.
Vizsgálati körülmények:
— pozitív és negatív (oldószeres/vivőanyagos) kontrollok;
— a dózisbehatároló vizsgálatból kapott adatok, ha történt ilyen vizsgálat;
— a dózisszintek kiválasztásának indoklása;
— a vizsgálati vegyi anyag előkészítésére vonatkozó részletek;
— a vizsgálati vegyi anyag beadására vonatkozó részletek;
— a beadási út és időtartam indoklása;
— annak ellenőrzésére szolgáló módszerek, hogy a vizsgálati vegyi anyag(ok) elérte-e (elérték-e) az általános keringési rendszert vagy a csontvelőt;
— tényleges dózis (mg/testtömeg kg/nap) a vizsgálati vegyi anyagnak a takarmányban/ivóvízben meglévő koncentrációjából (ppm) és a fogyasztásból számítva, ha alkalmazható;
— a táplálék és víz minőségére vonatkozó részletek;
— az eutanázia módja;
— a fájdalomcsillapítás módja (amennyiben alkalmaznak ilyet);
— a kezelési és mintavételi ütemtervek részletes leírása és kiválasztásuk indokolása;
— a tárgylemez preparálásának módszerei;
— a toxicitás mérésére szolgáló módszerek;
— a metafázis-blokkoló vegyi anyag összetétele, koncentrációja, dózisa és a mintavétel előtti beadásának időpontja;
— a minták izolálására és tartósítására alkalmazott eljárások;
— a rendellenességek értékelésének kritériumai;
— az állatonként elemzett, metafázisban lévő sejtek száma, valamint a mitotikus index meghatározása céljából elemzett sejtek száma;
— a vizsgálat elfogadhatóságának kritériumai;
— azok a kritériumok, amelyek meghatározzák, hogy a vizsgálatok pozitívnak, negatívnak vagy nem meggyőzőnek tekintendők-e.
Eredmények:
— az állatok állapota a vizsgálati időszak előtt és alatt, beleértve a toxicitás jeleit;
— a mitotikus index minden állat esetében külön-külön megadva;
— a rendellenességek és a rendellenességet mutató sejtek típusa és száma, minden egyes állat esetében külön-külön megadva;
— a rendellenességek csoportonkénti száma összesen, átlagokkal és szórással;
— a rendellenességeket mutató sejtek csoportonkénti száma átlagokkal és szórással;
— a ploidia változásai, ha észlelhetők, beleértve a poliploid és/vagy endoreduplikált sejtek gyakoriságát;
— a dózis-válasz összefüggés, ahol lehetséges;
— az alkalmazott statisztikai elemzések és módszer;
— a csontvelő expozícióját alátámasztó adatok;
— a párhuzamos negatív és pozitív kontrollokra vonatkozó adatok, a tartományok, az átlag és a szórás megadásával;
— a történeti negatív és pozitív kontrolladatok, a tartományok, az átlagok és a szórás, az eloszlásra vonatkozó 95 %-os ellenőrzési határértékek, valamint a tárgyidőszak és a megfigyelések számának megadásával;
— a pozitív vagy a negatív válasz esetén teljesített kritériumok.
Az eredmények tárgyalása.
Következtetés.
Hivatkozások.
SZAKIRODALOM
(1) OECD (2016). Overview of the set of OECD Genetic Toxicology Test Guidelines and updates performed in 2014-2015. ENV Publications. Series on Testing and Assessment, No. 234, OECD, Paris.
(2) Adler, I.D. (1984), “Cytogenetic Tests in Mammals”, in Mutagenicity Testing: A Practical Approach, Venittand, S., J.M. Parry (eds.), IRL Press, Washington, DC, pp. 275-306.
(3) Preston, R.J. et al. (1987), Mammalian in vivo cytogenetic assays. Analysis of chromosome aberrations in bone marrow cells, Mutation Research, Vol. 189/2, pp. 157-165.
(4) Richold, M. et al. (1990), “In Vivo Cytogenetics Assays”, in Basic Mutagenicity Tests, UKEMS Recommended Procedures. UKEMS Subcommittee on Guidelines for Mutagenicity Testing. Report. Part I revised, Kirkland, D.J. (ed.), Cambridge University Press, Cambridge, pp. 115-141.
(5) Tice, R.R. et al. (1994), Report from the working group on the in vivo mammalian bone marrow chromosomal aberration test, Mutation Research, Vol. 312/3, pp. 305-312.
(6) Adler, I.D. et al. (1998), Recommendations for statistical designs of in vivo mutagenicity tests with regard to subsequent statistical analysis, Mutation Research/Genetic Toxicology and Environmental Mutagenesis, Vol. 417/1, pp. 19-30.
(7) Ryan, T.P. (2000), Statistical Methods for Quality Improvement, 2nd ed., John Wiley and Sons, New York.
(8) Hayashi, M. et al. (2011), Compilation and use of genetic toxicity historical control data, Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, Vol. 723/2, pp. 87-90.
(9) Hayashi, M. et al. (1994), in vivo rodent erythrocyte micronucleus assay, Mutation Research/Environmental Mutagenesis and Related Subjects, Vol. 312/3, pp. 293-304.
(10) Fielder, R.J. et al. (1992), Report of British Toxicology Society/UK Environmental Mutagen Society Working Group. Dose setting in in vivo mutagenicity assays, Mutagenesis, Vol. 7/5, pp. 313-319.
(11) OECD (2000), “Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation”, OECD Environment, Health and Safety Publications (EHS), Series on Testing and Assessment, N°19, OECD Publishing, Paris.
(12) Pacchierotti, F., V. Stocchi (2013), Analysis of chromosome aberrations in somatic and germ cells of the mouse, Methods in Molecular Biology, Vol. 1044, pp. 147-163.
(13) Lovell, D.P. et al. (1989), “Statistical Analysis of in vivo Cytogenetic Assays”, in Statistical Evaluation of Mutagenicity Test Data. UKEMS SubCommittee on Guidelines for Mutagenicity Testing, Report, Part III, Kirkland, D.J. (ed.), Cambridge University Press, Cambridge, pp. 184-232.
1. függelék
FOGALOMMEGHATÁROZÁSOK
Aneuploidia : a normális diploid (vagy haploid) kromoszómaszámtól egyetlen kromoszómával vagy egynél több, szám feletti kromoszómával, de nem teljes kromoszómakészlet(ek) többszöröződésével (lásd a poliploidiát) való bármely eltérés.
Centroméra : olyan kromoszóma-régió(k), amely(ek)hez a sejtosztódás során orsórostok kötődnek, lehetővé téve a leánykromoszómáknak az utódsejtek pólusai felé irányuló szabályos mozgását.
Vegyi anyag : anyag vagy keverék.
Kromatid típusú rendellenesség : olyan szerkezeti kromoszómakárosodás, amely a különálló kromatidok törésében vagy a kromatidok törésében és újraegyesülésében nyilvánul meg.
Kromoszóma típusú rendellenesség : olyan szerkezeti kromoszómakárosodás, amely a két kromatid azonos helyén történt törésében, vagy törésben és újraegyesülésben nyilvánul meg.
Endoreduplikáció : az a folyamat, amely során valamely DNS-replikáció S fázisát követően a sejtmag nem lép be a mitózis fázisába, hanem egy másik S fázist indít. Az eredmény 4, 8, 16, … kromatiddal rendelkező kromoszómák létrejötte.
Gap : egyetlen kromatid szélességénél kisebb és a kromatidok minimális átrendeződését okozó akromatikus sérülés.
Mitotikus index : a mitózisban lévő sejtek és a sejtpopuláció összes sejtjének aránya, amely az adott sejtpopuláció proliferációs állapotának mérőszáma.
Számszerű rendellenesség : a kromoszómák számának eltérése a felhasznált állatokra jellemző normál számértéktől (aneuploidia).
Poliploidia : ellentétben a kromoszómakészlet egy részében jelentkező számszerű változással (lásd az aneuploidiát), a teljes kromoszómakészlet kromoszómaszámának változásával járó számszerű kromoszóma-rendellenesség.
Szerkezeti kromoszóma-rendellenesség : a sejtosztódás metafázisának mikroszkopikus vizsgálata során – deléciókként és fragmensekként, kromoszómán belüli vagy a kromoszómák közötti átrendeződésként – észlelhető változás a kromoszóma szerkezetében.
Vizsgálati vegyi anyag : bármely, e vizsgálati módszer alkalmazásával vizsgált anyag vagy keverék.
2. függelék
AZ IVAROK KÖZÖTTI ELTÉRÉSEK KROMOSZÓMA-RENDELLENESSÉGEK IN VIVO VIZSGÁLATA SORÁN TÖRTÉNŐ MEGHATÁROZÁSÁRA SZOLGÁLÓ FAKTORIÁLIS KÍSÉRLETTERVEZÉS
A faktoriális kísérlettervezés és annak elemzése
Ebben a kísérlettervezésben legalább 5 hím és 5 nőstény vizsgálatára kerül sor mindegyik koncentrációszintnél, ami legalább 40 állat (20 hím és 20 nőstény, valamint a releváns pozitív kontrollok) felhasználását eredményezi.
A kísérlettervezés, amely az egyszerűbb faktoriális kísérlettervezések egyike, kétirányú varianciaanalízissel egyenértékű, ahol a fő tényezők az ivar és a koncentrációszintek. Az adatok számos standard statisztikai szoftvercsomag, például az SPSS, az SAS, a STATA, a Genstat, valamint az R használatával elemezhetők.
Az analízis az adatkészleten belül a variabilitást az ivarok közötti variabilitásra, a koncentrációk közötti variabilitásra, valamint az ivarok és a koncentrációk közötti kölcsönhatáshoz kapcsolódó variabilitásra osztja. Az egyes feltételeket ugyanazon koncentrációnak kitett, az azonos ivarú állatok csoportjain belüli párhuzamos állatok közötti variabilitás becsült értékéhez viszonyítva kell megvizsgálni. A mögöttes módszertanra vonatkozó kimerítő részletek számos statisztikai tankönyvben (lásd a hivatkozásokat) és a statisztikai szoftvercsomagokkal együtt biztosított súgófájlokban is megtalálhatók.
Az analízis az ivar x koncentráció kölcsönhatási feltételnek az ANOVA-táblázatban ( 4 ) való vizsgálatával folytatódik. Szignifikáns kölcsönhatás hiányában az egyes ivarok vagy az egyes koncentrációszintek közötti értékek kombinálásával érvényes statisztikai vizsgálat végezhető a szintek között, az ANOVA szerinti, csoporton belül összesített variabilitási feltétel alapján.
Az analízis a becsült koncentrációk közötti variabilitás kontrasztokká osztásával folytatódik, ami lehetővé teszi a válaszok lineáris és kvadratikus kontrasztjainak megállapítását valamennyi koncentrációszintnél. Ha az ivar x koncentráció kölcsönhatás szignifikáns, ez a feltétel lineáris x ivar és kvadratikus x ivar kölcsönhatására vonatkozó kontrasztokká osztható. E feltételek arra vonatkozó vizsgálatokat biztosítanak, hogy a koncentráció-válaszok párhuzamosak-e a két ivar esetében, illetve hogy a két ivar különböző választ ad-e.
A csoporton belül összesített variabilitásra vonatkozó becslés felhasználható az átlagok közötti eltérés páronkénti vizsgálatához. Ezek az összehasonlítások elvégezhetők a két ivarra vonatkozó átlagok között és a különböző koncentrációszintekre vonatkozó átlagok között; ilyen például a negatív kontrollok szintjével való összehasonlítás. Amennyiben szignifikáns kölcsönhatás tapasztalható, összehasonlítható a különböző koncentrációk adott ivaron belüli átlaga vagy az ivarok azonos koncentrációnál számított átlaga.
Hivatkozások
Számos olyan statisztikai tankönyv létezik, amely a faktoriális kísérlettervezések elméletét, kialakítását, módszertanát, elemzését és értelmezését tárgyalja, a legegyszerűbb kétfaktoros elemzéstől a kísérlettervezés módszertanában alkalmazott bonyolultabb formákig. Az alábbi nem kimerítő lista. Egyes könyvekben összehasonlítható kísérlettervezésekre vonatkozó kidolgozott példák találhatók, esetenként az analízisek különféle szoftvercsomagok segítségével történő lefuttatásához szükséges kóddal együtt.
Box, G.E.P, Hunter, W.G. and Hunter, J.S. (1978). Statistics for Experimenters. An Introduction to Design, Data Analysis, and Model Building. New York: John Wiley & Sons.
Box G.E.P. & Draper, N.R. (1987). Empirical model-building and response surfaces. John Wiley & Sons Inc.
Doncaster, C.P. & Davey, A.J.H. (2007). Analysis of Variance and Covariance: How to Choose and Construct Models for the Life Sciences. Cambridge University Press.
Mead, R. (1990). The Design of Experiments. Statistical principles for practical application. Cambridge University Press.
Montgomery D.C. (1997). Design and Analysis of Experiments. John Wiley & Sons Inc.
Winer, B.J. (1971). Statistical Principles in Experimental Design. McGraw Hill.
Wu, C.F.J & Hamada, M.S. (2009). Experiments: Planning, Analysis and Optimization. John Wiley & Sons Inc.
”
(5) A B. részben a B.12. fejezet helyébe a következő szöveg lép:
„B.12 Emlős eritrocita mikronukleusz-vizsgálat
BEVEZETÉS
Ez a vizsgálati módszer egyenértékű az OECD 474. vizsgálati iránymutatásában (2014) leírt módszerrel. E vizsgálati módszer a genetikai toxikológiai vizsgálati módszerek sorozatának részét képezi. Kidolgozásra került egy, a genetikai toxikológiai vizsgálatokról tömör tájékoztatást nyújtó, a vizsgálati iránymutatások közelmúltbeli változásait áttekintő OECD-dokumentum (1).
Az emlősökön végzett in vivo mikronukleusz-vizsgálat azért különösen releváns a genotoxicitás értékelése szempontjából, mert az in vivo metabolizmus tényezői, a farmakokinetikai és a DNS-reparációs folyamatok – jóllehet fajonként eltérnek – aktívak és hozzájárulnak a reakciókhoz. Az in vivo vizsgálat valamely in vitro rendszer által kimutatott genotoxicitás további vizsgálatához is hasznos.
Az emlősökön végzett in vivo mikronukleusz-vizsgálat a vizsgálati vegyi anyag által a kromoszómákban vagy az eritroblasztok mitiotikus rendszerében előidézett károsodás kimutatására használatos. A vizsgálat az állatok, rendszerint rágcsálók csontvelőjéből vagy perifériás vérsejtjeiből vett mintákban található eritrocitákon belüli mikronukleusz-képződést értékeli.
A mikronukleusz-vizsgálat célja a visszamaradó kromoszómatöredékeket vagy egész kromoszómákat tartalmazó mikronukleuszok kialakulását eredményező citogenetikai károsodást okozó vegyi anyagok meghatározása.
Amikor a csontvelői eritroblasztból éretlen eritrocita (néha más néven polikromáziás eritrocita vagy retikulocita) fejlődik ki, a fő sejtmag kilökődik, a már esetlegesen létrejött mikronukleuszok hátramaradhatnak a citoplazmában. E sejtekben a fő sejtmag hiánya miatt könnyebb a mikronukleuszok láthatóvá tétele vagy kimutatása. A kezelt állatokban a mikronukleált éretlen eritrociták gyakoriságának növekedése az előidézett szerkezeti vagy számszerű kromoszóma-rendelleneségekre utal.
Az újonnan kialakult mikronukleált eritrociták azonosítására és számszerűsítésére megfestéssel kerül sor, melyet mikroszkóp segítségével végzett vizuális értékelés vagy automatizált elemzés követ. Az ivarérett állatok perifériás vérében vagy csontvelőjében lévő elegendő éretlen eritrocita megszámlálását jelentős mértékben megkönnyíti az automatizált értékelési platformok használata. Ezek a platformok a kézi értékelés elfogadható alternatívái (2). Összehasonlító tanulmányokból kiderült, hogy e módszerek a megfelelő kalibráló standardok használatával együtt a kézi mikroszkópos értékelésnél jobb laboratóriumközi és laboratóriumon belüli reprodukálhatóságot és érzékenységet biztosíthatnak (3) (4). A mikronukleált eritrociták gyakoriságának mérésére alkalmas automatizált rendszerek többek között, de nem kizárólag a következők: áramlási citométerek (5), képelemző platformok (6) (7) és lézerszkenneléses citométerek (8).
Bár a vizsgálat keretében általában erre nem kerül sor, a kromoszómatöredékek számos kritérium mentén megkülönböztethetők az egész kromoszómáktól. Ilyen többek között a kinetokor vagy centromer DNS jelenlétének vagy hiányának megállapítása, melyek mindegyike az intakt kromoszómákra jellemző. A kinetokor vagy a centromer DNS hiánya arra utal, hogy a mikronukleusz csak kromoszómatöredékeket tartalmaz, míg a jelenlétük kromoszómaveszteséget jelez.
A használt fogalmak meghatározását az 1. függelék tartalmazza.
KIINDULÁSI MEGFONTOLÁSOK
Ebben a vizsgálatban a genetikai károsodás vizsgálata szempontjából a fiatal, ivarérett rágcsálók csontvelője a célszövet, mivel az eritrociták ebben a szövetben termelődnek. A perifériás vérben található éretlen eritrocitákban lévő mikronukleuszok mérése elfogadható más olyan emlősfajokban, amelyek esetében az e sejtekben szerkezeti vagy számszerű kromoszóma-rendellenességeket okozó vegyi anyagok kimutatására való megfelelő érzékenység (mikronukleuszok éretlen eritrocitákban való indukciójával) bizonyítást nyert, és amennyiben e választást tudományosan megindokolták. A fő végpont a mikronukleált éretlen eritrociták gyakoriságának meghatározása. A mikronukleuszt tartalmazó érett eritrociták perifériás vérbeli gyakorisága is használható végpontként olyan fajoknál, amelyeknek a lépe nem végez erőteljes kiválasztást a mikronukleált sejtekkel szemben, valamint abban az esetben, ha az állatok folyamatos kezelése az alkalmazott fajokban előforduló eritrocita élettartamát meghaladó ideig tart (pl. egereknél 4 hétig vagy tovább).
Ha létezik arra vonatkozó bizonyíték, hogy a vizsgálati vegyi anyag(ok), vagy annak (azoknak) a metabolitja(i) nem éri(k) el a célszövetet, e vizsgálat alkalmazása nem feltétlenül megfelelő.
A vizsgálati módszer tervezett szabályozási célt szolgáló adatgenerálás érdekében, keveréken történő alkalmazása előtt meg kell vizsgálni, hogy az megfelelő eredményeket biztosíthat-e erre a célra, és ha igen, miért. Ilyen megfontolások nem szükségesek, ha létezik a keverék vizsgálatára vonatkozó szabályozási követelmény.
A VIZSGÁLATI MÓDSZER ELVE
Az állatokat megfelelő módon kell a vizsgálati vegyi anyagnak kitenni. Csontvelő használata esetén az állatokon a kezelés után megfelelő időpont(ok)ban humánus módon eutanáziát kell végrehajtani, a csontvelőt ki kell vonni, preparálni kell és meg kell festeni (9), (10), (11), (12), (13), (14), (15). Perifériás vér használatakor a vért a kezelés után megfelelő időpont(ok)ban össze kell gyűjteni és preparátumokat kell létrehozni, majd meg kell festeni azokat (12), (16), (17), (18). Akut kezelés esetén fontos, hogy a csontvelő vagy a vér összegyűjtésére olyan időpontban kerüljön sor, amikor a mikronukleált éretlen eritrociták kezeléssel összefüggő megjelenése kimutatható. Perifériás vérből történő mintavétel esetén az is követelmény, hogy elegendő idő teljen el ahhoz, hogy ezek a jelenségek előforduljanak a keringő vérben. A preparátumokat mikroszkóp, képelemzés, áramlási citometria vagy lézerszkenneléses citometria segítségével végzett megjelenítéssel kell elemezni a mikronukleuszok jelenléte szempontjából.
A LABORATÓRIUM JÁRTASSÁGÁNAK IGAZOLÁSA
A jártasság vizsgálata
A laboratóriumoknak a vizsgálat rutinszerű alkalmazása előtti, a vizsgálat lefolytatásával kapcsolatos elegendő tapasztalat igazolása érdekében bizonyítottan képesnek kell lenniük a közzétett (például (17) (19) (20) (21) (22) irodalom), a mikronukleusz gyakoriságára vonatkozó adatok alapján várható eredmények reprodukálására legalább két, pozitív kontrollként szolgáló – például az 1. táblázatban felsorolt – vegyi anyaggal (ideértve az alacsony dózisban adagolt pozitív kontrollok által kiváltott gyenge reakciókat is) és kompatibilis vivőanyagos/oldószeres kontrollokkal (lásd a 26. pontot). E kísérletek során olyan dózisokat kell alkalmazni, amelyek reprodukálható és dózissal összefüggő növekedést biztosítanak, továbbá bizonyítják a vizsgálati rendszer érzékenységét és dinamikus tartományát az érintett szövetben (a csontvelőben vagy a perifériás vérben), a laboratóriumon belül alkalmazandó értékelési módszer használatával. Ez a követelmény nem vonatkozik azokra a laboratóriumokra, amelyek tapasztalattal rendelkeznek, azaz amelyeknek a rendelkezésére áll 14–18. pontban meghatározott történeti adatbázis.
Történeti kontrolladatok
A jártassági vizsgálatok során a laboratóriumnak meg kell állapítania a következőket:
— a pozitív kontrollok történeti tartománya és eloszlása, valamint
— a negatív kontrollok történeti tartománya és eloszlása.
A negatív kontrollok történeti eloszlásához kapcsolódó első adatgyűjtés során a párhuzamos negatív kontrolloknak összhangban kell lenniük a kontrollokra vonatkozóan közzétett adatokkal, amennyiben léteznek. Amint több kísérleti adat adódik a kontrollok történeti eloszlásához, a párhuzamos negatív kontrolloknak ideális esetben az eloszlás 95 %-os ellenőrzési határértékén belül kell lenniük. A laboratórium negatív kontrollokat tartalmazó történeti adatbázisának statisztikailag megbízhatónak kell lennie annak garantálása érdekében, hogy a laboratórium képes legyen ellenőrizni a negatív kontrollra vonatkozó adatok eloszlását. A szakirodalom szerint legalább 10 kísérletre lehet szükség, de az adatbázisnak lehetőség szerint legalább 20, összehasonlítható kísérleti körülmények között végzett kísérletet kell tartalmaznia. A laboratóriumoknak minőségellenőrzési módszereket, például ellenőrzési diagramokat (C-diagramokat vagy X-bar diagramokat (23)) kell alkalmazniuk annak meghatározására, hogy adataik mennyire változóak, valamint annak bizonyítására, hogy náluk a módszertan »ellenőrzés alatt« áll. A történeti adatok összeállításának és felhasználásának módjára (azaz az adatok történeti adatokhoz számításának és azok közül való kizárásának kritériumaira, valamint egy adott kísérlet elfogadhatósági kritériumaira) vonatkozó további ajánlások megtalálhatók a szakirodalomban (24).
Amennyiben a laboratórium nem végez elegendő számú kísérletet a negatív kontrollok statisztikailag megbízható eloszlásának megállapítására (lásd a 15. pontot) a (13. pontban ismertetett) jártassági vizsgálatok során, elfogadható, hogy az eloszlást az első rutinszerű vizsgálatok során határozzák meg. Ennek a megközelítésnek a (24) szakirodalomban foglalt ajánlásokat kell követnie, és az e kísérletek során kapott negatív kontrolleredményeknek továbbra is összhangban kell lenniük a negatív kontrollokra vonatkozóan közzétett adatokkal.
A kísérleti protokoll bármely módosítását meg kell vizsgálni abból a szempontból, hogy milyen hatást gyakorol a létrejött adatoknak a laboratórium meglévő történeti kontrolladatbázisával való összhangjára. Csak jelentősebb következetlenségek fennállása esetén kell új történeti kontrolladatbázist létrehozni, amennyiben szakértői vélemény megállapítja az adatok korábbi eloszlástól való eltérését (lásd a 15. pontot). Az újbóli létrehozás során nem feltétlenül van szükség negatív kontrollokat tartalmazó teljes adatbázisra egy tényleges vizsgálat lebonyolításához, amennyiben a laboratórium bizonyítani tudja, hogy a párhuzamos negatív kontrolljainak értékei továbbra is összhangban lesznek a korábbi adatbázisával vagy a kapcsolódó, közzétett adatokkal.
A negatív kontrollokra vonatkozó adatok a mikronukleált éretlen eritrociták egyes állatokban történő előfordulását jelzik. A párhuzamos negatív kontrolloknak ideális esetben a laboratórium negatív kontrollokat tartalmazó történeti adatbázisa szerinti eloszlás 95 %-os ellenőrzési határértékén belül kell lenniük. Amennyiben a párhuzamos negatív kontrollokra vonatkozó adatok a 95 %-os ellenőrzési határértéken kívül esnek, akkor számíthatók be a kontrollok történeti eloszlásába, amennyiben ezek az adatok nem szélsőségesen kiugró értékek, továbbá bizonyíték van arra, hogy a vizsgálati rendszer »ellenőrzés alatt áll« (lásd a 15. pontot), valamint arra, hogy nem áll fenn szakmai vagy emberi mulasztás.
A MÓDSZER LEÍRÁSA
Előkészületek
Az állatfaj kiválasztása
Egészséges, fiatal, ivarérett, általánosan használt laboratóriumi állattörzsekből származó állatokat kell alkalmazni. Egerek, patkányok vagy más megfelelő emlősfajok használhatók. Perifériás vér használata esetén meg kell állapítani, hogy a mikronukleált sejteknek a lép általi eltávolítása nem veszélyezteti a kiválasztott fajokban indukált mikronukleuszok kimutatását. Ez az egerek és a patkányok perifériás vére tekintetében egyértelműen bizonyítást nyert (2). Patkányoktól és egerektől eltérő fajok használatának tudományos indokolását közölni kell a jelentésben. Rágcsálóktól eltérő fajok használata esetén az indukált mikronukleuszok mérését ajánlatos integrálni egy másik megfelelő toxicitásvizsgálatba.
Az állatok tartásának és etetésének körülményei
Rágcsálók esetében a kísérleti helyiség hőmérsékletének 22 °C (±3 °C)-nak kell lennie. Bár ideális esetben a helyiség relatív páratartalmának 50–60 %-nak kell lennie, legyen legalább 40 %, és a takarítás időtartamától eltekintve lehetőleg ne haladja meg a 70 %-ot. A világítás legyen mesterséges; 12 órás világos és 12 órás sötét periódusok váltsák egymást. Az etetéshez standard laboratóriumi takarmány alkalmazható, korlátlan mennyiségű ivóvíz biztosítása mellett. A takarmány megválasztását a vizsgálati vegyi anyaggal való megfelelő keveredés szükségessége is befolyásolhatja, ha a vizsgálati vegyi anyag beadása ilyen módon történik. Ha agresszív viselkedés nem várható, a rágcsálókat azonos ivarú és azonos kezelt csoporthoz tartozó kis csoportokban, lehetőleg szilárd aljú, megfelelő környezetgazdagítással ellátott ketrecekben kell tartani (ketrecenként legfeljebb öt egyed tartható). Az állatok kizárólag tudományosan indokolt esetben tarthatók egyenként.
Az állatok előkészítése
Szokásosan egészséges, fiatal, ivarérett állatokat kell alkalmazni (rágcsálók esetén ideális esetben a kezelés kezdetén 6–10 hetes állatokat, bár valamivel idősebb állatok is elfogadhatóak), és azokat véletlenszerűen kontroll- és kezelt csoportokba kell osztani. Az egyes állatokat humánus, minimálisan invazív módszerrel (például gyűrűzéssel, címkézéssel, mikrocsip beültetésével vagy biometrikus azonosítással, de a fül vagy a lábujj kilyukasztása nélkül) egyedi azonosítóval kell ellátni, és legalább öt napig szoktatni kell a laboratóriumi körülményekhez. A ketreceket úgy kell elrendezni, hogy minimálisak legyenek a ketrec elhelyezéséből adódó esetleges hatások. A pozitív kontrollal és a vizsgálati vegyi anyaggal való keresztszennyeződés kerülendő. A vizsgálat kezdetén az állatok tömege közötti eltérésnek minimálisnak kell lennie és nem haladhatja meg az ivaronkénti átlag ± 20 %-át.
A dózisok előkészítése
Az állatoknak történő adagolás előtt a szilárd halmazállapotú vizsgálati vegyi anyagokat fel kell oldani vagy szuszpendálni kell megfelelő oldószerekben vagy vivőanyagokban, vagy bele kell keverni a takarmányba vagy az ivóvízbe. A folyékony vizsgálati vegyi anyagok közvetlenül adagolhatók vagy az adagolás előtt hígíthatók. Belélegzéses expozíció esetén a vizsgálati vegyi anyagok fizikai-kémiai tulajdonságaiktól függően gáz, gőz vagy szilárd/folyadék aeroszol formában adagolhatók. A vizsgálati vegyi anyagból mindig friss készítményeket kell alkalmazni, kivéve akkor, ha a stabilitási adatok bizonyítják a tárolás elfogadhatóságát és meghatározzák a megfelelő tárolási feltételeket.
Vizsgálati körülmények
Oldószer/Vivőanyag
Az oldószer/vivőanyag nem okozhat toxikus hatásokat az alkalmazott dózisok mellett, és nem alkalmazható olyan oldószer/vivőanyag, amely képes kémiai reakcióba lépni a vizsgálati vegyi anyagokkal. Jól ismert oldószerektől eltérő oldószerek/vivőanyagok alkalmazása esetén azok használatát alá kell támasztani a kompatibilitásukat jelző referenciaadatokkal. Amennyiben lehetséges, először valamilyen vizes oldószer/vivőanyag használatát ajánlatos megfontolni. Általánosan használt, kompatibilis oldószer/vivőanyag például többek között a víz, a fiziológiás sóoldat, a metilcellulóz oldat, a karboximetil-cellulóz-nátriumsó oldat, az olívaolaj és a kukoricaolaj. Azt igazoló történeti vagy közzétett adatok hiányában, hogy a választott atipikus oldószer/vivőanyag nem idéz elő mikronukleuszokat vagy más ártalmas hatást, kiindulási vizsgálatot kell lebonyolítani az oldószeres/vivőanyagos kontroll elfogadhatóságának megállapítása érdekében.
Kontrollok
Pozitív kontrollok
Általában minden vizsgálat során alkalmazni kell olyan állatcsoportot, amelyet pozitív kontrollként szolgáló vegyi anyaggal kezeltek. Ettől el lehet tekinteni, ha a vizsgálólaboratórium bizonyítja a vizsgálat lebonyolításában való jártasságát és megállapítja a pozitív kontrollok történeti tartományát. Párhuzamos pozitív kontrollcsoport hiányában minden egyes kísérletben értékelési kontrollokat (az értékelési módszertől függően megfelelő, fixált és megfestetlen tárgylemezeket vagy sejtszuszpenzió-mintákat) kell alkalmazni. Ezek oly módon kaphatók meg, hogy a vizsgálat értékelésébe beszámítanak a rendszeres időközönként (például 6–18 hónaponként) – például a jártasság vizsgálata során, vagy szükség esetén azt követően rendszeresen – pozitív kontrollokkal végzett különálló kísérlettel létrejött és tárolt megfelelő referenciamintákat.
A pozitív kontrollként szolgáló vegyi anyagoknak megbízható módon ki kell váltaniuk a mikronukleuszok spontán szinthez képest kimutathatóan gyakoribbá válását. Mikroszkóppal végzett kézi értékelés alkalmazásakor a pozitív kontrollok dózisát úgy kell megválasztani, hogy a hatások egyértelműek legyenek, de az értékelő ne tudja beazonosítani azonnal a kódolt mintákat. Elfogadható, hogy a pozitív kontroll beadása a vizsgálati vegyi anyagétól eltérő módon, más kezelési ütemtervvel történjen, és hogy mintavételre csak egyetlen időpontban kerüljön sor. Ezen túlmenően, adott esetben megfontolható a vegyi anyagokkal azonos kémiai osztályba tartozó pozitív kontrollok használata. A pozitív kontrollként szolgáló vegyi anyagokra az 1. táblázat tartalmaz példákat.
1. táblázat
Példák pozitív kontrollként szolgáló vegyi anyagokra
Etil-metánszulfonát [CASRN 62-50-0]
Metil-metánszulfonát [CASRN 66-27-3]
N-etil-N-nitrozo-karbamid [CASRN 759-73-9]
Mitomicin C [CASRN 50-07-7]
Ciklofoszfamid monohidrát [CASRN 50-18-0 (CASRN 6055-19-2)]
Trietilén-melamin [CASRN 51-18-3]
Kolchicin [CASRN 64-86-8] vagy vinblasztin[CASRN 865-21-4] – mint aneugének
Negatív kontrollok
A negatív kontrollcsoport állatait minden mintavételi időpontban figyelembe kell venni, és azokat egyébként a kezelt csoportokkal azonos bánásmódban kell részesíteni, kivéve, hogy nem kapnak kezelést a vizsgálati vegyi anyaggal. Ha a vizsgálati vegyi anyag beadása során oldószert/vivőanyagot alkalmaznak, a kontrollcsoportnak meg kell kapnia ezt az oldószert/vivőanyagot. Ha azonban a vizsgálólaboratórium történeti adatai azt igazolják, hogy a negatív kontrollból származó, mikronukleált sejtek állatok közötti sokfélesége és gyakorisága állandó minden mintavételi időpontban, a negatív kontrollokból elegendő lehet csak egyetlen mintavétel is. Amennyiben a negatív kontrollokhoz egyetlen mintavételt alkalmaznak, azt a vizsgálat során alkalmazott első mintavételi időpontban kell elvégezni.
Perifériás vér használata esetén a rövid távú vizsgálatoknál a párhuzamos negatív kontroll helyett elfogadható egy kezelés előtti minta, ha a létrejött adatok összhangban vannak a vizsgálólaboratórium történeti kontrolladatbázisával. Patkányok vonatkozásában beigazolódott, hogy a kezelés előtti kis mennyiségű (például naponta 100 μl-nél kevesebb) mintavétel csekély mértékben befolyásolja a mikronukleusz-háttérgyakoriságot (25).
ELJÁRÁS
Az állatok száma és ivara
A mikronukleusz-válasz általában hasonló a hím- és a nőivarú állatok körében, és ezért a vizsgálatok többsége bármelyik nemnél elvégezhető (26). A hímek és a nőstények közötti lényeges eltéréseket (például a szisztémás toxicitás, a metabolizmus, a biológiai hasznosíthatóság, a csontvelő-toxicitás stb. például többek között dózisbehatároló vizsgálattal megállapított eltéréseit) bizonyító adatok mindkét ivar használatát ösztönöznék. Ebben az esetben helyénvaló lehet mindkét ivarnál vizsgálatot végezni, például ismételt dózisú toxicitási vizsgálat keretében. Mindkét ivar használata esetén helyénvaló lehet a faktoriális kísérlettervezés alkalmazása. Az e kísérlettervezés segítségével végzendő adatelemzés részletei a 2. függelékben találhatók.
A vizsgálat megkezdésekor a csoportok méretét úgy kell megállapítani, hogy csoportonként legalább öt azonos ivarú – illetve mindkét ivar használata esetén mindkét ivarból öt – elemezhető állat legyen. Amennyiben a vegyi anyagoknak való emberi expozíció szexspecifikus lehet, mint például egyes gyógyszerek esetében, a vizsgálatot a megfelelő ivarú állatokkal kell elvégezni. Útmutatás az állatok maximális számára vonatkozó tipikus követelményhez: a 37. pontban megállapított paraméterek szerint, három dóziscsoporttal, valamint párhuzamos negatív és pozitív kontrollcsoportokkal (melyek mindegyike öt, egy ivarhoz tartozó állatból áll) végzett csontvelővizsgálathoz 25-35 állatra lenne szükség.
Dózisszintek
Ha előzetes dózisbehatároló vizsgálatra kerül sor amiatt, hogy már nem állnak rendelkezésre megfelelő adatok a dózisok kiválasztásának segítéséhez, azt ugyanazon laboratóriumban, ugyanazon fajok, törzsek, ivarok és kezelési eljárások alkalmazásával kell végrehajtani, mint amelyek a fő vizsgálatban alkalmazandóak (27). A vizsgálatnak a maximális tolerálható dózis (MTD) meghatározására kell irányulnia, amely anélkül, hogy vizsgálatkorlátozó toxicitást mutatna, a legmagasabb tolerált dózis a vizsgálati időszak tartamához viszonyítva (például testtömeg-csökkenést vagy vérképző rendszeri citotoxicitást vált ki, de elhullást, illetve humánus eutanáziát igénylő, bizonyított fájdalmat, szenvedést vagy szorongást nem idéz elő (28)).
A legmagasabb dózis olyan dózisként is definiálható, amely toxicitást okoz a csontvelőben (például a csontvelőben vagy a perifériás vérben az összes eritrocita között az éretlen eritrociták arányának több mint 50 %-os csökkenését, amely arány ugyanakkor nem lehet kevesebb, mint a kontrollérték 20 %-a). A perifériás vérkeringésben előforduló CD71-pozitív sejtek (például áramlási citometriával végzett) elemzésekor azonban az éretlen eritrociták e nagyon fiatal frakciója gyorsabban reagál a toxikus kihívásokra, mint az éretlen eritrociták nagyobb RNS-pozitív kohorsza. Ezért a toxicitás magasabbnak tűnhet a CD71-pozitív éretlen eritrociták frakcióját vizsgáló akut expozíciós tervek mellett, mint az akut expozíció azon terve szerint, amelynek során az RNS-tartalom alapján történik az éretlen eritrociták azonosítása. Ennélfogva abban az esetben, ha a kísérletek során öt vagy kevesebb kezelési napot alkalmaznak, a toxicitást okozó vizsgálati vegyi anyagok esetében a legmagasabb dózisszint azon dózisként definiálható, amely statisztikailag szignifikáns – a kontrollérték 5 %-ánál alacsonyabbra azonban vissza nem eső – csökkenést okoz a CD71-pozitív éretlen eritrociták összes eritrocitához viszonyított arányában (29).
Azok a vegyi anyagok, amelyek a toxikokinetikai tulajdonságok telítődését mutatják, vagy olyan detoxifikációs folyamatokat idéznek elő, amelyek hosszú távú beadás után az expozíció csökkenéséhez vezethetnek, kivételek lehetnek a dózisbeállítási kritériumok alól, és azokat eseti alapon kell értékelni.
Annak érdekében, hogy dózis-válasz adatokat lehessen szerezni, a teljes vizsgálatnak egy negatív kontrollcsoportot, valamint legalább három dózisszintet kell tartalmaznia, ahol a dózisszintek közötti szorzótényező általában 2, de legfeljebb 4. Ha a vizsgálati vegyi anyag nem okoz toxicitást a dózisbehatároló vizsgálat során vagy meglévő adatok alapján, legalább 14 napig tartó beadási időszak esetén a legmagasabb dózisnak 1 000 mg/testtömeg kg/napnak, 14 napnál rövidebb beadási időszak esetében pedig 2 000 mg/testtömeg kg/napnak kell lennie Ha azonban a vizsgálati vegyi anyag toxicitást okoz, az MTD-nek a beadott legmagasabb dózisnak kell lennie, és a használt dózisszintek lehetőleg fedjék le a maximálistól az alacsony mértékű toxicitást okozó vagy toxicitást egyáltalán nem okozó dózisig terjedő tartományt. Ha a célszövet (csontvelő) toxicitása valamennyi vizsgált dózisszintnél megfigyelhető, érdemes nem toxikus dózisoknál további vizsgálatot végezni. A mennyiségi dózis-válasz adatok teljesebb körű jellemzését célzó vizsgálatok további dóziscsoportokat tehetnek szükségessé. Ezek a határértékek a vizsgálati vegyi anyagok bizonyos, külön követelmények hatálya alá tartozó típusai (például a humán gyógyszerek) esetében változóak lehetnek.
Határérték-vizsgálat
Ha a dózisbehatároló kísérletek vagy a rokon állattörzsekből származó meglévő adatok azt jelzik, hogy a legalább a határdózist tartalmazó (az alábbiakban ismertetett) kezelési eljárás semmilyen megfigyelhető toxikus hatást nem vált ki, (többek között nem váltja ki a csontvelősejtek proliferációjának visszaesését vagy a célszövet citotoxicitásának más bizonyítékát), és ha nem várható genotoxicitás az in vitro genotoxicitási vizsgálatok alapján vagy a szerkezetileg rokon anyagokra vonatkozó adatok alapján, akkor nem feltétlenül tekintendő szükségesnek három dózis használatával végrehajtott teljes vizsgálat, amennyiben bizonyítást nyert, hogy a vizsgálati vegyi anyag(ok) eléri(k) a célszövetet (a csontvelőt). Ilyen esetekben a határdózisnál alkalmazott egyetlen dózisszint elegendő lehet. Legalább 14 napig tartó beadási időszak esetén a határdózis 1 000 mg/testtömeg kg/nap. 14 napnál rövidebb beadási időszak esetén a határdózis 2 000 mg/testtömeg kg/nap.
A dózisok beadása
Az emberi expozíció várható útját figyelembe kell venni a vizsgálat tervezése során. Ezért az egyéb expozíciós utak (például takarmány, ivóvíz, helyi szubkután, intravénás, orális (gyomorszondával), inhalációs, intratracheális vagy implantáció) is kiválaszthatók indokoltként. Az utat mindenesetre úgy kell kiválasztani, hogy biztosítsa a célszövet(ek) megfelelő expozícióját. A hasüregbe adott injekció nem ajánlott, mivel az nem tervezett emberi expozíciós út, és kizárólag tudományos indokolással alkalmazható. Ha a vizsgálati vegyi anyagot a takarmányba vagy ivóvízbe keverik, különösen egyszeri adagolás esetén ügyelni kell arra, hogy a táplálék és a víz fogyasztása és a mintavétel közötti idő elegendő legyen a hatások kimutathatóságához (lásd a 37. pontot). A gyomorszondán át vagy injekcióval egyszerre beadható maximális folyadékmennyiség a kísérleti állat méretétől függ. A térfogata rendszerint nem haladhatja meg az 1 ml/100 testtömeggramm mennyiséget, kivéve vizes oldatok esetén, amelyeknél legfeljebb 2 ml/100 testtömeggramm használható. Ennél nagyobb mennyiségek használatát meg kell indokolni. A magasabb koncentrációértékeknél rendszerint fokozottabb hatást kiváltó irritatív vagy maró vizsgálati vegyi anyagok kivételével, a koncentráció megfelelő beállításával minimálisra kell csökkenteni a vizsgálati vegyi anyag mennyiségének eltéréseit, hogy valamennyi dózisszinten a testtömeghez viszonyítva konstans mennyiséget lehessen beadni a kísérleti állatoknak.
A kezelés ütemterve
Lehetőleg 2 vagy több kezelést kell 24 órás időközönként végezni, különösen e vizsgálat más toxicitásvizsgálatokba való beépítésekor. Alternatív esetben egyetlen kezelés végezhető, amennyiben tudományosan indokolt (például a vizsgálati vegyi anyagok közismerten blokkolják a sejtciklust). A vizsgálati vegyi anyagok több dózisra osztva is beadhatók, például nagy mennyiségű anyag beadásának megkönnyítése érdekében ugyanazon a napon két vagy több, legfeljebb 2–3 órás időközönként végzett kezeléssel. Ilyen körülmények között, vagy amikor a vizsgálati vegyi anyag beadása inhaláció útján történik, a mintavétel időpontját az utolsó dózis beadásának vagy az expozíció végének időpontja alapján kell ütemezni.
A vizsgálat egereken vagy patkányokon végezhető el az alábbi háromféle mód egyikén:
a. Az állatokat egyszer kell kezelni a vizsgálati vegyi anyaggal. Legalább kétszer kell csontvelőmintákat venni (független állatcsoportokból), a kezelés után 24 óránál nem korábban, de a kezelés utáni 48 órát nem meghaladó időpontban, a minták közötti megfelelő időközzel (időközökkel), kivéve, ha a vegyi anyagról ismert, hogy rendkívül hosszú a felezési ideje. A kezelés utáni 24 óránál korábbi mintavételi idők alkalmazását meg kell indokolni. Legalább kétszer kell perifériás vérmintákat venni (ugyanabból az állatcsoportból), a kezelés utáni 36 óránál nem korábban kezdve, az első mintát követő megfelelő időközzel vagy időközökkel, de 72 órát nem meghaladó időpontban. Az első mintavételi időpontban minden dóziscsoportot kezelni kell, és azokból elemzés céljára mintát kell gyűjteni, a későbbi mintavételi időpont(ok)ban azonban csak a legmagasabb dózist kell beadni. Ha egy mintavétel alkalmával pozitív reakció mutatható ki, további mintavétel nem követelmény, kivéve, ha a dózis-válasz összefüggésre vonatkozó mennyiségi adatokra van szükség. Az ismertetett begyűjtési időpontok a mikronukleuszok e szóban forgó két szövetkamrán belüli megjelenési és eltűnési kinetikájából következnek.
b. Két kezelés(például 24 órás időközzel történő két kezelés) alkalmazása esetén egyszer kell mintákat gyűjteni az utolsó kezelést követő 18 és 24 óra között a csontvelő, és egyszer az utolsó kezelést követő 36 és 48 óra között a perifériás vér vizsgálata esetében (30). Az ismertetett begyűjtési időpontok a mikronukleuszok e szóban forgó két szövetkamrán belüli megjelenési és eltűnési kinetikájából következnek.
c. Három vagy több kezelés (például megközelítőleg 24 órás időközönként három vagy több kezelés) alkalmazása esetén csontvelőmintákat az utolsó kezelés után legkésőbb 24 órával kell venni, a perifériás vért pedig az utolsó kezelés után legkésőbb 40 órával kell begyűjteni (31). Ez a kezelési lehetőség az üstökösvizsgálat (például az utolsó kezelés utáni 2–6 órával történő mintavétel) és a mikronukleusz-vizsgálat ötvözését, valamint a mikronuleusz-vizsgálat és az ismételt dózisú toxicitási vizsgálat ötvözését foglalja magában. Összesített adatok szerint a mikronukleuszok létrejötte ezekben a hosszabb időközökben három vagy több beadást követően figyelhető meg (15).
Releváns és tudományosan indokolt esetben, valamint más toxicitási vizsgálatokba való integráció megkönnyítése érdekében más adagolási vagy mintavételi eljárások is alkalmazhatók.
Megfigyelések
A kísérleti állatok esetében általános klinikai megfigyeléseket kell tenni, és a klinikai tüneteket legalább naponta egyszer, lehetőleg minden nap ugyanazon időpont(ok)ban rögzíteni kell, továbbá figyelembe kell venni az adagolást követően várható hatások érvényesülésének csúcsidőszakát. Az adagolási időszakban naponta legalább kétszer meg kell vizsgálni az összes állatot megbetegedés és elhullás szempontjából. Minden állat tömegét le kell mérni a vizsgálat megkezdésekor, az ismételt dózisú vizsgálatok esetén hetente legalább egyszer, valamint az állatok leölésekor. A legalább egy hétig tartó vizsgálatok során a felvett táplálék mennyiségét legalább heti rendszerességgel le kell mérni. Amennyiben a vizsgálati vegyi anyag beadására az ivóvízzel együtt kerül sor, a vízfogyasztást minden vízcsere alkalmával és legalább hetente le kell mérni. A túlzott toxicitás nem halálos jeleit mutató állatokon a vizsgálati időszak befejeződése előtt humánus módon eutanáziát kell végrehajtani (28). Bizonyos körülmények között az állatok testhőmérsékletét nyomon lehet követni, ugyanis a kezelés által előidézett hiper- és hipotermia közrejátszik a fals eredmények létrejöttében (32) (33) (34).
A célszövet expozíciója
Amennyiben indokolt, és amennyiben más expozíciós adatok nem léteznek (lásd a 48. pontot), megfelelő időpont(ok)ban vérmintát kell venni annak érdekében, hogy a vizsgálati vegyi anyagok plazmában lévő szintjét meg lehessen vizsgálni annak bizonyítása céljából, hogy a csontvelő expozíciója megtörtént.
Csontvelő/vér preparálása
A csontvelősejteket rendszerint az állatok combcsontjából vagy sípcsontjából kell venni közvetlenül a humánus eutanáziát követően. A sejteket általában el kell távolítani, preparálni kell és meg kell festeni bevált módszerek segítségével. Megfelelő állatjóléti előírások szerint kis mennyiségű perifériás vér vehető a kísérleti állat túlélését lehetővé tevő módszer segítségével, például a farokvénából vagy más megfelelő érből történő vérvétellel, szívpunkcióval, vagy az állaton végzett eutanázia alkalmával egy nagy érből történő mintavétellel. Mind a csontvelőből származó eritrociták, mind a perifériás vérből származó eritrociták esetében érvényes, hogy a sejteket – az elemzési módszertől függően – azonnal meg lehet festeni szupravitálisan (16) (17) (18), azokból kenetpreparátumokat kell létrehozni, majd azokat mikroszkópos vizsgálat céljából meg kell festeni, vagy áramlási citometriás elemzés céljából fixálni kell és megfelelően meg kell festeni. A DNS-specifikus festékek (például akridinnarancs (35) vagy Hoechst 33258 plusz pironin-Y (36)) használata kiküszöbölhet néhányat a DNS-re nem jellemző festőanyag használatával mesterségesen előidézett változás közül. Ez az előny nem zárja eleve ki a hagyományos festékek (például mikroszkópos elemzéshez Giemsa) használatát. További rendszerek (például a magvas sejtek eltávolítására szolgáló cellulózoszlopok (37) (38)) is használhatók, feltéve, hogy már bebizonyosodott e rendszerekről, hogy kompatibilisek a laboratóriumi mintapreparálással.
Amennyiben e módszerek alkalmazandóak, kinetokor elleni antitestek (39), fluoreszcens in situ hibridizációval (FISH) végzett pancentromérás DNS-próbák (40), vagy pancentroméra-specifikus primerekkel végzett in situ jelölés megfelelő DNS-kontrasztfestéssel (41) alkalmazható a mikronukleuszok jellegének (kromoszóma/kromoszómatöredék) azonosítására annak meghatározásához, hogy a mikronukleusz-indukálási mechanizmus klasztogén vagy aneugén aktivitásnak tudható-e be. A klasztogén és aneugén hatású anyagok megkülönböztetésére egyéb, korábban hatékonynak bizonyult módszerek is alkalmazhatók.
Elemzés (kézi és automatizált)
Az elemzésre szánt összes tárgylemezt és mintát, beleértve a pozitív és a negatív kontrollokét is, egyedi kódolással kell ellátni, és azokat véletlenszerűen kell kiválasztani bármilyen elemzés előtt, hogy a kézi értékelést végző személy ne ismerje a kezelés körülményeit; ilyen kódolás a nem szemrevételezéses vizsgálaton alapuló és a kezelő személy általi torzítással nem érintett automatizált értékelési rendszerek használatakor nem szükséges. Minden egyes állatnál meg kell határozni az összes (éretlen + érett) eritrocitához viszonyítottan az éretlenek arányát, csontvelő esetében összesen legalább 500 eritrocita, perifériás vér esetében pedig legalább 2 000 eritrocita megszámlálásával (42). Állatonként legalább 4 000 éretlen eritrocitát kell pontozni a mikronukleált éretlen eritrociták előfordulásának megállapítása céljából (43). Ha a negatív kontrollokat tartalmazó történeti adatbázis szerint a mikronukleált éretlen eritrociták gyakoriságának átlagos háttérértéke 0,1 %-nál kevesebb a vizsgálólaboratóriumban, meg kell fontolni további sejtek értékelését. A minták elemzésekor mikroszkópos vizsgálattal végzett értékelés esetén a kezelt állatokban az éretlen eritrociták összes eritrocitához viszonyított aránya nem lehet kevesebb a vivőanyagos/oldószeres kontrollok arányának 20 %-ánál, CD71+ éretlen eritrociták citometriás módszerekkel végzett értékeléskor pedig nem lehet kevesebb a vivőanyagos/oldószeres kontrollok arányának kb. 5 %-ánál (lásd a 31. pontot) (29). Például a mikroszkóppal értékelt csontvelővizsgálatnál, ha az éretlen eritrociták kontrollaránya 50 % a csontvelőben, a toxicitás felső határértéke az éretlen eritrociták 10 %-os aránya lenne.
Mivel a patkánylép elkülöníti és megsemmisíti a mikronukleált eritrocitákat, a patkányok perifériás vérének elemzése során a vizsgálat magas érzékenységének fenntartása érdekében a mikronukleált éretlen eritrociták elemzését érdemes a legfiatalabb frakcióra korlátozni. Automatizált elemzési módszerek alkalmazásakor ezek a legéretlenebb eritrociták az RNS-tartalmuk alapján, vagy a felületükön megjelenő transzferrin receptorok (CD71+) magas szintje alapján határozhatók meg (31). A különböző festési módszerekkel végzett közvetlen összehasonlításból azonban kiderült, hogy kielégítő eredmények kaphatók különféle módszerekkel, beleértve az akridinnaranccsal végzett festést is (3) (4).
ADATOK ÉS JEGYZŐKÖNYVEZÉS
Az eredmények feldolgozása
Az egyes állatok adatait táblázat formájában kell megadni. Minden egyes állat esetében külön-külön kell feljegyezni a pontozott éretlen eritrociták számát, a mikronukleált éretlen eritrociták számát és az éretlen eritrociták összes eritrocitához viszonyított arányát. Ha egereket kezelnek folyamatosan legalább négy hétig, a mikronukleált érett eritrociták számát és arányát meg kell adni, ha gyűjtöttek ilyen eritrocitákat. Az állati toxicitásra és a klinikai tünetekre vonatkozó adatokat szintén a jelentésbe kell foglalni.
Elfogadhatósági kritériumok
Az alábbi kritériumok határozzák meg a vizsgálat elfogadhatóságát:
a. A párhuzamos negatív kontrollok adatai bevihetők a laboratórium negatív kontrollokat tartalmazó történeti adatbázisába (lásd a 15–18. pontot).
b. A párhuzamos pozitív kontrolloknak vagy értékelési kontrolloknak a pozitív kontrollokat tartalmazó történeti adatbázisban generált válaszokkal összeegyeztethető válaszokat, valamint a párhuzamos negatív kontrollhoz viszonyítva statisztikailag szignifikáns növekedést kell előidézniük (lásd a 24–25. pontot).
c. A megfelelő számú dózis és sejt elemzésére sor került.
d. A legmagasabb dózis kiválasztására vonatkozó kritériumok összhangban vannak a 30-33. pontban ismertetett kritériumokkal.
Az eredmények értékelése és értelmezése
Amennyiben valamennyi elfogadhatósági kritérium teljesül, a vizsgálati vegyi anyag egyértelműen pozitívnak minősül, ha:
a. legalább az egyik kezelt csoport statisztikailag szignifikáns növekedést mutat a mikronukleált éretlen eritrocitákkal rendelkező sejtek gyakoriságában a párhuzamos negatív kontrollhoz viszonyítva,
b. a megfelelő trendpróbával történő értékelés arra utal, hogy a növekedés a dózissal összefügg, legalább egy mintavételi időpontban; és
c. ezen eredmények bármelyike a történeti negatív kontrolladatok eloszlásán (például Poisson-eloszlású 95 %-os ellenőrzési határértékeken) kívül esik.
Ha egy adott mintavételi időpontban csak a legmagasabb dózis vizsgálatára kerül sor, a vizsgálati vegyi anyag egyértelműen pozitívnak minősül, ha statisztikailag szignifikáns növekedés tapasztalható a párhuzamos negatív kontrollhoz viszonyítva, és az eredmények a történeti negatív kontrolladatok eloszlásán (például Poisson-eloszlású 95 %-os ellenőrzési határértékeken) kívül esnek. A legmegfelelőbb statisztikai módszerekre vonatkozó ajánlások megtalálhatók a szakirodalomban (44) (45) (46) (47). Dózis-válasz elemzéskor legalább három kezelt dóziscsoportot kell elemezni. A statisztikai vizsgálatoknak az állatot kell kísérleti egységként alkalmazniuk. A mikronukleusz-vizsgálat pozitív eredményei azt jelzik, hogy a vizsgálati vegyi anyag hatására kialakulnak olyan mikronukleuszok, amelyek a vizsgált fajok eritroblasztjain belüli kromoszómák károsodásának vagy a mitotikus rendszer károsodásának eredményeként jönnek létre. Amennyiben a vizsgálatot a mikronukleuszokon belüli centromérák kimutatása céljával végezték, a centromérát tartalmazó mikronukleuszok (teljes kromoszóma-veszteségre utaló centromer DNS vagy kinetokor) létrejötte azt bizonyítja, hogy a vizsgálati vegyi anyag aneugén.
Amennyiben valamennyi elfogadhatósági kritérium teljesül, a vizsgálati vegyi anyag egyértelműen negatívnak minősül, ha valamennyi vizsgált kísérleti körülmény esetén:
a. a kezelt csoportok egyike sem mutat statisztikailag szignifikáns növekedést a mikronukleált éretlen eritrociták gyakorisága tekintetében a párhuzamos negatív kontrollhoz viszonyítva,
b. a megfelelő trendpróbával történő értékelés arra utal, hogy egyetlen mintavételi időpontban sincs dózissal összefüggő növekedés,
c. valamennyi eredmény a történeti negatív kontrolladatok eloszlásán (például Poisson-eloszlású 95 %-os ellenőrzési határértékeken) belül van, valamint
d. a csontvelő vizsgálati vegyi anyag(ok)nak való expozíciója megtörtént.
A legmegfelelőbb statisztikai módszerekre vonatkozó ajánlások megtalálhatók a szakirodalomban (44) (45) (46) (47). A csontvelő vizsgálati vegyi anyag(ok)nak való expozíciójára vonatkozó bizonyíték lehet többek között az éretlen eritrociták érett eritrocitákhoz viszonyított arányának csökkenése vagy a vizsgálati vegyi anyag(ok) plazmában vagy vérben való előfordulásának mérése. Intravénás beadás esetén az expozícióra vonatkozó bizonyíték nem szükséges. Alternatív esetben az azonos expozíciós út és azonos faj alkalmazásával végzett független vizsgálat során kapott ADME-adatok használhatók a csontvelő-expozíció bizonyítására. A negatív eredmények azt jelzik, hogy a vizsgálati körülmények között a vizsgálati vegyi anyag nem idéz elő mikronukleuszokat a vizsgált fajok éretlen eritrocitáiban.
Az egyértelműen pozitív vagy egyértelműen negatív válasz igazolása nem követelmény.
Olyan esetekben, ha a válasz nem egyértelműen negatív és nem is egyértelműen pozitív, illetve egy adott eredmény (például kismértékű vagy határesethez közelítő növekedés) biológiai relevanciája megállapításának segítése érdekében az adatokat szakértői véleménnyel és/vagy a már lefolytatott kísérletek további vizsgálataival kell értékelni. Egyes esetekben hasznos lehet több sejt elemzése vagy módosított kísérleti körülmények mellett megismételt kísérlet végrehajtása.
Ritka esetekben, még további vizsgálatok után is, az adatok eleve kizárják azt a következtetést, hogy a vizsgálati vegyi anyag pozitív vagy negatív eredményeket hoz, ezért a végkövetkeztetés szerint a vizsgálat kétértelmű lesz.
Vizsgálati jegyzőkönyv
A Vizsgálati jegyzőkönyvnek a következőket kell tartalmaznia:
Összegzés
Vizsgálati vegyi anyag:
— eredet, tételszám, felhasználási határidő, ha rendelkezésre áll;
— a vizsgálati vegyi anyag stabilitása, ha ismert;
Egy összetevőből álló anyag:
— fizikai megjelenés, vízoldékonyság és a további releváns fizikai-kémiai tulajdonságok;
— kémiai azonosítás, például IUPAC- vagy CAS-név, CAS-szám, SMILES- vagy InChI-kód, szerkezeti képlet, tisztaság, adott esetben és amennyiben a gyakorlatban megvalósítható, a szennyeződések kémiai azonossága stb.
Több összetevőből álló anyag, UVCB-k és keverékek:
— amennyiben lehetséges, az összetevők kémiai azonosítója (lásd fent), mennyiségi előfordulása és releváns fizikai-kémiai tulajdonságai jellemzik.
A vizsgálati vegyi anyag előkészítése:
— a vivőanyag megválasztásának indoklása;
— a vizsgálati vegyi anyag oldhatósága és stabilitása az oldószerben/vivőanyagban, ha ismert;
— a takarmány-, ivóvíz- vagy inhalációs készítmények előkészítése;
— a készítmények analitikai meghatározásai (pl. stabilitás, homogenitás, névleges koncentráció), ha végeztek ilyen meghatározásokat.
Kísérleti állatok:
— a felhasznált faj/törzs és a felhasználásuk indokolása;
— az állatok száma, kora és ivara;
— az állatok származása, tartási körülmények, takarmány stb.;
— az állatok egyedi azonosítására szolgáló módszerek;
— rövid távú vizsgálatok esetében: az egyes állatok tömege a vizsgálat kezdetén; egy hétnél hosszabb vizsgálatok esetében: az egyes állatok testtömege a vizsgálat során és a táplálékfelvételük. A testtömegtartományt, az átlagot és a szórást minden egyes csoportnál meg kell adni.
Vizsgálati körülmények:
— a pozitív és negatív (vivőanyagos/oldószeres) kontrollok adatai;
— a dózisbehatároló vizsgálatból kapott adatok, ha történt ilyen vizsgálat;
— a dózisszintek kiválasztásának indoklása;
— a vizsgálati vegyi anyag előkészítésére vonatkozó részletek;
— a vizsgálati vegyi anyag beadására vonatkozó részletek;
— a beadási út és időtartam indoklása;
— annak ellenőrzésére szolgáló módszerek, hogy a vizsgálati vegyi anyag(ok) elérte-e (elérték-e) az általános keringési rendszert vagy a célszövetet;
— tényleges dózis (mg/testtömeg kg/nap) a vizsgálati vegyi anyagnak a takarmányban/ivóvízben meglévő koncentrációjából (ppm) és a fogyasztásból számítva, ha alkalmazható;
— a táplálék és víz minőségére vonatkozó részletek;
— az eutanázia módja;
— a fájdalomcsillapítás módja (amennyiben alkalmaznak ilyet);
— a kezelési és mintavételi ütemtervek részletes leírása és kiválasztásuk indoklása;
— a tárgylemez preparálásának módszerei;
— a minták izolálására és tartósítására alkalmazott eljárások;
— a toxicitás mérésére szolgáló módszerek;
— a mikronukleált éretlen eritrociták értékelésének kritériumai;
— az állatonként elemzett sejtek száma a mikronukleált éretlen eritrociták gyakoriságának meghatározása során, valamint az éretlen eritrociták érett eritrocitákhoz viszonyított arányának megállapítása céljából;
— a vizsgálat elfogadhatóságának kritériumai;
— adott esetben annak meghatározására szolgáló módszerek (például kinetokor elleni antitestek vagy centroméra-specifikus DNS-próbák alkalmazása), hogy a mikronukleuszok teljes kromoszómákat vagy kromoszómatöredékeket tartalmaznak-e.
Eredmények:
— az állatok állapota a vizsgálati időszak előtt és alatt, beleértve a toxicitás jeleit;
— az éretlen eritrociták összes eritrocitához viszonyított aránya;
— a mikronukleált éretlen eritrociták száma, minden egyes állat tekintetében külön megadva;
— csoportonként a mikronukleált éretlen eritrociták átlaga ± szórás;
— a dózis-válasz összefüggés, ahol lehetséges;
— statisztikai elemzések és alkalmazott módszerek;
— az egyidejű negatív és pozitív kontrollokra vonatkozó adatok, a tartományok, az átlagok és a szórás megadásával;
— a történeti negatív és pozitív kontrolladatok, a tartományok, az átlagok és a szórás, az eloszlásra vonatkozó 95 %-os ellenőrzési határértékek, valamint a tárgyidőszak és az adatpontok számának megadásával;
— a csontvelő expozícióját alátámasztó adatok;
— adott esetben azok a jellemzésre szolgáló adatok, amelyek jelzik, hogy a mikronukleuszok teljes kromoszómákat vagy kromoszómatöredékeket tartalmaznak-e;
— a pozitív vagy a negatív válasz esetén teljesített kritériumok.
Az eredmények tárgyalása.
Következtetés.
Hivatkozások.
SZAKIRODALOM
(1) OECD (2016). Overview of the set of OECD Genetic Toxicology Test Guidelines and updates performed in 2014-2015. ENV Publications. Series on Testing and Assessment, No. 234, OECD, Paris.
(2) Hayashi, M. et al. (2007), in vivo erythrocyte micronucleus assay III. Validation and regulatory acceptance of automated scoring and the use of rat peripheral blood reticulocytes, with discussion of non-hematopoietic target cells and a single dose-level limit test, Mutation Research/Genetic Toxicology and Environmental Mutagenesis, Vol. 627/1, pp. 10-30.
(3) MacGregor, J.T. et al. (2006), Flow cytometric analysis of micronuclei in peripheral blood reticulocytes: II. An efficient method of monitoring chromosomal damage in the rat, Toxicology Sciences, Vol. 94/1, pp. 92-107.
(4) Dertinger, S.D. et al. (2006), Flow cytometric analysis of micronuclei in peripheral blood reticulocytes: I. Intra- and interlaboratory comparison with microscopic scoring, Toxicological Sciences, Vol. 94/1, pp. 83-91.
(5) Dertinger, S.D. et al. (2011), Flow cytometric scoring of micronucleated erythrocytes: an efficient platform for assessing in vivo cytogenetic damage, Mutagenesis, Vol. 26/1, pp. 139-145.
(6) Parton, J.W., W.P. Hoffman, M.L. Garriott (1996), Validation of an automated image analysis micronucleus scoring system, Mutation Research, Vol. 370/1, pp. 65-73.
(7) Asano, N. et al. (1998), An automated new technique for scoring the rodent micronucleus assay: computerized image analysis of acridine orange supravitally stained peripheral blood cells, Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, Vol. 404/1-2, pp. 149-154.
(8) Styles, J.A. et al. (2001), Automation of mouse micronucleus genotoxicity assay by laser scanning cytometry, Cytometry, Vol. 44/2, pp. 153-155.
(9) Heddle, J.A. (1973), A rapid in vivo test for chromosomal damage, Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, Vol. 18/2, pp. 187-190.
(10) Schmid, W. (1975), The micronucleus test, Mutation Research, Vol. 31/1, pp. 9-15.
(11) Heddle, J.A. et al. (1983), The induction of micronuclei as a measure of genotoxicity. A report of the U.S. Environmental Protection Agency Gene-Tox Program, Mutation Research/Reviews in Genetic Toxicology, Vol. 123/1, pp. 61-118.
(12) Mavournin, K.H. et al. (1990), The in vivo micronucleus assay in mammalian bone marrow and peripheral blood. A report of the U.S. Environmental Protection Agency Gene-Tox Program, Mutation Research/Reviews in Genetic Toxicology, Vol. 239/1, pp. 29-80.
(13) MacGregor, J.T. et al. (1983), Micronuclei in circulating erythrocytes: a rapid screen for chromosomal damage during routine toxicity testing in mice, Developments in Toxicology Environmental Science, Vol. 11, pp. 555-558.
(14) MacGregor, J.T. et al. (1987), Guidelines for the conduct of micronucleus assays in mammalian bone marrow erythrocytes, Mutation Research/Genetic Toxicology, Vol. 189/2, pp. 103-112.
(15) MacGregor, J.T. et al. (1990), The in vivo erythrocyte micronucleus test: measurement at steady state increases assay efficiency and permits integration with toxicity studies, Fundamental and Applied Toxicology, Vol. 14/3, pp. 513-522.
(16) Hayashi, M. et al. (1990), The micronucleus assay with mouse peripheral blood reticulocytes using acridine orange-coated slides, Mutation Research/Genetic Toxicology, Vol. 245/4, pp. 245-249.
(17) CSGMT/JEMS.MMS – The Collaborative Study Group for the Micronucleus Test (1992), Micronucleus test with mouse peripheral blood erythrocytes by acridine orange supravital staining: the summary report of the 5th collaborative study, Mutation Research/Genetic Toxicology, Vol. 278/2-3, pp. 83-98.
(18) CSGMT/JEMS.MMS – The Mammalian Mutagenesis Study Group of the Environmental Mutagen Society of Japan (1995), Protocol recommended by the CSGMT/JEMS.MMS for the short-term mouse peripheral blood micronucleus test. The Collaborative Study Group for the Micronucleus Test (CSGMT) (CSGMT/JEMS.MMS, The Mammalian Mutagenesis Study Group of the Environmental Mutagen Society of Japan), Mutagenesis, Vol. 10/3, pp. 153-159.
(19) Salamone, M.F., K.H. Mavournin (1994), Bone marrow micronucleus assay: a review of the mouse stocks used and their published mean spontaneous micronucleus frequencies, Environmental and Molecular Mutagenesis, Vol. 23/4, pp. 239-273.
(20) Krishna, G., G. Urda, J. Paulissen (2000), Historical vehicle and positive control micronucleus data in mice and rats, Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, Vol. 453/1, pp. 45-50.
(21) Hayes, J. et al. (2009), The rat bone marrow micronucleus test--study design and statistical power, Mutagenesis, Vol. 24/5, pp. 419-424.
(22) Wakata, A. et al. (1998), Evaluation of the rat micronucleus test with bone marrow and peripheral blood: summary of the 9th collaborative study by CSGMT/JEMS. MMS. Collaborative Study Group for the Micronucleus Test. Environmental Mutagen Society of Japan. Mammalian Mutagenicity Study Group, Environmental and Molecular Mutagenesis, Vol. 32/1, pp. 84-100.
(23) Ryan, T.P. (2000), Statistical Methods for Quality Improvement, 2nd ed., John Wiley and Sons, New York.
(24) Hayashi, M. et al. (2011), Compilation and use of genetic toxicity historical control data, Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, Vol. 723/2, pp. 87-90.
(25) Rothfuss, A. et al. (2011), Improvement of in vivo genotoxicity assessment: combination of acute tests and integration into standard toxicity testing, Mutation Research/Genetic Toxicology and Environmental Mutagenesis, Vol. 723/2, pp. 108-120.
(26) Hayashi, M. et al. (1994), in vivo rodent erythrocyte micronucleus assay, Mutation Research/Environmental Mutagenesis and Related Subjects, Vol. 312/3, pp. 293-304.
(27) Fielder, R.J. et al. (1992), Report of British Toxicology Society/UK Environmental Mutagen Society Working Group. Dose setting in in vivo mutagenicity assays, Mutagenesis, Vol. 7/5, pp. 313-319.
(28) OECD (2000), “Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation”, OECD Environment, Health and Safety Publications (EHS), Series on Testing and Assessment, No. 19, OECD Publishing, Paris.
(29) LeBaron, M.J. et al. (2013), Influence of counting methodology on erythrocyte ratios in the mouse micronucleus test, Environmental and Molecular Mutagenesis, Vol. 54/3, pp. 222-228.
(30) Higashikuni, N., S. Sutou (1995), An optimal, generalized sampling time of 30 +/- 6 h after double dosing in the mouse peripheral blood micronucleus test, Mutagenesis, Vol. 10/4, pp. 313-319.
(31) Hayashi, M. et al. (2000), in vivo rodent erythrocyte micronucleus assay. II. Some aspects of protocol design including repeated treatments, integration with toxicity testing, and automated scoring, Environmental and Molecular Mutagenesis, Vol. 35/3, pp. 234-252.
(32) Asanami, S., K. Shimono (1997), High body temperature induces micronuclei in mouse bone marrow, Mutation Research/Genetic Toxicology and Environmental Mutagenesis, Vol. 390/1-2, pp. 79-83.
(33) Asanami, S., K. Shimono, S. Kaneda (1998), Transient hypothermia induces micronuclei in mice, Mutation Research/Genetic Toxicology and Environmental Mutagenesis, Vol. 413/1, pp. 7-14.
(34) Spencer, P.J. et al. (2007), Induction of micronuclei by phenol in the mouse bone marrow: I. Association with chemically induced hypothermia, Toxicological Sciences, Vol. 97/1, pp. 120-127.
(35) Hayashi, M., T. Sofuni, M. Jr. Ishidate (1983), An application of Acridine Orange fluorescent staining to the micronucleus test, Mutation Research Letters, Vol. 120/4, pp. 241-247.
(36) MacGregor, J.T., C.M. Wehr, R.G. Langlois (1983), A simple fluorescent staining procedure for micronuclei and RNA in erythrocytes using Hoechst 33258 and pyronin Y, Mutation Research, Vol. 120/4, pp. 269-275.
(37) Romagna, F., C.D. Staniforth (1989), The automated bone marrow micronucleus test, Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, Vol. 213/1, pp. 91-104.
(38) Sun, J.T., M.J. Armstrong, S.M. Galloway (1999), Rapid method for improving slide quality in the bone marrow micronucleus assay; an adapted cellulose column procedure, Mutation Research, Vol. 439/1, pp. 121-126.
(39) Miller, B.M., I.D. Adler (1990), Application of antikinetochore antibody staining (CREST staining) to micronuclei in erythrocytes induced in vivo, Mutagenesis, Vol. 5/4, pp. 411-415.
(40) Miller, B.M. et al. (1991), Classification of micronuclei in murine erythrocytes: immunofluorescent staining using CREST antibodies compared to in situ hybridization with biotinylated gamma satellite DNA, Mutagenesis, Vol. 6/4, pp. 297-302.
(41) Russo, A. (2002), PRINS tandem labeling of satellite DNA in the study of chromosome damage, American Journal of Medical Genetics, Vol. 107/2, pp. 99-104.
(42) Gollapudi, B.B., L.G. McFadden (1995), Sample size for the estimation of polychromatic to normochromatic erythrocyte ratio in the bone marrow micronucleus test, Mutation Research, Vol. 347/2, pp. 97-99.
(43) OECD (2014), “Statistical analysis supporting the revision of the genotoxicity Test Guidelines”, OECD Environment, Health and Safety Publications (EHS), Series on Testing and Assessment, No. 198, OECD Publishing, Paris.
(44) Richold, M. et al. (1990), “In Vivo Cytogenetics Assays”, in Basic Mutagenicity Tests, UKEMS Recommended Procedures. UKEMS Subcommittee on Guidelines for Mutagenicity Testing. Report. Part I revised, Kirkland, D.J. (ed.), Cambridge University Press, Cambridge, pp. 115-141.
(45) Lovell, D.P. et al. (1989), “Statistical Analysis of in vivo Cytogenetic Assays”, in Statistical Evaluation of Mutagenicity Test Data. UKEMS SubCommittee on Guidelines for Mutagenicity Testing, Report, Part III, Kirkland, D.J. (ed.), Cambridge University Press, Cambridge, pp. 184-232.
(46) Hayashi, M. et al. (1994), Statistical analysis of data in mutagenicity assays: rodent micronucleus assay, Environmental Health Perspectives, Vol. 102/Suppl 1, pp. 49-52.
(47) Kim, B.S., M. Cho, H.J. Kim (2000), Statistical analysis of in vivo rodent micronucleus assay, Mutation Research/Genetic Toxicology and Environmental Mutagenesis, Vol. 469/2, pp. 233-241.
1. függelék
FOGALOMMEGHATÁROZÁSOK
Centroméra : olyan kromoszóma-régió(k), amely(ek)hez a sejtosztódás során orsórostok kötődnek, lehetővé téve a leánykromoszómáknak az utódsejtek pólusai felé irányuló szabályos mozgását.
Vegyi anyag : anyag vagy keverék.
Eritroblaszt : az eritrocita fejlődésének az éretlen eritrocitát közvetlenül megelőző korai szakasza, amikor a sejt még tartalmaz magot.
Kinetokor : az eukarióta sejtek centroméráján kialakuló fehérjeszerkezet, amely a mitózis és a meiózis során összeköti a kromoszómát a mitotikus orsó mikrocsöves polimerjeivel, és amely a sejtosztódás során a testvérkromatidok szétválasztására szolgál.
Mikronukleusz : a sejtek fő magjától elkülönült kis járulékos mag, amelyet a mitózis (meiózis) telofázisa során hoznak létre visszamaradó kromoszómatöredékek vagy teljes kromoszómák.
Normokromáziás vagy érett eritrocita : olyan teljesen érett eritrocita, amely elveszítette az enukleációt követően megmaradó reziduális RNS-ét és/vagy más rövid életű sejtmarkereit, amelyek jellemzően eltűnnek az enukleáció után az utolsó eritroblaszt-osztódást követően.
Polikromáziás vagy éretlen eritrocita : köztes fejlődési szakaszban lévő, újonnan kialakult eritrocita, amely például a Wright–Giemsa elnevezésű klasszikus vérfesték kék és vörös komponenseivel egyaránt megfestődik az újonnan kialakult sejtben lévő reziduális RNS jelenléte miatt. Ezek az újonnan kialakult sejtek nagyjából azonosak a retikulocitákkal, vitális festék segítségével jelenítődnek meg, amelynek hatására a reziduális RNS retikulummá tömörül. Más módszerek, többek között az RNS fluoreszcens festékekkel történő monokróm festése vagy a CD71-hez hasonló, rövid életű felületi markerek fluoreszcens antitestekkel történő megjelölése jelenleg gyakran használatosak az újonnan kialakult vörösvérsejt azonosítására. A polikromáziás eritrociták, a retikulociták és a CD71-pozitív eritrociták mind éretlen eritrociták, bár mindegyiknek némileg eltérő az életkori eloszlása.
Retikulocita : a reziduális sejt-RNS jellegzetes retikulummá tömörülését okozó vitális festékkel megfestett, újonnan kialakult eritrocita. A retikulociták és a polikromáziás eritrociták egymáshoz nagyon közel álló fejlődési szakaszban vannak.
Vizsgálati vegyi anyag : bármely, e vizsgálati módszer alkalmazásával vizsgált anyag vagy keverék.
2. függelék
AZ IVAROK KÖZÖTTI ELTÉRÉSEK MEGHATÁROZÁSÁRA SZOLGÁLÓ FAKTORIÁLIS KÍSÉRLETTERVEZÉS AZ IN VIVO MIKRONUKLEUSZ-VIZSGÁLAT SORÁN
A faktoriális kísérlettervezés és annak elemzése
Ebben a kísérlettervezésben legalább 5 hím és 5 nőstény vizsgálatára kerül sor mindegyik koncentrációszintnél, ami legalább 40 állat (20 hím és 20 nőstény, valamint a releváns pozitív kontrollok) felhasználását eredményezi.
A kísérlettervezés, amely az egyszerűbb faktoriális kísérlettervezések egyike, kétirányú varianciaanalízissel egyenértékű, ahol a fő tényezők az ivar és a koncentrációszintek. Az adatok számos standard statisztikai szoftvercsomag, például az SPSS, az SAS, a STATA, a Genstat, valamint az R használatával elemezhetők.
Az analízis az adatkészleten belül a variabilitást az ivarok közötti variabilitásra, a koncentrációk közötti variabilitásra, valamint az ivarok és a koncentrációk közötti kölcsönhatáshoz kapcsolódó variabilitásra osztja. Az egyes feltételeket ugyanazon koncentrációnak kitett, az azonos ivarú állatok csoportjain belüli párhuzamos állatok közötti variabilitás becsült értékéhez viszonyítva kell megvizsgálni. A mögöttes módszertanra vonatkozó kimerítő részletek számos statisztikai tankönyvben (lásd a hivatkozásokat) és a statisztikai szoftvercsomagokkal együtt biztosított súgófájlokban is megtalálhatók.
Az analízis az ivar x koncentráció kölcsönhatási feltételnek az ANOVA-táblázatban ( 5 ) való vizsgálatával folytatódik. Szignifikáns kölcsönhatás hiányában az egyes ivarok vagy az egyes koncentrációszintek közötti értékek kombinálásával érvényes statisztikai vizsgálat végezhető a szintek között, az ANOVA szerinti, csoporton belül összesített variabilitási feltétel alapján.
Az analízis a becsült koncentrációk közötti variabilitás kontrasztokká osztásával folytatódik, ami lehetővé teszi a válaszok lineáris és kvadratikus kontrasztjainak megállapítását valamennyi koncentrációszintnél. Ha az ivar x koncentráció kölcsönhatás szignifikáns, ez a feltétel lineáris x ivar és kvadratikus x ivar kölcsönhatására vonatkozó kontrasztokká osztható. E feltételek arra vonatkozó vizsgálatokat biztosítanak, hogy a koncentráció-válaszok párhuzamosak-e a két ivar esetében, illetve hogy a két ivar különböző választ ad-e.
A csoporton belül összesített variabilitásra vonatkozó becslés felhasználható az átlagok közötti eltérés páronkénti vizsgálatához. Ezek az összehasonlítások elvégezhetők a két ivarra vonatkozó átlagok között és a különböző koncentrációszintekre vonatkozó átlagok között; ilyen például a negatív kontrollok szintjével való összehasonlítás. Amennyiben szignifikáns kölcsönhatás tapasztalható, összehasonlítható a különböző koncentrációk adott ivaron belüli átlaga vagy az ivarok azonos koncentrációnál számított átlaga.
Hivatkozások
Számos olyan statisztikai tankönyv létezik, amely a faktoriális kísérlettervezések elméletét, kialakítását, módszertanát, elemzését és értelmezését tárgyalja, a legegyszerűbb kétfaktoros elemzéstől a kísérlettervezés módszertanában alkalmazott bonyolultabb formákig. Az alábbi nem kimerítő lista. Egyes könyvekben összehasonlítható kísérlettervezésekre vonatkozó kidolgozott példák találhatók, esetenként az analízisek különféle szoftvercsomagok segítségével történő lefuttatásához szükséges kóddal együtt.
Box, G.E.P, Hunter, W.G. and Hunter, J.S. (1978). Statistics for Experimenters. An Introduction to Design, Data Analysis, and Model Building. New York: John Wiley & Sons.
Box G.E.P. & Draper, N.R. (1987). Empirical model-building and response surfaces. John Wiley & Sons Inc.
Doncaster, C.P. & Davey, A.J.H. (2007). Analysis of Variance and Covariance: How to Choose and Construct Models for the Life Sciences. Cambridge University Press.
Mead, R. (1990). The Design of Experiments. Statistical principles for practical application. Cambridge University Press.
Montgomery D.C. (1997). Design and Analysis of Experiments. John Wiley & Sons Inc.
Winer, B.J. (1971). Statistical Principles in Experimental Design. McGraw Hill.
Wu, C.F.J & Hamada, M.S. (2009). Experiments: Planning, Analysis and Optimization. John Wiley & Sons Inc.
”
(6) A B. részben a B.15. fejezetet el kell hagyni.
(7) A B. részben a B.16. fejezetet el kell hagyni.
(8) A B. részben a B.18. fejezetet el kell hagyni.
(9) A B. részben a B.19. fejezetet el kell hagyni.
(10) A B. részben a B.20. fejezetet el kell hagyni.
(11) A B. részben a B.24. fejezetet el kell hagyni.
(12) A B. részben a B.47. fejezet helyébe a következő szöveg lép:
„B.47. A szarvasmarha-szaruhártya opacitásának és permeabilitásának mérésén alapuló vizsgálati módszer i. a súlyos szemkárosodást okozó vegyi anyagok és ii. a szemirritáció vagy a súlyos szemkárosodás tekintetében besorolást nem igénylő vegyi anyagok azonosítására
BEVEZETÉS
Ez a vizsgálati módszer egyenértékű az OECD 437. vizsgálati iránymutatásában (2013) leírt módszerrel. A szarvasmarha-szaruhártya opacitásának és permeabilitásának mérésén alapuló vizsgálati módszert (a továbbiakban: BCOP vizsgálati módszer) az alternatív módszerek validálásával foglalkozó ügynökségközi koordinációs bizottság (ICCVAM) az Alternatív Módszerek Validálásával Foglalkozó Európai Központtal (ECVAM) és az Alternatív Módszerek Validálásával Foglalkozó Japán Központtal (JaCVAM) együtt értékelte 2006-ban és 2010-ben (1) (2). Az első értékelés során abból a szempontból értékelték a BCOP vizsgálati módszert, hogy mennyire hasznos a súlyos szemkárosodást okozó vegyi anyagok (anyagok és keverékek) (1) azonosításához. A második értékelés során abból a szempontból értékelték a BCOP vizsgálati módszert, hogy mennyire hasznos a szemirritáció vagy a súlyos szemkárosodás tekintetében nem besorolt vegyi anyagok (anyagok és keverékek) (2) azonosításához. A BCOP validációs adatbázis összesen 113 anyagot és 100 keveréket tartalmazott (2) (3). Ezen értékelések és szakmai vizsgálatuk alapján megállapítást nyert, hogy a vizsgálati módszer helyesen tudja azonosítani a vegyi anyagok osztályozásának és címkézésének az Egyesült Nemzetek Szervezete (ENSZ) által globálisan harmonizált rendszerének (GHS) (4), illetve az anyagok és keverékek osztályozásáról, címkézéséről és csomagolásáról szóló 1272/2008/EK rendeletnek ( 6 ) (CLP-rendelet) a meghatározása szerint súlyos szemkárosodást okozó (1. kategóriába tartozó) vegyi anyagokat (anyagokat és keverékeket egyaránt), továbbá szemirritáció vagy súlyos szemkárosodás tekintetében besorolást nem igénylő vegyi anyagokat, ezért azt tudományosan megalapozottként elfogadták mindkét célra. Súlyos szemkárosodás a vizsgálati vegyi anyagnak a szem elülső felszínén történő alkalmazását követően megjelenő és az alkalmazástól számított 21 napon belül nem teljes mértékben visszafordítható szövetkárosodás a szemben, vagy a látóképesség súlyos fizikai romlása. A súlyos szemkárosodást okozó vizsgálati vegyi anyagok az ENSZ-GHS szerinti 1. kategóriába sorolandók be. A szemirritáció vagy a súlyos szemkárosodás tekintetében be nem sorolt vegyi anyagok olyan vegyi anyagok, amelyek nem tesznek eleget az ENSZ-GHS szerinti 1. vagy 2. (2A. vagy 2B.) kategóriába való besorolás követelményeinek, vagyis azokra az ENSZ-GHS szerint kategória nélküliként történik hivatkozás. Ez a vizsgálati módszer a BCOP vizsgálati módszer ajánlott alkalmazását és korlátait tartalmazza a módszer értékelései alapján. Az OECD vizsgálati iránymutatásának eredeti, 2009-es változata és frissített, 2013-as változata közötti legfőbb eltérések többek között, de nem kizárólag a következők: a BCOP vizsgálati módszer ENSZ-GHS szerint besorolást nem igénylő vegyi anyagok azonosítására történő alkalmazása (2. és 7. pont); a BCOP vizsgálati módszer alkoholok, ketonok és szilárd anyagok vizsgálatára (6. és 7. pont), valamint anyagok és keverékek vizsgálatára (8. pont) való alkalmazhatóságával kapcsolatos pontosítások; a felületaktív anyagok és a felületaktív anyagokat tartalmazó keverékek vizsgálatának módjával kapcsolatos pontosítások (28. pont); a pozitív kontrollokra vonatkozó frissítések és pontosítások (39. és 40. pont); a BCOP vizsgálati módszerrel kapcsolatos döntés kritériumainak frissítése (47. pont); a vizsgálat elfogadhatósági kritériumainak frissítése (48. pont); a Vizsgálati jegyzőkönyv elemeinek frissítése (49. pont); a fogalommeghatározásokat tartalmazó 1. függelék frissítése; a 2. függelék beillesztése a BCOP vizsgálati módszer különféle osztályozási rendszerek szerinti prediktív értéke tekintetében; a jártassági tesztanyagok jegyzékét tartalmazó 3. függelék frissítése, valamint a BCOP vizsgálathoz alkalmazott szaruhártyatartóról (1. pont) és az opaciméterről (2. és 3. pont) szóló 4. függelék frissítése.
Jelenleg általánosan elfogadott, hogy az előre látható jövőben egyetlen in vitro szemirritációs vizsgálat sem tudja majd helyettesíteni a Draize-féle in vivo szemvizsgálatot a különböző kémiai osztályoknál felmerülő irritáció teljes skálájának előrejelzésére. Előfordulhat azonban, hogy egy-egy (többszintű) vizsgálati stratégián belüli több alternatív vizsgálati módszer stratégiai kombinációja helyettesíteni tudja a Draize-féle szemvizsgálatot (5). A felülről építkező megközelítés (5) akkor alkalmazandó, ha a meglévő információk alapján valamely vegyi anyag várhatóan rendkívül irritáló hatású lehet, míg az alulról építkező megközelítés (5) akkor alkalmazandó, ha a meglévő információk alapján valamely vegyi anyag várhatóan nem okoz a besorolás szükségességéhez elegendő szemirritációt. A BCOP vizsgálati módszer bizonyos körülmények között és meghatározott korlátokkal a vegyi anyagok szemet érintő veszélyességükre tekintettel történő osztályozására és címkézésére alkalmazható in vitro vizsgálati módszer. Bár a BCOP vizsgálati módszer nem minősül a nyulakon végzett in vivo szemvizsgálatot önállóan helyettesítő vizsgálati módszernek, első lépésként ajánlott a Scott és társai (5) által javasolt felülről építkező megközelítéshez hasonló vizsgálati stratégia keretében a súlyos szemkárosodást okozó vegyi anyagok, azaz a további vizsgálat nélkül az ENSZ-GHS szerinti 1. kategóriába sorolandó vegyi anyagok (4) azonosítására. A BCOP vizsgálati módszer ajánlott az ENSZ-GHS-ben meghatározott, a szemirritáció vagy a súlyos szemkárosodás tekintetében besorolást nem igénylő (az ENSZ-GHS szerinti kategória nélküli) vegyi anyagok (4) olyan vizsgálati stratégia keretében történő azonosítására, mint az alulról építkező megközelítés (5). Azonban az a vegyi anyag, amely a BCOP vizsgálati módszerrel előreláthatólag nem okoz súlyos szemkárosodást vagy nem tartozik a szemirritáció/súlyos szemkárosodás tekintetében nem besorolt anyagok közé, további (in vitro és/vagy in vivo) vizsgálatot tenne szükségessé a végleges osztály megállapításához.
E vizsgálati módszer célja a vizsgálati vegyi anyag szemet érintő veszélyességi potenciáljának értékelésére használt eljárások ismertetése annak alapján, hogy az anyag izolált szarvasmarha-szaruhártyában kivált-e opacitást és fokozott permeabilitást. A szaruhártyára gyakorolt toxikus hatások jellemzése i. a csökkent fényátbocsátás (opacitás) és ii. a fluoreszcein-nátrium festékanyag fokozott áthatolása (permeabilitás) mérésével történik. A szaruhártya vizsgálati vegyi anyagnak való expozícióját követően megállapítható opacitásból és permeabilitásból együttesen kell származtatni az ún. in vitro irritációs pontszámot (In Vitro Irritancy Score, a továbbiakban: IVIS), amely a vizsgálati vegyi anyag irritáció szempontjából való osztályba sorolására szolgál.
A fogalommeghatározások az 1. függelékben találhatók.
KIINDULÁSI MEGFONTOLÁSOK ÉS KORLÁTOK
Ez a vizsgálati módszer az ICCVAM BCOP vizsgálati módszerről szóló protokollján (6) (7) alapul, amelynek kidolgozása eredetileg az Institute for in vitro Sciences (In Vitro Tudományok Intézete; IIVS) protokolljából és a 124. INVITTOX-protokollból (8) származó információk alapján történt. Ez utóbbi az Európai Közösség által támogatott, 1997–1998-ban végzett elővalidációs vizsgálathoz használt protokoll. Mindkét protokoll alapja az a BCOP vizsgálati módszer volt, amelyről elsőként Gautheron és társai (9) számoltak be.
A BCOP vizsgálati módszer alkalmazható az ENSZ-GHS-ben meghatározott, súlyos szemkárosodást okozó vegyi anyagok, azaz az ENSZ-GHS szerinti 1. kategóriába (4) sorolandó vegyi anyagok azonosítására. Erre a célra történő alkalmazásakor a BCOP vizsgálati módszer általános pontossága 79 % (150/191), hamis pozitív aránya 25 % (32/126), hamis negatív aránya pedig 14 % (9/65) a nyulakon végzett in vivo szemvizsgálati módszer ENSZ-GHS osztályozási rendszer szerint besorolt adataival való összevetéskor (3) (lásd a 2. függelék 1. táblázatát). Amikor bizonyos kémiai osztályokba (például alkoholok, ketonok) vagy fizikai osztályokba (például szilárd anyagok) tartozó vizsgálati vegyi anyagok nem szerepelnek az adatbázisban, a BCOP vizsgálati módszer általános pontossága 85 % (111/131), hamis pozitív aránya 20 % (16/81), hamis negatív aránya pedig 8 % (4/50) az ENSZ-GHS osztályozási rendszer vonatkozásában (3). A BCOP vizsgálati módszernek a súlyos szemkárosodást okozó (az ENSZ-GHS szerinti 1. kategóriába sorolt) vegyi anyagok azonosítására történő alkalmazásakor felmerülő hiányosságai a validációs adatbázisban az alkoholok és a ketonok esetében tapasztalt magas hamis pozitív arányokon és a szilárd anyagok esetében tapasztalt magas hamis negatív arányon alapulnak (1) (2) (3). Mivel azonban a BCOP vizsgálati módszerrel nem minden alkohol és keton előrejelzése túlzó, és a módszer egyes alkoholokat és ketonokat helyesen jelez előre az ENSZ-GHS szerinti 1. kategóriába tartozóként, ez a két szerves funkciós csoport nem tekintendő a vizsgálati módszer alkalmazási területén kívül esőnek. A vizsgálati módszer alkalmazójának kell eldöntenie azt, hogy valamely alkohol vagy keton túlzó előrejelzése elfogadható-e, illetve azt, hogy kell-e további vizsgálatot végezni az adatok bizonyító erejének mérlegelésén alapuló megközelítés keretében. A szilárd anyagok esetében tapasztalt hamis negatív arányok tekintetében megjegyzendő, hogy változó és szélsőséges expozíciós körülményekhez vezethetnek a Draize-féle in vivo szemirritációs vizsgálat során, ami a tényleges irritációs hatásukra (10) vonatkozó irreleváns előrejelzéseket eredményezhet. Megjegyzendő az is, hogy a súlyos szemkárosodást okozó (az ENSZ-GHS szerinti 1. kategóriába tartozó) vegyi anyagok azonosításával összefüggésben az ICCVAM validációs adatbázisában (2) (3) meghatározott hamis negatív arányok következtében az IVIS értéke egyik esetben sem lett ≤ 3, amely érték az ENSZ-GHS szerint a nem besorolt vegyi anyagok azonosítására használt kritérium. Ezen túlmenően a BCOP szerinti hamis negatív arányok ebben az összefüggésben nem kritikus jelentőségűek, mivel minden 3-nál nagyobb, de legfeljebb 55 IVIS értékű vizsgálati vegyi anyag vizsgálatára sor kerülne más, megfelelően validált in vitro vizsgálatokkal, vagy – a szabályozási követelményektől függően, az adatok bizonyító erejének mérlegelésén alapuló megközelítés keretébe tartozó lépcsőzetes vizsgálati stratégia segítségével – utolsó lehetőségként nyulakon végzett vizsgálatokkal. Mivel a BCOP vizsgálati módszer egyes szilárd vegyi anyagokat helyesen jelez előre az ENSZ-GHS szerinti 1. kategóriába tartozóként, ez a halmazállapot szintén nem minősül a vizsgálati módszer alkalmazási területén kívül esőnek. A vizsgálók valamennyi típusú vegyi anyag esetében mérlegelhetik e vizsgálati módszer alkalmazását, amellyel 55-nél magasabb IVIS értéket további vizsgálat nélkül az ENSZ-GHS szerinti 1. kategóriába sorolandó súlyos szemkárosodást okozó reakcióra utaló jelként kell elfogadni. Ahogyan azonban már említésre került, az alkoholok és a ketonok esetében a kapott pozitív eredményeket az esetlegesen túlzó előrejelzés kockázata miatt óvatosan kell értelmezni.
A BCOP vizsgálati módszer az ENSZ-GHS osztályozási rendszer (4) szerint a szemirritáció vagy a súlyos szemkárosodás tekintetében besorolást nem igénylő vegyi anyagok azonosítására is alkalmazható. Erre a célra történő alkalmazásakor a BCOP vizsgálati módszer általános pontossága 69 % (135/196) hamis pozitív aránya 69 % (61/89), hamis negatív aránya pedig 0 % (0/107) a nyulakon végzett in vivo szemvizsgálati módszer ENSZ-GHS osztályozási rendszer szerint besorolt adataival való összevetéskor (3) (lásd a 2. függelék 2. táblázatát). A kapott hamis pozitív arány (a 3-nál magasabb IVIS értéket mutató, az ENSZ-GHS szerint kategória nélküli vegyi anyagok in vivo vizsgálata, lásd a 47. pontot) rendkívül magas, de ebben az összefüggésben nem kritikus jelentőségű, mivel a minden 3-nál nagyobb, de legfeljebb 55 IVIS értékű vegyi anyagot ezután más, megfelelően validált in vitro vizsgálatoknak vetnek alá, vagy utolsó lehetőségként – a szabályozási követelményektől függően, az adatok bizonyító erejének mérlegelésén alapuló megközelítés keretébe tartozó lépcsőzetes vizsgálati stratégia segítségével – nyulakon is megvizsgálják. A BCOP vizsgálati módszer nem mutat hiányosságokat az alkoholok, a ketonok és a szilárd anyagok vizsgálata tekintetében, amikor a cél a szemirritáció vagy a súlyos szemkárosodás tekintetében besorolást nem igénylő (az ENSZ-GHS szerint kategória nélküli) vegyi anyagok azonosítása (3). A vizsgálók valamennyi típusú vegyi anyag esetében mérlegelhetik e vizsgálati módszer alkalmazását, amellyel a negatív eredményt (IVIS ≤ 3) arra utaló jelzésként kell elfogadni, hogy besorolás nem szükséges (az ENSZ-GHS szerint kategória nélküli). Mivel a BCOP vizsgálati módszer a szemirritáció vagy a súlyos szemkárosodás tekintetében besorolást nem igénylő vegyi anyagoknak csak a 31 %-át tudja helyesen azonosítani, nem lehet első választási lehetőség az alulról építkező megközelítés (5) megkezdéséhez, ha rendelkezésre állnak más validált és elfogadott, hasonló érzékenységű, de specifikusabb in vitro módszerek.
A BCOP validációs adatbázis összesen 113 anyagot és 100 keveréket tartalmazott (2) (3). A BCOP vizsgálati módszer ezért az anyagok és a keverékek vizsgálatára egyaránt alkalmazhatónak tekintendő.
Az ENSZ-GHS szerinti 1. kategóriába tartozó, az ENSZ-GHS szerinti 2., 2A. vagy 2B. kategóriába alulosztályozott vegyi anyagok, valamint az ENSZ-GHS szerinti nem besorolt kategóriába tartozó, az ENSZ-GHS szerinti 2., 2A. vagy 2B. kategóriába felülosztályozott vegyi anyagok jelentős száma miatt a BCOP vizsgálati módszer nem ajánlott olyan vizsgálati vegyi anyagok azonosítására, amelyeket szemirritáló hatásúként (azaz az ENSZ-GHS szerinti 2. vagy 2A. kategóriába tartozóként) kell besorolni, illetve olyan vizsgálati vegyi anyagok azonosítására, amelyeket enyhén szemirritáló hatásúként (az ENSZ-GHS szerinti 2B. kategóriába tartozóként) kell besorolni (2) (3). E célból egy másik megfelelő módszerrel végzett további vizsgálatra lehet szükség.
A szarvasmarhaszemmel és a szarvasmarha-szaruhártyával végzett valamennyi eljárás során be kell tartani a vizsgáló intézménynek az állati eredetű anyagok – ideértve többek között, de nem kizárólag a szöveteket és a szöveti folyadékokat – kezelésére vonatkozó rendelkezéseit és eljárásait. Ajánlott továbbá követni az általános laboratóriumi óvintézkedéseket is (11).
Bár a BCOP vizsgálati módszer nem veszi figyelembe a kötőhártya- és az íriszsérüléseket, foglalkozik a szaruhártyára kifejtett hatásokkal, amelyek leginkább befolyásolják az in vivo besorolást az ENSZ-GHS osztályozás alkalmazásában. Önmagában a BCOP vizsgálati módszerrel nem értékelhető a szaruhártya-léziók visszafordíthatósága. Nyulakon végzett szemvizsgálatok alapján korábban azt javasolták, hogy a szaruhártya-sérülés kezdeti mélységének értékelése alkalmazható a visszafordíthatatlan hatások bizonyos típusainak azonosítására (12). További tudományos ismeretekre van azonban szükség annak megértéséhez, hogy a kezdeti nagyon súlyos sérüléssel össze nem függő visszafordíthatatlan hatások hogyan következnek be. Végezetül a BCOP vizsgálati módszer nem alkalmas a szembe kerülés következtében fellépő szisztémás toxicitási potenciál megítélésére.
Ez a vizsgálati módszer rendszeres időközönkénti frissítés tárgyát fogja képezni az új információk és adatok figyelembevételekor. Például kórszövettani vizsgálatok esetlegesen hasznosak lehetnek, ha a szaruhártya-károsodás teljesebb körű jellemzésére van szükség. Ahogyan a 160. OECD-iránymutatásban (13) vázlatosan szerepel, a felhasználóknak érdemes tartósítaniuk a szaruhártyákat és azokból kórszövettani mintákat preparálniuk, amelyek felhasználhatóak a vizsgálati módszer pontosságát esetlegesen tovább javító adatbázis fejlesztéséhez és döntési kritériumok kidolgozásához.
Minden olyan laboratóriumnak, amely először alkalmazza ezt a vizsgálati módszert, a 3. függelékben felsorolt jártassági tesztanyagokat kell használnia. Mielőtt a laboratórium a BCOP vizsgálati módszer adatait a szabályozási követelmények szerinti veszélyességi osztályozás céljaira rendelkezésre bocsátaná, e vegyi anyagok vizsgálatával demonstrálhatja a BCOP vizsgálati módszer végrehajtásában való szakmai jártasságát.
A VIZSGÁLAT ELVE
A BCOP vizsgálati módszer olyan organotipikus módszer, amely rövid távon in vitro fenntartja a szarvasmarhák izolált szaruhártyájának normál fiziológiai és biokémiai működését. E vizsgálati módszerrel a vizsgálati vegyi anyag által okozott károsodás értékelése a szaruhártya opacitásváltozásának opaciméterrel, illetőleg permeabilitásváltozásának látható fényes spektrofotométerrel való kvantitatív mérése útján történik. Mindkét mérés az IVIS értékének kiszámítására használatos, amely a vizsgálati vegyi anyag in vivo szemirritációs potenciáljának előrejelzését megalapozó in vitro irritációs veszélyességi osztályozási kategória megállapítására szolgál (lásd a 48. pontban található döntési kritériumokat).
A BCOP vizsgálati módszer frissen levágott szarvasmarhából izolált szaruhártyákat használ fel. A szaruhártya opacitásának mérése kvantitatív módon, a szaruhártyán átbocsátott fény mennyiségének mérésével történik. A permeabilitás mérése ugyancsak kvantitatív módon, a szaruhártya teljes vastagságán áthatoló és a hátsó kamrában található közegben kimutatható fluoreszcein-nátrium festékanyag mennyiségének mérésével történik. A vizsgálati vegyi anyagoknak a szaruhártya felhámjának felületére történő felvitele a szaruhártyatartó elülső kamrájába történő bevitellel történik. A 4. függelék tartalmazza a BCOP vizsgálati módszer során felhasznált szaruhártyatartó leírását és ábráját. A szaruhártyatartó a kereskedelmi forgalomban különféle forrásokból beszerezhető, vagy saját használatra megépíthető.
A szarvasmarhaszemek származása és életkora, valamint az állatfaj kiválasztása
A vágóhídon a szarvasmarhákat jellemzően emberi fogyasztás céljából vagy más kereskedelmi felhasználás céljából ölik le. A BCOP vizsgálati módszer keretében felhasználandó szaruhártyák csak az emberi élelmiszerláncba való bekerülésre alkalmasnak minősülő, egészséges állatokból vehetők. Mivel a szarvasmarhák tömege fajtától, életkortól és nemtől függőn jelentős mértékben eltérhet, a vágásra kerülő állatok tekintetében nincs ajánlott tömeg.
Különböző életkorú állatokból származó szemek esetén a szaruhártya mérete változó lehet. A 30,5 mm vízszintes átmérőt meghaladó és legalább 1 100 μm középponti vastagságú szaruhártyák általában nyolcévesnél idősebb, a 28,5 mm átmérő és 900 μm középponti vastagság alatti szaruhártyák általában ötévesnél fiatalabb szarvasmarhából származnak (14). Emiatt nem szokás 60 hónaposnál idősebb szarvasmarhákból származó szaruhártyákat felhasználni. Hagyományosan nem szokás 12 hónaposnál fiatalabb szarvasmarhákból származó szemeket sem felhasználni, mivel ebben az életkorban a szemek még fejlődésben vannak, és a szaruhártya vastagsága és átmérője lényegesen kisebb a kifejlett szarvasmarhából származó szaruhártyákon mért értékeknél. Előnyeikre való tekintettel ugyanakkor megengedhető a fiatal (6 és 12 hónap közötti életkorú) állatokból származó szaruhártyák használata is, mivel ezek nagyobb mennyiségben állnak rendelkezésre, szűkebb az életkori tartományuk, és ez esetben kisebb a személyzet szarvasmarhák szivacsos agyvelőbántalmával szembeni esetleges kitettsége is (15). Mivel a szaruhártya méretének vagy vastagságának a korróziót és az irritációt okozó vegyi anyagokkal szembeni reagálási képességre gyakorolt hatásával kapcsolatban hasznos lenne további értékelést végezni, a felhasználóknak célszerű beszámolniuk az egyes vizsgálatokban felhasznált szaruhártyákat adó állatok becsült életkoráról és/vagy tömegéről.
A szemek begyűjtése és beszállítása a laboratóriumba
A szemeket a vágóhíd alkalmazottai gyűjtik be. A mechanikai és egyéb károsodásnak a lehető legkisebb mértékűre való csökkentése érdekében a szemeket a halál bekövetkezése után mihamarabb el kell távolítani, és az eltávolítás után azonnal, illetve szállítás közben le kell hűteni. A szemek potenciálisan irritatív vegyi anyagokkal szembeni expozíciójának megelőzése érdekében a vágóhíd alkalmazottai az állat fejének leöblítésekor nem használhatnak mosószert.
A szemeket megfelelő méretű edénybe öntött, hűtött, Hank-féle kiegyenlített sóoldatba (HBBS-oldat) kell helyezni oly módon, hogy az oldat a szemeket teljesen ellepje, és azokat a laboratóriumba oly módon kell beszállítani, hogy a lehető legkisebb legyen a károsodás és/vagy a bakteriális fertőzés esélye. Mivel a szemek begyűjtése a vágás során történik, azok vérrel és más biológiai anyagokkal – többek között baktériumokkal és más mikroorganizmusokkal – érintkezhetnek. Ezért fontos annak biztosítása, hogy a kontamináció veszélye a lehető legkisebb legyen (például a szemeket tartalmazó edény nedves jégen tárolásával a begyűjtés és a szállítás során, a szemek szállítás közbeni tárolására használt HBSS-oldathoz antibiotikumok [például 100 IU/ml koncentrációban penicillin és 100 mg/ml koncentrációban sztreptomicin] hozzáadásával).
A szemek begyűjtése és a szaruhártyák BCOP vizsgálati módszer közbeni felhasználása között eltelt időnek a lehető legrövidebbnek kell lennie (a begyűjtésnek és a felhasználásnak jellemzően ugyanazon a napon meg kell történnie), és igazolni kell, hogy ez az idő nem befolyásolja a vizsgálat eredményeit. Ezek az eredmények a szemek kiválasztási kritériumain, valamint a pozitív és a negatív kontrollok reakcióin alapulnak. A vizsgálatban felhasznált valamennyi szemnek egy meghatározott napon begyűjtött szemállományból kell származnia.
A BCOP vizsgálati módszer során felhasznált szemek kiválasztási kritériumai
A szemek épségét a laboratóriumba való beérkezést követően gondosan meg kell vizsgálni a sérülések – többek között a fokozott opacitás, a karcolások és a rendellenes érburjánzás (neovaszkularizáció) – szempontjából. A vizsgálat céljára csak ép szemekből származó szaruhártyák használhatók fel.
Az egyes szaruhártyák minőségét a vizsgálat során később is kell értékelni. Azokat a szaruhártyákat, amelyek opacitása a kezdeti egyórás kiegyenlítődési időszak elteltével hét opacitásegységnél nagyobb vagy opaciméterrel azzal egyenértékű, valamint a felhasznált szaruhártyatartókat ki kell dobni (MEGJEGYZÉS: az opacimétert az opacitási egységek meghatározásához használt opacitás-etalonnal kell kalibrálni, lásd a 4. függeléket).
Minden kezelt csoportnak (a vizsgálati vegyi anyaggal kezelt csoportnak, a párhuzamos negatív és pozitív kontrolloknak) legalább három szemből kell állnia. A BCOP vizsgálati módszer során a negatív kontroll céljára három szaruhártyát kell felhasználni. Mivel minden szaruhártya a teljes szemgolyóból kivágással kerül eltávolításra, majd pedig rögzítésre kerül a szaruhártyakamrában, előfordulhat, hogy a kezelés mesterségesen befolyásolja az egyes szaruhártyák (a negatív kontrollt is ideértve) opacitás- és permeabilitásértékét. Ezenfelül, az IVIS számítása során a negatív kontrollal kezelt szaruhártyák opacitás- és permeabilitásértékeinek felhasználásával korrigálják a vizsgálati vegyi anyaggal és a pozitív kontrollal kezelt szaruhártyák opacitás- és permeabilitásértékeit.
ELJÁRÁS
A szemek előkészítése
Az ép szaruhártyákat a későbbi kezelés elősegítése érdekében oly módon kell preparálni, hogy az ínhártyából 2–3 mm-es perem maradjon, ügyelve arra, hogy a szaruhártya fel- és belhámja ne sérüljön. Az izolált szaruhártyákat fel kell erősíteni a külön erre a célra kialakított, a szaruhártya felhámjával érintkező elülső, illetve belhámjával érintkező hátsó kamrából álló szaruhártyatartókra. Mindkét kamrát (a hátsó kamrával kezdve) teljesen fel kell tölteni előmelegített, fenolvörösmentes Eagle-féle tápfolyadékkal (Eagle's Minimum Essential Medium, EMEM), ügyelve a buborékképződés megelőzésére. A berendezést ezt követően 32 ± 1 °C-on legalább egy órán át ekvilibrálni kell annak érdekében, hogy a szaruhártyák a közeggel kiegyenlítődjenek, és lehetőség szerint elérjék normális metabolikus aktivitásukat (a szaruhártya felületének hőmérséklete in vivo kb. 32 °C).
A kiegyenlítődési időszak eltelte után mindét kamrát friss, előmelegített, fenolvörösmentes Eagle-féle tápfolyadékkal fel kell tölteni, és minden egyes szaruhártyán le kell olvasni a kiindulási opacitásértéket. A makroszkopikus szöveti károsodást (például karcolásokat, elszíneződést, rendellenes érburjánzást) mutató, illetve a hétnél nagyobb vagy opaciméterrel azzal egyenértékű opacitású szaruhártyákat és a felhasznált szaruhártyatartókat el kell dobni. Legalább három szaruhártyát kell kiválasztani negatív (vagy oldószeres) kontrollként szolgáló szaruhártyaként. A megmaradó szaruhártyákat ezt követően kezelt csoportra és pozitív kontrollcsoportra kell osztani.
Mivel a víz fajhője nagyobb, mint a levegőé, a víz stabilabb hőmérsékleti viszonyokat biztosít az inkubáláshoz. Ezért a szaruhártyatartó és tartalmának 32 ± 1 °C hőmérsékleten való tartására vízfürdő használata ajánlott. A hőmérséklet állandóságának biztosítását szolgáló óvintézkedések (például a tartók és a közeg előmelegítése) mellett azonban használható levegős inkubátor is.
A vizsgálati vegyi anyag alkalmazása
Két eltérő kezelési protokoll használatos, az egyik a folyadékok és a szilárd és folyékony felületaktív anyagok, a másik pedig a nem felületaktív szilárd anyagok esetében.
A folyadékok vizsgálata hígítatlan állapotban történik. A félszilárd anyagok, krémek és gyanták vizsgálata rendszerint a folyadékokra vonatkozó protokoll szerint történik. A felületaktív anyagok vizsgálata 10 vegyesszázalék (m/V) koncentrációban, 0,9 %-os nátrium-klorid oldattal, desztillált vízzel vagy más olyan oldószerrel készített oldatban történik, amely igazoltan nem gyakorol káros hatást a vizsgálati rendszerre. Ha a hígítás koncentrációja ettől eltérő, akkor azt megfelelően meg kell indokolni. A felületaktív anyagokat tartalmazó keverékek hígítatlan állapotban vagy megfelelő koncentrációjúra hígított állapotban vizsgálhatók, a megfelelő in vivo expozíciós forgatókönyvtől függően. A vizsgált koncentrációt megfelelően meg kell indokolni. A szaruhártyákat a folyadéknak vagy felületaktív anyagnak 10 percig kell kitenni. Ettől eltérő expozíciós idő alkalmazását tudományos szempontból megfelelően meg kell indokolni. A felületaktív anyag és a felületaktív anyagot tartalmazó keverék fogalommeghatározását lásd az 1. függelékben.
A nem felületaktív szilárd anyagok jellemző vizsgálata 20 vegyesszázalék (m/V) koncentrációban, 0,9 %-os nátrium-klorid-oldattal, desztillált vízzel vagy más olyan oldószerrel készült oldat vagy szuszpenzió formájában történik, amely igazoltan nem gyakorol káros hatást a vizsgálati rendszerre. A szilárd anyagok bizonyos körülmények között és megfelelő tudományos indokolással hígítatlanul, a szaruhártya felületére a nyitott kamrás módszerrel (lásd a 32. pontot) való közvetlen felvitellel is vizsgálhatók. A szaruhártyát a szilárd anyagnak négy órán át kell kitenni, de a folyadékok és a felületaktív anyagok esetéhez hasonlóan – tudományos szempontú megfelelő indokolással – más expozíciós idő is alkalmazható.
A vizsgálati vegyi anyag fizikai jellegétől és kémiai tulajdonságaitól (például szilárd anyag vagy folyadék, viszkózus vagy nem viszkózus folyadék) függően más felviteli módok is alkalmazhatók. A legfontosabb annak biztosítása, hogy a vizsgálati vegyi anyag megfelelően beborítsa a felhám felületét, valamint az, hogy az öblítési lépések során megfelelően eltávolítsák. A nem és a kissé viszkózus, folyékony vizsgálati vegyi anyagok esetében jellemzően a zárt kamrás, míg a közepes és a nagy viszkozitású folyékony vizsgálati vegyi anyagok, illetve a tiszta szilárd anyagok esetében jellemzően a nyitott kamrás módszer használatos.
A zárt kamrás módszer esetében az elülső kamrába a szaruhártya felhámjának befedéséhez elegendő mennyiségű (750 μl) vizsgálati vegyi anyagot kell a kamra tetején található adagolónyílásokon keresztül bevinni, majd az expozíció idejére a nyílásokat a kamradugaszokkal le kell zárni. Fontos annak biztosítása, hogy valamennyi szaruhártya megfelelő időközig legyen kitéve a vizsgálati vegyi anyagnak.
A nyitott kamrás módszer esetében a kezelés előtt el kell távolítani az elülső kamra ablakzáró gyűrűjét és az ablaknyílás üvegét. A kontrollként szolgáló vagy a vizsgálati vegyi anyagot (750 μl vagy a szaruhártya teljes befedéséhez elegendő mennyiségben) mikropipettával közvetlenül a szaruhártya felhámjának felületére kell felvinni. Ha a vizsgálati vegyi anyagot nehezen lehet pipettába felszívni, az az adagolás elősegítése érdekében finnpipettába pumpálható. A finnpipetta hegyét bele kell helyezni a fecskendő adagolójába, hogy az anyagot nyomás alatt lehessen betölteni a hegybe. A fecskendő dugattyúját a pipetta szelepének felfelé húzásával egyidejűleg be kell nyomni. Ha a pipetta hegyében légbuborékok jelennek meg, a vizsgálati vegyi anyagot el kell távolítani (ki kell nyomni) és a műveletet mindaddig ismételni kell, amíg a pipetta hegye légbuborékok nélkül feltelik. Szükség esetén normál fecskendő is használható (tű nélkül), mivel lehetővé teszi a vizsgálati vegyi anyag mennyiségének pontos mérését és a szaruhártya felhámjának felületére való könnyebb felvitelét. Az adagolást követően a zárt rendszer visszaállítása érdekében az ablaknyílás üvegét vissza kell szerelni az elülső kamrára.
Inkubáció az expozíciót követően
Az expozíciós idő elteltével a vizsgálati vegyi anyagot, a negatív kontrollként vagy pozitív kontrollként szolgáló vegyi anyagot el kell távolítani az elülső kamrából, és a felhámot legalább háromszor (vagy mindaddig, amíg észlelhetőek a vizsgálati vegyi anyag látható nyomai) fenolvörös indikátort tartalmazó Eagle-féle tápfolyadékkal át kell mosni. Az öblítéshez azért kell fenolvörös indikátort tartalmazó közeget használni, mert a fenolvörös indikátor színváltozásának megfigyelésével ellenőrizhető a savas és a lúgos vizsgálati vegyi anyagok leöblítésének eredményessége. A szaruhártyát háromnál többször is le kell mosni, ha a fenolvörös indikátor még mindig elszíneződik (sárgára vagy lilára) vagy ha a vizsgálati vegyi anyag még mindig látható. A közeg vizsgálati vegyi anyagtól való megtisztítását követően a szaruhártyákat utoljára át kell öblíteni (fenolvörös indikátort nem tartalmazó) Eagle-féle tápfolyadékkal. Az utolsó öblítéshez azért kell (fenolvörös indikátort nem tartalmazó) Eagle-féle tápfolyadékot használni, mert így biztosítható az opacitásmérés előtt a fenolvörös indikátornak az elülső kamrából való eltávolítása. Ezt követően az elülső kamrát – fenolvörös indikátor bekeverése nélkül – ismételten fel kell tölteni friss Eagle-féle tápfolyadékkal.
Folyadékok és felületaktív anyagok esetében a szaruhártyákat az öblítést követően legalább további két órán át 32 ± 1 °C hőmérsékleten inkubálni kell. Bizonyos körülmények között hasznos lehet hosszabb utóexpozíciós időt alkalmazni, amiről eseti alapon kell dönteni. A szilárd anyagokkal kezelt szaruhártyákat a négyórás expozíciós idő végén alaposan le kell öblíteni, utóinkubáció azonban nem szükséges.
Folyadékok és felületaktív anyagok esetében az expozíciót követő inkubáció végén, nem felületaktív szilárd anyagok esetében a négyórás expozciós idő elteltével minden egyes szaruhártya opacitását és permeabilitását fel kell jegyezni. Egyben minden szaruhártyát szemrevételezéssel is meg kell vizsgálni, és a releváns észrevételeket (pl. szövetleválás, vizsgálati vegyi anyag maradéka, egyenetlen fényáteresztési minták) fel kell jegyezni. Ezek a megfigyelések fontosak lehetnek, mivel azok megjelenhetnek az opaciméteren leolvasott értékek eltéréseiben is.
Kontrollként szolgáló vegyi anyagok
Minden vizsgálatban párhuzamos negatív vagy oldószeres/vivőanyagos kontrollt és pozitív kontrollt is kell alkalmazni.
Hígítatlan folyékony anyagok vizsgálatakor a vizsgálati rendszer esetleges nem jellemző változásainak kimutatása és a vizsgálat végpontjaiban figyelembe veendő kiindulási értékek meghatározása céljából a BCOP vizsgálati módszerben párhuzamos negatív kontrollt (például 0,9 %-os nátrium-klorid oldatot vagy desztillált vizet) kell alkalmazni. Az egyidejű negatív kontroll alkalmazása egyben azt is biztosítja, hogy a vizsgálat körülményei ne eredményezzenek nem kívánt irritatív hatást.
Hígított folyadékok, felületaktív anyagok és szilárd anyagok vizsgálatakor a vizsgálati rendszer esetleges nem jellemző változásainak észlelése és a vizsgálat végpontjaiban figyelembe veendő kiindulási értékek meghatározása céljából a BCOP vizsgálati módszerben párhuzamos oldószeres/vivőanyagos kontrollt kell alkalmazni. Csak olyan oldószer, illetőleg vivőanyag alkalmazható, amely igazoltan nem gyakorol káros hatást a vizsgálati rendszerre.
Az a vegyi anyag, amelyről ismert, hogy pozitív hatást vált ki, minden vizsgálatban párhuzamos pozitív kontrollként szerepel a vizsgálati rendszer integritásának és helyes működtetésének igazolása érdekében. Annak érdekében azonban, hogy a pozitív kontrollnál jelentkező hatás időbeli változása is megfigyelhető legyen, az irritatív hatás nem lehet túlságosan erőteljes.
Folyékony vizsgálati vegyi anyagok esetében pozitív kontrollként például 100 %-os etanol vagy 100 %-os dimetil-formamid alkalmazható. Szilárd vizsgálati vegyi anyagok esetében pozitív kontrollként például 0,9 %-os nátrium-klorid-oldathoz 20 vegyesszázalék (m/V) koncentrációban adagolt imidazol alkalmazható.
A referencia-vegyianyagok jól használhatók egy adott kémiai vagy termékosztályba tartozó ismeretlen vegyi anyagok szemirritációs hatásának értékelésére vagy valamely szemirritációs anyag relatív irritatív hatásának az irritatív hatás egy adott tartományán belüli értékelésére.
Mért végpontok
Az opacitást a szaruhártyán átbocsátott fény mennyiségének mérésével kell meghatározni. A szaruhártya opacitásának kvantitatív mérése opaciméterrel történik, amely a mért opacitásértéket folyamatos skálán mutatja.
A permeabilitást a szaruhártya összes sejtrétegén (azaz a szaruhártya külső felületén a felhámtól a szaruhártya belső felületén a belhámig) áthatoló fluoreszcein-nátrium festékanyag mennyiségének mérésével kell meghatározni. A szaruhártyatartónak a felhámmal érintkező elülső kamráját 1 ml (folyadék vagy felületaktív anyag vizsgálata esetében 4 mg/ml, nem felületaktív szilárd anyag vizsgálata esetében 5 mg/ml) fluoreszcein-nátrium-oldattal, a belhámmal érintkező hátsó kamrát pedig friss EMEM oldattal kell feltölteni. A tartót ezt követően vízszintes helyzetben 90 ± 5 percig 32 ± 1 °C hőmérsékleten inkubálni kell. A hátsó kamrába áthatoló fluoreszcein-nátrium mennyiségének mérése ultraibolya- és látható fényes fényspektroszkópiás eljárással történik. Az eljárás keretében folyamatos skálán meg kell határozni és fel kell jegyezni a 490 nm-hez tartozó optikai sűrűségek (OD490) vagy abszorbanciák értékét. A fluoreszcein permeabilitásának értékeit szabványos 1 cm-es fényút alkalmazásával, a látható fényes spektrofotométerrel mért OD490 értékek alapján kell meghatározni.
Az előzőekben leírt módszer alternatívájaképpen 96 lyukú mikrotiterlemez-olvasó is alkalmazható azzal a feltétellel, hogy i. a fluoreszceines OD490 értékek meghatározásához megállapítható a lemezolvasó lineáris tartománya, és ii. a 96 lyukú lemezen annyi fluoreszceinmintát használnak, amennyi ahhoz szükséges, hogy az így meghatározott OD490 értékek megegyezzenek a szabványos 1 cm-es fényúttal mért értékekkel (ehhez teljesen [általában 360 μl-rel] feltöltött lyukak lehetnek szükségesek).
ADATOK ÉS JEGYZŐKÖNYVEZÉS
Az adatok kiértékelése
Azt követően, hogy az opacitás- és az átlagos permeabilitásértékeket (OD490) a háttéropacitás, illetve a negatív kontroll OD490 permeabilitásértékeinek figyelembevételével korrigálták, az egyes kezelt csoportok átlagos opacitás- és átlagos OD490 permabilitásértékeit egy kísérleti úton származtatott összefüggés segítségével kezelt csoportonként egyetlen jelzőszámmá, az in vitro irritációs pontszámmá (IVIS) kell alakítani:
IVIS = átlagopacitás + (15 × OD490 átlagpermeabilitás).
Sina és társai (16) szerint ezt a képletet belső és laboratóriumközi vizsgálatok keretében dolgozták ki. Egy több laboratóriumban 36 vegyületen elvégzett vizsgálatsorozat adatain többváltozós analízist hajtottak végre azon egyenlet meghatározása végett, amely az in vivo és az in vitro adatok között a legjobb illeszkedést biztosítja. Két különböző társaság tudományos szakemberei elvégezték ezt az analízist és közel azonos egyenleteket származtattak.
Az opacitás- és a permeabilitásértékeket egymástól függetlenül is ki kell értékelni annak meghatározására, hogy a vizsgálati vegyi anyag a korróziót vagy a súlyos irritációt nem csak a két végpont egyikében váltotta-e ki (lásd a döntési kritériumokat).
Döntési kritériumok
A vizsgálati vegyi anyagok súlyos szemkárosodást okozóként (az ENSZ-GHS szerinti 1. kategóriába tartozóként), valamint a szemirritáció vagy a súlyos szemkárosodás tekintetében besorolást nem igénylő (az ENSZ-GHS szerint kategória nélküli) vegyi anyagokként történő meghatározására szolgáló IVIS-határértékek az alábbiakban szerepelnek:
|
IVIS |
ENSZ-GHS |
|
≤ 3 |
Kategória nélküli |
|
> 3; ≤ 55 |
Előrejelzés nem végezhető |
|
> 55 |
1. kategória |
A vizsgálat elfogadhatósági kritériumai
A vizsgálat akkor minősül elfogadhatónak, ha a pozitív kontrollhoz tartozó IVIS érték az aktuális (legalább háromhavonta, illetőleg az ilyen vizsgálatot rendszertelenül, azaz havi egy alkalomnál ritkábban végző laboratóriumok esetében minden elfogadható vizsgálat után aktualizált) történeti átlag körüli két szórás intervalluma közé esik. A negatív vagy az oldószeres/vivőanyagos kontrollon tapasztalható hatásokhoz tartozó opacitás- és permeabilitásértékeknek kisebbnek kell lenniük az adott negatív kontrollal vagy oldószerrel/vivőanyaggal kezelt szarvasmarha-szaruhártya háttéropacitására és háttérpermeabilitására megállapított felső határnál. Ha a létrejött besorolás egyértelmű, akkor legalább három szaruhártya vizsgálatából álló egyszeri vizsgálatmenetnek elegendőnek kell lennie az adott vizsgálati vegyi anyag esetében. Az első vizsgálatmenet határesethez közeli eredményei esetében azonban fontolóra kell venni egy második vizsgálatmenetet (ez azonban nem feltétlenül szükséges), valamint egy harmadik vizsgálatmenetet is, ha az első két vizsgálatmenetnél nem egyezik meg az IVIS eredmények átlaga. Ebben az összefüggésben az első vizsgálatmenet eredménye akkor minősül határesethez közelinek, ha a három szaruhártyán alapuló előrejelzések nem egyeztek meg, például:
— a három szaruhártyából kettő eltérő előrejelzést adott a mindhárom szaruhártya átlagához viszonyítva, VAGY
— a három szaruhártyából egy a mindhárom szaruhártya átlagától eltérő előrejelzést adott, ÉS az eltérő eredmény 10-nél nagyobb IVIS-egység volt a küszöbértékhez (55) viszonyítva.
— Ha a megismételt vizsgálatmenet megerősíti az első vizsgálatmenet előrejelzését (az IVIS érték átlaga alapján), akkor további vizsgálat nélkül végleges döntést lehet hozni. Ha a megismételt vizsgálatmenet eltérő eredményt hoz az első vizsgálatmenethez képest (az IVIS érték átlaga alapján), akkor egy harmadik vizsgálatmenetet kell lefolytatni a kétértelmű előrejelzések eldöntése és a vizsgálati vegyi anyag osztályozása érdekében. Megengedhető lehet az osztályozás és a címkézés céljával végzendő további vizsgálatok elengedése, ha bármelyik vizsgálatmenet az ENSZ-GHS szerinti 1. kategóriát eredményez.
Vizsgálati jegyzőkönyv
A Vizsgálati jegyzőkönyvnek a következő információkat kell tartalmaznia, amennyiben azok a vizsgálat lefolytatása szempontjából relevánsak:
Vizsgálati vegyi anyagok és kontrollként szolgáló vegyi anyagok
— kémiai név (nevek): a Chemical Abstracts Service (CAS) szerinti szerkezeti név, ezt követően az egyéb ismert nevek, a CAS nyilvántartási szám, ha ismertek;
— a vizsgálati, illetve a kontrollként szolgáló vegyi anyag tisztasága és összetétele (tömegszázalékban), amennyiben ezek az információk rendelkezésre állnak;
— fizikai-kémiai tulajdonságok: halmazállapot, illékonyság, pH, stabilitás, kémiai osztály, vízoldékonyság, ha a vizsgálat szempontjából relevánsak;
— a vizsgálati, illetve a kontrollként szolgáló vegyi anyagok vizsgálatot megelőző kezelése, ha történt ilyen (például melegítés, porítás);
— stabilitás, ha ismert.
A megbízó és a vizsgálatot végző laboratórium adatai
— A megbízó, a vizsgálatot végző laboratórium és a vizsgálatvezető neve és címe.
A vizsgálati módszer körülményei
— az alkalmazott opaciméter (például modell és leírás) és a műszer beállításai;
— az opacitás és a permeabilitás mérésére használt műszerek (pl. opaciméter és spektrofotométer) kalibrálási adatai a mérések linearitásának biztosítása érdekében;
— a használt szaruhártyatartók típusa (például modell és leírás);
— az egyéb berendezések leírása;
— a vizsgálati módszer időbeli integritásának (például pontosságának és megbízhatóságának) biztosítására alkalmazott módszer (például a jártassági tesztanyagok rendszeres időközönkénti vizsgálata).
A vizsgálat elfogadhatóságának kritériumai
— a párhuzamos pozitív és negatív kontrollokra vonatkozó elfogadható tartományok a történeti adatok alapján;
— adott esetben az elfogadható párhuzamos referencia-kontrolltartományok a történeti adatok alapján.
A szemek begyűjtése és preparálása
— a szemek beszerzési helyének (azaz a begyűjtési létesítményük) megjelölése;
— a szaruhártya átmérője, amellyel a donorállat életkora és a vizsgálatra való alkalmassága mérhető;
— a szemek tárolásának és szállításának körülményei (például a szemek begyűjtésének dátuma és időpontja, a vizsgálat megkezdéséig eltelt idő, a szállítóeszköz és a hőmérsékleti viszonyok, az alkalmazott antibiotikumok);
— a szarvasmarha-szaruhártyák preparálása és tárgylemezre helyezése, többek között a minőségükre, a szaruhártyatartók hőmérsékletére, valamint a vizsgálathoz felhasznált szaruhártyák kiválasztási kritériumaira vonatkozó megjegyzések.
Vizsgálati eljárás
— az alkalmazott párhuzamosok száma;
— az alkalmazott negatív és pozitív kontrollok meghatározása (adott esetben az oldószeres és a referenciakontrolloké is);
— a vizsgálati vegyi anyag koncentrációja (koncentrációi), alkalmazása, expozíciós ideje és az expozíciót követő inkubáció ideje;
— az alkalmazott értékelési és döntési kritériumok leírása;
— az alkalmazott vizsgálat-elfogadhatósági kritériumok leírása;
— a vizsgálati eljárás bármilyen változtatásának leírása;
— az alkalmazott döntési kritériumok leírása.
Eredmények
— minden egyes vizsgált minta adatainak táblázatos formába foglalása (például a vizsgálati vegyi anyag, a pozitív, a negatív és a referenciakontrollok [ha voltak ilyenek] opacitás-, OD490 és kiszámított IVIS értékei táblázatos formában, ideértve adott esetben a megismételt párhuzamos kísérletek adatait, valamint az egyes kísérletek esetében az átlag ± a szórás megadásával);
— a megfigyelt egyéb hatások leírása;
— a származtatott in vitro ENSZ-GHS besorolás, amennyiben alkalmazandó.
Az eredmények tárgyalása
Következtetés
SZAKIRODALOM
(1) ICCVAM (2006). Test Method Evaluation Report – In Vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No.: 07-4517. Elérhető az alábbi címen: http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_tmer.htm.
(2) ICCVAM (2010). ICCVAM Test Method Evaluation Report: Current Validation Status of In Vitro Test Methods Proposed for Identifying Eye Injury Hazard Potential of Chemicals and Products. NIH Publication No.10-7553. Research Triangle Park, NC:National Institute of Environmental Health Sciences. Elérhető az alábbi címen: http://iccvam.niehs.nih.gov/methods/ocutox/MildMod-TMER.htm.
(3) OECD (2013). Streamlined Summary Document supporting the Test Guideline 437 for eye irritation/corrosion. Series on Testing and Assessment, No.189, OECD, Paris.
(4) UN (2011). United Nations Globally Harmonized System of Classification and Labelling of Chemicals (GHS), ST/SG/AC.10/30 Rev 4, New York and Geneva: United Nations. Elérhető az alábbi címen: http://www.unece.org/trans/danger/publi/ghs/ghs_rev04/04files_e.html.
(5) Scott, L., Eskes, C., Hoffmann, S., Adriaens, E., Alépée, N., Bufo, M., Clothier, R., Facchini, D., Faller, C., Guest, R., Harbell, J., Hartung, T., Kamp, H., Le Varlet, B., Meloni, M., McNamee, P., Osborne, R., Pape, W., Pfannenbecker, U., Prinsen, M., Seaman, C., Spielman, H., Stokes, W., Trouba, K., Van den Berghe, C., Van Goethem, F., Vassallo, M., Vinardell, P., and Zuang, V. (2010). A proposed eye irritation testing strategy to reduce and replace in vivo studies using Bottom-Up and Top-Down approaches. Toxicol. in Vitro 24:1-9.
(6) ICCVAM (2006). ICCVAM Recommended BCOP Test Method Protocol. In: ICCVAM Test Method Evaluation Report – in vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No.: 07-4517. Elérhető az alábbi címen: http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_tmer.htm.
(7) ICCVAM (2010). ICCVAM Recommended BCOP Test Method Protocol. In: ICCVAM Test Method Evaluation Report – Current Validation Status of In Vitro Test Methods Proposed for Identifying Eye Injury Hazard Potential of Chemicals and Products. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No.: 10-7553A. Elérhető az alábbi címen: http://iccvam.niehs.nih.gov/methods/ocutox/MildMod-TMER.htm.
(8) INVITTOX (1999). Protocol 124: Bovine Corneal Opacity and Permeability Assay – SOP of Microbiological Associates Ltd. Ispra, Italy: European Centre for the Validation of Alternative Methods (ECVAM).
(9) Gautheron, P., Dukic, M., Alix, D. and Sina, J.F. (1992). Bovine corneal opacity and permeability test: An in vitro assay of ocular irritancy. Fundam. Appl. Toxicol. 18:442-449.
(10) Prinsen, M.K. (2006). The Draize Eye Test and in vitro alternatives; a left-handed marriage? Toxicol. in Vitro 20:78-81.
(11) Siegel, J.D., Rhinehart, E., Jackson, M., Chiarello, L., and the Healthcare Infection Control Practices Advisory Committee (2007). Guideline for Isolation Precautions: Preventing Transmission of Infectious Agents in Healthcare Settings. Elérhető az alábbi címen: [http://www.cdc.gov/ncidod/dhqp/pdf].
(12) Maurer, J.K., Parker, R.D. and Jester, J.V. (2002). Extent of corneal injury as the mechanistic basis for ocular irritation: key findings and recommendations for the development of alternative assays. Reg. Tox. Pharmacol. 36:106-117.
(13) OECD (2011). Guidance Document on The Bovine Corneal Opacity and Permeability (BCOP) and Isolated Chicken Eye (ICE) Test Methods: Collection of Tissues for Histological Evaluation and Collection of Data on Non-severe Irritants. Series on Testing and Assessment, No. 160. Adopted October 25, 2011. Paris: Organisation for Economic Co-operation and Development.
(14) Doughty, M.J., Petrou, S. and Macmillan, H. (1995). Anatomy and morphology of the cornea of bovine eyes from a slaughterhouse. Can. J. Zool. 73:2159-2165.
(15) Collee, J. and Bradley, R. (1997). BSE: A decade on – Part I. The Lancet 349: 636-641.
(16) Sina, J.F., Galer, D.M., Sussman, R.S., Gautheron, P.D., Sargent, E.V., Leong, B., Shah, P.V., Curren, R.D., and Miller, K. (1995). A collaborative evaluation of seven alternatives to the Draize eye irritation test using pharmaceutical intermediates. Fundam. Appl. Toxicol. 26:20-31.
(17) E melléklet B.5., akut toxicitás: szemirritáció/szemkorróziós hatás című fejezete.
(18) ICCVAM (2006). Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Bovine Corneal Opacity and Permeability Test Method. NIH Publication No.: 06-4512. Research Triangle Park: National Toxicology Program. Elérhető az alábbi címen: [http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_bcop.htm].
(19) OECD (1998). Series on Good Laboratory Practice and Compliance Monitoring. No. 1: OECD Principles on Good Laboratory Practice (revised in 1997).
Elérhető a következő címen: http://www.oecd.org/document/63/0,3343,en_2649_34381_2346175_1_1_1_1,00.html
1. függelék
FOGALOMMEGHATÁROZÁSOK
Pontosság : a vizsgálati módszerrel kapott eredmények és az elfogadott referenciaértékek közötti egyezés mértéke. A vizsgálati módszer teljesítőképességének mértékét mutatja, és relevanciájának egyik szempontja. A kifejezés gyakran használatos az »egyezés« szó megfelelőjeként, amely arra utal, hogy egy adott vizsgálati módszer milyen arányban szolgáltat helyes eredményeket.
Referencia-vegyianyag : a vizsgálati vegyi anyaggal való összehasonlítás céljából etalonként használt vegyi anyag. A referencia-vegyianyagnak a következő tulajdonságokkal kell rendelkeznie: i. állandó és megbízható forrás(ok)ból kell származnia; ii. a vizsgálati vegyi anyagok osztályához hasonló szerkezettel és funkcionalitással kell rendelkeznie; iii. ismert fizikai-kémiai tulajdonságokkal kell rendelkeznie; iv. rendelkezésre kell állnia az ismert hatásait alátámasztó adatoknak; és v. a kívánt hatástartományban ismert hatásúnak kell lennie.
Alulról építkező megközelítés : a szemirritáció vagy a súlyos szemkárosodás tekintetében feltehetőleg besorolást nem igénylő vegyi anyag esetén alkalmazott lépcsőzetes megközelítés, amely a besorolást nem igénylő vegyi anyagok (negatív eredmény) más vegyi anyagokhoz (pozitív eredmény) viszonyított meghatározásával kezdődik.
Vegyi anyag : anyag vagy keverék.
Szaruhártya : a szemgolyó elülső részén az íriszt és a pupillát fedő és a szem belsejébe a fényt bevezető, áttetsző rész.
Szaruhártya opacitása : a szaruhártya vizsgálati vegyi anyagnak való expozícióját követő átlátszatlanság mértékét leíró jellemző. Az opacitás megnövekedése a szaruhártya károsodását jelzi. Az opacitás értékelése történhet szubjektív módon (mint például a nyulakon végzett Draize-féle szemvizsgálatban) vagy objektív módszerrel (műszerrel, például opaciméterrel).
Szaruhártya permeabilitása : a szaruhártya felhámjának károsodását leíró számadat; meghatározása a szaruhártya összes sejtrétegén áthatoló fluoreszcein-nátrium festékanyag mennyiségének mérése alapján történik.
Szemirritáció : a vizsgálati vegyi anyagnak a szem elülső felszínén történő alkalmazását követően megjelenő és az alkalmazástól számított 21 napon belül teljes mértékben visszafordítható szemelváltozások. Megfelel a »Reverzibilis szemkárosodás« fogalmának és az »ENSZ-GHS szerinti 2. kategóriának« (4).
Hamis negatív arány : a vizsgálati módszer alkalmazása során tévesen negatívnak minősített pozitív vegyi anyagok részaránya. A hamis negatív arány a vizsgálati módszer teljesítőképességének egyik mutatója.
Hamis pozitív arány : a vizsgálati módszer alkalmazása során tévesen pozitívnak minősített negatív vegyi anyagok részaránya. A hamis pozitív arány a vizsgálati módszer teljesítőképességének egyik mutatója.
Veszély : valamely anyag vagy helyzet azon velejáró sajátossága, hogy káros hatásokat képes előidézni egy élő szervezetet, egy rendszert vagy egy (al)populációt érintő expozíciója esetén.
In vitro irritációs pontszám (IVIS) : a BCOP vizsgálati módszer során alkalmazott, kísérleti úton származtatott összefüggés, amely az egyes kezelt csoportok opacitásának és permeabilitásának átlagértékeit minden egyes kezelt csoportra egyetlen in vitro pontszám formájában fejezi ki. IVIS = átlagopacitás + (15 x átlagpermeabilitás).
Irreverzibilis szemkárosodás : lásd: »Súlyos szemkárosodás«.
Keverék : két vagy több anyagból álló keverék vagy oldat, amelyben az anyagok nem lépnek egymással reakcióba (4).
Negatív kontroll : a vizsgálati rendszer valamennyi alkotóelemét tartalmazó kezeletlen replikátum. Ezt a mintát a vizsgálati vegyi anyaggal kezelt mintákkal és más kontrollmintákkal együtt dolgozzák fel annak megállapítása érdekében, hogy az oldószer kölcsönhatásba lép-e a vizsgálati rendszerrel.
Nem besorolt : a szemirritáció tekintetében (az ENSZ-GHS szerinti 2., 2A. vagy 2B. kategóriába tartozóként) nem besorolt vagy a súlyos szemkárosodás tekintetében (az ENSZ-GHS szerinti 1. kategóriába tartozóként) nem besorolt vegyi anyagok. Megfeleltethető az ENSZ-GHS szerinti »kategória nélküli« vegyi anyagoknak.
Opaciméter : a szaruhártya fényátbocsátását kvantitatív módon értékelő, a szaruhártya opacitásának mérésére alkalmazott műszer. Rendszerint két kamrából áll, amelyek mindegyike saját fényforrással és fotocellával van ellátva. Az egyik kamrában helyezkedik el a kezelt szaruhártya, míg a másik a műszer kalibrálására és alaphelyzetbe állítására szolgál. Egy kontrollrekeszt (folyadékkal nem töltött üres kamra ablakok nélkül) halogénlámpa fényével átvilágítanak, a fényt fotocellával érzékelik, és ezt összevetik a szaruhártyát tartalmazó kamrát magában foglaló vizsgálati rekeszen átvezetett, fotocellával érzékelt fénnyel. A fotocellák segítségével mért fényátbocsátás eltérését összevetik, és az ebből adódó számszerű opacitásérték digitális kijelzőn jelenik meg.
Pozitív kontroll : a vizsgálati rendszer valamennyi alkotóelemét tartalmazó, ismert pozitív hatást kiváltó vegyi anyaggal kezelt replikátum. Annak biztosítása érdekében, hogy a pozitív kontrollválaszban jelentkező hatás időbeli változását fel lehessen mérni, a pozitív hatás nem lehet túlságosan erőteljes.
Reverzibilis szemkárosodás : lásd: »Szemirritáció«.
Megbízhatóság : a vizsgálati módszer laboratóriumon belüli és laboratóriumok közötti időbeli reprodukálhatóságának mértéke ugyanazon protokoll alkalmazása mellett. Megállapítása a laboratóriumon belüli és a laboratóriumok közötti reprodukálhatóság, valamint a laboratóriumon belüli megismételhetőség kiszámításával történik.
Súlyos szemkárosodás : a vizsgálati vegyi anyagnak a szem külső felületére való juttatását követő olyan szövetkárosodás kialakulása, vagy a látás olyan súlyos fizikai romlása, amely a behatást követő 21 napon belül nem fordítható vissza teljes mértékben. Megfeleltethető az »Irreverzibilis szemkárosodás« fogalmának és az »ENSZ-GHS szerinti 1. kategóriának« (4).
Oldószeres/vivőanyagos kontroll : a vizsgálati rendszer valamennyi alkotóelemét az oldószerrel vagy vivőanyaggal együtt tartalmazó kezeletlen minta, amelyet hozzáadnak a vizsgálati vegyi anyaggal kezelt mintákhoz és más kontrollmintákhoz, és ennek alapján megállapíthatók az ugyanazon oldószerben oldott vagy vivőanyaggal felvitt vizsgálati vegyi anyaggal kezelt minták kiindulási értékei. A minta párhuzamos negatív kontrollal elvégzett vizsgálatával az is megállapítható, hogy az oldószer vagy vivőanyag kölcsönhatásba lép-e a vizsgálati rendszerrel.
Anyag : természetes állapotban előforduló vagy ipari termelőfolyamatból származó kémiai elemek és azok vegyületei, amelyek a termék stabilitásának megőrzéséhez szükséges adalékanyagokat és az alkalmazott folyamatból származó szennyeződéseket is tartalmazhatnak, de nem tartalmaznak olyan oldószereket, amelyek az anyag stabilitásának befolyásolása vagy összetételének megváltozása nélkül elkülöníthetők (4).
Felületaktív anyag : olyan anyag (például mosószer), amely képes csökkenteni a folyadékok felületi feszültségét, és így lehetővé tenni azok habképződését vagy szilárd anyagokba történő bejutását.
Felületaktív anyagot tartalmazó keverék : e vizsgálati módszer összefüggésében olyan keverék, amely egy vagy több felületaktív anyagot tartalmaz, 5 %-nál magasabb végső koncentrációban.
Felülről építkező megközelítés : a feltehetőleg súlyos szemkárosodást okozó vegyi anyag esetén alkalmazott lépcsőzetes megközelítés, amely a súlyos szemkárosodást okozó vegyi anyagok (pozitív eredmény) más vegyi anyagokhoz (negatív eredmény) viszonyított meghatározásával kezdődik.
Vizsgálati vegyi anyag : bármely, e vizsgálati módszer alkalmazásával vizsgált anyag vagy keverék.
Többszintű vizsgálati stratégia : olyan lépcsőzetes vizsgálati stratégia, amelynek keretében a vizsgálati vegyi anyagra vonatkozó valamennyi információt meghatározott sorrendben áttekintik, és az egyes szinteken az adatok bizonyító erejének elemzésével meghatározzák, hogy a következő szintre való továbblépés előtt a veszélyességi osztályozásra vonatkozó döntéshez elegendő információ áll-e rendelkezésre. Ha a vizsgálati vegyi anyag irritatív hatása a rendelkezésre álló információk alapján megállapítható, további vizsgálatra nincs szükség. Ha a vizsgálati vegyi anyag irritatív hatása a rendelkezésre álló információk alapján nem állapítható meg, több lépcsőben egymás után állatkísérleteket kell végezni mindaddig, amíg az egyértelmű besorolás meg nem állapítható.
A vegyi anyagok osztályozásának és címkézésének az Egyesült Nemzetek Szervezete által globálisan harmonizált rendszere (ENSZ-GHS) : a vegyi anyagoknak (anyagoknak és keverékeknek) a fizikai, egészségi és környezeti veszélyek szabványosított típusai és szintjei szerinti osztályokba sorolására és megfelelő kommunikációs elemekkel (például piktogramokkal, figyelmeztetésekkel, figyelmeztető mondatokkal, óvintézkedésekre vonatkozó mondatokkal és biztonsági adatlapokkal) történő jelölésére javaslatokat megfogalmazó rendszer, amelynek célja, hogy az emberek (köztük a munkáltatók, a munkavállalók, a fuvarozók, a fogyasztók és a sürgősségi segélyszolgálatok) és a környezet megóvása érdekében egységesítse a vegyi anyagok káros hatásaira vonatkozó információk továbbítását (4).
ENSZ-GHS szerinti 1. kategória : lásd: »Súlyos szemkárosodás«.
ENSZ-GHS szerinti 2. kategória : lásd: »Szemirritáció«.
ENSZ-GHS szerinti nem besorolt : az ENSZ-GHS szerinti 1. vagy 2. (2A. vagy 2B.) kategóriába való besorolás követelményeinek nem megfelelő vegyi anyagok. Megfelelnek a »Kategória nélküli« vegyi anyagoknak.
Validált vizsgálati módszer : olyan vizsgálati módszer, amelynek az adott céllal kapcsolatos relevanciája (pontosságát is ideértve) és megbízhatósága validálási vizsgálatok alapján megállapítást nyert. Fontos megjegyezni, hogy a validált vizsgálati módszer a javasolt felhasználási célra nem feltétlenül kínál megfelelő pontosságú és megbízhatóságú elfogadható eljárást.
Az adatok bizonyító erejének mérlegelése : a rendelkezésre álló különféle érvek és ellenérvek mérlegelésének folyamata az adott vegyi anyag veszélyességével kapcsolatban a megfelelő következtetés levonása és alátámasztása céljából.
2. függelék
A BCOP VIZSGÁLATI MÓDSZER PREDIKTÍV ÉRTÉKE
1. táblázat
A BCOP vizsgálatnak a súlyos szemkárosodást okozó [ENSZ-GHS/ CLP-rendelet szerinti 1. kategóriába, illetve nem 1. kategóriába (2. kategóriába tartozó + kategória nélküli); US EPA szerinti I. kategóriába, illetve nem I. kategóriába (II. + III. + IV. kategóriába) tartozó] vegyi anyagok azonosításával kapcsolatos prediktív értéke
|
Osztályozási rendszer |
Szám |
Pontosság |
Érzékenység |
Hamis negatív arányok |
Specifikusság |
Hamis pozitív arányok |
|||||
|
% |
Szám |
% |
Szám |
% |
Szám |
% |
Szám |
% |
Szám |
||
|
ENSZ-GHS CLP-rendelet |
191 |
78,53 |
150/191 |
86,15 |
56/65 |
13,85 |
9/65 |
74,60 |
94/126 |
25,40 |
32/126 |
|
US EPA |
190 |
78,95 |
150/190 |
85,71 |
54/63 |
14,29 |
9/63 |
75,59 |
96/127 |
24,41 |
31/127 |
2. táblázat
A BCOP vizsgálatnak a szemirritáció vagy a súlyos szemkárosodás tekintetében besorolást nem igénylő (»szemirrtációt nem okozó«) [az ENSZ-GHS/a CLP-rendelet szerint be nem sorolt, illetve nem »nem besorolt« (1. + 2. kategóriába tartozó); US EPA szerinti IV. kategóriába, illetve nem IV. kategóriába (I. + II. + III. kategóriába) tartozó] vegyi anyagok azonosításával kapcsolatos prediktív értéke
|
Osztályozási rendszer |
Szám |
Pontosság |
Érzékenység |
Hamis negatív arányok |
Specifikusság |
Hamis pozitív arányok |
|||||
|
% |
Szám |
% |
Szám |
% |
Szám |
% |
Szám |
% |
Szám |
||
|
ENSZ-GHS CLP-rendelet |
196 |
68,88 |
135/196 |
100 |
107/107 |
0 |
0/107 |
31,46 |
28/89 |
68,54 |
61/89 |
|
US EPA |
190 |
82,11 |
156/190 |
93,15 |
136/146 |
6,85 |
10/146 |
45,45 |
20/44 |
54,55 |
24/44 |
3. függelék
JÁRTASSÁGI TESZTANYAGOK A BCOP VIZSGÁLATI MÓDSZERHEZ
E vizsgálati módszer rutinszerű alkalmazása előtt a laboratóriumoknak az 1. táblázatban ajánlott 13 vegyi anyag szemet érintő veszélyességi osztályozásának helyes meghatározásával kell igazolniuk szakmai jártasságukat. E vegyi anyagok kiválasztása úgy történt, hogy a nyulakon végzett in vivo szemvizsgálat (405. vizsgálati iránymutatás) (17) eredményei és az ENSZ-GHS osztályozási rendszer (azaz az 1., 2A., 2B. vagy nem besorolt) alapján a szemet érintő veszélyek hatástartománya szempontjából reprezentatívak legyenek (4). A kiválasztás másik kritériuma az volt, hogy a vegyi anyagok kereskedelmi forgalomban beszerezhetők legyenek, azokra vonatkozóan kiváló minőségű in vivo referenciaadatok álljanak rendelkezésre, és a BCOP vizsgálati módszer alapján kiváló minőségű in vitro adatok álljanak rendelkezésre. A referenciaadatok az ésszerűsített összefoglaló dokumentumban (3) és a BCOP vizsgálati módszer felülvizsgálatára vonatkozó ICCVAM-háttérdokumentumban (2) (18) találhatók.
1. táblázat
A BCOP vizsgálati módszerben való szakmai jártasság ellenőrzéséhez ajánlott vegyi anyagok
|
Vegyi anyag |
CASRN |
Kémiai osztály (1) |
Halmazállapot |
In Vivo besorolás (2) |
BCOP szerinti besorolás |
|
Benzalkónium-klorid (5 %) |
8001-54-5 |
Óniumvegyület |
Folyadék |
1. kategória |
1. kategória |
|
Klórhexidin |
55-56-1 |
Amin, amidin |
Szilárd |
1. kategória |
1. kategória |
|
Dibenzoil-L-borkősav |
2743-38-6 |
Karbonsav, észter |
Szilárd |
1. kategória |
1. kategória |
|
Imidazol |
288-32-4 |
Heterociklikus |
Szilárd |
1. kategória |
1. kategória |
|
Triklór-ecetsav (30 %) |
76-03-9 |
Karbonsav |
Folyadék |
1. kategória |
1. kategória |
|
2,6-Diklór-benzoilklorid |
4659-45-4 |
Savhalogenid |
Folyadék |
2A. kategória |
Pontos/megbízható előrejelzés nem végezhető |
|
Etil-2-metilaceto-acetát |
609-14-3 |
Keton, észter |
Folyadék |
2B. kategória |
Pontos/megbízható előrejelzés nem végezhető |
|
Ammónium-nitrát |
6484-52-2 |
Szervetlen só |
Szilárd |
2. kategória (3) |
Pontos/megbízható előrejelzés nem végezhető |
|
EDTA, dikálium-só |
25102-12-9 |
Amin, karbonsav (só) |
Szilárd |
Nincs besorolás |
Nincs besorolás |
|
Tween 20 |
9005-64-5 |
Észter, poliéter |
Folyadék |
Nincs besorolás |
Nincs besorolás |
|
2-merkatopirimidin |
1450-85-7 |
Savhalogenid |
Szilárd |
Nincs besorolás |
Nincs besorolás |
|
Fenilbutazon |
50-33-9 |
Heterociklikus |
Szilárd |
Nincs besorolás |
Nincs besorolás |
|
Polioxietilén-23 lauril éter (BRIJ-35) (10 %) |
9002-92-0 |
Alkohol |
Folyadék |
Nincs besorolás |
Nincs besorolás |
|
(1) Az egyes vegyi anyagok kémiai osztályának meghatározása standard osztályozási rendszer alkalmazásával, a National Library of Medicine »Medical Subject Headings« (MeSH) elnevezésű osztályozási rendszere (elérhető a következő címen: http//www.nlm.nih.gov/mesh) alapján történt. (2) A nyulakon végzett in vivo szemvizsgálat (az OECD 405. vizsgálati iránymutatása) (17) eredményei alapján és az ENSZ-GHS (4) felhasználásával. (3) A 2A. vagy 2B. kategóriába sorolás az ENSZ-GHS rendszerének a két kategória megkülönböztetésére szolgáló kritériuma értelmezésétől függ, azaz három állatból egynél, illetve három állatból kettőnél a hetedik napon jelentkező hatások szükségesek a 2A. kategóriába soroláshoz. Az in vivo vizsgálatot három állaton végezték. Egy állaton a kötőhártya vörösségétől eltekintve minden végpont begyógyul, nulla pontos lesz a hetedik napra vagy korábban. Annak az egy állatnak, amely nem gyógyult meg teljesen a hetedik napra, a kötőhártya vörösségét értékelő pontszáma 1 volt (a hetedik napon), majd a 10. napon teljesen meggyógyult. Rövidítések: CASRN = a Chemical Abstracts Service (CAS) szerinti nyilvántartási szám (CAS-szám). |
|||||
4. függelék
SZARUHÁRTYATARTÓ A BCOP VIZSGÁLATHOZ
A BCOP vizsgálathoz alkalmazott szaruhártyatartó inert anyagból (például polipropilénből) készül. A tartó két részből (elülső és hátsó kamrából) áll, és két, egymáshoz hasonló hengeres belső kamrával rendelkezik. Mindkét kamra kb. 5 ml-nyi mennyiség befogadására alkalmas és üvegablakban végződik, amelyen keresztül az opacitás mérését rögzítik. Mindkét belső kamra átmérője 1,7 cm, mélysége 2,2 cm. ( 7 ) A szivárgás megelőzésére a hátsó kamrában tömítőgyűrű található. A szaruhártyákat a belhámi oldalukkal lefelé kell a hátsó kamra tömítőgyűrűjére fektetni, majd az elülső kamrákat a szaruhártyák felhámi oldalára kell elhelyezni. A kamrákat a kamrák külső peremén található három, rozsdamentes acélból készült csavar rögzíti. Az egyes kamraházak végén üvegablak található, amely a szaruhártyához való könnyebb hozzáférés érdekében eltávolítható. A szivárgás megelőzésére az üvegablak és a kamra között is van egy tömítőgyűrű. Mindegyik kamra tetején két nyílás található, amelyen keresztül betölthető és üríthető a közeg és a vizsgálati vegyi anyagok. A kezelési és az inkubációs időszak alatt ezeket a nyílásokat gumikupak zárja le. A szaruhártyatartókon keresztüli fényátbocsátás megváltozhat, mivel a belső kamra lyukainak vagy az üvegablakoknak a kopása vagy elhasználódása vagy a felületükön egyes kémiai maradékanyagok felhalmozódása befolyásolhatja a fényszóródást vagy -visszaverődést. Ez a szaruhártyatartókon keresztüli kiindulási fényátbocsátás (és ennek megfelelően a leolvasott kiindulási opacitésértékek) növekedését vagy csökkenését idézheti elő, és az egyes kamrákban mért szaruhártya-opacitás várható kiindulási értékében bekövetkezett jelentős változásban nyilvánulhat meg (azaz a szaruhártya-opacitás kezdeti értékei az egyes szaruhártyatartókban szokásosan 2 vagy 3 opacitásegységgel eltérhetnek a várt kiindulási értékektől). A vizsgálati vegyi anyagok jellegétől és a kamrák használatának gyakoriságától függően minden laboratóriumnak meg kell fontolnia a szaruhártyatartókon keresztüli fényátbocsátás változásainak értékelésére vonatkozó program kialakítását. A kiindulási értékek meghatározásához a szaruhártyatartók a rutinszerű használat előtt a teljes közeggel töltött, szaruhártyát nem tartalmazó kamrák kiindulási opacitásértékeinek (vagy fényátbocsátásának) mérésével ellenőrizhetők. A szaruhártyatartókat ezt követően rendszeresen ellenőrizni kell a használati ideje alatti fényátbocsátás változása szempontjából. A vizsgálati vegyi anyagok, a használatuk gyakorisága és a szaruhártya-opacitás kiindulási értékei változásának megfigyelése alapján minden laboratórium megállapíthatja a szaruhártyatartók ellenőrzésének gyakoriságát. Ha a szaruhártyatartókon keresztüli fényátbocsátás jelentős változása figyelhető meg, mérlegelni kell a szaruhártyatartók belső felületének megfelelő takarítását és/vagy tisztítását, illetve a szaruhártyatartók cseréjét.
Szaruhártyatartó: bontott diagram

5. függelék
AZ OPACIMÉTER
Az opaciméter a fényátbocsátás mérésére szolgáló műszer. Például az Electro Design (Riom, Franciaország) által gyártott, a BCOP vizsgálati módszer validálása során használt OP-KIT berendezés esetében egy halogénlámpa fényét kontrollrekeszen (ablaktalan, illetve folyadékkal nem töltött üres kamrán) keresztül egy fotocellához juttatják és összevetik a szaruhártyát tartalmazó kamrát magában foglaló vizsgálati rekeszen átvezetett, a fotocellával érzékelt fénnyel. A fotocellák segítségével mért fényátbocsátás eltérését összevetik, és az ebből adódó számszerű opacitásérték digitális kijelzőn jelenik meg. Ennek alapján történik az opacitásegységek megállapítása. Ettől eltérő beállítású (például a kontroll- és a kísérleti kamra párhuzamos mérését nem igénylő) opaciméter-típusok használhatók, ha bizonyítottan a validált berendezéséhez hasonló eredményeket adnak.
Az opaciméternek az előrejelző modellben leírt különféle besorolásokhoz tartozó határértékek által kijelölt tartományokban (vagyis a szemkorróziót, illetve a súlyos irritatív hatást meghatározó határértékig) lineáris viselkedést kell tanúsítania. Annak érdekében, hogy a leolvasások 75–80 opacitásegységig lineárisak és pontosak legyenek, az opacimétert több kalibrátorral kell kalibrálni. A kalibrátorokat a kalibrációs kamrába (a kalibrátorok tartására átalakított szaruhártyakamrába) kell helyezni, és leolvasást kell végezni az opaciméteren. A kalibrációs kamrákat úgy kell kialakítani, hogy a kalibrátorok a fényforrástól és a fotocellától ugyanolyan távolságra helyezkedjenek el, mint a szaruhártyák az opacitásmérés során. A referenciaértékek és a kezdeti beállított pont a használt berendezés típusától függ. Az opacitásmérés linearitását megfelelő (műszerspecifikus) eljárásokkal kell biztosítani. Az Electro Design (Riom, Franciaország) által gyártott OP-KIT berendezés esetében például az opacimétert először 0 opacitásegységre kalibrálják oly módon, hogy a kalibrációs kamrát használják, kalibrátort nem. Ezt követően három különböző kalibrátort kell egyenként a kalibrációs kamrába helyezni, és mérni kell az opacitást. Az első, a második és a harmadik kalibrátor behelyezésekor rendre az előre beállított 75, 150 és 225 (± 5 % tűrés) opacitásegységet kell tudni leolvasni.
”
(13) A B. részben a B.48. fejezet helyébe a következő szöveg lép:
„B.48 Izolált csirkeszem vizsgálatán alapuló vizsgálati módszer i. a súlyos szemkárosodást okozó vegyi anyagok és ii. a szemirritáció vagy a súlyos szemkárosodás tekintetében besorolást nem igénylő vegyi anyagok azonosítására
BEVEZETÉS
Ez a vizsgálati módszer egyenértékű az OECD 438. vizsgálati iránymutatásában (2013) leírt módszerrel. Az izolált csirkeszem vizsgálatán alapuló vizsgálati módszert (a továbbiakban: ICE vizsgálati módszer) az alternatív módszerek validálásával foglalkozó ügynökségközi koordinációs bizottság (ICCVAM) az Alternatív Módszerek Validálásával Foglalkozó Európai Központtal (ECVAM) és az Alternatív Módszerek Validálásával Foglalkozó Japán Központtal (JaCVAM) együtt értékelte 2006-ban és 2010-ben (1) (2) (3). Az első értékelés során az ICE vizsgálati módszert a vegyi anyagok osztályozásának és címkézésének az Egyesült Nemzetek Szervezete (ENSZ) által globálisan harmonizált rendszerében (GHS) (1) (2) (4), illetve az anyagok és keverékek osztályozásáról, címkézéséről és csomagolásáról szóló 1272/2008/EK rendeletben ( 8 ) (CLP-rendelet) meghatározott, súlyos szemkárosodást okozó (1. kategóriába tartozó) vegyi anyagok (anyagok és keverékek) azonosítására szolgáló szűrővizsgálatkénti használatra tudományosan megalapozott vizsgálati módszerként támogatták. A második értékelés során abból a szempontból értékelték az ICE vizsgálati módszert, hogy mennyire hasznos az ENSZ-GHS-ben meghatározott, a szemirritáció vagy a súlyos szemkárosodás tekintetében nem besorolt vegyi anyagok (3) (4) azonosításához. A validálási vizsgálat eredményei és a szakértői értékelő testület ajánlásai megtartották az ICE vizsgálati módszernek a súlyos szemkárosodást okozó (az ENSZ-GHS szerinti 1. kategóriába tartozó) vegyi anyagok besorolásához történő alkalmazására vonatkozó eredeti ajánlást, mivel a rendelkezésre álló adatbázis nem változott az ICCVAM általi eredeti validálás óta. Ebben a szakaszban az ICE vizsgálati módszer alkalmazási területének más kategóriákkal való bővítésére vonatkozó további ajánlásokat nem fogalmaztak meg. A validációs vizsgálatban használt in vitro és in vivo adatkészlet ismételt értékelése során arra helyeződött a hangsúly, hogy az ICE vizsgálati módszer mennyire hasznos a szemirritáció vagy a súlyos szemkárosodás tekintetében besorolást nem igénylő vegyi anyagok azonosításában (5). Ez az ismételt értékelés azt állapította meg, hogy az ICE vizsgálati módszer az ENSZ-GHS-ben meghatározott, a szemirritáció és a súlyos szemkárosodás tekintetében besorolást nem igénylő vegyi anyagok azonosítására is alkalmazható (4) (5). Ez a vizsgálati módszer az ICE vizsgálati módszer ajánlott alkalmazásait és korlátait ezen értékelések alapján tartalmazza. Az OECD vizsgálati iránymutatásának eredeti, 2009-es változata és frissített, 2013-as változata közötti legfőbb eltérések többek között, de nem kizárólag a következők: az ICE vizsgálati módszernek az ENSZ-GHS osztályozási rendszer szerint besorolást nem igénylő vegyi anyagok azonosítására történő alkalmazása, a Vizsgálati jegyzőkönyv elemeinek frissítése, a fogalommeghatározásokat tartalmazó 1. függelék frissítése és a jártassági tesztanyagokról szóló 2. függelék frissítése.
Jelenleg általánosan elfogadott, hogy az előre látható jövőben egyetlen in vitro szemirritációs vizsgálat sem tudja majd helyettesíteni a Draize-féle in vivo szemvizsgálatot a különböző kémiai osztályoknál felmerülő irritáció teljes skálájának előrejelzésére. Előfordulhat azonban, hogy egy-egy (többszintű) vizsgálati stratégián belüli több alternatív vizsgálati módszer stratégiai kombinációja helyettesíteni tudja a Draize-féle in vivo szemvizsgálatot (6). A felülről építkező megközelítés (7) akkor alkalmazandó, ha a meglévő információk alapján valamely vegyi anyag várhatóan rendkívül irritáló hatású lehet, míg az alulról építkező megközelítés (7) akkor alkalmazandó, ha a meglévő információk alapján valamely vegyi anyag várhatóan nem okoz a besorolás szükségességéhez elegendő szemirritációt. Az ICE vizsgálati módszer bizonyos körülmények között és a 8–10. pontban meghatározott korlátokkal a vegyi anyagok szemet érintő veszélyességükre tekintettel történő osztályozására és címkézésére alkalmazható in vitro vizsgálati módszer. Bár az ICE vizsgálati módszer nem minősül a nyulakon végzett in vivo szemvizsgálatot önállóan helyettesítő vizsgálati módszernek, első lépésként ajánlott a Scott és társai (7) által javasolt felülről építkező megközelítéshez hasonló vizsgálati stratégia keretében a súlyos szemkárosodást okozó vegyi anyagok, azaz a további vizsgálat nélkül az ENSZ-GHS szerinti 1. kategóriába sorolandó vegyi anyagok (4) azonosítására. Az ICE vizsgálati módszer ajánlott az ENSZ-GHS-ben meghatározott, a szemirritáció vagy a súlyos szemkárosodás tekintetében besorolást nem igénylő (az ENSZ-GHS szerinti nem besorolt) vegyi anyagok azonosítására (4), ezért első lépésként használható az alulról építkező megközelítésben (7). Azonban az a vegyi anyag, amely az ICE vizsgálati módszerrel előreláthatólag nem okoz súlyos szemkárosodást vagy nem tartozik a szemirritáció/súlyos szemkárosodás tekintetében nem besorolt anyagok közé, további (in vitro és/vagy in vivo) vizsgálatot tenne szükségessé a végleges osztály megállapításához. Ezenfelül az ICE vizsgálati módszernek az ENSZ-GHS-től eltérő osztályozási rendszeren belüli, alulról építkező megközelítés keretében történő alkalmazásáról egyeztetni kell a megfelelő szabályozó hatóságokkal.
E vizsgálati módszer célja a vizsgálati vegyi anyag szemet érintő veszélyességi potenciáljának értékelésére alkalmazott eljárások ismertetése annak alapján, hogy a csirkéből eltávolított csirkeszemben képes-e toxicitást kiváltani. A szaruhártyára gyakorolt toxikus hatások jellemzése i. az opacitás kvalitatív értékelésével, ii. a szembe juttatott fluoreszcein következtében bekövetkező felhámkárosodás (fluoreszcein-visszatartás) kvalitatív értékelésével, iii. a megvastagodás (felduzzadás) kvantitatív mérésével és iv. a felület makroszkopikus morfológiai károsodásának kvalitatív értékelésével történik. A szaruhártya vizsgálati vegyi anyagnak való expozícióját követően megállapítható szaruhártya-opacitás, felduzzadás és károsodás értékelését külön-külön kell végezni, majd ezekből a jellemzőkből együttesen kell származtatni az ún. szemirritációs osztályt.
A fogalommeghatározások az 1. függelékben találhatók.
KIINDULÁSI MEGFONTOLÁSOK ÉS KORLÁTOK
Ez a vizsgálati módszer a 160. OECD-iránymutatásban (8) javasolt protokollon alapul, melynek kidolgozására az alternatív módszerek validálásával foglalkozó ügynökségközi koordinációs bizottság (ICCVAM) nemzetközi validálási vizsgálatát (1) (3) (9) követően, az alternatív módszerek validálásával foglalkozó európai, illetve japán központ (ECVAM, JaCVAM), valamint a hollandiai TNO Quality of Life Department of Toxicology and Applied Pharmacology kutatószervezet részvételével került sor. A protokoll alapját publikált protokollokból származó információk, valamint a TNO által használt jelenlegi protokoll képezik (10) (11) (12) (13) (14).
A vizsgálati módszer alapjául szolgáló validálás során igen sokféle vegyi anyag vizsgálatára sor került, és a validálási vizsgálat empirikus adatbázisa összesen 152 vegyi anyagot, ezen belül 72 anyagot és 80 keveréket tartalmazott (5). A vizsgálati módszer szilárd anyagokra, folyadékokra, emulziókra és gélekre alkalmazandó. A folyadékok lehetnek vizesek vagy nem vizesek; a szilárd anyagok lehetnek vízben oldódóak vagy oldhatatlanok. Gázokat és aeroszolokat validálási vizsgálat keretében még nem vizsgáltak.
Az ICE vizsgálati módszer alkalmazható a súlyos szemkárosodást okozó vegyi anyagok, azaz az ENSZ-GHS szerinti 1. kategóriába (4) sorolandó vegyi anyagok azonosítására. Erre a célra történő alkalmazásakor az ICE vizsgálati módszer azonosított korlátai az alkoholok esetében tapasztalt hamis pozitív arányokon, valamint a szilárd és a felületaktív anyagok esetében tapasztalt hamis negatív arányon alapulnak (1) (3) (9). Ebben az összefüggésben azonban a hamis negatív arányok (az ENSZ-GHS szerinti 1. kategóriának nem az ENSZ-GHS szerinti 1. kategóriakénti azonosítása) nem kritikus jelentőségűek, mivel minden negatív eredményű vizsgálati vegyi anyag vizsgálatára sor kerülne más, megfelelően validált in vitro vizsgálattal (vizsgálatokkal), vagy utolsó lehetőségként – a szabályozási követelményektől függően, az adatok bizonyító erejének mérlegelésén alapuló megközelítés keretébe tartozó lépcsőzetes vizsgálati stratégia segítségével – nyulakon végzett vizsgálatokkal. Megjegyzendő, hogy a szilárd anyagok változó és szélsőséges expozíciós körülményekhez vezethetnek a Draize-féle in vivo szemirritációs vizsgálat során, ami a tényleges irritációs hatásukra (15) vonatkozó irreleváns előrejelzéseket eredményezhet. A vizsgálók valamennyi típusú vegyi anyag esetében mérlegelhetik e vizsgálati módszer alkalmazását, amellyel a pozitív eredményt súlyos szemkárosodásra utaló jelként, azaz további vizsgálat nélkül az ENSZ-GHS szerinti 1. kategóriába sorolandóként kell elfogadni. Az alkoholok esetében azonban a kapott pozitív eredményeket a túlzó előrejelzés kockázata miatt óvatosan kell értelmezni.
A súlyos szemkárosodást okozó (az ENSZ-GHS szerinti 1. kategóriába tartozó) vegyi anyagok azonosítására történő alkalmazásakor az ICE vizsgálati módszer általános pontossága 86 % (120/140), hamis pozitív aránya 6 % (7/113), hamis negatív aránya pedig 48 % (13/27) a nyulakon végzett in vivo szemvizsgálati módszer ENSZ-GHS osztályozási rendszer (4) (5) szerint besorolt adataival való összevetéskor.
Az ICE vizsgálati módszer az ENSZ-GHS osztályozási rendszer (4) szerint a szemirritáció vagy a súlyos szemkárosodás tekintetében besorolást nem igénylő vegyi anyagok azonosítására is alkalmazható. Az ICE vizsgálati módszernek az ENSZ-GHS-től eltérő osztályozási rendszeren belüli, alulról építkező megközelítés keretében történő alkalmazásáról egyeztetni kell a megfelelő szabályozó hatóságokkal. Ez a vizsgálati módszer valamennyi típusú vegyi anyagra alkalmazható, amellyel a negatív eredményt a szemirritáció és a súlyos szemkárosodás tekintetében nem besorolandóként kell elfogadni. A validációs adatbázisból származó egy eredmény alapján azonban előfordulhat, hogy a rothadásgátló szerves oldószert tartalmazó festékek előrejelzése nem megfelelő (5).
A szemirritáció vagy súlyos szemkárosodás tekintetében besorolást nem igénylő vegyi anyagok azonosítására történő alkalmazásakor az ICE vizsgálati módszer általános pontossága 82 % (125/152), hamis pozitív aránya 33 % (26/79), hamis negatív aránya pedig 1 % (1/73) a nyulakon végzett in vivo szemvizsgálati módszer ENSZ-GHS osztályozási rendszer szerint besorolt adataival való összevetéskor (4) (5). Amikor bizonyos kémiai osztályokba tartozó vizsgálati vegyi anyagok (például rothadásgátló szerves oldószert tartalmazó festékek) nem szerepelnek az adatbázisban, az ICE vizsgálati módszer pontossága 83 % (123/149), hamis pozitív aránya 33 % (26/78), hamis negatív aránya pedig 0 % (0/71) az ENSZ-GHS osztályozási rendszer vonatkozásában (4) (5).
Az ENSZ-GHS szerinti 1. kategóriába tartozó, az ENSZ-GHS szerinti 2., 2A. vagy 2B. kategóriába alulosztályozott vegyi anyagok, valamint az ENSZ-GHS szerint be nem sorolt kategóriába tartozó, az ENSZ-GHS szerinti 2., 2A. vagy 2B. kategóriába felülosztályozott vegyi anyagok jelentős száma miatt az ICE vizsgálati módszer nem ajánlott olyan vizsgálati vegyi anyagok azonosítására, amelyeket szemirritáló hatásúként (azaz az ENSZ-GHS szerinti 2. vagy 2A. kategóriába tartozóként) kell besorolni, illetve olyan vizsgálati vegyi anyagok azonosítására, amelyeket enyhén szemirritáló hatásúként (az ENSZ-GHS szerinti 2B. kategóriába tartozóként) kell besorolni. E célból egy másik megfelelő módszerrel végzett további vizsgálatra lehet szükség.
A csirkeszemmel végzett valamennyi eljárás során be kell tartani a vizsgáló intézménynek az emberi és az állati eredetű anyagok – ideértve többek között, de nem kizárólag a szöveteket és a szöveti folyadékokat – kezelésére vonatkozó rendelkezéseit és eljárásait. Ajánlott továbbá követni az általános laboratóriumi óvintézkedéseket is (16).
Bár az ICE vizsgálati módszer nem veszi figyelembe a nyulakon végzett szemirritációs vizsgálatban értékelt kötőhártya- és íriszsérüléseket, foglalkozik a szaruhártyára kifejtett hatásokkal, amelyek leginkább befolyásolják az in vivo besorolást az ENSZ-GHS osztályozás alkalmazásában. Másrészről, noha maga az ICE vizsgálat nem alkalmas a szaruhártya-léziók visszafordíthatóságának értékelésére, nyulakon végzett szemvizsgálatok alapján korábban javasolták, hogy a szaruhártya-sérülés kezdeti mélységének értékelése alkalmas lehet a visszafordíthatatlan hatások bizonyos típusainak azonosítására (17). Különösen további tudományos ismeretekre van szükség annak megértésére, hogy a kezdeti nagyon súlyos sérüléssel össze nem függő visszafordíthatatlan hatások hogyan következnek be. Végezetül az ICE vizsgálat nem alkalmas a szembe kerülés következtében fellépő szisztémás toxicitási potenciál megítélésére.
Ez a vizsgálati módszer rendszeres időközönkénti frissítés tárgyát fogja képezni az új információk és adatok figyelembevételekor. Például kórszövettani vizsgálatok esetlegesen hasznosak lehetnek, ha a szaruhártya-károsodás teljesebb körű jellemzésére van szükség. E lehetőség értékelése érdekében a felhasználóknak érdemes tartósítaniuk a szaruhártyákat és azokból kórszövettani mintákat preparálniuk, amelyek felhasználhatóak a vizsgálati módszer pontosságát esetlegesen tovább javító adatbázis fejlesztéséhez és döntési kritériumok kidolgozásához. Az OECD kidolgozott egy in vitro szemtoxicitás-vizsgálati módszerekről szóló útmutatót, amely a kórszövettani minták gyűjtésére vonatkozó részletes eljárásokat, valamint arra vonatkozó információkat tartalmaz, hogy hová kell benyújtani a mintákat és/vagy a kórszövettani adatokat (8).
Minden olyan laboratóriumnak, amely a vizsgálatot először alkalmazza, a 2. függelékben felsorolt jártassági tesztanyagok felhasználásával ajánlatos meggyőződnie felkészültségéről. Mielőtt a laboratórium az ICE vizsgálat adatait a szabályozói követelmények szerinti veszélyességi osztályozás céljaira rendelkezésre bocsátaná, e vegyi anyagok vizsgálatával demonstrálhatja az ICE vizsgálati módszer végrehajtásában való szakmai jártasságát.
A VIZSGÁLAT ELVE
Az ICE vizsgálat olyan organotipikus módszer, amely rövid távon in vitro fenntartja a csirkeszem működését. A módszerrel a vizsgálati vegyi anyag által okozott károsodás jellemzése a szaruhártya felduzzadásának, opacitásának és fluoreszcein-visszatartásának értékelése útján történik. Míg e két utóbbi paraméter kvalitatív értékelést igényel, a szaruhártya felduzzadásának elemzése kvantitatív módszerrel történik. A mérési eredményeket az általános irritációs index kiszámításához használatos kvantitatív pontszámmá vagy a szemet in vitro érintő veszélyesség osztályozásához használatos kvalitatív kategóriává, azaz az ENSZ-GHS szerinti 1. kategóriává vagy az ENSZ-GHS szerinti nem besorolttá kell alakítani. Ezt követően ezen eredmények bármelyike felhasználható a vizsgálati vegyi anyag potenciálisan súlyos in vivo szemkárosodást okozó hatásának vagy annak előrejelzésére, hogy az anyagot nem kell a szemet érintő veszélyességi osztályozás szerint besorolni (lásd a döntési kritériumokat). Nem sorolhatók be azonban az ICE vizsgálati módszer előrejelzései szerint súlyos szemkárosodást nem okozó, illetve nem besorolt vegyi anyagok (lásd a 11. pontot).
A csirkeszemek származása és életkora
A múltban a vizsgálathoz vágóhídról beszerzett, emberi fogyasztás céljából leölt csirkékből nyert szemeket használtak, ami biztosította, hogy nem kellett laboratóriumi állatokat tartani. Csak az emberi élelmiszerláncba való bekerülésre alkalmas, egészséges állatokból nyert szemek használhatóak fel.
Bár a csirkék optimális életkorának felmérése céljából nem végeztek ellenőrzött vizsgálatot, a vizsgálat céljára igénybe vett csirkék életkora és tömege a hagyományosan vágóhídra kerülő vágócsirkék életkorának és tömegének felel meg (azaz kb. 7 hetes, 1,5-2,5 kg tömegű csirkék).
A szemek begyűjtése és beszállítása a laboratóriumba
A csirke elkábítását (mely rendszerint elektromos sokkal történik) és a nyak kivéreztetési célú bemetszését követően a fejet azonnal el kell távolítani. Annak érdekében, hogy a csirkefejeket a vágóhídról a károsodás és/vagy bakteriális fertőzés megelőzéséhez szükséges gyorsasággal a laboratóriumba lehessen szállítani, célszerű a laboratórium közelében helyi beszerzési forrást találni. A vizsgálat elfogadhatósági kritériumai betartásának biztosítása érdekében a csirkefejek begyűjtése és a szemek enukleáció utáni szuperfúziós kamrába helyezése közötti időnek a lehető legrövidebbnek kell lennie (ennek jellemzően két órán belül meg kell történnie). A vizsgálatban felhasznált valamennyi szemnek egy meghatározott napon begyűjtött szemállományból kell származnia.
Mivel a szemeknek a fejből való kimetszése a laboratóriumban történik, az egész fejeket szobahőmérsékleten (jellemzően 18 °C és 25 °C közötti hőmérsékleten), fiziológiás sóoldattal nedvesített kendőkkel párásított műanyag dobozokban kell a vágóhídról a laboratóriumba szállítani.
Az ICE vizsgálatban felhasznált szemek kiválasztási kritériumai és a szemek száma
A vizsgálatból ki kell zárni azokat a szemeket, amelyek esetében a kivételt követően nagy (0,5-nél nagyobb) a fluoreszceines foltosodás kiindulási értéke vagy a szaruhártya-opacitási pontszám.
Minden kezelt csoportnak és a párhuzamos pozitív kontrollcsoportnak legalább három szemből kell állnia. A negatív, illetve – ha az oldószer nem sóoldat – az oldószeres kontrollcsoportnak legalább egy szemből kell állnia.
A GHS szerint nem besorolt eredményhez vezető szilárd anyagok esetében ajánlott három szemmel egy második vizsgálatmenetet is végrehajtani a negatív eredmény megerősítése vagy elvetése érdekében.
ELJÁRÁS
A szemek előkészítése
A szemhéjat óvatosan be kell metszeni, ügyelve a szaruhártya sérülésének elkerülésére. Ezután a szaruhártya épségét a szaruhártya felületére néhány másodpercre felvitt, majd izotóniás sóoldattal leöblített, egy cseppnyi 2 vegyesszázalékos (m/V) nátrium-fluoreszcein alkalmazásával mielőbb értékelni kell. A fluoreszceinnel kezelt szemeket ezután réslámpás mikroszkóppal meg kell vizsgálni, és ellenőrizni kell, hogy a szaruhártya nem sérült-e meg (vagyis a fluoreszcein-visszatartási és a szaruhártya-opacitási pontszám legfeljebb 0,5 lehet).
Ha a szem sérüléstől mentes, akkor el kell távolítani a koponyából, ügyelve a szaruhártya sérülésének elkerülésére. A szemgolyót – a pislogóhártyát sebészeti csipesszel feszesen tartva – ki kell húzni a szemüregből, és a szemizmokat tompa hegyű hajlított ollóval át kell vágni. A szaruhártya túlzott nyomás miatti károsodásának (azaz a nyomásos mesterséges szövetelváltozásnak) a kerülése fontos.
A szemnek a szemüregből való eltávolításakor a szemidegből egy szabad szemmel is jól látható részt rajta kell hagyni. A szemet a szemüregből való eltávolítást követően nedvszívó párnára kell helyezni, majd le kell vágni róla a pislogóhártyát és az egyéb kötőszöveteket.
A kivett szemet korrózióálló acél csíptetőre kell erősíteni oly módon, hogy a szaruhártya függőleges helyzetben legyen. A csíptetőt ezt követően be kell helyezni a szuperfúziós készülék egyik kamrájába (18). A csíptetőt a szuperfúziós készülékben úgy kell elhelyezni, hogy az izotóniás sóoldat cseppjei (percenként 3–4 csepp, illetve percenként 0,1–0,15 ml) a teljes szaruhártyát érjék. A szuperfúziós készülék kamráinak hőmérsékletét 32 ± 1,5 °C-on kell tartani. A 3. függelék bemutatja a szuperfúziós készülék jellemző kialakítását és a szemcsíptetőket; ezek az eszközök kereskedelmi forgalomban is kaphatók, de saját használatra is megépíthetők. A készülék az egyes laboratóriumok igényeinek (például a vizsgálandó szemek számának) megfelelően módosítható.
A szemeket a szuperfúziós készülékbe való behelyezés után ismét meg kell vizsgálni réslámpás mikroszkóppal annak ellenőrzésére, hogy az előkészítés során nem sérültek-e meg. A réslámpás mikroszkóp mélységmérőjével ekkor a szaruhártya csúcsán meg kell mérni a szaruhártya vastagságát is. Ki kell cserélni azokat a szemeket, i. amelyeknek fluoreszcein-visszatartási pontszáma 0,5-nél nagyobb, ii. amelyeknek szaruhártya-opacitása 0,5-nél nagyobb, valamint iii. amelyek a károsodás bármely további jelét mutatják. Az e szempontok alapján ki nem zárt szemek közül ki kell zárni mindazokat, amelyek szaruhártya-vastagsága az összes szem átlagától 10 %-kal nagyobb mértékben eltér. A felhasználóknak tisztában kell lenniük azzal, hogy a réslámpás mikroszkópok különböző résbeállítás esetén eltérő szaruhártya-vastagságot adhatnak. A résszélességet 0,095 mm-re kell állítani.
Valamennyi szem megvizsgálása és jóváhagyása után a szemeket körülbelül 45–60 percig inkubálni kell annak érdekében, hogy a vizsgálandó anyag felvitele előtt a vizsgálati rendszerrel ekvilibrálódjanak. A kiegyenlítődési idő eltelte után fel kell jegyezni a kiindulási (azaz a nulla időpillanatban érvényes) szaruhártya-vastagságot és opacitást. E végpont tekintetében az előkészítéskor meghatározott fluoreszcein-pontszámot kell kiindulási értékként használni.
A vizsgálati vegyi anyag alkalmazása
A kiindulási referenciamérések után a szemeket (tartójukkal együtt) azonnal ki kell venni a szuperfúziós készülékből, vízszintes helyzetbe kell hozni, majd fel kell vinni a vizsgálati vegyi anyagot a szaruhártyára.
A folyékony vizsgálati vegyi anyagokat általában hígítatlan állapotban kell vizsgálni, de szükség esetén (például ha a vizsgálati terv így rendelkezik) hígítás is alkalmazható. Hígított vizsgálati vegyi anyagok esetén lehetőleg fiziológiás sóoldatot kell alkalmazni. Ellenőrzött körülmények között másféle oldószer is használható, a fiziológiás sóoldattól eltérő oldószerek megfelelőségét azonban külön igazolni kell.
A folyékony vizsgálati vegyi anyagokat oly módon kell felvinni a szaruhártya felületére, hogy a szaruhártya teljes felületét egyenletesen befedje. A szabványos mennyiség 0,03 ml.
A szilárd vegyi anyagokat lehetőleg dörzscsészében, mozsárban vagy hasonló őrlőeszközben a lehető legfinomabbra kell őrölni. A port oly módon kell felvinni a szaruhártya felületére, hogy azt a vizsgálati vegyi anyag egyenletesen befedje; a szabványos mennyiség 0,03 g.
A (folyékony vagy szilárd) vizsgálati vegyi anyagot 10 másodpercig hatni kell hagyni, majd szobahőmérsékleten le kell öblíteni (kb. 20 ml) izotóniás sóoldattal. Ezt követően a szemet (tartójával együtt) az eredeti függőleges helyzetben vissza kell helyezni a szuperfúziós készülékbe. Szükség esetén a 10 másodperces felvitelt követően és későbbi időpontokban (például a vizsgálati vegyi anyag maradványainak a szaruhártyán való felfedezésekor) további öblítés alkalmazható. Az öblítéshez kiegészítőként használt sóoldat mennyisége általában nem kritikus jelentőségű, a vegyi anyag szaruhártyához tapadásának észlelése azonban fontos.
Kontrollként szolgáló vegyi anyagok
Minden vizsgálatban párhuzamos negatív vagy oldószeres/vivőanyagos kontrollt és pozitív kontrollt is kell alkalmazni.
Hígítatlan folyadékok és szilárd anyagok vizsgálatakor a vizsgálati rendszer esetleges nem jellemző változásainak észlelése céljából és annak biztosítására, hogy a vizsgálat körülményei ne eredményezzenek tévesen irritatív hatást, az ICE vizsgálatban párhuzamos negatív kontrollként fiziológiás sóoldatot kell alkalmazni.
Hígított folyadékok vizsgálatakor a vizsgálati rendszer esetleges nem jellemző változásainak kimutatása céljából és annak biztosítására, hogy a vizsgálat körülményei ne eredményezzenek tévesen irritatív hatást, az ICE vizsgálatban párhuzamos oldószeres/vivőanyagos kontrollt kell alkalmazni. A 31. pontban foglaltaknak megfelelően csak olyan oldószer, illetőleg vivőanyag alkalmazható, amely igazoltan nem gyakorol káros hatást a vizsgálati rendszerre.
Annak ellenőrzése érdekében, hogy a kiváltott hatás megfelelő-e, minden egyes kísérletben ismerten szemirritációt okozó anyagot is vizsgálni kell párhuzamos pozitív kontrollként. Mivel az ICE vizsgálat célja a szemkorróziót és a súlyos szemirritációt okozó anyagok azonosítása, a pozitív kontrollnak olyan referencia-vegyianyagnak kell lennie, amely ebben a vizsgálati módszerben súlyos hatást vált ki. Annak érdekében azonban, hogy a pozitív kontrollnál jelentkező hatás időbeli változása is megfigyelhető legyen, a súlyos hatás nem lehet túlságosan erőteljes. A pozitív kontrollra vonatkozóan megfelelő mennyiségű in vitro adatot kell generálni oly módon, hogy kiszámítható legyen a pozitív kontroll statisztikailag meghatározott elfogadható tartománya. Ha egy adott pozitív kontrollra vonatkozóan nincs elegendő korábbi adat az ICE vizsgálati módszer alkalmazásából, akkor ezen adatok előállításához külön vizsgálatok lehetnek szükségesek.
Folyékony vizsgálati vegyi anyagok esetében pozitív kontrollként például 10 %-os ecetsav vagy 5 %-os benzalkónium-klorid, szilárd vizsgálati vegyi anyagok esetében pedig például nátrium-hidroxid vagy imidazol alkalmazható.
A referencia-vegyianyagok jól használhatók egy adott kémiai vagy termékosztályba tartozó ismeretlen vegyi anyagok szemirritációs hatásának értékelésére vagy valamely szemirritációs anyag relatív irritatív hatásának az irritatív hatás egy adott tartományán belüli értékelésére.
Mért végpontok
A kezelt szaruhártyákat a kezelés előtt, majd a kezelést követő leöblítés után 30, 75, 120, 180 és 240 perc (± 5 perc) elteltével kell értékelni. Ezek az időpontok a négyórás kezelési időn belül megfelelő mennyiségű mérést adnak, miközben a mérések között elegendő idő marad valamennyi szem szükséges megfigyelésének elvégzésére.
Az értékelt végpontok: a szaruhártya opacitása, felduzzadása, fluoreszcein-visszatartása és morfológiai elváltozásai (például a felhám benyomódása vagy fellazulása). A fluoreszcein-visszatartás kivételével (amelyet csak a kezelés előtt és a vizsgálati vegyi anyagnak való expozíció után 30 perccel kell meghatározni) minden végpontot valamennyi fenti időpontban meg kell határozni.
A szaruhártya opacitásának, fluoreszcein-visszatartásának, morfológiai elváltozásainak és – lebonyolítás esetén – kórszövettani vizsgálatának dokumentálására ajánlott fényképeket készíteni.
A négy óra elteltével végrehajtott utolsó vizsgálatot követően ajánlatos a szemeket az esetleges kórszövettani vizsgálathoz megfelelő fixálóban (például semleges pufferolt formalinban) tartani (a részletekért lásd a 14. pontot és a (8) hivatkozást.
A szaruhártya felduzzadását a réslámpás mikroszkóp optikai pachométerével végzett szaruhártyavastagság-mérésekből kell meghatározni. A felduzzadást százalékos arányként kell kifejezni, és a következő képletből, a mért szaruhártya-vastagságok felhasználásával kell kiszámítani:

Minden megfigyelési időpontban meg kell határozni az összes vizsgált szem szaruhártya-felduzzadásának átlagos százalékos arányát. A bármely időpontban megfigyelt szaruhártya-felduzzadás átlagértékének maximuma alapján minden vizsgálati vegyi anyaghoz átfogó jellemzést adó pontszámot kell rendelni (lásd az 51. pontot).
Az 1. táblázatban szemléltetett szaruhártya-opacitási pontszámot a szaruhártya legsűrűbben opálos területe alapján kell megállapítani. Minden megfigyelési időpontban meg kell határozni az összes vizsgált szem szaruhártya-opacitásának átlagát. A bármely időpontban megfigyelt szaruhártya-opacitási pontszámok átlagának maximuma alapján minden vizsgálati vegyi anyaghoz átfogó jellemzést adó pontszámot kell rendelni (lásd az 51. pontot).
1. táblázat
Szaruhártya-opacitási pontszámok
|
Pontérték |
Észrevétel |
|
0 |
Nincs opálosodás |
|
0,5 |
Nagyon halvány opálosodás |
|
1 |
Szórt vagy zavaros területek; az írisz részletei tisztán kivehetőek |
|
2 |
Könnyen észrevehető áttetsző terület; az írisz részletei kissé elmosódottak |
|
3 |
Súlyos szaruhártya-opacitás; az írisznek egyetlen részlete sem vehető ki, a pupilla mérete alig érzékelhető |
|
4 |
A szaruhártya teljes opálosodása; az írisz nem látható |
A fluoreszcein-visszatartást kizárólag a 30 perc elteltével végzett megfigyelési időpontban kell értékelni a 2. táblázatban foglaltak szerint. A 30 perc elteltével végzett megfigyelés időpontjában meg kell határozni az összes vizsgált szem fluoreszcein-visszatartásának átlagát, és ennek alapján minden vizsgálati vegyi anyaghoz átfogó jellemzést adó pontszámot kell rendelni (lásd az 51. pontot).
2. táblázat
Fluoreszcein-visszatartási pontszámok
|
Pontérték |
Észrevétel |
|
0 |
Nincs fluoreszcein-visszatartás |
|
0,5 |
Igen csekély mértékű, egysejtes foltosodás |
|
1 |
Egysejtes foltosodás elszórtan a szaruhártya kezelt felületén |
|
2 |
Fokális vagy egybefüggő, sűrű egysejtes foltosodás |
|
3 |
A szaruhártya nagy egybefüggő területei tartanak vissza fluoreszceint |
A morfológiai elváltozások között megemlítendő a szaruhártya felhámsejtjeinek »benyomódása«, a felhám »fellazulása«, a szaruhártya felületének »érdesedése« és a vizsgálati vegyi anyag »feltapadása« a szaruhártya felületére. Ezek a megfigyelések különböző súlyosságúak lehetnek, és egyidejűleg is előfordulhatnak. E megállapítások besorolása a vizsgáló szubjektív megítélésétől függ.
ADATOK ÉS JEGYZŐKÖNYVEZÉS
Az adatok kiértékelése
A szaruhártya opacitását, felduzzadását és fluoreszcein-visszatartását külön-külön kell értékelni, és az egyes végpontokhoz külön-külön ICE-osztályt kell megállapítani. Ezt követően az egyes végpontokhoz tartozó ICE-osztályok együttes figyelembevételével meg kell határozni az egyes vizsgálati vegyi anyagok irritációs besorolását.
Döntési kritériumok
Az egyes végpontok értékelését követően az ICE-osztályok megállapítását előre meghatározott tartományok alapján kell elvégezni. A szaruhártya-felduzzadás (3. táblázat), a szaruhártya-opacitás (4. táblázat) és a fluoreszcein-visszatartás (5. táblázat) jellemzése az alábbiakban bemutatott skálákon, négy ICE-osztály alkalmazásával történik. Fontos megjegyezni, hogy a 3. táblázatban feltüntetett szaruhártya-felduzzadási pontszámok csak akkor érvényesek, ha a vastagság mérése (például Haag-Streit BP900 típusú) 1. számú mélységmérő tartozékkal felszerelt és 9
![]()
-re (0,095 mm) állított résszélességű réslámpás mikroszkóppal történik. A felhasználóknak tisztában kell lenniük azzal, hogy a réslámpás mikroszkópok különböző résbeállítás esetén eltérő szaruhártya-vastagságot adhatnak.
3. táblázat
A szaruhártya-felduzzadás besorolási kritériumai az ICE vizsgálatban
|
Szaruhártya-felduzzadás átlaga (%) (1) |
ICE-osztály |
|
0-tól 5-ig |
I. |
|
5-nél nagyobb, 12-ig |
II. |
|
12-nél nagyobb, 18-ig (a kezelés után több mint 75 perccel) |
II. |
|
12-nél nagyobb, 18-ig (a kezelés után legfeljebb 75 perccel) |
III. |
|
18-nál nagyobb, 26-ig |
III. |
|
26-nál nagyobb, 32-ig (a kezelés után több mint 75 perccel) |
III. |
|
26-nál nagyobb, 32-ig (a kezelés után legfeljebb 75 perccel) |
IV. |
|
32-nél nagyobb |
IV. |
|
(*1) Bármely időpontban megfigyelt legmagasabb átlag. |
|
4. táblázat
Az opacitás besorolási kritériumai az ICE vizsgálatban.
|
Opacitás maximális átlaga (1) |
ICE-osztály |
|
0,0–0,5 |
I. |
|
0,6–1,5 |
II. |
|
1,6–2,5 |
III. |
|
2,6–4,0 |
IV. |
|
(*1) Bármely időpontban megfigyelt pontszámok legmagasabb átlaga (az 1. táblázatban meghatározott opacitási pontszámok alapján) |
|
5. táblázat
A fluoreszcein-visszatartás átlagának besorolási kritériumai az ICE vizsgálatban
|
Fluoreszcein-visszatartás átlaga a kezelés után 30 perccel (1) |
ICE-osztály |
|
0,0–0,5 |
I. |
|
0,6–1,5 |
II. |
|
1,6–2,5 |
III. |
|
2,6–3,0 |
IV. |
|
(*1) A 2. táblázatban meghatározott pontszámok alapján. |
|
A vizsgálati vegyi anyag in vitro irritációs besorolását a szaruhártya opacitása, felduzzadása és a 6. táblázatban ismertetett fluoreszcein-visszatartása alapján meghatározott kategóriák kombinációjának megfelelő GHS-osztályozás leolvasásával kell értékelni.
6. táblázat
Összesített in vitro besorolás
|
ENSZ-GHS osztályozás |
A három végpont kombinációi |
|
Kategória nélküli |
3 × I 2 × I, 1 × II |
|
Előrejelzés nem végezhető |
Egyéb kombinációk |
|
1. kategória |
3 × IV 2 × IV, 1 × III 2 × IV, 1 × II (1) 2 × IV, 1 × I (1) 30 percnél a szaruhártya opacitása legalább 3 (legalább két szem esetében) Bármely időpontban a szaruhártya opacitása 4 (legalább két szem esetében) A felhám súlyos fellazulása (legalább egy szem esetében) |
|
(*1) Kevésbé valószínű kombinációk. |
|
A vizsgálat elfogadhatósági kritériumai
A vizsgálat akkor minősül elfogadhatónak, ha a párhuzamos negatív vagy vivőanyagos/oldószeres kontrollokat a GHS szerint nem besorolt anyagként, a párhuzamos pozitív kontrollokat pedig a GHS szerinti 1. kategóriába tartozóként azonosítják.
Vizsgálati jegyzőkönyv
A Vizsgálati jegyzőkönyvnek a következő információkat kell tartalmaznia, amennyiben azok a vizsgálat lefolytatása szempontjából relevánsak:
Vizsgálati vegyi anyag és kontrollként szolgáló vegyi anyagok
— kémiai név (nevek): a Chemical Abstracts Service (CAS) szerinti szerkezeti név, ezt követően az egyéb ismert nevek, ha vannak;
— a CAS szerinti nyilvántartási szám (CAS-szám), ha ismert;
— a vizsgálati, illetve a kontrollként szolgáló vegyi anyagok tisztasága és összetétele (tömegszázalékban), amennyiben ezek az információk rendelkezésre állnak;
— fizikai-kémiai tulajdonságok: halmazállapot, illékonyság, pH, stabilitás, kémiai osztály, vízoldékonyság, ha a vizsgálat szempontjából relevánsak;
— a vizsgálati, illetve a kontrollként szolgáló vegyi anyagok vizsgálatot megelőző kezelése, ha történt ilyen (például melegítés, porítás);
— stabilitás, ha ismert.
A megbízó és a vizsgálatot végző laboratórium adatai
— a megbízó, a vizsgálatot végző laboratórium és a vizsgálatvezető neve és címe;
— a szemek beszerzési helyének (pl. a begyűjtési létesítményük) megjelölése.
A vizsgálati módszer körülményei
— az alkalmazott vizsgálati rendszer leírása;
— az alkalmazott réslámpás mikroszkóp (például modell) és annak műszerbeállításai;
— a történeti negatív és pozitív kontrollok eredményeire való hivatkozás, valamint adott esetben az elfogadható párhuzamos referencia-kontrolltartományokat igazoló történeti adatok;
— a vizsgálati módszer időbeli integritásának (például pontosságának, megbízhatóságának) biztosítására alkalmazott módszer (például jártassági tesztanyagok rendszeres időközönkénti vizsgálata).
A szemek begyűjtése és preparálása
— a donorállat életkora és tömege, valamint adott esetben egyéb sajátosságai (például ivara, törzse), ha rendelkezésre állnak;
— a szemek tárolásának és szállításának körülményei (például a szemek begyűjtésének dátuma és időpontja, a csirkefejek begyűjtése és az eltávolított szemek szuperfúziós kamrába helyezése között eltelt idő);
— a szemek preparálása és tárgylemezre helyezése, többek között a minőségükre, a szemtartó kamrák hőmérsékletére, valamint a vizsgálathoz felhasznált szemek kiválasztási kritériumaira vonatkozó kijelentések.
Vizsgálati eljárás
— az alkalmazott párhuzamosok száma;
— az alkalmazott negatív és pozitív kontrollok meghatározása (adott esetben az oldószeres és a referenciakontrolloké is);
— a vizsgálati vegyi anyag dózisa, alkalmazása és expozíciós ideje;
— megfigyelési időpontok (a kezelés előtt és után);
— az alkalmazott értékelési és döntési kritériumok leírása;
— az alkalmazott vizsgálat-elfogadhatósági kritériumok leírása;
— a vizsgálati eljárás bármilyen változtatásának leírása.
Eredmények
— az egyes szemek esetében az egyes megfigyelési időpontokban kapott szaruhártya-felduzzadási, -opacitási és fluoreszcein-visszatartási pontszámok táblázatos formába foglalása, feltüntetve az összes vizsgált szem minden egyes megfigyelési időpontjában kapott átlagát is;
— a megfigyelt szaruhártya-felduzzadási, -opacitási és fluoreszcein-visszatartási átlagok maximuma (bármely időpontban) és a kapcsolódó ICE-osztály;
— minden más megfigyelt hatás leírása;
— a származtatott in vitro GHS osztályozás;
— a szemekről készült fényképek (ha vannak).
Az eredmények tárgyalása
Következtetés
SZAKIRODALOM
(1) ICCVAM (2007). Test Method Evaluation Report – In Vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No.: 07-4517. Elérhető az alábbi címen: http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_tmer.htm.
(2) ESAC (2007). Statement on the conclusion of the ICCVAM retrospective study on organotypic in vitro assays as screening tests to identify potential ocular corrosives and severe eye irritants. Elérhető az alábbi címen: http://ecvam.jrc.it/index.htm
(3) ICCVAM (2010). ICCVAM Test Method Evaluation Report – Current Status of in vitro Test Methods for Identifying Mild/Moderate Ocular Irritants: The Isolated Chicken Eye (ICE) Test Method. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No.: 10-7553A. Elérhető az alábbi címen: http://iccvam.niehs.nih.gov/methods/ocutox/MildMod-TMER.htm.
(4) United Nations (UN) (2011). Globally Harmonized System of Classification and Labelling of Chemicals (GHS), Fourth revised edition, UN New York and Geneva, 2011. Elérhető a következő címen: http://www.unece.org/trans/danger/publi/ghs/ghs_rev04/04files_e.html.
(5) Streamlined Summary Document Supporting OECD Test Guideline 438 on the Isolated Chicken Eye for Eye Irritation/Corrosion. Series on Testing and Assessment no. 188 (Part 1 and Part 2), OECD, Paris.
(6) E melléklet B.5., akut toxicitás: szemirritáció/szemkorróziós hatás című fejezete.
(7) Scott L, Eskes C, Hoffman S, Adriaens E, Alepee N, Bufo M, Clothier R, Facchini D, Faller C, Guest R, Hamernik K, Harbell J, Hartung T, Kamp H, Le Varlet B, Meloni M, Mcnamee P, Osborn R, Pape W, Pfannenbecker U, Prinsen M, Seaman C, Spielmann H, Stokes W, Trouba K, Vassallo M, Van den Berghe C, Van Goethem F, Vinardell P, Zuang V (2010). A proposed Eye Irritation Testing Strategy to Reduce and Replace in vivo Studies Using Bottom-up and Top-down Approaches. Toxicology In Vitro 24, 1-9.
(8) OECD (2011) Guidance Document on “The Bovine Corneal Opacity and Permeability (BCOP) and Isolated Chicken Eye (ICE) Test Methods: Collection of Tissues for Histological Evaluation and Collection of Data on Non-Severe Irritants”. Series on Testing and Assessment no. 160, OECD, Paris.
(9) ICCVAM. (2006). Background review document: Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Isolated Chicken Eye Test Method. NIH Publication No.: 06-4513. Research Triangle Park: National Toxicology Program. Elérhető a következő címen: http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_ice.htm.
(10) Prinsen, M.K. and Koëter, B.W.M. (1993). Justification of the enucleated eye test with eyes of slaughterhouse animals as an alternative to the Draize eye irritation test with rabbits. Fd. Chem. Toxicol. 31:69-76.
(11) DB-ALM (INVITTOX) (2009). Protocol 80: Chicken enucleated eye test (CEET) / Isolated Chicken Eye Test, 13pp. Elérhető az alábbi címen: http://ecvam-dbalm.jrc.ec.europa.eu/.
(12) Balls, M., Botham, P.A., Bruner, L.H. and Spielmann H. (1995). The EC/HO international validation study on alternatives to the Draize eye irritation test. Toxicol. In Vitro 9:871-929.
(13) Prinsen, M.K. (1996). The chicken enucleated eye test (CEET): A practical (pre)screen for the assessment of eye irritation/corrosion potential of test materials. Food Chem. Toxicol. 34:291-296.
(14) Chamberlain, M., Gad, S.C., Gautheron, P. and Prinsen, M.K. (1997). IRAG Working Group I: Organotypic models for the assessment/prediction of ocular irritation. Food Chem. Toxicol. 35:23-37.
(15) Prinsen, M.K. (2006). The Draize Eye Test and in vitro alternatives; a left-handed marriage? Toxicology in Vitro 20, 78-81.
(16) Siegel, J.D., Rhinehart, E., Jackson, M., Chiarello, L., and the Healthcare Infection Control Practices Advisory Committee (2007). Guideline for Isolation Precautions: Preventing Transmission of Infectious Agents in Healthcare Settings. Elérhető az alábbi címen: http://www.cdc.gov/ncidod/dhqp/pdf/isolation2007.pdf.
(17) Maurer, J.K., Parker, R.D. and Jester J.V. (2002). Extent of corneal injury as the mechanistic basis for ocular irritation: key findings and recommendations for the development of alternative assays. Reg. Tox. Pharmacol. 36:106-117.
(18) Burton, A.B.G., M. York and R.S. Lawrence (1981). The in vitro assessment of severe irritants. Fd. Cosmet.- Toxicol.- 19, 471-480.
1. függelék
FOGALOMMEGHATÁROZÁSOK
Pontosság : a vizsgálati módszerrel kapott eredmények és az elfogadott referenciaértékek közötti egyezés mértéke. A vizsgálati módszer teljesítőképességét mutatja, és relevanciájának egyik szempontja. A kifejezés gyakran használatos az »egyezés« szó megfelelőjeként, amely arra utal, hogy egy adott vizsgálati módszer milyen arányban szolgáltat helyes eredményeket.
Referencia-vegyianyag : a vizsgálati vegyi anyaggal való összehasonlítás céljából etalonként használt vegyi anyag. A referencia-vegyianyagnak a következő tulajdonságokkal kell rendelkeznie: i. állandó és megbízható forrás(ok)ból kell származnia; ii. a vizsgálati vegyi anyagok osztályához hasonló szerkezettel és funkcionalitással kell rendelkeznie; iii. ismert fizikai-kémiai tulajdonságokkal kell rendelkeznie; iv. rendelkezésre kell állnia az ismert hatásait alátámasztó adatoknak; és v. a kívánt hatástartományban ismert hatásúnak kell lennie.
Alulról építkező megközelítés : a szemirritáció vagy a súlyos szemkárosodás tekintetében feltehetőleg besorolást nem igénylő vegyi anyag esetén alkalmazott lépcsőzetes megközelítés, amely a besorolást nem igénylő vegyi anyagok (negatív eredmény) más vegyi anyagokhoz (pozitív eredmény) viszonyított meghatározásával kezdődik.
Vegyi anyag : anyag vagy keverék.
Szaruhártya : a szemgolyó elülső részén az íriszt és a pupillát fedő és a szem belsejébe a fényt bevezető, áttetsző rész.
Szaruhártya opacitása : a szaruhártya vizsgálati vegyi anyagnak való expozícióját követő átlátszatlanság mértékét leíró jellemző. Az opacitás megnövekedése a szaruhártya károsodását jelzi.
Szaruhártya felduzzadása : az ICE vizsgálatban a szaruhártya vizsgálati vegyi anyagnak való expozícióját követő felpuffadása mértékét objektív módon jellemző érték. Százalékos arányként kell kifejezni, és a szaruhártya-vastagság kiindulási (a vizsgálati vegyi anyag felvitele előtti) értékéből és az ICE vizsgálat során vizsgált vizsgálati vegyi anyagnak való expozíciót követően rendszeres időközönként végzett mérésekből kell kiszámítani. A szaruhártya felduzzadásának foka jelzi a szaruhártya károsodásának mértékét.
Szemirritáció : a vizsgálati vegyi anyagnak a szem elülső felszínén történő alkalmazását követően megjelenő és az alkalmazástól számított 21 napon belül teljes mértékben visszafordítható szemelváltozások. Megfelel a »Reverzibilis szemkárosodás« fogalmának és az »ENSZ-GHS szerinti 2. kategóriának« (4).
Hamis negatív arány : a vizsgálati módszer alkalmazása során tévesen negatívnak minősített pozitív vegyi anyagok részaránya. A hamis negatív arány a vizsgálati módszer teljesítőképességének egyik mutatója.
Hamis pozitív arány : a vizsgálati módszer alkalmazása során tévesen pozitívnak minősített negatív vegyi anyagok részaránya. A hamis pozitív arány a vizsgálati módszer teljesítőképességének egyik mutatója.
Fluoreszcein-visszatartás : az ICE vizsgálatban a szaruhártya felhámsejtjeiben a vizsgálati vegyi anyagnak való expozíciót követően visszatartott fluoreszcein-nátrium mennyiségét szubjektív módon jellemző adat. A fluoreszcein-visszatartás foka utal a szaruhártyafelhám károsodásának mértékére.
Veszély : valamely anyag vagy helyzet azon sajátossága, hogy káros hatásokat képes előidézni az élő szervezet, rendszer vagy (al)populáció anyagnak való expozíciójakor.
Irreverzibilis szemkárosodás : lásd: »Súlyos szemkárosodás« és »ENSZ-GHS szerinti 1. kategória«.
Keverék : két vagy több anyagból álló keverék vagy oldat, amelyben az anyagok nem lépnek egymással reakcióba (4).
Negatív kontroll : a vizsgálati rendszer valamennyi alkotóelemét tartalmazó kezeletlen replikátum. Ezt a mintát a vizsgálati vegyi anyaggal kezelt mintákkal és más kontrollmintákkal együtt kell feldolgozni annak megállapításához, hogy az oldószer kölcsönhatásba lép-e a vizsgálati rendszerrel.
Nem besorolt : a szemirritáció tekintetében (az ENSZ-GHS szerinti 2. kategóriába tartozóként) nem besorolt vagy a súlyos szemkárosodás tekintetében (az ENSZ-GHS szerinti 1. kategóriába tartozóként) nem besorolt vegyi anyagok. Megfelelnek az »ENSZ-GHS szerinti nem besorolt« vegyi anyagoknak.
Pozitív kontroll : a vizsgálati rendszer valamennyi alkotóelemét tartalmazó, ismert pozitív hatást kiváltó vegyi anyaggal kezelt replikátum. Annak biztosítása érdekében, hogy a pozitív kontrollban jelentkező hatás időbeli változását fel lehessen mérni, a súlyos hatás nem lehet túlságosan erőteljes.
Megbízhatóság : a vizsgálati módszer laboratóriumon belüli és laboratóriumok közötti időbeli reprodukálhatóságának mértéke ugyanazon protokoll alkalmazása mellett. Megállapítása a laboratóriumon belüli és a laboratóriumok közötti reprodukálhatóság, valamint a laboratóriumon belüli megismételhetőség kiszámításával történik.
Reverzibilis szemkárosodás : lásd: »Súlyos szemkárosodás« és »ENSZ-GHS szerinti 2. kategória«.
Súlyos szemkárosodás : a vizsgálati vegyi anyagnak a szem külső felületére való juttatását követően olyan szövetkárosodás kialakulása vagy a látás olyan súlyos fizikai romlása, amely a beadást követően 21 napon belül nem fordítható vissza teljes mértékben. Megfelel az »Irreverzibilis szemkárosodás« fogalmának és az »ENSZ-GHS szerinti 1. kategóriának« (4).
Réslámpás mikroszkóp : a szem binokuláris mikroszkóp nagyítása alatti, álló sztereoszkópiás kép alkotásával történő közvetlen vizsgálatára alkalmazott műszer. Az ICE vizsgálatban a műszer a csirkeszem elülső szerkezeteinek, illetve a mélységmérő tartozékkal a szaruhártya vastagságának objektív mérésére használatos.
Oldószeres/vivőanyagos kontroll : a vizsgálati rendszer valamennyi alkotóelemét az oldószerrel vagy vivőanyaggal együtt tartalmazó nem kezelt minta, amelyet a vizsgálati vegyi anyaggal kezelt mintákkal és más kontrollmintákkal együtt kell feldolgozni az ugyanazon oldószerben feloldott vagy ugyanazon vivőanyaggal felvitt vizsgálati vegyi anyaggal kezelt minták kiindulási értékeinek megállapítása érdekében. Párhuzamos negatív kontrollal elvégzett vizsgálata esetén ez a minta azt is bizonyítja, hogy az oldószer vagy vivőanyag kölcsönhatásba lép-e a vizsgálati rendszerrel.
Anyag : természetes állapotban előforduló vagy termelőfolyamatból származó kémiai elemek és azok vegyületei, amelyek a termék stabilitásának megőrzéséhez szükséges adalékanyagokat és az alkalmazott folyamatból származó szennyeződéseket is tartalmazhatnak, de nem tartalmaznak olyan oldószereket, amelyek az anyag stabilitásának befolyásolása vagy összetételének megváltozása nélkül elkülöníthetők (4).
Felületaktív anyag : olyan anyag (például mosószer), amely csökkentheti a folyadékok felületi feszültségét, és így lehetővé teszi, hogy habozzanak vagy áthatoljanak szilárd anyagokon; nedvesítőszerként is ismert.
Felülről építkező megközelítés : a feltehetőleg súlyos szemkárosodást okozó vegyi anyag esetén alkalmazott lépcsőzetes megközelítés, amely a súlyos szemkárosodást okozó vegyi anyagok (pozitív eredmény) más vegyi anyagokhoz (negatív eredmény) viszonyított meghatározásával kezdődik.
Vizsgálati vegyi anyag : bármely, e vizsgálati módszer alkalmazásával vizsgált anyag vagy keverék.
Többszintű vizsgálati stratégia : olyan lépcsőzetes vizsgálati stratégia, amelynek keretében a vizsgálati vegyi anyagra vonatkozó valamennyi információt meghatározott sorrendben áttekintik, és az egyes szinteken az adatok bizonyító erejének elemzésével meghatározzák, hogy a következő szintre való továbblépés előtt a veszélyességi osztályozásra vonatkozó döntéshez elegendő információ áll-e rendelkezésre. Ha a vizsgálati vegyi anyag irritatív hatása a rendelkezésre álló információk alapján megállapítható, további vizsgálatra nincs szükség. Ha a vizsgálati vegyi anyag irritatív hatása a rendelkezésre álló információk alapján nem állapítható meg, több lépcsőben egymás után állatkísérleteket kell végezni mindaddig, amíg az egyértelmű besorolás meg nem állapítható.
A vegyi anyagok osztályozásának és címkézésének az Egyesült Nemzetek Szervezete által globálisan harmonizált rendszere (ENSZ-GHS) : a vegyi anyagoknak (anyagoknak és keverékeknek) a fizikai, egészségi és környezeti veszélyek szabványosított típusai és szintjei szerinti osztályokba sorolására és megfelelő kommunikációs elemekkel (például piktogramokkal, figyelmeztetésekkel, figyelmeztető mondatokkal, óvintézkedésekre vonatkozó mondatokkal és biztonsági adatlapokkal) történő jelölésére javaslatokat megfogalmazó rendszer, amelynek célja, hogy az emberek (köztük a munkáltatók, a munkavállalók, a fuvarozók, a fogyasztók és a sürgősségi segélyszolgálatok) és a környezet megóvása érdekében egységesítse a vegyi anyagok káros hatásaira vonatkozó információk továbbítását (4).
ENSZ-GHS szerinti 1. kategória : lásd: »Súlyos szemkárosodás« és/vagy »Irreverzibilis szemkárosodás«.
ENSZ-GHS szerinti 2. kategória : lásd: »Szemirritáció« és/vagy »Reverzibilis szemkárosodás«.
ENSZ-GHS szerinti »nem besorolt« : az ENSZ-GHS szerinti 1. vagy 2. (2A. vagy 2B.) kategóriába való besorolás követelményeinek nem megfelelő vegyi anyagok. Megfelelnek a »Nem besorolt« vegyi anyagoknak.
Validált vizsgálati módszer : olyan vizsgálati módszer, amelynek az adott céllal kapcsolatos relevanciája (pontosságát is ideértve) és megbízhatósága validálási vizsgálatok alapján megállapítást nyert. Fontos megjegyezni, hogy a validált vizsgálati módszer a javasolt felhasználási célra nem feltétlenül kínál megfelelő pontosságú és megbízhatóságú elfogadható eljárást.
Az adatok bizonyító erejének mérlegelése : a rendelkezésre álló különféle érvek és ellenérvek mérlegelésének folyamata az adott vegyi anyag veszélyességével kapcsolatban a megfelelő következtetés levonása és alátámasztása céljából.
2. függelék
JÁRTASSÁGI TESZTANYAGOK AZ ICE VIZSGÁLATI MÓDSZERHEZ
Az e vizsgálati módszerre támaszkodó vizsgálati módszer rutinszerű alkalmazása előtt a laboratóriumoknak az 1. táblázatban ajánlott 13 vegyi anyag szemet érintő veszélyességi osztályozásának helyes meghatározásával kell igazolniuk szakmai jártasságukat. E vegyi anyagok kiválasztása úgy történt, hogy a nyulakon végzett in vivo szemvizsgálat (405. vizsgálati iránymutatás) eredményei és az ENSZ-GHS osztályozási rendszer (azaz az 1., 2A., 2B. vagy kategória nélküli) alapján a szemet érintő veszélyek hatástartománya szempontjából reprezentatívak legyenek (4) (6). A kiválasztás másik kritériuma az volt, hogy a vegyi anyagok kereskedelmi forgalomban beszerezhetők legyenek, azokra vonatkozóan kiváló minőségű in vivo referenciaadatok álljanak rendelkezésre, és az ICE vizsgálati módszer alapján kiváló minőségű in vitro adatok álljanak rendelkezésre. A referenciaadatok az ésszerűsített összefoglaló dokumentumban (5) és az ICE vizsgálati módszer felülvizsgálatára vonatkozó ICCVAM-háttérdokumentumban (9) találhatók.
1. táblázat
Az ICE vizsgálati módszerben való szakmai jártasság ellenőrzéséhez ajánlott vegyi anyagok
|
Vegyi anyag |
CASRN |
Kémiai osztály (1) |
Halmazállapot |
In Vivo besorolás (2) |
In Vitro besorolás (3) |
|
Benzalkónium-klorid (5 %) |
8001-54-5 |
Óniumvegyület |
Folyadék |
1. kategória |
1. kategória |
|
Klórhexidin |
55-56-1 |
Amin, amidin |
Szilárd |
1. kategória |
1. kategória |
|
Dibenzoil-L-borkősav |
2743-38-6 |
Karbonsav, észter |
Szilárd |
1. kategória |
1. kategória |
|
Imidazol |
288-32-4 |
Heterociklikus |
Szilárd |
1. kategória |
1. kategória |
|
Triklór-ecetsav (30 %) |
76-03-9 |
Karbonsav |
Folyadék |
1. kategória |
1. kategória |
|
2,6-Diklórbenzoil-klorid |
4659-45-4 |
Savhalogenid |
Folyadék |
2A. kategória |
Előrejelzés nem végezhető (4) |
|
Ammónium-nitrát |
6484-52-2 |
Szervetlen só |
Szilárd |
2A. kategória (5) |
Előrejelzés nem végezhető (4) |
|
Etil-2-metilaceto-acetát |
609-14-3 |
Keton, észter |
Folyadék |
2B. kategória |
Előrejelzés nem végezhető (4) |
|
Dimetil-szulfoxid |
67-68-5 |
Szerves kénvegyület |
Folyadék |
Kategória nélküli |
Kategória nélküli |
|
Glicerin |
56-81-5 |
Alkohol |
Folyadék |
Kategória nélküli |
Kategória nélküli (határeset) |
|
Metil-ciklopentán |
96-37-7 |
Szénhidrogének (ciklikus) |
Folyadék |
Kategória nélküli |
Kategória nélküli |
|
n-Hexán |
110-54-3 |
Szénhidrogén (aciklikus) |
Folyadék |
Kategória nélküli |
Kategória nélküli |
|
Triacetin |
102-76-1 |
Lipid |
Folyadék |
Nem osztályozott |
Kategória nélküli |
|
(1) Az egyes vegyi anyagok kémiai osztályának meghatározása standard osztályozási rendszer alkalmazásával, a National Library of Medicine »Medical Subject Headings« (MeSH) elnevezésű osztályozási rendszere (elérhető a következő címen: http//www.nlm.nih.gov/mesh) alapján történt. (2) A nyulakon végzett in vivo szemvizsgálat (az OECD 405. vizsgálati iránymutatása) eredményei alapján és az ENSZ-GHS (4) (6) felhasználásával. (3) Az ICE vizsgálat 6. táblázatban ismertetett eredményei alapján. (4) A 6. táblázatban a GHS szerint nem besorolt és a GHS szerinti 1. kategóriába tartozó vegyi anyagokra vonatkozóan ismertetett ICE-pontszámoktól eltérő ICE-pontszámok kombinációja (lásd a 6. táblázatot). (5) A 2A. vagy 2B. kategóriába sorolás az ENSZ-GHS rendszerének a két kategória megkülönböztetésére szolgáló kritériuma értelmezésétől függ, azaz három állatból egynél, illetve három állatból kettőnél a hetedik napon jelentkező hatások szükségesek a 2A. kategóriába soroláshoz. Az in vivo vizsgálatot három állaton végezték. Egy állaton a kötőhártya vörösségétől eltekintve minden végpont begyógyul, nulla pontos lesz a hetedik napra vagy korábban. Annak az egy állatnak, amely nem gyógyult meg teljesen a hetedik napra, a kötőhártya vörösségét értékelő pontszáma 1 volt (a hetedik napon), majd a 10. napon teljesen meggyógyult. Rövidítések: CASRN = a Chemical Abstracts Service (CAS) szerinti nyilvántartási szám (CAS-szám). |
|||||
3. függelék
AZ ICE VIZSGÁLATHOZ SZUPERFÚZIÓS KÉSZÜLÉKET ÉS SZEMCSÍPTETŐKET SZEMLÉLTETŐ ÁBRÁK
(A szuperfúziós készülék és a szemcsíptető további általános leírását lásd: Burton et al. (18))

|
Tétel |
Megnevezés |
Tétel |
Megnevezés |
|
1 |
melegvíz-kifolyónyílás |
9 |
kamra |
|
2 |
csúszóajtó |
10 |
szemtartó |
|
3 |
szuperfúziós készülék |
11 |
csirkeszem |
|
4 |
optikai mérőműszer |
12 |
sóoldat-kifolyónyílás |
|
5 |
melegvíz-befolyónyílás |
13 |
állítócsavar |
|
6 |
sóoldat |
14 |
állítható felső kar |
|
7 |
meleg víz |
15 |
rögzített alsó kar |
|
8 |
sóoldat-befolyónyílás |
|
|
”
(14) A B. részben a B.49. fejezet helyébe a következő szöveg lép:
„B.49 In vitro celluláris mikronukleusz-vizsgálat emlősökön
BEVEZETÉS
Ez a vizsgálati módszer egyenértékű az OECD 487. vizsgálati iránymutatásával (2016). Ez a vizsgálati módszer a genetikai toxikológiai vizsgálati módszerek sorozatának részét képezi. Kidolgozásra került egy, a genetikai toxikológiai vizsgálatokról tömör tájékoztatást nyújtó, a vizsgálati iránymutatások közelmúltbeli változásait áttekintő OECD-dokumentum (1).
Az in vitro mikronukleusz-vizsgálat (a továbbiakban: MNvit vizsgálat) interfázisban lévő sejtek citoplazmájában mikronukleuszok (MN) kimutatására szolgáló genotoxicitási vizsgálat. A mikronukleuszok acentrikus (vagyis centromérával nem rendelkező) kromoszómatöredékekből vagy olyan ép kromoszómákból származhatnak, amelyek a sejtosztódás anafázisa során nem képesek a sejtpólusokra vándorolni. Ezért az MNvit vizsgálat olyan in vitro módszer, amely átfogó alapot szolgáltat a kromoszóma-károsító potenciál in vitro vizsgálatához, ugyanis a vizsgálati vegyi anyagnak való expozíció során vagy után sejtosztódáson átesett sejtekben aneugének és klasztogének egyaránt kimutathatók (2) (3) (további részletekért lásd a 13. pontot). A mikronukleuszok olyan károsodást jeleznek, amely átkerült az utódsejtekbe, míg a metafázisban lévő sejtekben értékelt kromoszóma-rendellenességek nem feltétlenül öröklődnek. A változások egyik esetben sem feltétlenül egyeztethetők össze a sejtek túlélésével.
Ez a vizsgálati módszer egyaránt lehetővé teszi az aktin-polimerizációt gátló citokalazin-B-t (a továbbiakban: citoB) tartalmazó és nélkülöző protokollok használatát. A citoB mitózist megelőző hozzáadása kétmagvú sejteket eredményez, és ennélfogva kizárólag a mitózison átesett sejtek esetében teszi lehetővé a mikronukleuszok azonosítását és analízisét (4) (5). Ez a vizsgálati módszer a citokinezis-gátlást nem alkalmazó protokollok használatát is lehetővé teszi, feltéve, hogy a vizsgált sejtpopuláció mitózisa bizonyítható.
Amellett, hogy MNvit vizsgálat alkalmazható a mikronukleuszokat indukáló vegyi anyagok azonosítására, a kinetokorok immunkémiai jelölése, illetve a centroméra/teloméra-próbák hibridizációja (fluoreszcens in situ hibridizáció (FISH)) arról is további információkat biztosíthat, hogy milyen mechanizmussal történt a kromoszómasérülés és a mikronukleusz-képződés (6) (7) (8) (9) (10) (11) (12) (13) (14) (15) (16) (17). Az említett jelölési és a hibridizációs technikákat akkor lehet alkalmazni, ha fokozódik a mikronukleusz-képződés, és a vizsgáló szeretné megállapítani, hogy ez a fokozódás klasztogén és/vagy aneugén hatásra jött-e létre.
Mivel az interfázisos sejtekben lévő mikronukleuszok viszonylag objektív módon vizsgálhatók, a laboratóriumi személyzetnek csak a citoB használata esetén előforduló kétmagvú sejtek számát, valamint a mikronukleált sejtek összes esetbeli előfordulását kell meghatároznia. Ennek következtében a tárgylemezek viszonylag gyorsan értékelhetők, és az elemzés automatizálható. Ez a gyakorlatban kezelésenként több száz helyett több ezer sejt értékelését teszi lehetővé, növelve a vizsgálat erejét. Végül megállapítható, hogy mivel a mikronukleuszok visszamaradó kromoszómákból keletkezhetnek, lehetséges olyan aneuploidiát indukáló anyagok azonosítása, amelyek a kromoszóma-rendellenességek hagyományos vizsgálatával, például e melléklet B.10. fejezete (18) szerint nehezen tanulmányozhatók. Az e vizsgálati módszerben ismertetett MNvit vizsgálat ugyanakkor speciális technikák, például a 4. pontban említett FISH alkalmazása nélkül nem teszi lehetővé a kromoszómaszám változását és/vagy ploidiát okozó és a klasztogén hatású vegyi anyagok megkülönböztetését.
Az MNvit vizsgálat számos különféle sejttípus esetében, valamint citoB jelenlétében és hiányában is megbízhatóan lebonyolítható. Az MNvit vizsgálat hitelességét különböző sejttípusok (sejtvonal-tenyészetek vagy primer sejtkultúrák) alkalmazásával nyert nagy mennyiségű adat támasztja alá (19) (20) (21) (22) (23) (24) (25) (26) (27) (28) (29) (30) (31) (32) (33) (34) (35) (36). Ezek közé tartoznak különösen a Société Française de Toxicologie Génétique (SFTG) által koordinált nemzetközi validálási vizsgálatok (19) (20) (21) (22) (23) és a genotoxicitás vizsgálatával foglalkozó nemzetközi műhely (International Workshop on Genotoxicity Testing) jelentései (5) (17). A rendelkezésre álló adatokat az Európai Bizottság Alternatív Módszerek Validálásával Foglalkozó Európai Központja (ECVAM) is újraértékelte egy, az adatok bizonyító erejét mérlegelő retrospektív validálási vizsgálatban, és a vizsgálati módszert az ECVAM tudományos tanácsadó bizottsága (ESAC) tudományosan megalapozott módszerként jóváhagyta (37) (38) (39).
Az emlőssejtek MNvit vizsgálata során emberekből vagy rágcsálókból származó sejtvonal-tenyészetek vagy primer sejtkultúrák alkalmazhatók. Mivel a mikronukleusz-képződés háttérgyakorisága befolyásolja a vizsgálat érzékenységét, ezért stabil és meghatározott mikronukleusz-képződési háttérgyakorisággal rendelkező sejttípusok alkalmazása javasolt. A felhasznált sejteket a tenyészetben való megfelelő növekedési képesség, a kariotípusuk stabilitása (többek között a kromoszómaszám) és a mikronukleuszok spontán gyakorisága alapján kell kiválasztani (40). A rendelkezésre álló adatok jelenleg nem teszik lehetővé határozott ajánlások megfogalmazását, azonban arra utalnak, hogy a kémiai veszélyek értékelése során fontos figyelembe venni a vizsgálat céljára kiválasztott sejtek p53 státuszát, genetikai (kariotípus-) stabilitását, DNS-reparációs képességét és eredetét (rágcsáló-, illetve emberi sejtek). E vizsgálati módszer alkalmazóinak tehát érdemes figyelembe venniük a sejtek szóban forgó és egyéb tulajdonságainak a sejtvonalak teljesítményére kifejtett hatását a mikronukleuszok indukálásának kimutatása során, mivel a tudomány fejlődik ezen a területen.
A használt fogalmak meghatározását az 1. függelék tartalmazza.
KIINDULÁSI MEGFONTOLÁSOK ÉS KORLÁTOK
Az in vitro végrehajtott vizsgálatok rendszerint szükségessé teszik a metabolikus aktiválás valamilyen exogén forrásának használatát, kivéve, ha a sejtek metabolizálják a vizsgálati vegyi anyagokat. Az exogén metabolikus aktivációs rendszer nem utánozza teljesen az in vivo körülményeket. Ügyelni kell arra, hogy ne álljanak elő olyan körülmények, amelyek a vizsgálati vegyi anyagok genotoxicitását nem tükröző, hamis pozitív eredményekhez vezethetnek. Ilyen körülmény többek között a pH (41) (42) (43) vagy az ozmolalitás változása, a sejttenyésztő közeggel fellépő kölcsönhatás (44) (45) vagy a túlzott mértékű citotoxicitás (lásd a 29. pontot).
A mikronukleuszok indukálásának vizsgálatához elengedhetetlen, hogy a kezelt és a nem kezelt tenyészetekben egyaránt végbemenjen mitózis. A mikronukleuszok értékeléséhez az a szakasz szolgáltatja a legtöbb információt, amelyben a sejt a vizsgálati vegyi anyaggal végzett kezelés során vagy után egy mitózison esett át. A gyártott nanoanyagok esetében e vizsgálati módszer egyedi adaptálására van szükség, amelyet azonban ez a vizsgálati módszer nem ismertet.
A vizsgálati módszer tervezett szabályozási célt szolgáló adatgenerálás érdekében, keveréken történő alkalmazása előtt meg kell vizsgálni, hogy az megfelelő eredményeket biztosíthat-e erre a célra, és ha igen, miért. Ilyen megfontolások nem szükségesek, ha létezik a keverék vizsgálatára vonatkozó szabályozási követelmény.
A VIZSGÁLAT ELVE
Az emberből vagy más emlősből származó sejttenyészeteket exogén metabolikus aktiválási forrással vagy anélkül is kezelni kell a vizsgálati vegyi anyaggal, kivéve megfelelő metabolizáló képességű sejtek használata esetén (lásd a 19. pontot).
A vizsgálati vegyi anyaggal történt expozíció során vagy után a sejteket elegendő ideig kell tenyészteni ahhoz, hogy kromoszómakárosodás vagy a sejtciklusra/sejtosztódásra kifejtett egyéb hatás jöhessen létre, és ez az interfázisban lévő sejtekben mikronukleuszok képződéséhez vezessen. Az aneuploidia indukálásához a vizsgálati vegyi anyagnak általában jelen kell lennie a mitózis során. A mikronukleuszok jelenlétét a begyűjtött és megfestett, interfázisban lévő sejtekben vizsgálják. Ideális esetben a mikronukleuszokat csak azokban a sejtekben kell megszámolni, amelyek a vizsgálati vegyi anyaggal történt expozíció során vagy – ha van ilyen – a kezelés utáni időszakban estek át mitózison. A citokinezis-gátlóval kezelt tenyészetekben ez könnyen megvalósítható csupán a kétmagvú sejtek értékelésével. Citokinézis-gátló hiányában fontos annak bizonyítása, hogy a vizsgált sejtek – a sejtpopuláció növekedése alapján – valószínűleg sejtosztódáson estek át a vizsgálati vegyi anyaggal történt expozíció során vagy után. Minden protokoll esetében fontos bizonyítani, hogy a sejtproliferáció a kontroll- és a kezelt tenyészetekben egyaránt végbement, és a mikronukleuszok értékeléséhez használt összes tenyészetben meg kell állapítani a vizsgálati vegyi anyag által kiváltott citotoxicitás vagy citosztázis mértékét.
A MÓDSZER LEÍRÁSA
Sejtek
Emberek vagy más emlősök perifériás véréből származó tenyésztett primer limfociták (7) (20) (46) (47) és bizonyos rágcsáló sejtvonalak, például a CHO, V79, CHL/IU és L5178Y sejtek vagy humán sejtvonalak, például TK6 sejtvonal alkalmazhatók (19) (20) (21) (22) (23) (26) (27) (28) (29) (31) (33) (34) (35) (36) (lásd a 6. pontot). Eddig egyéb sejtvonalak, például HT29 (48), Caco-2 (49), HepaRG (50) (51), HepG2 sejtek (52) (53), A549 és szíriai hörcsögembrióból származó primer sejtek (54) voltak használatosak mikronukleusz-vizsgálathoz, ezúttal azonban nem volt teljes a validálásuk. E sejtvonalak és sejttípusok alkalmazását a vizsgálat során mutatott teljesítményük alapján, az »Elfogadhatósági kritériumok« című részben leírtak szerint kell indokolni. Beszámolók szerint a citoB potenciálisan befolyásolhatja az L5178Y sejtek növekedését, ezért nem ajánlott ezzel a sejtvonallal (23). Primer sejtek használatakor állatjóléti okok miatt meg kell fontolni emberi eredetű sejtek használatát – amennyiben megvalósítható –, és azokból a humán etikai elveknek és a vonatkozó szabályozásoknak megfelelően kell mintát venni.
Az emberi perifériás limfocitákat olyan fiatal (kb. 18–35 éves), nem dohányzó egyénektől kell venni, akik ismert betegséggel nem rendelkeznek, illetve a közelmúltban genotoxikus szereknek (például vegyi anyagoknak, ionizáló sugárzásnak) nem voltak kitéve olyan mértékben, amely fokozná a mikronukleált sejtek háttérbeli előfordulását. Ez biztosítaná, hogy a mikronukleált sejtek háttérbeli előfordulása alacsony és egységes legyen. A mikronukleált sejtek alapesetbeli előfordulása az életkor előrehaladtával nő, és ez a tendencia a nőknél jellemzőbb, mint a férfiaknál (55). Amennyiben több donortól származó sejteket együtt használnak fel, akkor a donorok számát meg kell adni. Igazolni kell, hogy a sejtek a vizsgálati vegyi anyaggal való kezelés kezdetétől a sejtekből történő mintavételig osztódtak. A sejttenyészeteket exponenciális növekedési fázisban (sejtvonalakban) kell tartani vagy osztódásra kell késztetni (primer limfocita-tenyészetek) a sejteknek a sejtciklus különböző szakaszaiban történő expozíciója érdekében, mivel a sejtfázisoknak a vizsgálati vegyi anyagokra való érzékenysége nem feltétlenül lehet ismert. Azok a primer sejtek, amelyeket az osztódás érdekében mitogén szerekkel kell stimulálni, a vizsgálati vegyi anyagnak való expozíció során általában már nem szinkronizáltak (például az emberi limfociták 48 órás mitogén stimulációt követően). Szinkronizált sejtek használata nem javasolt a vizsgálati vegyi anyaggal való kezelés során, indokolt esetben azonban elfogadható.
Tenyészközegek és tenyésztési körülmények
A tenyészetek fenntartására megfelelő tenyészközeget és inkubációs feltételeket (tenyésztőedények, megfelelő esetben 5 %-os CO2-koncentrációjú párás légkör, 37 °C-os hőmérséklet) kell alkalmazni. A sejtvonalakat rutinszerűen ellenőrizni kell a modális kromoszómaszám stabilitása és a mikoplazma-fertőzés hiánya szempontjából, és a sejtek nem használhatók fel, ha fertőzöttek, vagy ha a modális kromoszómaszám megváltozott. A vizsgálólaboratóriumban használt sejtvonalak, illetve primer sejtkultúrák rendes sejtciklusidejét meg kell állapítani, és annak összhangban kell lennie a közzétett sejtjellemzőkkel.
A tenyészetek előkészítése
Sejtvonalak: a sejteket törzstenyészetekből fel kell szaporítani, majd tenyészközegbe kell leoltani olyan sejtszámmal, hogy a sejtek a szuszpenziókban vagy a monolayer tenyészetekben továbbra is exponenciálisan növekedjenek a begyűjtés idejéig (a monolayer tenyészetekben növő sejtek esetében például kerülendő a konfluencia).
Limfociták: alvadásgátlóval (például heparinnal) kezelt teljes vért vagy szeparált limfocitákat kell tenyészteni (például emberi limfociták esetében 48 óráig) mitogén szer [emberi limfociták esetében például phytohaemagglutinin (PHA)] jelenlétében, annak érdekében, hogy a vizsgálati vegyi anyagnak és a citoB-nek való expozíció előtt sejtosztódást váltsanak ki.
Metabolikus aktiválás
Megfelelő endogén metabolikus kapacitással nem rendelkező sejtek használata esetén exogén metabolizáló rendszereket kell alkalmazni. Amennyiben másik rendszer nem indokolt, az alapértelmezetten ajánlott, legáltalánosabban használt rendszer a rágcsálók (általában patkányok) enziminducerrel (ilyen például az Aroclor 1254 (56) (57) vagy fenobarbitál és b-naftoflavon kombinációjával (58) (59) (60)) kezelt májából preparált, kofaktor-kiegészítésű posztmitokondriális frakció (S9). Ez utóbbi kombináció nem ütközik a környezetben tartósan megmaradó szerves szennyező anyagokról szóló stockholmi egyezménnyel (61), és kiderült róla, hogy olyan hatékony, mint az Aroclor 1254 a vegyes funkciójú oxidáz indukálásához (58) (59) (60). Az S9 frakció jellemzően 1–2 térfogatszázalék koncentrációban használatos, de a végső vizsgálati közegben 10 térfogatszázalékra növelhető. A mitotikus indexet csökkentő termékek, különösen a kalcium-komplexáló termékek (62) használata kerülendő a kezelés során. Az alkalmazott exogén metabolikus aktivációs rendszer vagy metabolikus induktor típusának és koncentrációjának megválasztását befolyásolhatja a vizsgált anyagok osztálya.
A vizsgálati vegyi anyag előkészítése
A szilárd halmazállapotú vizsgálati vegyi anyagokat a sejtek kezelése előtt megfelelő oldószerben elő kell készíteni, és szükség esetén hígítani kell. A folyékony halmazállapotú vizsgálati vegyi anyagok közvetlenül hozzáadhatók a vizsgálati rendszerhez és/vagy hígíthatók a vizsgálati rendszer kezelése előtt. A gáz halmazállapotú vagy illékony vizsgálati vegyi anyagokat a standard protokollok megfelelő módosításával, például légmentesen lezárt edényekben történő kezeléssel kell vizsgálni (63) (64) (65). A vizsgálati vegyi anyagot tartalmazó készítményeket pontosan a kezelés előtt kell előállítani, kivéve, ha a stabilitásra vonatkozó adatok a tárolás elfogadhatóságát bizonyítják.
Vizsgálati körülmények
Oldószerek
Az oldószert oly módon kell kiválasztani, hogy optimalizálja a vegyi anyag oldhatóságát, ugyanakkor ne befolyásolja hátrányosan a vizsgálat lebonyolítását, vagyis ne változtassa meg a sejtek növekedését, ne érintse a vizsgálati vegyi anyag integritását, ne lépjen reakcióba a tenyésztőedényekkel, és ne károsítsa a metabolikus aktivációs rendszert. Amennyiben lehetséges, először valamilyen vizes oldószer (vagy tenyészközeg) használatát érdemes megfontolni. Jól bevált oldószer a víz vagy a dimetil-szulfoxid (DMSO). A szerves oldószerek mennyisége nem haladhatja meg az 1 térfogatszázalékot. CitoB DMSO-ban történő feloldása esetén a vizsgálati vegyi anyaghoz és a citoB-hez felhasznált szerves oldószer teljes mennyisége sem haladhatja meg az 1 térfogatszázalékot; annak biztosítása érdekében, hogy a szerves oldószer százalékos aránya ne fejtsen ki káros hatást, nem kezelt kontrollokat kell használni. A végleges kezelési közegben a vizes oldószerek (sós lé vagy víz) nem haladhatják meg a 10 térfogatszázalékot. Ha jól bevált szerves oldószerektől eltérő oldószereket (például etanolt vagy acetont) használnak, a használatukat a vizsgálati vegyi anyaggal és a vizsgálati rendszerrel való összeegyeztethetőségükre utaló, valamint azt jelző adatokkal kell alátámasztani, hogy a használt koncentrációnál nem genotoxikusak. Alátámasztó adatok hiányában fontos nem kezelt kontrollok (lásd az 1. függeléket), valamint oldószeres kontrollok alkalmazása annak bizonyítására, hogy a kiválasztott oldószer nem vált ki ártalmas vagy kromoszómakárosító hatást (például aneuploidiát vagy klasztogén hatást).
CitoB alkalmazása citokinezis-gátlóként
Az MNvit vizsgálat teljesítményét illetően az egyik legfőbb szempont annak biztosítása, hogy az értékelt sejtek a kezelés során vagy – ha volt ilyen – a kezelés utáni inkubációs periódusban mitózison essenek át. A mikronukleuszok értékelése ezért azokra a sejtekre korlátozandó, amelyek a kezelés során vagy után átestek mitózison. A citokinezis gátlására a legelterjedtebben alkalmazott szer a citoB, mivel gátolja az aktin kapcsolódását, ezzel megakadályozza az utódsejtek mitózis utáni szétválását, ami kétmagvú sejtek képződéséhez vezet (6) (66) (67). A vizsgálati vegyi anyag által a sejtproliferáció kinetikájára gyakorolt hatás citoB használata esetén párhuzamosan mérhető. Humán limfociták alkalmazása esetén a citoB citokinezis-gátlóként alkalmazandó, mivel a sejtciklusidők változóak lesznek a donorok körében, és mivel nem az összes limfocita fog reagálni a PHA-stimulációra. A citoB nem kötelező más sejttípusok esetén, ha megállapítható, hogy sejtosztódáson mentek át, ahogyan a 27. pontban szerepel. A citoB továbbá nem általánosan használatos, ha a mintákat áramlási citometriás módszerekkel értékelik a mikronukleuszok szempontjából.
A citoB megfelelő koncentrációját az egyes sejttípusokra vonatkozóan a laboratóriumnak kell meghatároznia annak érdekében, hogy az oldószeres kontrolltenyészetekben optimális gyakorisággal alakuljanak ki kétmagvú sejtek, továbbá be kell igazolódnia annak, hogy az értékeléshez megfelelő számú kétmagvú sejtet hoz létre. A citoB megfelelő koncentrációja általában 3–6 μg/ml (19).
A sejtproliferáció és a citotoxicitás mérése, valamint a kezelési koncentrációk kiválasztása
A vizsgálati vegyi anyag legmagasabb koncentrációjának meghatározása során kerülendő az olyan koncentráció, amely hamis pozitív válaszreakciókat válthat ki, ilyen a túlzott citotoxicitást okozó koncentráció (lásd a 29. pontot), a tenyészközegben való kicsapódást okozó koncentráció (lásd a 30. pontot), illetve a pH vagy az ozmolalitás jelentős változását okozó koncentráció (lásd az 9. pontot). Ha a vizsgálati vegyi anyag a hozzáadásakor jelentős változást okoz a tenyészközeg pH-jában, a pH a kezelésre szolgáló végleges tenyészközeg pufferelésével kiigazítható, hogy elkerülhetők legyenek a hamis pozitív eredmények és megfelelő tenyésztési feltételeket lehessen fenntartani.
Mérni kell a sejtproliferációt annak biztosítása érdekében, hogy a vizsgálat során elegendő kezelt sejt átessen a mitózison, és hogy a kezelésekre megfelelő szintű citotoxicitás mellett kerüljön sor (lásd a 29. pontot). A citotoxicitást a fő kísérletben metabolikus aktiválással és anélkül is kell meghatározni a sejtelhalás és a sejtnövekedés megfelelő mutatóinak használatával (lásd a 26. és a 27. pontot). Bár egy kiindulási előzetes vizsgálat során hasznos lehet a citotoxicitás értékelése a fő kísérletben alkalmazandó koncentrációk jobb meghatározásához, a kiindulási vizsgálat nem kötelező. Végrehajtása esetén nem helyettesítheti a citotoxicitás fő kísérlet során történő mérését.
A tenyészetek citoB-vel történő kezelése, valamint a tenyészetben található egymagvú, kétmagvú és többmagvú sejtek relatív gyakoriságainak mérése pontos módszer a kezelés sejtproliferációt előidéző és citotoxikus vagy citosztatikus hatásának mennyiségi meghatározására (6), valamint biztosítja, hogy csak a kezelés során vagy után osztódott sejtek kerüljenek értékelésre. A tenyészetenként legalább 500 sejtből számított citokinezis-gátlási proliferációs index (CBPI) (6) (27) (68) vagy replikációs index (RI) (a képletekért lásd a 2. függeléket) ajánlott egy-egy kezelés citotoxikus vagy citosztatikus aktivitásának a kezelt és a kontrolltenyészetekben kapott értékek összevetésével történő becsléséhez. A citotoxicitás egyéb mutatóinak (például a sejtek egybefüggősége, apoptózis, nekrózis, metafázis-számolás, sejtciklus) értékelése hasznos információval szolgálhat, de azokat a CBPI vagy az RI helyett kell használni.
A citoB nélkül végzett vizsgálatokban igazolni kell, hogy a tenyészeten belüli sejtek osztódtak, annak érdekében, hogy a vizsgálati vegyi anyaggal végzett kezelés alatt vagy az után az értékelt sejtek jelentős hányada átessen az osztódáson, ellenkező esetben hamis negatív válaszreakciók alakulhatnak ki. Egy-egy kezelés citotoxikus és citosztatikus aktivitásának becslésére (17) (68) (69) (70) (71) a relatív populációduplázódásnak (RPD) vagy a sejtszám relatív növekedésének (RICC) a mérése ajánlott (a képletekért lásd a 2. függeléket). Meghosszabbított mintavételi idők esetén (például 1,5–2 normál sejtciklusideig tartó kezelés és további 1,5–2 normál sejtciklusidő eltelte utáni begyűjtés, ami összesen a 38. és 39. pontban foglalt 3–4 normál sejtciklusidőnél hosszabb mintavételi időket eredményez) az RPD alulbecsülheti a citotoxicitást (71). Ilyen körülmények között az RICC jobb mértékegység lehet, illetve a citotoxicitás 1,5–2 normál sejtciklusidő utáni értékelése hasznos becslés lehet. A citotoxicitás, illetve a citosztázis egyéb markereinek (például a sejtek egybefüggősége, apoptózis, nekrózis, metafázis-számolás, proliferációs index (PI), sejtciklus, nukleoplazmikus hidak vagy sejtmag-kidudorodások) értékelése további hasznos információkkal szolgálhat, azonban nem alkalmazható sem az RPD, sem az RICC helyett.
Az elfogadhatósági kritériumokat (megfelelő citotoxicitás, sejtszám stb.) teljesítő, (az oldószeres és a pozitív kontrollokat nem tartalmazó) legalább három vizsgálati koncentrációt kell értékelni. A sejtek típusától (limfocita-sejtvonalak vagy primer limfocita-tenyészetek) függetlenül, minden egyes vizsgált koncentrációnál párhuzamos vagy szimpla kezelt tenyészetek használhatók. Bár két párhuzamos tenyészet használata ajánlatos, a szimpla tenyészetek is elfogadhatóak, amennyiben a szimpla vagy a párhuzamos tenyészetek esetében megegyezik az összességében értékelt sejtek száma. A szimpla tenyészetek használata különösen releváns, ha több mint három koncentráció értékelésére kerül sor (lásd a 44–45. pontot). A független párhuzamos tenyészetekből adott koncentráció mellett kapott eredmények összevonhatók az adatelemzéshez. Az alacsony citotoxicitást vagy a citotoxicitás hiányát mutató vizsgálati vegyi anyagok esetében rendszerint megközelítőleg kétszeres-háromszoros koncentrációs intervallumok helyénvalóak. Citotoxicitás fellépése esetén a vizsgálati koncentrációknak le kell fedniük a 29. pontban ismertetett, citotoxicitást okozó koncentrációtól azokig a koncentrációkig terjedő tartományt, ahol mérsékelt vagy alacsony a citotoxicitás, illetve nem jelentkezik citotoxicitás. Számos vizsgálati vegyi anyagnak meredek a koncentráció-válasz görbéje, és annak érdekében, hogy alacsony és mérsékelt citotoxicitásnál adatokat lehessen nyerni, vagy részletesen meg lehessen vizsgálni a dózis-válasz összefüggést, egymáshoz közelebbi koncentrációkat és/vagy háromnál több koncentrációt (szimpla tenyészeteket vagy párhuzamos tenyészeteket) kell használni, különösen olyan helyzetekben, ahol megismételt kísérlet szükséges (lásd a 60. pontot).
Ha a legmagasabb koncentráció a citotoxicitáson alapul, a legmagasabb koncentrációval 55 ± 5 %-os citotoxicitást kell megcélozni a citotoxicitás ajánlott paramétereinek alkalmazásával (azaz citoB használatának hiányában a sejtvonalak RICC és RPD mutatójának, illetve citoB használata esetén a CBPI vagy RI mutatónak a párhuzamos negatív kontroll 45± 5 %-ára csökkentésével) (72). Az 55 ± 5 %-os citotoxicitási tartománynak csak a magasabb részén megtalálható pozitív eredmények értelmezése során körültekintően kell eljárni (71).
A legalacsonyabb oldhatatlan koncentrációnál alacsonyabb koncentrációk mellett nem citotoxikus, kevéssé oldható vegyi anyagok esetében a legmagasabb analizált koncentrációnak a vizsgálati vegyi anyaggal történő kezelés végén szemmel vagy inverz mikroszkóp segítségével látható zavarosságot vagy kicsapódást kell okoznia. Még abban az esetben is, ha citotoxicitás a legalacsonyabb oldhatatlan koncentráció felett jön létre, ajánlatos egyetlen egy, zavarosságot vagy látható kicsapódást okozó koncentrációt vizsgálni, mivel a kicsapódás álhatásokat eredményezhet. A kicsapódást okozó koncentrációnál ügyelni kell annak biztosítására, hogy a kicsapódás ne zavarja a vizsgálat lebonyolítását (például a megfestést vagy az értékelést). Hasznos lehet a tenyészközegben való oldhatóság meghatározása a kísérlet előtt.
Ha nem figyelhető meg kicsapódás vagy korlátozó citotoxicitás, a legmagasabb vizsgálati koncentrációnak 10 mM-nek, 2 mg/ml-nek vagy 2 μ/ml-nek kell megfelelnie, melyek közül a legalacsonyabb a mérvadó (73) (74) (75). Ha a vizsgálati vegyi anyag nem meghatározott összetételű, például ismeretlen szerkezetű vagy változó összetételű, összetett reakcióban keletkezett vagy biológiai eredetű anyag (UVCB) (76), környezeti extraktum stb., előfordulhat, hogy kellő citotoxicitás hiányában a legmagasabb koncentrációnak magasabbnak (például 5 mg/ml-nek) kell lennie ahhoz, hogy növekedjen az egyes összetevők koncentrációja. Megjegyzendő azonban, hogy ezek a követelmények eltérőek lehetnek a humán gyógyszerek esetében (93).
Kontrollok
Minden begyűjtés alkalmával párhuzamos negatív kontrollokat kell használni (lásd a 21. pontot), amelyeknél csak oldószert alkalmaznak a kezelt közegben, és a feldolgozásuk ugyanolyan módon történik, mint a kezelt tenyészeteké.
Párhuzamos pozitív kontrollok szükségesek annak igazolására, hogy a laboratórium képes az alkalmazott vizsgálati protokoll feltételei mellett klasztogének és aneugének azonosítására, valamint adott esetben az exogén metabolikus aktivációs rendszer eredményességének igazolása érdekében. Pozitív kontrollokra vonatkozó példák az alábbi 1. táblázatban találhatók. Indokolt esetben pozitív kontrollként alternatív vegyi anyagok használhatók.
Jelenleg nem ismert olyan aneugén hatású anyag, amely genotoxikus aktivitásához metabolikus aktiválást igényelne (17). Mivel az emlőssejtek genetikai toxicitás szempontjából végzett in vitro vizsgálatai a metabolikus aktiválással és anélkül, ugyanannyi ideig egyidejűleg végzett rövid távú kezelések esetében kellően szabványosítottak, a pozitív kontrollok használata a metabolikus aktiválást igénylő klasztogénekre korlátozódhat. Ebben az esetben egyetlen klasztogén pozitív kontroll válaszreakciója a metabolikus aktivációs rendszer aktivitását és a vizsgálati rendszer reagálóképességét is bizonyítani fogja. A(z S9 nélküli) hosszú távú kezelésnek azonban kell, hogy legyen saját pozitív kontrollja, mivel a kezelés időtartama eltér a metabolikus aktiválás alkalmazása mellett végzett vizsgálatétól. Ha metabolikus aktiválással és anélkül végzett rövid távú kezeléshez klasztogént választanak ki egyetlen pozitív kontrollként, a metabolikus aktiválás nélküli hosszú távú kezeléshez aneugént kell kiválasztani. Az S9 preparátumot nem igénylő, metabolikusan megfelelő sejtekben a klasztogén és az aneugén hatás vizsgálatához egyaránt szükséges pozitív kontrollt alkalmazni.
Mindegyik pozitív kontrollt egy vagy több olyan koncentrációban kell alkalmazni, amely a háttérértékekben reprodukálható és kimutatható növekedést okoz, hogy bizonyítani lehessen a vizsgálati rendszer érzékenységét (azaz a hatások egyértelműek, de értékelést végző személy nem tudja beazonosítani azonnal a kódolt tárgylemezt), és a választ nem veszélyeztetheti a vizsgálati módszerben meghatározott határértékeket meghaladó citotoxicitás.
1. táblázat
A laboratóriumok jártasságának értékeléséhez és a pozitív kontrollok kiválasztásához ajánlott referenciaanyagok
|
Kategória |
Vegyi anyag |
CASRN |
|
1. Metabolikus aktiválás nélkül is aktív klasztogének |
||
|
|
Metil-metánszulfonát |
66-27-3 |
|
|
Mitomicin-C |
50-07-7 |
|
|
4-Nitro-kinolin-N-oxid |
56-57-5 |
|
|
Citozin-arabinozid |
147-94-4 |
|
2. Metabolikus aktiválást igénylő klasztogének |
||
|
|
Benzo(a)pirén |
50-32-8 |
|
|
Ciklofoszfamid |
50-18-0 |
|
3. Aneugén anyagok |
||
|
|
Kolchicin |
64-86-8 |
|
|
Vinblasztin |
143-67-9 |
ELJÁRÁS
A kezelés ütemterve
A sejtciklus meghatározott fázisában ható aneugén, illetve klasztogén anyagok azonosítási valószínűségének maximalizálása érdekében fontos, hogy a sejtek összes különböző ciklusát képviselő elegendő számú sejt kezelésére kerüljön sor a vizsgálati vegyi anyaggal. Minden kezelésnek a sejtek exponenciális növekedése alatt kell kezdődnie és befejeződnie, és a sejteknek a mintavétel időpontjáig tovább kell növekedniük. A kezelés ütemterve a sejtvonalak és primer sejtkultúrák esetében ezért valamelyest eltérhet a limfocitákétól, amelyek mitogén stimulációt igényelnek ahhoz, hogy megkezdődjön a sejtciklusuk (17). Limfociták esetében a leghatékonyabb módszer, ha a vizsgálati vegyi anyaggal végzett kezelés a PHA-stimuláció után 44–48 órával kezdődik, amikorra a sejtek aszinkron módon fognak osztódni (6).
A közzétett adatokból (19) az derül ki, hogy a legtöbb aneugén és klasztogén anyag kimutatása rövid, 3–6 órás kezelési időszak alkalmazásával – S9 jelenlétében vagy hiányában – történik, amelyet a vizsgálati vegyi anyag eltávolítása, majd – a kezelés megkezdése után kb. 1,5–2,0 normál sejtciklusidőnek megfelelő időpontban történő –mintavétel követ (7).
A negatív eredmény megállapításához szükséges alapos értékeléshez ugyanakkor mindhárom alábbi kísérleti körülményt meg kell teremteni, metabolikus aktiválással és anélkül végzett rövid távú kezeléssel, valamint metabolikus aktiválás nélküli hosszú távú kezeléssel (lásd az 56., 57. és 58. pontot):
— a sejteket metabolikus aktiválás nélkül 3–6 órára ki kell tenni a vizsgálati vegyi anyag hatásának, és azokból a kezelés megkezdése után kb. 1,5–2,0 normál sejtciklusidőnek megfelelő időpontban mintát kell venni (19),
— a sejteket metabolikus aktiválással 3–6 órára ki kell tenni a vizsgálati vegyi anyag hatásának, és azokból a kezelés megkezdése után kb. 1,5–2,0 normál sejtciklusidőnek megfelelő időpontban mintát kell venni (19),
— a sejteket a kezelés megkezdése után kb. 1,5–2,0 normál sejtciklusidőnek megfelelő időpontban történő mintavételig metabolikus aktiválás nélkül folyamatosan ki kell tenni a vizsgálati vegyi anyagnak.
Abban az esetben, ha a fenti kísérleti körülmények pozitív válaszreakciót eredményeznek, a többi kezelési eljárás vizsgálata nem feltétlenül szükséges.
Amennyiben ismert vagy feltehető, hogy a vizsgálati vegyi anyag befolyásolja a sejtciklusidőt (például nukleozidanalógok vizsgálatakor), különösen a p53 státusz meghatározására alkalmas sejtek esetében (35) (36) (77), a mintavételi vagy visszanyerési idők legfeljebb további 1,5–2,0 normál sejtciklusidővel (azaz a rövid távú és a hosszú távú kezelés megkezdése után összesen 3,0–4,0 sejtciklusidőre) meghosszabbíthatók. Ezeknek a választási lehetőségeknek azokban a helyzetekben van jelentőségük, amikor problémát jelenthet a vizsgálati vegyi anyag és a citoB lehetséges kölcsönhatása. Meghosszabbított mintavételi idők (azaz összesen 3,0–4,0 sejtciklusidőnyi tenyésztési idő) alkalmazásakor ügyelni kell annak biztosítására, hogy a sejtek még mindig aktívan osztódjanak. Limfociták esetében például az exponenciális növekedés a stimuláció utáni 96 óra elteltével csökkenhet és a sejtek monolayer tenyészetei konfluenssé válhatnak.
A sejtek kezelésének javasolt ütemtervét az 2. táblázat foglalja össze. Ezek az általános kezelési ütemtervek a vizsgálati vegyi anyag stabilitásától és reaktivitásától, illetve az alkalmazott sejtek konkrét szaporodási jellemzőitől függően módosíthatóak (és indokolandóak).
2. táblázat
A sejtek kezelésének és begyűjtésének ideje az MNvit vizsgálat esetében
|
CitoB-vel kezelt limfociták, primer sejtek és sejtvonalak |
+ S9 Rövid kezelés |
A sejteket 3–6 órán át S9 jelenlétében kell kezelni; el kell távolítani az S9-et és a kezelési közeget; friss közeget és citoB-t kell hozzáadni; a kezelés megkezdése után 1,5–2,0 normál sejtciklusidő elteltével kell begyűjteni. |
|
– S9 Rövid kezelés |
A sejteket 3–6 órán át kell kezelni; el kell távolítani a kezelési közeget; friss közeget és citoB-t kell hozzáadni; a kezelés megkezdése után 1,5–2,0 normál sejtciklusidő elteltével kell begyűjteni. |
|
|
– S9 Meghosszabbított kezelés |
A sejteket 1,5–2,0 normál sejtciklusidőnek megfelelő ideig citoB jelenlétében kell kezelni; a kezelési időszak végén be kell gyűjteni a sejteket. |
|
|
CitoB nélkül kezelt sejtvonalak (Megegyezik a fentebb ismertetett kezelési ütemtervvel, azzal a kivétellel, hogy citoB hozzáadására nem kerül sor) |
||
A monolayer tenyészetekben a 3–6 órás kezelés végén mitotikus sejtek (ismertetőjegyük, hogy alakjuk kerek, és leválnak a felszínről) lehetnek jelen. Mivel ezek a mitotikus sejtek könnyen leválnak, a vizsgálati vegyi anyagot tartalmazó közeg eltávolításakor elveszhetnek. Ha bizonyíték van arra, hogy a mitotikus sejtek száma a kontrollokéhoz képest jelentősen megnő, valószínűsíthető mitotikus leállást jelezve, a sejteket centrifugálással be kell gyűjteni és vissza kell tenni a tenyészetbe, annak elkerülése érdekében, hogy a begyűjtéskor elvesszenek a mitózisban lévő sejtek, valamint azok a sejtek, amelyeknél mikronukleuszok/kromoszóma-rendellenesség kockázata áll fenn.
A sejtek begyűjtése és a tárgylemez preparálása
A begyűjtést és a feldolgozást minden tenyészetnél külön kell végezni. A sejtek előkészítéséhez hozzátartozhat a hipotóniás kezelés, ez a lépés azonban nem szükséges, ha a sejtek megfelelő szétterítése egyéb módon is elérhető. A tárgylemez preparálása során különböző technikák alkalmazhatók, amennyiben ezek az értékeléshez jó minőségű sejtpreparátumokat eredményeznek. Az érintetlen sejtmembránú és citoplazmájú sejteket meg kell tartani, hogy ki lehessen mutatni a mikronukleuszokat és (a citokinezis-gátlási módszer esetén) megbízhatóan azonosítani lehessen a kétmagvú sejteket.
A tárgylemezek különböző módszerekkel festhetők meg, például Giemsa vagy fluoreszkáló DNS-specifikus festékekkel. A megfelelő fluoreszcens festékek (például akridinnarancs (78) vagy Hoechst 33258 plusz pironin-Y (79)) használata kiküszöbölhet néhányat a DNS-re nem jellemző festőanyag használatával mesterségesen előidézett változás közül. A mikronukleuszok tartalmának azonosítására kinetokor elleni antitestek, FISH módszerrel végzett pancentromérás DNS-próbák vagy pancentromer-specifikus primerekkel végzett in situ jelölés megfelelő DNS-kontrasztfestéssel alkalmazható (az egész kromoszómák megfestődnek, míg az acentrikus kromoszómatöredékek nem), amennyiben a mikronukleuszok keletkezésének mechanizmusára vonatkozó információkra van szükség (16)(17). A klasztogén és aneugén hatású anyagok megkülönböztetésére egyéb, korábban hatékonynak bizonyult és validált módszerek is alkalmazhatók. Egyes sejtvonalak esetében például a szub-2N sejtmagok képelemzéshez, lézerszkenneléses citometriához vagy áramlási citometriához hasonló eljárásokkal hipodiploid eseményekként történő mérése szintén szolgáltathat hasznos információt (80) (81) (82). A sejtmagok morfológiai megfigyelései ugyancsak utalhatnak lehetséges aneuploidiára. Ezenfelül a metafázisban lévő sejtek kromoszóma-rendellenességeinek lehetőleg ugyanazon sejttípuson és hasonló érzékenységű protokollal történő vizsgálata is hasznos lehet annak meghatározásához, hogy a mikronukleuszok kromoszómatörésnek tudhatók-e be (annak ismeretében, hogy a kromoszómaveszteség kimutatására nem kerülne sor a kromoszóma-rendellenességek vizsgálata során).
Elemzés
A mikronukleuszok gyakoriságának vizsgálatára irányuló mikroszkópos elemzés előtt minden tárgylemezt, az oldószeres és a nem kezelt (ha használnak ilyeneket), valamint a pozitív kontrollokét is ideértve, önálló kódolással kell ellátni. Megfelelő eljárásokat kell alkalmazni az automatizált értékelési rendszer, például áramlási citometria, lézerszkenneléses citometria vagy képelemzés alkalmazásakor esetlegesen felmerülő elfogultság vagy részrehajlás szabályozása érdekében. Függetlenül attól, hogy milyen automatizált platform használatos a mikronukleuszok számolására, a CBPI, az RI, az RPD, illetve az RICC mutatót egyidejűleg vizsgálni kell.
A citoB-vel kezelt tenyészetekben a mikronukleuszok gyakoriságát koncentrációnként és kontrollonként legalább 2 000 kétmagvú sejtben elemezni kell (83), amelyeknek párhuzamosok alkalmazása esetén egyenlően kell megoszlaniuk a párhuzamosok között. Dózisonként egy tenyészet esetén (lásd a 28. pontot) tenyészetenként legalább 2 000 kétmagvú sejtet (83) kell értékelni ebben az egy tenyészetben. Ha (párhuzamos tenyészetek esetén) az egyes koncentrációkban tenyészetenként 1 000 -nél vagy (egy tenyészet alkalmazása esetén) 2 000 -nél jelentősen kevesebb kétmagvú sejt áll rendelkezésre értékelés céljára, és nem mutatható ki a mikronukleuszok számának jelentős növekedése, akkor vizsgálatot adott esetben több sejt vagy kevésbé citotoxikus koncentrációk alkalmazásával meg kell ismételni. Ügyelni kell arra, hogy ne kerüljenek értékelésre olyan kétmagvú sejtek, amelyek szabálytalan alakúak vagy amelyeknél a két mag mérete jelentősen eltér. Ezen túlmenően a kétmagvú sejtek nem tévesztendők össze a rosszul szétterített többmagvú sejtekkel. A kettőnél több fő magot tartalmazó sejteknél nem szabad vizsgálni a mikronukleuszokat, mivel ezekben a sejtekben magasabb lehet a mikronukleusz-képződés háttérgyakorisága (84). Egymagvú sejtek értékelése elfogadható, amennyiben a vizsgálati vegyi anyagról bebizonyosodott, hogy interferál a citoB aktivitásával. Ilyen esetekben a citoB nélkül megismételt vizsgálat hasznos lehet. A kétmagvú sejtek mellett az egymagvú sejtek értékelése hasznos információval szolgálhat (85) (86), de nem kötelező.
A citoB-vel végzett kezelés nélkül vizsgált sejtvonalakban vizsgálati koncentrációnként és kontrollonként legalább 2 000 sejtben (83) kell értékelni a mikronukleuszokat, amely sejteknek párhuzamosok alkalmazása esetén egyenlően kell megoszlaniuk a párhuzamosok között. Koncentrációnként egy tenyészet alkalmazása esetén (lásd a 28. pontot) legalább 2 000 sejtet kell értékelni ebben az egy tenyészetben. Ha (párhuzamos tenyészetek esetén) az egyes koncentrációkban tenyészetenként 1 000 -nél vagy (egy tenyészet alkalmazása esetén) 2 000 -nél jelentősen kevesebb sejt áll rendelkezésre értékelés céljára, és nem mutatható ki a mikronukleuszok számának jelentős növekedése, akkor vizsgálatot adott esetben több sejt vagy kevésbé citotoxikus koncentrációk alkalmazásával meg kell ismételni.
CitoB alkalmazása esetén a sejtproliferáció értékelése érdekében tenyészetenként legalább 500 sejtből meg kell határozni a CBPI-t vagy az RI-t (lásd a 2. függeléket). Amennyiben a kezeléseket citoB hiányában végzik, a 24–28. pontban foglaltaknak megfelelően elengedhetetlen annak bizonyítása, hogy a tenyészetben lévő sejtek osztódtak.
A laboratórium jártassága
A laboratóriumoknak a vizsgálat rutinszerű alkalmazása előtti elegendő tapasztalat igazolása érdekében kísérletsorozatot kell végrehajtaniuk referenciaként szolgáló, más-más mechanizmusú pozitív vegyi anyagokkal (legalább egy metabolikus aktiválással és legalább egy metabolikus aktiválás nélkül ható, valamint egy aneugén mechanizmus útján ható, az 1. táblázatban felsoroltak közül kiválasztott vegyi anyaggal), és különféle negatív kontrollokkal (többek között nem kezelt tenyészetek és különböző oldószerek/vivőanyagok). E pozitív és negatív kontrollok válaszreakcióinak összhangban kell lenniük a szakirodalommal. Ez nem vonatkozik azokra a laboratóriumokra, amelyek tapasztalattal rendelkeznek, azaz amelyeknek a rendelkezésére áll a 49–52. pontban meghatározott történeti adatbázis.
A pozitív kontrollként szolgáló, kiválasztott vegyi anyagokat (lásd az 1. táblázatot) metabolikus aktiválás nélkül végzett rövid és hosszú kezeléssel, továbbá metabolikus aktiválás jelenlétében végzett rövid kezeléssel is meg kell vizsgálni a laboratórium klasztogén és aneugén hatású vegyi anyagok kimutatásában való jártasságának bizonyítása, a metabolikus aktivációs rendszer eredményességének meghatározása, valamint az értékelési eljárások (mikroszkóppal végzett vizuális elemzés, áramlási citometria, lézerszkenneléses citometria vagy képelemzés) megfelelőségének bizonyítása érdekében. A vizsgálati rendszer érzékenységének és dinamikus tartományának bizonyítása érdekében a kiválasztott vegyi anyagok koncentrációtartományát úgy kell megválasztani, hogy reprodukálható és koncentrációval összefüggő növekedést biztosítson a háttérértékekhez viszonyítva.
Történeti kontrolladatok
A laboratóriumnak meg kell állapítania a következőket:
— a pozitív kontrollok történeti tartománya és eloszlása,
— a negatív (nem kezelt, oldószeres) kontrollok történeti tartománya és eloszlása.
A negatív kontrollok történeti eloszlásához kapcsolódó első adatgyűjtés során a párhuzamos negatív kontrolloknak összhangban kell lenniük a negatív kontrollokra vonatkozóan közzétett adatokkal, amennyiben léteznek. Amint több kísérleti adat adódik a kontrollok eloszlásához, a párhuzamos negatív kontrolloknak ideális esetben az eloszlás 95 %-os ellenőrzési határértékén belül kell lenniük (87) (88). A laboratórium negatív kontrollokat tartalmazó történeti adatbázisát első lépésként legalább 10 kísérlettel kell kiépíteni, de az adatbázisnak lehetőség szerint legalább 20, összehasonlítható kísérleti körülmények között végzett kísérletet kell tartalmaznia. A laboratóriumoknak minőségellenőrzési módszereket, például ellenőrzési diagramokat (C-diagramokat vagy X-bar diagramokat (88)) kell alkalmazniuk annak meghatározására, hogy a pozitív és a negatív kontrollokra vonatkozó adataik mennyire változóak, valamint annak bizonyítására, hogy náluk a módszertan »ellenőrzés alatt« áll (83). A történeti adatok összeállításának és felhasználásának módjára (azaz az adatok történeti adatokhoz számításának és azok közül való kizárásának kritériumaira, valamint egy adott kísérlet elfogadhatósági kritériumaira) vonatkozó további ajánlások megtalálhatók a szakirodalomban (87).
A kísérleti protokoll bármely módosítását meg kell vizsgálni abból a szempontból, hogy az adatok összhangban vannak-e a laboratórium meglévő történeti kontrolladatbázisaival. Jelentősebb következetlenségek fennállása esetén új történeti kontrolladatbázist kell létrehozni.
A negatív kontrollokra vonatkozó adatok az egy tenyészetből vagy párhuzamos tenyészetek összességéből származó mikronukleált sejtek előfordulását mutatják, ahogyan az a 28. pontban szerepel. A párhuzamos negatív kontrolloknak ideális esetben a laboratórium negatív kontrollokat tartalmazó történeti adatbázisa szerinti eloszlás 95 %-os ellenőrzési határértékén belül kell lenniük (87) (88). Amennyiben a párhuzamos negatív kontrollokra vonatkozó adatok a 95 %-os ellenőrzési határértéken kívül esnek, akkor számíthatók be a kontrollok történeti eloszlásába, amennyiben ezek az adatok nem szélsőségesen kiugró értékek, továbbá bizonyíték van arra, hogy a vizsgálati rendszer »ellenőrzés alatt áll« (lásd az 50. pontot), valamint arra, hogy nem áll fenn szakmai vagy emberi mulasztás.
ADATOK ÉS JEGYZŐKÖNYVEZÉS
Az eredmények ismertetése
A citokinezis-gátlási módszer alkalmazása esetén a mikronuleusz-képződés indukciójának értékelése során (a mikronukleuszok sejtenkénti számától függetlenül) csak a mikronukleuszokkal rendelkező kétmagvú sejtek gyakoriságát kell felhasználni. Az egy, két vagy több mikronukleusszal rendelkező sejtek értékelése külön-külön jelentésbe foglalható és hasznos információval szolgálhat, de nem kötelező.
Egyidejűleg az összes kezelt tenyészet, negatív és pozitív kontrolltenyészet esetében el kell végezni a citotoxicitás és/vagy a citosztázis méréseit (16). A citokinezis-gátlási módszer alkalmazása esetén a kezelt és kontrolltenyészetek esetében a sejtciklus késésének mutatójaként ki kell számolni a CBPI-t vagy az RI-t. CitoB nélkül végzett vizsgálatoknál az RPD-t vagy az RICC-t kell alkalmazni (lásd a 2. függeléket).
Az egyes tenyészetekhez tartozó adatokat meg kell adni. Ezenkívül minden adatot táblázat formájában kell összefoglalni.
Elfogadhatósági kritériumok
Egy-egy vizsgálat elfogadása az alábbi kritériumokon alapul:
— A párhuzamos negatív kontroll az 50. pont szerint belefoglalható a laboratórium negatív kontrollokat tartalmazó történeti adatbázisába.
— A párhuzamos pozitív kontrolloknak (lásd az 50. pontot) a laboratórium pozitív kontrollokat tartalmazó történeti adatbázisában generált válaszokkal összeegyeztethető válaszokat, valamint a párhuzamos negatív kontrollhoz viszonyítva statisztikailag szignifikáns növekedést kell előidézniük.
— Az oldószeres kontrollban teljesülniük kell a sejtproliferáció kritériumainak (25-27. pont).
— Valamennyi kísérleti körülmény vizsgálatára sor került, kivéve, ha az egyik pozitív eredményeket hozott (36–40. pont).
— Megfelelő számú sejt és koncentráció elemezhető (28. és 44–46. pont).
— A legmagasabb koncentráció kiválasztására vonatkozó kritériumok összhangban vannak a 24–31. pontban ismertetett legmagasabb koncentrációkkal.
Az eredmények értékelése és értelmezése
Amennyiben valamennyi elfogadhatósági kritérium teljesül, a vizsgálati vegyi anyag egyértelműen pozitívnak minősül, ha a vizsgált kísérleti körülmények bármelyikében (lásd a 36–39. pontot):
— legalább az egyik vizsgálati koncentráció statisztikailag szignifikáns növekedést mutat a párhuzamos negatív kontrollhoz viszonyítva (89),
— a megfelelő trendpróbával történő értékelés arra utal, hogy a növekedés legalább egy kísérleti körülménynél a dózissal összefügg (lásd a 28. pontot),
— az eredmények bármelyike a történeti negatív kontrolladatok eloszlásán (például Poisson-eloszlású 95 %-os ellenőrzési határértékeken; lásd az 52. pontot) kívül esik.
Mindezen kritériumok teljesülése esetén úgy tekintendő, hogy a vizsgálati vegyi anyag ebben a vizsgálati rendszerben kromoszómatöréseket és/vagy szám feletti kromoszómákat vagy kromoszómaveszteséget képes előidézni. A legmegfelelőbb statisztikai módszerekre vonatkozó ajánlások a szakirodalomban is megtalálhatók (90) (91) (92).
Amennyiben valamennyi elfogadhatósági kritérium teljesül, a vizsgálati vegyi anyag egyértelműen negatívnak minősül, ha valamennyi vizsgált kísérleti körülmény mellett (lásd a 36–39. pontot):
— a vizsgálati koncentrációk egyike sem mutat statisztikailag szignifikáns növekedést a párhuzamos negatív kontrollhoz viszonyítva,
— a megfelelő trendpróbával végzett értékelés nem mutat koncentrációval összefüggő növekedést,
— valamennyi eredmény a történeti negatív kontrolladatok eloszlásán (például Poisson-eloszlású 95 %-os ellenőrzési határértékeken; lásd az 52. pontot) belül van.
Ezt követően úgy tekintendő, hogy a vizsgálati vegyi anyag ebben a vizsgálati rendszerben nem képes kromoszómatöréseket és/vagy szám feletti kromoszómákat vagy kromoszómaveszteséget előidézni. A legmegfelelőbb statisztikai módszerekre vonatkozó ajánlások a szakirodalomban is megtalálhatók (90) (91) (92).
Az egyértelműen pozitív vagy egyértelműen negatív válasz igazolása nem követelmény.
Amennyiben a reakció nem egyértelműen negatív és nem is egyértelműen pozitív, ahogyan az a fentiekben szerepel, illetve egy adott eredmény biológiai relevanciája megállapításának segítése érdekében az adatokat szakértői véleménnyel és/vagy további vizsgálatokkal kell értékelni. Hasznos lehet további sejtek értékelése (adott esetben) vagy megismételt kísérlet lehetőleg módosított kísérleti körülmények (például a koncentrációk távolsága, más [S9-es koncentráció vagy S9 eredetű] metabolikus aktiválási feltételek) melletti elvégzése.
Ritka esetekben, még további vizsgálatok után is, az adatkészlet nem teszi lehetővé a pozitív vagy negatív reakcióra vonatkozó következtetést, ezért kétértelmű reakció lesz a következtetés.
Az MNvit vizsgálatban a mikronukleusz-képződést indukáló vizsgálati vegyi anyagok azért válthatnak ki ilyen hatást, mert kromoszómatörést, kromoszómaveszteséget vagy a kettő együttesét idézik elő. Annak vizsgálatára, hogy a mikronukleusz-képződés indukciója klasztogén és/vagy aneugén hatás eredménye-e, kinetokor elleni antitestekkel, centroméraspecifikus in situ próbákkal vagy egyéb módszerekkel végzett további elemzések alkalmazhatók.
Vizsgálati jegyzőkönyv
A Vizsgálati jegyzőkönyvnek a következőket kell tartalmaznia:
Vizsgálati vegyi anyag:
— eredet, tételszám, felhasználási határidő, ha rendelkezésre áll;
— a vizsgálati vegyi anyag stabilitása, ha ismert;
— a vizsgálati vegyi anyag reaktivitása az oldószerrel/vivőanyaggal vagy a sejttenyészethez alkalmazott tenyészközegekkel;
— a vizsgálati vegyi anyag oldhatósága és stabilitása az oldószerben, ha ismert;
— adott esetben a pH-érték, az ozmolalitás és a kicsapódás mérése abban a tenyészközegben, amelyhez a vizsgálati vegyi anyagot hozzáadták.
Egy összetevőből álló anyag:
— fizikai megjelenés, vízoldékonyság és a további releváns fizikai-kémiai tulajdonságok;
— kémiai azonosítás, például IUPAC- vagy CAS-név, CAS-szám, SMILES- vagy InChI-kód, szerkezeti képlet, tisztaság, adott esetben és amennyiben a gyakorlatban megvalósítható, a szennyeződések kémiai azonossága stb.
Több összetevőből álló anyag, UVCB-k és keverékek:
— amennyiben lehetséges, az összetevők kémiai azonosítója (lásd fent), mennyiségi előfordulása és releváns fizikai-kémiai tulajdonságai jellemzik.
Oldószer:
— az oldószer kiválasztásának indoklása;
— az oldószernek a végleges tenyészközegen belüli aránya.
Sejtek:
— az alkalmazott sejtek típusa és eredete,
— az alkalmazott sejttípus alkalmassága,
— sejtvonalak esetében a mikoplazma hiánya;
— sejtvonalak esetében a sejtciklus hosszúságára vagy a proliferációs indexre vonatkozó információk;
— limfociták használata esetén a vérdonorok ivara, életkora, valamint a donorra, a teljes vérre vagy az elkülönített limfocitákra, a használt mitogénre vonatkozó bármely releváns információ;
— a normál (negatív kontroll) sejtciklusidő,
— sejtvonalak esetében a passzálások száma, ha rendelkezésre áll;
— sejtvonalak esetében a sejttenyészetek fenntartásának módszerei;
— sejtvonalak esetében a modális kromoszómaszám.
Vizsgálati körülmények:
— amennyiben alkalmaznak citokinezis-gátló anyagot, annak megnevezése (például citoB), illetve koncentrációja és a sejtek expozíciójának időtartama;
— a vizsgálati vegyi anyag koncentrációja a tenyészközegen belüli végleges koncentrációjaként kifejezve (például μg, mg/a tenyészközeg mL-e vagy mM-ja);
— a koncentrációk kiválasztásának és a tenyészetek számának indoklása, beleértve a citotoxicitási adatokat és az oldhatóságra vonatkozó korlátokat;
— a közeg összetétele, CO2-koncentráció, amennyiben alkalmazandó, nedvességtartalom;
— a tenyészközeghez adott oldószer és vizsgálati vegyi anyag koncentrációja (és/vagy térfogata);
— inkubációs hőmérséklet és idő;
— a kezelés időtartama;
— a kezelés utáni begyűjtés időpontja;
— adott esetben a sejtszám a leoltáskor;
— a metabolikus aktivációs rendszer típusa és összetétele (az S9 eredete, az S9 keverék elkészítési módszerei, az S9 keverék koncentrációja vagy térfogata és az S9 a végleges tenyészközegben, az S9 minőségellenőrzése, például az enzimaktivitásra, a sterilitásra, a metabolikus képességre kiterjedően);
— pozitív és negatív kontrollként szolgáló vegyi anyagok, végleges koncentrációk, a kezelés körülményei és időtartama, valamint a visszanyerési idők;
— az alkalmazott tárgylemez-preparálási módszer és festési technika;
— a mikronukleált sejtek értékelésének kritériumai (az elemezhető sejtek kiválasztása és a mikronukleusz azonosítása);
— a vizsgált sejtek száma;
— a citotoxicitás mérésére alkalmazott módszerek;
— a citotoxicitás és az alkalmazott módszer szempontjából lényeges kiegészítő információk;
— a pozitív, negatív és kétes vizsgálati eredmény kritériumai;
— az alkalmazott statisztikai elemzési módszer(ek);
— adott esetben annak meghatározására alkalmazott módszerek (például kinetokor elleni antitest vagy pancentromérás próbák), hogy a mikronukleuszok teljes kromoszómákat vagy csak kromoszómatöredékeket tartalmaznak;
— a pH-érték, az ozmolalitás és a kicsapódás meghatározására alkalmazott módszerek.
Eredmények:
— az elemzéshez elfogadható sejtek meghatározása;
— citoB hiányában, sejtvonalaknál az egyes tenyészetek esetében kezelt sejtek száma és begyűjtött sejtek száma;
— a citokinezis-gátlási módszer esetében az alkalmazott citotoxicitás mérése, például CBPI vagy RI meghatározásával; citokinezis-gátlási módszerek alkalmazása nélkül az RICC vagy az RPD meghatározása; egyéb megfigyelések, ha vannak, például a sejtek egybefüggősége, apoptózis, nekrózis, metafázis-számolás, kétmagvú sejtek előfordulási gyakorisága;
— a kicsapódás jelei és a meghatározás időpontja;
— a kezelési közeg pH-jára és ozmolalitására vonatkozó adatok, amennyiben meghatározásra kerültek,
— az egymagvú, kétmagvú és többmagvú sejtek megoszlása, amennyiben citokinezis-gátlási módszer használatos;
— a mikronukleuszokkal rendelkező sejtek száma minden kezelt és kontrolltenyészetre megadva, valamint adott esetben annak meghatározása, hogy kétmagvú vagy egymagvú sejtben találhatók-e;
— amennyiben lehetséges, a koncentráció-válasz összefüggés;
— a párhuzamos negatív (oldószeres) és pozitív kontrollokra vonatkozó adatok (koncentrációk és oldószerek);
— történeti negatív (oldószeres) és pozitív kontrollokra vonatkozó adatok, a tartományok, az átlagok, a szórás, valamint az eloszlás esetében a 95 %-os ellenőrzési határértékek megadásával, továbbá az adatok száma;
— statisztikai elemzés; p-értékek, ha meghatározásra kerültek.
Az eredmények tárgyalása.
Következtetések.
SZAKIRODALOM
(1) OECD (2016). Overview of the set of OECD Genetic Toxicology Test Guidelines and updates performed in 2014-2015. ENV Publications. Series on Testing and Assessment, No. 234, OECD, Paris.
(2) Kirsch-Volders, M. (1997). Towards a validation of the micronucleus test. Mutation Research, Vol. 392/1-2, pp. 1-4.
(3) Parry, J.M., A. Sors (1993). The detection and assessment of the aneugenic potential of environmental chemicals: the European Community aneuploidy project. Mutation Research, Vol. 287/1, pp. 3-15.
(4) Fenech, M., A.A. Morley (1985). Solutions to the kinetic problem in the micronucleus assay. Cytobios, Vol. 43/172-173, pp. 233-246.
(5) Kirsch-Volders, M. et al. (2000). Report from the In Vitro Micronucleus Assay Working Group. Environmental and Molecular Mutagenesis, Vol. 35/3, pp. 167-172.
(6) Fenech, M. (2007). Cytokinesis-block micronucleus cytome assay. Nature Protocols, Vol. 2/5, pp. 1084-1104.
(7) Fenech, M., A.A. Morley (1986). Cytokinesis-block micronucleus method in human lymphocytes: effect of in-vivo ageing and low dose X-irradiation. Mutation Research, Vol. 161/2, pp. 193-198.
(8) Eastmond, D.A., J.D. Tucker (1989). Identification of aneuploidy-inducing agents using cytokinesis-blocked human lymphocytes and an antikinetochore antibody. Environmental and Molecular Mutagenesis, Vol. 13/1, pp. 34-43.
(9) Eastmond, D.A., D. Pinkel (1990). Detection of aneuploidy and aneuploidy-inducing agents in human lymphocytes using fluorescence in-situ hybridisation with chromosome-specific DNA probe. Mutation Research, Vol. 234/5, pp. 9-20.
(10) Miller, B.M. et al. (1991). Classification of micronuclei in murine erythrocytes: immunofluorescent staining using CREST antibodies compared to in situ hybridization with biotinylated gamma satellite DNA. Mutagenesis, Vol. 6/4, pp. 297-302.
(11) Farooqi, Z., F. Darroudi, A. T. Natarajan (1993). The use of fluorescence in-situ hybridisation for the detection of aneugens in cytokinesis-blocked mouse splenocytes. Mutagenesis, Vol. 8/4, pp. 329-334.
(12) Migliore, L. et al. (1993). Cytogenetic damage induced in human lymphocytes by four vanadium compounds and micronucleus analysis by fluorescence in situ hybridization with a centromeric probe. Mutation Research, Vol. 319/3, pp. 205-213.
(13) Norppa, H., L. Renzi, C. Lindholm (1993). Detection of whole chromosomes in micronuclei of cytokinesis-blocked human lymphocytes by antikinetochore staining and in situ hybridization. Mutagenesis, Vol. 8/6, pp. 519-525.
(14) Eastmond, D.A, D.S. Rupa, L.S. Hasegawa (1994). Detection of hyperdiploidy and chromosome breakage in interphase human lymphocytes following exposure to the benzene metabolite hydroquinone using multicolor fluorescence in situ hybridization with DNA probes. Mutation Research, Vol. 322/1, pp. 9-20.
(15) Marshall, R.R. et al. (1996). Fluorescence in situ hybridisation (FISH) with chromosome-specific centromeric probes: a sensitive method to detect aneuploidy. Mutation Research, Vol. 372/2, pp. 233-245.
(16) Zijno, P. et al. (1996). Analysis of chromosome segregation by means of fluorescence in situ hybridization: application to cytokinesis-blocked human lymphocytes. Mutation Research, Vol. 372/2, 211-219.
(17) Kirsch-Volders et al. (2003). Report from the in vitro micronucleus assay working group. Mutation Research, Vol. 540/2, pp. 153-163.
(18) E melléklet B.10., Mutagenitás – kromoszóma-rendellenességek in vitro vizsgálata emlősökön című fejezete.
(19) Lorge, E. et al. (2006). SFTG International collaborative Study on in vitro micronucleus test. I. General conditions and overall conclusions of the study. Mutation Research, Vol. 607/1, pp. 13-36.
(20) Clare, G. et al. (2006). SFTG International collaborative study on the in vitro micronucleus test. II. Using human lymphocytes. Mutation Research, Vol. 607/1, pp. 37-60.
(21) Aardema, M.J. et al. (2006). SFTG International collaborative study on the in vitro micronucleus test, III. Using CHO cells. Mutation Research, Vol. 607/1, pp. 61-87.
(22) Wakata, A. et al. (2006). SFTG International collaborative study on the in vitro micronucleus test, IV. Using CHO/IU cells. Mutation Research, Vol. 607/1, pp. 88-124.
(23) Oliver, J. et al. (2006). SFTG International collaborative study on the in vitro micronucleus test, V. Using L5178Y cells. Mutation Research, Vol. 607/1, pp. 125-152.
(24) Albertini, S. et al. (1997). Detailed data on in vitro MNT and in vitro CA: industrial experience. Mutation Research, Vol. 392/1-2, pp. 187-208.
(25) Miller, B. et al. (1997). Comparative evaluation of the in vitro micronucleus test and the in vitro chromosome aberration test: industrial experience. Mutation Research, Vol. 392/1-2, pp. 45-59.
(26) Miller, B. et al. (1998). Evaluation of the in vitro micronucleus test as an alternative to the in vitro chromosomal aberration assay: position of the GUM Working Group on the in vitro micronucleus test. Gesellschaft fur Umwelt-Mutations-forschung, Mutation Research, Vol. 410, pp. 81-116.
(27) Kalweit, S. et al. (1999). Chemically induced micronucleus formation in V79 cells – comparison of three different test approaches. Mutation Research, Vol. 439/2, pp. 183-190.
(28) Kersten, B. et al. (1999). The application of the micronucleus test in Chinese hamster V79 cells to detect drug-induced photogenotoxicity. Mutation Research, Vol. 445/1, pp. 55-71.
(29) von der Hude, W. et al. (2000). In vitro micronucleus assay with Chinese hamster V79 cells – results of a collaborative study with in situ exposure to 26 chemical substances. Mutation Research, Vol. 468/2, pp. 137-163.
(30) Garriott, M.L., J.B. Phelps, W.P. Hoffman (2002). A protocol for the in vitro micronucleus test, I. Contributions to the development of a protocol suitable for regulatory submissions from an examination of 16 chemicals with different mechanisms of action and different levels of activity. Mutation Research, Vol. 517/1-2, pp. 123-134.
(31) Matsushima, T. et al. (1999). Validation study of the in vitro micronucleus test in a Chinese hamster lung cell line (CHL/IU). Mutagenesis, Vol. 14/6, pp. 569-580.
(32) Elhajouji, A., E. Lorge (2006). Special Issue: SFTG International collaborative study on in vitro micronucleus test. Mutation Research, Vol. 607/1, pp. 1-152.
(33) Kirkland, D. (2010). Evaluation of different cytotoxic and cytostatic measures for the in vitromicronucleus test (MNVit): Introduction to the collaborative trial. Mutation Research, Vol. 702/2, pp. 139-147.
(34) Hashimoto K. et al. (2011). Comparison of four different treatment conditions of extended exposure in the in vitro micronucleus assay using TK6 lymphoblastoid cells. Regulatory Toxicology and Pharmacology, Vol. 59/1, pp. 28-36.
(35) Honma, M., M. Hayashi (2011). Comparison of in vitro micronucleus and gene mutation assay results for p53-competent versus p53-deficient human lymphoblastoid cells. Environmental and Molecular Mutagenesis, Vol. 52/5, pp. 373-384.
(36) Zhang, L.S. et al. (1995). A comparative study of TK6 human lymphoblastoid and L5178Y mouse lymphoma cell lines in the in vitro micronucleus test. Mutation Research Letters, Vol. 347/3-4, pp. 105-115.
(37) ECVAM (2006). Statement by the European Centre for the Validation of Alternative Methods (ECVAM) Scientific Advisory Committee (ESAC) on the scientific validity of the in vitro micronucleus test as an alternative to the in vitro chromosome aberration assay for genotoxicity testing. ESAC 25th meeting, 16-17 November 2006, Elérhető a következő címen: http://ecvam.jrc.it/index.htm.
(38) ESAC (2006). ECVAM Scientific Advisory Committee (ESAC) Peer Review, Retrospective Validation of the In Vitro Micronucleus Test, Summary and Conclusions of the Peer Review Panel. Elérhető a következő címen: http://ecvam.jrc.it/index.htm.
(39) Corvi, R. et al. (2008). ECVAM Retrospective Validation of in vitro Micronucleus Test (MNT). Mutagenesis, Vol 23/4, pp. 271-283.
(40) ILSI paper (draft). Lorge, E., M.M. Moore, J. Clements, M. O'Donovan, M. Honma, A. Kohara, J. van Benthem, S. Galloway, M.J. Armstrong, A. Sutter, V. Thybaud, B. Gollapudi, M. Aardema, J. Young-Tannir. Standardized Cell Sources and Recommendations for Good Cell Culture Practices in Genotoxicity Testing. Mutation Research.
(41) Scott, D. et al. (1991). International Commission for Protection Against Environmental Mutagens and Carcinogens, Genotoxicity under extreme culture conditions. A report from ICPEMC Task Group 9. Mutation Research, Vol. 257/2, pp. 147-205.
(42) Morita, T. et al. (1992). Clastogenicity of low pH to various cultured mammalian cells. Mutation Research, Vol. 268/2, pp. 297-305.
(43) Brusick, D. (1986). Genotoxic effects in cultured mammalian cells produced by low pH treatment conditions and increased ion concentrations. Environmental Mutagenesis, Vol. 8/6, pp. 789-886.
(44) Long, L.H. et al. (2007). Different cytotoxic and clastogenic effects of epigallocatechin gallate in various cell-culture media due to variable rates of its oxidation in the culture medium. Mutation Research, Vol. 634/1-2, pp. 177-183.
(45) Nesslany, F. et al. (2008). Characterization of the Genotoxicity of Nitrilotriacetic Acid. Environmental and Molecular Mutation., Vol. 49, pp. 439-452.
(46) Fenech, M., A.A. Morley (1985). Measurement of micronuclei in lymphocytes. Mutation Research, Vol. 147/1-2, pp. 29-36.
(47) Fenech, M. (1997). The advantages and disadvantages of cytokinesis-blood micronucleus method. Mutation Research, Vol. 392, pp. 11-18.
(48) Payne, C.M. et al. (2010). Hydrophobic bile acid-induced micronuclei formation, mitotic perturbations, and decreases in spindle checkpoint proteins: relevance to genomic instability in colon carcinogenesis. Nutrition and Cancer, Vol. 62/6, pp. 825-840.
(49) Bazin, E. et al. (2010). Genotoxicity of a Freshwater Cyanotoxin,Cylindrospermopsin, in Two Human Cell Lines: Caco-2 and HepaRG. Environmental and Molecular Mutagenesis, Vol. 51/3, pp. 251-259.
(50) Le Hegarat, L. et al. (2010). Assessment of the genotoxic potential of indirect chemical mutagens in HepaRG cellsby the comet and the cytokinesis-block micronucleus assays. Mutagenesis, Vol. 25/6, pp. 555-560.
(51) Josse, R. et al. (2012). An adaptation of the human HepaRG cells to the in vitro micronucleus assay. Mutagenesis, Vol. 27/3, pp. 295-304.
(52) Ehrlich, V. et al. (2002). Fumonisin B1 is genotoxic in human derived hepatoma (HepG2) cells. Mutagenesis, Vol. 17/3, pp. 257-260.
(53) Knasmüller, S. et al. (2004). Use of human-derived liver cell lines for the detection of environmental and dietary genotoxicants; current state of knowledge. Toxicology, Vol. 198/1-3, pp. 315-328.
(54) Gibson, D.P. et al. (1997). Induction of micronuclei in Syrian hamster embryo cells: comparison to results in the SHE cell transformation assay for National Toxicology Program test chemicals. Mutation Research, Vol. 392/1-2, pp. 61-70.
(55) Bonassi, S. et al. (2001). HUman MicroNucleus Project: international database comparison for results with the cytokinesis-block micronucleus assay in human lymphocytes, I. Effect of laboratory protocol, scoring criteria and host factors on the frequency of micronuclei. Environmental and Molecular Mutagenesis, Vol. 37/1, pp. 31-45.
(56) Maron, D.M., B.N. Ames (1983). Revised methods for the Salmonella mutagenicity test. Mutation Research, Vol. 113/3-4, pp. 173-215.
(57) Ong, T.-m. et al. (1980). Differential effects of cytochrome P450-inducers on promutagen activation capabilities and enzymatic activities of S-9 from rat liver. Journal of Environmental Pathology and Toxicology, Vol. 4/1, pp. 55-65.
(58) Elliott, B.M. et al. (1992). Alternatives to Aroclor 1254-induced S9 in in-vitro genotoxicity assays. Mutagenesis, Vol. 7, pp. 175-177.
(59) Matsushima, T. et al. (1976). “A safe substitute for Polychlorinated Biphenyls as an Inducer of Metabolic Activation Systems”, in In Vitro Metabolic Activation in Mutagenesis Testing. de Serres, F.J. et al. (eds), Elsevier, North-Holland, pp. 85-88.
(60) Johnson, T.E., D. R. Umbenhauer, S.M. Galloway (1996). Human liver S-9 metabolic activation: proficiency in cytogenetic assays and comparison with phenobarbital/beta-naphthoflavone or Aroclor 1254 induced rat S-9. Environmental and Molecular Mutagenesis, Vol. 28, pp. 51-59.
(61) UNEP (2001). Stockholm Convention on Persistent Organic Pollutants, United Nations Environment Programme (UNEP). Elérhető a következő címen: http://www.pops.int/
(62) Tucker, J.D., M.L. Christensen (1987). Effects of anticoagulants upon sister-chromatid exchanges, cell-cycle kinetics, and mitotic index in human peripheral lymphocytes. Mutation Research, Vol.190/3, pp. 225-8.
(63) Krahn, D.F., F.C. Barsky, K.T. McCooey (1982). “CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids”, in Genotoxic Effects of Airborne Agents. Tice, R.R., D.L. Costa, K.M. Schaich (eds.), Plenum, New York, pp. 91-103.
(64) Zamora, P.O. et al. (1983). Evaluation of an exposure system using cells grown on collagen gels for detecting highly volatile mutagens in the CHO/HGPRT mutation assay. Environmental Mutagenesis, Vol. 5/6, pp. 795-801.
(65) Asakura, M. et al. (2008). An improved system for exposure of cultured mammalian cells to gaseous compounds in the chromosomal aberration assay. Mutation Research, Vol. 652/2, pp. 122-130.
(66) Fenech, M. (1993). The cytokinesis-block micronucleus technique: a detailed description of the method and its application to genotoxicity studies in human populations. Mutation Research, Vol. 285/1, pp. 35-44.
(67) Phelps, J.B., M.L. Garriott, W.P. Hoffman (2002). A protocol for the in vitro micronucleus test. II. Contributions to the validation of a protocol suitable for regulatory submissions from an examination of 10 chemicals with different mechanisms of action and different levels of activity. Mutation Research, Vol. 521/1-2, pp. 103-112.
(68) Kirsch-Volders, M. et al. (2004). Corrigendum to “Report from the in vitro micronucleus assay working group”. Mutation Research, 564, 97-100.
(69) Lorge, E. et al. (2008). Comparison of different methods for an accurate assessment of cytotoxicity in the in vitro micronucleus test. I. Theoretical aspects. Mutation Research, Vol. 655/1-2, pp. 1-3.
(70) Surralles, J. et al. (1995). Induction of micronuclei by five pyrethroid insecticides in whole-blood and isolated human lymphocyte cultures. Mutation Research, Vol. 341/3, pp. 169-184.
(71) Honma, M. (2011). Cytotoxicity measurement in in vitro chromosome aberration test and micronucleus test. Mutation Research, Vol. 724, pp. 86-87.
(72) Pfuhler, S. et al. (2011). In vitro genotoxicity test approaches with better predictivity: Summary of an IWGT workshop. Mutation Research, Vol. 723/2, pp. 101-107.
(73) OECD (2014). Document supporting the WNT decision to implement revised criteria for the selection of the top concentration in the in vitro mammalian cell assays on genotoxicity (Test Guidelines 473, 476 and 487). ENV/JM/TG(2014)17. Kérésre beszerezhető.
(74) Morita T., M. Honma, K. Morikawa (2012). Effect of reducing the top concentration used in the in vitro chromosomal aberration test in CHL cells on the evaluation of industrial chemical genotoxicity. Mutation Research, Vol. 741, pp. 32-56.
(75) Brookmire L., J.J. Chen, D.D. Levy (2013). Evaluation of the Highest Concentrations Used in the in vitro Chromosome Aberrations Assay. Environmental and Molecular Mutagenesis, Vol. 54/1, pp. 36-43.
(76) EPA, Office of Chemical Safety and Pollution Prevention (2011). Chemical Substances of Unknown or Variable Composition, Complex Reaction Products and Biological Materials: UVCB Substances. http://www.epa.gov/opptintr/newchems/pubs/uvcb.txt.
(77) Sobol, Z. et al. (2012). Development and validation of an in vitro micronucleus assay platform in TK6 cells. Mutation Research, Vol.746/1, pp. 29-34.
(78) Hayashi, M., T. Sofuni, M. Jr. Ishidate (1983). An Application of Acridine Orange Fluorescent Staining to the Micronucleus Test. Mutation Research, Vol. 120/4, pp. 241-247.
(79) MacGregor, J. T., C.M. Wehr, R.G. Langlois (1983). A Simple Fluorescent Staining Procedure for Micronuclei and RNA in Erythrocytes Using Hoechst 33258 and Pyronin Y. Mutation Research, Vol. 120/4, pp. 269-275.
(80) Bryce, S.M. et al. (2011). Miniaturized flow cytometry-based CHO-K1 micronucleus assay discriminates aneugenic and clastogenic modes of action. Environmental and Molecular Mutagenesis, Vol. 52/4, pp. 280–286.
(81) Nicolette, J. et al. (2011). in vitro micronucleus screening of pharmaceutical candidates by flow cytometry in Chinese hamster V79 cells. Environmental and Molecular Mutagenesis, Vol. 52/5, pp. 355–362.
(82) Shi, J., R. Bezabhie, A. Szkudlinska (2010). Further evaluation of a flow cytometric in vitro micronucleus assay in CHO-K1 cells: a reliable platform that detects micronuclei and discriminates apoptotic bodies. Mutagenesis, Vol. 25/1, pp. 33-40.
(83) OECD (2014). Statistical analysis supporting the revision of the genotoxicity Test Guidelines. OECD Environment, Health and Safety Publications (EHS), Series on testing and assessment, No.198, OECD Publishing, Paris.
(84) Fenech, M. et al. (2003). HUMN project: detailed description of the scoring criteria for the cytokinesis-block micronucleus assay using isolated human lymphocyte cultures. Mutation Research, Vol. 534/1-2, pp. 65-75.
(85) Elhajouji, A., M. Cunha, M. Kirsch-Volders (1998). Spindle poisons can induce polyploidy by mitotic slippage and micronucleate mononucleates in the cytokinesis-block assay. Mutagenesis, Vol. 13/2, pp. 193-8.
(86) Kirsch-Volders, M. et al. (2011). The in vitro MN assay in 2011: origin and fate, biological significance, protocols, high throughput methodologies and toxicological relevance. Archives of Toxicology, Vol. 85/8, pp. 873-99.
(87) Hayashi, M. et al. (2010). Compilation and use of genetic toxicity historical control Data. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, Vol.723/2, pp. 87-90.
(88) Ryan, T. P. (2000). Statistical Methods for Quality Improvement. 2nd ed., John Wiley and Sons, New York.
(89) Hoffman, W.P., M.L. Garriott, C. Lee (2003). “In vitro micronucleus test’, in Encyclopedia of Biopharmaceutical Statistics, 2nd ed. Chow, S. (ed.), Marcel Dekker, Inc. New York, pp. 463-467.
(90) Fleiss, J. L., B. Levin, M.C. Paik (2003). Statistical Methods for Rates and Proportions, 3rd ed. John Wiley & Sons, New York.
(91) Galloway, S.M. et al. (1987). Chromosome aberration and sister chromatid exchanges in Chinese hamster ovary cells: Evaluation of 108 chemicals. Environmental and Molecular Mutagenesis, Vol. 10/suppl. 10, pp. 1-175.
(92) Richardson, C. et al. (1989). Analysis of Data from in vitro Cytogenetic Assays. in Statistical Evaluation of Mutagenicity Test Data, Kirkland, D.J. (ed), Cambridge University Press, Cambridge, pp. 141-154.
(93) International Conference on Harmonisation (ICH) Guidance S2 (R1) on Genotoxicity Testing and Data Interpretation for Pharmaceuticals Intended For Human Use.
1. függelék
FOGALOMMEGHATÁROZÁSOK
Aneugén : olyan vegyi anyag vagy folyamat, amely a mitózissal vagy meiózissal történő sejtosztódási ciklus elemeivel kölcsönhatásba lépve a sejtek vagy organizmusok aneuploidiáját eredményezi.
Aneuploidia : a normális diploid (vagy haploid) kromoszómaszámtól egyetlen kromoszómával vagy egynél több, szám feletti kromoszómával, de nem teljes kromoszómakészlettel (kromoszómakészletekkel) (poliploidia) való bármely eltérés.
Apoptózis : programozott sejthalál olyan lépések során keresztül, amelyek a sejt membránhoz kötött részecskékre történő szétesését eredményezik; a részecskék ezután fagocitózissal vagy sejtfelszínről történő leválással kerülnek eltávolításra.
Sejtproliferáció : a sejtek számának növekedése mitotikus sejtosztódással.
Centroméra : a kromoszóma azon DNS-régiója, ahol a két kromatida összeér, és amelyhez a két kinetokor oldalirányban kapcsolódik.
Vegyi anyag : anyag vagy keverék.
Koncentrációk : a vizsgálati vegyi anyagnak a tenyészközegen belüli végleges koncentrációira utalnak.
Klasztogén : bármely olyan vegyi anyag vagy hatás, amely sejtek vagy eukarióta szervezetek populációjában szerkezeti kromoszóma-rendellenességeket okoz.
Citokinezis : a mitózist közvetlenül követő sejtosztódási folyamat, amelynek eredményeként két utódsejt képződik egy-egy sejtmaggal.
Citokinezis-gátlási proliferációs index (CBPI) : a kezelt populációban tapasztalható másodszor osztódó sejtek aránya a nem kezelt kontrollhoz képest (a képletet lásd a 2. függelékben).
Citosztázis : a sejtszaporodás gátlása (a képletet lásd a 2. függelékben).
Citotoxicitás :
az e vizsgálati módszerbe tartozó, citokalazin-B jelenlétében végzett vizsgálatok esetében a citotoxicitás a kezelt sejtek citokinezis-gátlási proliferációs indexének (CBPI) vagy replikációs indexének (RI) csökkenése a negatív kontrollhoz viszonyítva (lásd a 26. pontot és a 2. függeléket).
Az e vizsgálati módszerbe tartozó, citokalazin-B nélkül végzett vizsgálatok esetében a citotoxicitás a kezelt sejtek relatív populációduplázódásának (RPD) vagy a relatív sejtszám-növekedésnek (RICC) a csökkenése a negatív kontrollhoz viszonyítva (lásd a 27. pontot és a 2. függeléket):
Genotoxikus : olyan általános kifejezés, amely magában foglalja a DNS- vagy kromoszómakárosodás valamennyi típusát, köztük a töréseket, a deléciókat, az adduktok képződését, a nukleotidok módosulását és kapcsolódását, az átrendeződéseket, a génmutációkat, a kromoszóma-rendellenességeket és az aneuploidiát. A genotoxikus hatás nem minden típusa eredményez mutációkat vagy stabil kromoszómakárosodást.
Interfázisban lévő sejtek : azok a sejtek, amelyek nincsenek a mitózis fázisában.
Kinetokor : protein tartalmú struktúra, amely a kromoszóma centroméra részén épül fel, és amelyhez a sejtosztódás során orsórostok kötődnek, lehetővé téve a leánykromoszómáknak az utódsejtek pólusai felé irányuló szabályos mozgását.
Mikronukleusz : a sejtek fő magjától elkülönült kis járulékos mag, amelyet a mitózis (meiózis) telofázisa során hoznak létre visszamaradó kromoszómatöredékek vagy teljes kromoszómák.
Mitózis : a sejtmag osztódása, amely általában profázisra, prometafázisra, metafázisra, anafázisra és telofázisra osztható fel.
Mitotikus index : a metafázisban lévő sejtek és a sejtpopuláció összes sejtjének aránya; e populáció sejtproliferációja mértékének jelzése.
Mutagén : örökletes elváltozást idéz elő a génekben lévő DNS-bázispár szekvenciában/szekvenciákban vagy a kromoszómák szerkezetében (kromoszóma-rendellenességek).
Nondiszjunkció : a kromatidpárok nem válnak szét, és különülnek el a kifejlődő utódsejtekbe, rendellenes kromoszómaszámmal rendelkező utódsejteket eredményezve.
p53 státusz : A p53 fehérje vesz részt a sejtciklus-szabályozásban, az apoptózisban és a DNS-reparációban. Azok a sejtek, amelyeknél hiányzik funkcionális p53 fehérje, nem képesek apoptózis útján vagy a DNS-károsodásra reagáló p53 funkciókkal összefüggő egyéb mechanizmusok útján (például DNS-reparáció kiváltásával) leállítani a sejtciklust vagy eltávolítani a károsodott sejteket, elméletileg hajlamosabbnak kell lenniük génmutációkra vagy kromoszóma-rendellenességekre.
Poliploidia : ellentétben a csak egyetlen kromoszómát vagy bizonyos kromoszómákat érintő számszerű rendellenességekkel (aneuploidia), teljes kromoszómakészlet(ek) sejtekben és organizmusokban jelentkező számszerű rendellenessége.
Proliferációs index (PI) : a citotoxicitás mérésére használható módszer olyan esetekben, amikor nem alkalmaznak citoB-t (a képletet lásd a 2. függelékben).
A sejtszám relatív növekedése (RICC) : a citotoxicitás mérésére használható módszer olyan esetekben, amikor nem alkalmaznak citoB-t (a képletet lásd a 2. függelékben).
Relatív populációduplázódás (RPD) : a citotoxicitás mérésére használható módszer olyan esetekben, amikor nem alkalmaznak citoB-t (a képletet lásd a 2. függelékben).
Replikációs index (RI) : a kezelt tenyészetben tapasztalható sejtosztódási ciklusok aránya a nem kezelt kontrollhoz képest, az expozíciós időszakban és a visszanyerés időszakában (a képletet lásd a 2. függelékben).
S9 májfrakció : 9 000 g centrifugálás utáni májhomogenátum felülúszója, azaz a nyers májextraktum.
S9 keverék : az S9 májfrakció és a metabolikus enzimaktivitáshoz szükséges kofaktorok keveréke.
Oldószeres kontroll : a csak a vizsgálati vegyi anyag feloldására használatos oldószert befogadó kontrolltenyészetek meghatározására szolgáló általános kifejezés.
Vizsgálati vegyi anyag : bármely, e vizsgálati módszer alkalmazásával vizsgált anyag vagy keverék.
Nem kezelt kontroll : nem kezelt (azaz sem a vizsgálati vegyi anyaggal, sem oldószerrel nem kezelt), de a vizsgálati vegyi anyagot befogadó tenyészetekkel párhuzamosan, azonos módon feldolgozott tenyészetek.
2. függelék
A CITOTOXICITÁS ÉRTÉKELÉSÉRE SZOLGÁLÓ KÉPLETEK
CitoB alkalmazása esetén a citotoxicitás értékelését a citokinezis-gátlási proliferációs index (CBPI) vagy a replikációs index (RI) alapján kell végezni (17) (69). A CBPI a sejtenkénti sejtmagok átlagos számát mutatja meg, így alkalmazható a sejtproliferáció kiszámítására. Az RI a citoB-expozíció időszaka alatt megmutatja a kezelt tenyészeteken belüli sejtenkénti sejtciklusok relatív számát a kontrolltenyészetekhez viszonyítva, így alkalmazható a %-os citosztázis kiszámítására.
%-os citosztázis = 100 – 100{(CBPIT – 1) ÷ (CBPIC – 1)}
valamint:
|
T |
= |
a vizsgálati vegyi anyaggal kezelt tenyészet |
|
C |
= |
kontrolltenyészet |
ahol:
Tehát az 1-es CBPI (az összes sejt egymagvú) 100 %-os citosztázisnak felel meg.
Citosztázis = 100 – RI

|
T |
= |
kezelt tenyészetek |
|
C |
= |
kontrolltenyészetek |
Tehát az 53 %-os RI azt jelenti, hogy a kontrolltenyészetben kétmagvú és többmagvú sejtekké osztódott sejtek számához képest a kezelt tenyészetben ennek csak 53 %-a osztódott, vagyis a citosztázis 47 %-os.
Amennyiben citoB-t nem alkalmaznak , a citotoxicitás értékelésére a sejtszám relatív növekedése (RICC) vagy a relatív populációduplázódás (RPD) ajánlott (69), mivel mindkét módszer figyelembe veszi az osztódott sejtpopuláció arányát.

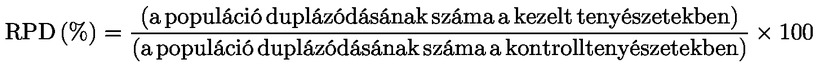
ahol:
Populációduplázódás = [log (kezelés utáni sejtszám ÷ kiindulási sejtszám)] ÷ log 2
Tehát az 53 %-os RICC vagy RPD 47 %-os citotoxicitást/citosztázist jelez.
Proliferációs index (PI) alkalmazásával a citotoxicitás az 1 sejtből (cl1), 2 sejtből (cl2), 3-4 sejtből (cl4) és 5–8 sejtből (cl8) álló telepek megszámlálásával határozható meg.

A PI a citotoxicitás értékes és megbízható paramétereként használatos a citoB nélkül in vitro tenyésztett sejtvonalak esetében is (35) (36) (37) (38), és hasznos további paraméternek tekinthető.
A kezelés előtti sejtszámnak minden esetben meg kell egyeznie a kezelt tenyészetek és a negatív kontrolltenyészetek esetében.
Míg az RCC (azaz a kezelt tenyészeteken belüli sejtszám és a kontrolltenyészeteken belüli sejtszám hányadosa) a múltban citotoxicitási paraméterként volt használatos, a továbbiakban már nem javasolt, mivel alulbecsülheti a citotoxicitást.
Automatizált értékelési rendszerek, például áramlási citometria, lézerszkenneléses citometria vagy képelemzés alkalmazása esetén a képletben a sejtszám helyettesíthető a sejtmagok számával.
A negatív kontrolltenyészetekben a populációduplázódásnak vagy a replikációs indexnek összeegyeztethetőnek kell lennie azzal a követelménnyel, hogy a sejtekből a kezelés után kb. 1,5–2,0 normál sejtciklusidőnek megfelelő időpontban kell mintát venni.
”
(15) A B. rész a következő fejezetekkel egészül ki:
„B.59. In chemico bőrszenzibilizáció: közvetlen peptidreaktivitási vizsgálat
BEVEZETÉS
Ez a vizsgálati módszer egyenértékű az OECD 442C. vizsgálati iránymutatásában (2015) leírt módszerrel. A bőrszenzibilizáló anyag a vegyi anyagok osztályozásának és címkézésének az Egyesült Nemzetek Szervezete (ENSZ) által globálisan harmonizált rendszere (ENSZ-GHS) (1) és az anyagok és keverékek osztályozásáról, címkézéséről és csomagolásáról szóló 1272/2008/EK rendelet ( 9 ) (CLP-rendelet) szerint olyan anyag, amely a bőrrel való érintkezést követően allergiás reakciót vált ki. Ez a vizsgálati módszer olyan in chemico eljárást (közvetlen peptidreaktivitási vizsgálat, a továbbiakban: DPRA) tesz lehetővé, amellyel elősegíti a bőrszenzibilizáló és a nem szenzibilizáló anyagok megkülönböztetését az ENSZ-GHS-nek és a CLP-rendeletnek megfelelően.
A bőrszenzibilizációt előidéző főbb biológiai eseményeket illetően általános egyetértés van. A bőrszenzibilizációhoz kapcsolódó kémiai és biológiai mechanizmusokról már rendelkezésre álló ismereteket úgynevezett káros kimeneti út (Adverse Outcome Pathway, AOP) (2) foglalja össze a molekuláris kiváltó eseménytől a köztes eseményeken át a káros hatásig, amely embereknél allergiás kontakt bőrgyulladás, rágcsálóknál pedig kontakt túlérzékenység. A bőrszenzibilizációs káros kimeneti út esetében a molekuláris kiváltó esemény az elektrofil anyagok és a bőrben lévő fehérjék nukleofil centrumai között létrejövő kovalens kötés.
A bőrszenzibilizáció vizsgálata jellemzően kísérleti állatokon történő vizsgálatot foglal magában. A tengerimalacokon alkalmazott klasszikus módszerek, vagyis a Magnusson–Kligman-féle tengerimalac-maximizációs vizsgálat és a Bühler-féle vizsgálat (B.6. vizsgálati módszer (3)) egyaránt a bőrszenzibilizáció indukciós és kiváltási fázisával foglalkozik. Az egereken alkalmazott lokális nyirokcsomó-vizsgálati módszer (LLNA, B.42. vizsgálati módszer (4)) és két nem radioaktív változata, az LLNA: DA (B.50. vizsgálati módszer (5)) és az LLNA: BrdU-ELISA (B.51. vizsgálati módszer (6)), amely mind csak az indukciós reakciót vizsgálja, szintén elfogadottá vált, mivel állatjólét szempontjából előnyösebbek, mint a tengerimalacon végzett vizsgálatok, és objektív mérést tesznek lehetővé a bőrszenzibilizáció indukciós fázisában.
Újabban a mechanisztikus alapú in chemico és in vitro vizsgálati módszerek a vegyi anyagok bőrszenzibilizációs veszélyének értékelése szempontjából tudományosan megalapozottnak tekinthetőek. Szükség lesz azonban nem állatokon alkalmazott módszerek (in silico, in chemico, in vitro) integrált vizsgálati és értékelési megközelítésen belüli kombinációira a jelenleg alkalmazott állatkísérletek teljes felváltásához, mivel a jelenleg rendelkezésre álló, nem állatokon alkalmazott vizsgálati módszerekre a káros kimeneti út mechanisztikus szempontjai csak korlátozott mértékben terjednek ki (2) (7).
A bőrszenzibilizációs káros kimeneti út molekuláris kiváltó eseményét, vagyis a fehérjereaktivitást illetően a DPRA alkalmazása javasolt, amelynek keretében a vizsgálati vegyi anyagok reaktivitását a lizint vagy ciszteint tartalmazó szintetikus peptidmodellekhez viszonyítva kell számszerűsíteni (8). Ezt követően a cisztein és a lizin százalékos peptidkiürülési értékei alapján az anyag besorolható a négy reaktivitási osztály egyikébe, amivel támogatható a bőrszenzibilizáló és a nem szenzibilizáló anyagok megkülönböztetése (9).
A DPRA-t az állatkísérletek alternatív módszereinek uniós referencialaboratóriuma (EURL ECVAM) által irányított validálási vizsgálatban értékelték, az EURL ECVAM tudományos tanácsadó bizottsága (ESAC) pedig független szakértői értékelésnek vetette alá; mindezek alapján megállapítást nyert, hogy a DPRA tudományosan megalapozott (10) ahhoz, hogy integrált vizsgálati és értékelési megközelítés keretében a bőrszenzibilizáló és a nem szenzibilizáló anyagok megkülönböztetésének támogatására lehessen felhasználni veszélyességi osztályozás és címkézés céljából. A DPRA-ból származó adatok és más információk együttes használatára fellelhetők példák a szakirodalomban (11) (12) (13) (14).
A fogalommeghatározások az 1. függelékben találhatók.
KIINDULÁSI MEGFONTOLÁSOK, ALKALMAZHATÓSÁG ÉS KORLÁTOK
A fehérjereaktivitás és a bőrszenzibilizáló potenciál közötti összefüggés jól ismert (15) (16) (17). Mindazonáltal, mivel a fehérjekötés csak egy kulcsfontosságú esemény, jóllehet a bőrszenzibilizációs káros kimeneti út molekuláris kiváltó eseménye, a fehérjereaktivitásról vizsgálati és vizsgálat nélküli módszerekkel előállított információk önmagukban nem feltétlenül elegendőek ahhoz, hogy megállapítható legyen a vegyi anyagok bőrszenzibilizáló potenciáljának hiánya. Ezért az e vizsgálati módszerrel kapott adatokat integrált megközelítés, például integrált vizsgálati és értékelési megközelítés összefüggésében kell mérlegelni olyan egyéb, kiegészítő információkkal együtt, mint a bőrszenzibilizációs káros kimeneti út más kulcsfontosságú eseményeivel foglalkozó in vitro vizsgálatok eredményei, valamint a vizsgálat nélküli módszerekkel, köztük a kémiai analógokból kereszthivatkozással kapott adatok.
Ez a vizsgálati módszer az integrált vizsgálati és értékelési megközelítéssel összefüggésben egyéb, kiegészítő információkkal együtt alkalmazva felhasználható a bőrszenzibilizáló (vagyis az ENSZ-GHS/CLP-rendelet szerinti 1. kategóriába tartozó) és a nem szenzibilizáló anyagok megkülönböztetésének támogatására. Ez a vizsgálati módszer nem alkalmazható önmagában sem a bőrszenzibilizáló anyagoknak az ENSZ-GHS-ben/a CLP-rendeletben meghatározott 1A. és 1B. alkategóriába sorolására, sem a hatáserősség előrejelzésére a biztonsági értékeléssel kapcsolatos döntések esetén. A szabályozási kerettől függően azonban a DPRA pozitív eredménye önmagában is felhasználható a vegyi anyagok ENSZ-GHS/CLP-rendelet szerinti 1. kategóriába sorolására.
A DPRA vizsgálati módszerről bebizonyosodott, hogy áthelyezhető a nagyhatékonyságú folyadék-kromatográfiával (HPLC) végzett elemzés területén tapasztalattal rendelkező laboratóriumokba. A vizsgálati módszertől várható előrejelzések reprodukálhatóságának mértéke a laboratóriumokon belül 85 %, a laboratóriumok között pedig 80 % (10). A validálási vizsgálatban (18) és a közzétett tanulmányokban (19) kapott eredmények összességében azt jelzik, hogy a DPRA a szenzibilizáló (azaz az ENSZ-GHS/a CLP-rendelet szerinti 1. kategóriába tartozó) anyagokat az LLNA vizsgálati módszer eredményeihez képest 80 %-os (N=157) pontossággal különbözteti meg a nem szenzibilizáló anyagoktól, 80 % az érzékenysége (88/109), a specifikussága pedig 77 % (37/48). A DPRA nagyobb valószínűséggel jelez előre alacsonyabb értékeket olyan vegyi anyagoknál, amelyeknek alacsonytól mérsékeltig terjedő a szenzibilizáló hatása (azaz az ENSZ-GHS/CLP-rendelet szerinti 1B. alkategóriába tartozó anyagoknál), mint a rendkívül bőrszenzibilizáló hatást mutató vegyi anyagoknál (azaz az ENSZ-GHS/CLP-rendelet szerinti 1A. alkategóriába tartozó anyagoknál) (18) (19). A DPRA mint önálló vizsgálati módszer esetében itt megadott pontossági értékek azonban csak irányadóak, ugyanis a vizsgálati módszert az integrált vizsgálati és értékelési megközelítés keretében más információforrásokkal együtt és a fenti 9. pont rendelkezéseivel összhangban kell figyelembe venni. Ezen túlmenően a bőrszenzibilizáció nem állatokon alkalmazott módszereinek értékelésekor nem szabad megfeledkezni arról, hogy az LLNA vizsgálat, valamint más állatkísérletek nem feltétlenül tükrözik teljes egészében az érintett fajnál, például az embernél fennálló helyzetet. Az összes rendelkezésre álló adat alapján a DPRA-ról bebizonyosodott, hogy különféle szerves funkciós csoportokat, reakciómechanizmusokat, (in vivo vizsgálatok során meghatározott) bőrszenzibilizáló hatásokat és fizikai-kémiai tulajdonságokat képviselő vizsgálati vegyi anyagokra alkalmazható (8) (9) (10) (19). Ezek az információk összességében azt jelzik, hogy a DPRA érdemben hozzájárul a bőrszenzibilizáció veszélyének azonosításához.
E vizsgálati módszer esetében a »vizsgálati vegyi anyag« kifejezés a vizsgálat tárgyát képező vegyi anyagra vonatkozik, nem a DPRA anyagok és/vagy keverékek vizsgálatára való alkalmazhatóságához kapcsolódik. Ez a vizsgálati módszer fémvegyületek vizsgálatára nem alkalmazandó, mivel ismert, hogy azok kovalens kötéstől elérő mechanizmusok útján lépnek reakcióba a fehérjékkel. A vizsgálati vegyi anyagnak 100 mM végső koncentrációjú, megfelelő oldószerben oldhatónak kell lennie (lásd a 18. pontot). Az említett koncentrációnál nem oldható vizsgálati vegyi anyagok azonban alacsonyabb oldható koncentrációkban még vizsgálhatók. Ilyen esetben a pozitív eredmény továbbra is felhasználható a vizsgálati vegyi anyag bőrszenzibilizáló hatásúként történő azonosítására, a negatív eredmény alapján azonban nem szabad a reakcióképesség hiányára következtetni. Jelenleg kevés információ áll rendelkezésre a DPRA ismert összetételű keverékekre való alkalmazhatóságával kapcsolatban (18) (19). A DPRA mindazonáltal technikailag alkalmazandónak tekinthető az ismert összetételű, több összetevőből álló anyagok és keverékek vizsgálatára (lásd a 18. bekezdést). E vizsgálati módszer tervezett szabályozási célt szolgáló adatgenerálás érdekében, keveréken történő alkalmazása előtt meg kell vizsgálni, hogy az megfelelő eredményeket biztosíthat-e erre a célra, és ha igen, miért. Ilyen megfontolások nem szükségesek, ha létezik a keverék vizsgálatára vonatkozó szabályozási követelmény. A jelenlegi előrejelzési modell a vizsgálati vegyi anyag és a peptid meghatározott mólaránya miatt nem alkalmazható ismeretlen összetételű, összetett keverékekre, ismeretlen szerkezetű vagy változó összetételű, összetett reakcióban keletkezett vagy biológiai eredetű anyagokra (azaz az UVCB anyagokra). E célból új, gravimetriás megközelítésen alapuló előrejelzési megközelítést kell kidolgozni. Olyan esetekben, ha bizonyítékkal igazolható, hogy a vizsgálati módszer nem alkalmazható más, konkrét vegyianyag-kategóriákra, a vizsgálati módszert nem szabad e vegyianyag-kategóriákra alkalmazni.
Ez a vizsgálati módszer a metabolikus rendszert nem érintő in chemico módszer. E vizsgálati módszerrel nem mutathatók ki olyan vegyi anyagok, amelyek enzimatikus bioaktivációt igényelnek a bőrszenzibilizáló potenciáljuk kifejtéséhez (azaz a pro-hapténok). Beszámolók szerint az abiotikus átalakulást követően szenzibilizálóvá váló vegyi anyagok (azaz a pre-hapténok) egyes esetekben megfelelően kimutathatók ezzel a vizsgálati módszerrel (18). A fentiek fényében: a vizsgálati módszerrel kapott negatív eredményeket a közölt korlátokra tekintettel és az integrált vizsgálati és értékelési megközelítés keretébe tartozó egyéb információforrásokkal összefüggésben kell értelmezni. A peptidhez nem kovalens kötéssel kapcsolódó, de az oxidációjához (cisztein-dimerizációval) hozzájáruló vizsgálati vegyi anyagok a peptidkiürülés esetleges túlbecsléséhez vezethetnek, esetlegesen hamis pozitív előrejelzéseket és/vagy magasabb reaktivitási osztályba sorolást eredményezve (lásd a 29. és a 30. pontot).
A fentieknek megfelelően a DPRA a bőrszenzibilizáló és a nem szenzibilizáló anyagok megkülönböztetését támogatja. Hozzájárulhat azonban a szenzibilizáló hatás értékeléséhez is (11), ha az integrált vizsgálati és értékelési megközelítéshez hasonló integrált megközelítések keretében alkalmazzák. Lehetőleg humán adatokon alapuló további munkára van azonban szükség annak meghatározásához, hogy a DPRA eredményei hogyan járulhatnak hozzá a hatáserősség vizsgálatához.
A VIZSGÁLAT ELVE
A DPRA a cisztein- vagy lizintartalmú peptidek vizsgálati vegyi anyaggal 25±2,5 °C-on 24 óráig végzett inkubációt követően megmaradó koncentrációját számszerűsítő in chemico módszer. A szintetikus peptidek a kimutatás elősegítése érdekében fenilalanint tartalmaznak. A relatív peptidkoncentráció mérése gradiens elúcióval és 220 nm hullámhosszon UV-detektálással végzett nagyhatékonyságú folyadék-kromatográfiával (HPLC) történik. A cisztein- és a lizintartalmú peptidek százalékos kiürülési értékeit ezt követően ki kell számítani és előrejelzési modellben kell alkalmazni (lásd a 29. pontot), ami lehetővé teszi a vizsgálati vegyi anyagnak a szenzibilizáló és a nem szenzibilizáló anyagok közötti különbségtétel alátámasztására használt négy reaktivitási osztály egyikébe sorolását.
Az e vizsgálati módszerben ismertetett módszer rutinszerű alkalmazása előtt a laboratóriumoknak a 2. függelékben felsorolt tíz jártassági tesztanyag felhasználásával kell igazolniuk szakmai jártasságukat.
ELJÁRÁS
Ez a vizsgálati módszer a DPRA-ra vonatkozó 154. sz. DB-ALM protokollon (20) alapul, amely az EURL ECVAM által koordinált validálási vizsgálathoz használt protokoll. A módszer laboratóriumi végrehajtása és alkalmazása során e protokoll alkalmazása ajánlott. Az alábbiakban a DPRA főbb összetevőinek és eljárásainak leírása található. Alternatív HPLC-beállítás alkalmazása esetén annak DB-ALM protokollban ismertetett, validált rendszerrel való egyenértékűségét bizonyítani kell (például a 2. függelékben található jártassági tesztanyagok vizsgálatával).
A cisztein- illetve a lizintartalmú peptidek előkészítése
A ciszteintartalmú (Ac-RFAACAA-COOH) és lizintartalmú (Ac-RFAAKAA-COOH), 85 %-osnál nagyobb és lehetőleg 90–95 %-os tisztaságú szintetikus peptideket tartalmazó törzsoldatokat frissen kell elkészíteni, közvetlenül a vizsgálati vegyi anyaggal való inkubálásukat megelőzően. A ciszteintartalmú peptidek végső koncentrációjának 7,5 pH-jú foszfátpufferben 0,667 mM-nek, míg a lizintartalmú peptidek végső koncentrációjának 10,2 pH-jú ammónium-acetát pufferben 0,667 mM-nek kell lennie. A HPLC-vizsgálatmenet sorozatát úgy kell beállítani, hogy a HPLC-elemzés ideje 30 óránál rövidebb maradjon. A validálási vizsgálatban használt és az e vizsgálati módszerben ismertetett HPLC-rendszerhez egyetlen HPLC-vizsgálatmenetben legfeljebb 26 elemzési minta alkalmazható (amelyek magukban foglalják a vizsgálati vegyi anyagot, a pozitív kontrollt és a megfelelő számú oldószeres kontrollokat a vizsgálat során használt oldószerek száma alapján; minden mintát három példányban kell vizsgálni). Az ugyanazon vizsgálatmenetben elemzett összes párhuzamoshoz ugyanazokat a cisztein- és lizintartalmú peptideket tartalmazó törzsoldatokat kell felhasználni. Az egyes gyártási sorozatokból származó peptidek esetében a felhasználás előtt ajánlott bebizonyítani a megfelelő oldhatóságukat.
A vizsgálati vegyi anyag előkészítése
A vizsgálati vegyi anyag megfelelő oldószerben való oldhatóságát a DPRA DB-ALM protokolljában (20) ismertetett szolubilizációs eljárás utáni vizsgálat végrehajtása előtt kell vizsgálni. Egy megfelelő oldószer teljes egészében feloldja a vizsgálati vegyi anyagot. Mivel a DPRA során a vizsgálati vegyi anyag inkubálása túlnyomórészt a cisztein- vagy lizintartalmú peptidekkel történik, az áttetsző oldat képződésének szemrevételezéses ellenőrzése elegendőnek tekintendő annak megállapításához, hogy a vizsgálati vegyi anyag (és több összetevőből álló anyag vagy keverék vizsgálata esetén a vizsgálati vegyi anyag valamennyi összetevője) feloldódik. Megfelelő oldószer az acetonitril, a víz, illetve a víz és az acetonitril 1:1 arányú keveréke, az izopropanol, az aceton vagy az aceton és az acetonitril 1:1 arányú keveréke. Más oldószerek akkor alkalmazhatók, ha nem fejtenek ki hatást a peptid C. referenciakontrollokkal (azaz a megfelelő oldószerben feloldott, csak peptidből álló mintákkal; lásd a 3. függeléket) nyomon követett stabilitására. Utolsó lehetőségként, ha a vizsgálati vegyi anyag nem oldható ezen oldószerek egyikében sem, kísérletet kell tenni 300 μL dimetil-szulfoxidban való szolubilizálására, a keletkezett oldatot pedig 2 700 μL acetonitrillel kell hígítani, és ha a vizsgálati vegyi anyag nem oldható ebben a keverékben, kísérletet kell tenni ugyanakkora mennyiségű vizsgálati vegyi anyag 1 500 μL dimetil-szulfoxidban való szolubilizálására, a keletkezett oldatot pedig 1 500 μL acetonitrillel kell hígítani. 100 mM koncentrációjú oldat elkészítéséhez a vizsgálati vegyi anyagot előzetesen ki kell mérni üvegfiolákba és közvetlenül a vizsgálata előtt megfelelő oldószerben fel kell oldani. Ismert összetételű keverékek és több összetevőből álló anyagok esetében az összetevők (a víz kivételével) arányának összegzésével egyetlen tisztaságot kell meghatározni, továbbá a keverék minden egyes összetevője (a víz kivételével) molekulatömegének és azok egyedi arányának figyelembevételével egyetlen látszólagos molekulatömeget kell meghatározni. Ezt követően a kapott tisztaságot és látszólagos molekulatömeget kell felhasználni a vizsgálati vegyi anyag 100 mM koncentrációjú oldat elkészítéséhez szükséges tömegének kiszámításához. Olyan polimerek esetében, amelyeknél a domináns molekulatömeg nem határozható meg, 100 mM koncentrációjú oldat elkészítéséhez figyelembe vehető a monomer molekulatömege (vagy polimert alkotó különféle monomerek látszólagos molekulatömege). Ismert összetételű keverékek, több összetevőből álló anyagok vagy polimerek vizsgálata során azonban mérlegelni kell a tiszta vegyi anyag vizsgálatát is. Folyadékok esetében a tiszta vegyi anyagot önmagában, előzetes hígítás nélkül, a ciszteintartalmú peptidekkel 1:10, illetve a lizintartalmú peptidekkel 1:50 mólarányban végzett inkubálással kell vizsgálni. Szilárd anyagok esetében a vizsgálati vegyi anyagot a látszólagos 100 mM koncentrációjú oldat elkészítéséhez használt oldószerrel megegyező oldószerben, maximális oldható koncentrációjában kell feloldani. Ezt követően önmagában, további hígítás nélkül, a ciszteintartalmú peptidekkel 1:10, illetve a lizintartalmú peptidekkel 1:50 arányban végzett inkubálással kell vizsgálni. A látszólagos 100 mM koncentrációjú oldat és a tiszta vegyi anyag egyező eredményeinek (reaktív vagy nem reaktív) az eredményre vonatkozó határozott következtetést kell lehetővé tenniük.
A pozitív kontroll, a referenciakontrollok és a koelúciós kontrollok elkészítése
Pozitív kontrollként acetonitrilben oldott, 100 mM koncentrációjú fahéjaldehidet (CAS-szám: 104-55-2; ≥95 %-os élelmiszer-minőségű tisztaság) kell alkalmazni. Alkalmazhatók más, lehetőleg középtartományba eső kiürülési értékeket biztosító, megfelelő pozitív kontrollok is, ha rendelkezésre állnak történeti adatok hasonló vizsgálatmenet-elfogadhatósági kritériumok származtatásához. A HPLC-vizsgálatmenet sorozatának ezenfelül referenciakontrollokat (azaz mindössze a megfelelő oldószerben feloldott peptidet tartalmazó mintákat) is tartalmaznia kell, amelyek a HPLC rendszer alkalmasságának a vizsgálat előtti ellenőrzésére (A. referenciakontrollok), a referenciakontrollok időbeli stabilitásának ellenőrzésére (B. referenciakontrollok), valamint annak ellenőrzésére használatosak, hogy a vizsgálati vegyi anyag feloldására alkalmazott oldószer nincs hatással a százalékos peptidkiürülésre (C. referenciakontrollok) (lásd a 3. függeléket). Az egyes vegyi anyagok tekintetében a megfelelő referenciakontroll használatos az adott vegyi anyagok százalékos peptidkiürülésének kiszámításához (lásd a 26. pontot). Ezenfelül a vizsgálatmenet-sorozatnak minden egyes elemzett vizsgálati vegyi anyag esetében kizárólag a vizsgálati vegyi anyaggal alkotott koelúciós kontrollt kell tartalmaznia a vizsgálati vegyi anyag lizintartalmú vagy ciszteintartalmú peptidekkel való lehetséges koelúciójának kimutatására.
A vizsgálati vegyi anyag ciszteintartalmú és lizintartalmú peptideket tartalmazó oldatokkal való inkubálása
A ciszteintartalmú peptideket tartalmazó oldatokat 1:10 arányban, a lizintartalmú peptideket tartalmazó oldatokat pedig 1:50 arányban kell automata mintaadagoló üvegfiolákban inkubálni a vizsgálati vegyi anyaggal. Ha a vizsgálati vegyi anyag alacsony vízoldékonysága miatt a vizsgálati vegyi anyagot tartalmazó oldat peptidoldathoz történő hozzáadásakor azonnal kicsapódás figyelhető meg, ebben az esetben nem lehet megbizonyosodni arról, hogy a vizsgálati vegyi anyagból mennyi maradt az oldatban ahhoz, hogy a peptiddel reakcióba lépjen. Ezért ilyen esetben a pozitív eredmények még felhasználhatóak, a negatív eredmények azonban bizonytalanok és kellő körültekintéssel értelmezendőek (a 100 mM koncentrációig nem oldható vegyi anyagok vizsgálatához lásd még a 11. pont rendelkezéseit). A reakcióoldatot a HPLC-elemzés lefuttatása előtt 24±2 óráig 25±2,5 °C-on, sötétben kell hagyni. Minden egyes vizsgálati vegyi anyagot mindkét peptid esetében három példányban kell elemezni. A HPLC-elemzés előtt a mintákat szemrevételezéssel kell ellenőrizni. Ha kicsapódás vagy fázisszétválás figyelhető meg, a mintákat elővigyázatosságból alacsony sebességen (100–400xg) centrifugálni lehet, hogy a kicsapódás a fiola aljára kerüljön, ugyanis a nagy mennyiségű kicsapódás eltömítheti a HPLC-csöveket vagy -oszlopokat. Ha az inkubációs időszak után kicsapódás vagy fázisszétválás figyelhető meg, a peptidkiürülés esetlegesen alulbecsülhető, és a reaktivitás hiányra vonatkozó következtetés nem vonható le kellő bizonyossággal negatív eredmény esetén.
A HPLC standard kalibrációs görbe elkészítése
A ciszteintartalmú és a lizintartalmú peptidekhez is standard kalibrációs görbét kell létrehozni. A peptidstandardokat 20 %-os vagy 25 %-os acetonitril-oldatban kell előkészíteni: a ciszteintartalmú peptidek esetében (7,5 pH-jú) foszfátpufferrel, a lizintartalmú peptidek esetében pedig (10,2 pH-jú) ammónium-acetát pufferrel előállított pufferben. A (0,667 mM koncentrációjú) peptid-törzsoldat sorozathígítási standardjainak alkalmazásával 6 kalibráló oldatot kell készíteni a 0,534–0,0167 mM közötti tartomány lefedése érdekében. A standard kalibrációs görbén a hígítópuffer vakpróbáját is fel kell tüntetni. Megfelelő kalibrációs görbék esetén r2 > 0,99.
A HPLC előkészítése és HPLC-elemzés
A HPLC-rendszer megfelelőségét ellenőrizni kell az elemzés elvégzése előtt. A peptidkiürülést UV-detektorral (fotodiódasoros detektorral vagy 220 nm-en küldött jellel működő hullámhossz-abszorbancia-detektorral) ellátott HPLC segítségével kell nyomon követni. A megfelelő oszlopot telepíteni kell a HPLC-rendszerbe. A validált protokollban ismertetett HPLC-beállítás előnyben részesített oszlopként Zorbax SB-C-18 típusú, 2,1 mm x 100 mm x 3,5 mikron méretű oszlopot alkalmaz. Az egész rendszert a működtetése előtt legalább két órán keresztül ezzel a fordított fázisú HPLC-oszloppal kell 30 °C-on 50 % A. fázissal (0,1 térfogatszázalék trifluoracetát-sav vízben) és 50 % B. fázissal (0,0,85 térfogatszázalék trifuloracetát-sav acetonitrilben) ekvilibrálni. A HPLC-elemzést 0,35 ml/perc áramlási sebesség mellett, lineáris gradiensként 10 percen keresztül 10–25 %-os acetonitrilt alkalmazva kell elvégezni oly módon, hogy ezután az egyéb anyagok eltávolítása érdekében gyorsan 90 %-osra kell növelni az acetonitrilt. Az egyes standardokból, mintákból és kontrollokból egyenlő mennyiséget kell befecskendezni. Az oszlopot a befecskendezések között hét percig az eredeti körülmények között újra ekvilibrálni kell. Eltérő fordított fázisú HPLC alkalmazása esetén a fent ismertetett beállítási paramétereket esetlegesen ki kell igazítani a cisztein- és a lizintartalmú peptidek megfelelő elúciójának és integrációjának biztosítása érdekében, esetlegesen ki kell igazítani a befecskendezett mennyiséget is, amely az alkalmazott rendszertől függően változhat (jellemzően 3–10 μl tartományban mozoghat). Fontos, hogy alternatív HPLC-beállítás alkalmazása esetén a fent ismertetett, validált beállítással való egyenértékűségét bizonyítani kell (például a 2. függelékben található jártassági tesztanyagok vizsgálatával). Az abszorbanciát 220 nm hullámhosszon kell nyomon követni. Fotodiódasoros detektor használata esetén a 258 nm-en mért abszorbanciát is rögzíteni kell. Megjegyzendő, hogy egyes acetonitril-szállítmányok negatív hatást fejthetnek ki a peptidek stabilitására, és ezt figyelembe kell venni az új gyártási sorozatból származó acetonitril használatakor. A 220-as csúcsterület és a 258-as csúcsterület aránya a koelúció mutatójaként használható. Az egyes minták esetében a 90 % <kontrollminták területi mutatójának átlaga ( 10 )<100 % közötti tartományba eső mutató megbízhatóan jelezheti, hogy nem következett be koelúció.
Egyes vizsgálati vegyi anyagok kiválthatják a ciszteintartalmú peptid oxidációját. A dimerizált ciszteintartalmú peptid csúcsa szemrevételezéssel ellenőrizhető. Ha úgy tűnik, hogy a dimerizáció bekövetkezett, ezt fel kell jegyezni, mivel a százalékos peptidkiürülés túlbecsülhető, ami hamis pozitív előrejelzésekhez és/vagy magasabb reaktivitási osztályba soroláshoz vezethet (lásd a 29. és 30. pontot).
A cisztein- és a lizintartalmú peptidek esetében a HPLC-elemzés egyidejűleg (ha két HPLC-rendszer áll rendelkezésre) vagy különböző napokon is elvégezhető. Ha az elemzésre különböző napokon kerül sor, mindkét napon frissen kell elkészíteni a vizsgálati vegyi anyagokat tartalmazó összes oldatot. Az elemzést úgy kell időzíteni, hogy biztosítható legyen az, hogy az első minta injektálása 22–26 órával a vizsgálati vegyi anyag peptidoldattal való elegyítését követően kezdődjön meg. A HPLC-vizsgálatmenet sorozatát úgy kell beállítani, hogy a HPLC-elemzés ideje 30 óránál rövidebb maradjon. A validálási vizsgálatban használt és az e vizsgálati módszerben ismertetett HPLC-beállítás legfeljebb 26 elemzési mintához alkalmazható egyetlen HPLC-vizsgálatmenetben (lásd még a 17. pontot). A HPLC-elemzési sorozat egy példája a 3. függelékben található.
ADATOK ÉS JEGYZŐKÖNYVEZÉS
Az adatok kiértékelése
A cisztein- és a lizintartalmú peptid koncentrációját minden egyes mintában 220 nm-en kell fotometrikusan meghatározni a megfelelő csúcsok csúcsterületének (görbe alatti terület, AUC) mérésével és a peptid koncentrációjának a standardokból származtatott lineáris kalibrációs görbe segítségével történő kiszámításával.
A százalékos peptidkiürülést minden egyes mintában a csúcsterület mérésével, majd ennek a releváns C. referenciakontrollok (lásd a 3. függeléket) csúcsterület-átlagával, az alább ismertetett képlet szerint kell meghatározni.
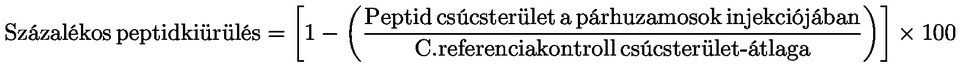
Elfogadhatósági kritériumok
Ahhoz, hogy a vizsgálatmenet érvényesnek minősüljön, az alábbi kritériumoknak kell teljesülniük:
a. a standard kalibrációs görbe esetén r2 > 0,99,
b. a pozitív kontrollként szolgáló fahéjaldehid három párhuzamosa százalékos peptidkiürülési átlaga a ciszteintartalmú peptid esetében 60,8 % és 100 % között, a lizintartalmú peptid esetében pedig 40,2 % és 69,0 % között legyen, a pozitív kontrollként szolgáló párhuzamosoknál a maximális szórás 14,9 %-nál kisebb legyen a százalékos ciszteinkiürülés esetében és 11,6 %-nál kisebb legyen a százalékos lizinkiürülés esetében, továbbá
c. az A. referenciakontrollok peptidkoncentráció-átlagának 0,50±0,05 mM értékűnek kell lennie, az acetonitrilben lévő kilenc B. és C. referenciakontroll peptid-csúcsterülete variációs koefficiensének 15,0 %-nál alacsonyabbnak kell lennie.
Ha e kritériumok közül egy vagy több nem teljesül, a vizsgálatmenetet meg kell ismételni.
Ahhoz, hogy a vizsgálati vegyi anyag eredményei érvényesnek minősüljenek, az alábbi kritériumoknak kell teljesülniük:
a. a vizsgálati vegyi anyag párhuzamosai maximális szórásának a százalékos ciszteinkiürülés esetében 14,9 %-nál alacsonyabbnak, a százalékos lizinkiürülésnek pedig 11,6 %-nál alacsonyabbnak kell lennie,
b. a megfelelő oldószerben lévő három C. referenciakontroll peptidkoncentrációja átlagának 0,50±0,05 mM-nek kell lennie. E kritériumok teljesülésének hiányában az adatokat el kell vetni, és az adott vizsgálati vegyi anyag esetében a vizsgálatmenetet meg kell ismételni.
Előrejelző modell
A százalékos cisztein- és lizinkiürülés átlagát minden egyes vegyi anyagnál ki kell számítani. A negatív kiürülés »0«-nak tekintendő az átlag kiszámítása során. Az 1. táblázatban szemléltetett, 1:10 arányban ciszteint, 1:50 arányban lizint alkalmazó előrejelzési modell alkalmazásával a 6,38 %-os átlagos peptidkiürülési küszöbértéket kell használni a bőrszenzibilizáló és a nem szenzibilizáló anyagok integrált vizsgálati és értékelési megközelítés keretében történő megkülönböztetésének alátámasztására. Az előrejelzési modellnek a vizsgálati vegyi anyagok adott reaktivitási osztályba (alacsony, mérsékelt és magas reaktivitás) sorolásához történő alkalmazása talán hasznosnak bizonyulhat egy integrált vizsgálati és értékelési megközelítésen belüli hatáserősség-vizsgálat szempontjából.
1. táblázat
1:10 arányban ciszteint, 1:50 arányban lizint alkalmazó előrejelzési modell (1)
|
A százalékos cisztein- és lizinkiürülés átlaga |
Reaktivitási osztály |
DPRA-val végzett előrejelzés (2) |
|
0 % ≤ %-os kiürülés átlaga ≤ 6,38 % |
Reaktivitás hiánya vagy minimális reaktivitás |
Negatív |
|
6,38 % < %-os kiürülés átlaga ≤ 22,62 % |
Alacsony reaktivitás |
Pozitív |
|
22,62 % < %-os kiürülés átlaga ≤ 42,47 % |
Mérsékelt reaktivitás |
|
|
42,47 % < %-os kiürülés átlaga ≤ 100 % |
Magas reaktivitás |
|
|
(1) A számok statisztikailag generált küszöbértékekre vonatkoznak, és nem függnek össze a mérés pontosságával. (2) A DPRA-val végzett előrejelzést integrált értékelési és vizsgálati megközelítés keretében, valamint a 9. és 12. pont rendelkezéseivel összhangban kell figyelembe venni. |
||
Előfordulhatnak olyan esetek, amikor a vizsgálati vegyi anyag (az anyag, illetve valamely több összetevőből álló anyag vagy keverék egy vagy több összetevője) jelentős mértékben abszorbeálódik 220 nm-en, és retenciós ideje megegyezik a peptidével (koelúció). A vizsgálati vegyi anyag és a peptid elúciós idejének további szétválasztása érdekében a koelúció megoldható a HPLC-beállítás kismértékű kiigazításával. Ha a koelúció megoldására alternatív HPLC-beállítás használatos, a validált beállítással való egyenértékűségét be kell bizonyítani (például a 2. függelékben található jártassági tesztanyagok vizsgálatával). Koelúció bekövetkezésekor a peptid csúcsa nem integrálható és a százalékos peptidkiürülés kiszámítása nem lehetséges. Ha az ilyen vizsgálati vegyi anyagok koelúciója a cisztein- és a lizintartalmú peptidekkel is bekövetkezik, az elemzésről »nem meggyőző«-ként kell beszámolni. Olyan esetekben, ha a koelúció csak a lizintartalmú peptiddel következik be, a 2. táblázatban közölt, 1:10 arányban ciszteint alkalmazó előrejelzési modell alkalmazható.
2. táblázat
1:10 arányban ciszteint alkalmazó előrejelzési modell (1)
|
Százalékos ciszteinkiürülés |
Reaktivitási osztály |
DPRA-val végzett előrejelzés (2) |
|
0 % ≤ %-os ciszteinkiürülés ≤ 13,89 % |
Reaktivitás hiánya vagy minimális reaktivitás |
Negatív |
|
13,89 % < %-os ciszteinkiürülés ≤ 23,09 % |
Alacsony reaktivitás |
Pozitív |
|
23,09 % < %-os ciszteinkiürülés ≤ 98,24 % |
Mérsékelt reaktivitás |
|
|
98,24 % < %-os ciszteinkiürülés ≤ 100 % |
Magas reaktivitás |
|
|
(1) A számok statisztikailag generált küszöbértékekre vonatkoznak, és nem függnek össze a mérés pontosságával. (2) A DPRA-val végzett előrejelzést integrált értékelési és vizsgálati megközelítés keretében, valamint a 9. és 12. pont rendelkezéseivel összhangban kell figyelembe venni. |
||
Előfordulhatnak egyéb olyan esetek, amikor a vizsgálati vegyi anyag vagy bármelyik peptid retenciós ideje közötti átfedés nem teljes. Ilyen esetekben a százalékos peptidkiürülési értékeket meg lehet becsülni és fel lehet használni az 1:10 arányban ciszteint, illetve az 1:50 arányban lizint alkalmazó előrejelzési modellben, a vizsgálati vegyi anyag reaktivitási osztályba sorolása ugyanakkor nem végezhető el pontosan.
A vizsgálati vegyi anyag esetében a cisztein- és a lizintartalmú peptideknél is elegendőnek kell lennie egyetlen HPLC-elemzésnek, ha az eredmény nem egyértelmű. A pozitív és a negatív eredmények megkülönböztetéséhez használt küszöbértékhez közeli eredmények (vagyis határesethez közeli eredmények) esetében további vizsgálatokra lehet szükség. Ha a százalékos kiürülés átlaga az 1:10 arányban ciszteint/1:50 arányban lizint alkalmazó előrejelzési modell esetén 3–10 % közé esik, vagy ha a százalékos ciszteinkiürülés az 1:10 arányban ciszteint alkalmazó előrejelzési modell esetén 9–17 % közé esik, mérlegelni kell egy második vizsgálatmenetet, valamint az első két vizsgálatmenet nem egyező eredményei esetén egy harmadik vizsgálatmenetet.
Vizsgálati jegyzőkönyv
A Vizsgálati jegyzőkönyvnek a következőket kell tartalmaznia:
Vizsgálati vegyi anyag
— Egy összetevőből álló anyag:
—
— kémiai azonosítás, például IUPAC- vagy CAS-név (nevek), CAS-szám(ok), SMILES- vagy InChI-kód, szerkezeti képlet és/vagy más azonosítók;
— fizikai megjelenés, vízoldékonyság, molekulatömeg, valamint további releváns fizikai-kémiai tulajdonságok, amennyiben rendelkezésre állnak;
— tisztaság, adott és a gyakorlatban megvalósítható esetben a szennyeződések kémiai azonossága stb.;
— vizsgálat előtti kezelés, ha történt ilyen (pl. melegítés, őrlés);
— vizsgált koncentráció(k);
— tárolási feltételek és stabilitás, amennyiben rendelkezésre állnak.
— Több összetevőből álló anyagok, UVCB-k és keverékek:
—
— amennyiben lehetséges, az összetevőknek például a kémiai azonosítója (lásd fent), tisztasága, mennyiségi előfordulása és releváns fizikai-kémiai tulajdonságai (lásd fent) jellemzik, amennyiben rendelkezésre állnak;
— fizikai megjelenés, vízoldékonyság és a további releváns fizikai-kémiai tulajdonságok, amennyiben rendelkezésre állnak;
— molekulatömeg vagy látszólagos molekulatömeg ismert összetételű keverékek/polimerek esetén, vagy a vizsgálat lebonyolítása szempontjából releváns egyéb információ;
— vizsgálat előtti kezelés, ha történt ilyen (pl. melegítés, őrlés);
— vizsgált koncentráció(k);
— tárolási feltételek és stabilitás, amennyiben rendelkezésre állnak.
Kontrollok
— Pozitív kontroll
—
— kémiai azonosítás, például IUPAC- vagy CAS-név (nevek), CAS-szám(ok), SMILES- vagy InChI-kód, szerkezeti képlet és/vagy más azonosítók;
— fizikai megjelenés, vízoldékonyság, molekulatömeg, valamint további releváns fizikai-kémiai tulajdonságok, amennyiben rendelkezésre állnak;
— tisztaság, adott és a gyakorlatban megvalósítható esetben a szennyeződések kémiai azonossága stb.;
— vizsgálat előtti kezelés, ha történt ilyen (pl. melegítés, őrlés);
— vizsgált koncentráció(k);
— tárolási feltételek és stabilitás, amennyiben rendelkezésre állnak;
— adott esetben a pozitív kontrolloknak a vizsgálatmenet elfogadhatósági kritériumoknak való megfelelőségét bizonyító korábbi eredményei.
— Oldószer/Vivőanyag
—
— az alkalmazott oldószer/vivőanyag és adott esetben az összetevőinek aránya;
— kémiai azonosítás(ok), például IUPAC- vagy CAS-név (nevek), CAS-szám(ok) és/vagy más azonosítók;
— tisztaság, adott és a gyakorlatban megvalósítható esetben a szennyeződések kémiai azonossága stb.;
— fizikai megjelenés, molekulatömeg, valamint további releváns fizikai-kémiai tulajdonságok, amennyiben a vizsgálati módszerben említett oldószerektől/vivőanyagoktól eltérő oldószerek/vivőanyagok használatosak, és amennyiben rendelkezésre állnak;
— tárolási feltételek és stabilitás, amennyiben rendelkezésre állnak;
— az oldószer kiválasztásának indoklása minden egyes vizsgálati vegyi anyag esetében;
— az acetonitril esetében a peptid stabilitására kifejtett hatás vizsgálatának eredményei.
A peptidek, a pozitív kontroll és a vizsgálati vegyi anyag előkészítése
— a peptidoldatok jellemzése (a peptid beszállítója, tétele, pontos tömege, a törzsoldathoz adott mennyisége);
— a pozitív kontrollt tartalmazó oldatok jellemzése (a pozitív kontrollanyag pontos tömege, a vizsgálati oldathoz adott mennyisége);
— a vizsgálati vegyi anyagot tartalmazó oldatok jellemzése (a vizsgálati vegyi anyag pontos tömege, a vizsgálati oldathoz adott mennyisége)
A HPLC-műszer beállítása és az azzal végzett elemzés
— a HPLC-műszer, a HPLC- és az előtétoszlopok, a detektor, az automata mintaadagoló típusa;
— a HPLC-elemzés szempontjából releváns paraméterek, például az oszlop hőmérséklete, a befecskendezett térfogat, az áramlási sebesség és a gradiens.
A rendszer alkalmassága
— valamennyi standard és párhuzamos A. referenciakontroll peptid-csúcsterülete 220 nm-en;
— a grafikusan ábrázolt lineáris kalibrációs görbe és a bejelentett r2;
— az egyes párhuzamos A. referenciakontrollok peptidkoncentrációja;
— a három A. referenciakontroll peptidkoncentrációjának (mM) átlaga, szórása és variációs koefficiense;
— az A. és C. referenciakontrollok peptidkoncentrációja.
Elemzéssorozat
— A referenciakontrollok esetében:
—
— mindegyik párhuzamos B. és C. referenciakontroll peptid-csúcsterülete 220 nm-en;
— az acetonitrilben lévő kilenc B. és C. referenciakontroll 220 nm-en számított peptid-csúcsterületének átlaga, szórása és variációs koefficiense (a referenciakontrollok elemzési idő alatti stabilitásához);
— mindegyik használt oldószer esetében a három megfelelő C. referenciakontroll 220 nm-en számított peptid-csúcsterületének átlaga (a százalékos peptidkiürülés számításához);
— mindegyik használt oldószer esetében a három megfelelő C. referenciakontroll peptidkoncentrációja (mM);
— mindegyik használt oldószer esetében a három megfelelő C. referenciakontroll peptidkoncentrációjának (mM) átlaga, szórása és variációs koefficiense.
— A pozitív kontroll esetében:
—
— mindegyik párhuzamos kontroll 220 nm-en számított peptid-csúcsterülete;
— mindegyik párhuzamos kontroll százalékos peptidkiürülése;
— mindhárom párhuzamos kontroll százalékos peptidkiürülésének átlaga, szórása és variációs koefficiense.
— Minden egyes vizsgálati vegyi anyag esetében:
—
— kicsapódás megjelenése a reakciókeverékben az inkubációs idő végén, ha megfigyelték; a kicsapódást újra feloldották-e vagy centrifugálták-e;
— koelúció jelenléte;
— adott esetben bármely egyéb releváns észrevétel leírása;
— mindegyik párhuzamos kontroll 220 nm-en számított peptid-csúcsterülete;
— mindegyik párhuzamos kontroll százalékos peptidkiürülése;
— a három párhuzamos kontroll százalékos peptidkiürülésének átlaga, szórása és variációs koefficiense;
— a százalékos cisztein- és a százalékos lizinkiürülési értékek átlaga;
— az alkalmazott előrejelzési modell és a DPRA-val végzett előrejelzés.
Jártassági vizsgálat
— Adott esetben a vizsgálati módszer végrehajtásában való laboratóriumi jártasság igazolására alkalmazott eljárás (például jártassági tesztanyagok vizsgálatával) vagy a vizsgálati módszer idővel reprodukálható végrehajtásának igazolására alkalmazott eljárás.
Az eredmények tárgyalása
— a DPRA-val kapott eredmények tárgyalása;
— a vizsgálati módszer eredményeinek integrált vizsgálati és értékelési megközelítés keretében történő tárgyalása, amennyiben rendelkezésre állnak más releváns információk.
Következtetés
SZAKIRODALOM
(1) Egyesült Nemzetek Szervezete (ENSZ) (2013). Globally Harmonized System of Classification and Labelling of Chemicals (GHS). Fifth revised edition, UN New York and Geneva, 2013. Elérhető a következő címen: http://www.unece.org/trans/danger/publi/ghs/ghs_rev05/05files_e.html
(2) OECD (2012). The Adverse Outcome Pathway for Skin Sensitisation Initiated by Covalent Binding to Proteins. Part 1: Scientific Evidence. Series on Testing and Assessment No. 168, OECD, Paris.
(3) E melléklet B.6., Bőrszenzibilizáció című fejezete.
(4) E melléklet B.42., Lokális nyirokcsomó-vizsgálati módszer című fejezete
(5) E melléklet B.50., Bőrszenzibilizáció: Lokális nyirokcsomó-vizsgálati módszer (LLNA): DA című fejezete.
(6) E melléklet B.51., Bőrszenzibilizáció: Lokális nyirokcsomó-vizsgálati módszer: BrdU-ELISA című fejezete
(7) Adler et al. (2011). Alternative (non-animal) methods for cosmetics testing: current status and future prospects-2010. Archives of Toxicology 85:367-485.
(8) Gerberick et al. (2004). Development of a peptide reactivity assay for screening contact allergens. Toxicological Sciences 81:332-343.
(9) Gerberick et al. (2007). Quantification of chemical peptide reactivity for screening contact allergens: A classification tree model approach. Toxicological Sciences 97:417-427.
(10) EC EURL-ECVAM (2013). Recommendation on the Direct Peptide Reactivity Assay (DPRA) for skin sensitisation testing. Elérhető a következő címen: https://eurl-ecvam.jrc.ec.europa.eu/eurl-ecvam-recommendations/eurl-ecvam-recommendation-on-the-direct-peptide-reactivity-assay-dpra
(11) Jaworska et al. (2013). Bayesian integrated testing strategy to assess skin sensitization potency: from theory to practice. Journal of Applied Toxicology, published online, 14 May 2013, DOI: 10.1002/jat.2869.
(12) Bauch et al. (2012). Putting the parts together: combining in vitro methods to test for skin sensitizing potential. Regulatory Toxicology and Pharmacology 63: 489-504.
(13) Nukada et al. (2013). Data integration of non-animal tests for the development of a test battery to predict the skin sensitizing potential and potency of chemicals. Toxicology in vitro 27:609 618.
(14) Ball et al (2011). Evaluating the sensitization potential of surfactants: integrating data from the local lymph node assay, guinea pig maximization test, and in vitro methods in a weight-of-evidence approach. Regulatory Toxicology and Pharmacology 60:389-400.
(15) Landsteiner and Jacobs (1936). Studies on the sensitization of animals with simple chemical compounds. Journal of Experimental Medicine 64:625-639.
(16) Dupuis and Benezra (1982). Allergic contact dermatitis to simple chemicals: a molecular approach. New York & Basel: Marcel Dekker Inc.
(17) Lepoittevin et al. (1998). Allergic contact dermatitis: the molecular basis. Springer, Berlin.
(18) EC EURL ECVAM (2012). Direct Peptide Reactivity Assay (DPRA) Validation Study Report 74pp. Accessible at: http://ihcp.jrc.ec.europa.eu/our_labs/eurl-ecvam/eurl-ecvam-recommendations/eurl-ecvam-recommendation-on-the-direct-peptide-reactivity-assay-dpra
(19) Natsch et al. (2013). A dataset on 145 chemicals tested in alternative assays for skin sensitization undergoing prevalidation. Journal of Applied Toxicology, published online, 9 April 2013, DOI:10.1002/jat.2868.
(20) DB-ALM (INVITTOX) Protocol 154: Direct Peptide Reactivity assay (DPRA) for skin sensitisation testing 17pp. Elérhető a következő címen: http://ecvam-dbalm.jrc.ec.europa.eu/
(21) OECD (2005). Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment. OECD Series on Testing and Assessment, No. 34. Organisation for Economic Cooperation and Development, Paris, France.
(22) FDA (Food and Drug Administration (2001). Guidance for Industry: Bioanalytical Method Validation 22pp. Elérhető a következő címen: www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidance/ucm070107.pdf – 138
(23) ECETOC (2003). Contact sensitization: Classification according to potency. European Centre for Ecotoxicology & Toxicology of Chemicals (Technical Report No. 87).
1. függelék
FOGALOMMEGHATÁROZÁSOK
Pontosság : a vizsgálati módszerrel kapott eredmények és az elfogadott referenciaértékek közötti egyezés mértéke. A vizsgálati módszer teljesítőképességét mutatja, és relevanciájának egyik szempontja. A kifejezés gyakran használatos az »egyezés« szó megfelelőjeként, amely arra utal, hogy egy adott vizsgálat milyen arányban szolgáltat helyes eredményeket (21).
Káros kimeneti út (Adverse Outcome Pathway, AOP) : valamely megcélzott vegyi anyag vagy hasonló vegyi anyagok csoportjának kémiai szerkezetéből kiinduló, a molekuláris kiváltó eseményen keresztül az érintett in vivo eredményig végbemenő eseménysorozat (2).
Kalibrációs görbe : valamely ismert anyag kísérleti válaszértéke és analitikai koncentrációja közötti összefüggés (más néven: standard görbe).
Vegyi anyag : anyag vagy keverék.
Variációs koefficiens : a variabilitás mértékegysége, amelyet a párhuzamos adatcsoportok esetében a szórás és az átlag hányadosaként kell kiszámítani. Százalékos arányként történő kifejezéséhez 100-zal megszorozható.
Veszély : valamely anyag vagy helyzet azon sajátossága, hogy káros hatásokat képes előidézni az élő szervezet, rendszer vagy (al)populáció anyagnak való expozíciójakor.
Integrált vizsgálati és értékelési megközelítés : valamely vegyi anyag vagy vegyianyag-csoport veszélyeinek azonosításához (potenciál), jellemzéséhez (hatáserősség) és/vagy biztonsági értékeléséhez (potenciál, hatáserősség és expozíció) alkalmazott strukturált megközelítés, amely stratégiai szempontból beépít és mérlegel minden olyan releváns adatot, amely hozzájárul a lehetséges veszélyre és/vagy kockázatra és/vagy a további célirányos és ezért minimális vizsgálat szükségességére vonatkozó szabályozói döntéshozatalhoz.
Molekuláris kiváltó esemény : valamely biológiai rendszer vegyi anyag által, molekuláris szinten kiváltott zavara, amely a káros kimeneti útban a kezdőeseményként határozandó meg.
Keverék : két vagy több anyagból álló keverék vagy oldat, amelyben az anyagok nem lépnek egymással reakcióba (1).
Egy összetevőből álló anyag : olyan, a mennyiségi összetétele alapján meghatározott anyag, amelyben az egyik fő összetevő legalább 80 tömegszázalékban van jelen.
Több összetevőből álló anyag : olyan, a mennyiségi összetétele alapján meghatározott anyag, amelyben egynél több fő összetevő legalább 10 tömegszázalékban, de 80 tömegszázalékot nem meghaladó koncentrációban van jelen. A több összetevőből álló anyag gyártási folyamat eredménye. A keverék és a több összetevőből álló anyag között az a különbség, hogy a keverék két vagy több anyag összekeverésével, kémiai reakció nélkül jön létre. A több összetevőből álló anyag kémiai reakció eredménye.
Pozitív kontroll : a vizsgálati rendszer valamennyi alkotóelemét tartalmazó, ismert pozitív hatást kiváltó anyaggal kezelt replikátum. Annak biztosítása érdekében, hogy a pozitív kontrollban jelentkező hatás időbeli változását fel lehessen mérni, a pozitív hatás nem lehet túlságosan erőteljes.
Referenciakontroll : a vizsgálati rendszer valamennyi alkotóelemét az oldószerrel vagy vivőanyaggal együtt tartalmazó nem kezelt minta, amelyet a vizsgálati vegyi anyaggal kezelt mintákkal és más kontrollmintákkal együtt kell feldolgozni az ugyanazon oldószerben feloldott vagy ugyanazon vivőanyaggal felvitt vizsgálati vegyi anyaggal kezelt minták kiindulási értékeinek megállapítása érdekében. Párhuzamos negatív kontrollal elvégzett vizsgálata esetén ez a minta azt is bizonyítja, hogy az oldószer vagy vivőanyag kölcsönhatásba lép-e a vizsgálati rendszerrel.
Relevancia : a vizsgálat és a vizsgált hatás kapcsolatát adja meg, valamint azt, hogy van-e a vizsgálatnak az adott cél szempontjából értelme és haszna. Azt tükrözi, hogy a vizsgálat mennyire pontosan méri vagy jelzi előre a vizsgált biológiai hatást. A relevancia meghatározása során a vizsgálati módszer pontosságát (az eredmények egyezését) figyelembe kell venni (21).
Megbízhatóság : a vizsgálati módszer laboratóriumon belüli és laboratóriumok közötti időbeli reprodukálhatóságának mértéke ugyanazon protokoll alkalmazása mellett. Megállapítása a laboratóriumon belüli és a laboratóriumok közötti reprodukálhatóság, valamint a laboratóriumon belüli megismételhetőség kiszámításával történik (21).
Reprodukálhatóság : ugyanazon vegyi anyag ugyanazon vizsgálati protokollal végzett vizsgálata során kapott eredmények egyezése (lásd: megbízhatóság) (21).
Érzékenység : az összes olyan pozitív/aktív vegyi anyag aránya, amelyet a vizsgálati módszer helyesen sorolt be. A kategorikus eredményt adó vizsgálati módszerek pontosságának mutatója, valamint fontos szempont a vizsgálati módszerek relevanciájának megítélésében (21).
Specifikusság : a vizsgálati módszerrel helyesen besorolt összes negatív/inaktív vegyi anyag aránya. A kategorikus eredményt adó vizsgálati módszerek pontosságának mutatója, valamint fontos szempont a vizsgálati módszerek relevanciájának megítélésében (21).
Anyag : természetes állapotban előforduló vagy ipari termelőfolyamatból származó kémiai elemek és azok vegyületei, amelyek a termék stabilitásának megőrzéséhez szükséges adalékanyagokat és az alkalmazott folyamatból származó szennyeződéseket is tartalmazhatnak, de nem tartalmaznak olyan oldószereket, amelyek az anyag stabilitásának befolyásolása vagy összetételének megváltozása nélkül elkülöníthetők (1).
A rendszer alkalmassága : a műszer teljesítményének (például érzékenységének) az analitikai programcsomag lefuttatása előtt, referenciastandard segítségével végzett elemzésével történő meghatározása (22).
Vizsgálati vegyi anyag : a »vizsgálati vegyi anyag« kifejezés a vizsgálat tárgyát képező anyagra való hivatkozáshoz használatos.
A vegyi anyagok osztályozásának és címkézésének az Egyesült Nemzetek Szervezete által globálisan harmonizált rendszere (ENSZ-GHS) : a vegyi anyagoknak (anyagoknak és keverékeknek) a fizikai, egészségi és környezeti veszélyek szabványosított típusai és szintjei szerinti osztályokba sorolására és megfelelő kommunikációs elemekkel (például piktogramokkal, figyelmeztetésekkel, figyelmeztető mondatokkal, óvintézkedésekre vonatkozó mondatokkal és biztonsági adatlapokkal) történő jelölésére javaslatokat megfogalmazó rendszer, amelynek célja, hogy az emberek (köztük a munkáltatók, a munkavállalók, a fuvarozók, a fogyasztók és a sürgősségi segélyszolgálatok) és a környezet megóvása érdekében egységesítse a vegyi anyagok káros hatásaira vonatkozó információk továbbítását (1).
UVCB : Ismeretlen szerkezetű vagy változó összetételű, összetett reakcióban keletkezett vagy biológiai eredetű anyagok.
Érvényes vizsgálati módszer : olyan vizsgálati módszer, amely kellően relevánsnak és megbízhatónak minősül egy adott célra, és amely tudományosan megalapozott elveken alapul. Egy-egy vizsgálati módszer abszolút értelemben soha nem érvényes, kizárólag meghatározott céllal összefüggésben az (21).
2. függelék
JÁRTASSÁGI TESZTANYAGOK
In chemico bőrszenzibilizáció: közvetlen peptidreaktivitási vizsgálat
E vizsgálati módszer rutinszerű alkalmazása előtt a laboratóriumoknak oly módon kell igazolniuk szakmai jártasságukat, hogy az 1. táblázatban javasolt 10 jártassági tesztanyagra vonatkozóan a közvetlen peptidreaktivitási vizsgálattal a várható előrejelzést helyesen állapítják meg, továbbá az egyes peptidek tekintetében a 10 jártassági tesztanyag közül 8 esetében a referenciatartományba eső cisztein- és lizinkiürülési értékeket kapják meg. E jártassági tesztanyagok kiválasztása oly módon történt, hogy a bőrszenzibilizáció veszélye esetén bekövetkező különféle válaszreakciókat képviseljék. További kiválasztási kritérium volt, hogy a jártassági tesztanyagok kereskedelmi forgalomban kaphatóak legyenek, azokra vonatkozóan kiváló minőségű in vivo referenciaadatok és a közvetlen peptidreaktivitási vizsgálattal generált, kiváló minőségű in vitro adatok álljanak rendelkezésre, és azokat az EURL ECVAM által koordinált validálási vizsgálatban felhasználják a vizsgálati módszernek a vizsgálatban részt vevő laboratóriumokban történő sikeres végrehajtásának bizonyítása érdekében.
1. táblázat
A közvetlen peptidreaktivitási vizsgálatban való szakmai jártasság bizonyításához ajánlott anyagok
|
Jártassági tesztanyagok |
CASRN |
Halmazállapot |
In vivo előrejelzés (1) |
DPRA-val végzett előrejelzés (2) |
A ciszteintartalmú peptid százalékos kiürülésének tartománya (3) |
A lizintartalmú peptid százalékos kiürülésének tartománya (3) |
|
2,4-dinitro-klór-benzol |
97-00-7 |
Szilárd |
Szenzibilizáló (szélsőségesen) |
Pozitív |
90–100 |
15-45 |
|
Oxazolon |
15646-46-5 |
Szilárd |
Szenzibilizáló (szélsőségesen) |
Pozitív |
60–80 |
10–55 |
|
Formaldehid |
50-00-0 |
Folyadék |
Szenzibilizáló (erősen) |
Pozitív |
30–60 |
0–24 |
|
Benzilidén-aceton |
122-57-6 |
Szilárd |
Szenzibilizáló (mérsékelten) |
Pozitív |
80–100 |
0–7 |
|
Farnezal |
19317-11-4 |
Folyadék |
Szenzibilizáló (enyhén) |
Pozitív |
15–55 |
0-25 |
|
2,3-butándion |
431-03-8 |
Folyadék |
Szenzibilizáló (enyhén) |
Pozitív |
60–100 |
10–45 |
|
1-butanol |
71-36-3 |
Folyadék |
Nem szenzibilizáló |
Negatív |
0–7 |
0–5,5 |
|
6-metil-kumarin |
92-48-8 |
Szilárd |
Nem szenzibilizáló |
Negatív |
0–7 |
0–5,5 |
|
Tejsav |
50-21-5 |
Folyadék |
Nem szenzibilizáló |
Negatív |
0–7 |
0–5,5 |
|
4-metoxi-acetofenon |
100-06-1 |
Szilárd |
Nem szenzibilizáló |
Negatív |
0–7 |
0–5,5 |
|
(1) Az in vivo veszélyekre és (a hatáserősségre vonatkozó) előrejelzések LLNA-adatokon alapulnak (19). Az in vivo hatáserősség levezetése az ECETOC által javasolt kritériumok segítségével történik (23). (2) A DPRA-val végzett előrejelzést integrált értékelési és vizsgálati megközelítés keretében, valamint a 9. és 11. pont rendelkezéseivel összhangban kell figyelembe venni. (3) 6 független laboratórium által előállított, legalább 10 kiürülési érték alapján meghatározott tartományok. |
||||||
3. függelék
ELEMZÉSSOROZATRA VONATKOZÓ PÉLDÁK
|
Kalibráló standardok és referenciakontrollok |
STD1 STD2 STD3 STD4 STD5 STD6 Hígítópuffer A. referenciakontroll, 1. párhuzamos A. referenciakontroll, 2. párhuzamos A. referenciakontroll, 3. párhuzamos |
|
Koelúciós kontrollok |
Az 1. vizsgálati vegyi anyaghoz tartozó 1. koelúciós kontroll Az 2. vizsgálati vegyi anyaghoz tartozó 2. koelúciós kontroll |
|
Referenciakontrollok |
B. referenciakontroll, 1. párhuzamos B. referenciakontroll, 2. párhuzamos B. referenciakontroll, 3. párhuzamos |
|
Párhuzamosok első sorozata |
C. referenciakontroll, 1. párhuzamos Fahéjaldehid, 1. párhuzamos 1. minta, 1. párhuzamos 2. minta, 1. párhuzamos |
|
Párhuzamosok második sorozata |
C. referenciakontroll, 2. párhuzamos Fahéjaldehid, 2. párhuzamos 1. minta, 2. párhuzamos 2. minta, 2. párhuzamos |
|
Párhuzamosok harmadik sorozata |
C. referenciakontroll, 3. párhuzamos Fahéjaldehid, 3. párhuzamos 1. minta, 3. párhuzamos 2. minta, 3. párhuzamos |
|
Referenciakontrollok |
B. referenciakontroll, 4. párhuzamos B. referenciakontroll, 5. párhuzamos B. referenciakontroll, 6. párhuzamos |
|
Három referenciakontroll-sorozatot (azaz mindössze a megfelelő oldószerben feloldott peptidből álló mintákat) kell az elemzéssorozatban alkalmazni: A. referenciakontroll: a HPLC-rendszer alkalmasságának ellenőrzésére használatos. B. referenciakontroll: az elemzéssorozat elején és végén alkalmazzák a referenciakontrollok elemzési idő alatti stabilitásának ellenőrzéséhez. C. referenciakontroll: annak ellenőrzése érdekében alkalmazzák az elemzéssorozatban, hogy a vizsgálati vegyi anyag feloldására használt oldószer nem befolyásolja-e a százalékos peptidkiürülést. |
|
B.60. In vitro bőrszenzibilizáció: ARE-Nrf2 luciferáz alapú vizsgálati módszer
BEVEZETÉS
Ez a vizsgálati módszer egyenértékű az OECD 442D. vizsgálati iránymutatásában (2015) leírt módszerrel. A bőrszenzibilizáló anyag a vegyi anyagok osztályozásának és címkézésének az Egyesült Nemzetek Szervezete (ENSZ) által globálisan harmonizált rendszere (ENSZ-GHS) (1) és az anyagok és keverékek osztályozásáról, címkézéséről és csomagolásáról szóló 1272/2008/EK rendelet ( 11 ) (CLP-rendelet) szerint olyan anyag, amely a bőrrel való érintkezést követően allergiás reakciót vált ki. Ez a vizsgálati módszer olyan in vitro eljárást (ARE-Nrf2 luciferáz alapú vizsgálat) tesz lehetővé, amellyel támogatható a bőrszenzibilizáló és a nem szenzibilizáló anyagok megkülönböztetése az ENSZ-GHS-nek (1) és a CLP-rendeletnek megfelelően.
A bőrszenzibilizációt előidéző főbb biológiai eseményeket illetően általános egyetértés van. A bőrszenzibilizációhoz kapcsolódó kémiai és biológiai mechanizmusokról már rendelkezésre álló ismereteket úgynevezett káros kimeneti út (Adverse Outcome Pathway, AOP) (2) foglalja össze a molekuláris kiváltó eseménytől a köztes eseményeken át a káros hatásig, amely embereknél allergiás kontakt bőrgyulladás, rágcsálóknál pedig kontakt túlérzékenység (2) (3). A molekuláris kiváltó esemény az elektrofil anyagok és a bőrben lévő fehérjék nukleofil centrumai között létrejövő kovalens kötés. E káros kimeneti úton a második kulcsfontosságú esemény a keratinsejtekben következik be, többek között gyulladást okozó reakciók, valamint konkrét sejtjelző útvonalakhoz, például az antioxidáns/elektrofil válaszelemtől (ARE) függő útvonalakhoz kapcsolódó génexpresszió formájában. A harmadik kulcsfontosságú esemény a dendritikus sejtek aktivációja, melynek értékelése jellemzően konkrét sejtfelületi markerek, kemokinek és citokinek expressziója alapján történik. A negyedik kulcsfontosságú esemény a T-sejtek proliferációja, melynek közvetett értékelése az egereken alkalmazott lokális nyirokcsomó-vizsgálati módszer (4) keretében történik.
A bőrszenzibilizáció vizsgálata jellemzően kísérleti állatokon történő vizsgálatot foglal magában. A tengerimalacokon alkalmazott klasszikus módszerek, vagyis a Magnusson–Kligman-féle tengerimalac-maximizációs vizsgálat és a Bühler-féle vizsgálat (B.6. vizsgálati módszer (5)) egyaránt a bőrszenzibilizáció indukciós és kiváltási fázisával foglalkozik. Az egereken alkalmazott lokális nyirokcsomó-vizsgálati módszer (LLNA, B.42. vizsgálati módszer (4)) és két nem radioaktív változata, az LLNA: DA (B.50. vizsgálati módszer (6)) és az LLNA: BrdU-ELISA (B.51. vizsgálati módszer (7)), amely mind csak az indukciós reakciót vizsgálja, szintén elfogadottá vált, mivel állatjólét szempontjából előnyösebbek, mint a tengerimalacon végzett vizsgálatok, és objektív mérést tesznek lehetővé a bőrszenzibilizáció indukciós fázisában.
Újabban a mechanisztikus alapú in chemico és in vitro vizsgálati módszerek a vegyi anyagok bőrszenzibilizációs veszélyének értékelése szempontjából tudományosan megalapozottnak tekinthetőek. Szükség lesz azonban nem állatokon alkalmazott módszerek (in silico, in chemico, in vitro) integrált vizsgálati és értékelési megközelítésen belüli kombinációira a jelenleg alkalmazott állatkísérletek teljes felváltásához, mivel a jelenleg rendelkezésre álló, nem állatokon alkalmazott vizsgálati módszerekre a káros kimeneti út mechanisztikus szempontjai csak korlátozott mértékben terjednek ki (2) (3).
Ez a vizsgálati módszer (ARE-Nrf2 luciferáz alapú vizsgálat) a 2. pontban kifejtett második kulcsfontosságú esemény tárgyalására javasolt. Beszámolók szerint a bőrszenzibilizáló anyagok antioxidáns válaszelemmel (ARE) szabályozott géneket idéznek elő (8) (9). A bőrszenzibilizáló anyagokhoz hasonló, kisméretű elektrofil anyagok kifejthetnek hatást a Keap1 szenzorfehérjére (Kelch-like ECH-associated protein 1) például cisztein-maradékának kovalens módosításával, ami az Nrf2 transzkripciós faktortól (nukleáris faktor-eritroid 2-kapcsolt faktor 2) való különválását eredményezi. A disszociált Nrf2 ezt követően aktiválhat ARE-függő géneket, például a II. fázisban ható detoxifikáló enzimeket kódoló géneket (8) (10) (11).
Jelenleg az e vizsgálati módszer keretébe tartozó in vitro ARE-Nrf2 luciferáz alapú vizsgálat csak a KeratinoSensTM vizsgálat, amelyre vonatkozóan validálási vizsgálatokat bonyolítottak (9) (12) (13), és azokat az állatkísérletek alternatív módszereinek uniós referencialaboratóriuma (EURL ECVAM) által végzett független szakértői értékelés (14) követte. A KeratinoSensTM vizsgálat egy integrált vizsgálati és értékelési megközelítés keretében történő alkalmazásra, a veszélyességi osztályozás és címkézés céljából a bőrszenzibilizáló és nem szenzibilizáló anyagok megkülönböztetésének alátámasztására tudományosan megalapozottnak minősült (14). A vizsgálati módszert bevezetni kívánó laboratóriumok a KeratinoSensTM vizsgálat során használt rekombináns sejtvonalat a vizsgálati módszer kifejlesztőjével kötött licenciamegállapodással szerezhetik meg (15).
A fogalommeghatározások az 1. függelékben találhatók.
KIINDULÁSI MEGFONTOLÁSOK, ALKALMAZHATÓSÁG ÉS KORLÁTOK
Mivel a Keap1-Nrf2-ARE útvonal aktiválása a bőrszenzibilizációs káros kimeneti útnak csak a második kulcsfontosságú eseményét érinti, nem valószínű, hogy a vizsgálati módszerekből származó, ezen útvonal aktiválásán alapuló információk önmagukban elegendőek a vegyi anyagok bőrszenzibilizáló hatásának megállapításához. Ezért az e vizsgálati módszerrel kapott adatokat integrált megközelítés, például integrált vizsgálati és értékelési megközelítés összefüggésében kell mérlegelni olyan egyéb, kiegészítő információkkal együtt, mint a bőrszenzibilizációs káros kimeneti út más kulcsfontosságú eseményeivel foglalkozó in vitro vizsgálatok eredményei, valamint a vizsgálat nélküli módszerekkel, köztük a kémiai analógokból kereszthivatkozással kapott adatok. Az ARE-Nrf2 luciferáz alapú vizsgálati módszer alkalmazására vonatkozó példák egyéb információkkal együtt a szakirodalomban szerepelnek (13) (16) (17) (18) (19).
Ez a vizsgálati módszer az integrált vizsgálati és értékelési megközelítéssel összefüggésben felhasználható a bőrszenzibilizáló (vagyis az ENSZ-GHS/CLP-rendelet szerinti 1. kategóriába tartozó) és a nem szenzibilizáló anyagok megkülönböztetésének támogatására. Ez a vizsgálati módszer nem alkalmazható önmagában sem a bőrszenzibilizáló anyagoknak az ENSZ-GHS-ben/a CLP-rendeletben meghatározott 1A. és 1B. alkategóriába sorolására, sem a hatáserősség előrejelzésére a biztonsági értékeléssel kapcsolatos döntések esetén. A szabályozási kerettől függően azonban a pozitív eredmények önmagukban is felhasználhatók a vegyi anyagok ENSZ-GHS/CLP-rendelet szerinti 1. kategóriába sorolására.
A validálási vizsgálat adatkészlete és a vizsgálati módszer független szakértői értékeléséhez használt házon belüli vizsgálatok alapján a KeratinoSensTM vizsgálatról bebizonyosodott, hogy áthelyezhető a sejttenyésztés területén tapasztalattal rendelkező laboratóriumokba. A vizsgálati módszertől várható előrejelzések reprodukálhatóságának mértéke a laboratóriumokon belül és között mintegy 85 % (14). A KeratinoSensTM vizsgálatnak a bőrszenzibilizáló (azaz az ENSZ-GHS/a CLP-rendelet szerinti 1. kategóriába tartozó) anyagok nem szenzibilizáló anyagoktól való megkülönböztetése tekintetében érvényes, az LLNA vizsgálati módszer eredményéhez viszonyított pontossága, (77 % – 155/201), érzékenysége (78 % – 71/91) és specifikussága (76 % – 84/110) a vizsgálati módszer értékelése és szakértői értékelése céljából az EURL ECVAM-hoz benyújtott összes adat figyelembevételével került kiszámításra (14). Ezek a számadatok hasonlóak a mintegy 145 anyag (77 %-os pontosság, 79 %-os érzékenység, 72 %-os specifikusság) házon belüli vizsgálata alapján nemrég közzétett számadatokhoz (13). A KeratinoSensTM vizsgálat nagyobb valószínűséggel jelez előre alacsonyabb értékeket olyan vegyi anyagoknál, amelyeknek alacsonytól mérsékeltig terjedő a szenzibilizáló hatása (azaz az ENSZ-GHS/CLP-rendelet szerinti 1B. alkategóriába tartozó anyagoknál), mint a rendkívül bőrszenzibilizáló hatást mutató vegyi anyagoknál (azaz az ENSZ-GHS/a CLP-rendelet szerinti 1A. alkategóriába tartozó anyagoknál) (13) (14). Ezek az információk összességében azt jelzik, hogy a KeratinoSensTM vizsgálat érdemben hozzájárul a bőrszenzibilizáció veszélyének azonosításához. A KeratinoSensTM vizsgálat mint önálló vizsgálati módszer esetében itt megadott pontossági értékek azonban csak irányadóak, ugyanis a vizsgálati módszert az integrált vizsgálati és értékelési megközelítés keretében más információforrásokkal együtt és a fenti 9. pont rendelkezéseivel összhangban kell figyelembe venni. Ezen túlmenően a bőrszenzibilizáció nem állatokon alkalmazott módszereinek értékelésekor nem szabad megfeledkezni arról, hogy az LLNA vizsgálat, valamint más állatkísérletek nem feltétlenül tükrözik teljes egészében az érintett fajnál, például az embernél fennálló helyzetet.
E vizsgálati módszer esetében a »vizsgálati vegyi anyag« kifejezés a vizsgálat tárgyát képező vegyi anyagra vonatkozik, nem az ARE-Nrf2 luciferáz alapú vizsgálat anyagok és/vagy keverékek vizsgálatára való alkalmazhatóságához kapcsolódik. A jelenleg rendelkezésre álló adatok alapján a KeratinoSensTM vizsgálatról bebizonyosodott, hogy különféle szerves funkciós csoportokat, reakciómechanizmusokat, (in vivo vizsgálatok során meghatározott) bőrszenzibilizáló hatásokat és fizikai-kémiai tulajdonságokat képviselő vizsgálati vegyi anyagokra alkalmazandó (9) (12) (13) (14). Elsősorban egy összetevőből álló anyagok vizsgálatára került sor, bár a keverékek vizsgálatára vonatkozóan is rendelkezésre áll korlátozott mennyiségű információ (20). A vizsgálati módszer mindazonáltal a több összetevőből álló anyagok és keverékek vizsgálatára technikailag alkalmazható. E vizsgálati módszer tervezett szabályozási célt szolgáló adatgenerálás érdekében, keveréken történő alkalmazása előtt azonban meg kell vizsgálni, hogy az megfelelő eredményeket biztosíthat-e erre a célra, és ha igen, miért. Ilyen megfontolások nem szükségesek, ha létezik a keverék vizsgálatára vonatkozó szabályozási követelmény. Ezenfelül a több összetevőből álló anyagok vagy keverékek vizsgálata során figyelembe kell venni a citotoxikus összetevőknek a megfigyelt válaszreakciókkal való lehetséges kölcsönhatását. A vizsgálati módszer olyan vizsgálati vegyi anyagokra alkalmazandó, amelyek a vízben vagy dimetil-szulfoxidban oldhatók vagy azokkal stabil diszperziót (azaz olyan kolloidot vagy szuszpenziót, amelyben a vizsgálati vegyi anyag nem ülepedik le, illetve nem válik szét az oldószertől különböző fázisokra) alkotnak (több összetevőből álló anyag vagy keverék vizsgálata esetén ez a vizsgálati vegyi anyag összes összetevőjére igaz). Azok a vizsgálati vegyi anyagok, amelyek a legmagasabb előírt végleges koncentrációnál (2 000 μM) nem teljesítik ezeket a feltételeket (lásd a 22. pontot), alacsonyabb koncentrációknál továbbra is vizsgálhatók. Ilyen esetben a pozitivitás 39. pontban ismertetett kritériumainak megfelelő eredmények továbbra is felhasználhatók a vizsgálati vegyi anyag bőrszenzibilizálóként történő azonosítására, míg az 1 000 μM koncentrációnál alacsonyabb koncentrációk alkalmazásával kapott negatív eredmény nem meggyőzőnek tekintendő (lásd a 39. pontban lévő előrejelzési modellt). Az 5-nél nem magasabb LogP értékű anyagok vizsgálata általában sikeres, míg a 7-nél magasabb LogP értékű, rendkívül hidrofób anyagok a vizsgálati módszert ismert alkalmazhatóságán kívül esnek (14). Az 5 és 7 közötti LogP értékű anyagokra vonatkozóan csak kevés információ áll rendelkezésre.
A negatív eredményeket óvatosan kell értelmezni, mivel a kizárólagosan a lizinmaradékok felé reaktivitást mutató anyagokat a vizsgálati módszer negatívként mutathatja ki. Ezen túlmenően az alkalmazott sejtvonal korlátozott metabolikus képessége (21) és a kísérleti körülmények miatt különösen a lassú oxidációs rátájú pro-hapténok (azaz például a P450 enzim közreműködésével enzimatikus aktivációt igénylő vegyi anyagok) és pre-hapténok (azaz az automatikus oxidációval aktiválódó vegyi anyagok) is adhatnak negatív eredményeket. Másrészt a nem szenzibilizálóként ható, de ennek ellenére kémiai stresszorként fellépő vizsgálati vegyi anyagok hamis pozitív eredményekhez vezetnek (14). Ezenfelül a rendkívül citotoxikus vizsgálati vegyi anyagok nem mindig értékelhetők megbízhatóan. Végezetül a luciferáz enzimmel kölcsönhatásba lépő vizsgálati vegyi anyagok megzavarhatják a luciferáz hatását a sejtes tesztekben, látszólagos gátlást vagy megnövekedett lumineszcenciát okozva (22). Beszámoltak például arról, hogy az 1 μM-nél magasabb fitoösztrogén-koncentráció a luciferáz riportergén túlzott aktiválása miatt zavarja a lumineszcencia jeleit más, luciferáz alapú riportergén-vizsgálatokban (23). Következésképp a magas fitoösztrogén-koncentráció mellett vagy feltehetőleg a luciferáz riportergént a fitoösztrogénhez hasonlóan túlzottan aktiváló hasonló vegyi anyagok magas koncentrációja mellett kapott luciferáz-expressziót körültekintően meg kell vizsgálni (23). Olyan esetekben, ha bizonyítékkal igazolható, hogy a vizsgálati módszer nem alkalmazható más, konkrét vegyianyag-kategóriákra, a vizsgálati módszert nem szabad e vegyianyag-kategóriákra alkalmazni.
A KeratinoSensTM vizsgálat – amellett, hogy alátámasztja a bőrszenzibilizáló és a nem szenzibilizáló anyagok közötti különbségtételt – olyan koncentráció-válasz információval is szolgál, amely hozzájárulhat a szenzibilizáló hatáserősség értékeléséhez is, ha az integrált értékelési és vizsgálati megközelítéshez hasonló integrált megközelítés keretében használják (19). Szükség van azonban további, lehetőleg megbízható humán adatokon alapuló kutatásra annak meghatározása érdekében, hogy a KeratinoSensTM vizsgálat eredményei hogyan járulnak hozzá a hatáserősség értékeléséhez (24) és a szenzibilizáló anyagoknak az ENSZ-GHS/CLP-rendelet szerinti alkategóriákba sorolásához.
A VIZSGÁLAT ELVE
Az ARE-Nrf2 luciferáz alapú vizsgálati módszer a szelektálható plazmiddal stabilan transzfektált HaCaT emberi keratinocitákból származó immortalizált adherens sejtvonalakat használ. A sejtvonal az azt alkotó promóter, valamint a bőrszenzibilizáló anyagokkal közismerten felülszabályozott génből származó antioxidáns válaszelem fúziójának transzkripciós szabályozása mellett tartalmazza a luciferáz gént (25) (26). A luciferáz jel az endogén Nrf2-függő gének szenzibilizáló anyagokkal való aktiválását tükrözi, és a rekombináns sejtvonalon belüli luciferáz jelnek az Nrf2 transzkripciós faktortól való függősége bizonyítást nyert (27). Ez lehetővé teszi a luciferázgén-indukció (lumineszcencia-detektálással történő) kvantitatív mérését, mégpedig az Nfr2 transzkripciós faktor elektrofil anyagoknak való expozíciót követő, sejteken belüli aktivitásának mutatójaként jól bevált fénytermelő luciferáz szubsztrátok segítségével.
A KeratinoSens™ vizsgálatban a vizsgálati vegyi anyagok akkor minősülnek pozitívnak, ha egy adott küszöbérték felett a luciferáz-aktivitás statisztikailag szignifikáns (azaz 1,5-szeresnél nagyobb vagy 50 %-os) indukcióját idézik elő egy olyan meghatározott koncentráció alatt, amely nem befolyásolja jelentősen a sejtéletképességet (azaz 1 000 μM alatti és olyan koncentráció mellett, amelynél a sejtéletképesség 70 % feletti (9) (12)). E célból az oldószeres (negatív) kontrollal szembeni luciferáz-aktivitás valahányszoros indukciójának maximális értékét (Imax) meg kell határozni. Ezen túlmenően, mivel a sejteket a vizsgálati vegyi anyag több koncentrációjának kell kitenni, a luciferáz-aktivitás küszöbérték (azaz EC1,5 érték) feletti, statisztikailag szignifikáns indukciójához szükséges koncentrációt a dózis-válasz görbéből kell interpolálni (a számításokért lásd a 32. pontot). Végezetül citotoxicitás-méréseket kell végezni annak értékeléséhez, hogy a luciferáz-aktivitás indukciójának szintje a citotoxikus koncentrációknál alacsonyabb koncentráció mellett bekövetkezik-e.
Az e vizsgálati módszerhez kapcsolódó, ARE-Nrf2 luciferáz alapú vizsgálat rutinszerű alkalmazása előtt a laboratóriumoknak a 2. függelékben felsorolt tíz jártassági tesztanyag felhasználásával kell igazolniuk szakmai jártasságukat.
A KeratinoSens™ vizsgálathoz hasonló ARE-Nrf2 luciferáz alapú, új vagy módosított in vitro vizsgálati módszerek validálásának megkönnyítéséhez rendelkezésre állnak teljesítményszabványok (28), amelyek lehetővé teszik e vizsgálati iránymutatás időben történő módosítását az új módszerek e vizsgálati iránymutatásba való beépítéséhez. Az adatok OECD-megállapodás szerinti kölcsönös elfogadása csak a teljesítményszabványoknak megfelelően validált vizsgálati módszerek esetében lesz garantált, ha e vizsgálati módszereket az OECD felülvizsgálta és belefoglalta a megfelelő vizsgálati iránymutatásba.
ELJÁRÁS
Az e vizsgálati iránymutatás keretébe tartozó egyetlen módszer jelenleg a tudományosan megalapozott KeratinoSensTM vizsgálat (9) (12) (13) (14). A KeratinoSensTM vizsgálathoz rendelkezésre állnak a standard műveleti eljárások, amelyeket alkalmazni kell e vizsgálati módszer laboratóriumi végrehajtása és igénybevétele során (15). A vizsgálati módszert bevezetni kívánó laboratóriumok a KeratinoSensTM vizsgálat során használt rekombináns sejtvonalat a vizsgálati módszer kifejlesztőjével kötött licenciamegállapodással szerezhetik meg. A következő pontok ismertetik az ARE-Nrf2 luciferáz alapú vizsgálati módszer főbb összetevőit és eljárásait.
A keratinocita-tenyészetek előkészítése
A luciferáz riportergént az ARE-elem szabályozása mellett stabilan beillesztő transzgénikus sejtvonalat kell használni (például a KeratinoSens™ sejtvonalat). A sejteket a beérkezésüket követően (például 2–4 passzálással) szaporítani kell, és homogén állományként fagyasztva kell tárolni. Az ebből az eredeti állományból származó sejtek maximális számú passzálással szaporíthatók (ez a KeratinoSensTM esetében 25), és megfelelő fenntartó közeg használatával (a KeratinoSensTM esetében ez szérumot és Geneticint tartalmazó DMEM) rutinszerű vizsgálat céljára alkalmazhatók.
A sejteknek a vizsgálathoz 80–90 %-ban konfluensnek kell lenniük, és ügyelni kell annak biztosítására, hogy a sejtek soha ne növekedjenek a teljes konfluencia eléréséig. A vizsgálat előtt egy nappal a sejteket be kell gyűjteni, és azokat 96-lyukú lemezeken szét kell oszlatni (a KeratinoSensTM esetében lyukanként 10 000 sejt lehet). Annak biztosítása érdekében, hogy az egyes lyukak között homogén legyen a sejtszám eloszlása, ügyelni kell annak elkerülésére, hogy a leoltás alatt a sejtek leülepedjenek. Eltérő esetben e lépés következtében nagymértékű lehet a lyukankénti variabilitás. Minden megismételt kísérlet esetében a luciferáz-aktivitás méréséhez három párhuzamost, a sejtéletképesség-vizsgálathoz pedig egy párhuzamost kell alkalmazni.
A vizsgálati vegyi anyag és a kontrollanyagok előkészítése
A vizsgálati vegyi anyagot és a kontrollanyagokat a vizsgálat napján kell előkészíteni. A KeratinoSensTM vizsgálathoz a vizsgálati vegyi anyagokat dimetil-szulfoxidban (DMSO) kell a kívánt végső koncentrációra (például 200 mM) feloldani. A DMSO-oldatok önsterilizálónak tekinthetők, ezért csíramentesítő szűrésre nincs szükség. A DMSO-ban nem oldható vizsgálati vegyi anyagot csíramentes vízben vagy tenyészközegben kell feloldani, és az oldatokat például szűréssel kell csíramentesíteni. A meghatározott molekulatömeggel nem rendelkező vizsgálati vegyi anyaghoz a KeratinoSensTM vizsgálatban alapértelmezett koncentrációjú (40 mg/mL vagy 4 vegyesszázalékos) törzsoldatot kell készíteni. A DMSO-tól, a víztől vagy a tenyészközegtől eltérő oldószerek használata esetén kellő mértékű tudományos indokolást kell adni.
A vizsgálati vegyi anyagot tartalmazó DMSO-törzsoldatok alapján a vizsgálandó vegyi anyag 12 (a KeratinoSensTM vizsgálatban 0,098 mM és 200 mM közötti) törzskoncentrációjának előállításához DMSO-val kell oldatsorozatot készíteni. A DMSO-ban nem oldható vizsgálati vegyi anyagok esetében a törzskoncentráció előállításához szükséges hígításokat csíramentes vízzel vagy csíramentes tenyészközeggel kell elvégezni. A használt oldószertől függetlenül a törzskoncentrációkat ezt követően szérumot tartalmazó tenyészközegben 25-szörösükre tovább kell hígítani, végül pedig további 4-szeres hígítási tényezővel kell kezeléshez felhasználni, hogy a vizsgálati vegyi anyag végső koncentrációja a KeratinoSensTM vizsgálatban 0,98 és 2 000 μM közötti tartományba essen. Indokolt esetben más koncentrációk is alkalmazhatók (például citotoxicitás vagy gyenge oldhatóság esetén).
A KeratinoSensTM vizsgálatban alkalmazott negatív (oldószeres) kontroll a DMSO (CAS-szám: 67-68-5, ≥ 99 %-os tisztaság), amelyhez lemezenként hat lyukat kell előkészíteni. Ahhoz, hogy a végső negatív (oldószeres) kontroll koncentrációja 1 % legyen, a 22. pontban a törzskoncentrációkra vonatkozóan leírtakkal megegyező módon kell hígítani; e koncentrációról ismeretes, hogy nem befolyásolja a sejtéletképességet, emellett ugyanazon DMSO-koncentrációnak felel meg, mint a vizsgálati vegyi anyagban és a pozitív kontrollban található DMSO-koncentráció. DMSO-ban nem oldható, vízzel hígított vizsgálati vegyi anyag esetében a DMSO szintjét a végső vizsgálati oldatot tartalmazó összes lyukban 1 %-ra kell kiigazítani, csakúgy, mint a többi vizsgálati vegyi anyag és kontrollanyag esetében.
A KeratinoSensTM vizsgálatban alkalmazott pozitív kontroll a fahéjaldehid (CAS-szám: 14371-10-9, ≥ 98 %-os tisztaság), amelyhez (6,4 mM koncentrációjú törzsoldatból) öt, 0,4–6,4 mM közötti törzskoncentráció-sorozatot kell készíteni DMSO-ban, és a 22. pontban a törzskoncentrációkra vonatkozóan leírtakkal megegyező módon kell hígítani, hogy a pozitív kontroll végső koncentrációja 4–64 μM között legyen. Alkalmazhatók más, megfelelő, lehetőleg középtartományban lévő EC1,5 értékeket adó pozitív kontrollok is, ha rendelkezésre állnak történeti adatok hasonló vizsgálatmenet elfogadhatósági kritériumainak származtatásához.
A vizsgálati vegyi anyag és a kontrollanyagok alkalmazása
Minden egyes vizsgálati vegyi anyag és pozitív kontrollanyag esetében egy kísérletre van szükség a (pozitív vagy negatív) előrejelzéshez, amely kísérlet három-három párhuzamost tartalmazó, legalább két független ismétlésből áll (azaz n=6). A két független ismétlés nem egyező eredményei esetén három párhuzamost tartalmazó harmadik ismétlést kell végezni (azaz n=9). Mindegyik független ismétlést más-más napon, a vizsgálati vegyi anyagot és az egymástól függetlenül begyűjtött sejteket tartalmazó friss törzsoldattal kell elvégezni. A sejtek azonban származhatnak ugyanabból a passzálásból.
A 20. pontban ismertetett leoltást követően a sejteket 24 órán át 96-lyukú mikrotiterlemezeken kell növeszteni. A közeget ezt követően el kell távolítani és friss tenyészközeggel (a KeratinoSensTM vizsgálat esetén 150 μl mennyiségű, szérumot igen, de Geneticint nem tartalmazó tenyészközeggel) kell felváltani, amelyhez a 25-szörös hígítású vizsgálati vegyi anyagból és a kontrollanyagokból 50 μl-t kell adni. A háttérértékek megállapítása érdekében lemezenként legalább egy lyukat üresen (sejt és kezelés nélkül) kell hagyni.
A KeratinoSensTM vizsgálatban a kezelt lemezeket ezt követően kb. 48 óráig 37±1 °C-on 5 % CO2 jelenlétében inkubálni kell. Ügyelni kell az illékony vizsgálati vegyi anyagok elpárolgásának elkerülésére, valamint a lyukak vizsgálati vegyi anyagokkal való keresztszennyeződésének elkerülésére, például a lemezek vizsgálati vegyi anyagokkal való inkubálás előtt fóliával való befedésével.
A luciferáz-aktivitás mérése
A megfelelő lumineszcencia-leolvasások biztosításához három tényező kulcsfontosságú:
— érzékeny luminométer választása,
— a fény-keresztszennyeződés elkerülése érdekében kellő magasságú lemezformátum használata, valamint
— a kellő szenzitivitás és az alacsony variabilitás biztosításához kellő fénykimenetű luciferáz szubsztrát használata.
E három tényező teljesülésének biztosítása érdekében a vizsgálat előtt a 3. függelékben ismertetett beállítással kontrollkísérletet kell végezni.
A KeratinoSensTM vizsgálatban a vizsgálati vegyi anyaggal és a kontrollanyagokkal alkalmazott 48 órás expozíciós idő elteltével a sejteket foszfáttal pufferolt sóoldattal kell átmosni, és a lumineszcencia-leolvasásokhoz tartozó megfelelő lízispuffert 20 percig szobahőmérsékleten az egyes lyukakba kell adagolni.
A sejtlizátumokat tartalmazó lemezeket ezt követően leolvasás céljából a luminométerbe kell helyezni, amelyet a KeratinoSensTM vizsgálatban a következőkre programoznak be: i. a luciferáz szubsztrát hozzáadása az egyes lyukakhoz (például 50 μl), ii. 1 másodperces várakozás, és iii. a luciferáz-aktivitás integrálása 2 másodpercig. Alternatív beállítások használata esetén, például az alkalmazott luminométer-modelltől függően ezeket meg kell indokolni. Ezenfelül fénylő szubsztrát is alkalmazható azzal a feltétellel, hogy a 3. függelék szerinti minőség-ellenőrzési kísérlet teljesül.
Citotoxicitás-vizsgálat
A KeratinoSensTM sejtéletképesség-vizsgálathoz a közeget a 48 órás expozíciós idő elteltével az MTT-t (3-(4,5-dimetil tiazol-2-il)-2,5- difenil-tetrazólium-bromid, Tiazolil kék tetrazólium-bromid; CAS-szám: 298-93-1) tartalmazó friss közeggel kell felváltani, és a sejteket 4 órán keresztül 37 °C-on 5 % CO2 jelenlétében inkubálni kell. Az MTT-közeget ezt követően el kell távolítani és a sejteket egy éjszakán át lizálni kell (például az egyes lyukakba adagolt 10 %-os SDS-oldattal). A felrázás után az abszorpciót például 600 nm-en meg kell mérni fotométerrel.
ADATOK ÉS JEGYZŐKÖNYVEZÉS
Az adatok kiértékelése
A KeratinoSensTM vizsgálatban az alábbi paramétereket kell kiszámítani:
— a luciferáz-aktivitás valahányszoros indukciójának a vizsgálati vegyi anyag és a pozitív kontrollanyag bármely koncentrációjánál megfigyelt legmagasabb átlagértéke (Imax);
— az EC1,5 érték, azaz az a koncentráció, amelynél a luciferáz-aktivitás 1,5-szeres küszöbértéket meghaladó indukciója (azaz az 50 %-kal erősebb luciferáz-aktivitás) létrejött; valamint
— a sejtéletképesség 50 %-os, illetve 30 %-os csökkenésének megfelelő IC50 illetve IC30 koncentráció-értékek.
— A luciferáz-aktivitás valahányszoros indukcióját az 1. egyenlettel, az általában legmagasabb valahányszoros indukciót (Imax) pedig az egyes megismételt kísérletek átlagaként kell kiszámítani:
1. egyenlet:
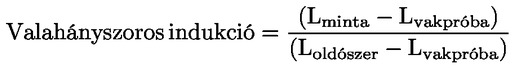
ahol:
|
Lminta |
a vizsgálati vegyi anyagot tartalmazó lyukban leolvasott lumineszcencia-érték |
|
Lvakpróba |
a sejtek és kezelés nélküli vakpróbalyukban leolvasott lumineszcencia-érték |
|
Loldószer |
a sejteket és az oldószeres (negatív) kontrollt tartalmazó lyukakban leolvasott átlagos lumineszcencia-érték |
Az EC1,5 értéket a 2. egyenlet szerinti lineáris interpolációval, az általános EC1,5 értéket pedig az egyes ismétlések mértani középértékeként kell kiszámítani.
2. egyenlet:

ahol:
|
Ca |
a μM-ben kifejezett legalacsonyabb koncentráció 1,5-szeres indukciónál magasabb indukció mellett |
|
Cb |
a μM-ben kifejezett legmagasabb koncentráció 1,5-szeres indukciónál alacsonyabb indukció mellett |
|
Ia |
a 1,5-szeres indukciónál magasabb indukció melletti legalacsonyabb koncentrációnál mért valahányszoros indukció (három párhuzamos lyuk átlaga) |
|
Ib |
a 1,5-szeres indukciónál alacsonyabb indukció melletti legmagasabb koncentrációnál mért valahányszoros indukció (három párhuzamos lyuk átlaga) |
Az életképességet a 3. egyenlettel kell kiszámítani:
3. egyenlet:

ahol:
|
Vminta |
a vizsgálati vegyi anyagot tartalmazó lyukban leolvasott MTT-abszorbanciaérték |
|
Vvakpróba |
a sejtek és kezelés nélküli vakpróbalyukban leolvasott MTT-abszorbanciaérték |
|
Voldószer |
a sejteket és az oldószeres (negatív) kontrollt tartalmazó lyukakban leolvasott átlagos MTT-abszorbanciaérték |
Az IC50 és az IC30 értéket a 4. egyenlet szerinti lineáris interpolációval, az általános IC50 és IC30 értéket pedig az egyes ismétlések mértani középértékeként kell kiszámítani.
4. egyenlet:
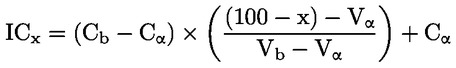
ahol:
|
X |
a kiszámítandó %-os csökkenés az adott koncentrációnál (50, illetve 30 az IC50 és az IC30 esetén) |
|
Ca |
a μM-ben kifejezett legalacsonyabb koncentráció x %-ot meghaladó életképesség-csökkenés mellett |
|
Cb |
a μM-ben kifejezett legmagasabb koncentráció x %-ot el nem érő életképesség-csökkenés mellett |
|
Va |
az x %-ot meghaladó életképesség-csökkenés melletti legalacsonyabb koncentrációnál várható %-os életképesség |
|
Vb |
az x %-ot el nem érő életképesség-csökkenés melletti legmagasabb koncentrációnál várható %-os életképesség |
A 1,5-szeresnél magasabb luciferáz-aktivitás indukciót mutató koncentrációknál oly módon kell kiszámítani a statisztikai szignifikanciát (például kétvégű Student-féle t-próbával), hogy a három párhuzamos minta lumineszcencia-értékeit össze kell vetni az oldószeres (negatív) kontrollként szolgáló lyukakban leolvasott lumineszcencia-értékekkel annak meghatározásához, hogy a luciferáz-aktivitás indukciója statisztikailag szignifikáns-e (p <0 ,05). A 1,5-szeresnél magasabb luciferáz-aktivitás indukció melletti legalacsonyabb koncentráció az EC1,5 értéket meghatározó érték. Minden esetben ellenőrizni kell, hogy ez az érték az IC30 érték alatt van-e, ami arra utal, hogy az EC1,5 értéket meghatározó koncentráció mellett 30 %-nál kisebb mértékű a sejtéletképesség csökkenése.
Az adatokat ajánlott szemrevételezéssel ellenőrizni grafikonok segítségével. Ha nem figyelhető meg egyértelmű dózis-válasz görbe, vagy ha a kapott dózis-válasz görbe kétfázisú (azaz kétszer lépi túl a másfélszeres küszöbértéket), a kísérletet meg kell ismételni annak ellenőrzése érdekében, hogy ez a vizsgálati vegyi anyagra jellemző-e vagy kísérleti műhibának tulajdonítható-e. Abban az esetben, ha a kétfázisú válasz független kísérletben reprodukálható, az alacsonyabb EC1,5 értéket (a 1,5-szeres küszöbérték első átlépésének időpontjában megfigyelt koncentrációt) kell jelentésbe foglalni.
Azon ritka esetekben, ha 1,5-szeres küszöbérték feletti, statisztikailag nem szignifikáns indukció figyelhető meg, majd statisztikailag szignifikáns indukció magasabb koncentráció mellett, ezen ismétlések eredményei csak akkor minősülnek érvényesnek és pozitívnak, ha a 1,5-szeres küszöbérték feletti statisztikailag nem szignifikáns indukció nem citotoxikus koncentráció esetén következett be.
Végezetül azon vizsgálati vegyi anyagok esetében, amelyek már a 0,98 μM legalacsonyabb vizsgálati koncentrációnál 1,5-szeres vagy magasabb indukciót idéznek elő, a 0,98-nál kisebb EC1,5 értéket a dózis-válasz görbe szemrevételezéses ellenőrzése alapján kell meghatározni.
Elfogadhatósági kritériumok
A KeratinoSensTM vizsgálat alkalmazásakor az alábbi elfogadhatósági kritériumoknak kell teljesülniük. Először is a pozitív kontrollanyaggal, a fahéjaldehiddel elért luciferáz-aktivitás indukciónak a 1,5-szeres küszöbérték felett statisztikailag szignifikánsnak kell lennie (például t-próba alkalmazásával) legalább a vizsgált koncentrációk egyikében (4-64 μM között).
Másodszor, az EC1,5 értéknek a vizsgálatot végző létesítmény történeti átlagát magában foglaló két szórás intervallumában kell lennie (például a validációs adatkészlet alapján 7 μM és 30 μM közötti értéknek), amit rendszeresen frissíteni kell. Ezen túlmenően a fahéjaldehidre vonatkozó három párhuzamosban az átlagos indukciónak 64 μM koncentráció mellett 2 és 8 között kell lennie. Ha az utóbbi kritérium nem teljesül, a fahéjaldehid dózis-válaszát körültekintően kell ellenőrizni, és a vizsgálatok kizárólag akkor elfogadhatóak, ha a luciferáz-aktivitás indukció és a pozitív kontrollanyag koncentrációja együttes növekedése mellett egyértelmű dózis-válasz van.
Végezetül a negatív (oldószeres) DMSO-tartalmú kontroll esetében leolvasott lumineszcencia-értékek átlagos variációs koefficiensének minden ismétlésben (három példányban vizsgált 6 lyukban) 20 %-nál alacsonyabbnak kell lennie. Ha magasabb a variabilitás, az eredményeket el kell vetni.
Az eredmények értelmezése és az előrejelzési modell
A KeratinoSensTM előrejelzés akkor minősül pozitívnak, ha két ismétlésből kettőben vagy három ismétlésből ugyanabban a kettőben mind a négy alábbi feltétel teljesül, egyéb esetben a KeratinoSensTM előrejelzés negatívnak minősül (1. ábra):
1. az Imax érték több mint (>) 1,5-szeres és statisztikailag szignifikáns az oldószeres (negatív) kontrollhoz viszonyítva (kétvégű, páratlan, Student-féle t-próbával meghatározott érték);
2. a sejtéletképesség meghaladja a (>) 70 %-ot a 1,5-szerest meghaladó luciferáz-aktivitás indukció melletti legalacsonyabb koncentrációnál (azaz az EC1,5 értéket adó koncentrációnál);
3. az EC1,5 érték kisebb, mint (<) 1 000 μM (vagy < 200 μg/ml a nem meghatározott MW értékű vizsgálati vegyi anyagok esetében);
4. látszólag általános dózis-válasz figyelhető meg a luciferáz-indukció esetében (vagy a 33. pontban foglaltak szerinti kétfázisú válasz).
Ha egy adott ismétlésen belül az első három feltétel mindegyike teljesül, de nem figyelhető meg egyértelmű dózis-válasz a luciferáz-indukció esetében, akkor ezen ismétlés eredményét nem meggyőzőnek kell tekinteni és további vizsgálatokra lehet szükség (1. ábra). Ezenfelül az 1 000 μM-nál kisebb (vagy a nem meghatározott MW értékű vizsgálati vegyi anyagok esetében 200 μg/ml-nél kisebb) koncentráció mellett kapott negatív eredményt szintén nem meggyőzőnek kell tekinteni (lásd a 11. pontot).
1. ábra
A KeratinoSensTM vizsgálatban alkalmazott előrejelzési modell. A KeratinoSensTM előrejelzést integrált értékelési és vizsgálati megközelítés keretében, valamint a 9. és 11. pont rendelkezéseivel összhangban kell figyelembe venni.

Ritka esetekben a citotoxikus szintekhez nagyon közel luciferáz-aktivitást indukáló vizsgálati vegyi anyagok egyes ismétlésekben és nem citotoxikus szinteknél pozitívak lehetnek (azaz az EC1,5 értéket meghatározó koncentráció alacsonyabb, mint (<) az IC30 érték), más ismétlésekben pedig csak a citotoxikus szinteknél (azaz az EC1,5 értéket meghatározó koncentráció magasabb, mint (>) az IC30 érték). Az ilyen vizsgálati vegyi anyagokat szűkebb körű dózis-válasz elemzéssel és alacsonyabb hígítási tényezővel (például 1,33-szoros vagy Ö2 (=1,41)-szeres hígítással a lyukak között) újra meg kell vizsgálni annak meghatározásához, hogy az indukció citotoxikus szinten történt-e vagy sem (9).
Vizsgálati jegyzőkönyv
A Vizsgálati jegyzőkönyvnek a következőket kell tartalmaznia:
Vizsgálati vegyi anyag
— Egy összetevőből álló anyag:
—
— kémiai azonosítás, például IUPAC- vagy CAS-név (nevek), CAS-szám(ok), SMILES- vagy InChI-kód, szerkezeti képlet és/vagy más azonosítók;
— fizikai megjelenés, vízoldékonyság, DMSO-ban való oldhatóság, molekulatömeg, valamint további releváns fizikai-kémiai tulajdonságok, amennyiben rendelkezésre állnak;
— tisztaság, adott és a gyakorlatban megvalósítható esetben a szennyeződések kémiai azonossága stb.;
— vizsgálat előtti kezelés, ha történt ilyen (pl. melegítés, őrlés);
— vizsgált koncentráció(k);
— tárolási feltételek és stabilitás, amennyiben rendelkezésre állnak.
— Több összetevőből álló anyagok, UVCB-k és keverékek:
—
— amennyiben lehetséges, az összetevőknek például a kémiai azonosítója (lásd fent), tisztasága, mennyiségi előfordulása és releváns fizikai-kémiai tulajdonságai (lásd fent) jellemzik, amennyiben rendelkezésre állnak;
— fizikai megjelenés, vízoldékonyság, DMSO-ban való oldhatóság és a további releváns fizikai-kémiai tulajdonságok, amennyiben rendelkezésre állnak;
— molekulatömeg vagy látszólagos molekulatömeg ismert összetételű keverékek/polimerek esetén, vagy a vizsgálat lebonyolítása szempontjából releváns egyéb információ;
— vizsgálat előtti kezelés, ha történt ilyen (pl. melegítés, őrlés);
— vizsgált koncentráció(k);
— tárolási feltételek és stabilitás, amennyiben rendelkezésre állnak.
Kontrollok
— Pozitív kontroll:
—
— kémiai azonosítás, például IUPAC- vagy CAS-név (nevek), CAS-szám(ok), SMILES- vagy InChI-kód, szerkezeti képlet és/vagy más azonosítók;
— Fizikai megjelenés, vízoldékonyság, DSMO-ban való oldhatóság, molekulatömeg, valamint további releváns fizikai-kémiai tulajdonságok, amennyiben rendelkezésre állnak és szükség szerint;
— tisztaság, adott és a gyakorlatban megvalósítható esetben a szennyeződések kémiai azonossága stb.;
— vizsgálat előtti kezelés, ha történt ilyen (pl. melegítés, őrlés);
— vizsgált koncentráció(k);
— tárolási feltételek és stabilitás, amennyiben rendelkezésre állnak;
— adott esetben a pozitív kontrolloknak a vizsgálatmenet elfogadhatósági kritériumoknak való megfelelőségét bizonyító korábbi eredményei.
— Negatív (vivőanyagos) kontroll:
—
— kémiai azonosítás, például IUPAC- vagy CAS-név (nevek), CAS-szám(ok) és/vagy más azonosítók;
— tisztaság, adott és a gyakorlatban megvalósítható esetben a szennyeződések kémiai azonossága stb.;
— fizikai megjelenés, molekulatömeg, valamint további releváns fizikai-kémiai tulajdonságok, amennyiben a vizsgálati módszerben említett negatív kontrolloktól eltérő negatív kontrollok használatosak, és amennyiben rendelkezésre állnak;
— tárolási feltételek és stabilitás, amennyiben rendelkezésre állnak;
— az oldószer kiválasztásának indoklása minden egyes vizsgálati vegyi anyag esetében.
A vizsgálati módszer körülményei
— a megbízó, a vizsgálatot végző laboratórium és a vizsgálatvezető neve és címe;
— az alkalmazott vizsgálati módszer leírása;
— használt sejtvonal, tárolási feltételei és eredete (például az a létesítmény, ahonnan azt beszerezték);
— a vizsgálathoz használt sejtek passzálásának száma és konfluenciájának szintje;
— a vizsgálat előtt a leoltáshoz alkalmazott sejtszámlálási módszer és a homogén sejtszám-eloszlás biztosítása érdekében hozott intézkedések (lásd a 20. pontot);
— az alkalmazott luminométer (például modell), beleértve a műszer beállításait, a használt luciferáz szubsztrátot, valamint a megfelelő lumineszcencia-mérések szemléltetése a 3. függelékben ismertetett kontrollvizsgálat alapján;
— a vizsgálati módszer végrehajtásában való laboratóriumi jártasság bizonyítására alkalmazott eljárás (például jártassági tesztanyagok vizsgálatával) vagy a vizsgálati módszer idővel reprodukálható végrehajtásának bizonyítására alkalmazott eljárás.
Vizsgálati eljárás
— az alkalmazott ismétlések és párhuzamosok száma;
— a vizsgálati vegyi anyag koncentrációi, alkalmazási eljárása és az igénybe vett expozíciós idő (ha eltér az ajánlottól);
— az alkalmazott értékelési és döntési kritériumok leírása;
— az alkalmazott vizsgálat-elfogadhatósági kritériumok leírása;
— a vizsgálati eljárás bármilyen változtatásának leírása.
Eredmények
— minden ismétlésben a vizsgálati vegyi anyag és a pozitív kontroll esetében kapott Imax, EC1,5 értékek és életképességre vonatkozó értékek (azaz az IC50, IC30 értékek), valamint átlagok (Imax: átlagérték; EC1,5 és az életképességre vonatkozó értékek: mértani középérték), továbbá az összes ismétlésből származó adatok felhasználásával kiszámított szórás és a vizsgálati vegyi anyagnak az előrejelzési modell szerinti minősítése;
— az egyes kísérleteknél a negatív kontroll esetében leolvasott lumineszcencia-értékekkel kapott variációs koefficiens;
— a luciferáz-aktivitás indukciójára és az életképességre vonatkozó dózis-válasz görbéket ábrázoló grafikon;
— adott esetben bármely más releváns észrevétel leírása.
Az eredmények tárgyalása
— a KeratinoSensTM vizsgálattal kapott eredmények tárgyalása;
— a vizsgálati módszer eredményeinek integrált vizsgálati és értékelési megközelítés keretében történő tárgyalása, amennyiben rendelkezésre állnak más releváns információk.
Következtetés
SZAKIRODALOM
(1) United Nations (UN) (2013). Globally Harmonized System of Classification and Labelling of Chemicals (GHS), Fifth revised edition, UN New York and Geneva, 2013. Elérhető a következő címen: http://www.unece.org/trans/danger/publi/ghs/ghs_rev05/05files_e.html.
(2) OECD (2012). The Adverse Outcome Pathway for Skin Sensitisation Initiated by Covalent Binding to Proteins. Part 1: Scientific Evidence. OECD Environment, Health and Safety publications, Series on Testing and Assessment No. 168. OECD, Paris.
(3) Adler S., Basketter D., Creton S., Pelkonen O., van Benthem J., Zuang V., Andersen K.E., Angers-Loustau A., Aptula A., Bal-Price A., Benfenati E., Bernauer U., Bessems J., Bois F.Y., Boobis A., Brandon E., Bremer S., Broschard T., Casati S., Coecke S., Corvi R., Cronin M., Daston G., Dekant W., Felter S., Grignard E., Gundert-Remy U., Heinonen T., Kimber I., Kleinjans J., Komulainen H., Kreiling R., Kreysa J., Leite S.B., Loizou G., Maxwell G., Mazzatorta P., Munn S., Pfuhler S., Phrakonkham P., Piersma A., Poth A., Prieto P., Repetto G., Rogiers V., Schoeters G., Schwarz M., Serafimova R., Tähti H., Testai E., van Delft J., van Loveren H., Vinken M., Worth A., Zaldivar J.M. (2011). Alternative (non-animal) methods for cosmetics testing: current status and future prospects-2010. Archives of Toxicology 85, 367-485.
(4) E melléklet B.42. fejezete: Bőrszenzibilizáció: Lokális nyirokcsomó-vizsgálati módszer.
(5) E melléklet B.6. fejezete: Bőrszenzibilizáció.
(6) E melléklet B.50. fejezete: Bőrszenzibilizáció: Lokális nyirokcsomó-vizsgálati módszer (LLNA): DA.
(7) E melléklet B.51. fejezete: Bőrszenzibilizáció: Lokális nyirokcsomó-vizsgálati módszer (LLNA): BrdU-ELISA.
(8) Natsch A. (2010). The Nrf2-Keap1-ARE Toxicity Pathway as a Cellular Sensor for Skin Sensitizers-Functional Relevance and Hypothesis on Innate Reactions to Skin Sensitizers. Toxicological Sciences 113, 284-292.
(9) Emter R., Ellis G., Natsch A. (2010). Performance of a novel keratinocyte-based reporter cell line to screen skin sensitizers in vitro. Toxicology and Applied Pharmacology 245, 281-290.
(10) Dinkova-Kostova A.T., Holtzclaw W.D., Kensler T.W. (2005). The role of Keap1 in cellular protective responses. Chem. Res. Toxicol. 18, 1779-1791.
(11) Kansanen E., Kuosmanen S.M., Leinonen H., Levonen A.L. (2013). The Keap1-Nrf2 pathway: Mechanisms of activation and dysregulation in cancer. Redox Biol. 1(1), 45-49.
(12) Natsch A., Bauch C., Foertsch L., Gerberick F., Normann K., Hilberer A., Inglis H., Landsiedel R., Onken S., Reuter H., Schepky A., Emter R. (2011). The intra- and inter-laboratory reproducibility and predictivity of the KeratinoSens assay to predict skin sensitizers in vitro: results of a ring-study in five laboratories. Toxicol. In Vitro 25, 733-744.
(13) Natsch A., Ryan C.A., Foertsch L., Emter R., Jaworska J., Gerberick G.F., Kern P. (2013). A dataset on 145 chemicals tested in alternative assays for skin sensitization undergoing prevalidation. Journal of Applied Toxicology, 33, 1337-1352.
(14) EURL-ECVAM (2014). Recommendation on the KeratinoSensTM assay for skin sensitisation testing, 42 pp. Available at: http://ihcp.jrc.ec.europa.eu/our_labs/eurl-ecvam/eurl-ecvam-recommendations/recommendation-keratinosens-skin-sensitisation.
(15) DB-ALM (INVITTOX) (2013) Protocol 155: KeratinoSensTM., 17 pp. Elérhető az alábbi címen: http://ecvam-dbalm.jrc.ec.europa.eu/beta/index.cfm/methodsAndProtocols/index
(16) Natsch A., Emter R., Ellis G. (2009). Filling the concept with data: integrating data from different in vitro and in silico assays on skin sensitizers to explore the battery approach for animal-free skin sensitization testing. Toxicol. Sci. 107, 106-121.
(17) Ball N., Cagen S., Carrillo J.C., Certa H., Eigler D., Emter R., Faulhammer F., Garcia C., Graham C., Haux C., Kolle S.N., Kreiling R., Natsch A., Mehling A. (2011). Evaluating the sensitization potential of surfactants: integrating data from the local lymph node assay, guinea pig maximization test, and in vitro methods in a weight-of-evidence approach. Regul. Toxicol. Pharmacol. 60, 389-400.
(18) Bauch C., Kolle S.N., Ramirez T., Eltze T., Fabian E., Mehling A., Teubner W., van Ravenzwaay B., Landsiedel R. (2012). Putting the parts together: combining in vitro methods to test for skin sensitizing potentials. Regul. Toxicol. Pharmacol. 63, 489-504.
(19) Jaworska J., Dancik Y., Kern P., Gerberick F., Natsch A. (2013). Bayesian integrated testing strategy to assess skin sensitization potency: from theory to practice. J Appl Toxicol. 33, 1353-1364.
(20) Andres E., Sa-Rocha V.M., Barrichello C., Haupt T., Ellis G., Natsch A. (2013). The sensitivity of the KeratinoSensTM assay to evaluate plant extracts: A pilot study. Toxicology In Vitro 27, 1220-1225.
(21) Fabian E., Vogel D., Blatz V., Ramirez T., Kolle S., Eltze T., van Ravenzwaay B., Oesch F., Landsiedel R. (2013). Xenobiotic metabolizin enzyme activities in cells used for testing skin sensitization in vitro. Arch. Toxicol. 87, 1683-1969.
(22) Thorne N., Inglese J., Auld D.S. (2010). Illuminating Insights into Firefly Luciferase and Other Bioluminescent Reporters Used in Chemical Biology. Chemistry and Biology 17, 646-657.
(23) OECD (2012). BG1Luc Estrogen Receptor Transactivation Test Method for Identifying Estrogen Receptor Agonists and Antagonists. OECD Guidelines for Chemical Testing No. 457. OECD, Paris.
(24) ECETOC (2003). Contact sensitization: Classification according to potency. European Centre for Ecotoxicology & Toxicology of Chemicals (Technical Report No. 87).
(25) Gildea L.A., Ryan C.A., Foertsch L.M., Kennedy J.M., Dearman R.J., Kimber I., Gerberick G.F. (2006). Identification of gene expression changes induced by chemical allergens in dendritic cells: opportunities for skin sensitization testing. J. Invest. Dermatol., 126, 1813-1822.
(26) Ryan C.A., Gildea L.A., Hulette B.C., Dearman R.J., Kimber I., Gerberick G.F. (2004). Gene expressing changes in peripheral blood-derived dendritic cells following exposure to a contact allergen. Toxicol. Lett. 150, 301-316.
(27) Emter R., van der Veen J.W., Adamson G., Ezendam J., van Loveren H., Natsch A. (2013). Gene expression changes induced by skin sensitizers in the KeratinoSens™ cell line: Discriminating Nrf2-dependent and Nrf2-independent events. Toxicol. in vitro 27, 2225-2232.
(28) OECD (2015). Performance Standards for assessment of proposed similar or modified in vitro skin sensitisation ARE-Nrf2 luciferase test methods. OECD Environment, Health and Safety publications, Series on Testing and Assessment N0 213, OECD, Paris.
(29) OECD (2005). Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment. OECD Environment, Health and Safety publications, Series on Testing and Assessment No.34. OECD, Paris, France.
(30) NAFTA (North American Free Trade Agreement) (2012). Technical Working Group on Pesticides – (Quantitative) Structure Activity Relationship ((Q)SAR) Guidance Document. 186 pp. http://www.epa.gov/oppfead1/international/naftatwg/guidance/qsar-guidance.pdf
1. függelék
FOGALOMMEGHATÁROZÁSOK
Pontosság : a vizsgálati módszerrel kapott eredmények és az elfogadott referenciaértékek közötti egyezés mértéke. A vizsgálati módszer teljesítőképességét mutatja, és relevanciájának egyik szempontja. A kifejezés gyakran használatos az »egyezés« szó megfelelőjeként, amely arra utal, hogy egy adott vizsgálat milyen arányban szolgáltat helyes eredményeket (29).
Káros kimeneti út (Adverse Outcome Pathway, AOP) : valamely megcélzott vegyi anyag vagy hasonló vegyi anyagok csoportjának kémiai szerkezetéből kiinduló, a molekuláris kiváltó eseményen keresztül az érintett in vivo eredményig végbemenő eseménysorozat (2).
ARE : antioxidáns válaszelem (más néven: EpRE, elektrofil válaszelem), számos citoprotektív és II. fázisú gén felfelé irányuló promóter régiójában megtalálható válaszelem. Ha Nfr2 aktiválja, e gének transzkripciós indukcióját közvetíti.
Vegyi anyag : anyag vagy keverék.
Variációs koefficiens : a variabilitás mértékegysége, amelyet a párhuzamos adatcsoportok esetében a szórás és az átlag hányadosaként kell kiszámítani. Százalékos arányként történő kifejezéséhez 100-zal megszorozható.
EC1,5 : 1,5-szeres luciferáz-indukció esetén interpolált koncentráció.
IC30 : a sejtéletképesség 30 %-os csökkenését kiváltó koncentráció.
IC50 : a sejtéletképesség 50 %-os csökkenését kiváltó koncentráció.
Veszély : valamely anyag vagy helyzet azon sajátossága, hogy káros hatásokat képes előidézni az élő szervezet, rendszer vagy (al)populáció anyagnak való expozíciójakor.
Integrált vizsgálati és értékelési megközelítés : valamely vegyi anyag vagy vegyianyag-csoport veszélyeinek azonosításához (potenciál), jellemzéséhez (hatáserősség) és/vagy biztonsági értékeléséhez (potenciál, hatáserősség és expozíció) alkalmazott strukturált megközelítés, amely stratégiai szempontból beépít és mérlegel minden olyan releváns adatot, amely hozzájárul a lehetséges veszélyre és/vagy kockázatra és/vagy a további célirányos és ezért minimális vizsgálat szükségességére vonatkozó szabályozói döntéshozatalhoz.
Imax : a luciferáz-aktivitásnak az oldószeres (negatív) kontrollhoz viszonyított maximális indukciós tényezője, amelyet a vizsgálati vegyi anyag bármely koncentrációjánál mérnek.
Keap1 : Kelch-like ECH-associated protein 1, az Nrf2-aktivitást szabályozó szenzorfehérje. Nem indukált feltételek mellett a Keap1 szenzorfehérje az Nrf2 transzkripciós faktort célozza meg a proteaszómán belüli ubikvitináció és fehérjebomlás céljából. A Keap1 reaktív ciszteinmaradékainak kis molekulákkal végbemenő kovalens módosítása az Nrf2 transzkripciós faktornak a Keap1 szenzorfehérjétől való szétválásához vezethet (8) (10) (11).
Keverék : két vagy több anyagból álló keverék vagy oldat, amelyben az anyagok nem lépnek egymással reakcióba (1).
Egy összetevőből álló anyag : olyan, a mennyiségi összetétele alapján meghatározott anyag, amelyben az egyik fő összetevő legalább 80 tömegszázalékban van jelen.
Több összetevőből álló anyag : olyan, a mennyiségi összetétele alapján meghatározott anyag, amelyben egynél több fő összetevő legalább 10 tömegszázalékban, de 80 tömegszázalékot nem meghaladó koncentrációban van jelen. A több összetevőből álló anyag gyártási folyamat eredménye. A keverék és a több összetevőből álló anyag között az a különbség, hogy a keverék két vagy több anyag összekeverésével, kémiai reakció nélkül jön létre. A több összetevőből álló anyag kémiai reakció eredménye.
Nrf2 : Nuclear factor (erythroid-derived 2)-like 2, az antioxidáns válaszelem útvonalában érintett transzkripciós faktor. Ha az Nrf2-ben nem megy végbe ubikvitináció, felépíti a citoplazmát és transzlokálódik a sejtmagba, ahol számos citoprotektív gén felfelé tartó promóter régiójában kapcsolódik az ARE válaszelemhez, elindítva e gének transzkripcióját (8) (10) (11).
Pozitív kontroll : a vizsgálati rendszer valamennyi alkotóelemét tartalmazó, ismert pozitív hatást kiváltó anyaggal kezelt replikátum. Annak biztosítása érdekében, hogy a pozitív kontrollban jelentkező hatás időbeli változását fel lehessen mérni, a pozitív hatás nem lehet túlságosan erőteljes.
Relevancia : a vizsgálat és a vizsgált hatás kapcsolatát adja meg, valamint azt, hogy van-e a vizsgálatnak az adott cél szempontjából értelme és haszna. Azt tükrözi, hogy a vizsgálat mennyire pontosan méri vagy jelzi előre a vizsgált biológiai hatást. A relevancia meghatározása során a vizsgálati módszer pontosságát (az eredmények egyezését) figyelembe kell venni (29).
Megbízhatóság : a vizsgálati módszer laboratóriumon belüli és laboratóriumok közötti időbeli reprodukálhatóságának mértéke ugyanazon protokoll alkalmazása mellett. Megállapítása a laboratóriumon belüli és a laboratóriumok közötti reprodukálhatóság, valamint a laboratóriumon belüli megismételhetőség kiszámításával történik (29).
Reprodukálhatóság : ugyanazon vegyi anyag ugyanazon vizsgálati protokollal végzett vizsgálata során kapott eredmények egyezése (lásd: megbízhatóság) (29).
Érzékenység : az összes olyan pozitív/aktív vegyi anyag aránya, amelyet a vizsgálati módszer helyesen sorolt be. A kategorikus eredményt adó vizsgálati módszerek pontosságának mutatója, valamint fontos szempont a vizsgálati módszerek relevanciájának megítélésében (29).
Oldószeres/vivőanyagos kontroll : valamely vizsgálati rendszernek a vizsgálati vegyi anyagon kívüli összes összetevőjét tartalmazó párhuzamos, amely azonban magában foglalja az alkalmazott oldószert. Az ugyanabban az oldószerben feloldott vizsgálati vegyi anyaggal kezelt minták esetében a kiindulási érték létrehozásához használatos.
Specifikusság : a vizsgálati módszerrel helyesen besorolt összes negatív/inaktív vegyi anyag aránya. A kategorikus eredményt adó vizsgálati módszerek pontosságának mutatója, valamint fontos szempont a vizsgálati módszerek relevanciájának megítélésében (29).
Anyag : természetes állapotban előforduló vagy ipari termelőfolyamatból származó kémiai elemek és azok vegyületei, amelyek a termék stabilitásának megőrzéséhez szükséges adalékanyagokat és az alkalmazott folyamatból származó szennyeződéseket is tartalmazhatnak, de nem tartalmaznak olyan oldószereket, amelyek az anyag stabilitásának befolyásolása vagy összetételének megváltozása nélkül elkülöníthetők (1).
Vizsgálati vegyi anyag : a »vizsgálati vegyi anyag« kifejezés a vizsgálat tárgyát képező anyagra való hivatkozáshoz használatos.
A vegyi anyagok osztályozásának és címkézésének az Egyesült Nemzetek Szervezete által globálisan harmonizált rendszere (ENSZ-GHS) : a vegyi anyagoknak (anyagoknak és keverékeknek) a fizikai, egészségi és környezeti veszélyek szabványosított típusai és szintjei szerinti osztályokba sorolására és megfelelő kommunikációs elemekkel (például piktogramokkal, figyelmeztetésekkel, figyelmeztető mondatokkal, óvintézkedésekre vonatkozó mondatokkal és biztonsági adatlapokkal) történő jelölésére javaslatokat megfogalmazó rendszer, amelynek célja, hogy az emberek (köztük a munkáltatók, a munkavállalók, a fuvarozók, a fogyasztók és a sürgősségi segélyszolgálatok) és a környezet megóvása érdekében egységesítse a vegyi anyagok káros hatásaira vonatkozó információk továbbítását (1).
UVCB : Ismeretlen szerkezetű vagy változó összetételű, összetett reakcióban keletkezett vagy biológiai eredetű anyagok.
Érvényes vizsgálati módszer : olyan vizsgálati módszer, amely kellően relevánsnak és megbízhatónak minősül egy adott célra, és amely tudományosan megalapozott elveken alapul. Egy-egy vizsgálati módszer abszolút értelemben soha nem érvényes, kizárólag meghatározott céllal összefüggésben az (29).
2. függelék
JÁRTASSÁGI TESZTANYAGOK
In vitro bőrszenzibilizáció: ARE-Nrf2 luciferáz alapú vizsgálati módszer
E vizsgálati módszer rutinszerű alkalmazása előtt a laboratóriumoknak igazolniuk kell szakmai jártasságukat oly módon, hogy az 1. táblázatban javasolt 10 jártassági tesztanyagra vonatkozóan a KeratinoSens™ vizsgálattal várható előrejelzést helyesen kapják meg, továbbá a 10 jártassági tesztanyag közül 8 esetében a referenciatartományba eső EC1,5 és IC50 értékeket kapják meg. E jártassági tesztanyagok kiválasztása oly módon történt, hogy az a bőrszenzibilizáció veszélye esetén bekövetkező különféle válaszreakciók tartományát illetően reprezentatív legyen. További kiválasztási kritérium volt, hogy a jártassági tesztanyagok kereskedelmi forgalomban kaphatóak legyenek, azokra vonatkozóan kiváló minőségű in vivo referenciaadatok és a KeratinoSensTM vizsgálatból származó, kiváló minőségű in vitro adatok álljanak rendelkezésre.
1. táblázat
A KeratinoSensTM vizsgálatban való szakmai jártasság bizonyításához ajánlott anyagok
|
Jártassági tesztanyagok |
CASRN |
Halmazállapot |
In vivo előrejelzés (1) |
KeratinoSensTM előrejelzés (2) |
EC1,5 (μM) referenciatartomány (3) |
IC50 (μM) referenciatartomány (3) |
|
Izopropanol |
67-63-0 |
Folyadék |
Nem szenzibilizáló |
Negatív |
> 1 000 |
> 1 000 |
|
Szalicilsav |
69-72-7 |
Szilárd |
Nem szenzibilizáló |
Negatív |
> 1 000 |
> 1 000 |
|
Tejsav |
50-21-5 |
Folyadék |
Nem szenzibilizáló |
Negatív |
> 1 000 |
> 1 000 |
|
Glicerin |
56-81-5 |
Folyadék |
Nem szenzibilizáló |
Negatív |
> 1 000 |
> 1 000 |
|
Fahéjalkohol |
104-54-1 |
Szilárd |
Szenzibilizáló (enyhén) |
Pozitív |
25–175 |
> 1 000 |
|
Etilén-glikol-dimetakrilát |
97-90-5 |
Folyadék |
Szenzibilizáló (enyhén) |
Pozitív |
5–125 |
> 500 |
|
2-Merkapto-benzotiazol |
149-30-4 |
Szilárd |
Szenzibilizáló (mérsékelten) |
Pozitív |
25–250 |
> 500 |
|
Metil-dibróm-glutár-nitril |
35691-65-7 |
Szilárd |
Szenzibilizáló (erősen) |
Pozitív |
< 20 |
20–100 |
|
4-metil-amino-fenol-szulfát |
55-55-0 |
Szilárd |
Szenzibilizáló (erősen) |
Pozitív |
< 12,5 |
20–200 |
|
2,4-dinitro-klórbenzol |
97-00-7 |
Szilárd |
Szenzibilizáló (szélsőségesen) |
Pozitív |
< 12,5 |
5–20 |
|
(1) Az in vivo veszélyekre és (a hatáserősségre vonatkozó) előrejelzések LLNA-adatokon alapulnak (13). Az in vivo hatáserősség levezetése az ECETOC által javasolt kritériumok segítségével történik (24). (2) A KeratinoSensTM előrejelzést integrált értékelési és vizsgálati megközelítés keretében, valamint e vizsgálati módszer 9. és 11. pontjának rendelkezéseivel összhangban kell figyelembe venni. (3) A megfigyelt történeti értékek alapján (12). |
||||||
3. függelék
A LUMINESZCENCIA-MÉRÉSEK MINŐSÉG-ELLENŐRZÉSE
A KeratinoSensTM vizsgálat során optimális lumineszcencia-mérések biztosításához kapcsolódó alapkísérlet
Ahhoz, hogy a luminométerrel megbízható eredmények szülessenek, az alábbi három paraméter kritikus jelentőségű:
— a kontroll-lyukakban stabil hátteret biztosító, kellő érzékenység legyen;
— ne legyen gradiens a lemezen hosszú leolvasási idők miatt; valamint
— a szomszédos lyukakban ne legyen az erősen aktív lyukak felől érkező fényszennyezés.
A vizsgálat előtt a kontroll-lemez alábbiakban ismertetett beállítás melletti vizsgálatával (hármas elemzéssel) ajánlott meggyőződni a lumineszcencia-mérések megfelelőségéről.
A lemez beállítása az első kísérlethez
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
A |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
|
B |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
|
C |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
|
D |
EGDMA 0,98 |
EGDMA 1,95 |
EGDMA 3,9 |
EGDMA 7,8 |
EGDMA 15,6 |
EGDMA 31,25 |
EGDMA 62,5 |
EGDMA 125 |
EGDMA 250 |
EGDMA 500 |
EGDMA 1000 |
EGDMA 2000 |
|
E |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
|
F |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
|
G |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
|
H |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
DMSO |
CA 4 |
CA 8 |
CA 16 |
CA 32 |
CA 64 |
Vakpróba |
EGDMA = etilén-glikol-dimetakrilát (CAS-szám: 97-90-5), erős indukciót kiváltó vegyi anyag
CA = fahéjaldehid, pozitív referenciaanyag (CAS-szám: 104-55-2)
A minőségellenőrzés céljából végzett elemzésnek a következőket kell bebizonyítania:
— egyértelmű dózis-válasz a D sorban, Imax a háttérértékeknek több mint 20-szorosa (a legtöbb esetben 100 és 300 közötti Imax értékek kaphatók);
— dózis-válasz hiánya a C és az E sorban (nincs 1,5 feletti – ideális esetben 1,3 feletti – indukciós érték) különösen az EGDMA-t tartalmazó sorban lévő erősen aktív lyukak mellett lehetséges fényszennyezés miatt;
— nincs statisztikailag szignifikáns eltérés az A, B, C, E, F és G sor között (azaz nincs gradiens a lemez felett); továbbá
— az A, B, C, E, F és G sor bármelyikében és a H sorban, DMSO-t tartalmazó lyukakban a variabilitás alacsonyabb 20 %-nál (azaz stabil háttér).
B.61. Fluoreszcein-szivárgáson alapuló vizsgálat a szemkorróziót és a súlyos szemirritációt okozó anyagok azonosítására
BEVEZETÉS
Ez a vizsgálati módszer egyenértékű az OECD 460. vizsgálati iránymutatásában (2012) leírt módszerrel. A fluoreszcein-szivárgáson alapuló vizsgálati módszer bizonyos körülmények között és konkrét korlátok mellett alkalmazható a vegyi anyagok (anyagok és keverékek) szemkorróziót és súlyos szemirritációt okozóként történő besorolására, amely kategóriákat a vegyi anyagok osztályozásának és címkézésének az Egyesült Nemzetek Szervezete (ENSZ) által globálisan harmonizált rendszere (GHS) (1. kategória), az anyagok és keverékek osztályozásáról, címkézéséről és csomagolásáról szóló 1272/2008/EK rendelet ( 12 ) (CLP-rendelet) (1. kategória), valamint az USA Környezetvédelmi Ügynöksége (EPA) (I. kategória) határozta meg (1) (2). E vizsgálati módszer alkalmazásában a súlyos szemirritációt okozó anyagok olyan vegyi anyagok, amelyek a vizsgálati vegyi anyag beadását követően 21 napon belül vissza nem fordítható szövetkárosodást okoznak a szemben, vagy amelyek a látás súlyos fizikai romlását okozzák, míg a szemkorróziót okozó anyagok olyan vegyi anyagok, amelyek visszafordíthatatlan szövetkárosodást okoznak a szemben. E vegyi anyagok az ENSZ-GHS szerinti 1. kategóriába, a CLP-rendelet szerinti 1. kategóriába vagy az US EPA szerinti I. kategóriába sorolt vegyi anyagok.
Míg a fluoreszcein-szivárgáson alapuló vizsgálati módszer nem tekintendő érvényesnek a nyulakon végzett in vivo szemvizsgálatot teljes egészében helyettesítő vizsgálatként, a szabályozói követelmények szerinti osztályozásra és címkézésre szolgáló, többszintű vizsgálati stratégia részeként ajánlott. Ezért a fluoreszcein-szivárgáson alapuló vizsgálati módszer a szemkorróziót/súlyos szemirritációt okozó anyagok azonosítására szolgáló, felülről építkező megközelítés első lépéseként ajánlott, kifejezetten bizonyos vegyianyag-típusok (azaz vízoldékony anyagok és keverékek) esetén (3) (4).
Jelenleg általánosan elfogadott, hogy az előrelátható jövőben egyetlen in vitro szemirritációs vizsgálat sem tudja majd helyettesíteni az in vivo szemvizsgálatot (B.5. vizsgálati módszer, (5)) a különböző kémiai osztályok okozta irritációk teljes körének előrejelzéséhez. Előfordulhat azonban, hogy egy adott (többszintű) vizsgálati stratégián belüli több alternatív vizsgálati módszer stratégiai kombinációi helyettesíteni tudják az in vivo szemvizsgálatot (4). A felülről építkező megközelítés (4) akkor alkalmazandó, amikor a rendelkezésre álló információk alapján valamely vegyi anyag várhatóan rendkívül irritatív potenciállal rendelkezik.
A 35. pontban részletezett előrejelzési modell alapján a fluoreszcein-szivárgáson alapuló vizsgálati módszer korlátozott alkalmazási területen belül további vizsgálat nélkül azonosíthat vegyi anyagokat szemkorróziót/súlyos szemirritációt okozóként (az ENSZ-GHS szerinti 1. kategóriába tartozóként, a CLP-rendelet szerinti 1. kategóriába tartozóként, az US EPA szerinti I. kategóriába tartozóként). Ugyanez feltételezhető a keverékek esetében, bár azokra nem terjedt ki a validálás. Ezért a fluoreszcein-szivárgáson alapuló vizsgálati módszer a B.5. vizsgálati módszer (5) lépcsőzetes vizsgálati stratégiája alapján alkalmazható a vegyi anyagok szemirritációs/szemkorróziós hatásának meghatározásához. A fluoreszcein-szivárgáson alapuló vizsgálati módszerrel nem szemkorróziót okozóként vagy súlyos szemirritációt okozóként előrejelzett vegyi anyagokat azonban legalább egy olyan további (in vitro és/vagy in vivo) vizsgálati módszerrel meg kell vizsgálni, amelyek képesek pontosan azonosítani i. a fluoreszcein-szivárgáson alapuló vizsgálatban in vitro hamis negatív szemkorróziót/súlyos szemirritációt okozó (az ENSZ-GHS szerinti 1. kategóriába, a CLP-rendelet szerinti 1. kategóriába és az US EPA szerinti I. kategóriába tartozó) vegyi anyagokat; ii. a szemkorrózió/szemirritáció tekintetében be nem sorolt (az ENSZ-GHS szerinti nem besorolt, a CLP-rendelet szerinti nem besorolt és az US EPA szerinti IV. kategóriába tartozó) vegyi anyagokat; és/vagy iii. a mérsékelten/enyhén szemirritáló (az ENSZ-GHS szerinti 2A. és 2B. kategóriába, a CLP-rendelet szerinti 2. kategóriába és az US EPA szerinti II. és III. kategóriába tartozó) vegyi anyagokat.
E vizsgálati módszer célja a vizsgálati vegyi anyag szemkorróziót vagy súlyos szemirritációt okozó esetleges hatásának értékelésére alkalmazott eljárások ismertetése annak alapján, hogy az anyag képes-e károsodást előidézni impermeábilis, konfluens felhám-monolayerben. A transzepitheliális permeabilitás integritása a például kötőhártyában és a szaruhártyában megtalálható felhám egyik fő funkciója. A transzepitheliális permeabilitást különféle tight junctionok szabályozzák. Kiderült, hogy a szaruhártyafelhám permeabilitásának in vivo körülmények közötti növekedése korrelál a szemirritáció kialakulása során megfigyelt gyulladás és szemfelszín-károsodás mértékével.
A fluoreszcein-szivárgáson alapuló vizsgálati módszerben a vizsgálati vegyi anyaggal való rövid expozíciós időt követően fellépő toxikus hatásokat a permeábilis inzerteken tenyésztett Madin-Darby kutyavese (MDCK) sejtek felhám-monolayerében áthatoló fluoreszcein-nátrium permeabilitásának növekedésével mérik. A bekövetkező fluoreszcein-szivárgás mennyisége arányos a vegyi anyag által a tight junctionokban, a dezmoszómákban és a sejtmembránokban előidézett károsodással, és felhasználható a vizsgálati vegyi anyag által a szemre kifejtett esetleges toxicitás becsléséhez. Az 1. függelékben található egy diagram a fluoreszcein-szivárgáson alapuló vizsgálati módszerhez inzert membránján tenyésztett MDCK-sejtekről.
A fogalommeghatározások a 2. függelékben találhatók.
KIINDULÁSI MEGFONTOLÁSOK ÉS KORLÁTOK
Ez a vizsgálati módszer a 71. sz. INVITTOX-protokollon (6) alapul, amelynek értékelésére az Alternatív Módszerek Validálásával Foglalkozó Európai Központ (ECVAM), valamint az USA alternatív módszerek validálásával foglalkozó ügynökségközi koordinációs bizottsága (ICCVAM) és az Alternatív Módszerek Validálásával Foglalkozó Japán Központ (JaCVAM) együttműködése keretében végzett nemzetközi validálási vizsgálatban került sor.
A fluoreszcein-szivárgáson alapuló vizsgálati módszer nem ajánlott enyhén/mérsékelten irritálóként besorolandó vegyi anyagok, illetve a szemirritáció tekintetében be nem sorolandó (azaz az ENSZ-GHS szerinti 2A., 2B. kategóriába tartozó, nem besorolt, a CLP-rendelet szerinti 2. kategóriába tartozó, nem besorolt, az US EPA szerinti II., III. és IV. kategóriába tartozó) vegyi anyagok (anyagok és keverékek) azonosítására, ahogyan azt a validálási vizsgálat demonstrálta (3) (7).
A vizsgálati módszer kizárólag a vízoldékony vegyi anyagokra (anyagokra és keverékekre) alkalmazandó. A fluoreszcein-szivárgáson alapuló vizsgálati módszer általában pontosan előrejelzi a vízoldékony vegyi anyagok és/vagy azon vegyi anyagok súlyos szemirritációs potenciálját, amelyeknek a toxikus hatását nem érinti a hígítás (7). Ahhoz, hogy egy vegyi anyagot kísérleti körülmények között vízoldékonyként soroljanak be, steril, (1,0–1,8 mM koncentrációban) kalciumot tartalmazó, fenolvörösmentes Hank-féle kiegyensúlyozott sóoldatban (HBBS-oldat) oldhatónak kell lennie ≥ 250 mg/ml (a 100 mg/ml határértéket egy dózissal meghaladó) koncentráció mellett. Ha azonban a vizsgálati vegyi anyag a 100 mg/ml koncentrációnál alacsonyabb koncentrációnál oldható, de már e koncentrációnál 20 % fluoreszcein-szivárgást idéz elő (azaz FL20 < 100 mg/ml), még mindig besorolható a GHS szerinti 1. vagy az EPA szerinti I. kategóriába.
E vizsgálati módszer meghatározott korlátai kizárják az alkalmazási körből az erős savakat és bázisokat, a sejtfixáló anyagokat, valamint a rendkívül illékony vegyi anyagokat. E vegyi anyagoknak a fluoreszcein-szivárgáson alapuló vizsgálati módszerrel nem mért mechanizmusai vannak, ilyen például a kiterjedt koaguláció, a szappanosodás vagy a speciális kémiai reakciók. E vizsgálati módszer más meghatározott korlátai a színes és viszkózus vizsgálati vegyi anyagok esetén érvényes prediktív képességre vonatkozó eredményeken alapulnak (7). A módszerben javasolt, hogy mivel mindkét említett vegyianyag-típus nehezen eltávolítható a monolayerből a rövid expozíciós idő után, a vizsgálati módszer prediktivitása több mosási szakasz alkalmazásával javítható. A folyadékban szuszpendált szilárd vegyi anyagok hajlamosak kicsapódni, és előfordulhat, hogy a sejteket érő végső koncentráció nehezen határozható meg. Ha az említett kémiai és fizikai osztályokba tartozó anyagokat kizárják az adatbázisból, akkor a fluoreszcein-szivárgáson alapuló vizsgálat pontossága az EU, az EPA és a GHS osztályozási rendszerében egyaránt jelentősen javul (7).
E vizsgálati módszer célját (azaz kizárólag a szemkorróziót, illetve a súlyos szemirritációt okozó anyagok azonosítása) figyelembe véve a hamis negatív arányok (lásd a 13. pontot) jelentősége nem kritikus, hiszen az érintett vegyi anyagokat a szabályozói követelményektől függően – az adatok bizonyító erejének mérlegelésén alapuló megközelítés (5) keretébe tartozó lépcsőzetes vizsgálati stratégia alkalmazásával – később más, megfelelően validált in vitro vizsgálatokkal vagy nyulakon végzett vizsgálatokkal is megvizsgálják (lásd még a 3. és a 4. pontot).
A fluoreszcein-szivárgáson alapuló vizsgálati módszer más, meghatározott korlátai a hamisnegatív- és hamis pozitív arányokon alapulnak. Ha felülről építkező megközelítés első lépéseként használták a szemkorróziót/súlyos szemirritációt okozó, vízoldékony anyagok és keverékek (azaz az ENSZ-GHS szerinti 1. kategóriába, a CLP-rendelet szerinti 1. kategóriába, az US EPA szerinti I. kategóriába tartozó anyagok és keverékek) azonosítására, a fluoreszcein-szivárgáson alapuló vizsgálati módszer hamis pozitív aránya in vivo eredményekkel összevetve 7 % (7/103; ENSZ-GHS és CLP-rendelet) és 9 % (9/99; US EPA) közé esett, hamis negatív aránya pedig in vivo eredményekkel összevetve 54 % (15/28; US EPA) és 56 % (27/48; ENSZ-GHS és CLP-rendelet) közé esett. A fluoreszcein-szivárgáson alapuló vizsgálati módszerben hamis pozitív és/vagy hamis negatív eredményeket mutató vegyianyag-csoportok itt nincsenek meghatározva.
Bizonyos technikai korlátok az MDCK-sejttenyészetre jellemzőek. A fluoreszcein-nátrium festéknek a monolayeren történő áthaladását blokkoló tight junctionokat a sejtpasszálások számának növekedése egyre inkább veszélyezteti. A tight junctionok hiányos kialakulása következében egyre több fluoreszcein-szivárgás történik a nem kezelt kontrollokban. Ezért fontos a nem kezelt kontrollokban megengedhető maximális szivárgás meghatározása (lásd a 38. pontot: 0 % szivárgás). Az összes in vitro vizsgálathoz hasonlóan előfordulhat, hogy a sejtek idővel átalakulnak, ezért elengedhetetlen, hogy a vizsgálatokhoz közöljék a passzálások számának tartományát.
A jelenlegi alkalmazási terület egyes esetekben bővíthető, de csak a tanulmányozott vizsgálati vegyi anyagok kiterjesztett – lehetőleg vizsgálatokkal előállított – adatkészletének elemzését követően (3). Ez a vizsgálati módszer ennek megfelelően frissítés tárgyát fogja képezni az új információk és adatok figyelembevételekor.
Minden olyan laboratóriumnak, amely a vizsgálatot először alkalmazza, a 3. függelékben felsorolt jártassági tesztanyagok felhasználásával ajánlatos meggyőződnie felkészültségéről. Mielőtt a laboratórium a fluoreszcein-szivárgáson alapuló vizsgálat adatait a szabályozói követelmények szerinti veszélyességi osztályozás céljaira rendelkezésre bocsátaná, e vegyi anyagok vizsgálatával demonstrálhatja a fluoreszcein-szivárgáson alapuló vizsgálati módszer végrehajtásában való szakmai jártasságát.
A VIZSGÁLAT ELVE
A fluoreszcein-szivárgáson alapuló vizsgálati módszer féligáteresztő inzerteken tenyésztett MDCK CB997 sejtvonalhoz tartozó cső alakú felhámsejtek konfluens monolayerében végzett citotoxicitás- és sejtfunkció-alapú in vitro vizsgálat, amely sejtek az in vivo szaruhártya-felhám nem proliferáló állapotát modellezik. Az MDCK sejtvonal jól bevált sejtvonal, amely a kötőhártya- és a szaruhártya-felhám apikális oldalán megtalálható tight junctionokhoz és dezmoszómákhoz hasonló tight junctionokat és dezmoszómákat alkot. A tight junctionok és a dezmoszómák in vivo körülmények között megakadályozzák, hogy oldott anyagok és idegen anyagok hatoljanak a szaruhártya-felhámba. A károsodott tight junctionok és dezmoszómák miatt megszűnő transzepitheliális impermeabilitás a vegyi anyag által előidézett szemirritáció egyik korai eseménye.
A vizsgálati vegyi anyagot az inzert apikális oldalán tenyésztett sejtek konfluens rétegére kell felvinni. Rövid, 1 perces expozíciót kell rutinszerűen alkalmazni a humán expozíció során adódó normál kiürülési arány visszaadása érdekében. A rövid expozíciós idő egyik előnye, hogy a víz alapú anyagok és keverékek tisztán vizsgálhatók, ha az expozíciós idő után könnyen eltávolíthatók. Ez lehetővé teszi az eredmények közvetlenebb összehasonlítását a vegyi anyagok emberekre gyakorolt hatásaival. A vizsgálati vegyi anyagot ezt követően el kell távolítani, és a nem toxikus, rendkívül fluoreszcens fluoreszcein-nátrium festéket 30 percre a monolayer apikális oldalán kell hatni hagyni. A vizsgálati vegyi anyag által a tight junctionokban okozott károsodást a sejtrétegen meghatározott időn belül átszivárgó fluoreszcein mennyiségével kell meghatározni.
A monolayeren és az inzert membránján keresztül a lyukban lévő oldat meghatározott térfogatába átkerülő fluoreszcein-nátrium festéket (a fluoreszcein-nátrium festék a lyukba szivárog) a lyukban lévő fluoreszcein-koncentráció spektrofluorométerrel végzett mérésével kell meghatározni. A fluoreszcein-szivárgás (FL) mennyiségét két kontrollon – egy vakpróba-kontrollon és a maximális szivárgást képviselő kontrollon – leolvasott fluoreszcein-intenzitás (FI) értékére hivatkozva kell kiszámítani. A szivárgás százalékos arányát és ennélfogva a tight junctionok károsodásának mértékét e kontrollokhoz viszonyítva kell kifejezni, a vizsgálati vegyi anyag mindegyik meghatározott koncentrációja esetében. Ezt követően ki kell számítani az FL20 értéket (azaz azt a koncentrációt, amely a nem kezelt konfluens monolayernél és a sejtek nélküli inzerteknél rögzített értékhez viszonyítva 20 % fluoreszcein-szivárgást okoz). Az FL20 (mg/ml) érték a szemkorróziót okozó és a súlyos szemirritációt okozó anyagok azonosításához tartozó előrejelzési modellben használatos (lásd a 35. pontot).
A visszanyerés a vizsgálati vegyi anyag toxicitási profiljának fontos része, amelyet az in vivo szemirritációs vizsgálat szintén értékel. Előzetes elemzések azt jelezték, hogy a visszanyerésre vonatkozó adatok (a vizsgálati vegyi anyagnak való expozíciót követő legfeljebb 72 óráig) fokozhatják a 71. sz. INVITTOX-protokoll prediktív értékét, azonban további értékelésre van szükség, és ahhoz – lehetőleg további vizsgálatokkal előállított – további adatok kellenek (6). Ez a vizsgálati módszer ennek megfelelően frissítés tárgyát fogja képezni az új információk és adatok figyelembevételekor.
ELJÁRÁS
A monolayer sejttenyészet elkészítése
Az MDCK CB997 sejtvonalhoz tartozó sejtekből álló monolayer sejttenyészetet sejttenyésztő lombikban Dulbecco-féle módosított Eagle-féle tápfolyadékban (DMEM) és F12-es tápanyagkeverékben (L-glutaminnal, 15 mM HEPES pufferrel, 1,0–1,8 mM koncentrációjú kalciummal és 10 %-os, melegen deaktivált FCS/FBS szérummal előállított 1-szeres koncentrátumban) fejlődő szubkonfluens sejtek felhasználásával kell elkészíteni. Fontos, hogy a fluoreszcein-szivárgáson alapuló vizsgálat során alkalmazott valamennyi közegnek/oldatnak a tight junctionok kialakulásának és épségének biztosítása érdekében 1,0 mM (111 mg/l) és 1,8 mM (200 mg/l) közötti koncentrációban kalciumot kell tartalmaznia. A tight junctionok egyenletes és reprodukálható kialakulásának biztosítása érdekében ellenőrizni kell a sejtpasszálások számának tartományát. A sejteknek a felolvasztástól számítva 3–30 közötti passzálási tartományban kell lenniük, mivel az e passzálási tartományon belüli sejtek hasonló funkciójúak, ami elősegíti, hogy a vizsgálati eredmények reprodukálhatóak legyenek.
A fluoreszcein-szivárgáson alapuló vizsgálati módszer végrehajtása előtt a sejteket tripszines emésztéssel le kell választani a lombikról, centrifugálni kell, és megfelelő mennyiségű sejtet le kell oltani a 24-lyukú lemezekre helyezett inzertekbe (lásd az 1. függeléket). A sejtek leoltásához 80–150 μm vastagságú és 0,45 μm méretű pórusokkal rendelkező, vegyes cellulóz-észterekből álló membránokkal ellátott, 12 mm átmérőjű inzerteket kell használni. A validálási vizsgálatban Millicell-HA típusú, 12 mm-es inzerteket használtak. Az inzert- és a membrántípus tulajdonságai fontosak, mivel befolyásolhatják a sejtnövekedést és a kémiai kötést. Egyes vegyianyag-típusok a Millicell-HA típusú inzert membránjához kötődhetnek, ami befolyásolhatja az eredmények értelmezését. Más membránok használata esetén jártassági tesztanyagokat (lásd a 3. függeléket) kell használni az egyenértékűség igazolására.
Az inzert membránjához kapcsolódó kémiai kötés gyakoribb a töltéssel rendelkező membránhoz vonzódó kationos vegyi anyagok, például a benzalkónium-klorid esetében (7). Az inzert membránjához kapcsolódó kémiai kötés növelheti a vegyi anyag expozíciós idejét, ami a vegyi anyag toxikus potenciáljának túlbecsléséhez vezet, ugyanakkor fizikailag is csökkentheti az inzerten keresztüli fluoreszcein-szivárgást azáltal, hogy az inzert membránjához kötődő kationos vegyi anyaghoz köti a festéket, ami a vegyi anyag toxikus potenciáljának alulbecsléséhez vezet. Ez könnyen nyomon követhető oly módon, hogy kizárólag a membránt teszik ki a vizsgálati vegyi anyag legmagasabb koncentrációjának, és ezt követően a fluoreszcein-nátrium festéket normál koncentráció mellett, standard ideig (sejtkontroll nélkül) kell hozzáadni. Ha a fluoreszcein-nátrium festék kötése bekövetkezik, az inzert membránja a vizsgálati vegyi anyag lemosását követően megsárgul. Ezért ahhoz, hogy értelmezni lehessen a vizsgálati vegyi anyag sejtekre kifejtett hatását, a kötési tulajdonságainak ismerete elengedhetetlen.
A sejtek inzertekre történő leoltásának konfluens monolayert kell létrehozniuk a vizsgálati vegyi anyagnak való expozíció időpontjában. Inzertenként 1,6 × 105 sejtet (400 μl, 4 × 105 sejt/ml sűrűségű sejtszuszpenziót) kell adagolni. E körülmények között 96 órás tenyésztést követően általában konfluens monolayer jön létre. A leoltás előtt az inzerteket szemrevételezéssel kell ellenőrizni, hogy meggyőződjenek arról, hogy a 30. pontban leírt szemrevételezéses ellenőrzéskor rögzített esetleges károsodások a kezelésnek tudhatók be.
Az MDCK sejttenyészeteket párás légkörben, 5 % ± 1 % CO2-koncentráció mellett és 37 ± 1 °C-on, inkubátorban kell tartani. A sejteknek baktérium-, vírus-, mikoplazma- és gombafertőzéstől mentesnek kell lenniük.
A vizsgálati és a kontrollként szolgáló vegyi anyagok alkalmazása
Minden egyes kísérletmenethez a vizsgálati vegyi anyagot tartalmazó friss törzsoldatot kell készíteni, és azt az elkészítéstől számított 30 percen belül fel kell használni. A szérum-fehérjekötés elkerülése érdekében a vizsgálati vegyi anyagokat (1,0–1,8 mM koncentrációban) kalciumot tartalmazó, fenolvörösmentes HBBS-oldatban kell előkészíteni. A vizsgálati vegyi anyag 250 mg/ml koncentráció melletti, HBBS-oldatban való oldhatóságát a vizsgálat előtt fel kell mérni. Ha a vizsgálati vegyi anyag e koncentráció mellett 30 perc alatt stabil szuszpenziót vagy emulziót alkot (azaz megőrzi egységességét és nem ülepedik le, vagy nem válik szét egynél több fázissá), a HBBS-oldat továbbra is használható oldószerként. Ha azonban megállapítást nyer, hogy a vegyi anyag HBBS-oldatban oldhatatlan e koncentráció mellett, mérlegelni kell a fluoreszcein-szivárgáson alapuló vizsgálati módszertől eltérő vizsgálati módszerek alkalmazását. Olyan esetekben, ha megállapítást nyer, hogy a vegyi anyag HBBS-oldatban oldhatatlan, körültekintően kell mérlegelni a könnyű ásványolaj oldószerként történő alkalmazását, mivel nem áll rendelkezésre elegendő adat annak megállapításához, hogy a fluoreszcein-szivárgáson alapuló vizsgálat ilyen körülmények között hogyan teljesít.
Az összes vizsgálandó vegyi anyagot a törzsoldatból, steril, (1,0–1,8 mM koncentrációban) kalciumot tartalmazó, fenolvörösmentes HBBS-oldatban kell előkészíteni öt, előre meghatározott koncentrációban: tömeg per térfogat alapján hígítva (1,25, 100, 250 mg/ml), továbbá egy tiszta vagy telített oldat formájában. Szilárd vegyi anyag vizsgálatakor egy nagyon magas, 750 mg/ml koncentrációt is alkalmazni kell. A vegyi anyag e koncentrációját esetlegesen finnpipettával kell a sejtekre felvinni. Ha a toxicitás 25 és 100 mg/ml közötti koncentráció mellett állapítható meg, az következőkben felsorolt, további koncentrációkat kell kétszer megvizsgálni: 1, 25, 50, 75, 100 mg/ml. Az FL20 értéket e koncentrációkból kell levezetni, amennyiben az elfogadhatósági kritériumok teljesülnek.
A vizsgálati vegyi anyagokat konfluens monolayerekre kell felvinni a sejttenyésztő közeg eltávolítását és a steril, meleg (37 °C-os), (1,0–1,8 mM koncentrációban) kalciumot tartalmazó, fenolvörösmentes HBBS-oldatban történt kétszeri mosást követően. Ezt megelőzően a szűrőket szemrevételezéssel ellenőrizni kell abból a szempontból, hogy előfordulnak-e rajtuk olyan korábbi rongálódások, amelyeket tévesen tulajdoníthatnának a vizsgálati vegyi anyagokkal való esetleges összeegyeztethetetlenségnek. A vizsgálati vegyi anyag minden egyes koncentrációjához és a kontrollanyagokhoz minden egyes vizsgálatmenetben legalább három párhuzamost kell használni. 1 percig tartó, szobahőmérsékleten végzett expozíciót követően a vizsgálati vegyi anyagot felszívással óvatosan el kell távolítani, a monolayert kétszer át kell mosni steril, meleg (37 °C-os), (1,0–1,8 mM koncentrációban) kalciumot tartalmazó, fenolvörösmentes HBBS-oldattal és a fluoreszcein-szivárgást azonnal meg kell mérni.
A párhuzamos negatív kontrollokat és a párhuzamos pozitív kontrollokat minden egyes vizsgálatmenetben annak bizonyítására kell felhasználni, hogy a sejtek monolayeren belüli integritása (negatív kontrollok) és érzékenysége (pozitív kontrollok) egy meghatározott történeti elfogadhatósági tartományba esik. A pozitív kontrollként javasolt vegyi anyag a 100 mg/ml koncentrációban alkalmazott Brij 35 (CAS-szám: 9002-92-0). E koncentrációnak kb. 30 % fluoreszcein-szivárgást kell biztosítania (a fluoreszcein-szivárgás, azaz a sejtréteg-károsodás elfogadott tartománya: 20–40 %). A negatív kontrollként javasolt vegyi anyag az (1,0–1,8 mM koncentrációban) kalciumot tartalmazó, fenolvörösmentes HBBS-oldat (nem kezelt, vakpróba-kontroll). A FL20 értékek kiszámíthatósága érdekében a maximális szivárgást képviselő kontrollt is alkalmazni kell minden egyes vizsgálatmenetben. A maximális szivárgást sejteket nem tartalmazó kontrollinzert felhasználásával kell meghatározni.
A fluoreszcein-permeabilitás meghatározása
Közvetlenül a vizsgálati és a kontrollként szolgáló vegyi anyagok eltávolítását követően 400 μl térfogatú, 0,1 mg/ml koncentrációjú fluoreszcein-nátrium oldatot (0,01 vegyesszázalékos, [1,0–1,8mM koncentrációban] kalciumot tartalmazó, fenolvörösmentes HBBS-oldatban) kell a (például Millicell-HA típusú) inzertekhez adni. A tenyészeteket 30 percig szobahőmérsékleten kell tartani. A fluoreszceinnel végzett inkubálás végén az inzerteket óvatosan el kell távolítani az egyes lyukakból. Minden szűrőn szemrevételezéses ellenőrzést kell végezni, és a kezelés során esetlegesen bekövetkezett károsodásokat rögzíteni kell.
A monolayeren és az inzerten átszivárgott fluoreszcein mennyiségét számszerűsíteni kell az inzertek eltávolítását követően a lyukakban maradt oldatban. A méréseket 485 nm-es gerjesztési hullámhossznál, illetve 530 nm-es kibocsátási hullámhossznál kell elvégezni. A spektrofluorométer érzékenységét úgy kell beállítani, hogy a maximális fluoreszcein-szivárgás (a sejteket nem tartalmazó inzertnél) és a minimális fluoreszcein-szivárgás (negatív kontrollal kezelt konfluens monolayert tartalmazó inzertnél) közötti számszerű eltérés a lehető legmagasabb legyen. A használt spektrofluorométer eltérései miatt olyan érzékenység alkalmazása javasolt, amely a maximális fluoreszcei-szivárgást képviselő kontrollnál 4 000 -nél magasabb fluoreszcencia-intenzitást ad. A fluoreszcein-szivárgás maximális értéke nem haladhatja meg a 9 999 -et. A fluoreszcein-szivárgás maximális intenzitásának a használt spektrofluorométer lineáris tartományába kell esnie.
Az eredmények értelmezése és az előrejelzési modell
A fluoreszcein-szivárgás mennyiségének arányosnak kell lennie a tight junctionok vegyi anyag által előidézett károsodásával. A vegyi anyag minden vizsgált koncentrációja esetén a fluoreszcein-szivárgás százalékos arányát a vizsgálati vegyi anyagnak a negatív kontroll (a negatív kontrollal kezelt sejtek konfluens monolayerében leolvasott érték) alapján és a maximális szivárgást képviselő kontroll (a sejteket nem tartalmazó inzerten keresztüli fluoreszcein-szivárgás leolvasott értéke) alapján adódó FL-értékekre hivatkozással kapott FL-értékeiből kell kiszámítani
A maximális szivárgás fluoreszcencia-intenzitásának átlaga = x
A 0 %-os szivárgás fluoreszcencia-intenzitásának átlaga = y
A 100 %-os szivárgás átlagát a 0 %-os szivárgás átlagának a maximális szivárgás átlagából való kivonásával kell kiszámítani,
azaz x – y = z
Az egyes rögzített dózisok százalékos szivárgását oly módon kell kiszámítani, hogy a 0 %-os szivárgást ki kell vonni a három párhuzamos leolvasás (m) fluoreszcencia-intenzitása átlagából, és a kapott értéket el kell osztani a 100 %-os szivárgással, azaz %FL = [(m-y) / z] × 100 %, ahol:
|
m |
= |
az érintett koncentrációra vonatkozó három párhuzamos mérés fluoreszcencia-intenzitásának átlaga |
|
% FL |
= |
a sejtrétegen átszivárgó fluoreszcein százalékos aránya |
A 20 % fluoreszcein-szivárgást okozó vegyianyag-koncentráció kiszámítására szolgáló alábbi egyenletet kell alkalmazni:
FLD = [(A-B) / (C-B)] × (MC –MB) + MB
ahol:
|
D |
= |
a gátlás %-os aránya |
|
A |
= |
a károsodás %-os aránya (20 % fluoreszcein-szivárgás) |
|
B |
= |
a fluoreszcein-szivárgás %-os aránya < A |
|
C |
= |
a fluoreszcein-szivárgás %-os aránya > A |
|
MC |
= |
C koncentrációja (mg/ml-ben) |
|
MB |
= |
B koncentrációja (mg/ml-ben) |
Az alábbiakban szerepel az az FL20 határérték, amelynek segítéségével előrejelezhető a vegyi anyagok szemkorróziót/súlyos szemirritációt okozókénti besorolása:
|
FL20 (mg/ml) |
ENSZ-GHS szerinti O&C |
CLP-rendelet szerinti O&C |
US EPA szerinti O&C |
|
≤ 100 |
1. kategória |
1. kategória |
I. kategória |
|
O&C: osztályozás és címkézés, |
|||
A fluoreszcein-szivárgáson alapuló vizsgálati módszer csak a vízoldékony, szemkorróziót okozó és súlyos szemirritációt okozó (az ENSZ-GHS szerinti 1. kategóriába, a CLP-rendelet szerinti 1. kategóriába, az US EPA szerinti I. kategóriába tartozó) anyagok azonosításához ajánlott (lásd az 1. és a 10. pontot).
Ahhoz, hogy a vízoldékony vegyi anyagokat (anyagokat és keverékeket (3) (6) (7) »súlyos szemkárosodást okozóként« (az ENSZ-GHS/a CLP-rendelet szerinti 1. kategóriába tartozóként) vagy »szemkorróziót vagy súlyos szemirritációt okozóként« (az US EPA szerinti I. kategóriába tartozóként) azonosítsanak, a vizsgálati vegyi anyag FL20 értéke legfeljebb 100 mg/ml lehet.
Az eredmények elfogadása
A maximális fluoreszcein-szivárgás átlagának (x) nagyobbnak kell lennie 4 000 -nél (lásd a 31. pontot), a 0 %-os szivárgás átlaga (y) legfeljebb 300 lehet, a 100 %-os szivárgás átlagának (z) pedig 3 700 és 6 000 közé kell esnie.
Egy-egy vizsgálat akkor minősül elfogadhatónak, ha a pozitív kontroll 20–40 %-os károsodást okozott a sejtrétegben (melynek mérésére a %-os fluoreszcein-szivárgás szolgál).
ADATOK ÉS JEGYZŐKÖNYVEZÉS
Adatok
Az egyes vizsgálatmenetek esetében az egyes párhuzamos lyukakból származó adatokat (például minden vizsgálati vegyi anyag esetében a fluoreszcencia-intenzitás értékeit és a fluoreszcencia-szivárgás kiszámított százalékos adatait, beleértve a besorolást is) táblázatos formában kell jelentésbe foglalni. Ezen túlmenően az egyes párhuzamos mérések átlagait ± szórását minden egyes vizsgálatmenetben jelentésbe kell foglalni.
Vizsgálati jegyzőkönyv
A Vizsgálati jegyzőkönyvnek a következőket kell tartalmaznia:
Vizsgálati vegyi anyagok és kontrollként szolgáló vegyi anyagok
— kémiai név (nevek): a Chemical Abstracts Service (CAS) szerinti szerkezeti név, ezt követően az egyéb ismert nevek, ha vannak;
— a vegyi anyag CAS-száma, ha ismert;
— az anyag vagy keverék tisztasága és összetétele (tömegszázalékban), a rendelkezésre álló információknak megfelelően;
— a vizsgálat elvégzése szempontjából lényeges fizikai-kémiai tulajdonságok (például fizikai állapot, illékonyság, pH, stabilitás, vízoldékonyság, kémiai osztály);
— a vizsgálati/kontrollként szolgáló vegyi anyag vizsgálatot megelőző kezelése, ha történt ilyen (például melegítés, porítás);
— tárolási feltételek.
Az alkalmazott vizsgálati módszer és protokoll indokolása
— tartalmaznia kell a vizsgálati módszer alkalmazási területére és korlátaira vonatkozó megfontolásokat.
Vizsgálati körülmények
— a használt sejtrendszer leírása, beleértve a sejtvonal eredetiségigazolását és mikoplazma-állapotát is;
— az alkalmazott vizsgálati eljárás részletei;
— a vizsgálati vegyi anyagok alkalmazott koncentrációja (koncentrációi);
— a vizsgálati vegyi anyagnak való expozíció időtartama;
— a fluoreszceinnel végzett inkubálás időtartama;
— a vizsgálati eljárás bármilyen változtatásának leírása;
— az alkalmazott értékelési kritériumok leírása;
— utalás a modellel kapcsolatos történeti adatokra (például negatív és pozitív kontrollok, referencia-vegyianyagok, ha vannak ilyenek);
— a laboratórium igazolt szakmai jártasságára vonatkozó adatok.
Eredmények
— az egyes vizsgálati vegyi anyagokra és kontrollokra vonatkozó adatok táblázatos bemutatása minden egyes vizsgálatmenet és párhuzamos mérés esetében (beleértve az egyes eredményeket, az átlagokat és a szórást);
— az alkalmazott előrejelzési modellre és/vagy döntési kritériumokra hivatkozással meghatározott osztályozás(ok);
— a megfigyelt egyéb hatások leírása.
Az eredmények tárgyalása
— tartalmaznia kell a vizsgálat nem meggyőző kimenetelére vonatkozó megfontolásokat (35. pont: FL20 > 100 mg/ml) és további vizsgálatokat.
Következtetések
SZAKIRODALOM
(1) UN (2009), United Nations Globally Harmonized System of Classification and Labelling of Chemicals (GHS), Third revised edition, New York & Geneva: United Nations Publications. ISBN: 978-92-1-117006-1. Elérhető a következő címen: [http://www.unece.org/trans/danger/publi/ghs/ghs_rev03/03files_e.html]
(2) U.S. EPA (1996), Label Review Manual: 2nd Edition, EPA737-B-96-001, Washington DC: U.S. Environmental Protection Agency.
(3) EC-ECVAM (2009), Statement on the scientific validity of cytotoxicity/cell-function based in vitro assays for eye irritation testing.
(4) Scott, L. et al. (2010), A proposed eye irritation testing strategy to reduce and replace in vivo studies using Bottom-Up and Top-Down approaches, Toxicol. In Vitro 24, 1-9
(5) E melléklet Akut szemirritáció/szemkorrózió című, B.5. fejezete
(6) EC-ECVAM (1999), INVITOX Protocol 71: Fluorescein Leakage Test, Ispra, Italy: European Centre for the Validation of Alternative Methods (ECVAM). Elérhető a következő címen: [http://ecvam-dbalm.jrc.ec.europa.eu
(7) EC-ECVAM (2008), Fluorescein Leakage Assay Background Review Document as an Alternative Method for Eye Irritation Testing.
(8) OECD (2005), Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment, OECD Series on Testing and Assessment No. 34. OECD, Paris.
1. függelék
A FLUORESZCEIN-SZIVÁRGÁSON ALAPULÓ VIZSGÁLATI MÓDSZERHEZ INZERT MEMBRÁNJÁN TENYÉSZTETT MDCK SEJTEKET ÁBRÁZOLÓ DIAGRAM
MDCK sejtek konfluens rétegét egy inzert féligáteresztő membránján kell tenyészteni. Az inzerteket 24-lyukú lemezek lyukaiba kell helyezni.
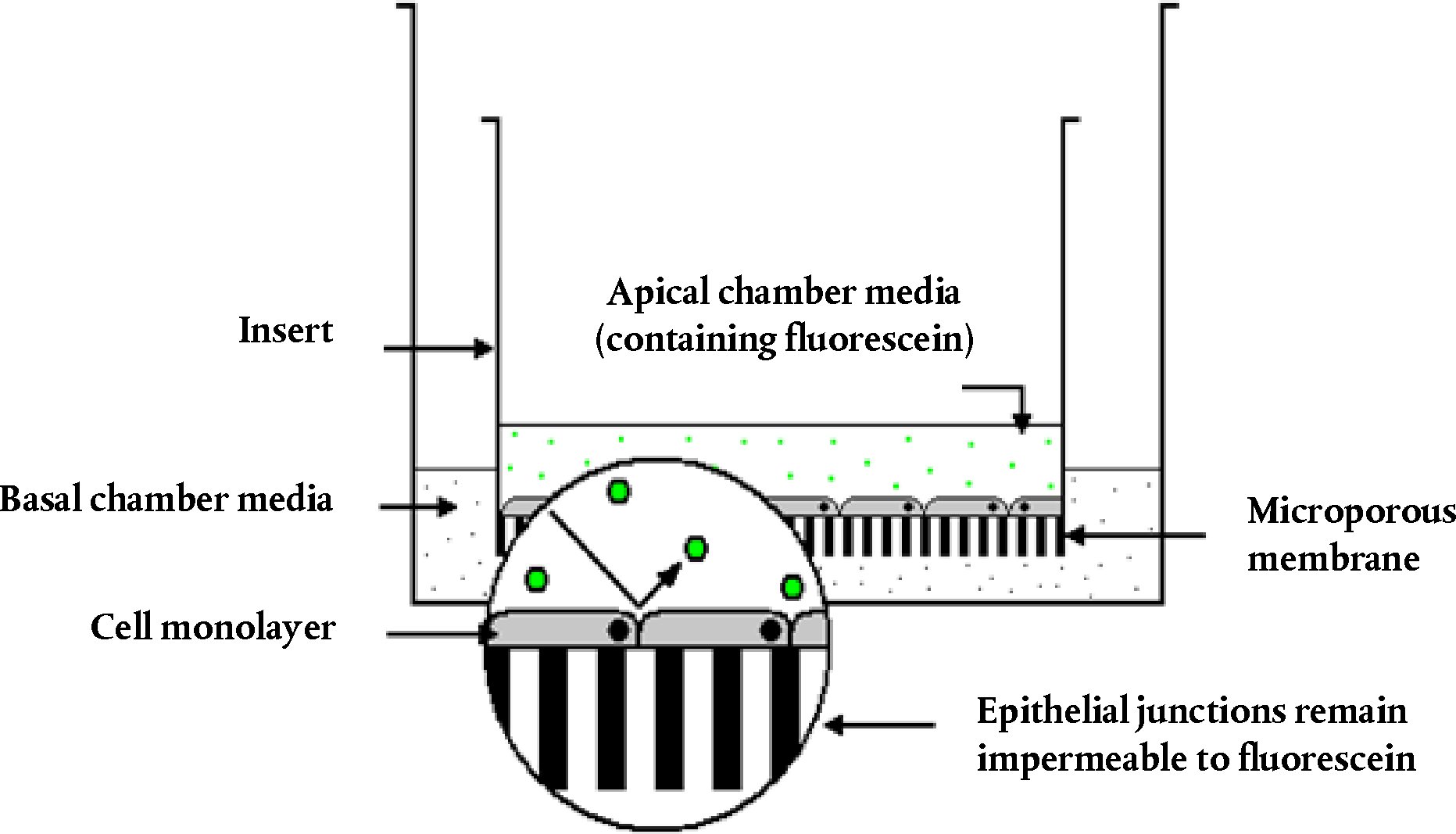
Ábra forrása: Wilkinson, P.J. (2006), Development of an in vitro model to investigate repeat ocular exposure, Ph.D. Thesis, University of Nottingham, UK.
2. függelék
FOGALOMMEGHATÁROZÁSOK
Pontosság : a vizsgálati módszerrel kapott eredmények és az elfogadott referenciaértékek közötti egyezés mértéke. A vizsgálati módszer teljesítőképességét mutatja, és relevanciájának egyik szempontja. A kifejezés gyakran használatos az »egyezés« szó megfelelőjeként, amely arra utal, hogy egy adott vizsgálati módszer milyen arányban szolgáltat helyes eredményeket.
Vegyi anyag : anyag vagy keverék.
EPA szerinti I. Kategória : 21 napnál hosszabb ideig fennálló szemkorróziót (a szem szöveteiben visszafordíthatatlan pusztulást) vagy szaruhártya-elváltozást vagy -irritációt okozó vegyi anyag (2).
CLP-rendelet (az anyagok és keverékek osztályozásáról, címkézéséről és csomagolásáról szóló 1272/2008/EU rendelet) : a vegyi anyagok (anyagok és keverékek) osztályozásának az ENSZ által kidolgozott globálisan harmonizált rendszerét (GHS) az Európai Unióban (EU) végrehajtó rendelet.
Hamis negatív arány : a vizsgálati módszer alkalmazása során tévesen negatívnak minősített pozitív vegyi anyagok részaránya. A hamis negatív arány a vizsgálati módszer teljesítőképességének egyik mutatója.
Hamis pozitív arány : a vizsgálati módszer alkalmazása során tévesen pozitívnak minősített negatív vegyi anyagok részaránya. A hamis pozitív arány a vizsgálati módszer teljesítőképességének egyik mutatója.
FL20 : azon koncentráció meghatározásával becsülhető meg, amelynél a vizsgálati vegyi anyag a sejtrétegen keresztül 20 %-os fluoreszcein-szivárgást okoz.
Fluoreszcein-szivárgás : a sejtrétegen átjutó fluoreszcein spektrofluorométerrel mért mennyisége.
GHS (a vegyi anyagok osztályozásának és címkézésének az ENSZ által globálisan harmonizált rendszere) : a vegyi anyagoknak (anyagoknak és keverékeknek) a fizikai, egészségi és környezeti veszélyek szabványosított típusai és szintjei szerinti osztályokba sorolására és megfelelő kommunikációs elemekkel (például piktogramokkal, figyelmeztetésekkel, figyelmeztető mondatokkal, óvintézkedésekre vonatkozó mondatokkal és biztonsági adatlapokkal) történő jelölésére javaslatokat megfogalmazó rendszer, amelynek célja, hogy az emberek (köztük a munkáltatók, a munkavállalók, a fuvarozók, a fogyasztók és a sürgősségi segélyszolgálatok) és a környezet megóvása érdekében egységesítse a vegyi anyagok káros hatásaira vonatkozó információk továbbítását.
GHS szerinti 1. kategória : a vizsgálati vegyi anyagnak a szem külső felületére való juttatását követően olyan szövetkárosodás kialakulása vagy a látás olyan súlyos fizikai romlása, amely a beadást követően 21 napon belül nem fordítható vissza teljes mértékben.
Veszély : valamely anyag vagy helyzet azon sajátossága, hogy káros hatásokat képes előidézni az élő szervezet, rendszer vagy (al)populáció anyagnak való expozíciójakor.
Keverék : az ENSZ-GHS összefüggésében olyan, két vagy több anyagból álló keverék vagy oldat, amelyben ezek az anyagok nem lépnek egymással reakcióba.
Negatív kontroll : a vizsgálati rendszer valamennyi alkotóelemét tartalmazó kezeletlen replikátum. Ezt a mintát a vizsgálati vegyi anyaggal kezelt mintákkal és más kontrollmintákkal együtt kell feldolgozni annak megállapításához, hogy az oldószer kölcsönhatásba lép-e a vizsgálati rendszerrel.
Nem besorolt : az ENSZ-GHS szerinti 1., 2A. vagy 2B., a CLP-rendelet szerinti 1. vagy 2., vagy az US EPA szerinti I., II. vagy III. kategóriába szemirritációt okozóként nem besorolt vegyi anyagok.
Szemkorróziót okozó anyag : a) a szemben visszafordíthatatlan szövetkárosodást okozó vegyi anyag; b) az ENSZ-GHS szerinti 1., a CLP-rendelet szerinti 1., vagy az US EPA szerinti I. kategóriába besorolt, szemirritációt okozó vegyi anyag.
Szemirritációt okozó anyag : a) olyan vegyi anyag, amelynek a szem külső felületére való felvitele visszafordítható elváltozást okoz; b) az ENSZ-GHS szerinti 2A. vagy 2B., a CLP-rendelet szerinti 2., vagy az US EPA szerinti II. vagy III. kategóriába besorolt, szemirritációt okozó vegyi anyag.
Súlyos szemirritációt okozó anyag : a) olyan vegyi anyag, amelynek a szem külső felületére való felvitele a beadást követően 21 napon belül vissza nem fordítható szövetkárosodást vagy a látás súlyos fizikai romlását okozza; b) az ENSZ-GHS szerinti 1., a CLP-rendelet szerinti 1., vagy az US EPA szerinti I. kategóriába besorolt, szemirritációt okozó vegyi anyag.
Pozitív kontroll : a vizsgálati rendszer valamennyi alkotóelemét tartalmazó, ismert pozitív hatást kiváltó vegyi anyaggal kezelt replikátum. Annak biztosítása érdekében, hogy a pozitív kontrollban jelentkező hatás időbeli változását fel lehessen mérni, a pozitív hatás nem lehet túlságosan erőteljes.
Jártassági tesztanyagok : a referencia-vegyianyagok jegyzékén belüli alcsoport, amelyet a tapasztalattal nem rendelkező laboratóriumok a validált referencia-vizsgálatimódszerben való jártasságuk igazolására használhatnak fel.
Relevancia : a vizsgálat és a vizsgált hatás kapcsolatát adja meg, valamint azt, hogy van-e a vizsgálatnak az adott cél szempontjából értelme és haszna. Azt tükrözi, hogy a vizsgálat mennyire pontosan méri vagy jelzi előre a vizsgált biológiai hatást. A relevancia meghatározása során a vizsgálati módszer pontosságát (az eredmények egyezését) figyelembe kell venni (8).
Megbízhatóság : a vizsgálati módszer laboratóriumon belüli és laboratóriumok közötti időbeli reprodukálhatóságának mértéke ugyanazon protokoll alkalmazása mellett. Megállapítása a laboratóriumon belüli és a laboratóriumok közötti reprodukálhatóság, valamint a laboratóriumon belüli megismételhetőség kiszámításával történik.
Helyettesítő vizsgálat : olyan vizsgálat, amelynek célja, hogy a veszélyek azonosítására és/vagy kockázatértékelésre rutinszerűen alkalmazott és elfogadott vizsgálatot helyettesítse, és amelyről megállapították, hogy az elfogadott vizsgálattal összehasonlítva, az összes lehetséges vizsgálati helyzetben és vegyi anyag esetében a humán vagy állati egészség egyenértékű vagy jobb védelmét biztosítja.
Érzékenység : az összes olyan pozitív/aktív vegyi anyag aránya, amelyet a vizsgálat helyesen sorolt be. A kategorikus eredményt adó vizsgálati módszerek pontosságának mutatója, valamint fontos szempont a vizsgálati módszerek relevanciájának megítélésében (8).
Súlyos szemkárosodás : a vizsgálati vegyi anyagnak a szem külső felületére való juttatását követően olyan szövetkárosodás kialakulása vagy a látás olyan súlyos fizikai romlása, amely a beadást követően 21 napon belül nem fordítható vissza teljes mértékben.
Oldószeres/vivőanyagos kontroll : a vizsgálati rendszer valamennyi alkotóelemét az oldószerrel vagy vivőanyaggal együtt tartalmazó nem kezelt minta, amelyet a vizsgálati vegyi anyaggal kezelt mintákkal és más kontrollmintákkal együtt kell feldolgozni az ugyanazon oldószerben feloldott vagy ugyanazon vivőanyaggal felvitt vizsgálati vegyi anyaggal kezelt minták kiindulási értékeinek megállapítása érdekében. Párhuzamos negatív kontrollal elvégzett vizsgálata esetén ez a minta azt is bizonyítja, hogy az oldószer vagy vivőanyag kölcsönhatásba lép-e a vizsgálati rendszerrel.
Specifikusság : a vizsgálat elvégzésével helyesen besorolt összes negatív/inaktív vegyi anyag aránya. A kategorikus eredményt adó vizsgálati módszerek pontosságának mutatója, valamint fontos szempont a vizsgálati módszerek relevanciájának megítélésében.
Anyag : az ENSZ-GHS összefüggésében használt fogalom a természetes állapotban előforduló vagy ipari termelőfolyamatból származó kémiai elemekre és azok vegyületeire, amelyek a termék stabilitásának megőrzéséhez szükséges adalékanyagokat és az alkalmazott folyamatból származó szennyeződéseket is tartalmazhatnak, de nem tartalmaznak olyan oldószereket, amelyek az anyag stabilitásának befolyásolása vagy összetételének megváltozása nélkül elkülöníthetők.
Vizsgálati vegyi anyag : bármely, e vizsgálati módszer alkalmazásával vizsgált anyag vagy keverék.
Többszintű vizsgálati stratégia : olyan lépcsőzetes vizsgálati stratégia, amelynek keretében a vizsgálati vegyi anyagra vonatkozó valamennyi információt meghatározott sorrendben áttekintik, és az egyes szinteken az adatok bizonyító erejének elemzésével meghatározzák, hogy a következő szintre való továbblépés előtt a veszélyességi osztályozásra vonatkozó döntéshez elegendő információ áll-e rendelkezésre. Ha a vizsgálati vegyi anyag irritatív hatása a rendelkezésre álló információk alapján megállapítható, további vizsgálatra nincs szükség. Ha a vizsgálati vegyi anyag irritatív hatása a rendelkezésre álló információk alapján nem állapítható meg, több lépcsőben egymás után állatkísérleteket kell végezni mindaddig, amíg az egyértelmű besorolás meg nem állapítható.
Validált vizsgálati módszer : olyan vizsgálati módszer, amelynek az adott céllal kapcsolatos relevanciája (pontosságát is ideértve) és megbízhatósága validálási vizsgálatok alapján megállapítást nyert. Fontos megjegyezni, hogy a validált vizsgálati módszer a javasolt felhasználási célra nem feltétlenül kínál megfelelő pontosságú és megbízhatóságú elfogadható eljárást (8).
Az adatok bizonyító erejének mérlegelése : a rendelkezésre álló különféle érvek és ellenérvek mérlegelésének folyamata az adott vegyi anyag veszélyességével kapcsolatban a megfelelő következtetés levonása és alátámasztása céljából.
3. függelék
JÁRTASSÁGI TESZTANYAGOK A FLUORESZCEIN-SZIVÁRGÁSON ALAPULÓ VIZSGÁLATI MÓDSZERHEZ
E vizsgálati módszer rutinszerű alkalmazása előtt a laboratóriumoknak az 1. táblázatban ajánlott 8 vegyi anyag szemkorróziót érintő veszélyességi osztályozásának helyes meghatározásával kell igazolniuk szakmai jártasságukat. E vegyi anyagok kiválasztása úgy történt, hogy a nyulakon végzett in vivo szemvizsgálat (405. vizsgálati iránymutatás, B.5. vizsgálati módszer (5)) alapján a lokális szemirritáció/szemkorrózió (azaz az ENSZ-GHS szerinti 1., 2A. és 2B. kategória, valamint az ENSZ-GHS rendelet szerinti nem besorolt) hatástartománya szempontjából reprezentatívak legyenek. A fluoreszcein-szivárgáson alapuló vizsgálati módszer validált alkalmazási körét (azaz kizárólag a szemkorróziót, illetve a súlyos szemirritációt okozó anyagok azonosítását) figyelembe véve azonban a jártasság igazolása osztályozási célból csak két vizsgálati kimenetelre (szemkorróziót vagy súlyos szemirritációt okozó, vagy szemkorróziót, illetve súlyos szemirritációt nem okozó) értelmezhető. A kiválasztás másik kritériuma az volt, hogy a vegyi anyagok kereskedelmi forgalomban beszerezhetők legyenek, azokra vonatkozóan kiváló minőségű in vivo referenciaadatok álljanak rendelkezésre, és a fluoreszcein-szivárgáson alapuló vizsgálati módszer alapján kiváló minőségű in vitro adatok álljanak rendelkezésre. Ezen okból kifolyólag a jártassági tesztanyagok kiválasztása a „Fluorescein Leakage Assay Background Review Document as an Alternative Method for Eye Irritation Testing” (8) című, a fluoreszcein-szivárgáson alapuló vizsgálati módszer visszamenőleges validálásához felhasznált dokumentum alapján történt.
1. táblázat
A fluoreszcein-szivárgáson alapuló vizsgálati módszerben való szakmai jártasság ellenőrzéséhez ajánlott vegyi anyagok
|
Vegyi anyag |
CASRN |
Kémiai osztály (1) |
Halmazállapot |
In vivo besorolás (2) |
In vitro besorolás (3) |
|
Benzalkónium-klorid (5 %) |
8001-54-5 |
Óniumvegyület |
Folyadék |
1. kategória |
Szemkorróziót/súlyos szemirritációt okozó anyag |
|
Prometazin-hidroklorid |
58-33-3 |
Amin/amidin, heterociklikus, szerves kénvegyület |
Szilárd |
1. kategória |
Szemkorróziót/súlyos szemirritációt okozó anyag |
|
Nátrium-hidroxid (10 %) |
1310-73-2 |
Lúg |
Folyadék |
1. kategória |
Szemkorróziót/súlyos szemirritációt okozó anyag |
|
Nátrium-lauril-szulfát (15 %) |
151-21-3 |
Karbonsav (só) |
Folyadék |
1. kategória |
Szemkorróziót/súlyos szemirritációt okozó anyag |
|
4-karboxi-benzaldehid |
619-66-9 |
Karbonsav, aldehid |
Szilárd |
2(A.) kategória |
Szemkorróziót nem okozó/Súlyos szemirritációt nem okozó |
|
Ammónium-nitrát |
6484-52-2 |
Szervetlen só |
Szilárd |
2(A.) kategória |
Szemkorróziót nem okozó/Súlyos szemirritációt nem okozó |
|
Etil-2-metilaceto-acetát |
609-14-3 |
Keton, észter |
Folyadék |
2(B.) kategória |
Szemkorróziót nem okozó/Súlyos szemirritációt nem okozó |
|
Glicerin |
56-81-5 |
Alkohol |
Folyadék |
Kategória nélküli |
Szemkorróziót nem okozó/Súlyos szemirritációt nem okozó |
|
(1) Az egyes vegyi anyagok kémiai osztályának meghatározása standard osztályozási rendszer alkalmazásával, a National Library of Medicine »Medical Subject Headings« (MeSH) elnevezésű osztályozási rendszere (elérhető a következő címen: http//www.nlm.nih.gov/mesh) alapján történt. (2) A nyulakon végzett in vivo szemvizsgálat (az OECD 405. vizsgálati iránymutatása, a B.5. vizsgálati módszer) eredményei alapján, valamint az ENSZ-GHS és a CLP-rendelet felhasználásával. (3) A fluoreszcein-szivárgáson alapuló vizsgálati módszerrel kapott eredmények alapján (71(6). sz. INVITTOX-protokoll) Rövidítések: CASRN= a Chemicals Abstract Service szerinti nyilvántartási szám |
|||||
B.62. Lúgos közegben végzett in vivo üstökösvizsgálat emlősökön
BEVEZETÉS
Ez a vizsgálati módszer egyenértékű az OECD 489. vizsgálati iránymutatásában (2016) leírt módszerrel. A lúgos közegben végzett in vivo üstökösvizsgálat (egysejtes gélelektroforézis) (a továbbiakban egyszerűen: üstökösvizsgálat) állatok – rendszerint rágcsálók – potenciálisan genotoxikus anyag(ok)nak kitett több szövetéből izolált sejtekben vagy sejtmagokban bekövetkező DNS-száltörések kimutatására használatos. Az üstökösvizsgálatot különféle szakértői csoportok felülvizsgálták, és arra vonatkozóan ajánlásokat tettek közzé (1) (2) (3) (4) (5) (6) (7) (8) (9) (10). E vizsgálati módszer a genetikai toxikológiai vizsgálati módszerek sorozatának részét képezi. Kidolgozásra került egy, a genetikai toxikológiai vizsgálatokról tömör tájékoztatást nyújtó, a vizsgálati iránymutatások közelmúltbeli változásait áttekintő OECD-dokumentum (11).
Az üstökösvizsgálat célja a DNS-károsodást okozó vegyi anyagok azonosítása. Az üstökösvizsgálat lúgos közegben (> pH 13) kimutathatja azokat az egyszeres és kettős DNS-száltöréseket, amelyek például a DNS-sel, az alkalikus közegben labilis helyekkel való közvetlen kölcsönhatásból vagy a DNS kivágásos reparációja miatti átmeneti DNS-száltörésekből fakadnak. E száltörések reparálódhatnak tartós hatás bekövetkezése nélkül, okozhatnak sejthalált, vagy rögzülhetnek tartós, életképes változást eredményező mutációban. Okozhatnak kromoszóma-károsodást is, amely számos emberi betegséggel, többek között a rákkal is összefügg.
A rágcsálókon végzett üstökösvizsgálat hivatalos validációs kísérletét 2006–2012 között, az Alternatív Módszerek Validálásával Foglalkozó Japán Központ (JaCVAM) koordinálása mellett, az Alternatív Módszerek Validálásával Foglalkozó Európai Központ (ECVAM), az alternatív módszerek validálásával foglalkozó ügynökségközi koordinációs bizottság (ICCVAM) és az Országos Toxikológiai Program (NTP) Alternatív Toxikológiai Módszerek Értékelésével Foglalkozó Ügynökségközi Központja (NICEATM) (12) közreműködésével végezték. Ez a vizsgálati módszer tartalmazza az üstökösvizsgálat ajánlott alkalmazását és korlátait, emellett a validálási kísérlet során felhasznált végleges protokollon (12), valamint további releváns, közzétett és közzé nem tett (laboratóriumi védett) adatokon alapul.
A kulcsfontosságú fogalmak meghatározásai az 1. függelékben találhatók. Megjegyzendő, hogy ehhez a vizsgálathoz számos különböző platform használható (mikroszkóp-tárgylemezek, gél-spotok, 96-lyukú lemezek stb.). Praktikus okokból e dokumentum fennmaradó részében végig a »tárgylemez« kifejezés használatos, de magában foglalja az összes többi platformot is.
KIINDULÁSI MEGFONTOLÁSOK ÉS KORLÁTOK
Az üstökösvizsgálat az eukarióta sejtekben bekövetkező DNS-száltörések mérésére szolgáló módszer. A tárgylemezen lévő agarózba helyezett különálló sejteket/sejtmagokat detergenssel, magas sókoncentráció mellett lizálni kell. A lízis szakasza digerálja a sejtek és a sejtmagok membránját, továbbá lehetővé teszi az általában nukleoidoknak és DNS-fragmensnek nevezett spirálszerű DNS-hurkok kioldódását. A magas pH melletti elektroforézis üstökösre emlékeztető szerkezeteket eredményez, amelyek – megfelelő fluoreszcens festékek használatával – fluoreszcens mikroszkópos vizsgálattal megfigyelhetők; a DNS-fragmensek a méretükből adódóan a »magtól« a »csóváig« vándorolnak, és az üstököscsóva intenzitásának az összes intenzitáshoz (a mag és a csóva együttvéve) viszonyított aránya a DNS-töredezettség mértékét tükrözi (13) (14) (15).
A lúgos közegben végzett in vivo üstökösvizsgálat különösen releváns a genotoxikus veszély értékeléséhez, amennyiben a vizsgálatra adott válaszok az in vivo felszívódástól, eloszlástól, metabolizmustól és kiválasztástól (ADME: absorption, distribution, metabolism, excretion), valamint a DNS-reparációs folyamatoktól is függnek. Ezek a fajoktól, a szövetektől és a DNS-károsodás típusaitól függően változhatnak.
Az állatjólétre vonatkozó követelmények teljesítése, különösen az állatok alkalmazásának visszaszorítása (3R-elv – Replacement, Reduction, Refinement; az állatkísérletek helyettesítése, csökkentése, finomítása) érdekében ez a vizsgálat beépíthető más toxikológiai vizsgálatokba, például ismételt dózisú toxicitási vizsgálatokba (10) (16) (17), vagy a végpont ötvözhető más genotoxicitási végpontokkal, például az in vivo emlős eritrocita mikronukleusz-vizsgálattal (18) (19) (20). Üstökösvizsgálatot leggyakrabban rágcsálókon végeznek, bár alkalmazzák más emlősfajokra és emlősöktől eltérő fajokra is. A rágcsálóktól eltérő fajok alkalmazását tudományos és etikai szempontból eseti alapon meg kell indokolni, és kifejezetten ajánlott, hogy üstökösvizsgálatot rágcsálóktól eltérő fajokon csak másik toxicitásvizsgálat keretében végezzenek, nem pedig önálló vizsgálatként.
Az expozíciós út és a vizsgálandó szövet(ek) kiválasztását a vizsgálati vegyi anyagokra vonatkozóan rendelkezésre álló/létező összes ismeret alapján kell meghatározni, például a tervezett/várható emberi expozíciós út, metabolizmus és eloszlás, az érintkezés helyén kiváltott esetleges hatások, szerkezeti figyelmeztető jelek, genotoxicitásra vagy toxicitásra vonatkozó egyéb adatok, valamint a vizsgálat célja alapján. Ezért adott esetben a vizsgálati vegyi anyagok genotoxikus potenciálját meg lehet vizsgálni a rákkeltő és/vagy más toxikus hatás célszövetében/célszöveteiben. Ez a vizsgálat valamely in vitro rendszer által kimutatott genotoxicitás további vizsgálatához is hasznosnak minősül. A vizsgált szövetben akkor helyénvaló in vivo üstökösvizsgálatot végezni, ha ésszerűen lehet számítani a vizsgált szövet megfelelő expozíciójára.
A vizsgálat legkiterjedtebb validálására eddig együttműködésen alapuló vizsgálatok, például a JaCVAM által (12) és Rothfuss és társai által 2010-ben végzett kísérlet (10) keretében, hímivarú patkányok szomatikus szöveteiben került sor. A JaCVAM nemzetközi validálási kísérletben májat és gyomrot használtak. A májat azért, mert a legaktívabb szerv a vegyi anyagok anyagcseréjében és azért is, mert gyakori célszerv a karcinogenitás vizsgálatához. A gyomrot azért használták, mert az orális expozíciót követően általában a gyomor a vegyi anyagokkal való első érintkezés helye, bár a gyomor-bél traktus más területeit, például a patkóbelet és az éhbelet is figyelembe kell venni az érintkezési hely szöveteiként, amelyek relevánsabbnak tekinthetők az emberi gyomor, mint a rágcsálók mirigyes gyomra tekintetében. Ügyelni kell annak biztosítására, hogy ezek a szövetek ne legyenek kitéve a vizsgálati vegyi anyag túl magas koncentrációinak (21). Ez az eljárás elvileg minden olyan szövetre alkalmazható, amelyekből elemezhető, egysejtes szuszpenziók vagy sejtmagszuszpenziók állíthatók elő. Több laboratórium védett adatai igazolják, hogy sikeresen alkalmazható sok különféle szövetnél, és számos olyan kiadvány létezik, amelyekből kiderül, hogy az eljárás alkalmazható májtól és gyomortól eltérő szervekre vagy szövetekre, például az éhbélre (22), a vesére (23) (24), a bőrre (25) (26), vagy a húgyhólyagból (27) (28), a tüdő- és bronchoalveoláris mosásból származó (a belélegzett vegyi anyagok vizsgálata szempontjából releváns) sejtekre (29) (30), a vizsgálatokat emellett elvégezték több szerven is (31) (32).
Bár a csírasejtekre kifejtett genotoxikus hatások érdekesek lehetnek, meg kell jegyezni, hogy a lúgos közegben végzett standard üstökösvizsgálat, ahogyan e vizsgálati módszer leírásában szerepel, az érett csírasejtekben végbemenő DNS-száltörések méréséhez nem tekintendő megfelelőnek. Mivel a csírasejt-genotoxicitásra irányuló üstökösvizsgálat (33) alkalmazásával kapcsolatos szakirodalmi áttekintésben a DNS-károsodásra vonatkozóan magas és változó szintű háttérértékeket közöltek, az érett csírasejtekre (például spermára) irányuló üstökösvizsgálatnak a vizsgálati módszerbe való beépíthetősége előtt szükség lehet a protokoll módosítására, valamint jobb szabványosítási és validálási vizsgálatokra. Ezen túlmenően az e vizsgálati módszerben ismertetett, ajánlott expozíciós séma nem optimális, és az érett spermában bekövetkező DNS-száltörések érdemi elemzéséhez hosszabb expozíciós vagy mintavételi időre lenne szükség. A szakirodalomban a különböző differenciálódási szakaszokban lévő heresejteken végzett üstökösvizsgálattal mért genotoxikus hatásokról számoltak be (34) (35). Megjegyzendő azonban, hogy az ivarmirigyek szomatikus és csírasejteket egyaránt tartalmaznak. Ezen okból kifolyólag a teljes ivarmirigyben (herében) kapott pozitív eredmények nem feltétlenül tükröznek csírasejt-károsodást, mindazonáltal azt jelzik, hogy a vizsgálati vegyi anyag(ok) és/vagy metabolitjai(k) elérték az ivarmirigyet.
Az üstökösvizsgálat standard kísérleti körülményei mellett a keresztkötések nem mutathatók ki megbízhatóan. Bizonyos, módosított kísérleti körülmények mellett a DNS-DNS és a DNS-fehérje keresztkötések és más bázismódosulások, például oxidálódott bázisok mutathatók ki (23) (36) (37) (38) (39). A protokoll szükséges módosításainak megfelelő jellemzéséhez azonban további munkára lenne szükség. Ezért az itt ismertetett vizsgálatnak nem a keresztkötő ágensek kimutatása az elsődleges célja. A vizsgálat még módosításokkal együtt sem megfelelő az aneugének kimutatására.
A tudomány jelenlegi állása miatt az in vivo üstökösvizsgálathoz több további korlát kapcsolódik (lásd a 3. függeléket). A vizsgálati módszer a jövőben várhatóan felülvizsgálat tárgyát fogja képezni, és szükség esetén a szerzett tapasztalatok fényében is felülvizsgálatra kerül.
A vizsgálati módszer tervezett szabályozási célt szolgáló adatgenerálás érdekében, keveréken történő alkalmazása előtt meg kell vizsgálni, hogy az megfelelő eredményeket biztosíthat-e erre a célra, és ha igen, miért. Ilyen megfontolások nem szükségesek, ha létezik a keverék vizsgálatára vonatkozó szabályozási követelmény.
A VIZSGÁLATI MÓDSZER ELVE
Az állatokat megfelelő módon kell a vizsgálati vegyi anyagnak kitenni. Az adagolás és a mintavétel részletes leírása a 36–40. pontban található. A kiválasztott mintavételi időpont(ok)ban a vizsgált szöveteket preparálni kell, majd egysejtes szuszpenziókat vagy sejtmagszuszpenziókat kell készíteni (hasznosnak ítélt esetben, például máj esetében in situ perfúzió végezhető), és azokat puha agarba kell ágyazni, hogy ne mozduljanak el a tárgylemezeken. A sejteket/sejtmagokat lízispufferrel kell kezelni a sejt és/vagy a sejtmag membránjának eltávolítása érdekében, és erős lúgnak (például pH≥13) kell kitenni a DNS kitekeredésének, valamint a kilazult DNS-hurkok és -fragmensek kioldódásának lehetővé tétele érdekében. Az agarban lévő sejtmag-DNS-t ezt követően elektroforézisnek kell alávetni. A rendes, nem fragmentált DNS-molekulák abban a helyzetben maradnak, amelyben a sejtmag-DNS volt az agarban, míg a fragmentált DNS-ek és a kilazult DNS-hurkok az anód felé vándorolnak. Az elektroforézist követően a DNS-t megfelelő fluoreszcens festék segítségével kell megjeleníteni. A preparátumokat mikroszkóp, valamint teljesen vagy félig automatizált képelemző rendszerek segítségével kell elemezni. Az elektroforézis során történő DNS-vándorlás mértéke és távolsága a DNS-fragmensek mennyiségét és méretét tükrözi. Az üstökösvizsgálat esetében több végpont van. A DNS-károsodás vizsgálatához a csóvában lévő DNS-tartalom (csóva DNS %-os aránya vagy a csóva intenzitásának %-os aránya) ajánlott (12) (40) (41) (42). Elegendő számú sejtmag elemzését követően a vizsgálati eredmények elbírálása érdekében az adatokat megfelelő módszerekkel kell elemezni.
Megjegyzendő, hogy a módszertan különböző aspektusainak – többek között a minták preparálásának, az elektroforézis feltételeinek, a vizuális elemzési paramétereknek (például a festék intenzitásának, a mikroszkóp-izzófény intenzitásának, illetve a mikroszkópszűrő- és -kameradinamikák használatának) és a környezeti feltételeknek (például a háttérvilágításnak) – a módosítása vizsgálat tárgyát képezte és befolyásolhatja a DNS-vándorlást (43) (44) (45) (46).
A LABORATÓRIUM JÁRTASSÁGÁNAK IGAZOLÁSA
Az egyes laboratóriumoknak az üstökösvizsgálatban való kísérleti szakértelmüket annak demonstrálásával kell igazolniuk, hogy mindegyik alkalmazott faj mindegy egyes célszövete esetében képesek megfelelő minőségű egysejtes szuszpenziókat vagy sejtmagszuszpenziókat előállítani. A preparátumok minőségét először a vivőanyaggal kezelt állatok reprodukálhatóan alacsony tartományba eső %-os csóva DNS-ével kell értékelni. A jelenlegi adatok szerint a patkánymájban a csóva DNS %-os arányának csoportos átlaga (a mediánok átlaga alapján, e kifejezések részletezését lásd az 57. pontban) lehetőleg ne haladja meg a 6 %-ot, ami összhangban lenne a JaCVAM validálási kísérletében (12) szereplő értékekkel, valamint más, közzétett és védett adatokkal. Jelenleg nem áll rendelkezésre elég információ ahhoz, hogy az egyéb szövetek esetében optimális vagy elfogadható tartományokra vonatkozóan ajánlásokat lehessen megfogalmazni. Ez indokolt esetben nem zárja ki eleve más szövetek alkalmazását. A Vizsgálati jegyzőkönyvnek megfelelő áttekintést kell adnia az e szövetekben végrehajtott üstökösvizsgálat teljesítőképességéről, a közzétett szakirodalomra vagy a védett adatokra hivatkozással. Először is a csóva DNS %-os arányának a kontrollokban lehetőleg alacsony tartományban kell lennie ahhoz, hogy pozitív hatás kimutatásához kellően dinamikus tartományt lehessen biztosítani. Másodszor, az egyes laboratóriumoknak képesnek kell lenniük arra, hogy a különböző hatásmechanizmusú, az 1. táblázatban javasolt direkt mutagén és a promutagén anyagok esetében reprodukálják a várt válaszokat (lásd a 29. pontot).
Adott esetben ki lehet választani pozitív anyagokat például a JaCVAM validálási kísérletéből (12) vagy más közzétett adatok alapján (lásd a 9. pontot), a választást meg kell indokolni, és a vizsgált szövetekben kiváltott, egyértelmű pozitív válaszokat demonstrálni kell. Az ismert mutagének, például az alacsony dózisban adagolt EMS elenyésző hatásának kimutatására való képességet is igazolni kell, például megfelelő számú és elosztású dózisokkal fennálló dózis-válasz összefüggések létrehozásával. Eleinte a leggyakrabban használt szövetek, például a rágcsálómáj tekintetében szerzett jártasságra kell összpontosítani, ahol a meglévő adatokkal és a várt eredményekkel összehasonlítást lehet végezni (12). Más szövetekből, például a gyomorból, a patkóbélből, az éhbélből, a vérből stb. származó adatokat egyszerre kell összegyűjteni. A laboratóriumnak minden vizsgálni tervezett faj minden egyes szövete tekintetében igazolnia kell a jártasságát, továbbá azt, hogy egy ismert mutagénnel (például EMS-sel) elfogadható pozitív válasz kapható az adott szövetben.
A vivőanyagos/a negatív kontrollokra vonatkozó adatokat össze kell gyűjteni a negatív adatválaszok reprodukálhatóságának igazolása, valamint annak megállapítása érdekében, hogy a vizsgálat technikai aspektusait megfelelően kontrollálták, illetve annak jelzésére, hogy a kontrollok történeti tartományát újra létre kell hozni (lásd a 22. pontot).
Megjegyzendő, hogy míg boncoláskor többféle szövet begyűjthető és feldolgozható üstökösvizsgálat céljából, a laboratóriumnak jártasnak kell lennie egyetlen állat többféle szövetének begyűjtésében, biztosítva ezáltal, hogy egyetlen potenciális DNS-károsodás se vesszen el és az üstökösvizsgálat ne kerüljön veszélybe. Az eutanáziától a szövetek feldolgozás céljából végzett eltávolításáig eltelt idő kritikus jelentőségű lehet (lásd a 44. pontot).
Az e vizsgálatban való jártasság kialakítása során figyelembe kell venni az állatjólétet, ennélfogva az egyéb vizsgálatok során felhasznált állatok szövetei felhasználhatók a vizsgálat különböző aspektusaival kapcsolatos kompetencia kifejlesztése során. Ezen túlmenően nem feltétlenül kell teljes körű vizsgálatot végrehajtani az új vizsgálati módszerek laboratóriumi kialakításának szakaszaiban, a szükséges készségek kifejlesztése során pedig kevesebb állatot vagy vizsgálati koncentrációt lehet alkalmazni.
Történeti kontrollokadatok
A jártassági vizsgálatok során a laboratóriumnak a releváns szövetek és fajok esetében a pozitív és negatív kontrollok történeti tartományának és eloszlásának megállapítását szolgáló történeti adatbázist kell kiépítenie. A történeti adatok összeállításának és felhasználásának módjára (azaz az adatok történeti adatokhoz számításának és azok közül való kizárásának kritériumaira, valamint egy adott kísérlet elfogadhatósági kritériumaira) vonatkozó ajánlások megtalálhatók a szakirodalomban (47). A különböző szövetek és a különböző fajok, továbbá a különböző vivőanyagok és beadási módok a negatív kontrollok esetében eltérő értékeket adhatnak a csóva DNS %-os arányára. Ezért fontos minden egyes szövet és faj esetében negatív kontrollokra vonatkozó tartományokat létrehozni. A laboratóriumoknak minőségellenőrzési módszereket, például ellenőrzési diagramokat (C-diagramokat vagy X-bar diagramokat (48)) kell alkalmazniuk annak meghatározására, hogy adataik mennyire változóak, valamint annak bizonyítására, hogy náluk a módszertan »ellenőrzés alatt« áll. Előfordulhat, hogy a megfelelő pozitív kontrollanyagokat, a dózistartományokat és a kísérleti körülményeket (például az elektroforézis feltételeit) is optimalizálni kell az elenyésző hatások kimutatásához (lásd a 17. pont).
A kísérleti protokoll bármely módosítását meg kell vizsgálni abból a szempontból, hogy összhangban van-e a laboratórium meglévő történeti kontrolladatbázisaival. Jelentősebb következetlenségek fennállása esetén új történeti kontrolladatbázist kell létrehozni.
A MÓDSZER LEÍRÁSA
Előkészületek
Az állatfaj kiválasztása
Szokásosan egészséges, fiatal, ivarérett, általánosan használt laboratóriumi törzsekből származó rágcsálókat kell alkalmazni (amelyeknek a kezelés kezdetén 6–10 hetesnek kell lenniük, bár valamivel idősebb állatok is elfogadhatóak). A rágcsálófaj kiválasztásának i. (az adatok viszonyíthatósága és az integrált vizsgálatok elvégezhetősége érdekében) az egyéb toxicitásvizsgálatokban használt fajokon, ii. (a karcinogenezis mechanizmusának vizsgálata során) a karcinogenitás-vizsgálatban tumort kifejlesztett fajokon, vagy iii. az emberek szempontjából leginkább releváns anyagcseréjű fajokon kell alapulnia, ha ismerek ilyen fajok. E vizsgálatban rendszerint patkányokat kell használni. Etikai és tudományosan indokolt esetben azonban más fajok is használhatók.
Az állatok tartásának és etetésének körülményei
Rágcsálók esetében a kísérleti helyiség hőmérsékletének ideális esetben 22 °C (±3 °C)-nak kell lennie. Ideális esetben a helyiség relatív páratartalmának 50–60 %-nak kell lennie, de legyen legalább 30 %, illetve a takarítás időtartamától eltekintve lehetőleg ne haladja meg a 70 %-ot. A világítás legyen mesterséges; 12 órás világos és 12 órás sötét periódusok váltsák egymást. Az etetéshez standard laboratóriumi takarmány alkalmazható, korlátlan mennyiségű ivóvíz biztosítása mellett. A takarmány megválasztását a vizsgálati vegyi anyaggal való megfelelő keveredés szükségessége is befolyásolhatja, ha a vizsgálati vegyi anyag beadása ilyen módon történik. A rágcsálókat azonos ivarú rágcsálókból (általában legfeljebb öt egyedből) álló kis csoportokban kell elhelyezni, amennyiben nem várható agresszív viselkedés. Az állatok kizárólag tudományosan indokolt esetben tarthatók egyenként. Amennyiben lehetséges, szilárd aljzatot kell használni, mivel a rácspadló súlyos sérülést okozhat (49). Megfelelő környezetgazdagítást kell biztosítani.
Az állatok előkészítése
Az állatokat véletlenszerűen kell besorolni a kontroll- és kezelt csoportokba. Az egyes állatokat egyedi azonosítóval kell ellátni, és a kezelés megkezdése előtt legalább öt napig szoktatni kell a laboratóriumi körülményekhez. Az állatok azonosításához a legkevésbé invazív módszert kell alkalmazni. Megfelelő módszer a gyűrűzés, a címkézés, a mikrocsip beültetése vagy a biometrikus azonosítás. A fül vagy a lábujj kilyukasztása tudományosan nem indokolt ezekben a vizsgálatokban. A ketreceket úgy kell elrendezni, hogy a lehető legkisebb legyen a ketrec elhelyezéséből eredő esetleges hatás. A vizsgálat kezdetén az állatok tömege közötti eltérésnek minimálisnak kell lennie és nem haladhatja meg a ± 20 %-ot.
A dózisok előkészítése
Az állatoknak történő adagolás előtt a szilárd halmazállapotú vizsgálati vegyi anyagokat fel kell oldani vagy szuszpendálni kell megfelelő vivőanyagokban, vagy bele kell keverni a takarmányba vagy az ivóvízbe. A folyékony vizsgálati vegyi anyagok közvetlenül adagolhatók vagy az adagolás előtt hígíthatók. Belélegzéses expozíció esetén a vizsgálati vegyi anyagok fizikai-kémiai tulajdonságaiktól függően gáz, gőz vagy szilárd/folyadék aeroszol formában adagolhatók (50) (51).
A vizsgálati vegyi anyagból mindig friss készítményeket kell alkalmazni, kivéve akkor, ha a stabilitási adatok bizonyítják a tárolás elfogadhatóságát és meghatározzák a megfelelő tárolási feltételeket.
Vizsgálati körülmények
Vivőanyag
A vivőanyag nem okozhat toxikus hatásokat az alkalmazott dózisok mellett, és nem alkalmazható olyan vivőanyag, amelyről feltehető, hogy kémiai reakcióba fog lépni a vizsgálati vegyi anyagokkal. Jól ismert oldószerektől eltérő vivőanyagok használata esetén azok használatát alá kell támasztani a kísérleti állatok, a beadási mód és a végpont tekintetében a kompatibilitásukat jelző referenciaadatokkal. Amennyiben lehetséges, először valamilyen vizes oldószer/vivőanyag használatát ajánlatos megfontolni. Megjegyzendő, hogy egyes vivőanyagok (különösen a viszkózus vivőanyagok) gyulladást okozhatnak és az érintkezés helyén növelhetik a DNS-száltörések háttérszintjét, különösen többszöri beadás esetén.
Kontrollok
Pozitív kontrollok
Ez alkalommal legalább három, egy ivarhoz tartozó, vagy mindkét ivar használata esetén mindkét ivarhoz tartozó állatból álló (lásd a 32. pontot), pozitív kontrollal kezelt csoportot kell alkalmazni minden vizsgálatnál. Lehet, hogy a jövőben igazolható lesz, hogy a megfelelő jártassággal csökkenthető a pozitív kontrollok szükségessége. Több mintavételi időpont alkalmazása esetén (például egyetlen beadást tartalmazó protokollnál) elég az egyik mintavételi időpontban pozitív kontrollt alkalmazni, de biztosítani kell a kiegyensúlyozott kísérlettervezést (lásd a 48. pontot). A párhuzamos pozitív kontrollanyagokat nem szükséges a vizsgálati vegyi anyaggal azonos útvonalon adagolni, bár az érintkezés helyén kifejtett hatások mérésekor fontos ugyanannak az útvonalnak az alkalmazása. A pozitív kontrollanyagoknak igazoltan DNS-száltöréseket kell előidézniük a vizsgálati vegyi anyag szempontjából lényeges összes szövetben; a választott pozitív kontroll valószínűsíthetően az EMS, mivel az az összes vizsgált szövetben DNS-száltöréseket okoz. A pozitív kontrollanyagok dózisát úgy kell megválasztani, hogy mérsékelt hatást fejtsenek ki, lehetővé téve a vizsgálat teljesítőképességének és érzékenységének kritikus szempontú értékelését; e dózisok a laboratórium által a jártasság igazolása során készített dózis-válasz görbéken is alapulhatnak. A párhuzamos pozitív kontroll állataiban a csóva DNS %-os arányának összhangban kell lennie az adott faj egyes szövetei és az adott fajnál alkalmazott mintavételi időpont esetében előre meghatározott laboratóriumi tartománnyal (lásd a 16. pontot). A pozitív kontrollként szolgáló anyagokra és a hozzájuk tartozó (rágcsáló) célszövetekre az 1. táblázat tartalmaz példákat. Az 1. táblázatban megadottaktól eltérő anyagok tudományosan indokolt esetben választhatók.
1. táblázat
Példák a pozitív kontrollként szolgáló anyagokra és azok célszöveteire
Etil-metánszulfonát (CAS-szám: 62-50-0) bármely szövet esetében
N-etil-N-nitrozo-karbamid (CAS-szám: 759-73-9) a máj, a gyomor, a patkóbél vagy az éhbél esetében
Metil-metánszulfonát (CAS-szám: 66-27-3) a máj, a gyomor, a patkóbél vagy az éhbél esetében, a tüdő- és bronchoalveoláris (BAL) mosással kinyert sejtek, a vese, a húgyhólyag, a tüdő, a here és a csontvelő/vér esetében
N-metil-N′ -nitro-N-nitrozoguanidin (CAS-szám: 70-25-7) a gyomor, a patkóbél vagy az éhbél esetében
1,2-dimetil-hidrazin 2-hidroklorid (CAS-szám: 306-37-6) a máj és a zsigerek esetében
N-metil-N-nitrozo-karbamid (CAS-szám: 684-93-5) a máj, a csontvelő, a vér, a vese, a gyomor, az éhbél és az agy esetében.
Negatív kontrollok
Az egyes vizsgálatokban minden mintavételi időpont és szövet esetében csak vivőanyaggal és egyébiránt a kezelt csoportokéval megegyező módon kezelt negatív kontrollállat-csoportot kell használni. A negatív kontroll állataiban lévő csóva DNS %-os arányának az adott faj egyes szövetei és az adott fajnál alkalmazott mintavételi időpont esetében előre meghatározott laboratóriumi háttértartományban kell lennie (lásd a 16. pontot). Ha a kontrollokra vonatkozóan nem állnak rendelkezésre olyan történeti vagy közzétett adatok, amelyek igazolják, hogy a választott vivőanyag, a beadások száma vagy a beadási mód nem idéz elő ártalmas vagy genotoxikus hatásokat, a vivőanyag-kontroll elfogadhatóságának megállapítása érdekében a teljes vizsgálat lebonyolítása előtt kiindulási vizsgálatot kell végezni.
ELJÁRÁS
Az állatok száma és ivara
Bár kevés adat létezik olyan nőivarú állatokra vonatkozóan, amelyek alapján ivarok közötti összehasonlítást lehetne végezni az üstökösvizsgálattal kapcsolatban, az egyéb in vivo genotoxicitási válaszok általában hasonlóak a hím- és a nőivarú állatok között, ezért a vizsgálatok többsége mindkét ivarnál elvégezhető. A hímek és a nőstények közötti lényeges eltéréseket (például a szisztémás toxicitás, a metabolizmus, a biológiai hasznosíthatóság stb. például többek között dózisbehatároló vizsgálattal megállapított eltéréseit) bizonyító adatok mindkét ivar használatát ösztönzik. Ebben az esetben helyénvaló lehet mindkét ivarnál vizsgálatot végezni, például ismételt dózisú toxicitási vizsgálat keretében. Mindkét ivar használata esetén helyénvaló lehet a faktoriális kísérlettervezés alkalmazása. Az e kísérlettervezés segítségével végzendő adatelemzés részletei a 2. függelékben találhatók.
A vizsgálat megkezdésekor (és a jártasság megállapítása során) a csoportok méretét úgy kell megállapítani, hogy csoportonként legalább öt azonos ivarú – illetve mindkét ivar használata esetén mindkét ivarból öt – (a párhuzamos pozitív kontrollcsoportban kevesebb; lásd a 29. pontot) elemezhető állat legyen. Amennyiben a vegyi anyagoknak való emberi expozíció szexspecifikus lehet, mint például egyes gyógyszerek esetében, a vizsgálatot a megfelelő ivarú állatokkal kell elvégezni. Útmutatás a tipikus állatok maximális számára vonatkozó követelményhez: a 33. pontban megállapított paraméterek szerint, három dóziscsoporttal, valamint párhuzamos negatív és pozitív kontrollcsoportokkal (melyek mindegyike öt, egy ivarhoz tartozó állatból áll) végzett vizsgálathoz 25–35 állatra lenne szükség.
A KEZELÉS ÜTEMTERVE
Az állatokat legalább két napon át napi rendszerességgel kezelni kell (azaz az állatokat kb. 24 órás időközönként két vagy több alkalommal kell kezelni), és a mintákat az utolsó kezelést követő 2–6 órában (vagy a Tmax időpontban) kell begyűjteni (12). A hosszabb ideig tartó adagolási rendből (például 28 napos napi adagolásból) származó minták elfogadhatóak. Bizonyítást nyert, hogy az üstökösvizsgálat és az eritrocita mikronukleusz-vizsgálat sikeresen ötvözhető (10) (19). Az üstökösvizsgálat céljából történő szövetmintavétel lebonyolítását, valamint a más típusú toxikológiai vizsgálatokhoz végzett szövetmintavétel követelményeit azonban alaposan figyelembe kell venni. Az utolsó dózist követő 24 óra elteltével végzett mintagyűjtés, amely az általános toxicitásvizsgálatok esetében jellemző, a legtöbb esetben nem megfelelő (lásd a mintavétel időpontjáról szóló 40. pontot). Más kezelési és mintavételi ütemtervek alkalmazását meg kell indokolni (lásd a 3. függeléket). Alkalmazható például egyetlen kezelés és több mintavétel, azonban megjegyzendő, hogy az egyetlen beadással végzett vizsgálathoz a több mintavételi időpont szükségessége miatt több állatra van szükség, de alkalmanként ez előnyben részesíthető, például akkor, ha a vizsgálati vegyi anyag a megismételt beadását követően túlzott toxicitást idéz elő.
A vizsgálat végrehajtásának módjától függetlenül a vizsgálat elfogadható, amennyiben a vizsgálati vegyi anyag pozitív választ vált ki, illetve negatív vizsgálat esetében, amennyiben igazolást nyert a célszövet(ek) expozícióját vagy a célszövet(ek)re kifejtett toxikus hatást közvetlen vagy közvetett módon alátámasztó bizonyíték, vagy a határdózis elérése esetén (lásd a 36. pont).
A vizsgálati vegyi anyagok több dózisra osztva is beadhatók, például nagy mennyiségű anyag beadásának megkönnyítése érdekében ugyanazon a napon két, legfeljebb 2–3 órás időközönként végzett kezeléssel. Ilyen körülmények között a mintavételi időpontokat az utolsó adagolás időpontja alapján kell ütemezni (lásd a 40. pontot).
Dózisszintek
Ha előzetes dózisbehatároló vizsgálatra kerül sor amiatt, hogy más, releváns vizsgálatokból nem állnak rendelkezésre megfelelő adatok a dózisok kiválasztásának segítéséhez, azt ugyanazon laboratóriumban, ugyanazon fajok, törzsek, ivarok és kezelési eljárások alkalmazásával kell végrehajtani, mint amelyek a fő vizsgálatban alkalmazandóak, a dózisbehatároló vizsgálat végrehajtására vonatkozó aktuális megközelítések szerint. A vizsgálatnak a maximális tolerálható dózis (MTD) meghatározására kell irányulnia, amely a vizsgálati időszak hosszához képest enyhe toxikus hatásokat kiváltó dózis (például egyértelmű klinikai tüneteket, köztük rendellenes viselkedést vagy reakciókat, enyhe testtömeg-csökkenést vagy a célszövetben citotoxicitást vált ki), de amely elhullást, illetve eutanáziát igénylő, bizonyított fájdalmat, szenvedést vagy szorongást nem idéz elő. Legalább 14 napig adagolt, nem toxikus vizsgálati vegyi anyag esetén a maximális dózis (határdózis) 1 000 mg/testtömeg kg/nap. 14 napnál rövidebb beadási időszak esetén a maximális dózis (határdózis) 2 000 mg/testtömeg kg/nap. Ezek a határértékek a vizsgálati vegyi anyagok bizonyos, külön szabályozás hatálya alá tartozó típusai (például a humán gyógyszerek) esetében változóak lehetnek.
Azok a vegyi anyagok, amelyek a toxikokinetikai tulajdonságok telítődését mutatják, vagy olyan detoxifikációs folyamatokat idéznek elő, amelyek hosszú távú beadás után az expozíció csökkenéséhez vezethetnek, kivételek lehetnek a dózisbeállítási kritériumok alól, és azokat eseti alapon kell értékelni.
Az üstökösvizsgálat akut és szubakut változata esetében egyaránt a maximális dózis (MTD, maximális megvalósítható dózis, maximális expozíciós dózis vagy határdózis) mellett az egyes mintavételi időpontok esetében a dózissal összefüggő válaszok bizonyításához legalább két további, megfelelően elosztott (lehetőleg kevesebb mint 10 hányadosú) dózisszint csökkenő sorozatát kell kiválasztani. Az alkalmazott dózisszinteknek ugyanakkor lehetőleg át kell fogniuk a maximálistól a már csak kissé vagy egyáltalán nem toxikusig terjedő tartományt is. Ha a célszövet toxicitása valamennyi vizsgált dózisszintnél megfigyelhető, érdemes nem toxikus dózisoknál további vizsgálatot végezni (lásd az 54–55. pontot). A dózis-válasz görbe alakjának teljesebb körű jellemzését célzó vizsgálatok további dóziscsoporto(ka)t tehetnek szükségessé.
A dózisok beadása
Az emberi expozíció várható útját figyelembe kell venni a vizsgálat tervezése során. Ezért az egyéb expozíciós utak (például takarmány, ivóvíz, helyi szubkután, intravénás, orális (gyomorszondával), inhalációs, intratracheális vagy implantáció) is kiválaszthatók indokoltként. Az utat mindenesetre úgy kell kiválasztani, hogy biztosítsa a célszövet(ek) megfelelő expozícióját. A hasüregbe adott injekció általában nem ajánlott, mivel az nem jellemző emberi expozíciós út, és kizárólag tudományos indokolással alkalmazható (például vizsgálati célra alkalmazott egyes pozitív kontrollanyagok vagy bizonyos, hasüregbe adott gyógyszerek esetében). A gyomorszondán át vagy injekcióval egyszerre beadható maximális folyadékmennyiség a kísérleti állat méretétől függ. A térfogata nem haladhatja meg a 1 ml/100 testtömeggramm mennyiséget, kivéve vizes oldatok esetén, amelyeknél legfeljebb 2 ml/100 testtömeggramm használható. Ennél nagyobb mennyiségek használatát (ha az állatjóléti tárgyú jogszabályok lehetővé teszik) meg kell indokolni. Amennyiben lehetséges, a különböző dózisszinteket az adagolt készítmény koncentrációjának kiigazításával kell elérni, hogy valamennyi dózisszintnél a testtömeghez képest állandó térfogatot lehessen biztosítani.
Mintavételi időpont
A mintavételi időpont kritikus változó, ugyanis az az időszak határozza meg, amely ahhoz szükséges, hogy a vizsgálati vegyi anyagok maximális koncentrációt érjenek el a célszövetben, valamint ahhoz, hogy DNS-száltörések következzenek be, de még mielőtt ezek a törések megszűnnek, reparálódnak vagy sejthalálhoz vezetnek. Az üstökösvizsgálattal kimutatott egyes, DNS-száltörésekhez vezető léziók fennállása nagyon rövid lehet, legalább is egyes, in vitro körülmények között vizsgált vegyi anyagok esetében (52) (53). Ennek megfelelően, amennyiben feltehető, hogy átmeneti DNS-károsodások alakulnak ki, intézkedéseket kell tenni az eltűnésük mérséklése érdekében, mégpedig annak biztosításával, hogy a szövetmintavételre kellően korán, lehetőleg az alább megadott, alapértelmezett időpontok előtt kerüljön sor. Az optimális mintavételi időpont(ok) a vegyi anyagra vagy a beadási módra jellemző(ek) lehet(nek), ami például a szövet intravénás beadással történő vagy belélegzéses expozíciója esetén gyors expozíciót eredményez. Ennek megfelelően a mintavételi időpontokat kinetikus adatok alapján kell meghatározni, ha rendelkezésre állnak ilyen adatok (például Tmax időpontban, a plazmán vagy a szöveten belüli csúcskoncentráció (Cmax) elérésekor, vagy többszöri beadás esetén állandósult állapotban). Kinetikus adatok hiányában a genotoxicitás mérésére megfelelő kompromisszumot jelent két vagy több kezelés esetén az utolsó kezelést követő 2–6 órán belüli mintavétel, illetve egyszeri beadást követően 2–6 órán belüli és 16–26 órán belüli mintavétel, bár ügyelni kell arra, hogy az utolsó (vagy egyetlen) dózist követően minden állat boncolása egyszerre történjen. A célszervekben kiváltott toxikus hatások megjelenésére vonatkozó adatok (ha rendelkezésre állnak) szintén felhasználhatók a megfelelő mintavételi időpontok kiválasztásához.
Megfigyelések
Naponta legalább egyszer, lehetőleg minden nap ugyanazon időpont(ok)ban az állatok egészségére vonatkozó, általános klinikai megfigyelést kell végezni és azt dokumentálni kell, figyelembe véve az adagolást követően várható hatások érvényesülésének csúcsidőszakát (54). Naponta legalább kétszer meg kell vizsgálni az összes állatot megbetegedés és elhullás szempontjából. Hosszabb időtartamú vizsgálatok esetén az állatokat legalább hetente egyszer, valamint a vizsgálati időszak befejeződésekor le kell mérni. A felvett táplálékot a takarmány megváltoztatásakor és legalább heti rendszerességgel le kell mérni. Amennyiben a vizsgálati vegyi anyag beadására az ivóvízzel együtt kerül sor, a vízfogyasztást minden vízcsere alkalmával és legalább hetente le kell mérni. A túlzott toxicitás nem halálos jeleit mutató állatokon a vizsgálati időszak befejeződése előtt eutanáziát kell végrehajtani, és azok általában nem használhatóak üstökösvizsgálathoz.
A szövetek gyűjtése
Mivel a DNS-száltörések (üstökösök) indukcióját gyakorlatilag bármilyen szövetben tanulmányozni lehet, a begyűjtendő szövet(ek) kiválasztását egyértelműen meg kell indokolni, és azt a vizsgálat lefolytatásának okára, illetve a vizsgálati vegyi anyaggal kapcsolatban rendelkezésre álló ADME-, genotoxicitási, karcinogenitási és más toxicitási adatokra kell alapozni. A megfontolandó lényeges tényezők közé kell tartoznia a vizsgálati vegyi anyagok beadási útjának (a valószínű emberi expozíciós útra/utakra alapozva), becsült szöveti megoszlásának és felszívódásának, anyagcseréje szerepének, valamint a lehetséges hatásmechanizmusának. A leggyakrabban vizsgált szövet a máj, és a májra vonatkozóan áll rendelkezésre a legtöbb adat. Ezért háttérinformációk hiányában, és amennyiben nem kerül sor konkrét célszövetek azonosítására, a májból történő mintavétel indokolt, mivel ez a xenobiotikus anyagcsere elsődleges helye, és gyakran ki van téve a kiindulási anyag(ok)nak és metabolitjának (azok metabolitjainak). Egyes esetekben relevánsabb lehet az érintkezés helyének vizsgálata (orálisan adagolt vegyi anyagok esetében például a mirigyes gyomor vagy a patkóbél/éhbél vizsgálata, vagy belélegzett vegyi anyagok esetében a tüdő vizsgálata). A vizsgálat konkrét céljai alapján további vagy más szöveteket kell kiválasztani, de hasznos lehet ugyanazon állatok több szövetének vizsgálata, amennyiben a laboratórium igazolta az adott szövetek terén szerzett jártasságát és több szövet egyidejű kezelése terén szerzett szakértelmét.
Minták elkészítése
A következő (44–49.) pontokban ismertetett eljárások esetében fontos, hogy minden oldatot, illetve stabil szuszpenziót a lejárati idejükön belül fel kell használni, vagy szükség esetén azokat frissen kell elkészíteni. A következő bekezdésekben az is szerepel, hogy i. az egyes szövetek boncolás utáni eltávolításához, ii. az egyes szövetek sejtszuszpenziókban/sejtmagszuszpenziókban történő feldolgozásához, valamint iii. a szuszpenzió feldolgozásához és a tárgylemezek preparálásához igénybe vett idő egyaránt kritikus változónak minősül (a fogalommeghatározásokat lásd az 1. függelékben), és az e műveletszakaszoknál elfogadható időtartamot a módszer kialakítása és a jártasság igazolása során kell meghatározni.
Az állatokon a hatályos állatjóléti jogszabályokkal és a 3R elvével összhangban a vizsgálati vegyi anyaggal végzett utolsó kezelés utáni megfelelő időpont(ok)ban eutanáziát kell végrehajtani. A kiválasztott szövet(ek)et el kell távolítani, fel kell boncolni, egy részét (részüket) pedig az üstökösvizsgálat céljára kell begyűjteni, ugyanakkor a szövet ugyanazon részéből származó metszetet kell kivágni és azt formaldehid-oldatba vagy hasonló fixálószerbe kell helyezni egy standard módszerek (12) szerint végzendő, esetleges kórszövettani elemzés céljából (lásd az 55. pontot). Az üstökösvizsgálat céljára szánt szövetet zúzópufferbe kell helyezni, a maradék vér eltávolítása érdekében megfelelően át kell öblíteni hideg zúzópufferrel, és a feldolgozásig jéghideg zúzópufferben kell tárolni. In situ perfúziót is lehet végezni, például a máj, a vese esetében.
A sejtizolálásra/sejtmag-izolálásra vonatkozóan számos közzétett módszer létezik. Ilyen többek között a szövetek – például a máj és a vese – összezúzása, a nyálkahártya felületének kaparása a gyomor-bél traktus esetében, a homogenizálás és az enzimatikus emésztés. A JaCVAM validálási kísérlete csak izolált sejteket vizsgált, ezért annak érdekében, hogy a módszer kialakításánál, valamint a jártasság igazolásánál a JaCVAM kísérleti adataira lehessen hivatkozni, az izolált sejtek részesítendők előnyben. Kiderült azonban, hogy izolált sejtek vagy nem izolált sejtek használata esetén nincs lényeges különbség a vizsgálati eredmények között (8). A sejtek/sejtmagok izolálására szolgáló különböző módszerek (például homogenizálás, zúzás, enzimatikus emésztés és hálóval végzett szűrés) is hasonló eredményeket adtak (55). Következésképp izolált sejtek vagy izolált sejtmagok is felhasználhatók. A laboratóriumoknak alaposan értékelniük és validálniuk kell a különálló sejtek/sejtmagok izolálására szolgáló szövetspecifikus módszereket. A 40. pontban foglaltaknak megfelelően az üstökösvizsgálattal kimutatott DNS-száltörésekhez vezető bizonyos léziók fennállása igen rövid lehet (52) (53). Ezért az egysejtes szuszpenziók vagy a sejtmagszuszpenziók elkészítéséhez alkalmazott módszertől függetlenül fontos, hogy a szövetek feldolgozására az állatok leölését követő lehető legrövidebb időn belül sor kerüljön, és azok olyan körülmények közé kerüljenek, amelyek visszafogják a léziók megszűnését (például a szövet alacsony hőmérsékleten tartásával). A sejtszuszpenziókat – mindaddig, amíg nem használatra készek – jéghideg hőmérsékleten kell tárolni annak érdekében, hogy a minták közötti minimális eltérést, valamint a pozitív és a negatív kontrollok megfelelő válaszát lehessen demonstrálni.
TÁRGYLEMEZEK PREPARÁLÁSA
A tárgylemez-preparálást az egysejtes szuszpenziók vagy a sejtmagszuszpenziók elkészítése után a lehető legrövidebb időn belül (ideális esetben egy órán belül) el kell végezni, az állat elpusztulása és a tárgylemez-preparálás közötti hőmérsékletet és időt azonban szigorúan ellenőrizni és validálni kell a laboratóriumi körülmények között. Az alacsony olvadáspontú agarózhoz a tárgylemezek elkészítése érdekében adott sejtszuszpenzió mennyisége (általában 0,5–1,0 %) nem csökkentheti az alacsony olvadáspontú agaróz százalékos arányát 0,45 % alá. Az optimális sejtszámot az üstökösök számlálásához használt képelemző rendszer határozza meg.
Lízis
A lízis feltételei szintén kritikus változót jelentenek, és zavarhatják a DNS-módosulás konkrét típusaiból (egyes DNS-alkilációkból és DNS-bázisok melléktermékeiből) fakadó száltöréseket. Ezért a lízis feltételeit az egyes kísérleteken belüli összes tárgylemez esetében a lehető legállandóbban kell tartani. A preparálást követően a tárgylemezeket lehűtött lizáló oldatba kell helyezni legalább egy órára (vagy egy éjszakára), kb. 2–8 °C-os hőmérsékleten, tompított fényviszonyok mellett, az esetlegesen UV-komponenseket tartalmazó fehér fényt kiiktató például sárga fényre (vagy fénytől védett közegbe). Ezen inkubációs időszakot követően, még a lúgos közegben végbemenő kitekeredés előtt a tárgylemezeket a maradék detergens és só eltávolítása érdekében át kell öblíteni. Az öblítés végezhető tisztított vízzel, semlegesítő pufferrel vagy foszfátpufferrel. Elektroforézis-puffer is használható. Ezáltal fennmarad a lúgos közeg az elektroforézis-kamrában.
Kitekeredés és elektroforézis
A tárgylemezeket véletlenszerűen kell elhelyezni a merülő típusú elektroforézis-egység platformján, amelynek elegendő elekroforézis-oldatot kell tartalmaznia ahhoz, hogy a tárgylemezek felületét teljesen elfedje (az elmerítés mélységének is következetesnek kell lennie az egyes vizsgálatmenetekben). Egy másik típusú üstökösvizsgálatban például az aktív hűtésű, keringtetésű és nagyfeszültségű áramellátású elektroforézis-egységeknél magasabb az oldat rétege, ezáltal nagyobb lesz az elektromos áram erőssége, míg a feszültség állandó marad. A minták elektroforézis-tartályba helyezéséhez kiegyensúlyozott kísérlettervezést kell alkalmazni, hogy mérséklődjenek a tartályon belüli esetleges trendhatások vagy peremhatások és minimálisra csökkenjen az egyes tételek közötti variabilitás, azaz az egyes elektroforézis-vizsgálatmenetekben a vizsgált állatokból ugyanakkora számú tárgylemezt, valamint a különböző dóziscsoportokból, negatív és pozitív kontrollokból származó mintákat kell felhasználni. A tárgylemezeket legalább 20 percig állni kell hagyni, hogy a DNS kitekeredjen, ezt követően pedig a vizsgálat érzékenységét és dinamikus tartományát maximalizáló (azaz az érzékenység maximalizálása érdekében a negatív és a pozitív kontrolloknál a csóva DNS elfogadható %-os arányát eredményező), szabályozott körülmények között elektroforézisnek kell alávetni. A DNS-vándorlás mértéke lineárisan összefügg az elektroforézis időtartamával, valamint a potenciállal (V/cm) is. A JaCVAM kísérlete alapján legalább 20 percre vonatkoztatva ez 0,7 V/cm lehet. Az elektroforézis időtartama kritikus változónak minősül, és az elektroforézis idejét úgy kell beállítani, hogy optimális legyen a dinamikus tartomány. A hosszabb ideig (például az érzékenység maximalizálása érdekében 30 vagy 40 percig) tartó elektroforézis következtében rendszerint erősebb pozitív válaszok alakulnak ki az ismert mutagénekkel. A hosszabb ideig tartó elektroforézis azonban túlzott vándorlást is előidézhet a kontrollmintákban. Az egyes vizsgálatokban a feszültséget állandó szinten kell tartani, a többi paraméter variabilitásának pedig szűk és meghatározott tartományban kell lennie, a JaCVAM kísérletében például a 0,7 V/m 300 mA kezdeti áramerősséget eredményezett. Az előírt feltételek elérése és a kísérlet alatti fenntartása érdekében a puffer mélységét ki kell igazítani. Az elekroforézis kezdetén és végén mért áramerősséget rögzíteni kell. Ezért az egyes vizsgált szövetek tekintetében érintett laboratóriumok jártasságának első alkalommal történő igazolásakor meg kell határozni az optimális feltételeket. Az elektroforézis-oldat hőmérsékletét a kitekeredés és az elektroforézis során alacsony szinten, rendszerint 2–10 °C-on kell tartani (10). Az elektroforézis-oldatnak a kitekeredés kezdetén, az elektroforézis kezdetén és az elektroforézis végén mért hőmérsékletét rögzíteni kell.
Az elektroforézis befejezését követően a tárgylemezeket legalább 5 percig a semlegesítő pufferbe kell meríteni, illetve azzal át kell öblíteni. A gélek »friss« állapotban (azaz 1–2 napon belül) megfesthetők és kiértékelhetők, vagy későbbi kiértékelés céljából (azaz a megfestést követő 1–2 héten belül) dehidratálhatók (56). A feltételeket azonban a jártasság igazolása során kell validálni, és e feltételek mindegyike vonatkozásában történeti adatokat kell előállítani, amelyeket külön-külön kell tárolni. Az utóbbi esetben a tárgylemezeket legalább 5 percen keresztül, abszolút etanolba merítéssel kell dehidratálni, hagyni kell a levegőn megszáradni, majd a kiértékelésig szobahőmérsékleten vagy hűtőben tartott edényben kell tárolni.
Mérési módszerek
Az üstökösökről automatizált vagy félig automatizált képelemző rendszer segítségével kvantitatív értékelést kell készíteni. A tárgylemezeket megfelelő fluoreszcens festékkel (például SYBR Gold, Green I, propídium-jodid vagy etídium-bromid) meg kell festeni, és megfelelő (például 200-szoros) nagyításnál meg kell figyelni megfelelő detektorokkal vagy digitális (például CCD-) kamerával felszerelt epifluoreszcens mikroszkóppal.
A sejtek az üstökösképek atlaszában (57) ismertetett három kategóriába sorolhatók: értékelhető, nem értékelhető és »fantomsejt« (a további magyarázatot lásd az 56. pontban). A mesterségesen előidézett változások elkerülése érdekében a csóva DNS százalékos aránya szempontjából csak az (egyértelműen meghatározott maggal és csóvával rendelkező, a szomszédos sejtekkel kölcsönhatásba nem lépő) értékelhető sejteket kell értékelni. A nem értékelhető sejtek gyakoriságát nem kell dokumentálni. A fantomsejtek gyakoriságát mintánként legalább 150 sejt (további részletekért lásd az 56. pontot) vizuális értékelése alapján kell meghatározni (mivel az egyértelműen meghatározott mag hiánya azt jelenti, hogy nem mutathatók ki könnyen képelemzéssel), valamint külön-külön kell dokumentálni.
Minden elemzendő tárgylemezt, a pozitív és negatív kontrollokét is ideértve, önálló kódolással kell ellátni és »vakon« kell értékelni, hogy az értékelést végző személy ne ismerje a kezelés körülményeit. Minden egyes minta (szövetenként és állatonként vett minta) esetében legalább 150 sejtet kell elemezni (a fantomsejtek kivételével – lásd az 56. pontot). Dózisonként legalább öt állat (a párhuzamos pozitív kontrollban kevesebb állat – lásd a 29. pontot) esetében állatonként 150 sejt értékelése Smith és társai 2008-as elemzése (5) szerint megfelelő statisztikai erőt biztosít. Tárgylemezek használata esetén ez csoportonként öt állatból álló mintánál mintánként 2–3 értékelt tárgylemezt jelent. A tárgylemez több területén kell megfigyelést végezni olyan sűrűség mellett, amely biztosítja, hogy a csóvák ne legyenek átfedésben. A tárgylemezek peremén végzett értékelés kerülendő.
Az üstökösvizsgálatban a DNS-száltörések független végpontokkal mérhetők, ilyen a csóva DNS %-os aránya, a csóvahossz és a csóva létrejöttének pillanata. Megfelelő képelemző szoftver használata esetén mindhárom mérés elvégezhető. A csóva DNS %-os aránya (más néven: a csóva %-os intenzitása) azonban ajánlott az eredmények értékeléséhez és értelmezéséhez (12) (40) (41) (42), és (a sejtek teljes intenzitásának százalékos arányában kifejezett) a csóvában lévő DNS-fragmens intenzitása határozza meg (13).
Szövetkárosodás és citotoxicitás
Az üstökösvizsgálat pozitív megállapításai nem feltétlenül kizárólag a genotoxicitásnak tulajdoníthatók, a célszövet toxiticitása is fokozhatja a DNS-vándorlást (12) (41). Ezzel ellentétben az ismert genotoxikus anyagok esetében gyakran megfigyelhető alacsony vagy mérsékelt citotoxicitás (12), ami arra utal, hogy kizárólag üstökösvizsgálatban nem lehet megkülönböztetni a genotoxicitás által előidézett DNS-vándorlást a citotoxicitás által előidézett DNS-vándorlástól. A DNS-vándorlás fokozódásának megfigyelése esetén azonban ajánlott megvizsgálni egy vagy több citotoxicitás-mutatót, ugyanis ez segíthet a megállapítások értelmezésében. A citotoxicitás egyértelmű bizonyítékának fennállása esetén fokozódó DNS-vándorlást óvatosan kell értelmezni.
Számos citotoxicitás-mérésre született javaslat, és ezek közül a kórszövettani elváltozások a szövetekre kifejtett toxicitás releváns kritériumának tekintendők. Többek között a gyulladásra, a sejtbeszűrődésre, az apoptotikus vagy a nekrotikus elváltozásokra vonatkozó megfigyeléseket összefüggésbe hozták a DNS-vándorlás fokozódásával, azonban ahogyan azt a JaCVAM validálási kísérlete (12) bebizonyítja, a DNS-vándorlás fokozódásával mindig összefüggő kórszövettani elváltozások végleges jegyzéke nem áll rendelkezésre. A klinikai kémiai változások (például AST, ALT) szintén szolgálhatnak a szövetkárosodásra vonatkozó hasznos információkkal, és figyelembe vehetők további mutatók is, mint a kaszpáz-aktiválás, a TUNEL-festés, az Anexin V-festés stb. Mindemellett kevés közzétett adat van e mutatók in vivo vizsgálatokhoz történő felhasználására vonatkozóan, és egyes mutatók nem annyira megbízhatóak, mint mások.
A fantomsejtek olyan sejtek, amelyek mikroszkopikus képe kisméretű vagy hiányzó magból és nagyméretű, kiterjedt csóvából áll, továbbá súlyosan károsodott sejteknek minősülnek, bár az etiológiájuk bizonytalan (lásd a 3. függeléket). A csóva DNS %-os arányának képelemzéssel végzett mérése a csóva külső megjelenése miatt megbízhatatlan, ezért a fantomsejteket külön kell értékelni. A fantomsejtek előfordulását fel kell jegyezni és jelentésbe kell foglalni, és a vélhetően a vizsgálati vegyi anyagnak tulajdonítható, releváns növekedést óvatosan kell megvizsgálni és értelmezni. A vizsgálati vegyi anyagok potenciális hatásmechanizmusának ismerete segítséget nyújt ezekhez a megfontolásokhoz.
ADATOK ÉS JEGYZŐKÖNYVEZÉS
Az eredmények feldolgozása
Az állat a kísérleti egység, ezért mind az egyes állatokra vonatkozó adatokat, mind az összefoglalt eredményeket meg kell jeleníteni táblázatos formában. Az adatok hierarchikus jellege miatt a csóva DNS %-os arányának mediánját ajánlott minden egyes tárgylemez esetében meghatározni, és minden egyes állat esetében ajánlott kiszámítani a mediánértékek átlagát (12). Ezt követően az egyes állatokra vonatkozó átlagértékek átlagát kell meghatározni a csoportra vonatkozó átlag kiszámításához. Mindezeket az értékeket bele kell foglalni a jelentésbe. Tudományos és statisztikai szempontból indokolt esetben más megközelítések is alkalmazhatók (lásd az 53. pont). Statisztikai elemzés különféle megközelítések alapján végezhető (58) (59) (60) (61). Az alkalmazandó statisztikai módszerek kiválasztásakor a fenti hivatkozásokban tárgyalt módon mérlegelni kell, hogy kell-e transzformálni az adatokat (például logaritmusra vagy négyzetgyökre) vagy az összes értékhez (még a nullától különböző értékekhez is) hozzá kell-e adni egy alacsony számot (például 0,001-et) a sejtek nulla értéke által kifejtett hatások mérséklése érdekében. Mindkét ivar használata esetén a kezelés és az ivar közötti kölcsönhatás elemzésének részletezése, valamint a megállapított eltérések meglététől vagy elmaradásától függően végzett későbbi adatelemzés a 2. függelékben található. A toxicitásra és a klinikai tünetekre vonatkozó adatokat szintén jelentésbe kell foglalni.
Elfogadhatósági kritériumok
Egy-egy vizsgálat elfogadása az alábbi kritériumokon alapul:
a. A párhuzamos negatív kontroll a 16. pont szerint belefoglalható a laboratórium negatív kontrollokat tartalmazó történeti adatbázisába.
b. A párhuzamos pozitív kontrolloknak (lásd a 29. pontot) a pozitív kontrollokat tartalmazó történeti adatbázisban generált válaszokkal összeegyeztethető válaszokat, valamint a párhuzamos negatív kontrollhoz viszonyítva statisztikailag szignifikáns növekedést kell előidézniük.
c. Megfelelő számú sejt és dózis képezte elemzés tárgyát (52. és 36–38. pont).
d. A legmagasabb dózis kiválasztására vonatkozó kritériumok összhangban vannak a 36. pontban ismertetett kritériumokkal.
Az eredmények értékelése és értelmezése
Amennyiben valamennyi elfogadhatósági kritérium teljesül, a vizsgálati vegyi anyag egyértelműen pozitívnak minősül, ha:
a. legalább az egyik vizsgálati dózis statisztikailag szignifikáns növekedést mutat a párhuzamos negatív kontrollhoz viszonyítva,
b. a megfelelő trendpróbával történő értékelés arra utal, hogy a növekedés a dózissal összefügg,
c. az adott faj, vivőanyag, beadási mód, szövet és beadások adott száma vonatkozásában ezen eredmények bármelyike a történeti negatív kontrolladatok eloszlásán kívül esik.
Mindezen kritériumok teljesülése esetén úgy tekintendő, hogy a vizsgálati vegyi anyag DNS-száltöréseket képes előidézni az ebben a vizsgálati rendszerben tanulmányozott szövetekben. Ha e kritériumok közül csak egy vagy kettő teljesül, lásd a 62. pontot.
Amennyiben valamennyi elfogadhatósági kritérium teljesül, a vizsgálati vegyi anyag egyértelműen negatívnak minősül, ha:
a. a vizsgálati koncentrációk egyike sem mutat statisztikailag szignifikáns növekedést a párhuzamos negatív kontrollhoz viszonyítva,
b. a megfelelő trendpróbával végzett értékelés nem mutat koncentrációval összefüggő növekedést,
c. az adott faj, vivőanyag, beadási mód, szövet és beadások adott száma vonatkozásában ezen eredmények mindegyike a történeti negatív kontrolladatok eloszlásán belül található,
d. a célszövet(ek) expozícióját vagy toxicitását alátámasztó közvetlen vagy közvetett bizonyíték igazolást nyert.
Ezt követően úgy tekintendő, hogy a vizsgálati vegyi anyag az e vizsgálati rendszerben tanulmányozott szövetekben nem képes DNS-száltörést előidézni.
Az egyértelműen pozitív vagy negatív válasz igazolása nem követelmény.
Amennyiben a válasz nem egyértelműen negatív és nem is egyértelműen pozitív (azaz az 59. és a 60. pontban felsorolt kritériumok mindegyike nem teljesül), illetve egy adott eredmény biológiai relevanciája megállapításának segítése érdekében az adatokat szakértői véleménnyel és/vagy további vizsgálatokkal kell értékelni, ha ez tudományosan indokolt. Hasznos lehet további sejtek értékelése (adott esetben) vagy megismételt kísérlet lehetőleg optimalizált kísérleti körülmények (például dózisok távolsága, más beadási módok, eltérő mintavételi időpontok vagy más szövetek alkalmazása) melletti elvégzése.
Ritka esetekben, még további vizsgálatok után is, az adatkészlet eleve kizárja a pozitív vagy negatív eredményekre vonatkozó következtetést, ezért kétértelmű reakció lesz a következtetés.
A pozitív vagy kétértelmű eredmény biológiai relevanciájának értékeléséhez szükség van a célszövetben kifejtett citotoxicitásra vonatkozó információkra (lásd az 54–55. pontot). Ha pozitív vagy kétértelmű megállapítások kizárólag a citotoxicitásra utaló egyértelmű bizonyíték fennállása esetén figyelhetők meg, arra kell következtetni, hogy a vizsgálat a genotoxicitás szempontjából kétértelmű, kivéve, ha rendelkezésre áll elegendő olyan információ, amely alátámasztja a végleges következtetést. A vizsgálat negatív kimenetele esetében, amennyiben minden vizsgált dózisnál toxicitásra utaló jelek vannak, érdemes lehet nem toxikus dózisoknál további vizsgálatot végezni.
Vizsgálati jegyzőkönyv
A Vizsgálati jegyzőkönyvnek a következőket kell tartalmaznia:
Vizsgálati vegyi anyag:
— eredet és rendelkezésre állás esetén a tételszám;
— a vizsgálati vegyi anyag stabilitása, felhasználási határideje vagy ismételt elemzésének napja, ha ismert.
Egy összetevőből álló anyag:
— fizikai megjelenés, vízoldékonyság és a további releváns fizikai-kémiai tulajdonságok;
— kémiai azonosítás, például IUPAC- vagy CAS-név, CAS-szám, SMILES- vagy InChI-kód, szerkezeti képlet, tisztaság, adott esetben és amennyiben a gyakorlatban megvalósítható, a szennyeződések kémiai azonossága stb.
Több összetevőből álló anyag, UVCB-k és keverékek:
— amennyiben lehetséges, az összetevők kémiai azonosítója (lásd fent), mennyiségi előfordulása és releváns fizikai-kémiai tulajdonságai jellemzik.
Oldószer/vivőanyag:
— az oldószer/vivőanyag kiválasztásának indoklása;
— a vizsgálati vegyi anyag oldhatósága és stabilitása az oldószerben/vivőanyagban, ha ismert;
— a dóziskészítmények elkészítése;
— a készítmények analitikai meghatározásai (pl. stabilitás, homogenitás, névleges koncentráció).
Kísérleti állatok:
— a felhasznált faj/törzs, valamint megválasztásuk tudományos és etikai szempontú indokolása;
— az állatok száma, kora és ivara;
— az állatok származása, tartási körülmények, takarmány, környezetgazdagítás stb.;
— az állatok tömege a vizsgálat kezdetén és végén, az egyes csoportok esetében a testtömegtartományt, az átlagot és a szórást is ideértve.
Vizsgálati körülmények:
— a pozitív és negatív (vivőanyagos/oldószeres) kontrollok adatai;
— a dózisbehatároló vizsgálat eredményei (ha történt ilyen vizsgálat);
— a dózisszintek kiválasztásának indoklása;
— a vizsgálati vegyi anyag előkészítésére vonatkozó részletek;
— a vizsgálati vegyi anyag beadására vonatkozó részletek;
— a beadási mód indoklása,
— befecskendezés helye (szubkután vagy intravénás vizsgálatoknál);
— a minták preparálásának módszerei, illetve ha rendelkezésre állnak, a kórszövettani elemzések, különösen a pozitív üstökösválaszt adó vegyi anyag esetén;
— a szövet megválasztásának indoklása;
— negatív eredmény esetén annak ellenőrzésére szolgáló módszerek, hogy a vizsgálati vegyi anyag elérte-e a célszövetet vagy az általános keringési rendszert;
— tényleges dózis (mg/testtömeg kg/nap) a vizsgálati vegyi anyagnak a takarmányban/ivóvízben meglévő koncentrációjából (ppm) és a fogyasztásból számítva, ha alkalmazható;
— a takarmány és a víz minőségére vonatkozó adatok;
— a kezelési és mintavételi ütemtervek részletes leírása és kiválasztásuk indoklása (például toxikokinetikus adatok, amennyiben rendelkezésre állnak);
— a fájdalomcsillapítás, analgézia módja;
— az eutanázia módja;
— a szövetek izolálására és tartósítására használt eljárások;
— az egysejtes szuszpenziók vagy sejtmagszuszpenziók előállítására szolgáló módszerek;
— valamennyi reagens eredete és tételszáma (amennyiben lehetséges);
— a citotoxicitás értékelésére szolgáló módszerek;
— az elektroforézis feltételei;
— az alkalmazott festési eljárások, valamint
— az üstökösök értékelésére és mérésére szolgáló módszerek.
Eredmények:
— az egyes állatokra vonatkozóan a vizsgálat időszaka előtt és során végzett általános klinikai megfigyelések, ha végeztek ilyeneket;
— a citotoxicitásra vonatkozó bizonyítékok, ha vizsgálták;
— az egy hétnél hosszabb vizsgálatok esetében: az egyes állatok testtömege a vizsgálat során, beleértve minden csoportnál a testtömegtartományt, az átlagot és a szórást; táplálékfogyasztás;
— dózis-válasz összefüggés, amennyiben nyilvánvaló;
— az egyes szövetek/állatok esetében a csóva DNS %-os aránya (vagy más mérések, ha választottak ilyen méréseket), valamint a mediánértékek tárgylemezenként, az átlagértékek állatonként és az átlagértékek csoportonként;
— a párhuzamos és a történeti negatív és pozitív kontrolladatok, a tartományok, az átlagok/a mediánértékek és a szórás megadásával minden egyes értékelt szövetnél;
— a párhuzamos kontrolladatok és a történeti pozitív kontrolladatok;
— a májtól eltérő szöveteknél a pozitív kontroll felhasználásával ábrázolt dózis-válasz görbe. Ez a görbe előállítható a jártasság igazolása során gyűjtött adatokból (lásd a 16-17. pontot), és indoklással, az aktuális szakirodalomból származó idézetekkel kell alátámasztani, amelyek mutatják, hogy az adott szövetben a kontrollokra adott válaszok terjedelme és eloszlása megfelelő;
— az alkalmazott statisztikai elemzések és módszerek, valamint a válaszok pozitívvá, negatívvá vagy kétértelművé minősítésének kritériumai;
— az egyes csoportokban és állatonként előforduló fantomsejtek gyakorisága.
Az eredmények tárgyalása
Következtetés
Hivatkozások
SZAKIRODALOM
(1) Kirkland, D., G. Speit (2008), Evaluation of the ability of a battery of three in vitro genotoxicity tests to discriminate rodent carcinogens and non-carcinogens III. Appropriate follow-up testing in vivo, Mutation Research, Vol. 654/2, pp. 114-32.
(2) Brendler-Schwaab, S. et al. (2005), The in vivo Comet assay: use and status in genotoxicity testing, Mutagenesis, Vol. 20/4, pp. 245-54.
(3) Burlinson, B. et al. (2007), Fourth International Workgroup on Genotoxicity Testing: result of the in vivo Comet assay workgroup, Mutation Research, Vol. 627/1, pp. 31-5.
(4) Burlinson, B. (2012), The in vitro and in vivo Comet assays, Methods in Molecular Biology, Vol. 817, pp. 143-63.
(5) Smith, C.C. et al. (2008), Recommendations for design of the rat Comet assay, Mutagenesis, Vol. 23/3, pp. 233-40.
(6) Hartmann, A. et al. (2003), Recommendations for conducting the in vivo alkaline Comet assay, Mutagenesis, Vol. 18/1, pp. 45-51.
(7) McKelvey-Martin, V.J. et al. (1993), The single cell gel electrophoresis assay (Comet assay): a European review, Mutation Research, Vol. 288/1, pp. 47-63.
(8) Tice, R.R. et al. (2000), Single cell gel/Comet assay: guidelines for in vitro and in vivo genetic toxicology testing, Environmental and Molecular Mutagenesis, Vol. 35/3, pp. 206-21.
(9) Singh, N.P. et al. (1988), A simple technique for quantitation of low levels of DNA damage in individual cells, Experimental Cell Research, Vol. 175/1, pp. 184-91.
(10) Rothfuss, A. et al. (2010), Collaborative study on fifteen compounds in the rat-liver Comet assay integrated into 2- and 4-week repeat-dose studies, Mutation Research, Vol., 702/1, pp. 40-69.
(11) OECD (2016). Overview of the set of OECD Genetic Toxicology Test Guidelines and updates performed in 2014-2015. ENV Publications. Series on Testing and Assessment, No. 234, OECD, Paris.
(12) OECD (2014), Reports of the JaCVAM initiative international pre-validation and validation studies of the in vivo rodent alkaline comet assay for the detection of genotoxic carcinogens, Series on Testing and Assessment, Nos. 195 and 196, OECD Publishing, Paris.
(13) Olive, P.L., J.P. Banath, R.E. Durand (1990), Heterogeneity in radiation-induced DNA damage and repair in tumor and normal cells using the “Comet” assay, Radiation Research, Vol. 122/1, pp. 86-94.
(14) Tice, R.R., G.H. Strauss (1995), The single cell gel electrophoresis/Comet assay: a potential tool for detecting radiation-induced DNA damage in humans, Stem Cells, Vol. 13/1, pp. 207-14.
(15) Collins, A.R (2004), The Comet assay for DNA damage and repair: principles, applications, and limitations, Molecular Biotechnology, Vol. 26/3, pp. 249-61.
(16) Rothfuss, A. et al. (2011), Improvement of in vivo genotoxicity assessment: combination of acute tests and integration into standard toxicity testing, Mutation Research/Genetic Toxicology and Environmental Mutagenesis, Vol. 723/2, pp. 108-20.
(17) Kushwaha, S. et al. (2010), Evaluation of multi-organ DNA damage by Comet assay from 28 days repeated dose oral toxicity test in mice: A practical approach for test integration in regulatory toxicity testing, Regulatory Toxicology and Pharmacology, Vol. 58/1, pp. 145–54.
(18) Vasquez, M.Z. (2010), Combining the in vivo Comet and micronucleus assays: a practical approach to genotoxicity testing and data interpretation, Mutagenesis , Vol. 25/2, pp. 187-99.
(19) Bowen, D.E. (2011), Evaluation of a multi-endpoint assay in rats, combining the bone-marrow micronucleus test, the Comet assay and the flow-cytometric peripheral blood micronucleus test, Mutation Research, Vol. 722/1, pp. 7-19.
(20) Recio, L. et al. (2010), Dose-response assessment of four genotoxic chemicals in a combined mouse and rat micronucleus (MN) and Comet assay protocol, The Journal of Toxicological Science, Vol. 35/2, pp. 149-62.
(21) O'Donovan, M., B. Burlinson (2013), Maximum dose levels for the rodent comet assay to examine damage at the site of contact or to the gastrointestinal tract, Mutagenesis, Vol. 28/6, pp. 621-3.
(22) Hartmann, A. (2004), Use of the alkaline in vivo Comet assay for mechanistic genotoxicity investigations, Mutagenesis, Vol. 19/1, pp. 51-9.
(23) Nesslany, F. (2007), In vivo Comet assay on isolated kidney cells to distinguish genotoxic carcinogens from epigenetic carcinogens or cytotoxic compounds, Mutation Research/Genetic Toxicology and Environmental Mutagenesis, Vol. 630/1, pp. 28-41.
(24) Brendler-Schwaab, S.Y., B.A. Herbold (1997), A new method for the enrichment of single renal proximal tubular cells and their first use in the Comet assay, Mutation Research/Genetic Toxicology and Environmental Mutagenesis, Vol. 393/1-2, pp. 175-8.
(25) Toyoizumi, T. et al. (2011), Use of the in vivo skin Comet assay to evaluate the DNA-damaging potential of chemicals applied to the skin, Mutation Research/Genetic Toxicology and Environmental Mutagenesis, Vol. 726/2, pp. 175-80.
(26) Struwe, M. et al. (2008), Detection of photogenotoxicity in skin and eye in rat with the photo Comet assay, Photochemical and Photobiological Sciences, Vol. 7/2, pp. 240-9.
(27) Wada, K. et al. (2012), A comparison of cell-collecting methods for the Comet assay in urinary bladders of rats, Mutation Research/Genetic Toxicology and Environmental Mutagenesis, Vol. 742/1-2, pp. 26-30.
(28) Wang, A. et al. (2007), Measurement of DNA damage in rat urinary bladder transitional cells: improved selective harvest of transitional cells and detailed Comet assay protocols, Mutation Research/Genetic Toxicology and Environmental Mutagenesis, Vol. 634/ 1-2, pp. 51-9.
(29) Burlinson, B. et al. (2007), In Vivo Comet Assay Workgroup, part of the Fourth International Workgroup on Genotoxicity Testing. Fourth International Workgroup on Genotoxicity testing: results of the in vivo Comet assay workgroup, Mutation Research/Genetic Toxicology and Environmental Mutagenesis, Vol. 627/1, pp. 31-5.
(30) Jackson, P. et al. (2012), Pulmonary exposure to carbon black by inhalation or instillation in pregnant mice: effects on liver DNA strand breaks in dams and offspring, Nanotoxicology, Vol. 6/5, pp. 486-500.
(31) Sasaki, Y.F. et al. (2000), The comet assay with multiple mouse organs: comparison of Comet assay results and carcinogenicity with 208 chemicals selected from the IARC monographs and U.S. NTP Carcinogenicity Database, Critical Reviews in Toxicology, Vol. 30/6, pp. 629-799.
(32) Sekihashi, K. et al. (2002), Comparative investigations of multiple organs of mice and rats in the Comet assay, Mutation Research, Vol. 517/1-2, pp. 53-74.
(33) Speit, G, M. Vasquez, A. Hartmann (2009), The comet assay as an indicator test for germ cell genotoxicity, Mutation Research, Vol. 681/1, pp. 3-12.
(34) Zheng, H., P.L. Olive (1997), Influence of oxygen on radiation-induced DNA damage in testicular cells of C3H mice, International Journal of Radiation Biology, Vol. 71/3, pp. 275-282.
(35) Cordelli, E. et al. (2003), Evaluation of DNA damage in different stages of mouse spermatogenesis after testicular X irradiation, Journal of Radiation Research, Vol. 160/4, pp. 443-451.
(36) Merk, O., G. Speit (1999), Detection of crosslinks with the Comet assay in relationship to genotoxicity and cytotoxicity, Environmental and Molecular Mutagenesis, Vol. 33/2, pp. 167-72.
(37) Pfuhler, S., H.U. Wolf (1996), Detection of DNA-crosslinking agents with the alkaline Comet assay, Environmental and Molecular Mutagenesis, Vol. 27/3, pp. 196-201.
(38) Wu, J.H., N.J. Jones (2012), Assessment of DNA interstrand crosslinks using the modified alkaline Comet assay, Methods in Molecular Biology, Vol. 817, pp. 165-81.
(39) Spanswick, V.J., J.M. Hartley, J.A. Hartley (2010), Measurement of DNA interstrand crosslinking in individual cells using the Single Cell Gel Electrophoresis (Comet) assay, Methods in Molecular Biology, Vol. 613, pp. 267-282.
(40) Kumaravel, T.S., A.N. Jha (2006), Reliable Comet assay measurements for detecting DNA damage induced by ionizing radiation and chemicals, Mutation Research/Genetic Toxicology and Environmental Mutagenesis, Vol. 605(1-2), pp. 7-16.
(41) Burlinson, B. et al. (2007), Fourth International Workgroup on Genotoxicity Testing: result of the in vivo Comet assay workgroup, Mutation Research, Vol.627/1, pp. 31-5.
(42) Kumaravel, T.S. et al. (2009), Comet Assay measurements: a perspective, Cell Biology and Toxicology, Vol. 25/1, pp. 53-64.
(43) Ersson, C., L. Möller (2011), The effects on DNA migration of altering parameters in the Comet assay protocol such as agarose density, electrophoresis conditions and durations of the enzyme or the alkaline treatments, Mutagenesis, Vol. 26/6, pp. 689-95.
(44) Møller, P. et al. (2010), Assessment and reduction of Comet assay variation in relation to DNA damage: studies from the European Comet Assay Validation Group, Mutagenesis, Vol. 25/2, pp. 109-11.
(45) Forchhammer, L. et al. (2010), Variation in the measurement of DNA damage by Comet assay measured by the ECVAG inter-laboratory validation trial, Mutagenesis, Vol. 25/2, pp. 113-23.
(46) Azqueta, A. et al. (2011), Towards a more reliable comet assay: Optimising agarose concentration, unwinding time and electrophoresis conditions, Mutation Research, Vol. 724/1-2, pp. 41-45.
(47) Hayashi, M. et al. (2011), Compilation and use of genetic toxicity historical control data, Mutation Research, Vol. 723/2, pp. 87-90.
(48) Ryan, T. P. (2000), Statistical Methods for Quality Improvement, John Wiley and Sons, New York 2nd ed.
(49) Appendix A of the European Convention for the Protection of Vertebrate Animals used for Experimental and other Scientific Purposes (ETS No. 123)
(50) E melléklet B.8.: Akut inhalációs toxicitás: 28 napos vizsgálat című fejezete.
(51) E melléklet B.29.: Krónikus inhalációs toxicitás: 90 napos vizsgálat című fejezete.
(52) Blakey, D.H., G.R. Douglas (1984), Transient DNA lesions induced by benzo[a]pyrene in Chinese hamster ovary cells, Mutation Research, Vol. 140/2-3, pp. 141-45.
(53) Blakey, D.H., G.R. Douglas (1990), The role of excision repair in the removal of transient benzo[a]pyrene-induced DNA lesions in Chinese hamster ovary cells, Mutation Research, Vol. 236/1, pp. 35-41.
(54) OECD (2002), “Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation”, OECD Environment, Health and Safety Publications (EHS), Series on Testing and Assessment, No. 19, OECD Publishing, Paris.
(55) Nakajima, M. (2012), Tissue sample preparation for in vivo rodent alkaline Comet assay, Genes and Environment, Vol. 34/1, pp. 50-4.
(56) Hartmann, A. et al. (2003), Recommendations for conducting the in vivo alkaline Comet assay, Mutagenesis, Vol.18/1, pp.45–51.
(57) Atlas of Comet Assay Images, Scientist Press Co., Ltd., Tokyo, Japan.
(58) Lovell, D.P., G. Thomas, R. Dubow (1999), Issues related to the experimental design and subsequent statistical analysis of in vivo and in vitro Comet studies, Teratogenesis Carcinogenesis Mutagenesis, Vol. 19/2, pp. 109-19.
(59) Wiklund, S.J., E. Agurell (2003), Aspects of design and statistical analysis in the Comet assay, Mutagenesis, Vol. 18/2, pp. 167-75.
(60) Bright, J. et al. (2011), Recommendations on the statistical analysis of the Comet assay, Pharmaceutical Statistics, Vol. 10/6, pp. 485-93.
(61) Lovell, D.P., T. Omori (2008), Statistical issues in the use of the Comet assay, Mutagenesis, Vol. 23/3, pp. 171-82.
1. függelék
FOGALOMMEGHATÁROZÁSOK
Lúgos közegben végzett egysejtes gélelektroforézis : az egyes sejtek/sejtmagok szintjén bekövetkezett elsődleges DNS-károsodás kimutatására szolgáló, érzékeny eljárás.
Vegyi anyag : anyag vagy keverék.
Üstökös : a nukleoidok elektroforetikus mezőben felvett, az üstökösökéhez hasonlító alakja: a mag a sejtmag, a csóvát pedig a sejtmagból az elektromos mezőbe vándorló DNS alkotja.
Kritikus változó/paraméter : a protokoll változója, amelynek kismértékű változása jelentős hatást gyakorolhat a vizsgálat következtetésére. A kritikus változók szövetspecifikusak lehetnek. A kritikus változók nem módosítandók, különösen a vizsgálaton belül, annak figyelembevétele nélkül, hogy a módosítás hogyan változtatja meg a vizsgálaton belüli választ, például ahogyan a pozitív és a negatív kontrollok válaszának terjedelme és variabilitása azt jelzi. A Vizsgálati jegyzőkönyvben fel kell sorolni a kritikus változókat érintően a vizsgálat során vagy a laboratóriumra vonatkozó standard protokollhoz képest végzett változtatásokat, és azok mindegyikét meg kell indokolni.
Csóva-intenzitás vagy a csóva DNS %-os aránya : az üstököscsóva intenzitása a teljes intenzitáshoz (mag és csóva együttvéve) viszonyítva. A százalékos arányként kifejezett DNS-töredezettség mértékét tükrözi.
Vizsgálati vegyi anyag : bármely, e vizsgálati módszer alkalmazásával vizsgált anyag vagy keverék.
UVCB : ismeretlen szerkezetű vagy változó összetételű, összetett reakcióban keletkezett vagy biológiai eredetű anyagok.
2. függelék
AZ IVAROK KÖZÖTTI ELTÉRÉSEK MEGHATÁROZÁSÁRA SZOLGÁLÓ FAKTORIÁLIS KÍSÉRLETTERVEZÉS AZ IN VIVO ÜSTÖKÖSVIZSGÁLAT SORÁN
A faktoriális kísérlettervezés és annak elemzése
Ebben a kísérlettervezésben legalább 5 hím és 5 nőstény vizsgálatára kerül sor mindegyik koncentrációszintnél, ami legalább 40 állat (20 hím és 20 nőstény, valamint a releváns pozitív kontrollok) felhasználását eredményezi.
A kísérlettervezés, amely az egyszerűbb faktoriális kísérlettervezések egyike, kétirányú varianciaanalízissel egyenértékű, ahol a fő tényezők az ivar és a koncentrációszintek. Az adatok számos standard statisztikai szoftvercsomag, például az SPSS, az SAS, a STATA, a Genstat, valamint az R használatával elemezhetők.
Az analízis az adatkészleten belül a variabilitást az ivarok közötti variabilitásra, a koncentrációk közötti variabilitásra, valamint az ivarok és a koncentrációk közötti kölcsönhatáshoz kapcsolódó variabilitásra osztja. Az egyes feltételeket ugyanazon koncentrációnak kitett, az azonos ivarú állatok csoportjain belüli párhuzamos állatok közötti variabilitás becsült értékéhez viszonyítva kell megvizsgálni. A mögöttes módszertanra vonatkozó kimerítő részletek számos statisztikai tankönyvben (lásd a hivatkozásokat) és a statisztikai szoftvercsomagokkal együtt biztosított súgófájlokban is megtalálhatók.
Az analízis az ivar x koncentráció kölcsönhatási feltételnek az ANOVA-táblázatban ( 13 ) való vizsgálatával folytatódik. Szignifikáns kölcsönhatás hiányában az egyes ivarok vagy az egyes koncentrációszintek közötti értékek kombinálásával érvényes statisztikai vizsgálat végezhető a szintek között, az ANOVA szerinti, csoporton belül összesített variabilitási feltétel alapján.
Az analízis a becsült koncentrációk közötti variabilitás kontrasztokká osztásával folytatódik, ami lehetővé teszi a válaszok lineáris és kvadratikus kontrasztjainak megállapítását valamennyi koncentrációszintnél. Ha az ivar x koncentráció kölcsönhatás szignifikáns, ez a feltétel lineáris x ivar és kvadratikus x ivar kölcsönhatására vonatkozó kontrasztokká osztható. E feltételek arra vonatkozó vizsgálatokat biztosítanak, hogy a koncentráció-válaszok párhuzamosak-e a két ivar esetében, illetve hogy a két ivar különböző választ ad-e.
A csoporton belül összesített variabilitásra vonatkozó becslés felhasználható az átlagok közötti eltérés páronkénti vizsgálatához. Ezek az összehasonlítások elvégezhetők a két ivarra vonatkozó átlagok között és a különböző koncentrációszintekre vonatkozó átlagok között; ilyen például a negatív kontrollok szintjével való összehasonlítás. Amennyiben szignifikáns kölcsönhatás tapasztalható, összehasonlítható a különböző koncentrációk adott ivaron belüli átlaga vagy az ivarok azonos koncentrációnál számított átlaga.
Hivatkozások
Számos olyan statisztikai tankönyv létezik, amely a faktoriális kísérlettervezések elméletét, kialakítását, módszertanát, elemzését és értelmezését tárgyalja, a legegyszerűbb kétfaktoros elemzéstől a kísérlettervezés módszertanában alkalmazott bonyolultabb formákig. Az alábbi nem kimerítő lista. Egyes könyvekben összehasonlítható kísérlettervezésekre vonatkozó kidolgozott példák találhatók, esetenként az analízisek különféle szoftvercsomagok segítségével történő lefuttatásához szükséges kóddal együtt.
(1) Box, G.E.P, Hunter, W.G. and Hunter, J.S. (1978). Statistics for Experimenters. An Introduction to Design, Data Analysis, and Model Building. New York: John Wiley & Sons.
(2) Box G.E.P. & Draper, N.R. (1987) Empirical model-building and response surfaces. John Wiley & Sons Inc.
(3) Doncaster, C.P. & Davey, A.J.H. (2007) Analysis of Variance and Covariance: How to choose and Construct Models for the Life Sciences. Cambridge University Press.
(4) Mead, R. (1990) The Design of Experiments. Statistical principles for practical application. Cambridge University Press.
(5) Montgomery D.C. (1997) Design and Analysis of Experiments. John Wiley & Sons Inc.
(6) Winer, B.J. (1971) Statistical Principles in Experimental Design. McGraw Hill.
(7) Wu, C.F.J & Hamada, M.S. (2009) Experiments: Planning, Analysis and Optimization. John Wiley & Sons Inc.
3. függelék
A VIZSGÁLAT JELENLEGI KORLÁTAI
A tudomány jelenlegi állása miatt az in vivo üstökösvizsgálathoz több korlát kapcsolódik. E korlátok várhatóan mérséklődni fognak vagy a meghatározásuk szűkebb körű lesz, mivel a vizsgálat alkalmazása terén szerzett több tapasztalat megválaszolja a szabályozási környezetben felmerülő biztonsági kérdéseket.
1. Előfordulhat, hogy a DNS-károsodások egyes típusai rövid ideig tartanak, azaz túl gyorsan reparálódnak ahhoz, hogy az utolsó dózist követő legalább 24 óra elteltével megfigyelhetőek legyenek. Nem található olyan lista, amely a rövid ideig tartó károsodásokat, illetve azokat a vegyi anyagokat tartalmazná, amelyek feltehetőleg ezt a károsodástípust okozzák, továbbá az sem ismert, hogy ez a károsodástípus mennyi ideig mutatható ki. Az optimális mintavételi időpont(ok) is lehet(nek) a vegyi anyagra vagy a beadási módra jellemzőek, és a mintavételi időpontokat kinetikus adatok alapján kell meghatározni, amennyiben rendelkezésre állnak ilyen adatok (például Tmax időpontban, a plazmán vagy a szöveten belüli csúcskoncentráció elérésekor). Az e vizsgálati módszert alátámasztó validálási vizsgálatok többsége az utolsó dózis beadását követő 2 vagy 3 óra elteltével végzett boncolást határozott meg. A közzétett szakirodalomban található tanulmányokban az szerepel, hogy az utolsó dózist a leölés előtti 2–6 órán belül kell beadni. Ezért ezek a kísérletek szolgáltak alapul a vizsgálati módszer azon ajánlásához, hogy amennyiben az adatok nem utalnak másra, az utolsó dózist a boncolás előtti 2–6 órán belüli, meghatározott időpontban kell beadni.
2. Nem találhatók olyan vizsgálati adatok, amelyek azt jeleznék, hogy a vizsgálat mennyire érzékeny a táplálékba vagy az ivóvízbe juttatás után bekövetkező, rövid ideig tartó DNS-károsodás kimutatása tekintetében a gyomorszondán keresztüli beadáshoz képest. A táplálékba és az ivóvízbe juttatást követően kimutattak DNS-károsodást, ez azonban viszonylag kevés Vizsgálati jegyzőkönyvben szerepel a gyomorszondán keresztüli vagy a hasüregbe történő beadás terén szerzett jóval több tapasztalathoz képest. Ezért a vizsgálat érzékenysége csökkenhet olyan vegyi anyagok esetében, amelyek a táplálékba vagy az ivóvízbe juttatással idéznek elő rövid ideig tartó károsodást.
3. A májtól és a gyomortól eltérő szövetekben nem végeztek laboratóriumközi vizsgálatot, ezért nem születtek arra vonatkozó ajánlások, hogy hogyan kell érzékeny és reprodukálható választ elérni a májtól eltérő szövetekben, például a pozitív és negatív kontrollok tartományaival. A máj esetében a negatív kontrollra vonatkozó alacsonyabb határérték meghatározásával kapcsolatban sem sikerült megegyezni.
4. Bár több olyan kiadvány létezik, amely bebizonyítja a citotoxicitás in vitro körülmények közötti zavaró hatását, nagyon kevés in vivo adatot tettek közzé, ezért nem lehet egyetlen mérőszámot javasolni a citotoxicitásra. A gyulladáshoz, a sejtbeszűrődéshez, az apoptotikus vagy a nekrotikus elváltozásokhoz hasonló kórszövettani elváltozásokat összefüggésbe hozták a DNS-vándorlás fokozódásával, azonban ahogyan azt a JaCVAM validálási kísérlete (OECD, 2014) bebizonyítja, ezek az elváltozások nem mindig eredményeznek az üstökösök tekintetében pozitív megállapításokat, következésképp a DNS-vándorlás fokozódásával mindig összefüggő kórszövettani elváltozások végleges jegyzéke nem áll rendelkezésre. A fantomsejteket korábban a citotoxicitás egyik mutatójaként javasolták, azonban a fantomsejtek etiológiája bizonytalan. Rendelkezésre állnak olyan adatok, amelyek arra utalnak, hogy a fantomsejteket kiválthatja vegyi anyaggal összefüggő citotoxicitás, mechanikai/enzim által indukált károsodás a mintapreparálás során (Guerard et al., 2014) és/vagy a vizsgálati vegyi anyag genotoxicitásának szélsőségesebb hatása. Úgy tűnik, más adatok azt jelzik, hogy a fantomsejtek a túlzott, de talán reparálható DNS-károsodásnak tulajdoníthatók (Lorenzo et al., 2013).
5. A szöveteket vagy a sejtmagokat sikeresen lefagyasztják későbbi elemzés céljára. Ez rendszerint a vivőanyagos és a pozitív kontroll válaszára kifejtett, mérhető hatást eredményez (Recio et al., 2010; Recio et al., 2012; Jackson et al., 2013). Amennyiben a laboratórium alkalmaz fagyasztási módszereket, az e téren szerzett szakértelmét igazolnia kell, továbbá meg kell erősítenie a csóva DNS %-os arányának elfogadható alacsony tartományát a vivőanyaggal kezelt állatok célszöveteiben, és meg kell erősítenie, hogy továbbra is kimutathatók pozitív válaszok. A szakirodalomban különböző szövetfagyasztási módszerek szerepelnek. Jelenleg azonban nincs egyetértés azt illetően, hogy mi a szövetek fagyasztásának és felolvasztásának legmegfelelőbb módja, valamint azt illetően sem, hogy hogyan értékelendő, hogy egy esetlegesen módosult válasz befolyásolhatja a vizsgálat érzékenységét.
6. Közelmúltbeli munkák bizonyítják, hogy a kritikus változók jegyzéke várhatóan rövidebb, a kritikus változók paramétereinek meghatározása pedig pontosabb lesz (Guerard et al., 2014).
Hivatkozások
(1) Guerard, M., C. Marchand, U. Plappert-Helbig (2014), Influence of Experimental Conditions on Data Variability in the Liver Comet Assay, Environmental and Molecular Mutagenesis, Vol. 55/2, pp. 114-21.
(2) Jackson, P. et al. (2013), Validation of use of frozen tissues in high-throughput comet assay with fully-automatic scoring, Mutagenesis, Vol. 28/6, pp. 699-707.
(3) Lorenzo,Y. et al. (2013), The comet assay, DNA damage, DNA repair and cytotoxicity: hedgehogs are not always dead, Mutagenesis, Vol. 28/4, pp. 427-32.
(4) OECD (2014), Reports of the JaCVAM initiative international pre-validation and validation studies of the in vivo rodent alkaline comet assay for the detection of genotoxic carcinogens, Series on Testing and Assessment, Nos. 195 and 196, OECD Publishing, Paris.
(5) Recio L, Hobbs C, Caspary W, Witt KL, (2010), Dose-response assessment of four genotoxic chemicals in a combined mouse and rat micronucleus (MN) and Comet assay protocol, J. Toxicol. Sci. 35:149-62.
(6) Recio, L. et al. (2012), Comparison of Comet assay dose-response for ethyl methanesulfonate using freshly prepared versus cryopreserved tissues, Environmental and Molecular Mutagenesis, Vol. 53/2, pp. 101-13.
”
(16) A C. részben a C.13. fejezet helyébe a következő szöveg lép:
„C.13. Bioakkumuláció halakban: Vízi vagy étrendi expozíció
BEVEZETÉS
Ez a vizsgálati módszer egyenértékű az OECD 305. vizsgálati iránymutatásában (2012) leírt módszerrel. E vizsgálati módszer felülvizsgálatának kettős célja van: Először is, magában kíván foglalni egy étrendi bioakkumulációs ( 14 ) vizsgálatot, amely alkalmas arra, hogy meghatározza a nagyon csekély vízoldékonyságú anyagok bioakkumulációs potenciálját. Másodszor szándékolt olyan vizsgálati módszer létrehozása, amely állatjóléti indokból adott esetben kevesebb halat használ fel, és amely költséghatékonyabb.
A C.13. konszolidált vizsgálati módszer (1) elfogadása óta eltelt évek során számos anyag vizsgálatára sor került, és mind a laboratóriumok, mind a szabályozó hatóságok jelentős tapasztalatra tettek szert. Ennek alapján arra a meggyőződésre jutottak, hogy a vizsgálat bonyolultságát mérsékelni lehet bizonyos konkrét kritériumok (vö. 88. pont) teljesülése esetén, és hogy lehetőség van lépcsőzetes megközelítésre. A tapasztalat azt is mutatta, hogy az olyan biológiai tényezők, mint a növekedés és a halak lipidtartalma, jelentősen befolyásolhatják az eredményeket, és azokat esetleg figyelembe kell venni. Ráadásul elismert tény, hogy a vízben nagyon csekély mértékben oldható anyagok vizsgálata a gyakorlatban nem mindig megvalósítható. Emellett vízi környezetben található, nagyon csekély mértékben vízoldékony anyagok tekintetében a vízi expozíció korlátozott jelentőségű lehet az étrendi módszerhez viszonyítva. Ez olyan vizsgálati módszer kialakításához vezetett, ahol a halakra étrendi expozíciót alkalmaznak (vö. 7–14. pont és 97. ponttól). Az étrendi expozíciós vizsgálat validálása (laboratóriumok közötti összehasonlítás) 2010-ben zajlott (51).
A fontosabb változások többek között a következők:
— Elegendőnek tekinthető egyetlen vizsgálati koncentráció tesztelése, ha valószínű, hogy a biokoncentrációs tényező (BCF) független a vizsgálati koncentrációtól.
— Bizonyos kritériumok teljesülése esetén lehetőség van minimális vízi expozíciós vizsgálati tervre is, csökkentett számú mintaponttal.
— A halak lipidtartalmát mérni kell, hogy a BCF-et ki lehessen fejezni 5 %-os lipidtartalom alapján.
— Nagyobb hangsúlyt kap a kinetikus BCF-becslés (ha lehetséges) az állandósult állapoti BCF becslését követően.
— Bizonyos anyagcsoportok esetében az étrendi expozíciós vizsgálat ajánlott, ha azt alkalmasabbnak tekintik a vízi expozíciós vizsgálatnál.
— A halak tömegét mérni kell, hogy a BCFk-t ki lehessen igazítani a növekedés okozta hígulás tekintetében.
A bioakkumulációs vizsgálatok bármelyikének lefolytatása előtt a vizsgálati anyagról a következőket kell tudni:
(a) A mind a vizsgálati anyag, mind a lehetséges metabolitok szövetekben, vízben vagy tápban meglévő koncentrációinak mérését szolgáló elemzési technika érzékenysége (vö. 65. pont).
(b) Vízoldékonyság [A.6. vizsgálati módszer; (2)]; ezt olyan módszerrel összhangban kell meghatározni, amely a (becsült) oldhatósági tartomány szempontjából megfelelő a megbízható érték megszerzéséhez. A víztaszító anyagok tekintetében ez szokásosan az oszlopelúciós módszer.
(c) n-oktanol-víz megoszlási együttható, K OW ( 15 ) [A.8. (4), A.24. (5), A.23. (6) vizsgálati módszer]; vagy más alkalmas információ a megoszlási viselkedésről (pl. lipidekhez való szorpció, K OC); ezt olyan módszerrel összhangban kell meghatározni, amely a (becsült) K OW tartomány szempontjából megfelelő a megbízható érték megszerzéséhez. A víztaszító anyagok tekintetében ez szokásosan a lassú keveréses módszer [A.23. vizsgálati módszer (6)];
(d) Az anyag stabilitása vízben (hidrolízis [C.7. vizsgálati módszer (7)]);
(e) Az anyag stabilitása a tápban (különösen, ha étrendi expozíciós megközelítést választanak);
(f) A vizsgálat megvilágítási körülményei szempontjából releváns fototranszformációra vonatkozó információ (8);
(g) Felületi feszültség (azaz olyan anyagoknál, ahol a log KOW-t nem lehet meghatározni) [A.5. vizsgálati módszer (9)];
(h) Gőznyomás [A.4. vizsgálati módszer (10)];
(i) A vízben való biológiai vagy abiotikus lebonthatósággal kapcsolatos információ, például (de nem kizárólag) a gyors biológiai lebonthatóság [C.4. vizsgálati módszer, II–VII. rész(11), C.29. vizsgálati módszer (12)], adott esetben;
(j) A metabolitokkal kapcsolatos információ: szerkezet, log KOW, képződés és lebonthatóság, adott esetben;
(k) Sav disszociációs állandó (pK a) az esetlegesen ionizáló anyagok esetében. Ha szükséges, a vizsgálati víz pH-ját ki kell igazítani annak garantálására, hogy az anyag nem ionizált formában legyen jelen a vizsgálat során, ha ez a halfajjal összeegyeztethető.
A választott expozíciós módszertől vagy mintavételi rendszertől függetlenül ez a vizsgálati módszer az anyagok halakban megjelenő bioakkumulációs potenciáljának jellemzésére szolgáló eljárást írja le. Bár az átfolyásos vizsgálatot előnyben kell részesíteni, félstatikus rendszerek is megengedhetők, feltéve hogy az érvényességi kritériumoknak (vö. 24. és 113. pont) megfelelnek. Az étrendi expozíciós útvonalban nincs szükség átfolyásos rendszerre a vizsgálati anyag vízi koncentrációjának fenntartása érdekében, de segít fenntartani az oldott oxigén koncentrációját és tiszta vizet biztosít, továbbá megszünteti pl. az exkrétumok hatását.
A választott vizsgálati módszertől függetlenül e módszer elegendő részlettel szolgál a vizsgálat kivitelezéséhez, miközben kellő szabadságot enged a kísérleti terv egyes laboratóriumok körülményeihez és a vizsgálati anyagok változó jellemzőihez igazítására. A vízi expozíciós vizsgálat leghatékonyabban 1,5–6,0 log KOW értékkel rendelkező stabil szerves vegyi anyagokra alkalmazható (13), de még alkalmazható erőteljesen víztaszító anyagokra is (amelyek esetében a log KOW > 6,0), ha igazolható a vizsgálati anyag stabil és teljesen feloldott koncentrációja a vízben. Ha nem mutatható ki a vizsgálati anyag stabil koncentrációja a vízben, a vizes vizsgálat nem lenne megfelelő, és ezért az anyag halakban történő teszteléséhez az étrendi megközelítésre lesz szükség (jóllehet az étrendi vizsgálat eredményeinek kiértékelése és felhasználása a szabályozói kerettől függ). A kb. 9,0-ig terjedő log KOW értékkel rendelkező szerves vegyi anyagok előzetesen becsült biokoncentrációs tényezője (BCF, illetve néha KB) a Bintein és társai egyenletével kapható meg (14). A biokoncentrációs tényező (BCF) előzetesen becsült értéke az ilyen erősen víztaszító anyagok esetében feltehetően nagyobb lesz, mint a laboratóriumi kísérletekből várt állandósult állapoti biokoncentrációs tényező (BCFSS) értéke, különösen, ha egyszerű lineáris modellt alkalmaznak az előzetes becsléshez. A bioakkumulációs potenciált jellemző paraméterek a felvételi sebességi állandó (k 1), az ürülési sebességi állandó, ideértve a tisztulási sebességi állandót (k 2), az állandósult állapoti biokoncentrációs tényező (BCFSS), a kinetikus biokoncentrációs tényező (BCFK) és az étrendi biomagnifikációs tényező (BMF) ( 16 ).
A radioaktívan jelölt vizsgálati anyagok megkönnyíthetik a víz-, táp- és halminták analízisét, és felhasználhatók annak eldöntésére, hogy kell-e metabolit-azonosítást és -számszerűsítést végezni. Amennyiben csak az összes radioaktív maradékot mérték (például égetéssel vagy szövetfeloldással), a BCF vagy a BMF a kiindulási anyagon, bármely visszatartott metaboliton és az asszimilált szénen is alapul. A valamennyi radioaktív maradékon alapuló BCF vagy BMF értékeket ezért nem lehet közvetlenül összehasonlítani egyedül a kiindulási anyag egyedi kémiai analíziséből nyert BCF vagy BMF értékkel. A BCF vagy BMF kiindulási anyagon alapuló meghatározása érdekében a radioaktív jelölésen alapuló vizsgálatok során végzett elemzések előtt szétválasztási eljárásokat, pl. TLC, HPLC vagy GC ( 17 ) lehet alkalmazni. Szétválasztási módszerek alkalmazása esetén el kell végezni a kiindulási anyag és a megfelelő metabolitok azonosítását és számszerűsítését ( 18 ) (vö. 65. pont), ha a BCF vagy BMF értéknek a kiindulási anyag halban meglévő koncentrációján és nem az összes radioaktívan jelölt maradékon kell alapulnia. A halakon végzett anyagcsere-vizsgálatot vagy in vivo eloszlási vizsgálatot bioakkumuláció-vizsgálattal is lehet kombinálni a szövetekben levő maradékok analízise és azonosítása révén. Az anyagcsere lehetősége megfelelő eszközökkel jelezhető előre (pl. OECD QSAR eszköztár (15) és szabadalmaztatott QSAR programok).
Az azzal kapcsolatos döntést, hogy vízi vagy értrendi expozíciós vizsgálatot végezzenek-e és milyen összeállításban, a 3. pontban felsorolt tényezőkre kell alapozni, a megfelelő szabályozói keretet is figyelembe véve. Például a magas log KOW értékkel rendelkező, de a rendelkezésre álló analitikai módszerek érzékenységének fényében értékelhető vízoldékonyságot mutató anyagok tekintetében elsődlegesen a vízi expozíciós vizsgálatot kell mérlegelni. Lehetséges ugyanakkor, hogy a vízoldékonyságra vonatkozó információ nem meghatározó e víztaszító anyagok esetében, ezért az alkalmazandó vizsgálati módszerrel kapcsolatos döntés meghozatala előtt vizsgálni kell a vízi expozíciós vizsgálatra alkalmas, stabil, mérhető oldott vízi koncentrációk elkészítésének lehetőségét (a stabil emulziók nem megengedettek) (16). Nem lehet pontos, előíró jellegű iránymutatást adni arra vonatkozóan, hogy a vízoldékonyság és az oktanol-víz megoszlási hányados kizárási kritériumai alapján melyik módszert kell alkalmazni, mivel más tényezők (analitikai módszerek, bomlás, adszorpció stb.) észlelhető hatást gyakorolhatnak a módszer alkalmazhatóságára a fent említett okokból. Ugyanakkor az 5 feletti log KOW érték és a ~0,01 – 0,1 mg/l alatti vízoldékonyság kijelöli az anyagok azon tartományát, ahol a vízi expozíció egyre nehézkesebbé válhat.
A vizsgálat megválasztását esetlegesen befolyásoló más tényezőket is mérlegelni kell, beleértve az anyag vizsgálati edényekhez és készülékhez való lehetséges adszorpcióját, a vizes oldatokban való stabilitását szemben a haltápban tapasztalható stabilitásával (17) (18), stb.
Az ilyen gyakorlati szempontokkal kapcsolatos információ elérhető más, lezárt vizes vizsgálatokból. A bioakkumulációs vizsgálatok végrehajtásával kapcsolatos szempontok értékelésére vonatkozó további információ elérhető a szakirodalomban (pl. (19)).
Az olyan anyagok esetében, amelyeknél az oldhatóság vagy a vízben oldott koncentráció fenntartása, illetve e koncentrációk elemzése nem jelent korlátot a vízi expozíciós módszer megvalósítása számára, az anyagok biokoncentrációs potenciálját lehetőség szerint ezzel a módszerrel kell meghatározni. Mindenesetre ellenőrizni kell, hogy az alkalmazandó vízi expozíciós koncentráció(k) a vizsgálati közegben a vízoldékonyságon belül marad(nak). Az oldott vizsgálati anyag állandó koncentrációinak fenntartására különböző módszerek használhatók, például törzsoldatok vagy passzív adagolási rendszerek (pl. az oszlopelúciós módszer) alkalmazása, ameddig bizonyítható, hogy a koncentráció fenntartható és a vizsgálati közeg nem tér el a 27. pontban ajánlottól.
Az erőteljesen víztaszító anyagok (5 feletti log KOW érték és ~0,01 – 0,1 mg/l alatti vízoldékonyság) esetén a vízi expozíció egyre nehézkesebbé válhat. A korlátok oka lehet, hogy a vízben oldott koncentráció nem tartható fenn egy kellően állandónak tekinthető szinten (pl. az expozíciós tartóedények üvegére való rárakódás vagy a halak általi gyors felvétel miatt), vagy az, hogy az alkalmazandó vízi koncentráció annyira alacsony, hogy az analitikai meghatározási határ tartományába esik, vagy elmarad attól ( 19 ). E nagymértékben víztaszító anyagok esetében az étrendi vizsgálat ajánlott, feltéve hogy a vizsgálat összhangban van a vonatkozó szabályozói kerettel és a kockázatértékelési igényekkel.
A felületaktív anyagok esetében mérlegelni kell, hogy a vízi biokoncentrációs vizsgálat megvalósítható-e, tekintettel az anyag tulajdonságaira, egyébként az étrendi vizsgálat valószínűleg megfelelőbb. A felületaktív anyagok csökkentik a két folyadék közötti határfelületi feszültséget. Amfifil jellegük miatt (azaz, hogy mind hidrofil, mind víztaszító résszel rendelkeznek) felhalmozódnak olyan határfelületeken, mint a víz-levegő határfelület, a víz-táp határfelület és az üvegfalak, ami megakadályozza ezek vízi koncentrációjának meghatározását.
Az étrendi vizsgálat kiküszöbölheti az expozíciós szempontok némelyikét olyan összetett keverékek esetében, amelyek összetevőinek vízoldékonysági határértékei különböznek, ennyiben a keverék valamennyi alkotóelemének való hasonló expozíció valószínűbb, mint a vizes módszer esetén (vö. (20))
Meg kell jegyezni, hogy az étrendi megközelítés inkább étrendi biomagnifikációs tényezőt és nem biokoncentrációs tényezőt (BCF) ad ( 20 ). Rendelkezésre állnak megközelítések a kinetikus biokoncentrációs tényező (BCFK) becslésére az étrendi vizsgálatból nyert adatok alapján (amint azt a 8. függelék ismerteti), ám ezeket fenntartásokkal kell alkalmazni. Ezek a megközelítések elsősorban elsőrendű kinetikát feltételeznek, és csak vegyületek bizonyos csoportjaira alkalmazhatók. Valószínűtlen, hogy ezeket használni lehessen felületaktív anyagok esetében (lásd a 12. pontot).
Az olyan minimalizált vízi expozíciós vizsgálat, amelyet kevesebb mintavételi ponttal építenek fel az állatok számának és/vagy az erőforrásoknak a csökkentése érdekében (vö. a 83. ponttól), csak azokra az anyagokra alkalmazható, amelyek esetében okkal várható, hogy a felvétel és a tisztulás megközelítőleg elsőrendű kinetikát követ (azaz általában nem ionizált szerves anyagok esetében, vö. 88. pont).
C.13. – I: Vízi expozíción alapuló biokoncentrációs halvizsgálat
A VIZSGÁLAT ELVE
A vizsgálat két fázisból áll: az expozíciós (felvételi) és az expozíció utáni (tisztulási) fázisból. A felvételi fázis alatt az egy fajhoz tartozó halak csoportja a vizsgálati anyag egy vagy több választott koncentrációjával érintkezik, a vizsgálati anyag tulajdonságaitól függően (vö. 49. pont). Ezután átkerülnek a vizsgálati anyagot nem tartalmazó közegbe a tisztulási fázisra. A tisztulási fázis mindig szükséges, kivéve, ha az anyag felvétele a felvételi fázis alatt elhanyagolható volt. A vizsgálati anyag koncentrációját a halakban/halakon (vagy meghatározott szövetén/szövetében) a vizsgálat mindkét fázisa alatt figyelemmel kísérik. A kitett csoporton túlmenően, a halak egy kontrollcsoportját azonos körülmények között tartják – leszámítva a vizsgálati anyag hiányát – annak érdekében, hogy a biokoncentrációs vizsgálat során megfigyelt esetleges ártalmas hatások a megfelelő kontrollcsoporthoz legyenek viszonyíthatók, és meghatározhatók legyen a vizsgálati anyag háttér-koncentrációi ( 21 ).
A vízi expozíciós vizsgálat során a felvételi fázis általában 28 nap. Ez az időtartam szükség esetén meghosszabbítható (vö. 18. pont), vagy lerövidíthető, ha igazolt, hogy az állandósult állapotot korábban elérték (a fogalommeghatározások és mértékegységek tekintetében lásd az 1. függeléket). Az 5. függelék egyenleteivel lehet következtetni a felvételi fázis hosszára és az állandósult állapot eléréséhez szükséges időre. A tisztulási periódus ezután a hal vizsgálati anyagnak való expozíciója megszüntetésével, azaz egy másik tiszta, ugyanolyan közeget, de vizsgálati anyagot nem tartalmazó edénybe való áthelyezésével kezdődik. Amennyiben lehetséges, a biokoncentrációs tényezőt lehetőleg az állandósult állapotban a halban (Cf) és vízben lévő (Cw) koncentráció arányaként (BCFSS; a meghatározást lásd az 1. függelékben), továbbá a felvételi (k 1) és tisztulási (k 2) sebességi állandó hányadosával, elsőrendű kinetikát feltételezve, kinetikus biokoncentrációs tényezőként (BCFK; a meghatározást és a mértékegységeket lásd az 1. függelékben) kell kiszámítani ( 22 ).
Amennyiben 28 nap alatt nem áll be az állandósult állapot, a BCF-et vagy kinetikus megközelítés alkalmazásával kell kiszámítani (vö. 38. pont), vagy a felvételi fázist meg kell hosszabbítani. Amennyiben ez megvalósíthatatlanul hosszú felvételi fázishoz vezetne az állandósult állapot eléréséig (vö. 37. és 38. pont, valamint 5. függelék), előnyben kell részesíteni a kinetikus megközelítést. Vagylagosan, nagymértékben víztaszító anyagok esetében az étrendi vizsgálat ajánlott ( 23 ), feltéve hogy az étrendi vizsgálat összhangban van a vonatkozó szabályozói kerettel.
A felvételi sebességi állandót, a tisztulási (ürülési) sebességi állandót (vagy állandókat, amennyiben összetettebb modellt alkalmaztak), a biokoncentrációs tényezőt (állandósult állapot és/vagy kinetikai), és amennyiben lehetséges, e paraméterek mindegyike esetében a konfidenciahatárokat, a halban és a vízben mért vizsgálatianyag-koncentrációt legjobban leíró modell szerint számítják ki (vö. 5. függelék).
A halak tömegének a vizsgálat során bekövetkező növekedése következtében a fejlődő halakban csökken a vizsgálatianyag-koncentráció (ez az úgynevezett növekedés okozta hígulás), így a kinetikus BCF-et alulbecslik, ha nem korrigálják a növekedés tekintetében (vö. 72. és73. pont).
A BCF a halban megfigyelt teljes koncentráción alapul (azaz teljes nedves tömegének függvényeként fejezik ki). Különleges célokra azonban meghatározott szövetek és szervek (pl. izom, máj) is használhatók, amennyiben a hal elég nagy, illetve ha a hal ehető (filé) és nem ehető (zsiger) részekre osztható. Mivel számos szerves anyagnál egyértelmű kapcsolat van a biokoncentrációs potenciál és a víztaszító képesség között, ezért ugyanilyen kapcsolat van a vizsgálati hal lipidtartalma és az ilyen anyagok megfigyelt biokoncentrációja között is. Ezért a nagy lipofilitású (azaz log KOW > 3) anyagokra kapott vizsgálati eredmények variabilitása e forrásának csökkentéséhez a biokoncentrációt 5 %-os lipidtartalmú halra normalizálva kell kifejezni (a teljes nedves testtömeg alapján), a vizsgálatból közvetlenül származtatott lipidtartalmon kívül. Erre azért van szükség, hogy olyan alapot szolgáltassanak, amelyből kiindulva a különböző anyagokkal és/vagy vizsgálati fajokkal kapcsolatos eredmények összevethetők egymással. Az 5 %-os lipidtartalom széles körben alkalmazott, mivel ez az ilyen vizsgálati módszerben általában használt halak átlagos lipidtartalmát jelenti (21).
A VIZSGÁLATI ANYAGRA VONATKOZÓ INFORMÁCIÓK
A vizsgálati anyag bevezetésben (3. pont) megadott tulajdonságain felül más szükséges információ a vizsgálat során alkalmazandó halfajokra gyakorolt, lehetőleg aszimptotikus LC50 (azaz az idő függvényében meghatározott) toxicitás és/vagy a hosszú távú halvizsgálatok (pl. C.47. (22), C.15. (23), C.14. (24) vizsgálati módszer) alapján becsült toxicitás.
Ismert pontosságú és érzékenységű analitikai módszernek kell rendelkezésre állnia a vizsgálati anyag kvantifikálására a vizsgálati oldatokban és a biológiai anyagban, a mintakészítés és tárolás részleteivel együtt. A vizsgálati anyag vízben és halszövetekben érvényes analitikai meghatározási határának is ismertnek kell lennie. Amennyiben radioaktívan jelölt vizsgálati anyagot használnak, annak a legnagyobb tisztaságúnak kell lennie (pl. lehetőség szerint > 98 %), és ismerni kell a szennyeződésekhez tartozó százalékos radioaktivitást.
A VIZSGÁLAT ÉRVÉNYESSÉGE
A vizsgálat érvényességéhez a következő feltételeknek kell teljesülniük:
A vízhőmérséklet változása kevesebb, mint ± 2 °C, mivel a nagy eltérések befolyásolhatják a felvétel és a tisztulás szempontjából fontos biológiai paramétereket, továbbá stressznek tehetik ki az állatokat.
Az oldott oxigén koncentrációja nem eshet 60 %-os telítettség alá.
A kamrákban a vizsgálati anyag koncentrációját a felvételi fázisban mért értékek átlagának ± 20 %-án belül kell tartani.
A vizsgálati anyag koncentrációja a vízoldékonysági határértékén belül van, figyelembe véve a vizsgálati víz tényleges oldhatóságra gyakorolt hatását ( 24 ).
A vizsgálat végén a kontroll és a kezelt halak mortalitásának és egyéb káros hatásoknak/betegségeknek 10 %-nál kisebbnek kell lenni; amennyiben a vizsgálat több hétig vagy hónapig tart, a pusztulásnak, vagy más ártalmas hatásnak a halak mindkét csoportjában kisebbnek kell lenni havi 5 %-nál, és összességében nem haladhatja meg a 30 %-ot. Az átlagos növekedésnek a mintába felvett halak vizsgálati és a kontrollcsoportja közötti jelentős különbségei a vizsgálati anyag toxikus hatására utalhatnak.
REFERENCIAANYAGOK
Ismert biokoncentrációs potenciállal és alacsony anyagcserével jellemzett referenciaanyagok alkalmazása hasznos lehet a kísérleti eljárás ellenőrzéséhez, ha erre szükség van (pl. ha a laboratórium nem rendelkezik korábbi tapasztalattal a vizsgálatot érintően, vagy ha a kísérleti körülmények megváltoztak).
A MÓDSZER ISMERTETÉSE
Felszerelés
A vizsgálat során kerülni kell az olyan anyagok használatát, amelyek oldódhatnak, szorbeálódhatnak vagy kimosódhatnak az eszközökből, és ártalmasak lehetnek a halakra. Szabványos, kémiailag közömbös anyagból készült, a töltési aránynak megfelelő térfogatú négyszögletes vagy hengeres tartályok használhatók (vö. 43. pont). A puha műanyag csövek használatát minimalizálni kell. Politetrafluoretilén, rozsdamentes acél és/vagy üvegcsövek használata ajánlott. A tapasztalatok alapján a nagy adszorpciós együtthatójú vizsgálati anyagok, mint a szintetikus piretroidok esetében szükséges lehet szilanizált üveg használata. Ilyen esetekben a felszerelést használat után el kell dobni. A vizsgálati szervezetek hozzáadása előtt a vizsgálati rendszereket lehetőség szerint annyi ideig kell kitenni a vizsgálati vegyi anyag vizsgálat során alkalmazandó koncentrációinak, amennyi a stabil expozíciós koncentrációk fenntartásának bizonyításához előírt.
Víz
A vizsgálathoz általában természetes vizet kell használni, amely nem szennyezett, és állandó minőségű forrásból származik. Ugyanakkor mesterséges víz (azaz olyan ásványmentesített víz, amelyhez ismert mennyiségben tápanyagot adtak) alkalmasabb lehet az állandó minőség időbeli biztosítására. A hígítóvíz (azaz a vizsgálati anyaggal a vizsgálati edénybe helyezés előtt elkevert víz, vö. 30. pont) minőségének lehetővé kell tennie a választott halfajok túlélését az akklimatizációs és a vizsgálati időszakok alatt anélkül, hogy bármilyen rendellenes külső megjelenés vagy viselkedés jelentkezne. Ideális esetben a vizsgálati fajok bizonyítottan képesek túlélni, fejlődni és szaporodni a hígítóvízben (pl. laboratóriumi tenyészetben, vagy életciklusra vonatkozó toxicitásvizsgálatnál). A vizet legalább a pH-val, keménységgel, valamennyi szilárd anyaggal, teljes szervesszén-tartalommal (TOC ( 25 )), és lehetőleg ammónium-, nitrittartalommal és alkalitással, továbbá tengeri fajok esetében sótartalommal is jellemezni kell. A halak optimális jólétéhez fontos paraméterek nem teljesen ismertek, de a 2. függelék megadja számos paraméter esetében az ajánlott maximális koncentrációt a vizsgálathoz használt édes- és tengervízre.
A vizsgálati időszak alatt a hígítóvíznek állandó minőségűnek kell lennie. A pH-értékének 6,0 és 8,5 között kell lennie a vizsgálat kezdetekor, de egy adott vizsgálat során ± 0,5 pH egységnyi tartományon belül kell maradnia. Analízis céljából bizonyos időközönként, de legalább a vizsgálat kezdetekor és végén mintákat kell venni annak érdekében, hogy a hígítóvíz ne befolyásolhassa hátrányosan a vizsgálati eredményeket (például a vizsgálati anyag komplexálásával), vagy ne legyen káros hatással a halállomány teljesítményére. Meg kell határozni a következők mennyiségét: a nehézfémek (pl. Cu, Pb, Zn, Hg, Cd és Ni), a fontosabb anionok és kationok (pl. Ca2+, Mg2+, Na+, K+, Cl–, és SO4 2–), a peszticidek (pl. összes szerves foszfor és összes szerves klór tartalmú peszticidek), a teljes szervesszén-tartalom és a szuszpendált szilárd anyagok, például háromhavonta, amennyiben a hígítóvízről tudott, hogy viszonylag állandó minőségű. Amennyiben a hígítóvíz minősége legalább egy éven keresztül állandónak bizonyul, a vizsgálatot ritkábban és nagyobb időközönként is el lehet végezni (pl. minden hat hónapban).
A hígítóvíz természetes részecske- és teljes szervesszén-tartalmának (TOC) is a lehető legalacsonyabbnak kell lenni, hogy a vizsgálati anyag ne adszorbeálódjon szerves anyagon, ami csökkenthetné a biológiai hasznosíthatóságot és egyúttal a BCF alulbecslését eredményezné. A maximális elfogadható érték 5 mg/l szemcsés anyagok esetében (szárazanyag, 0,45 μm-es szűrőn nem jut át) és 2 mg/l a teljes szervesszén-tartalom esetében (vö. 2. függelék). A hígítóvizet szűrni kell felhasználás előtt, amennyiben szükséges. A kísérleti halaktól (ürülék) és a tápmaradékból származó szerves széntartalom járulékának a lehető legkisebbnek kell lenni a vizsgálati vízben (vö. 46. pont).
Vizsgálati oldatok
A vizsgálati anyagból megfelelő koncentrációjú törzsoldatot kell készíteni. A törzsoldatot célszerű a vizsgálati anyagnak egyszerűen a hígítóvízbe keverésével vagy összerázással elkészíteni. Egyes esetekben megfelelő alternatíva lehet szilárd fázisú deszorpciós adagolási rendszer. Oldószerek és diszpergálószerek (oldódást segítő szerek) alkalmazása általában nem ajánlott (vö (25)); ugyanakkor ezen anyagok használata elfogadható lehet a megfelelő koncentrációjú törzsoldat létrehozásához, de minden erőfeszítést meg kell tenni az ilyen anyagok használatának minimalizálására, és ezeknek a micellák képződése szempontjából kritikus koncentrációját nem szabad túllépni (ha van ilyen). Alkalmazható oldószer az aceton, az etanol, a metanol, a dimetil-formamid és a trietilén-glikol; a korábban használt diszpergálószerek pedig a Tween 80, a 0,01 %-os metilcellulóz és a HCO-40. A végleges vizsgálati közegben az oldószer koncentrációjának valamennyi kezelés során azonosnak kell lennie (azaz függetlenül a vizsgálati anyag koncentrációjától), és az nem lépheti túl az oldószerre vizsgálati körülmények tekintetében meghatározott toxicitási küszöbértékeket. A legmagasabb szint a 100 mg/l (vagy 0,1 ml/l) koncentráció. Valószínűtlen, hogy a 100 mg/l oldószer-koncentráció jelentősen változtatna a vizsgálati anyag maximális, a közegben elérhető oldott koncentrációján (25). Ismerni kell, hogy az oldószer (a vizsgálati anyaggal együtt) mennyivel járul hozzá a vizsgálati víz teljes szervesszén-tartalmához. A vizsgálat során a vizsgálati edényekben a teljes szervesszén-tartalom nem haladhatja meg a vizsgálati anyagból és, amennyiben alkalmazták, az oldószerből vagy oldódást segítő szerből ( 26 ) származó szerves szén koncentrációját 10 mg/l-nél nagyobb mértékben (± 20 %). A szervesanyag-tartalom jelentős hatást gyakorolhat a szabadon oldott vizsgálati anyag mennyiségére az átfolyásos halvizsgálatok során, különösen az erősen lipofil anyagok tekintetében. A szilárd fázisú mikroextrakció (vö. 60. pont) fontos információt szolgáltathat a kötött és szabadon oldott vegyületek arányáról; a kettő közül ez utóbbi képviseli vélhetően a biológiailag hasznosítható részt. A vizsgálati anyag koncentrációja el kell maradjon a vizsgálati anyag vizsgálati közegben tapasztalható oldhatósági határértékétől oldószer vagy oldódást segítő szer használata ellenére. Gondosan kell eljárni a biológiailag könnyen lebontható oldószerek használata esetén, mivel átfolyásos vizsgálatokban baktériumnövekedés révén problémát okozhatnak. Ha oldódást segítő szer használata nélkül nem lehetséges törzsoldatot készíteni, meg kell fontolni, hogy az étrendi vizsgálat nem megfelelőbb-e a vízi expozíciós vizsgálattal szemben.
Átfolyásos vizsgálatokban a vizsgálati anyag törzsoldatát folyamatosan adagoló és hígító rendszerre (pl. állandó áramlási sebességet biztosító pumpa, szabályozható hígító rendszer, telítőrendszer) vagy szilárd fázisú deszorpciós adagolási rendszerre van szükség a vizsgálati koncentrációk kísérleti kamrákba juttatásához. Az egyes kamrák esetében lehetőség szerint legalább a napi öt térfogatcserét lehetővé kell tenni. Az átfolyásos mód részesítendő előnyben, de amennyiben nem alkalmazható (pl. ha a vizsgálati szervezetekre károsan hat), félstatikus módszer használható, feltéve hogy az érvényességi kritériumok teljesülnek (vö. 24. pont). A törzsoldatok és a hígítóvíz áramlási sebességét a vizsgálat előtt 48 órával, és azt követően a vizsgálat során legalább naponta ellenőrizni kell. Az ellenőrzés magában foglalja az áramlási sebesség meghatározását az egyes vizsgálati kamrákban, és biztosítja, hogy ne változzon 20 %-nál nagyobb mértékben sem az egyes kamrákban, sem azok között.
A fajok megválasztása
A fajok megválasztásánál fontos követelmény, hogy könnyen és megfelelő méretben elérhetők, és a laboratóriumban kielégítő körülmények között tarthatók legyenek. A halfajok megválasztásának egyéb követelményei közé tartozik a fontosság rekreációs, kereskedelmi, ökológiai szempontból éppúgy, mint az összehasonlítható érzékenység, múltbeli sikeres használat stb. Az ajánlott vizsgálati fajok a 3. függelékben találhatók. Más fajok is használhatók, de a vizsgálati eljárást esetleg át kell dolgozni a megfelelő vizsgálati körülmények biztosításához. Ez esetben a fajok és a kísérleti módszer megválasztásának indoklását fel kell tüntetni a Vizsgálati jegyzőkönyvben. Általánosságban a kisebb halfajok használata lerövidíti az állandósult állapot eléréséhez szükséges időt, de több halra (mintára) lehet szükség a lipidtartalom és a halban található vizsgálatianyag-koncentrációk megfelelő elemzéséhez. Emellett lehetséges, hogy a fiatal és időseb egyedek közötti, a légzés sebességét és az anyagcserét érintő különbségek gátolhatják a különböző vizsgálatokkal és vizsgálati fajokkal elért eredmények összehasonlítását. Meg kell jegyezni, hogy a halfajok gyors növekedéssel járó (fiatal) életszakaszban történő vizsgálata bonyolíthatja az adatok kiértékelését.
A halak tartása (mind a vízi, mind az étrendi expozíció esetében)
A törzsállományt legalább kéthetes időszakban a vizsgálati hőmérsékleten akklimatizálni kell (vö. 28. pont), és kellő táplálékot kell biztosítani ez idő alatt (vö. 45. pont). Mind a víz, mind az étrend típusának meg kell egyeznie a vizsgálat során használttal.
A 48 órás betelepítési időszak után a mortalitást rögzíteni kell, és az alábbi követelményeket kell alkalmazni:
— amennyiben hét nap alatt a populáció mortalitása 10 %-nál magasabb, az egész állományt ki kell cserélni;
— amennyiben hét nap alatt a populáció mortalitása 5–10 %: ha további hét nap akklimatizációs időszak beiktatása után a mortalitási arány ezt követően is magasabb 5 %-nál – az egész állományt ki kell cserélni;
— amennyiben hét nap alatt a populáció mortalitása 5 %-nál alacsonyabb, az állományt el kell fogadni.
A vizsgálathoz csak láthatóan betegségtől és rendellenességtől mentes halak használhatók. A beteg halakat el kell dobni. A vizsgálatot megelőző két hétben és a vizsgálat alatt a halak nem kaphatnak kezelést betegségre.
A VIZSGÁLAT ELVÉGZÉSE
Elővizsgálat
Hasznos lehet elővizsgálatokat végezni a meghatározó vizsgálat vizsgálati körülményeinek optimalizálására (pl. a vizsgálati anyag koncentrációjának megválasztása, a felvételi és tisztulási fázisok tartama), vagy annak meghatározása érdekében, hogy teljes vizsgálatot kell-e folytatni. Az elővizsgálatot úgy kell kialakítani, hogy be lehessen szerezni a szükséges információt. El lehet dönteni, hogy a BCF megállapításához elegendő-e minimalizált vizsgálat, vagy teljes vizsgálatra van szükség (vö. a minimalizált vizsgálatot ismertető 83–95. pont).
Az expozíció körülményei
A felvételi fázis időtartama
A felvételi fázis időtartamának előrejelzése előzetes tapasztalatból (pl. előző vizsgálatból vagy szerkezetileg rokon anyagot érintő akkumulációs vizsgálatból), vagy bizonyos, a vizsgálati anyag vízoldékonysága, vagy oktanol/víz megoszlási együtthatója ismeretét felhasználó tapasztalati összefüggésekből nyerhető (feltéve, hogy a felvétel első rendű kinetikát követ, vö. 5. függelék).
A felvételi fázisnak 28 napig kell tartania, kivéve, ha igazolható, hogy az állandósult állapot korábban kialakult (lásd az 1. függeléket a fogalommeghatározások és mértékegységek tekintetében). Állandósult állapot látható a halban mért vizsgálati anyag (Cf) időfüggő ábráján, amennyiben a görbe párhuzamos az időtengellyel, és a Cf három egymást követő, legalább két nap különbséggel vett mintán alapuló elemzése ± 20 %-on belül van egymáshoz képest, és a Cf jelentős időbeli növekedése nem tapasztalható az első és az utolsó egymást követő elemzés között. Összevont minták analízisénél legalább négy egymást követő analízis szükséges. Olyan vizsgálati anyagoknál, amelyek felvétele lassú, megfelelőbbek a hétnapos időközök. Amennyiben az állandósult állapot nem áll be 28 nap alatt, vagy a BCF-et kell kizárólag a kinetikus megközelítéssel kiszámítani, ami nem függ az állandósult állapot elérésétől, vagy a felvételi fázist kell kiterjeszteni további méréseket végezve, amíg az állandósult állapot beáll, vagy legfeljebb 60 napig. Emellett a felvételi fázis végén a vizsgálati anyag halban lévő koncentrációjának kellően magasnak kell lennie a tisztulási fázisból a k2 megbízható becslésének garantálása érdekében. Ha 28 nap elteltével nem mutatható ki jelentős felvétel, a vizsgálat leállítható.
A tisztulási fázis időtartama
Az elsőrendű kinetikát követő anyagok esetében a felvételi fázis időtartamának a fele rendszerint elég a test anyagterhelésének megfelelő (pl. 95 %-os) csökkenéséhez (vö. 5. függelék a becslés magyarázatához). Amennyiben a 95 %-os csökkenéshez szükséges idő aránytalanul hosszú, meghaladja például a felvételi fázis hosszának kétszeresét (azaz több mint 56 nap), rövidebb időtartam is alkalmazható (azaz amíg a vizsgálati anyag koncentrációja kisebb lesz az állandósult állapoti koncentráció 10 %-ánál). Az elsőrendű kinetikát eredményező egyrekeszes modellnél összetettebb felvételi és tisztulási fázissal rendelkező anyagoknál azonban hosszabb tisztulási fázisra lehet szükség. Ha ennyire összetett mintázat tapasztalható és/vagy várható, a vizsgálat megfelelő kialakításának biztosítása érdekében ajánlott biostatisztikustól és/vagy farmakokinetikustól szakvéleményt kérni. Meghosszabbított tisztulási időszak esetén a mintába felveendő halak száma korlátokat jelenthet, és a halak közötti növekedésbeli különbségek befolyásolhatják az eredményt. Az időtartamot az a periódus szabhatja meg, amelynek során a halban a vizsgálati anyag koncentrációja az analitikai meghatározási határ fölött marad.
A vizsgálati halak száma
A halak számát vizsgálati koncentrációnként úgy kell kiválasztani, hogy legalább négy hal álljon rendelkezésre minden mintavételi ponton. A halakat csak akkor lehet összevonni, ha az egyedi halvizsgálat nem megvalósítható. Ha a görbeillesztésben (és a származtatott paraméterekben) nagyobb pontosságot kívánnak elérni, vagy ha anyagcsere-vizsgálatra van szükség (pl. a metabolitok és a kiindulási anyag közötti különbségtétel érdekében radioaktívan jelölt vizsgálati anyagok esetén), mintavételi pontonként több halat kell biztosítani. A lipidtartalmat ugyanazon a biológiai anyagon kell meghatározni, mint amit a vizsgálati anyag koncentrációjának meghatározására használtak. Amennyiben ez nem megvalósítható, további halakra lehet szükség (vö. 56–57. pont).
Ha felnőtt (azaz ivarérett) halakat használnak, azok nem lehetnek az ívási időszakban, illetve nem lehetnek olyanok, amelyek a közelmúltban raktak ikrát (azaz már leikrázott halak) akár a vizsgálat előtt, akár annak során. Rögzíteni kell, hogy hímeket vagy nőstényeket, vagy mindkettőt használnak-e a kísérletben. Mindkét ivar használata esetén dokumentálni kell, hogy az expozíció kezdete előtt a két ivar között a növekedés és a lipidtartalom különbsége jelentéktelen; különösen, ha szükséges lehet a hím és nőstény halak egybegyűjtése az anyag kimutatható koncentrációinak és/vagy a lipidtartalom garantálására.
Mindegyik vizsgálatban hasonló tömegű halakat kell kiválasztani úgy, hogy a legkisebbek ne legyenek kisebbek a legnagyobb hal tömegének kétharmadánál. Ugyanabba a korcsoportba tartozzanak, és a származásuk is azonos legyen. Mivel a halak tömege és kora jelentős hatással lehet a BCF értékekre (12), ezeket a részleteket pontosan rögzíteni kell. Ajánlott az átlagtömeg becslése érdekében a vizsgálat kezdete előtt röviddel a halállomány egy mintaalcsoportját lemérni (vö. 61. pont).
Betelepítés
A halak méretéhez viszonyítva nagy mennyiségű vizet kell használni annak érdekében, hogy minimalizálni lehessen a vizsgálati vegyület vízben lévő koncentrációjában a vizsgálat kezdetén halak hozzáadásával okozott csökkenést, és hogy elkerülhető legyen az oldott oxigén koncentrációjának csökkenése. Fontos, hogy a betelepítési arány a használt vizsgálati fajnak megfelelő legyen. Minden esetben 0,1–1,0 g hal (nedves tömeg) per liter víz per nap az ajánlott betelepítési arány. Akkor használható nagyobb betelepítési arány, ha igazolt, hogy a vizsgálati anyag megkövetelt koncentrációja ± 20 %-os határon belül tartható, és hogy az oldott oxigén koncentrációja nem esik 60 %-os telítettség alá (vö. 24. pont).
A megfelelő betelepítési rendszerek kiválasztásánál a halfajok természetes élőhelyét figyelembe kell venni. A fenéken élő halak például nagyobb alapterületű akváriumot igényelnek ugyanazon víztérfogat esetén, mint a nyílt vízi halfajok.
Etetés
Az akklimatizációs és vizsgálati időszak alatt a halakat megfelelő, ismert lipid- és összfehérje-tartalmú táppal kell etetni, az egészségük megőrzéséhez és a testtömegük fenntartásához elegendő mennyiségben (valamennyi növekedés megengedett). Az alkalmazott fajtól, a kísérleti körülményektől és a tápanyag kalorikus értékétől függően naponta rögzített szinten kell etetni az akklimatizációs és a vizsgálati időszakban (pl. a szivárványos pisztráng esetében a testtömeg megközelítőleg 1–2 %-a naponta). Az etetési arányt úgy kell megválasztani, hogy el lehessen kerülni a gyors növekedést és a lipidtartalom számottevő emelkedését. Azonos etetési arány fenntartása érdekében a táp mennyiségét adott esetben, például hetente újra kell számolni. E számításhoz az egyes vizsgálati kamrákban található halak tömege a kamrából legújabban vett halminta tömegéből becsülhető meg. A kamrában maradó halakat nem kell lemérni.
A vizsgálati kamrákból a maradék tápot és az ürüléket az etetést követően rövid időn belül (30 perc–1 óra) naponta szívócsövön keresztül el kell távolítani. A vizsgálat alatt a kamrákat a lehető legtisztábban kell tartani, hogy a szervesanyag-koncentráció a lehető legkisebb legyen (vö. 29. pont), mivel a szerves szén jelenléte korlátozhatja a vizsgálati anyag biológiai hasznosíthatóságát (12).
Mivel számos táp készül hallisztből, biztosítani kell, hogy a táp ne befolyásolja a vizsgálati eredményeket vagy váltson ki káros hatásokat, pl. abból eredően, hogy növényvédő szereket, nehézfémeket és/vagy magát a vizsgálati anyagot (vagy ezek nyomait) tartalmazza.
Fény és hőmérséklet
12–16 órás megvilágítási idő javasolt, és hőmérsékletnek megfelelőnek (± 2 °C) kell lennie vizsgálati fajok számára (vö. 3. függelék). A megvilágítás típusának és jellemzőinek ismertnek kell lennie. Figyelmet kell fordítani a vizsgálati anyag – a vizsgálat megvilágítási körülményei közötti – lehetséges fototranszformációjára. Megfelelő megvilágítást kell használni, hogy a fény hatására nem természetes bomlástermékek lehetőleg ne keletkezzenek. Néhány esetben megfelelő lehet a 290 nm alatti UV-sugárzást kiszűrő ernyő használata.
Vizsgálati koncentrációk
A vizsgálatot eredetileg nem poláris szerves anyagokra tervezték. Az ilyen típusú anyagok esetében a halak egyetlen koncentrációjának való expozíciója elegendő, mivel nem várható koncentrációs hatás, jóllehet a vonatkozó szabályozói keret kétféle koncentrációt is előírhat. Ha e körön kívüli anyagokat vizsgálnak, vagy a koncentrációtól való lehetséges függésre utaló jelek ismertek, a vizsgálatot két vagy több koncentrációval kell lefolytatni. Ha csak egy koncentrációt vizsgálnak, az egy koncentráció alkalmazását indokolni kell (vö. 79. pont). A vizsgálati koncentrációnak emellett olyan alacsonynak kell lennie, ami praktikus vagy gyakorlatilag megvalósítható (azaz nem közel az oldhatósági határhoz).
Egyes esetekben várható, hogy az anyag biokoncentrációja a vízbeli koncentrációtól függ (azaz fémek esetében, ahol a halak általi felvétel legalább részben szabályozott lehet). Ilyen esetben szükséges, hogy legalább két, de inkább több, környezeti szempontból releváns koncentrációt vizsgáljanak (vö. 49. pont). Emellett olyan anyagok esetében, amelyeknél a vizsgálati koncentrációnak gyakorlati okokból az oldhatósági határhoz közel kell lennie, javasolt legalább két koncentráció vizsgálata, mivel ez rálátást biztosíthat az expozíciós koncentrációk megbízhatóságára. A vizsgálati koncentrációk megválasztásába bele kell foglalni a környezeti szempontból reális koncentrációt, illetve az adott értékelés céljából releváns koncentrációt.
A vizsgálati anyag koncentrációját/koncentrációit úgy kell megválasztani, hogy azok a krónikus hatási szintje alatt, vagy az akut aszimptotikus LC50-értékének körülbelül 1 %-a alatt maradjanak egy környezeti szempontból releváns tartományban, és legalább egy nagyságrenddel meg kell haladják az alkalmazott analitikai módszerre vízben jellemző meghatározási határt. A legnagyobb megengedett vizsgálati koncentráció az akut (96 órás)/krónikus LC50 aránnyal is meghatározható (néhány anyag esetében a megfelelő arány kb. 3 lehet, de egyes esetekben 100 felett). Amennyiben második koncentrációt is alkalmaznak, azt úgy kell megválasztani, hogy a fenti értéktől 10-es szorzótényezővel különbözzön. Amennyiben ez nem lehetséges a toxicitási kritérium miatt (amely korlátozza a vizsgálati koncentráció felső határát) és az analitikai határérték miatt (amely korlátozza a vizsgálati koncentráció alsó határát), 10-nél kisebb szorzótényező is használható, és fontolóra kell venni radioaktívan jelölt (a legmagasabb, lehetőség szerint > 98 % tisztaságú) vizsgálati anyag használatát. Gondoskodni kell arról, hogy a vizsgálati anyag vizsgálati közegben jellemző oldhatósági határa feletti koncentrációt ne alkalmazzanak.
Kontrollcsoportok
A vizsgálati sorozaton kívül hígítóvizet tartalmazó kontrollt (vö. 30. és 31. pont), és az oldószert tartalmazó kontrollt is be kell állítani.
A vízminőség mérésének gyakorisága
A vizsgálat során mindegyik vizsgálati és kontrolledényben mérni kell az oldottoxigén-koncentrációt, a teljes szervesszén-tartalmat (TOC), a pH-értéket és a hőmérsékletet. A vízkeménységet és a sótartalmat (amennyiben ez mérvadó szempont) mérni kell a kontroll(ok)ban és az egyik edényben. Ha két vagy több koncentrációt vizsgálnak, ezeket a paramétereket a magasabb (vagy a legmagasabb) koncentrációnál kell mérni. Az oldott oxigént és (adott esetben) a sótartalmat legalább háromszor kell mérni a felvételi periódusban – annak elején, közepén és a végén – és egyszer egy héten a tisztulási periódusban. TOC-t a vizsgálat kezdetén (a felvételi fázis előtt 24 és 48 órával) a halak bevitele előtt, és a felvételi és tisztulási fázis alatt pedig legalább hetente egyszer kell mérni. A hőmérsékletet naponta, pH-t a periódusok kezdetén és végén, a keménységet vizsgálatonként egyszer kell mérni és rögzíteni. A hőmérsékletet ajánlott folyamatosan mérni, legalább egy edényben.
Hal- és vízmintavételezés és -analízis
Mintavételezési ütemterv
A vizsgálati kamrákból a vizsgálati anyag koncentrációjának meghatározásához a halak bevitele előtt, valamint a felvételi és a tisztulási fázis alatt kell vízmintát venni. Vízmintát a halmintával egy időben, etetés előtt kell venni. A gyakoribb mintavétel hasznos lehet a halak bevitelét követő állandó koncentráció biztosítása érdekében. A felvételi fázis alatt meg kell határozni a vizsgálati anyag koncentrációját az érvényességi kritériumok teljesülésének ellenőrzése céljából (24. pont). Ha a tisztulási fázis elején vett vízminta elemzése nem mutat ki vizsgálati anyagot, ez felhasználható annak indokolására, hogy miért nem mérik a vizsgálati anyagot a vizsgálati és a kontrollvízben a tisztulási fázis fennmaradó részében.
A felvételi fázis alatt legalább ötször, a tisztulási fázis alatt legalább négyszer kell halmintát venni a vizsgálati anyag tekintetében. Mivel egyes esetekben e mintaszámok alapján nehéz ésszerűen pontosan megbecsülni a BCF értékét, különösen, ha az egyszerű elsőrendűtől eltérő felvételi és tisztulási kinetika mutatkozik, tanácsos mindkét periódusban gyakrabban mintát venni (vö. 4. függelék).
A lipidtartalmat ugyanazon a biológiai anyagon kell meghatározni, mint amelyet a vizsgálati anyag koncentrációjának meghatározására használtak, legalább a felvételi fázis elején és végén, illetve a tisztulási fázis végén. Amennyiben ez nem megvalósítható, legalább három független halat kell mintavételezni a lipidtartalom meghatározására ugyanezen három időpont mindegyikében. A halak tartályonkénti számát a kísérlet kezdetekor ennek megfelelően kell kiigazítani ( 27 ). Vagylagosan, ha a kontrollhalakban (azaz a törzsállományból származó halakban) nem mutatható ki a vizsgálati anyag jelentős mennyisége, a vizsgálatban alkalmazott kontrollhalakat csak a lipidtartalom tekintetében kell vizsgálni, és a vizsgálati csoport(ok)ban a vizsgálati anyag elemzése (és a kapcsolódó felvételi sebességi állandó, tisztulási sebességi állandó és BCF-értékek) kiigazítható a kontrollcsoport lipidtartalmában a vizsgálat során bekövetkezett változásoknak megfelelően ( 28 ).
Elpusztult vagy beteg halat nem szabad a vizsgálati anyag vagy a lipidkoncentráció tekintetében elemezni.
Az elfogadható mintavételi ütemterv egy példája a 4. függelékben található. Más feltételezett KOW-értékkel más ütemtervet is gyorsan ki lehet dolgozni a 95 %-os felvételhez szükséges expozíciós idő kiszámításához (a számítások tekintetében lásd az 5. függeléket).
A mintavételezést a felvételi fázisban addig kell folytatni, amíg létre nem jön az állandósult állapot (lásd az 1. függeléket a fogalommeghatározások és a mértékegységek tekintetében), vagy ameddig a felvételi fázis más okból le nem zárul (28 vagy 60 napot követően; vö. 37. és 38. pont). A tisztulási fázis kezdete előtt a halakat át kell helyezni tiszta edényekbe.
Mintavételezés és minta-előkészítés
Az analízishez a vízmintákat például inert csövön keresztül, a vizsgálati kamra középső pontjából veszik. A centrifugálás és a szűrés sem képes mindenkor arra, hogy szétválassza a vizsgálati anyag biológiailag nem hasznosítható részét a biológiailag hasznosíthatótól. Ha szétválasztási technikát alkalmaznak, a Vizsgálati jegyzőkönyvben mindig meg kell adni e technika indoklását vagy validálását, tekintettel a biológiai hasznosíthatósággal kapcsolatos nehézségekre (25). Főként a nagymértékben víztaszító anyagok esetében (azaz, amelyeknél a log KOW érték > 5) (12) (26), ahol előfordulhat a szűrőre vagy a centrifugáló tartályokra való rárakódás, a mintákat nem szabad ilyen kezelésnek alávetni. Ehelyett a tartályokat minél tisztábban kell tartani (vö. 46. pont), és a teljes szervesszén-tartalmat a felvételi és a tisztulási fázis alatt is figyelemmel kell kísérni (vö. 53. pont). Az alacsonyabb biológiai hasznosíthatósággal kapcsolatos lehetséges problémák elkerülése érdekében szilárd fázisú mikroextrakciós technikákkal történő mintavételt lehet alkalmazni a csekély mértékben oldható és rendkívül víztaszító anyagok esetében.
A mintába felvett halat azonnal le kell ölni, a legmegfelelőbb és leghumánusabb módszerrel (a teljes halra vonatkozó mérések esetén a vízzel való leöblítésen, vö. 28. pont, és a hal itatóspapírral történő szárításán túlmenően nincs szükség további eljárásra). A hal tömegét és teljes hosszát meg kell mérni ( 29 ). Az egyes halak esetében a mért tömeget és hosszt össze kell kapcsolni az elemzett anyag koncentrációjával (és adott esetben a lipidtartalommal), például az egyes mintavételezett halakra alkalmazott egyedi azonosító kóddal.
A lebomlás vagy egyéb veszteségek elkerülése érdekében a halakat és a vizet lehetőleg rögtön mintavételezés után kell analizálni, és a vizsgálat előrehaladtával ki kell számolni a felvételi és a tisztulási sebességi állandó közelítő értékeit. Az azonnali analízis lehetővé teszi annak kiküszöbölését is, hogy egy platót (állandósult állapotot) késve ismerjenek fel.
Az azonnali analízis meghiúsulása esetén a mintákat megfelelő módszerrel kell tárolni. A vizsgálat kezdete előtt információkat kell szerezni a különböző vizsgálati anyagok tárolásának megfelelő módszeréről – például mélyhűtés, 4 °C-on tartás, extrakció stb. A tárolás időtartamát úgy kell megválasztani, hogy biztosított legyen, hogy az anyag ne romoljon meg a tárolás során.
Az analitikai módszer minősége
Mivel az egész eljárást alapvetően a vizsgálati anyaghoz használt analitikai módszer pontossága és érzékenysége határozza meg, kísérlettel ellenőrizni kell az anyag analízisének pontosságát és reprodukálhatóságát, és azt, hogy a vizsgálati anyag vízből és halakból való visszanyerése az adott módszer tekintetében kielégítő-e. Ennek az elővizsgálat részét kell képeznie. Azt is ellenőrizni kell, hogy a vizsgálati anyag nem észlelhető-e a használt hígítóvízben. A vizsgálati anyag vízben és halakban meglévő koncentrációjának a vizsgálat során kapott értékeit – szükség szerint – korrigálni kell a visszanyeréssel és a kontrollok háttérértékeivel. A hal- és vízmintákkal végig úgy kell bánni, hogy minimális legyen a szennyezés és a (pl. a mintavevő eszköz adszorpciójából eredő) veszteség.
Halminták analízise
Amennyiben a vizsgálat során radioaktívan jelölt anyagokat használtak, mérhető az össz-radioaktivitás (a kiindulási anyagé és a metabolitokét együttesen), vagy a minták megtisztíthatók úgy, hogy a kiindulási anyag külön analizálható legyen. Ha a BCF-nek a kiindulási anyagon kell alapulnia, legalább a felvételi fázis végén jellemezni kell a főbb metabolitokat (vö. 6. pont). A főbb metabolitok azok, amelyek a halszövetben az összes maradékanyag ≥ 10 %-át képviselik, amelyek két egymást követő mintavételi ponton ≥ 5 %-át képviselik, amelyek a felvételi fázis egészében emelkedő szintet mutatnak, továbbá amelyekkel kapcsolatosan toxikológiai aggályok ismertek. Ha az egész halra vonatkozó BCF az összes radioaktív jelöléssel ellátott maradékanyag esetében ≥ 500, tanácsos – és az anyagok egyes kategóriái, például a peszticidek esetében erőteljesen ajánlott – a főbb metabolitok azonosítása és számszerűsítése. E metabolitok számszerűsítését egyes szabályozó hatóságok is előírhatják. Ha a halszövetben az összes radioaktív jelöléssel ellátott maradékanyag ≥ 10 %-ában azonosítanak és számszerűsítenek bomlástermékeket, ajánlott a bomlástermékek vizsgálati vízben történő azonosítása és számszerűsítése is. Amennyiben ez nem megvalósítható, ezt ki kell fejteni a Vizsgálati jegyzőkönyvben.
A vizsgálati anyag koncentrációját rendszerint meg kell határozni minden lemért halban. Amennyiben ez nem lehetséges, az egyes mintavételi alkalmakkor összevonhatók a minták, de az összesítés korlátozza az adatokra alkalmazható statisztikai eljárások számát, ezért a kívánt összevonási eljáráshoz, statisztikai eljáráshoz és statisztikai erőhöz szükséges, megfelelő számú halat kell felvenni a vizsgálatba. A (27) és (28) referencia használható a megfelelő összevonási eljárások bevezetéseként.
A BCF-et (a nedves tömeg alapján) 5 %-os lipidtartalmú halra normalizálva kell kifejezni a vizsgálatból közvetlenül származtatotton kívül (vö. 21. pont), kivéve, ha igazolható, hogy a vizsgálati anyag elsődlegesen nem lipidekben halmozódik fel. A halak lipidtartalmát minden mintavételi alkalommal meg kell határozni amennyiben lehetséges, ezt lehetőség szerint a vizsgálati anyag analíziséhez készítettel azonos extraktumon kell elvégezni, mert a lipideket gyakran el kell távolítani az extraktumból, mielőtt kromatográfiásan elemezhetők lennének. Ugyanakkor a vizsgálati anyagok elemzéséhez gyakran speciális extrakciós eljárásokra van szükség, amelyek ellentmondásban lehetnek a lipid meghatározására szolgáló vizsgálati módszerekkel. Ebben az esetben (amíg nem áll rendelkezésre megfelelő, nem destruktív műszeres módszer), ajánlott különböző stratégiát alkalmazni a hal lipidtartalmának meghatározására (vö. 56. pont). A lipidtartalom meghatározására megfelelő módszereket kell alkalmazni (20). Szabványmódszerként a kloroform/metanol extrakciós technika (29) ajánlott (30), alternatív technikaként pedig a Smedes-féle módszer (31). Ez utóbbi módszert az extrakció összehasonlítható hatékonysága, nagy pontosság, kevesebb toxikus szerves oldószer alkalmazása jellemzi, emellett könnyen elvégezhető. Megfelelő indoklással alkalmazhatók más olyan módszerek, amelyek tekintetében a pontosság lehetőség szerint az ajánlott módszerekhez hasonló. Az alkalmazott módszert fontos részletesen ismertetni.
A halak növekedésének mérése
A vizsgálat kezdetén a törzsállományból öt–tíz hal tömegét és teljes hosszát kell egyenként lemérni. Ezek megegyezhetnek a lipidanalízishez használt halakkal (vö. 56. pont). Az egyes mintavételekhez használt, mind a vizsgálati, mind a kontrollcsoportból származó halak tömegét és hosszát a kémiai és lipidanalízis előtt meg kell mérni. E mintába felvett halakra vonatkozó mérések használhatók a vizsgálati és kontrolltartályokban maradó halak tömegének és hosszának becsléséhez (vö. 45. pont).
ADATOK ÉS JEGYZŐKÖNYVEZÉS
Eredmények feldolgozása
A vizsgálati anyag felvételi görbéje úgy jön létre, hogy a felvételi fázisban a halakban/halakon (vagy meghatározott szövetekben/szöveteken) mért koncentrációt az idő függvényében, aritmetikus skálán ábrázolják. Amennyiben a görbe platót ér el, vagyis megközelítőleg párhuzamos az időtengellyel, az állandósult állapoti BCF (BCFSS) a következő képlet alapján számolható:

A Cf alakulását befolyásolhatja a halak növekedése (vö. 72. és 73. pont). Az expozíciós koncentráció átlagát (Cw) az időbeli eltérés befolyásolja. Várható, hogy az idővel súlyozott átlagos koncentráció relevánsabb és pontosabb a bioakkumulációs vizsgálatok szempontjából, még akkor is, ha az eltérés a megfelelő validálási tartományon belül van (vö. 24. pont). A vízben mért idővel súlyozott átlagos koncentráció (TWA) az 5. függelék 1. szakasza alapján számítható ki.
A kinetikus biokoncentrációs tényezőt (BCFK) a két elsőrendű kinetikai sebességállandó k 1/k 2 hányadosaként kell meghatározni. A k 1, k 2 sebességállandókat és a BCFK-t a felvételi és a tisztulási fázis egyidejű illesztéséből lehet kinyerni. Vagylagosan a k 1-et és a k 2-t lépcsőzetesen is meg lehet határozni (lásd az 5. függeléket e két módszer leírása és összehasonlítása tekintetében). A tisztulási sebességi állandót (k 2) esetleg korrigálni kell a növekedés okozta hígulásra tekintettel (vö. 72. és 73. pont). Amennyiben a felvételi és/vagy tisztulási görbe nyilvánvalóan nem elsőrendű, összetettebb modelleket kell alkalmazni (lásd az 5. függelék hivatkozásait), és biostatisztikus és/vagy farmakokinetikus szakvéleményét kell kikérni.
A halak tömegére/hosszára vonatkozó adatok
Az egyes halak nedves tömegét és teljes hosszát minden mintavételezési intervallum vonatkozásában elkülönített táblázatban kell vezetni a vizsgálati és a kontrollcsoport tekintetében a felvételi (ideértve a felvételi fázis kezdetén meglévő törzsállományt) és a tisztulási fázis során. Az egyes halak esetében a mért tömeget és hosszt össze kell kapcsolni az elemzett vegyi anyag koncentrációjával, például a mintába felvett egyes halakra alkalmazott egyedi azonosító kóddal. A kinetikus BCF-értékek növekedés okozta hígulásra tekintettel történő korrigálásának céljára a növekedés előnyben részesített mértéke a tömeg (lásd a 73. pontot és az 5. függeléket a növekedés okozta hígulás tekintetében alkalmazott korrekció módszere vonatkozásában).
A növekedés okozta hígulásra tekintettel alkalmazott korrekció és a lipidtartalomra tekintettel történő normalizáció
A halak tisztulási fázisban bekövetkezett növekedése csökkentheti a halakban mért vegyianyag-koncentrációt, ezáltal a teljes tisztulási sebességi állandó (k 2) magasabb lesz, mint a kiválasztási folyamatokból (pl. légzés, anyagcsere, kiürítés) eredne. A kinetikus biokoncentrációs tényezőket korrigálni kell a növekedés okozta hígulásra tekintettel. A növekedés a BCFSS-t is befolyásolja, de nem áll rendelkezésre elfogadott eljárás a BCFSS növekedésre tekintettel történő korrigálására. Jelentős növekedés esetén a növekedésre tekintettel korrigált BCFK-t (BCFKg) is számítani kell, mivel lényegesebb mérték lehet, mint a biokoncentrációs tényező. A vizsgálati halak lipidtartalma (amely nagymértékben összefügg a víztaszító anyagok biológiai felhalmozódásával) kellő mértékben változhat a gyakorlatban, így szükség lehet egy rögzített lipidtartalomra (5 % w/w) tekintettel történő normalizációra, amely hasznosan jeleníti meg mind a kinetikus, mind az állandósult állapoti biokoncentrációs tényezőket, kivéve, ha igazolható, hogy a vizsgálati anyag elsődlegesen nem lipidekben halmozódik fel (pl. egyes perfluorozott anyagok fehérjékhez kapcsolódhatnak). Az e számításokkal kapcsolatos egyenletek és példák az 5. függelékben találhatók.
A kinetikus BCF növekedés okozta hígulásra tekintettel történő korrigálásához a tisztulási sebességi állandót ki kell igazítani a növekedés figyelembevételével. A növekedéssel korrigált tisztulási sebességi állandó (k 2g) a növekedési sebességi állandó (a mért tömeggel kapcsolatos adatokból számolt k g) teljes tisztulási sebességi állandóból (k 2) való kivonásával számítható ki. A növekedéssel korrigált kinetikus biokoncentrációs tényezőt ezt követően úgy lehet kiszámítani, hogy el kell osztani a felvételi sebességi állandót (k 1) a növekedéssel korrigált tisztulási sebességi állandóval (k 2g) (vö. 5. függelék). Egyes esetekben ez a megközelítés hibás lehet. Például nagyon lassan tisztuló, gyorsan növekedő halakban vizsgált anyagok esetében a származtatott k 2g nagyon csekély lehet, így az ennek származtatásához használt két sebességi állandóban kritikus lesz a hiba, és bizonyos esetekben a k g becslései meghaladhatják a k 2-t. A növekedés okozta hígulásra tekintettel végzett korrekciót szükségtelenné tevő alternatív megközelítés a vizsgálati anyag halankénti (egész halra vetített) tömegét tükröző tisztulási adatokat alkalmazza, szemben a szokásos, a vizsgálati anyagnak a hal egységnyi tömegéhez viszonyított tömegére (koncentrációra) vonatkozó adatokkal. Ez könnyen elérhető adat, mivel az e vizsgálati módszer szerinti vizsgálatoknak a feljegyzett szöveti koncentrációkat az egyes halak tömegéhez kell kapcsolniuk. Az erre szolgáló egyszerű eljárást az 5. függelék ismerteti. Meg kell jegyezni, hogy a k 2-t akkor is fel kell tüntetni a Vizsgálati jegyzőkönyvben, ha ezt az alternatív megközelítést alkalmazzák.
A kinetikus és az állandósult állapoti biokoncentrációs tényezőket a halak alapértelmezett 5 %-os (w/w) lipidtartalmához viszonyítva is fel kell tüntetni a Vizsgálati jegyzőkönyvben, hacsak nem igazolható, hogy a vizsgálati anyag elsődlegesen nem lipidekben halmozódik fel. A halakkal kapcsolatos koncentrációs adatokat vagy a BCF-et az 5 % és a (nedves tömeg százalékában kifejezett) tényleges (egyedi) átlagos lipidtartalom hányadosa szerint kell normalizálni (vö. 5. függelék).
Ha a kémiai és a lipidanalízist ugyanazon a halon végezték el, akkor az adott halra vonatkozó, egyedi, a lipidtartalom tekintetében normalizált adatokat kell felhasználni a lipidtartalom szempontjából normalizált BCF kiszámításához. Vagylagosan, ha a kontrollcsoportba és a kitett csoportba tartozó halak növekedése hasonlóan alakul, a kontrollhalak lipidtartalma önmagában felhasználható a lipidtartalomra tekintettel történő korrekcióhoz (vö. 56. pont). A lipidtartalom szempontjából normalizált BCF kiszámításának egyik módszere az 5. függelékben található.
Az eredmények kiértékelése
Amennyiben a vizsgálati oldatok mért koncentrációi az analitikai módszer érzékelési határához közeli szinten vannak, az eredményeket óvatosan kell kiértékelni.
A vizsgálati és a kontrollcsoportban megfigyelt átlagos növekedés elvben nem lehet nagymértékben különböző, hogy a toxikus hatások kizárhatók legyenek. A két csoport növekedési sebességi állandóit vagy növekedési görbéit megfelelő eljárással össze kell hasonlítani ( 30 ).
Az egyértelműen definiált felvételi és tisztulási görbe megbízható biokoncentrációs adatokat jelez. A sebességi állandók tekintetében a χ2 görbeillesztési vizsgálat eredményeinek megfelelő illeszkedést kell mutatniuk (azaz kis mérési hibaszázalékot (32)) a bioakkumulációs modell esetében, hogy a sebességi állandókat megbízhatónak lehessen tekintetni (vö. 5. függelék). Ha egynél több vizsgálati koncentrációt alkalmaznak, a felvételi/tisztulási állandók vizsgálati koncentrációk közötti eltérésének 20 % alatt kell lennie ( 31 ). Amennyiben ez nem áll fenn, az koncentrációtól való függésre utalhat. Az alkalmazott vizsgálati koncentrációk felvételi/tisztulási sebességi állandóinak megfigyelt jelentős különbségét rögzíteni kell, és meg kell adni rá a lehetséges magyarázatokat. A jól megtervezett vizsgálatokból kapott BCF-ek 95 %-os konfidenciahatára általában megközelíti a származtatott BCF ± 20 %-át.
Ha két vagy több koncentrációt vizsgálnak, az eredményeket mindkét vagy valamennyi koncentráció esetében felhasználják annak vizsgálatára, hogy az eredmények következetesek-e, továbbá annak kimutatására, hogy van-e koncentrációfüggés. Ha csak egy koncentrációt vizsgálnak az állatok és/vagy erőforrások használatának mérséklése érdekében, indokolni kell az egy koncentráció alkalmazását.
Az eredményként adódó BCFSS kétséges, ha a BCFK lényegesen nagyobb, mint a BCFSS, mivel ez arra utalhat, hogy nem jött létre állandósult állapot, vagy hogy nem vették figyelembe a növekedés okozta hígulást és a mennyiség csökkenésével járó folyamatokat. Ha a BCFSS jóval meghaladja a BCFK-t, a felvételi és tisztulási sebességi állandók származtatását ellenőrizni kell a hibák tekintetében és újra kell értékelni. Más illesztési eljárás javíthatja a BCFK becslését (vö. 5. függelék).
Vizsgálati jegyzőkönyv
A vizsgálati anyagra vonatkozó, a 3. pontban feltüntetett információn felül a Vizsgálati jegyzőkönyv a következő információt tartalmazza:
Vizsgálati anyag:
fizikai jelleg és adott esetben a fizikai és kémiai tulajdonságok,
— kémiai azonosító adatok, például IUPAC- vagy CAS-név, CAS-szám, SMILES- vagy InChI-kód, szerkezeti képlet, tisztaság, adott esetben és amennyiben a gyakorlatban megvalósítható, a szennyeződések kémiai azonosítója stb. (ideértve adott esetben a szervesszén-tartalmat).
— A több összetevőből álló anyagok és UVCB-k (ismeretlen szerkezetű vagy változó összetételű, összetett reakciótermékek vagy biológiai anyagok) esetében lehetőség szerint az egyedi alkotóelemek kémiai azonosítójának leírása, és minden alkotóelemnek az anyag össztömegében képviselt százaléka. Össze kell foglalni, hogy a vizsgálat során alkalmazott analitikai módszer miként jeleníti meg az anyag koncentrációjának mérését; valamennyi analitikai eljárást be kell mutatni, ideértve a módszer pontosságát, érzékelési határát és meghatározási határát;
— Amennyiben radioaktívan jelölt(ek), a jelölt atom(ok) pontos helyzete, és a szennyeződésekhez kapcsolódó radioaktivitás százaléka.
— A vizsgálati anyag halakkal (ideális esetben a vizsgálati fajokkal) szembeni toxicitásával kapcsolatos információ. A toxicitást akut 96 órás LC50-ként kell a Vizsgálati jegyzőkönyvben feltüntetni, és meg kell adni a krónikus vizsgálatból (azaz korai életszakaszra vonatkozó vizsgálat vagy teljes életciklusra vonatkozó vizsgálat, ha rendelkezésre áll) származó NOAEC és LOAEC értékeket.
— A vizsgálati vegyi anyag vagy vizsgálati anyag tárolási körülményei, illetve a vizsgálati vegyi anyag vagy vizsgálati anyag tárolás alatti stabilitása, ha a használat előtt tárolják.
Vizsgálati fajok:
tudományos név, törzs, származás, bármilyen előkezelés, akklimatizálás, kor, ivar (ha releváns), mérettartomány (tömeg és hossz) stb.
Vizsgálati körülmények
— Az alkalmazott vizsgálati eljárás (pl. félstatikus vagy átfolyásos); rendszeres vizsgálat vagy minimalizált terv (magyarázattal és indokolással együtt).
— Az alkalmazott megvilágítás típusa és jellemzői, valamint a megvilágítási időszak(ok).
— Vizsgálati terv (pl. a vizsgálati kamrák száma és mérete, víztérfogat-csere sebessége, betelepítési arány, ismétlések száma, halak száma ismétlésenként, kísérleti koncentrációk száma, a felvételi és a tisztulási fázis hossza, hal- és vízminták mintavételi gyakorisága).
— Törzsoldatok előállításának módszere és a megújítás gyakorisága (amennyiben használtak ilyet, meg kell adni az oldószert, koncentrációját, és hogy a vizsgálati víz szervesszén-tartalmához mennyiben járult hozzá), vagy az alternatív adagolási rendszer leírása.
— A névleges vizsgálati koncentrációk, a vizsgálati edényben mért értékek átlaga és ezek szórása, továbbá a kiszámítás módszere és gyakorisága.
— A hígítóvíz forrása, az előkezelések leírása, a vizsgálati hal azon tulajdonságát igazoló eredmények, hogy képes a vízben élni, továbbá a víz tulajdonságai: pH-érték, keménység, hőmérséklet, oldottoxigén-koncentráció, maradékklór-tartalom (amennyiben mérik), teljes szervesszén-tartalom, szuszpendált szilárd anyagok, a vizsgálati közeg sótartalma (amennyiben mérik) és bármely más mérési adat.
— Vízminőség a vizsgálati edényekben, pH, keménység, TOC, hőmérséklet és oldottoxigén-koncentráció; az alkalmazott módszerek és a mérési gyakoriság.
— Az etetésre vonatkozó részletes információk (például a táp(ok) fajtája, eredete, összetétele – legalább a lipid- és fehérjetartalom, amennyiben lehetséges) a kiválasztott etetési arány, a beadott táp mennyisége és az etetési gyakoriság;
— Információk a hal- és vízminták kezeléséről, beleértve az előállítás részleteit, a tárolást, az extrakciót és az analitikai eljárásokat (és pontosságot) a vizsgálati anyag és a lipidtartalom vonatkozásában.
— A kezelések randomizálására és a halak vizsgálati edényekbe osztására alkalmazott módszerek.
— A vizsgálati szervezetek vizsgálati oldatokba helyezésének napja és a vizsgálat időtartama.
— A dózisbehatároló vizsgálat és az eredményeinek bemutatása, ha van ilyen.
Eredmények:
— Minden elvégzett előzetes vizsgálat eredménye.
— A kontrollhalak és az egyes expozíciós kamrákban lévő halak mortalitása, és bármely megfigyelt rendellenes viselkedés.
— Minden megfigyelt káros hatás leírása.
— A kémiai analízis valamennyi alkalmazott eljárásának leírása, ideértve az érzékelési határt és a meghatározási határt, a változékonyságot és a visszanyerést.
— A hal lipidtartalma, ideértve az alkalmazott módszert, és ha számítják ezt az adatot, a lipidnormalizációs tényezőt (Ln, az 5 %-os lipidtartalomhoz viszonyított eredményeket kifejező tényező).
— A hal tömegével (és hosszával) kapcsolatos adatok táblázatos formában, amelyeket összekapcsolnak a vegyi anyagok egyedi halakban mért koncentrációival (és adott esetben a lipidtartalmukkal), mind a kontroll-, mind a kitett csoportban (például a mintába felvett egyes halakra egyedi azonosító alkalmazásával) és a származtatott növekedési sebességi állandó(k) számítása.
— A vizsgálati anyag koncentrációja halakban (Cf az egyes halakhoz kapcsolva) és vízben (Cw), táblázatos formában (átlagok a vizsgálati és a kontrollcsoportra, szórás és tartomány adott esetben), minden mintavételi idő tekintetében (Cf mg/kg-ban kifejezve a teljes test vagy konkrét szövetei nedves tömegéhez viszonyítva, pl. lipid, és Cw mg/l-ben). A kontrollsorozat Cw értékei (a háttérértékeket is fel kell tüntetni a Vizsgálati jegyzőkönyvben).
— Görbék (ideértve valamennyi mért adatot), amelyek a következőket mutatják be (adott esetben a koncentrációt az egész testhez és az 5 %-ban normalizált állati vagy szöveti lipidtartalomhoz viszonyítva is ki lehet fejezni):
—
— növekedés, azaz a hal tömege az idő függvényében, vagy a természetes alapú logaritmussá transzformált tömeg az idő függvényében (ideértve a származtatott növekedési sebességi állandót, k g);
— a vizsgálati anyag halban megfigyelt felvétele és tisztulása (egyetlen grafikonon);
— az állandósult állapot eléréséhez szükséges idő (ha létrejött az állandósult állapot);
— természetes alapú logaritmussá transzformált koncentráció a felvételi idő függvényében (ideértve a származtatott k 1 felvételi sebességi állandót);
— természetes alapú logaritmussá transzformált koncentráció (ln koncentráció) a tisztulási idő függvényében (ideértve a származtatott k 2 tisztulási sebességi állandót);
— mind a felvételi, mind a tisztulási fázis görbéi, amelyek mind az adatokat, mind az illesztési modellt bemutatják.
— Ha az ábra szemmel láthatóan egyértelmű kiugró értékeket mutat, statisztikailag érvényes kiugróérték-tesztet lehet alkalmazni a hamis adatpontok törlésére, valamint ezek mellőzését indokolni kell.
— Az állandósult állapoti biokoncentrációs tényező (BCFSS), ha az állandósult állapot (majdnem) létrejött.
— A kinetikus biokoncentrációs tényező (BCFK) és a származtatott felvételi és tisztulási sebességi állandók (k 1 és k 2) a k 2 szóródásaival együtt (meredekség és metszés) lépcsőzetes illesztés alkalmazása esetén.
— Konfidenciahatárok, szórás (ha rendelkezésre áll) és az alkalmazott vizsgálati anyag minden egyes koncentrációjának minden egyes paraméterére vonatkozó számítás/adatelemzés módszerei
—
— A radioaktív jelöléssel ellátott vizsgálati anyagok metabolitjaira és felhalmozódásukra vonatkozó információ.
— Növekedési sebességi állandó(k) (ideértve a 95 %-os konfidencia-intervallumo(ka)t), illetve a számított, növekedéssel korrigált tisztulási sebességi állandók (k 2g), felezési idő, BCF (BCFKg) értékek.
— Bármi szokatlan dolog a vizsgálattal kapcsolatban, bármilyen eltérés ezektől az eljárásoktól, és bármely más vonatkozó információ.
— A releváns mért és számított adatok összefoglaló táblázata az alábbiakban látható:
—
|
Az anyag felvételi és tisztulási sebességi állandói és biokoncentrációs tényezők (BCF) |
|
|
k g (növekedési sebességi állandó; nap– 1): |
Írja be az értéket (95 % KI) (1) |
|
k 1 (teljes felvételi sebességi állandó; l kg– 1 nap– 1): |
Írja be az értéket (95 % KI) (1) |
|
k 2 (teljes tisztulási sebességi állandó; nap– 1): |
Írja be az értéket (95 % KI) (1) |
|
k 2g (növekedéssel korrigált tisztulási sebességi állandó; nap– 1): |
Írja be az értéket (95 % KI) (1) |
|
C f (a vegyi anyag koncentrációja a halban állandósult állapotnál; mg kg– 1): |
Írja be az értéket ± SD (2) |
|
C w (a vegyi anyag koncentrációja a vízben; mg l– 1): |
Írja be az értéket ± SD (2) |
|
L n (lipidnormalizációs tényező): |
Írja be az értéket (3) |
|
BCFSS (állandósult állapoti BCF; l kg– 1) |
Írja be az értéket ± SD (2) |
|
BCFSSL (lipidtartalom tekintetében normalizált, állandósult állapoti BCF; l kg– 1) |
Írja be az értéket (3) ± SD (2) |
|
BCFK (kinetikus BCF; l kg– 1) |
Írja be az értéket (95 % KI) (1) |
|
BCFKg (növekedéssel korrigált kinetikus BCF; l kg– 1) |
Írja be az értéket (95 % KI) (1) |
|
t 1/2g (növekedéssel korrigált felezési idő, nap): |
Írja be az értéket (95 % KI) (1) |
|
BCFKL (lipidtartalom tekintetében normalizált kinetikus BCF; l kg– 1) |
Írja be az értéket |
|
BCFKLG (lipidtartalom tekintetében normalizált, növekedéssel korrigált kinetikus BCF; l kg– 1) |
Írja be az értéket |
|
(1) KI: konfidencia-intervallum (ha meg lehet becsülni) (2) SD: szórás (ha meg lehet becsülni) |
|
— Az előzetes vizsgálati módszer fejlesztésével és kísérlettervezéssel »érzékelési határon/meghatározási belül nem kimutatott/meghatározott« eredményeket kerülni kell, mert az ilyen eredmények nem használhatók sebességi állandók számolásához.
C.13. – II: Vízi expozíción alapuló minimalizált halvizsgálat
BEVEZETÉS
A mind a laboratóriumok, mind a szabályozó hatóságok által a teljes vizsgálatok lefolytatása és kiértékelése során szerzett egyre több tapasztalat azt mutatja, hogy néhány kivétellel elsőrendű kinetika érvényes a felvételi és tisztulási sebességi állandók becslésére. Így a felvételi és tisztulási sebességi állandók becsülhetők minimális mintavételi ponttal, és származtatható a kinetikus BCF.
A BCF-vizsgálatok alternatív tervei megvizsgálásának eredeti célja az volt, hogy kialakítsanak egy kisebb vizsgálatot, amelyet köztes vizsgálati lépésként fel lehet használni a KOW-n és QSAR-okon alapuló BCF-becslések megcáfolására vagy megerősítésére, és így nem lesz szükség teljes vizsgálat lefolytatására számtalan anyag tekintetében, minimalizálhatók a költségek és az állatok felhasználása a mintavételezés és a végrehajtott elemzési szekvenciák számának csökkentése útján. A korábbi vizsgálati módszerek elsődleges tervét követve annak érdekében, hogy lehetővé váljon a vizsgálati eredmények meglévő BCF-adatokkal való integrációja, és hogy könnyebb legyen a vizsgálat végrehajtása és az adatok kiértékelése, a cél az volt, hogy kellő pontosságú BCF-becsléseket biztosítsanak a kockázatértékelési döntésekhez. A teljes vizsgálatra alkalmazandó megfontolások közül számos ebben az esetben is érvényes (vö. 24. pont), pl. az érvényességi kritériumok, valamint a vizsgálat leállítása, ha jelentéktelen felvétel látható a felvételi fázis végén (vö. 16. és 38. pont).
A minimalizált vizsgálati tervbe felvehető anyagoknak ahhoz az általános területhez kell tartozniuk, amelynek tekintetében e vizsgálati módszert kialakították, ezek a nem poláris szerves anyagok (vö. 49. pont). Ha bármi arra utal, hogy a vizsgálandó anyag esetlegesen eltérő viselkedést mutat (pl. egyértelműen eltér az elsőrendű kinetikától), teljes vizsgálatot kell végezni szabályozói céllal.
A minimalizált vizsgálat általában nem tart rövidebb ideig, mint a standard BCF-vizsgálat, hanem kevesebb halminta-vételt foglal magában (a magyarázat tekintetében lásd a 6. függeléket). Ugyanakkor a tisztulási időszak csökkenthető a gyorsan tisztuló anyagok esetében, hogy ne legyenek a érzékelési/meghatározási határtól elmaradó, halban megfigyelt koncentrációk a vizsgálat vége előtt. Az egyetlen koncentrációt és minimális expozíciót alkalmazó halvizsgálat felhasználható a teljes vizsgálat szükségességének meghatározására; és ha a sebességi állandók és a BCF kiszámításához használt, eredményül adódó adatok megbízhatóak (vö. 93. pont), a teljes vizsgálattól el lehet tekinteni, ha az eredményként adódó BCF nem éri el az aggodalomra okot adó szabályozói értékeket.
Egyes esetekben előnyösebb lehet egynél több koncentrációt alkalmazó minimalizált vizsgálati terv mint előzetes vizsgálat lefolytatása annak meghatározására, hogy egy adott anyagra vonatkozó BCF-becslések koncentrációfüggőek-e. Ha a minimalizált vizsgálatból származó BCF-becslések koncentrációfüggést mutatnak, szükség lesz a teljes vizsgálat lefolytatására. Ha e minimalizált vizsgálat alapján a BCF-becslések nem koncentrációfüggőek, de az eredmények nem tekinthetők döntőnek, minden további teljes vizsgálat lefolytatható egyetlen koncentrációval, ezáltal csökkentve az állatok felhasználását a két (vagy több) koncentrációt alkalmazó teljes vizsgálathoz képest.
A minimalizált vizsgálatra alkalmas anyagok esetében a következő feltételeknek kell teljesülniük:
— Valószínűleg megközelítőleg elsőrendű felvételi és tisztulási kinetikát tanúsítanak, pl. hasonló anyagokra való kereszthivatkozással származtatva;
— A log KOW értékük < 6, kivéve, ha gyors anyagcsere várható ( 32 );
— Kellően vízoldékonyak az analitikai technikára tekintettel (vö. 24. pont);
— Egyértelműen számszerűsíthetők (azaz a koncentrációknak legalább egy nagyságrenddel a meghatározási határ felett kell lenniük), mind a halban, mind a vízben, radioaktív jelölés ajánlott (vö. 23. pont); és
— Tisztulási időszakuk hosszabb, mint a várható felezési idő (vö. 5. függelék a számítások tekintetében) vagy a tisztulási időszakot ennek megfelelően kell kiigazítani (vö. 91. pont). E szabály alól kivétel engedett, ha várható az anyag gyors anyagcseréje.
A MINIMALIZÁLT TERVET KÖVETŐ VIZSGÁLATOK MINTAVÉTELI TERVE
Halak mintavételezése
A halak mintavételezése négy mintavételi pontra korlátozódik:
— A felvételi fázis közepén és végén (ez utóbbi a tisztulási fázis kezdete is), pl. 14 és 28 nap után (33).
— A tisztulási fázis közepén és a vizsgálat végén (amikor az anyag koncentrációja < a maximális koncentráció 10 %-ánál, vagy legalább egyértelműen túl van az anyag egy felezési idején) pl. a tisztulás 7. és 14. napját követően (33). Ha gyors tisztulás várható vagy tapasztalt, szükség lehet a tisztulási időszak lerövidítésére, hogy elkerülhetők legyenek a meghatározási határ alatti, halban mért koncentrációk.
— Lipidmérés, mint a teljes vizsgálatnál.
— Növekedésre tekintettel történő korrekció, mint a teljes vizsgálatnál.
— A BCF-et kinetikus BCF-ként számítják ki.
Víz mintavételezése
A minimalizált terv szerint a vizet a teljes vizsgálathoz hasonlóan mintavételezik (vö. 54. pont) vagy legalább a felvételi fázis során ötször, egyenlően elosztott időközönként, a tisztulási fázisban pedig hetente.
A tervezés módosításai
Tekintettel a vizsgálati anyag tulajdonságaira, az érvényes QSAR előrejelzésekre és a vizsgálat konkrét céljára, mérlegelni lehet a vizsgálati terv módosításait:
— Ha nagyobb pontosságra van szükség, több hal (a 4 helyett 6 vagy 8) használható a felvételi fázis végén vett mintához.
— Egy »további« halcsoport felvétele, ha a 14 napos tisztulás (vagy a tisztulási fázis előrejelzett vége) nem volt elég a megfelelő tisztuláshoz (azaz > 50 %). Ha a tisztulási fázis előrejelzett időtartama 14 napnál hosszabb vagy rövidebb, a mintavételi ütemtervet ki kell igazítani (azaz egy halcsoport a tisztulási fázis előrejelzett végén, és egy csoport ezen idő felénél).
— Két vizsgálati koncentráció alkalmazása a lehetséges koncentrációfüggés feltárása érdekében. Ha a két vizsgálati koncentrációval lefolytatott minimalizált vizsgálat eredményei azt mutatják, hogy a BCF nem koncentrációfüggő (azaz 20 %-nál csekélyebb az eltérés), egy koncentráció elegendőnek tekinthető a teljes vizsgálathoz, ha azt elvégzik.
— Valószínűsíthető, hogy a bioakkumulációs folyamatok modelljei, mint amelyeket Arnot és munkatársai javasolnak (35), felhasználhatók a felvételi és tisztulási fázisok időtartamának tervezéséhez (lásd még az 5. függeléket).
Számítások
E megközelítés mögött az a logika húzódik, hogy a teljes vizsgálatban a biokoncentrációs tényező vagy állandósult állapoti biokoncentrációs tényezőként (BCFSS) határozható meg a vizsgálati anyag halszövetben mért koncentrációja és a vizsgálati anyag vízben mért koncentrációja hányadosának kiszámításával, vagy kinetikus biokoncentrációs tényezőként a (BCFK) felvételi sebességi állandó k 1 és a tisztulási sebességi állandó k 2 hányadosának kiszámításával. A BCFK akkor is érvényes, ha az anyag állandósult állapoti koncentrációját nem érik el a felvételi fázisban, feltéve, hogy a felvétel és a tisztulás megközelítőleg elsőrendű kinetikai folyamatokat követ. Abszolút minimumként két adatpontra van szükség a felvételi és tisztulási sebességi állandók becsléséhez, egyre a felvételi fázis végén (azaz a tisztulási fázis kezdetén) egyre pedig a tisztulási fázis végén (vagy annak jelentős része elteltét követően). Közbenső mintavételi pont ajánlott a felvételi és tisztulási kinetika ellenőrzésére ( 33 ). A számítások tekintetében lásd az 5. és 6. függeléket.
Az eredmények kiértékelése
A vizsgálat érvényességének és informatív értékének áttekintéséhez meg kell győződni arról, hogy a tisztulási fázis meghalad-e egy felezési időt. A BCFKm-et (a minimalizált vizsgálatból számított kinetikus BCF-et) össze kell hasonlítani a minimalizált BCFSS értékkel (amely a felvételi fázis végén azon feltételezés mellett számított BCFSS, hogy az állandósult állapot létrejött. Ez puszta feltételezés, mivel a mintavételi pontok száma nem elegendő ennek bizonyításához). Ha BCFKm < minimalizált BCFSS, a minimalizált BCFSS érték az előnyben részesített érték. Ha a BCFKm a minimalizált BCFSS kevesebb, mint 70 %-a, az eredmények nem érvényesek, és teljes vizsgálatot kell lefolytatni.
Ha a minimalizált vizsgálat olyan BCFKm eredményt ad, amely a szabályozói aggályokat felvető értéktartományba esik, teljes vizsgálatot kell folytatni. Ha az eredmény messze elmarad a szabályozói aggályokat felvető értékektől (jóval felette vagy alatta van), nincs feltétlenül szükség teljes vizsgálatra, vagy egyetlen koncentráción alapuló teljes vizsgálat is lefolytatható, ha a vonatkozó szabályozói keret ezt előírja.
Ha az egy koncentráció alkalmazásával lefolytatott minimalizált vizsgálatot követően megállapítást nyer, hogy teljes vizsgálatra van szükség, ezt el lehet végezni egy második koncentráción. Ha az eredmények összhangban vannak, el lehet tekinteni egy eltérő koncentrációval lefolytatott további teljes vizsgálattól, mivel várhatóan az anyag biokoncentrációja nem koncentrációfüggő. Ha a minimalizált vizsgálatot két koncentráció mellett folytatták le, és az eredmények nem utalnak koncentrációfüggésre, a teljes vizsgálat lefolytatható csak egy koncentrációval is (vö. 87. pont).
Vizsgálati jegyzőkönyv
A minimalizált vizsgálatra vonatkozó jelentésnek a teljes vizsgálatra előírt valamennyi információt tartalmaznia kell (vö. 81. pont), kivéve azokat, amelyeket nem lehet előállítani (azaz az állandósult állapotig eltelt időt bemutató görbét vagy az állandósult állapoti biokoncentrációs tényezőt, ez utóbbi helyett a minimalizált vizsgálatban számított BCFSS-t kell megadni). Emellett a Vizsgálati jegyzőkönyvben ki kell térni a minimalizált vizsgálat alkalmazásának indokolására és az eredményként adódó BCFKm-re.
C.13. – III.: Étrendi expozíción alapuló bioakkumulációs halvizsgálat
BEVEZETÉS
Az e szakaszban bemutatott módszert olyan anyagok tekintetében kell használni, amelyek esetében a vízi expozíciós módszer nem megvalósítható (például mivel az állandó, mérhető vízi koncentrációk nem tarthatók fenn, vagy a test megfelelő anyagterhelése nem érhető el az expozíció 60 napja alatt; a vízi expozíció tekintetében lásd az előző szakaszokat). Meg kell jegyezni ugyanakkor, hogy e vizsgálat végpontja inkább étrendi biomagnifikációs tényező (BMF) és nem biokoncentrációs tényező (BCF) ( 34 ).
2001 májusában a vízben csekély mértékben oldódó szerves anyagok biológiai felhalmozódásának vizsgálatára új módszert mutattak be a SETAC Europe (Környezettoxikológiai és Kémiai Társaság) madridi konferenciáján (36). Ez a munka a szakirodalomban ismertetett, különböző közölt bioakkumulációs vizsgálatokon alapult, amelyekben a vizsgálati anyaggal kiegészített tápot tartalmazó adagolási módszert alkalmaztak (pl. (37)). 2004 elején olyan protokolltervezetet (38) nyújtottak be az EU PBT munkacsoportjához, amelynek célja a vízben csekély mértékben oldódó szerves anyagok bioakkumulációs potenciáljának mérése, amely anyagok esetében a standard, vízi expozíción alapuló biokoncentrációs módszer nem megvalósítható; e tervezetet háttérdokumentum kísérte (39). A módszer tekintetében megadott további indok az volt, hogy a vízben csekély mértékben oldódó (azaz, ahol log K OW >5) ezen anyagoknak való potenciális környezeti expozíció jórészt az étrend útján alakulhat ki (vö. (40) (41) (42) (43) (44)). Ebből az okból az étrendi expozíciós vizsgálatokra egyes, vegyi anyagokra vonatkozó közzétett rendeletek is hivatkoznak ( 35 ). Fel kell ismerni ugyanakkor, hogy az itt bemutatott módszerben a vizes fázisú expozíciót gondosan kerülik, így az e vizsgálati módszerből adódó BMF érték közvetlenül nem hasonlítható össze a terepvizsgálat során nyert BMF értékkel (ahol kombinálható a vízi és az étrendi expozíció).
E vizsgálati módszer e szakasza ezen a protokollon (38) alapul, és olyan új módszer, amely a C.13. vizsgálati módszer korábbi verziójában nem jelent meg. Ez az alternatív vizsgálat lehetővé teszi, hogy az étrendi expozíciós útvonalat szabályozott laboratóriumi körülmények között közvetlenül vizsgálják.
A lehetséges vizsgálóknak e vizsgálati módszer 1–14. pontját kell áttekinteniük, hogy tájékozódjanak, mikor részesítendő előnyben az étrendi expozíciós vizsgálat a vízi expozíciós vizsgálattal szemben. Az anyagokkal kapcsolatos különböző megfontolások vonatkozásában rendelkezésre állnak információk, amelyeket a vizsgálat lefolytatása előtt mérlegelni kell.
A radioaktív jelöléssel ellátott vizsgálati anyagok alkalmazását ugyanolyan megfontolások mentén kell mérlegelni, mint a vízi expozíciós módszer esetén (vö. 6. és 65. pont).
Az étrendi módszer egynél több anyag egyetlen vizsgálat keretében való elemzésére is alkalmas bizonyos kritériumok teljesülése esetén; ezeket a 112. pont fejti ki részletesebben. Az egyszerűség érdekében a módszer itt egyetlen vizsgálati anyagot elemző vizsgálatot mutat be.
Az étrendi vizsgálat sok szempontból hasonló a vízi expozíciós módszerhez, nyilvánvalóan az expozíciós útvonal kivételével. Így az itt bemutatott módszer és az előző szakaszban ismertetett vízi expozíciós módszer között számos vonatkozásban átfedés van. Lehetőség szerint kereszthivatkozás utal a korábbi szakasz vonatkozó pontjaira, de az olvashatóság és érthetőség érdekében bizonyos mennyiségű ismétlés elkerülhetetlen.
A VIZSGÁLAT ELVE
Átfolyásos vagy félstatikus körülmények alkalmazhatók (vö. 4. pont); az átfolyásos körülmények javasoltak az anyagnak vízi úton való, a vizsgálati anyaggal kiegészített táp vagy ürülék deszorpciója eredményeként előálló esetleges expozíció mérséklése érdekében. A vizsgálat két fázisból áll: felvétel (vizsgálati anyaggal kiegészített táp) és tisztulás (tiszta, kezeletlen táp) (vö. 16. pont). A felvételi fázisban a halak vizsgálati csoportját a vizsgálati anyaggal kiegészített, ismert összetételű kereskedelmi haltápon alapuló, előre meghatározott étrend szerint etetik, napi rendszerességgel. A halaknak ideális esetben valamennyi beadott tápot el kell fogyasztaniuk (vö. 141. pont). A halakat ezt követően tiszta, kezeletlen kereskedelmi haltáppal kell etetni a tisztulási időszakban. A vízi expozíciós módszerhez hasonlóan, szükség esetén egynél több, különböző kiegészített vizsgálatianyag-koncentrációknak kitett vizsgálati csoportokat lehet alkalmazni, de a nagymértékben víztaszító szerves vizsgálati anyagok többsége esetében elegendő egyetlen vizsgálati csoport (vö. 49. és 107. pont). Ha félstatikus körülményeket alkalmaznak, a halakat új közegbe és/vagy új vizsgálati kamrába kell áthelyezni a felvételi fázis végén (amennyiben a felvételi fázisban alkalmazott közeg és/vagy eszköz kimosódás következtében a vizsgálati anyaggal szennyeződött). A vizsgálati anyag halakban lévő koncentrációit a vizsgálat mindkét fázisa alatt mérik. A vizsgálati anyaggal kiegészített étrenden tartott halak csoportja (a vizsgálati csoport) mellett kontrollcsoportot is kell beállítani azonos körülmények között, és ezeket ugyanúgy kell etetni, leszámítva, hogy a kereskedelmi haltápot nem egészítik ki a vizsgálati anyaggal. E kontrollcsoport lehetővé teszi, hogy a vizsgálati anyag háttérszintjeit számszerűsítsék a vizsgálati anyagnak ki nem tett halakban, és összehasonlításul szolgál bármely, a vizsgálati csoportban megfigyelt, kezeléssel összefüggő káros hatás vonatkozásában ( 36 ). Ezenfelül lehetővé teszi a növekedési sebességi állandók csoportok közötti összehasonlítását, annak ellenőrzésére, hogy a beadott táp azonos mennyiségeit fogyasztották-e el (az étrendek ízletessége közötti lehetséges különbségeket szintén figyelembe kell venni a különböző növekedési sebességi állandók magyarázataként, vö. 138. pont). Fontos, hogy mind a felvételi, mind a tisztulási fázisban egyenértékű tápanyagot tartalmazó étrenddel etessék a vizsgálati és a kontrollcsoportot is.
A módszer kialakítóinak tapasztalatai alapján általában elegendő a 7–14 napig tartó felvételi fázis (38) és (39). E tartománynak úgy kellene a lehető legkisebbre csökkentenie a vizsgálat elvégzésének költségét, hogy továbbra is biztosítja a legtöbb anyagnak való elegendő expozíciót. Ugyanakkor egyes esetekben a felvételi fázis meghosszabbítható (vö. 127. pont). A felvételi fázis során az anyag koncentrációja a halban nem biztos, hogy állandósult állapotot ér el, így az adatkezelés és az e módszerből adódó eredmények szokásosan a szöveti maradékok kinetikus elemzésén alapulnak. (Megjegyzés: az állandósult állapot eléréséhez szükséges idő becslésére szolgáló egyenleteket itt alkalmazni lehet, mint a vízi expozíciós vizsgálatnál – lásd az 5. függeléket.) A tisztulási fázis akkor kezdődik, amikor a halat először etetik kiegészítetlen táppal, és szokásosan legfeljebb 28 napig tart, vagy – amennyiben az korábban következik be –, addig az időpontig, amikor a vizsgálati vegyi anyag mennyisége már nem számszerűsíthető az egész halban. A tisztulási fázis lerövidíthető vagy meghosszabbítható 28 napon túlra, a mért vegyianyag-koncentráció és a halak méretének időbeli változásától függően.
Ez a módszer lehetővé teszi a következők meghatározását: anyagspecifikus felezési idő (t 1/2, a k 2 tisztulási sebességi állandóból), a halban lévő vizsgálati anyag asszimilációs hatékonysága (felszívódás a bélből; a); kinetikus étrendi biomagnifikációs tényezője (BMFK), a növekedéssel korrigált kinetikus étrendi biomagnifikációs tényezője (BMFKg), és a lipidtartalommal korrigált ( 37 ) kinetikus étrendi biomagnifikációs tényezője (BMFKL) (és/vagy a növekedéssel és lipidtartalommal korrigált kinetikus étrendi biomagnifikációs tényező, BMFKgL). A vízi expozíciós módszerhez hasonlóan, a halak tömegének a vizsgálat során bekövetkező növekedése következtében a fejlődő halakban felhígul a vizsgálati anyag, így a (kinetikus) BCF-et alulbecslik, ha nem korrigálják a növekedés tekintetében (vö. 162 és 163. pont). Ráadásul, ha a becslések szerint az állandósult állapotot elérték a felvételi fázisban, tájékoztató jellegű állandósult állapoti BMF-et lehet számolni. Rendelkezésre állnak olyan megközelítések, amelyek lehetővé teszik a kinetikus biokoncentrációs tényező (BCFK) étrendi vizsgálatból nyert adatok alapján történő becslését (pl. (44) (45) (46) (47) (48)). Az e megközelítések mellett és ellen szóló érvek a 8. függelékben találhatók.
A vizsgálatot elsődlegesen csekély mértékben oldható, nem poláris szerves anyagokra dolgozták ki, amelyek megközelítőleg elsőrendű felvételi és tisztulási kinetikát követnek a halakban. Amennyiben olyan anyagot vizsgálnak, amely megközelítőleg nem elsőrendű felvételi és tisztulási kinetikát követ, összetettebb modelleket kell alkalmazni (lásd az 5. függelék hivatkozásait), és biostatisztikus és/vagy farmakokinetikus szakvéleményét kell kikérni.
A BMF-et szokásosan a vizsgálati anyag egész halra (nedves tömeg) vetített elemzésével határozzák meg. Amennyiben a vizsgálat célkitűzései szempontjából releváns, konkrét szövetekből (pl. izom, máj) mintát lehet venni, ha a hal ehető és nem ehető részekre osztható (vö. 21. pont). Emellett el lehet végezni a gyomor-bél traktus eltávolítását és különálló elemzését az egész halban mérhető koncentrációhoz való hozzájárulás meghatározása érdekében a felvételi fázis végén található és a tisztulási fázis kezdetéhez közeli mintavételi pontok tekintetében, vagy anyagmérleg alapú megközelítés részeként.
A mintába felvett egész hal lipidtartalmát mérni kell, így a koncentrációk a lipidtartalomra tekintettel korrigálhatók, figyelembe véve mind az étrend, mind a hal lipidtartalmát (vö. 56. és 57. pont, valamint 7. függelék).
A vizsgálat során esetleg bekövetkező növekedés kiszámításának céljából a mintába felvett egyedek tömegét mérni és rögzíteni kell, továbbá azt az adott egyed tekintetében elemzett vegyianyag-koncentrációhoz kell kapcsolni (pl. egyedi azonosító kóddal kell feltüntetni a mintába felvett minden hal tekintetében). A halak teljes hosszát is mérni kell, ahol lehetséges ( 38 ). A tömegre vonatkozó adatok szükségesek a BCF-nek az étrendi vizsgálat tisztulási adatai felhasználásával készült becsléséhez is.
A VIZSGÁLATI ANYAGRA VONATKOZÓ INFORMÁCIÓK
A vizsgálati anyagra vonatkozó, a 3. és 22. pontban feltüntetett információt rendelkezésre kell bocsátani. Általában nincs szükség a vizsgálati anyag vízi koncentrációjával kapcsolatos analitikai módszerre; a koncentráció haltápban és halszövetben történő mérését szolgáló, kellően érzékeny módszer előírt.
A módszer egynél több anyag egyetlen vizsgálat keretében való elemzésére is alkalmas. A vizsgálati anyagoknak ugyanakkor egymással kompatibilisnek kell lenniük, hogy ne lépjenek kölcsönhatásba egymással, vagy ne változzon meg kémiai azonosságuk a haltáphoz való hozzáadásukkal. A cél az, hogy az egyes együtt vizsgálati anyagok tekintetében mért eredmények ne különbözzenek nagy mértékben azoktól az eredményektől, amelyek az egyes vizsgálati anyagok egyedi vizsgálatából adódnának. Előzetes analitikai munkával kell megállapítani, hogy mindegyik anyag visszanyerhető-e a többszörösen kiegészített táp- és halszövetmintából, i. nagy visszanyerési arány (pl. > a névleges 85 %-a) mellett és ii. a szükséges vizsgálati érzékenységgel. Az együtt vizsgált anyagok teljes dózisának el kell maradnia az esetlegesen toxikus hatást okozó kombinált koncentrációtól (vö. 51. pont). Ezenfelül a halban bekövetkező lehetséges káros hatásokat és a több anyag egyidejű vizsgálatával összefüggő potenciális kölcsönhatásokat (pl. anyagcserehatások) figyelembe kell venni a kísérlettervezés során. Kerülni kell az ionizálható anyagok egyidejű vizsgálatát. Az expozíciót tekintve ez a módszer alkalmas összetett keverékek esetén is (vö. 13. pont, jóllehet a más módszerek esetén érvényes analitikai korlátozásokat itt is alkalmazni kell).
A VIZSGÁLAT ÉRVÉNYESSÉGE
A vizsgálat érvényességéhez a következő feltételeknek kell teljesülniük (vö. 24. pont):
— A vízhőmérséklet-változás kevesebb mint ± 2 °C a kezelt és a kontrollcsoportban.
— Az oldott oxigén koncentrációja nem eshet 60 %-os levegőtelítettségi érték alá.
— A vizsgálati vegyi anyag haltápban lévő koncentrációja a felvételi fázis előtt és végén ± 20 %-os tartományon belül marad (mindkét időpontban legalább három minta alapján).
— Az anyag nagymértékű homogenitását a tápban a vizsgálati anyaggal kiegészített étrendre vonatkozó előzetes analitikai munkával kell bizonyítani; az anyagnak a vizsgálat kezdetekor mintavételezett legalább három koncentrációja nem térhet el ± 15 %-ot meghaladóan az átlagtól.
— A kiegészítetlen tápban, illetve a kontrollhalak szöveteiben a vizsgálati anyag a kezelt mintákhoz képest nem kimutatható, vagy csak a szokásosnak megfelelő nyomokban.
— A vizsgálat végén a kontroll- és a kezelt halak mortalitása és egyéb káros hatások/betegségek legfeljebb 10 %-ban fordulhatnak elő; amennyiben a vizsgálat bármilyen okból meghosszabbodik, a káros hatás a halak mindkét csoportjában legfeljebb havi 5 %, és összesen legfeljebb 30 % lehet. Az átlagos növekedésnek a mintába felvett halak vizsgálati és kontrollcsoportja közötti jelentős különbségei a vizsgálati anyag toxikus hatására utalhatnak.
REFERENCIAANYAGOK
Ha a laboratórium korábban még nem végezte a vizsgálatot vagy jelentős változások történtek (pl. a haltörzs vagy a beszállító változásai, más halfajok, a halak méretének, a haltápnak vagy a tápkiegészítési módszernek a jelentős változása stb.), célszerű technikai jártassági vizsgálatot lefolytatni referenciaanyag alkalmazásával. A referenciaanyagot elsődlegesen annak megállapítására használják, hogy a tápkiegészítési módszer megfelelő-e a maximális homogenitás és a vizsgálati anyag biológiai hasznosíthatóságának garantálásához. A nem poláris víztaszító anyagok esetében például hexaklór-benzolt (HCB) alkalmaztak, de a HCB veszélyessége miatt mérlegelni kell más olyan anyagok alkalmazását, amelyeket érintően a felvétel és a biomagnifikáció tekintetében megbízható adatok állnak rendelkezésre ( 39 ). Ha referenciaanyagot alkalmaznak, az azzal kapcsolatos alapvető információt fel kell tüntetni a Vizsgálati jegyzőkönyvben, ideértve a nevet, a tisztaságot, a CAS-számot, a szerkezetet és a toxicitási adatokat (ha rendelkezésre állnak), mint a vizsgálati anyag esetében (vö. 3. és 22. pont).
A MÓDSZER ISMERTETÉSE
Felszerelés
Az anyagokat és felszereléseket a vízi expozíciós módszernél bemutatottak szerint kell használni (vö. 26. pont). Átfolyásos vagy statikus megújítási vizsgálati rendszert kell alkalmazni, amely biztosítja, hogy elegendő mennyiségű hígítóvíz áramoljon a vizsgálati tartályokba. Az áramlási sebességet rögzíteni kell.
Víz
A vizsgálati vizet a vízi expozíciós módszernél bemutatottak szerint kell használni (vö. 27–29. pont). A vizsgálati közegnek a leírt jellemzőkkel kell rendelkeznie, minőségének pedig állandónak kell maradnia a vizsgálat során. A természetes részecsketartalomnak és teljes szervesszén-tartalomnak a lehető legalacsonyabbnak kell lennie a vizsgálat megkezdése előtt (≤ 5 mg/l részecske; ≤ 2 mg/l teljes szervesszén-tartalom). A teljes szervesszén-tartalmat csak a vizsgálat megkezdése előtt, a vizsgálati víz jellemzésének részeként kell mérni (vö. 53. pont).
Étrend
Kereskedelmi forgalomban kapható haltáp (lebegő és/vagy lassan elsüllyedő pellet) ajánlott, amelynek legalább fehérje- és zsírtartalma ismert. A tápnak egységes pelletméretűnek kell lennie, hogy fokozottabb legyen az étrendi expozíció hatékonysága, azaz a halak többet egyenek a tápból, ahelyett, hogy megeszik a nagyobb darabokat, a kisebbeket pedig nem. A pelleteknek a hal méretéhez viszonyítva megfelelő méretűnek kell lenniük a vizsgálat kezdetén (pl. durván 0,6–0,85 mm pelletátmérő alkalmazható a 3–7 cm teljes hosszúságú halak esetén, valamint 0,85–1,2 mm pelletátmérő alkalmazható a 6–12 cm teljes hosszúságú halak esetén). A tisztulási szakasz kezdetén a pellet méretét a halak növekedéséhez lehet igazítani. A megfelelő, kereskedelemben is forgalmazott tápösszetételre a 7. függelékben található példa. E módszer kialakítása során szokásosan 15–20 % (w/w) teljes lipidtartalmú vizsgálati étrendet alkalmaztak. Egyes területeken nem biztos, hogy kapható ilyen magas lipidkoncentrációjú haltáp. Ilyen esetekben a vizsgálatot le lehet folytatni alacsonyabb lipidtartalmú táppal, és szükség esetén az etetési arányt kell megfelelően kiigazítani a hal egészségének megőrzéséhez (előzetes vizsgálat alapján). A vizsgálati és kontrollcsoport étrendjének teljes lipidtartalmát mérni és rögzíteni kell a vizsgálat megkezdése előtt és a felvételi fázis végén. A Vizsgálati jegyzőkönyvben fel kell tüntetni a kereskedelmi haltápbeszállító által a tápanyagok, a nedvesség, a rost és a hamu, és lehetőség szerint az ásványi anyagok, továbbá a növényvédőszer-maradékok (pl. »standard«, prioritásként kezelendő szennyező anyagok) elemzése tekintetében közölt részletes adatokat.
A táp vizsgálati anyaggal való kiegészítésekor minden erőfeszítést meg kell tenni annak érdekében, hogy biztosított legyen a homogenitás a vizsgálati étrendben. A vizsgálati csoport tekintetében a vizsgálati anyag tápban meglévő koncentrációjának megválasztása során figyelembe kell venni az analitikai módszer érzékenységét, a vizsgálati anyag toxicitását (NOEC, ha ismert), és a releváns fizikai és kémiai adatokat. Ha alkalmaznak referenciaanyagot, azt a vizsgálati anyag koncentrációjának 10 %-a körüli koncentrációval kell bevezetni (de mindenesetre a lehető legalacsonyabb szinten), figyelemmel az elemzés érzékenységére (pl. a hexaklór-benzol esetében a tápban mért 1–100 μg/g koncentrációt elfogadhatónak tekintették; vö. (47) a HCB asszimilációs hatékonyságát érintő további információ tekintetében).
A haltáp számos módszerrel kiegészíthető a vizsgálati anyaggal, az anyag fizikai tulajdonságai és oldhatósága függvényében (lásd a 7. függeléket a tápkiegészítési módszerek további részletei tekintetében):
— Ha az anyag trigliceridekben oldható és stabil, az anyagot kis mennyiségű halolajban vagy növényi étolajban kell feloldani, mielőtt a haltápba bekevernék. Ebben az esetben törekedni kell arra, hogy ne készítsenek túl magas lipidtartalmú adagot, figyelembe véve a kiegészített táp természetes lipidtartalmát; így a vizsgálati anyag tápban történő megfelelő eloszlását és homogenitását ismerten biztosító legkisebb mennyiségű olajat kell hozzáadni, vagy
— A tápot megfelelő szerves oldószer alkalmazásával kell kiegészíteni, ameddig a homogenitás és a biológiai hasznosíthatóság nem kerül veszélybe (lehetséges, hogy a vizsgálati anyag (mikro)kristályokká alakul a tápban az oldószer párolgásának következtében, és nem könnyen bizonyítható, hogy ez nem következett be; vö. (49)), vagy
— Nem viszkózus folyadékot kell adni közvetlenül a haltáphoz, de azt jól el kell keverni a homogenitás előmozdítása és a megfelelő asszimiláció megkönnyítése érdekében. A keverési technikának biztosítania kell a kiegészített táp homogenitását.
Néhány esetben, pl. kevésbé víztaszító vizsgálati anyagoknál valószínűbb, hogy deszorbeálnak a tápból, ezért szükség lehet arra, hogy az elkészített pelleteket kis mennyiségű kukorica-/halolajjal bevonják (lásd 142. pont). Ilyen esetekben a kontrolltápot hasonlóan kell kezelni, és a végül elkészített tápot kell használni a lipidtartalom mérésénél.
Ha referenciaanyagot alkalmaznak, az azzal kapcsolatos eredményeknek összehasonlíthatóknak kell lenniük az ugyanilyen körülmények között, hasonló etetési aránnyal végzett vizsgálatok szakirodalmi adataival (vö. 45. pont) és a referenciaanyag-specifikus paramétereknek meg kell felelniük a 113. pontban megfogalmazott, vonatkozó kritériumoknak (3., 4. és 5. pont).
Ha olajat vagy hordozó oldószert használnak a vizsgálati anyag vivőanyagaként, e vivőanyag ugyanolyan mennyiségét a kontrollcsoport étrendjébe is bele kell keverni (a vizsgálati anyag nélkül), hogy fenntartsák a kiegészített étrenddel való egyenértékűséget. Fontos, hogy mind a felvételi, mind a tisztulási fázisban egyenértékű tápanyagot tartalmazó étrenddel etessék a vizsgálati és a kontrollcsoportot is.
A kiegészített tápot olyan körülmények között kell tárolni, hogy fennmaradjon a vizsgálati anyag stabilitása a tápkeverékben (pl. hűtés), és e körülményeket fel kell tüntetni a Vizsgálati jegyzőkönyvben.
A halfajok kiválasztása
A vízi expozíciónál meghatározott halfajokat lehet használni (vö. 32. pont és 3. függelék). Általánosságban szivárványos pisztrángot (Oncorhynchus mykiss), pontyot (Cyprinus carpio), amerikai csellét (Pimephales promelas) használtak a szerves anyagokat érintő étrendi bioakkumulációs vizsgálatokban még e vizsgálati módszer közzététele előtt. A vizsgálati fajok olyan étkezési szokásokkal kell rendelkezzenek, hogy a beadott tápadagot gyorsan elfogyasszák, annak biztosítása érdekében, hogy a vizsgálati anyag tápbeli koncentrációját befolyásoló tényezőket (pl. vízbe szivárgás és vízi expozíció lehetősége) a minimálisra szorítsák. Az ajánlott méret/tömegtartományba tartozó halakat kell használni (vö. 3. függelék). A halak nem lehetnek olyan kicsik, hogy a méretük gátolja az egyedenkénti könnyű analízist. A halfajok gyors növekedéssel járó életszakaszban történő vizsgálata bonyolíthatja az adatok kiértékelését, és a nagy növekedési sebesség befolyásolhatja az asszimilációs hatékonyság kiszámítását ( 40 ).
A halak tartása
Az akklimatizációra, a mortalitásra és a betegségre vonatkozó elfogadhatósági kritériumok megegyeznek a vízi expozíciós módszernél a vizsgálat lefolytatása előtti időszak vonatkozásában ismertetettekkel (vö. 33–35. pont).
A VIZSGÁLAT ELVÉGZÉSE
Elővizsgálati munka és dózisbehatároló vizsgálat
Elővizsgálati analitikai munkára van szükség az anyag kiegészített tápból/halszövetből történő visszanyerésének igazolására. A tápbeli megfelelő koncentráció megválasztására irányuló dózisbehatároló vizsgálat nem mindig szükséges. Annak igazolása céljából, hogy nem figyeltek meg káros hatásokat, illetve a kiegészített táp ízletességének, az analitikai módszer halszövet és táp szempontjából vett érzékenységének, valamint a tisztulási fázis során a megfelelő etetési arány és mintavételezési időközök megválasztásának stb. értékelése érdekében előzetes etetési kísérleteket lehet végezni, de ezek nem kötelezőek. Az előzetes vizsgálat hasznos lehet a tisztulási szakaszban mintába veendő halak számának becsléséhez. Ennek eredményeként lényegesen csökkenhet az alkalmazott halak száma, különösen azon vizsgálati anyagok tekintetében, amelyek kifejezetten alkalmasak anyagcserére.
Az expozíció körülményei
A felvételi fázis tartama
7–14 napos felvételi fázis általában elegendő; ezalatt egy halcsoportot a kontrolltáppal kell etetni, egy másikat a vizsgálati táppal, naponta, a vizsgálati faj és a kísérleti körülmények függvényében előre meghatározott adagban, pl. a testtömeg (nedves tömeg) 1–2 %-ában szivárványos pisztráng esetén. Az etetési arányt úgy kell megválasztani, hogy el lehessen kerülni a gyors növekedést és a lipidtartalom számottevő emelkedését. Szükség esetén a felvételi fázis meghosszabbítható korábbi vizsgálatok gyakorlati tapasztalatainak vagy a vizsgálati (vagy hasonló) anyag halban megfigyelt felvétele/tisztulása ismeretének függvényében. A vizsgálat kezdete a vizsgálati anyaggal kiegészített táppal való első etetés időpontja. Egy kísérleti nap az etetés időpontjától röviddel (pl. egy órával) a következő etetés időpontja előttig tart. A felvétel első kísérleti napja tehát a kiegészített táppal való első etetés időpontjában kezdődik, és röviddel a kiegészített táppal való második etetés előtt ér véget. A gyakorlatban a felvételi fázis röviddel (pl. egy órával) a kiegészítetlen vegyi anyaggal való első etetés előtt ér véget, mivel a hal továbbra is emészti a kiegészített tápot és felszívja a vizsgálati anyagot a közbeeső 24 órában. Fontos biztosítani, hogy a vizsgálati anyaggal az analitikai módszerre tekintettel a test kellően magas (nem toxikus) anyagterhelését érjék el, hogy legalább egy nagyságrendnyi csökkenés mérhető legyen a tisztulási fázisban. Különleges esetekben (28 napig) meghosszabbított felvételi fázis is alkalmazható, további mintavétel mellett, hogy betekintést lehessen nyerni a felvételi kinetikába. A felvétel során a halban mért koncentráció nem feltétlenül éri el az állandósult állapotot. Az állandósult állapot eléréséhez szükséges idő, mint a halban mért értékelhető koncentráció eléréséhez szükséges valószínűsíthető időtartamra utaló jel becslésére szolgáló egyenleteket itt alkalmazni lehet, mint a vízi expozíciós vizsgálatnál (vö. 5. függelék).
Néhány esetben tudott lehet, hogy – akár gyenge analitikai érzékenység, akár alacsony asszimilációs hatékonyság miatt – az anyag hal általi felvételére nem lesz elég a 7–14 nap ahhoz, hogy a tápban alkalmazott koncentrációval kellően magas halban mért koncentrációt lehessen elérni, hogy elemezhető legyen legalább egy nagyságrendnyi csökkenés a tisztulási szakaszban. Ilyen esetekben előnyös lehet az eredeti etetési fázist 14 napon túlra meghosszabbítani, vagy kifejezetten a nagymértékben feldolgozható anyagok esetében magasabb étrendi koncentrációt kell fontolóra venni. Ugyanakkor óvatosan kell eljárni, hogy a test anyagterhelése a felvétel során a (becsült) krónikus hatást nem okozó koncentráció (NOEC) alatt maradjon a halszövetben (vö. 138. pont).
A tisztulási fázis időtartama
A tisztulás szokásosan 28 napig tart, és akkor kezdődik, amikor a vizsgálati csoportba tartozó halakat tiszta, kezeletlen táppal etetik a felvételi fázist követően. A tisztulási fázis a »kiegészítetlen« táppal való első etetéssel kezdődik, és nem közvetlenül az utolsó »kiegészített« táppal való etetést követően, mivel a hal továbbra is emészti a kiegészített tápot és felszívja a vizsgálati anyagot a közbeeső 24 órában, amint az a 126. pontban is szerepel. Ennélfogva a tisztulási fázisban az első mintát rövid idővel a kiegészítetlen táppal való második etetés előtt kell venni. E tisztulási szakasz célja azon anyagok felderítése, amelyek potenciális felezési ideje legfeljebb 14 nap, ami összhangban áll a bioakkumulatív anyagok felezési idejével ( 41 ), így a 28 napra két felezési idő jut ilyen anyagok esetében. A nagyon nagy mértékben bioakkumulatív anyagok esetében előnyös lehet a tisztulási fázis meghosszabbítása (ha az előzetes vizsgálat erre utal).
Ha az anyag nagyon lassan ürül ki, és így pontos felezési idő nem határozható meg a tisztulási szakaszban, az információ még mindig elengedő lehet értékelési célokra a nagyfokú bioakkumuláció jelzésére. Ezzel ellentétben, ha egy anyag olyan gyorsan ürül ki, hogy megbízható nulla időpillanati koncentráció (a felvétel vége/tisztulás kezdetekori koncentráció, C 0,d) és k 2 nem származtatható, el lehet végezni a k 2 konzervatív becslését (vö. 7. függelék).
Ha a hal korábbi intervallumok (pl. 7 vagy 14 nap) során végzett elemzései azt mutatják, hogy az anyag a 28 napos teljes periódus előtt a számszerűsítési szintek alatt ürült ki, a további mintavételezés megszakítható és a vizsgálat lezárható.
Egyes esetekben a vizsgálati anyagnak esetleg nem mérhető a felvétele a felvételi időszak végén (vagy a második tisztulási mintában). Ha igazolható, hogy i. a 113. pontban foglalt érvényességi kritériumok teljesültek, és ii. a felvétel hiánya nem a vizsgálat egyéb hiányosságaiból ered (pl. nem elég hosszú felvételi idő, a tápkiegészítési technika hiányossága, amelynek következtében gyengül a biológiai hasznosíthatóság, az analitikai módszer nem érzékeny, a hal nem fogyasztja el a tápot stb.), be lehet fejezni a vizsgálatot anélkül, hogy újra le kellene azt folytatni hosszabb felvételi időszakkal. Ha az előzetes munka arra utalt, hogy ez lehet a helyzet, az anyagmérleg megközelítés részeként tanácsos lehet az ürülék elemzése, ha lehetséges, emésztetlen vizsgálati anyag feltárása érdekében.
A vizsgálati halak száma
A vízi expozíciós vizsgálatnál leírtak szerint hasonló tömegű és hosszúságú halakat kell kiválasztani, úgy, hogy a legkisebbek ne legyenek kisebbek a legnagyobb hal tömegének kétharmadánál (vö. 40–42. pont).
A vizsgálandó halak teljes számát a mintavételi ütemterv szerint kell megválasztani (minimum egy mintát kell venni a felvételi fázis végén, és négy–hat mintát a tisztulási fázisban, de a fázisok időtartamának függvényében), figyelembe véve az analitikai módszer érzékenységét, a felvételi fázis végén (előzetes ismeretek alapján) valószínűleg elérendő koncentrációt, és a tisztulás időtartamát (ha a korábbi ismeretek lehetővé teszik a becslést). Minden egyes alkalommal öt–tíz halat kell mintavételezni, és a növekedési paramétereket (tömeg és teljes hossz) a kémiai vagy lipidanalízis előtt kell megmérni.
A halak körében az inherens méretbeli, a növekedési sebességet érintő és a fiziológiai különbségek, továbbá az egyes halak által elfogyasztott beadott táp valószínű mennyiségi eltérése miatt legalább öt halat mintába kell venni az egyes intervallumok során a vizsgálati csoportból és ötöt a kontrollcsoportból, hogy megfelelően meg lehessen állapítani az átlagos koncentrációt és annak változékonyságát. A felhasznált halak közötti eltérések valószínűleg nagyobb mértékben járulnak hozzá a vizsgálatban az általános akaratlan változékonysághoz, mint az alkalmazott analitikai módszerekben rejlő változékonyság, és ezáltal indokolja a mintavételezési pontonkénti legfeljebb tíz hal használatát egyes esetekben. Ugyanakkor, amennyiben a vizsgálati anyag kontrollhalakban lévő háttér-koncentrációja nem mérhető a tisztulási fázis kezdetén, két–három kontrollhal kémiai elemzése a végső mintavételi alkalommal csak addig elegendő, ameddig a többi kontrollhalat minden mintavételi ponton továbbra is mintavételezik a tömeg és teljes hossz tekintetében (azért, hogy ugyanolyan számú halat mintavételezzenek a vizsgálati és a kontrollcsoportban a növekedés tekintetében). A halakat egyedileg kell tárolni, tömegüket és teljes hosszukat mérni (még akkor is, ha a mintavételi eredmények szempontjából későbbi összevonás szükséges).
A például 28 napos tisztulási időtartamot és öt tisztulási mintavételt tartalmazó standard vizsgálat tekintetében ez összesen 59–120 halat jelent a vizsgálati csoportból és 50–110 halat a kontrollcsoportból, feltételezve, hogy az anyagra vonatkozó analitikai módszer lehetővé teszi a lipidanalízis ugyanazon a halon történő elvégzését. Ha a lipidanalízis nem végezhető el ugyanazon a halon, mint a kémiai analízis, és a kontrollhalak kizárólag lipidanalízishez való felhasználása szintén nem megvalósítható (vö. 56. pont), további 15 halra lesz szükség (háromra a vizsgálat kezdetekor a törzsállományból, háromra a tisztulási fázis kezdetekor a kontroll- és vizsgálati csoport mindegyikéből és háromra a kísérlet végén a kontroll- és vizsgálati csoportok mindegyikéből). A mintavételezési ütemtervre és a halak számára vonatkozó példa a 4. függelékben található.
Betelepítés
A vízi expozíciós módszernél bemutatottak szerint hasonlóan magas víz–hal arányt kell alkalmazni (vö. 43. és 44. pont). Jóllehet a hal–víz betelepítési arányok nem gyakorolnak hatást az expozíciós koncentrációra ebben a vizsgálatban, literenként naponta 0,1–1,0 g hal (nedves tömeg) betelepítési arány ajánlott a megfelelő oldottoxigén-koncentrációk fenntartása és a vizsgálati szervezeteket érő stressz minimálisra csökkentése érdekében.
Vizsgálati étrend és etetés
Az akklimatizációs időszakban a halakat megfelelő, a fent leírt étrend szerint kell etetni (117. pont). Ha a vizsgálatot átfolyásos körülmények között végzik, az áramlást az etetés idejére fel kell függeszteni.
A vizsgálat során a vizsgálati csoportnak adott étrendnek meg kell felelnie a fent meghatározottnak (116–121. pont). Az anyagspecifikus tényezők, az analitikai érzékenység, az étrendben környezeti feltételek mellett várható koncentráció, valamint a krónikus toxicitási szintnek/a test anyagterhelésének figyelembevétele mellett a kiegészítési célkoncentráció megválasztása során tekintettel kell lenni a táp ízletességére (hogy a halak megegyék). A vizsgálati anyag névleges kiegészítési koncentrációját fel kell tüntetni a Vizsgálati jegyzőkönyvben. A tapasztalatok szerint a kiegészítési koncentrációk a 1–1000 μg/g közötti tartományban olyan vizsgálati anyagok tekintetében jelentenek gyakorlati munkatartományt, amelyek nem mutatnak specifikus toxikus mechanizmust. A nem specifikus mechanizmuson keresztül reagáló anyagok esetében a szöveti maradékértékek nem haladhatják meg az 5 μmol/g lipidet, mivel az e feletti maradékok valószínűsíthetően krónikus hatást okoznak (19) (48) (50) ( 42 ). Más anyagok esetén gondoskodni kell arról, hogy a halmozott expozíció nyomán ne alakuljanak ki káros hatások (vö. 127. pont). Ez kimondottan igaz, ha egynél több anyagot vizsgálnak egyidejűleg (vö. 112. pont).
A haltáp háromféleképpen egészíthető ki a vizsgálati anyag megfelelő mennyiségével, amint az a 119. pontban és a 7. függelékben szerepel. A táp kiegészítésének módszereit és eljárásait fel kell tüntetni a Vizsgálati jegyzőkönyvben. A kontrollhalakat kezeletlen táppal kell etetni, amelynek ugyanolyan mennyiségű kiegészítetlen olajos vivőanyagot kell tartalmaznia, ha ilyet a kiegészített táp esetében alkalmaztak a felvételi fázisban, vagy »tiszta« oldószerrel kezelt táppal, ha a vizsgálati csoport tápjának elkészítéséhez oldószer vivőanyagot használtak. A kezelt és kezeletlen tápot legalább három példányban kell analitikailag mérni a vizsgálati anyag koncentrációjára tekintettel a vizsgálat megkezdése előtt és a felvételi fázis végén. A kezelt tápnak való expozíciót (felvételi fázis) követően a halakat (mindkét csoportban) kezeletlen táppal kell etetni (tisztulási fázis).
A halakat előre meghatározott adaggal kell etetni (a faj függvényében, pl. naponta a nedves testtömeg 1–2 %-ának megfelelő mennyiséggel a szivárványos pisztráng esetében). Az etetési arányt úgy kell megválasztani, hogy el lehessen kerülni a gyors növekedést és a lipidtartalom számottevő emelkedését. Az etetés kísérlet során beállított pontos arányát fel kell jegyezni. Az első etetést a törzsállomány tömegének a közvetlenül a vizsgálat megkezdése előtt tervezett méréséhez kell igazítani. A kísérlet során bekövetkező növekedés figyelembevétele érdekében a táp mennyiségét az egyes mintavételi alkalmakkor mintavételezett halak nedves tömegéhez kell igazítani. A vizsgálati és kontrolltartályokban található halak tömege és hossza megbecsülhető az egyes mintavételi alkalmakkor használt halak tömege és teljes hossza alapján; a vizsgálati és kontrolltartályokban maradó halak tömegét és hosszát nem kell megmérni. Fontos, hogy a kísérlet során fenntartsák ugyanazt az etetési arányt.
Az etetést meg kell figyelni, hogy meggyőződjenek arról, a halak láthatóan elfogyasztják a beadott tápot, annak garantálására, hogy a számításokhoz megfelelő táplálékfelvételi sebességet alkalmazzanak. Az előzetes etetési kísérleteket vagy korábbi tapasztalatokat figyelembe kell venni, hogy olyan etetési arányt válasszanak, amely biztosítja, hogy a napi egyszeri etetés során beadott valamennyi táp elfogyjon. Ha következetesen marad el nem fogyasztott táp, célszerű az adagot egy további etetési időre elosztani minden kísérleti napon (tehát pl. a napi egyszeri etetést felváltani a kétszeri, fele adagot tartalmazó etetéssel). Ha erre van szükség, a második etetést előre meghatározott időpontban kell elvégezni, és azt úgy kell ütemezni, hogy a halak mintavételezése előtt a lehető legtöbb idő teljen el (pl. a második etetés idejét a kísérleti nap első felére kell tenni).
Jóllehet a halak általában gyorsan elfogyasztják a tápot, fontos annak biztosítása, hogy a vegyi anyag adszorbeálódjon a táphoz. Törekedni kell annak elkerülésére, hogy a vizsgálati anyag kioldódjon a tápból a vízbe és ezáltal a halat az étrendi út mellett a vizsgálati anyag vízi koncentrációinak tegye ki. Ez úgy érhető el, hogy az el nem fogyasztott tápot (és az ürüléket) az etetést követő egy órán, de lehetőség szerint 30 percen belül eltávolítják a vizsgálati és kontrolltartályokból. Ezenfelül használható olyan rendszer, amelyben a vizet folyamatosan tisztítják aktívszén-szűrővel, amely elnyel bármilyen »oldott« szennyező anyagot. Az átfolyásos rendszerek segíthetnek a táp részecskéinek és az oldott anyagoknak a gyors kiöblítésében ( 43 ). Egyes esetekben a csekély mértékben módosított kiegészítetttáp-készítési technika segíthet e probléma enyhítésében (lásd a 119. pontot).
Fény és hőmérséklet
Amint a vízi expozíciós módszernél is (vö. 48. pont), 12–16 órás megvilágítási idő javasolt, és a hőmérsékletnek megfelelőnek (± 2 °C) kell lennie a vizsgálathoz használt fajok számára (vö. 3. függelék). A megvilágítás típusának és jellemzőinek ismertnek kell lenni, és azt dokumentálni kell.
Kontrollcsoportok
Egy kontrollcsoportot kell alkalmazni, és a halakat ugyanakkora adaggal kell etetni, mint a vizsgálati csoportot, de a tápban nem lehet jelen a vizsgálati anyag. Ha olajat vagy oldószer vivőanyagot használtak a táp kiegészítésére a vizsgálati csoportban, a kontrollcsoportnál ugyanilyen módon kell eljárni, leszámítva, hogy nem lehet jelen vizsgálati anyag, így a vizsgálati és a kontrollcsoport étrendje egyenértékű (vö. 121. és 139. pont).
A vízminőség mérésének gyakorisága
A vízi expozíciónál leírt feltételek itt is érvényesek, kivéve, hogy a teljes szervesszén-tartalmat csak a vizsgálat megkezdése előtt, a vizsgálati víz jellemzésének részeként kell mérni (vö. 53. pont).
Hal- és tápmintavételezés és -analízis
Tápminták analízise
A vizsgálati és kontrolltáp mintáit legalább három példányban kell analizálni a vizsgálati anyagra és a lipidtartalomra tekintettel, legalább a felvételi fázis kezdete előtt és a végén. Az analitikai módszereket és a táp homogenitását biztosító eljárásokat fel kell tüntetni a Vizsgálati jegyzőkönyvben.
A mintákat a vizsgálati anyag tekintetében az elfogadott és validált módszer alapján kell analizálni. Előzetes vizsgálatot lehet végezni a meghatározási határ, a százalékos visszanyerés, a kölcsönhatások és a tervezett mintamátrixban az analitikai változékonyság megállapítására. Radioaktív jelöléssel ellátott anyagok vizsgálata esetén hasonló megfontolásokat kell mérlegelni, mint a vízi expozíciónál, de a víz analízisének helyébe a táp analízise lép (vö. 65. pont).
Halak analízise
Az egyes halminta-vételi alkalmakkor 5–10 egyedet kell mintába venni a kitett és a kontrollcsoportokból (bizonyos esetekben a kontrollhalak száma csökkenthető, vö. 134. pont).
A mintavételi alkalmakat minden kísérleti napon ugyanakkorra kell időzíteni (az etetési időhöz viszonyítva), és azokat úgy kell ütemezni, hogy minimálisra csökkenjen annak valószínűsége, hogy táp maradjon a bélben a felvételi fázis alatt és a tisztulási fázis korai szakaszában, annak megelőzése érdekében, hogy a teljes vizsgálatianyag-koncentrációt hamis adatok alapján határozzák meg (azaz a mintába felvett halakat el kell távolítani a kísérleti nap végén; figyelembe véve, hogy a kísérleti nap az etetéskor kezdődik és a következő etetéskor ér véget, megközelítőleg 24 órával később. A tisztulási fázis a kiegészítetlen táppal való első etetéssel kezdődik (vö. 128. pont). A tisztulási fázis első mintája (amelyet röviddel a kiegészítetlen táppal való második etetés előtt vesznek) fontos, mivel e mérésből kiindulva egy nappal visszamenőleges extrapolációt alkalmaznak a nulla időpillanati koncentráció becslésére (C 0,d, a felvétel végén/tisztulás kezdetén a halban lévő koncentráció). Fakultatívan eltávolítható a hal gyomor-bél traktusa, és elkülönítetten analizálható a felvétel végén és a tisztulás 1. és 3. napján.
Az egyes mintavételi alkalmakkor a halakat ki kell venni mindkét vizsgálati edényből, és a vizes módszerben leírtakkal megegyező módon kell kezelni (vö. 61–63. pont).
A vizsgálati anyag koncentrációit az egész halban (nedves tömeg) legalább a felvételi fázis végén és a tisztulási fázis során mérni kell, mind a kontroll-, mind a vizsgálati csoportban. A tisztulási fázisban négy–hat mintavételi pont ajánlott (pl. az 1., a 3., a 7., a 14. és a 28. napon). Fakultatívan további mintavételi pont vehető fel 1–3 napnyi felvétel után, hogy az asszimilációs hatékonyságot meg lehessen becsülni a felvétel lineáris fázisából, míg a hal még az expozíciós időszak elején van. Az ütemtervtől két főbb eltérés lehet: i. ha meghosszabbított felvételi fázist alkalmaznak a felvételi kinetika vizsgálása céljából, további mintavételi pontokra van szükség a felvételi fázisban, így további halakat kell a vizsgálatba bevonni (vö. 126. pont); ii. ha a vizsgálat a felvételi fázis végén nem mérhető felvétel miatt lezárul (vö. 131. pont). A mintába felvett halegyedek tömegét (és teljes hosszát) mérni kell, hogy meg lehessen határozni a növekedési sebességi állandókat. Az anyag konkrét halszövetben lévő koncentrációját is mérni lehet a felvétel végén és kiválasztott tisztulási időpontokban. Radioaktív jelöléssel ellátott anyagok vizsgálata esetén hasonló megfontolásokat kell mérlegelni, mint a vízi expozíciónál, de a víz analízisének helyébe a táp analízise lép (vö. 65. pont).
Referenciaanyagok időszakos alkalmazása esetén (vö. 25. pont) lehetőség szerint a koncentrációkat a vizsgálati csoportban a felvételi fázis végén és a vizsgálati anyag szempontjából meghatározott valamennyi tisztulási időpontban mérni kell (egész hal); a koncentrációkat a kontrollcsoportokban csak a felvétel végén kell analizálni (egész hal). Bizonyos körülmények között (például ha a vizsgálati anyagra és a referenciaanyagra vonatkozó analitikai módszerek nem összeegyeztethetők, és ezért további halakra lenne szükség a mintavételi ütemterv betartásához), más megközelítést lehet alkalmazni a következők szerint, a további szükséges halak számának minimálisra csökkentése érdekében. A referenciaanyag koncentrációit a tisztulás során csak az 1. és 3. napon és két további mintavételi pontban kell mérni, amelyeket úgy kell megválasztani, hogy a nulla időpillanati koncentráció (C 0,d) és a k 2 megbízhatóan becsülhető legyen a referenciaanyag tekintetében.
Ha lehetséges, az egyes halak lipidtartalmát minden mintavételi alkalommal, vagy legalább a felvételi fázis elején és végén, illetve a tisztulási fázis végén meg kell határozni (vö. 56. és 67. pont). Az analitikai módszertől függően (vö. 67. pont és 4. függelék), lehetőség van ugyanazt a halat használni a lipidtartalom és a vizsgálatianyag-koncentráció meghatározásához. Ez a halak számának minimálisra csökkentése miatt javasolt. Ugyanakkor, amennyiben ez nem lehetséges, a vízi expozíciós módszernél leírt megközelítés alkalmazható (lásd az 56. pontot ezen alternatív lipidmérési lehetőségek tekintetében). A lipidtartalom számszerűsítésére alkalmazott módszert dokumentálni kell a Vizsgálati jegyzőkönyvben.
Az analitikai módszer minősége
Kísérleti ellenőrzéseket kell végezni az anyagspecifikus analitikai módszer specifikusságának, pontosságának és utánozhatóságának, valamint a vizsgálati anyag tápból és halból való visszanyerésének biztosítására.
A halak növekedésének mérése
A vizsgálat kezdetén a törzsállományból vett halmintát kell lemérni tömeg (és teljes hossz) tekintetében. E halakat röviddel (pl. egy órával) azelőtt kell mintavételezni, hogy az első kiegészített tápot beadnák, és azokat a 0. kísérleti naphoz kell rendelni. A halak számának ebben a mintában legalább annyinak kell lennie, mint a vizsgálat során vett mintákban. Ezek némelyike megegyezhet a lipidanalízishez a felvételi fázis kezdete előtt használt halakkal (vö. 153. pont). Az egyes mintavételekkor a halak tömegét és hosszát meg kell mérni. Az egyes halak esetében a mért tömeget és hosszt össze kell kapcsolni az elemzett vegyi anyag koncentrációjával (és adott esetben a lipidtartalommal), például a mintába felvett egyes halakra alkalmazott egyedi azonosító kóddal. E mintába felvett halak mérései a vizsgálati és kontrolltartályokban maradó halak tömegének és hosszának becsléséhez használhatók.
A kísérlet értékelése
A mortalitást naponta meg kell figyelni és rögzíteni kell. Emellett a káros hatásokat is meg lehet figyelni, például az abnormális viselkedést vagy a pigmentációt; ezeket rögzíteni kell. A halak akkor tekinthetők élettelennek, ha nem látható semmilyen légzőmozgás és az enyhe mechanikus stimulációra sincs reakció. Az élettelen vagy egyértelműen elhullásközeli állapotban lévő halat el kell távolítani.
ADATOK ÉS JEGYZŐKÖNYVEZÉS
Eredmények feldolgozása
A vizsgálati eredményeket a tisztulási sebességi állandónak (k 2) a hal nedves össztömege függvényében történő kiszámítására használják. A növekedési sebességi állandót (k g) a hal tömege növekedésének átlaga alapján számítják ki, és abból adható meg a növekedéssel korrigált tisztulási sebességi állandó (k 2g) szükség esetén. Rögzíteni kell továbbá az asszimilációs hatékonyságot (aa bélből való felszívódást), a kinetikus biomagnifikációs tényezőt (BMFK) (szükség esetén a növekedéssel korrigálva, BMFKg), annak lipidtartalommal korrigált értékét (BMFKL vagy BMFKgL, ha a növekedés okozta hígulásra tekintettel korrigálják) és az etetési arányt. Emellett becsülhető a felvételi fázisban az állandósult állapot eléréséhez szükséges idő (pl. az állandósult állapot 95 %-a vagy t 95 = 3,0/k 2), és felvehető az állandósult állapoti BMF (BMFSS) (vö. 105. és 106. pont és az 5. függelék), ha a t 95 érték arra utal, hogy az állandósult állapot valószínűleg megvalósult. Ugyanazt a lipidkorrekciót kell alkalmazni erre a BMFSS-re, mint a kinetikailag származtatott BMF-re (BMFK) a lipidtartalommal korrigált érték (BMFSSL) megadása érdekében (figyelembe kell venni, hogy nincs elfogadott eljárás az állandósult állapoti BMF növekedés okozta hígulásra tekintettel történő korrigálására). Az e számításokkal kapcsolatos képletek és példák a 7. függelékben találhatók. Rendelkezésre állnak megközelítések a kinetikus biokoncentrációs tényező (BCFK) becslésére az étrendi vizsgálatból nyert adatok alapján. Ezt a 8. függelék tárgyalja.
A halak tömegére/hosszára vonatkozó adatok
A halegyedek nedves tömegét és hosszát minden időtartam tekintetében külön kell feltüntetni a táblázatban a vizsgálati és a kontrollcsoportok vonatkozásában, a felvételi fázis minden mintavételi napjára (a törzsállomány esetén a felvétel kezdetén; a kontrollcsoport és a vizsgálati csoport esetén a felvétel végén és – ha van ilyen mintavétel – a korai fázisban, azaz a felvétel 1–3. napján, továbbá a tisztulási fázisban, pl. az 1., 2., 4., 7., 14., 28. napon a kontroll- és vizsgálati csoport esetén). A növekedés és a növekedés okozta hígulás mérésére a tömeg az előnyben részesített mérték. Az adatok növekedés okozta hígulásra tekintettel történő korrigálásához használt módszer(eke)t lásd alább (162. és 163. pont) és az 5. függelékben.
A vizsgálati anyagok koncentrációja a halra vonatkozó adatokban
A halegyedekben (vagy összevont halmintákban, ha az egyedi mérés nem lehetséges) található vizsgálatianyag-maradékokra vonatkozó méréseket nedves tömeg koncentrációban (w/w) kifejezve kell táblázatba foglalni a vizsgálati és a kontrollhalak tekintetében az egyes mintavételi alkalmakra vonatkoztatva. Ha lipidanalízist is végeztek minden mintába felvett halon, az egyedi lipidtartalommal korrigált koncentrációkat lipidkoncentrációban (w/w lipid) kifejezve lehet származtatni és táblázatba foglalni.
— A halegyedekben (vagy összevont halmintákban, ha az egyedi mérés nem lehetséges, vö. 66. pont) mért vizsgálatianyag-maradékokat a tisztulási időszakban átváltják természetes alapú logaritmusaikra, és az idő függvényében (nap) ábrázolják. Ha az ábra szemmel láthatóan egyértelmű kiugró értékeket mutat, statisztikailag érvényes kiugróérték-tesztet lehet alkalmazni a hamis adatpontok törlésére, valamint ezek mellőzését indokolni kell.
— A ln(koncentráció)/tisztulás (nap) függvény adatai tekintetében legkisebb négyzetes lineáris korrelációt számítanak. Az egyenes meredekségét és metszését mint teljes tisztulási sebességi állandót (k 2) és a származtatott nulla időpillanati koncentráció (C 0,d) természetes alapú logaritmusát kell rögzíteni (vö. 5. függelék és 7. függelék a további adatok tekintetében). Amennyiben ez nem lehetséges, mivel a koncentrációk a második tisztulási mintában a meghatározási határ alatt vannak, elvégezhető a k 2 konzervatív becslése (vö. 7. függelék).
— Az egyenes meredekségének és metszésének szóródásait standard statisztikai eljárásokkal kell kiszámítani, valamint értékelni kell és be kell mutatni az ezen eredmények körüli 90 %-os (vagy 95 %-os) konfidencia-intervallumokat.
— Ki kell számítani a felvétel utolsó napja vonatkozásában a halban mért koncentráció átlagát is (mért nulla időpillanati koncentráció, C0,m), és azt össze kell hasonlítani a C0,dszármaztatott értékkel. Amennyiben a származtatott érték nem éri el a mért értéket, a különbség arra utalhat, hogy emésztetlen kiegészített táp található a bélben. Ha a származtatott érték sokkal magasabb, mint a mért érték, ez arra utalhat, hogy a tisztulási adatok lineáris regressziójából származtatott értékek hibásak és azokat újra kell értékelni (lásd a 7. függeléket).
Tisztulási sebesség és biomagnifikációs tényező
A biomagnifikációs tényező adatokból történő kiszámítása érdekében először is az asszimilációs hatékonyságot (a vizsgálati anyag bélből való felszívódását, α) kell meghatározni. Ehhez a 7. függelékben található A7.1. egyenletet kell használni, amelyhez ismerni kell a következő adatokat: a származtatott koncentráció a halban a tisztulási fázis nulla időpillanatában, a (teljes) tisztulási sebességi állandó (k 2), koncentráció a tápban (Cfood), a táplálékfelvételi sebességi állandó (I), továbbá a felvételi időszak tartama (t). Az ln (koncentráció) és a tisztulási idő közötti lineáris kapcsolat meredekségét és metszését mint teljes tisztulási sebességi állandót (k 2= meredekség) és a nulla időpillanati koncentrációt (C 0,d = eintercept) kell rögzíteni, a fentiek szerint. A származtatott értékeket ellenőrizni kell a biológiai elfogadhatóság szempontjából (pl. az asszimilációs együttható mint tört, nem lehet nagyobb 1-nél). Az (I)-t a táp tömegének és az egyes napokon etetett halak tömegének hányadosaként kell megadni (ha az etetés a testtömeg 2 %-ának megfelelő arányban történik, az (I) 0,02 lesz). Ugyanakkor szükség lehet arra, hogy a számításhoz használt etetési arányt a halak növekedéséhez igazítsák (ez elvégezhető úgy, hogy az ismert növekedési sebességi állandó felhasználásával becslik a halaknak a felvételi fázis egyes időpillanataira jellemző tömegét; vö. 7. függelék). Amennyiben k 2-t és C 0,d-t nem lehet származtatni, például mivel a koncentrációk a második tisztulási mintában a meghatározási határ alatt vannak, elvégezhető a k 2 és a BMFK»felső határának« konzervatív becslése (vö. 7. függelék).
Az asszimilációs hatékonyság (α) meghatározását követően a biomagnifikációs tényező kiszámítható úgy, hogy az α és a táplálékfelvételi sebességi állandó (I) szorzatát elosztják a (teljes) tisztulási sebességi állandóval (k 2). A növekedéssel korrigált biomagnifikációs tényezőt ugyanígy kell kiszámítani, de a növekedéssel korrigált tisztulási együtthatót kell használni (k 2g; vö. 162. és 163. pont). Az asszimilációs hatékonyság alternatív becslését akkor lehet származtatni, ha a felvételi fázis korai, lineáris szakaszában vett halmintán szövetanalízist végeztek; vö. 151. pont és 7. függelék. Ez az érték az asszimilációs hatékonyság független becslése egy lényegében expozícióval nem érintett szervezet esetében (azaz a halak a felvételi fázis elejéhez közel vannak). A tisztulási adatok alapján becsült asszimilációs hatékonyságot általában a BMF származtatására használják.
A lipidtartalomra és a növekedés okozta hígulásra tekintettel alkalmazott korrekció
A halak tisztulási fázisban bekövetkezett növekedése csökkentheti a halban mért vegyianyag-koncentrációt, ezáltal a teljes tisztulási sebességi állandó (k2 ) magasabb lesz, mint ami csak a kiválasztási folyamatokból (pl. anyagcsere, kiürítés) eredne (vö. 72. pont). A vizsgálati halak lipidtartalma (amely nagymértékben összefügg a víztaszító anyagok bioakkumulációjával), valamint a táp lipidtartalma a gyakorlatban kellően változékony ahhoz, hogy korrekcióra legyen szükség annak érdekében, hogy a biomagnifikációs tényezőket hasznosan lehessen bemutatni. A biomagnifikációs tényezőt korrigálni kell a növekedés okozta hígulásra tekintettel (mint a kinetikus BCF-et a vízi expozíciós módszernél), továbbá korrigálni kell a tápnak a hal lipidtartalmához viszonyított lipidtartalma vonatkozásában (lipidkorrekciós tényező). Az e számításokkal kapcsolatos egyenletek és példák az 5., illetve a 7. függelékben találhatók.
A növekedés okozta hígulásra tekintettel történő korrekcióhoz ki kell számítani a növekedéssel korrigált tisztulási sebességi állandót (k 2g) (az egyenletek tekintetében lásd az 5. függeléket). Ezt a növekedéssel korrigált tisztulási sebességi állandót (k 2g) kell használni a növekedéssel korrigált biomagnifikációs tényező kiszámításához, mint a 73. pontban. Egyes esetekben ez a megközelítés nem alkalmazható. A növekedés okozta hígulásra tekintettel végzett korrekciót szükségtelenné tevő alternatív megközelítés a vizsgálati anyag halankénti (egész halra vetített) tömegét tükröző tisztulási adatokat alkalmazza, szemben a szokásos, a vizsgálati anyagnak a hal egységnyi tömegéhez viszonyított tömegére (koncentrációra) vonatkozó adatokkal. Ez könnyen elérhető adat, mivel az e vizsgálati módszer szerinti vizsgálatoknak a feljegyzett szöveti koncentrációkat az egyes halak tömegéhez kell kapcsolniuk. Az erre szolgáló egyszerű eljárást az 5. függelék ismerteti. Meg kell jegyezni, hogy a k 2-t akkor is becsülni kell és fel kell tüntetni a Vizsgálati jegyzőkönyvben, ha ezt az alternatív megközelítést alkalmazzák.
A hal és a táp lipidtartalmára tekintettel végzett korrekcióhoz, ha nem végeztek lipidanalízist valamennyi mintavételezett halon, a halban és a tápban lévő lipidfrakciók (w/w) átlagát származtatni kell ( 44 ). A lipidkorrekciós tényezőt (Lc ) ezt követően úgy kell kiszámítani, hogy a halak lipidfrakciójának átlagát el kell osztani a táp lipidfrakciójának átlagával. A lipidtartalommal korrigált biomagnifikációs tényező kiszámításához a növekedéssel korrigált vagy adott esetben nem korrigált biomagnifikációs tényezőt el kell osztani a lipidkorrekciós tényezővel.
Ha a kémiai és a lipidanalízist ugyanazon a halon végezték el mindegyik mintavételi ponton, akkor az adott halra vonatkozó, egyedi, a lipidtartalom tekintetében korrigált szöveti adatokat kell felhasználni a lipidtartalom szempontjából korrigált BMF közvetlen kiszámításához (vö. (37)). A lipidtartalomra tekintettel korrigált koncentrációs adatok ábrája megmutatja a lipid alapú C 0,d-t és a k 2-t. Ekkor matematikai elemzést lehet végezni a 7. függelék ugyanazon egyenleteivel, de az asszimilációs hatékonyságot (a) a lipidtartalom tekintetében normalizált táplálékfelvételi sebességi állandó (I lipid) és a lipidalapú étrendi koncentráció (C food-lipid) felhasználásával kell kiszámítani. A lipiddel korrigált paramétereket ezt követően ugyanúgy felhasználják a BMF kiszámítására (meg kell jegyezni, hogy a növekedési sebességi állandóval való korrekciót a lipidfrakcióra kell alkalmazni és nem a hal nedves tömegére a lipidtartalommal és a növekedéssel korrigált BMFKgL kiszámításához).
Az eredmények kiértékelése
A vizsgálati és a kontrollcsoportban megfigyelt átlagos növekedés elvben nem lehet nagymértékben különböző, hogy a toxikus hatások kizárhatók legyenek. A két csoport növekedési sebességi állandóit vagy növekedési görbéit megfelelő eljárással össze kell hasonlítani ( 45 )).
Vizsgálati jegyzőkönyv
A vizsgálat végeztével végleges jelentés készül, amely tartalmazza a vizsgálati anyaggal, a vizsgálati fajokkal és a vizsgálati körülményekkel kapcsolatos, a 81. pontban felsorolt információkat (mint a vízi expozíciós módszer esetében). Ezek mellett az alábbi információt kell megadni:
Vizsgálati anyag:
— a vizsgálati anyag stabilitása az elkészített tápban.
Vizsgálati körülmények:
— Az anyag névleges koncentrációja a tápban, tápkiegészítési technika, a tápkiegészítési eljárásban használt (lipid) vivőanyag mennyisége (ha alkalmaztak ilyet), a mért vizsgálatianyag-koncentráció a kiegészített tápban minden egyes analízis tekintetében (legalább három példányban a vizsgálat megkezdése előtt és a felvétel végén), valamint az átlagértékek.
— Ha alkalmaztak ilyet, a táp kiegészítéséhez használt olaj vagy oldószer hordozóanyag típusa és minősége (besorolás, beszállító stb.).
— Az alkalmazott táp típusa (a felépítésben részt vevő anyag elemzése ( 46 ), besorolás vagy minőség, beszállító stb.), az etetési arány a felvételi fázisban, a beadott táp mennyisége és gyakorisága (ideértve bármely kiigazítást a mintavételezett hal tömege alapján).
— A halak kémiai analízis céljából való begyűjtésének és leölésének időpontja minden mintavételi ponton (pl. egy órával a következő napi etetés előtt).
Eredmények:
— Minden elvégzett előzetes vizsgálat eredménye.
— Minden megfigyelt káros hatás leírása.
— A kémiai analízis valamennyi alkalmazott eljárásának leírása, ideértve az érzékelési határt és a meghatározási határt, a variabilitást és a visszanyerést.
— A tápban (kiegészített és kontrolltáp) mért lipidkoncentráció, egyedi és átlagértékek, valamint szórás.
— A hal tömegével (és hosszával) kapcsolatos adatok táblázatos formában, amelyeket összekapcsolnak a halegyedekkel mind a kontroll-, mind a kitett csoportban (például a mintába felvett egyes halakra egyedi azonosító alkalmazásával), és a számítások, a származtatott növekedési sebességi állandó(k) és 95 %-os konfidencia-intervallum(ok).
— A halban lévő vizsgálatianyag-koncentráció táblázatos formában, a mért átlagkoncentráció a felvétel végén (C 0,m), a származtatott (teljes) tisztulási sebességi állandó (k 2) és a halban lévő koncentráció a tisztulási fázis kezdetén (C 0,d), ezen értékek szóródásaival együtt (meredekség és metszés).
— A hal lipidtartalmával kapcsolatos adatok táblázatos formában (adott esetben a konkrét anyagkoncentrációkhoz hasonlítva), a vizsgálati csoportra és a kontrollcsoportra vonatkozó átlagértékek a vizsgálat kezdetén, a felvétel végén és a tisztulás végén.
— Görbék (ideértve valamennyi mért adatot), amelyek a következőket mutatják be (adott esetben a koncentrációt az állat egész testéhez vagy konkrét szöveteihez viszonyítva is ki lehet fejezni):
—
— növekedés, (azaz a hal tömege és hossza az idő függvényében), vagy a természetes alapú logaritmussá alakított tömeg az idő függvényében;
— a vizsgálati anyag halban megfigyelt tisztulása; valamint
— természetes alapú logaritmussá alakított koncentráció (ln koncentráció) a tisztulási idő függvényében (ideértve a származtatott tisztulási sebességi állandót, k 2, és a halban a tisztulási fázis kezdetén jellemző, származtatott koncentráció természetes alapú logaritmusát C 0,d).
— Ha az ábra szemmel láthatóan egyértelmű kiugró értékeket mutat, statisztikailag érvényes kiugróérték-tesztet lehet alkalmazni a hamis adatpontok törlésére, valamint ezek mellőzését indokolni kell.
— Számított, növekedéssel korrigált tisztulási sebességi állandó és növekedéssel korrigált felezési idő.
— Számított asszimilációs hatékonyság (α).
— »Nyers« étrendi BMF, lipidtartalommal és növekedés okozta hígulásra tekintettel korrigált kinetikus BMF (»nyers« és lipidtartalommal korrigált az egész hal nedves tömege alapján), szövetspecifikus BMF adott esetben.
— A radioaktív jelöléssel ellátott vizsgálati anyagok metabolitjaira és felhalmozódásukra vonatkozó információ.
— Bármi szokatlan dolog a vizsgálattal kapcsolatban, bármilyen eltérés ezektől az eljárásoktól, és bármely más vonatkozó információ.
— A releváns mért és számított adatok összefoglaló táblázata az alábbiakban látható:
—
|
Az anyag tisztulási sebességi állandói és biomagnifikációs tényezők (BMFK) |
|
|
k g (növekedési sebességi állandó; nap– 1): |
Írja be az értéket (95 % KI) (1) |
|
k 2 (teljes tisztulási sebességi állandó; nap– 1): |
Írja be az értéket (95 % KI) |
|
k 2g (növekedéssel korrigált tisztulási sebességi állandó; nap– 1): |
Írja be az értéket (95 % KI) (1) |
|
C0,m (mért nulla időpillanati koncentráció, koncentráció a halban a felvétel végén) (μg/g): |
Írja be az értéket ± SD (2) |
|
C 0,d (a tisztulási fázis származtatott nulla időpillanati koncentrációja) (μg/g): |
Írja be az értéket ± SD (2) |
|
I (meghatározott táplálékfelvételi sebesség; g táp/g hal/nap): |
Írja be az értéket |
|
I g (tényleges etetési arány, növekedés tekintetében kiigazítva; g táp/g hal/nap) (2): |
Írja be az értéket ± SD (2) |
|
C food (vegyianyag-koncentráció a tápban; μg/g): |
Írja be az értéket ± SD (2) |
|
α (az anyag asszimilációs hatékonysága): |
Írja be az értéket ± SD (2) |
|
BMFK (kinetikus étrendi BMF): |
Írja be az értéket (95 % KI) (1) |
|
BMFKg (növekedéssel korrigált kinetikus étrendi BMF): |
Írja be az értéket (95 % KI) (1) |
|
t 1/2g (növekedéssel korrigált felezési idő napokban): |
Írja be az értéket ± SD (2) |
|
Lc (lipidkorrekciós tényező): |
Írja be az értéket |
|
BMFKgL (lipidtartalommal és növekedéssel korrigált kinetikus BMF): |
Írja be az értéket |
|
BMFSS-L (indikatív, lipidtartalommal korrigált állandósult állapoti BMF) (2): |
Írja be az értéket ± SD (2) |
|
(1) KI: konfidencia-intervallum (ha meg lehet becsülni) (2) SD: szórás (ha meg lehet becsülni) |
|
SZAKIRODALOM
(1) E melléklet C.13., Bioakkumuláció halakban: Vízi vagy étrendi expozíció című fejezete.
(2) E melléklet A.6., Oldhatóság vízben című fejezete
(3) Li A, Doucette W.J. (1993), The effect of cosolutes on the aqueous solubilities and octanol/water partition coefficients of selected polychlorinated biphenyl congeners. Environ Toxicol Chem 12: 2031-2035
(4) E melléklet A.8., Megoszlási hányados (n-oktanol/víz): Lombikrázásos módszer című fejezete.
(5) E melléklet A.24., Megoszlási hányados (n-oktanol/víz), HPLC módszer című fejezete.
(6) E melléklet A.23., Megoszlási hányados (1-Oktanol/víz): Lassú keveréses módszer című fejezete.
(7) E melléklet C.7., Hidrolízis a ph függvényében című fejezete.
(8) (OECD (1997), OECD Environmental Health and Safety Publications Series on Testing and Assessment Number 7: Guidance Document on Direct Phototransformation of Chemicals in Water OCDE/GD(97)21. Organisation for Economic Co-operation and Development (OECD), Paris, France.
(9) E melléklet A.5., Felületi feszültség című fejezete.
(10) E melléklet A.4., Gőznyomás című fejezete.
(11) E melléklet C.4., A „gyors” biológiai lebonthatóság meghatározása című fejezete.
(12) E melléklet C.29., Gyors biológiai lebonthatóság: szén-dioxid-vizsgálat légmentesen zárt edényekben című fejezete
(13) Connell D.W. (1988), Bioaccumulation behaviour of persistent chemicals with aquatic organisms. Rev. Environ. Contam. Toxicol. 102: 117-156.
(14) Bintein S., Devillers J. and Karcher W. (1993), Nonlinear dependence of fish bioconcentration on n-octanol/water partition coefficient. SAR QSAR Environ. Res. 1: 29-39.
(15) OECD (2011), QSAR Toolbox 2.1. February 2011. Available from: http://www.oecd.org/document/54/0,3746,en_2649_34379_42923638_1_1_1_1,00.html.
(16) Brown R.S., Akhtar P., Åkerman J., Hampel L., Kozin I.S., Villerius L.A. and Klamer H.J.C. (2001), Partition controlled delivery of hydrophobic substances in toxicity tests using poly(dimethylsiloxane) (PDMS) films. Environ. Sci. Technol. 35: 4097-4102.
(17) Fernandez J.D., Denny J.S. and Tietge J.E. (1998), A simple apparatus for administering 2,3,7,8-tetrachlorodibenzo-p-dioxin to commercially available pelletized fish food. Environ. Toxicol. Chem. 17: 2058-2062.
(18) Nichols J.W., Fitzsimmons P.N., Whiteman F.W. and Dawson T.D. (2004), A physiologically based toxicokinetic model for dietary uptake of hydrophobic organic compounds by fish: I. Feeding studies with 2,2′, 5,5′-tetrachlorobiphenyl. Toxicol. Sci. 77: 206-218.
(19) Parkerton T.F., Arnot J.A., Weisbrod A.V., Russom C., Hoke R.A., Woodburn K., Traas T., Bonnell M., Burkhard L.P. and Lampi M.A. (2008), Guidance for evaluating in vivo fish bioaccumulation data. Integr. Environ. Assess. Manag. 4: 139-155.
(20) Verbruggen E.M.J., Beek M., Pijnenburg J. and Traas T.P. (2008). Ecotoxicological environmental risk limits for total petroleum hydrocarbons on the basis of internal lipid concentrations. Environ. Toxicol. Chem. 27: 2436-2448.
(21) Schlechtriem C., Fliedner A. and Schäfers C. (2012), Determination of lipid content in fish samples from bioaccumulation studies: Contributions to the revision of OECD Test Guideline 305. Environmental Sciences Europe 2012, 24:13. published: 3 April 2012.
(22) E melléklet C.47., A halak korai életszakaszára vonatkozó toxicitási vizsgálat című fejezete.
(23) E melléklet C.15., Rövid távú toxicitási vizsgálat halembriókkal és hallárvákkal című fejezete
(24) E melléklet C.14., Halivadékok növekedési vizsgálata című fejezete.
(25) OECD (2000), OECD Environmental Health and Safety Publications Series on Testing and Assessment No. 23: Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures ENV/JM/MONO(2000)6. Organisation for Economic Co-operation and Development (OECD), Paris, France.
(26) US-EPA (1994), Great Lake water quality initiative technical support document for the procedure to determine bioaccumulation factors 822-R-94-002. US EPA, Office of Water, Office of Science and Technology, Washington, DC, USA.
(27) US-FDA (1999), Pesticide analytical manual (PAM). Vol.1. US Food and Drug Administration, Rockville, MD, USA.
(28) US-EPA (1974), Section 5, A (1) Analysis of Human or Animal Adipose Tissue, in Analysis of Pesticide Residues in Human and Environmental Samples, Thompson, J.F., Editor. US-EPA, Research Triangle Park, NC, USA
(29) Bligh E.G. and Dyer W.J. (1959), A rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol. 37: 911-917.
(30) Gardner W.S., Frez W.A., Cichocki E.A. and Parrish C.C. (1985), Micromethod for lipids in aquatic invertebrates. Limnol. Oceanogr. 30: 1099-1105.
(31) Smedes F. (1999), Determination of total lipid using non-chlorinated solvents. Analyst. 124: 1711-1718.
(32) OECD (2006), OECD Environmental Health and Safety Publications Series on Testing and Assessment No. 54: Current approaches in the statistical analysis of ecotoxicity data: a guidance to application. ENV/JM/MONO(2006)18. Organisation for Economic Co-operation and Development (OECD), Paris, France.
(33) Springer T.A., Guiney P.D., Krueger H.O. and Jaber M.J. (2008), Assessment of an approach to estimating aquatic bioconcentration factors using reduced sampling. Environ. Toxicol. Chem. 27: 2271-2280.
(34) Springer T.A. (2009), Statistical Research Related to Update of OECD Guideline 305. Wildlife International, Ltd, Easton, MD, USA.
(35) Arnot J.A., Meylan W., Tunkel J., Howard P.H., Mackay D., Bonnell M. and Boethling R.S. (2009), A quantitative structure-activity relationship for predicting metabolic biotransformation rates for organic chemicals in fish. Environ. Toxicol. Chem. 28: 1168-1177.
(36) Parkerton T., Letinski D., Febbo E., Davi R., Dzambia C., Connelly M., Christensen K. and Peterson D. (2001), A practical testing approach for assessing bioaccumulation potential of poorly water soluble organic chemicals (presentation). in SETAC Europe 12th Annual Meeting: Madrid, Spain.
(37) Fisk A.T., Cymbalisty C.D., Bergman Ã. and Muir D.C.G. (1996), Dietary accumulation of C12- and C16-chlorinated alkanes by juvenile rainbow trout (Oncorhynchus mykiss). Environ. Toxicol. Chem. 15: 1775-1782.
(38) Anonymous (2004), Fish, dietary bioaccumulation study – Basic protocol, document submitted to the TC-NES WG on PBT.
(39) Anonymous (2004), Background document to the fish dietary study protocol, document submitted to the TC-NES WG on PBT.
(40) Bruggeman W.A., Opperhuizen A., Wijbenga A. and Hutzinger O. (1984), Bioaccumulation of super-lipophilic chemicals in fish, Toxicol. Environ. Chem. 7: 173-189.
(41) Muir D.C.G., Marshall W.K. and Webster G.R.B. (1985), Bioconcentration of PCDDs by fish: effects of molecular structure and water chemistry. Chemosphere. 14: 829-833.
(42) Thomann R.V. (1989), Bioaccumulation model of organic chemical distribution in aquatic food chains. Environ. Sci. Technol. 23: 699-707.
(43) Nichols J.W., Fitzsimmons P.N. and Whiteman F.W. (2004), A physiologically based toxicokinetic model for dietary uptake of hydrophobic organic compounds by fish: II. Stimulation of chronic exposure scenarios. Toxicol. Sci. 77: 219-229.
(44) Gobas F.A.P.C., de Wolf W., Burkhard L.P., Verbruggen E. and Plotzke K. (2009), Revisiting bioaccumulation criteria for POPs and PBT assessments. Integr. Environ. Assess. Manag. 5: 624-637.
(45) Sijm D.T.H.M. and van der Linde A. (1995), Size-dependent bioconcentration kinetics of hydrophobic organic chemicals in fish based on diffusive mass transfer and allometric relationships. Environ. Sci. Technol. 29: 2769-2777.
(46) Sijm D.T.H.M., Verberne M.E., de Jonge W.J., Pärt P. and Opperhuizen A. (1995), Allometry in the uptake of hydrophobic chemicals determined in vivo and in isolated perfused gills. Toxicol. Appl. Pharmacol. 131: 130-135.
(47) Fisk A.T., Norstrom R.J., Cymbalisty C.D. and Muir D.G.G. (1998), Dietary accumulation and depuration of hydrophobic organochlorines: Bioaccumulation parameters and their relationship with the octanol/water partition coefficient. Environ. Toxicol. Chem. 17: 951-961.
(48) McGrath J.A., Parkerton T.F. and Di Toro D.M. (2004), Application of the narcosis target lipid model to algal toxicity and deriving predicted-no-effect concentrations. Environ. Toxicol. Chem. 23: 2503-2517.
(49) Poppendieck D.G. (2002), Polycyclic Aromatic Hydrocarbon Desorption Mechanisms from Manufactured Gas Plant Site Samples. Dissertation. Department of Civil, Architectural and Environmental Engineering, University of Texas, Austin, TX, USA.
(50) McCarty L.S. and Mackay D. (1993), Enhancing ecotoxicological modelling and assessment: body residues and modes of toxic action. Environ. Sci. Technol. 27: 1718-1728.
(51) OECD (2012), OECD Environmental Health and Safety Publications Series on Testing and Assessment No. 175: Part I – Validation Report of a ring test for the OECD TG 305 dietary exposure bioaccumulation fish test. Part II – Additional Report including comparative analysis of trout and carp results ENV/JM/MONO(2012)20. Organisation for Economic Co-operation and Development (OECD), Paris, France.
1. függelék
FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
Asszimilációs hatékonyság (α): a bélből a szervezetbe felszívódott anyag relatív mennyisége (az α-nak nincs mértékegysége, de gyakran százalékos arányban fejezik ki és nem törtként).
Bioakkumuláció: általában olyan folyamatként hivatkoznak rá, amelyben az anyag egy adott szervezetbeli koncentrációja olyan szintet ér el, amely meghaladja a légzés közegében (pl. a halak esetében a vízben, az emlősök esetében a levegőben), az étrendben vagy mindkettőben található koncentrációt (1).
A biokoncentráció a vizsgálati anyag koncentrációjának növekedése egy szervezetben/szervezeten (meghatározott szöveteiben/szövetein) a vizsgálati anyagnak a környező közegben lévő koncentrációjához viszonyítva.
A biokoncentrációs tényező (BCF, vagy KB) az akkumulációs vizsgálat felvételi fázisának bármely időpontjában a vizsgálati anyag halban/halon, vagy meghatározott szöveteiben/szövetein lévő koncentrációjának (Cf, mg/g) és az anyag környező közegben lévő koncentrációjának (Cw, mg/l) a hányadosa. A BCF-et l kg-1-ben kell kifejezni. Kérjük, tartsa szem előtt, hogy a növekedésre tekintettel történő korrekció és/vagy standard lipidtartalom itt nem jön figyelembe.
A biomagnifikáció a vizsgálati anyag koncentrációjának növekedése egy szervezetben/szervezeten (meghatározott szöveteiben/szövetein) a vizsgálati anyagnak a tápban lévő koncentrációjához viszonyítva.
A biomagnifikációs tényező (BMF) az anyag koncentrációja a ragadozóban a ragadozó zsákmányában (vagy táplálékában) található állandósult állapoti koncentrációhoz viszonyítva. Az e vizsgálati módszerben bemutatott módszerben a vizes fázisú expozíciót gondosan kerülik, így az e vizsgálati módszerből adódó BMF érték közvetlenül nem hasonlítható össze a terepvizsgálat során nyert BMF értékkel (ahol kombinálható a vízi és az étrendi expozíció).
Az étrendi biomagnifikációs tényező (étrendi BMF) az e vizsgálati módszerben az étrendi expozíciós vizsgálat eredményének leírására használt kifejezés, amely vizsgálatban a vizes fázisú expozíciót gondosan kerülik, így az e vizsgálati módszerből adódó BMF érték közvetlenül nem hasonlítható össze a terepvizsgálat során nyert BMF értékkel (ahol kombinálható a vízi és az étrendi expozíció).
A tisztulási vagy expozíció utáni (ürülési) fázis az az időtartam a vizsgálati halnak a vizsgálati anyagot tartalmazó közegből az anyagot nem tartalmazó közegbe történő áthelyezését követően, amelynek során az anyag vizsgálati halból (vagy meghatározott szövetéből) történő tisztulását (vagy nettó ürülését) figyelemmel kísérik.
A tisztulási (ürülési) sebességi állandó (k 2) a vizsgálati anyag koncentrációjának a vizsgálati halban (vagy meghatározott szöveteiben) való csökkenési sebességét definiáló numerikus érték, a vizsgálati halnak a vizsgálati anyagot tartalmazó közegből az anyagot nem tartalmazó közegbe való áthelyezését követően (a k 2-t nap-1-ben fejezik ki).
Oldott szerves szén (DOC) a vizsgálati közegekben található oldott szerves forrásokból eredő szénkoncentráció mértéke.
Az expozíciós vagy felvételi fázis az az időtartam, amíg a hal érintkezik a vizsgálati anyaggal.
A táplálékfelvételi sebesség (I) az egyes halak által naponta elfogyasztott táp átlagos mennyisége a halak becsült átlagos teljes testtömegéhez viszonyítva (g táp/g hal/napban kifejezve).
A kinetikus biokoncentrációs tényező (BCFK) a felvételi sebességi állandó (k 1) tisztulási sebességi állandóhoz (k 2) viszonyított aránya (azaz k 1/k 2 – a megfelelő meghatározásokat lásd ebben a függelékben). Elvben ennek az értéknek összehasonlíthatónak kellene lennie a BCFSS-szel (a meghatározást lásd fent), de eltérések fordulhatnak elő, ha az állandósult állapot bizonytalan volt, vagy ha a kinetikus BCF-et növekedéssel korrigálták.
A lipidtartalom tekintetében normalizált kinetikus biokoncentrációs tényező (BCFKL) az 5 %-os lipidtartalmú hal tekintetében normalizált tényező.
A lipidtartalom tekintetében normalizált, növekedéssel korrigált kinetikus biokoncentrációs tényező (BCFKgL) a vizsgálat során az 5 %-os lipidtartalmú hal tekintetében normalizált, növekedéssel korrigált tényező, az 5. függelékben leírtak szerint.
A lipidtartalom tekintetében normalizált állandósult állapoti biokoncentrációs tényező (BCFSSL) az 5 %-os lipidtartalmú hal tekintetében normalizált tényező.
Több összetevőből álló anyag a REACH alkalmazásában olyan anyag, amelyben egynél több fő alkotóelem van jelen 10–80 % (w/w) koncentrációban.
Az oktanol-víz megoszlási együttható (KOW) az anyag n-oktanolban és vízben, egyensúlyban mért oldhatóságának aránya (A.8. (2), A.24. (3), A.23. (4)módszer); POW-vel is jelölik. Az anyag vízi szervezetekbeli biokoncentrációs potenciálja jelzésére a KOW logaritmusát használják.
Szemcsés szerves szén (POC) a vizsgálati közegekben található szuszpendált szerves forrásokból eredő szénkoncentráció mértéke.
Szilárd fázisú mikroextrakció (SPME) oldószermentes analitikai módszer, amelyet a hígítási rendszerekhez fejlesztettek ki. E módszer keretében a polimerrel bevont rostot a vizsgálandó analitot tartalmazó gáz- vagy folyadékfázisnak teszik ki. Általában egy minimális analitikai időt írnak elő, hogy a szilárd és folyékony fázisok között egyensúly alakuljon ki, tekintettel a mérendő fajokra. Ezt követően a vizsgálandó analit koncentrációja a meghatározási módszertől függően meghatározható közvetlenül a rostból, vagy miután azt a rostból egy oldószerbe kivonták.
Állandósult állapot látható a halban található vizsgálati anyag (C f) időfüggő ábráján, amikor a görbe párhuzamos az időtengellyel, és a C f három egymást követő, legalább két nap különbséggel vett mintán alapuló elemzése ± 20 %-on belül van egymáshoz képest, és a C f jelentős időbeli növekedése nem tapasztalható az első és az utolsó sorozatos elemzés között. Összevont minták analízisénél legalább négy egymást követő analízis szükséges. Olyan vizsgálati anyagoknál, amelyek felvétele lassú, megfelelőbbek a hétnapos időközök.
Az állandósult állapoti biokoncentrációs tényező (BCFSS) nem változik jelentősen egy hosszabb időtartam során, amely alatt a vizsgálati anyag koncentrációja állandó a környező közegben (vö. az állandósult állapot meghatározásával).
Teljes szervesszén-tartalom (TOC) a vizsgálati közegben található valamennyi szerves forrásból, ideértve a szemcsés és az oldott forrásokat, eredő szénkoncentráció mértéke.
A felvételi sebességi állandó (k 1) a vizsgálati anyag – halban/halon (vagy meghatározott szöveteiben/szövetein) lévő – koncentrációjának az expozíciós idő alatti növekedési sebességét definiáló numerikus érték (a k 1-et l kg-1 nap-1-ben fejezik ki).
Az ismeretlen szerkezetű vagy változó összetételű, összetett reakcióban keletkezett vagy biológiai eredetű anyagok UVCB-ként ismertek.
Vegyi anyag: anyag vagy keverék.
Vizsgálati vegyi anyag: e vizsgálati módszer alkalmazásával vizsgált anyag vagy keverék.
SZAKIRODALOM
(1) Gobas F.A.P.C., de Wolf W., Burkhard L.P., Verbruggen E. and Plotzke K. (2009), Revisiting bioaccumulation criteria for POPs and PBT assessments. Integr. Mol. Assess. Manag. 5: 624-637.
(2) E melléklet A.8. fejezete: Megoszlási együttható (n-oktanol/víz) Lombikrázásos módszer
(3) E melléklet A.24. fejezete: Megoszlási együttható (n-oktanol/víz), HPLC módszer
(4) E melléket A.23. fejezete: Megoszlási együttható (1-oktanol/víz) Lassú keveréses módszer.
2. függelék
AZ ELFOGADHATÓ MINŐSÉGŰ HÍGÍTÓVÍZ NÉHÁNY FONTOSABB KÉMIAI TULAJDONSÁGA
|
Összetevő |
Határkoncentráció |
|
Finomszemcsés anyag |
5 mg/l |
|
Összes szerves szén |
2 mg/l |
|
Nem ionizált ammónia |
1 μg/l |
|
Maradék klór |
10 μg/l |
|
Szerves foszfort tartalmazó peszticidek |
50 ng/l |
|
Szerves klórtartalmú peszticidek + poliklórozott bifenilek összesen |
50 ng/l |
|
Összes szerves klór |
25 ng/l |
|
Alumínium |
1 μg/l |
|
Arzén |
1 μg/l |
|
Króm |
1 μg/l |
|
Kobalt |
1 μg/l |
|
Réz |
1 μg/l |
|
Vas |
1 μg/l |
|
Ólom |
1 μg/l |
|
Nikkel |
1 μg/l |
|
Cink |
1 μg/l |
|
Kadmium |
100 ng/l |
|
Higany |
100 ng/l |
|
Ezüst |
100 ng/l |
3. függelék
VIZSGÁLATHOZ AJÁNLOTT HALFAJOK
|
Ajánlott fajok |
Ajánlott vizsgálatihőmérséklet-tartomány (°C) |
Vizsgálati állat ajánlott teljes hossza (cm) (2) |
|
Danio rerio (1) (Teleostei, Cyprinidae) (Hamilton-Buchanan) Zebradánió |
20 – 25 |
3,0 ± 0,5 |
|
Pimephales promelas (Teleostei, Cyprinidae) (Rafinesque) Amerikai cselle |
20 – 25 |
5,0 ± 2,0 |
|
Cyprinus carpio (Teleostei, Cyprinidae) (Linnaeus) Ponty |
20 – 25 |
8,0 – 4,0 (3) |
|
Oryzias latipes (Teleostei, Poecilliidae) (Temminck and Schlegel) Japán rizshal |
20 – 25 |
4,0 ± 1,0 |
|
Poecilia reticulata (Teleostei, Poecilliidae) (Peters) Szivárványos guppi |
20 – 25 |
3,0 ± 1,0 |
|
Lepomis macrochirus (Teleostei Centrarchidae) (Rafinesque) Kékkopoltyús naphal |
20 – 25 |
5,0 ± 2,0 |
|
Oncorhynchus mykiss (Teleostei Salmonidae) (Walbaum) Szivárványos pisztráng |
13 – 17 |
8,0 ± 4,0 |
|
Gasterosteus aculeatus (Teleostei, (Gasterosteidae) (Linnaeus) Tüskés pikó |
18 – 20 |
3,0 ± 1,0 |
|
(1) Meyer et al. (1) (2) Meg kell jegyezni, hogy magában a vizsgálatban a méret és a növekedési sebességi állandók származékainak megállapításához szükséges előnyben részesített mérték a tömeg. Elismert ugyanakkor, hogy a hossz praktikusabb, ha a halakat látvány alapján kell kiválasztani a kísérlet elején (azaz a törzsállományból). (3) Ezt a hossztartományt az új vegyi anyagok stb. japán vegyianyag-ellenőrzési törvényen alapuló vizsgálati módszerei tüntetik fel. |
||
Különböző torkolati és tengeri fajok kevésbé széles körben használtak, például:
|
Pettyes árnyékhal |
(Leiostomus xanthurus) |
|
Tarka fogasponty |
(Cyprinodon variegatus) |
|
Atlanti ezüstösoldalú hal |
(Menidia beryllina) |
|
Shiner perch |
(Cymatogaster aggregata) |
|
English sole |
(Parophrys vetulus) |
|
Staghorn sculpin |
(Leptocottus armatus) |
|
Tüskés pikó |
(Gasterosteus aculeatus) |
|
Farkassügér |
(Dicentracus labrax) |
|
Szélhajtó küsz |
(Alburnus alburnus) |
A táblázatban felsorolt édesvízi halak könnyen tenyészthetők, és/vagy könnyen beszerezhetők egész évben, míg a tengeri és torkolati fajok beszerezhetősége részben bizonyos országokra korlátozódik. A fent felsorolt halfajok halastóban vagy laboratóriumban is (betegségek és paraziták szempontjából ellenőrzött körülmények között) tenyészthetők, így a vizsgálati állatok egészségesek lesznek és származásuk ismert lesz. Ezek a halak a világ sok részében beszerezhetők.
SZAKIRODALOM
(1) Meyer A., Biermann C.H. and Orti G. (1993), The phylogenetic position of the zebrafish (Danio rerio), a model system in developmental biology: An invitation to the comparative method Proc. R. Soc. Lond. B. 252: 231-236.
4. függelék
MINTAVÉTELI ÜTEMTERVEK A VÍZI ÉS AZ ÉTRENDI EXPOZÍCIÓS VIZSGÁLATHOZ
1. Elméleti példa teljes vízi expozíciós biokoncentrációs vizsgálat mintavételi ütemtervére log KOW = 4 anyagok esetében
|
Halak mintavételezése |
Mintavétel ütemezése |
Vízminták száma (1) |
Halak száma mintánként (1) |
|
|
Minimálisan megkövetelt gyakoriság (nap) (2) |
További mintavétel (nap) (2) |
|||
|
Felvételi fázis |
|
|
|
|
|
1 |
– 1 |
|
2 (3) |
4 (4) |
|
|
0 |
|
(2) |
(3 (6)) |
|
2 |
0,3 |
|
2 |
4 |
|
|
|
0,4 |
(2) |
(4) |
|
3 |
0,6 |
|
2 |
4 |
|
|
|
0,9 |
(2) |
(4) |
|
4 |
1,2 |
|
2 |
4 |
|
|
|
1,7 |
(2) |
(4) |
|
5 |
2,4 |
|
2 |
4 |
|
|
|
3,3 |
(2) |
(4) |
|
6 |
4,7 |
|
2 |
4 – 8 (5) |
|
|
|
|
|
(3 (6)) |
|
Tisztulási fázis |
|
|
|
Halak áthelyezése vizsgálati vegyi anyagtól mentes vízbe |
|
7 |
5,0 |
|
2 |
4 |
|
|
|
5,3 |
|
(4) |
|
8 |
5,9 |
|
2 |
4 |
|
|
|
7,0 |
|
(4) |
|
9 |
9,3 |
|
2 |
4 |
|
|
|
11,2 |
|
(4) |
|
10 |
14,0 |
|
2 |
4 – 8 (5) |
|
|
|
17,5 |
|
(4 + 3 (6)) |
|
ÖSSZESEN |
|
|
|
40 – 72 (48 – 80) (5) |
|
(1) A zárójeles értékek a minták (víz, hal) számát jelentik, amennyiben járulékos mintavételezés történik. (2) A k 2 vizsgálat előtti becslése log K OW = 4,0 esetén 0,652 nap– 1. A kísérlet teljes időtartama 3 × t SS = 3 × 4,6 nap, azaz 14 nap. A t SS becslését lásd az 5. függelékben. (3) Vízminta minimum három teljestérfogat-csere után lett véve. (4) A halmintát a törzsállományból vették. (5) Ha nagyobb pontosság vagy anyagcsere-vizsgálatok szükségesek, amely esetben több hal kell, ezeket különösen a felvételi fázis és a tisztulási fázis végén kell mintavételezni (vö. 40. pont). (6) A lipidtartalom analíziséhez legalább 3 további halra van szükség, ha nem lehet ugyanazt a halat használni, mint amelyiket a vizsgálati anyag koncentrációjának meghatározására vettek mintába a vizsgálat kezdetén, a felvételi fázis végén, illetve a tisztulási fázis végén. Figyelembe kell venni, hogy sok esetben lehetséges a 3 kontrollhal kizárólagos használata (vö. 56. pont). |
||||
2. Elméleti példa az anyag étrendi bioakkumulációs vizsgálatának mintavételezési ütemtervére 10 napos felvételi és 42 napos tisztulási fázist követve
|
Mintavételi alkalmak |
Mintavétel ütemezése |
Tápminták száma |
Halak száma mintánként |
||
|
A fázis napja |
További halminták? |
Vizsgálati csoport |
Kontrollcsoport |
||
|
Felvételi fázis |
|
|
|
|
|
|
1 |
0 |
3 – vizsgálati csoport |
0 |
5 – 10 |
|
|
3 – kontrollcsoport (1) |
|
(8 – 13) (2) |
|||
|
1A (3) |
1–3 |
|
|
5 – 10 |
5 – 10 |
|
2 |
10 |
Igen (4) |
3 – vizsgálati csoport |
10 – 15 (4) |
5 – 10 |
|
3 – kontrollcsoport (1) |
(13 – 18) (5) |
(8 – 13) (5) |
|||
|
Tisztulási fázis |
|
|
|
|
|
|
3 |
1 |
Igen (4) |
|
10 – 15 (4) |
5 – 10 |
|
4 |
2 |
|
|
5 – 10 |
5 – 10 |
|
5 |
4 |
|
|
5 – 10 |
5 – 10 |
|
6 |
7 |
Igen (4) |
|
10 – 15 (4) |
5 – 10 |
|
7 |
14 |
|
|
5 – 10 |
5 – 10 |
|
8 |
28 |
|
|
5 – 10 |
5 – 10 |
|
9 |
42 |
Igen (4) |
|
10 – 15 (4) (13 – 18) (5) |
5 – 10 (8 – 13) (5) |
|
ÖSSZESEN |
|
|
|
59 – 120 |
50 – 110 |
|
(1) 3 tápmintát analizálnak mind a kontroll-, mind a vizsgálati csoport esetében, a vizsgálati anyag koncentrációi és a lipidtartalom tekintetében. (2) A halmintát a törzsállományból veszik a vizsgálat kezdetéhez a lehető legközelebbi időpontban; a lipidtartalom tekintetében legalább 3 halat kell mintába venni a törzsállományból a vizsgálat kezdetén. (3) A felvételi fázis korai szakaszában történő (opcionális) mintavétel olyan adatokat szolgáltat a vizsgálati anyag étrendi asszimilációjának számításához, amelyek összehasonlíthatók a tisztulási fázis adataiból számított asszimilációs hatékonysággal. (4) 5 további hal vehető mintába a szövetspecifikus analízishez. (5) A lipidtartalom analíziséhez legalább 3 további halra van szükség, ha nem lehet ugyanazt a halat használni, mint amelyiket a vizsgálati anyag koncentrációinak meghatározására vettek mintába a vizsgálat kezdetén, a felvételi fázis végén, illetve a tisztulási fázis végén. Figyelembe kell venni, hogy sok esetben lehetséges a 3 kontrollhal kizárólagos használata (vö. 56. és 153. pont). |
|||||
A fázis és a mintavétel ütemezésével kapcsolatos észrevétel: a felvételi fázis a kiegészített táppal való első etetéskor kezdődik. Egy kísérleti nap az etetés időpontjától röviddel a 24 órával későbbi következő etetés időpontja előttig tart. Az első mintavételre (a táblázatban 1) röviddel (pl. egy órával) az első etetés előtt kell sort keríteni. A vizsgálat során a mintavételt ideális esetben röviddel a következő napi etetés előtt kell elvégezni (azaz körülbelül a mintavételi napon végrehajtott etetést követően 23 órával). A felvételi fázis röviddel azelőtt ér véget, hogy az első kiegészítetlen tápot beadnák, amikor a tisztulási fázis kezdődik (a vizsgálati csoportba tartozó halak valószínűleg még emésztik a kiegészített tápot a kiegészített táppal való utolsó etetést követő 24 órában). Ez azt jelenti, hogy a felvételi fázis végi mintát röviddel a kiegészítetlen táppal való első etetés előtt kell venni, a tisztulási fázis első mintáját pedig a kiegészítetlen táppal való első etetést követő körülbelül 23 órával.
5. függelék
ÁLTALÁNOS SZÁMÍTÁSOK
1. Bevezetés
2. A felvételi fázis időtartamának előrejelzése
3. A tisztulási fázis időtartamának előrejelzése
4. Lépcsőzetes módszer a k2 tisztulási (ürülési) sebességi állandó meghatározására
5. Lépcsőzetes módszer a k1 felvételi sebességi állandó meghatározására (csak vízi expozíciós módszer esetén)
6. Egyidejű módszer a felvételi és a tisztulási (ürülési) sebességi állandó számítására (csak vízi expozíciós módszer esetén)
7. A növekedés okozta hígulásra tekintettel alkalmazott korrekció kinetikus BCF és BMF esetén
8. Az 5 %-os lipidtartalomra történő lipidnormalizáció (csak vízi expozíciós módszer esetén)
1. BEVEZETÉS
Az általános vízi bioakkumulációs halvizsgálati modell a felvételi és ürülési folyamatokkal írható le, figyelmen kívül hagyva a tápon keresztül történő felvételt. A halban lévő koncentráció változási sebességét (mg·kg-1·nap-1) leíró differenciál egyenlet (dC f/dt) a következő (1):
|
|
[A5.1. egyenlet] |
ahol:
|
k 1 |
= |
A hal általi felvétel elsőrendű sebességi állandója (l·kg-1·nap-1). |
|
k 2 |
= |
A halból való tisztulás elsőrendű sebességi állandója (nap-1). |
|
kg |
= |
A halnövekedés elsőrendű sebességi állandója (»növekedés okozta hígulás«) (nap-1). |
|
km |
= |
A metabolikus átalakulás elsőrendű sebességi állandója (nap-1). |
|
ke |
= |
A fekália ürítésének elsőrendű sebességi állandója (nap-1). |
|
C w |
= |
Koncentráció a vízben (mg·l-1). |
|
Cf |
= |
Koncentráció a halban (mg·kg-1 nedves tömeg). |
A biológiailag felhalmozódó anyagok esetében várható, hogy az idővel súlyozott átlag (TWA) a leginkább releváns expozíciós koncentráció a vízben (Cw) a megengedett ingadozási tartományon belül (vö. 24. pont). A vízbeli koncentráció idővel súlyozott átlagát ajánlott a C.20. vizsgálati módszer 6. függelékében található eljárás szerint kiszámítani (2). Meg kell jegyezni, hogy a vízi koncentráció ln-transzformációja akkor megfelelő, ha exponenciális bomlás várható a megújítási időszakok között, pl. félstatikus vizsgálati terv esetén. Átfolyásos rendszerben nincs szükség az expozíciós koncentrációk ln-transzformációjára. Ha származtatják a vízi koncentráció idővel súlyozott átlagát, azt fel kell tüntetni a Vizsgálati jegyzőkönyvben, és fel kell használni a későbbi számítások során.
A BCF-re irányuló standard halvizsgálatban a felvétel és a tisztulás leírható két elsőrendű kinetikai folyamattal.
|
Felvételi sebesség = k 1 × C w |
[A5.2. egyenlet] |
|
Összes tisztulási arány = (k 2 + k g + k m + k e) × C f |
[A5.3. egyenlet] |
Állandósult állapotban, feltételezve, hogy a növekedés és az anyagcsere elhanyagolható (azaz a k g és k m értékek nem különböztethetők meg a nullától), a felvételi sebesség megegyezik a tisztulási sebességgel, így az A5.2. egyenlet és az A5.3. egyenlet kombinálásából a következő összefüggés adódik:
|
|
[A5.4. egyenlet] |
ahol:
|
C f-SS |
= |
Állandósult állapoti koncentráció a halban (mg·kg-1 nedves tömeg). |
|
C w-SS |
= |
Állandósult állapoti koncentráció a vízben (mg l-1). |
A k 1/k 2 hányadosa kinetikus BCF-ként (BCFK) ismert, és annak meg kell egyeznie az állandósult állapoti BCF-fel (BCFSS), amely a halban lévő állandósult állapoti koncentráció és a vízben lévő ilyen koncentráció hányadosából adódik, de eltérések fordulhatnak elő, ha az állandósult állapot bizonytalan volt, vagy ha a kinetikus BCF-et növekedéssel korrigálták. Ugyanakkor, mivel a k 1 és k 2 állandók, az állandósult állapotot nem feltétlenül kell elérni a BCFK származtatásához.
Ez az 5. függelék ezen elsőrendű egyenletek alapján általános számításokat tartalmaz, amelyek mind a vízi, mind az étrendi expozíciós bioakkumulációs módszerekhez szükségesek. Az 5. 6. és 8. szakasz ugyanakkor csak a vízi expozíciós módszer tekintetében releváns, ám itt »általános« módszerként szerepel. A lépcsőzetes (4. és 5. szakasz) és szimultán (6. szakasz) modellek lehetővé teszik a kinetikus BCF-ek származtatásához használt felvételi és tisztulási állandók kiszámítását. A k 2 meghatározásának lépcsőzetes módszere (4. szakasz) fontos az étrendi módszer esetében, mivel mind az asszimilációs hatékonyság, mind a BMF kiszámításához nélkülözhetetlen. Az étrendi módszerre sajátosan jellemző számításokat a 7. függelék mutatja be.
2. A FELVÉTELI FÁZIS IDŐTARTAMÁNAK ELŐREJELZÉSE
A vizsgálat elvégzése előtt a k 2, és így az állandósult állapot eléréséhez szükséges idő adott százaléka megbecsülhető a k 2 és az n-oktanol/víz megoszlási együttható (K OW) vagy a k 1 és a BCF tapasztalati összefüggéséből. Fontos megjegyezni azonban, hogy az e szakaszban bemutatott egyenletek csak akkor alkalmazhatók, ha a felvétel és a tisztulás elsőrendű kinetikát követ. Ha egyértelműen nem ez a helyzet, ajánlott biostatisztikustól és/vagy farmakokinetikustól szakvéleményt kérni, amennyiben a felvételi fázissal kapcsolatos előrejelezésekre van szükség.
A k 2 (nap-1) becslése több módszerrel is végezhető. Például elsőként az alábbi tapasztalati összefüggéseket lehet felhasználni ( 47 ):
|
log k 2 = 1,47 – 0,414logKOW |
(r2=0,95) [(3); A5.5. egyenlet] |
vagy
|
|
[A5.6. egyenlet] |
|
Ahol k 1 = 520 × W – 0,32 (a log K OW > 3 anyagok esetében) |
(r 2 = 0,85) [(4); A5.7. egyenlet] |
| és
|
(r 2 = 0,90) [(5); A5.8. egyenlet] |
W = a kezelt halak tömegének átlaga (nedves tömeg grammja) a felvétel végén/tisztulás kezdetén ( 48 )
Egyéb összefüggéseket lásd a (6) hivatkozásban. Előnyös lehet összetettebb modellek alkalmazása a k 2 becslése során, ha például valószínűsíthető, hogy jelentős anyagcserére kerülhet sor (7) (8). Ugyanakkor, minél bonyolultabb az adott modell, annál nagyobb körültekintést kell tanúsítani az előrejelzések értelmezésénél. A nitrocsoportok jelenléte például gyors anyagcserére utalhat, de nem mindig ez a helyzet. Ezért a felhasználónak mindig össze kell vetnie az előrejelzési módszer eredményeit a kémiai szerkezettel és bármely más releváns információval (például előzetes vizsgálatokkal) a vizsgálat ütemtervének meghatározásakor.
A k2-becslés felhasználásával, a felvételt és tisztulást leíró általános kinetikai egyenletből (elsőrendű kinetika) kiszámítható az állandósult állapot bizonyos százalékának eléréséhez szükséges idő, feltételezve, hogy a növekedés és az anyagcsere elhanyagolható. Ha a vizsgálat során jelentős növekedés tapasztalható, az alább leírt becslések nem megbízhatók. Ilyen esetekben jobb a növekedéssel korrigált k 2g alkalmazása, amint az később bemutatásra kerül (lásd e függelék 7. szakaszát):
|
|
[A5.9. egyenlet] |
vagy ha Cw állandó:
|
|
[A5.10. egyenlet] |
Az állandósult állapot közelítésekor (t→∞) az A5.10. egyenlet egyszerűsíthető (vö. (9) (10)):
|
|
[A5.11. egyenlet] |
vagy
|
|
[A5.12. egyenlet] |
Ekkor a BCF × Cw a halakban mérhető koncentráció közelítése »állandósult állapotban« (Cf-SS). [Megjegyzés: ugyanez a megközelítés alkalmazható az állandósult állapoti BMF becslésére az étrendi vizsgálatnál. Ebben az esetben a BCF helyébe a BMF, a C w helyébe a C food, azaz a tápban lévő koncentráció lép a fenti egyenletekben]
Az A5.10. egyenlet átírható:
|
|
[A5.13. egyenlet] |
vagy
|
|
[A5.14. egyenlet] |
Az A5.14. egyenlet alkalmazásával megjósolható az állandósult állapot bizonyos százalékának eléréséhez szükséges idő, amennyiben az A5.5. vagy A5.6. egyenlet felhasználásával a k 2-t előzetesen megbecsülték.
Iránymutatásként: statisztikailag elfogadható adatok (BCFK) előállításához a felvételi fázis statisztikailag optimális időtartama az a periódus, ami ahhoz szükséges, hogy a halban lévő vizsgálatianyag-koncentráció logaritmusának görbéje lineáris időskálán ábrázolva elérje az állandósult állapot 50 %-át (azaz 0,69/k 2), de ne legyen nagyobb az állandósult állapot 95 %-ánál (azaz 3,0/k 2-nél)(11). Amennyiben a felhalmozódás túllép az állandósult állapot 95 %-án, el lehet végezni a BCFSS kiszámítását.
Az állandósult állapot 80 %-ának eléréséhez szükséges idő (az A5.14. egyenlet felhasználásával):
|
|
[A5.15. egyenlet] |
vagy
|
|
[A5.16. egyenlet] |
Ugyanígy az állandósult állapot 95 %-ának eléréséhez szükséges idő:
|
|
[A5.17. egyenlet] |
Például log Kow = 4 értékkel jellemzett vizsgálati anyag esetében a felvételi fázis időtartama (azaz az állandósult állapot bizonyos százalékának eléréséhez szükséges idő, pl. t 80 vagy t 95) (az A5.5., A5.16. és A5.17. egyenletet használva):
logk 2 = 1,47 – 0,414 · 4
k 2 =0,652 nap-1

vagy
Ezenkívül:
|
teSS = 6,54 · 10 – 3 · K OW + 55,31 (óra) |
[A5.18. egyenlet] |
kifejezés használható az effektív állandósult állapot eléréséhez szükséges idő (t eSS) kiszámításához (12). Amelynek eredménye a log K OW = 4 értékkel jellemzett anyagok esetében:
teSS = 6,54 · 10 – 3 · 104 + 55,31 = 121 óra
3. A TISZTULÁSI FÁZIS IDŐTARTAMÁNAK ELŐREJELZÉSE
A test anyagterhelésének a kezdeti koncentráció bizonyos százalékára való csökkentéséhez szükséges idő megbecsülhető a felvételt és tisztulást leíró általános egyenletből (elsőrendű kinetikát feltételezve, vö. A5.9. egyenlet) (1) (13).
A tisztulási fázisban Cw (vagy az étrendi vizsgálat esetén Cfood) nullának feltételezett. Az egyenlet ezt követően egyszerűsíthető:
|
|
[A5.19. egyenlet] |
vagy
|
|
[A5.20. egyenlet] |
ahol Cf,0 a koncentráció a tisztulási fázis kezdetén.
Az 50 %-os tisztulás aztán t 50 időpontban következik be:

vagy

Hasonlóan, a 95 %-os tisztulás elérésének időpontja:

Amennyiben 80 %-os felvételt használnak az első periódusban (1,6/k 2), és 95 %-os ürülést a tisztulási fázisban (3,0/k 2), akkor a tisztulási fázis megközelítőleg kétszer hosszabb a felvételi fázisnál.
Meg kell jegyezni, hogy a becslések azon a feltevésen alapulnak, hogy a felvételi és tisztulási mintázat elsőrendű kinetikát követ. Amennyiben nyilvánvalóan nem elsőrendű a kinetika, ezek a becslések nem érvényesek.
4. LÉPCSŐZETES MÓDSZER A K 2 TISZTULÁSI (ÜRÜLÉSI) SEBESSÉGI ÁLLANDÓ MEGHATÁROZÁSÁRA
A legtöbb biokoncentrációs adatról feltételezett, hogy »ésszerűen« jól leírható egy egyszerű kétváltozós modellel, amely a tisztulási fázisban (természetes alapú logaritmusos skálán) a halakban lévő koncentrációk pontjaira illeszthető egyenest ad.

Meg kell jegyezni, hogy az egyenes vonaltól való eltérések elsőrendűnél összetettebb tisztulási mintázatot jelezhetnek. Az elsőrendű kinetikától eltérő tisztulási típusok meghatározására a grafikus módszer alkalmazható.
A k 2 több (mintavételi) időpont esetén történő kiszámítására az ln (koncentráció) lineáris regresszióját kell elvégezni az idő függvényében. A regressziós egyenes meredeksége adja a tisztulási sebességi állandó, k 2 becslését ( 49 ). A metszésből könnyen (hibahatárokra is figyelemmel) kiszámítható a halban lévő átlagos koncentráció a tisztulási fázis kezdetén (C0,d; amely megfelel a halban a felvételi fázis végén lévő átlagos koncentrációnak) (49) :
|
C 0, d = eintercept |
[A5.21. egyenlet] |
A k 2 kiszámítása, ha csak két (mintavételi) időpont áll rendelkezésre (mint a minimalizált terv esetén), a két átlagkoncentrációt a következő egyenlet váltja fel:
|
|
[A5.22. egyenlet] |
Ahol ln(C f1) és ln(C f2) a t 1, illetve t 2, időre jellemző koncentráció természetes alapú logaritmusa, továbbá t 2 és t 1 a két minta begyűjtésének ideje a tisztulási fázis kezdetéhez viszonyítva ( 50 ).
5. LÉPCSŐZETES MÓDSZER A K 1 FELVÉTELI SEBESSÉGI ÁLLANDÓ MEGHATÁROZÁSÁRA (CSAK VÍZI EXPOZÍCIÓS MÓDSZER ESETÉN)
A k 1 értékének a felvételi fázisra jellemző, egymást követő időpontok koncentrációs adataira tekintettel történő meghatározásához a következő modellhez illeszkedő számítógépes programot kell használni:
|
|
[A5.23. egyenlet] |
Ahol a k 2 az előző számításból adódik, C f(t) és C w(t) pedig a halban és a vízben lévő koncentráció t időben.
A k 1 kiszámítására, ha csak két (mintavételi) időpont áll rendelkezésre (mint a minimalizált terv esetén), a következő képletet kell használni:
|
|
[A5.24. egyenlet] |
Ahol a k 2 a korábbi számításból adódik, Cf a halban lévő koncentráció a tisztulási fázis kezdetén, Cw pedig a vízben lévő átlagkoncentráció a felvételi fázisban ( 51 ).
A megfelelő illeszkedés értékeléséhez alkalmazható a k 1 és k 2 mért, mintavételezett pontadatokhoz viszonyítva ábrázolt meredekségének vizuális megfigyelése. Ha az derül ki, hogy a lépcsőzetes módszer gyenge becslést ad a k 1-re, akkor a k 1 és a k 2 kiszámítására az egyidejű megközelítést kell alkalmazni (lásd a következő 6. szakaszt). Az eredményül adódó meredekséget össze kell vetni az ábrázolt mért adatokkal a megfelelő illeszkedés vizuális vizsgálatának céljából. Ha az illeszkedés továbbra sem megfelelő, az arra utalhat, hogy nem elsőrendű kinetikáról van szó, és összetettebb modelleket kell alkalmazni.
6. EGYIDEJŰ MÓDSZER A FELVÉTELI ÉS A TISZTULÁSI (ÜRÜLÉSI) SEBESSÉGI ÁLLANDÓ SZÁMÍTÁSÁRA (CSAK VÍZI EXPOZÍCIÓS MÓDSZER ESETÉN)
Számítógépes programok használhatók a k 1 és k 2 értékének az egymást követő időpontok koncentrációs adataiból és az alábbi modell alapján történő kiszámítására
|
|
0 < t < t c |
[A5.25. egyenlet] |
|
|
t > t c |
[A5.26. egyenlet] |
ahol:
|
t c |
= |
a felvételi fázis végének időpontja. |
Ez a megközelítés közvetlenül megadja a k 1 és k 2 becsléseinek standard hibáit. Ha a k 1/k 2 helyébe a BCF lép (vö. A5.4. egyenlet) az A5.25 A5.26. egyenletben, a BCF standard hibáját és a 95 %-os konfidencia-intervallumot is meg lehet becsülni. Ez kifejezetten hasznos, ha különböző becsléseket kell összehasonlítani adattranszformáció következtében. A függő változó (a halban lévő koncentráció) ln-transzformációval vagy anélkül is illeszthető, és értékelhető az eredményül adódó BCF bizonytalansága.
Mivel egyidejű becslés esetén erőteljes korreláció állapítható meg a k 1 és k 2 paraméterek között, tanácsos lehet először csak a tisztulási adatokból kiszámolni a k 2-t (lásd fent); a k 2 a legtöbb esetben a tisztulási görbéből viszonylag nagy pontossággal megbecsülhető. Ezt követően nem lineáris regresszióval ki lehet számolni k 1-et a felvételi adatokból ( 52 ). A lépcsőzetes illesztéskor tanácsos ugyanazt az adattranszformációt alkalmazni.
A megfelelő illeszkedés értékeléséhez alkalmazható az eredményül adódó, a mintavételezett pontadatokhoz viszonyítva ábrázolt meredekségek vizuális megfigyelése. Ha az derül ki, hogy ez a módszer gyenge becslést ad a k 1-re, akkor a k 1 és a k 2 kiszámítására az egyidejű megközelítést kell alkalmazni. Az illesztett modellt itt is össze kell vetni az ábrázolt mért adatokkal a megfelelő illeszkedés vizuális vizsgálatának céljából; és az egyes illesztési típusoknál az eredményül adódó paraméterbecsléseket össze kell vetni a k 1 és k 2 tekintetében, az eredményül adódó BCF-et, standard hibáikat és/vagy konfidencia-intervallumaikat.
Ha az illeszkedés nem megfelelő, az arra utalhat, hogy nem elsőrendű kinetikáról van szó, és más, összetettebb modelleket kell alkalmazni. Az egyik legáltalánosabb komplikáció a halak növekedése a vizsgálat során.
7. A NÖVEKEDÉS OKOZTA HÍGULÁSRA TEKINTETTEL ALKALMAZOTT KORREKCIÓ KINETIKUS BCF ÉS BMF ESETÉN
Ez a szakasz a hal vizsgálat során történő növekedésére (az úgynevezett növekedés okozta hígulásra) tekintettel végzett korrekció standard módszerét ismerteti, amely csak elsőrendű kinetika esetén érvényes. Ha arra utaló jelek láthatók, hogy az elsőrendű kinetika nem valósul meg, ajánlott biostatisztikus szakvéleményét kérni a növekedés okozta hígulásra tekintettel végzett megfelelő korrekció tekintetében, vagy az alább bemutatott, tömeg alapú megközelítést alkalmazni.
Egyes esetekben a növekedés okozta hígulásra tekintettel végzett korrekció módszere nem kellően pontos, vagy néha nem működik (például nagyon lassan tisztuló, gyorsan növekedő halakban vizsgált anyagok esetében a származtatott, növekedés okozta hígulásra tekintettel korrigált tisztulási sebességi állandó, k 2g nagyon csekély lehet, így az ennek származtatásához használt két sebességi állandóban kritikus lesz a hiba, és bizonyos esetekben a k g becslései meghaladhatják a k 2-t). Ilyen esetben alternatív megközelítés (azaz tömeg alapú megközelítés) használható, amely akkor is működik, ha a folyamat nem elsőrendű kinetikát követett, és ekkor nem lesz szükség a korrekcióra. E megközelítés a szakasz végén olvasható.
A növekedési sebességi állandó kivonásának módszere a növekedésre tekintettel történő korrekcióhoz
A standard módszerhez valamennyi egyedi tömeg- és hosszadatot természetes alapú logaritmusára kell konvertálni és az ln(tömeg) vagy ln(1/tömeg) adatokat az idő (nap) függvényében kell ábrázolni, külön a kezelt és a kontrollcsoport vonatkozásában. Ugyanazt az eljárást kell lefolytatni külön a felvételi és a tisztulási fázisra. A növekedés okozta hígulásra tekintettel végzett korrekcióhoz általában megfelelőbb az egész vizsgálat során nyert tömegadatokat használni a növekedési sebességi állandó (k g) kiszámítása érdekében, de a felvételi és a tisztulási fázis tekintetében származtatott növekedési sebességi állandók közötti statisztikailag szignifikáns eltérések arra utalhatnak, hogy a tisztulási fázis sebességi állandóját kell alkalmazni. A kezeléssel összefüggő hatások ellenőrzéséhez használhatók a vizes vizsgálatokból származó, a vizsgálati és kontrollcsoportra vonatkozó teljes növekedési sebességek.
Legkisebb négyzetes lineáris korrelációt számítanak a nap függvényében kifejezett ln(haltömeg)-re (és a nap függvényében kifejezett ln(1/tömeg)-re), minden csoport (vizsgálati és kontrollcsoportok, egyedi adatok és nem a napi átlagértékek) és az egész vizsgálat, a felvételi és a tisztulási fázis tekintetében, standard statisztikai eljárásokkal. Az egyenesek meredekségeinek szóródását kiszámítják és felhasználják a meredekségek (növekedési sebességi állandók) közötti eltérések statisztikai szignifikanciájának értékeléséhez (p = 0,05), a Student-féle t-próba (vagy egynél több koncentráció vizsgálata esetén az ANOVA) alkalmazásával. A növekedésre tekintettel történő korrekció céljaira általában előnyösebb tömegadatokat használni. Az ugyanilyen módon kezelt hosszadatok hasznosak lehetnek a kontroll- és a vizsgálati csoportok kezeléssel összefüggő hatásokra tekintettel történő összehasonlítására. Ha a tömegadatok analízise nem utal statisztikailag szignifikáns eltérésre, a vizsgálati és kontrolladatokat össze lehet vonni, és a vizsgálat céljára teljes halnövekedési sebességi állandót (k g) lehet számítani, mint a lineáris korreláció általános meredekségét. Ha statisztikailag szignifikáns különbségek figyelhetők meg, az egyes halcsoportokra és/vagy vizsgálati fázisra jellemző növekedési sebességi állandókat külön-külön kell feltüntetni a Vizsgálati jegyzőkönyvben. Az egyes kezelt csoportokból származó sebességi állandót ekkor az adott csoportban kell a növekedés okozta hígulásra tekintettel végzett korrekcióhoz használni. Ha a felvételi és a tisztulási fázis sebességi állandói között statisztikai különbségek figyelhetők meg, a tisztulási fázis tekintetében származtatott sebességi állandókat kell alkalmazni.
A tisztulási sebességi állandó (k 2g) meghatározásához a számított növekedési sebességi állandó (k g) nap–1-ben kifejezve) kivonható a teljes tisztulási sebességi állandóból (k 2).
|
k 2 g = k 2 – kg |
[A5.27. egyenlet] |
A felvételi sebességi állandót elosztják a növekedéssel korrigált tisztulási sebességi állandóval a növekedéssel korrigált kinetikus BCF kiszámításához (amelynek jelölése BCFKg, vagy BMFKg).
|
|
[A5.28. egyenlet] |
Az étrendi vizsgálathoz származtatott növekedési sebességi állandót az A7.5 egyenletben használják fel a növekedéssel korrigált BMFKg kiszámításához (vö. 7. függelék).
Tömeg alapú módszer a növekedésre tekintettel történő korrekcióhoz
A fenti, növekedési sebességi állandó kivonásán alapuló módszer alternatívája, ahol nincs szükség növekedésre tekintettel történő korrekcióra, a következőképpen használható. Az elv a tisztulási adatok egész halra vetített tömeg alapján történő használata, és nem koncentrációalapú használata.
A tisztulási fázis szöveti koncentrációit (vizsgálati anyag tömege/ a hal egységnyi tömege) konvertálni kell a vizsgálati anyag tömege/hal hányadosra: a koncentrációkat és az egyes halak tömegét táblázatos formában meg kell feleltetni egymásnak (pl. számítógépes táblázatkezelővel) és az egyes koncentrációkat meg kell szorozni a teljes haltömeggel az adott mérés tekintetében, így adódik a vizsgálati anyag tömege/hal hányadosok sora a tisztulási fázis valamennyi mintája vonatkozásában.
A vizsgálati anyag tömegére vonatkozó adatok természetes alapú logaritmusát a kísérleti idő (tisztulási fázis) függvényében kell ábrázolni, szokás szerint.
A vízi expozíciós módszer tekintetében a felvételi sebességi állandót a szokásos módon kell származtatni (lásd a 4. és 6. szakaszt; megjegyzendő, hogy a »szokásos«k 2 értéket kell használni a görbeillesztési egyenletekben a k 1 tekintetében), és a tisztulási sebességi állandót a fenti adatokból kell származtatni. Minthogy a tisztulási sebességi állandó eredményül adódó értéke független a növekedéstől, mivel azt egész halankénti tömeg alapján számították ki, ezt k 2g-vel és nem k 2-vel kell jelölni.
8. AZ 5 %-OS LIPIDTARTALOMRA TÖRTÉNŐ LIPIDNORMALIZÁCIÓ (CSAK VÍZI EXPOZÍCIÓS MÓDSZER ESETÉN)
A vízi expozíciós vizsgálatból adódó (kinetikus és állandósult állapoti) BCF-eredményeket a halak alapértelmezett 5 %-os (nedves tömeg) lipidtartalmához viszonyítva is fel kell tüntetni a Vizsgálati jegyzőkönyvben, hacsak nem igazolható, hogy a vizsgálati anyag elsődlegesen nem lipidekben halmozódik fel (pl. egyes perfluorozott anyagok fehérjékhez kapcsolódhatnak). A halakkal kapcsolatos koncentrációs adatokat vagy a BCF-et a nedves tömegre vetített 5 %-os lipidtartalomra kell konvertálni. Ha az anyagkoncentráció és a lipidtartalom mérésére ugyanazokat a halakat használják valamennyi mintavételi ponton, a halban mért minden egyedi koncentrációt korrigálni kell az adott halnak a lipidtartalma vonatkozásában.
|
|
[A5.29. egyenlet] |
ahol:
|
C f,L |
= |
a lipidtartalomra vonatkoztatott koncentráció a halban (mg kg–1 nedves tömeg) |
|
L |
= |
a lipidfrakció (nedves tömeg alapján) |
|
C f |
= |
a vizsgálatianyag-koncentráció a halban (mg kg–1 nedves tömeg) |
Ha a lipidanalízist nem végezték el minden, mintába felvett halon, akkor a lipidérték átlaga alapján kerül sor a BCF normalizálására. Az állandósult állapoti BCF tekintetében a kezelt csoportban a felvételi fázis végén rögzített átlagértéket kell használni. A kinetikus BCF normalizációja esetén lehetnek olyan esetek, amelyeknél eltérő megközelítés indokolt, például ha a lipidtartalom jelentősen módosul a felvételi vagy a tisztulási fázis során. Ugyanakkor továbbra is szokás szerint azt az etetési arányt kell alkalmazni, amely a lehető legkisebbre csökkenti a lipidtartalomban beállt drasztikus változásokat.
|
|
[A5.30. egyenlet] |
ahol:
|
BCFKL |
= |
a lipidtartalomra vonatkoztatott kinetikus BCF (L kg–1) |
|
L n |
= |
az átlagos lipidfrakció (nedves tömeg alapján) |
|
BCFK |
= |
a kinetikus BCF (L kg–1) |
SZAKIRODALOM
(1) Arnot J.A. and Gobas F.A.P.C. (2004), A food web bioaccumulation model for organic chemicals in aquatic ecosystems, Environ. Toxicol. Chem. 23: 2343–2355.
(2) E melléklet C.20., Daphnia magnán végzett reprodukciós vizsgálat című fejezete.
(3) Spacie A. and Hamelink J.L. (1982), Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. Chem. 1: 309-320.
(4) Sijm D.T.H.M., Verberne M.E., de Jonge W.J., Pärt P. and Opperhuizen A. (1995), Allometry in the uptake of hydrophobic chemicals determined in vivo and in isolated perfused gills. Toxicol. Appl. Pharmacol. 131: 130-135.
(5) Bintein S., Devillers J. and Karcher W. (1993), Nonlinear dependence of fish bioconcentration on n-octanol/water partition coefficient. SAR QSAR Environ. Res. 1: 29-39.
(6) Kristensen P. (1991), Bioconcentration in fish: comparison of BCF's derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Danish Water Quality Institute, Hørsholm, Denmark.
(7) Arnot J.A., Meylan W., Tunkel J., Howard P.H., Mackay D., Bonnell M. and Boethling R.S. (2009), A quantitative structure-activity relationship for predicting metabolic biotransformation rates for organic chemicals in fish. Environ. Toxicol. Chem. 28: 1168-1177.
(8) OECD (2011), QSAR Toolbox 2.1. February 2011. Available from: http://www.oecd.org/document/54/0,3746,en_2649_34379_42923638_1_1_1_1,00.html.
(9) Branson D.R., Blau G.E., Alexander H.C. and Neely W.B. (1975). Bioconcentration of 2,2',4,4' tetrachlorobiphenyl in rainbow trout as measured by an accelerated test. T. Am. Fish. Soc. 104: 785-792.
(10) Ernst W. (1985), Accumulation in aquatic organisms, in Appraisal of tests to predict the environmental behaviour of chemicals, Sheeman, P., et al., Editors. John Wiley & Sons Ltd, New York, NY, USA: 243-255.
(11) Reilly P.M., Bajramovic R., Blau G.E., Branson D.R. and Sauerhoff M.W. (1977), Guidelines for the optimal design of experiments to estimate parameters in first order kinetic models. Can. J. Chem. Eng. 55: 614-622.
(12) Hawker D.W. and Connell D.W. (1988), Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22: 701-707.
(13) Konemann H. and van Leeuwen K. (1980), Toxicokinetics in fish: Accumulation and elimination of six chlorobenzenes by guppies. Chemosphere. 9: 3-19.
6. függelék
A VÍZI EXPOZÍCIÓS VIZSGÁLAT EGYENLETI SZAKASZA: MINIMALIZÁLT VIZSGÁLATI TERV
E megközelítés mögött az a logika húzódik, hogy a teljes vizsgálatban a biokoncentrációs tényező vagy állandósult állapoti biokoncentrációs tényezőként (BCFSS) határozható meg a vizsgálati anyag halszövetben mért koncentrációja és a vizsgálati anyag vízben mért koncentrációja hányadosának kiszámításával, vagy kinetikus biokoncentrációs tényezőként a (BCFK) felvételi sebességi állandó k 1 és a tisztulási sebességi állandó k 2 hányadosának kiszámításával. A BCFK akkor is érvényes, ha az anyag állandósult állapoti koncentrációját nem érik el a felvételi fázisban, feltéve, hogy a felvétel és a tisztulás megközelítőleg elsőrendű kinetikai folyamatokat követ.
Ha a vizsgálati anyag szövetekben lévő koncentrációjának (C f1) mérését az expozíció végén (t 1) végzik el, és a szöveti koncentrációt (C f2) ezt követően egy bizonyos idő elteltével (t 2) újra megmérik, a tisztulási sebességi állandó (k 2) megbecsülhető az 5. függelékben található A5.22. egyenlettel.
A k 1 felvételi sebességi állandó ezt követően algebrikusan meghatározható az 5. függelék A5.23. egyenletével (ahol a C f megegyezik a C f1-gyel, a t pedig t 1-gyel)(1). A minimalizált terv kinetikus biokoncentrációs tényezője (amelyet BCFKm-ként jelölnek a más módszerek alkalmazásával meghatározott kinetikus biokoncentrációs tényezőktől való megkülönböztetés céljával) így a következő:
|
|
[A6.1. egyenlet] |
A koncentrációkat vagy eredményeket a növekedés okozta hígulásra tekintettel ki kell igazítani és normalizálni kell a hal 5 %-os lipidtartalmára, amint az az 5. függelékben szerepel.
A minimalizált BCFSS a felvételi fázis végén számított BCF, feltéve, hogy az állandósult állapot létrejött. Ez puszta feltételezés, mivel a mintavételi pontok száma nem elegendő ennek bizonyításához.
|
|
[A6.2. egyenlet] |
ahol:
C f-minSS = Koncentráció a halban a felvételi fázis végén a feltételezett állandósult állapotban (mg·kg–1 nedves tömeg).
C w-minSS = Koncentráció a vízben a felvételi fázis végén a feltételezett állandósult állapotban (mg·l–1).
SZAKIRODALOM
(1) Springer T.A., Guiney P.D., Krueger H.O. and Jaber M.J. (2008), Assessment of an approach to estimating aquatic bioconcentration factors using reduced sampling. Environ. Toxicol. Chem. 27: 2271-2280.
7. függelék
AZ ÉTRENDI EXPOZÍXIÓS VIZSGÁLAT EGYENLETEKET TARTALMAZÓ SZAKASZA
1. Példa a megfelelő kereskedelmi haltáp alkotóelemeinek mennyiségére
2. Példák tápkiegészítési módszerekre
3. Az asszimilációs hatékonyság és a biomagnifikációs tényező kiszámítása
4. Lipidtartalomra tekintettel történő korrekció
5. A mért nulla időpillanati koncentráció (C0,m) és a származtatott nulla időpillanati koncentráció (C0,d ) közötti különbségek értékelése
6. Útmutatás nagyon gyorsan tisztuló vizsgálati anyagokhoz
1. PÉLDA A MEGFELELŐ KERESKEDELMI HALTÁP ALKOTÓELEMEINEK MENNYISÉGÉRE
|
Elsődleges alkotóelem |
halliszt |
|
Nyersfehérje |
≤ 55,0 % |
|
Nyerszsír |
≤ 15,0 % (1) |
|
Nyersrost |
≥ 2,0 % |
|
Nedvesség |
≥ 12 % |
|
Hamu |
≥ 8 % |
|
(1) Egyes régiókban esetleg csak olyan haltápot lehet beszerezni, amelynek lipidkoncentrációja jóval elmarad e felső határtól. Ilyen esetekben a vizsgálatot a beszállított alacsonyabb lipidkoncentrációjú táppal kell lefolytatni, és az etetési arányt kell megfelelően kiigazítani a hal egészségének megőrzéséhez. Az étrend lipidtartalma mesterségesen nem növelhető több olaj hozzáadásával. |
|
2. PÉLDÁK TÁPKIEGÉSZÍTÉSI MÓDSZEREKRE
Általános szempontok
A kontrolltápokat pontosan úgy kell elkészíteni, ahogy a kiegészített tápokat, de a vizsgálati anyag nélkül.
A kezelt táp koncentrációjának ellenőrzéséhez az adagolt tápból három példányban kell kivonni mintát megfelelő extrakciós módszerrel, valamint a vizsgálatianyag-koncentrációt és a radioaktivitást mérni kell a kivonatokban. Igazolni kell a minták közötti alacsony eltérés melletti nagyfokú (> 85 %) analitikai visszanyerést (az anyagnak a vizsgálat kezdetekor mintavételezett legalább három koncentrációja nem térhet el ± 15 %-ot meghaladóan az átlagtól).
Az étrendi vizsgálat során három tápmintát kell gyűjteni analitikai célból a 0. napon és a felvételi fázis végén a tápban található vizsgálatianyag-tartalom meghatározása érdekében.
A haltáp elkészítése (hígítatlan) folyékony vizsgálati anyaggal
A kezelt haltápban a névleges koncentráció célértékét például 500 μg vizsgálati anyag/g tápban kell meghatározni. A hígítatlan vizsgálati anyag (molekulatömegben vagy konkrét radioaktivitással kifejezett) megfelelő mennyiségét hozzá kell adni a haltáp ismert tömegéhez üvegedényben vagy rotációs bepárló edényben. A haltáp tömegének elegendőnek kell lennie a felvételi fázis tartamára (figyelembe véve, hogy szükség lehet a mennyiségek növelésére az egyes etetésekkor a halak növekedése miatt). A haltápot/vizsgálati anyagot előző este kell összekeverni lassú keveréssel (pl. roto-rack keverővel vagy rotációval, ha rotációs bepárló edényt alkalmaznak). A kiegészített tápot olyan körülmények között kell tárolni, hogy a használatig fennmaradjon a vizsgálati anyag stabilitása a tápkeverékben (pl. hűtés).
A haltáp elkészítése kukoricaolaj vagy halolaj vivőanyaggal
A szilárd vizsgálati anyagokat mozsárban finom porrá kell őrölni. A folyékony vizsgálati anyagok közvetlenül hozzáadhatók a kukorica- vagy halolajhoz. A vizsgálati anyagot kukoricaolaj vagy halolaj ismert mennyiségével kell feloldani (pl. 5–15 ml). Az adagolt olajat mennyiségileg egy megfelelő méretű rotációs bepárló edénybe kell áthelyezni. Az adagolt olaj készítéséhez használt lombikot az olaj két kis alikvotjával kell kiöblíteni, és ezt az edényhez hozzá kell adni annak biztosítása érdekében, hogy az oldott vizsgálati anyag egésze átkerüljön oda. Az olajban való teljes feloldódás/diszperzió biztosítására (vagy ha egynél több vizsgálati anyagot alkalmaznak a vizsgálat során) mikrokeverőt kell behelyezni, a lombikot le kell dugaszolni és a keveréket gyorsan össze kell keverni előző este. A vizsgálathoz szükséges haltáp megfelelő mennyiségét (szokásosan pellet formában) az edénybe kell helyezni, és az edény tartalmát homogénné kell keverni az üvegedény folyamatos, legalább 30 percig tartó forgatásával, de lehetőség szerint előző este. Ezt követően a kiegészített tápot megfelelően kell tárolni (pl. hűteni kell) annak garantálására, hogy a tápban a vizsgálati anyag stabilitása a használatig megmaradjon.
A haltáp elkészítése szerves oldószerrel
A vizsgálati anyag megfelelő (molekulatömegben vagy konkrét radioaktivitással kifejezett), a célzott dózis elérésére alkalmas mennyiségét megfelelő szerves oldószerben fel kell oldani (pl. ciklohexán vagy aceton, 10–40 ml, de nagyobb térfogat alkalmazandó, ha a kiegészítendő táp mennyiségétől függően ez szükséges). Az oldat alikvotját vagy egészét (az adagnak megfelelően hozzáadva) el kell keverni az ahhoz elegendő haltáp megfelelő mennyiségével, hogy a vizsgálat során elérjék az előírt névleges dózisszintet. A tápot/vizsgálati anyagot rozsdamentes keverőtálban lehet keverni, és a frissen adagolt haltáp bent hagyható a tálban vegyifülke alatt két napig (alkalmanként megkeverve), hogy a felesleges oldószer elpárologjon, vagy összekeverhető rotációs bepárló edényben, folyamatos keverés mellett. A felesleges oldószer »elfújható« légárammal vagy nitrogénnel, ha szükséges. Vigyázni kell arra, hogy a vizsgálati anyag ne kristályosodjon az oldószer eltávolítását követően. A kiegészített tápot olyan körülmények között kell tárolni (pl. hűtés), hogy a használatig fennmaradjon a vizsgálati anyag stabilitása a tápkeverékben.
3. AZ ASSZIMILÁCIÓS HATÉKONYSÁG ÉS A BIOMAGNIFIKÁCIÓS TÉNYEZŐ KISZÁMÍTÁSA
Az asszimilációs hatékonyság kiszámításához a teljes tisztulási sebességi állandót először meg kell becsülni az 5. függelék 4. szakasza alapján (a lépcsőzetes módszer alkalmazásával, azaz standard lineáris regresszióval), a tisztulási fázis mintavételezett koncentrációinak átlagát használva. Az etetési arány állandója, I és a felvétel időtartama, t a vizsgálat ismert paraméterei. A C food, a vizsgálati anyag tápban mért koncentrációjának átlaga a vizsgálatban mért változó. C 0,d a felvételi fázis végén a vizsgálati anyag halban lévő koncentrációja általában a tisztulási napok függvényében ábrázolt ln(koncentráció) metszéspontjából származtatható.
Az anyag asszimilációs hatékonysága (a, a vizsgálati anyag bélből való felszívódása) a következőképpen számítható ki:
|
|
[A7.1. egyenlet] |
ahol:
C 0,d = származtatott koncentráció a halban a felvételi fázis nulla időpillanatában (mg·kg-1);
k 2 = teljes (növekedéssel nem korrigált) tisztulási sebességi állandó (nap-1), az 5. függelék 3. szakaszában szereplő egyenletek szerint számítva;
I = táplálékfelvételi sebességi állandó (g táp g-1·hal nap-1).
C food = koncentráció a tápban (mg·kg-1 táp);
t = az etetési időszak tartama (nap)
Ugyanakkor, a számításhoz használt etetési arányt (I) adott esetben ki kell igazítani a hal növekedésével, hogy pontos asszimilációs hatékonyságot (a) kapjunk. Olyan vizsgálatban, amelynek során a halak jelentősen növekednek a felvételi fázisban (ahol nem korrigálják a tápmennyiséget az előre meghatározott etetési arány fenntartása érdekében), a tényleges etetési arány a felvételi fázis előrehaladtával elmarad az előre meghatározottól, így magasabb lesz a »valódi« asszimilációs hatékonyság. (Meg kell jegyezni, hogy a BMF általános számítása szempontjából ez nem fontos, mivel az I feltételei ténylegesen kiesnek az A7.1. és az A7.4. egyenlet között.) A növekedés okozta hígulással korrigált átlagos etetési arány, I g többféleképpen származtatható, de a leginkább lényegre törő és legprecízebb módszer az ismert növekedési sebességi állandó felhasználása (k g) a vizsgálati halak tömegének felvételi fázis időpillanataiban történő becslésére, azaz:
|
|
[A7.2. egyenlet] |
ahol:
W f(t) = az átlagos haltömeg t felvételi napon
W f,0 = az átlagos haltömeg a kísérlet kezdetén
Ezen a módon (legalább) a kísérlet utolsó napjára vonatkozó átlagos haltömeg (W f,end-of-uptake) megbecsülhető. Minthogy az etetési arányt a Wf,0 alapján állapították meg, a felvétel egyes napjainak tényleges etetési arányát e két tömegértékkel ki lehet számítani. A növekedéssel korrigált etetési arány, I g (g táp g-1 hal nap-1), amelyet az I helyett használnak, ha a felvételi fázisban gyors növekedés tapasztalható, ezt követően kiszámítható így:
|
|
[A7.3. egyenlet] |
Az asszimilációs hatékonyság (α) meghatározását követően a BMF kiszámítható úgy, hogy az α és az etetési arány állandójának (I, vagy I g, ha az α kiszámítására azt használják) szorzatát elosztják a teljes tisztulási sebességi állandóval (k 2):
|
|
[A7.4. egyenlet] |
A növekedéssel korrigált biomagnifikációs tényezőt is ugyanígy kell kiszámítani, a növekedéssel korrigált tisztulási együttható használatával (az 5. függelék 7. szakaszának megfelelően származtatott érték). Ugyanígy, ha az I g-t α kiszámítására használják, akkor itt is azt kell használni az I helyett:
|
|
[A7.5. egyenlet] |
ahol:
α = asszimilációs hatékonyság (a vizsgálati anyag bélből való felszívódása):
k 2 = teljes (növekedéssel nem korrigált) tisztulási sebességi állandó (nap-1), az 5. függelék 3. szakaszában szereplő egyenletek szerint számítva;
k 2g = növekedéssel korrigált tisztulási sebességi állandó (nap-1)
I. = táplálékfelvételi sebességi állandó (g táp g-1·hal nap-1).
A növekedéssel korrigált felezési idő (t 1/2) a következőképpen számítható ki.
|
|
[A7.6. egyenlet] |
Az anyag tápból való asszimilációs hatékonysága meg is becsülhető, ha a felvételi fázis lineáris szakaszában (az 1. és a 3. nap között) meghatározták a szöveti maradékokat. Ebben az esetben az anyag asszimilációs hatékonysága (α) a következőképpen határozható meg:
|
|
[A7.7. egyenlet] |
ahol:
C fish (t) = a vizsgálati anyag koncentrációja a halban t időpontban (mg kg-1 nedves tömeg).
4. LIPIDTARTALOMRA TEKINTETTEL TÖRTÉNŐ KORREKCIÓ
Ha minden mintavételi intervallum tekintetében ugyanazon a halon mérték a lipidtartalmat, mint amelyiken a kémiai analízist végezték, az egyedi koncentrációkat korrigálni kell a lipidtartalom alapján és az ln(lipidtartalommal korrigált koncentráció)-t a tisztulás függvényében (nap) kell ábrázolni a C0,d és a k 2 levezetéséhez. Az asszimilációs hatékonyság (A7.1. egyenlet) ezt követően lipidtartalom alapján is kiszámítható, a Cfood lipidtartalom alapján történő használatával (azaz a Cfood-ot meg kell szorozni a táp átlagos lipidfrakciójával). Az ezt követő, az A7.4. egyenlet és az A7.5. egyenlet alkalmazásával végzett számítások közvetlenül megadják a lipidtartalommal (és a növekedés okozta hígulásra tekintettel) korrigált BMF-et.
Másként a halban és a tápban található átlagos lipidfrakciót (w/w) mind a kezelt, mind a kontrollcsoport tekintetében származtatják (a táp és a kontrollcsoportba tartozó halak tekintetében ez általában az expozíció kezdetén és végén mért adatokból nyerik, a kezelt csoportba tartozó halak tekintetében pedig kizárólag az expozíció végi adatokból). Egyes vizsgálatokban a halak lipidtartalma jelentősen emelkedhet; ilyen esetekben helyénvalóbb a vizsgálati halban lévő átlagos lipidkoncentráció alkalmazása, amelyet az expozíció és a tisztulás végén mért értékekből számítanak ki. Általánosságban a csak a kezelt csoportból származó adatokat mindkét lipidfrakció származtatására használni kell.
A lipidkorrekciós tényezőt (L c) a következőképpen kell kiszámítani:
|
|
[A7.8. egyenlet] |
ahol az L fish és az L food az átlagos lipidfrakció a halban, illetve a tápban.
A lipidkorrekciós tényezőt a lipidtartalommal korrigált biomagnifikációs tényező (BMFL) számítására használják:
|
|
[A7.9. egyenlet] |
5. A MÉRT NULLA IDŐPILLANATI KONCENTRÁCIÓ (C 0,m ) ÉS A SZÁRMAZTATOTT NULLA IDŐPILLANATI KONCENTRÁCIÓ (C 0,d) KÖZÖTTI KÜLÖNBSÉGEK ÉRTÉKELÉSE
A mért nulla időpillanati koncentrációt (C0,m) és a származtatott nulla időpillanati koncentrációt (C0,d) össze kell hasonlítani. Ha nagyon hasonlóak, akkor az a tisztulási paraméterek származtatásához használt elsőrendű modellt támasztja alá.
Egyes vizsgálatokban jelentős különbség lehet a származtatott nulla időpillanati érték (C 0,d) és a mért nulla időpillanati átlagkoncentráció (C 0,m)között (lásd e vizsgálati módszer 159. pontjának utolsó ponttal jelölt bekezdését). Ha a C 0,d sokkal alacsonyabb, mint a C 0,m (C 0,d << C 0,m), a különbség arra utalhat, hogy emésztetlen kiegészített táp található a bélben. Ezt kísérletben lehet vizsgálni az eltávolított bél külön analízisével, ha további (egész hal) mintákat vettek és tároltak a felvételi fázis végén. Másfelől, ha a tisztulási fázis lineáris regressziójára alkalmazott, statisztikailag érvényes kiugróérték-teszt arra utal, hogy a tisztulási fázis első mintavételi pontja tévesen magas, megfelelő lehet a lineáris regresszió elvégzése a k 2 származtatásához, de el kell hagyni az első tisztulási koncentrációs pontot. Ilyen esetekben, ha a lineáris regresszióban rejlő bizonytalanság nagymértékben csökken, és egyértelmű, hogy megközelítőleg elsőrendű kinetika érvényesült, megfelelő lehet az eredményként adódó C 0,d és k 2 érték alkalmazása az asszimilációs hatékonysági számításokban. Ezt teljes körűen meg kell indokolni a Vizsgálati jegyzőkönyvben. Az is lehet, hogy nem elsőrendű kinetika érvényesült a tisztulási fázisban. Ha ez valószínű (azaz a természetes alapú logaritmusra transzformált adatok láthatóan görbét adnak a lineáris regresszió egyeneséhez képest), akkor a k 2 és a C 0,d számításai valószínűleg nem lesznek érvényesek, és biostatisztikus szakvéleményét ajánlott kikérni.
Ha a C 0,d sokkal magasabb, mint a mért érték (C 0,d >> C 0,m), ez a következőkre utalhat: az anyag nagyon gyorsan ürült ki (azaz a mintavételi pontok az analitikai módszer meghatározási határához közelítettek már a tisztulási fázis igen korai szakaszában, vö. az alábbi 6. szakaszt); eltérés történt az elsőrendű tisztulási kinetikától; a k 2 és a C 0,d származtatásához használt lineáris regresszió hibás, vagy a mintavétel valamely időpontjában probléma történt a mért vizsgálati koncentrációkkal. Ilyen esetben a lineáris regresszió ábráját gondosan át kell vizsgálni olyan minták után kutatva, amelyek a meghatározási határon vagy ahhoz közel vannak, keresve a kiugró értékeket és a nyilvánvaló görbületet (ami a nem elsőrendű kinetikára utal), ezt pedig ki kell emelni a Vizsgálati jegyzőkönyvben. A lineáris regresszió bármely későbbi, a becsült értékek javítását szolgáló újraértékelését be kell mutatni és meg kell indokolni. Ha jelentős eltérés figyelhető meg az elsőrendű kinetikához képest, akkor a k 2 és a C 0,d számításai valószínűleg nem lesznek érvényesek, és biostatisztikus szakvéleményét ajánlott kikérni.
6. ÚTMUTATÁS NAGYON GYORSAN TISZTULÓ VIZSGÁLATI ANYAGOKHOZ
Amint a vizsgálati módszer 129. pontjában kifejtésre került, egyes anyagok olyan gyorsan tisztulhatnak, hogy megbízható nulla időpillanati koncentráció, C 0,d és k 2 nem származtatható, mivel a tisztulási fázis nagyon korai szakaszában (azaz a második tisztulási mintától kezdve) az anyag ténylegesen nem mérhető (a koncentrációk a jelentés szerint a meghatározási határon vannak). Ez a helyzet volt megfigyelhető az e vizsgálati módszer alátámasztására végzett laboratóriumok közötti összehasonlításban a benzo[a]pirén esetén, és ezt rögzítették a módszer validálási jelentésében is. Ilyen esetekben a lineáris regresszió nem végezhető el megbízhatóan, és valószínűleg irreálisan magasra becsüli a C 0,d-t, amelynek következtében az asszimilációs hatékonyság jóval nagyobb lesz, mint 1. Ezekben az esetekben ki lehet számítani a k 2 konzervatív becslését és a BMF felső határát.
A tisztulási fázis azon adatpontjainak felhasználásával, ahol a koncentrációt mérték, az első »nem érzékelt« koncentrációval (a meghatározási határon megállapított koncentráció) bezárólag, a lineáris regresszió (a természetes alapú logaritmusra transzformált koncentrációs adatok az idő függvényében) megadja a k 2 becslését Az ilyen típusú esetek tekintetében valószínű, hogy csak két adatpontot vonnak be (pl. a tisztulás 1. és 2. mintavételi napja), és ezt követően a k 2 megbecsülhető az 5. függelék A5.22. egyenletének felhasználásával. Ezt a becsült k 2 értéket lehet használni az asszimilációs hatékonyság A7.1. egyenlet szerinti becsléséhez, ahol az egyenletben szereplő C 0,d értéket a mért nulla időpillanati koncentrációval (C 0,m) lehet helyettesíteni azokban az esetekben, ahol a C 0,d-t egyértelműen jóval magasabbra becsülik, mint amit a vizsgálattal el lehetett volna érni. Ha a C0,m nem mérhető, a halszövetekben megfigyelhető érzékelési határt kell alkalmazni. Ha egyes esetekben az α érték > 1, az asszimilációs hatékonyságot legrosszabb esetben 1-nek kell feltételezni.
A legnagyobb BMFK ezt követően megbecsülhető az A7.4. egyenlettel, és azt »jóval kisebb mint« (<<) értékként kell megadni. Ha például 3 %-os etetési aránnyal végeznek vizsgálatot, a tisztulási felezési idő pedig kevesebb, mint három nap, a legrosszabb esetre jellemző α = 1, akkor a BMFK valószínűleg körülbelül 0,13 alatt lesz. Tekintve e becslés célját és azt a tényt, hogy az értékek jellegüket tekintve konzervatívak lesznek, nem szükséges azokat korrigálni a növekedés okozta hígulásra, illetve a hal és a táp lipidtartalmára tekintettel.
8. függelék
A KÍSÉRLETI BCF-EK ÉTRENDI EXPOZÍCIÓS VIZSGÁLAT SORÁN GYŰJTÖTT ADATOK ALAPJÁN TÖRTÉNŐ BECSLÉSÉT SZOLGÁLÓ MEGKÖZELÍTÉSEK
Az étrendi módszer azért került be ebbe a vizsgálati módszerbe, hogy vizsgálni lehessen olyan anyagok bioakkumulációját, amelyek gyakorlatilag a vízi expozíciós módszerrel nem vizsgálhatók. A vízi expozíciós módszer biokoncentrációs tényezőt ad, míg az étrendi módszer közvetlenül tájékoztat az etetés biomagnifikációs potenciáljáról. Számos kémiai biztonsági rendszerben a vízi biokoncentrációval kapcsolatos információra van szükség (például a kockázatértékelésben és a globálisan harmonizált osztályozási rendszerben). Éppen ezért az étrendi vizsgálat során generált adatokat fel kell használni a vízi expozíciós módszer szerint lefolytatott vizsgálatokkal összehasonlítható biokoncentrációs tényező becslésére ( 53 ). Ez a szakasz kifejti azokat a megközelítéseket, amelyeket követni lehet ennek elvégzéséhez, ugyanakkor elismeri az e becslésekben rejlő hiányosságokat is.
Az étrendi vizsgálat méri a tisztulást, hogy megadja a tisztulási sebességi állandót, k 2. Ha a rendelkezésre álló adatok alapján felvételi sebességi állandó becsülhető olyan helyzetben, amikor a halat vízen keresztül tették ki a vizsgálati anyagnak, megbecsülhető a kinetikus BCF.
A felvételi sebességi állandó vizsgálati anyagnak való vízi expozíció tekintetében történő becslése számos feltevésre épül, amelyek közül bármelyik hozzájárulhat a becslés bizonytalanságához. Emellett a BCF becslésének e megközelítése feltételezi, hogy a teljes tisztulási sebesség (ideértve az olyan hozzájáruló tényezőket, mint a testben való megoszlás és az egyedi tisztulási folyamatok) független a vizsgálati anyag által a test anyagterhelésének előidézéséhez használt expozíciós módszertől.
Az e becslési megközelítésben rejlő főbb feltételezések az alábbiak szerint foglalhatók össze:
Az étrendi felvételt követő tisztulás ugyanolyan, mint a vízi expozíciót követő tisztulás egy adott anyag tekintetében.
A vízből való felvétel elsőrendű kinetikát követ.
A felvétel becslésére használt módszertől függően:
— a felvétel korrelálható kizárólag a hal tömegével
— a felvétel korrelálható kizárólag az anyag oktanol-víz megoszlási együtthatójával
— a felvétel korrelálható a hal tömegének és az anyag oktanol-víz megoszlási együtthatójának kombinációjával
— a felvételt a vízi expozíciós vizsgálatban a gyakorlatban esetleg befolyásoló tényezők, mint az anyag biológiai hasznosíthatósága, a készülékre való lerakódása, a molekulaméret stb. csekély hatással járnak
— és döntően:
A felvétel becslési módszerének kifejlesztéséhez használt adatbázis (»oktatóanyag«) reprezentatív a vizsgálat alá vont anyag szempontjából.
A nyilvánosság számára hozzáférhető szakirodalom több publikációjában szerepelnek egyenletek, amelyek a hal által a vízből a kopoltyún keresztül történő felvételt egy anyag oktanol-víz megoszlási együtthatójához, a haltömeghez (1) (2) (3) (4), a térfogathoz és/vagy a lipidtartalomhoz, a membrán permeációjához/diffúziójához (5) (6), a hal légcsere-térfogatához (7) kapcsolják, és amelyeket illékonysági/anyagmérleg-megközelítésből származtatnak (8) (9) (10). Ezzel összefüggésben e módszereket Crookes és Brooke (11) értékeli részletesen. Barbernek (12) az étrendi felvételen alapuló bioakkumuláció modellezésére összpontosító publikációja szintén hasznos e tekintetben, mivel adatokat tartalmaz a kopoltyún keresztüli felvétel sebességi modelljeiből. A 2004-es étrendi protokoll (13) háttérdokumentumának egy szakaszát is e szempontnak szentelték.
E modellek legtöbbjét korlátozott adatbázisok felhasználásával vezették le. Az olyan modellek esetében, ahol rendelkezésre állnak a modell kifejlesztéséhez használt adatbázisok részletei, úgy tűnik, hogy az alkalmazott anyagok hasonló szerkezetűek vagy hasonló osztályba tartoznak (a rendeltetést tekintve, pl. szerves klórtartalmú anyagok). Ez is hozzáadódik ahhoz a bizonytalansághoz, amely egy adott modell másfajta anyag felvételi sebességi állandójának előrejelzésére történő használatában rejlik, a vizsgálatspecifikus megfontolások, mint a faj, a hőmérséklet stb. mellett.
A rendelkezésre álló módszerek áttekintése (11) kiemelte, hogy egyik módszer sem »helytállóbb« a másiknál. Éppen ezért az alkalmazott modellt egyértelműen indokolni kell. Ahol több olyan módszer áll rendelkezésre, amelynek a használata indokolható, körültekintőnek tűnik több k 1 (és így BCF) becslés bemutatása, illetve k 1 (és BCF) értéktartományok megadása a többféle felvételi becslési módszer szerint. Ugyanakkor, tekintettel a modelltípusokban és az azok kidolgozásához használt adatsorokban rejlő különbségekre, az e különbözőképpen származtatott becslések átlagértékének alkalmazása nem mindig helyénvaló.
Egyes kutatók azt javasolták, hogy a BCF ilyen becsléseit korrigálják a biológiai hasznosíthatóságra tekintettel, hogy figyelembe vegyék az anyag oldott szerves szénre (DOC) való adszorpcióját a vízi expozíciós feltételek mellett, és így összhangba hozzák a becslést a vízi expozíciós vizsgálatok eredményeivel (pl. (13) (14)). Ez a korrekció ugyanakkor nem feltétlenül helytálló, tekintettel a vízi expozíciós vizsgálathoz »a legrosszabb eset« becslése vonatkozásában szükséges alacsony DOC-szintekre (azaz a biológiailag hasznosítható anyagok aránya az oldatban mért anyagokhoz). A nagymértékben víztaszító anyagok esetében a kopoltyún keresztül történő felvétel korlátozott lehet a kopoltyúfelülethez közeli passzív diffúzió sebessége miatt, ebben az esetben lehetséges, hogy a korrekció ezt a hatást veszi figyelembe, és nem azt, amelyre eredetileg szánták.
Tanácsos azokra a módszerekre összpontosítani, amelyekhez olyan ráfordításokra van szükség, amelyek esetében azonnal rendelkezésre állnak adatok az itt bemutatott étrendi vizsgálatban vizsgált anyagok vonatkozásában (azaz a log KOW, a haltömeg). Összetettebb ráfordításokat igénylő más módszerek is alkalmazhatók, de további mérésekre lehet szükség a vizsgálat során, vagy részletesen ismerni kell a vizsgálati anyagot, illetve a halfajt, amely információ lehet, hogy nem széles körben elérhető. Emellett a modell megválasztását befolyásolhatja a validálási szint és az alkalmazhatósági terület (az áttekintés és a különböző módszerek összehasonlítása tekintetében lásd a (11) hivatkozást).
Szem előtt kell tartani, hogy az eredményül adódó k 1 becslés és a becsült BCF bizonytalan, és azt a bizonyító erő elemzésén alapuló megközelítés szerint kell kezelni a származtatott BMF-fel és az anyag paramétereivel (pl. molekulaméret) együtt, hogy átfogó képet lehessen kapni az anyag bioakkumulációs potenciáljáról. E paraméterek értelmezése és alkalmazása a szabályozói kerettől függhet.
SZAKIRODALOM
(1) Sijm D.T.H.M., Pärt P. and Opperhuizen A. (1993), The influence of temperature on the uptake rate constants of hydrophobic compounds determined by the isolated perfused gills of rainbow trout (Oncorhynchus mykiss). Aquat. Toxicol. 25: 1-14.
(2) Sijm D.T.H.M., Verberne M.E., Part P. and Opperhuizen A. (1994), Experimentally determined blood and water flow limitations for uptake of hydrophobic compounds using perfused gills of rainbow trout (Oncorhynchus mykiss): Allometric applications. Aquat. Toxicol. 30: 325-341.
(3) Sijm D.T.H.M., Verberne M.E., de Jonge W.J., Pärt P. and Opperhuizen A. (1995), Allometry in the uptake of hydrophobic chemicals determined in vivo and in isolated perfused gills. Toxicol. Appl. Pharmacol. 131: 130-135.
(4) Barber M.C. (2003), A review and comparison of models for predicting dynamic chemical bioconcentration in fish. Environ. Toxicol. Chem. 22: 1963-1992.
(5) Opperhuizen A. (1986), Bioconcentration of hydrophobic chemicals in fish, in Aquatic Toxicology and Environmental Fate, STP 921, Poston, T.M. and Purdy, R., Editors. American Society for Testing and Materials, Philadelphia, PA, USA: 304-315.
(6) Arnot J.A. and Gobas F.A.P.C. (2004), A food web bioaccumulation model for organic chemicals in aquatic ecosystems. Environ. Toxicol. Chem. 23: 2343-2355.
(7) Thomann R.V. (1989), Bioaccumulation model of organic chemical distribution in aquatic food chains. Environ. Sci. Technol. 23: 699-707.
(8) Hendriks A.J., van der Linde A., Cornelissen G. and Sijm D.T.H.M. (2001). The power of size. 1. Rate constants and equilibrium ratios for accumulation of organic substances related to octanol-water partition ratio and species weight. Environ. Toxicol. Chem. 20: 1399-1420.
(9) Campfens J. and Mackay D. (1997), Fugacity-based model of PCB bioaccumulation in complex aquatic food webs. Environ. Sci. Technol. 31: 577-583.
(10) Arnot J.A. and Gobas F.A.P.C. (2003), A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb. Sci. 22: 337-345.
(11) Crookes M. and Brooke D. (2010), Estimation of fish bioconcentration factor (BCF) from depuration data. Draft Report. Environmental Agency, Bristol, UK.
(12) Barber M.C. (2008), Dietary uptake models used for modelling the bioaccumulation of organic contaminants in fish. Environ. Toxicol. Chem. 27: 755-777
(13) Anonymous (2004), Background document to the fish dietary study protocol, document submitted to the TC-NES WG on PBT.
(14) Gobas F. and Morrison H. (2000), Bioconcentration and biomagnification in the aquatic environment, in Handbook of property estimation methods for chemicals, Boethling, R.S. and Mackay, D., Editors. Lewis Publishers, Boca Racton, FL, USA: 189-231.
”
(17) A C. részben a C.20. fejezet helyébe a következő szöveg lép:
„C.20. Daphnia magnán végzett reprodukciós vizsgálat
BEVEZETÉS
Ez a vizsgálati módszer egyenértékű az OECD 211. vizsgálati iránymutatásában (2012) leírt módszerrel. Az OECD iránymutatásait időszakonként felülvizsgálják a tudományos fejlődés fényében. A reprodukciós vizsgálatra vonatkozó 211. iránymutatás alapját a 202. vizsgálati iránymutatás (1984) II. része képezi, amely a Daphnia-fajok reprodukciós vizsgálatával foglalkozik. Általánosan elismert, hogy az említett 202. vizsgálati iránymutatásnak megfelelően végrehajtott vizsgálatokból nyert adatok eltérőek lehetnek. Ennek nyomán jelentős erőfeszítést tettek e változatosság okainak meghatározása érdekében, egy jobb vizsgálati módszer kidolgozásának céljával. A 211. vizsgálati iránymutatás ezen 1992-ben (1), 1994-ben (2) és 2008-ban (3) folytatott kutatási tevékenység, laboratóriumok közötti összehasonlítás és validálási vizsgálatok eredménye.
A reprodukciós vizsgálati iránymutatás eredeti verziója (202. vizsgálati iránymutatás, 1984) és második verziója (211. vizsgálati iránymutatás, 1998) közötti alapvető különbségek a következők:
— a vizsgálat során használni ajánlott faj a Daphnia magna;
— a vizsgálat időtartama 21 nap;
— a félstatikus vizsgálatoknál a vizsgálati koncentrációnként használt állatok száma a legalább 40, lehetőség szerint négy 10-es csoportra osztott egyedről legalább 10, elkülönítve tartott állatra csökken (jóllehet, különböző tervek alkalmazhatók az átfolyásos vizsgálatoknál);
— konkrétabb ajánlások készültek a vizsgálati közeg és az etetési körülmények vonatkozásában.
— a reprodukciós vizsgálati iránymutatás második verziója (211. vizsgálati iránymutatás, 1998) és e verzió közötti alapvető különbségek a következők:
— a szöveg egy 7. függelékkel egészül ki, amely bemutatja az újszülött ivara igény szerinti meghatározásának eljárását. E vizsgálati módszer korábbi verzióival összhangban az ivararány opcionális végpont.
— az egy túlélő szülőre jutó élő utódok hatásváltozójának száma kiegészül egy további, a Daphnia szaporodására vonatkozó hatásváltozóval, azaz a vizsgálat elején meglévő egy Daphnia szülőre jutó, a vizsgálat végén élő utódok teljes számával, az elemzésből kizárva a szülők baleseti és/vagy véletlenszerű elhullását. E további hatásváltozó hozzáadásának célja, hogy e hatásváltozót összhangba lehessen hozni a gerinctelenekre vonatkozó más reprodukciós vizsgálati módszerekkel. Emellett e hatásváltozóval összefüggésben e vizsgálati módszer keretében lehetőség van egy hibaforrás, azaz a véletlenszerű és/vagy baleseti szülői elhullás kiiktatására, amennyiben bekövetkezik szülői elhullás az expozíciós időszakban.
— a vizsgálati tervre és az eredmények kezelésére vonatkozóan további statisztikai útmutatást foglaltak a szövegbe mind az ECx (pl. EC10 vagy EC50), mind a NOEC/LOEC megközelítés tekintetében.
— határérték-vizsgálat is bevezetésre került
A használt fogalmak meghatározását az 1. függelék tartalmazza.
A VIZSGÁLAT ELVE
E vizsgálat elsődleges célja annak felmérése, hogy a vegyi anyagok milyen hatást gyakorolnak a Daphnia magna reprodukciós teljesítményére. Ebből a célból fiatal, a vizsgálat kezdetekor 24 órásnál nem idősebb nőstény Daphniákat (a szülőket) a vízhez különféle koncentrációszintekben adagolt vizsgálati vegyi anyag hatásának kell kitenni. A vizsgálat időtartama 21 nap. A vizsgálat végén fel kell mérni az élő utódok teljes számát. A szülők reprodukciós teljesítményét más módokon is ki lehet fejezni (pl. az első utód megjelenésének napjától számítva a naponta egy állatra jutó élő utódok száma), ezt azonban a vizsgálat végén élő utódok teljes száma mellett, kiegészítésként fel kell tüntetni a jelentésben. A félstatikus vizsgálat más, gerinctelenekre vonatkozó reprodukciós vizsgálati módszerekhez képest egyedi kialakítása miatt lehetőség van az egyes szülőkre egyenként jutó élő utódok számának megállapítására is. Ez a gerinctelenekre vonatkozó más reprodukciós vizsgálati módszerekkel szemben lehetővé teszi, hogy amennyiben a szülő balesetszerűen és/vagy véletlenszerűen elpusztul a vizsgálati időszakban, szaporulatát ki lehessen venni az adatok értékeléséből. Így amennyiben szülői elhullás következik be a vegyi anyagnak kitett párhuzamosokban, vizsgálni kell, hogy a mortalitás koncentráció-válasz mintázatot követ-e, azaz hogy a válaszban jelentős regresszió tapasztalható-e a vizsgálati vegyi anyag koncentrációjának függvényében, pozitív meredekség mellett (a Cochran–Armitage-féle trendpróbához hasonló statisztikai vizsgálat alkalmazható erre a célra). Ha a mortalitás nem koncentráció-válasz mintázatot követ, azokat a párhuzamosokat, amelyeknél szülői elhullás tapasztalható, ki kell venni a vizsgálati eredmény elemzéséből. Ha a mortalitás koncentráció-válasz mintázatot követ, a szülői elhullást a vizsgálati vegyi anyag hatásának kell tulajdonítani, és a párhuzamosokat nem szabad kivenni az elemzésből. Ha a vizsgálat során a szülő nem megfelelő bánásmód vagy baleset miatt balesetszerűen, illetve a vizsgálati vegyi anyag hatásával össze nem függő, meg nem magyarázható váratlan esemény következtében véletlenszerűen pusztul el, illetve ha a szülőről kiderül, hogy hímivarú, a párhuzamost ki kell venni az elemzésből (lásd még az 51. pontban). A vizsgálati vegyi anyag reprodukciós teljesítményre gyakorolt toxikus hatását ECx-ben kell megadni úgy, hogy az adatokat nem lineáris regresszióval egy megfelelő modellbe illesztik, hogy meg lehessen becsülni azt a koncentrációt, amely x % csökkenést okoz a reprodukciós teljesítményben; illetve vagylagosan NOEC/LOEC értékben kell kifejezni (4). A legalacsonyabb használt hatásos koncentrációnak (pl. EC10) lehetőség szerint a vizsgálati koncentrációk tartományain belül kell elhelyezkednie, ami azt jelenti, hogy ezt az értéket interpolációval és nem extrapolációval kell kiszámítani.
A jelentésben a szülők túlélési arányát és az első ivadékok megjelenésének idejét is fel kell tüntetni. Vizsgálni lehet továbbá a vegyi anyag más paraméterekre pl. a növekedésre (testhossz) gyakorolt hatásait is, és lehetőség szerint a populáció belső növekedési ütemét (lásd a 44. pontot).
A VIZSGÁLATI VEGYI ANYAGRA VONATKOZÓ INFORMÁCIÓK
A Daphnia magna fajjal végzett akut toxicitási vizsgálatok eredményei (lásd e melléklet C.2. fejezetét: Daphnia-fajok akut immobilizációs vizsgálata) hasznosak lehetnek a reprodukciós vizsgálatok során a vizsgálati koncentrációk megfelelő tartományának kiválasztásában. Ismerni kell a vizsgálati vegyi anyag vízoldékonyságát és gőznyomását, és a vizsgálati oldatokban lévő vegyi anyag mennyiségi meghatározásához rendelkezni kell egy olyan megbízható analitikai módszerrel, amelynél ismert a visszanyerési hatékonyság és meghatározási határ.
A vizsgálati vegyi anyagra vonatkozó azon információkhoz, amelyek hasznosak lehetnek a vizsgálati körülmények megállapításához, tartozik még a vegyi anyag szerkezeti képlete, tisztasága, fénystabilitása, stabilitása vizsgálati körülmények között, a pKa és Pow értékek, valamint a biológiai lebonthatóságra vonatkozó vizsgálat eredményei is (lásd e melléklet C.4. fejezetét a gyors biológiai lebonthatóság meghatározásáról, illetve a C.29. fejezetet a gyors biológiai lebonthatóságról – CO2 légmentesen lezárt edényekben).
A VIZSGÁLAT ÉRVÉNYESSÉGE
A vizsgálat érvényességéhez az alábbi teljesítménykritériumoknak kell teljesülniük a kontrollcsoport(ok)ban:
— a vizsgálat végén a szülők (nőstény Daphnia) mortalitása nem haladja meg a 20 %-ot,
— a vizsgálat végén még élő szülők élő szaporulatának átlagos száma ≥ 60.
Megjegyzés: Ugyanez az érvényességi kritérium (20 %) alkalmazható a baleseti és véletlenszerű szülői elhullásra a kontrollcsoportokban, valamint a vizsgálati koncentrációk mindegyike tekintetében.
A MÓDSZER ISMERTETÉSE
Felszerelés
A vizsgálati edények és minden más, a vizsgálati oldatokkal közvetlenül érintkező más felszerelések üvegből vagy más, kémiailag közömbös anyagból készülnek. A vizsgálati edények általában üveglombikok.
Ezenfelül szükség lehet az alábbi berendezések némelyikére vagy mindegyikére:
— oxigénmérő (mikroelektróddal vagy más olyan berendezéssel, amelynek a rendeltetése oldott oxigén mérése csekély mennyiségű mintában);
— megfelelő hőmérséklet-szabályozó készülék;
— pH-mérő;
— a vízkeménységet meghatározó készülékek;
— a víz teljes szervesszén-tartalmának (TOC) vagy a kémiai oxigénigénynek (KOI) a meghatározására alkalmas készülékek;
— megfelelő berendezés a fény szabályozására és intenzitásának mérésére.
Vizsgálati szervezet
A vizsgálat során használandó állatfaj a Daphnia magna Straus ( 54 ).
A klónt lehetőleg genotípusos meghatározással kell beazonosítani. Kutatások (1) kimutatták, hogy az A. Klón (amely a franciaországi IRCHA-ból származik) (5) reprodukciós teljesítménye következetesen kielégíti az e vizsgálati módszerben leírt feltételek mellett tenyésztett, a vizsgálatot túlélő egyes szülőkre átlagosan jutó ≥ 60 utód érvényességi kritériumot. Emellett azonban más klónok is elfogadhatók, feltéve, hogy a Daphnia tenyészetről kimutatható, hogy kielégíti a vizsgálat érvényességi kritériumait.
A vizsgálat kezdetekor az állatok nem lehetnek 24 óránál idősebbek, és nem származhatnak az első szaporulatból. Egészséges törzstenyészetből kell származniuk (azaz nem szabad stressz jeleit mutatniuk, ilyen például magas mortalitás, hímek és ephippiumok jelenléte, az első szaporulat késedelme, színtelen állatok stb.). A törzstenyészet állatait a vizsgálat céljaira alkalmazandókhoz hasonló tenyésztési körülmények között kell tartani (megvilágítás, hőmérséklet, közeg, táplálék és állatok mennyisége térfogategységre számolva). Ha a vizsgálat során használandó tenyészközeg jellemzői eltérnek azon közeg jellemzőitől, amelyben a Daphniákat szokásos módon tenyésztik, akkor helyénvaló egy szokásosan mintegy háromhetes akklimatizációs időszak biztosítása a vizsgálat előtt (azaz egy generációnyi idő), a szülők stresszmentesítése érdekében.
Vizsgálati közeg
Javasolt egy teljes körűen meghatározott közeg használata a vizsgálat során. Így elkerülhető az adalékanyagok (pl. alga, talajkivonatok) használata, amelyeket nehéz jellemezni, és mindez elősegíti a laboratóriumok közötti szabványosítás lehetőségét. E célra az Elendt M4 (6) és M7 közeg (lásd a 2. függeléket) bizonyult alkalmasnak. Azonban másfajta közegek (pl. (7) és (8)) is elfogadhatók, feltéve, hogy a Daphnia tenyészet teljesítménye bizonyíthatóan kielégíti a vizsgálat érvényességi kritériumait.
Nem definiált adalékanyagokat tartalmazó közegek használata esetén az ilyen adalékanyagokat egyértelműen meg kell határozni, és információkat kell adni a Vizsgálati jegyzőkönyvben az összetételükről és különösen a széntartalmukról, mert az hozzájárulhat az alkalmazott etetéshez. Javasolt a szerves adalékanyagot tartalmazó törzsoldat teljes szervesszén-tartalmának (TOC) és/vagy a kémiai oxigénigényének (KOI) meghatározása, és annak becslése, hogy ez mennyivel járul hozzá az elkészített vizsgálati közeg TOC/KOI tartalmához. Javasolt továbbá a közeg (algák hozzáadása előtti) TOC szintjét 2 mg/l alatt tartani (9).
Fémtartalmú vegyi anyagok vizsgálatakor fontos annak felismerése, hogy a vizsgálati közeg tulajdonságai (pl. keménységi fok, kelátképző képesség) hatással lehetnek a vizsgálati vegyi anyag toxicitására. Emiatt kívánatos a teljes körűen meghatározott közeg használata. Jelenleg azonban a Daphnia magna hosszú távú tenyésztésére alkalmasnak ítélt, teljes körűen meghatározott közeg egyedül az Elendt M4 és M7. Mindkét közeg tartalmaz EDTA kelátképző szert. Az eddigi vizsgálatok (2) kimutatták, hogy – szemben az EDTA-t egyáltalán nem tartalmazó közegekkel – a kadmium »látszólagos toxicitása« általában alacsonyabb, amennyiben a reprodukciós vizsgálatot az M4 és M7 közegben végzik el. Ezért az M4 és M7 használata nem javasolt a fémtartalmú vegyi anyagok vizsgálatához, és célszerű kerülni az ismert kelátképző szereket tartalmazó másfajta közegek használatát is. A fémtartalmú vegyi anyagok vizsgálatához tanácsos alternatív közeg használata, mint pl. az EDTA-t nem tartalmazó, ASTM szerint előállított kemény édes mesterséges víz (9). Az ASTM szerint előállított kemény édes mesterséges víz és a tengerialga-kivonat e keveréke (10) alkalmas a Daphnia magna (2) hosszú távú tenyésztésére.
Az oldott oxigén koncentrációját a vizsgálat kezdetekor és a vizsgálat során mindvégig 3 mg/l felett kell tartani. A pH-értéknek a 6–9 közötti tartományba kell esnie, és az nem változhat egyik vizsgálat során sem 1,5 egységnél nagyobb mértékben. Javasolt a 140 mg/l (CaCO3) vízkeménység választása. Az e szintet elérő és ezt meghaladó feltételek mellett elvégzett vizsgálatok bizonyították a reprodukciós teljesítmény összhangját az érvényességi kritériumokkal (11) (12).
Vizsgálati oldatok
A kiválasztott koncentrációknak megfelelő vizsgálati oldatokat rendszerint a törzsoldat hígításával készítik el. A törzsoldatot lehetőleg a vizsgálati vegyi anyagnak a vizsgálati közegbe mechanikai eszközök, pl. keverő, ultrahang vagy más megfelelő módszer segítségével történő bekeverésével vagy hozzákeverésével kell elkészíteni, lehetőség szerint oldószer vagy diszpergálószer felhasználása nélkül. A vizsgálati szervezetek hozzáadása előtt a vizsgálati rendszereket lehetőség szerint annyi ideig kell kitenni a vizsgálati vegyi anyag vizsgálat során alkalmazandó koncentrációinak, amennyi a stabil expozíciós koncentrációk fenntartásának bizonyításához előírt. Ha a vizsgálati vegyi anyag nehezen oldható vízben, az OECD nehezen vizsgálható anyagok kezelésére vonatkozó iránymutatását kell követni (13). Az oldószerek vagy diszpergálószerek használatát kerülni kell, de azokra szükség lehet az adagolás szempontjából megfelelő koncentrációjú törzsoldat elkészítéséhez.
A vizsgálati koncentrációkon kívül egy hígítóvíz-kontrollt (megfelelő párhuzamosokkal) és – ha elkerülhetetlen – egy oldószert tartalmazó kontrollt (megfelelő párhuzamosokkal) kell működtetni. A vizsgálat során csak olyan oldószer vagy diszpergálószer alkalmazható, amely igazoltan nem gyakorol jelentős hatást vagy csak minimális hatást gyakorol a hatásváltozóra. Az alkalmas oldószereket (pl. aceton, etanol, metanol, dimetil-formamid és trietilén-glikol), valamint az alkalmas diszpergálószereket (pl. Cremophor, RH40, 0,01 %-os metilcellulóz és a HCO-40) a (13) irodalom sorolja fel. Amennyiben oldószert vagy diszpergálószert használnak, annak végső koncentrációja nem lehet nagyobb 0,1 ml/l-nél (13), és annak minden vizsgálati edényben azonosnak kell lennie, a hígítóvíz-kontrolltartályt kivéve. Törekedni kell azonban az ilyen oldószerek koncentrációjának minimalizálására.
VIZSGÁLATI ELJÁRÁS
Az expozíció körülményei
Időtartam
A vizsgálat időtartama 21 nap.
Betelepítés
A szülőket elkülönítetten tartják, vizsgálati edényenként egyesével, edényenként általában 50–100 ml közegben (a Daphnia magna tekintetében; egyes kisebb Daphnia-fajok esetében, mint pl. a Ceriodaphnia dubia, kisebb mennyiség is elegendő lehet), kivéve, ha a vizsgálathoz átfolyásos vizsgálati tervre van szükség.
Néha szükségessé válhat nagyobb térfogatok használata a vizsgálati vegyi anyag koncentrációjának meghatározására használt analitikai eljárás követelményeinek a teljesítése érdekében, de megengedett a párhuzamosok összevonása is kémiai analízis céljára. Amennyiben 100 ml-nél nagyobb térfogatot használnak, akkor szükségessé válhat a Daphniáknak adott tápadag növelése, a megfelelő táplálékmennyiség és az érvényességi kritériumok betartásának biztosítása érdekében.
Kísérlethez felhasznált állatok
A félstatikus vizsgálatok esetében minden egyes koncentrációszintnél legalább tíz, egyedileg elhelyezett állatra, továbbá a kontrollcsoportokban is legalább tíz, egyedileg elhelyezett állatra van szükség.
Az átfolyásos vizsgálatokhoz alkalmasnak bizonyult minden egyes koncentrációszinthez tartozóan negyven állatot négy, egyenként tíz állatból álló csoportba osztani (1). Kisebb számú vizsgálati szervezet is felhasználható, ez esetben koncentrációszintenként minimum 20 állat bevonása javasolt, amelyeket egyenlő létszámban kell elosztani legalább két edényben (pl. négy párhuzamos, egyenként öt darab Daphniával). Megjegyzendő, hogy az olyan vizsgálatok során, ahol az állatokat csoportosan tartják, nem zárható ki egyetlen utód sem a statisztikai elemzésből, ha véletlenszerű vagy baleseti szülői elhullás következik be a szaporodást követően, így ezekben az esetekben a reprodukciós teljesítményt a vizsgálat kezdetekor meglévő egy szülőre jutó élő utódok teljes számában kell kifejezni.
A kezelések vizsgálati edények közötti elosztását és a vizsgálati edények összes későbbi kezelését véletlenszerű sorrendben kell végezni. Az ennek elmulasztásából eredő eltéréseket a koncentrációhatásnak lehet tulajdonítani. Különösen igaz ez, ha a kísérleti egységeket kezelési vagy koncentráció szerinti sorrendben vizsgálják, és ekkor egyes, az idővel összefüggő hatások (mint pl. a kezelő személy fáradtsága vagy más jellegű hibák) jelentősebb hatásokat eredményezhetnek magasabb koncentrációknál. Továbbá, ha a vizsgálati eredményeket valószínűsíthetően befolyásolja a vizsgálat egy kezdeti vagy környezeti vonatkozású feltétele – pl. a laboratóriumon belüli elhelyezés –, akkor fontolóra kell venni a vizsgálat leállítását.
Etetés
A félstatikus vizsgálatoknál lehetőleg naponta kell a tápot beadni, de legalább hetente háromszor (azaz a közeg cseréjével megegyezően). Figyelembe kell venni az expozíciós koncentrációk táp hozzáadása okán történő esetleges hígulását, és lehetőség szerint ezt kellő koncentrációjú algaszuszpenziókkal kell elkerülni. Az ettől való eltéréseket (pl. az átfolyásos vizsgálatoknál) jelezni kell.
A vizsgálat során a szülőknek beadott étrendet lehetőleg a következő élő algasejtekből (egy vagy több felhasználásával) kell összeállítani: Chlorella sp., Pseudokirchneriella subcapitata (korábban Selenastrum capricornutum) és Desmodesmus subspicatus (korábban Scenedesmus subspicatus). A beadott étrendet az egyes szülőknek biztosítandó szerves szén (C) mennyiségére kell alapozni. Kutatások (14) bizonyították, hogy a Daphnia magna esetében a 0,1 és 0,2 mg C/Daphnia/nap közötti adagok elegendőek a vizsgálati érvényességi kritériumokat kielégítő megfelelő szaporulatszám eléréséhez. Az adagolást a vizsgálat időtartama alatt vagy egyenletesen lehet végezni, vagy, amennyiben megfelelőbbnek látszik, akkor kezdetben egy alacsonyabb szint alkalmazható, majd az fokozatosan növelhető, figyelembe véve a szülők növekedésének ütemét. Ebben az esetben is az adagolásnak mindenkor meg kell maradnia a 0,1–0,2 mg C/Daphnia/nap tartományon belül.
Amennyiben helyettesítő méréseket alkalmaznak (pl. algasejtszám vagy fényelnyelés) a tápadagban szükséges széntartalom adagolása érdekében (célszerűségi okokból, hiszen a széntartalom mérése időigényes elfoglaltság), úgy minden egyes laboratóriumnak ki kell dolgoznia a saját nomogramját, amely az algatenyészet széntartalmával kapcsolatos helyettesítő paraméterekre vonatkozik (lásd a 3. függelékben a nomogramok elkészítéséhez adott tanácsokat). A nomogramokat évente legalább egyszer ellenőrizni kell, vagy még gyakrabban, amennyiben időközben megváltoznak az algatenyészeti feltételek. A széntartalom helyettesítő mérésére a fényelnyelés vizsgálata jobb módszernek bizonyult, mint a sejtek száma (15).
A Daphniáknak koncentrált algaszuszpenziót kell adni, hogy minimalizálható legyen az alga tenyészközeg tesztedényekbe átkerülő mennyisége. Algakoncentrátumot centrifugálással lehet nyerni, amit Daphnia tenyészközegben történő reszuszpenzió követ.
Megvilágítás
16 órás megvilágítás 15–20 μE · m–2 · s–1 mértéket meg nem haladó fényerősséggel, amelyet a víz felszínén kell mérni. A luxban kalibrált fénymérő műszereknél a hideg fehér fényre megadott 1 000 –1 500 luxos tartomány felel meg az ajánlott 15–20 μE·m–2 · s–1-es fényerősségnek.
Hőmérséklet
A vizsgálati közeg hőmérsékletének 18–22 °C között kell lennie. Emellett a hőmérséklet – lehetőség szerint – egyik vizsgálat esetében sem változik e tartományon belül 2 °C-nál nagyobb mértékben (pl. 18–20, 19–21 vagy 20–22 °C) napi szinten. Helyes módszer lehet egy további vizsgálati edényt a hőmérséklet alakulásának nyomon követésére beállítani.
Levegőztetés
A vizsgálati edényeket nem szabad a vizsgálat során levegőztetni.
Vizsgálati terv
Dózisbehatároló vizsgálat
Szükség esetén dózisbehatároló vizsgálatot kell végezni például a vizsgálati vegyi anyag ötfajta koncentrációjával és két párhuzamossal minden egyes kezelt és kontrolltenyészet vonatkozásában. A Daphnia és/vagy más vízi szervezetekkel szembeni akut toxicitásra vonatkozó, a hasonló vegyi anyagokkal folytatott vizsgálatokból vagy a szakirodalomból nyert további információ hasznos lehet a dózisbehatároló vizsgálatban alkalmazandó koncentrációk tartományának meghatározásában.
A dózisbehatároló vizsgálat tartama 21 nap vagy a hatásszintek megbízható előrejelzése szempontjából kellően hosszú időtartam. A vizsgálat végén fel kell mérni a Daphnia reprodukcióját. Fel kell jegyezni a szülők számát és az utódok megjelenését.
Meghatározó vizsgálat
Szokásos esetben legalább ötfajta, a hatásos koncentrációt (pl. ECx) magában foglaló vizsgálati koncentrációt kell olyan mértani sorban elrendezni, amelyet 3,2-t meg nem haladó szorzótényező jellemez. Minden vizsgálati koncentrációhoz megfelelő számú párhuzamost kell használni (lásd a 24–25. pontot). Ötnél kevesebb vizsgálati koncentráció használatát indokolni kell. A vegyi anyagokat nem szabad a vizsgálati közegben való oldhatósági határértékük felett vizsgálni. A kísérlet lefolytatása előtt tanácsos a vizsgálati terv statisztikai erejének és a megfelelő statisztikai módszerek használatának figyelembevétele (4). A koncentrációk meghatározása során az alábbiakat kell szem előtt tartani:
i. A reprodukcióra gyakorolt hatásokra vonatkozó ECx becslésekor tanácsos kellően nagy koncentrációértékeket használni az ECx megfelelő konfidenciaszinten történő meghatározása érdekében. A becsült ECx-nek lehetőség szerint a vizsgálati koncentrációk tartományán belül kell elhelyezkednie, így az ECx-et inkább interpolációval és nem extrapolációval kell megállapítani. A későbbi statisztikai elemzés szempontjából előnyös több vizsgálati koncentrációt (pl. 10-et) és az egyes koncentrációk tekintetében kevesebb párhuzamost alkalmazni (pl. 5-öt, így az edények teljes száma állandó lehet), 10 kontrolltenyészettel.
ii. A LOEC és/vagy NOEC érték becslésekor a legalacsonyabb vizsgálati koncentrációnak kellően alacsonynak kell lennie ahhoz, hogy a reprodukciós teljesítmény e koncentrációnál ne legyen lényegesen alacsonyabb, mint a kontrollcsoportban. Ellenkező esetben a vizsgálatot egy csökkentett legalacsonyabb koncentrációszinten meg kell ismételni.
iii. A LOEC és/vagy NOEC érték becslésekor a legmagasabb vizsgálati koncentrációnak kellően magasnak kell lennie ahhoz, hogy a reprodukciós teljesítmény e koncentrációnál lényegesen alacsonyabb legyen, mint a kontrollcsoportban. Ellenkező esetben a vizsgálatot egy megnövelt legmagasabb koncentrációszinten meg kell ismételni, kivéve, ha az eredeti vizsgálatban legmagasabb vizsgálati koncentrációként a krónikus hatások vizsgálatához szükséges maximális vizsgálati koncentrációt (pl. 10 mg/l) alkalmazták.
Ha a dózisbehatároló vizsgálat során a legmagasabb koncentrációnál (pl. 10 mg/l) nem figyelhetők meg hatások, vagy ha a vizsgálati vegyi anyag a más szervezetekre kifejtett toxicitás hiánya és/vagy alacsony felvétel vagy a felvétel hiánya alapján nagyon valószínűsíthetően alacsony toxicitású vagy nem toxikus, a reprodukciós vizsgálatot határérték-vizsgálatként is el lehet végezni pl. 10 mg/l vizsgálati koncentráció és kontrolltenyészet alkalmazásával. Tíz párhuzamost kell használni mind a kezelt csoport, mind a kontrollcsoport esetében. Ha a határérték-vizsgálatot átfolyásos rendszerben kell elvégezni, kevesebb párhuzamos is elegendő. A határérték-vizsgálat lehetőséget biztosít annak igazolására, hogy a határkoncentrációnál nem áll fenn statisztikailag szignifikáns hatás, ha azonban hatásokat jegyeznek fel, általában teljes vizsgálatra van szükség.
Kontrollcsoportok
A vizsgálati anyaggal kezelt vizsgálati sorozatokkal párhuzamosan a vizsgálati közeg egy kontrollcsoport-sorozatát és – adott esetben – egy, oldószert vagy diszpergálószert tartalmazó kontrollcsoport-sorozatot kell beállítani. Ebben az esetben az oldószer vagy diszpergálószer koncentrációjának meg kell egyeznie a vizsgálati vegyi anyagot tartalmazó edényekben használt koncentrációval. Megfelelő számú párhuzamost kell használni (lásd 23–24. pont).
Egy jól végrehajtott vizsgálat során általában a kontrollcsoportban lévő egy szülőre jutó élő szaporulat variációs koefficiense az átlagos szám körül ≤ 25 %; ezt azon vizsgálati terv esetén kell rögzíteni, ha a szülőket elkülönítve tartják a vizsgálat során.
A vizsgálati közeg megújítása
A közeg megújításának gyakorisága a vizsgálati vegyi anyag stabilitásától függ, azonban hetente legalább három csere szükséges. Amennyiben az előzetes stabilitási vizsgálatok (lásd 7. pont) azt mutatták, hogy a vizsgálati vegyi anyag koncentrációja nem stabil (azaz kívül esik a névleges koncentráció 80–120 %-os tartományán, vagy a kiinduláskor mért koncentráció 80 %-a alá csökken) a két megújítás közötti maximális időtartam (azaz három nap) alatt, úgy számba kell venni a vizsgálati közeg gyakoribb megújításának lehetőségét vagy egy átfolyásos vizsgálat alkalmazását.
Amennyiben a közeget félstatikus vizsgálatok során megújítják, akkor a vizsgálati edényekből egy második sorozatot is be kell állítani, és a szülőket pl. egy megfelelő átmérőjű üvegpipetta segítségével kell áthelyezni. A Daphniákkal együtt áthelyezett vizsgálati közeg mennyiségét a minimumra kell csökkenteni.
Megfigyelések
A vizsgálat során tett megfigyelések eredményeit adatlapokon kell rögzíteni (lásd a példákat a 4. és 5. függelékben). Amennyiben más mérések elvégzése is követelmény (lásd 44. pont), akkor további megfigyelések elvégzése is szükséges lehet.
Utódok
Az egyes szülőktől származó utódokat lehetőleg naponta ki kell emelni és meg kell számlálni az első utódnemzedék megjelenésének napjától kezdve, annak megakadályozására, hogy elfogyasszák a szülőknek szánt táplálékot. E módszer alkalmazásában csak az élő utódokat kell megszámlálni, de feljegyezhető az abortált peték és az elhullott utódok száma is.
Mortalitás
Lehetőleg naponta, vagy legalább az utódok megszámlálásával megegyező gyakorisággal fel kell jegyezni a szülő állatok elhullását.
Egyéb paraméterek
Bár e módszert alapvetően a reprodukciós teljesítményre gyakorolt hatások felmérése érdekében dolgozták ki, általa azonban más hatások is kellő részletességgel számszerűsíthetők, statisztikai elemzéseket lehetővé téve. A túlélő szülő reprodukciós teljesítményét, azaz a vizsgálat során túlélő szülőnként született élő utódok számát fel lehet jegyezni. Ezt össze lehet vetni a legfontosabb hatásváltozóval (a vizsgálat kezdetekor meglévő, a vizsgálat során nem véletlen- vagy balesetszerűen elpusztult szülők egyenkénti reprodukciós teljesítményével). Amennyiben szülői elhullás következik be a vegyi anyagnak kitett párhuzamosokban, vizsgálni kell, hogy a mortalitás koncentráció-válasz mintázatot követ-e, azaz hogy a válaszban jelentős regresszió tapasztalható-e a vizsgálati vegyi anyag koncentrációjának függvényében, pozitív meredekség mellett (a Cochran–Armitage-féle trendpróbához hasonló statisztikai vizsgálat alkalmazható erre a célra). Ha a mortalitás nem koncentráció-válasz mintázatot követ, azokat a párhuzamosokat, amelyeknél szülői elhullás tapasztalható, ki kell venni a vizsgálati eredmény elemzéséből. Ha a mortalitás koncentráció-válasz mintázatot követ, a szülői elhullást a vizsgálati vegyi anyag hatásának kell tulajdonítani, és a párhuzamosokat nem szabad kivenni a vizsgálati eredmény elemzéséből. A növekedési ütem mérése igen kívánatos, mert ezzel információk nyerhetők az esetleges szubletális hatásokról, ami hasznos lehet a kizárólag a reprodukciós hatásokra irányuló mérések mellett; a szülők hosszának (azaz a léctüske nélkül mért testhossznak) a mérése javasolt a vizsgálat végén. A többi mérhető vagy számítható paraméter közé tartozik az első utódnemzetség (majd a következő csoportok) megjelenéséig eltelt idő, az egy szülőre jutó utódok száma és mérete, az abortált utódok száma, hím újszülöttek (OECD, 2008) vagy ephippia jelenléte és lehetőség szerint a populáció belső növekedési üteme (a meghatározás tekintetében lásd az 1. függeléket és az újszülöttek ivarának meghatározása tekintetében a 7. függeléket).
Az analitikai meghatározások és mérések gyakorisága
Az oxigénkoncentrációt, a hőmérsékletet, a keménységet és a pH-értékeket hetente legalább egyszer mérni kell, a közeg megújítása előtt és után, a kontrollcsoportokban és a vizsgálati vegyi anyag legmagasabb koncentrációit tartalmazó edényekben.
A vizsgálat során szabályos időközönként meg kell határozni a vizsgálati vegyi anyag koncentrációit.
A félstatikus vizsgálatok során, ahol a vizsgálati vegyi anyag koncentrációja a névleges koncentráció ± 20 százalékos sávján belülre várható (azaz a 80–120 %-os sávon belül; lásd 6., 7. és 39. pont), minimális intézkedésként javasolt a legmagasabb és a legalacsonyabb vizsgálati koncentrációk elemzése frissen elkészített és a megújítás idején meglévő állapotban, a vizsgálat első hete során egy alkalommal (azaz az elemzéseket az azonos oldatból vett mintán kell elvégezni; először, amikor az oldat frissen elkészült, majd a megújítás alkalmával). E meghatározásokat ezt követően legalább hetente egyszer meg kell ismételni.
Az olyan vizsgálatok során, ahol a vizsgálati vegyi anyag koncentrációja nem várható a névleges koncentráció ± 20 százalékos sávján belülre, elemezni kell az összes vizsgálati koncentrációt a frissen elkészült oldatoknál és a megújítás alkalmával. Azonban az olyan vizsgálatok esetében, ahol a vizsgálati vegyi anyag kezdetkor mért koncentrációja nem marad meg a névleges koncentráció ± 20 százalékos sávján belül, viszont elégséges bizonyíték hozható fel annak bemutatására, hogy a kezdeti koncentrációk megismételhetők és stabilak (azaz a kezdeti koncentrációértékek 80–120 %-os tartományán belül vannak), a kémiai jellegű méréseket a vizsgálat 2. és 3. hetében a legmagasabb és a legalacsonyabb vizsgálati koncentrációk meghatározására lehet lecsökkenteni. Mindegyik esetben a vizsgálati vegyi anyag koncentrációinak a megújítást megelőző meghatározását csak minden egyes vizsgálati koncentráció egyetlen párhuzamos edényén kell elvégezni.
Az átfolyásos vizsgálatok esetében megfelelő a félstatikus vizsgálatoknál leírtakhoz hasonló mintavételi eljárás alkalmazása (azonban a »régi« oldatok mérése nem alkalmazható ezen esetben). Az első hét során azonban tanácsos lehet a mintavételi esetek számát megnövelni (pl. három méréssorozatra), a vizsgálati koncentrációk stabilitásának biztosítása érdekében. Az ilyen típusú vizsgálatok esetében a hígítóvíz és a vizsgálati vegyi anyag átfolyási sebességét naponta kell ellenőrizni.
Amennyiben bizonyítható, hogy a vizsgálati vegyi anyag koncentrációja a vizsgálat teljes időtartama alatt mindvégig sikeresen a névleges vagy a kezdetkor mért koncentráció ± 20 százalékán belül marad, akkor az eredményeket a névleges vagy a kezdeti mért értékekre lehet alapozni. Ha a névleges vagy a kezdeti mért koncentrációhoz képest az eltérés nagyobb ± 20 százaléknál, akkor az eredményeket az idővel súlyozott átlaghoz képest lehet kifejezni (a számítási útmutatót lásd a 6. függelékben).
ADATOK ÉS JEGYZŐKÖNYVEZÉS
Eredmények feldolgozása
E vizsgálat célja a vizsgálati vegyi anyag által a reprodukciós teljesítményre gyakorolt hatás meghatározása. Az egy szülőre jutó utódok összlétszámát minden egyes vizsgálati edényre (azaz párhuzamosra) nézve ki kell számítani. Ezenfelül a reprodukció kiszámítható a túlélő szülő szervezet élő szaporulata alapján is. Ugyanakkor az ökológiailag leginkább releváns hatásváltozó az azon szülőkre jutó utódok teljes száma, amelyek nem balesetszerűen ( 55 ) vagy véletlenszerűen ( 56 ) pusztultak el a vizsgálat során. Ha valamely szülő baleset- vagy véletlenszerűen elpusztul a vizsgálat során, vagy kiderül róla, hogy hím, akkor az ilyen párhuzamost ki kell hagyni az elemzésből. Az elemzést ekkor csökkentett számú párhuzamosra kell alapozni. Amennyiben szülői elhullás következik be a vegyi anyagnak kitett párhuzamosokban, vizsgálni kell, hogy a mortalitás koncentráció-válasz mintázatot követ-e, azaz hogy a válaszban jelentős regresszió tapasztalható-e a vegyi anyag koncentrációjának függvényében, pozitív meredekség mellett (a Cochran-Armitage-féle trendpróbához hasonló statisztikai vizsgálat alkalmazható erre a célra). Ha a mortalitás nem koncentráció-válasz mintázatot követ, azokat a párhuzamosokat, amelyeknél szülői elhullás tapasztalható, ki kell venni a vizsgálati eredmény elemzéséből. Ha a mortalitás koncentráció-válasz mintázatot követ, a szülői elhullást a vizsgálati vegyi anyag hatásának kell tulajdonítani, és a párhuzamosokat nem szabad kivenni a vizsgálati eredmény elemzéséből.
Összegezve, ha a hatásokat LOEC és NOEC vagy ECx segítségével fejezik ki, ajánlott a reprodukcióra gyakorolt hatást a fent említett mindkét hatásváltozó alkalmazásával kiszámítani, azaz
— az azon szülőkre jutó utódok teljes száma alapján, amelyek nem pusztultak el baleset- vagy véletlenszerűen a vizsgálat során; valamint
— a túlélő szülőkre jutó élő utódok száma alapján;
és ezt követően végső eredményként az e két hatásváltozó valamelyikének felhasználásával kiszámított NOEC, LOEC vagy ECx értéket alkalmazni.
A statisztikai elemzés alkalmazása, pl. ANOVA-eljárások, a kontrollcsoport kezeléseinek Student-féle t-próba, Dunnett-féle próba, Williams-féle próba vagy lefelé lépegető Jonckheere–Terpstra-próba segítségével történő összehasonlítása előtt ajánlott az adatok transzformációját mérlegelni, ha ez szükséges az adott statisztikai vizsgálat követelményeinek való megfelelés érdekében. Nem paraméteres alternatívaként alkalmazható a Dunn-féle vagy a Mann–Whitney-féle próba. 95 %-os konfidencia-intervallumokat kell számítani az egyedi kezelési átlagokhoz.
A túlélő szülők száma a nem kezelt kontrollokban érvényességi kritérium, és azt dokumentálni kell és fel kell tüntetni a jelentésben. Más ártalmas hatásokat, például az abnormális viselkedést és a toxikológiailag szignifikáns megállapításokat a végleges jelentésben is fel kell tüntetni.
ECx
Az ECx értékeket, ideértve az azokhoz tartozó alsó és felső konfidenciahatárokat, a megfelelő statisztikai módszerek segítségével kell kiszámítani (pl. logisztikai vagy Weibull-függvény, csonkolt Spearman–Karber módszer vagy egyszerű interpoláció). Az EC10, EC50 vagy bármely más ECx kiszámításához a teljes adatállományt regresszióanalízisnek kell alávetni.
NOEC/LOEC
Ha a statisztikai elemzés célja a NOEC/LOEC meghatározása, megfelelő statisztikai módszereket kell alkalmazni az OECD »Aktuális megközelítések az ökotoxicitási adatok statisztikai elemzésében: alkalmazási útmutató« című 54. dokumentuma (4) szerint. Általában a vizsgálati vegyi anyag káros hatásait a kontrollal összehasonlítva egyoldali hipotézisvizsgálattal (p ≤ 0,05) vizsgálják.
A normál eloszlást és a szóródáshomogenitást megfelelő statisztikai próbával pl. Shapiro-Wilk-próbával, illetve Levene-féle próbával (p≤ 0,05) lehet tesztelni. Egyirányú ANOVA és azt követően többszörös összehasonlító próbákat lehet végezni. Többszörös összehasonlítással (pl. Dunnett-féle próba) vagy lefelé lépegető trendpróbákkal (pl.: Williams-féle próba vagy lefelé lépegető Jonckheere–Terpstra-próba) lehet kiszámítani, hogy vannak-e jelentős különbségek (p ≤ 0,05) a kontrollok és a vizsgálati vegyi anyag különböző koncentrációi között (az ajánlott próbát az OECD 54. útmutató dokumentuma (4) szerint kell kiválasztani). Ellenkező esetben nemparaméteres módszereket (pl. a Holm szerint módosított Bonferroni-féle U-próbát vagy a Jonckheere–Terpstra-féle trendpróbát) kell használni a NOEC és a LOEC meghatározására.
Határérték-vizsgálat
Ha határérték-vizsgálatot (a kontroll és egyetlen kezelés összehasonlítása) végeztek, és a paraméteres vizsgálati eljárások előfeltételei (normalitás, homogenitás) teljesülnek, a metrikus válaszokat a Student-féle próbával (t-próba) lehet értékelni. Ha ezek a feltételek nem teljesülnek, akkor a nem egyenlő varianciákat feltételező t-próba (például Welch-féle próba) vagy egy nemparaméteres próba, például a Mann–Whitney-féle U-próba alkalmazható.
A kontrollok (kontroll és oldószeres vagy diszpergálószeres kontroll) közötti szignifikáns különbségek meghatározása céljából az egyes kontrollok párhuzamosait a határérték-vizsgálatnál leírtak szerint kell vizsgálni. Ha ezek a tesztek nem mutatnak ki szignifikáns eltérést, a kontroll és az oldószeres kontroll párhuzamosait össze lehet vonni. Ellenkező esetben az összes kezelést az oldószeres kontrollal kell összehasonlítani.
Vizsgálati jegyzőkönyv
A Vizsgálati jegyzőkönyvnek a következőket kell tartalmaznia:
Vizsgálati vegyi anyag:
— fizikai állapota és releváns fiziko-kémiai tulajdonságai,
— a kémiai azonosítási adatok, beleértve a tisztaságot.
Vizsgálati fajok:
— a klón (meg kell jelölni, ha genetikailag tipizált), a beszállító vagy eredet (amennyiben ismert) és az alkalmazott tenyésztési körülmények; rögzíteni és indokolni kell, ha a Daphnia magnától eltérő fajt használnak.
Vizsgálati körülmények
— az alkalmazandó vizsgálati eljárás (pl. félstatikus vagy átfolyásos, térfogat, az egy literre jutó Daphniák számában kifejezett betelepítés);
— megvilágítási időszak és fényerősség;
— vizsgálati terv (pl. párhuzamosok száma, párhuzamosonkénti szülőszám);
— a felhasznált tenyészközeg részletes leírása;
— hozzáadott szerves anyagok (amennyiben ilyenre sor kerül), beleértve azok összetételét, eredetét, elkészítési módját, a törzsoldat-készítmények TOC/KOI értékeit, a vizsgálati közegben mutatkozó TOC/KOI becslését;
— részletes információk az etetésről, beleértve a mennyiséget (mg C/Daphnia/nap) és az ütemezést (pl. táp(ok) típusa), beleértve az algáknál a speciális elnevezést/fajt, továbbá – amennyiben ismert – a törzset és a tenyésztési körülményeket);
— a törzsoldat elkészítésének módszere és megújításának gyakorisága (az esetleg használt oldószer vagy diszpergálószer megnevezését és koncentrációját meg kell adni).
Eredmények:
— a vizsgálati vegyi anyag stabilitására vonatkozó előzetes vizsgálatok eredményei;
— a névleges vizsgálati koncentrációk és az összes olyan elemzés eredménye, amelyek célja a vizsgálati vegyi anyag vizsgálati edényekben mért koncentrációjának a meghatározása (lásd a mintaadatlapokat az 5. függelékben); az analízis visszanyerési hatékonyságát és a meghatározási határt is fel kell tüntetni a jelentésben;
— a vizsgálati edényekben lévő víz minősége (azaz pH-érték, hőmérséklet, oldottoxigén-koncentráció, TOC és/vagy KOI értékek és keménység, adott esetben) (lásd a mintaadatlapokat a 4. függelékben);
— az élő utódok vizsgálat során történő megjelenésének teljes nyilvántartása minden egyes szülőnél (lásd a mintaadatlapokat a 4. függelékben);
— az elhullott szülők száma és az elhullás bekövetkezésének a napja (lásd a mintaadatlapokat a 4. függelékben);
— a kontrollcsoportbeli reprodukciós teljesítmény variációs koefficiense (a vizsgálat végén élő szülőre jutó élő utódok összlétszámára alapozva);
— az egyes párhuzamosokban az egy szülőre (kivéve a baleset- vagy véletlenszerűen elhullott szülőket) jutó élő utódok teljes számát a vizsgálati vegyi anyag koncentrációjának függvényében ábrázoló grafikon;
— adott esetben az egyes párhuzamosokban az egy túlélő szülőre jutó élő utódok teljes számát a vizsgálati vegyi anyag koncentrációjának függvényében ábrázoló grafikon;
— adott esetben a reprodukció szempontjából megfigyelhető hatást okozó legalacsonyabb koncentráció (LOEC), ideértve az alkalmazott statisztikai eljárásokat és annak feltüntetését, hogy várhatóan milyen hatást tárnak majd fel (ennek érdekében a kísérlet megkezdése előtt erőelemzést lehet végezni), továbbá a reprodukció szempontjából megfigyelhető hatást nem okozó koncentráció (NOEC); azzal kapcsolatos információ, hogy az LOEC és az NOEC kiszámításához melyik hatásváltozót használták (a vizsgálat során baleset- vagy véletlenszerűen el nem pusztult anyai szervezetre jutó élő utódok összes száma, vagy a túlélő anyai szervezetre jutó élő utódok teljes száma), adott esetben a szülők mortalitása tekintetében vett LOEC-t vagy NOEC-t is fel kell tüntetni a jelentésben;
— szükség esetén a reprodukcióra vonatkozó ECx és a konfidencia-intervallum (pl. 90 % vagy 95 %), valamint a számításhoz használt, illesztett modell grafikonja, a koncentráció-válasz görbe meredeksége és a standard hibája;
— más megfigyelt biológiai hatások vagy mérések: a jelentésben fel kell tüntetni minden megfigyelt vagy mért más jellegű biológiai hatást (pl. szülők növekedése), a megfelelő indoklással együtt;
— az előírt vizsgálati módszertől való bármely eltérés magyarázata.
SZAKIRODALOM
(1) OECD Test Guidelines Programme. Report of the Workshop on the Daphnia magna Pilot Ring Test, Sheffield University, U.K., 20-21 March 1993.
(2) OECD (1997). Guidance Document on Acute Inhalation Toxicity Testing. Report of the Final Ring Test of the Daphnia magna Reproduction Test. Environmental Health and Safety Publications, Series on Testing and Assessment No.6. OECD, Paris.
(3) OECD (2008). Guidance Document on Acute Inhalation Toxicity Testing. Validation report for an enhancement of OECD TG 211 Daphnia magna reproduction test. Environmental Health and Safety Publications, Series on Testing and Assessment, No.88. OECD, Paris.
(4) OECD (2006). Current approaches in the statistical analysis of ecotoxicity data: a guidance to application. Environmental Health and Safety Publications, Series on Testing and Assessment Number 54. OECD, Paris.
(5) Baird, D.J., et al. (1991). A comparative study of genotype sensitivity to acute toxic stress using clones of Daphnia magna Straus. Ecotox. and Environ. Safety, 21, 257-265.
(6) Elendt, B.-P. (1990). Selenium deficiency in Crustacea; An ultrastructural approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, 25-33.
(7) EPA (2002). Methods for Measuring the Acute Toxicity of Effluents and Receiving Waters to Freshwater and Marine Organisms. Fifth Edition. EPA/821/R-02/012. U.S. Environmental Protection Agency, Office of Water, Washington, DC. www.epa.gov/waterscience/methods
(8) Vigano, L. (1991). Suitability of commercially available spring waters as standard medium for culturing Daphnia magna. Bull. Environ. Contam. Toxicol., 47, 775-782.
(9) ASTM. (2008) Standard Guide for Conducting Acute Toxicity Tests with Fishes, Macroinvertebrates, and Amphibians. In: Annual Book of ASTM Standards; Water and Environmental Technology, vol. 11.04; ASTM E729 – 96 (2007) American Society for Testing and Materials, Philadelphia, PA
(10) Baird, D.J., et al. (1989). The long term maintenance of Daphnia magna Straus for use in ecotoxicological tests; problems and prospects. In: Proceedings of the 1st European Conference on Ecotoxicology. Copenhagen 1988. (H. Løkke, H. Tyle and F. Bro-Rasmussen. Eds.) pp 144-148.
(11) Parkhurst, B.R., J.L Forte. And G.P. and Wright (1981) Reproducibility of a life-cycle toxicity test with Daphnia magna. Bull. Environ. Contam. and Toxicol., 26: 1-8.
(12) Cowgill, U.M. and Milazzo, D.P. (1990). The sensitivity of two cladocerans to water quality variables: salinity and hardness. Arch. Hydrobiol., 120(2): 185-196.
(13) OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Environmental Health and Safety Publications, Series on Testing and Assessment No. 23. OECD, Paris.
(14) Sims, I.R., S. Watson. and D. Holmes (1993) Toward a standard Daphnia juvenile production test. Environ. Toxicol. and Chem., 12, 2053-2058.
(15) Sims, I. (1993). Measuring the growth of phytoplankton: the relationship between total organic carbon with three commonly used parameters of algal growth. Arch. Hydrobiol., 128, 459-466.
1. függelék
FOGALOMMEGHATÁROZÁSOK
E vizsgálati módszer alkalmazásában a következő fogalommeghatározások alkalmazandók:
Baleseti elhullás : nem szándékoltan bekövetkező váratlan esemény (azaz ismert ok) által előidézett, a vegyi anyaggal össze nem függő elhullás.
Vegyi anyag : anyag vagy keverék.
ECx : a vízben oldott vizsgálati vegyi anyag azon koncentrációja, amely a Daphnia reprodukciójában x % csökkenést okoz meghatározott expozíciós időszak alatt.
Véletlenszerű elhullás : ismeretlen okból bekövetkezett, a vegyi anyaggal össze nem függő elhullás.
A populáció belső növekedési üteme : a populáció növekedésének mértéke, amely a reprodukciós teljesítményből és a korspecifikus pusztulásból tevődik össze (1) (2) (3). Az egyensúlyi populációk esetében ez pontosan nulla. A növekedő populációknál pozitív, a csökkenő populációknál negatív. Ez utóbbi nyilvánvalóan nem fenntartható, és végül kihaláshoz vezet.
Érzékelési határ : a legalacsonyabb koncentráció, amelyet érzékelni lehet, de számszerűsíteni már nem.
Meghatározási határ : a számszerűsíthetően mérhető legalacsonyabb koncentráció.
Megfigyelhető hatást okozó legalacsonyabb koncentráció (LOEC) : azon legalacsonyabb vizsgálati koncentráció, amelynél a kontrollcsoporttal összevetve megfigyelhető a vizsgálati vegyi anyag statisztikailag szignifikáns hatása a reprodukcióra és a szülők mortalitására (p < 0,05-nél) a megfigyelt expozíciós időszakban. Azonban a LOEC-szint feletti valamennyi vizsgálati koncentrációnak olyan ártalmas hatást kell kifejtenie, amely legalább egyenlő a LOEC-szinten megfigyelttel vagy súlyosabb annál. Amennyiben e két feltétel nem teljesíthető, akkor kimerítő magyarázatot kell adni arra, hogy hogyan történt a LOEC (és ennélfogva a NOEC) kiválasztása.
Mortalitás : egy állat akkor tekinthető kimúltnak, ha mozdulatlan, azaz ha nem képes úszni, vagy ha a tesztedény enyhe rázogatása után 15 másodpercen belül nem figyelhető meg mozgás a függelékben vagy az utóbélben. (Más meghatározás használata esetén ezt a hozzá tartozó irodalmi hivatkozással együtt kell megadni.)
Megfigyelhető hatást nem okozó koncentráció (NOEC) : a közvetlenül a LOEC alatti vizsgálati koncentráció, amely – a kontrollcsoporttal való összevetésben – nem fejt ki statisztikailag szignifikáns hatást (p < 0,05) a meghatározott expozíciós időszak alatt.
Utódok : azon fiatal Daphnia-egyedek, amelyek a vizsgálat során születnek a szülőktől.
Szülők : a vizsgálat kezdetén jelen lévő nőstény Daphnia-egyedek, amelyek reprodukciós teljesítménye e vizsgálat tárgyát képezi.
Reprodukciós teljesítmény : a vizsgálati időszakban a túlélő szülőkre jutó élő utódok száma.
Vizsgálati vegyi anyag : bármely, e vizsgálati módszer alkalmazásával vizsgálati anyag vagy keverék.
SZAKIRODALOM
(1) Wilson, E.O. and Bossert, W.H. (1971). A Primer of Population Biology. Sinauer Associates Inc. Publishers.
(2) Poole, R.W. (1974). An Introduction to quantitative Ecology. Mc Graw Hill Series in Population Biology, New York, p 532.
(3) Meyer, J. S., Ingersoll, C. G., McDonald, L.L. and Boyce, M.S. (1986). Estimating uncertainty in population growth rates: Jackknife vs bootstrap techniques. Ecology, 67, 1156-1166.
2. függelék
TELJES KÖRŰEN MEGHATÁROZOTT ELENDT M7 ÉS M4 KÖZEG ELŐÁLLÍTÁSA
Akklimatizálás az Elendt M7 és M4 közeghez
Egyes laboratóriumok nehézségekbe ütköztek, amikor Daphniát próbáltak átvinni M4 (1) és M7 közegbe. Fokozatos akklimatizálással, azaz a saját közegből előbb 30, majd 60, végül 100 százalékos Elendt-közegbe való áthelyezéssel azonban némi sikert értek el. Az akklimatizáció akár egy hónapig is eltarthat.
Előkészítés
Nyomelemek
Először megfelelő tisztaságú (azaz deionizált, desztillált vagy fordított ozmózissal előállított) víz felhasználásával egyedi nyomelemeket tartalmazó, különféle törzsoldatokat (I) kell készíteni. E különféle törzsoldatokból (I) egy második, egyetlen törzsoldat (II) készül, amely már tartalmazza az összes nyomelemet (kombinált oldat), azaz:
|
I. törzsoldat(ok) (egyetlen anyag) |
A vízhez adott mennyiség |
Koncentráció (az M4 közegre vonatkoztatva) |
A II. kombinált törzsoldat elkészítéséhez az I. törzsoldatból az alábbi mennyiséget kell vízhez hozzáadni |
|
|
|
mg/l |
|
ml/l |
|
|
|
|
|
M4 |
M7 |
|
H3BO3 |
57 190 |
20 000 -szeres |
1,0 |
0,25 |
|
MnCl2 · 4 H2O |
7 210 |
20 000 -szeres |
1,0 |
0,25 |
|
LiCl |
6 120 |
20 000 -szeres |
1,0 |
0,25 |
|
RbCl |
1 420 |
20 000 -szeres |
1,0 |
0,25 |
|
SrCl2 · 6 H2O |
3 040 |
20 000 -szeres |
1,0 |
0,25 |
|
NaBr |
320 |
20 000 -szeres |
1,0 |
0,25 |
|
Mo Na2O4 · 2 H2O |
1 260 |
20 000 -szeres |
1,0 |
0,25 |
|
CuCl2 · 2 H2O |
335 |
20 000 -szeres |
1,0 |
0,25 |
|
ZnCl2 |
260 |
20 000 -szeres |
1,0 |
1,0 |
|
CoCl2 · 6 H2O |
200 |
20 000 -szeres |
1,0 |
1,0 |
|
KI |
65 |
20 000 -szeres |
1,0 |
1,0 |
|
Na2SeO3 |
43,8 |
20 000 -szeres |
1,0 |
1,0 |
|
NH4VO3 |
11,5 |
20 000 -szeres |
1,0 |
1,0 |
|
Na2EDTA · 2 H2O |
5 000 |
2 000 -szeres |
— |
— |
|
FeSO4 · 7 H2O |
1 991 |
2 000 -szeres |
— |
— |
|
Mind a Na2EDTA, mind a FeSO4 oldatot külön kell elkészíteni, majd összeönteni és azonnal autoklávban kezelni. Ez a következőt eredményezi: |
||||
|
Fe-EDTA oldat |
|
1 000 -szeres |
20,0 |
5,0 |
M4 és M7 közeg
Az M4 és M7 közeget a II. törzsoldatból, makroelemekből és vitaminokból kell elkészíteni a következőképpen:
|
|
A vízhez adott mennyiség |
Koncentráció (az M4 közegre vonatkoztatva) |
A közeg elkészítéséhez hozzáadott törzsoldat mennyisége |
|
|
|
mg/l |
|
ml/l |
|
|
|
|
|
M4 |
M7 |
|
II. törzsoldat (kombinált nyomelemek) |
|
20-szoros |
50 |
50 |
|
Makroelemek törzsoldatai (egyetlen anyag) |
|
|
|
|
|
CaCl2 · 2 H2O |
293 800 |
1 000 -szeres |
1,0 |
1,0 |
|
MgSO4 · 7 H2O |
246 600 |
2 000 -szeres |
0,5 |
0,5 |
|
KCl |
58 000 |
10 000 -szeres |
0,1 |
0,1 |
|
NaHCO3 |
64 800 |
1 000 -szeres |
1,0 |
1,0 |
|
Na2SiO3 · 9 H2O |
50 000 |
5 000 -szeres |
0,2 |
0,2 |
|
NaNO3 |
2 740 |
10 000 -szeres |
0,1 |
0,1 |
|
KH2PO4 |
1 430 |
10 000 -szeres |
0,1 |
0,1 |
|
K2HPO4 |
1 840 |
10 000 -szeres |
0,1 |
0,1 |
|
Kombinált vitamintörzsoldat |
— |
10 000 -szeres |
0,1 |
0,1 |
|
A kombinált vitamintörzsoldat készítéséhez a 3 vitamint 1 liter vízhez kell adni, a következőképpen: |
||||
|
|
mg/l |
|
|
|
|
Tiamin-hidroklorid |
750 |
10 000 -szeres |
|
|
|
Cianokobalamin (B12) |
10 |
10 000 -szeres |
|
|
|
Biotin |
7,5 |
10 000 -szeres |
|
|
A kombinált vitamintörzsoldatot kis alikvot mennyiségekben, fagyasztott állapotban kell tartani. A közeghez a vitaminokat röviddel a felhasználás előtt kell hozzáadni.
Megjegyzés: A végleges közeg elkészítésekor a sók kicsapódásának elkerülése érdekében az alikvot törzsoldatokat kb. 500–800 ml deionizált vízhez kell adni, majd a mennyiséget fel kell tölteni 1 literre.
Megjegyzés: Az M4 közegről szóló első publikáció itt található: Elendt, B. P. (1990). Selenium deficiency in crustacea; an ultrastructural approach to antennal damage in Daphnia magna Straus. Protoplasma, 154., 25–33.
3. függelék
ÖSSZES SZERVES SZÉN (TOC) MEGHATÁROZÁSA ÉS NOMOGRAM KÉSZÍTÉSE ALGAALAPÚ TÁP TOC-TARTALMÁNAK ÁBRÁZOLÁSÁRA
Elismert tény, hogy az algaalapú táp széntartalmát általában nem közvetlenül kell mérni, hanem olyan helyettesítő paraméterekkel rendelkező korrelációk (azaz nomogramok) alapján, mint pl. az algaszám vagy a fényelnyelés.
A TOC értékét az UV-sugárzásra alapozott vagy a perszulfátos módszerek helyett inkább magas hőmérsékletű oxidáció által célszerű mérni. (Útmutatásul lásd: The Instrumental Determination of Total Organic Carbon, Total Oxygen Demand and Related Determinands 1979, HMSO 1980; 49 High Holborn, London WC1V 6HB).
A nomogram elkészítéséhez az algákat a tenyészközegtől centrifugálással el kell különíteni, amit desztillált vízben való reszuszpenzió követ. A helyettesítő paramétert és a TOC-koncentrációt minden mintában három példányban kell mérni. Kizárólag desztillált vizet tartalmazó vakmintákat kell elemezni, és a TOC-koncentrációt az algát tartalmazó minta TOC-koncentrációjából kell levonni.
A nomogram lineárisan fut a szénkoncentrációk megkövetelt tartományában. A példák alább találhatók.
Megjegyzés: E példákat nem szabad konverzióra használni; alapvető fontosságú, hogy a laboratóriumok elkészítsék a saját nomogramjukat.

Chlorella vulgaris var. viridis (CCAP 211/12).
mg/l száraz tömeg regressziója mg C/l-re vetítve. Félfolyamatos batch tenyésztéssel tenyésztett sejtek desztillált vízben újraszuszpendált koncentrált szuszpenziójából nyert adatok.
x-tengely: a koncentrált algaalapú táplálék mg C/l-ben
y-tengely: a koncentrált algaalapú táp száraz tömege mg/l-ben
Korrekciós együttható – 0,980

Chlorella vulgaris var. viridis (CCAP 211/12).
A sejtszám regressziója mg C/l-re vetítve. Félfolyamatos batch tenyésztéssel tenyésztett sejtek desztillált vízben újraszuszpendált koncentrált szuszpenziójából nyert adatok.
x-tengely: a koncentrált algaalapú táplálék mg C/l-ben
y-tengely: a koncentrált algaalapú táplálék sejtszám/l-ben
Korrekciós együttható – 0,926
Chlorella vulgaris var. viridis (CCAP 211/12).
Az elnyelés regressziója mg C/l-re vetítve (1 cm-es fényúttal). Félfolyamatos batch tenyésztéssel tenyésztett sejtek desztillált vízben újraszuszpendált koncentrált szuszpenziójából nyert adatok.
x-tengely: a koncentrált algaalapú táplálék mg C/l-ben
y-tengely: 1/10 hígítású koncentrált algaalapú táplálék abszorbanciája 440 nm-en
Korrekciós együttható – 0,998
4. függelék
MINTAADATLAP A KÖZEGMEGÚJÍTÁS, FIZIKAI/KÉMIAI FIGYELEMMEL KÍSÉRÉS SORÁN KELETKEZETT ADATOK, ETETÉS, DAPHNIA-REPRODUKCIÓ ÉS SZÜLŐI MORTALITÁS RÖGZÍTÉSÉHEZ
|
Kísérlet sorszáma: |
Kezdőnap: |
|
Klón: |
|
Közeg: |
|
Táp típusa: |
|
Vizsgálati vegyi anyag: |
|
|
Névleges konc.: |
||||||||||||
|
Nap |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
|
|
|
Közegmegújítás (x-szel jelöljük) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (1) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
új |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
régi |
|
|
O2 (mg/l) (1) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
új |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
régi |
|
|
Hőmérséklet (°C) (1) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
új |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
régi |
|
|
Beadott táp (x-szel jelöljük) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Élő utódok száma (2) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Összes |
|
Edény 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Összes |
|
|
Kumulált szülői mortalitás (3) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(*1) Tüntesse fel, hogy melyik edényt használta a kísérlethez (*2) AB-val jegyezze be a megfelelő rovatba az abortált ivadékokat (*3) M-mel jegyezze be a megfelelő rovatba a szülők elhullását |
||||||||||||||||||||||||
5. függelék
MINTAADATLAP KÉMIAI ANALÍZISEK EREDMÉNYEINEK RÖGZÍTÉSÉHEZ
a) Mért koncentrációk
|
Névleges konc. |
1. heti minta |
2. heti minta |
3. heti minta |
|||
|
|
friss |
régi |
friss |
régi |
friss |
régi |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
b) Mért koncentrációk a névleges koncentrációk százalékában
|
Névleges konc. |
1. heti minta |
2. heti minta |
3. heti minta |
|||
|
|
friss |
régi |
friss |
régi |
friss |
régi |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6. függelék
IDŐVEL SÚLYOZOTT ÁTLAG SZÁMÍTÁSA
Idővel súlyozott átlag
Mivel a vizsgálati vegyi anyag koncentrációja a közeg megújításai közötti időintervallumban csökkenhet, szükséges mérlegelni, hogy melyik az a koncentráció, amelyet reprezentatívnak kell kiválasztani azon koncentrációtartomány meghatározása szempontjából, amelynek a Daphnia szülők ki vannak téve. A kiválasztást biológiai és statisztikai megfontolásokra kell alapozni. Például amennyiben úgy tűnik, hogy a reprodukciót főként az alkalmazásra kerülő legmagasabb koncentráció befolyásolja, akkor azt kell alkalmazni. Amennyiben azonban fontosabbnak látszik a toxikus vegyi anyag halmozott vagy hosszabb idő alatt jelentkező hatása, akkor egy átlagos koncentráció választása a célszerűbb. Ebben az esetben az idővel súlyozott átlagkoncentráció a megfelelő, mivel ez figyelembe veszi a pillanatnyi koncentrációnak az idő függvényében történő változásait.
1. ábra
Példa az idővel súlyozott átlagra

Az 1. ábra egy (egyszerűsített) hétnapos, a közeg megújítását a 0., 2. és 4. napra ütemező vizsgálatot mutat be.
— A vékony, cikcakkos vonal ábrázolja a koncentrációt az idő függvényében. A koncentráció visszaesése feltételezhetően egy exponenciális csökkenési folyamatot követ.
— A hat, kis négyzettel jelzett pont jelöli az egyes közegmegújítási időszakok elején és végén mért koncentrációkat.
— A vastag vonal jelzi az idővel súlyozott átlagot.
Az idővel súlyozott átlagot úgy kell kiszámítani, hogy az idővel súlyozott átlag nagysága megegyezzen a koncentrációgörbe alatti területtel. A fenti példa számítási menetét az 1. táblázat mutatja be.
1. táblázat
Az idővel súlyozott átlag számítása
|
Megújítás Szám |
Napok |
Konc. 0 |
Konc. 1 |
Ln(Konc. 0) |
Ln(Konc. 1) |
Terület |
|
1 |
2 |
10,000 |
4,493 |
2,303 |
1,503 |
13,767 |
|
2 |
2 |
11,000 |
6,037 |
2,398 |
1,798 |
16,544 |
|
3 |
3 |
10,000 |
4,066 |
2,303 |
1,403 |
19,781 |
|
Napok száma, összesen: |
7 |
|
|
|
Összterület |
50,092 |
|
|
|
|
|
|
IS átlag |
7,156 |
A napok kifejezés a megújítási folyamat napjainak a számát jelenti.
A Konc. 0 kifejezés az egyes megújítási időszakok kezdetekor mért koncentráció.
A Konc. 1 kifejezés az egyes megújítási időszakok végén mért koncentráció.
Az Ln(Konc. 0) kifejezés a Konc. 0 természetes alapú logaritmusa.
Az Ln(Konc. 1) kifejezés a Konc. 1 természetes alapú logaritmusa.
A terület az egyes megújítási időszakokra megszerkesztett exponenciális görbe alatti területet jelöli. A következő képlettel kell kiszámítani:

Az idővel súlyozott átlag (IS átlag) a Teljes terület és az Összes nap hányadosa.
A Daphnia reprodukciós vizsgálat céljaira természetesen a táblázatot úgy kell kiterjeszteni, hogy az 21 napot fedjen le.
Egyértelmű, hogy ha csak a közeg egyes megújítási időszakainak az elején és végén végeznek megfigyeléseket, akkor nincs mód annak a megerősítésére, hogy a csökkenés valóban exponenciális. Egy másfajta görbe a Területre nézve másfajta számítási eredményre vezetne. Az exponenciális csökkenési folyamat azonban valószínűsíthető, és egyéb információk hiányában valószínűleg a legjobb görbét adja.
Óvatosságra int azonban, ha a megújítási időszak végén a kémiai analízis nem mutat ki semmilyen vegyi anyagot. Ha nem lehet megbecsülni, hogy milyen gyorsan tűnt el a vizsgálati vegyi anyag az oldatból, akkor lehetetlen reálisan megítélni a görbe alatti terület nagyságát, és emiatt lehetetlen megállapítani egy ésszerű, idővel súlyozott átlagot.
7. függelék
ÚTMUTATÁS AZ ÚJSZÜLÖTT IVARÁNAK MEGHATÁROZÁSÁHOZ
Megváltozott környezeti körülmények között, például lerövidített megvilágítási időszak, hőmérséklet, csökkenő tápkoncentráció és növekvő populációsűrűség előfordulhat hímivarú újszülött egyedek megjelenése (Hobaek and Larson, 1990; Kleiven et al., 1992). A hímivarú egyedek megjelenése emellett egyes rovarfejlődés-szabályozókra adott ismert válasz (Oda et al., 2005). Olyan körülmények között, amelyekben vegyi stresszforrások a partenogén nőstényektől származó reproduktív utódok csökkenéséhez vezetnek, várható a hímivarúegyedek nagyobb száma (OECD, 2008). A rendelkezésre álló információ alapján nem jelezhető előre, hogy az ivararány vagy a reprodukciós végpont lesz-e érzékenyebb, ugyanakkor vannak arra utaló jelek (referencia »validálási jelentés«, 1. rész), hogy a hímivarú egyedek számának e növekedése kevésbé érzékeny, mint a szaporulatban bekövetkező csökkenés. Ezért e vizsgálati módszer elsődleges célja annak felmérése, hogy mennyi utód születik, a hímivarú egyedek megjelenése opcionális megfigyelés tárgyát képezheti. Ha a tanulmány ezt az opcionális végpontot értékeli, egy további, a kontrollban legfeljebb 5 % hímivarú egyeddel kapcsolatos vizsgálati érvényességi kritériumot kell alkalmazni.
A Daphnia ivara megkülönböztetésének leginkább gyakorlatias és legkönnyebb módja a fenotípusos tulajdonságok alkalmazása, minthogy a hímek és a nőstények genetikailag azonosak, és ivarukat a környezet határozza meg. A hímek és nőstények első csápjának hossza és alakja eltérő, azaz a hímivarú egyedeké hosszabb, mint a nőstényeké (1. ábra). A különbség már közvetlenül a születést követően észlehető, jóllehet másodlagos ivari jellegek is kifejlődnek a növekedéskor (lásd pl. a 2. ábrát, in: Olmstead és LeBlanc, 2000).
A morfológiai ivar megfigyelése érdekében az egyes vizsgálati állatok újszülöttjeit pipettával át kell helyezni vizsgálati közeget tartalmazó petricsészébe. A közegnek a lehető legkisebbnek kell lennie, hogy korlátozza az állatok mozgását. Az első csáp sztereomikroszkóppal (× 10–60) figyelhető meg.
1. ábra
A D. magna 24 órás hím (balra) és nőstény (jobbra) egyede. A hímek a nőstényektől az első csápjuk hossza és alakja alapján különböztethetők meg, amint az a bekarikázott részen látható (Tatarazako et al., 2004).
HIVATKOZÁSOK
Hobaek A and Larson P. 1990. Sex determination in Daphnia magna. Ecology 71: 2255-2268.
Kleiven O.T., Larsson P., Hobaek A. 1992. Sexual reproduction in Daphnia magna requires three stimuli. Oikos 65, 197-206.
Oda S., Tatarazako N, Watanabe H., Morita M., and Iguchi T. 2005. Production of male neonates in Daphnia magna (Cladocera, Crustacea) exposed to juvenile hormones and their analogs. Chemosphere 61:1168-1174.
OECD, 2008. Validation report for an enhancement of OECD TG 211 Daphnia magna reproduction test. OECD Series on Testing and Assessment, Number 88. Organisation for Economic Co-operation and Development, Paris.
Olmstead, A.W., LeBlanc, G.A., 2000. Effects of endocrine-active chemicals on the development characteristics of Daphnia magna. Environmental Toxicology and Chemistry 19:2107-2113.
Tatarazako, N., Oda, S., Abe, R., Morita M. and Iguchi T., 2004. Development of a screening method for endocrine disruptors in crustaceans using Daphnia magna (Cladocera, Crustacea). Environmental Science 17, 439-449.
”
(18) A C. részben a C.29. fejezet 66. pontjának helyébe a következő szöveg lép:
„66. A vizsgálat akkor tekinthető érvényesnek, ha:
a) a referencia-vegyianyagot tartalmazó FC edényekben a százalékos lebomlás átlaga 60 % fölé emelkedik az inkubálás 14. napjáig; és
b) a vakpróbákhoz használt FB edényekben jelen lévő TIC mennyiségének átlaga a vizsgálat végén nem éri el a 3 mg C/l értéket.
Ha ezek a határértékek nem teljesülnek, akkor a vizsgálatot egy másik forrásból származó oltóanyaggal meg kell ismételni, és/vagy felül kell vizsgálni az eljárásokat. Például ha az a probléma, hogy a vakpróbákban sok IC keletkezik, akkor a 27–32. pontban leírt eljárást kell alkalmazni.”
(19) A C. rész a következő fejezetekkel egészül ki:
„C.47 A halak korai életszakaszára vonatkozó toxicitási vizsgálat
BEVEZETÉS
1. Ez a vizsgálati módszer egyenértékű az OECD 210. vizsgálati iránymutatásában (2013) leírt módszerrel. A halak korai életszakaszára vonatkozó vizsgálatok célja a vegyi anyagok által a vizsgált fajokra és azok fejlődési szakaszaira gyakorolt letális és szubletális hatások meghatározása. A vizsgálatok értékes információkkal szolgálnak a vegyi anyagok által más halfajokra gyakorolt krónikus letális és szubletális hatások becsléséhez.
2. A 210. vizsgálati iránymutatás az Egyesült Királyság által benyújtott javaslaton alapul, amelyet az OECD szakértőinek Medmenhamben (Egyesült Királyság) 1988 novemberében tartott ülésén vitattak meg és 2013-ban aktualizáltak annak érdekében, hogy a dokumentumba beépítsék a vizsgálat alkalmazása során szerzett tapasztalatokat és a halakon végzett toxicitásvizsgálatokról szóló, 2010 szeptemberében tartott OECD-munkaértekezlet javaslatait (1).
A VIZSGÁLAT ELVE
3. A korai életszakaszban lévő halak a vízben oldott vizsgálati vegyi anyag széles tartományon belüli koncentrációinak vannak kitéve. Átfolyásos körülmények javasoltak; amennyiben ez nem megoldható, úgy félstatikus feltételek is elfogadhatók. A részletekért „A nehezen vizsgálható anyagok és keverékek vízi toxikológiai vizsgálata” című OECD-iránymutatást (2) kell tanulmányozni. A vizsgálat azzal kezdődik, hogy frissen megtermékenyített petéket vizsgálati kamrákba helyeznek, és a vizsgálatot az adott fajtól függően annyi ideig folytatják, amennyi ahhoz szükséges, hogy a kontrollhal növendékké fejlődjön. A letális és szubletális hatásokat kiértékelik, és összehasonlítják a kontrollcsoportbeli értékekkel a megfigyelhető hatást okozó legalacsonyabb koncentráció (LOEC) meghatározása érdekében, hogy meg lehessen állapítani i. a megfigyelhető hatást nem okozó koncentrációt (NOEC) és/vagy ii. az ECx (pl. EC10, EC20) értéket regressziós modell segítségével azon becsült koncentrációt, amely a mért hatásban x % változást okozna. A releváns hatásos koncentrációk és paraméterek jelentése a szabályozási kerettől függhet. Az ECx értékének a vizsgálati koncentrációk által meghatározott tartományon belül kell elhelyezkednie annak érdekében, hogy az ECx értékét extrapoláció helyett interpolációval lehessen meghatározni (a fogalommeghatározásokat lásd az 1. függelékben).
A VIZSGÁLATI VEGYI ANYAGRA VONATKOZÓ INFORMÁCIÓK
4. A vizsgálati vegyi anyag a vizsgálat tárgyát képező anyag. Ismerni kell a vizsgálati vegyi anyag vízoldékonyságát (lásd e melléklet A.6. fejezetét) és gőznyomását (lásd e melléklet A.4. fejezetét), és a vizsgálati oldatokban lévő vegyi anyag mennyiségi meghatározásához rendelkezni kell olyan megbízható analitikai módszerrel, amelynek pontossága és a meghatározási határai ismertek és dokumentáltak. A lehetőleg e vizsgálat céljára kiválasztott fajokkal korábban már elvégzett akut toxicitási vizsgálatok eredményei (lásd e melléklet C.1. és C.49. fejezetét) a vizsgálat lefolytatásához nem szükségesek, ugyanakkor hasznos információkkal szolgálhatnak.
5. Ha a vizsgálati módszert keverék vizsgálatára alkalmazzák, annak összetételét a lehető legpontosabban kell jellemezni, pl. az alkotóelemeinek kémiai azonosítójával, azok mennyiségi előfordulásával, továbbá (pl. a fent említett) anyagspecifikus tulajdonságaival. A vizsgálati módszernek adott keverék szabályozási célú vizsgálatára történő alkalmazása előtt meg kell vizsgálni, hogy az megfelelő eredményeket biztosíthat-e a szándékolt szabályozási célra.
6. A hasznos információk közé tartozik még a szerkezeti képlet, az anyag tisztasága, vízoldékonysága, vízben és fény hatására tanúsított stabilitása, a pKa- és Pow-értékek, valamint a gyors biológiai lebonthatóságra vonatkozó vizsgálatok eredményei is (lásd e melléklet C.4. és C.29. fejezetét).
A VIZSGÁLAT ÉRVÉNYESSÉGE
7. A vizsgálat érvényességéhez a következő feltételeknek kell teljesülniük:
— a kísérlet során az oldott oxigén koncentrációját mindvégig a levegőtelítettségi érték 60 %-a felett kell tartani,
— a víz hőmérséklete a vizsgálat során a vizsgálati kamrák, illetve bármelyik két egymást követő nap között ±1,5 °C-nál nagyobb mértékben nem térhet el, és a hőmérsékletet a vizsgálati fajra nézve meghatározott hőmérséklet-tartományon belül kell tartani (2. függelék);
— a vizsgálati koncentráció analitikai mérése kötelező;
— a kontrollcsoportokban és – ahol ez releváns – az oldószeres kontrollokban a megtermékenyített peték összesített túlélési arányszámainak és a kikelést követő életképességük arányának a 2. függelékben meghatározott határértékeknél nagyobbnak vagy azzal egyenlőnek kell lenniük.
8. Amennyiben az érvényességi kritériumokhoz képest csekély eltérés figyelhető meg, a következményeket a vizsgálati adatok megbízhatóságának tükrében mérlegelni kell és ezeket a megfontolásokat a jelentésben fel kell tüntetni. Az oldószeres kontrollban előforduló túlélésre, kikelésre vagy növekedésre gyakorolt hatásokat a negatív kontrollal összehasonlítva kell jelenteni, és a vizsgálati adatok megbízhatóságának tükrében kell értékelni.
A MÓDSZER ISMERTETÉSE
Vizsgálati kamrák
9. Üvegből, rozsdamentes acélból vagy más, kémiailag semleges anyagból készült edényeket lehet használni. Mint ismeretes a szilikon a lipofil anyagokat erősen abszorbeálja, ezért a szilikon csövek átfolyásos vizsgálatokhoz való használatát és a vízzel érintkező szilikon tömítések alkalmazását pl. monoblokkos üvegakváriumok használatával minimálisra kell csökkenteni. Az edényeknek elég nagynak kell lenniük ahhoz, hogy lehetővé tegyék a kontrollok megfelelő növekedését, az oldott oxigén koncentrációjának fenntartását (pl. kisebb halfajok esetében egy 7 literes tartály elegendő) és a 19. pontban a betelepítési arányra vonatkozóan megadott kritériumok teljesítését. Tanácsos a vizsgálati kamrák véletlenszerű elhelyezése a vizsgálatra kijelölt területen. A teljesen véletlenszerű elrendezéssel szemben célszerűbb a véletlen blokk elrendezés alkalmazása, ahol mindegyik blokkban mindegyik kezelési mód képviselt. A vizsgálati kamrákat védeni kell a nem kívánt zavaró hatásoktól. A vizsgálati rendszert lehetőleg annyi ideig kell a vizsgálati vegyi anyag koncentrációival kondicionálni, amely elegendő ahhoz, hogy a vizsgált élőlények elhelyezése előtt stabil expozíciós koncentrációt lehessen kimutatni.
Az állatfaj kiválasztása
10. A vizsgálat céljaira javasolt halfajok listáját az 1. táblázat tartalmazza. Ez nem zárja ki más fajok használatát, de az eljárást ekkor a megfelelő vizsgálati feltételek biztosítása érdekében esetleg módosítani kell. A fajok és a kísérleti módszer megválasztásának indoklását fel kell tüntetni a jelentésben.
A tenyészhalak tartása
11. A tenyészállomány megfelelő feltételek melletti tartására vonatkozó részletek a 3. függelékben és a (3) (4) (5) hivatkozásban találhatók.
A megtermékenyített peték, embriók és lárvák kezelése
12. A megtermékenyített petéket, embriókat és lárvákat kezdetben a fő tartályon belül elhelyezett, oldalaiknál vagy végeiknél hálós, üvegből vagy rozsdamentes acélból készült kisebb edényekben lehet kitenni a tartályon átfolyó vizsgálati oldatnak. E kisebb edényekben a turbulenciamentes áramlást úgy lehet elérni, hogy az edényeket fel-le mozgatható karra függesztik fel, ügyelve, hogy az élőlények mindig a vizsgálati oldatban legyenek. Lazacfélék megtermékenyített petéit olyan rácsokon vagy hálókon lehet tartani, amelyek nyílásai elég nagyok ahhoz, hogy a petékből kibújó lárvák átessenek rajtuk.
13. Amennyiben a peték fő kísérleti tartályon belüli tartására kis tartályokat, rácsokat vagy hálókat használnak, akkor a lárvák kikelése után ezeket a visszatartó eszközöket – a 3. függelékben található útmutatás szerint – el kell távolítani, kivéve, ha a lárvák szökésének megakadályozása érdekében van rájuk szükség. Amennyiben a lárvákat át kell helyezni, azokat nem szabad kitenni a levegő hatásának, és nem szabad hálót használni a lárváknak a peték tárolására használt tartályból való kiemelésére. Az ilyen áthelyezés időzítése az egyes fajoktól függően változik, és azt a jegyzőkönyvben dokumentálni kell. Az áthelyezés azonban nem mindig szükséges.
Víz
14. A vizsgálat céljára bármilyen víz felhasználható, amelyben a vizsgálati fajok kellően hosszú ideig túlélik a vizsgálati körülményeket és növekednek (lásd a 4. függeléket). A víz minőségét a vizsgálat során mindvégig azonos szinten kell tartani. Annak biztosítására, hogy a hígítóvíz ne gyakoroljon nem kívánt hatást a vizsgálat eredményeire (pl. mert komplexet képez a vizsgálati vegyi anyaggal), illetve ne gyakoroljon kedvezőtlen hatásokat a tenyészállomány teljesítményére, időnként mintákat kell venni elemzésre. Mérni kell a következőket: a nehézfémek (pl. Cu, Pb, Zn, Hg, Cd és Ni), a fontosabb anionok és kationok (pl. Ca2+, Mg2+, Na+, K+, Cl–, SO4 2–), az ammónia, az összes klórtartalmú növényvédőszer-maradék, a teljes szervesszén-tartalom és a szuszpendált szilárd anyagok, például félévente, amennyiben a hígítóvízről tudott, hogy viszonylag állandó minőségű. Amennyiben ismert, hogy a víz változó minőségű, úgy a méréseket gyakrabban kell elvégezni; a gyakoriság attól függ, hogy a víz minősége mennyire változó. Az elfogadható minőségű hígítóvíz néhány kémiai tulajdonságának felsorolása a 4. függelékben található.
Vizsgálati oldatok
15. Az átfolyásos vizsgálatok céljára olyan rendszert kell használni, amely folyamatosan adagolja és hígítja a vizsgálati vegyi anyag törzsoldatát (pl. adagolószivattyú, proporcionális hígító vagy telítőrendszer), annak érdekében, hogy a vizsgálati kamrához eljusson a koncentrációk sorozata. A kísérlet során időnként ellenőrizni kell a törzsoldatok és a hígítóvíz áramlási sebességét, amelynek értéke a vizsgálat során nem változhat 10 %-nál nagyobb mértékben. A 24 óránként legalább öt vizsgálati kamrányi vízcserének megfelelő áramlási sebességet találták megfelelőnek (3). A 19. pontban előírt betelepítési arány követése esetén azonban alacsonyabb, pl. 2–3 vizsgálati kamrányi vízcserének megfelelő áramlási sebesség is alkalmazható, hogy megakadályozzák a táplálék gyors eltávozását.
16. A kiválasztott koncentrációjú vizsgálati oldatok a törzsoldat hígításával készíthetők el. A törzsoldatot lehetőleg a vizsgálati vegyi anyagnak a hígítóvízbe, mechanikai eszközök (pl. keverő és/vagy ultrahang) segítségével történő bekeverésével vagy megmozgatásával kell elkészíteni. Telítési oszlopok (oldhatósági oszlopok) vagy passzív adagolási módszerek (6) is alkalmazhatók a megfelelő koncentrációjú törzsoldat elkészítéséhez. Oldószer-hordozóanyag használata nem ajánlott. Abban az esetben azonban, ha oldószerre van szükség, párhuzamosan egy oldószeres kontrollt is futtatni kell a vegyi anyaggal történő kezelésekben alkalmazottal megegyező oldószer-koncentrációval; vagyis az oldószer szintjének azonosnak kell lennie minden koncentrációban és az oldószeres kontrollban. Néhány hígítási rendszer esetében ez esetleg technikailag nehezen kivitelezhető; ebben az esetben az oldószer koncentrációjának az oldószeres kontrollban a kezelt csoportokban lévő legnagyobb oldószer-koncentrációval kell megegyeznie. A nehezen vizsgálható anyagok esetében „A nehezen vizsgálható anyagok és keverékek vízi toxikológiai vizsgálata” című, 23. számú OECD-iránymutatást (2) kell tanulmányozni. Oldószer használata esetén a megfelelő oldószert az anyag kémiai tulajdonságai határozzák meg. A 23. számú OECD-iránymutatás 100 μl/l maximális koncentrációt ajánl. Annak érdekében, hogy elkerülhető legyen az oldószer esetleges hatása a mért végpontokra (7), az oldószer koncentrációját a lehető legalacsonyabb szinten javasolt tartani.
17. Félstatikus vizsgálatok során két különböző vízcsere-módszer közül lehet választani: új vizsgálati oldatokat kell készíteni tiszta edényekben és a kísérlet korábbi fázisait túlélő petéket és lárvákat kíméletesen át kell telepíteni az új edényekbe, vagy az élőlényeket a vizsgálati edényben kell tartani, miközben a vizsgálati oldat/kontroll mennyiségének egy részét (legalább kétharmadát) le kell cserélni.
ELJÁRÁS
Az expozíció körülményei
Időtartam
18. A vizsgálatokat a peték megtermékenyítését követően a lehető legrövidebb időn belül el kell kezdeni, és a megtermékenyített petéket lehetőleg a csírakorong osztódásának kezdete előtt, vagy e fázist követően mihamarabb a vizsgálati oldatba kell helyezni. A vizsgálat időtartama a használt fajtól függ. Néhány javasolt időtartam a 2. függelékben található.
Betelepítés
19. A vizsgálat kezdetén használt megtermékenyített peték számának elegendőnek kell lennie a statisztikai követelmények kielégítéséhez. A petéket véletlenszerűen kell elosztani a különböző kezelési módok között, és koncentrációszintenként legalább 80, legkevesebb négy párhuzamos edény között egyenletesen elosztott, megtermékenyített petét kell behelyezni. A betelepítési aránynak (a vizsgálati oldat egységnyi térfogatára jutó biomassza) megfelelően alacsonynak kell lennie, hogy a pete és lárva fejlődési fázisokban az oldottoxigén-koncentrációt külön levegőztetés nélkül is a levegőtelítettségi érték legalább 60 %-ának megfelelő szinten lehessen tartani. Átfolyásos vizsgálatok esetében 24 órára számítottan 0,5 g/liter nedves tömegnél, illetve bármely időpontban 5 g/liter oldatnál nem magasabb betelepítési arány tartása javasolt (3).
Fény és hőmérséklet
20. A megvilágítási időszakokat és a víz hőmérsékletét a vizsgálati fajok sajátosságaihoz kell igazítani (lásd a 2. függeléket).
Etetés
21. A táplálék és az etetés rendkívül fontos, és elengedhetetlen, hogy az egyes életszakaszokban a megfelelő táplálékot a megfelelő időponttól kezdve a normális fejlődéshez szükséges mennyiségben adják. A táplálék mennyiségének az egyes párhuzamos vizsgálatokban megközelítőleg azonosnak kell lennie, kivéve ha azt a mortalitási arány figyelembevételével ki kell igazítani. A táplálékfelesleget és az ürüléket szükség szerint el kell távolítani a hulladékok felhalmozódásának elkerülése érdekében. Az etetési rend részletei a 3. függelékben találhatók, azonban a tapasztalatok birtokában a táplálékot és az etetési rendet a túlélési arány növelése és a fejlődés optimalizálása érdekében folyamatosan tökéletesítik. Az élő táplálék a környezetgazdagítás egyik forrása, ezért azt – fajtól és életszakasztól függően – a száraz vagy fagyasztott táp helyett vagy mellett ajánlott adni.
Vizsgálati koncentrációk
22. A vizsgálati vegyi anyagból általában – koncentrációnként minimum négy replikátummal – ötféle, legfeljebb 3,2 konstans szorzótényezővel különböző koncentráció használata szükséges. A vizsgálati koncentrációk tartományának kiválasztásakor célszerű mérlegelni a lehetőleg ugyanazokon a fajokon végzett akut vizsgálatokra és/vagy dózisbehatároló vizsgálatokra vonatkozó információkat (1), amennyiben azok rendelkezésre állnak. A vizsgálati koncentrációk tartományának kiválasztásakor viszont minden információforrást figyelembe kell venni, többek között a kereszthivatkozásokat, illetve a halembriókon végzett akut toxicitásvizsgálatokra vonatkozó adatokat. Egy határérték-vizsgálat vagy kiterjesztett határérték-vizsgálat ötnél kevesebb koncentrációval akkor fogadható el meghatározó vizsgálatként, ha csak az empirikus NOEC szintjét kell meghatározni. Ötnél kevesebb vizsgálati koncentráció használatát indokolni kell. Nem szükséges vizsgálni a vizsgálati vegyi anyag koncentrációját a 96 órás LC50-nél vagy (amennyiben alacsonyabb) a 10 mg/l értéknél magasabb értékek esetében.
Kontrollok
23. A vizsgálati vegyi anyag koncentrációsorozataival párhuzamosan hígítóvizes kontrollt és szükség esetén kizárólag az oldószer-hordozóanyagot tartalmazó oldószeres kontrollt is le kell futtatni (lásd a 16. pontot).
Az analitikai meghatározások és mérések gyakorisága
24. Az expozíciós időszak megkezdése előtt (például a vizsgálati koncentrációk mérésével) gondoskodni kell arról, hogy a vegyi anyagot adagoló rendszer minden párhuzamos esetében megfelelően működjön. Meg kell állapítani a szükséges analitikai módszereket, ideértve a megfelelő meghatározási határt (LOQ), és az anyag vizsgálati rendszerben való stabilitásáról megfelelő ismereteket kell szerezni. A vizsgálat során a vizsgálati vegyi anyag koncentrációit az expozíció jellemzése érdekében rendszeres időközönként meg kell határozni. Legalább öt meghatározás szükséges. Átfolyásos rendszerek esetében a vizsgálati vegyi anyag analitikai mérését koncentrációnként egy párhuzamoson legalább hetente egyszer kell elvégezni, felváltva vizsgálva az egyes párhuzamosokat. A további analitikai meghatározások gyakran javítják a vizsgálatok eredményének minőségét. A szemcsés anyagok eltávolítása érdekében szükség lehet a minták szűrésére (pl. egy 0,45 μm pórusméretű szűrőbetét használatával) vagy centrifugálására annak biztosítására, hogy a meghatározások valódi oldatban lévő vegyi anyagra vonatkozzanak. A vizsgálati vegyi anyag adszorpciójának csökkentése érdekében a szűrőket a felhasználásuk előtt telíteni kell. Amennyiben a mért koncentrációértékek nem maradnak a névleges koncentrációérték 80–120 %-án belül, úgy a hatásos koncentrációkat átfolyásos vizsgálatok esetében a számtani átlaghoz viszonyítva kell meghatározni és kifejezni (lásd a C.20 vizsgálati módszer 6. függelékében a számtani átlag kiszámítását (8)), félstatikus vizsgálatok esetében pedig a mért koncentrációk mértani átlagához viszonyítva kell kifejezni (lásd „A nehezen vizsgálható anyagok és keverékek vízi toxikológiai vizsgálata” című, OECD-iránymutatás 5. fejezetét (2)).
25. A vizsgálat során minden vizsgálati edényben legalább hetente egyszer meg kell mérni az oldott oxigén koncentrációját, a pH-t és a hőmérsékletet, valamint indokolt esetben a sótartalmat és a keménységet a vizsgálat elején és végén. A hőmérsékletet legalább egy vizsgálati edényben folyamatosan figyelemmel kell kísérni.
Megfigyelések
|
26. |
Az embrionális fejlődés fázisa : a vizsgálati vegyi anyag hatásának való expozíció kezdetén az embrionális fejlődési fázis azonosítását a lehető legpontosabban kell elvégezni. Erre a megfelelően tartósított és megtisztított peték egy reprezentatív mintája használható. |
|
27. |
A peték kikelése és túlélése
: A kikelés és túlélés folyamatait naponta egyszer meg kell figyelni, és a tapasztalt számadatokat fel kell jegyezni. Amennyiben az embrionális fejlődési fázisban (pl. a vizsgálat első vagy második napján) gombaképződés figyelhető meg a petéken, úgy az érintett petéket meg kell számlálni és el kell távolítani. Az elpusztult embriókat, lárvákat és növendék halakat észlelésükkor azonnal el kell távolítani, mert gyorsan bomlásnak indulnak és a többi hal mozgásának hatására széteshetnek. Az elhullott egyedek kiemelésekor különös gondot kell fordítani arra, hogy a szomszédos embriók/lárvák nehogy fizikailag sérüljenek. Az elhullás jelei a fajtól és az életciklus szakaszától függően változnak. Például: — megtermékenyített peték: különösen a korai szakaszokban az áttetszőség jelentős csökkenése és színbeli elváltozás, amit a fehérjék koagulációja és/vagy kicsapódása okoz, ami fehér opálos színt eredményez, — embriók, lárvák és növendék halak: mozdulatlanság és/vagy a légzőmozgások és/vagy a szívverés hiánya és/vagy reakció elmaradása fizikai ingerekre. |
|
28. |
Rendellenes külső megjelenés : a vizsgálat időtartamától és a leírt rendellenesség jellegétől függően megfelelő időközönként fel kell jegyezni a rendellenes testformájú lárvák vagy növendék halak számát. Meg kell jegyezni, hogy rendellenesen fejlődött lárvák és növendék halak természetes körülmények között is előfordulnak, és egyes fajok esetében a kontrollcsoport(ok)ban mennyiségük akár több százalékot is elérhet. Amennyiben a deformitás és az ezzel összefüggő rendellenes viselkedés olyan súlyosnak tekinthető, hogy az az élőlény számára már jelentős szenvedést okoz, és elérte azt a pontot, amikor a felépülés már nem lehetséges, úgy az érintett egyedet el lehet távolítani a vizsgálatból. Az ilyen állatokon eutanáziát kell végrehajtani, és a további adatelemzés szempontjából mortalitásként kell kezelni. E vizsgálati módszer tekintetében ajánlott legtöbb faj esetében normális embrionális fejlődést dokumentáltak (9) (10) (11) (12). |
|
29. |
Rendellenes viselkedés : a rendellenes viselkedésmódokat – pl. hiperventilláció, koordinálatlan úszásmód, a fajra nem jellemző nyugalom és a fajra nem jellemző táplálkozási mód – a vizsgálat teljes időtartamától függő időközönként (például a melegvízi halfajok esetében naponta egyszer) fel kell jegyezni. Bár e hatásokat nehéz számszerűsíteni, ha megfigyelhetők, akkor segíthetnek a mortalitási adatok értelmezésében. |
|
30. |
Tömeg : a vizsgálat végén az összes életben maradt halat le kell mérni legalább párhuzamosonként (feljegyezve a párhuzamosban szereplő állatok számát és az egyes állatok átlagos tömegét): lehetőség szerint a halak nedves (itatóspapírral szárított) tömegét kell jelentésbe foglalni, de a száraz tömeg is elfogadható (13). |
|
31. |
Hosszúság : a kísérlet végén le kell mérni az egyedi hosszúságokat. Ajánlott a teljes hossz mérése, ugyanakkor, ha a farokuszonyon rothadás vagy kimaródás, pusztulás jelei fordulnak elő, akkor a standard hosszt lehet használni. Egy adott vizsgálatban szereplő valamennyi hal esetében ugyanazt a módszert kell alkalmazni. Az egyedi hosszúságot például tolómérővel, digitális fényképezőgéppel vagy kalibrált okulár-mikrométerrel lehet mérni. A jellemző minimális hosszúságok meghatározása a 2. függelékben található. |
ADATOK ÉS JEGYZŐKÖNYVEZÉS
Az eredmények feldolgozása
32. Ajánlatos a kísérletet úgy kialakítani és olyan statisztikai vizsgálatot választani, hogy a biológiai szempontból fontos változásokat az olyan végpontokon, ahol megfigyelhető hatást nem okozó koncentrációt kell jelenteni, megfelelő (80 %-os vagy ennél nagyobb) statisztikai erővel lehessen észlelni. A releváns hatásos koncentrációk és paraméterek jegyzőkönyvezése a szabályozási kerettől függhet. Amennyiben ECx értéket kell jelenteni, úgy a kísérleti tervek és a regressziós modell kiválasztásának lehetővé kell tennie az ECx érték becslését úgy, hogy i. az ECx 95 %-os konfidencia-intervalluma ne tartalmazzon nullát és ne legyen túl tág, ii. az ECx-nél várható átlag 95 %-os konfidencia-intervalluma ne tartalmazza a kontroll átlagát és iii. a regressziós modell viszonylag jól illeszkedjen az adatokhoz. Bármelyik megközelítés esetében meg kell határozni a százalékos változást minden egyes végponton, amelyet fontos kimutatni vagy megbecsülni. A vizsgálatot úgy kell kialakítani, hogy ez megoldható legyen. Amennyiben az ECx-érték meghatározásának fenti feltételei nem teljesülnek, az NOEC-megközelítést kell alkalmazni. Nem valószínű, hogy a százalékos változás minden végponton megegyezik, és az sem valószínű, hogy olyan megvalósítható kísérletet lehet tervezni, amely minden végpont tekintetében megfelel a fenti feltételeknek, tehát a kísérlet megfelelő kialakítása során azokra a végpontokra kell összpontosítani, amelyek az adott kísérlet szempontjából lényegesek. Az 5. és 6. függelék minden egyes megközelítésre vonatkozóan tartalmaz statisztikai folyamatábrákat és útmutatást, amelyek segítséget nyújtanak az adatok kezeléséhez, valamint a legmegfelelőbb statisztikai vizsgálat vagy modell kiválasztásához. Alkalmazhatók más statisztikai megközelítések is, amennyiben azok használata tudományos szempontból indokolt.
33. Szükséges a párhuzamos eredmények közti eltérések varianciaanalízissel vagy kontingenciatáblázatos módszerrel való elemzése, és az elemzés alapján a megfelelő statisztikai elemző módszerek alkalmazása. Az egyedi koncentrációszintek és a kontrollcsoport szintjei esetében kapott eredmények közötti többszörös összehasonlítás érdekében a lefelé lépegető Jonckheere–Terpstra-féle próba vagy a Williams-féle próba elvégzése javasolt folytonos válaszok esetében, és a lefelé lépegető Cochran–Armitage-féle próba alkalmazása javasolt diszkrét válaszok esetében, amelyek monoton koncentráció-válasznak felelnek meg és az „extra-binomiális” varianciára nincs bizonyíték (14). Amennyiben az „extra-binomiális” variancia igazolható, a Cochran–Armitage-féle próba Rao–Scott-féle módosítása javasolt (15) (16), illetve a Williams- vagy a Dunnett-féle próba (négyzetgyök arkusz-szinusz transzformáció után) vagy a Jonckheere–Terpstra-féle próba a párhuzamosok arányaira. Amennyiben az adatok nem monoton koncentráció-válasznak felelnek meg, folytonos válaszok esetében a Dunnett- vagy a Dunn- vagy a Mann–Whitney-féle módszer bizonyulhat hasznosnak, diszkrét válaszok tekintetében pedig a Fisher-egzakt teszt (14) (17) (18). Bármely statisztikai módszer vagy modell alkalmazása során figyelmet kell fordítani arra, hogy a módszer vagy modell követelményei teljesüljenek (pl. a kísérlet megtervezésekor és a vizsgálat vagy modell alkalmazásakor meg kell becsülni és számításba kell venni a kamránkénti variabilitást). Az adatokat a normális eloszlás szempontjából értékelni kell, és az 5. függelék iránymutatást ad arra vonatkozóan, hogy az ANOVA reziduálisaival mi a teendő. A 6. függelék a regressziós megközelítés további megfontolásait tárgyalja. A statisztikai vizsgálatok követelményeinek való megfelelés érdekében transzformációkra lehet szükség. A regressziós modellek illesztése során végzett transzformációknál körültekintéssel kell eljárni, hiszen megeshet, hogy a nem transzformált adatokban megmutatkozó 25 %-os változás nem felel meg a transzformált adatokban megjelenő 25 %-os változásnak. Minden elemzés esetében a vizsgálati kamra és nem a halegyed az elemzési egység és a kísérleti egység, és ezt a hipotézisvizsgálatnak és a regressziónak is tükröznie kell (3) (14) (19) (20).
Vizsgálati jegyzőkönyv
34. A vizsgálati jegyzőkönyvnek a következőket kell tartalmaznia:
Vizsgálati vegyi anyag:
Egy összetevőből álló anyag:
— fizikai megjelenés, vízoldékonyság és a további releváns fizikai-kémiai tulajdonságok;
— kémiai azonosítás, például IUPAC- vagy CAS-név, CAS-szám, SMILES- vagy InChI-kód, szerkezeti képlet, tisztaság, adott esetben és amennyiben a gyakorlatban megvalósítható, a szennyeződések kémiai azonossága stb. (ideértve adott esetben a szervesszén-tartalmat).
Több összetevőből álló anyag, UVCB-k és keverékek:
— amennyire részletesen lehetséges, az összetevőknek például a kémiai azonosítója (lásd fent), mennyiségi előfordulása és releváns fizikai-kémiai tulajdonságai révén való jellemzés.
Vizsgálati fajok:
— tudományos név, törzs, származás és a megtermékenyített peték begyűjtésének módja, valamint a későbbi kezelés.
Vizsgálati körülmények:
— alkalmazott vizsgálati eljárás (például félstatikus vagy átfolyásos, betelepítés);
— megvilágítási időszak(ok);
— vizsgálati elrendezés (pl. a vizsgálati kamrák és a párhuzamosok száma, a peték száma párhuzamosonként, a vizsgálati kamrák anyaga és mérete (magasság, szélesség, térfogat), víztérfogat vizsgálati kamránként);
— a törzsoldat elkészítésének módszere és a vízcsere gyakorisága (az esetleg használt diszpergálószer nevét és koncentrációját meg kell adni);
— a vizsgálati vegyi anyag adagolásának módszere (például szivattyú, hígítási rendszerek);
— a módszer visszanyerési hatékonysága és a névleges vizsgálati koncentrációk, a meghatározási határ, a mért értékek átlaga és szórása a vizsgálati edényekben, az ilyen adatok megszerzésének módszerei és bizonyítékok annak alátámasztására, hogy a mérések a valódi oldatban lévő vizsgálati vegyi anyag koncentrációszintjeire vonatkoznak,
— a hígítóvíz jellemzői: pH-érték, keménység, hőmérséklet, oldottoxigén-koncentráció, maradékklór-tartalom (amennyiben mérik), teljes szervesszén-tartalom (amennyiben mérik), szuszpendált szilárd anyagok (amennyiben mérik), a vizsgálati közeg sótartalma (amennyiben mérik) és bármely más mérési adat;
— vízminőség a vizsgálati edényekben: pH-érték, keménység, hőmérséklet és az oldottoxigén-koncentráció;
— részletes információk a táplálékról (pl. a haltáp típusa, eredete, az adagolt mennyiség és az adagolás gyakorisága).
A következő végpontokra vonatkozóan egyedileg (vagy párhuzamosonként) dokumentált eredmények, azok átlaga, valamint adott esetben a variációs koefficiens:
— annak bizonyítása, hogy a kontrollok megfelelnek a vizsgálati fajok teljes túlélési elfogadhatósági normáinak (lásd 2. függelék);
— az egyes fejlődési fázisok (embrió, lárva és növendék hal) mortalitására és az összesített mortalitásra vonatkozó adatok;
— a kikelésig eltelt napok és a kikelt lárvák száma naponta, és a kikelés végének időpontja;
— az egészséges halak száma a vizsgálat végén;
— a túlélő állatok hosszára (standard vagy teljes hossz megadása) és tömegére vonatkozó adatok;
— az esetleges morfológiai rendellenességek előfordulása, jellemzése és száma;
— az esetleges viselkedésbeli eltérések előfordulása, leírása és száma;
— a statisztikai elemzés során alkalmazott megközelítés (regressziós analízis vagy varianciaanalízis) és az adatok feldolgozása (az alkalmazott statisztikai vizsgálat vagy modell);
— megfigyelhető hatást nem okozó koncentráció minden egyes kiértékelt válaszreakcióra nézve (NOEC);
— a megfigyelhető hatást okozó legalacsonyabb koncentráció (p = 0,05-nél) minden egyes kiértékelt válaszreakcióra nézve (LOEC);
— ECx adott esetben minden egyes kiértékelt válaszreakcióra nézve, konfidencia-intervallumok (például 90 vagy 95 %) és a számításhoz használt illesztett modell grafikonja, a koncentráció–hatás görbe meredeksége, a regressziós modell egyenlete, a modell becsült paraméterei és a becslés standard hibái.
A vizsgálati módszertől való bármely eltérés.
Az eredmények tárgyalása, ideértve a vizsgálati módszertől való eltérésnek a vizsgálat eredményére gyakorolt esetleges hatását.
1. táblázat
Vizsgálathoz ajánlott halfajok
|
ÉDESVÍZI |
TORKOLATI és TENGERI |
|
Oncorhynchus mykiss Szivárványos pisztráng |
Cyprinodon variegatus Tarka fogasponty |
|
Pimephales promelas Amerikai cselle |
Menidia sp. Atlanti ezüstösoldalú hal |
|
Danio rerio Zebradánió |
|
|
Oryzias latipes Japán rizshal vagy Medaka |
|
SZAKIRODALOM
(1) OECD (2012), Fish Toxicity Testing Framework, Environmental Health and Safety Publications Series on Testing and Assessment No.171, OECD, Paris.
(2) OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Environmental Health and Safety Publications, Series on Testing and Assessment. No. 23, OECD Paris.
(3) ASTM (1988), Standard Guide for Conducting Early LifeStage Toxicity Tests with Fishes. American Society for Testing and Materials, E 124188. 26 pp.
(4) Brauhn, J.L. and R.A. Schoettger (1975), Acquisition and Culture of Research Fish: Rainbow trout, Fathead minnows, Channel catfish and Bluegills, Ecological Research Series, EPA660/375011, Duluth, Minnesota.
(5) Brungs, W.A. and B.R. Jones (1977), Temperature Criteria for Freshwater Fish: Protocol and Procedures, Ecological Research Series EPA600/377061, Duluth, Minnesota.
(6) Adolfsson-Erici, et al. (2012), A flow-through passive dosing system for continuously supplying aqueous solutions of hydrophobic chemicals to bioconcentration and aquatic toxicity tests, Chemosphere 86, 593-599.
(7) Hutchinson, T.H. et al. (2006), Acute and chronic effects of carrier solvents in aquatic organisms: A critical review, Aquatic Toxicology, 76, 69-92.
(8) Chapter C.20 of this Annex, Daphnia magna Reproduction Test.
(9) Hansen, D.J. and P.R. Parrish (1977), Suitability of sheepshead minnows (Cyprindon variegatus) for lifecycle toxicity tests, In Aquatic Toxicology and Hazard Evaluation (edited by F.L. Mayer and J.L. Hamelink), ASTM STP 634.
(10) Kimmel, H. B.et al. (1995), Stages of embryonic development of the zebrafish. Developmental Dynamics, 203:253–310.
(11) Gonzalez-Doncel, M. et al (2005), A quick reference guide to the normal development of Oryzias latipes (Teleostei, Adrinichthydae) Journal of Applied Ichthyology, 20:1–14.
(12) Devlin, E.W. et al. (1996), Prehatching Development of the Fathead Minnow, Pimephales promelas Rafinesque. EPA/600/R-96/079. USEPA, Office of Research and Development, Washington, D.C.
(13) Oris, J.T., S.C. Belanger, and A.J. Bailer, (2012), Baseline characteristics and statistical implications for the OECD 210 Fish Early Life Stage Chronic Toxicity Test, Environmental Toxicology and Chemistry 31; 2, 370 – 376.
(14) OECD (2006). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application, Environmental Health and Safety Publications Series on Testing and Assessment No.54, OECD, Paris.
(15) Rao, J.N.K. and A.J. Scott (1992), A simple method for the analysis of clustered binary data, Biometrics 48, 577-585.
(16) Rao, J.N.K. and A.J. Scott (1999), A simple method for analyzing overdispersion in clustered Poisson data, Statistics in Medicine 18, 1373-1385.
(17) Dunnett C.W. (1955), A multiple comparisons procedure for comparing several treatments with a control, Journal of Ameican Statistical Association, 50, 10961121.
(18) Dunnett C.W. (1964), New tables for multiple comparisons with a control. Biometrics, 20, 482-491.
(19) Rand, G.M. and S.R. Petrocelli (1985), Fundamentals of Aquatic Toxicology. Hemisphere Publication Corporation, New York.
(20) McClave, J.T., J.H. Sullivan and J.G. Pearson (1980). Statistical Analysis of Fish Chronic Toxicity Test Data, Proceedings of 4th Aquatic Toxicology Symposium, ASTM, Philadelphia.
1. függelék
FOGALOMMEGHATÁROZÁSOK
A farok tövéig mért hossz : az orrcsúcs és a farokúszó középső sugarának végpontja közötti távolság, és olyan halak esetében alkalmazandó, amelyeknél nehéz meghatározni, hogy a gerincoszlop hol ér véget (www.fishbase.org)
Standard hossz : az orrcsúcstól az utolsó csigolya poszterior végéig vagy a hipurális lemez mediolaterális részének poszterior végéig mért távolság. Leegyszerűsítve ez a mérés nem tartalmazza a farokúszó hosszát. (www.fishbase.org)
Teljes hossz :
az orrcsúcs és a farokúszó hosszabbik lebenyének csúcsa közötti távolság, amelyet általában a lebenyek középvonal mentén való összenyomásával mérnek. Ez egy egyenes vonalú mérés, nem követi a test görbületét (www.fishbase.org)
1. ábra
A használt különböző hosszúságok leírása

Vegyi anyag : anyag vagy keverék.
ECx (hatásos koncentráció x % hatás eléréséhez) : az a koncentráció, amely valamely hatás x %-át okozza a vizsgálati szervezetekben egy adott expozíciós időn belül, a kontrollal összehasonlítva. Például az EC50 az a becsült koncentráció, amely a vizsgálat valamilyen végpontja tekintetében a kitett populáció 50 %-ában okoz hatást a meghatározott expozíciós idő alatt.
Megfigyelhető hatást okozó legalacsonyabb koncentráció (LOEC) : a vizsgálati vegyi anyag azon legalacsonyabb vizsgálati koncentrációja, amelynél a kontrollal összevetve még megfigyelhető a vegyi anyag statisztikailag szignifikáns hatása (p < 0,05). Azonban az LOEC-szint feletti valamennyi vizsgálati koncentrációnak olyan ártalmas hatást kell kifejtenie, amely legalább egyenlő az LOEC-szinten megfigyelttel vagy súlyosabb annál. Amennyiben e két feltétel nem teljesíthető, akkor kimerítő magyarázatot kell adni arra, hogy hogyan történt az LOEC (és ennélfogva az NOEC) kiválasztása. Az 5. és 6. függelék útmutatást ad.
Megfigyelhető hatást nem okozó koncentráció (NOEC) : a közvetlenül az LOEC alatti vizsgálati koncentráció, amely – a kontrollcsoporttal való összevetésben – nem fejt ki statisztikailag szignifikáns hatást (p < 0,05) a meghatározott expozíciós időszak alatt.
Vizsgálati vegyi anyag : bármely, e vizsgálati módszer alkalmazásával vizsgált anyag vagy keverék.
UVCB : ismeretlen szerkezetű vagy változó összetételű, összetett reakcióban keletkezett vagy biológiai eredetű anyag.
IUPAC : International Union of Pure and Applied Chemistry (Elméleti és Alkalmazott Kémia Nemzetközi Uniója).
SMILES : molekulák egyszerűsített egy sorban történő beviteli rendszere
2. függelék
VIZSGÁLATI KÖRÜLMÉNYEK, IDŐTARTAM ÉS A JAVASOLT FAJOK TÚLÉLÉSI KRITÉRIUMAI
|
FAJ |
VIZSGÁLATI KÖRÜLMÉNYEK |
A VIZSGÁLAT JAVASOLT IDŐTARTAMA |
A kontrollhalak vizsgálat végén mért jellemző minimális átlagos teljes hossza (mm) (1) |
A KONTROLLCSOPORT TÚLÉLÉSI ARÁNYA (minimum) |
|||
|
|
Hőmérséklet (°C) |
Sótartalom (0/00) |
Megvilágítás (óra) |
Kikelés sikeressége |
Kikelést követő életképesség |
||
|
Édesvíz: |
|||||||
|
Oncorhynchus mykiss Szivárványos pisztráng |
10 ± 1,5 (2) |
|
12 – 16 (3) |
2 hét azt követően, hogy a kontrollok szabadon táplálkoznak (vagy 60 nap a kikelést követően) |
40 |
75 % |
75 % |
|
Pimephales promelas Amerikai cselle |
25 ± 1,5 |
|
16 |
a vizsgálat kezdetét követően 32 nap (vagy a kikelést követően 28 nap) |
18 |
70 % |
75 % |
|
Danio rerio Zebradánió |
26 ± 1,5 |
|
12 – 16 (4) |
a kikelést követően 30 nap |
11 |
70 % |
75 % |
|
Oryzias latipes Japán rizshal vagy Medaka |
25 ± 2 |
|
12 – 16 (4) |
a kikelést követően 30 nap |
17 |
80 % |
80 % |
|
Torkolati és tengeri |
|||||||
|
Cyprinodon variegatus Tarka fogasponty |
25 ± 1,5 |
15–35 (5) |
12 – 16 (4) |
a vizsgálat kezdetét követően 32 nap (vagy a kikelést követően 28 nap) |
17 |
75 % |
80 % |
|
Menidia sp. Atlanti ezüstösoldalú hal |
22–25 |
15–35 (5) |
13 |
28 nap |
20 |
80 % |
60 % |
|
(1) A jellemző minimális átlagos teljes hossz nem érvényességi kritérium, ugyanakkor a megadott értéktől való elmaradást a vizsgálat érzékenységének tükrében körültekintően vizsgálni kell. A minimális átlagos teljes hossz az aktuálisan rendelkezésre álló adatokból származik. (2) A szivárványos pisztrángok vizsgált törzse más hőmérsékletek alkalmazását teheti szükségessé. A tenyészállományt ugyanolyan hőmérsékleten kell tartani, mint a petéket. A tenyésztőtől történő átvételt követően rövid adaptációs időre (pl. 1–2 óra) van szükség, hogy a peték alkalmazkodjanak a vizsgálati hőmérséklethez. (3) A lárvákat a kikelés után egy hétig sötétben kell tartani, kivéve a vizsgálatok idejét, majd a vizsgálat folyamán mindvégig félhomályt kell fenntartani (12–16 órás megvilágítás) (4). (4) Bármilyen vizsgálati körülmény esetén a megvilágítási rend legyen állandó. (5) Bármilyen vizsgálat esetén ez ± 20/00-ben térhet el. |
|||||||
3. függelék
A VIZSGÁLATHOZ JAVASOLT FAJOKBÓL SZÁRMAZÓ TENYÉSZÁLLATOK ÉS KÍSÉRLETI ÁLLATOK ETETÉSÉRE ÉS KEZELÉSÉRE VONATKOZÓ IRÁNYMUTATÁS
|
FAJ |
TÁP (1) |
A KIKELÉST KÖVETŐ ÁTHELYEZÉS IDŐPONTJA |
AZ ELSŐ ETETÉSIG ELTELT IDŐ |
|||
|
Tenyészhalak |
Frissen kikelt lárvák |
Növendék halak |
||||
|
Típus |
Gyakoriság |
|||||
|
Édesvízi: |
||||||
|
Oncorhynchus mykiss Szivárványos pisztráng |
pisztrángtáp |
Nincs () |
starter pisztrángtáp BSN |
napi 2–4 adag táp |
14–16 nappal a kikelést követően vagy a felúszáskor (nem fontos) |
19 nappal a kikelést követően vagy a felúszáskor |
|
Pimephales promelas Amerikai cselle |
BSN, pehely FBS |
BSN |
BSN48, pehely |
napi 2–3 alkalommal |
amikor a kikelés 90 %-os |
2 nappal a kikelést követően |
|
Danio rerio Zebradánió |
BSN, pehely |
BSN48, pehely, |
BSN, naponta egyszer; pehely naponta kétszer |
amikor a kikelés 90 %-os |
2 nappal a kikelést követően |
|
|
Oryzias latipes Japán rizshal vagy Medaka |
pehely |
BSN, pehely (vagy protozoa vagy kerekesférgek) |
BSN48, pehely (vagy kerekesférgek) |
BSN naponta egyszer; pehely naponta kétszer vagy pehely és kerekesférgek naponta egyszer |
nem alkalmazandó |
6–7 nappal az ívást követően |
|
Torkolati és tengeri: |
||||||
|
Cyprinodon variegatus Tarka fogasponty |
BSN, pehely, FBS |
BSN |
BSN48 |
napi 2–3 adag táp |
nem alkalmazandó |
1 nappal a kikelést követően/felúszáskor |
|
Menidia sp. Atlanti ezüstösoldalú hal |
BSN48, pehely |
BSN |
BSN48 |
napi 2–3 adag táp |
nem alkalmazandó |
1 nappal a kikelést követően/felúszáskor |
|
(*1) A táplálékot a jóllakásig javasolt adni. A felesleges táplálékot és az ürüléket a hulladékok felhalmozódásának elkerülése érdekében el kell távolítani (1) a szikzacskós lárvák nem igényelnek táplálékot (2) vegyes tenyészetből szűrve (3) fermentációs folyamatból származó granulumok FBS fagyasztott sórákok; kifejlett Artemia sp BSN nauplius sórák; frissen kikelt BSN48 nauplius sórák; 48 órás |
||||||
4. függelék
AZ ELFOGADHATÓ MINŐSÉGŰ HÍGÍTÓVÍZ NÉHÁNY FONTOSABB KÉMIAI TULAJDONSÁGA
|
Összetevő |
Határkoncentráció |
|
Finomszemcsés anyag |
5 mg/l |
|
Teljes szervesszén-tartalom |
2 mg/l |
|
Nem ionizált ammónia |
1 μg/l |
|
Maradék klór |
10 μg/l |
|
Szerves foszfort tartalmazó növényvédő szerek összesen |
50 ng/l |
|
Szerves klórtartalmú peszticidek + poliklórozott bifenilek |
50 ng/l |
|
Összes szerves klór |
25 ng/l |
|
Alumínium |
1 μg/l |
|
Arzén |
1 μg/l |
|
Króm |
1 μg/l |
|
Kobalt |
1 μg/l |
|
Réz |
1 μg/l |
|
Vas |
1 μg/l |
|
Ólom |
1 μg/l |
|
Nikkel |
1 μg/l |
|
Cink |
1 μg/l |
|
Kadmium |
100 ng/l |
|
Higany |
100 ng/l |
|
Ezüst |
100 ng/l |
5. függelék
STATISZTIKAI ÚTMUTATÓ AZ NOEC MEGHATÁROZÁSÁHOZ
Általános rész
Az elemzés egysége a párhuzamos tartály. Tehát folyamatos mennyiségek esetén, mint például a méret, ki kell számítani a párhuzamos minták átlagát vagy mediánját, és ezek a párhuzamos értékek lesznek az elemzendő adatok. Az alkalmazott vizsgálat statisztikai erejét lehetőleg az egyes laboratóriumok megfelelő, korábbi kontrolladatokból álló adatbázisa alapján igazolni kell. A 75–80 %-os erő mellett kimutatható mérethatást minden egyes végpontra vonatkozóan meg kell adni az alkalmazandó statisztikai próbával.
A vizsgálati módszer kidolgozásának időpontjában rendelkezésre álló adatbázisok meghatározzák a javasolt statisztikai eljárások keretében elérhető statisztikai erőt. Az egyes laboratóriumoknak igazolniuk kell, hogy teljesíteni tudják az említett statisztikai erőre vonatkozó követelményt, oly módon, hogy saját maguk elvégzik az erőre vonatkozó elemzést vagy igazolják, hogy a variációs koefficiens egyetlen válaszreakció esetében sem haladja meg a vizsgálati iránymutatás kidolgozása során használt variációs koefficiensek 90. percentilisét. A variációs koefficiens értékeit az 1. táblázat tartalmazza. Amennyiben csak a párhuzamosok átlagai vagy mediánjai állnak rendelkezésre, a párhuzamoson belüli variációs koefficienst figyelmen kívül lehet hagyni.
1. táblázat
A kiválasztott édesvízi fajok 90. percentilis értékeinek variációs koefficiense
|
Faj |
Válaszreakció |
A párhuzamosok közötti variációs koefficiens |
A párhuzamosokon belüli variációs koefficiens |
|
Szivárványos pisztráng |
Hossz |
17,4 |
9,8 |
|
Tömeg |
10,1 |
28 |
|
|
Amerikai cselle |
Hossz |
16,9 |
13,5 |
|
Tömeg |
11,7 |
38,7 |
|
|
Zebradánió |
Hossz |
43,7 |
11,7 |
|
Tömeg |
11,9 |
32,8 |
A laboratóriumi toxikológiai vizsgálatok értékelésére alkalmazott szinte valamennyi statisztikai vizsgálat célja a kezelt és a nem kezelt csoport összehasonlítása. Ezért a Dunnett- vagy a Williams-féle próbák elvégzése előtt nem helyénvaló szignifikáns ANOVA F-próbát előírni, vagy szignifikáns Kruskal–Wallis-féle próbát Jonckheere–Terpstra-, Mann–Whitney- vagy Dunn-féle próba elvégzése előtt (Hochberg és Tamhane 1987, Hsu 1996, Dunnett 1955, 1964, Williams 1971, 1972, 1975, 1977, Robertson et al. 1988, Jonckheere 1954, Dunn 1964).
A Dunnett-féle próba magában foglalja a többszörös összehasonlítás korrekcióját, a szelekciós tesztként elvégzett F-próba kedvezőtlen hatással van a Dunnett-féle próba által kiadott hamis pozitív és hamis negatív eredmények arányára. Ehhez hasonlóan a lépésenként 0,05-ös szignifikanciaszintet alkalmazó Williams- és Jonckheere–Terpstra-féle lefelé lépegető próbák általánosan megőrzik az 5 %-os hamis pozitív arányt, és ezt az arányt, valamint a vizsgálat statisztikai erejét a szelekciós tesztként elvégzett F- vagy Kruskal–Wallis-féle próba negatívan befolyásolja. A Mann–Whitney- és a Dunn-féle próba esetében is el kell végezni a többszörös összehasonlításra tekintettel történő korrekciót, és a Bonferroni–Holm-féle korrekció javasolt.
A hipotézisvizsgálatokra vonatkozó ajánlások többségét és az említett vizsgálatok alapját képező feltételezések ellenőrzését a széles körű szakirodalmi jegyzéket is tartalmazó OECD (2006) iránymutatás részletesen tárgyalja.
A kontrollok kezelése oldószer használata esetén
Oldószer alkalmazása esetén hígítóvizes és oldószeres kontrollt is be kell állítani. A két kontrollt minden egyes válaszreakció tekintetében össze kell hasonlítani, és amennyiben a kontrollok között nem tapasztalható szignifikáns eltérés, úgy azokat statisztikai elemzés céljából egyesíteni kell. Ellenkező esetben az oldószeres kontrollt kell használni az NOEC meghatározására vagy az ECx érték becslésére, a vizes kontrollt pedig figyelmen kívül kell hagyni. Lásd az érvényességi kritériumokban szereplő korlátozásokat (7. pont)
A hosszúság, a tömeg, a peték kikelési vagy a lárvák mortalitási aránya, illetve a rendellenesen fejlődött lárvák aránya, továbbá a kikelés vagy a felúszás első vagy utolsó napja tekintetében t-próbát vagy Mann–Whitney-féle próbát kell végezni a hígítóvizes és az oldószeres kontroll összehasonlítására 0,05-ös szignifikanciaszint mellett, valamennyi kezelt csoport figyelmen kívül hagyásával. A vizsgálatok eredményeit jegyzőkönyvbe kell foglalni.
A méretre vonatkozó mérések (hossz és tömeg)
A halegyedek hosszára és tömegére vonatkozó értékek normális vagy log-normális eloszlásúak lehetnek. A párhuzamos vizsgálatok átlagai a centrális határeloszlás-tétel értelmében általában mindkét esetben normális eloszlást mutatnak, és ezt három édesvízi fajjal végzett több mint száz ELS (korai életszakasz)-vizsgálat adatai is alátámasztják. Amennyiben az adatok vagy a korábbi adatbázisok a halegyedek méretére vonatkozó értékek tekintetében log-normális eloszlásra utalnak, úgy ki lehet számítani a párhuzamosonként a halegyedekre vonatkozó átlagértékek logaritmusát, ahol az elemzendő adatok a párhuzamosok átlagai logaritmusainak antilogaritmusai lesznek.
Az adatokat a normális eloszlásnak való megfelelés és a varianciahomogenitás teljesülése szempontjából értékelni kell. E célból az ANOVA modell reziduálisai a koncentrációval mint egyetlen magyarázó változóval használandók. Vizuális meghatározást lehet végezni szórásdiagramok és hisztogramok segítségével, vagy szár-levél diagramokat lehet használni. E helyett végezhető formális próba is, mint például a Shapiro–Wilk- vagy az Anderson–Darling-féle próba. A varianciahomogenitás teljesülését ugyanazon szórásdiagram alapján vizuális meghatározással vagy formálisan, Levene-féle próbával lehet megállapítani. A normalitás és a variancia homogenitása tekintetében csak paraméteres próbákat (pl. Williams, Dunnett) kell értékelni.
Figyelmet kell fordítani az esetleges kiugró értékekre és azok elemzésre gyakorolt hatására. A Tukey-féle kiugróérték-próbát és a fent leírt reziduálisok ábráinak vizuális ellenőrzését lehet alkalmazni. Figyelembe kell venni, hogy a megfigyelések a párhuzamos vizsgálatok egészére vonatkoznak, tehát egy kiugró értéket csak gondos mérlegelés után tanácsos az elemzés során figyelmen kívül hagyni.
Azok a statisztikai vizsgálatok, amelyek felhasználják a kísérleti elrendezés jellemzőit és a biológiai elvárásokat, lefelé lépegető trendpróbák, mint például a Williams- és Jonckheere–Terpstra-féle próbák. Ezek a vizsgálatok monoton koncentráció-hatás összefüggést feltételeznek, és az adatokat aszerint kell értékelni, hogy megfelelnek-e ennek a feltételezésnek. Ezt a párhuzamosok átlagát a vizsgálati koncentráció függvényében ábrázoló szórásdiagram vizuális értékelésével lehet megállapítani. Segíthet, ha a szórásdiagramra egy szakaszonként lineáris görbét fektetnek, ami összeköti a párhuzamos vizsgálatokon belüli mintamérettel súlyozott átlagkoncentrációkat. A szakaszonként lineáris görbe nagymértékű eltérése a monotonitástól arra utalna, hogy a trendpróbák helyett más próbákat kellene használni. Alternatívaként formális próbák alkalmazhatók. Egy egyszerű formális próba a koncentrációk átlagértékeinek lineáris és kvadratikus kontrasztjainak kiszámítását célozza. Amennyiben a kvadratikus kontraszt szignifikáns, a lineáris kontraszt pedig nem szignifikáns, az a monotonitással kapcsolatos problémára utalhat, amit a görbék alapján további értékelésnek kell alávetni. Ahol felvetődik a normalitás és a varianciahomogenitás kérdése, az említett kontrasztokat rangsorba rendezett transzformált adatokból lehet létrehozni. Egyéb eljárások, mint például a Bartholomew-teszt is alkalmazhatók a monotonicitás vizsgálatára, viszont ezek összetettebb eljárások.
2. ábra
NOEC folyamatábra – a méretre vonatkozó mérések (hosszúság és tömeg)

Azokat az eseteket kivéve, ahol az adatok nem felelnek meg ezen próbák követelményeinek, a NOEC a Williams- vagy a Jonckheere–Terpstra-féle próba lefelé lépegető alkalmazásával határozható meg. Az OECD (2006) iránymutatása részletesen ismerteti ezeket az eljárásokat. A lefelé lépegető trendpróba követelményeinek nem megfelelő adatok esetén Dunnett-féle próbát vagy Tamhane–Dunnett (T3) tesztet lehet alkalmazni; mindkét teszt magában foglalja a többszörös összehasonlítások miatt szükséges korrekciót. Ezek a próbák feltételezik a normalitást, a Dunnett-féle próba pedig a variancia homogenitását. Amennyiben ezek a feltételek nem teljesülnek, Dunn-féle nem-paraméteres próbát lehet végezni. Az OECD (2006) iránymutatása tartalmazza az említett próbák részleteit. A 2. ábra áttekintést ad arról, hogy a megfelelő vizsgálatot hogyan lehet megválasztani.
A peték kikelése és a lárvák túlélése
Az adatok a kikelt peték vagy a túlélő lárvák aránya az egyedi párhuzamosokban. Ezeket az arányokat az extra-binomiális variancia szempontjából értékelni kell, ami az ilyen mérések esetében szokásos, de nem általános eljárás. A 3. ábrán látható folyamatábra útmutatást ad a választható vizsgálatokra vonatkozóan; a részletes leírást lásd a szövegben.
Két próbát alkalmaznak gyakran. A Tarone C(α) tesztet (Tarone, 1979) és a khí-négyzet próbát, amelyeket minden egyes vizsgálati koncentrációra külön-külön kell alkalmazni. Amennyiben akár egyetlen vizsgálati koncentráció esetében extra-binomiális varianciát találnak, akkor az erre alkalmas módszert kell használni.
1. képlet
Tarone C (α) teszt (Tarone 1979)

ahol
![]() az átlagos arány egy adott koncentráció esetében, m a párhuzamos tartályok száma, nj
a párhuzamosokban lévő állatok száma j, és xj
az adott párhuzamosban lévő válaszreakciót mutató állatok száma, pl. nem kelt ki vagy elpusztult. Ezt a vizsgálatot minden egyes koncentrációra külön-külön kell elvégezni. Ezt a tesztet módosított khí-négyzet próbának lehet tekinteni, ugyanakkor a Tarone által végzett, korlátozott statisztikai erőre vonatkozó szimulációk azt bizonyították, hogy nagyobb statisztikai erőt képvisel, mint a khí-négyzet próba.
az átlagos arány egy adott koncentráció esetében, m a párhuzamos tartályok száma, nj
a párhuzamosokban lévő állatok száma j, és xj
az adott párhuzamosban lévő válaszreakciót mutató állatok száma, pl. nem kelt ki vagy elpusztult. Ezt a vizsgálatot minden egyes koncentrációra külön-külön kell elvégezni. Ezt a tesztet módosított khí-négyzet próbának lehet tekinteni, ugyanakkor a Tarone által végzett, korlátozott statisztikai erőre vonatkozó szimulációk azt bizonyították, hogy nagyobb statisztikai erőt képvisel, mint a khí-négyzet próba.
3. ábra
A peték kikelésére és a lárvák mortalitására vonatkozó NOEC folyamatábra

Amennyiben az extra-binomiális varianciára nincs szignifikáns bizonyíték, a lefelé lépegető Cochran–Armitage-féle próbát lehet alkalmazni. Ez a próba nem veszi figyelembe a párhuzamosokat, így amennyiben van ilyen bizonyíték, úgy a Cochran–Armitage-féle próba Rao–Scott-féle módosítását javasolt elvégezni, amely számításba veszi a párhuzamosokat, azok méretét és az extra-binomiális varianciát. Végezhető még lefelé lépegető Williams- és Jonckheere–Terpstra-féle próba, valamint Dunnett-féle próba a méretre vonatkozó mérésekre leírtak szerint. Az említett próbák extra-binomiális variancia esetén, illetve annak hiányában is alkalmazhatók, azonban némiképp alacsonyabb statisztikai erőt képviselnek (Agresti 2002, Morgan 1992, Rao és Scott 1992, 1999, Fung et al. 1994, 1996).
A kikelés vagy a felúszás első vagy utolsó napja
A válaszreakció egy egész szám, amely azt a vizsgálati napot adja meg, amelyen a jelzett megfigyelést végezték az adott párhuzamos tartály esetében. Az értéktartomány általában igen szűk, és gyakran nagy a kötött értékek aránya, pl. a kikelés első napja valamennyi kontrollpárhuzamosban és esetleg egy vagy két alacsony vizsgálati koncentrációban megegyezik. Az ilyen adatok esetében a paraméteres próbák, mint például a Williams- és a Dunnett-féle próba, nem megfelelőek. Hacsak nincs bizonyíték arra, hogy az eredmények a monotonitástól jelentősen eltérnek, a lefelé lépegető Jonckheere–Terpstra-féle próba nagyon erőteljes módszer a vizsgálati vegyi anyag hatásainak kimutatására. Egyébként a Dunn-féle próbát lehet alkalmazni.
A lárvák rendellenességei
A válaszreakció a valamilyen rendellenességet mutató lárvák száma. Ennek a válaszreakciónak az előfordulási gyakorisága általában alacsony, és néhány olyan probléma merül fel vele kapcsolatban, mint a kikelés első napja esetében, valamint a koncentráció-hatás összefüggés néha szabálytalan. Amennyiben az adatok legalább hozzávetőleg monoton koncentrációs görbét követnek, a lefelé lépegető Jonckheere–Terpstra-féle próba erőteljes módszer a hatások kimutatására. Egyébként a Dunn-féle próbát lehet alkalmazni.
HIVATKOZÁSOK:
Agresti, A. (2002); Categorical Data Analysis, second edition, Wiley, Hoboken.
Dunnett C. W. (1955); A multiple comparison procedure for comparing several treatments with a control, J. American Statistical Association 50, 1096-1121.
Dunn O. J. (1964 ); Multiple Comparisons Using Rank Sums, Technometrics 6, 241-252.
Dunnett C. W. (1964); New tables for multiple comparisons with a control, Biometrics 20, 482-491.
Fung, K.Y., D. Krewski, J.N.K. Rao, A.J. Scott (1994); Tests for Trend in Developmental Toxicity Experiments with Correlated Binary Data, Risk Analysis 14, 639-648.
Fung, K.Y, D. Krewski, R.T. Smythe (1996); A comparison of tests for trend with historical controls in carcinogen bioassay, Canadian Journal of Statistics 24, 431-454.
Hochberg, Y. and A. C. Tamhane (1987); Multiple Comparison Procedures, Wiley, New York.
Hsu, J.C. (1996); Multiple Comparisons: Theory and Methods; Chapman and Hall/CRC Press, Boca Raton.
Jonckheere A. R. (1954); A distribution-free k-sample test against ordered alternatives, Biometrika 41, 133.
Morgan, B.J.T. (1992); Analysis of Quantal Response Data, Chapman and Hall, London.
OECD (2006). Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. Series on Testing and Assessment, No. 54. Organisation for Economic Co-operation and Development, OECD, Paris.
Rao J.N.K. and Scott A.J. (1992) – A simple method for the analysis of clustered binary data, Biometrics 48, 577-585.
Rao J.N.K. and Scott A.J. (1999) – A simple method for analyzing overdispersion in clustered Poisson data, Statistics in Medicine 18, 1373-1385.
Robertson, T., Wright F.T. and Dykstra R.L. (1988); Order restricted statistical inference, Wiley.
Tarone, R.E. (1979); Testing the goodness of fit of the Binomial distribution, Biometrika 66, 585-590.
Williams D.A. (1971); A test for differences between treatment means when several dose levels are compared with a zero dose control, Biometrics 27, 103-117.
Williams D.A. (1972); The comparison of several dose levels with a zero dose control, Biometrics 28, 519-531.
Williams D. A. (1975); The Analysis of Binary Responses from Toxicological Experiments Involving Reproduction and Teratotlogy, Biometrics 31, 949-952.
Williams D.A. (1977); Some inference procedures for monotonically ordered normal means, Biometrika 64, 9-14.
6. függelék
STATISZTIKAI ÚTMUTATÓ REGRESSZIÓS BECSLÉSEKHEZ
Általános rész
A modell illesztéséhez alkalmazott megfigyelések a párhuzamosok átlagai (hosszúság és tömeg) vagy azok arányai (a peték kikelése és a lárvák mortalitása) (OECD 2006).
Általában a párhuzamos minták méretét súlyként használó súlyozott regresszió a javasolt módszer. Más súlyozási rendszerek is alkalmazhatók, mint például az előrejelzett átlagos válaszreakcióval történő súlyozás, valamint ennek és a párhuzamos minták méretével való súlyozásnak a kombinációja. A koncentráción belüli mintavariancia reciprokával történő súlyozás nem ajánlott (Bunke et al. 1999, Seber és Wild, 2003, Motulsky és Christopoulos 2004, Huet et al. 2003).
A válaszreakciók elemzést megelőző bármilyen transzformációja esetén meg kell őrizni a megfigyelések függetlenségét, és az ECx értékét és konfidenciahatárait az eredeti mértékegységben és nem a transzformált egységben kell kifejezni. Például a hosszúság logaritmusának 20 %-os változása nem egyenértékű a hosszúság 20 %-os változásával (Lyles et al. 2008, Draper és Smith 1999).
A 4. ábrán látható folyamatábra áttekintést nyújt az ECx becsléseire vonatkozóan. További részletek az alábbi szövegben találhatók.
4. ábra
A párhuzamosok átlagos hosszára és tömegére, vagy a peték kikelésére és a lárvák mortalitására vonatkozó ECx becslések folyamatábrája, a részleteket lásd a szövegben

A peték kikelésével és a lárvák mortalitásával kapcsolatos megfontolások
A peték kikelése és a lárvák mortalitása tekintetében általában a legjobb megoldás egy csökkenő modell illesztése, kivéve, ha az alább ismertetett probit modell illesztését választják. Tehát a ki nem kelt peték vagy az elpusztult lárvák arányát kell modellezni. Ennek az az oka, hogy az ECx arra a koncentrációra utal, amely esetében a kontrollok átlagos válaszreakciójának x %-ával egyenértékű változás következik be. Amennyiben a kontrollpeték 5 %-a nem kel ki és a kikelés sikertelenségét modellezik, akkor az EC20 azt a koncentrációt jelenti, amely esetében a kontrollpeték 5 %-os sikertelen kikelése 20 %-kal változik, ami 0,2*0,05=0,01 értékű vagy 1 százalékpontos változásnak, azaz 6 %-os sikertelen kikelésnek felel meg. Ilyen csekély változást a rendelkezésre álló adatokból nem lehet megbecsülni és annak biológiai szempontból nincs jelentősége. Amennyiben a kikelő peték arányát modellezik, a kontrollarány ebben a példában 95 % lesz és a kontroll átlagának 20 %-os csökkenése 0,95*0,2=0,18 értékű változást jelentene, tehát a kikelés sikeressége 95 %-ról 77 %-ra csökken (= 95–18) és ezt a hatást okozó koncentrációt lehet megbecsülni, ami feltehetően nagyobb jelentőséggel bírhat. Ez a méretre vonatkozó mérésekkel kapcsolatosan nem jelent problémát, noha a méretre gyakorolt kedvezőtlen hatások általában méretcsökkenést jelentenek.
A méretre (hosszúság és tömeg) és a peték kikelésének sikerességére vagy a lárvák túlélésére vonatkozó modellek
A Brain–Cousens-féle hormetikus modell kivételével az OECD (2006) iránymutatás az említett modellek mindegyikét ismerteti és ajánlja. Az OECD 2–5 elnevezésű modellekben foglaltakat az ökotoxicitás-vizsgálatok kapcsán Slob (2002) tanulmánya is tárgyalja. Természetesen számos egyéb modell hasznos lehet. Bunke és munkatársai (1999) számos olyan modellt sorolnak fel, amelyek itt nem kerültek említésre, és bőségesen állnak rendelkezésre más modellekre való hivatkozások. Az alábbiakban felsorolt modellek az ökotoxicitás-vizsgálatok esetében különösen alkalmasak és széles körben elterjedtek.
5 vizsgálati koncentrációval és kontrollal
— Bruce–Versteeg
— Egyszerű exponenciális (OECD 2)
— Exponenciális alak-paraméterrel (OECD 3)
— Egyszerű exponenciális alsó határértékkel (OECD 4)
6 vagy ennél több vizsgálati koncentrációval és kontrollal
— Exponenciális alak-paraméterrel és alsó határértékkel (OECD 5)
— Michaelis–Menten
— Hill
Amennyiben hormézis látható (a peték sikeres kikelése vagy a lárvák túlélése esetén nem valószínű, ugyanakkor a méretre vonatkozó megfigyelések során néha előfordul)
— Brain–Cousens hormetikus modellje; Brain és Cousens (1989)
A peték sikertelen kikelésére és a lárvák mortalitására vonatkozó egyéb modellek
— Az ilyen válaszreakciókra alkalmazható növekvő modellekre probit (vagy logisztikus) modelleket lehet illeszteni, amennyiben az extra-binomiális varianciára nincs bizonyíték és a kontroll incidenciája becsülve van a modell illesztésekor. Nem ezt a módszert kell előnyben részesíteni, mivel ebben az egyed és nem a párhuzamos az elemzési egység (Morgan 1992, O'Hara Hines és Lawless 1993, Collett 2002, 2003).
Egyetlen modell illeszkedésének megfelelősége
— Minden egyes vizsgálati koncentráció esetében vizuálisan össze kell hasonlítani a megfigyelt és az előrejelzett százalékos csökkenést (Motulsky és Christopoulos 2004, Draper és Smith 1999).
— F-próba alkalmazásával össze kell hasonlítani a regresszió átlagos négyzetes hibáját a tiszta átlagos négyzetes hibával (Draper és Smith 1999).
— Ellenőrizni kell, hogy a modell minden feltétele jelentősen eltér-e a nullától (vagyis meg kell határozni, hogy a modell valamennyi feltétele fontos-e) (Motulsky és Christopoulos 2004).
— A regresszió reziduálisainak a vizsgálati koncentráció függvényében történő ábrázolása, lehetőleg log(koncentráció) skálán. Ennek az ábrának nem kell semmilyen mintázatot követnie; a pontoknak véletlenszerűen kell szóródniuk egy vízszintes egyenes mentén a nulla magasságában.
— Az adatokat a normalitás és varianciahomogenitás szempontjából kell értékelni az 5. függelékben feltüntetett módszerrel megegyezően.
— Emellett a regressziós modell maradékainak normalitását ugyanazokat a módszereket alkalmazva kell értékelni, mint amelyeket az 5. függelék az ANOVA reziduálisai tekintetében ismertet.
A modellek összehasonlítása
— Akiake AICc-kritériumait kell alkalmazni. Az alacsonyabb AICc-értékek a jobb illeszkedést jelzik és amennyiben AICc(B)-AICc(A)≥10, akkor az A. modell szinte biztosan jobb, mint a B. modell (Motulsky és Christopoulos (2004).
— Vizuálisan össze kell hasonlítani a két modellt aszerint, hogy az egyetlen modellre vonatkozó fenti kritériumoknak mennyire felelnek meg.
— A takarékosság elvét javasolt követni, miszerint a legegyszerűbb modellt kell alkalmazni azok közül, amelyek kellően jól illeszkednek az adatokhoz (Ratkowsky 1993, Lyles et al. 2008).
Az ECx becslés minősége
Az ECx konfidencia-intervalluma nem lehet túl tág. Statisztikai megítélés szükséges annak eldöntésére, hogy a konfidencia-intervallum mennyire lehet tág, hogy az ECx még használható legyen. A peték kikelésére és a méretre vonatkozó adatokhoz illeszkedő regressziós modellek szimulációi azt mutatják, hogy az ECx (x=10, 20 vagy 30) konfidencia-intervallumainak 75 %-a nem lép túl két vizsgálati koncentrációt. Ez általános útmutatást ad arra vonatkozóan, hogy mi az elfogadható, és praktikus útmutató arra, hogy mi az, ami megvalósítható. Számos szerző állítja, hogy szükség van arra, hogy a konfidencia-intervallumokat a modellek minden paramétere tekintetében feljegyezzék, és hogy a modellparaméterek tág konfidencia-intervallumai elfogadhatatlan modelleket jeleznek (Ott és Longnecker 2008, Alvord és Rossio 1993, Motulsky és Christopoulos 2004, Lyles et al. 2008, Seber és Wild 2003, Bunke et al. 1999, Environment Canada 2005).
Az ECx (vagy bármely más modellparaméter) konfidencia-intervalluma nem tartalmazhatja a nullát (Motulsky és Christopoulos 2004). Ez a minimális szignifikáns különbséggel egyenértékű regresszió, amelyet a hipotézisvizsgálati megközelítésekben gyakran említenek (pl. Wang et al. 2000). Ez a konfidencia-intervallummal is megegyezik, hogy az LOEC szintjén mért átlagos válaszreakció ne tartalmazza a kontroll átlagát. Vizsgálni kell, hogy a paraméterek becslései tudományosan elfogadhatók-e. Pl. ha az y0 konfidencia-intervalluma ±20 %, akkor egyetlen EC10 becslés sem elfogadható. Amennyiben a modell 20 %-os hatást jelez előre C koncentrációnál és a maximális megfigyelhető hatás C és annál alacsonyabb koncentrációnál 10 %-os, akkor az EC20 nem elfogadható (Motulsky és Christopoulos 2004, Wang et al. 2000, Environment Canada 2005).
Az ECx nem teheti szükségessé a pozitív koncentrációk tartományán kívüli extrapolációt (Draper és Smith 1999, OECD 2006). Az ECx értékére vonatkozó általános iránymutatás az lehet, hogy az érték ne legyen több mint kb. 25 %-kal a legalacsonyabb vizsgálati koncentráció alatt, vagy ne legyen több mint kb. 25 %-kal a legmagasabb vizsgálati koncentráció felett.
HIVATKOZÁSOK:
Alvord, W.G., Rossio, J.L. (1993); Determining confidence limits for drug potency in immunoassay, Journal of Immunological Methods 157, 155-163.
Brain P. and Cousens R. (1989); An equation to describe dose responses where there is stimulation of growth at low doses. Weed res. 29: 93-96.
Bunke, O., Droge, B. and Polzehl, J. (1999). Model selection, transformations and variance estimation in nonlinear regression. Statistics 33, 197-240.
Collett, D. (2002); Modelling Binary Data, second edition, Chapman and Hall, London.
Collett, D. (2003); Modelling Survival Data in Medical Research, second edition, Chapman and Hall, London.
Draper, N.R. and Smith, H. (1999); Applied Regression Analysis, third edition. New York: John Wiley & Sons.
Environment Canada (2005); Guidance Document on Statistical Methods for Environmental Toxicity Tests, Report EPS 1/RM/46
Huet, S., A. Bouvier, M.-A. Poursat, E. Jolivet (2003); Statistical Tools for Nonlinear Regression: A Practical Guide with S-PLUS and R Examples, Springer Series in Statistics, New York.
Lyles, R. H., C. Poindexter, A. Evans, M. Brown, and C.R. Cooper (2008); Nonlinear Model-Based Estimates of IC50 for Studies Involving Continuous Therapeutic Dose-Response Data, Contemp Clin Trials. 2008 November; 29(6): 878–886.
Morgan, B.J.T. (1992); Analysis of Quantal Response Data, Chapman and Hall, London.
Motulsky, H., A. Christopoulos (2004); Fitting Models to Biological Data Using Linear and Nonlinear Regression: A Practical Guide to Curve Fitting, Oxford University Press, USA.
O'Hara Hines, R. J. and J. F. Lawless (1993); Modelling Overdispersion in Toxicological Mortality Data Grouped over Time, Biometrics Vol. 49, pp. 107-121
OECD (2006); Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. Series Testing and Assessment, No. 54, Organisation for Economic Co-operation and Development, OECD, Paris.
Ott, R.L., M.T. Longnecker, An Introduction to Statistical Methods and Data Analysis, sixth edition, 2008, Brooks-Cole, Belmont, CA
Ratkowsky, D.A. (1993); Principles of nonlinear regression, Journal of Industrial Microbiology 12, 195-199.
Seber, G.A.F., C.J. Wild, Nonlinear Regression, Wiley, 2003
Slob W. (2002); Dose-response modelling of continuous endpoints. Toxicol. Sci., 66, 298-312
Wang, Q., D.L. Denton, and R. Shukla (2000); Applications and Statistical Properties Of Minimum Significant Difference-Based Criterion Testing In a Toxicity Testing Program, Environmental Toxicology and Chemistry, Vol. 19, pp. 113–117, 2000.
C.48. A halakon végzett rövid távú reprodukciós vizsgálat
BEVEZETÉS
1. Ez a vizsgálati módszer egyenértékű az OECD 229. vizsgálati iránymutatásában (2012) leírt módszerrel. Az endokrin rendszerre ható vegyi anyagok halfajokban történő kimutatására alkalmas vizsgálat kifejlesztése és validálása iránti igény azokból az aggodalmakból ered, hogy a vegyi anyagok a környezetben előforduló mennyiségükben az endokrin rendszerrel való kölcsönhatásuk révén káros hatással lehetnek az emberekre és az élővilágra egyaránt. 1998-ban az OECD a meglévő vizsgálati iránymutatások felülvizsgálatára, valamint a hormonháztartást esetlegesen zavaró anyagok kiszűrését és vizsgálatát célzó új vizsgálati iránymutatások kidolgozására irányuló, kiemelt fontosságú tevékenységet indított. E tevékenység egyik eleme a halfajok endokrin rendszerére ható vegyi anyagok kiszűrésére vonatkozó vizsgálati iránymutatás kidolgozása volt. A halakon végzett rövid távú reprodukciós vizsgálatot a kiválasztott vegyi anyagokkal végzett, laboratóriumok közötti vizsgálatokból álló alapos validálási programnak vetették alá, hogy bizonyítsák a vizsgálat relevanciáját és megbízhatóságát a halak szaporodását különböző, többek között az endokrin rendszerre ható mechanizmusokon keresztül befolyásoló vegyi anyagok kimutatása szempontjából (1, 2, 3, 4, 5). Az OECD vizsgálati iránymutatásában szereplő valamennyi végpontot validálták az amerikai cselle tekintetében, és a végpontok egy részét (vagyis a vitellogenint és a másodlagos ivari jellegeket) a japán rizshal és (a vitellogenint) a zebradánió esetében. A validációs munka szakértői értékelését egyrészről az OECD vizsgálati iránymutatási programjának nemzeti koordinátorai által kinevezett szakértői testület (6), másrészről az Egyesült Államok Környezetvédelmi Ügynöksége által megbízott független szakértői testület (29) végezte. A vizsgálat célja nem a hormonális zavarok specifikus mechanizmusainak meghatározása, mivel a vizsgálati állatok ép hipotalamusz-hipofízis-gonád (HPG) tengellyel rendelkeznek, amely olyan vegyi anyagokra is reagálhat, amelyek eltérő szinteken gyakorolnak hatást a HPG-tengelyre.
2. Az e fejezetben ismertetett vizsgálati módszer egy in vivo szűrővizsgálati eljárást ír le, amelynek során ivarérett hím és ívási szakaszban lévő nőstény halakat tartanak együtt és tesznek ki vegyi anyag hatásának életciklusuk egy korlátozott szakaszában (21 napig). A 21 napig tartó expozíciós időszak végén két biomarker végpontot kell mérni a hímeknél és a nőstényeknél a vizsgálati vegyi anyag endokrin rendszerre kifejtett hatásának mutatójaként; ez a két végpont a vitellogenin és a másodlagos ivari jellegek. A vitellogenint az amerikai csellénél, a japán rizshalnál és a zebradániónál kell mérni, míg a másodlagos ivari jelleget az amerikai csellénél és a japán rizshalnál. Ezenkívül a vizsgálat során a fekunditás mennyiségi ellenőrzését naponta el kell végezni. Az ivarmirigyeket is konzerválni kell, és kórszövettani értékelés végezhető a kísérleti állatok szaporodási képességének ellenőrzése, valamint más végpontok bizonyító erejének növelése céljából.
3. Ez a biológiai vizsgálat in vivo reprodukciós szűrővizsgálati célokat szolgál, és alkalmazását az »OECD fogalmi kerete az endokrin rendszert károsító vegyi anyagok tesztelésére és értékelésére« (30) című dokumentum összefüggésében kell szemlélni. Ebben a fogalmi keretben a halakon végzett rövid távú reprodukciós vizsgálat 3. szinten javasolt mint olyan in vivo vizsgálat, amely a kiválasztott endokrin mechanizmus(ok)ról/útvonal(ak)ról szolgáltat adatokat.
KIINDULÁSI MEGFONTOLÁSOK ÉS KORLÁTOK
4. A vitellogenin (VTG) általában a nőstény ikrarakó gerincesek májában termelődik a keringő endogén ösztrogénekre adott válaszként. A szikben található fehérjék prekurzora, és a májban történő megtermelődése után a vérárammal jut el a petefészekbe, ahol a fejlődő ikrák felveszik és módosítják. A vitellogenin szinte kimutathatatlan a fiatal nőstény és hím halak vérplazmájában, mivel a szervezetükben nincs elegendő keringő ösztrogén; ugyanakkor a máj az exogén ösztrogénstimulációra adott válaszul is képes vitellogenin szintetizálására és kiválasztására.
5. A vitellogenin mérésével kimutathatók a különböző ösztrogén hatásmechanizmusú vegyi anyagok. Az ösztrogenikus vegyi anyagok kimutathatók a hím halakban végbemenő vitellogeninindukció mérésével, amely módszerre számos hivatkozás található a szakértői értékelésnek alávetett tudományos szakirodalomban (pl. (7)). A vitellogenin indukcióját aromatizálható androgénekkel szembeni expozíció után is kimutatták (8, 9). A keringő ösztrogén szintjének csökkenése a nőstényeknél – például az endogén androgént természetes ösztrogén 17β-ösztradiollá konvertáló aromatáz gátlása miatt – a vitellogeninszint csökkenését okozza, amelyet az aromatázgátló tulajdonságokkal rendelkező vegyi anyagok kimutatására lehet használni (10, 11). Az ösztrogén/aromatázgátlást követően létrejövő vitellogenin-válasz biológiai jelentőségét megállapították és széles körben dokumentálták. Lehetséges azonban, hogy a VTG-termelést a nőstényeknél az általános toxicitás és a nem az endokrin rendszerre ható toxikus hatásmechanizmusok, pl. a hepatotoxicitás is befolyásolják.
6. Több rutin mérési módszert fejlesztettek már ki és szabványosítottak. Ilyenek a fajspecifikus enzimhez kötött immunoszorbens vizsgálati módszerek (ELISA), amelyek immunkémiai eljárásokat használnak a termelt vitellogeninmennyiség meghatározására az egyes halakból gyűjtött kis vér- vagy májmintákban (12, 13, 14, 15, 16, 17, 18). A VTG mérése céljából az amerikai cselléből vér-, a zebradánióból vér- vagy fej/farok homogenizátumot, a japán rizshalból pedig májmintát kell venni. A japán rizshal esetében jó korreláció áll fenn a vérben és a májban mért VTG-értékek között (19). A vitellogeninanalízishez előírt mintavételi eljárásokat a 6. függelék tartalmazza. A VTG mérésére szolgáló készletek széles körben elérhetők; az ilyen készleteknek validált fajspecifikus ELISA-módszeren kell alapulniuk.
7. Egyes halfajok hím egyedeinek másodlagos ivari jellegei kívülről láthatók, számszerűsíthetők és reagálnak az endogén androgének szervezetben keringő mennyiségeire; ez a helyzet az amerikai cselle és a japán rizshal esetében, de a zebradánió esetében nem, mert ez a faj nem rendelkezik számszerűsíthető másodlagos ivari jellemzőkkel. A nőstények megőrzik az arra irányuló képességüket, hogy hím másodlagos ivari jellegeket fejlesszenek ki, ha vízben androgén hatású vegyi anyagoknak vannak kitéve. A tudományos irodalomban több olyan vizsgálat áll rendelkezésre, amely dokumentálja az ilyen típusú választ az amerikai cselle (20) és a japán rizshal (21) esetében. A másodlagos ivari jellegek csökkenését a hím egyedekben óvatosan kell értelmezni az alacsony statisztikai erő miatt, és az értelmezést szakértői megítélésre és a bizonyítékok súlyának mérlegelésére kell alapozni. A vizsgálatban a zebradánió használatának – az androgénhatású vegyi anyagokra reagáló számszerűsíthető másodlagos ivari jellemzők hiánya miatt –korlátai vannak.
8. Az amerikai csellében az exogén androgén expozíció fő mutatója a nőstény hal orrán található nászkiütések száma. A japán rizshal nőstény egyedeiben a papilláris nyúlványok száma képezi az androgén vegyi anyagoknak való exogén kitettség fő markerét. Az amerikai cselle és a japán rizshal ivari jellegének értékelése során követendő eljárásokat az 5A., illetve az 5B. függelék tartalmazza.
9. A halakon végzett 21 napos vizsgálat magában foglalja az ikratermelés mennyiségének értékelését és az ivarmirigyek opcionális kórszövettani vizsgálat céljából történő konzerválását. Néhány szabályozó hatóság előírhatja ezt a további végpontot is annak érdekében, hogy a kísérleti állatok szaporodási képességét átfogóbban lehessen értékelni, illetve olyan esetekben, amikor a vitellogenin és a másodlagos ivari jellegek a vegyi anyaggal történő expozícióra nem reagáltak. Noha néhány végpont nagy diagnosztikai értékű lehet (pl. a VTG-indukció a hímekben és a nászkiütés-képződés a nőstényekben), a vizsgálat nem minden végpontja (pl. a fekunditás és az ivarmirigyek kórszövettani vizsgálata) alkalmas a specifikus sejtszintű hatásmechanizmusok egyértelmű meghatározására. Ehelyett a végpontok együttesen teszik lehetővé az esetleges endokrin zavarokkal kapcsolatos következtetések levonását, és ezáltal adnak útmutatást a további vizsgálatokhoz. Noha nem endokrinspecifikus, a fekunditás – az endokrin rendszerre ható ismert vegyi anyagokra való bizonyított érzékenysége miatt (5) – egy fontos figyelembeveendő végpont, mivel ha a vizsgálati vegyi anyag a fekunditást és a többi végpontot nem befolyásolja, akkor nagyobb biztonsággal állítható, hogy a vegyület az endokrin rendszerre valószínűleg nincs hatással. Ugyanakkor, ha a fekunditást befolyásolja, az nagy súllyal esik latba a bizonyítékok mérlegelésekor. Az adatok értelmezésére és a vizsgálati eredmények elfogadhatóságára vonatkozó útmutatás ezen vizsgálati módszerek leírásában található.
10. Az e vizsgálati módszerben használt fogalommeghatározások az 1. függelékben találhatók.
A VIZSGÁLAT ELVE
11. A vizsgálat során a vizsgálati edényekben vegyesen elhelyezett, párzóképes állapotú hím és nőstény halakat kell kitenni valamely vegyi anyagnak. A felnőtt korú és párzóképes állapotú halakon a nemek egyértelműen megkülönböztethetők és ezáltal az egyes végpontok ivaronként elemezhetők, illetve biztosított a halak érzékenysége az exogén vegyi anyagok iránt. A vizsgálat befejezésekor a halak ivarát az ivarmirigyek makroszkopikus vizsgálatával kell alátámasztani a has ollóval történő ventrális felnyitása után. A biológiai vizsgálat lényeges feltételeiről a 2. függelék nyújt áttekintést. A vizsgálat általában ívási állapotban lévő populációból vett halakkal indul; öregedő állatokat nem szabad használni. A halak életkorára és párzóképességére vonatkozó útmutató „A halak kiválasztása” című szakaszban található. A vizsgálatot a vegyi anyag három expozíciós koncentrációjával, valamint egy vizes kontrollal és szükség esetén egy oldószeres kontrollal kell végezni. A zebradánió esetében kezelésenként két edényt vagy párhuzamost (minden edény 5 hímet és 5 nőstényt tartalmaz) kell alkalmazni. Az amerikai cselle esetében kezelésenként négy edényt vagy párhuzamost kell használni (minden edény 2 hímet és 4 nőstényt tartalmaz). Ez azért szükséges, hogy érvényesülhessen a hím amerikai csellék territoriális viselkedése, úgy, hogy a vizsgálathoz szükséges statisztikai erő is biztosított legyen. A japán rizshal esetében kezelésenként négy edényt vagy párhuzamost kell használni (minden edény 3 hímet és 3 nőstényt tartalmaz). Az expozíciót 21 napig kell folytatni, és a halakból az expozíció 21. napján kell mintát venni. A fekunditás mennyiségi ellenőrzését naponta kell végezni.
12. A 21. napon végzett mintavétel keretében az állatokat kíméletesen le kell ölni. Az amerikai cselle és a japán rizshal esetében a másodlagos ivari jelleget mérni kell (lásd az 5A. és 5B. függeléket); a zebradánióból és az amerikai cselléből vérmintát kell gyűjteni a vitellogenin meghatározására, míg a zebradánió esetében a vitellogenin meghatározására alternatívaként fej/farok mintát is lehet gyűjteni (6. függelék); a japán rizshalból májmintát kell gyűjteni VTG-analízis céljára (6. függelék); az ivarmirigyeket egészben vagy preparálva kell fixálni az esetleges kórszövettani értékelés céljából (22).
A VIZSGÁLAT ELFOGADHATÓSÁGI KRITÉRIUMAI
13. A következő feltételeknek kell teljesülniük ahhoz, hogy a vizsgálat elfogadható legyen:
— a mortalitási arány a vizes (vagy oldószeres) kontrollokban az expozíciós idő végén nem haladhatja meg a 10 %-ot,
— az expozíciós idő alatt az oldott oxigén koncentrációjának mindvégig legalább a levegőtelítettségi érték (ASV) 60 %-ának kell lennie,
— a víz hőmérsékletében soha nem lehet ±1,5 °C-nál nagyobb eltérés az egyes vizsgálati edények között, és a hőmérséklet a vizsgálati fajra nézve meghatározott hőmérsékleti tartományon belül 2 °C-ot ingadozhat (2. függelék),
— bizonyítékkal kell alátámasztani, hogy a vizsgálati vegyi anyag oldatban lévő koncentrációit az átlagos mért értékek ±20 %-os tartományán belül sikerült tartani;
— bizonyítékkal kell alátámasztani, hogy a halak a vegyi anyaggal történő expozíciót megelőzően minden párhuzamos tartályban és a vizsgálat során a kontrollokban aktívan ívnak.
A MÓDSZER LEÍRÁSA
Felszerelés
14. Normál laboratóriumi felszerelés és különösen az alábbiak:
(a) oxigéntartalom- és pH-mérők;
(b) a víz keménységi fokának és lúgosságának mérésére szolgáló berendezések;
(c) a hőmérséklet szabályozására és lehetőleg folyamatos figyelemmel kísérésére is alkalmas készülékek;
(d) kémiailag semleges anyagból készült és az ajánlott betelepítési aránynak és állománysűrűségnek megfelelő kapacitású tartályok (lásd a 2. függeléket);
(e) ívási aljzat az amerikai cselle és a zebradánió részére, a szükséges adatok a 4. függelékben találhatók;
(f) megfelelő (azaz ±0,5 mg) pontosságú mérleg.
Víz
15. A vizsgálat céljára bármilyen víz felhasználható, amelyben a vizsgálati fajok kellően hosszú ideig megélnek a vizsgálati körülmények mellett, és növekednek. A víz minőségét a vizsgálat során mindvégig azonos szinten kell tartani. A víz pH-értékének a 6,5–8,5 tartományon belül kell lennie, azonban egy adott vizsgálat során a pH-érték csak ± 0,5 egységgel térhet el a kiindulási értéktől. Annak biztosítása céljából, hogy a hígítóvíz ne gyakoroljon nem kívánt hatást a vizsgálat eredményeire (pl. mert komplexet képez a vizsgálati vegyi anyaggal), bizonyos időközönként vízmintákat kell venni és elemezni. Mérni kell a következőket: a nehézfémek (pl. Cu, Pb, Zn, Hg, Cd és Ni), a fontosabb anionok és kationok (pl. Ca2+, Mg2+, Na+, K+, Cl–, és SO4 2–), a peszticidek (pl. összes szerves foszfor és összes szerves klór tartalmú peszticidek), a teljes szervesszén-tartalom és a szuszpendált szilárd anyagok, például háromhavonta, amennyiben a hígítóvíz ismerten viszonylag állandó minőségű. Amennyiben legalább egy éven keresztül állandónak bizonyul a vízminőség, a vizsgálatot ritkábban és nagyobb időközönként is el lehet végezni (pl. minden hat hónapban). Az elfogadható minőségű hígítóvíz néhány kémiai tulajdonságának felsorolása a 3. függelékben található.
Vizsgálati oldatok
16. A kiválasztott koncentrációjú vizsgálati oldatok a törzsoldat hígításával készíthetők el. A törzsoldatot lehetőleg a vizsgálati vegyi anyagnak a hígítóvízbe mechanikai eszközök (pl. keverő és/vagy ultrahang) segítségével történő bekeverésével vagy megmozgatásával kell elkészíteni. Telítési oszlopok (oldhatósági oszlopok) is használhatók a megfelelő koncentrációjú törzsoldat elkészítéséhez. Oldószer-hordozóanyag használata nem ajánlott. Ugyanakkor, ha oldószerre van szükség, párhuzamosan egy oldószeres kontrollt is futtatni kell a vegyi anyaggal történő kezelésekben alkalmazottal megegyező oldószer-koncentrációval. A nehezen vizsgálható vegyi anyagok esetében az oldószer lehet technikailag a legjobb megoldás; e tekintetben „A nehezen vizsgálható anyagok és keverékek vízi toxikológiai vizsgálata” című OECD-iránymutatást (23) kell tanulmányozni. A megfelelő oldószert az anyag vagy a keverék tulajdonságai határozzák meg. Az OECD-iránymutatás maximum 100 μl/l értéket javasol, amelyet be kell tartani. Egy közelmúltban végzett felülvizsgálat (24) azonban további aggályokra hívta fel a figyelmet az oldószerek endokrin rendszerre kifejtett hatások vizsgálatában való használatával kapcsolatban. Ezért ajánlott, hogy amennyiben feltétlenül szükség van rá, az oldószer koncentrációja a lehető legkisebb legyen, ha ez technikailag megvalósítható (a vizsgálati vegyi anyag fizikai-kémiai tulajdonságaitól függően).
17. Átfolyásos vizsgálati rendszert kell használni. Ez a rendszer a koncentrációsorozatnak a vizsgálati kamrákba történő bejuttatása céljából folyamatosan adagolja és hígítja a vizsgálati vegyi anyag törzsoldatát (pl. adagolószivattyú, proporcionális hígító vagy telítőrendszer segítségével). A vizsgálat során időnként – lehetőleg naponta – ellenőrizni kell a törzsoldatok és a hígítóvíz áramlási sebességét, amelynek értéke a vizsgálat során nem változhat 10 %-nál nagyobb mértékben. Ügyelni kell arra, hogy ne használjanak rossz minőségű műanyag csöveket vagy egyéb olyan anyagokat, amelyek biológiailag aktív vegyi anyagokat tartalmazhatnak. Az átfolyásos rendszerhez használt anyagok kiválasztásakor figyelembe kell venni a vizsgálati vegyi anyagnak a kiválasztott anyaghoz való lehetséges adszorpcióját is.
A halak tartása
18. A vizsgálati halakat laboratóriumi populációból kell kiválasztani, lehetőleg egyetlen tenyészetből, és a halakat a vizsgálat megkezdése előtt legalább két hétig a vizsgálat során alkalmazandó körülmények, vízminőség és megvilágítás mellett kell akklimatizálni. Fontos, hogy a betelepítési arány és az állománysűrűség (a fogalmak meghatározását lásd az 1. függelékben) a felhasznált vizsgálati fajnak megfelelő legyen (lásd a 2. függeléket).
19. A 48 órás betelepítési időszak után a mortalitást dokumentálni kell, és az alábbi követelményeket kell alkalmazni:
— amennyiben a mortalitás a populáció 10 %-ánál nagyobb hét nap alatt: az egész halállományt ki kell cserélni,
— amennyiben a mortalitás a populáció 5–10 %-a: további hét napig kell akklimatizálni, amennyiben a mortalitási arány ezt követően is magasabb 5 %-nál, az egész állományt ki kell cserélni;
— a mortalitás a populáció 5 %-ánál kisebb hét nap alatt: az állomány alkalmazható a vizsgálathoz.
20. Az akklimatizációs időszak során, az expozíciót előkészítő időszakban és az expozíciós idő alatt a halak nem kaphatnak semmilyen betegség elleni kezelést.
Az expozíciót előkészítő időszak és a halak kiválasztása
21. Egy-két hetes expozíciót előkészítő időszak javasolt, amelynek során az állatokat a tényleges vizsgálatban alkalmazotthoz hasonló edényekben kell elhelyezni. A halakat a tartási időszak és az expozíciós fázis alatt ad libitum kell etetni. Az expozíciós fázist olyan, az ivarérett kifejlett állatok laboratóriumi készletéből származó, ivari kétalakúságot mutató (pl. az amerikai cselle és a japán rizshal esetében jól látható másodlagos ivari jellegekkel rendelkező) halakkal kell megkezdeni, amelyek aktívan ívnak. Általános iránymutatásként (és ezt a szempontot nem szabad az adott halállomány tényleges reprodukciós képességétől elszigetelten szemlélni) az amerikai csellék kb. 20 (± 2) hetesek legyenek, feltételezve, hogy egész életük során 25 ± 2 °C-on tartották őket. A japán rizshalak körülbelül 16 (± 2) hetesek legyenek, feltételezve, hogy egész életük során 25 ± 2 °C-on tartották őket. A zebradániók körülbelül 16 (± 2) hetesek legyenek, feltételezve, hogy egész életük során 26 ± 2°C-on tartották őket. Az expozíciót előkészítő szakaszban az ikratermelést naponta meg kell becsülni. Az ívást ajánlatos a vizsgálat expozíciós szakaszába való bevonásukat megelőzően minden párhuzamos tartályban megfigyelni. A kívánatos napi ikratermelést illetően erre a szakaszra vonatkozóan nem lehet mennyiségi iránymutatást adni, ugyanakkor minden egyes faj esetében viszonylag általános, hogy >10 pete/nőstény/nap átlagos ikramennyiség figyelhető meg. A párhuzamosok különböző vizsgálati szintekhez való kiosztásához az ikratermelés mennyisége szerinti véletlen blokk elrendezés alkalmazandó a párhuzamosok kiegyensúlyozott eloszlásának biztosítása érdekében.
VIZSGÁLATI ELRENDEZÉS
22. A vizsgálati vegyi anyag három koncentrációját, egy (vizes) kontrollt, illetve – szükség esetén – egy oldószeres kontrollt kell beállítani. Az adatok a kezelések és a kontrollok esetében kapott válaszok közötti statisztikailag szignifikáns különbség meghatározása érdekében elemezhetők. Ezek az elemzések nem a kockázatelemzésben hasznosak (25), sokkal inkább arról adnak tájékoztatást, hogy szükség van-e a vegyi anyag káros hatásainak további hosszabb távú vizsgálatára (vagyis a túlélés, a fejlődés, a növekedés és a szaporodás vizsgálatára).
23. A zebradánió esetében a kísérlet 21. napján hím és nőstény állatokat kell mintavételezni minden kezelési szintből (5 hím és 5 nőstény mindkét párhuzamosban), valamint a kontrollcsoport(ok)ból is a vitellogenin mérésére. A japán rizshal esetében a kísérlet 21. napján hím és nőstény állatokat kell mintavételezni minden kezelési szintből (3 hím és 3 nőstény mind a négy párhuzamosban), valamint a kontrollcsoport(ok)ból is a vitellogenin és a másodlagos ivari jellegek mérésére. Az amerikai cselle esetében az expozíció 21. napján hím és nőstény állatokat kell mintavételezni (2 hím és 4 nőstény mind a négy párhuzamosban), valamint a kontrollcsoport(ok)ból is a vitellogenin és másodlagos ivari jellegek mérésére. El kell végezni a fekunditás mennyiségi értékelését és a gonadális szöveteket egészben kell fixálni, vagy ki kell metszeni az esetleges kórszövettani értékelés céljából, amennyiben az szükséges.
A vizsgálati koncentrációk megválasztása
24. E vizsgálat esetében a legnagyobb vizsgálati koncentrációt a legnagyobb elviselhető koncentráció (maximum tolerated concentration, MTC) alapján kell meghatározni, amelyet dózisbehatároló vizsgálattal vagy egyéb toxicitási adatokból, illetve 10 mg/l-ben, vagy a maximális vízoldékonyság mértékében kell megállapítani (amelyik a legalacsonyabb). Az MTC a vegyi anyag azon legnagyobb vizsgálati koncentrációja, amely kevesebb, mint 10 %-os mortalitást eredményez. E megközelítés azt feltételezi, hogy rendelkezésre állnak azok az empirikus akut toxicitási vagy egyéb toxicitási adatok, amelyekből az MTC-t meg lehet becsülni. Az MTC becslése pontatlan lehet és alkalmazhatóságáról jellemzően egyéni szakmai megítélés alapján kell dönteni.
25. Három vizsgálati koncentrációra van szükség, amelyek közötti konstans szorzótényező nem haladja meg a 10-et, valamint egy hígítóvizes kontrollra (és szükség esetén egy oldószeres kontrollra is). 3,2 és 10 közötti szorzótényező ajánlott.
ELJÁRÁS
A vizsgálati halak kiválasztása és lemérése
26. Fontos a halak testtömegeltéréseinek minimumra csökkentése a vizsgálat elején. A vizsgálathoz javasolt különböző halfajok megfelelő mérettartományait a 2. függelék tartalmazza. A vizsgálatban alkalmazott egész halállomány tekintetében a hím és nőstény halak vizsgálat elején mért egyéni testtömegének lehetőleg az azonos nemű halak testtömege számtani átlagának ± 20 %-os tartományában kell lennie. Az átlagos testtömeg előzetes becslése céljából javasolt a vizsgálat előtt a halállomány egy részmintájának a tömegét lemérni.
Az expozíció körülményei
Időtartam
27. A vizsgálat időtartama 21 nap, egy expozíciót előkészítő időszakot követően. Az expozíciót előkészítő időszak ajánlott ideje egy–két hét.
Etetés
28. A halakat ad libitum kell etetni a megfelelő táplálékkal (2. függelék) olyan mennyiségben, amely segít fenntartani fizikai állapotukat. Gondosan kerülni kell a mikrobatenyészetek kialakulását és a víz zavarossá válását. Általános iránymutatásként a napi adagot két vagy három egyenlő részre lehet osztani, és a halakat naponta többször etetni, az egyes etetések között legalább három órát hagyva. Az egyszerre adott nagyobb adag is elfogadható, különösen hétvégén. A halak a mintavételezés/boncolás előtti 12 órában nem kaphatnak táplálékot.
29. A haltápban vizsgálni kell a szennyező anyagok – szerves klórt tartalmazó növényvédő szerek, policiklikus aromás szénhidrogének (PAH) és poliklórozott bifenilek (PCB-k) – jelenlétét. Kerülni kell a magas fitoösztrogén-tartalmú táplálékokat, amelyek a vizsgálatban befolyásolnák az ismert ösztrogénagonistákra (pl. a 17b-ösztradiolra) adott választ.
30. Az el nem fogyasztott táplálékot és az ürüléket legalább hetente kétszer el kell távolítani az edényekből, pl. a tartályok alját szifonnal megtisztítva.
Fény és hőmérséklet
31. A megvilágítási időszakokat és a víz hőmérsékletét a vizsgálati fajok sajátosságaihoz kell igazítani (lásd a 2. függeléket).
Az analitikai meghatározások és mérések gyakorisága
32. Az expozíciós időszak megkezdése előtt gondoskodni kell a vegyi anyagot adagoló rendszer megfelelő működéséről. Az összes szükséges analitikai módszernek megalapozottnak kell lennie, ideértve a vegyi anyag tesztrendszerben való stabilitásával kapcsolatos ismereteket. A vizsgálat alatt a vizsgálati vegyi anyag koncentrációit rendszeres időközönként meg kell határozni az alábbiak szerint: a hígító és a toxikus törzsoldat áramlási sebességét lehetőleg naponta kell ellenőrizni, de minimum hetente kétszer, és értéke a vizsgálat során nem változhat 10 %-nál nagyobb mértékben. A vizsgálati vegyi anyag tényleges koncentrációit ajánlott minden edényben a vizsgálat elején és azt követően hetente egyszer megmérni.
33. Az eredményeket célszerű a ténylegesen mért koncentrációértékekre alapozni. Amennyiben azonban az oldatban lévő vizsgálati vegyi anyag koncentrációját sikerült a vizsgálatok során mindvégig a névleges koncentráció ± 20 %-os tartományán belül tartani, akkor az eredményeket a névleges vagy a mért értékekre is lehet alapozni.
34. Szükség lehet a minták szűrésére (0,45 μm pórusméretű szűrőbetét használatával) vagy centrifugálására. Ha erre van szükség, akkor a centrifugálás az ajánlott eljárás. Amennyiben azonban a vizsgálati anyag nem adszorbeálódik a szűrő felszínén, akkor a szűrés is elfogadható módszer.
35. A vizsgálat alatt minden vizsgálati edényben legalább hetente egyszer meg kell mérni az oldott oxigén koncentrációját, a hőmérsékletet és a pH-t. Az víz teljes keménységét és a lúgosságát legalább hetente egyszer meg kell mérni a kontrollokban és a legmagasabb vizsgálati koncentrációt tartalmazó egyik edényben. A hőmérsékletet legalább egy vizsgálati edényben folyamatosan figyelemmel kell kísérni.
Megfigyelések
36. Több általános (pl. túlélési arány) és biológiai választ (pl. VTG-szintek) kell értékelni a vizsgálat során vagy a vizsgálat befejezésekor. A fekunditás mennyiségi ellenőrzését naponta el kell végezni. E végpontok mérését és értékelését, illetve hasznosságát az alábbiak ismertetik.
Túlélés
37. A halakat a vizsgálati időszak alatt naponta meg kell vizsgálni, a mortalitást fel kell jegyezni, és az elpusztult halakat a lehető leghamarabb el kell távolítani. Az elpusztult halakat nem szabad sem a kontroll-, sem a kezelési edényekben újakra cserélni. A vizsgálat során elpusztult halak ivarát meg kell határozni az ivarmirigyek makroszkopikus vizsgálatával.
Viselkedés és külső megjelenés
38. Minden, (a kontrollhoz képest) rendellenes viselkedést fel kell jegyezni; ide sorolhatók az általános toxicitás jelei, beleértve a hiperventillációt, a koordinálatlan úszást, az egyensúly elvesztését és az atipikus nyugalmat vagy táplálkozást. Emellett a külső rendellenességeket (vérzés, elszíneződés) is fel kell jegyezni. A toxicitás ilyen jeleit az adatok értelmezése során gondosan mérlegelni kell, mert olyan koncentrációkat jelezhetnek, amelyek mellett a hormonhatás biomarkerei nem megbízhatóak. A viselkedésre vonatkozó ilyen jellegű megfigyelések hasznos kvalitatív információkkal szolgálhatnak azzal kapcsolatban, hogy milyen jövőbeli halvizsgálatokra lehet szükség. Az amerikai cselle esetében például androgénexpozíció hatására területi agresszivitást figyeltek meg a hímekben vagy a maszkulinizált nőstényekben; a zebradániónál az ösztrogén- és antiandrogén-expozíció csökkenti vagy akadályozza a fajnál jellegzetesen az első hajnali fénnyel jelentkező párzási és ívási magatartást.
39. Mivel a külső megjelenés néhány aspektusa (elsősorban a szín) az állatok kezelésének hatására gyorsan változhat, fontos, hogy a kvalitatív megfigyeléseket az állatoknak a vizsgálati rendszerből való eltávolítása előtt végezzék el. Az amerikai csellével szerzett eddigi tapasztalatok arra utalnak, hogy egyes endokrin rendszerre ható vegyi anyagok először a következő külső jellemzőkben idéznek elő változásokat: testszín (világos vagy sötét), mintázat (függőleges sávok jelenléte), valamint a test alakja (a fej és a pektorális régió). Ezért a halak fizikai megjelenésével kapcsolatos megfigyeléseket kell tenni a vizsgálat során és a vizsgálat végén.
Fekunditás
40. Az ívás naponta végzett mennyiségi megfigyelését párhuzamosonként fel kell jegyezni. Az ikratermelést párhuzamosonként az egy túlélő nőstényre jutó napi ikrák számával kell kifejezni. Az ikrákat naponta el kell távolítani a vizsgálati kamrákból. Az amerikai cselle és a zebradánió esetében az ívási aljzatot kell a vizsgálati kamrába helyezni, hogy lehetővé váljon a halak számára a szokásos körülmények közötti ívás. A 4. függelék további részleteket tartalmaz a zebradánió (4A. függelék) és az amerikai cselle (4B. függelék) részére javasolt ívási aljzatokkal kapcsolatban. A japán rizshal esetében nem szükséges ívási aljzatot biztosítani.
A halak humánus leölése
41. A 21. napon – azaz az expozíció befejezésekor – a halakon a nyálkahártya-irritáció csökkentése érdekében 300 mg/l NaHCO3 (nátrium-hidrogén-karbonát, CAS.144-55-8) oldattal pufferolt megfelelő mennyiségű trikainnal (trikain-metán-szulfonát, Metacain, MS-222 (CAS.886-86-2), 100–500 mg/l) eutanáziát kell végezni; ezután a „Vitellogenin” című szakaszban leírtak szerint vér- vagy szövetmintát kell venni a VTG-szint meghatározásához.
A másodlagos ivari jellegek megfigyelése
42. Egyes endokrin rendszerre ható vegyi anyagok változásokat idézhetnek elő a speciális másodlagos ivari jellegekben (a nászkiütések száma a hím amerikai csellében, a papilláris nyúlványok száma a hím japán rizshalban). Bizonyos hatásmechanizmusú vegyi anyagok az ellenkező ivarú állatokra jellemző másodlagos ivari jelleg kóros előfordulását idézhetik elő; a trenbolonhoz, a metiltesztoszteronhoz és a dihidrotesztoszteronhoz hasonló androgénreceptor-agonisták például a nőstény amerikai cselléknél jól fejlett nászkiütések, nőstény japán rizshalaknál pedig papilláris nyúlványok megjelenését okozhatják (11, 20, 21). Azt is feljegyezték, hogy felnőtt hím amerikai csellében az ösztrogénreceptor-agonisták csökkenthetik a nászkiütések számát és a dorzális tarkólemez méretét (26, 27). Az ilyen általános morfológiára vonatkozó megfigyelések hasznos kvalitatív és kvantitatív információt nyújthatnak a jövőben elvégzendő, potenciálisan szükséges halvizsgálatokkal kapcsolatban. Az amerikai csellénél a nászkiütések, illetve a japán rizshalnál a papilláris nyúlványok számát és méretét közvetlenül, vagy egyszerűbben, konzervált példányokon lehet számszerűsíteni. Az amerikai cselle és a japán rizshal másodlagos ivari jellemzőinek értékelésére ajánlott eljárások az 5A., illetve az 5B. függelékben találhatók.
Vitellogenin (VTG)
43. A vérmintákat a farokartériából/vénából heparinnal kezelt mikrohematokrit kapilláriscsővel, vagy pedig fecskendővel végzett szívpunkcióval kell gyűjteni. A hal méretétől függően a begyűjthető vértérfogat példányonként általában 5–60 μl az amerikai cselle és 5–15 μl a zebradánió esetében. A plazmát a vérből centrifugálással kell elkülöníteni, és a vitellogeninszint vizsgálatáig proteázinhibitorokat hozzáadva – 80 °C-on tárolni. Alternatív megoldásként a japán rizshal esetében a májból, zebradánió esetében pedig a fej/farok homogenizátumból vett szövetminta is használható a VTG-szint meghatározásához (6. függelék). A VTG mérésének homológ VTG standardokat és homológ antitesteket használó validált homológ ELISA módszeren kell alapulnia. Olyan módszer alkalmazása javasolt, amely a VTG-t alacsony, akár néhány ng/ml vérplazma (vagy ng/mg szövet) koncentrációban is képes kimutatni, ami a vizsgálati vegyi anyagnak nem kitett hím halakban megfigyelhető háttérszintnek felel meg.
44. A VTG-analízis minőségellenőrzését standardok és vakpróbák alkalmazásával, illetve legalább két ismétlésben végzett analízis révén kell biztosítani. A minimális mintahígítási tényező meghatározása céljából minden ELISA módszer esetében le kell futtatni egy tesztet a mátrixhatás (a mintahígítás hatásának) vizsgálatára. A VTG vizsgálati eljárásokban felhasznált minden ELISA-lemeznek a következő minőségellenőrzési mintákat kell tartalmaznia: a várható VTG-koncentrációkat lefedő legalább 6 kalibrációs standard, és legalább egy nem specifikus kötődési vakpróba (két példányban analizálva). E vakpróbák abszorbanciája a kalibrációs standard maximális abszorbanciájának 5 %-ánál kisebbnek kell lennie. Az egyes hígítási minták legalább két alikvotjának (párhuzamos lyukak) analízisét el kell végezni. Azokat a párhuzamos lyukakban vizsgált mintákat, amelyek értékei között az eltérés nagyobb, mint 20 %, újra kell analizálni.
45. A kalibrációs görbék korrelációs együtthatója (R2) 0,99-nál nagyobb kell legyen. Ugyanakkor azonban a magas korreláció nem garantálja a koncentráció megfelelő előrejelzését minden tartományban. A kalibrációs görbe elegendően nagy korrelációja mellett az egyes standardok kalibrációs görbe alapján számolt koncentrációjának a névleges koncentráció 70–120 %-a közé kell esnie. Ha a névleges koncentráció távolodik a kalibrációs regressziós egyenestől (pl. az alacsonyabb koncentrációknál), szükség lehet arra, hogy a kalibrációs görbét alacsony és magas tartományra osszák, vagy hogy egy nemlineáris modellt alkalmazzanak az abszorbanciaadatok megfelelő illesztésére. Ha a görbét kettéosztják, mindkét vonalszakasznak R2 > 0,99 értékkel kell rendelkeznie.
46. A kimutatási határérték (LOD) a legalacsonyabb analitikai standard koncentrációja, a meghatározási határ (LOQ) pedig a legalacsonyabb analitikai standard koncentrációjának és a legkisebb hígítási tényezőnek a szorzata.
47. Minden olyan napon, amikor VTG-vizsgálatot végeznek, egy inter-assay (vizsgálatközi) referenciastandard felhasználásával készült dúsított mintát is analizálni kell (7. függelék). Az adott napon végzett vizsgálatok eredményeivel együtt dokumentálni kell a várt koncentrációnak a mért koncentrációhoz viszonyított arányát is.
A gonadális kórszövettani vizsgálat értékelése
48. A szabályozó hatóságok előírhatják a gonadális kórszövettani vizsgálat elvégzését annak érdekében, hogy vizsgálni lehessen a HPG-tengelyen lévő célszervet a vegyi anyaggal történő expozíciót követően. E tekintetben az ivarmirigyeket az egész testben vagy preparálva kell fixálni. Amennyiben kórszövettani vizsgálat szükséges, a vizsgálati vegyi anyag endokrin aktivitásának értékelése érdekében a hormonrendszer ivarmirigyekre gyakorolt specifikus válaszreakcióit kell keresni. Ezek a diagnosztikus válaszreakciók alapvetően a következők lehetnek: petesejtek jelenléte a herékben, Leydig-sejt hiperplázia, csökkent szikképződés, megnövekedett spermatogonium szám és perifollikuláris hiperplázia. Más gonadális elváltozásoknak, mint például a petevezeték átjárhatatlanságának, a herék elváltozásainak és a stádiumbeli változásoknak különböző okai lehetnek. A halak gonadális kórszövettani vizsgálatáról szóló iránymutatás előírja az ivarmirigyek boncolása, fixálása, a metszetkészítés és a kórszövettani értékelés tekintetében alkalmazandó eljárásokat (22).
ADATOK ÉS JEGYZŐKÖNYVEZÉS
A biomarker-válaszok értékelése varianciaanalízissel (ANOVA)
49. Egy vegyi anyag potenciális hatásának azonosítása céljából varianciaanalízissel (ANOVA) össze kell hasonlítani a kezelésenként és kontrollcsoportonként kapott válaszokat. Ha oldószeres kontrollt is alkalmaznak, minden végpont tekintetében megfelelő statisztikai próbát kell végezni a hígítóvizes és az oldószeres kontrollok összehasonlítására is. A hígítóvizes és az oldószeres kontrollok esetében kapott adatoknak a rákövetkező statisztikai elemzés során való felhasználására vonatkozó iránymutatás az OECD 2006c (28) szakirodalmi hivatkozásban található. Az összes biológiai válaszadatot elemezni és ivaronként jegyzőkönyvezni kell. Amennyiben nem teljesülnek a paraméteres módszerekhez szükséges feltételek – nem normális eloszlás (pl. Shapiro–Wilk-próba) vagy heterogénvariancia (Bartlett- vagy Levene-féle próba) –, akkor fontolóra lehet venni az adatok transzformálását a variancia homogenizálása érdekében az ANOVA elemzés elvégzése előtt, vagy a súlyozott ANOVA elemzés alkalmazását. Nem monoton dózis-válasz esetén a többszörös páronkénti összehasonlítással végzett Dunnett-féle próba (parametrikus) vagy a Bonferroni-korrekcióval végzett Mann–Whitney-féle próba (nem paraméteres) is használható. Ha a dózis-hatás nagyjából monoton, egyéb statisztikai próbákat lehet alkalmazni (pl. Jonckheere–Terpstra próba vagy Williams-féle próba). A 8. függelékben található statisztikai folyamatábra segít a legmegfelelőbb statisztikai próba kiválasztásában. További információ található az „Aktuális megközelítések az ökotoxicitási adatok statisztikai elemzésében” című OECD-dokumentumban (28).
A vizsgálati eredmények jegyzőkönyvezése
50. A vizsgálati adatoknak tartalmazniuk kell a következőket
Vizsgáló intézmény:
— a felelős személyzet és a vizsgálattal kapcsolatos felelősségi körök;
— minden laboratóriumnak igazolnia kell a jártasságát reprezentatív vegyi anyagok használatával.
Vizsgálati vegyi anyag:
— a vizsgálati vegyi anyag jellemzése;
— fizikai jelleg és lényeges fizikai-kémiai tulajdonságok;
— a vizsgálati koncentrációk elkészítésének módja és gyakorisága;
— a stabilitásra és a biológiai lebonthatóságra vonatkozó információk.
Oldószer:
— az oldószer jellemzése (jelleg, alkalmazott koncentráció);
— az oldószer kiválasztásának indoklása (ha nem víz).
Kísérleti állatok:
— faj és törzs;
— beszállító és konkrét beszállító létesítmény;
— a halak életkora a vizsgálat elején, valamint a halak párzóképes/ívási állapota;
— az állatok akklimatizációjának részletei;
— a halak testtömege az expozíció elején (a halállomány részmintájában).
Vizsgálati körülmények:
— alkalmazott vizsgálati eljárás (vizsgálat típusa, betelepítési arány, állománysűrűség stb.);
— a törzsoldatok elkészítésének módszere és az áramlási sebesség;
— névleges vizsgálati koncentrációk, a vizsgálati oldatok hetente mért koncentrációi és az analitikai módszer, a vizsgálati edényekben mért értékek átlaga és szórása, valamint bizonyíték arra, hogy a mérések a vizsgálati vegyi anyag valódi oldatban lévő koncentrációira vonatkoznak;
— a hígítóvíz jellemzői (beleértve a pH-t, a keménységet, a lúgosságot, a hőmérsékletet, az oldott oxigén koncentrációját, a maradékklór-tartalmat, a teljes szervesszén-tartalmat, a szuszpendált szilárd anyagokat és bármely egyéb elvégzett mérés eredményét);
— vízminőség a tesztedényekben: pH-érték, keménység, hőmérséklet és az oldottoxigén-koncentráció,
— az etetésre vonatkozó részletes információk (pl. a táp(ok) típusa, forrása, az adagolt mennyiség és az etetés gyakorisága, valamint a lényeges szennyező anyagok elemzése (pl. PCB-k, PAH-k, és szerves klórt tartalmazó növényvédő szerek), ha rendelkezésre állnak.
Eredmények
— annak igazolása, hogy a kontrollok teljesítették a vizsgálat elfogadhatósági kritériumait;
— a vizsgálati koncentrációk és a kontrollok bármelyikében előforduló egyedpusztulásokra vonatkozó adatok;
— az alkalmazott statisztikai elemzési technikák, az adatok kezelése és az alkalmazott technikák indoklása;
— az általános morfológiára vonatkozó biológiai megfigyelések adatai, beleértve a másodlagos ivari jellegeket, az ikratermelést és a VTG-szintjét;
— az adatelemzés eredményei lehetőleg táblázatos és grafikus formában;
— a halak szokatlan reakcióinak és a vizsgálati vegyi anyag által előidézett bármely látható elváltozásnak az előfordulása.
ÚTMUTATÓ A VIZSGÁLATI EREDMÉNYEK KIÉRTÉKELÉSÉHEZ ÉS ELFOGADÁSÁHOZ
51. Ez a szakasz olyan szempontokat tartalmaz, amelyeket figyelembe kell venni a különböző mért végpontok vizsgálati eredményeinek kiértékelése során. Az eredményeket körültekintően kell értelmezni, ha úgy tűnik, hogy a vizsgálati vegyi anyag nyilvánvaló toxicitást okoz vagy befolyásolja a kísérleti állatok általános állapotát.
52. A vizsgálati koncentrációk tartományának kijelölése során ügyelni kell arra, hogy ne lépjék túl a legnagyobb elviselhető koncentrációt, mert csak így lesz lehetőség az adatok megfelelő értelmezésére. Fontos, hogy legalább egy olyan kezelés legyen, ahol nincs jele toxikus hatásoknak. A betegség és a toxikus hatások jeleit alaposan meg kell vizsgálni és jegyzőkönyvezni kell. Lehetséges például, hogy a nőstényeknél a VTG termelését az általános toxicitás és a nem az endokrin rendszerre ható toxikus hatásmechanizmusok, pl. a hepatotoxicitás is befolyásolják. A hatások helyes értelmezését azonban segíthetik azok az egyéb kezelési szintek, amelyeket nem zavar a szisztémás toxicitás.
53. Van néhány szempont, amelyet figyelembe kell venni a vizsgálati eredmények elfogadása során. Útmutatásként a hímek és a nőstények kontrollcsoportjaiban mért VTG-szinteknek különbözőnek és egymástól körülbelül három nagyságrenddel eltérőnek kell lenniük az amerikai cselle és a zebradánió esetében, illetve körülbelül egy nagyságrenddel eltérőnek a japán rizshal esetében. A kontroll- és a kezelési csoportokban előforduló értéktartományokra a validálási jegyzőkönyvekben találhatók példák (1, 2, 3, 4). A kontrollcsoport hímjeinél mért magas VTG-értékek veszélyeztethetik a vizsgálat válaszkészségét és a gyenge ösztrogénagonisták felismerésére való képességét. A kontrollnőstényekben mért alacsony VTG-értékek veszélyeztethetik a vizsgálat válaszkészségét, illetve az aromatázgátlók és az ösztrogénantagonisták felismerésére való képességét. Ez az útmutatás a validálási vizsgálatok alapján készült.
54. Az ikratermelés mennyiségi meghatározását jelentős eltérések befolyásolják [a variációs koefficiens 20 és 60 % között mozoghat], amelyek hatással lehetnek arra, hogy a vizsgálat képes-e kimutatni az ikratermelés 70 %-nál kisebb mértékű jelentős csökkenését, ha a variációs koefficiens 50 %-hoz közelít vagy meghaladja azt. Amennyiben a variációs koefficienst le lehet alacsonyabb (20–30 % körüli) értékre szorítani, úgy a vizsgálat elfogadható statisztikai erővel (80 %) tudja kimutatni az ikratermelés 40–50 %-os csökkenését. Az amerikai cselle esetében alkalmazott, kezelési szintenként négy párhuzamost tartalmazó vizsgálati terv a fekunditási végpont tekintetében a mindössze két párhuzamost alkalmazó tervnél nagyobb statisztikai erőt biztosít.
55. Ha a laboratórium korábban még nem végezte a vizsgálatot vagy jelentős változások történtek (pl. a haltörzsben vagy a szállítóban), célszerű lefolytatni technikai jártassági vizsgálatot. Olyan vegyi anyagokat javasolt használni, amelyek különböző hatásmechanizmussal rendelkeznek vagy több vizsgálati végpontra is hatással vannak. A gyakorlatban a laboratóriumokat arra ösztönzik, hogy építsenek fel saját adatbázist a hímekre és a nőstényekre vonatkozó múltbeli kontrolladatokból, és hogy végezzenek pozitív kontrollvizsgálatot egy ösztrogénhatású vegyi anyaggal (pl. 17β-ösztradiollal 100 μg/l koncentrációban, vagy egy ismert gyenge agonistával), amely megnöveli a VTG szintjét a hím halakban, továbbá pozitív kontrollvizsgálatot végeznek egy aromatázgátló vegyi anyaggal (pl. fadrozollal vagy proklorazzal 300 μg/l koncentrációban), amely csökkenti a VTG szintjét a nőstény halakban, és pozitív kontrollvizsgálatot végeznek egy androgénhatású vegyi anyaggal (pl. 17β-trenbolonnal 5 μg/l koncentrációban), amely a másodlagos ivari jellegek megjelenését eredményezi a nőstény amerikai csellében és japán rizshalban. Ezeket az adatokat a laboratórium jártasságának igazolása céljából össze lehet hasonlítani a validációs vizsgálatokból (1, 2, 3) származó adatokkal.
56. A VTG-méréseket általában akkor kell pozitívnak tekinteni, ha – legalább a legmagasabb vizsgált dózisban – a VTG statisztikailag szignifikáns növekedése (p < 0,05) figyelhető meg a hímeknél vagy statisztikailag szignifikáns csökkenése (p < 0,05) figyelhető meg a nőstényeknél a kontrollcsoporttal összehasonlítva, általános toxicitásra utaló jelek nélkül. A pozitív eredményt még inkább alátámaszthatja a biológiai szempontból valószínűsíthető dózis–válasz összefüggés. Mint korábban említésre került, a VTG csökkenése nem feltétlenül teljesen endokrin eredetű; a pozitív eredményt azonban általában az in vivo endokrin hatás bizonyítékaként kell értelmezni, és rendszerint az eredmény tisztázása érdekében tett további intézkedések követik.
57. A szabályozó hatóságok előírhatják a gonadális kórszövettani vizsgálat értékelését a kísérleti állatok reprodukciós képességének meghatározása céljából, valamint hogy lehetővé tegyék a vizsgálati eredmények bizonyítékok súlyának mérlegelésén alapuló értékelését. Gonadális kórszövettani vizsgálat elvégzése nem feltétlenül szükséges olyan esetben, ha a VTG vagy a másodlagos ivari jellegek mérése pozitív eredményt mutat (vagyis a VTG-szint emelkedése vagy csökkenése, illetve a másodlagos ivari jellegek indukciója esetén).
SZAKIRODALOM
(1) OECD (2006a). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1A). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.60, Paris.
(2) OECD (2006b). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1B). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.61, Paris.
(3) OECD (2007). Final report of the Validation of the 21-day Fish Screening Assay for the Detection of Endocrine Active Substances. Phase 2: Testing Negative Substances. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.78, Paris.
(4) Owens JW (2007). Phase 3 report of the validation of the OECD Fish Screening Assay. CEFIC LRI Project, Endocrine. http://www.cefic-lri.org/index.php?page=projects (accessed 18/09/08).
(5) US EPA (2007). Validation of the Fish Short-Term Reproduction Assay: Integrated Summary Report. 15 December 2007. US Environmental Protection Agency, Washington, DC. 104 pp.
(6) OECD (2008). Report of the Validation Peer Review for the 21-Day Fish Endocrine Screening Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.94, Paris.
(7) Sumpter J.P. and S. Jobling (1995). Vitellogenesis as a biomarker for estrogenic contamination of the aquatic environment. Environmental Health Perspectives; 103 Suppl 7:173-8 Review.
(8) Pawlowski S., et al. (2004). Androgenic and estrogenic effects of the synthetic androgen 17alpha-methyltestosterone on sexual development and reproductive performance in the fathead minnow (Pimephales promelas) determined using the gonadal recrudescence assay. Aquatic Toxicology; 68(3):277-91.
(9) Andersen L., et al (2006). Short-term exposure to low concentrations of the synthetic androgen methyltestosterone affects vitellogenin and steroid levels in adult male zebrafish (Danio rerio). Aquatic Toxicology; 76(3-4):343-52.
(10) Ankley G.T., et al. (2002). Evaluation of the aromatase inhibitor fadrozole in a short-term reproduction assay with the fathead minnow (Pimephales promelas). Toxicological Sciences; 67(1):121-30.
(11) Panter G.H., et al. (2004). Successful detection of (anti-)androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development. Aquatic Toxicology; 70(1):11-21.
(12) Parks L.G., et al. (1999). Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds. Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 123(2):113-25.
(13) Panter G.H., et al. (1999). Application of an ELISA to quantify vitellogenin concentrations in fathead minnows (Pimephales promelas) exposed to endocrine disrupting chemicals. CEFIC-EMSG research report reference AQ001. CEFIC, Brussels, Belgium.
(14) Fenske M., et al. (2001). Development and validation of a homologous zebrafish (Danio rerio Hamilton- Buchanan) vitellogenin enzyme-linked immunosorbent assay (ELISA) and its application for studies on estrogenic chemicals. Comp. Biochem. Phys. C 129 (3): 217-232.
(15) Holbech H., et al. (2001). Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio). Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 130: 119-131
(16) Rose J., et al. (2002). Vitellogenin induction by 17b-estradiol and 17a-ethinylestradiol in male zebrafish (Danio rerio). Comp. Biochem. Physiol. C. 131: 531-539.
(17) Brion F., et al. (2002). Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio). Environmental Toxicology and Chemistry; vol 21: 1699-1708.
(18) Yokota H., et al. (2001). Development of an ELISA for determination of the hepatic vitellogenin in Medaka (Oryzias latipes). Jpn J Environ Toxicol 4:87–98.
(19) Tatarazako N., et al. (2004). Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the Medaka. Journal of Health Science 50:301-308.
(20) Ankley G.T., et al. (2003). Effects of the androgenic growth promoter 17-beta-trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environmental Toxicology and Chemistry; 22(6): 1350-60.
(21) Seki M, et al (2004). Fish full life-cycle testing for androgen methyltestosterone on medaka (Oryzias latipes). Environmental Toxicology and Chemistry; 23(3):774-81.
(22) OECD (2010). Guidance Document on Fish Gonadal Histopathology. OECD Environmental Health and Safety Publications Series on Testing and Assessment No. 123, Paris.
(23) OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 23. Paris
(24) Hutchinson T.H., et al. (2006a). Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; pp.69–92.
(25) Hutchinson T.H., et al. (2006b). Screening and testing for endocrine disruption in fish-biomarkers as „signposts,” not „traffic lights,” in risk assessment. Environmental Health Perspectives; 114 Suppl 1:106-14.
(26) Miles-Richardson S.R., et al. (1999). Effects of waterborne exposure to 17β-estradiol on secondary sex characteristics and gonads of the fathead minnow (Pimephales promelas). Aquat. Toxicol. 47, 129-145.
(27) Martinovic D., et al. (2008). Characterization of reproductive toxicity of vinclozolin in the fathead minnow and co-treatment with an androgen to confirm an anti-androgenic mode of action. Environ. Toxicol. Chem. 27, 478-488.
(28) OECD (2006c), Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application, OECD Environmental Health and Safety Publications, Series on Testing and Assessment No.54, OECD, Paris.
(29) US EPA (2008), Peer-Review Results for the Fish Short-Term Reproduction Assay, dated 30 January 2008, US Environmental Protection Agency, Washington DC. 110 pp.
(30) OECD (2012), OECD Conceptual Framework for Testing and Assessment of Endocrine Disrupters, OECD Environmental Health and Safety Publications, Series on Testing and Assessment No. 150, OECD, Paris.
1. függelék
RÖVIDÍTÉSEK ÉS FOGALOMMEGHATÁROZÁSOK
Vegyi anyag : anyag vagy keverék.
CV : variációs koefficiens
ELISA : enzimhez kötött immunoszorbens vizsgálat (enzyme-linked immunosorbent assay).
HPG-tengely : hipotalamusz-hipofízis-gonád tengely.
Betelepítési arány : a halak nedvesen mért tömege egységnyi mennyiségű vízben.
MTC : legnagyobb elviselhető koncentráció, amely az LC50 körülbelül 10 %-a.
Állománysűrűség : a halak egy térfogategységre eső száma.
Vizsgálati vegyi anyag : bármely, e vizsgálati módszer alkalmazásával vizsgált anyag vagy keverék.
VTG : a vitellogenin a szikben található foszfo-, lipo- és glikoproteinek prekurzora, amely alapesetben az ikrarakó fajok szexuálisan aktív nőstényeiben fordul elő.
2. függelék
A HALAKBAN VÉGZETT ENDOKRIN SZŰRŐVIZSGÁLAT KÍSÉRLETI KÖRÜLMÉNYEI
|
1. Ajánlott fajok |
Amerikai cselle (Pimephales promelas) |
Japán rizshal (Oryzias latipes) |
Zebradánió (Danio rerio) |
|
2. Vizsgálattípus |
Átfolyásos |
Átfolyásos |
Átfolyásos |
|
3. Vízhőmérséklet |
25 ± 2 °C |
25± 2 °C |
26 ± 2 °C |
|
4. A megvilágítás minősége |
Fluoreszcens izzók (széles spektrum) |
Fluoreszcens izzók (széles spektrum) |
Fluoreszcens izzók (széles spektrum) |
|
5. Fényerősség |
10–20 μE/m2/s, 540–1 000 lux vagy 50–100 ft-c (környezeti laboratóriumi szintek) |
10–20 μE/m2/s, 540–1 000 lux vagy 50–100 ft-c (környezeti laboratóriumi szintek) |
10–20 μE/m2/s, 540–1 000 lux vagy 50–100 ft-c (környezeti laboratóriumi szintek) |
|
6. Megvilágítási időszak (hajnali/alkonyati átmeneti időszakok is alkalmazhatók, de nem feltétlenül szükségesek) |
16 óra fény, 8 óra sötét |
12–16 óra fény, 12–8 óra sötét |
12–16 óra fény, 12–8 óra sötét |
|
7. Betelepítési arány |
< 5 g/l |
< 5 g/l |
< 5 g/l |
|
8. A vizsgálati kamra mérete |
10 l (minimum) |
2 l (minimum) |
5 l (minimum) |
|
9. A vizsgálati oldat térfogata |
8 l (minimum) |
1,5 l (minimum) |
4 l (minimum) |
|
10. A vizsgálati oldatok térfogatának cseréje |
Naponta legalább 6x |
Naponta legalább 5x |
Naponta legalább 5x |
|
11. A vizsgált élőlények kora |
Lásd a 21. pontot |
Lásd a 21. pontot |
Lásd a 21. pontot |
|
12. A kifejlett halak nedvesen mért tömege hozzávetőleg (g) |
Nőstények: 1,5 ± 20 % Hímek: 2,5 ± 20 % |
Nőstények: 0,35 ± 20 % Hímek: 0,35 ± 20 % |
Nőstények: 0,65 ± 20 % Hímek: 0,4 ± 20 % |
|
13. Halak száma vizsgálati edényenként |
6 (2 hím és 4 nőstény) |
6 (3 hím és 3 nőstény) |
10 (5 hím és 5 nőstény) |
|
14. A kezelések száma |
= 3 (plusz megfelelő kontrollok) |
= 3 (plusz megfelelő kontrollok) |
= 3 (plusz megfelelő kontrollok) |
|
15. Az edények száma kezelésenként |
Minimum 4 |
Minimum 4 |
Minimum 2 |
|
16. Halak száma vizsgálati koncentrációnként |
16 felnőtt nőstény és 8 hím (4 nőstény és 2 hím minden párhuzamosban) |
12 felnőtt nőstény és 12 hím (3 nőstény és 3 hím minden párhuzamosban) |
10 felnőtt nőstény és 10 hím (5 nőstény és 5 hím minden párhuzamosban) |
|
17. Etetési rend |
Naponta két-három alkalommal (ad libitum) élő vagy fagyasztott kifejlett vagy nauplius sórák, kereskedelmi forgalomban kapható táp vagy ezek kombinációja |
Naponta két-három alkalommal (ad libitum) nauplius sórák, kereskedelmi forgalomban kapható táp vagy ezek kombinációja |
Naponta két-három alkalommal (ad libitum) nauplius sórák, kereskedelmi forgalomban kapható táp vagy ezek kombinációja |
|
18. Levegőztetés |
Nincs, kivéve, ha az oldottoxigén-koncentráció a 60 %-os levegőtelítettség alá esik |
Nincs, kivéve, ha az oldottoxigén-koncentráció a 60 %-os levegőtelítettség alá esik |
Nincs, kivéve, ha az oldottoxigén-koncentráció a 60 %-os levegőtelítettség alá esik |
|
19. Hígítóvíz |
Tiszta felszíni víz, kútvíz, mesterséges víz vagy klórmentesített csapvíz |
Tiszta felszíni víz, kútvíz, mesterséges víz vagy klórmentesített csapvíz |
Tiszta felszíni víz, kútvíz, mesterséges víz vagy klórmentesített csapvíz |
|
20. Expozíciót előkészítő időszak |
7–14 nap ajánlott |
7–14 nap ajánlott |
7–14 nap ajánlott |
|
21. Vizsgálati vegyi anyaggal történő expozíció időtartama |
21 nap |
21 nap |
21 nap |
|
22. Biológiai végpontok |
— túlélési arány — viselkedés — termékenység — másodlagos ivari jellegek — VTG — választhatóan gonadális kórszövettani vizsgálat |
— túlélési arány — viselkedés — termékenység — másodlagos ivari jellegek — VTG — választhatóan gonadális kórszövettani vizsgálat |
— túlélési arány — viselkedés — termékenység — VTG — választhatóan gonadális kórszövettani vizsgálat |
|
23. A vizsgálat elfogadhatósága |
Az oldott oxigén a telítettség ≥ 60 %-a; az átlagos hőmérséklet 25 ± 2 °C; a halak 90 %-os túlélési aránya a kontrollokban; a mért vizsgálati koncentrációk a kezelési szintek átlagos mért értékeinek 20 %-os tartományán belül helyezkednek el. |
Az oldott oxigén a telítettség ≥ 60 %-a; az átlagos hőmérséklet 25 ± 2 °C; a halak 90 %-os túlélési aránya a kontrollokban; a mért vizsgálati koncentrációk a kezelési szintek átlagos mért értékeinek 20 %-os tartományán belül helyezkednek el. |
Az oldott oxigén a telítettség ≥ 60 %-a; az átlagos hőmérséklet 26 ± 2 °C; a halak 90 %-os túlélési aránya a kontrollokban; a mért vizsgálati koncentrációk a kezelési szintek átlagos mért értékeinek 20 %-os tartományán belül helyezkednek el. |
3. függelék
AZ ELFOGADHATÓ MINŐSÉGŰ HÍGÍTÓVÍZ NÉHÁNY FONTOSABB KÉMIAI TULAJDONSÁGA
|
ÖSSZETEVŐ |
KONCENTRÁCIÓ |
|
Finomszemcsés anyag |
< 20 mg/l |
|
Teljes szervesszén-tartalom |
< 2 mg/l |
|
Ionizálatlan ammónia |
< 1μg/l |
|
Maradék klór |
< 10 μg/l |
|
Összes szerves foszfort tartalmazó növényvédő szer |
< 50 ng/l |
|
Szerves klórtartalmú peszticidek + poliklórozott bifenilek |
< 50 ng/l |
|
Összes szerves klór |
< 25 ng/l |
4A.függelék
ÍVÁSI ALJZAT A ZEBRADÁNIÓ RÉSZÉRE
Ívási tálca : bármilyen, üvegből készült eszköztartó edény, például 22 × 15 × 5,5 cm méretű (hosszúság × szélesség × mélység), eltávolítható rozsdamentes acél ráccsal fedve (2 mm-es lyukbőség). A rácsnak a perem alatti magasságban kell fednie az eszköztartó edény nyílását.

A rácsra ívási aljzatot kell rögzíteni. A közegnek olyan szerkezetet kell biztosítania a halak részére, amelybe beköltözhetnek. A zöld műanyagból készült mesterséges akváriumnövények például alkalmasak erre a célra (megjegyzés: figyelembe kell venni a vizsgálati vegyi anyagnak a műanyaghoz való lehetséges adszorpcióját). A műanyagot elegendő ideig megfelelő mennyiségű meleg vízben kell áztatni, hogy ne bocsásson ki vegyi anyagokat a vizsgálati vízbe. Üvegből készült anyagok használata esetén biztosítani kell, hogy a halak intenzív mozgásuk során ne sérüljenek meg vagy szoruljanak be.
A tálca és az üvegfalak közötti távolság legalább 3 cm legyen, hogy az ívás ne történhessen a tálcán kívül. A tálcára lerakott ikrák átesnek a rácson, és 45–60 perccel a megvilágítás kezdete után mintát lehet venni belőlük. Az átlátszó ikrák nem tapadnak, és keresztirányú fény segítségével könnyen meg lehet számolni őket. Edényenként öt nőstény használata esetén a legfeljebb 20 ikra/nap mennyiség alacsonynak, a legfeljebb 100 ikra/nap mennyiség közepesnek, a több mint 100 ikra/nap mennyiség pedig magasnak számít. Az ívási tálcát – a lehető legkésőbbi esti időpontban vagy kora reggel – el kell távolítani, az ikrákat össze kell gyűjteni, majd az ívási tálcát újra be kell helyezni a vizsgálati edénybe. Az újrabehelyezésig eltelt idő nem haladhatja meg az egy órát, különben az ívási aljzat hatása szokatlan időben jelentkező egyedi párzást és ívást válthat ki. Ha valamilyen körülmény az ívási tálca későbbi behelyezését teszi szükségessé, ezt legalább 9 órával a megvilágítás kezdete után kell megtenni. E késői napszakban a tálca behelyezése már nem vált ki ívást.
4B. függelék
ÍVÁSI ALJZAT AMERIKAI CSELLE RÉSZÉRE
Két vagy három kombinált műanyag/kerámia/üveg vagy rozsdamentes acél ívási lemezt és tálcát kell helyezni mindegyik vizsgálati kamrába (pl. 80 mm hosszú szürke, félkör alakú ereszcsatorna-darab egy 130 mm hosszú szegélyes tálcára helyezve) (lásd a képet). A megfelelően kezelt PVC- vagy kerámialemezek megfelelő ívási aljzatnak bizonyultak (Thorpe et al, 2007.).
A jobb tapadás érdekében ajánlott a lemezeket megcsiszolni. Emellett a tálcát célszerű hálóval lefedni azt megakadályozandó, hogy a halak hozzáférjenek a lehullott ikrákhoz, kivéve, ha igazolt, hogy az ikrák hatékonyan tapadnak a használt ívási aljzathoz.

Az alaplap célja, hogy felfogja azokat az ikrákat, amelyek nem tapadnak meg a lemez felületén és ezért a tartály aljára esnének (vagy azokat az ikrákat, amelyeket a halak közvetlenül a lapos műanyag alaplapra raktak le). Az ívási aljzatot felhasználás előtt legalább 12 órán keresztül áztatni kell a hígítóvízben.
Thorpe KL, Benstead R, Hutchinson TH, Tyler CR, 2007. An optimised experimental test procedure for measuring chemical effects on reproduction in the fathead minnow, Pimephales promelas. Aquatic Toxicology, 81, 90–98.
5A. függelék
A MÁSODLAGOS IVARI JELLEGEK VIZSGÁLATA AZ AMERIKAI CSELLÉBEN BIZONYOS ENDOKRIN RENDSZERRE HATÓ VEGYI ANYAGOK KIMUTATÁSA CÉLJÁBÓL
Áttekintés
A hormonháztartást zavaró anyagok vizsgálata során a fizikai megjelenés potenciálisan fontos jellemzői lehetnek a felnőtt amerikai csellék esetében többek között: a testszín (azaz világos/sötét), a mintázat (azaz a függőleges sávok jelenléte vagy hiánya), a test alakja (azaz a fej és a pektorális régió alakja, a has puffadtsága), valamint a speciális másodlagos ivari jellegek (azaz a nászkiütések száma és mérete, a dorzális lemez és a tojócső mérete).
A nászkiütések a szaporodásbiológiailag aktív hím amerikai csellék fején (dorzális lemez) találhatók, és általában kétoldali szimmetrikus mintázatba rendeződnek (Jensen et al. 2001). A kontrollnőstényeken, illetve a növendék hímeken és nőstényeken nem figyelhető meg a nászkiütések kifejlődése (Jensen et al. 2001). A hímek szeme körül és orrlyukai között akár nyolc egyedi nászkiütés is lehet. A legtöbb és legnagyobb nászkiütés közvetlenül az orrlyukak alatt és a száj fölött, két párhuzamos vonalban található. Számos halban nászkiütés-csoportok helyezkednek el az alsó állkapocs alatt; ezek közül a szájhoz legközelebb elhelyezkedők általában egy különálló párt alkotnak, míg a ventrálisabb csoportok akár négy nászkiütésből is állhatnak. A gyakorlatban a nászkiütések száma ritkán haladja meg a 30-at (tartomány: 18–28; Jensen et al. 2001). A (számuk tekintetében) domináns nászkiütések különálló, viszonylag kerek képződmények, amelyek magassága körülbelül megegyezik a sugarukkal. A szaporodásbiológiailag aktív hímek többségének van legalább néhány olyan nászkiütése, amely olyan mértékben megnagyobbodott és hangsúlyossá vált, hogy az egyes struktúrákat nem lehet megkülönböztetni.
A hormonháztartást zavaró anyagok bizonyos típusai egyes másodlagos ivari jellegek rendellenes előfordulását okozhatják a másik nemben; például az androgénreceptor-agonisták – mint a 17α-metiltesztoszteron vagy a 17β-trenbolon – nászkiütések kifejlődését okozhatják a nőstény amerikai cselléknél (Smith, 1974; Ankley et al. 2001, 2003), míg az ösztrogénreceptor-agonisták a hímeknél csökkenhetik a nászkiütések számát vagy méretét (Miles–Richardson et al. 1999; Harris et al. 2000.).
Az alábbiakban az Egyesült Államok Környezetvédelmi Ügynökségének (US Environmental Protection Agency) duluth-i (Minnesota állam) laboratóriumában alkalmazott eljárások alapján ismertetjük a nászkiütések jellemzését az amerikai cselle esetében. Az egyes termékek és/vagy berendezések hasonló rendelkezésre álló anyagokkal is helyettesíthetők.
A nászkiütések megfigyelésére leginkább megvilágított nagyító vagy 3X nagyítású megvilágított preparálómikroszkóp alkalmas. A halat dorzális irányból és anterior részével előre kell vizsgálni (fejjel a megfigyelő felé).
— A halat anterior részével előre és ventrális részével lefelé kis (pl. 100 mm átmérőjű) Petri-csészébe kell helyezni. A keresőt fókuszálni kell, hogy a nászkiütésekbeazonosíthatók legyenek. A halat lassan, finoman egyik oldaláról a másikra kell forgatni a nászkiütés-területek beazonosítása érdekében. A nászkiütéseket meg kell számolni és pontozni kell.
— A megfigyelést a fej ventrális felületén is meg kell ismételni úgy, hogy a halat hátára fektetve, anterior részével előre helyezik a Petri-csészébe.
— Az egyes halak megfigyelését 2 percen belül be kell fejezni.
A nászkiütések megszámlálása és pontozása
Felnőtt amerikai cselle esetében hat specifikus területet határoztak meg, ahol meg kell vizsgálni a nászkiütések jelenlétét és fejlődését. A jelenlévő nászkiütések elhelyezkedésének és mennyiségének feltérképezésére kifejlesztettek egy sablont (lásd a függelék végén). Az egyes élőlények esetében a nászkiütések számát rögzíteni kell, méretüket a következőképpen lehet mennyiségileg rangsorolni: 0 – hiányzik, 1– jelen van, 2 – megnagyobbodott és 3 – hangsúlyos (1. ábra).
0 pont – hiányoznak a nászkiütések. 1 pont – jelen van, és a tuberkulumnak van egy olyan pontja, amelynek magassága csaknem egyenlő a nászkiütés sugarával. 2 pont – megnagyobbodott, megjelenésében csillagra emlékeztető szövet jellemzi, és rendszerint nagy sugaras alapja van a középpontból eredő bordákkal vagy barázdákkal. A nászkiütés felszíne gyakran egyenetlen, de időnként kissé lekerekedett is lehet. 3 pont – hangsúlyos, általában elég nagy és lekerekedett, kevésbé definiált struktúrával. Időnként ezek a nászkiütések összefutnak és egy adott területen vagy különböző területek kombinációján összefüggő tömeget képeznek (B, C és D, alább ismertetve). A nászkiütések színezete és struktúrája a 2 ponttal értékelt nászkiütésekéhoz hasonlít, de időnként eléggé megkülönböztethetetlen. Ez a pontozási rendszer a 18–20 nászkiütéssel rendelkező normál kontrollhímek esetében általában < 50 általános nászkiütés-pontszámot eredményez (Jensen et al. 2001).
1. ábra

Az adott minősítési területen lévő nászkiütések tényleges száma néhány hal esetében meghaladhatja a sablon celláinak számát. Ilyen esetben a további pontszámokat a cellán belül, illetve a cellától jobbra vagy balra lehet megadni. A sablonnak ezért nem kell szimmetrikusnak lennie. További technika a párban álló vagy a száj vízszintes síkja mentén vertikálisan összekapcsolódott nászkiütések feltérképezésére, hogy egy cellában két nászkiütés-minősítő pontszámot adnak meg.
Feltérképezendő régiók:
A – a szem körül található nászkiütések. A szem elülső pereme körül dorzoventrális irányban feltérképezve. A kifejlett kontrollhímeknél általában több is található, a kontrollnőstényeknél nincsenek jelen, az androgénnek kitett nőstényekben pedig általában párban (mindkét szem közelében egy pár) vagy önállóan fordulnak elő.
B-az orrnyílások (szenzoros csatorna pórusok) között találhatók nászkiütések. A kontrollhímeknél normális esetben párokban, magasabb fejlettségi szintjen (2 – megnagyobbodott vagy 3 – hangsúlyos) fordulnak elő. A kontrollnőstényeknél nincsenek jelen, az androgéneknek kitett nőstényeknél alkalmanként előfordulnak és bizonyos mértékben fejlettek.
C – az orrlyukaktól közvetlenül anterior irányban, a szájjal párhuzamosan található nászkiütések. A kifejlett kontrollhímekben általában megnagyobbodtak vagy hangsúlyosak. A kevésbé fejlett hímekben vagy az androgénnel kezelt nőstényekben jelen vannak vagy megnagyobbodtak.
D – a szájvonallal párhuzamosan elhelyezkedő nászkiütések. A kontrollhímeknél általában fejlettnek minősülnek. A kontrollnőstények esetében hiányoznak, de az androgénnek kitett nőstényeknél jelen vannak.
E – az alsó állkapcson, a száj közelében található nászkiütések, általában kisméretűek és gyakran párban vannak. A kontroll- és a kezelt hímek, valamint a kezelt nőstények esetében változó jellemzőkkel rendelkeznek.
F – az E-vel jelölt nászkiütésektől ventrálisan elhelyezkedő nászkiütések. Gyakran kisméretűek és párban vannak. A kontrollhímeknél és az androgénnek kitett nőstényeknél vannak jelen.
Hivatkozások:
(1) Ankley GT, Jensen KM, Kahl MD, Korte JJ, Makynen ME. 2001. Description and evaluation of a short-term reproduction test with the fathead minnow (Pimephales promelas). Environ Toxicol Chem 20:1276-1290.
(2) Ankley GT, Jensen KM, Makynen EA, Kahl MD, Korte JJ, Hornung MW, Henry TR, Denny JS, Leino RL, Wilson VS, Cardon MC, Hartig PC, Gray EL. 2003. Effects of the androgenic growth promoter 17-β trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environ Toxicol Chem 22:1350-1360.
(3) Harries JE, Runnalls T, Hill E, Harris CA, Maddix S, Sumpter JP, Tyler CR. 2000. Development of a reproductive performance test for endocrine disrupting chemicals using pair-breeding fathead minnows (Pimephales promelas). Environ Sci Technol 34:3003-3011.
(4) Jensen KM, Korte JJ, Kahl MD, Pasha MS, Ankley GT. 2001. Aspects of basic reproductive biology and endocrinology in the fathead minnow (Pimephales promelas). Comp Biochem Physiol C 128:127-141.
(5) Kahl MD, Jensen KM, Korte JJ, Ankley GT. 2001. Effects of handling on endocrinology and reproductive performance of the fathead minnow. J Fish Biol 59:515-523.
(6) Miles-Richardson SR, Kramer VJ, Fitzgerald SD, Render JA, Yamini B, Barbee SJ, Giesy JP. 1999. Effects of waterborne exposure of 17-estradiol on secondary sex characteristics and gonads of fathead minnows (Pimephales promelas). Aquat Toxicol 47:129-145.
(7) Smith RJF. 1974. Effects of 17α-methyltestosterone on the dorsal pad and tubercles of fathead minnows (Pimephales promelas). Can J Zool 52:1031-1038.

5B. függelék
A MÁSODLAGOS IVARI JELLEGEK VIZSGÁLATA A JAPÁN RIZSHALBAN EGYES, AZ ENDOKRIN RENDSZERRE HATÓ VEGYI ANYAGOK KIMUTATÁSA CÉLJÁBÓL
Az alábbiakban a papilláris nyúlványok ( *1 ) mérési módját ismertetjük, amelyek a japán rizshal (Oryzias latipes) jellemző másodlagos ivari jellegei.
(1) A máj kimetszése után (6. függelék) a tetemet egy kúpos csőbe kell helyezni, amely körülbelül 10 ml 10 %-os semleges pufferelt formalint tartalmaz (felső rész: fej, alsó rész: farok). Ha az ivarmirigyet 10 %-os semleges pufferelt formalintól eltérő oldatban fixálják, a testet keresztirányban kell átvágni borotvapenge segítségével a farok alatti úszó anterior régiója és a végbélnyílás között, ügyelve arra, hogy ne sértsék meg az ivarnyílást és magát az ivarmirigyet (3. ábra). A haltest feji végét fixálóoldatba kell helyezni az ivarmirigy megőrzése céljából, a haltest farki végét pedig – a fent leírtak szerint – 10 %-os semleges pufferolt formalinba.
(2) Miután a haltestet 10 %-os semleges pufferelt formalinba helyezték, csipesszel meg kell fogni a farok alatti úszó anterior régióját és meghajlítva kell tartani körülbelül 30 másodpercig, hogy a farok alatti úszó nyitva maradjon. A farok alatti úszó csipesszel való megfogása során csak néhány úszósugarat szabad meg fogni az anterior régióban, ügyelve arra, hogy a papilláris nyúlványok ne karcolódjanak meg.
(3) Miután körülbelül 30 másodpercig nyitva tartották a farok alatti úszót, a haltestet a papilláris nyúlványok méréséig 10 %-os semleges pufferolt formalinban kell tárolni szobahőmérsékleten (a mérést legalább 24 órával a fixálás után kell elvégezni).
Mérés
(1) Miután a hal testét legalább 24 órán keresztül fixálták 10 %-os semleges pufferelt formalinban, a haltestet ki kell venni a kúpos csőből, és a formalint szűrőpapírral (vagy papírtörlővel) le kell törölni.
(2) A halat hassal felfelé kell elhelyezni. Kisméretű boncolóollóval óvatosan le kell vágni a farok alatti úszót (célszerű a farok alatti úszót a pterygiophorus kis darabjával együtt levágni).
(3) Csipesszel meg kell fogni a levágott, farok alatti úszót az anterior régióban, és néhány csepp vízzel üveg tárgylemezre kell helyezni. Ezután le kell fedni a farok alatti úszót egy üveg fedőlemezzel. Vigyázni kell, hogy ne karcolják meg a papilláris nyúlványokat, amikor a farok alatti úszót a csipesszel megfogják.
(4) A számláló segítségével meg kell számolni a papilláris nyúlványokkal rendelkező összekapcsolódott lemezeket biológiai mikroszkóp (álló mikroszkóp vagy inverz mikroszkóp) alatt. A papilláris nyúlvány arról ismerhető fel, hogy egy kis nyúlvány kialakulása látható az összekapcsolódott lemez poszterior szélén. A munkalapra fel kell jegyezni a papilláris nyúlvánnyal rendelkező összekapcsolódott lemezek számát minden úszósugáron (pl. első úszósugár: 0, második úszósugár: 10, harmadik úszósugár: 12, stb.), és halanként fel kell jegyezni ezeknek a számoknak az összegét az Excel-munkalapon. Szükség esetén le kell fényképezni a farok alatti úszót, és a fényképen meg kell számolni a papilláris nyúlvánnyal rendelkező összekapcsolódott lemezeket.
(5) A mérés után tárolás céljából a farok alatti úszót az (1) pontban leírt kúp alakú csőbe kell helyezni.
1. ábra
A farok alatti úszó alakjában és méretében megfigyelhető, ivarok közötti különbséget bemutató ábra. A, hím; B, nőstény. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218.

2. ábra
A: nyúlványok a farok alatti úszósugár összekapcsolódott lemezein. J.P.: összekapcsolódott lemez; A.S.: axiális tér; P.: nyúlvány. B.: az úszósugár disztális vége. Actinotrichia (Act.) az úszósugár hegyén. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218.

3. ábra
A hal testéről készült fénykép a kettévágás helyével, ha az ivarmirigyet 10 %-os semleges pufferelt formalintól eltérő fixálóoldatban fixálják. Ebben az esetben a testet a farok alatti úszó anterior régiója és a végbélnyílás között borotva segítségével ketté kell vágni (piros vonal), majd a haltest feji része az ivarmirigy-fixálóoldatba, míg a haltest farki része 10 %-os semleges pufferelt formalinba kerül.

6. függelék
A VITELLOGENINANALÍZIS CÉLJÁRA AJÁNLOTT MINTAVÉTELI ELJÁRÁSOK
Ügyelni kell arra, hogy elkerüljék a hímekből és nőstényekből vett VTG-minták közötti keresztszennyeződést.
1A. eljárás: Amerikai cselle, vérvétel farokvénából/-artériából
Érzéstelenítés után a faroktestet szikével részben át kell vágni, és heparinnal kezelt mikrohematokrit kapilláriscsővel vért kell gyűjteni a farokvénából/-artériából. A vér levételét követően a vérplazmát 3 percig 15 000 g -vel (vagy alternatív megoldásként 10 percig 15 000 g-vel 4 °C-on) történő centrifugálással gyorsan el kell választani. Centrifugálás után szükség esetén meg lehet határozni a százalékos hematokritértéket. A plazmarészt ezután el kell távolítani a mikrohematokrit csőből, és 0,13 egység aprotinin (proteáz-inhibitor) hozzáadása után a VTG-meghatározás elvégzéséig centrifugacsőben, – 80 °C hőmérsékleten kell tárolni. A begyűjthető vérplazmatérfogat az amerikai cselle méretétől függően (ami ivarfüggő) általában 5–60 mikroliter/hal (Jensen et al. 2001).
1B. eljárás: Amerikai cselle, vérvétel szívpunkcióval
Alternatív megoldásként a vér szívpunkcióval is gyűjthető heparinnal kezelt fecskendő használatával (1 000 egység heparin/ml). A vért (jégen tartott) Eppendorf-csövekbe kell áttölteni, majd centrifugálni (5 perc, 7 000 g, szobahőmérséklet). A vérplazmát tiszta Eppendorf-csövekbe kell áttölteni (alikvotokban, ha a vérplazma térfogata ezt lehetővé teszi), majd -80 °C-on azonnal le kell fagyasztani és az analízisig így tárolni (Panter et al. 1998).
2 A. eljárás: Japán rizshal, a máj kimetszése a rizshal esetében
A vizsgálati halak eltávolítása a vizsgálati kamrából
(1) A vizsgálati halakat kis merítőhálóval kell eltávolítani a vizsgálati kamrából. Vigyázni kell, hogy ne ejtsék bele a vizsgálati halakat egy másik vizsgálati kamrába.
(2) A vizsgálati halakat elvileg a következő sorrendben kell eltávolítani: kontroll, oldószeres kontroll (adott esetben), legalacsonyabb koncentráció, közepes koncentráció, legmagasabb koncentráció és pozitív kontroll. Ezenkívül az összes hímet el kell távolítani a vizsgálati kamrából, mielőtt a nőstények eltávolítására sor kerülne.
(3) A vizsgálati halak ivarát a külső másodlagos ivari jellegek alapján kell megállapítani (pl. a farok alatti úszó alakja).
(4) A vizsgálati halakat szállítótartályba kell helyezni, és a máj kimetszésére szolgáló munkaállomásra kell átvinni. Ellenőrizni kell, hogy a vizsgálati kamra és a szállítótartály címkéje pontos adatokat tartalmaz-e, illetve meg kell erősíteni, hogy a vizsgálati kamrából eltávolított halak száma és a kamrában maradó halak száma összhangban van-e az elvárttal.
(5) Ha az ivart a halak külső megjelenése alapján nem lehet azonosítani, el kell távolítani az összes halat a vizsgálati kamrából. Ebben az esetben az ivart az ivarmirigy vagy a másodlagos ivari jellegek sztereomikroszkóp alatti megfigyelésével kell meghatározni.
A máj kimetszése
(1) A vizsgálati halat kis merítőhálóval át kell helyezni a szállítótartályból az érzéstelenítő oldatba.
(2) Érzéstelenítés után a vizsgálati halakat csipesszel (kereskedelmi forgalomban kapható típus) szűrőpapírra (vagy papírtörlőre) kell helyezni. A vizsgálati halat a fej két oldalán kell megfogni a csipesszel, hogy elkerülhető legyen a farok eltörése.
(3) Le kell törölni a vizet a szűrőpapírral (vagy a papírtörlővel) a vizsgálati hal testének felületéről.
(4) A halat hassal felfelé kell elhelyezni. Boncolóollóval kis keresztirányú bemetszést kell ejteni félúton a ventrális nyaki régió és a középhasi régió között.
(5) A boncolóollót a kis bemetszésbe kell vezetni, majd a kopoltyúfedőtől kaudális irányban elhelyezkedő ponttól a végbélnyílás kraniális széléig fel kell vágni a hasat a has középvonala mentén. Vigyázni kell, hogy ne vezessék be túl mélyen a boncolóollót, nehogy károsodjon a máj és az ivarmirigy.
(6) A következő műveleteket sztereomikroszkóp alatt kell végezni.
(7) A vizsgálati halat hassal felfelé a papírtörlőre kell helyezni (üveg Petri-csésze vagy tárgylemez is rendelkezésre áll).
(8) Precíziós csipesszel szét kell húzni a hasüreg falait, és fel kell tárni a belső szerveket. Szükség esetén az is elfogadható, ha a belső szerveket a hasüreg egyik falának eltávolításával tárják fel.
(9) Egy másik precíziós csipesszel fel kell tárni a máj és az epehólyag kapcsolódó részét. Ezután meg kell fogni az epevezetéket, majd le kell vágni az epehólyagot. Vigyázni kell, nehogy kilyukasszák az epehólyagot.
(10) Meg kell fogni a nyelőcsövet, és ugyanígy le kell vágni a gyomor-bél traktust a májról. Vigyázni kell, nehogy kiszivárogjon a gyomor- és béltartalom. A kaudális gyomor-bél traktust le kell vágni a végbélnyílásról, és el kell távolítani a hasüregből.
(11) A zsírt és az egyéb szöveteket le kell metszeni a májperifériáról. Vigyázni kell, nehogy felsértsék a májat.
(12) A máj portális területét a precíziós csipesszel meg kell fogni, és a májat el kell távolítani a hasüregből.
(13) A májat a tárgylemezre kell helyezni. Szükség esetén a máj felületéről precíziós csipesszel el kell távolítani minden további zsírt és külső szövetet (pl. hasüreget bélelő szövetek).
(14) Elektronikus analitikai mérlegen meg kell mérni a máj tömegét 1,5 ml-es mikrocsővel mint tárával együtt. Az értéket fel kell jegyezni a munkalapra (leolvasás: 0,1 mg pontossággal). A mikrocső címkéjén található azonosító adatokat ellenőrizni kell.
(15) Le kell zárni a májat tartalmazó mikrocső kupakját. A csövet hűtőállványon (vagy fagyasztótartályban) kell tárolni.
(16) A máj kimetszése után a boncolóeszközöket meg kell tisztítani, vagy le kell cserélni azokat tiszta eszközökre.
(17) A szállítótartályban található minden halból a fent leírtak szerint el kell távolítani a májat.
(18) Miután a szállítótartályban lévő összes halból kivágták a májat (azaz az adott vizsgálati kamrából származó minden hímből vagy nőstényből), az összes májmintát azonosító címkével ellátva csőtartó állványra kell helyezni, majd fagyasztóban tárolni. Ha a májakat kimetszés után nem sokkal előkezelésre bocsátják, a mintadarabokat hűtőállványon (vagy fagyasztótartályban) át kell vinni a következő munkaállomásra.
A hal teste a máj kimetszését követően felhasználható ivarmirigy-szövettanra és a másodlagos ivari jellegek vizsgálatára.
Mintapéldány
Ha a vizsgálati halakból vett májmintákat röviddel a kimetszés után nem használják fel előkezelésre, akkor ≤ – 70 °C-on kell azokat tárolni.
1. ábra
Ollóval bemetszést kell ejteni közvetlenül a mellúszók előtt.

2. ábra
A has középvonalát a végbélnyílástól körülbelül 2 mm-re kraniálisan elhelyezkedő pontig ollóval fel kell vágni.

3. ábra
A hasfalat a máj és az egyéb belső szervek szabaddá tétele céljából fogóval ki kell tárni.
(Alternatív megoldásként a hasfalat oldalra is le lehet tűzni.)
A nyíl a májat jelzi.

4. ábra
A májat fogóval határozottan fel kell tárni és kimetszeni.
5. ábra
A beleket fogóval óvatosan vissza kell húzni.

6. ábra
A belek mindkét végét és a mesenterialis függelékeket ollóval el kell vágni.
7. ábra (nőstény)
Az eljárás a nőstények esetében is ugyanaz.

8. ábra
A befejezett eljárás.

2B. eljárás: Japán rizshal (Oryzias latipes), a máj előkezelése vitellogeninanalízishez
A homogenizátumpuffert ki kell venni az ELISA-készletből, és az üvegében hagyva zúzott jéggel le kell hűteni (az oldat hőmérséklete: ≤ 4 °C). Ha az EnBio ELISA rendszer homogenizáló pufferét használják, az oldatot szobahőmérsékleten fel kell olvasztani, majd a palackot zúzott jéggel lehűteni.
A májhoz szükséges homogenizátumpuffer térfogatát a máj tömege alapján kell kiszámítani (egy mg májhoz 50 μl homogenizátumpuffert kell adni). Például ha a máj tömege 4,5 mg, a májhoz adandó homogenizátumpuffer mennyisége 225 μl. Listát kell készíteni az összes májhoz szükséges homogenizátumpuffer térfogatáról.
A máj előkészítése az előkezeléshez
(1) A májat tartalmazó 1,5 ml-es mikrocsövet közvetlenül az előkezelés előtt kell kivenni a fagyasztóból.
(2) A vitellogeninszennyeződés megelőzése érdekében a hímekből származó májak előkezelését a nőstényekből származó májak előkezelése előtt kell elvégezni. Ezen túlmenően a vizsgálati csoportok előkezelését a következő sorrendben kell lefolytatni: kontroll, oldószeres kontroll (adott esetben), legalacsonyabb koncentráció, közepes koncentráció, legmagasabb koncentráció és pozitív kontroll.
(3) A fagyasztóból egy adott időpontban kivett – májmintákat tartalmazó – 1,5 ml-es mikrocsövek száma nem haladhatja meg az abban az időpontban lecentrifugálható mikrocsövek számát.
(4) A májmintákat tartalmazó 1,5 ml-es mikrocsöveket a mintadarabok sorszámai szerinti sorrendben kell elrendezni a fagyasztótartályban (a májakat nem kell felolvasztani).
Az előkezelés végrehajtása
1) A homogenizátumpuffer hozzáadása
A listán ellenőrizni kell a homogenizátumpuffernek az adott májmintához használandó térfogatát, és be kell állítani a mikropipettát (térfogattartomány: 100–1 000 μl) a megfelelő térfogatra. A mikropipettához tiszta hegyet kell csatlakoztatni.
A homogenizátumpuffert fel kell szívni a reagenspalackból, és a puffert be kell adni a májat tartalmazó 1,5 ml-es mikrocsőbe.
A májat tartalmazó valamennyi 1,5 ml-es mikrocsőbe be kell adni a homogenizátumpuffert a fent leírt eljárás szerint. A mikropipetta hegyét nem kell kicserélni. Ha azonban a pipettahegy szennyezett vagy feltehetően szennyezett, a hegyet ki kell cserélni.
2) A máj homogenizálása
— A homogenizáláshoz új mozsártörőt kell csatlakoztatni a mikrocső-homogenizátorhoz.
— A mozsártörőt be kell vezetni a 1,5 ml-es mikrocsőbe. A mikrocső-homogenizátort úgy kell tartani, hogy a májat a mozsártörő felülete és a 1,5 ml-es mikrocső belső fala közé préselje.
— A mikrocső-homogenizátort 10–20 másodpercre be kell kapcsolni. A művelet során a 1,5 ml-es mikrocsövet zúzott jéggel kell hűteni.
— Ki kell emelni a mozsártörőt a 1,5 ml-es mikrocsőből, és a csövet körülbelül 10 másodpercig nyugalomban kell hagyni. Ezután vizuálisan ellenőrizni kell a szuszpenzió állapotát.
— Ha májdarabok figyelhetők meg a szuszpenzióban, a (3) és (4) műveletet meg kell ismételni, hogy kielégítő minőségű májhomogenizátumot lehessen készíteni.
— A centrifugálásig a szuszpendált májhomogenizátumot fagyasztótartályban kell hűteni.
— A mozsártörőt minden homogenizátumhoz újra kell cserélni.
— Az összes májat homogenizálni kell a homogenizátumpufferrel a fent leírt eljárás szerint.
3) A szuszpendált májhomogenizátum centrifugálása
— A hűtött centrifugakamra hőmérsékletét ellenőrizni kell (≤ 5 °C.).
— A szuszpendált májhomogenizátumot tartalmazó 1,5 ml-es mikrocsöveket be kell helyezni a hűtött centrifugába (szükség esetén ki kell egyensúlyozni).
— A szuszpendált májhomogenizátumot 10 percig centrifugálni kell ≤ 5 °C hőmérsékleten 13 000 g-vel. Ugyanakkor, ha a felülúszók megfelelően elválnak, a centrifugálás sebességét és időtartamát szükség szerint módosítani lehet.
— A centrifugálás után ellenőrizni kell, hogy a felülúszók megfelelően elkülönültek-e (felszín: lipid, középső réteg: felülúszó, alsó réteg: májszövet). Ha az elkülönülés nem megfelelő, azonos körülmények mellett ismét centrifugálni kell a szuszpenziót.
— El kell távolítani minden mintadarabot a hűtött centrifugából, és azokat a mintadarabok sorszámának megfelelően kell elhelyezni a fagyasztótartályban. Vigyázni kell, nehogy a centrifugálás után újraszuszpendálják a már elválasztott rétegeket.
4) A felülúszó gyűjtése
— A csőtartó állványba négy db 0,5 ml-es mikrocsövet kell helyezni a felülúszó tárolására.
— Mikropipettával 30 μl-t kel kivenni minden felülúszóból (a középső rétegben különül el), és 0,5 ml-es mikrocsőbe kell áttölteni. Vigyázni kell, hogy ne szívják fel a felszínen található lipidet vagy az alsó rétegben található májszövetet.
— A fentebb leírtakkal megegyező módon kell kivenni a felülúszóból, és be kell tölteni két másik 0,5 ml-es mikrocsőbe.
— A maradék felülúszót be kell gyűjteni a mikropipettával (lehetőség szerint: ≥ 100 μl). Ezután a felülúszót a fennmaradó 0,5 ml-es mikrocsőbe kell tölteni. Vigyázni kell, hogy ne szívják fel a felszínen található lipidet vagy az alsó rétegben található májszövetet.
— Le kell zárni a 0,5 ml-es mikrocső kupakját, és a címkére rá kell írni a felülúszó térfogatát. Ezután azonnal le kell hűteni a mikrocsöveket a fagyasztótartályban (ice rack).
— A mikropipetta hegyét minden felülúszónál újra kell cserélni. Ha nagy mennyiségű lipid halmozódik fel a mikropipetta hegyén, a májkivonat zsírral való szennyeződésének elkerülése érdekében azonnal le kell cserélni egy új hegyre.
— Az összes lecentrifugált felülúszót szét kell osztani négy 0,5 ml-es mikrocsőbe a fent leírt eljárás szerint.
— A felülúszó 0,5 ml-es mikrocsövekbe történő szétöntését követően az azonosító címkével ellátott mikrocsöveket a csőtartó állványba kell helyezni, majd fagyasztóban azonnal lefagyasztani. Ha a VTG koncentrációját az előkezelés után azonnal mérik, a csőtartó állványban egy 0,5 ml-es mikrocsövet (a 30 μl felülúszót tartalmazó csövet) hűvösen kell tartani, és át kell vinni arra a munkaállomásra, ahol az ELISA-vizsgálatot végzik. Ebben az esetben a többi mikrocsövet csőtartó állványba kell helyezni, és le kell fagyasztani a fagyasztóban.
— A felülúszó begyűjtését követően a maradékot megfelelően meg kell semmisíteni.
A minta tárolása
A májhomogenizátum felülúszóját tartalmazó 0,5 ml-es mikrocsöveket az ELISA-vizsgálatban történő felhasználásig ≤ – 70 °C-on kell tárolni.
3A. eljárás: Zebradánió, vérvétel farokvénából/-artériából
A faroktövet közvetlenül az érzéstelenítés után keresztben át kell vágni, és heparinnal kezelt mikrohematokrit kapilláriscsővel fel kell fogni a vért a farokvénából/-artériából. A vér térfogata a hal méretétől függően 5–15 μl. A mikrokapilláris-csőbe azonos térfogatú aprotinin puffert (6 μg/ml PBS-ben) kell adni, és a vérplazmát centrifugálással (5 perc, 600 g) szeparálni a vérből. A vérplazmát a kémcsövekben kell összegyűjteni, és a vitellogenin vagy az egyéb vizsgált fehérjék analizálásáig – 20 °C-on kell tárolni.
3B. eljárás: Zebradánió, vérvétel szívpunkcióval
A véralvadás és a fehérjék lebomlásának elkerülése érdekében a mintákat heparint (1 000 egység/ml) és aprotinin proteázinhibitort (2 TIU/ml) tartalmazó foszfáttal pufferolt sóoldatban (PBS) kell gyűjteni. A puffer összetevőjeként heparin, ammóniumsó és liofilizált aprotinin használata ajánlott. A vérvétel céljára rögzített vékony tűvel (pl. Braun Omnikan-F) ellátott fecskendő (1 ml) használata javasolt. A fecskendőt előre meg kell tölteni a pufferrel (körülbelül 100 μl), hogy teljesen feloldja a halakból származó kis vértérfogatokat. A vérmintát szívpunkcióval kell venni. Először a halat MS-222 oldattal (100 mg/l) érzésteleníteni kell. Megfelelő érzéstelenítéssel kivehetővé válik a zebradánió szívverése. A szív megszúrása közben enyhe nyomást kell kifejteni a fecskendő dugattyújára. A begyűjthető vértérfogat 20–40 mikroliter között van. A szívpunkció után a vér-puffer keveréket a kémcsőbe kell tölteni. A vérplazmát a vérből centrifugálással (20 perc, 5 000 g) kell elkülöníteni, és az analízisig – 80 °C-on tárolni.
3C. eljárás Szabványműveleti előírás: Zebradánió, fej/farok homogenizátum készítése
1. A halakat a vizsgálati leírásnak megfelelően érzésteleníteni kell, majd le kell ölni.
2. A halak fejét és farkát az 1. ábrának megfelelően le kell vágni.
Fontos megjegyzés: A nem indukált hímek nőstényektől vagy indukált hímektől eredő »vitellogeninszennyeződésének« megelőzése céljából a boncolóeszközöket, valamint a vágódeszkát az egyes halak kezelése között le kell öblíteni és alaposan meg kell tisztítani (pl. 96 %-os etanollal).
1. ábra

3. Az egyes halak fejének és farkának együttesen mért tömegét a legközelebbi mg-ra kell kerekíteni.
4. A mérés után a testrészek megfelelő (pl. 1,5 ml-es Eppendorf-) csövekbe kerülnek, és – 80 °C-on homogenizálódásig kell azokat fagyasztani, vagy jégen két műanyag mozsártörővel közvetlenül homogenizálni. (Más módszerek is használhatók, ha azokat jégen végezik, és homogén tömeget eredményeznek). Fontos megjegyzés: A csöveket megfelelően meg kell számozni, hogy az adott halból származó fejet és farkat össze lehessen kapcsolni az ivarmirigy szövettani vizsgálatához használt megfelelő törzsdarabbal.
5. A homogén massza létrejöttét követően a szövet tömegének 4-szeresét kitevő mennyiségű jéghideg homogenizáló puffert ( *2 ) kell hozzáadni. A mozsártörővel addig kell dolgozni, amíg a keverék homogén nem lesz. Fontos megjegyzés: Minden halhoz új mozsártörőt kell használni.
6. A mintákat a 4 °C-on 50 000 g-vel 30 percig zajló centrifugálásig jégre kell tenni.
7. A felülúszóból pipettával 20 μl térfogatú adagokat át kell vinni legalább két csőbe úgy, hogy a pipetta hegyét a felületen lévő zsírréteg alá kell meríteni és a zsír- vagy pelletfrakció nélküli felülúszót óvatosan fel kell szívni.
8. A csöveket felhasználásig – 80 °C hőmérsékleten kell tárolni.
7. függelék
DÚSÍTOTT VITELLOGENINMINTÁK ÉS INTER-ASSAY (VIZSGÁLATKÖZI) REFERENCIASTANDARD
Minden olyan napon, amikor VTG-vizsgálatot végeznek, egy inter-assay (vizsgálatközi) referenciastandard felhasználásával készült dúsított mintát is analizálni kell. Az inter-assay referenciastandard készítéséhez használt VTG-nek az elvégzendő vizsgálat céljára készített kalibrációs standardokban használt vitellogenintől eltérő tételből kell származnia.
A dúsított minta ismert mennyiségű inter-assay standardnak egy kontrollhím vérplazmájából vett mintához történő hozzáadásával készül. A mintát úgy kell feldúsítani, hogy a VTG koncentrációja elérje a kontrollcsoportban lévő hím halakban várható vitellogeninszint 10–100-szorosát. A kontrollhím vérplazmájából vett dúsítandó minta származhat egyetlen halból vagy lehet több halból származó kompozit minta is.
A kontrollhímből vett vérplazma nem dúsított részmintáját legalább két lyukban analizálni kell. A dúsított mintát is legalább két lyukban kell analizálni. A várható koncentráció meghatározásához a VTG-nek a kontrollhím vérplazmájából vett két nem dúsított mintában mért átlagos mennyiségét hozzá kell adni a dúsított mintákhoz adott VTG számított mennyiségéhez. E várható koncentrációnak a mért koncentrációhoz viszonyított arányát az adott napon elvégzett valamennyi vizsgálat eredményeivel együtt jegyzőkönyvezni kell.
8. függelék
DÖNTÉSI FOLYAMATÁBRA A STATISZTIKAI ELEMZÉSI MÓDSZER KIVÁLASZTÁSÁHOZ

C.49. A halembriók akut toxicitási vizsgálata
BEVEZETÉS
1. Ez a vizsgálati módszer egyenértékű az OECD 236. vizsgálati iránymutatásában (2013) leírt módszerrel. A halembriók akut toxicitási vizsgálatát (FET) zebradániókon (Danio rerio) mutatja be. E vizsgálat célja a vegyi anyagok halak embrionális életszakaszaira gyakorolt akut toxicitásának megállapítása. Az FET-vizsgálat a zebradániókon végzett vizsgálatokon és validálási tevékenységeken alapul (1)(2)(3)(4)(5)(6)(7)(8)(9)(10)(11)(12)(13)(14). Az FET-vizsgálatot sikeresen alkalmazták különböző hatásmechanizmusokat kifejtő, oldhatóságuk, illékonyságuk és víztaszító képességük szempontjából eltérő vegyi anyagok széles skáláján (áttekintés a 15. és 16. pontban).
2. Az e vizsgálati módszerben használt fogalommeghatározások az 1. függelékben találhatók.
A VIZSGÁLAT ELVE
3. Újonnan megtermékenyített zebradánióikrákat 96 órára kiteszik a vizsgálati vegyi anyagnak. Minden 24 órában legfeljebb négy apikális megfigyelést rögzítenek, az elhullás indikátoraként (6): i. a megtermékenyített peték koagulációja, ii. az őscsigolyák (szomiták) kialakulásának elmaradása; iii. a farokbimbó szikzacskóról való leválásának elmaradása; iv. szívverés hiánya. Az expozíciós időszak végén az akut toxicitást a négy feljegyzett apikális megfigyelés egyikében tapasztalt pozitív eredmény alapján határozzák meg, és kiszámítják az LC50-et.
KIINDULÁSI MEGFONTOLÁSOK
4. Az anyagspecifikus tulajdonságokkal kapcsolatos hasznos információk többek között a szerkezeti képlet, a molekulatömeg, a tisztaság, a vízben és a fény hatására tanúsított stabilitás, a pKa és a Kow, a vízoldékonyság, a gőznyomás, továbbá az azonnali biológiai lebonthatóságra irányuló vizsgálat eredményei (C.4. vizsgálati módszer (17) vagy C.29. (18) vizsgálati módszer). A vízoldékonyságból és a gőznyomásból meghatározható a Henry-állandó, amely megmutatja, hogy előfordulhat-e a vizsgálati vegyi anyag párolgás miatt eltávozása. Olyan megbízható analitikai módszerrel kell rendelkezni a vizsgálati oldatokban lévő anyag számszerűsítésére, amelynek pontossága és érzékelési határa ismert és dokumentált.
5. Ha a vizsgálati módszert keverék vizsgálatára alkalmazzák, annak összetételét lehetőség szerint jellemezni kell, pl. az alkotóelemeinek kémiai azonosításával, azok mennyiségi előfordulásával, továbbá anyagspecifikus tulajdonságaival (lásd a 4. pontot). A vizsgálati módszernek adott keverék szabályozási célú vizsgálatára történő alkalmazása előtt meg kell vizsgálni, hogy az elfogadható eredményeket biztosít-e a szándékolt szabályozási célra.
6. Az anyagcsere során aktiválható anyagokat érintően bizonyított, hogy a zebradánió embriói rendelkeznek biotranszformációs képességgel (19)(20)(21)(22). Ugyanakkor az embrióállapotú halak anyagcsere-képessége nem mindig hasonló egy növendékéhez vagy felnőtt egyedéhez. Például az allilalkoholt (9), mint metabolikus prekurzort az FET-vizsgálattal nem lehetett kimutatni. Ezért amennyiben arra utaló jelek tapasztalhatók, hogy a metabolitok vagy más releváns transzformációs termékek toxikusabbak lehetnek az anyavegyületnél, javasolt továbbá a vizsgálatot e metabolitokkal/transzformációs termékekkel lefolytatni, és ezeket az eredményeket felhasználni a vizsgálati vegyi anyag toxicitásával kapcsolatos következtetésekhez, vagy pedig egy másik vizsgálatot lefolytatni, amely nagyobb mértékben figyelembe veszi az anyagcserét.
7. A ≥ 3kDa molekulatömegű (igen terjedelmes molekulaszerkezetű) anyagok, illetve a kikelést késleltető anyagok esetében, amelyek kizárhatják vagy mérsékelhetik a kikelést követő expozíciót, az embriók várhatóan nem lesznek érzékenyek az anyag korlátozott biológiai hasznosíthatósága miatt, és más toxicitási vizsgálatok megfelelőbbek lehetnek.
A VIZSGÁLAT ÉRVÉNYESSÉGE
8. A következő feltételeknek kell teljesülniük ahhoz, hogy a vizsgálat eredményei érvényesek legyenek:
a) A begyűjtött peték általános megtermékenyítési aránya ≥ 70 % kell legyen a vizsgált tételben.
b) A vízhőmérsékletet 26 ± 1 °C-on kell tartani a vizsgálati kamrákban a vizsgálat teljes tartama alatt.
c) A negatív (hígítóvizes) kontrollban és adott esetben az oldószeres kontrollban az embriók általános túlélésének ≥ 90 %-nak kell lennie a 96 órás expozíció végéig.
d) A pozitív kontrollnak való expozíció (pl. 4,0 mg/l 3,4-diklór-anilin a zebradánió esetében) eredményeként a 96 órás expozíció végén a mortalitásnak legalább 30 %-nak kell lennie.
e) A negatív (hígítóvizes) kontrollban és adott esetben az oldószeres kontrollban a kikelési aránynak ≥ 80 %-nak kell lennie a 96 órás expozíció végéig.
f) A 96 órás expozíció végén az oldottoxigén-koncentrációnak a negatív kontrollban és a legmagasabb vizsgálati koncentrációnak ≥ 80 %-os telítettségűnek kell lennie.
A MÓDSZER ISMERTETÉSE
9. A javasolt fenntartási és vizsgálati körülményekről a 2. függelék nyújt áttekintést.
Felszerelés
10. A következő berendezésekre van szükség:
a) kémiailag semleges anyagból (pl. üvegből) készült és az ajánlott betelepítési aránynak megfelelő kapacitású tartályok (lásd a tenyészhalak tartására vonatkozó részt a 14. pontban);
b) inverz mikroszkóp és/vagy binokuláris mikroszkóp, amely legalább 80-szoros nagyításra képes. Amennyiben a megfigyelések dokumentálására használt helyiséget nem lehet 26 ± 1 °C-ra szabályozni, szabályozott hőmérsékletű, keresztirányban eltolható tárgyasztal vagy más, a hőmérséklet fenntartását szolgáló módszerek szükségesek;
c) vizsgálati kamrák; pl. standard 24 lyukú lemezek, megközelítőleg 20 mm mélységgel (a vizsgálati kamrákról szóló részt lásd a 11. pontban);
d) öntapadó fólia pl. a 24 lyukú lemezek lefedésére;
e) inkubátor, vagy szabályozott hőmérsékletű légkondicionált helyiség, amely lehetővé teszi a lyukakban (vagy a vizsgálati kamrákban) a 26 ± 1 °C fenntartását.
f) pH-mérő;
g) oxigénmérő,
h) vízkeménység és vezetőképesség meghatározására szolgáló berendezés,
i) ivadékcsapda: üveg, rozsdamentes acél vagy más semleges anyagból készült eszköztálcák; rozsdamentes acélból vagy más semleges anyagból készült (2 ± 0,5 mm szembőségű) drótháló a már lerakott ikrák védelmére; ívási aljzat (növényutánzatok semleges anyagból) (C.48. vizsgálati módszer, 4a. függelék (23));
j) szélesített nyílású pipetták a peték összegyűjtéséhez;
k) a különböző vizsgálati koncentrációk és hígítóvíz készítésére használt üvegedények (főzőpohár, mérőlombik, mérőhenger, mérőpipetták), vagy a zebradániópeték összegyűjtésére szolgáló eszközök (pl. főzőpoharak, kristályosító csészék);
l) ha alternatív expozíciós rendszereket, pl. átfolyásos (24) vagy passzív adagoló rendszert (25) használnak a vizsgálat lefolytatásához, ehhez megfelelő eszközök és felszerelések szükségesek.
Vizsgálati kamrák
11. Üveg vagy polisztirol vizsgálati kamrákat kell használni (pl. 24 lyukú lemezeket, lyukanként 2,5–5 ml töltési kapacitással). Ha gyanítható a polisztirolhoz való adszorpció (pl. a nem poláris, kétdimenziós anyagok esetében, amelyek KOW értéke magas) semleges anyagokat (üveget) kell használni az adszorpcióból eredő veszteség mérséklésére (26). A vizsgálati kamrákat véletlenszerűen kell az inkubátorban elhelyezni.
A vízre és a vizsgálatra vonatkozó körülmények
12. A tartásra szolgáló vizet ajánlott hígítani, hogy a felszíni vizek széles skálájára jellemző keménységi szintet érjenek el. A hígítóvizet művízből kell elkészíteni (27). Az eredményül adódó keménységi foknak 100–300 mg/l CaCO3 értékkel kell egyenértékűnek lennie a kalcium-karbonát túlzott kicsapódásának megelőzése érdekében. Más, kellően jellemzett felszíni vagy kútvíz használható. A művizet ionmentesített vízzel történő 1:5 arányú hígítással legalább 30–35 mg/l CaCO3 keménységűre lehet beállítani a tartásra szolgáló, alacsony keménységű víz előállításához. A vizet az oxigéntelítettséghez levegőztetni kell a vizsgálati vegyi anyag hozzáadása előtt. A hőmérsékletet 26 ± 1°C-on kell tartani a lyukakban a teljes vizsgálat során. A pH-értéknek a 6,5–8,5 közötti tartományba kell esnie, és e tartományon belül nem változhat a vizsgálat során 1,5 egységnél nagyobb mértékben. Ha a pH várhatóan nem marad e tartományon belül, akkor a vizsgálat megkezdése előtt a pH-t be kell állítani. A pH-beállítást úgy kell elvégezni, hogy a törzsoldat koncentrációja ne változzon jelentős mértékben, és a vizsgálati vegyi anyag ne lépjen kémiai reakcióba más anyaggal, vagy ne csapódjon ki. A vizsgálati vegyi anyagot tartalmazó oldatokban hidrogén-klorid (HCl) vagy nátrium-hidroxid (NaOH) ajánlott.
Vizsgálati oldatok
13. A kiválasztott koncentrációjú vizsgálati oldatok pl. a törzsoldat hígításával készíthetők el. A törzsoldatot lehetőleg a vizsgálati vegyi anyagnak a hígítóvízbe mechanikai eszközök (pl. keverő és/vagy ultrahang) segítségével történő bekeverésével vagy hozzákeverésével kell elkészíteni. Ha a vizsgálati vegyi anyag nehezen oldható vízben, az OECD nehezen vizsgálható anyagok és keverékek kezelésére vonatkozó 23. iránymutatásában leírt eljárásokat kell követni (28). Az oldószerek használatát kerülni kell, de egyes esetekben szükség lehet oldószer használatára a megfelelő töménységű törzsoldat előállításához. Amennyiben oldószert használnak a törzsoldat elkészítéséhez, az oldószer végső koncentrációja nem lehet több, mint 100 μl/l, és lehetőleg azonosnak kell lennie az összes vizsgálati edényben. Ha oldószert használnak, egy további oldószeres kontrollra lesz szükség.
A tenyészhalak tartása
14. Az ikratermeléshez expozícióval nem érintett vad zebradániók tenyészállományát kell használni, amelyek esetében a megtermékenyítési arány megfelelően dokumentált. A halaknak mentesnek kell lenniük fertőzések és betegségek makroszkopikusan észlelhető tüneteitől, és nem kaphatnak (akut vagy megelőző) gyógyszeres kezelést az ívás előtti két hónapban. A tenyészhalakat akváriumban kell tartani, amelynek ajánlott töltési kapacitása halanként 1 l víz, emellett 12–16 órás, rögzített megvilágítási idő javasolt (29)(30)(31)(32)(33). Az optimális szűrés mértékét be kell állítani; kerülni kell a vizet nagyon felkavaró, túlzott mértékű szűrést. Az etetési körülményeket lásd a 2. függelékben. Kerülni kell a túletetést; a vízminőséget és az akvárium tisztaságát pedig rendszeresen ellenőrizni kell, és szükség esetén az eredeti állapotot helyre kell állítani.
Jártassági vizsgálat
15. Lehetőség szerint évente kétszer referenciaanyagként (a validálási vizsgálatokban használt (1)(2)) 3,4-diklór-anillint kell vizsgálni teljes koncentráció-válasz tartományban, hogy ellenőrizzék az alkalmazott haltörzs érzékenységét. Minden olyan laboratóriumnak, amely a vizsgálatot először alkalmazza, ezt a referenciaanyagot kell használnia. Mielőtt a laboratórium szabályozási célokra adatokat bocsátana rendelkezésre, e vegyi anyag vizsgálatával demonstrálhatja a vizsgálat elvégzésében való jártasságát.
Peteképződés
16. A zebradánió petéi képződhetnek ívási csoportokban (egyedi ívótartályokban) vagy tömeges ívással (a halak tartására szolgáló tartályokban). Az ívási csoport esetében a tenyészcsoportba tartozó hímeket és nőstényeket (pl. 2:1 arányban) ívótartályokba kell helyezni a vizsgálat előtti napon a sötétedés beállta előtt néhány órával. Mivel alkalmanként előfordulhat, hogy a zebradániók ívócsoportjai nem ívnak, legalább három ívótartály párhuzamos használata ajánlott. A genetikai torzulások megelőzése érdekében a petéket legalább három tenyészcsoportból gyűjtik be, vegyesen és véletlenszerűen választva.
17. A peték begyűjtéséhez az ívócsapdákat az ívótartályokba vagy a haltartásra szolgáló tartályokba helyezik a vizsgálat előtti napon a sötétedés beállta előtt, vagy a vizsgálat napján a megvilágítás kezdete előtt. Annak megelőzésére, hogy a felnőtt zebradániók megegyék a petéket, az ívócsapdákat semleges anyagból készült, megfelelő szembőségű (megközelítőleg 2 ±0,5 mm) dróthálóval fedik le. Ha szükségesnek ítélik, semleges anyagból (pl. műanyagból vagy üvegből) készült műnövényeket lehet a hálóra rögzíteni az ívás ösztönzése érdekében (3)(4)(5)(23)(35). Vízlepergető műanyagokat kell használni, amelyek nem mosódnak bele a vízbe (pl. ftaláltok). A párzás, ívás és megtermékenyítés a megvilágítás kezdetétől számítva 30 percen belül következik be, és az ívócsapdákat a begyűjtött petékkel óvatosan kell eltávolítani. Ajánlott a petéket a csapdákból való begyűjtést követően művízzel lemosni.
Peték differenciálódása
18. 26°C-on mintegy 15 perc múlva végbemegy a megtermékenyített peték első osztódása, és az azt követő egyidejű osztódások során 4, 8, 16 és 32 szelvény (blastomera) alakul ki (lásd a 3. függeléket) (35). Ezekben a szakaszokban a megtermékenyített peték egyértelműen azonosíthatók a blastula kialakulásával.
VIZSGÁLATI ELJÁRÁS
Az expozíció körülményei
19. Koncentrációnként húsz embriót (lyukanként egyet) tesznek ki a vizsgálati vegyi anyagnak. Az expozíciót úgy kell kialakítani, hogy a névleges vegyianyag-koncentráció ±20 %-án maradjon fenn az egész vizsgálat során. Ha ez statikus rendszerben nem lehetséges, megvalósítható félstatikus oldatcserés intervallumot kell alkalmazni (pl. 24 óránkénti cserét). Ezekben az esetekben az expozíciós koncentrációkat legalább a legmagasabb és legalacsonyabb vizsgálati koncentrációnál ellenőrizni kell az egyes expozíciós intervallumok kezdetekor és végén (lásd a 36. pontot). Ha a névleges vegyianyag-koncentráció ±20 %-ának megfelelő expozíciós koncentráció nem tartható fenn, minden koncentrációt ellenőrizni kell az egyes expozíciós intervallumok kezdetekor és végén (lásd a 36. pontot). Az oldatcserénél gondoskodni kell arról, hogy az embriókat legalább csekély mennyiségben fedje a régi vizsgálati oldat a kiszáradás elkerülése érdekében. A vizsgálati tervet adott anyagok vizsgálati követelményeinek teljesítése érdekében ki lehet igazítani (pl. átfolyásos (24) vagy passzív adagolási rendszer (25) alkalmazható a könnyen lebomló vagy nagymértékben adszorbeáló anyagok (29) esetében, vagy más rendszer az illékony anyagok esetében (36)(37)). Minden esetben gondosan ügyelni kell arra, hogy az embriókat a lehető legkevesebb stresszhatás érje. A vizsgálati kamrákat a vizsgálat kezdete előtt legalább 24 óráig kondicionálni kell a vizsgálati oldatokkal. A vizsgálati körülményeket a 2. függelék foglalja össze.
Vizsgálati koncentrációk
20. A vizsgálati vegyi anyagból általában ötféle, egy 2,2 értékű konstans tényezőt meg nem haladó osztások szerint beállított koncentráció használata szükséges a statisztikai követelményeknek való megfelelés érdekében. Ötnél kevesebb vizsgálati koncentráció használatát indokolni kell. A legmagasabb vizsgált koncentráció eredményezzen lehetőleg 100 %-os elhullást, a legalacsonyabb vizsgált koncentráció pedig lehetőleg ne okozzon megfigyelhető hatást, amint azt a 28. pont meghatározza. A meghatározó vizsgálatot megelőző dózisbehatároló vizsgálat lehetővé teszi a megfelelő koncentrációtartomány megválasztását. A dózisbehatároláshoz szokásosan koncentrációnként tíz embriót használnak. A következő utasítások a 24 lyukú lemezen végrehajtott vizsgálatra vonatkoznak. Ha eltérő vizsgálati kamrákat (pl. kisebb Petri-csészéket) használnak, vagy több koncentrációt vizsgálnak, ezeket az utasításokat ennek megfelelően kell kiigazítani.
21. A koncentrációk 24 lyukú lemezek közötti elosztására vonatkozó részleteket és vizuális utasításokat a 27. pont, valamint a 4. függelék 1. ábrája tartalmazza.
Kontrollcsoportok
22. Hígítóvizes kontrollokat kell képezni mind negatív kontrollként, mind egy lemez belső kontrolljaként. Ha a lemez belső kontrolljában több mint egy elhullott embrió figyelhető meg, a lemezt ki kell venni a vizsgálatból, és így csökken az LC50 származtatásához használt koncentrációk száma. Ha egy teljes lemezt kivonnak, a megfigyelt hatások értékelése vagy észlelése nehézkesebbé válik, főleg akkor, ha a kivett lemez az oldószeres kontrollt tartalmazó lemez, vagy olyan lemez, amelyben kezelt embriók is érintettek. Az első esetben a vizsgálatot meg kell ismételni. A második esetben egy teljes kezelt csoportnak a belső kontroll mortalitása miatti kiesése korlátozhatja a hatások értékelését és az LC50 értékek meghatározását.
23. A vizsgálatra használt valamennyi peteadagon 3,4-diklór-anilin 4 mg/l rögzített koncentrációjával pozitív kontrollt kell beállítani.
24. Amennyiben oldószert használnak, egy további, 20 embrióból álló csoportot tesznek ki az oldatnak egy különálló 24 lyukú lemezen, amely így az oldószeres kontroll lesz. A vizsgálat akkor ítélhető elfogadhatónak, ha az oldószer bizonyítottan nem gyakorol jelentős hatást a kikeléshez szükséges időre és a túlélésre, illetve nem idéz elő semmilyen más káros hatást az embrióra nézve (vö. 8c. pont).
Az expozíció kezdete és a vizsgálat időtartama
25. A vizsgálat a peték megtermékenyítését követően a lehető leghamarabb elkezdődik, és 96 órás expozíciót követően ér véget. Az embriókat a csírakorong osztódása előtt, de legkésőbb a 16 sejtes stádium előtt a vizsgálati oldatokba kell helyezni. Annak érdekében, hogy az expozíció minimális késedelemmel kezdődjön, a megtermékenyítést követően legfeljebb 90 perccel a kezelt csoportonként szükséges számú pete legalább kétszeresét kell véletlenszerűen kiválasztani és a megfelelő koncentrációjú oldatokba, illetve kontrollokba helyezni (pl. 100 ml-es kristályosító csészébe; a petéket az oldatnak teljesen el kell lepnie).
26. Az életképes megtermékenyített petéket el kell különíteni a meg nem termékenyült petéktől, és azokat 24 órás előzetes kondicionálásnak alávetett 24 lyukú lemezekre kell áthelyezni, továbbá tartályonként 2 ml frissen elkészített vizsgálati oldattal kell feltölteni a megtermékenyítést követő 180 percen belül. Sztereomikroszkóp segítségével (ami lehetőség szerint ≥30-szoros nagyítást biztosít) kiválasztásra kerülnek az osztódó és az osztódás során nyilvánvaló rendellenességet (pl. aszimmetria, hólyagképződés) vagy a chorion sérülését nem mutató megtermékenyített peték. A peték begyűjtése és elkülönítése tekintetében lásd a 3. függelék 1. és 3. ábráját, illetve a 4. függelék 2. ábráját.
A peték elosztása a 24 lyukú lemezek között
27. A petéket a lyukas lemezek között a következő számban kell elosztani (lásd még a 4. függelék 1. ábráját).
— 20 pete egy lemezen valamennyi vizsgálati koncentráció esetében;
— 20 pete oldószeres kontrollként egy lemezen (ha szükséges);
— 20 pete pozitív kontrollként egy lemezen;
— 4 pete hígítóvizben, mint a lemez belső kontrollja a fenti lemezek mindegyikében;
— 24 pete hígítóvízben negatív kontrollként egy lemezen.
Megfigyelések
28. Az egyes vizsgált embriókon végzett apikális megfigyelések a következőkre terjednek ki: az embriók koagulációja, az őscsigolyák (szomiták) kialakulásának elmaradása; a farok leválásának elmaradása; a szívverés hiánya (1. táblázat). Ezeket a megfigyeléseket az elhullás meghatározására használják. E megfigyelések bármelyikének pozitív eredménye azt jelenti, hogy a zebradánió embriója elpusztult. Emellett rögzíteni kell a kikelést a kezelt és a kontrollcsoportban, naponta, a 48. órát követően. A megfigyeléseket a vizsgálat végéig 24 óránként rögzíteni kell.
1. táblázat
Az akut toxicitás apikális megfigyelései zebradániók embrióiban a megtermékenyítést követő 24–96 órában.
|
|
Expozíciós időtartam |
|||
|
|
24 óra |
48 óra |
72 óra |
96 óra |
|
Koagulált embriók |
+ |
+ |
+ |
+ |
|
Őscsigolya kialakulásának elmaradása |
+ |
+ |
+ |
+ |
|
A farok leválásának elmaradása |
+ |
+ |
+ |
+ |
|
Szívverés hiánya |
|
+ |
+ |
+ |
29. Az embrió koagulációja: A koagulált embriók tejfehérek, mikroszkóp alatt sötétnek tűnnek (lásd az 5. függelék 1. ábráját). A koagulált embriók számát 24, 48, 72 és 96 óra elteltével kell meghatározni.
30. Őscsigolya kialakulásának elmaradása: A rendesen fejlődő zebradánióembrióban 26 ± 1 °C-on mintegy 20 őscsigolya alakul ki 24 óra elteltével (lásd az 5. függelék 2. ábráját). A rendesen fejlődő embrió spontán mozgást mutat (kétoldali összehúzódások) A spontán mozgás az őscsigolyák kialakulását jelzi. Az őscsigolyák hiányát fel kell jegyezni 24, 48, 72 és 96 óra elteltével. Ha 24 óra elteltével nem alakulnak ki őscsigolyák, az esetleg a fejlődés általános késedelmének következménye. Legkésőbb 48 óra elteltével az őscsigolyáknak ki kell alakulniuk. Ennek elmaradása esetén az embrió elhullottnak tekinthető.
31. A farok leválásának elmaradása: A rendesen fejlődő zebradánióembrió esetében a farok szikzacskóról való leválása (lásd az 5. függelék 3. ábráját) az embriótest megnyúlását követően figyelhető meg. A farok leválásának elmaradását 24, 48, 72 és 96 óra elteltével kell rögzíteni.
32. Szívverés hiánya: A rendesen fejlődő zebradánióembrióban 26 ± 1 °C-on a szívverés 48 óra elteltével látható (lásd az 5. függelék 4. ábráját). Különös gondot kell fordítani e végpont rögzítésére, mivel a szabálytalan (akadozó) szívverést nem szabad elhullásként rögzíteni. Emellett az aorta abdominalisban való keringés nélküli látható szívverés szintén nem tekinthető elhullásnak. E végpont dokumentálásához a szívverést nem mutató embriókat minimum 80-szoros nagyítás alatt, legalább egy percig meg kell figyelni. A szívverés hiányát 48, 72 és 96 óra elteltével kell rögzíteni.
33. Valamennyi kezelt és kontrollcsoport esetén a kikelési arányokat 48 órát követően kell rögzíteni, és fel kell tüntetni a jelentésben. Jóllehet a kikelés nem az LC50 számításához használt végpont, a kikelés biztosítja az embrió expozícióját a chorion potenciális védőfunkciója nélkül, és ezáltal segíthet az adatok kiértékelésében.
34. A zebradánióembriók rendes (35) és rendellenes fejlődésére vonatkozó példákat a 3. és az 5. függelék mutatja be.
Analitikai mérések
35. A vizsgálat kezdetekor és a végén a kontroll(ok)ban és a vizsgálati vegyi anyag legmagasabb koncentrációjában mérni kell a pH-értéket, a teljes keménységet és a vezetőképességet. Félstatikus oldatcserés rendszerekben a pH-t a vízcsere előtt és után kell mérni. Az oldottoxigén-koncentrációt a vizsgálat végén kell mérni a negatív kontrollokban és az életképes embriót tartalmazó legmagasabb vizsgálati koncentrációban, ahol annak összhangban kell lennie a vizsgálat érvényességi kritériumaival (lásd a 8f. pontot). Ha aggályos, hogy a hőmérséklet eltérő a 24 lyukú lemezek között, a hőmérsékletet három véletlenszerűen kiválasztott edényben mérni kell. A hőmérsékletet lehetőség szerint folyamatosan rögzíteni kell a vizsgálat során, de legalább naponta.
36. Statikus rendszerben a vizsgálati vegyi anyag koncentrációját legalább a legmagasabb és legalacsonyabb vizsgálati koncentrációnál, de lehetőség szerint minden kezelt csoportban mérni kell a vizsgálat kezdetekor és végén. A félstatikus (oldatcserés) vizsgálatok esetében, ahol a vizsgálati vegyi anyag koncentrációja várhatóan a névleges értékek ± 20 %-os tartományán belül marad, minimális intézkedésként javasolt a legmagasabb és a legalacsonyabb vizsgálati koncentrációk elemzése a frissen elkészített közegben és közvetlenül az oldatcserét megelőzően. Amennyiben a vizsgálati vegyi anyag koncentrációértékei várhatóan nem maradnak a névleges értékek ± 20 %-os tartományán belül, az összes kísérleti koncentrációt a frissen elkészített közegben és közvetlenül az oldatcserét megelőzően elemezni kell. Ha az analízishez nem elegendő a térfogat, hasznos lehet a vizsgálati oldatok egyesítése vagy ugyanolyan anyagból készült és a 24 lyukú lemezekhez hasonló térfogat/felület aránnyal rendelkező pótkamrák használata. Határozottan javasolt, hogy az eredmények a mért koncentrációkon alapuljanak. Ha a koncentrációk nem maradnak a névleges koncentráció 80–120 %-os tartományán belül, a hatásos koncentrációkat a mért koncentrációk mértani közepéhez viszonyítva kell kifejezni; a részletek tekintetében lásd az OECD nehezen vizsgálható anyagok és keverékek akut toxicitási vizsgálatáról szóló iránymutatásának 5. fejezetét (28)
HATÁRÉRTÉK-VIZSGÁLAT
37. Az e vizsgálati módszerben leírt eljárások segítségével a vizsgálati vegyi anyaggal 100 mg/l mértéken vagy a vizsgálati közegben való oldhatósági határig (amelyik alacsonyabb) határérték-vizsgálat hajtható végre annak bizonyítására, hogy az LC50 nagyobb, mint e koncentráció. A határérték-vizsgálatot a kezelt csoportban, a pozitív kontrollban és szükség esetén az oldószeres kontrollban 20 embrióval, a negatív kontrollban pedig 24 embrióval kell végrehajtani. Ha az elhullás százalékos aránya a vizsgált koncentráció mellett 10 %-kal meghaladja a negatív kontrollban (vagy oldószeres kontrollban) tapasztalható mortalitást, teljes vizsgálatot kell végezni. Minden megfigyelt hatást rögzíteni kell. Ha a mortalitás 10 %-nál nagyobb mértékű a negatív kontrollban (vagy az oldószeres kontrollban), a vizsgálat érvénytelen, és azt meg kell ismételni.
ADATOK ÉS JEGYZŐKÖNYVEZÉS
Eredmények feldolgozása
38. Ebben a vizsgálatban az egyedi lyukakat független párhuzamosoknak kell tekinteni a statisztikai analízis szempontjából. A vizsgálati koncentrációk függvényében kell ábrázolni azon embriók százalékos arányát, amelyek esetében legalább egy apikális megfigyelés 48 órát és/vagy 96 órát követően pozitív. A görbe meredekségének, az LC50 értékeknek és a konfidenciahatároknak (95 %) a számításához megfelelő statisztikai módszereket kell alkalmazni (38), és az OECD „Aktuális megközelítések az ökotoxicitási adatok statisztikai elemzésében: alkalmazási útmutató” című dokumentumaát (39) kell tanulmányozni.
Vizsgálati jegyzőkönyv
39. A vizsgálati jegyzőkönyvnek a következőket kell tartalmaznia:
Vizsgálati vegyi anyag:
Egy összetevőből álló anyag:
— fizikai megjelenés, vízoldékonyság és a további releváns fizikai-kémiai tulajdonságok;
— kémiai azonosító adatok, például IUPAC- vagy CAS-név, CAS-szám, SMILES- vagy InChI-kód, szerkezeti képlet, tisztaság, adott esetben és amennyiben a gyakorlatban megvalósítható, a szennyeződések kémiai azonossága stb. (ideértve adott esetben a szervesszén-tartalmat).
Több összetevőből álló anyag, UVCB-k és keverékek:
— amennyiben lehetséges, az összetevők kémiai azonossága (lásd fent), mennyiségi előfordulása és releváns fizikai-kémiai tulajdonságai jellemzik.
Vizsgálati szervezetek:
— tudományos név, törzs, forrás és a megtermékenyített peték begyűjtésének módja, valamint a későbbi kezelés.
Vizsgálati körülmények:
— alkalmazott vizsgálati eljárás (pl. félstatikus oldatcserés);
— megvilágítási időszak;
— vizsgálati terv (pl. a vizsgálati kamrák száma, a kontrollok típusa);
— vízminőségi jellemzők a halak tartására szolgáló edényekben (pl. pH-érték, keménység, hőmérséklet, vezetőképesség és oldott oxigén);
— a vizsgálati oldatok oldottoxigén-koncentrációja, pH-értéke, teljes keménysége, hőmérséklete és vezetőképessége a vizsgálat kezdetén és 96 óra elteltével;
— a törzsoldatok és vizsgálati oldatok előállításának módszere és az oldatcsere gyakorisága;
— az oldószer alkalmazásának indoklása, továbbá kiválasztásának indoklása, ha nem víz;
— a névleges vizsgálati koncentrációk és a vizsgálati edényekben lévő vizsgálati vegyi anyag koncentrációinak meghatározására végzett valamennyi analízis eredménye; a módszer visszanyerési hatékonyságáról és a meghatározási határról (LoQ) is beszámolva;
— annak igazolása, hogy a kontrollok teljesítették a vizsgálat általános túlélésre vonatkozó érvényességi kritériumait;
— a peték megtermékenyítésének aránya;
— kikelési arány a kezelt és a kontrollcsoportban.
Eredmények:
— az a legmagasabb koncentráció, amely még nem okoz pusztulást a vizsgálat során;
— az a legalacsonyabb koncentráció, amely 100 %-os pusztulást okoz a vizsgálat során;
— az egyes koncentrációk által előidézett összes elhullás a javasolt megfigyelési időpontokban;
— az LC50 értékek 96 óránál (és opcionálisan 48 óránál) a mortalitás tekintetében, 95 %-os konfidenciahatár mellett, ha lehetséges;
— a koncentráció/mortalitás görbe grafikus ábrázolása a vizsgálat végén;
— mortalitás a kontrollokban (negatív kontrollok, lemezek belső kontrolljai, továbbá pozitív kontroll és bármely alkalmazott oldószeres kontroll);
— a négy apikális megfigyelés mindegyikének eredményével kapcsolatos adatok;
— a morfológiai és fiziológiai rendellenességek váratlan előfordulása és leírása, ha vannak ilyenek (lásd az 5. függelék 2. ábrájánál megadott példákat);
— a vizsgálat során bekövetkezett váratlan események, amelyek befolyásolhatták az eredményeket;
— statisztikai analízis és adatkezelés (probit analízis, logisztikai regressziós modell, és az LC50 mértani átlaga);
— a (transzformált) koncentráció-válasz görbe meredeksége és regressziójának konfidenciahatárai.
Az alkalmazott vizsgálati módszerektől való bármely eltérés és a megfelelő indokolások.
Eredmények kifejtése és kiértékelése.
SZAKIRODALOM
(1) OECD (2011) Validation Report (Phase 1) for the Zebrafish Embryo Toxicity Test: Part I and Part II. Series on Testing and Assessment No. 157, OECD, Paris.
(2) OECD (2012) Validation Report (Phase 2) for the Zebrafish Embryo Toxicity Test: Part I and Part II (Annexes). Series on Testing and Assessment No. 179, OECD, Paris.
(3) Braunbeck, T., Böttcher, M., Hollert, H., Kosmehl, T., Lammer, E., Leist, E., Rudolf, M. and Seitz, N. (2005) Towards an alternative for the acute fish LC50 test in chemical assessment: The fish embryo toxicity test goes multi-species-an update. ALTEX 22: 87-102.
(4) ISO (2007) International Standard Water quality – Determination of the acute toxicity of waste water to zebrafish eggs (Danio rerio). ISO 15088:2007(E) International Organization for Standardization.
(5) Nagel, R. (2002) DarT: The embryo test with the zebrafish (Danio rerio) – a general model in ecotoxicology and toxicology. ALTEX 19: 38-48.
(6) Schulte, C. and Nagel, R. (1994) Testing acute toxicity in embryo of zebrafish, Brachydanio rerio as alternative to the acute fish test – preliminary results. ATLA 22, 12-19.
(7) Bachmann, J. (2002) Development and validation of a teratogenicity screening test with embryos of the zebrafish (Danio rerio). PhD-thesis, Technical University of Dresden, Germany.
(8) Lange, M., Gebauer, W., Markl, J. and Nagel, R. (1995) Comparison of testing acute toxicity on embryo of zebrafish (Brachydanio rerio), and RTG-2 cytotoxicity as possible alternatives to the acute fish test. Chemosphere 30/11: 2087-2102.
(9) Knöbel, M., Busser, F.J.M., Rico-Rico, A., Kramer, N.I., Hermens, J.L.M., Hafner, C., Tanneberger, K., Schirmer, K., Scholz, S. (2012). Predicting adult fish acute lethality with the zebrafish embryo: relevance of test duration, endpoints, compound properties, and exposure concentration analysis. Environ. Sci. Technol. 46, 9690-9700.
(10) Kammann, U., Vobach, M. and Wosniok, W. (2006) Toxic effects of brominated indoles and phenols on zebrafish embryos. Arch. Environ. Contam. Toxicol., 51: 97-102.
(11) Groth, G., Kronauer, K. and Freundt, K.J. (1994) Effects of N,N-diemethylformamide and its degradation products in zebrafish embryos. Toxicol. In Vitro 8: 401-406.
(12) Groth, G., Schreeb, K., Herdt, V. and Freundt, K.J. (1993) Toxicity studies in fertilized zebrafish fish eggs treated with N-methylamine, N,N-dimethylamine, 2-aminoethanol, isopropylamine, aniline, N-methylaniline, N,N-dimethylaniline, quinone, chloroacetaldehyde, or cyclohexanol. Bull. Environ. Contam. Toxicol. 50: 878-882.
(13) Nguyen, L.T. and Janssen, C.R. (2001) Comparative sensitivity of embryo-larval toxicity assays with African catfish (Clarias gariepinus) and zebra fish (Danio rerio). Environ. Toxicol. 16: 566-571.
(14) Cheng, S.H., Wai, A.W.K., So, C.H. and Wu, R.S.S. (2000) Cellular and molecular basis of cadmium-induced deformities in zebrafish embryos. Environ. Toxicol. Chem. 19: 3024-3031.
(15) Belanger, S. E., Rawlings J. M. and Carr G. J. (2013). Use of Fish Embryo Toxicity Tests for the Prediction of Acute Fish Toxicity to Chemicals. Environmental Toxicology and Chemistry 32: 1768-1783.
(16) Lammer, E., Carr, G. J., Wendler, K., Rawlings, J. M., Belanger, S. E., Braunbeck, T. (2009) Is the fish embryo toxicity test (FET) with the zebrafish (Danio rerio) a potential alternative for the fish acute toxicity test? Comp. Biochem. Physiol. C Toxicol. Pharmacol.: 149 (2), 196-209
(17) Chapter C.4 of this Annex: Ready Biodegradability.
(18) Chapter C.29 of this Annex: Ready Biodegradability, CO2 in sealed vessels.
(19) Weigt, S., Huebler, N., Strecker, R., Braunbeck, T., Broschard, T.H. (2011) Zebrafish (Danio rerio) embryos as a model for testing proteratogens. Toxicology 281: 25-36.
(20) Weigt, S., Huebler, N., Strecker, R., Braunbeck, T., Broschard, T.H. (2012) Developmental effects of coumarin and the anticoagulant coumarin derivative warfarin on zebrafish (Danio rerio) embryos. Reprod. Toxicol. 33: 133-141.
(21) Incardona, J.P, Linbo, T.L., Scholz, N.L. (2011) Cardiac toxicity of 5-ring polycyclic aromatic hydrocarbons is differentially dependent on the aryl hydrocarbon receptor 2 isoform during zebrafish development. Toxicol. Appl. Pharmacol. 257: 242-249.
(22) Kubota, A., Stegeman, J.J., Woodin, B.R., Iwanaga, T., Harano, R., Peterson, R.E., Hiraga, T., Teraoka, H. (2011) Role of zebrafish cytochrome P450 CYP1C genes in the reduced mesencephalic vein blood flow caused by activation of AHR2. Toxicol. Appl. Pharmacol. 253: 244-252.
(23) E melléklet C.48. fejezete: Halak rövid távú reprodukciós vizsgálata. Lásd a 4a. függeléket.
(24) Lammer, E., Kamp, H.G., Hisgen, V., Koch, M., Reinhard, D., Salinas, E.R., Wendlar, K., Zok, S., Braunbeck, T. (2009) Development of a flow-through system for the fish embryo toxicity test (FET) with zebrafish (Danio rerio). Toxicol. in vitro 23: 1436-1442.
(25) Brown, R.S., Akhtar, P., Åkerman, J., Hampel, L., Kozin, I.S., Villerius, L.A., Klamer, H.J.C., (2001) Partition controlled delivery of hydrophobic substances in toxicity tests using poly(dimethylsiloxane) (PDMS) films. Environ. Sci. Technol. 35, 4097–4102.
(26) Schreiber, R., Altenburger, R., Paschke, A., Küster, E. (2008) How to deal with lipophilic and volatile organic substances in microtiter plate assays. Environ. Toxicol. Chem. 27, 1676-1682.
(27) ISO (1996) International Standards. Water quality – Determination of the acute lethal toxicity of substances to a freshwater fish [Brachydanio rerio Hamilton-Buchanan (Teleostei, Cyprinidae)]. ISO 7346-3: Flow-through method. Elérhető az alábbi címen: [http://www.iso.org].
(28) OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Series on Testing and Assessment No. 23, OECD, Paris.
(29) Laale, H.W. (1977) The biology and use of zebrafish, Brachydanio rerio, in fisheries research. A literature review. J. Fish Biol. 10: 121-173.
(30) Westerfield, M. (2007) The zebrafish book: A guide for the laboratory use of zebrafish (Brachydanio rerio). 5th edition. Eugene, University of Oregon Press, Institute of Neuroscience, USA.
(31) Canadian Council on Animal Care (2005) Guidelines on: the Care and Use of Fish in Research, Teaching and Testing, ISBN: 0-919087-43-4 http://www.ccac.ca/Documents/Standards/Guidelines/Fish.pdf
(32) Európai Bizottság (2007): A Bizottság 2007. június 18-i 2007/526/EK ajánlása a kísérleti és egyéb tudományos célokra használt állatok elhelyezésére és gondozására vonatkozó iránymutatásról (az értesítés a C(2007) 2525. számú dokumentummal történt) [http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2007:197:0001:0089:HU:PDF]
(33) Európai Unió (2010): Az Európai Parlament és a Tanács 2010. szeptember 22-i 2010/63/EU irányelve a tudományos célokra felhasznált állatok védelméről. (HL L 276., 2010.10.20., 33. o.)
http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2010:276:0033:0079:HU:PDF
(34) Nagel, R. (1986) Untersuchungen zur Eiproduktion beim Zebrabärbling (Brachydanio rerio, Ham.-Buch.). J. Appl. Ichthyol. 2: 173-181.
(35) Kimmel, C.B., Ballard, W.W., Kimmel, S.R., Ullmann, B. and Schilling, T.F. (1995) Stages of embryonic development of the zebrafish. Dev. Dyn. 203: 253-310.
(36) Chapter C.2 of this Annex: Daphnia sp., Acute Immobilistaion Test.
(37) Weil, M., Scholz, S., Zimmer, M., Sacher, F., Duis, K. (2009) Gene expression analysis in zebrafish embryos: a potential approach to predict effect conentrations in the fish early life stage test. Environ. Toxicol. Chem. 28: 1970-1978
(38) ISO (2006) International Standard. Water quality – Guidance on statistical interpretation of ecotoxicity data ISO TS 20281. Elérhető az alábbi címen: [http://www.iso.org].
(39) OECD (2006) Guidance Document on Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application. Series on Testing and Assessment No. 54. OECD, Paris.
(40) Braunbeck, T., Lammer, E., 2006. Detailed review paper “Fish embryo toxicity assays”. UBA report under contract no. 20385422 German Federal Environment Agency, Berlin. 298 pp.
1. függelék
FOGALOMMEGHATÁROZÁSOK
Apikális végpont : populációszintű hatás előidézése.
Blastula : az animalis pólus körüli sejtképződés, amely a szik egy részét is lefedi.
Vegyi anyag : anyag vagy keverék.
Epibólia : elsődlegesen epidermalis sejtek erőteljes elterjedése az embrió gastrula állapotában, és a háti szakaszról a hasi szakaszra vándorlása, amelynek eredményeként az entrodermális sejtrétegek betüremkedéshez hasonló folyamattal internalizálódnak és az embrió körülöleli a szikanyagot.
Átfolyásos vizsgálat : az expozíció során a vizsgálati oldat vizsgálati rendszeren történő folyamatos áramlása mellett folytatott vizsgálat.
Lemez belső kontrollja : olyan belső kontroll, amelyben a 24 lyukú lemezen 4 lyukat hígítóvízzel töltenek meg, hogy azonosítsák a lemezek gyártó általi vagy az eljárás során a kutató általi lehetséges szennyezését, illetve a lemezből eredő azon hatásokat, amelyek esetleg befolyásolhatják a vizsgálat eredményét (pl. hőmérséklet gradiens).
IUPAC : International Union of Pure and Applied Chemistry (Elméleti és Alkalmazott Kémia Nemzetközi Uniója).
A halak tartására szolgáló víz : az a víz, amelyben a felnőtt halakat tartják.
Medián letális koncentráció (LC50) : a vizsgálati vegyi anyag azon koncentrációja, amely a becslések szerint a vizsgálat időtartama alatt a vizsgálati szervezetek 50 %-ára nézve halálos.
Félstatikus oldatcserés vizsgálat : olyan vizsgálat, amelynél rendszeresen, meghatározott időszakonként (pl. 24 óránként) ki kell cserélni a vizsgálati oldatokat.
SMILES : Simplified Molecular Input Line Entry Specification (molekulák egyszerűsített egy sorban történő beviteli rendszere).
Szomita : a gerinces embriók fejlődése során az őscsigolyák (szomiták) a mezoderma oldalirányú, a velőcső körüli rendeződései, amelyekből adott estben kifejlődik a kötőszövet (dermatoma), a vázizomzat (miotoma) és a csigolyák (szklerotoma).
Statikus vizsgálat : olyan vizsgálat, amelyben az oldatok mindvégig változatlanok maradnak a vizsgálat során.
Vizsgálati vegyi anyag : bármely, e vizsgálati módszer alkalmazásával vizsgált anyag vagy keverék.
UVCB-k : ismeretlen szerkezetű vagy változó összetételű, összetett reakciótermékek vagy biológiai anyagok.
2. függelék
A ZEBRADÁNIÓEMBRIÓVAL FOLYTATOTT AKUT TOXICITÁSI VIZSGÁLATOKRA VONATKOZÓ TARTÁSI, TENYÉSZTÉSI ÉS TIPIKUS KÖRÜLMÉNYEK
|
Zebradánió (Danio rerio) |
||
|
Az állatfaj eredete |
India, Burma, Malakka, Szumátra |
|
|
Ivari kétalakúság |
Nőstények: kitüremkedő has, ha abban ikrák vannak Hímek: vékonyabbak, a kék hosszanti csíkok között narancsszínű árnyalattal (különösen az anális úszónál szembetűnő) |
|
|
Etetési rend |
Száraz, pelyhesített haleledel (a hal tömegének legfeljebb 3 %-a/nap mennyiségben), napi 3–5 alkalommal; emellett megfelelő méretű és nem szennyezett forrásból származó nauplius sórák (Artemia sp. nauplii) és/vagy kis vízibolha. Az élő táplálék a környezetgazdagítás forrása, ezért lehetőség szerint élő tápot kell adni. Az optimális vízminőség garantálása érdekében a táplálékfelesleget és az ürüléket az etetést követő körülbelül egy órával el kell távolítani. |
|
|
A felnőtt halak közelítő tömege |
Nőstények: 0,65 ±0,13 g Hímek: 0,5 ±0,1 g |
|
|
Az ikrás nőstények tartása |
Megvilágítás |
(Széles spektrumú) fluoreszkáló izzók 10–20 μE/m2/s, 540–1 080 lux, vagy 50–100 ft-c (környezeti laboratóriumi szintek); 12–16 óra megvilágítási időszak |
|
Vízhőmérséklet |
26 ± 1 °C |
|
|
Vízminőség |
O2 ≥80 % telítettség, keménység: pl. ~30–300 mg/l CaCO3, NO3 -: ≤48 mg/l, NH4 + és NO2 -: <0,001 mg/l, maradék klór <10 μg/l, összes szerves klór <25 ng/l, pH = 6,5–8,5 |
|
|
A vízminőségre vonatkozó további követelmények |
Szemcsés anyag <20 mg/l, teljes szervesszén-tartalom <2 mg/l, összes szervesfoszfor-tartalmú növényvédő szer <50 ng/l, összes szervesklór-tartalmú növényvédő szer plusz poliklórozott bifenilek <50 ng/l |
|
|
A tartásra szolgáló tartály mérete |
pl. 180 l, 1 hal/l |
|
|
Víztisztítás |
Állandó (szénszűrős); egyéb lehetőségek többek között a félstatikus, vízcserén alapuló tartással vagy a folyamatos vízcserét biztosító átfolyásos rendszerrel való kombináció |
|
|
Ajánlott hím/nőstény arány a tenyésztés szempontjából |
2:1 (vagy tömeges ívás) |
|
|
Ívótartályok |
pl. 4 l-es tartály acélrács fenékkel és az ívás ösztönzésére műnövénnyel; külső melegítő szőnyegek, vagy tömeges ívás a tartásra szolgáló tartályban |
|
|
A peték felépítése és megjelenése |
Stabil chorion (azaz nagymértékben átlátszó, nem ragadós, ~ 0,8–1,5 mm átmérőjű) |
|
|
Ívási arány |
Egy ivarérett nőstény naponta legalább 50–80 petét rak le. A törzstől függően az ívási arány jóval magasabb lehet. A megtermékenyítési aránynak ≥70 %-nak kell lennie. Az először ívó halak esetében a peték megtermékenyítési aránya az első néhány íváskor alacsonyabb lehet. |
|
|
A vizsgálat típusa |
Statikus, félstatikus oldatcserés vagy átfolyásos, 26 ± 1 °C, 24 órán át kondicionált vizsgálati kamrák (pl. 24 lyukú lemezek, 2,5–5 ml üregenként) |
|
3. függelék
A ZEBRADÁNIÓK RENDES FEJLŐDÉSE 26 °C-ON
1. ábra: A zebradánió (Danio rerio) korai fejlődésének kiválasztott szakaszai: A megtermékenyítést követő 0,2 – 1,75 óra (forrás: Kimmel et al., 1995 (35)). A szokásos fejlődés időrendjét lehet alapul venni a megtermékenyülés és a peték életképességének megállapításához (lásd a 26. pontot: A megtermékenyített peték kiválasztása).

2. ábra: A zebradánió (Danio rerio) késői fejlődésének kiválasztott szakaszai (chorion nélküli embriók a láthatóság optimalizálása érdekében): A megtermékenyítést követő 22 – 48 óra (forrás: Kimmel et al., 1995 (35)).
3. ábra: A zebradánió (Danio rerio) embrióinak rendes fejlődése: (1) 0,75 óra, kétsejtes szakasz; (2) 1 óra, négysejtes szakasz; (3) 1,2 óra, nyolcsejtes szakasz (4) 1,5 óra, 16 sejtes szakasz; (5) 4,7 óra, az epibólia kezdete; (6) 5,3 óra, megközelítőleg 50 %-os epibólia (forrás: Braunbeck & Lammer 2006 (40)).
4. függelék
1. ábra
A 24 lyukú lemez kialakítása

|
1–5 |
= |
öt vizsgálati koncentráció / vegyi anyag; |
|
nC |
= |
negatív kontroll (hígítóvíz); |
|
iC |
= |
lemez belső kontrollja (hígítóvíz); |
|
pC |
= |
pozitív kontroll (3,4-DCA 4mg/l); |
|
sC |
= |
oldószeres kontroll |
2. ábra
A zebradánióembrióval folytatott akut toxicitási vizsgálat folyamatábrája (balról jobbra): peték termelődése, a peték begyűjtése, előzetes expozíció a megtermékenyítés után azonnal, üvegedényekben; a megtermékenyített peték kiválasztása inverz mikroszkóppal vagy binokuláris mikroszkóppal, továbbá a megtermékenyített peték megfelelő vizsgálati koncentrációkat/kontrolloldatokat tartalmazó 24 lyukú lemezekbe történő kiosztása, n=a vizsgálati koncentrációnként/kontrollonként szükséges peték száma (itt 20), hpf = a megtermékenyítést követően eltelt órák.

5. függelék
A ZEBRADÁNIÓEMBRIÓVAL FOLYTATOTT AKUT TOXICITÁSI VIZSGÁLAT LETÁLIS VÉGPONTJAINAK ATLASZA
A következő apikus végpontok akut toxicitásra, és ennélfogva az embriók elhullására utalnak: az embrió koagulációja, a farok elválásának elmaradása, az őscsigolyák képződésének elmaradása és a szívverés hiánya. E végpontok illusztrálására az alábbi mikrofelvételek szolgálnak:
1. ábra
Az embrió koagulációja

Erős fényű helyszíni megvilágítás mellett a koagulált zebradánióembriók változatos átlátszatlan zárványokat mutatnak.
2. ábra
Őscsigolya kialakulásának elmaradása

Jóllehet a fejlődése megközelítőleg 10 órával elmaradott, a 24 órás zebradánióembrió az a) ábrán jól kifejlett szomitákat mutat (→), míg a b) ábrán látható embriónál nem tapasztalhatók szomitaképződésre utaló jelek (→). Jóllehet a szikzacskó kifejezetten ödémás (*), a 48 órás zebradánióembrió a c) ábrán jól kifejlett szomitákat mutat (→), míg a d) ábrán látható 96 órás embriónál nem tapasztalhatók szomitaképződésre utaló jelek (→). Meg kell jegyezni, hogy a d) ábrán szereplő embrió esetében gerincferdülés (scoliosis) és perikardiális ödéma (*) látható.
3. ábra
A farokbimbó elválásának elmaradása oldalnézetből

(a: →; 96 órás zebradánióembrió). Megfigyelhető a szemhólyagok hiánya is (*).
4. ábra
A szívverés hiányát
A szívverés hiányát – jellegéből adódóan – nehéz mikrofelvételen megjeleníteni. A szívverés hiányát a szív összehúzódásának elmaradása jelöli (kettős nyíl). A vérsejtek mozdulatlansága pl. az aorta abdominalisban (→ a kis képen) nem a szívverés hiányára utal. Megjegyzendő a szomitaképződés hiánya is ennél az embriónál (*az izomszövetek homogén és nem szegmentált megjelenése). A szívverés hiányának megfigyelésére irányadó idő legalább egy perc, minimum 80-szoros nagyítás mellett.
C.50. Myriophyllum spicatummal végzett üledékmentes toxicitási vizsgálat
BEVEZETÉS
1. Ez a vizsgálati módszer egyenértékű az OECD 238. vizsgálati iránymutatásában (2014) leírt módszerrel. Célja a vegyi anyagok egy víz alatti kétszikű növénnyel, a süllőhínárok családjába tartozó Myriophyllum spicatummal szembeni toxicitásának értékelése. A módszer alapját az ASTM egy meglévő vizsgálati módszere (1) képezi, amelyet egy üledékmentes vizsgálati rendszerré módosítottak (2), hogy meg lehessen becsülni a vizsgálati vegyi anyagok saját ökotoxicitását (függetlenül a vizsgálati vegyi anyag azon viselkedésétől, hogy hogyan oszlik el a víz és az üledék között). Az üledékmentes vizsgálati rendszer analitikai szempontból kevéssé bonyolult (csak a vizes fázisban), az eredmények pedig párhuzamosan vizsgálhatók és/vagy összevethetők a Lemna sp. vizsgálat (3) során kapott eredményekkel; emellett az előírt steril feltételek lehetővé teszik a mikroorganizmusok és algák hatásának (a vegyi anyag felvétele/bomlása stb.) lehető legkisebbre csökkentését. E vizsgálat nem helyettesíti a többi vízi toxicitási vizsgálatot, hanem inkább azok kiegészítőjeként szolgál, lehetővé téve, hogy teljesebb képet kaphassunk a vízinövényeket érő veszélyek és kockázatok értékeléséről. A vizsgálati módszer validálása laboratóriumok közötti összehasonlítással (4) történt.
2. Az alábbiak részletesen ismertetik a vizsgálati oldat cseréjével végzett (félstatikus) és a vizsgálati oldat cseréje nélkül végzett (statikus) vizsgálatokat. A vizsgálat céljától és a szabályozási követelményektől függően a félstatikus módszer alkalmazása ajánlott, például az oldatból gyorsan eltávozó (illékony, adszorbeáló, fény hatására lebomló, hidrolizáló, kicsapódó vagy biológiailag lebomló) anyagok esetén. További iránymutatást az (5) irodalom tartalmaz. E vizsgálati módszer azokra az anyagokra vonatkozik, amelyek tekintetében a módszert validálták (lásd a laboratóriumok közötti összehasonlítás vizsgálati jelentését (4)), illetve készítményekre vagy ismert keverékekre; amennyiben keveréket vizsgálnak, annak összetevőit lehetőség szerint azonosítani és számszerűsíteni kell. A Myriophyllum spicatummal végzett üledékmentes vizsgálati módszer kiegészíti a Myriophyllum spicatummal végzett víz–üledék rendszerű toxicitási vizsgálatot (6). A vizsgálati módszernek adott keverék szabályozási célú vizsgálatra történő használata előtt mérlegelni kell, hogy e módszer megfelelő eredményeket adhat-e e cél szempontjából, és ha igen, miért. Ilyen megfontolások nem szükségesek, ha létezik a keverék vizsgálatára vonatkozó szabályozási követelmény.
A VIZSGÁLAT ELVE
3. Folyamatosan növekedő, a Myriophyllum spicatum nemzetséghez tartozó növénytenyészeteket (kizárólag módosított Andrews-féle közegben, lásd a 2. függeléket) monokultúraként 14 napig növekedni kell hagyni a vizsgálati vegyi anyag különböző koncentrációinak jelenlétében, üledékmentes vizsgálati rendszerben. A vizsgálat célja a vizsgálat időtartama alatt a vegyi anyag vegetatív növekedésre gyakorolt hatásainak számszerű kifejezése választott mérési változók értékelése alapján. E mérési változók a hajtáshossz, az oldalágak és a gyökerek növekedése, továbbá a nedves és száraz tömeg alakulása és az örvök gyarapodása. Emellett figyelembe kell venni a vizsgálati szervezetben bekövetkező jellegzetes minőségi változásokat, például a torzulásokat vagy a klorózist és nekrózist, amelyekre a sárgulás, illetve a fehér és barna elszíneződés utal. A vegyi anyag hatásainak számszerű kifejezése érdekében a vizsgálati oldatban bekövetkező növekedést össze kell vetni a kontrolltenyészetben bekövetkező növekedéssel, és meg kell határozni azt az ECx-szel kifejezett koncentrációt, amely egy adott x %-os növekedésgátlást idéz elő (az x a szabályozási követelmények függvényében bármilyen érték lehet, pl. EC10, EC20, EC50). Meg kell jegyezni, hogy az EC10 és EC20 értékek becslése csak olyan vizsgálatokban megbízható és megfelelő, ahol a variációs koefficiens a kontrollnövényekben elmarad a becsült hatásszinttől, azaz a variációs koefficiens <20 % kell legyen az EC20 durva becslése esetén.
4. A kezelt és nem kezelt növények átlagos fajlagos növekedési sebességét (a fő hajtás hosszára és három további mérési változóra vonatkozó értékelésekből származó becslés alapján) és a hozamát (amelyet a fő hajtás hosszának és három további mérési változónak a növekedéséből kell becsülni) egyaránt meg kell határozni. A fajlagos növekedési sebességet (r) és a hozamot (y) ezt követően felhasználják az ErCx (pl. ErC10, ErC20, ErC50), illetve az EyCx (pl. EyC10, EyC20, EyC50) meghatározására.
5. Statisztikai eljárással meghatározható továbbá a megfigyelhető hatást okozó legalacsonyabb koncentráció (LOEC) és a megfigyelhető hatást nem okozó koncentráció (NOEC) értéke is.
A VIZSGÁLATI VEGYI ANYAGRA VONATKOZÓ INFORMÁCIÓK
6. Rendelkezésre kell állnia olyan analitikai eljárásnak, amellyel a vizsgálati közegben lévő vizsgálati vegyi anyag mennyisége kellő pontossággal meghatározható. A vizsgálati körülmények meghatározása érdekében célszerű lehet tájékozódni többek között a vizsgálati vegyi anyag szerkezeti képletéről, tisztaságáról és a szennyezésekről, vízoldékonyságáról, vízben és fény hatására tanúsított stabilitásáról, sav disszociációs állandójáról (pKa) és oktanol-víz megoszlási együtthatójáról (KOW), gőznyomásáról és biológiai lebonthatóságáról. A vízoldékonyságból és a gőznyomásból meghatározható a Henry-állandó, amely megmutatja, mennyire valószínű, hogy a vizsgálat során a vizsgálati vegyi anyag jelentős mennyiségben eltávozik. Ennek alapján eldönthető, kell-e külön gondoskodni az így adódó veszteségek ellensúlyozásáról. Ha a vizsgálati vegyi anyag oldhatóságára és stabilitására vonatkozó információk bizonytalanok, célszerű ezeket a vizsgálat körülményei, azaz a vizsgálatban alkalmazandó tápoldat, hőmérséklet és fényviszonyok mellett meghatározni.
7. Különösen fontos a vizsgálati közeg pH-értékének szabályozása, például fémek vagy könnyen hidrolizálódó anyagok vizsgálata esetén. Az OECD iránymutatása (5) további útmutatást ad olyan vegyi anyagok vizsgálatához, amelyek fizikai-kémiai tulajdonságaiknál fogva nehezen vizsgálhatók.
A VIZSGÁLAT ÉRVÉNYESSÉGE
8. A vizsgálat érvényességéhez a fő hajtás hosszának megkétszereződéséhez szükséges idő a kontrollban kevesebb kell, hogy legyen 14 napnál. Az e vizsgálati módszerben ismertetett közegek és vizsgálati körülmények alkalmazása esetén ez a feltétel statikus vagy félstatikus vizsgálati rendszerrel kielégíthető.
9. A hozam variációs koefficiensének átlaga a hajtások nedves tömegének (a vizsgálat kezdete és vége közötti) mérése és további mérési változók alapján (lásd a 37. pontot) a kontrolltenyészetekben nem haladhatja meg a 35 %-ot a párhuzamosok között.
10. A kontrollcsoport párhuzamosainak több mint 50 %-át steril körülmények között kell tartani a 14 napos expozíciós időszakban, ami azt jelenti, hogy az oldat láthatóan mentes kell, hogy legyen más szervezetek, például algák, gombák és baktériumok okozta szennyeződésektől (tiszta oldat). Megjegyzés: A sterilitás méréséhez a laboratóriumok közötti összehasonlítás vizsgálati jelentése (4) nyújt útmutatást.
REFERENCIA-VEGYIANYAG
11. Referencia-vegyianyago(ka)t, például a laboratóriumok közötti összehasonlítás (4) során használt 3,5-diklórfenolt vizsgálni lehet a vizsgálati eljárás ellenőrzése érdekében; a laboratóriumok közötti összehasonlítás adatai alapján a 3,5-diklórfenol EC50 átlagértékei a különböző hatásváltozók tekintetében (lásd e vizsgálati módszer 37–41. pontját) 3,2 mg/l és 6,9 mg/l között vannak (lásd a laboratóriumok közötti összehasonlítás vizsgálati jelentését ezen értékek konfidencia-intervallumai tekintetében). Referencia-vegyianyaggal legalább évente kétszer (ha ennél ritkábban végeznek vizsgálatot, akkor a vizsgálati vegyi anyag toxicitásának meghatározásával párhuzamosan) ajánlott vizsgálatot végezni.
A MÓDSZER ISMERTETÉSE
Felszerelés
12. Minden, a vizsgálati közeggel érintkező eszköznek üvegből vagy más, kémiailag semleges anyagból kell lennie. A tenyésztés és a vizsgálat céljára felhasznált üvegeszközöknek sterilnek kell lenniük, és azokat meg kell tisztítani minden olyan kémiai szennyeződéstől, amely a vizsgálati közegbe bemosódhatna. A vizsgálati edényeknek kellően hosszúnak kell lenniük ahhoz, hogy a kontrolltenyészetekben a különböző hajtások a vizes fázisban a vizsgálat végéig növekedhessenek anélkül, hogy a vizsgálati közeg felszínét elérnék. Javasolt olyan tömör falú, boroszilikát üvegből készült, alumíniumkupakkal ellátott, perem nélküli kémcsöveket használni, amelyek átmérője megközelítőleg 20 mm, hossza körülbelül 250 mm.
13. Mivel a módosított Andrews-féle közeg szacharózt tartalmaz (amely kedvez a gombák és baktériumok növekedésének), a vizsgálati oldatokat steril körülmények között kell elkészíteni. Valamennyi folyadékot és berendezést a használat előtt sterilizálni kell. A sterilizációt 4 órás hőkezeléssel (210 °C) kell elvégezni, vagy autoklávval 121 °C-on 20 percig. Emellett minden lombikot, edényt, tálat stb. és egyéb eszközt lángkezelésnek kell alávetni közvetlenül a használat előtt steril munkaasztalon.
14. A tenyészeteket és a vizsgálati edényeket nem szabad együtt tartani. A legjobb megoldás a külön környezeti növesztőkamrák, inkubátorok vagy helyiségek igénybevétele. A fényviszonyok és a hőmérsékletek szabályozhatók legyenek, és állandó szinten kell azokat tartani.
Vizsgálati szervezet
15. Myriophyllum spicatum – a süllőhínárok családjába tartozó, víz alatti kétszikű növény. Június és augusztus között nem feltűnő, rózsaszín/fehér virágok törnek a vízfelszínre. A növények erős rizómarendszerrel a talajban gyökereznek, és a teljes északi féltekén megtalálhatók tápanyagban gazdag, ugyanakkor nem szennyezett és magas mésztartalmú állóvizekben, sáros táptalajban. A Myriophyllum spicatum az édesvizet kedveli, de brakkvízben is megél.
16. Az üledékmentes toxicitási vizsgálathoz steril növényekre van szükség. Ha a vizsgálatot végző laboratóriumban nem áll rendelkezésre rendszeresen Myriophyllum spicatum tenyészet, a steril növényanyagot be lehet szerezni más laboratóriumtól vagy a (nem steril) növény begyűjthető terepről, illetve beszerezhető kereskedelmi beszállítótól; ha a növények terepről származnak, elő kel irányozni a faj taxonómiai ellenőrzését. A terepről származó vagy kereskedelmi beszállító által átadott növényeket sterilizálni kell (1), és felhasználás előtt legalább nyolc hétig a vizsgálat során alkalmazandóval megegyező közegben kell tartani. A tenyészet kialakításához a növényanyagot nyilvánvaló szennyeződéstől mentes helyszínről kell begyűjteni. Nagyfokú gondossággal kell eljárni annak biztosítása érdekében, hogy a megfelelő fajt találják meg a Myriophyllum spicatum terepről való begyűjtésekor, különösen azokon a területeken, ahol az más Myriophyllum fajokkal hibridet alkothat. A más laboratóriumból származó növényanyagot legalább három hétig kell hasonló körülmények között tartani. A jelentésben mindig rögzíteni kell a növényanyag eredetét és a vizsgálathoz felhasznált fajt.
17. A vizsgálat során felhasznált növények minősége és egységessége jelentősen befolyásolja a vizsgálat eredményeit, ezért megválasztásuk során kellő gondossággal kell eljárni. Fiatal, gyorsan növekvő, látható sérüléstől és fakulástól (klorózistól) mentes egyedeket kell felhasználni. A vizsgálati szervezet előkészítését részletesen a 4. függelék ismerteti.
Tenyésztés
18. Az átoltás gyakoriságának csökkentése érdekében (például ha egy ideig előreláthatóan nem terveznek Myriophyllum-vizsgálatokat) a tenyészet csökkentett fényviszonyok mellett és hőmérsékleten (50 μE m–2 s–1, 20 ± 2 °C) tartható. A tenyésztés körülményeit részletesen a 3. függelék ismerteti.
19. A vizsgálatok előtt legalább 14–21 nappal elegendő mennyiségű vizsgálati szervezetet csíramentesen friss, steril közegbe kell áthelyezni, majd 14–21 napon át a vizsgálatnak megfelelő körülmények között tartani előkultúraként. Az előkultúra elkészítését részletesen a 4. függelék ismerteti.
Vizsgálati közeg
20. A Myriophyllum spicatum tekintetében egyetlen táptalaj javasolt a 2. függelékben leírt üledékmentes vizsgálati rendszerben. Ajánlott az Andrews-féle közeg módosítása a Myriophyllum spicatum tenyésztésére és vizsgálatára, amint azt az (1) irodalom ismerteti. A módosított Andrews-féle közeg beállítható 3 % szacharóz öt külön elkészített tápanyag-törzsoldathoz való hozzáadásával. A közeg elkészítését részletesen a 2. függelék ismerteti.
21. Tízszeres koncentrációjú módosított Andrews-féle közegre van szükség a vizsgálati oldatok (lehetőség szerint hígítással történő) elkészítéséhez. E közeg összetételét a 2. függelék ismerteti.
Vizsgálati oldatok
22. A vizsgálati oldatokat általában törzsoldat hígításával kell előállítani. A vizsgálati vegyi anyag törzsoldatait általában úgy kell készíteni, hogy a vegyi anyagot ásványmentesített (azaz desztillált vagy ioncserélt) vízben feloldják. A tápanyagok hozzáadása a tízszeres koncentrációjú, módosított Andrews-féle közeg felhasználásával történik.
23. A vegyi anyag törzsoldata sterilizálható autoklávban 121 °C-on 20 percig, vagy steril szűréssel, feltéve hogy a sterilizálásra szolgáló módszer nem semlegesíti a vegyi anyagot A vizsgálati oldatok elkészíthetők steril ásványmentesített vízben vagy közegben, steril körülmények között. A vizsgálati vegyi anyag törzsoldatainak sterilizálására szolgáló eljárás megválasztása során figyelembe kell venni a hőstabilitást és a különböző felületeken való adszorpciót. Ezért javasolt, hogy a törzsoldatokat steril körülmények között készítsék el, azaz a vizsgálati vegyi anyag steril körülmények közötti, steril vízben való oldásához szükséges steril eszközök felhasználásával (pl. lángsterilizálás, lamináris áramlású fülkék stb.). A steril törzsoldat elkészítésére szolgáló e technika mind az anyagok, mind a keverékek esetén érvényes.
24. A vizsgálati vegyi anyag legmagasabb vizsgált koncentrációja általában nem haladhatja meg a vegyi anyag vizsgálati körülmények között érvényes vízoldékonyságát. Vízben kis mértékben oldódó vizsgálati vegyi anyag esetén szükséges lehet szerves oldó- vagy diszpergálószer alkalmazásával nagy koncentrációjú törzsoldatot vagy -diszperziót készíteni annak érdekében, hogy könnyebb legyen a vizsgálati vegyi anyagból a pontos mennyiséget a vizsgálati közegbe adagolni, és könnyebben végbemenjen az oldódás vagy a diszperzió. Ilyen anyag alkalmazását lehetőség szerint kerülni kell. A segédoldószer vagy -diszpergálószer alkalmazása nem járhat fitotoxikus hatással. A széles körben alkalmazott oldószerek közül például az aceton vagy a dimetil-formamid 100 μl/l koncentrációig nem okoz fitotoxikus hatást. Az esetleg alkalmazott oldó- vagy diszpergálószer végső koncentrációja – amelyet a jelentésben rögzíteni kell – a lehető legalacsonyabb kell, hogy legyen (≤100 μl/l), és az oldó- vagy diszpergálószert a kezelt és a kontrolltenyészet esetében azonos koncentrációban kell alkalmazni. Az (5) irodalom bővebb iránymutatást ad a diszpergálószerekre vonatkozóan.
Vizsgálati csoportok és kontrollcsoportok
25. A vizsgálati vegyi anyag Myriophyllum spicatumra gyakorolt toxikus hatásának előzetes ismerete alapján, amely származhat dózisbehatároló vizsgálatból, megválaszthatók az alkalmas vizsgálati koncentrációk. A meghatározó toxicitási vizsgálatban szokásosan (az e melléklet C.26. fejezetében olvasható Lemna növekedésgátlási próbára jellemző) öt–hét vizsgálati koncentrációt kell mértani sorba rendezni; ezeket oly módon kell megválasztani, hogy az NOEC és EC50 értékek a koncentrációs tartományon belül legyenek (lásd alább). A koncentrációk közötti szorzótényező általában ne legyen 3,2-nél nagyobb, de lapos koncentráció–hatás görbe esetén ennél nagyobb érték lehet indokolt. Ötnél kevesebb vizsgálati koncentráció használatát indokolni kell. Minden koncentráció tekintetében legalább öt párhuzamost kell beállítani.
26. A vizsgálati koncentrációk tartományának kijelölése során (akár dózisbehatároló vizsgálatot, akár a meghatározó vizsgálatot megelőzően) a következőket célszerű megfontolni.
Az ECx meghatározásához a megfelelő konfidenciaszint biztosítása érdekében a vizsgálati koncentrációknak közre kell fogniuk az ECx értéket. Az EC50 érték becslésekor például a legmagasabb vizsgálati koncentrációnak nagyobbnak kell lennie az EC50 értéknél. Ha az EC50 érték kívül esik a vizsgálati koncentrációk tartományán, akkor a kiadódó konfidencia-intervallumok tágak lesznek, és előfordulhat, hogy nem végezhető el a modell statisztikai illeszkedésének megfelelő értékelése.
LOEC és/vagy NOEC meghatározása esetén a legalacsonyabb vizsgálati koncentráció legyen elegendően alacsony ahhoz, hogy a növekedés ne legyen jelentősen kisebb, mint a kontrollcsoportban. A legmagasabb koncentráció ugyanakkor legyen elegendően nagy ahhoz, hogy a növekedés jelentősen kisebb legyen, mint a kontrollcsoportban. Ha ez nem teljesül, a vizsgálatot más koncentrációtartománnyal meg kell ismételni (kivéve akkor, ha a legmagasabb koncentráció megegyezik az oldhatósági határral vagy az előírt maximális határkoncentrációval, például 100 mg/l-rel).
27. Az egyes vizsgálatok mellett kontrolltenyészeteket is kell vizsgálni a vizsgálati edényekével megegyező táptalaj, vizsgálati szervezet (a megválasztott növényanyagoknak a lehető leghomogénebbnek kell lenniük; azt az előkultúrából származó friss oldalágak alkotják, amelyeket a tőtől számított 2,5 cm-re vágnak vissza), a vizsgálati edényekével megegyező környezeti körülmények és eljárások alkalmazásával, de a vizsgálati vegyi anyag nélkül. Segédoldószer vagy -diszpergálószer alkalmazása esetén egy további kontrolltenyészet is szükséges, amelyben az oldó- vagy diszpergálószer azonos koncentrációban van jelen, mint a vizsgálati vegyi anyagot tartalmazó edényekben. Legalább tíz párhuzamost kell alkalmazni a kontrolledények (illetőleg szükség szerint az oldószeres edények) esetén.
28. Ha nem kell meghatározni az NOEC értékét, a vizsgálati terv módosítható oly módon, hogy több koncentrációt, de koncentrációnként kevesebb párhuzamost tartalmazzon. A kontrollban a párhuzamosok száma azonban ilyenkor is legalább tíz kell, hogy legyen.
Expozíció
29. A tőtől számítva 2,5 cm-re visszavágott, az előkultúrából származó friss oldalágakat véletlenszerűen kell kiosztani a vizsgálati edényekbe, csíramentes körülmények között; az egyes vizsgálati edényekbe egy 2,5 cm-es oldalágat kell behelyezni, amelynek egyik végén csúcsmerisztémának kell lennie. Az egyes vizsgálati edényekben a választott növényanyagnak azonos minőségűnek kell lennie.
30. Az inkubátorban a vizsgálati edényeket véletlenszerű elrendezésben kell elhelyezni annak érdekében, hogy a fényerősség és a hőmérséklet térbeli változatossága minél kisebb hatást gyakoroljon a vizsgálatokra. A megfigyelések végzésekor az edényeket véletlenszerűen vagy blokkonkénti kiosztási terv alapján (vagy gyakrabban) át kell rendezni.
31. Ha az előzetesen elvégzett stabilitásvizsgálat azt jelzi, hogy a vizsgálati vegyi anyag koncentrációja a vizsgálat időtartama (14 nap) alatt nem tartható fenn (azaz a mért koncentráció a kezdeti mért koncentráció 80 %-a alá csökken), akkor félstatikus vizsgálatot ajánlatos végezni. Ennek keretében a növényeket a vizsgálat során legalább egy alkalommal (pl. a 7. napon) friss vizsgálati és kontrolloldatokba kell helyezni. A friss közegbe helyezés gyakorisága a vizsgálati vegyi anyag stabilitásától függ; nagymértékben instabil vagy illékony anyagok esetén a közel állandó koncentráció fenntartása gyakoribb oldatcserét igényelhet.
32. Ez a vizsgálati módszer nem tartalmazza a levélre történő felvitellel (permetezéssel) megvalósuló expozíciót.
Vizsgálati körülmények
33. Meleg- és/vagy hidegfehér fluoreszkáló megvilágítást kell alkalmazni oly módon, hogy a fotoszintetikusan aktív sugárzásban (400–700 nm), a fényforrástól a vizsgálati edények aljával megegyező távolságban lévő pontokban mért irradiancia 100–150 μE m–2 s–1 legyen (amely körülbelül 6 000 –9 000 luxnak felel meg); a fény/sötét ciklusnak pedig 16/8 órásnak kell lennie. A fényérzékelésének és mérésének módszere, különösen az érzékelők típusa befolyásolja a mért értéket. A gömbérzékelők (amelyek a mérési sík alatt és felett tetszőleges irányból érkező fény mérésére alkalmasak) és a „koszinuszos” érzékelők (amelyek csak a mérési sík felett tetszőleges irányból érkező fény mérésére alkalmasak) előnyben részesítendők az egytengelyű érzékelőkkel szemben, mert az e módszerben előírt többpontos fényforrás esetén nagyobb értékeket szolgáltatnak.
34. A vizsgálati edényekben a hőmérsékletnek 23 ± 2 °C-nak kell lennie. További gondot kell fordítani a pH-érték eltolódására egyes esetekben, pl. instabil vegyi anyagok vagy fémek vizsgálatakor; a pH-értéknek 6–9 közötti tartományban kell maradnia. További iránymutatást az (5) irodalom tartalmaz.
Időtartam
35. A vizsgálat a növények vizsgálati edényekbe helyezése után 14 nappal fejeződik be.
Mérések és analitikai meghatározások
36. A vizsgálat kezdetén a vizsgálati szervezet fő hajtásának hossza 2,5 cm (lásd a 29. pontot); ezt vonalzóval kell megmérni (lásd a 4. függeléket), vagy fényképezéssel és képelemzéssel kell megállapítani. A vizsgálati szervezet normálisnak vagy rendellenesnek tűnő fő hajtásának hosszát a vizsgálat kezdetén, továbbá a 14 napos expozíciós időszak alatt legalább egyszer és a vizsgálat végén kell meghatározni. Megjegyzés: Alternatívaként azok számára, akik nem rendelkeznek képelemzési lehetőséggel, ha a munkaasztalt sterilizálják a növények vizsgálati edényekbe helyezése előtt, steril vonalzó használható a fő hajtás hosszának mérésére a vizsgálat kezdetén és a vizsgálat során. Fel kell jegyezni a növények fejlődésében beálló változásokat, például a hajtások deformitását vagy a megjelenést, a nekrózisra, a klorózisra utaló jeleket, a megszakadást vagy az úszóképesség megszűnését, a gyökerek hosszának vagy megjelenésének megváltozását. Fel kell továbbá jegyezni a vizsgálati közeg jellegzetességeit is (például oldatlan anyag jelenléte, alga-, gomba- vagy baktériumképződés a vizsgálati edényben).
37. A vizsgálat során a fő hajtás hossza mellett a vizsgálati vegyi anyagnak a következő mérési változók közül háromra (vagy többre) gyakorolt hatását is meg kell határozni:
i. Az oldalágak teljes hossza
ii. A hajtások teljes hossza
iii. A gyökerek teljes hossza
iv. Nedves tömeg
v. Száraz tömeg
vi. Örvök száma
1. megjegyzés: A dózisbehatároló vizsgálat során tett megfigyelések segíthetnek a fent felsorolt hat változó közül a megfelelő további mérések kiválasztásában.
2. megjegyzés: Határozottan javasolt a nedves és száraz tömeg meghatározása (iv. és v. paraméter).
3. megjegyzés: Mivel a szacharóz és a fény (a gyökerek fénynek való kitettsége a vizsgálat során) hatást gyakorolhat a növények növekedési hormonjának, az auxinnak a transzportereire, és mivel egyes vegyi anyagok hatásmechanizmusa auxin típusú lehet, a gyökérre vonatkozó végpontok felvétele (iii. paraméter) megkérdőjelezhető.
4. megjegyzés: A laboratóriumok közötti összehasonlítás magas variációs koefficienst mutat (> 60 %) az oldalágak teljes hossza tekintetében (i. paraméter). Az oldalágak teljes hosszára mindenesetre kiterjed a hajtások teljes hosszának mérése (ii. paraméter), amely elfogadhatóbb variációs koefficienst mutat (< 30 %).
5. megjegyzés: A fenti megfontolásokból kiindulva az ajánlott mérési végpontok a következők: a hajtások teljes hossza, a nedves és a száraz tömeg (ii., iv. és v. paraméter); a vi. paraméterről, az örvök számáról a kísérletet végző saját megítélése alapján dönthet.
38. A fő hajtás hossza és az örvök száma azért előnyös mérési változók, mert a vizsgálat kezdetén, folyamán és végén minden vizsgálati és kontrolledényben külön-külön meghatározhatók fényképezéssel és képelemzéssel, jóllehet (steril) vonalzó is használható.
39. Az oldalágak teljes hossza, a gyökerek teljes hossza (mint az összes oldalág vagy összes gyökér összege) és a hajtások teljes hossza (mint a fő hajtás hossza és az oldalágak teljes hossza) vonalzóval mérhető az expozíció végén.
40. A száraz és/vagy a nedves tömeget a vizsgálat elején a vizsgálat megkezdéséhez alkalmazandó növények tekintetében reprezentatív előkultúrából származó mintán, majd a vizsgálat végén az egyes vizsgálati és kontrolledények növényanyagán kell meghatározni.
41. Az oldalágak teljes hosszát, a hajtások teljes hosszát, a gyökerek teljes hosszát, a nedves és a száraz tömeget, továbbá az örvök számát a következőképpen kell meghatározni:
|
i. |
Az oldalágak teljes hossza : Az oldalágak hosszát úgy lehet meghatározni, hogy az összes oldalágat vonalzóval lemérik az expozíció végén. Az oldalágak teljes hossza az egyes vizsgálati és kontrolledényekben található összes oldalág hosszának összege. |
|
ii. |
A hajtások teljes hossza : A fő hajtás hosszát képelemzéssel vagy vonalzó segítségével lehet megállapítani. A hajtások teljes hossza az egyes vizsgálati és kontrolledényekben található oldalágak teljes hosszának és a fő hajtás hosszának összege az expozíció végén. |
|
iii. |
A gyökerek teljes hossza : A gyökér hosszát úgy lehet meghatározni, hogy az összes gyökeret vonalzóval lemérik az expozíció végén. A gyökerek teljes hossza az egyes vizsgálati és kontrolledényekben található összes gyökér összege. |
|
iv. |
Nedves tömeg : A nedves tömeget úgy lehet meghatározni, hogy a vizsgálati szervezetek tömegét megmérik az expozíció végén. Az egyes vizsgálati és kontrolledényekben található valamennyi növényanyagot desztillált vízzel le kell öblíteni és cellulózpapírral szárazra kell itatni. Ezen előkészületeket követően a nedves tömeget méréssel határozzák meg. A kezdeti élőanyag-tömeget (nedves tömeg) a vizsgálati edények beoltásához használt tételből származó vizsgálati szervezetekből vett minta alapján kell meghatározni. |
|
v. |
Száraz tömeg : A nedves tömeg meghatározásának előkészületeit követően a vizsgálati szervezeteket 60 °C-on állandó tömegűre kell szárítani. Ez a tömeg a száraz tömeg. A kezdeti élőanyag-tömeget (száraz tömeg) a vizsgálati edények beoltásához használt tételből származó vizsgálati szervezetekből vett minta alapján kell meghatározni. |
|
vi. |
Örvök száma : A fő hajtás mentén valamennyi örvöt meg kell számlálni. |
A mérések és az analitikai meghatározások gyakorisága
42. Statikus vizsgálati terv alkalmazása esetén az egyes kezelt edények pH-értékét a vizsgálat elején és végén kell megmérni. Félstatikus vizsgálati terv alkalmazása esetén a pH-értéket minden oldatcsere alkalmával meg kell határozni mind a friss, mind az elhasznált oldaton.
43. A fényerősséget a növesztőkamrában, az inkubátorban vagy a vizsgálati helyiségben a fényforrástól a vizsgálati szervezetekkel megegyező távolságban elhelyezkedő pontokban kell mérni. Fényerősséget a vizsgálat során legalább egyszer kell mérni. A növesztőkamrában, az inkubátorban vagy a vizsgálati helyiségben azonos körülmények között külön erre a célra tartott edényben legalább naponta (vagy adatgyűjtő egységgel folyamatosan) méni kell a közeg hőmérsékletét.
44. A vizsgálat során alkalmas időközönként meg kell határozni a vizsgálati vegyi anyag(ok) koncentrációját. Statikus vizsgálat esetén a koncentrációt legalább a vizsgálat elején és végén meg kell határozni.
45. Félstatikus vizsgálat esetén, ha a vizsgálati vegyi anyag(ok) koncentrációja várhatóan nem marad a névleges koncentráció ±20 %-os tartományában, akkor minden friss vizsgálati oldatot elkészítésekor, továbbá minden lecserélt oldatot analitikai vizsgálatnak kell alávetni. Olyan vizsgálatok esetén ugyanakkor, amelyekben a vizsgálati vegyi anyag(ok) mért kezdeti koncentrációja ugyan nem a névleges koncentráció ±20 %-os tartományában van, de kellően bizonyítható, hogy a kezdeti koncentrációk megismételhetők és stabilak (azaz a kezdeti koncentráció 80–120 %-os tartományán belül vannak), akkor a kémiai meghatározásokat elegendő csak a legalacsonyabb és a legmagasabb vizsgálati koncentráción elvégezni. Az oldatcsere előtt a vizsgálati koncentrációt minden esetben elegendő vizsgálati koncentrációnként egy párhuzamos edényen (vagy a párhuzamosokat összevontan tartalmazó edényen) elvégezni.
46. Ha bizonyított, hogy a vizsgálati koncentráció kielégítő módon a névleges koncentráció vagy a mért kezdeti koncentráció ±20 %-án belül marad a vizsgálat során, akkor az eredmények értékelése alapulhat a névleges értéken vagy a mért kezdeti koncentráció értékén. Ha a névleges vagy a mért kezdeti koncentrációtól való eltérés meghaladja a ±20 %-ot, akkor az eredményeket az expozíció idején érvényes koncentrációértékek mértani középértéke vagy a vizsgálati vegyi anyag koncentrációjának csökkenését leíró modellek alapján kell elemezni (5).
Határérték-vizsgálat
47. Egyes esetekben, például ha egy előzetes vizsgálat azt jelzi, hogy a vizsgálati vegyi anyag 100 mg/l koncentrációig vagy az adott vizsgálati közegben való oldhatósági határig, illetőleg készítmény esetén a diszpergálóképesség határáig nem jár toxikus hatással, akkor egy kontrollcsoport és egyetlen (100 mg/l koncentrációnak vagy az adott vizsgálati oldatban való oldhatósági határhoz tartozó koncentrációnak megfelelő) kezelt csoport válaszainak összehasonlításával határérték-vizsgálat végezhető. Határozottan ajánlott ezt az expozíciós koncentráció elemzésével alátámasztani. A határérték-vizsgálat során biztosítani kell valamennyi fent leírt vizsgálati körülmény fennállását és érvényességi feltétel teljesülését azzal az eltéréssel, hogy kétszer annyi kezelt replikátumot kell vizsgálni. A kontrollcsoportban és a kezelt csoportban tapasztalt növekedés az átlagok összehasonlítására irányuló statisztikai próbával (például Student-féle t-próbával) elemezhető.
ADATOK ÉS JEGYZŐKÖNYVEZÉS
Hatásváltozók
48. A vizsgálat célja annak meghatározása, milyen hatást gyakorol a vizsgálati vegyi anyag a Myriophyllum spicatum vegetatív növekedésére. Ez a vizsgálati módszer két hatásváltozót ír le.
|
a) |
Átlagos fajlagos növekedési sebesség : Ezt a hatásváltozót a fő hajtás hossza logaritmusának, valamint más további mért paraméterek (a hajtások teljes hossza, a száraz tömeg vagy a nedves tömeg, az örvök száma) logaritmusának időbeli (napi) változása alapján kell kiszámítani a kontroll- és az egyes kezelt csoportokban. Megjegyzés: Az oldalágak teljes hossza és a gyökerek teljes hossza mérési paraméterek tekintetében nem számítható átlagos fajlagos növekedési sebesség. A vizsgálat elején a vizsgálati szervezetnek nincs oldalága és gyökérzete (az előkultúrából származó preparátum alapján); a nulla értékről kiindulva az átlagos fajlagos növekedési sebességet nem határozzák meg. |
|
b) |
Hozam : Ezt a hatásváltozót a fő hajtás hossza, valamint más további mért paramétereknek (azaz lehetőség szerint a hajtások teljes hosszának, a nedves tömegnek, a száraz tömegnek vagy az örvök számának) a kontroll- és az egyes kezelt csoportokban a vizsgálat végéig bekövetkező változása alapján kell kiszámítani. |
49. A toxicitást a fő hajtás hossza, valamint három további mérési változó (azaz lehetőség szerint a hajtások teljes hossza, a nedves tömeg, a száraz tömeg vagy az örvök száma, lásd a 37. pontot és az e ponthoz fűzött 2., 4. és 5. megjegyzést) alapján kell becsülni, mert bizonyos vegyi anyagok más mérési változókat sokkal erősebben befolyásolhatnak, mint a fő hajtás hosszát. Ez a hatás nem volna kimutatható csak a fő hajtás hosszának kiszámításával.
Átlagos fajlagos növekedési sebesség
50. Az adott időszakhoz tartozó átlagos fajlagos növekedési sebességet a növekedést leíró változók – a fő hajtás hossza, valamint három további mérési változó (azaz a hajtások teljes hossza, a nedves tömeg, a száraz tömeg vagy az örvök száma) – logaritmusának növekedéseként kell kiszámítani a vizsgálati és a kontrollcsoportok minden egyes párhuzamosára külön-külön, a következő összefüggés szerint:
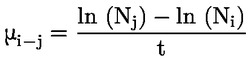
ahol:
μi-j : az átlagos fajlagos növekedési sebesség az „i”-től a „j” időpillanatig
Ni : a mérési változó értéke a vizsgálati vagy a kontrolledényben az „i” időpillanatban
Nj : a mérési változó értéke a vizsgálati vagy a kontrolledényben a „j” időpillanatban
t : az „i”-től „j”-ig terjedő időtartam.
Minden kezelt és kontrollcsoportra ki kell számítani egy átlagot a növekedési sebességre, valamint meg kell becsülni a szórásnégyzetet.
51. Az átlagos fajlagos növekedési sebességet a vizsgálat teljes időtartamára kell meghatározni (tehát úgy, hogy a fenti összefüggésben „i” a vizsgálat kezdetét, „j” a vizsgálat végét jelöli). Minden egyes vizsgálati koncentrációra és kontrollcsoportra meg kell határozni az átlagos fajlagos növekedési sebesség átlagát, és meg kell becsülni a szórásnégyzetet. Emellett (például a növekedési görbék logaritmikus transzformáltjának szemügyre vételével) meg kell adni a növekedési sebesség szakaszonkénti értékét is annak érdekében, hogy megítélhető legyen a vizsgálati vegyi anyag által az expozíciós időszak folyamán kifejtett hatás.
52. A növekedési sebesség százalékos gátlását (Ir) ezután vizsgálati koncentrációnként (kezelt csoportonként) a következő összefüggésből kell meghatározni:

ahol:
% Ir : átlagos fajlagos növekedési sebesség százalékos gátlása
μC : a μ átlaga a kontrollban
μT : a μ átlaga a kezelt csoportban
Hozam
53. A hozamra gyakorolt hatást vizsgálati edényenként, a fő hajtás hossza és három további mérési változó (azaz lehetőség szerint a hajtások teljes hossza, a nedves tömeg, a száraz tömeg vagy az örvök száma) alapján kell meghatározni a vizsgálat kezdetén és végén. A kezdeti élőanyag-tömeget (a nedves tömeg vagy a száraz tömeg tekintetében) a vizsgálati edények beoltásához használt tételből származó vizsgálati szervezetekből vett minta alapján kell meghatározni. Minden egyes vizsgálati koncentráció és kontrollcsoport esetén ki kell számítani a hozam átlagát, és meg kell becsülni a szórásnégyzetet. Az átlagos százalékos hozamgátlás ( % Iy) kezelt csoportonként a következő összefüggésből határozható meg:

ahol:
% Iy : a hozam százalékos csökkenése
bC : az élőanyag-tömeg végső értéke és kiindulási értéke közötti különbség a kontrollcsoportban
bT : az élőanyag-tömeg végső értéke és kiindulási értéke közötti különbség a kezelt csoportban.
Megkettőződési idő
54. A fő hajtás hossza megkettőződéséhez szükséges Td idő meghatározásához és az erre vonatkozó érvényességi kritérium (lásd a 8. pontot) betartásához a kontrolledények adataira a következő összefüggést kell alkalmazni:
Td = ln 2/μ
Ahol μ az 50–52. pontban leírtak szerint meghatározott átlagos fajlagos növekedési sebesség.
A koncentráció–hatás görbék elkészítése
55. El kell készíteni a hatásváltozóhoz tartozó átlagos százalékos gátlás értékét (az 53. pont szerint számított Ir, vagy Iy értéket) a vizsgálati vegyi anyag koncentrációja logaritmusának függvényében ábrázoló koncentráció–hatás görbéket.
Az ECx becslése
56. Az ECx becslését mind az átlagos fajlagos növekedési sebesség (ErCx), mind a hozam (EyCx) alapján el kell végezni, amelyeket viszont a fő hajtás hosszából és lehetőség szerint további mérési változókból (azaz elsődlegesen a hajtások teljes hosszából, a száraz tömegből, a nedves tömegből vagy az örvök számából) egyaránt ki kell számítani. Ez azért szükséges, mert egyes vegyi anyagok a fő hajtás hosszára és a többi mérési változóra eltérő hatást gyakorolnak. A kívánt toxicitási paraméterek tehát négy ECx érték az egyes x gátlási szintre számítva: ErCx (fő hajtás hossza); ErCx (azaz elsődlegesen a hajtások teljes hossza, a száraz tömeg, a nedves tömeg vagy az örvök száma); EyCx (fő hajtás hossza); és EyCx (azaz lehetőség szerint a hajtások teljes hossza, a nedves tömeg, a száraz tömeg vagy az örvök száma).
57. Megjegyzendő, hogy az e két hatásváltozó alapján számított ECx értékek nem hasonlíthatók egymáshoz, és a vizsgálati eredmények felhasználása során erre a különbségre tekintettel kell lenni. Az e vizsgálati módszerben előírt vizsgálati körülmények betartása mellett a két számítási eljárás matematikai háttere következtében az átlagos fajlagos növekedési sebességen alapuló ECx értékek (ErCx) általában nagyobbra adódnak, mint a hozamon alapuló ECx értékek (EyCx). Ezt az eltérést nem szabad úgy értelmezni, hogy egyik hatásváltozó érzékenyebb lenne a másiknál; egyszerűen arról van szó, hogy a két érték matematikailag mást jelent.
Statisztikai eljárások
58. A statisztikai számítások célja, hogy regresszióanalízissel kvantitatív koncentráció–hatás összefüggést állítsanak elő. Használható súlyozott lineáris regresszió, a hatásadatok például probit-, logit- vagy Weibull-modellekkel történő lineáris transzformációja után (7), de célszerű előnyben részesíteni a nem lineáris regressziós technikákat, amelyek jobban kezelik az elkerülhetetlen adatszabálytalanságokat és az egyenletes eloszlástól való eltéréseket. Akár a nulla gátlás, akár a teljes gátlás közelében a transzformáció megsokszorozhat bizonyos szabálytalanságokat, ami hibás elemzést eredményezhet (7). Megjegyzendő, hogy a probit-, logit- vagy Weibull-transzformáltat alkalmazó szokásos számítási módszerek elsősorban kvantált (például mortalitás kontra túlélés) adatok feldolgozására alkalmasak, így módosítást igényelnek, ha a növekedési sebességre vagy a hozamra kívánják azokat alkalmazni. Az ECx értékek folytonos adatokból való számítására alkalmas módszerek a (8), (9) és (10) irodalomban találhatók.
59. Az egyes hatásváltozók elemzéséhez a koncentráció–válasz összefüggésből ki kell számítani az ECx egyes pontokban becsült értékét. Ha lehetséges, meg kell határozni az egyes becslések 95 %-os konfidenciahatárát. A hatásadatok regressziós modellhez történő megfelelő illeszkedését (goodness of fit) grafikus vagy statisztikai módszerrel kell megállapítani. A regresszióanalízist az egyes párhuzamosokon nyert hatásokkal, nem pedig a kezelt csoportok átlagaival kell elvégezni.
60. Az EC50 becsült értékeit és a konfidenciahatárokat bootstrap módszerrel együtt alkalmazott lineáris interpolációval (10) is meg lehet kapni, ha a rendelkezésre álló regressziós modellek/módszerek nem használhatók a kapott adatokkal.
61. Az LOEC, és így az NOEC becsült értékének előállítása érdekében varianciaanalízis (ANOVA) segítségével össze kell vetni az egyes kezelésekhez tartozó átlagokat. Az egyes koncentrációkhoz tartozó átlagokat ezután alkalmasan megválasztott többszörös összehasonlító módszerrel vagy trendpróbát alkalmazó módszerrel a kontrollcsoporton nyert átlagokhoz kell hasonlítani. A Dunnett- vagy a Williams-féle próba hasznos lehet erre a célra (12)(13)(14)(15)(16). Lényeges ellenőrizni, hogy fennáll-e az ANOVA-nak a szórásnégyzetek homogenitására vonatkozó feltevése. Ez történhet grafikusan vagy formális próbával (15). A megfelelő tesztek a Levene- vagy a Bartlett-féle próba. A szórásnégyzetek homogenitására vonatkozó feltevés nem teljesülése olykor kiküszöbölhető az adatok logaritmikus transzformálásával. Ha a szórásnégyzetek heterogenitása túlságosan szélsőségesnek bizonyul, és transzformációval nem javítható, akkor célszerű megfontolni például a lefelé lépegető Jonkheere-féle trendpróba alkalmazását. Az NOEC meghatározásához további útmutatás is található a (10) hivatkozásban.
62. A legújabb kutatási eredmények alapján az az ajánlás fogalmazható meg, hogy az NOEC kiszámítása helyett célszerűbb az ECx pontonkénti értékét becsülni regresszió alapján. Ehhez a Myriophyllum-vizsgálathoz még nem állapítottak meg megfelelő x értéket. A 10–20 %-os tartomány azonban megfelelőnek tűnik (a választott hatásváltozótól függően), és célszerű mind az EC10-et, mind az EC20-at, továbbá konfidenciahatáraikat megadni a vizsgálati jegyzőkönyvben.
Jegyzőkönyvezés
63. A vizsgálati jegyzőkönyvnek a következőket kell tartalmaznia:
Vizsgálati vegyi anyag
Egy összetevőből álló anyag:
— fizikai megjelenés, vízoldékonyság és a további releváns fizikai-kémiai tulajdonságok;
— kémiai azonosító adatok, például IUPAC- vagy CAS-név, CAS-szám, SMILES- vagy InChI-kód, szerkezeti képlet, tisztaság, adott esetben és amennyiben a gyakorlatban megvalósítható, a szennyeződések kémiai azonossága stb. (ideértve adott esetben a szervesszén-tartalmat).
Több összetevőből álló anyag, UVCB-k vagy keverékek:
— amennyiben lehetséges, az összetevők kémiai azonossága (lásd fent), mennyiségi előfordulása és releváns fizikai-kémiai tulajdonságai jellemzik.
A vizsgálathoz használt fajok
— Tudományos név és eredet.
Vizsgálati körülmények
— Alkalmazott vizsgálati eljárás (statikus vagy félstatikus).
— A vizsgálat megkezdésének időpontja és időtartama.
— Vizsgálati közeg.
— A kísérleti terv ismertetése: vizsgálati edények és fedők, oldattérfogatok, fő hajtás hossza vizsgálati edényenként a vizsgálat megkezdésekor.
— Vizsgálati koncentrációk (szükség szerint névleges és mért értékek) és párhuzamosok száma koncentrációnként.
— A törzs- és a vizsgálati oldatok elkészítésének módszere, az esetleg alkalmazott oldó- vagy diszpergálószer.
— Hőmérséklet a vizsgálat folyamán.
— Fényforrás, a fény intenzitása és homogenitása.
— A vizsgálati és a kontrolloldatok pH-értékei.
— A vizsgálati vegyi anyag analizálásának módszere a megfelelő minőség-ellenőrzési adatokkal együtt (validálási vizsgálat, a szórás vagy az analízisek konfidenciahatárai).
— A fő hajtás hosszának és más mérési változóknak, pl. az oldalágak teljes hosszának, a hajtások teljes hosszának, a gyökerek teljes hosszának, a nedves tömegnek, a száraz tömegnek vagy az örvök számának a meghatározási módszerei.
— A tenyészet állapota (steril vagy nem steril) minden egyes vizsgálati és kontrolledényben minden adatfelvétel alkalmával.
— Minden eltérés ettől a vizsgálati módszertől.
Eredmények
— Nyers adatok: fő hajtás hossza és a további mérési változók minden egyes vizsgálati és kontrolledényben minden adatfelvételkor és analízis alkalmával.
— Az egyes mérési változók átlagai és szórásai.
— Az egyes mérési változók növekedésgörbéi.
— Hatásváltozók számított értéke minden kezelt replikátumra, továbbá az átlag és a variációs koefficiens a párhuzamosok tekintetében.
— A koncentráció–hatás összefüggés grafikus formában.
— A hatásváltozók toxikus végpontjainak becsült értékei, például EC50, EC10, EC20 és a hozzájuk tartozó konfidencia-intervallumok. Ha kiszámították, az LOEC, illetve az NOEC értéke, továbbá a számításukhoz alkalmazott statisztikai módszerek.
— ANOVA alkalmazása esetén a kimutatható hatás mértéke (például a legkisebb szignifikáns különbség).
— A kezelt csoportban észlelt esetleges növekedésserkentés.
— Fitotoxicitásra utaló esetleges látható jelek, valamint a vizsgálati oldatokkal kapcsolatos észrevételek.
— Az eredmények szöveges elemzése, beleértve az e vizsgálati módszertől való eltérések vizsgálat kimenetelére gyakorolt hatását.
SZAKIRODALOM
(1) ASTM Designation E 1913-04, Standard Guide for Conducting Static, Axenic, 14-Day Phytotoxicity Tests in Test Tubes with the Submersed Aquatic Macrophyte, Myriophyllum sibiricum Komarov.
(1) Maletzki, D. et al. (2010), Myriophyllum spicatum als ökotoxikologischer Testorganismus: Methodenentwicklung eines sedimentfreien Testsystems und erste Ergebnisse mit 3,5-Dichlorphenol, Umweltwiss Schadst Forsch, No. 22, pp. 702–710.
(2) E melléklet C.26. fejezete: Lemna sp. növekedésgátlási próba
(3) OECD (2014), “Myriophyllum spicatum Toxicity Test: Results of an inter-laboratory ring test using a sediment-free test system”, OECD Environment, Health and Safety Publications (EHS), Series Testing and Assessment, No. 205, OECD Publishing, Paris.
(4) OECD (2000), “Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures”, OECD Environment, Health and Safety Publications (EHS), Series on Testing and Assessment, No. 23, OECD Publishing, Paris.
(5) E melléklet C.51. fejezete: Myriophyllum spicatummal végzett víz–üledék toxicitási vizsgálat
(6) Christensen, E.R., N. Nyholm (1984), Ecotoxicological Assays with Algae: Weibull Dose-Response Curves, Environmental Science & Technology, Vol. 18/9, 713-718.
(7) Nyholm, N. et al. (1992), Statistical treatment of data from microbial toxicity tests, Environmental Toxicology and Chemistry, Vol. 11/2, pp. 157-167.
(8) Bruce, R.D., D.J. Versteeg (1992), A statistical procedure for modelling continuous toxicity data, Environmental Toxicology and Chemistry, Vol. 11/10, pp. 1485-1494.
(9) OECD (2006), “Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application”, OECD Environment, Health and Safety Publications (EHS), Series on Testing and Assessment, No. 54, OECD Publishing, Paris.
(10) Norberg-King, T.J. (1988), An interpolation estimate for chronic toxicity: The ICp approach, National Effluent Toxicity Assessment Center Technical Report 05-88, US EPA, Duluth, MN.
(11) Dunnett, C.W. (1955), A multiple comparisons procedure for comparing several treatments with a control, Journal of the American Statistical Association, Vol. 50/272, pp. 1096-1121.
(12) Dunnett, C.W. (1964), New tables for multiple comparisons with a control, Biometrics, Vol. 20/3, pp. 482-491.
(13) Williams, D.A. (1971), A test for differences between treatment means when several dose levels are compared with a zero dose control, Biometrics, Vol. 27/1, pp. 103-117.
(14) Williams, D.A. (1972), The comparison of several dose levels with a zero dose control, Biometrics, Vol. 28/2, pp. 519-531.
(15) Brain, P., R. Cousens (1989), An equation to describe dose-responses where there is stimulation of growth at low doses, Weed Research, Vol. 29/2, pp. 93-96.
1. függelék
FOGALOMMEGHATÁROZÁSOK
Élőanyagtömeg (biomassza) : a populációban jelen lévő élő anyag nedves és/vagy száraz tömege. Ebben a vizsgálatban az élőanyagtömeg a fő hajtás, az összes oldalág és az összes gyökér összege.
Vegyi anyag : anyag vagy keverék.
Klorózis : a vizsgálathoz felhasznált szervezet, különösen az örvök színének zöldről sárgásra történő változása.
ECx : a vizsgálati közegben oldott vizsgálati vegyi anyag azon koncentrációja, amely meghatározott expozíciós időszak alatt x %-os (pl. 50 %-os) csökkenést okoz a Myriophyllum spicatum növekedésében (ha eltér a teljes vagy szokásos vizsgálati időtartamtól, értékét külön meg kell adni). Annak egyértelmű jelzésére, hogy az EC-érték a növekedési sebesség vagy a hozam alapján került-e meghatározásra, növekedési sebesség esetén „ErC”, hozam esetén pedig „EyC” jelölést kell használni, majd ezt követően meg kell adni a mérési változót, például: ErC (a fő hajtás hossza).
Növekedés : a mérési változóknak, pl. a fő hajtás hosszának, az oldalágak teljes hosszának, a hajtások teljes hosszának, a gyökerek teljes hosszának, a nedves tömegnek, a száraz tömegnek vagy az örvök számának a növekedése a vizsgálati időszakra tekintve.
Növekedési sebesség (átlagos fajlagos növekedési sebesség) : a mérési változó logaritmikus növekedése az expozíciós idő alatt. Megjegyzés: A növekedési sebességgel összefüggő hatásváltozók függetlenek a vizsgálat időtartamától mindaddig, amíg az expozícióval nem érintett kontrollszervezetek növekedési mintázata exponenciális.
Megfigyelhető hatást okozó legalacsonyabb koncentráció (LOEC) : az a legalacsonyabb vizsgált koncentráció, amely mellett adott expozíciós idő alatt a vegyi anyag statisztikailag szignifikáns mértékben (p < 0,05) csökkenti a növekedésre kifejtett hatást a kontrolltenyészethez képest. Azonban az LOEC-szint feletti valamennyi vizsgálati koncentrációnak olyan ártalmas hatást kell kifejtenie, amely legalább egyenlő az LOEC-szinten megfigyelttel vagy súlyosabb annál. Amennyiben e két feltétel nem teljesíthető, akkor kimerítő magyarázatot kell adni arra, hogy hogyan történt az LOEC (és ennélfogva az NOEC) kiválasztása.
Mérési változók : a vizsgálat végpontjának egy vagy több különböző hatásváltozó segítségével történő kifejezése érdekében mért valamennyi változó. Ebben a vizsgálati módszerben a mérési változók a fő hajtás hossza, az oldalágak teljes hossza, a hajtások teljes hossza, a gyökerek teljes hossza, a nedves tömeg, a száraz tömeg és az örvök száma.
Monokultúra : egyetlen növényfajból álló tenyészet.
Nekrózis : a vizsgálati szervezet elhalt (például fehér vagy sötétbarna) szövete.
Megfigyelhető hatást nem okozó koncentráció (NOEC) : az a vizsgálati koncentráció, amely közvetlenül az LOEC alatt helyezkedik el.
Hatásváltozó : a toxikus hatás becslésére használt, az élőanyagtömeg leírására szolgáló bármely mért változóból különböző számítási módszerekkel levezethető változó. Ebben a vizsgálati módszerben hatásváltozó a növekedési sebesség és a hozam, amelyeket a fő hajtás hosszából, a hajtások teljes hosszából, a nedves tömegből, a száraz tömegből vagy az örvök számából mint mérési változókból származtatnak.
Félstatikus (oldatcserés) vizsgálat : olyan vizsgálat, amelynek során a vizsgálati oldatot bizonyos időközönként lecserélik.
Statikus vizsgálat : olyan vizsgálati módszer, amelynek során a vizsgálati oldatot nem cserélik le.
Vizsgálati vegyi anyag : e vizsgálati módszer alkalmazásával vizsgált anyag vagy keverék.
A vizsgálat végpontja : az az általános tényező, amelyre a vizsgálat irányul, és amely a vizsgálati vegyi anyag hatására a kontrolltenyészethez képest megváltozik. Ebben a vizsgálati módszerben a vizsgálat végpontja a növekedésgátlás, amely különböző, egy vagy több mérési változóból származtatott hatásváltozók segítségével fejezhető ki.
Vizsgálati közeg : az a teljes, szintetikus tápoldat, amelyben a vizsgálati növények a vizsgálati vegyi anyag jelenlétében növekednek. A vizsgálati vegyi anyag általában oldott formában van jelen a vizsgálati közegben.
UVCB-k : ismeretlen szerkezetű vagy változó összetételű, összetett reakciótermékek vagy biológiai anyagok.
Hozam : az élőanyagtömeget leíró mérési változó értéke az expozíciós idő végén, mínusz ugyanezen változó értéke az expozíciós idő kezdetén. Megjegyzés: ha az expozícióval nem érintett szervezetek növekedési mintázata exponenciális, a hozam alapú hatásváltozók a vizsgálat előrehaladtával csökkennek.
2. függelék
MÓDOSÍTOTT ANDREWS-FÉLE KÖZEG TÖRZSTENYÉSZETHEZ ÉS ELŐKULTÚRÁHOZ
A törzstenyészethez és előkultúrához szükséges módosított Andrews-féle közeget öt külön elkészített tápanyag-törzsoldatból kell elkészíteni 3 % szacharóz hozzáadásával.
1. táblázat
Az Andrews-féle tápoldat összetétele: (ASTM szerinti megjelölés: E 1913-04)
|
Tápanyag-törzsoldatok készítése |
Tápoldatok készítése |
||
|
Törzsoldat |
Vegyi anyag |
Kezdeti tömeg 1 000 ml-re |
ml 5 l tápoldatra |
|
1 |
KCl |
74,6 mg |
50 |
|
KNO3 |
8,08 g |
||
|
Ca(NO3)2 × 4 H2O |
18,88 g |
||
|
2 |
MgSO4 × 7 H2O |
9,86 g |
50 |
|
3 |
Lásd alább a 3.1. törzsoldatot. |
50 |
|
|
4 |
KH2PO4 |
2,72 g |
50 |
|
5 |
FeSO4 × 7 H2O |
0,278 g |
50 |
|
Na2EDTA × 2 H2O |
0,372 g |
||
A törzsoldatok 6 hónapig tárolhatók hűtőszekrényben (5–10 °C-on). Csak az 5. sz. törzsoldatnak kisebb az eltarthatósági ideje (két hónap).
2. táblázat
3.1. törzsoldat készítése a 3. törzsoldat előállításához
|
Vegyi anyag |
Kezdeti tömeg g/100 ml |
|
MnSO4 × 4 H2O |
0,223 |
|
ZnSO4 × 7 H2O |
0,115 |
|
H3BO3 |
0,155 |
|
CuSO4 × 5 H2O |
0,0125 |
|
(NH4)6Mo7O24 × 4 H2O |
0,0037 |
A 3.1. törzsoldat (2. táblázat) elkészítését követően mélyfagyasztani kell ezt az oldatot, megközelítőleg 11 ml-es alikvotokban (legalább – 18 °C-on). A mélyfagyasztott adagok öt évig tarthatók el.
A 3. törzsoldat elkészítéséhez ki kell olvasztani a 3.1. törzsoldatot, abból 10 ml-t 1 l -es mérőlombikba kell tölteni, és ultratiszta vizet kell hozzáadni a lombik jelzéséig.
A módosított Andrews-féle közeg előállításához 2 500 ml ultratiszta vizet kell tölteni egy 5 l-es mérőlombikba. Az egyes törzsoldatokból 50 ml hozzáadását követően a mérőlombikot fel kell tölteni 90 %-ra ultratiszta vízzel, a pH-t pedig 5,8-re kell beállítani.
Ezt követően 150 g oldott szacharózt kell hozzáadni (3 % 5 l-re); majd a mérőlombikot a jelölésig fel kell tölteni ultratiszta vízzel. Végül a tápoldatot 1 l-es Schott-lombikba kell tölteni, és autoklávban 121 °C-on 20 percig kell kezelni.
Az így nyert tápoldat hűtőszekrényben (5–10 °C-on) három hónapig sterilen tartható.
Módosított Andrews-féle közeg az üledékmentes toxicitási vizsgálathoz
Az 1. és 2. táblázatban említett öt tápanyag-törzsoldatból tízszeres koncentrációjú, a vizsgálati oldathoz szükséges, módosított Andrews-féle közeg készül, 30 % szacharóz hozzáadásával. Ehhez 100 ml ultratiszta vizet kell tölteni 1 l-es mérőlombikba. Az egyes törzsoldatokból 100 ml hozzáadását követően a pH-t 5,8-ra kell beállítani. Ezt követően 30 % oldott szacharózt kell hozzáadni (300 g-ot 1 000 ml-re); majd a mérőlombikot a jelölésig fel kell tölteni ultratiszta vízzel.
Végül a tápoldatot 0,5 l-es Schott-lombikba kell tölteni, és autoklávban 121 °C-on 20 percig kell kezelni.
Az így nyert tízszeres koncentrációjú tápoldat hűtőszekrényben (5–10 °C-on) három hónapig sterilen tartható.
3. függelék
A TÖRZSTENYÉSZETEK TARTÁSA
Ez a 3. függelék a Myriophyllum spicatum L ( 57 ), a süllőhínárok családjába tartozó, víz alatt növekedő kétszikű növény törzstenyészetét ismerteti. Június és augusztus között nem feltűnő, rózsaszín/fehér virágok törnek a vízfelszínre. A növények erős rizómarendszerrel a talajban gyökereznek, és a teljes északi féltekén megtalálhatók tápanyagban gazdag, ugyanakkor nem szennyezett és magas mésztartalmú állóvizekben, sáros táptalajban. A Myriophyllum spicatum az édesvizet kedveli, de brakkvízben is megél.
A laboratóriumi körülmények között használt üledékmentes törzstenyészethez steril növényekre van szükség. Steril növények beszerezhetők a német Umweltbundesamt (Németország Szövetségi Környezetvédelmi Ügynöksége) ökotoxikológiai laboratóriumából.
Vagylagosan a vizsgálati szervezetek nem steril növényekből is elkészíthetők az E 1913-04 ASTM-megjelöléssel összhangban. Lásd alább az ASTM-szabvány kivonatát, a terepről begyűjtött Myriophyllum sibiricum tenyésztési eljárására vonatkozóan:
„Ha a kiindulópont terepről begyűjtött, nem steril növény, a M. sibiricum sarjhajtásait ősszel kell begyűjteni. A sarjhajtásokat kvarchomokkal vagy pl. Turface®-szel fedett, 5 cm steril üledéket és 18 l reagens vizet tartalmazó 20 l-es akváriumba kell helyezni. Az akváriumot szellőztetni kell, továbbá 15 °C hőmérsékletet és naponta 16 órában 200–300 μmol m–2 s–1 fluxussűrűséget kell fenntartani. Az akváriumban található növénytenyészet háttérforrásként alkalmazható, ha a steril növénytenyészetek a növesztőfülke mechanikus meghibásodása vagy szennyezés miatt, illetve egyéb okból tönkremennek. Az akváriumban tenyésztett növények nem sterilek, a steril kultúrák pedig nem tarthatók megszakított tenyésztési rendszerben. A tenyészet sterilizálásához a növényeket ki kell venni az akváriumból, körülbelül fél órán keresztül ioncserélt folyóvízzel át kell öblíteni. Csíramentes környezetben, lamináris áramlású fülkében a növényeket kevesebb, mint 20 percig fertőtleníteni kell (amíg a növényszövet nagy része ki nem fehéredik és csak a rügy zöld) 3 %-os (térfogatszázalék), 0,01 % megfelelő felületaktív anyagot tartalmazó nátrium-hipoklorit oldatban. A fertőtlenítőszert és a növényi anyagot el kell keverni. A több nódusszal rendelkező szegmenseket 45 ml sterilizált, módosított Andrews-féle közeget tartalmazó steril tenyésztőcsövekbe kell áthelyezni, a csöveket egyszerű tenyésztőcső-kupakkal kell lezárni. Az egyes vizsgálati kamrákba csak egy növényi szegmens helyezhető be. A tenyésztőedény lezárását laboratóriumi tömítőfólia biztosítja. Amint a steril tenyészet elkészült, a több nóduszt tartalmazó növényi szegmenst 10–12 naponta friss, folyékony táptalajt tartalmazó új vizsgálati kamrákba kell áthelyezni. Az agarlemezen történő tenyésztésnél bemutatottak szerint a növényeknek sterilnek kell lenniük és maradniuk a vizsgálat megkezdése előtt nyolc héten át.”
Mivel a módosított Andrews-féle közeg szacharózt tartalmaz (amely kedvez a gombák és baktériumok növekedésének), valamennyi anyagot, oldatot steril körülmények között kell elkészíteni, és a tenyésztést is így kell elvégezni. Valamennyi folyadékot és berendezést a használat előtt sterilizálni kell. A sterilizációt 4 órás hőkezeléssel (210 °C) kell elvégezni, vagy autoklávval 121 °C-on 20 percig. Emellett minden lombikot, edényt, tálat stb. és egyéb eszközt lángkezelésnek kell alávetni közvetlenül a használat előtt steril munkaasztalon.
A törzstenyészetek csökkentett megvilágítás mellett alacsony hőmérsékleteken (50 μE m–2 s–1, 20 ± 2 °C) hosszabb ideig újbóli elkészítés nélkül is fenntarthatók. A Myriophyllum tápoldatának meg kell egyeznie a vizsgálatok során alkalmazottal, de a törzstenyészetek más, tápanyagokban gazdag közegben is tarthatók.
A növényi szegmenseket steril körülmények között több 500 ml-es Erlenmeyer-lombikban és/vagy 2 000 ml-es Fernbach-lombikban kell elosztani, amelyet megközelítőleg 450 ml, illetve 1 000 ml módosított Andrews-féle közeggel kell feltölteni. Ezt követően a lombikokat cellulóz dugóval steril körülmények között le kell dugaszolni.
Emellett teljes mértékben szükség van az eszközök steril munkaasztalon történő lángkezelésére közvetlenül a használat előtt. A számtól és a mérettől függően a növényeket friss tápoldatba kell áthelyezni megközelítőleg háromhetente.
E megújított tenyésztéshez a csúcs, illetve a szár középső részének szegmensei is használhatók. Az áthelyezett növények (vagy növényi szegmensek) száma és mérete attól függ, hogy mennyi növényre van szükség. Például áthelyezhető öt, 5 cm-es hajtásszegmens egy Fernbach-lombikba és három, szintén 5 cm-es hajtásszegmens egy Erlenmeyer-lombikba. A gyökeres, virágos, elhalt vagy egyébként a többitől eltérő részeket el kell dobni.
1. ábra
A növények feldarabolása a törzstenyészethez és az előkultúrához három hétig tartó tenyésztés után.

A növények tenyésztését 500 ml-es Erlenmeyer- és 2 000 ml-es Fernbach-lombikban kell elvégezni hűtött inkubátorban, 20 ± 2 °C-on megközelítőleg 100–150 μE m–2 s–1 vagy 6 000 –9 000 lux megvilágítás mellett („melegfehér” színhőmérsékletű kamrai megvilágítással).
2. ábra
Növények tenyésztése hűtő inkubátorban kamrai megvilágítással.

Kémiailag tiszta (savval lemosott) és steril üveg tenyésztőedényeket kell alkalmazni, a kezelés során csíramentes körülményeket biztosítva. A törzstenyészet pl. algával, gombával és/vagy baktériummal történő szennyeződése esetén új tenyészetet kell készíteni, vagy más laboratóriumból származó törzstenyészetet kell használni az adott tenyészet cseréjére.
4. függelék
AZ ELŐKULTÚRA TARTÁSA ÉS A VIZSGÁLATI SZERVEZET ELŐKÉSZÍTÉSE VIZSGÁLATRA
Az előkultúrához a törzstenyészet hajtásait két örvöt tartalmazó szegmensekre kell vágni; a szegmenseket módosított (3 % szacharózt tartalmazó) Andrews-féle közeggel feltöltött Fernbach-lombikba kell helyezni. Az egyes lombikok legfeljebb 50 hajtásszegmenst tartalmazhatnak. Gondoskodni kell ugyanakkor arról, hogy a szegmensek élő részek legyenek, ne legyen sem gyökerük, sem oldaláguk, sem bimbójuk (lásd a 3. függelék 1. ábráját).
Az előkultúra szervezeteit 14–21 napon át kell tenyészteni steril körülmények között, olyan környezeti kamrában, ahol a világos/sötét fázisok 16/8 órás periódusokban váltakoznak. A fényerősséget a 100–150 μE m–2 s–1 tartományban kell megválasztani. A vizsgálati edényekben a hőmérséklet 23 ± 2 °C legyen.
Mivel a módosított Andrews-féle közeg szacharózt tartalmaz (amely kedvez az algák, a gombák és a baktériumok növekedésének), a vizsgálati vegyi anyagok oldatait steril körülmények között kell elkészíteni, és a tenyésztést is így kell elvégezni. Valamennyi folyadékot és berendezést a használat előtt sterilizálni kell. A sterilizációt 4 órás hőkezeléssel (210 °C) kell elvégezni, vagy autoklávval 121 °C-on 20 percig. Emellett minden lombikot, edényt, tálat stb. és egyéb eszközt lángkezelésnek kell alávetni közvetlenül a használat előtt steril munkaasztalon.
A hajtásokat steril körülmények között el kell távolítani az előkultúrára szolgáló lombikból, a lehető leghomogénebb anyagot választva. Az egyes vizsgálatokhoz legalább 60 vizsgálati szervezet szükséges (a vizsgálati vegyi anyag nyolc koncentrációja melletti vizsgálat esetén). A vizsgálathoz az előkultúrák friss oldalágait kell kiválasztani, azokat a tőtől 2,5 cm-re le kell vágni (ezt vonalzóval kell mérni), majd át kell helyezni steril módosított Andrews-féle közeget tartalmazó főzőpohárba. Ezeket a friss oldalágakat fel lehet használni az üledékmentes Myriophyllum spicatummal végzett toxicitási vizsgálathoz.
2. ábra
Az előkultúrából származó növények feldarabolása az üledékmentes Myriophyllum spicatummal végzett toxicitási vizsgálathoz.

C.51. Myriophyllum spicatummal végzett víz–üledék rendszerű toxicitási vizsgálat
BEVEZETÉS
1. Ez a vizsgálati módszer egyenértékű az OECD 239. vizsgálati iránymutatásával (2014). Vizsgálati módszerek állnak rendelkezésre a lebegő egyszikű vízinövény, a Lemna fajok (1) és algafajok (2) tekintetében. E módszereket szokásosan használják a vizsgálati vegyi anyagok kockázatának kezeléséhez szükséges adatok generálására, különösen olyan vegyi anyagok esetén, amelyek gyomirtó hatást váltanak ki a nem célfajnak számító vízinövény-fajokkal szemben. Ugyanakkor, egyes esetekben szükség lehet adatokra további makrofita fajok esetében is. A Környezettoxikológiai és Kémiai Társaság (SETAC) vízi makrofiták kockázatértékelése a növényvédő szerek tekintetében (AMRAP) elnevezésű munkaértekezlete által a közelmúltban közzétett útmutató arra utalt, hogy szükség lehet a vizsgálati vegyi anyagokra vonatkozó adatokra a gyökeres makrofita fajok esetében, ahol a Lemna és az algák ismerten nem érzékenyek a hatásmechanizmusra, vagy ahol az üledékbe történő kiválás folytán gyökéren keresztül történő felvétel útján jelentkező expozíció várható (3). A jelenlegi ismeretek és tapasztalatok alapján Myriophyllum fajokat választottak ki, mint előnyben részesítendő fajokat azokra az esetekre, amelyekben adatokra van szükség a víz alatti, gyökeres kétszikű fajok vonatkozásában (4) (5) (6). E vizsgálat nem helyettesíti a többi vízi toxicitási vizsgálatot; inkább ki kell egészítenie azokat, így a vízinövényeket érő veszélyek és kockázatok értékelése teljesebb képet adhat. Myriophyllum spicatummal végzett víz–üledék rendszerű vizsgálati módszer kiegészíti a Myriophyllum spicatummal végzett üledékmentes toxicitási vizsgálatot (7).
2. Ez a dokumentum olyan vizsgálati módszert mutat be, amely lehetővé teszi annak értékelését, hogy milyen hatást gyakorol a vizsgálati vegyi anyag a Myriophyllum spicatum gyökeres vízínövényfajra, amely víz–üledék rendszerben növekszik. Ez a vizsgálati módszer részben meglévő módszerekre épül (1) (2) (8), és figyelembe veszi a vízinövényekre vonatkozó kockázatértékelésekkel összefüggő közelmúltbeli kutatásokat (3). A víz–üledék rendszerű módszert olyan Myriophyllum fajokkal végzett nemzetközi, laboratóriumok közötti összehasonlítással validálták, amelyeket statikus körülmények között tenyésztettek, továbbá a vízoszlopon keresztül tettek ki a vizsgálati vegyi anyagnak (9). A vizsgálati rendszer ugyanakkor gyorsan kiigazítható úgy, hogy lehetővé tegye a vegyi anyaggal kiegészített üledék útján történő expozíciót, illetve félstatikus vagy impulzusos adagolási forgatókönyvek szerint a vizes fázis útján történő expozíciót, jóllehet e forgatókönyveket hivatalosan nem vetették alá laboratóriumok közötti összehasonlításnak. Ezenfelül az általános módszer használható más gyökeres, víz alatti és vízből kiemelkedő fajokra, köztük más Myriophyllum fajokra (pl. Myriophyllum aquaticum) vagy a Glyceria maxima fajra (10). Más fajok esetében szükség lehet a vizsgálati körülmények, a vizsgálati terv és időtartam módosítására. Különösen több munkára van szükség a Myriophyllum aquaticumra vonatkozó megfelelő eljárások meghatározásához. Ezeket a lehetőségeket ez a vizsgálati módszer nem ismerteti részletesen, hanem a Myriophyllum spicatum statikus rendszerben, a vizes fázison keresztül történő expozíciójának standard megközelítését mutatja be.
3. Ez a vizsgálati módszer azon anyagokra vonatkozik, amelyek tekintetében a vizsgálati módszert validálták (a részleteket lásd a laboratóriumok közötti összehasonlításról szóló jelentésben (9)), illetve készítményekre vagy ismert keverékekre vonatkozik. A Myriophyllum-vizsgálatot le lehet folytatni a vizsgálati vegyi anyag üledékbe való esetleges kiválása, hatásmechanizmusa/megválasztási kérdések nyomán felmerülő első szintű adatokkal kapcsolatos igények teljesítésére. Ugyanígy, laboratóriumi Myriophyllum-vizsgálatra lehet szükség magasabb szintű stratégia részeként a vízinövényeket érő kockázatokkal kapcsolatos aggályok kezelésére. A vizsgálat lefolytatásának konkrét indoka határozza meg az expozíciós utat (azaz, hogy az expozíció a vízen vagy az üledéken keresztül történik-e). E vizsgálati módszernek adott keverék szabályozási célú vizsgálatára történő használata előtt mérlegelni kell, hogy e módszer megfelelő eredményeket adhat-e e cél szempontjából, és ha igen, miért. Ilyen megfontolások nem szükségesek, ha létezik a keverék vizsgálatára vonatkozó szabályozási követelmény.
A VIZSGÁLAT ELVE
4. A vizsgálatot annak érdekében alakították ki, hogy értékelni lehessen a standardizált közegben (víz, üledék és tápanyagok) élő Myriophyllum növények vegetatív növekedésére gyakorolt, vegyi anyagokkal összefüggő hatásokat. Ebből a célból az egészséges, nem virágzó növények hajtáscsúcsait standardizált, mesterséges üledékbe ültetik, amelyet további tápanyagokkal egészítenek ki a növény megfelelő növekedésének garantálása érdekében, majd Smart- és Barko-féle közegben tartják (1. függelék). A gyökérképződést lehetővé tevő telepítési időszakot követően a növényeket többféle vizsgálati koncentrációnak teszik ki, amelyeket a vízoszlophoz adagolnak. Vagylagosan üledék útján történő expozíció is előidézhető a mesterséges üledék vizsgálati vegyi anyaggal történő kiegészítésével, majd a növények e kiegészített üledékbe történő áthelyezésével. A növényeket ezt követően mindkét esetben szabályozott környezeti körülmények között tartják 14 napig. A növekedésre gyakorolt hatásokat a hajtáshossz, a nedves és a száraz tömeg mennyiségi értékeléséből, valamint az olyan tünetek, mint a klorózis, a nekrózis vagy a növekedési deformitások mennyiségi szempontú megfigyeléséből határozzák meg.
5. A vegyi anyag hatásainak számszerű kifejezése érdekében a vizsgálati oldatban bekövetkező növekedést össze kell vetni a kontrollnövények növekedésével, és meg kell határozni azt az ECx-szel kifejezett koncentrációt, amely egy adott x %-os növekedésgátlást idéz elő (az x a szabályozási követelmények függvényében bármilyen érték lehet, pl. EC10, EC20, EC50). Meg kell jegyezni, hogy az EC10 és EC20 értékek csak olyan vizsgálatokban megbízhatók és megfelelők, ahol a variációs koefficiens a kontrollnövényekben elmarad a becsült hatásszinttől, azaz a variációs koefficiens < 20 % kell legyen az EC20 durva becslése esetén.
6. A kezelt és nem kezelt növények átlagos fajlagos növekedési sebességét (a hajtás hosszára, nedves tömegére és száraz tömegére vonatkozó értékelésekből származó becslés alapján) és a hozamot (amelyet a hajtás hosszának, nedves tömegének és száraz tömegének a növekedéséből kell becsülni) egyaránt meg kell határozni. A fajlagos növekedési sebességet (r) és a hozamot (y) ezt követően felhasználják az ErCx (pl. ErC10, ErC20, ErC50), illetve az EyCx (pl. EyC10, EyC20, EyC50) meghatározására.
7. Szükség esetén az átlagos fajlagos növekedési sebesség és a hozam becsléséből statisztikai eljárással meghatározható továbbá a megfigyelhető hatást okozó legalacsonyabb koncentráció (LOEC) és a megfigyelhető hatást nem okozó koncentráció (NOEC) értéke is.
A VIZSGÁLATI VEGYI ANYAGRA VONATKOZÓ INFORMÁCIÓK
8. Rendelkezésre kell állnia olyan analitikai eljárásnak, amellyel a vizsgálati közegben lévő vegyi anyag mennyisége kellő pontossággal meghatározható.
9. A vizsgálati körülmények meghatározása érdekében célszerű lehet tájékozódni többek között a vizsgálati vegyi anyag szerkezeti képletéről, több összetevőből álló anyagok, UVCB-k, keverékek vagy készítmények esetén az összetételről, a vegyi anyag tisztaságáról, vízoldékonyságáról, vízben és fény hatására tanúsított stabilitásáról, sav disszociációs állandójáról (pKa) és oktanol-víz megoszlási együtthatójáról (KOW), ha rendelkezésre áll, az üledék tekintetében vett Kd értékéről, gőznyomásáról és biológiai lebonthatóságáról. A vízoldékonyságból és a gőznyomásból meghatározható a Henry-állandó, amely megmutatja, mennyire valószínű, hogy a vizsgálat során a vizsgálati vegyi anyag jelentős mennyiségben eltávozik. Ha a vizsgálati vegyi anyagból valószínűsíthetően eltávozik adott mennyiség, ezt számszerűsíteni kell, és az ilyen eltávozás kontrollálására szolgáló további lépéseket dokumentálni kell. Ha a vizsgálati vegyi anyag(ok) oldhatóságára és stabilitására vonatkozó információk bizonytalanok, célszerű ezeket a vizsgálat körülményei, azaz a vizsgálatban alkalmazandó tápoldat, hőmérséklet és fényviszonyok mellett meghatározni. Megjegyzés: fénytől függő peroxidáló gyomirtó szerek vizsgálatakor az alkalmazott laboratóriumi megvilágításnak a természetes napfényben megtalálható ultraibolya fénnyel egyenértékű fényt kell kibocsátania.
10. A pH-t mérni kell és adott esetben ki kell igazítani a vizsgálati közegben. Különösen fontos a vizsgálati közeg pH-értékének szabályozása, például fémek vagy könnyen hidrolizálódó vegyi anyagok vizsgálata esetén. Az OECD iránymutatása (11) további útmutatást ad olyan vegyi anyagok vizsgálatához, amelyek fizikai-kémiai tulajdonságaiknál fogva nehezen vizsgálhatók.
A VIZSGÁLAT ÉRVÉNYESSÉGE
11. Ahhoz, hogy a vizsgálati eredmények érvényesek legyenek, a hajtások teljes hossza átlagának és a hajtások teljes nedves tömege átlagának a kontrollnövényekben legalább meg kell kétszereződnie a vizsgálat expozíciós fázisában. Ezenfelül a kontrollnövények nem mutathatják klorózis látható jeleit, és azoknak láthatóan mentesnek kell lenniük a más szervezetek általi szennyezésektől, pl. algáktól és/vagy baktériumrétegektől a növényen, az üledék felszínén és a vizsgálati közegben.
12. A hozam variációs koefficiensének átlaga a hajtások nedves tömegének a mérése alapján (azaz a vizsgálat kezdete és vége között) a kontrolltenyészetekben nem haladhatja meg a 35 %-ot a párhuzamosok között.
REFERENCIA-VEGYIANYAG
13. A vizsgálati eljárás időbeli teljesítményének ellenőrzéseként a vizsgálatot időszakonként el kell végezni referencia-vegyianyaggal (referencia-vegyianyagokkal), például a laboratóriumok közötti összehasonlításban (9) használt 3,5-diklór-fenollal. A laboratóriumok közötti összehasonlításból származó adatok arra utalnak, hogy a 3,5-DCP EC50 átlagai a különböző hatásváltozók tekintetében 4,7 és 6,1 mg/l között voltak (az ezen értékek körüli, előrejelzett konfidencia-intervallum részletei tekintetében lásd a laboratóriumok közötti összehasonlításról szóló jelentést). Referencia-vegyianyaggal legalább évente kétszer (ha rendszertelenül végeznek vizsgálatot, akkor a végleges toxicitási vizsgálatokkal párhuzamosan) ajánlott vizsgálatot végezni. A 3,5-DCP várható EC50 értékeihez kapcsolódó útmutató megtalálható a nemzetközi laboratóriumok közötti összehasonlítás statisztikai jelentésében (9).
A MÓDSZER ISMERTETÉSE
Vizsgálati felszerelés
14. A vizsgálatot szabályozott környezeti körülmények között, azaz növesztőkamrában, növesztőhelyiségben vagy laboratóriumban kell lefolytatni, ahol szabályozni lehet a nappali világosságot, a megvilágítást és a hőmérsékletet (lásd a vizsgálati körülményekre vonatkozó 56–58. pontot). A törzstenyészeteket a vizsgálati edényektől elkülönítetten kell tárolni.
15. A vizsgálatot üvegből készült vizsgálati edények, azaz akváriumok vagy főzőpoharak felhasználásával kell lefolytatni; szokásosan (megközelítőleg 24 cm magas és 11 cm átmérőjű) 2 l-es üveg főzőpoharak használatosak. Ugyanakkor más (azaz nagyobb) edények alkalmasak lehetnek, feltéve, hogy a víz elég mély a korlátlan növekedéshez és ahhoz, hogy a növények a vizsgálat teljes időtartama alatt víz alatt legyenek.
16. (Megközelítőleg 9 cm átmérőjű, 8 cm magas és 500 ml térfogatú) műanyag vagy üveg növénytálak használhatók a növények üledékbe történő ültetésére. Vagylagosan üveg főzőpoharak használhatók, és egyes esetekben ezek előnyben részesítendők (pl. víztaszító vagy magas Kow értékkel rendelkező vegyi anyagok vizsgálata esetén).
17. A növénytál/főzőpohár méretének megválasztását mérlegelni kell a vizsgálati edény és az előnyben részesített vizsgálati tervvel együtt (lásd alább). Az A. vizsgálati terv esetén (növénytálanként egy hajtás, edényenként három tállal) kisebb tálakra vagy nagyobb edényekre lehet szükség. A B. vizsgálati terv esetén (növénytálanként három hajtás, edényenként egy tállal) az említett tálaknak és edényeknek megfelelőnek kell lenniük. Mindenesetre a vízmélységnek 12 cm-rel az üledék teteje felett kell lennie, és az üledék felszínének/térfogatának vízfelszínhez/térfogathoz viszonyított arányát rögzíteni kell.
Vizsgálati szervezet
18. Az ebben a vizsgálati módszerben leírt általános megközelítések egy sor vízinövényfaj vizsgálatára alkalmazhatók. Ugyanakkor az e vizsgálati módszerben ismertetett körülményeket a süllőhínárfaj, a Myriophyllum spicatum vizsgálatához igazították. Ez a faj a Haloragaceae kétszikűek családjába tartozik.
19. A Myriophyllum spicatum (eurázsiai süllőhínár) víz alatti, gyökérrel rendelkező faj, amely körülmények széles skáláját elviseli, és megtalálható mind az álló-, mind a folyóvizekben. A M. spicatum évelő növény, amely a gyökeréig elhal a tél folyamán. A növények általában szabadon virágoznak és hoznak magot, jóllehet a megtelepedés elsődleges módszere a hónaljrügyek vegetatív szaporodása vagy a természetesen vagy behatásra leváló szárrészek.
A vizsgálati szervezet tenyésztése
20. A növények beszerezhetők természetes populációkból vagy vízinövény-beszállítóktól. A növények eredetét mindkét esetben dokumentálni kell, és a fajok azonosságáról meg kell győződni. Nagyfokú gondossággal kell eljárni annak biztosítása érdekében, hogy a megfelelő fajt találják meg a Myriophyllum spicatum terepről való begyűjtésekor, különösen azokon a területeken, ahol az más Myriophyllum fajokkal hibridet alkothat. Kétség esetén ajánlott az ismert forrásból származó, ellenőrzött laboratóriumi tenyészeteket alkalmazni. E vizsgálatban nem használhatók vegyi szennyező anyagnak kitett vagy olyan terepről begyűjtött növények, amelyek szennyezettsége tudott.
21. Azokban a régiókban, ahol a M. spicatum nem áll azonnal rendelkezésre a téli hónapokban, a törzstenyészet hosszú távú fenntartására lehet szükség üvegházban vagy laboratóriumi körülmények között. A törzstenyészetet a vizsgálati körülményekhez hasonló feltételek mellett kell tartani, noha az irradiancia és a hőmérséklet csökkenthető annak érdekében, hogy mérsékelni lehessen a tenyészet kezelésének gyakoriságát (pl. ha egy időre nem terveznek Myriophyllum vizsgálatot). Ajánlott a vizsgálatban alkalmazandóknál nagyobb akváriumokat és növénytálakat használni, hogy teret biztosítsanak a burjánzáshoz. Az üledék és a vizes közeg összetételének meg kell egyeznie a vizsgálat során alkalmazandóval, jóllehet az üledék trágyázásának alternatív módszereit is el lehet fogadni (pl. kereskedelmi forgalomban kapható, lassú kibocsátású műtrágya-készítmények használata).
22. A törzsnövényeknek láthatóan mentesnek kell lenniük minden más szervezet, köztük csigák, szálas algák, gombák és rovarok, pl. a Paraponyx stratiotata moly petéi vagy lárvái, vagy az ormányosbogár-félék közé tartozó Eubrychius velutus lárvái vagy felnőtt egyedei általi szennyezéstől. A látható szennyeződés eltávolítása érdekében szükség lehet a növényanyag friss vízzel való leöblítésére. Ezenfelül törekedni kell az egysejtű algák és baktériumok általi szennyezés kialakulásának minimalizálására, jóllehet a növényanyagnak nem szükséges teljesen sterilinek lennie. A törzstenyészetet ellenőrizni kell, és szükség esetén át kell ültetni az algák és baktériumok általi szennyezés kialakulásának elkerülése érdekében. A törzstenyészet levegőztetése előnyös lehet, ha problémát jelent az algák és baktériumok általi szennyezés.
23. A növényeket mindenesetre a vizsgálatban alkalmazandóhoz hasonló, de azzal nem feltétlenül azonos körülmények között kell tenyészteni/akklimatizálni, a vizsgálatban való felhasználásukat megelőzően megfelelő ideig (azaz több mint két hétig).
24. Virágzó törzstenyészet nem használható a vizsgálatban, mivel a vegetatív növekedési sebesség általában csökken a virágzás alatt és azt követően.
Üledék
25. E vizsgálat során az alábbi, az e melléklet C.28. vizsgálati módszerében (8) alkalmazott mesterséges üledék alapján készített üledék alkalmazása ajánlott. Az üledéket a C.28. vizsgálati módszerben leírtak szerint kell elkészíteni, kivéve a tápanyagok alábbiak szerint leírt hozzáadását:
(a) 4–5 % (száraz tömeg, 2 ± 0,5 % szerves szénnek megfelelően) tőzeg, amelynek pH-ja a lehető legközelebb esik az 5,5–6,0 értékhez; fontos, hogy por alakú, finomra őrölt (részecskeméret lehetőleg < 1 mm) és kizárólag levegőn szárított tőzeget használjanak.
(b) 20 % (száraz tömeg) kaolinagyag (lehetőleg 30 % feletti kaolinittartalommal).
(c) 75–76 % (száraz tömeg) kvarchomok (túlnyomó részben finom homok, amely részecskéinek több mint 50 %-a 50 és 200 μm közötti szemcsemérettel rendelkezik).
(d) Vizes táptalajt kell hozzáadni, oly módon, hogy a végleges üledéktétel 200 mg ammónium-kloridot és nátrium-foszfátot tartalmazzon az üledék száraz tömegének kg-jára számítva, és a végső keverék nedvességtartalma a 30–50 %-os tartományba essen.
(e) A végtermékként kapott üledékkeverék pH-jának 7,0 ± 0,5 értékre történő beállításához vegytiszta minőségű kalcium-karbonátot (CaCO3) kell adni.
26. A tőzegnek, a kaolinagyagnak és a homoknak ismert forrásból kell származnia, és azt dokumentálni kell. Ha az eredet ismeretlen vagy bizonyos mértékig aggályos, ellenőrizni kell, hogy az üledék összetevőiben nem fordulnak-e elő kémiai szennyeződések (például nehézfémek, szerves klórvegyületek, szerves foszforvegyületek stb.).
27. Az üledék száraz alkotóelemeit egyenletesen el kell keverni, mielőtt a vizes tápoldatot alaposan az üledékbe kevernék. A nedves üledéket legalább két nappal a felhasználás előtt kell elkészíteni, hogy a tőzeg jól átitatódjon, és hogy ne lebegjenek víztaszító tőzegrészecskék a felszínen, amikor az üledékre ráöntik a közeget; felhasználás előtt a nedves üledéket sötét helyen kell tárolni.
28. A vizsgálathoz az üledéket megfelelő méretű tartályokba, például az üvegedényekbe beilleszthető átmérőjű növénytálakba kell helyezni (az üledék felületének legalább az edény felületének 70 %-át le kell fednie). Abban az esetben, ha a tartály alján lyukak találhatók, a tartály aljára helyezett szűrőpapír segít abban, hogy az üledék a tartályban maradjon. A tálakat oly módon kell megtölteni az üledékkel, hogy az üledék felülete egyenletes legyen, mielőtt azt vékony rétegben (~ 2–3 mm) befednék semleges anyaggal, például homokkal, vagy kertészeti aprókaviccsal (vagy zúzott korallal), ami a helyén tartja az üledéket.
Vizsgálati közeg
29. Smart- és Barko-féle közeg (12) ajánlott Myriophyllum spicatum tenyésztésére és vizsgálatára. E közegek elkészítését az 1. függelék ismerteti. A közegek pH-ja (vizes fázis) a vizsgálat kezdetén 7,5–8,0 között kell, hogy legyen a növények optimális növekedéséhez.
Kísérleti terv
30. A vizsgálatot legalább hat párhuzamos vizsgálati edényen kell elvégezni a nem kezelt kontroll, és legalább négy párhuzamos edényen az öt koncentrációszint mindegyike tekintetében.
31. Ha nem kell meghatározni az NOEC értékét, a vizsgálati terv módosítható oly módon, hogy több koncentrációt, de koncentrációnként kevesebb párhuzamost tartalmazzon.
32. Az egyes vizsgálati edények három hajtást tartalmazó párhuzamost jelentenek. Az egyes vizsgálati edényekben kétféleképpen lehet három hajtást nevelni:
— Az A. vizsgálati terv esetén növénytálanként egy hajtás, edényenként három tállal.
— A B. vizsgálati terv esetén növénytálanként három hajtás, edényenként egy tállal.
— Alternatív vizsgálati terv (növénytálanként egy hajtás és edényenként egy tál) is elfogadható, feltéve hogy a párhuzamosokat az előírt érvényességi kritérium teljesítéséhez szükséges módon kiigazítják.
33. Az egyes vizsgálati edényeket véletlenszerűen kell a kezelt csoportokba osztani. A vizsgálat helyén a vizsgálati edényeket véletlenszerű elrendezésben kell elhelyezni annak érdekében, hogy a fényerősség és a hőmérséklet térbeli változatossága minél kisebb hatást gyakoroljon a vizsgálatokra.
A vizsgálati vegyi anyag koncentrációi és kontrollcsoportok
34. A koncentrációknak szokásosan mértani sort kell alkotniuk, ahol a vizsgálati koncentrációk közötti szorzótényező nem haladhatja meg a 3,2-t. A vizsgálati vegyi anyag toxikus hatásának előzetes ismerete, amely származhat dózisbehatároló vizsgálatból, segít a megfelelő vizsgálati koncentrációk kiválasztásában.
35. Az ECx meghatározásához a megfelelő konfidenciaszint biztosítása érdekében a vizsgálati koncentrációknak közre kell fogniuk az ECx értéket. Az EC50 érték becslésekor például a legmagasabb vizsgálati koncentrációnak nagyobbnak kell lennie az EC50 értéknél. Ha az EC50 érték kívül esik a vizsgálati koncentrációk tartományán, akkor a kiadódó konfidencia-intervallumok tágak lesznek, és előfordulhat, hogy nem végezhető el a modell statisztikai illeszkedésének megfelelő értékelése. Több vizsgálati koncentráció alkalmazása javítja a kapott ECx érték körüli konfidencia-intervallumot.
36. LOEC és/vagy NOEC (opcionális végpont) meghatározása esetén a legalacsonyabb vizsgálati koncentráció legyen elegendően alacsony ahhoz, hogy a növekedés ne különbözzön jelentősen a kontrollcsoportétól. Emellett a legmagasabb vizsgálati koncentráció legyen elegendően nagy ahhoz, hogy a növekedés jelentősen kisebb legyen, mint a kontrollcsoportban. Több párhuzamos alkalmazása javítja a megfigyelhető hatást nem okozó koncentráción alapuló/ANOVA-t alkalmazó terv statisztikai erejét.
Határérték-vizsgálat
37. Azokban az esetekben, ahol a dózisbehatároló vizsgálatok azt jelzik, hogy a vizsgálati vegyi anyag 100 mg/l koncentrációig vagy az adott vizsgálati közegben való oldhatósági határig, illetőleg készítmény esetén a diszpergálóképesség határáig nem okoz káros hatást, akkor egy kontrollcsoport és egyetlen (100 mg/l koncentrációnak vagy az adott vizsgálati oldatban való oldhatósági határhoz tartozó koncentrációnak, vagy a száraz üledékben 1000 mg/kg koncentrációnak megfelelő) kezelt csoport válaszai összehasonlításának megkönnyítése érdekében határérték-vizsgálat végezhető. Ennek a vizsgálatnak egy standard dózisbehatároló vizsgálat általános elveit kell követnie, azzal a kivétellel, hogy tanácsos a párhuzamosok minimális számát hat vizsgálati edényre növelni kontroll- és koncentrációnak kitett csoportonként. A kontrollcsoportban és a kezelt csoportban tapasztalt növekedés olyan statisztikai próbával (például a Student-féle t-próbával) elemezhető, amely az átlagok összehasonlításán alapul.
Vizsgálati oldatok
38. A vizsgálati oldatokat szokásosan a törzsoldat hígításával készítik el, amelyhez a vizsgálati vegyi anyagot ásványmentesített (azaz desztillált vagy ioncserélt) víz felhasználásával Smart- és Barko-féle közegben kell feloldani vagy diszpergálni (lásd az 1. függeléket).
39. A legmagasabb vizsgálati koncentráció általában ne haladja meg a vizsgálati vegyi anyag vizsgálati körülmények között érvényesülő vízoldékonyságát, vagy készítmények esetén a diszpergálóképességét.
40. Vízben kis mértékben oldódó vizsgálati vegyi anyag esetén szükséges lehet szerves oldó- vagy diszpergálószer alkalmazásával nagy koncentrációjú törzsoldatot vagy -diszperziót készíteni annak érdekében, hogy könnyebb legyen a vizsgálati vegyi anyagból a pontos mennyiséget a vizsgálati közegbe adagolni, és könnyebben végbemenjen a diszperzióképződés és az oldódás. Ilyen oldószerek vagy diszpergálószerek alkalmazását lehetőség szerint kerülni kell. A segédoldószer vagy -diszpergálószer alkalmazása nem járhat fitotoxikus hatással. A széles körben alkalmazott oldószerek közül például az aceton vagy a dimetil-formamid 100 μl/l koncentrációig nem okoz fitotoxikus hatást. Az esetleg alkalmazott oldó- vagy diszpergálószer végső koncentrációja – amelyet a dokumentálni kell – a lehető legalacsonyabb kell, hogy legyen (≤100 μl/l). Ilyen esetekben az oldó- vagy diszpergálószert a kezelt és a(z oldószeres) kontroll esetében azonos koncentrációban kell alkalmazni. A vizsgálati terv ki kell terjedjen olyan nem kezelt kontroll párhuzamosokra is, amelyek nem tartalmaznak oldószert vagy diszepergálószert. Az OECD-iránymutatás (11) bővebb útmutatást ad a diszpergálószerekre vonatkozóan.
VIZSGÁLATI ELJÁRÁS
41. A vizsgálati eljárást a vizsgálati vegyi anyag alkalmazási útja határozza meg (azaz, hogy az alkalmazásra a vizes vagy az üledékes fázisban kerül-e sor). A vizsgálati vegyi anyag víz–üledék rendszerbeli viselkedését meg kell fontolni a vizsgálatban alkalmazandó expozíciós rendszer megalapozott megválasztásának érdekében (statikus vagy statikus oldatcserés, vizsgálati vegyi anyaggal kiegészített víz vagy üledék). A vizsgálati vegyi anyaggal kiegészített üledéken alapuló vizsgálat előnyben részesítendő bizonyos esetekben olyan vegyi anyagoknál, amelyek előreláthatóan jelentősen válnának ki az üledékbe.
Telepítési fázis
42. A tenyésztett növényekről egészséges hajtáscsúcsokat, azaz oldalhajtások nélkül, kell levágni nagyjából 6 cm (± 1 cm) hajtáshosszig. Az A. vizsgálati terv esetén (növénytálanként egy hajtás, edényenként három tállal) az egyes hajtáscsúcsokat egyenként ültetik a tálba. A B. vizsgálati terv esetén (növénytálanként három hajtás, edényenként egy tállal) az üledéket tartalmazó tálakba négy–öt hajtáscsúcsot ültetnek.
43. Mindkét esetben több tálat kell beültetni, hogy a vizsgálat kezdetén egységes növényeket lehessen választani, és hogy legyenek tartalék növények, amelyeket fel lehet használni a gyökérnövekedés közvetlenül a vizsgálat előtt történő megfigyelésére, továbbá a hajtás élőanyag-tömegének és hosszának a 0. napon történő megmérésére.
44. A hajtásokat úgy kell behelyezni, hogy megközelítőleg 3 cm, amely legalább két nóduszt jelent, az üledék felszíne alatt legyen.
45. A növénytálakat ezt követően át kell helyezni a vizsgálati edényekbe, ugyanolyan körülmények közé, mint az expozíciós fázisban, és azokat hét napig ott kell tartani Smart- és Barko-féle közegben a gyökérfejlődés beindítására.
46. Ezt követően a tartalék tálakban található több növényt ki kell venni a gyökérnövekedés vizsgálata érdekében. Ha gyökérnövekedés nem tapasztalható (azaz, ha a gyökércsúcsok nem láthatók), a telepítési fázist ki kell terjeszteni, amíg a gyökérnövekedés látható nem lesz. Ez a lépés ajánlott annak biztosítása érdekében, hogy a növények aktívan növekedjenek a vizsgálat megkezdése idején.
Egységes növényanyag megválasztása
47. Az A. vizsgálati terv esetén (növénytálanként egy hajtás, edényenként három tállal) a vizsgálat megkezdése előtt a tálakat egységességükre tekintettel választják ki. A B. vizsgálati terv esetén (növénytálanként három hajtás, edényenként egy tállal) a felesleges növényeket eltávolítják, és három növényt hagynak meg, amelyek méretre és megjelenésre egységesek.
Vizes fázisú expozíció
48. Az egységességre tekintettel kiválasztott tálakat a vizsgálati edényekbe helyezik, amint azt a kísérleti terv előírja. Ekkor a vizsgálati edényekbe Smart- és Barko-féle közeget kell tölteni. Gondosan kerülni kell az üledék felkavarását. Ebből a célból a közeget be lehet adni tölcsér felhasználásával, vagy műanyag lemezzel le lehet fedni az üledéket, amíg a közeget beleöntik a vizsgálati edényekbe, feltéve, hogy a lemezt közvetlenül ez után eltávolítják. Vagylagosan a növénytálak behelyezhetők a vizsgálati edényekbe a közeg hozzáadását követően is. Mindkét esetben friss közeg használható az expozíciós fázis kezdetén, ha szükséges az alga- és baktériumképződés minimalizálása érdekében, vagy annak lehetővé tételére, hogy a párhuzamosokhoz külön adagokban készítsék el a vizsgálati oldatot.
49. Az üledék feletti hajtáshosszt vagy a közeg beadása előtt vagy az után kell megmérni.
50. A vizsgálati vegyi anyag megfelelő mennyiségei azelőtt hozzáadhatók a vizsgálati közeghez, mielőtt azt a vizsgálati edényekbe töltenék. Vagylagosan a vizsgálati vegyi anyag azután is hozzáadható a vizsgálati közeghez, miután azt a vizsgálati edényekbe töltötték. Ebben az esetben ügyelni kell annak biztosítására, hogy a vizsgálati vegyi anyag egyenletesen oszoljon el a vizsgálati rendszerben, és kerülni kell az üledék felkavarását.
51. A vizsgálati közeg megjelenését (pl. tiszta, zavaros stb.) minden esetben fel kell jegyezni a vizsgálat kezdetén.
Üledék útján végzett expozíció
52. A kiválasztott koncentrációjú, vegyi anyaggal kiegészített üledéket rendszerint a vizsgálati vegyi anyag oldatának közvetlenül a friss üledékhez történő hozzáadásával készítik el. Az ioncserélt vízben feloldott vizsgálati vegyi anyag törzsoldatát őrlőmalommal, tápkeverővel vagy kézi keveréssel kell elkeverni az elkészített üledékkel. Ha a vizsgálati vegyi anyag csekély mértékben vízoldékony, a lehető legkisebb mennyiségű alkalmas szerves oldószerben (pl. hexán, aceton vagy kloroform) is feloldható. Ezt az oldatot ezt követően egy vizsgálati edényre számítva körülbelül 10 g finom kvarchomokkal kell elkeverni. Az oldószert hagyni kell elpárologni, ezt követően a homokot megfelelő mennyiségű üledékkel kell elkeverni vizsgálati főzőpoharanként. Csak könnyen illékony szerek használhatók fel a vizsgálati vegyi anyag szolubilizálására, diszpergálására vagy emulgeálására. Szem előtt kell tartani, hogy a vizsgálati vegyi anyaggal kiegészített homok tömegét/térfogatát figyelembe kell venni az üledék végleges elkészítésekor (azaz így az üledéket kevesebb homokkal kell elkészíteni). Gondoskodni kell annak biztosításáról, hogy a vizsgálati vegyi anyag teljesen és egyenletesen eloszoljon az üledékben.
53. A vizsgálati vegyi anyaggal kiegészített üledéket be kell tölteni a növénytálakba (a fent leírtak szerint). Az egységességre és megfelelő gyökérrendszerre tekintettel kiválasztott növényeket ki kell venni a telepítési fázisban használt tálakból és át kell ültetni a vegyi anyaggal kiegészített üledékbe, a fent leírtak szerint.
54. A tálakat a vizsgálati edényekbe kell helyezni, amint azt a kísérleti terv előírja. A Smart- és a Barko-féle közeget ezt követően – az üledék felkavarásának elkerülése érdekében – óvatosan (azaz tölcsérrel) kell hozzáadni. Az üledék feletti hajtáshosszt vagy a közegek beadása előtt, vagy az után kell megmérni.
A vízszint fenntartása a vizsgálat alatt
55. A végleges vízszintet rögzíteni kell, és azt minden edényen meg kell jelölni. Ha a víz több mint 10 %-a elpárolog a vizsgálat során, a vízszintet desztillált vízzel kell kiigazítani. Szükség esetén a főzőlombikokat lazán le lehet fedni átlátszó fedővel, például átlátszó műanyag fedővel, hogy minimálisra mérsékeljék a párolgást és az algaspórákkal való szennyezést.
Vizsgálati körülmények
56. Meleg- és/vagy hidegfehér fluoreszkáló megvilágítást kell alkalmazni oly módon, hogy a fotoszintetikusan aktív sugárzásban (400–700 nm), a víz felszínén mért irradiancia 140 (± 20) μE·m–2 s–1 legyen; a fény/sötét ciklusnak pedig 16/8 órásnak kell lennie. A választott irradiancia eltérései a vizsgálati területen nem haladhatják meg a ± 15 %-ot.
57. A vizsgálati edényekben a hőmérséklet 20 ± 2 °C legyen.
58. A vizsgálat során a kontrolltenyészet közegének pH-értéke nem növekedhet 1,5-nél nagyobb mértékben. Az 1,5-nél nagyobb eltérés ugyanakkor nem teszi érvénytelenné a vizsgálatot, ha igazolható, hogy a korábban meghatározott érvényességi feltételek teljesülnek.
A vizsgálat időtartama
59. Az expozíció időtartama 14 nap.
Mérések és analitikai meghatározások
60. A telepítési fázist követően és közvetlenül a kezelés előtt (azaz a 0. napon) a tálankénti három növénnyel jellemzett terv esetén öt, a tálankénti egy növénnyel jellemzett terv esetén 15 véletlenszerűen kiválasztott tálból származó tartaléknövényt vesznek ki a hajtáshossz, továbbá a nedves és száraz tömeg mérésére az alább leírtak szerint.
61. Az expozíciós fázisba áthelyezett növények esetében az 1. táblázatban bemutatott következő értékeléseket végzik el:
— A fő hajtás hosszát, az oldalhajtások számát és hosszát legalább az expozíciós fázis végén (pl. a 14. napon) meghatározzák és rögzítik.
— A növények egészségének vizuális értékelését legalább háromszor rögzíteni kell az expozíciós időszakban (pl. a 0., 7. és 14. napon).
— A hajtások nedves és száraz tömegét legalább az expozíciós fázis végén (pl. a 14. napon) meghatározzák és rögzítik.
62. A hajtás hosszát vonalzóval kell megmérni. Ha oldalhajtások is vannak, számukat és hosszukat is meg kell állapítani.
63. A növények egészségének vizuális értékelése során rögzítik a növények megjelenését és a vizsgálati közeg általános állapotát. A feljegyezendő észrevételek a következők:
— Nekrózis, klorózis vagy más elszíneződés, például a kontrollnövényekhez viszonyított túlzott pirosodás.
— Bakteriális vagy algafertőzés kialakulása;
— Növekedési rendellenességek, például satnyulás, megváltozott nóduszok közötti távolság, torz hajtások/levelek, oldalhajtások elburjánzása, levélhullás, a normális szövetrugalmasság elvesztése és a szár töredezése.
— A gyökerek egészségének vizuális értékelésére a vizsgálat végén kerül sor, ennek alkalmával alaposan le kell mosni a gyökerekről az üledéket, hogy lehetővé váljon a gyökérrendszer megfigyelése. A kontrollnövényekhez viszonyított értékelés ajánlott lépései az alábbiakban láthatók:
—
1) hiányzó gyökerek
2) kevés gyökér
3) csekély mértékű gyökérfejlődés
4) kiváló gyökérfejlődés, a kontrollokéhoz hasonlóan
64. A nedves tömeget a vizsgálat kezdetekor és végén kell meghatározni úgy, hogy levágják a hajtást az üledék szintjén, majd a tömeg mérése előtt szárazra itatják. Vigyázni kell arra, hogy az üledék részecskéi ne tapadjanak a hajtás aljához. A hajtásanyagot ezt követően nagyjából 60 °C-ra beállított szárító sütőbe helyezik, és állandó tömegűre szárítják a tömeg újbóli megmérése előtt, majd a száraz tömeget rögzítik.
65. A vizsgálat ideje alatt előírt minimális biológiai értékeléseket az 1. táblázat foglalja össze.
1. táblázat
Értékelési ütemterv
|
A kezelést követő nap (k.k.n.) |
Myriophyllum spicatum |
|||
|
A hajtás hossza, az oldalhajtások hossza és száma |
A hajtások vizuális értékelése |
A hajtások nedves és száraz tömege A gyökerek vizuális értékelése |
pH O2 |
|
|
0 |
A |
A |
A |
A |
|
4 |
— |
— |
— |
— |
|
7 |
— |
A |
— |
A |
|
14 |
A |
A |
A |
A |
|
A: arra utal, hogy ezen alkalmakkor értékelésre van szükség —: arra utal, hogy nincs szükség mérésekre |
||||
A mérések és az analitikai meghatározások gyakorisága
66. A növesztőkamrában, az inkubátorban vagy a vizsgálati helyiségben azonos körülmények között tartott további edényben legalább naponta (vagy adatgyűjtő egységgel folyamatosan) mérni kell a közeg hőmérsékletét.
67. A vizsgálati közeg pH-ját és oldottoxigén-koncentrációját a vizsgálat kezdetén, legalább egyszer a vizsgálat során és a vizsgálat végén valamennyi párhuzamos edényben mérni kell. Az egyes alkalmakkor a méréseket a nap ugyanazon időpontjában kell végezni. Ha az egyes vizsgálati koncentrációk valamennyi párhuzamosának elkészítéséhez egyetlen, nagy tételben készített oldatot használnak, akkor elfogadható, hogy a 0. napon csak ezt az oldatot mérjék.
68. Az irradianciát a növesztőkamrában, az inkubátorban vagy a vizsgálati helyiségben a vízfelszín szintjével megegyező távolságban elhelyezkedő pontokban kell mérni. A méréseket a vizsgálat kezdetén vagy a vizsgálat során legalább egyszer kell mérni. A fényerősség érzékelésére és mérésére szolgáló módszer, különösen pedig a fényérzékelő befolyásolja a mért értéket. A gömbérzékelők (amelyek a mérési sík alatt és felett tetszőleges irányból érkező fény mérésére alkalmasak) és a „koszinuszos” érzékelők (amelyek csak a mérési sík felett tetszőleges irányból érkező fény mérésére alkalmasak) előnyben részesítendők az egytengelyű érzékelőkkel szemben, mert az e módszerben előírt többpontos fényforrás esetén nagyobb értékeket szolgáltatnak.
A vizsgálati vegyi anyag analitikai mérései
69. A vizsgálati vegyi anyag helyes alkalmazását a vizsgálati vegyi anyag koncentrációinak analitikai méréseivel kell alátámasztani.
70. Valamennyi vizsgálati koncentráció tekintetében vízmintákat kell gyűjteni a vizsgálati vegyi anyag analizálásához röviddel a vizsgálat megkezdését követően (azaz a stabil vizsgálati vegyi anyagok esetén azok alkalmazásának napján vagy nem stabil vizsgálati vegyi anyagok esetén az alkalmazást követő egy órával) és a vizsgálat végén.
71. Az üledékben és az üledék pórusvizében lévő koncentrációt a vizsgálat kezdetén és végén meg kell határozni, legalább a legmagasabb vizsgálati koncentrációnál, kivéve, ha a vizsgálati vegyi anyag ismerten stabil a vízben (> a névleges 80 %-ánál). Az üledékre és a pórusvízre vonatkozó mérések nem feltétlenül szükségesek abban az esetben, ha a vizsgálati vegyi anyag megoszlása a víz és az üledék között egyértelműen meghatározható egy – például az üledék vízhez viszonyított aránya, az alkalmazás típusa, az üledék típusa tekintetében – összehasonlítható körülmények között végzett víz/üledék vizsgálat segítségével.
72. Az üledék vizsgálat kezdetekori mintavételezése valószínűleg megzavarja a vizsgálati rendszert. Így további kezelt vizsgálati edényre lehet szükség a vizsgálat kezdetekori és végi analitikai meghatározások megkönnyítése érdekében. Hasonlóképpen, ha a vizsgálat közben is szükségesnek tekintenek értékeléseket (például a 7. napon), és az analízishez nagy üledékminták szükségesek, amelyek nem gyűjthetők be könnyen a vizsgálati rendszerből, az analitikai meghatározásokat a biológiai értékelésekhez alkalmazottal azonos kezelésnek alávetett külön vizsgálati edények használatával kell elvégezni.
73. A szemcseközi víz izolálásához például 10 000 g intenzitással történő centrifugálás javasolt 4 °C-on 30 percig. Amennyiben azonban bizonyított, hogy a vizsgálati vegyi anyag nem adszorbeálódik a szűrőre, a szűrés is elfogadható lehet. Ha a minta mérete túl kicsi, akkor előfordulhat, hogy nem analizálható a koncentráció a pórusvízben.
74. Félstatikus vizsgálat esetén (azaz a vizes fázisú expozíció során), ha a vizsgálati vegyi anyag(ok) koncentrációja várhatóan nem marad a névleges koncentráció 20 %-os tartományában a vizsgálat ideje alatt a vizsgálati oldat cseréje nélkül, akkor minden használt és friss vizsgálati oldatot minden csere alkalmával mintavételezni kell a vizsgálati vegyi anyag koncentrációjának analizálása érdekében.
75. Olyan vizsgálatok esetén, amelyekben a vizsgálati vegyi anyag mért kezdeti koncentrációja ugyan nem a névleges koncentráció ± 20 %-os tartományában van, de kellően bizonyítható, hogy a kezdeti koncentrációk megismételhetők és stabilak (azaz a kezdeti koncentráció 80–120 %-os tartományában vannak), akkor a kémiai meghatározásokat elegendő csak a legalacsonyabb és a legmagasabb vizsgálati koncentráción elvégezni.
76. Mindegyik esetben a vizsgálati vegyi anyag koncentrációjának a meghatározását minden egyes vizsgálati koncentráció egyetlen párhuzamos edényén kell elvégezni. Vagylagosan az egyes vizsgálati koncentrációk valamennyi párhuzamosának vizsgálati oldata összevonható analizálásra.
77. Ha bizonyított, hogy a vizsgálati vegyi anyag koncentrációja a névleges koncentráció vagy a mért kezdeti koncentráció 20 %-án belül marad a vizsgálat során, akkor az eredmények értékelése és a végpontok ezt követő származtatása alapulhat a névleges értéken vagy a mért kezdeti értéken.
78. Ezen esetekben a hatásos koncentrációknak a vizsgálat kezdetekori névleges vagy mért vízkoncentrációkon kel alapulniuk.
79. Ugyanakkor, ha bizonyított, hogy a koncentráció csökkent (azaz nem maradt meg a névleges vagy a mért kezdeti koncentráció 20 %-án belül a kezelt kamrában) a vizsgálat alatt, akkor az eredményeket az expozíció idején érvényes koncentrációértékek mértani középértéke vagy a vizsgálati vegyi anyag koncentrációjának a kezelt kamrában történő csökkenését leíró modellek alapján kell elemezni (11).
AZ ADATOK ÉRTÉKELÉSE
80. Ha oldószer/diszpergálószer alkalmazására van szükség, az oldószeres és a nem kezelt kontrollból származó adatok összevonhatók a statisztikai elemzés céljaira, feltéve, hogy az oldószeres és a nem kezelt kontroll válaszai statisztikailag szignifikánsan nem térnek el.
Hatásváltozók
81. A vizsgálat célja annak meghatározása, milyen hatást gyakorol a vizsgálati vegyi anyag a vizsgálati fajok vegetatív növekedésére; ehhez az alábbiak szerint két hatásváltozót használnak, amelyek az átlagos fajlagos növekedési sebesség és a hozam:
Átlagos fajlagos növekedési sebesség
82. Ez a hatásváltozó a hajtások teljes hosszának, a hajtások teljes nedves tömegének és a hajtások teljes száraz tömegének logaritmusai kontrollokban és egyes kezelt csoportokban bekövetkezett időbeli változásain alapul. Ezt a változót az egyes kontroll- és kezelt csoportok minden párhuzamosára ki kell számítani. A vizsgálati edényenkénti (párhuzamosonkénti) három növény hosszának és tömegének átlagát, majd az egyes párhuzamosokra jellemző növekedési sebességet az alábbi képlettel kell kiszámítani:

ahol:
|
μi-j |
: |
az átlagos fajlagos növekedési sebesség az „i”-től a „j” időpillanatig |
|
Ni |
: |
a mérési változó értéke a vizsgálati vagy a kontrolledényben az „i” időpillanatban |
|
Nj |
: |
a mérési változó értéke a vizsgálati vagy a kontrolledényben a „j” időpillanatban |
|
t |
: |
az „i”-től „j”-ig terjedő időtartam. |
83. A párhuzamosok válaszaiból ki kell számítani a növekedési sebesség átlagértékét, valamint a szórásnégyzet becsléseit minden egyes kezelt és kontrollcsoport tekintetében.
84. Az átlagos fajlagos növekedési sebességet a vizsgálat teljes időtartamára kell meghatározni (tehát úgy, hogy a fenti összefüggésben „i” a vizsgálat kezdetét, „j” a vizsgálat végét jelöli). Minden egyes vizsgálati koncentrációra és kontrollcsoportra meg kell határozni az átlagos fajlagos növekedési sebesség átlagát, és meg kell becsülni a szórásnégyzetet.
85. A növekedési sebesség százalékos gátlását (Ir) ezután vizsgálati koncentrációnként (kezelt csoportonként) a következő összefüggésből kell meghatározni:

ahol:
|
% Ir |
: |
az átlagos fajlagos növekedési sebesség százalékos gátlása |
|
μC |
: |
a μ átlaga a kontrollban |
|
μT |
: |
a μ átlaga a kezelt csoportban |
Hozam
86. Ez a hatásváltozó a hajtások teljes hosszának, a hajtások teljes nedves tömegének és a hajtások teljes száraz tömegének kontrollokban és egyes kezelt csoportokban bekövetkezett időbeli változásain alapul. Az átlagos százalékos hozamgátlás ( % Iy) kezelt csoportonként a következő összefüggésből határozható meg:

ahol:
|
% Iy |
: |
a hozam százalékos csökkenése |
|
bC |
: |
az élőanyag-tömeg végső értéke és kiindulási értéke közötti különbség a kontrollcsoportban |
|
bT |
: |
az élőanyag-tömeg végső értéke és kiindulási értéke közötti különbség a kezelt csoportban. |
A koncentráció–hatás görbék elkészítése
87. El kell készíteni a hatásváltozóhoz tartozó átlagos százalékos gátlás értékét (a fentiek szerint számított Ir, vagy Iy értéket) a vizsgálati koncentráció logaritmusa függvényében ábrázoló koncentráció–hatás görbéket.
ECx becslése
88. Az ECx (pl. EC50) becslését mind az átlagos fajlagos növekedési sebesség (ErCx), mind a hozam (EyCx) alapján el kell végezni, amelyeket viszont a hajtások teljes hosszából, teljes száraz tömegéből és teljes nedves tömegéből kell kiszámítani.
89. Megjegyzendő, hogy az e két hatásváltozó alapján számított ECx értékek nem hasonlíthatók egymáshoz, és a vizsgálatok eredményeinek felhasználása során erre a különbségre tekintettel kell lenni. Az e vizsgálati módszerben előírt vizsgálati körülmények betartása mellett a két számítási eljárás matematikai háttere következtében az átlagos fajlagos növekedési sebességen alapuló ECx értékek (ErCx) általában nagyobbra adódnak, mint a hozamon alapuló ECx értékek (EyCx). Ezt az eltérést nem szabad úgy értelmezni, hogy egyik hatásváltozó érzékenyebb lenne a másiknál; egyszerűen arról van szó, hogy a két érték matematikailag mást jelent.
Statisztikai eljárások
90. A statisztikai számítások célja, hogy regresszióanalízissel kvantitatív koncentráció–hatás összefüggést állítsanak elő. Alkalmazható súlyozott lineáris regresszió, a hatásadatok például probit-, logit- vagy Weibull-egységekbe történő lineáris transzformációja után (13), de célszerű előnyben részesíteni a nem lineáris regressziós technikákat, amelyek jobban kezelik az elkerülhetetlen adatszabálytalanságokat és az egyenletes eloszlástól való eltéréseket. Akár a nulla gátlás, akár a teljes gátlás közelében a transzformáció megsokszorozhat bizonyos szabálytalanságokat, ami hibás elemzést eredményezhet (13). Megjegyzendő, hogy a probit-, logit- vagy Weibull-transzformáltat alkalmazó szokásos számítási módszerek elsősorban kvantált (például mortalitás kontra túlélés) adatok feldolgozására alkalmasak, így módosítást igényelnek, ha a növekedési sebességre vagy a hozamra kívánják azokat alkalmazni. Az ECx-értékek folytonos adatokból való számítására alkalmas módszerek a (14), (15) (16) és (17) irodalomban találhatók.
91. Az egyes hatásváltozók elemzéséhez a koncentráció–válasz összefüggésből ki kell számítani az ECx egyes pontokban becsült értékét. Az egyes becslések 95 %-os konfidenciahatárait és a hatásadatok regressziós modellhez történő megfelelő illeszkedését (goodness of fit) grafikus vagy statisztikai módszerrel kell értékelni. A regresszióanalízist az egyes párhuzamosokon nyert hatásokkal, nem pedig a kezelt csoportok átlagaival kell elvégezni.
92. Az EC50 becsült értékeit és a konfidenciahatárokat bootstrap módszerrel együtt alkalmazott lineáris interpolációval (18) is meg lehet kapni, ha a rendelkezésre álló regressziós modellek/módszerek nem használhatók a kapott adatokkal.
93. Az LOEC, és így az NOEC becsült értékének előállítása érdekében varianciaanalízis (ANOVA) segítségével össze kell vetni az egyes kezelésekhez tartozó átlagokat. Az egyes koncentrációkhoz tartozó átlagokat ezután alkalmasan megválasztott vizsgálati módszerrel (pl. Dunnett vagy Williams-féle próbával) a kontrollcsoporton nyert átlagokhoz kell hasonlítani (19) (20) (21) (22). Ellenőrizni kell, hogy fennáll-e az ANOVA-nak a normális eloszlásra (ND) és a szórásnégyzetek homogenitására (VH) vonatkozó feltevése. Ez a Shapiro–Wilks-féle (ND) vagy Levene-féle (VH) próbával értékelendő. A normális eloszlásra és a szórásnégyzetek homogenitására vonatkozó feltevés nemteljesülése időnként kiküszöbölhető az adatok logaritmikus transzformálásával. Ha a szórásnégyzetek heterogenitása és/vagy a normális eloszlástól való eltérés szélsőségesnek bizonyul, és transzformációval nem javítható, akkor célszerű megfontolni például a Bonferroni-Welch-t-próba, a lefelé lépegető Jonkheere-féle trendpróba és a Bonferroni-féle medián próba alkalmazását. Az NOEC meghatározásához további útmutatás is található a (16) irodalomban.
JELENTÉSTÉTEL
94. A vizsgálati jegyzőkönyvnek a következőket kell tartalmaznia:
Vizsgálati vegyi anyag
Egy összetevőből álló anyag:
— fizikai megjelenés, vízoldékonyság és a további releváns fizikai-kémiai tulajdonságok;
— kémiai azonosítás, például IUPAC- vagy CAS-név, CAS-szám, SMILES- vagy InChI-kód, szerkezeti képlet, tisztaság, adott esetben és amennyiben a gyakorlatban megvalósítható, a szennyeződések kémiai azonossága stb.
Több összetevőből álló anyag, UVCB-k és keverékek:
— amennyiben lehetséges, az összetevők kémiai azonossága (lásd fent), mennyiségi előfordulása és releváns fizikai-kémiai tulajdonságai jellemzik.
A vizsgálathoz használt fajok
— tudományos név és eredet.
Vizsgálati körülmények
— a telepítési fázis időtartama;
— az alkalmazott vizsgálati eljárás (statikus, félstatikus vagy impulzusos;
— a vizsgálat megkezdésének időpontja és időtartama;
— a vizsgálati közeg, azaz üledék és folyékony táptalaj;
— a kísérleti terv ismertetése: növesztőkamra/helyiség vagy laboratórium, vizsgálati edények és fedők, oldattérfogatok, a vizsgálati növények hossza és tömege vizsgálati edényenként a vizsgálat megkezdésekor, az üledék felületének és a víz felületének a hányadosa, az üledék és a víz térfogatának hányadosa;
— vizsgálati koncentrációk (szükség szerint névleges és mért értékek) és párhuzamosok száma koncentrációnként;
— a törzsoldat és a vizsgálati oldatok elkészítésének módszere, az esetleg alkalmazott oldó- vagy diszpergálószer;
— hőmérséklet a vizsgálat folyamán;
— fényforrás, irradiancia (μE·m–2 s–1);
— a vizsgálati és a kontrollközeg pH-értéke, valamint a vizsgálati közeg megjelenése a vizsgálat kezdetén és végén;
— oxigénkoncentrációk;
— az analitikai módszer a megfelelő minőség-ellenőrzési adatokkal együtt (validálási vizsgálat, a szórás vagy az analízis konfidenciahatára);
— a mérési változók (pl. hossz, száraz tömeg, nedves tömeg) meghatározásának módszere;
— minden eltérés ettől a vizsgálati módszertől.
Eredmények
— nyers adatok: a növények hajtáshossza és -tömege tálanként és a további mérési változók minden egyes vizsgálati és kontrolledényben minden adatfelvételkor és analízis alkalmával, az 1. táblázatban megadott értékelési ütemterv szerint;
— az egyes mérési változók átlagai és szórásai;
— az egyes koncentrációk növekedési görbéi;
— a megkétszereződési idő/növekedési sebesség a kontrollban a hajtáshossz és a nedves tömeg alapján, ideértve a variációs koefficienst a nedves tömeg hozama tekintetében;
— hatásváltozók számított értéke minden kezelt replikátumra, továbbá az átlag és a variációs koefficiens a párhuzamosok tekintetében;
— a koncentráció–hatás összefüggés grafikus formában;
— a toxikus végpontok becslései a hatásváltozók tekintetében, pl. EC50, és a kapcsolódó konfidencia-intervallumok. ha kiszámították, az LOEC, illetve az NOEC értéke, továbbá a számításukhoz alkalmazott statisztikai módszer;
— ANOVA alkalmazása esetén a kimutatható hatás mértéke (például a legkisebb szignifikáns különbség);
— a kezelt csoportban észlelt esetleges növekedésserkentés;
— fitotoxicitásra utaló esetleges látható jelek, valamint a vizsgálati oldatokkal kapcsolatos észrevételek;
— az eredmények szöveges elemzése, beleértve az e vizsgálati módszertől való eltérések vizsgálat kimenetelére gyakorolt hatását.
SZAKIRODALOM
(1) E melléklet C.26. fejezete: Lemna sp. növekedésgátlási próba
(2) E melléklet C.3. fejezete: Növekedésgátlási próba, édesvízi alga és cianobaktérium.
(3) Maltby, L. et al. (2010), Aquatic Macrophyte Risk Assessment for Pesticides, Guidance from the AMRAP Workshop in Wageningen (NL), 14-16 January 2008.
(4) Arts, G.H.P. et al. (2008), Sensitivity of submersed freshwater macrophytes and endpoints in laboratory toxicity tests, Environmental Pollution, Vol. 153, pp. 199-206.
(5) ISO 16191:2013 Water quality – Determination of the toxic effect of sediment on the growth behaviour of Myriophyllum aquaticum.
(6) Knauer, K. et al. (2006), Methods for assessing the toxicity of herbicides to submersed aquatic plants, Pest Management Science, Vol. 62/8, pp. 715-722.
(7) E melléklet C.50. fejezete: Myriophyllum spicatummal végzett üledékmentes toxicitási vizsgálat.
(8) E melléklet C.28. fejezete: Vegyi anyaggal kiegészített vízzel végzett üledék–víz rendszerű toxicitási vizsgálat árvaszúnyoglárvákkal.
(9) Ratte, M., H. Ratte (2014), “Myriophyllum Toxicity Test: Result of a ring test using M. aquaticum and M. spicatum grown in a water-sediment system”, OECD Environment, Health and Safety Publications (EHS), Series on Testing and Assessment, No. 206, OECD Publishing, Paris.
(10) Davies, J. et al. (2003), Herbicide risk assessment for non-target aquatic plants: sulfosulfuron – a case study, Pest Management Science, Vol. 59/2, pp. 231 – 237.
(11) OECD (2000), “Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures”, OECD Environment, Health and Safety Publications (EHS), Series on Testing and Assessment, No. 23, OECD Publishing, Paris.
(12) Smart, R.M., J.W. Barko (1985), Laboratory culture of submersed freshwater macrophytes on natural sediments, Aquatic Botany, Vol. 21/3, pp. 251-263.
(13) Christensen, E.R., N. Nyholm (1984), Ecotoxicological Assays with Algae: Weibull Dose-Response Curves, Environmental Science Technology, Vol. 18/9, pp. 713-718.
(14) Nyholm, N. et al. (1992), Statistical treatment of data from microbial toxicity tests, Environmental Toxicology and Chemistry, Vol. 11/2, pp. 157-167.
(15) Bruce, R.D., D.J. Versteeg (1992), A statistical procedure for modelling continuous toxicity data, Environmental Toxicology and Chemistry, Vol. 11/10, 1485-1494.
(16) OECD (2006), “Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application”, OECD Environment, Health and Safety Publications (EHS), Series on Testing and Assessment, No. 54, OECD Publishing, Paris.
(17) Brain, P., R. Cousens (1989), An equation to describe dose-responses where there is stimulation of growth at low doses, Weed Research, Vol. 29/2, pp/ 93-96.
(18) Norberg-King, T.J. (1988), An interpolation estimate for chronic toxicity: The ICp approach, National Effluent Toxicity Assessment Center Technical Report 05-88. US EPA, Duluth, MN.
(19) Dunnett, C.W. (1955), A multiple comparisons procedure for comparing several treatments with a control, Journal of the American Statistical Association, Vol. 50/272, pp. 1096-1121.
(20) Dunnett, C.W. (1964), New tables for multiple comparisons with a control, Biometrics, Vol. 20/3, pp. 482-491.
(21) Williams, D.A. (1971), A test for differences between treatment means when several dose levels are compared with a zero dose control, Biometrics, Vol. 27/1, pp. 103-117.
(22) Williams, D.A. (1972), The comparison of several dose levels with a zero dose control, Biometrics, Vol. 28/2, pp. 519-531.
1. függelék
A SMART- ÉS A BARKO-FÉLE KÖZEG ÖSSZETÉTELE
|
Összetevő |
A reagens vízhez adott mennyisége (1) (mg/l) |
|
CaCl2 · 2 H2O |
91,7 |
|
MgSO4 · 7 H2O |
69,0 |
|
NaHCO3 |
58,4 |
|
KHCO3 |
15,4 |
|
pH (egyensúlyban a levegővel) |
7,9 |
|
(*1) ásványmentesített (azaz desztillált vagy ioncserélt) víz |
|
2. függelék
FOGALOMMEGHATÁROZÁSOK
Élőanyag-tömeg : a populációban lévő élő anyag nedves és/vagy száraz tömege. Ebben a vizsgálatban az élőanyag-tömeg a fő hajtás, az összes oldalág és az összes gyökér összege.
Vegyi anyag : anyag vagy keverék.
Klorózis : a vizsgálati szervezet, különösen az örvök színének zöldről sárgásra történő változása.
ECx : a vizsgálati közegben oldott vizsgálati vegyi anyag azon koncentrációja, amely x % (pl. 50 %) csökkenést okoz a Myriophyllum spicatum növekedésében meghatározott expozíciós időszak alatt (kifejezetten ki kell térni rá, ha eltér a teljes vagy szokásos vizsgálati időtartamtól). Ahhoz, hogy egyértelmű legyen, hogy az EC értékét a növekedési sebességből vagy a hozamból nyerték-e, növekedési sebesség esetén „ErC”-t, hozam esetén „EyC”-t kell írni, majd ezt követően meg kell adni a mérési változót, például: ErC (a fő hajtás hossza).
Növekedés : a mérési változóknak, pl. a fő hajtás hosszának, az oldalágak teljes hosszának, a hajtások teljes hosszának, a gyökerek teljes hosszának, a nedves tömegnek, a száraz tömegnek vagy az örvök számának a növekedése a vizsgálati időszakban.
Növekedési sebesség (átlagos fajlagos növekedési sebesség) : a mérési változó logaritmikus növekedése az expozíciós idő alatt. Megjegyzés: a növekedési sebességgel összefüggő hatásváltozók függetlenek a vizsgálat időtartamától mindaddig, amíg az expozícióval nem érintett kontrollszervezetek növekedési mintázata exponenciális.
Megfigyelhető hatást okozó legalacsonyabb koncentráció (LOEC) : az a legalacsonyabb vizsgált koncentráció, amely mellett adott expozíciós idő alatt a vegyi anyag statisztikailag szignifikáns mértékben (p < 0,05) csökkenti a növekedésre kifejtett hatást a kontrolltenyészethez képest. Azonban az LOEC-szint feletti valamennyi vizsgálati koncentrációnak olyan ártalmas hatást kell kifejtenie, amely legalább egyenlő az LOEC-szinten megfigyelttel vagy súlyosabb annál. Amennyiben e két feltétel nem teljesíthető, akkor kimerítő magyarázatot kell adni arra, hogy hogyan történt az LOEC (és ennélfogva az NOEC) kiválasztása.
Mérési változók : minden olyan változó, amelyet a vizsgálat végpontjának egy vagy több különböző hatásváltozó segítségével történő kifejezése érdekében mérnek. Ebben a vizsgálati módszerben a mérési változók a fő hajtás hossza, az oldalágak teljes hossza, a hajtások teljes hossza, a gyökerek teljes hossza, a nedves tömeg, a száraz tömeg és az örvök száma.
Monokultúra : egyetlen növényfajból álló tenyészet.
Nekrózis : a vizsgálati szervezet elhalt (például fehér vagy sötétbarna) szövete.
Megfigyelhető hatást nem okozó koncentráció (NOEC) : az a vizsgálati koncentráció, amely közvetlenül az LOEC alatt helyezkedik el.
Hatásváltozó : a toxikus hatás becslésére használt változó, amely különböző számítási módokkal az élőanyag-tömeg leírására szolgáló bármelyik mért változóból levezethető. Ebben a vizsgálati módszerben hatásváltozó a növekedési sebesség és a hozam, amelyeket a fő hajtás hosszából, a hajtások teljes hosszából, a nedves tömegből, a száraz tömegből vagy az örvök számából, mint mérési változókból származtatnak.
Félstatikus (oldatcserés) vizsgálat : olyan vizsgálat, amelynek során a vizsgálati oldatot bizonyos időközönként lecserélik.
Statikus vizsgálat : olyan vizsgálati módszer, amelynek során a vizsgálati oldatot nem cserélik le.
Vizsgálati vegyi anyag : e vizsgálati módszer alkalmazásával vizsgált anyag vagy keverék.
A vizsgálat végpontja : az az általános tényező, amelyre a vizsgálat irányul, és amely a vizsgálati vegyi anyag hatására a kontrolltenyészethez képest megváltozik. Ebben a vizsgálati módszerben a vizsgálat végpontja a növekedésgátlás, amely különböző, egy vagy több mérési változóból származtatott hatásváltozók segítségével fejezhető ki.
Vizsgálati közeg : az a teljes, szintetikus tápoldat, amelyben a vizsgálati növények a vizsgálati vegyi anyag jelenlétében növekednek. A vizsgálati vegyi anyag általában oldott formában van jelen a vizsgálati közegben.
UVCB-k : ismeretlen szerkezetű vagy változó összetételű, összetett reakciótermékek vagy biológiai anyagok.
Hozam : az élőanyag-tömeget leíró mérési változó értéke az expozíciós idő végén, mínusz ugyanezen változó értéke az expozíciós idő kezdetén. Megjegyzés: ha az expozícióval nem érintett szervezetek növekedési mintázata exponenciális, a hozam alapú hatásváltozók a vizsgálat előrehaladtával csökkennek.
”
( 1 ) Az Európai Parlament és a Tanács 2006. december 18-i 1907/2006/EK rendelete a vegyi anyagok regisztrálásáról, értékeléséről, engedélyezéséről és korlátozásáról (REACH), az Európai Vegyianyag-ügynökség létrehozásáról, az 1999/45/EK irányelv módosításáról, valamint a 793/93/EGK tanácsi rendelet, az 1488/94/EK bizottsági rendelet, a 76/769/EGK tanácsi irányelv, a 91/155/EGK, a 93/67/EGK, a 93/105/EK és a 2000/21/EK bizottsági irányelv hatályon kívül helyezéséről. HL L 304., 2007.11.22., 1. o.
( 2 ) Az USA alternatív módszerek validálásával foglalkozó ügynökségközi koordinációs bizottsága.
( 3 ) A szemirritációnak a REACH szerinti átfogó vizsgálati stratégiájának alkalmazását lásd még az ECHA Útmutató az információs követelményekhez és a kémiai biztonsági értékeléshez című dokumentumának R.7a. fejezetében: Végpontokra vonatkozó útmutató: http://echa.europa.eu/documents/10162/13632/information_requirements_r7a_en.pdf
( 4 ) Az általános lineáris modellekhez (General Linear Models; GLM) hasonló modellezési megközelítést alkalmazó statisztikusok az analízist ettől eltérő, de hasonló módon is megközelíthetik, azonban nem feltétlenül vezetik le a számítógépes korszak előtt kidolgozott statisztikaszámítás algoritmikus megközelítéseiig visszanyúló, hagyományos ANOVA-táblázatot.
( 5 ) Az általános lineáris modellekhez (General Linear Models; GLM) hasonló modellezési megközelítést alkalmazó statisztikusok az analízist ettől eltérő, de hasonló módon is megközelíthetik, azonban nem feltétlenül vezetik le a számítógépes korszak előtt kidolgozott statisztikaszámítás algoritmikus megközelítéseiig visszanyúló, hagyományos ANOVA-táblázatot.
( 6 ) Az Európai Parlament és a Tanács 2008. december 16-i 1272/2008/EK rendelete az anyagok és keverékek osztályozásáról, címkézéséről és csomagolásáról, a 67/548/EGK és az 1999/45/EK irányelv módosításáról és hatályon kívül helyezéséről, valamint az 1907/2006/EK rendelet módosításáról (HL L 353., 2008.12.31., 1. o.).
( 7 ) A megadott méretek 12–60 hónapos tehenekhez használt szaruhártyatartókon alapulnak. 6–12 hónapos egyedek esetében a tartót úgy kell kialakítani, hogy mindkét kamra térfogata 4 ml, a belső kamrák átmérője 1,5 cm, mélysége pedig 2,2 cm legyen. Új típusú szaruhártyatartók esetében nagyon fontos, hogy a vizsgálati vegyi anyagnak kitett szaruhártya-felület és a hátsó karma térfogatának hányadosa megegyezzen a hagyományos szaruhártyatartó hasonló adatával. Ez azért szükséges, hogy az IVIS javasolt képletébe beírandó permeabilitásértékek helyesen legyenek meghatározva.
( 8 ) Az Európai Parlament és a Tanács 2008. december 16-i 1272/2008/EK rendelete az anyagok és keverékek osztályozásáról, címkézéséről és csomagolásáról, a 67/548/EGK és az 1999/45/EK irányelv módosításáról és hatályon kívül helyezéséről, valamint az 1907/2006/EK rendelet módosításáról (HL L 353., 2008.12.31., 1. o.).
( 9 ) Az Európai Parlament és a Tanács 2008. december 16-i 1272/2008/EK rendelete az anyagok és keverékek osztályozásáról, címkézéséről és csomagolásáról, a 67/548/EGK és az 1999/45/EK irányelv módosításáról és hatályon kívül helyezéséről, valamint az 1907/2006/EK rendelet módosításáról (HL L 353., 2008.12.31., 1. o.).
( 10 ) Átlag alatt a dokumentum egészében számtani átlag értendő.
( 11 ) Az Európai Parlament és a Tanács 2008. december 16-i 1272/2008/EK rendelete az anyagok és keverékek osztályozásáról, címkézéséről és csomagolásáról, a 67/548/EGK és az 1999/45/EK irányelv módosításáról és hatályon kívül helyezéséről, valamint az 1907/2006/EK rendelet módosításáról (HL L 353., 2008.12.31., 1. o.).
( 12 ) Az Európai Parlament és a Tanács 2008. december 16-i 1272/2008/EK rendelete az anyagok és keverékek osztályozásáról, címkézéséről és csomagolásáról, a 67/548/EGK és az 1999/45/EK irányelv módosításáról és hatályon kívül helyezéséről, valamint az 1907/2006/EK rendelet módosításáról (HL L 353., 2008.12.31., 1. o.).
( 13 ) Az általános lineáris modellekhez (General Linear Models; GLM) hasonló modellezési megközelítést alkalmazó statisztikusok az analízist ettől eltérő, de hasonló módon is megközelíthetik, azonban nem feltétlenül vezetik le a számítógépes korszak előtt kidolgozott statisztikaszámítás algoritmikus megközelítéseiig visszanyúló, hagyományos ANOVA-táblázatot.
( 14 ) A fogalommeghatározások és mértékegységek tekintetében lásd az 1. függeléket.
( 15 ) Néha P OW-vel is jelölik, amelyet az A.8. vizsgálati módszerben szereplő lombikrázásos módszerrel (4), az A.24. vizsgálati módszer szerinti HPLC-módszerrel (5) vagy az A.23. vizsgálati módszer szerinti lassú keveréses módszerrel (6) határoznak meg. A generátor-kolonna módszere alkalmanként használható a log KOW meghatározására. Korlátozott számú tanulmány áll rendelkezésre, amely ezen a technikán alapul, elsődlegesen a klórozott bifenilek és dibenzodioxinok esetében (pl. Li és Doucette, 1993) (3). Az esetlegesen ionizáló anyagok tekintetében a log K OW-nak a nem ionizált formára kell vonatkoznia.
( 16 ) A fogalommeghatározások és mértékegységek tekintetében lásd az 1. függeléket.
( 17 ) TLC: vékonyréteg-kromatográfia; HPLC: nagynyomású folyadékkromatográfia; GC: gázkromatográfia
( 18 ) Bizonyos szabályozói keretrendszerekben a metabolitok analízise adott feltételek teljesülése esetén kötelező lehet (vö. 65. pont).
( 19 ) Általában a vízben mért koncentrációnak a felvételi fázisban legalább egy nagyságrenddel a meghatározási határ felett kell lennie, hogy a vizsgálat tisztulási fázisában a test anyagterhelésének több mint egy felezési ideje mérhető legyen.
( 20 ) A fogalommeghatározások és mértékegységek tekintetében lásd az 1. függeléket.
( 21 ) A legtöbb vizsgálati anyag ideális esetben nem mutatható ki a kontrollvízben. A háttér-koncentráció csak természetes körülmények között előforduló anyagok (pl. egyes fémek), illetve olyan anyagok esetén lehet releváns, amelyek mindenütt megtalálhatók a környezetben.
( 22 ) Amennyiben az elsőrendű kinetika nyilvánvalóan nem teljesül, összetettebb modelleket kell használni (lásd az 5. függelék hivatkozásait), és biostatisztikus szakvéleményét kell kikérni.
( 23 ) A felvételt korlátozhatja az alacsony expozíciós koncentráció a biokoncentrációs vizsgálatban alkalmazott alacsony vízoldékonyság miatt, míg sokkal magasabb expozíciós koncentráció érhető el az étrendi vizsgálattal.
( 24 ) A több összetevőből álló anyagok, UVCB-k és keverékek esetében az egyes releváns összetevők vízoldékonyságát figyelembe kell venni a megfelelő expozíciós koncentrációk meghatározásához.
( 25 ) A TOC tartalmazza a részecskékből származó és az oldott szerves szenet is, azaz TOC = POC + DOC.
( 26 ) Jóllehet általánosságban nem ajánlott, oldószer vagy oldódást segítő anyag használata esetén az ezen anyagból származó szerves szenet hozzá kell adni a vizsgálati anyagból származó szerves szénhez, hogy értékelni lehessen a vizsgálati edényekben a szervesszén-koncentrációt.
( 27 ) Ha a lipidtartalmat nem ugyanabban a halban vizsgálják, mint a vizsgálati anyagot, a halaknak legalább hasonló tömegűnek és (ha releváns) azonos ivarúnak kell lenniük.
( 28 ) Ez az alternatíva csak arra az esetre érvényes, ha valamennyi vizsgálati csoportot hasonló méretű csoportokban tartanak, a halakat ugyanolyan mintázat szerint távolítják el és ugyanúgy etetik. Ez biztosítja, hogy a halak növekedése valamennyi vizsgálati csoportban hasonlóan alakuljon, ha a vizsgálati koncentráció elmarad a toxikus tartománytól. Hasonló növekedés esetén várhatóan a lipidtartalom is hasonló lesz. A kontroll eltérő növekedése az anyag hatását jelezheti és érvényteleníti a vizsgálatot.
( 29 ) A tömeg mellett a teljes hosszt is rögzíteni kell, mivel a vizsgálat során bekövetkezett hossznövekedés mértékének összehasonlítása megfelelően jelzi, hogy bekövetkezett-e káros hatás.
( 30 ) A növekedési sebességi állandókon t-próba végezhető annak vizsgálata érdekében, hogy a növekedés eltérő-e a kontroll- és a vizsgálati csoportok között, vagy F-próba végezhető a szóródás elemzése esetén. Szükség esetén F-próba vagy valószínűségi arány használható a megfelelő növekedési modell megválasztásához (54. OECD-monográfia, (32)).
( 31 ) E százalékos arányok feltételezik, hogy az analitikai módszer megbízható és a felezési idő kevesebb, mint 14 nap. Ha az analitikai módszer kevésbé megbízható, vagy ha a felezési idő (jóval) magasabb, e számok nagyobbak lesznek.
( 32 ) A minimalizált vizsgálat ténylegesen felhasználható gyors anyagcsere kimutatására, ha a gyors anyagcsere valószínűsége köztudott.
( 33 ) Ha csak két adatpontot mérnek, a BCFKm konfidenciahatárainak becslését bootstrap módszerekkel is el lehet végezni. Ha közbenső adatpontok is rendelkezésre állnak, a BCFKm konfidenciahatárait a teljes vizsgálathoz hasonlóan lehet kiszámítani.
( 34 ) A fogalommeghatározások és mértékegységek tekintetében lásd az 1. függeléket.
( 35 ) A vegyi anyagok regisztrálásáról, értékeléséről, engedélyezéséről és korlátozásáról (REACH) szóló 1907/2006/EK rendelet (HL L 396, 2006.12.30., 1. o.) alkalmazásában e kérdéssel a »Guidance on Information Requirements and Chemical Safety Assessment« című dokumentum R.7c., R.7.10.3.1. fejezete, R.7.10.4.1. fejezete, és R7.10-2. ábrája foglalkozik.
( 36 ) A legtöbb vizsgálati anyag ideális esetben nem mutatható ki a kontrollvízben. A háttér-koncentráció csak természetes körülmények között előforduló anyagok (pl. egyes fémek), illetve olyan anyagok esetén lehet releváns, amelyek mindenütt megtalálhatók a környezetben.
( 37 ) Ha a BMF-et egy anyag adott szervezetben mérhető koncentrációjának és a szervezet táplálékában mérhető koncentrációjának hányadosaként határozzák meg állandósult állapotban, a lipidtartalmat figyelembe kell venni azáltal, hogy a szervezet és a táp lipidtartalmára tekintettel kiigazítást végeznek, ezért ez pontosabban »korrekcióként« írható le. Ez a megközelítés eltér a szervezet előre megállapított lipidtartalmához viszonyított »normalizációtól«, amint arra a vízi expozíciós biokoncentrációs vizsgálatban sor kerül.
( 38 ) A teljes hosszt is rögzíteni kell a vizsgálat során, mivel megfelelően jelzi, hogy bekövetkezett-e káros hatás.
( 39 ) A HCB szerepel a Stockholmi Egyezmény A. és C. mellékletében, valamint a környezetben tartósan megmaradó szerves szennyező anyagokról szóló 850/2004/EK rendelet (HL L 158., 2004.4.30., 7. o.) I. és III. mellékletében.
( 40 ) A felvételi fázis során bekövetkezett gyors növekedés esetén a valódi etetési arány az expozíció elején beállított alá csökken.
( 41 ) Vízi expozíciós vizsgálatban a 14 napos felezési idő kb. 10 000 L/kg BCF-nek felel meg, 1 g-os halak és ennek megfelelő, mintegy 500 L/kg/d felvételi sebesség mellett (a Sijm és munkatársai féle egyenlet szerint (46)).
( 42 ) Mivel az aktuális belső koncentrációkat csak a vizsgálat végrehajtását követően lehet meghatározni, a várható belső koncentrációt becsülni kell (pl. a várható BMF és a tápban meglévő koncentráció alapján; vö. A5.8. egyenlet az 5. függelékben).
( 43 ) A vizsgálati anyag vizsgálati közegben való, a hal általi kiválasztásnak vagy a tápból való kioldódásnak köszönhető jelenléte nem küszöbölhető ki teljes mértékben. Ezért az egyik lehetőség az, hogy megmérik az anyag koncentrációját a vízben a felvételi időszak végén, különösen ha félstatikus kialakítást alkalmaznak, annak megállapítása érdekében, hogy sor kerülhetett-e vízi expozícióra.
( 44 ) Ez a megközelítés az étrendi vizsgálat sajátossága, amely eltér a vízi expozíció esetén követett eljárástól, ezért ebben az esetben az egyértelműség érdekében a korrekció szó használatos a normalizáció helyett – lásd még a (106) bekezdéshez tartozó lábjegyzetet.
( 45 ) A növekedési sebességi állandókon t-próba végezhető annak vizsgálata érdekében, hogy a növekedés eltérő-e a kontroll- és a vizsgálati csoportok között, vagy F-próba végezhető a szóródás elemzése esetén. Szükség esetén F-próba vagy valószínűségi arány használható a megfelelő növekedési modell megválasztásához (54. OECD-monográfia, (32)).
( 46 ) A táp fehérje-, lipid-, nyersrost- és hamutartalom tekintetében történő analízisére szolgáló módszer; ez az információ általában a táp beszállítójától szerezhető be.
( 47 ) Mint minden tapasztalati összefüggés esetében, itt is meg kell győződni arról, hogy a vizsgálati anyag az összefüggés alkalmazási körébe tartozik-e.
( 48 ) A halak felvételi fázis végén jellemző tömegét korábbi vizsgálati adatokból, vagy a vizsgálati faj vizsgálat kezdetére jellemző szokásos tömegéből kiinduló, egy tipikus (pl. 28 napos) felvételi fázis során valószínűsíthető méretnövekedésével kapcsolatos ismeretek alapján lehet megbecsülni.
( 49 ) A lineáris regressziót lehetővé tevő legtöbb programban megadják a becslések standard hibáit és konfidencia-intervallumait is, pl. a Microsoft Excelben az adatelemzési eszközcsomag használatával.
( 50 ) A lineáris regressziós módszerrel szemben e képlet alkalmazása nem ad standard hibát a k2 vonatkozásában.
( 51 ) A lineáris illesztési eljárással szemben e módszer általában nem ad standard hibát vagy konfidencia-intervallumot a becsült k1 vonatkozásában.
( 52 ) Meg kell jegyezni, hogy a k2 becslésének bizonytalanságát tulajdonképpen nem használják a bioakkumulációs modellben, ahol azt lényegében állandónak tekintik a k1 lépcsőzetes illesztési módszerbe történő beillesztésekor. Az eredményként adódó BCF-bizonytalanság ezért eltérő lesz az egyidejű és a lépcsőzetes illesztési módszerben.
( 53 ) A természetben a vízi környezetben a legnagyobb expozíciót előidéző út a felvétel a rendkívül víztaszító anyagok esetében, így a becsült BCF szorosan nem jeleníti meg az ilyen anyag bioakkumulációs potenciálját.
( 54 ) Más Daphnia-fajokat is fel lehet használni, feltéve, hogy azok kielégítik a megfelelő érvényességi kritériumokat (a kontrollcsoportban a reproduktív teljesítményre vonatkozó érvényességi kritérium valamennyi fajra alkalmazandó). Más Daphnia-fajok használata esetén ezeket egyértelműen azonosítani kell, és alkalmazásukat meg kell indokolni.
( 55 ) Akaratlan elhullás: nem szándékoltan bekövetkező váratlan esemény (azaz ismert ok) által előidézett, a vegyi anyaggal össze nem függő elhullás.
( 56 ) Véletlen elhullás: ismeretlen okból bekövetkezett, a vegyi anyaggal össze nem függő elhullás.
( *1 ) A papilláris nyúlványok normális esetben csak felnőtt hímeknél jelennek meg és a farok alatti úszó sugarain, az úszó poszterior végétől számított másodiktól a hetedik vagy nyolcadik úszósugárig találhatók meg (1. és 2. ábra). A nyúlványok ugyanakkor csak ritkán jelennek meg a farok alatti úszó poszterior végétől számított első úszósugáron. Ez a szabványműveleti előírás kiterjed a nyúlványok első úszósugáron történő mérésére is (ebben a szabványműveleti előírásban az úszósugarak számjele a farok alatti úszó poszterior végétől számított sorszámukra utal).
( *2 ) Homogenizáló puffer:
— (50 mmol Tris-HCl, pH 7,4; 1 % proteázgátló koktél (Sigma)): 12 ml Tris-HCl pH 7,4 + 120 μl proteázgátló koktél.
— TRIS: TRIS-ULTRA PURE (ICN) pl. Bie & Berntsen, Dánia.
— Proteázgátló koktél: Sigmától (emlősszövetekhez). Termékszám P 8340.
MEGJEGYZÉS: A homogenizáló pufferoldatot a készítés napján fel kell használni. Használat közben jégre kell helyezni.
( 57 ) Carl von Linné (*1707. május 23., Råshult /Älmhult; † 1778. január 10., Uppsala).