EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 01992L0065-20040520
Council Directive 92/65/EEC of 13 July 1992 laying down animal health requirements governing trade in and imports into the Community of animals, semen, ova and embryos not subject to animal health requirements laid down in specific Community rules referred to in Annex A (I) to Directive 90/425/EEC
Consolidated text: Direttiva 92/65/CEE del Consiglio, del 13 luglio 1992, che stabilisce norme sanitarie per gli scambi e le importazioni nella Comunità di animali, sperma, ovuli e embrioni non soggetti, per quanto riguarda le condizioni di polizia sanitaria, alle normative comunitarie specifiche di cui all'allegato A, sezione I, della direttiva 90/425/CEE
Direttiva 92/65/CEE del Consiglio, del 13 luglio 1992, che stabilisce norme sanitarie per gli scambi e le importazioni nella Comunità di animali, sperma, ovuli e embrioni non soggetti, per quanto riguarda le condizioni di polizia sanitaria, alle normative comunitarie specifiche di cui all'allegato A, sezione I, della direttiva 90/425/CEE
1992L0065 — IT — 03.09.2008 — 009.003
Trattandosi di un semplice strumento di documentazione, esso non impegna la responsabilità delle istituzioni
|
DIRETTIVA 92/65/CEE DEL CONSIGLIO del 13 luglio 1992 (GU L 268, 14.9.1992, p.54) |
Modificato da:
|
|
|
Gazzetta ufficiale |
||
|
No |
page |
date |
||
|
L 117 |
23 |
24.5.1995 |
||
|
L 102 |
63 |
12.4.2001 |
||
|
REGOLAMENTO (CE) N. 1282/2002 DELLA COMMISSIONE del 15 luglio 2002 |
L 187 |
3 |
16.7.2002 |
|
|
REGOLAMENTO (CE) N. 998/2003 DEL PARLAMENTO EUROPEO E DEL CONSIGLIO del 26 maggio 2003 |
L 146 |
1 |
13.6.2003 |
|
|
REGOLAMENTO (CE) N. 1398/2003 DELLA COMMISSIONE del 5 agosto 2003 |
L 198 |
3 |
6.8.2003 |
|
|
DIRETTIVA 2004/68/CE DEL CONSIGLIO Testo rilevante ai fini del SEE del 26 aprile 2004 |
L 139 |
320 |
30.4.2004 |
|
|
L 114 |
17 |
1.5.2007 |
||
|
DIRETTIVA 2008/73/CE DEL CONSIGLIO Testo rilevante ai fini del SEE del 15 luglio 2008 |
L 219 |
40 |
14.8.2008 |
|
Modificato da:
|
C 241 |
21 |
29.8.1994 |
||
|
|
L 001 |
1 |
.. |
|
|
L 236 |
33 |
23.9.2003 |
Rettificato da:
DIRETTIVA 92/65/CEE DEL CONSIGLIO
del 13 luglio 1992
che stabilisce norme sanitarie per gli scambi e le importazioni nella Comunità di animali, sperma, ovuli e embrioni non soggetti, per quanto riguarda le condizioni di polizia sanitaria, alle normative comunitarie specifiche di cui all'allegato A, sezione I, della direttiva 90/425/CEE
IL CONSIGLIO DELLE COMUNITÀ EUROPEE,
visto il trattato che istituisce la Comunità economica europea, in particolare l'articolo 43,
viste le proposte della Commissione ( 1 ),
visti i pareri del Parlamento europeo ( 2 ),
visti i pareri del Comitato economico e sociale ( 3 ),
considerando che gli animali vivi ed i prodotti d'origine animale sono inclusi nell'elenco dei prodotti di cui all'allegato II del trattato; che la commercializzazione di tali animali e prodotti costituisce una fonte di reddito per una parte della popolazione agricola;
considerando che, per garantire uno sviluppo razionale di tale settore e per accrescerne la produttività, è necessario stabilire a livello comunitario norme di polizia sanitaria per gli animali e i prodotti in questione;
considerando che la Comunità deve adottare le misure necessarie per garantire una graduale instaurazione del mercato interno entro il 31 dicembre 1992;
considerando che il perseguimento degli obiettivi di cui sopra ha indotto il Consiglio a stabilire norme di polizia sanitaria per i bovini, i suini, gli ovini e i caprini, gli equidi, il pollame e le uova da cova, i pesci e i prodotti della pesca, i molluschi bivalvi, lo sperma dei bovini e dei suini, gli embrioni del bovini, carni fresche, le carni di pollame, i prodotti a base di carne e le carni di selvaggina e di coniglio;
considerando che si devono stabilire norme di polizia sanitaria che disciplinino l'immissione sul mercato di animali e di prodotti d'origine animale non ancora soggetti alle norme di cui sopra;
considerando che occorre prevedere che la presente direttiva si applichi senza pregiudizio del regolamento (CEE) n. 3626/82 del Consiglio, del 3 dicembre 1982, relativo all'applicazione nella Comunità della convenzione sul commercio internazionale delle specie di flora e di fauna selvatiche minacciate d'estinzione ( 4 );
considerando che per alcuni aspetti tecnici si deve fare riferimento alla direttiva 64/432/CEE del Consiglio, del 26 giugno 1964, relativa a problemi di polizia sanitaria in materia di scambi intracomunitari di animali delle specie bovina e suina ( 5 ) e alla direttiva 85/511/CEE del Consiglio, del 18 novembre 1985, che stabilisce misure comunitarie di lotta contro l'afta epizootica ( 6 );
considerando che, per l'organizzazione e per il seguito da dare ai controlli nonché per le misure di salvaguardia da applicare, occorre fare riferimento alle norme generali fissate dalla direttiva 90/425/CEE del Consiglio, del 26 giugno 1990, relativa ai controlli veterinari e zootecnici applicabili negli scambi intracomunitari di taluni animali vivi e prodotti di origine animale, nella prospettiva del mercato interno ( 7 );
considerando che, salvo disposizioni contrarie, gli scambi di animali e di prodotti di origine animale devono essere liberalizzati, fermo restando il ricorso ad eventuali misure di salvaguardia;
considerando che, dati i rischi sensibili di propagazione di malattie a cui gli animali sono esposti, è necessario specificare, per taluni animali e prodotti di origine animale, i requisiti particolari da prescrivere all'atto dell'immissione sul mercato ai fini degli scambi, segnatamente quando la destinazione è una regione con un livello sanitario elevato;
considerando che la particolare situazione del Regno Unito di Gran Bretagna e di Irlanda del Nord e dell'Irlanda, derivante dalla loro insularità, giustifica, poiché tali Stati sono indenni dalla rabbia da molto tempo, le disposizioni particolari che consentono di assicurarsi che l'immissione sul mercato nel Regno Unito e in Irlanda di cani e gatti non originari di questi paesi non comporti rischi di introduzione della rabbia in detti Stati; che tuttavia ciò non influisce sulla soppressione dei controlli veterinari alle frontiere fra Stati membri;
considerando che il certificato sanitario costituisce il mezzo più appropriato per garantire e controllare il rispetto di tali requisiti;
considerando che, per mantenere la situazione sanitaria della Comunità, è necessario sottoporre, al momento dell'immissione sul mercato, gli animali e i prodotti di origine animale contemplati dalla presente direttiva ai requisiti minimi previsti per gli scambi e di controllarne l'osservanza conformemente ai principi e alle norme della direttiva 90/675/CEE del Consiglio, del 10 dicembre 1990, che fissa i principi relativi all'organizzazione dei controlli veterinari per i prodotti che provengano dai paesi terzi e che sono introdotti nella Comunità ( 8 );
considerando che occorre prevedere una procedura che istituisca una stretta cooperazione tra gli Stati membri e la Commissione in seno al comitato veterinario permanente;
considerando che è opportuno che il termine del 1o gennaio 1994 fissato nell'articolo 29 per il recepimento nelle legislazioni nazionali non incida sulla soppressione dei controlli veterinari alle frontiere stabilita per il 1o gennaio 1993,
HA ADOTTATO LA PRESENTE DIRETTIVA:
CAPITOLO I
Disposizioni generali
Articolo 1
La presente direttiva stabilisce le norme di polizia sanitaria che disciplinano gli scambi e le importazioni nella Comunità di animali, sperma, ovuli e embrioni non soggetti, per quanto riguarda le condizioni di polizia sanitaria, alle normative comunitarie specifiche di cui all'allegato F.
La presente direttiva lascia impregiudicate le disposizioni adottate nel quadro del regolamento (CEE) n. 3626/82.
La presente direttiva lascia impregiudicate le norme nazionali applicabili agli animali di compagnia; tuttavia, ciò non influisce sulla soppressione dei controlli veterinari alle frontiere fra Stati membri.
Articolo 2
1. Ai fini della presente direttiva, si intendono per:
|
a) |
«scambi» , gli scambi quali definiti all'articolo 2, punto 3, della direttiva 90/425/CEE; |
|
b) |
«animali» , gli esemplari appartenenti alle specie animali diverse da quelle contemplate dalle direttive 64/432/CEE, 90/426/CEE ( 9 ), 90/539/CEE ( 10 ), 91/67/CEE ( 11 ), 91/68/CEE ( 12 ), 91/492/CEE ( 13 ) e 91/493/CEE ( 14 ); |
|
c) |
«organismo, istituto o centro ufficialmente riconosciuto» , qualsiasi istituzione permanente, geograficamente limitata, riconosciuta conformemente all'articolo 13, in cui una o più specie di animali sono abitualmente detenuti o allevati a fini commerciali o no e destinati esclusivamente: — all'esposizione e a fini educativi, — alla conservazione della specie, — alla ricerca scientifica fondamentale o applicata o all'allevamento di animali per le esigenze della ricerca; |
|
d) |
«malattie soggette a denuncia» , le malattie contemplate all'allegato A. |
2. Sono inoltre applicabili per analogia le definizioni diverse da quelle dei centri e organismi riconosciuti di cui all'articolo 2 delle direttive 64/432/CEE, 91/67/CEE e 90/539/CEE.
CAPITOLO II
Disposizioni applicabili agli scambi
Articolo 3
Gli Stati membri provvedono affinché gli scambi, di cui all'articolo 1, primo comma, non siano vietati o limitati per ragioni di polizia sanitaria diverse da quelle risultanti dall'applicazione della presente direttiva o della legislazione comunitaria, segnatamente le misure di salvaguardia eventualmente prese.
In attesa di disposizioni comunitarie in materia, la Svezia può mantenere le norme nazionali per quanto riguarda i serpenti e altri rettili ad essa destinati.
Articolo 4
Gli Stati membri prendono le misure necessarie affinché, ai fini dell'applicazione dell'articolo 4, paragrafo 1, lettera a), della direttiva 90/425/CEE, gli animali contemplati dagli articoli da 5 a 10 possano, fatti salvi l'articolo 13 e le disposizioni particolari da adottare in applicazione dell'articolo 24, essere oggetto di scambio solo se soddisfano le condizioni di cui agli articoli da 5 a 10 e se provengono da aziende o esercizi commerciali, di cui all'articolo 12, paragrafi 1 e 3 della presente direttiva, che siano soggetti a registrazione da parte dell'autorità competente e si impegnino a:
— far visitare regolarmente gli animali detenuti, conformemente all'articolo 3, paragrafo 3, della direttiva 90/425/CEE;
— denunciare all'autorità competente, oltre alle malattie soggette a denuncia obbligatoria, il manifestarsi delle malattie di cui all'allegato B per le quali lo Stato membro interessato ha istituito un programma di lotta o di sorveglianza;
— rispettare le specifiche misure nazionali di lotta contro una malattia che rivesta, per un determinato Stato membro, un'importanza particolare e che formi oggetto di un programma fissato conformemente all'articolo 15, paragrafo 2;
— immettere sul mercato ai fini degli scambi soltanto animali esenti da sintomi di malattie e provenienti da aziende o da zone che non formano oggetto di nessuna misura di divieto per motivi di polizia sanitaria e, per quanto concerne gli animali non accompagnati da un certificato sanitario o da un documento commerciale previsto agli articoli da 5 a 11, immettere sul mercato soltanto animali accompagnati da un'autocertificazione dell'imprenditore agricolo attestante che gli animali in questione non presentano, al momento della spedizione, alcun segno clinico di malattia e che la sua azienda non è stata sottoposta a misure restrittive di polizia sanitaria;
— rispettare le esigenze che consentono di assicurare il benessere degli animali detenuti.
Articolo 5
1. Gli Stati membri provvedono affinché le scimmie (simiae e prosimiae) formino oggetto di scambi soltanto in provenienza da e a destinazione di organismi, istituti o centri ufficialmente riconosciuti dalle autorità competenti degli Stati membri conformemente all'articolo 13 e siano accompagnate da un certificato veterinario conforme al modello presentato all'allegato E, che deve essere completato nell'attestato dal veterinario ufficiale dell'organismo, dell'istituto o del centro di origine per garantire le condizioni di salute degli animali.
2. L'autorità competente di uno Stato membro, in deroga al paragrafo 1, può autorizzare l'acquisizione da parte di un organismo, di un istituto o di un centro riconosciuto di scimmie appartenenti a privati.
Articolo 6
A. Gli Stati membri provvedono affinché, fatti salvi gli articoli 14 e 15, gli ungulati di specie diverse da quelle contemplate dalle direttive 64/432/CEE, 90/426/CEE e 91/68/CEE possano formare oggetto di scambi unicamente se soddisfano i seguenti requisiti:
1) in generale:
a) siano identificati conformemente all'articolo 3, paragrafo 1, lettera c), della direttiva 90/425/CEE;
b) non debbano essere eliminati nel quadro di un programma di eradicazione di una malattia contagiosa;
c) non siano stati vaccinati contro l'afta epizootica e soddisfino ai requisiti pertinenti della direttiva 85/511/CEE e dell'articolo 4 bis della direttiva 64/432/CEE;
d) provengano da un'azienda di cui all'articolo 3, paragrafo 2, lettere b) e c) della direttiva 64/432/CEE, che non sia oggetto di alcuna delle misure di polizia sanitaria, segnatamente quelle adottate in applicazione delle direttive 85/511/CEE, 80/217/CEE ( 15 ) e 91/68/CEE, nella quale siano rimasti in permanenza sin dalla nascita o negli ultimi trenta giorni precedenti la spedizione;
e) siano accompagnati da un certificato conforme al modello che figura nell'allegato E, parte I, completato dal seguente attestato:

▼M7 —————
2) nel caso di ruminanti:
a) provengano da un allevamento ufficialmente indenne da tubercolosi e ufficialmente indenne o indenne da brucellosi conformemente alla direttiva 64/432/CEE o alla direttiva 91/68/CEE e soddisfino, per quanto riguarda le norme di polizia sanitaria, i pertinenti requisiti previsti per la specie bovina dall'articolo 3, paragrafo 2, lettere c), d), f), g) e h) della direttiva 64/432/CEE o dall'articolo 3 della direttiva 91/68/CEE;
b) qualora non provengano da un allevamento rispondente alle condizioni di cui alla lettera a), provengano da un'azienda in cui non sia stato constatato nessun caso di brucellosi e di tubercolosi nei 42 giorni precedenti il carico degli animali e nella quale i ruminanti abbiano subito, nei 30 giorni precedenti la spedizione, con esito negativo un test per verificare la presenza di brucellosi o tubercolosi;
c) secondo la procedura prevista all'articolo 26, possono essere adottate disposizioni relative alla leucosi;
3) nel caso di suidi:
a) non provengano da una zona soggetta a divieti in relazione alla presenza della peste suina africana in applicazione dell'articolo 9 bis della direttiva 64/432/CEE;
b) provengano da un'azienda non soggetta ad alcuna restrizione prevista dalla direttiva 80/217/CEE in relazione alla presenza della peste suina classica;
c) provengano da un allevamento indenne da brucellosi, conformemente alla direttiva 64/432/CEE, e soddisfino i pertinenti requisiti di polizia sanitaria previsti per la specie suina dalla direttiva 64/432/CEE;
d) qualora non provengano da un allevamento rispondente alle condizioni di cui alla lettera c), abbiano subito con esito negativo, nei 30 giorni precedenti la spedizione, un test inteso a dimostrare l'assenza di anticorpi contro la brucellosi;
▼M7 —————
4) i requisiti in materia di test previsti dal presente articolo e i criteri corrispondenti possono essere stabiliti secondo la procedura di cui all'articolo 26. Tali decisioni tengono conto dei ruminanti allevati nelle regioni artiche della Comunità.
In attesa delle decisioni di cui al comma precedente, continuano ad applicarsi le norme nazionali.
B. La direttiva 64/432/CEE è modificata come segue:
1) All'articolo 2, lettere b) e c), le parole «della specie bovina» sono sostituite dalle parole «delle specie bovine (comprese le specie Bubalus bubalus)».
2) È inserito il seguente articolo:
«Articolo 10 bis
Secondo la procedura di cui all'articolo 12, i certificati sanitari i cui modelli figurano nell'allegato F possono essere modificati o completati onde tener segnatamente conto dei requisiti dell'articolo 6 della direttiva 92/65/CEE.»
Articolo 7
A. Gli Stati membri provvedono affinché gli uccelli diversi da quelli contemplati dalla direttiva 90/539/CEE costituiscano oggetto di scambi unicamente se:
1) da un punto di vista generale:
a) provengono da un'azienda nella quale l'influenza aviaria non sia stata diagnosticata nei 30 giorni precedenti la spedizione;
b) provengono da un'azienda o da una zona non soggetta a restrizioni nel quadro delle misure di lotta da applicare contro la malattia di Newcastle.
In attesa che vengano attuate le misure comunitarie di cui all'articolo 19 della direttiva 90/539/CEE, i requisiti nazionali in materia di lotta contro la malattia di Newcastle rimangono applicabili fatte salve le disposizioni generali del trattato;
c) sono stati sottoposti, conformemente all'articolo 10, paragrafo 1, terzo trattino della direttiva 91/496/CEE, se importati in provenienza da un paese terzo, a una quarantena nell'azienda in cui sono stati introdotti dopo l'ammissione nel territorio della Comunità;
2) inoltre, se si tratta di psittacidi:
a) non provengono da un'azienda o non sono stati in contatto con animali di un'azienda in cui sia stata diagnosticata la psittacosi (clamida psittaci).
La durata del divieto deve essere di almeno due mesi a decorrere dall'ultimo caso diagnosticato e da un trattamento effettuato sotto controllo veterinario e riconosciuto conformemente alla procedura di cui all'articolo 26;
b) sono identificati conformemente all'articolo 3, paragrafo 1, lettera c), della direttiva 90/425/CEE.
I metodi di identificazione degli psittacidi, in particolare di quelli malati, sono determinati conformemente alla procedura di cui all'articolo 26;
c) sono muniti di un documento commerciale vistato dal veterinario ufficiale o dal veterinario responsabile dell'azienda o dell'esercizio commerciale di origine, al quale l'autorità competente abbia delegato tale responsabilità.
B. Nell'articolo 2, secondo comma, punto 2, della direttiva 91/495/CEE del Consiglio, del 27 novembre 1990, relativa ai problemi sanitari e di polizia sanitaria in materia di produzione e di commercializzazione di carni di coniglio e di selvaggina d'allevamento ( 16 ), le parole «e gli uccelli corridori (ratiti)» sono inserite nella quarta riga dopo le parole «della direttiva 90/539/CEE».
Nell'articolo 2, secondo comma, punto 1 della direttiva 90/539/CEE del Consiglio, del 15 ottobre 1990, relativa alle norme di polizia sanitaria per gli scambi intracomunitari e le importazioni in provenienza dai paesi terzi di pollame e di uova da cova ( 17 ), le parole «e gli uccelli corridori (ratiti)» sono inserite dopo le parole «e pernici».
Articolo 8
Gli Stati membri si assicurano che le api (Apis melifera) siano oggetto di scambi unicamente se:
a) provengono da una zona che non sia oggetto di un divieto connesso con il manifestarsi di peste americana.
La durata del divieto deve essere di almeno 30 giorni a decorrere dall'ultimo caso constatato e dalla data in cui tutti gli alveari situati in un raggio di 3 km sono stati controllati dall'autorità competente e tutti gli alveari infetti sono stati bruciati o trattati e controllati dalla suddetta autorità.
Conformemente alla procedura di cui all'articolo 26 e previo parere del comitato scientifico veterinario, i requisiti prescritti per le api (Apis melifera) o requisiti equivalenti possono essere estesi ai calabroni;
b) sono munite di certificato sanitario conforme al modello che figura all'allegato E, che dovrà essere debitamente completato dall'autorità competente per attestare il rispetto dei requisiti di cui alla lettera a).
Articolo 9
1. Gli Stati membri provvedono affinché i lagomorfi possano formare oggetto di scambi unicamente se:
a) non provengono da un'azienda in cui è comparsa la rabbia o è stata presunta la presenza di rabbia nel corso dell'ultimo mese o non sono stati in contatto con animali di tale azienda;
b) provengono da un'azienda nella quale nessun animale presenti segni clinici di mixomatosi.
2. Gli Stati membri che esigono un certificato sanitario per i movimenti di lagomorfi nel proprio territorio possono prescrivere che gli animali loro destinati siano muniti di un certificato sanitario conforme al modello previsto all'allegato E, completato dell'attestato seguente:
«Io sottoscritto …, certifico che la partita di cui sopra è conforme ai requisiti fissati dall'articolo 9 della direttiva 92/65/CEE e che all'atto dell'esame gli animali non hanno presentato alcun segno clinico di malattia.»
Questo attestato deve essere rilasciato dal veterinario ufficiale o dal veterinario responsabile dell'azienda d'origine, al quale l'autorità competente abbia delegato tale responsabilità e, per gli allevamenti industriali, dal veterinario ufficiale.
Gli Stati membri che intendano avvalersi di tale facoltà ne informano la Commissione, che deve accertarsi dell'osservanza di quanto prescritto al primo comma.
3. L'Irlanda e il Regno Unito possono prescrivere la presentazione di un certificato sanitario che attesti l'osservanza di quanto prescritto al paragrafo 1, lettera a).
Articolo 10
1. Gli Stati membri provvedono affinché siano vietati gli scambi di ►M5 ————— ◄ visoni e volpi che provengono da un'azienda in cui sia stata diagnosticata la rabbia oppure se ne sospetti la presenza negli ultimi sei mesi, oppure sono stati in contatto con animali di tale azienda nella misura in cui non siano soggetti ad un programma di vaccinazione sistematica.
2. Per formare oggetto di scambi, i gatti, i cani e i furetti devono soddisfare i requisiti di cui agli articoli 5 e 16 del regolamento (CE) n. 998/2003 del Parlamento europeo e del Consiglio, del 26 maggio 2003, relativo alle condizioni di polizia sanitaria applicabili ai movimenti a carattere non commerciale di animali da compagnia e che modifica la direttiva 92/65/CEE del Consiglio ( 18 ).
Il certificato di cui devono essere muniti gli animali deve inoltre attestare che un esame clinico è stato effettuato 24 ore prima della spedizione da un veterinario abilitato dall'autorità competente, da cui risulti che gli animali godono di buona salute e sono atti a sopportare il trasporto fino alla destinazione.
3. In deroga al paragrafo 2, se gli scambi sono destinati all'Irlanda, al Regno Unito o alla Svezia, i gatti, i cani e i furetti devono soddisfare i requisiti di cui agli articoli 6 e 16 del regolamento (CE) n. 998/2003.
Il certificato di cui devono essere muniti gli animali deve inoltre attestare che un esame clinico è stato effettuato 24 ore prima della spedizione da un veterinario abilitato dall'autorità competente, da cui risulti che gli animali godono di buona salute e sono atti a sopportare il trasporto fino alla destinazione.
4. Cipro, l'Irlanda, Malta ed il Regno Unito possono inoltre mantenere, fatti salvi i paragrafi 2 e 3, la loro normativa nazionale relativa alla quarantena per tutti i carnivori ►M5 eccettuate le specie di cui ai paragrafi 2 e 3 ◄ , primati, pipistrelli e altri animali ricettivi alla rabbia, contemplati dalla presente direttiva, per i quali non è possibile dimostrare che sono nati nell'allevamento d'origine e che sono stati tenuti dalla nascita in cattività; tuttavia, il mantenimento di tali normative non influisce sulla soppressione dei controlli veterinari alle frontiere tra Stati membri.
5. La decisione 90/638/CEE è modificata come segue:
1) All'articolo 1 è aggiunto il seguente trattino:
— «per quanto riguarda i programmi di lotta contro la rabbia: i criteri indicati nell'allegato III.»
2) È aggiunto il seguente allegato:
«ALLEGATO III
Criteri da adottare per i programmi contro la rabbia
I programmi contro la rabbia devono comprendere almeno:
a) i criteri di cui ai punti da 1 a 7 dell'allegato I;
b) informazioni particolareggiate sulla/e regione/i in cui ha luogo l'immunizzazione orale delle volpi e sui relativi limiti naturali. Questa/e regione/i abbraccia/abbracciano almeno 6 000 chilometri quadrati o la totalità del territorio di uno Stato membro e può/possono includere zone limitrofe di paesi terzi;
c) informazioni particolareggiate sui vaccini proposti, sul sistema di distribuzione, sulla densità e la frequenza del collocamento delle esche;
d) eventualmente tutti i dettagli, il costo e l'obiettivo delle azioni di conservazione o di tutela della flora e della fauna avviate da organizzazioni volontarie nel territorio contemplato da tali progetti.»
6. Il Consiglio, deliberando a maggioranza qualificata su proposta della Commissione, designa un istituto specifico responsabile per la fissazione dei criteri necessari alla standardizzazione dei test sierologici e ne decide le competenze.
7. Gli Stati membri si adoperano affinché le spese derivanti dall'applicazione dei test sierologici siano a carico degli importatori.
▼M5 —————
Articolo 10 bis
Per quanto riguarda la rabbia e secondo la procedura prevista all'articolo 26, previa presentazione delle opportune giustificazioni, gli articoli 9 e 10 sono modificati per tenere conto della situazione della Finlandia e della Svezia, allo scopo di applicare a questi paesi le stesse disposizioni applicabili agli Stati membri aventi una situazione equivalente.
Articolo 11
1. Gli Stati membri provvedono affinché, senza pregiudizio delle decisioni da prendere in applicazione degli articoli 21 e 23, formino oggetto di scambi unicamente lo sperma, gli ovuli e gli embrioni che soddisfano i requisiti di cui ai paragrafi 2, 3, 4 e 5.
2. Senza pregiudizio di eventuali criteri da rispettare ai fini dell'iscrizione degli equidi nei libri genealogici per determinate razze specifiche, lo sperma delle specie ovina, caprina ed equina deve:
— essere stato raccolto, trattato e immagazzinato ai fini della fecondazione artificiale in una stazione o in un centro riconosciuto, sotto il profilo sanitario, conformemente all'allegato D, capitolo I, oppure in deroga a quanto precede, qualora si tratti di ovini e caprini, in un'azienda che soddisfi i requisiti della direttiva 91/68/CEE,
— provenire da animali che rispondano alle condizioni stabilite nell'allegato D, capitolo II,
— essere stato raccolto, trattato, conservato, immagazzinato e trasportato conformemente all'allegato D, capitolo III,
— essere accompagnato, nel corso della spedizione verso un altro Stato membro, da un certificato sanitario conforme ad un modello da definire secondo la procedura di cui all'articolo 26.
3. Gli ovuli e gli embrioni delle specie ovina, caprina, equina e suina devono:
— essere stati prelevati su donatrici che rispondano alle condizioni fissate nell'allegato D, capitolo IV, da un gruppo di raccolta o essere stati prodotti da un gruppo di produzione riconosciuto dall'autorità competente dello Stato membro e soddisfare le condizioni da stabilire nell'allegato D, capitolo I, secondo la procedura di cui all'articolo 26,
— essere stati raccolti, trattati e conservati in un laboratorio appropriato, nonché immagazzinati e trasportati conformemente all'allegato D, capitolo III,
— essere accompagnati, nel corso della spedizione verso un altro Stato membro, da un certificato sanitario conforme ad un modello da definire secondo la procedura di cui all'articolo 26.
Lo sperma utilizzato per la fecondazione delle donatrici deve essere conforme alle disposizioni del paragrafo 2 per gli ovini, i caprini e gli equidi e alle disposizioni della direttiva 90/429/CEE per i suini.
Eventuali garanzie supplementari possono essere definite secondo la procedura di cui all'articolo 26.
4. L’autorità competente dello Stato membro interessato registra i centri riconosciuti di cui al primo trattino del paragrafo 2 e i gruppi riconosciuti di cui al primo trattino del paragrafo 3 e dà a ogni centro e gruppo un numero di registrazione veterinario.
Ogni Stato membro redige e tiene aggiornato un elenco dei suddetti centri e gruppi riconosciuti e dei rispettivi numeri di registrazione veterinari e lo mette a disposizione degli altri Stati membri e del pubblico.
Norme dettagliate per applicare il presente paragrafo in modo uniforme possono essere adottate secondo la procedura di cui all’articolo 26.
5. Le condizioni di polizia sanitaria e i modelli di certificati sanitari applicabili allo sperma, agli ovuli ed agli embrioni di specie non menzionate nei paragrafi 2 e 3 sono stabilite secondo la procedura di cui all'articolo 26.
In attesa della definizione di condizioni di polizia sanitaria e di modelli di certificati sanitari applicabili agli scambi di tali sperma, ovuli ed embrioni, continuano ad applicarsi le norme nazionali.
Articolo 12
1. Le norme di controllo previste dalla direttiva 90/425/CEE sono applicabili, specialmente per quanto riguarda l'organizzazione e le conseguenze dei controlli da effettuare, agli animali, allo sperma, agli ovuli e agli embrioni di cui alla presente direttiva, accompagnati da un certificato sanitario. Gli altri animali devono provenire da aziende conformi ai principi di cui alla presente direttiva per quanto concerne i controlli da effettuare all'origine e a destinazione.
2. L'articolo 10 della direttiva 90/425/CEE si applica agli animali, allo sperma, agli ovuli e agli embrioni di cui alla presente direttiva.
3. Ai fini degli scambi le disposizioni dell'articolo 12 della direttiva 90/425/CEE sono estese agli esercizi commerciali che detengano in modo permanente o a titolo occassionale gli animali di cui agli articoli 7, 9 e 10.
4. L'informazione riguardante il luogo di destinazione di cui all'articolo 4, paragrafo 2, della direttiva 90/425/CEE per gli animali, lo sperma, gli ovuli e gli embrioni, che sono accompagnati da un certificato sanitario, conformemente alla presente direttiva, deve avvenire mediante il sistema ANIMO.
5. Fatte salve le disposizioni specifiche della presente direttiva, l'autorità competente, qualora sospetti che non siano osservate le disposizioni della presente direttiva o dubiti della salute degli animali o della qualità dello sperma, degli ovuli e degli embrioni, di cui all'articolo 1, procede a tutti i controlli che ritenga opportuni.
6. Gli Stati membri adottano le adeguate misure amministrative o penali per comminare sanzioni contro qualsiasi infrazione della presente direttiva, in particolare quando si è constatato che i certificati o documenti redatti non corrispondono allo stato effettivo degli animali di cui all'articolo 1, che l'identificazione degli animali o la bollatura dello sperma, degli ovuli e degli embrioni in questione non sono conformi alla presente direttiva, o che animali e prodotti non sono stati presentati ai controlli previsti dalla presente direttiva.
Articolo 13
1. Gli scambi di animali di specie sensibili alle malattie di cui all'allegato A, o alle malattie di cui all'allegato B, nel caso in cui lo Stato membro di destinazione benefici di garanzie previste agli articoli 14 e 15, nonché gli scambi di sperma, ovuli o embrioni di detti animali, a partire da o verso organismi, istituti o centri riconosciuti conformemente all'allegato C, sono subordinati alla presentazione di un documento di trasporto conforme al modello di cui all'allegato E. Detto documento, che va completato dal veterinario responsabile dell'organismo, dell'istituto o del centro di origine, deve precisare che gli animali, gli ovuli, lo sperma o gli embrioni provengono da un organismo, istituto o centro riconosciuti conformemente all'allegato C e deve accompagnare gli animali, gli ovuli, lo sperma o gli embrioni nel trasporto.
2.
a) Per ottenere lo status di organismo, istituto o centro riconosciuto, riguardo alle malattie che devono essere dichiarate, gli organismi, istituti o centri devono presentare all'autorità competente dello Stato membro tutti i documenti giustificativi pertinenti ai requisiti di cui all'allegato C.
b) Dopo aver ricevuto il fascicolo concernente la domanda di riconoscimento o di rinnovo del riconoscimento, l'autorità competente la esamina alla luce delle informazioni che esso contiene e, se del caso, dei risultati dei controlli effettuati in loco.
c) L'autorità competente ritira il riconoscimento in conformità dell'allegato C, paragrafo 3.
d) Ogni ente, istituto e centro riconosciuto è registrato e riceve un numero di registrazione dall’autorità competente.
Ogni Stato membro redige e tiene aggiornato un elenco di enti, istituti e centri e dei rispettivi numeri di registrazione e lo mette a disposizione degli altri Stati membri e del pubblico.
Norme dettagliate per applicare il presente articolo in modo uniforme possono essere adottate secondo la procedura di cui all’articolo 26.
e) La Svezia dispone di un termine di due anni a decorrere dalla data di entrata in vigore del trattato di adesione per applicare le misure previste per quanto riguarda gli organismi, istituti o centri.
Articolo 14
1. Lo Stato membro che stabilisca o abbia stabilito — direttamente o tramite gli allevatori — un programma facoltativo o obbligatorio di lotta o di sorveglianza nei confronti di una delle malattie di cui all'allegato B, può sottoporre detto programma alla Commissione, precisando in particolare:
— la situazione della malattia nel proprio territorio;
— il carattere obbligatorio della notifica della malattia;
— la giustificazione del programma, tenuto conto dell'importanza della malattia, e relativi vantaggi sul piano del rapporto costo/beneficio;
— la zona geografica in cui il programma deve essere applicato;
— lo status da applicare alle aziende, i requisiti richiesti per ciascuna specie per l'inserimento nell'allevamento e le procedure per i test;
— le procedure di controllo del programma, compreso il grado di associazione degli allevatori all'applicazione del programma di lotta o di sorveglianza;
— le eventuali conseguenze della perdita di status dell'azienda, qualunque sia il motivo;
— le misure da prendere in caso di risultati positivi constatati al momento dei controlli effettuati conformemente al programma;
— la non discriminazione tra gli scambi nel territorio dello Stato membro interessato e gli scambi intracomunitari.
2. La Commissione esamina i programmi comunicati dagli Stati membri. I programmi possono essere approvati secondo la procedura prevista all'articolo 26, nel rispetto dei criteri di cui al paragrafo 1. Secondo la stessa procedura, contemporaneamente, o al più tardi tre mesi dopo che i programmi siano stati approvati, vengono precisate garanzie complementari generali o limitate esigibili negli scambi. Tali garanzie devono essere al massimo equivalenti a quelle applicate dallo Stato membro nell'ambito nazionale.
3. I programmi presentati dagli Stati membri possono essere modificati o completati secondo la procedura prevista all'articolo 26. Secondo la medesima procedura può essere apportata una modifica alle garanzie di cui al paragrafo 2.
Articolo 15
1. Uno Stato membro che si ritenga totalmente o parzialmente indenne da una delle malattie di cui all'allegato B, cui sono sensibili gli animali contemplati dalla presente direttiva, sottopone alla Commissione le opportune giustificazioni. Esso precisa, in particolare:
— la natura della malattia e la cronistoria della sua comparsa nel proprio territorio;
— i risultati dei test di controllo basati su una ricerca sierologica, microbiologica, patologica ed epidemiologica;
— da quanto tempo è prescritta la denuncia della malattia alle autorità competenti;
— la durata del controllo effettuato;
— eventualmente, il periodo durante il quale è stata vietata la vaccinazione contro la malattia e la zona geografica cui si estende il divieto;
— le norme che consentono di controllare l'assenza della malattia.
2. La Commissione, esaminate le giustificazioni di cui al paragrafo 1, presenta al comitato veterinario permanente una decisione di approvazione o di rifiuto del programma presentato dallo Stato membro. Qualora il programma venga accettato, le garanzie complementari generali o limitate esigibili negli scambi sono precisate secondo la procedura prevista dall'articolo 26. Tali garanzie devono essere al massimo equivalenti a quelle applicate dallo Stato membro nell'ambito nazionale.
In attesa di tale decisione, lo Stato membro interessato può mantenere negli scambi i requisiti pertinenti necessari al mantenimento del suo statuto.
3. Lo Stato membro interessato comunica alla Commissione qualsiasi modifica delle giustificazioni relative alla malattia menzionate al paragrafo 1. Alla luce delle informazioni comunicate, le garanzie definite conformemente al paragrafo 2 possono essere modificate o soppresse secondo la procedura prevista all'articolo 26.
CAPITOLO III
Disposizioni applicabili alle importazioni nella Comunità
Articolo 16
Le condizioni applicabili alle importazioni di animali, sperma, ovuli ed embrioni contemplati dalla presente direttiva devono essere almeno equivalente a quelle previste al capitolo II.
Per quanto riguarda i gatti, i cani e i furetti, le condizioni di importazione devono essere almeno equivalenti a quelle di cui al capitolo III del regolamento (CE) n. 998/2003.
Il certificato di cui devono essere muniti gli animali deve inoltre attestare che un esame clinico è stato effettuato 24 ore prima della spedizione da un veterinario abilitato dall'autorità competente, da cui risulti che gli animali godono di buona salute e sono atti a sopportare il trasporto fino alla destinazione.
Articolo 17
1. Per garantire l'applicazione uniforme dell'articolo 16 si applicano le disposizioni dei paragrafi che seguono.
2. Gli animali, lo sperma, gli ovuli e gli embrioni di cui all'articolo 1 possono formare oggetto di importazioni nella Comunità soltanto se:
a) provengono da un paese terzo compreso in un elenco da redigere conformemente al paragrafo 3, lettera a);
b) sono accompagnati da un certificato sanitario conforme ad un modello da elaborare secondo la procedura di cui all'articolo 26, firmato dall'autorità competente del paese esportatore che attesta che:
i) gli animali
— soddisfano le condizioni supplementari o offrono le garanzie equivalenti di cui al paragrafo 4, e
— provengono da centri, organismi o istituti riconosciuti che offrono garanzie almeno equivalenti a quelle stabilite nell'allegato C;
ii) lo sperma, gli ovuli e gli embrioni provengono da centri di raccolta e di immagazzinamento o da gruppi di raccolta e di produzione riconosciuti che offrano garanzie almeno equivalenti a quelle da definire nell'allegato D, capitolo I, secondo la procedura di cui all'articolo 26.
In attesa della definizione di elenchi dei paesi terzi, degli organismi riconosciuti di cui alla lettera b), delle condizioni di polizia sanitaria e dei modelli di certificati sanitari di cui alle lettere a) e b), continuano ad applicarsi le norme nazionali, a condizione che non siano più favorevoli di quelle stabilite nel capitolo II.
3. È stabilito quanto segue:
a) secondo la procedura di cui all’articolo 26, un elenco di paesi terzi o di parti di paesi terzi in grado di fornire agli Stati membri e alla Commissione garanzie equivalenti a quelle di cui al capitolo II sugli animali, lo sperma, gli ovuli e gli embrioni;
b) in conformità a questo punto, un elenco di centri riconosciuti o di gruppi di cui all’articolo 11, paragrafo 2, primo trattino, e paragrafo 3, primo trattino, situati in uno dei paesi terzi che compaiono nell’elenco di cui alla lettera a) del presente paragrafo e per i quali l’autorità competente è in grado di dare le garanzie previste dall’articolo 11, paragrafi 2 e 3.
L’elenco dei centri e dei gruppi riconosciuti di cui al primo comma e dei relativi numeri di registrazione veterinari è comunicato alla Commissione.
L’autorità competente del paese terzo sospende o ritira immediatamente il riconoscimento di un centro o di un gruppo se esso non soddisfa più le condizioni di cui all’articolo 11, paragrafi 2 e 3, e ne informa immediatamente la Commissione.
La Commissione fornisce agli Stati membri tutti gli elenchi nuovi e aggiornati che riceve ai sensi del secondo e terzo comma dall’autorità competente del paese terzo e li mette a disposizione del pubblico a scopo informativo.
Norme dettagliate per applicare il presente articolo in modo uniforme possono essere adottate secondo la procedura di cui all’articolo 26;
c) secondo la procedura di cui all’articolo 26, i requisiti specifici di polizia sanitaria, soprattutto per tutelare la Comunità da talune malattie esotiche, o garanzie equivalenti a quelle previste nella presente direttiva.
I requisiti specifici e le garanzie equivalenti fissati per i paesi terzi non possono essere più favorevoli di quelli previsti nel capitolo II.
4. Possono essere compresi nell'elenco di cui al paragrafo 3 solo i paesi terzi o parti dei paesi terzi:
a) in provenienza dai quali non siano vietate le importazioni:
— in ragione dell'assenza delle malattie di cui all'allegato A, o di qualsiasi altra malattia esotica nella Comunità;
— in applicazione degli articoli 6, 7 e 14 della direttiva 72/462/CEE e dell'articolo 17 delle direttive 91/495/CEE e 71/118/CEE ( 19 ) oppure, trattandosi degli altri animali oggetto della presente direttiva, in seguito ad una decisione presa conformemente alla procedura di cui all'articolo 26 tenendo conto della loro situazione sanitaria;
b) che, tenuto conto della legislazione e dell'organizzazione del loro servizio veterinario e dei loro servizi ispettivi, dei poteri attribuiti a tali servizi e della sorveglianza a cui sono sottoposti, sono stati riconosciuti idonei, conformemente all'articolo 3, paragrafo 2, della direttiva 72/462/CEE, a garantire l'applicazione della normativa nazionale vigente;
c) il cui servizio veterinario è in grado di garantire l'osservanza di norme sanitarie almeno equivalenti a quelle previste dal capitolo II.
5. Esperti della Commissione e degli Stati membri effettuano controlli sul posto per accertare se le garanzie offerte dal paese terzo in merito alle condizioni di produzione e di commercializzazione possono considerarsi equivalenti a quelle applicate nella Comunità.
Gli esperti degli Stati membri cui sono affidati questi controlli vengono designati dalla Commissione su proposta degli Stati membri.
I controlli sono svolti per conto della Comunità, che si assume l'onere delle relative spese.
6. In attesa dei controlli di cui al paragrafo 5, restano applicabili le disposizioni nazionali in materia di ispezione nei paesi terzi sempreché, in sede di comitato veterinario permanente, si forniscano informazioni sulle inadempienze alle garanzie di cui al paragrafo 3 accertate nel corso delle ispezioni.
Articolo 18
1. Gli Stati membri provvedono affinché gli animali, lo sperma, gli ovuli e gli embrioni oggetto della presente direttiva siano importati nella Comunità soltanto se:
— sono accompagnati da un certificato rilasciato dal veterinario ufficiale.
— Il modello del certificato è stabilito, a seconda delle specie, conformemente alla procedura di cui all'articolo 26;
— hanno soddisfatto i controlli previsti dalle direttive 90/675/CEE e 91/496/CEE ( 20 );
— sono stati sottoposti, prima dell'imbarco verso il territorio della Comunità, ad un controllo eseguito da un veterinario ufficiale inteso ad assicurare che le condizioni di trasporto di cui alla direttiva 91/628/CEE ( 21 ) siano rispettate, segnatamente per quanto riguarda l'approvvigionamento di acqua e cibo;
— sono oggetto, trattandosi degli animali di cui agli articoli da 5 a 10, di una quarantena prima dell'importazione, secondo modalità da fissare con la procedura di cui all'articolo 26.
2. In attesa di stabilire le modalità di applicazione del presente articolo le norme nazionali applicabili alle importazioni provenienti da un paese terzo, per il quale non siano stati decisi requisiti a livello comunitario, restano applicabili nella misura in cui non siano più favorevoli di quelle previste al capitolo II.
Articolo 19
Sono decise secondo la procedura di cui all'articolo 26:
a) le condizioni specifiche di polizia sanitaria, segnatamente all'importazione nella Comunità, la natura ed il contenuto dei documenti d'accompagnamento per gli animali destinati a zoo, circhi, parchi di divertimenti, laboratori di sperimentazione, secondo le specie;
b) garanzie aggiuntive a quelle previste per le diverse specie di animali oggetto della presente direttiva per proteggere le specie comunitarie in questione.
Articolo 20
Le norme stabilite dalla direttiva 97/78/CE si applicano in particolare all'organizzazione dei controlli e alle misure adottate in seguito a tali controlli da parte degli Stati membri, nonché alle misure di salvaguardia da adottare secondo la procedura di cui all’articolo 22 della suddetta direttiva.
In attesa dell'attuazione delle decisioni di cui all'articolo 8, punto 3 ed all'articolo 30 della direttiva 91/496/CEE e fatta salva l'osservanza dei principi e delle norme di cui al primo comma del presente articolo, le pertinenti modalità nazionali di applicazione dell'articolo 8, punti 1 e 2, di detta direttiva rimangono applicabili.
CAPITOLO IV
Disposizioni comuni e finali
Articolo 21
Gli eventuali modelli di certificati utilizzabili per gli scambi nonché le condizioni di polizia sanitaria cui devono soddisfare gli animali, lo sperma, gli ovuli e gli embrioni diversi da quelli di cui agli articoli da 5 a 11 per poter essere oggetto di scambi sono fissati, qualora necessario, secondo la procedura di cui all'articolo 26.
Articolo 22
Gli allegati sono modificati, qualora necessario, secondo la procedura di cui all'articolo 26.
L'allegato B è riesaminato prima della data di entrata in vigore del trattato di adesione per modificare in particolare l'elenco delle malattie includendovi le malattie cui sono soggetti i ruminanti e i suidi nonché quelle che possono essere trasmesse da sperma, ovuli e embrioni degli ovini.
Articolo 23
Conformemente alla procedura di cui all'articolo 26, all'occorrenza in deroga ►M7 ————— ◄ al capitolo II, possono essere stabilite condizioni specifiche per la circolazione degli animali al seguito di circhi e fiere e gli scambi di animali, sperma, ovuli e embrioni destinati a zoo.
Articolo 24
1. Gli Stati membri sono autorizzati a subordinare l'introduzione nel loro territorio degli animali (compresi gli uccelli da voliera) e dello sperma, degli ovuli e degli embrioni oggetto della presente direttiva che abbiano transitato attraverso il territorio di un paese terzo, alla presentazione di un certificato sanitario che attesti l'osservanza dei requisiti previsti dalla presente direttiva.
2. Gli Stati membri che si avvalgono della possibilità di cui al paragrafo 1 ne informano la Commissione e gli altri Stati membri nell'ambito del comitato veterinario permanente.
Articolo 25
All'allegato A della direttiva 90/425/CEE è aggiunta la seguente frase:
«Direttiva 92/65/CEE del Consiglio, del 13 luglio 1992, che stabilisce norme sanitarie per gli scambi e le importazioni nella Comunità di animali, sperma, ovuli e embrioni non soggetti, per quanto riguarda le condizioni di polizia sanitaria, alle normative comunitarie specifiche di cui all'allegato A, sezione I della direttiva 90/425/CEE (GU n. L 268 del 14.9.1992, pag. 54).»
Articolo 26
1. La Commissione è assistita dal comitato permanente per la catena alimentare e la salute degli animali istituito dall'articolo 58 del regolamento (CE) n. 178/2002 del Parlamento europeo e del Consiglio ( 22 ).
2. Nei casi in cui è fatto riferimento al presente paragrafo, si applicano gli articoli 5 e 7 della decisione 1999/468/CE.
Il periodo di cui all'articolo 5, paragrafo 6, della decisione 1999/468/CE ( 23 ) è fissato a 3 mesi.
3. Il comitato adotta il proprio regolamento interno.
Articolo 27
Gli Stati membri che attuano un regime alternativo di controllo, che comporti garanzie equivalenti a quelle previste dalla presente direttiva per i movimenti nel loro territorio di animali, sperma, ovuli ed embrioni da essa contemplati, possono accordarsi reciprocamente deroghe per quanto riguarda l'articolo 6, parte A, punto 1, lettera f), l'articolo 8, lettera b) e l'articolo 11, paragrafo 1, lettera d).
Articolo 28
Secondo la procedura prevista all'articolo 26 possono essere adottate per un periodo di tre anni le misure transitorie necessarie per agevolare il passaggio al nuovo regime previsto dalla presente direttiva.
Articolo 29
1. Gli Stati membri mettono in vigore le disposizioni legislative, regolamentari ed amministrative necessarie per conformarsi alle disposizioni della presente direttiva anteriormente al 1o gennaio 1994. Essi ne informano immediatamente la Commissione.
Quando gli Stati membri adottano tali disposizioni, queste contengono un riferimento alla presente direttiva o sono corredate da un siffatto riferimento all'atto della pubblicazione ufficiale. Le modalità di riferimento sono decise dagli Stati membri.
2. Gli Stati membri comunicano alla Commissione il testo delle disposizioni essenziali di diritto interno che essi adottano nel settore disciplinato dalla presente direttiva.
3. La fissazione del 1o gennaio 1994 quale termine ultimo per il recepimento nella legislazione nazionale lascia impregiudicata la soppressione dei controlli veterinari alle frontiere prevista nelle direttive 89/662/CEE e 90/425/CEE.
Articolo 30
Gli Stati membri sono destinatari della presente direttiva.
ALLEGATO A
Malattie soggette a denuncia nell'ambito della presente direttiva
|
Malattia |
Ordine/famiglia/specie principalmente interessata |
|
Peste equina |
Equidae |
|
Peste suina africana |
Suidae, Tayassuidae |
|
Influenza aviaria |
Aves |
|
Peste americana |
Apis |
|
Carbonchio ematico |
Bovidae, Camelidae, Cervidae, Elephantidae, Equidae, Hippopotamidae |
|
Febbre catarrale degli ovini |
Antilocapridae, Bovidae, Cervidae, Giraffidae, Rhinocerotidae |
|
Brucellosi bovina (Brucella abortus) |
Antilocapridae, Bovidae, Camelidae, Cervidae, Giraffidae, Hippopotamidae e Tragulidae |
|
Brucella melitensis |
Antilocapridae, Bovidae, Camelidae, Cervidae, Giraffidae, Hippopotamidae e Tragulidae |
|
Brucellosis ovis |
Camelidae, Tragulidae, Cervidae, Giraffidae, Bovidae, Antilocapridae |
|
Brucellosis suis |
Cervidae, Leporidae, Ovibos moschatus, Suidae, Tayassuidae |
|
Peste suina classica |
Suidae, Tayassuidae |
|
Pleuropolmonite contagiosa dei bovini |
Bovini (compresi zebù, bufali, bisonti e yak) |
|
Ebola |
Primati non umani |
|
Afta epizootica |
Artiodattili ed elefanti asiatici |
|
Necrosi ematopoietica infettiva |
Salmonidae |
|
Dermatite nodulare contagiosa |
Bovidae, Giraffidae |
|
Vaiolo delle scimmie |
Roditori e primati non umani |
|
Tubercolosi bovina (Mycobacterium bovis) |
Mammiferi, in particolare Antilocapridae, Bovidae, Camelidae, Cervidae, Giraffidae, Tragulidae |
|
Malattia di Newcastle |
Aves |
|
Peste dei piccoli ruminanti |
Bovidae, Suidae |
|
Encefalomielite enterovirale dei suini |
Suidae |
|
Psitacosis |
Psittaciformes |
|
Rabbia |
Carnivora, Chiroptera |
|
Febbre della Rift Valley |
Bovidae, specie Camelus, Rhinocerotidae |
|
Peste bovina |
Artiodactyla |
|
Piccolo scarabeo dell'alveare (Aethina tumida) |
Apis e Bombus |
|
Vaiolo degli ovicaprini |
Bovidae |
|
Malattia vesicolosa dei suini |
Suidae, Tayassuidae |
|
Acaro Tropilaelaps (Tropilaelaps spp.) |
Apis |
|
Stomatite vescicolosa |
Artiodactyla, Equidae |
|
TSE (encefalopatie spongiformi trasmissibili) |
Bovidae, Cervidae, Felidae, Mustelidae |
ALLEGATO B
ELENCO DELLE MALATTIE PER LE QUALI POSSONO ESSERE RICONOSCIUTI PROGRAMMI NAZIONALI IN VIRTÙ DELLA PRESENTE DIRETTIVA
|
Visoni |
Enterite virale Malattia aleutina |
|
Api |
Peste europea Varroasi e acariasi |
|
Scimmie e felini |
Tubercolosi |
|
Ruminanti |
Tubercolosi |
|
Lagomorfi |
Mixomatosi Malattie virali ed emorragiche Tularemia |
ALLEGATO C
CONDIZIONI PER IL RICONOSCIMENTO DEGLI ORGANISMI, ISTITUTI O CENTRI
1. Per essere ufficialmente riconosciuto ai sensi dell'articolo 13, paragrafo 2, della presente direttiva, l'organismo, istituto o centro quale definito all'articolo 2, paragrafo 1, lettera c), deve:
a) essere nettamente delimitato e separato dall'ambiente circostante o dagli animali e situato ad una distanza tale da non presentare alcun rischio o minaccia per lo status sanitario delle aziende agricole vicine;
b) possedere mezzi adeguati per catturare, rinchiudere e isolare gli animali, nonché disporre di strutture adeguate di quarantena e applicare procedure riconosciute per gli animali provenienti da fonti non riconosciute;
c) essere indenne dalle malattie di cui all'allegato A e, per quanto concerne le malattie oggetto, nel paese interessato, di un programma ai sensi dell'articolo 14, essere indenne dalle malattie di cui all'allegato B. Affinché un organismo, un istituto o un centro siano dichiarati indenni da tali malattie, l'autorità competente valuta i registri relativi allo stato di salute degli animali, conservati almeno per gli ultimi tre anni, nonché i risultati degli esami clinici e di laboratorio effettuati sugli animali presso l'organismo, l'istituto o il centro. Tuttavia, in deroga a questa disposizione, i nuovi stabilimenti vengono riconosciuti se gli animali ivi detenuti provengono da stabilimenti riconosciuti;
d) tenere aggiornati registri in cui sia indicato quanto segue:
i) il numero e l'identità (età, sesso, specie e identificazione individuale, se fattibile) dei capi di ogni specie presenti nello stabilimento;
ii) il numero e l'identità (età, sesso, specie e identificazione individuale, se fattibile) degli animali giunti nello stabilimento o che l'abbiano lasciato, nonché i dati relativi alla loro origine o destinazione, al trasporto in provenienza o a destinazione dello stabilimento e al loro stato di salute;
iii) i risultati degli esami sanguigni o di qualsiasi altro procedimento diagnostico;
iv) i casi di malattia ed eventualmente la terapia utilizzata;
v) i risultati degli esami post mortem di tutti gli animali deceduti nello stabilimento, compresi gli animali nati morti;
vi) le constatazioni effettuate durante eventuali periodi di isolamento o di quarantena;
e) avere accordi con un laboratorio competente, incaricato di effettuare gli esami post mortem o disporre di uno o più locali dove questi esami possano essere effettuati da una persona competente sotto l'autorità del veterinario riconosciuto;
f) aver preso disposizioni idonee o disporre sul posto delle strutture necessarie per l'eliminazione delle carcasse degli animali morti per malattia o soppressi per eutanasia;
g) assicurarsi, mediante contratto o strumento giuridico, i servizi di un veterinario riconosciuto dall'autorità competente e soggetto al controllo di quest'ultima. Tale veterinario deve:
i) rispondere, mutatis mutandis, ai requisiti di cui all'articolo 14, paragrafo 3, sezione B, della direttiva 64/432/CEE;
ii) provvedere affinché nell'organismo, istituto o centro vengano applicate misure adeguate di sorveglianza e di lotta in relazione alla situazione sanitaria del paese, approvate dalle competenti autorità. Tali misure comprendono:
— un piano annuale di sorveglianza delle malattie, contenente adeguate misure di lotta contro le zoonosi,
— test clinici, di laboratorio e post mortem sugli animali sospetti di essere affetti da malattie trasmissibili,
— ove del caso, la vaccinazione degli animali sensibili contro le malattie infettive, solo conformemente alla normativa comunitaria;
iii) provvedere affinché sia immediatamente notificata all'autorità competente qualsiasi morte sospetta o la presenza di qualunque altro sintomo che lasci supporre che gli animali abbiano contratto una o più delle malattie di cui agli allegati A e B, ove esse siano soggette a denuncia nello Stato membro;
iv) provvedere affinché gli animali in entrata siano stati debitamente isolati, a norma della presente direttiva e, se del caso, delle istruzioni emanate dall'autorità competente;
v) essere responsabile del rispetto quotidiano dei requisiti di polizia sanitaria previsti dalla presente direttiva e dalla normativa comunitaria relativa al benessere degli animali durante il trasporto e all'eliminazione dei rifiuti animali;
h) qualora detenga animali destinati a laboratori sperimentali, essere conforme a quanto disposto dall'articolo 5 della direttiva 86/609/CEE.
2. Il riconoscimento è confermato se sono soddisfatti i seguenti requisiti:
a) i locali vengono costantemente controllati da un veterinario ufficiale designato dall'autorità competente il quale:
i) visiti i locali dell'organismo, istituto o centro almeno una volta all'anno;
ii) controlli l'attività del veterinario riconosciuto e l'attuazione del piano annuale di sorveglianza delle malattie;
iii) vigili sul rispetto delle disposizioni della presente direttiva;
b) sono ammessi nello stabilimento solo animali provenienti da un altro organismo, istituto o centro riconosciuto, conformemente alle disposizioni della presente direttiva;
c) il veterinario ufficiale accerta che:
— le disposizioni della presente direttiva sono rispettate,
— i risultati degli esami clinici, post mortem e di laboratorio sugli animali non abbiano rivelato la presenza di nessun caso di malattie elencate negli allegati A e B;
d) l'organismo, istituto o centro conserva i registri di cui al punto 1, lettera d), per un periodo di almeno dieci anni dopo il riconoscimento.
3. In deroga all'articolo 5, paragrafo 1, della presente direttiva e al punto 2, lettera b), del presente allegato gli animali, comprese le scimmie (simiae e prosimiae) non provenienti da organismi, istituti o centri riconosciuti, possono essere introdotti in un organismo, un istituto o un centro riconosciuto purché siano preventivamente sottoposti a quarantena sotto controllo ufficiale, attenendosi alle istruzioni emanate dall'autorità competente.
Nel caso delle scimmie (simiae e prosimiae), devono essere rispettati i requisiti in materia di quarantena stabiliti dal codice zoosanitario dell'UIE (capitolo 2.10.1 e appendice 3.5.1).
Per gli altri animali messi in quarantena secondo quanto disposto al primo comma del presente punto, il periodo di quarantena deve essere di almeno 30 giorni per le malattie elencate nell'allegato A.
4. Gli animali detenuti in un organismo, istituto o centro riconosciuto possono uscire da tali stabilimenti soltanto se sono destinati ad un altro organismo, istituto o centro riconosciuto nello stesso Stato membro o in un altro Stato membro; tuttavia, se non sono destinati a un organismo, istituto o centro riconosciuto, tali animali possono uscire unicamente nel rispetto delle disposizioni stabilite dall'autorità competente per prevenire ogni rischio di contagio.
5. Gli Stati membri che beneficiano di garanzie supplementari in virtù della normativa comunitaria possono chiedere che all'organismo, istituto o centro riconosciuto siano imposti requisiti e certificati supplementari adeguati per le specie sensibili.
6. Il riconoscimento è parzialmente o interamente sospeso, revocato o ripristinato nei casi seguenti:
a) qualora l'autorità competente ritenga che non sono rispettati i requisiti di cui al punto 2 oppure che vi sia stato un cambiamento di destinazione non contemplato dall'articolo 2 della presente direttiva il riconoscimento è sospeso o revocato;
b) qualora si notifichi il sospetto della presenza di una delle malattie di cui all'allegato A o all'allegato B, l'autorità competente sospende il riconoscimento dell'organismo, istituto o centro fino a quando tale sospetto non sia stato ufficialmente escluso. In funzione della malattia sospettata e del rischio di trasmissione, la sospensione può applicarsi all'intero stabilimento o solo a determinate categorie di animali sensibili a tale malattia. L'autorità competente provvede affinché siano adottate le misure necessarie per confermare od escludere il sospetto e per evitare l'eventuale propagazione della malattia, conformemente alla normativa comunitaria relativa alle misure di lotta contro tale malattia e in materia di scambi di animali;
c) qualora la malattia sospettata sia confermata, l'organismo, l'istituto o il centro possono ottenere un nuovo riconoscimento solo se, dopo l'eradicazione della malattia e dei focolai d'infezione nei suoi locali, e dopo un'adeguata disinfezione e pulizia, sono nuovamente soddisfatte le condizioni di cui al punto 1 del presente allegato, ad eccezione di quelle enunciate al punto 1, lettera c);
d) l'autorità competente informa la Commissione in merito alla sospensione, alla revoca o al ripristino del riconoscimento di un organismo, di un istituto o di un centro.
ALLEGATO D
CAPITOLO I
I. Condizioni per il riconoscimento delle stazioni e dei centri di raccolta dello sperma
Le stazioni e i centri di raccolta dello sperma devono:
1) essere posti sotto la sorveglianza di un veterinario considerato responsabile del centro;
2) disporre almeno:
a) di locali per la stabulazione degli animali, provvisti di opportuni dispositivi di chiusura ed eventualmente di una zona d'esercizio per gli equini, separati materialmente dagli impianti di raccolta, nonché dai locali adibiti al trattamento e all'immagazzinamento dello sperma;
b) di impianti di isolamento, senza alcuna possibilità di comunicazione diretta con i normali locali di stabulazione;
c) di impianti per la raccolta dello sperma, comprendenti un locale separato per la pulitura e la disinfezione o la sterilizzazione delle attrezzature;
d) di un locale per il trattamento dello sperma, separato dagli impianti di raccolta e non situato necessariamente nello stesso luogo di questi ultimi;
e) di un locale per l'immagazzinamento dello sperma, non situato necessariamente nello stesso luogo;
3) essere costruiti od isolati in modo da evitare qualsiasi contatto col bestiame che si trovi al di fuori di essi;
4) essere costruiti in modo che l'intero centro o stazione, eccettuati i locali amministrativi e, per gli equini, la zona d'esercizio, possa venir rapidamente pulito e disinfettato.
II. Condizioni relative alla sorveglianza delle stazioni e dei centri di raccolta dello sperma
Le stazioni e i centri di raccolta dello sperma devono:
1) essere sorvegliati affinché vi vengano ospitati soltanto animali della specie di cui deve essere raccolto lo sperma.
Possono tuttavia esservi ammessi altri animali domestici, sempreché non presentino rischi d'infezione per le specie di cui dev'essere raccolto lo sperma e soddisfino le condizioni stabilite dal veterinario responsabile del centro.
Nel caso degli equini, qualora il centro di raccolta si trovi nello stesso luogo di un centro d'inseminazione artificiale o di una stazione per la monta naturale, le giumente, gli stalloni di prova e gli stalloni da monta possono esservi ammessi sempreché rispondano alle condizioni di cui all'allegato D, capitolo II, paragrafo A, punti 1), 2), 3) e 4);
2) essere sorvegliati ai fini della tenuta di un registro che permetta di conoscere:
— la specie, la razza, la data di nascita e l'identificazione di ogni animale presente nel centro,
— gli eventuali movimenti (entrate e uscite) degli animali presenti nel centro,
— l'anamnesi, nonché tutti gli esami diagnostici (con i relativi risultati), i trattamenti e le vaccinazioni cui gli animali sono stati sottoposti,
— la data di raccolta e di trattamento dello sperma,
— la destinazione dello sperma,
— le modalità di immagazzinamento dello sperma;
3) essere ispezionati durante il periodo di riproduzione da un veterinario ufficiale, il quale verifichi il rispetto delle condizioni di riconoscimento e sorveglianza ed esamini tutte le questioni attinenti, almeno una volta all'anno in caso di riproduzione stagionale e due volte all'anno in caso di riproduzione non stagionale;
4) beneficiare di una sorveglianza che impedisca l'accesso delle persone non autorizzate. Devono inoltre essere autorizzate le visite secondo le condizioni stabilite dal veterinario responsabile del centro;
5) disporre di personale competente e adeguatamente addestrato alle tecniche di disinfezione e alle tecniche igieniche intese a prevenire la propagazione delle malattie;
6) essere soggetti ad appropriata sorveglianza, tale da assicurare che:
— nessun animale detenuto nel centro venga utilizzato per la riproduzione naturale almeno nei 30 giorni precedenti la prima raccolta di sperma e durante il periodo di raccolta;
— la raccolta, il trattamento e l'immagazzinamento dello sperma possano aver luogo soltanto negli appositi locali;
— ogni strumento che entri in contatto con lo sperma o con l'animale donatore durante la raccolta o il trattamento venga opportunamente disinfettato o sterilizzato prima di ogni impiego, oppure sia nuovo e non riutilizzabile e venga eliminato dopo l'impiego.
— Per gli equini, se un centro di raccolta si trova nello stesso luogo di un centro di inseminazione artificiale o di una stazione per la monta naturale, gli strumenti e le attrezzature per l'inseminazione o la monta, nonché qualsiasi strumento e attrezzatura che venga a contatto con gli animali donatori o con altri animali detenuti nel centro di raccolta devono essere rigorosamente separati dallo sperma;
— per il trattamento dello sperma vengano utilizzati prodotti di origine animale (diluenti, additivi o riempitivi) che non comportino rischi per la salute degli animali o siano stati trattati prima dell'uso in modo da impedire tali rischi;
— in caso di sperma refrigerato o congelato, venga fatto uso di agenti criogeni che non siano stati impiegati in precedenza per altri prodotti di origine animale;
— qualsiasi recipiente destinato all'immagazzinamento o al trasporto dello sperma venga opportunamente disinfettato o sterilizzato prima di ogni impiego, oppure sia nuovo e non riutilizzabile e venga eliminato dopo l'impiego;
7) provvedere affinché ogni dose di sperma venga identificata in maniera indelebile ed in modo tale che sia possibile determinare lo Stato membro d'origine, la data di raccolta, la specie, la razza, l'identità dell'animale donatore, nonché il nome e/o il numero del centro riconosciuto che ha provveduto alla raccolta.
CAPITOLO II
Condizioni applicabili nei centri e nelle stazioni di raccolta
Condizioni relative all'ammissione dei maschi donatori
A. STALLONI
Possono essere destinati alla raccolta di sperma soltanto gli stalloni che, secondo il veterinario responsabile del centro, rispondano ai seguenti requisiti:
1) non presentino sintomi di malattie infettive o contagiose al momento dell'ammissione né nel giorno durante il periodo di raccolta dello sperma;
2) provengano dal territorio — oppure, in caso di regionalizzazione, da una parte del territorio — di uno Stato membro o di un paese terzo, nonché da un'azienda sottoposta a sorveglianza veterinaria, fermo restando che tale territorio (o parte di esso) ed azienda devono soddisfare le condizioni prescritte dalla direttiva 90/426/CEE del Consiglio;
3) abbiano soggiornato, per i 30 giorni precedenti la raccolta dello sperma, in aziende nelle quali nessun equino abbia presentato, durante lo stesso periodo, sintomi clinici dell'arterite virale;
4) abbiano soggiornato, per i 60 giorni precedenti la raccolta dello sperma, in aziende nelle quali nessun equino abbia presentato, durante lo stesso periodo, sintomi clinici di metrite contagiosa;
5) non siano stati utilizzati per la monta naturale nei 30 giorni precedenti la prima raccolta dello sperma, né durante il periodo di raccolta;
6) siano stati sottoposti ai seguenti esami, effettuati e certificati da un laboratorio riconosciuto dall'autorità competente, secondo il programma esposto al punto 7:
i) per la ricerca dell'anemia infettiva degli equidi, ad una reazione di immunodiffusione su gel di agar, detta «test di Coggins»;
ii) per la ricerca dell'arterite virale degli equidi, ad una prova di sieroneutralizzazione, oppure, se non si ottengono risultati negativi con una (diluizione < 1/4), a una prova di isolamento del virus dell'arterite, effettuata su una certa percentuale della quantità totale di sperma dello stallone donatore;
iii) per la ricerca della metrite contagiosa degli equidi mediante isolamento del germe Taylorella equigenitalis, ad un controllo effettuato in due occasioni, a 7 giorni d'intervallo, su prelievi di liquido preeiaculatorio o su un campione di sperma, nonché su tamponi genitali almeno in corrispondenza della fossetta uretrale, compreso il seno uretrale, e del pene, compresa la fossa glandis;
7) siano stati sottoposti ad uno dei seguenti programmi di controllo:
i) qualora lo sperma venga raccolto per essere commercializzato allo stato fresco o refrigerato:
— se lo stallone donatore ha soggiornato in modo continuativo nel centro di raccolta almeno per i 30 giorni precedenti la prima raccolta di sperma e durante il periodo di raccolta, e se nessun equino nel centro di raccolta è entrato in contatto diretto con equini in condizioni sanitarie inferiori a quelle dello stallone donatore, gli esami di cui al punto 6, lettere i), ii) e iii), devono essere effettuati almeno 14 giorni dopo l'inizio del periodo trascorso nel centro di raccolta ed almeno una volta all'anno all'inizio del periodo riproduttivo;
— se lo stallone donatore non ha soggiornato in modo continuativo nel centro di raccolta e/o se degli equini del centro di raccolta sono entrati in contatto diretto con altri equini in condizioni sanitarie inferiori, gli esami di cui al punto 6, lettere i), ii) e iii), devono essere effettuati nei 14 giorni precedenti la prima raccolta di sperma e almeno una volta all'anno all'inizio del periodo riproduttivo. Inoltre, l'esame di cui al punto 6, lettera i), deve essere ripetuto ad intervalli di 120 giorni durante il periodo di raccolta dello sperma. L'esame di cui al punto 6, lettera ii), deve essere effettuato non più di 30 giorni prima di ogni raccolta di sperma, salvo che — nel caso di uno stallone che ad un esame per la ricerca dell'arterite virale degli equidi sia risultato sieropositivo — la sua inidoneità alla donazione di sperma venga confermata da un esame d'isolamento del virus, che deve essere eseguito una volta all'anno;
ii) qualora lo sperma venga raccolto per essere commercializzato allo stato congelato, si applicano i programmi di controllo descritti al punto 7, lettera i), primo e secondo trattino, oppure si deve procedere agli esami di cui al punto 6, lettere i), ii) e iii); questi esami devono essere effettuati durante i 30 giorni del periodo obbligatorio di conservazione dello sperma e non meno di 14 giorni dopo la raccolta dello stesso, indipendentemente dal fatto che lo stallone abbia soggiornato nel centro in modo continuativo o meno.
B. OVINI E CAPRINI
1. Possono essere destinati alla raccolta di sperma solo gli ovini e i caprini dei centri, delle stazioni o aziende che, secondo il veterinario ufficiale:
a) godano di buona salute il giorno della raccolta;
b) soddisfino le condizioni di cui agli articoli 4, 5 e 6 della direttiva 91/68/CEE concernente gli scambi intracomunitari.
I donatori saranno inoltre sottoposti nei trenta giorni precedenti la raccolta, con risultato negativo, a:
— un test per la ricerca della brucellosi (Brucella melitensis), conformemente all'allegato C della direttiva 91/68/CEE;
— un test per la ricerca dell'epididimita contagiosa dell'ariete (Brucella ovis), conformemente all'allegato D della direttiva 91/68/CEE;
— un test di isolamento del virus del «Border disease»;
c) siano stati sottoposti ai test o controlli pertinenti volti a garantire l'osservanza dei requisiti di cui alle lettere a) e b).
2. Gli esami di cui al punto 1 devono essere effettuati presso un laboratorio riconosciuto dallo Stato membro.
C. Se uno degli esami di cui ai punti A e B risulta positivo, l'animale deve essere isolato e il suo sperma raccolto successivamente alla data dell'ultimo esame negativo non può essere commercializzato. Si opera in modo analogo per lo sperma degli altri animali ricettivi alla malattia in questione presenti nell'azienda o nel centro di raccolta a decorrere dalla data alla quale è stato effettuato l'esame con esito positivo. Gli scambi potranno riprendere solo quando sarà stata ristabilita la situazione sanitaria del centro di raccolta.
CAPITOLO III
Condizioni relative allo sperma, agli ovuli e agli embrioni
Lo sperma, gli ovuli e gli embrioni devono essere stati raccolti, trattati e conservati conformemente ai principi seguenti:
a) Il lavaggio degli ovuli e degli embrioni, anche nel caso degli equini, dev'essere effettuato secondo modalità da stabilire conformemente alla procedura descritta all'articolo 26. In attesa che tali modalità vengano stabilite, si applicano le norme internazionali.
La zona pellucida degli ovuli e degli embrioni deve restare intatta prima e dopo il lavaggio.
Possono essere lavati contemporaneamente soltanto ovuli ed embrioni dello stesso donatore.
Dopo il lavaggio, la zona pellucida di ogni ovulo od embrione dev'essere esaminata su tutta la superficie mediante ingrandimento di almeno 50 volte ed essere certificata intatta ed esente da qualsiasi sostanza aderente.
b) I mezzi e le soluzioni utilizzati per la raccolta, la lavorazione (esame, lavaggio e trattamento), la conservazione o il congelamento degli ovuli e degli embrioni devono essere sterilizzati secondo metodi riconosciuti ed essere manipolati in modo da restare sterili.
Ai mezzi di raccolta, di lavaggio e di conservazione degli ovuli e degli embrioni ed ai diluenti dello sperma devono essere aggiunti antibiotici. Se necessario, verranno adottate modalità d'applicazione secondo la procedura descritta all'articolo 26.
c) Tutto il materiale utilizzato per la raccolta, il trattamento, la conservazione o il congelamento dello sperma, degli ovuli e degli embrioni deve venir adeguatamente disinfettato o sterilizzato prima di ogni impiego, oppure essere nuovo e non riutilizzabile e venir eliminato dopo l'impiego.
d) Secondo la procedura descritta all'articolo 26 possono venir stabiliti esami complementari, relativi in particolare ai liquidi di raccolta o di lavaggio e volti a determinare l'assenza di germi patogeni.
e) Gli ovuli e gli embrioni sottoposti con esito positivo all'esame di cui alla lettera a), nonché lo sperma devono essere posti in contenitori sterilizzati e debitamente identificati, i quali devono contenere solo prodotti provenienti da uno stesso donatore o da una stessa donatrice e venir immediatamente sigillati.
L'identificazione, le cui modalità vanno stabilite secondo la procedura descritta all'articolo 26, deve permettere di determinare almeno il paese d'origine, la data di raccolta, la specie, la razza, l'identità dell'animale donatore, nonché il nome e/o il numero del centro di raccolta o dell'équipe che ha proceduto alla raccolta.
f) Lo sperma, gli ovuli e gli embrioni congelati devono essere posti in contenitori sterilizzati di azoto liquido che non presentino alcun rischio di contaminazione dei prodotti.
g) Lo sperma, gli ovuli e gli embrioni congelati devono essere immagazzinati in condizioni autorizzate per un periodo minimo di 30 giorni prima della spedizione.
h) Lo sperma, gli ovuli e gli embrioni devono essere trasportati in contenitori adeguatamente puliti, disinfettati o sterilizzati prima di ogni impiego, oppure nuovi e non riutilizzabili ed eliminati dopo l'impiego.
CAPITOLO IV
Femmine donatrici
Possono essere destinate alla raccolta di embrioni o di ovuli solo le femmine sempreché, a giudizio del veterinario ufficiale, esse e le mandrie di provenienza soddisfino, in base alla specie in questione, le condizioni di cui alle pertinenti direttive in materia di scambi intracomunitari di animali vivi d'allevamento e da produzione.
Le direttive 64/432/CEE e 91/68/CEE del Consiglio si applicano rispettivamente ai suini ed agli ovini/caprini.
Quanto agli equini, oltre a soddisfare le condizioni di cui alla direttiva 90/426/CEE del Consiglio, essi devono aver soggiornato, prima della raccolta degli ovuli o degli embrioni, in aziende che per almeno 60 giorni non abbiano presentato sintomi clinici delle metrite contagiosa degli equidi. Inoltre, per almeno 30 giorni prima della raccolta degli ovuli o degli embrioni, gli animali in questione non devono essere stati utilizzati per scopi di riproduzione naturale.
ALLEGATO E
Parte 1 — Certificato sanitario per gli scambi di animali provenienti da aziende
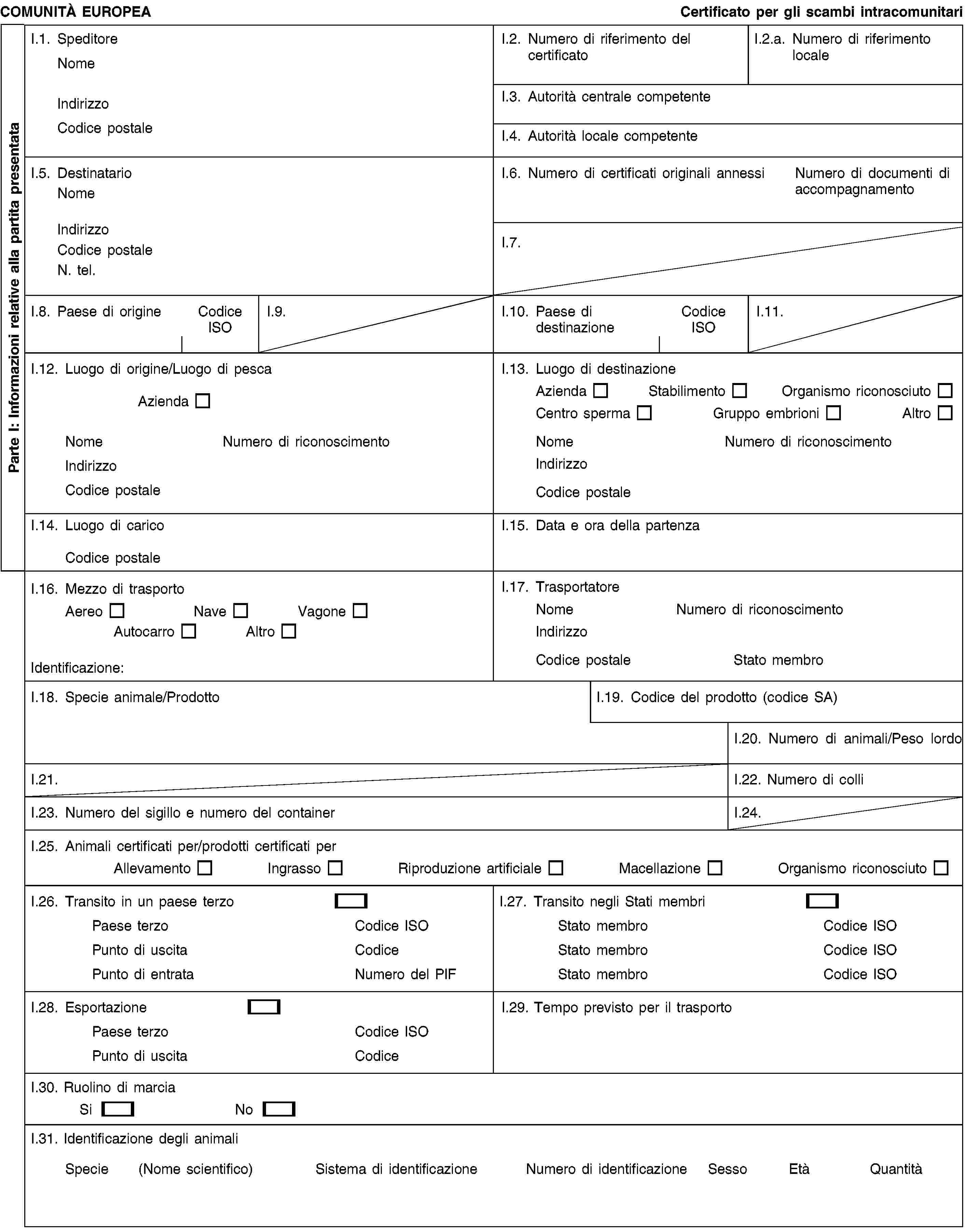
![Parte II: CertificazioneCOMUNITÀ EUROPEA92/65 EI Animali provenienti da aziende (ungulati, volatili, lagomorfi, cani, gatti e furetti)II. Informazioni sanitarieII.a. Numero di riferimento del certificatoII.b. Numero di riferimento localeIl sottoscritto, veterinario ufficiale (1)/veterinario responsabile dello stabilimento di origine e riconosciuto dall’ autorità competente certifica che:II.1. al momento dell’ispezione gli animali di cui al presente certificato erano idonei al trasporto lungo il tragitto previsto, conformemente alle disposizioni del regolamento (CE) n. 1/2005 del Consiglio.II.2. sono rispettate le condizioni di cui all’articolo 4 della direttiva 92/65/CEE del Consiglio.II.3.1. il ruminante/suino (1) diverso da quelli contemplati dalla direttiva 64/432/CEE (1):a) appartiene alla specie;b) al momento dell’esame, non presentava alcun segno clinico delle malattie alle quali è esposto;c) proviene da un allevamento ufficialmente indenne da tubercolosi e/o ufficialmente indenne o indenne da brucellosi e/o da un’azienda non soggetta a restrizioni relative alla peste suina (1) o da un’azienda in cui è stato sottoposto, con esito negativo, ai test previsti dall’articolo 6, paragrafo 2, lettera b), della direttiva 92/65/CEE.II.3.2. volatili diversi da quelli contemplati dalla direttiva 90/539/CEE (1).soddisfa le condizioni stabilite all’articolo 7 della direttiva 92/65/CEE e, al momento del test, gli animali non presentavano sintomi clinici di malattia.II.3.3. lagomorfi (1)soddisfano le condizioni stabilite all’articolo 9 della direttiva 92/65/CEE e, al momento del test, gli animali non presentavano sintomi clinici di malattia.II.3.4. cani, gatti e furetti (1)[a) soddisfano le condizioni stabilite dagli articoli 5 e 16 del regolamento (CE) n. 998/2003 del Parlamento europeo e del Consiglio, del 26 maggio 2003, relativo alle condizioni di polizia sanitaria applicabili ai movimenti a carattere non commerciale di animali da compagnia e che modifica la direttiva 92/65/CEE del Consiglio; e][a) soddisfano le condizioni stabilite dagli articoli 6 e 16 del regolamento (CE) n. 998/2003 ove gli scambi siano destinati all’Irlanda, al Regno Unito o alla Svezia; e]b) hanno subito un esame clinico nelle 24 ore precedenti la spedizione da parte di un veterinario riconosciuto dall’autorità competente, e da tale esame è risultato che gli animali erano in buona salute e in grado di essere trasportati.II.4. Le garanzie supplementari relative alle malattie elencate all’allegato B (2) della direttiva 92/65/CEE sono le seguenti (1):malattiadecisionemalattiadecisionemalattiadecisioneNoteParte I:Casella I.6: N. del/i documento/i di accompagnamento: CITES, se del caso.Casella I.19: Utilizzare i codici SA appropriati: 01.06.19, 01.06.31, 01.06.32, 01.06.39.Casella I.31: Identificazione: ove possibile, occorre procedere all’identificazione individuale, ma in caso di animali piccoli si può ricorrere all’identificazione per partita.Età e sesso: da compilare solo in caso di animali vivi.](./../../../resource.html?uri=celex:01992L0065-20080903.ITA.xhtml.L_2007114IT.01002001.tif.jpg)

Parte 2 — Certificato sanitario per gli scambi di colonie di api/api regine e calabroni


Parte 3 — Certificato sanitario per gli scambi di animali, sperma, embrioni e ovuli provenienti da organismi, istituti o centri riconosciuti
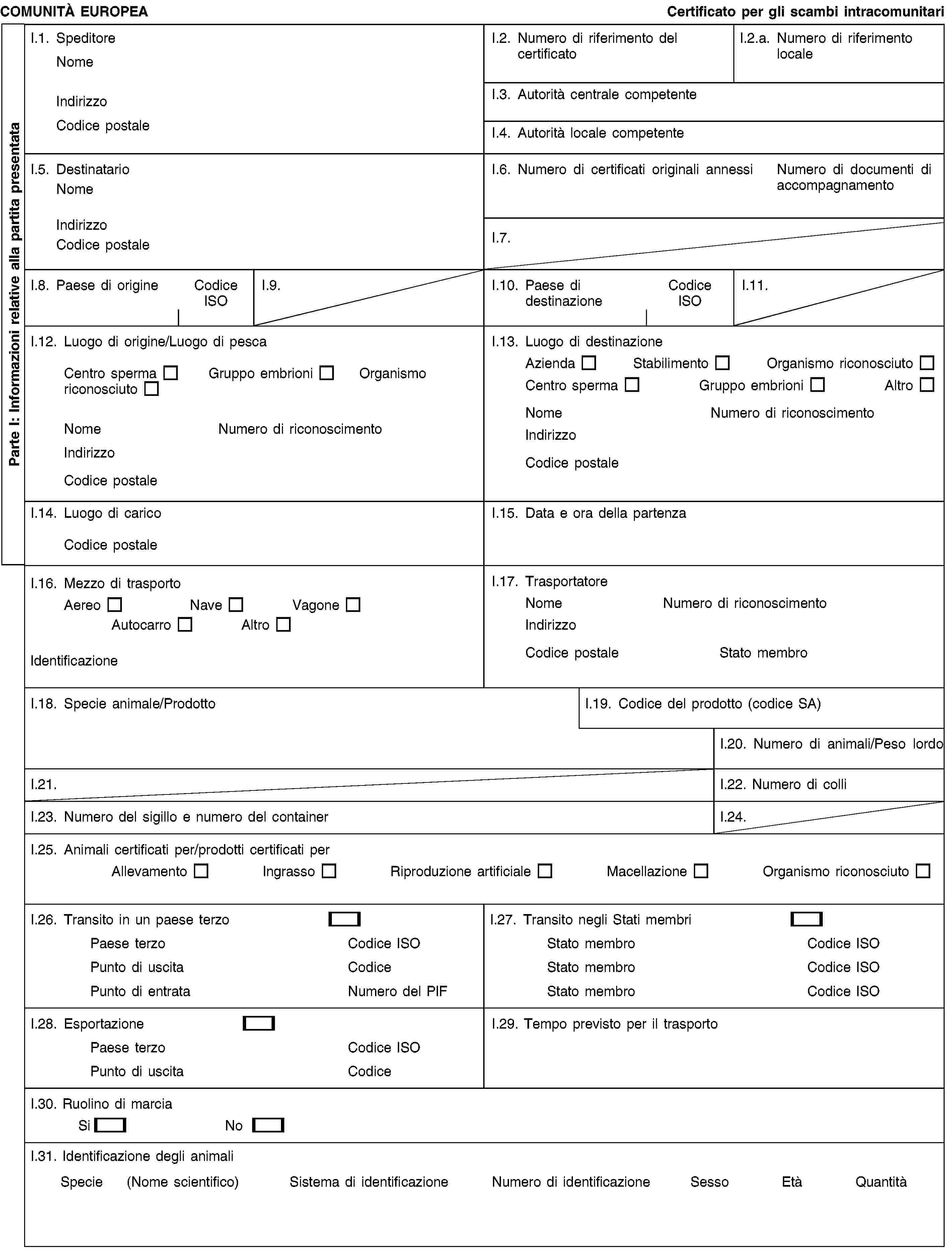

ALLEGATO F
Direttiva 64/432/CEE del Consiglio, del 26 giugno 1964, relativa a problemi di polizia sanitaria in materia di scambi intracomunitari di animali delle specie bovina e suina.
Direttiva 88/407/CEE del Consiglio, del 14 giugno 1988, che stabilisce le esigenze di polizia sanitaria applicabili agli scambi intracomunitari ed alle importazioni di sperma surgelato di animali della specie bovina.
Direttiva 89/556/CEE del Consiglio, del 25 settembre 1989, che stabilisce le condizioni di polizia sanitaria per gli scambi intracomunitari e le importazioni da paesi terzi di embrioni di animali domestici della specie bovina.
Direttiva 90/426/CEE del Consiglio, del 26 giugno 1990, relativa alle condizioni di polizia sanitaria che disciplinano i movimenti di equidi e le importazioni di equidi in provenienza dai paesi terzi.
Direttiva 90/429/CEE del Consiglio, del 26 giugno 1990, che stabilisce le esigenze di polizia sanitaria applicabili agli scambi intracomunitari ed alle importazioni di sperma di animali della specie suina.
Direttiva 90/539/CEE del Consiglio, del 15 ottobre 1990, relativa alle norme di polizia sanitaria per gli scambi intracomunitari e le importazioni in provenienza dai paesi terzi di pollame e uova da cova.
Direttiva 91/67/CEE del Consiglio, del 28 gennaio 1991, che stabilisce le norme di polizia sanitaria per la commercializzazione di animali e prodotti d'acquacoltura.
Direttiva 91/68/CEE del Consiglio, del 28 gennaio 1991, relativa alle condizioni di polizia sanitaria da applicare negli scambi intracomunitari di ovini e caprini.
Direttiva 2004/68/CE del Consiglio, del 26 aprile 2004, che stabilisce le norme di polizia sanitaria per l'importazione e il transito nella Comunità di determinati ungulati vivi, che modifica le direttive 90/426/CEE e 92/65/CEE e che abroga la direttiva 72/462/CEE.
( 1 ) GU n. C 327 del 30.12.1989, pag. 57, e GU n. C 84 del 2.4.1990, pag. 102.
( 2 ) GU n. C 38 del 19.2.1990, pag. 134, e GU n. C 149 del 18.6.1990, pag. 263.
( 3 ) GU n. C 62 del 12.3.1990, pag. 47, e GU n. C 182 del 23.7.1990, pag. 25.
( 4 ) GU n. L 384 del 31.12.1982, pag. 1. Regolamento modificato da ultimo dal regolamento (CEE) n. 197/90 (GU n. L 29 del 31.1.1990, pag. 1).
( 5 ) GU n. 121 del 29.7.1964, pag. 1977/64. Direttiva modificata da ultimo dalla direttiva 91/499/CEE (GU n. L 268 del 24.9.1991, pag. 107).
( 6 ) GU n. L 315 del 26.11.1985, pag. 11. Direttiva modificata dalla direttiva 90/423/CEE (GU n. L 224 del 18.8.1990, pag. 13).
( 7 ) GU n. L 224 del 18.8.1990, pag. 29. Direttiva modificata da ultimo dalla direttiva 91/496/CEE (GU n. L 268 del 24.9.1991, pag. 56).
( 8 ) GU n. L 373 del 31.12.1990, pag. 1. Direttiva modificata dalla direttiva 91/496/CEE (GU n. L 268 del 24.9.1991, pag. 56).
( 9 ) Direttiva 90/426/CEE del Consiglio, del 26 giugno 1990, relativa alle condizioni di polizia sanitaria che disciplinano i movimenti di equidi e le importazioni di equidi in provenienza dai paesi terzi (GU n. L 224 del 18.8.1990, pag. 42). Direttiva modificata da ultimo dalla direttiva 91/496/CEE (GU n. L 268 del 24.9.1991, pag. 56).
( 10 ) Direttiva 90/539/CEE del Consiglio, del 15 ottobre 1990, relativa alle norme di polizia sanitaria per gli scambi intracomunitari e le importazioni in provenienza dai paesi terzi di pollame e uova da cova (GU n. L 303 del 31.10.1990, pag. 6). Direttiva modificata da ultimo dalla direttiva 91/496/CEE (GU n. L 268 del 24.9.1991, pag. 56).
( 11 ) Direttiva 91/67/CEE del Consiglio, del 28 gennaio 1991, che stabilisce le norme di polizia sanitaria per la commercializzazione di animali e prodotti d'acquacoltura (GU n. L 46 del 19.2.1991, pag. 1).
( 12 ) Direttiva 91/68/CEE del Consiglio, del 28 gennaio 1991, relativa alle condizioni di polizia sanitaria da applicare negli scambi intracomunitari di ovini e caprini (GU n. L 46 del 19.2.1991, pag. 1).
( 13 ) Direttiva 91/492/CEE del Consiglio, del 15 luglio 1991, che stabilisce le norme sanitarie applicabili alla produzione e alla commercializzazione dei molluschi bivalvi vivi (GU n. L 268 del 24.9.1991, pag. 1).
( 14 ) Direttiva 91/493/CEE del Consiglio, del 22 luglio 1991, che stabilisce le norme sanitarie applicabili alla produzione e alla commercializzazione dei prodotti della pesca (GU n. L 268 del 24.9.1991, pag. 15).
( 15 ) Direttiva 80/217/CEE del Consiglio, del 22 gennaio 1989, che stabilisce misure comunitarie di lotta contro la peste suina classica (GU n. L 47 del 21.2.1980, pag. 11). Direttiva modificata da ultimo dalla direttiva 87/486/CEE (GU. n. L 280 del 3.10.1987, pag. 21).
( 16 ) GU n. L 268 del 24.9.1991, pag. 41.
( 17 ) GU n. L 303 del 31.10.1990, pag. 6.
( 18 ) GU L 146 del 13.6.2003, pag. 1.
( 19 ) Direttiva 71/118/CEE del Consiglio, del 15 febbraio 1971, relativa a problemi sanitari in materia di scambi di carni fresche di volatili da cortile (GU n. L 55 dell'8.3.1971, pag. 23). Direttiva modificata, da ultimo, dalla direttiva 90/654/CEE (GU n. L 353 del 17.12.1990, pag. 48).
( 20 ) Direttiva 91/496/CEE del Consiglio, del 15 luglio 1991, che fissa i principi relativi all'organizzazione dei controlli veterinari per gli animali che provengono dai paesi terzi e che sono introdotti nella Comunità e che modifica le direttive 89/662/CEE, 90/425/CEE e 90/675/CEE (Gu n. L 268 del 24.9.1991, pag. 56).
( 21 ) Direttiva 91/628/CEE del Consiglio, del 19 novembre 1991, relativa alla protezione degli animali durante il trasporto e recante modifica delle direttive 90/425/CEE e 91/496/CEE (GU n. L 340 dell'11.12.1991, pag. 17).
( 22 ) GU L 31 dell’1.2.2002, pag. 1
( 23 ) GU L 184 del 17.7.1999, pag. 23.


