ISSN 1977-0731
Az Európai Unió
Hivatalos Lapja
L 204

Magyar nyelvű kiadás
Jogszabályok
62. évfolyam
2019. augusztus 2.
|
ISSN 1977-0731 |
||
|
Az Európai Unió Hivatalos Lapja |
L 204 |
|

|
||
|
Magyar nyelvű kiadás |
Jogszabályok |
62. évfolyam |
|
|
|
|
|
(1) EGT-vonatkozású szöveg. |
|
HU |
Azok a jogi aktusok, amelyek címe normál szedéssel jelenik meg, a mezőgazdasági ügyek napi intézésére vonatkoznak, és rendszerint csak korlátozott ideig maradnak hatályban. Valamennyi más jogszabály címét vastagon szedik, és előtte csillag szerepel. |
II Nem jogalkotási aktusok
RENDELETEK
|
2.8.2019 |
HU |
Az Európai Unió Hivatalos Lapja |
L 204/1 |
A TANÁCS (EU) 2019/1292 VÉGREHAJTÁSI RENDELETE
(2019. július 31.)
a líbiai helyzetre tekintettel korlátozó intézkedések meghozataláról szóló (EU) 2016/44 rendelet 21. cikke (2) bekezdésének végrehajtásáról
AZ EURÓPAI UNIÓ TANÁCSA,
tekintettel az Európai Unió működéséről szóló szerződésre,
tekintettel a líbiai helyzetre tekintettel korlátozó intézkedések meghozataláról és a 204/2011/EU rendelet hatályon kívül helyezéséről szóló, 2016. január 18-i (EU) 2016/44 tanácsi rendeletre (1) és különösen annak 21. cikke (2) bekezdésére,
tekintettel az Unió külügyi és biztonságpolitikai főképviselőjének javaslatára,
mivel:
|
(1) |
A Tanács 2016. január 18-án elfogadta az (EU) 2016/44 rendeletet. |
|
(2) |
A Tanács az (EU) 2016/44 rendelet 21. cikke (6) bekezdésének megfelelően felülvizsgálta a jegyzékbe vett személyeknek és szervezeteknek az említett rendelet III. mellékletében foglalt jegyzékét. |
|
(3) |
Törölni kell két személyre vonatkozó bejegyzést a személyeknek és szervezeteknek az (EU) 2016/44 rendelet III. mellékletében szereplő jegyzékéből. |
|
(4) |
Az (EU) 2016/44 rendelet III. mellékletét ezért ennek megfelelően módosítani kell, |
ELFOGADTA EZT A RENDELETET:
1. cikk
Az (EU) 2016/44 rendelet III. melléklete az e rendelet mellékletének megfelelően módosul.
2. cikk
Ez a rendelet az Európai Unió Hivatalos Lapjában való kihirdetését követő napon lép hatályba.
Ez a rendelet teljes egészében kötelező és közvetlenül alkalmazandó valamennyi tagállamban.
Kelt Brüsszelben, 2019. július 31-én.
a Tanács részéről
az elnök
T. TUPPURAINEN
MELLÉKLET
Az (EU) 2016/44 rendelet III. mellékletében („A 6. cikk (2) bekezdésében említett természetes és jogi személyek, szervezetek és szervek jegyzéke”) az A. (Személyek) részben szereplő jegyzékből törölni kell az 1. (ABDUSSALAM, Abdussalam Mohammedre vonatkozó) és a 14. (AL-BAGHDADI, Dr Abdulqader Mohammedre vonatkozó) bejegyzést, a fennmaradó bejegyzések számozása pedig ennek megfelelően változik.
|
2.8.2019 |
HU |
Az Európai Unió Hivatalos Lapja |
L 204/3 |
A BIZOTTSÁG (EU) 2019/1293 VÉGREHAJTÁSI RENDELETE
(2019. július 29.)
az 577/2013/EU végrehajtási rendeletnek a területek és harmadik országok II. mellékletben foglalt jegyzéke, valamint a kutyákra, macskákra és görényekre vonatkozó állategészségügyi bizonyítvány IV. mellékletben foglalt mintája tekintetében történő módosításáról
(EGT-vonatkozású szöveg)
AZ EURÓPAI BIZOTTSÁG,
tekintettel az Európai Unió működéséről szóló szerződésre,
tekintettel a kedvtelésből tartott állatok nem kereskedelmi célú mozgásáról és a 998/2003/EK rendelet hatályon kívül helyezéséről szóló, 2013. június 12-i 576/2013/EU európai parlamenti és tanácsi rendeletre (1) és különösen annak 13. cikke (2) bekezdésére és 25. cikke (2) bekezdésére,
mivel:
|
(1) |
Az 577/2013/EU bizottsági végrehajtási rendelet (2) rendelkezik többek között az 576/2013/EU rendelet 13. cikkében említett területek és harmadik országok jegyzékeiről, valamint a kutyák, macskák és görények e területekről vagy harmadik országokból valamely tagállamba irányuló, nem kereskedelmi célú mozgásához szükséges állategészségügyi bizonyítványokról. |
|
(2) |
Az 577/2013/EU végrehajtási rendelet a 66/2016 EGT vegyes bizottsági határozat (3) útján beépült az Európai Gazdasági Térségről szóló megállapodásba (EGT-megállapodás), és immár Norvégiára is teljeskörűen alkalmazandó, épp úgy, ahogy az uniós tagállamokra. |
|
(3) |
Norvégia az 577/2013/EU végrehajtási rendelet II. mellékletének 1. részében foglalt jegyzékben szerepel. A 66/2016 EGT vegyes bizottsági határozat szabályozza a kutyák, macskák és görények Norvégiából valamely tagállamba irányuló, nem kereskedelmi célú mozgását. Ezért Norvégiát törölni kell az 577/2013/EU végrehajtási rendelet II. mellékletének 1. részében foglalt, területeket és harmadik országokat felsoroló jegyzékből. |
|
(4) |
Gondoskodni kell továbbá arról is, hogy az 577/2013/EU végrehajtási rendelet II. mellékletének 2. részében foglalt, területeket és harmadik országokat felsoroló jegyzékben Macedónia Volt Jugoszláv Köztársaság új neve szerepeljen. |
|
(5) |
Az 576/2013/EU rendelet előírja többek között azt, hogy a kutyák, macskák és görények valamely területről vagy harmadik országból egy tagállamba irányuló, nem kereskedelmi célú mozgása esetén az állatoknak meg kell felelniük a veszettségtől eltérő betegségekre vagy fertőzésekre a szóban forgó rendelet 19. cikkének (1) bekezdése alapján elfogadott megelőző egészségügyi intézkedéseknek, és azokat azonosító okmánynak, mégpedig a megfelelő formátumú állategészségügyi bizonyítványnak kell kísérnie. Az állategészségügyi bizonyítvány mintáját az 577/2013/EU bizottsági végrehajtási rendelet IV. mellékletének 1. része tartalmazza. |
|
(6) |
Emellett az 1152/2011/EU felhatalmazáson alapuló bizottsági rendelet (4) kötelező felülvizsgálatát követően a Bizottság elfogadta az (EU) 2018/772 felhatalmazáson alapuló rendeletet (5), amely többek meghatározza a tagállamok és részeik besorolására vonatkozó szabályokat a kutyák Echinococcus multilocularis fertőzése elleni védekezést célzó megelőző egészségügyi intézkedések alkalmazásához való jogosultságuk tekintetében. Az (EU) 2018/772 felhatalmazáson alapuló rendelet 2018. július 1-jétől hatályon kívül helyezte az 1152/2011/EU felhatalmazáson alapuló rendeletet. |
|
(7) |
Azon tagállamok jegyzékét, amelyek területük egésze vagy egyes részei tekintetében megfelelnek az (EU) 2018/772 felhatalmazáson alapuló rendeletben meghatározott besorolási szabályoknak, az (EU) 2018/878 bizottsági végrehajtási rendelet (6) melléklete tartalmazza. |
|
(8) |
Ezért helyénvaló előírni, hogy az 577/2013/EU végrehajtási rendelet IV. mellékletében meghatározott egészségügyi bizonyítványmintában az 1152/2011/EU felhatalmazáson alapuló rendeletre való hivatkozások helyébe az (EU) 2018/772 felhatalmazáson alapuló rendeletre és az (EU) 2018/878 végrehajtási rendeletre való hivatkozások lépjenek. |
|
(9) |
Az 577/2013/EU végrehajtási rendelet II. és IV. mellékletét ezért ennek megfelelően módosítani kell. |
|
(10) |
A kutyák, macskák és görények mozgásában bekövetkező bárminemű zavar elkerülése érdekében indokolt engedélyezni, hogy az 577/2013/EU rendelet IV. mellékletének az (EU) 2016/561 bizottsági végrehajtási rendelettel (7) módosított 1. részével összhangban kiadott állategészségügyi bizonyítványokat 2020. február 28-ig használni lehessen. |
|
(11) |
Az e rendeletben előírt intézkedések összhangban vannak a Növények, Állatok, Élelmiszerek és Takarmányok Állandó Bizottságának véleményével, |
ELFOGADTA EZT A RENDELETET:
1. cikk
Az 577/2013/EU végrehajtási rendelet a következőképpen módosul:
|
1. |
A II. melléklet 1. részének helyébe e rendelet I. mellékletének szövege lép. |
|
2. |
A II. melléklet 2. részének helyébe e rendelet II. mellékletének szövege lép. |
|
3. |
A IV. melléklet 1. részének helyébe e rendelet III. mellékletének szövege lép. |
2. cikk
Egy átmeneti, 2020. február 28-ig tartó időszakban a tagállamok engedélyezik olyan kutyák, macskák és görények valamely területről vagy harmadik országból egy tagállamba irányuló, nem kereskedelmi célú mozgását, amelyeket az 577/2013/EU végrehajtási rendelet IV. mellékletének az (EU) 2016/561 végrehajtási rendelettel módosított 1. részében előírt mintának megfelelő formátumú, legkésőbb 2019. október 31-én kiállított állategészségügyi bizonyítvány kísér.
3. cikk
Ez a rendelet az Európai Unió Hivatalos Lapjában való kihirdetését követő huszadik napon lép hatályba.
Ezt a rendeletet 2019. november 1-jétől kell alkalmazni.
Ez a rendelet teljes egészében kötelező és közvetlenül alkalmazandó valamennyi tagállamban.
Kelt Brüsszelben, 2019. július 29-én.
a Bizottság részéről
az elnök
Jean-Claude JUNCKER
(1) HL L 178., 2013.6.28., 1. o.
(2) A Bizottság 577/2013/EU végrehajtási rendelete (2013. június 28.) az 576/2013/EU európai parlamenti és tanácsi rendelet szerinti, a kutyák, macskák és görények nem kereskedelmi célú mozgásához szükséges azonosító okmányok mintájáról, területek és harmadik országok jegyzékének, valamint bizonyos feltételeknek való megfelelést igazoló nyilatkozatok formátumának, külső megjelenésének és nyelvének megállapításáról (HL L 178., 2013.6.28., 109. o.).
(3) Az EGT Vegyes Bizottság 66/2016 határozata (2016. április 29.) az Európai Gazdasági Térségről szóló megállapodás I. mellékletének (Állat- és növényegészségügyi kérdések) módosításáról [2017/2017] (HL L 300., 2017.11.16., 1. o.).
(4) A Bizottság 1152/2011/EU felhatalmazáson alapuló rendelete (2011. július 14.) a 998/2003/EK európai parlamenti és tanácsi rendeletnek kutyák Echinococcus multilocularis fertőzése elleni védekezést célzó megelőző egészségügyi intézkedések tekintetében történő kiegészítéséről (HL L 296., 2011.11.15., 6. o.).
(5) A Bizottság (EU) 2018/772 felhatalmazáson alapuló rendelete (2017. november 21.) az 576/2013/EU európai parlamenti és tanácsi rendeletnek a kutyák Echinococcus multilocularis fertőzése elleni védekezést célzó megelőző egészségügyi intézkedések tekintetében történő kiegészítéséről és az 1152/2011/EU felhatalmazáson alapuló rendelet hatályon kívül helyezéséről (HL L 130., 2018.5.28., 1. o.).
(6) A Bizottság (EU) 2018/878 végrehajtási rendelete (2018. június 18.) az (EU) 2018/772 felhatalmazáson alapuló rendelet 2. cikkének (2) és (3) bekezdésében meghatározott besorolási szabályoknak a kutyák Echinococcus multilocularis fertőzése elleni védekezést célzó megelőző egészségügyi intézkedések alkalmazása tekintetében megfelelő tagállamok vagy tagállami területrészek jegyzékének elfogadásáról (HL L 155., 2018.6.19., 1. o.).
(7) A Bizottság (EU) 2016/561 végrehajtási rendelete (2016. április 11.) az 577/2013/EU végrehajtási rendelet IV. mellékletének a kutyák, a macskák és a görények valamely területről vagy harmadik országból egy tagállamba történő, nem kereskedelmi célú mozgásához szükséges állategészségügyi bizonyítvány mintája tekintetében történő módosításáról (HL L 96., 2016.4.12., 26. o.).
I. MELLÉKLET
„1. RÉSZ
Az 576/2013/EU rendelet 13. cikkének (1) bekezdése szerinti területek és harmadik országok jegyzéke
|
ISO-kód |
Terület vagy harmadik ország |
|
AD |
Andorra |
|
CH |
Svájc |
|
FO |
Feröer szigetek |
|
GI |
Gibraltár |
|
GL |
Grönland |
|
IS |
Izland |
|
LI |
Liechtenstein |
|
MC |
Monaco |
|
SM |
San Marino |
|
VA |
Vatikánvárosi Állam” |
II. MELLÉKLET
„2. RÉSZ
Az 576/2013/EU rendelet 13. cikkének (2) bekezdése szerinti területek és harmadik országok jegyzéke
|
ISO-kód |
Terület vagy harmadik ország |
Ide tartozó területek |
|
AC |
Ascension |
|
|
AE |
Egyesült Arab Emírségek |
|
|
AG |
Antigua és Barbuda |
|
|
AR |
Argentína |
|
|
AU |
Ausztrália |
|
|
AW |
Aruba |
|
|
BA |
Bosznia-Hercegovina |
|
|
BB |
Barbados |
|
|
BH |
Bahrein |
|
|
BM |
Bermuda |
|
|
BQ |
Bonaire, Sint Eustatius és Saba (BES-szigetek) |
|
|
BY |
Belarusz |
|
|
CA |
Kanada |
|
|
CL |
Chile |
|
|
CW |
Curaçao |
|
|
FJ |
Fidzsi |
|
|
FK |
Falkland-szigetek |
|
|
HK |
Hongkong |
|
|
JM |
Jamaica |
|
|
JP |
Japán |
|
|
KN |
Saint Kitts és Nevis |
|
|
KY |
Kajmán-szigetek |
|
|
LC |
Saint Lucia |
|
|
MS |
Montserrat |
|
|
MK |
Észak-Macedónia |
|
|
MU |
Mauritius |
|
|
MX |
Mexikó |
|
|
MY |
Malajzia |
|
|
NC |
Új-Kaledónia |
|
|
NZ |
Új-Zéland |
|
|
PF |
Francia Polinézia |
|
|
PM |
Saint-Pierre és Miquelon |
|
|
RU |
Oroszország |
|
|
SG |
Szingapúr |
|
|
SH |
Szent Ilona |
|
|
SX |
Sint Maarten |
|
|
TT |
Trinidad és Tobago |
|
|
TW |
Tajvan |
|
|
US |
Amerikai Egyesült Államok |
AS — Amerikai Szamoa GU — Guam MP — Északi-Mariana-szigetek PR — Puerto Rico VI — Amerikai Virgin-szigetek” |
|
VC |
Saint Vincent és Grenadine-szigetek |
|
|
VG |
Brit Virgin-szigetek |
|
|
VU |
Vanuatu |
|
|
WF |
Wallis és Futuna |
|
III. MELLÉKLET
„1. RÉSZ
A kutyáknak, macskáknak és görényeknek az 576/2013/EU rendelet 5. cikkének (1) és (2) bekezdése szerinti, meghatározott területről vagy harmadik országból valamely tagállamba irányuló, nem kereskedelmi célú mozgásához szükséges állategészségügyi bizonyítvány mintája
 Szövege kép
Szövege kép
 Szövege kép
Szövege kép
 Szövege kép
Szövege kép
 Szövege kép
Szövege kép
 Szövege kép
Szövege kép
 Szövege kép
Szövege kép
 Szövege kép
”
Szövege kép
”|
2.8.2019 |
HU |
Az Európai Unió Hivatalos Lapja |
L 204/16 |
A BIZOTTSÁG (EU) 2019/1294 VÉGREHAJTÁSI RENDELETE
(2019. augusztus 1.)
a betain (EU) 2015/2283 európai parlamenti és tanácsi rendelet szerinti új élelmiszerként történő forgalomba hozatalának engedélyezéséről és az (EU) 2017/2470 bizottsági végrehajtási rendelet módosításáról
(EGT-vonatkozású szöveg)
AZ EURÓPAI BIZOTTSÁG,
tekintettel az Európai Unió működéséről szóló szerződésre,
tekintettel az új élelmiszerekről, az 1169/2011/EU európai parlamenti és tanácsi rendelet módosításáról, valamint a 258/97/EK európai parlamenti és tanácsi rendelet és az 1852/2001/EK bizottsági rendelet hatályon kívül helyezéséről szóló, 2015. november 25-i (EU) 2015/2283 európai parlamenti és tanácsi rendeletre (1) és különösen annak 12. cikkére,
mivel:
|
(1) |
Az (EU) 2015/2283 rendelet értelmében csak engedélyezett és az uniós jegyzékbe felvett új élelmiszerek hozhatók forgalomba az Unióban. |
|
(2) |
A Bizottság az (EU) 2015/2283 rendelet 8. cikke alapján elfogadta az engedélyezett új élelmiszerek uniós jegyzékét megállapító (EU) 2017/2470 bizottsági végrehajtási rendeletet (2). |
|
(3) |
Az (EU) 2015/2283 rendelet 12. cikke értelmében a Bizottság határoz az új élelmiszerek engedélyezéséről és az Unión belül történő forgalomba hozataláról, valamint az uniós jegyzék naprakésszé tételéről. |
|
(4) |
2015. június 12-én a DuPont Nutrition Biosciences ApS vállalat (a továbbiakban: kérelmező) a betainnak a 258/97/EK európai parlamenti és tanácsi rendelet (3) 1. cikke (2) bekezdésének e) pontja szerinti új élelmiszer-összetevőként az uniós piacon történő forgalomba hozatalára vonatkozó kérelmet nyújtott be Finnország illetékes hatóságához. A kérelem a betain 10. életévüket betöltött sportolóknak szánt müzli- és proteinszeletek, italporok, fogyasztásra kész izotóniás italok, valamint a 609/2013/EU európai parlamenti és tanácsi rendelet (4) szerinti, speciális gyógyászati célra szánt és/vagy a teljes napi étrendet helyettesítő müzli- és proteinszeletek és élelmiszerek – kivéve a csecsemőknek és kisgyermekeknek szánt élelmiszereket – összetevőjeként történő felhasználásának engedélyezésére irányult. |
|
(5) |
Az (EU) 2015/2283 rendelet 35. cikkének (1) bekezdése úgy rendelkezik, hogy a 258/97/EK rendelet 4. cikke alapján valamely tagállamhoz benyújtott, új élelmiszer Unión belüli forgalomba hozatalára irányuló olyan kérelmeket, amelyek kapcsán 2018. január 1-jéig nem született végleges döntés, az (EU) 2015/2283 rendelet alapján benyújtott kérelemként kell kezelni. |
|
(6) |
Noha a betainnak az uniós piacon új élelmiszerként történő forgalomba hozatalára irányuló kérelmet a 258/97/EK rendelet 4. cikkének megfelelően nyújtották be egy tagállamhoz, az az (EU) 2015/2283 rendeletben meghatározott követelményeknek is megfelel. |
|
(7) |
2015. október 21-én Finnország illetékes hatósága közzétette elsődleges értékelési jelentését. Az említett jelentésben arra a következtetésre jutott, hogy a betain megfelel a 258/97/EK rendelet 3. cikkének (1) bekezdésében az új élelmiszer-összetevők vonatkozásában megállapított feltételeknek. |
|
(8) |
A Bizottság az elsődleges értékelési jelentést 2015. október 23-án továbbította a többi tagállamnak. A többi tagállam részéről a 258/97/EK rendelet 6. cikke (4) bekezdésének első albekezdésében meghatározott 60 napos határidőn belül indokolt kifogások érkeztek be a kérelmező által a krónikus orális toxicitási és karcinogenitási vizsgálat kapcsán megfigyelhető káros hatást nem okozó szintként (NOAEL) javasolt szinten észlelhető káros hatások, a toxikológiai vizsgálatok során megfigyelhető hatásokat kiváltó betaindózisok közötti kis expozíciós tűréshatár, valamint a javasolt napi betainbevitel tekintetében. |
|
(9) |
Az említett indokolt kifogásokra tekintettel a Bizottság 2016. április 4-én konzultált az Európai Élelmiszerbiztonsági Hatósággal (a továbbiakban: Hatóság), és felkérte azt, hogy végezze el a betain mint a 258/97/EK rendelet szerinti új élelmiszer-összetevő kiegészítő értékelését. |
|
(10) |
2017. október 25-én a Hatóság elfogadta a betain mint a 258/97/EK rendelet szerinti új élelmiszer biztonságosságáról szóló tudományos szakvéleményt („Safety of Betaine as a novel food pursuant to Regulation (EC) No 258/97”) (5). Ez a szakvélemény, amelyet a Hatóság a 258/97/EK rendelet alapján dolgozott ki és fogadott el, az (EU) 2015/2283 rendelet 11. cikkében foglalt követelményekkel is összhangban van. |
|
(11) |
Tudományos szakvéleményében a Hatóság a „benchmark dózis” megközelítés (BMD) (6) alapján megállapította, hogy a betain biztonságos a tervezett célcsoportok számára, amennyiben 400 mg/nap (6 mg/testtömegkilogramm/nap) maximális napi adagban adják hozzá az élelmiszerekhez. Szakvéleményében a Hatóság arra a következtetésre jutott, hogy a kérelmező által javasolt felhasználási módok és mennyiségek mellett – ami napi 2 500 mg betain bevitelét jelentené – nem állapítható meg a betain biztonságossága. |
|
(12) |
2018. január 25-én a kérelmező kérelmet nyújtott be a Bizottsághoz az eredeti kérelme alátámasztására benyújtott kilenc tanulmány – nevezetesen az akut orális toxicitási vizsgálatról (7), két szubakut (egy 14 napos (8) és egy 28 napos (9)), valamint egy szubkrónikus (10) (42 napos) orális toxicitási vizsgálatról, három mutagenitási és genotoxicitási vizsgálatról (11), egy krónikus orális toxicitási és karcinogenitási vizsgálatról (12), valamint egy krónikus (hat hónapos) humán étrendi vizsgálatról (13) készült jelentések – szellemi tulajdont képező adatainak védelmére vonatkozóan. |
|
(13) |
A Hatóság 2018. február 18-án megállapította (14), hogy a betainra mint új élelmiszerre vonatkozó szakvéleményének kidolgozása során a krónikus orális toxicitási és karcinogenitási vizsgálat adatai alapul szolgáltak a BMD-elemzéshez és a betain célcsoportra vonatkozó biztonságos beviteli szintjeinek meghatározásához, a krónikus humán étrendi vizsgálat adatai a betain célcsoportra vonatkozó biztonságos bevitelének meghatározásához, a három genotoxicitási vizsgálat adatai pedig a betain lehetséges genotoxikus hatásával kapcsolatos aggodalmak eloszlatásához. Ezért megállapítható, hogy a betain biztonságosságára vonatkozó következtetéseket az említett vizsgálatokról szóló kiadatlan jelentésekből származó adatok nélkül nem lehetett volna levonni. |
|
(14) |
A Hatóság által megfogalmazott megfontolások kézhezvételét követően a Bizottság arra kérte a kérelmezőt, hogy pontosítsa a krónikus orális toxicitási és karcinogenitási vizsgálattal, a krónikus humán étrendi vizsgálattal, valamint a három mutagenitási és genotoxicitási vizsgálattal kapcsolatos adatok védett jellege kapcsán támasztott igénye indokolását, továbbá az (EU) 2015/2283 rendelet 26. cikke (2) bekezdésének a) és b) pontjában említett, a vizsgálatokra vonatkozó kizárólagos hivatkozási joggal kapcsolatos igényét. |
|
(15) |
A kérelmező kijelentette, hogy a kérelem benyújtásakor a nemzeti jog szerint védett, kizárólagos hivatkozási joggal rendelkezett a vizsgálatokkal kapcsolatban, és ezért harmadik felek nem férhettek hozzá azokhoz, illetve nem használhatták fel azokat jogszerűen. |
|
(16) |
A Bizottság értékelte a kérelmező által benyújtott valamennyi információt, és úgy ítélte meg, hogy a kérelmező kellően alátámasztotta az (EU) 2015/2283 rendelet 26. cikkének (2) bekezdésében meghatározott követelmények teljesülését. Ezért a kérelmező dossziéjában szereplő krónikus orális toxicitási és karcinogenitási vizsgálatot, krónikus humán étrendi vizsgálatot és három genotoxicitási vizsgálatot a Hatóság nem használhatja fel egy későbbi kérelmező javára az e rendelet hatálybalépésétől számított ötéves időtartamon belül. Ennek megfelelően az e rendelet által engedélyezett betain Unión belüli forgalombahozatali jogát az említett időtartamig a kérelmezőre kell korlátozni. |
|
(17) |
Ugyanakkor a betain és a kérelmező dossziéjában szereplő vizsgálatokra való hivatkozás engedélyezésének a kérelmezőre történő kizárólagos korlátozása nem akadályozza meg, hogy más kérelmezők ugyanezen új élelmiszer forgalomba hozatalának engedélyezését kérelmezzék, feltéve, hogy kérelmük az e rendelet szerinti engedélyezést alátámasztó, jogszerűen megszerzett információkon alapul. |
|
(18) |
2018. november 2-án a kérelmező az (EU) 2015/2283 rendelet 10. cikkének (1) bekezdése értelmében az általa 2015. június 12-én Finnország illetékes hatóságához benyújtott, a betain új élelmiszer-összetevőként az uniós piacon történő forgalomba hozatalára vonatkozó kérelemben a betain vonatkozásában szereplő felhasználási feltételek módosítását kérelmezte a Bizottságtól. A kérelmezett módosítások a betain sportolóknak szánt italporok, izotóniás italok, protein- és müzliszeletek, valamint a napi étrend egy részét helyettesítő élelmiszerek összetevőjeként történő felhasználásának módjait és mennyiségeit, továbbá a betainnak a 609/2013/EU európai parlamenti és tanácsi rendelet szerinti, a testtömeg-szabályozás céljára szolgáló, teljes napi étrendet helyettesítő, valamint speciális gyógyászati célra szánt élelmiszerek – kivéve a csecsemőknek és kisgyermekeknek szánt élelmiszereket – összetevőjeként történő felhasználását érintik. A kérelmezett módosítások révén biztosított lenne, hogy a lakosság betainbevitele ne haladja meg a Hatóság által a 2017-es szakvéleményében biztonságosnak ítélt 400 mg/nap (6 mg/testsúlykilogramm/nap) értéket. |
|
(19) |
2018. december 12-én a Bizottság konzultált a Hatósággal, és felkérte azt, hogy az (EU) 2015/2283 rendelet 10. cikke (3) bekezdésének megfelelően végezze el a betain mint új élelmiszer tervezett felhasználási módjai és mennyiségei módosításainak kiegészítő értékelését. |
|
(20) |
2019. március 14-én a Hatóság elfogadta a betain mint az (EU) 2015/2283 rendelet szerinti új élelmiszer biztonságosságáról szóló tudományos szakvéleményt („Safety of Betaine as a novel food pursuant to Regulation (EU) 2015/2283”) (15). A szóban forgó tudományos szakvélemény megfelel az (EU) 2015/2283 rendelet 11. cikkében meghatározott követelményeknek. |
|
(21) |
Szakvéleményében a Hatóság arra a következtetésre jutott, hogy a betain biztonságos a javasolt új felhasználási feltételek mellett. A szóban forgó tudományos szakvélemény ezért elegendő alapot ad annak megállapításához, hogy a javasolt felhasználási módok és mennyiségek betartása mellett a betain sportolóknak szánt italporok, izotóniás italok, protein- és müzliszeletek, valamint a napi étrend egy részét helyettesítő élelmiszerek, továbbá a 609/2013/EU rendelet szerinti, a testtömeg-szabályozás céljára szolgáló, teljes napi étrendet helyettesítő, valamint speciális gyógyászati célra szánt élelmiszerek – kivéve a csecsemőknek és kisgyermekeknek szánt élelmiszereket – összetevőjeként felhasználva megfelel az (EU) 2015/2283 rendelet 12. cikke (1) bekezdésében foglaltaknak. |
|
(22) |
A betaintartalmú élelmiszerek és a betaint tartalmazó étrend-kiegészítők együttes fogyasztása a betain biztonságos beviteli mennyiségének túllépéséhez vezethet. Ezért a fogyasztókat megfelelő jelöléssel kell tájékoztatni arról, hogy nem szabad betaintartalmú élelmiszereket fogyasztaniuk, ha ugyanazon a napon betaint tartalmazó étrend-kiegészítőket is fogyasztanak. |
|
(23) |
A betain felhasználását a csecsemők és kisgyermekek számára készült, a speciális gyógyászati célra szánt, valamint a testtömeg-szabályozás céljára szolgáló, teljes napi étrendet helyettesítő élelmiszerekre vonatkozó követelményeket megállapító 609/2013/EU rendelet sérelme nélkül kell engedélyezni. |
|
(24) |
Az e rendeletben előírt intézkedések összhangban vannak a Növények, Állatok, Élelmiszerek és Takarmányok Állandó Bizottságának véleményével, |
ELFOGADTA EZT A RENDELETET:
1. cikk
(1) Az e rendelet mellékletében meghatározott betaint fel kell venni az engedélyezett új élelmiszereknek az (EU) 2017/2470 végrehajtási rendelettel létrehozott uniós jegyzékébe.
(2) E rendelet hatálybalépésétől számítva öt éven keresztül csak az eredeti kérelmező, azaz a következő vállalat jogosult az (1) bekezdésben említett új élelmiszer Unión belüli forgalomba hozatalára:
|
|
vállalat: DuPont Nutrition Biosciences ApS; |
|
|
cím: Langebrogade 1 DK-1411 Copenhagen K, Dánia, |
kivéve, ha egy későbbi kérelmező az e rendelet 2. cikke alapján védett adatokra való hivatkozás nélkül, vagy a DuPont Nutrition Biosciences ApS beleegyezésével engedélyt kap ezen új élelmiszer forgalmazására.
(3) Az (1) bekezdésben említett uniós jegyzékben foglalt bejegyzésnek tartalmaznia kell az e rendelet mellékletében meghatározott felhasználási feltételeket és jelölési követelményeket is.
(4) Az e cikkben előírt engedély nem sértheti az 609/2013/EU rendelet rendelkezéseit.
2. cikk
A kérelmezési dossziéban szereplő tanulmányokat – amelyek alapján a Hatóság az 1. cikkben említett új élelmiszert értékelte, amelyek a kérelmező állítása szerint védettek, és amelyek nélkül az új élelmiszert nem lehetett volna engedélyezni – a Hatóság nem használhatja fel egy későbbi kérelmező javára az e rendelet hatálybalépésétől számított ötéves időtartamon belül a DuPont Nutrition Biosciences ApS beleegyezése nélkül.
3. cikk
Az (EU) 2017/2470 végrehajtási rendelet melléklete e rendelet mellékletének megfelelően módosul.
4. cikk
Ez a rendelet az Európai Unió Hivatalos Lapjában való kihirdetését követő huszadik napon lép hatályba.
Ez a rendelet teljes egészében kötelező és közvetlenül alkalmazandó valamennyi tagállamban.
Kelt Brüsszelben, 2019. augusztus 1-jén.
a Bizottság részéről
az elnök
Jean-Claude JUNCKER
(1) HL L 327., 2015.12.11., 1. o.
(2) A Bizottság (EU) 2017/2470 végrehajtási rendelete (2017. december 20.) az új élelmiszerek uniós jegyzékének az új élelmiszerekről szóló (EU) 2015/2283 európai parlamenti és tanácsi rendelet alapján történő megállapításáról (HL L 351., 2017.12.30., 72. o.).
(3) Az Európai Parlament és a Tanács 258/97/EK rendelete (1997. január 27.) az új élelmiszerekről és az új élelmiszer-összetevőkről (HL L 43., 1997.2.14., 1. o.).
(4) Az Európai Parlament és a Tanács 609/2013/EU rendelete (2013. június 12.) a csecsemők és kisgyermekek számára készült, a speciális gyógyászati célra szánt, valamint a testtömeg-szabályozás céljára szolgáló, teljes napi étrendet helyettesítő élelmiszerekről, továbbá a 92/52/EGK tanácsi irányelv, a 96/8/EK, az 1999/21/EK, a 2006/125/EK és a 2006/141/EK bizottsági irányelv, a 2009/39/EK európai parlamenti és tanácsi irányelv és a 41/2009/EK és a 953/2009/EK bizottsági rendelet hatályon kívül helyezéséről (HL L 181., 2013.6.29., 35. o.).
(5) The EFSA Journal (2017); 15(11):5057.
(6) The EFSA Journal (2017); 15(1):4658.
(7) LIFE Science Research Limited, 1990, kiadatlan.
(8) TNO BIBRA, 2001, kiadatlan.
(9) TNO BIBRA, 2001, kiadatlan.
(10) Imasde Aglomentaria, 2012, kiadatlan.
(11) Asquith 1989 a, b, c, kiadatlan.
(12) Hatano Research Institute, 2002, kiadatlan tanulmányok.
(13) Kiadatlan jelentés, dátum nélkül.
(14) Az EFSA diétás termékekkel, táplálkozással és allergiákkal foglalkozó tudományos testülete 2018. február 7–8-án megtartott 83. plenáris ülésének 2018. február 18-án jóváhagyott jegyzőkönyve (https://www.efsa.europa.eu/sites/default/files/event/180207-1-m.pdf).
(15) EFSA Journal (2019); 17(4):5658.
MELLÉKLET
Az (EU) 2017/2470 végrehajtási rendelet melléklete a következőképpen módosul:
|
1. |
Az 1. táblázat (Engedélyezett új élelmiszerek) az alábbi bejegyzéssel egészül ki a betűrend szerinti helyen:
|
||||||||||||||||||||||
|
2. |
A 2. táblázat (Specifikációk) az alábbi bejegyzéssel egészül ki a betűrend szerinti helyen:
|
||||||
(*1) A fogyasztásra kész állapotban forgalmazott vagy a gyártó utasításai alapján elkészített végtermékre vonatkozó maximális felhasználási mennyiségek.”
|
2.8.2019 |
HU |
Az Európai Unió Hivatalos Lapja |
L 204/22 |
A BIZOTTSÁG (EU) 2019/1295 VÉGREHAJTÁSI RENDELETE
(2019. augusztus 1.)
az Oroszországból és Ukrajnából származó egyes varrat nélküli vas- és acélcsövek behozatalára vonatkozó végleges dömpingellenes vám kivetéséről szóló (EU) 2018/1469 végrehajtási rendeletnek az (EU) 2016/1036 rendelet 11. cikkének (3) bekezdése szerinti részleges időközi felülvizsgálatot követő módosításáról
AZ EURÓPAI BIZOTTSÁG,
tekintettel az Európai Unió működéséről szóló szerződésre,
tekintettel az Európai Unióban tagsággal nem rendelkező országokból érkező dömpingelt behozatallal szembeni védelemről szóló, 2016. június 8-i (EU) 2016/1036 európai parlamenti és tanácsi rendeletre (1) (a továbbiakban: alaprendelet) és különösen annak 11. cikke (3) bekezdésére,
mivel:
1. ELJÁRÁS
1.1. Hatályban lévő intézkedések
|
(1) |
Egy vizsgálatot követően (a továbbiakban: eredeti vizsgálat) a Tanács a 954/2006/EK rendelettel (2) végleges dömpingellenes vámot vetett ki a Horvátországból, az Oroszországból és az Ukrajnából származó egyes varrat nélküli vas- és acélcsövek behozatalára. Az intézkedések keretében a Tanács a külön megnevezett ukrajnai exportáló gyártóktól érkező behozatalra 12,3 % és 25,7 % közötti, az összes többi ukrajnai vállalattól érkező behozatalra 25,7 %-os dömpingellenes értékvámot vetett ki. A jelenlegi felülvizsgálat tárgyát képező exportáló gyártóra, a CJSC Nikopolsky Seamless Tubes Plant Niko Tube és a OJSC Nizhnedneprovsky Tube Rolling Plant (jelenleg: LLC Interpipe Niko Tube és OJSC Interpipe Nizhnedneprovsky Tube Rolling Plant) együttesére (a továbbiakban együtt: kérelmező, Interpipe) kivetett végleges dömpingellenes vám mértéke 25,1 % volt. |
|
(2) |
Egy, az Interpipe által a 954/2006/EK tanácsi rendelet megsemmisítése érdekében indított keresetet követően az Európai Közösségek Elsőfokú Bírósága megsemmisítette a 954/2006/EK rendelet 1. cikkét annyiban, amennyiben az Interpipe esetében megállapított dömpingellenes vám meghaladta azt a vámot, amely akkor lett volna alkalmazandó, ha az exportárat nem igazították volna ki a jutalékkal azokban az esetekben, amikor az értékesítések a SEPco SA elnevezésű kapcsolt kereskedelmi társaság közvetítésével történtek. (3) Az Európai Unió Bírósága 2012. február 16-án helybenhagyta az Elsőfokú Bíróság ítéletét. (4) |
|
(3) |
A Tanács az ítéleteket követően az Interpipe vállalatra hibásan kivetett dömpingellenes vám helyreigazítása érdekében az 540/2012/EU végrehajtási rendelettel (5) módosította a 954/2006/EK tanácsi rendeletet. Ennek következtében az Interpipe esetében alkalmazandó vám mértéke 17,7 %-ra módosult. |
|
(4) |
Hatályvesztési felülvizsgálatot követően a Tanács az 585/2012/EU végrehajtási rendelettel (6) fenntartotta az Oroszországból és az Ukrajnából származó varratmentes vas- és acélcsövek behozatalára a 954/2006/EK tanácsi rendelettel bevezetett intézkedéseket. |
|
(5) |
Egy, az Interpipe által az alaprendelet 11. cikkének (3) bekezdése alapján benyújtott kérelmet követően a Tanács a 795/2012/EU végrehajtási rendelettel (7) módosította az Interpipe tekintetében az 585/2012/EU végrehajtási rendelettel bevezetett végleges intézkedéseket (a továbbiakban: legutóbbi időközi felülvizsgálat). Ennek következtében az Interpipe esetében alkalmazandó vám mértéke 13,8 %-ra módosult. |
|
(6) |
Hatályvesztési felülvizsgálatot követően a Bizottság az (EU) 2018/1469 végrehajtási rendelettel (8) fenntartotta az Oroszországból és az Ukrajnából származó varratmentes vas- és acélcsövek behozatalára a legutóbb a 795/2012/EU és az 1269/2012/EU tanácsi végrehajtási rendelettel (9) módosított 585/2012/EK végrehajtási rendelettel bevezetett intézkedéseket. |
|
(7) |
A jelenleg hatályban lévő dömpingellenes vámok az Oroszországból származó behozatal esetében 35,8 %-tól 24,1 %-ig, az Ukrajnából származó behozatal esetében pedig 25,7 %-tól 12,3 %-ig terjednek. |
1.2. Részleges időközi felülvizsgálat iránti kérelem
|
(8) |
Egy, az Európai Unió Hivatalos Lapjában közzétett értesítés (10) (a továbbiakban: az eljárás megindításáról szóló értesítés) útján a Bizottság 2018. május 7-én bejelentette, hogy az alaprendelet 11. cikkének (3) bekezdése alapján az Ukrajnából származó egyes varrat nélküli vas- és acélcsövek behozatalára alkalmazandó dömpingellenes intézkedésekkel kapcsolatban részleges időközi felülvizsgálatot indít. |
|
(9) |
A dömpingnek az Interpipe elnevezésű exportáló gyártó tekintetében történő vizsgálatára korlátozódó felülvizsgálat megindítása a vállalat által benyújtott indokolt kérelem alapján történt. A kérelemben az Interpipe elegendő bizonyítékot szolgáltatott arra vonatkozóan, hogy a meglévő intézkedések bevezetéséhez vezető körülmények megváltoztak, és ezek a változások tartósak. |
1.3. Vizsgálat
|
(10) |
A dömping mértékére vonatkozó vizsgálat a 2017. április 1-jétől2018. március 31-ig tartó időszakra (a továbbiakban: felülvizsgálati időszak) terjedt ki. |
|
(11) |
A részleges időközi felülvizsgálat megindításáról a Bizottság hivatalosan tájékoztatta a kérelmezőt, az exportáló ország hatóságait és az uniós gazdasági ágazatot. Az érdekelt felek lehetőséget kaptak arra, hogy az eljárás megindításáról szóló értesítésben megállapított határidőn belül írásban ismertessék álláspontjukat, illetve kérjék meghallgatásukat. |
|
(12) |
A Bizottság a vizsgálathoz szükségesnek tartott információk összegyűjtése érdekében kérdőívet küldött a kérelmezőnek, amely a megadott határidőn belül válaszolt. |
|
(13) |
A Bizottság minden olyan információt megkísérelt beszerezni és ellenőrzött, amelyet szükségesnek tartott a dömping mértékének megállapításához. A Bizottság a kérelmező, valamint a vele kapcsolatban álló LLC Interpipe Ukraine, Interpipe Europe SA és Interpipe Central Trade GmbH kereskedelmi társaságok telephelyén ellenőrző látogatást tett. |
2. A FELÜLVIZSGÁLAT TÁRGYÁT KÉPEZŐ TERMÉK ÉS A HASONLÓ TERMÉK
2.1. A felülvizsgálat tárgyát képező termék
|
(14) |
A felülvizsgálat tárgyát képező termék azonos a jelenleg hatályban lévő intézkedéseket bevezető 2018. október 1-jei (EU) 2018/1469 végrehajtási rendeletben meghatározott termékkel: az egyebek mellett Ukrajnából származó, jelenleg az ex 7304 11 00, ex 7304 19 10, ex 7304 19 30, ex 7304 22 00, ex 7304 23 00, ex 7304 24 00, ex 7304 29 10, ex 7304 29 30, ex 7304 31 80, ex 7304 39 58, ex 7304 39 92, ex 7304 39 93, ex 7304 51 89, ex 7304 59 92 és ex 7304 59 93 KN-kódok alá tartozó egyes olyan legfeljebb 406,4 mm külső átmérőjű, kör keresztmetszetű varrat nélküli vas- és acélcsövek, amelyeknek a Nemzetközi Hegesztési Intézet (IIW) képlete és kémiai vizsgálata (11) szerint meghatározott szénegyenértéke (CEV) nem haladja meg a 0,86-ot (a továbbiakban: a felülvizsgálat tárgyát képező termék). |
2.2. A hasonló termék
|
(15) |
Az eredeti vizsgálat és a későbbi felülvizsgálatok ténymegállapításainak megfelelően a jelenlegi vizsgálat megerősítette, hogy az Ukrajnában gyártott és az EU-ba exportált termék, az Ukrajnában gyártott és az ukrajnai belföldi piacon értékesített termék, valamint az EU-ban az uniós gyártók által gyártott és értékesített termék ugyanazokkal az alapvető fizikai és műszaki tulajdonságokkal rendelkezik, és végfelhasználási területeik is megegyeznek. Ezért ezek a termékek az alaprendelet 1. cikkének (4) bekezdése értelmében hasonló termékek. |
3. A MEGVÁLTOZOTT KÖRÜLMÉNYEK TARTÓS VOLTA
|
(16) |
A Bizottság az alaprendelet 11. cikkének (3) bekezdésével összhangban megvizsgálta, hogy a dömping tekintetében megváltozott körülmények tartósnak tekinthetők-e. |
|
(17) |
Az eredeti dömpingellenes vizsgálat időpontjában, 2006-ban, valamint az Interpipe-ot érintő legutóbbi, a 2010. október 1-jétől2011. szeptember 30-ig tartó felülvizsgálati időszakra kiterjedő 2012-es időközi felülvizsgálat időpontjában a felülvizsgálat tárgyát képező termék gyártása során felhasznált legfontosabb nyersanyagot, a kerek acélbugákat az Interpipe független beszállítóktól szerezte be. |
|
(18) |
Részleges időközi felülvizsgálat iránti kérelmében a kérelmező előadta, hogy az LLC Metallurgical Plant Dneprosteel 2013-as vertikális integrációja következtében a legfontosabb nyersanyagot, az acélbugákat most már házon belül gyártják, ami a jelentős költségmegtakarítás mellett a termékportfólió megváltozását is eredményezte. A kérelmező ezzel kapcsolatban előadta, hogy a legutóbbi időközi felülvizsgálat időpontjában gyártott és exportált terméktípusok (szokásos acélminőségek) új, összetettebb termékekkel egészültek ki („erősen ötvözött”, illetve „vezetékcső és gépészeti cső”), és ez utóbbi termékek a 2017. április 1-jétől2018. március 31-ig tartó jelenlegi felülvizsgálati időszakban már jelentős részét tették ki a vállalat EU-ba irányuló teljes kivitelének. |
|
(19) |
A vizsgálat megerősítette, hogy a legfontosabb nyersanyagot a kérelmező most már házon belül gyártja, valamint hogy ez a változás jelentős módosulást idézett elő a költségekben és a termékportfólióban. A vizsgálat megerősítette, hogy az Interpipe által az EU-ba exportált terméktípusok jelentősen eltérnek a legutóbbi időközi felülvizsgálat felülvizsgálati időszakában exportált terméktípusoktól. Mindezek alapján és a szóban forgó változások strukturális jellegére is tekintettel a Bizottság megállapította, hogy a (17) preambulumbekezdésben ismertetett változások tartósak, és valószínűtlen, hogy a jövőben megváltozzanak. Ebből következően a Bizottság úgy ítélte meg, hogy indokolt újraértékelni a meglévő intézkedések jelenlegi szinten történő alkalmazását. |
|
(20) |
Egy további, a kérelmező által a jelenlegi felülvizsgálat megindítását követően jelzett változást, nevezetesen hogy az Interpipe és a Vallourec Tubes közös vállalkozást hozott létre, illetve ilyen formában működik, a Bizottság nem vett figyelembe, mert a változás a jelenlegi időközi felülvizsgálat megindítása után következett be. |
4. DÖMPING
4.1.1. A vállalat struktúrája és a dömpingszámítás módja
|
(21) |
A felülvizsgálati időszakban az Interpipe kizárólagos tulajdonában és ellenőrzése alatt két exportáló gyártó állt (a továbbiakban együtt: gyártócégek): az LLC Interpipe Niko Tube (a továbbiakban: NIKO) és az OJSC Interpipe Nizhnedneprovsky Tube Rolling Plant (a továbbiakban: NTRP). |
|
(22) |
Tekintettel arra, hogy az eredeti vizsgálat idején a kérelmező számviteli rendszere nem tette lehetővé a gyártással foglalkozó vállalatok és az értékesítések egymáshoz rendelését, egyetlen dömpingkülönbözet meghatározására volt csak mód, amely a két gyártással foglalkozó vállalat összes európai uniós termelési, nyereségességi és értékesítési adatának összesítésén alapult. |
|
(23) |
A legutóbbi időközi felülvizsgálat idejére a vállalatcsoport struktúrájában bekövetkezett jelentős változások lehetővé tették, hogy a Bizottság az alaprendelet 2. cikkének (11) és (12) bekezdésével összhangban egymáshoz rendelje a gyártással foglalkozó vállalatokat és az értékesítéseket, és így a gyártással foglalkozó vállalatok adatainak összesítése helyett a standard módszert alkalmazza. E standard módszer alkalmazása keretében a Bizottság úgy rendelt egyetlen közös dömpingkülönbözetet a két exportáló gyártóhoz, hogy elsőként külön-külön kiszámította a két exportáló gyártó által folytatott dömping egyedi mértékét, majd ezek súlyozott átlagaként meghatározta a két vállalat által folytatott dömping közös mértékét. |
|
(24) |
A jelenlegi felülvizsgálatban ismét lehetőség volt a gyártással foglalkozó vállalatok és az értékesítések egymáshoz rendelésére. Ezért a Bizottság – az alaprendelet 2. cikkének (11) és (12) bekezdésével összhangban, az uniós intézmények következetes gyakorlatát követve – ugyanazt a módszert alkalmazta, mint a legutóbbi időközi felülvizsgálat keretében. |
4.1.2. Rendes érték
|
(25) |
Az alaprendelet 2. cikkének (2) bekezdésével összhangban a Bizottság elsőként mindegyik exportáló gyártó esetében megvizsgálta, hogy az adott vállalat EU-ba irányuló teljes exportvolumenével összehasonlítva a hasonló terméknek az adott vállalat által független vevők felé végrehajtott összes belföldi értékesítése reprezentatív volt-e, vagyis hogy ezen értékesítések összesített volumene elérte-e a felülvizsgálat tárgyát képező termék EU-ba irányuló teljes exportvolumenének 5 %-át. A vizsgálat kimutatta, hogy a belföldi értékesítések mindkét exportáló gyártó esetében reprezentatívak voltak. |
|
(26) |
Ezt követően a Bizottság az alaprendelet 2. cikkének (2) bekezdésével összhangban megvizsgálta, hogy az Unióba irányuló kivitel keretében értékesített terméktípusokkal azonos vagy összehasonlítható terméktípusoknak az Interpipe által a belföldi piacon végrehajtott belföldi értékesítései reprezentatívak voltak-e. Egy terméktípus belföldi értékesítései akkor reprezentatívak, ha a terméktípus vizsgálati időszak alatti, független vevők részére végrehajtott belföldi értékesítéseinek teljes volumene eléri az azonos vagy összehasonlítható terméktípus teljes Unióba irányuló exportvolumenének 5 %-át. A Bizottság megállapította, hogy a vizsgálati időszakban az Unióba irányuló kivitel keretében értékesített terméktípusokkal azonos vagy összehasonlítható terméktípusok belföldi értékesítései túlnyomórészt reprezentatívak voltak, tekintettel arra, hogy az exportált modellek 60–80 %-a (12) esetében megállapítást nyert a belföldi piacon értékesített mennyiségek reprezentativitása. |
|
(27) |
A Bizottság ezt követően az alaprendelet 2. cikkének (4) bekezdésével összhangban a reprezentatív mennyiségben értékesített terméktípusok mindegyike esetében megvizsgálta, hogy az adott terméktípus belföldi értékesítései a szokásos kereskedelmi forgalom keretében megvalósultnak tekinthetők-e. Ennek érdekében a Bizottság a felülvizsgálat tárgyát képező termék minden egyes exportált típusa esetében meghatározta a felülvizsgálati időszakban a belföldi piacon független vevők részére megvalósított nyereséges belföldi értékesítések részarányát. |
|
(28) |
Azon terméktípusok esetében, amelyek belföldi piacon értékesített mennyiségének több mint 80 %-át a költségeket meghaladó áron értékesítették és amelyek súlyozott átlagos értékesítési ára elérte vagy meghaladta a termelési egységköltséget, a terméktípus rendes értékének megállapítása az adott terméktípus teljes – tehát a nyereséges és a nem nyereséges értékesítéseket egyaránt tartalmazó – belföldi értékesítési volumenének figyelembevételével, a tényleges belföldi értékesítési árak összességének súlyozott átlagaként történt. |
|
(29) |
Azon terméktípusok esetében, amelyek nyereségesen értékesített mennyisége nem volt nagyobb a terméktípus teljes értékesített mennyiségének 80 %-ánál, valamint azon terméktípusok esetében, amelyek súlyozott átlagára alacsonyabb volt a termelési egységköltségnél, a rendes érték megállapítása kizárólag a terméktípusnak a felülvizsgálati időszakban megvalósult nyereséges belföldi értékesítései figyelembevételével, az azokhoz tartozó tényleges belföldi értékesítési árak súlyozott átlagaként történt. |
|
(30) |
A belföldi értékesítési árak elemzése azt mutatta, hogy az Unióba irányuló kivitel keretében értékesített terméktípussal azonos vagy összehasonlítható terméktípusok mindegyikét figyelembe véve az összes belföldi értékesítés 35–55 %-a (13) volt nyereséges, és a súlyozott átlagos értékesítési ár magasabb volt a termelési költségnél. Ennek megfelelően a Bizottság a rendes értéket a nyereséges értékesítések figyelembevételével képzett súlyozott átlagként számította ki. |
|
(31) |
A nem reprezentatív terméktípusok esetében (azaz azon terméktípusok esetében, amelyek belföldi értékesítései nem érték el az EU-ba irányuló exportértékesítés 5 %-át, valamint azon terméktípusok esetében, amelyeket a belföldi piacon egyáltalán nem értékesítettek) a rendes érték számítása terméktípusonként, a gyártási költségnek egy, az értékesítési, általános és igazgatási költségeket, valamint a nyereséget kifejező összeggel való megnövelésével történt. Ha voltak belföldi értékesítések, a Bizottság az adott terméktípusok esetében a belföldi piacon a szokásos kereskedelmi forgalom keretében megvalósult összes ügyletből származó nyereséget vette figyelembe. Ha nem voltak belföldi értékesítések, a Bizottság egy átlagos nyereséget vett figyelembe. (14) |
|
(32) |
Az érdekelt felek végső tájékoztatását követően az Interpipe csoport vitatta a Bizottság által a rendes érték megállapítása érdekében végzett számítások egyes elemeit. Az észrevételek i. az SGA-költségek számítására; ii. egyes további működési költségek vélt elhagyására; iii. a pénzügyi költségek figyelembevételére; valamint iv. az SGA-költségek kiigazításaival kapcsolatos kétszeres beszámításra vonatkoztak. |
|
(33) |
Az ügy kapcsán rendelkezésre álló információk áttekintése nyomán a Bizottság úgy határozott, hogy a fenti ii. és iv. jelű észrevételt elfogadja, a fenti i. és iii. jelű észrevételt pedig elutasítja. Az Interpipe csoport észrevételeiben és a Bizottság ezen észrevételekkel kapcsolatos elemzésében található üzleti információk bizalmas jellegére való tekintettel a Bizottság e rendelet elfogadásának napján egy újabb tájékoztatás keretében ismertette részletes érvelését az Interpipe csoporttal. |
|
(34) |
A ii. és a iv. jelű észrevétel elfogadása nyomán a Bizottság felülvizsgálta az Interpipe dömpingkülönbözetét. A Bizottság újabb tájékoztatást küldött a vállalatnak, amelyben ismertette a dömpingkülönbözetre kifejtett hatásokat, és felkérte a vállalatot észrevételeinek megtételére. A Bizottság emellett az uniós gazdasági ágazatot is tájékoztatta a vállalat dömpingkülönbözetének megváltozásáról. |
|
(35) |
Az újabb tájékoztatás után az Interpipe fenntartotta a Bizottság által elutasított észrevételeket, de nem szolgált olyan újabb információkkal, amelyek miatt a Bizottságnak módosítania kellett volna a vállalattal ismertetett következtetéseit. |
4.1.3. Exportár
|
(36) |
A felülvizsgálat tárgyát képező terméknek az EU-ba irányuló exportértékesítéseiben több, az Interpipe csoporthoz tartozó vállalat is részt vett: a gyártóüzemek, egy Ukrajnában működő koordináló vállalat (Interpipe Ukraine, a továbbiakban: IPU), egy Németországban működő, az exportáló gyártókkal kapcsolatban álló vállalat (az Interpipe Central Trade GmbH, a továbbiakban: IPCT), valamint egy Svájcban működő kapcsolt kereskedelmi társaság (az Interpipe Europe SA, a továbbiakban: IPE). |
|
(37) |
Az exportár megállapítása az alaprendelet 2. cikkének (8) bekezdésével összhangban történt. Kivételt képeztek ez alól a kérelmezővel kapcsolatban álló importőrön (az IPCT-n) keresztül végrehajtott értékesítések, amelyek esetében az exportár megállapítása az alaprendelet 2. cikkének (9) bekezdésével összhangban, az importált termék független vevőknek megvalósított első EU-beli viszonteladásakor alkalmazott ár alapján történt. Ez azt jelenti, hogy az árat ki kellett igazítani a behozatal és a viszonteladás között felmerült összes költséggel, valamint egy észszerű nyereséggel. E kiigazítások összegének számítása az IPE értékesítési, általános és igazgatási költségein, valamint a független importőrök által elérhető, a forgalom 2,5 %-ának megfelelő mértékű elméleti nyereségen alapult. |
4.1.4. Összehasonlítás
|
(38) |
A Bizottság a rendes értéket és a két exportáló gyártó exportárát gyártelepi szinten hasonlította össze egymással. A Bizottság a rendes érték és az exportár méltányos összehasonlítása érdekében – az alaprendelet 2. cikkének (10) bekezdésével összhangban – megfelelő kiigazítások formájában figyelembe vette az árakat és az árak összehasonlíthatóságát befolyásoló különbségeket. Ebből kiindulva a Bizottság a fuvarozási költségek, a biztosítási költségek, az anyagmozgatási költségek, a rakodási költségek és az ezekhez társuló mellékköltségek, az importköltségek, a vámok, a jutalékok, valamint a hitelköltségek figyelembevétele érdekében végzett kiigazítást. |
|
(39) |
A felülvizsgálati időszakban az Interpipe a felülvizsgálat tárgyát képező terméket két különböző értékesítési csatornán keresztül exportálta az EU-ba: egyfelől ugyanazon a Svájcban működő kapcsolt kereskedelmi társaságon (az IPE-n) keresztül, mint a legutóbbi időközi felülvizsgálat felülvizsgálati időszakában, másfelől pedig egy, az EU-ban működő, vele kapcsolatban álló, 2014-ben létrehozott importőrön (az IPCT-n) keresztül. Ez utóbbi értékesítési csatorna a legutóbbi időközi felülvizsgálat időpontjában még nem létezett. A Bizottság elemzésében található üzleti információk bizalmas jellegére való tekintettel a Bizottság e rendelet elfogadásának napján egy újabb tájékoztatás keretében ismertette részletes érvelését az Interpipe csoporttal. |
|
(40) |
Ebből következően a Bizottság indokoltnak tartotta, hogy az alaprendelet 2. cikke (10) bekezdésének i) pontja alapján kiigazítást végezzen. A Bizottság a kiigazítást úgy hajtotta végre, hogy az első független vevő felé felszámított értékesítési árból levonta a kapcsolt kereskedelmi társaság értékesítési, általános és igazgatási költségeinek azon részét, amelyet másutt még nem vett figyelembe, valamint a független importőrök által elérhető, a forgalom 2,5 %-ának megfelelő mértékű elméleti nyereséget. |
|
(41) |
Az újabb tájékoztatás után az Interpipe csoport vitatta a Bizottság azon következtetését, hogy az IPE nem tekinthető a NIKO-val, az NTRP-vel és az IPU-val együtt ugyanazon egyetlen gazdasági egységhez tartozónak. Az ügy kapcsán rendelkezésre álló információk áttekintése nyomán a Bizottság úgy határozott, hogy az észrevételt elutasítja. A Bizottság a (34) preambulumbekezdésben jelzett módon újabb tájékoztatást küldött a vállalatnak, amelyben ismertette a dömpingkülönbözetre kifejtett hatásokat, és felkérte a vállalatot észrevételeinek megtételére. Válaszában az Interpipe fenntartotta a Bizottság által elutasított észrevételeket. További észrevételeket ezzel kapcsolatban nem tett. |
|
(42) |
Az Interpipe csoport észrevételében és a Bizottság ezen észrevétellel kapcsolatos elemzésében található üzleti információk bizalmas jellegére való tekintettel a Bizottság e rendelet elfogadásának napján egy újabb tájékoztatás keretében ismertette részletes érvelését az Interpipe csoporttal. |
4.1.5. Dömpingkülönbözet
|
(43) |
A Bizottság az alaprendelet 2. cikkének (11) és (12) bekezdésével összhangban a rendes érték súlyozott átlagát a két exportáló gyártó mindegyike esetében terméktípusonként összehasonlította az exportárak gyártelepi szinten számított súlyozott átlagával. A Bizottság ezt követően úgy állapította meg az Interpipe teljes egészére vonatkozó dömpingkülönbözetet, hogy az Interpipe keretei között működő két exportáló gyártó adatai alapján egyetlen súlyozott átlagos dömpingkülönbözetet határozott meg. |
|
(44) |
Ennek alapján a dömpingkülönbözet a vámfizetés nélküli, uniós határparitáson számított CIF-ár százalékában kifejezve 8,1 %-ra adódott. |
|
(45) |
Az érdekelt felek újabb tájékoztatását követően az ESTA felvetette, hogy az Interpipe dömpingkülönbözetének csökkentése további kárt fog okozni az EU varratmentes acélcsövek gyártásával foglalkozó gazdasági ágazatának. A Bizottság megjegyzi, hogy az alaprendelet 9. cikkének (4) bekezdése szerint a dömpingellenes vám összege nem lehet nagyobb a dömpingkülönbözetnél, amely ez esetben 8,1 %-ban került megállapításra. |
|
(46) |
Az alaprendelet 15. cikkének (1) bekezdésével létrehozott bizottság nem nyilvánított véleményt, |
ELFOGADTA EZT A RENDELETET:
1. cikk
Az 585/2012/EU végrehajtási rendelet 1. cikkének (2) bekezdésében található táblázatban az „LLC Interpipe Niko Tube és OJSC Interpipe Nizhnedneprovsky Tube Rolling Plant (Interpipe NTRP)” vállalat sora helyébe a következő szöveg lép:
|
„LLC Interpipe Niko Tube és OJSC Interpipe Nizhnedneprovsky Tube Rolling Plant (Interpipe NTRP) |
8,1 % |
A743” |
2. cikk
Ez a rendelet az Európai Unió Hivatalos Lapjában való kihirdetését követő napon lép hatályba.
Ez a rendelet teljes egészében kötelező és közvetlenül alkalmazandó valamennyi tagállamban.
Kelt Brüsszelben, 2019. augusztus 1-jén.
a Bizottság részéről
az elnök
Jean-Claude JUNCKER
(1) HL L 176., 2016.6.30., 21. o.
(2) A Tanács 2006/954/EK rendelete (2006. június 27.) a Horvátországból, Romániából, Oroszországból és Ukrajnából származó, egyes varrat nélküli vas- és acélcsövek behozatalára vonatkozó végleges dömpingellenes vám kivetéséről, a 2320/97/EK és a 348/2000/EK tanácsi rendeletek hatályon kívül helyezéséről, a többek között Oroszországból és Romániából származó, egyes varrat nélküli vas- és ötvözetlen acélcsövek behozatalára vonatkozó dömpingellenes vámok időközi és intézkedés megszűnésére irányuló felülvizsgálatának megszüntetéséről és a többek között Oroszországból és Romániából, valamint Horvátországból és Ukrajnából származó egyes varrat nélküli vas- és ötvözetlen acélcsövek behozatalára kivetett dömpingellenes vámok időközi felülvizsgálatának megszüntetéséről (HL L 175., 2006.6.29., 4. o.).
(3) Az Elsőfokú Bíróság 2009. március 10-i ítélete, Interpipe Niko Tube and Interpipe NTRP kontra Tanács, T-249/06, ECLI:EU:T:2009:62.
(4) A Bíróság 2012. február 16-i ítélete, Tanács és Bizottság kontra Interpipe Niko Tube and Interpipe NTRP, C-191/09. P és C-200/09. P egyesített ügyek, ECLI:EU:C:2012:78.
(5) A Tanács 540/2012/EU végrehajtási rendelete (2012. június 21.) a Horvátországból, Romániából, Oroszországból és Ukrajnából származó, egyes varrat nélküli vas- és acélcsövek behozatalára vonatkozó végleges dömpingellenes vám kivetéséről szóló 954/2006/EK rendelet módosításáról (HL L 165., 2012.6.26., 1. o.).
(6) A Tanács 585/2012/EU végrehajtási rendelete (2012. június 26.) az 1225/2009/EK rendelet 11. cikkének (2) bekezdése szerinti hatályvesztési felülvizsgálatot követően az Oroszországból és Ukrajnából származó egyes varrat nélküli vas- és acélcsövek behozatalára vonatkozó végleges dömpingellenes vám kivetéséről, valamint a Horvátországból származó egyes varrat nélküli vas- és acélcsövek behozatalára vonatkozó hatályvesztési felülvizsgálati eljárás megszüntetéséről (HL L 174., 2012.7.4., 5. o.).
(7) A Tanács 795/2012/EU végrehajtási rendelete (2012. augusztus 28.) az 1225/2009/EK végrehajtási rendelet 11. cikkének (3) bekezdése szerinti időközi felülvizsgálatot követően az Oroszországból és Ukrajnából származó egyes varrat nélküli vas- és acélcsövek behozatalára vonatkozó végleges dömpingellenes vám kivetéséről szóló 585/2012/EU rendelet módosításáról (HL L 238., 2012.9.4., 1. o.).
(8) A Bizottság (EU) 2018/1469 végrehajtási rendelete (2018. október 1.) az Oroszországból és Ukrajnából származó egyes varrat nélküli vas- vagy acélcsövek behozatalára vonatkozó végleges dömpingellenes vámnak az (EU) 2016/1036 európai parlamenti és tanácsi rendelet 11. cikke (2) bekezdése szerinti hatályvesztési felülvizsgálatot követő kivetéséről (HL L 246., 2018.10.2., 20. o.).
(9) A Tanács 1269/2012/EU végrehajtási rendelete (2012. december 21.) az 1225/2009/EK rendelet 11. cikkének (3) bekezdése szerinti részleges időközi felülvizsgálatot követően a többek között Oroszországból származó egyes varrat nélküli vas- és acélcsövek behozatalára vonatkozó végleges dömpingellenes vám kivetéséről szóló 585/2012/EU végrehajtási rendelet módosításáról (HL L 357., 2012.12.28., 1. o.).
(10) HL C 159., 2018.5.7., 18. o.
(11) A szénegyenértéket a Nemzetközi Hegesztési Intézet által 1967-ben kiadott IIW IX-555-67. számú technikai jelentés szerint kell meghatározni.
(12) A pontos érték vállalatspecifikus adat, ezért megadását mellőzzük.
(13) A pontos érték vállalatspecifikus adat, ezért megadását mellőzzük.
(14) Ez a módszertani változás abból adódik, hogy az eredeti vizsgálatot követően a WTO Vitarendezési Testülete elfogadta a WTO-vizsgálóbizottság által az „Európai Közösségek – a Norvégiából származó tenyésztett lazacra vonatkozó dömpingellenes intézkedések” ügyben készített jelentést, amely kimondja, hogy a rendes érték meghatározását igénylő terméktípusoknak a szokásos kereskedelmi forgalom keretében megvalósuló ügyletei alapján megállapított tényleges haszonkulcs nem hagyható figyelmen kívül. Lásd: WT/DS337/R, 2007. november 16., a Vitarendezési Testület általi elfogadás időpontja: 2008. január 15., 7.289–7.319. pont.
HATÁROZATOK
|
2.8.2019 |
HU |
Az Európai Unió Hivatalos Lapja |
L 204/29 |
A TANÁCS (KKBP) 2019/1296 HATÁROZATA
(2019. július 31.)
a tömegpusztító fegyverek és hordozóeszközeik elterjedésének megakadályozásáról szóló 1540 (2004) sz. ENSZ BT-határozat végrehajtásával összhangban a biológiai biztonság és védelem Ukrajnában való megerősítésének támogatásáról
AZ EURÓPAI UNIÓ TANÁCSA,
tekintettel az Európai Unióról szóló szerződésre és különösen annak 28. cikke (1) bekezdésére és 31. cikke (1) bekezdésére,
tekintettel az Unió külügyi és biztonságpolitikai főképviselőjének javaslatára,
mivel:
|
(1) |
Az Európai Tanács 2003. december 12-én elfogadta a tömegpusztító fegyverek elterjedése elleni EU-stratégiát, amelynek II. fejezete tartalmazza az e fegyverek elterjedése elleni küzdelemre irányuló intézkedések listáját. Ezeket az intézkedéseket mind az Unióban, mind a harmadik országokban meg kell hozni. |
|
(2) |
Az Unió aktívan végrehajtja ezt a stratégiát, és érvényre juttatja a stratégia III. fejezetében felsorolt intézkedéseket, elsősorban a multilaterális intézmények által irányított konkrét projektek támogatására felszabadított pénzügyi források biztosításával, a tömegpusztító fegyverek elterjedése elleni intézkedések széles köréhez szükséges technikai segítségnyújtásnak és szakértelemnek az államok részére történő biztosításával, valamint az Egyesült Nemzetek Szervezete Biztonsági Tanácsa (ENSZ BT) szerepének megerősítésével. |
|
(3) |
Az ENSZ BT 2004. április 28-án elfogadta az 1540 (2004) sz. határozatot (a továbbiakban: az 1540 (2004) sz. ENSZ BT-határozat), az első olyan nemzetközi okmányt, amely átfogó és egységes módon foglalkozik a tömegpusztító fegyverek és hordozóeszközeik, valamint a tömegpusztító fegyverekhez kapcsolódó anyagok kérdésével. Az 1540 (2004) sz. ENSZ BT-határozat valamennyi állam számára kötelezettségeket állapított meg, és e kötelezettségek célja az volt, hogy megakadályozzák a nem állami szereplőket abban, illetve visszatartsák őket attól, hogy ilyen fegyverekhez és a fegyverekhez kapcsolódó anyagokhoz jussanak. Az ENSZ BT arról is határozott, hogy az államoknak olyan belföldi ellenőrzések létrehozását célzó, hatékony intézkedéseket kell hozniuk és végrehajtaniuk, amelyekkel megelőzhető a nukleáris, vegyi és biológiai fegyverek és hordozóeszközeik elterjedése, többek között a kapcsolódó anyagokra vonatkozó megfelelő ellenőrzések kialakítása révén. |
|
(4) |
A Tanács 2017. május 11-én elfogadta az 1540 (2004) sz. ENSZ BT-határozat végrehajtásának támogatásáról szóló (KKBP) 2017/809 határozatot (1). A (KKBP) 2017/809 határozat alapján végzett tevékenységek technikai végrehajtása az ENSZ Leszerelési Ügyek Hivatalának (UNODA) feladata, amit az UNODA az érintett regionális nemzetközi szervezetekkel – különösen az Európai Biztonsági és Együttműködési Szervezettel (EBESZ) – együttműködésben hajt végre. |
|
(5) |
A Tanács 2017. július 11-én elfogadta a 1540 (2004) sz. ENSZ BT-határozat végrehajtásával összhangban a kémiai biztonság és védelem Ukrajnában való megerősítésének támogatásáról szóló (KKBP) 2017/1252 határozatot (2). A (KKBP) 2017/1252 határozat alapján végzett tevékenységek technikai végrehajtása az EBESZ Titkárságának feladata. |
|
(6) |
A tömegpusztító fegyverek elterjedése elleni küzdelem terén Ukrajna fő prioritásai közé tartozik a biológiai- és toxinfegyver-tilalmi egyezményhez (BTWC), valamint az 1540 (2004) sz. ENSZ BT-határozathoz való egyetemes csatlakozás és ezek teljes körű végrehajtása. |
|
(7) |
Az Unió és Ukrajna 2014. március 21-én, illetve június 27-én társulási megállapodást (3) írt alá, amely többek között előírja az ukrán jogszabályoknak a vonatkozó uniós jogszabályokkal való gyorsított harmonizációját, egyebek mellett az 1540 (2004) sz. ENSZ BT-határozat átfogó végrehajtása előtt álló akadályoknak az Ukrajnában való kiküszöbölésével összefüggésben. Az EU–Ukrajna társulási megállapodás egyes részeit 2014. november 1-je óta ideiglenesen alkalmazzák. Az EU–Ukrajna társulási megállapodás 2017. szeptember 1-jén hatályba lépett. |
|
(8) |
Az ukrán kormánynak az EU–Ukrajna társulási megállapodás végrehajtására irányuló, a 2018 és 2020 közötti időszakra vonatkozó cselekvési terve értelmében Ukrajna – a BTWC és az 1540 (2004) sz. ENSZ BT-határozat, valamint egyéb nemzetközi normák és előírások, különösen az uniós jogszabályi keret tekintetében fennálló kötelezettségeivel összhangban – vállalta, hogy kidolgozza, illetve javítja a biológiai biztonság és védelem területére vonatkozó szabályait és mechanizmusait. |
|
(9) |
Ennek keretében az EBESZ Titkársága az ukrán illetékes hatóságokkal szoros együttműködésben három projektjavaslatot dolgozott ki az átfogó biológiai biztonság és védelem Ukrajnában való megerősítése érdekében. |
|
(10) |
Az e határozat alapján megvalósítandó projektek technikai végrehajtásával az EBESZ Titkárságát kell megbízni. |
|
(11) |
A projekteket az ukrán kormánynak az EU-Ukrajna társulási megállapodás végrehajtásáról szóló cselekvési terve vonatkozó rendelkezéseivel összhangban kell végrehajtani. A tevékenységek végrehajtása során figyelembe kell venni a (KKBP) 2017/1252 határozat végrehajtása során azonosított releváns bevált gyakorlatokat és a végrehajtás során levont tanulságokat. |
|
(12) |
Az EBESZ Titkárságának biztosítania kell a hatékony együttműködést az olyan érdekelt nemzetközi szervezetekkel és testületekkel, mint a BTWC végrehajtást támogató egysége, az 1540 (2004) ENSZ BT-határozat alapján létrehozott ENSZ BT-bizottság, az Állategészségügyi Világszervezet, valamint a Partnerség a tömegpusztító fegyverek és anyagok elterjedése ellen. Az EBESZ Titkárságának biztosítania kell az e határozat alapján végrehajtott projektek tekintetében a kiegészítő jelleget és a szinergiákat a területre irányuló, az egyes uniós tagállamok által támogatott idevágó, korábbi és folyamatban lévő ukrajnai projektekkel, valamint az egyéb, uniós támogatással működő programokkal, így többek között a stabilitás és a béke elősegítését szolgáló eszközzel, valamint az uniós vegyi, biológiai, radiológiai vagy nukleáris anyagokkal foglalkozó kiválósági központokkal, |
ELFOGADTA EZT A HATÁROZATOT:
1. cikk
(1) A béke és a biztonság, valamint a hatékony multilateralizmus globális és regionális szintű előmozdítása céljából az Unió törekszik az alábbi célok elérésére:
|
— |
a biológiai biztonság és védelem megerősítése Ukrajnában az ukrán jogszabályi és szabályozási keret, valamint az emberi és állategészségügyi rendszerek javítása, továbbá az élettudományokkal foglalkozó szakemberek tájékoztatása révén; |
|
— |
a hatékony multilateralizmus regionális szinten való támogatása az EBESZ arra irányuló tevékenységének támogatásával, hogy megerősítse a biológiai biztonság és védelem területén illetékes ukrán hatóságok képességeit az 1540 (2004) sz. ENSZ BT-határozat szerinti kötelezettségekkel és a BTWC-vel összhangban. |
(2) Az (1) bekezdésben említett célkitűzések megvalósítása érdekében az Unió az alábbi projekteket hajtja végre:
|
— |
a biológiai biztonság és védelem területére vonatkozó hatályos ukrán jogszabályok harmonizációja a nemzetközi normákkal; |
|
— |
a különösen veszélyes patogének okozta betegségekkel foglalkozó állategészségügyi felügyeleti rendszer fenntarthatóságának biztosítása Ukrajnában; |
|
— |
az élettudományokkal foglalkozó szakembereknek a biológiai biztonsági és védelmi kérdésekkel kapcsolatos tájékoztatása, oktatása és képzése. |
A fent említett projektek részletes leírása a mellékletben található.
2. cikk
(1) E határozat végrehajtásáért az Unió külügyi és biztonságpolitikai főképviselője (a továbbiakban: a főképviselő) felel.
(2) Az 1. cikk (2) bekezdésében említett projekteket az EBESZ Titkársága hajtja végre. A Titkárság e feladatát a főképviselő felügyelete alatt látja el. A főképviselő e célból megköti a szükséges megállapodásokat az EBESZ Titkárságával.
3. cikk
(1) Az 1. cikk (2) bekezdésében említett projektek végrehajtását szolgáló pénzügyi referenciaösszeg 1 913 900 EUR.
(2) Az (1) bekezdésben meghatározott összegből finanszírozott kiadásokat az Unió általános költségvetésére alkalmazandó eljárások és szabályok szerint kell kezelni.
(3) A Bizottság felügyeli az (1) bekezdésben említett kiadások megfelelő kezelését. E célból finanszírozási megállapodást köt az EBESZ Titkárságával. E megállapodásban rendelkezni kell arról, hogy az EBESZ Titkárságának biztosítania kell az uniós hozzájárulás láthatóságát a hozzájárulás mértékének megfelelően.
(4) A Bizottság törekszik a (3) bekezdésben említett finanszírozási megállapodásnak az e határozat hatálybalépését követő mielőbbi megkötésére. A Bizottság tájékoztatja a Tanácsot az ezen eljárás során esetlegesen felmerülő nehézségekről, valamint a finanszírozási megállapodás megkötésének időpontjáról.
4. cikk
A főképviselő e határozat végrehajtásáról jelentést tesz a Tanácsnak az EBESZ Titkársága által készített rendszeres jelentések alapján. Ezek a jelentések képezik a Tanács által végzett értékelés alapját. A Bizottság tájékoztatást nyújt az 1. cikk (2) bekezdésében említett projektek pénzügyi vonatkozásairól.
5. cikk
(1) Ez a határozat az elfogadásának napján lép hatályba.
(2) Ez a határozat a 3. cikk (3) bekezdésében említett finanszírozási megállapodás megkötését követően 36 hónap elteltével, vagy amennyiben az elfogadása időpontját követő hat hónapon belül nem kerül sor finanszírozási megállapodás megkötésére, az elfogadása időpontját követő hat hónap elteltével hatályát veszti.
Kelt Brüsszelben, 2019. július 31-én.
a Tanács részéről
az elnök
T. TUPPURAINEN
(1) A Tanács (KKBP) 2017/809 határozata (2017. május 11.) a tömegpusztító fegyverek és hordozóeszközeik elterjedésének megakadályozásáról szóló 1540 (2004) sz. ENSZ BT-határozat végrehajtásának támogatásáról (HL L 121., 2017.5.12., 39. o.).
(2) A Tanács (KKBP) 2017/1252 határozata (2017. július 11.) a tömegpusztító fegyverek és hordozóeszközeik elterjedésének megakadályozásáról szóló 1540 (2004) sz. ENSZ BT-határozat végrehajtásával összhangban a kémiai biztonság és védelem Ukrajnában való megerősítésének támogatásáról (HL L 179., 2017.7.12., 8. o.).
(3) Társulási megállapodás egyrészről az Európai Unió, az Európai Atomenergia-közösség és tagállamaik, másrészről Ukrajna között (HL L 161., 2014.5.29., 3. o.).
MELLÉKLET
A biológiai biztonság és védelem megerősítése Ukrajnában az 1540 (2004) sz. ENSZ BT-határozattal összhangban
1. Háttér-információk
A biológiai fegyverek tilalmát előíró ukrán jogi szabályozás részletes és átfogó. E jogszabályi és szabályozási előírások jelentős része ugyanakkor idejétmúlt, és nem felel meg a nemzetközi normáknak és előírásoknak. Ennélfogva azokat – a vonatkozó nemzetközi előírásokkal való harmonizációjuk fokozása érdekében – sürgősen felül kell vizsgálni és aktualizálni kell.
Ukrajnában nem létezik a biológiai biztonságra és védelemre vonatkozó olyan kerettörvény, amely létrehozna egy biológiai biztonsági és védelmi rendszert és ismertetné annak megfelelő működését (például, amely jogilag meghatározná a biológiai biztonsággal és védelemmel foglalkozó, valamint szakértői és nyomonkövetési feladatokat ellátó központi végrehajtó testületet). Ezenfelül jelenleg nincs átfogó együttműködés az összes érintett minisztérium, ügynökség és szervezet között a biológiai veszélyekhez kapcsolódó veszélyhelyzetek megelőzése és az azokra való reagálás céljából.
Hasonlóképpen hiányoznak azok az állami ellenőrző mechanizmusok is, amelyek biztosítanák a biológiai védelemmel kapcsolatos követelmények betartását a biológiai anyagokkal való munkavégzés során. Nem áll rendelkezésre nyilvántartás az Ukrajna területén veszélyes biológiai anyagokkal dolgozó gazdasági és nem gazdasági szereplőkről. Mindemellett a veszélyes biológiai anyagokkal dolgozó szereplőket nem kötelezi jogszabály a megfelelő engedély megszerzésére. Az engedélyezési rendszer megszüntetése valójában olyan helyzetet teremtett, amelyben a biológiai biztonságra és védelemre vonatkozó követelmények klinikai mikrobiológiai laboratóriumokban való betartását nem jelentik és nem ellenőrzik, és az ilyen laboratóriumok tényleges száma is ismeretlen. A veszélyes biológiai anyagok szállítását, tárolását és átadását, valamint az azokkal való elszámolást szabályozó normatív dokumentumot hatályon kívül helyezték. Az alkalmazandó dokumentumok kevéssé foglalkoznak a biológiai védelem más szempontjaival, így például az alkalmazottak megbízhatóságának ellenőrzésével és a bizalmas információk védelmével.
A mezőgazdasági termelés, a biotermelés, a közlekedés és a külkereskedelmi kapcsolatok modern világunkat jellemző gyors bővülésének tükrében az orvostudomány és az állatgyógyászat területén is sok probléma merül fel, különösen a biológiai anyagok elterjedésének kockázatával, különösen az emberek és állatok körében gyakori fertőző és parazitás megbetegedésekkel kapcsolatban.
Ukrajnában ma a biológiai védelem és az élelmezésbiztonság szempontjából az afrikai sertéspestis, a madárinfluenza, a ragadós száj- és körömfájás, valamint a multirezisztens bakteriális kórokozók jelentik a legfőbb veszélyt. Egyes helyeken fennáll az anthrax-, a veszettség-, a klasszikus sertéspestis- és a tularémiajárványok természetes kockázata. Az élelmezésbiztonság és a biológiai védelem szavatolása érzékeny kérdés, amely nem oldható meg az újonnan megjelenő és gazdasági szempontból jelentős fertőző állatbetegségek – köztük a zoonózisfertőzések – nyomon követésére, előrejelzésére és korai felismerésére szolgáló eszközök nélkül. A biológiai védelem és az élelmezésbiztonság problémája Ukrajnában csak akkor kezelhető, ha a genetikai és a molekuláris biotechnológiai alapkutatás beépítésre kerül az orvostudomány és az állatgyógyászat, illetve a diagnosztika területébe.
Az ukrán élettudományi laboratóriumok személyzetének többsége nagy tapasztalattal rendelkezik a veszélyes biológiai anyagok kezelése terén, ugyanakkor rendkívül ritka, hogy a laboratóriumokban a biológiai biztonság és védelem modern elvei és megközelítései, illetve korszerű módszerek és gyakorlatok, valamint az ilyen korszerű gyakorlatokhoz igazodó magatartási kódexek létezzenek. Több élettudományi laboratóriumban is található ugyan néhány korszerű berendezés, de az e berendezések működését ismertető képzés hiányában a laboratóriumi személyzet nem vagy nem megfelelően használja azokat. Mindemellett az élettudományokkal foglalkozó szakemberek egyes kategóriái esetében a meglévő magas szintű képzési rendszer nem tér ki minden szükséges biológiai biztonsági és védelmi kérdésre. Mindezek a tényezők együtt a veszélyes biológiai anyagokkal dolgozó laboratóriumokban a biológiai biztonság és védelem szintjének csökkenését eredményezhetik.
A fenti elemzés alapján az EBESZ három projektet dolgozott ki azzal a céllal, hogy megerősítse Ukrajnában a biológiai biztonság és védelem általános szintjét. Ezen projektek kidolgozására az illetékes ukrán hatóságokkal együttműködésben került sor. A projektek végrehajtása az EU-Ukrajna társulási megállapodás végrehajtásáról szóló cselekvési terv vonatkozó rendelkezéseivel összhangban történne.
A projektek végrehajtásakor figyelembe vennék továbbá a kémiai biztonság és védelem Ukrajnában való megerősítésének támogatásáról szóló (KKBP) 2017/1252 határozat végrehajtása során azonosított releváns bevált gyakorlatokat és a végrehajtás során levont tanulságokat.
2. Cél
E határozat általános célja, hogy Ukrajnának a BTWC és az 1540 (2004) sz. ENSZ BT-határozat szerinti kötelezettségeivel összhangban, továbbá az EU–Ukrajna társulási megállapodásnak megfelelően támogassa a biológiai biztonság és védelem Ukrajnában való megerősítését célzó EBESZ-projekteket.
3. A projektek leírása
3.1. A biológiai biztonság és védelem területére vonatkozó hatályos ukrán jogszabályok harmonizációja a nemzetközi normákkal
3.1.1. A projekt célja
|
— |
A biológiai biztonságra és védelemre vonatkozó ukrán jogszabályi és szabályozási keret javítása az 1540 (2004) sz. ENSZ BT-határozat szerinti kötelezettségekkel összhangban, nevezetesen olyan megfelelő és hatékony jogszabályok elfogadása és végrehajtása, amelyek minden nem állami szereplő számára megtiltják biológiai fegyverek és azok hordozóeszközei – különösen terrorizmus céljából történő – előállítását, megszerzését, birtoklását, kifejlesztését, szállítását, átadását és használatát. |
3.1.2. A projekt leírása
|
— |
Az e projektből közvetlen támogatásban részesülő, a biológiai biztonsággal és védelemmel kapcsolatos jogszabályok javítását célzó és mielőbbi végrehajtást igénylő konkrét intézkedések a következők:
|
3.1.3. A projekt várt eredményei
|
— |
Az ukrán biológiai biztonsági és védelmi rendszer javítása az e területre vonatkozó nemzeti jogszabályi és szabályozási keret megerősítése révén; |
|
— |
a biológiai biztonságért és védelemért felelős különböző ügynökségek közötti együttműködés előmozdítása; |
|
— |
a biológiai biztonsági és védelmi rendszer fenntarthatóságának biztosítása Ukrajnában. |
3.1.4. A projekt kedvezményezettjei
|
— |
Egészségügyi Minisztérium. |
3.2. A különösen veszélyes patogének okozta betegségekkel foglalkozó állategészségügyi felügyeleti rendszer fenntarthatóságának biztosítása Ukrajnában
3.2.1. A projekt célja
|
— |
A biológiai biztonság és védelem javítása Ukrajnában az emberi és állati egészségügyi rendszerek megerősítése révén, az 1540 (2004) sz. ENSZ BT-határozat alapján fennálló kötelezettségekkel összhangban, és különösen olyan belföldi ellenőrzések létrehozását célzó, hatékony intézkedések végrehajtása, amelyekkel megelőzhető a biológiai fegyverek és hordozóeszközeik elterjedése, többek között a kapcsolódó anyagokra vonatkozó megfelelő ellenőrzések kialakítása révén. |
3.2.2. A projekt leírása
|
— |
Az emberi és állatbetegségek hatékony nyomon követésének végrehajtása az egyes kiválasztott anyagok szekvenálására és genetikai jellemzésére szolgáló közös használatú központ létrehozása és a részt vevő intézmények reverz transzkripciós polimeráz láncreakciós (RT-PCR) gépekkel való felszerelése révén; |
|
— |
vészhelyzeti gyorsreagálási intézkedések kidolgozása és a különösen veszélyes állatbetegségek gyorsdiagnosztikájának bevezetése az egyes kiválasztott anyagok (a madárinfluenza, a Newcastle-betegség, a multirezisztens tuberkulózis, a bőrcsomósodáskór, a tularémia, az afrikai sertéspestis, a klasszikus sertéspestis, a ragadós száj- és körömfájás, a brucellózis, a multirezisztens szalmonellák és az anthrax kórokozói) PCR-alapú felismeréséhez használt RT-PCR-alapú diagnosztikai eszközök kifejlesztése révén, Ukrajnában kidolgozott belső protokollok alkalmazásával; |
|
— |
a kórokozók, köztük a zoonózisos, a vírusos és bakteriális kórokozók laboratóriumokban és lerakatokban történő biztonságos tárolásának megvalósítása az RT-PCR-alapú tesztkészletekre vonatkozó nyilvántartási dokumentumok létrehozása révén; |
|
— |
egységes technikai eljárás biztosítása a vizsgálati laboratóriumok megfelelőségértékelése területén, a bizalom elnyerése nemzeti és nemzetközi szinten egyaránt, a teljesítmény és az átláthatóság kölcsönös elismeréséhez szükséges feltételek megteremtése, valamint figyelemfelhívás és a szakértelem biztosítása a biológiai biztonság és védelem területén; |
|
— |
kapacitásépítés a különösen veszélyes patogének okozta betegségek molekuláris diagnosztikája területén. |
3.2.3. A projekt várt eredményei
|
— |
A nemzeti felügyeleti és előrejelző képesség megerősítése az állatgyógyászat területén; |
|
— |
RT-PCR- és izotermális PCR-eszközökön alapuló, hatékony nemzeti diagnosztikai és felügyeleti eszközök kifejlesztése (K+F, hitelesítés és laboratóriumi alkalmazás); |
|
— |
az állatbetegségek (köztük a zoonózisos betegségek) hatékony nyomon követésének végrehajtása; |
|
— |
humán kapacitás létrehozása a különösen veszélyes patogének okozta betegségek molekuláris diagnosztikája terén (a PCR-módszereket ismertető laboratóriumi képzés). |
3.2.4. A projekt kedvezményezettjei
|
— |
Az Ukrán Állami Élelmiszerbiztonsági és Fogyasztóvédelmi Szolgálat |
|
— |
A támogatás kedvezményezettje: A „Kísérleti és Klinikai Állatorvosi Intézet” elnevezésű nemzeti tudományos központ (Harkiv, Ukrajna) |
3.3. Az élettudományokkal foglalkozó szakembereknek a biológiai biztonsági és védelmi kérdésekkel kapcsolatos tájékoztatása, oktatása és képzése
3.3.1. A projekt célja
|
— |
A biológiai biztonság és védelem és a bioetika javítása Ukrajnában az élettudományokkal foglalkozó szakembereknek a biológiai biztonsági és védelemi kérdésekkel kapcsolatos tájékoztatása révén, az 1540 (2004) sz. ENSZ BT-határozat szerinti kötelezettségekkel összhangban, ideértve a biológiai fegyverek és hordozóeszközeik elterjedésének megakadályozását célzó hatékony belföldi intézkedések végrehajtását is. |
3.3.2. A projekt leírása
|
— |
Az ukrán élettudományi intézetek munkatársaiból álló oktatói csapat összeállítása, amelynek tagjai át tudják adni a biológiai biztonság és védelem és a bioetika elveivel kapcsolatos korszerű ismereteket, a bevált laboratóriumi gyakorlatokat, valamint a laboratóriumi biológiai kockázatok kezelését célzó eljárásokat és módszereket; |
|
— |
a már rendelkezésre álló erőforrások javítása annak érdekében, hogy az élettudományok oktatói, hallgatói és az élettudományokkal foglalkozó szakemberek, valamint más érdekelt felek körében fokozni lehessen a biológiai biztonsággal és védelemmel és a bioetikával kapcsolatos ismeretek terjesztését és tájékoztatást, maradéktalanul figyelembe véve az ukrán Tudományos és Technológiai Központ „Oktatás és ismeretterjesztés Ukrajnában” című P633. sz. projektjét; |
|
— |
a képzési kapacitás fenntarthatóságának biztosítása a projekt befejezését követően. |
3.3.3. A projekt várt eredményei
|
— |
a nemzeti és helyi érdekelt felek ismereteinek bővülése a biológiai biztonság és védelem területén; |
|
— |
az élettudományokkal foglalkozó szakemberek képességeinek javulása a veszélyes biológiai anyagok kezelése terén; |
|
— |
az élettudományokkal foglalkozó ukrán szakemberek fokozott képessége arra, hogy csökkentsék a kutatásaik során használt anyagokkal és eszközökkel való esetleges visszaélések, valamint az ismereteikkel és kutatási eredményeikkel való visszaélések kockázatát; |
|
— |
az élettudományokkal foglalkozó szakemberek biológiai biztonsági és védelmi képzést nyújtó, erős oktatói csapat létrehozása; |
|
— |
jobb és fenntartható erőforrások a biológiai biztonsággal és védelemmel és a bioetikával kapcsolatos ismeretek távoktatásához és terjesztéséhez. |
3.4. A projekt kedvezményezettjei
|
— |
Egészségügyi Minisztérium. |
4. Igazgatási támogatás a projektek végrehajtásához
Az ukrán partnerek közötti együttműködési keret továbbfejlesztése érdekében az EBESZ Titkárságán és az EBESZ ukrajnai projektkoordinációs hivatalában külön személyzet fogja koordinálni és irányítani a projekttel kapcsolatos, a 3. pontban említett tevékenységeket, többek között új releváns projektjavaslatok és nemzeti intézkedések kidolgozása révén.
A támogató személyzet a következő feladatokat fogja ellátni:
|
— |
a projektek irányítása a projektciklus valamennyi fázisában, |
|
— |
a projektek napi szintű pénzügyi felügyelete, |
|
— |
technikai és jogi szakértelem biztosítása, a nagyobb közbeszerzések támogatása, más nemzetközi szervezetek bevonása, a jóváhagyott projektek célkitűzéseivel kapcsolatos minőségbiztosítás és minőség-ellenőrzés, valamint jelentéstétel az Európai Uniónak. |
5. Időtartam
A projektek becsült teljes időtartama 36 hónap.
6. Technikai végrehajtó szerv
E határozat technikai végrehajtására az EBESZ Titkárságának konfliktusmegelőzési központja és az EBESZ ukrajnai projektkoordinációs hivatala kap megbízást. Az EBESZ más nemzetközi szervezetekkel és ügynökségekkel együttműködésben hajtja végre az e határozat szerinti tevékenységeket, különösen a hatékony szinergiák biztosítása és a párhuzamosságok elkerülése érdekében.
7. Jelentéstétel
Az EBESZ Titkársága rendszeresen, valamint a fent leírt egyes tevékenységek befejezését követően jelentést készít. A végleges jelentéseket legkésőbb hat héttel az adott tevékenység befejezését követően be kell nyújtani az Európai Unió részére.
8. Irányítóbizottság
E projekt irányítóbizottságát a főképviselő képviselője és az e melléklet 6. pontjában említett végrehajtó szerv képviselője alkotja. Az irányítóbizottság rendszeresen – legalább hathavonta – felülvizsgálja e határozat végrehajtását, többek között elektronikus távközlési eszközök használatával.
9. A projektek becsült összköltsége és az európai uniós pénzügyi hozzájárulás
A projektek összköltsége 1 913 900 EUR.
|
2.8.2019 |
HU |
Az Európai Unió Hivatalos Lapja |
L 204/36 |
A TANÁCS (KKBP) 2019/1297 HATÁROZATA
(2019. július 31.)
az Európai Biztonsági és Védelmi Főiskola (EBVF) létrehozásáról szóló (KKBP) 2016/2382 határozat módosításáról
AZ EURÓPAI UNIÓ TANÁCSA,
tekintettel az Európai Unióról szóló szerződésre és különösen annak 28. cikke (1) bekezdésére, 42. cikke (4) bekezdésére és 43. cikke (2) bekezdésére,
tekintettel az Unió külügyi és biztonságpolitikai főképviselőjének javaslatára,
mivel:
|
(1) |
A Tanács 2016. december 21-én elfogadta az Európai Biztonsági és Védelmi Főiskola (EBVF) létrehozásáról szóló (KKBP) 2016/2382 határozatot (1). |
|
(2) |
A Tanács 2018. május 14-én elfogadta a (KKBP) 2018/712 határozatot (2), amelyben megbízta az EBVF-t egy, a kiberoktatással, -képzéssel, -értékeléssel és -gyakorlattal kapcsolatos platform létrehozásával, azt is megjegyezve, hogy komplementaritást kell biztosítani az egyéb idevágó uniós erőfeszítésekkel és kezdeményezésekkel. |
|
(3) |
A Tanács 2018. november 6-án elfogadta a (KKBP) 2018/1655 határozatot (3), amellyel módosította a (KKBP) 2016/2382 határozatot és meghatározta a 2019. január 1-jétől2019. december 31-ig tartó időszakra szóló pénzügyi referenciaösszeget. |
|
(4) |
A Politikai és Biztonsági Bizottság 2018. szeptember 20-án elfogadta a Polgári Válságkezelő Bizottság különleges formációjaként működő uniós polgári képzési csoport megbízását. |
|
(5) |
A tagállamok 2019. március 15-én, az uniós polgári képzési csoport ülésén jelezték, hogy uniós pénzügyi támogatást kell biztosítani a polgári képzéskoordinátorok (CCT) számára. |
|
(6) |
Az EBVF irányítóbizottsága 2019. június 3-án úgy határozott, hogy az EBVF-nek kell adminisztrálnia és kezelnie a CCT utazási és szállásköltségeivel kapcsolatos kiadásokat. |
|
(7) |
A (KKBP) 2016/2382 határozatot ezért ennek megfelelően módosítani kell, |
ELFOGADTA EZT A HATÁROZATOT:
1. cikk
A (KKBP) 2016/2382 határozat 4. cikkének (3) bekezdése a következő ponttal egészül ki:
|
„j) |
a Polgári Válságkezelő Bizottság és az uniós polgári képzési csoport támogatása a polgári képzéskoordinátorok tevékenységeihez kapcsolódó utazási és szállásköltségek adminisztrálása és kezelése révén.” |
2. cikk
Ez a határozat az elfogadásának napján lép hatályba.
Kelt Brüsszelben, 2019. július 31-én.
a Tanács részéről
az elnök
T. TUPPURAINEN
(1) A Tanács (KKBP) 2016/2382 határozata (2016. december 21.) az Európai Biztonsági és Védelmi Főiskola (EBVF) létrehozásáról, valamint a 2013/189/KKBP határozat hatályon kívül helyezéséről (HL L 352., 2016.12.23., 60. o.).
(2) A Tanács (KKBP) 2018/712 határozata (2018. május 14.) az Európai Biztonsági és Védelmi Főiskola (EBVF) létrehozásáról szóló (KKBP) 2016/2382 határozat módosításáról (HL L 119., 2018.5.15., 37. o.).
(3) A Tanács (KKBP) 2018/1655 határozata (2018. november 6.) az Európai Biztonsági és Védelmi Főiskola (EBVF) létrehozásáról szóló (KKBP) 2016/2382 határozat módosításáról (HL L 276., 2018.11.7., 9. o.).
|
2.8.2019 |
HU |
Az Európai Unió Hivatalos Lapja |
L 204/37 |
A TANÁCS (KKBP) 2019/1298 HATÁROZATA
(2019. július 31.)
a fegyverek és lőszerek illetéktelen kezekbe jutásának Afrikában való megelőzésére irányuló Afrika–Kína–Európa párbeszéd és együttműködés támogatásáról
AZ EURÓPAI UNIÓ TANÁCSA,
tekintettel az Európai Unióról szóló szerződésre és különösen annak 28. cikke (1) bekezdésére és 31. cikke (1) bekezdésére,
tekintettel az Unió külügyi és biztonságpolitikai főképviselőjének javaslatára,
mivel:
|
(1) |
2014. december 24-én hatályba lépett a Fegyverkereskedelmi Szerződés, és annak az összes tagállam részes fele. A Fegyverkereskedelmi Szerződés célja, hogy a lehető legmagasabb szintű egységes nemzetközi előírásokat állapítsa meg a hagyományos fegyverek legális kereskedelmének szabályozására vonatkozóan, valamint hogy megelőzze és felszámolja a hagyományos fegyverek tiltott kereskedelmét, továbbá hogy megelőzze e fegyverek illetéktelen kezekbe jutását. |
|
(2) |
A Tanács 2018. november 19-én elfogadta a tiltott tűzfegyverek, kézi- és könnyűfegyverek, valamint az azokhoz szükséges lőszerek elleni, „A fegyverállomány biztonságossá tétele, a polgárok védelme” című uniós stratégiát (a továbbiakban: a stratégia). A stratégia fő célja a kézi- és könnyűfegyverek tiltott kereskedelme minden formájának megelőzéséről, leküzdéséről és megszüntetéséről szóló, 2001. évi ENSZ cselekvési program teljes körű és tényleges végrehajtása. A stratégia kimondja, hogy az EU továbbra is ösztönözni fogja a felelős és hatékony fegyverkiviteli ellenőrzést, valamint továbbra is támogatni fogja a Fegyverkereskedelmi Szerződés egyetemessé tételét és végrehajtását. A stratégia azt is kimondja, hogy az EU a továbbiakban is támogatni fogja az Afrikai Uniót és más, e tekintetben releváns regionális gazdasági közösségeket a kézi- és könnyűfegyverek, valamint az azokhoz szükséges lőszerek tiltott kereskedelme elleni küzdelemükben. |
|
(3) |
Az Afrikai Unió közgyűlése a 2017. januári, 28. rendes ülésszakán elfogadta az „Afrikában a fegyverek 2020-ra való elhallgattatását szolgáló gyakorlati lépésekre vonatkozó afrikai uniós kiemelt ütemtervet”, kötelezve ezzel az afrikai uniós tagállamokat a tiltott fegyverek illegális beáramlásának és forgalmának a megfékezésére; a lázadók/felkelők fegyverhez jutásának akadályozására; valamint arra, hogy a Fegyverkereskedelmi Szerződéssel összhangban megszakítsák a kapcsolatokat a tiltott fegyverek beszállítóival és átvevőivel, az idevágó tilalmak bevezetését is beleértve. |
|
(4) |
A Tanács a Kínára vonatkozó uniós stratégiáról szóló, 2016. július 18-i következtetéseiben támogatta egy rendszeres és érdemi párbeszéd kialakítását az EU és Kína között annak érdekében, hogy a tagállamokkal együttesen fokozott egyetértést sikerüljön kialakítani a leszerelés, a nonproliferáció, a terrorizmus elleni küzdelem és a kiberbiztonság terén. |
|
(5) |
A tiltott kézi- és könnyűfegyverek elleni ENSZ cselekvési program végrehajtásában elért előrehaladást áttekintő harmadik felülvizsgálati konferenciáján az ENSZ 2018. június 30-án záródokumentumot fogadott el, amelyben az államok megújítják elkötelezettségüket a kézi- és könnyűfegyverek illetéktelen kezekbe jutásának megelőzése és az ellene való küzdelem mellett. A dokumentumban az államok újólag megerősítik, hogy készen állnak a nemzetközi együttműködésre és arra, hogy a koordináció, az egyeztetések, az információcsere és az operatív együttműködés javítása révén erősítsék a regionális együttműködést, az érintett regionális és szubregionális szervezeteket, valamint a bűnüldözési, a határellenőrzési és a kiviteli és behozatali engedélyezésért felelős hatóságokat is bevonva a folyamatokba. Az államok továbbá amellett is elkötelezik magukat, hogy megosszák egymással a kézi- és könnyűfegyverek kivitelének, behozatalának és tranzitjának ellenőrzéséhez kapcsolódó tapasztalatokat, tanulságokat és bevált gyakorlatokat – a tanúsítási folyamatok és végfelhasználói tanúsítványok területét is beleértve –, valamint hogy a nemzeti jogi keretrendszerükkel és biztonsági követelményeikkel összhangban alkalmazzák is a szóban forgó tapasztalatokat, tanulságokat és bevált gyakorlatokat. |
|
(6) |
A 2030-ig tartó időszakra vonatkozó fenntartható fejlődési menetrend megerősíti, hogy a kézi- és könnyűfegyverek tiltott kereskedelme elleni küzdelem számos fenntartható fejlődési cél eléréséhez szükséges, ideértve többek között a békével, a jogérvényesüléssel és az erős intézményekkel, a szegénység csökkentésével, a gazdasági növekedéssel, az egészséggel, a nemek közötti egyenlőséggel, valamint a biztonságos városokkal kapcsolatos célokat. Következésképpen a 16.4. sz. fenntartható fejlődési cél keretében az összes állam elkötelezte magát amellett, hogy jelentős mértékben csökkentse a pénz és a fegyverek tiltott áramlását. |
|
(7) |
A Tanács 2012. február 27-én elfogadta a hagyományos fegyverek ellenőrzésével kapcsolatos, az Unió, Kína és Afrika közötti párbeszéd és együttműködés ösztönzését célzó tevékenységek támogatásáról szóló 2012/121/KKBP határozatot (1). A Saferworld eredményesen végrehajtotta ezt a projektet, de az említett határozatban foglalt célok eléréséhez további erőfeszítésekre van szükség ezen a területen. |
|
(8) |
A Tanács 2008 óta tizenegy határozatot fogadott el a Fegyverkereskedelmi Szerződéssel és a 2008/944/KKBP közös tanácsi állásponttal (2) összhangban álló, felelősségteljes fegyverkiviteli ellenőrzés területével kapcsolatos tájékoztatási tevékenységek támogatására, de Kínával ebben a témában csak korlátozott párbeszéd valósult meg, |
ELFOGADTA EZT A HATÁROZATOT:
1. cikk
(1) E határozat célja, hogy hozzájáruljon a fegyverek és lőszerek illetéktelen kezekbe jutásának megelőzéséhez és az ellene való küzdelemhez Afrikában.
(2) Az (1) bekezdés alapján az Unió az alábbi célkitűzéseket támogatja:
|
a) |
az afrikai, kínai és az uniós érdekelt felek figyelmének felhívása arra, hogy a fegyverek – és azon belül is mindenekelőtt a kézi- és könnyűfegyverek – és az azokhoz szükséges lőszerek illetéktelen személyekhez irányuló tiltott áramlása miként járul hozzá jelentős mértékben a biztonság hiányának és az erőszaknak a súlyosbodásához Afrika különböző részein, aláásva ezzel a társadalmi kohéziót, a közbiztonságot, a társadalmi-gazdasági fejlődést és az állami intézmények hatékony működését; |
|
b) |
a legális fegyverkereskedelemmel kapcsolatos elszámoltathatóság és felelősségvállalás előmozdítása, mégpedig annak az afrikai, kínai és az uniós érdekelt felek számára történő szemléltetésével, hogy a fegyverkivitel hatékony ellenőrzése miként járulhat hozzá a fegyverek illegális piacok felé történő eltérítése kockázatának a csökkentéséhez. |
(3) E célkitűzések elérése érdekében ez a határozat támogatja egy, a hagyományos fegyverek ellenőrzésével foglalkozó közös, nem kormányzati Afrika–Kína–Európa szakértői munkacsoport (a továbbiakban: szakértői munkacsoport) létrehozását és fejlesztését, amely munkacsoport fő feladata az lesz, hogy növelje az afrikai, a kínai és az uniós szakpolitikai közösségek tájékozottságát és szerepvállalását, valamint előmozdítsa ezek tevékenységét, továbbá hogy erősítse a fegyverek és lőszerek illetéktelen kezekbe jutásának Afrikában való megelőzésére irányuló regionális és nemzetközi együttműködést.
(4) E határozat várt eredményei a következők:
|
a) |
az afrikai, kínai és uniós kutatók és tudományos dolgozók által végzett közös kutatások és intézkedésorientált elemzések nyomán annak jobb megértése, hogy milyen hatásokkal jár a fegyverek illetéktelen kezekbe jutása és az azokkal való visszaélés Afrikában, ajánlásokat fogalmazva meg ezen a területen Kína által támogatott konkrét projektekre; |
|
b) |
az afrikai, kínai és uniós érdekelt felek azzal kapcsolatos tájékozottságának a javulása, hogy milyen szerepet tölt be a fegyverkivitel hatékony ellenőrzése Afrikában a fegyverek és lőszerek illetéktelen kezekbe jutása kockázatának a csökkentésében, valamint a tiltott fegyverek és lőszerek negatív hatásainak a mérséklésében; |
|
c) |
Kína nagyobb mértékű hozzájárulása idevágó nemzetközi és regionális kezdeményezésekhez, köztük az Afrikában a fegyverek 2020-ra való elhallgattatására irányuló afrikai uniós kezdeményezéshez, valamint a Fegyverkereskedelmi Szerződés végrehajtásához; |
|
d) |
a kézifegyverek ellenőrzése kérdésének napirendre tűzése a Kína–Afrika Együttműködési Fórum (FOCAC) keretei között folytatandó párbeszéd során; |
|
e) |
új fórumok létrehozása olyan kormányzati, civil társadalmi, üzleti és tudományos körökből érkező afrikai, kínai és uniós szakértők részvételével, akik információkkal segítik majd az EU és Kína közötti magas szintű stratégiai párbeszéd keretében zajló munkát. |
(5) A projekt közvetlen kedvezményezettje egy mintegy 500 főből – többek között nem kormányzati szervezetek képviselőiből, agytrösztök tagjaiból, az iparág képviselőiből, a hagyományos fegyverek kivitelének ellenőrzéséért felelős kormányzati tisztviselőkből, valamint parlamenti képviselőkből – álló afrikai, kínai és uniós szakpolitikai közösség lesz. A közvetett kedvezményezettek körét Afrika lakossága, nevezetesen azok az afrikai közösségek, csoportok és személyek alkotják, akiket hátrányosan érint a tiltott fegyverek és lőszerek elterjedése az afrikai kontinensen.
(6) A projekt részletes leírását e határozat melléklete tartalmazza.
2. cikk
(1) E határozat végrehajtásáért az Unió külügyi és biztonságpolitikai főképviselője (főképviselő) felel.
(2) Az 1. cikkben említett projekt technikai végrehajtását a Saferworld nevű nem kormányzati szervezet végzi.
(3) A Saferworld az ezzel kapcsolatos feladatait a főképviselő irányítása mellett végzi. A főképviselő e célból megköti a szükséges megállapodásokat a Saferworlddel.
3. cikk
(1) Az 1. cikkben említett uniós finanszírozású projekt végrehajtására szolgáló pénzügyi referenciaösszeg 994 007 EUR.
(2) Az (1) bekezdésben meghatározott referenciaösszegből finanszírozott kiadásokat az Unió költségvetésére alkalmazandó eljárások és szabályok szerint kell kezelni.
(3) Az (1) bekezdésben említett kiadások megfelelő kezelését a Bizottság felügyeli. E célból megköti a Saferworlddel a szükséges finanszírozási megállapodást. A finanszírozási megállapodásban ki kell kötni, hogy a Saferworldnek – a hozzájárulás nagyságának megfelelően – biztosítania kell az uniós hozzájárulás láthatóságát.
(4) A Bizottság törekszik a (3) bekezdésben említett finanszírozási megállapodásnak az e határozat hatálybalépését követő mielőbbi megkötésére. A Bizottság tájékoztatja a Tanácsot az ezen eljárás során esetlegesen felmerülő nehézségekről és a finanszírozási megállapodás megkötésének időpontjáról.
4. cikk
(1) A főképviselő a Saferworld által negyedévenként készített rendszeres beszámolók alapján jelentést tesz a Tanácsnak e határozat végrehajtásáról. Ezek a jelentések képezik a Tanács általi értékelés alapját.
(2) A Bizottság jelentést tesz az 1. cikkben említett projekt pénzügyi vonatkozásairól.
5. cikk
(1) Ez a határozat az elfogadásának napján lép hatályba.
(2) Ez a határozat a 3. cikk (3) bekezdésében említett finanszírozási megállapodás megkötésének időpontját követő 36 hónap elteltével hatályát veszti. Amennyiben azonban az említett megállapodás megkötésére e határozat hatálybalépését követő hat hónap elteltével nem kerül sor, úgy e határozat e hat hónap elteltével hatályát veszti.
Kelt Brüsszelben, 2019. július 31-én.
a Tanács részéről
az elnök
T. TUPPURAINEN
(1) A Tanács 2012/121/KKBP határozata (2012. február 27.) a hagyományos fegyverek ellenőrzésével kapcsolatos, az Unió, Kína és Afrika közötti párbeszéd és együttműködés ösztönzését célzó tevékenységek támogatásáról (HL L 54., 2012.2.28., 8. o.).
(2) A Tanács 2008/944/KKBP közös álláspontja (2008. december 8.) a katonai technológia és felszerelések kivitelének ellenőrzésére vonatkozó közös szabályok meghatározásáról (HL L 335., 2008.12.13., 99. o.).
MELLÉKLET
A FEGYVEREK ÉS LŐSZEREK ILLETÉKTELEN KEZEKBE JUTÁSÁNAK AFRIKÁBAN VALÓ MEGELŐZÉSÉRE IRÁNYULÓ AFRIKA–KÍNA–EURÓPA PÁRBESZÉD ÉS EGYÜTTMŰKÖDÉS
1. A projekt és a tevékenységek leírása
A projekt két fő szakaszból fog állni, amelyek összefoglalása alább, a szakértői munkacsoport létrehozásáról szóló 1.1. pontban, valamint az afrikai, a kínai és az uniós érdekelt feleknek a fegyverek és lőszerek illetéktelen kezekbe jutásának Afrikában való megelőzése céljából végrehajtandó intézkedések előmozdításába való bevonásáról szóló 1.2. pontban található.
1.1. 1. szakasz: A fegyverek és lőszerek illetéktelen kezekbe jutásának Afrikában való megelőzésével foglalkozó közös, nem kormányzati Afrika–Kína–Európa szakértői munkacsoport létrehozása és fejlesztése
1.1.1. Célkitűzések
Közös, nem kormányzati Afrika–Kína–Európa szakértői munkacsoport létrehozása olyan afrikai, kínai és uniós nem kormányzati szakértők részvételével, akik elősegítik az afrikai, a kínai és az uniós érdekelt felek bevonását és támogatják a fegyverek és lőszerek illetéktelen kezekbe jutásának Afrikában való megelőzésére irányuló háromoldalú párbeszédet és együttműködést, a következők céljából:
|
a) |
a fegyverek – mindenekelőtt a kézi- és könnyűfegyverek – és az azokhoz szükséges lőszerek Afrikán belül történő illetéktelen kezekbe jutásához kapcsolódó biztonsági, társadalmi-gazdasági és humanitárius hatások ismertetése és annak bemutatása, hogy a fegyverkereskedelem fokozottabb ellenőrzése – a kínálati oldalon is – hogyan járulhat hozzá a fegyverek illetéktelen kezekbe jutása veszélyének csökkentéséhez; |
|
b) |
az EU és Kína közötti magas szintű stratégiai párbeszéd keretében zajló munka segítése, különös tekintettel a biztonság és a fegyverek ellenőrzése terén Afrikában folytatott együttműködésre; |
|
c) |
információk, elképzelések, szakértelem és kutatási eredmények cseréje a tagok között és a jelenlegi szakpolitikák és kezdeményezések eredményességének értékelése; |
|
d) |
az érdekelt kormányzati szereplők aktív megkeresése és ajánlások megfogalmazása feléjük. Afrikai, kínai, uniós és a tagállamokból érkező tisztviselők kerülnek meghívásra, hogy megfigyelőként részt vegyenek a szakértői munkacsoport munkájában és hozzájáruljanak ahhoz. |
1.1.2. Tevékenységek
A 1. szakasz összefüggésében említett feladatok végrehajtása során támogatandó tevékenységek a következőket foglalják magukba:
|
a) |
a projekt sikere és fenntarthatósága szempontjából elengedhetetlen, a kormányzatban, az üzleti szférában, a társadalmi szervezetekben, a felsőoktatási intézményekben, a multilaterális ügynökségekben aktív kulcsfontosságú partnerek és érdekelt felek, valamint a regionális és közösségi szintű szereplők bevonására irányuló megközelítés felvázolása és kidolgozása a Saferworld által; |
|
b) |
a 2012/121/KKBP határozat alapján támogatott uniós projekt eredményeire építve i. legfeljebb 20 előkészítő és utókövetési találkozó szervezése Afrikában, Kínában és Európában a projekt – ideértve annak felépítését és ütemezését is – ismertségének javítása és az érintett hatóságok támogatásának biztosítása céljából; ii. a szakértői munkacsoportban való részvételre felkérendő legfőbb afrikai, kínai és uniós szakértők azonosítása; iii. a szakértői munkacsoport létrehozására és működőképessé tételére vonatkozó részletes munkatervek kidolgozása; iv. projektkoordinációs csoport létrehozása; v. a feladatok kiosztása és pontos meghatározása a csoporton belül; valamint vi. a tevékenységek végrehajtása terén elért eredmények nyomon követése és értékelése; |
|
c) |
szakértői munkacsoport létrehozása a háromoldalú párbeszéd és együttműködés támogatása céljából. A szakértői munkacsoportba a tervek szerint meghívást kap majd kilenc, kézifegyverek ellenőrzésével foglalkozó afrikai, kínai és európai szakértő agytrösztökből, kutatóközpontokból és felsőoktatási intézményekből, akik a szakterületük, a szakértelmük és a projektben való részvétellel kapcsolatos lehetőségeik alapján kerülnek majd kiválasztásra; |
|
d) |
a szakértői munkacsoport honlapjának létrehozása, amely a szakértői munkacsoport által a nyilvánossággal való kapcsolattartásra szolgáló internetes platform szerepét tölti majd be; |
|
e) |
három szakértői munkacsoporti találkozó megszervezése (egy Afrikában, egy Kínában, egy pedig Európában) a szakértői munkacsoport tagjai, továbbá az Afrikából, Kínából, az Unióból és a tagállamokból érkező tisztviselők közötti párbeszéd és közös tanulás lehetővé tétele, illetve annak céljából, hogy iránymutatást nyújtson a tájékoztató és a kutatási tevékenységek végrehajtása során. |
1.1.3. Eredmények
A szakértői munkacsoport biztosítja majd az e határozat által ösztönzött párbeszéd folyamatának szilárd alapját. E párbeszéd kulcsfontosságú szerepet tölt be abban, hogy egybefogja a kézifegyverek ellenőrzésével foglalkozó afrikai, kínai és európai szakértőket, segít áthidalni a kutató- és a szakpolitikai közösségek között tátongó szakadékot és biztosítja, hogy a projekt eredményei ténylegesen eljussanak az afrikai, kínai és európai kormányokhoz és az Unió intézményeihez.
1.2. 2. szakasz: Az afrikai, kínai és az uniós érdekelt kormányzati feleknek a fegyverek és lőszerek illetéktelen kezekbe jutásának és jogellenes birtoklásának, kereskedelmének és használatának Afrikában való megelőzésébe és az ezek elleni küzdelembe való bevonása
1.2.1. Célkitűzések
|
a) |
A fegyverek és lőszerek illetéktelen kezekbe jutásának visszaszorítása az afrikai kontinensen, csökkentve ezáltal az emberi biztonságra jelentett fenyegetéseket, továbbá a békés és biztonságos környezet kialakításának elősegítése az afrikai polgárok számára, valamint a fejlődés előmozdítása. |
|
b) |
Támogatás nyújtása az afrikai államok részére az Afrikában a fegyverek 2020-ra való elhallgattatását szolgáló gyakorlati lépésekre vonatkozó afrikai uniós kiemelt ütemtervnek, valamint a regionális gazdasági közösségek releváns stratégiáinak a végrehajtásához. |
|
c) |
Szinergiák előmozdítása más releváns nemzetközi és regionális kezdeményezések végrehajtásával, beleértve a Fegyverkereskedelmi Szerződést, a kézi- és könnyűfegyverek elleni ENSZ cselekvési programot és az ENSZ tűzfegyverekről szóló jegyzőkönyvét. |
|
d) |
Koordináció és szinergiák kialakítása az Unió által támogatott releváns afrikai kezdeményezésekkel, beleértve a fegyverkivitel ellenőrzésére és a Fegyverkereskedelmi Szerződéshez kapcsolódó tájékoztatásra vonatkozó, a (KKBP) 2018/299 (1) és a (KKBP) 2018/101 tanácsi határozat (2) által támogatott projekteket, valamint a Conflict Armament Research Ltd. (CAR) iTrace elnevezésű, a (KKBP) 2017/2283 tanácsi határozat (3) által támogatott projektjét. |
|
e) |
Kapcsolódás a Kínában jelenleg zajló többéves jogi felülvizsgálati folyamathoz, amelynek eredményeképpen új kivitelellenőrzési törvény kerül elfogadásra. |
|
f) |
A kézifegyverek ellenőrzésére vonatkozó közösségi szintű munka támogatása az emberekkel helyi szinten történő kapcsolatfelvétel révén, valamint azáltal, hogy lehetőséget biztosítanak számukra nézeteik kifejtésére és megoldásokat javasolnak a tiltott fegyverek és lőszerek emberi életekre gyakorolt hatásának csökkentésére. |
|
g) |
Az afrikai, kínai és uniós szakértők által az Afrikában a fegyverek és lőszerek illetéktelen kezekbe jutásához és az azokkal való visszaéléshez társuló problémákról végzett közös kutatások és intézkedésorientált elemzések támogatása, ajánlásokat fogalmazva meg olyan konkrét intézkedésekre, amelyek segítenek kezelni és csökkenteni a tiltott fegyverek és lőszerek által jelentett veszélyeket. Többek között az alábbiak tartozhatnak ide: kiviteli ellenőrzés; a fegyverek és a lőszerek védett és biztonságos tárolása; a fegyverek és a lőszerek többletkészleteinek megsemmisítése; megjelölés, nyilvántartás és nyomon követés, többek között a tiltott fegyverek azonosításával és nyomon követésével foglalkozó ENSZ-missziókkal együttműködésben; a fegyverembargók ellenőrzése és érvényre juttatása; valamint operatív információk cseréje a fegyvercsempész-hálózatok felszámolása céljából. |
1.2.2. Tevékenységek
A 2. szakasz összefüggésében említett feladatok végrehajtása során támogatandó tevékenységek a következőket foglalják magukba:
|
a) |
két szeminárium (egy Afrikában és egy Kínában) „Az elszámoltathatóság és a felelősségvállalás előmozdítása a fegyverkereskedelem tekintetében, valamint a fegyverek és lőszerek illetéktelen és destabilizáló szereplők részére való eltérítésének megakadályozása Afrikában” témájában a szakértői munkacsoport égisze alatt, amelynek tagjai segítséget nyújtanak a Saferworld számára és részt vesznek a rendezvényeken is; |
|
b) |
tájékoztató készítése és terjesztése „A tiltott fegyverek és lőszerek elterjedése elleni küzdelem Afrikában: ajánlások a FOCAC számára” címmel a FOCAC keretében 2021-ben tartandó csúcstalálkozót megelőzően; |
|
c) |
angol és kínai nyelvű tájékoztató készítése és terjesztése „A tiltott fegyverek és lőszerek elterjedése Afrikában: mit tehetnek a beszállító államok az illetéktelen kezekbe jutás kockázatának csökkentése érdekében?” címmel; |
|
d) |
a szakértői munkacsoport által teendő három, egyenként tíznapos helyszíni tanulmányút három kiválasztott afrikai országban a tiltott fegyverek és lőszerek elterjedésével és ellenőrizetlen forgalmával kapcsolatos kérdések kezelése érdekében (ideértve az engedélyezett átadásoktól vagy birtoklásoktól való eltérítés folyamatának összetettségét, valamint az olyan problémás, határokon átnyúló jelenségeket, mint a marharablás, amelyeket segít a tiltott fegyverek és lőszerek elterjedése); |
|
e) |
három tanulmány készítése a szakértői munkacsoport által (angol, francia és kínai nyelven) a helyszínen tett megállapításairól, amely ajánlásokat is tartalmaz a tiltott fegyverekkel és lőszerekkel szembeni fellépéshez szükséges gyakorlati intézkedésekre vonatkozóan, különös hangsúlyt helyezve az afrikai, kínai és uniós fegyverbeszállítók által az eltérítés kockázatának csökkentésében játszott szerepre; |
|
f) |
mintegy 20, kétoldalú találkozó afrikai, kínai és tagállami tisztviselőkkel a szakértői munkacsoport ajánlásainak megosztása és hatékony kommunikálása, valamint a hivatalos szinten az együttműködésen alapuló projektek ismertségének és politikai támogatottságának fokozása érdekében; |
|
g) |
egy tanulmány-jelentés készítése (angol, francia és kínai nyelven) és terjesztése a tiltott fegyverek és lőszerek afrikai elterjedéséről, amely értékeli az aktuális intézkedések hatékonyságát és ajánlásokat tartalmaz olyan megvalósítható projektekre vonatkozóan, amelyek segítik a tiltott fegyverekkel szembeni fellépés javítását, és ezáltal csökkentik azok káros hatását, valamint hozzájárulnak a nemzeti, regionális és nemzetközi béke és biztonság javulásához. A jelentésben különös hangsúly fog helyeződni az afrikai, kínai és uniós fegyverbeszállítók által a fegyverek afrikai eltérítésével kapcsolatos kockázat csökkentésében játszott szerepre; |
|
h) |
egy zárószeminárium megrendezése Kínában a tanulmánykészítés és a párbeszéd folyamata során megfogalmazott ajánlások kommunikálása és azon előnyök demonstrálása érdekében, amelyeket az Afrika, Kína, az Unió és a tagállamok közötti együttműködés és a közös tevékenységekben való részvételük magában rejt, továbbá abból a célból, hogy kialakítsák a párbeszéd jövőbeli fenntartását szolgáló folyamatokat. |
1.2.3. Eredmények
|
— |
500 afrikai, kínai és uniós szakpolitikai-közösségi szereplő – köztük a hagyományos fegyverek kivitelének ellenőrzéséért felelős tisztviselők, tudósok, parlamenti képviselők, nem kormányzati szervezetek, az ipar képviselői és újságírók – körében a következők jobb ismertsége, ismerete és megértése: azon tényezők, amelyek hozzájárulnak a tiltott fegyverek és lőszerek széles körű rendelkezésre állásához Afrikában, a legfontosabb helyi kérdések és hatások, valamint a fegyvereket beszállító államok szerepe és felelőssége az illetéktelen kezekbe jutás kockázatának csökkentésében a fegyverátadás során. |
|
— |
A fegyverek és a lőszerek eltérítésének megakadályozásával és az ellene való küzdelemmel kapcsolatos párbeszéd, interakció és együttműködés javulása 60 afrikai, kínai, uniós és tagállami tisztviselő és társadalmi szereplő között, többek között az Afrika, Kína és az Unió közötti gyakorlati együttműködés azon területeinek azonosítása révén, amelyek segítik csökkenteni a fegyverek és lőszerek illetéktelen kezekbe jutását Afrikában. |
|
— |
A fegyverek és lőszerek illetéktelen és destabilizáló afrikai szereplőkhöz való eltérítése előfordulásának és az ilyen esetek számának a csökkenése. |
|
— |
Támogatás nyújtása az Afrikában a fegyverek 2020-ra való elhallgattatását szolgáló gyakorlati lépésekre vonatkozó afrikai uniós kiemelt ütemterv, valamint a kézi- és könnyűfegyverek elleni ENSZ cselekvési program végrehajtásához. |
|
— |
Az afrikai és kínai nemzeti normák és szabályozások nagyobb mértékű összehangoltsága olyan nemzetközi fegyverexport-ellenőrzési normákkal, mint a Fegyverkereskedelmi Szerződés, a fegyverekkel való kereskedés során az eltérítés kockázatának mérséklése érdekében. |
|
— |
A fegyverzetellenőrzés visszakerülése a FOCAC napirendjére az Afrika és Kína közötti, az Afrikában a fegyverek és lőszerek illetéktelen és destabilizáló szereplők részére való eltérítésének megakadályozásával kapcsolatos párbeszéd és együttműködés fokozásának alapvető kiindulópontjaként. |
|
— |
Az afrikai tiltott fegyverek és lőszerek problémájával kapcsolatos, tényeken alapuló elemzésgyűjtemény készítése, amely az afrikai, kínai és uniós szakértők közös helyszíni tapasztalatain alapul, és amely hozzá fog járulni a fegyverek illetéktelen és destabilizáló afrikai szereplőkhöz való eltérítésének jobb átfogó megértéséhez, valamint szilárdabb alapot képez Afrika, Kína és az Unió számára a probléma hatékony kezelése érdekében való együttműködéshez. |
|
— |
A tiltott fegyverek és lőszerek elterjedéséhez kapcsolódó fenyegetések kezelésére szolgáló gyakorlati eszközök azonosítása, valamint a kollektív és együttműködésen alapuló nemzetközi válaszintézkedések szükségessége, összhangban a főbb nemzetközi és regionális kötelezettségvállalásokkal és szakpolitikai kezdeményezésekkel, úgy mint: a kézi- és könnyűfegyverek elleni ENSZ cselekvési program, a nemzetközi nyomonkövetési egyezmény, a 2030-ig tartó időszakra vonatkozó fenntartható fejlődési menetrend, a Fegyverkereskedelmi Szerződés, az Afrikai Uniónak a kézi- és könnyűfegyverek tiltott elterjedésének, forgalmának és tiltott kereskedelmének visszaszorítására vonatkozó stratégiája, a 2020-ig tartó időszakra szóló EU–Kína stratégiai együttműködési menetrend, az EU Kínára vonatkozó stratégiája, továbbá a tiltott tűzfegyverek, kézi- és könnyűfegyverek, valamint az azokhoz szükséges lőszerek elleni uniós stratégia és a regionális gazdasági közösségek releváns stratégiái és cselekvési tervei. |
|
— |
Az afrikai nemzeti hatóságok és regionális szervezetek fokozott kapacitása a technikai segítségnyújtással kapcsolatos konkrét szükségletek azonosítására, valamint az e szükségletek teljesítéséhez szükséges erőforrások biztosítása céljából Kínával és az EU-val folytatott párbeszédükhöz megfelelő platformok azonosítása. |
2. A szemináriumok/munkaértekezletek és a nyitó- és záró rendezvények résztvevői és helyszínei
Kivéve ha e melléklet szövegében az másként szerepel, a Saferworld javaslatot fog tenni a szemináriumok és a projekt keretében előirányzott egyéb rendezvények lehetséges résztvevőire és helyszíneire, amelyeket a főképviselő a Tanács illetékes szerveivel egyeztetve hagy jóvá.
3. Nemi dimenzió
A Saferworld általánosan érvényesíteni fogja a nemi dimenziót az e projekt végrehajtásával kapcsolatos stratégiákban és tevékenységekben, hogy a nők és a férfiak egyenlő mértékben befolyásolhassák a projektet, vehessenek részt abban és részesülhessenek annak eredményeiből. A Saferworld a lehetséges mértékben ösztönözni fogja a projektben részt vevő partnereket arra, hogy nemi szempontból vegyes összetételű küldöttségekre tegyenek javaslatot a projekttel kapcsolatos tevékenységekben való részvételre, és annak biztosítására, hogy a tiltott fegyverek és lőszerek nemekre gyakorolt hatásával minden szeminárium és tanulmányút keretében foglalkozzanak.
4. Partnerek
A tervek szerint a projektben részt vevő fő partnerek a kínai fegyverellenőrzési és leszerelési társaság és a biztonsági kutatási és információs központ (Kenya) lesz.
5. Irányítóbizottság
E projekt irányítóbizottságát a főképviselő, a Bizottság és a Saferworld képviselői fogják alkotni. Az irányítóbizottság hathavonta át fogja tekinteni e határozat végrehajtását, többek között elektronikus távközlési eszközök használatával.
6. Jelentéstétel
A Saferworld hathavonta leíró jelentéseket fog készíteni a projekt várt eredményeinek elérése terén tett előrelépés áttekintése céljából. A Saferworld ezenkívül évente leíró és pénzügyi jelentést fog benyújtani, valamint egy záró jelentést a végrehajtási időszak végétől számított 6 hónapon belül.
7. Az Unió láthatósága és a segítségnyújtási eszközök rendelkezésre állása
A projekttel összefüggésben készített anyagoknak és a projekttel kapcsolatos honlapnak biztosítania kell az Unió láthatóságát, különösen a logó és az Unió külső tevékenységeire vonatkozó kommunikációs és láthatósági kézikönyvben foglalt grafikai táblázat alapján. Az Unió küldöttségeit be kell vonni a harmadik országokban tartott rendezvényekbe a politikai nyomonkövetés és a láthatóság fokozása érdekében.
(1) A Tanács (KKBP) 2018/299 határozata (2018. február 26.) a tömegpusztító fegyverek elterjedése elleni EU-stratégia végrehajtását támogató, nonproliferációval és leszereléssel foglalkozó független szellemi műhelyek európai hálózatának a támogatásáról (HL L 56., 2018.2.28., 46. o.).
(2) A Tanács (KKBP) 2018/101 határozata (2018. január 22.) a fegyverkivitel hatékony ellenőrzésének előmozdításáról (HL L 17., 2018.1.23., 40. o.).
(3) A Tanács (KKBP) 2017/2283 határozata (2017. december 11.) a tiltott kézi- és könnyűfegyverekre, más tiltott hagyományos fegyverekre és mindezek lőszereire vonatkozó, az ilyen fegyverek és lőszerek tiltott kereskedelme kockázatának csökkentését célzó globális jelentési rendszer támogatásáról („iTrace III”) (HL L 328., 2017.12.12., 20. o.).
|
2.8.2019 |
HU |
Az Európai Unió Hivatalos Lapja |
L 204/44 |
A TANÁCS (KKBP) 2019/1299 VÉGREHAJTÁSI HATÁROZATA
(2019. július 31.)
a líbiai helyzetre tekintettel hozott korlátozó intézkedésekről szóló (KKBP) 2015/1333 határozat végrehajtásáról
AZ EURÓPAI UNIÓ TANÁCSA,
tekintettel az Európai Unióról szóló szerződésre és különösen annak 31. cikke (2) bekezdésére,
tekintettel a líbiai helyzetre tekintettel hozott korlátozó intézkedésekről és a 2011/137/KKBP határozat hatályon kívül helyezéséről szóló, 2015. július 31-i (KKBP) 2015/1333 tanácsi határozatra (1) és különösen annak 12. cikke (2) bekezdésére,
tekintettel az Unió külügyi és biztonságpolitikai főképviselőjének javaslatára,
mivel:
|
(1) |
A Tanács 2015. július 31-én elfogadta a (KKBP) 2015/1333 határozatot. |
|
(2) |
A Tanács a (KKBP) 2015/1333 határozat 17. cikke (2) bekezdésének megfelelően felülvizsgálta a jegyzékbe vett személyeknek és szervezeteknek az említett határozat II. és IV. mellékletében foglalt jegyzékét. |
|
(3) |
Törölni kell egy személyre vonatkozó bejegyzést a (KKBP) 2015/1333 határozat II. mellékletéből és törölni kell két személyre vonatkozó bejegyzést az említett határozat IV. mellékletéből. |
|
(4) |
A (KKBP) 2015/1333 határozatot ennek megfelelően módosítani kell, |
ELFOGADTA EZT A HATÁROZATOT:
1. cikk
A (KKBP) 2015/1333 határozat II. és IV. melléklete az e határozat mellékletének megfelelően módosul.
2. cikk
Ez a határozat az Európai Unió Hivatalos Lapjában való kihirdetésének napját követő napon lép hatályba.
Kelt Brüsszelben, 2019. július 31-én.
a Tanács részéről
az elnök
T. TUPPURAINEN
MELLÉKLET
A (KKBP) 2015/1333 határozat a következőképpen módosul:
|
1. |
A II. mellékletben („A 8. cikk (2) bekezdésében említett személyek és szervezetek jegyzéke”) az 1. (ABDUSSALAM, Abdussalam Mohammedre vonatkozó) bejegyzést törölni kell az A. (Személyek) részben szereplő jegyzékből. |
|
2. |
A IV. mellékletben („A 9. cikk (2) bekezdésében említett személyek és szervezetek jegyzéke”) az 1. (ABDUSSALAM, Abdussalam Mohammedre vonatkozó) és a 14. (AL-BAGHDADI, Dr Abdulqader Mohammedre vonatkozó) bejegyzést törölni kell az A. (Személyek) részben szereplő jegyzékből. |
|
2.8.2019 |
HU |
Az Európai Unió Hivatalos Lapja |
L 204/46 |
A BIZOTTSÁG (EU) 2019/1300 VÉGREHAJTÁSI HATÁROZATA
(2019. július 26.)
egy géntechnológiával módosított szegfű (Dianthus caryophyllus L., FLO-40685-2 vonal) forgalomba hozataláról
(az értesítés a C(2019) 5496. számú dokumentummal történt)
(Csak a holland nyelvű szöveg hiteles)
(EGT-vonatkozású szöveg)
AZ EURÓPAI BIZOTTSÁG,
tekintettel az Európai Unió működéséről szóló szerződésre,
tekintettel a géntechnológiával módosított szervezetek környezetbe történő szándékos kibocsátásáról és a 90/220/EGK tanácsi irányelv hatályon kívül helyezéséről szóló, 2001. március 12-i 2001/18/EK európai parlamenti és tanácsi irányelvre (1) és különösen annak 18. cikke (1) bekezdésének első albekezdésére,
az Európai Élelmiszerbiztonsági Hatósággal folytatott konzultációt követően,
mivel:
|
(1) |
A 2001/18/EK irányelv értelmében a géntechnológiával módosított szervezetet vagy géntechnológiával módosított szervezetek kombinációját tartalmazó vagy ezekből álló termék forgalomba hozatalához azon tagállam illetékes hatóságának írásbeli jóváhagyása szükséges, ahol az érintett termék forgalomba hozatalát bejelentették. |
|
(2) |
2013 októberében a Suntory Holdings Limited (Oszaka, Japán) géntechnológiával módosított szegfű (Dianthus caryophyllus L., FLO-40685-2 vonal) forgalomba hozatalával kapcsolatos bejelentést juttatott el Hollandia illetékes hatóságához. |
|
(3) |
E bejelentés a Dianthus caryophyllus L., FLO-40685-2 vonalú, géntechnológiával módosított szegfű vágott virágainak behozatalára, forgalmazására és kiskereskedelmi értékesítésére vonatkozott. |
|
(4) |
A 2001/18/EK irányelv 14. cikkének megfelelően Hollandia illetékes hatósága vizsgálati jelentést készített, amely megállapította, hogy nem merült fel olyan indok, amely alapján a Dianthus caryophyllus L., FLO-40685-2 vonalú, géntechnológiával módosított szegfű díszítésre szánt, vágott virágainak forgalomba hozatalát meg kellene tagadni, ha bizonyos különleges feltételek teljesülnek. |
|
(5) |
Az értékelő jelentést benyújtották a Bizottsághoz és a többi tagállam illetékes hatóságaihoz, amelyek közül néhányan kifogást nyújtottak be a termék forgalomba hozatalával kapcsolatban. Egy tagállam fenntartotta kifogásait. |
|
(6) |
2016. március 10-i véleményében az Európai Élelmiszerbiztonsági Hatóság (a továbbiakban: Hatóság) arra a következtetésre jutott, hogy nincs olyan tudományos ok, amely alapján feltételezni lehetne, hogy a FLO-40685-2 vonalú szegfű díszítésre szánt, vágott virágainak behozatala, forgalmazása és kiskereskedelmi értékesítése az Unióban káros hatással lenne az emberi egészségre vagy a környezetre. (2) A Hatóság állásfoglalása szerint az engedély birtokosa által benyújtott felügyeleti terv a géntechnológiával módosított, FLO-40685-2 vonalú szegfű tervezett felhasználása mellett kielégítő. |
|
(7) |
A Hatóság által készített, a bejelentés egészét figyelembe vevő véleménynek, a Hollandia illetékes hatósága által készített értékelő jelentésnek, a tagállamok kifogásainak, valamint a bejelentő által a tagállami kifogásokra adandó válasz céljából megadott kiegészítő információknak a vizsgálata alapján nincs ok annak feltételezésére, hogy a Dianthus caryophyllus L., FLO-40685-2 vonalú, géntechnológiával módosított szegfű vágott virágainak forgalomba hozatala a tervezett díszítő jellegű felhasználás mellett káros hatással lenne az emberi egészségre vagy a környezetre. |
|
(8) |
Az 1830/2003/EK európai parlamenti és tanácsi rendelet (3), valamint a 65/2004/EK bizottsági rendelet (4) alkalmazásában a Dianthus caryophyllus L., FLO-40685-2 vonalú, géntechnológiával módosított szegfűhöz egyedi azonosítót kell rendelni. |
|
(9) |
A Hatóság véleménye szerint nem szükséges különleges feltételeket megállapítani a termék tervezett felhasználása kapcsán a kezelés és csomagolás, valamint konkrét ökoszisztémák, környezetek és földrajzi területek védelme tekintetében. |
|
(10) |
A termék címkéjén azonban fel kell tüntetni, hogy a Dianthus caryophyllus L., FLO-40685-2 vonalú, géntechnológiával módosított szegfű vágott virágai nem használhatók emberi fogyasztásra, állatok takarmányozására vagy termesztésre. |
|
(11) |
Az uniós referencialaboratórium 2016 decemberében megvizsgálta és tesztelte a Dianthus caryophyllus L., FLO-40685-2 vonalú, géntechnológiával módosított szegfűre vonatkozó – a 2001/18/EK irányelv III.B. melléklete D. részének 12. pontjában előírt – kimutatási módszert. |
|
(12) |
A 2001/18/EK irányelv 30. cikkének (1) bekezdése értelmében létrehozott bizottság nem nyilvánított véleményt az elnöke által kitűzött határidőn belül. Mivel végrehajtási jogi aktus elfogadására volt szükség, az elnök a végrehajtási aktus tervezetét további megvitatás céljából a fellebbviteli bizottság elé terjesztette. A fellebbviteli bizottság nem nyilvánított véleményt, |
ELFOGADTA EZT A HATÁROZATOT:
1. cikk
Hozzájárulás
(1) Hollandia illetékes hatósága írásbeli jóváhagyását adja a 2. cikkben meghatározott Dianthus caryophyllus L., FLO-40685-2 vonalú, géntechnológiával módosított szegfű forgalomba hozatalához, amelynek tekintetében a Suntory Holdings Limited (Oszaka, Japán) nyújtott be értesítést (hiv. sz.: C/NL/13/02).
(2) Az írásbeli jóváhagyásban egyértelműen meg kell jelölni a 3. és a 4. cikkben foglalt feltételeket, valamint a 2. cikk (3) bekezdésében szereplő egyedi azonosítót.
(3) A jóváhagyás kizárólag a Dianthus caryophyllus L., FLO-40685-2 vonalú, géntechnológiával módosított szegfű vágott virágainak termékként történő forgalomba hozatalára vonatkozik.
(4) A jóváhagyás a Dianthus caryophyllus L., FLO-40685-2 vonalú, géntechnológiával módosított szegfű vegetatív szaporodásból származó szaporulatára is vonatkozik.
(5) A jóváhagyás érvényességének időtartama a kiállításának napjától számított 10 év.
2. cikk
A termék
(1) A termékként forgalomba hozandó, géntechnológiával módosított szervezet a Dianthus caryophyllus L. színében módosított szegfű vágott virága, amelyet a Dianthus caryophyllus L. sejtkultúra-vonalából az Agrobacterium tumefaciens AGL0 törzsének felhasználásával, a pCGP1991 vektorral való transzformáció során állítottak elő, az FLO-40685-2 vonalat eredményezve.
A géntechnológiával módosított szegfű a következő DNS-t tartalmazza három kazettában:
|
a) |
1. kazetta A dihidro-flavonol-4-reduktázt (DFR) kódoló petúnia dfr gén, amely az antocianin bioszintézisének egyik kulcsenzime, és amely saját promóterét és terminátorát is tartalmazza. |
|
b) |
2. kazetta Az oroszlánszáj (tátika) kalkon-szintázt kódoló génjének promóter szakasza, az antocianin bioszintézisének egyik kulcsenzimét, az F3′5′H-t kódoló Viola hortensis cDNS-éből származó flavonoid 3′5′-hidroxiláz (f3′5′h), és a petúnia vélelmezetten foszfolipid-transzferfehérjét kódoló D8 génjének terminátora. Ezt a két kazettát a kívánt virágszín elérése érdekében építették be a növény genomjába. |
|
c) |
3. kazetta A karfiol-mozaikvírus 35S promótere, a klorofill a/b kötőfehérjét kódoló petúniagén 5′ át nem írt szakasza, a SuRB (als) gén, amely a Nicotiana tabacumból származó acetolaktát-szintáznak (ALS) a szulfonil-karbamiddal szembeni ellenálló képességet biztosító mutánsát kódolja, és saját terminátorát is tartalmazza. Ezt a tulajdonságot markerként használták a transzformánsok kiválasztásához. |
(2) A géntechnológiával módosított szegfű a következő négy helyen tartalmazza a beépített szekvenciát vagy annak egy részét:
|
— |
1. hely: a T-DNS egy példánya, amely tartalmazza a három kazettát, valamint a T-DNS részleges példánya, amely kizárólag az f3′5′h kazettát és a T-DNS jobb oldali határszekvenciáját tartalmazza. A két T-DNS példányt egy, a szegfűt jellemző genomikus DNS-régió választja el egymástól, |
|
— |
2. hely: egy, a D8 terminátort és a T-DNS jobb oldali határszekvenciáját tartalmazó beépített szekvencia, |
|
— |
3. hely: az f3′5′h kazetta egy teljes és egy részleges példánya, amelyek közül mindkettő tartalmazza a D8 terminátor szekvenciákat és a T-DNS jobb oldali határszekvenciáit (farok-farok orientációban), |
|
— |
4. hely: az als kazetta részleges példánya és a T-DNS bal oldali határszekvenciája. |
(3) A géntechnológiával módosított szegfű egyedi azonosítója FLO-4Ø685-2.
3. cikk
A forgalomba hozatal feltételei
A Dianthus caryophyllus L., FLO-40685-2 vonalú, géntechnológiával módosított szegfű a következő feltételekkel hozható forgalomba:
|
a) |
a géntechnológiával módosított szegfű csak díszítésre használható; |
|
b) |
a géntechnológiával módosított szegfű termesztése tilos; |
|
c) |
a 2001/18/EK irányelv 25. cikkében foglalt titoktartási követelmények sérelme nélkül a géntechnológiával módosított szegfű kimutatására és azonosítására szolgáló módszereket – ideértve a módszer specifikusságát igazoló, az uniós referencialaboratórium által hitelesített kísérleti adatokat is – nyilvánosságra kell hozni a http://gmo-crl.jrc.ec.europa.eu/valid-2001-18.htm címen; |
|
d) |
a 2001/18/EK irányelv 25. cikkében foglalt titoktartási követelmények sérelme nélkül a jóváhagyás birtokosa kérésre köteles a termék vagy annak genetikai anyaga pozitív és negatív ellenőrző mintáit vagy a referenciaanyagokat az illetékes hatóságok és a tagállamok felügyeleti szervei, illetve az uniós ellenőrző laboratóriumok rendelkezésére bocsátani; |
|
e) |
a címkén vagy nem előrecsomagolt termékek esetében a géntechnológiával módosított szegfűt kísérő dokumentumon fel kell tüntetni a következő figyelmeztetések egyikét: „Ez a termék géntechnológiával módosított szervezet.” vagy „Ez a termék géntechnológiával módosított szegfű.”, valamint a következőt: „Emberi és állati fogyasztásra nem alkalmas, termeszteni tilos.” |
4. cikk
Felügyelet
(1) A jóváhagyás birtokosa a jóváhagyás teljes érvényességi időtartama alatt gondoskodik a bejelentésben szereplő, általános figyelemmel kísérési tervből álló felügyeleti terv felállításáról és végrehajtásáról annak érdekében, hogy nyomon kövesse a Dianthus caryophyllus L., FLO-40685-2 vonalú, géntechnológiával módosított szegfű kezeléséből vagy felhasználásából eredően az emberi egészségre vagy a környezetre gyakorolt esetleges kedvezőtlen hatásokat.
A nyomonkövetési terv a következő címen érhető el: [link: az interneten közzétett terv].
(2) A jóváhagyás birtokosa közvetlenül tájékoztatja a gazdasági szereplőket és a felhasználókat a géntechnológiával módosított szegfű biztonságosságáról és általános jellemzőiről, valamint a felügyelet feltételeiről, beleértve a véletlenszerű szaporítás esetén alkalmazandó megfelelő kezelési intézkedéseket.
(3) A jóváhagyás birtokosa éves jelentéseket nyújt be a Bizottsághoz és a tagállamok illetékes hatóságaihoz a felügyeleti tevékenységek eredményeiről.
(4) A jóváhagyás birtokosa mindenkor képes bizonyítani a Bizottság és a tagállamok illetékes hatóságai számára, hogy:
|
a) |
a meglévő felügyeleti hálózatok – ideértve a nemzeti botanikai megfigyelőhálózatokat és növényvédelmi szolgálatokat is – a bejelentésben szereplő felügyeleti tervnek megfelelően összegyűjtik a géntechnológiával módosított szegfű nyomon követéséhez szükséges információkat; és |
|
b) |
az a) pontban említett meglévő felügyeleti hálózatok beleegyeztek abba, hogy ezeket az információkat a jóváhagyás birtokosának rendelkezésére bocsátják a Bizottsághoz és a tagállamok illetékes hatóságaihoz a (3) bekezdéssel összhangban benyújtandó felügyeleti jelentés beadási időpontja előtt. |
5. cikk
Címzett
Ennek a határozatnak a Holland Királyság a címzettje.
Kelt Brüsszelben, 2019. július 26-án.
a Bizottság részéről
Vytenis ANDRIUKAITIS
a Bizottság tagja
(1) HL L 106., 2001.4.17., 1. o.
(2) Az EFSA GMO-testülete (az EFSA géntechnológiával módosított szervezetekkel foglalkozó tudományos testülete), 2016. Scientific Opinion on a Part C notification (reference C/NL/13/02) from Suntory Holdings Limited for the import, distribution and retailing of carnation FLO-40685-2 cut flowers with modified petal colour for ornamental use. (Tudományos szakvélemény a Suntory Holdings Limited által a szirom színét illetően módosított, FLO-40685-2 vonalú szegfű vágott virágának díszítő jellegű felhasználása céljából történő behozatalára, terjesztésére és kiskereskedelmi értékesítésére irányuló, C. rész szerinti értesítésről (h. sz. C/NL/13/02)). EFSA Journal 2016;14(4):4431, 18 oldal, doi: 10.2903/j.efsa.2016.4431.
(3) Az Európai Parlament és a Tanács 1830/2003/EK rendelete (2003. szeptember 22.) a géntechnológiával módosított szervezetek nyomonkövethetőségéről és címkézéséről, és a géntechnológiával módosított szervezetekből előállított élelmiszer- és takarmánytermékek nyomonkövethetőségéről, valamint a 2001/18/EK irányelv módosításáról (HL L 268., 2003.10.18., 24. o.).
(4) A Bizottság 65/2004/EK rendelete (2004. január 14.) a géntechnológiával módosított szervezetek egyedi azonosítóinak kialakítására és hozzárendelésére szolgáló rendszer létrehozásáról (HL L 10., 2004.1.16., 5. o.).
|
2.8.2019 |
HU |
Az Európai Unió Hivatalos Lapja |
L 204/50 |
A BIZOTTSÁG (EU) 2019/1301 VÉGREHAJTÁSI HATÁROZATA
(2019. július 26.)
a 2013/327/EU végrehajtási határozatnak a géntechnológiával módosított Ms8, Rf3 és Ms8 × Rf3 olajrepcét tartalmazó vagy abból álló takarmányok forgalomba hozatalára az 1829/2003/EK európai parlamenti és tanácsi rendelet szerint megadott engedély megújítása tekintetében történő módosításáról
(az értesítés a C(2019) 5499. számú dokumentummal történt)
(Csak a német nyelvű szöveg hiteles)
(EGT-vonatkozású szöveg)
AZ EURÓPAI BIZOTTSÁG,
tekintettel az Európai Unió működéséről szóló szerződésre,
tekintettel a géntechnológiával módosított élelmiszerekről és takarmányokról szóló, 2003. szeptember 22-i 1829/2003/EK európai parlamenti és tanácsi rendeletre (1) és különösen annak 11. cikke (3) bekezdésére és 23. cikke (3) bekezdésére,
mivel:
|
(1) |
A 2013/327/EU bizottsági végrehajtási határozat (2) engedélyezte a géntechnológiával módosított Ms8, Rf3 és Ms8 × Rf3 olajrepcét tartalmazó vagy abból álló élelmiszerek és az említett, géntechnológiával módosított olajrepcékből előállított élelmiszerek és takarmányok forgalomba hozatalát. |
|
(2) |
Korábban a 2007/232/EK bizottsági határozat (3) engedélyezte a géntechnológiával módosított Ms8, Rf3 és Ms8 × Rf3 olajrepcét tartalmazó vagy azokból álló takarmányok forgalomba hozatalát. Az engedély hatálya az Ms8, Rf3 és Ms8 × Rf3 olajrepcét tartalmazó vagy azokból álló, az élelmiszerektől és a takarmányoktól eltérő termékekhez való felhasználásra is kiterjedt, a termesztés kivételével. |
|
(3) |
2016. május 20-án a Bayer CropScience AG az 1829/2003/EK rendelet 11. és 23. cikkének megfelelően kérelmet nyújtott be a Bizottsághoz a 2007/232/EK határozat hatálya alá tartozó termékek forgalomba hozatalára vonatkozó engedély megújítása iránt. |
|
(4) |
2017. november 28-án az Európai Élelmiszerbiztonsági Hatóság (a továbbiakban: Hatóság) az 1829/2003/EK rendelet (4) 6. és 18. cikkével összhangban kedvező véleményt adott ki. Ebben az EFSA arra a következtetésre jutott, hogy a megújítás iránti kérelem nem vet fel olyan, új veszélyekre, az expozíció módosulására vagy tudományos bizonytalanságra vonatkozó bizonyítékokat, amelyek megváltoztatnák a Hatóság által az Ms8, Rf3 és Ms8 × Rf3 olajrepcére vonatkozóan 2005-ben elfogadott eredeti kockázatértékelés (5) következtetéseit. |
|
(5) |
Véleményében a Hatóság figyelembe vette az illetékes nemzeti hatóságokkal az 1829/2003/EK rendelet 6. cikkének (4) bekezdésében és 18. cikkének (4) bekezdésében előírtak szerint folytatott konzultáció keretében a tagállamok által felvetett összes konkrét kérdést és aggályt. |
|
(6) |
A Hatóság továbbá arra a következtetésre jutott, hogy a kérelmező által benyújtott, általános megfigyelési tervből álló, a környezeti hatásokra vonatkozó felügyeleti terv összhangban áll a termékek tervezett felhasználásával. |
|
(7) |
E megfontolásokat figyelembe véve a 2007/232/EK határozat hatálya alá tartozó termékek forgalomba hozatalára vonatkozó engedélyt meg kell újítani. |
|
(8) |
2017. november 30-án a kérelmező Bayer CropScience felkérte a Bizottságot, hogy az Ms8, Rf3 és Ms8 × Rf3 olajrepcének a megújítási kérelem hatálya alá tartozó felhasználásait és az említett olajrepcéknek a 2013/327/EU végrehajtási határozat hatálya alá tartozó felhasználásait egyetlen engedélyben egyesítse. A Bizottság 2017. december 5-én kelt levelében tájékoztatta a kérelmezőt, hogy az egyesítés a 2013/327/EU végrehajtási határozat hatályának a 2016. május 20-i megújítási kérelemben érintett termékekre történő kiterjesztésével lép hatályba. A kérelmezőt ezért tájékoztatták, hogy az egyesítés következtében a megújítási kérelem tárgyát képező termékekre a 2013/327/EU végrehajtási határozatban előírt engedélyezési feltételek vonatkoznak. |
|
(9) |
A Bizottság úgy véli, hogy a kérelmező kérése az egyszerűsítés érdekében indokolt. Ezért a 2013/327/EU végrehajtási határozatot módosítani kell oly módon, hogy hatálya kiterjedjen a jelenleg a 2007/232/EK határozat hatálya alá tartozó termékekre is. |
|
(10) |
A Bayer CropScience AG 2018. augusztus 1-jén kelt levelében kérelmezte a Bizottságtól az összes engedéllyel kapcsolatos jogainak és kötelezettségeinek a BASF Agricultural Solutions Sean US LLC-re való átruházását. A BASF SE 2018. augusztus 6-án kelt levelében a BASF Agricultural Solutions Seed US LLC nevében megerősítette az említett átruházásba való beleegyezését. Ez az átruházás a 2007/232/EK és a 2013/327/EU végrehajtási határozatokat érinti. |
|
(11) |
A 65/2004/EK bizottsági rendeletnek (6) megfelelően az Ms8, Rf3 és Ms8 × Rf3 olajrepcéhez egyedi azonosítót rendeltek. Továbbra is ezt az egyedi azonosítót kell használni. |
|
(12) |
A Hatóság által kiadott vélemény alapján úgy tűnik, hogy az e határozat hatálya alá tartozó termékekre vonatkozóan nincs szükség különleges címkézési előírásokra azokon kívül, amelyeket az 1829/2003/EK rendelet 13. cikkének (1) bekezdése és 25. cikkének (2) bekezdése, valamint az 1830/2003/EK európai parlamenti és tanácsi rendelet (7) 4. cikkének (6) bekezdése meghatároz. Annak biztosítására azonban, hogy a termékeket az e határozatban előírt engedélynek megfelelően használják fel, a géntechnológiával módosított Ms8, Rf3 és Ms8 × Rf3 olajrepcét tartalmazó vagy abból álló termékek címkézésének – az élelmiszereken kívül – egyértelműen utalnia kell arra, hogy a szóban forgó termékeket nem szabad termesztésre használni. |
|
(13) |
A 2013/327/EU végrehajtási határozat által meghatározott, a környezeti hatások megfigyelésére vonatkozó felügyeleti tervet nem kell módosítani, mivel lényegében megegyezik azzal, amelyet a Hatóság a megújítási kérelem keretében értékelt. |
|
(14) |
A termékek engedélyezésével kapcsolatos minden releváns információt be kell jegyezni a géntechnológiával módosított élelmiszerek és takarmányok 1829/2003/EK rendelet 28. cikkének (1) bekezdése szerinti közösségi nyilvántartásába. |
|
(15) |
A 2007/232/EK határozatot hatályon kívül kell helyezni. |
|
(16) |
E határozatról a Biológiai Biztonság Kérdéseiben illetékes Információs Központon keresztül értesíteni kell a Biológiai Sokféleség Egyezmény Biológiai Biztonságról szóló Cartagena Jegyzőkönyvének részes feleit, az 1946/2003/EK európai parlamenti és tanácsi rendelet (8) 9. cikkének (1) bekezdése és 15. cikke (2) bekezdésének c) pontja szerint. |
|
(17) |
A Növények, Állatok, Élelmiszerek és Takarmányok Állandó Bizottsága nem nyilvánított véleményt az elnöke által kitűzött határidőn belül. Mivel e végrehajtási jogi aktus elfogadását szükségesnek ítélték, az elnök azt további megvitatás céljából a fellebbviteli bizottság elé terjesztette. A fellebbviteli bizottság nem nyilvánított véleményt, |
ELFOGADTA EZT A HATÁROZATOT:
1. cikk
Módosítások
(1) A 2013/327/EU végrehajtási határozat a következőképpen módosul:
|
1. |
A cím helyébe a következő szöveg lép: „A Bizottság 2013/327/EU végrehajtási határozata (2013. június 25.) a géntechnológiával módosított Ms8, Rf3 és Ms8 × Rf3 olajrepcét tartalmazó, abból álló vagy abból előállított élelmiszerek és takarmányok forgalomba hozatalának az 1829/2003/EK európai parlamenti és tanácsi rendelet szerint történő engedélyezéséről” |
|
2. |
A 2. cikk helyébe a következő szöveg lép: „2. cikk Engedélyezés Az 1829/2003/EK rendelet 4. cikke (2) bekezdésének és 16. cikke (2) bekezdésének alkalmazásában a Bizottság az e határozatban megállapított feltételeknek megfelelően engedélyezi a következő termékeket:
|
|
3. |
A 3. cikk az alábbi új második bekezdéssel egészül ki: „Az élelmiszerek és élelmiszer-összetevők kivételével az 2. cikkben felsorolt, géntechnológiával módosított olajrepcét tartalmazó vagy azokból álló termékek címkéjén, valamint az ilyen termékeket kísérő dokumentumokon fel kell tüntetni a »nem termesztésre« feliratot.” |
|
4. |
A rendelet a következő új 3 a. cikkel egészül ki: „3 a. cikk A kimutatás módszere Az ACS-BNØØ5-8, ACS-BNØØ3-6 és ACS-BNØØ5-8 × ACS-BNØØ3-6 olajrepce kimutatására a melléklet d) pontjában meghatározott módszert kell alkalmazni.” |
|
5. |
A 6. cikk helyébe a következő szöveg lép: „6. cikk Az engedély jogosultja Az engedély jogosultja a BASF SE, (Németország) által képviselt BASF Agricultural Solutions Seed US LLC (Egyesült Államok).” |
|
6. |
A 8. cikk helyébe a következő szöveg lép: „8. cikk Címzett E határozat címzettje: BASF SE, Carl-Bosch-Str. 38, D-67063 Ludwigshafen, Németország” |
(2) A 2013/327/EU végrehajtási határozat melléklete a következőképpen módosul:
|
1. |
Az a) pont helyébe a következő szöveg lép: „a) A kérelmező és az engedély jogosultja
Képviselő: BASF SE, Carl-Bosch-Str. 38, D-67063 Ludwigshafen, Németország.” |
|
2. |
A b) pont helyébe a következő szöveg lép: „b) A termékek megnevezése és meghatározása
|
|
3. |
A c) pont az alábbi új második bekezdéssel egészül ki: „Az élelmiszerek és élelmiszer-összetevők kivételével a b) pontban felsorolt, géntechnológiával módosított olajrepcét tartalmazó vagy azokból álló termékek címkéjén, valamint az ilyen termékeket kísérő dokumentumokon fel kell tüntetni a »nem termesztésre« feliratot.” |
2. cikk
Hatályon kívül helyezés
A 2007/232/EK határozat hatályát veszti.
3. cikk
Címzett
E határozat címzettje: BASF SE, Carl-Bosch-Str. 38, D-67063 Ludwigshafen, Németország.
Kelt Brüsszelben, 2019. július 26-án.
a Bizottság részéről
Vytenis ANDRIUKAITIS
a Bizottság tagja
(1) HL L 268., 2003.10.18., 1. o.
(2) A Bizottság 2013/327/EU végrehajtási határozata (2013. június 25.) a géntechnológiával módosított Ms8, Rf3 és Ms8 × Rf3 olajrepcét tartalmazó vagy abból álló élelmiszerek, vagy az ezekből a géntechnológiával módosított szervezetekből előállított élelmiszerek és takarmányok forgalomba hozatalának az 1829/2003/EK európai parlamenti és tanácsi rendelet szerinti engedélyezéséről (HL L 175., 2013.6.27., 57. o.).
(3) A Bizottság 2007/232/EK határozata (2007. március 26.) a glufozinát-ammónium gyomirtó szerrel szembeni tűrőképességre géntechnológiával módosított olajrepce (Brassica napus L., Ms8, Rf3 és Ms8 × Rf3 vonal) termékeknek a 2001/18/EK európai parlamenti és tanácsi irányelvvel összhangban történő forgalomba hozataláról (HL L 100., 2007.4.17., 20. o.).
(4) Az EFSA GMO-testülete, 2017. Scientific opinion on the assessment of genetically modified oilseed rape MS8, RF3 and MS8 × RF3 for renewal of authorisation under regulation (EC) No 1829/2003 (application EFSA-GMO-RX-004). (Tudományos szakvélemény a géntechnológiával módosított MS8, RF3 és MS8 × RF3 olajrepcének a rá vonatkozó engedély 1829/2003/EK rendelet szerinti megújítása céljából elvégzett értékeléséről; kérelem: EFSA-GMO-RX-004). EFSA Journal 2017;15(11):5067.
(5) EFSA, 2005. Opinion of the Scientific Panel on Genetically Modified Organisms on a request from the Commission related to the application (Reference C/BE/96/01) for the placing on the market of glufosinate-tolerant hybrid oilseed rape Ms8 × Rf3, derived from genetically modified parental lines (Ms8, Rf3), for import and processing for feed and industrial uses, under Part C of Directive 2001/18/EC from Bayer CropScience. (A géntechnológiával módosított szervezetekkel foglalkozó tudományos testület Bizottság kérésére készített szakvéleménye a Bayer CropScience által a 2001/18/EK irányelv C. része alapján benyújtott, a genetikailag módosított szülői vonalakból ([Ms8 × Rf3] származó, glufozináttal szemben ellenálló Ms8 × Rf3 hibrid olajrepce behozatala és ipari felhasználása céljából történő forgalomba hozatalára vonatkozó kérelemről; hivatkozás: C/BE/96/01). EFSA Journal 2005; 3(10):281, p. 23.
(6) A Bizottság 65/2004/EK rendelete (2004. január 14.) a géntechnológiával módosított szervezetek egyedi azonosítóinak kialakítására és hozzárendelésére szolgáló rendszer létrehozásáról (HL L 10., 2004.1.16., 5. o.).
(7) Az Európai Parlament és a Tanács 1830/2003/EK rendelete (2003. szeptember 22.) a géntechnológiával módosított szervezetek nyomonkövethetőségéről és címkézéséről, és a géntechnológiával módosított szervezetekből előállított élelmiszer- és takarmánytermékek nyomonkövethetőségéről, valamint a 2001/18/EK irányelv módosításáról (HL L 268., 2003.10.18., 24. o.).
(8) Az Európai Parlament és a Tanács 1946/2003/EK rendelete (2003. július 15.) a géntechnológiával módosított szervezetek országhatárokon történő átviteléről (HL L 287., 2003.11.5., 1. o.).
|
2.8.2019 |
HU |
Az Európai Unió Hivatalos Lapja |
L 204/54 |
A BIZOTTSÁG (EU) 2019/1302 VÉGREHAJTÁSI HATÁROZATA
(2019. július 26.)
a géntechnológiával módosított GHB614 × LLCotton25 × MON 15985 gyapotot tartalmazó, abból álló vagy abból előállított termékek forgalomba hozatalának az 1829/2003/EK európai parlamenti és tanácsi rendelet szerinti engedélyezéséről
(az értesítés a C(2019) 5501. számú dokumentummal történt)
(Csak a német nyelvű szöveg hiteles)
(EGT-vonatkozású szöveg)
AZ EURÓPAI BIZOTTSÁG,
tekintettel az Európai Unió működéséről szóló szerződésre,
tekintettel a géntechnológiával módosított élelmiszerekről és takarmányokról szóló, 2003. szeptember 22-i 1829/2003/EK európai parlamenti és tanácsi rendeletre (1) és különösen annak 7. cikke (3) bekezdésére és 19. cikke (3) bekezdésére,
mivel:
|
(1) |
2011. február 11-én a Bayer CropScience AG (a továbbiakban: a kérelmező) kérelmet nyújtott be Hollandia illetékes nemzeti hatóságához az 1829/2003/EK rendelet 5. és 17. cikkével összhangban a GHB614 × LLCotton25 × MON 15985 gyapotot és az LLCotton25 × MON 15985 alkombinációt tartalmazó, abból álló vagy abból előállított élelmiszerek, élelmiszer-összetevők és takarmányok forgalomba hozatalára vonatkozóan (a továbbiakban: a kérelem). A kérelem kiterjed továbbá a géntechnológiával módosított GHB614 × LLCotton25 × MON 15985 gyapotot és az LLCotton25 × MON 15985 alkombinációt tartalmazó vagy abból álló termékeknek a termesztéstől eltérő felhasználás céljából, nem élelmiszerként vagy takarmányként történő forgalomba hozatalára is. |
|
(2) |
A kérelmezőt egy 2011. április 20-i levélben arról tájékoztatták, hogy a GHB614 × LLCotton25 × MON 15985 gyapot reprodukciós tulajdonságai miatt az LLCotton25 × MON 15985 alkombinációt ki kell venni a kérelemből, hogy azt külön lehessen értékelni. 2015. június 15-i levelében a kérelmező benyújtotta az Európai Élelmiszerbiztonsági Hatóságnak (a továbbiakban: Hatóság) a kérelem frissített változatát, amelynek hatálya immáron a GHB614 × LLCotton25 × MON 15985 gyapotot tartalmazó, abból álló vagy abból előállított élelmiszerek, élelmiszer-összetevők és takarmányok forgalomba hozatalára korlátozódott. |
|
(3) |
Az 1829/2003/EK rendelet 5. cikke (5) bekezdésének és 17. cikke (5) bekezdésének megfelelően a kérelem tartalmazta a 2001/18/EK európai parlamenti és tanácsi irányelv (2) II. mellékletében megállapított elvekkel összhangban végzett kockázatértékelésre vonatkozó információkat és következtetéseket, valamint az említett irányelv III. és IV. mellékletében előírt információkat. A kérelem magában foglalta továbbá a 2001/18/EK irányelv VII. mellékletének megfelelő, a környezeti hatásokra vonatkozó felügyeleti tervet is. |
|
(4) |
2018. április 20-án a Hatóság az 1829/2003/EK rendelet (3) 6. és 18. cikkével összhangban kedvező véleményt adott ki. A Hatóság arra a következtetésre jutott, hogy a kérelem alkalmazási körében a géntechnológiával módosított GHB614 × LLCotton25 × MON 15985 gyapot ugyanolyan biztonságos, és várhatóan ugyanolyan táplálkozási hatást fejt ki, mint a géntechnológiával nem módosított referencianövény. |
|
(5) |
Véleményében a Hatóság figyelembe vette az illetékes nemzeti hatóságokkal az 1829/2003/EK rendelet 6. cikkének (4) bekezdésében és 18. cikkének (4) bekezdésében előírtak szerint folytatott konzultáció keretében a tagállamok által felvetett összes konkrét kérdést és aggályt. |
|
(6) |
A Hatóság továbbá arra a következtetésre jutott, hogy a kérelmező által benyújtott, általános megfigyelési tervből álló, a környezeti hatásokra vonatkozó felügyeleti terv összhangban áll a termékek tervezett felhasználásával. |
|
(7) |
E megfontolásokat figyelembe véve indokolt engedélyezni a géntechnológiával módosított GHB614 × LLCotton25 × MON 15985 gyapotot tartalmazó, abból álló vagy abból előállított termékek forgalomba hozatalát. |
|
(8) |
2018. augusztus 1-jei levelében a Bayer CropScience AG kérelmezte, hogy a Bizottság ruházza át a BASF Agricultural Solutions Seed US LLC-re azokat a jogokat és kötelezettségeket, amelyek a Bayer CropScience AG-t illetik a géntechnológiával módosított termékekre vonatkozó összes engedély és függőben lévő kérelem kapcsán. 2018. augusztus 6-i levelében a BASF SE – a BASF Agricultural Solutions Sean US LLC nevében – megerősítette hozzájárulását ehhez a jog- és kötelezettségátruházáshoz. |
|
(9) |
A 65/2004/EK bizottsági rendelettel (4) összhangban a géntechnológiával módosított GHB614 × LLCotton25 × MON 15985 gyapothoz egyedi azonosítót kell hozzárendelni. |
|
(10) |
A Hatóság által kiadott vélemény alapján úgy tűnik, hogy az e határozat hatálya alá tartozó termékekre vonatkozóan nincs szükség különleges címkézési előírásokra azokon kívül, amelyeket az 1829/2003/EK rendelet 13. cikkének (1) bekezdése és 25. cikkének (2) bekezdése, valamint az 1830/2003/EK európai parlamenti és tanácsi rendelet (5) 4. cikkének (6) bekezdése meghatároz. Annak biztosítására azonban, hogy ezeket a termékeket továbbra is az e határozattal megadott engedélynek megfelelően használják fel, a géntechnológiával módosított GHB614 × LLCotton25 × MON 15985 gyapotot tartalmazó vagy abból álló, élelmiszerektől eltérő termékek címkézésének egyértelműen utalnia kell arra, hogy a szóban forgó termékek nem használhatók termesztésre. |
|
(11) |
Az engedély jogosultjának éves jelentéseket kell benyújtania a környezeti hatásokra vonatkozó felügyeleti tervben meghatározott tevékenységek végrehajtásáról és eredményeiről. Ezeket az eredményeket a 2009/770/EK bizottsági határozatban (6) előírt egységes jelentéstételi formanyomtatványra vonatkozó követelményeknek megfelelően kell benyújtani. |
|
(12) |
A Hatóság véleménye nem indokolja semmilyen, az élelmiszerek és takarmányok forgalomba hozatalára és/vagy felhasználására és kezelésére irányuló különleges feltétel vagy korlátozás bevezetését, beleértve a forgalomba hozatal utáni felügyeleti követelményeket is, sem pedig az 1829/2003/EK rendelet 6. cikke (5) bekezdésének e) pontjában és 18. cikke (5) bekezdésének e) pontjában előírt, a különleges ökológiai rendszerek/környezet és/vagy földrajzi területek védelmét célzó különleges feltételek bevezetését. |
|
(13) |
A termékek engedélyezésével kapcsolatos minden releváns információt be kell jegyezni a géntechnológiával módosított élelmiszerek és takarmányok 1829/2003/EK rendelet 28. cikkének (1) bekezdése szerinti közösségi nyilvántartásába. |
|
(14) |
E határozatról a Biológiai Biztonság Kérdéseiben illetékes Információs Központon keresztül értesíteni kell a Biológiai Sokféleség Egyezmény Biológiai Biztonságról szóló Cartagena Jegyzőkönyvének részes feleit, az 1946/2003/EK európai parlamenti és tanácsi rendelet (7) 9. cikkének (1) bekezdése és 15. cikke (2) bekezdésének c) pontja szerint. |
|
(15) |
A Növények, Állatok, Élelmiszerek és Takarmányok Állandó Bizottsága nem nyilvánított véleményt az elnöke által kitűzött határidőn belül. Mivel e végrehajtási jogi aktus elfogadását szükségesnek ítélték, az elnök azt további megvitatás céljából a fellebbviteli bizottság elé terjesztette. A fellebbviteli bizottság nem nyilvánított véleményt, |
ELFOGADTA EZT A HATÁROZATOT:
1. cikk
Géntechnológiával módosított szervezet és egyedi azonosító
A 65/2004/EK rendeletnek megfelelően az e határozat mellékletének b) pontjában meghatározott, géntechnológiával módosított GHB614 × LLCotton25 × MON 15985 gyapot (Gossypium hirsutum) a BCS-GHØØ2-5 × ACS-GHØØ1-3 × MON-15985-7 egyedi azonosítót kapja.
2. cikk
Engedélyezés
Az 1829/2003/EK rendelet 4. cikke (2) bekezdésének és 16. cikke (2) bekezdésének alkalmazásában a Bizottság az e határozatban megállapított feltételeknek megfelelően engedélyezi a következő termékeket:
|
a) |
GHB614 × LLCotton25 × MON 15985 gyapotot tartalmazó, abból álló vagy abból előállított élelmiszerek és élelmiszer-összetevők; |
|
b) |
GHB614 × LLCotton25 × MON 15985 gyapotot tartalmazó, abból álló vagy abból előállított takarmányok; |
|
c) |
az ebben a cikkben felsorolt, géntechnológiával módosított GHB614 × LLCotton25 × MON 15985 gyapotot tartalmazó vagy abból álló termékek az e cikk a) és b) pontjában említettektől eltérő felhasználásra, a termesztés kivételével. |
3. cikk
Címkézés
1. Az 1829/2003/EK rendelet 13. cikkének (1) bekezdésében és 25. cikkének (2) bekezdésében, illetve az 1830/2003/EK rendelet 4. cikkének (6) bekezdésében megállapított címkézési előírások alkalmazásában a „szervezet neve”: „gyapot”.
2. Az élelmiszerek és élelmiszer-összetevők kivételével az 1. cikkben felsorolt, géntechnológiával módosított gyapotot tartalmazó vagy abból álló termékek címkéjén, valamint az ilyen termékeket kísérő dokumentumokon fel kell tüntetni a „nem termesztésre” feliratot.
4. cikk
Kimutatási módszer
Az 1. cikkben felsorolt, géntechnológiával módosított gyapot kimutatására a melléklet d) pontjában meghatározott módszert kell alkalmazni.
5. cikk
A környezeti hatásokra vonatkozó felügyeleti terv
(1) Az engedély jogosultja gondoskodik a melléklet h) pontjában meghatározott, a környezeti hatásokra vonatkozó felügyeleti terv kidolgozásáról és végrehajtásáról.
(2) Az engedély jogosultja a 2009/770/EK határozatnak megfelelően éves jelentéseket nyújt be a Bizottsághoz a felügyeleti tervben meghatározott tevékenységek végrehajtásáról és eredményeiről.
6. cikk
Közösségi nyilvántartás
Az e határozat mellékletében szereplő információkat be kell jegyezni a géntechnológiával módosított élelmiszerek és takarmányok 1829/2003/EK rendelet 28. cikkének (1) bekezdése szerinti közösségi nyilvántartásába.
7. cikk
Az engedély jogosultja
Az engedély jogosultja a BASF SE, Németország által képviselt BASF Agricultural Solution Seed US LLC, USA.
8. cikk
Érvényesség
Ez a határozat az értesítés napjától számított tíz évig alkalmazandó.
9. cikk
Címzett
Ennek a határozatnak a címzettje a BASF SE, Carl-Bosch-Str. 38, D-67063 Ludwigshafen, Németország.
Kelt Brüsszelben, 2019. július 26-án.
a Bizottság részéről
Vytenis ANDRIUKAITIS
a Bizottság tagja
(1) HL L 268., 2003.10.18., 1. o.
(2) Az Európai Parlament és a Tanács 2001/18/EK irányelve (2001. március 12.) a géntechnológiával módosított szervezetek környezetbe történő szándékos kibocsátásáról és a 90/220/EGK tanácsi irányelv hatályon kívül helyezéséről (HL L 106., 2001.4.17., 1. o.).
(3) Az EFSA GMO-testülete (az EFSA géntechnológiával módosított szervezetekkel foglalkozó tudományos testülete), 2018. Tudományos vélemény a géntechnológiával módosított GHB614 × LLCotton25 × MON 15985 gyapot élelmiszerként és takarmányként való felhasználás céljából történő, az 1829/2003/EK rendelet szerinti értékeléséről; kérelem: EFSA-GMO-NL-2011-94 (Scientific opinion on the assessment of genetically modified cotton GHB614 × LLCotton25 × MON 15985 for food and feed uses, under Regulation (EC) No 1829/2003 (application EFSA-GMO-NL-2011-94)). EFSA Journal 2018;16(4):5213, 27. oldal, doi: 10.2903/j.efsa.2018.5213.
(4) A Bizottság 65/2004/EK rendelete (2004. január 14.) a géntechnológiával módosított szervezetek egyedi azonosítóinak kialakítására és hozzárendelésére szolgáló rendszer létrehozásáról (HL L 10., 2004.1.16., 5. o.).
(5) Az Európai Parlament és a Tanács 1830/2003/EK rendelete (2003. szeptember 22.) a géntechnológiával módosított szervezetek nyomonkövethetőségéről és címkézéséről, és a géntechnológiával módosított szervezetekből előállított élelmiszer- és takarmánytermékek nyomonkövethetőségéről, valamint a 2001/18/EK irányelv módosításáról (HL L 268., 2003.10.18., 24. o.).
(6) A Bizottság 2009/770/EK (2009. október 13.) határozata a 2001/18/EK európai parlamenti és tanácsi irányelv alapján a géntechnológiával módosított szervezetek környezetbe történő szándékos kibocsátásával, illetve forgalomba hozatalra szánt termékekben vagy termékekként való felhasználásával kapcsolatos felügyeleti eredmények ismertetésére szolgáló egységes jelentéstételi formanyomtatványok létrehozásáról (HL L 275., 2009.10.21., 9. o.).
(7) Az Európai Parlament és a Tanács 1946/2003/EK rendelete (2003. július 15.) a géntechnológiával módosított szervezetek országhatárokon történő átviteléről (HL L 287., 2003.11.5., 1. o.).
MELLÉKLET
a) Kérelmező és az engedély jogosultja:
|
Név |
: |
BASF Agricultural Solutions Seed US LLC |
|
Cím |
: |
100 Park Avenue, Florham Park, New Jersey 07932, Amerikai Egyesült Államok |
Képviseli: BASF SE, Carl-Bosch-Str. 38, D-67063 Ludwigshafen, Németország.
b) A termékek megnevezése és leírása:
|
1. |
GHB614 × LLCotton25 × MON 15985 gyapotot tartalmazó, abból álló vagy abból előállított élelmiszerek és élelmiszer-összetevők; |
|
2. |
GHB614 × LLCotton25 × MON 15985 gyapotot tartalmazó, abból álló vagy abból előállított takarmányok; |
|
3. |
GHB614 × LLCotton25 × MON 15985 gyapotot tartalmazó vagy abból álló termékek az 1. és 2. pontban említettektől eltérő felhasználásra, a termesztés kivételével. |
A kérelemben leírt, géntechnológiával módosított GHB614 × LLCotton25 × MON 15985 gyapot expresszálja a glifozáttartalmú gyomirtó szereknek való ellenállást biztosító 2 mEPSPS fehérjét, a glufozinát-ammónium-alapú gyomirtó szereknek való ellenállást biztosító PAT fehérjét, valamint a Lepidoptera rendbe tartozó egyes kártevőkkel szembeni védelmet biztosító Cry1Ac és Cry1Ab2 fehérjét. Ezenkívül a génmódosítás során a GUS fehérjét kódoló uidA gént, a kanamicinnel és neomicinnel szembeni ellenálló képességet biztosító nptII gént, valamint a szpektinomicinnel és a sztreptomicinnel szembeni ellenálló képességet biztosító aadAgént alkalmaztak szelekciós markerként.
c) Címkézés:
|
1. |
Az 1829/2003/EK rendelet 13. cikkének (1) bekezdésében és 25. cikkének (2) bekezdésében, illetve az 1830/2003/EK rendelet 4. cikkének (6) bekezdésében megállapított címkézési előírások alkalmazásában a „szervezet neve”: „gyapot”. |
|
2. |
Az élelmiszerek és élelmiszer-összetevők kivételével az e) pontban meghatározott GHB614 × LLCotton25 × MON 15985 gyapotot tartalmazó vagy abból álló termékek címkéjén, valamint az ilyen termékeket kísérő dokumentumokon fel kell tüntetni a „nem termesztésre” feliratot. |
d) Kimutatási módszer:
|
1. |
A GHB614 × LLCotton25 × MON 15985 gyapotra vonatkozó kvantitatív, eseményspecifikus PCR-kimutatási módszereket a géntechnológiával módosított GHØØ2-5, ACS-GHØØ1-3 és MON-15985-7 eseményekre hitelesített módszerek jelentik. A kimutatási módszereket a BCS-GHØØ2-5, az ACS-GHØØ1-3 és a MON-15985-7 gyapot leveléből kivont genomikus DNS-en hitelesítették. |
|
2. |
A hitelesítést az 1829/2003/EK rendelet alapján létrehozott uniós referencialaboratórium végezte; a hitelesítési jelentés az alábbi internetcímen olvasható: http://gmo-crl.jrc.ec.europa.eu/statusofdossiers.aspx; |
|
3. |
Referenciaanyag: AOCS 1108-A5 (a BCS-GHØØ2-5) esetében, AOCS 0306-E2 (azACS-GHØØ1-3 esetében) és AOCS 0804-D (a MON-15985-7 esetében) amelyekhez az American Oil Chemists' Society-n keresztül a https://www.aocs.org/crm internetcímen lehet hozzáférni. |
e) Egyedi azonosító:
BCS-GHØØ2-5 × ACS-GHØØ1-3 × MON-15985-7
f) A Biológiai Sokféleség Egyezmény Biológiai Biztonságról szóló Cartagena Jegyzőkönyvének II. melléklete szerint előírt információ:
[A Biológiai Biztonság Kérdéseiben illetékes Információs Központ, a bejegyzés azonosító száma: értesítést követően bejegyezésre kerül a géntechnológiával módosított élelmiszerek és takarmányok közösségi nyilvántartásába].
g) A termékek forgalomba hozatalára, felhasználására vagy kezelésére vonatkozó feltételek vagy korlátozások:
Nem szükségesek.
h) A környezeti hatásokra vonatkozó felügyeleti terv
A 2001/18/EK irányelv VII. mellékletének megfelelő, a környezeti hatások figyelemmel kísérését célzó terv.
[Hivatkozás: a géntechnológiával módosított élelmiszerek és takarmányok közösségi nyilvántartásában közzétett terv]
i) Forgalomba hozatal utáni felügyeleti követelmények az emberi fogyasztásra szánt élelmiszerek felhasználása tekintetében
Nem szükségesek.
Megjegyzés: idővel szükségessé válhat a vonatkozó dokumentumok internetes hivatkozásainak módosítása. Ezeket a módosításokat a géntechnológiával módosított élelmiszerek és takarmányok közösségi nyilvántartásának frissítése útján teszik közzé.
|
2.8.2019 |
HU |
Az Európai Unió Hivatalos Lapja |
L 204/60 |
A BIZOTTSÁG (EU) 2019/1303 VÉGREHAJTÁSI HATÁROZATA
(2019. július 26.)
a géntechnológiával módosított 5307-es (SYN-Ø53Ø7-1) kukoricát tartalmazó, abból álló vagy abból előállított termékek forgalomba hozatalának a géntechnológiával módosított élelmiszerekről és takarmányokról szóló 1829/2003/EK európai parlamenti és tanácsi rendelet szerinti engedélyezéséről
(az értesítés a C(2019) 5493. számú dokumentummal történt)
(Csak a francia és a holland nyelvű szöveg hiteles)
(EGT-vonatkozású szöveg)
AZ EURÓPAI BIZOTTSÁG,
tekintettel az Európai Unió működéséről szóló szerződésre,
tekintettel a géntechnológiával módosított élelmiszerekről és takarmányokról szóló, 2003. szeptember 22-i 1829/2003/EK európai parlamenti és tanácsi rendeletre (1) és különösen annak 7. cikke (3) bekezdésére és 19. cikke (3) bekezdésére,
mivel:
|
(1) |
2011. április 7-én a Syngenta Crop Protection AG – a Syngenta Crop Protection NV/SA kapcsolt vállalkozáson keresztül – az 1829/2003/EK rendelet 5. és 17. cikkével összhangban kérelmet nyújtott be Németország illetékes nemzeti hatóságához a géntechnológiával módosított 5307-es kukoricát tartalmazó, abból álló vagy abból előállított élelmiszerek, élelmiszer-összetevők és takarmányok forgalomba hozatalára vonatkozóan (a továbbiakban: a kérelem). A kérelem kiterjed továbbá a géntechnológiával módosított 5307-es kukoricát tartalmazó vagy abból álló termékeknek a termesztéstől eltérő felhasználás céljából, nem élelmiszerként vagy takarmányként történő forgalomba hozatalára is. |
|
(2) |
Az 1829/2003/EK rendelet 5. cikke (5) bekezdésének és 17. cikke (5) bekezdésének megfelelően a kérelem tartalmazta a 2001/18/EK európai parlamenti és tanácsi irányelv (2) II. mellékletében megállapított elvekkel összhangban végzett kockázatértékelésre vonatkozó információkat és következtetéseket, valamint az említett irányelv III. és IV. mellékletében előírt információkat. A kérelem magában foglalta továbbá a 2001/18/EK irányelv VII. mellékletének megfelelő, a környezeti hatásokra vonatkozó felügyeleti tervet is. |
|
(3) |
2015. május 5-én az Európai Élelmiszerbiztonsági Hatóság (a továbbiakban: Hatóság) az 1829/2003/EK rendelet (3) 6. és 18. cikkével összhangban kedvező véleményt adott ki. A Hatóság az 5307-es kukoricára vonatkozóan nem tudott átfogó következtetést levonni, mivel az eCry3.1Ab fehérjére vonatkozóan elvégzett 28 napos toxicitási vizsgálat nem volt megfelelő. |
|
(4) |
2016. december 8-án a kérelmező egy új 28 napos toxicitási vizsgálatot nyújtott be az eCry3.1Ab. fehérjére vonatkozóan. |
|
(5) |
2018. április 11-én a Hatóság a tudományos véleményét (4) kiegészítő állásfoglalást tett közzé, amelyhez figyelembe vette a kiegészítő toxicitási vizsgálatot. A Hatóság arra a következtetésre jutott, hogy az 5307-es kukorica a kérelem alkalmazási körében – az eredeti vélemény és a kiegészítő toxicitási vizsgálat értékelésének megfelelően – ugyanolyan biztonságos és tápláló, mint hagyományos megfelelője. |
|
(6) |
Véleményében a Hatóság figyelembe vette az illetékes nemzeti hatóságokkal az 1829/2003/EK rendelet 6. cikkének (4) bekezdésében és 18. cikkének (4) bekezdésében előírtak szerint folytatott konzultáció keretében a tagállamok által felvetett összes kérdést és aggályt. |
|
(7) |
A Hatóság továbbá arra a következtetésre jutott, hogy a kérelmező által benyújtott, általános megfigyelési tervből álló, a környezeti hatásokra vonatkozó felügyeleti terv összhangban áll a termékek tervezett felhasználásával. |
|
(8) |
E következtetésekre tekintettel engedélyezni kell a géntechnológiával módosított 5307-es kukoricát tartalmazó, abból álló vagy abból előállított termékek forgalomba hozatalát a kérelemben felsorolt felhasználási célokra. |
|
(9) |
A 65/2004/EK rendelettel (5) összhangban a géntechnológiával módosított 5307-es kukoricához egyedi azonosítót kell hozzárendelni. |
|
(10) |
A Hatóság által kiadott vélemény alapján úgy tűnik, hogy az e határozat hatálya alá tartozó termékekre vonatkozóan nincs szükség különleges címkézési előírásokra azokon kívül, amelyeket az 1829/2003/EK rendelet 13. cikkének (1) bekezdése és 25. cikkének (2) bekezdése, valamint az 1830/2003/EK európai parlamenti és tanácsi rendelet (6) 4. cikkének (6) bekezdése meghatároz. Annak biztosítására azonban, hogy a termékeket az e határozattal megadott engedélynek megfelelően használják fel, a géntechnológiával módosított, 5307-es kukoricát tartalmazó vagy abból álló, élelmiszerektől eltérő termékek címkézésének egyértelműen utalnia kell arra, hogy a szóban forgó termékek nem használhatók termesztésre. |
|
(11) |
A környezeti hatásokra vonatkozó felügyeleti tervben meghatározott tevékenységek végrehajtásáról és eredményeiről történő beszámolásként az engedély jogosultjának a 2009/770/EK bizottsági határozatban (7) előírt egységes jelentéstételi formanyomtatványra vonatkozó követelményeknek megfelelő éves jelentéseket kell benyújtania. |
|
(12) |
A Hatóság véleménye nem indokolja semmilyen, az élelmiszerek és takarmányok forgalomba hozatalára, felhasználására és kezelésére irányuló különleges feltétel vagy korlátozás bevezetését, beleértve a forgalomba hozatal utáni felügyeleti követelményeket is, sem pedig az 1829/2003/EK rendelet 6. cikke (5) bekezdésének e) pontjában és 18. cikke (5) bekezdésének e) pontjában előírt, a különleges ökológiai rendszerek/környezet és/vagy földrajzi területek védelmét célzó különleges feltételek bevezetését. |
|
(13) |
A termékek engedélyezésével kapcsolatos minden releváns információt be kell jegyezni a géntechnológiával módosított élelmiszerek és takarmányok 1829/2003/EK rendelet 28. cikkének (1) bekezdése szerinti közösségi nyilvántartásába. |
|
(14) |
E határozatról a Biológiai Biztonság Kérdéseiben illetékes Információs Központon keresztül értesíteni kell a Biológiai Sokféleség Egyezmény Biológiai Biztonságról szóló Cartagena Jegyzőkönyvének részes feleit, az 1946/2003/EK európai parlamenti és tanácsi rendelet (8) 9. cikkének (1) bekezdése és 15. cikke (2) bekezdésének c) pontja szerint. |
|
(15) |
A Növények, Állatok, Élelmiszerek és Takarmányok Állandó Bizottsága nem nyilvánított véleményt az elnöke által kitűzött határidőn belül. Mivel e végrehajtási jogi aktus elfogadását szükségesnek ítélték, az elnök azt további megvitatás céljából a fellebbviteli bizottság elé terjesztette. A fellebbviteli bizottság nem nyilvánított véleményt, |
ELFOGADTA EZT A HATÁROZATOT:
1. cikk
Géntechnológiával módosított szervezet és egyedi azonosító
A 65/2004/EK rendeletnek megfelelően az e határozat mellékletének b) pontjában meghatározott, géntechnológiával módosított 5307-es kukorica (Zea mays L.) a SYN-Ø53Ø7-1 egyedi azonosítót kapja.
2. cikk
Engedélyezés
Az 1829/2003/EK rendelet 4. cikke (2) bekezdése és 16. cikke (2) bekezdése alkalmazásában az e határozatban megállapított feltételeknek megfelelően a Bizottság engedélyezi a következő termékeket:
|
a) |
SYN-Ø53Ø7-1 kukoricát tartalmazó, abból álló vagy abból előállított élelmiszerek és élelmiszer-összetevők; |
|
b) |
SYN-Ø53Ø7-1 kukoricát tartalmazó, abból álló vagy abból előállított takarmányok; |
|
c) |
az ebben a cikkben felsorolt, géntechnológiával módosított SYN-Ø53Ø7-1 kukoricát tartalmazó vagy abból álló termékek az e cikk a) és b) pontjában említettektől eltérő felhasználásra, a termesztés kivételével. |
3. cikk
Címkézés
(1) Az 1829/2003/EK rendelet 13. cikkének (1) bekezdésében és 25. cikkének (2) bekezdésében, illetve az 1830/2003/EK rendelet 4. cikkének (6) bekezdésében megállapított címkézési előírások alkalmazásában a „szervezet neve”: „kukorica”.
(2) A 2. cikk a) pontjában említett termékek kivételével a SYN-Ø53Ø7-1 kukoricát tartalmazó vagy abból álló termékek címkéjén, valamint az ilyen termékeket kísérő dokumentumokon fel kell tüntetni a „nem termesztésre” feliratot.
4. cikk
Kimutatási módszer
A SYN-Ø53Ø7-1 kukorica kimutatására a melléklet d) pontjában meghatározott módszert kell alkalmazni.
5. cikk
A környezeti hatások felügyelete
(1) Az engedély jogosultja gondoskodik a melléklet h) pontjában meghatározott, a környezeti hatásokra vonatkozó felügyeleti terv kidolgozásáról és végrehajtásáról.
(2) Az engedély jogosultja a 2009/770/EK határozatnak megfelelő éves jelentéseket nyújt be a Bizottsághoz a felügyeleti tervben meghatározott tevékenységek végrehajtásáról és eredményeiről.
6. cikk
Közösségi nyilvántartás
Az e határozat mellékletében szereplő információkat be kell jegyezni a géntechnológiával módosított élelmiszerek és takarmányok 1829/2003/EK rendelet 28. cikkének (1) bekezdése szerinti közösségi nyilvántartásába.
7. cikk
Az engedély jogosultja
Az engedély jogosultja a Syngenta Crop Protection NV/SA (Belgium) által képviselt Syngenta Crop Protection AG (Svájc).
8. cikk
Érvényesség
Ez a határozat az értesítés napjától számított tíz évig alkalmazandó.
9. cikk
Címzett
Ennek a határozatnak a címzettje a Syngenta Crop Protection NV/SA, Avenue Louise, 489, 1050 Brüsszel, Belgium.
Kelt Brüsszelben, 2019. július 26-án.
a Bizottság részéről
Vytenis ANDRIUKAITIS
a Bizottság tagja
(1) HL L 268., 2003.10.18., 1. o.
(2) Az Európai Parlament és a Tanács 2001/18/EK irányelve (2001. március 12.) a géntechnológiával módosított szervezetek környezetbe történő szándékos kibocsátásáról és a 90/220/EGK tanácsi irányelv hatályon kívül helyezéséről (HL L 106., 2001.4.17., 1. o.).
(3) Az EFSA GMO-testülete (az EFSA géntechnológiával módosított szervezetekkel foglalkozó tudományos testülete), 2015. Tudományos vélemény a Syngenta Crop Protection AG EFSA-GMO-DE-2011-95 számú, a géntechnológiával módosított 5307-es kukorica élelmiszerként és takarmányként való felhasználás, behozatal és feldolgozás céljából történő forgalomba hozatalára vonatkozó, az 1829/2003/EK rendelet szerinti kérelméről (Scientific Opinion on application (EFSA-GMO-DE-2011-95) for the placing on the market of genetically modified maize 5307 for food and feed uses, import and processing under Regulation (EC) No 1829/2003 from Syngenta Crop Protection AG). EFSA Journal 2015;13(5):4083, 29. o. https://doi.org/10.2903/j.efsa.2015.4083
(4) Az EFSA GMO-testülete (az EFSA géntechnológiával módosított szervezetekkel foglalkozó tudományos testülete), 2018. A Syngenta Crop Protection AG EFSA-GMO-DE-2011-95 számú, a géntechnológiával módosított 5307-es kukorica élelmiszerként és takarmányként való felhasználás, behozatal és feldolgozás céljából történő forgalomba hozatalára vonatkozó, az 1829/2003/EK rendelet szerinti kérelméről kiadott EFSA tudományos véleményt kiegészítő, egy újabb toxikológiai tanulmány figyelembevételével kiadott állásfoglalás. (Statement complementing the EFSA Scientific Opinion on application (EFSA-GMO-DE-2011-95) for the placing on the market of genetically modified maize 5307 for food and feed uses, import and processing under Regulation (EC) No 1829/2003 from Syngenta Crop Protection AG taking into consideration an additional toxicological study.) EFSA Journal 2018;16(4):5233, 9. o. https://doi.org/10.2903/j.efsa.2018.5233
(5) A Bizottság 65/2004/EK rendelete (2004. január 14.) a géntechnológiával módosított szervezetek egyedi azonosítóinak kialakítására és hozzárendelésére szolgáló rendszer létrehozásáról (HL L 10., 2004.1.16., 5. o.).
(6) Az Európai Parlament és a Tanács 1830/2003/EK rendelete (2003. szeptember 22.) a géntechnológiával módosított szervezetek nyomonkövethetőségéről és címkézéséről, és a géntechnológiával módosított szervezetekből előállított élelmiszer- és takarmánytermékek nyomonkövethetőségéről, valamint a 2001/18/EK irányelv módosításáról (HL L 268., 2003.10.18., 24. o.).
(7) A Bizottság 2009/770/EK (2009. október 13.) határozata a 2001/18/EK európai parlamenti és tanácsi irányelv alapján a géntechnológiával módosított szervezetek környezetbe történő szándékos kibocsátásával, illetve forgalomba hozatalra szánt termékekben vagy termékekként való felhasználásával kapcsolatos felügyeleti eredmények ismertetésére szolgáló egységes jelentéstételi formanyomtatványok létrehozásáról (HL L 275., 2009.10.21., 9. o.).
(8) Az Európai Parlament és a Tanács 1946/2003/EK rendelete (2003. július 15.) a géntechnológiával módosított szervezetek országhatárokon történő átviteléről (HL L 287., 2003.11.5., 1. o.).
MELLÉKLET
a) Kérelmező és az engedély jogosultja:
|
Név |
: |
Syngenta Crop Protection AG |
|
Cím |
: |
Schwarzwaldallee 215, CH-4058 Basel, Svájc |
Képviseli: Syngenta Crop Protection NV/SA, Avenue Louise, 489, 1050 Brüsszel, Belgium.
b) A termékek megnevezése és leírása:
|
1. |
SYN-Ø53Ø7-1 kukoricát tartalmazó, abból álló vagy abból előállított élelmiszerek; |
|
2. |
SYN-Ø53Ø7-1 kukoricát tartalmazó, abból álló vagy abból előállított takarmányok; |
|
3. |
SYN-Ø53Ø7-1 kukoricát tartalmazó vagy abból álló termékek az 1. és 2. pontban említettektől eltérő felhasználásra, a termesztés kivételével. |
A kérelemben leírt, géntechnológiával módosított SYN-Ø53Ø7-1 kukorica expresszálja a Coleoptera rendbe tartozó egyes kártevőkkel szemben ellenállást biztosító eCry3.1Ab fehérjét és a szelekciós markerként használt PMI fehérjét.
c) Címkézés:
|
1. |
Az 1829/2003/EK rendelet 13. cikkének (1) bekezdésében és 25. cikkének (2) bekezdésében, illetve az 1830/2003/EK rendelet 4. cikkének (6) bekezdésében megállapított címkézési előírások alkalmazásában a „szervezet neve”: „kukorica”. |
|
2. |
A 2. cikk a) pontjában említett termékek kivételével a SYN-Ø53Ø7-1 kukoricát tartalmazó vagy abból álló termékek címkéjén, valamint az ilyen termékeket kísérő dokumentumokban fel kell tüntetni a „nem termesztésre” feliratot. |
d) Kimutatási módszer:
|
1. |
Eseményspecifikus, valós idejű kvantitatív PCR-alapú módszer a géntechnológiával módosított SYN-Ø53Ø7-1 kukorica kimutatására. |
|
2. |
A hitelesítést az 1829/2003/EK rendelet alapján létrehozott uniós referencialaboratórium végezte; a hitelesítési jelentés az alábbi internetes címen olvasható: http://gmo-crl.jrc.ec.europa.eu/StatusOfDossiers.aspx |
|
3. |
Referenciaanyag: AOCS 0411-C és AOCS 0411-D, amelyek elérhetők az American Oil Chemists Society-n (AOCS) keresztül a https://www.aocs.org/crm internetes címen. |
e) Egyedi azonosító:
SYN-Ø53Ø7-1
f) A Biológiai Sokféleség Egyezmény Biológiai Biztonságról szóló Cartagena Jegyzőkönyvének II. melléklete szerint előírt információ:
[A Biológiai Biztonság Kérdéseiben illetékes Információs Központ, a bejegyzés azonosító száma: értesítést követően bejegyezésre kerül a géntechnológiával módosított élelmiszerek és takarmányok közösségi nyilvántartásába].
g) A termékek forgalomba hozatalára, felhasználására vagy kezelésére vonatkozó feltételek vagy korlátozások:
Nem szükségesek.
h) A környezeti hatásokra vonatkozó felügyeleti terv
A 2001/18/EK irányelv VII. mellékletének megfelelő, a környezeti hatások figyelemmel kísérését célzó terv.
[Hivatkozás: a géntechnológiával módosított élelmiszerek és takarmányok nyilvántartásában közzétett terv.]
i) Forgalomba hozatal utáni felügyeleti követelmények az emberi fogyasztásra szánt élelmiszerek felhasználása tekintetében:
Nem szükségesek.
Megjegyzés: idővel szükségessé válhat a vonatkozó dokumentumok internetes hivatkozásainak módosítása. Ezeket a módosításokat a géntechnológiával módosított élelmiszerek és takarmányok nyilvántartásának frissítése útján teszik közzé.
|
2.8.2019 |
HU |
Az Európai Unió Hivatalos Lapja |
L 204/65 |
A BIZOTTSÁG (EU) 2019/1304 VÉGREHAJTÁSI HATÁROZATA
(2019. július 26.)
a géntechnológiával módosított 4114-es kukoricát (DP-ØØ4114-3) tartalmazó, abból álló vagy abból előállított termékek forgalomba hozatalának az 1829/2003/EK európai parlamenti és tanácsi rendelet szerinti engedélyezéséről
(az értesítés a C(2019) 5491. számú dokumentummal történt)
(Csak a holland és a francia nyelvű szöveg hiteles)
(EGT-vonatkozású szöveg)
AZ EURÓPAI BIZOTTSÁG,
tekintettel az Európai Unió működéséről szóló szerződésre,
tekintettel a géntechnológiával módosított élelmiszerekről és takarmányokról szóló, 2003. szeptember 22-i 1829/2003/EK európai parlamenti és tanácsi rendeletre (1) és különösen annak 7. cikke (3) bekezdésére és 19. cikke (3) bekezdésére,
mivel:
|
(1) |
2014. november 27-én a Pioneer Overseas Corporation – a Pioneer Hi-Bred International Inc. (Egyesült Államok) nevében – az 1829/2003/EK rendelet 5. és 17. cikkével összhangban kérelmet (a továbbiakban: kérelem) nyújtott be Hollandia illetékes nemzeti hatóságához. A kérelem a géntechnológiával módosított 4114-es kukoricát tartalmazó, abból álló vagy abból előállított élelmiszerek, élelmiszer-összetevők és takarmányok forgalomba hozatalára terjedt ki. A kérelem kiterjed továbbá a géntechnológiával módosított 4114-es kukoricát tartalmazó vagy abból álló termékeknek a termesztéstől eltérő felhasználás céljából, nem élelmiszerként vagy takarmányként történő forgalomba hozatalára is. |
|
(2) |
Az 1829/2003/EK rendelet 5. cikke (5) bekezdésének és 17. cikke (5) bekezdésének megfelelően a kérelem tartalmazta a 2001/18/EK európai parlamenti és tanácsi irányelv (2) II. mellékletében megállapított elvekkel összhangban végzett kockázatértékelésre vonatkozó információkat és következtetéseket. Tartalmazta továbbá az említett irányelv III. és IV. mellékletében előírt információkat, valamint az irányelv VII. mellékletének megfelelő, a környezeti hatások figyelemmel kísérését célzó tervet. |
|
(3) |
2018. május 24-én az Európai Élelmiszerbiztonsági Hatóság (a továbbiakban: Hatóság) az 1829/2003/EK rendelet (3) 6. és 18. cikkével összhangban kedvező véleményt adott ki. A Hatóság megállapította, hogy a kérelemben leírt, géntechnológiával módosított 4114-es kukorica az emberek és állatok egészségére, valamint a környezetre gyakorolt esetleges hatások tekintetében ugyanolyan biztonságos, mint a géntechnológiával nem módosított referencianövény(ek) és a kukorica vizsgált, géntechnológiával nem módosított referenciaváltozatai. |
|
(4) |
Véleményében a Hatóság figyelembe vette az illetékes nemzeti hatóságokkal az 1829/2003/EK rendelet 6. cikkének (4) bekezdésében és 18. cikkének (4) bekezdésében előírtak szerint folytatott konzultáció keretében a tagállamok által felvetett összes kérdést és aggályt. |
|
(5) |
Az EFSA továbbá arra a következtetésre jutott, hogy a kérelmező által benyújtott, általános megfigyelési tervből álló, a környezeti hatásokra vonatkozó felügyeleti terv összhangban áll a termékek tervezett felhasználásával. |
|
(6) |
Az említett következtetésekre tekintettel engedélyezni kell a géntechnológiával módosított 4114-es kukoricát tartalmazó, abból álló vagy abból előállított termékek forgalomba hozatalát a kérelemben felsorolt felhasználási célokra. |
|
(7) |
A 65/2004/EK bizottsági rendelettel (4) összhangban a géntechnológiával módosított 4114-es kukoricához egyedi azonosítót kell hozzárendelni. |
|
(8) |
A Hatóság által kiadott vélemény alapján úgy tűnik, hogy az e határozat hatálya alá tartozó termékekre vonatkozóan nincs szükség különleges címkézési előírásokra azokon kívül, amelyeket az 1829/2003/EK rendelet 13. cikkének (1) bekezdése és 25. cikkének (2) bekezdése, valamint az 1830/2003/EK európai parlamenti és tanácsi rendelet (5) 4. cikkének (6) bekezdése meghatároz. Annak biztosítására azonban, hogy a termékeket továbbra is az e határozattal megadott engedélynek megfelelően használják fel, a géntechnológiával módosított 4114-es kukoricát tartalmazó vagy abból álló, élelmiszerektől és élelmiszer-összetevőktől eltérő termékek címkézésének egyértelműen utalnia kell arra, hogy e termékek nem használhatók termesztésre. |
|
(9) |
A környezeti hatásokra vonatkozó felügyeleti tervben meghatározott tevékenységek végrehajtásáról és eredményeiről történő beszámolásként az engedély jogosultjának a 2009/770/EK bizottsági határozatban (6) előírt egységes jelentéstételi formanyomtatványra vonatkozó követelményeknek megfelelő éves jelentéseket kell benyújtania. |
|
(10) |
A Hatóság véleménye nem indokolja semmilyen, az élelmiszerek és takarmányok forgalomba hozatalára, felhasználására és kezelésére irányuló különleges feltétel vagy korlátozás bevezetését, beleértve a forgalomba hozatal utáni felügyeleti követelményeket is, sem pedig az 1829/2003/EK rendelet 6. cikke (5) bekezdésének e) pontjában és 18. cikke (5) bekezdésének e) pontjában előírt, a különleges ökológiai rendszerek/környezet és/vagy földrajzi területek védelmét célzó különleges feltételek bevezetését. |
|
(11) |
A termékek engedélyezésével kapcsolatos minden releváns információt be kell jegyezni a géntechnológiával módosított élelmiszerek és takarmányok 1829/2003/EK rendelet 28. cikkének (1) bekezdése szerinti közösségi nyilvántartásába. |
|
(12) |
E határozatról a Biológiai Biztonság Kérdéseiben illetékes Információs Központon keresztül értesíteni kell a Biológiai Sokféleség Egyezmény Biológiai Biztonságról szóló Cartagena Jegyzőkönyvének részes feleit, az 1946/2003/EK európai parlamenti és tanácsi rendelet (7) 9. cikkének (1) bekezdése és 15. cikke (2) bekezdésének c) pontja szerint. |
|
(13) |
A Növények, Állatok, Élelmiszerek és Takarmányok Állandó Bizottsága nem nyilvánított véleményt az elnöke által kitűzött határidőn belül. Mivel e végrehajtási jogi aktus elfogadása szükségesnek bizonyult, az elnök az aktus szövegét további megvitatás céljából a fellebbviteli bizottság elé terjesztette. A fellebbviteli bizottság nem nyilvánított véleményt, |
ELFOGADTA EZT A HATÁROZATOT:
1. cikk
Géntechnológiával módosított szervezet és egyedi azonosító
A 65/2004/EK rendeletnek megfelelően az e határozat mellékletének b) pontjában meghatározott, géntechnológiával módosított 4114-es kukorica (Zea mays L.) a DP-ØØ4114-3 egyedi azonosítót kapja.
2. cikk
Engedélyezés
Az 1829/2003/EK rendelet 4. cikke (2) bekezdése és 16. cikke (2) bekezdése alkalmazásában az e határozatban megállapított feltételeknek megfelelően a Bizottság engedélyezi a következő termékeket:
|
a) |
géntechnológiával módosított 4114-es kukoricát tartalmazó, abból álló vagy abból előállított élelmiszerek és élelmiszer-összetevők; |
|
b) |
géntechnológiával módosított 4114-es kukoricát tartalmazó, abból álló vagy abból előállított takarmányok; |
|
c) |
géntechnológiával módosított 4114-es kukoricát tartalmazó vagy abból álló termékek az a) és b) pontban említettektől eltérő felhasználásra, a termesztés kivételével. |
3. cikk
Címkézés
(1) Az 1829/2003/EK rendelet 13. cikkének (1) bekezdésében és 25. cikkének (2) bekezdésében, illetve az 1830/2003/EK rendelet 4. cikkének (6) bekezdésében megállapított címkézési előírások alkalmazásában a „szervezet neve”: „kukorica”.
(2) Az élelmiszerek és élelmiszer-összetevők kivételével a géntechnológiával módosított 4114-es kukoricát tartalmazó vagy abból álló termékek címkéjén, valamint az ilyen termékeket kísérő dokumentumokon fel kell tüntetni a „nem termesztésre” feliratot.
4. cikk
Kimutatási módszer
A géntechnológiával módosított 4114-es kukorica kimutatására a melléklet d) pontjában meghatározott módszert kell alkalmazni.
5. cikk
A környezeti hatások felügyelete
(1) Az engedély jogosultja gondoskodik a melléklet h) pontjában meghatározott, a környezeti hatásokra vonatkozó felügyeleti terv kidolgozásáról és végrehajtásáról.
(2) Az engedély jogosultja a 2009/770/EK határozatnak megfelelő éves jelentéseket nyújt be a Bizottsághoz a felügyeleti tervben meghatározott tevékenységek végrehajtásáról és eredményeiről.
6. cikk
Közösségi nyilvántartás
Az e határozat mellékletében szereplő információkat be kell jegyezni a géntechnológiával módosított élelmiszerek és takarmányok 1829/2003/EK rendelet 28. cikkének (1) bekezdése szerinti közösségi nyilvántartásába.
7. cikk
Az engedély jogosultja
Az engedély jogosultja a Pioneer Overseas Corporation (Belgium) által képviselt Pioneer Hi-Bred International, Inc. (Egyesült Államok).
8. cikk
Érvényesség
Ez a határozat az értesítés napjától számított tíz évig alkalmazandó.
9. cikk
Címzett
E határozat címzettje a Pioneer Overseas Corporation, Avenue des Arts 44, B-1040 Brussels – Belgium.
Kelt Brüsszelben, 2019. július 26-án.
a Bizottság részéről
Vytenis ANDRIUKAITIS
a Bizottság tagja
(1) HL L 268., 2003.10.18., 1. o.
(2) Az Európai Parlament és a Tanács 2001/18/EK irányelve (2001. március 12.) a géntechnológiával módosított szervezetek környezetbe történő szándékos kibocsátásáról és a 90/220/EGK tanácsi irányelv hatályon kívül helyezéséről (HL L 106., 2001.4.17., 1. o.).
(3) Az EFSA GMO-testülete (az EFSA géntechnológiával módosított szervezetekkel foglalkozó tudományos testülete), 2018. Scientific Opinion on the assessment of genetically modified maize 4114 for food and feed uses, under Regulation (EC) No 1829/2003 (Tudományos szakvélemény a géntechnológiával módosított 4114-es kukoricának élelmiszerként és takarmányként való felhasználására vonatkozó, az 1829/2003/EK rendelet szerinti értékelésről; kérelem: EFSA-GMO-NL-2014-123). EFSA Journal 2018; 16(5):5280, 25. o. https://doi.org/10.2903/j.efsa.2018.5280
(4) A Bizottság 65/2004/EK rendelete (2004. január 14.) a géntechnológiával módosított szervezetek egyedi azonosítóinak kialakítására és hozzárendelésére szolgáló rendszer létrehozásáról (HL L 10., 2004.1.16., 5. o.).
(5) Az Európai Parlament és a Tanács 1830/2003/EK rendelete (2003. szeptember 22.) a géntechnológiával módosított szervezetek nyomonkövethetőségéről és címkézéséről, és a géntechnológiával módosított szervezetekből előállított élelmiszer- és takarmánytermékek nyomonkövethetőségéről, valamint a 2001/18/EK irányelv módosításáról (HL L 268., 2003.10.18., 24. o.).
(6) A Bizottság 2009/770/EK határozata (2009. október 13.) a 2001/18/EK európai parlamenti és tanácsi irányelv alapján a géntechnológiával módosított szervezetek környezetbe történő szándékos kibocsátásával, illetve forgalomba hozatalra szánt termékekben vagy termékekként való felhasználásával kapcsolatos felügyeleti eredmények ismertetésére szolgáló egységes jelentéstételi formanyomtatványok létrehozásáról (HL L 275., 2009.10.21., 9. o.).
(7) Az Európai Parlament és a Tanács 1946/2003/EK rendelete (2003. július 15.) a géntechnológiával módosított szervezetek országhatárokon történő átviteléről (HL L 287., 2003.11.5., 1. o.).
MELLÉKLET
a) Kérelmező és az engedély jogosultja:
|
Név |
: |
Pioneer Hi-Bred International, Inc. |
|
Cím |
: |
7100 NW 62nd Avenue, P.O. Box 1014, Johnston, IA 50131-1014, U.S.A. |
Képviseli: Pioneer Overseas Corporation, Avenue des Arts 44, 1040 Brüsszel, Belgium
b) A termékek megnevezése és leírása:
|
1. |
géntechnológiával módosított 4114-es kukoricát tartalmazó, abból álló vagy abból előállított élelmiszerek és élelmiszer-összetevők; |
|
2. |
géntechnológiával módosított 4114-es kukoricát tartalmazó, abból álló vagy abból előállított takarmányok; |
|
3. |
géntechnológiával módosított 4114-es kukoricát tartalmazó vagy abból álló termékek az 1. és 2. pontban említettektől eltérő felhasználásra, a termesztés kivételével. |
A géntechnológiával módosított 4114-es kukorica a Lepidoptera és a Coleoptera rendbe tartozó egyes kártevőkkel szembeni védelmet biztosító Cry1F (csonkított változat), Cry34Ab1 és Cry35Ab1 fehérjéket és a glufozinát-ammónium-alapú gyomirtó szerekkel szembeni ellenállást biztosító PAT fehérjét expresszálja.
c) Címkézés:
|
1. |
Az 1829/2003/EK rendelet 13. cikkének (1) bekezdésében és 25. cikkének (2) bekezdésében, illetve az 1830/2003/EK rendelet 4. cikkének (6) bekezdésében megállapított címkézési előírások alkalmazásában a „szervezet neve”: „kukorica”. |
|
2. |
Az e melléklet b) pontjának 1. alpontjában említett termékek kivételével a géntechnológiával módosított 4114-es kukoricát tartalmazó vagy abból álló termékek címkéjén, valamint az ilyen termékeket kísérő dokumentumokban fel kell tüntetni a „nem termesztésre” feliratot. |
d) Kimutatási módszer:
|
1. |
Eseményspecifikus, valós idejű kvantitatív PCR-alapú módszer a géntechnológiával módosított DP-ØØ4114-3 kukorica kimutatására. |
|
2. |
A hitelesítést az 1829/2003/EK rendelet alapján létrehozott uniós referencialaboratórium végezte; a hitelesítési jelentés az alábbi internetcímen olvasható: http://gmo-crl.jrc.ec.europa.eu/StatusOfDossiers.aspx |
|
3. |
Referenciaanyag: ERM®-BF439, amely hozzáférhető az Európai Bizottság Közös Kutatóközpontján (JRC) keresztül a https://ec.europa.eu/jrc/en/reference-materials/catalogue/ internetcímen. |
e) Egyedi azonosító:
DP-ØØ4114-3
f) A Biológiai Sokféleség Egyezmény Biológiai Biztonságról szóló Cartagena Jegyzőkönyvének II. melléklete szerint előírt információ:
[A Biológiai Biztonság Kérdéseiben illetékes Információs Központ, a bejegyzés azonosító száma: értesítést követően kerül bejegyzésre a géntechnológiával módosított élelmiszerek és takarmányok nyilvántartásába.]
g) A termékek forgalomba hozatalára, felhasználására vagy kezelésére vonatkozó feltételek vagy korlátozások:
Nem szükségesek.
h) A környezeti hatásokra vonatkozó felügyeleti terv
A 2001/18/EK irányelv VII. mellékletének megfelelő, a környezeti hatások figyelemmel kísérését célzó terv.
[Hivatkozás: a géntechnológiával módosított élelmiszerek és takarmányok nyilvántartásában közzétett terv.]
i) Forgalomba hozatal utáni felügyeleti követelmények az emberi fogyasztásra szánt élelmiszerek felhasználása tekintetében:
Nem szükségesek.
Megjegyzés: idővel szükségessé válhat a vonatkozó dokumentumok internetes hivatkozásainak módosítása. Ezeket a módosításokat a géntechnológiával módosított élelmiszerek és takarmányok nyilvántartásának frissítése útján teszik közzé.
|
2.8.2019 |
HU |
Az Európai Unió Hivatalos Lapja |
L 204/69 |
A BIZOTTSÁG (EU) 2019/1305 VÉGREHAJTÁSI HATÁROZATA
(2019. július 26.)
a géntechnológiával módosított Bt11 × MIR162 × 1507 × GA21 kukoricát, valamint annak Bt11 × MIR162 × 1507, MIR162 × 1507 × GA21 és MIR162 × 1507 alkombinációit tartalmazó, abból álló vagy abból előállított termékek forgalomba hozatalának az 1829/2003/EK európai parlamenti és tanácsi rendelet szerinti engedélyezéséről
(az értesítés a C(2019) 5502 számú dokumentummal történt)
(Csak a holland és a francia nyelvű szöveg hiteles)
(EGT-vonatkozású szöveg)
AZ EURÓPAI BIZOTTSÁG,
tekintettel az Európai Unió működéséről szóló szerződésre,
tekintettel a géntechnológiával módosított élelmiszerekről és takarmányokról szóló, 2003. szeptember 22-i 1829/2003/EK európai parlamenti és tanácsi rendeletre (1) és különösen annak 7. cikke (3) bekezdésére és 19. cikke (3) bekezdésére,
mivel:
|
(1) |
2010. augusztus 10-én a Syngenta Crop Protection AG – a Syngenta Crop Protection NV/SA kapcsolt vállalkozáson keresztül – az 1829/2003/EK rendelet 5. és 17. cikkével összhangban kérelmet nyújtott be Németország illetékes nemzeti hatóságához a géntechnológiával módosított Bt11 × MIR162 × 1507 × GA21 kukoricát tartalmazó, abból álló vagy abból előállított élelmiszerek, élelmiszer-összetevők és takarmányok forgalomba hozatalára vonatkozóan (a továbbiakban: a kérelem). A kérelem kiterjedt továbbá a géntechnológiával módosított Bt11 × MIR162 × 1507 × GA21 kukoricát tartalmazó vagy abból álló termékeknek a termesztéstől eltérő felhasználás céljából, nem élelmiszerként vagy takarmányként történő forgalomba hozatalára is. |
|
(2) |
Az 1829/2003/EK rendelet 5. cikke (5) bekezdésének és 17. cikke (5) bekezdésének megfelelően a kérelem tartalmazta a 2001/18/EK európai parlamenti és tanácsi irányelv (2) II. mellékletében megállapított elvekkel összhangban végzett kockázatértékelésre vonatkozó információkat és következtetéseket, valamint az említett irányelv III. és IV. mellékletében előírt információkat. A kérelem magában foglalta továbbá a 2001/18/EK irányelv VII. mellékletének megfelelő, a környezeti hatásokra vonatkozó felügyeleti tervet is. |
|
(3) |
2013. július 30-án a Syngenta kiterjesztette a kérelmet a Bt11 × MIR162 × 1507 × GA21 kukoricát alkotó egyszeres genetikai események mind a tíz alkombinációjára. |
|
(4) |
2016. március 31-én a Syngenta naprakésszé tette a kérelmet, kizárva belőle azokat az alkombinációkat, amelyekre egy másik kérelem terjedt ki: az (EU) 2016/1685 bizottsági végrehajtási határozattal (3) engedélyezett Bt11 × MIR162 × GA21, Bt11 × MIR162, Bt11 × GA21 és MIR162 × GA21 alkombinációkat és az (EU) 2017/1209 bizottsági végrehajtási határozattal (4) engedélyezett Bt11 × 1507 × GA21, Bt11 × 1507 és1507 × GA21 alkombinációkat. A kérelem hatálya ezért a Bt11 × MIR162 × 1507, MIR162 × 1507 × GA21 és MIR162 × 1507 alkombinációkra terjed ki. |
|
(5) |
2018. július 11-én az Európai Élelmiszerbiztonsági Hatóság (a továbbiakban: Hatóság) az 1829/2003/EK rendelet (5) 6. és 18. cikkével összhangban kedvező véleményt adott ki. A Hatóság arra a következtetésre jutott, hogy a kérelem alkalmazási körében a kérelemben leírt, géntechnológiával módosított Bt11 × MIR162 × 1507 × GA21 kukorica ugyanolyan biztonságos, mint a géntechnológiával nem módosított referencianövény, és tápanyagtartalmát tekintve azzal egyenértékű. A kérelem hatálya alá tartozó három alkombináció tekintetében a Hatóság arra a következtetésre jutott, hogy azok várhatóan ugyanolyan biztonságosak, mint a Bt11, MIR162, 1507 és GA21 egyszeres genetikai események, a korábban értékelt alkombinációk, valamint a négyszeres genetikai eseménnyel létrehozott Bt11 × MIR162 × 1507 × GA21 kukorica. |
|
(6) |
Véleményében a Hatóság figyelembe vette az illetékes nemzeti hatóságokkal az 1829/2003/EK rendelet 6. cikkének (4) bekezdésében és 18. cikkének (4) bekezdésében előírtak szerint folytatott konzultáció keretében a tagállamok által felvetett kérdéseket és aggályokat. |
|
(7) |
A Hatóság továbbá arra a következtetésre jutott, hogy a kérelmező által benyújtott, általános megfigyelési tervből álló, a környezeti hatásokra vonatkozó felügyeleti terv összhangban áll a termékek tervezett felhasználásával. |
|
(8) |
E következtetésekre tekintettel engedélyezni kell a géntechnológiával módosított Bt11 × MIR162 × 1507 × GA21 kukoricát és a Bt11 × MIR162 × 1507, MIR162 × 1507 × GA21 és MIR162 × 1507 három kukorica-alkombinációt tartalmazó, abból álló vagy abból előállított termékek forgalomba hozatalát a kérelemben felsorolt felhasználási célokra. |
|
(9) |
A 65/2004/EK bizottsági rendelettel (6) összhangban minden egyes, e határozat által érintett, géntechnológiával módosított szervezethez egyedi azonosítót kell rendelni. |
|
(10) |
A Hatóság által kiadott vélemény alapján úgy tűnik, hogy az e határozat hatálya alá tartozó termékekre vonatkozóan nincs szükség különleges címkézési előírásokra azokon kívül, amelyeket az 1829/2003/EK rendelet 13. cikkének (1) bekezdése és 25. cikkének (2) bekezdése, valamint az 1830/2003/EK európai parlamenti és tanácsi rendelet (7) 4. cikkének (6) bekezdése meghatároz. Annak biztosítására azonban, hogy e termékeket továbbra is az e határozattal megadott engedélynek megfelelően használják fel, az ilyen termékek címkézésének – az élelmiszereken kívül – egyértelműen utalnia kell arra, hogy a szóban forgó termékeket nem termesztésre szánják. |
|
(11) |
A környezeti hatásokra vonatkozó felügyeleti tervben meghatározott tevékenységek végrehajtásáról és eredményeiről történő beszámolásként az engedély jogosultjának a 2009/770/EK bizottsági határozatban (8) előírt egységes jelentéstételi formanyomtatványra vonatkozó követelményeknek megfelelő éves jelentéseket kell benyújtania. |
|
(12) |
A Hatóság véleménye nem indokolja semmilyen, az élelmiszerek és takarmányok forgalomba hozatalára, felhasználására és kezelésére irányuló különleges feltétel vagy korlátozás bevezetését, beleértve a forgalomba hozatal utáni felügyeleti követelményeket is, sem pedig az 1829/2003/EK rendelet 6. cikke (5) bekezdésének e) pontjában és 18. cikke (5) bekezdésének e) pontjában előírt, a különleges ökológiai rendszerek/környezet és/vagy földrajzi területek védelmét célzó különleges feltételek bevezetését. |
|
(13) |
A termékek engedélyezésével kapcsolatos minden releváns információt be kell jegyezni a géntechnológiával módosított élelmiszerek és takarmányok 1829/2003/EK rendelet 28. cikkének (1) bekezdése szerinti közösségi nyilvántartásába. |
|
(14) |
E határozatról a Biológiai Biztonság Kérdéseiben illetékes Információs Központon keresztül értesíteni kell a Biológiai Sokféleség Egyezmény Biológiai Biztonságról szóló Cartagena Jegyzőkönyvének részes feleit, az 1946/2003/EK európai parlamenti és tanácsi rendelet (9) 9. cikkének (1) bekezdése és 15. cikke (2) bekezdésének c) pontja szerint. |
|
(15) |
A Növények, Állatok, Élelmiszerek és Takarmányok Állandó Bizottsága nem nyilvánított véleményt az elnöke által kitűzött határidőn belül. Mivel e végrehajtási jogi aktus elfogadását szükségesnek ítélték, az elnök azt további megvitatás céljából a fellebbviteli bizottság elé terjesztette. A fellebbviteli bizottság nem nyilvánított véleményt, |
ELFOGADTA EZT A HATÁROZATOT:
1. cikk
Géntechnológiával módosított szervezetek és egyedi azonosítók
A 65/2004/EK rendeletnek megfelelően az e határozat mellékletének b) pontjában meghatározott, géntechnológiával módosított kukorica az alábbi egyedi azonosítókat kapja:
|
a) |
a géntechnológiával módosított Bt11 × MIR162 × 1507 × GA21 kukorica (Zea mays L.) egyedi azonosítója: SYN-BTØ11-1 × SYN-IR162-4 × DAS-Ø15Ø7-1 × MON-ØØØ21-9; |
|
b) |
a géntechnológiával módosított Bt11 × MIR162 × 1507 kukorica (Zea mays L.) egyedi azonosítója: SYN-BTØ11-1 × SYN-IR162-4 × DAS-Ø15Ø7-1; |
|
c) |
a géntechnológiával módosított MIR162 × 1507 × GA21 kukorica (Zea mays L.) egyedi azonosítója: SYN-IR162-4 × DAS-Ø15Ø7-1 × MON-ØØØ21-9; |
|
d) |
a géntechnológiával módosított MIR162 × 1507 kukorica (Zea mays L.) egyedi azonosítója: SYN-IR162-4 × DAS-Ø15Ø7-1. |
2. cikk
Engedélyezés
Az 1829/2003/EK rendelet 4. cikke (2) bekezdésének és 16. cikke (2) bekezdésének alkalmazásában a Bizottság az e határozatban megállapított feltételeknek megfelelően engedélyezi a következő termékeket:
|
a) |
az 1. cikkben felsorolt, géntechnológiával módosított kukoricát tartalmazó, abból álló vagy abból előállított élelmiszerek és élelmiszer-összetevők; |
|
b) |
az 1. cikkben felsorolt, géntechnológiával módosított kukoricát tartalmazó, abból álló vagy abból előállított takarmányok; |
|
c) |
az 1. cikkben felsorolt, géntechnológiával módosított kukoricát tartalmazó vagy abból álló termékek az a) és b) pontban említettektől eltérő felhasználásra, a termesztés kivételével. |
3. cikk
Címkézés
(1) Az 1829/2003/EK rendelet 13. cikkének (1) bekezdésében és 25. cikkének (2) bekezdésében, illetve az 1830/2003/EK rendelet 4. cikkének (6) bekezdésében megállapított címkézési előírások alkalmazásában a „szervezet neve”: „kukorica”.
(2) A 2. cikk a) pontjában említett termékek kivételével az 1. cikkben felsorolt, géntechnológiával módosított kukoricát tartalmazó vagy abból álló termékek címkéjén, valamint az ilyen termékeket kísérő dokumentumokon fel kell tüntetni a „nem termesztésre” feliratot.
4. cikk
Kimutatási módszer
Az 1. cikkben felsorolt, géntechnológiával módosított kukorica kimutatására a melléklet d) pontjában meghatározott módszert kell alkalmazni.
5. cikk
A környezeti hatások felügyelete
(1) Az engedély jogosultja gondoskodik a melléklet h) pontjában meghatározott, a környezeti hatásokra vonatkozó felügyeleti terv kidolgozásáról és végrehajtásáról.
(2) Az engedély jogosultja a 2009/770/EK határozatnak megfelelő éves jelentéseket nyújt be a Bizottsághoz a felügyeleti tervben meghatározott tevékenységek végrehajtásáról és eredményeiről.
6. cikk
Közösségi nyilvántartás
Az e határozat mellékletében szereplő információkat be kell jegyezni a géntechnológiával módosított élelmiszerek és takarmányok 1829/2003/EK rendelet 28. cikkének (1) bekezdése szerinti közösségi nyilvántartásába.
7. cikk
Az engedély jogosultja
Az engedély jogosultja a Syngenta Crop Protection NV/SA (Belgium) által képviselt Syngenta Crop Protection AG (Svájc).
8. cikk
Érvényesség
Ez a határozat az értesítés napjától számított tíz évig alkalmazandó.
9. cikk
Címzett
E határozat címzettje a Syngenta Crop Protection NV/SA, Avenue Louise, 489, 1050 Brussels, Belgium.
Kelt Brüsszelben, 2019. július 26-án.
a Bizottság részéről
Vytenis ANDRIUKAITIS
a Bizottság tagja
(1) HL L 268., 2003.10.18., 1. o.
(2) Az Európai Parlament és a Tanács 2001/18/EK irányelve (2001. március 12.) a géntechnológiával módosított szervezetek környezetbe történő szándékos kibocsátásáról és a 90/220/EGK tanácsi irányelv hatályon kívül helyezéséről (HL L 106., 2001.4.17., 1. o.).
(3) A Bizottság (EU) 2016/1685 végrehajtási határozata (2016. szeptember 16.) a géntechnológiával módosított Bt11 × MIR162 × MIR604 × GA21 kukoricát tartalmazó, abból álló vagy abból előállított termékek, valamint a Bt11, MIR162, MIR604 és GA21 génmódosítási események közül kettőt vagy hármat ötvöző, géntechnológiával módosított kukoricák forgalomba hozataláról, továbbá a 2010/426/EU, a 2011/892/EU, a 2011/893/EU és a 2011/894/EU határozat hatályon kívül helyezéséről (HL L 254., 2016.9.20., 22. o.).
(4) A Bizottság (EU) 2017/1209 végrehajtási határozata (2017. július 4.) a géntechnológiával módosított Bt11 × 59122 × MIR604 × 1507 × GA21 kukoricát és a géntechnológiával módosított, a Bt11, az 59122, a MIR604, az 1507 és a GA21 génmódosítási események közül kettőt, hármat vagy négyet ötvöző kukoricát tartalmazó, abból álló vagy abból előállított termékek forgalomba hozatalának a géntechnológiával módosított élelmiszerekről és takarmányokról szóló 1829/2003/EK európai parlamenti és tanácsi rendelet szerinti engedélyezéséről (HL L 173., 2017.7.6., 28. o.).
(5) Az EFSA GMO-testülete (az EFSA géntechnológiával módosított szervezetekkel foglalkozó tudományos testülete), 2018. Scientific Opinion on the assessment of genetically modified maize Bt11 x MIR162 x 1507 x GA21 and three subcombinations independently of their origin, for food and feed uses under Regulation (EC) No 1829/2003 (Tudományos szakvélemény a géntechnológiával módosított Bt11 x MIR162 x 1507 x GA21 kukoricának és három alkombinációjának – azok származásától függetlenül – élelmiszerként és takarmányként való felhasználás céljából történő, az 1829/2003/EK rendelet szerinti értékeléséről; (kérelem: EFSA-GMO-DE-2010-86). EFSA Journal 2018;16(7):5309.
(6) A Bizottság 65/2004/EK rendelete (2004. január 14.) a géntechnológiával módosított szervezetek egyedi azonosítóinak kialakítására és hozzárendelésére szolgáló rendszer létrehozásáról (HL L 10., 2004.1.16., 5. o.).
(7) Az Európai Parlament és a Tanács 1830/2003/EK rendelete (2003. szeptember 22.) a géntechnológiával módosított szervezetek nyomonkövethetőségéről és címkézéséről, és a géntechnológiával módosított szervezetekből előállított élelmiszer- és takarmánytermékek nyomonkövethetőségéről, valamint a 2001/18/EK irányelv módosításáról (HL L 268., 2003.10.18., 24. o.).
(8) A Bizottság 2009/770/EK határozata (2009. október 13.) a 2001/18/EK európai parlamenti és tanácsi irányelv alapján a géntechnológiával módosított szervezetek környezetbe történő szándékos kibocsátásával, illetve forgalomba hozatalra szánt termékekben vagy termékekként való felhasználásával kapcsolatos felügyeleti eredmények ismertetésére szolgáló egységes jelentéstételi formanyomtatványok létrehozásáról (HL L 275., 2009.10.21., 9. o.).
(9) Az Európai Parlament és a Tanács 1946/2003/EK rendelete (2003. július 15.) a géntechnológiával módosított szervezetek országhatárokon történő átviteléről (HL L 287., 2003.11.5., 1. o.).
MELLÉKLET
a) Kérelmező és az engedély jogosultja:
|
Név |
: |
Syngenta Crop Protection AG |
|
Cím |
: |
Schwarzwaldallee 215, CH-4058 Basel, Svájc |
Képviseli: Syngenta Crop Protection NV/SA, 489, Avenue Louise, 1050 Brüsszel, Belgium.
b) A termékek megnevezése és leírása:
|
1. |
az e) pontban felsorolt, géntechnológiával módosított kukoricát (Zea mays L.) tartalmazó, abból álló vagy abból előállított élelmiszerek és élelmiszer-összetevők; |
|
2. |
az e) pontban felsorolt, géntechnológiával módosított kukoricát (Zea mays L.) tartalmazó, abból álló vagy abból előállított takarmányok; |
|
3. |
az e) pontban felsorolt, géntechnológiával módosított kukoricát tartalmazó vagy abból álló termékek az 1. és 2. pontban említettektől eltérő felhasználásra, a termesztés kivételével. |
A géntechnológiával módosított SYN-BTØ11-1 kukorica a Lepidoptera rendbe tartozó egyes kártevőkkel szembeni védelmet biztosító Cry1Ab fehérjét és a glufozinát-ammónium-alapú gyomirtó szerekkel szembeni ellenállást biztosító PAT fehérjét expresszálja.
A géntechnológiával módosított SYN-IR162-4 kukorica a Lepidoptera rendbe tartozó egyes kártevőkkel szemben védelmet biztosító Vip3Aa20 fehérjét és a szelekciós markerként használt PMI fehérjét expresszálja.
A géntechnológiával módosított DAS-Ø15Ø7-1 kukorica a Lepidoptera rendbe tartozó egyes kártevőkkel szembeni védelmet biztosító Cry1F fehérjét és a glufozinát-ammónium-alapú gyomirtó szerekkel szembeni ellenállást biztosító PAT fehérjét expresszálja.
A géntechnológiával módosított MON-ØØØ21-9 kukorica a glifozátalapú gyomirtókkal szemben toleranciát biztosító mEPSPS fehérjét expresszálja.
c) Címkézés:
|
1. |
Az 1829/2003/EK rendelet 13. cikkének (1) bekezdésében és 25. cikkének (2) bekezdésében, illetve az 1830/2003/EK rendelet 4. cikkének (6) bekezdésében megállapított címkézési előírások alkalmazásában a „szervezet neve”: „kukorica”. |
|
2. |
Az e melléklet b) pontjának 1. alpontjában említett termékek kivételével az e) pontban meghatározott kukoricát tartalmazó vagy abból álló termékek címkéjén, valamint az ilyen termékeket kísérő dokumentumokon fel kell tüntetni a „nem termesztésre” feliratot. |
d) Kimutatási módszer:
|
1. |
A Bt11 × MIR162 × MON 1507 × GA21 kukoricára vonatkozó kvantitatív, eseményspecifikus PCR-kimutatási módszereket a géntechnológiával módosított SYN-BTØ11-1, SYN-IR162-4, DAS-Ø15Ø7-1 és MON-ØØØ21-9 kukoricára hitelesített módszerek jelentik. |
|
2. |
A hitelesítést az 1829/2003/EK rendelet alapján létrehozott uniós referencialaboratórium végezte; a hitelesítési jelentés az alábbi internetcímen olvasható: http://gmo-crl.jrc.ec.europa.eu/statusofdossiers.aspx; |
|
3. |
Referenciaanyag: ERM®-BF412 (a SYN-BTØ11-1 esetében) és ERM®-BF418 (a DAS-Ø15Ø7-1 esetében), amelyek hozzáférhetők az Európai Bizottság Közös Kutatóközpontján (JRC) keresztül a https://ec.europa.eu/jrc/en/reference-materials/catalogue/ internetcímen, továbbá AOCS 1208-A és AOCS 0407-A (a SYN-IR162-4 esetében), AOCS 0407-A és AOCS 0407-B (a MON-ØØØ21-9 esetében), amelyekhez az American Oil Chemists Society-n keresztül a https://www.aocs.org/crm#maize címen lehet hozzáférni. |
e) Egyedi azonosítók:
SYN-BTØ11-1 × SYN-IR162-4 × DAS-Ø15Ø7-1 × MON-ØØØ21-9;
SYN-BTØ11-1 × SYN-IR162-4 × DAS-Ø15Ø7-1;
SYN-IR162-4 × DAS-Ø15Ø7-1 × MON-ØØØ21-9;
SYN-IR162-4 × DAS-Ø15Ø7-1.
f) A Biológiai Sokféleség Egyezmény Biológiai Biztonságról szóló Cartagena Jegyzőkönyvének II. melléklete szerint előírt információ:
[A Biológiai Biztonság Kérdéseiben illetékes Információs Központ, a bejegyzés azonosító száma: értesítést követően bejegyezésre kerül a géntechnológiával módosított élelmiszerek és takarmányok közösségi nyilvántartásába].
g) A termékek forgalomba hozatalára, felhasználására vagy kezelésére vonatkozó feltételek vagy korlátozások:
Nem szükségesek.
h) A környezeti hatásokra vonatkozó felügyeleti terv
A 2001/18/EK irányelv VII. mellékletének megfelelő, a környezeti hatások figyelemmel kísérését célzó terv.
[Hivatkozás: a géntechnológiával módosított élelmiszerek és takarmányok közösségi nyilvántartásában közzétett terv]
i) Forgalomba hozatal utáni felügyeleti követelmények az emberi fogyasztásra szánt élelmiszerek felhasználása tekintetében:
Nem szükségesek.
Megjegyzés: idővel szükségessé válhat a vonatkozó dokumentumok internetes hivatkozásainak módosítása. Ezeket a módosításokat a géntechnológiával módosított élelmiszerek és takarmányok közösségi nyilvántartásának frissítése útján teszik közzé.
|
2.8.2019 |
HU |
Az Európai Unió Hivatalos Lapja |
L 204/75 |
A BIZOTTSÁG (EU) 2019/1306 VÉGREHAJTÁSI HATÁROZATA
(2019. július 26.)
a géntechnológiával módosított 1507 × NK603 (DAS-Ø15Ø7-1 × MON-ØØ6Ø3-6) kukoricát tartalmazó, abból álló vagy abból előállított termékek forgalomba hozatalára vonatkozó engedély 1829/2003/EK európai parlamenti és tanácsi rendelet szerinti megújításáról
(az értesítés a C(2019) 5503. számú dokumentummal történt)
(Csak a holland és a francia nyelvű szöveg hiteles)
(EGT-vonatkozású szöveg)
AZ EURÓPAI BIZOTTSÁG,
tekintettel az Európai Unió működéséről szóló szerződésre,
tekintettel a géntechnológiával módosított élelmiszerekről és takarmányokról szóló, 2003. szeptember 22-i 1829/2003/EK európai parlamenti és tanácsi rendeletre (1) és különösen annak 11. cikke (3) bekezdésére és 23. cikke (3) bekezdésére,
mivel:
|
(1) |
A 2007/703/EK bizottsági határozat (2) engedélyezte a géntechnológiával módosított 1507 × NK603 kukoricát (a továbbiakban: 1507 × NK603 kukorica) tartalmazó, abból álló vagy abból előállított élelmiszerek és takarmányok forgalomba hozatalát. Az engedély hatálya kiterjed az 1507 × NK603 kukoricát tartalmazó vagy abból álló – élelmiszeren és takarmányon kívüli – olyan termékek forgalomba hozatalára is, amelyeket – a termesztésen kívül – ugyanarra a felhasználásra szánnak, mint bármely más kukoricát. |
|
(2) |
2016. október 20-án a Pioneer Overseas Corporation a Pioneer Hi-Bred International, Inc. nevében és a Dow AgroSciences Europe a Dow AgroSciences LLC nevében az 1829/2003/EK rendelet 11. és 23. cikkének megfelelően közös kérelmet nyújtott be a Bizottsághoz a szóban forgó engedély megújítása iránt. |
|
(3) |
2018. július 25-én az Európai Élelmiszerbiztonsági Hatóság (a továbbiakban: a Hatóság) az 1829/2003/EK rendelet (3) 6. és 18. cikkével összhangban kedvező véleményt adott ki. Ebben a Hatóság arra a következtetésre jutott, hogy a megújítás iránti kérelem nem vetett fel olyan, új veszélyekre, az expozíció módosulására vagy tudományos bizonytalanságra vonatkozó bizonyítékokat, amelyek megváltoztatnák a Hatóság által az 1507 × NK603 kukoricára vonatkozóan 2006-ban elfogadott eredeti kockázatértékelés (4) következtetéseit. |
|
(4) |
2018. július 25-i véleményében a Hatóság figyelembe vette az illetékes nemzeti hatóságokkal az 1829/2003/EK rendelet 6. cikkének (4) bekezdésében és 18. cikkének (4) bekezdésében előírtak szerint folytatott konzultáció keretében a tagállamok által felvetett összes kérdést és aggályt. |
|
(5) |
A Hatóság továbbá arra a következtetésre jutott, hogy a kérelmezők által benyújtott, általános megfigyelési tervből álló, a környezeti hatásokra vonatkozó felügyeleti terv összhangban áll a termékek tervezett felhasználásával. |
|
(6) |
E következtetéseket figyelembe véve a géntechnológiával módosított 1507 × NK603 kukoricát tartalmazó, abból álló vagy abból előállított élelmiszerek és takarmányok, valamint az abból álló, vagy azt tartalmazó, nem élelmiszerként vagy takarmányként való felhasználásra szánt termékek forgalomba hozatalára vonatkozó engedélyt a termesztés kivételével meg kell újítani. |
|
(7) |
2018. szeptember 13-án kelt levelében a Dow AgroSciences Europe az Egyesült Királyság Európai Unióból való kilépésével összefüggésben arra kérte a Bizottságot, hogy az amerikai egyesült államokbeli Dow AgroSciences LLC uniós képviselője a franciaországi székhelyű Dow AgroSciences Distribution S.A.S. legyen. A Dow AgroSciences Distribution S.A.S. 2018. szeptember 7-én kelt levelében megerősítette hozzájárulását. |
|
(8) |
2018. október 12-i levelében a Dow AgroSciences LLC is megerősítette, hogy hozzájárulását adja ahhoz, hogy a Dow AgroSciences Distribution S.A.S. képviselje, és tisztázta, hogy a Mycogen Seeds a Dow AgroSciences LLC leányvállalata. |
|
(9) |
A 65/2004/EK bizottsági rendelet (5) értelmében a géntechnológiával módosított 1507 × NK603 kukoricához annak eredeti engedélyezésekor egyedi azonosítót rendeltek. Továbbra is ezt az egyedi azonosítót kell használni. |
|
(10) |
A Hatóság által kiadott vélemény alapján úgy tűnik, hogy az e határozat hatálya alá tartozó termékekre vonatkozóan nincs szükség különleges címkézési előírásokra azokon kívül, amelyeket az 1829/2003/EK rendelet 13. cikkének (1) bekezdése és 25. cikkének (2) bekezdése, valamint az 1830/2003/EK európai parlamenti és tanácsi rendelet (6) 4. cikkének (6) bekezdése meghatároz. Annak biztosítására azonban, hogy az 1507 × NK603 kukoricát tartalmazó vagy abból álló termékeket továbbra is az e határozattal megadott engedélynek megfelelően használják fel, az ilyen termékek címkézésének – az élelmiszereken kívül – egyértelműen utalnia kell arra, hogy a szóban forgó termékeket nem szabad termesztésre használni. |
|
(11) |
Az engedély jogosultjainak együttes éves jelentéseket kell benyújtaniuk a felügyeleti tervben meghatározott tevékenységek végrehajtásáról és eredményeiről. Ezeket az eredményeket a 2009/770/EK bizottsági határozatban (7) előírt követelményeknek megfelelően kell benyújtani. |
|
(12) |
A Hatóság véleménye nem indokolja semmilyen, az élelmiszerek és takarmányok forgalomba hozatalára, felhasználására és kezelésére irányuló különleges feltétel vagy korlátozás bevezetését, beleértve a forgalomba hozatal utáni felügyeleti követelményeket is, sem pedig az 1829/2003/EK rendelet 6. cikke (5) bekezdésének e) pontjában és 18. cikke (5) bekezdésének e) pontjában előírt, a különleges ökológiai rendszerek/környezet vagy földrajzi területek védelmét célzó különleges feltételek bevezetését. |
|
(13) |
A termékek engedélyezésével kapcsolatos minden releváns információt be kell jegyezni a géntechnológiával módosított élelmiszerek és takarmányok 1829/2003/EK rendelet 28. cikkének (1) bekezdése szerinti közösségi nyilvántartásába. |
|
(14) |
E határozatról a Biológiai Biztonság Kérdéseiben illetékes Információs Központon keresztül értesíteni kell a Biológiai Sokféleség Egyezmény Biológiai Biztonságról szóló Cartagena Jegyzőkönyvének részes feleit, az 1946/2003/EK európai parlamenti és tanácsi rendelet (8) 9. cikkének (1) bekezdése és 15. cikke (2) bekezdésének c) pontja szerint. |
|
(15) |
A Növények, Állatok, Élelmiszerek és Takarmányok Állandó Bizottsága nem nyilvánított véleményt az elnöke által kitűzött határidőn belül. Mivel e végrehajtási jogi aktus elfogadására volt szükség, az elnök azt további megvitatás céljából a fellebbviteli bizottság elé terjesztette. A fellebbviteli bizottság nem nyilvánított véleményt, |
ELFOGADTA EZT A HATÁROZATOT:
1. cikk
Géntechnológiával módosított szervezet és egyedi azonosító
A 65/2004/EK rendeletnek megfelelően az e határozat mellékletének b) pontjában meghatározott, géntechnológiával módosított 1507 × NK603 kukorica (Zea mays L.) a DAS-Ø15Ø7-1 × MON-ØØ6Ø3-6 egyedi azonosítót kapja.
2. cikk
Az engedély megújítása
A következő termékek forgalomba hozatalára vonatkozó engedély az e határozatban meghatározott feltételeknek megfelelően megújításra kerül:
|
a) |
géntechnológiával módosított 1507 × NK603 kukoricát tartalmazó, abból álló vagy abból előállított élelmiszerek és élelmiszer-összetevők; |
|
b) |
géntechnológiával módosított 1507 × NK603 kukoricát tartalmazó, abból álló vagy abból előállított takarmányok; |
|
c) |
géntechnológiával módosított 1507 × NK603 kukoricát tartalmazó vagy abból álló termékek az e cikk a) és b) pontjában említettektől eltérő felhasználásra, a termesztés kivételével. |
3. cikk
Címkézés
(1) Az 1829/2003/EK rendelet 13. cikkének (1) bekezdésében és 25. cikkének (2) bekezdésében, illetve az 1830/2003/EK rendelet 4. cikkének (6) bekezdésében megállapított címkézési előírások alkalmazásában a „szervezet neve”„kukorica”.
(2) A 2. cikk a) pontjában említett termékek kivételével a géntechnológiával módosított 1507 × NK603 kukoricát tartalmazó vagy abból álló termékek címkéjén, valamint az ilyen termékeket kísérő dokumentumokon fel kell tüntetni a „nem termesztésre” feliratot.
4. cikk
Kimutatási módszer
A géntechnológiával módosított 1507 × NK603 kukorica kimutatására a melléklet d) pontjában meghatározott módszert kell alkalmazni.
5. cikk
A környezeti hatásokra vonatkozó felügyeleti terv
(1) Az engedély jogosultjai kötelesek gondoskodni a melléklet h) pontjában meghatározott, a környezeti hatásokra vonatkozó felügyeleti terv kidolgozásáról és végrehajtásáról.
(2) Az engedély jogosultjai a 2009/770/EK határozatban megadott mintának megfelelő együttes éves jelentést nyújtanak be a Bizottsághoz a felügyeleti tervben meghatározott tevékenységek végrehajtásáról és eredményeiről.
6. cikk
Közösségi nyilvántartás
Az e határozat mellékletében szereplő információkat be kell jegyezni a géntechnológiával módosított élelmiszerek és takarmányok 1829/2003/EK rendelet 28. cikkének (1) bekezdése szerinti közösségi nyilvántartásába.
7. cikk
Az engedély jogosultjai
(1) Az engedély jogosultjai:
|
a) |
a Pioneer Overseas Corporation (Belgium) által képviselt Pioneer Hi-Bred International, Inc. (Egyesült Államok); |
|
b) |
a Dow AgroSciences Distribution S.A.S., (Franciaország) által képviselt Dow AgroSciences LLC (Egyesült Államok). |
(2) Az engedély mindkét jogosultja eleget tesz az e határozatban és az 1829/2003/EK rendeletben az engedély jogosultjai számára előírt kötelezettségeknek.
8. cikk
Érvényesség
Ez a határozat az értesítés napjától számított tíz évig alkalmazandó.
9. cikk
Címzettek
E határozat címzettjei a következők:
|
a) |
Pioneer Overseas Corporation, Avenue des Arts 44, B-1040 Brüsszel, Belgium; valamint |
|
b) |
Dow AgroSciences Distribution S.A.S., 6, rue Jean Pierre Timbaud, 78180 Montigny-le-Bretonneux, Franciaország. |
Kelt Brüsszelben, 2019. július 26-án.
a Bizottság részéről
Vytenis ANDRIUKAITIS
a Bizottság tagja
(1) HL L 268., 2003.10.18., 1. o.
(2) A Bizottság 2007/703/EK határozata (2007. október 24.) a géntechnológiával módosított 1507 × NK603 kukoricát (DAS-Ø15Ø7-1 × MON-ØØ6Ø3-6) tartalmazó, abból álló vagy abból előállított termékek forgalomba hozatalának az 1829/2003/EK európai parlamenti és tanácsi rendelet szerinti engedélyezéséről (HL L 285., 2007.10.31., 47. o.).
(3) Az EFSA GMO-testülete, 2018. Scientific opinion on the assessment of genetically modified maize 1507 × NK603 for renewal of authorisation under Regulation (EC) No 1829/2003 (application EFSA-GMO-RX-008) (Tudományos szakvélemény a géntechnológiával módosított 1507 × NK603 kukoricának az arra vonatkozó engedély 1829/2003/EK rendelet szerinti megújítása céljából elvégzett értékeléséről; kérelem: EFSA-GMO-RX-008). EFSA Journal 2018;16(7): 5347.
(4) Opinion of the Scientific Panel on Genetically Modified Organisms on an application (Reference EFSA-GMO-UK-2004-05) for the placing on the market of insect-protected and glufosinate and glyphosate-tolerant genetically modified maize 1507 × NK603, for food and feed uses, import and processing under Regulation (EC) No 1829/2003 from Pioneer Hi-Bred and Mycogen Seeds. (A géntechnológiával módosított szervezetek tudományos testületének véleménye a Pioneer Hi-Bred és a Mycogen Seeds által a rovarokkal, a glufozináttal és a glifozáttal szemben ellenálló, géntechnológiával módosított 1507 × NK603 kukorica élelmiszerként és takarmányként való felhasználás céljából történő forgalomba hozatalára, valamint behozatalára és feldolgozására vonatkozó engedély iránt az 1829/2003/EK rendelettel összhangban benyújtott kérelemről [hiv. sz.: EFSA-GMO-UK-2004-05]). The EFSA Journal 2006;4(5): 355.
(5) A Bizottság 65/2004/EK rendelete (2004. január 14.) a géntechnológiával módosított szervezetek egyedi azonosítóinak kialakítására és hozzárendelésére szolgáló rendszer létrehozásáról (HL L 10., 2004.1.16., 5. o.).
(6) Az Európai Parlament és a Tanács 1830/2003/EK rendelete (2003. szeptember 22.) a géntechnológiával módosított szervezetek nyomonkövethetőségéről és címkézéséről, és a géntechnológiával módosított szervezetekből előállított élelmiszer- és takarmánytermékek nyomonkövethetőségéről, valamint a 2001/18/EK irányelv módosításáról (HL L 268., 2003.10.18., 24. o.).
(7) A Bizottság 2009/770/EK (2009. október 13.) határozata a 2001/18/EK európai parlamenti és tanácsi irányelv alapján a géntechnológiával módosított szervezetek környezetbe történő szándékos kibocsátásával, illetve forgalomba hozatalra szánt termékekben vagy termékekként való felhasználásával kapcsolatos felügyeleti eredmények ismertetésére szolgáló egységes jelentéstételi formanyomtatványok létrehozásáról (HL L 275., 2009.10.21., 9. o.).
(8) Az Európai Parlament és a Tanács 1946/2003/EK rendelete (2003. július 15.) a géntechnológiával módosított szervezetek országhatárokon történő átviteléről (HL L 287., 2003.11.5., 1. o.).
MELLÉKLET
a) Kérelmezők és az engedély jogosultjai:
|
Név |
: |
Pioneer Hi-Bred International, Inc. |
|
Cím |
: |
7100 NW 62nd Avenue, P.O. Box 1014, Johnston, IA 50131-1014, Egyesült Államok |
Képviseli: Pioneer Overseas Corporation, Avenue des Arts 44, 1040 Brüsszel, Belgium
és
|
Név |
: |
Dow AgroSciences LLC |
|
Cím |
: |
9330 Zionsville Road, Indianapolis, IN 46268-1054, Egyesült Államok |
Képviseli: Dow AgroSciences Distribution S.A.S., 6, rue Jean Pierre Timbaud, 78180 Montigny-le-Bretonneux, Franciaország.
b) A termékek megnevezése és leírása:
|
1. |
géntechnológiával módosított 1507 × NK603 kukoricát tartalmazó, abból álló vagy abból előállított élelmiszerek és élelmiszer-összetevők; |
|
2. |
géntechnológiával módosított 1507 × NK603 kukoricát tartalmazó, abból álló vagy abból előállított takarmányok; |
|
3. |
géntechnológiával módosított 1507 × NK603 kukoricát tartalmazó vagy abból álló termékek az 1. és 2. pontban említettektől eltérő felhasználásra, a termesztés kivételével. |
A géntechnológiával módosított 1507 × NK603 kukorica a Lepidoptera rendbe tartozó egyes kártevőkkel szembeni védelmet biztosító cry1F gént, a glufozinát-ammónium-alapú gyomirtó szerekkel szembeni ellenállást biztosító pat gént és a glifozát-alapú gyomirtó szerekkel szembeni ellenállást biztosító cp4 epsps gént expresszálja.
c) Címkézés:
|
1. |
Az 1829/2003/EK rendelet 13. cikkének (1) bekezdésében és 25. cikkének (2) bekezdésében, illetve az 1830/2003/EK rendelet 4. cikkének (6) bekezdésében megállapított címkézési előírások alkalmazásában a „szervezet neve”„kukorica”. |
|
2. |
Az e melléklet b) pontjának 1. alpontjában említett termékek kivételével a géntechnológiával módosított 1507 × NK603 kukoricát tartalmazó vagy abból álló termékek címkéjén, valamint az ilyen termékeket kísérő dokumentumokban fel kell tüntetni a „nem termesztésre” feliratot. |
d) Kimutatási módszer:
|
1. |
A DAS-Ø15Ø7-1 × MON-ØØ6Ø3-6 kukoricán hitelesített, eseményspecifikus, valós idejű, kvantitatív PCR-alapú módszer a géntechnológiával módosított DAS-Ø15Ø7-1 és MON-ØØ6Ø3-6 kukorica kimutatására. |
|
2. |
A hitelesítést az 1829/2003/EK rendelet alapján létrehozott uniós referencialaboratórium végezte; a hitelesítési jelentés az alábbi internetcímen olvasható: http://gmo-crl.jrc.ec.europa.eu/StatusOfDossiers.aspx. |
|
3. |
Referenciaanyag: ERM®-BF418 (a DAS-Ø15Ø7-1 tekintetében) és ERM®-BF415 (a MON-ØØ6Ø3-6 tekintetében), amelyek hozzáférhetők az Európai Bizottság Közös Kutatóközpontján (JRC) keresztül a https://ec.europa.eu/jrc/en/reference-materials/catalogue/ internetcímen. |
e) Egyedi azonosító:
DAS-Ø15Ø7-1 × MON-ØØ6Ø3-6
f) A Biológiai Sokféleség Egyezmény Biológiai Biztonságról szóló Cartagena Jegyzőkönyvének II. melléklete szerint előírt információ:
[A Biológiai Biztonság Kérdéseiben illetékes Információs Központ, a bejegyzés azonosító száma: értesítést követően kerül bejegyzésre a géntechnológiával módosított élelmiszerek és takarmányok nyilvántartásába.]
g) A termékek forgalomba hozatalára, felhasználására vagy kezelésére vonatkozó feltételek vagy korlátozások:
Nem szükségesek.
h) A környezeti hatásokra vonatkozó felügyeleti terv
A 2001/18/EK európai parlamenti és tanácsi irányelv (1) VII. mellékletének megfelelő, a környezeti hatások figyelemmel kísérését célzó felügyeleti terv.
[Hivatkozás: a géntechnológiával módosított élelmiszerek és takarmányok nyilvántartásában közzétett terv.]
i) Forgalomba hozatal utáni felügyeleti követelmények az emberi fogyasztásra szánt élelmiszerek felhasználása tekintetében:
Nem szükségesek.
Megjegyzés: idővel szükségessé válhat a vonatkozó dokumentumok internetes hivatkozásainak módosítása. Ezeket a módosításokat a géntechnológiával módosított élelmiszerek és takarmányok nyilvántartásának frissítése útján teszik közzé.
(1) Az Európai Parlament és a Tanács 2001/18/EK irányelve (2001. március 12.) a géntechnológiával módosított szervezetek környezetbe történő szándékos kibocsátásáról és a 90/220/EGK tanácsi irányelv hatályon kívül helyezéséről (HL L 106., 2001.4.17., 1. o.).
|
2.8.2019 |
HU |
Az Európai Unió Hivatalos Lapja |
L 204/81 |
A BIZOTTSÁG (EU) 2019/1307 VÉGREHAJTÁSI HATÁROZATA
(2019. július 26.)
a géntechnológiával módosított MON 87403 (MON-874Ø3-1) kukoricát tartalmazó, abból álló vagy abból előállított termékek forgalomba hozatalának az 1829/2003/EK európai parlamenti és tanácsi rendelet szerinti engedélyezéséről
(az értesítés a C(2019) 5481. számú dokumentummal történt)
(Csak a francia és a holland nyelvű szöveg hiteles)
(EGT-vonatkozású szöveg)
AZ EURÓPAI BIZOTTSÁG,
tekintettel az Európai Unió működéséről szóló szerződésre,
tekintettel a géntechnológiával módosított élelmiszerekről és takarmányokról szóló, 2003. szeptember 22-i 1829/2003/EK európai parlamenti és tanácsi rendeletre (1) és különösen annak 7. cikke (3) bekezdésére és 19. cikke (3) bekezdésére,
mivel:
|
(1) |
2015. június 26-án a Monsanto Europe S.A./N.V. a Monsanto Company, Egyesült Államok nevében kérelmet nyújtott be az illetékes belga nemzeti hatósághoz az 1829/2003/EK rendelet 5. és 17. cikkével összhangban a géntechnológiával módosított MON 87403 kukoricát tartalmazó, abból álló vagy abból előállított élelmiszerek, élelmiszer-összetevők és takarmányok forgalomba hozatalára vonatkozóan (a továbbiakban: a kérelem). A kérelem kiterjed továbbá a géntechnológiával módosított MON 87403 kukoricát tartalmazó vagy abból álló termékeknek a termesztéstől eltérő felhasználás céljából, nem élelmiszerként vagy takarmányként történő forgalomba hozatalára is. |
|
(2) |
Az 1829/2003/EK rendelet 5. cikke (5) bekezdésének és 17. cikke (5) bekezdésének megfelelően a kérelem tartalmazta a 2001/18/EK európai parlamenti és tanácsi irányelv (2) II. mellékletében megállapított elvekkel összhangban végzett kockázatértékelésre vonatkozó információkat és következtetéseket, valamint az említett irányelv III. és IV. mellékletében előírt információkat. A kérelem magában foglalta továbbá a 2001/18/EK irányelv VII. mellékletének megfelelő, a környezeti hatásokra vonatkozó felügyeleti tervet is. |
|
(3) |
2018. április 26-án az Európai Élelmiszerbiztonsági Hatóság (a továbbiakban: Hatóság) az 1829/2003/EK rendelet (3) 6. és 18. cikkével összhangban kedvező véleményt adott ki. A Hatóság megállapította, hogy a kérelemben leírt, géntechnológiával módosított MON 87403 kukorica az emberek és állatok egészségére, valamint a környezetre gyakorolt esetleges hatások tekintetében ugyanolyan biztonságos, mint hagyományos megfelelője és a vizsgált, géntechnológiával nem módosított referenciaváltozatai. |
|
(4) |
Véleményében a Hatóság figyelembe vette az illetékes nemzeti hatóságokkal az 1829/2003/EK rendelet 6. cikkének (4) bekezdésében és 18. cikkének (4) bekezdésében előírtak szerint folytatott konzultáció keretében a tagállamok által felvetett összes kérdést és aggályt. |
|
(5) |
A Hatóság továbbá arra a következtetésre jutott, hogy a kérelmező által benyújtott, általános megfigyelési tervből álló, a környezeti hatásokra vonatkozó felügyeleti terv összhangban áll a termékek tervezett felhasználásával. |
|
(6) |
E következtetésekre tekintettel engedélyezni kell a géntechnológiával módosított MON 87403 kukoricát tartalmazó, abból álló vagy abból előállított termékek forgalomba hozatalát a kérelemben felsorolt felhasználási célokra. |
|
(7) |
2018. augusztus 27-i levelében a Monsanto Europe N.V. arról tájékoztatta a Bizottságot, hogy a Monsanto Europe N.V. jogi formáját és nevét változtatta; a vállalat új neve Bayer Agriculture BVBA, Belgium. |
|
(8) |
A 65/2004/EK rendelettel (4) összhangban a géntechnológiával módosított MON 87403 kukoricához egyedi azonosítót kell hozzárendelni. |
|
(9) |
A Hatóság által kiadott vélemény alapján úgy tűnik, hogy az e határozat hatálya alá tartozó termékekre vonatkozóan nincs szükség különleges címkézési előírásokra azokon kívül, amelyeket az 1829/2003/EK rendelet 13. cikkének (1) bekezdése és 25. cikkének (2) bekezdése, valamint az 1830/2003/EK európai parlamenti és tanácsi rendelet (5) 4. cikkének (6) bekezdése meghatároz. Annak biztosítására azonban, hogy a termékeket továbbra is az e határozattal megadott engedélynek megfelelően használják fel, a géntechnológiával módosított, MON 87403 kukoricát tartalmazó vagy abból álló, élelmiszerektől eltérő termékek címkézésének egyértelműen utalnia kell arra, hogy e termékek nem használhatók termesztésre. |
|
(10) |
A környezeti hatásokra vonatkozó felügyeleti tervben meghatározott tevékenységek végrehajtásáról és eredményeiről történő beszámolásként az engedély jogosultjának a 2009/770/EK bizottsági határozatban (6) előírt egységes jelentéstételi formanyomtatványra vonatkozó követelményeknek megfelelő éves jelentéseket kell benyújtania. |
|
(11) |
A Hatóság véleménye nem indokolja semmilyen, az élelmiszerek és takarmányok forgalomba hozatalára, felhasználására és kezelésére irányuló különleges feltétel vagy korlátozás bevezetését, beleértve a forgalomba hozatal utáni felügyeleti követelményeket is, sem pedig az 1829/2003/EK rendelet 6. cikke (5) bekezdésének e) pontjában és 18. cikke (5) bekezdésének e) pontjában előírt, a különleges ökológiai rendszerek/környezet és/vagy földrajzi területek védelmét célzó különleges feltételek bevezetését. |
|
(12) |
A termékek engedélyezésével kapcsolatos minden releváns információt be kell jegyezni a géntechnológiával módosított élelmiszerek és takarmányok 1829/2003/EK rendelet 28. cikkének (1) bekezdése szerinti közösségi nyilvántartásába. |
|
(13) |
E határozatról a Biológiai Biztonság Kérdéseiben illetékes Információs Központon keresztül értesíteni kell a Biológiai Sokféleség Egyezmény Biológiai Biztonságról szóló Cartagena Jegyzőkönyvének részes feleit, az 1946/2003/EK európai parlamenti és tanácsi rendelet (7) 9. cikkének (1) bekezdése és 15. cikke (2) bekezdésének c) pontja szerint. |
|
(14) |
A Növények, Állatok, Élelmiszerek és Takarmányok Állandó Bizottsága nem nyilvánított véleményt az elnöke által kitűzött határidőn belül. Mivel e végrehajtási jogi aktus elfogadását szükségesnek ítélték, az elnök azt további megvitatás céljából a fellebbviteli bizottság elé terjesztette. A fellebbviteli bizottság nem nyilvánított véleményt, |
ELFOGADTA EZT A HATÁROZATOT:
1. cikk
Géntechnológiával módosított szervezet és egyedi azonosító
A 65/2004/EK rendeletnek megfelelően az e határozat mellékletének b) pontjában meghatározott, géntechnológiával módosított MON 87403 kukorica (Zea mays L.) a MON-874Ø3-1 egyedi azonosítót kapja.
2. cikk
Engedélyezés
Az 1829/2003/EK rendelet 4. cikke (2) bekezdése és 16. cikke (2) bekezdése alkalmazásában az e határozatban megállapított feltételeknek megfelelően a Bizottság engedélyezi a következő termékeket:
|
a) |
MON-874Ø3-1 kukoricát tartalmazó, abból álló vagy abból előállított élelmiszerek és élelmiszer-összetevők; |
|
b) |
MON-874Ø3-1 kukoricát tartalmazó, abból álló vagy abból előállított takarmányok; |
|
c) |
az ebben a cikkben felsorolt, géntechnológiával módosított MON-874Ø3-1 kukoricát tartalmazó vagy abból álló termékek az e cikk a) és b) pontjában említettektől eltérő felhasználásra, a termesztés kivételével. |
3. cikk
Címkézés
(1) Az 1829/2003/EK rendelet 13. cikkének (1) bekezdésében és 25. cikkének (2) bekezdésében, illetve az 1830/2003/EK rendelet 4. cikkének (6) bekezdésében megállapított címkézési előírások alkalmazásában a „szervezet neve”: „kukorica”.
(2) A 2. cikk a) pontjában említett termékek kivételével a MON-874Ø3-1 kukoricát tartalmazó vagy abból álló termékek címkéjén, valamint az ilyen termékeket kísérő dokumentumokon fel kell tüntetni a „nem termesztésre” feliratot.
4. cikk
Kimutatási módszer
A MON-874Ø3-1 kukorica kimutatására a melléklet d) pontjában meghatározott módszert kell alkalmazni.
5. cikk
A környezeti hatások felügyelete
(1) Az engedély jogosultja gondoskodik a melléklet h) pontjában meghatározott, a környezeti hatásokra vonatkozó felügyeleti terv kidolgozásáról és végrehajtásáról.
(2) Az engedély jogosultja a 2009/770/EK határozatnak megfelelő éves jelentéseket nyújt be a Bizottsághoz a felügyeleti tervben meghatározott tevékenységek végrehajtásáról és eredményeiről.
6. cikk
Közösségi nyilvántartás
Az e határozat mellékletében szereplő információkat be kell jegyezni a géntechnológiával módosított élelmiszerek és takarmányok 1829/2003/EK rendelet 28. cikkének (1) bekezdése szerinti közösségi nyilvántartásába.
7. cikk
Az engedély jogosultja
Az engedély jogosultja a Bayer Agriculture BVBA, Belgium által képviselt Monsanto Company, Egyesült Államok.
8. cikk
Érvényesség
E határozat az értesítés napjától számított tíz évig alkalmazandó.
9. cikk
Címzett
E határozat címzettje a Bayer Agriculture BVBA, Scheldelaan 460, 2040 Antwerpen, Belgium.
Kelt Brüsszelben, 2019. július 26-án.
a Bizottság részéről
Vytenis ANDRIUKAITIS
a Bizottság tagja
(1) HL L 268., 2003.10.18., 1. o.
(2) Az Európai Parlament és a Tanács 2001/18/EK irányelve (2001. március 12.) a géntechnológiával módosított szervezetek környezetbe történő szándékos kibocsátásáról és a 90/220/EGK tanácsi irányelv hatályon kívül helyezéséről (HL L 106., 2001.4.17., 1. o.).
(3) Az EFSA GMO-testülete (az EFSA géntechnológiával módosított szervezetekkel foglalkozó tudományos testülete), 2018. Scientific Opinion on the assessment of genetically modified maize MON 87403 for food and feed uses, import and processing, under Regulation (EC) No 1829/2003 (application EFSA-GMO-BE-2015-125) (Tudományos szakvélemény a géntechnológiával módosított MON 87403 kukoricának élelmiszerként és takarmányként való felhasználására, behozatalára és feldolgozására vonatkozó, az 1829/2003/EK rendelet szerinti értékelésről; kérelem: EFSA-GMO-BE-2015-125). EFSA Journal 2018;16(3):5225, 28 o. https://doi.org/10.2903/j.efsa.2018.5225
(4) A Bizottság 65/2004/EK rendelete (2004. január 14.) a géntechnológiával módosított szervezetek egyedi azonosítóinak kialakítására és hozzárendelésére szolgáló rendszer létrehozásáról (HL L 10., 2004.1.16., 5. o.).
(5) Az Európai Parlament és a Tanács 1830/2003/EK rendelete (2003. szeptember 22.) a géntechnológiával módosított szervezetek nyomonkövethetőségéről és címkézéséről, és a géntechnológiával módosított szervezetekből előállított élelmiszer- és takarmánytermékek nyomonkövethetőségéről, valamint a 2001/18/EK irányelv módosításáról (HL L 268., 2003.10.18., 24. o.).
(6) A Bizottság 2009/770/EK (2009. október 13.) határozata a 2001/18/EK európai parlamenti és tanácsi irányelv alapján a géntechnológiával módosított szervezetek környezetbe történő szándékos kibocsátásával, illetve forgalomba hozatalra szánt termékekben vagy termékekként való felhasználásával kapcsolatos felügyeleti eredmények ismertetésére szolgáló egységes jelentéstételi formanyomtatványok létrehozásáról (HL L 275., 2009.10.21., 9. o.).
(7) Az Európai Parlament és a Tanács 1946/2003/EK rendelete (2003. július 15.) a géntechnológiával módosított szervezetek országhatárokon történő átviteléről (HL L 287., 2003.11.5., 1. o.).
MELLÉKLET
a) Kérelmező és az engedély jogosultja:
|
Név |
: |
Monsanto Company |
|
Cím |
: |
800 N. Lindbergh Boulevard, St. Louis, Missouri 63167, Amerikai Egyesült Államok |
Képviseli: Bayer Agriculture BVBA, Scheldelaan 460, 2040 Antwerpen, Belgium.
b) A termékek megnevezése és leírása:
|
1. |
MON-874Ø3-1 kukoricát tartalmazó, abból álló vagy abból előállított élelmiszerek és élelmiszer-összetevők; |
|
2. |
MON-874Ø3-1 kukoricát tartalmazó, abból álló vagy abból előállított takarmányok; |
|
3. |
géntechnológiával módosított MON-874Ø3-1 kukoricát tartalmazó vagy abból álló termékek az 1. és 2. pontban említettektől eltérő felhasználásra, a termesztés kivételével. |
A géntechnológiával módosított MON-874Ø3–1 kukoricát úgy fejlesztették ki, hogy a csutka biomasszája az (Arabidopsis thaliana egyik génje által kódolt) AtHB17Δ113 fehérje expressziója révén megnövekedjen a korai reprodukciós fázisban.
c) Címkézés:
|
1. |
Az 1829/2003/EK rendelet 13. cikkének (1) bekezdésében és 25. cikkének (2) bekezdésében, illetve az 1830/2003/EK rendelet 4. cikkének (6) bekezdésében megállapított címkézési előírások alkalmazásában a „szervezet neve”: „kukorica”. |
|
2. |
A 2. cikk a) pontjában említett termékek kivételével a MON-874Ø3-1 kukoricát tartalmazó vagy abból álló termékek címkéjén, valamint az ilyen termékeket kísérő dokumentumokban fel kell tüntetni a „nem termesztésre” feliratot. |
d) Kimutatási módszer:
|
1. |
Eseményspecifikus, valós idejű kvantitatív PCR-alapú módszer a géntechnológiával módosított MON-874Ø3-1 kukorica kimutatására. |
|
2. |
A hitelesítést az 1829/2003/EK rendelet alapján létrehozott uniós referencialaboratórium végezte; a hitelesítési jelentés az alábbi internetcímen olvasható: http://gmo-crl.jrc.ec.europa.eu/StatusOfDossiers.aspx |
|
3. |
Referenciaanyag: AOCS 0216-A, amely elérhető az American Oil Chemists Society-n keresztül a https://www.aocs.org/crm internetes címen. |
e) Egyedi azonosító:
MON-874Ø3-1
f) A Biológiai Sokféleség Egyezmény Biológiai Biztonságról szóló Cartagena Jegyzőkönyvének II. melléklete szerint előírt információ:
[A Biológiai Biztonság Kérdéseiben illetékes Információs Központ, a bejegyzés azonosító száma: értesítést követően bejegyezésre kerül a géntechnológiával módosított élelmiszerek és takarmányok közösségi nyilvántartásába].
g) A termékek forgalomba hozatalára, felhasználására vagy kezelésére vonatkozó feltételek vagy korlátozások:
Nem szükségesek.
h) A környezeti hatásokra vonatkozó felügyeleti terv
A 2001/18/EK irányelv VII. mellékletének megfelelő, a környezeti hatások figyelemmel kísérését célzó terv.
[Hivatkozás: a géntechnológiával módosított élelmiszerek és takarmányok nyilvántartásában közzétett terv.]
i) Forgalomba hozatal utáni felügyeleti követelmények az emberi fogyasztásra szánt élelmiszerek felhasználása tekintetében:
Nem szükségesek.
Megjegyzés: idővel szükségessé válhat a vonatkozó dokumentumok internetes hivatkozásainak módosítása. Ezeket a módosításokat a géntechnológiával módosított élelmiszerek és takarmányok nyilvántartásának frissítése útján teszik közzé.
|
2.8.2019 |
HU |
Az Európai Unió Hivatalos Lapja |
L 204/85 |
A BIZOTTSÁG (EU) 2019/1308 VÉGREHAJTÁSI HATÁROZATA
(2019. július 26.)
a géntechnológiával módosított MON 87411 (MON-87411-9) kukoricát tartalmazó, abból álló vagy abból előállított termékek forgalomba hozatalának az 1829/2003/EK európai parlamenti és tanácsi rendelet szerinti engedélyezéséről
(az értesítés a C(2019) 5487. számú dokumentummal történt)
(Csak a francia és a holland nyelvű szöveg hiteles)
(EGT-vonatkozású szöveg)
AZ EURÓPAI BIZOTTSÁG,
tekintettel az Európai Unió működéséről szóló szerződésre,
tekintettel a géntechnológiával módosított élelmiszerekről és takarmányokról szóló, 2003. szeptember 22-i 1829/2003/EK európai parlamenti és tanácsi rendeletre (1) és különösen annak 7. cikke (3) bekezdésére és 19. cikke (3) bekezdésére,
mivel:
|
(1) |
2015. február 5-én a Monsanto Europe N.V. a Monsanto Company, Egyesült Államok nevében kérelmet nyújtott be az illetékes holland nemzeti hatósághoz az 1829/2003/EK rendelet 5. és 17. cikkével összhangban a géntechnológiával módosított MON 87411 kukoricát tartalmazó, abból álló vagy abból előállított élelmiszerek, élelmiszer-összetevők és takarmányok forgalomba hozatalára vonatkozóan (a továbbiakban: kérelem). A kérelem kiterjed továbbá a géntechnológiával módosított MON 87411 kukoricából álló, bármely más kukoricához hasonló, a termesztéstől eltérő felhasználásra szánt termékek nem élelmiszerként és takarmányként történő forgalomba hozatalára is. |
|
(2) |
Az 1829/2003/EK rendelet 5. cikke (5) bekezdésének és 17. cikke (5) bekezdésének megfelelően a kérelem tartalmazta a 2001/18/EK európai parlamenti és tanácsi irányelv (2) II. mellékletében megállapított elvekkel összhangban végzett kockázatértékelésre vonatkozó információkat és következtetéseket, valamint az említett irányelv III. és IV. mellékletében előírt információkat. A kérelem magában foglalta továbbá a 2001/18/EK irányelv VII. melléklete szerinti, a környezeti hatásokra vonatkozó felügyeleti tervet is. |
|
(3) |
2018. július 2-án az Európai Élelmiszerbiztonsági Hatóság (a továbbiakban: Hatóság) az 1829/2003/EK rendelet (3) 6. és 18. cikkével összhangban kedvező véleményt adott ki. Az EFSA arra a következtetésre jutott, hogy a kérelemben ismertetett, géntechnológiával módosított MON 87411 kukorica az emberek vagy az állatok egészségére, valamint a környezetre gyakorolt esetleges hatások tekintetében ugyanolyan biztonságos és tápláló, mint a hagyományos megfelelője és a géntechnológiával nem módosított referenciaváltozatai. |
|
(4) |
Véleményében a Hatóság figyelembe vette az illetékes nemzeti hatóságokkal az 1829/2003/EK rendelet 6. cikkének (4) bekezdésében és 18. cikkének (4) bekezdésében előírtak szerint folytatott konzultáció keretében a tagállamok által felvetett összes kérdést és aggályt. |
|
(5) |
A Hatóság továbbá arra a következtetésre jutott, hogy a kérelmező által benyújtott, általános megfigyelési tervből álló, a környezeti hatásokra vonatkozó felügyeleti terv összhangban áll a termékek tervezett felhasználásával. |
|
(6) |
E következtetésekre tekintettel engedélyezni kell a géntechnológiával módosított MON 87411 kukoricát tartalmazó, abból álló vagy abból előállított termékek forgalomba hozatalát a kérelemben felsorolt felhasználási célokra. |
|
(7) |
2018. augusztus 27-i levelében a Monsanto Europe N.V. arról tájékoztatta a Bizottságot, hogy a Monsanto Europe N.V. jogi formáját és nevét megváltoztatta; a vállalat új neve Bayer Agriculture BVBA, Belgium. |
|
(8) |
A 65/2004/EK bizottsági rendelettel (4) összhangban a géntechnológiával módosított MON 87411 kukoricához egyedi azonosítót kell hozzárendelni. |
|
(9) |
A Hatóság által kiadott vélemény alapján úgy tűnik, hogy az e határozat hatálya alá tartozó termékekre vonatkozóan nincs szükség különleges címkézési előírásokra azokon kívül, amelyeket az 1829/2003/EK rendelet 13. cikkének (1) bekezdése és 25. cikkének (2) bekezdése, valamint az 1830/2003/EK európai parlamenti és tanácsi rendelet (5) 4. cikkének (6) bekezdése meghatároz. Annak biztosítására azonban, hogy a termékeket továbbra is az e határozattal megadott engedélynek megfelelően használják fel, a géntechnológiával módosított, MON 87411 kukoricát tartalmazó vagy abból álló, élelmiszerektől eltérő termékek címkézésének egyértelműen utalnia kell arra, hogy e termékek nem használhatók termesztésre. |
|
(10) |
A környezeti hatásokra vonatkozó felügyeleti tervben meghatározott tevékenységek végrehajtásáról és eredményeiről történő beszámolásként az engedély jogosultjának a 2009/770/EK bizottsági határozatban (6) előírt egységes jelentéstételi formanyomtatványra vonatkozó követelményeknek megfelelő éves jelentéseket kell benyújtania. |
|
(11) |
A Hatóság véleménye nem indokolja semmilyen, az élelmiszerek és takarmányok forgalomba hozatalára, felhasználására és kezelésére irányuló különleges feltétel vagy korlátozás bevezetését, beleértve a forgalomba hozatal utáni felügyeleti követelményeket is, sem pedig az 1829/2003/EK rendelet 6. cikke (5) bekezdésének e) pontjában és 18. cikke (5) bekezdésének e) pontjában előírt, a különleges ökológiai rendszerek/környezet és/vagy földrajzi területek védelmét célzó különleges feltételek bevezetését. |
|
(12) |
A termékek engedélyezésével kapcsolatos minden releváns információt be kell jegyezni a géntechnológiával módosított élelmiszerek és takarmányok 1829/2003/EK rendelet 28. cikkének (1) bekezdése szerinti közösségi nyilvántartásába. |
|
(13) |
E határozatról a Biológiai Biztonság Kérdéseiben illetékes Információs Központon keresztül értesíteni kell a Biológiai Sokféleség Egyezmény Biológiai Biztonságról szóló Cartagena Jegyzőkönyvének részes feleit, az 1946/2003/EK európai parlamenti és tanácsi rendelet (7) 9. cikkének (1) bekezdése és 15. cikke (2) bekezdésének c) pontja szerint. |
|
(14) |
A Növények, Állatok, Élelmiszerek és Takarmányok Állandó Bizottsága nem nyilvánított véleményt az elnöke által kitűzött határidőn belül. Mivel e végrehajtási jogi aktus elfogadását szükségesnek ítélték, az elnök azt további megvitatás céljából a fellebbviteli bizottság elé terjesztette. A fellebbviteli bizottság nem nyilvánított véleményt, |
ELFOGADTA EZT A HATÁROZATOT:
1. cikk
Géntechnológiával módosított szervezet és egyedi azonosító
A 65/2004/EK rendeletnek megfelelően az e határozat mellékletének b) pontjában meghatározott, géntechnológiával módosított MON 87411 kukorica (Zea mays L.) a MON-87411-9 egyedi azonosítót kapja.
2. cikk
Engedélyezés
Az 1829/2003/EK rendelet 4. cikke (2) bekezdésének és 16. cikke (2) bekezdésének alkalmazásában a Bizottság az e határozatban megállapított feltételeknek megfelelően engedélyezi a következő termékeket:
|
a) |
MON-87411-9 kukoricát tartalmazó, abból álló vagy abból előállított élelmiszerek és élelmiszer-összetevők; |
|
b) |
MON-87411-9 kukoricát tartalmazó, abból álló vagy abból előállított takarmányok; |
|
c) |
az ebben a cikkben felsorolt, géntechnológiával módosított MON-87411-9 kukoricát tartalmazó vagy abból álló termékek az e cikk a) és b) pontjában említettektől eltérő felhasználásra, a termesztés kivételével. |
3. cikk
Címkézés
(1) Az 1829/2003/EK rendelet 13. cikkének (1) bekezdésében és 25. cikkének (2) bekezdésében, illetve az 1830/2003/EK rendelet 4. cikkének (6) bekezdésében megállapított címkézési előírások alkalmazásában a „szervezet neve”: „kukorica”.
(2) A 2. cikk a) pontjában említett termékek kivételével a MON-87411-9 kukoricát tartalmazó vagy abból álló termékek címkéjén, valamint az ilyen termékeket kísérő dokumentumokon fel kell tüntetni a „nem termesztésre” feliratot.
4. cikk
Kimutatási módszer
A MON-87411-9 kukorica kimutatására a melléklet d) pontjában meghatározott módszert kell alkalmazni.
5. cikk
A környezeti hatások felügyelete
(1) Az engedély jogosultja gondoskodik a melléklet h) pontjában meghatározott, a környezeti hatásokra vonatkozó felügyeleti terv kidolgozásáról és végrehajtásáról.
(2) Az engedély jogosultja a 2009/770/EK határozatnak megfelelő éves jelentéseket nyújt be a Bizottsághoz a felügyeleti tervben meghatározott tevékenységek végrehajtásáról és eredményeiről.
6. cikk
Közösségi nyilvántartás
Az e határozat mellékletében szereplő információkat be kell jegyezni a géntechnológiával módosított élelmiszerek és takarmányok 1829/2003/EK rendelet 28. cikkének (1) bekezdése szerinti közösségi nyilvántartásába.
7. cikk
Az engedély jogosultja
Az engedély jogosultja a Bayer Agriculture BVBA, Belgium által képviselt Monsanto Company, Egyesült Államok.
8. cikk
Érvényesség
Ez a határozat az értesítés napjától számított tíz évig alkalmazandó.
9. cikk
Címzett
E határozat címzettje a Bayer Agriculture BVBA, Scheldelaan 460, 2040 Antwerpen, Belgium.
Kelt Brüsszelben, 2019. július 26-án.
a Bizottság részéről
Vytenis ANDRIUKAITIS
a Bizottság tagja
(1) HL L 268., 2003.10.18., 1. o.
(2) Az Európai Parlament és a Tanács 2001/18/EK irányelve (2001. március 12.) a géntechnológiával módosított szervezetek környezetbe történő szándékos kibocsátásáról és a 90/220/EGK tanácsi irányelv hatályon kívül helyezéséről (HL L 106., 2001.4.17., 1. o.).
(3) Az EFSA GMO-testülete (az EFSA géntechnológiával módosított szervezetekkel foglalkozó tudományos testülete), 2018. Scientific Opinion on the assessment of genetically modified maize MON 87411 for food and feed uses, import and processing, under Regulation (EC) No 1829/2003 (application EFSA-GMO-NL-2015-124) (Tudományos szakvélemény a géntechnológiával módosított MON 87411 kukoricának élelmiszerként és takarmányként való felhasználására, behozatalára és feldolgozására vonatkozó, az 1829/2003/EK rendelet szerinti értékelésről; kérelem: EFSA-GMO-BE-2015-124). EFSA Journal 2018; 16(6):5310, 29 oldal. doi: 10.2903/j.efsa.2018.5310).
(4) A Bizottság 65/2004/EK rendelete (2004. január 14.) a géntechnológiával módosított szervezetek egyedi azonosítóinak kialakítására és hozzárendelésére szolgáló rendszer létrehozásáról (HL L 10., 2004.1.16., 5. o.).
(5) Az Európai Parlament és a Tanács 1830/2003/EK rendelete (2003. szeptember 22.) a géntechnológiával módosított szervezetek nyomonkövethetőségéről és címkézéséről, és a géntechnológiával módosított szervezetekből előállított élelmiszer- és takarmánytermékek nyomonkövethetőségéről, valamint a 2001/18/EK irányelv módosításáról (HL L 268., 2003.10.18., 24. o.).
(6) A Bizottság 2009/770/EK (2009. október 13.) határozata a 2001/18/EK európai parlamenti és tanácsi irányelv alapján a géntechnológiával módosított szervezetek környezetbe történő szándékos kibocsátásával, illetve forgalomba hozatalra szánt termékekben vagy termékekként való felhasználásával kapcsolatos felügyeleti eredmények ismertetésére szolgáló egységes jelentéstételi formanyomtatványok létrehozásáról (HL L 275., 2009.10.21., 9. o.).
(7) Az Európai Parlament és a Tanács 1946/2003/EK rendelete (2003. július 15.) a géntechnológiával módosított szervezetek országhatárokon történő átviteléről (HL L 287., 2003.11.5., 1. o.).
MELLÉKLET
a) Kérelmező és az engedély jogosultja:
|
Név |
: |
Monsanto Company |
|
Cím |
: |
800 N. Lindbergh Boulevard, St. Louis, Missouri 63167, Amerikai Egyesült Államok |
Képviseli: Bayer Agriculture BVBA, Scheldelaan 460, 2040 Antwerpen, Belgium.
b) A termékek megnevezése és leírása:
|
1. |
MON-87411-9 kukoricát tartalmazó, abból álló vagy abból előállított élelmiszerek és élelmiszer-összetevők; |
|
2. |
MON-87411-9 kukoricát tartalmazó, abból álló vagy abból előállított takarmányok; |
|
3. |
géntechnológiával módosított MON-87411-9 kukoricát tartalmazó vagy abból álló termékek az 1. és 2. pontban említettektől eltérő felhasználásra, a termesztés kivételével. |
A géntechnológiával módosított MON-87411-9 kukorica a glifozáttartalmú gyomirtó szerekkel szemben ellenállást biztosító CP4 EPSPS fehérjét, valamint a kukoricabogárral (Diabrotica spp.) szemben ellenállást biztosító Cry3Bb1 fehérjét és DvSnf7 dsRNS-t expresszálja.
c) Címkézés:
|
1. |
Az 1829/2003/EK rendelet 13. cikkének (1) bekezdésében és 25. cikkének (2) bekezdésében, illetve az 1830/2003/EK rendelet 4. cikkének (6) bekezdésében megállapított címkézési előírások alkalmazásában a „szervezet neve”: „kukorica”; |
|
2. |
Az e melléklet b) pontjának 1. alpontjában említett termékek kivételével a MON-87411-9 kukoricát tartalmazó vagy abból álló termékek címkéjén, valamint az ilyen termékeket kísérő dokumentumokban fel kell tüntetni a „nem termesztésre” feliratot. |
d) Kimutatási módszer:
|
1. |
Eseményspecifikus, valós idejű kvantitatív PCR-alapú módszer a géntechnológiával módosított MON 87411 kukorica kimutatására. |
|
2. |
A hitelesítést az 1829/2003/EK rendelet alapján létrehozott uniós referencialaboratórium végezte; a hitelesítési jelentés az alábbi internetcímen olvasható: http://gmo-crl.jrc.ec.europa.eu/statusofdossiers.aspx; |
|
3. |
Referenciaanyag: AOCS 0215-B, amely elérhető az American Oil Chemists Society-n (AOCS) keresztül a https://www.aocs.org/crm internetes címen. |
e) Egyedi azonosító:
MON-87411-9
f) A Biológiai Sokféleség Egyezmény Biológiai Biztonságról szóló Cartagena Jegyzőkönyvének II. melléklete szerint előírt információ:
[A Biológiai Biztonság Kérdéseiben illetékes Információs Központ, a bejegyzés azonosító száma: értesítést követően bejegyezésre kerül a géntechnológiával módosított élelmiszerek és takarmányok közösségi nyilvántartásába].
g) A termékek forgalomba hozatalára, felhasználására vagy kezelésére vonatkozó feltételek vagy korlátozások:
Nem szükségesek.
h) A környezeti hatásokra vonatkozó felügyeleti terv
A 2001/18/EK irányelv VII. mellékletének megfelelő, a környezeti hatások figyelemmel kísérését célzó terv.
[Hivatkozás: a géntechnológiával módosított élelmiszerek és takarmányok közösségi nyilvántartásában közzétett terv]
i) Forgalomba hozatal utáni felügyeleti követelmények az emberi fogyasztásra szánt élelmiszerek felhasználása tekintetében
Nem szükségesek.
Megjegyzés: idővel szükségessé válhat a vonatkozó dokumentumok internetes hivatkozásainak módosítása. Ezeket a módosításokat a géntechnológiával módosított élelmiszerek és takarmányok közösségi nyilvántartásának frissítése útján teszik közzé.
|
2.8.2019 |
HU |
Az Európai Unió Hivatalos Lapja |
L 204/90 |
A BIZOTTSÁG (EU) 2019/1309 VÉGREHAJTÁSI HATÁROZATA
(2019. július 26.)
a géntechnológiával módosított MON 87751 (MON-87751-7) szójababot tartalmazó, abból álló vagy abból előállított termékek forgalomba hozatalának az 1829/2003/EK európai parlamenti és tanácsi rendelet szerinti engedélyezéséről
(az értesítés a C(2019) 5489. számú dokumentummal történt)
(Csak a holland és a francia nyelvű szöveg hiteles)
(EGT-vonatkozású szöveg)
AZ EURÓPAI BIZOTTSÁG,
tekintettel az Európai Unió működéséről szóló szerződésre,
tekintettel a géntechnológiával módosított élelmiszerekről és takarmányokról szóló, 2003. szeptember 22-i 1829/2003/EK európai parlamenti és tanácsi rendeletre (1) és különösen annak 7. cikke (3) bekezdésére és 19. cikke (3) bekezdésére,
mivel:
|
(1) |
2014. szeptember 26-án a Monsanto Europe S.A./N.V. a Monsanto Company, Egyesült Államok nevében kérelmet nyújtott be az illetékes holland nemzeti hatósághoz az 1829/2003/EK rendelet 5. és 17. cikkével összhangban a géntechnológiával módosított MON 87751 szójababot tartalmazó, abból álló vagy abból előállított élelmiszerek, élelmiszer-összetevők és takarmányok forgalomba hozatalára vonatkozóan (a továbbiakban: a kérelem). A kérelem kiterjed továbbá a géntechnológiával módosított MON 87751 szójababot tartalmazó vagy abból álló termékeknek a termesztéstől eltérő felhasználás céljából, nem élelmiszerként vagy takarmányként történő forgalomba hozatalára is. |
|
(2) |
Az 1829/2003/EK rendelet 5. cikke (5) bekezdésének és 17. cikke (5) bekezdésének megfelelően a kérelem tartalmazta a 2001/18/EK európai parlamenti és tanácsi irányelv (2) II. mellékletében megállapított elvekkel összhangban végzett kockázatértékelésre vonatkozó információkat és következtetéseket, valamint az említett irányelv III. és IV. mellékletében előírt információkat. A kérelem magában foglalta továbbá a 2001/18/EK irányelv VII. mellékletének megfelelő, a környezeti hatásokra vonatkozó felügyeleti tervet is. |
|
(3) |
2018 augusztus 2-án az Európai Élelmiszerbiztonsági Hatóság (a továbbiakban: a Hatóság) az 1829/2003/EK rendelet (3) 6. és 18. cikkével összhangban kedvező véleményt adott ki. A Hatóság arra a következtetésre jutott, hogy a kérelemben ismertetett, géntechnológiával módosított MON 87751 szójabab az emberek vagy az állatok egészségére, valamint a környezetre gyakorolt esetleges hatások tekintetében ugyanolyan biztonságos és tápláló, mint a hagyományos megfelelője és a géntechnológiával nem módosított referenciaváltozatai. |
|
(4) |
Véleményében a Hatóság figyelembe vette az illetékes nemzeti hatóságokkal az 1829/2003/EK rendelet 6. cikkének (4) bekezdésében és 18. cikkének (4) bekezdésében előírtak szerint folytatott konzultáció keretében a tagállamok által felvetett összes kérdést és aggályt. |
|
(5) |
A Hatóság továbbá arra a következtetésre jutott, hogy a kérelmező által benyújtott, általános megfigyelési tervből álló, a környezeti hatásokra vonatkozó felügyeleti terv összhangban áll a termékek tervezett felhasználásával. |
|
(6) |
Az említett következtetésekre tekintettel engedélyezni kell a géntechnológiával módosított MON 87751 szójababot tartalmazó, abból álló vagy abból előállított termékek forgalomba hozatalát a kérelemben felsorolt felhasználási célokra. |
|
(7) |
2018. augusztus 27-i levelében a Monsanto Europe N.V. arról tájékoztatta a Bizottságot, hogy a Monsanto Europe N.V. megváltoztatta a jogi formáját és a nevét; a vállalat új neve Bayer Agriculture BVBA, Belgium. |
|
(8) |
A 65/2004/EK bizottsági rendelettel (4) összhangban a géntechnológiával módosított MON 87751 szójababhoz egyedi azonosítót kell hozzárendelni. |
|
(9) |
A Hatóság által kiadott vélemény alapján úgy tűnik, hogy az e határozat hatálya alá tartozó termékekre vonatkozóan nincs szükség különleges címkézési előírásokra azokon kívül, amelyeket az 1829/2003/EK rendelet 13. cikkének (1) bekezdése és 25. cikkének (2) bekezdése, valamint az 1830/2003/EK európai parlamenti és tanácsi rendelet (5) 4. cikkének (6) bekezdése meghatároz. Annak biztosítására azonban, hogy a termékeket továbbra is az e határozattal megadott engedélynek megfelelően használják fel, a géntechnológiával módosított, MON 87751 szójababot tartalmazó vagy abból álló, élelmiszerektől eltérő termékek címkézésének egyértelműen utalnia kell arra, hogy e termékek nem használhatók termesztésre. |
|
(10) |
A környezeti hatásokra vonatkozó felügyeleti tervben meghatározott tevékenységek végrehajtásáról és eredményeiről történő beszámolásként az engedély jogosultjának a 2009/770/EK bizottsági határozatban (6) előírt egységes jelentéstételi formanyomtatványra vonatkozó követelményeknek megfelelő éves jelentéseket kell benyújtania. |
|
(11) |
A Hatóság véleménye nem indokolja semmilyen, az élelmiszerek és takarmányok forgalomba hozatalára, felhasználására és kezelésére irányuló különleges feltétel vagy korlátozás bevezetését, beleértve a forgalomba hozatal utáni felügyeleti követelményeket is, sem pedig az 1829/2003/EK rendelet 6. cikke (5) bekezdésének e) pontjában és 18. cikke (5) bekezdésének e) pontjában előírt, a különleges ökológiai rendszerek/környezet vagy földrajzi területek védelmét célzó különleges feltételek bevezetését. |
|
(12) |
A termékek engedélyezésével kapcsolatos minden releváns információt be kell jegyezni a géntechnológiával módosított élelmiszerek és takarmányok 1829/2003/EK rendelet 28. cikkének (1) bekezdése szerinti közösségi nyilvántartásába. |
|
(13) |
E határozatról a Biológiai Biztonság Kérdéseiben illetékes Információs Központon keresztül értesíteni kell a Biológiai Sokféleség Egyezmény Biológiai Biztonságról szóló Cartagena Jegyzőkönyvének részes feleit, az 1946/2003/EK európai parlamenti és tanácsi rendelet (7) 9. cikkének (1) bekezdése és 15. cikke (2) bekezdésének c) pontja szerint. |
|
(14) |
A Növények, Állatok, Élelmiszerek és Takarmányok Állandó Bizottsága nem nyilvánított véleményt az elnöke által kitűzött határidőn belül. Mivel e végrehajtási jogi aktus elfogadására volt szükség, az elnök azt további megvitatás céljából a fellebbviteli bizottság elé terjesztette. A fellebbviteli bizottság nem nyilvánított véleményt, |
ELFOGADTA EZT A HATÁROZATOT:
1. cikk
Géntechnológiával módosított szervezet és egyedi azonosító
A 65/2004/EK rendelettel összhangban a géntechnológiával módosított MON 87751 szójababot (Glycine max (L.) Merr.) e határozat melléklete b) pontjának megfelelően a MON-87751-7 egyedi azonosítóval látják el.
2. cikk
Engedélyezés
Az 1829/2003/EK rendelet 4. cikke (2) bekezdése és 16. cikke (2) bekezdése alkalmazásában az e határozatban megállapított feltételeknek megfelelően a Bizottság engedélyezi a következő termékeket:
|
a) |
géntechnológiával módosított MON-87751-7 szójababot tartalmazó, abból álló vagy abból előállított élelmiszerek és élelmiszer-összetevők; |
|
b) |
MON-87751-7 szójababot tartalmazó, abból álló vagy abból előállított takarmányok; |
|
c) |
géntechnológiával módosított MON-87751-7 szójababot tartalmazó vagy abból álló termékek az a) és b) pontban említettektől eltérő felhasználásra, a termesztés kivételével. |
3. cikk
Címkézés
(1) Az 1829/2003/EK rendelet 13. cikkének (1) bekezdésében és 25. cikkének (2) bekezdésében, illetve az 1830/2003/EK rendelet 4. cikkének (6) bekezdésében megállapított címkézési előírások alkalmazásában a „szervezet neve”„kukorica”.
(2) A 2. cikk a) pontjában említett termékek kivételével a géntechnológiával módosított MON-87751-7 szójababot tartalmazó vagy abból álló termékek címkéjén, valamint az ilyen termékeket kísérő dokumentumokon fel kell tüntetni a „nem termesztésre” feliratot.
4. cikk
Kimutatási módszer
A géntechnológiával módosított MON-87751-7 szójabab kimutatására a melléklet d) pontjában meghatározott módszert kell alkalmazni.
5. cikk
A környezeti hatások felügyelete
(1) Az engedély jogosultja gondoskodik a melléklet h) pontjában meghatározott, a környezeti hatásokra vonatkozó felügyeleti terv kidolgozásáról és végrehajtásáról.
(2) Az engedély jogosultja a 2009/770/EK határozatnak megfelelő éves jelentéseket nyújt be a Bizottsághoz a felügyeleti tervben meghatározott tevékenységek végrehajtásáról és eredményeiről.
6. cikk
Közösségi nyilvántartás
A mellékletben szereplő információkat be kell jegyezni a géntechnológiával módosított élelmiszerek és takarmányok 1829/2003/EK rendelet 28. cikkének (1) bekezdése szerinti közösségi nyilvántartásába.
7. cikk
Az engedély jogosultja
Az engedély jogosultja a Bayer Agriculture BVBA, Belgium által képviselt Monsanto Company, Egyesült Államok.
8. cikk
Érvényesség
Ez a határozat az értesítés napjától számított tíz évig alkalmazandó.
9. cikk
Címzett
E határozat címzettje a Bayer Agriculture BVBA, Scheldelaan 460, 2040 Antwerpen, Belgium.
Kelt Brüsszelben, 2019. július 26-án.
a Bizottság részéről
Vytenis ANDRIUKAITIS
a Bizottság tagja
(1) HL L 268., 2003.10.18., 1. o.
(2) Az Európai Parlament és a Tanács 2001/18/EK irányelve (2001. március 12.) a géntechnológiával módosított szervezetek környezetbe történő szándékos kibocsátásáról és a 90/220/EGK tanácsi irányelv hatályon kívül helyezéséről (HL L 106., 2001.4.17., 1. o.).
(3) Az EFSA GMO-testülete (az EFSA géntechnológiával módosított szervezetekkel foglalkozó tudományos testülete), 2018. Scientific opinion on the assessment of genetically modified soybean MON 87751 for food and feed uses under Regulation (EC) No 1829/2003 (application EFSA-GMO-NL-2014–121) (Tudományos szakvélemény a géntechnológiával módosított MON 87751 szójababnak élelmiszerként és takarmányként való felhasználására vonatkozó, az 1829/2003/EK rendelet szerinti értékelésről; kérelem: EFSA-GMO-NL-2014–121). EFSA Journal 2018; 16(8):5346, 32 oldal, doi: 10.2903/j.efsa.2018.5346
(4) A Bizottság 65/2004/EK rendelete (2004. január 14.) a géntechnológiával módosított szervezetek egyedi azonosítóinak kialakítására és hozzárendelésére szolgáló rendszer létrehozásáról (HL L 10., 2004.1.16., 5. o.).
(5) Az Európai Parlament és a Tanács 1830/2003/EK rendelete (2003. szeptember 22.) a géntechnológiával módosított szervezetek nyomonkövethetőségéről és címkézéséről, és a géntechnológiával módosított szervezetekből előállított élelmiszer- és takarmánytermékek nyomonkövethetőségéről, valamint a 2001/18/EK irányelv módosításáról (HL L 268., 2003.10.18., 24. o.).
(6) A Bizottság 2009/770/EK (2009. október 13.) határozata a 2001/18/EK európai parlamenti és tanácsi irányelv alapján a géntechnológiával módosított szervezetek környezetbe történő szándékos kibocsátásával, illetve forgalomba hozatalra szánt termékekben vagy termékekként való felhasználásával kapcsolatos felügyeleti eredmények ismertetésére szolgáló egységes jelentéstételi formanyomtatványok létrehozásáról (HL L 275., 2009.10.21., 9. o.).
(7) Az Európai Parlament és a Tanács 1946/2003/EK rendelete (2003. július 15.) a géntechnológiával módosított szervezetek országhatárokon történő átviteléről (HL L 287., 2003.11.5., 1. o.).
MELLÉKLET
a) A kérelmező és az engedély jogosultja:
|
Név |
: |
Monsanto Company |
|
Cím |
: |
800 N. Lindbergh Boulevard, St. Louis, Missouri 63167, Amerikai Egyesült Államok |
Képviseli: Bayer Agriculture BVBA, Scheldelaan 460, 2040 Antwerpen, Belgium.
b) A termékek megnevezése és leírása:
|
1. |
géntechnológiával módosított MON-87751-7 szójababot tartalmazó, abból álló vagy abból előállított élelmiszerek és élelmiszer-összetevők; |
|
2. |
MON-87751-7 szójababot tartalmazó, abból álló vagy abból előállított takarmányok; |
|
3. |
géntechnológiával módosított MON-87751-7 szójababot tartalmazó vagy abból álló termékek az 1. és 2. pontban említettektől eltérő felhasználásra, a termesztés kivételével. |
A géntechnológiával módosított MON-87751-7 szójababot a cry1A.105 és a cry2Ab2 gén expressziója révén megvalósuló, a Lepidoptera rendbe tartozó egyes kártevőkkel szembeni védelem érdekében fejlesztették ki.
c) Címkézés:
|
1. |
Az 1829/2003/EK rendelet 13. cikkének (1) bekezdésében és 25. cikkének (2) bekezdésében, valamint az 1830/2003/EK rendelet 4. cikkének (6) bekezdésében megállapított, címkézésre vonatkozó követelmények alkalmazásában „a szervezet neve”„szójabab”; |
|
2. |
Az e melléklet b) pontjának 1. alpontjában említett termékek kivételével a géntechnológiával módosított MON-87751-7 szójababot tartalmazó vagy abból álló termékek címkéjén, valamint az ilyen termékeket kísérő dokumentumokban fel kell tüntetni a „nem termesztésre” feliratot. |
d) Kimutatási módszer:
|
1. |
Eseményspecifikus, valós idejű kvantitatív PCR-kimutatási módszerek a géntechnológiával módosított MON-87751-7 szójabab kimutatására. |
|
2. |
A hitelesítést az 1829/2003/EK rendelet alapján létrehozott uniós referencialaboratórium végezte; a hitelesítési jelentés az alábbi internetcímen olvasható: http://gmo-crl.jrc.ec.europa.eu/statusofdossiers.aspx; |
|
3. |
Referenciaanyag: AOCS 0215-A, amely elérhető az American Oil Chemists Society-n (AOCS) keresztül a https://www.aocs.org/crm internetes címen. |
e) Egyedi azonosító:
MON-87751-7
f) A Biológiai Sokféleség Egyezmény Biológiai Biztonságról szóló Cartagena Jegyzőkönyvének II. melléklete szerint előírt információ:
[A Biológiai Biztonság Kérdéseiben illetékes Információs Központ, a bejegyzés azonosító száma: értesítést követően bejegyezésre kerül a géntechnológiával módosított élelmiszerek és takarmányok közösségi nyilvántartásába].
g) A termékek forgalomba hozatalára, felhasználására vagy kezelésére vonatkozó feltételek vagy korlátozások:
Nem szükségesek.
h) A környezeti hatásokra vonatkozó felügyeleti terv
A 2001/18/EK irányelv VII. mellékletének megfelelő, a környezeti hatások figyelemmel kísérését célzó felügyeleti terv.
[Hivatkozás: a géntechnológiával módosított élelmiszerek és takarmányok közösségi nyilvántartásában közzétett terv]
i) Forgalomba hozatal utáni felügyeleti követelmények az emberi fogyasztásra szánt élelmiszerek felhasználása tekintetében
Nem szükségesek.
Megjegyzés: idővel szükségessé válhat a vonatkozó dokumentumok internetes hivatkozásainak módosítása. Ezeket a módosításokat a géntechnológiával módosított élelmiszerek és takarmányok közösségi nyilvántartásának frissítése útján teszik közzé.
|
2.8.2019 |
HU |
Az Európai Unió Hivatalos Lapja |
L 204/94 |
A BIZOTTSÁG (EU) 2019/1310 VÉGREHAJTÁSI HATÁROZATA
(2019. július 31.)
az európai polgári védelmi eszköztár és a rescEU működtetésére vonatkozó szabályok megállapításáról
(az értesítés a C(2019) 5614. számú dokumentummal történt)
(EGT-vonatkozású szöveg)
AZ EURÓPAI BIZOTTSÁG,
tekintettel az Európai Unió működéséről szóló szerződésre,
tekintettel az uniós polgári védelmi mechanizmusról szóló, 2013. december 17-i 1313/2013/EU európai parlamenti és tanácsi határozatra (1) és különösen annak 32. cikke (1) bekezdésének g) pontjára,
mivel:
|
(1) |
Miközben tiszteletben tartja a tagállamok elsődleges felelősségét a természeti és az ember okozta katasztrófák megelőzése, az azokra való felkészülés és reagálás tekintetében, az uniós mechanizmus – az Európai Unióról szóló szerződés (EUSZ) 3. cikkének (3) bekezdésével és az Európai Unió működéséről szóló szerződés (EUMSZ) 196. cikkével összhangban – előmozdítja a tagállamok közötti szolidaritást és együttműködést. |
|
(2) |
Az (EU) 2019/420 európai parlamenti és tanácsi határozat (2) elfogadásával megerősítették az uniós mechanizmust az európai polgári védelmi eszköztár uniós pénzügyi támogatásának növelése és a rescEU létrehozása révén. |
|
(3) |
Az 1313/2013/EU határozat 21. cikke (2) bekezdésének c) pontja szerint az átalakítási költségekhez uniós pénzügyi támogatásban részesülő reagálási képességeket a kapott finanszírozás függvényében legalább egy három és 10 év közötti – az eszköztár részeként való tényleges rendelkezésre állásuk kezdetétől számított – minimális időtartamra az európai polgári védelmi eszköztár rendelkezésére kell bocsátani. A jogbiztonság garantálása érdekében meg kell határozni a rendelkezésre bocsátás pontos időtartamát. |
|
(4) |
A rescEU célja az olyan kezelhetetlen helyzetekben való segítségnyújtás, amelyekben a tagállami szinten meglévő és a tagállamok által az európai polgári védelmi eszköztár céljára rendelkezésre bocsátott képességek összessége nem elegendő a katasztrófákra való hatékony reagáláshoz. A rescEU hatékony végrehajtásának biztosítása érdekében a rescEU-képességek létrehozására, igazgatására és fenntartására vonatkozó szabályokat kell elfogadni. |
|
(5) |
A rescEU-képességek az uniós mechanizmus keretében végzett reagálási műveletekre vehetők igénybe. A Veszélyhelyzet-reagálási Koordinációs Központon (ERCC) keresztül benyújtott segítségnyújtás iránti kérelmet követően a képességek telepítéséről a Bizottság határoz, szoros koordinációban a kérelmező tagállammal és a rescEU-képességet tulajdonló, bérlő vagy lízingelő tagállammal. A hatékony és átlátható döntéshozatali eljárás biztosítása érdekében meg kell határozni a telepítési határozatokra és az adott műveleti eljárásokra vonatkozó kritériumokat. Ki kell dolgozni továbbá a rescEU-képességek használatára irányuló, egymással esetleg ütköző kérelmek esetében a telepítésre vonatkozóan alkalmazandó döntéshozatali eljárás kritériumait. |
|
(6) |
A rescEU-képességeket kizárólag akkor lehet nemzeti célokra használni, amikor nem használják őket vagy nincs rájuk szükség az uniós mechanizmus valamely reagálási műveletéhez. Annak garantálása érdekében, hogy a rescEU-képességek készenlétben legyenek és a különböző típusú rescEU-képességek minőségi követelményeiben meghatározott időkereten belül készen álljanak az uniós mechanizmus keretében történő telepítésre, megfelelő szabályokat kell lefektetni a nemzeti célokra való használattal kapcsolatban. |
|
(7) |
Amennyiben valamely tagállam a rescEU-képességeket nemzeti célokra használja, értesítenie kell a Bizottságot. A rescEU-képességek nemzeti célokra történő használata esetén a bejelentési rendszernek egyszerűnek és hatékonynak kell lennie. |
|
(8) |
A műveleti hatékonyság biztosítása érdekében egyértelmű szabályokat kell megállapítani a rescEU-képességek leszerelésére és felszabadítására. |
|
(9) |
Az 1313/2013/EU határozat 12. cikkének (10) bekezdésével összhangban a tagállamok meghatározott esetekben megtagadhatják a rescEU-képességeket működtető személyzetük Unión kívüli telepítését. Az említett konkrét esetekre vonatkozóan szabályokat kell megállapítani. |
|
(10) |
Az (EU) 2019/570 bizottsági végrehajtási határozat (3) elfogadásával a légi erdőtűzoltó képességeket a rescEU-képességek közé sorolták. Annak érdekében, hogy az 1313/2013/EU határozat 21. cikkének (3) bekezdésével összhangban uniós pénzügyi támogatást lehessen nyújtani az ilyen képességek fejlesztéséhez, meg kell határozni azok becsült összköltségét. A becsült összköltségeket az elszámolható költségeknek az 1313/2013/EU határozat IA. mellékletében foglalt kategóriáit figyelembe véve kell megállapítani. |
|
(11) |
A telepítési idő csökkentése és a jogbiztonság javítása érdekében tisztázni kell a rescEU-képességek fogadására és működtetésére vonatkozó feltételeket. E feltételeknek kell képezniük a Bizottság és a tagállamok között létrejövő operatív szerződések alapját. |
|
(12) |
Az Uniónak és a rescEU-képességek telepítésének előtérbe helyezésének biztosítása, valamint az 1313/2013/EU határozat 20a. cikkének végrehajtása során az egységes feltételek biztosítása érdekében e határozatnak szabályokat kell megállapítania a megfelelő láthatóságot biztosító intézkedésekre vonatkozóan. |
|
(13) |
A tagállamoknak a rescEU-képességeket a meglévő nemzeti és nemzetközi szabályoknak megfelelően nyilvántartásba kell venniük, tanúsítaniuk kell, és megfelelően karban kell tartaniuk. Az uniós mechanizmus tanúsítási folyamatát is el kell végezni. |
|
(14) |
A (EU) 2019/420 határozat 2019. március 21-i hatálybalépésével az Unió mostantól pénzügyi támogatást nyújthat a műveleti költségekhez. Ezért szabályokat és eljárásokat kell meghatározni a tagállamok számára az ilyen jellegű segítség kérelmezésére. |
|
(15) |
Az e határozatban előírt intézkedések összhangban vannak az 1313/2013/EU határozat 33. cikkének (1) bekezdése szerinti bizottság véleményével, |
ELFOGADTA EZT A HATÁROZATOT:
1. cikk
Tárgy
Ez a határozat az 1313/2013/EU határozat végrehajtására alkalmazandó szabályokat állapítja meg a következők tekintetében:
|
a) |
az átalakítási költségek tekintetében finanszírozásban részesülő képességek rendelkezésre bocsátása az európai polgári védelmi eszköztár számára; |
|
b) |
a rescEU-képességekre vonatkozó telepítési határozatok kritériumai, beleértve az egymással ütköző kérelmek esetét is; |
|
c) |
a leszereléssel és felszabadítással kapcsolatos határozatok kritériumai; |
|
d) |
a rescEU-képességek nemzeti célokra való használata; |
|
e) |
a személyzet Unión kívüli telepítésének visszautasítása; |
|
f) |
az operatív szerződések általános tartalma; |
|
g) |
a rescEU-képességek használatára vonatkozó láthatósági követelmények; |
|
h) |
a rescEU-képességek minősítése és nyilvántartásba vétele; |
|
i) |
a légi erdőtűzoltó rescEU-képességek becsült összköltsége, valamint |
|
j) |
a műveleti költségekkel kapcsolatos pénzügyi támogatás igénylésére vonatkozó szabályok. |
2. cikk
Az átalakítási költségek tekintetében finanszírozásban részesülő képességek rendelkezésre bocsátása az európai polgári védelmi eszköztár számára
(1) A képességek átalakítási költségeihez az 1313/2013/EU határozat 21. cikke (2) bekezdésének c) pontja szerint uniós pénzügyi támogatásban részesülő tagállamok az említett képességeket a kapott finanszírozás teljes összegén alapuló különböző minimális időtartamokra az európai polgári védelmi eszköztár rendelkezésére bocsátják.
A minimális időtartamokat az alábbiak szerint kell meghatározni:
|
a) |
legalább 3 év a legfeljebb 300 000 EUR összegű uniós pénzügyi támogatásban részesülő képességek esetében; |
|
b) |
legalább 5 év a 300 001 EUR és 1 000 000 EUR közötti összegű uniós pénzügyi támogatásban részesülő képességek esetében; |
|
c) |
legalább 7 év az 1 000 001 EUR és 2 000 000 EUR közötti összegű uniós pénzügyi támogatásban részesülő képességek esetében; |
|
d) |
legalább 10 év a több mint 2 000 000 EUR összegű uniós pénzügyi támogatásban részesülő képességek esetében. |
(2) Amennyiben a képesség gazdasági élettartama rövidebb, mint az (1) bekezdésben említett minimális időtartam, a minimális időtartamot a gazdasági élettartam hossza határozza meg.
(3) A Bizottság az ERCC-n keresztül egy adott képességre vonatkozóan hozzájárulhat az (1) bekezdésben említett minimális időtartam megszüntetéséhez, ha azt egy tagállam kellően megindokolja.
3. cikk
A rescEU-képességekre vonatkozó telepítési határozatok kritériumai
(1) A segítségnyújtás iránti kérelem beérkezését követően az ERCC értékeli, hogy a tagállamok által az uniós mechanizmuson keresztül felajánlott meglévő képességek és az európai polgári védelmi eszköztár számára előzetesen rendelkezésre bocsátott képességek elégségesek-e a kérelemre való hatékony reagáláshoz. Amennyiben nem biztosítható hatékony reagálás, a Bizottság az ERCC-n keresztül határoz a rescEU-képességek telepítéséről az 1313/2013/EU határozat 12. cikkének (6) bekezdésében meghatározott eljárásnak megfelelően.
(2) A rescEU-képességek telepítésére vonatkozó döntésnél az alábbi konkrét kritériumokat kell figyelembe venni:
|
a) |
a különböző tagállamok műveleti helyzete, illetve a potenciális katasztrófakockázatok; |
|
b) |
a rescEU-képességek megfelelősége és elégségessége a katasztrófára való reagáláshoz; |
|
c) |
a rescEU-képességek földrajzi helye, beleértve az érintett területre való becsült szállítási időt; |
|
d) |
egyéb releváns kritériumok, beleértve a rescEU-képességek operatív szerződésekben meghatározott feltételeit. |
(3) Egymással ütköző segítségnyújtási kérelmek esetén a rescEU-képességek telepítésére vonatkozó döntésnél a következő további kritériumokat kell figyelembe venni:
|
a) |
az emberéleteket veszélyeztető várható kockázatok; |
|
b) |
a 2008/114/EK tanácsi irányelv (4) 2. cikkének a) bekezdése szerinti kritikus infrastruktúrát veszélyeztető várható kockázatok, függetlenül attól, hogy az az Unió területén belül vagy kívül található; |
|
c) |
a katasztrófák várható hatása, beleértve a környezeti hatásokat is; |
|
d) |
az ERCC által azonosított szükségletek és a meglévő telepítési tervek; |
|
e) |
a katasztrófák terjedésének potenciális kockázata; |
|
f) |
társadalmi-gazdasági hatások; |
|
g) |
a szolidaritási klauzula életbe lépésének kiváltása az Európai Unió működéséről szóló szerződés 222. cikke alapján; |
|
h) |
egyéb releváns műveleti tényezők. |
4. cikk
A leszereléssel és felszabadítással kapcsolatos határozatok kritériumai
(1) A rescEU-képességeket a következő esetekben kell leszerelni:
|
a) |
amennyiben a lezárás előtt üzenet érkezik a CECIS-ben; vagy |
|
b) |
amennyiben felszabadításra vonatkozó határozat születik a (2) bekezdéssel összhangban. |
(2) A rescEU-képesség felszabadításáról szóló határozatot a Bizottság hozza meg az ERCC-n keresztül, amikor a szóban forgó képességre máshol van nagyobb műveleti igény, vagy amikor a helyszínen jelentkező igények már nem indokolják annak használatát. A határozatot a rescEU-képességet fogadó tagállammal és a segítséget kérő tagállammal vagy tagállamokkal, adott esetben harmadik országokkal vagy nemzetközi szervezetekkel szorosan egyeztetve kell meghozni.
(3) A (2) bekezdésben említett határozat meghozatala céljából a Bizottság többek között figyelembe veszi a 3. cikk (2) és (3) bekezdésében felsorolt kritériumokat.
5. cikk
A rescEU-képességek nemzeti célokra való használata
(1) A rescEU-képességeket nemzeti célokra használó tagállamok a következőket biztosítják:
|
a) |
a vonatkozó minőségi követelményekben meghatározott időtartamon belül rendelkezésre állás és felkészültség az uniós mechanizmus keretében végzett műveletekre, kivéve, ha a Bizottsággal másként állapodtak meg; |
|
b) |
a rescEU-képességek és egyéb nemzeti képességek azonos kezelése a megfelelő karbantartás, tárolás, biztosítás, személyzet és egyéb vonatkozó irányítási és karbantartási tevékenységek tekintetében; |
|
c) |
kár esetén gyors javítás. |
(2) A tagállamok az ERCC-n keresztül értesítik a Bizottságot a rescEU-képességek nemzeti célokra való használatáról, és a használatot követően jelentést nyújtanak be.
(3) Amennyiben a rescEU-képességek nemzeti célokra való használata e cikk (1) bekezdésének a) pontja szerint hatással van a rendelkezésre állásra, a tagállam a telepítés előtt az ERCC-n keresztül megszerzi a Bizottság jóváhagyását.
A tagállamok a lehető legrövidebb időn belül biztosítják a rendelkezésre állást, amennyiben a szóban forgó rescEU-képességekre szükség van az uniós mechanizmus keretében végzett reagálási műveletekhez.
6. cikk
A személyzet Unión kívüli telepítésének visszautasítása
(1) Amennyiben az 1313/2013/EU határozat 12. cikkének (10) bekezdésével összhangban döntés született a rescEU-képességek Unión kívülre való telepítéséről, a tagállamok az alábbi esetekben visszautasíthatják a személyzetük telepítését:
|
a) |
amikor a tagállam és a kérelmező harmadik ország között megszakadt a diplomáciai kapcsolat; |
|
b) |
amikor fegyveres konfliktus, ennek veszélye vagy egyéb komoly esemény kockázatot jelentene a személyzet biztonságára és védelmére nézve, és megakadályozná az érintett tagállamot a gondossági kötelezettsége teljesítésében. |
(2) A személyzet bevetését elutasító tagállam haladéktalanul tájékoztatja kell a Bizottságot, és azt megalapozott indokolással kell szolgálnia.
7. cikk
Az operatív szerződések általános tartalma
Az 1313/2013/EU határozat 12. cikkének (5) bekezdésében említett operatív szerződéseknek többek között az alábbi feltételeknek kell megfelelniük:
|
a) |
meg kell határozniuk a rescEU-képességet fogadó létesítmény típusát; |
|
b) |
meg kell határozniuk a fogadott rescEU-képességek helyszínét; |
|
c) |
tájékoztatást kell nyújtaniuk a vonatkozó logisztikáról és biztosításról; |
|
d) |
ismertetniük kell, hogy milyen nemzeti döntéshozatali eljárással biztosítják a vonatkozó minőségi követelményekben meghatározott időtartamon belül a rescEU-képességek rendelkezésre állását és felkészültségét az uniós mechanizmus keretében végzett műveletekre; |
|
e) |
naprakész információkat kell tartalmazniuk a személyzetről, beleértve a munkaviszonyuk feltételeit, a biztosítási szerződéseiket és a képzést, valamint azoknak az intézkedéseknek a leírását, amelyeket nemzetközi telepítésük biztosítása érdekében hoztak; |
|
f) |
tartalmazniuk kell egy karbantartási munkákkal kapcsolatos tervet; |
|
g) |
konkrét jelentéstételi követelményeket kell lefektetniük; |
|
h) |
az 1313/2013/EU határozat 20. cikke a) pontjának megfelelően meg kell határozniuk a láthatósági követelményeket az Unió számára. |
8. cikk
A rescEU-képességek használatára vonatkozó láthatósági követelmények
Amennyiben a rescEU-képességeket az uniós mechanizmus keretében végzett reagálási műveletekre használják fel, a rescEU-képességet fogadó tagállam és a segítségnyújtást kérő tagállam megfelelő láthatóságot biztosít az Unió számára az 1313/2013/EU határozat 20. cikkének a) pontjával összhangban.
9. cikk
Felelősség és kártérítés
A tagállam lemond arról, hogy a Bizottságtól kártérítést követeljen, amennyiben a károk az uniós mechanizmus keretében biztosított segítségnyújtási beavatkozásokkal összefüggésben keletkeztek, vagy az uniós mechanizmus és az e határozat szerint biztosított rescEU-képességek telepítésének elmaradása, leszerelése vagy felszabadítása miatt keletkeztek, kivéve amennyiben ezek bizonyítottan csalásra vagy súlyos kötelességszegésre vezethetők vissza.
10. cikk
Minősítési és nyilvántartásba vételi szabályok
(1) A tagállamok az alkalmazandó nemzeti és nemzetközi szabályoknak és rendelkezéseknek megfelelően biztosítják a rescEU-képességek minősítését és nyilvántartásba vételét.
(2) Amennyiben a rescEU-képességek többféle célt szolgálnak, a minősítést és a nyilvántartásba vételt ennek megfelelően kell elvégezni.
(3) A tagállamok a lehető leghamarabb, az 1313/2013/EU határozat 11. cikke (4) bekezdésével és a 2014/762/EU bizottsági végrehajtási határozat (5) 5. fejezetével összhangban minősítik a rescEU-képességeket az uniós mechanizmus minősítési eljárása keretében. Azok a rescEU-képességek, amelyeknél folyamatban van az uniós minősítési eljárás, a 3. cikk értelmében telepíthetők.
11. cikk
A légi erdőtűzoltó rescEU-képességek becsült összköltsége
(1) A légi erdőtűzoltó rescEU-képességek becsült összköltségének kiszámításakor figyelembe kell venni az 1313/2013/EU határozat IA mellékletének 1–6. pontjában és 8. pontjában említett költségkategóriákat.
(2) A repülőgépes légi erdőtűzoltó képességek tekintetében az 1313/2013/EU határozat IA mellékletének 1. pontjában említett költségkategória szerinti felszerelésköltségeket a vonatkozó piaci árak alapján kell kiszámítani, amennyiben a képességeket az 1313/2013/EU határozat 12. cikke (3) bekezdésével összhangban szerzik meg, bérlik vagy lízingelik. Amennyiben a tagállamok rescEU-képességeket szereznek meg, bérelnek vagy lízingelnek, a Bizottság rendelkezésére bocsátják a vonatkozó aktuális piaci árakat igazoló dokumentumokat.
A helikopteres légi erdőtűzoltó képességek tekintetében az 1313/2013/EU határozat IA mellékletének 1. pontjában említett költségkategória szerinti felszerelésköltségeket a vonatkozó piaci árak alapján kell kiszámítani, amennyiben a képességeket az 1313/2013/EU határozat 12. cikke (3) bekezdésével összhangban szerzik meg, bérlik vagy lízingelik. Amennyiben a tagállamok rescEU-képességeket szereznek meg, bérelnek vagy lízingelnek, a Bizottság rendelkezésére bocsátják a vonatkozó aktuális piaci árakat igazoló dokumentumokat.
(3) A repülőgépes légi erdőtűzoltó képességek tekintetében az 1313/2013/EU határozat IA mellékletének 2–6. pontjában és 8. pontjában említett költségkategóriák költségeit az egyes többéves pénzügyi keretek időtartama során (a 2014–2020 közötti időszaktól kezdődően) legalább egyszer ki kell számítani a Bizottság rendelkezésére álló információk alapján, beleértve az inflációt és az 1313/2013/EU határozat 35. cikkével összhangban a nemzeti képességek finanszírozása céljából végzett költségszámításokat is. Ezt a költséget a Bizottság éves pénzügyi támogatás nyújtása céljából használja fel.
A helikopteres légi erdőtűzoltó képességek tekintetében az 1313/2013/EU határozat IA mellékletének 2–6. pontjában és 8. pontjában említett költségkategóriák költségeit az egyes többéves pénzügyi keretek időtartama során (a 2014–2020 közötti időszaktól kezdődően) legalább egyszer ki kell számítani a Bizottság rendelkezésére álló információk alapján, beleértve az inflációt és az 1313/2013/EU határozat 35. cikkével összhangban a nemzeti képességek finanszírozása céljából végzett költségszámításokat is. Ezt a költséget a Bizottság éves pénzügyi támogatás nyújtása céljából használja fel.
12. cikk
Elszámolható műveleti költségek
(1) Az 1313/2013/EU határozat 23. cikke (2) bekezdésében, illetve a (4) bekezdésének b) és c) pontjában említett műveleti költségek magukban foglalják a művelet során a képesség működőképességének biztosításához szükséges összes költséget. E költségek adott esetben magukban foglalhatják a személyzettel, a nemzetközi és helyi közlekedéssel, a logisztikával, a fogyóeszközökkel és az ellátmánnyal kapcsolatos költségeket, a karbantartást, valamint az ilyen képességek hatékony kihasználásához szükséges egyéb költségeket.
(2) Az (1) bekezdésben említett költségek nem jogosultak támogatásra abban az esetben, ha azokat a 2014/762/EU végrehajtási határozat 39. cikkével vagy az (EU) 2019/570 végrehajtási határozat 3. cikkének (2) bekezdésével összhangban befogadó nemzeti támogatás révén fedezik, vagy ha más uniós pénzügyi eszközből finanszírozzák azokat.
(3) A 2014/762/EU végrehajtási határozat 48. cikkében, 49. cikkének (1) és (3) bekezdésében, 51. cikkében, 53. cikkében és VIII. mellékletében előírt, a szállítási segítség iránti kérelemre vonatkozó eljárások értelemszerűen alkalmazandók a műveleti költségek pénzügyi támogatására irányuló kérelmekre, amíg adott esetben újak nem váltják fel őket.
13. cikk
Címzettek
Ennek a határozatnak a tagállamok a címzettjei.
Kelt Brüsszelben, 2019. július 31-én.
a Bizottság részéről
Christos STYLIANIDES
a Bizottság tagja
(1) HL L 347., 2013.12.20., 924. o.
(2) Az Európai Parlament és a Tanács (EU) 2019/420 határozata (2019. március 13.) az uniós polgári védelmi mechanizmusról szóló 1313/2013/EU határozat módosításáról (HL L 77I, 2019.3.20., 1. o.).
(3) A Bizottság (EU) 2019/570 végrehajtási határozata (2019. április 8.) az 1313/2013/EU európai parlamenti és tanácsi határozat végrehajtására a rescEU-képességekkel összefüggésben alkalmazandó szabályok megállapításáról, valamint a 2014/762/EU bizottsági végrehajtási határozat módosításáról (HL L 99., 2019.4.10., 41. o.).
(4) A Tanács 2008/114/EK irányelve ( 2008. december 8. ) az európai kritikus infrastruktúrák azonosításáról és kijelöléséről, valamint védelmük javítása szükségességének értékeléséről (HL L 345., 2008.12.23., 75. o.).
(5) A Bizottság végrehajtási határozata (2014. október 16.) az uniós polgári védelmi mechanizmusról szóló 1313/2013/EU európai parlamenti és tanácsi határozat végrehajtására vonatkozó szabályok megállapításáról, valamint a 2004/277/EK, Euratom és a 2007/606/EK, Euratom bizottsági határozat hatályon kívül helyezéséről (HL L 320., 2014.11.6., 1. o.).
|
2.8.2019 |
HU |
Az Európai Unió Hivatalos Lapja |
L 204/100 |
AZ EURÓPAI KÖZPONTI BANK (EU) 2019/1311 HATÁROZATA
(2019. július 22.)
a célzott hosszabb lejáratú refinanszírozási műveletek harmadik sorozatáról (EKB/2019/21)
AZ EURÓPAI KÖZPONTI BANK KORMÁNYZÓTANÁCSA,
tekintettel az Európai Unió működéséről szóló szerződésre és különösen annak 127. cikke (2) bekezdésének első francia bekezdésére,
tekintettel a Központi Bankok Európai Rendszere és az Európai Központi Bank Alapokmányára és különösen annak 3.1. cikke első francia bekezdésére, 12.1. cikkére, 18.1. cikke második francia bekezdésére és 34.1. cikke második francia bekezdésére,
mivel:
|
(1) |
Az EKB/2014/34 határozat (1) kétéves időszak alatt, 2014 és 2016 között lefolytatandó célzott hosszabb lejáratú refinanszírozási műveletek (TLTRO-k) sorozatáról (TLTRO-I) rendelkezik, az (EU) 2016/810 európai központi banki határozat (EKB/2016/10) (2) pedig a 2016 júniusa és 2017 márciusa között lefolytatandó TLTRO-k második sorozatáról (TLTRO-II). |
|
(2) |
2019. március 7-én a Kormányzótanács az árstabilitással kapcsolatos feladata ellátása során úgy határozott, hogy a 2019 szeptembere és 2021 márciusa között lefolytatandó hét célzott hosszabb lejáratú refinanszírozási műveletből álló új sorozatot (TLTRO-III) indít, kétéves futamidőkkel. A TLTRO-III célja hozzájárulni a kedvező banki hitelezési feltételek megőrzéséhez és támogatni az alkalmazkodó monetáris politikai irányvonalat azon tagállamokban, amelyek pénzneme az euro. Ezzel az intézkedéssel összefüggésben a figyelembe vehető hitelnyújtás magában foglalja a nem pénzügyi magánszektornak nyújtott hiteleket, a háztartásoknak nyújtott lakáscélú hitelek kivételével. Az egyéb fennálló rendkívüli intézkedésekkel együtt a TLTRO-III célja a hozzájárulás ahhoz, hogy az inflációs ráták visszaálljanak a középtávon 2 % alatti, azonban ahhoz közeli szintre. |
|
(3) |
Azon intézmények részvételének megkönnyítése érdekében, amelyek szervezeti okokból csoportszerkezet útján vesznek fel hitelt az eurorendszertől, a TLTRO-k első és második sorozatához hasonlóan a TLTRO-III-ban lehetővé kell tenni a csoport alapon való részvételt, meghatározott feltételek mellett. A csoportrészvételt az előírt feltételek teljesülése esetén, a csoport egy meghatározott tagján keresztül kell megvalósítani. Emellett a csoporton belüli likviditásmegosztáshoz kapcsolódó kérdések kezelése érdekében a tagok közötti szoros kapcsolatok alapján létrehozott csoportok esetében minden csoporttagnak írásban formálisan is meg kell erősítenie a csoportban való részvételét. Az (EU) 2016/810 határozat (EKB/2016/10) szerinti TLTRO-II-k céljára elismert TLTRO-csoportnak az értesítésre és elismerésre vonatkozó bizonyos eljárások alapján TLTRO-III-csoportként képesnek kell lennie részt venni a TLTRO-III-ban. |
|
(4) |
Az összes TLTRO-III keretében hitelként felvehető teljes összeg a résztvevő nem pénzügyi magánszektor részére nyújtott figyelembe vehető hiteleinek 2019. február 28-án fennálló állománya alapján kerül megállapításra, figyelembe véve a TLTRO-III résztvevő által az (EU) 2016/810 határozat (EKB/2016/10) szerinti TLTRO-II alapján korábban felvett és még kinnlevő összegeket. Továbbá a nem pénzügyi magánszektor részére nyújtott olyan figyelembe vehető hiteleket, amelyeket nem értékesítési célból értékpapírosítottak (azaz az értékpapírosítással létrehozott eszközfedezetű értékpapírokat teljes mértékben megtartják), bizonyos feltételek mellett ugyancsak figyelembe lehet venni a résztvevő hitelfelvételi keretének kiszámítása céljára. Ez javítani fogja a hitelfelvételi keret és a gazdaságnak történő hitelnyújtás között fennálló kapcsolatot. |
|
(5) |
Minden egyes TLTRO-III-ra felső ajánlati korlátot kell alkalmazni. Az ajánlatok nagysága korlátozásának célja az ajánlatok néhány műveletre való túlzott koncentrációjának elkerülése. |
|
(6) |
Az adott TLTRO-III-ra vonatkozó kamatláb a résztvevő 2019. április 1. és 2021. március 31. közötti hitelezési tevékenysége alapján kerül meghatározásra, az e határozatban rögzített elvekkel összhangban. |
|
(7) |
Minden egyes TLTRO-III futamideje két év. Az első TLTRO-hoz és a TLTRO-II-höz képest rövidebb futamidőre tekintettel a résztvevőknek nem állhat rendelkezésére a TLTRO-III-k keretében allokált összegek önkéntes visszafizetésének lehetősége azok lejárta előtt. |
|
(8) |
A TLTRO-III-ban részt venni kívánó intézményekre bizonyos adatszolgáltatási követelmények vonatkoznak. A szolgáltatott adatok a következő célokra kerülnek felhasználásra: a) a hitelfelvételi keret meghatározása; b) az alkalmazandó referenciaérték kiszámítása; c) a résztvevők teljesítményének értékelése a referenciaértékeikre tekintettel; és d) az eurorendszer feladatainak ellátásához szükséges egyéb elemzési célok. A tervek szerint továbbá azon tagállamok nemzeti központi bankjai, amelyek pénzneme az euro (a továbbiakban: NKB-k), és amelyek a szolgáltatott adatokat kapják, ezen adatok tekintetében az eurorendszeren belül adatcserét folytathatnak, amennyiben ez a TLTRO-III-keretrendszer megfelelő végrehajtásához és eredményességének elemzéséhez, valamint az eurorendszer egyéb elemzési céljaira szükséges, az ezekhez szükséges mértékben. A jelentett adatok az eurorendszeren belül megoszthatók a rendelkezésre bocsátott adatok megerősítése céljából. |
|
(9) |
Annak érdekében, hogy a hitelintézetek számára elegendő idő álljon rendelkezésre az első TLTRO-III-hoz kapcsolódó operatív előkészületek megtételére, e határozatnak indokolatlan késedelem nélkül hatályba kell lépnie, |
ELFOGADTA EZT A HATÁROZATOT:
1. cikk
Fogalommeghatározások
E határozat alkalmazásában a következő fogalommeghatározásokat kell alkalmazni:
1. „nettó hitelnyújtási referenciaérték”: azon figyelembe vehető nettó hitelnyújtás összege, amelyet a résztvevőnek a 2019. április 1. és 2021. március 31. közötti időszakban túl kell lépnie ahhoz, hogy jogosult legyen a TLTRO-III keretében történő hitelfelvételére vonatkozó olyan kamatlábra, amely alacsonyabb, mint az alkalmazott kezdeti kamatláb, és amely a 4. cikkben, illetve az I. mellékletben meghatározott elveknek és részletes rendelkezéseknek megfelelően kerül kiszámításra;
2. „állomány-referenciaérték”: a résztvevő figyelembe vehető hitelei 2019. március 31-i állományának és a résztvevő nettó hitelnyújtási referenciaértékének összege, amely a 4. cikkben, illetve az I. mellékletben meghatározott elveknek és részletes rendelkezéseknek megfelelően kerül kiszámításra;
3. „ajánlati korlát”: az a legmagasabb összeg, amelyet egy adott résztvevő hitelként valamely TLTRO-III keretében felvehet, és amely a 4. cikkben, illetve az I. mellékletben meghatározott elveknek és részletes rendelkezéseknek megfelelően kerül kiszámításra;
4. „hitelfelvételi keret”: az a teljes összeg, amelyet egy adott résztvevő hitelként az összes TLTRO-III keretében felvehet, és amely a 4. cikkben, illetve az I. mellékletben meghatározott elveknek és részletes rendelkezéseknek megfelelően kerül kiszámításra;
5. „hitelintézet”: az (EU) 2015/510 európai központi banki iránymutatás (EKB/2014/60) (3) 2. cikkének 14. pontjában meghatározott hitelintézet;
6. „az állomány-referenciaértéktől való eltérés”: az a százalékpont, amellyel a résztvevőnek 2019. április 1-je és 2021. március 31-e között nyújtott figyelembe vehető hitelek nőttek vagy csökkentek tekintettel az állomány-referenciaértékére, amely a 4. cikkben, illetve az I. mellékletben meghatározott részletes rendelkezéseknek megfelelően kerül kiszámításra;
7. „figyelembe vehető hitelek”: az azokban a tagállamokban, amelyek pénzneme az euro, a 2533/98/EK tanácsi rendelet (4) 1. cikkének 4. pontjában meghatározott értelemben rezidens nem pénzügyi vállalatoknak és a háztartásoknak (beleértve a háztartásokat segítő nonprofit intézményeket) nyújtott hitelek, a II. mellékletben részletesebben kifejtetteknek megfelelően, a háztartásoknak nyújtott lakáscélú hitelek kivételével;
8. „figyelembe vehető nettó hitelnyújtás”: a figyelembe vehető hitelek formájában történő bruttó hitelnyújtás, csökkentve a figyelembe vehető hitelek állományából egy meghatározott időszak alatt visszafizetett összegekkel, a II. mellékletben részletesebben kifejtetteknek megfelelően;
9. „pénzügyi közvetítő vállalat” (PKV): az 1075/2013/EU európai központi banki rendelet (EKB/2013/40) (5) 1. cikkének 1. pontjában meghatározott pénzügyi közvetítő vállalat;
10. „első referencia-időszak”: a 2018. április 1-jétől2019. március 31-ig tartó időszak;
11. „PKV-kód”: valamely PKV egyedi azonosító kódja a PKV-k jegyzékében, amelyet az Európai Központi Bank (EKB) az 1075/2013/EU rendelet (EKB/2013/40) 3. cikkével összhangban statisztikai célból vezet és közzétesz;
12. „a kamatláb ösztönző kiigazítása”: a TLTRO-III-k keretében hitelként felvett összegre alkalmazandó kamatláb csökkentése, amennyiben van ilyen, a maximális kamatláb és a minimális kamatláb közötti átlagos különbség hányadában kifejezve, amely az I. mellékletben meghatározott részletes rendelkezéseknek megfelelően kerül kiszámításra;
13. „jogalany-azonosító”: az ISO 17442 szabványnak megfelelő, valamely jogalanyhoz hozzárendelt alfanumerikus hivatkozási kód;
14. „monetáris pénzügyi intézmény” (MPI): az 1071/2013/EU európai központi banki rendelet (EKB/2013/33) (6) 1. cikkének a) pontjában meghatározott monetáris pénzügyi intézmény;
15. „MPI-kód”: valamely MPI egyedi azonosító kódja az MPI-k jegyzékében, amelyet az Európai Központi Bank (EKB) az 1071/2013/EU rendelet (EKB/2013/33) 4. cikkével összhangban statisztikai célból vezet és közzétesz;
16. „figyelembe vehető hitelek állománya”: a mérlegben szereplő figyelembe vehető hitelek állománya, a mérlegből való kivezetés nélkül értékpapírosított vagy más módon átruházott figyelembe vehető hitelek kivételével, a II. mellékletben részletesebben kifejtetteknek megfelelően;
17. „résztvevő”: az (EU) 2015/510 iránymutatással (EKB/2014/60) összhangban az eurorendszer monetáris politikai nyíltpiaci műveletei céljára elfogadható ügyfél, amely a TLTRO-III tendereljárásaiban egyéni alapon vagy csoport alapon vezető intézményként ajánlatokat nyújt be, és amelyre a TLTRO-III tendereljárásaiban való részvételével összefüggő valamennyi jog és kötelezettség vonatkozik;
18. „referencia-állomány”: a figyelembe vehető hitelek állománya és a 6. cikk (3) bekezdése szerinti lehetőség választása esetén a nem értékesítési célból értékpapírosított figyelembe vehető hitelek állományának összege 2019. február 28-án;
19. „érintett NKB”: egy adott résztvevő vonatkozásában azon tagállam NKB-ja, amelyben a résztvevő letelepedett;
20. „második referencia-időszak”: a 2019. április 1-jétől2021. március 31-éig tartó időszak;
21. „értékpapírosítás”: a következő tranzakciók: a) az (EU) 2017/2402 (7) európai parlamenti és tanácsi rendelet 2. cikkének 9. pontjában meghatározott hagyományos értékpapírosítás; vagy b) az 1075/2013/EU rendelet (EKB/2013/40) 1. cikkének 2. pontjában meghatározott értékpapírosítás, amelynek része az értékpapírosított hitelek valamely PKV-ra történő átruházása;
22. „nem értékesítési célból értékpapírosított figyelembe vehető hitelek”: olyan figyelembe vehető hitelek, amelyeket valamely résztvevő vagy valamely TLTRO-III-csoport tagja kezdeményezett és értékpapírosított, amely során az értékpapírosítással létrehozott eszközfedezetű értékpapírokat 100 %-ban megtartja a résztvevő vagy a TLTRO-III-csoport tag.
2. cikk
A célzott hosszabb lejáratú refinanszírozási műveletek harmadik sorozata
(1) Az eurorendszer hét TLTRO-III-t hajt végre, az EKB honlapján közzétett, a TLTRO-III-ra vonatkozó indikatív naptárnak megfelelően.
(2) Egy adott TLTRO-III a vonatkozó elszámolási napot követően két évvel jár le, az önkéntes korai visszafizetés lehetősége nélkül, olyan napon, amely egybeesik az eurorendszer valamely fő refinanszírozási műveletének elszámolási napjával, az EKB honlapján közzétett, a TLTRO-III-ra vonatkozó indikatív naptárnak megfelelően.
(3) A TLTRO-III:
|
a) |
likviditásbővítő penziós ügylet; |
|
b) |
az NKB-k által decentralizált módon kerül végrehajtásra; |
|
c) |
lebonyolítása standard tender útján történik; és |
|
d) |
lebonyolítása rögzített kamatú tendereljárások formájában történik. |
(4) Az általános feltételek, amelyek alapján az NKB-k készek hitelműveleteket végezni, e határozat eltérő rendelkezése hiányában alkalmazandók a TLTRO-III tekintetében. E feltételek magukban foglalják a nyíltpiaci műveletek folytatására vonatkozó eljárásokat, az eurorendszer hitelműveletei céljára az ügyfelek és a fedezetek elfogadhatóságát meghatározó kritériumokat és az ügyfelek kötelezettségeinek nemteljesítése esetén alkalmazandó szankciókat. E feltételeket a refinanszírozási műveletekre alkalmazandó általános és ideiglenes jogi keretek rögzítik, az NKB-k szerződéses és/vagy szabályozási nemzeti kereteiben végrehajtottaknak megfelelően.
(5) Az ezen határozat és az (EU) 2015/510 iránymutatás (EKB/2014/60) vagy a hosszabb lejáratú refinanszírozási műveletekre alkalmazandó jogi keretet rögzítő bármely más EKB jogi aktus és/vagy az azt nemzeti szinten végrehajtó nemzeti rendelkezések közötti ellentmondás esetén ez a határozat alkalmazandó.
3. cikk
Részvétel
(1) Valamely intézmény a TLTRO-III-ban egyéni alapon akkor vehet részt, ha az eurorendszer monetáris politikai nyíltpiaci műveletei céljára elfogadható ügyfél.
(2) Az intézmények a TLTRO-III-ban csoport alapon TLTRO-III-csoport alakítása útján vehetnek részt. A csoport alapon történő részvétel a 4. cikkben rögzített, alkalmazandó hitelfelvételi keret és a referenciaértékek kiszámítása, valamint a 6. cikkben rögzített, ehhez kapcsolódó adatszolgáltatási kötelezettségek szempontjából bír jelentőséggel. A csoport alapon történő részvételre a következő korlátozások vonatkoznak:
|
a) |
egy intézmény nem lehet egynél több TLTRO-III-csoport része; |
|
b) |
a TLTRO-III-ban csoport alapon részt vevő intézmény egyéni alapon nem vehet részt; |
|
c) |
a vezető intézményként kijelölt intézmény a TLTRO-III-csoport egyetlen olyan tagja, amely a TLTRO-III tendereljárásokban részt vehet; és |
|
d) |
a TLTRO-III-csoport összetétele és vezető intézménye – e cikk (5) és (6) bekezdése fenntartásával – az összes TLTRO-III alatt változatlan marad. |
(3) A TLTRO-III-ban TLTRO-III-csoport útján való részvételhez a következő feltételeknek kell teljesülniük.
|
a) |
Az e bekezdés d) pontjában említett kérelmet megelőző hónap utolsó napjától egy adott csoport minden egyes tagja:
|
|
b) |
A csoport kijelöl egy tagot a csoport vezető intézményének. A vezető intézmény az eurorendszer monetáris politikai nyíltpiaci műveletei céljára elfogadható ügyfél. |
|
c) |
A TLTRO-III-csoport valamennyi tagja olyan tagállamban letelepedett hitelintézet, amelynek pénzneme az euro, továbbá eleget tesz az (EU) 2015/510 iránymutatás (EKB/2014/60) 55. cikkének a), b) és c) pontjában rögzített feltételeknek. |
|
d) |
Az e) pont fenntartásával a vezető intézmény az NKB-jánál kérelmezi a csoport részvételét az EKB honlapján közzétett, a TLTRO-III-ra vonatkozó indikatív naptárnak megfelelően. A kérelem a következőket tartalmazza:
|
|
e) |
Az (EU) 2016/810 határozat (EKB/2016/10) szerinti TLTRO-II-k céljára elismert TLTRO-II-csoport részt vehet TLTRO-III-csoportként a TLTRO-III-ban, felvéve, hogy vezető intézménye erről írásbeli értesítést küld az érintett NKB-nak az EKB honlapján közzétett, a TLTRO-III-ra vonatkozó indikatív naptárnak megfelelően. Az értesítés a következőket tartalmazza:
|
|
f) |
A vezető intézménynek kérnie kell az NKB-je megerősítését, hogy a TLTRO-III-csoportot elismerték. E megerősítés kiadása előtt az érintett NKB a TLTRO-III-csoport potenciális összetételére vonatkozó értékelése szempontjából releváns további információkat kérhet a vezető intézménytől. A csoportkérelem értékelése során az érintett NKB szükség szerint figyelembe veszi a csoporttagok NKB-inek bármely értékelését is, például adott esetben a d) vagy e) ponttal összhangban szolgáltatott dokumentáció ellenőrzését. |
E határozat alkalmazásában a konszolidált felügyelet alatt álló hitelintézetek, beleértve az ugyanazon hitelintézet fióktelepeit, a TLTRO-III-csoportként történő elismerés céljára szintén megfelelő kérelmezőknek tekintendők, és megfelelően eleget kell tenniük az e cikkben rögzített feltételeknek. Ez megkönnyíti a TLTRO-III-csoport létrehozását az ilyen intézmények között, amennyiben azok ugyanazon jogi személy részét alkotják. Az ilyen jellegű TLTRO-III-csoport létrehozásának vagy összetétele módosításának megerősítésére a (3) bekezdés d) pontjának v. alpontja, illetve a (6) bekezdés b) pontja ii. alpontjának 5. tétele alkalmazandó.
(4) Amennyiben a TLTRO-III-csoportként történő elismerés iránti kérelemben szereplő egy vagy több intézmény nem tesz eleget a (3) bekezdésben rögzített feltételeknek, az érintett NKB részlegesen elutasíthatja a javasolt csoport kérelmét. Ebben az esetben a kérelmet benyújtó intézmények dönthetnek úgy, hogy a szükséges feltételeknek eleget tevő csoporttagokra korlátozódó összetételű TLTRO-III-csoportként járnak el, vagy visszavonják a TLTRO-III-csoportként történő elismerés iránti kérelmet.
(5) Kivételes esetekben, objektív indokok fennállása esetén a Kormányzótanács határozhat úgy, hogy eltér a (2) és a (3) bekezdésben megjelölt feltételektől.
(6) Az (5) bekezdés sérelme nélkül, a (3) bekezdéssel összhangban elismert csoport összetétele az alábbi körülmények esetén változhat:
|
a) |
A csoport valamely tagja kizárásra kerül a TLTRO-III-csoportból, amennyiben már nem tesz eleget a (3) bekezdés a) vagy c) pontjában foglalt követelményeknek. Az érintett csoporttag NKB-ja tájékoztatja a vezető intézményt arról, hogy a csoporttag nem felel meg e követelményeknek. Ebben az esetben a szóban forgó vezető intézmény értesíti az érintett NKB-t a csoportja tagjának jogállásában bekövetkezett változásról. |
|
b) |
Amennyiben a TLTRO-III-csoport vonatkozásában a (3) bekezdés d) pontjában említett kérelmet megelőző hónap utolsó napját követően további szoros kapcsolatok jöttek létre, vagy köztük további kötelező tartalékok eurorendszernél történő közvetett tartására került sor, a TLTRO-III-csoport összetétele megváltozhat annak érdekében, hogy tükrözze az új csoporttag felvételét, feltéve, hogy:
|
|
c) |
Amennyiben a TLTRO-III-csoport vonatkozásában a (3) bekezdés d) pontjában említett kérelmet megelőző hónap utolsó napját követően a TLTRO-III-csoport tagjait érintő egyesülés, befolyásszerzés vagy szétválás következik be, és ez a művelet nem vezet a figyelembe vehető hitelek körét érintő változáshoz, a TLTRO-III-csoport összetétele megváltozhat annak érdekében, hogy tükrözze az egyesülést, befolyásszerzést vagy szétválást, feltéve, hogy a b) pontban rögzített feltételek teljesülnek. |
(7) Amennyiben a TLTRO-III-csoport összetételében bekövetkezett változásokat a Kormányzótanács az (5) bekezdéssel összhangban elfogadta, vagy a TLTRO-III-csoportok összetételében a (6) bekezdéssel összhangban következtek be változások, a Kormányzótanács eltérő döntése hiányában a következők érvényesülnek:
|
a) |
azon változások tekintetében, amelyekre az (5) bekezdés vagy a (6) bekezdés b) vagy c) pontja vonatkozik, a vezető intézmény a TLTRO-III-csoportja új összetétele alapján csak azt követően vehet részt TLTRO-III-ban, hogy NKB-ja megerősítette számára a TLTRO-III-csoport új összetételének elismerését; és |
|
b) |
azon intézmény, amely már nem tagja TLTRO-III-csoportnak, nem vehet részt további TLTRO-III-ban, sem egyéni alapon, sem más TLTRO-III-csoport tagjaként, kivéve, ha az (1), (3) vagy (6) bekezdéssel összhangban új részvételi kérelmet nyújt be. |
(8) Amennyiben a vezető intézmény elveszíti az eurorendszer monetáris politikai nyíltpiaci műveletei céljára elfogadható ügyfélkénti jogállását, TLTRO-III-csoportjának elismerése megszűnik, és a vezető intézmény köteles a TLTRO-III keretében felvett összegek visszafizetésére.
4. cikk
Hitelfelvételi keret, ajánlati korlát és referenciaértékek
(1) Az egyéni résztvevőkre vonatkozó hitelfelvételi keretek az adott egyéni résztvevő referencia-állományára vonatkozó hiteladatok alapján kerülnek kiszámításra. A valamely TLTRO-III-csoport vezető intézményének minősülő résztvevőre vonatkozó hitelfelvételi keret a TLTRO-III-csoport valamennyi tagja referencia-állományaira vonatkozó aggregált hiteladatok alapján kerül kiszámításra.
(2) Az egyes résztvevők hitelfelvételi kerete a teljes referencia-állományuk 30 %-ának felel meg, csökkentve az adott TLTRO-III résztvevő által az (EU) 2016/810 határozat (EKB/2016/10) alapján a TLTRO-II keretében korábban felvett és a TLTRO-III elszámolási időpontjában még kintlévő összegekkel, figyelemmel a résztvevő által az(EU) 2016/810 határozat (EKB/2016/10) 6. cikkével összhangban benyújtott, korai visszafizetésre vonatkozó, jogilag kötelező erejű értesítésre. A vonatkozó technikai számításokat az I. melléklet vázolja.
(3) Amennyiben az (EU) 2016/810 határozat (EKB/2016/10) szerinti TLTRO-II-k céljára elismert TLTRO-csoport tagja nem kíván a megfelelő TLTRO-III-csoport tagjává válni, az adott hitelintézet mint egyéni résztvevő TLTRO-III szerinti hitelfelvételi kerete kiszámítása céljából az adott intézményt úgy kell tekinteni, mint amely a TLTRO-II-k keretében hitelként olyan összeget vett fel, amely megfelel a TLTRO-II-csoport vezető intézménye által a TLTRO-II keretében felvett és a TLTRO-III elszámolási időpontjában még kintlévő összeg, valamint a csoporttag figyelembe vehető hiteleinek a TLTRO-II-csoport figyelembe vehető hiteleihez viszonyított, 2016. január 31-én fennálló aránya szorzatának. Ez utóbbi összeget a vezető intézmény TLTRO-III szerinti hitelfelvételi kerete kiszámításának céljából le kell vonni a vonatkozó TLTRO-III-csoport által a TLTRO-II-k keretében hitelként felvettnek tekintendő összegből.
(4) A valamely TLTRO-III keretében az egyes résztvevőkre vonatkozó ajánlati korlát: i. a korábbi TLTRO-III-k keretében felvett összegekkel csökkentett hitelfelvételi keret; vagy ii. a teljes referencia-állomány egytizede közül az alacsonyabb. Ezt az összeget az adott résztvevőre vonatkozó felső ajánlati korlátnak kell tekinteni, és a felső ajánlati korlátot meghaladó ajánlatokra vonatkozó, az (EU) 2015/510 iránymutatás (EKB/2014/60) 36. cikkében rögzített szabályok alkalmazandóak. A vonatkozó technikai számításokat az I. melléklet vázolja.
(5) A résztvevő nettó hitelnyújtási referenciaértéke az első referencia-időszak alatti figyelembe vehető nettó hitelnyújtás alapján kerül meghatározásra, az alábbiak szerint:
|
a) |
azon résztvevők vonatkozásában, amelyek az első referencia-időszakban pozitív vagy nulla figyelembe vehető nettó hitelnyújtást jelentenek, a nettó hitelnyújtási referenciaérték nulla; |
|
b) |
azon résztvevők vonatkozásában, amelyek az első referencia-időszakban negatív figyelembe vehető nettó hitelnyújtást jelentenek, a nettó hitelnyújtási referenciaérték az első referencia-időszakban figyelembe vehető nettó hitelnyújtással egyenlő. |
A vonatkozó technikai számításokat az I. melléklet vázolja. A nettó hitelnyújtási referenciaérték nulla azon résztvevők vonatkozásában, amelyek működési engedélyét 2019. február 28-át követően adták ki, kivéve, ha a Kormányzótanács objektíven indokolt esetben eltérően határoz.
(6) A résztvevő állomány-referenciaértékét a figyelembe vehető hitelek 2019. március 31-i állománya és a nettó hitelnyújtási referenciaérték összegeként kell meghatározni. A vonatkozó technikai számításokat az I. melléklet vázolja.
5. cikk
Kamat
(1) A (2) bekezdés fenntartásával a valamely TLTRO-III keretében hitelként felvett összegre alkalmazandó kamatlábat az adott TLTRO-III élettartama alatt az irányadó refinanszírozási műveletre érvényes átlagos kamatláb felett 10 bázisponttal kell megállapítani.
(2) Az azon résztvevők által hitelként felvett összegekre alkalmazandó kamatlábnak, amelyek figyelembe vehető nettó hitelnyújtása a második referencia-időszakban meghaladja a nettó hitelnyújtási referenciaértéküket, alacsonyabbnak kell lennie az (1) bekezdésben meghatározott kamatlábnál, és lehet olyan, hogy 10 bázisponttal meghaladja az adott TLTRO-III élettartama alatt a betéti rendelkezésre állásra érvényes átlagos kamatlábat, az állomány-referenciaértéktől való eltéréstől függően. A részletes rendelkezéseket és számításokat az I. melléklet vázolja.
(3) Az állomány-referenciaértéktől való eltérést, a kamatláb ösztönző kiigazítását, amennyiben van ilyen, és a végső kamatlábakat az EKB honlapján közzétett, a TLTRO-III-ra vonatkozó indikatív naptárral összhangban közölni kell a résztvevőkkel.
(4) A kamatot az adott TLTRO-III lejáratakor utólag kell kiegyenlíteni.
(5) Amennyiben a valamely NKB szerződéses vagy szabályozási rendelkezéseivel összhangban az NKB rendelkezésére álló korrekciós intézkedések alkalmazása következtében egy résztvevőnek a TLTRO-III kintlévő összegeket azelőtt kell visszafizetnie, hogy az állomány-referenciaértéktől való eltérést vagy - amennyiben van ilyen - a kamatláb ösztönző kiigazítását közölték volna a résztvevővel, az adott résztvevő által az egyes TLTRO-III-k keretében hitelként felvett összegekre alkalmazandó kamatlábat az adott TLTRO-III élettartama alatt az irányadó refinanszírozási műveletre érvényes átlagos kamatláb felett 10 bázisponttal kell megállapítani a visszafizetés NKB által előírt időpontjáig. Amennyiben az állomány-referenciaértéktől való eltérésnek és - amennyiben van ilyen - a kamatláb ösztönző kiigazításának a résztvevővel történő közlését követően írnak elő ilyen visszafizetést, a résztvevő által az egyes TLTRO-III-k keretében felvett összegekre alkalmazandó kamatlábat az állomány-referenciaértéktől való eltérés figyelembevételével kell meghatározni.
6. cikk
Adatszolgáltatási követelmények
(1) A TLTRO-III résztvevőinek be kell nyújtaniuk az érintett NKB részére a II. mellékletben meghatározott adatszolgáltatási sablonokban azonosított adatokat, az alábbiak szerint:
|
a) |
a referencia-állományt a résztvevő hitelfelvételi keretének és ajánlati korlátainak megállapítása érdekében, és az első referencia-időszakra vonatkozó adatokat a résztvevő referenciaértékeinek megállapítása érdekében (a továbbiakban: első jelentés); és |
|
b) |
a második referencia-időszakra vonatkozó adatokat az alkalmazandó kamatlábak megállapítása érdekében (a továbbiakban: második jelentés). |
(2) Az adatokat az alábbiakkal összhangban kell szolgáltatni:
|
a) |
az EKB honlapján közzétett, a TLTRO-III-ra vonatkozó indikatív naptár; |
|
b) |
a II. mellékletben rögzített iránymutatások; és |
|
c) |
az 1071/2013/EU rendelet (EKB/2013/33) IV. mellékletében meghatározott, a pontosságra és a koncepcionális megfelelésre vonatkozó minimumszabályok. |
(3) Azok a résztvevők, akik figyelembe kívánják venni a nem értékesítési célból értékpapírosított figyelembe vehető hiteleket a hitelfelvételi keretkiszámítása céljából, azáltal élnek ezzel a lehetőséggel, hogy a valamennyi nem értékesítési célból értékpapírosított hitelre vonatkozó, a II. mellékletben részletezett kiegészítő tételt ezen kiegészítő tételek könyvvizsgáló általi értékelésével együtt rendelkezésre bocsátják a következő szabályok szerint:
|
a) |
Az első vagy a második TLTRO-III művelet résztvevői részt vehetnek olyan első jelentés alapján, amely nem tartalmazza a kiegészítő tételeket. Annak érdekében azonban, hogy a második vagy harmadik műveletre vonatkozó hitelfelvételi keret és ajánlati korlát kiszámításánál figyelembe vegyék a nem értékesítési célból értékpapírosított hiteleket, a kiegészítő tételeket és a kiegészítő tételek könyvvizsgáló általi értékelését az érintett NKB rendelkezésére kell bocsátani az ezen művelekekhez kapcsolódó első jelentésre vonatkozó, az EKB honlapján közzétett, a TLTRO-III-ra vonatkozó indikatív naptárban meghatározott határidő előtt; |
|
b) |
Az először a harmadik vagy azt követő TLTRO-III műveletben részt vevő résztvevőknek az EKB honlapján közzétett, a TLTRO-III-ra vonatkozó indikatív naptárban meghatározott határidőig az érintett NKB rendelkezésére kell bocsátani a kiegészítő tételeket tartalmazó első jelentést és a kiegészítő tételek könyvvizsgáló általi értékelését egyaránt. |
(4) A résztvevők által benyújtott jelentésben használt fogalmakat az e fogalmakra vonatkozóan az 1071/2013/EU rendeletben (EKB/2013/33) szereplő fogalommeghatározásokkal összhangban kell értelmezni.
(5) A TLTRO-III-csoportok vezető intézményeinek a TLTRO-III-csoport valamennyi tagja tekintetében összesített adatokat tükröző jelentéseket kell benyújtaniuk. Ezenkívül a vezető intézmény NKB-ja, vagy a vezető intézmény NKB-jával történő egyeztetés alapján a TLTRO-III-csoport egy tagjának NKB-ja előírhatja azt, hogy a vezető intézmény minden egyes csoporttag vonatkozásában tételes adatokat szolgáltasson.
(6) A résztvevőknek biztosítaniuk kell, hogy az (1)-(3) bekezdés alapján benyújtott adatok minőségét külső könyvvizsgáló értékelje, a következő szabályokkal összhangban:
|
a) |
a könyvvizsgáló első jelentésre vonatkozó értékelését az EKB honlapján közzétett, a TLTRO-III-ra vonatkozó indikatív naptárban meghatározott határidőig kell az érintett NKB rendelkezésére bocsátani; |
|
b) |
a könyvvizsgáló második jelentésre vonatkozó értékelésének eredményeit az EKB honlapján közzétett, a TLTRO-III-ra vonatkozó indikatív naptárban meghatározott határidőig kell az érintett NKB rendelkezésére bocsátani; |
|
c) |
a könyvvizsgáló értékelésének a (2) és (4) bekezdésben meghatározott követelményekre kell összpontosítania. A könyvvizsgáló különösen:
Csoport alapon történő részvétel esetén a könyvvizsgáló értékelésének eredményeit meg kell osztani a TLTRO-III-csoport egyéb tagjainak NKB-ivel is. A résztvevő NKB-jének kérésére az ezen bekezdés alapján elvégzett értékelések részletes eredményeit ezen NKB rendelkezésére kell bocsátani, és csoportrészvétel esetén ezt követően meg kell osztani a csoporttagok NKB-ival. |
|
d) |
A könyvvizsgáló értékelésének legalább a következő elemeket kell tartalmaznia:
|
Az eurorendszer további útmutatással szolgálhat arra vonatkozóan, hogy a könyvvizsgáló általi értékelést hogyan kell lefolytatni, ebben az esetben a résztvevőknek biztosítaniuk kell, hogy ezt az útmutatást a könyvvizsgálók értékelésük során alkalmazzák.
(7) A (8) bekezdés fenntartásával a TLTRO-III-csoport összetételében bekövetkező változást vagy a résztvevő figyelembe vehető hiteleinek körét érintő vállalati átszervezést – így összeolvadást, befolyásszerzést vagy szétválást (ideértve a résztvevő szanálásából vagy felszámolásából eredőt is) – követően a résztvevő NKB-jától kapott útmutatásoknak megfelelően egy felülvizsgált első jelentést kell benyújtani. Az érintett NKB értékeli a felülvizsgálat hatását és meghozza a megfelelő intézkedéseket. Ilyen intézkedés lehet többek között az azon hitelként felvett összegek visszafizetésére vonatkozó követelmény, amelyek a TLTRO-III-csoport összetételében bekövetkezett változás vagy a vállalati átszervezés figyelembevételével meghaladják a vonatkozó hitelfelvételi keretet. A szóban forgó résztvevő, amely lehet a vállalati átszervezést követően újonnan létrejött szervezet, a felülvizsgálat hatása értékelésének elősegítése érdekében az érintett NKB által kért bármely további információt rendelkezésre bocsát.
(8) A (7) bekezdéstől eltérően nem szükséges az első jelentés felülvizsgálata, helyette a figyelembe vehető hitelekre gyakorolt lényeges hatást lehet rögzíteni a második jelentésben kiigazításként a következő esetekben:
|
a) |
a vállalati átszervezés olyan intézményeket érint, amelyek a vállalati átszervezést megelőzően felügyeleti intézkedés vagy szanálási intézkedés hatálya alatt álltak, és ezek az intézkedések az érintett NKB által megerősítetten a második referencia-időszak legalább felében valóban akadályozták hitelnyújtási képességüket; |
|
b) |
a vállalati átszervezés olyan résztvevő általi szerzést foglal magában, amelyet a második referencia-időszak utolsó hat hónapjában hajtottak végre; vagy |
|
c) |
az érintett NKB olyanként értékeli a csoport összetételében bekövetkező változás vagy a vállalati átszervezés hatását, hogy az nem igényel felülvizsgált jelentést. |
A b) és a c) esetben a résztvevők továbbra is választhatják az első jelentés felülvizsgálatát a vállalati átszervezés figyelembevételéhez.
(9) A résztvevők által e cikk alapján rendelkezésre bocsátott adatokat az eurorendszer felhasználhatja a TLTRO-III-keretrendszer végrehajtásához, valamint a keret eredményességének értékeléséhez és az eurorendszer egyéb elemzési céljaira. E célból az e cikk alapján jelentett adatokat megkapó NKB-k kicserélhetik ezeket az adatokat az eurorendszerben. Az e cikk alapján jelentett adatok az eurorendszeren belül megoszthatók a rendelkezésre bocsátott adatok megerősítése céljából is.
7. cikk
Az adatszolgáltatási követelmények nem teljesítése
(1) Amennyiben egy résztvevő nem nyújt be valamely jelentést vagy nem tesz eleget az ellenőrzésre vonatkozó követelményeknek, illetve a szolgáltatott adatokban hibák kerülnek azonosításra, az alábbiak alkalmazandók:
|
a) |
Ha a résztvevő a vonatkozó határidőre nem bocsátja az érintett NKB rendelkezésére az első jelentést, hitelfelvételi kerete nulla értéken kerül megállapításra. |
|
b) |
Ha a résztvevő az EKB honlapján közzétett, a TLTRO-III-ra vonatkozó indikatív naptárban meghatározott határidőig nem bocsátja az érintett NKB rendelkezésére a könyvvizsgáló első jelentésre vonatkozó értékelésének eredményeit, a résztvevőnek vissza kell fizetnie a TLTRO-III keretében felvett minden összeget a következő irányadó refinanszírozási művelet elszámolási napján, az adott TLTRO-III élettartama alatt az irányadó refinanszírozási műveletre érvényes átlagos kamatlábat 10 bázisponttal meghaladó kamatlábbal. |
|
c) |
Ha a résztvevő a vonatkozó határidőre nem bocsátja az érintett NKB rendelkezésére a második jelentést, az adott TLTRO-III élettartama alatt az irányadó refinanszírozási műveletre érvényes átlagos kamatlábat 10 bázisponttal meghaladó kamatlábat kell alkalmazni a résztvevő által a TLTRO-III keretében felvett összegekre, egy további napi 500 euro összegű, de legfeljebb 15 000 euróig terjedő bírsággal a második jelentés benyújtásáig. A bírság halmozódik, és akkor kerül felszámításra, amikor az érintett NKB megkapja a második jelentést, vagy amikor elérik a bírság maximális összegét, ha addig az időpontig sem érkezik be a második jelentés. |
|
d) |
Ha a résztvevő a vonatkozó határidőre nem bocsátja az érintett NKB rendelkezésére a második jelentésre vonatkozó könyvvizsgálói értékelés eredményeit, az adott TLTRO-III élettartama alatt az irányadó refinanszírozási műveletre érvényes átlagos kamatlábat 10 bázisponttal meghaladó kamatlábat kell alkalmazni a résztvevő által a TLTRO-III keretében felvett összegekre. |
|
e) |
Ha a résztvevő más módon nem tesz eleget a 6. cikk (6) bekezdésében vagy (7) bekezdésében szereplő kötelezettségeknek, az adott TLTRO-III élettartama alatt az irányadó refinanszírozási műveletre érvényes átlagos kamatlábat 10 bázisponttal meghaladó kamatlábat kell alkalmazni a résztvevő által a TLTRO-III keretében felvett összegekre. |
|
f) |
Ha a résztvevő a 6. cikk (6) bekezdésében említett ellenőrzéssel összefüggésben vagy más módon a jelentésekben benyújtott adatokban hibákat azonosít, a pontatlanságot és a hiányosságot is beleértve, a lehető legrövidebb időn belül értesíti erről az érintett NKB-t. Ha az érintett NKB-t ilyen hibákról, pontatlanságokról vagy hiányosságokról értesítették, vagy az ilyen hibák, pontatlanságok vagy hiányosságok más módon a tudomására jutottak: i. a résztvevő a szóban forgó hiba, pontatlanság vagy hiányosság hatása értékelésének elősegítése érdekében az érintett NKB által kért bármely további információt a legrövidebb időn belül rendelkezésre bocsátja; és ii. az érintett NKB megfelelő intézkedéseket hozhat, ideértve a vonatkozó értékek újraszámolását, amely hatással lehet a résztvevő által a TLTRO-III-k keretében felvett hitelekre alkalmazott kamatlábra, és a hitelként felvett azon összegek visszafizetésére vonatkozó követelményt, amely összegek a hiba, pontatlanság vagy hiányosság következtében meghaladják a résztvevő hitelfelvételi keretét. |
(2) Az (1) bekezdés nem érinti az EKB/2010/10 határozat (9) alapján az 1071/2013/EU rendeletben (EKB/2013/33) meghatározott adatszolgáltatási kötelezettségek vonatkozásában kiszabható szankciókat.
8. cikk
Hatálybalépés
Ez a határozat 2019. augusztus 3-án lép hatályba.
Kelt Frankfurt am Mainban, 2019. július 22-én.
az EKB elnöke
Mario DRAGHI
(1) Az EKB/2014/34 határozata (2014. július 29.) a célzott hosszabb lejáratú refinanszírozási műveletekkel kapcsolatos intézkedésekről (HL L 258., 2014.8.29., 11. o.).
(2) Az Európai Központi Bank (EU) 2016/810 határozata (2016. április 28.) a célzott hosszabb lejáratú refinanszírozási műveletek második sorozatáról (EKB/2016/10) (HL L 132., 2016.5.21., 107. o.).
(3) Az Európai Központi Bank (EU) 2015/510 iránymutatása (2014. december 19.) az eurorendszer monetáris politikához kötődő keretének végrehajtásáról (EKB/2014/60) (HL L 91., 2015.4.2., 3. o.).
(4) A Tanács 2533/98/EK rendelete (1998. november 23.) az Európai Központi Bank által végzett statisztikai adatgyűjtésről (HL L 318., 1998.11.27., 8. o.).
(5) Az Európai Központi Bank 1075/2013/EU rendelete (2013. október 18.) az értékpapírosítási tranzakciókban részt vevő pénzügyi közvetítő vállalatok eszközeiről és forrásairól szóló statisztikákról (EKB/2013/40) (HL L 297., 2013.11.7., 107. o.).
(6) Az Európai Központi Bank 1071/2013/EU rendelete (2013. szeptember 24.) a monetáris pénzügyi intézmények ágazati mérlegéről (EKB/2013/33) (HL L 297., 2013.11.7., 1. o.).
(7) Az Európai Parlament és a Tanács (EU) 2017/2402 rendelete (2017. december 12.) az értékpapírosítás általános keretrendszerének meghatározásáról, az egyszerű, átlátható és egységesített értékpapírosítás egyedi keretrendszerének létrehozásáról, valamint a 2009/65/EK, a 2009/138/EK és a 2011/61/EU irányelv és az 1060/2009/EK és a 648/2012/EU rendelet módosításáról (HL L 347., 2017.12.28., 35. o.).
(8) Az Európai Központi Bank 1745/2003/EK rendelete (2003. szeptember 12.) a kötelező tartalékok alkalmazásáról (EKB/2003/9) (HL L 250., 2003.10.2., 10. o.).
(9) Az EKB/2010/10 határozat (2010. augusztus 19.) a statisztikai adatszolgáltatási kötelezettségek nem teljesítéséről (HL L 226., 2010.8.28., 48. o.).
I. MELLÉKLET
A CÉLZOTT HOSSZABB LEJÁRATÚ REFINANSZÍROZÁSI MŰVELETEK HARMADIK SOROZATÁNAK LEFOLYTATÁSA
1. A hitelfelvételi keret és az ajánlati korlát kiszámítása
A célzott hosszabb lejáratú refinanszírozási műveletek harmadik sorozatának (TLTRO-III) résztvevőjére – akár egyéni alapon, akár TLTRO-III-csoport vezető intézményeként jár el – hitelfelvételi keret vonatkozik. A számított hitelfelvételi keretet 10 000 eurónként felfelé kell kerekíteni.
A TLTRO-III egyéni résztvevőjére vonatkozó hitelfelvételi keretet azon referencia-állomány alapján kell kiszámítani, amely a figyelembe vehető hitelek állományából és a 6. cikk (3) bekezdése szerinti lehetőség választása esetén nem értékesítési célból értékpapírosított figyelembe vehető hitelekből tevődik össze 2019. február 28-án. A valamely TLTRO-III-csoport vezető intézményére vonatkozó hitelfelvételi keretet az adott TLTRO-III-csoport valamennyi tagja tekintetében a referencia-állomány alapján kell kiszámítani.
A hitelfelvételi keret a résztvevő (1) referencia-állományának 30 %-a mínusz a résztvevő által az (EU) 2016/810 határozat (EKB/2016/10) szerinti célzott hosszabb lejáratú refinanszírozási műveletek (TLTRO-II-k) keretében felvett és a megfelelő TLTRO-III elszámolási időpontjában még kintlévő összegeknek felel meg, vagy nulla, ha ez az összeg negatív, azaz:
BAk = max(0,3 × OR 2019. febr – OBk , 0), ahol k = 1,…,7.
Itt a BAk a TLTRO-III k szerinti hitelfelvételi keret (ahol k = 1,…,7), OR 2019. febr a résztvevő 2019. február 28-i referencia-állománya, és az OB k a résztvevő által a TLTRO-II keretében hitelként felvett és a TLTRO-III k elszámolási időpontjában még kintlévő összeg.
A valamely TLTRO-III keretében az egyes résztvevőkre vonatkozó ajánlati korlát: a) a korábbi TLTRO-III keretében felvett összegekkel csökkentett BAk hitelfelvételi keret; vagy b) a teljes referencia-állomány egytizede közül az alacsonyabb. Legyen Ck ≥ 0 a résztvevő hitelfelvétele a TLTRO-III k keretében, és Ck ≤ BLk , ahol BLk a k műveletben az ezen résztvevőre vonatkozó ajánlati korlát, a következő meghatározás szerint:
BL 1 = min(BA 1, 0,1 × OR 2019. febr )
és

ahol k = 2,…,7.
2. A referenciaértékek kiszámítása
Legyen az NLm a résztvevő figyelembe vehető nettó hitelnyújtása az m naptári hónapban, amelyet a résztvevő új figyelembe vehető hiteleinek bruttó forgalma az adott hónapban mínusz a II. mellékletben meghatározottak szerinti figyelembe vehető hitelek törlesztéseiként kell kiszámítani.
Jelölje NLB az adott résztvevő nettó hitelezési referenciaértékét. Ez a következőképpen kerül meghatározásra:
NLB = min (NL 2018. ápr + NL 2018. máj + … + NL 2019. márc , 0)
Ez azt jelenti, hogy ha a résztvevő az első referencia-időszakban pozitív vagy nulla figyelembe vehető nettó hitelnyújtással rendelkezik, akkor NLB = 0. Ha azonban a résztvevő az első referencia-időszakban negatív figyelembe vehető nettó hitelnyújtással rendelkezik, akkor NLB = NL 2018. ápr + NL 2018. máj + … + NL 2019. márc .
Jelölje OAB a résztvevő állomány-referenciaértékét. Ez a következőképpen kerül meghatározásra:
OAB = max (OL 2019. márc + NLB, 0)
Itt OL 2019. márc a figyelembe vehető hitelek 2019 márciusának végén fennálló állománya
3. A kamatláb kiszámítása
Jelölje NS 2021. márc a 2019. április 1. és 2021. március 31. közötti időszak figyelembe vehető nettó hitelnyújtásának és a figyelembe vehető hitelek 2019. március 31-i állományainak az összeadásával kapott összeget; ez a következőképpen kerül kiszámításra: NS 2021. márc = OL 2019. márc + NL 2019. ápr +… + NL 2021. márc .
Most jelölje EX az NS 2021. márc -nak az állomány-referenciaértéktől való százalékos eltérését, vagyis

Az Ex 15 tizedesjegyre kerekített százalékban kerül kifejezésre. Ahol az OAB nullával egyenlő, úgy tekintendő, hogy az EX 2,5-tel egyenlő.
Legyen  a TLTRO-III időtartama alatt érvényes irányadó refinanszírozási művelet (MRO) átlagos kamatlába k éves százalékos arányként kifejezve, és legyen
a TLTRO-III időtartama alatt érvényes irányadó refinanszírozási művelet (MRO) átlagos kamatlába k éves százalékos arányként kifejezve, és legyen 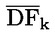 a TLTRO-III k időtartama alatt érvényes betéti rendelkezésre állás átlagos kamatlába, éves százalékos arányként kifejezve, azaz:
a TLTRO-III k időtartama alatt érvényes betéti rendelkezésre állás átlagos kamatlába, éves százalékos arányként kifejezve, azaz:

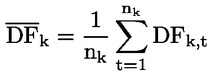
A fenti egyenletekben nk (ahol k = 1,..7) jelöli a TLTRO-III k napok számát, MROk,t jelöli a TLTRO-III k t-edik napján az MRO-ra alkalmazott kamatlábat, ha erre az MRO-ra rögzített kamatozású teljes allokálási szabály vonatkozik, vagy MROk,t jelöli a TLTRO-III k t-edik napján az MRO-ra alkalmazott minimális ajánlati kamatlábat, ha erre az MRO-ra változó kamatozású tendereljárás keretében kerül sor, éves százalékos arányként kifejezve. A fenti egyenletekben DFk,t jelöli a TLTRO-III k t-edik napján a betéti rendelkezésre állásra alkalmazott kamatlábat, éves százalékos arányként kifejezve.
Legyen a kamatláb ösztönző kiigazítása, a maximális kamatláb ( ) és a minimális kamatláb (
) és a minimális kamatláb ( ) közötti átlagos különbség hányadában kifejezve iri; legyen a TLTRO-III k-ra alkalmazott kamatláb, éves százalékos arányként kifejezve, rk
; iri és rk
meghatározása a következő:
) közötti átlagos különbség hányadában kifejezve iri; legyen a TLTRO-III k-ra alkalmazott kamatláb, éves százalékos arányként kifejezve, rk
; iri és rk
meghatározása a következő:
|
a) |
Ha a résztvevő 2021. március 31-én nem lépi túl a figyelembe vehető hitelei állomány-referenciaértékét, a résztvevő által a TLTRO-III keretében hitelként felvett összegekre alkalmazandó kamatlábat az adott TLTRO-III élettartama alatt az MRO-ra érvényes átlagos kamatláb felett 10 bázisponttal kell meghatározni, vagyis ha EX ≤ 0, akkor iri = 0 % és |
|
b) |
Ha a résztvevő 2021. március 31-én legalább 2,5 %-kal túllépi a figyelembe vehető hitelei állomány-referenciaértékét, a résztvevő által a TLTRO-III keretében hitelként felvett összegekre alkalmazandó kamatláb az adott TLTRO-III élettartama alatt a betéti rendelkezésre állásra érvényes átlagos kamatláb felett 10 bázisponttal van, vagyis ha EX ≥ 2,5, akkor iri = 100 % és |
|
c) |
Ha a résztvevő 2021. március 31-én túllépi a figyelembe vehető hitelei állomány-referenciaértékét, azonban kevesebb mint 2,5 %-kal, a résztvevő által a TLTRO-III keretében hitelként felvett összegekre alkalmazandó kamatláb lineárisan változik attól a százaléktól függően, amellyel a résztvevő a figyelembe vehető hitelei állomány-referenciaértékét túllépte, vagyis ha 0 < EX < 2,5, akkor |
A kamatláb ösztönző kiigazítása (iri) 15 tizedesjegyre kerekítve kerül kifejezésre.
A kamatláb (rk ) éves százalékos arányként kerül kifejezésre, a negyedik tizedesjegyre lefelé kerekítve.
(1) A „résztvevőre” vonatkozó hivatkozásokat az egyéni résztvevőkre, illetve a TLTRO-III-csoportokra is érteni kell.
II. MELLÉKLET
A CÉLZOTT HOSSZABB LEJÁRATÚ REFINANSZÍROZÁSI MŰVELETEK HARMADIK SOROZATA – IRÁNYMUTATÁSOK AZ ADATSZOLGÁLTATÁSI SABLONOK ÁLTAL ELŐÍRT ADATOK ÖSSZEÁLLÍTÁSÁHOZ
1. Bevezetés (1)
Ezek az iránymutatások a TLTRO-III résztvevői által a 6. cikkel összhangban benyújtandó adatjelentések összeállítására vonatkozó útmutatásokat tartalmaznak. Az adatszolgáltatási követelményeket az e melléklet végén található adatszolgáltatási sablonok mutatják. Ezek az iránymutatások részletezik továbbá a műveletekben részt vevő TLTRO-III-csoportok vezető intézményeire vonatkozó adatszolgáltatási követelményeket.
A 2. és 3. szakasz általános információkat nyújt az adatok összeállításáról és benyújtásáról, a 4. szakasz pedig bemutatja a jelentendő mutatókat.
2. Általános információk
A hitelfelvételi keret kiszámításához alkalmazandó mértékek a monetáris pénzügyi intézmények (MPI-k) által euroövezeti nem pénzügyi vállalatoknak nyújtott hitelekhez és az MPI-k által euroövezeti háztartásoknak (2) nyújtott hitelekhez kapcsolódnak, kivéve a lakáscélú hiteleket, valamennyi pénznemben. A 6. cikkel összhangban két adatjelentést kell benyújtani: az első jelentés lefedi a referencia-állományra vonatkozó adatokat és az első referencia-időszakra vonatkozó adatokat, és a második jelentés lefedi a második referencia-időszakra vonatkozó adatokat. Az összegeket a nem pénzügyi vállalatok és a háztartások esetén külön kell jelenteni. A figyelembe vehető hitelek állományait ki kell igazítani az értékpapírosított vagy más módon átruházott és a mérlegből ki nem vezetett hitelek tekintetbe vétele érdekében, mindazonáltal a résztvevők választhatják a 6. cikk (3) bekezdése szerinti lehetőséget arra, hogy a hitelfelvételi keretük kiszámítása céljára hozzáadják a nem értékesítési célból értékpapírosított figyelembe vehető hiteleket, a mérlegbeli megjelenésüktől függetlenül. Részletes információkra van szükség továbbá ezen tételek releváns alkategóriáira, valamint azon hatásokra vonatkozóan, amelyek változást eredményeznek a figyelembe vehető hitelek állományaiban, de nem kapcsolódnak figyelembe vehető nettó hitelnyújtáshoz (a továbbiakban: az állományok kiigazításai), a hitelértékesítésekre és hitelvásárlásokra, valamint az egyéb hitelátruházásokra is kiterjedően.
Az összegyűjtött információk felhasználását illetően a referencia-állományra vonatkozó adatok a hitelfelvételi keret megállapításához kerülnek felhasználásra. Ezenkívül az első referencia-időszak alatti figyelembe vehető nettó hitelnyújtásra vonatkozó adatok a nettó hitelnyújtási referenciaérték és az állomány-referenciaérték kiszámításához kerülnek felhasználásra. A második referencia-időszak alatti figyelembe vehető nettó hitelnyújtásra vonatkozó adatok a hitelezés alakulásának, és következésképpen az alkalmazandó kamatlábaknak az értékeléséhez kerülnek felhasználásra. Minden egyéb mutató az információk belső összhangjának, valamint az információknak az eurorendszeren belül gyűjtött statisztikai adatokkal való összhangjának ellenőrzésére, valamint a TLTRO-III-program hatásának részletes figyelemmel kísérésére szolgál.
Az adatjelentések kitöltését alátámasztó általános keretet az MPI mérlegstatisztikákkal kapcsolatban az euroövezeti MPI-kre vonatkozó, az 1071/2013/EU rendeletben (EKB/2013/33) meghatározott adatszolgáltatási követelmények adják meg. Így különösen a hitelek tekintetében az 1071/2013/EU rendelet (EKB/2013/33) 8. cikkének (2) bekezdése előírja, hogy azokat „névleges hónap végi állományként kell jelenteni, bruttó összegben. Ebből az összegből ki kell zárni a megfelelő számviteli szabályokban meghatározott leírásokat és kivezetéseket. A […] hitelek más eszközzel és forrással nem nettósíthatók”. Ugyanakkor, a 8. cikk (2) bekezdésében meghatározott szabályok alóli kivételként, amelyek azt is jelentik, hogy a hitelekre vonatkozó adatokat a céltartalékokkal növelve kell jelenteni, a 8. cikk (4) bekezdése rögzíti, hogy az „NKB-k lehetővé tehetik a céltartalékkal fedezett hitelek jelentését a céltartalékokkal csökkentett összegen, valamint a megvásárolt hitelek jelentését a beszerzéskori áron [azaz azok ügyleti értékén], feltéve, hogy az ilyen adatszolgáltatási gyakorlatokat valamennyi rezidens adatszolgáltató követi”. A nem értékesítési célból értékpapírosított figyelembe vehető hiteleket nem kell a céltartalékok levonásával jelenteni, ha kivezetik azokat a mérlegből. Az alábbiakban részletesebben is áttekintésre kerülnek azok a hatások, amelyeket az általános mérlegstatisztikai útmutatástól való ezen eltérés az adatjelentések összeállítására nézve eredményez.
Az 1071/2013/EU rendeletet (EKB/2013/33) az adatjelentések összeállítása során alkalmazandó fogalommeghatározások vonatkozásában is referenciadokumentumként kell használni. Lásd különösen az 1. cikket az általános fogalommeghatározásokért, valamint a II. melléklet 2. és 3. részét a „hitelek” által lefedendő instrumentumok kategóriáinak, illetve a résztvevők szektorainak meghatározásáért. Fontos, hogy a mérlegstatisztikai keretrendszerben a hitelek után járó felhalmozott kamatkövetelést főszabály szerint annak felmerülésekor kell a mérlegben kötelezően kimutatni (azaz eredményszemléletben és nem pedig a tényleges pénzbevétel időpontjában), de azt nem kell figyelembe venni a hitelek állományaira vonatkozó adatokban. A tőkésített kamatot ugyanakkor rögzíteni kell az állományokban.
Bár az MPI-k az 1071/2013/EU rendelet (EKB/2013/33) követelményeinek megfelelően a legtöbb jelentendő adatot már összeállítják, a TLTRO-III-ban ajánlatot tevő résztvevőknek bizonyos kiegészítő információkat össze kell állítaniuk. A mérlegstatisztika módszertani keretrendszere, amelyet az MPI mérlegstatisztikai kézikönyv (3) rögzít, tartalmaz minden szükséges háttérinformációt, amely ezen kiegészítő adatok összeállításához szükséges; további részletek az egyes mutatók meghatározására vonatkozó 4. pontban találhatók.
3. Általános adatszolgáltatási útmutatások
a) Az adatszolgáltatási sablonok szerkezete
A sablonok azon referencia-időszakokra való hivatkozásokat tartalmaznak, amelyekre az adatok vonatkoznak, és a mutatókat két hasábra csoportosítják: az euroövezeti nem pénzügyi vállalatoknak nyújtott MPI-hitelek, és az euroövezeti háztartásoknak nyújtott MPI-hitelek, kivéve a lakáscélú hiteleket. A sárgával jelölt valamennyi cellában az adatok az egyéb cellákba bevitt adatokból kerülnek kiszámításra a megadott képletek alapján. A sablonok tartalmaznak az adatok belső összhangjának ellenőrzésére szolgáló szabályokat is.
A TLTRO-III keretében két jelentés létezik:
|
— |
Az első jelentés a referencia-állományokra a hitelfelvételi keret és az ajánlati korlátok kiszámítása céljából vonatkozó, kitöltött A. adatszolgáltatási sablont írja elő. A 6. cikk (3) bekezdése szerinti lehetőséget választó résztvevőknek rendelkezésre kell bocsátani a nem értékesítési célból értékpapírosított figyelembe vehető hitelekre vonatkozó kiegészítő tételeket és a könyvvizsgáló ezen tételekre vonatkozó értékelését a 6. cikk (6) bekezdése c) pontja v. alpontjának megfelelően. Az első jelentés előírja továbbá a kitöltött B. sablont az „első referencia-időszak”, azaz a 2018. április 1-jétől2019. március 31-ig tartó időszak tekintetében a figyelembe vehető nettó hitelnyújtás és a mutatók kiszámítása céljából. |
|
— |
A második jelentés a „második referencia-időszak”, azaz a 2019. április 1-jétől2021. március 31-éig tartó időszak tekintetében írja elő a kitöltött B. adatszolgáltatási sablont a figyelembe vehető nettó hitelnyújtás kiszámítása, valamint az alkalmazandó kamatlábak alapjául szolgáló mutatókkal szembeni összehasonlítás céljából. |
A B. sablonban az állományokra vonatkozó mutatókat az adatszolgáltatási időszak kezdetét megelőző hónap vége és az adatszolgáltatási időszak vége szerinti állapotban kell jelenteni; így az első referencia-időszak vonatkozásában az állományokat a 2018. március 31-i és a 2019. március 31-i állapot szerint kell jelenteni, a második referencia-időszak vonatkozásában pedig az állományokat a 2019. március 31-i és a 2021. március 31-i állapot szerint kell jelenteni. A tranzakciókra és a kiigazításokra vonatkozó adatoknak viszont tartalmazniuk kell minden olyan jelentős hatást, amelyre az adatszolgáltatási időszakban kerül sor.
b) A TLTRO-III-csoportokra vonatkozó adatszolgáltatás
A TLTRO-III-ban való csoportrészvétel esetén az adatokat főszabály szerint összevont alapon kell jelenteni. Ugyanakkor azon tagállamok nemzeti központi bankjainak, amelyek pénzneme az euro (NKB-k) lehetőségük van arra, hogy az adatokat az egyedi intézmények szintjén gyűjtsék, ha ezt szükségesnek látják.
c) Az adatjelentések továbbítása
A kitöltött adatjelentéseket a 6. cikkben foglaltak szerint az érintett NKB részére kell továbbítani a TLTRO-III-ra vonatkozó, az EKB honlapján közzétett indikatív naptárral összhangban, amely meghatározza az egyes adattovábbítások által lefedendő referencia-időszakokat is, valamint azt, hogy melyik adat-évjáratokat kell használni az adatok összeállítása során.
d) Az adatok egysége
Az adatokat ezer eurós nagyságrendben kell jelenteni.
4. Fogalommeghatározások
E szakasz tartalmazza a jelentendő tételek fogalommeghatározásait; az adatszolgáltatási sablonokban használt számozás zárójelben szerepel.
a) A figyelembe vehető hitelek állományai (1. és 4.)
Az ezekben a mezőkben található adatokat a következő mérlegtételek vonatkozásában jelentett adatokból számítják: a „Mérlegben szereplő állományok” (1.1. és 4.1.) mínusz „A mérlegből való kivezetés nélkül értékpapírosított vagy más módon átruházott figyelembe vehető hitelek állományai” (1.2. és 4.2.), plusz a „Céltartalékok állománya” (1.3. és 4.3.). Ez utóbbi alfogalom csak azokban az esetekben releváns, amikor – az általános mérlegstatisztikai gyakorlattal ellentétben – a hiteleket a céltartalékok összegének levonásával jelentik.
A figyelembe vehető hitelek állományainak alapul szolgáló tételei a következők:
|
i. |
Mérlegben szereplő állományok (1.1. és 4.1.) Ez a tétel az euroövezeti nem pénzügyi vállalatoknak és az euroövezeti háztartásoknak nyújtott hitelek állományaiból áll, kivéve a lakáscélú hiteleket. A felhalmozott kamat, a tőkésített kamattal ellentétben, nem kerül figyelembevételre a mutatókban. E cellák közvetlenül kapcsolódnak az 1071/2013/EU rendelet (EKB/2013/33) I. mellékletének 2. részében (az 1. táblázat 2. rovata a havi állományokról) foglalt követelményekhez. Az adatjelentésekben szerepeltetendő tételek részletesebb meghatározásáért lásd az 1071/2013/EU rendelet (EKB/2013/33) II. mellékletének 2. részét és az MPI mérlegstatisztikai kézikönyv 4.3. szakaszát. |
|
ii. |
A mérlegből való kivezetés nélkül értékpapírosított vagy más módon átruházott figyelembe vehető hitelek állományai (1.2. és 4.2.) Ez a tétel a mérlegből való kivezetés nélkül értékpapírosított vagy más módon átruházott figyelembe vehető hitelek állományaiból áll. Minden értékpapírosítási tevékenységet jelenteni kell, függetlenül attól, hogy a bevont pénzügyi közvetítő vállalatok hol rezidensek. Nem tartoznak bele ebbe a tételbe az eurorendszernek monetáris politikai hitelműveletek céljára olyan hitelkövetelések formájában fedezetként rendelkezésre bocsátott hitelek, amelyek a mérlegből való kivezetés nélküli átruházáshoz vezetnek. Az 1071/2013/EU rendelet (EKB/2013/33) I. mellékletének 5. része (a havi adatokra vonatkozó 5a. táblázat 5.1. rovata) lefedi a mérlegből való kivezetés nélkül a nem pénzügyi vállalatoknak és háztartásoknak nyújtott értékpapírosított hitelekre vonatkozó szükséges információkat, de nem írja elő azok cél szerinti bontását. Ezenkívül a mérlegből való kivezetés nélkül más módon (azaz nem értékpapírosítás révén) átruházott hitelek állományaira az 1071/2013/EU rendelet (EKB/2013/33) nem terjed ki. Erre tekintettel az adatjelentések összeállítása érdekében az MPI-k belső adatbázisaiból történő különálló adatkivonás szükséges. Az adatjelentésekben szerepeltetendő tételekre vonatkozó további részletekért lásd az 1071/2013/EU rendelet (EKB/2013/33) I. mellékletének 5. részét és az MPI mérlegstatisztikai kézikönyv 4.3.11. szakaszát. |
|
iii. |
Céltartalékok állománya (1.3. és 4.3.) Ezek az adatok csak azon intézmények esetében relevánsak, amelyek – az általános mérlegstatisztikai gyakorlattal ellentétben – a hiteleket a céltartalékok összegének levonásával jelentik. A TLTRO-III-csoportként ajánlatot tevő intézmények esetében ez a követelmény csak a csoport azon intézményeire vonatkozik, amelyek a hiteleket a céltartalékok összegének levonásával rögzítik. Ez a tétel magában foglalja az értékvesztésre és a hitelezési veszteségekre vonatkozó egyéni és kollektív kereteket (még mielőtt a leírásokra, illetve kivezetésekre sor kerül). Az adatoknak utalniuk kell a „Mérlegben szereplő hitelek állományai”-ra (1.1 és 4.1.), kivéve a „Mérlegből való kivezetés nélkül értékpapírosított vagy más módon átruházott hitelek állományai”-t (1.2. és 4.2.). Amint azt a 2. pont harmadik bekezdése rögzíti, a mérlegstatisztikákban a hiteleket főszabály szerint tőkeösszegükön, állományként kell jelenteni, és a megfelelő céltartalékokat a „Tőke és tartalékok”-hoz kell rendelni. Ilyen esetekben a céltartalékokra vonatkozó külön információkat nem kell jelenteni. Ugyanakkor azon esetekben, amikor a hiteleket a céltartalékok összegének levonásával jelentik, ezt a kiegészítő információt jelenteni kell annak érdekében, hogy valamennyi MPI vonatkozásában teljes mértékben összehasonlítható adatok kerüljenek begyűjtésre. Ahol az a gyakorlat, hogy a hitelek állományát a céltartalékok összegének levonásával jelentik, az NKB-knak lehetősége van arra, hogy az ezen információkra vonatkozó adatszolgáltatást önkéntessé tegyék. Ugyanakkor az ilyen esetekben a TLTRO-III-keretrendszer alapján végzett számítások a mérlegben szereplő hiteleknek a céltartalékok összegével csökkentett állományán fognak alapulni (4). További részletekért lásd az 1071/2013/EU rendelet (EKB/2013/33) II. mellékletének 2. részében a „Tőke és tartalékok” meghatározásában a céltartalékokra vonatkozó hivatkozást. |
b) Figyelembe vehető nettó hitelnyújtás (2.)
E cellák rögzítik az adatszolgáltatási időszak alatt történő nettó hitelnyújtást (tranzakciókat). Az adatok az altételekben – nevezetesen „Bruttó hitelnyújtás” (2.1.) mínusz „Törlesztések” (2.2.) – jelentett számadatok alapján kerülnek kiszámításra.
Az adatszolgáltatási időszak alatt újratárgyalt hiteleket a „Törlesztések” és a „Bruttó hitelnyújtás” alatt is jelenteni kell abban az időpontban, amikor az újratárgyalásra sor kerül. A kiigazítási adatoknak tartalmazniuk kell a hitel-újratárgyaláshoz kapcsolódó hatásokat.
Az ezen időszak alatt visszafordított tranzakciókat (azaz az időszak alatt nyújtott és visszafizetett hiteleket) főszabály szerint a „Bruttó hitelnyújtás” és a „Törlesztések” alatt is jelenteni kell. Ugyanakkor az ajánlatot tevő MPI-k számára az is megengedett, hogy az adatjelentések összeállítása során ne vegyék figyelembe ezeket a műveleteket, amennyiben ez könnyítené a rájuk nehezedő adatszolgáltatási terhet. Ebben az esetben tájékoztatniuk kell az érintett NKB-t, és az állományok kiigazításaira vonatkozó adatokból szintén ki kell hagyni az ezen visszafordított műveletekhez kapcsolódó hatásokat. Ez a kivétel nem vonatkozik az adott időszakban nyújtott azon hitelekre, amelyek értékpapírosítottak vagy más módon átruházottak.
A hitelkártya-tartozásokat, a megújuló hiteleket és a folyószámlahiteleket is figyelembe kell venni. Ezen instrumentumok vonatkozásában az adatszolgáltatási időszak alatt felhasznált vagy felvett összegek következtében az egyenlegekben bekövetkezett változásokat a nettó hitelnyújtás helyettesítő értékeként kell felhasználni. A pozitív összegeket a „Bruttó hitelnyújtás” (2.1.) alatt, míg a negatív összegeket (pozitív előjellel) a „Törlesztések” (2.2.) alatt kell jelenteni.
|
i. |
Bruttó hitelnyújtás (2.1.) Ez a tétel az adatszolgáltatási időszakban a bruttó új hitelek forgalmából, mínusz a bármely hitelszerzésből áll. A hitelkártya-tartozásokhoz, a megújuló hitelekhez és a folyószámlahitelekhez kapcsolódóan nyújtott hitelekre vonatkozó adatokat szintén jelenteni kell, a fent részletezettek szerint. Az időszak alatt a fogyasztói egyenlegekhez – például a kamat tőkésítése (szemben a kamatfelhalmozással) és a díjak miatt – hozzáadott összegeket szintén jelenteni kell. |
|
ii. |
Törlesztések (2.2.) Ez a tétel az adatszolgáltatási időszak alatti tőketörlesztések forgalmából áll, kivéve azokat, amelyek a mérlegből való kivezetés nélkül értékpapírosított vagy más módon átruházott figyelembe vehető hitelek állományaihoz kapcsolódnak. A hitelkártya-tartozásokhoz, a megújuló hitelekhez és a folyószámlahitelekhez kapcsolódó törlesztéseket szintén jelenteni kell, a fent részletezettek szerint. A még nem tőkésített, felhalmozott kamathoz kapcsolódó kamatfizetéseket, a hitelelidegenítéseket és az állományok egyéb kiigazításait (beleértve a leírásokat és a kivezetéseket is) nem kell jelenteni. Az 1071/2013/EU rendelet (EKB/2013/33) előírja, hogy a hitel-tőke konverziókat tranzakcióknak kell tekinteni. Mindazonáltal a TLTRO-III adatjelentések összeállítása céljára a hitel-tőke konverziókat, ahol a résztvevő által a nem pénzügyi vállalatoknak nyújtott hiteleket felváltja a résztvevők által az e nem pénzügyi vállalatokban tartott részesedés, inkább átsorolásként és nem a hitelek törlesztéseként lehet jelenteni, feltéve, hogy a résztvevő által a reálgazdaságnak nyújtott finanszírozás ezáltal nem csökken, az érintett NKB által meghatározottaknak megfelelően. A résztvevő az NKB rendelkezésére fogja bocsátani az összes ahhoz szükséges információt, hogy dönteni tudjon a konverzió kezelésének mikéntjéről. |
c) Az állományok kiigazításai (3)
E cellák a figyelembe vehető hitelek állományaiban az adatszolgáltatási időszakban bekövetkezett azon változások (csökkenések (–) és növekmények (+)) jelentésére szolgálnak, amelyek nem kacsolódnak a figyelembe vehető nettó hitelnyújtáshoz. Az ilyen változások az olyan, az adatszolgáltatási időszak során bekövetkező műveletekből erednek, mint például a hitelek értékpapírosítása és más hitelátruházások, valamint az olyan egyéb kiigazításokból, amelyek az árfolyam-ingadozás következtében bekövetkezett átértékeléshez, a leírásokhoz, illetve kivezetésekhez, valamint átsorolásokhoz kapcsolódnak.
Az állományok kiigazításaira vonatkozó tételek az altételekben jelentett számadatok alapján kerülnek kiszámításra, nevezetesen „Hitelértékesítések és hitelvásárlások és az adatszolgáltatási időszak alatti egyéb hitelátruházások” (3.1.) plusz „Egyéb kiigazítások” (3.2.).
|
i. |
Hitelértékesítések és egyéb hitelátruházások és az adatszolgáltatási időszak alatti egyéb hitelátruházások (3.1.)
|
|
ii. |
Egyéb kiigazítások (3.2.) Az egyéb kiigazításokra vonatkozó következő tételeket jelenteni kell a mérlegben szereplő hitelek állománya vonatkozásában, kivéve a mérlegből való kivezetés nélkül értékpapírosított vagy más módon átruházott hiteleket.
|
d) Kiegészítő összegek a nem értékesítési célból értékpapírosított figyelembe vehető hitelek tekintetében (S.1)
A 6. cikk (3) bekezdése szerinti lehetőséget választó résztvevőknek rendelkezésre kell továbbá bocsátani a nem értékesítési célból értékpapírosított figyelembe vehető hitelek állományára vonatkozó következő kiegészítő tételeket az A. sablonban:
|
i. |
„A mérlegből való kivezetés nélkül nem értékesítési célból értékpapírosított figyelembe vehető hitelek állományai” (S.1.1) Ezek az adatok olyan hitelekre vonatkoznak, amelyeket nem értékesítési célból értékpapírosítottak, és hozzáadtak az 1.2. tétel alatt jelentett összegekhez. |
|
ii. |
„A mérlegből kivezetett nem értékesítési célból értékpapírosított figyelembe vehető hitelek állományai” (S.1.2) Ezek az adatok olyan hitelekre vonatkoznak, amelyeket nem értékesítési célból értékpapírosítottak, és amelyek már nem szerepelnek a mérlegben, mert kivezették azokat. Amennyiben a hiteleket továbbra is a résztvevő gondozza, vonatkozik rájuk az 1071/2013/EU rendelet (EKB/2013/33) I. mellékletének 5. része szerinti adatszolgáltatási kötelezettség (az 5a. és 5b. táblázat 3.1. rovata). |
|
iii. |
„A céltartalékok állománya a mérlegből való kivezetés nélkül nem értékesítési célból értékpapírosított figyelembe vehető hitelek ellenében” (S.1.3) Ezek az adatok olyan hitelekre vonatkoznak, amelyeket nem vezettek ki a mérlegből – azaz az S.1.1. alatt jelentett hitelekre. Ezeket a tételeket csak olyan esetben kell jelenteni, amelyekben az általános mérlegstatisztikai gyakorlattal elelntétben a hiteleket a céltartalékok összegének levonásával jelentik. Ilyen esetben azonban a résztvevők választhatják ezen információ szolgáltatásnak mellőzését, ekkor a vonatkozó összegeket nem adják hozzá a figyelembe vehető hitelek állományainak kiszámításakor. |
TLTRO-III adatszolgáltatás
TLTRO-III A. adatszolgáltatási sablon
|
Adatszolgáltatási időszak:2019. február 28. |
|||||||||
|
|
|||||||||
|
Nem pénzügyi vállalatoknak és háztartásoknak nyújtott hitelek, kivéve a lakáscélú hiteleket (euróban, ezres nagyságrendben) |
|||||||||
|
|
|||||||||
|
|
Főbb aggregátumok a referencia-állomány tekintetében |
|
Nem pénzügyi vállalatoknak nyújtott hitelek |
Háztartásoknak (beleértve a háztartásokat segítő nonprofit intézményeket) nyújtott hitelek, kivéve a lakáscélú hitelek |
|
|
|
||
|
|
|
|
|
|
|
|
tétel |
képlet |
ellenőrzés |
|
|
1 |
A figyelembe vehető hitelek állományai … |
|
0 |
0 |
1 |
1 = 1.1. – 1.2. (+ 1.3.) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S.1 |
Kiegészítő összegek a nem értékesítési célból értékpapírosított figyelembe vehető hitelek tekintetében … |
|
0 |
0 |
S.1 |
S.1 = S.1.1. + S.1.2. (+ S.1.3.) |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
Alapul szolgáló tételek |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A figyelembe vehető hitelek mérlegben szereplő állományai |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.1. |
A mérlegben szereplő állományok … |
|
|
|
1.1. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.2. |
A mérlegből való kivezetés nélkül értékpapírosított vagy más módon átruházott hitelek állományai … |
|
|
|
1.2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.3. |
A céltartalékok állománya az 1.1 tételben jelentett hitelek ellenében, kivéve az 1.2-t (*1)… |
|
|
|
1.3. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kiegészítő tételek a nem értékesítési célból értékpapírosított figyelembe vehető hitelek tekintetében |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S.1.1. |
A mérlegből való kivezetés nélkül nem értékesítési célból értékpapírosított figyelembe vehető hitelek állományai … |
|
|
|
S.1.1. |
|
S.1.1. <= 1.2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S.1.2. |
A mérlegből kivezetett nem értékesítési célból értékpapírosított figyelembe vehető hitelek állományai… |
|
|
|
S.1.2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S.1.3. |
A céltartalékok állománya a mérlegből való kivezetés nélkül nem értékesítési célból értékpapírosított figyelembe vehető hitelek ellenében (*1)… |
|
|
|
S.1.3. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
TLTRO-III B. adatszolgáltatási sablon
|
Adatszolgáltatási időszak:2018. április 1-jétől2019. március 31-ig (első referencia-időszak) / 2019. április 1-jétől2021. március 31-éig (második referencia-időszak) |
|||||||||
|
|
|||||||||
|
Nem pénzügyi vállalatoknak és háztartásoknak nyújtott hitelek, kivéve a lakáscélú hiteleket (euróban, ezres nagyságrendben) |
|||||||||
|
|
|||||||||
|
|
Főbb aggregátumok |
|
Nem pénzügyi vállalatoknak nyújtott hitelek |
Háztartásoknak (beleértve a háztartásokat segítő nonprofit intézményeket) nyújtott hitelek, kivéve a lakáscélú hitelek |
|
|
|
||
|
|
|
|
|
|
|
|
tétel |
képlet |
ellenőrzés |
|
|
1 |
A figyelembe vehető hitelek állományai az adatszolgáltatási időszak kezdetét megelőző hónap végén … |
|
0 |
0 |
1 |
1 = 1.1. – 1.2. (+ 1.3.) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
Az adatszolgáltatási időszakban figyelembe vehető nettó hitelnyújtás … |
|
0 |
0 |
2 |
2 = 2.1. – 2.2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
Az állományok kiigazításai: csökkenések (–) és növekmények (+) … |
|
0 |
0 |
3 |
3 = 3.1. + 3.2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
A figyelembe vehető hitelek állományai az adatszolgáltatási időszak végén … |
|
0 |
0 |
4 |
4 = 4.1. – 4.2. (+ 4.3.) |
4 = 1 + 2 + 3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Alapul szolgáló tételek |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A figyelembe vehető hitelek állományai az adatszolgáltatási időszak kezdetét megelőző hónap végén |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.1. |
A mérlegben szereplő állományok … |
|
|
|
1.1. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.2. |
A mérlegből való kivezetés nélkül értékpapírosított vagy más módon átruházott hitelek állományai … |
|
|
|
1.2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.3. |
A céltartalékok állománya az 1.1 tételben jelentett hitelek ellenében, kivéve az 1.2-t (*2)… |
|
|
|
1.3. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Az adatszolgáltatási időszakban figyelembe vehető nettó hitelnyújtás |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2.1. |
Bruttó hitelnyújtás … |
|
|
|
2.1. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2.2. |
Törlesztések … |
|
|
|
2.2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Az állományok kiigazításai: csökkenések (–) és növekmények (+) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.1. |
Hitelértékesítések és hitelvásárlások és az adatszolgáltatási időszak alatti egyéb hitelátruházások … |
|
0 |
0 |
3.1. |
3.1 = 3.1A + 3.1B + 3.1C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.1A |
A hitelállományra hatást gyakorló értékpapírosított hitelek nettó forgalma … |
|
|
|
3.1A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.1B |
A hitelállományra hatást gyakorló, más módon átruházott hitelek nettó forgalma … |
|
|
|
3.1B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.1C |
A hitelállományra hatást nem gyakorló, értékpapírosított vagy más módon átruházott hitelek nettó forgalma … |
|
|
|
3.1C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.2. |
Egyéb kiigazítások … |
|
0 |
0 |
3.2. |
3.2. = 3.2A + 3.2B + 3.2C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.2A |
Árfolyamingadozásból eredő átértékelések … |
|
|
|
3.2A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.2B |
Leírások illetve kivezetések … |
|
|
|
3.2B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.2C |
Átsorolások … |
|
|
|
3.2C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A figyelembe vehető hitelek állományai az adatszolgáltatási időszak végén |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.1. |
A mérlegben szereplő állományok … |
|
|
|
4.1. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.2. |
A mérlegből való kivezetés nélkül értékpapírosított vagy más módon átruházott hitelek állományai … |
|
|
|
4.2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.3. |
A céltartalékok állománya a 4.1 tételben jelentett hitelek ellenében, kivéve a 4.2-t (*2)… |
|
|
|
4.3. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1) Az adatszolgáltatási követelmények alapjául szolgáló koncepcionális keret az EKB/2014/34 határozatban és az (EU) 2016/810 (EKB/2016/10) határozatban rögzítetthez képest nem változik, kivéve a nem értékesítési célból értékpapírosított figyelembe vehető hiteleknek a hitelfelvételi keret kiszámítása céljára történő beillesztéséhez kapcsolódó változásokat.
(2) Az adatjelentések céljára a „háztartások” a háztartásokat segítő nonprofit intézményeket is magában foglalja.
(3) Lásd: „Manual on MFI balance sheet statistics” (MPI mérlegstatisztikai kézikönyv), EKB, 2019. január, elérhető az EKB honlapján: www.ecb.europa.eu. Különösen a 4.3.. szakasz (40. oldal) amely a hitelekre vonatkozó statisztikai adatszolgáltatással foglalkozik.
(4) Ez a kivétel a leírásokra, illetve kivezetésekre vonatkozó adatok jelentésére is hatást gyakorol, az alábbiakban kifejtettek szerint.
(5) Ez a jelkonvenció, amely az 1071/2013/EU rendeletben (EKB/2013/33) foglalt követelmények ellentéte, összhangban van a kiigazítási adatokra vonatkozó, a fentiekben meghatározott általános követelménnyel – vagyis azzal, hogy az állományok növekedéséhez, illetve csökkenéséhez vezető hatásokat pozitív, illetve negatív előjellel kell jelenteni.
(6) Az 1071/2013/EU rendelet (EKB/2013/33) lehetővé teszi az MPI-k számára, hogy a megvásárolt hiteleket azok ügyleti értékén jelentsék, amennyiben ez az országban rezidens valamennyi MPI által alkalmazott nemzeti gyakorlat. Ilyen esetekben az esetlegesen felmerülő átértékelési összetevőket a 3.2B. tétel alatt kell jelenteni.
(7) Az EKB referencia-árfolyamait kell használni. Lásd a közös piaci előírások meghatározásáról szóló 1998. július 8-i sajtóközleményt, amely elérhető az EKB honlapján: www.ecb.europa.eu.
(8) Ez a követelmény eltér az 1071/2013/EU rendelet (EKB/2013/33) szerinti adatszolgáltatási követelményektől.
(9) Ez a követelmény megegyezik az 1071/2013/EU rendelet (EKB/2013/33) alapján a hiteleket a céltartalékokkal csökkentett összegen nyilvántartó MPI-k által szolgáltatandó információkkal.
(*1) Csak azokban az esetekben alkalmazandó, amikor a hiteleket a céltartalékokkal csökkentve jelentik; további részletekért lásd az adatszolgáltatási útmutatásokat.
(*2) Csak azokban az esetekben alkalmazandó, amikor a hiteleket a céltartalékokkal csökkentve jelentik; további részletekért lásd az adatszolgáltatási útmutatásokat.
|
2.8.2019 |
HU |
Az Európai Unió Hivatalos Lapja |
L 204/123 |
AZ EURÓPAI KÖZPONTI BANK (EU) 2019/1312 HATÁROZATA
(2019. július 22.)
a célzott hosszabb lejáratú refinanszírozási műveletek második sorozatáról szóló (EU) 2016/810 (EKB/2016/10) határozat módosításáról (EKB/2019/22)
AZ EURÓPAI KÖZPONTI BANK KORMÁNYZÓTANÁCSA,
tekintettel az Európai Unió működéséről szóló szerződésre és különösen annak 127. cikke (2) bekezdésének első francia bekezdésére,
tekintettel a Központi Bankok Európai Rendszere és az Európai Központi Bank Alapokmányára és különösen annak 3.1. cikke első francia bekezdésére, 12.1. cikkére, 18.1. cikke második francia bekezdésére és 34.1. cikke második francia bekezdésére,
tekintettel az eurorendszer monetáris politikához kötődő keretének végrehajtásáról szóló, 2014. december 19-i (EU) 2015/510 európai központi banki iránymutatásra (EKB/2014/60) (1),
mivel:
|
(1) |
Az (EU) 2015/510 iránymutatás (EKB/2014/60) 1. cikkének (4) bekezdése értelmében a Kormányzótanács bármikor megváltoztathatja az eurorendszer monetáris politikai műveletei végrehajtásának eszközeit, instrumentumait, feltételeit, követelményeit és eljárásait. |
|
(2) |
2016. április 28-án az árstabilitással kapcsolatos mandátumának ellátása során és annak érdekében, hogy a nem pénzügyi magánszektornak történő banki hitelezés további ösztönzése révén erősítse a monetáris transzmissziót, a Kormányzótanács elfogadta az (EU) 2016/810 európai központi banki határozatot (EKB/2016/10) (2). Ez a határozat a 2016 júniusa és 2017 márciusa közötti időszakban lefolytatandó célzott hosszabb lejáratú refinanszírozási műveletek (TLTRO-II) második sorozatáról rendelkezett. |
|
(3) |
2019. március 7-én annak érdekében, hogy hozzájáruljon a kedvező banki hitelezési feltételek megőrzéséhez és támogassa az alkalmazkodó monetáris politikai irányvonalat azon tagállamokban, amelyek pénzneme az euro, a Kormányzótanács hét célzott hosszabb lejáratú refinanszírozási műveletből (TLTRO-III) álló új sorozatról határozott. A TLTRO-III-ra vonatkozó rendelkezéseket külön határozat fogja rögzíteni. |
|
(4) |
A TLTRO-III-ra vonatkozó ajánlati korlátok kiszámításának elősegítése és a TLTRO-II-k keretében felvett összegek esetleges önkéntes korai visszafizetéseinek figyelembevétele érdekében módosítani szükséges az ilyen korai visszafizetésre vonatkozó értesítési időszakot. |
|
(5) |
Annak érdekében, hogy a hitelintézetek számára elegendő idő álljon rendelkezésre az első TLTRO-III-hoz kapcsolódó operatív előkészületek megtételére, e határozatnak indokolatlan késedelem nélkül hatályba kell lépnie. |
|
(6) |
Ezért az (EU) 2016/810 határozatot (EKB/2016/10) megfelelően módosítani kell, |
ELFOGADTA EZT A HATÁROZATOT:
1. cikk
Módosítások
Az (EU) 2016/810 határozat (EKB/2016/10) 6 cikk (3) és (4) bekezdése helyébe a következő szöveg lép:
„(3) A korai visszafizetési eljárás igénybevétele érdekében a résztvevőnek – legalább a szóban forgó korai visszafizetési időpont előtt két héttel – értesítenie kell az érintett NKB-t arról, hogy a korai visszafizetési eljárás alapján a korai visszafizetési időpontban visszafizetéssel kíván élni.
(4) A (3) bekezdésben említett értesítés az abban megjelölt korai visszafizetési időpont előtt két héttel válik a résztvevőre nézve kötelezővé. Ha a résztvevő a korai visszafizetési eljárás alapján esedékes összeget a visszafizetési időpontig teljes egészében vagy részben nem fizeti meg, ennek következménye pénzügyi szankció kivetése lehet. Az alkalmazandó pénzügyi szankciót az (EU) 2015/510 iránymutatás (EKB/2014/60) VII. mellékletével összhangban kell kiszámítani, és az a monetáris politikai célokból végrehajtott penziós ügyletek tekintetében az ügyfél részére allokált összegre vonatkozóan a megfelelő fedezetnyújtásra és elszámolásra vonatkozó kötelezettség megszegése esetén alkalmazott pénzügyi szankciónak felel meg. A pénzügyi szankció kiszabása nem érinti az NKB azon jogát, hogy igénybe vegye az (EU) 2015/510 iránymutatás (EKB/2014/60) 166. cikke szerinti nemteljesítési esemény bekövetkezése esetére előírt korrekciós intézkedéseket.”
2. cikk
Hatálybalépés
Ez a határozat 2019. augusztus 3-án lép hatályba.
Kelt Frankfurt am Mainban, 2019. július 22-én.
az EKB Kormányzótanácsa részéről
az EKB elnöke
Mario DRAGHI
(1) Az Európai Központi Bank (EU) 2015/510 iránymutatása (2014. december 19.) az eurorendszer monetáris politikához kötődő keretének végrehajtásáról (EKB/2014/60) (Az általános dokumentációra vonatkozó iránymutatás) (HL L 91., 2015.4.2., 3. o.).
(2) Az Európai Központi Bank (EU) 2016/810 határozata (2016. április 28.) a célzott hosszabb lejáratú refinanszírozási műveletek második sorozatáról (EKB/2016/10) (HL L 132., 2016.5.21., 107. o.).