ISSN 1977-0847
Službeni list
Europske unije
L 331

Hrvatsko izdanje
Zakonodavstvo
Svezak 57.
18. studenoga 2014.
|
ISSN 1977-0847 |
||
|
Službeni list Europske unije |
L 331 |
|

|
||
|
Hrvatsko izdanje |
Zakonodavstvo |
Svezak 57. |
|
|
|
Ispravci |
|
|
|
* |
|
|
|
|
|
(1) Tekst značajan za EGP |
|
HR |
Akti čiji su naslovi tiskani običnim slovima su oni koji se odnose na svakodnevno upravljanje poljoprivrednim pitanjima, a općenito vrijede ograničeno razdoblje. Naslovi svih drugih akata tiskani su masnim slovima, a prethodi im zvjezdica. |
II. Nezakonodavni akti
UREDBE
|
18.11.2014 |
HR |
Službeni list Europske unije |
L 331/1 |
PROVEDBENA UREDBA VIJEĆA (EU) br. 1225/2014
od 17. studenoga 2014.
o provedbi Uredbe (EU) br. 269/2014 o mjerama ograničavanja u odnosu na djelovanja koja podrivaju ili ugrožavaju teritorijalnu cjelovitost, suverenost i neovisnost Ukrajine
VIJEĆE EUROPSKE UNIJE,
uzimajući u obzir Ugovor o funkcioniranju Europske unije,
uzimajući u obzir Uredbu Vijeća (EU) br. 269/2014 od 17. ožujka 2014. o mjerama ograničavanja u odnosu na djelovanja koja podrivaju ili ugrožavaju teritorijalnu cjelovitost, suverenost i neovisnost Ukrajine (1), a posebno njezin članak 14. stavak 1.,
budući da:
|
(1) |
Vijeće je 17. ožujka 2014. donijelo Uredbu (EU) br. 269/2014. |
|
(2) |
Trebalo bi izmijeniti podatke o jednoj osobi navedenoj u Uredbi (EU) br. 269/2014. |
|
(3) |
Prilog I. Uredbi (EU) br. 269/2014 trebalo bi stoga na odgovarajući način izmijeniti, |
DONIJELO JE OVU UREDBU:
Članak 1.
Prilog I. Uredbi (EU) br. 269/2014 mijenja se kako je navedeno u prilogu ovoj Uredbi.
Članak 2.
Ova Uredba stupa na snagu sljedećeg dana od dana objave u Službenom listu Europske unije.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 17. studenoga 2014.
Za Vijeće
Predsjednica
F. MOGHERINI
(1) SL L 78, 17.3.2014., str. 6.
PRILOG
Unos za sljedeću osobu naveden u Prilogu I. Uredbi (EU) br. 269/2014 zamjenjuje se dolje navedenim unosom.
|
|
Ime |
Identifikacijski podaci |
Obrazloženje |
Datum uvrštenja |
|
|
Vladimir Volfovich ZHIRINOVSKY Владимир Вольфович Жириновский |
Rođen 25.4.1946. u Almatyju (ranije poznatom kao Alma Ata), Kazakstan. |
Član Vijeća državne Dume; vođa stranke LDPR. Aktivno je podržavao upotrebu ruskih oružanih snaga u Ukrajini i pripajanje Krima. Aktivno je pozivao na podjelu Ukrajine. U ime stranke LDPR, na čijem je čelu, potpisao je sporazum s tzv. „Narodnom Republikom Donjetsk”. |
12.9.2014. |
|
18.11.2014 |
HR |
Službeni list Europske unije |
L 331/3 |
UREDBA KOMISIJE (EU) br. 1226/2014
оd 17. studenoga 2014.
o odobravanju zdravstvene tvrdnje koja se navodi na hrani, a odnosi se na smanjenje rizika od bolesti
(Tekst značajan za EGP)
EUROPSKA KOMISIJA,
uzimajući u obzir Ugovor o funkcioniranju Europske unije,
uzimajući u obzir Uredbu (EZ) br. 1924/2006 Europskog parlamenta i Vijeća od 20. prosinca 2006. o prehrambenim i zdravstvenim tvrdnjama koje se navode na hrani (1), a posebno njezin članak 17. stavak 3.,
budući da:
|
(1) |
U skladu s Uredbom (EZ) br. 1924/2006 zdravstvene tvrdnje koje se navode na hrani zabranjene su osim ako ih je odobrila Komisija u skladu s tom Uredbom i ako su uvrštene na popis dopuštenih tvrdnji. |
|
(2) |
Uredbom (EZ) br. 1924/2006 predviđa se i da subjekti u poslovanju s hranom mogu podnositi zahtjeve za odobrenje zdravstvenih tvrdnji nadležnom nacionalnom tijelu države članice. Nadležno nacionalno tijelo prosljeđuje valjane zahtjeve Europskoj agenciji za sigurnost hrane (EFSA), dalje u tekstu: „Agencija”. |
|
(3) |
Nakon primitka zahtjeva Agencija o njemu mora bez odlaganja obavijestiti druge države članice i Komisiju te dati mišljenje o toj zdravstvenoj tvrdnji. |
|
(4) |
Komisija odlučuje o odobravanju zdravstvenih tvrdnji uzimajući u obzir mišljenje Agencije. |
|
(5) |
Na temelju zahtjeva trgovačkog društva Lactalis B&C, koji je podnesen u skladu s člankom 14. stavkom 1. točkom (a) Uredbe (EZ) br. 1924/2006, zatraženo je mišljenje Agencije o zdravstvenoj tvrdnji povezano s tekstom „Niski udio masti i niski udio trans mazivih masti bogatih nezasićenim i omega-3 masnim kiselinama” i smanjenjem koncentracije LDL-kolesterola (Predmet br. EFSA-Q-2009-00458) (2). Tvrdnja koju je predložio podnositelj zahtjeva glasila je: „Zamjena masti bogatih zasićenim/trans masnim kiselinama s mastima bogatima nezasićenim masnim kiselinama pomaže smanjenju LDL-kolesterola. LDL kolesterol jest rizični faktor za kardiovaskularne bolesti”. |
|
(6) |
Na temelju dostavljenih podataka Agencija je u svojem mišljenju, koje su Komisija i države članice primile 25. svibnja 2011., zaključila da postoji uzročno-posljedična veza između uzimanja mješavina prehrambenih zasićenih masnih kiselina (SFA) i povećanja koncentracije LDL-kolesterola u krvi te da zamjena mješavine zasićenih masnih kiselina s cis-jednostruko nezasićenim masnim kiselinama i/ili cis-višestruko nezasićenim masnim kiselinama u hrani ili prehrani po načelu gram za gram smanjuje koncentraciju LDL-kolesterola. Stoga zdravstvenu tvrdnju u kojoj se taj zaključak odražava treba smatrati sukladnom zahtjevima Uredbe (EZ) br. 1924/2006 te je treba uvrstiti na popis dopuštenih tvrdnji Unije. Kliničku intervencijsku studiju, za koju podnositelj zahtjeva traži zaštitu vlasničkih podataka, Agencija nije smatrala potrebnom za donošenje zaključka. Stoga se smatra da zahtjev utvrđen člankom 21. stavkom 1. točkom (c) Uredbe (EZ) br. 1924/2006 nije ispunjen i u skladu s tim zaštita vlasničkih podataka ne treba se odobriti. |
|
(7) |
U svojem mišljenju Agencija zaključuje da je za korištenje tvrdnje potrebno zamijeniti znatne količine zasićenih masnih kiselina jednostruko nezasićenim i/ili višestruko nezasićenim masnim kiselinama u hrani ili prehrani po načelu gram za gram. Stoga je, kako bi se osiguralo da hrana osigurava znatne količine jednostruko nezasićenih i/ili višestruko nezasićenih masnih kiselina, primjereno ograničiti korištenje tvrdnje na masti i ulja te utvrditi uvjete korištenja poput onih za prehrambenu tvrdnju „VISOKI SADRŽAJ NEZASIĆENIH MASTI” kako je utvrđeno u Prilogu Uredbi (EZ) br. 1924/2006. |
|
(8) |
Člankom 16. stavkom 4. Uredbe (EZ) br. 1924/2006 propisuje se da mišljenje u korist odobravanja zdravstvene tvrdnje treba obuhvaćati određene podatke. U skladu s tim ti se podaci trebaju utvrditi u Prilogu ovoj Uredbi u pogledu odobrene tvrdnje i obuhvatiti, ovisno o slučaju, revidirani tekst tvrdnje, posebne uvjete njezina korištenja te, ako je primjenjivo, uvjete ili ograničenja korištenja hrane i/ili dodatnu izjavu ili upozorenje, u skladu s pravilima utvrđenima u Uredbi (EZ) br. 1924/2006 i u skladu s mišljenjima Agencije. |
|
(9) |
Jedan od ciljeva Uredbe (EZ) br. 1924/2006 jest osigurati da zdravstvene tvrdnje budu istinite, jasne, pouzdane i korisne potrošaču te da se u tom smislu uzimaju u obzir tekst i prikaz tih tvrdnji. Stoga, ako tekst određene tvrdnje za potrošače ima isto značenje kao i tekst neke dopuštene zdravstvene tvrdnje jer upućuje na istu vezu između zdravlja i određene kategorije hrane, određene hrane ili njezina sastojka, potrebno je da se na tu tvrdnju primjenjuju isti uvjeti korištenja kao oni navedeni u Prilogu ovoj Uredbi. |
|
(10) |
Pri određivanju mjera predviđenih ovom Uredbom Komisija je uzela u obzir primjedbe koje su joj dostavili podnositelji zahtjeva i predstavnici javnosti u skladu s člankom 16. stavkom 6. Uredbe (EZ) br. 1924/2006. |
|
(11) |
Mjere predviđene ovom Uredbom u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU UREDBU:
Članak 1.
1. Zdravstvena tvrdnja navedena u Prilogu ovoj Uredbi može se navoditi na hrani koja se stavlja na tržište Unije u skladu s uvjetima utvrđenima u tom Prilogu.
2. Zdravstvena tvrdnja iz stavka 1. uvrštava se na popis dopuštenih tvrdnji Unije kako je predviđeno člankom 14. stavkom 1. Uredbe (EZ) br. 1924/2006.
Članak 2.
Ova Uredba stupa na snagu dvadesetog dana od dana objave u Službenom listu Europske unije.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 17. studenoga 2014.
Za Komisiju
Predsjednik
Jean-Claude JUNCKER
(1) SL L 404, 30.12.2006., str. 9.
(2) EFSA Journal (2011.); 9(5):2168.
PRILOG
Dopuštena zdravstvena tvrdnja
|
Zahtjev – relevantne odredbe Uredbe (EZ) br. 1924/2006 |
Podnositelj zahtjeva – adresa |
Hranjiva tvar, tvar, hrana ili kategorija hrane |
Tvrdnja |
Uvjeti korištenja tvrdnje |
Uvjeti i/ili ograničenja korištenja hrane i/ili dodatna izjava ili upozorenje |
Upućivanje na mišljenje EFSA-e |
|
Članak 14. stavak 1. točka (a) – zdravstvena tvrdnja koja se odnosi na smanjenje rizika od bolesti |
Lactalis B&C, ZA Les Placis, 35230 Bourgbarré, Francuska |
Jednostruko nezasićene i/ili višestruko nezasićene masne kiseline |
Pokazalo se da se zamjenom zasićenih masti s nezasićenim mastima u prehrani snižava/smanjuje kolesterol u krvi. Visoki kolesterol jest rizični faktor za razvoj koronarne bolesti srca. |
Tvrdnja se može koristiti samo za hranu koja ima visoki sadržaj nezasićenih masnih kiselina, kako se upućuje u tvrdnji VISOKI SADRŽAJ NEZASIĆENIH MASTI kako je navedeno u Prilogu Uredbi (EZ) br. 1924/2006. |
Tvrdnja se može koristiti samo za masti i ulja. |
Q-2009-00458 |
|
18.11.2014 |
HR |
Službeni list Europske unije |
L 331/6 |
PROVEDBENA UREDBA KOMISIJE (EU) br. 1227/2014
оd 17. studenoga 2014.
o utvrđivanju stope prilagodbe za izravna plaćanja iz Uredbe Vijeća (EZ) br. 73/2009 za kalendarsku godinu 2014. i stavljanju izvan snage Provedbene uredbe Komisije (EU) br. 879/2014
EUROPSKA KOMISIJA,
uzimajući u obzir Ugovor o funkcioniranju Europske unije,
uzimajući u obzir Uredbu (EU) br. 1306/2013 Europskog parlamenta i Vijeća od 17. prosinca 2013. o financiranju, upravljanju i nadzoru zajedničke poljoprivredne politike i o stavljanju izvan snage uredaba Vijeća (EEZ) br. 352/78, (EZ) br. 165/94, (EZ) br. 2799/98, (EZ) br. 814/2000, (EZ) br. 1290/2005 i (EZ) br. 485/2008 (1), a posebno njezin članak 26. stavak 4.,
nakon savjetovanja s Odborom za poljoprivredne fondove,
budući da:
|
(1) |
Komisija je 21. ožujka 2014. donijela prijedlog Uredbe Europskog parlamenta i Vijeća o utvrđivanju stope prilagodbe za izravna plaćanja predviđena Uredbom Vijeća (EZ) br. 73/2009 za kalendarsku godinu 2014 (2). Europski parlament i Vijeće nisu utvrdili tu stopu prilagodbe do 30. lipnja 2014. Stoga je Komisija, u skladu s člankom 26. stavkom 3. Uredbe (EU) br. 1306/2013, utvrdila stopu prilagodbe Provedbenom uredbom Komisije (EU) br. 879/2014 (3). |
|
(2) |
Predviđanja za izravna plaćanja i izdatke povezane s tržištem iz Dokumenta o izmjeni Komisije br. 1 za nacrt proračuna za 2015. upućuju na potrebu za prilagodbom stope financijske discipline koja je uzeta u obzir u nacrtu proračuna za 2015. Taj dokument o izmjeni utvrđen je uzimajući u obzir iznos financijske discipline od 433 milijuna EUR za pričuvu za krize u poljoprivrednom sektoru iz članka 25. Uredbe (EU) br. 1306/2013. Kako bi se uzele u obzir nove informacije, Komisija bi trebala prilagoditi stopu prilagodbe utvrđenu Provedbenom uredbom (EU) br. 879/2014. |
|
(3) |
U pravilu, poljoprivrednici koji podnose zahtjev za potporu za izravna plaćanja za jednu kalendarsku godinu (N) plaćanja primaju unutar određenog razdoblja plaćanja u financijskoj godini (N + 1). Međutim, države članice u nekim slučajevima imaju mogućnost poljoprivrednicima plaćati i nakon tog razdoblja plaćanja, bez vremenskog ograničenja. Zakašnjela plaćanja mogu se obaviti i u nadolazećoj financijskoj godini. Kada se u određenoj kalendarskoj godini primjenjuje financijska disciplina, stopu prilagodbe ne bi trebalo primjenjivati na plaćanja za koja su zahtjevi za potporu podneseni u kalendarskim godinama u kojima se nije primjenjivala financijska disciplina. Stoga, kako bi se osiguralo jednako postupanje prema poljoprivrednicima, primjereno je predvidjeti da se stopa prilagodbe primjenjuje samo na plaćanja za koja su zahtjevi za potporu podneseni u kalendarskoj godini u kojoj se primjenjuje financijska disciplina, bez obzira na to kada se potpora isplaćuje poljoprivrednicima. |
|
(4) |
Člankom 8. stavkom 1. Uredbe (EU) br. 1307/2013 Europskog parlamenta i Vijeća (4) utvrđuje se da se stopa prilagodbe primjenjiva na izravna plaćanja utvrđena u skladu s člankom 26. Uredbe (EU) br. 1306/2013 primjenjuje samo na izravna plaćanja dodijeljena poljoprivrednicima u odgovarajućoj kalendarskoj godini koja premašuju 2 000 EUR. Nadalje, člankom 8. stavkom 2. Uredbe (EU) br. 1307/2013 propisuje se da se kao rezultat postupnog uvođenja izravnih plaćanja stopa prilagodbe primjenjuje na Bugarsku i Rumunjsku tek od 1. siječnja 2016., a na Hrvatsku od 1. siječnja 2022. Stoga se stopa prilagodbe utvrđena ovom Uredbom ne bi trebala primjenjivati na plaćanja poljoprivrednicima u tim državama članicama. |
|
(5) |
Kako bi se osiguralo da se prilagođena stopa prilagodbe primjenjuje od datuma kada će se započeti s plaćanjima poljoprivrednicima u skladu s Uredbom (EU) br. 1306/2013, ova bi se Uredba trebala primjenjivati od 1. prosinca 2014. |
|
(6) |
Prilagođenu stopu prilagodbe trebalo bi uzeti u obzir za izračun svih plaćanja koja se dodjeljuju poljoprivredniku na temelju zahtjeva za potporu koji je podnesen za kalendarsku godinu 2014. Stoga bi radi jasnoće Provedbenu uredbu (EU) br. 879/2014 trebalo staviti izvan snage, |
DONIJELA JE OVU UREDBU:
Članak 1.
1. Za potrebe primjene prilagodbe propisane člancima 25. i 26. Uredbe (EU) br. 1306/2013 i u skladu s člankom 8. stavkom 1. Uredbe (EU) br. 1307/2013, iznosi plaćanja koji se dodjeljuju poljoprivredniku na temelju zahtjeva za potporu koji je podnesen za kalendarsku godinu 2014. i koji premašuju 2 000 EUR u smislu članka 2. točke (d) Uredbe Vijeća (EZ) br. 73/2009 (5) smanjuju se za 1,302214 %.
2. Smanjenje iz stavka 1. ne primjenjuje se na Bugarsku, Hrvatsku i Rumunjsku.
Članak 2.
Provedbena uredba (EU) br. 879/2014 stavlja se izvan snage.
Članak 3.
Ova Uredba stupa na snagu sedmog dana od dana objave u Službenom listu Europske unije.
Primjenjuje se od 1. prosinca 2014.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 17. studenoga 2014.
Za Komisiju
Predsjednik
Jean-Claude JUNCKER
(1) SL L 347, 20.12.2013., str. 549.
(2) COM(2014)175.
(3) Provedbena uredba Komisije (EU) br. 879/2014 od 12. kolovoza 2014. o utvrđivanju stope prilagodbe za izravna plaćanja iz Uredbe Vijeća (EZ) br. 73/2009 za kalendarsku godinu 2014. (SL L 240, 13.8.2014., str. 20.).
(4) Uredba (EU) br. 1307/2013 Europskog parlamenta i Vijeća od 17. prosinca 2013. o utvrđivanju pravila za izravna plaćanja poljoprivrednicima u programima potpore u okviru zajedničke poljoprivredne politike i o stavljanju izvan snage Uredbe Vijeća (EZ) br. 637/2008 i Uredbe Vijeća (EZ) br. 73/2009 (SL L 347, 20.12.2013., str. 608.).
(5) Uredba Vijeća (EZ) br. 73/2009 od 19. siječnja 2009. o utvrđivanju zajedničkih pravila za programe izravne potpore za poljoprivrednike u okviru zajedničke poljoprivredne politike i utvrđivanju određenih programa potpore za poljoprivrednike, o izmjeni uredaba (EZ) br. 1290/2005, (EZ) br. 247/2006, (EZ) br. 378/2007 i stavljanju izvan snage Uredbe (EZ) br. 1782/2003 (SL L 30, 31.1.2009., str. 16.).
|
18.11.2014 |
HR |
Službeni list Europske unije |
L 331/8 |
UREDBA KOMISIJE (EU) br. 1228/2014
оd 17. studenoga 2014.
o odobrenju i uskraćivanju odobrenja za određene zdravstvene tvrdnje navedene na hrani koje se odnose na smanjenje rizika od bolesti
(Tekst značajan za EGP)
EUROPSKA KOMISIJA,
uzimajući u obzir Ugovor o funkcioniranju Europske unije,
uzimajući u obzir Uredbu (EZ) br. 1924/2006 Europskog parlamenta i Vijeća od 20. prosinca 2006. o prehrambenim i zdravstvenim tvrdnjama koje se navode na hrani (1), a posebno njezin članak 17. stavak 3.,
budući da:
|
(1) |
U skladu s Uredbom (EZ) br. 1924/2006 zabranjene su zdravstvene tvrdnje koje se navode na hrani osim ako ih je odobrila Komisija u skladu s tom Uredbom i ako su uvrštene na popis dopuštenih tvrdnji. |
|
(2) |
Uredbom (EZ) br. 1924/2006 predviđa se i da subjekti u poslovanju s hranom mogu podnositi zahtjeve za odobrenje zdravstvenih tvrdnji nadležnom nacionalnom tijelu države članice. Nadležno nacionalno tijelo prosljeđuje valjane zahtjeve Europskoj agenciji za sigurnost hrane (EFSA), dalje u tekstu: „Agencija”. |
|
(3) |
Nakon primitka zahtjeva, Agencija o njemu bez odlaganja obavješćuje druge države članice i Komisiju te daje mišljenje o dotičnoj zdravstvenoj tvrdnji. |
|
(4) |
Komisija odlučuje o odobravanju zdravstvenih tvrdnji uzimajući u obzir mišljenje Agencije. |
|
(5) |
Slijedom zahtjeva trgovačkog društva Abtei Pharma Vertriebs GmbH koji je podnesen u skladu s člankom 14. stavkom 1. točkom (a) Uredbe (EZ) br. 1924/2006, zatraženo je mišljenje Agencije o zdravstvenoj tvrdnji povezanoj s djelovanjem tableta za žvakanje koje sadržavaju kalcij i vitamin D3 na gubitak kostiju (Predmet br. EFSA-Q-2008-721) (2). Tvrdnja koju je predložio podnositelj zahtjeva glasila je: „Tablete za žvakanje koje sadržavaju kalcij i vitamin D poboljšavaju gustoću kostiju kod žena koje imaju 50 ili više godina. Tablete za žvakanje stoga mogu smanjiti rizik od lomova uzrokovanih osteoporozom”. |
|
(6) |
Na temelju iznesenih podataka Agencija je u svojem mišljenju, koje su Komisija i države članice primile 7. kolovoza 2009., zaključila da postoji uzročno-posljedična veza između unosa kalcija, pojedinačno ili u kombinaciji s vitaminom D, i smanjenja gubitka gustoće minerala kostiju (BMD) kod žena nakon menopauze. Smanjenje gubitka BMD-a može doprinijeti smanjenju rizika od loma kostiju. Stoga bi dvije zdravstvene tvrdnje koja odražavaju ovaj zaključak trebalo smatrati sukladnim zahtjevima Uredbe (EZ) br. 1924/2006 i uvrstiti na popis dozvoljenih tvrdnji Zajednice. Međutim, Agencija je zaključila da su dostavljene informacije bile nedostatne za utvrđivanje uvjeta uporabe za navedene tvrdnje. Nakon toga Komisija se ponovno obratila Agenciji za savjet kako bi osobe koje su odgovorne za upravljanje rizikom mogle odrediti odgovarajuće uvjete uporabe za dotične zdravstvene tvrdnje. Agencija je u svojem mišljenju, koje su Komisija i države članice primile 17. svibnja 2010. (Predmet br. EFSA-Q-2009-00940) (3), zaključila da je iz svih izvora dnevno potrebno unijeti najmanje 1 200 mg kalcija ili najmanje 1 200 mg kalcija i 800 I.U. (20 μg) vitamina D kako bi se ostvarila tvrdnja o djelovanju. |
|
(7) |
Kada se zdravstvena tvrdnja odnosi isključivo na kalcij i kako bi se osiguralo da hrana pruža značajnu količinu kalcija, primjereno je utvrditi uvjete za uporabu koji dopuštaju da se tvrdnja koristi samo za hranu koja u količinski određenoj porciji sadržava najmanje 400 mg kalcija. |
|
(8) |
Uzimajući u obzir visok stupanj unosa Vitamina D koji je potreban za ostvarivanje tvrdnje o djelovanju (20 μg), kada se zdravstvena tvrdnja odnosi na kombinaciju kalcija i vitamina D, primjereno je ograničiti uporabu te tvrdnje na dodatke prehrani. Kako bi se osiguralo da dodatak prehrani pruža značajne količine kalcija i vitamina D u kontekstu ove tvrdnje, primjereno je utvrditi uvjete za uporabu koji dopuštaju da se tvrdnja koristi samo za dodatke prehrani koji u dnevnoj dozi sadržavaju najmanje 400 mg kalcija i 15 μg vitamina D. |
|
(9) |
Slijedom zahtjeva trgovačkog društva DSM Nutritional Products Europe AG, koji je podnesen u skladu s člankom 14. stavkom 1. točkom (a) Uredbe (EZ) br. 1924/2006, zatraženo je mišljenje Agencije o zdravstvenoj tvrdnji povezanoj s djelovanjem vitamina D na rizik od padova muškaraca i žena koji imaju 60 ili više godina (Predmet br. EFSA-Q-2010-01233) (4). Tvrdnja koju je predložio podnositelj zahtjeva glasila je: „Vitamin D smanjuje rizik od padova. Padovi su rizični faktor za lomove”. |
|
(10) |
Na temelju iznesenih podataka Agencija je u svojem mišljenju, koje su Komisija i države članice primile 30. rujna 2011., zaključila da postoji uzročno-posljedična veza između uzimanja vitamina D i smanjenja rizika od padova kao posljedice posturalne nestabilnosti i mišićne slabosti. Smanjenje rizika od padova muškaraca i žena koji imaju 60 ili više godina pridonosi zdravlju ljudi zbog smanjenog rizika od loma kostiju. Zdravstvenu tvrdnju koja odražava ovaj zaključak trebalo bi stoga smatrati u skladu sa zahtjevima Uredbe (EZ) br. 1924/2006 te uvrstiti na popis dozvoljenih tvrdnji Unije. |
|
(11) |
U svojem je mišljenju Agencija zaključila i da je radi ostvarivanja tvrdnje o djelovanju potrebno svakodnevno unositi 800 I.U. (20 μg) vitamina D iz svih izvora. Uzimajući u obzir visok stupanj unosa vitamina D koji je potreban za ostvarivanje tvrdnje o djelovanju (20 μg), primjereno je ograničiti uporabu te tvrdnje na dodatke prehrani. Kako bi se osiguralo da dodatak prehrani pruža značajne količine vitamina D u kontekstu ove tvrdnje, primjereno je utvrditi uvjete za uporabu koji dopuštaju da se tvrdnja koristi samo za dodatke prehrani koji u dnevnoj dozi sadržavaju najmanje 15 μg vitamina D. |
|
(12) |
Člankom 16. stavkom 4. Uredbe (EZ) br. 1924/2006 propisuje se da bi mišljenje u korist odobrenja neke zdravstvene tvrdnje trebalo sadržavati određene podatke. U skladu s tim, te bi podatke trebalo navesti u Prilogu I. ovoj Uredbi u pogledu odobrenih tvrdnji i uključiti, ovisno o slučaju, revidirani tekst tvrdnje, specifične uvjete njezine uporabe te, gdje je to primjenjivo, uvjete ili ograničenja uporabe dotične hrane i/ili dodatnu izjavu ili upozorenje, u skladu s pravilima utvrđenima u Uredbi (EZ) br. 1924/2006 i u skladu s mišljenjem Agencije. |
|
(13) |
Jedan od ciljeva Uredbe (EZ) br. 1924/2006 jest osigurati da zdravstvene tvrdnje budu istinite, jasne, pouzdane i korisne potrošaču te da se u tom smislu treba uzeti u obzir tekst i predstavljanje tih tvrdnji. Stoga, ako tekst tvrdnji ima za potrošače isto značenje kao tekst neke dopuštene zdravstvene tvrdnje jer upućuje na isti odnos između određene kategorije hrane, određene hrane ili jednog od njezinih sastojaka i zdravlja, za dotične tvrdnje trebaju vrijediti isti uvjeti uporabe kako su navedeni u Prilogu I. ovoj Uredbi. |
|
(14) |
Slijedom zahtjeva trgovačkog društva GP International Holding B.V., koji je podnesen u skladu s člankom 14. stavkom 1. točkom (a) Uredbe (EZ) br. 1924/2006, zatraženo je mišljenje Agencije o zdravstvenoj tvrdnji povezanoj s djelovanjem glukozamin hidroklorida na usporavanje degeneracije hrskavice (Predmet br. EFSA-Q-2009-00412) (5). Tvrdnja koju je predložio podnositelj zahtjeva glasila je: „Usporava/smanjuje proces degeneracije hrskavice mišično-koštanog sustava i posljedično smanjuje rizik od osteoartritisa”. |
|
(15) |
Na temelju iznesenih podataka Agencija je u svojem mišljenju, koje su Komisija i države članice primile 29. listopada 2009., zaključila da nije utvrđena uzročno-posljedična veza između uzimanja glukozamin hidroklorida i tvrdnje o njegovu djelovanju. Stoga tu tvrdnju ne bi trebalo odobriti jer nije u skladu sa zahtjevima Uredbe (EZ) br. 1924/2006. |
|
(16) |
Slijedom zahtjeva Europskog udruženja proizvođača prirodne hrane od soje (ENSA), Europske federacije proizvođača biljnih bjelančevina (EUVEPRO) i Udruženja za sojine bjelančevine (SPA), koji je podnesen u skladu s člankom 14. stavkom 1. točkom (a) Uredbe (EZ) br. 1924/2006, zatraženo je mišljenje Agencije o zdravstvenoj tvrdnji povezanoj s djelovanjem izoliranih bjelančevina soje na smanjenje koncentracije LDL kolesterola u krvi (Predmet br. EFSA-Q-2011-00784) (6). Tvrdnja koju je predložio podnositelj zahtjeva glasila je: „Pokazalo se da sastojak bogat sojinim bjelančevinama snižava/smanjuje kolesterol u krvi; sniženje kolesterola u krvi može smanjiti rizik od (koronarne) bolesti srca”. |
|
(17) |
Na temelju iznesenih podataka Agencija je u svojem mišljenju, koje su Komisija i države članice primile 2. veljače 2012., zaključila da nije utvrđena uzročno-posljedična veza između uzimanja izoliranih bjelančevina soje i tvrdnje o njihovu djelovanju kako je podnositelj zahtjeva naveo. Stoga tu tvrdnju ne bi trebalo odobriti jer nije u skladu sa zahtjevima Uredbe (EZ) br. 1924/2006. |
|
(18) |
Slijedom zahtjeva trgovačkog društva Health Concern B.V., koji je podnesen u skladu s člankom 14. stavkom 1. točkom (a) Uredbe (EZ) br. 1924/2006, zatraženo je mišljenje Agencije o zdravstvenoj tvrdnji povezanoj s djelovanjem kombinacije biljnih sterola i mješavine Cholesternorm® na smanjenje koncentracije LDL kolesterola u krvi (Predmet br. EFSA-Q-2009-00237, EFSA-Q-2011-01114) (7). Tvrdnja koju je predložio podnositelj zahtjeva glasila je: „Aktivno snižava kolesterol”. |
|
(19) |
Na temelju iznesenih podataka Agencija je u svojem mišljenju, koje su Komisija i države članice primile 17. srpnja 2012., zaključila da nije utvrđena uzročno-posljedična veza između uzimanja kombinacije biljnih sterola i mješavine Cholesternorm® i tvrdnje o njezinu djelovanju. Stoga tu tvrdnju ne bi trebalo odobriti jer nije u skladu sa zahtjevima Uredbe (EZ) br. 1924/2006. |
|
(20) |
Slijedom zahtjeva trgovačkog društva Minami Nutrition Health BVBA, koji je podnesen u skladu s člankom 14. stavkom 1. točkom (a) Uredbe (EZ) br. 1924/2006, zatraženo je mišljenje Agencije o zdravstvenoj tvrdnji povezanoj s djelovanjem eikozapentaenoične kiseline (EPA) na smanjenje omjera arahidonske kiseline (AA)/EPA u krvi djece s poremećajem hiperaktivnosti i deficita pažnje (ADHD) (Predmet br. EFSA-Q-2012-00573) (8). Tvrdnja koju je predložio podnositelj zahtjeva glasila je: „EPA dokazano smanjuje omjer AA/EPA u krvi. Visoka razina AA/EPA rizični je faktor za razvoj poteškoća s pažnjom kod djece koja imaju simptome slične ADHD-u. Kod takve je djece manje izražena hiperaktivnost i/ili istodobno suprotstavljajuće ponašanje”. |
|
(21) |
Na temelju iznesenih podataka Agencija je u svojem mišljenju, koje su Komisija i države članice primile 8. travnja 2013., zaključila da je ciljana skupina zahtjeva skupina oboljele djece (tj. djeca s ADHD-om) i da su tvrdnje o njezinu djelovanju povezane s liječenjem bolesti. |
|
(22) |
Uredbom (EZ) br. 1924/2006 dopunjuju se opće odredbe Direktive 2000/13/EZ Europskog parlamenta i Vijeća od 20. ožujka 2000. o usklađivanju zakonodavstava država članica o označivanju, prezentiranju i oglašavanju hrane (9). Člankom 2. stavkom 1. točkom (b) Direktive 2000/13/EZ predviđa se da se označivanjem ne smiju pridavati bilo kojoj hrani svojstva prevencije, terapije ili liječenja bolesti ljudi ili se upućivati na takva svojstva. Prema tome, s obzirom na to da je pridavanje ljekovitih svojstava hrani zabranjeno, ne bi trebalo odobriti tvrdnju u vezi s djelovanjem eikozapentaenoične kiseline (EPA) na smanjenje omjera AA/EPA u krvi djece s ADHD-om. |
|
(23) |
Slijedom zahtjeva trgovačkog društva McNeil Nutritionals and Raisio Nutrition Ltd., koji je podnesen u skladu s člankom 14. stavkom 1. točkom (a) Uredbe (EZ) br. 1924/2006, zatraženo je mišljenje Agencije o zdravstvenoj tvrdnji povezanoj s uzimanjem 2 g/dnevno biljnih stanola (u obliku estera biljnih stanola) kao dio prehrane s niskim sadržajem zasićenih masti i dvostruko većeg smanjenja koncentracija LDL kolesterola u krvi u odnosu na prehranu samo s niskim sadržajem zasićenih masti (Predmet br. EFSA-Q-2012-00915) (10). Tvrdnja koju je predložio podnositelj zahtjeva glasila je: „Uzimanje 2 g/dnevno biljnih stanola (u obliku estera biljnih stanola) kao dio prehrane s niskim sadržajem zasićenih masti dovodi do dvostruko većeg smanjenja koncentracija LDL kolesterola u krvi u odnosu na uzimanje prehrane samo s niskim sadržajem zasićenih masti. Visoki kolesterol rizični je faktor za razvoj koronarne bolesti srca”. |
|
(24) |
Na temelju iznesenih podataka Agencija je u svojem mišljenju, koje su Komisija i države članice primile 8. travnja 2013., zaključila da na temelju dokaza koje je podnositelj zahtjeva dostavio nije utvrđeno da uzimanje 2 g/dnevno biljnih stanola (u obliku estera biljnih stanola) kao dio prehrane s niskim sadržajem zasićenih masti dovodi do dvostruko većeg smanjenja koncentracija LDL kolesterola u krvi u odnosu na uzimanje prehrane samo s niskim sadržajem zasićenih masti. Stoga tu tvrdnju ne bi trebalo odobriti jer nije u skladu sa zahtjevima Uredbe (EZ) br. 1924/2006. |
|
(25) |
Pri određivanju mjera predviđenih ovom Uredbom Komisija je uzela u obzir primjedbe koje su joj dostavili podnositelji zahtjeva i predstavnici javnosti u skladu s člankom 16. stavkom 6. Uredbe (EZ) br. 1924/2006. |
|
(26) |
Dodavanje tvari u hranu ili njihova uporaba u hrani uređuje se posebnim zakonodavstvom Unije i nacionalnim zakonodavstvom, kao i razvrstavanje proizvoda kao hrane ili lijeka. Svaka odluka o zdravstvenoj tvrdnji u skladu s Uredbom (EZ) br. 1924/2006, kao što je uvrštavanje na popis dozvoljenih tvrdnji navedenih u njezinu članku 14. stavku 1., ne predstavlja odobrenje za stavljanje na tržište tvari za koju se tvrdnja navodi ni odluku o tome može li se tvar upotrijebiti u hrani ili razvrstavanje određenog proizvoda kao hrane. |
|
(27) |
Mjere predviđene ovom Uredbom u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU UREDBU:
Članak 1.
1. Zdravstvene tvrdnje navedene u Prilogu I. ovoj Uredbi mogu se navoditi na hrani koja se stavlja na tržište Unije u skladu s uvjetima navedenima u tom Prilogu.
2. Zdravstvene tvrdnje navedene u stavku 1. uvrštavaju se na popis dopuštenih zdravstvenih tvrdnji Unije kako je predviđeno člankom 14. stavkom 1. Uredbe (EZ) br. 1924/2006.
Članak 2.
Zdravstvene tvrdnje navedene u Prilogu II. ovoj Uredbi ne uvrštavaju se na popis dopuštenih tvrdnji Unije kako je predviđeno člankom 14. stavkom 1. Uredbe (EZ) br. 1924/2006.
Članak 3.
Ova Uredba stupa na snagu dvadesetog dana od dana objave u Službenom listu Europske unije.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 17. studenoga 2014.
Za Komisiju
Predsjednik
Jean-Claude JUNCKER
(1) SL L 404, 30.12.2006., str. 9.
(2) EFSA Journal (2009.) 1180, 1.–13.
(3) EFSA Journal (2010);8(5):1609.
(4) EFSA Journal (2011);9(9):2382.
(5) EFSA Journal 2009;7(10):1358.
(6) EFSA Journal 2012;10(2):2555.
(7) EFSA Journal 2012;10(7):2810.
(8) EFSA Journal 2013;11(4):3161.
(9) SL L 109, 6.5.2000., str. 29.
(10) EFSA Journal 2013;11(4):3160.
PRILOG I.
Odobrene zdravstvene tvrdnje
|
Zahtjev – odgovarajuće odredbe Uredbe (EZ) br. 1924/2006 |
Podnositelj zahtjeva – adresa |
Hranjiva tvar, tvar, hrana ili kategorija hrane |
Tvrdnja |
Uvjeti uporabe tvrdnje |
Uvjeti i/ili ograničenja uporabe hrane i/ili dodatna izjava ili upozorenje |
Referentni broj mišljenja EFSA-e |
|
Članak 14. stavak 1. točka (a) – zdravstvena tvrdnja koja se odnosi na smanjenje rizika od bolesti |
Abtei Pharma Vertriebs GmbH, Abtei 1, 37696, Marienműnster, Njemačka. |
Kalcij |
Kalcij pridonosi smanjenju gubitka minerala kostiju kod žena nakon menopauze. Niska gustoća minerala kostiju rizični je faktor za lomove kostiju uzrokovane osteoporozom. |
Ova tvrdnja može se koristiti samo za hranu koja u količinski određenoj porciji sadržava najmanje 400 mg kalcija. Potrošač mora biti obaviješten da je ova tvrdnja posebno namijenjena ženama koje imaju 50 ili više godina i da se povoljan učinak postiže dnevnim unosom od najmanje 1 200 mg kalcija iz svih izvora. |
Za hranu s dodanim kalcijem ova se tvrdnja može koristiti samo za onu koja je namijenjena ženama koje imaju 50 ili više godina |
Q-2008-721 Q-2009-00940 |
|
Članak 14. stavak 1. točka (a) – zdravstvena tvrdnja koja se odnosi na smanjenje rizika od bolesti |
Abtei Pharma Vertriebs GmbH, Abtei 1, 37696, Marienműnster, Njemačka. |
Kalcij i vitamin D |
Kalcij i vitamin D pridonose smanjenju gubitka minerala kostiju kod žena nakon menopauze. Niska gustoća minerala kostiju rizični je faktor za lomove kostiju uzrokovane osteoporozom. |
Ova tvrdnja može se koristiti samo za dodatke prehrani koji u dnevnoj dozi sadržavaju najmanje 400 mg kalcija i 15 μg vitamina D. Potrošač mora biti obaviješten da je ova tvrdnja posebno namijenjena ženama koje imaju 50 ili više godina i da se povoljan učinak postiže dnevnim unosom od najmanje 1 200 mg kalcija i 20 μg vitamina D iz svih izvora. |
Za dodatke prehrani s dodanim kalcijem i vitaminom D ova se tvrdnja može koristiti samo za one koji su namijenjeni ženama koje imaju 50 ili više godina |
Q-2008-721 Q-2009-00940 |
|
Članak 14. stavak 1. točka (a) – zdravstvena tvrdnja koja se odnosi na smanjenje rizika od bolesti |
DSM Nutritional Products Europe AG, P.O. Box 2676, 4002 Basel, Švicarska. |
Vitamin D |
Vitamin D pridonosi smanjenju rizika od pada kao posljedice posturalne nestabilnosti i mišićne slabosti. Padovi su rizični faktor za lomove kostiju muškaraca i žena koji imaju 60 ili više godina. |
Ova tvrdnja može se koristiti samo za dodatke prehrani koji u dnevnoj dozi sadržavaju najmanje 15 μg vitamina D. Potrošač mora biti obaviješten da se povoljno djelovanje postiže dnevnim unosom od najmanje 20 μg vitamina D iz svih izvora. |
Za dodatke prehrani s dodanim vitaminom D ova se tvrdnja može koristiti samo za one koji su namijenjeni ženama i muškarcima koji imaju 60 ili više godina |
Q-2010-01233 |
PRILOG II.
Odbijene zdravstvene tvrdnje
|
Zahtjev – odgovarajuće odredbe Uredbe (EZ) br. 1924/2006 |
Hranjiva tvar, tvar, hrana ili kategorija hrane |
Tvrdnja |
Referentni broj mišljenja EFSA-e |
|
Članak 14. stavak 1. točka (a) – zdravstvena tvrdnja koja se odnosi na smanjenje rizika od bolesti |
Glukozamin hidroklorid |
Usporava/smanjuje proces degeneracije hrskavice mišićno-koštanog sustava i posljedično smanjuje rizik od osteoartritisa. |
Q-2009-00412 |
|
Članak 14. stavak 1. točka (a) – zdravstvena tvrdnja koja se odnosi na smanjenje rizika od bolesti |
Izolirane bjelančevine soje |
Pokazalo se da sastojak bogat sojinim bjelančevinama snižava/smanjuje kolesterol u krvi; snižavanje kolesterola u krvi može smanjiti rizik od (koronarne) bolesti srca. |
Q-2011-00784 |
|
Članak 14. stavak 1. točka (a) – zdravstvena tvrdnja koja se odnosi na smanjenje rizika od bolesti |
Biljni steroli u kombinaciji s mješavinom Cholesternorm® |
Aktivno snižava kolesterol. |
Q-2009-00237 Q-2011-01114 |
|
Članak 14. stavak 1. točka (a) – zdravstvena tvrdnja koja se odnosi na smanjenje rizika od bolesti |
Eikozapentaenoična kiselina (EPA) |
EPA dokazano smanjuje omjer AA/EPA u krvi. Visoka razina AA/EPA rizični je faktor za razvoj poteškoća s pažnjom kod djece koja imaju simptome slične ADHD-u. Kod takve je djece manje izražena hiperaktivnost i/ili istodobno suprotstavljajuće ponašanje. |
Q-2012-00573 |
|
Članak 14. stavak 1. točka (a) – zdravstvena tvrdnja koja se odnosi na smanjenje rizika od bolesti |
Biljni stanoli (u obliku estera biljnih stanola) |
Uzimanje 2 g/dnevno biljnih stanola (u obliku estera biljnih stanola) kao dio prehrane s niskim sadržajem zasićenih masti dovodi do dvostruko većeg smanjenja koncentracija LDL kolesterola u krvi u odnosu na uzimanje prehrane samo s niskim sadržajem zasićenih masti. Visoki kolesterol rizični je faktor za razvoj koronarne bolesti srca. |
Q-2012-00915 |
|
18.11.2014 |
HR |
Službeni list Europske unije |
L 331/14 |
UREDBA KOMISIJE (EU) br. 1229/2014
оd 17. studenoga 2014.
o uskraćivanju odobrenja za određene zdravstvene tvrdnje navedene na hrani osim onih koje se odnose na smanjenje rizika od bolesti te na razvoj i zdravlje djece
(Tekst značajan za EGP)
EUROPSKA KOMISIJA,
uzimajući u obzir Ugovor o funkcioniranju Europske unije,
uzimajući u obzir Uredbu (EZ) br. 1924/2006 Europskog parlamenta i Vijeća od 20. prosinca 2006. o prehrambenim i zdravstvenim tvrdnjama koje se navode na hrani (1), a posebno njezin članak 18. stavak 5.,
budući da:
|
(1) |
U skladu s Uredbom (EZ) br. 1924/2006 zabranjene su zdravstvene tvrdnje koje se navode na hrani osim ako ih je odobrila Komisija u skladu s tom Uredbom i ako su uvrštene na popis dopuštenih tvrdnji. |
|
(2) |
Uredbom (EZ) br. 1924/2006 predviđa se i da subjekti u poslovanju s hranom mogu podnositi zahtjeve za odobravanje zdravstvenih tvrdnji nadležnom nacionalnom tijelu države članice. Nadležno nacionalno tijelo prosljeđuje valjane zahtjeve Europskoj agenciji za sigurnost hrane (EFSA), dalje u tekstu „Agencija”, za znanstvenu procjenu te Komisiji i državama članicama za informaciju. |
|
(3) |
Agencija donosi mišljenje o dotičnoj zdravstvenoj tvrdnji. |
|
(4) |
Komisija odlučuje o odobravanju zdravstvenih tvrdnji uzimajući u obzir mišljenje Agencije. |
|
(5) |
Slijedom zahtjeva trgovačkog društva Italsur s.r.l., koji je podnesen u skladu s člankom 13. stavkom 5. Uredbe (EZ) br. 1924/2006, zatraženo je mišljenje Agencije o zdravstvenoj tvrdnji povezanoj s djelovanjem kombinacije toskanskog crnog kelja, „trobojne” rebraste blitve, „dvobojnog” špinata i kelja na zaštitu lipida u krvi od oksidativnog oštećenja (Predmet br. EFSA-Q-2013-00574) (2). Tvrdnja koju je predložio podnositelj zahtjeva glasila je: „pridonosi zaštiti lipida u krvi od oksidativnog oštećenja”. |
|
(6) |
Komisija i države članice primile su 30. listopada 2013. znanstveno mišljenje Agencije koja je zaključila da na temelju dostavljenih podataka nije utvrđena uzročno-posljedična veza između uzimanja kombinacije toskanskog crnog kelja, „trobojne” rebraste blitve, „dvobojnog” špinata i kelja i tvrdnje o njezinu djelovanju. Stoga tu tvrdnju ne bi trebalo odobriti jer nije u skladu sa zahtjevima Uredbe (EZ) br. 1924/2006. |
|
(7) |
Slijedom zahtjeva trgovačkog društva Italsur s.r.l., koji je podnesen u skladu s člankom 13. stavkom 5. Uredbe (EZ) br. 1924/2006, zatraženo je mišljenje Agencije o zdravstvenoj tvrdnji povezanoj s djelovanjem kombinacije crvenog špinata, zelenog špinata, crvene cikorije, zelene cikorije, zelene lisnate blitve, crvene lisnate blitve, crvene rebraste blitve, žute rebraste blitve i bijele rebraste blitve na zaštitu lipida u krvi od oksidativnog oštećenja (Predmet br. EFSA-Q-2013-00575) (3). Tvrdnja koju je predložio podnositelj zahtjeva glasila je: „pridonosi zaštiti lipida u krvi od oksidativnog oštećenja”. |
|
(8) |
Komisija i države članice primile su 30. listopada 2013. znanstveno mišljenje Agencije koja je zaključila da na temelju dostavljenih podataka nije utvrđena uzročno-posljedična veza između uzimanja kombinacije crvenog špinata, zelenog špinata, crvene cikorije, zelene cikorije, zelene lisnate blitve, crvene lisnate blitve, crvene rebraste blitve, žute rebraste blitve i bijele rebraste blitve i tvrdnje o njezinu djelovanju. Stoga tu tvrdnju ne bi trebalo odobriti jer nije u skladu sa zahtjevima Uredbe (EZ) br. 1924/2006. |
|
(9) |
Slijedom zahtjeva trgovačkog društva Italsur s.r.l., koji je podnesen u skladu s člankom 13. stavkom 5. Uredbe (EZ) br. 1924/2006, zatraženo je mišljenje Agencije o zdravstvenoj tvrdnji povezanoj s djelovanjem kombinacije toskanskog crnog kelja, „trobojne” rebraste blitve, „dvobojnog” špinata i kelja na održavanje normalne koncentracije LDL kolesterola u krvi (Predmet br. EFSA-Q-2013-00576) (4). Tvrdnja koju je predložio podnositelj zahtjeva glasila je: „održava normalnu koncentraciju kolesterola u krvi”. |
|
(10) |
Komisija i države članice primile su 30. listopada 2013. znanstveno mišljenje Agencije koja je zaključila da na temelju dostavljenih podataka nije utvrđena uzročno-posljedična veza između uzimanja kombinacije toskanskog crnog kelja, „trobojne” rebraste blitve, „dvobojnog” špinata i kelja i tvrdnje o njezinu djelovanju. Stoga tu tvrdnju ne bi trebalo odobriti jer nije u skladu sa zahtjevima Uredbe (EZ) br. 1924/2006. |
|
(11) |
Slijedom zahtjeva trgovačkog društva Italsur s.r.l., koji je podnesen u skladu s člankom 13. stavkom 5. Uredbe (EZ) br. 1924/2006, zatraženo je mišljenje Agencije o zdravstvenoj tvrdnji povezanoj s djelovanjem kombinacije crvenog špinata, zelenog špinata, crvene cikorije, zelene cikorije, zelene lisnate blitve, crvene lisnate blitve, crvene rebraste blitve, žute rebraste blitve i bijele rebraste blitve na održavanje normalne koncentracije LDL kolesterola u krvi (Predmet br. EFSA-Q-2013-00579) (5). Tvrdnja koju je predložio podnositelj zahtjeva glasila je: „održava normalne koncentracije kolesterola u krvi”. |
|
(12) |
Komisija i države članice primile su 30. listopada 2013. znanstveno mišljenje Agencije koja je zaključila da na temelju dostavljenih podataka nije utvrđena uzročno-posljedična veza između uzimanja kombinacije crvenog špinata, zelenog špinata, crvene cikorije, zelene cikorije, zelene lisnate blitve, crvene lisnate blitve, crvene rebraste blitve, žute rebraste blitve i bijele rebraste blitve i tvrdnje o njezinu djelovanju. Stoga tu tvrdnju ne bi trebalo odobriti jer nije u skladu sa zahtjevima Uredbe (EZ) br. 1924/2006. |
|
(13) |
Slijedom zahtjeva trgovačkog društva Omikron Italia S.r.l., koji je podnesen u skladu s člankom 13. stavkom 5. Uredbe (EZ) br. 1924/2006, zatraženo je mišljenje Agencije o zdravstvenoj tvrdnji povezanoj s djelovanjem kombinacije diosmina, trokserutina i hesperidina na održavanje normalne propusnosti vena i kapilara (Predmet br. EFSA-Q-2013-00353) (6). Tvrdnja koju je predložio podnositelj zahtjeva glasila je: „smjesa flavonoida koja sadržava 300 mg diosmina, 300 mg trokserutina i 100 mg hesperidina korisno je pomoćno sredstvo za održavanje fiziološke propusnosti vena i kapilara”. |
|
(14) |
Komisija i države članice primile su 13. siječnja 2014. znanstveno mišljenje Agencije koja je zaključila da na temelju dostavljenih podataka nije utvrđena uzročno-posljedična veza između uzimanja kombinacije diosmina, trokserutina i hesperidina i tvrdnje o njezinu djelovanju. Stoga tu tvrdnju ne bi trebalo odobriti jer nije u skladu sa zahtjevima Uredbe (EZ) br. 1924/2006. |
|
(15) |
Slijedom zahtjeva trgovačkog društva Omikron Italia S.r.l., koji je podnesen u skladu s člankom 13. stavkom 5. Uredbe (EZ) br. 1924/2006, zatraženo je mišljenje Agencije o zdravstvenoj tvrdnji povezanoj s djelovanjem kombinacije diosmina, trokserutina i hesperidina na održavanje normalnog tonusa vena (Predmet br. EFSA-Q-2013-00354) (7). Tvrdnja koju je predložio podnositelj zahtjeva glasila je: „smjesa flavonoida koja sadržava 300 mg diosmina, 300 mg trokserutina i 100 mg hesperidina korisno je pomoćno sredstvo za održavanje fiziološkog tonusa vena”. |
|
(16) |
Komisija i države članice primile su 13. siječnja 2014. znanstveno mišljenje Agencije koja je zaključila da na temelju dostavljenih podataka nije utvrđena uzročno-posljedična veza između uzimanja kombinacije diosmina, trokserutina i hesperidina i tvrdnje o njezinu djelovanju. Stoga tu tvrdnju ne bi trebalo odobriti jer nije u skladu sa zahtjevima Uredbe (EZ) br. 1924/2006. |
|
(17) |
Slijedom zahtjeva trgovačkog društva Italsur srl, koji je podnesen u skladu s člankom 13. stavkom 5. Uredbe (EZ) br. 1924/2006, zatraženo je mišljenje Agencije o zdravstvenoj tvrdnji povezanoj s djelovanjem ječmene juhe „Orzotto” na zaštitu lipida u krvi od oksidativnog oštećenja (Predmet br. EFSA-Q-2013-00578) (8). Tvrdnja koju je predložio podnositelj zahtjeva glasila je: „pridonosi zaštiti lipida u krvi od oksidativnog oštećenja”. |
|
(18) |
Komisija i države članice primile su 10. siječnja 2014. znanstveno mišljenje Agencije koja je zaključila da na temelju dostavljenih podataka nije utvrđena uzročno-posljedična veza između uzimanja ječmene juhe „Orzotto” i tvrdnje o njezinu djelovanju. Stoga tu tvrdnju ne bi trebalo odobriti jer nije u skladu sa zahtjevima Uredbe (EZ) br. 1924/2006. |
|
(19) |
Mjere predviđene ovom Uredbom u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU UREDBU:
Članak 1.
Zdravstvene tvrdnje navedene u Prilogu ovoj Uredbi ne uvrštavaju se na popis dopuštenih tvrdnji Unije kako je predviđeno člankom 13. stavkom 3. Uredbe (EZ) br. 1924/2006.
Članak 2.
Ova Uredba stupa na snagu dvadesetog dana od dana objave u Službenom listu Europske unije.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 17. studenoga 2014.
Za Komisiju
Predsjednik
Jean-Claude JUNCKER
(1) SL L 404, 30.12.2006., str. 9.
(2) EFSA Journal 2013; 11(10):3413.
(3) EFSA Journal 2013; 11(10):3414.
(4) EFSA Journal 2013; 11(10):3415.
(5) EFSA Journal 2013; 11(10):3416.
(6) EFSA Journal 2014; 12(1):3511.
(7) EFSA Journal 2014; 12(1):3512.
(8) EFSA Journal 2014; 12(1):3519.
PRILOG
Odbijene zdravstvene tvrdnje
|
Zahtjev – odgovarajuće odredbe Uredbe (EZ) br. 1924/2006 |
Hranjiva tvar, tvar, hrana ili kategorija hrane |
Tvrdnja |
Upućivanje na mišljenje EFSA-e |
|
Članak 13. stavak 5. – zdravstvena tvrdnja koja se temelji na novim znanstvenim dokazima i/ili uključuje zahtjev za zaštitom vlasničkih podataka |
Kombinacija toskanskog crnog kelja, „trobojne” rebraste blitve, „dvobojnog” špinata i kelja |
Pridonosi zaštiti lipida u krvi od oksidativnog oštećenja |
Q-2013-00574 |
|
Članak 13. stavak 5. – zdravstvena tvrdnja koja se temelji na novim znanstvenim dokazima i/ili uključuje zahtjev za zaštitom vlasničkih podataka |
Kombinacija crvenog špinata, zelenog špinata, crvene cikorije, zelene cikorije, zelene lisnate blitve, crvene lisnate blitve, crvene rebraste blitve, žute rebraste blitve i bijele rebraste blitve |
Pridonosi zaštiti lipida u krvi od oksidativnog oštećenja |
Q-2013-00575 |
|
Članak 13. stavak 5. – zdravstvena tvrdnja koja se temelji na novim znanstvenim dokazima i/ili uključuje zahtjev za zaštitom vlasničkih podataka |
Kombinacija toskanskog crnog kelja, „trobojne” rebraste blitve, „dvobojnog” špinata i kelja |
Održava normalnu koncentraciju kolesterola u krvi |
Q-2013-00576 |
|
Članak 13. stavak 5. – zdravstvena tvrdnja koja se temelji na novim znanstvenim dokazima i/ili uključuje zahtjev za zaštitom vlasničkih podataka |
Kombinacija crvenog špinata, zelenog špinata, crvene cikorije, zelene cikorije, zelene lisnate blitve, crvene lisnate blitve, crvene rebraste blitve, žute rebraste blitve i bijele rebraste blitve |
Održava normalnu koncentraciju kolesterola u krvi |
Q-2013-00579 |
|
Članak 13. stavak 5. – zdravstvena tvrdnja koja se temelji na novim znanstvenim dokazima i/ili uključuje zahtjev za zaštitom vlasničkih podataka |
Kombinacija diosmina, trokserutina i hesperidina |
Smjesa flavonoida koja sadržava 300 mg diosmina, 300 mg trokserutina i 100 mg hesperidina korisno je pomoćno sredstvo za održavanje fiziološke propusnosti vena i kapilara |
Q-2013-00353 |
|
Članak 13. stavak 5. – zdravstvena tvrdnja koja se temelji na novim znanstvenim dokazima i/ili uključuje zahtjev za zaštitom vlasničkih podataka |
Kombinacija diosmina, trokserutina i hesperidina |
Smjesa flavonoida koja sadržava 300 mg diosmina, 300 mg trokserutina i 100 mg hesperidina korisno je pomoćno sredstvo za održavanje fiziološkog tonusa vena |
Q-2013-00354 |
|
Članak 13. stavak 5. – zdravstvena tvrdnja koja se temelji na novim znanstvenim dokazima i/ili uključuje zahtjev za zaštitom vlasničkih podataka |
Ječmena juha „Orzotto” |
Pridonosi zaštiti lipida u krvi od oksidativnog oštećenja |
Q-2013-00578 |
|
18.11.2014 |
HR |
Službeni list Europske unije |
L 331/18 |
PROVEDBENA UREDBA KOMISIJE (EU) br. 1230/2014
оd 17. studenoga 2014.
o odobrenju bakrova bilizinata kao dodatka hrani za sve životinjske vrste
(Tekst značajan za EGP)
EUROPSKA KOMISIJA,
uzimajući u obzir Ugovor o funkcioniranju Europske unije,
uzimajući u obzir Uredbu (EZ) br. 1831/2003 Europskog parlamenta i Vijeća od 22. rujna 2003. o dodacima hrani za životinje (1), a posebno njezin članak 9. stavak 2.,
budući da:
|
(1) |
Uredbom (EZ) br. 1831/2003 propisuje se odobravanje dodataka hrani za životinje te osnove i postupci za izdavanje tog odobrenja. |
|
(2) |
U skladu s člankom 7. Uredbe (EZ) br. 1831/2003 podnesen je zahtjev za odobrenje bakrova bilizinata. Uz navedeni zahtjev priloženi su podaci i dokumenti propisani člankom 7. stavkom 3. Uredbe (EZ) br. 1831/2003. |
|
(3) |
Zahtjev se odnosi na odobrenje bakrova bilizinata kao dodatka hrani za životinje za sve životinjske vrste i njegovo razvrstavanje u kategoriju dodataka „nutritivni dodaci”. |
|
(4) |
Europska agencija za sigurnost hrane (dalje u tekstu: „Agencija”) u svojem je mišljenju od 3. srpnja 2014. (2) zaključila da bakrov bilizinat u predloženim uvjetima uporabe nema negativan učinak na zdravlje životinja, zdravlje ljudi ili na okoliš te da ga se može smatrati djelotvornim izvorom bakra za sve životinjske vrste. Agencija smatra da ne postoji potreba za posebnim zahtjevima za praćenje nakon stavljanja na tržište. Isto tako, potvrdila je izvješće o metodi analize dodatka hrani za životinje koje je dostavio referentni laboratorij osnovan Uredbom (EZ) br. 1831/2003. |
|
(5) |
Ocjenom bakrova bilizinata utvrdilo se da su ispunjeni uvjeti za odobrenje propisani člankom 5. Uredbe (EZ) br. 1831/2003. U skladu s tim treba odobriti uporabu te tvari kako je navedena u Prilogu ovoj Uredbi. |
|
(6) |
Mjere predviđene ovom Uredbom u skladu su s mišljenjem Stalnog odbora za bilje, životinje, hranu i hranu za životinje, |
DONIJELA JE OVU UREDBU:
Članak 1.
Tvar navedena u Prilogu, koja pripada kategoriji dodataka „nutritivni dodaci” i funkcionalnoj skupini „spojevi elemenata u tragovima”, odobrava se kao dodatak u hrani za životinje pod uvjetima utvrđenima u tom Prilogu.
Članak 2.
Ova Uredba stupa na snagu dvadesetog dana od dana objave u Službenom listu Europske unije.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 17. studenoga 2014.
Za Komisiju
Predsjednik
Jean-Claude JUNCKER
(1) SL L 268, 18.10.2003., str. 29.
(2) EFSA Journal (2014.); 12(7):3796.
PRILOG
|
Identifikacijski broj dodatka hrani za životinje |
Naziv nositelja odobrenja |
Dodatak hrani za životinje |
Sastav, kemijska formula, opis, analitička metoda |
Vrsta ili kategorija životinje |
Najviša dob |
Najmanja dopuštena količina |
Najveća dopuštena količina |
Ostale odredbe |
Datum isteka valjanosti odobrenja |
||||||||||||||||||||||||||||
|
Sadržaj elementa (Cu) u mg/kg potpune krmne smjese s udjelom vlage od 12 % |
|||||||||||||||||||||||||||||||||||||
|
Kategorija nutritivnih dodataka. Funkcionalna skupina: spojevi elemenata u tragovima |
|||||||||||||||||||||||||||||||||||||
|
3b411 |
— |
Bakrov bilizinat |
Karakteristike dodatka U prahu ili u obliku granula s masenim udjelom bakra ≥ 14,5 % i lizina ≥ 84,0 %. Karakteristika aktivne tvari bakrov kelat L-lizinat-HCl Kemijska formula: Cu(C6H13N2O2)2×2HCl CAS broj: 53383-24-7 Analitičke metode (1) Za kvantifikaciju sadržaja lizina u dodatku hrani za životinje:
Za kvantifikaciju ukupnog sadržaja bakra u dodatku hrani za životinje i premiksima:
Za kvantifikaciju ukupne količine bakra u krmivu i krmnoj smjesi:
|
Sve životinjske vrste |
— |
— |
Goveda:
Ovce: 15 (ukupno). Prasad do 12 tjedana: 170 (ukupno). Rakovi: 50 (ukupno). Ostale životinje: 25 (ukupno). |
|
8. prosinca 2024. |
||||||||||||||||||||||||||||
(1) Podaci o analitičkim metodama dostupni su na sljedećoj adresi referentnog laboratorija: https://ec.europa.eu/jrc/en/eurl/feed-additives/evaluation-reports
|
18.11.2014 |
HR |
Službeni list Europske unije |
L 331/22 |
PROVEDBENA UREDBA KOMISIJE (EU) br. 1231/2014
оd 17. studenoga 2014.
o utvrđivanju paušalnih uvoznih vrijednosti za određivanje ulazne cijene određenog voća i povrća
EUROPSKA KOMISIJA,
uzimajući u obzir Ugovor o funkcioniranju Europske unije,
uzimajući u obzir Uredbu (EU) br. 1308/2013 Europskog parlamenta i Vijeća od 17. prosinca 2013. o uspostavljanju zajedničke organizacije tržišta poljoprivrednih proizvoda i stavljanju izvan snage uredbi Vijeća (EEZ) br. 922/72, (EEZ) br. 234/79, (EZ) br. 1037/2001 i (EZ) br. 1234/2007 (1),
uzimajući u obzir Provedbenu uredbu Komisije (EU) br. 543/2011 od 7. lipnja 2011. o utvrđivanju detaljnih pravila za primjenu Uredbe Vijeća (EZ) br. 1234/2007 za sektore voća i povrća te prerađevina voća i povrća (2), a posebno njezin članak 136. stavak 1.,
budući da:
|
(1) |
Provedbenom uredbom (EU) br. 543/2011, prema ishodu Urugvajske runde multilateralnih pregovora o trgovini, utvrđuju se kriteriji kojima Komisija određuje paušalne vrijednosti za uvoz iz trećih zemalja, za proizvode i razdoblja određena u njezinu Prilogu XVI. dijelu A. |
|
(2) |
Paušalna uvozna vrijednost izračunava se za svaki radni dan, u skladu s člankom 136. stavkom 1. Provedbene uredbe (EU) br. 543/2011, uzimajući u obzir promjenjive dnevne podatke. Stoga ova Uredba treba stupiti na snagu na dan objave u Službenom listu Europske unije, |
DONIJELA JE OVU UREDBU:
Članak 1.
Paušalne uvozne vrijednosti iz članka 136. Provedbene uredbe (EU) br. 543/2011 određene su u Prilogu ovoj Uredbi.
Članak 2.
Ova Uredba stupa na snagu na dan objave u Službenom listu Europske unije.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 17. studenoga 2014.
Za Komisiju,
u ime predsjednika,
Jerzy PLEWA
Glavni direktor za poljoprivredu i ruralni razvoj
(1) SL L 347, 20.12.2013., str. 671.
(2) SL L 157, 15.6.2011., str. 1.
PRILOG
Paušalne uvozne vrijednosti za određivanje ulazne cijene određenog voća i povrća
|
(EUR/100 kg) |
||
|
Oznaka KN |
Oznaka treće zemlje (1) |
Standardna uvozna vrijednost |
|
0702 00 00 |
AL |
94,9 |
|
MA |
77,1 |
|
|
MK |
78,8 |
|
|
ZZ |
83,6 |
|
|
0707 00 05 |
AL |
67,4 |
|
JO |
194,1 |
|
|
TR |
128,5 |
|
|
ZZ |
130,0 |
|
|
0709 93 10 |
AL |
65,0 |
|
MA |
52,3 |
|
|
TR |
125,4 |
|
|
ZZ |
80,9 |
|
|
0805 20 10 |
MA |
130,6 |
|
ZZ |
130,6 |
|
|
0805 20 30, 0805 20 50, 0805 20 70, 0805 20 90 |
TR |
74,4 |
|
ZZ |
74,4 |
|
|
0805 50 10 |
TR |
78,7 |
|
ZZ |
78,7 |
|
|
0806 10 10 |
BR |
293,5 |
|
LB |
337,2 |
|
|
PE |
282,9 |
|
|
TR |
149,1 |
|
|
US |
303,0 |
|
|
ZZ |
273,1 |
|
|
0808 10 80 |
BR |
54,0 |
|
CA |
135,3 |
|
|
CL |
80,6 |
|
|
MD |
29,7 |
|
|
NZ |
144,2 |
|
|
US |
102,4 |
|
|
ZA |
108,6 |
|
|
ZZ |
93,5 |
|
|
0808 30 90 |
CN |
75,6 |
|
ZZ |
75,6 |
|
(1) Nomenklatura država utvrđena Uredbom Komisije (EU) br. 1106/2012 od 27. studenoga 2012. o provedbi Uredbe (EZ) br. 471/2009 Europskog parlamenta i Vijeća o statistici Zajednice u vezi s vanjskom trgovinom sa zemljama nečlanicama, u pogledu ažuriranja nomenklature država i područja (SL L 328, 28.11.2012., str. 7.). Oznakom „ZZ” označava se „drugo podrijetlo”.
ODLUKE
|
18.11.2014 |
HR |
Službeni list Europske unije |
L 331/24 |
ODLUKA VIJEĆA 2014/800/ZVSP
od 17. studenoga 2014.
o pokretanju savjetodavne misije Europske unije za reformu sektora civilne sigurnosti u Ukrajini (EUAM Ukraine) i o izmjeni Odluke 2014/486/ZVSP
VIJEĆE EUROPSKE UNIJE,
uzimajući u obzir Ugovor o Europskoj uniji, a posebno njegov članak 28., članak 42. stavak 4. i članak 43. stavak 2.,
uzimajući u obzir Odluku Vijeća 2014/486/ZVSP od 22. srpnja 2014. o savjetodavnoj misiji Europske unije za reformu sektora civilne sigurnosti u Ukrajini (EUAM Ukraine) (1), a posebno njezin članak 4.,
uzimajući u obzir prijedlog Visokog predstavnika Unije za vanjske poslove i sigurnosnu politiku,
budući da:
|
(1) |
Vijeće je 22. srpnja 2014. donijelo Odluku 2014/486/ZVSP. |
|
(2) |
Vijeće je 20. listopada 2014. odobrilo plan operacije za misiju EUAM Ukraine. |
|
(3) |
Slijedom preporuke zapovjednika civilne operacije i nakon što je misija EUAM Ukraine dosegnula početnu operativnu sposobnost, misiju EUAM Ukraine trebalo bi pokrenuti 1. prosinca 2014. |
|
(4) |
Odlukom 2014/486/ZVSP predviđen je financijski referentni iznos od 2 680 000 EUR za razdoblje do 30. studenoga 2014. Trebalo bi osigurati novi financijski referentni iznos za razdoblje od 12 mjeseci s početkom od 1. prosinca 2014. Stoga bi trebalo izmijeniti Odluku 2014/486/ZVSP. |
|
(5) |
Misija EUAM Ukraine provodit će se u kontekstu stanja koje se može pogoršati i koje bi moglo ugroziti ostvarenje ciljeva vanjskog djelovanja Unije kako su određeni u članku 21. Ugovora, |
DONIJELO JE OVU ODLUKU:
Članak 1.
Savjetodavna misija Europske unije za reformu sektora civilne sigurnosti u Ukrajini (EUAM Ukraine) pokreće se 1. prosinca 2014.
Članak 2.
Zapovjednika civilne operacije za misiju EUAM Ukraine ovlašćuje se za početak izvođenja operacije s trenutačnim učinkom.
Članak 3.
Članak 14. stavak 1. Odluke 2014/486/ZVSP zamjenjuje se sljedećim:
„1. Financijski referentni iznos namijenjen pokrivanju rashoda povezanih s misijom EUAM Ukraine do 30. studenoga 2014. iznosi 2 680 000 EUR. Financijski referentni iznos namijenjen pokrivanju rashoda povezanih s misijom EUAM Ukraine za razdoblje od 1. prosinca 2014. do 30. studenoga 2015. iznosi 13 100 000 EUR. Vijeće odlučuje o financijskom referentnom iznosu za sljedeća razdoblja.”
Članak 4.
Ova Odluka stupa na snagu na dan donošenja.
Sastavljeno u Bruxellesu 17. studenoga 2014.
Za Vijeće
Predsjednica
F. MOGHERINI
(1) SL L 217, 23.7.2014., str. 42.
|
18.11.2014 |
HR |
Službeni list Europske unije |
L 331/26 |
ODLUKA VIJEĆA 2014/801/ZVSP
od 17. studenoga 2014.
o izmjeni Odluke 2014/145/ZVSP o mjerama ograničavanja s obzirom na djelovanja kojima se podrivaju ili ugrožavaju teritorijalna cjelovitost, suverenitet i neovisnost Ukrajine
VIJEĆE EUROPSKE UNIJE,
uzimajući u obzir Ugovor o Europskoj uniji, a posebno njegov članak 29.,
budući da:
|
(1) |
Vijeće je 17. ožujka 2014. donijelo Odluku 2014/145/ZVSP (1). |
|
(2) |
Trebalo bi izmijeniti podatke o jednoj osobi navedenoj u Odluci 2014/145/ZVSP. |
|
(3) |
Prilog Odluci 2014/145/ZVSP trebalo bi stoga na odgovarajući način izmijeniti, |
DONIJELO JE OVU ODLUKU:
Članak 1.
Prilog Odluci 2014/145/ZVSP mijenja se kako je navedeno u prilogu ovoj Odluci.
Članak 2.
Ova Odluka stupa na snagu sljedećeg dana od dana objave u Službenom listu Europske unije.
Sastavljeno u Bruxellesu 17. studenoga 2014.
Za Vijeće
Predsjednica
F. MOGHERINI
(1) Odluka Vijeća 2014/145/ZVSP od 17. ožujka 2014. o mjerama ograničavanja s obzirom na djelovanja kojima se podrivaju ili ugrožavaju teritorijalna cjelovitost, suverenitet i neovisnost Ukrajine (SL L 78, 17.3.2014., str. 16.).
PRILOG
Unos za sljedeću osobu naveden u prilogu Odluci 2014/145/ZVSP zamjenjuje se dolje navedenim unosom.
|
|
Ime |
Identifikacijski podaci |
Obrazloženje |
Datum uvrštenja |
|
|
Vladimir Volfovich ZHIRINOVSKY Владимир Вольфович Жириновский |
Rođen 25.4.1946. u Almatyju (ranije poznatom kao Alma Ata), Kazakstan. |
Član Vijeća državne Dume; vođa stranke LDPR. Aktivno je podržavao upotrebu ruskih oružanih snaga u Ukrajini i pripajanje Krima. Aktivno je pozivao na podjelu Ukrajine. U ime stranke LDPR, na čijem je čelu, potpisao je sporazum s tzv. „Narodnom Republikom Donjetsk”. |
12.9.2014. |
|
18.11.2014 |
HR |
Službeni list Europske unije |
L 331/28 |
PROVEDBENA ODLUKA KOMISIJE
оd 14. studenoga 2014.
o izmjeni odluka 2010/470/EU i 2010/472/EU u odnosu na uvjete zdravlja životinja u pogledu grebeža ovaca za trgovinu unutar Unije i uvoz u Uniju zametaka ovaca i koza
(priopćeno pod brojem dokumenta C(2014) 8339)
(Tekst značajan za EGP)
(2014/802/EU)
EUROPSKA KOMISIJA,
uzimajući u obzir Ugovor o funkcioniranju Europske unije,
uzimajući u obzir Direktivu Vijeća 92/65/EEZ od 13. srpnja 1992. o utvrđivanju uvjeta zdravlja životinja kojima se uređuje trgovina i uvoz u Zajednicu životinja, sjemena, jajnih stanica i zametaka koji ne podliježu uvjetima zdravlja životinja utvrđenima u određenim propisima Zajednice iz dijela I. Priloga A Direktivi 90/425/EEZ (1), a posebno njezin članak 11. stavak 3. treću alineju, članak 17. stavak 2. točku (b), članak 18. stavak 1. prvu alineju te članak 19. točku (b) i uvodnu rečenicu,
budući da:
|
(1) |
U dijelu A Priloga IV. Odluci Komisije 2010/470/EU (2) utvrđen je obrazac zdravstvenog certifikata za trgovinu unutar Unije pošiljkama jajnih stanica i zametaka ovaca i koza sakupljenih ili proizvedenih nakon 31. kolovoza 2010. |
|
(2) |
U dijelu 2. Priloga IV. Odluci Komisije 2010/472/EU (3) utvrđen je obrazac zdravstvenog certifikata za uvoz u Uniju pošiljaka jajnih stanica i zametaka ovaca i koza. |
|
(3) |
Uredbom (EZ) br. 999/2001 Europskog parlamenta i Vijeća (4) utvrđuju se pravila za sprečavanje, kontrolu i iskorjenjivanje određenih transmisivnih spongiformnih encefalopatija (TSE) kod goveda, ovaca i koza. Poglavljem A Priloga VIII. toj Uredbi utvrđuju se uvjeti za trgovinu živim životinjama, sjemenom i zamecima unutar Unije. Osim toga, Prilogom IX. toj Uredbi utvrđuju se uvjeti za uvoz u Uniju živih životinja, zametaka, jajnih stanica i proizvoda životinjskog podrijetla iz trećih zemalja. |
|
(4) |
U svjetlu novih znanstvenih dokaza, Uredba (EZ) br. 999/2001 izmijenjena je Uredbom Komisije (EU) br. 630/2013 (5). Te izmjene, u pogledu grebeža ovaca, odražava Provedbena odluka Komisije 2013/470/EU (6) u obrascu zdravstvenog certifikata za trgovinu unutar Unije pošiljkama jajnih stanica i zametaka ovaca i koza utvrđenom u dijelu A Priloga IV. Odluci 2010/470/EU te u obrascu zdravstvenog certifikata za uvoz u Uniju pošiljaka jajnih stanica i zametaka ovaca i koza utvrđenom u dijelu 2. Priloga IV. Odluci 2010/472/EU, uz prijelazno razdoblje do 31. prosinca 2014. |
|
(5) |
U skladu sa znanstvenim mišljenjem Europske agencije za sigurnost hrane (EFSA) o riziku prijenosa klasičnog grebeža putem prijenosa zametaka dobivenih in vivo kod ovaca koje je doneseno 24. siječnja 2013. i u kojemu je zaključeno da se opasnost od prijenosa klasičnog grebeža ovaca implantacijom ovčjih homozigotnih ili heterozigotnih ARR zametaka može smatrati zanemarivom, pod uvjetom da se poštuju preporuke i postupci OIE-a koji se odnose na prijenos zametaka, odgovarajuće su odredbe Uredbe (EZ) br. 999/2001 izmijenjene Uredbom Komisije (EU) br. 1148/2014 (7). |
|
(6) |
Obrazac zdravstvenog certifikata za trgovinu unutar Unije pošiljkama jajnih stanica i zametaka ovaca i koza iz dijela A Priloga IV. Odluci 2010/470/EU te obrazac zdravstvenog certifikata za uvoz u Uniju pošiljaka jajnih stanica i zametaka ovaca i koza iz dijela 2. Priloga IV. Odluci 2010/472/EU potrebno je stoga izmijeniti kako bi se uzeli u obzir uvjeti utvrđeni u Uredbi (EZ) br. 999/2001, kako je izmijenjena Uredbom (EU) br. 1148/2014. |
|
(7) |
Uz to, potrebno je izmijeniti određena upućivanja na Uredbu (EZ) br. 999/2001 u obrascu zdravstvenog certifikata za trgovinu unutar Unije pošiljkama jajnih stanica i zametaka ovaca i koza utvrđenom u dijelu A Priloga IV. Odluci 2010/470/EU kako bi se uklonila svaka dvosmislenost. |
|
(8) |
Nadalje, u obrascu zdravstvenog certifikata za uvoz u Uniju pošiljaka jajnih stanica i zametaka ovaca i koza utvrđenom u dijelu 2. Priloga IV. Odluci 2010/472/EU potrebna je preciznija terminologija kako bi se osiguralo da je jasno da se režimi testiranja koji se odnose na epizootske hemoragijske bolesti (EHD) primjenjuju na ženke donore vrsta ovaca i koza. |
|
(9) |
Odluke 2010/470/EU i 2010/472/EU potrebno je stoga na odgovarajući način izmijeniti. |
|
(10) |
Mjere predviđene ovom Odlukom u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU ODLUKU:
Članak 1.
Prilog IV. Odluci 2010/470/EU izmjenjuje se u skladu s Prilogom I. ovoj Odluci.
Članak 2.
Prilog IV. Odluci 2010/472/EU izmjenjuje se u skladu s Prilogom II. ovoj Odluci.
Članak 3.
Ova se Odluka primjenjuje od 1. siječnja 2015.
Članak 4.
Ova je Odluka upućena državama članicama.
Sastavljeno u Bruxellesu 14. studenoga 2014.
Za Komisiju
Vytenis ANDRIUKAITIS
Član Komisije
(1) SL L 268, 14.9.1992., str. 54.
(2) Odluka Komisije 2010/470/EU od 26. kolovoza 2010. o obrascima zdravstvenih certifikata za trgovinu unutar Unije sjemenom, jajnim stanicama i zamecima kopitara, ovaca i koza te jajnim stanicama i zamecima svinja (SL L 228, 31.8.2010., str. 15.).
(3) Odluka Komisije 2010/472/EU od 26. kolovoza 2010. o uvozu sjemena, jajnih stanica i zametaka ovaca i koza u Uniju (SL L 228, 31.8.2010., str. 74.).
(4) Uredba (EZ) br. 999/2001 Europskog parlamenta i Vijeća od 22. svibnja 2001. o utvrđivanju pravila za sprečavanje, kontrolu i iskorjenjivanje određenih transmisivnih spongiformnih encefalopatija (SL L 147, 31.5.2001., str. 1.).
(5) Uredba Komisije (EU) br. 630/2013 od 28. lipnja 2013. o izmjeni priloga Uredbi (EZ) br. 999/2001 Europskog parlamenta i Vijeća o utvrđivanju pravila za sprečavanje, kontrolu i iskorjenjivanje određenih transmisivnih spongiformnih encefalopatija (SL L 179, 29.6.2013., str. 60.).
(6) Provedbena odluka Komisije 2013/470/EU оd 20. rujna 2013. o izmjeni odluka 2010/470/EU i 2010/472/EU o uvjetima zdravlja životinja u pogledu grebeža ovaca za trgovinu unutar Unije i uvoz u Uniju sjemena, jajnih stanica i zametaka ovaca i koza (SL L 252, 24.9.2013., str. 32.).
(7) Uredba Komisije (EU) br. 1148/2014 od 28. listopada 2014. o izmjeni priloga II., VII., VIII., IX. i X. Uredbi (EZ) br. 999/2001 Europskog parlamenta i Vijeća o utvrđivanju pravila za sprečavanje, kontrolu i iskorjenjivanje određenih transmisivnih spongiformnih encefalopatija (SL L 308, 29.10.2014., str. 66.).
PRILOG I.
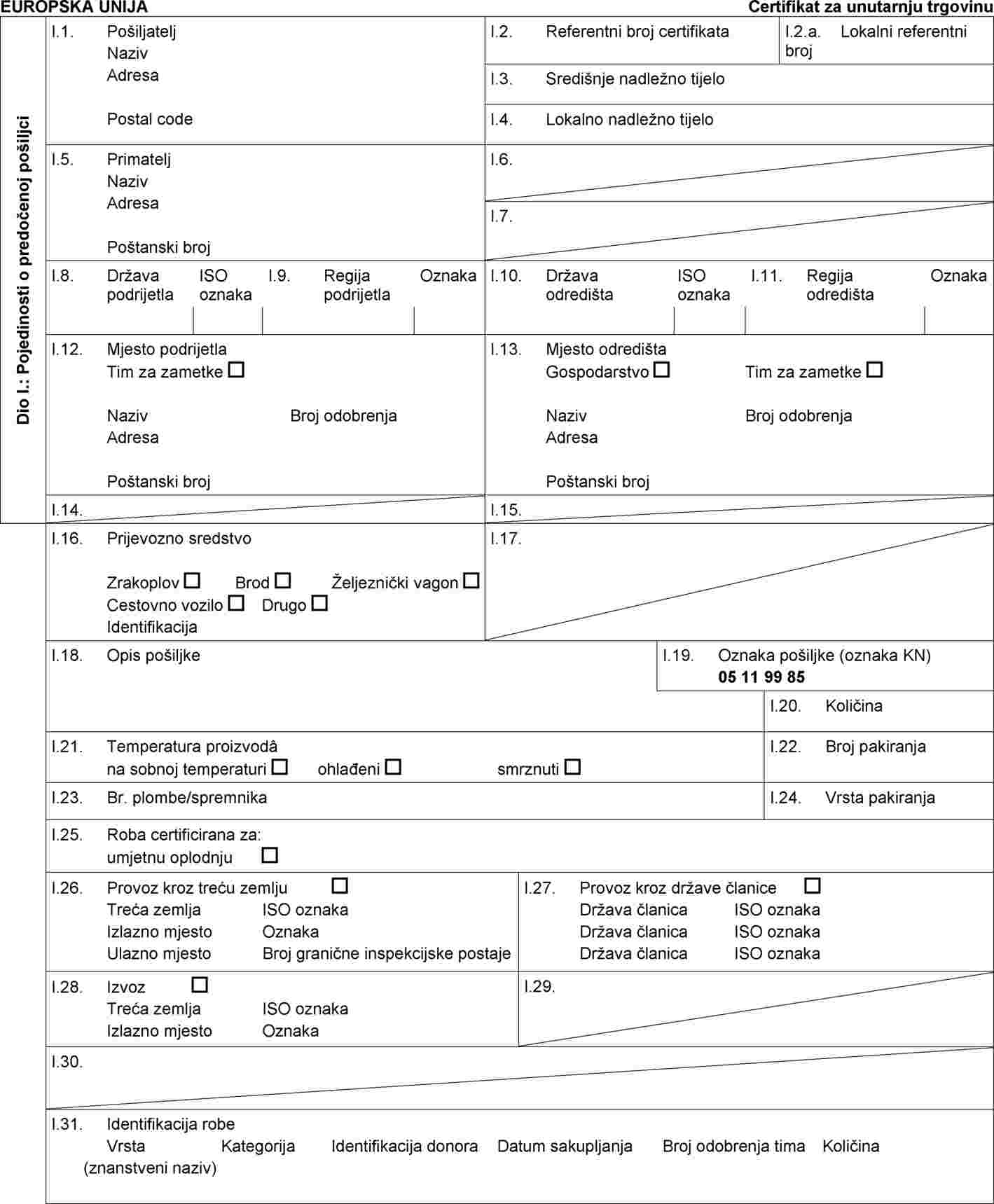
U Prilogu IV. Odluci 2010/470/EU dio A zamjenjuje se sljedećim:
„DIO A
Obrazac zdravstvenog certifikata IV.A za trgovinu unutar Unije pošiljkama jajnih stanica i zametaka ovaca i koza sakupljenih ili proizvedenih u skladu s Direktivom Vijeća 92/65/EEZ nakon 31. kolovoza 2010. i otpremljenih od strane odobrenog tima za sakupljanje ili proizvodnju zametaka od kojeg potječu jajne stanice ili zameci

 ”
”
PRILOG II.
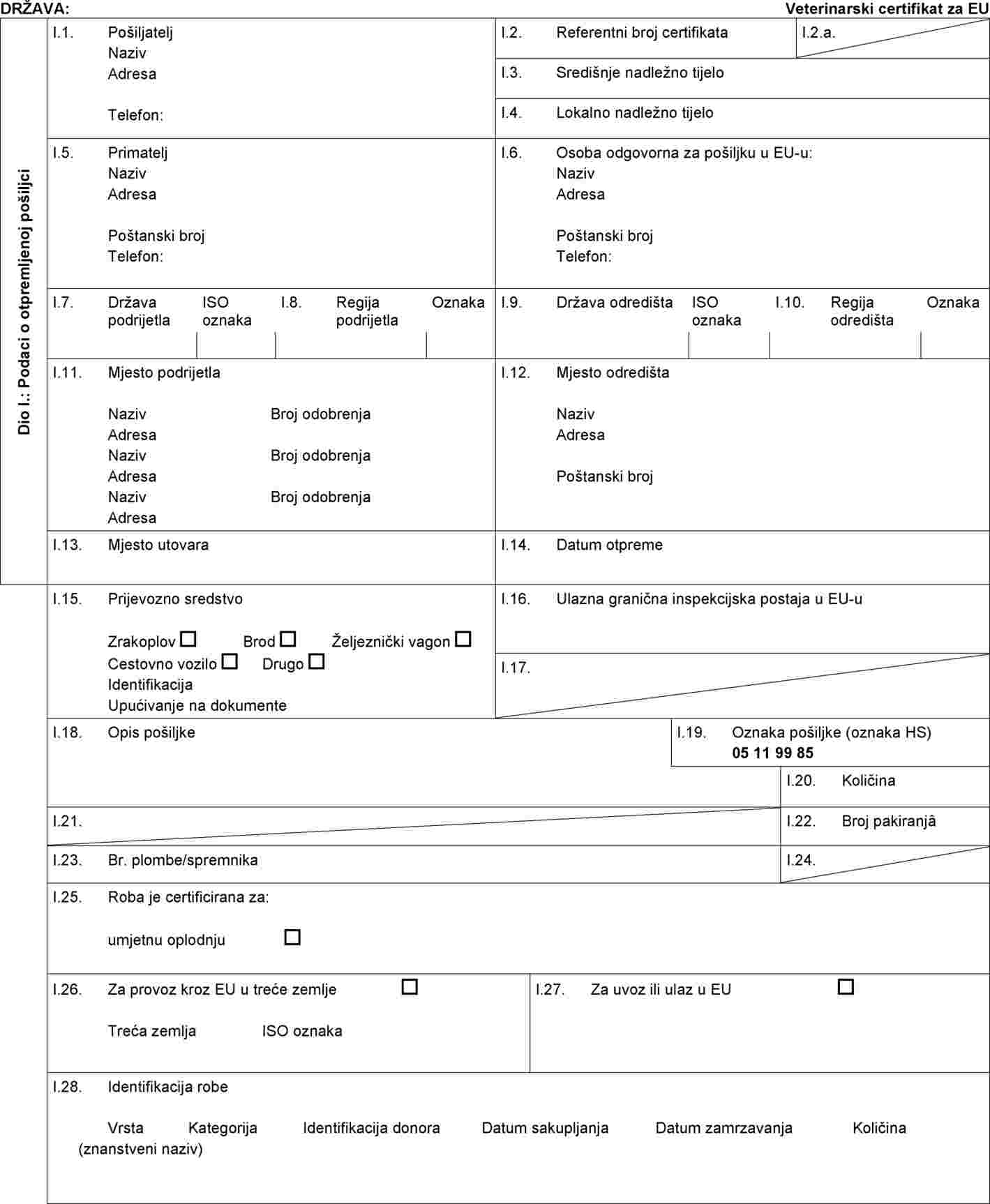
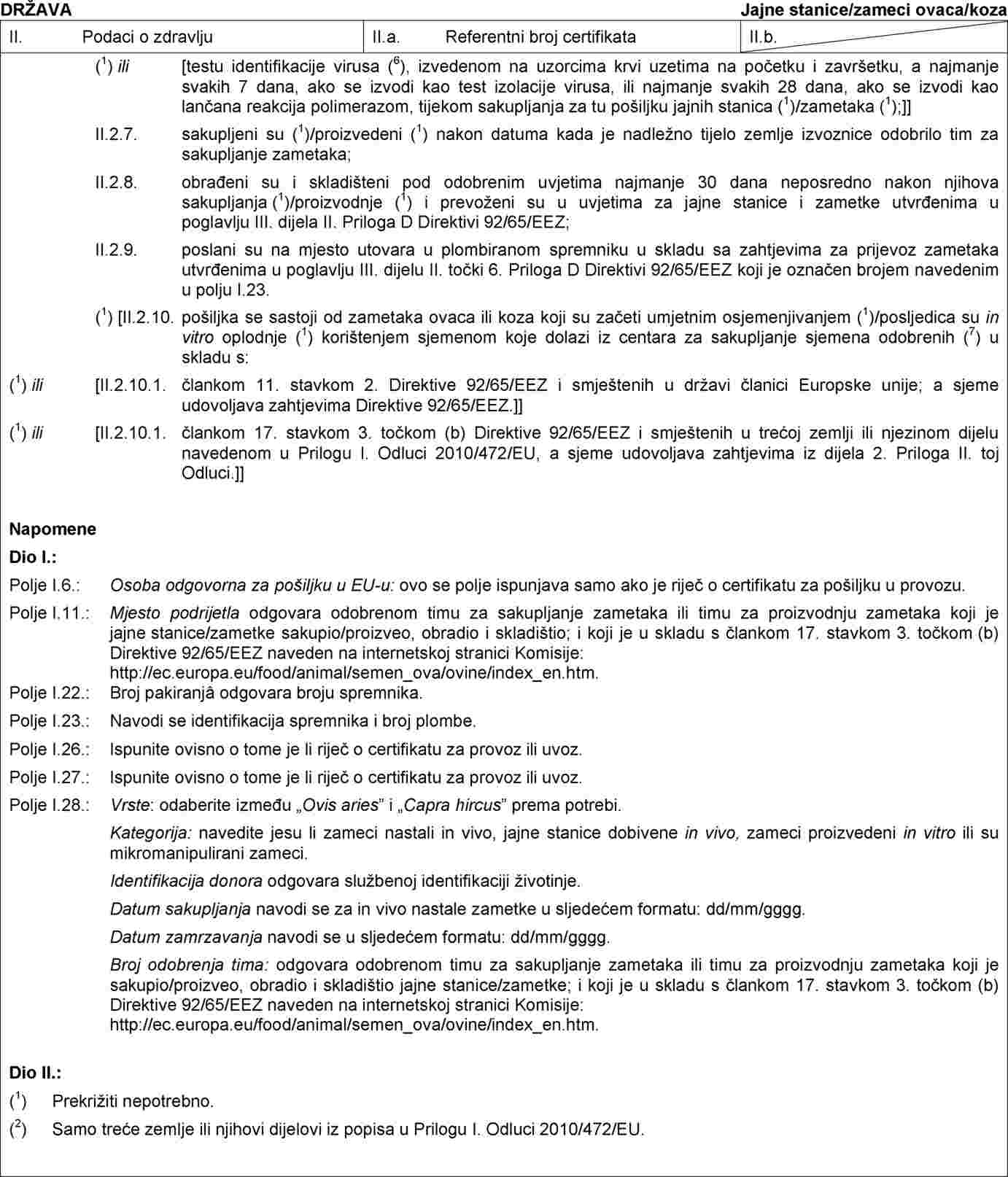
U Prilogu IV. Odluci 2010/472/EU dio 2. zamjenjuje se sljedećim:
„DIO 2.
Obrazac zdravstvenog certifikata za uvoz pošiljaka jajnih stanica i zametaka ovaca i koza


 ”
”
AKTI KOJE DONOSE TIJELA STVORENA MEĐUNARODNIM SPORAZUMIMA
|
18.11.2014 |
HR |
Službeni list Europske unije |
L 331/38 |
ODLUKA br. 1/2014 ZAJEDNIČKOG ODBORA EU-a I ŠVICARSKE
od 10. listopada 2014.
o određivanju slučajeva koji su izuzeti od prijenosa podataka iz članka 3. stavka 3. prvog podstavka Priloga I. Sporazumu od 25. lipnja 2009. između Europske zajednice i Švicarske Konfederacije o pojednostavnjenju inspekcija i formalnosti u odnosu na prijevoz roba i o carinskim sigurnosnim mjerama
(2014/803/EU)
ZAJEDNIČKI ODBOR,
uzimajući u obzir Sporazum od 25. lipnja 2009. između Europske zajednice i Švicarske Konfederacije o pojednostavnjenju inspekcija i formalnosti u odnosu na prijevoz roba i o carinskim sigurnosnim mjerama („Sporazum”), a posebno njegov članak 21. stavak 3. u vezi s člankom 3. stavkom 3. drugim podstavkom njegova Priloga I.,
budući da:
|
(1) |
Cilj je ovog Sporazuma održati pojednostavnjenje inspekcija i formalnosti u odnosu na prijevoz roba na granicama te neometani protok trgovine između dviju ugovornih stranaka, istodobno osiguravajući visoku razinu sigurnosti u opskrbnom lancu. |
|
(2) |
Ugovorne stranke obvezale su se na svojim državnim područjima jamčiti istovjetnu razinu sigurnosti putem mjera temeljenih na zakonodavstvu koje je na snazi u Europskoj uniji. |
|
(3) |
Kada roba koja se šalje u treću zemlju napušta carinsko područje ugovorne stranke kroz carinsko područje druge ugovorne stranke, nadležno tijelo prve ugovorne stranke, kojemu je podnesena izlazna skraćena deklaracija, prenosi sigurnosne podatke iz te deklaracije nadležnom tijelu druge ugovorne stranke. |
|
(4) |
Zajednički odbor može utvrditi slučajeve u kojima prijenos tih podataka nije potreban ako to ne utječe na razinu sigurnosti zajamčenu Sporazumom. |
|
(5) |
Države članice Europske unije i Švicarska Konfederacija ugovorne su stranke Čikaške konvencije o međunarodnom civilnom zrakoplovstvu; na temelju Priloga 17. Konvenciji, kako bi se međunarodno zrakoplovstvo zaštitilo od nezakonitog ometanja, zračni prijevoznici daju čitav teret zrakoplova na sigurnosnu kontrolu prije ukrcaja. |
|
(6) |
Europska zajednica i Švicarska Konfederacija obvezane su Sporazumom o zračnom prometu od 21. lipnja 1999. kojim se posebno uređuje zrakoplovna sigurnost i zaštita, |
ODLUČIO JE:
Članak 1.
Kad je riječ o izvozu robe na temelju članka 3. stavka 3. prvog podstavka Priloga I. Sporazumu, ne zahtijeva se prijenos podataka:
|
(a) |
ako je zračni prijevoznik prihvatio robu za prijevoz izvan carinskih područja ugovornih stranaka; |
|
(b) |
ako se izlaz robe kroz carinarnicu druge ugovorne stranke odvija zračnim putem; |
|
(c) |
ako je izlazna skraćena deklaracija ili carinska deklaracija o izvozu, koja udovoljava zahtjevima skraćene deklaracije, predana u carinarnici nadležnoj za mjesto odakle se roba izvozi; |
|
(d) |
kada roba stigne u carinarnicu na mjestu izlaska iz carinskog područja druge ugovorne stranke, prijevoznik daje toj carinarnici, na zahtjev, primjerak popratnog izvoznog dokumenta Unije ili bilo kakav drugi sličan dokument koji su izdala švicarska carinska tijela te koji sadrži sigurnosne podatke za izvezenu robu. |
Članak 2.
Ova Odluka stupa na snagu sljedećeg dana od dana njezina donošenja.
Sastavljeno u Vacallu 10. listopada 2014.
Za Zajednički odbor EU-a i Švicarske
Predsjednica
Michaela SCHÄRER-RICKENBACHER
Ispravci
|
18.11.2014 |
HR |
Službeni list Europske unije |
L 331/40 |
Ispravak Odluke Vijeća 2014/252/EU od 14. travnja 2014. o sklapanju Sporazuma između Europske unije i Republike Turske o ponovnom prihvatu osoba koje neovlašteno borave
( Službeni list Europske unije L 134 od 7. svibnja 2014. )
Stranica 1. uvodna izjava (3):
umjesto:
|
„(3) |
U skladu s člancima 1. i 2. Protokola (br. 21.) o stajalištu Ujedinjene Kraljevine i Irske u pogledu područja slobode, sigurnosti i pravde, koji je priložen Ugovoru o Europskoj uniji i Ugovoru o funkcioniranju Europske unije i ne dovodeći u pitanje članak 4. tog protokola, Ujedinjena Kraljevina ne sudjeluje u donošenju ove odluke, ona za nju nije obvezujuća niti se na nju primjenjuje.” |
treba stajati:
|
„(3) |
U skladu s člankom 3. Protokola (br. 21.) o stajalištu Ujedinjene Kraljevine i Irske u pogledu područja slobode, sigurnosti i pravde, koji je priložen Ugovoru o Europskoj uniji i Ugovoru o funkcioniranju Europske unije, Ujedinjena Kraljevina obavijestila je, pismom od 21. rujna 2012., da ne želi sudjelovati u donošenju i primjeni ove odluke.” |