Službeni list
Europske unije
1977-0588
doi:10.3002/19770588.2013.03.015.hrv

Hrvatsko izdanje
03. Poljoprivreda
Svezak 015
Posebno izdanje 2013.
|
Službeni list Europske unije |
1977-0588 doi:10.3002/19770588.2013.03.015.hrv |
|

Hrvatsko izdanje |
03. Poljoprivreda Svezak 015 Posebno izdanje 2013. |
|
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
1 |
|
/ |
SLUŽBENI LIST EUROPSKE UNIJE |
01.07.2013. |
Uvodna napomena
U skladu s člankom 52. Akta o uvjetima pristupanja Republike Hrvatske i prilagodbama Ugovora o Europskoj uniji, Ugovora o funkcioniranju Europske unije i Ugovora o osnivanju Europske zajednice za atomsku energiju, potpisanog 9. prosinca 2011., tekstovi akata institucija donesenih prije pristupanja koje su te institucije sastavile na hrvatskom jeziku od dana pristupanja vjerodostojni su pod istim uvjetima kao i tekstovi sastavljeni na sadašnjim službenim jezicima. Tim se člankom također predviđa da se tekstovi objavljuju u Službenom listu Europske unije ako su tekstovi na sadašnjim jezicima tako objavljeni.
U skladu s tim člankom objavljuje se posebno izdanje Službenog lista Europske unije na hrvatskom jeziku, koje sadržava tekstove obvezujućih općih akata. To izdanje obuhvaća akte usvojene u razdoblju od 1952. godine do dana pristupanja.
Objavljeni tekstovi podijeljeni su na 20 poglavlja koja slijede raspored iz Registra važećeg zakonodavstva Europske unije, i to:
|
01 |
Opća, financijska i institucionalna pitanja |
|
02 |
Carinska unija i slobodno kretanje robe |
|
03 |
Poljoprivreda |
|
04 |
Ribarstvo |
|
05 |
Sloboda kretanja radnika i socijalna politika |
|
06 |
Pravo poslovnog nastana i sloboda pružanja usluga |
|
07 |
Prometna politika |
|
08 |
Politika tržišnog natjecanja |
|
09 |
Porezi |
|
10 |
Ekonomska i monetarna politika i slobodno kretanje kapitala |
|
11 |
Vanjski odnosi |
|
12 |
Energetika |
|
13 |
Industrijska politika i unutarnje tržište |
|
14 |
Regionalna politika i koordinacija strukturnih instrumenata |
|
15 |
Okoliš, potrošači i zaštita zdravlja |
|
16 |
Znanost, informiranje, obrazovanje i kultura |
|
17 |
Pravo poduzećâ |
|
18 |
Zajednička vanjska i sigurnosna politika |
|
19 |
Područje slobode, sigurnosti i pravde |
|
20 |
Europa građana |
Spomenuti registar, koji vodi Ured za publikacije, dostupan je na internetu (eur-lex.europa.eu) na službenim jezicima Europske unije. Bibliografskoj bilješci svakog akta može se pristupiti putem registra, gdje se mogu pronaći upućivanja na posebno izdanje i na ostale analitičke metapodatke.
Akti objavljeni u posebnom izdanju, uz određene iznimke, objavljuju se u obliku u kojem su bili objavljeni u Službenom listu na izvornim službenim jezicima. Stoga pri uporabi posebnog izdanja treba uzeti u obzir naknadne izmjene, prilagodbe ili odstupanja koje su usvojile institucije, Europska središnja banka ili su predviđene u Aktu o pristupanju.
Iznimno, kad se opsežni tehnički prilozi poslije zamijene novim prilozima, navodi se samo upućivanje na posljednji akt koji zamjenjuje prilog. Takav je slučaj u pojedinim aktima koji sadržavaju popise carinskih oznaka (poglavlje 02), aktima o prijevozu opasnih tvari, aktima o pakiranju i označivanju tih tvari (poglavlja 07 i 13) te nekima od protokola i priloga Sporazumu o Europskom gospodarskom prostoru.
Također, Pravilnik o osoblju objavljuje se kao pročišćeni tekst koji obuhvaća sve izmjene do kraja 2012. godine. Daljnje izmjene objavljuju se u izvornom obliku.
Posebno izdanje sadržava dva sustava numeracije stranica:
|
i. |
izvorna numeracija stranica, zajedno s datumom objave francuskog, talijanskog, njemačkog i nizozemskog izdanja Službenog lista, engleskog i danskog izdanja od 1. siječnja 1973., grčkog izdanja od 1. siječnja 1981., španjolskog i portugalskog izdanja od 1. siječnja 1986., finskog i švedskog izdanja od 1. siječnja 1995., češkog, estonskog, latvijskog, litavskog, mađarskog, malteškog, poljskog, slovačkog i slovenskog izdanja od 1. svibnja 2004. te bugarskog i rumunjskog izdanja od 1. siječnja 2007. U numeraciji stranica postoje praznine jer svi akti objavljeni u to vrijeme nisu objavljeni u posebnom izdanju. Kada se prilikom citiranja akata upućuje na Službeni list, potrebno je navesti stranicu sukladno izvornoj numeraciji; |
|
ii. |
numeracija stranica posebnog izdanja neprekinuta je i ne smije se navoditi prilikom citiranja akata. |
Do lipnja 1967. numeracija stranica u Službenom listu počinjala je iznova svake godine. Od tada nadalje svaki broj Službenog lista počinje na prvoj stranici.
Od 1. siječnja 1968. Službeni list podijeljen je na dva dijela:
|
— |
Zakonodavstvo („L”), |
|
— |
Informacije i objave („C”). |
Od 1. veljače 2003. prijašnje ime „Službeni list Europskih zajednica” promijenjeno je, na temelju Ugovora iz Nice, u „Službeni list Europske unije”.
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
3 |
32001R0999
|
L 147/1 |
SLUŽBENI LIST EUROPSKE UNIJE |
22.05.2001. |
UREDBA (EZ) br. 999/2001 EUROPSKOG PARLAMENTA I VIJEĆA
od 22. svibnja 2001.
o utvrđivanju pravila za sprečavanje, kontrolu i iskorjenjivanje određenih transmisivnih spongiformnih encefalopatija
EUROPSKI PARLAMENT I VIJEĆE EUROPSKE UNIJE,
uzimajući u obzir Ugovor o osnivanju Europske zajednice, a posebno njegov članak 152. stavak 4. točku (b),
uzimajući u obzir prijedlog Komisije (1),
uzimajući u obzir mišljenje Gospodarskog i socijalnog odbora (2),
nakon savjetovanja s Odborom regija,
djelujući u skladu s postupkom utvrđenim u članku 251. Ugovora (3),
budući da:
|
(1) |
Otkriveno je kako se nekoliko različitih oblika transmisivnih spongiformnih encefalopatija (TSE) već niz godina pojavljuje odvojeno kod ljudi i životinja. Goveđa spongiformna encefalopatija (GSE) prvi je put otkrivena kod goveda 1986. a u godinama nakon toga utvrđeno je kako se pojavljuje i kod drugih vrsta životinja. Nova varijanta Creutzfeldt-Jakobove bolesti (CJB) opisana je 1996. Sve je veći broj dokaza o sličnosti između uzročnika GSE-a i nove varijante Creutzfeldt-Jakobove bolesti. |
|
(2) |
Od 1990. godine Zajednica je donijela niz mjera kojima se štiti zdravlje ljudi i životinja od opasnosti od GSE-a. Te se mjere zasnivaju na zaštitnim odredbama Direktiva o mjerama koje se poduzimaju u vezi sa zdravljem životinja. U svjetlu veličine opasnosti koju određeni oblici TSE predstavljaju za zdravlje ljudi i životinja, potrebno je donijeti posebna pravila za njihovo sprečavanje, kontrolu i iskorjenjivanje. |
|
(3) |
Ova Uredba izravno se odnosi na javno zdravstvo te je mjerodavna za funkcioniranje unutarnjeg tržišta. Ona obuhvaća proizvode koji su uključeni u Prilog I. Ugovoru kao i proizvode koji to nisu. Stoga je prikladno odabrati članak 152. stavak 4. točku (b) Ugovora kao pravnu osnovu. |
|
(4) |
Komisija je prikupila znanstvena mišljenja, posebno od strane Znanstvenoga nadzornog odbora i Znanstvenog odbora za veterinarske mjere, koje se odnose na javno zdravstvo, a u vezi s nekoliko vidova TSE-a. Ta mišljenja uključuju savjete o mjerama za smanjivanje potencijalne opasnosti za ljude i životinje zbog izlaganja zaraženim proizvodima životinjskog podrijetla. |
|
(5) |
Ova se pravila trebaju primjenjivati na proizvodnju i stavljanje na tržište živih životinja i proizvoda životinjskog podrijetla. Međutim, nije nužno da se primjenjuju na kozmetičke ili medicinske proizvode, medicinski pribor ili njihove sirovine ili intermedijarne proizvode na koje se primjenjuju ostala posebna pravila, posebno ona koja se odnose na neuporabu specificiranog rizičnog materijala. Niti bi se trebala primjenjivati na proizvode životinjskog podrijetla koji ne predstavljaju opasnost po zdravlje životinja ili ljudi, budući da su namijenjeni za druge svrhe, a ne za proizvodnju hrane namijenjene ljudima, hrane za životinje ili za proizvodnju umjetnih gnojiva. Prikladno je osigurati da proizvodi životinjskog podrijetla koji nisu obuhvaćeni ovom Uredbom, budu odvojeni od onih proizvoda koji njome jesu obuhvaćeni, osim kada zadovoljavaju barem jednake zdravstvene standarde kao i potonji. |
|
(6) |
Potrebno je predvidjeti sigurnosne mjere koje Komisija poduzima kada nadležna tijela države članice ili treće zemlje nisu na odgovarajući način pristupile uklanjanju opasnosti od TSE-a. |
|
(7) |
Potrebno je uspostaviti postupak utvrđivanja epidemiološkog statusa države članice, treće zemlje i neke od njihovih regija, dalje u tekstu „države ili regije”, kad je riječ o GSE-u, na temelju vjerojatnosti širenja i opasnosti od izloženosti ljudi toj bolesti, koristeći raspoložive informacije. Države članice i treće zemlje koje odluče ne prijaviti se za postupak utvrđivanja svoga epidemiološkog statusa, Komisija treba razvrstati u jednu od kategorija na temelju svih informacija kojima ona raspolaže. |
|
(8) |
Države članice trebaju uspostaviti obrazovne programe za osobe koje sudjeluju u sprečavanju i kontroli raznih oblika TSE-a, kao i za veterinare, poljoprivrednike i radnike koji su uključeni u prijevoz, stavljanje na tržište i klanje domaćih životinja. |
|
(9) |
Države članice trebaju provoditi godišnji program praćenja GSE-a i grebeži ovaca, te trebaju izvijestiti Komisiju i ostale države članice o rezultatima i pojavi bilo kojeg drugog oblika TSE-a. |
|
(10) |
Pojedina tkiva preživača potrebno je odrediti kao specificirani rizični materijal na temelju patogeneze različitih oblika TSE-a, te epidemiološkog statusa države ili regije podrijetla ili boravišta predmetne životinje. Specificirani rizični materijal je potrebno odstraniti i ukloniti na način koji neće predstavljati nikakvu opasnost po zdravlje ljudi ili životinja. Takav materijal posebno ne smije biti stavljen na tržište za uporabu u proizvodnji hrane namijenjene ljudima, hrane za životinje ili umjetnih gnojiva. Međutim, potrebno je predvidjeti jednakovrijednu razinu zdravstvene zaštite pomoću screening metode testiranja na TSE koja se provodi pojedinačno na životinjama čim je u potpunosti potvrđena. Tehnike klanja koje predstavljaju opasnost da bi moždano tkivo moglo zaraziti ostala tkiva ne bi smjele biti dopuštene u državama ili regijama osim onih u kojima je opasnost od GSE-a najmanja. |
|
(11) |
Potrebno je poduzeti mjere za sprečavanje prenošenja različitih oblika TSE-a na ljude ili životinje putem zabrane hranjenja pojedinih kategorija životinja određenim kategorijama životinjskih bjelančevina, te zabranom uporabe pojedinih tkiva preživača u hrani. Ove zabrane trebaju biti razmjerne potencijalnoj opasnosti. |
|
(12) |
Sumnju na prisutnost bilo kojeg oblika TSE-a kod bilo koje životinje potrebno je prijaviti nadležnim tijelima, koja bi trebala odmah poduzeti sve odgovarajuće mjere, uključujući stavljanje sumnjive životinje pod režim ograničenog premještanja u iščekivanju rezultata istrage, ili klanje sumnjive životinje pod službenim nadzorom. Ako nadležno tijelo ne može isključiti mogućnost prisutnosti jednog od oblika TSE-a, ono bi trebalo provesti odgovarajuća ispitivanja, te čuvati trupla pod službenim nadzorom sve dok se ne utvrdi dijagnoza. |
|
(13) |
Kod službene potvrde prisutnosti jednog oblika TSE-a, nadležno tijelo treba poduzeti sve nužne mjere, uključujući uništavanje trupala i provođenje istrage kako bi se utvrdile sve životinje koje su u opasnosti, te stavljanje svih životinja i proizvoda životinjskog podrijetla za koje se utvrdi da su u opasnosti pod režim ograničenog premještanja. Vlasnicima treba u najkraćem mogućem roku isplatiti naknadu za gubitak životinja i proizvoda životinjskog podrijetla koji su uništeni u skladu s ovom Uredbom. |
|
(14) |
Države članice trebaju izraditi krizne planove koji sadrže mjere koje se poduzimaju na nacionalnoj razini kod izbijanja GSE-a. Takve planove treba odobriti Komisija. Potrebno je predvidjeti proširenje ove odredbe i na druge oblike TSE-a osim GSE-a. |
|
(15) |
Potrebno je donijeti odredbe o stavljanju na tržište određenih živih životinja i proizvoda životinjskog podrijetla. Postojeća pravila Zajednice o identifikaciji i registraciji goveda osiguravaju sustav kojim se omogućuje praćenje podrijetla životinja sve do ženke i stada podrijetla u skladu s međunarodnim normama. Jednakovrijedna jamstva potrebno je pružiti za goveda koja se uvoze iz trećih zemalja. Životinje i proizvode životinjskog podrijetla koji su obuhvaćeni pravilima Zajednice, koji ulaze u trgovinu unutar Zajednice ili se uvoze iz trećih zemalja, trebaju biti popraćene certifikatima prema gore navedenim pravilima koje su prema potrebi dopunjene u skladu s ovom Uredbom. |
|
(16) |
Potrebno je zabraniti stavljanje na tržište pojedinih proizvoda životinjskog podrijetla dobivenih od goveda iz regija visokog rizika. Međutim, ta se zabrana ne bi trebala primjenjivati na određene proizvode životinjskog podrijetla koji su proizvedeni pod kontroliranim uvjetima od životinja za koje se može dokazati da ne predstavljaju veliku opasnost zaraze TSE-om. |
|
(17) |
Kako bi se osiguralo poštovanje pravila koja se odnose na sprečavanje, kontrolu i iskorjenjivanje raznih oblika TSE-a, nužno je uzeti uzorke za laboratorijske pretrage na temelju utvrđenog protokola koji bi mogli dati cjelokupnu epidemiološku sliku situacije kada je riječ o TSE. Kako bi se zajamčili ujednačeni postupci i rezultati pretraga, potrebno je uspostaviti nacionalne referentne laboratorije i referentne laboratorije Zajednice kao i pouzdane znanstvene metode, uključujući brze testove, posebno na prisutnost raznih oblika TSE-a. Brze testove trebalo bi koristi što je više moguće. |
|
(18) |
Inspekcijski pregledi Zajednice trebaju se provoditi u državama članicama kako bi se osigurala ujednačena provedba zahtjeva koji se odnose na sprečavanje, kontrolu i iskorjenjivanje raznih oblika TSE-a, a također je potrebno predvidjeti provedbu postupaka revizije. Kako bi se osiguralo da treće zemlje prigodom uvoza živih životinja i proizvoda životinjskog podrijetla u Zajednicu pružaju jamstva jednakovrijedna onima koja primjenjuje Zajednica, potrebno je na licu mjesta provoditi inspekcijske preglede i revizije Zajednice s ciljem potvrđivanja da treće zemlje izvoznice ispunjavaju uvjete za uvoz. |
|
(19) |
Trgovačke mjere za razne oblike TSE-a trebale bi se zasnivati na međunarodnim normama, smjernicama ili preporukama, ako one postoje. Međutim, mogu se donijeti znanstveno opravdane mjere koje će imati za posljedicu višu razinu zdravstvene zaštite, ako mjere koje se zasnivaju na mjerodavnim međunarodnim normama, smjernicama ili preporukama ne postignu odgovarajuću razinu zdravstvene zaštite. |
|
(20) |
Ovu Uredbu potrebno je ponovno preispitati nakon što nove znanstvene informacije postanu dostupne. |
|
(21) |
U okviru ove Uredbe potrebno je osigurati nužne prijelazne mjere, posebno kada je riječ o reguliranju uporabe specificiranog rizičnog materijala. |
|
(22) |
Mjere nužne za provedbu ove Uredbe donose se u skladu s Odlukom Vijeća 1999/468/EZ od 28. lipnja 1999. o utvrđivanju postupaka za izvršavanje provedbenih ovlasti dodijeljenih Komisiji (4). |
|
(23) |
Kako bi se provela ova Uredba, potrebno je propisati postupke kojima se uspostavlja bliska i učinkovita suradnja između Komisije i država članica unutar Stalnog veterinarskog odbora, Stalnog odbora za stočnu hranu te Stalnog odbora za hranu. |
|
(24) |
Uzevši u obzir da su odredbe o provedbi ove Uredbe opće mjere u smislu članka 2. Odluke 1999/468/EZ, potrebno ih je donijeti u skladu s regulatornim postupkom utvrđenim člankom 5. te Odluke, |
DONIJELI SU OVU UREDBU:
POGLAVLJE I.
OPĆE ODREDBE
Članak 1.
Područje primjene
1. Ovom se Uredbom utvrđuju pravila za sprečavanje, kontrolu i iskorjenjivanje raznih oblika transmisivnih spongiformnih encefalopatija (TSE) kod životinja. Primjenjuje se na proizvodnju i stavljanje na tržište živih životinja i proizvoda životinjskog podrijetla, te u nekim posebnim slučajevima na njihov izvoz.
2. Ova se Uredba ne primjenjuje na:
|
(a) |
kozmetičke ili medicinske proizvode, medicinski pribor ili njihove sirovine ili intermedijarne proizvode; |
|
(b) |
proizvode koji nisu namijenjeni za uporabu u prehrani ljudi, životinja ili za gnojiva ili njihove sirovine ili intermedijarne proizvode; |
|
(c) |
proizvode životinjskog podrijetla koji su namijenjeni izložbama, nastavnom radu, znanstvenom istraživanju, posebnim studijama ili analizama, pod uvjetom da se ti proizvodi u konačnici ne konzumiraju niti ih koriste ljudi ili životinje, osim onih koje se drže za potrebe predmetnih istraživačkih projekata; |
|
(d) |
žive životinje koje se rabe ili su namijenjene za potrebe istraživanja. |
Članak 2.
Razdvajanje živih životinja i proizvoda životinjskog podrijetla
Kako bi se izbjegla unakrsna kontaminacija ili zamjenjivanje živih životinja ili proizvoda životinjskog podrijetla iz članka 1. stavka 1. i proizvoda životinjskog podrijetla iz članka 1. stavka 2. (a), (b) i (c) ili živih životinja iz članka 1. stavka 2. (d), njih je u svakom trenutku potrebno držati odvojenima, osim ako takve životinje ili proizvodi životinjskog podrijetla nisu proizvedeni pod barem jednakovrijednim uvjetima zaštite zdravlja u odnosu na razne oblike TSE-a.
Provedbeni propisi ovog članka donose se u skladu s postupkom iz članka 24. stavka 2.
Članak 3.
Definicije
1. Za potrebe ove Uredbe primjenjuju se sljedeći pojmovi:
|
(a) |
razni oblici TSE-a: sve transmisivne spongiformne encefalopatije, osim onih koje se javljaju u ljudi; |
|
(b) |
stavljanje na tržište: svaki postupak čija je svrha prodati žive životinje ili proizvode životinjskog podrijetla na koje se odnosi ova Uredba trećoj strani u Zajednici, odnosno bilo koji drugi oblik opskrbe uz plaćanje ili besplatno takvoj trećoj strani, odnosno njihovo skladištenje s namjerom opskrbe takve treće strane; |
|
(c) |
proizvodi životinjskog podrijetla: svaki proizvod koji je dobiven ili koji sadrži proizvod dobiven od bilo koje životinje na koje se odnose odredbe Direktive 89/662/EEZ (5) ili Direktive 90/425/EEZ (6); |
|
(d) |
sirovine: sirovine ili bilo koji drugi proizvod životinjskog podrijetla od kojeg ili pomoću kojeg se proizvode proizvodi iz članka 1. stavka 2. (a) i (b); |
|
(e) |
nadležno tijelo: središnje tijelo države članice, nadležno za osiguranje sukladnosti sa zahtjevima iz ove Uredbe, ili bilo koje tijelo na koje je predmetno središnje tijelo prenijelo tu nadležnost, posebno kada je riječ o kontroli hrane za životinje; nadležno tijelo također uključuje, tamo gdje je to prikladno, odgovarajuće tijelo treće zemlje; |
|
(f) |
kategorija: jedna od klasifikacijskih kategorija iz poglavlja C Priloga II.; |
|
(g) |
specificirani rizični materijal: tkiva navedena u Prilogu V.; što ne uključuje proizvode koji sadrže ili koji su dobiveni od tih tkiva ako, osim ako nije drukčije navedeno; |
|
(h) |
životinja za koju se sumnja da je zaražena uzročnikom TSE: žive, zaklane ili uginule životinje koje pokazuju, ili su pokazivale neurološke poremećaje ili poremećaje u ponašanju ili progresivno pogoršanje općeg zdravstvenog stanja koje je povezano s oštećenjem središnjega živčanog sustava, te kod kojih informacije prikupljene na temelju kliničkog pregleda, reagiranja na liječenje, post mortem pregleda, ili ante mortem ili post mortem laboratorijske analize ne omogućuju postavljanje neke alternativne dijagnoze. Na goveđu spongiformnu encefalopatiju (dalje u tekstu GSE) sumnja se u goveda koja su dala pozitivan rezultat na brzi test specifičan za GSE; |
|
(i) |
gospodarstvo: svako mjesto na kojem se životinje na koje se odnosi ova Uredba uzgajaju, drže, koriste ili ih se izlaže javnosti; |
|
(j) |
uzorkovanje: uzimanje uzoraka tako da se osigura statistički ispravna reprezentativnost, od životinja ili iz njihovog okoliša ili od proizvoda životinjskog podrijetla, radi postavljanja dijagnoze bolesti, utvrđivanja srodstva, radi nadziranja zdravlja ili radi praćenja odsutnosti uzročnika ili određenih materijala u proizvodima životinjskog podrijetla; |
|
(k) |
gnojiva: svaka supstanca koja sadrži proizvode životinjskog podrijetla, koja se koristi na zemlji radi poticanja rasta vegetacije; tu mogu biti uključeni probavni ostaci od proizvodnje bioplina ili kompostiranja; |
|
(l) |
brzi testovi: metode analize iz Priloga X. poglavlja C točke 4. čiji su rezultati poznati unutar 24 sata; |
|
(m) |
alternativni test: testovi iz članka 8. stavka 2. koji se koriste kao alternativa metoda za donošenje odluke o uklanjanju specificiranog rizičnog materijala. |
2. Specifični pojmovi iz Priloga I. također se primjenjuju.
3. Kad neki pojmovi iz ove Uredbe nisu određeni u stavku 1. ili Prilogu I., odgovarajući pojmovi sadržani u Uredbi (EZ) br. 1760/2000 (7) kao i pojmovi sadržani u ili sukladni s direktivama 64/432/EEZ (8), 89/662/EEZ, 90/425/EEZ i 91/68/EEZ (9) primjenjuju se u onoj mjeri u kojoj postoje upute na njih u ovom tekstu.
Članak 4.
Zaštitne mjere
1. U odnosu na provedbu zaštitnih mjera primjenjuju se načela i odredbe iz članka 9. Direktive 89/662/EEZ, članka 10. Direktive 90/425/EEZ, članka 18. Direktive 91/496/EEZ (10) i članka 22. Direktive 97/78/EZ (11).
2. Zaštitne mjere donose se u skladu s postupkom iz članka 24. stavka 2., te se o njima istodobno izvješćuje Europski parlament, uz navođenje razloga za njihovo donošenje.
POGLAVLJE II.
UTVRĐIVANJE GSE STATUSA
Članak 5.
Klasifikacija
1. GSE status pojedine države članice, treće zemlje ili jedne od njihovih regija (dalje u tekstu „države ili regije”) moguće je utvrditi isključivo na temelju kriterija navedenih u Prilogu II. poglavlja A, dok se ishod analize rizika može utvrditi na temelju svih potencijalnih čimbenika koji mogu dovesti do pojave goveđe spongiformne encefalopatije kako je utvrđeno u Prilogu II. poglavlju B, te njihovog razvoja tijekom vremena.
Države članice i treće zemlje koje žele ostati na popisu trećih zemalja koje imaju dopuštenje za izvoz u Zajednicu živih životinja ili proizvoda obuhvaćenih ovom Uredbom, podnose Komisiji zahtjev za utvrđivanje GSE statusa u njihovoj državi, uz kojeg prilažu mjerodavne informacije o kriterijima navedenim u Prilogu II. poglavlju A, te o potencijalnim rizičnim čimbenicima navedenima u Prilogu II. poglavlju B kao i o njihovom razvoju tijekom vremena.
2. Odluka o svakom zahtjevu kojom se državu članicu ili treću zemlju ili regiju države članice ili treću zemlju, koja je podnijela zahtjev, uvrštava u jednu od kategorija utvrđenih u Prilogu II., poglavlju C donosi se uzimajući u obzir kriterije i potencijalne rizične čimbenike navedene u stavku 1. u skladu s postupkom iz članka 24. stavka 2.
Ova odluka donosi se u roku od šest mjeseci od podnošenja zahtjeva i mjerodavnih informacija iz drugog podstavka stavka 1. Ako Komisija utvrdi kako popratni dokazi ne uključuju informacije navedene u Prilogu II., poglavljima A i B, zatražiti će dostavu dodatnih informacija unutar roka kojega će posebno odrediti. Konačna odluka donosi se u roku od šest mjeseci od primitka svih potrebnih informacija.
Nakon što Međunarodni ured za epizotije (OIE) ustanovi postupak razvrstavanja država prema kategorijama, te ako je uvrstio državu podnositeljicu zahtjeva u jednu od tih kategorija, može se donijeti odluka o ponovnoj procjeni kategorizacije predmetne države u Zajednici, u skladu s prvim podstavkom ovog stavka, te, ako je to prikladno, u skladu s postupkom iz članka 24. stavka 2.
3. Ako Komisija utvrdi kako su informacije dostavljene od strane države članice ili treće zemlje u skladu s Prilogom II. poglavljima A i B nedostatni ili nejasni, ona može, u skladu s postupkom iz članka 24. stavka 2., utvrditi GSE status predmetne države članice ili treće zemlje na temelju pune analize rizika.
Takva analiza rizika mora uključiti konačnu statističku ocjenu epidemiološke situacije u vezi s raznim oblicima TSE-a u državi članici ili trećoj zemlji podnositeljici zahtjeva na temelju brzih testova koje se rabe u sklopu screening postupka. Komisija uzima u obzir kriterije klasifikacije koje rabi Međunarodni ured za epizotije.
Brzi testovi odobravaju se za tu te svrhu u skladu s postupkom iz članka 24. stavka 2. te se uključuju na popis naveden u Prilogu X. poglavlju C točki 4.
Takav screening postupak mogu također rabiti države članice ili treće zemlje koje žele da klasificiranje koje su provele na toj osnovi bude potvrđeno od strane Komisije - u skladu s postupkom iz članka 24. stavka 2.
Troškove takvog screening postupka snosi predmetna država članica ili treća zemlja.
4. Države članice ili treće zemlje koje nisu podnijele zahtjev u skladu sa stavkom 1. u roku od 6 mjeseci od 1. srpnja 2001. smatraju se u vezi s otpremom živih životinja i proizvoda životinjskog podrijetla s njihovih područja državama 5. kategorije o kojima se govori u Prilogu II. poglavlju C sve do trenutka dok ne podnesu takav zahtjev.
5. Države članice izvješćuju Komisiju što je prije moguće o bilo kakvom epidemiološkom dokazu ili drugim informacijama koje bi mogle dovesti do promjene u GSE statusu, a posebno o rezultatima programa praćenja iz članka 6.
6. Zadržavanje treće zemlje na jednom od popisa predviđenih pravilima Zajednice u svrhu dopuštanja izvoza u Zajednicu živih životinja i proizvoda životinjskog podrijetla za koje ova Uredba utvrđuje posebna pravila, donosi se u skladu s postupkom utvrđenim u članku 24. stavku 2., te se uvjetuje – u svjetlu dostupnih informacija ili tamo gdje se sumnja na prisutnost TSE-a – dostavom informacija predviđenih u stavku 1. U slučaju odbijanja dostave navedenih informacija u roku od tri mjeseca od datuma zahtjeva Komisije, odredbe stavka 4. ovog članka primjenjuju se sve dok se tražene informacije ne dostave i ocijene u skladu sa stavkom 2. ili 3.
Podobnost trećih zemalja da izvoze u Zajednicu žive životinje ili proizvode životinjskog podrijetla za koje ova Uredba utvrđuje posebna pravila, pod uvjetima zasnovanima na njihovoj kategoriji a koju je utvrdila Komisija, uvjetovana je njihovom obvezom da izvijeste Komisiju u pisanom obliku, što je prije moguće, o svim epidemiološkim ili drugim dokazima koji bi mogli dovesti do promjene u GSE statusu.
7. U skladu s postupkom utvrđenim u članku 24. stavku 2. može se donijeti odluka o promjeni klasificiranja s obzirom na GSE-a države članice ili treće zemlje ili jedne od njihovih regija u skladu s rezultatima pregleda predviđenih člankom 21.
8. Odluke iz stavka 2., 3., 4., 6. i 7. temelje se na procjeni rizika, pri čemu se uzimaju u obzir preporučeni kriteriji navedeni u Prilogu II., poglavljima A i B.
POGLAVLJE III.
SPREČAVANJE TSE-a
Članak 6.
Sustav praćenja
1. Svaka država članica provodi godišnji program praćenja GSE-a i grebeži ovaca u skladu s Prilogom III. poglavljem A. Taj program uključuje screening postupak pri čemu se rabe brzi testovi.
Brzi testovi odobravaju se u tu svrhu u skladu s postupkom iz članka 24. stavka 2. a navedeni su u Prilogu X. poglavlju C točki 4.
2. Svaka država članica izvješćuje Komisiju i ostale države članice u okviru Stalnog veterinarskog odbora o pojavi jednog od oblika TSE koji nije GSE.
3. Sva službena ispitivanja i laboratorijske pretrage bilježe se u skladu s Prilogom III. poglavljem B.
4. Države članice podnose Komisiji godišnje izvješće koje obuhvaća barem informacije iz Priloga III. poglavlja B dijela I. Izvješće za svaku kalendarsku godinu podnosi se najkasnije do 31. ožujka sljedeće godine. Komisija predstavlja sažetak nacionalnih izvješća, koji obuhvaća barem informacije iz Priloga III. poglavlja B dijela II. Stalnom veterinarskom odboru u roku od tri mjeseca od primitka navedenih izvješća.
Članak 7.
Zabrane koje se odnose na hranidbu životinja
1. Zabranjena je hranidba preživača bjelančevinama podrijetlom od sisavaca.
2. Nadalje, zabrana iz stavka 1. proširuje se na životinje i proizvode životinjskog podrijetla u skladu s točkom 1. Priloga IV.
3. Odredbe stavaka 1. i 2. primjenjuju se ne dovodeći u pitanje odredbe utvrđene u točki 2. Priloga IV.
4. Državama članicama, odnosno njihovim regijama koje su uvrštene u kategoriju 5. nije dopušten izvoz ili skladištenje hrane namijenjene životinjama iz uzgoja koja sadrži bjelančevine dobivene od sisavaca ili hrane namijenjenu sisavcima, s iznimkom hrane za pse i mačke, koja sadrži prerađene bjelančevine dobivene od sisavaca.
Trećim zemljama ili njihovim regijama koje su uvrštene u kategoriju 5. nije dopušteno izvoziti u Zajednicu hranu namijenjenu stoci koja sadrži bjelančevine dobivene od sisavaca ili hranu namijenjenu sisavcima, s iznimkom hrane za pse i mačke, koja sadrži prerađene bjelančevine dobivene od sisavaca.
5. Detaljna pravila za provedbu ovog članka, a posebno pravila o sprečavanju unakrsne kontaminacije, te pravila o metodama uzorkovanja i analiza potrebnih kako bi se utvrdila sukladnost s ovim člankom, donose se u skladu s postupkom iz članka 24. stavka 2.
Članak 8.
Specificirani rizični materijal
1 Specificirani rizični materijal mora biti uklonjen i uništen u skladu s točkama 2., 3., 4. i 8. Priloga V.
Specificirani rizični materijal ili materijal koji je od njega prerađen može se staviti na tržište ili, ako postoji potreba izvesti, samo za konačno uništenje u skladu s točkom 3. i 4. ili, ako je to prikladno, s točkom 7.c ili 8. Priloga V. Takav materijal nije dopušteno uvesti u Zajednicu. Provoz specificiranog rizičnog materijala kroz teritorij Zajednice mora se odvijati u skladu sa zahtjevima iz članka 3. Direktive 91/496/EEZ.
2. Odredbe stavka 1. ne primjenjuju se na tkiva životinja koje su bile podvrgnute alternativnom testiranju odobrenom za tu posebnu svrhu u skladu s postupkom iz članka 24. stavka 2., navedenom u Prilogu X. poglavlju C točki 5., te primijenjenim pod uvjetima navedenima u točki 5. Priloga V. – ako su rezultati testa bili negativni.
Države članice koje dopuste takav alternativni test moraju o tomu izvijestiti ostale države članice i Komisiju.
3. U državama članicama ili njihovim regijama koje su uvrštene u kategoriju 2., 3., 4. i 5. iz Priloga II. poglavlja C, razaranje, nakon omamljivanja središnjeg živčanog tkiva šipkom uvedenom u kranialnu šupljinu ili upuhivanje plina u kranialnu šupljinu u vezi s omamljivanjem, nije dozvoljeno primjenjivati na goveda, ovce i koze čije je meso namijenjeno prehrani ljudi ili hranidbi životinja.
4. Podaci o dobi iz Priloga V., redovito se mijenjaju. Navedene se promjene temelje na najnovijim provjerenim znanstvenim podacima o statističkoj vjerojatnosti pojave TSE-a u odgovarajućim starosnim skupinama populacije goveda, ovaca i koza u Zajednici.
5. Odstupajući od odredbi stavka 1. do 4., a u skladu s postupkom iz članka 24. stavka 2., može se donijeti odluka o datumu učinkovite provedbe članka 7. stavka 1. ili, ako je to prikladno, u trećim zemljama, odrediti datum zabrane uporabe bjelančevina dobivenih od sisavaca u hrani za preživače u svakoj državi ili regiji koja je uvrštena u kategoriju 3. ili 4., kako bi se ograničila primjena ovog članka na životinje rođene prije toga datuma u tim državama ili regijama.
Slično tomu, odstupajući od odredbi stavka 1. do 4., nakon savjetovanja s odgovarajućim znanstvenim odborom, te na temelju procjene opasnosti, širenja i izloženosti ljudi bolesti, u skladu s postupkom iz članka 24. stavka 2. može se donijeti odluka kojom se dopušta uporaba kralježnice i dorzalnih korijen ganglija od goveda koja dolaze iz svake države ili njezine regije uvrštene u kategoriju 5.
6. Pravila za provedbu ovog članka donose se u skladu s postupkom iz članka 24. stavka 2.
Članak 9.
Proizvodi životinjskog podrijetla dobiveni od preživača ili koji sadrže njihov materijal
1. Proizvodi životinjskog podrijetla navedeni u Prilogu VI. ne proizvode se od tkiva preživača iz zemalja ili njihovih regija koje su uvrštene u kategoriju 5. osim ako nisu proizvedeni u skladu s proizvodnim postupcima odobrenima u skladu s postupkom iz članka 24. stavka 2.
2. Kosti glave i kralježnice goveda, ovaca i koza iz zemalja ili njihovih regija koje su uvrštene u kategoriju 2., 3., 4. ili 5. ne rabe se za proizvodnju strojno otkoštenog mesa.
3. U kontekstu kriterija navedenih u točki 5. Priloga V. stavke 1. i 2. ne primjenjuju se na preživače koji su bili podvrgnuti alternativnom testu odobrenom u skladu s postupkom iz članka 24. stavka 2., ako su rezultati testa bili negativni.
4. Pravila za provedbu ovog članka donose se u skladu s postupkom iz članka 24. stavka 2.
Članak 10.
Obrazovni programi
1. Države članice osiguravaju da osoblje nadležnoga tijela, dijagnostičkih laboratorija, poljoprivrednih i veterinarskih fakulteta, službeni veterinari, veterinari praktičari, radnici u klaonicama te uzgajivači, čuvari i osobe koje postupaju sa životinjama prođu obuku u vezi s prepoznavanjem kliničkih znakova, epidemiologijom, te u slučaju osoba odgovornih za provedbu pregleda, tumačenjem laboratorijskih nalaza koji se odnose na TSE-ove.
2. Financijska pomoć od strane Zajednice može se dodijeliti s ciljem osiguranja učinkovite provedbe obrazovnih programa iz stavka 1. Visina takve pomoći utvrđuje se u skladu s postupkom iz članka 24. stavka 2.
POGLAVLJE IV.
KONTROLA I ISKORJENJIVANJE TSE-a
Članak 11.
Prijava
Ne dovodeći u pitanje Direktivu 82/894/EEZ (12), države članice osiguravaju da se nadležna tijela odmah izvijeste o svakoj životinji za koju se sumnja kako je zaražena s TSE.
Države članice redovito izvješćuju jedna drugu, kao i Komisiju, o prijavljenim slučajevima TSE-a.
Nadležno tijelo bez odgode poduzima mjere utvrđene člankom 12. ove Uredbe, zajedno sa svim ostalim nužnim mjerama.
Članak 12.
Mjere u odnosu na sumnjive životinje
1. Za svaku životinju za koju se sumnja da je zaražena TSE-om, mora se odrediti službena zabrana premještanja do dobivanja rezultata kliničkog i epidemiološkog ispitivanja od strane nadležnog tijela, ili mora biti usmrćena u svrhu laboratorijskog ispitivanja pod službenom kontrolom.
Ako je postavljena službena sumnja na GSE u goveda, koje se nalazi na gospodarstvu unutar države članice, za sva druga goveda na tom gospodarstvu određuje se službeno ograničenje premještanja do dobivanja rezultata ispitivanja.
Ako je postavljena službena sumnja na GSE u ovce ili koze koja se nalazi na gospodarstvu unutar države članice na temelju objektivnih dokaza, poput rezultata testova pomoću kojih se praktično može utvrditi razlika između različitih oblika TSE-a, za sve druge ovce i koze na tom gospodarstvu određuje se službeno ograničenje premještanja do dobivanja rezultata ispitivanja.
Ako postoji dokaz prema kojemu gospodarstvo, na kojem je životinja bila prisutna kada se pojavila sumnja na GSE, vjerojatno nije gospodarstvo na kojem je životinja mogla bila izložena GSE-u, nadležno tijelo može odlučiti da se samo životinji za koju se sumnja da je zaražena odredi službeno ograničenje premještanja. Ako se to smatra nužnim, nadležno tijelo može odlučiti da se druga gospodarstva ili samo gospodarstvo izloženo zarazi stave po službenom kontrolom ovisno o dostupnim epidemiološkim podacima.
U skladu s postupkom navedenim u članku 24. stavku 2., odstupajući od zahtjeva iz drugog, trećeg i četvrtog podstavka ovog stavka, država članica može biti izuzeta od primjene službenih ograničenja premještanja životinja ako primjenjuje jednakovrijedne zaštitne mjere.
2. Ako nadležno tijelo zaključi da se ne može isključiti mogućnost zaraze jednim od oblika TSE-a, životinja se usmrćuje ako je još živa; njezin mozak i sva druga tkiva, a prema odluci nadležnoga tijela odstranjuju se i šalju u službeno ovlašteni laboratorij, nacionalni referentni laboratorij iz članka 19. stavka 1. ili u referentni laboratorij Zajednice iz članka 19. stavka 2. na ispitivanje, u skladu s metodama ispitivanja utvrđenim člankom 20.
3. Svi dijelovi tijela sumnjive životinje, uključujući kožu, zadržavaju se pod službenom kontrolom sve dok se ne postavi negativna dijagnoza ili se uništavaju u skladu s Prilogom V., točkom 3. ili 4.
4. Pravila za provedbu ovog članka donose se u skladu s postupkom iz članka 24. stavka 2.
Članak 13.
Mjere nakon potvrđivanja TSE-a
1. Nakon službene potvrde TSE-a, u najkraćem mogućem roku moraju biti provedene sljedeće mjere:
|
(a) |
svi dijelovi tijela životinje u potpunosti se uništavaju u skladu s Prilogom V., s iznimkom tkiva koje se zadržava za potrebe zapisnika, u skladu s Prilogom III. poglavljem B naslovom III. točkom 2; |
|
(b) |
provodi se istraga s ciljem identifikacije svih životinja koje su ugrožene, u skladu s Prilogom VII., točkom 1.; |
|
(c) |
sve životinje i proizvodi životinjskog podrijetla iz Priloga VII. točke 2., za koje se istragom iz točke (b) utvrdi kako su ugrožene, usmrćuju se i u potpunosti uništavaju, u skladu s Prilogom V. točkom 3. i 4. |
Odstupajući od odredaba iz ovog stavka, države članice mogu primijeniti i druge mjere kojima se osigurava istovrsna razina zaštite ako su te mjere odobrene u skladu s postupkom iz članka 24. stavka 2.
2. Do početka primjene mjera iz stavka 1. (b) i (c), gospodarstvo na kome se životinja nalazila kada je potvrđena prisutnost jednog od oblika TSE stavlja se pod službenu kontrolu, a sva premještanja životinja podložnih oblicima TSE i proizvoda životinjskog podrijetla dobivenih od navedenih životinja, iz ili u gospodarstvo, podliježu odobrenju od strane nadležnoga tijela, s ciljem osiguranja trenutačnog praćenja i identifikacije predmetnih životinja i proizvoda životinjskog podrijetla.
Ako postoje dokazi da gospodarstvo na kome se zaražena životinja nalazila kada je potvrđena prisutnost TSE najvjerojatnije nije gospodarstvo na kome je životinja bila izložena TSE-i, nadležno tijelo može donijeti odluku o tome da se oba gospodarstva, ili samo gospodarstvo na kome je došlo do izlaganja, stave pod službenu kontrolu.
3. Države članice koje provode zamjenski program koji nudi jednakovrijedne zaštitne mjere iz petog podstavka članka 12. stavka 1. mogu, odstupajući od zahtjeva iz stavka 1. (b) i (c), biti izuzete od zahtjeva za primjenom službenog ograničenja premještanja životinja, te od zahtjeva za usmrćivanjem i uništavanjem životinja, u skladu s postupkom iz članka 24. stavka 2.
4. Vlasnicima se bez odgode isplaćuje naknada za gubitak životinja koje su usmrćene ili proizvoda životinjskog podrijetla koji su uništeni u skladu s člankom 12. stavkom 2. te stavkom 1 (a) i (c) ovog članka.
5. Ne dovodeći u pitanje Direktivu 82/894/EEZ, Komisija izvješćuje o potvrđenoj prisutnosti bilo kojeg oblika TSE-a osim GSE-a na godišnjoj osnovi.
6. Pravila za provedbu ovog članka donose se u skladu s postupkom iz članka 24. stavka 2.
Članak 14.
Krizni plan
1. Države članice izrađuju – u skladu s općim kriterijima pravila Zajednice o kontroli životinjskih bolesti – smjernice kojima se detaljno utvrđuju nacionalne mjere koje je potrebno provesti, te propisuju nadležnosti i odgovornosti kod potvrde slučajeva TSE.
2. Tamo gdje je to nužno kako bi se omogućila ujednačena primjena zakonodavstva Zajednice, smjernice se mogu uskladiti u skladu s postupkom iz članka 24. stavka 2.
POGLAVLJE V.
STAVLJANJE NA TRŽIŠTE I IZVOZ
Članak 15.
Žive životinje, njihovo sjeme, zameci i jajne stanice
1. Stavljanje na tržište, ili u slučaju potrebe, izvoz goveda, ovaca ili koza te njihovog sjemena, zametaka i jajnih stanica podliježe uvjetima utvrđenima Prilogom VIII. odnosno, u slučaju uvoza, uvjetima utvrđenima Prilogom IX. Žive životinje i njihovi zameci i jajne stanice, popraćene su odgovarajućim certifikatom o zdravlju životinja, kako je propisano zakonodavstvom Zajednice u skladu s člankom 17. odnosno, u slučaju uvoza, člankom 18.
2. Stavljanje na tržište potomstva prve generacije, sjemena, zametaka i jajnih stanica životinja za koje se sumnja, ili je potvrđeno da su zaražene s TSE, podliježe uvjetima utvrđenima Prilogom VIII. poglavlja B.
3. Pravila za provedbu ovog članka donose se u skladu s postupkom iz članka 24. stavka 2.
Članak 16.
Stavljanje na tržište proizvoda životinjskog podrijetla
1. Sljedeći proizvodi životinjskog podrijetla dobiveni od zdravih preživača ne podliježu ograničenjima vezanim za stavljanje na tržište ili, u slučaju potrebe, izvoza sukladno s ovim člankom Prilogom VIII. poglavljima C i D, te Prilogom IX. poglavljima A, C, F i G:
|
(a) |
proizvodi životinjskog podrijetla na koje se odnosi članak 15., a posebno sjeme, zameci i jajne stanice; |
|
(b) |
|
2. Proizvodi životinjskog podrijetla uvezeni iz treće zemlje koja je uvrštena u kategoriju 2., 3., 4. i 5. moraju potjecati od zdravih goveda, ovaca i koza koje nisu bile izložene laceraciji središnjih živčanih tkiva iz članka 8. stavka 3., niti su usmrćene ubrizgavanjem plina u kranijalnu šupljinu.
3. Proizvodi životinjskog podrijetla koji sadrže tkiva dobivena od goveda koja potječu iz države članice, pojedine regije države članice, ili iz treće zemlje, razvrstane u kategoriju 5., ne stavljaju se na tržište osim ako ne potiču od:
|
(a) |
životinja rođenih nakon datuma od kada je na snagu učinkovito stupila zabrana hranidbe preživača životinjskim bjelančevinama dobivenim od sisavaca; ili |
|
(b) |
životinja koje su rođeni i uzgajane i koje su ostale u stadima te koje imaju dokazanu povijest neizloženosti GSE tijekom razdoblja od najmanje sedam godina. |
Nadalje, proizvodi životinjskog podrijetla ne smiju se otpremati iz države članice ili iz pojedine regije države članice razvrstane u kategoriju 5. u drugu državu članicu, niti se smiju uvoziti iz treće zemlje razvrstane u kategoriju 5. Ova zabrana ne odnosi se na proizvode životinjskog podrijetla navedene u Prilogu VIII. poglavlju C koji ispunjavaju zahtjeve iz Priloga VIII. poglavlja C. Njih mora pratiti certifikat o zdravlju životinja koji izdaje službeni veterinar i kojim se potvrđuje kako su predmetni proizvodi proizvedeni u skladu s ovom Uredbom.
4. Kada se životinja premješta iz države ili regije u državu ili regiju uvrštenu u drugu kategoriju, razvrstava se u najvišu kategoriju zemalja ili regija u kojima je boravila više od 24 sata, osim ako se ne mogu pružiti odgovarajuća jamstva kojima se potvrđuje da životinja nije bila hranjena stočnom hranom iz države ili regije razvrstane u najvišu kategoriju.
5. Proizvode životinjskog podrijetla, za koje se u ovom članku utvrđuju posebna pravila, prate odgovarajući certifikati o zdravlju životinja ili trgovački dokumenti koje zahtijeva zakonodavstvo Zajednice u skladu s člancima 17. i 18. ili, ako takvi certifikati ili dokumenti nisu propisani zakonodavstvom Zajednice, tada ih prati zdravstveni certifikat ili trgovački dokument koji se sastavlja u skladu s postupkom iz članka 24. stavka 2.
6. Za potrebe uvoza u Zajednicu, proizvodi životinjskog podrijetla trebaju zadovoljavati uvjete utvrđene u Prilogu IX. poglavljima A, C, F i G.
7. U skladu s postupkom iz članka 24. stavka 2., odredbe stavaka 1. do 6. mogu se proširiti i na ostale proizvode životinjskog podrijetla. Pravila za primjenu ovog članka donose se po istom postupku.
Članak 17.
Prema postupku iz članka 24. stavka 2., zdravstveni certifikati iz Priloga F Direktivi 64/432/EEZ, modeli II. i III. u Prilogu E Direktivi 91/68/EEZ, te odgovarajući zdravstveni certifikati utvrđeni zakonodavstvom Zajednice koji se odnose na trgovinu sjemenom, zamecima i jajnim stanicama goveda, ovaca ili koza dopunjuju se, gdje je potrebno, upućivanjem na kategoriju u koju je uvrštena država članica ili regija podrijetla, u skladu s člankom 5.
Odgovarajući trgovački dokumenti koji se odnose na trgovinu proizvodima životinjskog podrijetla dopunjuju se, tamo gdje je to potrebno, upućivanjem na kategoriju u koju je razvrstana država članica ili regija podrijetla, a koju je utvrdila Komisija u skladu s člankom 5.
Članak 18.
Odgovarajući zdravstveni certifikati koji se odnose na uvoz, a propisani su zakonodavstvom Zajednice, dopunjuju se posebnim zahtjevima utvrđenima u Prilogu IX. prema postupku iz članka 24. stavka 2. u odnosu na treće zemlje razvrstane u jednu od kategorija prema članku 5. čim se donese takva odluka o razvrstavanju.
POGLAVLJE VI.
REFERENTNI LABORATORIJI, UZORKOVANJE, ISPITIVANJE I KONTROLE
Članak 19.
Referentni laboratoriji
1. Nacionalni referentni laboratoriji u svakoj državi članici, kao i njihove funkcije i dužnosti, moraju biti u skladu s onima koji su navedeni u Prilogu X. poglavlju A.
2. Referentni laboratorij Zajednice, kao i njegove funkcije i dužnosti, mora biti u skladu s onim navedenim u Prilogu X. poglavlju B.
Članak 20.
Uzorkovanje i laboratorijske metode
1. Uzorkovanje i laboratorijsko ispitivanje prisutnosti TSE provodi se uporabom metoda i protokola utvrđenih Prilogom X. poglavljem C.
2. Tamo gdje je to potrebno kako bi se osigurala ujednačena primjena ovog članka, provedbena pravila, uključujući metodu potvrđivanja GSE kod ovaca i koza, donose se u skladu s postupkom iz članka 24. stavka 2.
Članak 21.
Kontrole Zajednice
1. Stručnjaci Komisije mogu obavljati preglede na licu mjesta u suradnji s nadležnim tijelima država članica u onoj mjeri u kojoj je to nužno za ujednačenu primjenu ove Uredbe. Država članica na čijem području se vrše pregledi dužna je pružiti stručnjacima svu potrebnu pomoć u provedbi njihovih zadaća. Komisija izvješćuje nadležno tijelo o rezultatima provedenih pregleda.
Pravila za primjenu ovog članka, a posebno ona kojima se uređuje postupak suradnje s državnim tijelima, donose se u skladu s postupkom iz članka 24. stavka 2.
2. Pregledi Zajednice u trećim zemljama provode se u skladu s člancima 20. i 21. Direktive 97/78/EZ.
POGLAVLJE VII.
PRIJELAZNE I ZAVRŠNE ODREDBE
Članak 22.
Prijelazne mjere koje se odnose na specificirani rizični materijal
1. Odredbe Priloga XI. dijela A, primjenjuju se tijekom razdoblja od najmanje šest mjeseci od 1. srpnja 2001. a prestaju se primjenjivati neposredno nakon datuma donošenja odluke u skladu s člankom 5. stavcima 2. ili 4. S tim datumom članak 8. stupa na snagu.
2. Rezultati zaključnog statističkog istraživanja, provedenog u skladu s člankom 5. stavkom 3. tijekom prijelaznog razdoblja, rabe se kako bi se potvrdili ili odbacili zaključci analize rizika iz članka 5. stavka 1., pri čemu se vodi računa o kriterijima razvrstavanja koje je utvrdio Međunarodni ured za epizotije.
3. Nakon savjetovanja s odgovarajućim znanstvenim odborom, donose se podrobna pravila za predmetno statističko istraživanje u skladu s postupkom iz članka 24. stavka 2.
4. Minimalni kriteriji koje predmetno statističko istraživanje mora ispuniti su utvrđeni u dijelu B Priloga XI.
Članak 23.
Izmjene priloga i prijelaznih mjera
Nakon savjetovanja s odgovarajućim znanstvenim odborom o bilo kojem pitanju koje bi moglo utjecati na javno zdravstvo, prilozi se izmjenjuju, a sve prikladne prijelazne mjere se donose u skladu s postupkom iz članka 24. stavka 2.
U skladu s gore navedenim postupkom, prijelazne mjere se donose za razdoblje od maksimalno dvije godine kako bi se omogućio prijelaz sa sadašnjih uređenja na uređenja koja se uspostavljaju ovom Uredbom.
Članak 24.
Odbori
1. Komisiji pomaže Stalni veterinarski odbor. Međutim, kada je riječ o pitanjima koja se odnose isključivo na hranu za životinje, Komisiji pomaže Stalni odbor za hranu za životinje, a kada je riječ o pitanjima koja se odnose isključivo na hranu, Komisiji pomaže Stalni odbor za hranu.
2. Ako postoji upućivanje na ovaj stavak, primjenjuju se članak 5. i 7. Odluke 1999/468/EZ, u skladu s člankom 8. iste Odluke.
Razdoblje iz članka 5. stavka 6. predmetne Odluke je tri mjeseca, a kod zaštitnih mjera iz članka 4. stavka 2. ove Uredbe, 15 dana.
3. Svaki Odbor donosi svoj poslovnik.
Članak 25.
Savjetovanje sa znanstvenim odborima
Potrebno je posavjetovati se s odgovarajućim znanstvenim odborima o bilo kojem pitanju obuhvaćenim ovom Uredbom koje može imati utjecaja na javno zdravlje.
Članak 26.
Stupanje na snagu
Ova Uredba stupa na snagu dan nakon objave u Službenom listu Europskih zajednica.
Ona se primjenjuje od 1. srpnja 2001.
Ova Uredba je u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 22. svibnja 2001.
Za Europski Parlament
Predsjednik
N. FONTAINE
Za Vijeće
Predsjednik
M. WINBERG
(1) SL C 45, 19.2.1999., str. 2. i
SL C 120 E, 24.4.2001., str. 89.
(2) SL C 258, 10.9.1999., str. 19.
(3) Mišljenje Europskog parlamenta od 17. svibnja 2000. (SL C 59, 23.2.2001., str. 93.), Zajedničko stajalište Vijeća od 12. veljače 2001. (SL C 88, 19.3.2001., str. 1.) i Odluka Europskog parlamenta od 3. svibnja 2001.
(4) SL L 184, 17.7.1999., str. 23.
(5) Direktiva Vijeća 89/662/EEZ od 11. prosinca 1989. o veterinarskim pregledima u trgovini unutar Zajednice s ciljem uspostave unutarnjeg tržišta (SL L 395, 30.12.1989., str. 13.). Direktiva kako je zadnje izmijenjena Direktivom Vijeća 92/118/EEZ (SL L 62, 15.3.1993., str. 49.).
(6) Direktiva Vijeća 90/425/EEZ od 26. lipnja 1990. o veterinarskim i zootehničkim kontrolama pri trgovini određenim živim životinjama i proizvodima unutar Zajednice radi uspostave unutarnjeg tržišta (SL L 224, 18.8.1990., str. 29.). Direktiva kako je zadnje izmijenjena Direktivom Vijeća 92/118/EEZ.
(7) Uredba (EZ) br. 1760/2000 Europskog parlamenta i Vijeća od 17. srpnja 2000. o uspostavi sustava za identifikaciju i registraciju goveda i u vezi s označavanjem govedine i proizvoda od govedine i o stavljanju izvan snage Uredbe Vijeća (EZ) br. 820/97 (SL L 204, 11.8.2000., str. 1.).
(8) Direktiva Vijeća 64/432/EEZ od 26. lipnja 1964. o problemima vezanim za zdravlje životinja koji utječu na trgovinu govedima i svinjama unutar Zajednice (SL 121, 29.7.1964., str. 1977/64). Direktiva kako je zadnje izmijenjena Direktivom 2000/20/EZ Europskog parlamenta i Vijeća (SL L 163, 4.7.2000., str. 35.).
(9) Direktiva Vijeća 91/68/EEZ od 28. siječnja 1991. o uvjetima zdravlja životinja koji uređuju trgovinu ovcama i kozama unutar Zajednice (SL L 46, 19.2.1991., str. 19.). Direktiva kako je zadnje izmijenjena Odlukom Komisije 94/953/EZ (SL L 371, 31.12.1994., str. 14.).
(10) Direktiva Vijeća 91/496/EEZ od 15. srpnja 1991. o utvrđivanju načela kojima se uređuje organizacija veterinarskih pregleda životinja koje ulaze u Zajednicu iz trećih zemalja i o izmjenama Direktiva 89/662/EEZ, 90/425/EEZ i 90/675/EEZ (SL L 268, 24.9.1991., str. 56.). Direktiva kako je zadnje izmijenjena Direktivom 96/43/EZ (SL L 162, 1.7.1996., str. 1.).
(11) Direktiva Vijeća 97/78/EZ od 18. prosinca 1997. o utvrđivanju načela kojima se uređuje organizacija veterinarskih pregleda proizvoda koji ulaze u Zajednicu iz trećih zemalja (SL L 24, 30.1.1998., str. 9.).
(12) Direktiva Vijeća 82/894/EEZ od 21. prosinca 1982. o prijavljivanju bolesti životinja unutar Zajednice (SL L 378, 31.12.1982., str. 58.). Direktiva kako je zadnje izmijenjena Odlukom Komisije 2000/556/EZ (SL L 235, 19.9.2000., str. 27.).
(13) Direktiva Vijeća 92/46/EEZ od 16. lipnja 1992. o utvrđivanju zdravstvenih pravila za proizvodnju i stavljanje na tržište sirovog mlijeka, toplinski obrađenog mlijeka i proizvoda na bazi mlijeka (SL L 268, 14.9.1992., str. 1.). Direktiva kako je zadnje izmijenjena Direktivom 96/23/EZ (SL L 23.5.1996., str. 10.).
(14) Direktiva Vijeća 92/118/EEZ od 17. prosinca 1992. o utvrđivanju zahtjeva za zdravlje životinja i zahtjeva za javno zdravstvo kojima se uređuje trgovina i uvoz u Zajednicu proizvoda koji ne podliježu navedenim zahtjevima utvrđenima u posebnim pravilima Zajednice iz Priloga A dijela I. Direktive 89/662/EEZ te, s obzirom na patogene tvari, iz Direktive 90/425/EEZ (SL L 62, 15.3.1993., str. 49.). Direktiva kako je zadnje izmijenjena Odlukom Komisije 1999/724/EZ (SL L 290, 12.11.1999., str. 32.).
PRILOG I.
POSEBNE DEFINICIJE
U smislu ove Uredbe:
|
(a) |
„domaći slučaj goveđe spongiformne encefalopatije” znači slučaj goveđe spongiformne encefalopatije kod kojeg nema dovoljno jasnih dokaza kako se pojavila zbog zaraze prije uvoza žive životinje, zametka ili jajne stanice; |
|
(b) |
„zasebno adipozno tkivo” znači unutarnju i vanjsku tjelesnu mast koja se odstranjuje tijekom procesa klanja i rezanja, a posebno svježu masnoću sa srca, košuljice, bubrega i mezenterije goveda, kao i masnoću iz rasjekavaonica; |
|
(c) |
„kohorta” znači skupinu goveda koja su ili rođena u istom stadu kao i zaraženo govedo, i unutar 12 mjeseci prije ili poslije rođenja zaraženoga goveda koja su uzgajana zajedno sa zaraženom životinjom u bilo koje doba tijekom prve godine njihova života, te za koja je moguće da su se hranila istom hranom za životinje kakvom se hranila zaražena životinja tijekom prve godine njezina života; |
|
(d) |
„odlagalište otpada” znači prostor za odlaganje otpada, kako je opisano Direktivom 1999/31/EZ (1). |
(1) Direktiva Vijeća 1999/31/EZ od 26. travnja 1999. o odlagalištima otpada (SL L 182, 16.7.1999., str. 1.).
PRILOG II.
UTVRĐIVANJE STATUSA GSE-a
POGLAVLJE A
Status goveđe spongiformne encefalopatije (dalje u tekstu GSE status) pojedine države članice ili treće zemlje, odnosno neke od njihovih regija, dalje u tekstu „država ili regija”, utvrđuje se na temelju sljedećih kriterija:
|
(a) |
ishoda analize rizika kojom se utvrđuju svi potencijalni čimbenici za pojavu GSE navedeni u poglavlju B i njihov razvoj tijekom vremena; |
|
(b) |
obrazovnog programa za veterinare, uzgajivače i osobe koje prevoze, trguju i vrše klanja goveda, cilj kojega je ohrabriti ih na izvješćivanje o svim slučajevima neuroloških manifestacija kod odraslih goveda; |
|
(c) |
obvezatne prijave i pregleda svih goveda koja pokazuju kliničke znakove koji ukazuju na GSE; |
|
(d) |
sustava neprekidnog nadziranja i praćenja GSE, s posebnim naglaskom na opasnosti opisane u poglavlju B, vodeći računa o smjernicama u tablici iz poglavlja A Priloga III., odnosno u skladu s odgovarajućim međunarodnim normama; izvješća o broju izvršenih pregleda i o njihovim rezultatima moraju se čuvati najmanje sedam godina; |
|
(e) |
pretraga mozga ili drugih tkiva sakupljenih u okviru sustava nadziranja i praćenja iz točke (d), provedena u odobrenom laboratoriju. |
POGLAVLJE B
Analiza rizika iz poglavlja A točke (a) zasniva se na sljedećim čimbenicima:
|
— |
hranidba goveda mesno-koštanim brašnom ili lojem dobivenima od preživača, |
|
— |
uvoz mesno-koštanog brašna ili loja koji su potencijalno zaraženi jednim od oblika TSE-a ili hrane za životinje koja sadrži mesno-koštano brašno ili loj, |
|
— |
uvoz životinja ili jajnih stanica/zametaka koji su potencijalno zaraženi jednim od oblika TSE-a, |
|
— |
epidemiološki status države ili regija u pogledu TSE-a kod životinja, |
|
— |
opseg poznavanja strukture populacije goveda, ovaca i koza u državi ili regiji, |
|
— |
izvor životinjskog otpada, parametri postupaka obrade takvog otpada i metode proizvodnje hrane za životinje. |
POGLAVLJE C
Definicija kategorija
GSE status države članice ili treće zemlje ili pojedine od njihovih regija utvrđuje se razvrstavanjem u sljedeće kategorije:
A. KATEGORIJA 1.: Država ili regija slobodna od GSE
Država ili regija u kojoj je provedena analiza rizika zasnovana na podacima utvrđenima u poglavlju B koja je pokazala kako su tijekom mjerodavnog vremenskog razdoblja poduzete odgovarajuće mjere rješavanja bilo kojeg utvrđenog rizika te:
|
1. |
ILI nije bio zabilježen niti jedan slučaj GSE i:
|
|
2. |
ILI tamo gdje se jasno pokazalo kako svi slučajevi GSE potječu izravno od uvoza živih goveda ili goveđih zametaka/jajnih stanica, te da su sva zaražena goveda, kao i ako je riječ o ženkama, njihovo posljednje potomstvo rođeno dvije godine prije ili nakon prvih kliničkih znakova pojave bolesti, ako su živa u državi ili regiji, usmrćena i u potpunosti uništena te; ili
|
|
3. |
ILI tamo gdje je posljednji domaći slučaj GSE prijavljen prije više od sedam godina, kriterijima iz poglavlja A točke (b) do (e) udovoljava se najmanje sedam godina, a hranidba preživača mesno-koštanim brašnom ili lojem koji potječu od preživača je zabranjena i zabrana se učinkovito provodi tijekom razdoblja od najmanje osam godina. |
B. KATEGORIJA 2.: Država ili regija privremeno slobodna od GSE u kojoj nije prijavljen niti jedan domaći slučaj bolesti
Država ili regija u kojoj je provedena analiza rizika opisana u poglavlju B,koja je pokazala kako su tijekom mjerodavnog vremenskog razdoblja poduzete odgovarajuće mjere rješavanja bio kojeg utvrđenog rizika te:
|
1. |
ILI nije bio zabilježen niti jedan slučaj GSE i:
|
|
2. |
ILI tamo gdje se jasno pokazalo kako svi slučajevi GSE potječu izravno od uvoza živih goveda ili goveđih zametaka/jajnih stanica, te ako su sva zaražena goveda, kao i ako je riječ o ženkama, njihovo posljednje potomstvo rođeno dvije godine prije ili nakon prvih kliničkih znakova pojave bolesti, ako su živa u državi ili regiji, usmrćena i u potpunosti uništena te; ili
|
C. KATEGORIJA 3.: Država ili regija privremeno slobodna od GSE gdje je prijavljen najmanje jedan domaći slučaj bolesti
Bilo koja država ili regija u kojoj je provedena analiza rizika zasnovana na podacima utvrđenima u poglavlju B koja je pokazala kako su tijekom mjerodavnog vremenskog razdoblja poduzete odgovarajuće mjere rješavanja bilo kojeg utvrđenog rizika te:
|
1. |
ILI je posljednji domaći slučaj GSE-a bio zabilježen prije više od sedam godina, kriterijima iz poglavlja A točke (b) do (e) se udovoljava a zabrana hranidbe preživača mesno-koštanim brašnom ili lojem dobivenima od preživača učinkovito se provodi, ali:
|
|
2. |
ILI ako je posljednji domaći slučaj bio zabilježen prije manje od sedam godina, učestalost pojavljivanja GSE, izračunana na temelju broja domaćih slučajeva, manja je od jednog slučaja na milijun tijekom svakog od posljednja četiri uzastopna razdoblja od dvanaest mjeseci kod populacije goveda starijih od 24 mjeseca u državi ili regiji ili – ako populacija goveda starijih od 24 mjeseca u državi ili regiji ne prelazi milijun životinja – jedan slučaj po stvarnom broju predmetne populacije (izračunano na temelju statističkih podataka Eurostata), te ako se:
|
D. KATEGORIJA 4.: Država ili regija s niskom učestalošću pojavljivanja GSE
Svaka država ili regija u kojoj se:
|
1. |
kriterijima navedenima u poglavlju A udovoljava, a učestalost pojavljivanja GSE, izračunana tijekom posljednjih 12 mjeseci, veća je ili jednaka jednom domaćem slučaju na milijun, a manja ili jednaka stotinu slučajeva na milijun kod populacije goveda starijih od 24 mjeseca u državi ili regiji; ili |
|
2. |
kriterijima navedenima u poglavlju A udovoljava, a učestalost pojavljivanja GSE, izračunana kao što je utvrđeno točkom 1. manja je od jednog domaćeg slučaja na milijun u manje od četiri uzastopna razdoblja od dvanaest mjeseci, a zaražena stoka, kao i:
ako su još uvijek živa u predmetnoj državi ili regiji, usmrćuju i u potpunosti uništavaju. Kod ovog razvrstavanja, uzima se u obzir, odstupajući od ove točke, postojanje drugih mjera koje nude jednakovrijednu razinu zaštite u odnosu na usmrćivanje životinja koje su u opasnosti. Države ili regije kod kojih je učestalost pojavljivanja GSE, izračunana tijekom posljednjih 12 mjeseci manja od jednog domaćeg slučaja na milijun kod populacije goveda starijih od 24 mjeseca u državi ili regiji, no u kojima je provedena analiza rizika opisana u poglavlju A koja je pokazala kako nije udovoljeno najmanje jednom od kriterija koji omogućuju pojedinoj državi ili regiji da bude razvrstane u kategoriju 2. ili 3., moraju se smatrati državama ili regijama koje spadaju u kategoriju 4. |
E. KATEGORIJA 5.: Država ili regija s visokom učestalošću pojavljivanja GSE
Svaka država ili regija u kojoj:
|
1. |
se kriterijima navedenima u poglavlju A udovoljava, a učestalost pojavljivanja GSE, izračunana tijekom posljednjih 12 mjeseci, veća je od stotinu slučajeva na milijun kod populacije goveda starijih od 24 mjeseca u državi ili regiji; ili |
|
2. |
učestalost pojavljivanja GSE, izračunana tijekom posljednjih 12 mjeseci, veća je ili jednaka jednom slučaju na milijun, a manja od ili jednaka stotinu slučajeva na milijun kod populacije goveda starijih od 24 mjeseca u državi ili regiji, pri čemu nije udovoljeno najmanje jednom od kriterija navedenih u poglavlju A. |
PRILOG III.
SUSTAV PRAĆENJA
POGLAVLJE A
I. MINIMALNI ZAHTJEVI ZA PROGRAM PRAĆENJA GSE KOD GOVEDA
1. Odabir pod-populacija
Goveda starija od 30 mjeseci kako slijedi:
1.1. Životinje koje podliježu „klanju u nuždi”, kako je utvrđeno u članku 2. točki (n) Direktive 64/433/EEZ (1) te životinje koje su zaklane u skladu s Prilogom I. poglavljem VI. točkom 28. (c) Direktive 64/433/EEZ (uključujući životinje iz Uredbe (EZ) br. 716/96 (2) koje podliježu gore navedenom ‚klanju u nuždi’ ili koje su zaklane u skladu s Prilogom I. poglavljem VI. točkom 28. (c) Direktive 64/433/EEZ).
1.2. Mrtve životinje koje nisu zaklane za prehranu ljudi, a koje su uginule na gospodarstvu ili tijekom transporta (isključujući životinje iz Uredbe Komisije (EZ) br. 716/96).
1.3. Životinje koje su normalno zaklane za prehranu ljudi.
1.4. Životinje koje pokazuju neurološke poremećaje.
2. Veličina uzorka
2.1. Broj uzoraka ispitanih u godinu dana u svakoj državi članici iz pod-populacije iz točke 1.1. mora uključiti sve životinje u toj pod-populaciji.
2.2. Broj uzoraka ispitanih godišnje u svakoj državi članici iz pod-populacije iz točke 1.2 ne smije biti manji od veličina uzorka navedenih dolje u tablici. Odabir uzoraka treba biti nasumičan. Uzorkovanje mora biti reprezentativno za svaku regiju i kontinuirano.
2.3. Broj uzoraka ispitanih godišnje u svakoj državi članici iz pod-populacije iz točke 1.3 mora uključiti sve životinje iz te pod-populacije.
|
Ukupna populacija starija od 30 mjeseci (3) |
Veličina uzorka (4) |
|
100 000 |
950 |
|
200 000 |
1 550 |
|
300 000 |
1 890 |
|
400 000 |
2 110 |
|
500 000 |
2 250 |
|
600 000 |
2 360 |
|
700 000 |
2 440 |
|
800 000 |
2 500 |
|
900 000 |
2 550 |
|
1 000 000 |
2 590 |
|
1 500 000 |
3 000 |
|
2 000 000 |
3 500 |
|
2 500 000 |
4 000 |
|
3 000 000 |
4 500 |
|
3 500 000 |
5 000 |
|
4 000 000 |
5 500 |
|
4 500 000 |
6 000 |
|
5 000 000 |
6 500 |
|
5 500 000 |
7 000 |
|
6 000 000 |
7 500 |
|
6 500 000 |
8 000 |
|
7 000 000 |
8 500 |
|
7 500 000 |
9 000 |
|
8 000 000 |
9 500 |
|
8 500 000 |
10 000 |
|
9 000 000 |
10 500 |
|
9 500 000 |
11 000 |
|
10 000 000 |
11 500 |
|
10 500 000 |
12 000 |
|
11 000 000 |
12 500 |
|
11 500 000 |
13 000 |
|
12 000 000 |
13 500 |
II. MINIMALNI ZAHTJEVI ZA PROGRAM PRAĆENJA GREBEŽI OVACA KOD OVACA I KOZA
1. Odabir pod-populacija
Odabir se obavlja putem analize rizika pod-populacija životinja rođenih na gospodarstvu koje pokazuju kliničke znakove kompatibilne s grebeži ovaca. Odabir mora biti nasumičan unutar svake pod-populacije i starosne skupine.
Sljedeći kriteriji koriste se kao kriteriji za odabir:
|
— |
životinje koje pokazuju znakove neurološkog poremećaja odnosno poremećaja u ponašanju koje traje najmanje 15 dana, te koje je otporno na liječenje, |
|
— |
životinje na umoru bez znakova infektivne ili traumatske bolesti, |
|
— |
životinje koje pokazuju druga stanja progresivne bolesti. |
Ovce i koze moraju se pregledati na grebež ovaca, a tamo gdje su testovi kojima se u praksi može pokazati razlika među različitim oblicima TSE dostupni, i na GSE.
2. Starost ciljne skupine životinja
Uzorak se mora usredotočiti na najstarije životinje u pod-populaciji. Međutim, sve ciljane životinje moraju biti starije od 12 mjeseci.
3. Veličina uzorka
Najmanji broj životinja koje je potrebno pregledati na godišnjoj osnovi mora biti u skladu s veličinama uzoraka iz tablice. Životinje pregledane u skladu s člankom 12. mogu biti obuhvaćene najmanjom veličinom uzorka.
Tablica
Najmanji broj godišnjih neurohistoloških pretraga životinja koje pokazuju znakove kompatibilne s TSE
|
Ukupna populacija starija od 12 mjeseci (5) |
Veličina uzorka |
|
100 000 |
10 |
|
300 000 |
30 |
|
500 000 |
50 |
|
700 000 |
69 |
|
1 000 000 |
99 |
|
2 500 000 |
195 |
|
5 000 000 |
300 |
|
7 000 000 |
336 |
|
10 000 000 |
367 |
|
20 000 000 |
409 |
|
30 000 000 |
425 |
|
40 000 000 |
433 |
III. PRAĆENJE ŽIVOTINJA KOD KOJIH JE OPASNOST OD ZARAZE VEĆA
Praćenje životinja kod kojih je opasnost od zaraze veća
Pored programa praćenja navedenih u dijelu I. i II., države članice mogu na dobrovoljnoj osnovi provoditi ciljano praćenje TSE kod životinja kod kojih je opasnost od zaraze veća, poput:
|
— |
životinja koje potječu iz država u kojima je TSE udomaćena, |
|
— |
životinja koje su hranjene potencijalno zaraženom stočnom hranom, |
|
— |
životinja koje su rođene ili potječu od ženki zaraženih s TSE. |
IV. ZAJEDNIČKE ODREDBE
Države članice osiguravaju da se niti jedan dio tijela životinja, koji se uzorkuje u skladu s ovim Prilogom, ne rabi za prehranu ljudi, hranidbu životinja i gnojiva, sve dok nisu dovršene laboratorijske pretrage s negativnim rezultatima.
POGLAVLJE B
I. INFORMACIJE KOJE DRŽAVE ČLANICE MORAJU PRIKAZATI U SVOJIM IZVJEŠĆIMA
|
1. |
broj sumnjivih slučajeva po životinjskim vrstama za koje je uvedeno ograničenje premještanja u skladu s člankom 12. stavkom 1.; |
|
2. |
broj sumnjivih slučajeva po životinjskim vrstama koje podliježu laboratorijskim pretragama u skladu s člankom 12. stavkom 2. kao i ishod pretraga; |
|
3. |
procijenjena veličina svake pod-populacije iz poglavlja A dijela I. točke 1.; |
|
4. |
broj goveda ispitanih unutar svake pod-populacije iz poglavlja A dijela I. točke 1., a u poglavlju A dijelu III. metoda odabira uzorka i ishod pretraga; |
|
5. |
broj ovaca i koza ispitanih unutar svake pod-populacije iz poglavlja A dijela II., točke 1., a u poglavlju A dijelu III. metoda odabira uzorka i ishod ispitivanja; |
|
6. |
broj, starosna i zemljopisna razdioba pozitivnih slučajeva GSE i grebeži ovaca. Potrebno je navesti godinu i, tamo gdje je to moguće, mjesec rođenja kod slučajeva GSE rođenih nakon uvođenja zabrane uporabe bjelančevina dobivenih iz preživača u hrani za životinje; |
|
7. |
pozitivni slučajevi TSE potvrđeni kod drugih životinja osim goveda, ovaca i koza. |
II. INFORMACIJE KOJE KOMISIJA MORA PRIKAZATI U OBLIKU SAŽETKA
Sažetak se predstavlja u obliku tablice koja obuhvaća barem sljedeće informacije za svaku državu članicu:
|
1. |
ukupnu populaciju goveda starijih od 24 mjeseca, te procijenjenu veličinu svake pod-populacije iz poglavlja A dijela I. točke 1.; |
|
2. |
broj sumnjivih slučajeva po životinjskim vrstama kako je navedeno u članku 12.; |
|
3. |
broj ispitanih goveda kako je navedeno u poglavlju A dijelu I. točki 1.; |
|
4. |
broj ovaca i koza ispitanih kako je navedeno u poglavlju A dijela II. točki 1.; |
|
5. |
broj i starosna razdioba pozitivnih slučajeva GSE; |
|
6. |
pozitivni slučajevi GSE rođenih nakon uvođenja zabrane hranidbe te godina i mjesec rođenja; |
|
7. |
pozitivni slučajevi grebeži ovaca; |
|
8. |
pozitivni slučajevi TSE kod drugih životinja osim goveda, ovaca i koza. |
III. EVIDENCIJE
|
1. |
Nadležno tijelo čuva, u trajanju od sedam godina, sljedeće evidencije:
|
|
2. |
Istražni laboratorij čuva, u trajanju od sedam godina, sve evidencije provedenih testova, posebno laboratorijskih dnevnika, parafinskih blokova te, tamo gdje je to prikladno, fotografije analiza Western-blot. |
(1) Direktiva Vijeća 64/433/EEZ od 26. lipnja 1964. o zdravstvenim problemima koji utječu na trgovinu svježim mesom unutar Zajednice (SL 121, 29.7.1964., str. 2012/64.). Direktiva kako je zadnje izmijenjena Direktivom 95/23/EZ (SL L 243, 11.10.1993., str. 7.).
(2) Uredba Komisije (EZ) br. 716/96 od 19. travnja 1996. o donošenju izvanrednih mjera potpore tržištu govedine u Ujedinjenoj Kraljevini (SL L 99, 20.4.1996., str. 14.). Uredba kako je zadnje izmijenjena Uredbom (EZ) br. 1176/2000 Komisije (SL L 131, 1.6.2000., str. 37.).
(3) Ako je veličina ukupne populacije starije od 30 mjeseci nepoznata, kao osnova se uzima veličina populacije starije od 24 mjeseca.
(4) Veličina uzorka izračunava se kako bi se otkrilo prevladavanje od 0.1 % uz pouzdanost od 95 % kod pod-populacije iz točke 1., zasnovano na pretpostavci kako udio ovih pod-populacija u ukupnoj populaciji goveda starijih od 30 mjeseci iznosi 1 %. Ako veličina ukupne populacije goveda starijih od 30 mjeseci iznosi 1 500 000 životinja ili više, veličina uzorka povećava se za 500 uzoraka na svakih 500 000 životinja kao razmjerna prilagodba, kako bi se uzela u obzir veća vjerojatnost varijacija opasnosti od GSE unutar predmetne populacije.
(5) Ako je veličina ukupne populacije starije od 12 mjeseci nepoznata, veličina uzorka zasniva se na ukupnoj populaciji starijoj od 6 mjeseci.
PRILOG IV.
HRANIDBA ŽIVOTINJA
|
1. |
U državama članicama ili njihovim regijama koje su uvrštene u kategoriju 5. zabrana iz članka 7. stavka 1. proširuje se na:
|
|
2. |
Zabrana predviđena člankom 7. stavkom 1. i 2. ne primjenjuje se na sljedeće proizvode od zdravih životinja:
|
PRILOG V.
SPECIFICIRANI RIZIČNI MATERIJAL
1. Sljedeća tkiva su određena kao specificirani rizični materijal, ovisno o kategoriji države članice ili treće zemlje podrijetla ili prebivanja životinje, što je utvrđeno u skladu s člankom 5.:
|
|
KATEGORIJE 1. i 2. Nema. |
|
|
KATEGORIJE 3. i 4.
|
|
|
KATEGORIJA 5.
|
2. Specificirani rizični materijal odstranjuje se u:
|
(a) |
klaonicama; |
|
(b) |
rasjekavaonicama, pogonima ili prostorijama za preradu visoko rizičnih tkiva iz članaka 3. i 7. Direktive 90/667/EEZ (1), pod nadzorom ovlaštenog predstavnika koga je imenovalo nadležno tijelo. U tu svrhu, nadležno tijelo odobrava navedene proizvodne objekte. |
Međutim, dopušteno je odstraniti kralježnicu na mjestima prodaje potrošaču koji se nalazi na području predmetne države članice.
Ako specificirani rizični materijal nije odstranjen s mrtvih životinja koje nisu bile zaklane za prehranu ljudi, dijelovi trupla koji sadrže specificirani rizični materijal ili cijeli trup smatrat će se specificiranim rizičnim materijalom.
3. Sav specificirani rizični materijal se boji bojom i, prema potrebi, označava markerom odmah po odstranjivanju tkiva, i u cijelosti se uništava:
|
(a) |
spaljivanjem bez prethodne prerade; ili |
|
(b) |
pod uvjetom da boja ili marker ostaju vidljivi, nakon prethodne prerade:
|
4. Države članice mogu odstupiti od odredaba iz točke 2. i 3. kako bi dopustile spaljivanje ili zakapanje specificiranog rizičnog materijala ili cijelih trupova, bez prethodnog bojenja, ili, tamo gdje je to primjereno, uklanjanje specificiranog rizičnog materijala u okolnostima navedenima u članku 3. stavku 2. Direktive 90/667/EEZ, te sukladno s metodom koja isključuje svaku opasnost od prenošenja TSE te koju je odobrilo i koju nadzire nadležno tijelo, posebno ako su životinje uginule ili su usmrćene u kontekstu mjera za kontrolu bolesti i ne dovodeći u pitanje članak 12. i 13.
5. Uporaba alternativnog testa za odstranjivanje specificiranog rizičnog materijala može se odobriti pod sljedećim uvjetima:
|
(a) |
testovi se moraju provesti u klaonicama na svim životinjama koje dolaze u obzir za odstranjivanje specificiranog rizičnog materijala; |
|
(b) |
niti jedan proizvod dobiven od goveda, ovaca ili koza namijenjen prehrani ljudi ili životinja ne smije napustiti klaonicu prije nego što je nadležno tijelo zaprimilo i prihvatilo rezultate testova kojima su bile podvrgnute sve zaklane životinje kod kojih postoji mogućnost da su zaražene ako je GSE potvrđena kod jedne od njih; |
|
(c) |
ako alternativni test pokaže pozitivan rezultat, sav materijal goveda, ovaca i koza kod kojeg postoji mogućnost da je zaražen u klaonici treba uništiti u skladu s točkom 3., osim ako se svi dijelovi trupla uključujući kožu zaražene životinje mogu označiti i pohraniti odvojeno od ostalih. |
6. Države članice trebaju vršiti učestale službene preglede kako bi nadgledale pravilnu primjenu ovog Priloga i osigurale poduzimanje mjera za izbjegavanje zaraze, posebno u klaonicama, rasjekavaonicama, pogonima za preradu životinjskog otpada, pogonima ili prostorima za preradu visoko rizičnih tkiva koje su države članice odobrile u skladu s člankom 7. Direktive 90/667/EEZ, na mjestima prodaje potrošačima, odlagalištima otpada te drugim objektima za skladištenje ili spaljivanje.
7. Države članice trebaju posebno uspostaviti sustav kojim će se osigurati i kontrolirati sljedeće:
|
(a) |
specificirani rizični materijal koji se rabi u proizvodnji proizvoda iz članka 1. stavka 2. koristi se isključivo za odobrene namjene; |
|
(b) |
ako goveda, ovce ili koze ulaze u državu članicu koja je uvrštena u brojčano nižu kategoriju s oznakom boljega GSE statusa od onoga koji imaju životinje koje ulaze, navedene životinje ostaju pod službenim nadzorom sve do klanja ili otpremanja s njezinog područja; |
|
(c) |
specificirani rizični materijal, posebno ako se odstranjivanje provodi u objektima ili prostorima koje nisu klaonice, u potpunosti se odvaja od ostalog otpada koji nije namijenjen spaljivanju, odvojeno se sakuplja i odstranjuje u skladu s točkom 2., 3. i 4. Država članica može odobriti otpremanje glava ili trupova koje sadrže specificirani rizični materijal drugoj državi članici prema dogovoru s tom drugom državom članicom na temelju kojeg će ona prihvatiti navedeni materijal i primijeniti posebne uvjete koje treba ispuniti za takva premještanja. |
8. Države članice mogu poslati specificirani rizični materijal ili materijal dobiven njegovim prerađivanjem drugim državama članicama za potrebe spaljivanja samo pod uvjetima iz članka 4. stavka 2. Odluke 97/735/EZ (4), tamo gdje je to primjenjivo.
Te se točke mogu izmijeniti na zahtjev države članice kako bi se dopustilo otpremanje specificiranog rizičnog materijala ili materijala dobivenog njegovim prerađivanjem trećim zemljama za potrebe spaljivanja. Uvjeti koji uređuju izvoz usvajaju se istodobno poštujući isti postupak.
(1) Direktiva Vijeća 90/667/EEZ od 27. studenoga 1990. o utvrđivanju veterinarskih pravila za uklanjanje i preradu životinjskog otpada, njegovo stavljanje u promet i sprečavanje pojave patogena u stočnoj hrani životinjskog ili ribljeg podrijetla, kojom se izmjenjuje Direktiva 90/425/EEZ (SL L 363, 27.12.1990., str. 51.). Direktiva kako je zadnje izmijenjena Aktom o pristupanju iz 1994.
(2) Odluka Komisije 92/562/EEZ od 17. studenoga 1992. o odobrenju alternativnih sustava toplinske obrade za preradu visoko rizičnih tkiva (SL L 359, 9.12.1992., str. 23.). Odluka kako je izmijenjena Aktom o pristupanju iz 1994.
(3) Odluka Vijeća 1999/534/EZ od 19. srpnja 1999. o mjerama koje se primjenjuju na preradu određenog životinjskog otpada u svrhu zaštite od transmisivne spongiformne encefalopatije te o izmjenama Odluke Komisije 97/735/EZ (SL L 204, 4.8.1999., str. 37.).
(4) Odluka Komisije 97/735/EZ od 21. listopada 1997. o određenim mjerama zaštite u pogledu trgovine različitim vrstama životinjskog otpada dobivenim od sisavaca (SL L 294, 28.10.1997., str. 7.). Odluka kako je izmijenjena Odlukom Vijeća 1999/534/EZ (SL L 204, 4.8.1999., str. 37.).
PRILOG VI.
STANDARDI ZA ODREĐENE PROIZVODE ŽIVOTINJSKOG PODRIJETLA KOJI SU DOBIVENI IZ MATERIJALA OD PREŽIVAČA ILI KOJI IH SADRŽE
Uporaba materijala od preživača za proizvodnju sljedećih proizvoda životinjskog podrijetla zabranjuje se kako je navedeno u članku 9. stavku 1.:
|
(a) |
strojno otkošteno meso; |
|
(b) |
dikalcijev fosfat namijenjen za stočnu hranu; |
|
(c) |
želatina, osim ako je proizvedena od kože preživača; |
|
(d) |
prerađevine dobivene od otopljene masnoće preživača; |
|
(e) |
otopljena masnoća preživača, osim ako je proizvedena iz:
|
PRILOG VII.
ISKORJENJIVANJE TRANSMISIVNE SPONGIFORMNE ENCEFALOPATIJE
|
1. |
Istragom iz članka 13. stavka 1. točke (b) mora se utvrditi sljedeće:
|
|
2. |
Mjere navedene u članku 13. stavku 1. uključuju barem sljedeće:
|
PRILOG VIII.
STAVLJANJE NA TRŽIŠTE I IZVOZ
POGLAVLJE A
Uvjeti za trgovinu živim životinjama, zamecima i jajnim stanicama unutar Zajednice
I. UVJETI KOJI SE PRIMJENJUJU NEOVISNO O KATEGORIJI DRŽAVE ČLANICE ILI TREĆE ZEMLJE PODRIJETLA ILI BORAVIŠTA ŽIVOTINJE
1. Za otpremanje u druge države članice potrebno je poštovati pravila iz članka 15. stavka 1.
2. Sljedeći uvjeti primjenjuju se na kretanje goveđih zametaka i jajnih stanica:
Goveđi zameci i jajne stanice trebaju potjecati od ženki koje, u vrijeme sakupljanja:
|
— |
nisu bile pod sumnjom da su zaražene s GSE, |
|
— |
same udovoljavaju uvjetima propisanima u dijelu II. |
3. Sljedeći uvjeti primjenjuju se na trgovinu ovcama i kozama:
|
(a) |
Ovce i koze za rasplod moraju:
|
|
(b) |
Država članica koja posjeduje obvezan ili dobrovoljan nacionalni program kontrole grebeža ovaca za cijelo svoje područje ili njezin dio:
|
|
(c) |
Ako država članica smatra da je njezino područje ili dio njezinog područja slobodno od grebeži ovaca:
|
II. UVJETI KOJI SE PRIMJENJUJU OVISNO O KATEGORIJI DRŽAVE ČLANICE PODRIJETLA ILI BORAVIŠTA ŽIVOTINJE, UTVRĐENOJ U SKLADU S POGLAVLJEM C PRILOGOM II.
|
1. |
Za otpremanje u druge države članice potrebno je poštovati pravila iz članka 15. stavka 1. |
|
2. |
GSE-kategoriju države članice glede podrijetla goveda, ovaca i koza potrebno je priopćiti odredišnoj državi članici. |
|
3. |
Sljedeći uvjeti primjenjuju se na promet iz točke 1. goveda koja dolaze iz ili su boravila u državama članicama ili jednoj od njihovih regija, uvrštenih u:
|
POGLAVLJE B
Uvjeti koji se odnose na potomstvo životinja kod kojih postoji sumnja ili je potvrđena TSE, na koje se odnosi članak 15. stavak 2.
Zabranjuje se stavljanje na tržište zadnje rođenih potomaka ženki goveda zaraženih s TSE ili od ovaca ili koza kod kojih je potvrđen GSE tijekom proteklog razdoblja od dvije godine ili tijekom razdoblja nakon pojave prvih kliničkih znakova začetka bolesti.
POGLAVLJE C
Uvjeti za trgovinu određenim proizvodima životinjskog podrijetla unutar Zajednice
I. Sljedeći proizvodi životinjskog podrijetla izuzeti su od zabrane iz članka 16. stavka 3. pod uvjetom da su podrijetlom od goveda koja udovoljavaju dolje navedenim zahtjevima iz dijela II. ili III.:
|
— |
svježe meso, |
|
— |
mljeveno meso, |
|
— |
mesne prerađevine, |
|
— |
mesni proizvodi, |
|
— |
hrana za kućne ljubimce namijenjena domaćim mesožderima. |
Program utemeljen na datumu (rođenja životinja)
II. Otkošteno svježe meso s koga je odstranjeno sve prianjajuće tkivo, uključujući jasno vidljivo živčano i limfno tkivo, i iz njega dobiveni proizvodi životinjskog podrijetla iz dijela I. dobiveni od prikladnih životinja iz država ili regija uvrštenih u kategoriju 5., mogu se staviti na tržište u skladu s drugim podstavkom članka 16. stavka 3. ako su dobiveni od životinja rođenih nakon datuma od kojega se standardi za hranidbu životinja navedeni u članku 7. stavku 2. učinkovito provode, te kod kojih je potvrđeno da ispunjavaju uvjete iz točke 1. i da su proizvedeni u proizvodnim objektima koji zadovoljavaju uvjet iz točke 9. Nadležno tijelo osigurava ispunjavanje uvjeta u vezi kontrolnih pregleda navedenih u točkama 2. do 8. i točki 10.
1. Govedo se smatra prikladnim za uvrštenje u Program utemeljen na datumu (rođenja životinja) ako je rođeno i uzgajano u predmetnoj državi članici, te ako se tijekom klanja može potvrditi kako su ispunjeni sljedeći uvjeti:
|
(a) |
životinju se tijekom cijelog života može jasno identificirati, čime je omogućeno njezino praćenje unatrag do majke i stada podrijetla; njezin jedinstveni broj ušne markice; datum i gospodarstvo na kome je oteljena i svaki promet nakon rođenja bilježi se ili u službenu stočnu putovnicu ili u službeni elektronički sustav identifikacije i praćenja životinja; identitet majke životinje je poznat; |
|
(b) |
životinja je starija od šest mjeseci ali mlađa od 30 mjeseci, što je razvidno iz službene elektroničke evidencije o datumu njezina rođenja ili iz njezine stočne putovnice; |
|
(c) |
nadležno tijelo pribavilo je i provjerilo pozitivne dokaze da je majka goveda živjela najmanje šest mjeseci nakon rođenja prikladne životinje; |
|
(d) |
majka goveda nije oboljela od GSE i ne postoji sumnja da se zarazila s GSE. |
2. Ako bilo koja životinja privedena za klanje ili bilo koja okolnost pri njezinu klanju ne ispunjava sve zahtjeve iz ove Uredbe, životinja se mora automatski odbiti a njezina putovnica oduzeti. Ako takva informacija postane dostupna nakon klanja, nadležno tijelo mora odmah prekinuti izdavanje certifikata i otkazati certifikate koje je izdalo. Ako je pošiljka već otpremljena, nadležno tijelo mora obavijestiti nadležno tijelo mjesta odredišta. Nadležno tijelo mjesta odredišta mora poduzeti odgovarajuće mjere.
3. Klanje prikladnih životinja mora se obavljati u klaonicama koje se ne rabe za klanje drugih goveda osim onih koja su namijenjena klanju prema Programu utemeljenom na datumu (rođenja životinja) ili prema Programu potvrđenih stada.
4. Nadležno tijelo mora se uvjeriti kako postupci koji se rabe u rasjekavaonicama jamče odstranjivanje sljedećih limfnih čvorova:
poplitealni (Lnn. poplitei), ishiadični (Lnn. ischiadici), površinski preponski (Lnn. inguinales superficiales), dubinski preponski (Lnn. inguinales profund.), medialni i lateralni (Lnn. iliaci mediales et laterales), renalni (Lnn. renales), prefemoralni, Lnn. prefemorales, lumbalni (Lnn. lumbales), kostocervikalni (Lnn. costocervicales), sternalni (Lnn. sternales), preskapularni (Lnn. prescapulares), aksilarni (Lnn. axillares), kaudalni i dubinski cervikalni (Lnn. cervicales profundi caudales).
5. Mora postojati mogućnost praćenja mesa unatrag do stada prikladne životinje ili, nakon rezanja, do životinja koje su bile rezane u istoj seriji, na temelju elektroničkog sustava praćenja sve do trenutka klanja. Nakon klanja, potrebno je pomoću deklaracija osigurati praćenje svježeg mesa i proizvoda iz dijela I. Unatrag do prikladne životinje, kako bi se omogućilo povlačenje predmetne pošiljke iz prometa. U slučaju hrane za kućne ljubimce, praćenje se mora omogućiti pomoću pratećih dokumenata i zapisa.
6. Sve odobrena trupla moraju biti označena jedinstvenim brojevima koji odgovaraju broju ušne markice.
7. Država članica mora uspostaviti detaljne protokole koji obuhvaćaju:
|
(a) |
praćenje i kontrolne preglede prije klanja; |
|
(b) |
kontrolne preglede tijekom klanja; |
|
(c) |
kontrolne preglede tijekom prerade hrane za kućne ljubimce; |
|
(d) |
sve zahtjeve o označavanju i potvrđivanju nakon klanja do mjesta prodaje. |
8. Nadležno tijelo mora uspostaviti sustav bilježenja provjera o sukladnosti tako da je moguće provjeriti i dokazati kontrolne preglede.
|
9. |
Da bi proizvodni objekt dobio odobrenje, mora osmisliti i uspostaviti sustav kojim se osigurava označivanje u smislu identifikacije prikladnog mesa i/ili proizvoda te kojim je omogućeno praćenje svog mesa unatrag do prikladne životinje ili, nakon rezanja, do životinja koje su izrezane u istoj seriji. Sustav mora omogućiti potpuno praćenje mesa ili proizvoda životinjskog podrijetla u svim fazama, a zapise je potrebno čuvati najmanje dvije godine. Uprava proizvodnog objekta mora u pismenom obliku predočiti nadležnom tijelu detalje o sustavu koji se rabi. |
|
10. |
Nadležno tijelo mora ocijeniti, odobriti i nadzirati sustav koji je proizvodni objekt predočio kako bi osiguralo potpuno izdvajanje i praćenje prema unatrag i naprijed. |
Program potvrđenih stada
III. Otkošteno svježe meso s koga je odstranjeno sve prianjajuće tkivo, uključujući jasno vidljivo limfno i živčano tkivo, i iz njega dobiveni proizvodi životinjskog podrijetla iz dijela I. dobiveni od prikladnih životinja iz država ili regija uvrštenih u kategoriju 5. mogu se stavljati na tržište u skladu s drugim podstavkom članka 16. stavka 3. ako su dobiveni od životinja za koje je potvrđeno kako ispunjavaju uvjete iz točke 2. i dolaze iz stada u kojima se nije pojavio niti jedan slučaj GSE u proteklih sedam godina, te za koje je potvrđeno da ispunjavaju uvjete iz točke 1. i da su proizvedene u proizvodnim objektima koji zadovoljavaju uvjet iz točke 11. Nadležno tijelo osigurava ispunjavanje uvjeta iz točaka 3. do 10. i 12. u vezi s elektroničkim sustavom praćenja i kontrolnih pregleda.
|
1. |
|
|
2. |
|
|
3. |
Službeni elektronički sustav praćenja iz točke 2.(a) odobrava se samo ako je u funkciji dovoljno dugo da sadrži sve informacije u vezi životne dobi i kretanja životinja koje su nužne za provjeru sukladnosti sa zahtjevima ove Uredbe, i tiču se samo životinja koje su rođene nakon što je sustav počeo djelovati. U tu svrhu ne prihvaćaju se stari podaci uneseni u računalo za bilo koje razdoblje prije nego što je sustav počeo djelovati. |
4. Ako bilo koja životinja privedena za klanje ili bilo koja okolnost pri njezinu klanju ne ispunjava sve zahtjeve iz ove Uredbe, životinja se mora automatski odbiti a njezina stočna putovnica oduzeti. Ako takva informacija postane dostupna nakon klanja, nadležno tijelo mora odmah prekinuti izdavanje certifikata i otkazati certifikate koje je izdalo. Ako je pošiljka već otpremljena, nadležno tijelo mora obavijestiti nadležno tijelo u mjestu odredišta. Nadležno tijelo u mjestu odredišta mora poduzeti odgovarajuće mjere.
5. Klanje prikladnih životinja mora se obavljati u klaonicama koje se isključivo rabe za klanje životinja iz Programa utemeljenog na datumu (rođenja životinja), ili iz Programa potvrđenih stada.
6. Nadležno tijelo mora se uvjeriti kako postupci koji se rabe u rasjekavaonicama jamče odstranjivanje sljedećih limfnih čvorova:
poplitealni (Lnn. poplitei), ishiadični (Lnn. ischiadici), površinski preponski (Lnn. inguinales superficiales), dubinski preponski (Lnn. inguinales profund.), medialni i lateralni iliakalni (Lnn. iliaci mediales et laterales), renalni (Lnn. renales), prefemoralni (Lnn.prefemoralesl.), lumbalni (Lnn. lumbales), kostocervikalni (Lnn. costocervicales), sternalni (Lnn. sternales), preskapularni (Lnn. prescapulares), aksilarni (Lnn. axillares), kaudalni i dubinski cervikalni (Lnn. cervicales profundi caudales).
7. Mora postojati mogućnost praćenja mesa unatrag do stada prikladne životinje, ili, nakon rezanja, do životinja koje su bile rezane u istoj seriji, pomoću elektroničkog sustava praćenja, sve do trenutka klanja. Nakon klanja, potrebno je pomoću deklaracija osigurati praćenje svježeg mesa i proizvoda iz dijela I. unatrag sve do stada kako bi se omogućilo povlačenje predmetne pošiljke iz prometa. U slučaju hrane za kućne ljubimce, praćenje se mora omogućiti pomoću pratećih dokumenata i zapisa.
8. Sva odobrene prikladna trupla moraju biti označene jedinstvenim brojevima koji odgovaraju broju ušne markice.
9. Država članica mora uspostaviti detaljne protokole koji obuhvaćaju:
|
(a) |
praćenje i kontrolne preglede prije klanja; |
|
(b) |
kontrolne preglede tijekom klanja; |
|
(c) |
kontrolne preglede tijekom prerade hrane za kućne ljubimce; |
|
(d) |
sve zahtjeve o označavanju i potvrđivanju nakon klanja do prodajnog mjesta. |
10. Nadležno tijelo mora uspostaviti sustav bilježenja provjera sukladnosti tako da je moguće provjeriti i dokazati kontrolne preglede.
|
11. |
Da bi proizvodni objekt dobio odobrenje, mora osmisliti i uspostaviti sustav kojim se osigurava označivanje u smislu identifikacije prikladnog mesa i/ili proizvoda, te kojim je omogućeno praćenje svog mesa unatrag do stada podrijetla, ili, nakon rezanja, do životinja koje su rezane u istoj seriji. Sustav mora omogućiti potpuno praćenje mesa ili proizvoda životinjskog podrijetla u svim fazama, a zapise je potrebno čuvati najmanje dvije godine. Uprava proizvodnog objekta mora nadležnom tijelu u pismenom obliku predočiti detalje o sustavu koji se rabi. |
|
12. |
Nadležno tijelo mora ocijeniti, odobriti i nadzirati sustav koji je proizvodni objekt predočio kako bi se osiguralo potpuno izdvajanje i praćenje prema unatrag i prema naprijed. |
POGLAVLJE D
Uvjeti koji se primjenjuju na izvoz
Živa goveda i proizvodi životinjskog podrijetla dobiveni od njih moraju podlijegati – kada je riječ o izvozu u treće zemlje – propisima o trgovini unutar Zajednice utvrđenima ovom Uredbom.
PRILOG IX.
UVOZ U ZAJEDNICU ŽIVIH ŽIVOTINJA, ZAMETAKA, JAJNIH STANICA I PROIZVODA ŽIVOTINJSKOG PODRIJETLA
POGLAVLJE A
Kod uvoza iz država ili regija uvrštenih u kategoriju 1., nadležno tijelo dužno je, kod goveda i svih proizvoda goveđeg podrijetla za koje ova Uredba propisuje posebna pravila, zahtijevati predočenje međunarodnog certifikata o zdravlju životinja kojim se potvrđuje da država ili regija ispunjava uvjete iz poglavlja C. Priloga II. za uvrštenje u tu kategoriju.
POGLAVLJE B
Uvoz goveda
|
A. |
Kod uvoza goveda iz države ili regije uvrštene u kategoriju 2. potrebno je predočiti međunarodni certifikat o zdravlju životinja kojim se potvrđuje sljedeće:
|
|
B. |
Kod uvoza goveda iz država ili regija uvrštenih u kategoriju 3. potrebno je predočiti međunarodni certifikat o zdravlju životinja kojim se potvrđuje sljedeće:
|
|
C. |
Kod uvoza goveda iz država ili regija uvrštenih u kategoriju 4. potrebno je predočiti međunarodni certifikat o zdravlju životinja kojim se potvrđuje sljedeće:
|
|
D. |
Kod uvoza goveda iz država ili regija uvrštenih u kategoriju 5. potrebno je predočiti međunarodni certifikat o zdravlju životinja kojim se potvrđuje sljedeće:
|
POGLAVLJE C
Uvoz svježeg mesa i proizvoda podrijetlom od goveda
|
A. |
Kod uvoza svježeg mesa (s kostima ili otkoštenog) i proizvoda podrijetlom od goveda iz država ili regija uvrštenih u kategoriju 2. potrebno je predočiti međunarodni certifikat o zdravlju životinja kojim se potvrđuje da je hranidba preživača bjelančevinama dobivenim od sisavaca zabranjena, te da se zabrana učinkovito provodi. |
|
B. |
Kod uvoza svježeg mesa (s kostima ili otkoštenog) i proizvoda podrijetlom od goveda iz država ili regija uvrštenih u kategoriju 3. potrebno je predočiti međunarodni certifikat o zdravlju životinja kojim se potvrđuje sljedeće:
|
|
C. |
Kod uvoza svježeg mesa (s kostima ili otkoštenog) i mesnih proizvoda podrijetlom od goveda iz država ili regija uvrštenih u kategoriju 4. potrebno je predočiti međunarodni certifikat o zdravlju životinja kojim se potvrđuje sljedeće:
|
|
D. |
Zabranjuje se uvoz svježeg mesa i proizvoda podrijetlom od goveda iz država ili regija uvrštenih u kategoriju 5., osim proizvoda životinjskog podrijetla koji su navedeni u odjeljku I. poglavlja C Priloga VIII. Za takve vrste uvoza potrebno je predočiti međunarodni certifikat o zdravlju životinja kojim se potvrđuje da:
|
POGLAVLJE D
Uvoz goveđih zametaka i jajnih stanica
|
A. |
Kod uvoza goveđih zametaka/jajnih stanica iz država ili regija uvrštenih u kategoriju 2. potrebno je predočiti međunarodni certifikat o zdravlju životinja kojim se potvrđuje sljedeće:
|
|
B. |
Kod uvoza goveđih zametaka/jajnih stanica iz država ili regija uvrštenih u kategoriju 3. potrebno je predočiti međunarodni certifikat o zdravlju životinja, kojim se potvrđuje sljedeće:
|
|
C. |
Kod uvoza jajnih stanica/zametaka iz država ili regija uvrštenih u kategoriju 4. potrebno je predočiti međunarodni certifikat o zdravlju životinja kojim se potvrđuje sljedeće:
|
|
D. |
Kod uvoza goveđih zametaka/jajnih stanica iz država ili regija uvrštenih u kategoriju 5. potrebno je predočiti međunarodni certifikat o zdravlju životinja kojim se potvrđuje sljedeće:
|
POGLAVLJE E
Uvoz ovaca i koza
Ovce i koze koje se uvoze u Zajednicu moraju udovoljiti zahtjevima koji daju jednakovrijedna veterinarsko-zdravstvena jamstva jednakovrijedna jamstvima koja se traže ovom Uredbom ili koja su sukladna ovoj Uredbi.
POGLAVLJE F
Zabranjuje se uvoz u Zajednicu proizvoda životinjskog podrijetla iz poglavlja C Priloga VIII. iz trećih zemalja ili njihovih regija uvrštenih u kategoriju 5. u skladu s člankom 16. stavkom 3. ako sadrže ili su dobiveni od sljedećih proizvoda ili materijala dobivenih od preživača:
|
— |
strojno otkošteno meso, |
|
— |
dikalcijev fosfat namijenjen za hranidbu stoke, |
|
— |
želatina, osim ako je dobivena od koža, |
|
— |
otopljena masnoća preživača i iz nje proizvedeni derivati osim ako su proizvedeni od zasebnog adipoznog tkiva koje je proglašeno primjerenim za prehranu ljudi, ili iz sirovina koje su prerađene u skladu sa normama iz Odluke 1999/534/EZ. |
POGLAVLJE G
Kod uvoza proizvoda životinjskog podrijetla iz trećih zemalja ili njihovih regija koje nisu uvrštene u kategoriju 1., potrebno je nadopuniti odgovarajuće certifikate kako je propisano zakonodavstvom Zajednice, s izjavom koju potpisuje nadležno tijelo zemlje proizvođača koja glasi kako slijedi:
„Proizvod životinjskog podrijetla ne sadrži i nije dobiven iz specificiranog rizičnog materijala, kako je utvrđeno u Prilogu V. Uredbi (EZ) br. 999/2001 Europskog Parlamenta i Vijeća od 22. svibnja 2001. o utvrđivanju pravila za sprečavanje, kontrolu i iskorjenjivanje određenih transmisivnih spongiformnih encefalopatija ili strojno otkoštenog mesa dobivenog od kostiju glave ili kralježnice goveda. Životinje nisu zaklane nakon omamljivanja korištenjem plina, ubrizganog u kranijalnu šupljinu, niti su istom metodom ubijane odmah, niti su zaklane nakon omamljivanja laceracijom središnjih živčanih tkiva pomoću izduženog i štapićastog instrumenta koji se uvodi u kranijalnu šupljinu.”
(1) Direktiva Vijeća 89/556/EEZ od 25. rujna 1989. o uvjetima zdravlja životinja kojima se uređuje trgovina zamecima domaćih životinja vrste goveda unutar Zajednice i njihov uvoz iz trećih zemalja (SL L 302, 19.10.1989., str. 1.). Direktiva kako je zadnje izmijenjena Odlukom Komisije 94/113/EZ (SL L 53, 24.2.1994., str. 23.).
PRILOG X.
REFERENTNI LABORATORIJI, UZORKOVANJE I METODE LABORATORIJSKE ANALIZE
POGLAVLJE A
Nacionalni referentni laboratoriji
|
1. |
Ovlašteni nacionalni referentni laboratorij dužan je:
|
|
2. |
Međutim, iznimno od odredaba točke 1., one države članice koje ne posjeduju nacionalni referentni laboratorij dužne su koristiti se uslugama Referentnog laboratorija Zajednice ili uslugama nacionalnih laboratorija drugih država članica. |
|
3. |
Nacionalni referentni laboratoriji su:
|
POGLAVLJE B
Referentni laboratorij Zajednice
|
1. |
Referentni laboratorij Zajednice za razne oblike TSE je:
|
|
2. |
Funkcije i dužnosti Referentnog laboratorija Zajednice su:
|
POGLAVLJE C
Uzorkovanje i laboratorijske pretrage
1. Uzorkovanje i laboratorijsko ispitivanje na prisutnost GSE-a kod goveda
1.1.
Nadležno tijelo dužno je osigurati da uzorci budu prikupljeni primjenom metoda i protokola utvrđenih u najnovijem izdanju Priručnika o standardima za dijagnostičke pretrage i vakcine Međunarodnog ureda za epizootije (OIE), (dalje u tekstu Priručnik). U nedostatku takvih metoda i protokola, nadležno tijelo dužno je osigurati da se uzorci prikupljaju na način koji omogućuje pravilno obavljanje pretraga.
1.2.
1.2.1. Sumnjivi slučajevi
Tkiva podrijetlom od goveda koja su poslana na laboratorijsko ispitivanje u skladu s člankom 12. stavkom 2. podvrgavaju se histopatološkom pregledu, kako je to utvrđeno u posljednjem izdanju Priručnika osim ako se radi o autoliziranom materijalu. Ako su rezultati histopatološkog pregleda nejasni ili negativni ili ako se radi o autoliziranom materijalu/tkivu, tkiva se podvrgavaju pregledu prema jednoj od drugih dijagnostičkih metoda utvrđenih u gore navedenom Priručniku (imunocitokemija, imuno-blot analiza ili prikaz karakterističnih vlakanaca pomoću elektronske mikroskopije).
1.2.2. Životinje pregledane u okviru godišnjeg programa praćenja bolesti
Goveda, koja su pregledana u okviru godišnjeg programa praćenja bolesti kako je propisano točkom I. poglavlja A. Priloga III., i ciljanim programom nadzora iz dijela III. poglavlja A. Priloga III., pregledavaju se pomoću jedne od pretraga navedenih u točki 4.
Ako je rezultat brzog testa nejasan ili pozitivan, tkivo treba odmah biti podvrgnuto histopatološkom pregledu mozgovnog debla, kako je to utvrđeno u najnovijem izdanju Priručnika, osim ako se radi o autoliziranom materijalu ili materijalu koji iz drugog razloga nije primjeren za histopatološke preglede. Ako je rezultat histopatološkog pregleda nejasan ili negativan ili kada se radi o autoliziranom materijalu, tkiva treba podvrgnuti ispitivanju pomoću jedne od drugih dijagnostičkih metoda navedenih u točki 1.2.1.; međutim, ta metoda ne smije biti ona ista koja je upotrijebljena u screening pretrazi.
1.3.
Životinja pregledana u skladu s točkom 1.2.1. smatra se pozitivnim slučajem GSE-e, ako je rezultat jedne od pretraga bio pozitivan.
Životinja pregledana u skladu s točkom 1.2.2. smatra se pozitivnim slučajem GSE-e ako je rezultat screening pretrage bio pozitivan ili nejasan, te ako je
|
— |
rezultat naknadnog histopatološkog pregleda pozitivan, ili je |
|
— |
rezultat primjene druge dijagnostičke metode navedene u točki 1.2.1, pozitivan. |
2. Uzorkovanje i laboratorijsko ispitivanje na prisutnost jednog od oblika TSE-a kod ovaca i koza
Uzorkovanje i laboratorijsko ispitivanje na prisutnost grebeži ovaca kod ovaca i koza provodi se u skladu s metodama i protokolima propisanim u najnovijem izdanju Priručnika.
Pravila za uzorkovanje i laboratorijsko ispitivanje na prisutnost GSE-a kod ovaca i koza izrađuju se u skladu s postupkom navedenim u članku 24. stavku 2.
3. Potvrda prisutnosti drugih oblika TSE-a
Pretrage izvršene koko bi se potvrdila prisutnost TSE-a na koju se sumnja, a koje se razlikuju od pretraga navedenih u točkama 1. i 2., moraju obuhvatiti barem histopatološku pretragu tkiva mozga. Nadležno tijelo može također zahtijevati laboratorijske pretrage poput imunocitokemijskih i imunodijagnostičkih pretraga za otkrivanje karakterističnih vlakanaca za bolest grebeži ovaca, ako to smatra potrebnim. U svakom slučaju potrebno je obaviti najmanje još jedno drugo laboratorijsko ispitivanje u skladu s prethodnom rečenicom, ako se prvobitna histopatološka pretraga pokaže negativnom. Sve tri pretrage moraju se obaviti pri prvoj pojavi bolesti.
4. Brzi testovi
U svrhu provođenja pretraga u skladu s člankom 5. stavkom 3. i člankom 6. stavkom 1., sljedeće metode koriste se kao brzi testovi u smislu ove Uredbe:
|
— |
Western blot pretraga za otkrivanje fragmenta PrPRes otpornog na proteaze (pretraga za provjeru priona- Prionics Check test), |
|
— |
Kemiluminiscentna ELISA pretraga koja uključuje i metodu ekstrakcije, te ELISA tehnika, koja koristi poboljšani kemiluminiscentni reagens (Enfer test), |
|
— |
Sandwich immunoassay za PrPRes izvršen nakon postupka denaturizacije i koncentracije (BIORADE test). |
5. Alternativni testovi
(Potrebno ih je utvrditi)
PRILOG XI.
PRIJELAZNE MJERE
PRIJELAZNE MJERE IZ ČLANKA 22.
A. Koje se odnose na odstranjivanje specificiranog rizičnog materijala
1. Države članice dužne su osigurati odstranjivanje i uništavanje dolje navedenog specificiranog rizičnog materijala u skladu s točkama 6. do 11.
|
(a) |
Sljedeća tkiva određena su kao specificirani rizični materijal:
|
|
(b) |
Pored specificiranog rizičnog materijala nabrojanog pod točkom (a), u Ujedinjenom Kraljevstvu Velike Britanije i Sjevernoj Irskoj te u Portugalu, izuzimajući autonomnu regiju Azora, kao specificirani rizični materijal određuju se sljedeća tkiva:
|
2. Dopušteno je otpremanje specificiranog rizičnog materijala ili prerađevina koje su iz njega dobivene samo u svrhu naknadnog spaljivanja, u skladu s točkom 11. ili, gdje je to primjereno, točkom 7.(b).
3. Države članice dužne su osigurati da se kosti glave i kralježnice goveda, ovaca i koza ne koriste za proizvodnju strojno otkoštenog mesa.
4. Države članice dužne su osigurati da se na njihovom području, kada je riječ o govedima, ovcama ili kozama čije je meso namijenjeno za prehranu ljudi ili životinja, nakon omamljivanja ne rabi postupak laceracije središnjih živčanih tkiva pomoću izduženog štapićastog instrumenta, koji se uvodi u kranijalnu šupljinu.
5. Specificirani rizični materijal iz točke 1.(a) neće se uvoziti u Zajednicu nakon 31. ožujka 2001.
Dolje navedeni proizvodi životinjskog podrijetla podliježu ograničenjima uvoza:
|
— |
svježe meso: meso utvrđeno Direktivom 64/433/EEZ, |
|
— |
mljeveno meso i mesne prerađevine: mljeveno meso i mesne prerađevine utvrđene Direktivom 94/65/EZ (1), |
|
— |
mesni proizvodi: mesni proizvodi utvrđeni Direktivom 77/99/EEZ (2), |
|
— |
prerađene životinjske bjelančevine iz Direktive 92/118/EEZ, |
|
— |
goveđa crijeva iz podstavka v. članka 2. (b) Direktive 77/99/EEZ.
|
6. Točka 5. odnosi se samo na uvoz iz trećih zemalja:
|
(a) |
koje Komisiji nisu dostavile spis kojim bi opravdale svoj zahtjev za izuzećem od tih odredbi; |
|
(b) |
koje su dostavile takav spis u kojemu rezultat procjene rizika, kojom se određuju svi potencijalni rizični čimbenici, unatoč tomu nije zadovoljavajući. |
7. Države članice obavljaju učestale službene inspekcijske preglede kako bi nadgledale pravilnu primjenu ovog Priloga i osiguravale poduzimanje mjera za izbjegavanje bilo kakve zaraze, posebno u klaonicama, rasjekavaonicama, pogonima za preradu životinjskog otpada, pogonima ili prostorima za preradu visoko rizičnih tkiva koje su države članice odobrile u skladu s člankom 7. Direktive 90/667/EEZ, na mjestima prodaje potrošačima, odlagalištima otpada, te drugim objektima za skladištenje ili spaljivanje. Države članice dužne su posebno uspostaviti sustav kojim će se osigurati i kontrolirati da se:
|
(a) |
specificirani rizični materijal koji se rabi za dobivanje proizvoda iz članka 1. stavka 2. koristi isključivo za odobrene namjene; |
|
(b) |
specificirani rizični materijal, posebno ako se odstranjivanje provodi u proizvodnim objektima ili prostorima koje nisu klaonice u potpunosti odvaja od ostalog otpada koji nije namijenjen spaljivanju, odvojeno sakuplja i odstranjuje u skladu s točkom 1. i točkama 8. do 11. Države članice mogu odobriti otpremanje glava ili trupova koji sadrže specificirani rizični materijal drugoj državi članici nakon što je ta druga država članica pristala prihvatiti navedeni materijal i odobrila posebne uvjete koji se primjenjuju za takav prijevoz. |
8. Države članice osiguravaju da se specificirani rizični materijal odstranjuje u:
|
(a) |
klaonicama; |
|
(b) |
rasjekavaonicama, pogonima ili prostorijama za preradu visoko rizičnih tkiva iz članka 3. i 7. Direktive 90/667/EEZ, pod nadzorom ovlaštenog predstavnika kojega je imenovalo nadležno tijelo. U tu svrhu, nadležno tijelo odobrava navedene proizvodne objekte. |
Međutim, dopušteno je odstranjivanje kralježnice na mjestima prodaje potrošaču koji se nalazi na području predmetne države članice.
Ako specificirani rizični materijal nije odstranjen s mrtvih životinja, koje nisu bile zaklane za prehranu ljudi, dijelovi trupla koji sadrže specificirani rizični materijal ili cijelo truplo smatrat će se specificiranim rizičnim materijalom.
9. Države članice osiguravaju da se sav specificirani rizični materijal boji bojom i, gdje je primjereno, označava markerom odmah po odstranjivanju, i u cijelosti uništava:
|
(a) |
spaljivanjem bez prethodne prerade; ili |
|
(b) |
pod uvjetom da boja ili marker ostaju vidljivi, nakon prethodne prerade:
|
10. Države članice mogu odstupiti od odredaba iz točke 8. i 9. kako bi dozvolile spaljivanje ili zakapanje specificiranog rizičnog materijala ili cijelih trupala, bez prethodnog bojenja, ili, tamo gdje je to prikladno, bez uklanjanja specificiranog rizičnog materijala, pod okolnostima navedenima u članku 3. stavku 2. Direktive 90/667/EEZ, te prema metodi koja isključuje svaku opasnost prenošenja jednog od oblika TSE-a, a koju je odobrilo i koju nadzire nadležno tijelo, posebno ako su životinje uginule ili su usmrćene u kontekstu mjera kontrole bolesti.
11. Države članice mogu otpremati specificirani rizični materijal ili materijal koji je od njega dobiven drugim državama članicama na spaljivanje prema uvjetima propisanima u članku 4. stavku 2. Odluke Komisije 97/735/EZ, gdje je to prikladno.
Ova se točka može izmijeniti na zahtjev države članice kako bi se dopustilo otpremanje specificiranog rizičnog materijala ili materijala koji je dobiven iz njega na spaljivanje u treće zemlje, ako su prije toga usvojeni uvjeti koji uređuju takav izvoz.
B. Koje se odnose na statistička istraživanja
Statističko istraživanje iz članka 22. mora obuhvatiti sve životinje iz Priloga III. poglavlja A odjeljka I. točaka 1.1. i 1.2.
Ova odredba, koja je primjenjiva za razdoblje od jedne godine, može se revidirati u svjetlu iskustva stečenog u prvih šest mjeseci.
(1) Direktiva Vijeća 94/65/EZ od 14. prosinca 1994. o utvrđivanju uvjeta za proizvodnju i stavljanje mljevenog mesa i mesnih pripravaka na tržište (SL L 368, 31.12.1994., str. 10.).
(2) Direktiva Vijeća 77/99/EEZ od 21. prosinca 1976. o zdravstvenim problemima koji utječu na trgovinu mesnim proizvodima unutar Zajednice (SL L 26, 31.1.1977., str. 85.). Direktiva kako je zadnje izmijenjena Direktivom Vijeća 97/76/EZ (SL L 10, 16.1.1998., str. 25.).
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
43 |
32005R1739
|
L 279/47 |
SLUŽBENI LIST EUROPSKE UNIJE |
21.10.2005. |
UREDBA KOMISIJE (EZ) br. 1739/2005
od 21. listopada 2005.
o utvrđivanju zahtjeva zdravlja životinja za premještanje životinja iz cirkusa između država članica
(Tekst značajan za EGP)
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Direktivu Vijeća 92/65/EEZ od 13. srpnja 1992. o utvrđivanju uvjeta zdravlja životinja za trgovinu i uvoz u Zajednicu životinja, sjemena, jajnih stanica i embrija koji ne podliježu uvjetima zdravlja životinja propisanim u posebnim pravilima Zajednice iz Priloga AI. Direktivi 90/425/EEZ (1), a posebno njezin članak 23.,
budući da:
|
(1) |
Primjereno je utvrditi, u skladu s Direktivom 92/65/EEZ, odstupajući od općih pravila o premještanju životinja iz poglavlja II. te Direktive, posebne zahtjeve zdravlja životinja za premještanje životinja iz cirkusa. Mjere predviđene ovom Uredbom trebaju se primijeniti na putujuće izložbe, sajmove ili predstave sa životinjama, ali ne i na stalne ustanove iz članka 2. stavka 1. točke (c) Direktive 92/65/EEZ. |
|
(2) |
Nadležna tijela trebaju za potrebe zdravlja životinja imati određene podatke o cirkusima i sajmovima koji drže životinje iz cirkusa, posebno u pogledu premještanja između država članica. Stoga je primjereno zahtijevati registriranje takvih cirkusa i sajmova u državi članici i evidentiranje njihovih itinerara. |
|
(3) |
Cirkusi i sajmovi često nastupaju izvan svoje države članice podrijetla. Stoga im treba omogućiti da se registriraju u državi članici u kojoj uobičajeno borave ili u kojoj su smješteni, čak i ako to nije njihova država članica podrijetla. |
|
(4) |
Predstava sa životinjama obuhvaća jednu životinju ili ograničen broj životinja koje se drže radi izvođenja javnih predstava ili razonode, uz neovisno vlasništvo nad njima ili upravljanje. Predstave sa životinjama mogu se izvoditi izvan njihove države članice podrijetla, primjerice kada su oni dio cirkusa ili kada pojedinačno nastupaju radi razonode ili za potrebe filmskih snimanja. Stoga je predstave sa životinjama primjereno uključiti u područje primjene ove Uredbe. |
|
(5) |
Rizik koji za zdravlje životinja predstavlja cirkus ili sajam izravno se odnosi na vrste životinja koje su u njemu drže. Stoga je od upravitelja cirkusa i predstava sa životinjama primjereno zahtijevati vođenje evidencije koja sadrži odgovarajuće podatke o prisutnosti životinja. |
|
(6) |
Treba olakšati nadzor nad zdravstvenim stanjem životinja iz cirkusa. Vodeći računa o različitim načinima kojima se životinje iz cirkusa premještaju unutar Zajednice, primjereno je predvidjeti putovnice za životinje iz cirkusa koje trebaju sadržavati sve odgovarajuće podatke o zdravlju životinja, uključujući i pojedinosti o službenim testiranjima i cijepljenjima. |
|
(7) |
Zdravstvena pravila za životinje iz cirkusa mogu se temeljiti na istim načelima na kojima se temelji i zakonodavstvo Zajednice u pogledu zdravlja životinja kojima se trguje unutar Zajednice, domaćih životinja koje se drže na gospodarstvima, uključujući Direktivu Vijeća 64/432/EEZ od 26. lipnja 1964. o problemima u pogledu zdravlja životinja koji utječu na trgovinu govedima i svinjama unutar Zajednice (2), te Direktivu Vijeća 91/68/EEZ od 28. siječnja 1991. o uvjetima zdravlja životinja kojima se uređuje trgovina životinjama iz porodica ovaca i koza unutar Zajednice (3). Međutim, navedena pravila svakako se trebaju prilagoditi posebnim poteškoćama koje nameću određene vrste životinja kada se drže u cirkusima i na sajmovima te ih treba propisno potvrditi službeni veterinar na način koji je utvrđen u članku 2. stavku 7. Direktive Vijeća 90/425/EEZ (4). |
|
(8) |
Uvjeti zdravstvene zaštite životinja i prateća dokumentacija ili putovnice za premještanje mačaka, pasa i pitomih vretica unutar Zajednice utvrđeni su Uredbom (EZ) br. 998/2003 Europskog parlamenta i Vijeća (5), a za kopitare Odlukom Komisije 93/623/EEZ (6). Životinje iz cirkusa tih vrsta trebaju stoga ispunjavati pravila o putovnicama i zdravstvenoj zaštiti životinja koja su utvrđena u navedenoj Uredbi i Odluci. |
|
(9) |
U interesu dosljednosti, primjereno je dopustiti Irskoj, Cipru, Malti i Ujedinjenoj Kraljevini da primijene svoja nacionalna pravila o karanteni za životinje iz cirkusa koje su prijemljive na bjesnoću, kako je predviđeno Direktivom 92/65/EEZ. |
|
(10) |
Mjere predviđene ovom Uredbom ne smiju dovoditi u pitanje zakonodavstvo kojim se provodi Uredba Vijeća (EZ) br. 338/97 od 9. prosinca 1996. o zaštiti vrsta divlje faune i flore uređenjem trgovine u tom području (7). |
|
(11) |
Radi osiguravanja potpune sljedivosti životinja iz cirkusa, potrebno je bilježiti njihova premještanja unutar Zajednice koristeći sustav TRACES uveden Odlukom Komisije 2004/292/EZ (8) te ispuniti zahtjeve certificiranja za trgovanje unutar Zajednice, kako je utvrđeno u Uredbi Komisije (EZ) br. 599/2004 od 30. ožujka 2004. o usvajanju usklađenog obrasca certifikata i izvješća inspekcije povezanih s trgovinom životinjama i proizvodima životinjskog podrijetla unutar Zajednice (9). |
|
(12) |
Potrebno je omogućiti dovoljno vremena za provedbu novih zahtjeva predviđenih u ovoj Uredbi. |
|
(13) |
Mjere predviđene ovom Uredbom u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU UREDBU:
Članak 1.
Predmet i područje primjene
Odstupajući od poglavlja II. Direktive 92/65/EEZ, ovom se Uredbom utvrđuju zahtjevi u pogledu zdravlja životinja koji se odnose na premještanje životinja iz cirkusa između država članica.
Pravila za cirkuse primjenjuju se mutatis mutandis na predstave sa životinjama.
Ova se Uredba primjenjuje ne dovodeći u pitanje:
|
(a) |
mjere koje se primjenjuju na životinje prijemljive na bjesnoću, u određenim državama članicama kako je predviđeno člankom 10. stavkom 4. Direktive 92/65/EEZ; |
|
(b) |
odgovarajuća pravila za certificiranje koja su sadržana u zakonodavstvu kojim se provodi Uredba Vijeća (EZ) br. 338/97 od 9. prosinca 1996. o zaštiti vrsta divlje faune i flore uređenjem trgovine u tom području. |
Članak 2.
Definicije
U smislu ove Uredbe primjenjuju se sljedeće definicije:
|
1. |
„cirkus” znači putujuća predstava ili sajam u kojem sudjeluje jedna ili više životinja; |
|
2. |
„životinja” znači životinja vrsta navedenih u Prilogu A Direktivi 92/65/EEZ te koja je namijenjena javnim izložbama u svrhu razonode ili obrazovanja; |
|
3. |
„upravitelj cirkusa” znači vlasnik cirkusa, njegov zastupnik ili druga osoba s ukupnom odgovornošću za cirkus; |
|
4. |
„službeni veterinar” znači službeni veterinar kako je utvrđeno člankom 2. stavkom 7. Direktive 90/425/EEZ. |
Članak 3.
Premještanje između država članica
Cirkus se može premjestiti u drugu državu članicu samo ako je registriran u skladu s člankom 4. i ako je u skladu s člancima 8., 9. i 10.
Članak 4.
Registracija cirkusa
1. Najmanje 40 radnih dana prije prvog premještanja cirkusa u drugu državu članicu, upravitelj cirkusa mora podnijeti pisani zahtjev za registraciju nadležnom tijelu države članice u kojoj cirkus ima zakonsko boravište ili države članice u kojoj je smješten.
2. Nakon zaprimanja zahtjeva iz stavka 1., nadležno tijelo provodi sve nužne provjere o ispunjavanju zahtjeva za zdravlje životinja utvrđenih u ovoj Uredbi.
3. Ako su ispunjeni zahtjevi iz stavka 2., nadležno tijelo izdaje:
|
(a) |
jedinstveni registracijski broj za cirkus koji počinje s oznakom ISO države članice; |
|
(b) |
registar životinja iz cirkusa u skladu s člankom 5.; |
|
(c) |
registar mjesta u skladu s člankom 6.; |
|
(d) |
putovnice za životinje u skladu s člankom 7. |
4. Nadležno tijelo vodi evidenciju o svim dokumentima izdanima u skladu sa stavkom 3.
Članak 5.
Registar životinja
Registar životinja iz cirkusa iz članka 4. stavka 3. točke (b) mora biti u skladu s obrascem utvrđenim u Prilogu I. i sadržavati registracijski broj iz članka 4. stavka 3. točke (a). Svaku stranicu prije izdavanja ovjerava službeni veterinar pečatom i potpisom.
Članak 6.
Registar mjesta
Registar mjesta iz članka 4. stavka 3. točke (c) mora biti u skladu s obrascem utvrđenim u Prilogu II. i sadržavati registracijski broj iz članka 4. stavka 3. točke (a). Prije svakog premještanja iz članka 9., svaki unos podataka ovjerava službeni veterinar pečatom i potpisom.
Članak 7.
Putovnice za životinje
1. U skladu s člankom 4., nadležno tijelo za svaku životinju iz cirkusa, osim životinja iz stavaka 2., 3. i 4. ovog članka, izdaje putovnicu u skladu s obrascem utvrđenim u Prilogu III.
2. U skladu s člankom 4., nadležno tijelo izdaje zajedničku putovnicu za ptice i glodavce iz cirkusa u skladu s obrascem utvrđenim u Prilogu IV.
3. Za pse, mačke i pitome vretice iz cirkusa primjenjuju se pravila za putovnicu i zdravstvena pravila za životinje iz Uredbe (EZ) br. 998/2003.
4. Za kopitare iz cirkusa primjenjuju se pravila za putovnicu i zdravstvena pravila za životinje iz Odluke 93/623/EEZ.
Članak 8.
Obveze upravitelja cirkusa
1. Prije premještanja cirkusa u drugu državu članicu, upravitelj cirkusa mora osigurati:
|
(a) |
pravovremeno ažuriranje registara iz članka 4. stavka 3. točaka (b) i (c); |
|
(b) |
da sve životinje iz cirkusa imaju pravovremeno ažurirane putovnice; |
|
(c) |
da je nadležno tijelo države članice u kojoj je cirkus smješten obaviješteno o namjeri premještanja cirkusa u drugu državu članicu najmanje 10 radnih dana prije polaska. |
2. Upravitelj cirkusa mora osigurati da se svaka životinja iz cirkusa drži na način koji sprečava posredan ili neposredan doticaj sa životinjama koje nisu registrirane u skladu s ovom Uredbom.
3. Upravitelj cirkusa mora osigurati čuvanje svih podataka u registrima iz članka 4. stavka 3. točaka (b) i (c) najmanje pet godina.
Članak 9.
Zahtjevi za premještanje cirkusa između država članica
1. Prije premještanja cirkusa u drugu državu članicu, službeni veterinar države članice odlaska mora:
|
(a) |
provjeriti da mjesto odlaska nije podvrgnuto bilo kojem ograničenju u pogledu zdravlja životinja koje se odnosi na bolesti na koje su životinje iz cirkusa prijemljive; |
|
(b) |
pregledati sve životinje u cirkusu tijekom 10 radnih dana prije polaska kako bi utvrdio jesu li one klinički zdrave; |
|
(c) |
provjeriti je li registar životinja iz cirkusa iz članka 4. stavka 3. točke (b), na dan pregleda ažuriran i potpun; |
|
(d) |
provjeriti jesu li putovnice životinja iz cirkusa ažurirane. |
2. Ako su ispunjeni svi uvjeti iz stavka 1., službeni veterinar odobrava premještanje cirkusa u unutar sljedećih 10 radnih dana, što potvrđuje svojim potpisom i pečatom u zadnjem stupcu registra mjesta iz članka 4. stavka 3. točke (c).
Članak 10.
Podaci o premještanjima cirkusa između država članica
1. Upravitelj cirkusa mora najmanje 48 sati prije premještanja cirkusa iz jedne države članice u drugu dostaviti odgovarajuće podatke nadležnom tijelu države članice odlaska kako bi se zaključio upis podataka u certifikat sustava praćenja TRACES za trgovinu unutar Zajednice.
2. Koristeći sustav praćenja TRACES, nadležno tijelo države članice odlaska obavještava o premještanju nadležno tijelo države članice odredišta te nadležna tijela svih država članica provoza.
3. U obrascu certifikata za trgovanje unutar Zajednice, kako je utvrđeno u Uredbi (EZ) br. 599/2004, pod točkom I.31. o identifikaciji životinja/proizvoda upisuje se vrsta i broj putovnice životinja iz cirkusa; a broj ove Uredbe navodi se u dijelu II.
Članak 11.
Stupanje na snagu
Ova Uredba stupa na snagu dvadesetog dana od dana objave u Službenom listu Europske unije.
Ona se primjenjuje od 1. siječnja 2007.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 21. listopada 2005.
Za Komisiju
Markos KYPRIANOU
Član Komisije
(1) SL L 268, 14.9.1992., str. 54. Direktiva kako je zadnje izmijenjena Direktivom 2004/68/EZ (SL L 139, 30.4.2004., str. 320.); ispravljeno u (SL L 226, 25.6.2004., str. 128.).
(2) SL 121, 29.7.1964., str. 1977/64. Direktiva kako je zadnje izmijenjena Uredbom (EZ) br. 1/2005 (SL L 3, 5.1.2005., str. 1.).
(3) SL L 46, 19.2.1991., str. 19. Direktiva kako je zadnje izmijenjena Odlukom Komisije 2004/554/EZ (SL L 248, 22.7.2004., str. 1.).
(4) SL L 224, 18.8.1990., str. 29. Direktiva kako je zadnje izmijenjena Direktivom 2002/33/EZ Europskog parlamenta i Vijeća (SL L 315, 19.11.2002., str. 14.).
(5) SL L 146, 13.6.2003., str. 1. Uredba kako je zadnje izmijenjena Uredbom Komisije (EZ) br. 1193/2005 (SL L 194, 26.7.2005., str. 4.).
(6) SL L 298, 3.12.1993., str. 45. Odluka kako je izmijenjena Odlukom 2000/68/EZ (SL L 23, 28.1.2000., str. 72.).
(7) SL L 61, 3.3.1997., str. 1. Uredba kako je zadnje izmijenjena Uredbom Komisije (EZ) br. 1332/2005 (SL L 215, 19.8.2005., str. 1.).
(8) SL L 94, 31.3.2004., str. 63. Odluka kako je zadnje izmijenjena Odlukom 2005/515/EZ (SL L 187, 19.7.2005., str. 29.).
(9) SL L 94, 31.3.2004., str. 44.
PRILOG I.
REGISTAR ŽIVOTINJA IZ CIRKUSA ili ŽIVOTINJA IZ PREDSTAVE SA ŽIVOTINJAMA (prema Uredbi Komisije (EZ) br. 1739/2005) (1)

(1) Registar mora biti u obliku knjige čije stranice nije moguće zamijeniti. S tim ciljem službeni veterinar potpisuje i pečatom ovjerava svaku stranicu prije izdavanja upravitelju cirkusa. Registar se mora čuvati najmanje pet godina.
PRILOG II.
REGISTAR MJESTA CIRKUSA ili PREDSTAVE SA ŽIVOTINJAMA (prema Uredbi Komisije (EZ) br. 1739/2005)

PRILOG III.
POJEDINAČNA PUTOVNICA ZA ŽIVOTINJE IZ CIRKUSA ili PREDSTAVE SA ŽIVOTINJAMA






PRILOG IV.
PUTOVNICA ZA PTICE I GLODAVCE IZ CIRKUSA ili PREDSTAVE SA ŽIVOTINJAMA




|
03/Sv. 015 |
HR |
Službeni list Europske unije |
59 |
32005R2074
|
L 338/27 |
SLUŽBENI LIST EUROPSKE UNIJE |
05.12.2005. |
UREDBA KOMISIJE (EZ) br. 2074/2005
od 5. prosinca 2005.
o utvrđivanju provedbenih mjera za određene proizvode na temelju Uredbe (EZ) br. 853/2004 Europskog parlamenta i Vijeća i za organizaciju službenih kontrola na temelju Uredbe (EZ) br. 854/2004 Europskog parlamenta i Vijeća i Uredbe (EZ) br. 882/2004 Europskog parlamenta i Vijeća, odstupanju od Uredbe (EZ) br. 852/2004 Europskog parlamenta i Vijeća i o izmjeni uredbi (EZ) br. 853/2004 i (EZ) br. 854/2004
(Tekst značajan za EGP)
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Uredbu (EZ) br. 852/2004 Europskog parlamenta i Vijeća od 29. travnja 2004. o higijeni hrane (1), a posebno njezin članak 13. stavak 2.,
uzimajući u obzir Uredbu (EZ) br. 853/2004 Europskog parlamenta i Vijeća od 29. travnja 2004. o utvrđivanju određenih higijenskih pravila za hranu životinjskog podrijetla (2), a posebno njezine članke 9., 10. i 11.,
uzimajući u obzir Uredbu (EZ) br. 854/2004 Europskog parlamenta i Vijeća od 29. travnja 2004. o utvrđivanju posebnih pravila organizacije službenih kontrola proizvoda životinjskog podrijetla namijenjenih prehrani ljudi (3), a posebno njezine članke 16., 17. i 18.,
uzimajući u obzir Uredbu (EZ) br. 882/2004 Europskog parlamenta i Vijeća od 29. travnja 2004. o službenim kontrolama koje se provode radi provjeravanja poštivanja propisa o hrani i hrani za životinje te propisa o zdravlju i dobrobiti životinja (4), a posebno njezin članak 63.,
budući da:
|
(1) |
Uredbom (EZ) br. 853/2004 utvrđuju se određeni zahtjevi o higijenskim pravilima za hranu životinjskog podrijetla. Potrebno je utvrditi određene provedbene mjere za meso, žive školjkaše, proizvode ribarstva, mlijeko, jaja, žablje krakove i puževe te njihove prerađevine. |
|
(2) |
Uredbom (EZ) br. 854/2005 utvrđuju se posebna pravila organizacije službenih kontrola proizvoda životinjskog podrijetla namijenjenih prehrani ljudi. Potrebno je razviti određena pravila i dodatno odrediti ostale zahtjeve. |
|
(3) |
Uredbom (EZ) br. 882/2004 uspostavlja se na razini Zajednice usklađen okvir općih pravila organizacije službenih kontrola. Potrebno je razviti određena pravila i dodatno odrediti ostale zahtjeve. |
|
(4) |
Odlukom Komisije 20XX/2005/EZ (5) stavljaju se izvan snage određene odluke o provođenju mjera predviđenih direktivama stavljenim izvan snage Direktivom 2004/41/EZ Europskog parlamenta i Vijeća od 21. travnja 2004. o stavljanju izvan snage određenih direktiva o higijeni hrane i zdravstvenim uvjetima za proizvodnju i stavljanje na tržište određenih proizvoda životinjskog podrijetla namijenjenih prehrani ljudi i o izmjeni direktiva Vijeća 89/662/EEZ i 92/118/EEZ i Odluke Vijeća 95/408/EZ (6). Stoga se određeni dijelovi tih odluka moraju zadržati u ovoj Uredbi. |
|
(5) |
Uredbom (EZ) br. 852/2004 zahtijeva se da subjekti u poslovanju s hranom vode i održavaju evidenciju te da na zahtjev stave relevantne informacije iz tih evidencija na raspolaganje nadležnom tijelu i subjektu u poslovanju s hranom koji od njih preuzima hranu. |
|
(6) |
Uredbom (EZ) br. 853/2004 se također zahtijeva da subjekt koji upravlja klaonicom traži, prima, kontrolira i djeluje na informacije o lancu prehrane za sve životinje, osim divljači, koje se šalju ili se namjeravaju poslati u klaonicu. Osim toga, on mora osigurati da informacije o lancu prehrane sadrže sve podatke zahtijevane Uredbom (EZ) br. 853/2004. |
|
(7) |
Informacije o prehrambenom lancu pomažu subjektu koji upravlja klaonicom da organizira postupke klanja te pomažu službenom veterinaru da odredi potrebne postupke inspekcije. Službeni veterinar mora analizirati informacije o lancu prehrane i one se moraju koristiti kao sastavni dio postupaka inspekcije. |
|
(8) |
Postojeće sustave tijeka informacija treba koristiti u što je moguće većoj mjeri i prilagoditi ih tako da se usklade sa zahtjevima za informacijama o lancu prehrane utvrđenim u Uredbi (EZ) br. 854/2004. |
|
(9) |
Kako bi se unaprijedilo upravljanje životinjama na razini gospodarstva i u skladu s Uredbom (EZ) 854/2004, službeni veterinar mora voditi evidenciju i, ako je potrebno, obavijestiti subjekt u poslovanju s hranom na gospodarstvu podrijetla, veterinara koji se brine o gospodarstvu podrijetla, kao i svako nadležno tijelo o svakoj bolesti ili stanju koje je opazio u klaonici na pojedinim životinjama ili na stadu/jatu, a koji mogu utjecati na zdravlje ljudi ili životinja ili ugroziti dobrobit životinja. |
|
(10) |
Uredbama (EZ) br. 853/2004 i 854/2004 utvrđuju se zahtjevi za upravljanje pregledima parazita tijekom rada s proizvodima ribarstva na obali i na palubama brodova. Subjekti u poslovanju s hranom provode svoje vlastite kontrole u svim fazama proizvodnje proizvoda ribarstva u skladu s pravilima u poglavlju V. točki D odjeljka VIII. Priloga III. Uredbi (EZ) br. 853/2004 kako se riba koja je očigledno zaražena parazitima ne bi pustila u promet za prehranu ljudi. Usvajanje detaljnih pravila koji se odnose na vizualne preglede zahtijeva definiranje pojmova vidljivih parazita i vizualne kontrole te utvrđivanje tipa i učestalosti takvih opažanja. |
|
(11) |
Kontrole navedene u Uredbi (EZ) br. 853/2004 za sprečavanje stavljanja na tržište proizvoda ribarstva koji nisu podobni za prehranu ljudi mogu sadržavati određene kemijske kontrole, uključujući kontrolu ukupno isparivog bazičnog dušika (TVB-N). Potrebno je postaviti razine za TVB-N koje se kod određenih kategorija vrsta ne smiju prijeći te specificirati metode analiza koje se za to moraju koristiti. Treba nastaviti rutinsku upotrebu znanstveno priznatih metoda analize za kontrolu TVB-N, ali se mora specificirati referentna metoda koja se koristi kada postoji sumnja u vezi s rezultatima ili u slučaju spora. |
|
(12) |
U Uredbi (EZ) br. 853/2004 navedene su granične vrijednosti za biotoksin u školjkama koji uzrokuje paralizu (PSP), za biotoksin u školjkama koji izaziva gubitak pamćenja (ASP) i za lipofilne toksine. Biotestovi su referentna metoda za otkrivanje određenih toksina i za sprečavanje izlova toksičnih školjaka. Države članice moraju usvojiti i uskladiti maksimalne razine i analitičke metode s ciljem zaštite zdravlja ljudi. Osim metoda biološkog testiranja, moraju se dopustiti i alternativne metode otkrivanja, kao što su kemijske metode i pokusi in vitro, ukoliko se dokaže da su takve odabrane metode barem jednako djelotvorne kao biološke metode i da njihova provedba pruža jednaku razinu zaštite javnog zdravlja. Predložene maksimalne razine za lipofilne toksine temelje se na privremenim podacima i trebat će ih ponovno procijeniti kada se na raspolaganje stave novi znanstveni dokazi. Nedostatak referentnih materijala i isključiva upotreba nebioloških testova trenutačno znači da razina zaštite javnog zdravlja koja se pruža u odnosu na specificirane toksine nije jednaka onoj koju pružaju biološki testovi. Potrebno je omogućiti što bržu zamjenu biološkim testovima. |
|
(13) |
Mehanički iskošteno meso (MSM) proizvedeno tehnikama za proizvodnju MSM-a koje ne mijenjaju strukturu kostiju, mora se smatrati različitim od MSM-a proizvedenog tehnikama koje mijenjaju strukturu kostiju. |
|
(14) |
Mehanički iskošteno meso prvog tipa koje je proizvedeno pod određenim uvjetima i koje ima određeni sastav, dopušta se u mesnim prerađevinama koje očito nisu namijenjene za jelo bez prethodne termičke obrade. Ti uvjeti su posebno povezani sa sadržajem kalcija u MSM-u koji mora biti specificiran u skladu s člankom 11. stavkom 2. Uredbe (EZ) br. 853/2004. Maksimalni sadržaj kalcija utvrđen ovom Uredbom morat će se prilagoditi jednom kada na raspolaganju budu detaljne informacije o varijacijama koje se javljaju kod upotrebe različitih tipova sirovina. |
|
(15) |
Člankom 31. stavkom 2. točkom (f) Uredbe (EZ) br. 882/2004 zahtijeva se od država članica da vode ažurne liste odobrenih objekata. Potrebno je utvrditi zajednički okvir za predstavljanje odgovarajućih informacija drugim državama članicama i javnosti. |
|
(16) |
U odjeljku XI. Priloga III. Uredbi (EZ) br. 853/2004 navode se zahtjevi za pripremu žabljih krakova i puževa namijenjenih prehrani ljudi. Moraju se također utvrditi specifični zahtjevi, uključujući model zdravstvenog certifikata, za uvoz iz trećih zemalja žabljih krakova i puževa namijenjenih prehrani ljudi. |
|
(17) |
U odjeljcima XIV. i XV. Priloga III. Uredbi (EZ) br. 853/2004 utvrđuju se pravila za proizvodnju i stavljanje na tržište želatine i kolagena namijenjenih prehrani ljudi. Moraju se također utvrditi specifični zahtjevi, uključujući model zdravstvenog certifikata, za uvoz iz trećih zemalja želatine i kolagena i sirovina za proizvodnju želatine i kolagena namijenjenih prehrani ljudi. |
|
(18) |
Potrebna je fleksibilnost kako bi se mogla nastaviti proizvodnja hrane s tradicionalnim obilježjima. Države članice su već odobrile odstupanja za široki raspon takve hrane prema zakonodavstvu koje je bilo na snazi prije 1. siječnja 2006. Subjektima u poslovanju s hranom moralo bi se omogućiti da bez prekida primjenjivati sadašnju praksu i nakon tog datuma. U uredbama (EZ) br. 852/2004, (EZ) br. 853/2004 i (EZ) br. 854/2004 utvrđen je postupak koji državama članicama dopušta fleksibilnost. Međutim, u većini slučajeva u kojima je odstupanje već odobreno, radi se samo o nastavku utvrđene prakse pa bi primjena postupka potpunog obavješćivanja, uključujući kompletnu analizu opasnosti, mogla predstavljati nepotrebno i nerazmjerno opterećenje za države članice. Stoga treba definirati hranu s tradicionalnim obilježjima i utvrditi opće uvjete koji se primjenjuju na takvu hranu, odstupajući od strukturalnih zahtjeva utvrđenih Uredbom (EZ) br. 852/2004, uz poštivanje ciljeva zdrave hrane. |
|
(19) |
Budući da su uredbe (EZ) br. 853/2004 i 854/2004 donesene prije pristupanja 1. svibnja 2004., one se ne odnose na nove države članice. Stoga odgovarajuće odredbe tih uredbi treba nadopuniti ISO oznakama za te države članice i kraticama za Europsku zajednicu na njihovim jezicima. |
|
(20) |
U odjeljku I. Priloga III. Uredbi (EZ) br. 853/2004 utvrđena su pravila za proizvodnju i stavljanje na tržište mesa domaćih kopitara. U poglavlju IV. točki 8. tog odjeljka navedene su iznimke u odnosu na potpuno skidanje kože s trupa i drugih dijelova tijela namijenjenih prehrani ljudi. Potrebno je donijeti odredbe za proširenje tih izuzetaka na donje dijelove nogu odraslih goveda, uz uvjet da ispunjavaju iste uvjete koji se primjenjuju na donje dijelove nogu teladi. |
|
(21) |
Neki postupci mogu biti zbunjujući za potrošače s obzirom na sastav određenih proizvoda. Posebno kako se ne bi iznevjerila očekivanja potrošača, treba zabraniti prodaju svježeg mesa peradi obrađenog agensima za zadržavanje vode. |
|
(22) |
U mišljenju Europske agencije za sigurnost hrane usvojenom 30. kolovoza 2004., dokazano je da proizvodi ribarstva koji pripadaju porodici Gempylidae, posebno Ruvettus pretiosus i Lepidocybium flavobrunneum, mogu imati štetne želučano crijevne učinke ako se konzumiraju pod određenim uvjetima. Stoga se proizvodi ribarstva koji pripadaju ovoj porodici moraju prilagoditi uvjetima tržišta. |
|
(23) |
U odjeljku IX. Priloga III. Uredbi (EZ) br. 853/2004 utvrđena su specifična higijenska pravila za sirovo mlijeko i mliječne proizvode. Sukladno dijelu II.B točki 1.(e) poglavlja I., kupelji za vime i drugi proizvodi za čišćenje vimena mogu se koristiti samo ako ih je odobrilo nadležno tijelo. Međutim, u ovom dijelu nije dana detaljna shema odobrenja. Stoga je u svrhu osiguravanja usklađenog pristupa država članica potrebno razjasniti postupke za davanje takvih odobrenja. |
|
(24) |
Uredbom (EZ) br. 853/2004 zahtijeva se od subjekata u poslovanju s hranom da osiguraju usklađenost termičkih postupaka korištenih za obradu sirovog mlijeka i mliječnih proizvoda s međunarodno priznatim standardima. Međutim, zbog specifičnosti određenih termičkih postupaka koji se koriste u ovom sektoru i njihovih učinaka na sigurnost hrane i zdravlje životinja, subjektima u poslovanju s hranom moraju se dati jasnije smjernice u tom pogledu. |
|
(25) |
Uredbom (EZ) br. 853/2004 uvodi se nova definicija za proizvode od jaja koja nakon odstranjivanja ljuske još nisu obrađena. Stoga je potrebno razjasniti pravila koja se primjenjuju na te proizvode i sukladno tome izmijeniti odjeljak X. poglavlje II. Priloga III. Uredbi (EZ) br. 853/2004. |
|
(26) |
U odjeljku XIV. Priloga III. Uredbi (EZ) br. 853/2004 utvrđuju se specifična zdravstvena pravila za želatinu. Ova pravila uključuju zahtjeve u odnosu na tip sirovina koje se mogu upotrijebiti za proizvodnju želatine te u odnosu na transport i skladištenje takvih materijala. Njima se također utvrđuju specifikacije za proizvodnju želatine. Međutim, potrebno je utvrditi i pravila za označivanje želatine. |
|
(27) |
Znanstveni razvoj je doveo do uspostavljanja standarda ISO 16649-3 kao dogovorene referentne metode za analizu E. coli kod školjkaša. Ova referentna metoda je već uvedena za žive školjkaše iz područja A sukladno Uredbi Komisije (EZ) br. 2073/2005 o mikrobiološkim kriterijima za hranu (7). Dakle, ISO 16649-3 se mora također utvrditi kao referentna metoda MPN (najvjerojatniji broj) za analizu E. coli kod školjkaša koji dolaze iz područja B i C. Upotreba alternativnih metoda može se dopustiti samo ako se one smatraju jednakovrijednima referentnoj metodi. |
|
(28) |
Uredbe (EZ) br. 853/2004 i 854/2004 treba stoga na odgovarajući način izmijeniti. |
|
(29) |
Mjere utvrđene u ovoj Uredbi u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU UREDBU:
Članak 1.
Zahtjevi koji se odnose na informacije o prehrambenom lancu u smislu uredbi (EZ) br. 853/2004 i 854/2004
U Prilogu I. ovoj Uredbi utvrđeni su zahtjevi koji se odnose na informacije o prehrambenom lancu kako je navedeno u odjeljku III. Priloga II. Uredbi (EZ) br. 853/2004 i poglavlju II. točki A odjeljka I. Priloga I. Uredbi (EZ) br. 854/2004.
Članak 2.
Zahtjevi koji se odnose na proizvode ribarstva u smislu uredbi (EZ) br. 853/2004 i 854/2004
U Prilogu II. ovoj Uredbi utvrđeni su zahtjevi koji se odnose na proizvode ribarstva, kako je navedeno u članku 11. stavku 9. Uredbe (EZ) br. 853/2004 i članku 18. stavcima 14. i 15. Uredbe (EZ) br. 854/2004.
Članak 3.
Priznate metode testiranja za morske biotoksine u smislu uredbi (EZ) br. 853/2004 i 854/2004
U Prilogu III. ovoj Uredbi utvrđene su priznate metode testiranja za otkrivanje morskih biotoksina, kako je navedeno u članku 11. stavku 4. Uredbe (EZ) br. 853/2004 i članku 18. stavku 13. točki (a) Uredbe (EZ) br. 854/2004.
Članak 4.
Sadržaj kalcija u mehanički iskoštenom mesu u smislu Uredbe (EZ) br. 853/2004
U Prilogu IV. ovoj Uredbi utvrđen je sadržaj kalcija u mehanički iskoštenom mesu kako je navedeno u članku 11. stavku 2. Uredbe (EZ) br. 853/2004.
Članak 5.
Popis objekata u smislu Uredbe (EZ) br. 882/2004
U Prilogu V. ovoj Uredbi utvrđeni su zahtjevi koji se odnose na popis objekata kako je navedeno u članku 31. stavku 2. točki (f) Uredbe (EZ) br. 882/2004.
Članak 6.
Uzorci zdravstvenih certifikata za žablje krakove, puževe, želatinu i kolagen u smislu Uredbe (EZ) br. 853/2004
U Prilogu VI. ovoj Uredbi utvrđeni su uzorci zdravstvenih certifikata za uvoz žabljih krakova, puževa, želatine i kolagena, kako je navedeno u članku 6. stavku 1. točki (d) Uredbe (EZ) br. 853/2004, kao i za uvoz sirovina za proizvodnju želatine i kolagena.
Članak 7.
Odstupanja od Uredbe (EZ) br. 852/2004 za hranu s tradicionalnim obilježjima
1. Za potrebe ove Uredbe, „hrana s tradicionalnim obilježjima” je hrana koja se u državama članicama u kojima se tradicionalno proizvodi:
|
(a) |
povijesno prepoznaje kao tradicionalni proizvod, ili |
|
(b) |
se proizvodi u skladu s kodificiranim ili registriranim tehničkim referencama na tradicionalne postupke ili u skladu s tradicionalnim metodama proizvodnje, ili |
|
(c) |
je zaštićena kao tradicionalni prehrambeni proizvod zakonom Zajednice, nacionalnim, regionalnim ili lokalnim zakonom. |
2. Države članice mogu dopustiti proizvođačima hrane s tradicionalnim obilježjima individualno ili općenito odstupanje od zahtjeva navedenih u:
|
(a) |
poglavlju II. točki 1. Priloga II. Uredbi (EZ) br. 852/2004 s obzirom na prostorije u kojima su takvi proizvodi izloženi okolišu, što je nužno za djelomičan razvoj njihovih obilježja. Takve prostorije mogu posebno imati zidove, stropove i vrata koji nisu glatki, nepropusni, neupijajući ili izrađeni od nehrđajućeg materijala te prirodne geološke zidove, stropove i podove; |
|
(b) |
poglavlju II. točki 1.(f) i poglavlju V. točki 1. Priloga II. Uredbi (EZ) br. 852/2004 s obzirom na tip materijala od kojeg su izrađeni instrumenti i oprema koji se koriste posebno za pripremu, pakiranje i omatanje ovih proizvoda. Mjere čišćenja i dezinfekcije prostorija navedenih u točki (a) te učestalost njihovog izvođenja prilagođavaju se aktivnostima, kako bi se uzela u obzir njihova specifična ambijentalna flora. Instrumenti i oprema navedeni u točki (b) održavaju se neprestano na zadovoljavajućem stupnju higijene i moraju se redovito čistiti i dezinficirati. |
3. Države članice koje odobravaju odstupanja predviđena stavkom 2. obavještavaju o tome Komisiju i ostale države članice u roku od 12 mjeseci nakon odobrenja individualnih ili općenitih odstupanja. Svaka takva obavijest:
|
(a) |
sadrži kratak opis zahtjeva koji su prilagođeni; |
|
(b) |
opisuje hranu i predmetne objekte; i |
|
(c) |
daje sve ostale odgovarajuće informacije. |
Članak 8.
Izmjene Uredbe (EZ) br. 853/2004
Prilozi II. i III. Uredbi (EZ) br. 853/2004 izmjenjuju se u skladu s Prilogom VII. ovoj Uredbi.
Članak 9.
Izmjene Uredbe (EZ) br. 854/2004
Prilozi I., II. i III. Uredbi (EZ) br. 854/2004 izmjenjuju se u skladu s Prilogom VIII. ovoj Uredbi.
Članak 10.
Stupanje na snagu i primjenjivost
Ova Uredba stupa na snagu dvadesetog dana od dana objave u Službenom listu Europske unije.
Primjenjuje se od 1. siječnja 2006., osim poglavlja II. i III. Priloga V. koji se primjenjuju od 1. siječnja 2007.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 5. prosinca 2005.
Za Komisiju
Markos KYPRIANOU
Član Komisije
(1) SL L 139, 30.4.2004., str. 1. Ispravljeno u SL L 226, 25.6.2004., str. 3.
(2) SL L 139, 30.4.2004., str. 55. Ispravljeno u SL L 226, 25.6.2004., str. 22.
(3) SL L 139, 30.4.2004., str. 206. Ispravljeno u SL L 226, 25.6.2004., str. 83.
(4) SL L 165, 30.4.2004., str. 1. Ispravljeno u SL L 191, 28.5.2004., str. 1.
(5) Još nije objavljeno u Službenom listu.
(6) SL L 157, 30.4.2004., str. 33. Ispravljeno u SL L 195, 2.6.2004., str. 12.
(7) SL L 338, 22.12.2005., str. 1.
PRILOG I.
INFORMACIJE O PREHRAMBENOM LANCU
DIO I.
OBVEZE SUBJEKATA U POSLOVANJU S HRANOM
Subjekti u poslovanju s hranom koji se bave uzgojem životinja koje se šalju na klanje osiguravaju da se informacije o prehrambenom lancu iz Uredbe (EZ) br. 853/2004 na odgovarajući način upišu u dokumentaciju o poslanim životinjama, na način da budu na raspolaganju subjektu koji upravlja klaonicom.
DIO II.
OBVEZE NADLEŽNIH TIJELA
POGLAVLJE I.
PRIBAVLJANJE INFORMACIJA O PREHRAMBENOM LANCU
|
1. |
Nadležno tijelo na mjestu slanja obavještava subjekt u poslovanju s hranom koji otprema o najmanjim elementima informacija o prehrambenom lancu koje se moraju dostaviti klaonici sukladno odjeljku III. Priloga II. Uredbi (EZ) br. 853/2004. |
|
2. |
Nadležno tijelo na mjestu klanja provjerava:
|
|
3. |
Kada se životinje šalju na klanje u drugu državu članicu, nadležna tijela na mjestu slanja i na mjestu klanja surađuju kako bi se osiguralo da informacije koje daje subjekt u poslovanju s hranom koji šalje životinje budu lako dostupne subjektu koji upravlja klaonicom, koji te informacije prima. |
POGLAVLJE II.
POVRATNE INFORMACIJE GOSPODARSTVU PODRIJETLA
|
1. |
Službeni veterinar može koristiti uzorak dokumenta iz Dodatka I. za relevantne rezultate inspekcije koji se moraju priopćiti gospodarstvu na kojem su životinje uzgajane prije klanja u istoj državi članici, sukladno poglavlju I. odjeljka II. Priloga I. Uredbi (EZ) br. 854/2004. |
|
2. |
Nadležno tijelo je odgovorno za priopćavanje relevantnih rezultata inspekcije u slučajevima kada su životinje uzgajane na gospodarstvu u drugoj državi članici, pri čemu mora koristiti verziju uzorka dokumenta iz dodatka i na jeziku države otpreme i na jeziku države primitka. |
Dodatak Prilogu I.
UZORAK DOKUMENTA
|
1. |
Identifikacijski podaci |
|
|
|
1.1. |
gospodarstvo podrijetla (npr. vlasnik ili rukovoditelj) |
|
|
|
ime/broj |
|
|
|
puna adresa |
|
|
|
broj telefona |
|
|
1.2. |
identifikacijski brojevi (dodajte posebni list) |
|
|
|
ukupan broj životinja (po vrstama) |
|
|
|
problemi identifikacije (ako postoje) |
|
|
1.3. |
identifikacija stada/jata/kaveza (ako je primjenjivo) |
|
|
1.4. |
životinjske vrste |
|
|
1.5. |
referentni broj zdravstvenog certifikata |
|
2. |
Rezultati ante mortem pregleda |
|
|
|
2.1. |
dobro stanje |
|
|
|
broj zaraženih životinja |
|
|
|
vrsta/razred/starost |
|
|
|
opažanja (npr. grizenje repa) |
|
|
2.2. |
životinje su isporučene prljave |
|
|
2.3. |
klinički nalazi (bolesti) |
|
|
|
broj zaraženih životinja |
|
|
|
vrsta/razred/starost |
|
|
|
opažanja |
|
|
|
datum pregleda |
|
|
2.4. |
laboratorijski nalazi (1) |
|
3. |
Rezultati post-mortem pregleda |
|
|
|
3.1. |
(makroskopski) nalazi broj zaraženih životinja |
|
|
|
vrsta/razred/starost |
|
|
|
organ ili mjesto zaražene (zaraženih) životinja |
|
|
|
datum klanja |
|
|
3.2. |
bolest (može se upotrijebiti šifra (2)) |
|
|
|
broj zaraženih životinja |
|
|
|
vrsta/razred/starost |
|
|
|
organ ili mjesto zaražene (zaraženih) životinja |
|
|
|
djelomično ili u potpunosti neodobren trup (navesti razlog) |
|
|
|
datum klanja |
|
|
3.3. |
laboratorijski rezultati (3) |
|
|
3.4. |
drugi rezultati (npr. paraziti, strana tijela itd.) |
|
|
3.5. |
nalazi glede dobrog stanja (npr. slomljene noge) |
|
4. |
Dodatne informacije |
|
|
5. |
Kontakt podaci |
|
|
|
5.1. |
klaonica (broj odobrenja) |
|
|
|
ime |
|
|
|
potpuna adresa |
|
|
|
broj telefona |
|
|
5.2. |
elektronička adresa, ako postoji |
|
6. |
Službeni veterinar (ime tiskanim slovima) |
|
|
|
|
potpis i pečat |
|
7. |
Datum |
|
|
8. |
Broj strana priloženih ovom obrascu: |
|
(1) Mikrobiološki, kemijski, serološk itd. (uključiti rezultate kao što je priloženo)
(2) Nadležna tijela mogu uvesti sljedeće šifre: Šifra A za bolesti na listi OIE; šifre B100 i B200 za aspekte dobrostanja (poglavlje II. točka C odjeljka I. Priloga I. Uredbi (EZ) br. 854/2004) i šifre C100 do C290 za odluke koje se odnose na meso (poglavlje V. točka 1.(a) do odjeljka II. Priloga I. Uredbi (EZ) br. 854/2004). Ovaj sustav šifriranja može po potrebi uključivati daljnju podjelu (npr. C141 za blagu opću bolest, C142 za težu bolest itd.). Ukoliko se koriste šifre, one se moraju dati na raspolaganje subjektu u poslovanju s hranom, s prikladnim objašnjenjem njihovih značenja.
(3) Mikrobiološki, kemijski, serološki itd. (uključiti rezultate kao što je priloženo)
PRILOG II.
PROIZVODI RIBARSTVA
ODJELJAK I.
OBVEZE SUBJEKATA U POSLOVANJU S HRANOM
U ovom se odjeljku utvrđuju detaljna pravila vizualnog pregleda za otkrivanje parazita u proizvodima ribarstva.
POGLAVLJE I.
DEFINICIJE
|
1. |
„Vidljivi parazit” znači parazit ili grupa parazita koji se po svojim dimenzijama, boji ili strukturi jasno razlikuju od tkiva ribe. |
|
2. |
„Vizualni pregled” znači ne-destruktivni pregled riba ili proizvoda ribarstva sa ili bez optičkih pomagala za povećavanje te pod dobrim uvjetima osvjetljenja za ljudski vid, uključujući, ako je potrebno, osvjetljavanje. |
|
3. |
„Osvjetljavanje” znači kod plosnatih riba i ribljih filea podizanje ribe prema svjetlu u tamnoj prostoriji da bi se otkrili paraziti. |
POGLAVLJE II.
VIZUALNI PREGLED
|
1. |
Vizualni pregled se izvodi na reprezentativnom broju uzoraka. Odgovorne osobe u kopnenim pogonima i kvalificirane osobe na brodovima-tvornicama određuju raspon i učestalost pregleda ovisno o tipu proizvoda ribarstva, njihovom zemljopisnom podrijetlu i njihovoj upotrebi. Tijekom proizvodnje, kvalificirana osoba mora izvoditi vizualni pregled trbušne šupljine ribe kojoj su izvađeni unutrašnji organi te jetre i ikre namijenjenih prehrani ljudi. Vizualni pregled se izvodi ovisno o načinu odstranjivanja unutrašnjih organa:
|
|
2. |
Vizualni pregled ribljih filea ili odrezaka izvode kvalificirane osobe tijekom njihove pripreme i nakon filetiranja ili rezanja. Kada pojedinačni pregled nije moguć zbog veličine filea ili zbog postupaka filetiranja, mora se utvrditi plan uzimanja uzoraka koji se stavlja na raspolaganje nadležnom tijelu sukladno poglavlju II. točki 4. odjeljka VIII. Priloga III. Uredbi (EZ) br. 853/2004. Kada je s tehničkog stajališta potrebno osvjetljivanje filea, ono mora biti uključeno u plan uzimanja uzoraka. |
ODJELJAK II.
OBVEZE NADLEŽNIH TIJELA
POGLAVLJE I.
GRANIČNE VRIJEDNOSTI UKUPNOG ISPARIVOG BAZNOG DUŠIKA (TVB-N) ZA ODREĐENE KATEGORIJE RIBLJIH PROIZVODA I ANALITIČKE METODE KOJE SE MORAJU UPOTRIJEBITI
|
1. |
Neobrađeni proizvodi ribarstva koji pripadaju kategorijama vrsta navedenih u poglavlju II. smatraju se neodgovarajućim za prehranu ljudi kad organoleptička procjena izazove sumnju u vezi s njihovom svježinom i kada kemijske kontrole pokažu da su premašene sljedeće granične vrijednosti u odnosu na TVB-N:
Referentna metoda koja se koristi za kontrolu granične vrijednosti TVB-N-a uključuje destiliranje ekstrakta deproteiniziranog preklornom kiselinom, kako je to navedeno u poglavlju III. |
|
2. |
Destiliranje iz točke 1. mora se obavljati upotrebom aparata koji je sukladan dijagramu u poglavlju IV. |
|
3. |
Rutinske metode koje se mogu koristiti za kontrolu graničnih vrijednosti TVB-N-a su sljedeće:
|
|
4. |
Uzorak se mora sastojati od oko 100 g mesa uzetog s najmanje tri različita mjesta, koje se pomiješa zajedno mljevenjem. Države članice preporučuju da službeni laboratoriji rutinski upotrebljavaju prethodno navedenu referentnu metodu. Kada su podatci nesigurni ili u slučaju spora glede rezultata analize izvedene pomoću jedne od rutinskih metoda, za provjeru rezultata može se upotrijebiti samo referentna metoda. |
POGLAVLJE II.
KATEGORIJE VRSTA ZA KOJE SU ODREĐENE GRANIČNE VRIJEDNOSTI TVB-N-a
|
1. |
Sebastes spp., Helicolenus dactylopterus, Sebastichthys capensis. |
|
2. |
Vrste koje pripadaju porodici Pleuronectidae (osim velike ploče: Hyppoglossus spp.). |
|
3. |
Salmo salar, vrste koje pripadaju porodici Merlucciidae, vrste koje pripadaju porodici Gadidae. |
POGLAVLJE III.
UTVRĐIVANJE KONCENTRACIJE TVB-N-a U RIBAMA I RIBLJIM PROIZVODIMA
Referentni postupak
1. Svrha i područje primjene
Ova metoda opisuje referentni postupak za identificiranje koncentracije dušika TVB-N-a u ribama i proizvodima ribarstva. Ovaj se postupak primjenjuje na koncentracije TVB-N-a od 5 mg/100 g do najmanje 100 mg/100 g.
2. Definicija
„Koncentracija TVB-N-a” znači sadržaj dušika u isparivim dušičnim bazama, kako je to utvrđeno u opisanom postupku.
Koncentracija se izražava u mg/100 g.
3. Kratak opis
Isparive dušične baze se ekstrahiraju iz uzorka upotrebom otopine 0.6 mol perklorne kiseline. Nakon alkalinizacije ekstrakt se destilira vodenom parom, a komponente isparive baze se apsorbiraju u kiselinskom recipijentu. Koncentracija TVB-N-a se utvrđuje titracijom apsorbiranih baza.
4. Kemikalije
Ukoliko nije drugačije određeno, moraju se koristiti kemikalije razreda reagensa. Voda koja se koristi mora biti ili destilirana ili demineralizirana ili najmanje iste takve čistoće. Ukoliko nije drugačije naznačeno, „otopina” je vodena otopina kako slijedi:
|
(a) |
otopina perklorne kiseline = 6 g/100 ml; |
|
(b) |
otopina natrijevog hidroksida = 20 g/100 ml; |
|
(c) |
standardna otopina klorovodične kiseline 0,05 mol/l (0,05 N);
|
|
(d) |
otopina borne kiseline = 3 g/100 ml; |
|
(e) |
silikonski anti-pjeneći agens; |
|
(f) |
otopina fenolftaleina = 1 g/100 ml 95-postotnog etanola; |
|
(g) |
indikatorska otopina (Tashiro miješani indikator) 2 g metil-crvenog i 1 g metilen-plavog se otopi u 1 000 ml 95-postotnog etanola. |
5. Instrumenti i pribor
|
(a) |
Stroj za mljevenje mesa za izradu dovoljno homogene riblje mase. |
|
(b) |
Brza miješalica s brzinom između 8 000 i 45 000 okretaja/min. |
|
(c) |
Valoviti filter, promjera 150 mm, za brzo filtriranje. |
|
(d) |
Bireta, 5 ml, graduirana na 0,01 ml. |
|
(e) |
Aparat za destilaciju vodenom parom. Ovaj aparat mora omogućavati reguliranje različitih količina pare i proizvodnju konstantne količine pare kroz određeno vremensko razdoblje. Mora osiguravati da se tijekom dodavanja alkalizirajuće supstance ne oslobode rezultirajuće slobodne baze. |
6. Izvedba
Upozorenje: kada se radi s perklornom kiselinom koja ima snažno nagrizajuće djelovanje, potrebne su mjere opreza i prevencije. Uzorci se, ako je to uopće moguće, pripremaju što je prije moguće nakon njihovog prispijeća, u skladu sa sljedećim uputama:
|
(a) |
Uzorak za analizu se pažljivo melje u stroju za mljevenje mesa, kao što je to navedeno u točki 5.(a). Izvaže se točno 10 g ± 0,1 g mljevenog uzorka u prikladnu posudu. To se pomiješa s 90,0 ml otopine perklorne kiseline kao što je navedeno u točki 4.(a), dvije minute homogenizira u miješalici, kao što je opisano u točki 5.(b) i zatim filtrira. Ovako dobiveni ekstrakt može se čuvati najmanje sedam dana na temperaturi između 2 °C i 6 °C. |
|
(b) |
U aparat za destilaciju vodenom parom, koji je opisan u točki 5.(e), stavlja se 50,0 ml ekstrakta dobivenog na način opisan u točki (a). Za kasniju kontrolu alkalinizacije ekstrakta dodaje se nekoliko kapi fenolftaleina, kako je specificirano u točki 4.(f). Nakon dodavanja nekoliko kapi silikonskog anti-pjenećeg agensa, ekstraktu se dodaje 6.5 ml otopine natrijevog hidroksida, kako je specificirano u točki 4.(b) i odmah započinje destilacija vodenom parom. Destilacija vodenom parom se regulira tako da se u 10 minuta proizvede oko 100 ml destilata. Odvodna destilacijska cijev se uroni u prihvatnu posudu sa 100 ml otopine borne kiseline, kako je specificirano u točki 4.(d), u koju je dodano tri do pet kapi indikatorske otopine, kako je to opisano u točki 4.(g). Nakon točno 10 minuta, destilacija je gotova. Odvodna destilacijska cijev se izvadi iz prihvatne posude i ispere vodom. Isparive baze sadržane u otopini u prihvatnoj posudi utvrđuju se titracijom sa standardnom otopinom klorovodične kiseline, kao što je specificirano u točki 4.(c). PH vrijednost na krajnjoj točki mora biti 5,0 ± 0,1. |
|
(c) |
Potrebne su dvostruke analize. Primijenjena metoda je ispravna ako razlika između dviju analiza nije veća od 2 mg/100 g. |
|
(d) |
Slijepi se pokus izvodi kao što je opisano u točki (b). Umjesto ekstrakta, upotrebljava se 50,0 ml otopine perklorne kiseline, kako je specificirano u točki 4(a). |
7. Izračunavanje TVB-N
Titracijom otopine iz prihvatne posude s klorovodičnom kiselinom, kao u točki 4.(c), izračunava se koncentracija TVB-N-a upotrebom sljedeće jednadžbe:
TVB — N (expressed in mg/100 g sample) = 
|
V1 |
= |
Volumen 0,01 mola otopine klorovodične kiseline u ml za uzorak |
|
V0 |
= |
Volumen 0,01 mola otopine klorovodične kiseline u ml za slijepi pokus |
|
M |
= |
Težina uzorka u g. |
Napomena
|
1. |
Potrebna je dvostruka analiza. Primijenjena metoda je ispravna ako razlika između dva pokusa nije veća od 2 mg/100 g. |
|
2. |
Provjerite jednadžbu destiliranjem otopine NH4Cl ekvivalentne 50 mg TVB-N/100 g. |
|
3. |
Standardna devijacija ponovljivosti Sr = 1,20 mg/100 g. Standardna devijacija usporedivosti SR = 2,50 mg/100 g. |
POGLAVLJE IV.
APARAT ZA DESTILACIJU TVB-N VODENOM PAROM

PRILOG III.
PRIZNATE METODE TESTIRANJA ZA OTKRIVANJE MORSKIH BIOTOKSINA
Nadležna tijela, a kada je to prikladno i subjekti u poslovanju s hranom, upotrebljavaju sljedeće analitičke metode za kontrolu sukladnosti s graničnim vrijednostima navedenim u poglavlju V. točki 2. odjeljka VII. Priloga III. Uredbi (EZ) br. 853/2004.
Sukladno članku 7. stavcima 2. i 3. Direktive Vijeća 86/609/EEZ (1), kada se upotrebljavaju biološke metode moraju se uzeti u obzir elementi zamjene, poboljšanja i smanjenja.
POGLAVLJE I.
METODA ZA OTKRIVANJE BIOTOKSINA U ŠKOLJKAMA KOJI UZROKUJU PARALIZU (PSP)
|
1. |
Sadržina biotoksina koji izaziva paralizu (PSP) u jestivim dijelovima školjki (cijelo tijelo ili bilo koji jestivi dio posebno) utvrđuje se u skladu s metodom biološkog testiranja ili bilo kojom drugom međunarodno priznatom metodom. Metoda biološkog testiranja može se, ako je potrebno, izvoditi zajedno s nekom drugom metodom za otkrivanje saksitoksina i njegovih analoga, za koju su na raspolaganju standardi. |
|
2. |
Ukoliko su rezultati sporni, referentna metoda je biološka metoda. |
POGLAVLJE II.
METODA ZA OTKRIVANJE BIOTOKSINA U ŠKOLJKAMA KOJI IZAZIVAJU GUBITAK PAMĆENJA (ASP)
Ukupna sadržina biotoksina koji izazivaju gubitak pamćenja (ASP) u jestivim dijelovima školjki (cijelo tijelo ili bilo koji jestivi dio posebno) otkriva se upotrebom metode visoko-djelotvorne tekućinske kromatografije (HPLC) ili bilo kojom drugom priznatom metodom.
Ukoliko su rezultati sporni, referentna metoda je HPLC metoda.
POGLAVLJE III.
METODE ZA OTKRIVANJE LIPOFILNOG TOKSINA
A. Biološke metode
|
1. |
Za otkrivanje morskih toksina navedenih u poglavlju V. točkama 2. (c), (d), i (e), odjeljka VII. Priloga III. Uredbi (EZ) br. 853/2004 može se upotrijebiti niz postupaka biopokusa na miševima koji se razlikuju po dijelu tijela na kojem se obavlja pokus (hepatopankreas ili cijelo tijelo) te po otopinama koje se koriste za ekstrakciju i pročišćavanje. Osjetljivost i selektivnost ovise o izboru otopina koje se koriste za ekstrakciju i pročišćavanje i to se mora uzeti u obzir kod donošenja odluke o metodi koja će se upotrijebiti da bi se pokrio cijeli raspon toksina. |
|
2. |
Za otkrivanje okadaične kiseline, dinofizistoksina, pektenotoksina i jesotoksina može se upotrijebiti samo jedan biopokus na miševima s acetonskom ekstrakcijom. Ovaj se pokus, ako je potrebno, može nadopuniti koracima tekućinskog/tekućinskog razdvajanja pomoću etil acetata/vode za uklanjanje možebitnih interferencija. Za otkrivanje azaspiracida na regulatornim nivoima pomoću ovog postupka kao dio tijela za pokus upotrebljava se cijelo tijelo. |
|
3. |
Za svaki se test koriste tri miša. Kada od tri miša dva uginu unutar 24 sata od ubrizgavanja ekstrakta koji odgovara težini od 5 g hepatopankreasa ili 25 g cijelog tijela, to se smatra pozitivnim rezultatom u odnosu na prisutnost jednog ili više toksina navedenih u poglavlju V. točkama 2. (c), (d) i (e) odjeljka VII. Priloga III. Uredbi (EZ) 853/2004 na razinama iznad navedenih. |
|
4. |
Biopokus na miševima s acetatnom ekstrakcijom nakon koje slijedi tekućinsko/tekućinsko razdvajanje s dietileterom, može se upotrijebiti za otkrivanje okadaične kiseline, dinofizistoksina, pektenotoksina i azaspiracida, ali se ne može upotrijebiti za otkrivanje jesotoksina jer tijekom faze razdvajanja može doći do gubitaka ovih toksina. Za svaki se test koriste tri miša. Kada od tri miša dva uginu unutar 24 sata od ubrizgavanja ekstrakta koji odgovara težini od 5 g hepatopankreasa ili 25 g cijelog tijela, to se smatra pozitivnim rezultatom u odnosu na prisutnost okadaične kiseline, dinofizistoksina, pektenotoksina i azaspiracida na razinama iznad onih koji su navedeni u poglavlju V. točkama 2. (c) i (e), odjeljka VII. Priloga III. Uredbi (EZ) 853/2004. |
|
5. |
Za otkrivanje okadaične kiseline, dinofizistoksina i azaspiracida može se koristiti pokus na štakorima. Za svaki se pokus koriste tri štakora. Dijaretička reakcija kod bilo kojeg od tri štakora smatra se pozitivnim rezultatom za prisutnost okadaične kiseline, dinofizistoksina, pektenotoksina i azaspiracida na razinama iznad onih koji su navedeni u poglavlju V. točkama 2.(c) i (e), odjeljka VII. Priloga III. Uredbi (EZ) 853/2004. |
B. Alternativne metode otkrivanja
|
1. |
Kao alternativne ili dopunske metode biološkim testovima upotrebljava se niz metoda kao što su visokodjelotvorna tekućinska kromatografija (HPLC) s fluorometrijskim otkrivanjem, tekućinska kromatografija (LC), masena spektrometrija (MS), imunotestovi i funkcionalni testovi kao što je test inhibicije fosfataze, uz uvjet da pojedinačno ili u kombinaciji mogu otkriti barem sljedeće analoge, da nisu manje djelotvorne od bioloških metoda i da njihova provedba pruža jednaki nivo zaštite javnog zdravlja:
|
|
2. |
Ako se otkriju novi analozi značajni za javno zdravlje, treba ih se uključiti u analizu. Prije izvođenja kemijskih analiza, moraju se na raspolaganje staviti standardi. Ukupna toksičnost se izračunava upotrebom faktora konverzije koji se temelje na raspoloživim podacima o toksičnosti za svaki toksin. |
|
3. |
Karakteristike učinkovitosti ovih metoda određuju se nakon validacije prema međunarodno priznatom protokolu. |
|
4. |
Biološke metode se zamjenjuju alternativnim metodama otkrivanja čim se na raspolaganje stave referentni materijali za otkrivanje toksina koji su navedeni u poglavlju V. odjeljka VI. Priloga III. Uredbi (EZ) 853/2004 te čim se te metode validiraju i ovo poglavlje sukladno tome nadopuni. |
(1) SL L 358, 18.12.1986., str. 1.
PRILOG IV.
SADRŽINA KALCIJA U MEHANIČKI ISKOŠTENOM MESU
Sadržina kalcija u mehanički iskoštenom mesu (MSM) kako je navedeno u Uredbi (EZ) br. 853/2004:
|
1. |
ne smije prelaziti 0.1 % (= 100 mg/100 g ili 1 000 ppm) svježeg proizvoda; |
|
2. |
utvrđuje se standardnom međunarodnom metodom. |
PRILOG V.
LISTA ODOBRENIH PREHRAMBENIH OBJEKATA
POGLAVLJE I.
PRISTUP LISTAMA ODOBRENIH PREHRAMBENIH OBJEKATA
Kako bi pomogla državama članicama u izradi ažurnih lista odobrenih prehrambenih objekata koje se stavljaju na raspolaganje drugim državama članicama i javnosti, Komisija održava web lokaciju na kojoj svaka država članica daje poveznicu na svoju nacionalnu web stranicu.
POGLAVLJE II.
FORMAT NACIONALNIH WEB STRANICA
A. Glavna lista
|
1. |
Svaka država članica daje Komisiji adresu jedne nacionalne web lokacije koja sadrži glavnu listu svih lista odobrenih prehrambenih objekata za proizvode životinjskog podrijetla kako je definirano u točki 8. 1. Priloga I. Uredbi (EZ) br. 853/2004. |
|
2. |
Glavna lista navedena u točki 1. sastoji se od jednog lista papira i izrađena je na jednom ili više službenih jezika Zajednice. |
B. Operativna shema
|
1. |
Web lokacija koja sadrži glavnu listu razvija nadležno tijelo, ili kada je to prikladno, jedno od nadležnih tijela navedenih u članku 4. Uredbe (EZ) br. 882/2004. |
|
2. |
Glavna lista uključuje poveznice na:
|
POGLAVLJE III.
IZGLED I ŠIFRE LISTA ODOBRENIH OBJEKATA
Utvrđuje se izgled lista zajedno s relevantnim informacijama i šiframa kako bi se osigurala široka raspoloživost informacija koje se odnose na odobrene prehrambene objekte i kako bi se poboljšala razumljivost tih lista.
POGLAVLJE IV.
TEHNIČKE SPECIFIKACIJE
Zadaci i aktivnosti navedeni u poglavljima II. i III. izvode se u skladu s tehničkim specifikacijama koje objavljuje Komisija.
PRILOG VI.
UZORCI ZDRAVSTVENIH CERTIFIKATA ZA UVOZ ŽABLJIH KRAKOVA, PUŽEVA, ŽELATINE I KOLAGENA
ODJELJAK I.
ŽABLJI KRAKOVI I PUŽEVI
Zdravstveni certifikati navedeni u članku 6. točki 1.(d) Uredbe (EZ) br. 853/2004 za uvoz žabljih krakova i puževa moraju biti u skladu s uzorcima navedenim u dijelu A i dijelu B Dodatka I. ovom Prilogu.
ODJELJAK II.
ŽELATINA
Ne dovodeći u pitanje drugo specifično zakonodavstvo Zajednice, uključujući najmanje, ali ne ograničavajući se samo na zakonodavstvo o prijenosnim spongioformnim encefalitisima i hormonima, zdravstveni certifikati navedeni u članku 6. točki 1.(d) Uredbe (EZ) br. 853/2004 za uvoz želatine i sirovina za proizvodnju želatine moraju biti u skladu s uzorcima navedenim u dijelu A i dijelu B Dodatka II. ovom Prilogu.
ODJELJAK III.
KOLAGEN
Ne dovodeći u pitanje drugo specifično zakonodavstvo Zajednice, uključujući najmanje, ali ne ograničavajući se samo na zakonodavstvo o prijenosnim spongioformnim encefalitisima i hormonima, zdravstveni certifikati navedeni u članku 6. točki 1.(d) Uredbe (EZ) br. 853/2004 za uvoz kolagena i sirovina za proizvodnju kolagena moraju biti u skladu s uzorcima navedenim u dijelu A i dijelu B Dodatka III. ovom Prilogu.
Dodatak I. Prilogu VI.
DIO A
UZORAK ZDRAVSTVENOG CERTIFIKATA ZA UVOZ RASHLAĐENIH, ZAMRZNUTIH ILI PRERAĐENIH ŽABLJIH KRAKOVA NAMIJENJENI PREHRANI LJUDI


DIO B
UZORAK ZDRAVSTVENOG CERTIFIKATA ZA UVOZ PUŽEVA BEZ LJUŠTURE TE KUHANIH, PRERAĐENIH ILI KONZERVIRANIH PUŽEVA ZA PREHRANU LJUDI


Dodatak II. Prilogu VI.
DIO A
UZORAK ZDRAVSTVENOG CERTIFIKATA ZA UVOZ ŽELATINE NAMIJENJENE ZA PREHRANU LJUDI


DIO B
UZORAK ZDRAVSTVENOG CERTIFIKATA ZA UVOZ SIROVINA ZA PROIZVODNJU ŽELATINE NAMIJENJENE ZA PREHRANU LJUDI


Dodatak III. Prilogu VI.
DIO A
UZORAK ZDRAVSTVENOG CERTIFIKATA ZA UVOZ KOLAGENA NAMIJENJENOG ZA PREHRANU LJUDI


DIO B
UZORAK ZDRAVSTVENOG CERTIFIKATA ZA UVOZ SIROVINA ZA PROIZVODNJU KOLAGENA NAMIJENJENOG ZA PREHRANU LJUDI


PRILOG VII.
IZMJENE UREDBE (EZ) br. 853/2004
Prilozi II. i III. Uredbi (EZ) br. 853/2004 izmjenjuju se na sljedeći način:
|
1. |
Prilog II. odjeljak I. B mijenja se kako slijedi:
|
|
2. |
Prilog III. mijenja se kako slijedi:
|
(1) SL L 123, 24.4.1998., str. 1.
PRILOG VIII.
IZMJENE UREDBE (EZ) BR. 854/2004
Prilozi I., II. i III. Uredbi (EZ) br. 854/2004 izmjenjuju se na sljedeći način:
|
1. |
Prilog I. odjeljak I. poglavlje III.(3) mijenja se kako slijedi:
|
|
2. |
u Prilogu II. poglavlju II.(A) točke 4. i 5. se mijenjaju sljedećim:
|
|
3. |
u Prilogu III. poglavlju II.(G) točka 1. se zamjenjuje sljedećim:
|
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
92 |
32006D0028
|
L 019/32 |
SLUŽBENI LIST EUROPSKE UNIJE |
18.01.2006. |
ODLUKA KOMISIJE
od 18. siječnja 2006.
o produljenju maksimalnog razdoblja za obilježavanje određenih goveda ušnim markicama
(priopćena pod brojem dokumenta C(2006) 43)
(Tekst značajan za EGP)
(2006/28/EZ)
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Uredbu (EZ) br. 1760/2000 Europskog parlamenta i Vijeća od 17. srpnja 2000. o uspostavi sustava za označivanje i registraciju goveda i u vezi s označivanjem govedine i proizvoda od govedine i o stavljanju izvan snage Uredbe Vijeća (EZ) 820/97 (1), a posebno njezin članak 4. stavak 2,
uzimajući u obzir zahtjeve država članica,
budući da:
|
(1) |
Neke su države članice, u skladu s Uredbom (EZ) br. 1760/2000, zatražile da se maksimalno razdoblje utvrđeno za obilježavanje goveda ušnim markicama produlji na šest mjeseci ako se životinje drže u posebnim uvjetima gospodarenja i ako stavljanje ušnih markica u razdoblju od 20 dana nakon rođenja životinje otežavaju ili čak dovode u opasnost posebni prirodna ograničenja tog područja i vrlo agresivno ponašanje životinja. |
|
(2) |
Potrebno je dopustiti produljenje maksimalnog razdoblja za stavljanje ušnih markica u tim okolnostima i pod uvjetom primjene određenih zaštitnih mjera. Posebno je neophodno osigurati da to ne utječe negativno na kvalitetu podataka koji se dobivaju iz baze podataka za goveda i da se goveda na koja nisu stavljene ušne markice ne premještaju. |
|
(3) |
To produljenje će se primjenjivati samo na gospodarstva koja je pojedinačno ovlastila pojedina država članica u skladu s jasno definiranim kriterijima. |
|
(4) |
Budući da je potrebno da se mjere predviđene u ovoj Odluci primjenjuju u svim državama članicama, potrebno je staviti izvan snage Odluku Komisije 98/589/EZ od 12. listopada 1998. o produljenju maksimalnog razdoblja utvrđenog za obilježavanje ušnim markicama određenih goveda koja pripadaju španjolskom stadu (2), u kojoj su navedeni posebni propisi za Španjolsku. |
|
(5) |
Mjere predviđene ovom Odlukom u skladu su s mišljenjem Odbora za Europski fond za usmjeravanje i jamstva u poljoprivredi, |
DONIJELA JE OVU ODLUKU:
Članak 1.
Odobrenje za produljenje razdoblja obilježavanja
Države članice smiju ovlastiti gospodarstva da maksimalno razdoblje utvrđeno u prvom podstavku članka 4. stavka 2. Uredbe (EZ) br. 1760/2000 za stavljanje ušnih markica na telad krava dojilja koje se ne koriste za proizvodnju mlijeka produlje na šest mjeseci, pod uvjetom da su ispunjeni uvjeti predviđeni u člancima 2. do 5. ove Odluke.
Članak 2.
Uvjeti za odobravanje ovlaštenja
1. Države članice smiju davati ovlaštenja kako je predviđeno člankom 1. kad su se uvjerile da su ispunjeni sljedeći uvjeti:
|
(a) |
gospodarstvo je uzgajalište sa slobodnim načinima držanja životinja u kojem se krave dojilje uzgajaju u ekstenzivnim uvjetima; |
|
(b) |
područje na kojem se drže životinje obilježavaju znatna prirodna ograničenja koje dovode do smanjenog fizičkog kontakta s ljudima; |
|
(c) |
životinje nisu naviknute na redovit kontakt s ljudima i pokazuju vrlo agresivno ponašanje; |
|
(d) |
kad su stavljene ušne markice, svakom se teletu može jasno utvrditi majka. |
2. Države članice smiju utvrditi dodatne kriterije, posebno, kako je predviđeno člankom 1., ograničavanje ovlaštenja na pojedina zemljopisna područja ili određene pasmine.
3. Države članice obavješćuju Komisiju ako primjenjuju ovu Odluku i informiraju je o mogućim dodatnim kriterijima koje utvrde u skladu sa stavkom 2.
Članak 3.
Stavljanje ušnih markica
Na gospodarstvima koja su dobila ovlaštenja kako je predviđeno člankom 1., ušne se markice stavljaju najkasnije kad tele:
|
— |
dostigne dob od šest mjeseci, |
|
— |
bude odvojeno od svoje majke, |
|
— |
napusti gospodarstvo. |
Članak 4.
Kompjutorizirana baza podataka
1. Nadležno tijelo mora u svojoj kompjutoriziranoj bazi podataka za goveda iz članka 5. Uredbe (EZ) br. 1760/2000 evidentirati ovlaštenja kako je predviđeno člankom 1. ove Odluke u pogledu gospodarstva kojima su ona dodijeljena.
2. Kad izvještavaju o rođenju svake životinje u skladu s člankom 7. stavkom 1. Uredbe (EZ) br. 1760/2000, posjednici životinja moraju obavijestiti nadležno tijelo o životinjama kojima još nisu stavljene ušne markice u skladu s ovom Odlukom.
3. Nadležno tijelo mora evidentirati životinje kojima ušne markice nisu stavljene u trenutku rođenja i prikazati ih u kompjutoriziranoj bazi podataka za goveda kao neobilježene životinje.
Članak 5.
Nadzor
Nadležno tijelo mora svake godine obaviti najmanje jednu inspekcijsku posjetu svakom gospodarstvu kojemu je dano ovlaštenje prema članku 1. Ono mora povući ovlaštenje ako uvjeti iz članka 2. više nisu ispunjeni
Članak 6.
Stavljanje izvan snage
Odluka 98/589/EZ stavlja se izvan snage.
Članak 7.
Upućivanja
Ova je Odluka upućena državama članicama.
Sastavljeno u Bruxellesu 18. siječnja 2006.
Za Komisiju
Markos KYPRIANOU
Član Komisije
(1) SL L 204, 11.8.2000., str. 1. Uredba kako je izmijenjena Aktom o pristupanju iz 2003.
(2) SL L 283, 21.10.1998., str. 19. Odluka kako je izmijenjena Odlukom 1999/520/EZ (SL L 199, 30.7.1999., str. 72.).
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
94 |
32006R0253
|
L 044/9 |
SLUŽBENI LIST EUROPSKE UNIJE |
14.02.2006. |
UREDBA KOMISIJE (EZ) br. 253/2006
od 14. veljače 2006.
o izmjeni Uredbe (EZ) br. 999/2001 Europskog parlamenta i Vijeća u pogledu brzih testova i mjera za iskorjenjivanje TSE-a u ovaca i koza
(Tekst značajan za EGP)
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Uredbu (EZ) br. 999/2001 Europskog parlamenta i Vijeća od 22. svibnja 2001. o utvrđivanju pravila za sprečavanje, kontrolu i iskorjenjivanje određenih transmisivnih spongiformnih encefalopatija (1), a posebno njezin članak 23. stavak prvi,
budući da:
|
(1) |
Uredbom (EZ) br. 999/2001 utvrđuju se pravila za iskorjenjivanje transmisivnih spongiformnih encefalopatija (TSE-a) nakon potvrde prisutnosti TSE-a u stadu ovaca ili koza, te popis brzih testova koji su odobreni za praćenje TSE-a. |
|
(2) |
U skladu s Uredbom (EZ) br. 999/2001, kako je izmijenjena Uredbom Komisije (EZ) br. 260/2003 (2), od 1. listopada 2003. određene se mjere primjenjuju nakon potvrde prisutnosti TSE-a u stadima ovaca i koza. Tada kod ovaca i koza nije bilo moguće rutinski razlikovati dva tipa TSE-a koji se mogu pojaviti kod ovaca i koza, odnosno grebež ovaca i goveđu spongiformnu encefalopatiju (GSE). Stoga su donesene stroge mjere uslijed mogućnosti da svaki slučaj TSE-a u ovaca i koza može biti GSE. |
|
(3) |
U skladu s Uredbom (EZ) br. 999/2001, kako je izmijenjena Uredbom Komisije (EZ) br. 36/2005 (3), od siječnja 2005. posebno je testiranje obvezno za sve potvrđene slučajeve TSE-a kod ovaca i koza. Nakon što je 2005. pojačan nadzor nad ovcama i kozama u skladu s Uredbom (EZ) br. 999/2001, kako je izmijenjena Uredbom Komisije (EZ) br. 214/2005 (4), preliminarni rezultati ukazuju na to da se GSE može isključiti kod svih pozitivnih slučajeva TSE-a do danas. Potrebno je ponovno proučiti mjere za iskorjenjivanje TSE-a u ovaca i koza u okviru vremenskog rasporeda za TSE. Međutim, rasprava o toj temi neće biti okončana prije kraja 2005. |
|
(4) |
Kako bi se spriječila primjena strožih mjera za iskorjenjivanje TSE-a u ovaca usprkos postojećoj raspravi o njihovoj mogućoj reviziji, potrebno je produljiti valjanost prijelaznih mjera o obnovi stada izlučenih radi iskorjenjivanja TSE-a koje se trenutačno primjenjuju do 1. siječnja 2006. |
|
(5) |
U izvješću od 2. rujna 2005., Europska agencija za sigurnost hrane (EFSA) preporučila je odobravanje novih brzih post mortem testova za GSE. Taj je test potrebno uključiti u popis brzih testova za praćenje GSE-a. |
|
(6) |
Do sada nije dovršena službena procjena testova koji su posebno namijenjeni za testiranje ovaca ili koza. Pet je brzih testova iz Priloga X. Uredbi (EZ) br. 999/2001 privremeno odobreno u očekivanju njihove procjene za potrebe programa nadzora nad ovcama i kozama na temelju podataka koje dostavili proizvođači testova. |
|
(7) |
U izvješćima od 17. svibnja i 26. rujna 2005. o procjeni brzih post mortem testova namijenjenih za ovce i koze, EFSA je preporučila odobravanje osam novih brzih post mortem testova, uključujući pet privremeno odobrenih brzih testova. Te je testove potrebno uključiti u popis brzih testova za praćenje TSE-a u ovaca i koza. |
|
(8) |
Promjene je brzih testova i testnih protokola moguće izvršiti samo uz suglasnost Referentnog laboratorija Zajednice (CRL) za TSE. CRL je odobrio promjene brzih post mortem testova za GSE pod nazivom „Inpro CDI”. CRL je također prihvatio promjenu naziva u „Beckman Coulter InPro CDI kit”. |
|
(9) |
Uredbu (EZ) br. 999/2001 treba stoga na odgovarajući način izmijeniti. |
|
(10) |
Mjere predviđene ovom Uredbom u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU UREDBU:
Članak 1.
Prilozi VII. i X. Uredbi (EZ) br. 999/2001 izmjenjuju se u skladu s Prilogom ovoj Uredbi.
Članak 2.
Ova Uredba stupa na snagu dvadeseti dan od dana objave u Službenom listu Europske unije.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 14. veljače 2006.
Za Komisiju
Markos KYPRIANOU
Član Komisije
(1) SL L 147, 31.5.2001., str. 1. Uredba kako je zadnje izmijenjena Uredbom Komisije (EZ) br. 1974/2005 (SL L 317, 3.12.2005., str. 4.).
(2) SL L 37, 13.2.2003., str. 7.
(3) SL L 10, 13.1.2005., str. 9.
(4) SL L 37, 10.2.2005., str. 9.
PRILOG
|
1. |
U Prilogu VII. Uredbi (EZ) br. 999/2001, točka 6. zamjenjuje se sljedećim:
|
|
2. |
Prilogu X. Uredbi (EZ) br. 999/2001, Poglavlje C točka 4. mijenja se i glasi: „4. Brzi testovi S ciljem provedbe brzih testova u skladu s člankom 5. stavkom 3. i člankom 6. stavkom 1., sljedeće se metode koriste kao brzi testovi za praćenje GSE-a u goveda:
S ciljem provedbe brzih testova u skladu s člankom 5. stavkom 3. i člankom 6. stavkom 1., sljedeće se metode koriste kao brzi testovi za praćenje TSE-a u ovaca i koza:
Za sve testove uzorak tkiva koji se koristi za testiranje mora biti sukladan uputama proizvođača. Proizvođač brzih testova mora posjedovati sustav osiguranja kakvoće koji je odobrio Referentni laboratorij Zajednice (CRL) i kojim osigurava da se učinkovitost testa ne mijenja. Proizvođač je dužan dostaviti ispitni protokol Referentnom laboratoriju Zajednice. Promjene brzih testova ili ispitnih protokola mogu se izvršiti samo uz prethodnu obavijest poslanu Referentnom laboratoriju Zajednice i uz uvjet da Referentni laboratorij Zajednice utvrdi da ta promjena ne umanjuje osjetljivost, specifičnost ili pouzdanost brzog testa. Taj se nalaz dostavlja Komisiji i nacionalnim referentnim laboratorijima.” |
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
98 |
32006R0339
|
L 055/5 |
SLUŽBENI LIST EUROPSKE UNIJE |
24.02.2006. |
UREDBA KOMISIJE (EZ) br. 339/2006
od 24. veljače 2006.
o izmjeni Priloga XI. Uredbi (EZ) br. 999/2001 Europskog parlamenta i Vijeća u pogledu pravila za uvoz živih goveda i proizvoda goveđeg, ovčjeg i kozjeg podrijetla
(Tekst značajan za EGP)
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Uredbu (EZ) br. 999/2001 Europskog parlamenta i Vijeća od 22. svibnja 2001. o utvrđivanju pravila za sprečavanje, kontrolu i iskorjenjivanje određenih transmisivnih spongiformnih encefalopatija (1), a posebno njezin članak 23. stavak prvi,
budući da:
|
(1) |
U mišljenjima iz 2001. o zemljopisnoj opasnosti od goveđe spongiformne encefalopatije (GSE) u Brazilu, Čileu, El Salvadoru, Nikaragvi, Bocvani, Namibiji i Svazilandu, Znanstveni nadzorni odbor (SSC) zaključio je kako je pojava GSE-a kod autohtone stoke u tim državama malo vjerojatna. Stoga su te države uvrštene na popis država izuzetih iz primjene određenih trgovinskih uvjeta vezanih uz TSE za živa goveda i proizvode goveđeg, ovčjeg i kozjeg podrijetla. |
|
(2) |
U ažuriranim mišljenjima donesenima u veljači 2005. i kolovozu 2005. o zemljopisnoj opasnosti od GSE-a u određenim trećim zemljama, Europska agencija za sigurnost hrane zaključila je kako je pojava GSE-a kod autohtone stoke u Brazilu, Čileu, El Salvadoru, Nikaragvi, Bocvani, Namibiji i Svazilandu nije malo vjerojatna. Stoga te države više ne bi smjele biti izuzete iz primjene trgovinskih uvjeta vezanih uz TSE za živa goveda i proizvode goveđeg, ovčjeg i kozjeg podrijetla. |
|
(3) |
Uredbu (EZ) br. 999/2001 treba stoga na odgovarajući način izmijeniti. |
|
(4) |
Mjere predviđene ovom Uredbom u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU UREDBU:
Članak 1.
Prilog XI. Uredbi (EZ) br. 999/2001 mijenja se u skladu s Prilogom ovoj Uredbi.
Članak 2.
Ova Uredba stupa na snagu dvadesetog dana od dana objave u Službenom listu Europske unije.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 24. veljače 2006.
Za Komisiju
Markos KYPRIANOU
Član Komisije
(1) SL L 147, 31.5.2001., str. 1. Uredba kako je zadnje izmijenjena Uredbom Komisije (EZ) br. 1974/2005 (SL L 317, 3.12.2005., str. 4.).
PRILOG
Prilog XI. Uredbi (EZ) br. 999/2001 mijenja se i dopunjuje kako slijedi:
|
(a) |
U Dijelu A drugome podstavku točke 15. podtočke (b), popis država zamjenjuje se sljedećim:
|
|
(b) |
U Dijelu D točka 3. zamjenjuje se sljedećim:
|
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
100 |
32006R0546
|
L 094/28 |
SLUŽBENI LIST EUROPSKE UNIJE |
31.03.2006. |
UREDBA KOMISIJE (EZ) br. 546/2006
od 31. ožujka 2006.
o provedbi Uredbe (EZ) br. 999/2001 Europskog parlamenta i Vijeća u vezi s nacionalnim programima kontrole grebeža ovaca i dodatnih jamstava, te o odstupanju od određenih zahtjeva Odluke 2003/100/EZ i stavljanju izvan snage Uredbe (EZ) br. 1874/2003
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Uredbu (EZ) br. 999/2001 Europskog parlamenta i Vijeća od 22. svibnja 2001. o utvrđivanju pravila za sprečavanje, kontrolu i iskorjenjivanje određenih transmisivnih spongiformnih encefalopatija (1), a posebno njezin Prilog VIII. poglavlje A odjeljak 1. točku (b) podtočku ii.,
budući da:
|
(1) |
Uredbom (EZ) br. 999/2001 predviđa se odobrenje nacionalnih programa kontrole grebeža ovaca u državama članicama ako one ispune određene kriterije određene tom Uredbom. Uredbom (EZ) br. 999/2001 također je predviđena definicija svih dodatnih jamstava za kojima se može javiti potreba u okviru trgovine unutar Zajednice i uvoza u skladu s tom Uredbom. |
|
(2) |
Odlukom Komisije 2003/100/EZ od 13. veljače 2003. o utvrđivanju minimalnih zahtjeva za određivanje programa uzgoja ovaca otpornih na transmisivne spongiformne encefalopatije (2) propisuje se da svaka država članica mora uvesti program uzgoja radi odabira ovaca otpornih na TSE-e iz određenih pasmina ovaca. Tom se Odlukom također predviđa mogućnost da država članica odstupi od zahtjeva za uspostavom programa uzgoja na temelju njezinog nacionalnog programa kontrole grebeža ovaca, koji se podnosi i odobrava u skladu s Uredbom (EZ) br. 999/2001, ako je istim predviđen stalno aktivno praćenje ovaca i koza uginulih na gospodarstvu za sva stada u toj državi članici. |
|
(3) |
Uredbom Komisije (EZ) br. 1874/2003 od 24. listopada 2003. o odobravanju nacionalnih programa kontrole grebeža ovaca određenih država članica i definiranju dodatnih jamstava te odobravanju odstupanja u vezi s programima uzgoja ovaca otpornih na TSE-e u skladu s Odlukom 2003/100/EZ (3), odobreni su nacionalni programi kontrole grebeža ovaca u Danskoj, Finskoj i Švedskoj. |
|
(4) |
Austrija je 18. studenoga 2005. Komisiji predala nacionalni program kontrole grebeža ovaca. Komisiji su 5. siječnja 2006. dostavljene određene izmjene tog programa. Taj program, kako je izmijenjen, ispunjava potrebne kriterije određene Uredbom (EZ) br. 999/2001. Nadalje, nije vjerojatna raširenost ni prisutnost grebeža ovaca na državnom području Austrije. |
|
(5) |
Na temelju tog nacionalnog programa kontrole grebeža ovaca, Austriji bi trebalo odobriti odstupanje od programa uzgoja predviđenog Odlukom 2003/100/EZ. Nadalje, ovom je Uredbom potrebno odrediti dodatna trgovinska jamstva zahtijevana poglavljem A Priloga VIII. i poglavljem E Priloga IX. Uredbi (EZ) br. 999/2001. |
|
(6) |
Uredbom (EZ) br. 1874/2003 predviđena su određena dodatna jamstva za Dansku, Finsku i Švedsku u vezi s poljoprivrednim gospodarstvima. Međutim, ta je dodatna trgovinska jamstva potrebno izmijeniti da bi se povećala supsidijarnost tim državama članicama i Austriji, uzimajući u obzir različite epidemiološke i trgovinske situacije kao i razlike među sojevima grebeža ovaca koji su prisutni u te četiri države članice. |
|
(7) |
Stoga je iz praktičnih razloga i radi jasnoće zakonodavstva Zajednice primjereno staviti izvan snage Uredbu (EZ) br. 1874/2003 i zamijeniti je ovom Uredbom. |
|
(8) |
Mjere predviđene ovom Uredbom u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU UREDBU:
Članak 1.
Odobrenje nacionalnih programa kontrole grebeža ovaca
Ovime se odobravaju nacionalni programi kontrole grebeža ovaca, iz Priloga VIII. poglavlja A točke I. podtočke (b) Uredbe (EZ) br. 999/2001, država članica s popisa iz Priloga ovoj Uredbi.
Članak 2.
Dodatna jamstva u vezi s gospodarstvima
1. Ovce i koze namijenjene državama članicama koje se nalaze na popisu iz Priloga, a podrijetlom su iz drugih država članica koje se ne nalaze na popisu iz Priloga ili iz trećih zemalja, moraju se od rođenja držati na gospodarstvima koja su najmanje sedam godina prije datuma otpreme tih životinja ispunjavala sljedeće uvjete:
|
(a) |
nije bio potvrđen nijedan slučaj grebeža ovaca; |
|
(b) |
nisu bile primijenjene mjere iskorjenjivanja zbog pojave grebeža ovaca; |
|
(c) |
na gospodarstvu nisu bile prisutne životinje identificirane kao rizične životinje iz članka 13. stavka 1. točke (b) Uredbe (EZ) br. 999/2001. |
2. Ovce i koze namijenjene državama članicama koje se nalaze na popisu iz Priloga ovoj Uredbi, a podrijetlom su iz drugih država članica iz tog Priloga, morale su se držati na gospodarstvima na kojima najmanje sedam godina prije datuma otpreme tih životinja nijedna ovca ni koza nije podvrgnuta službenim ograničenjima premještanja zbog TSE-a u skladu s člankom 13. stavkom 2. Uredbe (EZ) br. 999/2001.
3. Sjeme, zametci i jajne stanice ovaca i koza namijenjenih državama članicama koje se nalaze na popisu iz Priloga dobivaju se od životinja koje se od rođenja drže na gospodarstvima koja ispunjavaju uvjete određene:
|
(a) |
stavkom 1., ako su podrijetlom iz drugih država članica koje nisu na popisu iz Priloga ili iz trećih zemalja; ili |
|
(b) |
stavkom 2., ako su podrijetlom iz drugih država članica koje se nalaze na popisu iz Priloga. |
Članak 3.
Službena ograničenja premještanja
1. Ovime se odobravaju službena ograničenja premještanja koja su podnijele države članice s popisa iz Priloga. Ona se primjenjuju na gospodarstva koja primaju ovce ili koze, ili sjeme, zametke i jajne stanice ovaca ili koza ako:
|
(a) |
su životinje, sjeme, zametci i jajne stanice podrijetlom iz drugih država članica koje nisu na popisu iz Priloga ili iz trećih zemalja; i |
|
(b) |
je grebež ovaca potvrđen tijekom tri godine prije ili nakon datuma otpreme životinja, sjemena, zametaka i jajnih stanica u državi članici ili trećoj zemlji otpreme, kako je navedeno u točki (a). |
2. Službena ograničenja premještanja predviđena stavkom 1. ne primjenjuju se na slučajeve primitka ovaca ARR/ARR prionsko proteinskoga genotipa ili sjemena, zametaka i jajnih stanica životinje ARR/ARR prionsko proteinskoga genotipa.
Članak 4.
Odstupanja od zahtjeva za uspostavu programa uzgoja
U skladu s člankom 3. stavkom 1. prvom alinejom Odluke 2003/100/EZ, državama članicama s popisa iz Priloga ovoj Uredbi ovime se odobrava odstupanje od zahtjeva za uspostavu programa uzgoja kako je predviđeno člankom 2. stavkom 1. navedene Odluke.
Članak 5.
Stavljanje izvan snage
Uredba (EZ) br. 1874/2003 stavlja se izvan snage.
Članak 6.
Stupanje na snagu
Ova Uredba stupa na snagu dvadeseti dan od dana objave u Službenom listu Europske unije.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 31. ožujka 2006.
Za Komisiju
Markos KYPRIANOU
Član Komisije
(1) SL L 147, 31.5.2001., str. 1. Uredba kako je zadnje izmijenjena Uredbom Komisije (EZ) br. 339/2006 (SL L 55, 25.2.2006., str. 5.).
(2) SL L 41, 14.2.2003., str. 41.
(3) SL L 275, 25.10.2003., str. 12. Uredba kako je izmijenjena Uredbom (EZ) br. 1472/2004 (SL L 271, 19.8.2004., str. 26.).
PRILOG
Države članice iz članaka 1. do 4.
Danska
Austrija
Finska
Švedska
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
104 |
32006R0590
|
L 104/8 |
SLUŽBENI LIST EUROPSKE UNIJE |
12.04.2006. |
UREDBA KOMISIJE (EZ) br. 590/2006
od 12. travnja 2006.
o izmjeni Priloga II. Uredbi (EZ) br. 998/2003 Europskog parlamenta i Vijeća u pogledu popisa država i teritorija
(Tekst značajan za EGP)
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Uredbu (EZ) br. 998/2003 Europskog parlamenta i Vijeća od 26. svibnja 2003. o uvjetima zdravlja životinja primjenjivim na nekomercijalno kretanje kućnih ljubimaca i o izmjeni Direktive Vijeća 92/65/EEZ (1), a posebno njezine članke 10. i 21.,
budući da:
|
(1) |
Uredbom (EZ) br. 998/2003 utvrđuje se popis trećih zemalja i teritorija iz kojih je moguće odobriti unos kućnih ljubimaca u Zajednicu ako se ispune određeni zahtjevi. |
|
(2) |
Privremeni popis trećih zemalja utvrđen je Uredbom (EZ) br. 998/2003, kako je izmijenjena Uredbom Komisije (EZ) br. 592/2004 (2). |
|
(3) |
Na tom se privremenom popisu, koji je izmijenjen i dopunjen već nekoliko puta, nalaze treće zemlje i teritoriji u kojima nema bjesnoće, te treće zemlje i teritoriji za koje je utvrđeno da opasnost od unosa bjesnoće u Zajednicu, kao posljedice kretanja iz tih trećih zemalja i teritorija, nije veća od opasnosti povezane s kretanjem između država članica. |
|
(4) |
Iz podataka koje su dostavile Bosna i Hercegovina i Bugarska vidljivo je kako opasnost od unosa bjesnoće u Zajednicu kao posljedice kretanja kućnih ljubimaca iz tih država, nije veća od opasnosti povezane s kretanjem kućnih ljubimaca između država članica ili iz trećih zemalja s popisa iz Uredbe (EZ) br. 998/2003. Stoga je te treće zemlje potrebno uvrstiti u privremeni popis trećih zemalja i teritorija iz dijela C Priloga II. Uredbi (EZ) br. 998/2003. |
|
(5) |
U interesu je jasnoće potrebno u potpunosti zamijeniti popis država i teritorija iz Uredbe (EZ) br. 998/2003. |
|
(6) |
Uredbu (EZ) br. 998/2003 treba stoga na odgovarajući način izmijeniti. |
|
(7) |
Mjere predviđene ovom Uredbom u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU UREDBU:
Članak 1.
Prilog II. Uredbi (EZ) br. 998/2003 zamjenjuje se tekstom iz Priloga ovoj Uredbi.
Članak 2.
Ova Uredba stupa na snagu dvadesetog dana od dana objave u Službenom listu Europske unije.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 12. travnja 2006.
Za Komisiju
Markos KYPRIANOU
Član Komisije
(1) SL L 146, 13.6.2003., str. 1. Uredba kako je zadnje izmijenjena Uredbom Komisije (EZ) br. 18/2006 (SL L 4, 7.1.2006., str. 3.).
(2) SL L 94, 31.3.2004., str. 7.
PRILOG
„PRILOG II.
POPIS DRŽAVA I TERITORIJA
DIO A
|
IE |
Irska |
|
MT |
Malta |
|
SE |
Švedska |
|
UK |
Ujedinjena Kraljevina |
DIO B
Odjeljak 1.
|
(a) |
DK |
Danska, uključujući GL – Grenland i FO – Farske otoke; |
|
(b) |
ES |
Španjolska uključujući Balearsko otočje, Kanarske otoke, Ceutu i Melillu; |
|
(c) |
FR |
Francuska, uključujući GF – Francusku Gvajanu, GP – Gvadelupu, MQ – Martinik i RE – Réunion; |
|
(d) |
GI |
Gilbratar; |
|
(e) |
PT |
Portugal, uključujući Azorske otoke i Madeira otoke; |
|
(f) |
Države članice osim onih iz dijela A i točaka (a), (b), (c) i (e) ovog odjeljka. |
Odjeljak 2.
|
AD |
Andora |
|
CH |
Švicarska |
|
IS |
Island |
|
LI |
Lihtenštajn |
|
MC |
Monako |
|
NO |
Norveška |
|
SM |
San Marino |
|
VA |
Država Vatikanskoga Grada |
DIO C
|
AC |
Otok Ascension |
|
AE |
Ujedinjeni Arapski Emirati |
|
AG |
Antigva i Barbuda |
|
AN |
Nizozemski Antili |
|
AR |
Argentina |
|
AU |
Australija |
|
AW |
Aruba |
|
BA |
Bosna i Hercegovina |
|
BB |
Barbados |
|
BG |
Bugarska |
|
BH |
Bahrein |
|
BM |
Bermuda |
|
BL |
Bjelorusija |
|
CA |
Kanada |
|
CL |
Čile |
|
FJ |
Fidži |
|
FK |
Falklandski otoci |
|
HK |
Hong Kong |
|
HR |
Hrvatska |
|
JM |
Jamajka |
|
JP |
Japan |
|
KN |
Sveti Kristofor i Nevis |
|
KY |
Kajmanski otoci |
|
MS |
Montserat |
|
MU |
Mauricijus |
|
MX |
Meksiko |
|
NC |
Nova Kaledonija |
|
NZ |
Novi Zeland |
|
PF |
Francuska Polinezija |
|
PM |
Sveti Petar i Mikelon |
|
RO |
Rumunjska |
|
RU |
Ruska federacija |
|
SG |
Singapur |
|
SH |
Sveta Helena |
|
TT |
Trinidad i Tobago |
|
TW |
Tajvan |
|
US |
Sjedinjene Američke Države (uključujući GU – Guam) |
|
VC |
Sveti Vincent i Grenadini |
|
VU |
Vanuatu |
|
WF |
Wallis i Futuna |
|
YT |
Mayotte” |
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
107 |
32006R0657
|
L 116/9 |
SLUŽBENI LIST EUROPSKE UNIJE |
10.04.2006. |
UREDBA KOMISIJE (EZ) br. 657/2006
od 10. travnja 2006.
o izmjeni Uredbe (EZ) br. 999/2001 Europskog parlamenta i Vijeća u pogledu Ujedinjene Kraljevine i o stavljanju izvan snage Odluke Vijeća 98/256/EZ i odluka 98/351/EZ i 1999/514/EZ
(Tekst značajan za EGP)
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Uredbu (EZ) br. 999/2001 Europskog parlamenta i Vijeća od 22. svibnja 2001. o utvrđivanju pravila za sprečavanje, nadzor i iskorjenjivanje određenih transmisivnih spongiformnih encefalopatija (1), a posebno njezin članak 23.,
uzimajući u obzir Direktivu Vijeća 90/425/EEZ od 26. lipnja 1990. o veterinarskim i zootehničkim kontrolama pri trgovini određenim živim životinjama i proizvodima unutar Zajednice radi uspostave unutarnjeg tržišta (2), a posebno njezin članak 10. stavak 4.,
uzimajući u obzir Direktivu Vijeća 89/662/EEZ od 11. prosinca 1989. o veterinarskim pregledima u trgovini unutar Zajednice s ciljem uspostave unutarnjeg tržišta (3), a posebno njezin članak 9. stavak 4.,
uzimajući u obzir Odluku Vijeća 98/256/EZ od 16. ožujka 1998. o hitnim mjerama za zaštitu od goveđe spongiformne encefalopatije, kojom se izmjenjuje Odluka 94/474/EZ i stavlja izvan snage Odluka 96/239/EZ (4), a posebno njezin članak 6. stavak 5.,
budući da:
|
(1) |
Odluka 98/256/EZ zadržana je kao prijelazna mjera Prilogom XI. Uredbi (EZ) br. 999/2001. |
|
(2) |
Odlukom 98/256/EZ zabranjuje se izvoz živih goveda iz Ujedinjene Kraljevine te proizvoda dobivenih od goveda zaklanih u Ujedinjenoj Kraljevini koji mogu postati dijelom prehrambenog lanca ljudi ili životinja, ili koji su namijenjeni za uporabu u kozmetici ili medicinskim ili farmaceutskim proizvodima. Utvrđeno je određeno odstupanje, i to za izvoz goveđeg mesa i proizvoda od goveđeg mesa u okviru programa izvoza na temelju datuma (DBES). |
|
(3) |
Dva uvjeta koja je potrebno ispuniti prije mogućeg ukidanja embarga na uvoz iz Ujedinjene Kraljevine su manje od 200 slučajeva GSE-a na milijun odraslih goveda i pozitivni zaključak inspekcije Ureda za hranu i veterinarstvo (FVO) u pogledu provedbe nadzora nad GSE-om u Ujedinjenoj Kraljevini, kao i spremnost Ujedinjene Kraljevine da ispuni zahtjeve zakonodavstva Zajednice, posebno u svezi s identifikacijom i registracijom goveda i testiranjem. |
|
(4) |
Na Općem zasjedanju u svibnju 2003., Svjetska organizacija za zaštitu zdravlja životinja (OIE) promijenila je mjerila kojima se utvrđuje granica između država umjerenog rizika (kategorija 4) i visokog rizika (kategorija 5). Granica je postavljena na 200 slučajeva GSE-a na milijun odraslih životinja u populaciji za države koje provode aktivni nadzor. |
|
(5) |
S obzirom da se pojava GSE-a u Ujedinjenoj Kraljevini približavala brojci od 200 i da se stoga ona više ne bi trebala smatrati državom visokog rizika OIE-a, u lipnju 2003. Ujedinjena Kraljevina zatražila je da joj se dopusti trgovina prema istim pravilima koja se primjenjuju na druge države članice. U prilog je tog zahtjeva Ujedinjena Kraljevina podnijela dokumentaciju koja sadržava procjene apsolutne pojave temeljene na rezultatima režima djelomičnog testiranja na snazi u Ujedinjenoj Kraljevini. |
|
(6) |
U mišljenju Znanstvenog odbora za biološke opasnosti Europske agencije za sigurnost hrane (EFSA) od 21. travnja 2004. o znanstvenom opravdanju prijedloga izmjena programa izvoza na temelju datuma (DBES) Ujedinjene Kraljevine i pravila testiranja goveda starijih od trideset mjeseci (OTM), zaključeno je kako bi goveda rođena ili uzgajana u Ujedinjenoj Kraljevini prije 1. kolovoza 1996. trebala ostati izvan prehrambenog lanca ljudi i životinja uslijed veće pojave GSE-a u toj skupini. Za goveda rođena nakon tog datuma u mišljenju je zaključeno kako je rizik od GSE-a za potrošače u rasponu usporedivom s onim u drugim državama članicama. Od 1. kolovoza 1996. sve su meso i kosti sisavaca bili zabranjeni za uporabu u hrani za sve domaće životinje u Ujedinjenoj Kraljevini. |
|
(7) |
12. svibnja 2004. EFSA je objavila mišljenje o statusu umjerenog rizika. U tom se mišljenju navodi kako bi se pojava GSE-a u Ujedinjenoj Kraljevini trebala smanjiti ispod 200 slučajeva između srpnja i prosinca 2004. Na plenarnoj je sjednici 9. i 10. ožujka 2005. EFSA zaključila kako podatci o nadzoru iz druge polovice 2004. potvrđuju zaključke iz njezinog mišljenja iz svibnja 2004., te kako je sukladno klasifikaciji OIE-a u pogledu GSE-a Ujedinjenu Kraljevinu moguće smatrati državom sa statusom umjerenog rizika za cijelu populaciju goveda. |
|
(8) |
19. srpnja 2004. FVO je objavio izvješće o misiji provedenoj između 26. travnja i 7. svibnja 2004. u Velikoj Britaniji i Sjevernoj Irskoj u pogledu opće revizije mjera zaštite od GSE-a. U izvješću je zaključeno kako je sustav uspostavljen u Sjevernoj Irskoj većinom zadovoljavajući, no zabilježeni su nedostatci u različitim područjima u Velikoj Britaniji, što zahtijeva daljnja poboljšanja. |
|
(9) |
28. rujna 2005. FVO je objavio izvješće o misiji provedenoj između 6. i 15. lipnja 2005. u Velikoj Britaniji u pogledu mjera zaštite od GSE-a. U okviru je te misije zaključeno kako je u većini područja zabilježen zadovoljavajući napredak. |
|
(10) |
7. studenoga 2005. Ujedinjena je Kraljevina zamijenila pravilo OTM s pravilom koje je bilo na snazi prije 1996. Goveda rođena prije 1. kolovoza 1996. ostaju trajno isključena iz prehrambenog lanca ljudi i životinja. Od listopada 2004. Ujedinjena Kraljevina primjenjuje isti program praćenja kao i druge države članice za populaciju goveda rođenih nakon 31. srpnja 1996. Potrebno je izmijeniti postojeći program praćenja koji se primjenjuje na životinje pod prethodnim programom uništenja koji je utvrđen Uredbom Komisije (EZ) br. 716/96 od 19. travnja 1996. o donošenju izvanrednih mjera potpore za tržište goveđeg mesa u Ujedinjenoj Kraljevini (5). |
|
(11) |
S obzirom na status umjerenog rizika populacije goveda i povoljna izvješća misije FVO-a, moguće je ukinuti ograničenja povezana s GSE-om koja se primjenjuju na trgovinu govedima i njihovim proizvodima. |
|
(12) |
Uvjeti za ukidanje embarga u potpunosti su ispunjeni 15. lipnja 2005., tj. na dan završetka misije FVO-a u Velikoj Britaniji. Stoga je učinak ove Uredbe na meso i ostale proizvode dobivene od zaklanih životinja potrebno ograničiti na meso i proizvode dobivene od životinja zaklanih nakon tog datuma. |
|
(13) |
Stoga je Odluku 98/256/EZ potrebno staviti izvan snage, a pravila utvrđena Uredbom (EZ) br. 999/2001 moraju se u potpunosti primijeniti. |
|
(14) |
Sukladno Odluci Komisije 2005/598/EZ (6), Ujedinjenoj je Kraljevini zabranjeno stavljati na tržište proizvode koji su dobiveni od goveda rođenih ili uzgajanih u Ujedinjenoj Kraljevini prije 1. kolovoza 1996. Isto tako Ujedinjena bi Kraljevina trebala osigurati da se goveda rođena ili uzgajana u Ujedinjenoj Kraljevini prije 1. kolovoza 1996. ne otpreme s njezinog državnog područja u druge države članice ili u treće zemlje. |
|
(15) |
Sukladno Uredbi (EZ) br. 999/2001, kralježnica se goveda starijih od 24 mjeseci smatra specificiranim rizičnim materijalom. Ujedinjena Kraljevina primjenjuje odstupanje kojim se dopušta uporaba kralježnice goveda mlađih od 30 mjeseci. Nadalje, tom je Uredbom za Ujedinjenu Kraljevinu utvrđen prošireni popis specificiranog rizičnog materijala. |
|
(16) |
Nakon ukidanja postojećih ograničenja, u Ujedinjenoj Kraljevini trebali bi se primjenjivati i dobna granica za uklanjanje kralježnice goveda i popis specificiranih rizičnih materijala koji se primjenjuju u drugim državama članicama. Stoga Uredbu (EZ) br. 999/2001 treba izmijeniti na odgovarajući način. |
|
(17) |
S obzirom na postojeću razliku u dobnoj granici za uklanjanje kralježnice kao specificiranog rizičnog materijala u Ujedinjenoj Kraljevini i drugim državama članicama, a za potrebe nadzora, neposredni se učinci ove Uredbe ne bi trebali primjenjivati na kralježnicu goveda rođenih ili uzgajanih u Ujedinjenoj Kraljevini nakon 31. srpnja 1996., te zaklanih prije stupanja na snagu ove Uredbe. Takva kralježnica i proizvodi dobiveni od takve kralježnice ne bi se trebali otpremati iz Ujedinjene Kraljevine u druge države članice ili u treće zemlje. |
|
(18) |
U interesu jasnoće i dosljednosti zakonodavstva Zajednice potrebno je staviti izvan snage Odluku Komisije 98/351/EZ od 29. svibnja 1998. o utvrđivanju datuma na koji sukladno članku 6. stavku 5. Odluke Vijeća 98/256/EZ (7) može započeti otpremanje proizvoda od goveđeg mesa iz Sjeverne Irske u okviru programa za izvoz certificiranih stada, te Odluku Komisije 1999/514/EZ od 23. srpnja 1999. o utvrđivanju datuma na koji sukladno članku 6. stavku 5. Odluke Vijeća 98/256/EZ (8) može započeti otpremanje proizvoda od goveđeg mesa iz Ujedinjene Kraljevine u okviru programa izvoza na temelju datuma. |
|
(19) |
Mjere predviđene ovom Uredbom u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU UREDBU:
Članak 1.
Prilozi III. i XI. Uredbi (EZ) br. 999/2001 izmjenjuju se u skladu s Prilogom ovoj Uredbi.
Članak 2.
Odluke 98/256/EZ, 98/351/EZ i 1999/514/EZ stavljaju se izvan snage.
Članak 3.
Ova Uredba stupa na snagu trećeg dana od dana objave u Službenom listu Europske unije.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 10. travnja 2006.
Za Komisiju
Markos KYPRIANOU
Član Komisije
(1) SL L 147, 31.5.2001., str. 1. Uredba kako je zadnje izmijenjena Uredbom Komisije (EZ) br. 339/2006 (SL L 55, 25.2.2006., str. 5.).
(2) SL L 224, 18.8.1990., str. 29. Direktiva kako je zadnje izmijenjena Direktivom 2002/33/EZ Europskog parlamenta i Vijeća (SL L 315, 19.11.2002., str. 14.).
(3) SL L 395, 30.12.1989., str. 13. Direktiva kako je zadnje izmijenjena Direktivom 2004/41/EZ Europskog parlamenta i Vijeća (SL L 157, 30.4.2004., str. 33.).
(4) SL L 113, 15.4.1998., str. 32. Odluka kako je zadnje izmijenjena Odlukom Komisije 2002/670/EZ (SL L 228, 24.8.2002., str. 22.).
(5) SL L 99, 20.4.1996., str. 14. Uredba kako je zadnje izmijenjena Uredbom (EZ) br. 2109/2005 (SL L 337, 22.12.2005., str. 25.).
(6) SL L 204, 5.8.2005., str. 22.
(7) SL L 157, 30.5.1998., str. 110.
(8) SL L 195, 28.7.1999., str. 42.
PRILOG
Prilozi III. i XI. Uredbi (EZ) br. 999/2001 izmjenjuju se kako slijedi:
|
1. |
U Prilogu III. poglavlju A odjeljku I., točka 4. mijenja se i glasi:
|
|
2. |
Prilog XI. mijenja se kako slijedi:
|
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
112 |
32006R0688
|
L 120/10 |
SLUŽBENI LIST EUROPSKE UNIJE |
04.05.2006. |
UREDBA KOMISIJE (EZ) br. 688/2006
od 4. svibnja 2006.
o izmjeni priloga III. i XI. Uredbi (EZ) br. 999/2001 Europskog parlamenta i Vijeća u pogledu praćenja transmisivnih spongiformnih encefalopatija i specificiranog rizičnog materijala goveda u Švedskoj
(Tekst značajan za EGP)
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Uredbu (EZ) br. 999/2001 Europskog parlamenta i Vijeća od 22. svibnja 2001. o utvrđivanju pravila za sprečavanje, nadzor i iskorjenjivanje određenih transmisivnih spongiformnih encefalopatija (1), a posebno njezin članak 23. stavak prvi,
budući da:
|
(1) |
Uredbom (EZ) br. 999/2001 utvrđuju se pravila za praćenje transmisivnih spongiformnih encefalopatija (TSE) u goveda, ovaca i koza. |
|
(2) |
U mišljenju od 6. srpnja 2000. Znanstveni nadzorni odbor Europske komisije (SSC) zaključio je kako pojava goveđih spongiformnih encefalopatija (GSE-a) u autohtonih goveda u Švedskoj nije vjerojatna, ali nije ni isključena. Na temelju tog mišljenja, Uredbom (EZ) br. 999/2001 Švedskoj je dopušteno odstupanje za pregled samo nasumični uzorak zdravih zaklanih goveda rođenih i uzgajanih na njezinom teritoriju. U ažuriranom mišljenju donesenom u srpnju 2004. o zemljopisnom riziku od GSE-a u Švedskoj, Europska agencija za sigurnost hrane poduprla je ovo stajalište kojim se Švedsku svrstava u kategoriju GBR II, tj. da nije vjerojatno da su domaća goveda zaražena GSE-om, ali to nije ni isključeno. Nadalje, Švedska je mogla primijeniti odstupanje kojim se dopušta uporaba kralježnice i korijenskih ganglija leđne moždine goveda u određenim uvjetima. Međutim, Švedska nije nikada primijenila to odstupanje. |
|
(3) |
Referentni laboratorij Zajednice za TSE potvrdio je 3. ožujka 2006. prvi slučaj GSE-a u Švedskoj. Stoga se pojava GSE-a u autohtonih goveda više ne može smatrati nevjerojatnom, te nije više primjereno da Švedska koristi odstupanja u vezi s nadzorom nad zdravim zaklanim govedima i dobnom granicom za uklanjanje kralježnice goveda. |
|
(4) |
Uredbu (EZ) br. 999/2001 treba stoga na odgovarajući način izmijeniti. |
|
(5) |
Mjere predviđene ovom Uredbom u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU UREDBU:
Članak 1.
Prilozi Uredbi (EZ) 999/2001 mijenjaju se kako slijedi:
|
(a) |
u Prilogu III. dijelu I. poglavlja A, točka 2.3 briše se; |
|
(b) |
u Prilogu XI. dijelu A, drugi podstavak točke 2. zamjenjuje sljedećim: „Države članice mogu zatražiti primjenu ovog odstupanja na način da podnesu uvjerljive prateće dokaze Komisiji u pogledu točke (a) ili (b), ovisno o slučaju.” |
Članak 2.
Ova Uredba stupa na snagu dvadeseti dan od dana objave u Službenom listu Europske unije.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 4. svibnja 2006.
Za Komisiju
Markos KYPRIANOU
Član Komisije
(1) SL L 147, 31.5.2001., str. 1. Uredba kako je zadnje izmijenjena Uredbom Komisije (EZ) br. 657/2006 (SL L 116, 29.4.2006., str. 9.).
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
113 |
32006R1041
|
L 187/10 |
SLUŽBENI LIST EUROPSKE UNIJE |
07.07.2006. |
UREDBA KOMISIJE (EZ) br. 1041/2006
od 7. srpnja 2006.
o izmjeni Priloga III. Uredbi (EZ) br. 999/2001 Europskog parlamenta i Vijeća u pogledu praćenja transmisivnih spongiformnih encefalopatija u ovaca
(Tekst značajan za EGP)
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Uredbu (EZ) br. 999/2001 Europskog parlamenta i Vijeća od 22. svibnja 2001. o utvrđivanju pravila za sprečavanje, kontrolu i iskorjenjivanje određenih transmisivnih spongiformnih encefalopatija (1), a posebno njezin članak 23. stavak prvi,
budući da:
|
(1) |
Uredbom (EZ) br. 999/2001 propisuju se pravila za praćenje transmisivnih spongiformnih encefalopatija (TSE) u ovaca. |
|
(2) |
8. ožujka 2006. skupina stručnjaka za TSE u malih preživača, kojom je predsjedavao Referentni laboratorij zajednice za TSE (CRL), potvrdila je da se goveđa spongiformna encefalopatija (GSE) u tih životinja ne može isključiti s obzirom na rezultate druge faze diskriminatornog testiranja uzoraka mozgova dviju ovaca iz Francuske i jedne ovce s Cipra. Potrebno je dodatno testiranje kako bi se isključila prisutnost GSE-a u takvih životinja. |
|
(3) |
U travnju 2002. bivši Znanstveni nadzorni odbor Europske komisije (SSC) donio je mišljenje o sigurnom uzimanju materijala malih preživača u slučaju da GSE postane vjerojatnim u malih preživača. U mišljenju iz studenoga 2003. Znanstveni odbor za biološke opasnosti Europske agencije za sigurnost hrane (EFSA) potvrdio je preporuke iz mišljenja SSC-a u pogledu sigurnosti određenih proizvoda malih preživača povezane s TSE-om. |
|
(4) |
Potrebno je proučiti važnost tih slučajeva TSE-a u Francuskoj i na Cipru, gdje se ne može isključiti prisutnost GSE-a. Zbog toga su rezultati pojačanog praćenja TSE-a u ovaca od ključnog značenja. U skladu s mišljenjima SSC-a i EFSA-e, potrebno je pojačati praćenje nad ovcama kako bi se unaprijedili programi iskorjenjivanja koje provodi Zajednica. Tim se programima također povećava razina zaštite potrošača, kao i sigurno dobivanje proizvoda ovaca, što se osigurava postojećim mjerama iz Uredbe (EZ) br. 999/2001, a posebno odredbama o uklanjanju materijala s posebnim rizikom. |
|
(5) |
Prošireno praćenje bi se trebao temeljiti na statistički valjanom istraživanju kako bi se što je prije moguće utvrdila vjerojatna učestalost pojave GSE-a u ovaca, te kako bi se unaprijedilo znanje o zemljopisnoj rasprostranjenosti bolesti. |
|
(6) |
Zbog visokog stupnja pojave TSE-a u populaciji ovaca i koza na Cipru, pojačani je praćenje ovaca moguće ograničiti na nezaražena stada. |
|
(7) |
Program praćenja nad ovcama potrebno je revidirati nakon barem šest mjeseci učinkovitog praćenja. |
|
(8) |
Uredbu (EZ) br. 999/2001 treba stoga na odgovarajući način izmijeniti. |
|
(9) |
Kako bi se osigurala najviša moguća razina zaštite potrošača ocjenom moguće učestalosti pojave GSE-a u ovaca, izmjene uvedene ovom Uredbom trebale bi stupiti na snagu bez odgode. |
|
(10) |
Mjere utvrđene ovom Uredbom u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU UREDBU:
Članak 1.
Prilog III. Uredbi (EZ) br. 999/2001 mijenja se u skladu s Prilogom ovoj Uredbi.
Članak 2.
Ova Uredba stupa na snagu sljedećeg dana od dana objave u Službenom listu Europske unije.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 7. srpnja 2006.
Za Komisiju
Markos KYPRIANOU
Član Komisije
(1) SL L 147, 31.5.2001., str. 1. Uredba kako je zadnje izmijenjena Uredbom Komisije (EZ) br. 688/2006 (SL L 120, 5.5.2006., str. 10.).
PRILOG
U dijelu II. Priloga III. Uredbi (EZ) br. 999/2001 točke 2. i 3. Poglavlja A zamjenjuju se sljedećim:
|
„2. |
Praćenje ovaca i koza zaklanih za prehranu ljudi
|
|
3. |
Praćenje ovaca i koza koje nisu zaklane za prehranu ljudi U skladu s pravilima uzorkovanja iz točke 4. i najmanjim veličinama uzoraka iz Tablice C i Tablice D, države članice dužne su testirati ovce i koze koje su uginule ili ubijene, ali koje nisu:
Tablica C
Tablica D
|
(1) Najmanjim veličinama uzoraka uzima se u obzir veličina broja zdravih zaklanih ovaca, namijenjenih utvrđivanju ciljeva koje je moguće postići. Najmanjim veličinama uzoraka većim od 30 000 omogućava se otkrivanje učestalosti od 0,003 % s pouzdanošću od 95 %.
(2) Najmanjim veličinama uzoraka uzima se u obzir veličina broja zdravih zaklanih koza i učestalost pojave GSE-a u pojedinim državama članicama. One su također namijenjene utvrđivanju ciljeva koje je moguće postići. Najmanjim veličinama uzoraka većim od 60 000 omogućava se otkrivanje učestalosti od 0,0017 % s pouzdanošću od 95 %.
(3) Najmanjim veličinama uzoraka uzima se u obzir veličina populacija ovaca i koza u pojedinim državama članicama, a namijenjene su utvrđivanju ciljeva koje je moguće postići.
(4) Najmanjim veličinama uzoraka uzima se u obzir veličina populacija ovaca i koza u pojedinim državama članicama, a namijenjene su utvrđivanju ciljeva koje je moguće postići.”
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
117 |
32006D0437
|
L 237/1 |
SLUŽBENI LIST EUROPSKE UNIJE |
04.08.2006. |
ODLUKA KOMISIJE
od 4. kolovoza 2006.
o odobravanju Dijagnostičkog priručnika za influencu ptica u skladu s Direktivom Vijeća 2005/94/EZ
(priopćeno pod brojem dokumenta C(2006) 3477)
(Tekst značajan za EGP)
(2006/437/EZ)
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Direktivu Vijeća 2005/94/EZ od 20. prosinca 2005. o mjerama Zajednice za kontrolu influence ptica i stavljanju izvan snage Direktive 92/40/EEZ (1), a posebno njezin članak 50. stavak 1. drugi podstavak,
budući da:
|
(1) |
Direktiva 2005/94/EZ propisuje određene preventivne mjere koje se odnose na nadziranje i rano otkrivanje influence ptica te najmanje kontrolne mjere koje se primjenjuju u slučaju izbijanja te bolesti kod peradi i drugih ptica koje se drže u zatočeništvu. |
|
(2) |
Na razini Zajednice potrebno je utvrditi dijagnostičke postupke, metode uzorkovanja i kriterije za vrednovanje rezultata laboratorijskih testova za potvrđivanje izbijanja influence ptica. |
|
(3) |
U Prilogu VII. Direktivi 2005/94/EZ utvrđuju se dužnosti i zadaće referentnog laboratorija Zajednice za influencu ptica, kako bi se uz savjetovanje s Komisijom uskladile metode koje se u državama članicama koriste za dijagnosticiranje te bolesti. Te dužnosti i zadaće uključuju organizaciju periodičnih usporednih testova i opskrbu standardnim reagensima na razini Zajednice. |
|
(4) |
Nedavno su razvijeni laboratorijski testovi kako bi se osiguralo brzo dijagnosticiranje influence ptica. |
|
(5) |
Iskustva stečena pri kontroli influence ptica, posljednjih su godina omogućila utvrđivanje najprikladnijih postupaka uzorkovanja i kriterija za vrednovanje rezultata laboratorijskih testova za pravilno dijagnosticiranje te bolesti u različitim situacijama. |
|
(6) |
Mjere iz ove Odluke u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU ODLUKU:
Članak 1.
Odobrava se dijagnostički priručnik u skladu s Direktivom 2005/94/EZ i utvrđen u Prilogu ovoj Odluci.
Članak 2.
Države članice primjenjuju dijagnostički priručnik od datuma prenošenja Direktive 2005/94/EZ ili od 1. srpnja 2007., ovisno o tome koji je datum ranije.
Članak 3.
Ova je Odluka upućena državama članicama.
Sastavljeno u Bruxellesu 4. kolovoza 2006.
Za Komisiju
Markos KYPRIANOU
Član Komisije
(1) SL L 10, 14.1.2006., str. 16.
PRILOG
DIJAGNOSTIČKI PRIRUČNIK ZA INFLUENCU PTICA
POGLAVLJE I.
Uvod, ciljevi i definicije
|
1. |
U svrhu osiguravanja ujednačenih postupaka za dijagnozu influence ptica u Zajednici, ovaj dijagnostički priručnik određuje:
|
|
2. |
Ovaj dijagnostički priručnik namijenjen je nadležnim tijelima koja su odgovorna za kontrolu influence ptica. Stoga se najviše odnosi na načela i primjenu laboratorijskih testova te procjenu rezultata testova i laboratorijske tehnike. |
|
3. |
Za potrebe ovog dijagnostičkog priručnika, osim definicija iz članka 2. Direktive 2005/94/EZ, također se primjenjuje i sljedeća definicija:
|
|
4. |
Potvrda influence ptica kod peradi i drugih ptica koje se drže u zatočeništvu mora biti u skladu s postupcima, metodama uzorkovanja i kriterijima za procjenu rezultata laboratorijskih testova određenim u dijagnostičkom priručniku i temeljiti se na jednom ili više kriterija iz točaka (a), (b) i (c):
|
|
5. |
Potvrda infekcije sisavaca visoko patogenim ili nisko patogenim virusom influence A podtip H5 ili H7 podrijetlom od ptica, mora se temeljiti na jednom ili više kriterija iz točaka (a) ili (b):
|
|
6. |
Postupci, metode uzorkovanja i kriteriji za procjenu rezultata laboratorijskih testova moraju biti:
|
POGLAVLJE II.
Opis influence ptica s naglaskom na diferencijalnu dijagnozu
1. Etiologija i virulencija
Influenca ptica je visoko kontagiozna virusna zaraza koju uzrokuju virusi iz porodice Orthomyxoviridae, genus influenzavirus A. Virusi influence A jedini su ortomiksovirusi za koje je poznato da mogu zaraziti ptice. Za mnoge je vrste ptica dokazano da su prijemljive na zaražavanje virusom influence A; glavni su rezervoar tih virusa vodene ptice, iako je velika većina izolata niske patogenosti izdvojena iz kokoši i pura, glavnih vrsta peradi od gospodarskog značaja pogođenih s ovom bolesti.
Virusi influence A imaju zajedničke antigene nukleoproteina i proteine matriksa, ali ih se svrstava u podtipove na temelju antigenske srodnosti površinskih glikoproteina hemaglutinina (HA) i neuraminidaze (NA). Trenutačno je priznato 16 podtipova HA (H1-H16) i 9 podtipova NA (N1-N9). Svaki virus influence A, očigledno u svakoj kombinaciji, ima po jedan antigen HA i po jedan antigen NA.
Virusi influence A podijeljeni su u dvije skupine na temelju svoje sposobnosti uzrokovanja bolesti u prijemljive peradi:
|
(a) |
virusi visoko patogene influence ptica (VPIP) koji uzrokuju vrlo tešku bolest, za koju je karakteristična generalizirana infekcija zaražene peradi, koja može uzrokovati vrlo visoku stopu mortaliteta jata (do 100 %); i |
|
(b) |
virusi nisko patogene influence ptica (NPIP) koji kod peradi uzrokuju blagu, u prvome redu dišnu bolest, osim ako nema pogoršanja bolesti zbog sekundarnih infekcija ili drugih čimbenika. |
Divlje ptice, a posebno migratorne vodene ptice, imaju vrlo važnu ulogu kao rezervoar virusa influence A, što dokazuje izolacija gotovo svih mogućih kombinacija podtipova HA i NA kod divljih ptica. Općenito se kod divljih ptica otkrivaju samo virusi NPIP, osim u slučaju prijenosa VPIP sa zaražene peradi.
Primarni unosi virusa influence ptica na peradarske farme najvjerojatnije su posljedica izravnog ili neizravnog kontakta s divljim pticama.
Kod domaće peradi postoji mogućnost da se takvi virusi NPIP-a koje su unijele divlje ptice cirkuliraju neotkriveni, jer su klinički znakovi često blagi ili nisu prisutni.
Jednom kad se sojevi virusa NPIP-a podtipova H5 i H7 prenesu na perad, oni mogu mutirati u sojeve VPIP-a. Dosad je samo za viruse podtipova H5 i H7 dokazano da mogu uzrokovati VPIP.
Iako se čini da je da je za mutaciju NPIP virusa u VPIP virus odgovorno više mehanizama, čimbenici koji tu mutaciju prouzrokuju, nisu poznati. U nekim se slučajevima čini kako je mutacija nastala brzo, na mjestu primarnog unosa s divljih ptica, u drugim je slučajevima virus NPIP prije mutacije više mjeseci cirkulirao među peradi. Stoga nije moguće predvidjeti hoće li i kada takva mutacija nastupiti. Međutim, s pravom se može pretpostaviti da što je cirkulacija NPIP-a među peradi raširenija, veće su šanse da će doći do mutacije u VPIP.
Vrijeme inkubacije teško je procijeniti i vjerojatno varira ovisno o soju virusa i domaćinu, a obično se navodi razdoblje od pet do šest dana, iako je raspon za pojedinačne ptice vjerojatno od nekoliko sati do približno sedam dana.
2. Klinički znakovi u ptica zaraženih virusom VPIP
Klinički su znakovi vrlo različiti i pod utjecajem čimbenika, kao što su virulencija infektivnog virusa, pogođena vrsta, dob, spol, druge prisutne bolesti i okoliš.
Rani znakovi uključuju inapetencu, smanjeno uzimanje vode i relativno nisku stopu smrtnosti. Međutim, alternativno, bolest se u jatu može pojaviti naglo i prouzročiti smrt velikog broja ptica bez prethodnih znakova, ili s minimalnim znakovima potištenosti, inapetence, nakostriješenog perja i vrućice. Općenito, što duže ptice prežive, klinički znakovi su izraženiji. Vrijeme potrebno za razvoj znakova ovisi o virusu, domaćinu i početnoj zaraznoj dozi te načinu držanja. Virus se širi sporije među kavezno držanim nesilicama i među pticama koje se drže na otvorenom u odnosu na one u nastambama u kojima se drže brojleri.
Nesilice, zaražene virusom VIPI-a, mogu u početku nesti jaja s mekom ljuskom, ali uskoro prestaju nesti. Bolesne ptice često sjede ili stoje u polusvjesnom stanju s glavama koje dotiču tlo. Kreste i podbradci su cijanotični i edematozni i mogu imati točkasta krvarenja na vrhovima. Često se javlja profuzni vodenasti proljev, a ptice su pretjerano žedne. Disanje može biti otežano, a opaža se i pojačano suzenje. Na površini kože bez perja mogu se vidjeti hemoragije. Stupanj smrtnosti u jatu varira između 50 i 100 %.
Kod brojlera znakovi VPIP-a često su manje uočljivi nego kod ostale peradi i obično uključuju izrazitu potištenost, inapetencu, a kao prvi znak abnormalnosti može se zamijetiti izrazito povećanje smrtnosti. Mogu se uočiti i otok glave i vrata te neurološki znakovi, kao što su tortikolis i ataksija.
Kod pura zaraza virusom VPIP-a slična je onoj kod domaćih ptica, ali čini se da su kod pura neki virusi VPIP-a virulentniji od drugih.
Kod gusaka zaraženih virusom VPIP-a znakovi potištenosti, inapetence i proljev slični su onima kod nesilica, iako često popraćeni otečenim sinusima. Mlađe ptice mogu pokazivati neurološke znakove.
Patke zaražene virusom VPIP-a ne moraju pokazivati kliničke znakove, iako se za neke sojeve navodi da uzrokuju slične znakove onima u gusaka s određenom stopom smrtnosti.
Kod infekcija nojeva virusima VPIP-a i NPIP-a, klinički znakovi mogu izostati. Kod izbijanja VPIP-a, kakvo je bilo ono u Italiji 1999. i 2000. biserke i japanske prepelice pokazale su se prijemljivima na infekciju, sa znakovima i smrtnošću sličnim kao kod kokoši i purana. Međutim, u određenim eksperimentalnim studijama uočeno je da su prepelice otporne na neke sojeve virusa VPIP-a. Kod svih ptica, prisutnost protutijela za isti H podtip, koja je posljedica cijepljenja ili prirodne infekcije, može značiti da infekcija virusom VPIP-a ne izaziva vidljive kliničke znakove.
3. Postmortalna oštećenja u ptica zaraženih virusom VPIP-a
Ptice koje ugibaju perakutno, mogu pokazivati minimalne patološke promjene, koje uključuju dehidraciju i kongestiju unutarnjih organa i mišića.
Kod ptica koje uginu nakon produženog kliničkog tijeka, po cijelom se tijelu pojavljuju točkasta krvarenja, osobitu u grkljanu, dušniku, žljezdanom želucu i epikardijalnom masnom tkivu te na serozama uz prsnu kost. Prisutni su jaki potkožni edemi, posebno oko glave i skočnog zgloba. Lešina može biti dehidrirana. Na slezeni, jetrima, bubrezima i plućima mogu biti prisutne žute ili sive nekrotične promjene (foci). Zračna vrećica može sadržati iscjedak. Slezena može biti povećana i hemoragična.
Influenca ptica histološki se karakterizira oštećenjem krvnih žila s posljedičnim edemom, krvarenjem i perivaskularnim promjenama, posebno na miokardu, slezeni, plućima, mozgu, gušterači i podbratku. U plućima, jetrima i bubrezima prisutne su nekrotične promjene. U mozgu se mogu naći glioza, vaskularna proliferacija i degeneracija neurona.
4. Diferencijalna dijagnoza
Kod diferencijalne dijagnoze VPIP-a potrebno je naročito uzeti u obzir sljedeće bolesti:
|
(a) |
druge bolesti koje uzrokuju iznenadnu visoku smrtnost, npr:
|
|
(b) |
druge bolesti koje uzrokuju otok kreste i podbratka, npr.:
|
5. Klinički znakovi kod ptica zaraženih virusima NPIP-a
Na ozbiljnost bolesti uzrokovanih virusima NPIP-a znatno utječe:
|
(a) |
soj virusa; |
|
(b) |
vrsta i dob domaćina; |
|
(c) |
imunosni status domaćina u odnosu na virus, a posebno prisutnost drugih infektivnih uzročnika, kao što su:
|
|
(d) |
stanja oslabljenog imuniteta; |
|
(e) |
čimbenici okoliša (kao što je višak amonijaka, prašina, visoka ili niska temperatura). |
U jednom krajnjem slučaju, klinički znakovi bolesti mogu biti inaparentni ili blagi te prouzročiti samo blage respiratorne znakove ili probleme u proizvodnji jaja kod nesilica. S druge strane, infekcije virusima NPIP-a mogu biti povezane i s ozbiljnim kliničkim znakovima bolesti, posebno kod pura, obično s krkljanjem, kašljanjem, otokom infraorbitalnih sinusa i ferbilnim stanjem povezanim s gubitkom apetita i visokom stopom smrtnosti.
NPIP se može zamijeniti s ili zakomplicirati mnogim bolestima popraćenim dišnim ili probavnim simptomima. Na influencu ptica mora se posumnjati pri svakom izbijanju bolesti kod peradi koja ne prestaje unatoč primjeni preventivnih ili terapeutskih mjera za druge bolesti.
6. Klinički znakovi kod ptica koje se drže u zatočeništvu
Raspon kliničkih znakova može biti veoma širok i, kao kod peradi, može varirati od inaparentnih do jakih s posljedičnim visokom stopom smrtnosti.
Općenito, infekcija se među pticama koje se drže u zatočeništvu širi sporije zbog raznolikosti vrsta koje se drže zajedno s razlikom u prijemljivosti, različitih količina izlučenog virusa i često relativno sporog prijenosa zbog niske stope kontakta među pticama i razmjerno niske gustoće populacije.
POGLAVLJE III.
Smjernice koje treba uzeti u obzir u slučaju sumnje na influencu ptica na gospodarstvu
Raznolikost kliničkih znakova i NPIP-a i VPIP-a znači da jasne smjernice u slučaju sumnje na izbijanje bolesti nisu moguće. Iznenadnu, visoku smrtnost sa ili bez bilo kakvih odgovarajućih kliničkih znakova opisanih u poglavlju II. potrebno je istražiti dostavljanjem uzoraka za laboratorijsko pretraživanje, ali u odsutnosti visoke smrtnosti teže je posumnjati na ili isključiti prisutnost influence ptica.
Budući da je brza dijagnoza NPIP i VPIP prouzročene podtipovima H5 i H7 veoma važna u ranoj kontroli i iskorjenjivanju, u sklopu diferencijalne dijagnoze dišnih problema, problema s razvojem jaja i povećanom smrtnosti peradi, potrebno je uvijek uzeti u obzir influencu ptica te dostaviti odgovarajuće uzorke na laboratorijska pretraživanja.
Slika
Shematski prikaz dijagnostičkih postupaka za potvrdu influence ptica

POGLAVLJE IV.
Opći postupci za prikupljanje i prijevoz uzoraka
1. Direktiva 2005/94/EZ i dijagnostički priručnik
Kad se u Direktivi 2005/94/EZ upućuje na dijagnostički priručnik, potrebno je provesti istraživanje, te postupke uzorkovanja i nadziranja, kako je određeno u ovom poglavlju dijagnostičkog priručnika.
2. Postupci koje treba provesti u slučaju sumnje na izbijanje influence ptica
Ako službeni veterinar izrazi kliničku sumnju na izbijanje influence ptica ili ako rezultati laboratorijskog testa za tu bolest nisu negativni, nadležno tijelo mora osigurati da se pretraživanje, kako je određeno u ovom poglavlju dijagnostičkog priručnika i u skladu s člankom 7. Direktive 2005/94/EZ, provede i uspješno zaključi, prije nego što se isključi prisutnost bolesti.
3. Tumačenje virološkog testiranja
Nadležno tijelo može isključiti prisutnost virusa influence ptica kad je u skladu s ovim poglavljem dostavljen odgovarajući broj bolesnih ili uginulih ptica i brisova dušnika/ždrijela ili kloake za otkrivanje tog virusa ili njegova genoma, i kad su dobiveni negativni rezultati korištenjem jedne od specifiranih metoda za otkrivanje virusa iz poglavlja V. ili VI. ili odobrenih od nadležnog tijela u skladu s točkom 6. (b) poglavlja I.
4. Standardni set uzoraka za virološko ili serološko laboratorijsko pretraživanje
Za pregled gospodarstva za koje se sumnja da je zaraženo virusom influence ptica potrebno je uzeti standardni set uzoraka za virološko ili serološko pretraživanje, kako je navedeno u točkama (a) i (b) (standardni uzorci) te ih izravno dostaviti na virološko i serološko laboratorijsko pretraživanje.
|
(a) |
Standardni set uzoraka za virološko testiranje uključuje:
Potrebno je uzeti lešine ptica koje su uginule nedavno ili ptica koje su teško bolesne ili moribundne i koje su usmrćene na human način. Brisove je potrebno uzeti od broja ptica navedenog u točki (a) ili od svih ptica na sumnjivom gospodarstvu na kojem je prisutno manje ptica. Uzorke je prvenstveno potrebno uzeti od ptica koje pokazuju kliničke znakove bolesti. Brisovi kloake moraju biti prekriveni fecesom (optimalno 1 g). Ako je iz bilo kojega razloga nije praktično uzimati bris kloake od živih ptica, pažljivo prikupljeni uzorci svježega fecesa mogu poslužiti kao zamjena. Brisove dušnika/ždrijela često je najpraktičnije prikupiti iz usne šupljine. Čim su poznata svojstva umnožavanja virusa, nadležno tijelo može, ovisno o tome umnožava li se virus bolje u dišnome ili probavnome traktu, uzimajući pritom u obzir pogođenu vrstu, odlučiti o uzimanju samo brisova dušnika/ždrijela ili samo brisova kloake, umjesto prikupljanja oba. |
|
(b) |
Standardni set uzoraka za serološko pretraživanje uključuje barem 20 uzoraka krvi. Uzorke je potrebno uzeti od onoliko ptica koliko je određeno u točki (b) ili od svih ptica na gospodarstvu na kojem se nalazi manji broj ptica. Uzorke je u prvom redu potrebno uzeti od ptica za koje se čini da su bolesne ili da su ozdravile. Nadležno tijelo može odlučiti da nije potrebno uzeti standardne uzorke u potpunosti, nego se može uzeti samo dio standardnog uzorka. |
5. Prijevoz uzoraka
Posebnu je pozornost potrebno posvetiti pohrani i prijevozu uzoraka u laboratorij za testiranje.
Brisove treba odmah ohladiti ledom ili ulošcima sa smrznutim gelom te ih što prije dostaviti u laboratorij. Uzorci se ne smiju zamrznuti, osim ako je to nužno potrebno. Ako se ne može jamčiti brz prijevoz u laboratorij unutar 24 sata, uzorke je potrebno odmah zamrznuti, pohraniti i zatim prevesti na suhom ledu.
Osim toga, ali ne kao zamjena za hlađenje, brisove je potrebno smjestiti u antibiotski ili specifični transportni medij za virus na 4 °C, tako da su u cijelosti uronjeni. U nedostatku takvog medija, brisove se mora vratiti u epruvete i suhe dostaviti u laboratorij na testiranje.
Na pohranu i prijevoz uzoraka mogu utjecati različiti čimbenici, stoga odabrani način prijevoza mora biti primjeren za tu svrhu.
6. Antibiotski medij
Antibiotski medij iz točke 5. mora se pripraviti na temelju puferirane fiziološke otopine pH 7,0 – 7,4 (provjerenoj nakon dodavanja antibiotika).
Proteinski medij, kao što je moždano-srčani bujon ili hranilište striptozom u tris puferu, virusu može dati dodatnu stabilnost, posebno za vrijeme prijevoza. Upotrijebljeni antibiotici i njihove koncentracije mogu se varirati s obzirom na lokalne uvjete i dostupnost.
Za uzorke fecesa mogu biti potrebne vrlo visoke koncentracije antibiotika: 10 000 IJ/ml penicilina, 10 mg/ml streptomicina, 0,25 mg/ml gentamicina i 5 000 IJ/ml nistatina. Navedene se koncentracije mogu smanjiti do pet puta za tkiva i brisove dušnika.
Ako se želi nadzirati Chlamydophilu, potrebno je dodati 0,05-0,1 mg/ml oksitetraciklina.
7. Moždano-srčani bujon
Otopina mora biti pripremljena u vodi i mora sadržavati 15 % m/v praška za moždano-srčani bujon prije sterilizacije (autoklaviranjem pri 121 °C/15 minuta).
Nakon sterilizacije potrebno je dodati antibiotike na sljedeći način: 10 000 IJ/ml penicilina G, 20 μg amfotericina B i 1 000 μg/ml gentamicina. Mediji se mogu pohraniti na 4 °C najduže dva mjeseca.
8. Postupci koje je potrebno provesti u pogledu odgovarajućih odredaba Direktive 2005/94/EZ
8.A.
8.1. Članak 7. stavak 1. – Mjere koje se provode na gospodarstvima kad postoji sumnja na izbijanje bolesti
Kad službeni veterinar pregledava gospodarstvo na kojem se sumnja na izbijanje bolesti potrebno je provesti sljedeće mjere:
|
(a) |
kontrola evidencije o proizvodnji i zdravlju na gospodarstvu, ako takve evidencije postoje. U inspekcijskom izvješću službenog veterinara moraju biti navedeni podaci o dnevnim uginućima, dnevnoj proizvodnji jaja i uzimanju hrane i/ili vode za vremensko razdoblje koje započinje tjedan dana prije pojave kliničkih znakova influence ptica i završava datumom kada je službeni veterinar pregledao gospodarstvo; |
|
(b) |
klinička inspekcija u svakoj proizvodnoj jedinici, uključujući procjenu povijesti bolesti i klinički pregled peradi ili drugih ptica koje se drže u zatočeništvu, posebno onih koje izgledaju bolesno; |
|
(c) |
osim kad je nadležno tijelo uvjereno da se na temelju kliničkog pregleda u skladu s točkama (a) i (b) izbijanje bolesti može isključiti, iz svake proizvodne jedinice potrebno je uzeti standardne uzorke; |
|
(d) |
neovisno o negativnim rezultatima testiranja standardnih uzoraka i ovisno o lokalnim čimbenicima, prije ukidanja službenog nadzora potrebno je provesti klinički pregled peradi u svakoj proizvodnoj jedinici. |
8.2. Članak 10. stavak 3. – Dodatne mjere koje se temelje na epidemiološkom istraživanju
U svakoj proizvodnoj jedinici treba uzeti uzorke usmrćene peradi i drugih ptica koje se drže u zatočeništvu.
8.B.
8.3. Članak 11. stavak 4. – Mjere koje se primjenjuju u slučaju peradi izvaljene iz jaja koja su prikupljena na gospodarstvima na kojima je potvrđeno izbijanje bolesti
Kad službeni veterinar pregledava gospodarstvo na kojem se nalazi perad koja je izvaljena iz jaja prikupljenih za vrijeme perioda inkubacije na gospodarstvu na kojemu je potvrđen VPIP, potrebno je provesti sljedeće mjere:
|
(a) |
kontrola evidencije o proizvodnji i zdravlju na gospodarstvu. U inspekcijskom izvješću službenog veterinara moraju biti navedeni podaci o dnevnim uginućima i uzimanju hrane i/ili vode, ako su dostupni, za vremensko razdoblje koje započinje tjedan dana prije pojave kliničkih znakova VPIP-a do datuma kad službeni veterinar pregleda gospodarstvo; |
|
(b) |
klinička inspekcija u svakoj proizvodnoj jedinici i klinički pregled peradi, posebno one koja se čini bolesnom ili koja ne raste prema očekivanju; |
|
(c) |
standardne uzorke treba uzeti od peradi stare dva do tri tjedna; |
|
(d) |
službeni nadzor nad gospodarstvom može se ukinuti nakon kliničkog pregleda peradi starije od 21 dana i negativnih rezultata testiranja standardnih uzoraka. |
8.4. Članak 13. stavak 2. točka (b) – Odstupanja za određena gospodarstva
Kad službeni veterinar pregledava gospodarstvo kojemu je odobreno odstupanje od članka 11. stavka 2. prvog podstavka Direktive 2005/94/EZ, potrebno je provesti sljedeće mjere:
|
(a) |
kontrola evidencije o proizvodnji i zdravlju na gospodarstvu, ako takve evidencije postoje; |
|
(b) |
klinička inspekcija u svakoj proizvodnoj jedinici, uključujući procjenu povijesti bolesti i kliničke preglede peradi ili drugih ptica koje se drže u zatočeništvu, posebno onih koje izgledaju bolesno; |
|
(c) |
umjesto standardnih uzoraka, 21 dan nakon posljednjega pozitivnog nalaza za VPIP u razmacima od 21 dan na laboratorijsko testiranje iz svake proizvodne jedinice treba poslati sljedeće uzorke:
Međutim, nadležno tijelo, na temelju rezultata procjene rizika, može odobriti odstupanja od veličine uzorka određenog u podtočkama i. i ii.; |
|
(d) |
uzorkovanje iz točke (c) i laboratorijsko testiranje navedenih uzoraka mora se nastaviti dok se ne postignu dva uzastopna negativna laboratorijska rezultata u razmaku od barem 21 dan. |
8.5. Članak 15. stavak 1. i stavak 3. – Mjere koje se provode na kontaktnim gospodarstvima
Kad službeni veterinar pregledava kontaktno gospodarstvo, potrebno je provesti sljedeće mjere:
|
(a) |
kontrola evidencije o proizvodnji i zdravlju na gospodarstvu, ako takve evidencije postoje. Ako su dostupni, u inspekcijskom izvješću službenog veterinara o provedenoj kontroli na farmi moraju biti dokumentirani podaci o dnevnim uginućima i uzimanju hrane i/ili vode za vremensko razdoblje od tjedan dana prije kontakta s jatom za koje se sumnja da je zaraženo influencom ptica do dana pregleda gospodarstva; |
|
(b) |
klinička inspekcija u svakoj proizvodnoj jedinici, uključujući procjenu povijesti bolesti i kliničke preglede peradi ili drugih ptica koje se drže u zatočeništvu, posebno onih koje izgledaju bolesno; |
|
(c) |
ako se kod peradi ili drugih ptica koje se drže u zatočeništvu pojave klinički znakovi ili indikacije o povećanom dnevnom uginuću (> 3 puta uobičajene stope uginuće u jatu) ili pad u dnevnoj proizvodnji jaja (> 5 %) ili smanjenom dnevnom unosu hrane i/ili vode (> 5 %), odmah je potrebno uzeti standardne uzorke iz svake proizvodne jedinice; |
|
(d) |
ako nema znakova iz točaka (b) i (c), standardne uzorke treba uzeti 21 dan od datuma zadnjeg sumnjivog kontakta s inficiranim gospodarstvom ili kad je perad i ostale ptice koje se drže u zatočeništvu usmrćena. |
8.6. Članak 18. točke (b) i (c) – Popis i kontrole od strane službenoga veterinara i nadziranje na gospodarstvima u zaraženom području
Kad službeni veterinar pregledava komercijalno gospodarstvo, treba provesti sljedeće mjere:
|
(a) |
kontrola evidencije o proizvodnji i zdravlju na gospodarstvu. Ako postoje indikacije o povećanom dnevnom uginuću (> 3 puta uobičajene stope uginuće u jatu) ili pad u dnevnoj proizvodnji jaja (> 5 %) ili smanjenom dnevnom unosu hrane i/ili vode (> 5 %), potrebno je uzeti standardne uzorke iz svake proizvodne jedinice; |
|
(b) |
klinička inspekcija u svakoj proizvodnoj jedinici, uključujući procjenu povijesti bolesti i kliničke preglede peradi i drugih ptica koje se drže u zatočeništvu, posebno onih koje izgledaju bolesno; |
|
(c) |
kad se od vrsta peradi ili drugih ptica koje se drže u zatočeništvu ne očekuje da jasno pokazuju kliničke znakove bolesti ili u slučaju cijepljenih ptica, nadležno tijelo može na temelju rezultata procjene rizika odlučiti da standardne uzorke treba uzeti iz svake proizvodne jedinice; |
|
(d) |
na temelju rezultata procjene rizika, nadležno tijelo mora odlučiti o dodatnome službenom nadzoru s kliničkim inspekcijama i uzorkovanjem za laboratorijsko testiranje na ciljnim gospodarstvima, kompartmentima i vrstama proizvodnje. |
8.7. Članak 19. točka (f) – Mjere koje se provode na gospodarstvima u zaraženim područjima
Kad službeni veterinar pregledava gospodarstvo na kojemu je prijavljen povećan pobol, uginuća ili promjena u podacima o proizvodnji, potrebno je provesti sljedeće mjere:
|
(a) |
kontrola evidencije o proizvodnji i zdravlju na gospodarstvu. Ako postoje indikacije o povećanom dnevnom uginuću (> 3 puta uobičajene stope uginuće u jatu) ili pad u dnevnoj proizvodnji jaja (> 5 %) ili smanjenom dnevnom unosu hrane i/ili vode (> 5 %), potrebno je uzeti standardne uzorke iz svake proizvodne jedinice; |
|
(b) |
klinička inspekcija u svakoj proizvodnoj jedinici, uključujući procjenu povijesti bolesti i kliničke preglede peradi ili drugih ptica koje se drže u zatočeništvu, posebno onih koje izgledaju bolesno. |
8.8. Članak 23. točka (b) – Odstupanja pri izravnom prijevozu peradi na neodgodivo klanje
Kad službeni veterinar pregledava gospodarstvo kojemu je odobreno odstupanje od članka 22. Direktive 2005/94/EZ, potrebno je provesti sljedeće mjere:
|
(a) |
kontrola evidencije o proizvodnji i zdravlju na gospodarstvu; |
|
(b) |
klinička inspekcija u svakoj proizvodnoj jedinici, uključujući procjenu povijesti bolesti i kliničke preglede peradi, posebno one koja izgleda bolesno, najviše 24 sata prije premještanja peradi; |
|
(c) |
na temelju rezultata procjene rizika koju provodi nadležno tijelo i umjesto standardnih uzoraka, mora se uzeti barem 60 brisova dušnika/ždrijela i/ili 60 brisova kloake od peradi iz svake proizvodne jedinice iz koje se perad šalje na klanje najviše 48 sati prije vremena premještanja peradi. |
8.9. Članak 25. točka (b) – Odstupanja pri izravnom prijevozu pilenki pred pronesak
Kad službeni veterinar pregledava gospodarstvo kojemu je odobreno odstupanje od članka 22., prije izravnog prijevoza pilenki, treba provesti sljedeće mjere:
|
(a) |
kontrola evidencije o proizvodnji i zdravlju na gospodarstvu; |
|
(b) |
kliničke inspekcije u svakoj proizvodnoj jedinici, uključujući procjenu povijesti bolesti i kliničke preglede peradi, posebno one koja izgleda bolesno, najviše 24 sata prije premještanja peradi; |
|
(c) |
na temelju rezultata procjene rizika koju provodi nadležno tijelo i umjesto standardnih uzoraka, mora se uzeti barem 60 brisova dušnika/ždrijela i/ili brisova kloake peradi iz svih proizvodnih jedinica koju se namjerava prevoziti najviše 48 sati prije njezina odvoza. |
8.10. Članak 26. stavak 1. točka (a) – Odstupanja pri izravnom prijevozu rasplodnih i konzumnih jaja
Kad službeni veterinar pregledava gospodarstvo s rasplodnim jatom kojem je odobreno odstupanje od članka 22., prije izravnog prijevoza rasplodnih jaja potrebno je provesti sljedeće mjere:
|
(a) |
kontrola evidencije o proizvodnji i zdravlju na gospodarstvu; |
|
(b) |
klinička inspekcija u svakoj proizvodnoj jedinici svakih 15 dana; |
|
(c) |
standardni uzorci moraju se uzeti iz svake proizvodne jedinice. |
8.11. Članak 29. stavak 1. – Trajanje mjera
Mjere koje se primjenjuju u zaraženom području u skladu s odjeljkom 3. poglavljem IV. Direktive 2005/94/EZ mogu se ukinuti ne ranije od 21 dana od datuma preliminarnog čišćenja i dezinfekcije zaraženih gospodarstava pod uvjetom da su:
|
(a) |
sva komercijalna gospodarstva u zaraženom području pregledana od strane službenog veterinara te da su rezultati svih kontrola i kliničkih inspekcija kao i laboratorijskih testova kako su određeni u točkama 8.6. (a), (b) i (c) i točki 8.7. negativni; |
|
(b) |
sva identificirana nekomercijalna gospodarstva u zaraženom području pregledana od strane službenog veterinara te da klinički pregled i rezultati provedenih laboratorijskih testova ne izazivaju sumnju na zarazu influencom ptica; |
|
(c) |
rezultati svakog dodatnog službenog nadziranja koje je provedeno, kako je određeno u točki 8.6.(d) negativni. |
8.12. Članak 30. točka (g) – Mjere koje se primjenjuju u ugroženim područjima
Kad službeni veterinar pregledava gospodarstvo na kojem je prijavljen povećan pobol, uginuća ili promjena podatcima o proizvodnji, potrebno je provesti sljedeće mjere:
|
(a) |
kontrola evidencije o proizvodnji i zdravlju na gospodarstvu; |
|
(b) |
klinička inspekcija u svakoj proizvodnoj jedinici, uključujući procjenu povijesti bolesti i kliničke preglede peradi ili drugih ptica koje se drže u zatočeništvu, posebno onih koje izgledaju bolesno; |
|
(c) |
standardni uzorci moraju se uzeti iz svake proizvodne jedinice. |
8.13. Članak 35. – Istraživanje sumnje na prisutnost VPIP-a u klaonicama i u prijevoznim sredstvima
Kad službeni veterinar pregledava gospodarstvo podrijetla ptica u klaonicama ili prijevozna sredstva, potrebno je provesti sljedeće mjere:
|
(a) |
kontrola evidencije o proizvodnji i zdravlju na gospodarstvu, ako takve evidencije postoje; |
|
(b) |
klinička inspekcija u svakoj proizvodnoj jedinici, uključujući procjenu povijesti bolesti i kliničke preglede peradi i drugih ptica koje se drže u zatočeništvu, uzimajući pritom u obzir savjetovanje sa službenim veterinarom u klaonici, koji mora dati podatke o prethodnim kontrolama i rezultatima ante- mortem i post-mortem pregleda; |
|
(c) |
osim kad je nadležno tijelo uvjereno da se sumnja u VPIP može isključiti na temelju veterinarskog pregleda u skladu s točkama (a) i (b), iz svake proizvodne jedinice potrebno je uzeti standardne uzorke; |
|
(d) |
osim standardnih uzoraka, za laboratorijsko testiranje potrebno je dostaviti uzorke barem pet bolesnih ptica, uginulih ptica ili ptica zaklanih u klaonici s patološkim promjenama. |
8.14. Članak 36. stavak 1. – Mjere koje se primjenjuju u klaonicama
Nakon završetka istraživanja iz točke 8.13. te u slučaju da su rezultati laboratorijskih testova negativni te da nema kliničke sumnje na prisutnost VPIP-a na gospodarstvu podrijetla ni u klaonici, službeni se nadzor može ukinuti.
8.15. Članak 37. stavak 1. i stavak 2. – Mjere koje se primjenjuju na graničnim veterinarskim prijelazima ili u prijevoznim sredstvima
|
8.15.1. |
Kad službeni veterinar pregledava perad ili druge ptice u zatočeništvu koje se drže u izolaciji, a koje su premještene s graničnih inspekcijskih postaja ili iz prijevoznih sredstava zbog sumnje u ili potvrde VPIP-a, potrebno je provesti sljedeće mjere:
|
|
8.15.2. |
Kad službeni veterinar pregledava identificirano gospodarstvo podrijetla, u slučaju da je perad ili druge ptice koje se drže u zatočeništvu zaklana, potrebno je provoditi sljedeće mjere:
|
8.C.
8.16. Članak 39. stavak 6. točke (b) i (h) – Mjere koje se primjenjuju na gospodarstvima na kojima je potvrđeno izbijanje NPIP-a
Kad službeni veterinar pregledava gospodarstvo prije prijevoza peradi u klaonicu ili gospodarstvo na kojem se nalazi perad izvaljena iz jaja koja su prikupljena za vrijeme perioda inkubacije, potrebno je provesti sljedeće mjere:
|
(a) |
kontrola evidencije o proizvodnji i zdravlju na gospodarstvu; |
|
(b) |
klinička inspekcija u svakoj proizvodnoj jedinici, uključujući procjenu povijesti bolesti i klinički pregled peradi i drugih ptica koje se drže u zatočeništvu; |
|
(c) |
iz svake proizvodne jedinice treba uzeti standardne uzorke ptica koje se šalju na klanje, najviše 48 sati prije premještanja peradi; |
|
(d) |
iz svake proizvodne jedinice treba uzeti standardne uzorke peradi izvaljene iz jaja prikupljenih za vrijeme perioda inkubacije. |
8.17. Članak 40. stavak 2. točka (b) – Odstupanja za određena gospodarstva od mjera koje se primjenjuju kad je potvrđeno izbijanje bolesti
Kad službeni veterinar pregledava gospodarstvo kojemu je odobreno odstupanje od članka 39. stavka 2. i članka 39. stavka 5. točke (b) Direktive 2005/94/EZ, potrebno je provesti sljedeće mjere:
|
(a) |
kontrola evidencije o proizvodnji i zdravlju na gospodarstvu, ako takve evidencije postoje; |
|
(b) |
klinička inspekcija u svakoj proizvodnoj jedinici u pravilnim intervalima, uključujući procjenu povijesti bolesti i klinički pregled peradi i drugih ptica koje se drže u zatočeništvu, posebno onih koje izgledaju bolesno; |
|
(c) |
umjesto standardnih uzoraka potrebno je, 21 dan nakon datuma zadnjega pozitivnog nalaza NPIP-a iz svake proizvodne jedinice, u razmacima od 21 dan, za laboratorijsko testiranje uzeti sljedeće uzorke:
Međutim, nadležno tijelo može odobriti odstupanja od veličine uzorka određenog u podtočkama i. i ii. na temelju rezultata procjene rizika; |
|
(d) |
uzorkovanje iz točke (c) i laboratorijsko testiranje navedenih uzoraka mora se nastaviti dok se ne postignu dva uzastopna negativna laboratorijska rezultata provedena u razmaku od barem 21 dan. |
8.18. Članak 42. stavak 1. i stavak 3. – Mjere koje se primjenjuju na kontaktnim gospodarstvima
Kad službeni veterinar pregledava kontaktno gospodarstvo, potrebno je provesti sljedeće mjere:
|
(a) |
kontrola evidencije o proizvodnji i zdravlju na gospodarstvu, ako takve evidencije postoje; |
|
(b) |
klinička inspekcija u svakoj proizvodnoj jedinici, uključujući procjenu povijesti bolesti i klinički pregled peradi ili drugih ptica koje se drže u zatočeništvu, posebno onih koje izgledaju bolesno; |
|
(c) |
standardne uzorke peradi ili drugih ptica koje se drže u zatočeništvu, a koje su usmrćene potrebno je uzeti iz svake proizvodne jedinice. |
8.19. Članak 44. stavak 1. točka (b) – Mjere koje se primjenjuju u zonama pod ograničenjem
Kad službeni veterinar pregledava komercijalno gospodarstvo u zoni pod ograničenjem potrebno je provesti sljedeće mjere:
|
(a) |
kontrola evidencije o proizvodnji i zdravlju na gospodarstvu; |
|
(b) |
klinička inspekcija u svakoj proizvodnoj jedinici, uključujući procjenu povijesti bolesti i klinički pregled peradi ili drugih ptica koje se drže u zatočeništvu, posebno onih koje izgledaju bolesno; |
|
(c) |
standardne uzorke potrebno je uzeti iz svake proizvodne jedinice; |
|
(d) |
na temelju rezultata procjene rizika, nadležno tijelo mora odlučiti o dodatnom službenom nadziranju s kliničkim pregledima i uzorkovanjem za laboratorijsko testiranje na ciljnim gospodarstvima, kompartmentima i vrstama proizvodnje. |
8.20. Članak 45. točke (a) i (b) – Trajanje mjera
Mjere koje se primjenjuju u zoni pod ograničenjem u skladu s odjeljkom 3. poglavlja V. Direktive 2005/94/EZ, mogu se ukinuti ne ranije od 21 dan od datuma preliminarnog čišćenja i dezinfekcije zaraženih gospodarstava, nakon uklanjanja peradi s gospodarstva ili ne ranije od 42 dana od potvrde NPIP-a, pod uvjetom da:
|
(a) |
sva komercijalna gospodarstva u zoni pod ograničenjem pregleda službeni veterinar te da su sva laboratorijska testiranja uzoraka iz točke 8.13. (c) i (d) provedena i dostupna; |
|
(b) |
su dostupni rezultati svih dodatnih kliničkih pregleda i laboratorijskih testiranja, koji mogu uključivati nekomercijalna gospodarstva, za određivanje rizika od širenja NPIP-a; |
|
(c) |
službeno tijelo na temelju rezultata procjene rizika, pri čemu se uzima u obzir epidemiološka situacija i rezultati laboratorijskih testiranja iz točaka (a) i (b), smatra da je rizik od širenja NPIP-a zanemariv; na temelju takve procjene može se zaključiti da se u slučaju pozitivnih seroloških nalaza i negativnih viroloških nalaza, ograničenja mogu ukinuti. |
8.D.
8.21. Članak 47. stavak 1. i stavak 6. – Laboratorijski testovi i druge mjere koje se odnose na svinje i druge vrste
Kad službeni veterinar pregledava gospodarstvo na kojem se drže svinje, nakon potvrde influence ptica, potrebno je provesti sljedeće mjere:
|
(a) |
kontrola evidencije o proizvodnji i zdravlju na gospodarstvu, ako takve evidencije postoje; |
|
(b) |
klinička inspekcija u svakoj proizvodnoj jedinici, uključujući procjenu povijesti bolesti i klinički pregled svinja, posebno onih koje izgledaju bolesno; |
|
(c) |
brisovi nosa/ždrijela od barem 60 svinja iz svake proizvodne jedinice ili svih svinja, ako ih je u proizvodnoj jedinici manje od 60, potrebno je uzeti prije ili na dan izdvajanja zaražene peradi ili drugih ptica koje se drže u zatočeništvu. Dva do četiri tjedna od dana izdvajanja, potrebno je uzeti barem 60 uzoraka krvi svinja. Uzorke je potrebno prikupiti na takav način da je barem jedan uzorak dobiven od skupina svinja koje su u izravnom međusobnom kontaktu; |
|
(d) |
premještanje svinja na druga gospodarstva može se odobriti ako su rezultati barem 60 brisova nosa/ždrijela i 60 uzoraka krvi svinja iz svake proizvodne jedinice 14 dana nakon pozitivnih nalaza na prisutnost influence ptica negativni. Premještanje svinja u klaonicu može se odobriti ako su rezultati barem 60 brisova nosa/ždrijela iz svake proizvodne jedinice, 14 dana nakon pozitivnih nalaza na prisutnost influence ptica negativni. U slučaju dvojbenih ili pozitivnih laboratorijskih rezultata, potrebne su dodatna istraživanja kako bi se isključila zaraza ili prijenos influence ptica među svinjama; |
|
(e) |
ako službeni veterinar sumnja da su drugi domaći sisavci na gospodarstvima, a posebno oni koji su identificirani kao prijemljivi na zarazu virusom influence ptica podtipova H5 i H7, bili u kontaktu sa zaraženom peradi ili drugim pticama koje se drže u zatočeništvu, moraju se uzeti uzorci za laboratorijsko testiranje. |
8.E.
8.22. Članak 49. stavak 3. točke (b) i (c) – Repopulacija gospodarstava
Kad službeni veterinar pregledava komercijalno gospodarstvo, koje je ponovno naseljeno, potrebno je provesti sljedeće mjere:
|
(a) |
kontrola evidencije o proizvodnji i zdravlju na gospodarstvu; |
|
(b) |
klinička inspekcija u svakoj proizvodnoj jedinici, uključujući procjenu povijesti bolesti i klinički pregled peradi ili drugih ptica koje se drže u zatočeništvu, posebno onih koje izgledaju bolesno; |
|
(c) |
umjesto standardnih uzoraka, iz svake proizvodne jedinice potrebno je uzeti sljedeće uzorke:
|
|
(d) |
ako je gospodarstvo bilo prethodno zaraženo VPIP-om, potrebno je uzeti 20 brisova dušnika/ždrijela i 20 brisova kloake vodenih ptica (patke/guske) iz svake proizvodne jedinice, ako je to potrebno, tijekom zadnjeg tjedna 21-dnevnog razdoblja od datuma ponovnog naseljavanja; |
|
(e) |
ako je gospodarstvo bilo prethodno zaraženo NPIP-om, iz svake proizvodne jedinice potrebno je uzeti 20 brisova dušnika/ždrijela i 20 brisova kloake te 20 uzoraka krvi. |
8.F.
8.23. Članak 56. stavak 2. točka i. – Preventivno cijepljenje peradi ili drugih ptica koje se drže u zatočeništvu
Laboratorijske testove kako je predviđeno u poglavlju IX. Direktive 2005/94/EZ potrebno je provesti na cijepljenoj peradi ili drugim pticama koje se drže u zatočeništvu, primjenom odobrenih DIVA testova, kad je divlji virus poznat.
Kad se koriste sentinel ptice, one moraju biti prisutne u svakom cijepljenom jatu, klinički pregledane i testirane korištenjem inhibicije hemaglutinacije (IHA). U tu svrhu barem svakih 60 dana treba uzeti 20 uzoraka krvi necijepljenih sentinel ptica u svakom cijepljenom gospodarstvu.
8.24. Prilog IX. – Zahtjevi za premještanje peradi ili drugih ptica koje se drže u zatočeništvu i proizvoda od peradi koji su primjenjivi u vezi s hitnim cijepljenjem
Za premještanje žive peradi i drugih ptica koje se drže u zatočeništvu i njihovih jaja treba primijeniti stroge mjere praćenja, kako bi se u najvećoj mogućoj mjeri smanjio rizik od daljnjeg širenja IP-a.
U tu je svrhu na početku kampanje hitnog cijepljenja potrebno primijeniti iste mjere praćenja u vezi s premještanjem žive peradi i drugih ptica koje se drže u zatočeništvu i njihovih jaja, kako bi se smanjio rizik daljnjeg širenja zaraze influencom ptica, unutar područja cijepljenja i izvan njega.
|
(a) |
Prije prvog premještanja jaja za valenje i konzumnih jaja unutar područja cijepljenja i izvan njega, te nakon toga barem svakih 30 dana, službeni veterinar mora provoditi sljedeće mjere:
|
|
(b) |
Radi premještanja žive cijepljene peradi i drugih ptica koje se drže u zatočeništvu na druga gospodarstva ili radi premještanja žive cijepljene peradi unutar područja cijepljena i izvan njega, službeni veterinar mora provesti sljedeće mjere:
|
POGLAVLJE V.
Dijagnostički virološki testovi i procjena rezultata
|
1. |
Do nastanka i razvoja molekularnih testova, izolacija virusa inokulacijom u embrioniranim kokošjim jajima smatrala se daleko najosjetljivijim dijagnostičkim testom za IP i ključnim za daljnju identifikaciju i karakterizaciju infektivnog virusa. Najvažniji koraci navedeni su u ovom poglavlju. |
2. Obrada uzoraka
Ako su brisovi dostavljeni „suhi”, potrebno ih je staviti u dostatnu količinu otopine antibiotika kako bi se osiguralo da su potpuno uronjeni. Uzorci mogu biti pulirani u skupine od pet, ako su uzeti od iste vrste, u isto vrijeme i iz iste epidemiološke jedinice.
Na lešinama dostavljenima u laboratorij potrebno je obaviti post mortem pregled te uzeti uzorke sljedećih organa: fecesa ili sadržaja crijeva, moždanog tkiva, dušnika, pluća, jetre, slezene i ostalih vidno promijenjenih organa. Te je organe i tkiva moguće pulirati, no potrebno je da se fekalni materijal obrađuje odvojeno.
Uzorke fecesa i organa treba homogenizirati (u zatvorenom homogenizatoru ili koristeći tarionik i tučak i sterilni pijesak) u otopini antibiotika, tako da se dobije 10 – 20 % m/v suspenzije u otopini.
Uronjene brisove i suspenzije treba ostaviti približno dva sata na sobnoj temperaturi (ili duže na 4 °C), a zatim pročistiti centrifugiranjem (npr. 10 minuta na 800 do 1 000 × g).
3. Izolacija virusa u embrioniranim kokošjim jajima
Količina od 0,1 – 0,2 ml očišćenog supernatanta inokulira se u alantoisnu šupljinu svakoga od najmanje četiri embrionirana kokošja jaja, koja su bila inkubirana od 9 do 11 dana. U idealnom slučaju, ta se jaja moraju dobiti iz jata slobodnog od specifičnih patogena (SPF), a ako to nije praktično, mogu se koristiti jaja iz jata za koje je dokazano da su slobodna od protutijela za virus influence ptica (negativna protutijela u serumu – SAN).
Inokulirana jaja moraju se držati na 37 °C i svakodnevno prosvjetljavana. Jaja s uginulim ili ugibajućim embrijima, kako se pojave, i sva ostala jaja, šest dana nakon inokulacije potrebno je ohladiti na 4 °C, a alantoamnioske tekućine testirati na hemaglutinacijsku aktivnost. Ako se hemaglutinacija ne detektira, postupak se mora ponoviti s nerazrijeđenom alantoamnioskom tekućinom kao inokulumom. Ako se hemaglutinacija detektira, potrebno je isključiti prisutnost bakterija u kulturi. Ako su bakterije prisutne, tekućine se mogu profiltrirati kroz membranski filtar s porama od 450nm; u embrionirana se jaja dodaju i inokuliraju antibiotici, kako je gore opisano.
Kako bi ubrzali dijagnosticiranje, neki su laboratoriji koristili dvije trodnevne pasaže ili dvodnevne i četverodnevne pasaže, te izvijestili o usporednim rezultatima s dvije šestodnevne pasaže, međutim to još nije u potpunosti procijenjeno.
Pozitivne tekućine treba testirati na odsutnost bakterija. Ako su bakterije prisutne, tekućine se mogu profiltrirati kroz membranski filtar s porama od 450 nm ili centrifugirati kako bi se odstranile bakterije, pa ih se zatim ponovno pasirati u jajima nakon dodavanja više antibiotika.
4. Diferencijalna dijagnoza
|
(a) |
Preliminarno razlikovanje Budući da je važno da se kontrolne mjere kojima je cilj ograničavanje širenja virusa IP provedu što prije, svaki nacionalni referentni laboratorij koji je izolirao hemaglutinirajući virus mora biti sposoban identificirati radi li se o virusu influence A podtipa H5 ili H7 ili virusu newcastleske bolesti. Hemaglutinirajuće tekućine treba koristiti u testovima inhibicije hemaglutinacije, kako je opisano u poglavlju IX. Pozitivna inhibicija, kao što je titar unutar 2 do 3 log2 pozitivne kontrole, s poliklonskim antiserumima specifičnim za podtipove H5 ili H7 virusa influence A, mogu poslužiti kao preliminarna identifikacija koja omogućuje uvođenje privremenih kontrolnih mjera. |
|
b) |
Potvrdna identifikacija Budući da postoji 16 podtipova hemaglutinina i 9 podtipova neuraminidaze virusa influence i budući da se unutar svakoga od njih javljaju varijacije, nije praktično, ni ekonomično, da svaki nacionalni referentni laboratorij posjeduje antiserume koji bi omogućili potpunu identifikaciju podtipa izolata influence. Međutim, svaki nacionalni referentni laboratorij mora barem:
Osim toga, poželjno je da laboratoriji koji imaju prikladna sredstva za:
Nacionalni referentni laboratoriji moraju također voditi računa o uvođenju stručne ekspertize i opreme, koji omogućuju određivanje slijeda nukleotida u genu hemaglutinina, kako bi se odredilo ima li ili nema višestruko zastupljenih bazičnih aminokiselina na mjestu cijepanja prekursora hemaglutininskog proteina za sve viruse NPIP-a podtipova H5 ili H7. Iako referentni laboratorij Zajednice provodi određivanje patogenosti kao glavni prioritet, kao dio obveza iz Priloga VII. 2(b) Direktivi 2005/94/EZ, takva karakterizacija virusa na nacionalnoj razini znatno će skratiti vrijeme potrebno za dijagnozu, a kad je pozitivna, za punu provedbu kontrolnih mjera za VPIP. |
|
(c) |
Daljnja tipizacija i karakteriziranje izolata Referentni laboratorij Zajednice mora od nacionalnih laboratorija primiti sve hemaglutinirajuće viruse za daljnja antigenska i genska istraživanja, kako bi se omogućilo bolje razumijevanje epizootiologije bolesti unutar Zajednice u skladu s obvezama i zadaćama referentnog laboratorija Zajednice, kako je određeno u Prilogu VII. Direktivi 2005/94/EZ. Osim ovih obvza i zadaća, referentni laboratorij Zajednice mora izvršiti potpunu antigensku tipizaciju za sve viruse influence koje je zaprimio. Za viruse H5 i H7 koji nemaju intravenske indekse patogenosti veće od 1,2 treba se odmah provesti određivanje slijeda nukleotida u genu hemaglutinina, kako bi se utvrdilo ima li na mjestu cijepanja prekursora hemaglutininskog proteina višestruko zastupljenih bazičnih aminokislina, a nacionalne referentne laboratorije i nadležna tijela u državi podrijetla treba odmah čim su rezultati dostupni obavijestiti o tome, kako bi se mjere kontrole za VPIP provele u cijelosti. |
|
d) |
S obzirom na promjenu epidemiološke situacije u vezi s VPIP/NPIP, moguće je sporazumom s Komisijom i s referentnim laboratorijem Zajednice, odobriti odstupanje laboratorijima s cjelovitim kapacitetom za brzu karakterizaciju virusa, da nakon pregleda podataka predaju manji broj tih virusa te da referentni laboratorij Zajednice napravi odgovarajući odabir. To odstupanje može biti dozvoljeno samo u slučaju da nacionalni referentni laboratorij mogu podatke brzo obraditi i dostaviti ih referentnom laboratoriju Zajednice. |
POGLAVLJE VI.
Molekularni testovi i procjena rezultata
Sadašnja definicija VPIP-a omogućuje molekularnu identifikaciju čimbenika virulencije i potvrđuje uporabu molekularnih tehnika u dijagnosticiranju influence ptica. U novije je vrijeme došlo je do razvoja u području njihove primjene za otkrivanje i karakterizaciju virusa IP izravno iz kliničkih uzoraka zaraženih ptica. Konvencionalne tehnike RT-PCR primijenjene na kliničkim uzorcima mogu, s dobro definiranim početnicama, omogućiti brzo otkrivanje i identifikaciju podtipa (barem H5 i H7), a produkt amplifikacije PCR može se upotrijebiti za određivanje slijeda nukleotida i za koji je dokazano da ima važnu primjenu brzim otkrivanjem novih izbijanja, nakon što su primarno zaraženi objekti otkriveni, a virus karakteriziran. Jednostupanjska metoda RT-PCR „u stvarnom vremenu”, korištenjem sustava početnica i fluorescentnih proba (rRT-PCR) omogućava još bržu i osjetljiviju dijagnozu detekcijom virusa influence ptica i određivanjem podtipova H5 ili H7 u kliničkim uzorcima.
Važan je problem u vezi sa sustavima RT-PCR i rRT-PCR da su do danas različiti laboratoriji razvili različite sustave koji, iako posve zakoniti, nisu bili validirani, ni testirani na većem broju uzoraka u različitim laboratorijima. Referentni laboratorij Zajednice i određeni nacionalni referentni laboratoriji bavili su se ovim problemom u okviru projekta (EU AVIFLU) koji je financirala Zajednica, kako bi proizveli ratificirane protokole za konvencionalne RT-PCR i rRT-PCR, koje bi mogli prihvatiti drugi nacionalni referentni laboratoriji. Ako se testni parametri, kao što su trajanje pojedinih ciklusa i vrijeme prijelaza među ciklusima (ramp time) razlikuju od preporučenih u specificiranim protokolima, prije upotrebe mora se dokazati njihova prikladnost za tu namjenu u skladu s točkom 6. poglavlja I. ovog dijagnostičkog priručnika.
Standardni protokoli za ove molekularne testove i njihovu procjenu kako ih primjenjuje referentni laboratorij Zajednice, mogu se naći na sljedećoj mrežnoj stranici:
http://www.defra.gov.uk/corporate/vla/science/science-viral-ai-reflab.htm
POGLAVLJE VII.
Testovi patogenosti in vivo i procjena rezultata
Virulenciju virusa influence A izoliranih iz ptica za piliće, mora se procijeniti testom za određivanje indeksa intravenske patogenosti (IVPI), koji treba provesti kako slijedi:
|
(a) |
svježa infektivna alantoisna tekućina s titrom HA > 1/16 (> 24 ili > log2 4, kad je izražen kao recipročna vrijednost) iz najniže raspoložive pasaže, po mogućnosti iz prve izolacije bez ikakve selekcije, razrjeđuje se na 1/10 u sterilnoj izotoničnoj fiziološkoj otopini; |
|
(b) |
0,1 ml razrijeđenog virusa intravenozno se injektira u svaki od deset pilića SPF ili SAN starih šest tjedana; |
|
(c) |
ptice se pregledavaju tijekom 10 dana svaka 24 sata. Pri svakom se pregledu ptica ocjenjuje s 0 ako je njezino stanje normalno, s 1 ako je bolesna, s 2 ako je jako bolesna i s 3 ako je mrtva. Ocjenjivanje ptice kao bolesne ili jako bolesne subjektivna je klinička procjena. „Bolesne” ptice obično pokazuju jedan od sljedećih znakova, a „jako bolesne” više sljedećih znakova: poteškoće s disanjem, iscrpljenost, proljev, cijanozu izložene kože ili podbratka, edem prednjega dijela glave i/ili glave, živčane poremećaje. Uginule ptice treba ocijeniti s 3 u svakom sljedećem dnevnom pregledu nakon uginuća. Zbog dobrobiti životinja, kada su ptice toliko bolesne da ne mogu jesti i piti, mora ih se usmrtiti na humani način i upisati ih kao uginule kod sljedećeg promatranja, jer će bez intervencije uginuti unutar 24 sata. Ovaj je pristup prihvatljiv za akreditacijska tijela. |
|
(d) |
IVPI srednji je rezultat po ptici za promatranje tijekom 10 dana. Indeks 3,00 znači da su sve ptice uginule unutar 24 sata, indeks 0,00 znači da nijedna ptica nije pokazala ni jedan klinički znak u razdoblju 10-dnevnog promatranja. |
Jednostavna metoda za bilježenje rezultata i izračun indeksa prikazani su u sljedećem primjeru:
|
Klinički znakovi |
Dan poslije inokulacije |
Ukupan rezultat |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
||
|
Normalni |
10 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
12 × 0 = 0 |
|
Oboljeli |
0 |
4 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
6 × 1 = 6 |
|
Jako bolesni |
0 |
2 |
2 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
6 × 2 = 12 |
|
Mrtvi |
0 |
2 |
6 |
8 |
10 |
10 |
10 |
10 |
10 |
10 |
76 × 3 = 228 |
|
|
|
|
|
|
|
|
|
|
|
|
Ukupno = 246 |
Bilješke:
10 ptica promatranih tijekom 10 dana = 100 promatranja
Indeks = srednji rezultat po ptici, po promatranju = 246/100 = 2,46
Svaki virus influence A, koji je bez obzira na podtip u testu IVPI pokazao vrijednost veću od 1,2, smatra se virusom VPIP.
POGLAVLJE VIII.
Serološki testovi i procjena rezultata
Preporučena metoda za dokazivanje prisutnosti virusa influence A dokaz je antigena nukleoproteina ili matriksa koji su zajednički svim virusima influence A.
To je moguće napraviti imunodifuzijskim testom, koji uključuje pripravke koncentriranih virusa ili ekstrakte iz zaraženih korioalantoisnih membrana.
Preporučene metode koje se koriste za serološke testove za otkrivanje protutijela za virus influence ptica test su hemaglutinacije (HA) i inhibicije hemaglutinacije (Hl).
Poglavlje 2.7.12. Priručnika o dijagnostičkim testovima i cjepivima za kopnene životinje Svjetske organizacije za zdravlje životinja (OIE) sadrži podrobne informacije o laboratorijskim tehnikama i procjeni rezultata.
Standardni protokoli za serološke testove i procjenu njihovih rezultata koje primjenjuje referentni laboratorij Zajednice, mogu se naći na sljedećoj mrežnoj stranici:
http://www.defra.gov.uk/corporate/vla/science/science-viral-ai-reflab.htm
POGLAVLJE IX.
Sustavi praćenja povezani s cijepljenjem
1. Direktiva 2005/94/EZ i dijagnostički priručnik
Odjeljak 2. i odjeljak 3. poglavlja IX. Direktive 2005/94/EZ omogućuju upotrebu hitnog i preventivnog cijepljenja pod određenim uvjetima. Jedan je od tih uvjeta da se primjenjuje strategija „DIVA” (Differentiating Infected from Vaccinated Animals – Strategija razlikovanja zaraženih od cijepljenih životinja).
Cijepljenje mora biti namijenjeno sprečavaju zaraze i daljnjeg širenja virusa među jatima. Postoji neosporan dokaz da cijepljenje povećava količinu virusa potrebnog da zarazi ptice i smanjuje količinu izlučenog virusa. Međutim, iako cijepljene ptice više ne razvijaju kliničke znakove, ipak, kad su izložene virusima, mogu ih širiti. Zato podtipovi virusa VPIP H5 i H7 neko vrijeme mogu neopaženo kružiti unutar jata sa suboptimalnom razinom otpornosti, na isti način na koji kruže virusi NPIP-a unutar necijepljenog jata. Zato je nužno da se prepoznaju virus-pozitivna cijepljena jata, koja su se zarazila divljim virusom, kako bi se mogle provesti druge kontrolne mjere, kao što je usmrćivanje (stamping-out).
2. Korištenje sentinel ptica za praćenje zaraze
Na razini jata, jednostavna je metoda redovito praćenje sentinel ptica koje u cijepljenom jatu nisu bile cijepljene, međutim taj pristup uzrokuje poteškoće povezane s upravljanjem, posebno u identificiranju sentinel ptica, posebno u velikim jatima. Mora se osigurati dodir između sentinel ptica i cijepljenih ptica.
3. Laboratorijski test DIVA za praćenje zaraze
Kao druga mogućnost ili dopuna na cijepljenim se pticama može provoditi testiranje na izloženost terenskom virusu uporabom laboratorijskih testova DIVA. Zadnjih godina razvijeno je više testnih sustava koji omogućavaju otkrivanje izloženosti cijepljenih ptica terenskom virusu. Jedna metoda koja se dokazala učinkovitom upotreba je cjepiva koje sadrži virus istog podtipa hemaglutinina (H), ali različitu neuraminidazu (N) od prevladavajućega divljeg virusa. Protutijela na N divljega virusa djeluju kao prirodni markeri zaraze.
Taj se sustav primjenjivao u Italiji 2000. nakon ponovne pojave virusa NPIP H7N1. Kako bi se dopunile neposredne mjere kontrole, primijenila se DIVA strategija, s upotrebom cjepiva koje je sadržavalo H7N3 za borbu protiv terenske zaraze s H7N1. Cijepljene ptice koje su bile izložene terenskom virusu diferencirane su serološkim testom za otkrivanje specifičnih anti-N1 protutijela. Ista strategija bila je upotrijebljena za nadzor NPIP-a koji je u Italiji 2002. i 2003. prouzročio virus H7N3 i to cjepivom H7N1 i serološkim testom za otkrivanje specifičnih anti-N3 protutijela. U oba je slučaja, cijepljenje s usmrćivanjem pomoću strategije DIVA rezultiralo iskorjenjivanjem divljeg virusa.
Poteškoće s ovim sustavom nastaju ako se pojavi divlji virus koji sadrži isti antigen N kao postojeći divlji virus, ali koji ima drugi podtip H a ne H5 ili H7, ili ako podtipovi s istim antigenima N već kruže terenom. Osobito su patke poznate kao kliconoše više od jednog podtipa. Postojala je također potreba da se razvije prikladan test koji bi omogućio rutinsko praćenje jata za protutijela neuraminidaze. U Italiji su razvili i upotrebljavali „ad hoc” serološki test, koji se temelji na indirektnoj imuno-fluorescenciji, upotrebom rekombinantnog bakulovirusa s ekspresijom antigena N proteina. Razvojem ELISA testa navedeno će imati širu i jednostavniju primjenu.
Uporaba cjepiva koja sadrže samo HA, kao što su rekombinantna vektorska cjepiva, omogućuje primjenu klasičnih testova AGID ili testova ELISA, koji se temelje na nukloproteinu, nestrukturnom proteinu ili proteinima matriksa za otkrivanje zaraze kod cijepljenih ptica.
Za inaktivirana cjepiva opisan je test koji otkriva protutijela za nestrukturne virusne proteine, koji nastaju samo za vrijeme prirodne infekcije. Takav sustav treba još validirati na terenu, međutim ima ograničenja, jer pri prirodnoj zarazi jata bilo kojim virusom influence, neovisno o podtipu, nastaju protutijela za nestrukturne proteine.
Razvoj brzih i osjetljivih metoda za otkrivanje virusa, posebno onih koji se lako automatiziraju kao što je metoda RT-PCR u stvarnom vremenu, znači da ih je moguće upotrebljavati za jednostavno i redovito testiranje velikog broja uzoraka cijepljenih ptica na prisutnost divljeg virusa. Otkrivanje uzročnika bit će, međutim, ograničeno na kratko razdoblje u akutnoj fazi zaraze i neće se moći koristiti za donošenje zaključka da jato u prošlosti nije bilo izloženo virusu. Ovaj je pristup najprikladniji za testiranje cijepljenih ptica prije njihova premještanja, kao dokaz da su slobodne od aktivne infekcije.
Broj uzoraka koji se trebaju testirati sustavima po izboru mora omogućiti isključivanje prevalencije zaraze virusom influence ptica u jatu veće od 15 % uz razinu pouzdanosti od 95 %.
POGLAVLJE X.
Strategije za dijagnozu IP-a
Kako je određeno u Prilogu IV. Direktivi 2005/94/EZ, odluke o primjenjivanju mjera na posebnim područjima ili na kontaktnim gospodarstvima i težina tih mjera može se u znatnoj mjeri razlikovati, ovisno o veličini rizika. Isto tako, tražena se dijagnostička potvrda bolesti vjerojatno usklađuje s prevladavajućim stanjem, veličinom opasnosti i stupnjem rizika. Nadležna veterinarska tijela moraju odlučiti o dijagnostičkim dokazima uzimajući u obzir brzinu provedbe kontrolnih mjera iskorjenjivanja bolesti te moguće posljedice pogrešne dijagnoze. Pri takvim je prosudbama potrebno istodobno uzeti u obzir mnoge čimbenike, a neke je situacije moguće i predvidjeti.
|
Stanje bolesti |
Mogući problem |
Dijagnostički kriteriji |
|
Bez specifičnih znakova, bez službene sumnje. |
Izolirano gospodarstvo. |
Provesti brzo otkrivanje na temelju tehnike RT-PCR za M gen. Prema potrebi diferencijalna dijagnoza. |
|
Prva sumnja na izbijanje bolesti. |
Izolirano gospodarstvo. |
Provesti cjelovito dijagnostičko testiranje, izolaciju i karakterizaciju virusa. |
|
Prva sumnja na izbijanje bolesti. |
Gospodarstvo na području s velikom gustoćom peradi. |
Provesti cjelovito dijagnostičko testiranje, izoliranje i karakterizaciju virusa, ali se pritom usredotočiti na metode brzog otkrivanja i metode karakterizacije, posebno one koje se temelje na RT-PCR i sekvenciranju (1). |
|
Druga i svaka sljedeća sumnja na izbijanje bolesti. |
Izolirana gospodarstva, epidemiološki povezana s prvom sumnjom na izbijanje bolesti. |
Usredotočiti se na metode brzog otkrivanja i metode karakterizacije, posebno one koje se temelje na RT-PCR i sekvenciranju (1) |
|
Druga i svaka sljedeća sumnja na izbijanje bolesti. |
Gospodarstvo na području s velikom gustoćom peradi ili s mnogo epidemioloških veza. |
Pouzdati se u metode brzog otkrivanja, koje najranije pružaju dokaz o prisutnosti bilo kojeg virusa influence (1) ptica. |
|
Višestruke sumnje na izbijanje bolesti ili brzo širenje bolesti, uključujući nadziranje. |
Bez brzog djelovanja neće biti moguće zaustaviti širenje bolesti. |
Osloniti se na metode brzog otkrivanja, koje najranije pružaju dokaz o prisutnosti bilo kojeg virusa influence (1) ptica. |
POGLAVLJE XI.
Dijagnoza zaraze virusima influence ptica u svinja i u drugih sisavaca
1. Influenca ptica u svinja
Virusi influence ptica lako se prenose na svinje i premda je umnožavanje u većini slučajeva relativno ograničeno, postoji mogućnost prijenosa bolesti sa zaraženih svinja na perad i druge prijemljive životinje. Do danas nema terenskih dokaza da zaražene svinje prenose viruse influence ptica podtipova H5 i H7.
Iskustvo stečeno za vrijeme izbijanja bolesti u Nizozemskoj 2003. godine pokazalo je da svinje zaražene H7N7 nisu pokazivale kliničke znakove, koji bi se mogli pripisati zarazi H7N7. Štoviše, nije bilo prijava bolesnih svinja za vrijeme izbijanja bolesti H5N1 u Aziji i drugdje.
Zato se pri utvrđivanju jesu li svinje zaražene ne može pouzdati u kliničke znakove, iako se klinički znakovi zbog zaraze svinja drugim virusima influence ptičjega podrijetla mogu pojaviti, nakon što se virus prilagodi domaćinu. Dijagnoza zaraze virusom influence ptica u svinja u biti je slična dijagnozi za ptičje vrste i temelji se na izolaciji virusa molekularnim tehnikama i otkrivanju specifičnih protutijela upotrebom testova inhibicije hemaglutinacije. Postoje, međutim, određene razlike i ni jedan test nije u cijelosti validiran za potvrđivanje zaraze virusima influence ptica u svinja.
2. Uzorci za izolaciju virusa
Zaraze virusom influence ptica obično su ograničene na dišni sustav i uzorci se moraju uzeti iz tkiva dišnoga sustava i, ako je to prikladno, brisova ždrijela ili nosa, po mogućnosti od svinja koje pokazuju znakove bolesti. Ti uzorci i brisovi mogu se obrađivati za izolaciju virusa ili molekularnu detekciju virusa, korištenjem istih tehnika koje su gore u tekstu opisane za uzorke ptica. Međutim, pri upotrebi tehnika PCR potrebno je koristiti odgovarajuće kontrole kako bi se osiguralo da sastojci u uzorcima svinja ne inhibiraju amplifikaciju.
3. Inokulacija i inkubacija jaja
Za izoliranje virusa influence u sisavaca u embrioniranim kokošjim jajima starim od 9 do 11 dana, uobičajena je praksa inokulirati svako jaje preko alantoisne šupljine u amniotsku šupljinu. Međutim, pri testiranju svinja koje su bile u dodiru s virusima influence ptica, kad je virus imao malo mogućnosti za adaptaciju, inokulacija alantoisne šupljine vjerojatno je dovoljna.
Slično tome, pri izolaciji virusa influence A kod sisavaca preporučena inkubacijska temperatura je 35 °C, iako za viruse koji su se slabo prilagodili svinjama 37 °C neće štetiti izolaciji virusa.
4. Test na specifična protutijela u testovima inhibicije hemaglutinacije (IHA)
Izolacija virusa ili molekularna detekcija vjerojatno su najosjetljivije metode za određivanje zaraze virusom influence ptica kod svinja. Međutim, serološki odgovori kod svinja opaženi su i bez izolacije ili detekcije virusa. Testovi IHA koji koriste svinjske serume zahtijevaju određene modifikacije testa koji se koristi za serume ptica, navedenih u poglavlju VIII.
Svinjski serumi poznati su po svojstvu nespecifične inhibicije u testovima IHA i zato se, kako bi se to spriječilo, svaki primjerak seruma mora tretirati receptorom koji uništava enzime (RDE). Potrebno je upotrijebiti sljedeću metodu:
|
(a) |
u 100 μl svinjskog seruma dodajte 400 μl RDE (djelatna koncentracija) i temeljito promiješajte; |
|
(b) |
inkubirajte jedan sat na 37 °C; |
|
(c) |
potom inkubirajte 30 minuta na 56 °C; |
|
(d) |
uzorke hladite na 4 °C barem 15 minuta; |
|
(e) |
dodajte 10 μl 30- postotnih eritrocita pilića i dobro promiješajte; |
|
(f) |
inkubirajte preko noći na 4 °C. Druga je mogućnost, ako je uzorke potrebno upotrijebiti još isti dan, da inkubirate jedan sat na 37 °C i pet minuta centrifugirate na 300 × g. |
Obrađeni serum potom se koristi u testovima IHA, kako je opisano za serume ptica u stavku […], početno razrjeđivanje je 1:10. Potrebno je upotrijebiti seriju seruma od svinja s poznatim sero-negativnim statusom u pogledu influence ptica, kako bi se procijenila specifičnost testa IHA za upotrijebljeni soj virusa (vidjeti uporabu soja virusa za serologiju, dobivenog kod izbijanja bolesti; poglavlje VIII.). Za vrijeme izbijanja bolesti u Nizozemskoj 2003. godine u testu IHA, u kojem se koristio serum svinja koje su odabrane neovisno o izbijanju bolesti, nađeno je do 2,6 % nespecifičnih reaktora.
5. Uzorkovanje svinja
Osobito na farmama na kojima se drže i svinje i perad, u zajedničkim ili odvojenim prostorijama, svinje su u opasnosti da se zaraze influencom ptica izravno ili neizravno, dodirom s peradi ili proizvodima od peradi. Kako bi se isključila takva infekcija, potrebno je uzeti brisove ždrijela ili nosa i uzorke krvi u skladu s postupcima opisanim u točki 8.21. poglavlja IV. Uzorke je potrebno uzeti od svinja koje pokazuju kliničke znakove bolesti. Međutim, kada su klinički znakovi odsutni uzorci se mogu uzeti nasumično iz različitih dijelova prostora. Ako su dostupni za laboratorijsko ispitivanje, brisovi se moraju testirati brzim molekularnim testovima i/ili izolacijom virusa. Metode RT-PCR treba na odgovarajući način potvrditi i njihova osjetljivost mora biti barem jednaka onoj izolacije virusa influence A u jajima.
Dva do četiri tjedna nakon izdvajanja peradi zaražene influencom ptica, potrebno je uzeti barem 60 uzoraka krvi svinja, tako da se barem neki uzorci uzmu iz skupina svinja koje su u međusobnom neposrednom kontaktu. Uzorke je potrebno testirati testom IHA uporabom virusa koji je dobiven pri izbijanju bolesti kod peradi. Uzorke iz akutne faze i faze oporavka treba testirati istim testom. Pozitivni uzorci mogu se potvrditi neutralizacijom i/ili Western blot analizom.
Kad je rezultat kojega od ovih testova pozitivan, potrebno je provesti epidemiološko istraživanje na svim farmama svinja koje se nalaze unutar zaraženog područja, bez obzira radi li se o farmama na kojima se drže samo svinje ili i druge vrste životinja.
6. Virusi influence ptica u drugih sisavaca, osim svinja
Potrebno je provesti pretrage drugih sisavaca osim svinja koje su prijemljivi na influencu ptica, uključujući mačke. Posebno u vezi s VPIP H5N1, pri testiranju mačaka potrebno je obaviti sljedeće pretrage:
Patoanatomske promjene, povezane s umnažanjem virusa, koncentriraju se u plućima i jetrima i zato je uzorke za virološke pretrage potrebno uzeti od tih organa uginulih životinja. Kod živih životinja, za detekciju virusa potrebno je uzeti brisove dušnika/ždrijela. Osim toga, odvojeno se mogu uzeti brisovi fecesa.
Uzorke krvi koji se pregledavaju analizama IHA potrebno je obraditi na temperaturi od 56 °C 30 minuta, a RDE obrada može se izostaviti.
POGLAVLJE XII.
Minimalni sigurnosni zahtjevi za prijevoz uzoraka
|
1. |
Za prijevoz uzoraka kod kojih je potvrđena prisutnost patogena ili postoji sumnja na njihovu prisutnost, vrijede strogi nacionalni i međunarodni propisi, kojih se je potrebno stalno pridržavati. Izolati virusa ne klasificiraju se kao dijagnostički uzorci, iako moraju biti pakirani u skladu s međunarodnim standardima. Upute dane u ovom poglavlju odnose se na zračni prijevoz, iako se slično pakiranje mora koristiti i kod kopnenog i pomorskog prijevoza uzoraka. |
2. Pakiranje dijagnostičkih uzoraka za prijevoz
Dijagnostičkim uzorcima, koji se prevoze u skladu s propisima IATA, dodijeljen je identifikacijski broj UN 2814, 2900 ili 3373, kako je prikladno.
Dok pošiljka ne stigne do primatelja za nju je odgovoran pošiljatelj, a ne prijevozna kompanija.
3. Prvi sloj ambalaže
|
(a) |
Primarna posuda (-e) mora (ju) biti nepropusna (-e), npr. zatvarači na zavrtanj moraju se zabrtviti parafilmom ili ljepljivom trakom ili se moraju poduzeti slične mjere zaštite. |
|
(b) |
Ako je primarnih posuda više, moraju se zamotati pojedinačno, kako bi se spriječilo razbijanje. |
|
(c) |
Kad se određuje količina dijagnostičkih uzoraka koji se prevoze, potrebno je voditi računa o transportnom mediju za viruse. |
|
(d) |
Primarna posuda (-e) ne smije (-u) sadržavati više od 500 ml ili 500 g. |
Ukupan sadržaj primarne posude dijagnostički je uzorak.
4. Drugi sloj ambalaže
|
(a) |
Za drugi sloj ambalaže potrebno je upotrijebiti dovoljno upijajućeg materijala, koji u slučaju curenja ili oštećenja može upiti čitav sadržaj iz svih primarnih posuda. |
|
(b) |
Drugi sloj ambalaže mora biti u skladu sa zahtjevima IATA za pakiranje dijagnostičkih uzoraka, uključujući postupak testa s padom s visine 1,2 m (3,9 stope). Budući da su zahtjevi za ambalažu za pakiranje zaraznog materijala stroži od zahtjeva za pakiranje dijagnostičkih uzoraka iz uputa za pakiranje 602 IATA, može ju se koristiti. |
|
(c) |
Ambalaža za zarazni materijal mora na vanjskoj strani sadržati tražene specifikacijske oznake (UN u krugu), na primjer: „UN 4G/CLASS 6.2/99/GB/2450” |
|
(d) |
Drugi sloj ambalaže mora biti nepropustan. Potrebno je pridržavati se uputa za pakiranje koje je priložio proizvođač ambalaže ili koja druga ovlaštena stranka. |
|
(e) |
Najmanje ukupne vanjske dimenzije drugoga sloja ambalaže moraju iznositi barem 100 mm. |
|
(f) |
Drugi sloj ambalaže mora biti dovoljno velik za slanje dokumenta, kao što je zračni tovarni list. |
5. Vanjski sloj ambalaže
|
(a) |
Vanjski sloj ambalaže ne smije sadržavati više od 4 l ili 4 kg. |
|
(b) |
Ako je to potrebno, izvan drugoga sloja ambalaže stavlja se suhi ili mokri led. Ako se koristi suhi led, ambalaža mora osigurati oslobađanje ugljičnog dioksida i ne dopustiti nastajanje tlaka koji bi mogao oštetiti ambalažu. Ako se koristi mokri led, ambalaža mora biti nepropusna. Svaka ambalaža i zračni tovarni list moraju biti označeni sljedećim navodom: „UN 3373 DIAGNOSTIC SPECIMEN PACKED IN COMPLIANCE WITH IATA PACKING INSTRUCTION 650” |
|
(c) |
Između drugoga sloja ambalaže i vanjskog sloja potrebno je priložiti podroban popis cijelog sadržaja. |
|
(d) |
Vanjski sloj ambalaže potrebno je staviti u hermetički zatvorenu plastičnu vreću kako bi ga se zaštitilo od vlage. |
|
(e) |
Deklaracija prijevoznika o opasnom teretu nije potrebna. |
POGLAVLJE XIII.
Slanje virusa i uzoraka u referentni laboratorij Zajednice
|
1. |
Uzorci koje se šalje u referentni laboratorij Zajednice moraju biti u skladu s preporukama za prijevoz opasnih patogenih tvari unutar Zajednice kao i propisima i zakonodavstvom koje je na snazi u Ujedinjenoj Kraljevini. Potrebno je pridržavati se uputa određenih u ovom poglavlju. |
2. Slanje virusa i drugih materijala u referentni laboratorij Zajednice
|
(a) |
Sve materijale potrebno je zapakirati u skladu s uputama određenim u ovom poglavlju. |
|
(b) |
Vanjski sloj ambalaže mora biti označen kako slijedi: „ANIMAL PATHOGEN – PACKAGE ONLY TO BE OPENED AT THE AVIAN VIROLOGY SECTION, VLA, WEYBRIDGE. IMPORTATION AUTHORISED BY LICENCE NUMBER ….*…… ISSUED UNDER THE IMPORTATION OF ANIMAL PATHOGENS ORDER.” |
|
(c) |
Potrebno je unijeti jedan od sljedećih brojeva dozvole:
Kako se ovi brojevi dozvole s vremena na vrijeme mijenjaju, laboratoriji koji šalju uzorke moraju osigurati da se koriste brojevi dozvole koji su trenutačno na snazi. |
|
(d) |
Ambalažu je potrebno nasloviti na:
|
|
(e) |
Uz pošiljku mora biti priloženo pismo sa što više podataka o izolatu, kao što su npr. vrsta i starost, područje/država izolacije, podaci o anamnezi. |
|
(f) |
Paketi se šalju zračnim poštanskim ili teretnim prijevozom. Ako se paketi šalju zračnim teretnim prijevozom, prije dolaska materijala, referentnom laboratoriju Zajednice potrebno je telefaksom, telefonom ili elektroničkom poštom javiti broj zračnoga tovarnog lista. Paketi koji se šalju teretnim zračnim prijevozom, moraju biti jasno označeni kako slijedi: „CARE OF TRANSGLOBAL” kako bi se osigurala brza obrada u zračnoj luci. Osobe za kontakt u referentnom laboratoriju Zajednice
|
POGLAVLJE XIV.
Minimalni sigurnosni zahtjevi u dijagnostičkom laboratoriju za influencu ptica
|
1. |
Sigurnosni zahtjevi u dijagnostičkim laboratorijima koji rade s virusima influence ptica moraju obuhvaćati suzbijanje virusa kao prijetnje za zdravlje životinja i zaštitu ljudi zaposlenih u laboratoriju (i onih izvan njega) od svih rizika zoonoza. U Zajednici minimalni sigurnosni zahtjevi za laboratorije propisani su odredbama nekoliko direktiva. Osim toga, u temeljnim europskim normama (EN) opisani su i predviđeni operativni aspekti. Za rad laboratorija za dijagnostičke svrhe postoje dodatni propisi (europske norme), kao što je dobra laboratorijska praksa. |
2. Direktive Zajednice o laboratorijima
Direktiva Vijeća 89/391/EEZ od 12. lipnja 1989. o uvođenju mjera za poticanje poboljšanja sigurnosti i zdravlja radnika na radu (SL L 183, 29.6.1989., str. 1.).
Direktiva Vijeća 90/679/EEZ od 26. studenoga 1990. o zaštiti radnika od rizika povezanih s izloženošću biološkim agensima na radu (sedma pojedinačna Direktiva u smislu članka 16. stavka 1. Direktive 89/391/EEZ) (SL L 374, 31.12.1990., str. 1.).
Ako se dijagnostika obavlja lančanom reakcijom polimeraze (PCR) i kloniranjem produkata PCR u bakterijskom plazmidu za razmnožavanje, kao na primjer za sekvenciranje DNK, osim ovih dviju direktiva, primjenjuje se sljedeća direktiva i europske norme (EN):
Direktiva Vijeća 90/219/EEZ od 23. travnja 1990. o ograničenoj upotrebi genetski modificiranih mikroorganizama (SL L 117, 8.5.1990., str. 1.).
|
3. |
Osim direktiva Zajednice potrebno je prihvatiti europske norme (EN):
Za rad/upravljanje laboratorijem primjenjuju se sljedeći uvjeti: |
4. Zahtjevi za laboratorije (razine izolacije (zadržavanja) od 1. do 4.)
U skladu s Direktivom 2000/54/EZ Europskog parlamenta i Vijeća od 18. rujna 2000. o zaštiti radnika od rizika povezanih s izlaganjem biološkim sredstvima na radu (sedma pojedinačna Direktiva u smislu članka 16. stavka 1. Direktive 89/391/EEZ) (SL L 262, 17.10.2000., str. 21.), Direktivom 90/219/EEZ i europskim normama: EN 12128; EN 12740; EN 12741.
|
Mjere suzbijanja |
Razina suzbijanja |
|||
|
1 |
2 |
3 |
4 |
|
|
Laboratorijski prostor: izolacija |
ne |
da |
da |
da |
|
Laboratoriji, odvojeni vratima |
ne |
da |
da |
da |
|
Prisutan prozor za promatranje ili alternativa, koja bi omogućila promatranje ljudi |
po izboru |
po izboru |
po izboru |
da |
|
Prostori za pranje ruku (za osoblje) |
da |
da |
da |
da |
|
Prostori za dezinfekciju (ruku) |
po izboru |
da |
da |
da |
|
Ograničen pristup |
ne |
da |
da |
da |
|
Posebne mjere za nadzor širenja aerosola |
ne |
da da |
da što više smanjiti |
spriječiti spriječiti |
|
Na vratima znak za biološku opasnost |
ne |
da |
da |
da |
|
Tuš |
ne |
ne |
po izboru |
da |
|
Ispiranje očiju |
da |
da |
da |
da |
|
Laboratorij: moguće ga je hermetički zatvoriti za fumigaciju |
ne |
ne |
da |
da |
|
Površine otporne na vodu, kiseline, lužine, otapala, sredstva za dezinfekciju i dekontaminaciju, jednostavne za čišćenje |
da (radna površina) |
da (radna površina) |
da (radna površina, pod) |
da (radna površina, pod) |
|
Ulaz u laboratorij kroz zračnu barijeru (airlock) |
ne |
ne |
po izboru |
da |
|
Podtlak s obzirom na tlak neposredne okoline |
ne |
ne |
po izboru |
da |
|
Izlazni i ulazni zrak iz laboratorija mora biti filtriran kroz filtar HEPA |
ne |
ne |
da (izlazni zrak) |
da |
|
Autoklav |
na lokaciji |
u zgradi |
u laboratoriju |
u laboratoriju, s vratima na oba kraja |
|
Zaštitna odjeća |
primjerena zaštitna odjeća |
primjerena zaštitna odjeća |
primjerena zaštitna odjeća (obuća po izboru) |
potpuno presvlačenje odjeće |
|
Rukavice |
ne |
po izboru |
da |
da |
|
Učinkovit nadzor vektora (npr. za glodavce i insekte) |
po izboru |
da |
da |
da |
|
Sigurno pohranjivanje biološkog agensa |
da |
da |
da |
da |
|
Laboratoriji imaju vlastitu opremu |
ne |
ne |
preporučuje se |
da |
Postoje dodatne europske norme koje se bave upravljanjem i ustrojem laboratorija.
Potrebno je poštovati druge nacionalne i međunarodne propise i preporuke. WHO je na svojoj mrežnoj stranici objavio svoj priručnik Laboratory Biosafety Manual (3. izdanje):
http://www.who.int/csr/resources/publications/biosafety/WHO_CDS_CSR_LYO_2004_11/en/
5. Mjere suzbijanja koje se odnose na zdravlje životinja
Veterinarska nadležna tijela u državama članicama moraju donijeti propise u vezi sa suzbijanjem virusa influence ptica, posebno VPIP, ali također i svih virusa influence ptica podtipova H5 i H7. Neke je upute dala Svjetska organizacija za zdravlje životinja (OIE) u poglavlju 1.4.5. Kodeksa o zdravlju kopnenih životinja 2005. i VPIP smatra se patogenom 4. skupine suzbijanja OIE.
Iako propise koji uređuju postupanje s virusima influence ptica donose nadležna veterinarska tijela država članica.
Minimalni zahtjevi sigurnosti, koje primjenjuje referentni laboratorij Zajednice, a koji predstavljaju nacionalne propise Ujedinjene Kraljevine, mogu se vidjeti na sljedećoj mrežnoj stranici:
http://www.defra.gov.uk/corporate/vla/science/science-viral-ai-reflab.htm
6. Mjere suzbijanja koje se odnose na zdravlje ljudi
Laboratoriji koji rade s virusima influence ptica moraju neprestano biti svjesni da su to barem potencijalno humani patogeni i rad laboratorija trebaju organizirati tako da se izbjegne zaraza djelatnika u laboratoriju i onemogući izlazak virusa iz laboratorija.
Upute za rukovanje s uzorcima za koje postoji sumnja na prisutnost virusa influence ptica A, mogu se naći na mrežnoj stranici Svjetske zdravstvene organizacije (WHO):
http://www.who.int/csr/disease/avian_influenza/guidelines/handlingspecimens/en/
(1) Za to je potrebno provesti cjelovito uzorkovanje, a uzorke uskladištiti za kasniju procjenu.
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
144 |
32006R1467
|
L 274/3 |
SLUŽBENI LIST EUROPSKE UNIJE |
04.10.2006. |
UREDBA KOMISIJE (EZ) br. 1467/2006
od 4. listopada 2006.
o izmjeni Priloga II. Uredbi (EZ) br. 998/2003 Europskog parlamenta i Vijeća u pogledu popisa država i teritorija
(Tekst značajan za EGP)
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Uredbu (EZ) br. 998/2003 Europskog parlamenta i Vijeća od 26. svibnja 2003. o uvjetima zdravlja životinja primjenjivim na nekomercijalno kretanje kućnih ljubimaca i o izmjeni Direktive Vijeća 92/65/EEZ (1), a posebno njezine članke 10. i 19.,
budući da:
|
(1) |
Uredbom (EZ) br. 998/2003 propisuju se uvjeti zdravlja životinja primjenjivi na nekomercijalno kretanje kućnih ljubimaca i pravila koja se primjenjuju na provjere takvih kretanja. |
|
(2) |
Uredbom (EZ) br. 998/2003 propisano je da se popis trećih zemalja, iz kojih je moguće odobriti kretanje kućnih ljubimaca u Zajednicu ako su ispunjeni određeni uvjeti, navodi u dijelu C Priloga II. toj Uredbi. |
|
(3) |
Na popisu iz dijela C Priloga II. Uredbi (EZ) br. 998/2003 nalaze se treće zemlje i teritoriji u kojima nema bjesnoće, te treće zemlje i teritoriji za koje je utvrđeno da opasnost od unosa bjesnoće u Zajednicu kao posljedice kretanja iz tih trećih zemalja i teritorija nije veća od opasnosti povezane s kretanjem između država članica. |
|
(4) |
Iz podataka koje je podnijela Ujedinjena Kraljevina u pogledu Britanskih Djevičanskih Otoka, vidljivo je kako opasnost od unosa bjesnoće u Zajednicu kao posljedice kretanja kućnih ljubimaca iz tog teritorija nije veća od opasnosti povezane s kretanjem kućnih ljubimaca između država članica ili iz trećih zemalja s popisa iz Uredbe (EZ) br. 998/2003. Stoga je Britanske Djevičanske Otoke potrebno uvrstiti u popis u dijelu C Priloga II. Uredbi (EZ) br. 998/2003. |
|
(5) |
U interesu jasnoće zakonodavstva Zajednice, potrebno je u potpunosti zamijeniti popis država i teritorija iz Priloga II. Uredbi (EZ) br. 998/2003. |
|
(6) |
Uredbu (EZ) br. 998/2003 treba stoga na odgovarajući način izmijeniti. |
|
(7) |
Mjere predviđene ovom Uredbom u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU UREDBU:
Članak 1.
Prilog II. Uredbi (EZ) br. 998/2003 zamjenjuje se tekstom iz Priloga ovoj Uredbi.
Članak 2.
Ova Uredba stupa na snagu dvadesetog dana od dana objave u Službenom listu Europske unije.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 4. listopada 2006.
Za Komisiju
Markos KYPRIANOU
Član Komisije
(1) SL L 146, 13.6.2003., str. 1. Uredba kako je zadnje izmijenjena Uredbom Komisije (EZ) br. 590/2006 (SL L 104, 13.4.2006., str. 8.).
PRILOG
„PRILOG II.
POPIS DRŽAVA I TERITORIJA
DIO A
|
IE |
Irska |
|
MT |
Malta |
|
SE |
Švedska |
|
UK |
Ujedinjena Kraljevina |
DIO B
Odjeljak 1.
|
(a) |
DK |
Danska, uključujući GL – Grenland i FO – Farske otočje; |
|
(b) |
ES |
Španjolska uključujući Balearsko otočje, Kanarske otoke, Ceutu i Melillu; |
|
(c) |
FR |
Francuska, uključujući GF – Francusku Gvajanu, GP – Gvadalupu, MQ – Martinik i RE - Reunion; |
|
(d) |
GI |
Gilbraltar; |
|
(e) |
PT |
Portugal, uključujući područje Azorskih otoka i otočje Madeira; |
|
(f) |
države članice osim onih iz dijela A i točaka (a), (b), (c) i (e) ovog Odjeljka. |
Odjeljak 2.
|
AD |
Andora |
|
CH |
Švicarska |
|
IS |
Island |
|
LI |
Lihtenštajn |
|
MC |
Monako |
|
NO |
Norveška |
|
SM |
San Marino |
|
VA |
Država Vatikanskoga Grada |
DIO C
|
AC |
Otok Ascension |
|
AE |
Ujedinjeni Arapski Emirati |
|
AG |
Antigva i Barbuda |
|
AN |
Nizozemski Antili |
|
AR |
Argentina |
|
AU |
Australija |
|
AW |
Aruba |
|
BA |
Bosna i Hercegovina |
|
BB |
Barbados |
|
BG |
Bugarska |
|
BH |
Bahrein |
|
BM |
Bermudi |
|
BY |
Bjelorusija |
|
CA |
Kanada |
|
CL |
Čile |
|
FJ |
Fidži |
|
FK |
Falklandi |
|
HK |
Hong Kong |
|
HR |
Hrvatska |
|
JM |
Jamajka |
|
JP |
Japan |
|
KN |
Sveti Kristofor i Nevis |
|
KY |
Kajmanski otoci |
|
MS |
Montserat |
|
MU |
Mauricijus |
|
MX |
Meksiko |
|
NC |
Nova Kaledonija |
|
NZ |
Novi Zeland |
|
PF |
Francuska Polinezija |
|
PM |
Sveti Petar i Mikelon |
|
RO |
Rumunjska |
|
RU |
Ruska federacija |
|
SG |
Singapur |
|
SH |
Sveta Helena |
|
TT |
Trinidad i Tobago |
|
TW |
Tajvan |
|
US |
Sjedinjene Američke Države (uključujući GU – Guam) |
|
VC |
Sveti Vincent i Grenadini |
|
VG |
Britanski Djevičanski Otoci |
|
VU |
Vanuatu |
|
WF |
Wallis i Futuna |
|
YT |
Mayotte” |
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
147 |
32006R1662
|
L 320/1 |
SLUŽBENI LIST EUROPSKE UNIJE |
06.11.2006. |
UREDBA KOMISIJE (EZ) br. 1662/2006
od 6. studenoga 2006.
o izmjeni Uredbe (EZ) br. 853/2004 Europskog parlamenta i Vijeća o utvrđivanju određenih higijenskih pravila za hranu životinjskog podrijetla
(Tekst značajan za EGP)
KOMISIJA EUROPSKIH ZAJEDNICA
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Uredbu (EZ) br. 853/2004 Europskog parlamenta i Vijeća od 29. travnja 2004. o utvrđivanju određenih higijenskih pravila za hranu životinjskog podrijetla (1), a posebno njezin članak 10. stavak 1.,
budući da:
|
(1) |
Sukladno odredbama Priloga III. Uredbi (EZ) br. 853/2004, subjekti u poslovanju s hranom trebali bi osigurati da svaki proizvod životinjskog podrijetla nosi identifikacijsku oznaku koja se koristi u skladu s odredbama iz odjeljka I. Priloga II. toj Uredbi. Proizvodi životinjskog podrijetla ne smiju nositi više od jedne identifikacijske oznake osim ako to nije izričito naznačeno i radi kontrole. |
|
(2) |
Odjeljkom I. Priloga III. Uredbi (EZ) br. 853/2004 utvrđuju se pravila za proizvodnju i stavljanje na tržište mesa domaćih papkara i kopitara. U točki 8. poglavlja IV. tog odjeljka navedene su iznimke od potpunog uklanjanja kože s trupa i ostalih dijelova tijela namijenjeni prehrani ljudi. Potrebno je proširiti te iznimke na njušku i usne goveda pod uvjetom da ispunjavaju iste uvjete koji se primjenjuju na glave ovaca i koza. |
|
(3) |
Krajnici služe kao filtar za sve štetne tvari koje ulaze u usnu šupljinu životinja te bi ih iz higijenskih i sigurnosnih razloga trebalo odstraniti tijekom klanja domaćih papkara i kopitara. Budući da je to uklanjanje bilo slučajno izostavljeno kao obvezno za domaće svinje, trebalo bi ponovno uvesti zahtjev za odstranjenje krajnika u svinja. |
|
(4) |
Odjeljkom VIII. Priloga III. Uredbi (EZ) br. 853/2004 utvrđuju se zahtjevi za proizvodnju i stavljanje na tržište proizvoda ribarstva namijenjeni prehrani ljudi. Riblje je ulje obuhvaćeno definicijom ribljih proizvoda. Stoga bi trebalo utvrditi posebne zahtjeve za proizvodnju i stavljanje na tržište ribljeg ulja za prehranu ljudi. Također je potrebno donijeti prijelazne odredbe kako bi se objekti u trećim zemljama mogli prilagoditi novonastalom stanju. |
|
(5) |
Kolostrum se smatra proizvodom životinjskog podrijetla, ali nije obuhvaćen definicijom sirovog mlijeka iz Priloga I. Uredbi (EZ) br. 853/2004. Kolostrum se proizvodi na sličan način, te se može smatrati da predstavlja istu opasnost za ljudsko zdravlje kao i sirovo mlijeko. Stoga je potrebno utvrditi posebna higijenska pravila za proizvodnju kolostruma. |
|
(6) |
Odjeljkom XV. Priloga III. Uredbi (EZ) br. 853/2004 utvrđuju se zahtjevi za proizvodnju kolagena. Posebno se navodi da se za proizvodnju kolagena mora primjenjivati postupak kojim se osigurava obrada sirovine pranjem, prilagodbom pH uporabom kiseline ili lužine, nakon čega slijedi jedno ili više ispiranja, filtracijom i ekstruzijom, ili odobrenim istovrijednim postupkom. Drugačiji postupak, pri kojemu nastaje hidrolizirani kolagen koji se ne može ekstrahirati, podnesen je EFSA-i na procjenu. EFSA je 26. siječnja 2005. donijela mišljenje o sigurnosti kolagena i o metodi obrade za proizvodnju kolagena. Zaključila je kako se gore spomenutim proizvodnim postupkom osigurava jednaka ili veća zdravstvena sigurnost kolagena namijenjenog prehrani ljudi u odnosu na sigurnost koja se postiže primjenom normi iz poglavlja XV. Stoga bi trebalo promijeniti uvjete proizvodnje kolagena. |
|
(7) |
Uredbu (EZ) br. 853/2004 trebalo bi izmijeniti na odgovarajući način. |
|
(8) |
Mjere predviđene ovom Uredbom u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU UREDBU:
Članak 1.
Uredba (EZ) br. 853/2004 mijenja se kako slijedi:
|
1. |
Prilog II. mijenja se u skladu s Prilogom I. ovoj Uredbi. |
|
2. |
Prilog III. mijenja se u skladu s Prilogom II. ovoj Uredbi. |
Članak 2.
Ova Uredba stupa na snagu sedmog dana od dana objave u Službenom listu Europske unije.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 6. studenoga 2006.
Za Komisiju
Markos KYPRIANOU
Član Komisije
(1) SL L 139, 30.4.2004., str. 55., kako je ispravljena u SL L 226, 25.6.2004., str. 22. Uredba kako je zadnje izmijenjena Uredbom Komisije (EZ) br. 2076/2005 (SL L 338, 22.12.2005., str. 83.).
PRILOG I.
Točka 2. odjeljka I. dijela A Priloga II. Uredbi (EZ) br. 853/2004 zamjenjuje se sljedećim:
|
„2. |
Međutim, ako se pakiranje i/ili ambalaža proizvoda uklone ili se proizvod dodatno prerađuje u drugome objektu, na proizvod je potrebno staviti novu oznaku. U tim slučajevima na novoj oznaci mora biti naveden broj odobrenja objekta u kojemu se obavljaju te radnje.” |
PRILOG II.
Prilog III. Uredbi (EZ) br. 853/2004 mijenja se kako slijedi:
|
1. |
Poglavlje IV. odjeljka I. mijenja se kako slijedi:
|
|
2. |
U odjeljku VIII. poglavlju III. dodaje se dio E kako slijedi: „E. ZAHTJEVI ZA RIBLJE ULJE ZA prehranu ljudi Subjekti u poslovanju s hranom dužni su osigurati da sirovine koje se koriste za pripremu ribljeg ulja za prehranu ljudi udovoljavaju sljedećim zahtjevima:
|
|
3. |
Odjeljak IX. zamjenjuje se sljedećim: „ODJELJAK IX.: SIROVO MLIJEKO, KOLOSTRUM, MLIJEČNI PROIZVODI I PROIZVODI NA OSNOVI KOLOSTRUMA Za potrebe ovog odjeljka,
POGLAVLJE I.: SIROVO MLIJEKO I KOLOSTRUM – PRIMARNA PROIZVODNJA Subjekti u poslovanju s hranom koji proizvode ili, ovisno o slučaju, prikupljaju sirovo mlijeko i kolostrum, dužni su osigurati ispunjenje zahtjeva iz ovog poglavlja. I. ZDRAVSTVENI UVJETI ZA PROIZVODNJU SIROVOG MLIJEKA I KOLOSTRUMA
II. HIGIJENSKI PROPISI ZA GOSPODARSTVA NA KOJIMA SE PROIZVODE MLIJEKO I KOLOSTRUM A. Zahtjevi za objekte i opremu
B. Higijenski propisi za mužnju, prikupljanje i prijevoz
C. Higijena osoblja
III. MJERILA ZA SIROVO MLIJEKO I KOLOSTRUM
POGLAVLJE II.: ZAHTJEVI ZA MLIJEČNE PROIZVODE I PROIZVODE NA OSNOVI KOLOSTRUMA I. ZAHTJEVI VEZANI UZ TEMPERATURU
II. ZAHTJEVI VEZANI UZ TOPLINSKU OBRADU
III. MJERILA ZA SIROVO KRAVLJE MLIJEKO
POGLAVLJE III.: AMBALAŽA I PAKIRANJE Zatvaranje ambalaže za potrošače obavlja se odmah nakon punjenja u objektu u kojemu je obavljena posljednja toplinska obrada tekućih mliječnih proizvoda i proizvoda na osnovi kolostruma, i to uređajima za zatvaranje kojima se sprječava kontaminacija. Sustav za zatvaranje mora biti izrađen na način da je nakon otvaranja ambalaže to lako prepoznatljivo i jednostavno za provjeru. POGLAVLJE IV.: OZNAČIVANJE PROIZVODA
POGLAVLJE V.: IDENTIFIKACIJSKE OZNAKE Odstupajući od zahtjeva iz Priloga II. odjeljka I.:
|
|
4. |
Točka 1. odjeljka XV. poglavlja III. zamjenjuje se sljedećim:
|
(1) Direktiva Vijeća 64/432/EEZ od 26. lipnja 1964. o zdravstvenim problemima životinja koji utječu na trgovinu govedima i svinjama unutar Zajednice (SL 121, 29.7.1964., str. 1977/64.). Direktiva kako je zadnje izmijenjena Uredbom (EZ) br. 21/2004 (SL L 5, 9.1.2004., str. 8.).
(2) Direktiva Vijeća 91/68/EEZ od 28. siječnja 1991. o veterinarsko-zdravstvenim uvjetima koji se primjenjuju na trgovinu ovcama i kozama unutar Zajednice (SL L 46, 19.2.1991., str. 19.). Direktiva kako je zadnje izmijenjena Odlukom Komisije 2005/932/EZ.
(3) SL L 123, 24.4.1998., str. 1. Direktiva kako je zadnje izmijenjena Direktivom Komisije 2006/50/EZ (SL L 142, 30.5.2006., str. 6.).
(4) Geometrijski prosjek u dvomjesečnome razdoblju s barem dva uzorka mjesečno.
(5) Geometrijski prosjek u tromjesečnome razdoblju s barem jednim uzorkom mjesečno, osim ako nadležno tijelo ne propiše drugu metodu kako bi se uzela u obzir sezonska odstupanja razine proizvodnje.
(6) Geometrijski prosjek u dvomjesečnome razdoblju s barem dva uzorka mjesečno.
(7) Geometrijski prosjek u dvomjesečnome razdoblju s barem dva uzorka mjesečno.
(8) Uredba Vijeća (EEZ) br. 2377/90 od 26. lipnja 1990. o utvrđivanju postupka Zajednice za određivanje najvećih dopuštenih količina rezidua veterinarsko-medicinskih proizvoda u hrani životinjskog podrijetla (SL L 224, 18.8.1990., str. 1.). Uredba kako je zadnje izmijenjena Uredbom Komisije (EZ) br. 1231/2006 (SL L 225, 17.8.2006., str. 3.).”
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
157 |
32006R1664
|
L 320/13 |
SLUŽBENI LIST EUROPSKE UNIJE |
06.11.2006. |
UREDBA KOMISIJE (EZ) br. 1664/2006
od 6. studenoga 2006.
o izmjeni Uredbe (EZ) br. 2074/2005 o provedbenim mjerama za određene proizvode životinjskog podrijetla namijenjene prehrani ljudi i o stavljanju izvan snage određenih provedbenih mjera
(Tekst značajan za EGP)
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Uredbu (EZ) br. 853/2004 Europskog parlamenta i Vijeća od 29. travnja 2004. o određivanju posebnih higijenskih pravila za hranu životinjskog podrijetla (1), a posebno njezine članke 9. i 11.,
uzimajući u obzir Uredbu (EZ) br. 854/2004 Europskog parlamenta i Vijeća od 29. travnja 2004. o određivanju posebnih pravila organizacije službenih kontrola proizvoda životinjskog podrijetla namijenjenih prehrani ljudi (2), a posebno njezin članak 16.,
uzimajući u obzir Uredbu (EZ) br. 882/2004 Europskog parlamenta i Vijeća od 29. travnja 2004. o službenim kontrolama koje se provode radi provjeravanja sukladnosti sa zakonima o hrani za životinje i hrani te propisima o zdravlju i dobrobiti životinja (3), a posebno njezin članak 11. stavak 4.,
budući da:
|
(1) |
Uredbom Komisije (EZ) br. 2074/2005 (4) određuju se provedbene mjere za uredbe (EZ) br. 853/2004, (EZ) br. 854/2004 i (EZ) br. 882/2004. |
|
(2) |
Prilogom VI. Uredbi (EZ) br. 2074/2005 određuje se obrazac zdravstvenih certifikata za uvoz određenih proizvoda životinjskog podrijetla namijenjenih prehrani ljudi. Ovi su certifikati napravljeni na način da budu usklađeni sa stručnim sustavom Traces koji je razvila Komisija radi praćenja svih kretanja životinja i proizvoda životinjskog podrijetla unutar područja Europske unije i iz trećih zemalja. Podaci u vezi s opisom roba nedavno su ažurirani. Postojeće obrasce zdravstvenih certifikata treba stoga na odgovarajući način izmijeniti. |
|
(3) |
Uredbama (EZ) br. 852/2004 Europskog parlamenta i Vijeća (5) i (EZ) br. 853/2004 određuju se pravila o proizvodnji proizvoda ribarstva, živih školjkaša i meda namijenjenih prehrani ljudi. Posebne uvjete za uvoz ovih proizvoda iz trećih zemalja, uključujući i obrasce zdravstvenih certifikata, treba odrediti Uredbom (EZ) br. 2074/2005. Postojeće Odluke o uvoznim potvrdama prema tome treba staviti izvan snage nakon razdoblja odgode kako bi se trećim zemljama omogućila prilagodba vlastitih zakonodavstava. |
|
(4) |
Primjereno je, također, pojednostavniti postupak izdavanja certifikata za proizvode ribarstva i žive školjkaše te uključiti uvjete izdavanja certificiranje zdravlja životinja za pošiljke namijenjene prehrani ljudi, navedene u Odluci Komisije 2003/804/EZ od 14. studenoga 2003. o određivanju uvjeta zdravlja životinja i zahtjeva za izdavanje certifikata za uvoz mekušaca, njihove ikre i gameta namijenjenih daljnjem uzgoju, tovu, ponovnom nasadu ili prehrani ljudi (6) te u Odluci Komisije 2003/858/EZ od 21. studenoga 2003. o određivanju uvjeta zdravlja životinja i zahtjeva za izdavanje certifikata za uvoz žive ribe, njihove ikre i gameta namijenjenih daljnjem uzgoju i žive ribe iz akvakulture i njenih proizvoda namijenjenih prehrani ljudi (7). |
|
(5) |
U skladu s člankom 11. stavkom 4. Uredbe (EZ) br. 882/2004 treba uspostaviti metode za analizu i testiranje mlijeka i mliječnih proizvoda. U ovom kontekstu, Referentni laboratorij Zajednice sastavio je popis ažuriranih referentnih metoda koji su odobrili nacionalni referentni laboratoriji tijekom svoga sastanka 2005. Stoga je u Uredbi (EZ) br. 2074/2005 potrebno uključiti posljednji dogovoreni popis referentnih metoda za analizu i testiranje koje treba koristiti za nadziranje udovoljavanja zahtjevima određenim Uredbom (EZ) br. 853/2004. Odluku Komisije 91/180/EEZ od 14. veljače 1991. o određivanju nekih metoda za analizu i ispitivanje sirovog i toplinski obrađenog mlijeka (8) stoga treba staviti izvan snage. Državama članicama treba odobriti odgodu primjene kako bi im se dalo vremena za usklađivanje s novim metodama. |
|
(6) |
Uredbom (EZ) br. 2074/2005 uspostavlja se analitička metoda za otkrivanje količine biotoksina koji izaziva paralizu (PSP) u jestivim dijelovima školjkaša (u cijelom tijelu ili u svakom jestivom dijelu zasebno). Takozvanu Lawrenceovu metodu, kako je od strane AOAC-a objavljena u Official Method 2005.06 (Paralytic Shellfish Poisoning Toxins in Shellfish), treba smatrati alternativnom metodom za otkrivanje PSP-a u školjkašima. Njezino korištenje treba preispitati u svjetlu analitičkog rada što ga trenutačno obavlja Referentni laboratorij Zajednice za morske biotoksine. |
|
(7) |
Uredbu (EZ) br. 2074/2005 trebalo bi stoga na odgovarajući način izmijeniti. |
|
(8) |
Mjere predviđene ovom Uredbom u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU UREDBU:
Članak 1.
Uredba (EZ) br. 2074/2005 mijenja se kako slijedi:
|
1. |
Članak 6 zamjenjuje se sljedećim: „Članak 6. Obrasci zdravstvenih certifikata za uvoz određenih proizvoda životinjskog podrijetla u smislu Uredbe (EZ) br. 853/2004 Obrasci zdravstvenih certifikata, kako su naznačeni u članku 6. stavku 1. točki (d) Uredbe (EZ) br. 853/2004, koje treba koristiti pri uvozu proizvoda životinjskog podrijetla popisanih Prilogom VI. ovoj Uredbi, određuju se u tom Prilogu VI.” |
|
2. |
Dodaje se sljedeći članak 6.a.: „Članak 6.a. Metode ispitivanja sirovog i toplinski obrađenog mlijeka Analitičkim metodama iz Priloga VI.a ovoj Uredbi koriste se nadležna tijela i, prema potrebi, subjekti iz poslovanja s hranom kako bi provjeravali udovoljavanje zahtjevima određenim u Prilogu III. odjeljku IX. poglavlju I. dijelu III. Uredbe (EZ) br. 853/2004 te osigurali odgovarajuću primjenu postupka pasterizacije mliječnih proizvoda navedenog u Prilogu III. odjeljku IX. poglavlju II. dijelu II. te Uredbe.” |
|
3. |
Prilog III. mijenja se u skladu s Prilogom I. ovoj Uredbi. |
|
4. |
Prilog VI. mijenja se u skladu s Prilogom II. ovoj Uredbi. |
|
5. |
Prilog VI.a dodaje se u skladu s Prilogom III. ovoj Uredbi. |
Članak 2.
Odluke popisane u Prilogu IV. ovoj Uredbi stavljaju se izvan snage s učinkom od 1. svibnja 2007.
Članak 3.
Ova Uredba stupa na snagu sedmog dana od objave u Službenom listu Europske unije.
Prilog III. ovoj Uredbi primjenjuje se najdulje šest mjeseci od stupanja na snagu ove Uredbe.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 6. studenoga 2006.
Za Komisiju
Markos KYPRIANOU
Član Komisije
(1) SL L 139, 30.4.2004., str. 55., ispravljeno u SL L 226, 25.6.2004., str. 22. Uredba kako je zadnje izmijenjena Uredbom Komisije (EZ) br. 2076/2005 (SL L 338, 22.12.2005., str. 83.).
(2) SL L 139, 30.4.2004., str. 206., ispravljeno u SL L 226, 25.6.2004., str. 83.
(3) SL L 165, 30.4.2004., str. 1., ispravljeno u SL L 191, 28.5.2004., str. 1. Uredba kako je zadnje izmijenjena Uredbom Komisije (EZ) br. 776/2006 (SL L 136, 24.5.2006., str. 3.).
(4) SL L 338, 22.12.2005., str. 27.
(5) SL L 139, 30.4.2004., str. 1., ispravljeno u SL L 226, 25.6.2004., str. 3.
(6) SL L 302, 20.11.2003., str. 22. Odluka kako zadnje izmijenjena Odlukom 2005/409/EZ (SL L 139, 2.6.2005., str. 16.).
(7) SL L 324, 11.12.2003., str. 37. Odluka kako je zadnje izmijenjena Odlukom 2006/680/EZ (SL L 279, 11.10.2006., str. 24.).
(8) SL L 93, 13.4.1991., str. 1.
PRILOG I.
Poglavlje I. Priloga III. Uredbi (EZ) br. 2074/2005 zamjenjuje se sljedećim:
„POGLAVLJE I.
METODA ZA OTKRIVANJE BIOTOKSINA KOJI IZAZIVA PARALIZU (PSP) U ŠKOLJKAŠIMA
|
1. |
Sadržaj biotoksina koji izaziva paralizu (PSP) u jestivim dijelovima školjkaša (u cijelom tijelu ili u svakom jestivom dijelu zasebno) mora se otkrivati u skladu s metodom biološkog testiranja ili bilo kojom drugom međunarodno priznatom metodom. Takozvana Lawrenceova metoda također se može koristiti kao alternativna metoda za otkrivanje tih toksina, kako je od strane AOAC-a objavljena u Official Method 2005.06 (Paralytic Shellfish Poisoning Toxins in Shellfish). |
|
2. |
Ako su rezultati upitni, referentna metoda mora biti biološka metoda. |
|
3. |
Točke 1. i 2. preispitat će Referentni laboratorij Zajednice za morske biotkosine nakon uspješno provedenog usklađivanja provedbenih mjera Lawrenceove metode.” |
PRILOG II.
Prilog VI. Uredbi (EZ) br. 2074/2005 zamjenjuje se sljedećim:
„PRILOG VI.
OBRAZAC ZDRAVSTVENIH CERTIFIKATA ZA UVOZ ODREĐENIH PROIZVODA ŽIVOTINJSKOG PODRIJETLA NAMIJENJENIH PREHRANI LJUDI
ODJELJAK I.
ŽABLJI KRACI I PUŽEVI
Zdravstveni certifikati za uvoz žabljih krakova i puževa, kako su navedene u članku 6. stavku 1. točki (d) Uredbe 853/2004, usklađuju se s obrascima određenim u dijelu A i dijelu B Dodatka I. ovom Prilogu.
ODJELJAK II.
ŽELATINA
Ne dovodeći u pitanje ostalo posebno zakonodavstvo Zajednice, posebno zakonodavstvo o transmisivnim spongiformnim encefalopatijama i hormonima, zdravstveni certifikati za uvoz želatine i sirovina za proizvodnju želatine, kako su navedene u članku 6. stavku 1. točki (d) Uredbe (EZ) br. 853/2004, usklađuju se s odgovarajućim obrascima određenim u dijelu A i dijelu B Dodatka II. ovom Prilogu.
ODJELJAK III.
KOLAGEN
Ne dovodeći u pitanje ostalo posebno zakonodavstvo Zajednice, posebno zakonodavstvo o transmisivnim spongiformnim encefalopatijama i hormonima, zdravstveni certifikati za uvoz kolagena i sirovina za proizvodnju kolagena, kako su navedene u članku 6. stavku 1. točki (d) Uredbe (EZ) br. 853/2004, usklađuju se s odgovarajućim obrascima određenim u dijelu A i dijelu B Dodatka III. ovom Prilogu.
ODJELJAK IV.
PROIZVODI RIBARSTVA
Zdravstveni certifikat za uvoz proizvoda ribarstva, kako je navedena u članku 6. stavku 1. točki (d) Uredbe (EZ) br. 853/2004, usklađuje se s obrascem određenim u Dodatku IV. ovom Prilogu.
ODJELJAK V.
ŽIVI ŠKOLJKAŠI
Zdravstveni certifikat za uvoz živih školjkaša, kako je navedena u članku 6. stavku 1. točki (d) Uredbe (EZ) br. 853/2004, usklađuje se s obrascem određenim u Dodatku V. ovom Prilogu.
ODJELJAK VI.
MED I DRUGI PČELARSKI PROIZVODI
Zdravstveni certifikat za uvoz meda i drugih pčelarskih proizvoda, kako je navedena u članku 6. stavku 1. točki (d) Uredbe (EZ) br. 853/2004, usklađuje se s obrascem određenim u Dodatku VI. ovom Prilogu.
Dodatak I. Prilogu VI.
DIO A
OBRAZAC ZDRAVSTVENOG CERTIFIKATA ZA UVOZ RASHLAĐENIH, SMRZNUTIH ILI PRIPREMLJENIH ŽABLJIH KRAKOVA NAMIJENJENIH PREHRANI LJUDI


DIO B
OBRAZAC ZDRAVSTVENOG CERTIFIKATA ZA UVOZ RASHLAĐENIH, SMRZNUTIH, OČIŠĆENIH, KUHANIH, PRIPREMLJENIH ILI KONZERVIRANIH PUŽEVA NAMIJENJENIH PREHRANI LJUDI


Dodatak II. Prilogu VI.
DIO A
OBRAZAC ZDRAVSTVENOG CERTIFIKATA ZA UVOZ ŽELATINE NAMIJENJENE PREHRANI LJUDI


DIO B
OBRAZAC ZDRAVSTVENOG CERITIFIKATA ZA UVOZ SIROVINA ZA PROIZVODNJU ŽELATINE NAMIJENJENE PREHRANI LJUDI


Dodatak III. Prilogu VI.
DIO A
OBRAZAC ZDRAVSTVENOG CERTIFIKATA ZA UVOZ KOLAGENA NAMIJENJENOG PREHRANI LJUDI


DIO B
OBRAZAC ZDRAVSTVENOG CERTIFIKATA ZA UVOZ SIROVINA ZA PROIZVODNJU KOLAGENA NAMIJENJENOG PREHRANI LJUDI


Dodatak IV. Prilogu VI.
OBRAZAC ZDRAVSTVENOG CERTIFIKATA ZA UVOZ PROIZVODA RIBARSTVA NAMIJENJENIH PREHRANI LJUDI



Dodatak V. Prilogu VI.
DIO A
OBRAZAC ZDRAVSTVENOG CERTIFIKATA ZA UVOZ ŽIVIH ŠKOLJKAŠA NAMIJENJENIH PREHRANI LJUDI



DIO B.
DODATNI OBRAZAC ZDRAVSTVENE POTVRDE ZA PRERAĐENE ŠKOLJKAŠE PRIPADNIKE VRSTE ACANTHOCARDIA TUBERCULATUM
Službeni inspektor ovime potvrđuje da su prerađeni školjkaši vrste Acanthocardia tuberculatum, ovjereni zdravstvenim certifikatom pod referentnim brojem: …
|
1. |
pobrani u proizvodnim područjima koje je nadležno tijelo jasno identificiralo, nadziralo i odobrilo u smislu Odluke Komisije 2006/766/EZ (1), gdje je razina PSP-a u jestivim dijelovima ovih školjkaša niža od 300 μg na 100 g; |
|
2. |
prevezeni izravno u objekt u kontejnerima ili vozilima koje je zapečatilo nadležno tijelo: … … (naziv i broj službenog odobrenja objekta koji je nadležno tijelo posebno ovlastilo za postupak njihove obrade); |
|
3. |
prevezeni u ovaj objekt uz prateći dokument koji je izdalo nadležno tijelo, kojim se odobrava prijevoz te potvrđuje priroda i količina proizvoda, područje podrijetla i odredišni objekt; |
|
4. |
podvrgnuti toplinskoj obradi prema Prilogu Odluci 96/77/EZ; |
|
5. |
ne sadrže razinu PSP-a koja bi se mogla otkriti biološkom metodom, kako je to i prikazano u priloženom analitičkom izvješću o ispitivanju provedenom na svakoj od partija sadržanih u pošiljci obuhvaćenoj ovom potvrdom. |
Službeni inspektor ovime potvrđuje da se nadležno tijelo uvjerilo kako se „vlastite zdravstvene” kontrole provedene u objektu iz točke 2. odnose na toplinsku obradu navedenu u točki 4.
Dolje potpisani službeni inspektor ovime izjavljuje da je on/ona upoznat(a) s odredbama Odluke 96/77/EZ te da priloženo analitičko izvješće odgovara ispitivanjima provedenim na proizvodima nakon prerade.
|
Službeni inspektor |
|
|
Ime (velikim tiskanim slovima): Datum: Pečat: |
Kvalifikacija i titula: Potpis: |
Dodatak VI. Prilogu VI.
OBRAZAC ZDRAVSTVENOG CERTIFIKATA ZA UVOZ MEDA I DRUGIH PČELARSKIH PROIZVODA NAMIJENJENIH PREHRANI LJUDI


(1) SL L 320, 18.11.2006., str. 53.
PRILOG III.
Uredbi (EZ) br. 2074/2005 se dodaje sljedeći Prilog VI.a o metodama ispitivanja sirovog i toplinski obrađenog mlijeka:
„PRILOG VI.a
METODE ISPITIVANJA SIROVOG I TOPLINSKI OBRAĐENOG MLIJEKA
POGLAVLJE I.
UTVRĐIVANJE BROJA MIKROORGANIZAMA I BROJA SOMATSKIH STANICA
|
1. |
Kod provjere prema kriterijima navedenim u Prilogu III. odjeljku IX. poglavlju I. dijelu III. Uredbe (EZ) br. 853/2004 primjenjuju se sljedeće norme kao referentne metode:
|
|
2. |
Primjena alternativnih analitičkih metoda je prihvatljiva:
|
POGLAVLJE II.
ODREĐIVANJE AKTIVNOSTI ALKALNE FOSFATAZE
|
1. |
Kod određivanja aktivnosti alkalne fosfataze primjenjuje se ISO norma 11816-1 kao referentna metoda. |
|
2. |
Aktivnost alkalne fosfataze izražava se u milijedinicama enzimske aktivnosti po litri (mU/l). Jedinica aktivnosti alkalne fosfataze je količina enzima alkalne fosfataze koji katalizira transformaciju 1 mikromola supstrata po minuti. |
|
3. |
Negativnim rezultatom testa na alkalnu fosfatazu smatra se izmjerena aktivnost u kravljem mlijeku ne veća od 350 mU/l. |
|
4. |
Primjena alternativnih analitičkih metoda je prihvatljiva kada su metode validirane prema referentnoj metodi navedenoj u točki 1. u skladu s međunarodno priznatim protokolima.” |
PRILOG IV.
|
1. |
Odluka Komisije 91/180/EEZ od 14. veljače 1991. o određivanju nekih metoda za analizu i ispitivanje sirovog i toplinski obrađenog mlijeka (1). |
|
2. |
Odluka Komisije 2000/20/EZ od 10. prosinca 1999. o uvođenju zdravstvenih certifikata za uvoz želatine namijenjene prehrani ljudi i za uvoz sirovina predviđenih za proizvodnju želatine namijenjene prehrani ljudi iz trećih zemalja (2). |
|
3. |
Odluke kojima se određuju uvjeti za uvoz proizvoda ribarstva:
|
|
4. |
Odluke kojima se određuju uvjeti za uvoz školjkaša, bodljikaša, plaštenjaka i morskih puževa:
|
(1) SL L 93, 13.4.1991., str. 1.
(2) SL L 6, 11.1.2000., str. 60.
(3) SL L 202, 12.8.1993., str. 31.
(4) SL L 202, 12.8.1993., str. 42.
(5) SL L 232, 15.9.1993., str. 37.
(6) SL L 232, 15.9.1993., str. 43.
(7) SL L 93, 12.4.1994., str. 26.
(8) SL L 93, 12.4.1994., str. 34.
(9) SL L 115, 6.5.1994., str. 38.
(10) SL L 145, 10.6.1994., str. 19.
(11) SL L 145, 10.6.1994., str. 23.
(12) SL L 145, 10.6.1994., str. 30.
(13) SL L 184, 20.7.1994., str. 16.
(14) SL L 305, 30.11.1994., str. 31.
(15) SL L 42, 24.2.1995., str. 32. kako je ispravljeno u SL L 48, 3.3.1995.
(16) SL L 70, 30.3.1995., str. 27.
(17) SL L 116, 23.5.1995., str. 41.
(18) SL L 123, 3.6.1995., str. 20.
(19) SL L 264, 7.11.1995., str. 37.
(20) SL L 304, 16.12.1995., str. 52.
(21) SL L 137, 8.6.1996., str. 24.
(22) SL L 137, 8.6.1996., str. 31.
(23) SL L 175, 13.7.1996., str. 27.
(24) SL L 269, 22.10.1996., str. 18.
(25) SL L 269, 22.10.1996., str. 23.
(26) SL L 269, 22.10.1996., str. 32.
(27) SL L 269, 22.10.1996., str. 37.
(28) SL L 35, 5.2.1997., str. 23.
(29) SL L 183, 11.7.1997., str. 21.
(30) SL L 307, 12.11.1997., str. 33.
(31) SL L 356, 31.12.1997., str. 57.
(32) SL L 46, 17.2.1998., str. 13.
(33) SL L 190, 4.7.1998., str. 59.
(34) SL L 190, 4.7.1998., str. 66.
(35) SL L 190, 4.7.1998., str. 71.
(36) SL L 190, 4.7.1998., str. 76.
(37) SL L 190, 4.7.1998., str. 81.
(38) SL L 277, 14.10.1998., str. 26. kako je ispravljeno u SL L 325, 3.12.1998.
(39) SL L 277, 14.10.1998., str. 36.
(40) SL L 277, 14.10.1998., str. 44.
(41) SL L 33, 8.12.1998., str. 9.
(42) SL L 91, 7.4.1999., str. 40.
(43) SL L 108, 27.4.1999., str. 52.
(44) SL L 203, 3.8.1999., str. 58.
(45) SL L 203, 3.8.1999., str. 63.
(46) SL L 203, 3.8.1999., str. 68.
(47) SL L 315, 9.12.1999., str. 39.
(48) SL L 26, 2.2.2000., str. 13.
(49) SL L 26, 2.2.2000., str. 26.
(50) SL L 280, 4.11.2000., str. 46.
(51) SL L 280, 4.11.2000., str. 52.
(52) SL L 280, 4.11.2000., str. 63.
(53) SL L 10, 13.1.2000., str. 59.
(54) SL L 221, 17.8.2001., str. 40.
(55) SL L 221, 17.8.2001., str. 45.
(56) SL L 221, 17.8.2001., str. 50.
(57) SL L 11, 15.1.2002., str. 25.
(58) SL L 11, 15.1.2002., str. 31.
(59) SL L 11, 15.1.2002., str. 36.
(60) SL L 163, 21.6.2002., str. 24.
(61) SL L 301, 5.11.2002., str. 1.
(62) SL L 301, 5.11.2002., str. 6.
(63) SL L 301, 5.11.2002., str. 11.
(64) SL L 301, 5.11.2002., str. 19.
(65) SL L 301, 5.11.2002., str. 24.
(66) SL L 301, 5.11.2002., str. 33.
(67) SL L 301, 5.11.2002., str. 38.
(68) SL L 301, 5.11.2002., str. 43.
(69) SL L 301, 5.11.2002., str. 48.
(70) SL L 110, 3.5.2003., str. 6.
(71) SL L 210, 20.8.2003., str. 25.
(72) SL L 210, 20.8.2003., str. 30.
(73) SL L 273, 24.10.2003., str. 18.
(74) SL L 273, 24.10.2003., str. 23.
(75) SL L 273, 24.10.2003., str. 28.
(76) SL L 273, 24.10.2003., str. 33.
(77) SL L 273, 24.10.2003., str. 38.
(78) SL L 8, 14.1.2004., str. 12.
(79) SL L 8, 14.1.2004., str. 17.
(80) SL L 8, 14.1.2004., str. 22.
(81) SL L 8, 14.1.2004., str. 27.
(82) SL L 113, 20.4.2004., str. 48.
(83) SL L 113, 20.4.2004., str. 54.
(84) SL L 28, 1.2.2005., str. 45.
(85) SL L 28, 1.2.2005., str. 54.
(86) SL L 28, 1.2.2005., str. 59.
(87) SL L 69, 16.3.2005., str. 50.
(88) SL L 183, 14.7.2005., str. 92.
(89) SL L 183, 14.7.2005., str. 99.
(90) SL L 183, 14.7.2005., str. 104.
(91) SL L 166, 8.7.1993., str. 40. Odluka kako je zadnje izmijenjena Odlukom 96/31/EZ.
(92) SL L 312, 6.12.1994., str. 35.
(93) SL L 264, 7.11.1995., str. 35. Odluka kako je zadnje izmijenjena Odlukom 2001/676/EZ.
(94) SL L 313, 3.12.1996., str. 38.
(95) SL L 183, 11.7.1997., str. 38.
(96) SL L 232, 23.8.1997., str. 9.
(97) SL L 277, 14.10.1998., str. 31. Odluka kako je zadnje izmijenjena Odlukom 2002/819/EZ.
(98) SL L 114, 13.5.2000., str. 42.
(99) SL L 10, 13.1.2001., str. 64.
(100) SL L 10, 12.1.2002., str. 73.
(101) SL L 163, 21.6.2002., str. 19.
(102) SL L 6, 10.1.2004., str. 53.
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
190 |
32006R1950
|
L 367/33 |
SLUŽBENI LIST EUROPSKE UNIJE |
13.12.2006. |
UREDBA KOMISIJE (EZ) br. 1950/2006
od 13. prosinca 2006.
o utvrđivanju lista tvari prijeko potrebnih za liječenje kopitara, sukladno Direktivi 2001/82/EZ Europskoga parlamenta i Vijeća o kodeksu Zajednice koji se odnosi na veterinarsko-medicinske proizvode
(Tekst značajan za EGP)
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Direktivu 2001/82/EZ Europskog parlamenta i Vijeća od 6. studenoga 2001. o kodeksu Zajednice koji se odnosi na veterinarsko-medicinske proizvode (1), a posebno njezin članak 10. stavak 3.,
budući da:
|
(1) |
Nijedan veterinarsko-medicinski proizvod ne smije biti stavljen na tržište države članice, osim ako nadležno tijelo te države članice, sukladno Direktivi 2001/82/EZ, odnosno Uredbi (EZ) br. 726/2004 Europskog parlamenta i Vijeća od 31. ožujka 2004. o utvrđivanju postupaka odobravanja primjene i postupaka nadzora nad primjenom lijekova koji se rabe u humanoj i veterinarskoj medicini, te uspostavlja Europsku agenciju za lijekove (2), nije izdalo dozvolu za stavljanje lijeka u promet. |
|
(2) |
Sukladno Uredbi Vijeća (EEZ) br. 2377/90 od 26. lipnja 1990. o utvrđivanju postupka Zajednice za određivanje najvećih dopuštenih količina rezidua veterinarsko-medicinskih proizvoda u hrani životinjskog podrijetla (3), primjena veterinarskih lijekova u životinja za proizvodnju hrane, uključujući tu i kopitare, može se odobriti samo pod uvjetima koji jamče da će proizvedeni prehrambeni proizvodi biti, što se tiče najvećih dopuštenih količina rezidua takvih lijekova u njima, posve neškodljivi za konzumente. |
|
(3) |
Iz razloga navedenih u Komunikaciji Komisije o „Dostupnosti veterinarsko-medicinskih proizvoda” (4), koje je Komisija uputila Vijeću i Europskom parlamentu, broj odobrenih veterinarsko-medicinskih proizvoda dostupnih na tržištu, posebno onih koji se primjenjuju u životinja za proizvodnju hrane, postupno opada. |
|
(4) |
Slijedom toga, potrebno je poduzeti mjere usmjerene na održivo povećanje broja dostupnih lijekova, kako bi se udovoljilo potrebama zdravstvene zaštite i dobrobiti životinja za proizvodnju hrane, kakve su one iz obitelji kopitara, pri čemu visoka razina zaštite konzumenata ne smije biti dovedena u pitanje. |
|
(5) |
Odstupajući od odredbi kako je predviđeno Direktivom 2001/82/EZ, u kopitara predviđenih za klanje u svrhu prehrane ljudi, terapijski se mogu primijeniti tvari prijeko potrebne za njihovo liječenje (u daljnjem tekstu: ‚prijeko potrebne tvari’), pri čemu je razdoblje karencije najmanje šest mjeseci. |
|
(6) |
U svrhu toga odstupanja nužno je uspostaviti listu prijeko potrebnih tvari. Određenu tvar treba uključiti u tu listu samo u iznimnim okolnostima, kada za tu terapijsku indikaciju nije odobren niti jedan drugi zadovoljavajući način liječenja, te kada bi bolesno stanje, ukoliko ga se ne liječi, životinji prouzročilo nepotrebnu patnju. |
|
(7) |
Specifična bolesna stanja ili zootehnološki zahvati, mogu iziskivati raspoloživost mogućnosti odabira ljekovitih tvari koje omogućuju udovoljavanje različitim zahtjevima vezanim uz starost kopitara i namjenu njihova uzgoja. |
|
(8) |
S obzirom da, sukladno Direktivi 2001/82/EZ-a, tvari nabrojene u prilozima I., II., odnosno III. Uredbi (EEZ) br. 2377/90, koje nisu odobrene kao sastavnice proizvoda namijenjenih uporabi u kopitara, u određenim okolnostima mogu biti primijenjene u liječenju istih, ove tvari ne smiju biti uključene u listu prijeko potrebnih tvari. Nadalje, u ovu listu ne smije biti uključena niti jedna tvar nabrojena u Prilogu IV. Uredbi (EEZ) br. 2377/90. Nadalje, uključivanje neke tvari u priloge I. do IV. Uredbi (EEZ) br. 2377/90, mora isključiti njezinu uporabu kao prijeko potrebne tvari u smislu ove Uredbe. |
|
(9) |
Nužno je pobrinuti se da se nad kopitarima liječenim prijeko potrebnim tvarima uspostavi odgovarajući nadzor. Stoga valja primijeniti kontrolne mehanizme predviđene Odlukom Komisije 93/623/EEZ od 20. listopada 1993. o identifikacijskom dokumentu (putovnici) koji prati registrirane kopitare (5), te Odlukom 2000/68/EZ od 22. prosinca 1999. kojom se izmjenjuje Odluka Komisije 93/623/EEZ, i utvrđuje potreba identifikacije kopitara predviđenih za uzgoj i proizvodnju (6), a sa svrhom očuvanja zdravlja konzumenta. |
|
(10) |
Nužno je pobrinuti se da bilo koja izmjena liste prijeko potrebnih tvari bude podložna usklađenom znanstvenom vrednovanju, koje će provesti Europska agencija za lijekove, osnovana Uredbom (EZ) br. 726/2004. Uz to, države članice i profesionalne veterinarske udruge koje su zatražile izmjenu ove liste, svoj zahtjev moraju primjereno potkrijepiti i dostaviti relevantne znanstvene podatke. |
|
(11) |
Mjere predviđene ovom Uredbom u skladu su s mišljenjem Stalnog odbora za veterinarsko-medicinske proizvode, |
DONIJELA JE OVU UREDBU:
Članak 1.
Lista tvari prijeko potrebnih za liječenje kopitara (u daljnjem tekstu: „prijeko potrebne tvari”), primjenjiva iznimno od odredaba članka 11. Direktive 2001/82/EZ, navedena je u Prilogu ovoj Uredbi.
Članak 2.
Prijeko potrebne tvari mogu se koristiti u liječenju specifičnih bolesnih stanja, u terapijske svrhe ili zootehničke potrebe navedene u Prilogu, samo u slučaju kada uporaba niti jednog lijeka odobrenog za primjenu u kopitara, ili navedenog u članku 11. Direktive 2001/82/EZ, ne bi urodila jednako zadovoljavajućim rezultatima u smislu uspješnog izlječenja životinje, sprečavanja njezine nepotrebne patnje, odnosno jamčenja sigurnosti osobama koje životinju liječe.
U svrhe navedene u prvom stavku, razmotrit će se alternativne terapijske opcije nabrojene u Prilogu.
Članak 3.
1. Prijeko potrebne tvari smiju se rabiti samo sukladno odredbama članka 10. stavka 1. Direktive 2001/82/EZ.
2. Pojedinosti o liječenju prijeko potrebnim tvarima valja zabilježiti sukladno napucima navedenima u IX. odlomku identifikacijskog dokumenta kopitara navedenog u odlukama 93/623/EZ i 2000/68/EZ.
Članak 4.
Svaka tvar uvrštena u neku od lista navedenih u prilozima I. do IV. Uredbi (EZ) br. 2377/90, odnosno tvar čija je primjena u kopitara zabranjena zakonodavstvom Zajednice, nadalje se, u smislu ove Uredbe, neće koristiti kao prijeko potrebna tvar.
Članak 5.
1. Europska agencija za lijekove će, na zahtjev Komisije, osigurati da Odbor za medicinske proizvode za veterinarsku uporabu provede znanstveno vrednovanje nacrta bilo koje izmjene i dopune liste navedene u Prilogu.
Unutar 210 dana od zaprimanja takvog zahtjeva, Europska agencija za lijekove će Komisiji dostaviti mišljenje od znanstvenoj primjerenosti predmetne izmjene.
Ako je potrebno pribavit će se i mišljenje Europske agencije za sigurnost hrane.
2. Kada države članice ili profesionalne veterinarske udruge od Komisije zatraže da izmijeni i dopuni listu navedenu u Prilogu, svoj će zahtjev primjereno potkrijepiti i u obrazloženje uključiti sve dostupne relevantne znanstvene podatke.
Članak 6.
Ova Uredba stupa na snagu trećeg dana nakon objave u Službenom listu Europske unije.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 13. prosinca 2006.
Za Komisiju
Günter VERHEUGEN
Potpredsjednik
(1) SL L 311, 28.11.2001., str. 1. Direktiva kako je zadnje izmijenjena Direktivom 2004/28/EZ (SL L 136, 30.4.2004., str. 58.).
(2) SL L 136, 30.4.2004., str. 1.
(3) SL L 224, 18.8.1990., str. 1. Uredba kako je zadnje izmijenjena Uredbom Komisije (EZ) br. 1451/2006 (SL L 271, 30.9.2006., str. 37.).
(4) COM(2000.) 806, final, 5.12.2000.
(5) SL L 298, 3.12.1993., str. 45.
(6) SL L 23, 28.1.2000., str. 72.
PRILOG
Lista tvari prijeko potrebnih za liječenje kopitara
Razdoblje karencije za svaku tvar na sljedećoj listi iznosi šest mjeseci.
|
Indikacija |
Djelatna tvar |
Opravdanost primjene i pojašnjenje uporabe |
||
|
Anestetici, analgetici i tvari primijenjene u sprezi s anestezijom |
||||
|
Acepromazin |
Svrha: premedikacija prije uvođenja u opću anesteziju, blaga sedacija. Ukazivanje na alternative: detomidin, romfidin, ksilazin, diazepam, midazolam. Rasprava o specifičnim prednostima: dosljedno se pokazuje da acepromazin smanjuje rizik od ugibanja anestezirane životinje. Način djelovanja (na limbički sustav) i jedinstvena kvaliteta sedacije, ne može se polučiti sedativima iz skupine alfa-2 agonista (detomidinom, romifidinom i ksilazinom), odnosno benzodiazepinima (diazepamom, midazolamom). |
||
|
Atipamezol |
Svrha: antagonist α-2 adrenoceptora, koji se koristi kao protuteža α-2 agonistima, odnosno poništava njihovo djelovanje. Ukazivanje na alternative: nisu poznate. Rasprava o specifičnim prednostima: samo za liječenje preosjetljivih primjeraka i slučajeva predoziranja. Lijek koji se koristi u urgentnim stanjima. Izričito se koristi u slučajevima depresije disanja. |
|||
|
Diazepam |
Svrha: premedikacija i uvođenje u anesteziju. Blago (benzodiazepinom polučeno) smirivanje životinje, popraćeno minimalnim nuspojavama od strane srčano-žilnog i dišnog sustava. Antikonvulziv, prijeko potreban u liječenju konvulzivnih napadaja. Ukazivanje na alternative: acepromazin, detomidin, romfidin, ksilazin, midazolam, primidon, fenitoin. Rasprava o specifičnim prednostima: prema suvremenim medicinskim standardima, ključna komponenta procedura uvođenja u anesteziju, uz znatna iskustva stečena primjenom na kopitarima. Uporabljen s ketaminom u fazi uvođenja u anesteziju, izaziva bazičnu opuštenost koja omogućuje neometano uvođenje u anesteziju i neometanu intubaciju. Način djelovanja (na razini receptora gama-aminobutirične kiseline ili tzv. GABA receptora), te postizanje jedinstvenog smirivanja životinje, pri kojem ne dolazi do depresije srčano-žilne funkcije, nije moguće postići sedativima iz skupine α-2 agonista (detomidinom, romifidinom i ksilazinom), odnosno acepromazinom. |
|||
|
Midazolam |
Svrha: premedikacija i uvođenje u anesteziju. Blago (benzodiazepinom polučeno) smirivanje životinje, popraćeno minimalnim nuspojavama od strane srčano-žilnog i dišnog sustava. Antikonvulziv, indiciran u liječenju konvulzivnih napadaja, napose u odraslih konja oboljelih od tetanusa. Ukazivanje na alternative: acepromazin, detomidin, romfidin, ksilazin, diazepam, primidon, fenitoin. Rasprava o specifičnim prednostima: djelovanje slično onome diazepama, ali je topiv u vodi, te stoga pogodan za primjenu u obliku intravenozne injekcije, a prijeko potreban pri primjeni u intravenoznoj infuziji, u kojoj ga se kombinira s anesteticima. Djeluje kraće od diazepama. U ždrjebadi pogodniji za uporabu od diazepama. Antikonvulziv, indiciran u liječenju konvulzivnih napadaja, napose u odraslih konja oboljelih od tetanusa – obzirom na njegovu topivost u vodi, za višednevno liječenje primjereniji od diazepama. Uporabljen s ketaminom u fazi uvođenja u anesteziju, izaziva bazičnu opuštenost koja omogućuje neometano anesteziranje i intubaciju. Način djelovanja (na razini GABA receptora), te postizanje jedinstvenog smirivanja životinje, pri kojem ne dolazi do depresije srčano-žilne funkcije, nije moguće postići sedativima iz skupine α-2 agonista (detomidinom, romifidinom i ksilazinom), odnosno acepromazinom. |
|||
|
Nalokson |
Svrha: protuotrov kod otrovanja opiodima, lijek koji se rabi u urgentnim stanjima. Ukazivanje na alternative: nisu poznate. Rasprava o specifičnim prednostima: raspoloživih alternativnih načina liječenja nema. |
|||
|
Propofol |
Svrha: anestetik za intravenoznu primjenu. Uvođenje ždrjebadi u anesteziju. Ukazivanje na alternative: inhalacijski anestetici kakvi su sevofluran, odnosno izofluran. Rasprava o specifičnim prednostima: anestetik koji se brzo izlučuje iz organizma, a moguće ga je primijeniti parenteralno. Nedavno podastrta izvješća pokazuju znatno veću stabilnost srčano-žilne funkcije anestezirane životinje, i bolju kvalitetu buđenja iz inhalacijske anestezije, kao i oporavka od nje. |
|||
|
Sarmazenil |
Svrha: antagonist benzodiazepina. Ukazivanje na alternative: flumazenil. Rasprava o specifičnim prednostima: posvemašnje poništenje učinka sedacije benzodiazepinom, do kojeg dolazi nakon infuzije sarmazenila date tijekom opće intravenozne anestezije. U odnosu na druge lijekove koje bi se moglo uključiti u listu prijeko potrebnih tvari, klinička iskustva stečena primjenom sarmazenila su najopsežnija. |
|||
|
Tiletamin |
Svrha: Disocijacijski anestetik sličan ketaminu, koji se napose koristi pri anesteziranju na terenu. Rabi ga se u kombinaciji sa zolazepamom. Ukazivanje na alternative: ketamin. Rasprava o specifičnim prednostima: Uporaba u kombinaciji sa zolazepamom, prijeko je potrebna ukoliko životinju nije moguće uvesti u inhalacijsku anesteziju, primjerice kod anesteziranja na terenu. Ovu kombinaciju anestetika prijeko je potrebno primijeniti i u slučajevima kada je kombinirana ketaminska anestezija prekratkog trajanja. Zahvati pri kojima je životinju uobičajeno anestezirati na ovdje opisani način, jesu kastracija, laringotomija, ogoljenje periosta, ekscizije cista ili kvrga, reparacija prijeloma kostiju lica, postavljanje sadrene imobilizacije i reparacija preponske kile. |
|||
|
Zolazepam |
Svrha: disocijativni anestetik sličan ketaminu, koji se napose koristi pri anesteziranju na terenu. Rabi ga se u kombinaciji s tiletaminom. Ukazivanje na alternative: ketamin. Rasprava o specifičnim prednostima: trankvilizator benzodiazepinskog reda, koji djeluje dulje od diazepama, odnosno midazolama. Tiletamin je prijeko potrebno primijeniti ukoliko životinju nije moguće uvesti u inhalacijsku anesteziju, primjerice kod anesteziranja na terenu. Ovu kombinaciju anestetika prijeko je potrebna i u slučajevima kada je kombinirana ketaminska anestezija prekratkog trajanja. Zahvati kod kojih je životinju uobičajeno anestezirati na ovdje opisani način, jesu kastracija, laringotomija, ogoljenje periosta, ekscizije cista ili kvrga, reparacija prijeloma kostiju lica, postavljanje sadrene imobilizacije i reparacija preponske kile. |
|||
|
Dobutamin |
Svrha: liječenje hipotenzije očitovane za trajanja anestezije. Ukazivanje na alternative: dopamin. Rasprava o specifičnim prednostima: terapija pozitivnog inotropnog učinka, vjerojatno korištena češće od dopamina, no preferencije se razlikuju. Hipotenzija očitovana za trajanja anestezije, uobičajena je u konja, pri čemu se pokazuje da održavanje normalnog krvnog tlaka smanjuje učestalost teške postoperativne rabdomiolize. Pri anesteziranju konja lako-hlapivim anesteticima, vrijednost dobutamina je neprocjenjiva. |
||
|
Dopamin |
Svrha: liječenje hipotenzije očitovane za trajanja anestezije. Ukazivanje na alternative: dobutamin. Rasprava o specifičnim prednostima: dopamin je nužno primijeniti u konja koji ne reagiraju na dobutamin. U ždrjebadi ga se koristi radije negoli dobutamin. Dodatnu indikaciju za njegovu uporabu predstavlja liječenje intraoperativnih bradiaritmija koje ne reagiraju na atropin. |
|||
|
Efedrin |
Svrha: liječenje hipotenzije očitovane za trajanja anestezije. Ukazivanje na alternative: dopamin, dobutamin. Rasprava o specifičnim prednostima: nužno ga je primijeniti u slučaju kada su dopamin i dobutamin nedjelotvorni. Jedinstveni simpatomimetik, strukturom sličan adrenalinu. U oboljelih kopitara, djelovanje kateholamina na specifične receptore u tijelu nemoguće je iskoristiti za postizanje pozitivnog terapijskog učinka, a da se pritom ne uporabi više lijekova ove klase, pri čemu svaki od njih djeluje na drugu vrst receptora. Stoga se efedrin, koji uzrokuje oslobađanje noradrenalina na završecima živaca, povećavajući time kontraktilnost miokarda i susljedno ublažavajući hipotenziju, koristi u slučajevima kada su dopamin i dobutamin nedjelotvorni. Djelovanje efedrina traje nekoliko minuta do nekoliko sati, a djelotvornost se postiže već jednokratnom intravenoznom injekcijom, dok djelovanje dobutamina i dopamina traje svega nekoliko sekundi ili minuta, te je potonje nužno davati u obliku infuzije. |
|||
|
Glikopirolat |
Svrha: sprečavanje bradikardije. Antikolinergik. Antikolinergici predstavljaju osnovu liječenja usmjerenog na sprečavanje parasimpatičkih učinaka kao što je bradikardija, te se stoga rutinski primjenjuju kao komponente anestezije u kojoj se vrše zahvati na oku i dišnim putovima. Ukazivanje na alternative: atropin. Rasprava o specifičnim prednostima: centralni učinak glikopirolata je ograničen, te ga je u konja pri svijesti (prije uvođenja u anesteziju i nakon buđenja iz nje), primjerenije uporabiti negoli atropin. |
|||
|
Noradrenalin (norepinefrin) |
Svrha: srčano-žilno zatajenje. Infuzija u svrhu liječenja srčano-žilnog zatajenja u ždrjebadi. Ukazivanje na alternative: nisu poznate. Rasprava o specifičnim prednostima: različite vrste kateholaminskih receptora, prisutne u tijelu životinje, precizno reagiraju na različite vrste lijekova koji djeluju na različitim sijelima. Stoga se za postizanje točno određenog terapijskog učinka koristi čitav niz kateholamina, koji, više ili manje isključivo, djeluju na različite adrenergičke receptore. Noradrenalin poglavito djeluje na alfa-1 receptore, uzrokujući vazokonstrikciju arteriola, a slijedom toga i povišenje krvnog tlaka, čime se održava središnji krvni optok. Noradrenalin je obično jedini kateholamin kojim se učinkovito liječi hipotenzivnu ždrjebad. |
|||
|
Buprenorfin |
Svrha: analgezija, koristi ga se u kombinaciji sa sedativima, kako bi se životinju sputalo. Ukazivanje na alternative: butorfanol, fentanil, morfij i petidin. Rasprava o specifičnim prednostima: opioidni analgetik koji djeluje kao djelomični μ-agonist. Poticanjem aktivnosti μ-receptora postiže se bolja analgezija negoli poticanjem aktivnosti κ-receptora opiodima koji djeluju kao njihovi agonisti, primjerice butorfanolom. Analgetik dugotrajnog djelovanja. Obzirom da je njegovo agonističko djelovanje samo djelomično, mogućnosti razvijanja ovisnosti i depresije disanja su ograničene. Indikacije za primjenu opioida dugotrajnog, odnosno kratkotrajnog djelovanja, međusobno se razlikuju, što nameće potrebu istodobne uporabe više lijekova ove farmakološke klase. |
||
|
Fentanil |
Svrha: analgezija. Ukazivanje na alternative: butorfanol, buprenorfin, morfij i petidin. Rasprava o specifičnim prednostima: opioid koji djeluje kao μ-agonist. Poticanjem aktivnosti μ-receptora postiže se bolja analgezija negoli poticanjem aktivnosti κ-receptora opiodima koji djeluju kao njihovi agonisti, primjerice butorfanolom. Zbog brzog metaboliziranja i izlučivanja iz organizma, djelovanje ovog lijeka je vrlo kratko. Fentanil je jedini opioid koji se rabi u konja, pogodan za infuzijsku primjenu i primjenu u obliku flastera koji se pričvršćuju na kožu. Iznimno učinkovito zbrinjava bol. |
|||
|
Morfij |
Svrha: analgezija. Ukazivanje na alternative: butorfanol, buprenorfin, petidin i fentanil. Rasprava o specifičnim prednostima: opioidni analgetik koji djeluje kao posvemašnji μ-agonist. Aktiviranjem μ-receptora postiže se najbolju analgeziju. Koristi ga se u kombinaciji sa sedativima, kako bi se životinju sapelo, te za uvođenje u epiduralnu anesteziju. Trajanje djelovanja je osrednje. Morfij je opiodni agonist μ-receptora, čija je topivost takva da ga čini najpogodnijim za epiduralnu primjenu. Njime se postiže dugotrajnu analgeziju, pri spomenutom načinu primjene popraćenu s tek nekoliko sistemskih učinaka. U suvremenoj veterinarskoj medicini, ovu tehniku široko se koristi u liječenju jake perioperativne, te kronične boli. |
|||
|
Petidin |
Svrha: analgezija. Ukazivanje na alternative: butorfanol, buprenorfin, morfij i fentanil. Rasprava o specifičnim prednostima: opiodni analgetik iz klase μ-agonista, koji djeluje oko 10 puta slabije od morfija. Opioid kratkotrajnog djelovanja, koji u konja dokazano učinkovito liječi spazmičku koliku. Jedini opioid sa spazmolitičkim djelovanjem. Njegovom primjenom u konja postiže se dublju sedaciju, a vjerojatnost očitovanja ekscitacijskih učinaka manja je negoli pri primjeni drugih opioida. |
|||
|
Atrakurij |
Svrha: opuštanje mišića za trajanja anestezije. Ukazivanje na alternative: guaifenezin. Rasprava o specifičnim prednostima: neuromuskularni blokator koji nema depolarizacijskih svojstava. Neuromuskularni blokatori napose se koriste tijekom zahvata na oku i dubokim abdominalnim strukturama. Njegov učinak potire se primjenom edrofonija. U odnosu na druge lijekove koje bi se moglo uključiti u listu prijeko potrebnih tvari, u prilog atrakurija i edrofonija govori najviše kliničkih podataka. |
||
|
Edrofonij |
Svrha: potiranje miorelaksacijskog učinka atrakurija. Ukazivanje na alternative: drugi inhibitori kolinesteraze. Rasprava o specifičnim prednostima: inhibitor kolinesteraze, prijeko potreban za potiranje neuromuskularne blokade. Od svih inhibitora kolinesteraze koji se primjenjuju u konja, edrofonij uzrokuje najmanje nuspojava. |
|||
|
Guaifenezin |
Svrha: opuštanje mišića za trajanja anestezije. Ukazivanje na alternative: atrakurij. Rasprava o specifičnim prednostima: ključna alternativa liječenju α-2 agensima/ketaminom u konja u kojih je primjena α-2 agensa i ketamina kontraindicirana, primjerice iz razloga što ne reagiraju na te agense, odnosno zato što su se pri ranijoj primjeni ovih lijekova očitovali neželjeni učinci. Od neprocjenjive vrijednosti u kombinaciji s ketaminom i α-2 agensima. Ovom kombinacijom lijekova poluči se iznimno neškodljivu anesteziju, za koju do danas nema učinkovitih intravenozno primjenjivih alternativa. |
|||
|
Sevofluran |
Svrha: inhalacijska anestezija konja koji su pretrpjeli prijelom nogu i druge ortopedske povrede, te uvođenje ždrjebadi u anesteziju putem maske. Ukazivanje na alternative: izofluran, halotan, enfluran. Rasprava o specifičnim prednostima: sevofluran je lako-hlapivi anestetik koji se sporo metabolizira, a brzo izlučuje. Kako je na području EU-e za izofluran propisana MRO, potonji zbog svojih značajki očitovanih tijekom buđenja iz anestezije nije pogodan za primjenu u svim slučajevima anesteziranja konja, jer zbog ekscitacijskih učinaka izoflurana u toj fazi, konj može slomiti nogu. Sevofluran je u konja prijeko potrebno primijeniti pri određenim kirurškim zahvatima koji iziskuju postupno i nesmetano buđenje iz anestezije, jer se pokazuje da se takvo, nesmetano i bolje kontrolirano buđenje, postiže upravo ovim lijekom. Stoga ga se kod konja koji su pretrpjeli prijelome nogu ili druge ortopedske ozljede, koristi radije negoli izofluran. Nadalje, sevofluran je prijeko potreban za uvođenje ždrjebadi u anesteziju putem maske, jer nema nikakvog nadražujućeg djelovanja, za razliku od izoflurana koji je nadražljivac, te stoga uzrokuje kašalj i zadržavanje daha. |
||
|
Bupivakain |
Svrha: lokalna anestezija. Ukazivanje na alternative: lidokain. Rasprava o specifičnim prednostima: lokalni anestetik dugotrajnog djelovanja. Dugotrajno djelovanje potrebno za postizanje perioperativne analgezije i liječenje kronične jake boli, kakva se javlja, primjerice, pri laminitisu. Bupivakain je lokalni anestetik dugotrajnijeg djelovanja od uobičajeno korištenog lidokaina. Monoterapija lidokainom osigurava po prilici jedan sat lokalne anesteziranosti. Dodavanjem adrenalina, učinak se može produljiti na dva sata, no ovo produljenje nosi rizik od prekida lokalnog krvnog optoka, te je stoga u nizu bolesnih stanja primjena ove kombinacije lijekova neprimjerena. Bupivakain osigurava četiri do šest sati lokalne anesteziranosti, te je stoga puno pogodniji za postizanje postoperativne analgezije i zbrinjavanje laminitisa, jer je za postizanje terapijskih učinaka često dostatna samo jedna injekcija; ovo je saznanje ključno s aspekta blagostanja životinje, jer je s tog aspekta primjerenije uporabiti ovaj lijek, negoli svakog sata opetovati injekcije lidokaina. Stoga pri gore navedenim indikacijama nije pogodno primijeniti lokalne anestetike kraćeg djelovanja, jer iziskuju učestale opetovane injekcije, s pratećim rizikom od neželjenih reakcija, a neprihvatljive su i s aspekta blagostanja liječene životinje. |
||
|
Oksibuprokain |
Svrha: lokalna anestezija koju se koristi pri okulističkim zahvatima. Ukazivanje na alternative: drugi lokalni anestetici koji se koriste pri okulističkim zahvatima, kakvi su ametokain, proksimetakain. Rasprava o specifičnim prednostima: u odnosu na druge lijekove koje bi se moglo uključiti u listu prijeko potrebnih tvari, klinička iskustva stečena primjenom oksibuprokaina su najbrojnija i najšira. |
|||
|
Prilokain |
Svrha: lokalna anestezija koja prethodi intravenoznoj kateterizaciji. Ukazivanje na alternative: nisu poznate. Rasprava o specifičnim prednostima: u specifičnim pripravcima (eutektička mješavina lokalnih anestetika predviđena za topičku primjenu na kožu, gdje se intradermalno apsorbira za 40 minuta. Koristi ju se za ubrzavanje i olakšavanje izvođenja intravenozne kateterizacije, posebno u ždrjebadi. |
|||
|
Lijekovi za liječenje srčano-žilnog sustava |
||||
|
|
Digoksin |
Svrha: liječenje zatajenja srca. Ukazivanje na alternative: nisu poznate. Rasprava o specifičnim prednostima: adjuvantna terapija digoksinom jedini je način liječenja nuspojava izazvanih kvinidinom. |
||
|
|
Kvinidin sulfat i kvinidin glukonat |
Svrha: liječenje srčanih aritmija. Ukazivanje na alternative: prokainamid, propanolol. Rasprava o specifičnim prednostima: anti-disritmik. Koristi ga se rijetko, no predstavlja važnu terapijsku opciju, različitog djelovanja za različite vrste aritmija. Lijek izbora za liječenje fibrilacije pretklijetke. |
||
|
|
Prokainamid |
Svrha: liječenje srčanih aritmija. Ukazivanje na alternative: kvinidin sulfat i kvinidin glukonat, propanolol. Rasprava o specifičnim prednostima: anti-disritmik. Koristi ga se rijetko, no predstavlja važnu terapijsku opciju, različitog djelovanja za različite vrste aritmija. |
||
|
|
Propanolol |
Svrha: liječenje srčanih aritmija. Ukazivanje na alternative: kvinidin sulfat i kvinidin glukonat, propanolol. Rasprava o specifičnim prednostima: antihipertenziv, koji se pri ovoj indikaciji koristi stoga što u izvjesnoj mjeri djeluje i kao antiaritmik. Koristi ga se rijetko, no predstavlja važnu terapijsku opciju. Slijedom činjenice da u podlozi aritmija leže različiti patofiziološki mehanizmi, prijeko je potrebno raspolagati nizom lijekova različitog načina djelovanja, kako bi se pojedino bolesno stanje moglo liječiti na odgovarajući način. Uporaba ovih lijekova obično je monoterapijska i jednokratna, te usmjerena na normalizaciju srčanog ritma, a opetovana primjena potrebna je tek u rijetkim prilikama. |
||
|
Konvulzije |
||||
|
|
Fenitoin |
Svrha: antikonvulziv koji se primjenjuje u ždrjebadi. Liječenje rabdomiolize. Liječenje mioklonusa stražnjih nogu konja, koji dovodi do njihova ukočenja u „stavu skoka”. Ukazivanje na alternative: diazepam, primidon, dantrolen natrij (za liječenje rabdomiolize). Rasprava o specifičnim prednostima: antikonvulziv od ključnog značaja za liječenje ždrjebadi. Općenito je pravilo da se fenitoin uvodi kao adjuvantnu terapiju usmjerenu na uspostavljanje kontrole nad konvulzivnim napadajima, u svim slučajevima kada se primidonom//fenobarbitalom ne poluči taj učinak. Fenitoin je blokator kalcijevih kanala, učinkovit u liječenju recidivirajućih oblika rabdomiolize. |
||
|
|
Primidon |
Svrha: antikonvulziv koji se primjenjuje u ždrjebadi. Ukazivanje na alternative: diazepam, fenitoin. Rasprava o specifičnim prednostima: liječenje primidonom indicirano je kao nastavak liječenja diazepamom, ili kao njegova alternativa. |
||
|
Lijekovi koji djeluju na želučano-crijevni trakt |
||||
|
|
Betanekol |
Svrha: liječenje ileusa, gastroduodenalne strikture očitovane u ždrjebadi, te recidivirajućih impakcija (blokada pasaže) tankog crijeva u odraslih životinja. Ukazivanje na alternative: neostigmin, metoklopramid, cisaprid, eritromicin i drugi prokinetici. Rasprava o specifičnim prednostima: betanekol je muskarinski kolinergički agonist koji stimulira receptore acetilkolina, smještene u glatkom mišićju želučano-crijevnog trakta, uzrokujući kontrakciju potonjih. Pokazalo se da ubrzava pražnjenje želuca i crijeva. I betanekol i metoklopramid pokazali su se djelotvornima u liječenju postoperativnog ileusa. |
||
|
Dioktil natrij sulfosukcinat |
Svrha: liječenje impakcija. Ukazivanje na alternative: mineralno ulje. Rasprava o specifičnim prednostima: ovim lijekom postiže se učinkovitije smekšavanje crijevnog sadržaja negoli primjenom mineralnog ulja, i to stoga što ovaj lijek potencira prodiranje vode u impaktiranu fekalnu masu. |
|||
|
Metoklopramid |
Svrha: liječenje postoperativnog ileusa. Ukazivanje na alternative: betanekol, neostigmin, cisaprid, eritromicin i drugi prokinetici. Rasprava o specifičnim prednostima: Metoklopramid je supstituirani benzamid koji ima nekoliko mehanizama djelovanja: (1) on je antagonist receptora dopamina; (2) pojačava oslobađanje acetilkolina iz intrinzičkih kolinergičkih neurona i (3) blokira adrenergičku aktivnost. Učinkovit je u obnavljanju postoperativne želučano-crijevne koordinacije, i smanjuje ukupni volumen, brzinu i trajanje želučanog refluksa. Metaklopramid je prokinetik, čije je djelovanje izraženije u gornjem dijelu želučano-crijevnog trakta I betanekol i metoklopramid pokazali su se djelotvornima u liječenju postoperativnog ileusa. |
|||
|
Propantelin bromid |
Svrha: anti-peristaltik. Ukazivanje na alternative: atropin, lidokain primijenjen intrarektalno u obliku klizme. Rasprava o specifičnim prednostima: propantelin bromid je sintetički kvarterni amonijak, koji djeluje kao antikolinergik inhibirajući motilitet želučano-crijevnog trakta, te grčenje njegove muskulature, čime smanjuje lučenje želučane kiseline. Inhibira i djelovanje acetilkolina na postganglijske završetke živaca parasimpatičkog živčanog sustava. Njegovi učinci slični su onima atropina, ali dugotrajniji (šest sati). Propantelin bromid je važna terapijska opcija, kojom se postiže usporavanje peristaltike, bilo zato da se prilikom rektalne palpacije izbjegne rupturu završnog crijeva, bilo zato da se eksplorira i liječi moguću rupturu toga crijeva u životinja u kojih se klizmom lidokaina ne uspijeva postići zadovoljavajući učinak. |
|||
|
Rabdomioliza |
||||
|
|
Dantrolen natrij |
Svrha: liječenje rabdomiolize. Liječenje maligne hipertermije očitovane za trajanja anestezije. Ukazivanje na alternative: fenitoin. Rasprava o specifičnim prednostima: dantrolen djeluje kao miorelaksans, i to izravnim djelovanjem na mišić, obzirom da oslobađa kalcij iz sarkoplazmatskog retikuluma i time uzrokuje razdvajanje ekscitativno-kontraktilnih mikrofilamenata (aktin-miozin). I fenitoin i dantrolen natrij pokazali su se korisnima u liječenju recidivirajućih oblika rabdomiolize. |
||
|
Antimikrobni lijekovi |
||||
|
Tikarcilin |
Svrha: liječenje infekcija uzrokovanih bakterijama iz roda Klebsiella. Ukazivanje na alternative: nisu poznate. Rasprava o specifičnim prednostima: Antibiotik kojim se ciljano liječe upravo infekcije uzrokovane bakterijama iz roda Klebsiella. |
||
|
Azitromicin |
Svrha: liječenje infekcija uzrokovanih bakterijom Rhodococcus equi. Ukazivanje na alternative: eritromicin. Rasprava o specifičnim prednostima: standardni način liječenja u kombinaciji s rifampicinom, ždrjebad ga podnosi bolje negoli eritromicin. |
||
|
Rifampicin |
Svrha: liječenje infekcija uzrokovanih bakterijom Rhodococcus equi. Ukazivanje na alternative: nisu poznate. Rasprava o specifičnim prednostima: liječenje infekcija uzrokovanih bakterijom Rhodococcus equi, primjenjuje se u kombinaciji s eritromicinom ili azitromicinom. Lijek izbora. |
|||
|
Amikacin |
Svrha: liječenje septičkog oblika artritisa. Ukazivanje na alternative: gentamicin ili drugi aminoglikozidi. Rasprava o specifičnim prednostima: ždrjebad ga podnosi bolje negoli gentamicin ili druge aminoglikozide. |
||
|
Lijekovi kojima se liječe bolesti dišnih putova |
||||
|
|
Ambroksol |
Svrha: poticanje lučenja surfaktanta u prerano oždrjebljenog ždrjebeta. Ukazivanje na alternative: nisu poznate. Rasprava o specifičnim prednostima: raspoloživih alternativnih načina liječenja nema. |
||
|
Ipratropij bromid |
Svrha: bronhodilatacija. Ukazivanje na alternative: nisu poznate. Rasprava o specifičnim prednostima: antikolinergičko djelovanje. Terapijska opcija kojoj je ponekad nužno pribjeći, jer zna biti učinkovitija od β-agonista. |
|||
|
Oksimetazolin |
Svrha: liječenje edema nosne sluznice. Ukazivanje na alternative: fenilefrin. Rasprava o specifičnim prednostima: agonist α-adrenoceptora izrazitih vazokonstrikcijskih svojstava, kojeg se uvodi radije negoli fenilefrin, jer mu je djelovanje dugotrajnije. |
|||
|
Antiprotozoici |
||||
|
|
Izometamidij |
Svrha: liječenje mijeloencefalitisa kopitara, uzrokovanog protozoama. Ukazivanje na alternative: pirimetamin. Rasprava o specifičnim prednostima: bolest je ponekad refraktorna (ne reagira) na terapiju pirimetaminom, te je stoga nužno raspolagati alternativnom terapijskom opcijom. |
||
|
|
Pirimetamin |
Svrha: liječenje mijeloencefalitisa kopitara, uzrokovanog protozoama. Ukazivanje na alternative: izometamidij. Rasprava o specifičnim prednostima: uporabi li ga se u sprezi sa sulfadiazinom-sulfonamidom, liječenje je uspješno u barem 75 % slučajeva |
||
|
Oftalmološki lijekovi |
||||
|
Aciklovir |
Svrha: liječenje ulkusa očiju (antiviralni lijek). Topička primjena. Ukazivanje na alternative: idoksiuridin. Rasprava o specifičnim prednostima: i aciklovir i idoksiuridin pokazali su se jednako učinkovitima u liječenju ulcerativnog herpetičkog keratitisa. |
||
|
Idoksiuridin |
Svrha: liječenje ulkusa očiju (antiviralni lijek). Topička primjena. Ukazivanje na alternative: aciklovir. Rasprava o specifičnim prednostima: i aciklovir i idoksiuridin pokazali su se jednako učinkovitima u liječenju ulcerativnog herpetičkog keratitisa. |
|||
|
Fenilefrin |
Svrha: liječenje glaukoma, epifore, edema nosne sluznice i uklještenja u području slezene. Ukazivanje na alternative: tropikamid (za glaukom), druge nisu poznate. Rasprava o specifičnim prednostima: i fenilepinefrin i tropikamid pokazali su se jednako učinkovitima u liječenju glaukoma. |
||
|
Tropikamid |
Svrha: liječenje glaukoma. Topička primjena. Ukazivanje na alternative: fenilefrin. Rasprava o specifičnim prednostima: i fenilefrin i tropikamid pokazali su se jednako učinkovitima u liječenju glaukoma. |
|||
|
Dorzolamid |
Svrha: liječenje glaukoma. Topička primjena. Ukazivanje na alternative: latanoprost, timolol maleat. Rasprava o specifičnim prednostima: njegov specifični način djelovanja u smislu inhibicije ugljične anhidraze. Važna terapijska opcija. |
|||
|
Latanoprost |
Svrha: liječenje glaukoma. Topička primjena. Ukazivanje na alternative: dorzolamid, timolol maleat. Rasprava o specifičnim prednostima: njegov specifični način djelovanja u smislu analoga prostaglandina F2α. Važna terapijska opcija. |
|||
|
Timolol maleat |
Svrha: liječenje glaukoma. Topička primjena. Ukazivanje na alternative: dorzolamid, latanoprost Rasprava o specifičnim prednostima: njegov specifični način djelovanja u smislu neselektivnog blokiranja beta-adrenergičkih receptora, uzrokuje vazokonstrikciju koja potom dovodi do smanjenja stvaranja očne vodice. Važna terapijska opcija. |
|||
|
Ciklosporin A |
Svrha: imunosupresiv koji se koristi u liječenju autoimunih bolesti oka. Ukazivanje na alternative: nisu poznate. Rasprava o specifičnim prednostima: raspoloživih alternativnih načina liječenja nema. |
|||
|
Ketorolak |
Svrha: liječenje boli u području oka i upale oka, nesteroidni antireumatik, kapi za oči, topička primjena. Ukazivanje na alternative: nisu poznate. Rasprava o specifičnim prednostima: u odnosu na druge lijekove koje bi se moglo uključiti u listu prijeko potrebnih tvari, klinička iskustva stečena primjenom ketorolaka su najopsežnija. |
|||
|
Ofloksacin |
Svrha: liječenje infekcija oka otpornih na uobičajeno korištene antibiotike. Ukazivanje na alternative: ciprofloksacin, cefamandol, uobičajeni režimi liječenja antibioticima Rasprava o specifičnim prednostima: u odnosu na druge lijekove koje bi se moglo uključiti u listu prijeko potrebnih tvari, klinička iskustva stečena primjenom ofloksacina su najopsežnija. U odnosu na uobičajene režime liječenja antibioticima, ofloksacin bi trebalo koristiti samo kao rezervnu opciju u pojedinačnim rezistentnim slučajevima. |
|||
|
Fluorescein |
Svrha: sredstvo za postavljanje dijagnoze ulceracije rožnice, topička primjena. Ukazivanje na alternative: Rose Bengal test (aglutinacija antigena u puferu). Rasprava o specifičnim prednostima: Rose Bengal test iskazuje izvjesnu antivirusnu aktivnost, dok fluorescein nema značajnog učinka na replikaciju virusa. Stoga dijagnostička primjena Rose Bengal testa koja prethodi kultivaciji virusa, može ishoditi lažno-negativnim rezultatom. Stoga, planira li se pristupiti kultivaciji virusa, fluorescein predstavlja dijagnostičko sredstvo izbora. |
|||
|
Rose Bengal |
Svrha: sredstvo za dijagnostiku početnog oštećenja rožnice, topička primjena. Ukazivanje na alternative: fluorescein. Rasprava o specifičnim prednostima: Rose Bengal je sredstvo izbora za dijagnostiku samih početaka oštećenja rožnice. |
|||
|
Hidroksipropil metilceluloza |
Svrha: zaštita rožnice, topička primjena. Ukazivanje na alternative: nisu poznate. Rasprava o specifičnim prednostima: raspoloživih alternativnih metoda nema. |
|||
|
Hiperlipermija |
||||
|
|
Inzulin |
Svrha: liječenje hiperlipemije, koristi ga se u kombinaciji s hipoglikemicima, dijagnostičko sredstvo za dokazivanje metaboličkih poremećaja. Ukazivanje na alternative: nisu poznate. Rasprava o specifičnim prednostima: raspoloživih alternativnih načina liječenja nema. |
||
|
Gljivične infekcije |
||||
|
|
Grizeofulvin |
Svrha: antimikotik sistemskog djelovanja. Liječenje lišajeva kože. Ukazivanje na alternative: nisu poznate. Rasprava o specifičnim prednostima: peroralno primijenjeni griseofulvin učinkovito djeluje na trihofiton, mikrosporum i epidermofiton. |
||
|
Ketokonazol |
Svrha: antimikotik sistemskog djelovanja. Liječenje gljivične pneumonije i mikoze ždrijelne vreće. Ukazivanje na alternative: drugi azoli, kakav je itrakonazol. Rasprava o specifičnim prednostima: u odnosu na druge lijekove koje bi se moglo uključiti u listu prijeko potrebnih tvari, klinička iskustva stečena primjenom ketokonazola su najopsežnija. |
|||
|
Mikonazol |
Svrha: liječenje mikoza oka. Ukazivanje na alternative: nisu poznate. Rasprava o specifičnim prednostima: topička primjena na oboljelom oku, antimikotičko djelovanje šireg spektra i/ili uz manji nadražaj negoli pri primjeni drugih antimikotika. |
|||
|
Nistatin |
Svrha: liječenje gljivičnih infekcija očiju i genitalnog trakta. Ukazivanje na alternative: nisu poznate. Rasprava o specifičnim prednostima: napose djelotvoran protiv gljivičnih infekcija. |
|||
|
Mješovito |
||||
|
|
Hondroitin sulfat |
Svrha: cijeljenje hrskavice. Zaštita hrskavice (hondroprotekcija). Liječenje artritisa. Ukazivanje na alternative: nisu poznate. Rasprava o specifičnim prednostima: poboljšanje kliničke slike vjerojatno se može pripisati protuupalnim učincima lijeka, koji uključuju i inhibiciju sinteze PGE2 i inhibiciju otpuštanja citokina. |
||
|
Domperidon |
Svrha: agalaktija u kobila. Ukazivanje na alternative: nisu poznate. Rasprava o specifičnim prednostima: djeluje kao antagonist dopamina, te pospješuje stvaranje prolaktina. Oksitocin ne predstavlja primjerenu alternativu, jer smanjuje proizvodnju mlijeka, za razliku od domperidona, čija je primjena upravo i usmjerena na povećanje njegove proizvodnje. Uz to, oksitocin primijenjen u visokim dozama, vjerojatno će uzrokovati bol u trbuhu. |
|||
|
Hidroksietil škrob |
Svrha: koloidna otopina indicirana u slučaju hipovolemije. Ukazivanje na alternative: nisu poznate. Rasprava o specifičnim prednostima: praktična i neposredno primjenjiva zamjena za krv ili plazmu. |
|||
|
Imipramin |
Svrha: farmakološki izazvana ejakulacija u pastuha koji imaju poremećaj iste. Ukazivanje na alternative: nisu poznate. Rasprava o specifičnim prednostima: raspoloživih alternativnih načina liječenja nema. |
|||
|
|
Hormon koji pospješuje otpuštanje tirotropina |
Svrha: dijagnostičko sredstvo kojim se potvrđuje postojanje bolesti štitnjače i hipofize. Ukazivanje na alternative: nisu poznate. Rasprava o specifičnim prednostima: raspoloživih alternativnih metoda nema. |
||
|
Barijev sulfat |
Svrha: radiografsko kontrastno sredstvo, koje se koristi za kontrastne pretrage jednjaka i želučano-crijevnog trakta. Ukazivanje na alternative: nisu poznate. Rasprava o specifičnim prednostima: raspoloživih alternativnih metoda nema. |
|||
|
Ioheksol |
Svrha: radiografsko kontrastno sredstvo, koje se rabi za kontrastni prikaz donjeg dijela mokraćnog sustava, artrografiju, mijelografiju, sino- ili fistulografiju, te dakriocistografiju. Ukazivanje na alternative: iopamidol. Rasprava o specifičnim prednostima: neionizirano kontrastno sredstvo niske osmolarnosti. I ioheksol i iopamidol jednako su prihvatljive opcije. |
|||
|
Iopamidol |
Svrha: radiografsko kontrastno sredstvo, koje se rabi za kontrastni prikaz donjeg dijela mokraćnog sustava, artrografiju, mijelografiju, sino- ili fistulografiju, te dakriocistografiju. Ukazivanje na alternative: ioheksol. Rasprava o specifičnim prednostima: neionizirano kontrastno sredstvo niske osmolarnosti, koje se koristi pri navedenim indikacijama. I ioheksol i iopamidol jednako su prihvatljive opcije. |
|||
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
203 |
32007D0142
|
L 062/27 |
SLUŽBENI LIST EUROPSKE UNIJE |
28.02.2007. |
ODLUKA KOMISIJE
od 28. veljače 2007.
o osnivanju veterinarske skupine Zajednice za izvanredne događaje koja pomaže Komisiji u podupiranju država članica i trećih zemalja u veterinarskim predmetima u pogledu određenih bolesti životinja
(2007/142/EZ)
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
budući da:
|
(1) |
U slučaju izbijanja određenih bolesti životinja ili sumnje na bolest, Komisija je dužna pružiti pomoć državama članicama i trećim zemljama putem veterinarsko-epidemiološke ekspertize velikog iskustva. Postavljeno je i pitanje dostupnosti veterinarske ekspertize u kontekstu Vijeća za poljoprivredu i ribarstvo. |
|
(2) |
Brza dostupnost pouzdane tehničke ekspertize u području veterinarstva nužna je kako bi Komisija bila u mogućnosti ispuniti svoje zadaće, posebno u slučaju većih izbijanja tih bolesti životinja. |
|
(3) |
Ekspertiza i podrška učinkovitije su osigurane pomoću specijalizirane stručne skupine, poput veterinarske skupine Zajednice za izvanredne događaje, čiji se članovi stavljaju na raspolaganje Komisiji na zahtjev. Takva se skupina treba uspostaviti, a njezina uloga i zadaće definirati. |
|
(4) |
Kako bi veterinarska skupina Zajednice za izvanredne događaje bila u mogućnosti Komisiji osigurati potrebnu veterinarsku tehničku pomoć, njezini se članovi mogu slati u dotične države članice ili treće zemlje. U tom slučaju članovi djeluju u suradnji s nadležnim tijelima dotične države članice ili treće zemlje. |
|
(5) |
Veterinarska skupina Zajednice za izvanredne događaje treba djelovati, prema potrebi, u bliskoj suradnji s ostalim skupinama međunarodnih stručnjaka, poput Europskog centra za prevenciju i kontrolu bolesti (ECDC), Svjetske organizacije za zdravlje životinja (OIE), Organizacije za hranu i poljoprivredu (FAO) i Svjetske zdravstvene organizacije (WHO) kako bi osigurali da se dostupna ekspertiza koristi na najučinkovitiji mogući način, |
ODLUČILA JE:
Članak 1.
1. Veterinarska skupina Zajednice za izvanredne događaje sastavljena od stručnjaka osnovana je u svrhu veterinarske tehničke pomoći pri kontrolnim mjerama koje se odnose na bolesti podložne obveznom prijavljivanju navedene u Prilogu I. Direktivi Vijeća 82/894/EEZ (1) (bolesti).
2. Članovi skupine imenuju se iz redova stručnjaka iz područja veterinarske epidemiologije, virologije, divljači, upravljanja programima iskorjenjivanja, laboratorijske dijagnostike, organizacije veterinarskih usluga i regulatornog okvira, obavješćivanja o riziku, upravljanja i bilo kojeg drugog relevantnog područja za kontrolu bolesti životinja.
Članak 2.
1. Skupina pomaže Komisiji u tehničkim veterinarskim predmetima koji se odnose na kontrolne mjere za bolesti životinja koje je potrebno poduzeti u slučaju izbijanja bolesti ili sumnje na bolest.
Takva pomoć posebno uključuje:
|
(a) |
znanstvenu, tehničku i upravljačku pomoć na licu mjesta koja se odnosi na nadzor, sustavno praćenje, kontrolu i iskorjenjivanje bolesti, u bliskoj suradnji s nadležnim tijelima dotične države članice ili treće zemlje, zabrinute radi izbijanja bolesti ili sumnje na bolest; |
|
(b) |
posebna znanstvena mišljenja o primjerenim dijagnostičkim metodama i epidemiološkim ispitivanjima u koordinaciji s nadležnim Referentnim laboratorijem Zajednice kako je navedeno u Prilogu VII. Uredbi (EZ) br. 882/2004 Europskog Parlamenta i Vijeća (2) i s drugim referentnim laboratorijima, prema potrebi; |
|
(c) |
specifičnu pomoć radi osiguravanja koordinacije među veterinarskim službama država članica i trećih zemalja i s nadležnim Referentnim laboratorijem Zajednice kako je navedeno u Prilogu VII. Uredbi (EZ) br. 882/2004 i s drugim referentnim laboratorijima, prema potrebi. |
2. Komisija može objaviti na svojoj internetskoj stranici sažetak izvješća o aktivnostima skupine i bilo koji zaključak ili radni dokument aktivnosti skupine.
Članak 3.
1. Svake godine najkasnije 1. lipnja, a prvi put najkasnije 30 dana od dana objave ove Odluke u Službenom listu Europske unije, države članice Komisiji podnose popis stručnjaka koje predlažu za članove skupine za sljedeću kalendarsku godinu.
Tom prilikom države članice dostavljaju sve primjerene informacije o profesionalnom profilu i polju ekspertize za svakog predloženog stručnjaka.
2. Članove skupine imenuje Komisija između stručnjaka koje su predložile države članice.
Svake godine najkasnije 1. studenoga Komisija izvješćuje države članice u okviru Stalnog odbora za prehrambeni lanac i zdravlje životinja o ažuriranom popisu članova skupine.
Komisija na svojoj internetskoj stranici objavljuje taj ažurirani popis.
Imena članova se prikupljaju, obrađuju i objavljuju u skladu s Uredbom (EZ) br. 45/2001 Europskog parlamenta i Vijeća (3).
Članovi koji više nisu u mogućnosti učinkovito doprinositi aktivnostima skupine ili koji podnesu ostavku ili ne poštuju pravila određena člankom 4. ove Odluke ili člankom 287. Ugovora o osnivanju Europske zajednice, mogu se zamijeniti drugim članovima.
Članak 4.
Djelovanje skupine usklađuje se s poslovnikom koji donose službe Komisije na temelju standardnih pravila o postupanju za skupine stručnjaka.
Poslovnik se objavljuje na internetskoj stranici Komisije.
Članak 5.
Članovi radne skupine:
|
(a) |
su na zahtjev Komisije u kratkom roku i u bilo kojem trenutku dostupni; |
|
(b) |
ne odaju podatke do kojih su došli tijekom rada u skupini, ako su obaviješteni da su navedeni podaci povjerljivi. |
Članak 6.
Članovi skupine imaju pravo na naknadu za svoje sudjelovanje u aktivnostima skupine na licu mjesta i za služenje u svojstvu predvodnika skupine ili izvjestitelja o pitanju posebne misije, kako je predviđeno u Prilogu ovoj Odluci.
Nadoknadu putnih troškova i dnevnica isplaćuje Komisija u skladu s pravilima nadoknade putnih troškova i dnevnica te drugih troškova za vanjske stručnjake u „Odsjeku za stručnjake”, Uredu za administraciju i namirenje pojedinačnih prava Europske komisije.
Sastavljeno u Bruxellesu 28. veljače 2007.
Za Komisiju
Markos KYPRIANOU
Član Komisije
(1) SL L 378, 31.12.1982., str. 58.
(2) SL L 165, 30.4.2004., str. 1. kako je ispravljeno u SL L 191, 28.5.2004., str. 1.
(3) SL L 8, 12.1.2001., str. 1.
PRILOG
NAKNADE
Članovi skupine imaju pravo na naknadu za svoje sudjelovanje u aktivnostima skupine kako slijedi:
|
|
Za sudjelovanje na licu mjesta u aktivnostima skupine:
|
|
|
Za djelovanje u svojstvu predvodnika skupine ili izvjestitelja za aktivnosti koje zahtijevaju najmanje jedan dan rada i uz prethodnu pisanu suglasnost Komisije:
|
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
206 |
32007D0407
|
L 153/26 |
SLUŽBENI LIST EUROPSKE UNIJE |
12.06.2007. |
ODLUKA KOMISIJE
od 12. lipnja 2007.
o usklađenom praćenju otpornosti bakterija iz roda Salmonella kod peradi i svinja na antimikrobne pripravke
(priopćeno pod brojem dokumenta C(2007) 2421)
(Tekst značajan za EGP)
(2007/407/EZ)
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Direktivu 2003/99/EZ Europskog parlamenta i Vijeća od 17. studenoga 2003. o praćenju zoonoza i uzročnika zoonoza, o izmjeni Odluke Vijeća 90/424/EEZ i o stavljanju izvan snage Direktive Vijeća 92/117/EEZ (1), a posebno njezin članak 7. stavak 3.,
budući da:
|
(1) |
Sukladno Direktivi 2003/99/EZ, države članice osiguravaju da praćenje pruža usporedive podatke o pojavnosti antimikrobne otpornosti uzročnika zoonoza, kao i ostalih uzročnika ako oni predstavljaju opasnost za javno zdravlje. |
|
(2) |
Na radionici FAO-a/OIE-a/WHO-a o znanstvenoj procjeni uporabe antimikrobnih pripravaka na životinjama i antimikrobne otpornosti održanoj 2003. godine zaključeno je da postoje jasni dokazi štetnih posljedica za zdravlje ljudi zbog otpornih uzročnika koji su se razvili nakon uporabe antimikrobnih pripravaka na životinjama: pojačana učestalost infekcija, pojačana učestalost neuspjeha liječenja (u nekim slučajevima smrt) i povećana ozbiljnost infekcija, kako je primjerice dokumentirano kod humanih infekcija bakterijama iz roda Salmonella koje su otporne na fluorokinolonske lijekove. Postoje dokazi da količina i obrazac uporabe antimikrobnih pripravaka na životinjama utječu na pojavnost otpornih bakterija u životinja i hrani (Zajednička stručna radionica FAO-a/OIE-a/WHO-a, 2003.). Međutim, potrebno je istaknuti da je većina poteškoća u pogledu otpornosti bakterija u humanoj medicini uzrokovana uporabom i prekomjernom uporabom antimikrobnih pripravaka za liječenje i profilaksu ljudi (Europski parlament, listopad 2006.). |
|
(3) |
Europska agencija za sigurnost hrane (EFSA) u svojem „Zbirnom izvješću Zajednice o trendovima i izvorima zoonoza, uzročnicima zoonoza, antimikrobnoj otpornosti i izbijanju bolesti uzrokovanih hranom u Europskoj uniji u 2005. godini” (2) ukazuje na to da je relativno visok udio izolata iz roda Campylobacter i Salmonella iz životinja i hrane bio otporan na antimikrobne pripravke koji se uobičajeno koriste u liječenju bolesti ljudi. Infekcije prenosive hranom koje te rezistentne bakterije uzrokuju predstavljaju poseban rizik za ljude zbog mogućeg neuspjeha liječenja. |
|
(4) |
Znanstveni panel o biološkim opasnostima i znanstveni panel o zdravlju i dobrobiti životinja EFSA-e usvojio je Mišljenje o „Pregledu zbirnog izvješća Zajednice o trendovima i izvorima zoonoza, uzročnicima zoonoza i antimikrobnoj otpornosti u Europskoj uniji u 2004. godini” (3) tijekom zasjedanja 7. i 8. rujna 2006. Uzimajući u obzir ispitivanje antimikrobne otpornosti, Mišljenje ukazuje na važnost pružanja detaljnih informacija o serovaru bakterija iz roda Salmonella za svaki izolat te važnost usklađivanja ključnih točaka koje se primjenjuju za procjenu otpornosti i sastavljanje izvješća. |
|
(5) |
Radna skupina EFSA-e za prikupljanje podataka o zoonozama 20. veljače 2007. donijela je „Izvješće koje uključuje prijedlog za usklađenu shemu praćenja antimikrobne otpornosti bakterija iz roda Salmonella u kokoši (Gallus gallus), purana i svinja te Campylobacter jejuni i C. coli u tovnih pilića” (4). Izvješće daje preporuke za usklađenu shemu praćenja i usklađenu metodologiju za ispitivanje osjetljivosti na antimikrobne pripravke. |
|
(6) |
Zbog povećanog rizika za javno zdravstvo koje predstavlja antimikrobna otpornost i dokaza da uporaba antibiotika utječe na taj rizik, potrebno je u svim državama članicama provedbom članka 7. Direktive 2003/99/EZ prikupiti usporedive podatke o pojavnosti antimikrobne otpornosti kod uzročnika zoonoza u životinja. Ta se provedba treba temeljiti na prijedlogu Radne skupine EFSA-e, no ne smije dovoditi u pitanje buduća daljnja provedbena pravila. |
|
(7) |
Mjere predviđene ovom Odlukom u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU ODLUKU:
Članak 1.
Predmet i područje primjene
Ova Odluka utvrđuje detaljna pravila za praćenje otpornosti na antimikrobne pripravke u skladu s člankom 7. stavkom 3. i Prilogom II. dijelom B Direktive 2003/99/EZ koja se trebaju provesti u svim državama članicama. Ona obuhvaća bakterije iz roda Salmonella spp. kod kokoši (Gallus gallus), purana i svinja za klanje, ne dovodeći u pitanje dodatno praćenje antimikrobne otpornosti u skladu sa zahtjevima članka 7. stavka 1. Direktive 2003/99/EZ.
Članak 2.
Prikupljanje i analize izolata
Prikupljanje izolata Salmonella spp. iz članka 1. i njihove analize provodi nadležno tijelo ili se one provode pod njegovim nadzorom u skladu s tehničkim specifikacijama određenim u Prilogu.
Članak 3.
Povjerljivost podataka
Nacionalni zbirni podaci i nalazi analiza moraju se staviti na raspolaganje javnosti u obliku koji osigurava povjerljivost.
Članak 4.
Primjena
Ova se Odluka primjenjuje od 1. siječnja 2008.
Članak 5.
Ova je Odluka upućena državama članicama.
Sastavljeno u Bruxellesu 12. lipnja 2007.
Za Komisiju
Markos KYPRIANOU
Član Komisije
(1) SL L 325, 12.12.2003., str. 31. Direktiva kako je izmijenjena Direktivom Vijeća 2006/104/EZ (SL L 363, 20.12.2006., str. 352.).
(2) The EFSA Journal (2006.), 94.
(3) The EFSA Journal (2006.), 403, str. 1. do 62.
(4) The EFSA Journal (2007.), 96, str. 1. do 46.
PRILOG
TEHNIČKE SPECIFIKACIJE IZ ČLANKA 2.
1. Podrijetlo izolata
Izolati bakterija roda Salmonella prikupljeni putem programa nadzora i praćenja, određenih u skladu s člankom 5. Uredbe (EZ) br. 2160/2003 Europskog parlamenta i Vijeća (1) i/ili odlukama Komisije 2006/662/EZ (2), 2006/668/EZ (3), prikupljaju se za praćenje antimikrobne otpornosti u skladu s tablicom 1.
Tablica 1.:
Godine u kojima se određeni uzročnici zoonoza izdvojeni iz navedenih populacija životinja odabiru za ispitivanje antimikrobne otpornosti
|
Godina |
Svi serovarovi Salmonella |
|||
|
Konzumne nesilice |
Tovni pilići |
Purani |
Svinje za klanje |
|
|
2007. |
|
|
X (4) |
X (5) |
|
2008. |
X |
|
|
|
|
2009. |
X |
X |
|
|
|
2010. |
X |
X |
X |
|
|
2011. |
X |
X |
X |
X |
|
2012. |
X |
X |
X |
X |
Za praćenje se ne smije uključiti više od jedan izolat po serovaru Salmonella iz iste epidemiološke jedinice po godini. Epidemiološka jedinica za konzumne nesilice, tovne piliće i purane je jato. Za svinje je epidemiološka jedinica gospodarstvo.
2. Broj izolata koji se testiraju
Broj izolata bakterija roda Salmonella koji se trebaju uključiti u praćenje otpornosti po državi članici godišnje je 170 za svaku ispitivanu populaciju (tj. konzumne nesilice, tovne piliće, purane i svinje za klanje).
U državama članicama u kojima je bilo koje godine iz programa praćenja ili nadzora dostupan niži broj izolata od ciljane veličine uzorka svi se ti izolati uključuju u praćenje antimikrobne otpornosti.
U državama članicama u kojima je dostupan veći broj izolata uključuju se svi izolati ili reprezentativni nasumični izbor izolata koji je jednak ili veći od ciljane veličine uzorka.
3. Ispitivanje antimikrobne osjetljivosti
Države članice ispituju barem antimikrobne pripravke koji su navedeni u tablici 2. koristeći zadane granične vrijednosti i odgovarajući raspon koncentracija za određivanje osjetljivosti bakterija roda Salmonella.
Mora se koristiti metoda razrjeđenja u skladu s postupcima koje opisuje Europsko povjerenstvo za ispitivanje antimikrobne osjetljivosti (EUCAST) i Institut za kliničke i laboratorijske standarde (CLSI), prihvaćena kao međunarodna referentna metoda (standard ISO 20776-1:2006). Preporuča se fagotipiziranje odabranih izolata bakterija S. enteritidis i S. typhimurium.
4. Prikupljanje podataka i izvješćivanje
Nalazi praćenja otpornosti bakterija na antimikrobne pripravke moraju biti obrađeni i prijavljeni u skladu s člankom 9. Direktive 2003/99/EZ u godišnjem izvješću o trendovima i izvorima zoonoza, uzročnika zoonoza i otpornosti bakterija na antimikrobne pripravke.
Ne dovodeći u pitanje odredbe Priloga IV. Direktivi 2003/99/EZ, sljedeći podaci moraju biti prijavljeni za bakterije iz roda Salmonella u konzumnih nesilica, tovnih pilića, purana i svinja:
|
— |
podrijetlo izolata, npr. osnovna studija, program kontrole, pasivno nadziranje, |
|
— |
broj izolata ispitanih na osjetljivost, |
|
— |
broj izolata kod kojih je utvrđena otpornost, po antimikrobnom pripravku, i |
|
— |
broj potpuno osjetljivih izolata i broj izolata otpornih na 1, 2, 3, 4 i više od 4 antimikrobna pripravka iz tablice 2. |
Tablica 2.:
Antimikrobni pripravci na koje se moraju ispitati barem izolati bakterija roda Salmonella i granične vrijednosti koje se koriste za određivanje osjetljivosti
|
|
Antimikrobni pripravak |
Granična vrijednost (mg/L) R > |
|
Salmonella |
Cefotaksim |
0,5 |
|
Naldiksična kiselina |
16 |
|
|
Ciprofloksacin |
0,06 |
|
|
Ampicilin |
4 |
|
|
Tetraciklin |
8 |
|
|
Kloramfenikol |
16 |
|
|
Gentamicin |
2 |
|
|
Streptomicin |
32 |
|
|
Trimetoprim |
2 |
|
|
Sulfonamidi |
256 |
(1) SL L 325, 12.12.2003., str. 1.
(2) SL L 272, 3.10.2006., str. 22.
(3) SL L 275, 6.10.2006., str. 51.
(4) Izolati iz uzoraka prikupljenih u 2007. i pohranjenih u skladu s odredbama Odluke 2006/662/EZ.
(5) Izolati iz uzoraka prikupljenih u 2007. i pohranjenih u skladu s odredbama Odluke 2006/668/EZ.
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
210 |
32007R1266
|
L 283/37 |
SLUŽBENI LIST EUROPSKE UNIJE |
26.10.2007. |
UREDBA KOMISIJE (EZ) br. 1266/2007
od 26. listopada 2007.
o provedbi pravila za Direktivu Vijeća 2000/75/EZ s obzirom na kontrolu, praćenje, nadziranje i ograničenje premještanja određenih životinja prijemljivih vrsta u odnosu na bolest plavog jezika
(Tekst značajan za EGP)
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Direktivu 82/894/EEZ od 21. prosinca 1982. o načinu prijave bolesti životinja unutar Zajednice (1), a posebno drugu alineju članka 5. stavka 2.,
uzimajući u obzir Direktivu Vijeća 2000/75/EZ od 20. studenoga 2000. o utvrđivanju posebnih odredaba za kontrolu i iskorjenjivanje bolesti plavog jezika (2), a posebno njezin članak 6. stavak 1. i stavak 3., članak 8. stavak 2. točku (d), članak 8. stavak 3., članak 9. stavak 1. točku (c), članke 11. i 12. i treći stavak članka 19.,
budući da:
|
(1) |
Direktiva 2000/75/EZ utvrđuje pravila za kontrolu i mjere za suzbijanje bolesti plavog jezika u Zajednici, uključujući uspostavljanje zaraženih i ugroženih područja te zabranu da životinje prijemljivih vrsta napuštaju ta područja. O izuzimanju od te zabrane može odlučiti Komisija u skladu s postupkom predviđenim u toj Direktivi. |
|
(2) |
Odluka Komisije 2005/393/EZ od 23. svibnja 2005. o zaraženim i ugroženim područjima u odnosu na bolest plavog jezika i uvjete koji se primjenjuju na premještanje iz ili kroz ta područja (3) predviđa demarkaciju globalnih zemljopisnih područja u kojima države članice trebaju odrediti zaražena i ugrožena područja (područja pod ograničenjem). |
|
(3) |
Nakon donošenja Odluke 2005/393/EZ, situacija u Zajednici u pogledu bolesti plavog jezika značajno se promijenila i stečena su nova iskustva o kontroli bolesti, posebno nakon nedavnih najezdi novih serotipova virusa bolesti plavog jezika, posebno serotipa 8 u području Zajednice gdje nikada prije nije bilo prijavljeno izbijanje bolesti i koje se nije smatralo ugroženim od bolesti plavog jezika, te serotipa 1 tog virusa. |
|
(4) |
Na temelju stečenih iskustava, primjereno je na razini Zajednice poboljšati usklađivanje pravila o kontroli, praćenju, nadziranju i ograničenju premještanju prijemljivih vrsta životinja, izuzimajući divlje životinje, u odnosu na bolest plavog jezika s obzirom da su od velike važnosti za sigurno trgovanje prijemljivim uzgajanim životinjama koje se kreću unutar i iz područja pod ograničenjem, s ciljem uspostavljanja održivije strategije za kontrolu bolesti plavog jezika. Stoga je radi usklađivanja i jasnoće nužno staviti Odluku 2005/393/EZ izvan snage i zamijeniti je ovom Uredbom. |
|
(5) |
Novonastalo stanje u pogledu bolesti plavog jezika Komisiju je dovelo do toga da zatraži znanstveni savjet i podršku od Europske agencije za sigurnost hrane (EFSA), koja je u 2007. dostavila dva znanstvena izvješća i dva znanstvena mišljenja o bolesti plavog jezika. |
|
(6) |
Sukladno Direktivi 2000/75/EZ, demarkacija zaraženih i ugroženih područja mora u obzir uzeti zemljopisne, administrativne, ekološke i epizootiološke čimbenike povezane s bolešću plavog jezika i mjerama kontrole. Kako bi se uzeli u obzir ti čimbenici, nužno je utvrditi pravila s obzirom na minimalne usklađene zahtjeve za praćenjem i nadziranjem bolesti plavog jezika u Zajednici. |
|
(7) |
Nadziranja i razmjena podataka ključni su elementi pristupa temeljenog na riziku za kontrolne mjere u pogledu bolesti plavog jezika. U tom je smislu primjereno, osim definicija utvrđenih u članku 2. Direktive 2000/75/EZ, predvidjeti posebno definiciju slučaja plavog jezika kako bi se svima omogućilo razumijevanje ključnih čimbenika vezanih uz izbijanje bolesti plavog jezika. |
|
(8) |
Nadalje, koncept područja pod ograničenjem, korišten u Odluci 2005/393/EZ, pokazao se primjerenim, posebno ako se nazočnost virusa bolesti plavog jezika otkrije u pogođenom području tijekom dva uzastopna godišnja doba. Zbog praktičnih razloga i radi jasnoće zakonodavstva Zajednice primjereno je predvidjeti definiciju područja pod ograničenjem, koja se sastoje i od zaraženih i ugroženih područja koje države članice demarkiraju na temelju članka 8. stavka 1. Direktive 2000/75/EZ. |
|
(9) |
Određivanje područja koje je sezonski slobodna od bolesti plavog jezika za koju nadziranje ne pokazuje dokaze prijenosa bolesti plavog jezika ili kompetentnih vektora ključno je oruđe za održivo rukovođenje prilikom izbijanja bolesti plavog jezika uz omogućavanje sigurnog premještanja. U tom je smislu primjereno osigurati usklađena načela koja se trebaju koristiti za definiciju razdoblja sezonski slobodnog od vektora. |
|
(10) |
Izbijanje bolesti plavog jezika potrebno je prijaviti, u skladu s člankom 3. Direktive Vijeća 82/894/EEZ, uporabom kodificiranih obrazaca i kodova koji su određeni Odlukom Komisije 2005/176/EZ od 1. ožujka 2005. o utvrđivanju kodificiranog obrasca i kodova za prijavu bolesti životinja na temelju Direktive Vijeća 82/894/EEZ (4). S obzirom na dosadašnji epidemiološki razvoj bolesti plavog jezika, opseg ovog zahtjeva za prijavom treba se privremeno prilagoditi preciznijom definicijom obveze za prijavom primarnih izbijanja bolesti. |
|
(11) |
Sukladno mišljenju Znanstvenog odbora EFSA-e o zdravlju i dobrobiti životinja o podrijetlu i pojavi bolesti plavog jezika (5), donesenom dana 27. travnja 2007., ključno je da se ustanove primjereni programi za nadziranje kako bi se otkrilo pojavljivanje bolesti plavog jezika u najranijoj mogućoj fazi. Takvi programi nadziranja trebaju uključivati kliničku, serološku i entomološku sastavnicu, koja treba besprijekorno djelovati diljem svih država članica. |
|
(12) |
Potreban je cjelovit pristup na razini Zajednice kako bi se mogli analizirati epidemiološki podaci dobiveni praćenjem bolesti plavog jezika i programima nadziranja, uključujući i regionalnu i globalnu distribuciju infekcije bolesti plavog jezika, kao i vektora. |
|
(13) |
Odluka Vijeća 90/424/EEZ od 26. lipnja 1990. o troškovima u području veterine (6) propisuje financijski doprinos Zajednice za iskorjenjivanje, kontrolu i praćenje bolesti plavog jezika. |
|
(14) |
Sukladno Odluci 90/424/EEZ, Odluka Komisije 2007/367/EZ od 25. svibnja 2007. koja se odnosi na financijski doprinos Zajednice za Italiju radi provedbe sustava prikupljanja i ispitivanja epidemioloških podataka o bolesti plavog jezika (7) uspostavila je aplikaciju BlueTongue NETwork (sustav BT-NET), koja je internetski sustav za prikupljanje, pohranu i analizu podataka nadziranja bolesti plavog jezika u državama članicama. Potpuna uporaba tog sustava od ključnog je značenja za uspostavljanje najprimjerenijih mjera za kontrolu bolesti, provjeravanje njihove učinkovitosti i omogućavanje sigurnog premještanja životinja prijemljivih vrsta. Stoga, kako bi se osigurala učinkovitija i bolja razmjena podataka o programima za praćenje i nadziranje bolesti plavog jezika uspostavljenih između država članica i Komisije, te se razmjene trebaju provoditi preko sustava BT-Net. |
|
(15) |
Osim ako se čini nužnim na razini Zajednice nastaviti s demarkacijom zaraženog i ugroženog područja na temelju članka 8. stavka 2. točke (d) Direktive 2000/75/EZ, tu demarkaciju trebaju provesti države članice. Međutim, radi transparentnosti, države članice trebaju bez odlaganja obavijestiti Komisiju o svojim zaraženim i ugroženim područjima te o bilo kojim promjenama u vezi s njima. Posebice, ako država članica ne namjerava održavati epidemiološki značajno zemljopisno područje u području pod ograničenjem, ona Komisiji unaprijed treba dostaviti relevantne podatke kako bi potkrijepila odsutnost kruženja virusa bolesti plavog jezika u tom području. |
|
(16) |
Izuzeci od zabrane izlaska koji se primjenjuju na premještanje prijemljivih životinja, njihovog sjemena, jajnih stanica i zametaka iz područja pod ograničenjem trebaju biti odobreni na temelju analize rizika, uzimajući u obzir podatke sakupljene kroz program nadziranja bolesti plavog jezika, razmjenu podataka s ostalim državama članicama i Komisijom kroz sustav BT-Net, odredište životinja i njihovo udovoljavanje određenim zahtjevima u pogledu zdravlja uz jamstvo sigurnosti životinja. Premještanja životinja radi neodgodivog klanja trebaju se pod određenim uvjetima isto izuzeti od zabrane izlaska. Uzimajući u obzir nisku razinu rizika od premještanja životinja radi neodgodivog klanja i određene čimbenike ublažavanja rizika, primjereno je osigurati posebne uvjete koji na najmanju mjeru umanjuju rizik prijenosa virusa usmjeravajući prijevoz životinja iz gospodarstva smještenog u području pod ograničenjem prema klaonicama određenim na temelju procjene rizika. |
|
(17) |
Premještanje životinja unutar istog područja pod ograničenjem u kojoj kruži isti serotip ili isti serotipovi virusa bolesti plavog jezika ne predstavlja dodatni rizik po zdravlje životinja pa ga stoga nadležno tijelo pod određenim uvjetima treba dopustiti. |
|
(18) |
Prema mišljenju Znanstvenog odbora EFSA-e o zdravlju i dobrobiti životinja o vektorima i cjepivima (8) donesenom dana 27. travnja 2007., premještanje životinja imuniziranih cijepljenjem ili prirodno imuniziranih životinja može se smatrati sigurnim bez obzira na kruženje virusa na mjestu podrijetla ili aktivnost vektora na odredištu. Stoga je nužno osigurati uvjete kojima imunizirane životinje moraju udovoljavati prije premještanja iz područja pod ograničenjem. |
|
(19) |
Direktiva Vijeća 64/432/EEZ od 26. lipnja 1964. o problemima vezanim uz zdravlje životinja koji utječu na trgovinu govedima i svinjama unutar Zajednice (9), Direktiva Vijeća 91/68/EEZ od 28. siječnja 1991. o zahtjevima zdravlja životinja, koja uređuje trgovinu ovcama i kozama unutar Zajednice (10), Direktiva Vijeća 92/65/EEZ od 13. srpnja 1992. o utvrđivanju zahtjeva zdravlja životinja kojima se uređuje trgovina unutar Zajednice i uvoz životinja, sjemena, jajnih stanica i zametaka koji ne podliježu veterinarsko-zdravstvenim uvjetima koji su utvrđeni posebnim pravilima Zajednice iz Priloga A poglavlja I. Direktive 90/425/EEZ (11), i Odluka Komisije 93/444/EEZ od 2. srpnja 1993. o detaljnim pravilima koja uređuje trgovinu unutar Zajednice određenim živim životinjama i proizvodima namijenjenim za izvoz u treće zemlje (12) utvrđuju da premještanje životinja trebaju popratiti zdravstveni certifikati. Ako se izuzeća od zabrane izlaska primjenjiva na premještanje životinja prijemljivih vrsta iz područja pod ograničenjem primjenjuju na životinje namijenjene za trgovinu unutar Zajednice ili za izvoz u treću zemlju, ti certifikati trebaju uključivati uputu na ovu Uredbu. |
|
(20) |
U skladu s mišljenjem EFSA-e o vektori i cjepivima, primjereno je utvrditi uvjete za tretiranje odobrenim insekticidima na mjestu utovara za vozila koja prevoze prijemljive životinje iz područja pod ograničenjem u ili kroz područja koja se nalaze izvan područja pod ograničenjem. Ako se tijekom provoza kroz područje pod ograničenjem utvrdi razdoblje odmora u kontrolnoj postaji, životinje treba zaštititi od bilo kakvih napada vektora. Međutim, tretiranje životinja, prostorija ili njihovog okoliša odobrenim insekticidima u zaraženim objektima treba izvesti samo slijedeći određeni protokol na temelju pozitivnog nalaza procjene rizika od slučaja do slučaja, koji u obzir uzima zemljopisne, epidemiološke, ekološke, okolišne, entomološke podatke te procjenu troškova i koristi. |
|
(21) |
Zdravstveni certifikati predviđeni direktivama 64/432/EEZ, 91/68/EEZ i 92/65/EEZ i Odlukom 93/444/EEZ koje obuhvaćaju životinje namijenjene za trgovinu unutar Zajednice ili za izvoz u treću zemlju trebaju sadržavati uputu na bilo koji tretman insekticidom koji se provede na temelju ove Uredbe. |
|
(22) |
U pogledu potrebe izbjegavanja nepotrebnog remećenja trgovine, žurno je potrebno uspostaviti održivu strategiju za kontrolu virusa bolesti plavog jezika što omogućuje sigurnu trgovinu životinjama prijemljivih vrsta koje se kreću unutar i iz područja pod ograničenjem. |
|
(23) |
Mjere predviđene ovom Uredbom u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU UREDBU:
POGLAVLJE 1.
PREDMET I DEFINICIJE
Članak 1.
Predmet
Ova Uredba predviđa pravila za kontrolu, praćenje, nadziranje i ograničenje premještanja životinja u smislu članka 2. točke (c) Direktive 2000/75/EZ, u odnosu na bolest plavog jezika, u području pod ograničenjem i iz njih.
Članak 2.
Definicije
Za potrebe ove Uredbe primjenjuju se definicije iz članka 2. Direktive 2000/75/EZ.
Nadalje, primjenjuju se sljedeće definicije:
|
(a) |
„slučaj bolesti plavog jezika” znači životinja koja udovoljava jednom od sljedećih zahtjeva:
Nadalje, zbir epidemioloških podataka mora upućivati na to da su klinički znakovi ili nalazi laboratorijskih ispitivanja koji ukazuju na zarazu bolešću plavog jezika posljedica kruženja virusa u objektu u kojemu se životinja drži, a ne posljedica uvođenja cijepljenih ili seropozitivnih životinja iz područja pod ograničenjem. |
|
(b) |
„izbijanje bolesti plavog jezika” znači izbijanje te bolesti kako je definirano člankom 2. točkom (c) Direktive 82/894/EEZ; |
|
(c) |
„primarno izbijanje bolesti plavog jezika” znači izbijanje kako je definirano člankom 2. točkom (d) Direktive 82/894/EEZ, uzimajući u obzir da je, za potrebe primjene prve alineje članka 3. stavka 1. te Direktive, slučaj bolesti plavog jezika primarno izbijanje u sljedećim slučajevima:
|
|
(d) |
„područje pod ograničenjem” znači područje koje se sastoji od zaraženog i ugroženog područja uspostavljenih na temelju članka 8. stavka 1. Direktive 2000/75/EZ; |
|
(e) |
„sezonski slobodno područje od bolesti plavog jezika” znači epidemiološki značajno zemljopisno područje države članice za koje, tijekom dijela godine, nadziranje nije dokazao prijenos virusa bolesti plavog jezika ili odraslih Culicoidesa u smislu dostatnih vektora bolesti plavog jezika; |
|
(f) |
„provoz” znači premještanje životinja:
|
POGLAVLJE 2.
PRAĆENJE I NADZIRANJE I RAZMJENA INFORMACIJA
Članak 3.
Prijava bolesti plavog jezika
Države članice moraju prijaviti primarno izbijanje i izbijanje bolesti plavog jezika kroz Sustav prijave bolesti životinja uporabom kodiranih obrazaca i kôdova određenih u Odluci 2005/176/EZ.
Članak 4.
Programi praćenja i nadziranja bolesti plavog jezika
Države članice moraju provoditi sljedeće programe u skladu s minimalnim zahtjevima određenim u Prilogu I.:
|
(a) |
programe praćenja bolesti plavog jezika u područjima pod ograničenjem (programi praćenja bolesti plavog jezika); |
|
(b) |
programe nadziranja bolesti plavog jezika izvan područja pod ograničenjem (programi nadziranja bolesti plavog jezika). |
Članak 5.
Epidemiološki podaci
1. Države članice moraju podatke o bolesti plavog jezika sakupljene u tijeku provedbe programa praćenja i/ili nadziranja bolesti plavog jezika prenijeti u aplikaciju BlueTongue NETwork (sustav BT-NET), uspostavljen Odlukom 2007/367/EZ, a posebno:
|
(a) |
mjesečno izvješće, koje se dostavlja najkasnije jedan mjesec nakon konca mjeseca za koji se piše izvješće, koje sadrži barem:
|
|
(b) |
privremeno izvješće koje obuhvaća prvih šest mjeseci kalendarske godine i koje se dostavlja svake godine najkasnije do 31. srpnja, te sadrži barem:
|
|
(c) |
godišnje izvješće koje se dostavlja najkasnije do 30. travnja sljedeće godine i sadrži podatke koji se spominju u točki (b) alinejama i. i ii. za prethodnu godinu. |
2. Podaci koji se moraju prenijeti u sustav BT-Net izloženi su u Prilogu II.
POGLAVLJE 3.
OGRANIČENJA PREMJEŠTANJA ŽIVOTINJA I NJIHOVOG SJEMENA, JAJNIH STANICA I ZAMETAKA
Članak 6.
Područja pod ograničenjem
1. Države članice moraju obavješćivati Komisiju o svojim područjima pod ograničenjem te o bilo kojim promjenama situacije u tim područjima i to u roku od 24 sata.
2. Prije donošenja bilo kakvih odluka o uklanjanju epidemiološki značajnog zemljopisnog područja iz područja pod ograničenjem, države članice Komisiji moraju dostaviti potkrijepljene podatke koji prikazuju odsutnost kruženja virusa bolesti plavog jezika u tom području tijekom razdoblja od dvije godine nakon provedbe programa praćenja bolesti plavog jezika.
3. Komisija o popisu područja pod ograničenjem izvješćuje države članice u okviru Stalnog odbora za prehrambeni lanac i zdravlje životinja.
4. Države članice moraju sastaviti i održavati ažurirani popis područja pod ograničenjem na svojem području te ga staviti na raspolaganje ostalim državama članicama i javnosti.
5. Komisija na svojoj internetskoj stranci objavljuje, samo u svrhu informiranja, ažurirani popis područja pod ograničenjem.
Taj popis mora uključivati podatke o serotipovima virusa bolesti plavog jezika koji kruže u svakom području pod ograničenjem, što omogućuje, za potrebe članaka 7. i 8, identifikaciju područja pod ograničenjem demarkiranih u različitim državama članicama u kojima kruže isti serotipovi virusa bolesti plavog jezika.
Članak 7.
Uvjeti za premještanje unutar istog područja pod ograničenjem
1. Premještanje životinja unutar istog područja pod ograničenjem u kojoj kruži isti serotip ili serotipovi virusa bolesti plavog jezika nadležno tijelo mora dopustiti pod uvjetom da životinje koje se trebaju premještati na dan prijevoza ne pokazuju nikakve kliničke znakove bolesti plavog jezika.
2. Međutim, premještanje životinja iz zaraženog i ugroženo područje može se dopustiti samo ako:
|
(a) |
životinje udovoljavaju uvjetima određenim u Prilogu III.; ili |
|
(b) |
životinje udovoljavaju bilo kojim drugim primjerenim jamstvima u pogledu zdravlja životinja temeljenim na pozitivnom ishodu procjene rizika mjera protiv širenja virusa bolesti plavog jezika i zaštite od napada vektora, što zahtijeva nadležno tijelo mjesta podrijetla i odobrava nadležno tijelo odredišta, prije premještanja takvih životinja; |
|
(c) |
su životinje namijenjene neodgodivom klanju. |
3. Država članica podrijetla mora odmah obavijestiti Komisiju i ostale države članice o jamstvima u pogledu zdravlja životinja kako se spominju u stavku 2. točki (b).
4. Za životinje iz stavaka 1. i 2. ovog članka, u odgovarajuće zdravstvene certifikate utvrđene u direktivama 64/432/EEZ, 91/68/EEZ i 92/65/EEZ ili koje se spominju u Odluci 93/444/EEZ dodaje se sljedeća dopunska formulacija:
„Životinje u skladu s … (člankom 7. stavkom 1. ili člankom 7. stavkom 2. točkom (a) ili člankom 7. stavkom 2. točkom (b) ili člankom 7. stavkom 2. točkom (c), naznačiti odgovarajuće) Uredbe (EZ) br. 1266/2007 (13).
Članak 8.
Uvjeti za izuzeće od zabrane izlaska predviđene Direktivom 2000/75/EZ
1. Premještanje životinja, njihovog sjemena, jajnih stanica i zametaka, iz gospodarstva ili centra za sakupljanje sjemena ili centra za pohranu sjemena smještenog u području pod ograničenjem u drugi objekt ili centar za prikupljanje sjemena ili centar za pohranu sjemena oslobađa se od zabrane izlaska uspostavljene na temelju članka 9. stavka 1. točke (c) i točke 1. članka 10. Direktive 2000/75/EZ pod uvjetom da životinje, njihovo sjeme, jajne stanice i zametci udovoljavaju:
|
(a) |
uvjetima određenim u Prilogu III. ovoj Uredbi; ili |
|
(b) |
bilo kojim drugim jamstvima u pogledu zdravlja životinja temeljenim na pozitivnom ishodu procjene rizika mjera protiv širenja virusa bolesti plavog jezika i zaštite od napada vektora, što zahtijeva nadležno tijelo mjesta podrijetla i odobrava nadležno tijelo odredišta, prije premještanja takvih životinja. |
2. Država članica podrijetla bez odgađanja obavještava Komisiju i ostale države članice o jamstvima u pogledu zdravlja životinja kako se spominju u stavku 1. točki (b).
3. Određuje se postupak usmjeravanja pod kontrolom nadležnog tijela odredišta kako bi se osiguralo da se životinje, njihovo sjeme, jajne stanice i zametci premješteni u skladu s uvjetima predviđenim stavkom 1. točkom (b) nakon toga ne premještaju u drugu državu članicu, osim ako životinje ne udovoljavaju uvjetima predviđenim stavkom 1. točkom (a).
4. Premještanje životinja iz objekta smještenog u području pod ograničenjem radi neodgodivog klanja izuzima se od zabrane izlaska uspostavljene na temelju članka 9. stavka 1. točke (c) i točke 1. članka 10. Direktive 2000/75/EZ pod uvjetom da:
|
(a) |
u objektu podrijetla barem 30 dana prije datuma slanja nije zabilježen niti jedan slučaj bolesti plavog jezika; |
|
(b) |
se životinje pod službenim nadzorom prevezu izravno do klaonice za klanje u roku od 24 sata po dolasku u odredišnu klaonicu; |
|
(c) |
nadležno tijelo u mjestu slanja barem 48 sati prije utovara životinja obavijesti nadležno tijelo u mjestu odredišta o predviđenom premještanju životinja. |
5. Neovisno o stavku 4. točki (b), nadležno tijelo odredišta može na temelju procjene rizika tražiti da nadležno tijelo podrijetla uspostavi postupak usmjeravanja za prijevoz životinja koje se u njemu spominju, prema određenim klaonicama.
Bilo koje određene klaonice identificiraju se na temelju procjene rizika koja u obzir uzima načela izložena u Prilogu IV.
Podaci o određenim klaonicama moraju se staviti na raspolaganje ostalim državama članicama i javnosti. Ti podaci se ustupaju putem sustava BT-Net.
6. Za životinje, njihovo sjeme, jajne stanice i zametke iz stavaka 1. i 4. ovog članka, u odgovarajuće zdravstvene certifikate određene u direktivama 64/432/EEZ, 91/68/EEZ i 92/65/EEZ ili koje se spominju u Odluci 93/444/EEZ dodaje se sljedeća dopunska formulacija:
”… (Životinje, sjeme, jajne stanice i zametci, naznačiti odgovarajuće) u skladu s … (člankom 8. stavkom 1. točkom (a) ili člankom 8. stavkom 1. točkom (b) ili člankom 8. stavkom 4, naznačiti odgovarajuće) Uredbe (EZ) br. 1266/2007 (14).
Članak 9.
Daljnji uvjeti za provoz životinja
1. Provoz životinja dopušta nadležno tijelo pod uvjetom da:
|
(a) |
životinje iz područja pod ograničenjem koje se premještaju kroz područja izvan područja pod ograničenjem i sredstva u kojima se prevoze budu tretirana odobrenim insekticidima i/ili repelentima nakon primjerenog čišćenja i dezinfekcije na mjestu utovara i u svakom slučaju prije napuštanja područja pod ograničenjem; |
|
(b) |
životinje koje se premještaju iz područja izvan područja pod ograničenjem kroz područje pod ograničenjem i sredstva u kojima se prevoze budu tretirana odobrenim insekticidima i/ili repelentima nakon primjerenog čišćenja i dezinfekcije na mjestu utovara i u svakom slučaju prije ulaska u zonu pod ograničenjem; |
|
(c) |
su tijekom premještanja kroz područje pod ograničenjem životinje zaštićene od bilo kakvih napada vektora prilikom predviđanja razdoblja odmora na kontrolnoj postaji. |
2. Za životinje iz stavka 1. ovog članka, u odgovarajuće zdravstvene certifikate predviđene u direktivama 64/432/EEZ, 91/68/EEZ i 92/65/EEZ ili iz Odluke 93/444/EEZ dodaje se sljedeća dopunska formulacija:
„Tretman insekticidom/repelentom (upisati naziv proizvoda) na dan (upisati datum) u (upisati sat) u skladu s Uredbom (EZ) br. 1266/2007 (15).
3. Stavak 1. ovog članka više se ne primjenjuje u epidemiološki značajnom zemljopisnom području područja sezonski slobodnog od vektora bolesti plavog jezika u slučaju kada je proteklo više od 60 dana od početka sezonski slobodnog razdoblja od vektora, kako je određeno u skladu s Prilogom V.
Međutim, to oslobođenje više se ne primjenjuje nakon kraja sezonski slobodnog razdoblja od vektora, na temelju programa praćenja bolesti plavog jezika.
POGLAVLJE 4.
ZAVRŠNE ODREDBE
Članak 10.
Stavljanje izvan snage
Odluka 2005/393/EZ stavlja se izvan snage.
Članak 11.
Stupanje na snagu
Ova Uredba stupa na snagu petog dana nakon objave u Službenom listu Europske unije.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 26. listopada 2007.
Za Komisiju
Markos KYPRIANOU
Član Komisije
(1) SL L 378, 31.12.1982. Direktiva kako je zadnje izmijenjena Odlukom Komisije 2004/216/EZ (SL L 67, 5.3.2004., str. 27.).
(2) SL L 327, 22.12.2000., str. 74. Direktiva kako je zadnje izmijenjena Direktivom 2006/104/EZ (SL L 363, 20.12.2006., str. 352.).
(3) SL L 130, 24.5.2005., str. 22. Odluka kako je zadnje izmijenjena Odlukom 2007/357/EZ (SL L 133, 25.5.2007., str. 44.).
(4) SL L 59, 5.3.2005., str. 40. Odluka kako je izmijenjena Odlukom 2006/924/EZ (SL L 354, 14.12.2006., str. 48.).
(5) The EFSA Journal (2007.) 480, 1-20.
(6) SL L 224, 18.8.1990., str. 19. Odluka kako je zadnje izmijenjena Uredbom (EZ) br. 1791/2006 (SL L 363, 20.12.2006., str. 1.).
(7) SL L 139, 31.5.2007., str. 30.
(8) The EFSA Journal (2007.) 479, 1-29.
(9) SL 121, 29.7.1964., str. 1977./1964. Direktiva kako je zadnje izmijenjena Direktivom 2006/104/EZ.
(10) SL L 46, 19.2.1991., str. 19. Direktiva kako je zadnje izmijenjena Direktivom 2006/104/EZ.
(11) SL L 268, 14.9.1992., str. 54. Direktiva kako je zadnje izmijenjena Odlukom Komisije 2007/265/EZ (SL L 114, 1.5.2007., str. 17.).
(12) SL L 208, 19.8.1993., str. 34.
(13) SL L 283, 27.10.2007., str. 37.”
(14) SL L 283, 27.10.2007., str. 37.”
(15) SL L 283, 27.10.2007., str. 37.”
PRILOG I.
Minimalni zahtjevi za programe praćenja i nadziranja bolesti plavog jezika (iz članka 4.)
1. Minimalni zahtjevi za programe praćenja bolesti plavog jezika koje države članice trebaju primijeniti u područjima pod ograničenjem
Programi praćenja bolesti plavog jezika u područjima pod ograničenjem usmjereni su prema pružanju informacija o dinamici bolesti plavog jezika u području koja već podliježe ograničenjima.
Referentna zemljopisna jedinica definira se mrežom od otprilike 45 × 45 km (oko 2 000 km2), osim ako posebni uvjeti okoliša ne opravdavaju drugačiju veličinu. U određenim državama članicama u svrhu praćenja kao referentna zemljopisna jedinica može se koristiti „regija”, kako je određena člankom 2. Direktive 64/432/EEZ.
Programi praćenja bolesti plavog jezika moraju se sastojati od barem sljedećih elemenata:
|
1.1 |
Serološko praćenje sa sentinel životinjama:
|
|
1.2 |
Entomološko praćenje
|
2. Minimalni zahtjevi za programe nadziranja bolesti plavog jezika koje države članice trebaju provoditi izvan područja pod ograničenjem
Programi nadziranja bolesti plavog jezika izvan područja pod ograničenjem usmjereni su na otkrivanje kruženja virusa u državi članici koja je slobodna od bolesti plavog jezika ili epidemiološki relevantnom zemljopisnom području i moraju se sastojati od barem sljedećih elemenata:
|
2.1. |
Pasivni klinički nadziranja:
|
|
2.2. |
Serološko nadziranje:
|
|
2.3. |
Entomološki nadziranja:
|
(1) Procjenjuje se da je normalna godišnja stopa serokonverzije u području zaraze 20 %. Međutim, u Zajednici se kruženje virusa uglavnom odvija u razdoblju od oko šest mjeseci (kraj proljeća/sredina jeseni). Stoga je konzervativna procjena očekivane mjesečne stope serokonverzije 2 %.
PRILOG II.
Podaci koje države članice moraju prenijeti u sustav BT-Net (kako se spominje u članku 5. stavku 2.)
Podaci koje države članice moraju prenijeti u sustav BT-Net uključuju barem sljedeće:
1. Serološki/virološki podaci o bolesti plavog jezika
|
(a) |
Upravni odjel/jedinica; |
|
(b) |
Vrsta životinje koja se podvrgava ispitivanju; |
|
(c) |
Vrsta sheme sustava nadziranja (pokusni sustav ili povremeno testiranje); |
|
(d) |
Vrsta obavljenih dijagnostičkih pretraga (ELISA, serum neutralizacija, PCR, izolacija virusa); |
|
(e) |
Mjesec i godina; |
|
(f) |
Broj ispitanih životinja (1); |
|
(g) |
Broj pozitivnih životinja; |
|
(h) |
Serotip određen serološkim ili virološkim putem (podaci koji se dostavljaju u slučaju pozitivnog ishoda serum neutralizacijskog testa ili testa izolacije virusa). |
2. Entomološki podaci o bolesti plavog jezika
|
(a) |
Upravni odjel; |
|
(b) |
Jedinstveni identitet lokaliteta (jedinstveni kôd za svako mjesto postavljanja zamki); |
|
(c) |
Datum sakupljanja; |
|
(d) |
Zemljopisna širina i dužina; |
|
(e) |
Ukupni broj sakupljenih Culicoides spp.; |
|
(f) |
Broj sakupljenih C. imicola, ako je dostupan; |
|
(g) |
Broj sakupljenih C. obsoletus Complex, ako je dostupan; |
|
(h) |
Broj sakupljenih C. obsoletus sensu strictu, ako je dostupan; |
|
(i) |
Broj sakupljenih C. scoticus, ako je dostupan; |
|
(j) |
Broj sakupljenih C. Pulicaris Complex, ako je dostupan; |
|
(k) |
Broj sakupljenih C. Nubeculosus complex, ako je dostupan; |
|
(l) |
Broj sakupljenih C. dewulfii, ako je dostupan; |
|
(m) |
Ostali značajni podaci. |
3. Podaci o cijepljenju protiv bolesti plavog jezika
|
(a) |
Upravni odjel; |
|
(b) |
Godina/semestar; |
|
(c) |
Vrsta cjepiva; |
|
(d) |
Kombinacija serotipa; |
|
(e) |
Cijepljene vrste životinja; |
|
(f) |
Ukupan broj stada u državi članici; |
|
(g) |
Ukupan broj životinja u državi članici; |
|
(h) |
Ukupan broj stada u programu cijepljenja; |
|
(i) |
Ukupan broj životinja u programu cijepljenja; |
|
(j) |
Ukupan broj cijepljenih stada; |
|
(k) |
Ukupan broj cijepljenih životinja (tamo gdje je vrsta cijepljenja cijepljenje mladih životinja); |
|
(l) |
Broj cijepljenih mladih životinja (tamo gdje je vrsta cijepljenja masovno cijepljenje); |
|
(m) |
Broj cijepljenih odraslih životinja (tamo gdje je vrsta cijepljenja masovno cijepljenje); |
|
(n) |
Doze primijenjenog cjepiva. |
(1) Ako se serumi grupiraju, potrebno je izvijestiti o procjeni broja životinja koje odgovaraju ispitivanoj grupi.
PRILOG III.
Uvjeti za oslobođenje od zabrane izlaska (navedeni u članku 7. stavku 2. točki (a) i članku 8. stavku 1. točki (a))
A. Životinje
Životinje se tijekom prijevoza do odredišta moraju zaštititi od napada vektora iz vrste Culicoides.
Nadalje, potrebno je udovoljiti barem jednom od uvjeta izloženih u točkama 1. do 7.:
|
1. |
Životinje su do slanja tijekom sezonski slobodnog razdoblja od vektora, kako je određeno u skladu s Prilogom V., držane u sezonski slobodnom području od bolesti plavog jezika od rođenja ili barem 60 dana prije datuma premještanja i bile su podvrgnute testu identifikacije uzročnika u skladu s Priručnikom za dijagnostičke pretrage i cjepiva za kopnene životinje Svjetske organizacije za zaštitu životinjskog zdravlja (OIE) (1) (Priručnik za kopnene životinje OIE-a) s negativnim ishodom, provedenom najranije sedam dana prije datuma premještanja životinja. Međutim, taj test identifikacije uzročnika nije nužan za države članice ili regije država članica u kojima dostatni epidemiološki podaci dobiveni slijedom provedbe programa za praćenje u trajanju od najmanje tri godine potkrepljuju određivanje sezonski slobodnog razdoblja od vektora određenog u skladu s Prilogom V. Države članice koje se koriste tom mogućnošću obavješćuju Komisiju i ostale države članice u okviru Stalnog odbora za prehrambeni lanac i zdravlje životinja; |
|
2. |
Životinje su do slanja tijekom razdoblja od 60 dana prije datuma slanja držane pod zaštitom od napada vektora; |
|
3. |
Životinje su do slanja držane u sezonski slobodnom području od bolesti plavog jezika tijekom sezonski slobodnog razdoblja od vektora, određenog u skladu s Prilogom V., ili su držane pod zaštitom od napada vektora tijekom razdoblja od najmanje 28 dana i tijekom tog razdoblja podvrgnute su serološkom ispitivanju u skladu s Priručnikom za kopnene životinje OIE-a radi otkrivanja protutijela na skupinu virusa bolesti plavog jezika, s negativnim ishodom, provedenom barem 28 dana nakon datuma početka razdoblja zaštite od napada vektora ili sezonski slobodnog razdoblja od vektora; |
|
4. |
Životinje su do slanja držane u sezonski slobodnom području od bolesti plavog jezika tijekom sezonski slobodnog razdoblja od vektora, određenog u skladu s Prilogom V., ili su držane pod zaštitom od napada vektora tijekom razdoblja od najmanje 14 dana i tijekom tog razdoblja podvrgnute su testu identifikacije uzročnika u skladu s Priručnikom za kopnene životinje OIE-a radi otkrivanja protutijela na skupinu virusa bolesti plavog jezika, s negativnim ishodom, provedenom barem 14 dana nakon datuma početka razdoblja zaštite od napada vektora ili sezonski slobodnog razdoblja od vektora; |
|
5. |
Životinje potječu iz stada koje je cijepljeno u skladu s programom cijepljenja koji je donijelo nadležno tijelo i životinje su cijepljene protiv serotipa/serotipova koji su nazočni ili čija je nazočnost vjerojatna u epidemiološki značajnom zemljopisnom području podrijetla, životinje su i nadalje unutar razdoblja imuniteta kako se jamči u specifikaciji cjepiva koje je odobreno u programu cijepljenja, i životinje udovoljavaju barem jednom od sljedećih zahtjeva:
Ako su životinje koje se spominju u ovoj točki namijenjene trgovini unutar Zajednice ili izvozu u treću zemlju, u odgovarajuće veterinarske certifikate predviđene u direktivama 64/432/EEZ, 91/68/EEZ i 92/65/EEZ ili koje se spominju u Odluci 93/444/EEZ dodaje se sljedeća dopunska formulacija: „Životinja/e cijepljena/e protiv serotipa/ova bolesti plavog jezika (upisati serotip/ove) sa (upisati naziv cjepiva) s inaktiviranim/modificiranim živim cjepivom (naznačiti odgovarajuće) dana (upisati datum) u skladu s Uredbom (EZ) br. 1266/2007 (2). |
|
6. |
Životinje su uvijek držane u epidemiološki značajnom zemljopisnom području podrijetla u kojemu nije nazočan ili nije vjerojatna nazočnost više od jednog serotipa i:
Ako su životinje koje se spominju u ovoj točki namijenjene trgovini unutar Zajednice ili izvozu u treću zemlju, u odgovarajuće veterinarske certifikate predviđene u direktivama 64/432/EEZ, 91/68/EEZ i 92/65/EEZ ili koje se spominju u Odluci 93/444/EEZ dodaje se sljedeća dopunska formulacija: „Životinja/e u skladu s Prilogom IV. točkom (6) Uredbe (EZ) br. 1266/2007 (3). |
|
7. |
Životinje su podvrgnute primjerenom specifičnom serološkom ispitivanju u skladu s Priručnikom za kopnene životinje OIE-a koji je u mogućnosti otkrivanja specifičnih protutijela na sve serotipove virusa bolesti plavog jezika, s pozitivnim ishodom na sve serotipove koji su nazočni ili je njihova nazočnost vjerojatna u epidemiološki značajnom zemljopisnom području podrijetla, i:
Ako su životinje koje se spominju u ovoj točki namijenjene trgovini unutar Zajednice ili izvozu u treću zemlju, u odgovarajuće zdravstvene certifikate predviđene u direktivama 64/432/EEZ, 91/68/EEZ i 92/65/EEZ ili koje se spominju u Odluci 93/444/EEZ dodaje se sljedeća dopunska formulacija: „Životinja/e u skladu s Prilogom IV.(7) Uredbi (EZ) br. 1266/2007 (4). |
B. Sjeme životinja
Sjeme se mora prikupiti od životinja davatelja koje udovoljavaju barem jednom od sljedećih uvjeta:
|
(a) |
bile su držane izvan područja pod ograničenjem barem posljednjih 60 dana prije početka i tijekom prikupljanja sjemena; |
|
(b) |
bile su zaštićene od napada vektora barem posljednjih 60 dana prije početka i tijekom prikupljanja sjemena; |
|
(c) |
držane su tijekom sezonski slobodnog razdoblja od vektora u sezonski slobodnom području od bolesti plavog jezika, određenoj u skladu s Prilogom V., barem posljednjih 60 dana prije početka i tijekom prikupljanja sjemena i podvrgnute su testu identifikacije uzročnika u skladu s Priručnikom za kopnene životinje OIE-a, s negativnim ishodom, provedenom najranije sedam dana prije datuma početka prikupljanja sjemena. Međutim, taj test identifikacije uzročnika nije nužan za države članice ili regije država članica u kojima dostatni epidemiološki podaci dobiveni slijedom provedbe programa praćenja u trajanju od najmanje tri godine potkrepljuju određivanje sezonski slobodnog razdoblja od vektora određenog u skladu s Prilogom V. Države članice koje se koriste tom mogućnošću izvješćuju Komisiju i ostale države članice u okviru Stalnog odbora za prehrambeni lanac i zdravlje životinja; |
|
(d) |
bile su podvrgnute serološkom testu u skladu s Priručnikom za kopnene životinje OIE radi otkrivanja protutijela skupine virusa bolesti plavog jezika, s negativnim ishodom, barem svakih 60 dana tijekom razdoblja prikupljanja i između 21 i 60 dana nakon posljednjeg prikupljanja; |
|
(e) |
bile su podvrgnute, s negativnim ishodom, testu identifikacije uzročnika u skladu s Priručnikom za kopnene životinje OIE provedenom na uzorcima krvi sakupljenim:
|
C. Jajne stanice i zametci životinja
|
1. |
In vivo dobiveni zametci i jajne stanice goveda moraju biti prikupljeni u skladu s Direktivom Vijeća 89/556/EEZ (5). |
|
2. |
In vivo dobiveni zametci i jajne stanice životinja koje nisu goveda te in vitro proizvedeni zametci goveda moraju se prikupiti od životinja davateljica, koje udovoljavaju barem jednom od sljedećih uvjeta:
|
(1) http://www.oie.int/eng/normes/en_mcode.htm?e1d10
(2) SL L 283, 27.10.2007., str. 37.”
(3) SL L 283, 27.10.2007., str. 37.”
(4) SL L 283, 27.10.2007., str. 37.”
(5) SL L 302, 19.10.1989., str. 1. Direktiva kako je zadnje izmijenjena Odlukom Komisije 2006/60/EZ (SL L 31, 3.2.2006., str. 24.).
PRILOG IV.
Načela za određivanje klaonica za oslobođenje od zabrane izlaska (iz drugog stavka članka 8. stavka 4.)
U smislu procjene rizika za određivanje klaonica radi usmjeravanja premještanja životinja iz objekta smještenog u području pod ograničenjem zbog neposrednog klanja, nadležno tijelo odredišta koristi barem sljedeća načela:
|
1. |
podatke dostupne kroz programe praćenja i nadziranja, posebno s obzirom na aktivnost vektora; |
|
2. |
udaljenost od točke ulaska u zonu koja nije područje pod ograničenjem do klaonice; |
|
3. |
entomološke podatke tijekom puta; |
|
4. |
razdoblje dana tijekom kojeg se odvija prijevoz u odnosu na sate aktivnosti vektora; |
|
5. |
moguću uporabu insekticida i repelenata u skladu s Direktivom Vijeća 96/23/EZ (1); |
|
6. |
lokaciju klaonice u odnosu na objekte sa stokom; |
|
7. |
biosigurnosne mjere uspostavljene u klaonici. |
(1) SL L 125, 23.5.1996., str. 10. Direktiva kako je zadnje izmijenjena Direktivom 2006/104/EZ.
PRILOG V.
Načela za određivanje sezonski slobodnog razdoblja od vektora (iz članka 9. stavka 3.)
U smislu određivanja sezonski slobodnog područja od bolesti plavog jezika, nadležno tijelo određuje sezonski slobodno razdoblje od vektora kako bi odredilo epidemiološki značajno zemljopisno područje države članice (epidemiološki značajno zemljopisno područje) uporabom najmanje sljedećih načela:
1. Opća načela
|
(a) |
Mora biti uspostavljen program praćenja i/ili program nadziranja. |
|
(b) |
Posebna načela i pragovi koji se rabe za određivanje sezonski slobodnog razdoblja od vektora određuju se uzimajući u obzir vrste Culicoidesa za koje je dokazano ili za koje se sumnja da su glavni vektori u epidemiološki značajnom zemljopisnom području. |
|
(c) |
Načela korištena za određivanje sezonski slobodnog razdoblja od vektora određuju se uzimajući u obzir podatke iz tekuće i iz prethodne godine (povijesne podatke). Nadalje, u razmatranje se uzimaju stanovišta vezana uz standardizaciju podataka o nadziranju. |
2. Posebna načela
|
(a) |
Nikakvo kruženje virusa bolesti plavog jezika unutar epidemiološki značajnog zemljopisnog područja, kako je dokazano programima nadziranja bolesti plavog jezika ili drugi dokaz koji ukazuje na zaustavljanje virusa bolesti plavog jezika. |
|
(b) |
Zaustavljanje vektora ili vjerojatne aktivnosti vektora, kako je dokazano entomološkim nadziranjem kao dijelom programa praćenja i/ili nadziranja bolesti plavog jezika. |
|
(c) |
Hvatanje vrsta Culicoides za koje je dokazano ili se sumnja da su vektori serotipa koji je nazočan u epidemiološki značajnom zemljopisnom području ispod maksimalnog praga prikupljenih vektora koji se određuje za epidemiološki značajno zemljopisno područje. U odsutnosti solidnih dokaza koji potkrepljuju određivanje maksimalnog praga, mora se koristiti potpuna odsutnost primjeraka vrste Culicoides imicola i manje od pet Culicoidesa po zamci. |
3. Dopunska načela
|
(a) |
Temperaturni uvjeti koji utječu na ponašanje aktivnosti vektora u epidemiološki značajnom zemljopisnom području. Temperaturni pragovi određuju se razmatrajući ekološko ponašanje vrsta Culicoides za koje je dokazano ili se sumnja da su vektori serotipa nazočnog u epidemiološki značajnom zemljopisnom području. |
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
226 |
32007D0777
|
L 312/49 |
SLUŽBENI LIST EUROPSKE UNIJE |
29.11.2007. |
ODLUKA KOMISIJE
od 29. studenoga 2007.
o utvrđivanju uvjeta za zdravlje životinja i javno zdravlje te obrazaca certifikata za uvoz iz trećih zemalja određenih mesnih proizvoda i obrađenih želudaca, mjehura i crijeva za prehranu ljudi i o stavljanju izvan snage Odluke 2005/432/EZ
(priopćena pod brojem dokumenta C(2007) 5777)
(Tekst značajan za EGP)
(2007/777/EZ)
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Direktivu Vijeća 92/118/EEZ od 17. prosinca 1992. o utvrđivanju zahtjeva za zdravlje životinja i zahtjeva za javno zdravlje kojima se uređuje trgovina i uvoz u Zajednicu proizvoda koji ne podliježu navedenim zahtjevima utvrđenima u posebnim pravilima Zajednice iz Priloga A dijela I. Direktive 89/662/EEZ te, s obzirom na patogene tvari, iz Direktive 90/425/EEZ (1), a posebno njezin članak 10. stavak 2. točku (c),
uzimajući u obzir Direktivu Vijeća 2002/99/EZ od 16. prosinca 2002. o utvrđivanju zdravstvenih pravila za životinje kojima se uređuje proizvodnja, prerada, stavljanje u promet i unošenje proizvoda životinjskog podrijetla namijenjenih prehrani ljudi (2), a posebno uvodnu rečenicu članka 8., prvi stavak točke 1. članka 8., članak 8. stavak 4., članak 9. stavak 2. točku (b) i članak 9. stavak 4. točke (b) i (c),
budući da:
|
(1) |
Odlukom Komisije 2005/432/EZ od 3. lipnja 2005. o utvrđivanju uvjeta zdravlja životinja i javnog zdravlja uvjetima te obrascima certifikata za uvoz mesnih proizvoda namijenjenih prehrani ljudi i o stavljanju izvan snage odluka 97/41/EZ, 97/221/EZ i 97/222/EZ (3), utvrđuju se pravila u vezi sa zdravljem životinja i javnim zdravljem te zahtjevi u vezi s certifikatima za uvoz pošiljaka određenih mesnih proizvoda u Zajednicu, uključujući popis trećih zemalja i njihovih dijelova iz kojih je uvoz takvih proizvoda odobren. |
|
(2) |
Odluka 2005/432/EZ, kako je izmijenjena Odlukom Komisije 2006/801/EZ (4), uzima u obzir zdravstvene zahtjeve i definicije utvrđene u Uredbi (EZ) br. 852/2004 Europskog parlamenta i Vijeća od 29. travnja 2004. o higijeni hrane (5), Uredbi (EZ) br. 853/2004 Europskog parlamenta i Vijeća od 29. travnja 2004. o utvrđivanju određenih higijenskih pravila za hranu životinjskog podrijetla (6), te u Uredbi (EZ) br. 854/2004 Europskog parlamenta i Vijeća od 29. travnja 2004. o utvrđivanju posebnih pravila organizacije službenih kontrola proizvoda životinjskog podrijetla koji su namijenjeni prehrani ljudi (7). |
|
(3) |
Prilogom I. Uredbi (EZ) br. 853/2004 utvrđuju se posebne definicije za mesne proizvode i za obrađene želuce, mjehure i crijeva. |
|
(4) |
Posebni postupci obrade koji su Odlukom 2005/432/EZ utvrđeni za svaku treću zemlju, uspostavljaju se na temelju obrada utvrđenih Direktivom 2002/99/EZ kako bi se uklonio mogući rizik u pogledu zdravlja životinja koji nosi svježe meso upotrijebljeno u pripremi mesnih proizvoda. S aspekta zdravlja životinja, obrađeni želuci, mjehuri i crijeva predstavljaju jednak rizik po zdravlje životinja kao i mesni proizvodi. Stoga se oni moraju obrađivati istim posebnim postupcima koji su predviđeni u Odluci 2005/423/EZ, a zatim podvrgnuti usklađenom veterinarskom certificiranju za uvoz u Zajednicu. |
|
(5) |
Zahtjevi za zdravlje životinja za uvoz crijeva u EU utvrđeni su u Odluci 2003/779/EZ (8). Stoga proizvode obuhvaćene Odlukom 2003/779/EZ treba isključiti iz definicije mesnih proizvoda i obrađenih želudaca, mjehura i crijeva utvrđenih ovom Odlukom. |
|
(6) |
U Odluci Komisije 2004/432/EZ od 29. travnja 2004. o odobravanju planova za praćenje ostataka koje su podnijele treće države u skladu s Direktivom Vijeća 96/23/EZ (9), nalazi se popis trećih zemalja koje imaju odobrenje za izvoz u Zajednicu na temelju njihovog odobrenog plana za praćenje ostataka. |
|
(7) |
Direktivom Vijeća 97/78/EZ (10) od 18. prosinca 1997. o utvrđivanju načela organizacije veterinarskih pregleda proizvoda koji ulaze u Zajednicu iz trećih zemalja, utvrđuju se pravila o veterinarskim pregledima životinjskih proizvoda koji se unose u Zajednicu iz trećih zemalja radi uvoza i provoza proizvoda životinjskog podrijetla u Zajednicu, uključujući određene zahtjeve u vezi sa certificiranjem. |
|
(8) |
Potrebno je utvrditi posebne uvjete za provoz pošiljaka mesnih proizvoda kroz Zajednicu u Rusiju i iz Rusije radi zemljopisnog položaja Kaliningrada te uzimajući u obzir klimatske poteškoće koje sprečavaju korištenje nekih luka u određenim razdobljima godine. |
|
(9) |
U Odluci Komisije 2001/881/EZ (11) od 7. prosinca 2001. o sastavljanju popisa graničnih inspekcijskih postaja dogovorenih za veterinarske preglede životinja i proizvoda životinjskog podrijetla iz trećih zemalja te o ažuriranju detaljnih pravila o pregledima koje provode stručnjaci Komisije, navode se granične inspekcijske postaje koje su ovlaštene za nadzor provoza pošiljaka mesnih proizvoda kroz Zajednicu u Rusiju i iz Rusije. |
|
(10) |
Prilogom II. Odluci Vijeća 79/542/EEZ od 21. prosinca 1976. o sastavljanju popisa trećih zemalja ili dijelova trećih zemalja te o utvrđivanju uvjeta za zdravlje životinja i javno zdravlje i uvjeta veterinarskog certificiranja, za uvoz u Zajednicu određenih živih životinja i njihovog svježeg mesa (12), uspostavlja se popis trećih zemalja ili njihovih dijelova iz kojih je odobren uvoz svježeg mesa određenih životinja. U Prilogu II. toj Odluci, Island je naveden kao država koja ima odobrenje za izvoz svježeg mesa određenih životinja. Stoga uvoz mesnih proizvoda i obrađenih želudaca, mjehura i crijeva tih životinja iz Islanda treba dopustiti bez primjene bilo kakve posebne obrade. |
|
(11) |
Prilogom 11. Sporazumu između Europske zajednice i Švicarske Konfederacije o trgovini poljoprivrednim proizvodima (13) utvrđuju se mjere za zdravlje životinja i javno zdravlje te zootehničke mjere koje se primjenjuju na trgovinu živim životinjama i proizvodima životinjskog podrijetla. Obrade koje se primjenjuju na mesne proizvode i obrađene želuce, mjehure i crijeva iz Švicarske Konfederacije moraju biti u skladu s tim sporazumom. Stoga nije potrebno odrediti te obrade u Prilogu ovoj Odluci. |
|
(12) |
Prilog IX. Uredbi (EZ) br. 999/2001 Europskog parlamenta i Vijeća od 22. svibnja 2001. o utvrđivanju pravila za sprečavanje, kontrolu i iskorjenjivanje određenih transmisivnih spongiformnih encefalopatija (14), izmijenjen je Uredbom Komisije (EZ) br. 722/2007 od 25. lipnja 2007. o izmjeni priloga II., V., VI., VIII., IX. i XI. Uredbi (EZ) br. 999/2001 (15) i Uredbom (EZ) br. 1275/2007 (16) o izmjeni Priloga IX. Uredbi (EZ) br. 999/2001 Europskog parlamenta i Vijeća o utvrđivanju pravila za sprečavanje, nadzor i iskorjenjivanje određenih transmisivnih encefalopatija. U certifikat treba uključiti nove zahtjeve u vezi s GSE statusom trećih zemalja koje izvoze mesne proizvode i obrađena crijeva u Zajednicu. |
|
(13) |
Odluka Komisije 2007/453/EZ od 29. lipnja 2007. o utvrđivanju GSE statusa država članica ili trećih zemalja ili njihovih regija na temelju njihova rizika od GSE (17), sadrži popis država ili regija podijeljen u tri skupine: zanemariv rizik od GSE-a, kontrolirani rizik od GSE-a pod nadzorom, i neutvrđeni od GSE-a. U certifikat treba uključiti upućivanje na taj popis. |
|
(14) |
U interesu jasnoće zakonodavstva Zajednice, primjereno je da se Odluka 2005/432/EZ stavi izvan snage i zamijeni ovom Odlukom. |
|
(15) |
Mjere predviđene ovom Odlukom u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU ODLUKU:
Članak 1.
Predmet i područje primjene
1. Ovom se Odlukom utvrđuju pravila za zdravlje životinja i javno zdravlje za uvoz u Zajednicu te provoz kroz Zajednicu i skladištenje u Zajednici pošiljaka:
|
(a) |
mesnih proizvoda, kako su definirani u točki 7.1. Priloga I. Uredbi (EZ) br. 853/2004; i |
|
(b) |
obrađenih želudaca, mjehura i crijeva, kako su definirani u točki 7.9. tog Priloga, koji su bili podvrgnuti jednom od postupaka obrade utvrđenih u dijelu 4. Priloga II. ovoj Odluci. |
Ta pravila uključuju popise trećih zemalja i njihovih dijelova iz kojih je ovaj uvoz odobren te obrasce javnozdravstvenih certifikata i certifikata o zdravlju životinja, kao i pravila u vezi s podrijetlom i obradom potrebnima za takav uvoz.
2. Ova se Odluka primjenjuje ne dovodeći u pitanje Odluku 2004/432/EZ i Odluku 2003/779/EZ.
Članak 2.
Uvjeti u pogledu životinjskih vrsta i životinja
Države članice osiguravaju da se u Zajednicu uvoze samo pošiljke mesnih proizvoda i obrađenih želudaca, mjehura i crijeva koji su dobiveni od mesa ili mesnih proizvoda od sljedećih životinjskih vrsta ili životinja:
|
(a) |
perad, uključujući kokoši, purane, biserke, patke, guske, prepelice, golubove, fazane i jarebice koji se uzgajaju ili drže u zatočeništvu za rasplod, proizvodnju mesa, ili jaja za prehranu,ili za obnovu populacije divljih ptica; |
|
(b) |
domaće životinje sljedećih vrsta: goveda, uključujući Bubalus bubalis i Bison bison, svinje, ovce, koze i jednopapkare; |
|
(c) |
kunići i zečevi, te divljač iz farmskog uzgoja, kako je definirano u točki 1.6. Priloga I. Uredbi (EZ) br. 853/2004; |
|
(d) |
divljač, kako je definirano u točki 1.5. Priloga I. Uredbi (EZ) br. 853/2004. |
Članak 3.
Zahtjevi zdravlja životinja u pogledu podrijetla i obrade mesnih proizvoda i obrađenih želudaca, mjehura i crijeva
Države članice odobravaju uvoz mesnih proizvoda i obrađenih želudaca, mjehura i crijeva u Zajednicu, koji:
|
(a) |
ispunjavaju uvjete u pogledu podrijetla i obrade iz Priloga I. točke 1. ili točke 2.; i |
|
(b) |
podrijetlom su iz sljedećih trećih zemalja i njihovih dijelova:
|
Članak 4.
Zahtjevi za javno zdravlje u pogledu svježeg mesa koje se upotrebljava u proizvodnji mesnih proizvoda i obrađenih želudaca, mjehura i crijeva za uvoz u Zajednicu te javnozdravstvenih certifikata i certifikata o zdravlju životinja
Države članice osiguravaju:
|
(a) |
da se u Zajednicu uvoze samo pošiljke mesnih proizvoda i obrađenih želudaca, mjehura i crijeva koji su dobiveni od svježeg mesa, kako je definirano u točki 1.10. Priloga I. Uredbi (EZ) br. 853/2004, koje je u skladu sa zahtjevima za javno zdravlje Zajednice; |
|
(b) |
da se u Zajednicu uvoze samo pošiljke mesnih proizvoda i obrađenih želudaca, mjehura i crijeva koji su u skladu sa zahtjevima obrazaca javnozdravstvenog certifikata i certifikata o zdravlju životinja određenog u Prilogu III.; |
|
(c) |
da je takvim pošiljkama priložen certifikat koji je propisno ispunio i potpisao službeni veterinar treće zemlje iz koje je ta pošiljka otpremljena. |
Članak 5.
Pošiljke mesnih proizvoda i obrađenih želudaca, mjehura i crijeva u provozu ili skladištene u Zajednici
Države članice osiguravaju da su pošiljke mesnih proizvoda i obrađenih želudaca, mjehura i crijeva koje su ušle u Zajednicu i koje su namijenjene trećoj zemlji odmah nakon provoza ili nakon skladištenja u skladu s člankom 12. stavkom 4. ili člankom 13. Direktive 97/78/EZ i koje nisu namijenjene uvozu u Zajednicu, u skladu sa sljedećim zahtjevima:
|
(a) |
dolaze iz državnog područja treće zemlje ili njezinog dijela navedenog u Prilogu II. i bile su podvrgnute minimalnoj obradi za uvoz mesnih proizvoda i obrađenih želudaca, mjehura i crijeva životinjskih vrsta predviđenih u tom Prilogu; |
|
(b) |
ispunjavaju posebne uvjete zdravlja životinja za predmetne životinjske vrste određene u obrascu certifikata o zdravlju životinja i javnozdravstvenog certifikata iz Priloga III.; |
|
(c) |
popraćene su certifikatom o zdravlju životinja sastavljenim u skladu s obrascem određenim u Prilogu IV. koji je na odgovarajući način potpisao službeni veterinar dotične treće zemlje; |
|
(d) |
službeni veterinar na graničnoj inspekcijskoj postaji ulaska u Zajednicu na zajedničkom veterinarskom dokumentu o ulasku potvrđuje njihovu prikladnost za provoz ili skladištenje, prema potrebi. |
Članak 6.
Odstupanja za određena odredišta u Rusiji
1. Odstupajući od članka 5., države članice odobravaju provoz cestom ili željeznicom kroz Zajednicu, između određenih graničnih inspekcijskih postaja Zajednice navedenih u Prilogu Odluci 2001/881/EZ, za pošiljke mesnih proizvoda i obrađenih želuca, mjehura i crijeva koji dolaze iz Rusije i kojima je odredište Rusija, izravno ili preko neke druge treće zemlje, pod uvjetom da su u skladu sa sljedećim zahtjevima:
|
(a) |
službeni veterinar nadležnog tijela granične inspekcijske postaje ulaza u Zajednicu pečati pošiljku serijski numeriranom plombom; |
|
(b) |
službeni veterinar nadležnog tijela granične inspekcijske postaje ulaza u Zajednicu, na svaku stranicu dokumenata koji se prilažu pošiljci i koji su navedeni u članku 7. Direktive 97/78/EZ stavlja pečat „SAMO ZA PROVOZ U RUSIJU PREKO EZ”; |
|
(c) |
ispunjeni su postupovni zahtjevi predviđeni u članku 11. Direktive 97/78/EZ; |
|
(d) |
službeni veterinar nadležnog tijela granične inspekcijske postaje ulaska u Zajednicu na zajedničkom veterinarskom dokumentu o ulasku potvrđuje prihvatljivost pošiljke za provoz. |
2. Države članice ne dopuštaju istovar ili skladištenje takvih pošiljaka u Zajednici, kako je definirano u članku 12. stavku 4. ili članku 13. Direktive 97/78/EZ.
3. Države članice osiguravaju da nadležno tijelo redovito obavlja revizije kako bi se osiguralo da broj pošiljaka i količina mesnih proizvoda i prerađenih želudaca, mjehura i crijeva koji dolaze iz Rusije ili su upućeni u Rusiju, koji napuštaju Zajednicu, odgovara broju i količinama koje su ušle u Zajednicu.
Članak 7.
Prijelazna odredba
Pošiljke za koje su veterinarski certifikati izdani prije 1. svibnja 2008. u skladu s obrascima utvrđenima Odlukom 2005/432/EZ prihvaćaju se za uvoz u Zajednicu do 1. lipnja 2008.
Članak 8.
Stavljanje izvan snage
Odluka 2005/432/EZ stavlja se izvan snage.
Članak 9.
Datum primjene
Ova se Odluka primjenjuje od 1. prosinca 2007.
Članak 10.
Upućivanje
Ova je Odluka upućena državama članicama.
Sastavljeno u Bruxellesu 29. studenoga 2007.
Za Komisiju
Markos KYPRIANOU
Član Komisije
(1) SL L 62, 15.3.1993., str. 49. Direktiva kako je zadnje izmijenjena Uredbom Komisije (EZ) br. 445/2004 (SL L 72, 11.3.2004., str. 60.).
(2) SL L 18, 23.1.2003., str. 11.
(3) SL L 151, 14.6.2005., str. 3. Odluka kako je zadnje izmijenjena Uredbom komisije (EZ) br. 1792/2006 (SL L 362, 20.12.2006., str. 1.).
(4) SL L 329, 25.11.2006., str. 26.
(5) SL L 139, 30.4.2004., str. 1.; ispravljena verzija SL L 226, 25.6.2004., str. 3.
(6) SL L 139, 30.4.2004., str. 55.; ispravljena verzija SL L 226, 25.6.2004., str. 22. Uredba kako je zadnje izmijenjena Uredbom Vijeća (EZ) br. 1791/2006 (SL L 363, 20.12.2006., str. 1.).
(7) SL L 139, 30.4.2004., str. 206.; ispravljena verzija SL L 226, 25.6.2004., str. 83. Uredba kako je zadnje izmijenjena Uredbom Vijeća (EZ) br. 1791/2006.
(8) SL L 285, 1.11.2003., str. 38. Odluka kako je izmijenjena Odlukom 2004/414/EZ (SL L 151, 30.4.2004., str. 56.).
(9) SL L 154, 30.4.2004., str. 44. Odluka kako je zadnje izmijenjena Odlukom 2007/362/EZ (SL L 138, 30.5.2007., str. 18.).
(10) SL L 24, 30.1.1998., str. 9. Direktiva kako je zadnje izmijenjena Direktivom 2006/104/EZ (SL L 363, 20.12.2006., str. 352.).
(11) SL L 326, 11.12.2006., str. 44. Odluka kako je zadnje izmijenjena Odlukom 2007/276/EZ (SL L 116, 4.5.2007., str. 34.).
(12) SL L 146, 14.6.1979., str. 15. Odluka kako je zadnje izmijenjena Uredbom (EZ) br. 1791/2006 (SL L 363, 20.12.2006., str. 1.).
(13) SL L 114, 30.4.2002., str. 132.
(14) SL L 147, 31.5.2001., str. 1. Uredba kako je zadnje izmijenjena Uredbom (EZ) br. 727/2007 (SL L 165, 27.6.2007., str. 8.).
(15) SL L 164, 26.6.2007., str. 7.
(16) SL L 284, 30.10.2007., str. 8.
(17) SL L 172, 30.6.2007., str. 84.
PRILOG I.
|
1. |
Mesni proizvodi i obrađeni želuci, mjehuri i crijeva podrijetlom iz trećih zemalja ili dijelova trećih zemalja iz članka 3. točke (b) podtočke i. ove Odluke:
|
|
2. |
Mesni proizvodi i obrađeni želuci, mjehuri i crijeva podrijetlom iz trećih zemalja ili dijelova trećih zemalja iz članka 3. točke (b) podtočke ii. ispunjavaju uvjete predviđene u točkama (a), (b) ili (c) ovog stavka:
|
|
3. |
Obrade određene u dijelu 4. Priloga II. čine minimalne prihvatljive uvjeti prerade u smislu zdravlja životinja za mesne proizvode i želuce, mjehure i crijeva koji su dobiveni od odgovarajuće životinjske vrste ili životinje podrijetlom iz trećih zemalja ili dijelova trećih zemalja koji su navedeni u Prilogu II. Međutim, ako zbog ograničenja Zajednice vezanih uz zdravlje životinja uvoz iznutrica nije odobren u skladu s Odlukom 79/542/EZ, one se mogu uvesti kao mesni proizvod ili obrađeni želuci, mjehuri ili crijeva, ili upotrijebljeni u mesnom proizvodu, pod uvjetom da je obavljena odgovarajuća obrada iz dijela 2. Priloga II. i ako su ispunjeni zahtjevi za javno zdravlje Zajednice. Povrh toga, objektu iz države navedene u Prilogu II. može se odobriti proizvodnja mesnih proizvoda i obrađenih želudaca, mjehura i crijeva koji su bili podvrgnuti obradama B, C ili D, kako je navedeno u dijelu 4. Priloga II. i kada se taj objekt nalazi u trećoj zemlji ili dijelu treće zemlje koji nema odobrenje za uvoz svježeg mesa u Zajednicu, pod uvjetom da su ispunjeni zahtjevi za javno zdravlje Zajednice. |
PRILOG II.
DIO 1.
Regionalizirana područja za države navedene u dijelovima 2. i 3.
|
Država |
Područje |
Opis područja |
|
|
Oznaka ISO |
Verzija |
||
|
Argentina |
AR |
01/2004 |
Cijela država |
|
AR-1 |
01/2004 |
Cijela država osim provincija Chubut, Santa Cruz i Tierra del Fuego za životinjske vrste obuhvaćene Odlukom 79/542/EEZ (kako je zadnje izmijenjena) |
|
|
AR-2 |
01/2004 |
Provincije Chubut, Santa Cruz i Tierra del Fuego za životinjske vrste obuhvaćene Odlukom 79/542/EEZ (kako je zadnje izmijenjena) |
|
|
Brazil |
BR |
01/2004 |
Cijela država |
|
BR-1 |
01/2005 |
Savezne države Rio Grande do Sul, Santa Catarina, Paraná, São Paulo i Mato Grosso do Sul |
|
|
BR-2 |
01/2005 |
Dio savezne države Mato Grosso do Sul (osim općina Sonora, Aquidauana, Bodoqueno, Bonito, Caracol, Coxim, Jardim, Ladario, Miranda, Pedro Gomes, Porto Murtinho, Rio Negro, Rio Verde of Mato Grosso i Corumbá); Savezna država Paraná; Savezna država Sao Paulo; Dio savezne države Minas Gerais (osim okružja Oliveira, Passos, São Gonçalo de Sapucai, Setelagoas i Bambuí); Savezna država Espíritu Santo; Savezna država Rio Grande do Sul; Savezna država Santa Catarina; Savezna država Goias; Dio savezne države Mato Grosso koji obuhvaća: regionalnu jedinicu Cuiaba (osim općina San Antonio de Leverger, Nossa Senhora do Livramento, Pocone i Barão de Melgaço); regionalnu jedinicu Caceres (osim općine Caceres); regionalnu jedinicu Lucas do Rio Verde; regionalnu jedinicu Rondonopolis (osim općine Itiquiora); regionalnu jedinicu Barra do Garça i regionalnu jedinicu Barra do Burgres. |
|
|
BR-3 |
01/2005 |
Savezne države Goiás, Minas Gerais, Mato Grosso, Mato Grosso do Sul, Paraná, Rio Grande do Sul, Santa Catarina i São Paulo |
|
|
Malezija |
MY |
01/2004 |
Cijela država |
|
MY-1 |
01/2004 |
Samo poluotočna (zapadna) Malezija |
|
|
Namibija |
NA |
01/2005 |
Cijela država |
|
NA-1 |
01/2005 |
Južno od granice kordona koji se proteže od Palgrave Pointa na zapadu do Gama na istoku |
|
|
Južna Afrika |
ZA |
01/2005 |
Cijela država |
|
ZA-1 |
01/2005 |
Cijela država osim: dijela područja koje je pod kontrolom radi slinavke i šapa i koje je smješteno u veterinarskim regijama Mpumalanga i sjevernim pokrajinama, u distriktu Ingwavuma veterinarske regije Natal, te u pograničnom području s Bocvanom istočno od 28° zemljopisne dužine, i distrikta Camperdown u pokrajini KwaZuluNatal |
|
DIO 2.
Treće zemlje ili dijelovi trećih zemalja iz kojih je odobren uvoz mesnih proizvoda i obrađenih želudaca, mjehura i crijeva u EU (za objašnjenje oznaka upotrijebljenih u ovoj tabeli vidjeti dio 4. ovog Priloga)
|
Oznaka ISO |
Država podrijetla ili njezin dio |
|
Domaće ovce/koze |
|
Domaći kopitari |
|
Farmski uzgojene bezgrebenke |
Domaći kunići i farmski uzgojeni leporidae |
Divlji dvopapkari (osim svinja) |
Divlje svinje |
Divlji kopitari |
Divlji leporidae (zečevi i kunići) |
Divlje ptice |
Divlji kopneni sisavci (osim papkara, kopitara i leporidae) |
||||||||||||
|
AR |
Argentina AR |
C |
C |
C |
A |
A |
A |
A |
C |
C |
XXX |
A |
D |
XXX |
||||||||||||
|
Argentina AR-1 (1) |
C |
C |
C |
A |
A |
A |
A |
C |
C |
XXX |
A |
D |
XXX |
|||||||||||||
|
Argentina AR-2 (1) |
A (2) |
A (2) |
C |
A |
A |
A |
A |
C |
C |
XXX |
A |
D |
XXX |
|||||||||||||
|
AU |
Australija |
A |
A |
A |
A |
D |
D |
A |
A |
A |
XXX |
A |
D |
A |
||||||||||||
|
BH |
Bahrein |
B |
B |
B |
B |
XXX |
XXX |
A |
C |
C |
XXX |
A |
XXX |
XXX |
||||||||||||
|
BR |
Brazil |
XXX |
XXX |
XXX |
A |
D |
D |
A |
XXX |
XXX |
XXX |
A |
D |
XXX |
||||||||||||
|
Brazil BR-1 |
XXX |
XXX |
XXX |
A |
XXX |
A |
A |
XXX |
XXX |
XXX |
A |
A |
XXX |
|||||||||||||
|
Brazil BR-2 |
C |
C |
C |
A |
D |
D |
A |
C |
XXX |
XXX |
A |
D |
XXX |
|||||||||||||
|
Brazil BR-3 |
XXX |
XXX |
XXX |
A |
A |
XXX |
A |
XXX |
XXX |
XXX |
A |
D |
XXX |
|||||||||||||
|
BW |
Bocvana |
B |
B |
B |
B |
XXX |
A |
A |
B |
B |
A |
A |
XXX |
XXX |
||||||||||||
|
BY |
Bjelarus |
C |
C |
C |
B |
XXX |
XXX |
A |
C |
C |
XXX |
A |
XXX |
XXX |
||||||||||||
|
CA |
Kanada |
A |
A |
A |
A |
A |
A |
A |
A |
A |
XXX |
A |
A |
A |
||||||||||||
|
CH |
Švicarska (3) |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
CL |
Čile |
A |
A |
A |
A |
A |
A |
A |
B |
B |
XXX |
A |
A |
XXX |
||||||||||||
|
CN |
Kina |
B |
B |
B |
B |
B |
B |
A |
B |
B |
XXX |
A |
B |
XXX |
||||||||||||
|
CO |
Kolumbija |
B |
B |
B |
B |
XXX |
A |
A |
B |
B |
XXX |
A |
XXX |
XXX |
||||||||||||
|
ET |
Etiopija |
B |
B |
B |
B |
XXX |
XXX |
A |
B |
B |
XXX |
A |
XXX |
XXX |
||||||||||||
|
GL |
Grenland |
XXX |
XXX |
XXX |
XXX |
XXX |
XXX |
A |
XXX |
XXX |
XXX |
A |
A |
A |
||||||||||||
|
HK |
Hong Kong |
B |
B |
B |
B |
D |
D |
A |
B |
B |
XXX |
A |
XXX |
XXX |
||||||||||||
|
HR |
Hrvatska |
A |
A |
D |
A |
A |
A |
A |
A |
D |
XXX |
A |
A |
XXX |
||||||||||||
|
IL |
Izrael |
B |
B |
B |
B |
A |
A |
A |
B |
B |
XXX |
A |
A |
XXX |
||||||||||||
|
IN |
Indija |
B |
B |
B |
B |
XXX |
XXX |
A |
B |
B |
XXX |
A |
XXX |
XXX |
||||||||||||
|
IS |
Island |
A |
A |
B |
A |
A |
A |
A |
A |
B |
XXX |
A |
A |
XXX |
||||||||||||
|
KE |
Kenija |
B |
B |
B |
B |
XXX |
XXX |
A |
B |
B |
XXX |
A |
XXX |
XXX |
||||||||||||
|
KR |
Južna Koreja |
XXX |
XXX |
XXX |
XXX |
D |
D |
A |
XXX |
XXX |
XXX |
A |
D |
XXX |
||||||||||||
|
MA |
Maroko |
B |
B |
B |
B |
XXX |
XXX |
A |
B |
B |
XXX |
A |
XXX |
XXX |
||||||||||||
|
ME |
Crna Gora |
A |
A |
D |
A |
D |
D |
A |
D |
D |
XXX |
A |
XXX |
XXX |
||||||||||||
|
MG |
Madagaskar |
B |
B |
B |
B |
D |
D |
A |
B |
B |
XXX |
A |
D |
XXX |
||||||||||||
|
MK |
bivša jugoslavenska republika Makedonija (4) |
A |
A |
B |
A |
XXX |
XXX |
A |
B |
B |
XXX |
A |
XXX |
XXX |
||||||||||||
|
MU |
Mauricijus |
B |
B |
B |
B |
XXX |
XXX |
A |
B |
B |
XXX |
A |
XXX |
XXX |
||||||||||||
|
MX |
Meksiko |
A |
D |
D |
A |
D |
D |
A |
D |
D |
XXX |
A |
D |
XXX |
||||||||||||
|
MY |
Malezija MY |
XXX |
XXX |
XXX |
XXX |
XXX |
XXX |
XXX |
XXX |
XXX |
XXX |
XXX |
XXX |
XXX |
||||||||||||
|
Malezija MY-1 |
XXX |
XXX |
XXX |
XXX |
D |
D |
A |
XXX |
XXX |
XXX |
A |
D |
XXX |
|||||||||||||
|
NA |
Namibija (1) |
B |
B |
B |
B |
D |
A |
A |
B |
B |
A |
A |
D |
XXX |
||||||||||||
|
NZ |
Novi Zeland |
A |
A |
A |
A |
A |
A |
A |
A |
A |
XXX |
A |
A |
A |
||||||||||||
|
PY |
Paragvaj |
C |
C |
C |
B |
XXX |
XXX |
A |
C |
C |
XXX |
A |
XXX |
XXX |
||||||||||||
|
RS |
Srbija (5) |
A |
A |
D |
A |
D |
D |
A |
D |
D |
XXX |
A |
XXX |
XXX |
||||||||||||
|
RU |
Rusija |
C |
C |
C |
B |
XXX |
XXX |
A |
C |
C |
XXX |
A |
XXX |
A |
||||||||||||
|
SG |
Singapur |
B |
B |
B |
B |
D |
D |
A |
B |
B |
XXX |
A |
XXX |
XXX |
||||||||||||
|
SZ |
Svaziland |
B |
B |
B |
B |
XXX |
XXX |
A |
B |
B |
A |
A |
XXX |
XXX |
||||||||||||
|
TH |
Tajland |
B |
B |
B |
B |
A |
A |
A |
B |
B |
XXX |
A |
D |
XXX |
||||||||||||
|
TN |
Tunis |
C |
C |
B |
B |
A |
A |
A |
B |
B |
XXX |
A |
D |
XXX |
||||||||||||
|
TR |
Turska |
XXX |
XXX |
XXX |
XXX |
D |
D |
A |
XXX |
XXX |
XXX |
A |
D |
XXX |
||||||||||||
|
UA |
Ukrajina |
XXX |
XXX |
XXX |
XXX |
XXX |
XXX |
A |
XXX |
XXX |
XXX |
A |
XXX |
XXX |
||||||||||||
|
US |
Sjedinjene Američke Države |
A |
A |
A |
A |
A |
A |
A |
A |
A |
XXX |
A |
A |
XXX |
||||||||||||
|
UY |
Urugvaj |
C |
C |
B |
A |
D |
A |
A |
XXX |
XXX |
XXX |
A |
D |
XXX |
||||||||||||
|
ZA |
Južna Afrika (1) |
C |
C |
C |
A |
D |
A |
A |
C |
C |
A |
A |
D |
XXX |
||||||||||||
|
ZW |
Zimbabve (1) |
C |
C |
B |
A |
D |
A |
A |
B |
B |
XXX |
A |
D |
XXX |
||||||||||||
|
||||||||||||||||||||||||||
DIO 3.
Treće zemlje ili dijelovi trećih zemalja koje nisu odobrene u okviru režima nespecifične obrade (A), ali iz kojih je dozvoljen uvoz usoljenog suhog mesa (biltong/jerky) i pasteriziranih mesnih proizvoda u Zajednicu
|
Oznaka ISO |
Država podrijetla ili njezin dio |
|
Domaće ovce/koze |
|
Domaći kopitari |
|
Bezgrebenke |
Domaći kunići i farmski uzgojeni leporidae |
Divlji dvopapkari (osim svinja) |
Divlje svinje |
Divlji kopitari |
Divlji leporidae (zečevi i kunići) |
Divlje ptice |
Divlji kopneni sisavci (osim papkara, kopitara i leporidae) |
||||||||||||
|
AR |
Argentina - AR |
F |
F |
XXX |
XXX |
XXX |
XXX |
A |
XXX |
XXX |
XXX |
A |
XXX |
XXX |
||||||||||||
|
NA |
Namibija |
XXX |
XXX |
XXX |
XXX |
E |
E |
A |
XXX |
XXX |
A |
A |
E |
XXX |
||||||||||||
|
Namibija NA-1 |
E |
E |
XXX |
XXX |
E |
E |
A |
XXX |
XXX |
A |
A |
E |
||||||||||||||
|
ZA |
Južna Afrika |
XXX |
XXX |
XXX |
XXX |
E |
E |
A |
XXX |
XXX |
A |
A |
E |
XXX |
||||||||||||
|
Južna Afrika ZA-1 |
E |
E |
XXX |
XXX |
E |
E |
A |
XXX |
XXX |
A |
A |
E |
|
|||||||||||||
|
ZW |
Zimbabve |
XXX |
XXX |
XXX |
XXX |
E |
E |
A |
XXX |
XXX |
E |
A |
E |
XXX |
DIO 4.
Objašnjenje oznaka upotrijebljenih u tablicama u dijelovima 2. i 3.
OBRADE IZ PRILOGA I.
Nespecifična obrada:
|
A |
= |
Za potrebe zdravlja životinja nije određena najniža temperatura ili drugi način obrade za mesne proizvode i obrađene želuce, mjehure i crijeva. Međutim, meso takvih mesnih proizvoda i obrađenih želudaca, mjehur i crijeva mora biti obrađeno tako da površina reza pokazuje da ono više nema obilježja svježeg mesa, a upotrijebljeno svježe meso mora također zadovoljavati zdravstvena pravila za životinje koja se primjenjuju za izvoz svježeg mesa u Zajednicu. |
Specifične obrade navedene silaznim slijedom po stupnju strogosti:
|
B |
= |
Obrada u hermetički zatvorenoj posudi do vrijednosti Fo tri ili više. |
||||
|
C |
= |
Za vrijeme obrade mesnog proizvoda i obrađenih želudaca, mjehura i crijeva mora se u svim dijelovima mesa i/ili želudaca, mjehura i crijeva postići temperatura od najmanje 80 °C. |
||||
|
D |
= |
Za vrijeme obrade mesnog proizvoda i obrađenih želudaca, mjehura i crijeva, mora se u svim dijelovima mesa i/ili želudaca, mjehura i crijeva postići temperatura od najmanje 70 °C, ili za sirovu šunku, obrada koja se sastoji od prirodne fermentacije i zrenja tijekom najmanje devet mjeseci i koja rezultira sljedećim obilježjima:
|
||||
|
E |
= |
u slučaju proizvoda tipa „biltong”, obrada kojom se postiže:
|
||||
|
F |
= |
Toplinska obrada koja osigurava da je temperatura u središtu najmanje 65 °C onoliko vremena koliko je potrebno da se dosegne vrijednost pasterizacije (pv), koja je jednaka ili veća od 40. |
(1) Vidjeti dio 3. ovog Priloga za minimalne zahtjeve u vezi s obradom koja se primjenjuje na pasterizirane mesne proizvode i biltong.
(2) Za mesne proizvode i obrađene želuce, mjehure i crijeva pripremljene od svježeg mesa dobivenog od životinja zaklanih nakon 1. ožujka 2002.
(3) U skladu sa Sporazumom između Europske zajednice i Švicarske Konfederacije o trgovini poljoprivrednim proizvodima
(4) bivša bugoslavenska republika Makedonija: privremena oznaka koja ni na koji način ne prejudicira konačnu nomenklaturu za ovu državu koja će biti dogovorena nakon što završe pregovori koji se trenutačno vode o ovom predmetu u Ujedinjenim narodima.
(5) Ne uključuje Kosovo kako je definirano u Rezoluciji Vijeća sigurnosti Ujedinjenih naroda 1244 od 10. lipnja 1999.
|
XXX |
Nije utvrđen certifikat, a mesni proizvodi i obrađeni želuci, mjehuri i crijeva koji sadrže meso ovih životinjskih vrsta nisu odobreni. |
PRILOG III.
Obrazac certifikata o zdravlju životinja i javnozdravstvenog certifikata za neke mesne proizvode i obrađene želuce, mjehure i crijeva koji su namijenjeni za otpremu u Europsku uniju iz trećih zemalja






PRILOG IV.
(Provoz i/ili skladištenje)


|
03/Sv. 015 |
HR |
Službeni list Europske unije |
245 |
32007D0782
|
L 314/29 |
SLUŽBENI LIST EUROPSKE UNIJE |
30.11.2007. |
ODLUKA KOMISIJE
od 30. studenoga 2007.
o odobravanju godišnjih i višegodišnjih nacionalnih programa i financijskog doprinosa Zajednice za iskorjenjivanje, kontrolu i praćenje određenih bolesti životinja i zoonoza, koje države članice predstavljaju za 2008. i za sljedeće godine
(priopćeno pod brojem dokumenta C(2007) 5776)
(2007/782/EZ)
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Odluku Vijeća 90/424/EEZ od 26. lipnja 1990. o troškovima u području veterinarstva (1), a posebno njezin članak 24. stavak 5.,
budući da:
|
(1) |
Odlukom 90/424/EEZ određuju se postupci koji uređuju financijski doprinos Zajednice za programe iskorjenjivanja, kontrole i praćenja bolesti životinja i zoonoza. |
|
(2) |
Nadalje, člankom 24. stavkom 1. Odluke 90/424/EEZ predviđeno je da se treba uvesti financijska mjera Zajednice kako bi se nadoknadili troškovi koji su državama članicama nastali financiranjem nacionalnih programa za iskorjenjivanje, kontrolu i praćenje bolesti životinja i zoonoza navedenih u toj Odluci. |
|
(3) |
Odlukom Vijeća 2006/965/EZ od 19. prosinca 2006. o izmjeni Odluke 90/424/EEZ o troškovima u području veterinarstva (2) zamijenjen je članak 24. te Odluke novom odredbom. Prijelaznim mjerama Odluke 2006/965/EZ osigurano je da se programi za enzootsku goveđu leukozu i bolest Aujeszkoga mogu nastaviti financirati sve do 31. prosinca 2010. |
|
(4) |
Odlukom Vijeća 90/638/EEZ od 27. studenoga 1990. o određivanju kriterija Zajednice za iskorjenjivanje i praćenje određenih bolesti životinja (3) predviđeno je da programi koje su podnijele države članice radi odobrenja na temelju mjera predviđenih člankom 24. stavkom 1. Odluke 90/424/EEZ moraju udovoljavati kriterijima izloženima u prilozima Odluci 90/638/EEZ. |
|
(5) |
Uredbom (EZ) br. 999/2001 Europskog parlamenta i Vijeća od 22. svibnja 2001. o određivanju pravila za sprječavanje, kontrolu i iskorjenjivanje određenih transmisivnih spongiformnih encefalopatija (4) predviđeni su godišnji programi država članica za praćenje transmisivnih spongiformnih encefalopatija (TSE) kod goveda, ovaca i koza. |
|
(6) |
Direktivom Vijeća 2005/94/EZ (5) o mjerama Zajednice za kontrolu influence ptica predviđeni su i programi praćenja od strane država članica koji se provode s obzirom na perad i divlje ptice radi doprinosa, inter alia, na temelju redovito ažuriranih procjena rizika, znanju o prijetnjama koje predstavljaju divlje ptice u odnosu na bilo koji virus influence ptičjeg podrijetla. Ti godišnji programi praćenja, kao i njihovo financiranje, isto trebaju biti odobreni. |
|
(7) |
Određene su države članice Komisiji dostavile godišnje programe za iskorjenjivanje, kontrolu i praćenje bolesti životinja, programe nadzora usmjerene suzbijanju zoonoza i godišnje programe praćenja za iskorjenjivanje i praćenje određenih TSE-a za koje žele primati financijski doprinos Zajednice. |
|
(8) |
Određene su države članice Komisiji dostavile i višegodišnje programe za iskorjenjivanje, kontrolu i praćenje bolesti životinja za koje žele primati financijski doprinos Zajednice. Obveze preuzimanja troškova za višegodišnje programe donose se u skladu s člankom 76. stavkom 3. Uredbe Vijeća (EZ, Euratom) br. 1605/2002 od 25. lipnja 2002. o Financijskoj uredbi primjenjivoj na opći proračun Europskih zajednica (6). Za višegodišnje programe prva se obveza proračuna donosi nakon njihovog odobrenja. Svaku sljedeću obvezu Komisija donosi na temelju odluke o dodjeli doprinosa iz članka 24. stavka 5. Odluke 90/424/EEZ. |
|
(9) |
Komisija je ocijenila godišnje i višegodišnje programe koje su podnijele države članice i s veterinarskog i s financijskoga gledišta. Za te je programe ustanovljeno da udovoljavaju odgovarajućem veterinarskom zakonodavstvu Zajednice, a posebno mjerilima izloženim u Odluci 90/638/EEZ. |
|
(10) |
S obzirom na važnost tih programa za postizanje ciljeva Zajednice u području zdravlja ljudi i životinja, kao i njihove obvezne primjene u svim državama članicama u slučaju programa za TSE i influencu ptica, primjereno je odrediti odgovarajuću stopu financijskog doprinosa Zajednice do najvišeg iznosa za svaki program kako bi se nadoknadili troškovi koji će nastati dotičnim državama članicama za mjere koje se spominju u ovoj Odluci. |
|
(11) |
Radi boljeg upravljanja, učinkovitije uporabe sredstava Zajednice i veće transparentnosti, nužno je za svaki program, tamo gdje je to primjereno, odrediti maksimalni iznos koji se državama članicama nadoknađuje za određene troškove, poput testova korištenih u državama članicama i kompenzacije vlasnicima za njihov gubitak radi klanja ili izdvajanja životinja. |
|
(12) |
Na temelju Uredbe Vijeća (EZ) br. 1290/2005 od 21. lipnja 2005. o financiranju zajedničke poljoprivredne politike (7), programi za iskorjenjivanje i kontrolu bolesti životinja trebaju se financirati iz Europskog fonda za jamstva u poljoprivredi. U svrhu financijskog kontrole primjenjuju se članci 9., 36. i 37. te Uredbe. |
|
(13) |
Financijski doprinos Zajednice treba se dodijeliti pod uvjetom da se planirane mjere učinkovito provode i da nadležna tijela dostavljaju sve nužne informacije u okviru vremenskog ograničenja predviđenog ovom Odlukom. Posebno se čini primjerenim tražiti učestalija privremena tehnička izvješća kako bi se procijenila učinkovitost provedbe odobrenih programa. |
|
(14) |
Zbog upravne učinkovitosti svi podneseni troškovi za financijski doprinos Zajednice trebaju biti izraženi u eurima. U skladu s Uredbom (EZ) br. 1290/2005, tečaj za troškove u valuti koja nije euro treba biti najnoviji tečaj koji je odredila Europska središnja banka prije prvog dana u mjesecu u kojem je dotična država članica podnijela zahtjev. |
|
(15) |
Mjere predviđene ovom Odlukom u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU ODLUKU:
POGLAVLJE I.
GODIŠNJI PROGRAMI
Članak 1.
Bruceloza goveda
1. Programi za iskorjenjivanje bruceloze goveda koje su podnijele Irska, Španjolska, Italija, Cipar, Portugal i Ujedinjena Kraljevina ovime se odobravaju za razdoblje od 1. siječnja 2008. do 31. prosinca 2008.
2. Financijski doprinos Zajednice određuje se u iznosu od 50 % troškova koji nastanu svakoj državi članici iz stavka 1. za troškove provođenja laboratorijskih pretraga, kompenzacije vlasnicima za vrijednost njihovih životinja zaklanih u skladu s tim programima kao i za kupnju doza cjepiva, i ne smije prelaziti:
|
(a) |
1 200 000 EUR za Irsku; |
|
(b) |
4 400 000 EUR za Španjolsku; |
|
(c) |
2 100 000 EUR za Italiju; |
|
(d) |
153 000 EUR za Cipar; |
|
(e) |
1 900 000 EUR za Portugal; |
|
(f) |
1 200 000 EUR za Ujedinjenu Kraljevinu. |
3. Maksimalni iznosi troškova koji se nadoknađuju državama članicama za programe iz stavka 1. ne prelaze:
|
(a) |
za rose bengal test |
0,2 EUR po testu; |
|
(b) |
za SAT test |
0,2 EUR po testu; |
|
(c) |
za test metodom reakcije vezivanja komplementa |
0,4 EUR po testu; |
|
(d) |
za ELISA test |
1 EUR po testu. |
Članak 2.
Tuberkuloza goveda
1. Programi za iskorjenjivanje tuberkuloze goveda koje su podnijele Estonija, Španjolska, Italija, Poljska i Portugal ovime se odobravaju za razdoblje od 1. siječnja 2008. do 31. prosinca 2008.
2. Financijski doprinos Zajednice određuje se u iznosu od 50 % troškova koji nastanu svakoj državi članici iz stavka 1. za troškove provođenja tuberkulinskog testa, laboratorijskih pretraga te kompenzacije vlasnicima za vrijednost njihovih životinja zaklanih u skladu s tim programima, i ne smije prelaziti:
|
(a) |
24 000 EUR za Estoniju; |
|
(b) |
6 100 000 EUR za Španjolsku; |
|
(c) |
2 700 000 EUR za Italiju; |
|
(d) |
1 100 000 EUR za Poljsku; |
|
(e) |
347 000 EUR za Portugal. |
3. Maksimalni iznosi troškova koji se nadoknađuju državama članicama za programe iz stavka 1. ne prelaze:
|
(a) |
za tuberkulinski test |
1 EUR po testu; |
|
(b) |
za gama-interferonski test |
5 EUR po testu. |
Članak 3.
Bruceloza ovaca i koza
1. Programi za iskorjenjivanje bruceloze ovaca i koza koje su podnijele Španjolska, Italija, Cipar i Portugal ovime se odobravaju za razdoblje od 1. siječnja 2008. do 31. prosinca 2008.
2. Financijski doprinos Zajednice određuje se u iznosu od 50 % troškova koji nastanu svakoj državi članici iz stavka 1. za troškove kupnje cjepiva, troškove provođenja laboratorijskih pretraga i kompenzacije vlasnicima za vrijednost njihovih životinja zaklanih u skladu s tim programima, i ne smije prelaziti:
|
(a) |
5 600 000 EUR za Španjolsku; |
|
(b) |
2 800 000 EUR za Italiju; |
|
(c) |
93 000 EUR za Cipar; |
|
(d) |
1 100 000 EUR za Portugal. |
3. Maksimalni iznosi troškova koji se nadoknađuju državama članicama za programe iz stavka 1. ne prelaze:
|
(a) |
za rose bengal test |
0,2 EUR po testu; |
|
(b) |
za test metodom reakcije vezivanja komplementa |
0,4 EUR po testu. |
Članak 4.
Bolest plavog jezika u endemičnim područjima ili područjima visokog rizika
1. Programi za iskorjenjivanje i praćenje bolesti plavog jezika koje su podnijele Belgija, Bugarska, Njemačka, Grčka, Španjolska, Francuska, Italija, Luksemburg, Nizozemska, Austrija, Portugal, Rumunjska i Slovenija ovime se odobravaju za razdoblje od 1. siječnja 2008. do 31. prosinca 2008.
2. Financijski doprinos Zajednice određuje se u iznosu od 50 % troškova koji nastanu svakoj državi članici iz stavka 1. za troškove provođenja laboratorijskih pretraga za virološki, serološki i entomološki nadzor te za kupnju zamki i cjepiva, i ne smije prelaziti:
|
(a) |
377 000 EUR za Belgiju; |
|
(b) |
5 400 EUR za Bugarsku; |
|
(c) |
3 100 000 EUR za Njemačku; |
|
(d) |
100 000 EUR za Grčku; |
|
(e) |
4 100 000 EUR za Španjolsku; |
|
(f) |
351 000 EUR za Francusku; |
|
(g) |
1 300 000 EUR za Italiju; |
|
(h) |
70 000 EUR za Luksemburg; |
|
(i) |
527 000 EUR za Nizozemsku; |
|
(j) |
245 000 EUR za Austriju; |
|
(k) |
1 004 000 EUR za Portugal; |
|
(l) |
43 000 EUR za Rumunjsku; |
|
(m) |
61 000 EUR za Sloveniju. |
3. Maksimalni iznosi troškova koji se nadoknađuju državama članicama za programe iz stavka 1. ne prelaze 2,5 EUR po testu za ELISA test.
Članak 5.
Salmoneloza (zoonotska salmoneloza) u rasplodnim jatima Gallus gallus
1. Programi za kontrolu određenih sojeva zoonotske salmonele u rasplodnim jatima Gallus gallus koje su podnijele Belgija, Bugarska, Češka Republika, Danska, Njemačka, Irska, Grčka, Španjolska, Francuska, Italija, Cipar, Latvija, Mađarska, Nizozemska, Austrija, Poljska, Portugal, Rumunjska i Slovačka ovime se odobravaju za razdoblje od 1. siječnja 2008. do 31. prosinca 2008.
2. Financijski doprinos Zajednice određuje se u iznosu od 50 % troškova koji nastanu svakoj državi članici iz stavka 1. za troškove provođenja bakterioloških pretraga i testove serotipizacije u okviru službenog uzorkovanja, te za kompenzacije vlasnicima za vrijednost izlučenih ptica, uništavanje jaja i kupnju cjepiva, i ne smije prelaziti:
|
(a) |
550 000 EUR za Belgiju; |
|
(b) |
10 000 EUR za Bugarsku; |
|
(c) |
200 000 EUR za Češku Republiku; |
|
(d) |
75 000 EUR za Dansku; |
|
(e) |
600 000 EUR za Njemačku; |
|
(f) |
120 000 EUR za Irsku; |
|
(g) |
150 000 EUR za Grčku; |
|
(h) |
800 000 EUR za Španjolsku; |
|
(i) |
500 000 EUR za Francusku; |
|
(j) |
470 000 EUR za Italiju; |
|
(k) |
45 000 EUR za Cipar; |
|
(l) |
60 000 EUR za Latviju; |
|
(m) |
400 000 EUR za Mađarsku; |
|
(n) |
1 300 000 EUR za Nizozemsku; |
|
(o) |
50 000 EUR za Austriju; |
|
(p) |
2 000 000 EUR za Poljsku; |
|
(q) |
600 000 EUR za Portugal; |
|
(r) |
400 000 EUR za Rumunjsku; |
|
(s) |
275 000 EUR za Slovačku. |
3. Maksimalni iznosi troškova koji se nadoknađuju državama članicama za programe iz stavka 1. ne prelaze:
|
(a) |
za bakteriološku pretragu (kultivaciju) |
5,0 EUR po testu; |
|
(b) |
za kupnju jedne doze cjepiva |
0,05 EUR po dozi; |
|
(c) |
za serotipizaciju relevantnih izolata Salmonella spp. |
20,0 EUR po testu. |
Članak 6.
Salmoneloza (zoonotska salmoneloza) u jatima kokoši nesilica Gallus gallus
1. Programi za kontrolu određenih sojeva zoonotske salmonele u jatima kokoši nesilica Gallus gallus koje su podnijele Belgija, Bugarska, Češka Republika, Njemačka, Estonija, Grčka, Španjolska, Francuska, Italija, Cipar, Latvija, Luksemburg, Mađarska, Nizozemska, Austrija, Poljska, Portugal, Rumunjska, Slovačka i Ujedinjena Kraljevina ovime se odobravaju za razdoblje od 1. siječnja 2008. do 31. prosinca 2008.
2. Financijski doprinos Zajednice određuje se u iznosu od 50 % troškova koji nastanu svakoj državi članici iz stavka 1. za troškove provođenja bakterioloških pretraga i testove serotipizacije u okviru službenog uzorkovanja, te za kompenzacije vlasnicima za vrijednost izlučenih ptica, uništavanje jaja i kupnju cjepiva, i ne smije prelaziti:
|
(a) |
750 000 EUR za Belgiju; |
|
(b) |
20 000 EUR za Bugarsku; |
|
(c) |
1 000 000 EUR za Češku; |
|
(d) |
2 000 000 EUR za Njemačku; |
|
(e) |
20 000 EUR za Estoniju; |
|
(f) |
500 000 EUR za Grčku; |
|
(g) |
3 500 000 EUR za Španjolsku; |
|
(h) |
2 500 000 EUR za Francusku; |
|
(i) |
1 000 000 EUR za Italiju; |
|
(j) |
80 000 EUR za Cipar; |
|
(k) |
300 000 EUR za Latviju; |
|
(l) |
10 000 EUR za Luksemburg; |
|
(m) |
2 000 000 EUR za Mađarsku; |
|
(n) |
2 000 000 EUR za Nizozemsku; |
|
(o) |
1 000 000 EUR za Austriju; |
|
(p) |
2 000 000 EUR za Poljsku; |
|
(q) |
1 000 000 EUR za Portugal; |
|
(r) |
500 000 EUR za Rumunjsku; |
|
(s) |
1 000 000 EUR za Slovačku; |
|
(t) |
80 000 EUR za Ujedinjenu Kraljevinu. |
3. Maksimalni iznosi troškova koji se nadoknađuju državama članicama za programe iz stavka 1. ne prelaze:
|
(a) |
za bakteriološku pretragu (kultivaciju) |
5,0 EUR po testu; |
|
(b) |
za kupnju jedne doze cjepiva |
0,05 EUR po dozi; |
|
(c) |
za serotipizaciju relevantnih izolata Salmonella spp. |
20,0 EUR po testu. |
Članak 7.
Klasična svinjska kuga i afrička svinjska kuga
1. Programi za kontrolu i praćenje:
|
(a) |
Klasične svinjske kuge koje su podnijele Bugarska, Njemačka, Francuska, Luksemburg, Rumunjska, Slovenija i Slovačka ovime se odobravaju za razdoblje od 1. siječnja 2008. do 31. prosinca 2008. |
|
(b) |
Klasične svinjske kuge i afričke svinjske kuge koje je podnijela Italija ovime se odobravaju za razdoblje od 1. siječnja 2008. do 31. prosinca 2008. |
2. Financijski doprinos Zajednice određuje se u iznosu od 50 % troškova koji nastanu svakoj državi članici iz stavka 1. za troškove viroloških i seroloških pretraga domaćih svinja i divljih svinja te za programe koje su podnijele Bugarska, Njemačka, Francuska, Rumunjska i Slovačka isto u iznosu od 50 % troškova koji nastanu svakoj državi članici za kupnju i distribuciju cjepiva i mamaca za cijepljenje divljih svinja, i ne smije prelaziti:
|
(a) |
400 000 EUR za Bugarsku; |
|
(b) |
1 000 000 EUR za Njemačku; |
|
(c) |
650 000 EUR za Francusku; |
|
(d) |
100 000 EUR za Italiju; |
|
(e) |
15 000 EUR za Luksemburg; |
|
(f) |
2 500 000 EUR za Rumunjsku; |
|
(g) |
40 000 EUR za Sloveniju; |
|
(h) |
525 000 EUR za Slovačku. |
3. Maksimalni iznosi troškova koji se nadoknađuju državama članicama za programe iz stavka 1. ne prelaze 2,5 EUR po testu za ELISA test.
Članak 8.
Vezikularna bolest svinja
1. Program za iskorjenjivanje vezikularne bolesti svinja koje je podnijela Italija ovime se odobrava za razdoblje od 1. siječnja 2008. do 31. prosinca 2008.
2. Financijski doprinos Zajednice određuje se u iznosu od 50 % troškova za laboratorijske pretrage, i ne prelazi 300 000 EUR.
Članak 9.
Influenca ptica u peradi i divljih ptica
1. Programi za ispitivanje influence ptica u peradi i divljih ptica koje su podnijele Belgija, Bugarska, Češka Republika, Danska, Njemačka, Estonija, Irska, Grčka, Španjolska, Francuska, Italija, Cipar, Latvija, Litva, Luksemburg, Mađarska, Nizozemska, Austrija, Poljska, Portugal, Rumunjska, Slovenija, Slovačka, Finska, Švedska i Ujedinjena Kraljevina ovime se odobravaju za razdoblje od 1. siječnja 2008. do 31. prosinca 2008.
2. Financijski doprinos Zajednice određuje se u iznosu od 50 % troškova koji nastanu svakoj državi članici iz stavka 1. za troškove provođenja laboratorijskih pretraga i paušala za uzorkovanje divljih ptica, i ne smije prelaziti:
|
(a) |
127 000 EUR za Belgiju; |
|
(b) |
76 000 EUR za Bugarsku; |
|
(c) |
65 000 EUR za Češku Republiku; |
|
(d) |
202 000 EUR za Dansku; |
|
(e) |
580 000 EUR za Njemačku; |
|
(f) |
8 000 EUR za Estoniju; |
|
(g) |
58 000 EUR za Irsku; |
|
(h) |
72 000 EUR za Grčku; |
|
(i) |
306 000 EUR za Španjolsku; |
|
(j) |
155 000 EUR za Francusku; |
|
(k) |
380 000 EUR za Italiju; |
|
(l) |
15 000 EUR za Cipar; |
|
(m) |
33 000 EUR za Latviju; |
|
(n) |
43 000 EUR za Litvu; |
|
(o) |
12 000 EUR za Luksemburg; |
|
(p) |
184 000 EUR za Mađarsku; |
|
(q) |
444 000 EUR za Nizozemsku; |
|
(r) |
55 000 EUR za Austriju; |
|
(s) |
81 000 EUR za Poljsku; |
|
(t) |
165 000 EUR za Portugal; |
|
(u) |
465 000 EUR za Rumunjsku; |
|
(v) |
43 000 EUR za Sloveniju; |
|
(w) |
50 000 EUR za Slovačku; |
|
(x) |
35 000 EUR za Finsku; |
|
(y) |
290 000 EUR za Švedsku; |
|
(z) |
400 000 EUR za Ujedinjenu Kraljevinu. |
3. Maksimalni iznosi troškova koji se nadoknađuju državama članicama za pretrage obuhvaćene programima iz stavka 1. ne prelaze:
|
(a) |
: |
ELISA test |
: |
1 EUR po testu; |
|
(b) |
: |
agar gel imunodifuzijski test |
: |
1,2 EUR po testu; |
|
(c) |
: |
HI test za H5/H7 |
: |
12 EUR po testu; |
|
(d) |
: |
virus izolacijski test |
: |
30 EUR po testu; |
|
(e) |
: |
PCR test |
: |
15 EUR po testu; |
|
(f) |
: |
uzorkovanje divljih ptica |
: |
20 EUR po ptici. |
Članak 10.
Transmisivne spongiformne encefalopatije (TSE)
1. Programi za praćenje transmisivnih spongiformnih encefalopatija (TSE) koje su podnijele Belgija, Bugarska, Češka Republika, Danska, Njemačka, Estonija, Irska, Grčka, Španjolska, Francuska, Italija, Cipar, Latvija, Litva, Luksemburg, Mađarska, Malta, Nizozemska, Austrija, Poljska, Portugal, Rumunjska, Slovenija, Slovačka, Finska, Švedska i Ujedinjena Kraljevina ovime se odobravaju za razdoblje od 1. siječnja 2008. do 31. prosinca 2008.
2. Financijski doprinos Zajednice određuje se u iznosu od 100 % troškova koji nastanu svakoj državi članici iz stavka 1. za provedbu tih programa, i ne smije prelaziti:
|
(a) |
1 950 000 EUR za Belgiju; |
|
(b) |
850 000 EUR za Bugarsku; |
|
(c) |
950 000 EUR za Češku Republiku; |
|
(d) |
1 600 000 EUR za Dansku; |
|
(e) |
9 500 000 EUR za Njemačku; |
|
(f) |
250 000 EUR za Estoniju; |
|
(g) |
5 000 000 EUR za Irsku; |
|
(h) |
950 000 EUR za Grčku; |
|
(i) |
4 700 000 EUR za Španjolsku; |
|
(j) |
14 750 000 EUR za Francusku; |
|
(k) |
3 050 000 EUR za Italiju; |
|
(l) |
250 000 EUR za Cipar; |
|
(m) |
300 000 EUR za Latviju; |
|
(n) |
550 000 EUR za Litvu; |
|
(o) |
150 000 EUR za Luksemburg; |
|
(p) |
700 000 EUR za Mađarsku; |
|
(q) |
37 000 EUR za Maltu; |
|
(r) |
3 150 000 EUR za Nizozemsku; |
|
(s) |
1 250 000 EUR za Austriju; |
|
(t) |
3 250 000 EUR za Poljsku; |
|
(u) |
1 250 000 EUR za Portugal; |
|
(v) |
7 500 EUR za Rumunjsku; |
|
(w) |
200 000 EUR za Sloveniju; |
|
(x) |
750 000 EUR za Slovačku; |
|
(y) |
650 000 EUR za Finsku; |
|
(z) |
1 150 000 EUR za Švedsku; |
|
(za) |
5 300 000 EUR za Ujedinjenu Kraljevinu. |
3. Financijski doprinos Zajednice za programe iz stavka 1. je za obavljene pretrage i ne smije prelaziti:
|
(a) |
5 EUR po testu za pretrage obavljene na govedima iz Priloga III. Uredbi (EZ) br. 999/2001; |
|
(b) |
30 EUR po testu za pretrage obavljene na ovcama i kozama iz Priloga III. Uredbi (EZ) br. 999/2001; |
|
(c) |
50 EUR po testu za pretrage obavljene na cervidima iz Priloga III. Uredbi (EZ) br. 999/2001; |
|
(d) |
175 EUR po testu za primarno molekularno testiranje obavljeno prema Prilogu X. poglavlju C. točki 3.2. podtočki (c) (i.) Uredbe (EZ) br. 999/2001. |
Članak 11.
Goveđa spongiformna encefalopatija (GSE)
1. Programi za iskorjenjivanje goveđe spongiformne encefalopatije (GSE) koje su podnijele Belgija, Bugarska, Češka Republika, Danska, Njemačka, Estonija, Irska, Grčka, Španjolska, Francuska, Italija, Luksemburg, Nizozemska, Austrija, Poljska, Portugal, Slovenija, Slovačka, Finska i Ujedinjena Kraljevina ovime se odobravaju za razdoblje od 1. siječnja 2008. do 31. prosinca 2008.
2. Financijski doprinos Zajednice određuje se u iznosu od 50 % troškova koji nastanu svakoj državi članici iz stavka 1. kompenzacije vlasnicima za vrijednost njihovih životinja, izdvojenih i uništenih u skladu s njihovim programima za iskorjenjivanje, do maksimalno 500 EUR po životinji, i ne prelazi:
|
(a) |
50 000 EUR za Belgiju; |
|
(b) |
50 000 EUR za Bugarsku; |
|
(c) |
150 000 EUR za Češku Republiku; |
|
(d) |
50 000 EUR za Dansku; |
|
(e) |
145 000 EUR za Njemačku; |
|
(f) |
50 000 EUR za Estoniju; |
|
(g) |
430 000 EUR za Irsku; |
|
(h) |
50 000 EUR za Grčku; |
|
(i) |
500 000 EUR za Španjolsku; |
|
(j) |
100 000 EUR za Francusku; |
|
(k) |
150 000 EUR za Italiju; |
|
(l) |
50 000 EUR za Luksemburg; |
|
(m) |
50 000 EUR za Nizozemsku; |
|
(n) |
50 000 EUR za Austriju; |
|
(o) |
100 000 EUR za Poljsku; |
|
(p) |
232 000 EUR za Portugal; |
|
(q) |
10 000 EUR za Sloveniju; |
|
(r) |
125 000 EUR za Slovačku; |
|
(s) |
25 000 EUR za Finsku; |
|
(t) |
176 000 EUR za Ujedinjenu Kraljevinu. |
Članak 12.
Grebež ovaca
1. Programi za iskorjenjivanje grebeža ovaca koje su podnijele Belgija, Bugarska, Češka Republika, Danska, Njemačka, Estonija, Irska, Grčka, Španjolska, Francuska, Italija, Cipar, Latvija, Litva, Luksemburg, Mađarska, Nizozemska, Austrija, Portugal, Rumunjska, Slovenija, Slovačka, Finska i Ujedinjena Kraljevina ovime se odobravaju za razdoblje od 1. siječnja 2008. do 31. prosinca 2008.
2. Financijski doprinos Zajednice određuje se u iznosu od 50 % troškova koji nastanu svakoj državi članici iz stavka 1. za kompenzacije vlasnicima za vrijednost njihovih životinja, izdvojenih i uništenih u skladu s njihovim programima za iskorjenjivanje, do maksimalno 100 EUR po životinji, i u iznosu od 50 % troškova analiza uzoraka za genotipizaciju, do maksimalno 10 EUR po testu za genotipizaciju, i ne smije prelaziti:
|
(a) |
66 000 EUR za Belgiju; |
|
(b) |
26 000 EUR za Bugarsku; |
|
(c) |
88 000 EUR za Češku Republiku; |
|
(d) |
204 000 EUR za Dansku; |
|
(e) |
1 000 000 EUR za Njemačku; |
|
(f) |
12 100 EUR za Estoniju; |
|
(g) |
550 000 EUR za Irsku; |
|
(h) |
700 000 EUR za Grčku; |
|
(i) |
3 800 000 EUR za Španjolsku; |
|
(j) |
3 000 000 EUR za Francusku; |
|
(k) |
1 500 000 EUR za Italiju; |
|
(l) |
1 100 000 EUR za Cipar; |
|
(m) |
1 100 EUR za Latviju; |
|
(n) |
3 000 EUR za Litvu; |
|
(o) |
27 000 EUR za Luksemburg; |
|
(p) |
343 000 EUR za Mađarsku; |
|
(q) |
258 000 EUR za Nizozemsku; |
|
(r) |
26 000 EUR za Austriju; |
|
(s) |
35 000 EUR za Portugal; |
|
(t) |
881 000 EUR za Rumunjsku; |
|
(u) |
61 000 EUR za Sloveniju; |
|
(v) |
302 000 EUR za Slovačku; |
|
(w) |
201 000 EUR za Finsku; |
|
(x) |
4 000 000 EUR za Ujedinjenu Kraljevinu. |
Članak 13.
Bjesnoća
1. Programi za iskorjenjivanje bjesnoće koje su podnijele Bugarska, Litva, Mađarska, Austrija, Poljska, Rumunjska i Slovačka ovime se odobravaju za razdoblje od 1. siječnja 2008. do 31. prosinca 2008.
2. Financijski doprinos Zajednice određuje se u iznosu od 50 % troškova koji nastanu svakoj državi članici iz stavka 1. za laboratorijske pretrage te kupnju i distribuciju cjepiva uz mamce za programe, i ne smije prelaziti:
|
(a) |
700 000 EUR za Bugarsku; |
|
(b) |
700 000 EUR za Litvu; |
|
(c) |
1 500 000 EUR za Mađarsku; |
|
(d) |
290 000 EUR za Austriju; |
|
(e) |
3 900 000 EUR za Poljsku; |
|
(f) |
2 500 000 EUR za Rumunjsku; |
|
(g) |
575 000 EUR za Slovačku. |
3. Maksimalni iznosi troškova koji se nadoknađuju državama članicama za programe iz stavka 1. ne prelaze:
|
(a) |
za ELISA test |
8 EUR po testu; |
|
(b) |
za pretragu otkrivanja tetraciklina u kostima |
8 EUR po testu. |
Članak 14.
Enzootska goveđa leukoza
1. Programi za iskorjenjivanje enzootske goveđe leukoze koje su podnijele Estonija, Litva i Poljska ovime se odobravaju za razdoblje od 1. siječnja 2008. do 31. prosinca 2008.
2. Financijski doprinos Zajednice određuje se u iznosu od 50 % troškova koji nastanu svakoj državi članici iz stavka 1. za laboratorijske pretrage te kompenzacije vlasnicima za vrijednost njihovih životinja, zaklanih u skladu s tim programom, i ne smije prelaziti:
|
(a) |
15 000 EUR za Estoniju; |
|
(b) |
200 000 EUR za Litvu; |
|
(c) |
800 000 EUR za Poljsku. |
3. Maksimalni iznosi troškova koji se nadoknađuju državama članicama za program iz stavka 1. ne prelaze:
|
(a) |
za ELISA test |
0,5 EUR po testu; |
|
(b) |
za agar gel imunodifuzijski test |
0,5 EUR po testu. |
Članak 15.
Bolest Aujeszkoga
1. Programi za iskorjenjivanje bolesti Aujeszkoga koje su podnijele Španjolska, Mađarska i Poljska ovime se odobravaju za razdoblje od 1. siječnja 2008. do 31. prosinca 2008.
2. Financijski doprinos Zajednice određuje se u iznosu od 50 % troškova koji nastanu svakoj državi članici iz stavka 1. za laboratorijske pretrage, i ne smije prelaziti:
|
(a) |
450 000 EUR za Španjolsku; |
|
(b) |
60 000 EUR za Mađarsku; |
|
(c) |
5 000 000 EUR za Poljsku. |
3. Maksimalni iznosi troškova koji se nadoknađuje državama članicama za programe iz stavka 1. ne prelazi 1 EUR po testu za ELISA test.
POGLAVLJE II.
VIŠEGODIŠNJI PROGRAMI
Članak 16.
Bjesnoća
1. Višegodišnji programi za iskorjenjivanje bjesnoće koje su podnijele Češka Republika, Njemačka, Estonija, Latvija, Slovenija i Finska ovime se odobravaju za razdoblje od:
|
(a) |
1. siječnja 2008. do 31. prosinca 2009. za Češku Republiku i Njemačku; |
|
(b) |
1. siječnja 2008. do 31. prosinca 2010. za Latviju i Finsku; |
|
(c) |
1. siječnja 2008. do 31. prosinca 2011. za Estoniju; |
|
(d) |
1. siječnja 2008. do 31. prosinca 2012. za Sloveniju. |
2. Financijski doprinos Zajednice za programe određuje se u iznosu od 50 % troškova koji nastanu svakoj državi članici iz stavka 1. za laboratorijske pretrage, te kupnju i distribuciju cjepiva uz mamce.
3. Maksimalni iznosi troškova koji se nadoknađuju državama članicama za programe iz stavka 1. ne prelaze:
|
(a) |
za ELISA test |
8 EUR po testu; |
|
(b) |
za pretragu otkrivanja tetraciklina u kostima |
8 EUR po testu. |
4. Doprinos koji obuhvaća razdoblje za provedbu višegodišnjih programa ne prelazi:
|
(a) |
1 000 000 EUR za Češku Republiku; |
|
(b) |
800 000 EUR za Njemačku; |
|
(c) |
4 750 000 EUR za Estoniju; |
|
(d) |
3 700 000 EUR za Latviju; |
|
(e) |
1 750 000 EUR za Sloveniju; |
|
(f) |
300 000 EUR za Finsku. |
5. Iznosi koji se dodjeljuju za 2008. su:
|
(a) |
500 000 EUR za Češku Republiku; |
|
(b) |
475 000 EUR za Njemačku; |
|
(c) |
1 000 000 EUR za Estoniju; |
|
(d) |
1 200 000 EUR za Latviju; |
|
(e) |
350 000 EUR za Sloveniju; |
|
(f) |
100 000 EUR za Finsku. |
6. O iznosima koji se dodjeljuju za sljedeće godine odlučuje se na temelju izvršenja programa u 2008. Niže je navedena naznaka tih iznosa (u eurima):
|
Država članica |
2009. |
2010. |
2011. |
2012. |
|
Češka Republika |
500 000 |
|
|
|
|
Njemačka |
325 000 |
|
|
|
|
Latvija |
1 250 000 |
1 250 000 |
|
|
|
Finska |
100 000 |
100 000 |
|
|
|
Estonija |
1 250 000 |
1 250 000 |
1 250 000 |
|
|
Slovenija |
350 000 |
350 000 |
350 000 |
350 000 |
Članak 17.
Bolest Aujeszkoga
1. Višegodišnji program za iskorjenjivanje bolesti Aujeszkoga koji je podnijela Belgija ovime se odobrava za razdoblje od 1. siječnja 2008. do 31. prosinca 2009.
2. Financijski doprinos Zajednice za program određuje se u iznosu od 50 % troškova koji Belgiji nastanu za laboratorijske pretrage.
3. Maksimalni iznos troškova koji se nadoknađuje Belgiji za program iz stavka 1. ne prelazi 1 EUR po testu za ELISA test.
4. Doprinos koji obuhvaća razdoblje za provedbu višegodišnjeg programa iz stavka 1. koji Belgija treba provesti ne prelazi 720 000 EUR.
5. Iznos koji se dodjeljuje za 2008. je 360 000 EUR.
6. O iznosu koji se dodjeljuje za sljedeće godine odlučuje se na temelju izvršenja programa u 2008. Njegova je naznaka 360 000 EUR.
Članak 18.
Enzootska goveđa leukoza
1. Višegodišnji programi za iskorjenjivanje enzootske goveđe leukoze koje su podnijele Italija, Latvija i Portugal ovime se odobravaju za razdoblje od 1. siječnja 2008. do 31. prosinca 2010.
2. Financijski doprinos Zajednice za programe određuje se u iznosu od 50 % troškova koji nastanu svakoj državi članici iz stavka 1. za laboratorijske pretrage, te kompenzacije vlasnicima za vrijednost njihovih životinja, zaklanih u skladu s tim programima.
3. Maksimalni iznosi troškova koji se nadoknađuju državama članicama za programe iz stavka 1. ne prelaze:
|
(a) |
za ELISA test |
0,5 EUR po testu; |
|
(b) |
za agar gel imunodifuzijski test |
0,5 EUR po testu. |
4. Doprinos koji obuhvaća razdoblje za provedbu višegodišnjih programa ne prelazi:
|
(a) |
2 000 000 EUR za Italiju; |
|
(b) |
170 000 EUR za Latviju; |
|
(c) |
1 000 000 EUR za Portugal. |
5. Iznosi koji se dodjeljuju za 2008. su:
|
(a) |
400 000 EUR za Italiju; |
|
(b) |
60 000 EUR za Latviju; |
|
(c) |
300 000 EUR za Portugal. |
6. O iznosima koji se dodjeljuju za sljedeće godine odlučuje se na temelju izvršenja programa u 2008. Niže je navedena naznaka tih iznosa (u eurima):
|
Država članica |
2009. |
2010. |
2011. |
2012. |
|
Italija |
800 000 |
800 000 |
|
|
|
Latvija |
55 000 |
55 000 |
|
|
|
Portugal |
350 000 |
350 000 |
|
|
POGLAVLJE III.
OPĆE I ZAVRŠNE ODREDBE
Članak 19.
1. Za programe iz članaka 1., 2., 3., 5., 6., 14. i 18., prikladni troškovi za kompenzacije vlasnicima životinja radi klanja ili izdvajanja ograničavaju se kako je predviđeno stavcima 2. i 3. ovog članka.
2. Prosječna kompenzacija koja se nadoknađuje državama članicama izračunava se na temelju broja zaklanih ili izdvojenih životinja u državi članici i to:
|
(a) |
za goveda do najviše |
375 EUR po životinji; |
|
(b) |
za ovce i koze do najviše |
50 EUR po životinji; |
|
(c) |
za rasplodna jata Gallus gallus do najviše |
3,5 EUR po ptici; |
|
(d) |
za kokoši nesilice Gallus gallus do najviše |
1,5 EUR po ptici. |
3. Maksimalni iznosi kompenzacija koje se nadoknađuju državama članicama po jednoj životinji ne prelazi 1 000 EUR po govedu i 100 EUR po ovci ili kozi.
Članak 20.
1. Trošak koji države članice podnose zajedno sa zahtjevom za financijski doprinos Zajednice izražava se u eurima i isključuje porez na dodanu vrijednost i ostale poreze.
2. Ukoliko je trošak države članice u valuti koja nije euro, dotična ga država članica preračunava u eure primjenjujući najnoviji tečaj koji je odredila Europska središnja banka prije prvog dana u mjesecu u kojem je dotična država članica podnijela zahtjev.
Članak 21.
1. Financijski doprinos Zajednice za programe iz članaka 1. do 18. dodjeljuje se pod uvjetom da dotične države članice:
|
(a) |
provode programe u skladu s odgovarajućim odredbama prava Zajednice, uključujući pravila o tržišnom natjecanju i dodjeli ugovora o javnoj nabavi; |
|
(b) |
najkasnije do 1. siječnja 2008. stave na snagu zakone i ostale propise koji su nužni za provedbu programa iz članaka 1. do 18.; |
|
(c) |
najkasnije do 1. lipnja 2008. Komisiji proslijede privremena tehnička i financijska izvješća za programe iz članaka 1. do 18., u skladu s člankom 24. stavkom 7. točkom (a) Odluke 90/424/EEZ; |
|
(d) |
za programe iz članka 9. Komisiji podnesu izvješće o pozitivnim i negativnim nalazima pretraga zabilježenim svaka tri mjeseca tijekom nadzora peradi i divljih ptica putem on-line sustava Komisije, prosljeđujući ga u razdoblju od četiri tjedna nakon kraja mjeseca obuhvaćenog izvješćem; |
|
(e) |
za programe iz članaka 10. do 12. Komisiji svaki mjesec proslijede izvješće o rezultatima programa sustavnog praćenja TSE-a, prosljeđujući ga u razdoblju od četiri tjedna nakon kraja mjeseca obuhvaćenog izvješćem; |
|
(f) |
za programe iz članaka 1. do 18. Komisiji najkasnije do 30. travnja 2009. u skladu s člankom 24. stavkom 7. točkom (b) Odluke 90/424/EEZ proslijede konačno izvješće o tehničkoj izvedbi programa popraćeno dokazima za troškove koji su državi članici nastali te nalazima stečenim tijekom razdoblja od 1. siječnja 2008. do 31. prosinca 2008.; |
|
(g) |
programe iz članaka 1. do 18. učinkovito provedu; |
|
(h) |
za programe iz članaka 1. do 18. ne podnose daljnje zahtjeve za druge doprinose Zajednice za te mjere, te da nisu prethodno podnijele takve zahtjeve. |
2. Ukoliko država članica ne udovolji stavku 1., Komisija će umanjiti financijski doprinos Zajednice uzimajući u obzir prirodu i težinu prekršaja te financijski gubitak za Zajednicu.
Članak 22.
Ova se Odluka primjenjuje od 1. siječnja 2008.
Članak 23.
Ova je Odluka upućena državama članicama.
Sastavljeno u Bruxellesu 30. studenoga 2007.
Za Komisiju
Markos KYPRIANOU
Član Komisije
(1) SL L 224, 18.8.1990., str. 19. Odluka kako je zadnje izmijenjena Uredbom (EZ) br. 1791/2006 (SL L 363, 20.12.2006., str. 1.).
(2) SL L 397, 30.12.2006., str. 22.
(3) SL L 347, 12.12.1990., str. 27. Odluka kako je zadnje izmijenjena Direktivom 92/65/EEZ (SL L 268, 14.9.1992., str. 54.).
(4) SL L 147, 31.5.2001., str. 1. Uredba kako zadnje izmijenjena Uredbom Komisije (EZ) br. 727/2007 (SL L 165, 27.6.2007., str. 8.).
(5) SL L 10, 14.1.2006., str. 16.
(6) SL L 248, 16.9.2002., str. 12.
(7) SL L 209, 11.8.2005., str. 1. Uredba kako je zadnje izmijenjena Uredbom (EZ) br. 378/2007 (SL L 95, 5.4.2007., str. 1.).
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
256 |
32007R1428
|
L 317/61 |
SLUŽBENI LIST EUROPSKE UNIJE |
04.12.2007. |
UREDBA KOMISIJE (EZ) br. 1428/2007
od 4. prosinca 2007.
o izmjeni Priloga VII. Uredbi (EZ) br. 999/2001 Europskog parlamenta i Vijeća o utvrđivanju pravila za sprečavanje, kontrolu i iskorjenjivanje određenih transmisivnih spongiformnih encefalopatija
(Tekst značajan za EGP)
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Uredbu (EZ) br. 999/2001 Europskog parlamenta i Vijeća od 22. svibnja 2001. o utvrđivanju pravila za sprečavanje, kontrolu i iskorjenjivanje određenih transmisivnih spongiformnih encefalopatija (1), a posebno prvi stavak njezinog članka 23.,
budući da:
|
(1) |
Prilog VII. Uredbi (EZ) br. 999/2001 propisuje mjere iskorjenjivanja koje se moraju provoditi nakon potvrde transmisivne spongiformne encefalopatije (TSE) kod ovaca i koza. |
|
(2) |
U okviru Komunikacije Komisije nazvanom „Commission TSE Roadmap” (2) od 15. srpnja 2005. i u skladu s radnim programom SANCO-a za razdoblje 2006. - 2007. o TSE-u (3) od 21. studenoga 2006., Komisija je donijela Uredbu (EZ) br. 727/2007 od 26. lipnja 2007. o izmjenama priloga I., III., VII. i X. Uredbi (EZ) br. 999/2001 Europskog parlamenta i Vijeća o utvrđivanju pravila za sprečavanje, kontrolu i iskorjenjivanje određenih transmisivnih spongiformnih encefalopatija. Tako izmijenjenom Uredbom (EZ) br. 999/2001 predviđaju se određene mjere koje treba provoditi u slučaju potvrde TSE-a na gospodarstvu s ovcama i kozama, i ako je prisutnost goveđe spongiformne encefalopatije (GSE) bila isključena. |
|
(3) |
S obzirom na to da je sektor ovaca i koza u Zajednici bitno različit, Uredba (EZ) br. 999/2001, kako je izmijenjena Uredbom (EZ) br. 727/2007, uvodi mogućnost primjene alternativne politike, pod uvjetom da su na razini Zajednice uspostavljeni usklađeni propisi. |
|
(4) |
Prilogom VII. Uredbi (EZ) br. 999/2001 predviđeno je odstupanje u pogledu uništavanja ovaca i koza nakon potvrde slučaja TSE-a kod tih životinja na gospodarstvu, prije njegove izmjene Uredbom (EZ) br. 727/2007. Sukladno tome, države članice mogu odlučiti o odgodi uništavanja životinja za najviše pet uzgojnih godina. Međutim, to odstupanje nije bilo uključeno u tako izmijenjeni Prilog VII. Uredbi (EZ) br. 999/2001, jer to više nije bilo potrebno. |
|
(5) |
Francuska je 17. srpnja 2007. sudskim predmetom T-257/07 uložila tužbu protiv Europske komisije na Prvostupanjskom sudu Europskih zajednica tražeći poništenje nekih odredbi Uredbe (EZ) br. 727/2007, a posebno u pogledu mjera koje se trebaju provoditi kod stada pogođenih TSE-om ili umjesto toga poništenje cijele Uredbe. Sud je u svom rješenju od 28. rujna 2007. kao privremenu mjeru ukinuo primjenu navedenih odredbi do donošenja konačne presude. |
|
(6) |
Nastavno na navedeno rješenje, države članice više nemaju mogućnost primjene privremeno ukinutih mjera. Stoga države članice mogu imati poteškoća kod uništavanja predmetnih životinja. |
|
(7) |
Stoga je primjereno ponovno uvesti odstupanje koje se primjenjivalo prije izmjena relevantnih odredbi Priloga VII. Uredbi (EZ) br. 999/2001 Uredbom (EZ) br. 727/2007, kako bi se omogućilo državama članicama, ukoliko je učestalost ARR alela unutar pasmine ili gospodarstva niska ili ako se smatra da je to potrebno radi izbjegavanja križanja životinja u bliskom srodstvu, da od datuma navedenog rješenja odgode uništavanje predmetnih životinja za najviše pet uzgojnih godina. |
|
(8) |
Uredbu (EZ) br. 999/2001 treba stoga na odgovarajući način izmijeniti. |
|
(9) |
Mjere predviđene ovom Uredbom u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU UREDBU:
Članak 1.
U Prilogu VII., poglavlju A, točki 2.3., dodaje se sljedeća točka (f):
|
„(f) |
Ako je učestalost ARR alela unutar pasmine ili gospodarstva niska, ili ako se smatra da je to potrebno radi izbjegavanja križanja životinja u bliskom srodstvu, države članice mogu odlučiti da se uništavanje životinja iz točke 2.3. (b) alineja (i) i (ii) odgodi za najviše pet uzgojnih godina.” |
Članak 2.
Ova Uredba stupa na snagu sljedećeg dana od dana objave u Službenom listu Europske unije.
Ona se primjenjuje od 28. rujna 2007.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 4. prosinca 2007.
Za Komisiju
Markos KYPRIANOU
Član Komisije
(1) SL L 147, 31.5.2001., str. 1. Uredba kako je zadnje izmijenjena Uredbom Komisije (EZ) br. 727/2007 (SL L 165, 27.6.2007., str. 8.).
(2) COM(2005) 322 završno.
(3) SEC(2006) 1527.
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
258 |
32007D0865
|
L 337/129 |
SLUŽBENI LIST EUROPSKE UNIJE |
20.12.2007. |
ODLUKA KOMISIJE
od 20. prosinca 2007.
o izmjeni Dodatka B Prilogu XII. Aktu o pristupanju iz 2003. s obzirom na određene objekte u sektoru mesa u Poljskoj
(priopćena pod brojem dokumenta C(2007) 6494)
(Tekst značajan za EGP)
(2007/865/EZ)
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Akt o pristupanju Češke Republike, Estonije, Cipra, Latvije, Litve, Mađarske, Malte, Poljske, Slovenije i Slovačke, a posebno njegov Prilog XII. poglavlje 6. odjeljak B pododjeljak I(1) stavak (e),
budući da:
|
(1) |
Poljskoj je dodijeljeno prijelazno razdoblje za određene objekte navedene u Dodatku B (1) Prilogu XII. Aktu o pristupanju iz 2003. Mogućnost dodjele prijelaznih razdoblja za objekte za meso u Poljskoj završava danom 31. prosinca 2007. |
|
(2) |
Dodatak B Prilogu XII. Aktu o pristupanju iz 2003. izmijenjen je odlukama Komisije: 2004/458/EZ (2), 2004/471/EZ (3), 2004/474/EZ (4), 2005/271/EZ (5), 2005/591/EZ (6), 2005/854/EZ (7), 2006/14/EZ (8), 2006/196/EZ (9), 2006/404/EZ (10), 2006/555/EZ (11), 2006/935/EZ (12), 2007/202/EZ (13), 2007/443/EZ (14), 2007/555/EZ (15) i 2007/864/EZ (16). |
|
(3) |
U skladu sa službenom izjavom poljskog nadležnog tijela, određeni objekti u sektoru mesa dovršili su svoj postupak unapređivanja i sada u potpunosti udovoljavaju zakonodavstvu Zajednice. Određeni objekti prestali su s aktivnostima za koje im je dodijeljeno prijelazno razdoblje. Ti se objekti stoga trebaju brisati s popisa objekata u postupku prijelaza. |
|
(4) |
Dodatak B Prilogu XII. Aktu o pristupanju iz 2003. treba stoga na odgovarajući način izmijeniti. |
|
(5) |
Stalni odbor za prehrambeni lanac i zdravlje životinja upoznat je s mjerama predviđenim ovom Odlukom, |
DONIJELA JE OVU ODLUKU:
Članak 1.
Objekti navedeni u Prilogu ovoj Odluci brišu se iz Dodatka B Prilogu XII. Aktu o pristupanju iz 2003.
Članak 2.
Ova je Odluka upućena državama članicama.
Sastavljeno u Bruxellesu 20. prosinca 2007.
Za Komisiju
Markos KYPRIANOU
Član Komisije
(1) SL C 227 E, 23.9.2003., str. 1392.
(2) SL L 156, 30.4.2004., str. 52., kako je ispravljeno u SL L 202, 7.6.2004., str. 39.
(3) SL L 160, 30.4.2004., str. 58., kako je ispravljeno u SL L 212, 12.6.2004., str. 31.
(4) SL L 160, 30.4.2004., str. 74., kako je ispravljeno u SL L 212, 12.6.2004., str. 44.
(5) SL L 86, 5.4.2005., str. 13.
(6) SL L 200, 30.7.2005., str. 96.
(7) SL L 316, 2.12.2005., str. 17.
(8) SL L 10, 14.1.2006., str. 66.
(9) SL L 70, 9.3.2006., str. 80.
(10) SL L 156, 9.6.2006., str. 16.
(11) SL L 218, 9.8.2006., str. 17.
(12) SL L 355, 15.12.2006., str. 105.
(13) SL L 90, 30.3.2007., str. 86.
(14) SL L 166, 28.6.2007., str. 24.
(15) SL L 212, 14.8.2007., str. 3.
(16) SL L 337, 21.12.2007., str. 127.
PRILOG
Popis objekata koji se brišu iz Dodatka B Prilogu XII. Aktu o pristupanju iz 2003.
Popis objekata za crveno meso u postupku prijelaza:
|
Broj |
Veterinarski broj |
Naziv objekta |
|
1 |
02120206 |
Zakład Mięsny Sp. jawna D.M. Niebieszczańscy |
|
3 |
02240301 |
P.P.H. „HE-MA” Przetwórnia Mięsa |
|
5 |
06080204 |
„SŁOMKA” Sp. j. Andrzej Słomka, Waldemar Słomka |
|
6 |
06080201 |
Zakład Przetwórstwa Mięsnego Bożena i Kazimierz Wójcik |
|
7 |
06080301 |
„GIZET” Sp. j. I. Galińska, B. Galińska |
|
8 |
06020207 |
PPH „MISA – W” Andrzej Wasąg |
|
10 |
06070201 |
Zakład Przetwórstwa Mięsnego „MAX” Sp. j. |
|
12 |
06180210 |
Zakład Przetwórstwa Mięsnego Sp. j. Wrębiak, Witkowski |
|
13 |
06200203 |
„Agrozam” Sp. z o.o. |
|
14 |
06090202 |
PHU Kowalczykowski Stanisław |
|
15 |
08040204 |
Biuro Handlowe „AMBERMAX” Sp. z o.o. |
|
16 |
08060203 |
Zakład Masarniczy Stanisław Przewoźny |
|
17 |
08070201 |
Zakład Przetwórstwa Mięsnego „WARTA” |
|
18 |
08080201 |
Zakłady Mięsne „TARGED” Sp. z o.o. |
|
19 |
08090202 |
Przedsiębiorstwo „DEREKS” Sp. z o.o. |
|
20 |
08100101 |
Przedsiębiorstwo Produkcyjno-Handlowe „Rolvex” Sp. z o.o. |
|
21 |
08100204 |
Zakład Masarniczy „Czernicki i syn” Jarosław Czernicki |
|
22 |
10060308 |
ZAKŁAD PRZETWÓRSTWA MIĘSNEGO |
|
23 |
10060215 |
ZMS „ŚCIBIORÓW” |
|
24 |
10610307 |
PPU „JUMAR” |
|
25 |
10030303 |
Zakład Wędliniarski Władysław Gabrysiak |
|
26 |
10020202 |
Zakład Przetw. Mięsn. „KONIAREK” |
|
27 |
10610311 |
Zakłady Mięsne „Wędzonka” |
|
29 |
12030203 |
Zakład Przetwórstwa Mięsnego s.j. |
|
30 |
12050304 |
F.P.H.U. „ANGELA” s.j. |
|
31 |
12060329 |
„BOREX-BECON” s.j. |
|
32 |
12060203 |
Firma „ADOZ” |
|
33 |
12100304 |
Firma Produkcyjno-Handlowa Maria i Zbigniew Szubryt Zakład Masarski Biczyce Dolne |
|
35 |
12120323 |
Zakład Przetwórstwa Mięsa, Sp. z o.o., Z. Pr. Chr. „BASO” |
|
36 |
12180204 |
„Adam Bąk – Wieprz” Sp. z o.o. |
|
37 |
12180205 |
Rzeźnictwo-Wędliniarstwo J. Tomczyk |
|
38 |
12180307 |
Rzeźnictwo-Wędliniarstwo Maciej Szlagor |
|
39 |
12150304 |
Zakłady Mięsne „MIŚKOWIEC” s.j. |
|
40 |
12190104 |
Ubojnia Zwierząt Rzeźnych Skup i Sprzedaż Ćwierci, Jacek Śliwa |
|
41 |
12190205 |
P.P.H.U. „RACHOŃ” s.c. |
|
42 |
14160205 |
Zakłady Mięsne „Mazowsze” |
|
43 |
14160201 |
Przetwórstwo Mięsne „KOSPOL” |
|
44 |
14300204 |
Zakład Masarski „Zbyszko” |
|
45 |
14190204 |
Zakład Masarski „Danko” |
|
47 |
14050201 |
Zakład Produkcyjno-Handlowy Przetwórstwo Mięsne Zbigniew Pniewski |
|
49 |
14310306 |
P.P.H. Hetman A. J. Lucińscy Zakład Masarski |
|
50 |
14340302 |
Zakład Masarski Radzymin s.c. |
|
51 |
14340310 |
Zakład Masarski „Mareta” Sp. J. T.A. Kłobuk E.W. Kacprzak |
|
55 |
14250327 |
Zakład Przetwórstwa Flaków |
|
56 |
14250104 |
Zakład Masarski „Sadełko” – Czapla – Świniarski Sp. J. |
|
57 |
14250201 |
P.P.H.U. „Nasz Produkt” Z. P. CHR. |
|
58 |
14250202 |
Masarnia ELMAS |
|
59 |
16010101 |
PPHU „PORKPOL” |
|
61 |
18070301 |
Zakład Masarski KON-BIT |
|
62 |
18110302 |
Firma Produkcyjno-Handlowa Andrzej Kurek |
|
63 |
18160204 |
Zakłady Mięsne „Dworak” |
|
64 |
20040202 |
Zakład Przemysłu Mięsnego „Europa” S. i Z. Zielińscy Sp. J. |
|
65 |
22040301 |
Masarnia Alicja Andrzej Majer |
|
66 |
22040306 |
Zakład Przetwórstwa Mięsnego Jerzy Labuda |
|
69 |
24020203 |
Rzeźnictwo i Handel Stanisław Kapecki |
|
70 |
24020308 |
Zakład Przetwórstwa Mięsnego Józef Bozek |
|
71 |
24020328 |
Przetwórstwo Mięsne Emil Droń |
|
72 |
24610311 |
„OAZA” Sp. z o.o. |
|
73 |
24040204 |
Zakład Przetwórstwa Mięsnego „UNILANG” |
|
75 |
24040304 |
PPHU „Zakłady Mięsne Lubliniec” E.R.J Drążek |
|
76 |
24070209 |
Zakłady Mięsne „JANDAR” Sp. z o.o. |
|
77 |
24120104 |
Marian Procek – Ubój, Skup i Sprzedaż |
|
78 |
24160302 |
„NELPOL” s.c. |
|
79 |
24170303 |
Zakład Przetwórstwa Mięsnego „Błachut” |
|
80 |
26040101 |
Ubojnia Bydła i Trzody – Ludwik Andrzej Stąpór |
|
81 |
26040307 |
Wyrób i Sprzedaż Artykułów Mięsnych – S. Woźniak |
|
82 |
26040316 |
PPHU „KORREKT” Wytwórnia Wędlin |
|
83 |
26090201 |
FHPU „Tarkowski” |
|
85 |
26610303 |
Przetwórnia Mięsa – Antonii Kamiński |
|
86 |
28010202 |
Zakład Uboju i Przetwórstwa Mięsnego s.c. Helena Rapa — Marek Jasiński |
|
87 |
28010201 |
Zakłady Mięsne Pek-Bart Sp. z o.o. |
|
88 |
28090201 |
Zakład Uboju i Przetwórstwa Mięsa i Wędlin, Krzysztof Brzeziński |
|
89 |
30070203 |
PPH „POLSKIE MIĘSO”, Krążyński s.j. |
|
90 |
30120307 |
ZPM „Janex” |
|
91 |
30180202 |
STEK-POL Przetwórstwo Mięsa Kazimierz i Jacek Stempniewicz |
|
92 |
30180304 |
Firma Produkcyjno Handlowa Paweł Łuczak |
|
93 |
30200101 |
Ubój Zwierząt Ptak, Michalak s.j. |
|
95 |
30240202 |
„KARWEX” s.c. Zakład Masarski |
|
96 |
30240205 |
Zakład Masarski s.c. Psarskie |
|
97 |
30260202 |
Rzeźnictwo Wędliniarstwo S.c. Urszula i Wiesław Ciachowscy |
|
99 |
30270308 |
Zakład Mięsny MAS POL, Tomasz Jacaszek |
|
100 |
32070201 |
„Rol-Banc” Sp. z o.o. |
|
101 |
32140207 |
Spółdzielcza Agrofirma Witkowo |
|
102 |
32160202 |
„Fermapol” Sp. z o.o. Rzeźnia w Smardzku |
Popis objekata za bijelo meso u postupku prijelaza:
|
Broj |
Veterinarski broj |
Naziv objekta |
|
103 |
02190623 |
„Mirjan” Sp. z o.o. M.J. Olendzcy |
|
104 |
08030601 |
PPHU „W-D” Sp. z o.o. |
|
105 |
08040501 |
„STUDRÓB” Sp. z o.o. |
|
106 |
12030620 |
Hurtownia Drobiu „KOKO” Jolanta Kozyra |
|
107 |
12180502 |
Z.M. „BRADO-2” S.A. |
|
108 |
12180503 |
„KO – BO” S.c. Bartosz Kot, Stanisław Wnęcek |
|
110 |
26040501 |
PPH „KIELDRÓB” S.c. |
|
111 |
26100401 |
„KULJASZ” S.j. J.W.Sz. Kuliński |
|
112 |
30090401 |
Ubojnia Drobiu – Marcin Frątczak |
|
114 |
32140502 |
Spółdzielcza Agrofirma Witkowo |
Popis objekata za crveno meso s niskim kapacitetom u postupku prijelaza:
|
Broj |
Naziv objekta |
|
115 |
„Nordis”; Chłodnie Polskie Sp. z o.o. Dział Produkcji Mrożonek ul. Zimna 1(a), 65-707 Zielona Góra |
Popis objekata za miješano meso s niskim kapacitetom u postupku prijelaza:
|
Broj |
Naziv objekta |
|
117 |
„Rudopal” Sp. z o.o. Rudniki 109, 64-330 Opalenica |
Popis hladnjača u postupku prijelaza:
|
Broj |
Veterinarski broj |
Naziv objekta |
Datum potpune usklađenosti |
|
118 |
26611101 |
Przedsiębiorstwo Przemysłu Chłodniczego Chłodnia Kielce P.P. |
31.12.2007. |
|
119 |
30611101 |
PPCh „Calfrost” |
31.12.2007. |
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
262 |
32007R1523
|
L 343/1 |
SLUŽBENI LIST EUROPSKE UNIJE |
11.12.2007. |
UREDBA KOMISIJE (EZ) br. 1523/2007 EUROPSKOG PARLAMENTA I VIJEĆA
od 11. prosinca 2007.
o zabrani stavljanja na tržište te uvoza u Zajednicu i izvoza iz Zajednice krzna pasa i mačaka te proizvoda koji sadrže takvo krzno
(Tekst značajan za EGP)
EUROPSKI PARLAMENT I VIJEĆE EUROPSKE UNIJE,
uzimajući u obzir Ugovor o osnivanju Europske zajednice, a posebno njegove članke 95. i 133.,
uzimajući u obzir prijedlog Komisije,
uzimajući u obzir mišljenje Europskoga gospodarskog i socijalnog odbora (1),
djelujući u skladu s postupkom utvrđenim u članku 251. Ugovora (2),
budući da:
|
(1) |
Prema viđenju građana Europske unije, psi i mačke smatraju se kućnim ljubimcima i stoga nije prihvatljivo koristiti njihovo krzno ili proizvode koji sadrže takvo krzno. Postoje dokazi o nazočnosti neoznačenog krzna pasa i mačaka te proizvoda koji sadrže takvo krzno u Zajednici. Zbog toga su potrošači zabrinuti jer postoji mogućnost da kupe pseće i mačje krzno ili proizvode koji takvo krzno sadrže. Dana 18. prosinca 2003. (3) Europski je parlament donio deklaraciju kojom izražava svoju zabrinutost zbog trgovine takvim krznom i proizvodima i kojom zahtijeva da se ona prekine kako bi se obnovilo povjerenje potrošača i trgovaca na malo u EU. Tijekom zasjedanja 17. studenoga 2003. i 30. svibnja 2005., Vijeće za poljoprivredu i ribarstvo istaklo je potrebu žurnog usvajanja pravila o trgovini krznom pasa i mačaka te proizvodima koji sadrže takvo krzno. |
|
(2) |
Primjereno je pojasniti da se ovom Uredbom trebaju obuhvatiti samo krzna vrsta domaćih pasa i mačaka. Međutim, budući da je znanstveno nemoguće razlikovati krzno domaćih mačaka od krzna ostalih podvrsta mačaka koje nisu domaće, ovom je Uredbom potrebno usvojiti definiciju mačke kao felis silvestris, koja uključuje i podvrste mačaka koje nisu domaće. |
|
(3) |
Kao odgovor na zabrinutost građana, nekoliko je država članica donijelo zakonodavstvo čiji je cilj sprečavanje proizvodnje i stavljanja na tržište krzna mačaka i pasa. |
|
(4) |
Postoje razlike između odredaba država članica o trgovini, uvozu, proizvodnji i označivanju krzna i proizvoda od krzna s ciljem sprečavanja stavljanja na tržište krzna pasa i mačaka ili drukčije uporabe u komercijalne svrhe. Dok su neke države članice donijele potpunu zabranu proizvodnje krzna pasa i mačaka zabranjujući uzgoj ili klanje takvih životinja radi proizvodnje krzna, druge su donijele ograničenja proizvodnje ili uvoza krzna i proizvoda koji sadrže takva krzna. U nekim državama članicama uvedeni su zahtjevi za označivanje krzna. Rastuća zabrinutost građana u pogledu tog pitanja vjerojatno će potaknuti više država članica na donošenje daljnjih mjera ograničavanja na nacionalnoj razini. |
|
(5) |
Kao rezultat, neki su trgovci krznom u EU uveli dobrovoljna pravila ponašanja kako bi se suzdržali od trgovanja krznom pasa i mačaka te proizvodima koji sadrže takvo krzno. Međutim, ta su se pravila pokazala nedovoljnima za sprečavanje uvoza i prodaje krzna pasa i mačaka, posebno u slučaju kada trgovci krznom trguju krznom na kojem nije naznačeno i nije jasno prepoznatljivo od koje je životinjske vrste, ili u slučaju kada kupuju proizvode koji sadrže takvo krzno i suočeni su s rizikom ili da se dotičnim proizvodima ne može legalno trgovati u jednoj ili više država članica ili da trgovina u jednoj ili više država članica podliježe dodatnim zahtjevima usmjerenim na sprečavanje uporabe krzna pasa i mačaka. |
|
(6) |
Razlike u nacionalnim mjerama o krznu pasa i mačaka predstavljaju zapreku trgovini krznom općenito. Te mjere priječe nesmetano funkcioniranje unutarnjeg tržišta, obzirom da postojanje različitih zakonskih zahtjeva ograničava proizvodnju krzna općenito i otežava legalan uvoz krzna u Zajednicu ili njegovu proizvodnju u Zajednici radi slobodnog prometovanja unutar Zajednice. Različiti zakonski zahtjevi diljem država članica dovode do dodatnih opterećenja i troškova trgovaca krznom. |
|
(7) |
Osim toga, javnost je zbunjena raznolikošću zakonskih zahtjeva u državama članicama, što samo po sebi čini zapreku trgovini. |
|
(8) |
Mjere predviđene ovom Uredbom stoga trebaju uskladiti propise u različitim državama članicama s obzirom na zabranu prodaje, nuđenja na prodaju i distribuciju krzna pasa i mačaka te proizvoda koji sadrže takvo krzno, i time spriječiti poremećaje u unutarnjem tržištu za sve ostale slične proizvode. |
|
(9) |
Kako bi se uklonila postojeća fragmentiranost unutarnjeg tržišta, postoji potreba za usklađivanjem tamo gdje je najučinkovitiji i najrazmjerniji instrument za suočavanje sa zaprekama trgovini zabrana stavljanja na tržište i na uvoz u Zajednicu ili izvoz iz Zajednice krzna pasa i mačaka te proizvoda koji sadrže takvo krzno. |
|
(10) |
Zahtjev za označivanjem ne bi bio prikladan za postizanje istog rezultata jer bi nerazmjerno opteretio industriju odjevnih predmeta, uključujući trgovce koji su se specijalizirali za lažno krzno, te bi bio i nerazmjerno skup u slučajevima u kojima krzno predstavlja samo malen dio proizvoda. |
|
(11) |
U Zajednici ne postoji tradicija uzgoja pasa i mačaka za proizvodnju krzna, iako su zabilježeni slučajevi proizvodnje krzna pasa i mačaka. Zapravo se čini da velika većina proizvoda od krzna pasa i mačaka u Zajednici potječe iz trećih zemalja. Stoga, kako bi se postigla veća učinkovitost, zabrana trgovine unutar Zajednice treba biti popraćena zabranom uvoza istih proizvoda u Zajednicu. Takva zabrana uvoza bi bila i odgovor na zabrinutost potrošača o mogućem unosu u Zajednicu krzna pasa i mačaka, posebno s obzirom na to da postoje naznake da se takve životinje drže i ubijaju na nehuman način. |
|
(12) |
Zabrana izvoza treba osigurati i da se krzno pasa i mačaka, kao i proizvodi koji sadrže takvo krzno, u Zajednici ne proizvode za izvoz. |
|
(13) |
Međutim, primjereno je predvidjeti mogućnost ograničenih odstupanja od opće zabrane stavljanja na tržište i uvoza u ili izvoza iz Zajednice krzna pasa i mačaka, kao i proizvoda koji sadrže takvo krzno. To je slučaj s krznom pasa i mačaka uvezenog i stavljenog na tržište u svrhu obrazovanja ili prepariranja životinja. |
|
(14) |
Uredba (EZ) br. 1774/2002 Europskog parlamenta i Vijeća (4) određuje zdravstvena pravila koja se odnose na javno zdravlje za stavljanje na tržište i uvoz ili izvoz nusproizvoda životinjskog podrijetla, uključujući krzno pasa i mačaka. Stoga je primjereno razjasniti opseg ove Uredbe, koja treba biti jedini akt koji se primjenjuje na stavljanje na tržište i uvoz ili izvoz krzna pasa i mačaka u svim fazama proizvodnje, uključujući neprerađeno krzno. Međutim, ova Uredba ne smije utjecati na obveze na temelju Uredbe (EZ) br. 1774/2002 u pogledu uklanjanja krzna pasa i mačaka radi javnog zdravstva. |
|
(15) |
Mjere za zabranu uporabe pasa i mačaka radi proizvodnje krzna trebaju se jednakomjerno provoditi u čitavoj Zajednici. Međutim, tehnike koje se trenutačno koriste za identifikaciju krzna pasa i mačaka, poput DNK pretraga, mikroskopije i MALDI-TOF masene spektrometrije, razlikuju se od jedne do druge države članice. Primjereno je da informacije u pogledu takvih tehnika budu dostupne Komisiji, tako da tijela koja provode zakonodavstvo budu upoznata s inovacijama na tom polju te da se mogu procijeniti mogućnosti propisivanja jednoobrazne tehnike. |
|
(16) |
Potrebno je donijeti mjere nužne za provedbu ove Uredbe u skladu s Odlukom Vijeća 1999/468/EZ od 28. lipnja 1999. o utvrđivanju postupaka za izvršavanje provedbenih ovlasti dodijeljenih Komisiji (5). |
|
(17) |
Posebno, Komisija treba biti ovlaštena za uspostavljanje analitičkih metoda za identifikaciju porijekla krzna i, iznimno, za donošenje mjera kojima se odstupa od zabrana utvrđenih u ovoj Uredbi. S obzirom da su te mjere općenitog opsega i namijenjene izmjeni sporednih elemenata ove Uredbe, inter alia dopunjujući je novim sporednim elementima, one se moraju donijeti u skladu s regulatornim postupkom s kontrolom predviđenom u članku 5.a Odluke 1999/468/EZ. |
|
(18) |
Države članice trebaju utvrditi pravila koja se primjenjuju na kršenja odredbi ove Uredbe i osigurati da se one provode. Te kazne trebaju biti učinkovite, razmjerne i odvraćati od ponavljanja djela. Posebno, države članice koje zaplijene pošiljke krzna pasa i mačaka slijedom primjene ove Uredbe trebaju donijeti zakone koji omogućavaju konfiskaciju i uništavanje takvih pošiljki i obustavljanje ili opoziv uvoznih ili izvoznih dozvola dodijeljenih dotičnim trgovcima krznom. Države članice trebaju se poticati na primjenu kaznenih sankcija tamo gdje je to moguće u skladu s njihovim nacionalnim zakonodavstvom. |
|
(19) |
S obzirom da se cilj ove Uredbe, posebno uklanjanje prepreka za funkcioniranje unutarnjeg tržišta usklađivanjem na razini Zajednice nacionalnih zabrana u pogledu trgovine krznom pasa i mačaka, kao i proizvodima koji sadrže takvo krzno, ne može u dostatnoj mjeri postići u državama članicama i stoga se može bolje doseći na razini Zajednice, Zajednica može donijeti mjere, u skladu s načelom supsidijarnosti, kako je izloženo u članku 5. Ugovora. U skladu s načelom proporcionalnosti, kako je utvrđeno u tom članku, ova Uredba ne prelazi okvire onoga što je nužno za postizanje tog cilja, |
DONIJELI SU OVU UREDBU:
Članak 1.
Cilj
Svrha ove Uredbe je zabraniti stavljanje na tržište i uvoz u ili izvoz iz Zajednice krzna pasa i mačaka te proizvoda koji sadrže takvo krzno kako bi se uklonile prepreke za funkcioniranje unutarnjeg tržišta i kako bi se vratilo povjerenje potrošača u činjenicu da proizvodi od krzna koje potrošači kupuju ne sadrže krzno pasa i mačaka.
Članak 2.
Definicije
U smislu ove Uredbe primjenjuju se sljedeće definicije:
|
1. |
„mačka” znači životinja vrste felis silvestris; |
|
2. |
„pas” znači životinja podvrste canis lupus familiaris; |
|
3. |
„stavljanje na tržište” znači držanje krzna pasa i/ili mačaka ili proizvoda koji sadrži takvo krzno u svrhu prodaje, što uključuje nuđenje na prodaju, prodaju i distribuciju; |
|
4. |
„uvoz” znači puštanje u slobodni promet u smislu članka 79. Uredbe Vijeća (EEZ) br. 2913/92 od 12. listopada 1992. o Carinskom zakoniku Zajednice (6), u iznimku uvoza nekomercijalne prirode u smislu članka 52. stavka 2. točke (b) Uredbe Vijeća (EEZ) br. 918/83 od 28. ožujka 1983. o uspostavi sustava bescarinskih aranžmana Zajednice (7); |
|
5. |
„izvoz” znači izvozni postupak koji robi Zajednice omogućava napuštanje carinskog područja Zajednice u smislu članka 161. Uredbe (EEZ) br. 2913/92. |
Članak 3.
Zabrane
Zabranjuje se stavljanje na tržište i uvoz u Zajednicu ili izvoz iz Zajednice krzna pasa i mačaka, kao i proizvoda koji sadrže takvo krzno.
Članak 4.
Odstupanja
Odstupajući od članka 3., Komisija može u izuzetnim slučajevima donijeti mjere koje omogućavaju stavljanje na tržište ili izvoz ili uvoz krzna pasa i mačaka ili proizvoda koji sadrže takvo krzno u svrhu obrazovanja ili prepariranja životinja.
Te su mjere namijenjene izmjeni sporednih elemenata ove Uredbe, određujući uvjete na temelju kojih se takva odstupanja primjenjuju, i moraju se donijeti u skladu s regulatornim postupkom s kontrolom iz članka 6. stavka 2.
Članak 5.
Metode identifikacije životinjske vrste od koje krzno potječe
Države članice do 31. prosinca 2008. izvješćuju Komisiju o analitičkim metodama koje koriste za identifikaciju životinjske vrste od koje krzno potječe, a nakon toga kada je god to potrebno u svjetlu novih dostignuća u znanosti.
Komisija može donijeti mjere o utvrđivanju metoda analize koje se trebaju koristiti za identifikaciju životinjske vrste od koje krzno potječe. Te mjere, namijenjene izmjeni sporednih elemenata ove Uredbe, moraju se donijeti u skladu s regulatornim postupkom s kontrolom iz članka 6. stavka 2. i biti sadržane u Prilogu ovoj Uredbi.
Članak 6.
Odbor
1. Komisiji pomaže Stalni odbor za prehrambeni lanac i zdravlje životinja uspostavljen člankom 58. stavkom 1. Uredbe (EZ) br. 178/2002 Europskog parlamenta i Vijeća od28. siječnja 2002. o utvrđivanju općih načela i uvjeta propisa o hrani, osnivanju Europske agencije za sigurnost hrane i utvrđivanju postupaka o pitanjima sigurnosti hrane (8).
2. Kod upućivanja na ovaj stavak primjenjuje se članak 5.a stavci 1. do 4. i članak 7. Odluke 1999/468/EZ, uzimajući u obzir odredbe njezinog članka 8.
Članak 7.
Izvješća
Države članice izvješćuju Komisiju o svojim nastojanjima za provođenje ove Uredbe.
Komisija najkasnije do 31. prosinca 2010. izvješćuje Europski parlament i Vijeće o primjeni ove Uredbe, uključujući carinske aktivnosti koje se na nju odnose.
Izvješće Komisije stavlja se na raspolaganje javnosti.
Članak 8.
Kazne
Države članice utvrđuju pravila o kaznama primjenljivim na kršenja ove Uredbe i poduzimaju sve nužne mjere kako bi osigurale njihovo primjenjivanje. Predviđene kazne moraju biti učinkovite, proporcionalne i odvraćajuće. Države članice do 31. prosinca 2008. izvješćuju Komisiju o tim odredbama te je bez odgode izvješćuju o bilo kojim naknadnim izmjenama tih odredbi.
Članak 9.
Stupanje na snagu i primjenljivost
Ova Uredba stupa na snagu dvadesetog dana od dana objave u Službenom listu Europske unije.
Primjenjuje se od 31. prosinca 2008.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Strasbourgu 11. prosinca 2007.
Za Europski parlament
Predsjednik
H.-G. PÖTTERING
Za Vijeće
Predsjednik
M. LOBO ANTUNES
(1) SL C 168, 20.7.2007., str. 42.
(2) Mišljenje Europskog parlamenta od 19. lipnja 2007. (još nije objavljeno u Službenom listu) i Odluka Vijeća od 26. studenoga 2007.
(3) SL C 91 E, 15.4.2004., str. 695.
(4) SL L 273, 10.10.2002., str. 1. Uredba kako je zadnje izmijenjena Uredbom Komisije (EZ) br. 829/2007 (SL L 191, 21.7.2007., str. 1.).
(5) SL L 184, 17.7.1999., str. 23. Odluka kako je izmijenjena Odlukom 2006/512/EZ (SL L 200, 22.7.2006., str. 11.).
(6) SL L 302, 19.10.1992., str. 1. Uredba kako je zadnje izmijenjena Uredbom (EZ) br. 1791/2006 (SL L 363, 20.12.2006., str. 1.).
(7) SL L 105, 23.4.1983., str. 1. Uredba kako je zadnje izmijenjena Aktom o pristupanju iz 2003.
(8) SL L 31, 1.2.2002., str. 1. Uredba kako je zadnje izmijenjena Uredbom Komisije (EZ) br. 575/2006 (SL L 100, 8.4.2006., str. 3.).
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
266 |
32008D0120
|
L 042/63 |
SLUŽBENI LIST EUROPSKE UNIJE |
07.02.2008. |
ODLUKA KOMISIJE
od 7. veljače 2008.
o izmjeni Priloga D Direktivi Vijeća 88/407/EEZ i Odluke Komisije 2004/639/EZ o utvrđivanju uvjeta za uvoz sjemena domaćih životinja vrste goveda
(priopćena pod brojem dokumenta C(2008) 409)
(Tekst značajan za EGP)
(2008/120/EZ)
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Direktivu Vijeća 88/407/EEZ od 14. lipnja 1988. o utvrđivanju zahtjeva za zdravlje životinja koji se primjenjuju na trgovinu unutar Zajednice i na uvoz duboko smrznutog sjemena domaćih životinja vrste goveda (1), a posebno njezin članak 8. stavak 1., članak 10. stavak 2. prvi podstavak, članak 11. stavak 2. i članak 17. drugi stavak,
budući da:
|
(1) |
Direktiva 88/407/EEZ utvrdila je zahtjeve za zdravlje životinja koji se primjenjuju na trgovinu unutar Zajednice i uvoz u Zajednicu sjemena domaćih životinja vrste goveda i utvrđuje obrazac veterinarskih certifikata za trgovinu tom robom unutar Zajednice. |
|
(2) |
Direktiva 2003/43/EZ (2) izmijenila je Direktivu 88/407/EEZ uvođenjem, inter alia, centara za skladištenje sjemena i uvjete za službeno odobrenje i službeni nadzor takvih centara. |
|
(3) |
Odluka Komisije 2004/639/EZ od 6. rujna 2004. o utvrđivanju uvjeta za uvoz sjemena domaćih životinja vrste goveda (3) utvrđuje obrazac veterinarskih certifikata za uvoz u Zajednicu sjemena domaćih životinja vrste goveda. Tu je Odluku potrebno prilagoditi u skladu s Direktivom 88/407/EEZ, a popis trećih zemalja iz kojih države članice odobravaju uvoz sjemena domaćih životinja vrste goveda potrebno je dopuniti. |
|
(4) |
Nadalje, potrebno je uvesti obrazac veterinarskog certifikata za trgovinu sjemenom domaćih životinja vrste goveda unutar Zajednice i uvoz u Zajednicu, koje se otprema iz odobrenih centara za skladištenje kako bi se osigurala potpuna sljedivost tog sjemena u trgovini unutar Zajednice. |
|
(5) |
Primjereno je da certifikati budu predstavljeni u skladu sa standardiziranim oblikom veterinarskih certifikata iz Odluke Komisije 2004/292/EZ od 30. ožujka 2004. o uvođenju sustava Traces i o izmjeni Odluke 92/486/EEZ (4) te uskladiti određene zahtjeve za zdravlje životinja. |
|
(6) |
Obrasci certifikata za trgovinu sjemenom domaćih životinja vrste goveda unutar Zajednice koji su utvrđeni u Prilogu D Direktivi 88/407/EEZ moraju također biti izmijenjeni uzimajući u obzir standardizirani oblik veterinarskih certifikata. |
|
(7) |
Direktivu 88/407/EEZ i Odluku 2004/639/EZ treba stoga na odgovarajući način izmijeniti. |
|
(8) |
Mjere predviđene ovom Odlukom u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU ODLUKU:
Članak 1.
Prilog D Direktivi 88/407/EEZ zamjenjuje se tekstom iz Priloga I. ovoj Odluci.
Članak 2.
Odluka 2004/639/EZ mijenja se kako slijedi:
|
1. |
u članku 1. dodaje se sljedeći stavak: „5. Bez utjecaja na stavak 4., države članice će dozvoliti uvoz sjemena iz stavaka 1. i 2. domaćih životinja vrste goveda otpremljenog iz odobrenih centara za skladištenje sjemena, koje udovoljava uvjetima propisanim na obrascu veterinarskog certifikata iz Priloga II. dijela 3. i popraćeno je takvim propisno ispunjenim certifikatom.” |
|
2. |
Prilozi I. i II. zamjenjuju se tekstom iz Priloga II. ovoj Odluci. |
Članak 3.
Ova se Odluka primjenjuje od 1. ožujka 2008.
Članak 4.
Ova je Odluka upućena državama članicama.
Sastavljeno u Bruxellesu 7. veljače 2008.
Za Komisiju
Markos KYPRIANOU
Član Komisije
(1) SL L 194, 22.7.1988., str. 10. Direktiva kako je zadnje izmijenjena Odlukom Komisije 2006/16/EZ (SL L 11, 17.1.2006., str. 21.).
(2) SL L 143, 11.6.2003., str. 23.
(3) SL L 292, 15.9.2004., str. 21., Odluka kako je zadnje izmijenjena Uredbom (EZ) br. 1792/2006 (SL L 362, 20.12.2006., str. 1.).
(4) SL L 94, 31.3.2004., str. 63., Odluka kako je zadnje izmijenjena Odlukom 2005/515/EZ (SL L 187, 19.7.2005., str. 29.).
PRILOG I.
„PRILOG D
OBRASCI CERTIFIKATA ZA TRGOVINU UNUTAR ZAJEDNICE
PRILOG D1.
Obrazac certifikata koji se primjenjuje za trgovinu unutar Zajednice sjemenom koje je sakupljeno u skladu s Direktivom Vijeća 88/407/EEZ, kako je izmijenjena Direktivom 2003/43/EZ, otpremljenog iz odobrenog centra za sakupljanje sjemena


PRILOG D2.
Obrazac certifikata koji se primjenjuje od 1. siječnja 2006. na trgovinu unutar Zajednice za sjeme koje je sakupljeno, obrađeno i/ili skladišteno prije 31. prosinca 2004. godine u skladu s odredbama Direktive Vijeća 88/407/EEZ koje su se primjenjivale do 1. srpnja 2003. i stavljeno na tržište nakon tog datuma u skladu s člankom 2. stavkom 2. Direktive 2003/43/EZ, otpremljeno iz odobrenog centra za sakupljanje sjemena
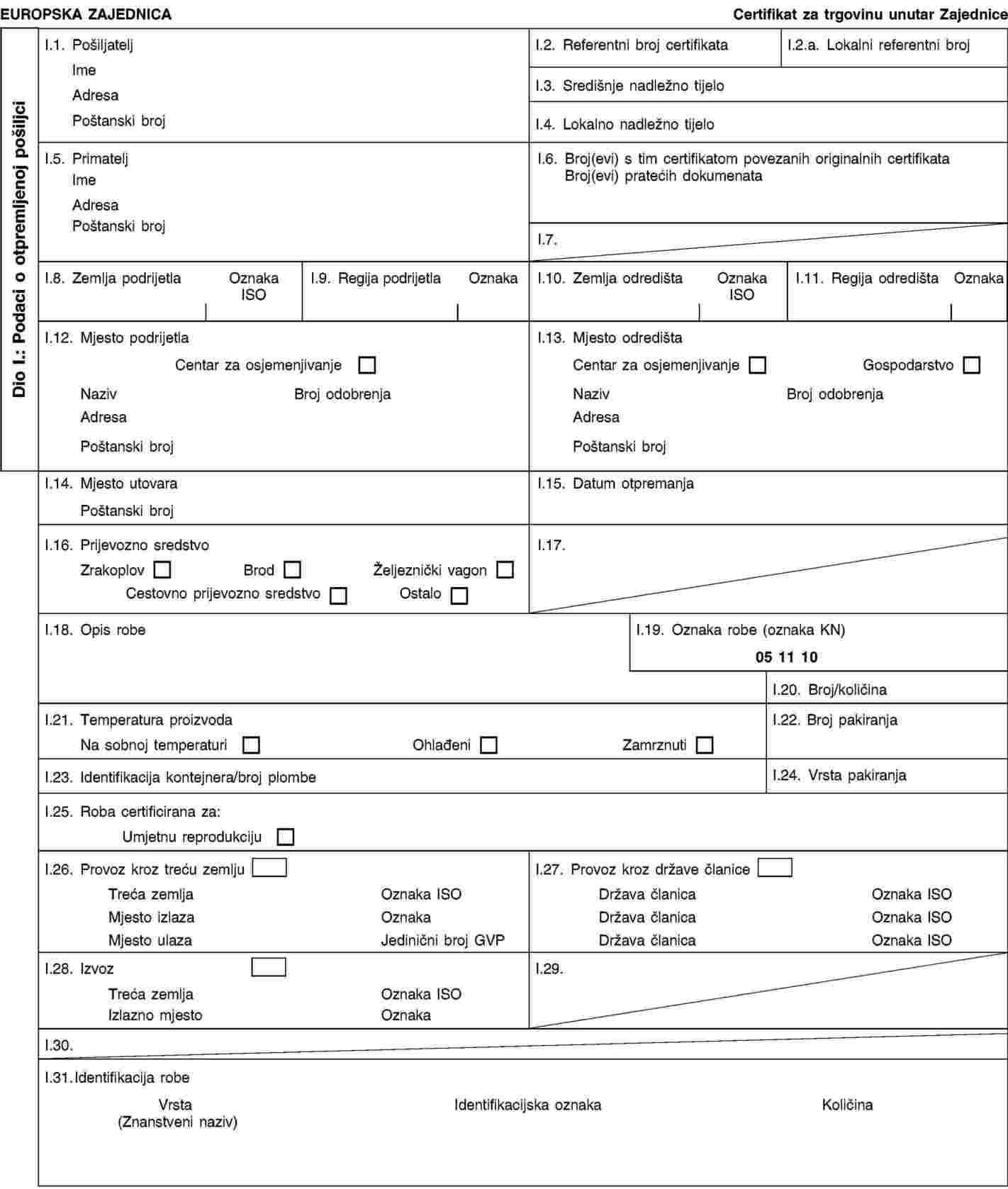


PRILOG D3.
Obrazac certifikata koji se primjenjuje na trgovinu unutar Zajednice za sjeme koje je otpremljeno iz odobrenog centra za skladištenje sjemena ili iz odobrenog centra za sakupljanje sjemena:
|
— |
bilo da je sakupljeno u skladu s Direktivom Vijeća 88/407/EEZ kako je izmijenjena Direktivom 2003/43/EZ, |
|
— |
ili je sakupljeno, obrađeno i/ili uskladišteno prije 31. prosinca 2004. u skladu s odredbama Direktive Vijeća 88/407/EEZ koje su se primjenjivale do 1. srpnja 2003. i stavljeno na tržište nakon tog datuma u skladu s člankom 2. stavkom 2. Direktive 2003/43/EZ. |


”
PRILOG II.
„
PRILOG I.
Popis trećih zemalja iz kojih države članice dozvoljavaju uvoz sjemena domaćih životinja vrste goveda
|
Oznaka ISO |
Zemlja |
Opis državnog područja (ako je primjereno) |
Dodatna jamstva |
|
AU |
Australija |
|
Dodatna jamstva iz točaka II.5.4.1.2. i II.5.4.2.2. certifikata iz dijela 1. Priloga II. su obvezna. |
|
CA |
Kanada |
Državno područje kako je opisano u dijelu 1. Priloga I. Odluci Vijeća 79/542/EEZ (1). |
Dodatno jamstvo iz točke II.5.4.1.2. certifikata iz dijela 1. Priloga II. je obvezno. |
|
CH |
Švicarska |
|
|
|
HR |
Hrvatska |
|
|
|
NZ |
Novi Zeland |
|
|
|
US |
Sjedinjene Države |
|
Dodatno jamstvo iz točke II.5.4.1.2. certifikata iz dijela 1. Priloga II. je obavezno. |
PRILOG II.
Obrazac veterinarskog certifikata za uvoz i provoz sjemena domaćih životinja vrste goveda (za uvoz, sakupljenog u skladu s Direktivom Vijeća 88/407/EEZ kako je izmijenjena Direktivom 2003/43/EZ)
DIO 1.
Obrazac certifikata koji se primjenjuje za uvoz i provoz sjemena sakupljenog u skladu s Direktivom Vijeća 88/407/EEZ kako je izmijenjena Direktivom 2003/43/EZ otpremljenog iz odobrenog centra za sakupljanje



DIO 2.
Obrazac certifikata koji se primjenjuje od 1. siječnja 2005. za uvoz i provoz pošiljki sjemena sakupljenog, obrađenog i uskladištenog prije 31. prosinca 2004. u skladu s odredbama Direktive Vijeća 88/407/EEZ koje su se primjenjivale prije 1. srpnja 2003., i uvezenog nakon 31. prosinca 2004. u skladu s člankom 2. stavkom 2. Direktive 2003/43/EZ, otpremljenog iz odobrenog centra za sakupljanje




DIO 3.
Obrazac certifikata koji se primjenjuje na uvoz i provoz sjemena otpremljenog iz odobrenog centra za skladištenje sjemena ili odobrenog centra za sakupljanje sjemena:
|
— |
koje je ili sakupljeno i obrađeno u skladu s Direktivom Vijeća 88/407/EEZ kako je izmijenjena Direktivom 2003/43/EZ, |
|
— |
ili je sakupljeno, obrađeno i uskladišteno prije 31. prosinca 2004. u skladu s odredbama Direktive Vijeća 88/407/EEZ koje su se primjenjivale do 1. srpnja 2003. i uvezeno je nakon 31. prosinca 2004. u skladu s člankom 2. stavkom 2. Direktive 2003/43/EZ. |



”
(1) SL L 146, 14.6.1979., str. 15. Prilog kako je zadnje izmijenjen Uredbom (EZ) br. 1791/2006 (SL L 363, 20.12.2006., str. 1.).
|
03/Sv. 015 |
HR |
Službeni list Europske unije |
286 |
32009R0119
|
L 039/12 |
SLUŽBENI LIST EUROPSKE UNIJE |
09.02.2009. |
UREDBA KOMISIJE (EZ) br. 119/2009
od 9. veljače 2009.
o utvrđivanju popisa trećih zemalja ili njihovih dijelova za uvoz mesa divljih leporida, određenih divljih kopnenih sisavaca i kunića iz uzgoja u Zajednicu ili njegov provoz kroz Zajednicu te zahtjeva za veterinarsko certificiranje
(Tekst značajan za EGP)
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Direktivu Vijeća 2002/99/EZ od 16. prosinca 2002. o utvrđivanju zdravstvenih pravila za životinje kojima se uređuje proizvodnja, prerada, stavljanje u promet i unošenje proizvoda životinjskog podrijetla namijenjenih prehrani ljudi (1), a posebno njezin članak 8. točku 1. prvi podstavak, članak 9. stavak 2. točku (b) te članak 9. stavak 4. točke (b) i (c),
uzimajući u obzir Uredbu (EZ) br. 852/2004 Europskog parlamenta i Vijeća od 29. travnja 2004. o higijeni hrane (2), a posebno njezin članak 12.,
uzimajući u obzir Uredbu (EZ) br. 853/2004 Europskog parlamenta i Vijeća od 29. travnja 2004. o utvrđivanju određenih higijenskih pravila za hranu životinjskog podrijetla (3), a posebno njezin članak 9.,
uzimajući u obzir Uredbu (EZ) br. 854/2004 Europskog parlamenta i Vijeća od 29. travnja 2004. o utvrđivanju posebnih pravila organizacije službenih kontrola proizvoda životinjskog podrijetla namijenjenih prehrani ljudi (4), a posebno njezin članak 11. stavak 1. i članak 14. stavak 4.,
uzimajući u obzir Uredbu (EZ) br. 882/2004 Europskog parlamenta i Vijeća od 29. travnja 2004. o službenim kontrolama koje se provode radi provjeravanja usklađenosti sa zakonom o hrani i hrani za životinje te s pravilima o zdravlju i dobrobiti životinja (5), a posebno njezin članak 48. stavak 1.,
budući da:
|
(1) |
Odlukom Komisije 2000/585/EZ (6) sastavlja se popis trećih zemalja iz kojih države članice odobravaju uvoz mesa kunića, određenog mesa divljači i divljači iz uzgoja i utvrđuju uvjeti zdravlja životinja i javnog zdravlja te veterinarsko certificiranje za takav uvoz. |
|
(2) |
U interesu dosljednosti zakonodavstva Zajednice, pravila Zajednice za uvoz mesa divljih leporida, određenih divljih kopnenih sisavaca i kunića iz uzgoja, treba uzeti u obzir zahtjeve za javno zdravlje iz Uredbi (EZ) br. 852/2004, (EZ) br. 853/2004, (EZ) br. 854/2004 i (EZ) br. 882/2004. |
|
(3) |
Mjere predviđene tom Uredbom ne dovode u pitanje zakonodavstvo o provedbi Uredbe Vijeća (EZ) br. 338/97 od 9. prosinca 1996. o zaštiti vrsta divlje faune i flore uređenjem trgovine u tom području (7). |
|
(4) |
S ciljem usklađivanja uvjeta Zajednice za uvoz predmetnih proizvoda u Zajednicu kao i radi veće transparentnosti i pojednostavljenja zakonodavnog postupka za izmjenu takvih uvjeta, te uvjete treba navesti u odgovarajućem obrascu veterinarskih certifikata iz ove Uredbe. |
|
(5) |
Veterinarski certifikati za uvoz mesa divljih leporida, određenih divljih kopnenih sisavaca i kunića iz uzgoja u Zajednicu te njegov provoz kroz Zajednicu, uključujući skladištenje tijekom provoza, moraju udovoljavati odgovarajućim standardnim obrascima iz Priloga I. Odluci Komisije 2007/240/EZ od 16. travnja 2007. o utvrđivanju novih veterinarskih certifikata za uvoz živih životinja, sjemena, jajnih stanica i proizvoda životinjskog podrijetla u Zajednicu, sukladno odlukama 79/542/EEZ, 92/260/EEZ, 93/195/EEZ, 93/196/EEZ, 93/197/EEZ, 95/328/EZ, 96/333/EZ, 96/539/EZ, 96/540/EZ, 2000/572/EZ, 2000/585/EZ, 2000/666/EZ, 2002/613/EZ, 2003/56/EZ, 2003/779/EZ, 2003/804/EZ, 2003/858/EZ, 2003/863/EZ, 2003/881/EZ, 2004/407/EZ, 2004/438/EZ, 2004/595/EZ, 2004/639/EZ i 2006/168/EZ (8). |
|
(6) |
Obrasci veterinarskih certifikata iz ove Uredbe za uvoz mesa divljih leporida, određenih divljih kopnenih sisavaca i kunića iz uzgoja u Zajednicu te provoz kroz Zajednicu, uključujući skladištenje tijekom provoza, moraju također biti usklađeni sa sustavom Traces, predviđenim Odlukom Komisije 2004/292/EZ od 30. ožujka 2004. o uvođenju sustava Traces (9). |
|
(7) |
Popis trećih zemalja ili njihovih dijelova iz Priloga II. Odluci Vijeća 79/542/EEZ (10) treba koristiti za uvoz mesa divljih leporida i kunića iz uzgoja u Zajednicu ili njihov provoz kroz Zajednicu. Treba sastaviti popis država za uvoz u Zajednicu mesa divljih kopnenih sisavaca osim kopitara, papkara i leporida ili njegov provoz kroz Zajednicu. |
|
(8) |
Zbog geografskog položaja Kaliningrada, treba predvidjeti posebne uvjete za provoz pošiljki za Rusiju ili iz Rusije kroz Zajednicu, a odnose se samo na Latviju, Litvu i Poljsku. |
|
(9) |
Da se izbjegnu poremećaji u trgovini, treba odobriti uporabu veterinarskih certifikata izdanih u skladu s Odlukom 2000/585/EZ tijekom prijelaznog razdoblja. |
|
(10) |
Radi jasnoće zakonodavstva Zajednice, Odluku Komisije 2000/585/EZ treba staviti izvan snage i zamijeniti je ovom Uredbom. |
|
(11) |
Mjere predviđene ovom Uredbom u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU UREDBU:
Članak 1.
Predmet i područje primjene
1. Ovom se Uredbom utvrđuje:
|
(a) |
popis trećih zemalja ili njihovih dijelova iz kojih je dozvoljen uvoz sljedećih proizvoda u Zajednicu ili njihov provoz kroz Zajednicu:
|
|
(b) |
zahtjevi u vezi s veterinarskim certificiranjem proizvoda iz podtočaka i., ii. i iii. („proizvodi”). |
2. Ne dovodeći u pitanje ograničenje iz članka 5. stavka 2., provoz za potrebe ove Uredbe obuhvaća i skladištenje tijekom provoza (uključujući stavljanje u skladište, kako je navedeno u članku 12. stavku 4. i članku 13. Direktive Vijeća 97/78/EZ (11)).
3. Ova se Uredba primjenjuje ne dovodeći u pitanje:
|
i. |
posebne zahtjeve za certificiranje predviđene sporazumima Zajednice s trećim zemljama; |
|
ii. |
odgovarajuća pravila za certificiranje koja su sadržana u zakonodavstvu o provedbi Uredbe (EZ) br. 338/97 o zaštiti vrsta divlje faune i flore uređenjem trgovine u tom području. |
Članak 2.
Definicija
Za potrebe ove Uredbe, „divlji leporidi” znači divlji kunići i zečevi.
Članak 3.
Popisi trećih zemalja ili njihovih dijelova iz kojih se proizvodi mogu uvoziti u Zajednicu ili provoziti kroz Zajednicu.
Proizvodi se uvoze u ili provoze kroz Zajednicu samo iz treće zemlje ili njezinog dijela navedenih ili spomenutih u dijelu 1. Priloga I.
Članak 4.
Veterinarsko certificiranje
1. Uz proizvode koji se uvoze u Zajednicu prilaže se veterinarski certifikat koji je sastavljen u skladu s obrascem certifikata iz Priloga II. za predmetni proizvod te ispunjen sukladno napomenama iz dijela 4. Priloga I.
2. Uz proizvode u provozu kroz Zajednicu prilaže se certifikat sastavljen u skladu s obrascem certifikata iz Priloga III.
3. Udovoljavanje dodatnim jamstvima, u skladu sa zahtjevima za određene države članice ili njezinog dijela, spomenutima u stupcima 4., 6. i 8. tablice u dijelu 1. Priloga I. te opisanima u dijelu 3. Priloga I., potvrđuje se popunjavanjem odgovarajućeg odjeljka veterinarskog certifikata za predmetne proizvode.
4. Mogu se koristiti i elektroničko certificiranje i drugi dogovoreni sustavi, usklađeni na razini Zajednice.
Članak 5.
Odstupanje za provoz kroz Latviju, Litvu i Poljsku
1. Odstupajući od članka 4. stavka 2., odobrava se provoz cestovnim putem ili željeznicom između graničnih inspekcijskih postaja u Latviji, Litvi i Poljskoj navedenih u Prilogu Odluci Komisije 2001/881/EZ (12) za pošiljke koje dolaze iz Rusije ili idu prema Rusiji, izravno ili preko neke druge treće zemlje, kad su ispunjeni sljedeći uvjeti:
|
(a) |
službeni veterinar na graničnoj inspekcijskoj postaji zapečaćuje pošiljku serijski numeriranom plombom; |
|
(b) |
na dokumente koji prate pošiljku, kako je predviđeno člankom 7. Direktive 97/78/EZ, službeni veterinar na graničnoj inspekcijskoj postaji pri ulasku stavlja na svaku stranicu žig s tekstom „Samo za provoz u Rusiju kroz EZ”; |
|
(c) |
mora se udovoljiti postupovnim zahtjevima iz članka 11. Direktive 97/78/EZ; |
|
(d) |
potvrđuje se da je pošiljka prihvatljiva za provoz na temelju zajedničkog veterinarskog ulaznog dokumenta koji izdaje službeni veterinar na inspekcijskoj postaji pri ulasku. |
2. Pošiljke iz stavka 1. ne smiju se istovariti ili stavljati u skladišta u Zajednici kako navedeno u članku 12. stavku 4. ili članku 13. Direktive 97/78/EZ.
3. Nadležna tijela provode redovite revizije kako bi se osiguralo da broj pošiljki iz stavka 1. i odgovarajuća količina proizvoda koji napuštaju Zajednicu, odgovara broju i količinama koje ulaze u Zajednicu.
Članak 6.
Stavljanje izvan snage
Odluka 2000/585/EZ stavlja se izvan snage.
Pozivanja na Odluku stavljenu izvan snage tumače se kao pozivanja na ovu Uredbu i tumače se u skladu s korelacijskom tablicom iz Priloga IV.
Članak 7.
Prijelazne odredbe
Proizvodi za koje su izdani odgovarajući veterinarski certifikati u skladu s Odlukom 2000/585/EZ mogu se uvoziti u Zajednicu ili provoziti kroz Zajednicu do 30. lipnja 2009.
Članak 8.
Stupanje na snagu i primjena
Ova Uredba stupa na snagu dvadesetog dana od dana objave u Službenom listu Europske unije.
Primjenjuje se od 1. lipnja 2009.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 9. veljače 2009.
Za Komisiju
Androulla VASSILIOU
Članica Komisije
(1) SL L 18, 23.1.2003., str. 11.
(2) SL L 139, 30.4.2004., str. 1., kako je ispravljeno u SL L 226, 25.6.2004., str. 3.
(3) SL L 139, 30.4.2004., str. 55., kako je ispravljeno u SL L 226, 25.6.2004., str. 22.
(4) SL L 139, 30.4.2004., str. 206., kako je ispravljeno u SL L 226, 25.6.2004., str. 83.
(5) SL L 165, 30.4.2004., str. 1., kako je ispravljeno u SL L 191, 28.5.2004., str. 1.
(6) SL L 251, 6.10.2000., str. 1.
(7) SL L 61, 3.3.1997., str. 1.
(8) SL L 104, 21.4.2007., str. 37.
(9) SL L 94, 31.3.2004., str. 63.
(10) SL L 146, 14.6.1979., str. 15.
(11) SL L 24, 30.1.1998., str. 9.
(12) SL L 326, 11.12.2001., str. 44.
PRILOG I.
MESO DIVLJIH LEPORIDA, ODREĐENIH DIVLJIH KOPNENIH SISAVACA I KUNIĆA IZ UZGOJA
DIO 1.
Popis trećih zemalja i njihovih dijelova i dodatna jamstva
|
Država |
Kod područja |
Leporidi |
Divlji kopneni sisavci, osim kopitara, papkara i leporida |
||||||||||
|
Divlji |
Zečevi iz uzgoja |
||||||||||||
|
MC |
AG |
MC |
AG |
MC |
AG |
||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
||||||
|
Australija |
AU |
WL |
|
RM |
|
WM |
|
||||||
|
Kanada |
CA |
WL |
|
RM |
|
WM |
|
||||||
|
Grenland |
GL |
WL |
|
RM |
|
WM |
|
||||||
|
Novi Zeland |
NZ |
WL |
|
RM |
|
WM |
|
||||||
|
Rusija |
RU |
WL |
|
RM |
|
WM |
|
||||||
|
Bilo koja treća zemlja ili njezin dio navedeni u stupcima 1. i 3. tablice u dijelu 1. Priloga II. Odluci 79/542/EEZ |
WL |
|
RM |
|
|
|
|||||||
|
|||||||||||||
DIO 2.
Obrasci veterinarskih certifikata
Obrazac (-sci):
|
„WL” |
: |
Obrazac veterinarskog certifikata za meso divljih leporida (kunića i zečeva) |
|
„WM” |
: |
Obrazac veterinarskog certifikata za meso divljih kopnenih sisavaca osim kopitara, papkara te leporida |
|
„RM” |
: |
Obrazac veterinarskog certifikata za meso zečeva iz uzgoja |
DIO 3.
Dodatna jamstva
DIO 4.
Napomene uz veterinarsko certificiranje
|
(a) |
Veterinarske certifikate koji se temelje na obrascima iz dijela 2. ovog Priloga i koji su sastavljeni kao obrazac za predmetni proizvod, izdaje treća zemlja izvoznica ili njezin dio. Oni sadrže potvrde nabrojene istim redoslijedom kojim se pojavljuju na obrascu, a koje su potrebne za bilo koju treću zemlju i, prema potrebi, dodatne uvjete zdravlja potrebne za treće zemlje izvoznice ili njihove dijelove. Ako odredišna država članica zahtijeva dodatna jamstva za predmetne proizvode, ona također trebaju biti unesena u izvorni obrazac veterinarskog certifikata. |
|
(b) |
Zasebni, jedinstveni certifikat mora biti izdan za svaku pošiljku proizvoda koja se izvozi u isto odredište s područja iz stupca 2. tablice u dijelu 1. ovog Priloga, a prevozi se željezničkim vagonom, kamionom, zrakoplovom ili brodom. |
|
(c) |
Izvornik certifikata sastoji se od jednog obostrano ispisanog lista papira, ili ako je potrebno više teksta, oblikuje se tako da sve stranice budu povezane u cjelinu i da su neodvojive. |
|
(d) |
Certifikat se sastavlja najmanje na jednom službenom jeziku države članice u kojoj se obavlja inspekcijski pregled na graničnoj inspekcijskoj postaji i na jednom službenom jeziku odredišne države članice. Međutim, te države članice mogu dozvoliti uporabu nekog drugog jezika Zajednice umjesto vlastitog, a prema potrebi se prilaže službeni prijevod. |
|
(e) |
Ako se zbog identifikacije stavki koje čine pošiljku prilažu dodatne stranice u certifikat, smatra se da i te stranice čine sastavni dio izvornika certifikata, tako što se na svaku pojedinu stranicu stavlja potpis i žig službenog veterinara koji ovjerava certifikat. |
|
(f) |
Ako certifikat, uključujući i dodatne stranice iz točke (e), obuhvaća više od jedne stranice, svaka se stranica numerira „–x (broj stranice) od y (ukupnog broja stranica)–” na dnu obrasca i nosi na vrhu obrasca šifru certifikata koju je odredilo nadležno tijelo. |
|
(g) |
Izvornik certifikata mora ispuniti i potpisati službeni veterinar najkasnije 24 sata prije utovara pošiljke za izvoz u Zajednicu, osim ako nije drukčije predviđeno zakonodavstvom Zajednice. U tu svrhu, nadležno tijelo treće zemlje izvoznice osigurava primjenu istih načela za certificiranje kao ona iz Direktive Vijeća 96/93/EZ (1). Boja potpisa mora se razlikovati od boje tiska. Isto pravilo vrijedi za žigove, osim reljefnih i vodenih žigova. |
|
(h) |
Izvornik certifikata mora biti priložen uz pošiljku do dolaska na graničnu inspekcijsku postaju pri ulasku u Europsku zajednicu. |
(1) SL L 13, 16.1.1997., str. 28.
PRILOG II.
OBRASCI VETERINARSKIH CERTIFIKATA ZA UVOZ MESA DIVLJIH LEPORIDA, ODREĐENIH DIVLJIH KOPNENIH SISAVACA I KUNIĆA IZ UZGOJA U EUROPSKU ZAJEDNICU









PRILOG III.
(kako je navedeno u članku 4. stavku 2.)
Obrazac veterinarskog certifikata za provoz/skladištenje mesa divljih leporida, kunića iz uzgoja i divljih kopnenih sisavaca, osim kopitara i papkara


PRILOG IV.
(kako je navedeno u članku 6.)
Korelacijska tablica
|
Odluka 2000/585/EZ |
Ova Uredba |
|
Članak 2. |
Članak 1. |
|
— |
Članak 2. |
|
Članak 2.a točka (a) |
Članak 3. |
|
Članak 2.a točke (b), (c) i (d) |
Članak 4. |
|
Članak 2.b |
Članak 5. |
|
Članak 4. stavak 1. |
Članak 6. |
|
Članak 4. stavak 2. |
Članak 7. |
|
Članak 3. |
Članak 8. |