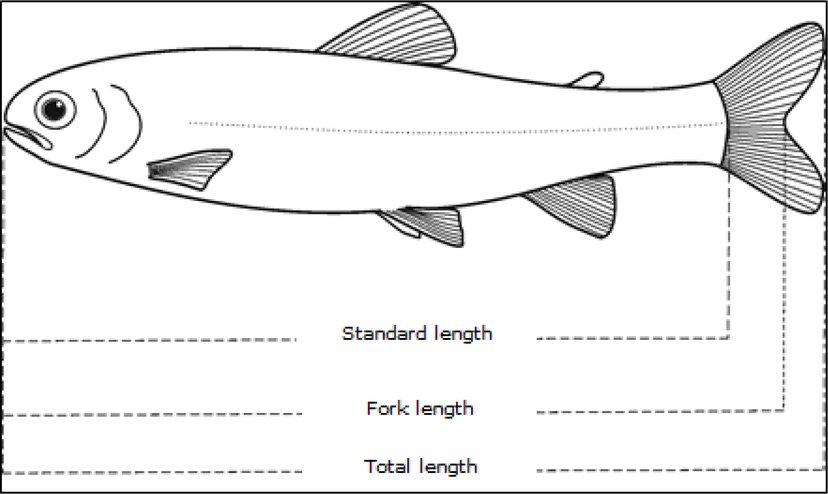
|
(8)
|
u dijelu B dodaju se sljedeća poglavlja:
„B.63. TEST PROBIRA ZA REPRODUKTIVNU/RAZVOJNU TOKSIČNOST
UVOD
|
1.
|
Ova ispitna metoda odgovara Smjernici OECD-a za ispitivanje 421 (TG) (2016.). Smjernice OECD-a za ispitivanje kemikalija periodično se preispituju uzimajući u obzir znanstveni napredak. Izvorna smjernica za test probira 421 donesena je 1995. na temelju protokola za preliminarni test probira za reproduktivnu toksičnost o kojem se raspravljalo na dva sastanka stručnjaka u Londonu 1990. (1.) i Tokiju 1992. (2.).
|
|
2.
|
Ova je ispitna metoda ažurirana relevantnim krajnjim učincima endokrinih ometača, kao nastavno djelovanje na aktivnost visokog prioriteta koju je OECD pokrenuo 1998. kako bi revidirao postojeće smjernice za ispitivanje i razvio nove smjernice za probir i ispitivanje potencijalnih endokrinih ometača (3.). Na primjer, Smjernica OECD-a za ispitivanje 407 (28-dnevno ispitivanje oralne toksičnosti na glodavcima uz primjenu ponovljenih doza, poglavlje B.7. ovog Priloga) poboljšana je 2008. parametrima koji su primjereni za otkrivanje endokrine aktivnosti ispitivanih kemikalija. Ažuriranjem Smjernice za ispitivanje 421 nastojalo se uključiti određene relevantne krajnje učinke endokrinih ometača u ispitne smjernice za probir ako razdoblja izlaganja obuhvaćaju neka od osjetljivih razdoblja tijekom razvoja (prenatalna razdoblja ili rana postnatalna razdoblja).
|
|
3.
|
Odabrani dodatni relevantni krajnji učinci endokrinih ometača, koji su i dio Smjernice za ispitivanje 443 (produljena studija reproduktivne toksičnosti na jednoj generaciji, poglavlje B.56. ovog Priloga), uključeni su u Smjernicu za ispitivanje 421 na temelju studije izvedivosti koja se bavi znanstvenim i tehničkim pitanjima povezanima s njihovim uključivanjem te mogućim prilagodbama plana ispitivanja koje su potrebne za njihovo uključivanje (4.).
|
|
4.
|
Ova je ispitna metoda osmišljena za dobivanje ograničenih informacija o učincima ispitivane kemikalije na reproduktivnost mužjaka i ženki kao što su funkcija gonada, ponašanje kod parenja, začeće, razvoj zametka i parturicija. Ona nije alternativa i ne zamjenjuje postojeće ispitne metode B.31., B.34., B.35. ili B.56.
|
POČETNA RAZMATRANJA
|
5.
|
Ova se ispitna metoda za probir može upotrebljavati za dobivanje početnih informacija o mogućim učincima na reprodukciju i/ili razvoj, u ranoj fazi procjene toksikoloških svojstava kemikalija ili za zabrinjavajuće kemikalije. Može se upotrebljavati i kao dio testova početnog probira za postojeće kemikalije za koje je dostupno malo ili nimalo toksikoloških informacija, kao istraživanje o utvrđivanju raspona doze za opsežnije reproduktivne/razvojne studije ili ako se smatra relevantnom iz drugih razloga. Pri provođenju istraživanja treba slijediti opća načela i razmatranja navedena u OECD-ovoj Smjernici br. 19 o priznavanju, procjeni i korištenju kliničkih znakova kao humanih krajnjih točaka za pokusne životinje koje se upotrebljavaju u ocjenama sigurnosti (5.).
|
|
6.
|
Ovom se ispitnom metodom ne dobivaju potpune informacije o svim aspektima reprodukcije i razvoja. Točnije, metoda pruža samo ograničena sredstva za otkrivanje postnatalnih manifestacija prenatalnog izlaganja ili učinaka koji se mogu inducirati tijekom postnatalnog izlaganja. Zbog (među ostalim) relativno malog broja životinja u skupinama koje primaju dozu, selektivnosti krajnjih učinaka i kratkog trajanja istraživanja ovom metodom neće se dobiti dokazi za konačne tvrdnje o nepostojanju učinaka. Osim toga, ako ne postoje podaci iz drugih ispitivanja reproduktivne/razvojne toksičnosti, pozitivni rezultati korisni su za početnu procjenu opasnosti i pridonose odlukama u pogledu potrebe za dodatnim ispitivanjem i njegova vremenskog okvira.
|
|
7.
|
Rezultate dobivene parametrima povezanima s endokrinim sustavom treba promatrati u kontekstu „OECD-ova konceptualnog okvira za ispitivanje i procjenu endokrino disruptivnih kemikalija” (6.). U tom Konceptualnom okviru poboljšana Smjernica OECD-a za ispitivanje 421 nalazi se na razini 4. kao in vivo test i pruža podatke o štetnim učincima na relevantne endokrine krajnje točke. Međutim, endokrini signal ne mora se sam po sebi smatrati dovoljnim dokazom da je ispitivana kemikalija endokrini ometač.
|
|
8.
|
U ovoj ispitnoj metodi pretpostavlja se oralna primjena ispitivane kemikalije. Ako se upotrebljavaju drugi načini izlaganja, mogu biti potrebne prilagodbe.
|
|
9.
|
Prije nego što se ova ispitna metoda primijeni na smjesi radi dobivanja podataka za predviđenu regulatornu svrhu, potrebno je razmotriti mogu li se te, ako se mogu, zašto se njome mogu dobiti primjereni rezultati za tu svrhu. Ta razmatranja nisu potrebna ako postoji regulatorni zahtjev za ispitivanje smjese.
|
|
10.
|
Upotrijebljene definicije navedene su u Dodatku 1.
|
NAČELO ISPITIVANJA
|
11.
|
Ispitivana kemikalija primjenjuje se u gradiranim dozama na nekoliko skupina mužjaka i ženki. Na mužjake treba primjenjivati dozu najmanje četiri tjedna te do dana i uključujući dan prije planiranog usmrćivanja (to uključuje najmanje dva tjedna prije parenja, tijekom razdoblja parenja i približno dva tjedna poslije parenja). S obzirom na ograničeno razdoblje doziranja prije parenja u mužjaka, plodnost možda neće biti osobito osjetljiv pokazatelj testikularne toksičnosti. Stoga je od ključne važnosti podroban histološki pregled sjemenika. Kombinacija razdoblja doziranja prije parenja od dva tjedna i naknadno promatranje parenja/plodnosti s ukupnim razdobljem doziranja od najmanje četiri tjedna, nakon čega slijedi podrobna histopatologija muških gonada smatraju se dovoljnima da bi se omogućilo otkrivanje većine učinaka na plodnost mužjaka i spermatogenezu.
|
|
12.
|
Ženkama dozu treba davati tijekom cijelog istraživanja. To uključuje dva tjedna prije parenja (pri čemu je cilj obuhvatiti najmanje dva cijela ciklusa estrusa), promjenjivo vrijeme do začeća, trajanje graviditeta i najmanje 13 dana nakon okota, do dana i uključujući dan prije planiranog usmrćivanja.
|
|
13.
|
Trajanje istraživanja, nakon aklimatizacije i procjene ciklusa estrusa prije doziranja, ovisi o ponašanju ženki i iznosi približno 63 dana [najmanje 14 dana prije parenja, (do) 14 dana parenja, 22 dana gestacije, 13 dana laktacije].
|
|
14.
|
Tijekom razdoblja primjene životinje se svakodnevno pažljivo promatraju radi uočavanja znakova toksičnosti. Životinje koje uginu ili su usmrćene tijekom razdoblja ispitivanja podvrgavaju se obdukciji, a na kraju ispitivanja preživjele se životinje usmrćuju i podvrgavaju obdukciji.
|
OPIS METODE
Odabir životinjske vrste
|
15.
|
Ova ispitna metoda osmišljena je za upotrebu na štakorima. Ako se parametri navedeni u ovoj ispitnoj metodi istražuju na drugoj vrsti glodavaca, treba pružiti detaljno obrazloženje. U međunarodnom validacijskom programu za određivanje endokrinih ometača u Smjernici OECD-a za ispitivanje 407 (koja odgovara poglavlju B.7. ovog Priloga) primjenjivali su se samo štakori. Sojeve slabe plodnosti ili poznate po velikoj učestalosti razvojnih defekata ne bi trebalo koristiti. Treba koristiti zdrave životinje koje se prethodno nisu parile i nisu sudjelovale u pokusima. Ispitne životinje treba opisati u pogledu vrste, soja, spola, mase i dobi. Na početku istraživanja razlike u tjelesnoj masi korištenih životinja trebale bi biti minimalne i ne bi trebale prelaziti 20 % srednje vrijednosti tjelesne mase svakog spola. Kad se istraživanje provodi kao preliminarno istraživanje u odnosu na dugotrajno istraživanje ili istraživanje cijele generacije, prednost se daje primjeni životinja istog soja i podrijetla u oba istraživanja.
|
Smještaj i hranjenje
|
16.
|
Svi postupci trebaju biti usklađeni s lokalnim standardima brige o životinjama u laboratoriju. Temperatura u prostoriji u kojoj se drže pokusne životinje treba biti 22 °C (±3 o). Iako bi relativna vlaga trebala biti najmanje 30 %, a poželjno je da ne prelazi 70 %, osim tijekom čišćenja prostorije, cilj bi trebao biti 50–60 %. Rasvjeta treba biti umjetna uz izmjenu 12 sati svjetla i 12 sati mraka. Za hranjenje se može upotrebljavati konvencionalna laboratorijska hrana uz neograničenu količinu vode za piće. Na izbor prehrane može utjecati potreba da se osigura odgovarajuća mješavina ispitivane kemikalije kad se ona daje na taj način.
|
|
17.
|
Životinje trebaju biti smještene u malim skupinama istoga spola; ako je to znanstveno opravdano, životinje se mogu držati u zasebnim nastambama. U slučaju skupnog smještaja, u jednom kavezu ne smije biti smješteno više od pet životinja. Postupci parenja trebali bi se odvijati u kavezima koji odgovaraju toj svrsi. Gravidne ženke treba smjestiti u posebne kaveze i treba im osigurati materijale za izradu gnijezda. Ženke se tijekom laktacije smještaju pojedinačno s njihovom mladunčadi.
|
|
18.
|
Treba redovito analizirati ima li u hrani kontaminanata. Uzorak hrane treba sačuvati do kraja izrade izvješća.
|
Priprema životinja
|
19.
|
Zdrave, mlade odrasle životinje nasumce se raspoređuju u kontrolne skupine i skupine za tretiranje. Kaveze bi trebalo rasporediti tako da se učinci do kojih bi moglo doći zbog položaja kaveza svedu na minimum. Životinje se označuju na jedinstven način i drže u kavezima najmanje pet dana prije početka istraživanja kako bi se prilagodile laboratorijskim uvjetima.
|
Priprema doza
|
20.
|
Preporučuje se da se ispitivana kemikalija daje oralno osim ako se neki drugi načini primjene smatraju prikladnijima. Ako se odabere oralna primjena, ispitivana kemikalija obično se primjenjuje oralnom intubacijom; međutim, u određenim slučajevima, ispitivane kemikalije mogu se primijeniti i s hranom ili vodom za piće.
|
|
21.
|
Prema potrebi, ispitivana se kemikalija otapa ili suspendira u odgovarajućem nosaču. Preporučuje se da se, kad je god moguće, u obzir najprije uzme vodena otopina/suspenzija pa zatim otopina/emulzija u ulju (npr. kukuruzno ulje) te zatim moguća otopina u drugim nosačima. Za nosače koji nisu voda moraju biti poznata toksična svojstva nosača. Treba utvrditi stabilnost i homogenost ispitivane kemikalije u nosaču.
|
POSTUPAK
Broj i spol životinja
|
22.
|
Preporučuje se da se u svakoj skupini započne s najmanje deset mužjaka i 12–13 ženki. Ženke će se prije izlaganja procijeniti u pogledu ciklusa estrusa i životinje koje ne pokažu uobičajeni ciklus od četiri do pet dana neće se uključiti u istraživanje; stoga se preporučuje više ženki kako bi se dobilo deset ženki po skupini. Osim u slučaju znatnih toksičnih učinaka, očekuje se da će se tako dobiti najmanje osam gravidnih ženki po skupini, a to je obično najmanji prihvatljivi broj gravidnih ženki po skupini. Cilj je dobiti dovoljno gravidnih životinja i potomaka kako bi se osigurala valjana procjena potencijala ispitivane kemikalije da utječe na plodnost, gravidnost, ponašanje ženki (majki) i potomaka koji sišu te rast i razvoj potomstva F1 od začeća do 13. dana nakon okota.
|
Doziranje
|
23.
|
Općenito, treba upotrijebiti najmanje tri ispitne skupine i jednu kontrolnu skupinu. Visine doze mogu se temeljiti na informacijama iz ispitivanja akutne toksičnosti ili na rezultatima istraživanja s ponovljenim dozama. Osim tretiranja ispitivanom kemikalijom, sa životinjama u kontrolnoj skupini treba postupati na isti način kao sa životinjama iz ispitne skupine. Ako se pri primjeni ispitivane kemikalije koristi nosač, volumen nosača koji primi kontrolna skupina treba biti jednak najvećem upotrijebljenom volumenu.
|
|
24.
|
Visine doza treba odabrati uzimajući u obzir sve postojeće podatke o toksičnosti i (toksiko)kinetici koji su dostupni. Treba uzeti u obzir i da je moguća razlika u osjetljivosti između gravidnih ženki i ženki koje nisu gravidne. Najvišu dozu treba odabrati s ciljem induciranja toksičnih učinaka, ali ne i smrti ili velike patnje životinja. Nakon toga treba odabrati slijed postupnog smanjivanja visine doze kako bi se dokazali svi odgovori povezani s doziranjem te da se kod najniže doze ne opažaju štetni učinci (NOAEL). Za određivanje sve nižih doza često su najpogodniji dvostruki do četverostruki intervali, i često je bolje dodati četvrtu ispitnu skupinu nego da između doziranja budu jako veliki intervali (npr. iznad faktora 10).
|
|
25.
|
Ako se opaze znakovi opće toksičnosti (npr. smanjena tjelesna masa, učinci na jetri, srcu, plućima ili bubrezima itd.) ili druge promjene koje ne moraju biti toksični odgovori (npr. smanjeno uzimanje hrane, povećanje jetre), uočene učinke na endokrinim krajnjim točkama treba tumačiti s oprezom.
|
Granični test
|
26.
|
Ako istraživanje provedeno oralnom primjenom jedne doze od najmanje 1 000 mg/kg tjelesne mase na dan, ili kod davanja doze s hranom ili vodom za piće, primjenom doze koja se u ekvivalentnom postotku daje s hranom ili vodom za piće, u skladu s postupcima opisanima u ovom istraživanju, ne proizvede uočljive toksične učinke i ako na temelju podataka iz strukturno srodnih tvari ne treba očekivati toksičnost, može se smatrati da provođenje potpune studije s nekoliko visina doza nije neophodno. Granični test je relevantan samo ako izloženost ljudi ne ukazuje na potrebu za primjenom veće oralne doze. Za druge vrste primjene doza, kao što su inhalacija ili dermalna primjena, maksimalna koncentracija koja se može postići često je određena fizikalno-kemijskim svojstvima ispitivanih kemikalija.
|
Primjena doza
|
27.
|
Životinjama se svakodnevno daje ispitivana kemikalija sedam dana tjedno. U slučaju primjene oralnom intubacijom ispitivanu kemikaliju treba životinjama dati u jednoj dozi s pomoću želučane sonde ili prikladne intubacijske kanile. Maksimalni volumen tekućine koji se može jednokratno dati ovisi o veličini ispitne životinje. Taj volumen ne smije biti veći od 1 ml/100 g tjelesne mase, osim kad se radi o vodenim otopinama koje dopuštaju primjenu volumena od 2 ml/100 g tjelesne mase. Osim u slučaju nadražujućih ili nagrizajućih ispitivanih kemikalija kod kojih se štetni učinci obično javljaju pri višim koncentracijama, varijabilnost ispitnog volumena treba prilagođavanjem koncentracije svesti na najmanju moguću mjeru kako bi se zajamčio stalni volumen pri svim visinama doza.
|
|
28.
|
Kod ispitivane kemikalije koja se primjenjuju s hranom ili vodom za piće važno je osigurati da količine ispitivane kemikalije ne utječu na uravnoteženi unos hrane ili vode. Kad se ispitivana kemikalija daje s hranom, može se koristiti ili stalna koncentracija u odnosu na količinu hrane (ppm) ili stalna visina doze u odnosu na tjelesnu masu životinje; treba navesti iskorištenu opciju. Za ispitivanu kemikaliju koja se primjenjuje oralnom intubacijom, dozu treba davati u podjednako vrijeme ili vremena svakog dana i prilagoditi je najmanje jednom tjedno kako bi se održala stalna visina doze s obzirom na tjelesnu masu životinje.
|
Plan pokusa
|
29.
|
Doziranje životinja oba spola trebalo bi započeti najmanje dva tjedna prije parenja, nakon aklimatizacije od najmanje pet dana te nakon što se ženke proberu u pogledu normalnog ciklusa estrusa (u razdoblju od dva tjedna prije tretiranja). Istraživanje treba planirati tako da procjena ciklusa estrusa počne ubrzo nakon što životinje postignu punu spolnu zrelost. To se može malo razlikovati za različite sojeve štakora u različitim laboratorijima, npr. deset tjedana kod štakora soja Sprague Dawley i 12 tjedana kod soja Wistar. Ženke (majke) s potomstvom trebalo bi usmrtiti 13. dana nakon okota ili ubrzo nakon toga. Dan okota (tj. kad se dovrši parturicija) definira se kao nulti dan nakon okota. Ženke koje ne pokazuju znakove kopulacije usmrćuju se 24–26 dana nakon posljednjeg dana razdoblja parenja. Doziranje se nastavlja kod oba spola tijekom razdoblja parenja. Mužjake bi i dalje trebalo dozirati nakon razdoblja parenja barem dok ne istekne ukupno razdoblje doziranja od 28 dana. Zatim se usmrćuju ili se zadržavaju i nastavljaju dozirati radi mogućeg provođenja drugog parenja ako se to smatra primjerenim.
|
|
30.
|
Svakodnevno doziranje roditeljskih ženki trebalo bi se nastaviti tijekom cijele gravidnosti i najmanje do 13. dana nakon okota, uključujući i taj dan, ili dan prije usmrćivanja. Kod istraživanja u kojima se ispitivana kemikalija primjenjuje inhalacijom i/ili dermalnim putem doziranje bi se trebalo nastaviti barem do 19. dana gestacije, uključujući i taj dan, i s doziranjem bi se trebalo ponovno početi što prije, a najkasnije na 4. postnatalni dan (PND).
|
|
31.
|
Dijagram plana pokusa prikazan je u Dodatku 2.
|
Postupak parenja
|
32.
|
U ovom bi se istraživanju obično trebalo upotrebljavati parenje 1:1 (jedan mužjak na jednu ženku). Iznimke se mogu javiti ako dođe do smrti mužjaka. Ženku bi trebalo smjestiti s istim mužjakom dok se ne uoče znakovi kopulacije ili dok ne isteknu dva tjedna. Svako jutro ženke treba pregledati s obzirom na prisutnost sperme ili vaginalnog čepa. Nultim danom graviditeta smatra se dan kad je potvrđeno parenje (pronađen je vaginalni čep ili sperma). Ako je parenje neuspješno, može se razmotriti mogućnost ponovnog parenja ženki s dokazanim mužjacima iste skupine.
|
Veličina legla
|
33.
|
Četiri dana nakon okota veličina svakog legla može se prilagoditi nasumičnim selekcijskim uklanjanjem suvišnih mladunaca tako da se po jednom leglu po mogućnosti ostavi četiri ili pet mladunaca svakog spola ovisno o uobičajenoj veličini legla soja štakora koji se upotrebljavaju. Uzorke krvi treba prikupiti od dva dodatna mladunca, objediniti ih i upotrijebiti za određivanje razina seruma T4. Nije prihvatljivo selektivno uklanjanje mladunaca, npr. prema tjelesnoj masi ili anogenitalnom razmaku. Kad je god broj muških ili ženskih mladunaca takav da nije moguće imati četiri ili pet mladunaca svakog spola po leglu, prihvatljivo je djelomično prilagođavanje (npr. šest mužjaka i četiri ženke). Mladunci se ne uklanjaju ako bi se veličina legla time smanjila ispod cilja izdvajanja mladunaca (osam ili deset mladunaca po leglu). Ako je dostupan samo jedan mladunac povrh cilja izdvajanja mladunaca, uklanja se samo jedan mladunac i od njega se uzima krv za moguću procjenu seruma T4.
|
|
34.
|
Ako se veličina legla ne prilagođava, 4. dana nakon okota usmrćuju se dva mladunca po leglu i uzimaju se uzorci krvi radi mjerenja koncentracija seruma hormona štitnjače. Ako je moguće, ta dva mladunca po leglu trebale bi biti ženke kako bi se mužjaci sačuvali za procjenu zadržavanja bradavica osim ako uklanjanjem tih mladunaca više ne bi ostalo ženki za procjenu pri završetku ispitivanja. Mladunci se neće uklanjati ako bi se time veličina legla smanjila na manje od osam ili deset mladunaca po leglu (ovisno o uobičajenoj veličini legla kod soja štakora koji se upotrebljava). Ako je dostupan samo jedan mladunac povrh uobičajene veličine legla, uklanja se samo jedan mladunac i od njega se uzima krv za moguću procjenu seruma T4.
|
Opažanja uživo
Klinička opažanja
|
35.
|
Tijekom cijelog razdoblja ispitivanja treba provoditi opća klinička opažanja barem jednom dnevno te češće ako se uoče znakovi toksičnosti. Poželjno ih je provoditi u isto vrijeme ili vremena svakog dana vodeći računa o razdoblju najvećeg intenziteta očekivanih učinaka nakon doziranja. Treba zabilježiti značajne promjene ponašanja, znakove otežane ili produljene parturicije i sve znakove toksičnosti, uključujući smrtnost. Te bi bilješke trebale uključivati vrijeme početka, stupanj i trajanje znakova toksičnosti.
|
Tjelesna masa i unos hrane/vode
|
36.
|
Mužjake i ženke treba vagati prvog dana primjene doze, a zatim najmanje jednom tjedno i zadnji dan. Tijekom graviditeta ženke bi trebalo vagati 0., 7., 14. i 20. dana te u roku od 24 sata od parturicije (0. ili 1. dan nakon okota) te barem 4. i 13. dana nakon okota. Ta opažanja treba unijeti u izvješće za svaku odraslu životinju posebno.
|
|
37.
|
Tijekom razdoblja prije parenja, graviditeta i laktacije unos hrane trebalo bi mjeriti najmanje jednom tjedno. Mjerenje unosa hrane tijekom parenja nije obvezno. Trebalo bi mjeriti i unos vode tijekom tih razdoblja ako se ispitivana kemikalija primjenjuje s vodom za piće.
|
Ciklusi estrusa
|
38.
|
Cikluse estrusa trebalo bi pratiti prije početka tretiranja kako bi se za studiju izabrale ženke s uobičajenim ciklusom (vidjeti stavak 22.). Svakodnevno bi se trebali pratiti i vaginalni brisovi od početka razdoblja tretiranja do pojave znakova parenja. Ako postoji zabrinutost u pogledu učinaka akutnog stresa koji bi mogli izmijeniti cikluse estrusa kad se počnu primjenjivati doze, laboratoriji mogu izlagati ispitne životinje dva tjedna, zatim svaki dan prikupiti vaginalne brisove kako bi pratili ciklus estrusa najmanje dva tjedna tijekom razdoblja prije parenja, uz stalno praćenje tijekom razdoblja parenja do pojave znakova parenja. Ako se uzimaju vaginalne/cervikalne stanice, treba paziti da se ne poremeti mukoza jer to može inducirati lažnu trudnoću (7. i 8.).
|
Parametri potomaka
|
39.
|
Vrijeme gestacije treba zabilježiti i računati od nultog dana graviditeta. Svako leglo nakon okota treba što prije pregledati kako bi se utvrdio broj i spol mladunaca, mrtvorođenih, živorođenih, patuljastih životinja (mladunci koji su znatno manji od odgovarajućih kontrolnih mladunaca) i prisutnost velikih abnormalnosti.
|
|
40.
|
Žive mladunce trebalo bi prebrojati i odrediti njihov spol te bi legla trebalo izvagati u roku od 24 sata od parturicije (0. ili 1. dan nakon okota) te barem 4. i 13. dana nakon okota. Uz opažanja opisana u stavku 35. trebalo bi zabilježiti i svako abnormalno ponašanje potomaka.
|
|
41.
|
Treba izmjeriti anogenitalni razmak u svakog mladunca na isti postnatalni dan, od nultog do 4. postnatalnog dana. Tjelesnu masu mladunaca treba utvrditi na dan mjerenja anogenitalnog razmaka, a njega treba normalizirati u odnosu na veličinu mladunca (najbolje kubni korijen tjelesne mase (9.)). Broj bradavica/areola u mužjaka mladunaca trebalo bi utvrditi 12. ili 13. postnatalnog dana, kako se preporučuje u Smjernici OECD-a 151 (10.).
|
Klinička biokemija
|
42.
|
Uzorci krvi uzimaju se s utvrđenog mjesta na temelju sljedećeg rasporeda:
|
—
|
od najmanje dva mladunca po leglu 4. dana nakon okota ako broj mladunaca to omogućuje (vidjeti stavke 33.–34.),
|
|
—
|
od svih ženki (majki) i najmanje dva mladunaca po leglu pri završetku ispitivanja 13. dana, i
|
|
—
|
od svih odraslih mužjaka pri završetku ispitivanja.
|
|
Svi uzorci krvi spremaju se u odgovarajućim uvjetima. Uzorci krvi mladunaca i odraslih mužjaka uzeti 13. dana procjenjuju se u pogledu razina seruma hormona štitnjače (T4). Daljnja procjena hormona T4 u uzorcima krvi ženki (majki) i mladunaca uzetih 4. dana obavlja se po potrebi. Moguće je i mjerenje drugih hormona ako je to relevantno. Krv mladunaca može se izvaditi po leglu radi analiza hormona štitnjače. Hormone štitnjače (T4 i TSH) po mogućnosti bi trebalo mjeriti kao „ukupni broj”.
|
43.
|
Sljedeći čimbenici mogu utjecati na varijabilnost i apsolutne koncentracije za određivanje hormona:
|
—
|
vrijeme usmrćivanja zbog dnevne varijacije koncentracije hormona,
|
|
—
|
metoda usmrćivanja radi izbjegavanja pretjeranog stresa za životinje koji može utjecati na koncentraciju hormona,
|
|
—
|
pribori za određivanje hormona koji se mogu razlikovati po njihovim standardnim krivuljama.
|
|
|
44.
|
Uzorke plazme koji su posebno namijenjeni određivanju hormona treba uzeti u usporedivo doba dana. Brojčane vrijednosti dobivene analizom koncentracija hormona razlikuju se ovisno o različitom, komercijalno dostupnom priboru.
|
Patologija
Makroskopska nekropsija
|
45.
|
U trenutku usmrćivanja ili u slučaju smrti tijekom istraživanja, odrasle životinje treba makroskopski pregledati radi otkrivanja bilo kakvih abnormalnosti ili patoloških promjena. Posebnu pozornost treba obratiti na organe reproduktivnog sustava. Broj mjesta za implantaciju treba zabilježiti. Vaginalne briseve treba pregledati ujutro na dan nekropsije kako bi se utvrdila faza ciklusa estrusa i omogućila korelacija s histopatologijom jajnika.
|
|
46.
|
Sjemenike i sjemene kanaliće (epididimis) te prostatu i sjemene mjehuriće s koagulacijskim žlijezdama, kao cjelinu, svih odraslih mužjaka treba po potrebi obrezivanjem osloboditi od svih prianjajućih tkiva te ih treba izvagati u mokrom stanju što prije nakon seciranja kako bi se spriječilo njihovo sušenje. Osim toga, mase neobaveznih organa mogle bi uključivati kompleks anusnog podizača i bulbokavernoznog mišića, Cowperove žlijezde i glans penisa kod mužjaka te jajnike u paru (mokra masa) i maternicu (uključujući cerviks) kod ženki; ako se uključuju, te bi mase trebalo prikupiti što prije nakon seciranja.
|
|
47.
|
Mrtve mladunce i mladunce koje se usmrti 13. dana nakon okota, ili ubrzo nakon toga, trebalo bi pažljivo pregledati kako bi se utvrdile barem vanjske velike abnormalnosti. Posebnu pozornost treba posvetiti vanjskim reproduktivnim genitalijama koje se pregledava kako bi se utvrdili mogući znakovi promijenjenog razvoja. Na 13. bi se dan trebala sačuvati štitnjača jednog muškog i jednog ženskog mladunca po leglu.
|
|
48.
|
Treba sačuvati jajnike, sjemenike, sekundarne spolne organe (maternica i cerviks, sjemeni kanalići, prostata, sjemeni mjehurići zajedno s koagulirajućim žlijezdama), štitnjaču i sve organe koji pokazuju makroskopske lezije svih odraslih životinja. Za rutinski pregled sjemenika i sjemenih kanalića ne preporučuje se fiksiranje u formalinu. Za ta je tkiva prihvatljiva metoda upotreba Bouinova fiksativa ili izmijenjenog Davidsonova fiksativa (11.). Vezivna ovojnica može se nježno i plitko punktirati na oba pola organa iglom koja omogućuje brzu penetraciju fiksativa.
|
Histopatologija
|
49.
|
Treba obaviti podroban histološki pregled jajnika, sjemenika i sjemenih kanalića (uz poseban naglasak na faze spermatogeneze i histopatologiju strukture intersticijskih stanica sjemenika) životinja iz skupine koja je primala najveću dozu i iz kontrolne skupine. Po potrebi se mogu pregledati i ostali sačuvani organi, uključujući štitnjaču mladunaca i odraslih životinja. Masa štitnjače može se odrediti nakon fiksacije. Obrezivanje također treba obaviti vrlo pažljivo te samo nakon fiksacije kako bi se izbjeglo oštećenje tkiva. Oštećena tkiva mogu kompromitirati histopatološku analizu. Ispitivanja treba proširiti na životinje iz drugih skupina doziranja ako su u skupini s najvećom dozom uočene promjene. Smjernice o histopatologiji (11.) pružaju dodatne podrobne informacije o sekciji, fiksaciji, seciranju i histopatologiji endokrinih tkiva.
|
PODACI I IZVJEŠĆIVANJE
Podaci
|
50.
|
Treba navesti podatke za svaku pojedinačnu životinju. Osim toga, sve podatke treba sažeti u obliku tablice, tako da se za svaku ispitnu skupinu navede broj životinja na početku ispitivanja, broj životinja koje su uginule tijekom ispitivanja ili su usmrćene iz humanih razloga, vrijeme smrti ili humanog usmrćenja, broj plodnih životinja, broj gravidnih ženki, broj životinja koje pokazuju znakove toksičnosti, opis uočenih znakova toksičnosti, uključujući vrijeme prve pojave, trajanje i ozbiljnost toksičnih učinaka, vrste histopatoloških promjena i sve relevantne podatke o leglu. Format sažetog izvješća u obliku tablice koji se pokazao vrlo korisnim za procjenu reproduktivnog/razvojnog učinka naveden je u Dodatku 3.
|
|
51.
|
Zbog ograničenih dimenzija istraživanja, statističke analize kojima se nastoji ispitati važnost rezultata imaju ograničenu vrijednost za mnoge krajnje točke, osobito za reproduktivne krajnje točke. Ako se upotrebljavaju statističke analize, odabrana metoda trebala bi biti primjerena za distribuciju varijable koja se ispituje i treba je odabrati prije početka istraživanja. Statistička analiza anogenitalnog razmaka i zadržavanja bradavica trebala bi se temeljiti na podacima za pojedinačne mladunce, uzimajući u obzir učinke na leglo. Ako je primjereno, jedinicu analize čini leglo. Statistička analiza tjelesne mase mladunaca trebala bi se temeljiti na podacima za pojedinačne mladunce, uzimajući u obzir veličinu legla. Zbog toga što su skupine male, kao pomoć u tumačenju istraživanja mogu biti korisni podaci iz prijašnjih kontrola (npr. za veličinu legla) ako su dostupni.
|
Ocjena rezultata
|
52.
|
Nalaze ovog istraživanja toksičnosti treba ocijeniti s obzirom na uočene učinke, nekropsiju i mikroskopske nalaze. Evaluacija treba obuhvatiti odnos između doze ispitivane kemikalije i prisutnosti ili izostanka, učestalosti i ozbiljnosti abnormalnosti, uključujući makrolezije, identificirane ciljne organe, neplodnost, kliničke abnormalnosti, promjene sposobnosti reprodukcije i legla, promjene tjelesne mase, učinke na smrtnost i sve ostale toksične učinke.
|
|
53.
|
Zbog kratkog razdoblja tretiranja mužjaka, pri procjeni učinaka na reprodukciju mužjaka uz podatke o plodnosti trebalo bi razmotriti histopatologiju sjemenika i sjemenih kanalića. Kao pomoć u tumačenju istraživanja može biti korisna i upotreba podataka o prijašnjim kontrolama u vezi s reprodukcijom/razvojem (npr. za veličinu legla, anogenitalni razmak, zadržavanje bradavica, razine seruma T4) ako su dostupni.
|
|
54.
|
Radi kontrole kvalitete predlaže se da se prikupljaju podaci o prijašnjim kontrolama te da se izračunaju koeficijenti varijacije za brojčane podatke, posebno za parametre povezane s otkrivanjem endokrinih ometača. Ti se podaci mogu upotrijebiti za uspoređivanje kad se ocjenjuju konkretna istraživanja.
|
Izvješće o ispitivanju
|
55.
|
Izvješće o ispitivanju trebalo bi sadržavati sljedeće informacije:
|
|
Ispitivana kemikalija:
|
—
|
izvor, broj serije, rok uporabe, ako su dostupni,
|
|
—
|
stabilnost ispitivane kemikalije, ako je poznata.
|
|
|
|
Tvar s jednim sastojkom:
|
—
|
fizički izgled, topljivost u vodi i druga relevantna fizikalno-kemijska svojstva,
|
|
—
|
kemijske identifikacijske oznake, kao što su IUPAC ili CAS naziv, CAS broj, SMILES ili InChI oznaka, strukturna formula, čistoća, kemijski identitet nečistoća prema potrebi i ako je izvedivo u praksi itd.
|
|
|
|
Tvari s više sastojaka, UVCB tvari i smjese:
|
—
|
opis (koliko je to moguće) kemijskog identiteta (vidjeti gore), kvantitativnog udjela i relevantnih fizikalno-kemijskih svojstava sastojaka.
|
|
|
|
Nosač (po potrebi):
|
—
|
obrazloženje odabira nosača ako nije riječ o vodi.
|
|
|
|
Ispitne životinje:
|
—
|
broj, dob i spol životinja,
|
|
—
|
podrijetlo, uvjeti smještaja, prehrana itd.,
|
|
—
|
pojedinačna tjelesna masa životinja na početku ispitivanja,
|
|
—
|
obrazloženje odabira vrste ako se ne radi o štakorima.
|
|
|
|
Ispitni uvjeti:
|
—
|
obrazloženje odabira visine doze,
|
|
—
|
pojedinosti o formulaciji ispitivane kemikalije/pripremanju hrane, postignuta koncentracija, stabilnost i homogenost pripravka,
|
|
—
|
pojedinosti o primjeni ispitivane kemikalije,
|
|
—
|
preračunavanje koncentracije ispitivane kemikalije u hrani/vodi za piće (ppm) u stvarnu dozu (mg/kg tjelesne težine/dan), prema potrebi,
|
|
—
|
pojedinosti o kvaliteti hrane i vode,
|
|
—
|
podroban opis postupka nasumičnog odabira mladunaca za izdvajanje ako se ono obavlja.
|
|
|
|
Rezultati:
|
—
|
tjelesna masa/promjene tjelesne mase,
|
|
—
|
unos hrane i unos vode, ako su dostupni,
|
|
—
|
podaci o toksičnom odgovoru po spolu i dozi, uključujući plodnost, gestaciju i sve druge znakove toksičnosti,
|
|
—
|
toksični ili drugi učinci na reprodukciju, potomstvo, rast nakon rođenja itd.,
|
|
—
|
vrsta, stupanj i trajanje uočenih kliničkih promjena (reverzibilne ili ireverzibilne),
|
|
—
|
broj odraslih ženki s normalnim ili abnormalnim ciklusom estrusa i trajanje ciklusa,
|
|
—
|
broj živorođenih i gubitaka nakon implantacija,
|
|
—
|
podaci o tjelesnoj masi mladunaca,
|
|
—
|
anogenitalni razmak svih mladunaca (i tjelesna masa na dan mjerenja anogenitalnog razmaka),
|
|
—
|
zadržavanje bradavica kod mužjaka mladunaca,
|
|
—
|
razine hormona štitnjače, u mladunaca starih 13 dana i odraslih mužjaka (i u ženki (majki) i mladunaca starih 4 dana ako se mjeri),
|
|
—
|
broj mladunaca s jako izraženim abnormalnostima, ukupna procjena vanjskih genitalija, broj patuljastih životinja,
|
|
—
|
vrijeme smrti tijekom istraživanja ili je li životinja preživjela do kraja,
|
|
—
|
broj implantacija, veličina i masa legla u trenutku evidentiranja,
|
|
—
|
tjelesna masa u trenutku usmrćenja i podaci o masi organa za roditeljske životinje,
|
|
—
|
iscrpan opis histopatoloških nalaza,
|
|
—
|
podaci o apsorpciji (ako su dostupni),
|
|
—
|
statistička obrada rezultata, prema potrebi.
|
|
Rasprava o rezultatima.
Zaključci.
|
Tumačenje rezultata
|
56.
|
Istraživanjem će se pružiti procjene reproduktivne/razvojne toksičnosti povezane s primjenom ponovljenih doza (vidjeti stavke 5. i 6.). Ono bi moglo dati naznaku u vezi s tim treba li provesti daljnja ispitivanjima te daje smjernice za osmišljavanje naknadnih istraživanja. Za pomoć pri tumačenju rezultata u pogledu reprodukcije i razvoja (12.) treba pogledati Smjernicu OECD-a 43. U Smjernici OECD-a br. 106 o histološkoj procjeni endokrinih i reproduktivnih ispitivanja na glodavcima (11.) navedene su informacije o pripremi i procjeni (endokrinih) organa i vaginalnih brisova koje mogu biti korisne za ovu smjernicu za ispitivanje.
|
LITERATURA
|
1.
|
OECD (1990). Room Document No 1 for the 14th Joint Meeting of the Chemicals Group and Management Committee. Na zahtjev dostupno kod Organizacije za gospodarsku suradnju i razvoj, Pariz.
|
|
2.
|
OECD (1992). Chairman’s Report of the ad hoc Expert Meeting on Reproductive Toxicity Screening Methods, Tokio, 27–29. listopada 1992. Na zahtjev dostupno kod Organizacije za gospodarsku suradnju i razvoj, Pariz.
|
|
3.
|
OECD (1998). Report of the First Meeting of the OECD Endocrine Disrupter Testing and Assessment (EDTA) Task Force, 10. – 11. ožujka 1998. Na zahtjev dostupno kod Organizacije za gospodarsku suradnju i razvoj, Pariz.
|
|
4.
|
OECD (2015). Feasibility Study for Minor Enhancements of TG 421/422 with ED Relevant Endpoints. Environment, Health and Safety Publications, Series on Testing and Assessment (No 217), Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
5.
|
OECD (2000). Guidance Document on the Recognition, Assessment, and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluations. Series on Testing and Assessment, (No 19), Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
6.
|
OECD (2011). Guidance Document on Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption. Environment, Health and Safety Publications, Series on Testing and Assessment (No 150), Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
7.
|
Goldman, J.M., Murr A.S., Buckalew A.R., Ferrell J.M. and Cooper R.L. (2007). The Rodent Estrous Cycle: Characterization of Vaginal Cytology and its Utility in Toxicological Studies, Birth Defects Research, Part B, 80 (2), 84.–97.
|
|
8.
|
Sadleir R.M.F.S (1979). Cycles and Seasons, in Auston C.R. and Short R.V. (eds.), Reproduction in Mammals: I. Germ Cells and Fertilization, Cambridge, New York.
|
|
9.
|
Gallavan R.H. Jr, Holson J.F., Stump D.G., Knapp J.F. and Reynolds V.L. (1999). Interpreting the Toxicologic Significance of Alterations in Anogenital Distance: Potential for Confounding Effects of Progeny Body Weights, Reproductive Toxicology, 13: 383.–390.
|
|
10.
|
OECD (2013). Guidance Document in Support of the Test Guideline on the Extended One Generation Reproductive Toxicity Study. Environment, Health and Safety Publications, Series on Testing and Assessment (No 151), Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
11.
|
OECD (2009). Guidance Document for Histologic Evaluation of Endocrine and Reproductive Tests in Rodents. Environment, Health and Safety Publications, Series on Testing and Assessment (No106), Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
12.
|
OECD (2008). Guidance Document on Mammalian Reproductive Toxicity Testing and Assessment. Environment, Health and Safety Publications, Series on Testing and Assessment (No 43), Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
Dodatak 1.
DEFINICIJE (VIDJETI I SMJERNICU OECD-A 150 (6.))
Androgeni učinak je sposobnost kemikalije da djeluje kao prirodni androgeni hormon (npr. testosteron) u organizmu sisavaca.
Antiandrogeni učinak je sposobnost kemikalije da potiskuje djelovanje prirodnog androgenog hormona (npr. testosterona) u organizmu sisavaca.
Antiestrogeni učinak je sposobnost kemikalije da potiskuje djelovanje prirodnog estrogenog hormona (npr. estradiol 17ß) u organizmu sisavaca.
Antitiroidna aktivnost je sposobnost kemikalije da potiskuje djelovanje prirodnog hormona štitnjače (npr. T3) u organizmu sisavaca.
Kemikalija je tvar ili smjesa.
Razvojna toksičnost: manifestacija reproduktivne toksičnosti koju čine prenatalni, postnatalni, strukturni ili funkcionalni poremećaji potomstva.
Doziranje je opći pojam koji obuhvaća dozu, njezinu učestalost i trajanje doziranja.
Doza je količina ispitivane kemikalije koja se primjenjuje. Doza se izražava kao masa ispitivane kemikalije po jedinici tjelesne mase ispitne životinje po danu (npr. mg/kg tjelesne mase po danu) ili kao stalna koncentracija u hrani.
Evidentna toksičnost je opći naziv koji opisuje jasne znakove toksičnosti nakon primjene ispitivane kemikalije. Ti bi znakovi trebali biti dovoljni za utvrđivanje opasnosti i trebaju biti takvi da se za primjenu povišene doze može očekivati da će rezultirati razvojem ozbiljnih znakova toksičnosti i mogućom smrtnošću.
Ometanje plodnosti čine poremećaji muških ili ženskih reproduktivnih funkcija ili reproduktivne sposobnosti.
Toksičnost kod majke: štetni učinci na gravidne ženke do kojih dolazi specifično (izravni učinak) ili nespecifično (neizravni učinak).
NOAEL je kratica za visinu doze bez vidljivih štetnih učinaka. To je najviša doza pri kojoj se ne opažaju nikakvi štetni učinci povezani s tretiranjem.
Estrogeni učinak je sposobnost kemikalije da djeluje kao prirodni estrogeni hormon (npr. estradiol 17ß) u organizmu sisavaca.
Reproduktivna toksičnost predstavlja štetne učinke na potomstvo i/ili oštećenje muške i ženske reproduktivne funkcije ili sposobnosti.
Ispitivana kemikalija je svaka tvar ili smjesa koja se ispituje ovom ispitnom metodom.
Tiroidna aktivnost je sposobnost kemikalije da djeluje kao prirodni hormon štitnjače (npr. T3) u organizmu sisavaca.
Validacija je znanstveni postupak s ciljem karakterizacije operativnih zahtjeva i ograničenja ispitne metode te pokazivanja njezine pouzdanosti i relevantnosti za određenu svrhu.
Dodatak 2.
DIJAGRAM PLANA POKUSA IZ KOJEG SE VIDI MAKSIMALNO TRAJANJE STUDIJE, NA TEMELJU CIJELOG 14-DNEVNOG RAZDOBLJA PARENJA

Dodatak 3.
SAŽETO IZVJEŠĆE U OBLIKU TABLICE O UČINCIMA NA REPRODUKCIJU/RAZVOJ
|
OPAŽANJA
|
VRIJEDNOSTI
|
|
|
|
Doziranje (jedinice)
|
0 (kontrola)
|
…
|
…
|
…
|
…
|
|
Formirani parovi (N)
|
|
|
|
|
|
|
Ciklus estrusa (barem srednja vrijednost duljine i učestalost nepravilnih ciklusa)
|
|
|
|
|
|
|
Ženke koje pokazuju znakove kopulacije (N)
|
|
|
|
|
|
|
Ženke koje su postale gravidne (N)
|
|
|
|
|
|
|
Dani začeća 1–5 (N)
|
|
|
|
|
|
|
Dani začeća 6–… (21) (N)
|
|
|
|
|
|
|
Graviditet ≤ 21 dan (N)
|
|
|
|
|
|
|
Graviditet = 22 dana (N)
|
|
|
|
|
|
|
Graviditet ≥ 23 dana (N)
|
|
|
|
|
|
|
Ženke (majke) sa živim mladuncima (N)
|
|
|
|
|
|
|
Ženke (majke) sa živim mladuncima 4. dana nakon okota (N)
|
|
|
|
|
|
|
Implantati po ženki (majci) (srednja vrijednost)
|
|
|
|
|
|
|
Živi mladunci po ženki (majci) pri okotu (srednja vrijednost)
|
|
|
|
|
|
|
Živi mladunci po ženki (majci) 4. dana (srednja vrijednost)
|
|
|
|
|
|
|
Omjer spolova (m/ž) pri okotu (srednja vrijednost)
|
|
|
|
|
|
|
Omjer spolova (m/ž) 4. dana (srednja vrijednost)
|
|
|
|
|
|
|
Masa legla pri okotu (srednja vrijednost)
|
|
|
|
|
|
|
Masa legla 4. dana (srednja vrijednost)
|
|
|
|
|
|
|
Masa mladunaca pri okotu (srednja vrijednost)
|
|
|
|
|
|
|
Masa mladunaca u trenutku mjerenja anogenitalnog razmaka (srednja vrijednost za mužjake i srednja vrijednost za ženke)
|
|
|
|
|
|
|
Anogenitalni razmak na isti postnatalni dan, dan okota – 4. dan (srednja vrijednost za mužjake i ženke, naznaka postnatalnog dana)
|
|
|
|
|
|
|
Masa mladunaca 4. dana (srednja vrijednost)
|
|
|
|
|
|
|
Zadržavanje bradavica kod mužjaka mladunaca 13. dana (srednja vrijednost)
|
|
|
|
|
|
|
Masa mladunaca 13. dana (srednja vrijednost)
|
|
|
|
|
|
|
|
|
ABNORMALNI MLADUNCI
|
|
Ženke (majke) s 0
|
|
|
|
|
|
|
Ženke (majke) s 1
|
|
|
|
|
|
|
Ženke (majke) s ≥ 2
|
|
|
|
|
|
|
|
|
GUBITAK POTOMAKA
|
|
|
|
Prenatalno/nakon implantacije (implantacije umanjene za broj živorođenih)
|
|
Ženke s 0
|
|
|
|
|
|
|
Ženke s 1
|
|
|
|
|
|
|
Ženke s 2
|
|
|
|
|
|
|
Ženke s ≥ 3
|
|
|
|
|
|
|
|
|
Postnatalno (broj živorođenih umanjen za broj živih mladunaca 13. dana nakon okota)
|
|
Ženke s 0
|
|
|
|
|
|
|
Ženke s 1
|
|
|
|
|
|
|
Ženke s 2
|
|
|
|
|
|
|
Ženke s ≥ 3
|
|
|
|
|
|
B.64. KOMBINIRANO ISTRAŽIVANJE TOKSIČNOSTI S PONOVLJENIM DOZAMA S TESTOM PROBIRA ZA REPRODUKTIVNU/RAZVOJNU TOKSIČNOST
UVOD
|
1.
|
Ova ispitna metoda odgovara Smjernici OECD-a za ispitivanje 422 (TG) (2016.). Smjernice OECD-a za ispitivanje kemikalija periodično se preispituju uzimajući u obzir znanstveni napredak. Izvorna smjernica za test probira 422 donesena je 1996. na temelju protokola za kombinirani test s ponovljenim dozama i testa probira za reproduktivnu/razvojnu toksičnost o kojem se raspravljalo na dva sastanka stručnjaka u Londonu 1990. (1.) i Tokiju 1992. (2.).
|
|
2.
|
U ovoj se ispitnoj metodi kombinira dio koji se odnosi na probir za reproduktivnu/razvojnu toksičnost, koji se temelji na iskustvu koje su zemlje članice stekle upotrebom izvorne metode o postojećim kemikalijama koje se proizvode u velikim količinama i na temelju istraživačkih ispitivanja s tvarima za pozitivnu kontrolu (3. i 4.), te dio koji se odnosi na toksičnost s ponovljenim dozama, u skladu sa Smjernicom OECD-a za ispitivanje 407 (28-dnevno ispitivanje oralne toksičnosti na glodavcima uz primjenu ponovljenih doza; odgovara poglavlju B.7. ovog Priloga).
|
|
3.
|
Ova je ispitna metoda ažurirana relevantnim krajnjim točkama endokrinih ometača, kao nastavno djelovanje na aktivnost visokog prioriteta koju je OECD pokrenuo 1998. kako bi revidirao postojeće smjernice za ispitivanje i razvio nove smjernice za probir i ispitivanje potencijalnih endokrinih ometača (5.). U tom kontekstu Smjernica za ispitivanje 407 (koja odgovara poglavlju B.7. ovog Priloga) poboljšana je 2008. parametrima koji su primjereni za otkrivanje endokrine aktivnosti ispitivanih kemikalija. Ažuriranjem Smjernice za ispitivanje 422 nastojalo se uključiti određene relevantne krajnje točke endokrinih ometača u ispitne smjernice za probir kod kojih razdoblja izlaganja obuhvaćaju neka od osjetljivih razdoblja tijekom razvoja (prenatalna razdoblja ili rana postnatalna razdoblja).
|
|
4.
|
Odabrane dodatne relevantne krajnje točke endokrinih ometača, koje su i dio Smjernice za ispitivanje 443 (produljena studija reproduktivne toksičnosti na jednoj generaciji, koja odgovara poglavlju B.56. ovog Priloga), uključeni su u Smjernicu za ispitivanje 422 na temelju studije izvedivosti koja se bavi znanstvenim i tehničkim pitanjima povezanima s njihovim uključivanjem te mogućim prilagodbama plana ispitivanja koje su potrebne za njihovo uključivanje (6.).
|
|
5.
|
Ova je ispitna metoda osmišljena za dobivanje ograničenih informacija o učincima ispitivane kemikalije na reproduktivnost mužjaka i ženki, kao što su funkcija gonada, ponašanje kod parenja, začeće, razvoj zametka i parturicija. Ona nije alternativa i ne zamjenjuje postojeće ispitne metode B.31., B.34., B.35. ili B.56.
|
POČETNA RAZMATRANJA
|
6.
|
Pri procjeni i ocjenjivanju toksičnih svojstava ispitivane kemikalije određivanje oralne toksičnosti uz primjenu ponavljanih doza može se provesti nakon dobivanja početnih informacija o toksičnosti iz ispitivanja akutne toksičnosti. To istraživanje pruža informacije o mogućnim opasnostima po zdravlje do kojih bi moglo doći zbog ponovljenog izlaganja tijekom relativno ograničenog vremenskog razdoblja. Ta metoda obuhvaća osnovno istraživanje toksičnosti s ponovljenim dozama koje se može upotrijebiti za kemikalije za koje nije opravdano 90-dnevno istraživanje (npr. ako proizvedena količina ne prelazi određene granice) ili kao preliminarno istraživanje za dugotrajno istraživanje. Pri provođenju istraživanja treba slijediti osnovna načela i razmatranja navedena u OECD-ovoj Smjernici br. 19 o priznavanju, procjeni i korištenju kliničkih znakova kao humanih krajnjih točaka za pokusne životinje koje se upotrebljavaju u ocjenama sigurnosti (7.).
|
|
7.
|
Nadalje, obuhvaća test probira za reproduktivnu/razvojnu toksičnost i stoga se može upotrebljavati i za dobivanje početnih informacija o mogućim učincima na reproduktivnost mužjaka i ženki kao što su funkcija gonada, ponašanje kod parenja, začeće, razvoj zametka i parturicija, u ranoj fazi procjene toksikoloških svojstava ispitivanih kemikalija ili za zabrinjavajuće ispitivane kemikalije. Ovom se ispitnom metodom ne dobivaju potpune informacije o svim aspektima reprodukcije i razvoja. Točnije, metoda pruža samo ograničena sredstva za otkrivanje postnatalnih manifestacija prenatalnog izlaganja ili učinaka koji se mogu inducirati tijekom postnatalnog izlaganja. Zbog (među ostalim) selektivnosti krajnjih točaka i kratkog trajanja istraživanja ovom metodom neće se dobiti dokazi za konačne tvrdnje o nepostojanju reproduktivnih/razvojnih učinaka. Osim toga, ako ne postoje podaci iz drugih ispitivanja reproduktivne/razvojne toksičnosti, pozitivni rezultati korisni su za početnu procjenu opasnosti i pridonose odlukama u pogledu potrebe za dodatnim ispitivanjem i njegova vremenskog okvira.
|
|
8.
|
Rezultate dobivene parametrima povezanima s endokrinim sustavom treba promatrati u kontekstu „OECD-ova konceptualnog okvira za ispitivanje i procjenu endokrino disruptivnih kemikalija” (8.). U tom konceptualnom okviru poboljšana Smjernica OECD-a za ispitivanje 422 nalazi se na razini 4. kao in vivo test i pruža podatke o štetnim učincima na relevantne endokrine krajnje točke. Međutim, endokrini signal ne mora se sam po sebi smatrati dovoljnim dokazom da je ispitivana kemikalija endokrini ometač.
|
|
9.
|
Ova ispitna metoda naglasak stavlja i na neurološke učinke kao specifičnu krajnju točku, a naglašava i potrebu za pozornim kliničkim opažanjem životinja kako bi se dobilo što više informacija. Cilj je ove metode identificirati kemikalije koje imaju neurotoksički potencijal, što može zahtijevati daljnja podrobna istraživanja tog aspekta. Osim toga, metoda može pokazati i osnovne imunološke učinke.
|
|
10.
|
Ako ne postoje podaci iz drugih istraživanja sustavne toksičnosti, reproduktivne/razvojne toksičnosti, neurotoksičnosti i/ili imunotoksičnosti, pozitivni rezultati korisni su za početnu procjenu opasnosti i pridonose odlukama u pogledu potrebe za dodatnim ispitivanjem i njegova vremenskog okvira. Ispitivanje može biti osobito korisno kao dio OECD-ova podatkovnog skupa za informacije o probiru (SIDS) za procjenu postojećih kemikalija za koje je dostupno malo ili nimalo toksikoloških informacija i može služiti kao alternativa provođenju dvaju zasebnih ispitivanja toksičnosti s ponovljenim dozama (Smjernica OECD-a za ispitivanje 407, koja odgovara poglavlju B.7. ovog Priloga) odnosno reproduktivne/razvojne toksičnosti (Smjernica OECD-a za ispitivanje 421, koja odgovara poglavlju B.63. ovog Priloga). Može se upotrebljavati i kao istraživanje o utvrđivanju raspona doze za opsežnija reproduktivna/razvojna istraživanja ili ako se smatra relevantnim iz drugih razloga.
|
|
11.
|
Općenito se pretpostavlja da postoje razlike u osjetljivosti između gravidnih životinja i onih koje nisu gravidne. Stoga u ovom kombiniranom testu može biti teže odrediti visine doza koje su primjerene i za procjenu opće sustavne toksičnosti i specifične reproduktivne/razvojne toksičnosti nego kod zasebnog provođenja pojedinačnih ispitivanja. Nadalje, tumačenje rezultata ispitivanja u pogledu opće sustavne toksičnosti može biti teže nego kod provođenja zasebnog istraživanja s ponovljenim dozama, osobito ako se serumski i histopatološki parametri ne procjenjuju u isto vrijeme tijekom istraživanja. Zbog te tehničke složenosti za provođenje ovog kombiniranog testa probira potrebno je znatno iskustvo u području ispitivanja toksičnosti. S druge strane, osim manjeg broja životinja koje sudjeluju, kombinirani test može pružiti bolji način za razlikovanje izravnih učinaka na reprodukciju/razvoj od učinaka koji su sekundarni u odnosu na druge (sustavne) učinke.
|
|
12.
|
U ovom je ispitivanju razdoblje doziranja dulje nego kod uobičajenog 28-dnevnog istraživanja s ponovljenim dozama. Međutim, upotrebljava se manje životinja svakog spola po skupini u usporedbi sa situacijom u kojoj se uz test probira za reproduktivnu/razvojnu toksičnost provodi uobičajeno 28-dnevno istraživanje s ponovljenim dozama.
|
|
13.
|
U ovoj ispitnoj metodi pretpostavlja se oralna primjena ispitivane kemikalije. Ako se upotrebljavaju drugi načini izlaganja, mogu biti potrebne prilagodbe.
|
|
14.
|
Prije nego što se ova ispitna metoda primijeni na smjesi radi dobivanja podataka za predviđenu regulatornu svrhu, potrebno je razmotriti mogu li se te, ako se mogu, zašto se njome mogu dobiti primjereni rezultati za tu svrhu. Ta razmatranja nisu potrebna ako postoji regulatorni zahtjev za ispitivanje smjese.
|
|
15.
|
Upotrijebljene definicije navedene su u Dodatku 1.
|
NAČELO ISPITIVANJA
|
16.
|
Ispitivana kemikalija primjenjuje se u gradiranim dozama na nekoliko skupina mužjaka i ženki. Na mužjake treba primjenjivati dozu najmanje četiri tjedna, do dana i uključujući dan prije planiranog usmrćivanja (to uključuje najmanje dva tjedna prije parenja, tijekom razdoblja parenja i približno dva tjedna poslije parenja). S obzirom na ograničeno razdoblje doziranja prije parenja u mužjaka, plodnost možda neće biti osobito osjetljiv pokazatelj testikularne toksičnosti. Stoga je od ključne važnosti podroban histološki pregled sjemenika. Kombinacija razdoblja doziranja prije parenja od dva tjedna i naknadno promatranje parenja/plodnosti s ukupnim razdobljem doziranja od najmanje četiri tjedna, nakon čega slijedi podrobna histopatologija muških gonada smatraju se dovoljnima da bi se omogućilo otkrivanje većine učinaka na plodnost mužjaka i spermatogenezu.
|
|
17.
|
Ženkama dozu treba davati tijekom cijelog istraživanja. To uključuje dva tjedna prije parenja (pri čemu je cilj obuhvatiti najmanje dva cijela ciklusa estrusa), promjenjivo vrijeme do začeća, trajanje graviditeta i najmanje 13 dana nakon okota, do dana i uključujući dan prije planiranog usmrćivanja.
|
|
18.
|
Trajanje istraživanja, nakon aklimatizacije i procjene ciklusa estrusa prije doziranja, ovisi o ponašanju ženki i iznosi približno 63 dana [najmanje 14 dana prije parenja, (do) 14 dana parenja, 22 dana gestacije, 13 dana laktacije].
|
|
19.
|
Tijekom razdoblja primjene životinje se svakodnevno pažljivo promatraju radi uočavanja znakova toksičnosti. Životinje koje ugibaju ili su usmrćene tijekom ispitivanja podvrgavaju se obdukciji, a na kraju ispitivanja preživjele se životinje usmrćuju i podvrgavaju obdukciji.
|
OPIS METODE
Odabir životinjske vrste
|
20.
|
Ova ispitna metoda osmišljena je za upotrebu na štakorima. Ako se parametri navedeni u ovoj Smjernici za ispitivanje 422 istražuju na drugoj vrsti glodavaca, treba pružiti detaljno obrazloženje. U međunarodnom validacijskom programu za određivanje endokrinih ometača o Smjernici za ispitivanje 407 primjenjivali su se samo štakori. Sojeve slabe plodnosti ili poznate po velikoj učestalosti razvojnih defekata ne bi trebalo koristiti. Treba koristiti zdrave životinje koje se prethodno nisu parile i nisu sudjelovale u pokusima. Ispitne životinje treba opisati u pogledu vrste, soja, spola, mase i dobi. Na početku istraživanja razlike u tjelesnoj masi korištenih životinja trebale bi biti minimalne i ne bi trebale prelaziti ±20 % srednje vrijednosti tjelesne mase svakog spola. Ako se istraživanje provodi kao preliminarno istraživanje u odnosu na dugotrajno istraživanje ili istraživanje cijele generacije, prednost se daje primjeni životinja istog soja i podrijetla u oba istraživanja.
|
Smještaj i hranjenje
|
21.
|
Svi postupci trebaju biti usklađeni s lokalnim standardima brige o životinjama u laboratoriju. Temperatura u prostoriji u kojoj se drže pokusne životinje treba biti 22 °C (± 3 °C). Relativna vlaga trebala bi iznositi najmanje 30 %, a poželjno je da ne prelazi 70 %, osim tijekom čišćenja prostorije. Rasvjeta treba biti umjetna uz izmjenu 12 sati svjetla i 12 sati mraka. Za hranjenje se može upotrebljavati konvencionalna laboratorijska hrana uz neograničenu količinu vode za piće. Na izbor prehrane može utjecati potreba da se osigura odgovarajuća mješavina ispitivane kemikalije kad se ona daje na taj način.
|
|
22.
|
Životinje trebaju biti smještene u malim skupinama istoga spola; ako je to znanstveno opravdano, životinje se mogu držati u zasebnim nastambama. U slučaju skupnog smještaja, u jednom kavezu ne smije biti smješteno više od pet životinja. Postupci parenja trebali bi se odvijati u kavezima koji odgovaraju toj svrsi. Gravidne ženke treba smjestiti u posebne kaveze i treba im osigurati materijale za izradu gnijezda. Ženke se tijekom laktacije smještaju pojedinačno s njihovom mladunčadi.
|
|
23.
|
Treba redovito analizirati ima li u hrani kontaminanata. Uzorak hrane treba sačuvati do kraja izrade izvješća.
|
Priprema životinja
|
24.
|
Zdrave, mlade odrasle životinje nasumce se odabiru i raspoređuju u skupine za tretiranje i kaveze. Kaveze bi trebalo rasporediti tako da se učinci do kojih bi moglo doći zbog položaja kaveza svedu na minimum. Životinje se označuju na jedinstven način i drže u kavezima najmanje pet dana prije početka istraživanja kako bi se prilagodile laboratorijskim uvjetima.
|
Priprema doza
|
25.
|
Preporučuje se da se ispitivana kemikalija daje oralno osim ako se neki drugi načini primjene smatraju prikladnijima. Ako se odabere oralna primjena, ispitivana kemikalija obično se daje oralnom intubacijom; međutim, u određenim slučajevima, ispitivane kemikalije mogu se primijeniti i s hranom ili vodom za piće.
|
|
26.
|
Prema potrebi, ispitivana se kemikalija otapa ili suspendira u odgovarajućem nosaču. Kad je god moguće, preporuča se najprije razmotriti mogućnost primjene vodene otopine/suspenzije, zatim mogućnost primjene otopine/suspenzije u ulju (npr. kukuruzno ulje) i tek na kaju mogućnost otapanja u ostalim nosačima. Za nosače bez vodene otopine moraju biti poznata toksična svojstva nosača. Treba utvrditi stabilnost i homogenost ispitivane kemikalije u nosaču.
|
POSTUPAK
Broj i spol životinja
|
27.
|
Preporučuje se da se u svakoj skupini započne s najmanje deset mužjaka i 12–13 ženki. Ženke će se prije izlaganja procijeniti u pogledu ciklusa estrusa pa se životinje koje ne pokažu uobičajeni ciklus od četiri do pet dana neće uključiti u istraživanje; stoga se preporučuje više ženki kako bi se dobilo deset ženki po skupini. Osim u slučaju znatnih toksičnih učinaka, očekuje se da će se tako dobiti najmanje osam gravidnih ženki po skupini, a to je obično najmanji prihvatljivi broj gravidnih ženki po skupini. Cilj je dobiti dovoljno gravidnih životinja i potomaka kako bi se osigurala valjana procjena potencijala ispitivane kemikalije da utječe na plodnost, gravidnost, ponašanje ženki (majki) i potomaka koji sišu te rast i razvoj potomstva F1 od začeća do 13. dana nakon okota. Ako se planira usmrćivanje životinja u međuvremenu, navedeni broj treba povećati za broj životinja predviđenih za usmrćivanje prije završetka istraživanja. Treba razmotriti mogućnost uključivanja dodatne satelitske skupine od pet životinja svakoga spola u kontrolnu skupinu i skupinu koja će primiti najvišu dozu radi opažanja reverzibilnosti, postojanosti ili zakašnjelog nastupa sustavnih toksičnih učinaka najmanje 14 dana nakon tretiranja. Životinje iz satelitskih skupina neće se pariti i stoga se ne upotrebljavaju za procjenu reproduktivne/razvojne toksičnosti.
|
Doziranje
|
28.
|
Općenito, treba upotrijebiti najmanje tri ispitne skupine i jednu kontrolnu skupinu. Ako nisu dostupni prikladni podaci o općoj toksičnosti, može se provesti istraživanje o utvrđivanju raspona (životinje istog soja i podrijetla) kako bi se pomoglo pri određivanju visina doze koje će se primjenjivati. Osim tretiranja ispitivanom kemikalijom, sa životinjama u kontrolnoj skupini treba postupati na isti način kao sa životinjama iz ispitne skupine. Ako se pri primjeni ispitivane kemikalije koristi nosač, volumen nosača koji primi kontrolna skupina treba biti jednak najvećem upotrijebljenom volumenu.
|
|
29.
|
Visine doza treba odabrati uzimajući u obzir sve postojeće podatke o toksičnosti i (toksiko)kinetici koji su dostupni. Treba uzeti u obzir i da je moguća razlika u osjetljivosti između gravidnih ženki i ženki koje nisu gravidne. Najvišu dozu treba odabrati s ciljem induciranja toksičnih učinaka, ali ne i smrti ili očite patnje. Nakon toga, treba odabrati slijed postupnog smanjivanja visine doze kako bi se dokazali svi odgovori povezani s doziranjem te da kod najniže doze nema štetnih učinaka. Često je optimalno doze primijeniti u dvostrukim do četverostrukim intervalima te je često bolje dodati i četvrtu ispitnu skupinu nego između primjene doza koristiti veoma velike vremenske intervale (npr. iznad faktora 10).
|
|
30.
|
Ako se opaze znakovi opće toksičnosti (npr. smanjena tjelesna masa, učinci na jetri, srcu, plućima ili bubrezima itd.) ili druge promjene koje ne moraju biti toksični odgovori (npr. smanjeno uzimanje hrane, povećanje jetre), uočene učinke na endokrinim krajnjim točkama treba tumačiti s oprezom.
|
Granični test
|
31.
|
Ako istraživanje provedeno oralnom primjenom jedne doze od najmanje 1 000 mg/kg tjelesne mase na dan ili, kod davanja doze s hranom, primjenom doze koja se u ekvivalentnom postotku daje s hranom ili vodom za piće (na temelju određivanja tjelesne mase), u skladu s postupcima opisanima za ovo istraživanje, ne proizvede uočljive toksične učinke i ako na temelju podataka iz strukturno srodnih tvari ne treba očekivati toksičnost, može se smatrati da provođenje potpunog istraživanja s nekoliko visina doza nije neophodno. Granični test je relevantan samo ako izloženost ljudi ne ukazuje na potrebu za primjenom veće doze. Za druge vrste primjene doza, kao što su inhalacija ili dermalna primjena, maksimalno izlaganje koje se može postići često je određeno fizikalno-kemijskim svojstvima ispitivanih kemikalija.
|
Primjena doza
|
32.
|
Životinjama se svakodnevno daje ispitivana kemikalija sedam dana tjedno. U slučaju primjene oralnom intubacijom ispitivanu kemikaliju treba dati životinjama u jednoj dozi s pomoću želučane sonde ili prikladne intubacijske kanile. Maksimalni volumen tekućine koji se može jednokratno dati ovisi o veličini ispitne životinje. Taj volumen ne smije biti veći od 1 ml/100 g tjelesne mase, osim kad se radi o vodenim otopinama koje dopuštaju primjenu volumena od 2 ml/100 g tjelesne mase. Osim u slučaju nadražujućih ili nagrizajućih ispitivanih kemikalija kod kojih se štetni učinci obično javljaju pri višim koncentracijama, varijabilnost ispitnog volumena treba prilagođavanjem koncentracije svesti na najmanju moguću mjeru kako bi se zajamčio stalni volumen pri svim visinama doza.
|
|
33.
|
Kod ispitivanih kemikalija koje se primjenjuju s hranom ili vodom za piće važno je osigurati da količine ispitivane kemikalije ne utječu na uravnoteženi unos hrane ili vode. Kad se ispitivana kemikalija daje s hranom, može se koristiti ili stalna koncentracija u odnosu na količinu hrane (ppm) ili stalna visina doze u odnosu na tjelesnu masu životinje; treba navesti iskorištenu opciju. Za ispitivanu kemikaliju koja se primjenjuje oralnom intubacijom, dozu treba davati u podjednako vrijeme ili vremena svakog dana i prilagoditi je najmanje jednom tjedno kako bi se održala stalna visina doze s obzirom na tjelesnu masu životinje. Kad se prije dugotrajnog ili potpunog istraživanja reproduktivne toksičnosti provodi kombinirano preliminarno istraživanje, u oba istraživanja prehrana životinja treba biti slična.
|
Plan pokusa
|
34.
|
Doziranje životinja oba spola trebalo bi započeti dva tjedna prije parenja, nakon aklimatizacije od najmanje pet dana te nakon što se ženke proberu u pogledu normalnog ciklusa estrusa (u razdoblju od dva tjedna prije tretiranja). Istraživanje treba planirati tako da procjena ciklusa estrusa počne ubrzo nakon što životinje postignu punu spolnu zrelost. To se može malo razlikovati za različite sojeve štakora u različitim laboratorijima, npr. deset tjedana kod štakora soja Sprague Dawley i 12 tjedana kod soja Wistar. Ženke (majke) s potomstvom trebalo bi usmrtiti 13. dana nakon okota ili ubrzo nakon toga. Kako bi se omogućio post ženki (majki) preko noći prije uzimanja krvi (ako se prednost daje toj opciji), ženke i njihovi potomci ne moraju se nužno usmrtiti istog dana. Dan okota (tj. kada se dovrši parturicija) definira se kao nulti dan nakon okota. Ženke koje ne pokazuju znakove kopulacije usmrćuju se 24–26 dana nakon posljednjeg dana razdoblja parenja. Doziranje se nastavlja kod oba spola tijekom razdoblja parenja. Mužjake bi i dalje trebalo dozirati nakon razdoblja parenja barem dok ne istekne ukupno razdoblje doziranja od 28 dana. Zatim se usmrćuju ili se zadržavaju i nastavljaju dozirati radi mogućeg provođenja drugog parenja ako se to smatra primjerenim.
|
|
35.
|
Svakodnevno doziranje roditeljskih ženki trebalo bi se nastaviti tijekom cijele gravidnosti i najmanje do 13. dana nakon okota, uključujući i taj dan, ili dan prije usmrćivanja. Kod istraživanja u kojima se ispitivana kemikalija primjenjuje inhalacijom i/ili dermalnim putem doziranje bi se trebalo nastaviti barem do 19. dana gestacije, uključujući i taj dan, i s doziranjem bi se trebalo ponovno početi što prije, a najkasnije na 4. postnatalni dan (PND).
|
|
36.
|
Životinje u satelitskoj skupini za koje se planira naknadno opažanje, ako su uključene, ne pare se. One se trebaju držati još najmanje 14 dana nakon prvog planiranog usmrćivanja ženki (majki), bez tretiranja, kako bi se otkrili zakašnjeli toksični učinci, postojanost toksičnih učinaka ili oporavak od toksičnih učinaka.
|
|
37.
|
Dijagram plana pokusa prikazan je u Dodatku 2.
|
Ciklusi estrusa
|
38.
|
Cikluse estrusa trebalo bi pratiti prije početka tretiranja kako bi se za istraživanje odabrale ženke s uobičajenim ciklusom (vidjeti stavak 27.). Svakodnevno bi se trebali pratiti i vaginalni brisovi od početka razdoblja tretiranja do pojave znakova parenja. Ako postoji zabrinutost u pogledu učinaka akutnog stresa koji bi mogli izmijeniti cikluse estrusa kad se počnu primjenjivati doze, laboratoriji mogu izlagati ispitne životinje dva tjedna, zatim svaki dan prikupiti vaginalne brisove kako bi pratili ciklus estrusa najmanje dva tjedna tijekom razdoblja prije parenja, uz stalno praćenje tijekom razdoblja parenja do pojave znakova parenja. Ako se uzimaju vaginalne/cervikalne stanice, treba paziti da se ne poremeti mukoza, što bi moglo inducirati lažnu trudnoću (8. i 9.).
|
Postupak parenja
|
39.
|
U ovom bi se istraživanju obično trebala upotrebljavati parenja 1:1 (jedan mužjak na jednu ženku). Iznimke se mogu javiti ako dođe do smrti mužjaka. Ženku bi trebalo smjestiti s istim mužjakom dok se ne uoče znakovi kopulacije ili dok ne isteknu dva tjedna. Svako jutro ženke treba pregledati u pogledu prisutnosti sperme ili vaginalnog čepa. Nultim danom graviditeta smatra se dan kad je potvrđeno parenje (pronađen je vaginalni čep ili sperma). Ako je parenje bilo neuspješno, može se razmotriti mogućnost ponovnog parenja ženki s dokazanim mužjacima iste skupine.
|
Veličina legla
|
40.
|
Četiri dana nakon okota veličina svakog legla može se prilagoditi nasumičnim selekcijskim uklanjanjem suvišnih mladunaca tako da se po jednom leglu po mogućnosti ostavi četiri ili pet mladunaca svakog spola ovisno o uobičajenoj veličini legla soja štakora koji se upotrebljavaju. Uzorke krvi treba prikupiti od dva suvišna mladunca, objediniti ih i upotrijebiti za određivanje razina seruma T4. Nije prihvatljivo selektivno uklanjanje mladunaca, npr. prema tjelesnoj masi ili anogenitalnom razmaku. Kad je god broj muških ili ženskih mladunaca takav da nije moguće imati četiri ili pet mladunaca svakog spola po leglu, prihvatljivo je djelomično prilagođavanje (npr. šest mužjaka i četiri ženke). Mladunci se ne uklanjaju ako bi se veličina legla time smanjila ispod cilja izdvajanja mladunaca (osam ili deset mladunaca po leglu). Ako je dostupan samo jedan mladunac povrh cilja izdvajanja mladunaca, uklanja se samo jedan mladunac i od njega se uzima krv za moguću procjenu seruma T4.
|
|
41.
|
Ako se veličina legla ne prilagođava, 4. dana nakon okota usmrćuju se dva mladunca po leglu i uzimaju se uzorci krvi radi mjerenja koncentracija seruma hormona štitnjače. Ako je moguće, ta dva mladunca po leglu trebale bi biti ženke kako bi se mužjaci sačuvali za procjenu zadržavanja bradavica, osim ako uklanjanjem tih mladunaca više ne bi ostalo ženki za procjenu pri završetku ispitivanja. Mladunci se neće uklanjati ako bi se time veličina legla smanjila na manje od osam ili deset mladunaca po leglu (ovisno o uobičajenoj veličini legla kod soja štakora koji se upotrebljava). Ako je dostupan samo jedan mladunac povrh uobičajene veličine legla, uklanja se samo jedan mladunac i od njega se uzima krv za moguću procjenu seruma T4.
|
Opažanja
|
42.
|
Opća klinička opažanja treba provoditi najmanje jednom dnevno, po mogućnosti svaki dan u isto vrijeme ili vremena, vodeći računa o razdoblju najvećeg intenziteta očekivanih učinaka nakon doziranja. Zdravstveno stanje životinja treba zabilježiti. Barem dvaput dnevno sve životinje treba pregledati radi otkrivanja mogućih simptoma morbiditeta i smrtnosti.
|
|
43.
|
Jednom prije prvog izlaganja i barem jednom tjedno nakon toga treba obaviti detaljno kliničko opažanje stanja svih roditeljskih životinja (to će omogućiti utvrđivanje promjena u stanju istih subjekata). Ta opažanja treba obavljati izvan kaveza u kojima se životinje drže, u standardnom ograđenom prostoru i, po mogućnosti, svaki dan u isto vrijeme. Rezultate opažanja treba pažljivo bilježiti, pri čemu je najbolje koristiti se sustavom ocjenjivanja koji je jasno definirao laboratorij koji obavlja ispitivanje. Treba poduzeti sve što je potrebno kako bi se osiguralo da odstupanja u uvjetima ispitivanja budu minimalna te da opažanja po mogućnosti provode promatrači koji nisu upoznati s tretiranjem. Znakovi koji se bilježe trebaju, među ostalim, uključivati promjene na koži, dlaci, očima, sluznicama, pojavu iscjedaka, izlučine i autonomne aktivnosti (npr. lakrimacija (lučenje suza), piloerekcija, veličina zjenica, nepravilnosti u disanju). Treba zabilježiti i promjene u hodu, držanju i reakcijama na postupanje sa životinjama, kao i pojavu kloničkih ili toničkih pokreta, stereotipije (npr. pretjerano njegovanje krzna, ponavljano kretanje u krug), otežane ili produljene parturicije ili neobičnog ponašanja (npr. samoozljeđivanje, hodanje unatrag) (10.).
|
|
44.
|
U određenom trenutku tijekom istraživanja treba procijeniti osjetilnu reaktivnost na podražaje raznih vrsta (npr. auditivne, vizualne i proprioceptivne podražaje) (8., 9. i 11.), jakost stiska (12.) i motornu aktivnost (13.) u pet mužjaka i pet ženki nasumično odabranih iz svake skupine. Daljnje pojedinosti o postupcima koji se mogu primjenjivati navedene su u odgovarajućoj referentnoj literaturi. Međutim, mogu se primjenjivati i drugi postupci koji nisu u njoj navedeni. Kod mužjaka bi se ta funkcionalna opažanja trebala provoditi pred kraj razdoblja doziranja, neposredno prije planiranog usmrćivanja, ali prije uzimanja uzoraka krvi za hematologiju ili kliničku kemiju (vidjeti stavke 53.–56., uključujući bilješku 1.). Ženke bi tijekom tih funkcionalnih ispitivanja trebale biti u fiziološki sličnom stanju i po mogućnosti bi ih trebalo ispitati jednom tijekom posljednjeg tjedna laktacije (npr. od 6. do 13. dana laktacije), neposredno prije planiranog usmrćivanja. Vrijeme razdvajanja ženki (majki) i mladunaca trebalo bi se smanjiti u mjeri u kojoj je to moguće.
|
|
45.
|
Funkcionalna opažanja koja se obavljaju jednom pred kraj istraživanja mogu se izostaviti ako se istraživanje provodi kao preliminarno istraživanje za naknadno (90-dnevno) istraživanje subkroničnosti ili dugotrajno istraživanje. U tom slučaju funkcionalna opažanja treba uključiti u to sljedeće istraživanje. S druge strane, dostupnost podataka o funkcionalnim opažanjima iz tog istraživanja uz primjenu ponovljenih doza može biti od pomoći u odabiru visina doza u naknadnom istraživanju subkroničnosti ili dugotrajnom istraživanju.
|
|
46.
|
U iznimnim slučajevima funkcionalna opažanja mogu izostati i kod skupina koje inače pokazuju simptome toksičnosti do mjere koja bi znatno ometala uspješnost funkcionalnog ispitivanja.
|
|
47.
|
Vrijeme gestacije treba zabilježiti i računati od nultog dana graviditeta. Svako leglo nakon okota treba što prije pregledati kako bi se utvrdio broj i spol mladunaca, mrtvorođenih, živorođenih, patuljastih životinja (mladunci koji su znatno manji od odgovarajućih kontrolnih mladunaca) i prisutnost velikih abnormalnosti.
|
|
48.
|
Žive mladunce trebalo bi prebrojati i odrediti njihov spol te bi legla trebalo izvagati u roku od 24 sata od parturicije (0. ili 1. dan nakon okota) te barem 4. i 13. dana nakon okota. Uz opažanja roditeljskih životinja (vidjeti stavke 43. i 44.) trebalo bi zabilježiti i svako abnormalno ponašanje potomaka.
|
|
49.
|
Treba izmjeriti anogenitalni razmak u svakog mladunca na isti postnatalni dan, od nultog do 4. postnatalnog dana. Tjelesnu masu mladunaca treba utvrditi na dan mjerenja anogenitalnog razmaka, a njega treba normalizirati u odnosu na veličinu mladunca (najbolje kubni korijen tjelesne mase (14.)). Broj bradavica/areola u mužjaka mladunaca trebalo bi utvrditi 12. ili 13. postnatalnog dana, kako se preporučuje u Smjernici OECD-a 151 (15.).
|
Tjelesna masa i unos hrane/vode
|
50.
|
Mužjake i ženke treba vagati prvog dana primjene doze, a zatim najmanje jednom tjedno i zadnji dan. Tijekom graviditeta ženke bi trebalo vagati 0., 7., 14. i 20. dana te u roku od 24 sata od parturicije (0. ili 1. dan nakon okota) te barem 4. i 13. dana nakon okota. Ta opažanja treba unijeti u izvješće za svaku odraslu životinju posebno.
|
|
51.
|
Tijekom razdoblja prije parenja, graviditeta i laktacije unos hrane trebalo bi mjeriti najmanje jednom tjedno. Mjerenje unosa hrane tijekom parenja nije obvezno. Trebalo bi mjeriti i unos vode tijekom tih razdoblja ako se ispitivana kemikalija primjenjuje tim putem.
|
Hematologija
|
52.
|
Na pet mužjaka i pet ženki koji se nasumično odaberu iz svake skupine trebalo bi jednom tijekom istraživanja provesti sljedeće hematološke preglede: hematokrit, koncentracija hemoglobina, broj eritrocita, retikulociti, ukupni i diferencijalni broj leukocita, broj trombocita i mjerenje vremena/potencijala zgrušavanja krvi. Ostala određivanja koja treba provesti ako ispitivana kemikalija ili njezini navodni metaboliti imaju ili se sumnja da imaju oksidacijska svojstva obuhvaćaju koncentraciju methemoglobina i Heinzova tjelešca.
|
|
53.
|
Uzorke krvi treba uzeti na specificiranom mjestu. Ženke bi tijekom uzimanja uzoraka trebale biti u fiziološki sličnom stanju. Kako bi se izbjegle praktične poteškoće povezane s varijabilnosti početka gestacije, krv se kod ženki može uzimati na kraju razdoblja prije parenja kao alternativa uzimanju uzoraka neposredno prije ili kao dio postupka za eutanaziju životinja. Uzorke krvi mužjaka po mogućnosti bi trebalo uzimati neposredno prije ili kao dio postupka za eutanaziju životinja. Kao alternativa, krv se kod mužjaka može uzimati i na kraju razdoblja prije parenja ako je tom vremenu uzorkovanja dana prednost kod ženki.
|
|
54.
|
Uzorke krvi trebalo bi pohraniti u primjerenim uvjetima.
|
Klinička biokemija
|
55.
|
Kliničko-biokemijske pretrage za istraživanje glavnih toksičnih učinaka u tkivima i posebno učinaka na bubrege i jetru treba obaviti na uzorcima krvi dobivenima od pet mužjaka i pet ženki odabranih iz svake skupine. Preporučuje se da životinje tijekom noći pred uzimanje uzoraka krvi poste (22). Pretrage koje se rade na plazmi ili serumu trebale bi obuhvatiti mjerenje natrija, kalija, glukoze, ukupne količine kolesterola, ureje, kreatinina, ukupne količine proteina i albumina te najmanje dva enzima koji su pokazatelji hepatocelularnih učinaka (kao što su alanin aminotransferaza, aspartat aminotransferaza i sorbitol dehidrogenaza) te žučne kiseline. Mjerenja dodatnih enzima (jetrenog ili drugog podrijetla) i bilirubina mogu u određenim okolnostima pružiti korisne informacije.
|
|
56.
|
Uzorci krvi uzimaju se s utvrđenog mjesta na temelju sljedećeg rasporeda:
|
—
|
od najmanje dva mladunca po leglu 4. dana nakon okota ako broj mladunaca to omogućuje (vidjeti stavke 40.–41.),
|
|
—
|
od svih ženki (majki) i najmanje dva mladunaca po leglu pri završetku ispitivanja 13. dana, i
|
|
—
|
od svih odraslih mužjaka pri završetku ispitivanja.
|
Svi uzorci krvi spremaju se u odgovarajućim uvjetima. Uzorci krvi mladunaca i odraslih mužjaka uzeti 13. dana procjenjuju se u pogledu razina seruma hormona štitnjače (T4). Daljnja procjena hormona T4 u uzorcima krvi ženki (majki) i mladunaca uzetih 4. dana obavlja se po potrebi. Moguće je i mjerenje drugih hormona ako je to relevantno. Krv mladunaca može se izvaditi po leglu radi analiza hormona štitnjače. Hormone štitnjače (T4 i TSH) po mogućnosti bi trebalo mjeriti kao „ukupni broj”.
|
|
57.
|
U zadnjem tjednu istraživanja, po izboru, mogu se obaviti analize urina pet nasumično odabranih mužjaka iz svake skupine dobivenog prikupljanjem u određenim vremenskim razmacima: izgled, količina, osmolalnost ili specifična težina, pH, protein, glukoza i krv/krvne stanice.
|
|
58.
|
Osim toga, treba razmisliti i o ispitivanju serumskih markera koji označavaju opće oštećenja tkiva. Ostale pretrage, koje bi trebalo obaviti ako poznata svojstva ispitivane kemikalije mogu ili se sumnja da bi mogla utjecati na povezane metaboličke profile uključuju utvrđivanje razine kalcija, fosfata, triglicerida natašte, glukoze natašte, razine specifičnih hormona, methemoglobina i aktivnosti kolinesteraze. Njih treba identificirati od slučaja do slučaja.
|
|
59.
|
Sljedeći čimbenici mogu utjecati na varijabilnost i apsolutne koncentracije za određivanje hormona:
|
—
|
vrijeme usmrćivanja zbog dnevne varijacije koncentracije hormona,
|
|
—
|
metoda usmrćivanja radi izbjegavanja pretjeranog stresa za životinje koji može utjecati na koncentraciju hormona,
|
|
—
|
pribori za određivanje hormona koji se mogu razlikovati po njihovim standardnim krivuljama.
|
|
|
60.
|
Uzorke plazme koji su posebno namijenjeni određivanju hormona treba uzeti u usporedivo doba dana. Brojčane vrijednosti dobivene analizom koncentracija hormona razlikuju se ovisno o različitom, komercijalno dostupnom priboru.
|
|
61.
|
Ako su prijašnji polazni podaci neprikladni, u obzir treba uzeti određivanje hematoloških i kliničkih biokemijskih varijabli prije početka doziranja ili po mogućnosti na skupini životinja koje nisu uključene u pokusne skupine. Kod ženki se podaci moraju dobiti od životinja koje doje.
|
PATOLOGIJA
Makroskopska nekropsija
|
62.
|
Sve odrasle životinje korištene u istraživanju trebale bi se podvrgnuti kompletnoj, podrobnoj makroskopskoj nekropsiji koja obuhvaća pažljiv pregled vanjske površine tijela, svih otvora te lubanjske, prsne i trbušne šupljine i njihova sadržaja. Posebnu pozornost treba obratiti na organe reproduktivnog sustava. Broj mjesta za implantaciju treba zabilježiti. Vaginalne briseve treba pregledati na dan nekropsije kako bi se utvrdila faza ciklusa estrusa i omogućila korelacija s histopatologijom ženskih reproduktivnih organa.
|
|
63.
|
Sjemenike i sjemene kanaliće te prostatu i sjemene mjehuriće s koagulacijskim žlijezdama, kao cjelinu, svih odraslih mužjaka treba po potrebi obrezivanjem osloboditi od svih prianjajućih tkiva te ih treba izvagati u mokrom stanju što prije nakon seciranja kako bi se spriječilo njihovo sušenje. Osim toga, mase neobaveznih organa mogle bi uključivati kompleks anusnog podizača i bulbokavernoznog mišića, Cowperove žlijezde i glans penisa kod mužjaka te jajnike u paru (mokra masa) i maternicu (uključujući cerviks) kod ženki; ako se uključuju, te bi mase trebalo prikupiti što prije nakon seciranja. Treba sačuvati jajnike, sjemenike, sjemene kanaliće, sekundarne spolne organe i sve organe koji pokazuju makroskopske lezije svih odraslih životinja.
|
|
64.
|
Štitnjača svih odraslih mužjaka i ženki te jednog mužjaka i jedne ženke starih 13 dana iz svakog legla trebala bi se sačuvati u najprimjerenijem sredstvu za fiksiranje radi planiranog kasnijeg histopatološkog pregleda. Masa štitnjače može se odrediti nakon fiksacije. Obrezivanje također treba obaviti vrlo pažljivo te samo nakon fiksacije kako bi se izbjeglo oštećenje tkiva. Oštećena tkiva mogu kompromitirati histopatološku analizu. Uzorke krvi treba uzeti na specificiranom mjestu i pohraniti u odgovarajućim uvjetima neposredno prije ili kao dio postupka za eutanaziju životinja (vidjeti stavak 56.).
|
|
65.
|
Osim toga, kod najmanje pet odraslih mužjaka i ženki nasumično odabranih iz svake skupine (osim onih za koje je utvrđeno da su na umoru i/ili su eutanazirani prije kraja istraživanja) s jetre, bubrega, nadbubrežnih žlijezda, timusa, slezene, mozga i srca treba obrezati sve prianjajuće tkivo, prema potrebi, te ih još mokre izvagati što prije nakon seciranja kako bi se spriječilo da se osuše. Sljedeća tkiva treba sačuvati u sredstvu za fiksiranje koje je najprimjerenije i za vrstu tkiva i za planirani kasniji histopatološki pregled: sve makrolezije, mozak (reprezentativne regije uključujući veliki mozak, mali mozak i medulu/most), leđnu moždinu, oko, želudac, tanko i debelo crijevo (uključujući Peyerove ploče), jetru, bubrege, nadbubrežne žlijezde, slezenu, srce, timus, dušnik i pluća (preparirane upuhivanjem fiksativa i zatim uranjanjem), spolne žlijezde (sjemenike i jajnike), sekundarne spolne organe (maternicu i cerviks, sjemene kanaliće, prostatu, sjemene mjehuriće s koagulacijskim žlijezdama), vaginu, mokraćni mjehur, limfne čvorove (osim najbližeg drenažnog čvora treba uzeti još jedan limfni čvor na temelju laboratorijskog iskustva (16.)), periferni živac (ishijadični ili tibijalni) po mogućnosti smješten uz mišić, skeletni mišić i kost, s leđnom moždinom (sekcija ili, kao alternativna, svježe pripremljen aspirat koštane srži). Preporučuje se da se sjemenici fiksiraju uranjanjem u Bouinov ili izmijenjeni Davidsonov fiksativ (16., 17. i 18.); za ta se tkiva ne preporučuje fiksacija u formalinu. Vezivna ovojnica može se nježno i plitko punktirati na oba pola organa iglom koja omogućuje brzu penetraciju fiksativa. Klinički i drugi nalazi mogu ukazati na potrebu za ispitivanjem dodatnih tkiva. Treba sačuvati i sve organe za koje se na temelju saznanja o svojstvima ispitivane kemikalije smatra da bi mogli biti ciljni.
|
|
66.
|
Sljedeća tkiva mogu dati dragocjenu indikaciju za učinke na endokrini sustav: spolne žlijezde (jajnici i sjemenici), sekundarni spolni organi (maternica s cerviksom, sjemeni kanalići, sjemeni mjehurići s koagulacijskim žlijezdama, dorzolateralna i ventralna prostata), vagina, hipofiza, muška mliječna žlijezda i nadbubrežna žlijezda. Promjene u muškim mliječnim žlijezdama nisu dovoljno dokumentirane, ali taj parametar može biti vrlo osjetljiv na tvari s estrogenskim djelovanjem. Opažanja organa/tkiva koja nisu navedena u stavku 65. nisu obvezna.
|
|
67.
|
Mrtve mladunce i mladunce koje se usmrti 13. dana nakon okota, ili ubrzo nakon toga, trebalo bi pažljivo pregledati kako bi se utvrdile barem vanjske velike abnormalnosti. Posebnu pozornost treba posvetiti vanjskim reproduktivnim genitalijama koje se pregledava kako bi se utvrdili mogući znakovi promijenjenog razvoja.
|
Histopatologija
|
68.
|
Na sačuvanim organima i tkivima odabranih životinja iz kontrolne skupine i skupina tretiranih visokim dozama treba napraviti kompletan histopatološki pregled (uz poseban naglasak na faze spermatogeneze kod muških spolnih žlijezdi i histopatologiju strukture intersticijskih stanica sjemenika). Po potrebi se mogu pregledati štitnjače mladunaca i preostalih odraslih životinja. Ta ispitivanja treba proširiti na životinje drugih skupina doziranja ako su u skupini s visokom dozom uočene promjene povezane s tretiranjem. Smjernica o histopatologiji (10.) pruža dodatne podrobne informacije o sekciji, fiksaciji, seciranju i histopatologiji endokrinih tkiva.
|
|
69.
|
Treba pregledati sve makrolezije. Kako bi se pomoglo pojasniti NOAEL-e, treba pregledati ciljne organe kod skupina tretiranih ostalim dozama, osobito u skupinama kod kojih se tvrdi da pokazuju NOAEL.
|
|
70.
|
Ako se koristi satelitska skupina, treba napraviti histopatološki pregled tkiva i organa kod kojih su u tretiranim skupinama uočeni učinci.
|
PODACI I IZVJEŠĆIVANJE
Podaci
|
71.
|
Treba navesti podatke za svaku pojedinačnu životinju. Osim toga, sve podatke treba sažeti u obliku tablice, tako da se za svaku ispitnu skupinu navede broj životinja na početku ispitivanja, broj životinja koje su uginule tijekom ispitivanja ili su eutanazirane iz humanih razloga, vrijeme smrti ili eutanazije, broj plodnih životinja, broj gravidnih ženki, broj životinja koje pokazuju znakove toksičnosti, opis uočenih znakova toksičnosti, uključujući vrijeme pojavljivanja, trajanje i ozbiljnost toksičnih učinaka, vrste histopatoloških promjena i sve relevantne podatke o leglu. Format sažetog izvješća u obliku tablice koji se pokazao vrlo korisnim za procjenu reproduktivnih/razvojnih učinaka naveden je u Dodatku 3.
|
|
72.
|
Ako je moguće, brojčane rezultate treba ocijeniti odgovarajućom i opće prihvaćenom statističkom metodom. Za usporedbe učinaka unutar raspona visina doza trebala bi se izbjeći uporaba višestrukih t-testova. Statističke metode treba odabrati u fazi planiranja istraživanja. Statistička analiza anogenitalnog razmaka i zadržavanja bradavica trebala bi se temeljiti na podacima za pojedinačne mladunce, uzimajući u obzir učinke na leglo. Ako je primjereno, jedinicu analize čini leglo. Statistička analiza tjelesne mase mladunaca trebala bi se temeljiti na podacima za pojedinačne mladunce, uzimajući u obzir veličinu legla. Zbog ograničenih dimenzija istraživanja, statističke analize kojima se nastoji ispitati važnost rezultata imaju ograničenu vrijednost za mnoge krajnje točke, osobito za reproduktivne krajnje točke. Nisu primjerene neke od često korištenih metoda, osobito parametrijska ispitivanja za mjerenje središnje tendencije. Ako se upotrebljavaju statističke analize, odabrana metoda trebala bi biti primjerena za distribuciju varijable koja se ispituje te je treba odabrati prije početka istraživanja.
|
Ocjena rezultata
|
73.
|
Nalaze ovog istraživanja toksičnosti treba ocijeniti s obzirom na uočene učinke, nekropsiju i mikroskopske nalaze. Evaluacija treba obuhvatiti odnos između doze ispitivane kemikalije i prisutnosti ili izostanka, učestalosti i ozbiljnosti abnormalnosti, uključujući makrolezije, identificirane ciljne organe, neplodnost, kliničke abnormalnosti, promjene sposobnosti reprodukcije i legla, promjene tjelesne mase, učinke na smrtnost i sve ostale toksične učinke.
|
|
74.
|
Zbog kratkog razdoblja tretiranja mužjaka, uz podatke o plodnosti trebalo bi razmotriti i histopatologiju sjemenika i sjemenih kanalića pri procjeni učinaka na reprodukciju mužjaka. Kao pomoć u tumačenju istraživanja može biti korisna i upotreba podataka o prijašnjim kontrolama u pogledu reprodukcije/razvoja (npr. za veličinu legla, anogenitalni razmak, zadržavanje bradavica, razine seruma T4), ako su dostupni.
|
|
75.
|
Radi kontrole kvalitete predlaže se prikupljanje podataka o prijašnjim kontrolama te izračunavanje koeficijenata varijacije za brojčane podatke, posebno za parametre povezane s otkrivanjem endokrinih ometača. Ti se podaci mogu upotrijebiti za uspoređivanje kad se ocjenjuju konkretna istraživanja.
|
Izvješće o ispitivanju
|
76.
|
Izvješće o ispitivanju trebalo bi sadržavati sljedeće informacije:
|
|
Ispitivana kemikalija:
|
—
|
izvor, broj serije, rok uporabe, ako su dostupni,
|
|
—
|
stabilnost ispitivane kemikalije, ako je poznata.
|
|
|
|
Tvar s jednim sastojkom:
|
—
|
fizički izgled, topljivost u vodi i druga relevantna fizikalno-kemijska svojstva,
|
|
—
|
kemijske identifikacijske oznake, kao što su IUPAC ili CAS naziv, CAS broj, SMILES ili InChI oznaka, strukturna formula, čistoća, kemijski identitet nečistoća prema potrebi i ako je izvedivo u praksi itd.
|
|
|
|
Tvari s više sastojaka, UVCB tvari i smjese:
|
—
|
opis (koliko je to moguće) kemijskog identiteta (vidjeti gore), kvantitativnog udjela i relevantnih fizikalno-kemijskih svojstava sastojaka
|
. |
|
|
Nosač (po potrebi):
|
—
|
obrazloženje odabira nosača ako nije riječ o vodi.
|
|
|
|
Ispitne životinje:
|
—
|
broj, dob i spol životinja,
|
|
—
|
podrijetlo, uvjeti smještaja, prehrana itd.,
|
|
—
|
pojedinačna tjelesna masa životinja na početku ispitivanja,
|
|
—
|
obrazloženje odabira vrste ako se ne radi o štakorima.
|
|
|
|
Ispitni uvjeti:
|
—
|
obrazloženje odabira visine doze,
|
|
—
|
pojedinosti o formulaciji ispitivane kemikalije/pripremanju hrane, postignuta koncentracija, stabilnost i homogenost pripravka,
|
|
—
|
pojedinosti o primjeni ispitivane kemikalije,
|
|
—
|
preračunavanje koncentracije ispitivane kemikalije u hrani/vodi za piće (ppm) u stvarnu dozu (mg/kg tjelesne težine/dan), prema potrebi,
|
|
—
|
pojedinosti o kvaliteti hrane i vode,
|
|
—
|
podroban opis postupka nasumičnog odabira mladunaca za izdvajanje ako se ono obavlja.
|
|
|
|
Rezultati:
|
—
|
tjelesna masa/promjene tjelesne mase,
|
|
—
|
unos hrane i unos vode, po potrebi,
|
|
—
|
podaci o toksičnom odgovoru po spolu i dozi, uključujući plodnost, gestaciju i sve druge znakove
|
|
—
|
duljina gestacije, toksični ili drugi učinci na reprodukciju, potomstvo, rast nakon rođenja itd.,
|
|
—
|
vrsta, stupanj i trajanje uočenih kliničkih promjena (reverzibilne ili ireverzibilne),
|
|
—
|
ocjena osjetilne aktivnosti, jakosti stiska i motorne aktivnosti,
|
|
—
|
hematološka ispitivanja s odgovarajućim referentnim vrijednostima,
|
|
—
|
klinička biokemijska ispitivanja s odgovarajućim referentnim vrijednostima,
|
|
—
|
broj odraslih ženki s normalnim ili abnormalnim ciklusom estrusa i trajanje ciklusa,
|
|
—
|
broj živorođenih i gubitaka nakon implantacije,
|
|
—
|
broj mladunaca s jako izraženim abnormalnostima, ukupna procjena vanjskih genitalija, broj patuljastih životinja,
|
|
—
|
vrijeme smrti tijekom istraživanja ili je li životinja preživjela do kraja,
|
|
—
|
broj implantacija, veličina i masa legla u trenutku evidentiranja,
|
|
—
|
podaci o tjelesnoj masi mladunaca,
|
|
—
|
anogenitalni razmak svih mladunaca (i tjelesna masa na dan mjerenja anogenitalnog razmaka),
|
|
—
|
zadržavanje bradavica kod mužjaka mladunaca,
|
|
—
|
razine hormona štitnjače, u mladunaca starih 13 dana i odraslih mužjaka (te u ženki (majki) i mladunaca starih 4 dana ako se mjeri),
|
|
—
|
tjelesna masa u trenutku usmrćenja i podaci o masi organa za roditeljske životinje,
|
|
—
|
iscrpan opis histopatoloških nalaza,
|
|
—
|
podaci o apsorpciji (ako su dostupni),
|
|
—
|
statistička obrada rezultata, prema potrebi.
|
|
|
Tumačenje rezultata
|
77.
|
U ovom će se istraživanju pružiti procjene reproduktivne/razvojne toksičnosti povezane s primjenom ponovljenih doza. Točnije, s obzirom na to da je naglasak stavljen i na opću toksičnost i na krajnje točke reproduktivne/razvojne toksičnosti, rezultati istraživanja omogućit će razlikovanje reproduktivnih/razvojnih učinaka koji se javljaju kad nema opće toksičnosti i onih koji se javljaju samo kod doza koje su toksične i za roditeljske životinje (vidjeti stavke 7.–11.). Mogla bi dati naznaku u vezi s tim treba li provesti daljnja ispitivanjima i dati smjernice za osmišljavanje naknadnih istraživanja. Za pomoć pri tumačenju rezultata u pogledu reprodukcije i razvoja (19.) treba pogledati Smjernicu OECD-a 43. U Smjernici OECD-a 106 o histološkoj procjeni endokrinih i reproduktivnih ispitivanja na glodavcima (16.) navedene su informacije o pripremi i procjeni (endokrinih) organa i vaginalnih brisova koje mogu biti korisne za ovu ispitnu metodu.
|
LITERATURA
|
1.
|
OECD (1990). Room Document No 1 for the 14th Joint Meeting of the Chemicals Group and Management Committee. Na zahtjev dostupno kod Organizacije za gospodarsku suradnju i razvoj, Pariz.
|
|
2.
|
OECD (1992). Chairman’s Report of the ad hoc Expert Meeting on Reproductive Toxicity Screening Methods, Tokio, 27–29. listopada 1992. Na zahtjev dostupno kod Organizacije za gospodarsku suradnju i razvoj, Pariz.
|
|
3.
|
Mitsumori K., Kodama Y., Uchida O., Takada K., Saito M. Naito K., Tanaka S., Kurokawa Y., Usami, M., Kawashima K., Yasuhara K., Toyoda K., Onodera H., Furukawa F., Takahashi M. and Hayashi Y. (1994). Confirmation Study, Using Nitro-Benzene, of the Combined Repeat Dose and Reproductive/ Developmental Toxicity Test Protocol Proposed by the Organization for Economic Cooperation and Development (OECD). J. Toxicol, Sci., 19, 141.–149.
|
|
4.
|
Tanaka S., Kawashima K., Naito K., Usami M., Nakadate M., Imaida K., Takahashi M., Hayashi Y., Kurokawa Y. and Tobe M. (1992). Combined Repeat Dose and Reproductive/Developmental Toxicity Screening Test (OECD): Familiarization Using Cyclophosphamide. Fundam. Appl. Toxicol., 18, 89.–95.
|
|
5.
|
OECD (1998). Report of the First Meeting of the OECD Endocrine Disrupter Testing and Assessment (EDTA) Task Force, 10.–11. ožujka 1998., Na zahtjev dostupno kod Organizacije za gospodarsku suradnju i razvoj, Pariz.
|
|
6.
|
OECD (2015). Feasibility Study for Minor Enhancements of TG 421/422 with ED Relevant Endpoints. Environment, Health and Safety Publications, Series on Testing and Assessment (No 217), Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
7.
|
OECD (2000). Guidance Document on the Recognition, Assessment, and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluations, Environment, Health and Safety Publications, Series on Testing and Assessment, (No 19), Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
8.
|
Goldman J.M., Murr A.S., Buckalew A.R., Ferrell J.M.and Cooper R.L. (2007). The Rodent Estrous Cycle: Characterization of Vaginal Cytology and its Utility in Toxicological Studies, Birth Defects Research, Part B, 80 (2), 84.–97.
|
|
9.
|
Sadleir R.M.F.S. (1979). Cycles and Seasons, in Auston C.R. and Short R.V. (Eds.), Reproduction in Mammals: I. Germ Cells and Fertilization, Cambridge, New York.
|
|
10.
|
IPCS (1986). Principles and Methods for the Assessment of Neurotoxicity Associated with Exposure to Chemicals. Environmental Health Criteria Document (No 60).
|
|
11.
|
Moser V.C., McDaniel K.M. and Phillips P.M. (1991). Rat Strain and Stock Comparisons Using a Functional Observational Battery: Baseline Values and Effects of Amitraz. Toxicol. Appl. Pharmacol., 108, 267.–283.
|
|
12.
|
Meyer O.A., Tilson H.A., Byrd W.C. and Riley M.T. (1979). A Method for the Routine Assessment of Fore- and Hindlimb Grip Strength of Rats and Mice. Neurobehav. Toxicol., 1, 233.–236.
|
|
13.
|
Crofton K.M., Howard J.L., Moser V.C., Gill M.W., Reiter L.W., Tilson H.A., MacPhail R.C. (1991). Interlaboratory Comparison of Motor Activity Experiments: Implication for Neurotoxicological Assessments. Neurotoxicol. Teratol. 13, 599.–609.
|
|
14.
|
Gallavan R.H. Jr, J.F. Holson, D.G. Stump, J.F. Knapp and V.L. Reynolds. (1999). Interpreting the Toxicologic Significance of Alterations in Anogenital Distance: Potential for Confounding Effects of Progeny Body Weights, Reproductive Toxicology, 13: 383.–390.
|
|
15.
|
OECD (2013). Guidance Document in Support of the Test Guideline on the Extended One Generation Reproductive Toxicity Study. Environment, Health and Safety Publications, Series on Testing and Assessment (No 151). Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
16.
|
OECD (2009).Guidance Document for Histologic Evaluation of Endocrine and Reproductive Tests in Rodents. Environment, Health and Safety Publications, Series on Testing and Assessment (No. 106), Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
17.
|
Hess RA and Moore BJ. (1993). Histological Methods for the Evaluation of the Testis. U: Methods in Reproductive Toxicology, Chapin RE and Heindel JJ (Eds.). Academic Press: San Diego, CA, str. 52.–85.
|
|
18.
|
Latendresse JR, Warbrittion AR, Jonassen H, Creasy DM. (2002). Fixation of Testes and Eyes Using a Modified Davidson’s Fluid: Comparison with Bouin’s Fluid and Conventional Davidson’s fluid. Toxicol. Pathol. 30, 524.–533.
|
|
19.
|
OECD (2008). Guidance Document on Mammalian Reproductive Toxicity Testing and Assessment. Environment, Health and Safety Publications, Series on Testing and Assessment (No 43), Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
20.
|
OECD (2011), Guidance Document on Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption (No 150), Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
Dodatak 1.
DEFINICIJE (VIDJETI I (20.) SMJERNICU OECD-A 150)
Androgeni učinak je sposobnost kemikalije da djeluje kao prirodni androgeni hormon (npr. testosteron) u organizmu sisavaca.
Antiandrogeni učinak je sposobnost kemikalije da potiskuje djelovanje prirodnog androgenog hormona (npr. testosterona) u organizmu sisavaca.
Antiestrogeni učinak je sposobnost kemikalije da potiskuje djelovanje prirodnog estrogenog hormona (npr. estradiol 17ß) u organizmu sisavaca.
Antitiroidna aktivnost je sposobnost kemikalije da potiskuje djelovanje prirodnog hormona štitnjače (npr. T3) u organizmu sisavaca.
Kemikalija je tvar ili smjesa.
Razvojna toksičnost manifestacija reproduktivne toksičnosti koju čine prenatalni, postnatalni, strukturni ili funkcionalni poremećaji potomstva.
Doza je količina ispitivane kemikalije koja se primjenjuje. Doza se izražava kao masa ispitivane kemikalije po jedinici tjelesne mase ispitne životinje po danu (npr. mg/kg tjelesne mase po danu) ili kao stalna koncentracija u hrani.
Doziranje je opći pojam koji obuhvaća dozu, njezinu učestalost i trajanje doziranja.
Evidentna toksičnost je opći naziv koji opisuje jasne znakove toksičnosti nakon primjene ispitivane kemikalije. Ti bi znakovi trebali biti dovoljni za utvrđivanje opasnosti i trebaju biti takvi da se za primjenu povišene doze može očekivati da će rezultirati razvojem ozbiljnih znakova toksičnosti i mogućom smrtnošću.
Ometanje plodnosti čine poremećaji muških ili ženskih reproduktivnih funkcija ili reproduktivne sposobnosti.
Toksičnost kod majke štetni učinci na gravidne ženke do kojih dolazi specifično (izravni učinak) ili nespecifično (neizravni učinak) i koji su povezani sa stanjem gravidnosti.
NOAEL je kratica za visinu doze bez vidljivih štetnih učinaka. To je najviša doza pri kojoj se ne opažaju nikakvi štetni učinci povezani s tretiranjem.
Estrogeni učinak je sposobnost kemikalije da djeluje kao prirodni estrogeni hormon (npr. estradiol 17ß) u organizmu sisavaca.
Reproduktivna toksičnost predstavlja štetne učinke na potomstvo i/ili oštećenje muške i ženske reproduktivne funkcije ili sposobnosti.
Ispitivana kemikalija je svaka tvar ili smjesa koja se ispituje ovom ispitnom metodom.
Tiroidna aktivnost je sposobnost kemikalije da djeluje kao prirodni hormon štitnjače (npr. T3) u organizmu sisavaca.
Validacija je znanstveni postupak s ciljem karakterizacije operativnih zahtjeva i ograničenja ispitne metode te pokazivanja njezine pouzdanosti i relevantnosti za određenu svrhu.
Dodatak 2.
DIJAGRAM PLANA POKUSA IZ KOJEG SE VIDI MAKSIMALNO TRAJANJE STUDIJE, NA TEMELJU CIJELOG 14-DNEVNOG RAZDOBLJA PARENJA


Dodatak 3.
SAŽETO IZVJEŠĆE U OBLIKU TABLICE O UČINCIMA NA REPRODUKCIJU/RAZVOJ
|
OPAŽANJA
|
VRIJEDNOSTI
|
|
Doziranje (jedinice)…….
|
0 (kontrola)
|
…
|
…
|
…
|
…
|
|
Formirani parovi (N)
|
|
|
|
|
|
|
Ciklus estrusa (barem srednja vrijednost duljine i učestalost nepravilnih ciklusa)
|
|
|
|
|
|
|
Ženke koje pokazuju znakove kopulacije (N)
|
|
|
|
|
|
|
Ženke koje su postale gravidne (N)
|
|
|
|
|
|
|
Dani začeća 1–5 (N)
|
|
|
|
|
|
|
Dani začeća 6–… (23) (N)
|
|
|
|
|
|
|
Graviditet ≤ 21 dan (N)
|
|
|
|
|
|
|
Graviditet = 22 dana (N)
|
|
|
|
|
|
|
Graviditet ≥ 23 dana (N)
|
|
|
|
|
|
|
Ženke (majke) sa živim mladuncima (N)
|
|
|
|
|
|
|
Ženke (majke) sa živim mladuncima 4. dana nakon okota (N)
|
|
|
|
|
|
|
Implantati po ženki (majci) (srednja vrijednost)
|
|
|
|
|
|
|
Živi mladunci po ženki (majci) pri okotu (srednja vrijednost)
|
|
|
|
|
|
|
Živi mladunci po ženki (majci) 4. dana (srednja vrijednost)
|
|
|
|
|
|
|
Omjer spolova (m/ž) pri okotu (srednja vrijednost)
|
|
|
|
|
|
|
Omjer spolova (m/ž) 4. dana (srednja vrijednost)
|
|
|
|
|
|
|
Masa legla pri okotu (srednja vrijednost)
|
|
|
|
|
|
|
Masa legla 4. dana (srednja vrijednost)
|
|
|
|
|
|
|
Masa mladunaca pri okotu (srednja vrijednost)
|
|
|
|
|
|
|
Masa mladunaca u trenutku mjerenja anogenitalnog razmaka (srednja vrijednost za mužjake i srednja vrijednost za ženke)
|
|
|
|
|
|
|
Anogenitalni razmak na isti postnatalni dan, dan okota – 4. dan (srednja vrijednost za mužjake i ženke, naznaka postnatalnog dana)
|
|
|
|
|
|
|
Masa mladunaca 4. dana (srednja vrijednost)
|
|
|
|
|
|
|
Masa mladunaca 13. dana (srednja vrijednost)
|
|
|
|
|
|
|
Zadržavanje bradavica kod mužjaka mladunaca 13. dana (srednja vrijednost)
|
|
|
|
|
|
|
ABNORMALNI MLADUNCI
|
|
Ženke (majke) s 0
|
|
|
|
|
|
|
Ženke (majke) s 1
|
|
|
|
|
|
|
Ženke (majke) s ≥ 2
|
|
|
|
|
|
|
GUBITAK POTOMAKA
|
|
Prenatalno (implantacije umanjene za broj živorođenih)
|
|
Ženke s 0
|
|
|
|
|
|
|
Ženke s 1
|
|
|
|
|
|
|
Ženke s 2
|
|
|
|
|
|
|
Ženke s ≥ 3
|
|
|
|
|
|
|
Postnatalno (broj živorođenih umanjen za broj živih mladunaca 13. dana nakon okota)
|
|
Ženke s 0
|
|
|
|
|
|
|
Ženke s 1
|
|
|
|
|
|
|
Ženke s 2
|
|
|
|
|
|
|
Ženke s ≥ 3
|
|
|
|
|
|
B.65.
IN VITRO ISPITNA METODA ZA NAGRIZANJE KOŽE S MEMBRANSKOM BARIJEROM
UVOD
|
1.
|
Ova ispitna metoda odgovara Smjernici OECD-a za ispitivanje 435 (TG) (2015.). Nagrizanje kože odnosi se na izazivanje ireverzibilnog oštećenja kože koje se manifestira kao vidljiva nekroza koja kroz epidermu prodire u dermu nakon primjene ispitivane kemikalije, kako je utvrđeno Globalno usklađenim sustavom razvrstavanja i označivanja kemikalija (GHS) Ujedinjenih naroda (UN) (1.) i Uredbom (EZ) br. 1272/2008 o razvrstavanju, označivanju i pakiranju tvari i smjesa (CLP) (24) Europske unije. Ova ispitna metoda, ekvivalentna ažuriranoj Smjernici OECD-a za ispitivanje 435, pruža in vitro ispitnu metodu za nagrizanje kože s membranskom barijerom koja se može upotrebljavati za identifikaciju nagrizajućih kemikalija. U ispitnoj metodi upotrebljava se umjetna membrana koja je osmišljena tako da reagira na nagrizajuće kemikalije na sličan način kao i životinjska koža in situ.
|
|
2.
|
Nagrizajuće djelovanje na kožu tradicionalno se procjenjivalo primjenom ispitivane kemikalije na kožu živih životinja i procjenom razmjera oštećenja tkiva nakon određenog vremenskog razdoblja (2.). Uz sadašnju ispitnu metodu donesen je niz drugih in vitro ispitnih metoda (3. i 4.) kao alternativa standardnom in vivo postupku na koži kunića (poglavlje B.4. ovog Priloga; ekvivalentan Smjernici OECD-a za ispitivanje 404) koji se upotrebljava za identifikaciju nagrizajućih kemikalija (2.). U stupnjevanoj strategiji ispitivanja i ocjenjivanja UN GHS-a za procjenu i razvrstavanje nagrizanja kože te u Smjernicama OECD-a o integriranim pristupima ispitivanju i procjeni (IATA) za nadraživanje/nagrizanje kože preporučuje se upotreba validiranih i prihvaćenih in vitro ispitnih metoda u okviru modula 3. i 4. (1. i 5.). U IATA-i je opisano nekoliko modula u kojima se grupiraju izvori informacija i alati za analizu te i. pružaju se smjernice o tome kako integrirati i upotrijebiti postojeće podatke o ispitivanju i podatke koji se dobivaju bez ispitivanja za procjenu potencijala kemikalija da uzrokuju nadraživanje i nagrizanje kože te ii. predlaže se pristup kad je potrebno daljnje ispitivanje, među ostalim i ako se dobiju negativni rezultati (5.). U tom modularnom pristupu pozitivni rezultati iz in vitro ispitnih metoda mogu se upotrebljavati za razvrstavanje kemikalije kao nagrizajuće bez potrebe za ispitivanjem na životinjama, čime se smanjuje i poboljšava upotreba životinja te se izbjegavaju bol i patnja do kojih može doći kada bi se u tu svrhu upotrebljavale životinje.
|
|
3.
|
Dovršene su validacijske studije za in vitro model membranske barijere koji je komercijalno dostupan pod nazivom Corrositex® (6., 7. i 8.) i koji pokazuje ukupnu točnost predviđanja nagrizanja kože od 79 % (128/163), osjetljivost od 85 % (76/89) i specifičnost od 70 % (52/74) za bazu podataka od 163 tvari i smjesa (7.). Na temelju njezine potvrđene valjanosti, ova je validirana referentna metoda (VRM) preporučena za upotrebu kao dio stupnjevane strategije ispitivanja za procjenu potencijalne opasnosti kemikalija da uzrokuju nagrizanje kože (5. i 7.). Prije nego što se in vitro model membranske barijere za nagrizanje kože može upotrijebiti u regulatorne svrhe, trebalo bi utvrditi njegovu pouzdanost, relevantnost (točnost) i ograničenja za njegovu predloženu uporabu kako bi se osigurala njegova sličnost s validiranom referentnom metodom (9.), u skladu s unaprijed utvrđenim zahtjevima izvedbe (10.). OECD-ovo uzajamno prihvaćanje podataka jamčit će se samo nakon što se svaka predložena nova ili ažurirana metoda koja je u skladu sa zahtjevima izvedbe pregleda i uključi u ekvivalentnu smjernicu OECD-a za ispitivanje. Smjernica OECD-a za ispitivanje 435 trenutačno obuhvaća samo jednu in vitro metodu i ovu ispitnu metodu – komercijalno dostupan model Corrositex®.
|
|
4.
|
Ostale ispitne metode za ispitivanje nagrizanja kože temelje se na upotrebi rekonstituirane ljudske kože (Smjernica OECD-a za ispitivanje 431) (3.) i izolirane kože štakora (Smjernica OECD-a za ispitivanje 430) (4.). Ova smjernica za ispitivanje omogućuje i daljnje razvrstavanje nagrizajućih kemikalija u tri potkategorije nagrizanja prema UN GHS-u i tri ambalažne skupine UN-a za prijevoz u pogledu opasnosti od nagrizanja. Ova Smjernica za ispitivanje izvorno je donesena 2006. i ažurirana je 2015. kako bi se odnosila na smjernice o IATA-i i kako bi se ažurirao popis tvari za za dokazivanje tehničke osposobljenosti.
|
DEFINICIJE
|
5.
|
Upotrijebljene definicije navedene su u Dodatku.
|
POČETNA RAZMATRANJA I OGRANIČENJA
|
6.
|
Ispitivanje opisano u ovoj ispitnoj metodi omogućuje identifikaciju nagrizajućih ispitivanih kemikalija i daljnje razvrstavanje nagrizajućih ispitivanih kemikalija u skladu s UN GHS-om/CLP-om (tablica 1.). Osim toga, ta se ispitna metoda može upotrebljavati kako bi se donijele odluke o nagrizajućem i nenagrizajućem svojstvu određenih razreda kemikalija, npr. organskih i anorganskih kiselina, derivata kiselina (25) i baza u svrhu ispitivanja određenih vrsta prijevoza (7., 11. i 12.). Ova ispitna metoda opisuje opći postupak koji je sličan validiranoj referentnoj ispitnoj metodi (7.). Iako se ovom ispitnom metodom ne dobivaju primjerene informacije o nadraživanju kože, trebalo bi napomenuti da se ispitna metoda B.46. (ekvivalentna Smjernici OECD-a za ispitivanje 439) posebno bavi učinkom nadraženosti kože na zdravlje in vitro (13.). Za potpunu evaluaciju lokalnih učinaka na kožu nakon jednostrukog dermalnog izlaganja potrebno je proučiti Smjernice OECD-a o integriranim pristupima ispitivanju i procjeni (5.).
Tablica 1.
Kategorija „nagrizajuće za kožu” s potkategorijama prema UN GHS-u (26)
|
Kategorija nagrizajućeg djelovanja (1. kategorija) (za tijela koja se ne koriste potkategorijama)
|
Potkategorije potencijalno nagrizajućeg djelovanja (26) (za tijela koja se koriste potkategorijama, uključujući Uredbu o CLP-u)
|
Nagrizajuće kod ≥ 1 od 3 životinje
|
|
Izloženost
|
Opažanje
|
|
Nagrizajuće
|
Potkategorija nagrizajućeg djelovanja 1.A
|
≤ 3 minute
|
≤ 1 sat
|
|
Potkategorija nagrizajućeg djelovanja 1.B
|
> 3 minute / ≤ 1 sat
|
≤ 14 dana
|
|
Potkategorija nagrizajućeg djelovanja 1.C
|
> 1 sat / ≤ 4 sata
|
≤ 14 dana
|
|
|
7.
|
Ograničenje validirane referentne metode (7.) je to što mnoge kemikalije koje ne djeluju nagrizajuće i neke kemikalije koje djeluju nagrizajuće možda neće ispuniti uvjete za ispitivanje na temelju rezultata početnog ispitivanja kompatibilnosti (vidjeti stavak 13.). Vodene otopine kemikalija čija je pH-vrijednost u rasponu od 4,5 do 8,5 često ne ispunjavaju uvjete za ispitivanje; međutim, 85 % ispitanih kemikalija u tom pH-rasponu nije djelovalo nagrizajuće u ispitivanjima na životinjama (7.). In vitro metoda s membranskom barijerom može se upotrebljavati za ispitivanje krutih tvari (topljivih ili netopljivih u vodi), tekućina (vodenih i bezvodnih) i emulzija. Međutim, ispitivane kemikalije koje ne uzrokuju uočljivu promjenu u ispitivanju kompatibilnosti (tj. promjenu boje u detekcijskom sustavu za kemikalije (CDS) validirane referentne ispitne metode) ne mogu se ispitati primjenom metode s membranskom barijerom i trebale bi se ispitati drugim ispitnim metodama.
|
NAČELO ISPITIVANJA
|
8.
|
Ispitni sustav sastoji se od dvije sastavnice: sintetičke makromolekularne biološke barijere i detekcijskog sustava za kemikalije; u ovoj se ispitnoj metodi detekcijskim sustavom za kemikalije otkriva oštećenje membranske barijere koje uzrokuju nagrizajuće ispitivane kemikalije nakon primjene ispitivane kemikalije na površinu sintetičke makromolekularne membranske barijere (7.), uz pretpostavku da se to odvija istim mehanizmima nagrizanja koji djeluju i na živu kožu.
|
|
9.
|
Prodiranje kroz membransku barijeru može se mjeriti različitim postupcima ili detekcijskim sustavima za kemikalije, uključujući promjenu boje pH-indikatorske boje ili nekog drugog svojstva otopine indikatora ispod barijere.
|
|
10.
|
Trebalo bi se utvrditi da je membranska barijera valjana, tj. relevantna i pouzdana za predviđenu upotrebu. To uključuje i osiguravanje dosljednosti različitih pripravaka u pogledu svojstava barijere, npr. sposobnost očuvanja barijere u dodiru s nenagrizajućim kemikalijama, sposobnost razvrstavanja nagrizajućih svojstava kemikalija prema različitim potkategorijama nagrizajućeg djelovanja prema UN GHS-u (1.). Odluka o razvrstavanju temelji se na vremenu koje je kemikaliji potrebno da prodre kroz membransku barijeru do otopine indikatora.
|
DOKAZIVANJE OSPOSOBLJENOSTI
|
11.
|
Prije rutinske upotrebe in vitro metode s membranskom barijerom koja je u skladu s ovom ispitnom metodom laboratoriji bi trebali dokazati tehničku osposobljenost pravilnim utvrđivanjem kategorije dvanaest tvari za dokazivanje osposobljenosti koje su preporučene u tablici 2. U slučajevima u kojima nije dostupna navedena tvar ili ako je to opravdano, može se upotrijebiti druga tvar za koju su dostupni primjereni referentni in vivo i in vitro podaci (npr. s popisa referentnih kemikalija (10.)) pod uvjetom da se primjenjuju isti kriteriji za odabir kako su opisani u tablici 1.
Tablica 2.
Tvari za dokazivanje tehničke osposobljenosti
(27)
|
Tvar (28)
|
CAS br.
|
Kemijski razred
|
In vivoUN GHS-u potkategorija prema (29)
|
In vitro potkategorija prema UN GHS-u (29)
|
|
Borov trifluorid dihidrat
|
13319-75-0
|
Anorganske kiseline
|
1.A
|
1.A
|
|
Dušična kiselina
|
7697-37-2
|
Anorganske kiseline
|
1.A
|
1.A
|
|
Fosforov pentaklorid
|
10026-13-8
|
Prekursori anorganskih kiselina
|
1.A
|
1.A
|
|
Valeril klorid
|
638-29-9
|
Kloridi kiselina
|
1.B
|
1.B
|
|
Natrijev hidroksid
|
1310-73-2
|
Anorganske baze
|
1.B
|
1.B
|
|
1-(2-aminoetil)piperazin
|
140-31-8
|
Alifatski amini
|
1.B
|
1.B
|
|
Benzensulfonil klorid
|
98-09-9
|
Kloridi kiselina
|
1.C
|
1.C
|
|
N,N-dimetil-benzilamin
|
103-83-3
|
Anilini
|
1.C
|
1.C
|
|
Tetraetilenpentamin
|
112-57-2
|
Alifatski amini
|
1.C
|
1.C
|
|
Eugenol
|
97-53-0
|
Fenoli
|
NC
|
NC
|
|
Nonil akrilat
|
2664-55-3
|
Akrilati/metakrilati
|
NC
|
NC
|
|
Natrijev bikarbonat
|
144-55-8
|
Anorganske soli
|
NC
|
NC
|
|
POSTUPAK
|
12.
|
U sljedećim se stavcima opisuju sastavnice i postupci ispitne metode s umjetnom membranskom barijerom za procjenu nagrizajućeg djelovanja (7. i 15.) na temelju važeće validirane referentne metode, tj. komercijalno dostupnog modela Corrositex®. Membranska barijera i otopine za utvrđivanje kompatibilnosti/otopine indikatora i otopine za razvrstavanje mogu se izraditi, pripremiti ili nabaviti iz komercijalnih izvora, kao što je slučaj s validiranom referentnom metodom – Corrositex®. Dostupan je uzorak protokola ispitne metode za validiranu referentnu ispitnu metodu (7.). Ispitivanje bi se trebalo provoditi na temperaturi okoline (17–25 °C) i sastavnice bi trebale biti u skladu sa sljedećim uvjetima.
|
Ispitivanje kompatibilnosti ispitivane kemikalije
|
13.
|
Prije provedbe ispitivanja s membranskom barijerom provodi se ispitivanje kompatibilnosti kako bi se utvrdilo može li detekcijski sustav za kemikalije otkriti ispitivanu kemikaliju. Ako detekcijski sustav za kemikalije ne otkrije kemikaliju, ispitna metoda s membranskom barijerom nije primjerena za procjenu potencijalnog nagrizajućeg djelovanja te ispitivane kemikalije i trebalo bi upotrijebiti drugu ispitnu metodu. Detekcijski sustav za kemikalije i uvjeti izlaganja koji se upotrebljavaju za ispitivanje kompatibilnosti trebali bi odražavati izlaganje u kasnijem ispitivanju s membranskom barijerom.
|
Test kategorizacije ispitivane kemikalije s obzirom na vremenski okvir
|
14.
|
Ako je primjereno za ispitnu metodu, ispitivanu kemikaliju koja je u ispitivanju kompatibilnosti ispunila uvjete treba podvrgnuti testu kategorizacije s obzirom na vremenski okvir, tj. testu probira kojim se razlikuju slabe i jake kiseline i baze. Na primjer, u validiranoj referentnoj metodi test kategorizacije s obzirom na vremenski okvir služi za određivanje koji bi se od dva vremenska okvira trebao upotrijebiti na temelju toga je li otkrivena znatna kisela ili alkalna rezerva. Za utvrđivanje nagrizajućeg djelovanja i potkategorije nagrizajućeg djelovanja na kožu prema UN GHS-u trebalo bi upotrijebiti dva različita vremenska okvira, na temelju kisele ili alkalne rezerve ispitivane kemikalije.
|
SASTAVNICE ISPITNE METODE S MEMBRANSKOM BARIJEROM
Membranska barijera
|
15.
|
Membranska barijera ima dvije sastavnice: proteinski makromolekularni vodeni gel i propusnu potpornu membranu. Proteinski gel trebao bi biti nepropustan za tekućine i krute tvari, ali trebao bi moći korodirati i postati propustan. Potpuno izrađenu membransku barijeru trebalo bi pohraniti u unaprijed utvrđenim uvjetima za koje se pokazalo da onemogućuju pogoršanje kvalitete gela, npr. sušenje, rast mikroba, pomicanje, pucanje, koje bi narušilo njegovu učinkovitost. Treba utvrditi prihvatljivo vrijeme skladištenja te se pripravci membranske barijere ne koriste nakon tog razdoblja.
|
|
16.
|
Propusna potporna membrana pruža mehaničku potporu proteinskom gelu tijekom procesa geliranja i izlaganja ispitivanoj kemikaliji. Potporna membrana trebala bi spriječiti ulegnuće ili pomicanje gela i biti propusna za sve ispitivane kemikalije.
|
|
17.
|
Proteinski gel, koji se sastoji od proteina, npr. keratina, kolagena, ili mješavine proteina, čini matricu gela i služi kao cilj za ispitivanu kemikaliju. Proteinski materijal stavlja se na površinu potporne membrane i ostavlja se da se stvori gel prije nego što se membranska barijera stavi na otopinu indikatora. Proteinski gel posvud bi trebao biti jednake debljine i gustoće te ne bi trebao sadržavati mjehuriće zraka ili nedostatke koji bi mogli utjecati na njegov funkcionalni integritet.
|
Detekcijski sustav za kemikalije (CDS)
|
18.
|
Otopina indikatora (ista otopina koja se upotrebljavala za ispitivanje kompatibilnosti) treba reagirati u prisutnosti ispitivane kemikalije. Treba se koristiti pH-indikatorskom bojom ili kombinacijom boja, npr. krezol crvenilom i metiloranžom, koja će promijeniti boju u prisutnosti ispitivane kemikalije. Sustav mjerenja može biti vizualni ili elektronički.
|
|
19.
|
Detekcijski sustavi razvijeni za otkrivanje prolazaka ispitivane kemikalije kroz membransku barijeru treba procijeniti u pogledu relevantnosti i pouzdanosti kako bi se utvrdio raspon kemikalija koje se mogu otkriti i kvantitativna ograničenja otkrivanja.
|
PROVOĐENJE TESTA
Sastavljanje sastavnica ispitne metode
|
20.
|
Membranska barijera postavlja se u bočicu (ili cijev) koja sadržava otopinu indikatora tako da je potporna membrana potpuno u kontaktu s otopinom indikatora i da nisu prisutni mjehurići zraka. Treba paziti da se osigura integritet barijere.
|
Primjena ispitivane kemikalije
|
21.
|
Primjerena količina ispitivane kemikalije, npr. 500 μl tekućine ili 500 mg krute tvari fino usitnjene u prah (7.) pažljivo se u slojevima nanosi na gornju površinu membranske barijere i ravnomjerno raspoređuje. Za svaku ispitivanu kemikaliju i njezine odgovarajuće kontrole priprema se odgovarajući broj ponovljenih uzoraka, npr. četiri (7.), (vidjeti stavke od 23. do 25.). Evidentira se vrijeme primjene ispitivane kemikalije na membransku barijeru. Kako bi se osiguralo da se kratka vremena nagrizanja točno evidentiraju, vremena primjene ispitivane kemikalije na ponovljene bočice postupno se mijenjaju.
|
Mjerenje prodiranja kroz membransku barijeru
|
22.
|
Svaka se bočica primjereno prati i evidentira se vrijeme prve promjene otopine indikatora, tj. prodiranja kroz barijeru, te se utvrđuje vrijeme koje je proteklo od primjene do prodiranja kroz membransku barijeru.
|
Kontrole
|
23.
|
Kod ispitivanja u kojima se s ispitivanom kemikalijom upotrebljava nosač ili otapalo, nosač ili otapalo treba biti kompatibilno sa sustavom membranske barijere, tj. ne smije izmijeniti integritet sustava membranske barijere ni nagrizajuće djelovanje ispitivane kemikalije. Ako je primjenjivo, kontrolu otapala (ili nosača) treba ispitati istodobno kad i ispitivanu kemikaliju kako bi se dokazala kompatibilnost otapala sa sustavom membranske barijere.
|
|
24.
|
Pozitivnu (nagrizajuću) kontrolu sa srednje nagrizajućom aktivnosti, npr. 110 ± 15 mg natrijeva hidroksida (potkategorija 1.B nagrizajućeg djelovanja prema UN GHS-u) (7.) treba ispitati istodobno kad i ispitivanu kemikaliju kako bi se procijenilo funkcionira li ispitni sustav zadovoljavajuće. Za procjenu relativnog potencijala za nagrizajuće djelovanje nagrizajuće ispitivane kemikalije može biti korisna druga pozitivna kontrola iz istog kemijskog razreda kao ispitivana kemikalija. Treba odabrati pozitivnu kontrolu ili kontrole srednje nagrizajućeg djelovanja (npr. potkategorija 1.B prema UN GHS-u) kako bi se otkrile promjene u vremenu prodiranja koje mogu biti neprihvatljivo dulje ili kraće od utvrđene referentne vrijednosti, što ukazuje na to da ispitni sustav ne funkcionira pravilno. Korisnost kemikalija koje djeluju iznimno nagrizajuće (potkategorija 1.A prema UN GHS-u) ili koje ne djeluju nagrizajuće u tu je svrhu ograničena. Nagrizajuća kemikalija iz potkategorije 1.B prema UN GHS-u omogućila bi otkrivanje predugog ili prekratkog vremena prodiranja. Kemikalija slabo nagrizajućeg djelovanja (potkategorija 1.C prema UN GHS-u) mogla bi se upotrijebiti kao pozitivna kontrola za mjerenje sposobnosti ispitne metode da dosljedno razlikuje kemikalije koje imaju slabo nagrizajuće djelovanje od kemikalija koje ne djeluju nagrizajuće. Neovisno o tome koji se pristup primjenjuje, treba razviti prihvatljivi raspon odgovora pozitivne kontrole na temelju prijašnjeg raspona vremena prodiranja za primijenjenu pozitivnu kontrolu ili kontrole, kao što je srednja vrijednost ±2–3 standardne devijacije. U svakoj studiji treba utvrditi točno vrijeme prodiranja za pozitivnu kontrolu kako bi se mogle otkriti devijacije koje su izvan prihvatljivog raspona.
|
|
25.
|
Negativnu (nenagrizajuću) kontrolu, npr. 10-postotnu limunsku kiselinu, 6-postotnu propionsku kiselinu (7.) isto bi trebalo ispitati istodobno kad i ispitivanu kemikaliju kao još jednu mjeru kontrole kvalitete za dokazivanje funkcionalnog integriteta membranske barijere.
|
Kriteriji prihvatljivosti istraživanja
|
26.
|
U skladu s utvrđenim vremenskim parametrima za svaku potkategoriju nagrizajućeg djelovanja prema UN GHS-u, vrijeme (u minutama) koje protekne od primjene ispitivane kemikalije na membransku barijeru do prodiranja kroz barijeru služi za predviđanje nagrizajućeg djelovanja ispitivane kemikalije. Da bi se istraživanje smatralo prihvatljivim, istodobna pozitivna kontrola trebala bi pokazati očekivano vrijeme reakcije prodiranja (npr. vrijeme prodiranja od osam do 16 minuta za natrijev hidroksid ako se upotrebljava kao pozitivna kontrola), istodobna negativna kontrola ne bi trebala djelovati nagrizajuće, a ako je uključena, istodobna kontrola s otapalom ne bi trebala djelovati nagrizajuće ni izmijeniti potencijal za nagrizajuće djelovanje ispitivane kemikalije. Laboratoriji bi prije rutinske primjene metode koja ispunjava zahtjeve ove ispitne metode trebali dokazati tehničku osposobljenost primjenom 12 tvari preporučenih u tablici 2. Za nove me-too metode koje se razviju na temelju ove ispitne metode i koje su strukturno i funkcionalno slične validiranoj referentnoj metodi (14.) trebaju se upotrebljavati unaprijed definirani zahtjevi izvedbe kako bi se dokazala pouzdanost i točnost nove metode prije njezine primjene za ispitivanje u regulatorne svrhe (10.).
|
Tumačenje rezultata i razvrstavanje ispitivanih kemikalija prema nagrizajućem djelovanju
|
27.
|
Vrijeme (u minutama) koje protekne od primjene ispitivane kemikalije na membransku barijeru do prodiranja kroz barijeru služi za razvrstavanje ispitivane kemikalije u potkategorije nagrizajućeg djelovanja prema UN GHS-u (1.) i, ako je primjenjivo, u ambalažne skupine UN-a (16.). Granične vrijednosti vremena za svaku od tri potkategorije nagrizajućeg djelovanja utvrđuju se za svaku predloženu ispitnu metodu. U konačnim odlukama o graničnim vremenima treba uzeti u obzir potrebu da se smanji preblago razvrstavanje opasnosti od nagrizajućeg djelovanja (tj. lažno negativni rezultati). U ovoj smjernici za ispitivanje trebala bi se koristi granična vremena za Corrositex®, kako su navedena u tablici 3., jer je to jedina ispitna metoda koja je trenutačno obuhvaćena ovom smjernicom za ispitivanje (7.).
Tablica 3.
Model predviđanja Corrositex®
|
Srednje vrijeme prodiranja (min.)
|
Predviđanje prema sustavu UN GHS (32)
|
|
Ispitivana kemikalija 1. kategorije (30) (utvrđeno testom kategorizacije, koji je dio metode)
|
Ispitivana kemikalija 2. kategorije (31) (utvrđeno testom kategorizacije, koji je dio metode)
|
|
0–3 min
|
0–3 min
|
Nagrizajuće, neobavezna potkategorija 1.A
|
|
> 3 do 60 min
|
> 3 do 30 min
|
Nagrizajuće, neobavezna potkategorija 1.B
|
|
> 60 do 240 min
|
> 30 do 60 min
|
Nagrizajuće, neobavezna potkategorija 1.C
|
|
> 240 min
|
> 60 min
|
Nije nagrizajuće
|
|
PODACI I IZVJEŠĆIVANJE
Podaci
|
28.
|
Vrijeme (u minutama) koje prođe od primjene ispitivane kemikalije i pozitivne kontrole ili kontrola do prodiranja barijere treba prikazati u tabličnom obliku kao podatke o pojedinačnim ponovljenim uzorcima te srednje vrijednosti ± standardna devijacija za svaki pokus.
|
Izvješće o ispitivanju
|
29.
|
Izvješće o ispitivanju trebalo bi sadržavati sljedeće informacije:
|
|
Ispitivana kemikalija i kontrolne tvari:
|
—
|
tvar s jednim sastojkom: kemijske identifikacijske oznake, kao što su IUPAC ili CAS naziv, CAS broj, SMILES ili InChI oznaka, strukturna formula, čistoća, kemijski identitet nečistoća prema potrebi i ako je izvedivo u praksi itd.,
|
|
—
|
tvar s više sastojaka, UVCB tvar i smjesa: opis (koliko je to moguće) kemijskog identiteta (vidjeti gore), kvantitativnog udjela i relevantnih fizikalno-kemijskih svojstava sastojaka,
|
|
—
|
fizički izgled, topljivost u vodi i dodatna relevantna fizikalno-kemijska svojstva,
|
|
—
|
izvor, broj serije, ako su dostupni,
|
|
—
|
tretiranje ispitivane kemikalije/kontrolne tvari prije ispitivanja, ako je primjenljivo (npr. grijanje, mljevenje),
|
|
—
|
stabilnost ispitivane kemikalije, rok uporabe ili datum za ponovnu analizu ako je poznat,
|
|
|
|
Nosač:
|
—
|
identifikacijska oznaka, koncentracija (prema potrebi), upotrijebljeni volumen,
|
|
—
|
obrazloženje za odabir nosača.
|
|
|
|
Upotrijebljeni in vitro model membranske barijere i protokol, uključujući dokazanu točnost i pouzdanost
|
|
|
Ispitni uvjeti:
|
—
|
opis korištenog uređaja i postupaka pripreme,
|
|
—
|
podrijetlo i sastav korištene in vitro membranske barijere,
|
|
—
|
sastav i svojstva otopine indikatora,
|
|
—
|
količina ispitivane kemikalije i kontrolne tvari,
|
|
—
|
opis i obrazloženje testa kategorizacije s obzirom na vremenski okvir,
|
|
—
|
opis primijenjenih kriterija ocjenjivanja i razvrstavanja,
|
|
—
|
dokazivanje osposobljenosti za izvođenje ispitne metode prije rutinske upotrebe ispitivanjem kemikalija za dokazivanje tehničke osposobljenosti.
|
|
|
|
Rezultati:
|
—
|
tablični prikaz pojedinačnih neobrađenih podataka o pojedinačnim ispitnim i kontrolnim uzorcima za svako ponavljanje,
|
|
—
|
opis drugih uočenih učinaka,
|
|
—
|
utvrđeno razvrstavanje, s upućivanjem na primijenjeni model predviđanja/kriterije odlučivanja.
|
|
Rasprava o rezultatima
Zaključci
|
LITERATURA
|
1.
|
Ujedinjeni narodi (UN) (2013). Globally Harmonized System of Classification and Labelling of Chemicals (GHS), Fifth Revised Edition, UN New York i Ženeva, 2013. Dostupno na: http://www.unece.org/trans/danger/publi/ghs/ghs_rev05/05files_e.html.
|
|
2.
|
Poglavlje B.4. ovog Priloga, Akutno nadraživanje/nagrizanje kože.
|
|
3.
|
Poglavlje B.40.bis ovog Priloga, Nagrizanje kože in vitro: ispitna metoda na modelu rekonstruirane ljudske epiderme (RhE).
|
|
4.
|
Poglavlje B.40. ovog Priloga, Nagrizanje kože in vitro: transkutani električni otpor (TER).
|
|
5.
|
OECD (2015). Guidance Document on Integrated Approaches to Testing and Assessment of Skin Irritation/Corrosion. Environment, Health and Safety Publications, Series on Testing and Assessment (No 203). Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
6.
|
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhutter, H.-G. and Liebsch, M. (1998). The ECVAM International Validation Study on In Vitro Tests for Skin Corrosivity. 2. Results and Evaluation by the Management Team. Toxicology In Vitro 12, 483.–524.
|
|
7.
|
ICCVAM (1999). Corrositex®. An In Vitro Test Method for Assessing Dermal Corrosivity Potential of Chemicals. The Results of an Independent Peer Review Evaluation Coordinated by ICCVAM, NTP and NICEATM. NIEHS, NIH Publication (No 99-4495).
|
|
8.
|
Gordon V.C., Harvell J.D. and Maibach H.I. (1994). Dermal Corrosion, the Corrositex® System: A DOT Accepted Method to Predict Corrosivity Potential of Test Materials. In vitro Skin Toxicology-Irritation, Phototoxicity, Sensitization. Alternative Methods in Toxicology 10, 37.–45.
|
|
9.
|
OECD (2005). Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment. Environmental, Health and Safety Publications. Series on testing and Assessment (No 34).
|
|
10.
|
OECD (2014). Performance Standards for the Assessment of Proposed Similar or Modified In Vitro Membrane Barrier Test Method for Skin Corrosion in Relation to TG 435. Organizacija za gospodarsku suradnju i razvoj, Pariz. Dostupno na: http://www.oecd.org/chemicalsafety/testing/PerfStand-TG430-June14.pdf.
|
|
11.
|
ECVAM (2001). Statement on the Application of the CORROSITEX® Assay for Skin Corrosivity Testing. 15th Meeting of ECVAM Scientific Advisory Committee (ESAC), Ispra, Italija. ATLA 29, 96.–97.
|
|
12.
|
U.S. DOT (2002). Exemption DOT-E-10904 (Fifth Revision). (20. rujna 2002.). Washington, D.C., U.S. DOT.
|
|
13.
|
Poglavlje B.46. ovog Priloga, Nadraživanje kože in vitro: ispitna metoda na modelu rekonstruirane ljudske epiderme. ICCVAM (2004). ICCVAM Recommended Performance Standards for In Vitro Test Methods for Skin Corrosion. NIEHS, NIH Publication No 04-4510. Dostupno na: http://www.ntp.niehs.nih.gov/iccvam/docs/dermal_docs/ps/ps044510.pdf.
|
|
14.
|
U.S. EPA (1996). Method 1120, Dermal Corrosion. Dostupno na: http://www.epa.gov/osw/hazard/testmethods/sw846/pdfs/1120.pdf.
|
|
15.
|
Ujedinjeni narodi (UN) (2013). UN Recommendations on the Transport of Dangerous Goods, Model Regulations, 18th Revised Edition (Part, Chapter 2.8), UN, 2013. Dostupno na: http://www.unece.org/fileadmin/DAM/trans/danger/publi/unrec/rev18/English/Rev18_Volume1_Part2.pdf.
|
Dodatak
DEFINICIJE
Točnost
: stupanj podudarnosti rezultata ispitne metode i prihvaćenih referentnih vrijednosti. Ona je mjerilo učinkovitosti ispitne metode i jedan od aspekata relevantnosti. Pojam je često međusobno zamjenjiv s pojmom „podudarnost” u smislu udjela točnih ishoda ispitne metode (9.).
Kemikalija
: tvar ili smjesa.
Detekcijski sustav za kemikalije (CDS)
: vizualni ili elektronički sustav mjerenja s otopinom indikatora koja reagira u prisutnosti ispitivane kemikalije, npr. promjenom pH-indikatorske boje ili kombinacije boja, koja će promijeniti boju u prisutnosti ispitivane kemikalije ili drugim vrstama kemijskih ili elektrokemijskih reakcija.
Podudarnost
: mjerilo učinkovitosti ispitne metode za ispitne metode koje daju kategorijski rezultat i jedan je od aspekata relevantnosti. Pojam je ponekad međusobno zamjenjiv s pojmom točnosti i definira se kao udio svih ispitanih kemikalija koje su pravilno razvrstane kao pozitivne ili negativne. Podudarnost u velikoj mjeri ovisi o prisutnosti pozitivnih rezultata u vrstama ispitivane kemikalije (9.).
GHS (Globalno usklađeni sustav razvrstavanja i označivanja kemikalija)
: sustav za razvrstavanje kemikalija (tvari i smjesa) prema standardiziranim vrstama i stupnjevima fizičkih opasnosti te opasnosti za zdravlje i okoliš, kojim su obuhvaćena odgovarajuća komunikacijska sredstva kao što su piktogrami, oznake opasnosti, oznake upozorenja, oznake obavijesti i sigurnosno-tehnički listovi, kojima se prenose informacije o njihovim štetnim učincima u cilju zaštite ljudi (uključujući poslodavce, radnike, prijevoznike, potrošače i interventno osoblje) i okoliša (1.).
IATA
: integrirani pristup ispitivanju i procjeni.
Smjesa
: smjesa ili otopina koja se sastoji od dviju ili više tvari.
Tvar s jednim sastojkom
: tvar, definirana količinskim sastavom, u kojoj je jedan glavni sastojak prisutan u koncentraciji od najmanje 80 % (w/w).
Tvar s više sastojaka
: tvar, definirana količinskim sastavom, u kojoj je više od jednog glavnog sastojka prisutno u koncentraciji od 10 % (w/w) ili većoj te manjoj od 80 % (w/w). Tvar s više sastojaka rezultat je procesa proizvodnje. Smjesa i tvar s više sastojaka razlikuju se po tome što se smjesa dobiva miješanjem dviju ili više tvari bez kemijske reakcije. Tvar s više sastojaka rezultat je kemijske reakcije.
NC
: nije nagrizajuće.
Zahtjevi izvedbe
: zahtjevi koji se temelje na validiranoj ispitnoj metodi i pružaju temelj za ocjenjivanje usporedivosti predložene, funkcionalno i mehanicistički slične, ispitne metode. Obuhvaćaju: i. ključne elemente ispitne metode; ii. minimalni popis referentnih kemikalija odabranih među kemikalijama koje se upotrebljavaju za dokazivanje prihvatljive učinkovitosti validirane ispitne metode te iii. slične razine pouzdanosti i točnosti, utemeljene na rezultatima dobivenim za validiranu ispitnu metodu, koje se prilikom ocjenjivanja trebaju dokazati predloženom ispitnom metodom koristeći minimalni popis referentnih kemikalija (9.).
Relevantnost
: opis odnosa između ispitne metode i istraživanog učinka te je li ispitivanje prikladno i korisno za određenu svrhu. Pokazuje u kojoj se mjeri ispitnom metodom točno mjeri ili predviđa istraživani biološki učinak. Relevantnost uključuje razmatranje o točnosti (podudarnosti) ispitne metode (9.).
Pouzdanost
: pokazuje u kojoj se mjeri ispitna metoda može obnovljivo primijeniti unutar jednog laboratorija i između više laboratorija tijekom vremena uz primjenu istog protokola. Ocjenjuje se izračunavanjem obnovljivosti unutar jednog laboratorija i između više laboratorija (9.).
Osjetljivost
: udio svih pozitivnih/aktivnih kemikalija koje su pravilno razvrstane primjenom ispitne metode. To je mjera točnosti ispitne metode koja daje kategorijske rezultate i važan je čimbenik za ocjenu relevantnosti ispitne metode (9.).
Nagrizanje kože in vivo
: uzrokovanje ireverzibilnog oštećenja kože, točnije, vidljive nekroze koja kroz epidermu dospijeva u dermu nakon što je ispitivana kemikalija primjenjivana u trajanju do najviše četiri sata. Za nagrizanje kože tipična je pojava čireva, krvarenja, krvavih krasta te, do kraja opažanja od 14 dana, gubitak boje kože zbog nestajanja pigmenta, cijele površine zahvaćene alopecijom (gubitak dlake) i ožiljci. Za ocjenjivanje sumnjivih lezija treba razmotriti mogućnost histopatoloških pretraga.
Specifičnost
: udio svih negativnih/neaktivnih kemikalija koje su pravilno razvrstane primjenom ispitne metode. To je mjera točnosti ispitne metode koja daje kategorijske rezultate i važan je čimbenik za ocjenu relevantnosti ispitne metode (9.).
Tvar
: kemijski element i njegovi spojevi u prirodnom stanju ili dobiveni proizvodnim postupkom, što uključuje i aditive koji su nužni za održavanje stabilnosti proizvoda te nečistoće koje proizlaze iz primijenjenoga postupka, ali isključuje otapala koja se mogu izdvojiti bez utjecaja na stabilnost tvari ili promjene njezina sastava.
Ispitivana kemikalija
: svaka tvar ili smjesa koja se ispituje ovom ispitnom metodom.
UVCB
: tvari nepoznatog ili promjenjivog sastava, složeni reakcijski proizvodi ili biološki materijali.
B.66.
IN VITRO TESTOVI TRANSAKTIVACIJE SA STABILNOM TRANSFEKCIJOM ZA OTKRIVANJE AGONISTA I ANTAGONISTA ESTROGENSKIH RECEPTORA
OPĆI UVOD
Smjernica OECD-a za ispitivanje koja se temelji na uspješnosti
|
1.
|
Ova ispitna metoda odgovara Smjernici OECD-a za ispitivanje 455 (TG) (2016.). Smjernica za ispitivanje 455 je smjernica za ispitivanje koja se temelji na uspješnosti (PBTG) i u njoj se opisuje metodologija in vitro testova transaktivacije sa stabilnom transfekcijom za otkrivanje agonista i antagonista estrogenskih receptora (ER TA testovi). Sastoji se od nekoliko mehanicistički i funkcionalno sličnih ispitnih metoda za identifikaciju agonista i antagonista estrogenskih receptora (tj. ERα i/ili ERβ) i trebala bi olakšati razvoj novih sličnih ili izmijenjenih ispitnih metoda u skladu s načelima za validaciju utvrđenima u Vodiču OECD-a o validaciji i međunarodnom prihvaćanju novih ili ažuriranih ispitnih metoda za procjenu opasnosti (1.). Potpuno validirane referentne ispitne metode (Dodatak 2. i Dodatak 3.) koje čine osnovu ove smjernice za ispitivanje koja se temelji na uspješnosti uključuju:
|
—
|
test TA sa stabilnom transfekcijom (STTA) (2.) uz primjenu stanične linije (h) ERα-HeLa-9903, i
|
|
—
|
test VM7Luc ER TA (3.) uz primjenu stanične linije VM7Luc4E2 (33), koja većinom izražava receptor hERα uz određeni doprinos receptora hERββ(4. i 5.).
|
Za razvoj i validaciju sličnih testova za iste konačne učinke opasnosti dostupni su zahtjevi izvedbe (6. i 7.) te bi ih trebalo upotrebljavati. Oni omogućuju pravovremenu izmjenu PBTG-a 455 kako bi se novi slični testovi mogli dodati u ažurirani PBTG; međutim, slični testovi dodat će se samo nakon što ih OECD pregleda i složi se da su ispunjeni zahtjevi izvedbe. Testovi uključeni u Smjernicu za ispitivanje 455 mogu se upotrebljavati bez razlike za ispunjavanje zahtjeva zemalja članica OECD-a u pogledu rezultata ispitivanja transaktivacije estrogenskih receptora, uz ostvarivanje koristi od OECD-ova uzajamnog prihvaćanja podataka.
|
Kontekst i načela testova uključenih u ovu ispitnu metodu
|
2.
|
OECD je 1998. pokrenuo aktivnost visokog prioriteta revizije postojećih i razvoja novih smjernica za ispitivanje za probir i ispitivanje potencijalnih endokrino disruptivnih kemikalija. OECD-ov konceptualni okvir (CF) za ispitivanje i procjenu potencijalnih endokrino disruptivnih kemikalija revidiran je 2012. Izvorni i revidirani konceptualni okviri uključeni su kao prilozi Vodiču OECD-a o standardiziranim ispitnim smjernicama za ocjenu kemikalija u pogledu endokrine disrupcije (8.). Konceptualni okvir sastoji se od pet razina, a svaka razina odgovara različitoj razini biološke složenosti. Testovi ER transaktivacije (TA) opisani u ovoj ispitnoj metodi testovi su 2. razine, koja uključuje „in vitro testove koji pružaju podatke o odabranim endokrinim mehanizmima/putovima”. Ova je ispitna metoda namijenjena in vitro testovima transaktivacije (TA) koji su osmišljeni za identifikaciju agonista i antagonista estrogenskih receptora (ER).
|
|
3.
|
Interakcija estrogena i estrogenskih receptora može utjecati na transkripciju gena koje kontrolira estrogen, a to može dovesti do indukcije ili inhibicije staničnih procesa, među ostalim i onih koji su potrebni za proliferaciju stanica, normalni razvoj fetusa i reproduktivnu funkciju (9., 10. i 11.). Poremećaj uobičajenih estrogenskih sustava mogao bi izazvati štetne učinke za normalni razvoj (ontogeneza), reproduktivno zdravlje i integritet reproduktivnog sustava.
|
|
4.
|
In vitro TA testovi temelje se na izravnoj ili neizravnoj interakciji tvari sa specifičnim receptorom koji regulira transkripciju proizvoda reporterskog gena. Ti se testovi u velikoj mjeri upotrebljavaju za procjenu genske ekspresije koju reguliraju specifični receptori u jezgri, kao što su estrogenski receptori (12., 13., 14., 15. i 16.). Predloženi su za otkrivanje estrogenske transaktivacije koju regulira estrogenski receptor (17., 18. i 19.). Postoje najmanje dvije glavne podvrste estrogenskih receptora u jezgri, α i β, a kodiraju ih posebni geni. Pojedini proteini imaju različite biološke funkcije te različitu distribuciju u tkivima i afinitete vezanja liganda (20., 21., 22., 23., 24., 25. i 26.). Jezgreni ERα posreduje u klasičnom estrogenskom odgovoru (27., 28., 29. i 30.) pa je stoga većina modela koji se trenutačno razvijaju za mjerenje aktivacije ili inhibicije estrogenskog receptora specifična za ERα. Testovi se upotrebljavaju za identifikaciju kemikalija koje aktiviraju (ili inhibiraju) estrogenski receptor nakon vezivanja liganda, nakon čega se kompleks receptora i liganda veže na specifične elemente DNK odgovora i transaktivira reporterski gen, što dovodi do povećane stanične ekspresije markerskog proteina. U tim se testovima mogu koristiti različiti reporterski odgovori. U sustavima koji se temelje na luciferazi, enzim luciferaza pretvara supstrat luciferina u bioluminiscentni proizvod koji se može kvantitativno izmjeriti s pomoću luminometra. Drugi primjeri uobičajenih reporterskih gena uključuju fluorescentni protein i gen LacZ, koji kodira β-galaktozidazu, enzim koji može pretvoriti bezbojni supstrat X-gal (5-bromo-4-kloro-indolil-galaktopiranozid) u plavi proizvod koji se može kvantificirati spektrofotometrom. Ti se reporterski geni mogu procijeniti brzo i jeftino primjenom komercijalno dostupnog pribora za ispitivanje.
|
|
5.
|
Validacijske studije STTA i VM7Luc TA testova pokazale su relevantnost i pouzdanost tih testova za predviđenu svrhu (3., 4., 5. i 30.). Zahtjevi izvedbe za ER TA testove koji se temelje na luminiscenciji u kojima se upotrebljavaju stanične linije mliječnih žlijezda uključene su u Evaluacijsko izvješće ICCVAM-a o ispitnoj metodi LUMI-CELL® ER (VM7Luc ER TA): in vitro test za identifikaciju agonističkog ili antagonističkog djelovanja kemikalije na ljudski estrogenski receptor (3.). Ti su zahtjevi izvedbe izmijenjeni kako bi se mogli primjenjivati i na STTA i VM7Luc TA testove (2.).
|
|
6.
|
Definicije i kratice upotrijebljene u ovoj ispitnoj metodi opisuju se u Dodatku 1.
|
Područje primjene TA testova i ograničenja povezana s njima
|
7.
|
Ovi se testovi predlažu u svrhu probira i utvrđivanja prioriteta, ali u njima se mogu dobiti i mehanicističke informacije koje se mogu upotrijebiti u pristupu snage dokaza. Bave se transaktivacijom koju inducira kemijsko vezivanje na estrogenske receptore u in vitro sustavu. Stoga rezultate ne bi trebalo izravno ekstrapolirati na signalizaciju kompleksa i regulaciju netaknutog endokrinog sustava in vivo.
|
|
8.
|
Transaktivacija koju posreduju estrogenski receptori smatra se jednim od ključnih mehanizama endokrine disrupcije (ED), iako postoje i drugi mehanizmi preko kojih može doći do endokrine disrupcije, uključujući: i. interakcije s ostalim receptorima i enzimskim sustavima u endokrinom sustavu; ii. sintezu hormona; iii. metaboličku aktivaciju i/ili inaktivaciju hormona; iv. distribuciju hormona u ciljna tkiva i v. uklanjanje hormona iz tijela. Ni jedan test u okviru ove ispitne metode ne bavi se tim načinima djelovanja.
|
|
9.
|
Ova se ispitna metoda bavi sposobnošću kemikalija da aktiviraju (tj. djeluju kao agonisti) i da potiskuju (tj. djeluju kao antagonisti) transkripciju koja ovisi o estrogenskim receptorima. Određene kemikalije mogu pokazati i agonističko i antagonističko djelovanje ovisno o vrsti stanica i poznate su kao selektivni modulatori estrogenskih receptora (SERM-ovi). Kemikalije koje su u ovim testovima negativne mogle bi se procijeniti u testovima vezivanja na estrogenski receptor prije nego što se zaključi da se kemikalija ne veže na receptor. Osim toga, u ovim će se testovima vjerojatno dobiti samo podaci o aktivnosti polazne molekule, imajući na umu ograničene metaboličke mogućnosti in vitro staničnih sustava. Budući da su se u validaciji upotrebljavale samo pojedinačne tvari, nije se razmatrala primjenjivost za ispitivanje smjesa. Unatoč tomu, ova je ispitna metoda u teoriji primjenjiva za ispitivanje tvari s više sastojaka, UVCB tvari i smjesa. Prije nego što se ova ispitna metoda primijeni na tvari s više sastojaka, UVCB tvari ili smjesi radi dobivanja podataka za predviđenu regulatornu svrhu, potrebno je razmotriti mogu li se te, ako se mogu, zašto se njome mogu dobiti primjereni rezultati za tu svrhu. Ta razmatranja nisu potrebna ako postoji regulatorni zahtjev za ispitivanje smjese.
|
|
10.
|
U informativne svrhe u tablici 1. navedeni su rezultati ispitivanja agonista za 34 tvari koje su ispitane u obje potpuno validirane ispitne metode opisane u ovoj ispitnoj metodi. Od tih tvari 26 ih je razvrstano kao definitivni agonisti estrogenskih receptora, a osam ih je bilo negativno na temelju objavljenih izvješća, uključujući in vitro testove za vezivanje estrogenskih receptora i transaktivaciju i/ili uterotrofni test (2., 3., 18., 31., 32., 33. i 34.). U tablici 2. navedeni su rezultati ispitivanja antagonista za 15 tvari koje su ispitane u obje potpuno validirane ispitne metode opisane u ovoj ispitnoj metodi. Od tih tvari četiri su razvrstane kao definitivni/pretpostavljeni antagonisti estrogenskih receptora, a deset ih je bilo negativno na temelju objavljenih izvješća, uključujući in vitro testove za vezivanje estrogenskih receptora i transaktivaciju (2., 3., 18. i 31.). S obzirom na podatke sažete u tablicama 1. i 2., postojalo je 100-postotno slaganje obiju referentnih ispitnih metoda o razvrstavanju svih tvari osim jedne tvari (mifepristona) u testu antagonista i svaka je tvar točno razvrstana kao agonist/antagonist estrogenskih receptora ili kao negativna tvar. Dodatne informacije o ovoj skupini kemikalija i o dodatnim kemikalijama koje su ispitane u STTA i VM7Luc ER TA testovima tijekom validacijskih studija navedene su u zahtjevima izvedbe za testove ER TA (6. i 7.), Dodatak 2. (tablice 1., 2. i 3.).
|
Tablica 1.
Pregled rezultata iz STTA i VM7Luc ER TA testova za tvari ispitane u oba testa agonista i razvrstane kao agonisti estrogenskog receptora (POZ) ili negativne tvari (NEG)
|
|
Tvar
|
CAS br.
|
STTA test (35)
|
VM7Luc ER TA test (36)
|
Izvor podataka za razvrstavanje (38)
|
|
ER TA aktivnost
|
Vrijednost PC10 (M)
|
Vrijednost PC50
(2) (M)
|
ER TA aktivnost
|
Vrijednost EC50
(2), (37) (M)
|
Ostali ER TA-ovi (34)
|
Vezivanje ER-a
|
Uterotrofni
|
|
1
|
17ß-estradiol (1)
|
50-28-2
|
POZ
|
< 1,00 × 10-11
|
< 1,00 × 10-11
|
POZ
|
5,63 × 10-12
|
POZ (227/227)
|
POZ
|
POZ
|
|
2
|
17α-estradiol (1)
|
57-91-0
|
POZ
|
7,24 × 10-11
|
6,44 × 10-10
|
POZ
|
1,40 × 10-9
|
POZ (11/11)
|
POZ
|
POZ
|
|
3
|
17α-etinilestradiol (1)
|
57-63-6
|
POZ
|
< 1,00 × 10-11
|
< 1,00 × 10-11
|
POZ
|
7,31 × 10-12
|
POZ (22/22)
|
POZ
|
POZ
|
|
4
|
17β-trenbolon
|
10161-33-8
|
POZ
|
1,78 × 10-8
|
2,73 × 10-7
|
POZ
|
4,20 × 10-8
|
POZ (2/2)
|
NI
|
NI
|
|
5
|
19-nortestosteron (1)
|
434-22-0
|
POZ
|
9,64 × 10-9
|
2,71 × 10-7
|
POZ
|
1,80 × 10-6
|
POZ (4/4)
|
POZ
|
POZ
|
|
6
|
4-kumilfenol (1)
|
599-64-4
|
POZ
|
1,49 × 10-7
|
1,60 × 10-6
|
POZ
|
3,20 × 10-7
|
POZ (5/5)
|
POZ
|
NI
|
|
7
|
4-tert-oktilfenol (1)
|
140-66-9
|
POZ
|
1,85 × 10-9
|
7,37 × 10-8
|
POZ
|
3,19 × 10-8
|
POZ (21/24)
|
POZ
|
POZ
|
|
8
|
Apigenin (1)
|
520-36-5
|
POZ
|
1,31 × 10-7
|
5,71 × 10-7
|
POZ
|
1,60 × 10-6
|
POZ (26/26)
|
POZ
|
NI
|
|
9
|
Atrazin (1)
|
1912-24-9
|
NEG
|
—
|
—
|
NEG
|
—
|
NEG (30/30)
|
NEG
|
NI
|
|
10
|
Bisfenol A (1)
|
80-05-7
|
POZ
|
2,02 × 10-8
|
2,94 × 10-7
|
POZ
|
5,33 × 10-7
|
POZ (65/65)
|
POZ
|
POZ
|
|
11
|
Bisfenol B (1)
|
77-40-7
|
POZ
|
2,36 × 10-8
|
2,11 × 10-7
|
POZ
|
1,95 × 10-7
|
POZ (6/6)
|
POZ
|
POZ
|
|
12
|
Benzil-butil-ftalat (1)
|
85-68-7
|
POZ
|
1,14 × 10-6
|
4,11 × 10-6
|
POZ
|
1,98 × 10-6
|
POZ (12/14)
|
POZ
|
NEG
|
|
13
|
Kortikosteron (1)
|
50-22-6
|
NEG
|
—
|
—
|
NEG
|
—
|
NEG (6/6)
|
NEG
|
NI
|
|
14
|
Kumestrol (1)
|
479-13-0
|
POZ
|
1,23 × 10-9
|
2,00 × 10-8
|
POZ
|
1,32 × 10-7
|
POZ (30/30)
|
POZ
|
NI
|
|
15
|
Daidzein (1)
|
486-66-8
|
POZ
|
1,76 × 10-8
|
1,51 × 10-7
|
POZ
|
7,95 × 10-7
|
POZ (39/39)
|
POZ
|
POZ
|
|
16
|
Dietilstilbestrol (1)
|
56-53-1
|
POZ
|
< 1,00 × 10-11
|
2,04 × 10-11
|
POZ
|
3,34 × 10-11
|
POZ (42/42)
|
POZ
|
NI
|
|
17
|
Di-n-butil-ftalat
|
84-74-2
|
POZ
|
4,09 × 10-6
|
|
POZ
|
4,09 × 10-6
|
POZ (6/11)
|
POZ
|
NEG
|
|
18
|
Etil paraben
|
120-47-8
|
POZ
|
5,00 × 10-6
|
(bez PC50)
|
POZ
|
2,48 × 10-5
|
POZ
|
|
NI
|
|
19
|
Estron (1)
|
53-16-7
|
POZ
|
3,02 × 10-11
|
5,88 × 10-10
|
POZ
|
2,34 × 10-10
|
POZ (26/28)
|
POZ
|
POZ
|
|
20
|
Genistein (1)
|
446-72-0
|
POZ
|
2,24 × 10-9
|
2,45 × 10-8
|
POZ
|
2,71 × 10-7
|
POZ (100/102)
|
POZ
|
POZ
|
|
21
|
Haloperidol
|
52-86-8
|
NEG
|
—
|
—
|
NEG
|
—
|
NEG (2/2)
|
NEG
|
NI
|
|
22
|
Kemferol (1)
|
520-18-3
|
POZ
|
1,36 × 10-7
|
1,21 × 10-6
|
POZ
|
3,99 × 10-6
|
POZ (23/23)
|
POZ
|
NI
|
|
23
|
Kepon (1)
|
143-50-0
|
POZ
|
7,11 × 10-7
|
7,68 × 10-6
|
POZ
|
4,91 × 10-7
|
POZ (14/18)
|
POZ
|
NI
|
|
24
|
Ketokonazol
|
65277-42-1
|
NEG
|
—
|
—
|
NEG
|
—
|
NEG (2/2)
|
NEG
|
NI
|
|
25
|
Linuron (1)
|
330-55-2
|
NEG
|
—
|
—
|
NEG
|
—
|
NEG (8/8)
|
NEG
|
NI
|
|
26
|
Mezo-heksestrol (1)
|
84-16-2
|
POZ
|
< 1,00 × 10-11
|
2,75 × 10-11
|
POZ
|
1,65 × 10-11
|
POZ (4/4)
|
POZ
|
NI
|
|
27
|
Metil testosteron (1)
|
58-18-4
|
POZ
|
1,73 × 10-7
|
4,11 × 10-6
|
POZ
|
2,68 × 10-6
|
POZ (5/6)
|
POZ
|
NI
|
|
28
|
Morin
|
480-16-0
|
POZ
|
5,43 × 10-7
|
4,16 × 10-6
|
POZ
|
2,37 × 10-6
|
POZ (2/2)
|
POZ
|
NI
|
|
29
|
Noretinodrel (1)
|
68-23-5
|
POZ
|
1,11 × 10-11
|
1,50 × 10-9
|
POZ
|
9,39 × 10-10
|
POZ (5/5)
|
POZ
|
NI
|
|
30
|
p,p’-metoksiklor (1)
|
72-43-5
|
POZ
|
1,23 × 10-6
|
(bez PC50) (2)
|
POZ
|
1,92 × 10-6
|
POZ (24/27)
|
POZ
|
POZ
|
|
31
|
Fenobarbital (1)
|
57-30-7
|
NEG
|
—
|
—
|
NEG
|
—
|
NEG (2/2)
|
NEG
|
NI
|
|
32
|
Reserpin
|
50-55-5
|
NEG
|
—
|
—
|
NEG
|
—
|
NEG (4/4)
|
NEG
|
NI
|
|
33
|
Spironolakton (1)
|
52-01-7
|
NEG
|
—
|
—
|
NEG
|
—
|
NEG (4/4)
|
NEG
|
NI
|
|
34
|
Testosteron
|
58-22-0
|
POZ
|
2,82 × 10-8
|
9,78 × 10-6
|
POZ
|
1,75 × 10-5
|
POZ (5/10)
|
POZ
|
NI
|
|
Kratice: CAS br. = registarski broj Službe za podatke o kemijskim tvarima; M = molarno; EC50 = pola najveće učinkovite koncentracije ispitivane tvari; NEG = negativno; POZ = pozitivno; NI = nije ispitano; PC10 (i PC50) = koncentracija ispitivane tvari pri kojoj odgovor iznosi 10 % (ili 50 % za PC50) odgovora koji inducira pozitivna kontrola (E2, 1nM) na svakoj ploči.
|
Tablica 2.
Usporedba rezultata iz STTA i VM7Luc ER TA testova za tvari ispitane u oba testa antagonista i razvrstane kao antagonisti estrogenskog receptora (POZ) ili negativne tvari (NEG)
|
|
Tvar (3)
|
CAS br.
|
ER STTA test (39)
|
VM7Luc ER TA test (40) Mogući učinci testa
|
ER STTA (42)
|
ICCVAM-ovo (43) sporazumno razvrstavanje Kemijski razred
|
prema MeSH-u (44)
|
Razred proizvoda (45)
|
|
ER TA aktivnost
|
Vrijednost IC50
(4) (M)
|
ER TA aktivnost
|
Vrijednost IC50
(4), (41) (M)
|
|
1
|
4-hidroksitamoksifen
|
68047-06-3
|
POZ
|
3,97 × 10-9
|
POZ
|
2,08 × 10-7
|
umjereno POZ
|
POZ
|
Ugljikovodik (ciklički)
|
Farmaceutski proizvod
|
|
2
|
Dibenzo[a,h]antracen
|
53-70-3
|
POZ
|
Bez IC50
|
POZ
|
Bez IC50
|
POZ
|
PP
|
Policiklički spoj
|
Laboratorijska kemikalija, prirodni proizvod
|
|
3
|
Mifepriston
|
84371-65-3
|
POZ
|
5,61 × 10-6
|
NEG
|
—
|
Blago POZ
|
NEG
|
Steroid
|
Farmaceutski proizvod
|
|
4
|
Raloksifen HCl
|
82640-04-8
|
POZ
|
7,86 × 10-10
|
POZ
|
1,19 × 10-9
|
umjereno POZ
|
POZ
|
Ugljikovodik (ciklički)
|
Farmaceutski proizvod
|
|
5
|
Tamoksifen
|
10540-29-1
|
POZ
|
4,91 × 10-7
|
POZ
|
8,17 × 10-7
|
POZ
|
POZ
|
Ugljikovodik (ciklički)
|
Farmaceutski proizvod
|
|
6
|
17β-estradiol
|
50-28-2
|
NEG
|
—
|
NEG
|
—
|
PN
|
PN
|
Steroid
|
Farmaceutski proizvod, veterinarski proizvod
|
|
7
|
Apigenin
|
520-36-5
|
NEG
|
—
|
NEG
|
—
|
NEG
|
NEG
|
Heterociklički spoj
|
Boja, prirodni proizvod, farmaceutski međuproizvod
|
|
8
|
Atrazin
|
1912-24-9
|
NEG
|
—
|
NEG
|
—
|
NEG
|
PN
|
Heterociklički spoj
|
Herbicid
|
|
9
|
Di-n-butil-ftalat
|
84-74-2
|
NEG
|
—
|
NEG
|
—
|
NEG
|
NEG
|
Ester, ftalna kiselina
|
Kozmetički sastojak, industrijska kemikalija, plastifikator
|
|
10
|
Fenarimol
|
60168-88-9
|
NEG
|
—
|
NEG
|
—
|
nije ispitano
|
PN
|
Heterociklički spoj, pirimidin
|
Fungicid
|
|
11
|
Flavon
|
525-82-6
|
NEG
|
—
|
NEG
|
—
|
PN
|
PN
|
Flavonoid, heterociklički spoj
|
Prirodni proizvod, farmaceutski proizvod
|
|
12
|
Flutamid
|
13311-84-7
|
NEG
|
—
|
NEG
|
—
|
NEG
|
PN
|
Amid
|
Farmaceutski proizvod, veterinarski proizvod
|
|
13
|
Genistein
|
446-72-0
|
NEG
|
—
|
NEG
|
—
|
PN
|
NEG
|
Flavonoid, heterociklički spoj
|
Prirodni proizvod, farmaceutski proizvod
|
|
14
|
p-n-nonilfenol
|
104-40-5
|
NEG
|
—
|
NEG
|
—
|
nije ispitano
|
NEG
|
Fenol
|
Kemijski međuproizvod
|
|
15
|
Resveratrol
|
501-36-0
|
NEG
|
—
|
NEG
|
—
|
PN
|
NEG
|
Ugljikovodik (ciklički)
|
Prirodni proizvod
|
|
Kratice: CAS br. = registarski broj Službe za podatke o kemijskim tvarima; M = molarno; IC50 = pola najveće inhibitorne koncentracije ispitivane tvari; NEG = negativno; PN = pretpostavlja se da je negativno; POZ = pozitivno; PP = pretpostavlja se da je pozitivno.
|
SASTAVNICE ER TA TESTA
Ključne sastavnice testa
|
11.
|
Ova ispitna metoda primjenjuje se na testove u kojima se upotrebljava model stabilno transficiranog ili endogenog receptora ERα i stabilno transficiranog reporterskog gena koje kontrolira jedan element odgovora estrogena ili više njih; međutim, mogu biti prisutni i drugi receptori kao što je ERβ. To su ključne sastavnice testa.
|
Kontrole
|
12.
|
Treba opisati osnovu za predložene istodobne referentne norme za svaki test agonista i antagonista. Istodobne kontrole (negativna, otapalo i pozitivna), prema potrebi, znak su da test djeluje u ispitnim uvjetima i osnova su za usporedbe među pokusima; obično su dio kriterija prihvatljivosti za određeni pokus (1.).
|
Standardni postupci kontrole kvalitete
|
13.
|
Standardne postupke kontrole kvalitete treba provoditi kako je opisano za svaki test kako bi se osiguralo da stanična linija ostane stabilna tijekom višestrukih pasaža, da ne sadržava mikoplazme (tj. nije kontaminirana bakterijama) i da zadrži sposobnost da tijekom vremena daje očekivane odgovore posredovane estrogenskim receptorima. Stanične linije nadalje bi trebalo provjeriti u pogledu točnog identiteta i ostalih kontaminanata (npr. gljivice, kvasac i virusi).
|
Dokazivanje osposobljenosti laboratorija
|
14.
|
Prije ispitivanja nepoznatih kemikalija primjenom bilo kojeg od testova u okviru ove ispitne metode, svaki laboratorij treba dokazati osposobljenost za primjenu testa. Kako bi dokazao osposobljenost, svaki bi laboratorij trebao ispitati 14 tvari za dokazivanje tehničke osposobljenosti navedenih u tablici 3. za test agonista i 10 tvari za dokazivanje tehničke osposobljenosti iz tablice 4. za test antagonista. To ispitivanje osposobljenosti potvrdit će i osjetljivost ispitnog sustava. Popis tvari za dokazivanje tehničke osposobljenosti podskup je referentnih tvari koje su navedene u zahtjevima izvedbe za ER TA testove (6.). Te su tvari komercijalno dostupne, čine razrede kemikalija koji se obično povezuju s aktivnošću agonista ili antagonista estrogenskih receptora, pokazuju primjeren raspon jakosti koji se očekuje za agoniste/antagoniste estrogenskih receptora (tj. slabi do jaki) i uključuju negativne tvari. Ispitivanje tvari za dokazivanje tehničke osposobljenosti treba se ponoviti barem dvaput na različite dane. Osposobljenost se dokazuje točnim razvrstavanjem (pozitivno/negativno) svake tvari za dokazivanje osposobljenosti. Pri učenju testova svaki tehničar treba dvaput ponoviti ispitivanje osposobljenosti. Ovisno o vrsti stanica neke se od tvari za dokazivanje tehničke osposobljenosti mogu ponašati kao SERM-ovi i pokazivati aktivnosti i kao agonisti i antagonisti. Međutim, tvari za dokazivanje tehničke osposobljenosti u tablicama 3. i 4. razvrstane su prema poznatoj dominantnoj aktivnosti koja bi se trebala koristiti za procjenu osposobljenosti.
|
|
15.
|
Kako bi se dokazala uspješnost i u svrhe kontrole kvalitete svaki bi laboratorij trebao izraditi bazu podataka prijašnjih agonista i antagonista s podacima o referentnoj normi (npr. 17β-estradiol i tamoksifen), pozitivnim i negativnim kontrolnim kemikalijama i kontroli s otapalom (npr. DMSO). Za početak, bazu podataka treba izraditi iz najmanje deset neovisnih ciklusa ispitivanja agonista (npr. 17β-estradiola) i deset neovisnih ciklusa ispitivanja antagonista (npr. tamoksifena). Rezultate iz budućih analiza tih referentnih normi i kontrola s otapalom treba dodati kako bi se povećala baza podataka i osigurala dosljednost i uspješnost laboratorija u provedbi biotestova tijekom vremena.
|
Tablica 3.
Popis (14) tvari za dokazivanje tehničke osposobljenosti za test agonista
(53)
|
Br. (52)
|
Tvar
|
CAS br.
|
Predviđeni odgovor (46)
|
STTA test
|
VM7Luc ER TA test
|
Kemijski razred prema MeSH-u (50)
|
Razred proizvoda (51)
|
|
Vrijednost PC10 (M) (47)
|
Vrijednost PC50 (M) (47)
|
Raspon ispitnih konc. (M)
|
Vrijednost EC50 u VM7Luc (M) (48)
|
Najviša konc. za studiju o utvrđivanju raspona (M) (49)
|
|
14
|
Dietilstilbestrol
|
56-53-1
|
POZ
|
< 1,00 × 10-11
|
2,04 × 10-11
|
10-14 – 10-8
|
3,34 × 10-11
|
3,73 × 10-4
|
Ugljikovodik (ciklički)
|
Farmaceutski proizvod, veterinarski proizvod
|
|
12
|
17α-estradiol
|
57-91-0
|
POZ
|
4,27 × 10-11
|
6,44 × 10-10
|
10-11 – 10-5
|
1,40 × 10-9
|
3,67 × 10-3
|
Steroid
|
Farmaceutski proizvod, veterinarski proizvod
|
|
15
|
Mezo-heksestrol
|
84-16-2
|
POZ
|
< 1,00 × 10-11
|
2,75 × 10-11
|
10-11 – 10-5
|
1,65 × 10-11
|
3,70 × 10-3
|
Ugljikovodik (ciklički), fenol
|
Farmaceutski proizvod, veterinarski proizvod
|
|
11
|
4-tert-oktilfenol
|
140-66-9
|
POZ
|
1,85 × 10-9
|
7,37 × 10-8
|
10-11 – 10-5
|
3,19 × 10-8
|
4,85 × 10-3
|
Fenol
|
Kemijski međuproizvod
|
|
9
|
Genistein
|
446-72-0
|
POZ
|
2,24 × 10-9
|
2,45 × 10-8
|
10-11 – 10-5
|
2,71 × 10-7
|
3,70 × 10-4
|
Flavonoid, heterociklički spoj
|
Prirodni proizvod, farmaceutski proizvod
|
|
6
|
Bisfenol A
|
80-05-7
|
POZ
|
2,02 × 10-8
|
2,94 × 10-7
|
10-11 – 10-5
|
5,33 × 10-7
|
4,38 × 10-3
|
Fenol
|
Kemijski međuproizvod
|
|
2
|
Kemferol
|
520-18-3
|
POZ
|
1,36 × 10-7
|
1,21 × 10-6
|
10-11 – 10-5
|
3,99 × 10-6
|
3,49 × 10-3
|
Flavonoid, heterociklički spoj
|
Prirodni proizvod
|
|
3
|
Benzil-butil-ftalat
|
85-68-7
|
POZ
|
1,14 × 10-6
|
4,11 × 10-6
|
10-11 – 10-5
|
1,98 × 10-6
|
3,20 × 10-4
|
Karboksilna kiselina, ester, ftalna kiselina
|
Plastifikator, industrijska kemikalija
|
|
4
|
p,p’-metoksiklor
|
72-43-5
|
POZ
|
1,23 × 10-6
|
—
|
10-11 – 10-5
|
1,92 × 10-6
|
2,89 × 10-3
|
Ugljikovodik (halogenirani)
|
Pesticid, veterinarski proizvod
|
|
1
|
Etil paraben
|
120-47-8
|
POZ
|
5,00 × 10-6
|
—
|
10-11 – 10-5
|
2,48 × 10-5
|
6,02 × 10-3
|
Karboksilna kiselina, fenol
|
Farmaceutski proizvod, konzervans
|
|
17
|
Atrazin
|
1912-24-9
|
NEG
|
—
|
—
|
10-10 – 10-4
|
—
|
4,64 × 10-4
|
Heterociklički spoj
|
Herbicid
|
|
20
|
Spironolakton
|
52-01-7
|
NEG
|
—
|
—
|
10-11 – 10-5
|
—
|
2,40 × 10-3
|
Lakton, steroid
|
Farmaceutski proizvod
|
|
21
|
Ketokonazol
|
65277-42-1
|
NEG
|
—
|
—
|
10-11 – 10-5
|
—
|
9,41 × 10-5
|
Heterociklički spoj
|
Farmaceutski proizvod
|
|
22
|
Reserpin
|
50-55-5
|
NEG
|
—
|
—
|
10-11 – 10-5
|
—
|
1,64 × 10-3
|
Heterociklički spoj, indol
|
Farmaceutski proizvod, veterinarski proizvod
|
|
Kratice: CAS br. = registarski broj Službe za podatke o kemijskim tvarima; EC50 = pola najveće učinkovite koncentracije ispitivane tvari; NEG = negativno; POZ = pozitivno; PC10 (i PC50) = koncentracija ispitivane tvari pri kojoj odgovor iznosi 10 % (ili 50 % za PC50) odgovora koji inducira pozitivna kontrola (E2, 1nM) na svakoj ploči.
|
Tablica 4.
Popis (10) tvari za dokazivanje tehničke osposobljenosti za test antagonista
|
|
Tvar (5)
|
CAS br.
|
ER STTA test (54)
|
VM7Luc ER TA test (55)
|
Mogući učinci testa ER STTA (54)
|
ICCVAM-ovo (58) sporazumno razvrstavanje
|
Kemijski razred prema MeSH-u (59)
|
Razred proizvoda (60)
|
|
ER TA aktivnost
|
IC50 (M)
|
Raspon ispitnih konc. (M)
|
ER TA aktivnost
|
IC50
(56) (M)
|
Najviša konc. za studiju o utvrđivanju raspona (M) (57)
|
|
1
|
4-hidroksitamoksifen
|
68047-06-3
|
POZ
|
3,97 × 10-9
|
10-12 – 10-7
|
POZ
|
2,08 × 10-7
|
2,58 × 10-4
|
umjereno POZ
|
POZ
|
Ugljikovodik (ciklički)
|
Farmaceutski proizvod
|
|
2
|
Raloksifen HCl
|
82640-04-8
|
POZ
|
7,86 × 10-10
|
10-12 – 10-7
|
POZ
|
1,19 × 10-9
|
1,96 × 10-4
|
umjereno POZ
|
POZ
|
Ugljikovodik (ciklički)
|
Farmaceutski proizvod
|
|
3
|
Tamoksifen
|
10540-29-1
|
POZ
|
4,91 × 10-7
|
10-10 – 10-5
|
POZ
|
8,17 × 10-7
|
2,69 × 10-4
|
POZ
|
POZ
|
Ugljikovodik (ciklički)
|
Farmaceutski proizvod
|
|
4
|
17β-estradiol
|
50-28-2
|
NEG
|
—
|
10-9 – 10-4
|
NEG
|
—
|
3,67 × 10-3
|
vjerojatno negativno (*4)
|
PN
|
Steroid
|
Farmaceutski proizvod, veterinarski proizvod
|
|
5
|
Apigenin
|
520-36-5
|
NEG
|
—
|
10-9 – 10-4
|
NEG
|
—
|
3,70 × 10-4
|
NEG
|
NEG
|
Heterociklički spoj
|
Boja, prirodni proizvod, farmaceutski međuproizvod
|
|
6
|
Di-n-butil-ftalat
|
84-74-2
|
NEG
|
—
|
10-8 – 10-3
|
NEG
|
—
|
3,59 × 10-3
|
NEG
|
NEG
|
Ester, ftalna kiselina
|
Kozmetički sastojak, industrijska kemikalija, plastifikator
|
|
7
|
Flavon
|
525-82-6
|
NEG
|
—
|
10-8 – 10-3
|
NEG
|
—
|
4,50 × 10-4
|
vjerojatno negativno (*4)
|
PN
|
Flavonoid, heterociklički spoj
|
Prirodni proizvod, farmaceutski proizvod
|
|
8
|
Genistein
|
446-72-0
|
NEG
|
—
|
10-9 – 10-4
|
NEG
|
—
|
3,70 × 10-4
|
vjerojatno negativno (*4)
|
NEG
|
Flavonoid, heterociklički spoj
|
Prirodni proizvod, farmaceutski proizvod
|
|
9
|
p-n-nonilfenol
|
104-40-5
|
NEG
|
—
|
10-9 – 10-4
|
NEG
|
—
|
4,54 × 10-4
|
nije ispitano
|
NEG
|
Fenol
|
Kemijski međuproizvod
|
|
10
|
Resveratrol
|
501-36-0
|
NEG
|
—
|
10-8 – 10-3
|
NEG
|
—
|
4,38 × 10-4
|
vjerojatno negativno (*4)
|
NEG
|
Ugljikovodik (ciklički)
|
Prirodni proizvod
|
|
Kratice: CAS br. = registarski broj Službe za podatke o kemijskim tvarima; M = molarno; IC50 = pola najveće inhibitorne koncentracije ispitivane tvari; NEG = negativno; PN = pretpostavlja se da je negativno; POZ = pozitivno.
|
Kriteriji prihvatljivosti ciklusa ispitivanja
|
16.
|
Prihvaćanje ili odbijanje ciklusa ispitivanja temelji se na procjeni rezultata dobivenih za referentne norme i kontrole koje se koriste za svaki pokus. Vrijednosti za PC50 (EC50) ili IC50 za referentne norme trebaju ispunjavati kriterije prihvatljivosti kako su predviđeni za odabrani test (za STTA vidjeti Dodatak 2., za VM7Luc ER TA vidjeti Dodatak 3.) i sve pozitivne/negativne kontrole trebale bi se točno razvrstati za svaki prihvaćeni pokus. Sposobnost dosljedne provedbe testa treba dokazati razvojem i održavanjem baze s prijašnjim podacima za referentne norme i kontrole (vidjeti stavak 15.). Kao mjera obnovljivosti unutar jednog laboratorija mogu se koristiti standardne devijacije (SD) ili koeficijenti varijacije (CV) za srednje vrijednosti parametara prilagođavanja krivulje referentnih normi. Osim toga, treba ispuniti sljedeća načela u pogledu kriterija prihvatljivosti:
|
—
|
potrebno je dovoljno podataka za kvantitativnu procjenu aktivacije (za test agonista) ili potiskivanja (za test antagonista) estrogenskog receptora (tj. učinkovitost i jakost),
|
|
—
|
srednja reporterska aktivnost za referentnu koncentraciju referentnog estrogena treba biti barem minimum utvrđen u testovima u odnosu na aktivnost kontrole s nosačem (otapalom) kako bi se osigurala primjerena osjetljivost. Za STTA i VM7Luc ER TA testove to je četiri puta više od srednje kontrole s nosačem na svakoj ploči,
|
|
—
|
ispitane koncentracije trebale bi biti unutar područja topljivosti ispitivanih kemikalija i ne bi smjele pokazivati citotoksičnost.
|
|
Analiza podataka
|
17.
|
Za razvrstavanje pozitivnih i negativnih odgovora treba upotrebljavati utvrđeni postupak za tumačenje podataka za svaki test.
|
|
18.
|
Ispunjavanje kriterija prihvatljivosti (stavak 16.) znači da test pravilno funkcionira, ali time se ne osigurava da će svaki pojedinačni ciklus ispitivanja dati točne rezultate. Ponavljanje rezultata prvog ciklusa najbolji je znak toga da su dobiveni točni podaci. Ako se u dva ciklusa dobiju ponovljivi rezultati (npr. rezultati u oba ciklusa ispitivanja pokazuju da je ispitivana kemikalija pozitivna), ne treba provoditi treći ciklus.
|
|
19.
|
Ako se u dva ciklusa ne dobiju ponovljivi rezultati (npr. ispitivana kemikalija pozitivna je u jednom ciklusu, a negativna u drugom) ili ako je potreban veći stupanj sigurnosti u pogledu ishoda testa, treba provesti najmanje tri neovisna ciklusa. U tom se slučaju razvrstavanje temelji na dva sukladna rezultata od tri.
|
Opći kriteriji za tumačenje podataka
|
20.
|
Trenutačno ne postoji općeprihvaćena metoda za tumačenje ER TA podataka. Međutim, i kvalitativne (npr. pozitivno/negativno) i/ili kvantitativne (npr. EC50, PC50, IC50) procjene aktivnosti posredovane estrogenskim receptorima trebaju se temeljiti na empirijskim podacima i valjanoj znanstvenoj prosudbi. Ako je moguće, pozitivne rezultate treba karakterizirati razmjer učinka u usporedbi s kontrolom nosača (otapala) ili referentnim estrogenom te koncentracija pri kojoj se javlja učinak (npr. EC50, PC50, RPCMax, IC50 itd.).
|
Izvješće o ispitivanju
|
21.
|
Izvješće o ispitivanju trebalo bi sadržavati sljedeće informacije:
|
|
Test:
|
—
|
kontrolna/referentna norma/ispitivana kemikalija,
|
|
—
|
izvor, broj serije, rok uporabe, ako su dostupni,
|
|
—
|
stabilnost ispitivane kemikalije, ako je poznata,
|
|
—
|
topljivost i stabilnost ispitivane kemikalije u otapalu, ako su poznate,
|
|
—
|
izmjerene vrijednosti za pH, osmolalnost i taloženje u mediju za uzgoj kulture u koju je dodana ispitivana kemikalija, prema potrebi.
|
|
|
|
Tvar s jednim sastojkom:
|
—
|
fizički izgled, topljivost u vodi i druga relevantna fizikalno-kemijska svojstva,
|
|
—
|
kemijske identifikacijske oznake, kao što su IUPAC ili CAS naziv, CAS broj, SMILES ili InChI oznaka, strukturna formula, čistoća, kemijski identitet nečistoća prema potrebi i ako je izvedivo u praksi itd.
|
|
|
|
Tvari s više sastojaka, UVCB tvari i smjese:
|
—
|
opis (koliko je to moguće) kemijskog identiteta (vidjeti gore), kvantitativnog udjela i relevantnih fizikalno-kemijskih svojstava sastojaka.
|
|
|
|
Otapalo/nosač:
|
—
|
karakterizacija (priroda, dobavljač i serija),
|
|
—
|
obrazloženje za odabir otapala/nosača,
|
|
—
|
topljivost i stabilnost ispitivane kemikalije u otapalu/nosaču, ako su poznate.
|
|
|
|
Stanice:
|
—
|
vrsta i izvor stanica:
|
—
|
je li estrogenski receptor izražen endogeno? Ako nije, koji su receptori transficirani,
|
|
—
|
korišteni konstrukti reporterskih gena (uključujući izvornu vrstu),
|
|
—
|
metoda odabira za održavanje stabilne transfekcije (ako je primjenjivo),
|
|
—
|
je li metoda transfekcije relevantna za stabilne linije,
|
|
|
—
|
Broj pasaža stanica (od odmrzavanja),
|
|
—
|
Broj pasaža stanica pri odmrzavanju,
|
|
—
|
metode održavanja staničnih kultura.
|
|
|
|
Ispitni uvjeti:
|
—
|
ograničenja topljivosti,
|
|
—
|
opis metoda primijenjenih za procjenu vijabilnosti,
|
|
—
|
sastav medija, koncentracija CO2,
|
|
—
|
koncentracije ispitivane kemikalije,
|
|
—
|
volumen dodanog nosača i ispitivane kemikalije,
|
|
—
|
temperatura i vlažnost inkubacije,
|
|
—
|
gustoća stanica na početku i za vrijeme tretiranja,
|
|
—
|
pozitivne i negativne referentne norme,
|
|
—
|
reporterski reagensi (naziv proizvoda, dobavljač i serija),
|
|
—
|
kriteriji na temelju kojih se ciklusi ispitivanja smatraju pozitivnim, negativnim ili dvosmislenim.
|
|
|
|
Provjera prihvatljivosti:
|
—
|
multiplikacijski faktori indukcije za svaku ploču testa i ispunjavaju li najmanju vrijednost za test na temelju prijašnjih kontrola,
|
|
—
|
stvarne vrijednosti za kriterije prihvatljivosti, npr. log10EC50, log10PC50, logIC50 i vrijednosti Hillova nagiba za istodobne pozitivne kontrole/referentne norme.
|
|
|
|
Rezultati:
|
—
|
neobrađeni i normirani podaci,
|
|
—
|
najveća razina multiplikacijskog faktora indukcije,
|
|
—
|
podaci o citotoksičnosti,
|
|
—
|
ako postoji, najniža učinkovita koncentracija (LEC),
|
|
—
|
vrijednosti RPCMax, PCMax, PC50, IC50 i/ili EC50, prema potrebi,
|
|
—
|
odnos koncentracije i odgovora, ako je moguće,
|
|
—
|
statističke analize, ako postoje, te mjera pogreške i pouzdanosti (npr. SEM, SD, CV ili interval 95-postotne pouzdanosti) te opis načina na koji se došlo do tih vrijednosti.
|
|
|
LITERATURA
|
1.
|
OECD (2005). Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment. Environment, Health and Safety Publications, Series on Testing and Assessment (No 34), Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
2.
|
OECD (2015). Report of the Inter-Laboratory Validation for Stably Transfected Transactivation Assay to detect Estrogenic and Anti-estrogenic Activity. Environment, Health and Safety Publications, Series on Testing and Assessment (No 225), Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
3.
|
ICCVAM (2011). ICCVAM Test Method Evaluation Report on the LUMI-CELL® ER (BG1Luc ER TA) Test Method, an In Vitro Method for Identifying ER Agonists and Antagonists, National Institute of Environmental Health Sciences: Research Triangle Park, NC.
|
|
4.
|
Pujol P. et al. (1998). Differential Expression of Estrogen Receptor-Alpha and -Beta Messenger RNAs as a Potential Marker of Ovarian Carcinogenesis, Cancer. Res., 58(23): str. 5367.–73.
|
|
5.
|
Rogers J.M. and Denison M.S. (2000). Recombinant Cell Bioassays for Endocrine Disruptors: Development of a Stably Transfected Human Ovarian Cell Line for the Detection of Estrogenic and Anti-Estrogenic Chemicals, In Vitro and Molecular Toxicology: Journal of Basic and Applied Research, 13(1): str. 67.–82.
|
|
6.
|
OECD (2012). Performance Standards For Stably Transfected Transactivation In Vitro Assay to Detect Estrogen Receptor Agonists (for TG 455). Environment, Health and Safety Publications, Series on Testing and Assessment (No 173), Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
7.
|
OECD (2015). Performance Standards For Stably Transfected Transactivation In Vitro Assay to Detect Estrogen Receptor Antagonists. Environment, Health and Safety Publications, Series on Testing and Assessment (No 174), Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
8.
|
OECD (2012). Guidance Document on Standardized Test Guidelines for Evaluating Chemicals for Endocrine Disruption. Environment, Health and Safety Publications, Series on Testing and Assessment (No 150), Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
9.
|
Cavailles V. (2002). Estrogens and Receptors: an Evolving Concept. Climacteric, 5 Suppl 2: str. 20.–6.
|
|
10.
|
Welboren W.J. et al. (2009). Genomic Actions of Estrogen Receptor Alpha: What are the Targets and how are they Regulated? Endocr. Relat. Cancer, 16(4): str. 1073.–89.
|
|
11.
|
Younes M. and Honma N. (2011). Estrogen Receptor Beta, Arch. Pathol. Lab. Med., 135(1): str. 63.–6.
|
|
12.
|
Jefferson W.N., et al. (2002). Assessing Estrogenic Activity of Phytochemicals Using Transcriptional Activation and Immature Mouse Uterotrophic Responses, Journal of Chromatography B, 777(1-2): str. 179.–189.
|
|
13.
|
Sonneveld E. et al. (2006). Comparison of In Vitro and In Vivo Screening Models for Androgenic and Estrogenic Activities, Toxicol. Sci., 89(1): str. 173.–187.
|
|
14.
|
Takeyoshi M. et al. (2002). The Efficacy of Endocrine Disruptor Screening Tests in Detecting Anti- Estrogenic Effects Downstream of Receptor-Ligand Interactions, Toxicology Letters, 126(2): str. 91.–98.
|
|
15.
|
Combes R.D. (2000). Endocrine Disruptors: a Critical Review of In Vitro and In Vivo Testing Strategies for Assessing their Toxic Hazard to Humans, ATLA Alternatives to Laboratory Animals, 28(1): str. 81.–118.
|
|
16.
|
Escande A. et al. (2006). Evaluation of Ligand Selectivity Using Reporter Cell Lines Stably Expressing Estrogen Receptor Alpha or Beta, Biochem. Pharmacol, 71(10): str. 1459.–69.
|
|
17.
|
Gray L.E. Jr. (1998). Tiered Screening and Testing Strategy for Xenoestrogens and Antiandrogens, Toxicol. Lett, 102-103, 677.–680.
|
|
18.
|
EDSTAC (1998). Endocrine Disruptor Screening and Testing Advisory Committee (EDSTAC) Final Report.
|
|
19.
|
ICCVAM (2003). ICCVAM Evaluation of In Vitro Test Methods for Detecting Potential Endocrine Disruptors: Estrogen Receptor and Androgen Receptor Binding and Transcriptional Activation Assays.
|
|
20.
|
Gustafsson J.Ö. (1999). Estrogen Receptor ß - A New Dimension in Estrogen Mechanism of Action, Journal of Endocrinology, 163(3): str. 379.–383.
|
|
21.
|
Ogawa S. et al. (1998). The Complete Primary Structure of Human Estrogen Receptor ß (hERß) and its Heterodimerization with ERαIn Vivo and In Vitro, Biochemical and Biophysical Research Communications, 243(1): str. 122.–126.
|
|
22.
|
Enmark E. et al. (1997). Human Estrogen Receptor ß-Gene Structure, Chromosomal Localization, and Expression Pattern, Journal of Clinical Endocrinology and Metabolism, 82(12): str. 4258.–4265.
|
|
23.
|
Ball L.J. et al. (2009). Cell Type- and Estrogen Receptor-Subtype Specific Regulation of Selective Estrogen Receptor Modulator Regulatory Elements, Molecular and Cellular Endocrinology, 299(2): str. 204.–211.
|
|
24.
|
Barkhem T. et al. (1998). Differential Response of Estrogen Receptor Alpha and Estrogen Receptor Beta to Partial Estrogen Agonists/Antagonists, Mol. Pharmacol, 54(1): str. 105.–12.
|
|
25.
|
Deroo B.J. and Buensuceso A.V. (2010). Minireview: Estrogen Receptor-ß: Mechanistic Insights from Recent Studies, Molecular Endocrinology, 24(9): str. 1703.–1714.
|
|
26.
|
Harris D.M. et al. (2005). Phytoestrogens Induce Differential Estrogen Receptor Alpha- or Beta- Mediated Responses in Transfected Breast Cancer Cells, Experimental Biology and Medicine, 230(8): str. 558.–568.
|
|
27.
|
Anderson J.N. Clark J.H. and Peck E.J.Jr. (1972). The Relationship Between Nuclear Receptor- Estrogen Binding and Uterotrophic Responses, Biochemical and Biophysical Research Communications, 48(6): str. 1460.–1468.
|
|
28.
|
Toft D. (1972). The Interaction of Uterine Estrogen Receptors with DNA, Journal of Steroid Biochemistry, 3(3): str. 515.–522.
|
|
29.
|
Gorski J. et al. (1968), Hormone Receptors: Studies on the Interaction of Estrogen with the Uterus, Recent Progress in Hormone Research, 24: str. 45.–80.
|
|
30.
|
Jensen E.V. et al. (1967), Estrogen-Receptor Interactions in Target Tissues, Archives d’Anatomie Microscopique et de Morphologie Experimentale, 56(3): str. 547.–569.
|
|
31.
|
ICCVAM (2002). Background Review Document: Estrogen Receptor Transcriptional Activation (TA) Assay. Appendix D, Substances Tested in the ER TA Assay, NIH Publication Report (No 03-4505.).
|
|
32.
|
Kanno J. et al. (2001). The OECD Program to Validate the Rat Uterotrophic Bioassay to Screen Compounds for In Vivo Estrogenic Responses: Phase 1, Environ. Health Persp., 109:785.–94.
|
|
33.
|
Kanno J. et al. (2003). The OECD Program to Validate the Rat Uterotrophic Bioassay: Phase Two Dose -Response Studies, Environ. Health Persp., 111:1530.–1549.
|
|
34.
|
Kanno J. et al. (2003), The OECD Program to Validate the Rat Uterotrophic Bioassay: Phase Two – Coded Single-Dose Studies, Environ. Health Persp., 111:1550.–1558.
|
|
35.
|
Geisinger et al. (1989) Characterization of a human ovarian carcinoma cell line with estrogen and progesterone receptors, Cancer 63, 280.–288.
|
|
36.
|
Baldwin et al. (1998) BG-1 ovarian cell line: an alternative model for examining estrogen-dependent growth in vitro, In Vitro Cell. Dev. Biol. – Animal, 34, 649.–654.
|
|
37.
|
Li, Y. et al. (2014) Research resource: STR DNA profile and gene expression comparisons of human BG-1 cells and a BG-1/MCF-7 clonal variant, Mol. Endo. 28, 2072.–2081.
|
|
38.
|
Rogers, J.M. and Denison, M.S. (2000) Recombinant cell bioassays for endocrine disruptors: development of a stably transfected human ovarian cell line for the detection of estrogenic and anti-estrogenic chemicals, In Vitro & Molec. Toxicol. 13, 67.–82.
|
Dodatak 1.
DEFINICIJE I KRATICE
Kriteriji prihvatljivosti
: minimalne norme za provedbu eksperimentalnih kontrola i referentnih normi. Da bi se pokus smatrao valjanim, trebali bi biti ispunjeni svi kriteriji prihvatljivosti.
Točnost (podudarnost)
: stupanj podudarnosti između rezultata testa i prihvaćenih referentnih vrijednosti. Ona je mjerilo učinkovitosti testa i jedan od aspekata relevantnosti. Pojam je često međusobno zamjenjiv s pojmom „podudarnost” u smislu udjela točnih ishoda testa (1.).
Agonist
: tvar koja daje odgovor, npr. transkripciju, kada se veže na specifični receptor.
Antagonist
: vrsta liganda na receptor ili kemikalije koja sama po sebi ne izaziva biološki odgovor nakon vezivanja na receptor, ali blokira ili ublažava odgovore posredovane agonistima.
Antiestrogeno djelovanje
: sposobnost kemikalije da potiskuje djelovanje 17β-estradiola kojim se posreduje preko estrogenskog receptora.
Morfologija stanica
: oblik i izgled stanica uzgojenih u monosloju jedne jažice ploče s kulturom tkiva. Stanice koje umiru često pokazuju abnormalnu morfologiju stanica.
CF
: OECD-ov konceptualni okvir za ispitivanje i procjenu endokrino disruptivnih kemikalija.
Tretiranje ugljenom/dekstranom
: tretiranje seruma koji se koristi u staničnoj kulturi. Tretiranjem ugljenom/dekstranom (koje se često naziva „stripiranje”) uklanjaju se endogeni hormoni i proteini koji vežu hormone.
Kemikalija
: tvar ili smjesa.
Citotoksičnost
: štetni učinci na staničnu strukturu ili funkciju koji naposljetku mogu uzrokovati smrt stanice i mogu se odraziti u smanjenju broja stanica prisutnih u jažici na kraju razdoblja izlaganja ili smanjenje kapaciteta za mjeru stanične funkcije u usporedbi s istodobnom kontrolom s nosačem.
CV
: koeficijent varijacije.
DCC-FBS
: fetalni goveđi serum tretiran ugljenom premazanim dekstranom.
DMEM
: Dulbeccov modificirani Eagleov medij.
DMSO
: dimetilsulfoksid.
E2
: 17β-estradiol.
EC50
: pola najveće učinkovite koncentracije ispitivane kemikalije.
ED
: endokrina disrupcija.
hERα
: ljudski estrogenski receptor alfa.
hERß
: ljudski estrogenski receptor beta.
EFM
: medij bez estrogena. Dulbeccov modificirani Eagleov medij (DMEM) obogaćen s 4,5 % FBS-a tretiranog ugljenom premazanim dekstranom, 1,9 % L-glutamina i 0,9 % mješavine penicilina i streptomicina.
ER
: estrogenski receptor.
ERE
: element odgovora estrogena.
Estrogeno djelovanje
: sposobnost kemikalije da oponaša 17β-estradiol u pogledu sposobnosti da se veže na estrogenske receptore i da ih aktivira. Ovom se ispitnom metodom može otkriti estrogeno djelovanje posredovano receptorom hERα.
ERTA
: transaktivacija estrogenskog receptora.
FBS
: fetalni goveđi serum.
HeLa
: imortalizirana stanična linija humanog cervikalnog karcinoma.
HeLa9903
: podklon stanice HeLa u koji su stabilno transficirani hERαα i reporterski gen za luciferazu.
IC50
: pola najveće učinkovite koncentracije inhibitorne ispitivane kemikalije.
ICCVAM
: Međuagencijski koordinacijski odbor za validaciju alternativnih metoda (The Interagency Coordinating Committee on the Validation of Alternative Methods).
Obnovljivost između laboratorija
: mjera u kojoj različiti kvalificirani laboratoriji mogu dobiti kvalitativno i kvantitativno slične rezultate primjenom istog protokola i ispitivanjem istih tvari. Obnovljivost između laboratorija utvrđuje se tijekom predvalidacijskih i validacijskih procesa te pokazuje mjeru u kojoj se test može uspješno prenositi među laboratorijima, a poznata je i kao interlaboratorijska obnovljivost (1.).
Obnovljivost unutar laboratorija
: utvrđivanje mjere u kojoj kvalificirane osobe u istom laboratoriju mogu uspješno ponoviti rezultate primjenom specifičnog protokola u različito vrijeme. Poznata je i kao intralaboratorijska obnovljivost (1.).
LEC
: najniža učinkovita koncentracija najniža je koncentracija ispitivane kemikalije koja dovodi do odgovora (tj. najniža koncentracija ispitivane kemikalije pri kojoj je multiplikacijski faktor indukcije statistički različit od istodobne kontrole s nosačem).
I ja također test
: kolokvijalni izraz za test koji je strukturno i funkcionalno sličan validiranoj i prihvaćenoj referentnoj ispitnoj metodi. Izraz se često koristi u istom značenju kao slična ispitna metoda.
MT
: metalotionein.
MMTV
: virus mišjeg tumora dojke.
OHT
: 4-hidroksitamoksifen.
PBTG
: smjernica za ispitivanje koja se temelji na uspješnosti.
PC (pozitivna kontrola): jako aktivna tvar, po mogućnosti 17ß-estradiol, koja se uključuje u sva ispitivanja kako bi se pomoglo osigurati pravilno funkcioniranje testa.
PC10
: koncentracija ispitivane kemikalije pri kojoj izmjerena aktivnost u testu agonista iznosi 10 % maksimalne aktivnosti koju inducira pozitivna kontrola (1 nM E2 za STTA test) na svakoj ploči.
PC50
: koncentracija ispitivane kemikalije pri kojoj izmjerena aktivnost u testu agonista iznosi 50 % maksimalne aktivnosti koju inducira pozitivna kontrola (E2 u referentnoj koncentraciji utvrđenoj u ispitnoj metodi) na svakoj ploči.
PCMax
: koncentracija ispitivane kemikalije koja inducira RPCMax
Zahtjevi izvedbe
: zahtjevi koji se temelje na validiranoj ispitnoj metodi i pružaju temelj za ocjenjivanje usporedivosti predložene, funkcionalno i mehanicistički slične, ispitne metode. Oni obuhvaćaju: 1. ključne elemente testa; 2. minimalni popis referentnih kemikalija odabranih između kemikalija koje se koriste za dokazivanje prihvatljive učinkovitosti validirane ispitne metode, i 3. slične razine točnosti i pouzdanosti, utemeljene na rezultatima dobivenim za validiranu ispitnu metodu, koje se prilikom ocjenjivanja trebaju dokazati predloženim testom koristeći minimalni popis referentnih kemikalija (1.).
Tvari za dokazivanje osposobljenosti
: podskupina referentnih tvari iz zahtjeva izvedbe kojima se laboratoriji mogu koristiti kako bi dokazali tehničku osposobljenost za provođenje standardizirane ispitne metode. Kriteriji za odabir tih tvari obično uključuju to da predstavljaju cijeli raspon odgovora, da su komercijalno dostupni i da su za njih dostupni visokokvalitetni referentni podaci.
Osposobljenost
: dokazana sposobnost za pravilno provođenje testa prije ispitivanja nepoznatih tvari.
Referentni estrogen (pozitivna kontrola, PC)
: 17β-estradiol (E2, CAS 50-28-2).
Referentna norma
: referentna tvar koja se upotrebljava za dokazivanje primjerenosti testa. 17β-estradiol referentna je norma za STTA i VM7Luc ER TA testove.
Referentne ispitne metode
: testovi na kojima se temelji PBTG 455.
Relevantnost
: opis odnosa između testa i istraživanog učinka te je li test prikladan i koristan za određenu svrhu. Pokazuje u kojoj se mjeri testom točno mjeri ili predviđa istraživani biološki učinak. Relevantnost uključuje razmatranje o točnosti (podudarnosti) testa (1.).
Pouzdanost
: pokazuje u kojoj se mjeri test može obnovljivo primijeniti unutar jednog laboratorija i između više laboratorija tijekom vremena uz primjenu istog protokola. Ocjenjuje se izračunavanjem obnovljivosti unutar jednog laboratorija i između više laboratorija.
RLU
: relativne jedinice svjetlosti.
RNK
: ribonukleinska kiselina.
RPCMax
: maksimalna razina odgovora koju inducira ispitivana kemikalija, izražena kao postotak odgovora koji inducira 1 nM E2 na istoj ploči.
RPMI
: medij RPMI 1 640 obogaćen s 0,9 % mješavine penicilina i streptomicina te 8,0 % fetalnog goveđeg seruma (FBS).
Ciklus
: pojedinačni pokus kojim se ocjenjuje kemijsko djelovanje na temelju biološkog ishoda testa. Svaki je ciklus potpuni pokus koji se provodi na jažicama s ponavljanjem sa stanicama koje se istodobno nasađuju iz zajedničke banke stanica.
Neovisni ciklus
: zaseban, neovisan pokus kojim se ocjenjuje kemijsko djelovanje na temelju biološkog ishoda testa, upotrebom stanica iz različite banke i svježe razrijeđenih kemikalija, koji se provodi na različite dane ili ih provode različiti članovi osoblja na isti dan.
SD
: standardna devijacija.
Osjetljivost
: udio svih pozitivnih/aktivnih tvari koje su pravilno razvrstane primjenom testa. To je mjera točnosti za test koji daje kategorijske rezultate i važan je čimbenik za ocjenu relevantnosti testa (1.).
Specifičnost
: udio svih negativnih/neaktivnih tvari koje su pravilno razvrstane primjenom ispitivanja. To je mjera točnosti za test koji daje kategorijske rezultate i važan je čimbenik za ocjenu relevantnosti testa (1.).
Stabilna transfekcija
: kada se DNK transficira u uzgojene stanice tako da je stabilno integriran u genom stanica, što dovodi do stabilne ekspresije transficiranih gena. Klonovi stabilno transficiranih stanica odabiru se na temelju stabilnih markera (npr. otpornost na G418).
STTA test
: test transaktivacije sa stabilnom transfekcijom, test transkripcijske aktivacije estrogenskog receptora α primjenom stanične linije HeLa 9 903.
Studija
: sveukupni eksperimentalni rad koji se obavlja radi procjene pojedinačne, specifične tvari primjenom specifičnog testa. Studija obuhvaća sve korake, uključujući razrjeđivanja ispitne tvari u ispitnom mediju, preliminarne cikluse za određivanje raspona, sve potrebne iscrpne cikluse, analize podataka, osiguranje kvalitete, procjene citotoksičnosti itd. Dovršetak studije omogućuje razvrstavanje aktivnosti ispitivane kemikalije prema cilju toksičnosti (tj. aktivno, neaktivno ili nejednoznačno) koji se procjenjuje korištenim testom te procjenu jakosti u odnosu na pozitivnu referentnu kemikaliju.
Tvar
: Na temelju Uredbe REACH (61) tvar se definira kao kemijski element i njegovi spojevi u prirodnom stanju ili dobiveni proizvodnim postupkom, uključujući i dodatke (aditive) koji su nužni za održavanje stabilnosti te nečistoće koje proizlaze iz primijenjenog postupka, ali isključujući otapala koja se mogu izdvojiti bez utjecaja na stabilnost tvari i promjene njezina sastava. Vrlo slična definicija koristi se i u kontekstu sustava UN GHS (1.).
TA (Transaktivacija)
: pokretanje sinteze molekula mRNA kao odgovor na specifični kemijski signal, kao što je vezivanje estrogena na estrogenski receptor.
Test
: u kontekstu ove ispitne metode test je jedna od metodologija koje su prihvaćene kao valjane u pogledu ispunjavanja utvrđenih kriterija uspješnosti. Sastavnice testa uključuju, na primjer, specifičnu staničnu liniju s povezanim uvjetima rasta, specifični medij u kojem se provodi ispitivanje, uvjete postavljanja ploča, raspored i razrjeđenja ispitivanih kemikalija i sve ostale potrebne mjere za kontrolu kvalitete i povezane korake procjene podataka.
Ispitivana kemikalija
: svaka tvar ili smjesa koja se ispituje ovom ispitnom metodom.
Transkripcija
: sinteza molekula mRNA.
UVCB
: kemijske tvari nepoznatog ili promjenjivog sastava, složeni reakcijski proizvodi i biološki materijali.
Validirana ispitna metoda
: test za koji su provedene validacijske studije za utvrđivanje relevantnosti (uključujući točnost) i pouzdanosti za specifičnu namjenu. Važno je napomenuti da validirana ispitna metoda možda neće biti u dovoljnoj mjeri uspješna s obzirom na točnost i pouzdanost da bi je se moglo smatrati prihvatljivom za predloženu namjenu (1.).
Validacija
: proces kojim se utvrđuju pouzdanost i relevantnost određenog pristupa, metode, testa, procesa ili procjene za definiranu svrhu (1.)
VC (kontrola s nosačem)
: otapalo koje se upotrebljava za otapanje ispitnih i kontrolnih kemikalija ispituje se samo kao nosač, bez otopljene kemikalije.
VM7
: imortalizirana stanica adenokarcinoma koja endogeno eksprimira estrogenski receptor.
VM7Luc4E2
: Stanična linija VM7Luc4E2 izvedena je iz VM7 imortaliziranih humanih stanica adenokarcinoma koje endogeno eksprimiraju oba oblika estrogenskog receptora (ERα i ERβ) i stabilno su transficirane plazmidom pGudLuc7.ERE. Taj plazmid sadržava četiri primjerka sintetičkog oligonukleotida koji sadržava element odgovora estrogena uzlazno od promotora virusa mišjeg tumora dojke (MMTV) i gen za luciferazu krijesnice.
Slaba pozitivna kontrola
: slabo aktivna tvar odabrana s popisa referentnih kemikalija koja se uključuje u sva ispitivanja kako bi se pomoglo osigurati pravilno funkcioniranje testa.
Dodatak 2.
TEST TRANSAKTIVACIJE STABILNO TRANSFICIRANOG LJUDSKOG ESTROGENSKOG RECEPTORA-Α ZA OTKRIVANJE ESTROGENSKOG AGONISTIČKOG I ANTAGONISTIČKOG DJELOVANJA KEMIKALIJA PRIMJENOM STANIČNE LINIJE HERΑ-HELA-9903
POČETNA RAZMATRANJA I OGRANIČENJA (VIDJETI I OPĆI UVOD)
|
1.
|
U ovom testu transaktivacije (TA) upotrebljava se stanična linija hERα-HeLa-9 903 radi otkrivanja estrogenskog agonističkog djelovanja kojim posreduje ljudski estrogenski receptor alfa (hERα). Validacijska studija testa transaktivacije sa stabilnom transfekcijom (STTA) koju je proveo CERI (Japanski institut za procjenu i istraživanje kemikalija) primjenom stanične linije hERα-HeLa-9 903 za otkrivanje estrogenskog agonističkog i antagonističkog djelovanja kojim posreduje ljudski estrogenski receptor alfa (hERα) pokazala je relevantnost i pouzdanost testa za predviđenu svrhu (1.).
|
|
2.
|
Ovaj je test posebno osmišljen za otkrivanje transaktivacije kojom posreduje hERα mjerenjem kemiluminiscencije kao krajnje točke. Međutim, pri koncentracijama fitoestrogena većima od 1 μM zabilježeni su signali luminiscencije kojima ne posreduju receptori zbog pretjerane aktivacije reporterskog gena za luciferazu (2. i 3.). Iako krivulja doza – odgovor pokazuje da do stvarne aktivacije sustava estrogenskog receptora dolazi pri manjim koncentracijama, ekspresiju luciferaze dobivenu pri visokim koncentracijama fitoestrogena ili sličnih spojeva za koje se pretpostavlja da poput fitoestrogena dovode do pretjerane aktivacije reporterskog gena za luciferazu treba pažljivo ispitati sustavima ER TA testova sa stabilnom transfekcijom (Dodatak 1.).
|
|
3.
|
Prije upotrebe ovog testa u regulatorne svrhe treba pročitati odjeljke „OPĆI UVOD” i „SASTAVNICE ER TA TESTA”. Definicije i kratice upotrijebljene u ovoj Smjernici za ispitivanje navedene su u Dodatku 2.1.
|
NAČELO TESTA (VIDJETI I OPĆI UVOD)
|
4.
|
Test se upotrebljava za signalizaciju vezivanja estrogenskog receptora s ligandom. Nakon vezivanja s ligandom kompleks receptora i liganda translocira u jezgru, gdje se veže na specifične elemente DNK odgovora i transaktivira reporterski gen za luciferazu krijesnice, što dovodi do povećane stanične ekspresije enzima luciferaze. Luciferin je supstrat koji enzim luciferaze pretvara u bioluminiscentni proizvod koji se može kvantitativno izmjeriti s pomoću luminometra. Aktivnost luciferaze može se procijeniti brzo i jeftino primjenom nekoliko komercijalno dostupnih pribora za ispitivanje.
|
|
5.
|
U ispitnom sustavu upotrebljava se stanična linija hERα-HeLa-9 903, koja se dobiva iz humanog cervikalnog tumora, s dva stabilno umetnuta konstrukta: i. konstruktom za ekspresiju hERαα (kodiranje cijelog ljudskog receptora) i ii. konstruktom reporterskog gena za luciferazu krijesnice koji nosi pet tandemskih ponavljanja elementa vitelogenina koji reagira na estrogen (ERE) koje pokreće TATA element promotora gena za mišji metalotionein (MT). Pokazalo se da je mišji MT TATA genski konstrukt najuspješniji pa se često upotrebljava. Stoga ova stanična linija hERα-HeLa-9 903 može mjeriti sposobnost ispitivane kemikalije da inducira transaktivaciju genske ekspresije luciferaze kojom posreduje hERα.
|
|
6.
|
U slučaju testa agonista estrogenskog receptora, tumačenje podataka temelji se na tome je li maksimalna razina odgovora koju inducira ispitivana kemikalija jednaka ili veća od odgovora agonista koji iznosi 10 % odgovora koji inducira koncentracija pozitivne kontrole 17β-estradiola (E2) s najvećim učinkom (1 nM) (tj. PC10). U slučaju testa antagonista estrogenskog receptora, tumačenje podataka temelji se na tome pokazuje li odgovor smanjenje aktivnosti od najmanje 30 % u odnosu na odgovor koji inducira kontrola s dodanom poznatom količinom tvari (spike-in) (25 pM E2) bez pojave citotoksičnosti. O analizi i tumačenju podataka podrobno se raspravlja u stavcima od 34. do 48.
|
POSTUPAK
Stanične linije
|
7.
|
Za test bi se trebala upotrebljavati stabilno transficirana stanična linija hERα-HeLa-9 903. Stanična linija može se dobiti iz banke stanica JCRB-a (Japanese Collection of Research Bioresources, Japanska zbirka istraživačkih bioresursa) (62) nakon potpisivanja sporazuma o prijenosu materijala (MTA).
|
|
8.
|
U ispitivanju se trebaju upotrebljavati samo stanice koje ne sadržavaju mikoplazmu. RT-PCR (lančana reakcija polimerazom u stvarnom vremenu) preferirana je metoda za osjetljivo otkrivanje zaraze mikoplazmom (4., 5. i 6.).
|
Stabilnost stanične linije
|
9.
|
Kako bi se pratila stabilnost stanične linije, kao referentne norme za test agonista treba upotrebljavati E2, 17α-estradiol, 17α-metiltestosteron i kortikosteron te treba izmjeriti cijelu krivulju koncentracija – odgovor u rasponu ispitne koncentracije navedenom u tablici 1. barem jednom kod svake provedbe testa, a rezultati bi se trebali slagati s rezultatima navedenima u tablici 1.
|
|
10.
|
U slučaju testa antagonista, pri svakom ciklusu treba istodobno mjeriti cijele krivulje koncentracije za dvije referentne norme, tamoksifen i flutamid. Treba pratiti točno kvalitativno razvrstavanje tih dviju kemikalija kao pozitivnih i negativnih.
|
Stanična kultura i uvjeti nasađivanja
|
11.
|
Stanice treba održavati u Eagleovu minimalnom esencijalnom mediju (EMEM) bez fenolne crvene, obogaćenom sa 60 mg/l antibiotika kanamicina i 10 % fetalnog goveđeg seruma tretiranog ugljenom premazanim dekstranom (DCC-FBS), u inkubatoru CO2 (5 % CO2) na 37 ± 1 °C. Kada se postigne konfluencija od 75 do 90 %, može se uzgojiti supkultura po 10 ml 0,4 x 105 – 1 x 105 stanica/ml za zdjelicu sa staničnom kulturom od 100 mm. Stanice treba suspendirati u 10 % medija FBS-EMEM (što je isto kao i EMEM s DCC-FBS-om) i zatim nasaditi u jažice mikroploče pri gustoći od 1 x 104 stanica/(100 μl x jažica). Stanice zatim treba predinkubirati u inkubatoru s 5 % CO2 na 37 ± 1 °C u trajanju od tri sata prije izlaganja kemikaliji. U plastičnoj opremi ne smije biti estrogene aktivnosti.
|
|
12.
|
Kako bi se održao integritet odgovora, stanice treba uzgajati za više od jedne pasaže od zamrznute matične zalihe u kondicioniranom mediju i ne bi se trebale uzgajati za više od 40 pasaža. Za staničnu liniju hERα-HeLa-9 903 to će trajati manje od tri mjeseca. Međutim, uspješnost stanica može se smanjiti ako se one uzgajaju u uvjetima koji nisu primjereni za uzgoj kulture.
|
|
13.
|
DCC-FBS se može pripremiti kako je opisano u Dodatku 2.2. ili se može nabaviti iz komercijalnih izvora.
|
Kriteriji prihvatljivosti
Pozitivne i negativne referentne norme za test agonista estrogenskog receptora
|
14.
|
Prije i tijekom provođenja studije treba potvrditi osjetljivost ispitnog sustava primjenom odgovarajućih koncentracija jakog estrogena: E2, slabog estrogena (17α-estradiol), vrlo slabog agonista (17α-metiltestosteron) i negativne tvari (kortikosteron). Vrijednosti prihvatljivog raspona izvedene iz validacijske studije (1.) navedene su u tablici 1. Ove četiri paralelne referentne norme treba uključiti u svaki pokus i rezultati bi trebali biti unutar prihvatljivih ograničenja. Ako nisu, treba utvrditi uzrok neispunjavanja kriterija prihvatljivosti (npr. rukovanje stanicama, serum i antibiotici za kvalitetu i koncentracija) te ponoviti test. Kada se ispune kriteriji prihvatljivosti, ključna je dosljedna upotreba materijala za uzgoj stanica kako bi se osigurala minimalna varijabilnost vrijednosti EC50, PC50 i PC10. S pomoću četiriju paralelnih referentnih normi, koje treba uključiti u svaki pokus (proveden u istim uvjetima, uključujući materijale, razinu pasaže stanica i tehničare), može se osigurati osjetljivost testa jer vrijednosti PC10 triju pozitivnih referentnih normi trebaju biti unutar prihvatljivog raspona, isto kao i vrijednosti PC50 i EC50 ako se mogu izračunati (vidjeti tablicu 1.).
|
Tablica 1.
Vrijednosti prihvatljivog raspona četiriju referentnih normi za test agonista estrogenskog receptora
|
Naziv
|
logPC50
|
logPC10
|
logEC50
|
Hillov nagib
|
Raspon ispitivanja
|
|
17β-estradiol (E2) CAS br.: 50-28-2
|
–11,4 ~ –10,1
|
< –11
|
–11,3 ~ –10,1
|
0,7 ~ 1,5
|
10–14 ~ 10–8 M
|
|
17α-estradiol CAS br.: 57-91-0
|
–9,6 ~ –8,1
|
–10,7 ~ –9,3
|
–9,6 ~ –8,4
|
0,9 ~ 2,0
|
10–12 ~ 10–6 M
|
|
Kortikosteron CAS br.: 50-22-6
|
—
|
—
|
—
|
—
|
10–10 ~ 10–4 M
|
|
17α-metiltestosteron CAS br.: 58-18-4
|
–6,0 ~ –5,1
|
–8,0 ~ –6,2
|
—
|
—
|
10–11 ~ 10–5 M
|
Pozitivne i negativne referentne norme za test antagonista estrogenskog receptora
|
15.
|
Prije i tijekom provođenja studije treba potvrditi osjetljivost ispitnog sustava primjenom odgovarajućih koncentracija pozitivne tvari (tamoksifen) i negativne tvari (flutamid). Vrijednosti prihvatljivog raspona izvedene iz validacijske studije (1.) navedene su u tablici 2. Ove dvije paralelne referentne norme treba uključiti u svaki pokus i rezultati bi trebali biti procijenjeni točnima, kako je prikazano u kriterijima. Ako nisu, treba utvrditi uzrok neispunjavanja kriterija (npr. rukovanje stanicama, serum i antibiotici za kvalitetu i koncentracija) te ponoviti test. Osim toga, treba izračunati vrijednosti IC50 za pozitivnu tvar (tamoksifen) i rezultati bi trebali biti unutar utvrđenih prihvatljivih ograničenja. Kada se ispune kriteriji prihvatljivosti, ključna je dosljedna upotreba materijala za uzgoj stanica kako bi se osigurala minimalna varijabilnost vrijednosti IC50. S pomoću tih dviju paralelnih referentnih normi, koje treba uključiti u svaki pokus (proveden u istim uvjetima, uključujući materijale, razinu pasaže stanica i tehničare), može se osigurati osjetljivost testa (vidjeti tablicu 2.).
|
Tablica 2.
Kriteriji i vrijednosti prihvatljivog raspona dviju referentnih normi za test antagonista estrogenskog receptora
|
Naziv
|
Kriteriji
|
LogIC50
|
Raspon ispitivanja
|
|
Tamoksifen CAS br.: 10 540 -29-1
|
Pozitivno: treba izračunati IC50
|
–5,942 ~ –7,596
|
10–10 ~ 10–5 M
|
|
Flutamid CAS br.: 13 311 -84-7
|
Negativno: ne treba izračunati IC30
|
—
|
10–10 ~ 10–5 M
|
Pozitivne kontrole i kontrole s nosačem
|
16.
|
Pozitivnu kontrolu (PC) za test agonista estrogenskog receptora (1 nM E2) i za test antagonista estrogenskog receptora (10 μM tamoksifena) treba ispitati najmanje u tri ponavljanja na svakoj ploči. Nosač koji se upotrebljava za otapanje ispitivane kemikalije treba ispitati kao kontrolu s nosačem (VC) barem u tri ponavljanja na svakoj ploči. Osim te kontrole s nosačem, ako se u pozitivnoj kontroli upotrebljava nosač različit od onoga koji se upotrebljava s ispitivanom kemikalijom, treba ispitati drugu kontrolu s nosačem u najmanje tri ponavljanja na istoj ploči s pozitivnom kontrolom.
|
Kriteriji kvalitete za test agonista estrogenskog receptora
|
17.
|
Srednja aktivnost luciferaze u pozitivnoj kontroli (1 nM E2) treba biti barem četiri puta veća od srednje vrijednosti u kontroli s nosačem na svakoj ploči. Kriterij se utvrđuje na temelju pouzdanosti vrijednosti krajnjih točaka iz validacijske studije (prema prijašnjim podacima četiri do 30 puta više).
|
|
18.
|
Kad je riječ o kontroli kvalitete testa, multiplikacijski faktor indukcije koji odgovara vrijednosti PC10 istodobne pozitivne kontrole (1 nM E2) trebao bi biti veći od 1 + 2 standardne devijacije vrijednosti multiplikacijskog faktora indukcije (= 1) istodobne kontrole s nosačem. U svrhu određivanja prioriteta, vrijednost PC10 može biti korisna za pojednostavnjenje potrebne analize podataka u usporedbi sa statističkom analizom. Iako statistička analiza pruža podatke o značajnosti, ta analiza nije kvantitativan parametar u pogledu potencijala koji se temelji na koncentraciji i stoga je manje korisna u svrhu određivanja prioriteta.
|
Kriteriji kvalitete za test antagonista estrogenskog receptora
|
19.
|
Srednja aktivnost luciferaze u kontroli s dodanom poznatom količinom tvari (spike-in) (25 nM E2) treba biti barem četiri puta veća od srednje vrijednosti u kontroli s nosačem na svakoj ploči. Kriterij se utvrđuje na temelju pouzdanosti vrijednosti krajnjih točaka iz validacijske studije.
|
|
20.
|
Kad je riječ o kontroli kvalitete testa, relativna transkripcijska aktivacija (RTA) 1 nM E2 treba biti veća od 100 %, RTA 1 μM 4-hidroksitamoksifena (OHT) treba biti manji od 40,6 % i RTA 100 μM digitonina (Dig) treba biti manji od 0 %.
Dokazivanje osposobljenosti laboratorija (vidjeti stavak 14. i tablice 3. i 4. u odjeljku „SASTAVNICE ER TA TESTA” ove ispitne metode).
|
Nosač
|
21.
|
Kao istodobnu kontrolu s nosačem treba upotrijebiti dimetilsulfoksid (DMSO) ili primjereno otapalo, u istoj koncentraciji koja se upotrebljava za različite pozitivne i negativne kontrole i ispitivane kemikalije. Ispitivane kemikalije treba otopiti u otapalu koje otapa ispitivanu kemikaliju te se može miješati s medijem za stanice. Primjereni su nosači voda, etanol (čistoće od 95 % do 100 %) i DMSO. Ako se upotrebljava DMSO, ne bi se trebalo koristiti više od 0,1 % (v/v). Za sve bi nosače trebalo dokazati da najveći volumen koji se upotrebljava nije citotoksičan i da ne utječu na uspješnost testa.
|
Priprema ispitivanih kemikalija
|
22.
|
Ispitivane kemikalije obično treba otopiti u DMSO-u ili drugom primjerenom otapalu i serijski razrijediti istim otapalom u omjeru 1: 10 kako bi se pripremile otopine za razrjeđivanje s medijem.
|
Topljivost i citotoksičnost: razmatranja o utvrđivanju raspona
|
23.
|
Treba provesti preliminarno ispitivanje kako bi se utvrdio primjereni raspon koncentracije kemikalije koja se ispituje i kako bi se utvrdilo postoje li određeni problemi povezani s topljivosti i citotoksičnosti ispitivane kemikalije. Kemikalije se u početku ispituju do najveće koncentracije od 1 μl/ml, 1 mg/ml ili 1 mM, ovisno o tome što je najmanje. Na temelju mjere citotoksičnosti ili nedovoljne topljivosti uočene u preliminarnom ispitivanju, u prvom definitivnom ciklusu kemikaliju treba ispitati po log-serijskim razrjeđenjima, počevši od najveće prihvatljive koncentracije (npr. 1 mM, 100 μM, 10 μM itd.) i zabilježiti zamućenje, talog ili citotoksičnost. Koncentracije u drugom, a prema potrebi i trećem ciklusu treba po potrebi prilagoditi radi bolje karakterizacije krivulje koncentracija – odgovor i kako bi se izbjegle koncentracije za koje se utvrdi da nisu topljive ili da induciraju preveliku citotoksičnost.
|
|
24.
|
Kod agonista i antagonista estrogenskog receptora prisutnost povećanih razina citotoksičnosti može znatno izmijeniti ili eliminirati uobičajeni sigmoidni odgovor i treba je uzeti u obzir pri tumačenju podataka. Treba upotrebljavati metode za ispitivanje citotoksičnosti koje mogu dati informacije o 80-postotnoj vijabilnosti stanica, uz primjenu primjerenog testa na temelju iskustva laboratorija.
|
|
25.
|
Ako rezultati ispitivanja citotoksičnosti pokažu da je koncentracija ispitivane kemikalije smanjila broj stanica za 20 % ili više, ta se koncentracija treba smatrati citotoksičnom, a koncentracije koje su jednake citotoksičnoj koncentraciji ili veće treba isključiti iz procjene.
|
Izlaganje kemikaliji i organizacija testne ploče
|
26.
|
Postupak za razrjeđivanja kemikalija (koraci 1. i 2.) i izlaganje stanica (korak 3.) može se provoditi na sljedeći način.
Korak 1.: Svaku ispitivanu kemikaliju treba serijski razrijediti u DMSO-u ili primjerenom otapalu i dodati u jažice mikrotitracijske pločice kako bi se dobile konačne serijske koncentracije kako su utvrđene u preliminarnom ispitivanju za utvrđivanje raspona (obično u serijama, na primjer 1 mM, 100 μM, 10 μM, 1 μM, 100 nM, 10 nM, 1 nM, 100 pM i 10 pM (10–3 – 10–11 M)) za ispitivanje u tri ponavljanja.
Korak 2.: razrjeđivanje kemikalija: prvo razrijediti 1,5 μl ispitivane kemikalije u otapalu na volumen od 500 μl medija.
Korak 3.: izlaganje stanica kemikaliji: dodati 50 μl razrijeđene kemikalije s medijem (pripremljene u koraku 2.) u testnu jažicu koja sadržava 104 stanica/100 μl/jažica.
Preporučeni konačni volumen medija potrebnog za svaku jažicu iznosi 150 μl. Ispitni uzorci i referentne norme mogu se rasporediti kako je prikazano u tablici 3. i tablici 4.
|
Tablica 3.
Primjer rasporeda koncentracija na pločama za referentne norme na testnoj ploči za agonist estrogenskog receptora
|
Redak
|
17α-metiltestosteron
|
Kortikosteron
|
17α-estradiol
|
E2
|
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
|
A
|
konc. 1 (10 μM)
|
→
|
→
|
100 μM
|
→
|
→
|
1 μM
|
→
|
→
|
10 nM
|
→
|
→
|
|
B
|
konc. 2 (1 μM)
|
→
|
→
|
10 μM
|
→
|
→
|
100 nM
|
→
|
→
|
1 nM
|
→
|
→
|
|
C
|
konc. 3 (100 nM)
|
→
|
→
|
1 μM
|
→
|
→
|
10 nM
|
→
|
→
|
100 pM
|
→
|
→
|
|
D
|
konc. 4 (10 nM)
|
→
|
→
|
100 nM
|
→
|
→
|
1 nM
|
→
|
→
|
10 pM
|
→
|
→
|
|
E
|
konc. 5 (1 nM)
|
→
|
→
|
10 nM
|
→
|
→
|
100 pM
|
→
|
→
|
1 pM
|
→
|
→
|
|
F
|
konc. 6 (100 pM)
|
→
|
→
|
1 nM
|
→
|
→
|
10 pM
|
→
|
→
|
0,1 pM
|
→
|
→
|
|
G
|
konc. 7 (10 pM)
|
→
|
→
|
100 pM
|
→
|
→
|
1 pM
|
→
|
→
|
0,01 pM
|
→
|
→
|
|
H
|
VC
|
→
|
→
|
→
|
→
|
→
|
PC
|
→
|
→
|
→
|
→
|
→
|
|
VC: kontrola s nosačem (0,1 % DMSO); PC: pozitivna kontrola (1 nM E2)
|
|
27.
|
Referentne norme (E2, 17α-estradiol, 17 α-metil testosteron i kortikosteron) treba ispitati u svakom ciklusu (tablica 3.). Jažice s pozitivnom kontrolom tretirane s 1 nM E2 koje mogu proizvesti najveću indukciju E2 te jažice s kontrolom nosača tretirane samo DMSO-om (ili primjerenim otapalom) treba uključiti u svaku testnu ploču u ispitivanju (tablica 4.). Ako se u istom pokusu upotrebljavaju stanice iz različitih izvora (npr. različiti broj pasaže, različita serija itd.), referentne norme trebaju se ispitati za svaki izvor stanica.
|
Tablica 4.
Primjer rasporeda koncentracija na pločama za ispitivane kemikalije i kemikalije za kontrolu na testnoj ploči u testu agonista estrogenskog receptora
|
Redak
|
Ispitivana kemikalija 1
|
Ispitivana kemikalija 2
|
Ispitivana kemikalija 3
|
Ispitivana kemikalija 4
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
|
A
|
konc. 1 (10 μM)
|
→
|
→
|
1 mM
|
→
|
→
|
1 μM
|
→
|
→
|
10 nM
|
→
|
→
|
|
B
|
konc. 2 (1 μM)
|
→
|
→
|
100 μM
|
→
|
→
|
100 nM
|
→
|
→
|
1 nM
|
→
|
→
|
|
C
|
konc. 3 (100 nM)
|
→
|
→
|
10 μM
|
→
|
→
|
10 nM
|
→
|
→
|
100 pM
|
→
|
→
|
|
D
|
konc. 4 (10 nM)
|
→
|
→
|
1 μM
|
→
|
→
|
1 nM
|
→
|
→
|
10 pM
|
→
|
→
|
|
E
|
konc. 5 (1 nM)
|
→
|
→
|
100 nM
|
→
|
→
|
100 pM
|
→
|
→
|
1 pM
|
→
|
→
|
|
F
|
konc. 6 (100 pM)
|
→
|
→
|
10 nM
|
→
|
→
|
10 pM
|
→
|
→
|
0,1 pM
|
→
|
→
|
|
G
|
konc. 7 (10 pM)
|
→
|
→
|
1 nM
|
→
|
→
|
1 pM
|
→
|
→
|
0,01 pM
|
→
|
→
|
|
H
|
VC
|
→
|
→
|
→
|
→
|
→
|
PC
|
→
|
→
|
→
|
→
|
→
|
|
VC: kontrola s nosačem (0,1 % DMSO); PC: pozitivna kontrola (1 nM E2)
|
Tablica 5
Primjer rasporeda koncentracija na pločama za referentne norme na testnoj ploči u testu antagonista estrogenskog receptora

|
28.
|
Kako bi se procijenilo antagonističko djelovanje kemikalija, u testne jažice koje se nalaze u recima od A do G treba dodati 25 pM E2. Referentne norme (tamoksifen i flutamid) treba ispitati u svakom ciklusu. Svaka testna ploča u ispitivanju treba uključivati jažice s pozitivnom kontrolom tretirane s 1 nM E2 koje se mogu upotrijebiti kao kontrola kvalitete za staničnu liniju hERα-HeLa-9 903, jažice s kontrolom nosača tretirane DMSO-om (ili odgovarajućim otapalom), jažice s 0,1 % DMSO-a tretirane dodatkom DMSO-a i E2 koje odgovaraju kontroli s dodanom poznatom količinom tvari („spike-in” kontrola), jažice tretirane s konačnom koncentracijom 1 μM OHT-a te jažice tretirane s 100 μM digitonina (tablica 5.). Kod kasnijih testnih ploča treba se slijediti isti raspored na ploči bez jažica iz referentnih normi (tablica 6.). Ako se u istom pokusu upotrebljavaju stanice iz različitih izvora (npr. različiti broj pasaže, različita serija itd.), referentne norme trebaju se ispitati za svaki izvor stanica.
|
Tablica 6
Primjer rasporeda koncentracija na pločama za ispitivane kemikalije i kemikalije za kontrolu na testnoj ploči za antagonist estrogenskog receptora
|
29.
|
Prema potrebi treba potvrditi izostanak rubnih učinaka, a ako se sumnja na rubne učinke, treba promijeniti raspored na ploči kako bi se izbjegli ti učinci. Na primjer, može se upotrijebiti raspored na ploči koji isključuje rubne jažice.
|
|
30.
|
Nakon dodavanja kemikalija testne ploče treba inkubirati u inkubatoru s 5 % CO2 na 37 ± 1 oC od 20 do 24 sata kako bi se inducirali proizvodi reporterskog gena.
|
|
31.
|
Posebnu pozornost treba posvetiti spojevima koji su jako hlapljivi. U tim slučajevima kontrolne jažice koje se nalaze u blizini mogu dati lažno pozitivne rezultate i to treba uzeti u obzir u kontekstu očekivanih i prijašnjih vrijednosti kontrola. U nekim slučajevima u kojima hlapljivost može biti problem mogu se upotrijebiti poklopci za ploče kako bi se tijekom ispitivanja učinkovito izolirale pojedinačne jažice pa se stoga u tim slučajevima preporučuje njihova upotreba.
|
|
32.
|
Ponavljanja konačnih ispitivanja za istu kemikaliju treba provoditi na različite dane kako bi se osigurala neovisnost.
|
Test luciferaze
|
33.
|
Za test se može upotrijebiti komercijalni reagens za test luciferaze [npr. Steady-Glo® Luciferase Assay System (Promega, E2510 ili ekvivalentno)) ili standardni sustav testa luciferaze (npr. Promega, E1500 ili ekvivalentno) pod uvjetom da su ispunjeni kriteriji prihvatljivosti. Reagens za test treba odabrati na temelju osjetljivosti luminometra koji se koristi. Ako se koristi standardni sustav testa luciferaze, prije dodavanja supstrata treba upotrijebiti reagens za liziranje stanične kulture. Reagens za luciferazu treba primijeniti prema uputama proizvođača.
|
ANALIZA PODATAKA
Test agonista estrogenskog receptora
|
34.
|
Kad je riječ o testu agonista estrogenskog receptora, da bi se dobila relativna transkripcijska aktivnost u odnosu na pozitivnu kontrolu (1 nM E2), signali luminiscencije s iste ploče mogu se analizirati prema sljedećim koracima (prihvatljivi su i drugi ekvivalentni matematički postupci):
Korak 1. Izračunati srednju vrijednost za kontrolu s nosačem.
Korak 2. Oduzeti srednju vrijednost kontrole s nosačem od vrijednosti svake jažice kako bi se podaci normalizirali.
Korak 3. Izračunati srednju vrijednost za normaliziranu pozitivnu kontrolu.
Korak 4. Podijeliti normaliziranu vrijednost svake jažice na ploči srednjom vrijednošću normalizirane pozitivne kontrole (PC = 100 %).
Konačna vrijednost svake jažice relativna je transkripcijska aktivnost za tu jažicu u usporedbi s odgovorom pozitivne kontrole.
Korak 5. Izračunati srednju vrijednost relativne transkripcijske aktivnosti za svaku koncentracijsku skupinu ispitivane kemikalije. Odgovor ima dvije dimenzije: prosječnu transkripcijsku aktivnost (odgovor) i koncentraciju pri kojoj dolazi do odgovora (vidjeti sljedeći odjeljak).
|
Razmatranja o indukciji vrijednosti EC50, PC50 i PC10
|
35.
|
Za izračun vrijednosti EC50 potrebna je cijela krivulja koncentracija – odgovor, ali to se ne može uvijek postići ili nije praktično zbog ograničenja raspona ispitne koncentracije (na primjer, zbog citotoksičnosti ili poteškoća s topljivosti). Međutim, budući da su EC50 i najveća razina indukcije (koja odgovara najvećoj vrijednosti Hillove jednadžbe) informativni parametri, treba ih navesti kada je to moguće. Za izračun vrijednosti EC50 i najveće razine indukcije treba koristiti primjereni statistički softver (npr. statistički softver Graphpad Prism). Ako je na podatke o koncentraciji i odgovoru primjenjiva Hillova logistička jednadžba, vrijednost EC50 treba izračunati prema sljedećoj jednadžbi (7.):
Y = dno + (vrh – dno) / (1 + 10 exp ((log EC50 – X) x Hillov nagib)) pri čemu je:
X logaritam koncentracije, a
Y odgovor te Y počinje na dnu i kreće se do vrha sigmoidne krivulje. Dno je u Hillovoj logističkoj jednadžbi utvrđeno na nulu.
|
|
36.
|
Za svaku ispitivanu kemikaliju treba navesti sljedeće:
RPCMax (maksimalna razina odgovora koju inducira ispitivana kemikalija, izražena kao postotak odgovora koji inducira 1 nM E2 na istoj ploči) te PCMax (koncentracija povezana s vrijednosti RPCMax) i,
u slučaju pozitivnih kemikalija, koncentracije koje induciraju PC10 i, ako je primjereno, PC50.
|
|
37.
|
Vrijednost PCx može se izračunati interpolacijom između dvije točke na koordinatama X-Y, jedne neposredno iznad i jedne neposredno ispod vrijednosti PCx. Ako podatkovne točke koje se nalaze neposredno iznad i ispod vrijednosti PCx imaju koordinate (a,b) i (c,d), vrijednost PCx može se izračunati prema sljedećoj jednadžbi:
log[PCx] = log[c] + (x – d) / (d – b)
|
|
38.
|
Opisi vrijednosti PC navedeni su na slici 1. u nastavku.
Sliika 1
Primjer načina na koji se izvode vrijednosti pozitivne kontrole. PC (1 nM E2) stavlja se na svaku testnu ploču

|
Test antagonista estrogenskog receptora
|
39.
|
Kad je riječ o testu antagonista estrogenskog receptora, da bi se dobila relativna transkripcijska aktivnost u odnosu na kontrolu s dodanom poznatom količinom tvari (spike-in) (25 nM E2), signali luminiscencije s iste ploče mogu se analizirati prema sljedećim koracima (prihvatljivi su i drugi ekvivalentni matematički postupci).
Korak 1. Izračunati srednju vrijednost za kontrolu s nosačem.
Korak 2. Oduzeti srednju vrijednost kontrole s nosačem od vrijednosti svake jažice kako bi se podaci normalizirali. Korak 3. Izračunati srednju vrijednost za normaliziranu kontrolu s dodanom poznatom količinom tvari (spike-in).
Korak 4. Podijeliti normaliziranu vrijednost svake jažice na ploči srednjom vrijednošću normalizirane kontrole s dodanom poznatom količinom tvari (spike-in kontrola = 100 %).
Konačna vrijednost svake jažice relativna je transkripcijska aktivnost za tu jažicu u usporedbi s odgovorom kontrole s dodanom poznatom količinom tvari.
Korak 5. Izračunati srednju vrijednost relativne transkripcijske aktivnosti za svako tretiranje.
|
Razmatranja o indukciji vrijednosti IC30 i IC50
|
40.
|
U slučaju pozitivnih kemikalija treba navesti koncentracije koje induciraju IC30 i, ako je primjereno, IC50.
|
|
41.
|
Vrijednost ICx može se izračunati interpolacijom između dvije točke na koordinatama X-Y, jedne neposredno iznad i jedne neposredno ispod vrijednosti ICx. Ako podatkovne točke koje se nalaze neposredno iznad i ispod vrijednosti ICx imaju koordinate (c,d) i (a,b), vrijednost ICx može se izračunati prema sljedećoj jednadžbi:
lin ICx = a – (b – (100 – x)) (a – c) / (b – d)
Slika 2
Primjer načina na koji se izvode vrijednosti IC. Kontrola s dodanom poznatom količinom tvari (spike-in) (25 pM E2) stavlja se na svaku testnu ploču

RTA: relativna transkripcijska aktivnost
|
|
42.
|
Rezultati se trebaju temeljiti na dva (ili tri) neovisna ciklusa. Ako se u dva ciklusa dobiju usporedivi, a time i ponovljivi rezultati, ne mora se provoditi treći ciklus. Da bi bili prihvatljivi, rezultati trebaju:
|
—
|
ispunjavati kriterije prihvatljivosti (vidjeti stavke od 14. do 20. o kriterijima prihvatljivosti),
|
|
Kriteriji za tumačenje podataka
Tablica 7.
Kriteriji za donošenje pozitivne i negativne odluke u testu agonista estrogenskog receptora
|
Pozitivna
|
Ako se dobije vrijednost RPCMax koja je jednaka ili veća od 10 % odgovora pozitivne kontrole u najmanje dva od dva provedena ciklusa ili u dva od tri provedena ciklusa.
|
|
Negativna
|
Ako se ne uspije dobiti vrijednost RPCMax koja iznosi barem 10 % odgovora pozitivne kontrole u dva od dva provedena ciklusa ili u dva od tri provedena ciklusa.
|
Tablica 8.
Kriteriji za donošenje pozitivne i negativne odluke u testu antagonista estrogenskog receptora
|
Pozitivna
|
Ako se IC30 izračuna u najmanje dva od dva provedena ciklusa ili u dva od tri provedena ciklusa.
|
|
Negativna
|
Ako se IC30 ne uspije izračunati u dva od dva provedena ciklusa ili u dva od tri provedena ciklusa.
|
|
43.
|
Kriteriji za tumačenje podataka navedeni su u tablicama 7. i 8. Pozitivne rezultate karakterizirat će i razmjer učinka i koncentracija pri kojoj dolazi do učinka. Oba ta cilja ostvaruju se izražavanjem rezultata kao koncentracije pri kojoj se postiže 50 % (PC50) ili 10 % (PC10) vrijednosti PC za test agonista te se inhibira 50 % (IC50) ili 30 % (IC30) vrijednosti kontrole s dodanom poznatom količinom tvari (spike-in) za test antagonista. Međutim, ispitivana kemikalija određuje se kao pozitivna ako je najveći odgovor koji ona inducira (RPCMax) jednak ili veći od 10 % odgovora pozitivne kontrole u najmanje dva od dva provedena ciklusa ili dva od tri provedena ciklusa, dok se ispitivana kemikalija smatra negativnom ako RPCMax ne uspije ostvariti 10 % odgovora pozitivne kontrole u dva od dva provedena ciklusa ili u dva od tri provedena ciklusa.
|
|
44.
|
Vrijednosti PC10, PC50 i PCMax u testu agonista estrogenskog receptora te IC30 i IC50 u testu antagonista estrogenskog receptora mogu se izračunati s pomoću proračunske tablice koja je dostupna sa Smjernicom za ispitivanje na javnom web-mjestu OECD-a (63).
|
|
45.
|
Trebalo bi biti dovoljno dobiti vrijednosti PC10 ili PC50 i IC30 ili IC50 najmanje dva puta. Međutim, ako osnovica za podatke u istom rasponu koncentracije koja iz toga proizađe pokazuje varijabilnost s neprihvatljivo visokim koeficijentom varijacije (CV; %), podaci se ne mogu smatrati pouzdanima i treba utvrditi izvor velike varijabilnosti. Koeficijent varijacije neobrađenih podataka iz tri ponavljanja (tj. podaci o intenzitetu fluorescencije) podatkovnih točaka koje se upotrebljavaju za izračun vrijednosti PC10 treba biti manji od 20 %.
|
|
46.
|
Ispunjavanje kriterija prihvatljivosti znači da sustav testa pravilno funkcionira, ali time se ne osigurava da će svaki pojedinačni ciklus dati točne rezultate. Ponavljanje rezultata prvog ciklusa najbolje je jamstvo toga da su dobiveni točni podaci.
|
|
47.
|
U slučaju testa agonista estrogenskog receptora, ako je za ispitivanje za pozitivne ispitivane kemikalije, osobito za kemikalije PC10-PC49 te kemikalije za koje se sumnja da pretjerano stimuliraju luciferazu, potrebno više informacija u svrhu probira i utvrđivanja prioriteta ove smjernice za ispitivanje, upotrebom antagonista ERα može se potvrditi da je uočena aktivnost luciferaze isključivo odgovor specifičan za ERα (vidjeti Dodatak 2.1.).
|
IZVJEŠĆE O ISPITIVANJU
|
48.
|
Vidjeti stavak 20. odjeljka „SASTAVNICE ER TA TESTA”.
|
LITERATURA
|
1.
|
OECD (2015). Report of the Inter-Laboratory Validation for Stably Transfected Transactivation Assay to detect Estrogenic and Anti-estrogenic Activity. Environment, Health and Safety Publications, Series on Testing and Assessment (No 225), Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
2.
|
Escande A., et al. (2006). Evaluation of Ligand Selectivity Using Reporter Cell Lines Stably Expressing Estrogen Receptor Alpha or Beta, Biochem. Pharmacol., 71, 1 459.–1 469.
|
|
3.
|
Kuiper G.G., et al. (1998). Interaction of Estrogenic Chemicals and Phytoestrogens with Estrogen Receptor Beta, Endocrinol., 139, 4 252.–4 263.
|
|
4.
|
Spaepen M., et al. (1992). Detection of Bacterial and Mycoplasma Contamination in Cell Cultures by Polymerase Chain Reaction, FEMS Microbiol. Lett., 78(1), 89.–94.
|
|
5.
|
Kobayashi H., et al. (1995). Rapid Detection of Mycoplasma Contamination in Cell Cultures by Enzymatic Detection of Polymerase Chain Reaction (PCR) Products, J. Vet. Med. Sci., 57(4), 769.–71.
|
|
6.
|
Dussurget O. and Roulland-Dussoix D. (1994). Rapid, Sensitive PCR-Based Detection of Mycoplasmas in Simulated Samples of Animal Sera, Appl. Environ. Microbiol., 60(3), 953.–9.
|
|
7.
|
De Lean A., Munson P.J. and Rodbard D. (1978). Simultaneous Analysis of Families of Sigmoidal Curves: Application to Bioassay, Radioligand Assay, and Physiological Dose-Response Curves, Am. J. Physiol., 235, E97.–El02.
|
Dodatak 2.1.
LAŽNO POZITIVNI REZULTATI: PROCJENA SIGNALA LUMINISCENCIJE KOJIMA NE POSREDUJU RECEPTORI
|
1.
|
Lažno pozitivne rezultate u testu agonista estrogenskog receptora može uzrokovati aktivacija gena luciferaze koja nije posredovana estrogenskim receptorom ili izravna aktivacija genskog produkta ili nepovezana fluorescencija. Na takve učinke upućuje nepotpuna ili neobična krivulja doza – odgovor. Ako se sumnja na takve učinke, treba ispitati učinak antagonista estrogenskog receptora (npr. 4-hidroksitamoksifena (OHT) pri koncentraciji koja nije toksična) na odgovor. U tu svrhu možda neće biti primjeren čisti antagonist ICI 1827 80 jer dovoljna koncentracija antagonista ICI 1827 80 može smanjiti vrijednost kontrole s nosačem, a to će utjecati na analizu podataka.
|
|
2.
|
Kako bi se osigurala valjanost ovog pristupa, na istoj se ploči mora ispitati:
|
—
|
agonističko djelovanje nepoznate kemikalije sa/bez 10 μM OHT-a,
|
|
—
|
kontrola s nosačem (tri ponavljanja),
|
|
—
|
1 nM E2 (tri ponavljanja) kao agonistička pozitivna kontrola,
|
|
—
|
1 nM E2 + OHT (tri ponavljanja).
|
|
Kriteriji za tumačenje podataka
Napomena: sve jažice treba tretirati istom koncentracijom nosača.
|
—
|
Ako tretiranje antagonistom estrogenskog receptora NE utječe na agonističko djelovanje nepoznate kemikalije, ona se razvrstava kao „negativna”.
|
|
—
|
Ako je agonističko djelovanje nepoznate kemikalije potpuno inhibirano, primjenjuju se kriteriji za donošenje odluke.
|
|
—
|
Ako je agonističko djelovanje pri najmanjoj koncentraciji jednako ili veće od odgovora PC10, nepoznata kemikalija inhibirana je jednako ili više od odgovora PC10. Računa se razlika u odgovorima između jažica koje nisu tretirane i koje su tretirane agonistom estrogenskog receptora i tu razliku treba smatrati stvarnim odgovorom i koristiti za izračun odgovarajućih parametara kako bi se omogućilo donošenje odluke o razvrstavanju.
|
Analiza podataka
Provjeriti zahtjeve izvedbe.
Provjeriti koeficijent varijacije između jažica tretiranih u istim uvjetima.
|
1.
|
Izračunati srednju vrijednost kontrole s nosačem.
|
|
2.
|
Oduzeti srednju vrijednost kontrole s nosačem od vrijednosti svake jažice koja nije tretirana OHT-om.
|
|
3.
|
Izračunati srednju vrijednost OHT-a.
|
|
4.
|
Oduzeti srednju vrijednost kontrole s nosačem od vrijednosti svake jažice koja je tretirana OHT-om.
|
|
5.
|
Izračunati srednju vrijednost pozitivne kontrole.
|
|
6.
|
Izračunati relativnu transkripcijsku aktivnost svih ostalih jažica u odnosu na pozitivnu kontrolu.
|
Dodatak 2.2.
PRIPREMA SERUMA TRETIRANOG UGLJENOM PREMAZANIM DEKSTRANOM (DCC)
|
1.
|
Tretiranje seruma ugljenom premazanim dekstranom (DCC) opća je metoda za uklanjanje estrogenih spojeva iz seruma koji se dodaje mediju za stanice kako bi se isključio pristrani odgovor povezan s preostalim estrogenom u serumu. Ovim se postupkom može tretirati 500 ml fetalnog goveđeg seruma (FBS).
|
Sastavnice
|
2.
|
Bit će potrebni sljedeći materijali i oprema:
|
Materijali
|
Magnezijev klorid heksahidrat (MgCl2·6H2O)
|
|
1 M puferske otopine HEPES (pH 7,4)
|
|
Ultračista voda dobivena sustavom za filtriranje
|
Oprema
Staklena posuda obrađena u autoklavu (veličinu treba prilagoditi po potrebi) Opća laboratorijska centrifuga (u kojoj se temperatura može postaviti na 4 °C)
Postupak
|
3.
|
Sljedeći postupak prilagođen je za upotrebu epruveta za centrifugiranje od 50 ml.
[Dan 1.] Pripremiti suspenziju ugljena premazanog dekstranom s 1 l ultračiste vode koja sadržava 1,5 mM MgCl2, 0,25 M saharoze, 2,5 g ugljena, 0,25 g dekstrana i 5 mM HEPES-a te miješati preko noći na 4 °C.
[Dan 2.] Uliti suspenziju u epruvete za centrifugiranje od 50 ml i centrifugirati deset minuta na 10 000 °/min i temperaturi od 4 °C. Ukloniti supernatant i pohraniti polovinu sedimenta ugljena na temperaturi od 4 °C za upotrebu na dan 3. Suspendirati drugu polovinu ugljena s FBS-om koji je postupno odmrznut kako bi se izbjeglo taloženje i inaktiviran toplinom 30 minuta na 56 °C, a zatim prenijeti u staklenu posudu obrađenu u autoklavu kao što je Erlenmeyerova tikvica. Ovu suspenziju lagano miješati preko noći na temperaturi od 4 °C.
[Dan 3.] Uliti suspenziju s FBS-om u epruvete za centrifugiranje i centrifugirati deset minuta na 10 000 °/min i temperaturi od 4 °C. Prikupiti FBS i prenijeti ga u novi sediment ugljena pripremljen i pohranjen na dan 2. Suspendirati sediment ugljena i preko noći lagano miješati tu suspenziju na 4 °C u staklenoj posudi obrađenoj u autoklavu.
[Dan 4.] Uliti suspenziju i centrifugirati je deset minuta na 10 000 °/min i temperaturi od 4 °C te sterilizirati supernatant filtriranjem kroz sterilni filtar od 0,2 μm. Ovaj FBS tretiran DCC-om treba pohraniti na -20 °C i može se upotrijebiti u roku od godinu dana.
|
Dodatak 3.
TEST TRANSAKTIVACIJE ESTROGENSKOG RECEPTORA ZA OTKRIVANJE AGONISTA I ANTAGONISTA ESTROGENSKOG RECEPTORA PRIMJENOM STANIČNE LINIJE VM7LUC
POČETNA RAZMATRANJA I OGRANIČENJA (VIDJETI I OPĆI UVOD)
|
1.
|
U ovom se testu upotrebljava stanična linija VM7Luc4E2 (64). Validirali su ga NICEATM (Nacionalni toksikološki program Međuagencijskog centra za evaluaciju alternativnih toksikoloških metoda) i ICCVAM (Međuagencijski koordinacijski odbor za validaciju alternativnih metoda) (1.). Stanične linije VM7Luc uglavnom eksprimiraju endogeni ERα i manju količinu endogenog ERβ (2., 3. i 4.).
|
|
2.
|
Ovaj je test primjenjiv na velik raspon tvari pod uvjetom da se one mogu otopiti u dimetilsulfoksidu (DMSO; CAS br. 67-68-5), da ne reagiraju s DMSO-om ili medijem za uzgoj stanične kulture te da nisu citotoksične pri koncentracijama koje se ispituju. Ako nije moguće upotrijebiti DMSO, može se upotrijebiti drugi nosač kao što su etanol ili voda (vidjeti stavak 12.). Dokazana uspješnost testa (ant)agonista VM7Luc ER TA ukazuje na to da podaci koju se dobiju primjenom tog testa mogu dati informacije o mehanizmima djelovanja kojima posreduje estrogenski receptori te bi ga se moglo uzeti u obzir pri utvrđivanju prioriteta tvari za daljnje ispitivanje.
|
|
3.
|
Ovaj je test posebno osmišljen za otkrivanje transaktivacije kojom posreduju hERα i hERß mjerenjem kemiluminiscencije kao krajnje točke. Kemiluminiscencija se često upotrebljava u biotestovima jer daje dovoljno snažan signal u odnosu na pozadinu. Međutim, aktivnost luciferaze krijesnica u testovima na staničnoj osnovi mogu poremetiti tvari koje inhibiraju enzim luciferaze, što uzrokuje i prividnu inhibiciju ili povećanu luminiscenciju zbog stabilizacije proteina. Osim toga, kod nekih luciferaznih testova reporterskog gena estrogenskog receptora pri koncentracijama fitoestrogena većima od 1 μM zabilježeni su signali luminiscencije kojima ne posreduju receptori zbog pretjerane aktivacije reporterskog gena za luciferazu (9) (11). Iako krivulja doza – odgovor pokazuje da do stvarne aktivacije sustava estrogenskog receptora dolazi pri manjim koncentracijama, ekspresiju luciferaze dobivenu pri visokim koncentracijama fitoestrogena ili sličnih spojeva za koje se pretpostavlja da poput fitoestrogena dovode do pretjerane aktivacije reporterskog gena za luciferazu treba pažljivo ispitati sustavima ER TA testova sa stabilnom transfekcijom.
|
|
4.
|
Prije upotrebe ovog testa u regulatorne svrhe treba pročitati odjeljke „OPĆI UVOD” i „SASTAVNICE ER TA TESTA”. Definicije i kratice upotrijebljene u ovoj ispitnoj metodi opisuju se u Dodatku 1.
|
NAČELO TESTA (VIDJETI I OPĆI UVOD)
|
5.
|
Test se upotrebljava kako bi se označilo vezivanje estrogenskog receptora i liganda, nakon čega kompleks receptora i liganda translocira u jezgru. U jezgri se kompleks receptora i liganda veže na specifične elemente DNK odgovora i transaktivira reporterski gen (luc), što dovodi do nastanka luciferaze i kasnije emisije svjetla, koja se može kvantificirati s pomoću luminometra. Aktivnost luciferaze može se procijeniti brzo i jeftino primjenom nekoliko komercijalno dostupnih pribora za ispitivanje. U testu VM7Luc ER TA upotrebljava se stanična linija humanog adenokarcinoma dojke koja reagira na estrogenski receptor, VM7, koja je stabilno transficirana konstruktom reporterskog gena luc krijesnice koji kontroliraju četiri elementa odgovora estrogena postavljena uzlazno od promotora virusa mišjeg tumora dojke (MMTV) kako bi se otkrile tvari s in vitro agonističkim ili antagonističkim djelovanjem na estrogenski receptor. Taj promotor MMTV-a pokazuje samo manju unakrsnu reaktivnost s ostalim steroidnim i nesteroidnim hormonima (8.). Kriteriji za tumačenje podataka podrobno su opisani u stavku 41. Ukratko, pozitivni odgovor utvrđuje se na temelju krivulje koncentracija – odgovor, koja sadržava najmanje tri točke sa stupcima pogreške koje se ne preklapaju (srednja vrijednost ± standardna devijacija) te promjene amplitude (normalizirana relativna jedinica svjetlosti (RLU)) od najmanje 20 % najveće vrijednosti za referentnu normu (17β-estradiol [E2; CAS br. 50-28-2] za test agonista, raloksifen HCl [Ral; CAS br. 84449-90-1]/E2 za test antagonista).
|
POSTUPAK
Stanična linija
|
6.
|
Za test bi se trebala upotrebljavati stabilno transficirana stanična linija VM7Luc4E2. Stanična linija trenutačno je dostupna samo sklapanjem tehničkog sporazuma o licenciranju s ustanovom University of California, Davis, Kalifornija, SAD (65) i društvom Xenobiotic Detection Systems Inc., Durham, Sjeverna Karolina, SAD (66).
|
Stabilnost stanične linije
|
7.
|
Kako bi se održali stabilnost i integritet stanične linije, stanice treba uzgajati za više od jedne pasaže od zamrznute matične zalihe u mediju za održavanje stanica (vidjeti stavak 9.). Stanice se ne bi trebale uzgajati za više od 30 pasaža. Za staničnu liniju VM7Luc4E2 30 pasaža trajat će približno tri mjeseca.
|
Stanična kultura i uvjeti nasađivanja
|
8.
|
Treba poštovati postupke utvrđene u Smjernicama za dobru praksu za stanične kulture (5. i 6.) kako bi se osigurala kvaliteta svih materijala i metoda te tako održali integritet, valjanost i obnovljivost svih provedenih aktivnosti.
|
|
9.
|
Stanice VM7Luc4E2 održavaju se u mediju RPMI 1640 obogaćenom s 0,9 % mješavine penicilina i streptomicina i 8,0 % fetalnog goveđeg seruma (FBS) u namjenskom inkubatoru kulture tkiva na 37 oC ± 1 oC, vlažnosti od 90 % ± 5 % i s 5,0 % ± 1 % CO2 u zraku.
|
|
10.
|
Kada se dosegne konfluencija od ~ 80 %, uzgaja se supkultura stanica VM7Luc4E2 koje se kondicioniraju na okolinu bez estrogena 48 sati prije nasađivanja na ploče s 96 jažica radi izlaganja ispitivanim kemikalijama i analize indukcije aktivnosti luciferaze koja ovisi o estrogenu. Medij bez estrogena (EFM) sadržava Dulbeccov modificirani Eagleov medij (DMEM) obogaćen s 4,5 % FBS-a tretiranog ugljenom premazanim dekstranom, 1,9 % L-glutamina i 0,9 % mješavine penicilina i streptomicina. U plastičnoj opremi ne smije biti estrogene aktivnosti [vidjeti podrobni protokol (7.)].
|
Kriteriji prihvatljivosti
|
11.
|
Prihvaćenje ili odbijanje ispitivanja temelji se na procjeni rezultata referentne norme i kontrole iz svakog pokusa provedenog na pločici s 96 jažica. Svaka referentna norma ispituje se s više koncentracija i koristi se više uzoraka svake referentne i kontrolne koncentracije. Rezultati se uspoređuju s kontrolama kvalitete (KK) u pogledu tih parametara koji su izvedeni iz baza prijašnjih podataka o agonistima i antagonistima koje je izradio svaki laboratorij tijekom dokazivanja osposobljenosti. Baze prijašnjih podataka kontinuirano se dopunjuju vrijednostima referentnih normi i kontrola. Promjene u opremi ili laboratorijskim uvjetima možda će zahtijevati ažuriranje baza prijašnjih podataka.
|
Test agonista
Ispitivanje za utvrđivanje raspona
|
•
|
Indukcija: indukciju na ploči treba mjeriti tako da se prosječna vrijednost relativne jedinice svjetlosti (RLU) najveće referentne norme E2 podijeli prosječnom vrijednosti RLU kontrole s DMSO-om. Obično se postiže peterostruka indukcija, ali u svrhu prihvaćanja indukcija bi trebala biti četverostruka ili veća.
|
|
•
|
Rezultati kontrola s DMSO-om: vrijednosti RLU kontrole s otapalom trebale bi biti do 2,5 puta standardne devijacije srednje vrijednosti RLU prijašnje kontrole s otapalom.
|
|
•
|
Pokus koji ne ispuni bilo koji kriterij prihvatljivosti treba odbaciti i ponoviti.
|
Iscrpno ispitivanje
Obuhvaća kriterije prihvatljivosti iz ispitivanja za utvrđivanje raspona agonista i sljedeće:
|
•
|
rezultate referentne norme: krivulja koncentracija – odgovor referentne norme E2 trebala bi imati sigmoidni oblik i barem tri vrijednosti koje se nalaze na linearnom dijelu krivulje koncentracija – odgovor,
|
|
•
|
rezultate pozitivne kontrole: vrijednosti RLU kontrole s metoksiklorom trebale bi biti veće od srednje vrijednosti DMSO-a uvećane za tri standardne devijacije srednje vrijednosti DMSO-a,
|
|
•
|
pokus koji ne ispuni bilo koji kriterij prihvatljivosti treba odbaciti i ponoviti.
|
Test antagonista
Ispitivanje za utvrđivanje raspona
|
•
|
Smanjenje: smanjenje na ploči mjeri se tako da se prosječna vrijednost relativne jedinice svjetlosti (RLU) najveće referentne norme Ral/E2 podijeli prosječnom vrijednosti RLU kontrole s DMSO-om. Obično se postiže peterostruko smanjenje, ali u svrhu prihvaćanja smanjenje bi trebalo biti trostruko ili veće.
|
|
•
|
Rezultati kontrole s E2: vrijednosti RLU kontrole s E2 trebale bi biti do 2,5 puta standardne devijacije srednje vrijednosti RLU prijašnje kontrole s E2.
|
|
•
|
Rezultati kontrola s DMSO-om: vrijednosti RLU kontrole s DMSO-om trebale bi biti do 2,5 puta standardne devijacije srednje vrijednosti RLU prijašnje kontrole s otapalom.
|
|
•
|
Pokus koji ne ispuni bilo koji kriterij prihvatljivosti odbacuje se i ponavlja.
|
Iscrpno ispitivanje
Obuhvaća kriterije prihvatljivosti iz ispitivanja za utvrđivanje raspona antagonista i sljedeće:
|
•
|
rezultate referentne norme: krivulja koncentracija – odgovor referentne norme Ral/E2 trebala bi imati sigmoidni oblik i barem tri vrijednosti koje se nalaze na linearnom dijelu krivulje koncentracija – odgovor,
|
|
•
|
rezultate pozitivne kontrole: vrijednosti RLU kontrole s tamoksifenom/E2 trebale bi biti manje od srednje vrijednosti kontrole s E2 umanjene za tri standardne devijacije srednje vrijednosti kontrole s E2,
|
|
•
|
pokus koji ne ispuni bilo koji kriterij prihvatljivosti odbacuje se i ponavlja.
|
Referentne norme, pozitivne kontrole i kontrole s nosačem
Kontrola s nosačem (testovi agonista i antagonista)
|
12.
|
Nosač koji se upotrebljava za otapanje ispitivanih kemikalija treba ispitati kao kontrolu s nosačem. Nosač koji se koristio tijekom validacije testa VM7Luc ER TA bio je 1-postotni (v/v) dimetilsulfoksid (DMSO, CAS br. 67-68-5) (vidjeti stavak 24.). Ako se upotrebljava nosač koji nije DMSO, sve referentne norme, kontrole i ispitivane kemikalije treba prema potrebi ispitati u istom nosaču.
|
Referentna norma (utvrđivanje raspona agonista)
|
13.
|
Referentnu normu čini E2 (CAS br. 50-28-2). Za ispitivanje za utvrđivanje raspona referentna norma sastoji se od serijskog razrjeđivanja četiriju koncentracija E2 (1,84 x 10–10, 4,59 x 10–11, 1,15 x 10–11 i 2,87 x 10–12 M), pri čemu se svaka koncentracija ispituje u dvostrukim jažicama.
|
Referentna norma (iscrpno ispitivanje agonista)
|
14.
|
E2 za iscrpno ispitivanje sastoji se od serijskog razrjeđivanja u omjeru 1: 2 koje se sastoji od 11 koncentracija (u rasponu od 3,67 x 10–10 do 3,59 x 10–13 M) E2 u dvostrukim jažicama.
|
Referentna norma (utvrđivanje raspona antagonista)
|
15.
|
Referentna norma kombinacija je tvari Ral (CAS br. 84449-90-1) i E2 (CAS br. 50-28-2). Ral/E2 za ispitivanje za utvrđivanje raspona sastoji se od serijskog razrjeđivanja triju koncentracija tvari Ral (3,06 x 10–9, 7,67 x 10–10 i 1,92 x 10–10 M) i fiksne koncentracije (9,18 × 10-11 M) E2 u dvostrukim jažicama.
|
Referentna norma (iscrpno ispitivanje antagonista)
|
16.
|
Ral/E2 za iscrpno ispitivanje sastoji se od serijskog razrjeđivanja tvari Ral u omjeru 1: 2 (u rasponu od 2,45 x 10–8 do 9,57 x 10–11 M) i fiksne koncentracije (9,18 × 10–11 M) E2, a obuhvaća devet koncentracija tvari Ral/E2 u dvostrukim jažicama.
|
Slaba pozitivna kontrola (agonist)
|
17.
|
Slabu pozitivnu kontrolu čini 9,06 x 10–6 M p,p’-metoksiklora (metoksiklor; CAS br. 72-43-5) u EFM-u.
|
Slaba pozitivna kontrola (antagonist)
|
18.
|
Slaba pozitivna kontrola sastoji se od tamoksifena (CAS br. 10540-29-1) 3,36 x 10–6 M s 9,18 × 10-11 M E2 u EFM-u.
|
Kontrola s E2 (samo za test antagonista)
|
19.
|
Kontrolu s E2 čini 9,18 × 10–11 M E2 u EFM-u i koristi se kao osnovna negativna kontrola.
|
Multiplikacijski faktor indukcije (agonist)
|
20.
|
Indukcija aktivnosti luciferaze referentne norme (E2) mjeri se tako da se prosječna vrijednost RLU najveće referentne norme E2 podijeli prosječnom vrijednosti RLU kontrole s DMSO-om i rezultat bi trebao biti veći od četverostruke vrijednosti.
|
Multiplikacijski faktor smanjenja (antagonist)
|
21.
|
Srednja aktivnost luciferaze za referentnu normu (Ral/E2) mjeri se tako da se prosječna vrijednost RLU najveće referentne norme Ral/E2 podijeli prosječnom vrijednosti RLU kontrole s DMSO-om i trebala bi biti veća od trostruke vrijednosti.
Dokazivanje osposobljenosti laboratorija (vidjeti stavak 14. i tablice 3. i 4. u odjeljku „SASTAVNICE ER TA TESTA” ove ispitne metode)
|
Nosač
|
22.
|
Ispitivane kemikalije treba otopiti u otapalu koje otapa tu ispitivanu kemikaliju te se može miješati s medijem za stanice. Primjereni su nosači voda, etanol (čistoće od 95 % do 100 %) i DMSO. Ako se upotrebljava DMSO, ne bi se trebalo koristiti više od 1 % (v/v). Za sve bi nosače trebalo dokazati da najveći volumen koji se upotrebljava nije citotoksičan i da ne utječe na uspješnost testa. Referentne norme i kontrole otapaju se u 100-postotnom otapalu i zatim se razrjeđuju na odgovarajuće koncentracije u EFM-u.
|
Priprema ispitivanih kemikalija
|
23.
|
Ispitivane kemikalije otapaju se u 100-postotnom DMSO-u (ili odgovarajućem otapalu) i zatim se razrjeđuju na odgovarajuće koncentracije u EFM-u. Sve ispitivane kemikalije trebalo bi ostaviti tako da se njihova temperatura izjednači sa sobnom temperaturom prije nego što ih se otopi i razrijedi. Za svaki pokus treba pripremiti svježe otopine ispitivane kemikalije. U otopinama ne smije biti primjetan talog ili zamućenje. Uzorci referentne norme i kontrole mogu se pripremati zbirno; međutim, za svaki pokus treba pripremiti svježu konačnu referentnu normu, razrjeđivanja kontrole i ispitivane kemikalije i treba ih upotrijebiti u roku od 24 sata od pripreme.
|
Topljivost i citotoksičnost: razmatranja o utvrđivanju raspona
|
24.
|
Ispitivanje za utvrđivanje raspona sastoji se od serijskih razrjeđivanja u sedam točaka u omjeru 1: 10 i provodi se dvaput. Ispitivane kemikalije prvo se ispituju do najveće koncentracije od 1 mg/ml (~ 1 mM) za test agonista i 20 μg/ml (~ 10 μM) za test antagonista. Pokusi za utvrđivanje raspona provode se kako bi se utvrdilo sljedeće:
|
|
—
|
početne koncentracije ispitivane kemikalije koje će se upotrebljavati tijekom iscrpnog ispitivanja,
|
|
—
|
razrjeđivanja ispitivane kemikalije (1: 2 ili 1: 5) koja će se upotrebljavati tijekom iscrpnog ispitivanja.
|
|
25.
|
U protokole za test agonista i antagonista uključena je procjena vijabilnosti stanica/citotoksičnosti (7.) te se ona uključuje u test za utvrđivanje raspona i iscrpno ispitivanje. Metoda citotoksičnosti upotrijebljena za procjenu vijabilnosti stanica tijekom validacije testa VM7Luc ER TA (1.) bila je metoda razmjernog kvalitativnog vizualnog opažanja; međutim, za utvrđivanje citotoksičnosti može se upotrijebiti kvantitativna metoda (vidjeti protokol (7.)). Ne mogu se upotrebljavati podaci iz koncentracija ispitivane kemikalije koje uzrokuju smanjenje vijabilnosti veće od 20 %.
|
Izlaganje ispitivanoj kemikaliji i organizacija testne ploče
|
26.
|
Stanice se broje i nasađuju na ploče s kulturom tkiva s 96 jažica (2 × 105 stanica po jažici) u EFM-u i inkubiraju se 24 sata kako bi se omogućilo da se stanice pričvrste na ploču. EFM se uklanja i zamjenjuje ispitivanim i referentnim kemikalijama u EFM-u te se inkubira 19–24 sata. Posebnu pozornost treba posvetiti tvarima koje su jako hlapljive jer kontrolne jažice koje se nalaze u blizini mogu dati lažno pozitivne rezultate. U tim slučajevima mogu pomoći „poklopci za ploče” kojima se učinkovito izoliraju pojedinačne jažice pa se stoga preporučuje njihova upotreba.
|
Ispitivanja za utvrđivanje raspona
|
27.
|
U ispitivanjima za utvrđivanje raspona upotrebljavaju se sve jažice ploče s 96 jažica kako bi se dvaput ispitalo do šest ispitivanih kemikalija kao serijska razrjeđivanja u sedam točaka u omjeru 1: 10 (vidjeti slike 1. i 2.).
|
|
—
|
U ispitivanju za utvrđivanje raspona agonista upotrebljavaju se četiri koncentracije E2 u dva ponavljanja kao referentna norma i četiri jažice s ponavljanjem za kontrolu s DMSO-om.
|
|
—
|
U ispitivanju za utvrđivanje raspona antagonista upotrebljavaju se tri koncentracije tvari Ral/E2 s 9,18 × 10-11 M E2 u dva ponavljanja kao referentna norma i tri jažice s ponavljanjem za kontrole s E2 i DMSO-om.
|
Slika 1.
Raspored na ploči s 96 jažica kod ispitivanja za utvrđivanje raspona agonista

Kratice: E2-1 do E2-4 = koncentracije referentne norme E2 (od visoke do niske); TC1-1 do TC1-7 = koncentracije (od visoke do niske) ispitivane kemikalije 1 (TC1); TC2-1 do TC2-7 = koncentracije (od visoke do niske) ispitivane kemikalije 2 (TC2); TC3-1 do TC3-7 = koncentracije (od visoke do niske) ispitivane kemikalije 3 (TC3); TC4-1 do TC4-7 = koncentracije (od visoke do niske) ispitivane kemikalije 4 (TC4); TC5-1 do TC5-7 = koncentracije (od visoke do niske) ispitivane kemikalije 5 (TC5); TC6-1 do TC6-7 = koncentracije (od visoke do niske) ispitivane kemikalije 6 (TC6); VC = kontrola s nosačem (DMSO (1 % v/v EFM-a)).
Slika 2.
Raspored na ploči s 96 jažica kod ispitivanja za utvrđivanje raspona antagonista
Kratice: E2 = kontrola s E2; Ral-1 do Ral-3 = koncentracije raloksifena/referentne norme E2 (od visoke do niske); TC1-1 do TC1-7 = koncentracije (od visoke do niske) ispitivane kemikalije 1 (TC1); TC2-1 do TC2-7 = koncentracije (od visoke do niske) ispitivane kemikalije 2 (TC2); TC3-1 do TC3-7 = koncentracije (od visoke do niske) ispitivane kemikalije 3 (TC3); TC4-1 do TC4-7 = koncentracije (od visoke do niske) ispitivane kemikalije 4 (TC4); TC5-1 do TC5-7 = koncentracije (od visoke do niske) ispitivane kemikalije 5 (TC5); TC6-1 do TC6-7 = koncentracije (od visoke do niske) ispitivane kemikalije 6 (TC6); VC = kontrola s nosačem (DMSO [1 % v/v EFM-a]).
Napomena: Sve ispitivane kemikalije ispituju se s 9,18 × 10-11 M E2.
|
28.
|
Preporučeni konačni volumen medija potrebnog za svaku jažicu iznosi 200 μl. Trebaju se upotrebljavati samo ispitne ploče kod kojih vijabilnost stanica u svim jažicama iznosi 80 % ili više.
|
|
29.
|
Utvrđivanje početne koncentracije za iscrpno ispitivanje
agonista
podrobno je opisano u protokolu za agoniste (7.). Ukratko, primjenjuju se sljedeći kriteriji:
|
|
—
|
ako na krivulji koncentracije ispitivane kemikalije nema točaka koje su veće od srednje vrijednosti uvećane za tri standardne devijacije kontrole s DMSO-om, iscrpno ispitivanje provest će se upotrebom serijskog razrjeđivanja u 11 točaka u omjeru 1: 2, počevši od najviše topljive koncentracije,
|
|
—
|
ako na krivulji koncentracije ispitivane kemikalije postoje točke koje su veće od srednje vrijednosti uvećane za tri standardne devijacije kontrole s DMSO-om, početna koncentracija koja se u iscrpnom ispitivanju upotrebljava za plan razrjeđivanja od 11 točaka treba biti jedan log viša od koncentracije koja je dala najvišu prilagođenu vrijednost RLU u ispitivanju za utvrđivanje raspona. Plan razrjeđivanja od 11 točaka temeljit će se na omjeru 1: 2 ili 1: 5 u skladu sa sljedećim kriterijima:
|
serijsko razrjeđivanje od 11 točaka u omjeru 1: 2 treba upotrijebiti ako će nastali raspon koncentracija obuhvaćati cijeli raspon odgovora na temelju krivulje koncentracija – odgovor koja je nastala u ispitivanju za utvrđivanje raspona. U suprotnom treba upotrijebiti razrjeđivanje u omjeru 1: 5,
|
|
|
—
|
ako ispitivana kemikalija u ispitivanju za utvrđivanje raspona pokaže dvofazičnu krivulju koncentracija – odgovor, obje faze treba utvrditi i u iscrpnom ispitivanju.
|
|
30.
|
Utvrđivanje početnih koncentracija za iscrpno ispitivanje
antagonista
podrobno je opisano u protokolu za antagoniste (7.). Ukratko, primjenjuju se sljedeći kriteriji:
|
|
—
|
ako na krivulji koncentracije ispitivane kemikalije nema točaka koje su manje od srednje vrijednosti umanjene za tri standardne devijacije kontrole E2, iscrpno ispitivanje provest će se upotrebom serijskog razrjeđivanja u 11 točaka u omjeru 1: 2, počevši od najviše topljive koncentracije,
|
|
—
|
ako na krivulji koncentracije ispitivane kemikalije postoje točke koje su manje od prosječne vrijednosti umanjene za tri standardne devijacije kontrole s E2, početna koncentracija koja se u iscrpnom ispitivanju upotrebljava za plan razrjeđivanja od 11 točaka treba biti jedna od sljedećih opcija:
|
—
|
koncentracija koja daje najmanju prilagođenu vrijednost RLU u testu za utvrđivanje raspona,
|
|
—
|
najviša topljiva koncentracija (vidjeti protokol za antagoniste (7.), slika 14-2.),
|
|
—
|
najniža citotoksična koncentracija (vidjeti protokol za antagoniste (7.), slika 14-3. za povezani primjer),
|
|
|
—
|
plan razrjeđivanja od 11 točaka temeljit će se na serijskom razrjeđivanju u omjeru 1: 2 ili 1: 5 u skladu sa sljedećim kriterijima:
|
serijsko razrjeđivanje od 11 točaka u omjeru 1: 2 treba upotrijebiti ako će nastali raspon koncentracija obuhvaćati cijeli raspon odgovora na temelju krivulje koncentracija – odgovor koja je nastala u ispitivanju za utvrđivanje raspona. U suprotnom treba upotrijebiti razrjeđivanje u omjeru 1: 5.
|
|
Iscrpno ispitivanje
|
31.
|
Iscrpno ispitivanje sastoji se od serijskih razrjeđivanja od 11 točaka (serijska razrjeđivanja u omjeru 1: 2 ili 1: 5 na temelju početne koncentracije za kriterije iscrpnih testova), pri čemu se svaka koncentracija ispituje u trostrukim jažicama ploče s 96 jažica (vidjeti slike 3. i 4.).
|
|
—
|
U iscrpnom ispitivanju agonista kao referentna norma upotrebljava se 11 koncentracija E2 u dva ponavljanja. Svaka ploča uključuje četiri jažice s ponavljanjem za kontrolu s DMSO-om i četiri jažice s ponavljanjem za kontrolu s metoksiklorom (9,06 x 10–6 M).
|
|
—
|
U iscrpnom ispitivanju antagonista kao referentna norma upotrebljava se devet koncentracija tvari Ral/E2 s 9,18 × 10-11 M E2 u dva ponavljanja, s četiri jažice s ponavljanjem za kontrolu 9,18 x 10–11 M E2, četiri jažice s ponavljanjem za kontrolu s DMSO-om i četiri jažice s ponavljanjem za tamoksifen 3,36 x 10-6 M.
|
Slika 3.
Raspored na ploči s 96 jažica kod iscrpnog ispitivanja agonista
Kratice: TC1-1 do TC1-11 = koncentracije ispitivane kemikalije 1 (od visoke do niske); TC2-1 do TC2-11 = koncentracije ispitivane kemikalije 2 (od visoke do niske); E2-1 do E2-11 = koncentracije referentne norme E2 (od visoke do niske); Meth = slaba pozitivna kontrola p,p’ metoksiklor; VC = kontrola s nosačem DMSO (1 % v/v) u EFM-u.
Slika 4.
Raspored na ploči s 96 jažica kod iscrpnog ispitivanja antagonista
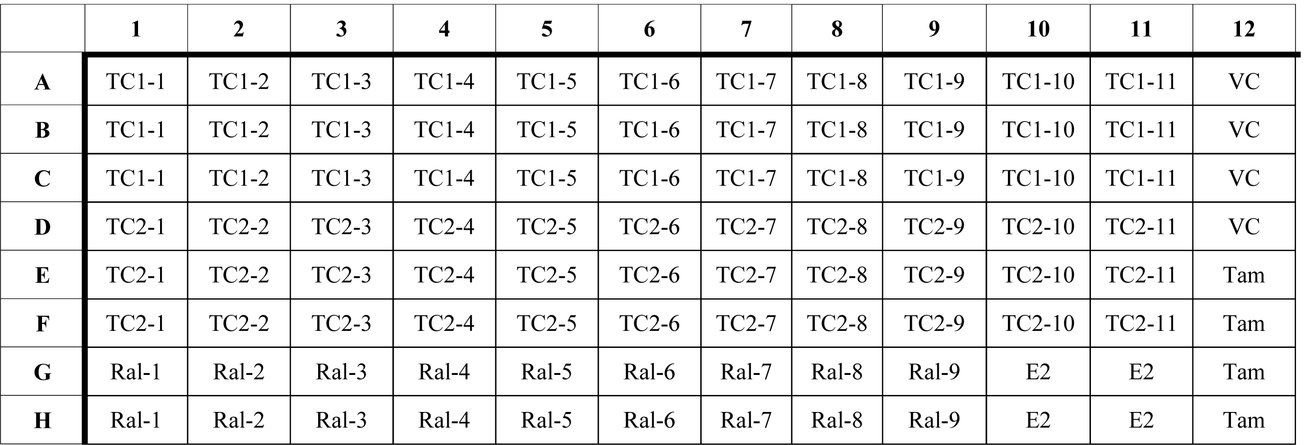
Kratice: E2 = kontrola s E2; Ral-1 do Ral-9 = koncentracije raloksifena/referentne norme E2 (od visoke do niske); Tam = slaba pozitivna kontrola s tamoksifenom/E2; TC1-1 do TC1-11 = koncentracije (od visoke do niske) ispitivane kemikalije 1 (TC1); TC2-1 do TC2-11 = koncentracije (od visoke do niske) ispitivane kemikalije 2 (TC2); VC = kontrola s nosačem (DMSO [1 % v/v EFM-a]).
Napomena: kako je navedeno, sve referentne i ispitivane jažice sadržavaju fiksnu koncentraciju E2 (9,18 x 10–11 M).
|
32.
|
Ponavljanja iscrpnih ispitivanja za istu kemikaliju treba provoditi na različite dane kako bi se osigurala neovisnost. Treba provesti barem dva iscrpna ispitivanja. Ako su rezultati testova kontradiktorni (npr. jedan je test pozitivan, a drugi negativan) ili ako jedan od testova nije primjeren, treba provesti treći dodatni test.
|
Mjera luminiscencije
|
33.
|
Luminiscencija se mjeri u rasponu od 300 do 650 nm, upotrebom ubrizgavajućeg luminometra sa softverom koji kontrolira volumen ubrizgavanja i interval mjerenja (7.). Emisija svjetlosti iz svake jažice izražava se kao RLU po jažici.
|
ANALIZA PODATAKA
Utvrđivanje vrijednosti EC50/IC50
|
34.
|
Vrijednost EC50 (pola najveće učinkovite koncentracije ispitivane kemikalije [agonisti]) i vrijednost IC50 (pola najveće inhibitorne koncentracije ispitivane kemikalije [antagonisti]) utvrđuju se na temelju podataka o koncentraciji i odgovoru. Za ispitivane kemikalije koje su pozitivne pri jednoj koncentraciji ili njih više, koncentracija ispitivane kemikalije koja uzrokuje pola najvećeg odgovora (IC50 ili EC50) računa se upotrebom analize Hillove funkcije ili primjerene alternative. Hillova funkcija logistički je matematički model s četiri parametra kojim se povezuju koncentracija ispitivane kemikalije i odgovor (obično u obliku sigmoidne krivulje) primjenom sljedeće jednadžbe:
|

pri čemu je:
X= logaritam koncentracije
Y= odgovor (tj. RLU-ovi)
dno= najmanji odgovor
vrh= najveći odgovor
lg EC50 (ili lg IC50)= logaritam od X kao odgovor koji se nalazi točno između vrha i dna
Hillov nagib= kosina krivulje.
Modelom se računa najbolja vrijednost za parametre vrha, dna, Hillova nagiba te vrijednosti IC50 i EC50. Za izračun vrijednosti EC50 i IC50 treba upotrijebiti primjereni statistički softver (npr. statistički softver Graphpad PrismR).
Utvrđivanje netipičnih vrijednosti
|
35.
|
Dobro statističko prosuđivanje moglo bi se olakšati uključivanjem (ali ne i isključivo) Q testa (vidjeti protokole za agoniste i antagoniste (7.) o utvrđivanju „neupotrebljivih” jažica koje će se isključiti iz analiza podataka).
|
|
36.
|
Za ponovljene uzorke referentne norme E2 (dva uzorka) bilo koja prilagođena vrijednost RLU za ponovljeni uzorak pri određenoj koncentraciji E2 smatra se netipičnom vrijednosti ako je za više od 20 % veća ili manja od prilagođene vrijednosti RLU te koncentracije iz baze prijašnjih podataka.
|
Prikupljanje i prilagodba podataka luminometra za ispitivanje za utvrđivanje raspona
|
37.
|
Neobrađene podatke iz luminometra treba prenijeti u predložak proračunske tablice koja je izrađena za test. Treba utvrditi postoje li netipične podatkovne točke koje treba ukloniti. (Vidjeti kriterije prihvatljivosti ispitivanja za parametre koji se utvrđuju u analizama.) Trebalo bi provesti sljedeće izračune.
|
Agonist
|
Korak 1.
|
Izračunati srednju vrijednost za kontrolu s nosačem DMSO.
|
|
Korak 2.
|
Oduzeti srednju vrijednost kontrole s nosačem DMSO od vrijednosti svake jažice kako bi se podaci normalizirali.
|
|
Korak 3.
|
Izračunati srednji multiplikacijski faktor indukcije za referentnu normu (E2).
|
|
Korak 4.
|
Izračunati srednju vrijednost EC50 za ispitivane kemikalije.
|
Antagonist
|
Korak 1.
|
Izračunati srednju vrijednost za kontrolu s nosačem DMSO.
|
|
Korak 2.
|
Oduzeti srednju vrijednost kontrole s nosačem DMSO od vrijednosti svake jažice kako bi se podaci normalizirali.
|
|
Korak 3.
|
Izračunati srednji multiplikacijski faktor smanjenja za referentnu normu (Ral/E2).
|
|
Korak 4.
|
Izračunati srednju vrijednost za referentnu normu E2.
|
|
Korak 5.
|
Izračunati srednju vrijednost IC50 za ispitivane kemikalije.
|
Prikupljanje i prilagodba podataka luminometra za iscrpna ispitivanja
|
38.
|
Neobrađene podatke iz luminometra treba prenijeti u predložak proračunske tablice koja je izrađena za test. Treba utvrditi postoje li netipične podatkovne točke koje treba ukloniti. (Vidjeti kriterije prihvatljivosti ispitivanja za parametre koji se utvrđuju u analizama.) Provode se sljedeći izračuni:
|
Agonist
|
Korak 1.
|
Izračunati srednju vrijednost za kontrolu s nosačem DMSO.
|
|
Korak 2.
|
Oduzeti srednju vrijednost kontrole s nosačem DMSO od vrijednosti svake jažice kako bi se podaci normalizirali.
|
|
Korak 3.
|
Izračunati srednji multiplikacijski faktor indukcije za referentnu normu (E2).
|
|
Korak 4.
|
Izračunati srednju vrijednost EC50 za E2 i ispitivane kemikalije.
|
|
Korak 5.
|
Izračunati srednju prilagođenu vrijednost RLU za metoksiklor.
|
Antagonist
|
Korak 1.
|
Izračunati srednju vrijednost za kontrolu s nosačem DMSO.
|
|
Korak 2.
|
Oduzeti srednju vrijednost kontrole s nosačem DMSO od vrijednosti svake jažice kako bi se podaci normalizirali.
|
|
Korak 3.
|
Izračunati srednji multiplikacijski faktor indukcije za referentnu normu (Ral/E2).
|
|
Korak 4.
|
Izračunati srednju vrijednost IC50 za Ral/E2 i ispitivane kemikalije.
|
|
Korak 5.
|
Izračunati srednju prilagođenu vrijednost RLU za tamoksifen.
|
|
Korak 6.
|
Izračunati srednju vrijednost za referentnu normu E2.
|
Kriteriji za tumačenje podataka
|
39.
|
Test VM7Luc ER TA dio je pristupa snage dokaza kako bi se pomoglo utvrditi prioritetne tvari za in vivo ispitivanje endokrine disrupcije. Dio ovog postupka za utvrđivanje prioriteta bit će razvrstavanje ispitivane kemikalije kao pozitivne ili negativne u pogledu agonističkog ili antagonističkog djelovanja na estrogenski receptor. Kriteriji za donošenje pozitivne i negativne odluke koji su upotrijebljeni u validacijskoj studiji testa VM7Luc ER TA opisani su u tablici 1.
|
Tablica 1.
Kriteriji za donošenje pozitivne i negativne odluke
|
|
|
AGONISTIČKO DJELOVANJE
|
|
Pozitivno
|
|
—
|
Sve ispitivane kemikalije razvrstane kao pozitivne na agonističko djelovanje na estrogenski receptor trebaju imati krivulju koncentracija – odgovor koja se sastoji od osnovice, nakon koje dolazi pozitivan nagib i završava platoom ili najvišom točkom. U nekim se slučajevima mogu utvrditi samo dva svojstva (osnovica – nagib ili nagib – najviša točka).
|
|
—
|
Linija koja označava pozitivan nagib treba sadržavati najmanje tri točke sa stupcima pogreške koje se ne preklapaju (srednja vrijednost ± standardna devijacija). Isključene su točke koje čine osnovicu, ali linearni dio krivulje može uključivati najvišu točku ili prvu točku platoa.
|
|
—
|
Za razvrstavanje kemikalije kao pozitivne potrebna je amplituda odgovora (razlika između osnovice i najviše točke) od najmanje 20 % najveće vrijednosti za referentnu normu, E2 (tj. 2 000 RLU-ova ili više ako je najveća vrijednost odgovora referentnih normi [E2] prilagođena na 10 000 RLU-ova).
|
|
—
|
Ako je moguće, treba izračunati vrijednost EC50 za svaku pozitivnu ispitivanu kemikaliju.
|
|
|
Negativno
|
Prosječni prilagođeni RLU za određenu koncentraciju jednak je ili manji od srednje vrijednosti RLU kontrole s DMSO-om uvećane za tri standardne devijacije RLU-a DMSO-a.
|
|
Neprimjereno
|
Podaci koji se ne mogu tumačiti kao valjani za pokazivanje prisutnosti ili izostanka aktivnosti zbog velikih kvalitativnih ili kvantitativnih ograničenja smatraju se neprimjerenima i ne mogu se koristiti za utvrđivanje je li ispitivana kemikalija pozitivna ili negativna. Kemikalije treba ponovno ispitati.
|
|
|
|
ANTAGONISTIČKO DJELOVANJE
|
|
Pozitivno
|
|
—
|
Podaci o ispitivanoj kemikaliji daju krivulju koncentracija – odgovor koja se sastoji od osnovice, nakon koje dolazi negativan nagib.
|
|
—
|
Linija koja označava negativan nagib treba sadržavati najmanje tri točke sa stupcima pogreške koje se ne preklapaju; isključene su točke koje čine osnovicu, ali linearni dio krivulje može uključivati prvu točku platoa.
|
|
—
|
Trebalo bi postojati smanjenje aktivnosti od najmanje 20 % najveće vrijednosti za referentnu normu, tvar Ral/E2 (tj. 8 000 RLU-ova ili manje ako je najveća vrijednost odgovora referentne norme [Ral/E2] prilagođena na 10 000 RLU-ova).
|
|
—
|
Najviše koncentracije ispitivane kemikalije koje nisu citotoksične trebale bi biti 1 x 10–5 M ili niže.
|
|
—
|
Ako je moguće, treba izračunati vrijednost IC50 za svaku pozitivnu ispitivanu kemikaliju.
|
|
|
Negativno
|
Sve podatkovne točke iznad su vrijednosti EC80 (80 % odgovora E2 ili 8 000 RLU-ova), pri koncentracijama nižima od 1,0 × 10–5 M.
|
|
Neprimjereno
|
Podaci koji se ne mogu tumačiti kao valjani za pokazivanje prisutnosti ili izostanka aktivnosti zbog velikih kvalitativnih ili kvantitativnih ograničenja smatraju se neprimjerenima i ne mogu se koristiti za utvrđivanje je li ispitivana kemikalija pozitivna ili negativna. Kemikaliju treba ponovno ispitati.
|
|
40.
|
Ako je moguće, pozitivne rezultate karakterizirat će i razmjer učinka i koncentracija pri kojoj dolazi do učinka. Primjeri pozitivnih, negativnih i neprimjerenih podataka prikazani su na slikama 5. i 6.
|
Slika 5.
Primjeri agonista: pozitivni, negativni i neprimjereni podaci

Isprekidana linija pokazuje 20 % odgovora E2, 2 000 prilagođenih i normaliziranih RLU-ova.
Slika 6.
Primjeri antagonista: pozitivni, negativni i neprimjereni podaci

Isprekidana linija pokazuje 80 % odgovora Ral/E2, 8 000 prilagođenih i normaliziranih RLU-ova.
Puna linija pokazuje 1,00 × 10–5 M. Da bi se odgovor smatrao pozitivnim, treba se nalaziti ispod linije 8 000 RLU-ova i pri koncentracijama nižima od 1,00 × 10–5 M.
Koncentracije označene zvjezdicama na grafikonu mezo-heksestrola pokazuju rezultate vijabilnosti od „2” ili veće.
Rezultati ispitivanja za mezo-heksestrol smatraju se neprimjerenim podacima jer se do jedinog odgovora koji se nalazi ispod 8 000 RLU-ova dolazi pri 1,00 × 10–5 M.
|
41.
|
Vrijednosti EC50 i IC50 mogu se izračunati primjenom Hillove funkcije s četiri parametra (više pojedinosti potražiti u protokolima za agoniste i antagoniste (7.)). Ispunjavanje kriterija prihvatljivosti znači da sustav pravilno funkcionira, ali time se ne osigurava da će svaki pojedinačni ciklus dati točne rezultate. Ponavljanje rezultata prvog ciklusa najbolje je jamstvo toga da su dobiveni točni podaci (vidjeti stavak 19. odjeljka „SASTAVNICE ER TA TESTA”).
|
IZVJEŠĆE O ISPITIVANJU
|
42.
|
Vidjeti stavak 20. odjeljka „SASTAVNICE ER TA TESTA”.
|
LITERATURA
|
1.
|
ICCVAM. (2011). ICCVAM Test Method Evaluation Report on the LUMI-CELL® ER (BG1Luc ER TA) Test Method: An In Vitro Method for Identifying ER Agonists and Antagonists, National Institute of Environmental Health Sciences: Research Triangle Park, NC.
|
|
2.
|
Monje P., Boland R. (2001). Subcellular Distribution of Native Estrogen Receptor α and β Isoforms in Rabbit Uterus and Ovary, J. Cell Biochem., 82(3): 467.–479.
|
|
3.
|
Pujol P., et al. (1998). Differential Expression of Estrogen Receptor-Alpha and -Beta Messenger RNAs as a Potential Marker of Ovarian Carcinogenesis, Cancer Res., 58(23): 5367.–5373.
|
|
4.
|
Weihua Z., et al. (2000). Estrogen Receptor (ER) β, a Modulator of ERα in the Uterus, Proceedings of the National Academy of Sciences of the United States of America 97(11): 936.–5941.
|
|
5.
|
Balls M., et al. (2006). The Importance of Good Cell Culture Practice (GCCP), ALTEX, 23(Suppl): str. 270.–273.
|
|
6.
|
Coecke S., et al. (2005). Guidance on Good Cell Culture Practice: a Report of the Second ECVAM Task Force on Good Cell Culture Practice, Alternatives to Laboratory Animals, 33: str. 261.–287.
|
|
7.
|
ICCVAM (2011). ICCVAM Test Method Evaluation Report, The LUMI-CELL® ER (BG1Luc ER TA) Test Method: An In Vitro Assay for Identifying Human Estrogen Receptor Agonist and Antagonist Activity of Chemicals, NIH Publication No 11-7850.
|
|
8.
|
Rogers J.M., Denison M.S. (2000). Recombinant Cell Bioassays for Endocrine Disruptors: Development of a Stably Transfected Human Ovarian Cell Line for the Detection of Estrogenic and Anti-Estrogenic Chemicals, In Vitro Mol. Toxicol.,13(1):67.–82.
|
|
9.
|
Escande A., et al. (2006). Evaluation of Ligand Selectivity Using Reporter Cell Lines Stably Expressing Estrogen Receptor Alpha or Beta, Biochem. Pharmacol., 71(10):1459.–69.
|
|
10.
|
Thorne N., Inglese J., Auld D.S. (2010). Illuminating Insights into Firefly Luciferase and Other Bioluminescent Reporters Used in Chemical Biology, Chemistry and Biology,17(6):646.–57.
|
|
11.
|
Kuiper G.G, et al. (1998). Interaction of Estrogenic Chemicals and Phytoestrogens with Estrogen Receptor Beta, Endocrinology, 139(10):4252.–63.
|
|
12.
|
Geisinger, et al. (1989). Characterization of a human ovarian carcinoma cell line with estrogen and progesterone receptors, Cancer 63, 280.–288.
|
|
13.
|
Baldwin, et al. (1998). BG-1 ovarian cell line: an alternative model for examining estrogen-dependent growth in vitro, In Vitro Cell. Dev. Biol. – Animal, 34, 649.–654.
|
|
14.
|
Li, Y., et al. (2014). Research resource: STR DNA profile and gene expression comparisons of human BG-1 cells and a BG-1/MCF-7 clonal variant, Mol. Endo. 28, 2072.–2081.
|
|
15.
|
Rogers, J.M. and Denison, M.S. (2000). Recombinant cell bioassays for endocrine disruptors:development of a stably transfected human ovarian cell line for the detection of estrogenicand anti-estrogenic chemicals, In Vitro & Molec. Toxicol. 13, 67.–82.
|
Dodatak 4.
TEST TRANSAKTIVACIJE STABILNO TRANSFICIRANOG LJUDSKOG ESTROGENSKOG RECEPTORA-Α ZA OTKRIVANJE ESTROGENSKOG AGONISTIČKOG I ANTAGONISTIČKOG DJELOVANJA KEMIKALIJA PRIMJENOM STANIČNE LINIJE ERΑ CALUX
POČETNA RAZMATRANJA I OGRANIČENJA (VIDJETI I OPĆI UVOD)
|
1.
|
U testu transaktivacije ERα CALUX upotrebljava se humana stanična linija U2OS radi otkrivanja estrogenskog agonističkog i antagonističkog djelovanja kojim posreduje ljudski estrogenski receptor alfa (hERα). Validacijska studija biotesta sa stabilno transficiranim stanicama ERα CALUX koju je proveo BioDetection Systems BV (Amsterdam, Nizozemska) pokazala je relevantnost i pouzdanost testa za predviđenu svrhu (1.). Stanična linija ERα CALUX eksprimira samo stabilno transficirani humani ERα (2. i 3.).
|
|
2.
|
Ovaj je test posebno osmišljen za otkrivanje transaktivacije kojom posreduje hERα mjerenjem bioluminiscencije kao krajnje točke. Bioluminiscencija se često upotrebljava u biotestovima zbog visokog omjera signala i šuma (4.).
|
|
3.
|
Postoje izvješća o tome da koncentracije fitoestrogena veće od 1 μM pretjerano aktiviraju reporterski gen za luciferazu, što dovodi do luminiscencije kojom ne posreduju receptori (5., 6. i 7.). Stoga veće koncentracije fitoestrogena ili drugih sličnih spojeva koji mogu pretjerano aktivirati ekspresiju luciferaze treba pažljivo ispitati testovima transaktivacije stabilno transficiranog estrogenskog receptora (vidjeti Dodatak 2.).
|
|
4.
|
Prije upotrebe ovog testa u regulatorne svrhe treba pročitati odjeljke „OPĆI UVOD” i „SASTAVNICE ER TA TESTA”. Definicije i kratice upotrijebljene u ovoj ispitnoj metodi opisuju se u Dodatku 1.
|
NAČELO TESTA (VIDJETI I OPĆI UVOD)
|
5.
|
Biotest se upotrebljava kako bi se procijenilo vezivanje estrogenskog receptora i liganda te kasnija translokacija kompleksa receptora i liganda u jezgru. U jezgri se kompleks receptora i liganda veže na specifične elemente DNK odgovora i transaktivira reporterski gen za luciferazu krijesnice, što dovodi do povećane stanične ekspresije enzima luciferaze. Nakon dodavanja supstrata luciferaze luciferinu, luciferin se pretvara u bioluminescentan proizvod. Proizvedeno svjetlo može se jednostavno uočiti i kvantificirati s pomoću luminometra.
|
|
6.
|
U ispitnom sustavu upotrebljavaju se stabilno transficirane stanice ERα CALUX. Stanice ERα CALUX potječu od stanične linije U2OS humanog osteoblastičnog osteosarkoma. Humane stanice U2OS stabilno su transficirane konstruktima 3xHRE-TATA-Luc i pSG5-neo-hERα upotrebom metode zajedničkog taloženja s kalcijevim fosfatom. Stanična linija U2OS odabrana je kao najbolji kandidat za reportersku staničnu liniju koja reagira na estrogen (i ostale steroidne hormone) na temelju opažanja da stanična linija U2OS pokazuje slabu endogenu aktivnost receptora ili je uopće ne pokazuje. Odsustvo endogenih receptora procijenjeno je upotrebom samo reporterskih plazmida za luciferazu, koji nisu pokazali nikakvu aktivnost kada su dodani ligandi na receptor. Nadalje, ta je stanična linija dala snažne odgovore posredovane hormonima kada su privremeno uvedeni srodni receptori (2., 3. i 8.).
|
|
7.
|
Ispitivanje kemikalija radi utvrđivanja estrogene ili antiestrogene aktivnosti upotrebom stanične linije ERα CALUX uključuje ciklus predprobira i iscrpne cikluse. Tijekom ciklusa predprobira utvrđuju se topljivost, citotoksičnost i rafinirani raspon koncentracija ispitivanih kemikalija za iscrpno ispitivanje. Tijekom iscrpnih ciklusa rafinirani rasponi koncentracija ispitivanih kemikalija ispituju se biotestovima ERα CALUX, nakon čega slijedi razvrstavanje ispitivanih kemikalija u pogledu agonizma ili antagonizma.
|
|
8.
|
Kriteriji za tumačenje podataka podrobno su opisani u stavku 59. Ukratko, ispitivana kemikalija smatra se pozitivnom za agonizam ako barem dvije uzastopne koncentracije ispitivane kemikalije pokažu odgovor koji iznosi 10 % najvećeg odgovora referentne norme 17β-estradiol ili više (PC10). Ispitivana kemikalija smatra se pozitivnom za antagonizam ako barem dvije uzastopne koncentracije ispitivane kemikalije pokažu odgovor koji iznosi 80 % najvećeg odgovora referentne norme tamoksifena ili manje (PC80).
|
POSTUPAK
Stanične linije
|
9.
|
Za test bi se trebala upotrebljavati stabilno transficirana stanična linija U2OS ERα CALUX. Stanična linija može se dobiti od društva BioDetection Systems BV, Amsterdam, Nizozemska, sklapanjem tehničkog sporazuma o licenciranju.
|
|
10.
|
Treba upotrebljavati samo stanične kulture u kojima nema mikoplazme. Šarže stanica koje se upotrebljavaju trebaju imati potvrdu da nisu kontaminirane mikoplazmom ili prije upotrebe treba provesti test na mikoplazmu. Za osjetljivo otkrivanje zaraze mikoplazmom treba upotrijebiti RT-PCR (lančana reakcija polimerazom u stvarnom vremenu) (9.).
|
Stabilnost stanične linije
|
11.
|
Kako bi se održali stabilnost i integritet stanica CALUX, stanice treba pohraniti u tekućem dušiku (–80 °C). Nakon odmrzavanja stanica kako bi se razvila nova kultura, stanice treba supkultivirati barem dva puta prije nego što ih se upotrijebi za procjenu estrogenskog agonističkog i antagonističkog djelovanja kemikalija. Stanice se ne bi se trebale supkultivirati za više od 30 pasaža.
|
|
12.
|
Kako bi se pratila stabilnost stanične linije tijekom vremena, treba potvrditi osjetljivost ispitnog sustava za agonizam i antagonizam procjenom vrijednosti EC50 ili IC50 referentne norme. Osim toga, treba pratiti relativnu indukciju pozitivnog kontrolnog uzorka (PC) i negativnog kontrolnog uzorka (NC). Rezultati bi trebali biti u skladu s kriterijima prihvatljivosti za agonistički (tablica 3.C) ili antagonistički biotest ERα CALUX (tablica 4.C). Referentne norme, pozitivne i negativne kontrole navedene su u tablici 1. za agonistički oblik i tablici 2. za antagonistički oblik.
|
Stanična kultura i uvjeti nasađivanja
|
13.
|
Stanice U2OS treba uzgajati u mediju za uzgoj (medij DMEM/F12 (1: 1) s fenol crvenom kao indikatorom pH-vrijednosti, obogaćenom fetalnim goveđim serumom (7,5 %), neesencijalnim aminokiselinama (1 %), s 10 jedinica/ml penicilina, streptomicina i geneticina (G-418) kao markerom za selekciju). Stanice treba staviti u inkubator CO2 (5 % CO2) na 37 °C uz 100-postotnu vlažnost. Kada stanice dosegnu konfluenciju od 85 do 95 %, treba ih supkultivirati ili pripremiti za nasađivanje na mikrotitracijske ploče s 96 jažica. U potonjem slučaju, stanice treba ponovno suspendirati u koncentraciji 1 × 105 stanica/ml u mediju za test bez estrogena (DMEM/F12 (1: 1) bez fenol crvene, obogaćenom fetalnim goveđim serumom tretiranim ugljenom premazanim dekstranom (5 % v/v), neesencijalnim aminokiselinama (1 % v/v), s 10 jedinica/ml penicilina i streptomicina) te nasaditi u jažice mikrotitracijskih ploča s 96 jažica (100 μl homogenizirane suspenzije stanica). Stanice treba predinkubirati u inkubatoru CO2 (5 % CO2, 37 °C, 100-postotna vlažnost) 24 sata prije izlaganja. U plastičnoj opremi ne smije biti estrogena.
|
Kriteriji prihvatljivosti
|
14.
|
Agonističko i antagonističko djelovanje ispitivanih kemikalija ispituju se u nizovima ispitivanja. Niz ispitivanja sastoji se od najviše šest mikrotitracijskih ploča. Svaki niz ispitivanja sadržava najmanje jednu cijelu seriju razrjeđivanja referentne norme, pozitivan kontrolni uzorak, negativan kontrolni uzorak i kontrole s otapalom. Na slikama 1. i 2. prikazan je raspored ploča za nizove ispitivanja agonizma i antagonizma.
|
|
15.
|
Svako razrjeđivanje referentnih normi, ispitivane kemikalije, sve kontrole s otapalom te pozitivne i negativne kontrole treba analizirati u tri ponavljanja. Svaka analiza triju ponavljanja treba ispuniti zahtjeve navedene u tablici 3.A i tablici 4.A.
|
|
16.
|
Cijela serija razrjeđivanja referentne norme (17β-estradiol za agonizam; tamoksifen za antagonizam) mjeri se na prvoj ploči u svakom nizu ispitivanja. Kako bi se rezultati analize preostalih pet mikrotitracijskih ploča mogli usporediti s prvom mikrotitracijskom pločom koja sadržava cijelu krivulju koncentracija – odgovor referentne norme, sve bi ploče trebale sadržavati tri kontrolna uzorka: kontrolu s otapalom, najvišu koncentraciju ispitane referentne norme i približnu koncentraciju EC50 (agonizam) ili IC50 (antagonizam) referentne norme. Omjer prosječnih kontrolnih uzoraka na prvoj ploči i preostalih pet ploča treba ispunjavati zahtjeve navedene u tablici 3.C (agonizam) ili tablici 4.C (antagonizam).
|
|
17.
|
Za sve mikrotitracijske ploče u nizu ispitivanja računa se z-faktor (10.). Z-faktor treba izračunati upotrebom odgovora pri najvišoj i najnižoj koncentraciji referentne norme. Mikrotitracijska ploča smatra se valjanom ako ispunjava zahtjeve kako su navedeni u tablici 3.C (agonizam) ili tablici 4.C (antagonizam).
|
|
18.
|
Referentna norma treba pokazati sigmoidnu krivulju doza – odgovor. EC50 ili IC50 izvedeni iz odgovora serije razrjeđivanja referentne norme trebaju ispunjavati zahtjeve kako su navedeni u tablici 3.C (agonizam) ili tablici 4.C (antagonizam).
|
|
19.
|
Svaki niz ispitivanja treba sadržavati pozitivni i negativni kontrolni uzorak. Izračunana relativna indukcija i pozitivnog i negativnog kontrolnog uzorka treba ispunjavati zahtjeve kako su navedeni u tablici 3.C (agonizam) ili tablici 4.C (antagonizam).
|
|
20.
|
Tijekom svih mjerenja faktor indukcije najviše koncentracije referentne norme treba izmjeriti tako da se prosječni najviši odgovor u obliku relativne jedinice svjetlosti (RLU) na referentnu normu 17β-estradiol podijeli prosječnim odgovorom u obliku RLU-a na referentnu kontrolu s otapalom. Taj faktor indukcije treba ispuniti minimalne zahtjeve za multiplikacijski faktor indukcije kako je navedeno u tablici 3.C (agonizam) ili tablice 4.C (antagonizam).
|
|
21.
|
Valjanima se smatraju samo mikrotitracijske ploče koje ispunjavaju sve prethodno navedene kriterije prihvatljivosti i samo se one mogu koristiti za procjenu odgovora ispitivanih kemikalija.
|
|
22.
|
Kriteriji prihvatljivosti primjenjivi su i na predprobir i na iscrpne cikluse.
|
Tablica 1.
Koncentracije referentne norme, pozitivne kontrole (PC) i negativne kontrole (NC) za agonistički biotest CALUX
|
|
Tvar
|
CAS br.
|
Raspon ispitivanja (M)
|
|
Referentna norma
|
17β-estradiol
|
50-28-2
|
1 * 10-13 – 1 * 10-10
|
|
Pozitivna kontrola (PC)
|
17α-metiltestosteron
|
58-18-4
|
3 * 10-6
|
|
Negativna kontrola (NC)
|
kortikosteron
|
50-22-6
|
1 * 10-8
|
Tablica 2.
Koncentracije referentne norme, pozitivne kontrole (PC) i negativne kontrole (NC) za antagonistički biotest CALUX
|
|
Tvar
|
CAS br.
|
Raspon ispitivanja (M)
|
|
Referentna norma
|
tamoksifen
|
10540-29-1
|
3 * 10-9 – 1 * 10-5
|
|
Pozitivna kontrola (PC)
|
4-hidroksitamoksifen
|
68047-06-3
|
1 * 10-9
|
|
Negativna kontrola (NC)
|
resveratrol
|
501-36-0
|
1 * 10-5
|
Tablica 3.
Kriteriji prihvatljivosti za agonistički biotest ERα CALUX
|
A – pojedinačni uzorci na ploči
|
Kriterij
|
|
1
|
Najveći % standardne devijacije jažica s tri ponavljanja (za NC, PC, svako razrjeđivanje ispitivane kemikalije i referentne norme, osim C0)
|
< 15 %
|
|
2
|
Najveći % standardne devijacije jažica s tri ponavljanja (za kontrole s otapalom referentne norme i ispitivane kemikalije (C0, SC))
|
< 30 %
|
|
3
|
Najveće propuštanje LDH-a, kao mjera citotoksičnosti
|
< 120 %
|
|
B – unutar jedne mikrotitracijske ploče
|
|
|
4
|
Omjer kontrole s otapalom referentne norme (C0; ploča 1) i kontrole s otapalom ispitivane kemikalije (SC; od ploče 2 do ploče x)
|
0,5 do 2,0
|
|
5
|
Omjer približ. vrijednosti EC50 i najviših koncentracija referentne norme na ploči 1 i približ. vrijednosti EC50 i najviših koncentracija referentne norme na ploči 2 do ploče x (C4, C8)
|
0,70 do 1,30
|
|
6
|
Z-faktor za svaku ploču
|
> 0,6
|
|
C – unutar jednog niza analiza (sve ploče u jednom nizu)
|
|
|
7
|
Sigmoidna krivulja referentne norme
|
Da (17ß-estradiol)
|
|
8
|
Raspon EC50 referentne norme 17ß-estradiol
|
4 * 10–12 – 4 * 10–11 M
|
|
9
|
Najmanji multiplikacijski faktor indukcije najviše koncentracije 17ß-estradiola, s obzirom na kontrolu s otapalom referentne norme
|
5
|
|
10
|
Relativna indukcija (%) PC-a
|
> 30 %
|
|
11
|
Relativna indukcija (%) NC-a
|
< 10 %
|
Približ. približno; PC: pozitivna kontrola; NC: negativna kontrola; SC: kontrola s otapalom ispitivane kemikalije; C0: kontrola s otapalom referentne norme; SD: standardna devijacija; LDH: laktat dehidrogenaza.
Tablica 4.
Kriteriji prihvatljivosti za antagonistički biotest ERα CALUX
|
A – pojedinačni uzorci na ploči
|
Kriterij
|
|
1
|
Najveći % standardne devijacije trostrukih jažica (za NC, PC, svako razrjeđivanje ispitivane kemikalije i referentne norme, kontrolu s otapalom (C0))
|
< 15 %
|
|
2
|
Najveći % standardne devijacije trostrukih jažica (za kontrolu s nosačem (VC) i najvišu koncentraciju referentne norme (C8))
|
< 30 %
|
|
3
|
Najveće propuštanje LDH-a, kao mjera citotoksičnosti
|
< 120 %
|
|
B – unutar jedne mikrotitracijske ploče
|
|
|
4
|
Omjer kontrole s otapalom referentne norme (C0; ploča 1) i kontrole s otapalom ispitivane kemikalije (SC; od ploče 2 do ploče x)
|
0,70 do 1,30
|
|
5
|
Omjer približ. vrijednosti IC50 koncentracija referentne norme na ploči 1 i približ. vrijednosti IC50 koncentracija referentne norme na ploči 2 do ploče x (C4)
|
0,70 do 1,30
|
|
6
|
Omjer najviših koncentracija referentne norme na ploči 1 i najviših koncentracija referentne norme na ploči 2 do ploče x (C8)
|
0,50 do 2,0
|
|
7
|
Z-faktor za svaku ploču
|
> 0,6
|
|
C – unutar jednog niza analiza (sve ploče u jednom nizu)
|
|
|
8
|
Sigmoidna krivulja referentne norme
|
Da (tamoksifen)
|
|
9
|
Raspon IC50 referentne norme (tamoksifen)
|
1 * 10–8 – 1 * 10–7 M
|
|
10
|
Najmanji multiplikacijski faktor indukcije kontrole s otapalom referentne norme, s obzirom na najvišu koncentraciju tamoksifena
|
2,5
|
|
11
|
Relativna indukcija (%) PC-a
|
< 70 %
|
|
12
|
Relativna indukcija (%) NC-a
|
> 85 %
|
Približ. približno; PC: pozitivna kontrola; NC: negativna kontrola; VC: kontrola s nosačem (kontrola s otapalom bez fiksne koncentracije referentne norme agonista); SC: kontrola s otapalom ispitivane kemikalije; C0: kontrola s otapalom referentne norme; SD: standardna devijacija; LDH: laktat dehidrogenaza.
Kontrola s otapalom/nosačem, referentne norme, pozitivne kontrole, negativne kontrole
|
23.
|
I za ciklus predprobira i za iscrpne cikluse treba upotrebljavati istu kontrolu s otapalom/nosačem, referentne norme, pozitivne i negativne kontrole. Osim toga, koncentracija referentnih normi, pozitivnih i negativnih kontrola treba biti ista.
|
Kontrola s otapalom
|
24.
|
Otapalo koje se upotrebljava za otapanje ispitivanih kemikalija treba ispitati kao kontrolu s otapalom. Tijekom validacije biotesta ERα CALUX kao nosač se upotrebljavao dimetilsulfoksid (DMSO, 1 % (v/v); CAS br. 67-68-5). Ako se upotrebljava otapalo koje nije DMSO, sve referentne norme, kontrole i ispitivane kemikalije treba ispitati u istom nosaču. Potrebno je napomenuti da kontrola s otapalom za antagonističke studije sadržava fiksnu koncentraciju 17β-estradiola – referentne norme agonista (približno koncentracija EC50). Kako bi se ispitalo otapalo koje se upotrebljava u antagonističkim studijama, treba pripremiti i ispitati kontrolu s nosačem.
|
Kontrola s nosačem (antagonizam)
|
25.
|
Kod ispitivanja antagonizma medij za test obogaćuje se fiksnom koncentracijom 17β-estradiola – referentne norme agonista (približno koncentracija EC50). Kako bi se ispitalo otapalo koje se upotrebljava za otapanje ispitivanih kemikalija za antagonizam, treba pripremiti medij za test bez fiksne koncentracije 17β-estradiola – referentne norme agonista. Taj se kontrolni uzorak označava kao kontrola s nosačem. Tijekom validacije biotesta ERα CALUX kao nosač se upotrebljavao dimetilsulfoksid (DMSO, 1 % (v/v); CAS br. 67-68-5). Ako se upotrebljava otapalo koje nije DMSO, sve referentne norme, kontrole i ispitivane kemikalije treba ispitati u istom nosaču.
|
Referentne norme
|
26.
|
Referentnu normu agonista čini 17β-estradiol (tablica 1.). Referente norme sastoje se od serije razrjeđivanja osam koncentracija 17β-estradiola (1 * 10–13, 3 * 10–13, 1 * 10–12, 3 * 10–12, 6 * 10–12, 1 * 10–11, 3 * 10–11, 1 * 10–10 M).
|
|
27.
|
Referentnu normu antagonista čini tamoksifen (tablica 2.). Referente norme sastoje se od serije razrjeđivanja osam koncentracija tamoksifena (3 * 10–9, 1 * 10–8, 3 * 10–8, 1 * 10–7, 3 * 10–7, 1 * 10–6, 3 * 10–6, 1 * 10–5 M). Svaka koncentracija referentne norme antagonista inkubira se zajedno s fiksnom koncentracijom 17β-estradiola – referentnom normom agonista (3 * 10–12 M).
|
Pozitivna kontrola
|
28.
|
Pozitivnu kontrolu za agonističke studije čini 17α-metiltestosteron (tablica 1.).
|
|
29.
|
Pozitivnu kontrolu za antagonističke studije čini 4-hidroksitamoksifen (tablica 2.). Pozitivna kontrola antagonista inkubira se zajedno s fiksnom koncentracijom 17β-estradiola – referentnom normom agonista (3 * 10–12 M).
|
Negativna kontrola
|
30.
|
Negativnu kontrolu za agonističke studije čini kortikosteron (tablica 1.).
|
|
31.
|
Negativnu kontrolu za antagonističke studije čini resveratrol (tablica 2.). Negativna kontrola antagonista inkubira se zajedno s fiksnom koncentracijom 17β-estradiola – referentnom normom agonista (3 * 10–12 M).
|
Dokazivanje osposobljenosti laboratorija (vidjeti stavak 14. i tablice 3. i 4. u odjeljku „SASTAVNICE ER TA TESTA” ove ispitne metode)
Nosač
|
32.
|
Otapalo koje se upotrebljava za otapanje ispitivanih kemikalija treba potpuno otopiti ispitivanu kemikaliju i mora se moći miješati s medijem za stanice. Primjerena su otapala DMSO, voda i etanol (čistoće od 95 % do 100 %). Ako se kao otapalo upotrebljava DMSO, najviša koncentracija DMSO-a tijekom inkubacije ne treba biti veća od 1 % (v/v). Otapalo prije upotrebe treba ispitati kako bi se utvrdilo da nije citotoksično i da ne utječe na uspješnost testa.
|
Priprema referentnih normi, pozitivnih kontrola, negativnih kontrola i ispitivanih kemikalija
|
33.
|
Referentne norme, pozitivne kontrole, negativne kontrole i ispitivane kemikalije otapaju se u 100-postotnom DMSO-u (ili primjerenom otapalu). U istom otapalu zatim treba pripremiti i primjerena (serijska) razrjeđivanja. Prije otapanja sve tvari treba ostaviti tako da se njihova temperatura izjednači sa sobnom temperaturom. U svježe pripremljenim glavnim otopinama referentnih normi, pozitivnih kontrola, negativnih kontrola i ispitivanih kemikalija ne smije biti primjetan talog ili zamućenje. Uzorci referentne norme i kontrole mogu se pripremati zbirno. Prije svakog pokusa treba pripremiti glavne otopine ispitivanih kemikalija. Za svaki pokus treba pripremiti svježa konačna razrjeđivanja referentnih normi, pozitivnih kontrola, negativnih kontrola i ispitivanih kemikalija te ih treba upotrijebiti u roku od 24 sata od pripreme.
|
Topljivost, citotoksičnost i utvrđivanje raspona
|
34.
|
Tijekom ciklusa predprobira utvrđuje se topljivost ispitivanih kemikalija u odabranom otapalu. Priprema se najviša koncentracija glavne otopine od 0,1 M. Ako se pri toj koncentraciji pojave poteškoće s topljivosti, treba pripremiti glavne otopine niže koncentracije dok se ispitivane kemikalije potpuno ne otope. Tijekom ciklusa predprobira ispituju se serijska razrjeđivanja ispitivane kemikalije u omjeru 1: 10. Najveća koncentracija u testu za ispitivanje agonista i antagonista iznosi 1 mM. Nakon predprobira izvodi se primjereni rafinirani raspon koncentracija za ispitivane kemikalije koji treba ispitati tijekom iscrpnih ciklusa. U iscrpnom ispitivanju trebaju se ispitati razrjeđivanja od 1x, 3x, 10x, 30x, 100x, 300x, 1000x i 3000x.
|
|
35.
|
Ispitivanje citotoksičnosti uključeno je u protokol za test agonista i antagonista (11.). Ispitivanje citotoksičnosti uključeno je i u ciklus predprobira i u iscrpne cikluse. Metoda upotrijebljena za procjenu citotoksičnosti tijekom validacije biotesta ERα CALUX bio je test propuštanja laktat dehidrogenaze (LDH) u kombinaciji s kvalitativnim vizualnim pregledom stanica (vidjeti Dodatak 4.1.) nakon izlaganja ispitivanim kemikalijama. Međutim, za utvrđivanje citotoksičnosti mogu se upotrijebiti druge kvantitativne metode (npr. kolorimetrijski test na temelju tetrazolija (MTT) ili biotest citotoksičnosti CALUX). Općenito, koncentracije ispitivane kemikalije koje pokažu smanjenje vijabilnosti stanica veće od 20 % smatraju se citotoksičnima i stoga se ne mogu upotrijebiti za procjenu podataka. Kad je riječ o testu propuštanja LDH-a, koncentracija ispitivane kemikalije smatra se citotoksičnom ako je postotak propuštanja LDH-a veći od 120 %.
|
Izlaganje ispitivanoj kemikaliji i organizacija testne ploče
|
36.
|
Nakon tripsinizacije konfluentne tikvice uzgojenih stanica, stanice se ponovno suspendiraju pri koncentraciji od 1 x 105 stanica/ml u mediju za test bez estrogena. Sto μl stanica koje su ponovno suspendirane nasađuju se u unutarnje jažice mikrotitracijske ploče s 96 jažica. Vanjske jažice pune se s 200 μl fiziološke otopine puferirane fosfatnim puferom (PBS) (vidjeti slike 1. i 2.). Nasađene stanice predinkubiraju se 24 sata u inkubatoru CO2 (5 % CO2, 37 °C, 100-postotna vlažnost).
|
|
37.
|
Nakon predinkubacije ploče se pregledavaju kako bi se vizualno utvrdile citotoksičnost (vidjeti Dodatak 4.1.), kontaminacija i konfluencija. Za ispitivanje se koriste samo ploče na kojima nema vizualnih znakova citotoksičnosti, kontaminacije i kod kojih konfluencija iznosi najmanje 85 %. Medij iz unutarnjih jažica pažljivo se uklanja i zamjenjuje s 200 μl medija za test bez estrogena koji sadržava primjerene serije razrjeđivanja referentnih normi, ispitivanih kemikalija, pozitivnih kontrola, negativnih kontrola i kontrola s otapalom (tablica 5.: studije agonista; tablica 6.: studije antagonista). Sve referentne norme, ispitivane kemikalije, pozitivne kontrole, negativne kontrole i kontrole s otapalom ispituju se u tri ponavljanja. Na slici 1. prikazan je raspored na ploči za ispitivanje agonista. Na slici 2. prikazan je raspored na ploči za ispitivanje antagonista. Raspored na ploči za predprobir isti je kao i za iscrpno ispitivanje. Kod ispitivanja antagonista sve unutarnje jažice, osim jažica za kontrolu s nosačem (VC), sadržavaju i fiksnu koncentraciju 17β-estradiola – referentne norme agonista (3 * 10–12 M). Treba napomenuti da referentne norme C8 i C4 treba dodati svakoj ploči s ispitivanom kemikalijom.
|
|
38.
|
Nakon izlaganja stanica svim kemikalijama, mikrotitracijske ploče s 96 jažica treba inkubirati još 24 sata u inkubatoru CO2 (5 % CO2, 37 °C, 100-postotna vlažnost).
|
Slika 1.
Raspored na mikrotitracijskoj ploči s 96 jažica za predprobir i procjenu agonističkog učinka

C0 = otapalo referentne norme.
C(1 – 8) = serije razrjeđivanja (1 – 8, koncentracije od niže do više) referentne norme.
PC = pozitivna kontrola.
NC = negativna kontrola.
TCx-(1 – 8) = razrjeđivanja (1 – 8, koncentracije od niže do više) ispitivane kemikalije za ciklus predprobira i procjenu agonističkog učinka ispitivane kemikalije x.
SC = kontrola s otapalom ispitivane kemikalije (po mogućnosti isto otapalo kao i pod C0, ali moguće iz druge šarže).
Siva polja: = vanjske jažice, napunjene s 200 μl PBS-a.
Slika 2.
Raspored na mikrotitracijskoj ploči s 96 jažica za antagonistički predprobir i procjenu antagonističkog učinka
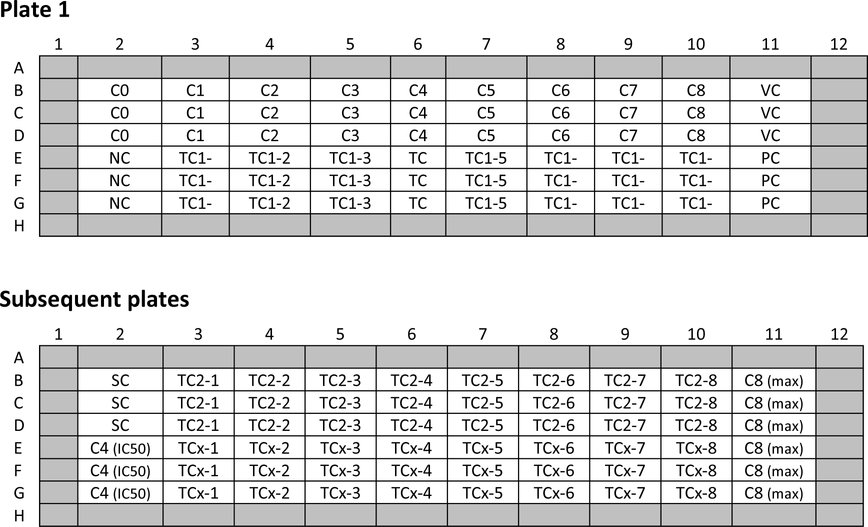
C0 = otapalo referentne norme.
C(1 – 8) = serije razrjeđivanja (1 – 8, koncentracije od niže do više) referentne norme.
NC = negativna kontrola.
PC = pozitivna kontrola.
TCx-(1 – 8) = razrjeđivanja (1 – 8, koncentracije od niže do više) ispitivane kemikalije za ciklus predprobira i procjenu agonističkog učinka ispitivane kemikalije x.
SC = kontrola s otapalom ispitivane kemikalije (po mogućnosti isto otapalo kao i pod C0, ali moguće iz druge šarže).
VC = kontrola s nosačem (kontrola s otapalom bez fiksne koncentracije referentne norme agonista – 17β-estradiola).
Siva polja: = vanjske jažice, napunjene s 200 μl PBS-a.
Napomena: sve unutarnje jažice, osim jažica za kontrolu s nosačem (VC), sadržavaju i fiksnu koncentraciju 17β-estradiola – referentne norme agonista (3,0 * 10–12 M).
Mjerenje luminiscencije
|
39.
|
Mjerenje luminiscencije podrobno je opisano u protokolu za test agonista i antagonista (10.). Medij treba ukloniti iz jažica i stanice treba lizirati nakon 24 sata inkubacije kako bi se otvorila stanična membrana i omogućilo mjerenje aktivnosti luciferaze.
|
|
40.
|
Kod mjerenja luminiscencije za taj je postupak potreban luminometar s dva ubrizgavača. Reakcija luciferaze pokreće se ubrizgavanjem supstrata luciferina. Reakcija se zaustavlja dodavanjem 0,2 M NaOH. Reakcija se zaustavlja kako bi se spriječilo prenošenje luminiscencije iz jedne jažice u drugu.
|
|
41.
|
Emisija svjetlosti iz svake jažice izražava se kao relativna jedinica svjetlosti (RLU) po jažici.
|
Ciklus predprobira
|
42.
|
Rezultati analize predprobira upotrebljavaju se za utvrđivanje rafiniranog raspona koncentracija ispitivanih kemikalija za iscrpna ispitivanja. Procjena rezultata analize predprobira i utvrđivanja rafiniranog raspona koncentracije ispitivanih kemikalija za iscrpno ispitivanje podrobno je opisana u protokolu za test agonista i antagonista (10.). Ovdje je naveden kratak sažetak postupaka za utvrđivanje raspona koncentracije ispitivanih kemikalija za ispitivanje agonista i antagonista. Smjernice o dizajnu serijskog razrjeđivanja potražiti u tablicama 5. i 6.
|
Odabir koncentracija za procjenu agonističkih učinaka
|
43.
|
Tijekom ciklusa predprobira ispitivane kemikalije treba ispitati upotrebom serija razrjeđivanja kako je prikazano u tablicama 5. (agonizam) i 6. (antagonizam). Sve koncentracije treba ispitati u trostrukim jažicama u skladu s rasporedom na ploči kako je prikazano na slici 1. (agonizam) ili slici 2. (antagonizam).
|
|
44.
|
Valjanima se smatraju samo rezultati analize koji ispunjavaju kriterije prihvatljivosti (tablica 3.) i samo se oni mogu koristiti za procjenu odgovora ispitivanih kemikalija. Ako jedna mikrotitracijska ploča ili više mikrotitracijskih ploča u analitičkoj seriji ne ispune kriterije prihvatljivosti, te mikrotitracijske ploče treba ponovno analizirati. Ako prva ploča koja sadržava cijelu seriju razrjeđivanja referentne norme ne ispuni kriterije prihvatljivosti, mora se ponovno analizirati cijeli niz ispitivanja (šest ploča).
|
|
45.
|
Treba prilagoditi početne raspone koncentracija ispitivanih kemikalija i ponoviti ciklus predprobira:
|
—
|
ako se uoči citotoksičnost. Postupak predprobira treba ponoviti s nižim koncentracijama ispitivane kemikalije koje nisu toksične,
|
|
—
|
ako predprobir ispitivane kemikalije ne pokaže cijelu krivulju doza – odgovor jer ispitane koncentracije uzrokuju najveću indukciju. Ciklus predprobira treba ponoviti s nižim koncentracijama ispitivane kemikalije.
|
|
|
46.
|
Kada se opazi valjani odgovor na dozu, treba odabrati (najnižu) koncentraciju pri kojoj se opazi najveća indukcija i koja ne pokazuje citotoksičnost. Najviša koncentracija ispitivane kemikalije koju treba ispitati u iscrpnim ciklusima treba biti tri puta veća od te odabrane koncentracije.
|
|
47.
|
Treba pripremiti cijelu rafiniranu seriju razrjeđivanja ispitivane kemikalije u skladu s koracima razrjeđivanja kako su navedeni u tablici 5., počevši od najviše koncentracije kako je prethodno utvrđena.
|
|
48.
|
Ispitivanu kemikaliju koja ne izazove nikakav agonistički učinak treba ispitati u iscrpnim ciklusima, počevši od najviše koncentracije koja nije citotoksična, a koja je utvrđena tijekom predprobira.
|
Odabir koncentracija za procjenu antagonističkih učinaka
|
49.
|
Valjanima se smatraju samo rezultati analize koji ispunjavaju kriterije prihvatljivosti (tablica 4.) i samo se oni mogu koristiti za procjenu odgovora ispitivanih kemikalija. Ako jedna mikrotitracijska ploča ili više mikrotitracijskih ploča u analitičkoj seriji ne ispune kriterije prihvatljivosti, te mikrotitracijske ploče treba ponovno analizirati. Ako prva ploča koja sadržava cijelu seriju razrjeđivanja referentne norme ne ispuni kriterije prihvatljivosti, mora se ponovno analizirati cijeli niz ispitivanja (šest ploča).
|
|
50.
|
Treba prilagoditi početne raspone koncentracija ispitivanih kemikalija i ponoviti ciklus predprobira:
|
—
|
ako se uoči citotoksičnost. Postupak predprobira treba ponoviti s nižim koncentracijama ispitivane kemikalije koje nisu toksične,
|
|
—
|
ako predprobir ispitivane kemikalije ne pokaže cijelu krivulju doza – odgovor jer ispitane koncentracije uzrokuju najveću inhibiciju. Predprobir treba ponoviti s nižim koncentracijama ispitivane kemikalije.
|
|
|
51.
|
Kada se pronađe valjani odgovor na dozu treba odabrati (najnižu) koncentraciju pri kojoj se uoči najveća inhibicija i koja ne pokazuje citotoksičnost. Najviša koncentracija ispitivane kemikalije koju treba ispitati u iscrpnim ciklusima treba biti tri puta veća od te odabrane koncentracije.
|
|
52.
|
Treba pripremiti cijelu rafiniranu seriju razrjeđivanja ispitivane kemikalije u skladu s koracima razrjeđivanja kako su navedeni u tablici 6., počevši od najviše koncentracije kako je prethodno utvrđena.
|
|
53.
|
Ispitivane kemikalije koje ne izazovu nikakve antagonističke učinke treba ispitati u iscrpnim ciklusima, počevši od najviše koncentracije koja nije citotoksična, a koja je ispitana tijekom predprobira.
|
Iscrpni ciklusi
|
54.
|
Nakon odabira rafiniranih raspona koncentracija ispitivane kemikalije treba iscrpno ispitati upotrebom serija razrjeđivanja kako je prikazano u tablicama 5. (agonizam) i 6. (antagonizam). Sve koncentracije treba ispitati u trostrukim jažicama u skladu s rasporedom na ploči kako je prikazano na slici 1. (agonizam) ili slici 2. (antagonizam).
|
|
55.
|
Valjanima se smatraju samo rezultati analize koji ispunjavaju kriterije prihvatljivosti (tablice 3. i 4.) i samo se oni mogu koristiti za procjenu odgovora ispitivanih kemikalija. Ako jedna mikrotitracijska ploča ili više mikrotitracijskih ploča u analitičkoj seriji ne ispune kriterije prihvatljivosti, te mikrotitracijske ploče treba ponovno analizirati. Ako prva ploča koja sadržava cijelu seriju razrjeđivanja referentne norme ne ispuni kriterije prihvatljivosti, mora se ponovno analizirati cijeli niz ispitivanja (šest ploča).
|
Tablica 5.
Koncentracija i razrjeđivanja referentnih normi, kontrola i ispitivanih kemikalija koje se koriste za ispitivanje agonista
|
Referentni 17β-estradiol
|
TCx – ciklus predprobira –
|
TCx – iscrpni ciklus –
|
Kontrole
|
|
konc. (M)
|
razrjeđivanje
|
razrjeđivanje
|
konc. (M)
|
|
C0
|
0
|
TCx-1
|
10 000 000 x
|
TCx-1
|
3 000 x
|
PC
|
3 * 10-6
|
|
C1
|
1 * 10-13
|
TCx-2
|
1 000 000 x
|
TCx-2
|
1 000 x
|
NC
|
1 * 10-8
|
|
C2
|
3 * 10-13
|
TCx-3
|
100 000 x
|
TCx-3
|
300 x
|
C0
|
0
|
|
C3
|
1 * 10-12
|
TCx-4
|
10 000 x
|
TCx-4
|
100 x
|
SC
|
0
|
|
C4
|
3 * 10-12
|
TCx-5
|
1 000 x
|
TCx-5
|
30 x
|
|
|
|
C5
|
6 * 10-12
|
TCx-6
|
100 x
|
TCx-6
|
10 x
|
|
|
|
C6
|
1 * 10-11
|
TCx-7
|
10 x
|
TCx-7
|
3 x
|
|
|
|
C7
|
3 * 10-11
|
TCx-8
|
1 x
|
TCx-8
|
1 x
|
|
|
|
C8
|
1 * 10-10
|
|
|
|
|
|
|
|
TCx – ispitivana kemikalija x
PC – pozitivna kontrola (17α-metiltestosteron)
NC – negativna kontrola (kortikosteron)
C0 – kontrola s otapalom referentne norme
SC – kontrola s otapalom ispitivane kemikalije
|
Tablica 6.
Koncentracija i razrjeđivanja referentnih normi, kontrola i ispitivanih kemikalija koje se koriste za ispitivanje antagonista
|
Referentni tamoksifen
|
TCx – ciklus predprobira –
|
TCx – iscrpni ciklus –
|
Kontrole
|
|
konc. (M)
|
razrjeđivanje
|
razrjeđivanje
|
konc. (M)
|
|
C0
|
0
|
TCx-1
|
10 000 000 x
|
TCx-1
|
3 000 x
|
PC
|
1 * 10-9
|
|
C1
|
3 * 10-9
|
TCx-2
|
1 000 000 x
|
TCx-2
|
1 000 x
|
NC
|
1 * 10-5
|
|
C2
|
1 * 10-8
|
TCx-3
|
100 000 x
|
TCx-3
|
300 x
|
C0
|
0
|
|
C3
|
3 * 10-8
|
TCx-4
|
10000 x
|
TCx-4
|
100 x
|
SC
|
0
|
|
C4
|
1 * 10-7
|
TCx-5
|
1000 x
|
TCx-5
|
30 x
|
|
|
|
C5
|
3 * 10-
|
TCx-6
|
100 x
|
TCx-6
|
10 x
|
Obogaćeni agonist
|
|
C6
|
1 * 10-6
|
TCx-7
|
10 x
|
TCx-7
|
3 x
|
konc. (M)
|
|
C7
|
3 * 10-6
|
TCx-8
|
1 x
|
TCx-8
|
1 x
|
17β-estradiol
|
3 * 10-12
|
|
C8
|
1 * 10-5
|
|
|
|
|
|
|
|
TCx – ispitivana kemikalija x
PC – pozitivna kontrola (4-hidroksitamoksifen)
NC – negativna kontrola (resveratrol)
C0 – kontrola s otapalom referentne norme
SC – kontrola s otapalom ispitivane kemikalije
VC – kontrola s nosačem (ne sadržava fiksnu koncentraciju 17β-estradiola – referentne norme agonista (3,0 * 10–12 M))
|
Prikupljanje i analiza podataka
|
56.
|
Nakon ciklusa predprobira i iscrpnih ciklusa treba utvrditi EC10, EC50, PC10, PC50 i najveću indukciju (TCxmax) ispitivane kemikalije za agonističko ispitivanje. Za antagonističko ispitivanje treba izračunati IC20, IC50, PC80, PC50 i najmanju indukciju (TCxmin). Na slikama 3. (agonizam) i 4. (antagonizam) nalazi se grafički prikaz tih parametara. Potrebni parametri računaju se na temelju relativne indukcije svake ispitivane kemikalije (u odnosu na najveću indukciju referentne norme (= 100 %)). Za procjenu podataka treba upotrebljavati nelinearnu regresiju (varijabilan nagib, četiri parametra) prema sljedećoj jednadžbi:

pri čemu je:
X = log doze ili koncentracije
Y = odgovor (relativna indukcija (%))
Vrh = najveća indukcija (%)
Dno = najmanja indukcija (%)
LogEC50 = log koncentracije pri kojoj se uočava 50 % najvećeg odgovora
Hillov nagib = faktor nagiba ili Hillov nagib
|
|
57.
|
Neobrađene podatke iz luminometra, izražene kao relativne jedinice svjetlosti (RLU-ovi), treba prenijeti u proračunsku tablicu za analizu podataka koja je izrađena za cikluse predprobira i iscrpne cikluse. Neobrađeni podaci trebaju ispunjavati kriterije prihvatljivosti kako su navedeni u tablicama 3.A i 3.B (agonizam) ili 4.A i 4.B (antagonizam). Ako neobrađeni podaci ispunjavaju kriterije prihvatljivosti, provode se sljedeći koraci za izračun kako bi se utvrdili potrebni parametri.
|
Agonizam
|
—
|
Oduzeti prosječni RLU kontrole s otapalom referentne norme od svakog sirovog podatka iz analize referentnih normi.
|
|
—
|
Oduzeti prosječni RLU za kontrolu s otapalom ispitivane kemikalije od svakog sirovog podatka iz analize ispitivanih kemikalija.
|
|
—
|
Izračunati relativnu indukciju svake koncentracije referentne norme. Postaviti indukciju najviše koncentracije referentne norme na 100 %.
|
|
—
|
Izračunati relativnu indukciju svake koncentracije ispitivane kemikalije u usporedbi s najvišom koncentracijom referentne norme kao 100 %.
|
|
—
|
Procijeniti rezultate analize nakon nelinearne regresije (varijabilan nagib, četiri parametra).
|
|
—
|
Utvrditi EC50 i EC10 referentne norme.
|
|
—
|
Utvrditi EC50 i EC10 ispitivanih kemikalija.
|
|
—
|
Utvrditi najveću relativnu indukciju ispitivane kemikalije (TCmax).
|
|
—
|
Utvrditi PC10 i PC50 ispitivanih kemikalija.
|
Kod ispitivanih kemikalija ne može se uvijek dobiti cijela krivulja doza – odgovor, na primjer zbog citotoksičnosti ili poteškoća s topljivosti. Stoga se ne mogu utvrditi vrijednosti EC50, EC10 i PC50. U tom se slučaju mogu utvrditi samo vrijednosti PC10 i TCmax.
Antagonizam
|
—
|
Oduzeti prosječni RLU najviše koncentracije referentne norme od svakog sirovog podatka iz analize referentnih normi.
|
|
—
|
Oduzeti prosječni RLU najviše koncentracije referentne norme od svakog sirovog podatka iz analize ispitivanih kemikalija.
|
|
—
|
Izračunati relativnu indukciju svake koncentracije referentne norme. Postaviti indukciju najniže koncentracije referentne norme na 100 %.
|
|
—
|
Izračunati relativnu indukciju svake koncentracije ispitivane kemikalije u usporedbi s najnižom koncentracijom referentne norme kao 100 %.
|
|
—
|
Procijeniti rezultate analize nakon nelinearne regresije (varijabilan nagib, četiri parametra).
|
|
—
|
Utvrditi IC50 i IC20 referentne norme.
|
|
—
|
Utvrditi IC50 i IC20 ispitivanih kemikalija.
|
|
—
|
Utvrditi najmanju relativnu indukciju ispitivane kemikalije (TCmin).
|
|
—
|
Utvrditi PC80 i PC50 ispitivanih kemikalija.
|
Slika 3.
Pregled parametara koji se utvrđuju u testu agonista
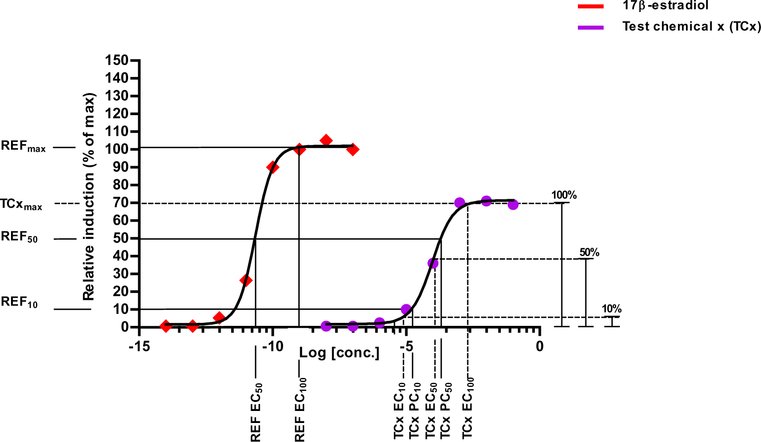
EC10 = koncentracija tvari pri kojoj se opaža 10 % njezina najvećeg odgovora.
EC50 = koncentracija tvari pri kojoj se opaža 50 % njezina najvećeg odgovora.
PC10 = koncentracija ispitivane kemikalije pri kojoj je njezin odgovor jednak vrijednosti EC10 referentne norme.
PC50 = koncentracija ispitivane kemikalije pri kojoj je njezin odgovor jednak vrijednosti EC50 referentne norme.
TCxmax = najveća relativna indukcija ispitivane kemikalije.
Slika 4.
Pregled parametara koji se utvrđuju u testu antagonista

IC20 = koncentracija tvari pri kojoj se opaža 80 % njezina najvećeg odgovora (20-postotna inhibicija).
IC50 = koncentracija tvari pri kojoj se opaža 50 % njezina najvećeg odgovora (50-postotna inhibicija).
PC80 = koncentracija ispitivane kemikalije pri kojoj je njezin odgovor jednak vrijednosti IC20 referentne norme.
PC50 = koncentracija ispitivane kemikalije pri kojoj je njezin odgovor jednak vrijednosti IC50 referentne norme.
TCxmin = najmanja relativna indukcija ispitivane kemikalije.
Kod ispitivanih kemikalija ne može se uvijek dobiti cijela krivulja doza – odgovor, na primjer zbog citotoksičnosti ili poteškoća s topljivosti. Stoga se ne mogu utvrditi vrijednosti IC50, IC20 i PC50. U tom se slučaju mogu utvrditi samo vrijednosti PC20 i TCmin.
|
58.
|
Rezultati se trebaju temeljiti na dva (ili tri) neovisna ciklusa. Ako se u dva ciklusa dobiju usporedivi, a time i ponovljivi rezultati, ne mora se provoditi treći ciklus. Da bi bili prihvatljivi, rezultati trebaju:
|
—
|
ispunjavati kriterije prihvatljivosti (vidjeti stavke od 14. do 22. o kriterijima prihvatljivosti),
|
|
Kriteriji za tumačenje podataka
|
59.
|
Za tumačenje podataka i odluku o tome smatra li se ispitivana kemikalija pozitivnom ili negativnom treba primjenjivati sljedeće kriterije.
|
U svakom iscrpnom ciklusu ispitivana kemikalija smatra se pozitivnom:
|
1.
|
ako je TCmax jednak ili veći od 10 % najvećeg odgovora referentne norme (REF10);
|
|
2.
|
ako su najmanje dvije uzastopne koncentracije ispitivane kemikalije jednake vrijednosti REF10 ili veće od nje.
|
|
|
U svakom iscrpnom ciklusu ispitivana kemikalija smatra se negativnom:
|
1.
|
ako TCmax nije veći od 10 % najvećeg odgovora referentne norme (REF10);
|
|
2.
|
ako su manje od dvije koncentracije ispitivane kemikalije jednake vrijednosti REF10 ili veće od nje.
|
|
|
U svakom iscrpnom ciklusu ispitivana kemikalija smatra se pozitivnom:
|
1.
|
ako je TCmin jednak ili manji od 80 % najvećeg odgovora referentne norme (REF80 = 20-postotna inhibicija);
|
|
2.
|
ako su najmanje dvije uzastopne koncentracije ispitivane kemikalije jednake vrijednosti REF80 ili manje od nje.
|
|
|
U svakom iscrpnom ciklusu ispitivana kemikalija smatra se negativnom:
|
1.
|
ako je TCmin veći od 80 % najvećeg odgovora referentne norme (REF80 = 20-postotna inhibicija);
|
|
2.
|
ako su manje od dvije koncentracije ispitivane kemikalije jednake vrijednosti REF80 ili manje od nje.
|
|
|
|
60.
|
Kako bi se opisala jakost pozitivnog odgovora ispitivane kemikalije, treba navesti razmjer učinka (agonizam: TCmax; antagonizam: TCmin) i koncentraciju pri kojoj dolazi do učinka (agonizam: EC10, EC50, PC10, PC50; antagonizam: IC20, IC50, PC80, PC50).
|
IZVJEŠĆE O ISPITIVANJU
|
61.
|
Vidjeti stavak 20. odjeljka „SASTAVNICE ER TA TESTA”.
|
LITERATURA
|
1.
|
OECD (2016). Draft Validation report of the (anti-) ERα CALUX bioassay - transactivation bioassay for the detection of compounds with (anti)estrogenic potential. Environmental Health and Safety Publications, Series on Testing and Assessment (No 240). Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
2.
|
Sonneveld E, Jansen HJ, Riteco JA, Brouwer A, van der Burg B. (2005). Development of androgen- and estrogen-responsive bioassays, members of a panel of human cell line-based highly selective steroid-responsive bioassays. Toxicol Sci. 83(1), 136.–148.
|
|
3.
|
Quaedackers ME, van den Brink CE, Wissink S, Schreurs RHMM, Gustafsson JA, van der Saag PT, and van der Burg B. (2001). 4-Hydroxytamoxifen trans-represses nuclear factor-kB Activity in human osteoblastic U2OS cells through estrogen receptor (ER)α and not through ERβ. Endocrinology 142(3), 1156.–1166.
|
|
4.
|
Thorne N, Inglese J and Auld DS. (2010). Illuminating Insights into Firefly Luciferase and Other Bioluminescent Reporters Used in Chemical Biology, Chemistry and Biology17(6):646.–57.
|
|
5.
|
Escande A, Pillon A, Servant N, Cravedi JP, Larrea F, Muhn P, Nicolas JC, Cavaillès V and Balaguer P. (2006). Evaluation of ligand selectivity using reporter cell lines stably expressing estrogen receptor alpha or beta. Biochem. Pharmacol., 71, 1459.–1469.
|
|
6.
|
Kuiper GG, Lemmen JG, Carlsson B, Corton JC, Safe SH, van der Saag PT, van der Burg B and Gustafsson JA. (1998). Interaction of estrogenic chemicals and phytoestrogens with estrogen receptor beta. Endocrinol., 139, 4252.–4263.
|
|
7.
|
Sotoca AM, Bovee TFH, Brand W, Velikova N, Boeren S, Murk AJ, Vervoort J, Rietjens IMCM. (2010). Superinduction of estrogen receptor mediated gene expression in luciferase based reporter gene assays is mediated by a post-transcriptional mechanism. J. Steroid. Biochem. Mol. Biol., 122, 204.–211.
|
|
8.
|
Sonneveld E, Riteco JAC, Jansen HJ, Pieterse B, Brouwer A, Schoonen WG, and van der Burg B. (2006). Comparison of in vitro and in vivo screening models for androgenic and estrogenic activities. Toxicol. Sci., 89(1), 173.–187.
|
|
9.
|
Kobayashi H, Yamamoto K, Eguchi M, Kubo M, Nakagami S, Wakisaka S, Kaizuka M and Ishii H. (1995). Rapid detection of mycoplasma contamination in cell cultures by enzymatic detection of polymerase chain reaction (PCR) products. J. Vet. Med. Sci., 57(4), 769.–771.
|
|
10.
|
Zhang J-H, Chung TDY, and Oldenburg KR. (1999). A simple statistical parameter for use in evaluation and validation of high throuphut screening assays. J. Biomol. Scr., 4, 67.–73.
|
|
11.
|
Besselink H, Middelhof I, and Felzel, E. (2014). Transactivation assay for the detection of compounds with (anti)estrogenic potential using ERα CALUX cells. BioDetection Systems BV (BDS). Amsterdam, Nizozemska.
|
Dodatak 4.1.
VIZUALNI PREGLED VIJABILNOSTI STANICA
B.67.
IN VITRO ISPITIVANJA GENSKIH MUTACIJA STANICA SISAVACA UPOTREBOM GENA ZA TIMIDIN KINAZU
UVOD
|
1.
|
Ova ispitna metoda odgovara Smjernici OECD-a za ispitivanje 490 (2016.). Ispitne metode periodično se preispituju i revidiraju uzimajući u obzir znanstveni napredak, regulatorne potrebe i dobrobit životinja. Test limfoma miša (MLA) i test TK6 u kojima se upotrebljava lokus timidin kinaze (TK) izvorno su bili dio ispitne metode B.17. Kasnije je Stručna skupina za MLA Međunarodne radionice o ispitivanju genotoksičnosti (IWGT) razvila međunarodno usklađene preporuke za kriterije prihvatljivosti testova i tumačenje podataka za MLA (1., 2., 3., 4. i 5.) i te su preporuke uključene u ovu novu ispitnu metodu B.67. Ova je ispitna metoda napisana za MLA i za test TK6 jer se i u njemu upotrebljava lokus timidin kinaze. Dok se MLA često upotrebljava u regulatorne svrhe, TK6 se upotrebljava mnogo rjeđe. Treba napomenuti da te dvije stanične linije nisu međusobno zamjenjive unatoč sličnosti između krajnjih točaka te se u regulatornim programima s pravom može dati prednost jednoj od tih metoda za određenu regulatornu upotrebu. Na primjer, u validaciji testa MLA pokazala se primjerenost tog testa za otkrivanje genskih mutacija, ali i sposobnost ispitivanih kemikalija da induciraju strukturno oštećenje kromosoma. Ova je ispitna metoda dio niza ispitnih metoda u području genetske toksikologije. OECD je sastavio dokument u kojem se daju sažete informacije o ispitivanju u području genetske toksikologije te pregled novijih promjena smjernica OECD-a za ispitivanje genotoksičnosti (6.).
|
|
2.
|
Svrha je in vitro testova genskih mutacija stanica sisavaca otkrivanje genskih mutacija induciranih (uzrokovanih) kemikalijama. Stanične linije koje se upotrebljavaju u ovim testovima mjere napredne mutacije na reporterskim genima, točnije genu za endogenu timidin kinazu (TK za ljudske stanice i Tk za stanice glodavaca, koje se u ovoj ispitnoj metodi zajedno nazivaju TK). Ova ispitna metoda namijenjena je za upotrebu s dvjema staničnim linijama: staničnom linijom limfoma miša L5178Y TK+/–3.7.2C (obično se naziva L5178Y) i staničnom linijom ljudskih limfoblastoida TK6 (obično se naziva TK6). Iako se te dvije stanične linije razlikuju po svojem podrijetlu, rastu stanica, statusu p53 itd., testovi mutacija gena TK mogu se provesti na sličan način za obje vrste stanica, kako je opisano u ovoj ispitnoj metodi.
|
|
3.
|
Autosomalna i heterozigotna priroda gena za timidin kinazu omogućuje opažanje vijabilnih kolonija čijim stanicama nedostaje enzim timidin kinaza nakon mutacije iz TK+/-
u TK-/-
. Taj nedostatak može biti posljedica genetskih pojava koje utječu na gen TK, uključujući i genske mutacije (točkaste mutacije, mutacije pomaka okvira očitavanja, manje delecije itd.) i kromosomske pojave (velike delecije, premještanja kromosoma i mitotske rekombinacije). Potonje pojave eksprimiraju se kao gubitak heterozigotnosti, a to je uobičajena genetska promjena gena supresora tumora u karcinogeneze kod ljudi. U teoriji se testom MLA može otkriti gubitak cijelog kromosoma koji nosi gen TK, što je posljedica oštećenja diobenog vretena i/ili mitotskog nerazdvajanja. Doista, kombinacija citogenetske i molekularne analize jasno pokazuje da su neki mutanti TK u testu MLA posljedica nerazdvajanja. Međutim, analiza snage dokaza ukazuje na to da ispitivanja mutacija gena TK ne mogu pouzdano otkriti aneugene kada se primjenjuju standardni kriteriji citotoksičnosti (kako je opisano u ovoj ispitnoj metodi) i stoga nije primjereno upotrebljavati te testove za otkrivanje aneugena (7., 8. i 9.).
|
|
4.
|
U testovima mutacije gena TK nastaju dva različita razreda fenotipa mutanata TK: mutanti koji rastu normalno istom brzinom kao i heterozigotne stanice TK-a i mutanti koji rastu sporo i imaju produljeno vrijeme udvostručivanja. Mutanti koji rastu normalno i mutanti koji rastu sporo prepoznaju se kao mutanti u velikim kolonijama i mutanti u malim kolonijama u testu MLA te kao mutanti u kolonijama koje se javljaju rano i koje se javljaju kasno u testu TK6. Molekularna i citogenetska svojstva mutanata u velikim i malim kolonijama u testu MLA podrobno su ispitana (8., 10., 11., 12. i 13.). Podrobno su ispitana i molekularna i citogenetska svojstva mutanata koji se javljaju rano i koji se javljaju kasno u testu TK6 (14., 15., 16. i 17.). Mutanti koji rastu sporo za obje vrste stanica pretrpjeli su genetsko oštećenje koje pogađa gene koji navodno reguliraju rast u blizini lokusa timidin kinaze, što dovodi do produljenih vremena udvostručivanja i nastanka kolonija koje se javljaju kasno ili malih kolonija (18.). Indukcija mutanata koji rastu sporo povezuje se s kemikalijama koje izazivaju velike strukturne promjene na razini kromosoma. Stanice kojima nisu oštećeni geni koji navodno reguliraju rast u blizini lokusa timidin kinaze rastu brzinom koja je slična roditeljskim stanicama i postaju mutanti koji rastu normalno. Indukcija mutanata koji prvenstveno rastu normalno povezana je s kemikalijama koje prvenstveno djeluju kao mutageni koji uzrokuju točkaste mutacije. Stoga je od ključne važnosti izbrojiti i mutante koji rastu sporo i one koji rastu normalno kako bi se dobili svi mutanti i određeni uvid u vrste oštećenja (mutageni u odnosu na klastogene) koje inducira ispitivana kemikalija (10., 12., 18. i 19.).
|
|
5.
|
Ispitna metoda organizirana je tako da se daju opće informacije koje se primjenjuju i na MLA i TK6 te specijalizirane smjernice za pojedinačne testove.
|
|
6.
|
Upotrijebljene definicije navedene su u Dodatku 1.
|
POČETNA RAZMATRANJA I OGRANIČENJA
|
7.
|
Testovi koji se obavljaju in vitro obično zahtijevaju primjenu egzogenog (vanjskog) izvora metaboličke aktivacije. Egzogenim sustavom metaboličke aktivacije ne oponašaju se u cijelosti in vivo uvjeti.
|
|
8.
|
Trebalo bi voditi računa o tome da se izbjegnu uvjeti koji bi mogli dovesti do lažno pozitivnih rezultata (odnosno moguće interakcije s ispitnim sustavom) koji nisu uzrokovani interakcijom ispitivane kemikalije i genetskog materijala stanice; takvi uvjeti uključuju promjene pH-vrijednosti ili osmolalnosti, interakciju s komponentama medija (20. i 21.) ili prekomjerne razine citotoksičnosti (22., 23. i 24.). Citotoksičnost koja premašuje preporučene najviše razine citotoksičnosti, kako su definirane u stavku 28., smatra se prekomjernom za MLA i TK6. Osim toga, treba napomenuti da ispitivane kemikalije koje su analogne timidinu ili se ponašaju kao da su analogne timidinu mogu povećati učestalost pojave mutanata selektivnim rastom spontanih pozadinskih mutanata tijekom tretiranja stanica te su za primjerenu procjenu potrebne dodatne ispitne metode (25.).
|
|
9.
|
U slučaju proizvedenih nanomaterijala mogu biti potrebne posebne prilagodbe ove ispitne metode, ali one nisu opisane u ovoj ispitnoj metodi.
|
|
10.
|
Prije nego što se ova ispitna metoda primijeni za ispitivanje smjese radi dobivanja podataka za predviđenu regulatornu svrhu, potrebno je razmotriti mogu li se njome dobiti primjereni rezultati za tu svrhu te ako mogu, zašto. Ta razmatranja nisu potrebna ako postoji regulatorni zahtjev za ispitivanje smjese.
|
|
11.
|
Mutirane stanice bez aktivnosti enzima timidin kinaze otporne su na citostatske učinke analoga primidona, trifluorotimidina (TFT), zbog mutacije TK+/-
u TK-/-
. Stanice koje sadržavaju dosta TK-a osjetljive su na TFT, što uzrokuje inhibiciju staničnog metabolizma i sprečava daljnju diobu stanica. Tako se mutirane stanice uz prisutnost TFT-a mogu razmnožavati i stvarati vidljive kolonije, dok stanice koje sadržavaju enzim TK ne mogu.
|
NAČELO ISPITIVANJA
|
12.
|
Stanice u suspenziji izlažu se u odgovarajućem trajanju ispitivanoj kemikaliji (vidjeti stavak 33.), s egzogenim izvorom metaboličke aktivacije i bez njega (vidjeti stavak 19.), te se zatim supkultiviraju da bi se utvrdila citotoksičnost i omogućila fenotipska ekspresija prije selekcije mutanata. Citotoksičnost se utvrđuje relativnim ukupnim rastom (RTG – vidjeti stavak 25.) za MLA i relativnom stopom preživljavanja (RS – vidjeti stavak 26.) za TK6. Tretirane se kulture drže u mediju za rast tijekom dovoljno dugog razdoblja, koje je karakteristično za svaki tip stanice (vidjeti stavak 37.), što omogućuje skoro optimalnu fenotipsku ekspresiju induciranih mutacija. Nakon fenotipske ekspresije učestalost pojave mutanata utvrđuje se nasađivanjem poznatog broja stanica u medij koji sadržava selektivni agens kako bi se otkrile kolonije mutanata odnosno u medij bez selektivnog agensa kako bi se odredila učinkovitost kloniranja (vijabilnost). Nakon odgovarajućeg razdoblja inkubacije kolonije se prebroje. Učestalost pojave mutanata računa se na temelju broja kolonija mutanata koji se ispravlja učinkovitošću kloniranja u trenutku selekcije mutanata.
|
OPIS METODE
Pripreme
Stanice
|
13.
|
Za MLA: budući da je MLA razvijen i opisan za upotrebu podlinije TK+/-
–3.7.2C stanica L5178Y, za MLA se mora upotrebljavati upravo ta podlinija. Stanična linija L5178Y izvedena je iz limfoma timusa DBA-2 miša induciranog metilkolantrenom (26.). Clive i suradnici tretirali su stanice L5178Y (koje je Clive odredio kao TK+/+ –3) etil metansulfonatom i izolirali klon TK-/- (određen kao TK-/- –3.7) primjenom bromodeoksiuridina kao selektivnog agensa. Iz klona TK-/- izolirani su spontani klon TK+/- (određen kao TK+/- –3.7.2.) i podklon (određen kao TK+/- –3.7.2C) te su opisani za upotrebu u testu MLA (27.). Objavljen je kariotip za staničnu liniju (28., 29., 30. i 31.). Modalni je broj kromosoma 40. Postoji jedan metacentrični kromosom (t12;13) koji treba brojiti kao jedan kromosom. Lokus timidin kinaze miša nalazi se na distalnom kraju kromosoma 11. Stanična linija L5178Y TK+/-
–3.7.2C ima mutacije na oba alela p53 i proizvodi protein mutanta p53 (32. i 33.). Status p53 stanične linije TK+/- –3.7.2C vjerojatno omogućuje da se testom otkrije veliko oštećenje (17.).
|
|
14.
|
Za TK6: TK6 je stanična linija ljudskih limfoblastoida. Roditeljsku staničnu liniju čini WI-L2, stanična linija transformirana Epstein-Barrovim virusom, koja je izvorno izvedena iz petogodišnjeg mužjaka s hereditarnom sferocitozom. Prvi izolirani klon, HH4, mutageniran je mutagenom ICR191 i stvorena je heterozigotna stanična linija TK-a – TK6 (34.). Stanice TK6 skoro su diploidne i reprezentativni je kariotip 47, XY, 13+, t(14; 20), t(3; 21) (35.). Lokus ljudske timidin kinaze nalazi se na dugom kraku kromosoma 17. TK6 je stanična linija kompetentna u pogledu p53 jer ima slijed p53 divljeg tipa na oba alela i eksprimira samo protein p53 divljeg tipa (36.).
|
|
15.
|
I kod testa MLA i testa TK6 preporučuje se da laboratorij koji obavlja ispitivanje osigura odsustvo kontaminacije mikoplazmom, odredi kariotip stanica ili oboji kromosome koji imaju lokus timidin kinaze te da provjeri vremena udvostručenja populacije kada se glavni uzorak prvi put stvara ili nadopunjuje. Trebalo bi utvrditi uobičajeno trajanje staničnog ciklusa upotrijebljenih stanica u ispitnom laboratoriju i ono bi trebalo biti usklađeno s objavljenim svojstvima stanica (16., 19. i 37.). Taj glavni uzorak treba pohraniti na temperaturi od –150 °C ili nižoj i upotrebljavati za pripremu svih radnih uzoraka stanica.
|
|
16.
|
Prije stvaranja velikog broja krioprezerviranih radnih uzoraka ili neposredno prije upotrebe u pokusu iz kultura će možda trebati odstraniti mutirane stanice koje postoje otprije [osim ako je učestalost pojave mutanata (MF) u kontroli s otapalom već unutar prihvatljivog raspona – vidjeti tablicu 2. za test MLA)]. To se postiže upotrebom metotreksata (aminopterin) kako bi se izdvojile stanice koje ne sadržavaju timidin kinazu te dodavanjem timidina, hipoksantina i glicina (L5178Y) ili 2’-deoksicitidina (TK6) kulturi kako bi se osigurao optimalan rast stanica kompetentnih u pogledu timidin kinaze (19., 38., 39. i 40.) za test TK6. Opći savjeti o dobroj praksi za održavanje staničnih kultura i savjeti specifični za stanice L5178Y i TK6 mogu se naći u literaturi (19., 31., 37., 39. i 41.). Za laboratorije koji trebaju matične uzorke za započinjanje testa MLA ili TK6 ili za dobivanje novih matičnih uzoraka dostupan je repozitorij stanica koje su dobro opisane (37.).
|
Uvjeti koje moraju zadovoljavati mediji i kulture
|
17.
|
U oba bi testa u svrhu održavanja kultura trebalo primijeniti prikladne uvjete za medij za uzgoj kulture i uvjete inkubacije (npr. posude za kulture, vlažne atmosferske uvjete od 5 % CO2 i temperaturu inkubacije od 37 °C). Stanične kulture uvijek bi se trebale održavati u uvjetima kojima se osigurava da one rastu u logaritamskoj fazi. Posebno je važno odabrati uvjete u pogledu medija i kultura kojima se osiguravaju optimalan rast stanica tijekom razdoblja ekspresije i kloniranje kako mutiranih tako i nemutiranih stanica. Za MLA i TK6 važno je i da uvjeti kulture osiguraju optimalan rast TK mutanata i u velikim kolonijama/mutanata koji se javljaju rano i mutanata u malim kolonijama/mutanata koji se javljaju kasno. Više pojedinosti o kulturi, uključujući potrebu da se konjski serum pravilno inaktivira toplinom ako se tijekom selekcije mutanata upotrebljava medij RPMI, dostupno je u literaturi (19., 31., 38., 39., 40. i 42.).
|
Priprema kultura
|
18.
|
Stanice se razmnožavaju iz matičnih kultura te se nasađuju u medij za uzgoj kulture takvom gustoćom da kulture u suspenziji nastave eksponencijalno rasti tijekom razdoblja tretiranja i ekspresije.
|
Metabolička aktivacija
|
19.
|
Kod uporabe stanica L5178Y i TK6 trebalo bi upotrebljavati egzogene sustave metaboličkog djelovanja jer te stanice nemaju odgovarajuću endogenu metaboličku sposobnost. Sustav koji se najčešće upotrebljava i automatski preporučuje, osim ako je drukčije opravdano, jest postmitohondrijska frakcija s dodanim kofaktorom (S9), pripravljena od jetre glodavaca (općenito štakora), koja je bila tretirana sredstvima za indukciju enzima, kao što je Aroclor 1254 (43., 44. i 45.), ili mješavinom fenobarbitala i β-naftoflavona (46., 47., 48., 49., 50. i 51.). Upotreba navedene smjese nije u suprotnosti sa Stockholmskom konvencijom o postojanim organskim onečišćujućim tvarima (52.) i dokazano je da je jednako učinkovita za indukciju oksidaza s miješanom funkcijom kao Aroclor 1254 (45., 46., 47., 48. i 49.). Frakcija S9 obično se upotrebljava u koncentracijama u rasponu od 1 do 2 %, ali može se povećati na 10 % (v/v) u konačnom ispitnom mediju. Na odabir vrste i koncentracije upotrijebljenog egzogenog sustava metaboličke aktivacije ili metaboličkog pokretača može utjecati kategorija ispitivanih kemikalija.
|
Priprema ispitivane kemikalije
|
20.
|
Prije tretiranja stanica krute ispitivane kemikalije trebalo bi pripremiti u prikladnim otapalima i prema potrebi razrijediti (vidjeti stavak 21.). Tekuće ispitivane kemikalije mogu se dodati izravno u ispitni sustav i/ili razrijediti prije tretiranja ispitnog sustava. Plinovite ili hlapljive ispitivane kemikalije trebalo bi ispitivati nakon što se prikladno izmijene standardni protokoli, kao što je tretiranje u hermetički zatvorenim posudama za kulture (53., 54. i 55.). Ispitivanu kemikaliju potrebno je pripremiti neposredno prije tretiranja, osim ako je prema podacima o stabilnosti prihvatljivo skladištenje.
|
ISPITNI UVJETI
Otapala
|
21.
|
Otapalo bi trebalo odabrati tako da se optimizira topljivost ispitivane kemikalije bez negativnih učinaka na provedbu testa, kao što su npr. promjena rasta stanica, učinak na integritet ispitivane kemikalije, reagiranje s posudama za kulture ili oštećenje sustava metaboličke aktivacije. Preporučuje se da se, kada god je to moguće, prvo uzme u obzir upotreba vodenog otapala (ili medija za uzgoj kulture). Uobičajena su otapala voda ili dimetilsulfoksid. Općenito, organska otapala ne bi trebala prelaziti 1 % (v/v), dok vodena otapala (fiziološka otopina ili voda) ne bi trebala prelaziti 10 % (v/v) u mediju za završno tretiranje. Upotrebu neuobičajenih otapala (npr. etanola ili acetona) potrebno je opravdati podacima koji govore da su ta otapala kompatibilna s ispitivanim kemikalijama i ispitnim sustavom te da ne djeluju genotoksično pri upotrijebljenoj koncentraciji. Ako ne postoje takvi popratni podaci, važno je dodati netretirane kontrole (vidjeti Dodatak 1., Definicije) kako bi se dokazalo da odabrano otapalo nema štetne ili mutagene učinke.
|
MJERENJE CITOTOKSIČNOSTI I ODABIR KONCENTRACIJA TRETIRANJA
|
22.
|
Pri utvrđivanju najviše koncentracije ispitivane kemikalije trebalo bi izbjegavati koncentracije koje imaju sposobnost izazivanja lažno pozitivnih odgovora, kao što su koncentracije koje izazivaju prekomjernu citotoksičnost (vidjeti stavak 28.), taloženje u mediju za uzgoj kulture (vidjeti stavak 29.) ili znatne promjene pH-vrijednosti ili osmolalnosti (vidjeti stavak 8.). Ako ispitivana kemikalija u trenutku dodavanja uzrokuje znatnu promjenu pH-vrijednosti medija, pH-vrijednost može se prilagoditi puferiranjem medija za završno tretiranje kako bi se izbjegli lažno pozitivni rezultati te održali primjereni uvjeti za uzgoj kulture.
|
|
23.
|
Odabir koncentracije temelji se na citotoksičnosti i drugim razmatranjima (vidjeti stavke 27.–30.). Iako ocjena citotoksičnosti u početnom ispitivanju može biti korisna za bolje određivanje koncentracija koje će se upotrebljavati u glavnom pokusu, početno ispitivanje nije potrebno. Čak i ako se provodi početna ocjena citotoksičnosti, i dalje je obvezno mjerenje citotoksičnosti za svaku kulturu u glavnom pokusu. Ako se provodi pokus za utvrđivanje raspona, on treba obuhvatiti širok raspon koncentracija i može se završiti 1. dana nakon tretiranja ili nastaviti na 2. dan ekspresije i do selekcije mutanata (ako se pokaže da su upotrijebljene koncentracije primjerene).
|
|
24.
|
Citotoksičnost treba utvrditi za svaku pojedinačnu ispitnu kulturu i kontrolnu kulturu: metode za MLA (2.) i TK6 (15.) utvrđene su međunarodno prihvaćenom praksom.
|
|
25.
|
I za verziju testa MLA s agarom i s mikrojažicama citotoksičnost treba procijeniti upotrebom relativnog ukupnog rasta (RTG), koji su izvorno definirali Clive i Spector 1975. (2.). Ta mjera uključuje relativni rast u suspenziji (RSG: ispitna kultura u usporedbi s kontrolom s otapalom) tijekom tretiranja stanica, vrijeme ekspresije i relativnu učinkovitost kloniranja (RCE: ispitna kultura u usporedbi s kontrolom s otapalom) u trenutku odabira mutanata (2.). Treba napomenuti da RSG obuhvaća bilo kakav gubitak stanica do kojeg dolazi u ispitnoj kulturi tijekom tretiranja (formule potražiti u Dodatku 2.).
|
|
26.
|
Za TK6: citotoksičnost bi se trebala ocjenjivati primjenom relativne stope preživljavanja (RS), tj. učinkovitošću kloniranja stanica koje se nasade odmah nakon tretiranja, prilagođeno za mogući gubitak stanica tijekom tretiranja, na temelju broja stanica u usporedbi s negativnom kontrolom (kojoj se dodjeljuje stopa preživljavanja od 100 %) (formulu vidjeti u Dodatku 2.).
|
|
27.
|
Potrebno je ocijeniti najmanje četiri ispitne koncentracije (ne uključujući kontrolu s otapalom i pozitivnu kontrolu) koje ispunjavaju kriterije prihvatljivosti (odgovarajuća citotoksičnost, broj stanica itd.). Iako se preporučuje upotreba usporednih kultura, za svaku se ispitivanu koncentraciju može upotrijebiti samo jedna tretirana kultura ili više njezinih ponovljenih uzoraka. Rezultati dobiveni iz ponovljenih kultura pri određenoj koncentraciji trebali bi se navoditi odvojeno, ali mogu se objediniti radi analize podataka (55.). Za ispitivane kemikalije koje pokazuju malu ili nikakvu citotoksičnost uglavnom će biti prikladne približno dvostruke ili trostruke koncentracije. Ako se pojavi citotoksičnost, treba odabrati koncentracije koje obuhvaćaju raspon citotoksičnosti od koncentracije koja uzrokuje citotoksičnost kako je opisano u stavku 28. te uključujući koncentracije pri kojima se javlja umjerena citotoksičnost i one pri kojima je citotoksičnost mala ili je nema. Mnoge ispitivane kemikalije imaju oštre krivulje odgovora na koncentraciju te će za obuhvaćanje cijelog raspona citotoksičnosti ili podrobno istraživanje odgovora na koncentracije možda biti potrebno upotrijebiti sličnije koncentracije i više od četiri koncentracije, posebno u situacijama u kojima je potrebno ponavljanje pokusa (vidjeti stavak 70.). Upotreba više od četiri koncentracije može biti osobito važna kada se upotrebljava jedna kultura.
|
|
28.
|
Ako se maksimalna koncentracija temelji na citotoksičnosti, najvećom koncentracijom trebao bi se nastojati ostvariti relativni ukupni rast od 20 do 10 % za MLA i relativna stopa preživljavanja od 20 do 10 % za TK6 (stavak 67.).
|
|
29.
|
Za slabo topljive ispitivane kemikalije koje nisu citotoksične pri koncentracijama nižima od najniže koncentracije pri kojoj kemikalija nije topljiva najviša bi analizirana koncentracija trebala dovesti do zamućenosti ili taloga vidljivog golim okom ili inverznim mikroskopom na kraju tretiranja ispitivanom kemikalijom. Čak i ako se citotoksičnost pojavi iznad najniže netopljive koncentracije, preporučuje se ispitivanje pri samo jednoj koncentraciji koja dovodi do zamućenja ili s vidljivim talogom jer lažni učinci mogu biti posljedica taloga. Budući da se u testovima MLA i TK6 upotrebljavaju kulture u suspenziji, posebnu pozornost treba posvetiti tome da se osigura da talog ne utječe na izvođenje ispitivanja. Može biti korisno i odrediti topljivost u mediju za uzgoj kulture prije izvođenja pokusa.
|
|
30.
|
Ako nisu uočeni talog ili ograničavajuća citotoksičnost, najviša ispitna koncentracija trebala bi odgovarati najnižoj od sljedećih vrijednosti: 10 mM, 2 mg/ml ili 2 μl/ml (57. i 58.). Ako sastav ispitivane kemikalije nije definiran, npr. ako je riječ o tvarima nepoznatog ili promjenjivog sastava, složenim reakcijskim proizvodima ili biološkim materijalima (tj. kemijske tvari nepoznatog ili promjenjivog sastava ili UVCB tvari), proizvodima ekstrahiranima iz okoliša itd., najvišu koncentraciju može biti potrebno povećati (npr. 5 mg/ml) u odsustvu dovoljne citotoksičnosti, a kako bi se povećala koncentracija svakog sastojka. Međutim, trebalo bi napomenuti da ti zahtjevi mogu biti drukčiji za farmaceutske proizvode namijenjene ljudima (59.).
|
Kontrole
|
31.
|
Kod svakog uvjeta pokusa potrebno je uključiti i istodobne negativne kontrole (vidjeti stavak 21.) koje se sastoje samo od otapala u mediju za tretiranje i koje su tretirane na isti način kao i kulture za tretiranje.
|
|
32.
|
Istodobne pozitivne kontrole potrebne su za dokazivanje sposobnosti laboratorija za određivanje mutagena u uvjetima upotrijebljenog protokola ispitivanja, učinkovitosti egzogenog sustava metaboličke aktivacije (ako je primjenjivo) i za dokazivanje primjerenog otkrivanja i malih TK mutanata/mutanata koji se javljaju kasno i velikih TK mutanata/mutanata koji se javljaju rano. Primjeri pozitivnih kontrola navedeni su u tablici 1. u nastavku. Ako je to opravdano, mogu se koristiti alternativne tvari za pozitivnu kontrolu. S obzirom na to da je in vitro ispitivanje genotoksičnosti na stanicama sisavaca u dostatnoj mjeri standardizirano za kratkotrajna tretiranja (od tri do četiri sata) koja se istodobno provode s metaboličkom aktivacijom i bez nje uz isto trajanje tretiranja, upotreba pozitivnih kontrola može se ograničiti na mutagene tvari koje zahtijevaju metaboličku aktivaciju. U tom će slučaju taj jedan odgovor pozitivne kontrole dokazati djelovanje sustava metaboličke aktivacije i osjetljivost ispitnog sustava. Ako se upotrebljava, dugotrajno tretiranje (tj. 24 sata bez S9) trebalo bi imati svoju pozitivnu kontrolu jer će se trajanje tretiranja razlikovati od ispitivanja u kojem se primjenjuje metabolička aktivacija. Svaku pozitivnu kontrolu trebalo bi primijeniti pri jednoj ili više koncentracija za koje se očekuje da će dovesti do ponovljivih i zamjetnih povećanja u odnosu na pozadinu kako bi se dokazala osjetljivost ispitnog sustava, a odgovor ne bi trebala dovesti u pitanje citotoksičnost koja prelazi granične vrijednosti utvrđene u ovoj ispitnoj metodi (vidjeti stavak 28.).
|
Tablica 1.
Referentne tvari preporučene za ocjenu osposobljenosti laboratorija i za odabir pozitivnih kontrola
|
Kategorija
|
Tvar
|
CAS br.
|
|
1. Mutageni aktivni bez metaboličke aktivacije
|
|
Metil metansulfonat
|
66-27-3
|
|
Mitomicin C
|
50-07-7
|
|
4-nitrokinolin-N-oksid
|
56-57-5
|
|
2. Mutageni koji zahtijevaju metaboličku aktivaciju
|
|
Benzo(a)piren
|
50-32-8
|
|
Ciklofosfamid (monohidrat)
|
50-18-0 (6055-19-2)
|
|
7,12-dimetilbenzantracen
|
57-97-6
|
|
3-metilkolantren
|
56-49-5
|
POSTUPAK
Tretiranje ispitivanom kemikalijom
|
33.
|
Stanice koje se razmnožavaju tretiraju se ispitivanom kemikalijom uz prisustvo i odsustvo sustava metaboličke aktivacije. Izlaganje treba trajati odgovarajuće vrijeme (obično je primjereno od tri do četiri sata). Međutim, trebalo bi napomenuti da ti zahtjevi mogu biti drukčiji za farmaceutske proizvode namijenjene ljudima (59.). Kod testa MLA u slučajevima kada se kratkotrajnim tretiranjem dobiju negativni rezultati, a postoje informacije koje ukazuje na potrebu za duljim tretiranjem (npr. nukleozidni analozi, slabo topljive kemikalije (5. i 59.)), treba razmotriti provođenje testa s duljim tretiranjem, tj. 24 sata bez S9.
|
|
34.
|
Minimalni broj stanica koje se koriste za svaku ispitnu kulturu (kontrolnu i tretiranu) u svakoj fazi ispitivanja trebao bi se temeljiti na učestalosti pojave spontanih mutanata. Opća je smjernica tretirati i pasažirati dovoljno stanica u svakoj pokusnoj kulturi kako bi se održalo najmanje deset, ali po mogućnosti 100 spontanih mutanata u svim fazama testa (tretiranje, fenotipska ekspresija i selekcija mutanata) (56.).
|
|
35.
|
Za test MLA preporučuje se prihvatljiva učestalost spontanih mutanata od 35–140 × 10-6 (verzija s agarom) i 50–170 × 10-6 (verzija s mikrojažicama) (vidjeti tablicu 2.). Da bi se dobilo najmanje deset, a po mogućnosti 100 spontanih mutanata koje će preživjeti tretiranje, za svaku ispitnu kulturu treba tretirati najmanje 6 × 106 stanica. Tretiranjem tog broja stanica i održavanjem dovoljnog broja stanica tijekom ekspresije i kloniranja za selekciju mutanata dobiva se dovoljan broj spontanih mutanata (deset ili više) tijekom svih faza pokusa, čak i za kulture tretirane pri koncentracijama koje uzrokuju 90-postotnu citotoksičnost (kako je izmjereno relativnim ukupnim rastom od 10 %) (19., 38. i 39.).
|
|
36.
|
Za test TK6 učestalost spontanih mutanata općenito iznosi od 2 do 10 × 10-6. Da bi se dobilo najmanje deset spontanih mutanata koje će preživjeti tretiranje, za svaku kulturu treba tretirati najmanje 20 × 106 stanica. Tretiranjem tog broja stanica dobiva se dovoljan broj spontanih mutanata (deset ili više), čak i za kulture tretirane pri koncentracijama koje uzrokuju 90-postotnu citotoksičnost tijekom tretiranja (relativna stopa preživljavanja od 10 %). Osim toga, mora se kultivirati dovoljan broj stanica tijekom razdoblja ekspresije i nasaditi radi selekcije mutanata (60.).
|
Vrijeme fenotipske ekspresije i mjerenje citotoksičnosti i učestalosti pojave mutanata
|
37.
|
Na kraju razdoblja tretiranja stanice se kultiviraju u zadanom vremenskom razdoblju kako bi se omogućila gotovo optimalna fenotipska ekspresija novoinduciranih mutacija; specifično za svaku staničnu liniju. Za test MLA razdoblje fenotipske ekspresije iznosi dva dana. Za test TK6 razdoblje fenotipske ekspresije iznosi od tri do četiri dana. Ako se upotrebljava tretiranje u trajanju od 24 sata, razdoblje ekspresije počinje nakon kraja tretiranja.
|
|
38.
|
Tijekom razdoblja fenotipske ekspresije stanice se prebrojavaju svakog dana. Kod testa MLA svakodnevno brojanje stanica upotrebljava se za izračun svakodnevnog rasta u suspenziji (SG). Nakon dvodnevnog razdoblja ekspresije stanice se suspendiraju u mediju sa selektivnim agensom ili bez njega radi utvrđivanja broja mutacija (ploče za odabir) i učinkovitosti kloniranja (ploče za vijabilnost). Za test MLA postoje dvije jednako prihvatljive metode za kloniranje selekcije mutanata; u jednoj se upotrebljava meki agar, a u drugom tekući medij u pločama s 96 jažica (19., 38. i 39.). Kloniranje u testu TK6 provodi se upotrebom tekućih medija i ploča s 96 jažica (16.).
|
|
39.
|
Za TK mutante kao selektivni agens preporučuje se samo trifluorotimidin (TFT) (61).
|
|
40.
|
Kod testa MLA agarne ploče i ploče s mikrojažicama prebrojavaju se nakon 10–12 dana inkubacije. Kod testa TK6 kolonije u pločama s mikrojažicama ocjenjuju se nakon 10–14 dana kako bi se uočili mutanti koji se javljaju rano. Kako bi se obnovili TK6 mutanti koji rastu sporo (koji se javljaju kasno), stanicama treba ponovno dodati medij za uzgoj i TFT nakon što se prebroje mutanti koji se javljaju rano i zatim inkubirati ploče dodatnih 7–10 dana (62.). Za pojedinosti o prebrojavanju TK mutanata koji rastu sporo i onih koji rastu normalno vidjeti stavke 42. i 44.
|
|
41.
|
Odgovarajući izračuni za dva testa, uključujući i dvije metode (agar i mikrojažice) za test MLA, nalaze se u Dodatku 2. Kod metode testa MLA u kojoj se upotrebljava agar, za izračun učestalosti pojave mutanata kolonije se prebrojavaju i broj kolonija mutanata prilagođava se s obzirom na učinkovitost kloniranja. Kod verzije testova MLA i TK6 s mikrojažicama, učinkovitost kloniranja i za ploče za selekciju i za ploče za učinkovitost kloniranja (63.) utvrđuje se u skladu s Poissonovom distribucijom. Učestalost pojave mutanata računa se iz tih dviju učinkovitosti kloniranja.
|
Opis kolonije mutanata
|
42.
|
Kod testa MLA, ako je ispitivana kemikalija pozitivna (vidjeti stavke od 62. do 63.), opisivanje kolonije razvrstavanjem po veličini kolonije ili po njezinom rastu treba provesti na najmanje jednoj od ispitnih kultura (obično najviša prihvatljiva pozitivna koncentracija) te na negativnim i pozitivnim kontrolama. Ako je ispitivana kemikalija negativna (vidjeti stavak 64.), opisivanje kolonije mutanata treba provesti na negativnim i pozitivnim kontrolama. Kod metode testa MLA s mikrojažicama mutanti koji tvore male kolonije definiraju se kao mutanti koji prekrivaju manje od 25 % promjera jažice, a mutanti koji tvore velike kolonije kao oni koji prekrivaju više od 25 % promjera jažice. Kod metode s agarom za prebrojavanje kolonija mutanata i razvrstavanje kolonija po veličini upotrebljava se automatski brojač kolonija. Pristupi razvrstavanju kolonija po veličini podrobno su opisani u literaturi (19., 38. i 40.). Opis kolonija na negativnoj i pozitivnoj kontroli potreban je kako bi se dokazalo da su studije provedene na primjeren način.
|
|
43.
|
Ne može se utvrditi da je ispitivana kemikalija negativna ako se u pozitivnoj kontroli pravilno ne otkriju i mutanti koji tvore velike kolonije i oni koji tvore male kolonije. Opis kolonije može se upotrijebiti za davanje općih informacija o sposobnosti ispitivane kemikalije da uzrokuje točkaste mutacije i/ili kromosomske pojave (stavak 4.).
|
|
44.
|
TK6: mutanti koji rastu normalno i oni koji rastu sporo razlikuju se prema različitim vremenima inkubacije (vidjeti stavak 40.) Kod testa TK6 mutanti koji se javljaju rano i oni koji se javljaju kasno obično se ocjenjuju za sve kulture, uključujući negativne i pozitivne kontrole. Opis kolonija negativne i pozitivne kontrole potreban je kako bi se dokazalo da su studije provedene na primjeren način. Ne može se utvrditi da je ispitivana kemikalija negativna ako se u pozitivnoj kontroli pravilno ne otkriju i mutanti koji se javljaju rano i mutanti koji se javljaju kasno. Opis kolonije može se upotrijebiti za davanje općih informacija o sposobnosti ispitivane kemikalije da uzrokuje točkaste mutacije i/ili kromosomske pojave (stavak 4.).
|
Osposobljenost laboratorija
|
45.
|
Kako bi dokazao da ima dovoljno iskustva u izvođenju testa prije njegove rutinske primjene, laboratorij treba izvesti niz pokusa s referentnim pozitivnim tvarima koje djeluju putem različitih mehanizama (najmanje jedna aktivna s metaboličkom aktivacijom i jedna aktivna bez metaboličke aktivacije, odabrana s popisa tvari iz tablice 1.) te s različitim negativnim kontrolama (uključujući netretirane kulture i različita otapala/nosače). Odgovori pozitivnih i negativnih kontrola trebali bi biti u skladu s literaturom. Taj se zahtjev ne odnosi na laboratorije s iskustvom, odnosno laboratorije s bazom prijašnjih podataka koja je stavljena na raspolaganje u skladu s definicijom iz stavaka 47.–50. Kod testa MLA vrijednosti koje se dobiju i za pozitivne i za negativne kontrole trebaju biti u skladu s preporukama IWGT-a (vidjeti tablicu 2.).
|
|
46.
|
Odabir tvari za pozitivnu kontrolu (vidjeti tablicu 1.) trebao bi se ispitati s kratkim i dugim tretiranjima (ako se upotrebljavaju duga tretiranja) u odsustvu metaboličke aktivacije i kratkim tretiranjima u prisustvu metaboličke aktivacije kako bi se dokazala osposobljenost za otkrivanje mutagenih kemikalija, za utvrđivanje djelotvornosti sustava metaboličke aktivacije i za dokazivanje primjerenosti uvjeta za rast stanica tijekom tretiranja, fenotipske ekspresije i selekcije mutanata te postupaka ocjenjivanja. Potrebno je izabrati raspon koncentracija odabranih tvari pri kojima će doći do ponovljivih povećanja u odnosu na pozadinu, koja su povezana s koncentracijom, kako bi se dokazala osjetljivost i dinamički raspon ispitnog sustava.
|
Podaci o prijašnjim kontrolama
|
47.
|
Laboratorij bi trebao utvrditi:
|
—
|
raspon i distribuciju prijašnjih pozitivnih kontrola,
|
|
—
|
raspon i distribuciju prijašnjih negativnih kontrola (netretirane kulture, kontrole s otapalom).
|
|
|
48.
|
Pri prvom bi dobivanju podataka za distribuciju podataka o prijašnjim negativnim kontrolama istodobne negativne kontrole trebale biti u skladu s objavljenim podacima o negativnim kontrolama. Kako se budu dodavali novi eksperimentalni podaci o distribuciji kontrola, istodobne negativne kontrole trebale bi u idealnom slučaju biti unutar kontrolnih granica od 95 % te distribucije (64. i 65.).
|
|
49.
|
Baza podataka o prijašnjim negativnim kontrolama laboratorija trebala bi u početku obuhvaćati najmanje deset pokusa, međutim bilo bi poželjno da se sastoji od najmanje 20 pokusa provedenih u usporedivim pokusnim uvjetima. Laboratoriji bi trebali primjenjivati metode za kontrolu kvalitete, kao što su kontrolni dijagrami (npr. C-dijagrami ili X-stupčasti dijagrami; 65.), kako bi utvrdili koliko su promjenjivi njihovi podaci o pozitivnim i negativnim kontrolama i dokazali da je u njihovu laboratoriju metodologija „pod kontrolom” (66.). Daljnje pojedinosti i preporuke o tome kako izraditi i upotrebljavati prijašnje podatke mogu se pronaći u literaturi (64.).
|
|
50.
|
Podaci o negativnim kontrolama trebali bi se sastojati od podataka o učestalosti pojave mutanata u jednoj kulturi ili, po mogućnosti, u ponovljenim kulturama kako je opisano u stavku 27. Istodobne negativne kontrole u idealnom bi slučaju trebale biti unutar kontrolnih granica od 95 % distribucije prijašnjih negativnih kontrola koje se nalaze u bazi podataka laboratorija. Ako se podaci o negativnim kontrolama nalaze izvan kontrolnih granica od 95 %, mogu biti prihvatljivi za uključenje u distribuciju prijašnjih kontrola pod uvjetom da ti podaci nisu ekstremne netipične vrijednosti te da postoje dokazi o tome da je ispitni sustav „pod kontrolom” (vidjeti stavak 49.) i da nema tehničke ili ljudske pogreške.
|
|
51.
|
Svaku izmjenu pokusnog protokola trebalo bi razmotriti s obzirom na to jesu li podaci u skladu s postojećim bazama podataka laboratorija o prijašnjim kontrolama. Svaka veća nesukladnost trebala bi dovesti do uspostave nove baze podataka o prijašnjim kontrolama.
|
PODACI I IZVJEŠĆIVANJE
Predstavljanje rezultata
|
52.
|
Predstavljanje podataka i za test MLA i za test TK6 treba uključivati, i za tretirane i kontrolne kulture, podatke potrebne za izračun citotoksičnosti (relativni ukupni rast ili relativna stopa preživljavanja) i učestalosti pojave mutanata, kako je opisano u nastavku.
|
|
53.
|
Kod testa MLA treba navesti podatke o pojedinačnim kulturama za relativni rast u suspenziji, relativni ukupni rast, učinkovitost kloniranja u trenutku selekcije mutanata i broj kolonija mutanata (za verziju s agarom) ili broj praznih jažica (za verziju s mikrojažicama). Učestalost pojave mutanata treba izraziti kao broj mutiranih stanica na milijun preživjelih stanica. Ako je odgovor pozitivan, učestalost pojave mutanata u malim i velikim kolonijama (i/ili postotak ukupne učestalosti pojave mutanata) treba navesti za barem jednu koncentraciju ispitivane kemikalije (obično najviša pozitivna koncentracija) te negativne i pozitivne kontrole. U slučaju negativnog odgovora učestalost pojave mutanata u malim i velikim kolonijama treba navesti za negativnu i pozitivnu kontrolu.
|
|
54.
|
Kod testa TK6 podatke o pojedinačnim kulturama treba navesti za relativnu stopu preživljavanja, učinkovitost kloniranja u trenutku selekcije mutanata i broj praznih jažica za mutante koji se javljaju rano i one koji se javljaju kasno. Učestalost pojave mutanata treba izraziti kao broj mutiranih stanica na broj preživjelih stanica, a treba uključivati ukupnu učestalost pojave mutanata te učestalost pojave mutanata (i/ili postotak ukupne učestalosti pojave mutanata) koji se javljaju rano i onih koji se javljaju kasno.
|
Kriteriji prihvatljivosti
|
55.
|
I za test MLA i za test TK6 treba ispuniti sljedeće kriterije prije nego što se utvrde ukupni rezultati za određenu ispitivanu kemikaliju:
|
—
|
provedena su dva pokusna uvjeta (kratko tretiranje s metaboličkom aktivacijom i bez nje – vidjeti stavak 33.), osim ako je jedan doveo do pozitivnih rezultata,
|
|
—
|
odgovarajući broj stanica i koncentracija prikladan je za analizu (stavci 27., 34.–36.),
|
|
—
|
kriteriji za odabir najveće koncentracije u skladu su s kriterijima opisanima u stavcima 28.–30.
|
|
Kriteriji prihvatljivosti za negativne i pozitivne kontrole
|
56.
|
Analiza velike količine podataka iz testova MLA koju je provela IWGT-ova Stručna skupina za MLA dovela je do međunarodnog konsenzusa u pogledu specifičnih kriterija prihvatljivosti za test MLA (1., 2., 3., 4. i 5.). Stoga se u toj ispitnoj metodi navode specifične preporuke za utvrđivanje prihvatljivosti negativnih i pozitivnih kontrola te za procjenu rezultata pojedinačnih tvari u testu MLA. Baza podataka za test TK6 mnogo je manja te ga stručna skupina nije procjenjivala.
|
|
57.
|
Kod testa MLA svaki pokus treba procijeniti s obzirom na to ispunjava li netretirana kontrola/kontrola s otapalom kriterije prihvatljivosti IWGT-ove Stručne skupine za MLA (4. i tablica 2. u nastavku) za: 1. učestalost pojave mutanata (treba napomenuti da se IWGT-ove prihvatljive učestalosti pojave mutanata razlikuju za verzije testa MLA s agarom i mikrojažicama); 2. učinkovitost kloniranja (CE) u trenutku selekcije mutanata i 3. rast u suspenziji (SG) za kontrolu s otapalom (formule potražiti u Dodatku 2.).
Tablica 2.
Kriteriji prihvatljivosti za MLA
|
Parametar
|
Metoda s mekim agarom
|
Metoda s mikrojažicama
|
|
Učestalost pojave mutanata
|
35 – 140 × 10-6
|
50 – 170 × 10-6
|
|
Učinkovitost kloniranja
|
65–120 %
|
65–120 %
|
|
Rast u suspenziji
|
8–32 puta (tretiranje od tri do četiri sata) 32–180 puta (tretiranje od 24 sata, ako se provodi)
|
8–32 puta (tretiranje od tri do četiri sata) 32–180 puta (tretiranje od 24 sata, ako se provodi)
|
|
|
58.
|
Kad je riječ o testu MLA, svaki test treba procijeniti i u pogledu toga ispunjavaju li pozitivne kontrole barem jedan od sljedeća dva kriterija prihvatljivosti koje je razvila stručna skupina IWGT-a:
|
—
|
pozitivna kontrola trebala bi pokazati apsolutno povećanje ukupne učestalosti pojave mutanata, tj. povećanje veće od pozadinske učestalosti pojave spontanih mutanata (inducirana učestalost pojave mutanata (IMF)) od najmanje 300 × 10-6. Najmanje 40 % IMF-a trebalo bi se odraziti u učestalosti pojave mutanata u maloj koloniji,
|
|
—
|
pozitivna kontrola pokazuje povećanje učestalosti pojave mutanata u maloj koloniji koje je za najmanje 150 × 10-6 veće od učestalosti u istodobnoj netretiranoj kontroli/kontroli s otapalom (IMF u malim kolonijama od 150 × 10-6).
|
|
|
59.
|
Kad je riječ o testu TK6, test će biti prihvatljiv ako se istodobna negativna kontrola smatra prihvatljivom za dodavanje u bazu podataka laboratorija o prijašnjim negativnim kontrolama kako je opisano u stavcima 48.–49. Osim toga, istodobne pozitivne kontrole (vidjeti stavak 32.) trebale bi inducirati odgovore koji su u skladu s onima generiranima u bazi podataka o prijašnjim pozitivnim kontrolama te dovesti do statistički značajnog povećanja u odnosu na istodobnu negativnu kontrolu.
|
|
60.
|
Kod oba bi testa gornja granica citotoksičnosti uočene kod pozitivne kontrolne kulture trebala biti ista kao i kod pokusnih kultura. Drugim riječima, relativni ukupni rast ili relativna stopa preživljavanja ne bi trebali biti manji od 10 %. Dovoljno je upotrijebiti jednu koncentraciju (ili jednu od koncentracija pozitivnih kontrolnih kultura ako se upotrebljava više koncentracija) kako bi se dokazalo da su ispunjeni kriteriji prihvatljivosti za pozitivnu kontrolu. Nadalje, učestalost pojave mutanata pozitivne kontrole mora biti unutar prihvatljivog raspona utvrđenog za laboratorij.
|
Ocjenjivanje i tumačenje rezultata
|
61.
|
Za test MLA znatan posao u vezi s biološkom relevantnosti i kriterijima za pozitivni odgovor obavila je IWGT-ova stručna skupina za limfome miša (4.). Stoga se u ovoj ispitnoj metodi pružaju specifične preporuke za tumačenje rezultata ispitivanih kemikalija iz testa MLA (vidjeti stavke 62.–64.). Baza podataka za test TK6 mnogo je manja te ga stručna skupina nije procjenjivala. Stoga su preporuke za tumačenja podataka za test TK6 općenitije (vidjeti stavke 65.–66.). Dodatne preporuke primjenjuju se na oba testa (vidjeti stavke 67.–71.).
|
MLA
|
62.
|
Preporučuje se pristup za utvrđivanje pozitivnih i negativnih odgovora kako bi se osiguralo da je povećana učestalost pojave mutanata biološki relevantna. Umjesto statističke analize koja se obično upotrebljava za ostale testove, ovaj se pristup oslanja na upotrebu unaprijed utvrđene inducirane učestalosti pojave mutanata (tj. povećanje učestalosti pojave mutanata veće nego u istodobnoj kontroli), određene kao globalni evaluacijski faktor (GEF), koji se temelji na analizi distribucije podataka o učestalosti pojave mutanata u negativnoj kontroli iz uključenih laboratorija (4.). Kod verzije testa s agarom GEF iznosi 90 × 10-6, a za verziju testa MLA s mikrojažicama GEF iznosi 126 × 10-6.
|
|
63.
|
Pod uvjetom da su ispunjeni svi kriteriji prihvatljivosti, ispitivana kemikalija smatra se jasno pozitivnom ako je u bilo kojem ispitanom pokusnom uvjetu (vidjeti stavak 33.) povećanje učestalosti pojave mutanata u odnosu na istodobno provedeno pozadinsko mjerenje veće od GEF-a te je povezano s koncentracijom (npr. upotrebom testa trenda). Tada se smatra da ispitivana kemikalija može inducirati mutacije u tom ispitnom sustavu.
|
|
64.
|
Pod uvjetom da su ispunjeni svi kriteriji prihvatljivosti, ispitivana kemikalija smatra se jasno negativnom ako u svim ispitnim pokusnim uvjetima (vidjeti stavak 33.) nema odgovora povezanog s koncentracijom ili, ako postoji povećanje učestalosti pojave mutanata, ono nije veće od GEF-a. Tada se smatra da ispitivana kemikalija ne može inducirati mutacije u tom ispitnom sustavu.
|
TK6
|
65.
|
Pod uvjetom da su ispunjeni svi kriteriji prihvatljivosti, ispitivana kemikalija smatra se jasno pozitivnom ako je u bilo kojem od ispitanih pokusnih uvjeta (vidjeti stavak 33.):
|
—
|
najmanje pri jednoj ispitnoj koncentraciji uočeno je statistički značajno povećanje u odnosu na istodobnu negativnu kontrolu,
|
|
—
|
odgovarajući test trenda pokazuje da je povećanje povezano s koncentracijom (vidjeti stavak 33.),
|
|
—
|
bilo koji od rezultata je izvan distribucije podataka o prijašnjim negativnim kontrolama (npr. kontrolne granice od 95 % prema Poissonovoj distribuciji; vidjeti stavak 48.).
|
Kada su ispunjeni svi ti uvjeti, smatra se da ispitivana kemikalija može inducirati mutacije u tom sustavu ispitivanja. Preporuke za najprikladnije statističke metode nalaze se u literaturi (66. i 67.).
|
|
66.
|
Pod uvjetom da su ispunjeni svi kriteriji prihvatljivosti, ispitivana kemikalija smatra se jasno negativnom ako u svim ispitanim pokusnim uvjetima (vidjeti stavak 33.):
|
—
|
ni pri jednoj ispitnoj koncentraciji nije uočeno statistički značajno povećanje u odnosu na istodobnu negativnu kontrolu,
|
|
—
|
odgovarajući test trenda pokazuje da nema povećanja povezanog s koncentracijom,
|
|
—
|
svi su rezultati u okviru distribucije podataka o prijašnjim negativnim kontrolama (npr. kontrolne granice od 95 % prema Poissonovoj distribuciji; vidjeti stavak 48.).
|
Tada se smatra da ispitivana kemikalija ne može inducirati mutacije u tom ispitnom sustavu.
|
I za test MLA i za test TK6:
|
67.
|
Ako se najveća koncentracija temelji na citotoksičnosti, najvećom koncentracijom trebao bi se nastojati ostvariti RTG/RS od 20 do 10 %. Konsenzus je da treba oprezno tumačiti pozitivne rezultate koji se nalaze samo u rasponu RTG-a/RS-a od 20 do 10 % te da se rezultat neće smatrati pozitivnim ako je do povećanja učestalosti pojave mutanata došlo samo kod RTG-a/RS-a od 10 % ili manjeg (ako se procjenjuje) (2. i 59.).
|
|
68.
|
Postoje određene okolnosti u kojima dodatne informacije mogu pomoći u utvrđivanju da ispitivana kemikalija nije mutagena ako nema kulture koja pokazuje vrijednost RTG-a od 10 do 20 % RTG-a/RS-a. Te su situacije sažete u nastavku teksta. 1. Ne postoje dokazi o mutagenom učinku (npr. nema odgovora na dozu, nema učestalosti pojave mutanata veće od one koja se opaža kod istodobne negativne kontrole ili u odnosu na prijašnje pozadinske raspone itd.) u nizu podatkovnih točaka od 100 % do 20 % RTG-a/RS-a te postoji barem jedna podatkovna točka u rasponu od 20 do 25 % RTG-a/RS-a. 2. Ne postoje dokazi o mutagenom učinku (npr. nema odgovora na dozu, nema učestalosti pojave mutanata veće od one koja se opaža kod istodobne negativne kontrole ili u odnosu na prijašnje pozadinske raspone itd.) u nizu podatkovnih točaka od 100 % do 25 % RTG-a/RS-a te postoji i negativna podatkovna točka koja je malo niža od 10 % RTG-a/RS-a. U te dvije situacije može se zaključiti da je ispitivana kemikalija negativna.
|
|
69.
|
Jasno pozitivan ili negativan odgovor nije potrebno provjeravati.
|
|
70.
|
Ako odgovor nije ni jasno pozitivan ni jasno negativan kako je prethodno opisano i/ili kako bi se pridonijelo utvrđivanju biološke relevantnosti rezultata, podatke bi trebalo ocjenjivati na temelju stručne prosudbe i/ili daljnjih istraživanja. Moglo bi biti korisno ponoviti pokus, eventualno u izmijenjenim pokusnim uvjetima (npr. razmak između koncentracija kako bi se povećala vjerojatnost dobivanja podatkovnih točaka u rasponu od 10 do 20 % RTG-a/RS-a, upotreba drugih uvjeta metaboličke aktivacije (tj. koncentracija S9 ili podrijetlo S9) i trajanje tretiranja).
|
|
71.
|
U rijetkim slučajevima, čak i nakon dodatnih istraživanja, skup podataka neće omogućiti donošenje zaključka o tome je li rezultat pozitivan ili negativan. Stoga bi se trebalo zaključiti da je odgovor na ispitivanu kemikaliju dvosmislen (tumači se da je jednako vjerojatno da je pozitivan ili negativan).
|
IZVJEŠĆE O ISPITIVANJU
|
72.
|
Izvješće o ispitivanju trebalo bi sadržavati sljedeće informacije:
|
|
Ispitivana kemikalija:
|
—
|
izvor, broj serije, rok uporabe, ako su dostupni,
|
|
—
|
stabilnost ispitivane kemikalije, ako je poznata,
|
|
—
|
topljivost i stabilnost ispitivane kemikalije u otapalu, ako su poznate,
|
|
—
|
izmjerene vrijednosti za pH, osmolalnost i taloženje u mediju za uzgoj kulture u koju je dodana ispitivana kemikalija, prema potrebi.
|
|
|
Tvar s jednim sastojkom:
|
—
|
fizički izgled, topljivost u vodi i druga relevantna fizikalno-kemijska svojstva,
|
|
—
|
kemijske identifikacijske oznake, kao što su IUPAC ili CAS naziv, CAS broj, SMILES ili InChI oznaka, strukturna formula, čistoća, kemijski identitet nečistoća prema potrebi i ako je izvedivo u praksi itd.
|
|
|
|
Tvari s više sastojaka, UVCB tvari i smjese:
|
—
|
opis (koliko je to moguće) kemijskog identiteta (vidjeti gore), kvantitativnog udjela i relevantnih fizikalno-kemijskih svojstava sastojaka.
|
|
|
|
|
Otapalo:
|
—
|
obrazloženje odabira otapala,
|
|
—
|
postotak otapala u konačnom mediju za uzgoj kulture.
|
|
|
|
Stanice:
|
|
za laboratorijske glavne kulture:
|
—
|
vrsta i izvor stanica te prethodna upotreba u ispitnom laboratoriju,
|
|
—
|
kariotipna svojstva i/ili modalni broj kromosoma,
|
|
—
|
metode održavanja staničnih kultura,
|
|
—
|
vremena udvostručivanja stanica.
|
|
|
|
|
Ispitni uvjeti:
|
—
|
obrazloženje odabira koncentracija i broja staničnih kultura, uključujući, npr. podatke o citotoksičnosti i ograničenja topljivosti,
|
|
—
|
sastav medija, koncentracija CO2, razina vlažnosti,
|
|
—
|
koncentracija ispitivane kemikalije izražena kao konačna koncentracija u mediju za uzgoj kulture (npr. μg ili mg/ml ili mM medija za uzgoj kulture),
|
|
—
|
koncentracija (i/ili volumen) otapala i ispitivane kemikalije koji su dodani mediju za uzgoj kulture,
|
|
—
|
temperatura inkubacije,
|
|
—
|
gustoća stanica za vrijeme tretiranja,
|
|
—
|
vrsta i sastav sustava metaboličke aktivacije (izvor S9, metoda pripreme mješavine S9, koncentracija ili volumen mješavine S9 i S9 u konačnom mediju za uzgoj kulture, kontrole kvalitete S9),
|
|
—
|
tvari za pozitivnu i negativnu kontrolu, konačne koncentracije za svaki uvjet tretiranja,
|
|
—
|
dužina razdoblja ekspresije (uključujući broj nasađenih stanica te režim uzgoja supkultura i dodavanja hranjivih tvari, ako je primjereno),
|
|
—
|
identitet selektivnog agensa i njegova koncentracija,
|
|
—
|
kod testa MLA treba navesti primijenjenu metodu (agar ili mikrojažice),
|
|
—
|
kriteriji prihvatljivosti testova,
|
|
—
|
metode korištene za prebrojavanje vijabilnih i mutiranih stanica,
|
|
—
|
metode mjerenja citotoksičnosti,
|
|
—
|
sve dodatne informacije koje se odnose na citotoksičnost i upotrijebljenu metodu,
|
|
—
|
trajanje inkubacije nakon nasađivanja,
|
|
—
|
definicija kolonija kod kojih se razmatra veličina i vrsta (uključujući kriterije za „male” i „velike” kolonije, ako je primjereno),
|
|
—
|
kriteriji prema kojima se studija smatra pozitivnom, negativnom ili dvosmislenom,
|
|
—
|
metode upotrijebljene za određivanje pH-vrijednosti i osmolalnosti, ako se provode, te za određivanje taloženja, ako je relevantno.
|
|
|
|
Rezultati:
|
—
|
broj tretiranih stanica i broj supkultiviranih stanica za svaku kulturu,
|
|
—
|
parametri toksičnosti (RTG za MLA i RS za TK6),
|
|
—
|
znakovi taloženja i vrijeme utvrđivanja,
|
|
—
|
broj stanica nasađenih u selektivni i neselektivni medij,
|
|
—
|
broj kolonija u neselektivnom mediju i broj otpornih kolonija u selektivnom mediju te povezana učestalost pojave mutanata,
|
|
—
|
razvrstavanje kolonija po veličini za negativne i pozitivne kontrole, a ako je ispitivana kemikalija pozitivna, najmanje jedna koncentracija i povezane učestalosti pojave mutanata,
|
|
—
|
odnos koncentracije i odgovora, ako je moguće,
|
|
—
|
podaci o istodobnim negativnim kontrolama (otapalo) i pozitivnim kontrolama (koncentracije i otapala),
|
|
—
|
podaci o prijašnjim negativnim (otapalo) i pozitivnim kontrolama (koncentracije i otapala) s rasponima, srednjim vrijednostima i standardnim devijacijama, broj ispitivanja na kojima se temelje kontrole iz prijašnjih ispitivanja,
|
|
—
|
statističke analize (za pojedinačne kulture i objedinjena ponavljanja ako je primjereno) i p-vrijednosti, ako postoje, te procjena GEF-a za test MLA.
|
|
|
LITERATURA
|
1.
|
Moore, M.M., Honma, M. Clements, J. (Rapporteur), Awogi, T., Bolcsfoldi, G., Cole, J., Gollapudi, B., Harrington-Brock, K., Mitchell, A., Muster, W., Myhr, B., O’Donovan, M., Ouldelhkim, M-C., San, R., Shimada, H. and Stankowski, L.F. Jr. (2000). Mouse Lymphoma Thymidine Kinase Locus (TK) Gene Mutation Assay: International Workshop on Genotoxicity Test Procedures (IWGTP) Workgroup Report, Environ. Mol. Mutagen., 35 (3): 185.–190.
|
|
2.
|
Moore, M.M., Honma, M., Clements, J., Harrington-Brock, K., Awogi, T., Bolcsfoldi, G., Cifone, M., Collard, D., Fellows, M., Flanders, K., Gollapudi, B., Jenkinson, P., Kirby, P., Kirchner, S., Kraycer, J., McEnaney, S., Muster, W., Myhr, B., O’Donovan, M., Oliver, Ouldelhkim, M-C., Pant, K., Preston, R., Riach, C., San, R., Shimada, H. and Stankowski, L.F. Jr. (2002). Mouse Lymphoma Thymidine Kinase Locus Gene Mutation Assay: Follow-Up International Workshop on Genotoxicity Test Procedures, New Orleans, Louisiana, (travanj 2000.), Environ. Mol. Mutagen., 40 (4): 292.–299.
|
|
3.
|
Moore, M.M., Honma, M., Clements, J., Bolcsfoldi, G., Cifone, M., Delongchamp, R., Fellows, M., Gollapudi, B., Jenkinson, P., Kirby, P., Kirchner, S., Muster, W., Myhr, B., O’Donovan, M., Ouldelhkim, M-C., Pant, K., Preston, R., Riach, C., San, R., Stankowski, L.F. Jr., Thakur, A., Wakuri, S. and Yoshimura, I. (2003). Mouse Lymphoma Thymidine Kinase Locus Gene Mutation Assay: International Workshop (Plymouth, UK) on Genotoxicity Test Procedures Workgroup Report, Mutation Res., 540: 127.–140.
|
|
4.
|
Moore, M.M., Honma, M., Clements, J., Bolcsfoldi, G., Burlinson, B., Cifone, M., Clarke, J., Delongchamp, R., Durward, R., Fellows, M., Gollapudi, B., Hou, S., Jenkinson, P., Lloyd, M., Majeska, J., Myhr, B., O’Donovan, M., Omori, T., Riach, C., San, R., Stankowski, L.F. Jr., Thakur, A.K., Van Goethem, F., Wakuri, S. and Yoshimura, I. (2006). Mouse Lymphoma Thymidine Kinase Gene Mutation Assay: Follow-Up Meeting of the International Workshop on Genotoxicity Tests – Aberdeen, Scotland, 2003 – Assay Acceptance Criteria, Positive Controls, and Data Evaluation, Environ. Mol. Mutagen., 47 (1): 1.–5.
|
|
5.
|
Moore, M.M., Honma, M., Clements, J., Bolcsfoldi, G., Burlinson, B., Cifone, M., Clarke, J., Clay, P., Doppalapudi, R., Fellows, M., Gollapudi, B., Hou, S., Jenkinson, P., Muster, W., Pant, K., Kidd, D.A., Lorge, E., Lloyd, M., Myhr, B., O’Donovan, M., Riach, C., Stankowski, L.F. Jr., Thakur A.K. and Van Goethem, F. (2007). Mouse Lymphoma Thymidine Kinase Mutation Assay: Meeting of the International Workshop on Genotoxicity Testing, San Francisco, 2005, Recommendations for 24-h Treatment, Mutation. Res., 627 (1): 36.–40.
|
|
6.
|
OECD (2016). Overview of the set of OECD Genetic Toxicology Test Guidelines and updates performed in 2014-2015. ENV Publications. Series on Testing and Assessment, No. 234, OECD, Pariz.
|
|
7.
|
Fellows M.D., Luker, T., Cooper, A. and O’Donovan, M.R. (2012). Unusual Structure-Genotoxicity Relationship in Mouse Lymphoma Cells Observed with a Series of Kinase Inhibitors. Mutation, Res., 746 (1): 21.–28.
|
|
8.
|
Honma, M., Momose, M., Sakamoto, H., Sofuni, T. and Hayashi, M. (2001). Spindol Poisons Induce Allelic Loss in Mouse Lymphoma Cells Through Mitotic Non-Disjunction. Mutation Res., 493 (1-2): 101.–114.
|
|
9.
|
Wang, J., Sawyer, J.R., Chen, L., Chen, T., Honma, M., Mei, N. and Moore, M.M. (2009). The Mouse Lymphoma Assay Detects Recombination, Deletion, and Aneuploidy, Toxicol. Sci., 109 (1): 96.–105.
|
|
10.
|
Applegate, M.L., Moore, M.M., Broder, C.B., Burrell, A., and Hozier, J.C. (1990). Molecular Dissection of Mutations at the Heterozygous Thymidine Kinase Locus in Mouse Lymphoma Cells. Proc. National. Academy. Sci. SAD, 87 (1): 51.–55.
|
|
11.
|
Hozier, J., Sawyer, J., Moore, M., Howard, B. and Clive, D. (1981). Cytogenetic Analysis of the L5178Y/TK+/- Leads to TK-/- Mouse Lymphoma Mutagenesis Assay System, Mutation Res., 84 (1): 169.–181.
|
|
12.
|
Hozier, J., Sawyer, J., Clive, D. and Moore, M.M. (1985). Chromosome 11 Aberrations in Small Colony L5178Y TK-/- Mutants Early in their Clonal History, Mutation Res., 147 (5): 237.–242.
|
|
13.
|
Moore, M.M., Clive, D., Hozier, J.C., Howard, B.E., Batson, A.G., Turner, N.T. and Sawyer, J. (1985). Analysis of Trifluorothymidine-Resistant (TFTr) Mutants of L5178Y/TK+/- Mouse Lymphoma Cells. Mutation Res., 151 (1): 161.–174.
|
|
14.
|
Liber H.L., Call K.M. and Little J.B. (1987). Molecular and Biochemical Analyses of Spontaneous and X-Ray-Induced Mutants in Human Lymphoblastoid Cells. Mutation Res., 178 (1): 143.–153.
|
|
15.
|
Li C.Y., Yandell D.W. and Little J.B. (1992). Molecular Mechanisms of Spontaneous and Induced Loss of Heterozygosity in Human Cells In Vitro. Somat. Cell Mol. Genet., 18 (1): 77.–87.
|
|
16.
|
Honma M., Hayashi M. and Sofuni T. (1997). Cytotoxic and Mutagenic Responses to X-Rays and Chemical Mutagens in Normal and P53-Mutated Human Lymphoblastoid Cells. Mutation. Res., 374 (1): 89.–98.
|
|
17.
|
Honma, M., Momose, M., Tanabe, H., Sakamoto, H., Yu, Y., Little, J.B., Sofuni, T. and Hayashi, M. (2000). Requirement of Wild-Type P53 Protein for Maintenance of Chromosomal Integrity. Mol. Carcinogen., 28 (4): 203.–14.
|
|
18.
|
Amundson S.A. and Liber H.L. (1992). A Comparison of Induced Mutation at Homologous Alleles of the TK Locus in Human Cells. II. Molecular Analysis of Mutants. Mutation Res., 267 (1): 89.–95.
|
|
19.
|
Schisler M.R., Moore M.M. and Gollapudi B.B. (2013). In Vitro Mouse Lymphoma (L5178Y TK+/- -3.7.2C) Forward Mutation Assay. In Protocols in Genotoxicity Assessment A. Dhawan and M. Bajpayee (Eds.), Springer Protocols, Humana Press: 27.–50.
|
|
20.
|
Long, L.H., Kirkland, D., Whitwell, J. and Halliwell, B. (2007). Different Cytotoxic and Clastogenic Effects of Epigallocatechin Gallate in Various Cell-Culture Media Due to Variable Rates of its Oxidation in the Culture Medium, Mutation Res., 634 (1-2): 177.–183.
|
|
21.
|
Nesslany, F., Simar-Meintieres, S., Watzinger, M., Talahari, I. and Marzin, D. (2008). Characterization of the Genotoxicity of Nitrilotriacetic Acid. Environ. Mol. Mutagen., 49 (6): 439.–452.
|
|
22.
|
Brusick D. (1986). Genotoxic Effects in Cultured Mammalian Cells Produced by Low pH Treatment Conditions and Increased Ion Concentrations. Environ. Mutagen., 8 (6): 879.–886.
|
|
23.
|
Morita, T., Nagaki, T., Fukuda, I. and Okumura, K. (1992). Clastogenicity of Low pH to Various Cultured Mammalian Cells. Mutation Res., 268 (2): 297.–305.
|
|
24.
|
Scott, D., Galloway, S.M., Marshall, R.R., Ishidate, M.Jr, Brusick, D., Ashby, J. and Myhr, B.C. (1991). Genotoxicity under Extreme Culture Conditions. A report from ICPEMC Task Group 9. Mutation Res., 257: 147.–204.
|
|
25.
|
Wang J., Heflich R.H. and Moore M.M. (2007). A Method to Distinguish Between the De Novo Induction of Thymidine Kinase Mutants and the Selection of Pre-Existing Thymidine Kinase Mutants in the Mouse Lymphoma Assay. Mutation Res., 626 (1-2): 185.–190.
|
|
26.
|
Fischer, G.A. (1958). Studies on the Culture of Leukemic Cells In Vitro. Ann. N.Y. Academy Sci., 76: 673.–680.
|
|
27.
|
Clive, D., Johnson, K.O., Spector, J.F.S., Batson, A.G. and Brown, M.M.M. (1979). Validation and Characterization of the L5178Y/TK+/-- Mouse Lymphoma Mutagen Assay System. Mutation Res., 59(1): 61.–108.
|
|
28.
|
Sawyer, J., Moore, M.M., Clive, D. and Hozier, J. (1985). Cytogenetic Characterization of the L5178Y TK+/- 3.7.2C Mouse Lymphoma Cell Line, Mutation Res., 147 (5): 243.–253.
|
|
29.
|
Sawyer J.R., Moore M.M. and Hozier J.C. (1989). High-Resolution Cytogenetic Characterization of the L5178Y TK+/- Mouse Lymphoma Cell Line, Mutation Res., 214 (2): 181.–193.
|
|
30.
|
Sawyer, J.R., Binz, R.L., Wang, J. and Moore, M.M. (2006). Multicolor Spectral Karyotyping of the L5178Y TK+/--3.7.2C Mouse Lymphoma Cell Line, Environ. Mol. Mutagen., 47 (2): 127.–131.
|
|
31.
|
Fellows, M.D., McDermott, A., Clare, K.R., Doherty, A. and Aardema, M.J. (2014). The Spectral Karyotype of L5178Y TK+/- Mouse Lymphoma Cells Clone 3.7.2C and Factors Affecting Mutant Frequency at the Thymidine Kinase (TK) Locus in the Microtitre Mouse Lymphoma Assay, Environ. Mol. Mutagen., 55 (1): 35.–42.
|
|
32.
|
Storer, R.D., Jraynak, A.R., McKelvey, T.W., Elia, M.C., Goodrow, T.L. and DeLuca, J.G. (1997). The Mouse Lymphoma L5178Y TK+/- Cell Line is Heterozygous for a Codon 170 Mutation in the P53 Tumor Suppressor Gene. Mutation. Res., 373 (2): 157.–165.
|
|
33.
|
Clark L.S., Harrington-Brock, K., Wang, J., Sargent, L., Lowry, D., Reynolds, S.H. and Moore, M.M. (2004). Loss of P53 Heterozygosity is not Responsible for the Small Colony Thymidine Kinase Mutant Phenotype in L5178Y Mouse Lymphoma Cells. Mutagen., 19 (4): 263.–268.
|
|
34.
|
Skopek T.R., Liber, H.L., Penman, B.W. and Thilly, W.G. (1978). Isolation of a Human Lymphoblastoid Line Heterozygous at the Thymidine Kinase Locus: Possibility for a Rapid Human Cell Mutation Assay. Biochem. Biophys. Res. Commun., 84 (2): 411.–416.
|
|
35.
|
Honma M. (2005). Generation of Loss of Heterozygosity and its Dependency on P53 Status in Human Lymphoblastoid Cells. Environ. Mol. Mutagen., 45 (2-3): 162.–176.
|
|
36.
|
Xia, F., Wang, X., Wang, Y.H., Tsang, N.M., Yandell, D.W., Kelsey, K.T. and Liber, H.L. (1995). Altered P53 Status Correlates with Differences in Sensitivity to Radiation-Induced Mutation and Apoptosis in Two Closely Related Human Lymphoblast Lines. Cancer. Res., 55 (1): 12.–15.
|
|
37.
|
Lorge, E., M. Moore, J. Clements, M. O Donovan, M. Honma, A. Kohara, J. van Benthem, S. Galloway, M.J. Armstrong, V. Thybaud, B. Gollapudi, M. Aardema, J. Kim, A. Sutter, D.J. Kirkland (2015). Standardized Cell Sources and Recommendations for Good Cell Culture Practices in Genotoxicity Testing. (Rukopis u pripremi).
|
|
38.
|
Lloyd M. and Kidd D. (2012). The Mouse Lymphoma Assay. Springer Protocols: Methods in Molecular Biology 817, Genetic Toxicology Principles and Methods, ed. Parry and Parry, Humana Press. ISBN, 978-1-61779-420-9, 35-54.
|
|
39.
|
Mei N., Guo X. and Moore M.M. (2014). Methods for Using the Mouse Lymphoma Assay to Screen for Chemical Mutagenicity and Photo-Mutagenicity. U: Optimization in Drug Discover: In Vitro Methods: Yan Z and Caldwell (Eds), 2nd Edition, GW; Humana Press, Totowa, NJ.
|
|
40.
|
Liber H.L. and Thilly W.G. (1982). Mutation Assay at the Thymidine Kinase Locus in Diploidhuman Lymphoblasts. Mutation Res., 94 (2): 467.–485.
|
|
41.
|
Coecke, S., Balls, M., Bowe, G., Davis, J., Gstraunthaler, G., Hartung, T., Hay, R., Merten, OW., Price, A., Schechtman, L., Stacey, G. and Stokes, W. (2005). Guidance on Good Cell Culture Practice. A Report of the Second ECVAM Task Force on Good Cell Culture Practice. ATLA, 33 (3): 261.–287.
|
|
42.
|
Moore M.M. and Howard B.E. (1982). Quantitation of Small Colony Trifluorothymidine-Resistant Mutants of L5178Y/TK+/- Mouse Lymphoma Cells in RPMI-1640 Medium, Mutation Res., 104 (4-5): 287.–294.
|
|
43.
|
Ames B.N., McCann J. and Yamasaki E. (1975). Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian Microsome Mutagenicity Test. Mutation Res., 31 (6): 347.–364.
|
|
44.
|
Maron D.M. and Ames B.N. (1983). Revised Methods for the Salmonella Mutagenicity Test. Mutation Res., 113 (3-4): 173.–215.
|
|
45.
|
Natarajan, A.T., Tates, A.D, Van Buul, P.P.W., Meijers, M. and De Vogel, N. (1976). Cytogenetic Effects of Mutagens/Carcinogens After Activation in a Microsomal System In Vitro, I. Induction of Chromosomal Aberrations and Sister Chromatid Exchanges by Diethylnitrosamine (DEN) and Dimethylnitrosamine (DMN) in CHO Cells in the Presence of Rat-Liver Microsomes. Mutation Res., 37 (1): 83.–90.
|
|
46.
|
Matsuoka A., Hayashi M. and Ishidate M. Jr. (1979). Chromosomal Aberration Tests on 29 Chemicals Combined with S9 Mix In Vitro. Mutation Res., 66 (3): 277.–290.
|
|
47.
|
Ong T.M., et al. (1980). Differential Effects of Cytochrome P450-Inducers on Promutagen Activation Capabilities and Enzymatic Activities of S-9 from Rat Liver, J. Environ. Pathol. Toxicol., 4 (1): 55.–65.
|
|
48.
|
Elliott, B.M., Combes, R.D., Elcombe, C.R., Gatehouse, D.G., Gibson, G.G., Mackay, J.M. and Wolf, R.C. (1992). Report of UK Environmental Mutagen Society Working Party. Alternatives to Aroclor 1254-Induced S9 in In Vitro Genotoxicity Assays. Mutagen., 7 (3): 175.–177.
|
|
49.
|
Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T. (1976). A Safe Substitute for Polychlorinated Biphenyls as an Inducer of Metabolic Activation Systems. U: In Vitro Metabolic Activation in Mutagenesis Testing. de Serres F.J., et al. (Eds, Elsevier, North-Holland, str. 85.–88.
|
|
50.
|
Galloway S.M., et al. (1994). Report from Working Group on In Vitro Tests for Chromosomal Aberrations. Mutation Res., 312 (3): 241.–261.
|
|
51.
|
Johnson T.E., Umbenhauer D.R. and Galloway S.M. (1996). Human Liver S-9 Metabolic Activation: Proficiency in Cytogenetic Assays and Comparison with Phenobarbital/Beta-Naphthoflavone or Aroclor 1254 Induced Rat S-9, Environ. Mol. Mutagen., 28 (1): 51.–59.
|
|
52.
|
UNEP (2001). Stockholm Convention on Persistent Organic Pollutants, United Nations Environment Programme (UNEP).
|
|
53.
|
Krahn D.F., Barsky F.C. and McCooey K.T. (1982). CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids. U: Genotoxic Effects of Airborne Agents Tice R.R., Costa D.L.and Schaich K.M. (Eds.) New York, Plenum, str. 91.–103.
|
|
54.
|
Zamora, P.O., Benson, J.M., Li, A.P. and Brooks, A.L. (1983). Evaluation of an Exposure System Using Cells Grown on Collagen Gels for Detecting Highly Volatile Mutagens in the CHO/HGPRT Mutation Assay. Environ. Mutagen., 5 (6): 795.–801.
|
|
55.
|
Asakura M., Sasaki T., Sugiyama T., Arito H., Fukushima, S. and Matsushima, T. (2008). An Improved System for Exposure of Cultured Mammalian Cells to Gaseous Compounds in the Chromosomal Aberration Assay. Mutation Res., 652 (2): 122.–130.
|
|
56.
|
Arlett C.F., et al. (1989). Mammalian Cell Gene Mutation Assays Based upon Colony Formation. U: Statistical Evaluation of Mutagenicity Test Data, Kirkland, D.J. (Ed.), Cambridge University Press, str. 66.–101.
|
|
57.
|
Morita T., Honma M. and Morikawa K. (2012). Effect of Reducing the Top Concentration Used in the In Vitro Chromosomal Aberration Test in CHL Cells on the Evaluation of Industrial Chemical Genotoxicity. Mutation Res., 741 (1-2): 32.–56.
|
|
58.
|
Brookmire L., Chen J.J. and Levy D.D. (2013). Evaluation of the Highest Concentrations Used in the In Vitro Chromosome Aberrations Assay. Environ. Mol. Mutagen., 54 (1): 36.–43.
|
|
59.
|
USFDA (2012). International Conference on Harmonisation (ICH) Guidance S2 (R1) on Genotoxicity Testing and Data Interpretation for Pharmaceuticals Intended For Human Use. Dostupno na: [https://www.federalregister.gov/a/2012-13774].
|
|
60.
|
Honma M. and Hayashi M. (2011). Comparison of In Vitro Micronucleus and Gene Mutation Assay Results for P53-Competent Versus P53-Deficient Human Lymphoblastoid Cells. Environ. Mol. Mutagen., 52 (5): 373.–384.
|
|
61.
|
Moore-Brown, M.M., Clive, D., Howard, B.E., Batson, A.G. and Johnson, K.O. (1981). The Utilization of Trifluorothymidine (TFT) to Select for Thymidine Kinase-Deficient (TK-/-) Mutants from L5178Y/TK+/- Mouse Lymphoma Cells, Mutation Res., 85 (5): 363.–378.
|
|
62.
|
Liber H.L., Yandell D.W. and Little J.B. (1989). A Comparison of Mutation Induction at the TK and HRPT Loci in Human Lymphoblastoid Cells; Quantitative Differences are Due to an Additional Class of Mutations at the Autosomal TK locus. Mutation Res., 216 (1): 9.–17.
|
|
63.
|
Furth E.E., Thilly, W.G., Penman, B.W., Liber, H.L. and Rand, W.M. (1981). Quantitative Assay for Mutation in Diploid Human Lymphoblasts Using Microtiter Plates. Anal. Biochem., 110 (1): 1.–8.
|
|
64.
|
Hayashi, M., Dearfield, K., Kasper, P., Lovell, D., Martus, H. J. and Thybaud, V. (2011). Compilation and Use of Genetic Toxicity Historical Control Data, Mutation Res., 723 (2): 87.–90.
|
|
65.
|
Ryan T.P. (2000). Statistical Methods for Quality Improvement. John Wiley and Sons, New York 2nd Edition.
|
|
66.
|
OECD (2014). Statistical analysis supporting the revision of the genotoxicity Test Guidelines. Environmental Health and Safety Publications, Series on Testing and Assessment, (No 199), Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
67.
|
Fleiss J.L., Levin B. and Paik M.C. (2003). Statistical Methods for Rates and Proportions, Third Edition, New York: John Wiley & Sons.
|
Dodatak 1.
DEFINICIJE
Aneugen
: svaka kemikalija ili postupak koji u interakciji s elementima mitotičkog i mejotičkog ciklusa diobe stanice uzrokuje aneuploidiju u stanicama ili organizmima.
Aneuploidija
: svako odstupanje od uobičajenog diploidnog (ili haploidnog) broja kromosoma za jedan kromosom ili više njih, ali ne za cijelu skupinu ili skupine kromosoma (poliploidija).
Mutageni supstitucije baznih parova
: kemikalije koje uzrokuju supstituciju baznih parova u DNK-u.
Kemikalija
: tvar ili smjesa.
Učinkovitost kloniranja
: postotak stanica nasađenih pri malenoj gustoći koje mogu narasti u koloniju koja se može prebrojiti.
Klastogen
: svaka kemikalija ili proces koji uzrokuju strukturne kromosomske aberacije u populacijama stanica ili organizama.
Citotoksičnost
: za testove obuhvaćene ovom ispitnom metodom citotoksičnost se definira kao smanjenje relativnog ukupnog rasta (RTG) za MLA ili relativne stope preživljavanja (RS) za TK6.
Napredna mutacija
: genska mutacija od roditeljskog tipa u mutantni oblik, koja uzrokuje promjenu ili gubitak enzimskog djelovanja ili funkcije kodiranog proteina.
Mutageni pomaka okvira očitavanja (frameshift mutageni)
: kemikalije koje uzrokuju adiciju ili deleciju jednog baznog para ili više njih u molekuli DNK.
Genotoksičnost
: opći izraz kojim su obuhvaćene sve vrste oštećenja DNK ili kromosoma uključujući lomove DNK, adukte, premještanja, mutacije, aberacije kromosoma i aneuploidiju. Ne dovode sve vrste genotoksičnih učinaka do mutacija ili trajnog oštećenja kromosoma.
Mitotska rekombinacija
: rekombinacija između homolognih kromatida koja može dovesti do indukcije lomova oba lanca DNK ili gubitka heterozigotnosti, a do koje dolazi tijekom mitoze.
Mutagen
: uzrokuje nasljednu promjenu slijeda (sljedova) parova baza DNK u genima ili strukture kromosoma (kromosomske aberacije).
Učestalost pojave mutanata (MF)
: broj uočenih mutiranih stanica podijeljen brojem vijabilnih stanica.
Vrijeme fenotipske ekspresije
: vrijeme nakon tretiranja tijekom kojeg se genetske modifikacije fiksiraju unutar genoma i postojeći genski produkti odstranjuju do te mjere da se mijenja fenotipsko svojstvo.
Relativna stopa preživljavanja (RS)
: relativna stopa preživljavanja upotrebljava se kao mjera citotoksičnosti povezane s tretiranjem u testu TK6. To je relativna učinkovitost kloniranja (CE) stanica koje se nasade odmah nakon što ih se tretira, prilagođeno za mogući gubitak stanica tijekom tretiranja u odnosu na učinkovitost kloniranja negativne kontrole.
Relativni rast u suspenziji (RSG)
: kod testa MLA, relativni ukupni rast ispitivane kulture u suspenziji tijekom dva dana u usporedbi s ukupnim rastom negativne kontrole/kontrole s otapalom u suspenziji tijekom dva dana (Clive i Spector, 1975.). Relativni rast u suspenziji treba uključivati relativni rast ispitivane kulture u usporedbi s negativnom kontrolom/kontrolom s otapalom tijekom razdoblja tretiranja.
Relativni ukupni rast (RTG)
: relativni ukupni rast upotrebljava se kao mjera citotoksičnosti povezane s tretiranjem u testu MLA. To je mjera relativnog (u odnosu na kontrolu s nosačem) rasta ispitivanih kultura tijekom faza tretiranja, dvodnevne ekspresije i kloniranja selekcije mutanata u testu. Relativni ukupni rast svake ispitivane kulture množi se relativnom učinkovitošću kloniranja ispitivane kulture u trenutku selekcije mutanata i izražava se u odnosu na učinkovitost kloniranja negativne kontrole/kontrole s otapalom (Clive i Spector, 1975.).
Frakcije jetre S9
: supernatant homogenata jetre centrifugiran na 9 000 g, tj. ekstrakt sirove jetre.
Mješavina S9
: mješavina frakcije jetre S9 i kofaktora potrebnih za djelovanje metaboličkih enzima.
Rast u suspenziji (SG)
: multiplikacijski faktor povećanja broja stanica tijekom faza tretiranja i ekspresije testa MLA. Kod kratkog tretiranja (tri ili četiri sata) rast u suspenziji računa se tako da se multiplikacijski faktor povećanja prvog dana pomnoži s multiplikacijskim faktorom povećanja drugog dana. Ako se upotrebljava 24-satno tretiranje, rast u suspenziji računa se tako da se multiplikacijski faktor povećanja tijekom 24-satnog tretiranja pomnoži multiplikacijskim faktorima povećanja prvog i drugog dana.
Kontrola s otapalom
: opći izraz za označivanje kontrolnih kultura kojima je dodano jedino otapalo koje je upotrijebljeno za otapanje ispitivane kemikalije.
Ispitivana kemikalija
: svaka tvar ili smjesa koja se ispituje ovom ispitnom metodom.
Netretirane kontrole
: netretirane kontrole kulture su koje nisu ni s čim tretirane (tj. ni ispitivanom kemikalijom ni otapalom), ali se obrađuju na isti način kao kulture tretirane ispitivanom kemikalijom.
Dodatak 2.
FORMULE
Citotoksičnost
Za obje verzije testa MLA (s agarom i mikrojažicama)
Citotoksičnost se definira kao relativni ukupni rast (RTG), što uključuje relativni rast u suspenziji (RSG) tijekom dvodnevnog razdoblja ekspresije i relativnu učinkovitost kloniranja (RCE) dobivenu u trenutku selekcije mutanata. RTG, RSG i RCE izražavaju se kao postotak.
Izračun RSG-a: rast u suspenziji jedan (SG1) stopa je rasta od nultog do prvog dana (koncentracija stanica prvog dana/koncentracija stanica nultog dana), a rast u suspenziji dva (SG2) stopa je rasta od prvog do drugog dana (koncentracija stanica drugog dana/koncentracija stanica prvog dana). RSG je ukupni SG (SG1 x SG2) za tretiranu kulturu u usporedbi s netretiranom kontrolom/kontrolom s otapalom. To jest: RSG = [SG1
(test) x SG2
(test)] /[SG1
(kontrola) x SG2
(kontrola)]. SG1 treba izračunati iz početne koncentracije stanica koja je upotrijebljena na početku tretiranja stanica. Time se uzima u obzir bilo kakva diferencijalna citotoksičnost do koje dolazi u ispitivanim kulturama tijekom tretiranja stanica.
RCE je relativna učinkovitost kloniranja ispitivane kulture u usporedbi s relativnom učinkovitošću kloniranja netretirane kontrole/kontrole s otapalom dobivena u trenutku selekcije mutanata.
Relativni ukupni rast (RTG):
RTG = RSG x RCE
TK6
Relativna stopa preživljavanja (RS):
Citotoksičnost se procjenjuje relativnom stopom preživljavanja, tj. učinkovitošću kloniranja stanica koje se nasade odmah nakon tretiranja, prilagođeno za mogući gubitak stanica tijekom tretiranja u odnosu na učinkovitost kloniranja u negativnim kontrolama (kojima se dodjeljuje stopa preživljavanja od 100 %). Prilagodba za gubitak stanica tijekom tretiranja može se izračunati na sljedeći način:

Relativna stopa preživljavanja za kulturu tretiranu ispitivanom kemikalijom računa se na sljedeći način:

Učestalost pojave mutanata za testove MLA i TK6
Učestalost pojave mutanata (MF) učinkovitost je kloniranja kolonija mutanata u selektivnom mediju (CEM), prilagođeno s obzirom na učinkovitost kloniranja u neselektivnom mediju u trenutku selekcije mutanata (CEV). Drugim riječima, MF = CEM/CEV. Izračun tih dviju učinkovitosti kloniranja za metode kloniranja s agarom i mikrojažicama opisan je u nastavku.
Verzija testa MLA s agarom: u verziji testa MLA s mekim agarom broj kolonija na ploči za selekciju mutanata (CM) i broj kolonija na neprobranoj ploči ili ploči za učinkovitost kloniranja (broj vijabilnih stanica) (CV) dobiva se izravnim brojanjem klonova. Ako se 600 stanica nasadi na ploče za selekciju mutanata (CEM) za učinkovitost kloniranja (CE) te na neprobrane ploče ili ploče za učinkovitost kloniranja (broj vijabilnih stanica) (CEV) te se za selekciju mutanata upotrijebi 3 × 106 stanica,
CEM = CM / (3 × 106) = (CM / 3) × 10–6
CEV = CV / 600
Verzija testova MLA i TK6 s mikrojažicama:
u verziji testa MLA CM i CV utvrđuju se kao umnožak ukupnog broja mikrojažica (TW) i vjerojatnog broja kolonija po jažici (P) na pločama s mikrojažicama.
CM = PM × TWM
CV = PV × TWV
Od nulte točke Poissonove distribucije (Furth et al., 1981.) P se određuje kao
P = –ln (EW / TW)
Pri tom EW označava prazne jažice, a TW ukupne jažice. Zato je
CEM = CM / TM = (PM × TWM) / TM
CEV = CV / TV = (PV × TWV) / TV
Kod verzije testa MLA s mikrojažicama učestalost pojave mutanata u malim i velikim kolonijama računat će se na isti način, upotrebom odgovarajućeg broja praznih jažica za male i velike kolonije.
Kod testa TK6 učestalost pojave mutanata u malim i velikim kolonijama temelji se na mutantima koji se javljaju rano i onima koji se javljaju kasno.
B.68. IN VITRO ISPITNA METODA S KRATKIM VREMENOM IZLAGANJA ZA UTVRĐIVANJE: i. KEMIKALIJA KOJE INDUCIRAJU TEŠKU OZLJEDU OKA I ii. KEMIKALIJA KOJE NIJE POTREBNO RAZVRSTATI S OBZIROM NA NADRAŽIVANJE OKA ILI TEŠKU OZLJEDU OKA
UVOD
|
1.
|
Ova ispitna metoda odgovara Smjernici OECD-a za ispitivanje 491 (2017.). In vitro ispitna metoda s kratkim vremenom izlaganja (STE) jest in vitro metoda koja se može upotrebljavati u određenim okolnostima i uz specifična ograničenja za razvrstavanje i označivanje kemikalija (tvari i smjese) koje induciraju tešku ozljedu oka s obzirom na opasnosti te onih za koje nije potrebno razvrstavanje s obzirom na tešku ozljedu oka ili nadraživanje oka, kako je utvrđeno Globalno usklađenim sustavom razvrstavanja i označivanja kemikalija (GHS) Ujedinjenih naroda (UN) (1.) i Uredbom (EZ) br. 1272/2008 o razvrstavanju, označivanju i pakiranju tvari i smjesa (CLP) Europske unije (67).
|
|
2.
|
Dulji niz godina potencijal opasnosti kemikalija za oko ocjenjivao se prvenstveno upotrebom in vivo ispitivanja na oku kunića (ispitna metoda B.5. (8.), ekvivalentna Smjernici OECD-a za ispitivanje 405). Opće je prihvaćena činjenica da se u doglednoj budućnosti in vivo ispitivanje na oku kunića neće moći potpuno zamijeniti nijednim alternativnim pojedinačnim in vitro ispitivanjem za predviđanje različitih kemijskih razreda u punom rasponu teških ozljeda oka/nadraživanja oka. Međutim, kao potpuna zamjena za ispitivanje na oku kunića mogle bi se primjenjivati strateške kombinacije alternativnih ispitnih metoda u okviru strategije (višerazinskog) ispitivanja (2.). Pristup odozgo prema dolje osmišljen je za ispitivanje kemikalija za koje se na temelju postojećih informacija može očekivati da imaju veliki potencijal za nadražujuće djelovanje ili da induciraju teške ozljede oka. Nasuprot tome, pristup odozdo prema gore osmišljen je za ispitivanje kemikalija za koje se na temelju postojećih informacija može očekivati da ne izazivaju dovoljno nadraživanje oka da bi ih se moralo razvrstati. Iako se ispitna metoda STE ne smatra potpunom zamjenom za in vivo ispitivanje na oku kunića, primjerena je za upotrebu kao dio strategije višerazinskog ispitivanja za regulatorno razvrstavanje i označivanje, kao što je pristup odozgo prema dolje/odozdo prema gore, kako bi se bez daljnjeg ispitivanja utvrdile: i. kemikalije koje induciraju tešku ozljedu oka (kategorija 1. sustava UN GHS/CLP-a) i ii. kemikalije (pri čemu se isključuju vrlo hlapljive tvari i sve kemikalije u krutom stanju osim površinski aktivnih tvari) koje nije potrebno razvrstati u pogledu nadraživanja ili teške ozljede oka (bez kategorije prema sustavu UN GHS/CLP-u) (1. i 2.). Međutim, kemikalija za koju se ispitnom metodom STE ne predvidi ni da inducira tešku ozljedu oka (kategorija 1. sustava UN GHS/CLP-a) ni da je bez kategorije prema sustavu UN GHS/CLP-u (ne inducira ni teške ozljede oka ni nadraživanje oka) morala bi se dodatno ispitati kako bi se utvrdilo konačno razvrstavanje. Nadalje, prije primjene ispitne metode STE u okviru pristupa odozdo prema gore u skladu s drugim shemama razvrstavanja osim sustava UN GHS/CLP-a trebalo bi se savjetovati s odgovarajućim regulatornim tijelima. Odabir najprimjerenije ispitne metode i upotrebu te ispitne metode treba razmotriti u kontekstu Smjernica OECD-a o integriranim pristupima ispitivanju i procjeni za teške ozljede oka i nadraživanje oka (14.).
|
|
3.
|
Svrha je ove ispitne metode opisati postupke koji se primjenjuju za ocjenjivanje potencijala opasnosti ispitivane kemikalije za oko na temelju njezine sposobnosti induciranja citotoksičnosti u ispitnoj metodi s kratkim vremenom izlaganja. Citotoksični učinak kemikalija na epitelne stanice rožnice važan je način djelovanja (MOA) koji dovodi do oštećenja epitela rožnice i nadraživanja oka. Vijabilnost stanica u ispitnoj metodi STE procjenjuje se kvantitativnim mjerenjem nakon što se iz stanica ekstrahira sol plavog formazana koju proizvode žive stanice enzimskom konverzijom vitalne boje MTT (3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolijev bromid), poznate i kao tiazolil plavo tetrazolijev bromid (3.). Dobivena vijabilnost stanica uspoređuje se s kontrolom s otapalom (relativna vijabilnost) i upotrebljava za procjenu potencijala opasnosti ispitivane kemikalije za oko. Ispitivana kemikalija razvrstava se u kategoriju 1. sustava UN GHS-a/CLP-a ako i koncentracija od 5 % i 0,05 % rezultiraju vijabilnošću stanica od 70 % ili manjom (≤). Nasuprot tome, predviđa se da je kemikalija bez kategorije prema sustavu UN GHS/CLP-u ako i koncentracija od 5 % i 0,05 % rezultiraju vijabilnošću stanica većom od (>) 70 %.
|
|
4.
|
U ovoj se ispitnoj metodi izraz „ispitivana kemikalija” upotrebljava za označivanje onoga što se ispituje te se ne odnosi na primjenjivost ispitne metode STE za ispitivanje tvari i/ili smjesa. Definicije su navedene u Dodatku.
|
POČETNA RAZMATRANJA I OGRANIČENJA
|
5.
|
Ova se ispitna metoda temelji na protokolu koji je razvilo društvo Kao Corporation (4.) i koji je bio predmet dviju različitih validacijskih studija: jednu je proveo Validacijski odbor JSAAE-a (Japansko društvo za alternative pokusima na životinjama) (5.), a drugu JaCVAM (Japanski centar za validaciju alternativnih metoda) (6.). Stručnu reviziju proveo je NICEATM/ICCVAM na temelju izvješća validacijskih studija i osnovnih dokumenata za preispitivanje o ispitnoj metodi (7).
|
|
6.
|
Kada su se upotrijebili za utvrđivanje kemikalija (tvari i smjesa) koje induciraju teške ozljede oka (kategorija 1. prema sustavu UN GHS/CLP-u (1.), podaci dobiveni upotrebom ispitne metode STE na 125 kemikalija (koje uključuju i tvari i smjese) pokazali su ukupnu točnost od 83 % (104/125), udio lažno pozitivnih rezultata od 1 % (1/86) i udio lažno negativnih rezultata od 51 % (20/39) u usporedbi s in vivo ispitivanjem na oku kunića (7.). Dobiveni udio lažno negativnih rezultata nije presudan u ovom kontekstu jer bi se sve ispitivane kemikalije koje induciraju vijabilnost stanica ≤ 70 % pri koncentraciji od 5 % i > 70 % pri koncentraciji od 0,05 % kasnije ispitale drugim primjereno validiranim in vitro ispitnim metodama ili, kao posljednja opcija, in vivo ispitivanjem na oku kunića, ovisno o regulatornim zahtjevima i u skladu sa strategijom sekvencijskog ispitivanja i pristupima snage dokaza koji se sada preporučuju (1. i 8.). Uglavnom su ispitane tvari s jednim sastojkom, iako postoji ograničena količina podataka i o ispitivanju smjesa. Unatoč tomu ova je ispitna metoda tehnički primjenjiva i za ispitivanje tvari s više sastojaka i smjesa. Međutim, prije nego što se ova ispitna metoda primijeni na smjesi radi dobivanja podataka za predviđenu regulatornu svrhu, potrebno je razmotriti mogu li se njome dobiti primjereni rezultati za tu svrhu te ako mogu, zašto. Ta razmatranja nisu potrebna ako postoji regulatorni zahtjev za ispitivanje smjese. Kod ispitne metode STE nisu uočeni nikakvi drugi specifični nedostaci kada se upotrebljava za utvrđivanje ispitivanih kemikalija kao kemikalija iz kategorije 1. sustava UN GHS/CLP-a. Istraživači bi mogli razmotriti primjenu ove ispitne metode na ispitivanim kemikalijama, pri čemu bi vijabilnost stanica ≤ 70 % pri koncentracijama od 5 % i 0,05 % trebalo prihvatiti kao pokazatelj odgovora da kemikalija inducira tešku ozljedu oka i da bi je bez daljnjeg ispitivanja trebalo razvrstati u kategoriju 1. sustava UN GHS/CLP-a.
|
|
7.
|
Kada su se upotrijebili za utvrđivanje kemikalija (tvari i smjesa) koje nije potrebno razvrstati u pogledu nadraživanja i teške ozljede oka (tj. bez kategorije prema sustavu UN GHS/CLP-u), podaci dobiveni upotrebom ispitne metode STE na 130 kemikalija (koje uključuju i tvari i smjese) pokazali su ukupnu točnost od 85 % (110/130), udio lažno pozitivnih rezultata od 12 % (9/73) i udio lažno negativnih rezultata od 19 % (11/57) u usporedbi s in vivo ispitivanjem na oku kunića (7.). Ako se iz skupa podataka isključe vrlo hlapljive tvari i krute tvari osim površinski aktivnih tvari, ukupna točnost poboljšava se na 90 % (92/102), udio lažno negativnih rezultata na 2 % (1/54), a udio lažno pozitivnih rezultata na 19 % (9/48) (7.). Kao posljedica, potencijalni nedostaci ispitne metode STE, kada se upotrebljava za utvrđivanje ispitivanih kemikalija za koje nije potrebno razvrstavanje u pogledu nadraživanja i teških ozljeda oka (bez kategorije prema sustavu UN GHS/CLP-u), uključuju visok udio lažno negativnih rezultata za: i. vrlo hlapljive tvari s tlakom pare većim od 6 kPa i ii. kemikalije u krutom stanju (tvari i smjese) osim površinski aktivnih tvari i smjesa koje se sastoje samo od površinski aktivnih tvari. Te kemikalije isključene su iz područja primjene ispitne metode STE (7.).
|
|
8.
|
Uz kemikalije navedene u stavcima 6. i 7., skup podataka dobiven ispitnom metodom STE sadržava i interne podatke o 40 smjesa, koji su nakon što ih se usporedilo s in vivo Draizeovim ispitivanjem na oku pokazali točnost od 88 % (35/40), udio lažno pozitivnih rezultata od 50 % (5/10) i udio lažno negativnih rezultata od 0 % (0/30) u pogledu smjesa za koje nije potrebno razvrstavanje na temelju sustava razvrstavanja UN GHS/CLP-a (9.). Ispitna metoda STE stoga se može primjenjivati za utvrđivanje smjesa bez kategorije prema sustavu UN GHS/CLP-u u pristupu odozdo prema gore, uz iznimku smjesa u krutom stanju osim onih koje se sastoje samo od površinski aktivnih tvari, kao proširenje njezina ograničenja na tvari u krutom stanju. Nadalje, smjese koje sadržavaju tvari s tlakom pare većim od 6 kPa treba oprezno ocijeniti kako bi se izbjegla moguća preblaga predviđanja i treba ih ocijeniti na pojedinačnoj osnovi.
|
|
9.
|
Ispitna metoda STE ne može se upotrebljavati za utvrđivanje ispitivanih kemikalija kao kemikalija iz kategorije 2. prema sustavu UN GHS/CLP-u ili kategorije 2.A (nadraživanje oka) ili 2.B (blago nadraživanje oka) prema sustavu UN GHS zbog znatnog broja kemikalija iz kategorije 1. prema GHS-u UN-a koje se preblago predviđaju kao kemikalije iz kategorije 2., 2.A ili 2.B te kemikalija bez kategorije prema sustavu UN GHS/CLP-u koje se prestrogo predviđaju kao kemikalije iz kategorije 2., 2.A ili 2.B (7.). U tu svrhu može biti potrebno daljnje ispitivanje drugom prikladnom metodom.
|
|
10.
|
Ispitna metoda STE primjerena je za ispitivane kemikalije koje se otapaju ili ravnomjerno suspendiraju najmanje pet minuta u fiziološkoj otopini, 5-postotnom dimetilsulfoksidu (DMSO) u fiziološkoj otopini ili u mineralnom ulju. Ispitna metoda STE nije primjerena za ispitivane kemikalije koje nisu topljive ili se ne mogu ravnomjerno suspendirati najmanje pet minuta u fiziološkoj otopini, 5-postotnom dimetilsulfoksidu (DMSO) u fiziološkoj otopini ili u mineralnom ulju. Upotreba mineralnog ulja u ispitnoj metodi STE moguća je zbog kratkotrajnog izlaganja. Stoga je ispitna metoda STE primjerena za predviđanje potencijala opasnosti ispitivanih kemikalija netopivih u vodi za oko (npr. dugolančani masni alkoholi ili ketoni) pod uvjetom da se mogu miješati u najmanje jednom od tri prethodno predložena otapala (4).
|
|
11.
|
U ovoj se ispitnoj metodi izraz „ispitivana kemikalija” upotrebljava za označivanje onoga što se ispituje (68) te se ne odnosi na primjenjivost ispitne metode STE za ispitivanje tvari i/ili smjesa.
|
NAČELO ISPITIVANJA
|
12.
|
Ispitna metoda STE in vitro je test koji se temelji na citotoksičnosti, a provodi se na konfluentnom monosloju stanica rožnice kunića Statens Serum Instituta (SIRC), koje se uzgajaju na polikarbonatnoj mikroploči s 96 jažica (4.). Nakon petominutnog izlaganja ispitivanoj kemikaliji citotoksičnost se kvantitativno mjeri kao relativna vijabilnost stanica SIRC upotrebom MTT testa (4.). Smanjena vijabilnost stanica upotrebljava se za predviđanje potencijalnih štetnih učinaka koji dovode do oštećenja oka.
|
|
13.
|
Navedeno je da se 80 % otopine koja se nakapa u oko kunića izluči preko konjunktivalne vrećice u roku od tri do četiri minute, dok se više od 80 % otopine koja se nakapa u ljudsko oko izluči u roku od jedne do dvije minute (10.). Ispitnom metodom STE pokušavaju se uskladiti ta vremena izlaganja te se citotoksičnost upotrebljava kao krajnja točka za procjenu razmjera oštećenja stanica SIRC nakon petominutnog izlaganja ispitivanoj kemikaliji.
|
DOKAZIVANJE OSPOSOBLJENOSTI
|
14.
|
Prije rutinske upotrebe ispitne metode STE opisane u ovoj ispitnoj metodi laboratoriji bi trebali dokazati tehničku osposobljenost točnim utvrđivanjem kategorije jedanaest tvari koje su preporučene u tablici 1. Te su tvari odabrane kako bi predstavljale cijeli raspon odgovora za ozbiljnu ozljedu oka ili nadraživanje oka na temelju rezultata in vivo ispitivanja na oku kunića (Smjernica za ispitivanje 405) i sustava razvrstavanja UN GHS/CLP-a (1.). Među ostalim su kriterijima za odabir: tvari bi trebale biti komercijalno dostupne, trebali bi biti dostupni visokokvalitetni in vivo referentni podaci i trebali bi biti dostupni visokokvalitetni in vitro podaci iz ispitne metode STE (3.). U slučajevima u kojima nije dostupna navedena tvar ili ako je to opravdano može se upotrijebiti druga tvar za koju su dostupni primjereni referentni in vivo i in vitro podaci pod uvjetom da se primjenjuju isti kriteriji kao ovdje opisani kriteriji.
Tablica 1.
Popis tvari koje služe za dokazivanje osposobljenosti
|
Tvar
|
CAS br.
|
Kemijski razred (69)
|
Agregatno stanje
|
In vivo kat. sustava UN GHS ili CLP-a (70)
|
Otapalo u testu STE
|
STE kat. sustava UN GHS ili CLP-a
|
|
Benzalkonijev klorid (10 %, vodena otopina)
|
8001-54-5
|
Onijev spoj
|
Tekuće
|
Kategorija 1.
|
Fiziološka otopina
|
Kategorija 1.
|
|
Triton X-100 (100 %)
|
9002-93-1
|
Eter
|
Tekuće
|
Kategorija 1.
|
Fiziološka otopina
|
Kategorija 1.
|
|
Kiselo crvena 92
|
18472-87-2
|
Heterociklički spoj; spoj broma; spoj klora
|
Kruto
|
Kategorija 1.
|
Fiziološka otopina
|
Kategorija 1.
|
|
Natrijev hidroksid
|
1310-73-2
|
Lužina; anorganska kemikalija
|
Kruto
|
Kategorija 1. (71)
|
Fiziološka otopina
|
Kategorija 1.
|
|
Butirolakton
|
96-48-0
|
Lakton; heterociklički spoj
|
Tekuće
|
Kategorija 2.A (kategorija 2. prema CLP-u)
|
Fiziološka otopina
|
Predviđanje nije moguće
|
|
1-oktanol
|
111-87-5
|
Alkohol
|
Tekuće
|
Kategorija 2.A/B (72) (kategorija 2. prema CLP-u)
|
Mineralno ulje
|
Predviđanje nije moguće
|
|
Ciklopentanol
|
96-41-3
|
Alkohol; ugljikovodik, ciklički
|
Tekuće
|
Kategorija 2.A/B (73) (kategorija 2. prema CLP-u)
|
Fiziološka otopina
|
Predviđanje nije moguće
|
|
2-etoksietilacetat
|
111-15-9
|
Alkohol; eter
|
Tekuće
|
Bez kategorije
|
Fiziološka otopina
|
Bez kategorije
|
|
Dodekan
|
112-40-3
|
Ugljikovodik, aciklički
|
Tekuće
|
Bez kategorije
|
Mineralno ulje
|
Bez kategorije
|
|
Metil-izobutil-keton
|
108-10-1
|
Keton
|
Tekuće
|
Bez kategorije
|
Mineralno ulje
|
Bez kategorije
|
|
1,1-dimetilgvanidin sulfat
|
598-65-2
|
Amidin; spoj sumpora
|
Kruto
|
Bez kategorije
|
Fiziološka otopina
|
Bez kategorije
|
|
Kratice: CAS br. = registarski broj Službe za podatke o kemijskim tvarima
|
|
POSTUPAK
Priprema staničnog monosloja
|
15.
|
Za provođenje ispitne metode STE treba upotrebljavati SIRC, staničnu liniju rožnice kunića. Preporučuje se da se stanice SIRC nabave iz kompetentne banke stanica kao što je American Type Culture Collection CCL60.
|
|
16.
|
Stanice SIRC uzgajaju se na 37 °C s 5 % CO2 i u vlažnim atmosferskim uvjetima u tikvici s kulturom koja sadržava medij za uzgoj kulture koji se sastoji od Eagleova minimalnog esencijalnog medija (MEM) obogaćenog s 10 % fetalnog goveđeg seruma (FBS), 2 mM L-glutamina, 50–100 jedinica/ml penicilina i 50–100 μg/ml streptomicina. Stanice koje su postale konfluentne u tikvici s kulturom treba izdvojiti upotrebom otopine tripsin etilendiamintetraoctene kiseline, uz upotrebu pribora za struganje stanica ili bez njega. Stanice se razmnožavaju (npr. od dvije do tri pasaže) u tikvici s kulturom prije nego što se upotrijebe za rutinsko ispitivanje te se od odmrzavanja trebaju pasažirati najviše 25 puta.
|
|
17.
|
Stanice koje su spremne za upotrebu u testu STE zatim se pripremaju u odgovarajućoj gustoći te se nasađuju u ploče s 96 jažica. Preporučuje se gustoća nasađivanja stanica od 6,0 × 103 stanica po jažici ako se stanice upotrebljavaju četiri dana nakon nasađivanja ili 3,0 × 103 stanica po jažici ako se stanice upotrebljavaju pet dana nakon nasađivanja, pri volumenu kulture od 200 μl. Stanice koje se upotrebljavaju za test STE i koje se nasade u medij za uzgoj kulture pri odgovarajućoj gustoći dosegnut će konfluenciju od više od 80 % u vrijeme ispitivanja, tj. četiri ili pet dana nakon nasađivanja.
|
Primjena ispitivanih kemikalija i kontrolnih tvari
|
18.
|
Fiziološka otopina prvi je odabir za otapalo za otapanje ili suspendiranje ispitivanih kemikalija. Ako ispitivana kemikalija pokazuje slabu topljivost ili se u najmanje pet minuta ne može ravnomjerno otopiti ili suspendirati u fiziološkoj otopini, kao drugi izbor za otapalo upotrebljava se 5-postotni DMSO (CAS br. 67-68-5) u fiziološkoj otopini. Kod ispitivanih kemikalija koje se u najmanje pet minuta ne mogu ravnomjerno otopiti ili suspendirati u fiziološkoj otopini ili 5-postotnom DMSO-u u fiziološkoj otopini, kao treći izbor za otapalo upotrebljava se mineralno ulje (CAS br. 8042-47-5) u fiziološkoj otopini.
|
|
19.
|
Ispitivane kemikalije ravnomjerno se otapaju ili suspendiraju u odabranom otapalu pri koncentraciji od 5 % (w/w) i dodatno razrjeđuju serijskim deseterostrukim razrjeđivanjem do koncentracije od 0,5 % i 0,05 %. Svaka se kemikalija mora ispitati i pri koncentraciji od 5 % i 0,05 %. Stanice koje se uzgajaju na ploči s 96 jažica izlažu se dozi od 200 μl/jažica otopine (ili suspenzije) ispitivane kemikalije u koncentraciji od 5 % ili 0,05 % na pet minuta na sobnoj temperaturi. Ispitivane kemikalije (tvari s jednim sastojkom ili tvari s više sastojaka ili smjese) smatraju se čistim tvarima i razrjeđuju se ili suspendiraju u skladu s metodom, neovisno o njihovoj čistoći.
|
|
20.
|
Medij za uzgoj kulture opisan u stavku 16. upotrebljava se kao kontrola s medijem na svakoj ploči svakog ponavljanja. Nadalje, stanice se izlažu i uzorcima kontrole s otapalom na svakoj ploči svakog ponavljanja. Za otapala navedena u stavku 18. potvrđeno je da ne utječu štetno na vijabilnost stanica SIRC.
|
|
21.
|
Kod ispitne metode STE kao pozitivna kontrola na svakoj ploči svakog ponavljanja upotrebljava se 0,01-postotni natrijev lauril sulfat (SLS) u fiziološkoj otopini. Kako bi se izračunala vijabilnost stanica pozitivne kontrole, svaka ploča svakog ponavljanja mora uključivati i fiziološku otopinu kao kontrolu s otapalom.
|
|
22.
|
Slijepa proba potrebna je kako bi se utvrdila kompenzacija za optičku gustoću i treba je provesti u jažicama koje sadržavaju samo fiziološku otopinu puferiranu fosfatnim puferom, ali ne kalcij i magnezij (PBS-) ni stanice.
|
|
23.
|
Svaki uzorak (ispitivana kemikalija pri koncentraciji od 5 % i 0,05 %, kontrola s medijem, kontrola s otapalom i pozitivna kontrola) treba ispitati triput za svako ponavljanje izlaganjem stanica dozi od 200 μl odgovarajuće ispitivane ili kontrolne kemikalije na pet minuta na sobnoj temperaturi.
|
|
24.
|
Referentne tvari korisne su za ocjenjivanje potencijala za nadražujuće djelovanje na oči nepoznatih kemikalija iz specifičnog kemijskog razreda ili razreda proizvoda ili za ocjenjivanje relativnog potencijala za nadražujuće djelovanje tvari koja nadražuje oči unutar specifičnog raspona odgovora na nadražujuću tvar.
|
Mjerenje vijabilnosti stanica
|
25.
|
Stanice se nakon izlaganja ispiru s 200 μl PBS-a i dodaje im se 200 μl otopine MTT-a (0,5 mg MTT/ml medija za uzgoj kulture). Nakon dvosatnog vremena reakcije u inkubatoru (37 °C, 5 % CO2), otopina MTT-a pretače se, MTT formazan ekstrahira se tako da se doda 200 μl 0,04 N klorovodične kiseline i izopropanola tijekom 60 minuta u mraku na sobnoj temperaturi te se apsorbancija otopine MTT formazana mjeri pri 570 nm upotrebom čitača ploča. Ispitivane kemikalije utječu na MTT test (bojilima ili tvarima koje neposredno reduciraju MTT) samo ako se u ispitnom sustavu zadržava znatna količina ispitivane kemikalije nakon ispiranja koje se obavlja nakon izlaganja, a to je slučaj kod 3D tkiva rekonstruirane ljudske rožnice ili rekonstruirane ljudske epiderme, ali nije relevantno za 2D stanične kulture koje se upotrebljavaju za ispitnu metodu STE.
|
Tumačenje rezultata i model predviđanja
|
26.
|
Vrijednosti optičke gustoće (OD) za svaku ispitivanu kemikaliju zatim se upotrebljavaju za izračun vijabilnosti stanica u odnosu na kontrolu s otapalom, koja je određena kao 100 %. Relativna vijabilnost stanica izražava se kao postotak i dobiva se tako da se optička gustoća ispitivane kemikalije podijeli optičkom gustoćom kontrole s otapalom nakon što se od obiju vrijednosti oduzme optička gustoća slijepe probe.

Slično tome, relativna vijabilnost stanica kod svake kontrole s otapalom izražava se kao postotak i dobiva se tako da se optička gustoća svake kontrole s otapalom podijeli optičkom gustoćom kontrole s medijem nakon što se od obiju vrijednosti oduzme optička gustoća slijepe probe.
|
|
27.
|
Treba provesti tri neovisna ponavljanja s po tri jažice s ponavljanjem (tj. n = 9). Aritmetička sredina triju jažica za svaku ispitivanu kemikaliju i kontrolu s otapalom u svakom neovisnom ponavljanju upotrebljava se za izračun aritmetičke sredine relativne vijabilnosti stanica. Konačna aritmetička sredina vijabilnosti stanica računa se iz tri neovisna ponavljanja.
|
|
28.
|
Granične vrijednosti vijabilnosti stanica za utvrđivanje ispitivanih kemikalija koje induciraju tešku ozljedu oka (kategorija 1. sustava UN GHS/CLP-a) i ispitivanih kemikalija koje nije potrebno razvrstati s obzirom na nadraživanje oka ili tešku ozljedu oka (bez kategorije prema sustavu UN GHS/CLP-u) navedene su u nastavku.
|
Tablica 2.
Model predviđanja ispitne metode STE
|
Vijabilnost stanica
|
Razvrstavanje prema sustavu GHS UN-a ili CLP-u
|
Primjenjivost
|
|
Pri 5 %
|
Pri 0,05 %
|
|
> 70 %
|
> 70 %
|
Bez kategorije
|
Tvari i smjese uz iznimku: i. vrlo hlapljivih tvari s tlakom pare većim od 6 kPa (74); i ii. kemikalija u krutom stanju (tvari i smjese) osim površinski aktivnih tvari i smjesa koje se sastoje samo od površinski aktivnih tvari
|
|
≤ 70 %
|
> 70 %
|
Predviđanje nije moguće
|
Nije primjenjivo
|
|
≤ 70 %
|
≤ 70 %
|
Kategorija 1.
|
Tvari i smjese (75)
|
Kriteriji prihvatljivosti
|
29.
|
Rezultati ispitivanja ocjenjuju se kao prihvatljivi ako su ispunjeni svi sljedeći kriteriji:
|
a)
|
optička gustoća kontrole s medijem (izložene mediju za uzgoj kulture) treba biti 0,3 ili veća nakon što se oduzme optička gustoća slijepe probe;
|
|
b)
|
vijabilnost kontrole s otapalom treba biti 80 % ili veća u odnosu na kontrolu s medijem. Ako se u svakom ponavljanju upotrebljava više kontrola s otapalom, svaka kontrola treba pokazivati vijabilnost stanica veću od 80 % kako bi se razvrstale ispitivane kemikalije koje se ispituju tim otapalima;
|
|
c)
|
vijabilnost stanica koja se dobije s pozitivnom kontrolom (0,01 % SLS) treba biti u okviru dvije standardne devijacije prijašnje srednje vrijednosti. Gornju i donju granicu prihvatljivosti za pozitivnu kontrolu treba često ažurirati, tj. svaka tri mjeseca ili svaki put kada se provodi prihvatljivi test u laboratorijima u kojima se testovi ne provode često (tj. rjeđe od jednom mjesečno). Ako laboratorij ne provede dovoljan broj pokusa kako bi se utvrdila statistički pouzdana distribucija pozitivnih kontrola, prihvatljiva je upotreba gornje i donje granice prihvatljivosti koju je utvrdio subjekt koji je razvio metodu, tj. od 21,1 % do 62,3 % prema prijašnjim podacima laboratorija, dok se interna distribucija izrađuje tijekom prvih rutinskih testova;
|
|
d)
|
standardna devijacija konačne vijabilnosti stanica koja se dobije iz tri neovisna ponavljanja treba biti manja od 15 % i kod koncentracije od 5 % i od 0,05 % ispitivane kemikalije.
Ako nije ispunjen jedan ili više od tih kriterija, rezultate treba odbaciti i treba provesti još tri neovisna ponavljanja.
|
|
PODACI I IZVJEŠĆIVANJE
Podaci
|
30.
|
Treba navesti podatke za svaku pojedinačnu jažicu (npr. vrijednosti vijabilnosti stanica) svakog ponavljanja te ukupnu srednju vrijednost, standardnu devijaciju i razvrstavanje.
|
Izvješće o ispitivanju
|
31.
|
Izvješće o ispitivanju trebalo bi sadržavati sljedeće informacije:
|
|
Ispitivana kemikalija i kontrolne tvari
|
—
|
tvar s jednim sastojkom: kemijske identifikacijske oznake, kao što su IUPAC ili CAS naziv(i), CAS registracijski broj(evi), SMILES ili InChI oznaka, strukturna formula i/ili druge identifikacijske oznake,
|
|
—
|
tvar s više sastojaka, UVCB tvar i smjesa: opisane koliko god je to moguće npr. kemijskim identitetom (vidjeti gore), čistoćom, količinskom zastupljenošću i relevantnim fizikalno-kemijskim svojstvima sastojaka (vidjeti gore), u mjeri u kojoj su podaci dostupni,
|
|
—
|
agregatno stanje, hlapljivost, pH-vrijednost, LogP, molekularna masa, kemijski razred i dodatna relevantna fizikalno-kemijska svojstva relevantna za provedbu studije, u mjeri u kojoj su podaci dostupni,
|
|
—
|
čistoća, kemijski identitet nečistoća prema potrebi i ako je izvedivo u praksi itd.,
|
|
—
|
obrada prije ispitivanja, prema potrebi (npr. zagrijavanje, usitnjavanje),
|
|
—
|
uvjeti skladištenja i stabilnost, u mjeri u kojoj su podaci dostupni.
|
|
|
|
Uvjeti i postupci ispitne metode
|
—
|
naziv i adresa naručitelja, ustanove koja provodi ispitivanje i voditelja istraživanja,
|
|
—
|
opis upotrijebljene ispitne metode,
|
|
—
|
upotrijebljena stanična linija, njezin izvor, broj pasaže i konfluencija stanica koje se koriste za ispitivanje,
|
|
—
|
pojedinosti o primijenjenom ispitnom postupku,
|
|
—
|
broj primijenjenih ponavljanja i ponovljenih uzoraka,
|
|
—
|
koncentracije ispitivane kemikalije (ako je drukčije od preporučenog),
|
|
—
|
obrazloženje za odabir otapala za svaku ispitivanu kemikaliju,
|
|
—
|
trajanje izlaganja ispitivanoj kemikaliji (ako je drukčije od preporučenog),
|
|
—
|
opis svih izmjena ispitnog postupka,
|
|
—
|
opis primijenjenih kriterija ocjenjivanja i odlučivanja,
|
|
—
|
upućivanje na prijašnju srednju vrijednost pozitivne kontrole i standardno odstupanje,
|
|
—
|
dokazivanje osposobljenosti laboratorija za izvođenje ispitne metode (npr. ispitivanjem tvari koje služe za dokazivanje osposobljenosti) ili dokazivanje obnovljive primjene ispitne metode tijekom vremena.
|
|
|
|
Rezultati
|
—
|
za svaku ispitivanu kemikaliju i kontrolnu tvar te svaku ispitanu koncentraciju treba navesti tablični prikaz za pojedinačne vrijednosti optičke gustoće po jažici ponovljenog uzorka, aritmetičke srednje vrijednosti optičke gustoće za svako neovisno ponavljanje, postotak vijabilnosti stanica za svako neovisno ponavljanje i konačnu aritmetičku sredinu postotka vijabilnosti stanica i standardnu devijaciju u tri ponavljanja,
|
|
—
|
rezultati za kontrolu s medijem, kontrolu s otapalom i pozitivnu kontrolu kojima se dokazuju odgovarajući kriteriji prihvatljivosti istraživanja,
|
|
—
|
opis drugih uočenih učinaka,
|
|
—
|
ukupno utvrđeno razvrstavanje, s upućivanjem na primijenjeni model predviđanja/kriterije odlučivanja.
|
|
|
LITERATURA
|
1.
|
Ujedinjeni narodi (UN) (2013). Globally Harmonized System of Classification and Labelling of Chemicals (GHS). Fifth revised edition. New York! & Geneva: United Nations Publications. ISBN: 978-92-1-117006-1. Dostupno na: http://www.unece.org/trans/danger/publi/ghs/ghs_rev05/05files_e.html.
|
|
2.
|
Scott L, et al. (2010). A proposed Eye Irritation Testing Strategy to Reduce and Replace in vivo Studies Using Bottom-Up and Top-Down Approaches. Toxicol. In Vitro 24, 1.–9.
|
|
3.
|
Mosmann T. (1983). Rapid Colorimetric Assay for Cellular Growth and Survival: Application to 7 Proliferation and Cytotoxicity Assays. J. Immunol. Methods 65, 55.–63.
|
|
4.
|
Takahashi Y, et al. (2008). Development of the Short Time Exposure (STE) Test: an In Vitro Eye Irritation Test Using SIRC Cells. Toxicol. In Vitro 22, 760.–770.
|
|
5.
|
Sakaguchi H, et al. (2011). Validation Study of the Short Time Exposure (STE) Test to Assess the Eye Irritation Potential of Chemicals. Toxicol. In Vitro 25, 796.–809.
|
|
6.
|
Kojima H, et al. (2013). Second-Phase Validation of Short Time Exposure Tests for Assessment of Eye Irritation Potency of Chemicals. Toxicol. In Vitro 27, str. 1855.–1869.
|
|
7.
|
ICCVAM (2013). Short Time Exposure (STE) Test Method Summary Review Document, NIH. Dostupno na: [http://www.ntp.niehs.nih.gov/iccvam/docs/ocutox_docs/STE-SRD-NICEATM-508.pdf].
|
|
8.
|
Poglavlje B.5. ovog Priloga, Akutno nadraživanje/nagrizanje oka.
|
|
9.
|
Saito K, et al. (2015). Predictive Performance of the Short Time Exposure Test for Identifying Eye Irritation Potential of Chemical Mixtures.
|
|
10.
|
Mikkelson TJ, Chrai SS and Robinson JR. (1973). Altered Bioavailability of Drugs in the Eye Due to Drug-Protein Interaction. J. Pharm. Sci. 1648.–1653.
|
|
11.
|
ECETOC (1998). Eye Irritation Reference Chemicals Data Bank. Technical Report (No 48. (2)), Bruxelles, Belgija.
|
|
12.
|
Gautheron P, et al. (1992). Bovine Corneal Opacity and Permeability Test: an In Vitro Assay of Ocular Irritancy. Fundam Appl Toxicol. 18, 442.–449.
|
|
13.
|
OECD (2005). Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment. Environmental, Health and Safety Publications, Series on Testing and Assessment (No 34). Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
14.
|
OECD (2017). Guidance Document on an Integrated Approaches on Testing and Assessment for Serious Eye Damage and Eye irritation. Environmental, Health and Safety Publications, Series on Testing and Assessment (No 263). Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
Dodatak
DEFINICIJE
Točnost
: stupanj podudarnosti između rezultata ispitne metode i prihvaćenih referentnih vrijednosti. Ona je mjerilo učinkovitosti ispitne metode i jedan od aspekata relevantnosti. Pojam je često međusobno zamjenjiv s pojmom „podudarnost” u smislu udjela točnih ishoda ispitne metode (13.).
Referentna tvar
: tvar koja se primjenjuje kao standard za usporedbu s ispitivanom kemikalijom. Referentna tvar trebala bi imati sljedeća svojstva: i. podrijetlo iz dosljednih i pouzdanih izvora; ii. strukturnu i funkcionalnu sličnost s razredom tvari koje se ispituju; iii. poznata fizikalna/kemijska svojstva; iv. podatke kojima se dokazuju poznati učinci i v. poznatu snagu u rasponu željenog odgovora.
Pristup odozdo prema gore
: stupnjeviti pristup koji se primjenjuje za ispitivanu kemikaliju u pogledu koje postoji sumnja da joj nije potrebno razvrstavanje s obzirom na nadraživanje oka ili tešku ozljedu oka, a koji počinje utvrđivanjem kemikalija za koje nije potrebno razvrstavanje (negativan ishod) u odnosu na druge kemikalije (pozitivan ishod).
Kemikalija
: tvar ili smjesa.
Nadraživanje oka
: promjena na oku nastala kao rezultat primjene ispitivane kemikalije na prednju površinu oka, koja je potpuno reverzibilna u roku od 21 dana nakon primjene. Pojam je međusobno zamjenjiv s pojmovima „reverzibilni učinci na oko” i „kategorija 2. sustava UN GHS/CLP-a”.
Udio lažno negativnih rezultata
: udio svih pozitivnih kemikalija koje su ispitnom metodom pogrešno identificirane kao negativne. Jedan je od pokazatelja uspješnosti ispitne metode.
Stopa lažno pozitivnih rezultata
: udio svih negativnih kemikalija koje su ispitnom metodom pogrešno identificirane kao pozitivne. Jedan je od pokazatelja uspješnosti ispitne metode.
Opasnost
: inherentno svojstvo nekog agensa ili stanje koje može uzrokovati štetne učinke kada su organizam, sustav ili (sub)populacija izloženi tom agensu.
Kontrola s medijem
: netretirani ponovljeni uzorak koji sadržava sve sastavnice ispitnog sustava. Taj se uzorak obrađuje s uzorcima tretiranima ispitivanom kemikalijom i drugim kontrolnim uzorcima kako bi se utvrdilo je li otapalo u interakciji s ispitnim sustavom.
Smjesa
: smjesa ili otopina koja se sastoji od dviju ili više tvari.
Tvar s jednim sastojkom
: tvar, definirana količinskim sastavom, u kojoj je jedan glavni sastojak prisutan u koncentraciji od najmanje 80 % (w/w).
MTT
: 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolijev bromid; tiazolil plavo tetrazolijev bromid.
Tvar s više sastojaka
: tvar, definirana količinskim sastavom, u kojoj je više od jednog glavnog sastojka prisutno u koncentraciji od 10 % (w/w) ili većoj te manjoj od 80 % (w/w). Tvar s više sastojaka rezultat je procesa proizvodnje. Smjesa i tvar s više sastojaka razlikuju se po tome što se smjesa dobiva miješanjem dviju ili više tvari bez kemijske reakcije. Tvar s više sastojaka rezultat je kemijske reakcije.
OD
: optička gustoća.
Pozitivna kontrola
: ponovljeni uzorak koji sadržava sve komponente ispitnog sustava i tretiran je s tvari za koju je poznato da inducira pozitivan odgovor. Kako bi se osigurala mogućnost procjene varijabilnosti odgovora pozitivne kontrole tijekom vremena, pozitivan odgovor ne bi smio biti presnažan.
Relevantnost
: opis odnosa između ispitivanja i istraživanog učinka te je li ispitivanje prikladno i korisno za određenu svrhu. Pokazuje u kojoj se mjeri ispitivanjem točno mjeri ili predviđa istraživani biološki učinak. Relevantnost uključuje razmatranje o točnosti (podudarnosti) ispitne metode (10.).
Pouzdanost
: pokazuje u kojoj se mjeri ispitna metoda može obnovljivo primijeniti unutar jednog laboratorija i između više laboratorija tijekom vremena uz primjenu istog protokola. Ocjenjuje se izračunavanjem obnovljivosti unutar jednog laboratorija i između više njih te ponovljivosti unutar jednog laboratorija (13.).
Osjetljivost
: udio svih pozitivnih/aktivnih kemikalija koje su pravilno razvrstane primjenom ispitivanja. To je mjera točnosti ispitne metode koja daje kategorijske rezultate i važan je čimbenik za ocjenu relevantnosti ispitne metode (10.).
Teška ozljeda oka
: oštećenje očnog tkiva ili ozbiljno fizičko pogoršanje vida izazvano primjenom ispitivane kemikalije na prednju površinu oka, koje nije u potpunosti reverzibilno unutar 21 dana od primjene. Pojam je međusobno zamjenjiv s pojmovima „ireverzibilni učinci na oko” i „kategorija 1. sustava UN GHS/CLP-a”.
Kontrola s otapalom/nosačem
: netretirani uzorak koji sadržava sve komponente ispitnog sustava, uključujući otapalo ili nosač koji se obrađuje s uzorcima tretiranima ispitivanom kemikalijom i drugim kontrolnim uzorcima kako bi se utvrdio polazni odgovor za uzorke koji se tretiraju ispitivanom kemikalijom otopljenom u istom otapalu ili nosaču. Kada se ispituje s istodobnom kontrolom s medijem, taj uzorak isto tako pokazuje jesu li otapalo ili nosač u interakciji s ispitnim sustavom.
Specifičnost
: udio svih negativnih/neaktivnih kemikalija koje su pravilno razvrstane primjenom ispitivanja. To je mjera točnosti ispitne metode koja daje kategorijske rezultate i važan je čimbenik za ocjenu relevantnosti ispitne metode (13.).
Tvar
: kemijski element i njegovi spojevi u prirodnome stanju ili dobiveni proizvodnim postupkom, što uključuje i aditive koji su nužni za održavanje stabilnosti proizvoda te nečistoće koje proizlaze iz primijenjenoga postupka, ali isključuje otapala koja se mogu izdvojiti bez utjecaja na stabilnost tvari ili promjene njezina sastava.
Površinski aktivna tvar
: kemikalija, kao npr. deterdžent, koju se naziva i površinski aktivnim agensom, a kojom se može smanjiti površinska napetost tekućine i time omogućiti pjenjenje i prodiranje u krute tvari; poznata je i kao sredstvo za vlaženje.
Ispitivana kemikalija
: svaka tvar ili smjesa koja se ispituje ovom ispitnom metodom.
Strategija višerazinskog ispitivanja
: strategija stupnjevitog ispitivanja u kojoj se sve postojeće informacije o ispitivanoj kemikaliji preispituju točno utvrđenim redoslijedom, pri čemu se prije prelaska na sljedeću razinu na svakoj razini primjenjuje postupak analize snage dokaza kako bi se odredilo je li na raspolaganju dovoljno informacija za donošenje odluke o razvrstavanju tvari s obzirom na opasnost. Ako se na temelju postojećih podataka ispitivanoj kemikaliji može pripisati potencijal nadražujućeg djelovanja, daljnje ispitivanje nije potrebno. Ako se na temelju postojećih informacija ispitivanoj kemikaliji ne može pripisati potencijal za nadražujuće djelovanje, provodi se postupak stupnjevitog sekvencijskog ispitivanja na životinjama sve dok se nedvosmisleno ne utvrdi razvrstavanje.
Pristup odozgo prema dolje
: stupnjevit pristup koji se primjenjuje za ispitivanu kemikaliju u pogledu koje postoji sumnja da uzrokuje tešku ozljedu oka, a koji počinje utvrđivanjem kemikalija koje induciraju tešku ozljedu oka (pozitivan ishod) u odnosu na druge kemikalije (negativan ishod).
Globalno usklađeni sustav Ujedinjenih naroda za razvrstavanje i označivanje kemikalija (UN GHS)
: sustav za razvrstavanje kemikalija (tvari i smjesa) prema standardiziranim vrstama i stupnjevima fizičkih opasnosti i opasnosti za zdravlje i okoliš, kojim su obuhvaćena odgovarajuća komunikacijska sredstva kao što su piktogrami, oznake opasnosti, oznake upozorenja, oznake obavijesti i sigurnosno-tehnički listovi, kojima se prenose informacije o njihovim štetnim učincima u cilju zaštite ljudi (uključujući poslodavce, radnike, prijevoznike, potrošače i interventno osoblje) i okoliša (1.).
Kategorija 1. sustava UN GHS/CLP-a
: vidjeti „tešku ozljedu oka”.
Kategorija 2. sustava UN GHS/CLP-a
: vidjeti „nadraživanje oka”.
Bez kategorije prema sustavu UN GHS
: kemikalije koje nisu razvrstane u kategoriju 1. ili 2. prema sustavu UN GHS/CLP-u, (ili kategoriju 2.A ili 2.B prema sustavu UN GHS).
UVCB
: tvari nepoznatog ili promjenjivog sastava, složeni reakcijski proizvodi i biološki materijali.
B.69. ISPITNA METODA REKONSTRUIRANOG EPITELA KOJI NALIKUJE LJUDSKOJ ROŽNICI (RhCE) ZA UTVRĐIVANJE KEMIKALIJA KOJE NIJE POTREBNO RAZVRSTATI I OZNAČITI S OBZIROM NA NADRAŽIVANJE OKA ILI TEŠKU OZLJEDU OKA
UVOD
|
1.
|
Ova ispitna metoda odgovara Smjernici OECD-a za ispitivanje 492 (2017.). Teška ozljeda oka odnosi se na izazivanje oštećenja tkiva oka ili ozbiljno fizičko pogoršanje vida nakon primjene ispitivane kemikalije na prednju površinu oka, a koje nije potpunosti reverzibilno unutar 21 dana od primjene, kako je utvrđeno Globalno usklađenim sustavom razvrstavanja i označivanja kemikalija Ujedinjenih naroda (UN GHS) (1.) i Uredbom (EZ) br. 1272/2008 o razvrstavanju, označivanju i pakiranju tvari i smjesa (CLP) (76) Europske unije. Prema sustavu UN GHS i CLP-u nadraživanje oka odnosi se na izazivanje promjena u oku nakon primjene ispitivane kemikalije na prednju površinu oka, koje su u potpunosti reverzibilne unutar 21 dana nakon primjene. Ispitivane kemikalije koje induciraju tešku ozljedu oka razvrstane su u kategoriju 1. sustava UN GHS i CLP-a, dok su kemikalije koje induciraju nadraživanje oka razvrstane u kategoriju 2. sustava UN GHS i CLP-a. Ispitivane kemikalije koje su nerazvrstane s obzirom na nadraživanje oka ili tešku ozljedu oka definirane su kao one koje ne ispunjavaju zahtjeve za razvrstavanje u kategoriju 1. ili 2. (2.A ili 2.B) sustava UN GHS i CLP-a, odnosno one se navode kao kemikalije bez kategorije prema sustavu UN GHS i CLP-u.
|
|
2.
|
Procjena teške ozljede oka/nadraživanja oka obično je uključivala upotrebu laboratorijskih životinja (ispitna metoda B.5. (2.)). Odabir najprimjerenije ispitne metode i upotrebu te ispitne metode treba razmotriti u kontekstu Smjernica OECD-a o integriranim pristupima ispitivanju i procjeni za teške ozljede oka i nadraživanje oka (39.).
|
|
3.
|
U ovoj ispitnoj metodi opisuje se in vitro postupak koji omogućuje utvrđivanje kemikalija (tvari i smjesa) koje nije potrebno razvrstati i označiti s obzirom na nadraživanje oka ili tešku ozljedu oka u skladu sa sustavom UN GHS i CLP-om. U njoj se upotrebljava rekonstruirani epitel koji nalikuje ljudskoj rožnici (RhCE) i koji vjerno oponaša histološka, morfološka, biokemijska i fiziološka svojstva epitela ljudske rožnice. Validirane su još četiri in vitro ispitne metode koje se smatraju znanstveno valjanima te su donesene kao ispitne metode B.47. (3.), B.48. (4.), B.61. (5.) i B.68. (6.), a bave se krajnjom točkom teške ozljede oka/nadraživanja oka na zdravlje ljudi.
|
|
4.
|
Ova ispitna metoda obuhvaća dva validirana testa u kojima se upotrebljavaju komercijalno dostupni modeli RhCE-a. Validacijske studije za procjenu nadraživanja oka/teške ozljede oka provedene su (7., 8., 9., 10., 11., 12. i 13.) upotrebom testa nadraživanja oka (EIT) EpiOcular™ (EIT) i testa nadraživanja oka s epitelom ljudske rožnice (HCE) SkinEthic™. U svakom od tih testova kao ispitni sustav upotrebljavaju se komercijalno dostupni modeli tkiva RhCE, koje se dalje u tekstu navode kao validirane referentne metode VRM1 i VRM2. Iz tih validacijskih studija i njihovih neovisnih stručnih pregleda (9. i 12.) donesen je zaključak da se testom nadraživanja oka EpiOcular™ i testom nadraživanja oka s epitelom ljudske rožnice SkinEthic™ mogu točno utvrditi kemikalije (i tvari i smjese) koje nije potrebno razvrstati i označiti s obzirom na nadraživanje oka ili tešku ozljedu oka u skladu sa sustavom UN GHS te su testovi preporučeni kao znanstveno valjani za tu svrhu (13.).
|
|
5.
|
Trenutačno je opće prihvaćena činjenica da se u doglednoj budućnosti in vivo Draizeovo ispitivanje na oku kunića (2. i 14.) neće moći potpuno zamijeniti nijednom pojedinačnom in vitro ispitnom metodom za predviđanje različitih kemijskih razreda u punom rasponu teških ozljeda oka/nadraživanja oka. Međutim, kao potpuna zamjena za Draizeovo ispitivanje na oku mogu se primjenjivati strateške kombinacije nekoliko alternativnih ispitnih metoda u okviru strategija (višerazinskog) ispitivanja, kao što je pristup odozdo prema gore/odozgo prema dolje (15.). Pristup odozdo prema gore (15.) trebalo bi primijeniti kada se na temelju postojećih informacija očekuje da kemikalija neće izazvati znatno nadraživanje oka koje bi zahtijevalo razvrstavanje, dok bi pristup odozgo prema dolje (15.) trebalo primijeniti kada se na temelju postojećih informacija očekuje da će kemikalija izazvati tešku ozljedu oka. Test nadraživanja oka EpiOcular™ i test nadraživanja oka s epitelom ljudske rožnice SkinEthic™ preporučuju se za utvrđivanje kemikalija za koje nije potrebno razvrstavanje u pogledu nadraživanja ili teške ozljede oka u skladu sa sustavom UN GHS/CLP-om (bez kategorije) bez daljnjeg ispitivanja, u okviru strategije ispitivanja kao što je pristup odozdo prema gore/odozgo prema dolje koju su predložili Scott i dr., npr. kao početni korak u pristupu odozdo prema gore ili kao jedan od posljednjih koraka u pristupu odozgo prema dolje (15.). Međutim, test nadraživanja oka EpiOcular™ i test nadraživanja oka s epitelom ljudske rožnice SkinEthic™ nisu namijenjeni za razlikovanje kategorije 1. sustava UN GHS/CLP-a (teška ozljeda oka) od kategorije 2. tog sustava (nadraživanje oka). Ta razlika morat će se utvrditi na drugoj razini strategije ispitivanja (15.). Ispitivanu kemikaliju za koju se testom nadraživanja oka EpiOcular™ ili testom nadraživanja oka s epitelom ljudske rožnice SkinEthic™ utvrdi da ju je potrebno razvrstati u pogledu nadraživanja oka/teške ozljede oka stoga će trebati dodatno ispitati (in vitro i/ili in vivo) kako bi se došlo do konačnog zaključka (bez kategorije, kategorija 2. ili kategorija 1. prema sustavu UN GHS/CLP-u), npr. upotrebom ispitne metode B.47., B.48., B.61. ili B.68.
|
|
6.
|
Svrha je ove ispitne metode opisati postupak koji se primjenjuje za ocjenjivanje potencijala opasnosti ispitivane kemikalije za oko na temelju njezine sposobnosti induciranja citotoksičnosti u modelu tkiva RhCE, kako se izmjeri MTT testom (16.) (vidjeti stavak 21.). Vijabilnost tkiva RhCE nakon izlaganja ispitivanoj kemikaliji utvrđuje se u usporedbi s tkivima koja se tretiraju s tvari za negativnu kontrolu (postotak vijabilnosti) i zatim se upotrebljava za predviđanje potencijala opasnosti ispitivane kemikalije za oko.
|
|
7.
|
Za lakšu validaciju novih ili izmijenjenih in vitro testova koji se temelje na RhCE-u i koji su slični testu nadraživanja oka EpiOcular™ i testu nadraživanja oka s epitelom ljudske rožnice SkinEthic™ dostupni su zahtjevi izvedbe (17.), u skladu s načelima Smjernice OECD-a br. 34 (18.) te oni omogućuju pravovremenu izmjenu Smjernice OECD-a za ispitivanje 492 radi uključivanja tih načela. Uzajamno prihvaćanje podataka na temelju sporazuma OECD-a jamči se samo za testove koji su validirani u skladu sa zahtjevima izvedbe ako je OECD pregledao te testove i uključio ih u odgovarajuću smjernicu OECD-a za ispitivanje.
|
DEFINICIJE
|
8.
|
Definicije su navedene u Dodatku 1.
|
POČETNA RAZMATRANJA I OGRANIČENJA
|
9.
|
Ova ispitna metoda temelji se na komercijalnim trodimenzionalnim modelima tkiva RhCE koji se proizvode upotrebom primarnih ljudskih epidermalnih keratinocita (tj. EpiOcular™ OCL-200) ili ljudskih imortaliziranih epitelnih stanica rožnice (tj. SkinEthic™ HCE/S). Modeli tkiva RhCE EpiOcular™ OCL-200 i SkinEthic™ HCE/S slični su in vivo trodimenzionalnoj strukturi epitela rožnice i proizvode se upotrebom stanica vrste koja se proučava (19. i 20.). Nadalje, testovima se izravno mjeri citotoksičnost koja je rezultat prolaska kemikalije kroz rožnicu i izazivanja oštećenja stanica i tkiva; citotoksični odgovor zatim određuje ukupni ishod in vivo teške ozljede oka/nadraženosti oka. Do oštećenja stanica može doći preko nekoliko načina djelovanja (vidjeti stavak 20.), ali citotoksičnost ima važnu, a možda i primarnu, mehanicističku ulogu u određivanju ukupnog odgovora na kemikaliju u obliku teške ozljede oka/nadraživanja oka, koja se in vivo uglavnom očituje u pojavi zamućenja rožnice, iritisa, crvenila konjunktive i/ili kemoze konjunktive, neovisno o fizikalno-kemijskim procesima na kojima se temelji oštećenje tkiva.
|
|
10.
|
U validacijskoj studiji na kojoj se temelji ova ispitna metoda ispitan je širok raspon kemikalija, koje obuhvaćaju vrlo različite vrste kemikalija, kemijske razrede, molekularne mase, vrijednosti LogP, kemijske strukture itd. Validacijska baza podataka za test nadraživanja oka EpiOcular™ sadržavala je ukupno 113 kemikalija, koje su obuhvaćale 95 različitih organskih funkcionalnih skupina u skladu s analizom OECD-ova alata QSAR (8.). Većinu tih kemikalija činile su tvari s jednim sastojkom, ali u studiju je uključeno i nekoliko tvari s više sastojaka (uključujući tri homopolimera, pet kopolimera i deset kvazipolimera). Kad je riječ o agregatnom stanju i kategorijama sustava UN GHS/CLP-a, 113 ispitanih kemikalija distribuirano je na sljedeći način: 13 tekućina iz kategorije 1., 15 kemikalija u krutom stanju iz kategorije 1., šest tekućina iz kategorije 2.A, deset kemikalija u krutom stanju iz kategorije 2.A, sedam tekućina iz kategorije 2.B, sedam kemikalija u krutom stanju iz kategorije 2.B, 27 tekućina bez kategorije i 28 kemikalija u krutom stanju bez kategorije (8.). Validacijska baza podataka za test nadraživanja oka s epitelom ljudske rožnice SkinEthic™ sadržavala je ukupno 200 kemikalija, koje su obuhvaćale 165 različitih organskih funkcionalnih skupina (8., 10. i 11.). Većinu tih kemikalija činile su tvari s jednim sastojkom, ali u studiju je uključeno i nekoliko tvari s više sastojaka (uključujući deset polimera). Kad je riječ o agregatnom stanju i kategorijama sustava UN GHS/CLP-a, 200 ispitanih kemikalija distribuirano je na sljedeći način: 27 tekućina iz kategorije 1., 24 kemikalije u krutom stanju iz kategorije 1., 19 tekućina iz kategorije 2.A, deset kemikalija u krutom stanju iz kategorije 2.A, devet tekućina iz kategorije 2.B, osam kemikalija u krutom stanju iz kategorije 2.B, 50 tekućina bez kategorije i 53 kemikalije u krutom stanju bez kategorije (10. i 11.).
|
|
11.
|
Ova je ispitna metoda primjenjiva na tvari i smjese te na kemikalije u krutom stanju, tekućine, polukrute kemikalije i voskove. Tekućine mogu biti vodene i bezvodne; krute tvari mogu biti topljive ili netopljive u vodi. Krute tvari prije primjene treba samljeti u sitni prah kad god je to moguće; nije potrebna nikakva druga prethodna obrada uzorka. Plinovi i aerosoli nisu ocijenjeni u validacijskoj studiji. Iako je moguće da se oni mogu ispitati upotrebom tehnologije RhCE, trenutačnom ispitnom metodom nije omogućeno ispitivanje plinova i aerosola.
|
|
12.
|
Ispitivane kemikalije koje apsorbiraju svjetlost u istom rasponu kao i MTT formazan (prirodno ili nakon tretiranja) i ispitivane kemikalije koje mogu izravno reducirati vitalnu boju MTT (na MTT formazan) mogu utjecati na mjerenje vijabilnosti tkiva te se kod njih trebaju upotrebljavati prilagođene kontrole za ispravke. Vrsta prilagođenih kontrola koja može biti potrebna mijenjat će se ovisno o vrsti interferencije koju proizvodi ispitivana kemikalija i postupku koji se upotrebljava za kvantificiranje MTT formazana (vidjeti stavke 36.–42.).
|
|
13.
|
Rezultati dobiveni u predvalidacijskoj (21. i 22.) i cjelokupnoj validacijskoj (8., 10. i 11.) studiji pokazali su da se i test nadraživanja oka EpiOcular™ i test nadraživanja oka s epitelom ljudske rožnice SkinEthic™ mogu prenijeti u laboratorije koji još nikada nisu provodili te testove te da su obnovljivi unutar jednog laboratorija i između više laboratorija. Na temelju tih studija razina obnovljivosti u smislu usklađenosti predviđanja koja se može očekivati iz testa nadraživanja oka EpiOcular™ na temelju podataka o 113 kemikalija iznosi približno 95 % unutar laboratorija i 93 % između više laboratorija. Razina obnovljivosti u smislu usklađenosti predviđanja koja se može očekivati iz testa nadraživanja oka s epitelom ljudske rožnice SkinEthic™ na temelju podataka o 120 kemikalija iznosi približno 92 % unutar laboratorija i 95 % između više laboratorija.
|
|
14.
|
Test nadraživanja oka EpiOcular™ može se primjenjivati za utvrđivanje kemikalija koje nije potrebno razvrstati s obzirom na nadraživanje oka ili tešku ozljedu oka u skladu sa sustavom razvrstavanja UN GHS i CLP-om. Uzimajući u obzir podatke dobivene u validacijskoj studiji (8.), test nadraživanja oka EpiOcular™ ima ukupnu točnost od 80 % (na temelju 112 kemikalija), osjetljivost od 96 % (na temelju 57 kemikalija), udio lažno negativnih rezultata od 4 % (na temelju 57 kemikalija), specifičnost od 63 % (na temelju 55 kemikalija) i udio lažno pozitivnih rezultata od 37 % (na temelju 55 kemikalija), u usporedbi s referentnim podacima in vivo ispitivanja na oku kunića (ispitna metoda B.5.) (2. i 14.), razvrstano u skladu sa sustavom razvrstavanja UN GHS i CLP-om. Studija u kojoj je 97 tekućih agrokemijskih formulacija ispitano testom nadraživanja oka EpiOcular™ pokazala je sličnu uspješnost ispitne metode za tu vrstu smjesa kao što je ona dobivena u validacijskoj studiji (23.). Tih je 97 formulacija distribuirano na sljedeći način: 21 kemikalija iz kategorije 1., 19 kemikalija iz kategorije 2.A, 14 kemikalija iz kategorije 2.B i 43 kemikalije bez kategorije, razvrstano u skladu sa sustavom razvrstavanja UN GHS na temelju referentnih podataka in vivo ispitivanja na oku kunića (ispitna metoda B.5.) (2. i 14.). Dobivena je ukupna točnost od 82 % (na temelju 97 formulacija), osjetljivost od 91 % (na temelju 54 formulacije), udio lažno negativnih rezultata od 9 % (na temelju 54 formulacije), specifičnost od 72 % (na temelju 43 formulacije) i udio lažno pozitivnih rezultata od 28 % (na temelju 43 formulacije) (23.).
|
|
15.
|
Test nadraživanja oka s epitelom ljudske rožnice SkinEthic™ može se primjenjivati za utvrđivanje kemikalija koje nije potrebno razvrstati s obzirom na nadraživanje oka ili tešku ozljedu oka u skladu sa sustavom razvrstavanja UN GHS i CLP-om. Uzimajući u obzir podatke dobivene u validacijskoj studiji (10. i 11.), test nadraživanja oka s epitelom ljudske rožnice SkinEthic™ ima ukupnu točnost od 84 % (na temelju 200 kemikalija), osjetljivost od 95 % (na temelju 97 kemikalija), udio lažno negativnih rezultata od 5 % (na temelju 97 kemikalija), specifičnost od 72 % (na temelju 103 kemikalije) i udio lažno pozitivnih rezultata od 28 % (na temelju 103 kemikalije), u usporedbi s referentnim podacima in vivo ispitivanja na oku kunića (ispitna metoda B.5.) (2. i 14.), razvrstano u skladu sa sustavom razvrstavanja UN GHS i CLP-om.
|
|
16.
|
Udjeli lažno negativnih rezultata dobiveni u oba testa RhCE, s tvarima ili smjesama, ulaze u 12-postotnu ukupnu vjerojatnost da se kemikalije u in vivo Draizeovu ispitivanju na oku u ponovljenim testovima utvrde kao kemikalije iz kategorije 2. ili bez kategorije u skladu sa sustavom UN GHS ili CLP-om; uzrok je tomu inherentna varijabilnost unutar testa u toj metodi (24.). Stope lažno negativnih rezultata dobivene u obje ispitne metode RhCE s tvarima ili smjesama nisu presudne u kontekstu ove ispitne metode jer je sve ispitivane kemikalije kod kojih je vijabilnost tkiva jednaka utvrđenim graničnim vrijednostima ili manja od njih (vidjeti stavak 44.) potrebno dodatno ispitati drugim in vitro ispitnim metodama ili, kao posljednja opcija kod kunića, ovisno o regulatornim zahtjevima, upotrebom strategije sekvencijskog ispitivanja u analizi snage dokaza. Ove se ispitne metode mogu primjenjivati za sve vrste kemikalija, pri čemu negativni rezultat treba biti prihvatljiv za nerazvrstavanje kemikalije s obzirom na nadraživanje oka i tešku ozljedu oka (bez kategorije prema sustavu UN GHS i CLP-u). Prije primjene testa nadraživanja oka EpiOcular™ i testa nadraživanja oka s epitelom ljudske rožnice SkinEthic™ u skladu s drugim shemama razvrstavanja osim sustava UN GHS/CLP-a trebalo bi se savjetovati s odgovarajućim regulatornim tijelima.
|
|
17.
|
Ograničenje je ove ispitne metode to što ne omogućuje razlikovanje nadraživanja oka/reverzibilnih učinaka na oko (kategorija 2.) od teške ozljede oka/ireverzibilnih učinaka na oko (kategorija 1.), kako je utvrđeno sustavom UN GHS i CLP-om, niti razlikovanje kemikalija nadražujućih za oči (neobvezna kategorija 2.A) od kemikalija blago nadražujućih za oči (neobavezna kategorija 2.B), kako je utvrđeno sustavom UN GHS (1.). U te je svrhe potrebno daljnje ispitivanje drugim in vitro ispitnim metodama.
|
|
18.
|
U ovoj se ispitnoj metodi izraz „ispitivana kemikalija” upotrebljava za označivanje onoga što se ispituje (77) te se ne odnosi na primjenjivost ispitne metode RhCE za ispitivanje tvari i/ili smjesa.
|
NAČELO ISPITIVANJA
|
19.
|
Ispitivana kemikalija lokalno se nanosi na najmanje dva trodimenzionalna modela tkiva RhCE, a vijabilnost tkiva mjeri se nakon izlaganja i razdoblja inkubacije nakon tretiranja. Tkiva RhCE rekonstruiraju se iz primarnih ljudskih epidermalnih keratinocita ili ljudskih imortaliziranih epitelnih stanica rožnice, koje su uzgajane nekoliko dana kako bi tvorile stratificirani, visoko izdiferencirani ljuskavi epitel koji je morfološki sličan onom koji se nalazi u ljudskoj rožnici. Model tkiva EpiOcular™ RhCE sastoji se od najmanje tri vijabilna sloja stanica i nekeratinizirane površine, koji imaju strukturu koja nalikuje rožnici i analogna je strukturi in vivo. Model tkiva SkinEthic™ HCE RhCE sastoji se od najmanje četiri vijabilna sloja stanica, uključujući stupičaste bazalne stanice, prijelazne krilate stanice i površinske ljuskave stanice koje su slične uobičajenom epitelu ljudske rožnice (20. i 26.).
|
|
20.
|
Kemijski inducirana teška ozljeda oka/nadraživanje oka, koji se in vivo uglavnom očituju kao zamućenje rožnice, iritis, crvenilo konjunktive i/ili kemoza konjunktive, rezultat je niza događaja koji započinju prodiranjem kemikalije kroz rožnicu i/ili konjunktivu i oštećenjem stanica. Do oštećenja stanica može doći preko nekoliko načina djelovanja, uključujući: liziranje stanične membrane (npr. površinski aktivnim tvarima, organskim otapalima); koagulaciju makromolekula (osobito proteina) (npr. površinski aktivnim tvarima, organskim otapalima, lužinama i kiselinama); saponifikaciju lipida (npr. lužinama); i alkilaciju ili druge kovalentne interakcije s makromolekulama (npr. izbjeljivačima, peroksidima i alkilatorima) (15., 27. i 28.). Međutim, pokazalo se da citotoksičnost ima važnu, a možda i primarnu, mehanicističku ulogu u određivanju ukupnog odgovora na kemikaliju u obliku teške ozljede oka/nadraživanja oka, neovisno o fizikalno-kemijskim procesima na kojima se temelji oštećenje tkiva (29. i 30.). Nadalje, potencijal kemikalije da izazove tešku ozljedu oka/nadraživanje oka prvenstveno je određen razmjerom početne ozljede (31.), koji je u korelaciji s razmjerom smrti stanica (29.) i s razmjerom naknadnih odgovora i konačnih ishoda (32.). Stoga slabo nadražujuće kemikalije obično utječu samo na površinski epitel rožnice, blago i umjereno nadražujuće kemikalije uglavnom oštećuju epitel i površinsku stromu, a jako nadražujuće kemikalije oštećuju epitel, dubinsku stromu, a ponekad i endotel rožnice (30. i 33.). Mjerenje vijabilnosti modela tkiva RhCE nakon lokalnog izlaganja ispitivanoj kemikaliji radi utvrđivanja kemikalija koje nije potrebno razvrstati s obzirom na tešku ozljedu oka/nadraživanje oka (bez kategorije prema sustavu UN GHS i CLP-u) temelji se na pretpostavci da će sve kemikalije koje induciraju tešku ozljedu oka ili nadraživanje oka inducirati citotoksičnost u epitelu rožnice i/ili konjunktivi.
|
|
21.
|
Vijabilnost tkiva u modelima RhCE obično se mjeri enzimskom konverzijom vitalne boje MTT [3-(4,5-dimetiltiazol-2-il)-2,5-difenil tetrazol bromid; tiazolil plavo tetrazolijev bromid; CAS broj 298-93-1], koju vrše vijabilne stanice tkiva, u sol plavog MTT formazana koja se kvantitativno mjeri nakon ekstrakcije iz tkiva (16.). Kemikalije koje ne treba razvrstati i označiti u skladu sa sustavom UN GHS/CLP-om (bez kategorije) utvrđene su kao kemikalije koje ne smanjuju vijabilnost tkiva ispod utvrđenog praga (tj. vijabilnost tkiva > 60 % u testu EIT EpiOcular™ i testu EITL (78) s HCE-om SkinEthic™ ili > 50 % u testu EITS (79) s HCE-om SkinEthic™) (vidjeti stavak 44.).
|
DOKAZIVANJE OSPOSOBLJENOSTI
|
22.
|
Prije rutinske upotrebe testova RhCE u regulatorne svrhe laboratoriji trebaju dokazati tehničku osposobljenost tako da točno predvide 15 kemikalija koje služe za dokazivanje osposobljenosti navedenih u tablici 1. Te su kemikalije odabrane među kemikalijama upotrijebljenima u validacijskim studijama validiranih referentnih metoda (8., 10. i 11.). Odabir uključuje, u mjeri u kojoj je to moguće, kemikalije: i. koje obuhvaćaju različita agregatna stanja; ii. koje obuhvaćaju puni raspon odgovora u obliku in vivo teške ozljede oka/nadraživanja oka na temelju visokokvalitetnih rezultata dobivenih u referentnom in vivo ispitivanju na oku kunića (ispitna metoda B.5.) (2. i 14.) te prema sustavu razvrstavanja UN GHS (tj. kategorije 1., 2.A, 2.B ili bez kategorije) (1.) i CLP-u (tj. kategorije 1., 2. ili bez kategorije); iii. koje obuhvaćaju različite in vivo pokretače razvrstavanja (24. i 25.); iv. koje su reprezentativne za kemijske razrede koji su korišteni u validacijskoj studiji (8., 10. i 11.); v. koje obuhvaćaju dobru i široku zastupljenost organskih funkcionalnih skupina (8., 10. i 11.); vi. koje imaju dobro utvrđene kemijske strukture (8., 10. i 11.); vii. koje su obojene i/ili koje izravno reduciraju MTT; viii. koje su dale ponovljive rezultate u ispitnim metodama RhCE tijekom njihovih validacija; ix. koje su točno predviđene ispitnim metodama RhCE tijekom njihovih validacijskih studija; x. koje obuhvaćaju puni raspon in vitro odgovora na temelju visokokvalitetnih podataka iz ispitnih metoda RhCE (vijabilnost od 0 do 100 %); xi. koje su komercijalno dostupne; i xii. koje nisu povezane s neprimjereno visokim troškovima nabave i/ili zbrinjavanja. U situacijama kada navedena kemikalija nije dostupna ili se ne može upotrijebiti iz drugih opravdanih razloga, mogla bi se upotrijebiti druga kemikalija koja ispunjava prethodno opisane kriterije, npr. kemikalije koje su upotrijebljene u validaciji validirane referentne metode. Međutim, takva odstupanja treba obrazložiti.
Tablica 1.
Popis kemikalija koje služe za dokazivanje osposobljenosti
|
Kemijski naziv
|
CAS br.
|
Organska funkcionalna skupina (80)
|
Agregatno stanje
|
Vijabilnost za VRM1 (%) (81)
|
Vijabilnost za VRM2 (%) (82)
|
Predviđanje VRM-a
|
Tvar koja reducira MTT
|
Interferencija s bojom
|
|
In vivo kategorija 1. (83)
|
|
|
Metil-tioglikolat
|
2365-48-2
|
Ester karboksilne kiseline; tioalkohol
|
Tekuće
|
10,9 ± 6,4
|
5,5 ± 7,4
|
Predviđanje nije moguće
|
Da (jako)
|
Ne
|
|
Hidroksietil-akrilat
|
818-61-1
|
Akrilat; alkohol
|
Tekuće
|
7,5 ± 4,7 (84)
|
1,6 ± 1,0
|
Predviđanje nije moguće
|
Ne
|
Ne
|
|
2,5-dimetil-2,5-heksandiol
|
110-03-2
|
Alkohol
|
Kruto
|
2,3 ± 0,2
|
0,2 ± 0,1
|
Predviđanje nije moguće
|
Ne
|
Ne
|
|
Natrijev oksalat
|
62-76-0
|
Okso-karboksilna kiselina
|
Kruto
|
29,0 ± 1,2
|
5,3 ± 4,1
|
Predviđanje nije moguće
|
Ne
|
Ne
|
|
In vivo kategorija 2.A (83)
|
|
|
2,4,11,13-tetraazatetradekan-diimidamid, N,N″-bis(4-klorfenil)-3,12-diimino-, di-D-glukonat (20 %, vodena otopina) (85)
|
18472-51-0
|
Aromatski heterociklički halid; aril halid; dihidroksilna skupina; gvanidin
|
Tekuće
|
4,0 ± 1,1
|
1,3 ± 0,6
|
Predviđanje nije moguće
|
Ne
|
Da (slabo)
|
|
Natrijev benzoat
|
532-32-1
|
Aril; karboksilna kiselina
|
Kruto
|
3,5 ± 2,6
|
0,6 ± 0,1
|
Predviđanje nije moguće
|
Ne
|
Ne
|
|
In vivo kategorija 2.B (83)
|
|
|
Dietiltoluamid
|
134-62-3
|
Benzamid
|
Tekuće
|
15,6 ± 6,3
|
2,8 ± 0,9
|
Predviđanje nije moguće
|
Ne
|
Ne
|
|
2,2-dimetil-3-metilenbiciklo [2.2.1] heptan
|
79-92-5
|
Alkan, razgranat tercijarnim ugljikom; alken; bicikloheptan; karbociklički spojevi s premoštenim prstenastim sustavom; cikloalkan
|
Kruto
|
4,7 ± 1,5
|
15,8 ± 1,1
|
Predviđanje nije moguće
|
Ne
|
Ne
|
|
In vivo bez kategorije (83)
|
|
|
1-etil-3-metilimidazolium etilsulfat
|
342573-75-5
|
Alkoksi; amonijeva sol; aril; imidazol; sulfat
|
Tekuće
|
79,9 ± 6,4
|
79,4 ± 6,2
|
Bez kat.
|
Ne
|
Ne
|
|
Dikaprilil eter
|
629-82-3
|
Alkoksi; eter
|
Tekuće
|
97,8 ± 4,3
|
95,2 ± 3,0
|
Bez kat.
|
Ne
|
Ne
|
|
Piperonil butoksid
|
51-03-6
|
Alkoksi; benzodioksol; benzil; eter
|
Tekuće
|
104,2 ± 4,2
|
96,5 ± 3,5
|
Bez kat.
|
Ne
|
Ne
|
|
Polietilen glikol (PEG-40) hidrogeniranog ricinusovog ulja
|
61788-85-0
|
Acilal; alkohol; alil; eter
|
Viskozno
|
77,6 ± 5,4
|
89,1 ± 2,9
|
Bez kat.
|
Ne
|
Ne
|
|
1-(4-klorfenil)-3-(3,4-diklorfenil) urea
|
101-20-2
|
Aromatski heterociklički halid; aril halid; derivati uree
|
Kruto
|
106,7 ± 5,3
|
101,9 ± 6,6
|
Bez kat.
|
Ne
|
Ne
|
|
2,2′-metilen-bis-(6-(2H-benzotriazol-2-il)-4-(1,1,3,3-tetrametilbutil)-fenol)
|
103597-45-1
|
Alkan razgranat kvarternim ugljikom; vezani karbociklički aromatski spoj; vezani zasićeni heterociklički spojevi; prekursori kinoidnih spojeva; tert-butil
|
Kruto
|
102,7 ± 13,4
|
97,7 ± 5,6
|
Bez kat.
|
Ne
|
Ne
|
|
Kalijev tetrafluoroborat
|
14075-53-7
|
Anorganska sol
|
Kruto
|
88,6 ± 3,3
|
92,9 ± 5,1
|
Bez kat.
|
Ne
|
Ne
|
|
Kratice:
CAS br. = registarski broj Službe za podatke o kemijskim tvarima; UN GHS = Globalno usklađeni sustav Ujedinjenih naroda za razvrstavanje i označivanje kemikalija (1.); VRM1 = validirana referentna metoda, EpiOcular™ EIT; VRM2 = validirana referentna metoda, SkinEthic™ HCE EIT; Interferencija s bojom = interferencija s bojom kod mjerenja standardne apsorbancije (optička gustoća (OD)) MTT formazana.
|
|
|
23.
|
U okviru ispitivanja osposobljenosti preporučuje se da korisnici po primitku provjere svojstva barijere tkiva u skladu sa specifikacijama proizvođača modela tkiva RhCE (vidjeti stavke 25., 27. i 30.) To je posebno važno ako se tkiva šalju na velike udaljenosti/tijekom dugih vremenskih razdoblja. Nakon što se ispitivanje uspješno uspostavi te nakon što se stekne i dokaže osposobljenost u pogledu njegove upotrebe, takva rutinska provjera neće biti potrebna. Međutim, kod rutinske upotrebe ispitivanja preporučuje se daljnje ocjenjivanje svojstava barijere u pravilnim vremenskim razmacima.
|
POSTUPAK
|
24.
|
Ovom ispitnom metodom trenutačno su obuhvaćeni znanstveno valjani test nadraživanja oka EpiOcular™ i test nadraživanja oka s epitelom ljudske rožnice SkinEthic™ (9., 12. i 13.), koji se nazivaju validirane referentne metode (VRM1 i VRM2). Dostupni su standardni operativni postupci (SOP) za ispitnu metodu RhCE te bi ih trebalo primjenjivati pri provedbi i primjeni ispitnih metoda u laboratoriju (34. i 35.). U sljedećim stavcima i Dodatku 2. opisuju se glavni elementi i postupci testova RhCE.
|
ELEMENTI ISPITNE METODE RHCE
Opći uvjeti
|
25.
|
Treba upotrebljavati relevantne ljudske stanice za rekonstrukciju trodimenzionalnog tkiva epitela koje nalikuje rožnici, a koje bi se trebalo sastojati od progresivno stratificiranih, ali ne i kornificiranih stanica. Model tkiva RhCE priprema se u umetcima s poroznom sintetičkom membranom kroz koju hranjive tvari mogu proći do stanica. U rekonstruiranom epitelu koji nalikuje rožnici trebaju biti prisutni višestruki slojevi vijabilnih, nekeratiniziranih stanica epitela. Model tkiva RhCE trebao bi imati površinu epitela koja je u izravnom dodiru sa zrakom kako bi se omogućilo izravno lokalno izlaganje ispitivanim kemikalijama na način koji je sličan načinu na koji bi epitel rožnice bio izložen in vivo. Model tkiva RhCE treba činiti funkcionalnu barijeru koja je dovoljno otporna da zaustavi brzi prodor citotoksičnih referentnih tvari, npr. Tritona X-100 ili natrijeva dodecil-sulfata (SDS). Treba dokazati funkciju barijere, a ona se može ocijeniti utvrđivanjem ili vremena izlaganja potrebnog za smanjenje vijabilnosti tkiva za 50 % (ET50) nakon primjene referentne tvari u utvrđenoj, fiksnoj koncentraciji (npr. 100 μl 0,3-postotnog (v/v) Tritona X-100) ili koncentracije pri kojoj referentna tvar smanjuje vijabilnost tkiva za 50 % (IC50) nakon fiksnog vremena izlaganja (npr. 30 minuta tretiranja s 50 μl SDS-a) (vidjeti stavak 30.). Model tkiva RhCE treba biti dovoljno nepropustan da spriječi prolazak ispitivane kemikalije oko ruba vijabilnog tkiva, jer bi to moglo značiti loše modeliranje izlaganja rožnice. Ljudske stanice koje se upotrebljavaju za utvrđivanje modela tkiva RhCE ne smiju biti onečišćene bakterijama, virusima, mikoplazmom i gljivicama. Dobavljač treba provjeriti je li model tkiva sterilan i utvrditi da nema kontaminacije gljivicama i bakterijama.
|
Funkcionalni uvjeti
Vijabilnost
|
26.
|
Za kvantifikaciju vijabilnosti tkiva upotrebljava se MTT test (16.). Vijabilne stanice modela tkiva RhCE reduciraju vitalnu boju MTT u talog plavog MTT formazana, koji se zatim ekstrahira iz tkiva izopropanolom (ili sličnim otapalom). Ekstrahirani MTT formazan može se kvantificirati upotrebom mjerenja standardne apsorbancije (optička gustoća (OD)) ili postupkom HPLC/UPLC spektrofotometrije (36.). Optička gustoća (OD) samog ekstrakcijskog otapala treba biti dovoljno mala, tj. OD < 0,1. Korisnici modela tkiva RhCE trebali bi osigurati da svaka šarža modela tkiva RhCE koji se upotrebljava ispunjava utvrđene kriterije za negativnu kontrolu. Rasponi prihvatljivosti za vrijednosti optičke gustoće negativne kontrole za validirane referentne metode navedeni su u tablici 2. Korisnik HPLC/UPLC spektrofotometrije trebao bi upotrebljavati raspone optičke gustoće negativne kontrole navedene u tablici 2. kao kriterij prihvatljivosti za negativnu kontrolu. U ispitnom izvješću potrebno je dokumentirati da su tkiva tretirana s tvari za negativnu kontrolu stabilna u kulturi (daju slična mjerenja vijabilnosti tkiva) za vrijeme trajanja ispitnog izlaganja. Proizvođač tkiva trebao bi slijediti isti postupak kao dio kontrole kvalitete šarže tkiva, ali u tom se slučaju mogu primjenjivati različiti kriteriji prihvatljivosti od kriterija navedenih u tablici 2. Raspon prihvatljivosti (gornja i donja granica) za vrijednosti optičke gustoće negativne kontrole (u uvjetima ispitne metode za kontrolu kvalitete) treba utvrditi subjekt koji je razvio model tkiva RhCE ili dobavljač tog modela.
|
Tablica 2.
Rasponi prihvatljivosti vrijednosti optičke gustoće negativne kontrole (za korisnike testa)
|
Test
|
Donja granica prihvatljivosti
|
Gornja granica prihvatljivosti
|
|
EIT EpiOcular™ (OCL-200) – VRM1 (za protokole za tekućine i krute tvari)
|
> 0,8 (86)
|
< 2,5
|
|
EIT s HCE-om SkinEthic™ (HCE/S) – VRM2 (za protokole za tekućine i krute tvari)
|
> 1,0
|
≤ 2,5
|
Funkcija barijere
|
27.
|
Model tkiva RhCE treba biti dovoljno debeo i čvrst kako bi onemogućio brzu penetraciju citotoksičnih referentnih tvari, kako je procijenjeno npr. vrijednošću ET50 (Triton X-100) ili IC50 (SDS) (tablica 3.). Subjekt koji je razvio model tkiva RhCE ili njegov prodavatelj trebao bi pri dostavi tkiva krajnjem korisniku dokazati funkciju barijere svake šarže modela tkiva RhCE koji se upotrebljava (vidjeti stavak 30.).
|
Morfologija
|
28.
|
Histološko ispitivanje modela tkiva RhCE trebalo bi pokazivati strukturu epitela koja nalikuje ljudskoj rožnici (uključujući barem tri sloja vijabilnih stanica epitela i nekeratiniziranu površinu). Subjekt koji je razvio model ili dobavljač utvrdio je odgovarajuću morfologiju za validirane referentne metode te je stoga korisnik ispitne metode ne mora ponovno dokazivati za svaku šaržu tkiva.
|
Obnovljivost
|
29.
|
Rezultati pozitivne i negativne kontrole ispitne metode trebaju dokazati obnovljivost tijekom vremena.
|
Kontrola kvalitete (KK)
|
30.
|
Model tkiva RhCE trebao bi se upotrebljavati samo ako subjekt koji ga je razvio ili dobavljač dokaže da svaka šarža upotrijebljenog modela tkiva RhCE ispunjava definirane kriterije za odobrenje proizvoda, među kojima su najvažniji vijabilnost (stavak 26.) i funkcija barijere (vidjeti stavak 27.). Raspon prihvatljivosti (gornje i donje granice) za funkcije barijere, kako se mjeri vrijednošću ET50 ili IC50 (vidjeti stavke 25. i 26.), treba utvrditi subjekt koji je razvio model tkiva RhCE ili njegov dobavljač. Raspon prihvatljivosti vrijednosti ET50 i IC50 koji subjekt koji je razvio modele tkiva RhCE (koji se upotrebljavaju u validiranim referentnim metodama) ili njihov dobavljač upotrebljava kao kriterij za kontrolu kvalitete šarže naveden je u tablici 3. Subjekt koji je razvio model tkiva RhCE ili njegov dobavljač treba korisnicima ispitne metode dostaviti podatke kojima se dokazuje usklađenost sa svim kriterijima za odobrenje proizvoda kako bi korisnici mogli uključiti te informacije u izvješće o ispitivanju. Samo rezultati dobiveni s tkivima koja ispunjavaju sve te kriterije za odobrenje proizvoda mogu se prihvatiti za pouzdano predviđanje kemikalija koje ne treba razvrstati i označiti s obzirom na nadraživanje oka ili tešku ozljedu oka u skladu sa sustavom UN GHS/CLP-om.
|
Tablica 3.
Kriterij za kontrolu kvalitete šarže
|
Test
|
Donja granica prihvatljivosti
|
Gornja granica prihvatljivosti
|
|
EIT EpiOcular™ (OCL-200) – VRM1 (100 μl 0,3-postotnog (v/v) Tritona X-100)
|
ET50 = 12,2 min
|
ET50 = 37,5 min
|
|
EIT s HCE-om SkinEthic™ (HCE/S) – VRM2 (30 minuta tretiranja s 50 μl SDS-a)
|
IC50 = 1 mg/ml
|
IC50 = 3,2 mg/ml
|
Primjena ispitivane kemikalije i kontrolnih tvari
|
31.
|
Za svaku ispitivanu kemikaliju i svaku kontrolnu tvar trebalo bi upotrijebiti najmanje dva ponovljena uzorka tkiva u svakom ciklusu. Upotrebljavaju se dva različita protokola za tretiranje, jedan za tekuće ispitivane kemikalije i jedan za kemikalije u krutom stanju (34. i 35.). Kod obje metode i oba protokola površinu modela tkiva treba navlažiti Dulbeccovom fiziološkom otopinom puferiranom fosfatnim puferom bez kalcija i magnezija (DPBS bez Ca2+/Mg2+) prije primjene ispitivanih kemikalija kako bi se oponašali vlažni uvjeti ljudskog oka. Tretiranje tkiva započinje izlaganjem ispitivanim kemikalijama i kontrolnim tvarima. Kod oba protokola za tretiranje u obje validirane ispitne metode treba primijeniti dovoljnu količinu ispitivane kemikalije ili kontrolne tvari kako bi se ravnomjerno prekrila površina epitela tako da se izbjegne beskonačna doza (vidjeti stavke 32. i 33.) (Dodatak 2.).
|
|
32.
|
Ispitivane kemikalije koje se mogu pipetirati pri temperaturi od 37 °C ili nižoj (prema potrebi upotrebom pipete koja radi na načelu pozitivnog istisnog volumena) tretiraju se kao tekućine u validiranim referentnim metodama, a u suprotnom bi se trebale tretirati kao kemikalije u krutom stanju (vidjeti stavak 33.). U validiranim referentnim metodama tekuće ispitivane kemikalije ravnomjerno se nanose na površinu tkiva (tj. primjenjuje se najmanje 60 μl/cm2) (vidjeti Dodatak 2., 33. i 34.). Kapilarnost (učinak površinske napetosti) do koje može doći zbog malih volumena koji se primjenjuju na umetak (na površinu tkiva) treba izbjegavati u mjeri u kojoj je to moguće kako bi se zajamčilo točno doziranje tkiva. Tkiva tretirana tekućim ispitivanim kemikalijama inkubiraju se 30 minuta u standardnim uvjetima kulture (37 ± 2 °C, 5 ± 1 % CO2, relativna vlažnost ≥ 95 %). Na kraju razdoblja izlaganja tekuću ispitivanu kemikaliju i kontrolne tvari treba pažljivo ukloniti s površine tkiva obilnim ispiranjem DPBS-om bez Ca2+/Mg2+ na sobnoj temperaturi. Nakon tog koraka ispiranja slijedi uranjanje u svježi medij na sobnoj temperaturi nakon izlaganja (kako bi se uklonila ispitivana kemikalija koju je tkivo apsorbiralo) u unaprijed utvrđenom razdoblju koje ovisi o upotrijebljenoj validiranoj referentnoj metodi. Samo u slučaju metode VRM1 prije provedbe MTT testa primjenjuje se inkubacija nakon izlaganja u svježem mediju u standardnim uvjetima kulture (vidjeti Dodatak 2., 34. i 35.).
|
|
33.
|
Ispitivane kemikalije koje se ne mogu pipetirati pri temperaturama do 37 °C u validiranim referentnim metodama tretiraju se kao krute tvari. Količina ispitivane kemikalije koja se primjenjuje treba biti dovoljna kako bi se prekrila cijela površina tkiva, tj. treba primijeniti najmanje 60 mg/cm2 (Dodatak 2.). Kad god je to moguće, kemikalije u krutom stanju treba ispitivati u obliku sitnog praha. Tkiva tretirana ispitivanim kemikalijama u krutom stanju inkubiraju se u unaprijed utvrđenom razdoblju (ovisno o upotrijebljenoj validiranoj referentnoj metodi) u standardnim uvjetima kulture (vidjeti Dodatak 2., 34. i 35.). Na kraju razdoblja izlaganja ispitivanu kemikaliju u krutom stanju i kontrolne tvari treba pažljivo ukloniti s površine tkiva obilnim ispiranjem DPBS-om bez Ca2+/Mg2+ na sobnoj temperaturi. Nakon tog koraka ispiranja, a prije provedbe MTT testa, nakon izlaganja slijedi uranjanje u svježi medij na sobnoj temperaturi (kako bi se uklonila ispitivana kemikalija koju je tkivo apsorbiralo) u unaprijed utvrđenom razdoblju, koje ovisi o upotrijebljenoj validiranoj referentnoj metodi, te inkubacija u svježem mediju nakon izlaganja u standardnim uvjetima kulture (vidjeti Dodatak 2., 34. i 35.).
|
|
34.
|
U svaki ciklus treba uključiti istodobne negativne i pozitivne kontrole kako bi se dokazalo da su vijabilnost (utvrđena negativnom kontrolom) i osjetljivost (utvrđena pozitivnom kontrolom) tkiva u okviru raspona prihvatljivosti koji su utvrđeni na temelju prijašnjih podataka. Istodobna negativna kontrola pruža i osnovicu (100-postotna vijabilnost) za izračun postotka relativne vijabilnosti tkiva tretiranih ispitivanom kemikalijom (%vijabilnosttest). Kao tvar za pozitivnu kontrolu za upotrebu s validiranim referentnim metodama preporučuje se čisti metil-acetat (CAS br. 79-20-9, komercijalno dostupan kod npr. društva Sigma-Aldrich, Cat# 45997; tekućina). Kao tvari za negativnu kontrolu za upotrebu s metodama VRM1 i VRM2 preporučuju se ultračisti H2O i DPBS bez Ca2+/Mg2+. Te su se kontrolne tvari upotrebljavale u validacijskim studijama validiranih referentnih metoda i za njih postoji najviše prijašnjih podataka. Upotrebu primjerenih alternativnih tvari za pozitivnu i negativnu kontrolu treba znanstveno i primjereno obrazložiti. Negativne i pozitivne kontrole treba ispitati primjenom istih protokola kao što su oni koji su upotrijebljeni za ispitivane kemikalije uključene u ciklus (tj. za tekućine i/ili kemikalije u krutom stanju). Nakon te primjene slijedi tretiranje izlaganjem, ispiranje, uranjanje nakon izlaganja i inkubacija nakon izlaganja, ako je primjenjivo, kako je opisano za kontrole koje se provode istodobno s tekućim ispitivanim kemikalijama (vidjeti stavak 32.) ili za kontrole koje se provode istodobno s ispitivanim kemikalijama u krutom stanju (vidjeti stavak 33.), prije provedbe MTT testa (vidjeti stavak 35. i literaturu pod 34. i 35.). Jedan skup negativnih i pozitivnih kontrola dovoljan je za sve ispitivane kemikalije u istom agregatnom stanju (tekućine ili kemikalije u krutom stanju) uključene u isti ciklus.
|
Mjerenja vijabilnosti tkiva
|
35.
|
MTT test standardizirana je kvantitativna metoda (16.) koja bi se trebala upotrebljavati za mjerenje vijabilnosti tkiva u okviru ove ispitne metode. Taj je test prikladan za trodimenzionalni model tkiva. MTT test provodi se neposredno nakon razdoblja inkubacije nakon izlaganja. Kod validiranih referentnih metoda uzorak modela tkiva RhCE stavlja se u 0,3 ml otopine MTT-a koncentracije 1 mg/ml na 180 ± 15 min u standardnim uvjetima kulture. Vijabilne stanice modela tkiva RhCE reduciraju vitalnu boju MTT u talog plavog MTT formazana. Nataloženi proizvod plavog MTT formazana zatim se ekstrahira iz tkiva upotrebom primjerenog volumena izopropanola (ili sličnog otapala) (34. i 35.). Tkiva koja se ispituju tekućim ispitivanim kemikalijama treba ekstrahirati i iz gornjeg i donjeg dijela tkiva, dok tkiva koja se ispituju kemikalijama u krutom stanju i obojenim tekućinama treba ekstrahirati samo iz donjeg dijela tkiva (kako bi se smanjila potencijalna kontaminacija ekstrakcijske otopine izopropanola ispitivanom kemikalijom koja je možda ostala u tkivu). Tkiva koja se ispituju tekućim ispitivanim kemikalijama koje nije jednostavno isprati isto se mogu ekstrahirati samo iz donjeg dijela tkiva. Tvari za negativnu i pozitivnu kontrolu koje se ispituju istodobno treba tretirati slično kao i ispitivane kemikalije. Ekstrahirani MTT formazan može se kvantificirati mjerenjem standardne apsorbancije (OD) na 570 nm upotrebom pojasa propuštanja do najviše ±30 nm ili upotrebom postupka HPLC/UPLC spektrofotometrije (vidjeti stavak 42. i literaturu pod 11. i 36.).
|
|
36.
|
Optička svojstva ispitivanih kemikalija ili njihovo kemijsko djelovanje na MTT može utjecati na mjerenje MTT formazana, što dovodi do pogrešne procjene vijabilnosti tkiva. Ispitivane kemikalije mogu utjecati na mjerenje MTT formazana izravnom redukcijom MTT-a u plavi MTT formazan i/ili interferencijom s bojom ako ispitivana kemikalija apsorbira, prirodno ili zbog postupaka obrade, u istom rasponu optičke gustoće kao i MTT formazan (tj. približno 570 nm). Prije ispitivanja treba provesti prethodne provjere kako bi se omogućilo utvrđivanje potencijalnih tvari koje izravno reduciraju MTT i/ili kemikalija koje interferiraju s bojom te se trebaju upotrijebiti dodatne kontrole za otkrivanje i ispravljanje moguće interferencije tih ispitivanih kemikalija (vidjeti stavke od 37. do 41.). To je osobito važno kada se određena ispitivana kemikalija ne ispere u potpunosti s modela tkiva RhCE ili prodre u epitel koji nalikuje rožnici te je stoga prisutna u modelima tkiva RhCE pri provođenju MTT testa. Za ispitivane kemikalije koje apsorbiraju svjetlost u istom rasponu kao i MTT formazan (prirodno ili nakon tretiranja), koje nisu kompatibilne s mjerenjem standardne apsorbancije (OD) MTT formazana zbog prejake interferencije, tj. jake apsorbancije na 570 ± 30 nm, za mjerenje MTT formazana može se upotrijebiti postupak HPLC/UPLC spektrofotometrije (vidjeti stavke 41. i 42.) (11. i 36.). Podroban opis načina na koji se otkrivaju i ispravljaju izravna redukcija MTT-a i interferencije s bojilima dostupan je u standardnim operativnim postupcima za validirane referentne metode (34. i 35.). Ilustrativni dijagrami toka koji daju smjernice o tome kako utvrditi kemikalije koje izravno reduciraju MTT i/ili kemikalije koje interferiraju s bojom te kako postupati s njima u okviru VRM1 i VRM2 navedeni su u dodacima III. i IV.
|
|
37.
|
Kako bi se utvrdila potencijalna interferencija ispitivanih kemikalija koje apsorbiraju svjetlost u istom rasponu kao i MTT formazan (prirodno ili nakon tretiranja) i odlučilo jesu li potrebne dodatne kontrole, ispitivana kemikalija dodaje se vodi i/ili izopropanolu te se inkubira na odgovarajuće vrijeme na sobnoj temperaturi (vidjeti Dodatak 2. te literaturu pod 34. i 35.). Ako ispitivana kemikalija u vodi i/ili izopropanolu apsorbira dovoljno svjetlosti u rasponu od 570 ± 20 nm za VRM1 (vidjeti Dodatak 3.) ili ako se miješanjem ispitivane kemikalije s vodom za VRM2 dobije obojena otopina (vidjeti Dodatak 4.), pretpostavlja se da ispitivana kemikalija utječe na mjerenje standardne apsorbancije (OD) MTT formazana i treba provesti daljnje kontrole bojila ili treba upotrijebiti postupak HPLC/UPLC spektrofotometrije, u kojem slučaju te kontrole nisu potrebne (vidjeti stavke 41. i 42., dodatke III. i IV. te literaturu pod 34. i 35.). Pri provedbi mjerenja standardne apsorbancije (OD), svaku interferirajuću ispitivanu kemikaliju treba primijeniti na najmanje dva ponovljena uzorka vijabilnog tkiva, koji se podvrgavaju cijelom postupku ispitivanja, ali se u koraku inkubacije MTT-a inkubiraju s medijem, a ne s otopinom MTT-a, kako bi se provela kontrola nespecifične boje u živim tkivima (NSCliving) (34. i 35.). Kontrolu NSCliving treba obavljati istodobno uz ispitivanje obojene ispitivane kemikalije, a u slučaju više ispitivanja sa svakim provedenim ispitivanjem (u svakom ciklusu) treba provesti neovisnu kontrolu NSCliving zbog svojstvene biološke varijabilnosti živih tkiva. Prava vijabilnost tkiva računa se kao: postotak vijabilnosti tkiva koji se dobiva iz živih tkiva izloženih interferirajućoj ispitivanoj kemikaliji i inkubiranih otopinom MTT-a (%Vijabilnosttest), umanjeno za postotak nespecifične boje dobiven sa živim tkivima izloženima interferirajućoj ispitivanoj kemikaliji i inkubiranima s medijem bez MTT-a, koji se provodi istodobno kao i test koji se ispravlja (%NSCliving), tj. prava vijabilnost tkiva = [%Vijabilnosttest] – [%NSCliving].
|
|
38.
|
Kako bi se identificirale tvari koje izravno reduciraju MTT, svaku bi ispitivanu kemikaliju trebalo dodati u svježe pripremljenu otopinu MTT-a. Primjerena količina ispitivane kemikalije dodaje se otopini MTT-a i smjesa se inkubira približno tri sata u standardnim uvjetima kulture (vidjeti dodatke III. i IV.) (34. i 35.). Ako smjesa MTT-a koja sadržava ispitivanu kemikaliju (ili suspenziju za netopljive ispitivane kemikalije) postane plava/ljubičasta, pretpostavlja se da ispitivana kemikalija izravno reducira MTT i treba se provesti daljnja funkcionalna provjera nevijabilnih modela tkiva RhCE, neovisno o upotrebi mjerenja standardne apsorbancije (OD) ili postupka HPLC/UPLC spektrofotometrije. U toj dodatnoj funkcionalnoj provjeri upotrebljavaju se mrtva tkiva kod kojih je prisutna samo preostala metabolička aktivnost, ali koja apsorbiraju i zadržavaju ispitivanu kemikaliju na sličan način kao i vijabilna tkiva. Mrtva tkiva za metodu VRM1 pripremaju se izlaganjem niskoj temperaturi („usmrćivanje zamrzavanjem”). Mrtva tkiva za metodu VRM2 pripremaju se produljenom inkubacijom (npr. najmanje 24 ± 1 h) u vodi, nakon čega slijedi skladištenje na niskoj temperaturi („usmrćivanje vodom”). Svaka ispitivana kemikalija koja reducira MTT primjenjuje se na najmanje dva ponovljena uzorka mrtvog tkiva koji se podvrgavaju cijelom postupku ispitivanja kako bi se provela kontrola nespecifične redukcije MTT-a (NSMTT) (34. i 35.). Dovoljna je jedna kontrola NSMTT po ispitivanoj kemikaliji neovisno o broju provedenih neovisnih ispitivanja/ciklusa. Prava vijabilnost tkiva računa se kao: postotak vijabilnosti tkiva dobiven sa živim tkivima izloženima tvari koja reducira MTT (%Vijabilnosttest), umanjen za postotak nespecifične redukcije MTT-a dobiven s mrtvim tkivima izloženima istoj tvari koja reducira MTT, izračunano u odnosu na negativnu kontrolu koja se provodi istodobno kao i test koji se ispravlja (%NSMTT), tj. prava vijabilnost tkiva = [%Vijabilnosttest] – [%NSMTT].
|
|
39.
|
Za ispitivane kemikalije za koje se utvrdi da interferiraju s bojom (vidjeti stavak 37.) i izravno reduciraju MTT (vidjeti stavak 38.) bit će potreban i treći skup kontrola pri mjerenju standardne apsorbancije (OD) osim kontrola NSMTT i NSCliving opisanih u prethodnim stavcima. To je obično slučaj kod tamno obojenih ispitivanih kemikalija koje apsorbiraju svjetlost u rasponu od 570 ± 30 nm (npr. plave, ljubičaste ili crne kemikalije) jer njihova intrinzična boja sprečava procjenu njihove sposobnosti da izravno reduciraju MTT, kako je opisano u stavku 38. Zbog toga je automatski obvezna upotreba kontrola NSMTT, zajedno s kontrolama NSCliving. I živa i mrtva tkiva mogu apsorbirati i zadržati ispitivane kemikalije za koje se provode i kontrola NSMTT i kontrola NSCliving. Stoga se u tom slučaju kontrolom NSMTT može ispraviti ne samo potencijalna izravna redukcija MTT-a ispitivanom kemikalijom, već i interferencija s bojom koja je posljedica apsorpcije i zadržavanja ispitivane kemikalije u mrtvim tkivima. To bi moglo dovesti do dvostrukog ispravka za interferenciju s bojom jer se kontrolom NSCliving već ispravlja interferencija s bojom koja je posljedica apsorpcije i zadržavanja ispitivane kemikalije u živim tkivima. Kako bi se izbjegao mogući dvostruki ispravak za interferenciju s bojom, treba provesti treću kontrolu za nespecifičnu boju u mrtvim tkivima (NSCkilled) (vidjeti dodatke III. i IV. te literaturu pod 34. i 35.). U toj dodatnoj kontroli ispitivana kemikalija primjenjuje se na najmanje dva ponovljena uzorka mrtvog tkiva, koja se podvrgavaju cijelom postupku ispitivanja, ali se u koraku inkubacije MTT-a inkubiraju s medijem, a ne s otopinom MTT-a. Dovoljna je jedna kontrola NSCkilled po ispitivanoj kemikaliji neovisno o broju provedenih neovisnih ispitivanja/ciklusa, ali treba je provoditi istodobno s kontrolom NSMTT i s istom šaržom tkiva. Prava vijabilnost tkiva računa se kao: postotak vijabilnosti tkiva dobiven sa živim tkivima izloženima ispitivanoj kemikaliji (%Vijabilnosttest), umanjeno za %NSMTT i %NSCliving te uvećano za postotak nespecifične boje dobiven s mrtvim tkivima izloženima interferirajućoj ispitivanoj kemikaliji i inkubiranima s medijem bez MTT-a, izračunano u odnosu na negativnu kontrolu koja se provodi istodobno kao i test koji se ispravlja (%NSCkilled), tj. prava vijabilnost tkiva = [%Vijabilnosttest] – [%NSMTT] – [%NSCliving] + [%NSCkilled].
|
|
40.
|
Važno je napomenuti da nespecifična redukcija MTT-a i interferencije s nespecifičnim bojama mogu povećati optičku gustoću (kod mjerenja standardne apsorbancije) ekstrakta tkiva iznad raspona linearnosti spektrofotometra i da nespecifična redukcija MTT-a može povećati i površinu pika MTT formazana (kod mjerenja HPLC/UPLC spektrofotometrijom) ekstrakta tkiva iznad raspona linearnosti spektrofotometra. Na temelju toga važno je da svaki laboratorij prije početka ispitivanja ispitivanih kemikalija u regulatorne svrhe utvrdi raspon linearnosti optičke gustoće/površine pika svojeg spektrofotometra, npr. s MTT formazanom (CAS # 57360-69-7), komercijalno dostupnim kod npr. društva Sigma-Aldrich (Cat# M2003).
|
|
41.
|
Mjerenje standardne apsorbancije spektrofotometrom primjereno je za procjenu kemikalija koje izravno reduciraju MTT i ispitivanih kemikalija koje interferiraju s bojom ako je uočena interferencija kod mjerenja MTT formazana prevelika (tj. vrijednosti optičke gustoće ekstrakata tkiva dobivenih s ispitivanom kemikalijom bez ispravaka za izravnu redukciju MTT-a i/ili interferencija s bojom unutar su linearnog raspona spektrofotometra). Ipak, rezultate za ispitivane kemikalije koji daju %NSMTT i/ili %NSCliving ≥ 60 % (VRM1 i VRM2 za protokol za tekućine) ili 50 % (VRM2 za protokol za kemikalije u krutom stanju) negativne kontrole trebalo bi oprezno tumačiti jer je to utvrđena granična vrijednost koja se u validiranim referentnim metodama upotrebljava za razlikovanje razvrstanih i nerazvrstanih kemikalija (vidjeti stavak 44.). Međutim, standardna apsorbancija ne može se mjeriti kada je interferencija s mjerenjem MTT formazana prejaka (tj. kada dovodi do neispravljenih vrijednosti optičke gustoće ispitivanih ekstrakata tkiva izvan linearnog raspona spektrofotometra). Obojene ispitivane kemikalije ili ispitivane kemikalije koje se oboje u dodiru s vodom ili izopropanolom koje prejako interferiraju s mjerenjem standardne apsorbancije (OD) MTT formazana mogu se procijeniti primjenom HPLC/UPLC spektrofotometrije (vidjeti dodatke III. i IV.). Razlog je tome što sustav HPLC/UPLC omogućuje izdvajanje MTT formazana iz kemikalije prije njegove kvantifikacije (36.). Zato pri upotrebi HPLC/UPLC spektrofotometrije nikada nisu potrebne kontrole NSCliving i NSCkilled, neovisno o kemikaliji koja se ispituje. Kontrole NSMTT ipak treba upotrijebiti ako se sumnja u to da ispitivana kemikalija izravno reducira MTT (nakon postupka opisanog u stavku 38.). Kontrole NSMTT treba upotrijebiti i s ispitivanim kemikalijama koje imaju boju (intrinzičnu ili koja se javlja u vodi) koja sprečava procjenu njihove sposobnosti da izravno reduciraju MTT, kako je opisano u stavku 38. Ako se za mjerenje MTT formazana upotrebljava HPLC/UPLC spektrofotometrija, postotak vijabilnosti tkiva računa se kao postotak površine pika MTT formazana dobiven sa živim tkivima izloženima ispitivanoj kemikaliji u odnosu na pik MTT formazana dobiven s istodobnom negativnom kontrolom. Za ispitivane kemikalije koje mogu izravno reducirati MTT prava vijabilnost tkiva računa se kao: %Vijabilnosttest
umanjeno za %NSMTT, kako je opisano u posljednjoj rečenici stavka 38. Naposljetku, treba napomenuti da se ispitnim metodama RhCE ne mogu procijeniti kemikalije koje izravno reduciraju MTT ili kemikalije koje izravno reduciraju MTT koje ujedno mogu interferirati s bojom, koje se zadržavaju u tkivima nakon tretiranja i reduciraju MTT toliko jako da dovode do optičke gustoće (upotrebom standardnog mjerenja optičke gustoće) ili površina pika (upotrebom UPLC/HPLC spektrofotometrije) ispitivanih ekstrakata tkiva koje su izvan raspona linearnosti spektrofotometra, iako se očekuje da će se one javljati samo u iznimno rijetkim slučajevima.
|
|
42.
|
HPLC/UPLC spektrofotometrija može se upotrebljavati sa svim vrstama ispitivanih kemikalija (obojenima i neobojenima, koje reduciraju MTT i koje ga ne reduciraju) za mjerenje MTT formazana (11. i 36.). Zbog raznolikosti sustava HPLC/UPLC spektrofotometrije nije izvedivo da svaki korisnik uspostavi identične uvjete sustava. Stoga bi kvalifikaciju sustava HPLC/UPLC spektrofotometrije trebalo dokazati prije njegove upotrebe za kvantificiranje MTT formazana iz ekstrakata tkiva tako da sustav ispuni kriterije prihvatljivosti za skup standardnih parametara kvalifikacije u skladu s parametrima opisanima u smjernicama američke Uprave za hranu i lijekove o validaciji bioanalitičkih metoda namijenjenih industriji (36. i 38.). Ti ključni parametri i njihovi kriteriji prihvatljivosti prikazani su u Dodatku 5. Kada se ispune kriteriji prihvatljivosti definirani u Dodatku 5., smatra se da je sustav HPLC/UPLC spektrofotometrije kvalificiran i spreman za mjerenje MTT formazana u pokusnim uvjetima opisanima u ovoj ispitnoj metodi.
|
Kriteriji prihvatljivosti
|
43.
|
Za svaki ciklus u kojem se upotrebljavaju šarže tkiva RhCE koje ispunjavaju kontrolu kvalitete (vidjeti stavak 30.), tkiva tretirana s tvari za negativnu kontrolu trebala bi imati optičku gustoću koja odražava kvalitetu tkiva za koja su poštovani koraci dopreme i preuzimanja te svi postupci protokola i koja ne bi smjela biti izvan prethodno utvrđenih granica opisanih u tablici 2. (vidjeti stavak 26.). Slično tome, tkiva tretirana s tvari za pozitivnu kontrolu, tj. metilacetatom, trebaju pokazivati srednju vijabilnost tkiva < 50 % u odnosu na negativnu kontrolu u metodi VRM1 s protokolom za tekućine ili kemikalije u krutom stanju i ≤ 30 % (protokol za tekućine) ili ≤ 20 % (protokol za kemikalije u krutom stanju) u odnosu na negativnu kontrolu u metodi VRM2, što odražava sposobnost tkiva da odgovore na nadražujuću ispitivanu kemikaliju u uvjetima ispitivane metode (34. i 35.). Varijabilnost između ponovljenih uzoraka tkiva s ispitivanim kemikalijama i kontrolnim tvarima trebala bi biti unutar prihvaćenih granica (tj. razlika u vijabilnosti između dva ponovljena uzorka tkiva trebala bi biti manja od 20 % odnosno standardna devijacija u tri ponovljena uzorka tkiva ne bi trebala biti veća od 18 %). Ako je negativna ili pozitivna kontrola uključena u ciklus izvan prihvaćenih raspona, smatra se da ciklus ne ispunjava zahtjeve i treba ga ponoviti. Ako je varijabilnost između ponovljenih uzorka tkiva s ispitivanom kemikalijom izvan prihvaćenog raspona, mora se smatrati da test ne ispunjava zahtjeve i ispitivanu kemikaliju treba ponovno ispitati.
|
Tumačenje rezultata i model predviđanja
|
44.
|
Vrijednosti optičke gustoće/površine pika dobivene s ponovljenim ekstraktima tkiva za svaku ispitivanu kemikaliju treba upotrebljavati za izračun srednjeg postotka vijabilnosti tkiva (srednja vrijednost među ponovljenim uzorcima tkiva) normaliziranog u odnosu na negativnu kontrolu, koja je određena kao 100 %. Granična vrijednost postotka vijabilnosti tkiva za utvrđivanje ispitivanih kemikalija koje ne treba razvrstati s obzirom na nadraživanje oka ili tešku ozljedu oka (bez kategorije prema sustavu UN GHS i CLP-u) navedena je u tablici 4. Rezultate stoga treba tumačiti na sljedeći način:
|
—
|
utvrđuje se da ispitivanu kemikaliju ne treba razvrstati i označiti u skladu sa sustavom UN GHS i CLP-om (bez kategorije) ako je srednji postotak vijabilnosti tkiva nakon izlaganja i inkubacije nakon izlaganja veći od (>) utvrđene granične vrijednosti postotka vijabilnosti tkiva, kako je prikazano u tablici 4. U tom slučaju nije potrebno daljnje ispitivanje drugim ispitnim metodama,
|
|
—
|
ako je srednji postotak vijabilnosti tkiva nakon izlaganja te inkubacije nakon izlaganja manji od ili jednak (≤) utvrđenoj graničnoj vrijednosti postotka vijabilnosti tkiva, predviđanje nije moguće, kako je prikazano u tablici 4. U tom će slučaju biti potrebno daljnje ispitivanje s drugim ispitnim metodama jer ispitne metode RhCE pokazuju određeni broj lažno pozitivnih rezultata (vidjeti stavke 14. i 15.) i ne razlikuju kategorije 1. i 2. prema sustavu UN GHS i CLP-u (vidjeti stavak 17.).
|
Tablica 4.
Modeli predviđanja u skladu s razvrstavanjem prema sustavu UN GHS i CLP-u
|
VRM
|
Bez kategorije
|
Predviđanje nije moguće
|
|
VRM 1 – EIT EpiOcular™ (za oba protokola)
|
Srednja vijabilnost tkiva > 60 %
|
Srednja vijabilnost tkiva ≤ 60 %
|
|
VRM 2 – EIT s HCE-om SkinEthic™ (za protokol za tekućine)
|
Srednja vijabilnost tkiva > 60 %
|
Srednja vijabilnost tkiva ≤ 60 %
|
|
VRM2 – EIT s HCE-om SkinEthic™ (za protokol za kemikalije u krutom stanju)
|
Srednja vijabilnost tkiva > 50 %
|
Srednja vijabilnost tkiva ≤ 50 %
|
|
|
45.
|
Jedan test koji obuhvaća najmanje dva ponovljena uzorka tkiva trebao bi biti dovoljan za ispitivanu kemikaliju ako je rezultat nedvosmislen. Međutim, u slučajevima graničnih rezultata, kao što su neusklađena ponovljena mjerenja i/ili srednji postotak vijabilnosti tkiva od 60 ± 5 % (VRM1 i VRM2 za protokol za tekućine) ili 50 ± 5 % (VRM2 za protokol za kemikalije u krutom stanju), trebalo bi razmotriti drugi test, a i treći test u slučaju neusklađenih rezultata između prva dva testa.
|
|
46.
|
Za specifične vrste smjesa mogu se razmotriti različite granične vrijednosti postotaka vijabilnosti tkiva prema kojima se razvrstane ispitivane kemikalije razlikuju od nerazvrstanih, ako je primjereno i obrazloženo, kako bi se povećala ukupna uspješnost ispitne metode za te vrste smjesa (vidjeti stavak 14.). Referentne kemikalije mogu biti korisne za procjenu potencijala nepoznate ispitivane kemikalije ili razreda proizvoda da uzrokuju tešku ozljedu oka/nadraživanje oka ili za procjenu relativne potencijalne okularne toksičnosti razvrstane kemikalije unutar specifičnog raspona pozitivnih odgovora.
|
PODACI I IZVJEŠĆIVANJE
Podaci
|
47.
|
Podatke iz pojedinačnih ponovljenih tkiva u ciklusu (npr. podaci o vrijednosti optičke gustoće/površini pika MTT formazana i izračunanom postotku vijabilnosti tkiva za ispitivanu kemikaliju i kontrole te konačno predviđanje na temelju ispitne metode RhCE) treba navesti u obliku tablice za svaku ispitivanu kemikaliju, prema potrebi uključujući i podatke iz ponovljenih testova. Osim toga, treba navesti i srednji postotak vijabilnosti tkiva i razliku vijabilnosti između dva ponovljena uzorka tkiva (ako je n = 2 ponovljena uzorka tkiva) ili standardnu devijaciju (ako je n ≥ 3 ponovljena uzorka tkiva) za svaku pojedinačnu ispitivanu kemikaliju i kontrolu. Za svaku ispitanu kemikaliju treba navesti svaku uočenu interferenciju s mjerenjem MTT formazana koje ispitivana kemikalija uzrokuje izravnom redukcijom MTT-a i/ili interferencijom s bojom.
|
Izvješće o ispitivanju
|
48.
|
Izvješće o ispitivanju trebalo bi sadržavati sljedeće informacije.
Ispitivana kemikalija
|
|
Tvar s jednim sastojkom:
|
—
|
kemijske identifikacijske oznake, kao što su IUPAC ili CAS naziv(i), CAS registracijski broj(evi), SMILES ili InChI oznaka, strukturna formula i/ili druge identifikacijske oznake,
|
|
—
|
agregatno stanje, hlapljivost, pH-vrijednost, LogP, molekularna masa, kemijski razred i dodatna relevantna fizikalno-kemijska svojstva relevantna za provedbu studije, u mjeri u kojoj su podaci dostupni,
|
|
—
|
čistoća, kemijski identitet nečistoća prema potrebi i ako je izvedivo u praksi itd.,
|
|
—
|
obrada prije ispitivanja, prema potrebi (npr. zagrijavanje, usitnjavanje),
|
|
—
|
uvjeti skladištenja i stabilnost, u mjeri u kojoj su podaci dostupni.
|
|
|
|
Tvar s više sastojaka, UVCB tvar i smjesa:
|
—
|
opisane koliko god je to moguće npr. kemijskim identitetom (vidjeti gore), čistoćom, količinskom zastupljenošću i relevantnim fizikalno-kemijskim svojstvima sastojaka (vidjeti gore), u mjeri u kojoj su podaci dostupni,
|
|
—
|
agregatno stanje i dodatna relevantna fizikalno-kemijska svojstva relevantna za provedbu studije, u mjeri u kojoj su podaci dostupni,
|
|
—
|
čistoća, kemijski identitet nečistoća prema potrebi i ako je izvedivo u praksi itd.,
|
|
—
|
obrada prije ispitivanja, prema potrebi (npr. zagrijavanje, usitnjavanje),
|
|
—
|
uvjeti skladištenja i stabilnost, u mjeri u kojoj su podaci dostupni.
|
|
Tvari za pozitivnu i negativnu kontrolu
|
—
|
kemijske identifikacijske oznake, kao što su IUPAC ili CAS naziv(i), CAS registracijski broj(evi), SMILES ili InChI oznaka, strukturna formula i/ili druge identifikacijske oznake,
|
|
—
|
agregatno stanje, hlapljivost, molekularna masa, kemijski razred i dodatna relevantna fizikalno-kemijska svojstva relevantna za provedbu studije, u mjeri u kojoj su podaci dostupni,
|
|
—
|
čistoća, kemijski identitet nečistoća prema potrebi i ako je izvedivo u praksi itd.,
|
|
—
|
obrada prije ispitivanja, prema potrebi (npr. zagrijavanje, usitnjavanje),
|
|
—
|
uvjeti skladištenja i stabilnost, u mjeri u kojoj su podaci dostupni,
|
|
—
|
ako je primjenjivo, obrazloženje upotrebe negativne kontrole koja nije ultračisti H2O ili DPBS bez Ca2+/Mg2+,
|
|
—
|
ako je primjenjivo, obrazloženje upotrebe pozitivne kontrole koja nije čisti metil-acetat,
|
|
—
|
upućivanje na rezultate koji se odnose na prijašnje pozitivne i negativne kontrole i pokazuju primjerenost kriterija prihvatljivosti ciklusa.
|
Informacije o naručitelju i ustanovi koja provodi ispitivanje:
|
—
|
naziv i adresa naručitelja, ustanove koja provodi ispitivanje i voditelja istraživanja.
|
|
—
|
Upotrijebljeni model tkiva RhCE i protokol (uz obrazloženje odabira ako je primjenjivo)
|
Uvjeti primjene ispitne metode:
|
—
|
upotrijebljeni model tkiva RhCE, uključujući broj šarže,
|
|
—
|
valna duljina i pojas propuštanja (ako je primjenjivo) koji se upotrebljavaju za kvantifikaciju MTT formazana te raspon linearnosti mjernog uređaja (npr. spektrofotometra),
|
|
—
|
opis metode koja se upotrebljava za kvantifikaciju MTT formazana,
|
|
—
|
opis upotrijebljenog sustava HPLC/UPLC spektrofotometrije, ako je primjenjivo,
|
|
—
|
potpune popratne informacije o konkretnom modelu tkiva RhCE koji je korišten, uključujući njegove radne značajke. To bi, među ostalim, trebalo uključivati:
|
i.
|
kontrolu kvalitete vijabilnosti (dobavljač);
|
|
ii.
|
vijabilnost u uvjetima primjene ispitne metode (korisnik);
|
|
iii.
|
kontrolu kvalitete funkcije barijere;
|
|
iv.
|
morfologiju ako je dostupna;
|
|
v.
|
obnovljivost i prediktivnu sposobnost;
|
|
vi.
|
druge kontrole kvalitete (KK) modela tkiva RhCE ako su dostupne,
|
|
|
—
|
upućivanje na prijašnje podatke za model tkiva RhCE. To bi, među ostalim, trebalo uključivati: prihvatljivost podataka o kontroli kvalitete s upućivanjem na prijašnje podatke o šarži,
|
|
—
|
izjava o tome da je ustanova koja provodi ispitivanje dokazala osposobljenost za upotrebu ispitne metode prije rutinske upotrebe ispitivanjem kemikalija koje služe za dokazivanje osposobljenosti.
|
Kriteriji prihvatljivosti ciklusa i ispitivanja:
|
—
|
srednje vrijednosti i rasponi prihvatljivosti pozitivnih i negativnih kontrola na temelju prijašnjih podataka,
|
|
—
|
prihvatljiva varijabilnost između ponovljenih uzoraka tkiva za pozitivne i negativne kontrole,
|
|
—
|
prihvatljiva varijabilnost između ponovljenih uzoraka tkiva za ispitivanu kemikaliju.
|
Ispitni postupak:
|
—
|
pojedinosti o upotrijebljenom ispitnom postupku,
|
|
—
|
doze upotrijebljenih ispitivanih kemikalija i kontrolnih tvari,
|
|
—
|
trajanja i temperature izlaganja, uranjanja nakon izlaganja i inkubacije nakon izlaganja (ako je primjenjivo),
|
|
—
|
opis svih izmjena ispitnog postupka,
|
|
—
|
oznake kontrola koje se koriste za tvari koje neposredno reduciraju MTT i/ili ispitivane kemikalije za bojenje, ako je primjenjivo,
|
|
—
|
broj ponovljenih uzoraka tkiva upotrijebljenih po ispitivanoj kemikaliji i kontrolama (pozitivna kontrola, negativna kontrola i NSMTT, NSCliving i NSCkilled, ako je primjenjivo).
|
Rezultati
|
—
|
tablični prikaz podataka za pojedinačne ispitivane kemikalije i kontrolne tvari za svaki ciklus (uključujući ponovljene pokuse ako je primjenjivo) i svako ponovljeno mjerenje, uključujući vrijednost optičke gustoće ili površinu pika MTT formazana, postotak vijabilnosti tkiva, srednji postotak vijabilnosti tkiva, razlike između ponovljenih uzoraka tkiva ili standardne devijacije te konačno predviđanje,
|
|
—
|
ako je primjenjivo, rezultati kontrola upotrijebljenih za kemikalije koje neposredno reduciraju MTT i/ili obojenih ispitivanih kemikalija, uključujući vrijednost optičke gustoće ili površinu pika MTT formazana, %NSMTT, %NSCliving, %NSCkilled, razliku između ponovljenih uzoraka tkiva ili standardnu devijaciju, konačni točni postotak vijabilnosti tkiva i konačno predviđanje,
|
|
—
|
rezultati dobiveni s ispitivanim kemikalijama i kontrolnim tvarima u odnosu na utvrđene kriterije prihvatljivosti za ciklus i ispitivanje,
|
|
—
|
opis drugih uočenih učinaka, npr. ako obojena ispitivana kemikalija oboji tkiva.
|
Rasprava o rezultatima
Zaključak
|
LITERATURA
|
1.
|
UN (2015). United Nations Globally Harmonized System of Classification and Labelling of Chemicals (GHS). ST/SG/AC.10/30/Rev.6, Sixth Revised Edition, New York i Ženeva. United Nations. Dostupno na: http://www.unece.org/fileadmin/DAM/trans/danger/publi/ghs/ghs_rev06/English/ST-SG-AC10-30-Rev6e.pdf.
|
|
2.
|
Poglavlje B.5. ovog Priloga, Akutno nadraživanje/nagrizanje oka.
|
|
3.
|
Poglavlje B.47. ovog Priloga, Metoda ispitivanja zamućenja i propusnosti goveđe rožnice za utvrđivanje i. kemikalija koje izazivaju tešku ozljedu oka i ii. kemikalija koje nije potrebno razvrstati s obzirom na nadraživanje oka ili tešku ozljedu oka.
|
|
4.
|
Poglavlje B.48. ovog Priloga, Metoda ispitivanja na izoliranom pilećem oku za utvrđivanje i. kemikalija koje izazivaju tešku ozljedu oka i ii. kemikalija koje nije potrebno razvrstati s obzirom na nadraživanje oka ili tešku ozljedu oka.
|
|
5.
|
Poglavlje B.61. ovog Priloga, Metoda ispitivanja propuštanja fluoresceina za identifikaciju tvari nagrizajućih i jako nadražujućih za oči.
|
|
6.
|
Poglavlje B.68. ovog Priloga, In vitro ispitna metoda s kratkim vremenom izlaganja za utvrđivanje: i. kemikalija koje induciraju tešku ozljedu oka i ii. kemikalija koje nije potrebno razvrstati s obzirom na nadraživanje oka ili tešku ozljedu oka.
|
|
7.
|
Freeman, S.J., Alépée N., Barroso, J., Cole, T., Compagnoni, A., Rubingh, C., Eskes, C., Lammers, J., McNamee, P., Pfannenbecker, U., Zuang, V. (2010). Prospective Validation Study of Reconstructed Human Tissue Models for Eye Irritation Testing. ALTEX 27, Special Issue 2010,261.–266.
|
|
8.
|
EC EURL ECVAM (2014). The EURL ECVAM - Cosmetics Europe prospective validation study of Reconstructed human Cornea-like Epithelium (RhCE)-based test methods for identifying chemicals not requiring classification and labelling for serious eye damage/eye irritation: Validation Study Report. EUR 28125 EN; doi:10.2787/41680. Dostupno na: http://publications.jrc.ec.europa.eu/repository/handle/JRC100280.
|
|
9.
|
EURL ECVAM Science Advisory Committee (2014). ESAC Opinion on the EURL ECVAM Eye Irritation Validation Study (EIVS) on EpiOcular™ EIT and SkinEthic™ HCE and a related Cosmetics Europe study on HPLC/UPLC-spectrophotometry as an alternative endpoint detection system for MTT-formazan. ESAC Opinion No 2014-03 od 17. studenoga 2014.; EUR 28173 EN; doi: 10.2787/043697. Dostupno na: http://publications.jrc.ec.europa.eu/repository/handle/JRC103702.
|
|
10.
|
Alépée, N., Leblanc, V., Adriaens, E., Grandidier, M.H., Lelièvre, D, Meloni, M., Nardelli, L., Roper, C.S, Santirocco, E., Toner, F., Van Rompay, A., Vinall, J., Cotovio, J. (2016). Multi-laboratory validation of SkinEthic HCE test method for testing serious eye damage/eye irritation using liquid chemicals. Toxicol. In Vitro 31, 43.–53.
|
|
11.
|
Alépée, N., Adriaens, E., Grandidier, M.H., Meloni, M., Nardelli, L., Vinall, C.J., Toner, F., Roper, C.S, Van Rompay, A.R., Leblanc, V., Cotovio, J. (2016). Multi-laboratory evaluation of SkinEthic HCE test method for testing serious eye damage/eye irritation using solid chemicals and overall performance of the test method with regard to solid and liquid chemicals testing. Toxicol. In Vitro 34, 55.–70.
|
|
12.
|
EURL ECVAM Science Advisory Committee (2016). ESAC Opinion on the SkinEthic™ Human Corneal Epithelium (HCE) Eye Irritation Test (EIT). ESAC Opinion No 2016-02 od 24. lipnja 2016.; EUR 28175 EN; doi: 10.2787/390390. Dostupno na: http://publications.jrc.ec.europa.eu/repository/handle/JRC103704.
|
|
13.
|
EC EURL ECVAM (2016). Recommendation on the Use of the Reconstructed human Cornea-like Epithelium (RhCE) Test Methods for Identifying Chemicals not Requiring Classification and Labelling for Serious Eye Damage/Eye Irritation According to UN GHS. (Rukopis u pripremi).
|
|
14.
|
Draize, J.H., Woodard, G., Calvery, H.O. (1944). Methods for the Study of Irritation and Toxicity of Substances Applied Topically to the Skin and Mucous Membranes. Journal of Pharmacol. and Exp. Therapeutics 82, 377.–390.
|
|
15.
|
Scott, L., Eskes, C., Hoffmann, S., Adriaens, E., Alépée, N., Bufo, M., Clothier, R., Facchini, D., Faller, C., Guest, R., Harbell, J., Hartung, T., Kamp, H., Le Varlet, B., Meloni, M., McNamee, P., Osborne, R., Pape, W., Pfannenbecker, U., Prinsen, M., Seaman, C., Spielman, H., Stokes, W., Trouba, K., Van den Berghe, C., Van Goethem, F., Vassallo, M., Vinardell, P., Zuang, V. (2010). A Proposed Eye Irritation Testing Strategy to Reduce and Replace In Vivo Studies Using Bottom-Up and Top-Down Approaches. Toxicol. In Vitro 24, 1.–9.
|
|
16.
|
Mosmann, T. (1983). Rapid Colorimetric Assay for Cellular Growth and Survival: Application to Proliferation and Cytotoxicity Assays. J. Immunol. Methods 65, 55.–63.
|
|
17.
|
OECD (2016). Series on Testing and Assessment No 216: Performance Standards for the Assessment of Proposed Similar or Modified In Vitro Reconstructed Human Cornea-Like Epithelium (RhCE) Test Methods for Identifying Chemicals not Requiring Classification and Labelling for Eye Irritation or Serious Eye Damage, Based on the Validated Reference Methods EpiOcular™ EIT and SkinEthic™ HCE EIT described in TG 492. Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
18.
|
OECD (2005). Series on Testing and Assessment No 34: Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment. Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
19.
|
Kaluzhny, Y., Kandárová, H., Hayden, P., Kubilus, J., d’Argembeau-Thornton, L., Klausner, M. (2011). Development of the EpiOcular™ Eye Irritation Test for Hazard Identification and Labelling of Eye Irritating Chemicals in Response to the Requirements of the EU Cosmetics Directive and REACH Legislation. Altern. Lab. Anim. 39, 339.–364.
|
|
20.
|
Nguyen, D.H., Beuerman, R.W., De Wever, B., Rosdy, M. (2003). Three-dimensional construct of the human corneal epithelium for in vitro toxicology. U: Salem, H., Katz, S.A. (Eds), Alternative Toxicological Methods, CRC Press, str. 147.–159.
|
|
21.
|
Pfannenbecker, U., Bessou-Touya, S., Faller, C., Harbell, J., Jacob, T., Raabe, H., Tailhardat, M., Alépée, N., De Smedt, A., De Wever, B., Jones, P., Kaluzhny, Y., Le Varlet, B., McNamee, P., Marrec-Fairley, M., Van Goethem, F. (2013). Cosmetics Europe multi-laboratory pre-validation of the EpiOcular™ reconstituted Human Tissue Test Method for the Prediction of Eye Irritation. Toxicol. In Vitro 27, 619.–626.
|
|
22.
|
Alépée, N., Bessou-Touya, S., Cotovio, J., de Smedt, A., de Wever, B., Faller, C., Jones, P., Le Varlet, B., Marrec-Fairley, M., Pfannenbecker, U., Tailhardat, M., van Goethem, F., McNamee, P. (2013). Cosmetics Europe Multi-Laboratory Pre-Validation of the SkinEthic™ Reconstituted Human Corneal Epithelium Test Method for the Prediction of Eye Irritation. Toxicol. In Vitro 27, 1476.–1488.
|
|
23.
|
Kolle, S.N., Moreno, M.C.R., Mayer, W., van Cott, A., van Ravenzwaay, B., Landsiedel, R. (2015). The EpiOcular™ Eye Irritation Test is the Method of Choice for In Vitro Eye Irritation Testing of Agrochemical Formulations: Correlation Analysis of EpiOcular™ Eye Irritation Test and BCOP Test Data to UN GHS, US EPA and Brazil ANIVSA Classifications. Altern. Lab. Anim. 43, 1.–18.
|
|
24.
|
Adriaens, E., Barroso, J., Eskes, C., Hoffmann, S., McNamee, P., Alépée, N., Bessou-Touya, S., De Smedt, A., De Wever, B., Pfannenbecker, U., Tailhardat, M., Zuang, V. (2014). Retrospective Analysis of the Draize Test for Serious Eye Damage/Eye Irritation: Importance of Understanding the In Vivo Endpoints Under UN GHS/EU CLP for the Development and Evaluation of In Vitro Test Methods. Arch. Toxicol. 88, 701.–723.
|
|
25.
|
Barroso, J., Pfannenbecker, U., Adriaens, E., Alépée, N., Cluzel, M., De Smedt, A., Hibatallah, J., Klaric, M., Mewes, K.R., Millet, M., Templier, M., McNamee, P. (2017). Cosmetics Europe compilation of historical serious eye damage/eye irritation in vivo data analysed by drivers of classification to support the selection of chemicals for development and evaluation of alternative methods/strategies: the Draize eye test Reference Database (DRD). Arch. Toxicol. 91, 521.–547.
|
|
26.
|
Meloni, M., De Servi, B., Marasco, D., Del Prete, S. (2011). Molecular mechanism of ocular surface damage: Application to an in vitro dry eye model on human corneal epithelium. Molecular Vision 17, 113.–126.
|
|
27.
|
Hackett, R.B., McDonald, T.O. (1991). Eye Irritation. U: Advances in Modern Toxicology: Dermatoxicology Marzulli F.N.and Maibach H.I. (Eds.), 4th Edition, str. 749.–815. Washington, DC, SAD: Hemisphere Publishing Corporation.
|
|
28.
|
Fox, D.A., Boyes, W.K. (2008). Toxic Responses of the Ocular and Visual System. In Cassaret and Doull’s Toxicology: The Basic Science of Poisons Klaassen C.D.(Ed.), 7th Edition, str. 665.–697. Withby, ON, Canada: McGraw-Hill Ryerson.
|
|
29.
|
Jester, J.V., Li, H.F., Petroll, W.M., Parker, R.D., Cavanagh, H.D., Carr, G.J., Smith, B., Maurer, J.K. (1998). Area and Depth of Surfactant Induced Corneal Injury Correlates with Cell Death. Invest. Ophthalmol. Vis. Sci. 39, 922.–936.
|
|
30.
|
Maurer, J.K., Parker, R.D., Jester, J.V. (2002). Extent of Corneal Injury as the Mechanistic Basis for Ocular Irritation: Key Findings and Recommendations for the Development of Alternative Assays. Reg. Tox. Pharmacol. 36, 106.–117.
|
|
31.
|
Jester, J.V., Li, L., Molai, A., Maurer, J.K. (2001). Extent of Corneal Injury as a Mechanistic Basis for Alternative Eye Irritation Tests. Toxicol. In Vitro 15, 115.–130.
|
|
32.
|
Jester, J.V., Petroll, W.M., Bean, J., Parker, R.D., Carr, G.J., Cavanagh, H.D., Maurer, J.K. (1998). Area and Depth of Surfactant-Induced Corneal Injury Predicts Extent of Subsequent Ocular Responses. Invest. Ophthalmol. Vis. Sci. 39, 2610.–2625.
|
|
33.
|
Jester, J.V. (2006). Extent of Corneal Injury as a Biomarker for Hazard Assessment and the Development of Alternative Models to the Draize Rabbit Eye Test. Cutan. Ocul. Toxicol. 25, 41.–54.
|
|
34.
|
EpiOcular™ EIT SOP, Version 8 (March 05, 2013). EpiOcular™ EIT for the Prediction of Acute Ocular Irritation of Chemicals. Dostupno na: [https://ecvam-dbalm.jrc.ec.europa.eu/beta/index.cfm/methodsAndProtocols/index].
|
|
35.
|
SkinEthic™ HCE EIT SOP, Version 1. (July 20, 2015). SkinEthic™ HCE Eye Irritation Test (EITL for Liquids, EITS for Solids) for the Prediction of Acute Ocular Irritation of Chemicals. Dostupno na: https://ecvam-dbalm.jrc.ec.europa.eu/beta/index.cfm/methodsAndProtocols/index.
|
|
36.
|
Alépée, N., Barroso, J., De Smedt, A., De Wever, B., Hibatallah, J., Klaric, M., Mewes, K.R., Millet, M., Pfannenbecker, U., Tailhardat, M., Templier, M., McNamee, P. (2015). Use of HPLC/UPLC-Spectrophotometry for Detection of Formazan in In Vitro Reconstructed Human Tissue (RhT)-Based Test Methods Employing the MTT-Reduction Assay to Expand their Applicability to Strongly Coloured Test Chemicals. Toxicol. In Vitro 29, 741.–761.
|
|
37.
|
Kaluzhny, Y., Kandárová, H., Handa, Y., DeLuca, J., Truong, T., Hunter, A., Kearney, P., d’Argembeau-Thornton, L., Klausner, M. (2015). EpiOcular™ Eye Irritation Test (EIT) for Hazard Identification and Labeling of Eye Irritating Chemicals: Protocol Optimization for Solid Materials and Extended Shipment Times. Altern. Lab Anim. 43, 101.–127.
|
|
38.
|
US FDA (2001). Guidance for Industry: Bioanalytical Method Validation. U.S. Department of Health and Human Services, Food and Drug Administration. Svibanj 2001. Dostupno na: http://www.fda.gov/downloads/Drugs/Guidances/ucm070107.pdf.
|
|
39.
|
OECD (2017). Guidance Document on an Integrated Approaches on Testing and Assessment for Serious Eye Damage and Eye irritation. Series on Testing and Assessment No 263. ENV Publications, Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
Dodatak 1.
DEFINICIJE
Točnost
: stupanj podudarnosti između rezultata ispitne metode i prihvaćenih referentnih vrijednosti. Ona je mjerilo učinkovitosti ispitne metode i jedan od aspekata „relevantnosti”. Pojam je često međusobno zamjenjiv s pojmom „podudarnost” u smislu udjela točnih ishoda ispitne metode (18.).
Referentna kemikalija
: kemikalija koja se primjenjuje kao standard za usporedbu s ispitivanom kemikalijom. Referentna kemikalija trebala bi imati sljedeća svojstva: i. dosljedne i pouzdane izvore za njezinu identifikaciju i karakterizaciju; ii. strukturnu, funkcionalnu i/ili kemijsku sličnost ili razred proizvoda sličan kemikalijama koje se ispituju; iii. poznata fizikalno-kemijska svojstva; iv. podatke kojima se dokazuju poznati učinci; i v. poznatu jakost u rasponu željenog odgovora.
Pristup odozdo prema gore
: stupnjeviti pristup koji se primjenjuje za ispitivanu kemikaliju u pogledu koje postoji sumnja da joj nije potrebno razvrstavanje i označivanje s obzirom na nadraživanje oka ili tešku ozljedu oka, a koji počinje utvrđivanjem kemikalija za koje nije potrebno razvrstavanje i označivanje (negativan ishod) u odnosu na druge kemikalije (pozitivan ishod).
Kemikalija
: tvar ili smjesa.
Podudarnost
: vidjeti „Točnost”.
Rožnica
: transparentni dio prednje strane očne jabučice kojim su prekrivene šarenica i zjenica i koji propušta svjetlost u unutrašnjost oka.
CV
: koeficijent varijacije.
Dev.
: odstupanje.
EIT
: test nadraživanja oka.
EURL ECVAM
: referentni laboratorij Europske unije za alternative ispitivanju na životinjama.
Nadraživanje oka
: promjene na oku nastale kao rezultat primjene ispitivane kemikalije na prednju površinu oka, koje su potpuno reverzibilne u roku od 21 dana nakon primjene. Pojam je međusobno zamjenjiv s pojmovima „reverzibilni učinci na oko” i „kategorija 2. sustava UN GHS/CLP-a”.
ET50
: vrijeme izlaganja potrebno za smanjenje vijabilnosti tkiva za 50 % nakon primjene referentne kemikalije u određenoj, fiksnoj koncentraciji.
Udio lažno negativnih rezultata
: udio svih pozitivnih tvari koje su ispitnom metodom pogrešno identificirane kao negativne. Jedan je od pokazatelja uspješnosti ispitne metode.
Stopa lažno pozitivnih rezultata
: udio svih negativnih tvari koje su ispitnom metodom pogrešno identificirane kao pozitivne. Jedan je od pokazatelja uspješnosti ispitne metode.
Opasnost
: inherentno svojstvo nekog agensa ili stanje koje može uzrokovati štetne učinke kada su organizam, sustav ili (sub)populacija izloženi tom agensu.
HCE
: epitel ljudske rožnice SkinEthic™.
HPLC
: tekućinska kromatografija visoke djelotvornosti.
IC50
: koncentracija pri kojoj referentna kemikalija smanjuje vijabilnost tkiva za 50 % nakon fiksnog vremena izlaganja (npr. 30 minuta tretiranja SDS-om).
Beskonačna doza
: količina ispitivane kemikalije primijenjena na model tkiva RhCE koja je veća od količine potrebne da bi se potpuno i ravnomjerno pokrila površina epitela.
Ireverzibilni učinci na oko
: vidjeti „tešku ozljedu oka”.
LLOQ
: donja granica kvantifikacije.
LogP
: logaritam podjelnog koeficijenta oktanol-voda.
Smjesa
: smjesa ili otopina koja se sastoji od dviju ili više tvari.
Tvar s jednim sastojkom
: tvar, definirana količinskim sastavom, u kojoj je jedan glavni sastojak prisutan u koncentraciji od najmanje 80 % (w/w).
Tvar s više sastojaka
: tvar, definirana količinskim sastavom, u kojoj je više od jednog glavnog sastojka prisutno u koncentraciji od 10 % (w/w) ili većoj te manjoj od 80 % (w/w). Tvar s više sastojaka rezultat je procesa proizvodnje. Smjesa i tvar s više sastojaka razlikuju se po tome što se smjesa dobiva miješanjem dviju ili više tvari bez kemijske reakcije. Tvar s više sastojaka rezultat je kemijske reakcije.
MTT
: 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolijev bromid; tiazolil plavo tetrazolijev bromid.
Negativna kontrola
: uzorak koji sadržava sve komponente ispitnog sustava i tretiran je s tvari za koju je poznato da ne inducira pozitivan odgovor u ispitnom sustavu. Taj se uzorak obrađuje s uzorcima tretiranima ispitivanom kemikalijom i drugim kontrolnim uzorcima te se upotrebljava kako bi se utvrdila 100-postotna vijabilnost tkiva.
Nerazvrstano
: kemikalije koje nisu razvrstane s obzirom na nadraživanje oka (kategorija 2. sustava UN GHS/CLP-a, kategorija 2.A ili 2.B sustava UN GHS) ili tešku ozljedu oka (kategorija 1. sustava UN GHS/CLP-a). Pojam je međusobno zamjenjiv s pojmom „bez kategorije prema sustavu UN GHS/CLP-u”.
NSCkilled
: nespecifična boja u mrtvim tkivima.
NSCliving
: nespecifična boja u živim tkivima.
NSMTT
: nespecifična redukcija MTT-a.
OD
: optička gustoća.
Zahtjevi izvedbe
: zahtjevi koji se temelje na validiranoj ispitnoj metodi koja se smatrala znanstveno valjanom i pružaju temelj za ocjenjivanje usporedivosti predložene, funkcionalno i mehanicistički slične, ispitne metode. Oni uključuju: i. ključne elemente ispitne metode; ii. minimalni popis referentnih kemikalija odabranih između kemikalija koje se koriste za dokazivanje prihvatljive učinkovitosti validirane ispitne metode; i iii. slične razine točnosti i pouzdanosti, utemeljene na rezultatima dobivenim za validiranu ispitnu metodu, koje se prilikom ocjenjivanja trebaju dokazati predloženom ispitnom metodom koristeći minimalni popis referentnih kemikalija (18.).
Pozitivna kontrola
: uzorak koji sadržava sve komponente ispitnog sustava i tretiran je s tvari za koju je poznato da inducira pozitivan odgovor u ispitnom sustavu. Taj se uzorak obrađuje s uzorcima tretiranima ispitivanom kemikalijom i drugim kontrolnim uzorcima. Kako bi se osigurala mogućnost procjene varijabilnosti odgovora pozitivne kontrole tijekom vremena, pozitivan odgovor ne bi smio biti presnažan.
Relevantnost
: opis odnosa između ispitivanja i istraživanog učinka te je li ispitivanje prikladno i korisno za određenu svrhu. Pokazuje u kojoj se mjeri ispitivanjem točno mjeri ili predviđa istraživani biološki učinak. Relevantnost uključuje razmatranje o točnosti (podudarnosti) ispitne metode (18.).
Pouzdanost
: pokazuje u kojoj se mjeri ispitna metoda može obnovljivo primijeniti unutar jednog laboratorija i između više laboratorija tijekom vremena uz primjenu istog protokola. Ocjenjuje se izračunavanjem obnovljivosti unutar jednog laboratorija i između više njih te ponovljivosti unutar jednog laboratorija (18.).
Zamjensko ispitivanje
: ispitivanje koje zamjenjuje rutinsko i prihvaćeno ispitivanje za određivanje opasnosti i/ili procjenu rizika, za koje je utvrđeno da osigurava istovjetnu ili bolju zaštitu zdravlja ljudi, zdravlja životinja ili okoliša u odnosu na prihvaćeno ispitivanje u svim mogućim okolnostima ispitivanja i za sve kemikalije (18.).
Obnovljivost
: podudarnost rezultata dobivenih ponovljenim ispitivanjem iste ispitivane kemikalije uz primjenu istog ispitnog protokola (vidjeti „pouzdanost”) (18.).
Reverzibilni učinci na oko
: vidjeti „nadraživanje oka”.
RhCE
: rekonstruirani epitel koji nalikuje ljudskoj rožnici.
Ciklus
: ciklus se sastoji od jedne ispitivane kemikalije ili više njih koje se ispituju istodobno s negativnom i pozitivnom kontrolom.
SD
: standardna devijacija.
Osjetljivost
: udio svih pozitivnih/aktivnih ispitivanih kemikalija koje su pravilno razvrstane primjenom ispitivanja. To je mjera točnosti ispitne metode koja daje kategorijske rezultate i važan je čimbenik za ocjenu relevantnosti ispitne metode (18.).
Teška ozljeda oka
: oštećenje očnog tkiva ili ozbiljno fizičko pogoršanje vida izazvano primjenom ispitivane tvari na prednju površinu oka, koje nije u potpunosti reverzibilno unutar 21 dana od primjene. Pojam je međusobno zamjenjiv s pojmovima „ireverzibilni učinci na oko” i „kategorija 1. sustava UN GHS/CLP-a”.
Standardni operativni postupci (SOP)
: formalni, pisani postupci kojima se podrobno opisuje kako treba provoditi specifične rutinske laboratorijske operacije i operacije specifične za test. Obvezni su na temelju dobre laboratorijske prakse.
Specifičnost
: udio svih negativnih/neaktivnih ispitivanih kemikalija koje su pravilno razvrstane primjenom ispitivanja. To je mjera točnosti ispitne metode koja daje kategorijske rezultate i važan je čimbenik za ocjenu relevantnosti ispitne metode (18.).
Tvar
: kemijski element i njegovi spojevi u prirodnome stanju ili dobiveni proizvodnim postupkom, što uključuje i aditive koji su nužni za održavanje stabilnosti proizvoda te nečistoće koje proizlaze iz primijenjenoga postupka, ali isključuje otapala koja se mogu izdvojiti bez utjecaja na stabilnost tvari ili promjene njezina sastava.
Test
: jedna ispitivana kemikalija koja se istodobno ispituje na najmanje dva ponovljena uzorka tkiva kako je utvrđeno u odgovarajućem SOP-u.
Vijabilnost tkiva
: parametar za mjerenje ukupne aktivnosti populacije stanica u rekonstruiranom tkivu u obliku njihove sposobnosti da reduciraju vitalnu boju MTT, što ovisno o krajnjoj točki koja se mjeri i planu ispitivanja korelira s ukupnim brojem i/ili vitalnošću živih stanica.
Pristup odozgo prema dolje
: stupnjeviti pristup koji se primjenjuje za kemikaliju u pogledu koje postoji sumnja da inducira tešku ozljedu oka, a koji počinje utvrđivanjem kemikalija koje induciraju tešku ozljedu oka (pozitivan ishod) u odnosu na druge kemikalije (negativan ishod).
Ispitivana kemikalija
: svaka tvar ili smjesa koja se ispituje ovom ispitnom metodom.
Strategija višerazinskog ispitivanja
: strategija stupnjevitog ispitivanja u kojoj se ispitne metode upotrebljavaju sekvencijski. Sve postojeće informacije o ispitivanoj kemikaliji preispituju se na svakoj razini, pri čemu se prije prelaska na sljedeću razinu strategije primjenjuje postupak analize snage dokaza kako bi se odredilo je li na raspolaganju dovoljno informacija za donošenje odluke o razvrstavanju tvari s obzirom na opasnost. Ako se na temelju postojećih podataka ispitivanoj kemikaliji može pripisati potencijal/jakost opasnog djelovanja, daljnje ispitivanje nije potrebno (18.).
ULOQ
: gornja granica kvantifikacije.
Globalno usklađeni sustav Ujedinjenih naroda za razvrstavanje i označivanje kemikalija (UN GHS)
: sustav za razvrstavanje kemikalija (tvari i smjesa) prema standardiziranim vrstama i stupnjevima fizičkih opasnosti i opasnosti za zdravlje i okoliš, kojim su obuhvaćena odgovarajuća komunikacijska sredstva kao što su piktogrami, oznake opasnosti, oznake upozorenja, oznake obavijesti i sigurnosno-tehnički listovi, kojima se prenose informacije o njihovim štetnim učincima u cilju zaštite ljudi (uključujući poslodavce, radnike, prijevoznike, potrošače i interventno osoblje) i okoliša (1.).
Kategorija 1. sustava UN GHS/CLP-a
: vidjeti „tešku ozljedu oka”.
Kategorija 2. sustava UN GHS/CLP-a
: vidjeti „nadraživanje oka”.
Bez kategorije prema sustavu UN GHS i CLP-u
: kemikalije koje ne ispunjavaju zahtjeve za razvrstavanje u kategoriju 1. ili 2. sustava UN GHS/CLP-a (ili kategoriju 2.A ili 2.B sustava UN GHS). Pojam je međusobno zamjenjiv s pojmom „nerazvrstano”.
UPLC
: tekućinska kromatografija iznimno visoke djelotvornosti.
UVCB
: tvari nepoznatog ili promjenjivog sastava, složeni reakcijski proizvodi i biološki materijali.
Valjana ispitna metoda
: ispitna metoda za koju se smatra da je dovoljno relevantna i pouzdana za određenu svrhu te koja se temelji na znanstveno utemeljenim načelima. Ispitna metoda nije nikada valjana u apsolutnom smislu nego samo u odnosu na određenu svrhu (18.).
Validirana ispitna metoda
: ispitna metoda za koju su provedena validacijska istraživanja za utvrđivanje relevantnosti (uključujući točnost) i pouzdanosti za specifičnu namjenu. Važno je napomenuti da validirana ispitna metoda možda neće biti u dovoljnoj mjeri uspješna s obzirom na točnost i pouzdanost da bi je se moglo smatrati prihvatljivom za predloženu namjenu (18.).
VRM
: validirana referentna metoda.
VRM1
: test nadraživanja oka EpiOcular™ naziva se validiranom referentnom metodom 1.
VRM2
: test nadraživanja oka s epitelom ljudske rožnice SkinEthic™ naziva se validiranom referentnom metodom 2.
Analiza snage dokaza
: proces razmatranja prednosti i slabosti različitih informacija u donošenju i dokazivanju zaključka o potencijalu opasnosti ispitivane tvari.
Dodatak 2.
GLAVNI ELEMENTI TESTOVA RHCE VALIDIRANIH ZA UTVRĐIVANJE KEMIKALIJA KOJE NIJE POTREBNO RAZVRSTATI I OZNAČITI S OBZIROM NA NADRAŽIVANJE OKA ILI TEŠKU OZLJEDU OKA
|
Elementi testa
|
EIT EpiOcular™
(VRM 1)
|
EIT s HCE-om SkinEthic™
(VRM 2)
|
|
Protokoli
|
Tekućine
(koje se mogu pipetirati na temperaturi od 37 ± 1 °C ili nižoj 15 min)
|
Kemikalije u krutom stanju
(ne mogu se pipetirati)
|
Tekućine i viskozne kemikalije
(mogu se pipetirati)
|
Kemikalije u krutom stanju
(ne mogu se pipetirati)
|
|
Površina modela
|
0,6 cm2
|
0,6 cm2
|
0,5 cm2
|
0,5 cm2
|
|
Broj ponovljenih uzoraka tkiva
|
Najmanje dva
|
Najmanje dva
|
Najmanje dva
|
Najmanje dva
|
|
Prethodna provjera za interferenciju s bojom
|
50 μl + 1 ml H2O 60 min na 37 ± 2 oC, 5 ± 1 % CO2, relativna vlažnost ≥ 95 % (bezbojne ispitivane kemikalije) ili 50 μl + 2 ml izopropanola miješano 2–3 h na sobnoj temp. (obojene ispitivane kemikalije)
|
 ako je OD ispitivane kemikalije pri 570 ± 20 nm, nakon što se oduzme OD za izopropanol ili vodu, > 0,08 (što odgovara približno 5 % srednjeg OD-a negativne kontrole), trebalo bi provesti prilagođene kontrole na živom tkivu
ako je OD ispitivane kemikalije pri 570 ± 20 nm, nakon što se oduzme OD za izopropanol ili vodu, > 0,08 (što odgovara približno 5 % srednjeg OD-a negativne kontrole), trebalo bi provesti prilagođene kontrole na živom tkivu
|
|
50 mg + 1 ml H2O 60 min na 37 ± 2 oC, 5 ± 1 % CO2, relativna vlažnost ≥ 95 %
(bezbojne ispitivane kemikalije) i/ili
50 mg + 2 ml izopropanola miješano 2–3 h na sobnoj temp. (obojene i bezbojne ispitivane kemikalije)
|
 ako je OD ispitivane kemikalije pri 570 ± 20 nm, nakon što se oduzme OD za izopropanol ili vodu, > 0,08 (što odgovara približno 5 % srednjeg OD-a negativne kontrole), trebalo bi provesti prilagođene kontrole na živom tkivu
ako je OD ispitivane kemikalije pri 570 ± 20 nm, nakon što se oduzme OD za izopropanol ili vodu, > 0,08 (što odgovara približno 5 % srednjeg OD-a negativne kontrole), trebalo bi provesti prilagođene kontrole na živom tkivu
|
|
10 μl + 90 μl H2O miješano 30 ± 2 min na sobnoj temperaturi (18–28 oC)
|
 ako je ispitivana kemikalija obojena, trebalo bi provesti prilagođene kontrole na živom tkivu
ako je ispitivana kemikalija obojena, trebalo bi provesti prilagođene kontrole na živom tkivu
|
|
10 mg + 90 μl H2O miješano 30 ± 2 min na sobnoj temperaturi
|
 ako je ispitivana kemikalija obojena, trebalo bi provesti prilagođene kontrole na živom tkivu
ako je ispitivana kemikalija obojena, trebalo bi provesti prilagođene kontrole na živom tkivu
|
|
|
Prethodna provjera izravne redukcije MTT-a
|
otopina 50 μl + 1 ml MTT 1 mg/ml tijekom 180 ± 15 min na 37 ± 2 oC, 5 ± 1 % CO2, relativna vlažnost ≥ 95 %
|
 ako otopina postane plava/ljubičasta, treba provesti prilagođene kontrole usmrćivanjem zamrzavanjem
ako otopina postane plava/ljubičasta, treba provesti prilagođene kontrole usmrćivanjem zamrzavanjem
(kao negativna kontrola upotrebljava se 50 μl sterilne deionizirane vode u otopini MTT-a)
|
|
otopina 50 mg + 1 ml MTT 1 mg/ml tijekom 180 ± 15 min na 37 ± 2 oC, 5 ± 1 % CO2, relativna vlažnost ≥ 95 %
|
 ako otopina postane plava/ljubičasta, treba provesti prilagođene kontrole usmrćivanjem zamrzavanjem
ako otopina postane plava/ljubičasta, treba provesti prilagođene kontrole usmrćivanjem zamrzavanjem
(kao negativna kontrola upotrebljava se 50 μl sterilne deionizirane vode u otopini MTT-a)
|
|
otopina 30 μl + 300 μl MTT 1 mg/ml tijekom 180 ± 15 min na 37 ± 2 oC, 5 ± 1 % CO2, relativna vlažnost ≥ 95 %
|
 ako otopina postane plava/ljubičasta, treba provesti prilagođene kontrole usmrćivanjem vodom
ako otopina postane plava/ljubičasta, treba provesti prilagođene kontrole usmrćivanjem vodom
(kao negativna kontrola upotrebljava se 30 μl sterilne deionizirane vode u otopini MTT-a)
|
|
30 mg + 300 μl MTT otopina 1 mg/ml tijekom 180 ± 15 min na 37 ± 2 oC, 5 ± 1 % CO2, relativna vlažnost ≥ 95 %
|
 ako otopina postane plava/ljubičasta, treba provesti prilagođene kontrole usmrćivanjem vodom
ako otopina postane plava/ljubičasta, treba provesti prilagođene kontrole usmrćivanjem vodom
(kao negativna kontrola upotrebljava se 30 μl sterilne deionizirane vode u otopini MTT-a)
|
|
|
Prethodna obrada
|
20 μl DPBS-a bez Ca2+/Mg2+
tijekom 30 ± 2 min na 37 ± 2 oC, 5 ± 1 % CO2, relativna vlažnost ≥ 95 %, zaštićeno od svjetla
|
20 μl DPBS-a bez Ca2+/Mg2+
tijekom 30 ± 2 min na 37 ± 2 oC, 5 ± 1 % CO2, relativna vlažnost ≥ 95 %, zaštićeno od svjetla
|
–
|
–
|
|
Doze za tretiranje i primjena
|
50 μl (83,3 μl/cm2)
|
50 mg (83,3 mg/cm2) upotrebom kalibriranog alata (npr. žlica kalibrirana tako da sadržava 50 mg natrijeva klorida kada je vrhom puna)
|
10 μl DPBS-a bez Ca2+/Mg2+ + 30 ± 2 μl (60 μl/cm2)
Za viskozne kemikalije upotrijebiti najlonsku mrežu
|
30 μl DPBS-a bez Ca2+/Mg2+ + 30 ± 2 mg (60 mg/cm2)
|
|
Vrijeme i temperatura izloženosti
|
30 min (± 2 min)
u mediju za uzgoj kulture
na 37 ± 2 oC, 5 ± 1 % CO2, relativna vlažnost ≥ 95 %
|
6 sati (± 0,25 sati)
u mediju za uzgoj kulture
na 37 ± 2 oC, 5 ± 1 % CO2, relativna vlažnost ≥ 95 %
|
30 min (± 2 min)
u mediju za uzgoj kulture
na 37 ± 2 oC, 5 ± 1 % CO2, relativna vlažnost ≥ 95 %
|
4 sata (± 0,1 sat)
u mediju za uzgoj kulture
na 37 ± 2 oC, 5 ± 1 % CO2, relativna vlažnost ≥ 95 %
|
|
Ispiranje na sobnoj temperaturi
|
3 puta u 100 ml DPBS-a bez Ca2+/Mg2+
|
3 puta u 100 ml DPBS-a bez Ca2+/Mg2+
|
20 ml DPBS-a bez Ca2+/Mg2+
|
25 ml DPBS-a bez Ca2+/Mg2+
|
|
Uranjanje nakon izlaganja
|
12 min (± 2 min) na sobnoj temp. u mediju za uzgoj kulture
|
25 min (± 2 min) na sobnoj temp. u mediju za uzgoj kulture
|
30 min (± 2 min) na 37 oC, 5 % CO2, relativna vlažnost od 95 % u mediju za uzgoj kulture
|
30 min (± 2 min) na sobnoj temp. u mediju za uzgoj kulture
|
|
Inkubacija nakon izlaganja
|
120 min (± 15 min) u mediju za uzgoj kulture na 37 ± 2 oC, 5 ± 1 % CO2, relativna vlažnost ≥ 95 %
|
18 h (± 0,25 h) u mediju za uzgoj kulture na 37 ± 2 oC, 5 ± 1 % CO2, relativna vlažnost ≥ 95 %
|
nema
|
18 h (± 0,5 h) u mediju za uzgoj kulture na 37 ± 2 oC, 5 ± 1 % CO2, relativna vlažnost ≥ 95 %
|
|
Negativna kontrola
|
50 μl H2O
Ispitano istodobno
|
50 μl H2O
Ispitano istodobno
|
30 ± 2 μl DPBS-a bez Ca2+/Mg2+
Ispitano istodobno
|
30 ± 2 μl DPBS-a bez Ca2+/Mg2+
Ispitano istodobno
|
|
Pozitivna kontrola
|
50 μl metilacetata
Ispitano istodobno
|
50 μl metilacetata
Ispitano istodobno
|
30 ± 2 μl metilacetata
Ispitano istodobno
|
30 ± 2 μl metilacetata
Ispitano istodobno
|
|
Otopina MTT-a
|
300 μl 1 mg/ml
|
300 μl 1 mg/ml
|
300 μl 1 mg/ml
|
300 μl 1 mg/ml
|
|
Vrijeme i temperatura inkubacije MTT-a
|
180 min (± 15 min) na 37 ± 2 oC, 5 ± 1 % CO2, relativna vlažnost ≥ 95 %
|
180 min (± 15 min) na 37 ± 2 oC, 5 ± 1 % CO2, relativna vlažnost ≥ 95 %
|
180 min (± 15 min) na 37 ± 2 oC, 5 ± 1 % CO2, relativna vlažnost ≥ 95 %
|
180 min (± 15 min) na 37 ± 2 oC, 5 ± 1 % CO2, relativna vlažnost ≥ 95 %
|
|
Ekstrakcijsko otapalo
|
2 ml izopropanola
(ekstrakcija s vrha i dna umetka bušenjem tkiva)
|
2 ml izopropanola
(ekstrakcija s dna umetka bušenjem tkiva)
|
1,5 ml izopropanola
(ekstrakcija s vrha i dna umetka)
|
1,5 ml izopropanola
(ekstrakcija s dna umetka)
|
|
Vrijeme i temperatura ekstrakcije
|
2–3 h uz protresanje (~ 120 o/min) na sobnoj temp. ili preko noći na 4–10 °C
|
2–3 h uz protresanje (~ 120 o/min) na sobnoj temp. ili preko noći na 4–10 °C
|
4 h uz protresanje (~ 120 o/min) na sobnoj temp. ili barem preko noći bez protresanja na 4–10 °C
|
Najmanje 2 h uz protresanje (~ 120 o/min) na sobnoj temp.
|
|
Očitavanje optičke gustoće
|
570 nm (550–590 nm)
bez referentnog filtra
|
570 nm (550–590 nm)
bez referentnog filtra
|
570 nm (540–600 nm)
bez referentnog filtra
|
570 nm (540–600 nm)
bez referentnog filtra
|
|
Kontrola kvalitete tkiva
|
Tretiranje sa 100 μl 0,3-postotnog (v/v) Tritona X-100
12,2 min ≤ ET50 ≤ 37,5 min
|
Tretiranje sa 100 μl 0,3-postotnog (v/v) Tritona X-100
12,2 min ≤ ET50 ≤ 37,5 min
|
tretiranje SDS-om 30 min (50 μl)
1,0 mg/ml ≤ IC50 ≤ 3,5 mg/ml
|
tretiranje SDS-om 30 min (50 μl)
1,0 mg/ml ≤ IC50 ≤ 3,2 mg/ml
|
|
Kriteriji prihvatljivosti
|
|
1.
|
Srednja optička gustoća ponovljenih uzoraka tkiva tretiranih negativnom kontrolom trebala bi biti > 0,8 i < 2,5.
|
|
2.
|
Srednja vijabilnost ponovljenih uzoraka tkiva izloženih pozitivnoj kontroli na 30 min, izražena kao postotak negativne kontrole, trebala bi biti < 50 %.
|
|
3.
|
Razlika u vijabilnosti između dva ponovljena uzorka tkiva trebala bi biti manja od 20 %.
|
|
|
1.
|
Srednja optička gustoća ponovljenih uzoraka tkiva tretiranih negativnom kontrolom trebala bi biti > 0,8 i < 2,5.
|
|
2.
|
Srednja vijabilnost ponovljenih uzoraka tkiva izloženih pozitivnoj kontroli na šest sati, izražena kao postotak negativne kontrole, trebala bi biti < 50 %.
|
|
3.
|
Razlika u vijabilnosti između dva ponovljena uzorka tkiva trebala bi biti manja od 20 %.
|
|
|
1.
|
Srednja optička gustoća ponovljenih uzoraka tkiva tretiranih negativnom kontrolom trebala bi biti > 1,0 i ≤ 2,5.
|
|
2.
|
Srednja vijabilnost ponovljenih uzoraka tkiva izloženih pozitivnoj kontroli na 30 min, izražena kao postotak negativne kontrole, trebala bi biti ≤ 30 %.
|
|
3.
|
Razlika u vijabilnosti između dva ponovljena uzorka tkiva trebala bi biti manja od 20 %.
|
|
|
1.
|
Srednja optička gustoća ponovljenih uzoraka tkiva tretiranih negativnom kontrolom trebala bi biti > 1,0 i ≤ 2,5.
|
|
2.
|
Srednja vijabilnost ponovljenih uzoraka tkiva izloženih pozitivnoj kontroli na četiri sata, izražena kao postotak negativne kontrole, trebala bi biti ≤ 20 %.
|
|
3.
|
Razlika u vijabilnosti između dva ponovljena uzorka tkiva trebala bi biti manja od 20 %.
|
|
Dodatak 3.
ILUSTRATIVNI DIJAGRAM TOKA KOJI DAJE SMJERNICE O TOME KAKO UTVRDITI KEMIKALIJE KOJE IZRAVNO REDUCIRAJU MTT I/ILI KEMIKALIJE KOJE INTERFERIRAJU S BOJOM TE KAKO S NJIMA POSTUPATI, NA TEMELJU STANDARDNIH OPERATIVNIH POSTUPAKA ZA VRM1
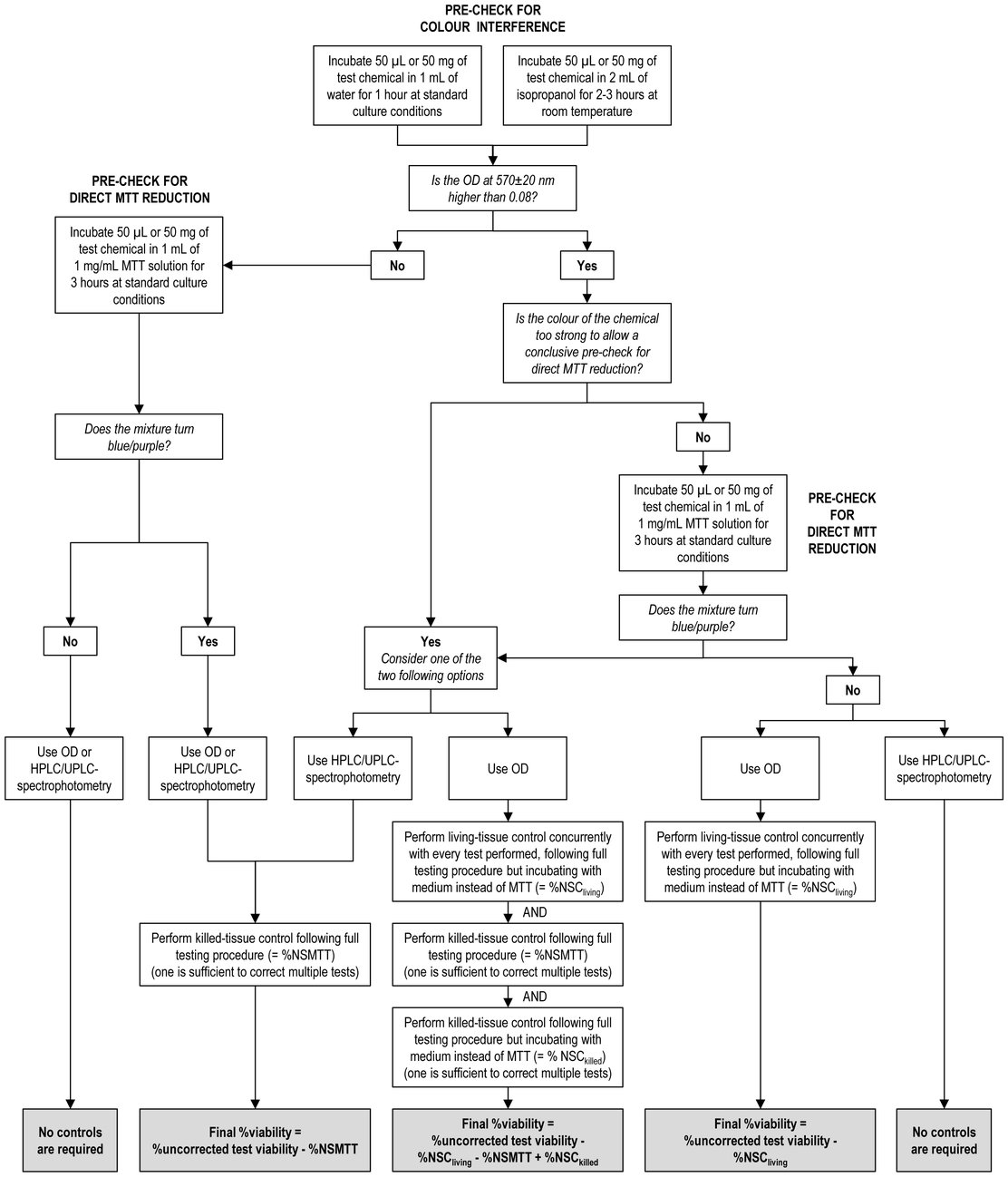
Dodatak 4.
ILUSTRATIVNI DIJAGRAM TOKA KOJI DAJE SMJERNICE O TOME KAKO UTVRDITI KEMIKALIJE KOJE IZRAVNO REDUCIRAJU MTT I/ILI KEMIKALIJE KOJE INTERFERIRAJU S BOJOM TE KAKO S NJIMA POSTUPATI, NA TEMELJU STANDARDNIH OPERATIVNIH POSTUPAKA ZA VRM2

Dodatak 5.
KLJUČNI PARAMETRI I KRITERIJI PRIHVATLJIVOSTI ZA KVALIFIKACIJU SUSTAVA HPLC/UPLC SPEKTROFOTOMETRIJE ZA MJERENJE MTT FORMAZANA EKSTRAHIRANOG IZ MODELA TKIVA RHCE
|
Parametar
|
Protokol izveden iz smjernica Uprave za hranu i lijekove (FDA) (36. i 38.)
|
Kriteriji prihvatljivosti
|
|
Selektivnost
|
Analiza izopropanola, slijepe probe na živom tkivu (ekstrakt izopropanola iz modela živih tkiva RhCE bez ikakve obrade), slijepe probe na mrtvom tkivu (ekstrakt izopropanola iz modela mrtvih tkiva RhCE bez ikakve obrade) i boje (npr. metilensko plavilo)
|
Površinainterference ≤ 20 % površineLLOQ
(87)
|
|
Preciznost
|
Kontrole kvalitete (tj. MTT formazan pri 1,6 μg/ml, 16 μg/ml i 160 μg/ml) u izopropanolu (n = 5)
|
CV ≤ 15 % ili ≤ 20 % za LLOQ
|
|
Točnost
|
Kontrole kvalitete u izopropanolu (n = 5)
|
%Dev ≤ 15 % ili ≤ 20 % za LLOQ
|
|
Učinak matrice
|
Kontrole kvalitete u slijepoj probi na živom tkivu (n = 5)
|
85 % ≤ % učinka matrice ≤ 115 %
|
|
Prijenos
|
Analiza izopropanola nakon standardnog ULOQ (88)
|
Površinainterference ≤ 20 % površineLLOQ
|
|
Obnovljivost (u danu)
|
3 neovisne kalibracijske krivulje (na temelju šest uzastopnih razrjeđivanja 1/3 MTT formazana u izopropanolu, počevši s ULOQ-om, tj. 200 μg/ml)
Kontrole kvalitete u izopropanolu (n = 5)
|
Kalibracijske krivulje: %Dev ≤ 15 % ili ≤ 20 % za LLOQ
Kontrole kvalitete: %Dev ≤ 15 % i CV ≤ 15 %
|
|
Obnovljivost (među danima)
|
Prvi dan: 1 kalibracijska krivulja i kontrole kvalitete u izopropanolu (n = 3)
Drugi dan: 1 kalibracijska krivulja i kontrole kvalitete u izopropanolu (n = 3)
Treći dan: 1 kalibracijska krivulja i kontrole kvalitete u izopropanolu (n = 3)
|
|
Kratkoročna stabilnost MTT formazana u ekstraktu tkiva RhCE
|
Kontrole kvalitete u slijepoj probi na živom tkivu (n = 3) analizirane na dan pripreme i nakon 24 sata skladištenja na sobnoj temperaturi
|
%Dev ≤ 15 %
|
|
Dugoročna stabilnost MTT formazana u ekstraktu tkiva RhCE, ako je potrebno
|
Kontrole kvalitete u slijepoj probi na živom tkivu (n = 3) analizirane na dan pripreme i nakon nekoliko dana skladištenja na –20 °C
|
%Dev ≤ 15 %
|
B.70.
IN VITRO TESTOVI LJUDSKOG REKOMBINANTNOG ESTROGENSKOG RECEPTORA (hrER) ZA OTKRIVANJE KEMIKALIJA S AFINITETOM VEZIVANJA NA ESTROGENSKI RECEPTOR
OPĆI UVOD
OECD-ova smjernica za ispitivanje koja se temelji na uspješnosti
|
1.
|
Ova ispitna metoda odgovara Smjernici OECD-a za ispitivanje 493 (TG) (2015.). Smjernica za ispitivanje 493 jest smjernica za ispitivanje koja se temelji na uspješnosti (PBTG), u kojoj se opisuje metodologija za in vitro testove ljudske rekombinante za otkrivanje tvari s afinitetom vezivanja na estrogenske receptore (testovi vezivanja na hrER). Sastoji se od dva mehanicistički i funkcionalno slična testa za identifikaciju kemikalija koje se vežu na estrogenske receptore (tj. ERα) i trebala bi olakšati razvoj novih sličnih ili izmijenjenih testova u skladu s načelima za validaciju utvrđenima u Vodiču OECD-a o validaciji i međunarodnom prihvaćanju novih ili ažuriranih ispitnih metoda za procjenu opasnosti (1.). Potpuno validirane referentne ispitne metode (Dodatak 2. i Dodatak 3.) koje čine osnovu ove smjernice za ispitivanje koja se temelji na uspješnosti uključuju:
|
—
|
Freyberger-Wilsonov (FW) in vitro test vezivanja na estrogenske receptore (ER) upotrebom cijelog ljudskog rekombinantnog receptora ERα (2.), i
|
|
—
|
in vitro test vezivanja na estrogenski receptor upotrebom ljudskog rekombinantnog proteina domene vezivanja liganda koji je razvio CERI (Institut za procjenu i istraživanje kemikalija) (2.).
|
Dostupni su zahtjevi izvedbe (PS) (3.) za lakši razvoj i validaciju sličnih ispitnih metoda za istu krajnju točku opasnosti te omogućivanje pravovremene izmjene PBTG-a 493 kako bi se novi slični testovi mogli dodati u ažurirani PBTG. Međutim, slični testovi dodat će se samo nakon što ih OECD pregleda i složi se da su ispunjeni zahtjevi izvedbe. Testovi uključeni u Smjernicu za ispitivanje 493 mogu se upotrebljavati neselektivno za ispunjavanje zahtjeva zemalja članica OECD-a u pogledu rezultata ispitivanja vezivanja na estrogenske receptore, uz ostvarivanje koristi od OECD-ova uzajamnog prihvaćanja podataka.
|
Kontekst i načela testova uključenih u ovu ispitnu metodu
|
2.
|
OECD je 1998. pokrenuo aktivnost visokog prioriteta u cilju revizije postojećih i razvoja novih smjernica za ispitivanje za probir i ispitivanje potencijalnih endokrino disruptivnih kemikalija. OECD-ov konceptualni okvir (CF) za ispitivanje i procjenu potencijalnih endokrino disruptivnih kemikalija revidiran je 2012. Izvorni i revidirani konceptualni okvir uključeni su kao prilozi Vodiču o standardiziranim smjernicama za ispitivanje za ocjenu kemikalija u pogledu endokrine disrupcije (4.). Konceptualni okvir sastoji se od pet razina, a svaka razina odgovara različitoj razini biološke složenosti. Testovi vezivanja na estrogenske receptore opisani u ovoj ispitnoj metodi testovi su 2. razine, koja uključuje „in vitro testove koji pružaju podatke o odabranim endokrinim mehanizmima/putovima”. Ova je ispitna metoda namijenjena za in vitro testove vezivanja na receptor osmišljene za identifikaciju liganda na ljudski estrogenski receptor alfa (ERα).
|
|
3.
|
Relevantnost in vitro testa vezivanja na estrogenske receptore za biološke funkcije jasno je dokazana. Testovi vezivanja na estrogenski receptor osmišljeni su za utvrđivanje kemikalija koje potencijalno mogu ometati hormonski put estrogena te su se u posljednja dva desetljeća često upotrebljavali za opisivanje distribucije estrogenskog receptora u tkivu i za utvrđivanje agonista/antagonista estrogenskog receptora. Tim se testovima oponaša interakcija liganda i receptora koja čini početni korak estrogenskog signalnog puta i ključna je za reproduktivnu funkciju svih kralježnjaka.
|
|
4.
|
Interakcija estrogena i estrogenskog receptora može utjecati na transkripciju gena koje kontrolira estrogen i inducirati negenomske učinke, a to može dovesti do indukcije ili inhibicije staničnih procesa, među ostalim i onih koji su potrebni za proliferaciju stanica, uobičajeni fetalni razvoj i reproduktivnu funkciju (5., 6. i 7.). Poremećaj uobičajenih estrogenskih sustava potencijalno može uzrokovati štetne učinke na uobičajeni razvoj (ontogeneza), reproduktivno zdravlje i integritet reproduktivnog sustava. Neispravno signaliziranje estrogenskog receptora može dovesti do učinaka kao što su povećani rizik od karcinoma koji ovise o hormonima, smanjenje plodnosti te promjene fetalnog rasta i razvoja (8.).
|
|
5.
|
In vitro testovi vezivanja temelje se na izravnoj interakciji tvari sa specifičnim mjestom vezivanja liganda na receptor koje regulira transkripciju gena. Ključni element testa vezivanja na ljudski rekombinantni estrogenski receptor alfa (hrERα) mjeri sposobnost radioaktivno obilježenog liganda ([3H]17β-estradiol) da se veže na estrogenski receptor u prisutnosti povećavajućih koncentracija ispitivane kemikalije (tj. konkurenata). Ispitivane kemikalije koje imaju velik afinitet za estrogenski receptor natječu se s radioaktivno obilježenim ligandom pri nižoj koncentraciji u odnosu na kemikalije s manjim afinitetom za taj receptor. Ovaj se test sastoji od dva glavna elementa: pokusa vezivanja do zasićenja kako bi se opisali parametri interakcije receptora i liganda i evidentirala specifičnost estrogenskog receptora, nakon čega slijedi pokus konkurentskog vezivanja u kojem se ispitivana kemikalija i radioaktivno obilježeni ligand natječu u vezivanju na estrogenski receptor.
|
|
6.
|
Validacijske studije CERI-jevog i FW testa vezivanja pokazale su njihovu relevantnost i pouzdanost za predviđenu svrhu (2.).
|
|
7.
|
Definicije i kratice upotrijebljene u ovoj ispitnoj metodi opisuju se u Dodatku 1.
|
Područje primjene testova vezivanja na receptore i ograničenja povezana s njima
|
8.
|
Ovi se testovi predlažu u svrhu probira i utvrđivanja prioriteta, ali u njima se mogu dobiti i informacije za početni molekularni događaj (MIE) koje se mogu upotrijebiti u pristupu snage dokaza. Testovima se ispituje kemijsko vezivanje na domenu vezivanja liganda receptora ERα u in vitro sustavu. Stoga rezultate ne bi trebalo izravno ekstrapolirati na signalizaciju kompleksa i regulaciju netaknutog endokrinog sustava in vivo.
|
|
9.
|
Vezivanje prirodnog liganda, 17β-estradiola, početni je korak u nizu molekularnih događaja koji aktivira transkripciju ciljnih gena i naposljetku kulminira fiziološkom promjenom (9.). Stoga se vezivanje na domenu vezivanja liganda receptora ERα smatra jednim od ključnih mehanizama endokrine disrupcije posredovane estrogenskim receptorom, iako postoje i drugi mehanizmi preko kojih može doći do endokrine disrupcije, uključujući: i. interakcije s mjestima na receptoru ERα koja nisu džep za vezivanje liganda; ii. interakcije s ostalim receptorima relevantnima za signaliziranje estrogena, receptorom ERβ i estrogenskim receptorom spregnutim s G-proteinima, ostalim receptorima i enzimskim sustavima u endokrinom sustavu; iii. sintezu hormona; iv. metaboličku aktivaciju i/ili inaktivaciju hormona; v. distribuciju hormona u ciljna tkiva i vi. uklanjanje hormona iz tijela. Nijedan test u okviru ove ispitne metode ne bavi se tim načinima djelovanja.
|
|
10.
|
Ovom ispitnom metodom ispituje se sposobnost tvari da se vežu na ljudski receptor ERα i njome se ne razlikuju agonisti i antagonisti receptora ERα. Test se ne bavi daljnjim događajima kao što su transkripcija gena ili fiziološke promjene. Budući da su se u validaciji upotrebljavale samo pojedinačne tvari s jednim sastojkom, nije se razmatrala primjenjivost za ispitivanje smjesa. Unatoč tomu, testovi su u teoriji primjenjivi i za ispitivanje tvari s više sastojaka i smjesa. Prije nego što se ova ispitna metoda primijeni na smjesi radi dobivanja podataka za predviđenu regulatornu svrhu, potrebno je razmotriti mogu li se njome dobiti primjereni rezultati za tu svrhu te ako mogu, zašto. Ta razmatranja nisu potrebna ako postoji regulatorni zahtjev za ispitivanje smjese.
|
|
11.
|
Sustavi receptora koji ne sadržavaju stanice nemaju intrinzičnu metaboličku sposobnost i nisu validirani u kombinaciji s metaboličkim enzimskim sustavima. Međutim, metabolička aktivnost možda se može uključiti u plan istraživanja, ali za to bi bila potrebna dodatna validacija.
|
|
12.
|
Kemikalije koje mogu denaturirati protein (tj. protein receptora), kao što su površinski aktivne tvari ili kemikalije koje mogu promijeniti pH-vrijednost testnog pufera, ne mogu se ispitati ili se mogu ispitati samo pri koncentracijama kod kojih nema tih interakcija. Osim toga, raspon koncentracija koji se može ispitati u testovima za ispitivanu kemikaliju ograničen je njezinom topljivošću u testnom puferu.
|
|
13.
|
U informativne svrhe u tablici 1. navedeni su rezultati ispitivanja za 24 tvari koje su ispitane u oba potpuno validirana testa opisana u ovoj ispitnoj metodi. Na temelju objavljenih izvješća, od tih tvari 17 ih je razvrstano kao kemikalije koje se vežu na estrogenski receptor, a šest kao kemikalije koje se ne vežu, uključujući in vitro testove za transkripcijsku aktivaciju estrogenskog receptora i/ili uterotrofni test (9., 10., 11., 12., 13., 14. i 15.). S obzirom na podatke sažete u tablici 1., postojala je gotovo 100-postotna podudarnost između dva testa u vezi s razvrstavanjem svih tvari do 10-4 M i svaka je tvar točno razvrstana kao kemikalija koja se veže ili ne veže na estrogenske receptore. Dodatne informacije o ovoj skupini tvari i o dodatnim tvarima koje su ispitane u testovima vezivanja na estrogenske receptore tijekom validacijskih studija navedene su u zahtjevima izvedbe za test vezivanja na hrER (3.), Dodatak 2. (tablice 1., 2. i 3.).
Tablica 1.
Razvrstavanje tvari kao kemikalija koje se vežu ili ne vežu na estrogenske receptore kada se ispituju u FW i CERI-jevom testu vezivanja na hrER
|
|
Naziv tvari
|
CAS br.
|
Predviđeni odgovor
|
FW test
|
CERI-jev test
|
Kemijski razred prema MESH-u
|
Razred proizvoda
|
|
|
Raspon konc. (M)
|
Razvrstavanje
|
Raspon konc. (M)
|
Razvrstavanje
|
|
1
|
17β-estradiol
|
50-28-2
|
Kemikalija koja se veže
|
1 × 10-11 – 1 × 10-6
|
Kemikalija koja se veže
|
1 × 10-11 – 1 × 10-6
|
Kemikalija koja se veže
|
Steroid
|
Farmaceutski proizvod, veterinarski proizvod
|
|
2
|
Noretinodrel
|
68-23-5
|
Kemikalija koja se veže
|
3 × 10-9 – 30 × 10-4
|
Kemikalija koja se veže
|
3 × 10-9 – 30 × 10-4
|
Kemikalija koja se veže
|
Steroid
|
Farmaceutski proizvod, veterinarski proizvod
|
|
3
|
Noretindron
|
68-22-4
|
Kemikalija koja se veže
|
3 × 10-9 – 30 × 10-4
|
Kemikalija koja se veže
|
3 × 10-9 – 30 × 10-4
|
Kemikalija koja se veže
|
Steroid
|
Farmaceutski proizvod, veterinarski proizvod
|
|
4
|
Di-n-butil-ftalat
|
84-74-2
|
Kemikalija koja se ne veže (*5)
|
1 × 10-10 – 1 × 10-4
|
Kemikalija koja se ne veže (*6)
(1)
|
1 × 10-10 – 1 × 10-4
|
Kemikalija koja se ne veže (*6)
(1)
|
Ugljikovodik (ciklički), ester
|
Plastifikator, kemijski međuproizvod
|
|
5
|
DES
|
56-53-1
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
Ugljikovodik (ciklički), fenol
|
Farmaceutski proizvod, veterinarski proizvod
|
|
6
|
17α-etinilestradiol
|
57-63-6
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
Steroid
|
Farmaceutski proizvod, veterinarski proizvod
|
|
7
|
Mezo-heksestrol
|
84-16-2
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
Ugljikovodik (ciklički), fenol
|
Farmaceutski proizvod, veterinarski proizvod
|
|
8
|
Genistein
|
446-72-0
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
Ugljikovodik (heterocikl.), flavonoid
|
Prirodni proizvod
|
|
9
|
Ekvuol
|
531-95-3
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
Metabolit fitoestrogena
|
Prirodni proizvod
|
|
10
|
Butil paraben (n butil-4-hidroksibenzoat)
|
94-26-8
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
Paraben
|
Konzervans
|
|
11
|
Nonilfenol (smjesa)
|
84852-15-3
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
Alkilfenol
|
Međuspoj
|
|
12
|
o,p’-DDT
|
789-02-6
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
Organoklor
|
Insekticid
|
|
13
|
Kortikosteron
|
50-22-6
|
Kemikalija koja se ne veže (*5)
|
1 × 10-10 – 1 × 10-4
|
Kemikalija koja se ne veže
|
1 × 10-10 – 1 × 10-4
|
Kemikalija koja se ne veže
|
Steroid
|
Prirodni proizvod
|
|
14
|
Zearalenon
|
17924-92-4
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
Ugljikovodik (heterocikl.), lakton
|
Prirodni proizvod
|
|
15
|
Tamoksifen
|
10540-29-1
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
Ugljikovodik (ciklički)
|
Farmaceutski proizvod, veterinarski proizvod
|
|
16
|
5α-dihidrotestosteron
|
521-18-6
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
Steroid, nefenolni
|
Prirodni proizvod
|
|
17
|
Bisfenol A
|
80-05-7
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
Fenol
|
Kemijski međuproizvod
|
|
18
|
4-n-heptilfenol
|
1987-50-4
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Daje dvosmislen odgovor (6)
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
Alkilfenol
|
Međuproizvod
|
|
19
|
Kepon (klordekon)
|
143-50-0
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
Ugljikovodik (halogenirani)
|
Pesticid
|
|
20
|
Benz(a)antracen
|
56-55-3
|
Kemikalija koja se ne veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se ne veže (7)
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se ne veže (7)
|
Aromatični ugljikovodik
|
Međuproizvod
|
|
21
|
Enterolakton
|
78473-71-9
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se veže
|
Fitoestrogen
|
Prirodni proizvod
|
|
22
|
Progesteron
|
57-83-0
|
Kemikalija koja se ne veže (*5)
|
1 × 10-10 – 1 × 10-4
|
Kemikalija koja se ne veže
|
1 × 10-10 – 1 × 10-4
|
Kemikalija koja se ne veže
|
Steroid
|
Prirodni proizvod
|
|
23
|
Oktil-trietoksisilan
|
2943-75-1
|
Kemikalija koja se ne veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se ne veže
|
1 × 10-10 – 1 × 10-3
|
Kemikalija koja se ne veže
|
Silan
|
Modifikator površine
|
|
24
|
Atrazin
|
1912-24-9
|
Kemikalija koja se ne veže (*5)
|
1 × 10-10 – 1 × 10-4
|
Kemikalija koja se ne veže
|
1 × 10-10 – 1 × 10-4
|
Kemikalija koja se ne veže
|
Heterociklički spoj
|
Herbicid
|
|
SASTAVNICE TESTA VEZIVANJA NA hrER
Ključne sastavnice testa
|
14.
|
Ova se ispitna metoda primjenjuje na testove u kojima se upotrebljava estrogenski receptor i primjereno snažan ligand na receptor koji se može upotrijebiti kao marker/obilježivač za test i koji se može istisnuti s povećavajućim koncentracijama ispitivane kemikalije. Testovi vezivanja sadržavaju sljedeće dvije glavne sastavnice: 1. vezivanje do zasićenja i 2. konkurentsko vezivanje. Test vezivanja do zasićenja upotrebljava se za potvrdu specifičnosti i aktivnosti pripreme receptora, dok se pokus konkurentskog vezivanja upotrebljava za procjenu sposobnosti ispitivane kemikalije da se veže na receptor hrER.
|
Kontrole
|
15.
|
Treba opisati osnovu za predloženi istodobni referentni estrogen i kontrole. Istodobne kontrole (otapalo (nosač), pozitivne kontrole (kemikalija koja se veže na estrogenski receptor; snažan i slab afinitet), negativne kontrole (kemikalija koja se ne veže)), prema potrebi, znak su da test djeluje u ispitnim uvjetima i osnova su za usporedbe između pokusa; obično su dio kriterija prihvatljivosti za određeni pokus (1.). Na jednoj ploči tijekom svakog ciklusa treba upotrijebiti cijelu krivulju koncentracija referentnog estrogena i kontrola (tj. kemikalije koja se slabo veže i koja se ne veže). Sve ostale ploče trebaju sadržavati: 1. visoku (približno potpuno istiskivanje radioaktivno obilježenog liganda) i srednju (približno IC50) koncentraciju E2 i kemikalije koja se slabo veže u tri ponavljanja; 2. kontrolu s otapalom i nespecifično vezivanje, svako u tri ponavljanja.
|
Standardni postupci kontrole kvalitete
|
16.
|
Treba provesti standardne postupke kontrole kvalitete kako je opisano za svaki test da bi se osigurala stabilnost aktivnih receptora, točne koncentracije kemikalija i održavanja granica tolerancije kroz više ponavljanja i zadržala sposobnost pružanja očekivanih odgovora vezivanja na estrogenske receptore tijekom vremena.
|
Dokazivanje osposobljenosti laboratorija
|
17.
|
Prije ispitivanja nepoznatih kemikalija primjenom bilo kojeg od testova u okviru ove ispitne metode, svaki laboratorij treba dokazati osposobljenost za primjenu testa provođenjem testova zasićenja kako bi se potvrdile specifičnost i aktivnost pripravka estrogenskog receptora te testova konkurentskog vezivanja s referentnim estrogenom i kontrolama (kemikalije koje se slabo vežu i koje se ne vežu). Laboratorij treba uspostaviti bazu prijašnjih podataka s rezultatima za referentni estrogen i kontrole nastale u 3–5 neovisnih pokusa provedenih na različite dane. Ti će pokusi biti osnova za referentni estrogen i prijašnje kontrole za laboratorij te će se upotrebljavati kao djelomična ocjena prihvatljivosti testa za buduće cikluse.
|
|
18.
|
Osjetljivost ispitnog sustava potvrdit će se i ispitivanjem tvari za dokazivanje osposobljenosti navedenih u tablici 2. Popis tvari za dokazivanje osposobljenosti podskup je referentnih tvari koje su navedene u zahtjevima izvedbe za testove vezivanja na estrogenske receptore (3.). Te su tvari komercijalno dostupne, čine razrede kemikalija koji se obično povezuju s aktivnošću vezivanja na estrogenski receptor, pokazuju primjeren raspon jakosti koji se očekuje za kemikalije koje se vežu (tj. slabe do jake) i koje se ne vežu na estrogenski receptor (tj. negativne). Ispitane koncentracije svake tvari za dokazivanje osposobljenosti trebaju obuhvaćati raspon naveden u tablici 2. Za svaku tvar treba provesti najmanje tri pokusa i rezultati trebaju biti u skladu s očekivanom aktivnošću kemikalije. Svaki pokus treba provesti neovisno (tj. sa svježim razrjeđivanjima receptora, kemikalija i reagensa), s tri ponavljanja za svaku koncentraciju. Osposobljenost se dokazuje točnim razvrstavanjem (pozitivno/negativno) svake tvari za dokazivanje osposobljenosti. Pri učenju testova svaki tehničar treba provesti ispitivanje osposobljenosti.
Tablica 2.
Popis kontrola i tvari za dokazivanje osposobljenosti za testove konkurentskog vezivanja na hrER
(89)
|
Br.
|
Naziv tvari
|
CAS br. (90)
|
Predviđeni odgovor (91)
(92)
|
Raspon ispitne koncentracije (M)
|
Kemijski razred prema MeSH-u (93)
|
Razred proizvoda (94)
|
|
Kontrole (referentni estrogen, kemikalija koja se slabo veže, kemikalija koja se ne veže)
|
|
1
|
17β-estradiol
|
50-28-2
|
Kemikalija koja se veže
|
1 × 10-11 – 1 × 10-6
|
Steroid
|
Farmaceutski proizvod, veterinarski proizvod
|
|
2
|
Noretinodrel (ili) noretindron
|
68-23-5 (ili) 68-22-4
|
Kemikalija koja se veže
|
3 × 10-9 – 30 × 10-6
|
Steroid
|
Farmaceutski proizvod, veterinarski proizvod
|
|
3
|
Oktil-trietoksisilan
|
2943-75-1
|
Kemikalija koja se ne veže
|
1 × 10-10 – 1 × 10-3
|
Silan
|
Modifikator površine
|
|
Tvari za dokazivanje osposobljenosti (94)
|
|
4
|
Dietilstilbestrol
|
56-53-1
|
Kemikalija koja se veže
|
1 × 10-11 – 1 × 10-6
|
Ugljikovodik (ciklički), fenol
|
Farmaceutski proizvod, veterinarski proizvod
|
|
5
|
17α-etinilestradiol
|
57-63-6
|
Kemikalija koja se veže
|
1 × 10-11 – 1 × 10-6
|
Steroid
|
Farmaceutski proizvod, veterinarski proizvod
|
|
6
|
Mezo-heksestrol
|
84-16-2
|
Kemikalija koja se veže
|
1 × 10-11 – 1 × 10-6
|
Ugljikovodik (ciklički), fenol
|
Farmaceutski proizvod, veterinarski proizvod
|
|
7
|
Tamoksifen
|
10540-29-1
|
Kemikalija koja se veže
|
1 × 10-11 – 1 × 10-6
|
Ugljikovodik (ciklički)
|
Farmaceutski proizvod, veterinarski proizvod
|
|
8
|
Genistein
|
446-72-0
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Heterociklički spoj, flavonoid
|
Prirodni proizvod
|
|
9
|
Bisfenol A
|
80-05-7
|
Kemikalija koja se veže
|
1 × 10-10 – 1 × 10-3
|
Fenol
|
Kemijski međuproizvod
|
|
10
|
Zearalenon
|
17924-92-4
|
Kemikalija koja se veže
|
1 × 10-11 – 1 × 10-3
|
Heterociklički spoj, lakton
|
Prirodni proizvod
|
|
11
|
Butil paraben
|
94-26-8
|
Kemikalija koja se veže
|
1 × 10-11 – 1 × 10-3
|
Karboksilna kiselina, fenol
|
Konzervans
|
|
12
|
Atrazin
|
1912-24-9
|
Kemikalija koja se ne veže
|
1 × 10-11 – 1 × 10-6
|
Heterociklički spoj
|
Herbicid
|
|
13
|
Di-n-butil-ftalat (DBP) (95)
|
84-74-2
|
Kemikalija koja se ne veže (96)
|
1 × 10-10 – 1 × 10-4
|
Ugljikovodik (ciklički), ester
|
Plastifikator, kemijski međuproizvod
|
|
14
|
Kortikosteron
|
50-22-6
|
Kemikalija koja se ne veže
|
1 × 10-11 – 1 × 10-4
|
Steroid
|
Prirodni proizvod
|
|
Ispitivanje topljivosti i utvrđivanje raspona koncentracija za ispitivane kemikalije
|
19.
|
Treba provesti preliminarno ispitivanje kako bi se utvrdila granica topljivosti za svaku ispitivanu kemikaliju i utvrdio primjereni raspon koncentracija za upotrebu u testu. Granicu topljivosti svake ispitivane kemikalije prvo treba utvrditi u otapalu i zatim potvrditi u uvjetima testa. Konačna koncentracija ispitana u testu ne bi trebala biti veća od 1 mM. Ispitivanje za utvrđivanje raspona sastoji se od kontrole s otapalom i osam log-serijskih razrjeđivanja, počevši od najveće prihvatljive koncentracije (npr. 1 mM ili manje, na temelju granice topljivosti) i uočene prisutnosti zamućenja ili taloga. Koncentracije u drugom i trećem pokusu po potrebi treba prilagoditi kako bi se bolje opisala krivulja koncentracija – odgovor.
|
Kriteriji prihvatljivosti ciklusa ispitivanja
|
20.
|
Prihvaćanje ili odbijanje ciklusa ispitivanja temelji se na procjeni rezultata dobivenih za referentni estrogen i kontrolu koji se koriste za svaki pokus. Prvo, kod ploče 1 cijele krivulje koncentracija referentne kontrole iz svakog pokusa trebaju zadovoljiti mjerila uspješnosti s pomoću parametara prilagođene krivulje (npr. IC50 i Hillov nagib) na temelju rezultata navedenih za odgovarajuće protokole za CERI-jev i FW test (dodaci 2. i 3.) i prijašnjih kontrolnih podataka laboratorija koji provodi test. Sve kontrole (referentni estrogen, kemikalija koja se slabo veže i kemikalija koja se ne veže) treba točno razvrstati za svaki pokus. Kontrole na svim kasnijim pločama zatim treba procijeniti u pogledu dosljednosti s pločom 1. Treba upotrijebiti dovoljan raspon koncentracija ispitivane kemikalije kako bi se jasno utvrdio vrh krivulje konkurentskog vezivanja. Varijabilnost među ponavljanjima pri svakoj koncentraciji ispitivane kemikalije te među tri neovisna ciklusa treba biti razumna i znanstveno opravdana. Sposobnost dosljedne provedbe testa treba dokazati razvojem i održavanjem baze prijašnjih podataka za referentni estrogen i kontrole. Kao mjera obnovljivosti unutar jednog laboratorija mogu se koristiti standardne devijacije (SD) ili koeficijenti varijacije (CV) za srednje vrijednosti parametara prilagođavanja krivulja referentnog estrogena i kontrolne kemikalije koja se slabo veže. Pri pregledu rezultata kontrole na ploči iz svakog ciklusa te za svaku ispitivanu kemikaliju treba primijeniti stručnu prosudbu.
Osim toga, treba ispuniti sljedeća načela u pogledu kriterija prihvatljivosti:
|
—
|
podaci bi trebali biti dovoljni za kvantitativnu procjenu vezivanja na estrogenske receptore,
|
|
—
|
ispitane koncentracije trebale bi biti unutar područja topljivosti ispitivane kemikalije.
|
|
Analiza podataka
|
21.
|
Utvrđeni postupak analize podataka o vezivanju do zasićenja i konkurentskom vezivanju treba ispunjavati ključna načela za opis interakcija receptora i liganda. Podaci o vezivanju do zasićenja obično se analiziraju upotrebom modela nelinearne regresije kojim se uzimaju u obzir ukupno i nespecifično vezivanje. Pri utvrđivanju vrijednosti Bmax i Kd možda će biti potreban ispravak potrošnje liganada (npr. Swillens, 1995. (19.)). Podaci iz testova konkurentskog vezivanja obično se transformiraju (npr. postotak specifičnog vezivanja i koncentracija ispitivane kemikalije (log M)). Procjene za log (IC50) za svaku ispitivanu kemikaliju treba utvrditi upotrebom primjerenog softvera za nelinearno prilagođavanje krivulje kako bi se prilagodila Hillova jednadžba s četiri parametra. Nakon početne analize treba izvršiti pregled parametara prilagođene krivulje i izvršiti vizualni pregled mjere u kojoj podaci o vezivanju odgovaraju izrađenoj krivulji konkurentskog vezivanja. U nekim slučajevima može biti potrebna dodatna analiza kako bi se dobila najbolje prilagođena krivulja (npr. ograničavanje vrha i/ili dna krivulje, upotreba pravila od 10 %; vidjeti Dodatak 4. i literaturu pod 2. (odjeljak III.A.2.)).
|
|
22.
|
Ispunjavanje kriterija prihvatljivosti (stavak 20.) znači da sustav testa pravilno funkcionira, ali time se ne osigurava da će svaki pojedinačni test dati točne podatke. Ponavljanje točnih rezultata prvog testa najbolji je znak toga da su dobiveni točni podaci.
|
Opći kriteriji za tumačenje podataka
|
23.
|
Trenutačno ne postoji općeprihvaćena metoda za tumačenje podataka o vezivanju na estrogenske receptore. Međutim, i kvalitativne (npr. kemikalija koja se veže/ne veže) i/ili kvantitativne (npr. IC50, relativni afinitet vezivanja (RBA) itd.) procjene aktivnosti posredovane hrER-om trebaju se temeljiti na empirijskim podacima i valjanoj znanstvenoj prosudbi.
|
Izvješće o ispitivanju
|
24.
|
Izvješće o ispitivanju trebalo bi sadržavati sljedeće informacije:
|
|
Kontrolna/referentna/ispitivana kemikalija:
|
—
|
izvor, broj serije, rok uporabe, ako su dostupni,
|
|
—
|
stabilnost ispitivane kemikalije, ako je poznata,
|
|
—
|
topljivost i stabilnost ispitivane kemikalije u otapalu ako su poznate,
|
|
—
|
prema potrebi, mjerenja pH-vrijednosti, osmolalnosti i taloga u mediju za uzgoj kulture kojem je dodana ispitivana kemikalija.
|
|
|
|
Tvar s jednim sastojkom:
|
—
|
fizički izgled, topljivost u vodi i druga relevantna fizikalno-kemijska svojstva,
|
|
—
|
kemijske identifikacijske oznake, kao što su IUPAC ili CAS naziv, CAS broj, SMILES ili InChI oznaka, strukturna formula, čistoća, kemijski identitet nečistoća prema potrebi i ako je izvedivo u praksi itd.
|
|
|
|
Tvari s više sastojaka, UVCB tvari i smjese:
|
—
|
opis (koliko je to moguće) kemijskog identiteta (vidjeti gore), kvantitativnog udjela i relevantnih fizikalno-kemijskih svojstava sastojaka.
|
|
|
|
Otapalo/nosač:
|
—
|
karakterizacija (priroda, dobavljač i serija),
|
|
—
|
obrazloženje za odabir otapala/nosača,
|
|
—
|
topljivost i stabilnost ispitivane kemikalije u otapalu/nosaču, ako su poznate.
|
|
|
|
Receptori:
|
—
|
izvor receptora (dobavljač, kataloški broj, serija, vrste receptora, koncentracija aktivnih receptora koju je naveo dobavljač, potvrda dobavljača),
|
|
—
|
opis receptora (uključujući rezultate vezivanja do zasićenja): Kd, Bmax,
|
|
—
|
skladištenje receptora,
|
|
—
|
radioaktivno obilježeni ligand,
|
|
—
|
dobavljač, kataloški broj, serija, specifična aktivnost.
|
|
|
|
Ispitni uvjeti:
|
—
|
ograničenja topljivosti u uvjetima testa,
|
|
—
|
sastav pufera za vezivanje,
|
|
—
|
koncentracija receptora,
|
|
—
|
koncentracija obilježivača (tj. radioaktivno obilježenog liganda),
|
|
—
|
koncentracije ispitivane kemikalije,
|
|
—
|
postotak nosača u konačnom testu,
|
|
—
|
temperatura i vrijeme inkubacije,
|
|
—
|
metoda odvajanja vezanih/slobodnih tvari,
|
|
—
|
pozitivne i negativne kontrole/referentne tvari,
|
|
—
|
kriteriji na temelju kojih se test smatra pozitivnim, negativnim ili dvosmislenim.
|
|
|
|
Provjera prihvatljivosti:
|
—
|
stvarne vrijednosti IC50 i vrijednosti Hillova nagiba za istodobne pozitivne kontrole/referentne tvari.
|
|
|
|
Rezultati:
|
—
|
neobrađeni podaci i podaci o vezanim/slobodnim tvarima,
|
|
—
|
ako je primjereno, provjera radi potvrde denaturiranja,
|
|
—
|
ako postoji, najniža učinkovita koncentracija (LEC),
|
|
—
|
vrijednosti RBA i/ili IC50, ako je primjereno,
|
|
—
|
odnos koncentracije i odgovora, ako je moguće,
|
|
—
|
statističke analize, ako postoje, i mjera pogreške i pouzdanosti (npr. SEM, SD, CV interval 95-postotne pouzdanosti) te opis načina na koji se došlo do tih vrijednosti.
|
|
|
|
Rasprava o rezultatima:
|
—
|
primjena pravila od 10 %.
|
|
Zaključak
|
LITERATURA
|
1.
|
OECD (2005). Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment. Environmental Health and Safety Publications, Series on Testing and Assessment, (No 34), Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
2.
|
OECD (2015). Integrated Summary Report: Validation of Two Binding Assays Using Human Recombinant Estrogen Receptor Alpha (hrERα), Health and Safety Publications, Series on Testing and Assessment (No 226), Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
3.
|
OECD (2015). Performance Standards for Binding Assays Using Human Recombinant Estrogen Receptor Alpha (hrERα), Health and Safety Publications, Series on Testing and Assessment (No 222), Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
4.
|
OECD (2012). Guidance Document on Standardized Test Guidelines for Evaluating Chemicals for Endocrine Disruption. Environmental Health and Safety Publications, Series on Testing and Assessment, (No 150), Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
5.
|
Cavailles V. (2002). Estrogens and Receptors: an Evolving Concept, Climacteric, 5 Suppl 2: str. 20.–6.
|
|
6.
|
Welboren W.J., et al. (2009). Genomic Actions of Estrogen Receptor Alpha: What are the Targets and How are they Regulated? Endocr. Relat. Cancer., 16(4): str. 1073.–89.
|
|
7.
|
Younes M. and Honma N. (2011). Estrogen Receptor Beta, Arch. Pathol. Lab. Med., 135(1): str. 63.–6.
|
|
8.
|
Diamanti-Kandarakis et al. (2009). Endocrine-Disrupting Chemicals: an Endocrine Society Sci. Statement, Endo Rev 30(4):293.–342.
|
|
9.
|
ICCVAM (2002). Background Review Document. Current Status of Test Methods for Detecting Endocrine Disruptors: In Vitro Estrogen Receptor Binding Assays. (NIH Publication No 03-4504). National Institute of Environmental Health Sciences, Research Triangle Park, NC.
|
|
10.
|
ICCVAM (2003). ICCVAM Evaluation of In Vitro Test Methods for Detecting Potential Endocrine Disruptors: Estrogen Receptor and Androgen Receptor Binding and Transcriptional Activation Assays.
|
|
11.
|
ICCVAM (2006). ICCVAM Evaluation of In Vitro Test Methods for Detecting Potential Endocrine Disruptors: Estrogen Receptor and Androgen Receptor Binding and Transcriptional Activation Assays.
|
|
12.
|
Akahori Y. et al. (2008). Relationship Between the Results of In Vitro Receptor Binding Assay to Human Estrogen Receptor Alpha and In Vivo Uterotrophic Assay: Comparative Study with 65 Selected Chemicals, Toxicol. In Vitro, 22(1): 225.–231.
|
|
13.
|
OECD (2007). Additional Data Supporting the Test Guideline on the Uterotrophic Bioassay in Rodents, Environment, Health and Safety Publications, Series on Testing and Assessment (No 67), Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
14.
|
Takeyoshi, M. (2006). Draft Report of Pre-validation and Inter-laboratory Validation For Stably Transfected Transcriptional Activation (TA) Assay to Detect Estrogenic Activity - The Human Estrogen Receptor Alpha Mediated Reporter Gene Assay Using hER-HeLa-9903 Cell Line, Chemicals Evaluation and Research Institute (CERI): Japan. str. 1.–188.
|
|
15.
|
Yamasaki, K; Noda, S; Imatanaka, N; Yakabe, Y. (2004). Comparative Study of the Uterotrophic Potency of 14 Chemicals in a Uterotrophic Assay and their Receptor-Binding Affinity, Toxicol. Letters, 146: 111.–120.
|
|
16.
|
Kummer V; Maskova, J; Zraly, Z; Neca, J; Simeckova, P; Vondracek, J; Machala, M. (2008). Estrogenic Activity of Environmental Polycyclic Aromatic Hydrocarbons in Uterus of Immature Wistar Rats. Toxicol. Letters, 180: 213.–221.
|
|
17.
|
Gozgit, JM; Nestor, KM; Fasco, MJ; Pentecost, BT; Arcaro, KF. (2004). Differential Action of Polycyclic Aromatic Hydrocarbons on Endogenous Estrogen-Responsive Genes and on a Transfected Estrogen-Responsive Reporter in MCF-7 Cells. Toxicol. and Applied Pharmacol., 196: 58.–67.
|
|
18.
|
Santodonato, J. (1997). Review of the Estrogenic and Antiestrogenic Activity of Polycyclic Aromatic Hydrocarbons: Relationship to Carcinogenicity. Chemosphere, 34: 835.–848.
|
|
19.
|
Swillens S (1995). Interpretation of Binding Curves Obtained with High Receptor Concentrations: Practical Aid for Computer Analysis, Mol Pharmacol 47(6):1197.–1203.
|
Dodatak 1.
DEFINICIJE I KRATICE
Pravilo od 10 %: opcija da se iz analize isključe podatkovne točke kod kojih je srednja vrijednost ponovljenih uzoraka za postotak specifično vezanog [3H]17β-estradiola za 10 % ili više iznad srednje vrijednosti uočene pri nižoj koncentraciji (vidjeti Dodatak 4.).
Kriteriji prihvatljivosti: minimalne norme za provedbu eksperimentalnih kontrola i referentnih normi. Da bi se pokus smatrao valjanim, trebali bi biti ispunjeni svi kriteriji prihvatljivosti.
Točnost (podudarnost): stupanj podudarnosti između rezultata testa i prihvaćenih referentnih vrijednosti. Ona je mjerilo učinkovitosti testa i jedan od aspekata relevantnosti. Pojam je često međusobno zamjenjiv s pojmom „podudarnost” u smislu udjela točnih ishoda testa (1.).
CF: OECD-ov konceptualni okvir za ispitivanje i procjenu endokrino disruptivnih kemikalija.
Kemikalija: tvar ili smjesa.
CV: koeficijent varijacije.
E2: 17β-estradiol.
ED: endokrina disrupcija.
hERα: ljudski estrogenski receptor alfa.
ER: estrogenski receptor.
Estrogeno djelovanje: sposobnost kemikalije da oponaša 17β-estradiol u pogledu sposobnosti da se veže na estrogenske receptore. Ovom se ispitnom metodom može otkriti vezivanje na receptor hERα.
IC50
: pola najveće učinkovite koncentracije inhibitorne ispitivane kemikalije.
ICCVAM: The Interagency Coordinating Committee on the Validation of Alternative Methods (Međuagencijski koordinacijski odbor za validaciju alternativnih metoda).
Obnovljivost između laboratorija: mjera u kojoj različiti kvalificirani laboratoriji mogu dobiti kvalitativno i kvantitativno slične rezultate primjenom istog protokola i ispitivanjem istih tvari. Obnovljivost između više laboratorija utvrđuje se tijekom predvalidacijskih i validacijskih procesa te pokazuje mjeru u kojoj se test može uspješno prenositi među laboratorijima, a poznata je i kao interlaboratorijska obnovljivost (1.).
Obnovljivost unutar jednog laboratorija: utvrđivanje mjere u kojoj kvalificirane osobe u istom laboratoriju mogu uspješno ponoviti rezultate primjenom specifičnog protokola u različito vrijeme. Poznata je i kao intralaboratorijska obnovljivost (1.).
LEC: najniža učinkovita koncentracija jest najniža koncentracija ispitivane kemikalije koja dovodi do odgovora (tj. najniža koncentracija ispitivane kemikalije pri kojoj je multiplikacijski faktor indukcije statistički različit od istodobne kontrole s nosačem).
I ja također test: kolokvijalni izraz za test koji je strukturno i funkcionalno sličan validiranoj i prihvaćenoj referentnoj ispitnoj metodi. Izraz se često koristi u istom značenju kao slična ispitna metoda.
PBTG: smjernica za ispitivanje koja se temelji na uspješnosti.
Zahtjevi izvedbe: zahtjevi koji se temelje na validiranoj ispitnoj metodi i pružaju temelj za ocjenjivanje usporedivosti predložene, funkcionalno i mehanicistički slične, ispitne metode. Oni obuhvaćaju: 1. ključne sastavnice testa; 2. minimalni popis referentnih kemikalija odabranih između kemikalija koje se koriste za dokazivanje prihvatljive učinkovitosti validirane ispitne metode, i 3. slične razine točnosti i pouzdanosti, utemeljene na rezultatima dobivenim za validiranu ispitnu metodu, koje se prilikom ocjenjivanja trebaju dokazati predloženom ispitnom metodom koristeći minimalni popis referentnih kemikalija (1.).
Tvari za dokazivanje osposobljenosti: podskupina referentnih tvari iz zahtjeva izvedbe kojima se laboratoriji mogu koristiti kako bi dokazali tehničku osposobljenost za provođenje standardiziranog testa. Kriteriji za odabir tih tvari obično uključuju to da predstavljaju cijeli raspon odgovora, da su komercijalno dostupni i da su za njih dostupni visokokvalitetni referentni podaci.
Osposobljenost: dokazana sposobnost za pravilno provođenje testa prije ispitivanja nepoznatih tvari.
Referentni estrogen: 17ß-estradiol (E2, CAS 50-28-2).
Referentne ispitne metode: testovi na kojima se temelji PBTG 493.
RBA: relativni afinitet vezivanja. RBA tvari računa se kao postotak log (IC50) za tvar u odnosu na log (IC50) za 17β-estradiol.
Relevantnost: opis odnosa između testa i istraživanog učinka te je li test prikladan i koristan za određenu svrhu. Pokazuje u kojoj se mjeri testom točno mjeri ili predviđa istraživani biološki učinak. Relevantnost uključuje razmatranje o točnosti (podudarnosti) testa (1.).
Pouzdanost: pokazuje u kojoj se mjeri test može obnovljivo primijeniti unutar jednog laboratorija i između više laboratorija tijekom vremena uz primjenu istog protokola. Ocjenjuje se izračunavanjem obnovljivosti unutar jednog laboratorija i između više laboratorija.
SD: standardna devijacija.
Ispitivana kemikalija: svaka tvar ili smjesa koja se ispituje ovom ispitnom metodom.
Validirana ispitna metoda: test za koji su provedene validacijske studije za utvrđivanje relevantnosti (uključujući točnost) i pouzdanosti za specifičnu namjenu. Važno je napomenuti da validirana ispitna metoda možda neće biti u dovoljnoj mjeri uspješna s obzirom na točnost i pouzdanost da bi je se moglo smatrati prihvatljivom za predloženu namjenu (1.).
Validacija: proces kojim se utvrđuju pouzdanost i relevantnost određenog pristupa, metode, testa, procesa ili procjene za definiranu svrhu (1.).
Dodatak 2.
FREYBERGER-WILSONOVI IN VITRO TESTOVI VEZIVANJA NA ESTROGENSKI RECEPTOR (ERΑ) DO ZASIĆENJA I KONKURENTSKOG VEZIVANJA UPOTREBOM CIJELOG REKOMBINANTNOG RECEPTORA ERΑ
POČETNA RAZMATRANJA I OGRANIČENJA (VIDJETI I OPĆI UVOD)
|
1.
|
U ovom in vitro testu vezivanja na estrogenski receptor (ERα) do zasićenja i konkurentskog vezivanja upotrebljava se cijeli ljudski receptor ERαα(hrERα) koji se proizvodi i izolira iz stanica kukaca zaraženih bakulovirusom. Protokol koji su razvili Freyberger i Wilson podvrgnut je međunarodnoj validacijskoj studiji u više laboratorija (2.) i ona je pokaza njegovu relevantnost i pouzdanost za predviđenu svrhu testa.
|
|
2.
|
Ovaj je test postupak probira za utvrđivanje tvari koje se mogu vezati na cijeli receptor hrERα. Upotrebljava se za utvrđivanje sposobnosti ispitivanih kemikalija da se natječu sa 17β-estradiolom u vezivanju na hrERα. Kvantitativni rezultati testa mogu uključivati IC50 (mjera koncentracije ispitivane kemikalije koja je potrebna da se istisne pola [3H]-17β-estradiola s receptora hrERα) i relativne afinitete vezivanja ispitivanih kemikalija za hrERα u usporedbi sa 17β-estradiolom. U svrhu probira kemikalija prihvatljivi kvalitativni rezultati testa mogu uključivati razvrstavanja ispitivanih kemikalija kao kemikalija koje se vežu na hrERα, koje se ne vežu ili koje daju dvosmislen odgovor na temelju kriterija opisanih za krivulje vezivanja.
|
|
3.
|
U testu se upotrebljava radioaktivno obilježeni ligand, što znači da laboratorij mora imati dozvolu za radioaktivne materijale. U svim postupcima s radioizotopima i opasnim kemikalijama treba poštovati propise i postupke kako je opisano u nacionalnom zakonodavstvu.
|
|
4.
|
Prije upotrebe ovog testa u regulatorne svrhe treba pročitati odjeljke „OPĆI UVOD” i „SASTAVNICE TESTA VEZIVANJA NA hrER”. Definicije i kratice upotrijebljene u ovoj Smjernici za ispitivanje navedene su u Dodatku 1.
|
NAČELA TESTA (VIDJETI I OPĆI UVOD)
|
5.
|
Test vezivanja na hrERα mjeri sposobnost vezivanja radioaktivno obilježenog liganda ([3H]17β-estradiol) na estrogenski receptor u prisutnosti povećavajućih koncentracija ispitivane kemikalije (tj. konkurenta). Ispitivane kemikalije koje imaju velik afinitet za estrogenski receptor natječu se s radioaktivno obilježenim ligandom pri nižoj koncentraciji u odnosu na kemikalije s manjim afinitetom za taj receptor.
|
|
6.
|
Ovaj se test sastoji od dva glavna elementa: pokusa vezivanja do zasićenja kako bi se opisali parametri interakcije receptora i liganda, nakon čega slijedi pokus konkurentskog vezivanja u kojem se ispitivana kemikalija i radioaktivno obilježeni ligand natječu u vezivanju na estrogenski receptor.
|
|
7.
|
Svrha je pokusa vezivanja do zasićenja opisati određenu šaržu receptora u pogledu afiniteta vezivanja i broja u pripravku za pokus konkurentskog vezivanja. Pokusom vezivanja do zasićenja mjeri se, u uvjetima ravnoteže, afinitet fiksne koncentracije estrogenskog receptora za njegov prirodni ligand (koji predstavlja konstanta disocijacije, Kd) i koncentracija aktivnih mjesta na receptorima (Bmax).
|
|
8.
|
Pokusom konkurentskog vezivanja mjeri se afinitet tvari da se natječe s [3H]17β-estradiolom u vezivanju na estrogenski receptor. Afinitet se kvantificira koncentracijom ispitivane kemikalije koja, u uvjetima ravnoteže, inhibira 50 % specifičnog vezivanja [3H]17β-estradiola (koja se naziva „50-postotna inhibitorska koncentracija” ili IC50). To se može procijeniti i upotrebom relativnog afiniteta vezivanja (RBA, u odnosu na IC50 estradiola koji je izmjeren zasebno u istom ciklusu). Pokusom konkurentskog vezivanja mjeri se vezivanje [3H]17β-estradiola pri fiksnoj koncentraciji u prisutnosti širokog raspona (osam redova veličine) koncentracija ispitivanih kemikalija. Ako je moguće, podaci se zatim prilagođavaju u oblik Hillove jednadžbe (Hill, 1910.) koja opisuje istiskivanje radioaktivno obilježenog liganda konkurentnom kemikalijom koja se veže na jedno mjesto. Mjera istiskivanja radioaktivno obilježenog estradiola u uvjetima ravnoteže upotrebljava se za opis ispitivane kemikalije kao kemikalije koja se veže, koja se ne veže ili koja daje dvosmislen odgovor.
|
POSTUPAK
Dokazivanje prihvatljivog djelovanja proteina receptora hrERα
|
9.
|
Prije rutinske provedbe testova vezivanja do zasićenja i konkurentskog vezivanja za svaku novu šaržu receptora hrERα treba dokazati da ispravno djeluju u laboratoriju u kojem će se upotrebljavati. Za dokazivanje uspješnosti treba upotrijebiti proces koji se sastoji od dva koraka. Riječ je o sljedećim koracima:
|
—
|
provedbi testa vezivanja [3H]-17β-estradiola do zasićenja kako bi se dokazali specifičnost i zasićenje receptora hrERα. Nelinearnom regresijskom analizom tih podataka (npr. BioSoft; McPherson, 1985.; Motulsky, 1995.) i kasnijom Scatchardovom krivuljom treba evidentirati afinitet vezivanja [3H]-17β-estradiola na receptor hrERα (Kd) i broj receptora (Bmax) za svaku šaržu receptora hrERα,
|
|
—
|
provedbi testa konkurentskog vezivanja upotrebom kontrolnih tvari (referentni estrogen (17β-estradiol)), kemikalije koja se slabo veže (npr. noretinodrel ili noretindron) i kemikalije koja se ne veže (oktil-trietoksisilan, OTES). Svaki laboratorij treba uspostaviti bazu prijašnjih podataka kako bi evidentirao dosljednost vrijednosti IC50 i drugih relevantnih vrijednosti za referentni estrogen i kemikaliju koja se slabo veže između pokusa i među različitim šaržama receptora hrERα. Parametri krivulja konkurentskog vezivanja za kontrolne tvari trebaju biti unutar ograničenja intervala pouzdanosti od 95 % (vidjeti tablicu 1.) koja su određena na temelju podataka iz laboratorija koji su sudjelovali u validacijskoj studiji za ovaj test (2.).
|
|
Tablica 1.
Kriteriji uspješnosti razvijeni za referentni estrogen i kemikaliju koja se slabo veže, FW test vezivanja na hrER
|
Tvar
|
Parametar
|
Srednja vrijednost (8)
|
Standardna devijacija (n)
|
Intervali pouzdanosti od95 % (9)
|
|
Donja granica
|
Gornja granica
|
|
17β-estradiol
|
Vrh (%)
|
100,44
|
10,84 (67)
|
97,8
|
103,1
|
|
Dno (%)
|
0,29
|
1,25 (67)
|
–0,01
|
0,60
|
|
Hillov nagib
|
–1,06
|
0,20 (67)
|
–1,11
|
–1,02
|
|
LogIC50 (M)
|
–8,92 (10)
|
0,18 (67)
|
–8,97
|
–8,88
|
|
Noretinodrel
|
Vrh (%)
|
99,42
|
8,90 (68)
|
97,27
|
101,60
|
|
Dno (%)
|
2,02
|
3,42 (68)
|
1,19
|
2,84
|
|
Hillov nagib
|
–1,01
|
0,38 (68)
|
–1,10
|
–0,92
|
|
Log IC50 (M)
|
–6,39
|
0,27 (68)
|
–6,46
|
–6,33
|
|
Noretindronc
|
Vrh (%)
|
96,14
|
8,44 (27)
|
92,80
|
99,48
|
|
Dno (%)
|
2,38
|
5,02 (27)
|
0,40
|
4,37
|
|
Hillov nagib
|
–1,41
|
0,32 (27)
|
–1,53
|
–1,28
|
|
LogIC50 (M)
|
–5,73
|
0,27 (27)
|
–5,84
|
–5,62
|
Dokazivanje osposobljenosti laboratorija
|
10.
|
Vidjeti stavke 17. i 18. te tablicu 2. u odjeljku „SASTAVNICE TESTA VEZIVANJA NA hrER” ove ispitne metode. Svaki test (zasićenje i konkurentsko vezivanje) treba se sastojati od tri neovisna ciklusa (tj. sa svježim razrjeđivanjima receptora, kemikalija i reagensa) provedena na različite dane te svaki ciklus treba sadržavati tri ponavljanja.
|
Utvrđivanje koncentracije receptora (hrERα)
|
11.
|
Koncentracija aktivnih receptora malo se razlikuje s obzirom na šaržu i uvjete skladištenja. Zato treba utvrditi koncentraciju aktivnih receptora koja je dobivena od dobavljača. Tako će se dobiti primjerena koncentracija aktivnih receptora u trenutku provedbe ciklusa.
|
|
12.
|
Nominalne koncentracije od 0,25, 0,5, 0,75 i 1 nM receptora treba inkubirati bez (ukupno vezivanje) i sa (nespecifično vezivanje) 1 μM neobilježenog estradiola u uvjetima koji odgovaraju konkurentskom vezivanju (tj. 1 nM [3H]-estradiola). Specifično vezivanje, izračunano kao razlika ukupnog i nespecifičnog vezivanja, grafički se prikazuje u ovisnosti o nominalnoj koncentraciji receptora. Koncentracija receptora koja pokaže specifične vrijednosti vezivanja koje odgovaraju 20 % dodane radioaktivne oznake povezana je s odgovarajućom nominalnom koncentracijom receptora i tu koncentraciju receptora treba upotrebljavati za pokuse vezivanja do zasićenja i konkurentskog vezivanja. Konačna koncentracija receptora hrER od 0,5 nM često će ispunjavati taj uvjet.
|
|
13.
|
Ako se kriterij od 20 % ne može ispuniti u više navrata, treba provjeriti plan pokusa kako bi se utvrdile potencijalne pogreške. Neuspjeh u ispunjavanju kriterija od 20 % može biti znak toga da u rekombinantnoj šarži ima vrlo malo aktivnih receptora pa treba razmotriti upotrebu druge šarže receptora.
|
Test zasićenja
|
14.
|
Osam povećavajućih koncentracija [3H]17β-estradiola treba procijeniti u tri ponavljanja, u sljedeća tri uvjeta (vidjeti tablicu 2.):
|
—
|
bez neobilježenog 17β-estradiola i u prisutnosti estrogenskog receptora. Tako se utvrđuje ukupno vezivanje mjerenjem radioaktivnosti u jažicama u kojima se nalazi samo [3H]17β-estradiol,
|
|
—
|
u prisutnosti koncentracije neobilježenog 17β-estradiola koja je 1 000 veća od koncentracije obilježenog 17β-estradiola i u prisutnosti estrogenskog receptora. Svrha je ovog uvjeta zasititi aktivna vezna mjesta neobilježenim 17β-estradiolom te mjerenjem radioaktivnosti u jažicama utvrditi nespecifično vezivanje. Sav radioaktivno obilježeni estradiol koji je preostao a koji se može vezati na receptor smatra se vezanim na nespecifično mjesto jer bi neobilježeni estradiol trebao biti prisutan u tako visokoj koncentraciji da se veže na sva dostupna specifična mjesta na receptoru,
|
|
—
|
bez neobilježenog 17β-estradiola i bez estrogenskog receptora (utvrđivanje ukupne radioaktivnosti).
|
|
Priprema otopina [3H]-17β-estradiola i neobilježenog 17β-estradiola
|
15.
|
Razrjeđivanja [3H]-17β-estradiola trebaju se pripremiti dodavanjem testnog pufera u glavnu otopinu [3H]-17β-estradiola od 12 nM kako bi se dobile koncentracije koje su prvotno u rasponu od 0,12 nM do 12 nM. Dodavanjem 40 μl tih otopina odgovarajućim testnim jažicama na mikrotitracijskoj ploči s 96 jažica (u konačnom volumenu od 160 μl) dobit će se konačne koncentracije testa, u rasponu od 0,03 do 3,0 nM. Priprema testnog pufera, glavne otopine [3H]-17β-estradiola i razrjeđivanja te utvrđivanje koncentracija podrobno su opisani u protokolu za FW test (2.).
|
|
16.
|
Razrjeđivanja etanolskih otopina 17β-estradiola treba pripremiti dodavanjem testnog pufera kako bi se dobilo osam povećavajućih koncentracija koje su prvo u rasponu od 0,06 μM do 6 μM. Dodavanjem 80 μl tih otopina odgovarajućim testnim jažicama na mikrotitracijskoj ploči s 96 jažica (u konačnom volumenu od 160 μl) dobit će se konačne koncentracije testa, u rasponu od 0,03 do 3 μM. Konačna koncentracija neobilježenog 17β-estradiola u pojedinačnim testnim jažicama za nespecifično vezivanje treba biti 1 000 puta veća od koncentracije obilježenog [3H]-17β-estradiola. Priprema razrjeđivanja neobilježenog 17β-estradiola podrobno je opisana u protokolu za FW test (2.).
|
|
17.
|
Treba upotrebljavati nominalnu koncentraciju receptora koja rezultira specifičnim vezivanjem od 20 ± 5 % (vidjeti stavke 12. i 13.). Otopinu receptora hrERα treba pripremiti neposredno prije upotrebe.
|
|
18.
|
Mikrotitracijske ploče s 96 jažica pripremaju se kako je prikazano u tablici 2., pufera i receptora na pločama naveden je u Dodatku 2.2.
|
Tablica 2.
Raspored na mikrotitracijskoj ploči za test vezivanja do zasićenja
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
|
|
A
|
0,03 nM [3H] E2 + ER
|
0,06 nM [3H] E2 + ER
|
0,08 nM [3H] E2 + ER
|
0,10 nM [3H] E2 + ER
|
Ukupno vezivanje (otapalo)
|
|
B
|
0,30 nM [3H] E2 + ER
|
0,60 nM [3H] E2 + ER
|
1,0 nM [3H] E2 + ER
|
3,0 nM [3H] E2 + ER
|
|
|
C
|
|
|
|
|
|
|
D
|
0,03 nM [3H] E2 + ER + 0,03 μM E2
|
0,06 nM [3H] E2 + ER + 0,06 μM E2
|
0,08 nM [3H] E2 + ER + 0,08 μM E2
|
0,10 nM [3H] E2 + ER + 0,10 μM E2
|
Nespec. vezivanje
|
|
E
|
0,30 nM [3H] E2 + ER + 0,30 μM E2
|
0,60 nM [3H] E2 + ER + 0,60 μM E2
|
1,0 nM [3H] E2 + ER + 1,0 μM E2
|
3,0 nM [3H] E2 + ER + 3,0 μM E2
|
|
|
F
|
|
|
|
|
|
|
G
|
|
|
|
|
|
|
H
|
|
|
|
|
|
|
[3H] E2: [3H]-17β-estradiol
ER: estrogenski receptor
E2: neobilježenog 17β-estradiola
|
|
19.
|
Mikrotitracijske ploče testa treba inkubirati na temperaturi od 2 do 8 °C od 16 do 20 sati te ih tijekom razdoblja inkubacije treba staviti u rotator.
|
Mjerenje [3H]-17β-estradiola koji se vezao na receptore hrERα
|
20.
|
[3H]-17β-estradiol koji se vezao na receptore hrERα treba odvojiti od slobodnog [3H]-17β-estradiola dodavanjem 80 μl hladne suspenzije DCC-a svakoj jažici, protresanjem mikrotitacijskih ploča deset minuta i centrifugiranjem tijekom deset minuta pri približno 2 500 o/min. Kako bi se tijekom tog procesa smanjila disocijacija vezanog [3H]-17β-estradiola s receptora hrERα, vrlo je važno da se puferi i testne jažice drže na temperaturi od 2 do 8 °C i da se svaki korak provede brzo. Potrebna je jedinica za miješanje za mikrotitracijske ploče kako bi se ploče obradile učinkovito i brzo.
|
|
21.
|
Zatim vrlo oprezno treba uzeti 50 μl supernatanta koji sadržava [3H]-17β-estradiol vezan na receptor hrERα kako bi se izbjegla bilo kakva kontaminacija jažica dodirivanjem DCC-a i treba ga staviti na drugu mikrotitracijsku ploču.
|
|
22.
|
Zatim u svaku jažicu treba dodati 200 μl scintilacijske tekućine, koja može pretvoriti kinetičku energiju nuklearnih emisija u svjetlosnu energiju (A1–B12 i D1–E12). Jažice G1–H12 (utvrđene kao ukupni dpm) predstavljaju serijska razrjeđivanja [3H]-17β-estradiola (40 μl) koja treba izravno dodati scintilacijskoj tekućini u jažicama ploče za mjerenje, kako je navedeno u tablici 3., tj. te jažice sadržavaju samo 200 μl scintilacijske tekućine i odgovarajuće razrjeđivanje [3H]-17β-estradiola. Te mjere pokazuju koliko je [3H]-17β-estradiola u dpm-ovima dodano svakoj skupini jažica za ukupno vezivanje i nespecifično vezivanje.
|
Tablica 3.
Raspored na mikrotitracijskoj ploči za test vezivanja do zasićenja, mjerenje radioaktivnosti
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
|
|
A
|
0,03 nM [3H] E2 + ER
|
0,06 nM [3H] E2 + ER
|
0,08 nM [3H] E2 + ER
|
0,10 nM [3H] E2 + ER
|
Ukupno vezivanje (otapalo)
|
|
B
|
0,30 nM [3H] E2 + ER
|
0,60 nM [3H] E2 + ER
|
1,0 nM [3H] E2 + ER
|
3,0 nM [3H] E2 + ER
|
|
C
|
|
|
|
|
|
|
D
|
0,03 nM [3H] E2 + ER + 0,03 μM E2
|
0,06 nM [3H] E2 + ER + 0,06 μM E2
|
0,08 nM [3H] E2 + ER + 0,08 μM E2
|
0,10 nM [3H] E2 + ER + 0,10 μM E2
|
Nespec. vezivanje
|
|
E
|
0,30 nM [3H] E2 + ER + 0,30 μM E2
|
0,60 nM [3H] E2 + ER + 0,60 μM E2
|
1,0 nM [3H] E2 + ER + 1,0 μM E2
|
3,0 nM [3H] E2 + ER + 3,0 μM E2
|
|
F
|
|
|
|
|
|
|
G
|
0,03 nM [3H] E2(ukupno dpm)
|
0,06 nM [3H] E2
|
0,08 nM [3H] E2
|
0,10 nM [3H] E2
|
Ukupno dpm (*7)
|
|
H
|
0,30 nM [3H] E2
|
0,60 nM [3H] E2
|
1,0 nM [3H] E2
|
3,0 nM [3H] E2
|
|
[3H] E2: [3H]-17β-estradiol
ER: estrogenski receptor
E2: neobilježeni 17β-estradiol
dpm: raspadi u minuti
|
|
23.
|
Mjerenje treba započeti s odgodom od najmanje dva sata i vrijeme brojenja treba iznositi 40 minuta po jažici. Kako bi se utvrdio dpm po jažici, treba upotrijebiti scintilacijski brojač za mikrotitracijske ploče s ispravkom za gašenje. Umjesto toga, ako nije dostupan scintilacijski brojač za mikrotitracijsku ploču, uzorci se mogu mjeriti uobičajenim brojačem. U tim uvjetima treba razmotriti smanjenje vremena brojenja.
|
Test konkurentskog vezivanja
|
24.
|
Testom konkurentskog vezivanja mjeri se vezivanje jedne koncentracije [3H]-17β-estradiola u prisutnosti povećavajućih koncentracija ispitivane kemikalije. Za svaku koncentraciju unutar jednog ciklusa treba upotrijebiti tri istodobna ponovljena uzorka. Osim toga, za svaku ispitanu kemikaliju treba provesti tri istodobna ciklusa. Test treba provesti na jednoj mikrotitracijskoj ploči s 96 jažica ili više ploča.
|
Kontrole
|
25.
|
Pri provedbi testa u svaki pokus istodobno treba uključiti otapalo i kontrole (tj. referentni estrogen, kemikaliju koja se slabo veže i kemikaliju koja se ne veže). Na jednoj ploči tijekom svakog ciklusa treba upotrijebiti cijelu krivulju koncentracija referentnog estrogena i kontrola (tj. kemikalije koja se slabo veže i koja se ne veže). Sve ostale ploče trebaju sadržavati: i. visoku (najveće istiskivanje) i srednju (približno IC50) koncentraciju E2 i kemikalije koja se slabo veže u triplikatima; ii. kontrolu s otapalom i nespecifično vezivanje, najmanje u tri ponavljanja. Postupci za pripremu testnog pufera, kontrola, [3H]-17β-estradiola, receptora hrERα i otopina ispitivanih kemikalija opisani su u literaturi pod 2. (Prilog K, vidjeti protokol za test FW).
|
Kontrola s otapalom:
|
26.
|
Kontrola s otapalom pokazuje da otapalo nije u interakciji s ispitnim sustavom i mjeri ukupno vezivanje (TB). Poželjno je otapalo etanol. Umjesto toga, ako najviša koncentracija ispitivane kemikalije nije topljiva u etanolu, može se upotrijebiti DMSO. Koncentracija etanola ili DMSO-a, ako se upotrebljavaju, u konačnim testnim jažicama iznosi 1,5 % i ne smije biti veća od 2 %.
|
Kontrola s puferom
|
27.
|
Kontrola s puferom (BC) ne smije sadržavati ni otapalo ni ispitivanu kemikaliju, ali treba sadržavati sve ostale sastavnice testa. Rezultati kontrole s puferom uspoređuju se s kontrolom s otapalom kako bi se potvrdilo da otapalo koje se upotrebljava ne utječe na ispitni sustav.
|
Kemikalija koja se jako veže (referentni estrogen)
|
28.
|
Endogeni je ligand 17β-estradiol (CAS 50-28-2) i on se veže s velikim afinitetom na estrogenski receptor podvrste alfa. Za svaki test konkurentskog vezivanja na hrERα treba pripremiti standardnu krivulju u kojoj se upotrebljava neobilježeni 17β-estradiol kako bi se omogućila procjena varijabilnosti pri provedbi testa tijekom vremena u istom laboratoriju. Treba pripremiti osam otopina neobilježenog 17β-estradiola u etanolu, s koncentracijama u testnim jažicama u rasponu od 100 nM do 10 pM (od –7[logM] do –11[logM]), raspoređeno na sljedeći način: (–7[logM], –8[logM], –8,5[logM], –9[logM], –9,5[logM], –10[logM], –11[logM]). Najviša koncentracija neobilježenog 17β-estradiola (1 μM) služi i kao pokazatelj nespecifičnog vezivanja. Ova se koncentracija prepoznaje po oznaci „NSB” u tablici 4. iako je ona isto dio standardne krivulje.
|
Kemikalija koja se slabo veže
|
29.
|
Treba uključiti kemikaliju koja se slabo veže (noretinodrel (CAS 68-23-5) ili noretindron (CAS 68-22-4)) kako bi se dokazala osjetljivost svakog pokusa i omogućila procjena varijabilnosti pri provedbi testa tijekom vremena. Treba pripremiti osam otopina kemikalije koja se slabo veže u etanolu, s koncentracijama u testnim jažicama u rasponu od 3 nM do 30 pM (od –8,5[logM] do –4,5[logM]), raspoređeno na sljedeći način: –4,5[logM], –5[logM], –5,5[logM], –6[logM], –6,5[logM], –7[logM], –7,5[logM], –8,5[logM].
|
Kemikalija koja se ne veže
|
30.
|
Kao negativnu kontrolu (kemikaliju koja se ne veže) treba upotrebljavati oktil-trietoksisilan (OTES, CAS 2 943-75-1). Ona je jamstvo da će se načinom na koji se test provodi otkriti kada se ispitivane kemikalije ne vežu na receptor hrERα. Treba pripremiti osam otopina kemikalije koja se ne veže u etanolu, s koncentracijama u testnim jažicama u rasponu od 0,1 nM do 1 000 μM (od –10[logM] do –3[logM]), u log povećanjima. Kao alternativna kontrolna kemikalija koja se ne veže može se upotrebljavati di-n-butil-ftalat (DBP). Pokazalo se da je njegova najveća topljivost –4[logM].
|
Koncentracija receptora hrERα
|
31.
|
Treba upotrebljavati količinu receptora koja daje specifično vezivanje od 20 ± 5 % 1 nM radioaktivno obilježenog liganda (vidjeti stavke 12. i 13. Dodatka 2.). Otopinu receptora hrERα treba pripremiti neposredno prije upotrebe.
|
[3H]-17β-estradiol
|
32.
|
Koncentracija [3H]-17β-estradiola u testnim jažicama treba biti 1,0 nM.
|
Ispitivane kemikalije
|
33.
|
U prvom se redu treba ispitati topljivost kako bi se utvrdila granica topljivosti za svaku ispitivanu kemikaliju i utvrdio primjereni raspon koncentracija za upotrebu u protokolu ispitivanja. Granicu topljivosti svake ispitivane kemikalije prvo treba utvrditi u otapalu i zatim potvrditi u uvjetima testa. Konačna koncentracija koja se ispituje u testu ne smije biti veća od 1 mM. Test za utvrđivanje raspona sastoji se od kontrole s otapalom i osam log-serijskih razrjeđivanja, počevši od najveće prihvatljive koncentracije (npr. 1 mM ili manje, na temelju granice topljivosti) i uočene prisutnosti zamućenja ili taloga (vidjeti i stavak 35.). Ispitivanu kemikaliju treba ispitati upotrebom krivulja s osam raspoređenih log koncentracija, kako se utvrdi u prethodnom ispitivanju za utvrđivanje raspona. Koncentracije u drugom i trećem pokusu po potrebi treba prilagoditi kako bi se bolje opisala krivulja koncentracija – odgovor.
|
|
34.
|
Razrjeđivanja ispitivane kemikalije treba pripremiti u odgovarajućem otapalu (vidjeti stavak 26. Dodatka 2.). Ako najviša koncentracija ispitivane kemikalije nije topljiva ni u etanolu ni u DMSO-u te bi dodavanjem još otapala koncentracija otapala u konačnoj epruveti porasla iznad prihvatljivog ograničenja, najviša koncentracija može se smanjiti na sljedeću nižu koncentraciju. U tom se slučaju može dodati dodatna koncentracija na donjem kraju niza koncentracija. Ostale koncentracije u nizu ne smiju se mijenjati.
|
|
35.
|
Otopine ispitivane kemikalije treba pažljivo pratiti kada se dodaju u testnu jažicu jer se ispitivana kemikalija može nataložiti nakon dodavanja u testnu jažicu. Podatke za sve jažice koje sadržavaju talog treba isključiti iz prilagođavanja krivulje i treba evidentirati razlog za isključivanje podataka.
|
|
36.
|
Ako već postoje informacije iz drugih izvora koje pokazuju log(IC50) ispitivane kemikalije, može biti primjereno geometrijski rasporediti razrjeđivanja (tj. polovine log jedinica oko očekivane vrijednosti log(IC50). Konačni rezultat treba odražavati dovoljnu raspoređenost koncentracija na obje strane log(IC50), uključujući „vrh” i „dno”, tako da se krivulja vezivanja može primjereno opisati.
|
Organizacija testne ploče
|
37.
|
Označene mikrotitracijske ploče treba pripremiti razmatrajući inkubacije u šest ponavljanja sa šiframa za kontrolu s otapalom, najviše koncentracije referentnog estrogena koji služi i kao pokazatelj nespecifičnog vezivanja (NSB) i kontrole s puferom te uzimajući u obzir inkubacije u tri ponavljanja sa šiframa za svaku od osam koncentracija kontrole koja se ne veže (oktil-trietoksisilan), sedam nižih koncentracija za referentni estrogen, osam razina koncentracije kemikalije koja se slabo veže i osam koncentracija svake ispitivane kemikalije (TC). Primjer rasporeda dijagrama ploče za cijele krivulje koncentracija referentnog estrogena i kontrola naveden je u tablici 4. u nastavku. Za ispitivanu kemikaliju upotrebljavaju se dodatne mikrotitracijske ploče koje trebaju uključivati kontrole na ploči, tj.: 1. visoku (najveće istiskivanje) i srednju (približno IC50) koncentraciju E2 i kemikalije koja se slabo veže u tri ponavljanja; 2. kontrolu s otapalom i nespecifično vezivanje u šest ponavljanja (tablica 5.). Primjer radnog lista s rasporedom na mikrotitracijskoj ploči za test konkurentskog vezivanja s tri nepoznate ispitivane kemikalije naveden je u Dodatku 2.3. Koncentracije navedene u tablicama 4. i 5. konačne su koncentracije testa. Najveća koncentracija za E2 treba iznositi 1 × 10–7 M, a za kemikaliju koja se slabo veže treba upotrebljavati najvišu koncentraciju koja se upotrebljavala za kemikaliju koja se slabo veže na ploči 1. Laboratorij mora utvrditi koncentraciju IC50 na temelju svoje baze podataka o prijašnjim kontrolama. Očekuje se da će ta vrijednost biti slična vrijednosti uočenoj u validacijskim studijama (vidjeti tablicu 1.).
|
Tablica 4.
Raspored na mikrotitracijskoj ploča za test konkurentskog vezivanja, cijele krivulje koncentracija referentnog estrogena i kontrola (ploča 1)
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
|
A
|
TB (samo otapalo)
|
TB (samo otapalo)
|
NSB
|
NSB
|
|
B
|
E2 (1 × 10–7)
|
E2 (1 × 10–8)
|
E2 (1 × 10–8,5)
|
E2 (1 × 10–9)
|
|
C
|
E2 (1 × 10–9,5)
|
E2 (1 × 10–10)
|
E2 (1 × 10–11)
|
Slijepa proba (*8)
|
|
D
|
NE (1 × 10–4,5)
|
NE (1 × 10–5)
|
NE (1 × 10–5,5)
|
NE (1 × 10–6)
|
|
E
|
NE (1 × 10–6,5)
|
NE (1 × 10–7)
|
NE (1 × 10–7,5)
|
NE (1 × 10–8,5)
|
|
F
|
OTES (1 × 10–3)
|
OTES (1 × 10–4)
|
OTES (1 × 10–5)
|
OTES (1 × 10–6)
|
|
G
|
OTES (1 × 10–7)
|
OTES (1 × 10–8)
|
OTES (1 × 10–9)
|
OTES (1 × 10–10)
|
|
H
|
Slijepa proba (za radioakt.) (*9)
|
Slijepa proba (za radioakt.) (*9)
|
Kontrola s puferom
|
Kontrola s puferom
|
|
U ovom se primjeru kao kemikalija koja se slabo veže upotrebljava noretinodrel (NE)
|
Tablica 5.
Raspored na mikrotitracijskoj ploči za test konkurentskog vezivanja, cijele krivulje koncentracija ispitivane kemikalije i kontrola na ploči
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
|
A
|
TB (samo otapalo)
|
TB (samo otapalo)
|
NSB
|
NSB
|
|
B
|
TC1 (1 × 10–3)
|
TC1 (1 × 10–4)
|
TC1 (1 × 10–5)
|
TC1 (1 × 10–6)
|
|
C
|
TC1 (1 × 10–7)
|
TC1 (1 × 10–8)
|
TC1 (1 × 10–9)
|
TC1 (1 × 10–10)
|
|
D
|
TC2 (1 × 10–3)
|
TC2 (1 × 10–4)
|
TC2 (1 × 10–5)
|
TC2 (1 × 10–6)
|
|
E
|
TC2 (1 × 10–7)
|
TC2 (1 × 10–8)
|
TC2 (1 × 10–9)
|
TC2 (1 × 10–10)
|
|
F
|
TC3 (1 × 10–3)
|
TC3 (1 × 10–4)
|
TC3 (1 × 10–5)
|
TC3 (1 × 10–6)
|
|
G
|
TC3 (1 × 10–7)
|
TC3 (1 × 10–8)
|
TC3 (1 × 10–9)
|
TC3 (1 × 10–10)
|
|
H
|
NE (IC50)
|
NE (1 × 10–4,5)
|
E2 (IC50)
|
E2 (1 × 10–7)
|
|
U ovom se primjeru kao kemikalija koja se slabo veže upotrebljava noretinodrel (NE)
|
Dovršetak testa konkurentskog vezivanja
|
38.
|
Kako je prikazano u tablici 6., u jažice treba dodati 80 μl kontrole s otapalom, kontrole s puferom, referentnog estrogena, kemikalije koja se slabo veže, kemikalije koja se ne veže i ispitivanih kemikalija pripremljenih u testnom puferu. Zatim u svaku jažicu treba dodati 40 μl otopine 4 nM [3H]-17β-estradiola. Nakon lagane rotacije od 10 do 15 minuta na temperaturi od 2 do 8 °C, treba dodati 40 μl otopine receptora hrERα. Mikrotitracijske ploče testa treba inkubirati na temperaturi od 2 do 8 °C od 16 do 20 sati te ih tijekom razdoblja inkubacije treba staviti u rotator.
|
Tablica 6.
Volumen sastavnica testa za test konkurentskog vezivanja na hrER, mikrotitracijske ploče
|
Volumen (μl)
|
Sastojak
|
|
80
|
Neobilježeni 17β-estradiol, noretinodrel, OTES, ispitivane kemikalije, otapalo ili pufer
|
|
40
|
otopina 4 nM [3H]-17β-estradiola
|
|
40
|
otopina hrERα, koncentracija kako je utvrđena
|
|
160
|
Ukupni volumen u svakoj testnoj jažici
|
|
39.
|
Zatim treba kvantificirati [3H]-17β-estradiol vezan na receptore hrERα, nakon odvajanja [3H]-17β-estradiola vezanog na receptore hrERα od slobodnog [3H]-17β-estradiola dodavanjem 80 μl suspenzije hladnog DCC-a u svaku jažicu, kako je opisano u stavcima od 20. do 23. za test vezivanja do zasićenja.
|
|
40.
|
Jažice H1–6 (utvrđene kao slijepe probe (za radioaktivnost) u tablici 4.) predstavljaju dpm radioaktivno obilježenog [3H] estradiola u 40 μl. Alikvot od 40 μl treba izravno dodati scintilacijskoj tekućini u jažicama H1–H6.
|
Kriteriji prihvatljivosti
Test vezivanja do zasićenja
|
41.
|
Krivulja specifičnog vezivanja treba dosegnuti plato kako se upotrebljavaju povećavajuće koncentracije [3H]-17β-estradiola, što ukazuje na zasićenje receptora hrERα ligandom.
|
|
42.
|
Specifično vezivanje pri 1 nM [3H]-17β-estradiola treba biti unutar prihvatljivog raspona od 15 % do 25 % prosječne izmjerene ukupne radioaktivnosti dodane u svim ciklusima. Prihvatljiva su povremena manja odstupanja od tog raspona, ali ako su ciklusi dosljedno izvan tog raspona ili je određeni ciklus znatno izvan tog raspona, koncentraciju proteina treba prilagoditi i treba ponoviti test zasićenja.
|
|
43.
|
Iz podataka bi trebala nastati linearna Scatchardova krivulja.
|
|
44.
|
Nespecifično vezivanje ne bi trebalo biti preveliko. Vrijednost za nespecifično vezivanje obično bi trebala biti < 35 % ukupnog vezivanja. Međutim, omjer povremeno može biti veći od tog ograničenja kada se mjeri vrlo niski dpm za najniže koncentracije ispitanog radioaktivno obilježenog 17β-estradiola.
|
Test konkurentskog vezivanja
|
45.
|
Povećavanjem koncentracija neobilježenog 17β-estradiola trebao bi se istisnuti [3H]-17β-estradiol s receptora na način koji je dosljedan konkurentskom vezivanju na jedno mjesto.
|
|
46.
|
Vrijednost IC50 za referentni estrogen (tj. 17β-estradiol) treba biti približno jednaka molarnoj koncentraciji [3H]-17β-estradiola uvećanoj za Kd utvrđen u testu vezivanja do zasićenja.
|
|
47.
|
Ukupno specifično vezivanje dosljedno bi trebalo biti unutar prihvatljivog raspona od 20 ± 5 % ako je prosječna izmjerena koncentracija ukupne radioaktivnosti dodane svakoj jažici iznosila 1 nM u svim ciklusima. Prihvatljiva su povremena manja odstupanja od tog raspona, ali ako su ciklusi dosljedno izvan tog raspona ili je određeni ciklus znatno izvan tog raspona, koncentraciju proteina treba prilagoditi.
|
|
48.
|
Otapalo ne bi smjelo promijeniti osjetljivost ili obnovljivost testa. Rezultati kontrole s otapalom (jažice TB) uspoređuju se s kontrolom s puferom kako bi se potvrdilo da otapalo koje se upotrebljava ne utječe na ispitni sustav. Ako otapalo ne utječe na test, rezultati TB-a i kontrole s puferom trebaju biti usporedivi.
|
|
49.
|
Kemikalija koje se ne veže ne bi trebala istisnuti više od 25 % [3H]-17β-estradiola s receptora hrERα ako se ispituje do 10–3 M (OTES) ili 10–4 M (DBP).
|
|
50.
|
Kriteriji uspješnosti razvijeni su za referentni estrogen i dvije kemikalije koje se slabo vežu (npr. noretinodrel, noretindron) upotrebom podataka iz validacijske studije FW testa vezivanja na hrER (Prilog N literaturi pod 2.). Intervali pouzdanosti od 95 % navode se za srednju vrijednost (n) +/– standardnu devijaciju za sve kontrolne cikluse u svim laboratorijima koji sudjeluju u validacijskoj studiji. Intervali pouzdanosti od 95 % izračunani su za parametre prilagođene krivulje (tj. vrh, dno, Hillov nagib, logIC50) za referentni estrogen i kemikalije koje se slabo vežu te za log10RBA kemikalija koje se slabo vežu u odnosu na referentni estrogen te se navode kao kriteriji uspješnosti za pozitivne kontrole. U tablici 1. navedeni su očekivani rasponi za parametre prilagođene krivulje koji se mogu upotrebljavati kao kriteriji uspješnosti. U praksi se raspon vrijednosti IC50 može neznatno razlikovati ovisno o vrijednosti Kd pripravka receptora i koncentraciji liganda.
|
|
51.
|
Za parametre prilagođene krivulje za ispitivane kemikalije nisu razvijeni kriteriji uspješnosti zbog velikog raspona postojećih potencijalnih ispitivanih kemikalija i varijacije u mogućim afinitetima i ishodima (npr. cijela krivulja, djelomična krivulja, bez prilagođavanja krivulje). Međutim, pri pregledu rezultata iz svakog ciklusa za ispitivanu kemikaliju treba primijeniti stručnu prosudbu. Treba upotrijebiti dovoljan raspon koncentracija ispitivane kemikalije kako bi se jasno utvrdio vrh (npr. od 90 do 100 % vezivanja) konkurentske krivulje. Varijabilnost među ponavljanjima pri svakoj koncentraciji ispitivane kemikalije te među tri neistodobna ciklusa treba biti razumna i znanstveno opravdana. Kontrole iz svakog ciklusa za ispitivanu kemikaliju trebale bi se približiti mjerama uspješnosti koje su navedene za ovaj FW test i biti dosljedne prijašnjim podacima o kontrolama iz svakog odgovarajućeg laboratorija.
|
ANALIZA PODATAKA
Test vezivanja do zasićenja
|
52.
|
Mjere se i ukupno i nespecifično vezivanje. Iz tih se vrijednosti računa specifično vezivanje povećavajućih koncentracija [3H]-17β-estradiola u uvjetima ravnoteže tako da se nespecifično vezivanje oduzme od ukupnoga. Grafikon specifičnog vezivanja u odnosu na koncentraciju [3H]-17β-estradiola treba dosegnuti plato za najveće specifično vezivanje koje ukazuje na zasićenje receptora hrERα [3H]-17β-estradiolom. Osim toga, analizom podataka treba evidentirati vezivanje [3H]-17β-estradiola na jedno vezno mjesto s velikim afinitetom. Nespecifično, ukupno i specifično vezivanje treba prikazati na krivulji vezivanja do zasićenja. Za daljnju analizu tih podataka treba upotrijebiti nelinearnu regresijsku analizu (npr. BioSoft; McPherson, 1985.; Motulsky, 1995.), s konačnim prikazom podataka u obliku Scatchardove krivulje.
|
|
53.
|
Analizom podataka treba utvrditi Bmax i Kd samo iz podataka o ukupnom vezivanju upotrebom pretpostavke da je nespecifično vezivanje linearno, osim ako se obrazloži upotreba druge metode. Osim toga, pri utvrđivanju najbolje prilagodbe treba upotrijebiti temeljitu regresiju osim ako se obrazloži drugačiji odabir. Treba navesti metodu odabranu za temeljitu regresiju. Kod utvrđivanja vrijednosti Bmax i Kd iz podataka o vezivanju do zasićenja uvijek treba primijeniti ispravak potrošnje liganada (npr. upotrebom Swillensove metode iz 1995.).
|
Test konkurentskog vezivanja
|
54.
|
Krivulja konkurentskog vezivanja grafički se prikazuje kao specifično vezivanje [3H]-17β-estradiola u odnosu na koncentraciju (log10 jedinice) konkurenta. Koncentracija ispitivane kemikalije koja inhibira 50 % najvećeg specifičnog vezivanja [3H]-17β-estradiola čini vrijednost IC50.
|
|
55.
|
Procjene za vrijednosti log(IC50) za pozitivne kontrole (npr. referentni estrogen i kemikalija koja se slabo veže) treba utvrditi upotrebom primjerenog softvera za nelinearno prilagođavanje krivulje kako bi se prilagodila Hillova jednadžba s četiri parametra (npr. BioSoft; McPherson, 1985.; Motulsky, 1995.). Vrh, dno, nagib i log(IC50) obično ne bi trebalo ograničavati pri prilagođavanju tih krivulja. Pri utvrđivanju najbolje prilagodbe treba upotrijebiti temeljitu regresiju osim ako se obrazloži drugačiji odabir. Ne treba primijeniti ispravak potrošnje liganada. Nakon početne analize svaku krivulju vezivanja treba pregledati kako bi se osigurala odgovarajuća prilagodba modelu. Relativni afinitet vezivanja (RBA) za kemikaliju koja se slabo veže treba izračunati kao postotak log (IC50) za kemikaliju koja se slabo veže u odnosu na log (IC50) za 17β-estradiol. Rezultate iz pozitivnih kontrola i kontrola s kemikalijama koje se ne vežu treba procijeniti upotrebom mjera uspješnosti testa iz stavaka od 45. do 50. u ovom Dodatku 2.
|
|
56.
|
Podatke za sve ispitivane kemikalije treba analizirati upotrebom stupnjevitog pristupa kako bi se osiguralo da su podaci primjereno analizirani i da je svaka krivulja konkurentskog vezivanja pravilno razvrstana. Preporučuje se da se svaki ciklus za ispitivanu kemikaliju prvo podvrgne standardiziranoj analizi podataka koja je identična analizi upotrijebljenoj za referentni estrogen i kontrolne kemikalije koje se slabo vežu (vidjeti prethodni stavak 55.). Kada se to dovrši, treba izvršiti tehnički pregled parametara prilagođene krivulje i vizualni pregled mjere u kojoj podaci odgovaraju izrađenoj krivulji konkurentskog vezivanja za svaki ciklus. Tijekom tog tehničkog pregleda dobar pokazatelj toga da su test i analiza podataka pravilno provedeni uključuju opažanje smanjenja postotka specifično vezanog [3H]-17β-estradiola koje ovisi o koncentraciji, malu varijabilnost među tehničkim ponavljanjima pri svakoj koncentraciji kemikalije i dosljednost u parametrima prilagodbe među tri ciklusa.
|
Tumačenje podataka
|
57.
|
Pod uvjetom da su ispunjeni svi kriteriji prihvatljivosti, ispitivana kemikalija smatra se kemikalijom koja se veže na receptor hrERα ako se krivulja vezivanja može prilagoditi, a najniža točka na krivulji odgovora u rasponu podataka manja je od 50 % (slika 1.).
|
|
58.
|
Pod uvjetom da su ispunjeni svi kriteriji prihvatljivosti, ispitivana kemikalija smatra se kemikalijom koja se ne veže na receptor hrERα:
|
—
|
ako se krivulja vezivanja može prilagoditi i ako je najniža točka na prilagođenoj krivulji odgovora u rasponu podataka veća od 75 %, ili
|
|
—
|
ako se krivulja vezivanja ne može prilagoditi i ako je najniži neizglađeni prosječni postotak vezivanja među skupinama koncentracija u podacima veći od 75 %.
|
|
|
59.
|
Smatra se da ispitivane kemikalije daju dvosmislen odgovor ako se ne ispuni nijedan od prethodno navedenih uvjeta (npr. najniža točka na prilagođenoj krivulji odgovora nalazi se između 76 i 51 %).
|
Tablica 7.
Kriteriji za dodjelu razvrstavanja na temelju krivulje konkurentskog vezivanja za ispitivanu kemikaliju
|
Razvrstavanje
|
Kriteriji
|
|
Kemikalija koja se vežea
|
Može se prilagoditi krivulja vezivanja.
Najniža točka na krivulji odgovora u rasponu podataka manja je od 50 %.
|
|
Kemikalija koja se ne vežeb
|
Ako se krivulja vezivanja može prilagoditi,
najniža točka na prilagođenoj krivulji odgovora u rasponu podataka veća je od 75 %.
Ako se krivulja vezivanja ne može prilagoditi,
najniži neizglađeni prosječni postotak vezivanja među skupinama koncentracija u podacima veći je od 75 %.
|
|
Daje dvosmislen odgovorc
|
Bilo koji ciklus koji se može ispitati, a nije ni kemikalija koja se veže ni koja se ne veže (npr. najniža točka na prilagođenoj krivulji odgovora nalazi se između 76 i 51 %).
|
Slika 1.
Primjeri razvrstavanja ispitivanih kemikalija upotrebom krivulje konkurentskog vezivanja
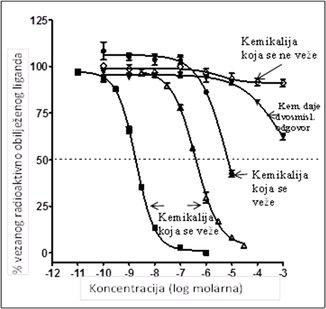
|
60.
|
Višestruki ciklusi koji se provedu u laboratoriju za ispitivanu kemikaliju kombiniraju se dodjeljivanjem numeričkih vrijednosti svakom ciklusu i određivanjem prosjeka svih ciklusa kako je prikazano u tablici 8. Rezultati za kombinirane cikluse u svakom laboratoriju uspoređuju se s očekivanim razvrstavanjem za svaku ispitivanu kemikaliju.
|
Tablica 8.
Metoda za razvrstavanje ispitivane kemikalije upotrebom višestrukih ciklusa unutar laboratorija
|
Za dodjelu vrijednosti svakom ciklusu:
|
|
|
Razvrstavanje
|
Brojčana vrijednost
|
|
Kemikalija koja se veže
|
2
|
|
Daje dvosmislen odgovor
|
1
|
|
Kemikalija koja se ne veže
|
0
|
|
Za razvrstavanje prosječne brojčane vrijednosti u svim ciklusima:
|
|
|
Razvrstavanje
|
Brojčana vrijednost
|
|
Kemikalija koja se veže
|
Prosječno ≥ 1,5
|
|
Daje dvosmislen odgovor
|
0,5 ≤ prosječno < 1,5
|
|
Kemikalija koja se ne veže
|
Prosječno < 0,5
|
IZVJEŠĆE O ISPITIVANJU
|
61.
|
Vidjeti stavak 24. u odjeljku „SASTAVNICE TESTA VEZIVANJA NA hrER” ove ispitne metode.
|
Dodatak 2.1.
POPIS TERMINA
[3H]E2: 17β-estradiol radioaktivno obilježen tricijem.
DCC: ugljen premazan dekstranom.
E2: neobilježeni 17β-estradiol (inertni).
Testni pufer: 10 mM trisa, 10 mg/ml goveđeg serumskog albumina, 2 mM DTT-a, 10-postotnoga glicerola, 0,2 mM leupeptina, pH-vrijednost od 7,5.
hrERα: ljudski rekombinantni estrogenski receptor alfa.
Ponavljanje: jedna od više jažica s istim sadržajem u istoj koncentraciji koje se ispituju istodobno u istom ciklusu. U ovom se protokolu svaka koncentracija ispitivane kemikalije ispituje u tri ponavljanja; drugim riječima, tri se ponavljanja ispituju istovremeno pri svakoj koncentraciji ispitivane kemikalije.
Ciklus: cijeli skup jažica s istodobno provedenim testovima na mikrotitracijskoj ploči koji daje sve informacije potrebne za opis vezivanja ispitivane kemikalije na receptor hrERα (odnosno ukupni [3H]-17β-estradiol dodan testnoj jažici, najveće vezivanje [3H]-17β-estradiola na receptore hrERα, nespecifično vezivanje i ukupno vezivanje pri različitim koncentracijama ispitivane kemikalije). Ciklus se može sastojati od samo jedne testne jažice (tj. ponovljeni uzorak) po koncentraciji, ali zbog toga što se ovim protokolom zahtijeva ispitivanje u tri ponavljanja, jedan se ciklus sastoji od tri testne jažice po koncentraciji. Osim toga, ovim se protokolom zahtijevaju tri neovisna (tj. neistodobna) ciklusa po kemikaliji.
Dodatak 2.2.
UOBIČAJENI TEST ZASIĆENJA S [3H]-17Β-ESTRADIOLOM S TRI JAŽICE S PONAVLJANJEM
|
Uobičajeni test zasićenja s [3H]-17β-estradiolom s tri jažice s ponavljanjem
|
|
Položaj
|
Ponavljanje
|
Šifra vrste jažice
|
Početna koncentracija rad. obilj. E2 (nM)
|
Volumen radioaktivno obilježenog E2 (μl)
|
Konačna koncentracija radioaktivno obilježenog E2 (nM)
|
Početna koncentracija neobilježenog E2 (μM)
|
Volumen neobilježenog E2 (μl)
|
Konačna koncentracija neobilježenog E2 (μM)
|
Volumen pufera (μl)
|
Volumen receptora (μl)
|
Ukupni volumen u jažicama
|
|
A1
|
1
|
H
|
0,12
|
40
|
0,03
|
——
|
——
|
——
|
80
|
40
|
160
|
|
A2
|
2
|
H
|
0,12
|
40
|
0,03
|
——
|
——
|
——
|
80
|
40
|
160
|
|
A3
|
3
|
H
|
0,12
|
40
|
0,03
|
——
|
——
|
——
|
80
|
40
|
160
|
|
A4
|
1
|
H
|
0,24
|
40
|
0,06
|
——
|
——
|
——
|
80
|
40
|
160
|
|
A5
|
2
|
H
|
0,24
|
40
|
0,06
|
——
|
——
|
——
|
80
|
40
|
160
|
|
A6
|
3
|
H
|
0,24
|
40
|
0,06
|
——
|
——
|
——
|
80
|
40
|
160
|
|
A7
|
1
|
H
|
0,32
|
40
|
0,08
|
——
|
——
|
——
|
80
|
40
|
160
|
|
A8
|
2
|
H
|
0,32
|
40
|
0,08
|
——
|
——
|
——
|
80
|
40
|
160
|
|
A9
|
3
|
H
|
0,32
|
40
|
0,08
|
——
|
——
|
——
|
80
|
40
|
160
|
|
A10
|
1
|
H
|
0,40
|
40
|
0,10
|
——
|
——
|
——
|
80
|
40
|
160
|
|
A11
|
2
|
H
|
0,40
|
40
|
0,10
|
——
|
——
|
——
|
80
|
40
|
160
|
|
A12
|
3
|
H
|
0,40
|
40
|
0,10
|
——
|
——
|
——
|
80
|
40
|
160
|
|
B1
|
1
|
H
|
1,20
|
40
|
0,30
|
——
|
——
|
——
|
80
|
40
|
160
|
|
B2
|
2
|
H
|
1,20
|
40
|
0,30
|
——
|
——
|
——
|
80
|
40
|
160
|
|
B3
|
3
|
H
|
1,20
|
40
|
0,30
|
——
|
——
|
——
|
80
|
40
|
160
|
|
B4
|
1
|
H
|
2,40
|
40
|
0,60
|
——
|
——
|
——
|
80
|
40
|
160
|
|
B5
|
2
|
H
|
2,40
|
40
|
0,60
|
——
|
——
|
——
|
80
|
40
|
160
|
|
B6
|
3
|
H
|
2,40
|
40
|
0,60
|
——
|
——
|
——
|
80
|
40
|
160
|
|
B7
|
1
|
H
|
4,00
|
40
|
1,00
|
——
|
——
|
——
|
80
|
40
|
160
|
|
B8
|
2
|
H
|
4,00
|
40
|
1,00
|
——
|
——
|
——
|
80
|
40
|
160
|
|
B9
|
3
|
H
|
4,00
|
40
|
1,00
|
——
|
——
|
——
|
80
|
40
|
160
|
|
B10
|
1
|
H
|
12,00
|
40
|
3,00
|
——
|
——
|
——
|
80
|
40
|
160
|
|
B11
|
2
|
H
|
12,00
|
40
|
3,00
|
——
|
——
|
——
|
80
|
40
|
160
|
|
B12
|
3
|
H
|
12,00
|
40
|
3,00
|
——
|
——
|
——
|
80
|
40
|
160
|
|
D1
|
1
|
HC
|
0,12
|
40
|
0,03
|
0,06
|
80
|
0,03
|
——
|
40
|
160
|
|
D2
|
2
|
HC
|
0,12
|
40
|
0,03
|
0,06
|
80
|
0,03
|
——
|
40
|
160
|
|
D3
|
3
|
HC
|
0,12
|
40
|
0,03
|
0,06
|
80
|
0,03
|
——
|
40
|
160
|
|
D4
|
1
|
HC
|
0,24
|
40
|
0,06
|
0,12
|
80
|
0,06
|
——
|
40
|
160
|
|
D5
|
2
|
HC
|
0,24
|
40
|
0,06
|
0,12
|
80
|
0,06
|
——
|
40
|
160
|
|
D6
|
3
|
HC
|
0,24
|
40
|
0,06
|
0,12
|
80
|
0,06
|
——
|
40
|
160
|
|
D7
|
1
|
HC
|
0,32
|
40
|
0,08
|
0,16
|
80
|
0,08
|
——
|
40
|
160
|
|
D8
|
2
|
HC
|
0,32
|
40
|
0,08
|
0,16
|
80
|
0,08
|
——
|
40
|
160
|
|
D9
|
3
|
HC
|
0,32
|
40
|
0,08
|
0,16
|
80
|
0,08
|
——
|
40
|
160
|
|
D10
|
1
|
HC
|
0,40
|
40
|
0,10
|
0,2
|
80
|
0,1
|
——
|
40
|
160
|
|
D11
|
2
|
HC
|
0,40
|
40
|
0,10
|
0,2
|
80
|
0,1
|
——
|
40
|
160
|
|
D12
|
3
|
HC
|
0,40
|
40
|
0,10
|
0,2
|
80
|
0,1
|
——
|
40
|
160
|
|
E1
|
1
|
HC
|
1,20
|
40
|
0,30
|
0,6
|
80
|
0,3
|
——
|
40
|
160
|
|
E2
|
2
|
HC
|
1,20
|
40
|
0,30
|
0,6
|
80
|
0,3
|
——
|
40
|
160
|
|
E3
|
3
|
HC
|
1,20
|
40
|
0,30
|
0,6
|
80
|
0,3
|
——
|
40
|
160
|
|
E4
|
1
|
HC
|
2,40
|
40
|
0,60
|
1,2
|
80
|
0,6
|
——
|
40
|
160
|
|
E5
|
2
|
HC
|
2,40
|
40
|
0,60
|
1,2
|
80
|
0,6
|
——
|
40
|
160
|
|
E6
|
3
|
HC
|
2,40
|
40
|
0,60
|
1,2
|
80
|
0,6
|
——
|
40
|
160
|
|
E7
|
1
|
HC
|
4,00
|
40
|
1,00
|
2
|
80
|
1
|
——
|
40
|
160
|
|
E8
|
2
|
HC
|
4,00
|
40
|
1,00
|
2
|
80
|
1
|
——
|
40
|
160
|
|
E9
|
3
|
HC
|
4,00
|
40
|
1,00
|
2
|
80
|
1
|
——
|
40
|
160
|
|
E10
|
1
|
HC
|
12,00
|
40
|
3,00
|
6
|
80
|
3
|
——
|
40
|
160
|
|
E11
|
2
|
HC
|
12,00
|
40
|
3,00
|
6
|
80
|
3
|
——
|
40
|
160
|
|
E12
|
3
|
HC
|
12,00
|
40
|
3,00
|
6
|
80
|
3
|
——
|
40
|
160
|
|
G1
|
1
|
radioakt.
|
0,12
|
40
|
0,03
|
——
|
——
|
——
|
——
|
——
|
40
|
|
G2
|
2
|
radioakt.
|
0,12
|
40
|
0,03
|
——
|
——
|
——
|
——
|
——
|
40
|
|
G3
|
3
|
radioakt.
|
0,12
|
40
|
0,03
|
——
|
——
|
——
|
——
|
——
|
40
|
|
G4
|
1
|
radioakt.
|
0,24
|
40
|
0,06
|
——
|
——
|
——
|
——
|
——
|
40
|
|
G5
|
2
|
radioakt.
|
0,24
|
40
|
0,06
|
——
|
——
|
——
|
——
|
——
|
40
|
|
G6
|
3
|
radioakt.
|
0,24
|
40
|
0,06
|
——
|
——
|
——
|
——
|
——
|
40
|
|
G7
|
1
|
radioakt.
|
0,32
|
40
|
0,08
|
——
|
——
|
——
|
——
|
——
|
40
|
|
G8
|
2
|
radioakt.
|
0,32
|
40
|
0,08
|
——
|
——
|
——
|
——
|
——
|
40
|
|
G9
|
3
|
radioakt.
|
0,32
|
40
|
0,08
|
——
|
——
|
——
|
——
|
——
|
40
|
|
G10
|
1
|
radioakt.
|
0,40
|
40
|
0,10
|
——
|
——
|
——
|
——
|
——
|
40
|
|
G11
|
2
|
radioakt.
|
0,40
|
40
|
0,10
|
——
|
——
|
——
|
——
|
——
|
40
|
|
G12
|
3
|
radioakt.
|
0,40
|
40
|
0,10
|
——
|
——
|
——
|
——
|
——
|
40
|
|
H1
|
1
|
radioakt.
|
1,20
|
40
|
0,30
|
——
|
——
|
——
|
——
|
——
|
40
|
|
H2
|
2
|
radioakt.
|
1,20
|
40
|
0,30
|
——
|
——
|
——
|
——
|
——
|
40
|
|
H3
|
3
|
radioakt.
|
1,20
|
40
|
0,30
|
——
|
——
|
——
|
——
|
——
|
40
|
|
H4
|
1
|
radioakt.
|
2,40
|
40
|
0,60
|
——
|
——
|
——
|
——
|
——
|
40
|
|
H5
|
2
|
radioakt.
|
2,40
|
40
|
0,60
|
——
|
——
|
——
|
——
|
——
|
40
|
|
H6
|
3
|
radioakt.
|
2,40
|
40
|
0,60
|
——
|
——
|
——
|
——
|
——
|
40
|
|
H7
|
1
|
radioakt.
|
4,00
|
40
|
1,00
|
——
|
——
|
——
|
——
|
——
|
40
|
|
H8
|
2
|
radioakt.
|
4,00
|
40
|
1,00
|
——
|
——
|
——
|
——
|
——
|
40
|
|
H9
|
3
|
radioakt.
|
4,00
|
40
|
1,00
|
——
|
——
|
——
|
——
|
——
|
40
|
|
H10
|
1
|
radioakt.
|
12,00
|
40
|
3,00
|
——
|
——
|
——
|
——
|
——
|
40
|
|
H11
|
2
|
radioakt.
|
12,00
|
40
|
3,00
|
——
|
——
|
——
|
——
|
——
|
40
|
|
H12
|
3
|
radioakt.
|
12,00
|
40
|
3,00
|
——
|
——
|
——
|
——
|
——
|
40
|
|
Napominje se da su „radioaktivne” jažice prazne tijekom inkubacije. Dodaje se 40 μl samo za brojenje scintilacijom.
|
Dodatak 2.3.
RASPORED JAŽICA ZA TEST KONKURENTSKOG VEZIVANJA
|
Ploča
|
Položaj
|
Ponavljanje
|
Vrsta jažice
|
Šifra jažice
|
Šifra koncentracije
|
Početna koncentracija konkurenta (M)
|
Glavni hrER (μl)
|
Vol. pufera (μl)
|
Vol. obilježivača (rad. obilj. E2) (μl)
|
Volumen s ploče za razrjeđivanje (μl)
|
Konačni volumen (μl)
|
Konačna koncentracija konkurenta (M)
|
|
S
|
A1
|
1
|
ukupno vezivanje
|
TB
|
TB1
|
–
|
40
|
|
40
|
80
|
160
|
–
|
|
S
|
A2
|
2
|
ukupno vezivanje
|
TB
|
TB2
|
–
|
40
|
|
40
|
80
|
160
|
–
|
|
S
|
A3
|
3
|
ukupno vezivanje
|
TB
|
TB3
|
–
|
40
|
|
40
|
80
|
160
|
–
|
|
S
|
A4
|
1
|
ukupno vezivanje
|
TB
|
TB4
|
–
|
40
|
|
40
|
80
|
160
|
–
|
|
S
|
A5
|
2
|
ukupno vezivanje
|
TB
|
TB5
|
–
|
40
|
|
40
|
80
|
160
|
–
|
|
S
|
A6
|
3
|
ukupno vezivanje
|
TB
|
TB6
|
–
|
40
|
|
40
|
80
|
160
|
–
|
|
S
|
A7
|
1
|
neob. E2 (visoki)
|
NSB
|
S0
|
2,00E-06
|
40
|
–
|
40
|
80
|
160
|
1,0E-06
|
|
S
|
A8
|
2
|
neob. E2 (visoki)
|
NSB
|
S0
|
2,00E-06
|
40
|
–
|
40
|
80
|
160
|
1,0E-06
|
|
S
|
A9
|
3
|
neob. E2 (visoki)
|
NSB
|
S0
|
2,00E-06
|
40
|
–
|
40
|
80
|
160
|
1,0E-06
|
|
S
|
A10
|
1
|
neob. E2 (visoki)
|
NSB
|
S0
|
2,00E-06
|
40
|
–
|
40
|
80
|
160
|
1,0E-06
|
|
S
|
A11
|
2
|
neob. E2 (visoki)
|
NSB
|
S0
|
2,00E-06
|
40
|
–
|
40
|
80
|
160
|
1,0E-06
|
|
S
|
A12
|
3
|
neob. E2 (visoki)
|
NSB
|
S0
|
2,00E-06
|
40
|
–
|
40
|
80
|
160
|
1,0E-06
|
|
S
|
B1
|
1
|
neobilježeni E2
|
S
|
S1
|
2,00E-07
|
40
|
–
|
40
|
80
|
160
|
1,0E-07
|
|
S
|
B2
|
2
|
neobilježeni E2
|
S
|
S1
|
2,00E-07
|
40
|
–
|
40
|
80
|
160
|
1,0E-07
|
|
S
|
B3
|
3
|
neobilježeni E2
|
S
|
S1
|
2,00E-07
|
40
|
–
|
40
|
80
|
160
|
1,0E-07
|
|
S
|
B4
|
1
|
neobilježeni E2
|
S
|
S2
|
2,00E-08
|
40
|
–
|
40
|
80
|
160
|
1,0E-08
|
|
S
|
B5
|
2
|
neobilježeni E2
|
S
|
S2
|
2,00E-08
|
40
|
–
|
40
|
80
|
160
|
1,0E-08
|
|
S
|
B6
|
3
|
neobilježeni E2
|
S
|
S2
|
2,00E-08
|
40
|
–
|
40
|
80
|
160
|
1,0E-08
|
|
S
|
B7
|
1
|
neobilježeni E2
|
S
|
S3
|
6,00E-09
|
40
|
–
|
40
|
80
|
160
|
3,0E-09
|
|
S
|
B8
|
2
|
neobilježeni E2
|
S
|
S3
|
6,00E-09
|
40
|
–
|
40
|
80
|
160
|
3,0E-09
|
|
S
|
B9
|
3
|
neobilježeni E2
|
S
|
S3
|
6,00E-09
|
40
|
–
|
40
|
80
|
160
|
3,0E-09
|
|
S
|
B10
|
1
|
neobilježeni E2
|
S
|
S4
|
2,00E-09
|
40
|
–
|
40
|
80
|
160
|
1,0E-09
|
|
S
|
B11
|
2
|
neobilježeni E2
|
S
|
S4
|
2,00E-09
|
40
|
–
|
40
|
80
|
160
|
1,0E-09
|
|
S
|
B12
|
3
|
neobilježeni E2
|
S
|
S4
|
2,00E-09
|
40
|
–
|
40
|
80
|
160
|
1,0E-09
|
|
S
|
C1
|
1
|
neobilježeni E2
|
S
|
S5
|
6,00E-10
|
40
|
–
|
40
|
80
|
160
|
3,0E-10
|
|
S
|
C2
|
2
|
neobilježeni E2
|
S
|
S5
|
6,00E-10
|
40
|
–
|
40
|
80
|
160
|
3,0E-10
|
|
S
|
C3
|
3
|
neobilježeni E2
|
S
|
S5
|
6,00E-10
|
40
|
–
|
40
|
80
|
160
|
3,0E-10
|
|
S
|
C4
|
1
|
neobilježeni E2
|
S
|
S6
|
2,00E-10
|
40
|
–
|
40
|
80
|
160
|
1,0E-10
|
|
S
|
C5
|
2
|
neobilježeni E2
|
S
|
S6
|
2,00E-10
|
40
|
–
|
40
|
80
|
160
|
1,0E-10
|
|
S
|
C6
|
3
|
neobilježeni E2
|
S
|
S6
|
2,00E-10
|
40
|
–
|
40
|
80
|
160
|
1,0E-10
|
|
S
|
C7
|
1
|
neobilježeni E2
|
S
|
S7
|
2,00E-11
|
40
|
–
|
40
|
80
|
160
|
1,0E-11
|
|
S
|
C8
|
2
|
neobilježeni E2
|
S
|
S7
|
2,00E-11
|
40
|
–
|
40
|
80
|
160
|
1,0E-11
|
|
S
|
C9
|
3
|
neobilježeni E2
|
S
|
S7
|
2,00E-11
|
40
|
–
|
40
|
80
|
160
|
1,0E-11
|
|
S
|
C10
|
1
|
slijepa proba
|
slij. proba
|
B1
|
–
|
–
|
160
|
–
|
–
|
160
|
–
|
|
S
|
C11
|
2
|
slijepa proba
|
slij. proba
|
B2
|
–
|
–
|
160
|
–
|
–
|
160
|
–
|
|
S
|
C12
|
3
|
slijepa proba
|
slij. proba
|
B3
|
–
|
–
|
160
|
–
|
–
|
160
|
–
|
|
S
|
D1
|
1
|
noretinodrel
|
NE
|
WP1
|
6,00E-05
|
40
|
–
|
40
|
80
|
160
|
3,0E-05
|
|
S
|
D2
|
1
|
noretinodrel
|
NE
|
WP1
|
6,00E-05
|
40
|
–
|
40
|
80
|
160
|
3,0E-05
|
|
S
|
D3
|
1
|
noretinodrel
|
NE
|
WP1
|
6,00E-05
|
40
|
–
|
40
|
80
|
160
|
3,0E-05
|
|
S
|
D4
|
1
|
noretinodrel
|
NE
|
WP2
|
2,00E-05
|
40
|
–
|
40
|
80
|
160
|
1,0E-05
|
|
S
|
D5
|
1
|
noretinodrel
|
NE
|
WP2
|
2,00E-05
|
40
|
–
|
40
|
80
|
160
|
1,0E-05
|
|
S
|
D6
|
1
|
noretinodrel
|
NE
|
WP2
|
2,00E-05
|
40
|
–
|
40
|
80
|
160
|
1,0E-05
|
|
S
|
D7
|
1
|
noretinodrel
|
NE
|
WP3
|
6,00E-06
|
40
|
–
|
40
|
80
|
160
|
3,0E-06
|
|
S
|
D8
|
1
|
noretinodrel
|
NE
|
WP3
|
6,00E-06
|
40
|
–
|
40
|
80
|
160
|
3,0E-06
|
|
S
|
D9
|
1
|
noretinodrel
|
NE
|
WP3
|
6,00E-06
|
40
|
–
|
40
|
80
|
160
|
3,0E-06
|
|
S
|
D10
|
1
|
noretinodrel
|
NE
|
WP4
|
2,00E-06
|
40
|
–
|
40
|
80
|
160
|
1,0E-06
|
|
S
|
D11
|
1
|
noretinodrel
|
NE
|
WP4
|
2,00E-06
|
40
|
–
|
40
|
80
|
160
|
1,0E-06
|
|
S
|
D12
|
1
|
noretinodrel
|
NE
|
WP4
|
2,00E-06
|
40
|
–
|
40
|
80
|
160
|
1,0E-06
|
|
S
|
E1
|
1
|
noretinodrel
|
NE
|
WP
|
6.00E-07
|
40
|
|
40
|
80
|
160
|
3,0E-07
|
|
S
|
E2
|
2
|
noretinodrel
|
NE
|
WP
|
6.00E-07
|
40
|
|
40
|
80
|
160
|
3,0E-07
|
|
S
|
E3
|
3
|
noretinodrel
|
NE
|
WP
|
6.00E-07
|
40
|
|
40
|
80
|
160
|
3,0E-07
|
|
S
|
E4
|
1
|
noretinodrel
|
NE
|
WP
|
2.00E-07
|
40
|
|
40
|
80
|
160
|
1,0E-07
|
|
S
|
E5
|
2
|
noretinodrel
|
NE
|
WP
|
2.00E-07
|
40
|
|
40
|
80
|
160
|
1,0E-07
|
|
S
|
E6
|
3
|
noretinodrel
|
NE
|
WP
|
2.00E-07
|
40
|
|
40
|
80
|
160
|
1,0E-07
|
|
S
|
E7
|
1
|
noretinodrel
|
NE
|
WP
|
6.00E-08
|
40
|
–
|
40
|
80
|
160
|
3,0E-08
|
|
S
|
E8
|
2
|
noretinodrel
|
NE
|
WP
|
6.00E-08
|
40
|
–
|
40
|
80
|
160
|
3,0E-08
|
|
S
|
E9
|
3
|
noretinodrel
|
NE
|
WP
|
6.00E-08
|
40
|
–
|
40
|
80
|
160
|
3,0E-08
|
|
S
|
E10
|
1
|
noretinodrel
|
NE
|
WP
|
6.00E-09
|
40
|
–
|
40
|
80
|
160
|
3,0E-09
|
|
S
|
E11
|
2
|
noretinodrel
|
NE
|
WP
|
6.00E-09
|
40
|
–
|
40
|
80
|
160
|
3,0E-09
|
|
S
|
E12
|
3
|
noretinodrel
|
NE
|
WP
|
6.00E-09
|
40
|
–
|
40
|
80
|
160
|
3,0E-09
|
|
S
|
F1
|
1
|
OTES
|
N
|
OTES
|
2,00E-03
|
40
|
–
|
40
|
80
|
160
|
1,0E-03
|
|
S
|
F2
|
2
|
OTES
|
N
|
OTES
|
2,00E-03
|
40
|
–
|
40
|
80
|
160
|
1,0E-03
|
|
S
|
F3
|
3
|
OTES
|
N
|
OTES
|
2,00E-03
|
40
|
–
|
40
|
80
|
160
|
1,0E-03
|
|
S
|
F4
|
1
|
OTES
|
N
|
OTES
|
2,00E-04
|
40
|
–
|
40
|
80
|
160
|
1,0E-04
|
|
S
|
F5
|
2
|
OTES
|
N
|
OTES
|
2,00E-04
|
40
|
–
|
40
|
80
|
160
|
1,0E-04
|
|
S
|
F6
|
3
|
OTES
|
N
|
OTES
|
2,00E-04
|
40
|
–
|
40
|
80
|
160
|
1,0E-04
|
|
S
|
F7
|
1
|
OTES
|
N
|
OTES
|
2,00E-05
|
40
|
–
|
40
|
80
|
160
|
3,0E-05
|
|
S
|
F8
|
2
|
OTES
|
N
|
OTES
|
2,00E-05
|
40
|
–
|
40
|
80
|
160
|
3,0E-05
|
|
S
|
F9
|
3
|
OTES
|
N
|
OTES
|
2,00E-05
|
40
|
–
|
40
|
80
|
160
|
3,0E-05
|
|
S
|
F10
|
1
|
OTES
|
N
|
OTES
|
2,00E-06
|
40
|
–
|
40
|
80
|
160
|
1,0E-06
|
|
S
|
F11
|
2
|
OTES
|
N
|
OTES
|
2,00E-06
|
40
|
–
|
40
|
80
|
160
|
1,0E-06
|
|
S
|
F12
|
3
|
OTES
|
N
|
OTES
|
2,00E-06
|
40
|
–
|
40
|
80
|
160
|
1,0E-06
|
|
S
|
G1
|
1
|
OTES
|
N
|
OTES
|
2,00E-07
|
40
|
–
|
40
|
80
|
160
|
3,0E-07
|
|
S
|
G2
|
2
|
OTES
|
N
|
OTES
|
2,00E-07
|
40
|
–
|
40
|
80
|
160
|
3,0E-07
|
|
S
|
G3
|
3
|
OTES
|
N
|
OTES
|
2,00E-07
|
40
|
–
|
40
|
80
|
160
|
3,0E-07
|
|
S
|
G4
|
1
|
OTES
|
N
|
OTES
|
2,00E-08
|
40
|
–
|
40
|
80
|
160
|
1,0E-08
|
|
S
|
G5
|
2
|
OTES
|
N
|
OTES
|
2,00E-08
|
40
|
–
|
40
|
80
|
160
|
1,0E-08
|
|
S
|
G6
|
3
|
OTES
|
N
|
OTES
|
2,00E-08
|
40
|
–
|
40
|
80
|
160
|
1,0E-08
|
|
S
|
G7
|
1
|
OTES
|
N
|
OTES
|
2,00E-09
|
40
|
–
|
40
|
80
|
160
|
1,0E-09
|
|
S
|
G8
|
2
|
OTES
|
N
|
OTES
|
2,00E-09
|
40
|
–
|
40
|
80
|
160
|
1,0E-09
|
|
S
|
G9
|
3
|
OTES
|
N
|
OTES
|
2,00E-09
|
40
|
–
|
40
|
80
|
160
|
1,0E-09
|
|
S
|
G10
|
1
|
OTES
|
N
|
OTES
|
2,00E-10
|
40
|
–
|
40
|
–
|
160
|
1,0E-10
|
|
S
|
G11
|
2
|
OTES
|
N
|
OTES
|
2,00E-10
|
40
|
–
|
40
|
–
|
160
|
1,0E-10
|
|
S
|
G12
|
3
|
OTES
|
N
|
OTES
|
2,00E-10
|
40
|
–
|
40
|
–
|
160
|
1,0E-10
|
|
S
|
H1
|
1
|
radioakt.
|
H
|
H
|
–
|
–
|
–
|
40
|
–
|
40
|
–
|
|
S
|
H2
|
1
|
radioakt.
|
H
|
H
|
–
|
–
|
–
|
40
|
–
|
40
|
–
|
|
S
|
H3
|
1
|
radioakt.
|
H
|
H
|
–
|
–
|
–
|
40
|
–
|
40
|
–
|
|
S
|
H4
|
1
|
radioakt.
|
H
|
H
|
–
|
–
|
–
|
40
|
–
|
40
|
–
|
|
S
|
H5
|
1
|
radioakt.
|
H
|
H
|
–
|
–
|
–
|
40
|
–
|
40
|
–
|
|
S
|
H6
|
1
|
radioakt.
|
H
|
H
|
–
|
–
|
–
|
40
|
–
|
40
|
–
|
|
S
|
H7
|
1
|
kontrola s puferom
|
BC
|
BC
|
–
|
40
|
80
|
40
|
–
|
160
|
–
|
|
S
|
H8
|
1
|
kontrola s puferom
|
BC
|
BC
|
–
|
40
|
80
|
40
|
–
|
160
|
–
|
|
S
|
H9
|
1
|
kontrola s puferom
|
BC
|
BC
|
–
|
40
|
80
|
40
|
–
|
160
|
–
|
|
S
|
H10
|
1
|
kontrola s puferom
|
BC
|
BC
|
–
|
40
|
80
|
40
|
–
|
160
|
–
|
|
S
|
H11
|
1
|
kontrola s puferom
|
BC
|
BC
|
–
|
40
|
80
|
40
|
–
|
160
|
–
|
|
S
|
H12
|
1
|
kontrola s puferom
|
BC
|
BC
|
–
|
40
|
80
|
40
|
–
|
160
|
–
|
Napominje se da su „radioaktivne” jažice prazne tijekom inkubacije. Dodaje se 40 μl samo za brojenje scintilacijom.
|
Raspored jažica za test konkurentskog vezivanja
|
|
Ploča
|
Položaj
|
Ponavljanje
|
Vrsta jažice
|
Šifra jažice
|
Šifra koncentracije
|
Početna konc. konkurenta (M)
|
Glavni hrER (μl)
|
Vol. pufera (μl)
|
Vol. obilježivača (rad. obilj. E2) (μl)
|
Vol. s ploče za razrj. (μl)
|
Konačni volumen (μl)
|
Konačna koncentracija konkurenta (M)
|
|
P1
|
A1
|
1
|
ukupno vezivanje
|
TB
|
TBB1B1
|
–
|
40
|
–
|
40
|
80
|
160
|
–
|
|
P1
|
A2
|
2
|
ukupno vezivanje
|
TB
|
TB2
|
–
|
40
|
–
|
40
|
80
|
160
|
–
|
|
P1
|
A3
|
3
|
ukupno vezivanje
|
TB
|
TB3
|
–
|
40
|
–
|
40
|
80
|
160
|
–
|
|
P1
|
A4
|
1
|
ukupno vezivanje
|
TB
|
TB4
|
–
|
40
|
–
|
40
|
80
|
160
|
–
|
|
P1
|
A5
|
2
|
ukupno vezivanje
|
TB
|
TB5
|
–
|
40
|
–
|
40
|
80
|
160
|
–
|
|
P1
|
A6
|
3
|
ukupno vezivanje
|
TB
|
TB6
|
–
|
40
|
–
|
40
|
80
|
160
|
–
|
|
P1
|
A7
|
1
|
neob. E2 (visoki)
|
NSB
|
S0
|
2,00E-06
|
40
|
–
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
A8
|
2
|
neob. E2 (visoki)
|
NSB
|
S0
|
2,00E-06
|
40
|
–
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
A9
|
3
|
neob. E2 (visoki)
|
NSB
|
S0
|
2,00E-06
|
40
|
–
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
A10
|
1
|
neob. E2 (visoki)
|
NSB
|
S0
|
2,00E-06
|
40
|
–
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
A11
|
2
|
neob. E2 (visoki)
|
NSB
|
S0
|
2,00E-06
|
40
|
–
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
A12
|
3
|
neob. E2 (visoki)
|
NSB
|
S0
|
2,00E-06
|
40
|
–
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
B1
|
1
|
ispit. kemikalija 1
|
TC1
|
1
|
2,00E-03
|
40
|
0
|
40
|
80
|
160
|
1,0E-03
|
|
P1
|
B2
|
2
|
ispit. kemikalija 1
|
TC1
|
1
|
2,00E-03
|
40
|
0
|
40
|
80
|
160
|
1,0E-03
|
|
P1
|
B3
|
3
|
ispit. kemikalija 1
|
TC1
|
1
|
2,00E-03
|
40
|
0
|
40
|
80
|
160
|
1,0E-03
|
|
P1
|
B4
|
1
|
ispit. kemikalija 1
|
TC1
|
2
|
2,00E-04
|
40
|
0
|
40
|
80
|
160
|
1,0E-04
|
|
P1
|
B5
|
2
|
ispit. kemikalija 1
|
TC1
|
2
|
2,00E-04
|
40
|
0
|
40
|
80
|
160
|
1,0E-04
|
|
P1
|
B6
|
3
|
ispit. kemikalija 1
|
TC1
|
2
|
2,00E-04
|
40
|
0
|
40
|
80
|
160
|
1,0E-04
|
|
P1
|
B7
|
1
|
ispit. kemikalija 1
|
TC1
|
3
|
2,00E-05
|
40
|
0
|
40
|
80
|
160
|
1,0E-05
|
|
P1
|
B8
|
2
|
ispit. kemikalija 1
|
TC1
|
3
|
2,00E-05
|
40
|
0
|
40
|
80
|
160
|
1,0E-05
|
|
P1
|
B9
|
3
|
ispit. kemikalija 1
|
TC1
|
3
|
2,00E-05
|
40
|
0
|
40
|
80
|
160
|
1,0E-05
|
|
P1
|
B10
|
1
|
ispit. kemikalija 1
|
TC1
|
4
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
B11
|
2
|
ispit. kemikalija 1
|
TC1
|
4
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
B12
|
3
|
ispit. kemikalija 1
|
TC1
|
4
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
C1
|
1
|
ispit. kemikalija 1
|
TC1
|
5
|
2,00E-07
|
40
|
0
|
40
|
80
|
160
|
1,0E-07
|
|
P1
|
C2
|
2
|
ispit. kemikalija 1
|
TC1
|
5
|
2,00E-07
|
40
|
0
|
40
|
80
|
160
|
1,0E-07
|
|
P1
|
C3
|
3
|
ispit. kemikalija 1
|
TC1
|
5
|
2,00E-07
|
40
|
0
|
40
|
80
|
160
|
1,0E-07
|
|
P1
|
C4
|
1
|
ispit. kemikalija 1
|
TC1
|
6
|
2,00E-08
|
40
|
0
|
40
|
80
|
160
|
1,0E-08
|
|
P1
|
C5
|
2
|
ispit. kemikalija 1
|
TC1
|
6
|
2,00E-08
|
40
|
0
|
40
|
80
|
160
|
1,0E-08
|
|
P1
|
C6
|
3
|
ispit. kemikalija 1
|
TC1
|
6
|
2,00E-08
|
40
|
0
|
40
|
80
|
160
|
1,0E-08
|
|
P1
|
C7
|
1
|
ispit. kemikalija 1
|
TC1
|
7
|
2,00E-09
|
40
|
0
|
40
|
80
|
160
|
1,0E-09
|
|
P1
|
C8
|
2
|
ispit. kemikalija 1
|
TC1
|
7
|
2,00E-09
|
40
|
0
|
40
|
80
|
160
|
1,0E-09
|
|
P1
|
C9
|
3
|
ispit. kemikalija 1
|
TC1
|
7
|
2,00E-09
|
40
|
0
|
40
|
80
|
160
|
1,0E-09
|
|
P1
|
C10
|
1
|
ispit. kemikalija 1
|
TC1
|
8
|
2,00E-10
|
40
|
0
|
40
|
80
|
160
|
1,0E-10
|
|
P1
|
C11
|
2
|
ispit. kemikalija 1
|
TC1
|
8
|
2,00E-10
|
40
|
0
|
40
|
80
|
160
|
1,0E-10
|
|
P1
|
C12
|
3
|
ispit. kemikalija 1
|
TC1
|
8
|
2,00E-10
|
40
|
0
|
40
|
80
|
160
|
1,0E-10
|
|
P1
|
D1
|
1
|
ispit. kemikalija 2
|
TC2
|
1
|
2,00E-03
|
40
|
0
|
40
|
80
|
160
|
1,0E-03
|
|
P1
|
D2
|
2
|
ispit. kemikalija 2
|
TC2
|
1
|
2,00E-03
|
40
|
0
|
40
|
80
|
160
|
1,0E-03
|
|
P1
|
D3
|
3
|
ispit. kemikalija 2
|
TC2
|
1
|
2,00E-03
|
40
|
0
|
40
|
80
|
160
|
1,0E-03
|
|
P1
|
D4
|
1
|
ispit. kemikalija 2
|
TC2
|
2
|
2,00E-04
|
40
|
0
|
40
|
80
|
160
|
1,0E-04
|
|
P1
|
D5
|
2
|
ispit. kemikalija 2
|
TC2
|
2
|
2,00E-04
|
40
|
0
|
40
|
80
|
160
|
1,0E-04
|
|
P1
|
D6
|
3
|
ispit. kemikalija 2
|
TC2
|
2
|
2,00E-04
|
40
|
0
|
40
|
80
|
160
|
1,0E-04
|
|
P1
|
D7
|
1
|
ispit. kemikalija 2
|
TC2
|
3
|
2,00E-05
|
40
|
0
|
40
|
80
|
160
|
1,0E-05
|
|
P1
|
D8
|
2
|
ispit. kemikalija 2
|
TC2
|
3
|
2,00E-05
|
40
|
0
|
40
|
80
|
160
|
1,0E-05
|
|
P1
|
D9
|
3
|
ispit. kemikalija 2
|
TC2
|
3
|
2,00E-05
|
40
|
0
|
40
|
80
|
160
|
1,0E-05
|
|
P1
|
D10
|
1
|
ispit. kemikalija 2
|
TC2
|
4
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
D11
|
2
|
ispit. kemikalija 2
|
TC2
|
4
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
D12
|
3
|
ispit. kemikalija 2
|
TC2
|
4
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
E1
|
1
|
ispit. kemikalija 2
|
TC2
|
5
|
2,00E-07
|
40
|
0
|
40
|
80
|
160
|
1,0E-07
|
|
P1
|
E2
|
2
|
ispit. kemikalija 2
|
TC2
|
5
|
2,00E-07
|
40
|
0
|
40
|
80
|
160
|
1,0E-07
|
|
P1
|
E3
|
3
|
ispit. kemikalija 2
|
TC2
|
5
|
2,00E-07
|
40
|
0
|
40
|
80
|
160
|
1,0E-07
|
|
P1
|
E4
|
1
|
ispit. kemikalija 2
|
TC2
|
6
|
–
|
40
|
0
|
40
|
80
|
160
|
1,0E-08
|
|
P1
|
E5
|
2
|
ispit. kemikalija 2
|
TC2
|
6
|
–
|
40
|
0
|
40
|
80
|
160
|
1,0E-08
|
|
P1
|
E6
|
3
|
ispit. kemikalija 2
|
TC2
|
6
|
–
|
40
|
0
|
40
|
80
|
160
|
1,0E-08
|
|
P1
|
E7
|
1
|
ispit. kemikalija 2
|
TC2
|
7
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-09
|
|
P1
|
E8
|
2
|
ispit. kemikalija 2
|
TC2
|
7
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-09
|
|
P1
|
E9
|
3
|
ispit. kemikalija 2
|
TC2
|
7
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-09
|
|
P1
|
E10
|
1
|
ispit. kemikalija 2
|
TC2
|
8
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-10
|
|
P1
|
E11
|
2
|
ispit. kemikalija 2
|
TC2
|
8
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-10
|
|
P1
|
E12
|
3
|
ispit. kemikalija 2
|
TC2
|
8
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-10
|
|
P1
|
F1
|
1
|
ispit. kemikalija 3
|
TC3
|
1
|
2,00E-03
|
40
|
0
|
40
|
80
|
160
|
1,0E-03
|
|
P1
|
F2
|
2
|
ispit. kemikalija 3
|
TC3
|
1
|
2,00E-03
|
40
|
0
|
40
|
80
|
160
|
1,0E-03
|
|
P1
|
F3
|
3
|
ispit. kemikalija 3
|
TC3
|
1
|
2,00E-03
|
40
|
0
|
40
|
80
|
160
|
1,0E-03
|
|
P1
|
F4
|
1
|
ispit. kemikalija 3
|
TC3
|
2
|
2,00E-04
|
40
|
0
|
40
|
80
|
160
|
1,0E-04
|
|
P1
|
F5
|
2
|
ispit. kemikalija 3
|
TC3
|
2
|
2,00E-04
|
40
|
0
|
40
|
80
|
160
|
1,0E-04
|
|
P1
|
F6
|
3
|
ispit. kemikalija 3
|
TC3
|
2
|
2,00E-04
|
40
|
0
|
40
|
80
|
160
|
1,0E-04
|
|
P1
|
F7
|
1
|
ispit. kemikalija 3
|
TC3
|
3
|
2,00E-05
|
40
|
0
|
40
|
80
|
160
|
1,0E-05
|
|
P1
|
F8
|
2
|
ispit. kemikalija 3
|
TC3
|
3
|
2,00E-05
|
40
|
0
|
40
|
80
|
160
|
1,0E-05
|
|
P1
|
F9
|
3
|
ispit. kemikalija 3
|
TC3
|
3
|
2,00E-05
|
40
|
0
|
40
|
80
|
160
|
1,0E-05
|
|
P1
|
F10
|
1
|
ispit. kemikalija 3
|
TC3
|
4
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
F11
|
2
|
ispit. kemikalija 3
|
TC3
|
4
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
F12
|
3
|
ispit. kemikalija 3
|
TC3
|
4
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
G1
|
1
|
ispit. kemikalija 3
|
TC3
|
5
|
2,00E-07
|
40
|
0
|
40
|
80
|
160
|
1,0E-07
|
|
P1
|
G2
|
2
|
ispit. kemikalija 3
|
TC3
|
5
|
2,00E-07
|
40
|
0
|
40
|
80
|
160
|
1,0E-07
|
|
P1
|
G3
|
3
|
ispit. kemikalija 3
|
TC3
|
5
|
2,00E-07
|
40
|
0
|
40
|
80
|
160
|
1,0E-07
|
|
P1
|
G4
|
1
|
ispit. kemikalija 3
|
TC3
|
6
|
2,00E-08
|
40
|
0
|
40
|
80
|
160
|
1,0E-08
|
|
P1
|
G5
|
2
|
ispit. kemikalija 3
|
TC3
|
6
|
2,00E-08
|
40
|
0
|
40
|
80
|
160
|
1,0E-08
|
|
P1
|
G6
|
3
|
ispit. kemikalija 3
|
TC3
|
6
|
2,00E-08
|
40
|
0
|
40
|
80
|
160
|
1,0E-08
|
|
P1
|
G7
|
1
|
ispit. kemikalija 3
|
TC3
|
7
|
2,00E-09
|
40
|
0
|
40
|
80
|
160
|
1,0E-09
|
|
P1
|
G8
|
2
|
ispit. kemikalija 3
|
TC3
|
7
|
2,00E-09
|
40
|
0
|
40
|
80
|
160
|
1,0E-09
|
|
P1
|
G9
|
3
|
ispit. kemikalija 3
|
TC3
|
7
|
2,00E-09
|
40
|
0
|
40
|
80
|
160
|
1,0E-09
|
|
P1
|
G10
|
1
|
ispit. kemikalija 3
|
TC3
|
8
|
2,00E-10
|
40
|
0
|
40
|
80
|
160
|
1,0E-10
|
|
P1
|
G11
|
2
|
ispit. kemikalija 3
|
TC3
|
8
|
2,00E-10
|
40
|
0
|
40
|
80
|
160
|
1,0E-10
|
|
P1
|
G12
|
3
|
ispit. kemikalija 3
|
TC3
|
8
|
2,00E-10
|
40
|
0
|
40
|
80
|
160
|
1,0E-10
|
|
P1
|
H1
|
1
|
noretinodrel
|
NE
|
|
IC50
|
40
|
0
|
40
|
80
|
160
|
|
|
P1
|
H2
|
2
|
noretinodrel
|
NE
|
|
IC50
|
40
|
0
|
40
|
80
|
160
|
|
|
P1
|
H3
|
3
|
noretinodrel
|
NE
|
|
IC50
|
40
|
0
|
40
|
80
|
160
|
|
|
P1
|
H4
|
1
|
noretinodrel
|
NE
|
|
1,00E-4,5
|
40
|
0
|
40
|
80
|
160
|
|
|
P1
|
H5
|
2
|
noretinodrel
|
NE
|
|
1,00E-4,5
|
40
|
0
|
40
|
80
|
160
|
|
|
P1
|
H6
|
3
|
noretinodrel
|
NE
|
|
1,00E-4,5
|
40
|
0
|
40
|
80
|
160
|
|
|
P1
|
H7
|
1
|
neobilježeni E2 S
|
|
|
IC50
|
40
|
0
|
40
|
80
|
160
|
|
|
P1
|
H8
|
2
|
neobilježeni E2 S
|
|
|
IC50
|
40
|
0
|
40
|
80
|
160
|
|
|
P1
|
H9
|
3
|
neobilježeni E2 S
|
|
|
IC50
|
40
|
0
|
40
|
80
|
160
|
|
|
P1
|
H10
|
1
|
neobilježeni E2 S
|
|
|
1,00 E-7
|
40
|
0
|
40
|
80
|
160
|
|
|
P1
|
H11
|
2
|
neobilježeni E2 S
|
|
|
1,00 E-7
|
40
|
0
|
40
|
80
|
160
|
|
|
P1
|
H12
|
3
|
neobilježeni E2 S
|
|
|
1,00 E-7
|
40
|
0
|
40
|
80
|
160
|
|
Dodatak 3.
IN VITRO
TEST VEZIVANJA NA ESTROGENSKI RECEPTOR UPOTREBOM LJUDSKOG REKOMBINANTNOG PROTEINA DOMENE VEZIVANJA LIGANDA RECEPTORA ERΑ KOJI JE RAZVIO CERI (INSTITUT ZA PROCJENU I ISTRAŽIVANJE KEMIKALIJA)
POČETNA RAZMATRANJA I OGRANIČENJA (VIDJETI I OPĆI UVOD)
|
1.
|
U ovom in vitro testu vezivanja na estrogenski receptor (ERα) do zasićenja i konkurentskog vezivanja upotrebljava se domena vezivanja liganda (LBD) ljudskog receptora ERα (hrERα). Taj konstrukt proteina proizveo je CERI (institut za procjenu i istraživanje kemikalija) iz Japana te on postoji kao fuzijski protein glutation S-transferaza (GST) i eksprimira se u bakteriji E. coli. CERI-jev protokol podvrgnut je međunarodnoj validacijskoj studiji u više laboratorija (2.) koja je pokaza njegovu relevantnost i pouzdanost za predviđenu svrhu testa.
|
|
2.
|
Ovaj je test postupak probira za utvrđivanje tvari koje se mogu vezati na receptor hrERα. Upotrebljava se za utvrđivanje sposobnosti ispitivanih kemikalija da se natječu sa 17β-estradiolom u vezivanju na domenu vezivanja liganda receptora hrERα. Kvantitativni rezultati testa mogu uključivati IC50 (mjera koncentracije ispitivane kemikalije koja je potrebna da se istisne pola [3H]-17β-estradiola s receptora hrERα) i relativne afinitete vezivanja ispitivanih kemikalija na hrERα u usporedbi sa 17β-estradiolom. U svrhu probira kemikalija prihvatljivi kvalitativni rezultati testa mogu uključivati razvrstavanja ispitivanih kemikalija kao kemikalija koje se vežu na hrERα, koje se ne vežu ili koje daju dvosmislen odgovor na temelju kriterija opisanih za krivulje vezivanja.
|
|
3.
|
U testu se upotrebljava radioaktivno obilježeni ligand, što znači da laboratorij mora imati dozvolu za radioaktivne materijale. U svim postupcima s radioizotopima i opasnim kemikalijama treba poštovati propise i postupke kako je opisano u nacionalnom zakonodavstvu.
|
|
4.
|
Prije upotrebe ovog testa u regulatorne svrhe treba pročitati odjeljke „OPĆI UVOD” i „SASTAVNICE TESTA VEZIVANJA NA hrER”. Definicije i kratice upotrijebljene u ovoj Smjernici za ispitivanje navedene su u Dodatku 1.
|
NAČELA TESTA (VIDJETI I OPĆI UVOD)
|
5.
|
Test vezivanja na hrERα mjeri sposobnost vezivanja radioaktivno obilježenog liganda ([3H]17β-estradiol) na estrogenski receptor u prisutnosti povećavajućih koncentracija ispitivane kemikalije (tj. konkurenta). Ispitivane kemikalije koje imaju velik afinitet za estrogenski receptor natječu se s radioaktivno obilježenim ligandom pri nižoj koncentraciji u odnosu na kemikalije s manjim afinitetom za taj receptor.
|
|
6.
|
Ovaj se test sastoji od dva glavna elementa: pokusa vezivanja do zasićenja kako bi se opisali parametri interakcije receptora i liganda, nakon čega slijedi pokus konkurentskog vezivanja u kojem se ispitivana kemikalija i radioaktivno obilježeni ligand natječu u vezivanju na estrogenski receptor.
|
|
7.
|
Svrha je pokusa vezivanja do zasićenja opisati određenu šaržu receptora u pogledu afiniteta vezivanja i broja u pripravku za pokus konkurentskog vezivanja. Pokusom vezivanja do zasićenja mjeri se, u uvjetima ravnoteže, afinitet fiksne koncentracije estrogenskog receptora za njegov prirodni ligand (koji predstavlja konstanta disocijacije, Kd) i koncentracija aktivnih mjesta na receptorima (Bmax).
|
|
8.
|
Pokusom konkurentskog vezivanja mjeri se afinitet tvari da se natječe s [3H]17β-estradiolom u vezivanju na estrogenski receptor. Afinitet se kvantificira koncentracijom ispitivane kemikalije koja, u uvjetima ravnoteže, inhibira 50 % specifičnog vezivanja [3H]17β-estradiola (koja se naziva „50-postotna inhibitorska koncentracija” ili IC50). To se može procijeniti i upotrebom relativnog afiniteta vezivanja (RBA, u odnosu na IC50 estradiola koji je izmjeren zasebno u istom ciklusu). Pokusom konkurentskog vezivanja mjeri se vezivanje [3H]17β-estradiola pri fiksnoj koncentraciji u prisutnosti širokog raspona (osam redova veličine) koncentracija ispitivanih kemikalija. Ako je moguće, podaci se zatim prilagođavaju u oblik Hillove jednadžbe (Hill, 1910.) koja opisuje istiskivanje radioaktivno obilježenog liganda konkurentnom kemikalijom koja se veže na jedno mjesto. Mjera istiskivanja radioaktivno obilježenog estradiola u uvjetima ravnoteže upotrebljava se za opis ispitivane kemikalije kao kemikalije koja se veže, koja se ne veže ili koja daje dvosmislen odgovor.
|
POSTUPAK
Dokazivanje prihvatljivog djelovanja proteina receptora hrERα
|
9.
|
Prije rutinske provedbe testova vezivanja do zasićenja i konkurentskog vezivanja za svaku novu šaržu receptora hrERα treba dokazati da ispravno djeluju u laboratoriju u kojem će se upotrebljavati. Za dokazivanje uspješnosti treba upotrijebiti proces koji se sastoji od dva koraka. Riječ je o sljedećim koracima:
|
—
|
provedbi testa vezivanja [3H]-17β-estradiola do zasićenja kako bi se dokazali specifičnost i zasićenje receptora hrERα. Nelinearnom regresijskom analizom tih podataka (npr. BioSoft; McPherson, 1985.; Motulsky, 1995.) i kasnijom Scatchardovom krivuljom treba evidentirati afinitet vezivanja [3H]-17β-estradiola na receptor hrERα (Kd) i broj receptora (Bmax) za određenu šaržu receptora hrERα,
|
|
—
|
provedbi testa konkurentskog vezivanja upotrebom kontrolnih tvari (referentni estrogen (17β-estradiol), kemikalije koja se slabo veže (npr. noretinodrel ili noretindron) i kemikalije koja se ne veže (oktil-trietoksisilan, OTES)). Svaki laboratorij treba uspostaviti bazu prijašnjih podataka kako bi evidentirao dosljednost vrijednosti IC50 i relevantnih vrijednosti za referentni estrogen i kemikaliju koja se slabo veže između pokusa i među različitim šaržama receptora hrERα. Osim toga, parametri krivulja konkurentskog vezivanja za kontrolne tvari trebaju biti unutar ograničenja intervala pouzdanosti od 95 % (vidjeti tablicu 1.) koja su razvijena upotrebom podataka iz laboratorija koji su sudjelovali u validacijskoj studiji za ovaj test (2.).
|
Tablica 1
Kriteriji uspješnosti razvijeni za referentni estrogen i kemikaliju koja se slabo veže, CERI-jev test vezivanja na hrER
|
Tvar
|
Parametar
|
Srednja vrijednost (11)
|
Standardna devijacija (n)
|
Intervali pouzdanosti od 95 % (12)
|
|
Donja granica
|
Gornja granica
|
|
17β-estradiol
|
Vrh
|
104,74
|
13,12 (70)
|
101,6
|
107,9
|
|
Dno
|
0,85
|
2,41 (70)
|
0,28
|
1,43
|
|
Hillov nagib
|
– 1,22
|
0,20 (70)
|
– 1,27
|
– 1,17
|
|
LogIC50
|
– 8,93
|
0,23 (70)
|
– 8,98
|
– 8,87
|
|
Noretinodrel
|
Vrh
|
101,31
|
10,55 (68)
|
98,76
|
103,90
|
|
Dno
|
2,39
|
5,01 (68)
|
1,18
|
3,60
|
|
Hillov nagib
|
– 1,04
|
0,21 (68)
|
– 1,09
|
– 0,99
|
|
LogIC50
|
– 6,19
|
0,40 (68)
|
– 6,29
|
– 6,10
|
|
Noretindron (13)
|
Vrh
|
92,27
|
7,79 (23)
|
88,90
|
95,63
|
|
Dno
|
16,52
|
10,59 (23)
|
11,94
|
21,10
|
|
Hillov nagib
|
– 1,18
|
0,32 (23)
|
– 1,31
|
– 1,04
|
|
LogIC50
|
– 6,01
|
0,54 (23)
|
– 6,25
|
– 5,78
|
|
Dokazivanje osposobljenosti laboratorija
|
10.
|
Vidjeti stavke 17. i 18. te tablicu 2. u odjeljku „SASTAVNICE TESTA VEZIVANJA NA hrER” ove ispitne metode. Svaki test (zasićenje i konkurentsko vezivanje) treba se sastojati od tri neovisna ciklusa (tj. sa svježim razrjeđivanjima receptora, kemikalija i reagensa) provedena na različite dane te svaki ciklus treba sadržavati tri ponavljanja.
|
Utvrđivanje koncentracije receptora (hrERα)
|
11.
|
Koncentracija aktivnih receptora malo se razlikuje s obzirom na šaržu i uvjete skladištenja. Zato treba utvrditi koncentraciju aktivnih receptora koja je dobivena od dobavljača. Tako će se dobiti primjerena koncentracija aktivnih receptora u trenutku provedbe ciklusa.
|
|
12.
|
Nominalne koncentracije od 0,1, 0,2, 0,4 i 0,6 nM receptora treba inkubirati bez (ukupno vezivanje) i s (nespecifično vezivanje) 1 μM neobilježenog estradiola u uvjetima koji odgovaraju konkurentskom vezivanju (tj. 0,5 nM [3H]-estradiola). Specifično vezivanje, izračunano kao razlika ukupnog i nespecifičnog vezivanja, grafički se prikazuje u ovisnosti o nominalnoj koncentraciji receptora. Koncentracija receptora koja pokaže specifične vrijednosti vezivanja koje odgovaraju 40 % dodane radioaktivne oznake povezana je s odgovarajućom koncentracijom receptora i tu koncentraciju receptora treba upotrebljavati za pokuse vezivanja do zasićenja i konkurentskog vezivanja. Konačna koncentracija receptora hrER od 0,2 nM često će ispunjavati taj uvjet.
|
|
13.
|
Ako se kriterij od 40 % ne može ispuniti u više navrata, treba provjeriti plan pokusa kako bi se utvrdile potencijalne pogreške. Neuspjeh u ispunjavanju kriterija od 40 % može biti znak toga da u rekombinantnoj šarži ima vrlo malo aktivnih receptora i zatim treba razmotriti upotrebu druge šarže receptora.
|
Test zasićenja
|
14.
|
Osam povećavajućih koncentracija [3H]17β-estradiola treba procijeniti u tri ponavljanja, u sljedeća tri uvjeta (vidjeti tablicu 2.):
|
a.
|
bez neobilježenog 17β-estradiola i u prisutnosti estrogenskog receptora. To je utvrđivanje ukupnog vezivanja mjerenjem radioaktivnosti u jažicama u kojima se nalazi samo [3H]17β-estradiol;
|
|
b.
|
u prisutnosti koncentracije neobilježenog 17β-estradiola koja je 2000 veća od koncentracije obilježenog 17β-estradiola i u prisutnosti estrogenskog receptora. Namjera je ovog uvjeta zasititi aktivna vezna mjesta neobilježenim 17β-estradiolom te mjerenjem radioaktivnosti u jažicama utvrditi nespecifično vezivanje. Sav radioaktivno obilježeni estradiol koji je preostao koji se može vezati na receptor smatra se vezanim na nespecifično mjesto jer bi neobilježeni estradiol trebao biti prisutan u tako visokoj koncentraciji da se veže na sva dostupna specifična mjesta na receptoru;
|
|
c.
|
bez neobilježenog 17β-estradiola i bez estrogenskog receptora (utvrđivanje ukupne radioaktivnosti).
|
Priprema otopina [3H]-17β-estradiola, neobilježenog 17β-estradiola i receptora hrERα
|
15.
|
Otopinu 40 nM [3H]-17β-estradiola treba pripremiti iz 1 μM glavne otopine [3H]-17β-estradiola u DMSO-u, dodavanjem DMSO-a (kako bi se pripremilo 200 nM) i testnog pufera na sobnoj temperaturi (kako bi se pripremilo 40 nM). Upotrebom te otopine od 40 nM priprema se niz razrjeđivanja [3H]-17β-estradiola, u rasponu od 0,313 nM do 40 nM s testnim puferom na sobnoj temperaturi (kako je prikazano u retku 12 tablice 2.). Konačne koncentracije u testu, u rasponu od 0,0313 do 4,0 nM, dobit će se dodavanjem 10 μl tih otopina odgovarajućim testnim jažicama na mikrotitracijskoj ploči s 96 jažica (vidjeti tablice 2. i 3.). Priprema testnog pufera, izračun izvorne glavne otopine [3H]-17β-estradiola na temelju njezine specifične aktivnosti, priprema razrjeđivanja te utvrđivanje koncentracija podrobno su opisani u protokolu za CERI-jev test (2.).
|
|
16.
|
Razrjeđivanja neobilježenih otopina 17β-estradiola treba pripremiti iz 1 nM glavne otopine 17β-estradiola dodavanjem testnog pufera kako bi se dobilo osam povećavajućih koncentracija koje su prvotno u rasponu od 0,625 μM do 80 μM. Konačne koncentracije u testu, u rasponu od 0,0625 do 8 μM, dobit će se dodavanjem 10 μl tih otopina odgovarajućim testnim jažicama na mikrotitracijskoj ploči s 96 jažica namijenjenima za mjerenje nespecifičnog vezivanja (vidjeti tablice 2. i 3.). Priprema razrjeđivanja neobilježenog 17β-estradiola podrobno je opisana u protokolu za CERI-jev test (2.).
|
|
17.
|
Treba upotrebljavati koncentraciju receptora koja daje specifično vezivanje od 40 ± 10 % (vidjeti stavke 12. i 13.). Otopinu receptora hrERα treba pripremiti s vrlo hladnim testnim puferom neposredno prije upotrebe, tj. nakon što se pripreme sve jažice za ukupno vezivanje, nespecifično vezivanje i samo radioaktivno obilježeni ligand.
|
|
18.
|
Mikrotitracijske ploče s 96 jažica pripremaju se kako je prikazano u tablici 2., s tri ponavljanja po koncentraciji [3H]-17β-estradiola. Raspored volumena [3H]-17β-estradiola, neobilježenog 17β-estradiola, pufera i receptora prikazan je u tablici 3.
Tablica 2
Raspored na mikrotitracijskoj ploči za test vezivanja do zasićenja
|
|
1 (*10)
|
2 (*10)
|
3 (*10)
|
4 (*10)
|
5 (*10)
|
6 (*10)
|
7 (*10)
|
8 (*10)
|
9 (*10)
|
10
|
11 (*11)
|
12 (*11)
|
|
Za mjerenje TB-a
|
Za mjerenje NSB-a
|
Za utvrđivanje samo radioaktivno obilježenog liganda
|
|
Razrjeđivanja neobilježenog E2 za stupce ploče 4–6
|
Razrjeđivanja [3H]E2 za stupce ploče 1–9
|
|
A
|
0,0313 nM [3H] E2+ ER
|
0,0313 nM [3H] E2+ 0,0625 μM E2+ ER
|
0,0313 nM
|
|
0,625 μM
|
0,313 nM
|
|
B
|
0,0625 nM [3H] E2+ ER
|
0,0625 nM [3H] E2+ 0,125 μM E2+ ER
|
0,0625 nM
|
|
1,25 μM
|
0,625 nM
|
|
C
|
0,125 nM [3H] E2+ ER
|
0,125 nM [3H] E2+ 0,25 μM E2+ ER
|
0,125 nM
|
|
2,5 μM
|
1,25 nM
|
|
D
|
0,250 nM [3H] E2+ ER
|
0,250 nM [3H] E2+ 0,5 μM E2+ ER
|
0,250 nM
|
|
5 μM
|
2,5 nM
|
|
E
|
0,50 nM [ H] E2+ ER
|
0,50 nM [3H] E2+ 1 μM E2+ ER
|
0,50 nM
|
|
10 μM
|
5 nM
|
|
F
|
1,00 nM [3H] E2+ ER
|
1,00 nM [3H] E2+ 2 μM E2+ ER
|
1,00 nM
|
|
20 μM
|
10 nM
|
|
G
|
2,00 nM [3H] E2+ ER
|
2,00 nM [3H] E2+ 4 μM E2+ ER
|
2,00 nM
|
|
40 μM
|
20 nM
|
|
H
|
4,00 nM [3H] E2+ ER
|
4,00 nM [3H] E2+ 8 μM E2+ ER
|
4,00 nM
|
|
80 μM
|
40 nM
|
|
TB
|
:
|
ukupno vezivanje
|
|
NSB
|
:
|
nespecifično vezivanje
|
|
[3H] E2
|
:
|
[3H]17β-estradiol
|
|
E2
|
:
|
neobilježeni 17β-estradiol
|
|
Tablica 3
Volumeni reagensa za mikrotitracijsku ploču za zasićenje
|
Broj retka
|
1
|
2
|
3
|
4
|
5
|
6
|
7 (*12)
|
8 (*12)
|
9 (*12)
|
|
Koraci pripreme
|
Jažice za TB
|
Jažice za NSB
|
Samo radioaktivno obilježeni ligand
|
|
Volumen sastavnica za prethodne reakcijske jažice i redoslijed dodavanja
|
Pufer
|
60 μl
|
50 μl
|
90 μl
|
|
neobilježeni E2 iz retka 11 u tablici 2.
|
–
|
10 μl
|
–
|
|
[3H]E2 iz retka 12 u tablici 2.
|
10 μl
|
10 μl
|
10 μl
|
|
hrERα
|
30 μl
|
30 μl
|
–
|
|
Ukupni reakcijski volumen
|
100 μl
|
100 μl
|
100 μl
|
|
Inkubacija
|
REAKCIJA NAKON DVA SATA INKUBACIJE
|
Kvantifikacija radioaktivnosti odmah nakon pripreme. Bez inkubacije
|
|
Tretiranje 0,4-postotnim DCC-om
|
Da
|
Da
|
Ne
|
|
Volumen 0,4-postotnog DCC-a
|
100 μl
|
100 μl
|
–
|
|
Filtriranje
|
Da
|
Da
|
Ne
|
|
MJERENJE DPMS-a
|
|
Kvantifikacijski volumen dodan scintilacijskom koktelu
|
100 μl (*13)
|
100 μl (*13)
|
50 μl
|
|
|
19.
|
Mikrotitracijske ploče testa za utvrđivanje ukupnog i nespecifičnog vezivanja treba inkubirati dva sata na sobnoj temperaturi (od 22 °C do 28 °C).
|
|
Mjerenje [3H]-17β-estradiola koji se vezao na receptore hrERα
|
20.
|
Nakon dvosatnog razdoblja inkubacije [3H]-17β-estradiol vezan na receptore hrERα treba odvojiti od slobodnog [3H]-17β-estradiola tako da se u jažice doda 100 μl 0,4-postotne vrlo hladne suspenzije DCC-a. Ploče zatim treba staviti na led deset minuta, a reakcijsku smjesu i suspenziju DCC-a filtrirati prenošenjem na filtar mikrotitracijske ploče kako bi se uklonio DCC. Zatim 100 μl filtrata treba dodati scintilacijskoj tekućini u bočice LSC-a za utvrđivanje raspada u minuti (dpm) po bočici brojenjem metodom tekućinske scintilacije.
|
|
21.
|
Umjesto toga, ako nije dostupan mikrotitracijski filtar, DCC se može ukloniti centrifugiranjem. Zatim vrlo oprezno treba uzeti 50 μl supernatanta koji sadržava [3H]-17β-estradiol vezan na receptor hrERα kako bi se izbjegla bilo kakva kontaminacija jažica dodirivanjem DCC-a i to se treba upotrijebiti za brojenje scintilacijom.
|
|
22.
|
Uvjet sa samo radioaktivno obilježenim ligandom upotrebljava se za utvrđivanje raspada u minuti (dpm) [3H]-17β-estradiola dodanog u testne jažice. Radioaktivnost treba kvantificirati odmah nakon pripreme. Te jažice ne treba inkubirati ni tretirati suspenzijom DCC-a, već se njihov sadržaj treba izravno dodati scintilacijskoj tekućini. Te mjere pokazuju koliko je [3H]-17β-estradiola u dpm-ovima dodano svakoj skupini jažica za ukupno vezivanje i nespecifično vezivanje.
|
Test konkurentskog vezivanja
|
23.
|
Testom konkurentskog vezivanja mjeri se vezivanje jedne koncentracije [3H]-17β-estradiola u prisutnosti povećavajućih koncentracija ispitivane kemikalije. Za svaku koncentraciju unutar jednog ciklusa treba upotrijebiti tri istodobna ponovljena uzorka. Osim toga, za svaku ispitanu kemikaliju treba provesti tri neparalelna ciklusa. Test treba provesti na jednoj mikrotitracijskoj ploči s 96 jažica ili više ploča.
|
Kontrole
|
24.
|
Pri provedbi testa u svaki pokus istodobno treba uključiti otapalo i kontrole (tj. referentni estrogen, kemikaliju koja se slabo veže i kemikaliju koja se ne veže). Na jednoj ploči tijekom svakog ciklusa treba upotrijebiti cijelu krivulju koncentracija referentnog estrogena i kontrola (tj. kemikalije koja se slabo veže i koja se ne veže). Sve ostale ploče trebaju sadržavati: i. visoku (najveće istiskivanje, tj. približno potpuno istiskivanje radioaktivno obilježenog liganda) i srednju (približno IC50) koncentraciju E2 i kemikalije koja se slabo veže u tri ponavljanja; ii. kontrolu s otapalom i nespecifično vezivanje, svako u tri ponavljanja. Postupci za pripremu testnog pufera, [3H]-17β-estradiola, receptora hrERα i otopina ispitivanih kemikalija podrobno su opisani u protokolu za test CERI (2.).
|
Kontrola s otapalom
|
25.
|
Kontrola s otapalom pokazuje da otapalo nije u interakciji s ispitnim sustavom i mjeri ukupno vezivanje (TB). Poželjno je otapalo DMSO. Umjesto toga, ako najviša koncentracija ispitivane kemikalije nije topljiva u DMSO-u, može se upotrijebiti etanol. Koncentracija DMSO-a u konačnim testnim jažicama treba biti 2,05 % i može se povećati do 2,5 % ako ispitivana kemikalija nije dovoljno topljiva. Ne treba upotrebljavati koncentracije DMSO-a veće od 2,5 % zbog utjecaja većih koncentracija otapala na test. Za ispitivane kemikalije koje nisu topljive u DMSO-u, ali su topljive u etanolu, u testu se može upotrijebiti najviše 2 % etanola bez interferencije.
|
Kontrola s puferom
|
26.
|
Kontrola s puferom (BC) ne smije sadržavati ni otapalo ni ispitivanu kemikaliju, ali treba sadržavati sve ostale sastavnice testa. Rezultati kontrole s puferom uspoređuju se s kontrolom s otapalom kako bi se potvrdilo da otapalo koje se upotrebljava ne utječe na ispitni sustav.
|
Kemikalija koja se jako veže (referentni estrogen)
|
27.
|
Endogeni je ligand 17β-estradiol (CAS 50-28-2) i on se veže s velikim afinitetom za estrogenski receptor podvrste alfa. Za svaki test konkurentskog vezivanja na hrERα treba pripremiti standardnu krivulju u kojoj se upotrebljava neobilježeni 17β-estradiol kako bi se omogućila procjena varijabilnosti pri provedbi testa tijekom vremena u istom laboratoriju. Treba pripremiti osam otopina neobilježenog 17β-estradiola u DMSO-u i testnom puferu, sa sljedećim konačnim koncentracijama u testnim jažicama koje se trebaju upotrijebiti za standardnu krivulju: 10–6, 10–7, 10–8, 10–8,5, 10–9, 10–9,5, 10–10, 10–11 M. Najviša koncentracija neobilježenog 17β-estradiola (1 μM) treba služiti kao pokazatelj nespecifičnog vezivanja. Ova se koncentracija prepoznaje po oznaci „NSB” u tablici 4. iako je ona i dio standardne krivulje.
|
Kemikalija koja se slabo veže
|
28.
|
Treba uključiti kemikaliju koja se slabo veže (noretinodrel (CAS 68-23-5) ili alternativno noretindron (CAS 68-22-4)) kako bi se dokazala osjetljivost svakog pokusa i omogućila procjena varijabilnosti pri provedbi testa tijekom vremena. Treba pripremiti osam otopina kemikalije koja se slabo veže u DMSO-u i testnom puferu, sa sljedećim konačnim koncentracijama u testnim jažicama: 10–4,5, 10–5,5, 10–6, 10–6,5, 10–7, 10–7,5, 10–8 i 10–9 M.
|
Kemikalija koja se ne veže
|
29.
|
Kao negativnu kontrolu (kemikaliju koja se ne veže) treba upotrebljavati oktil-trietoksisilan (OTES, CAS 2943-75-1). Ona je jamstvo da će se načinom na koji se test provodi otkriti ispitivane kemikalije koje se ne vežu na receptor hrERα. Treba pripremiti osam otopina kemikalije koja se ne veže u DMSO-u i testnom puferu, sa sljedećim konačnim koncentracijama u testnim jažicama: 10–3, 10–4, 10–5, 10–6, 10–7, 10–8, 10–9, 10–10 M. Kao alternativna kemikalija koja se ne veže može se upotrebljavati di-n-butil-ftalat (DBP, CAS 84-72-2), ali se ispituje samo do 10–4 M. Pokazalo se da je 10–4 M najveća topljivost DBP-a u testu.
|
Koncentracija receptora hrERα
|
30.
|
Treba upotrebljavati količinu receptora koja daje specifično vezivanje od 40 ± 10 % (vidjeti stavke 12. i 13. Dodatka 3.). Otopinu receptora hrERα treba pripremiti razrjeđivanjem funkcionalnog receptora hrERα u vrlo hladnom testnom puferu, neposredno prije upotrebe.
|
[3H]-17β-estradiol
|
31.
|
Konačna koncentracija [3H]-17β-estradiola u testnim jažicama treba biti 0,5 nM.
|
Ispitivane kemikalije
|
32.
|
U prvom se redu treba ispitati topljivost kako bi se utvrdila granica topljivosti za svaku ispitivanu kemikaliju i utvrdio primjereni raspon koncentracija za upotrebu u protokolu ispitivanja. Granicu topljivosti svake ispitivane kemikalije prvo treba utvrditi u otapalu i zatim potvrditi u uvjetima testa. Konačna koncentracija koja se ispituje u testu ne smije biti veća od 1 mM. Ispitivanje za utvrđivanje raspona uključuje kontrolu s otapalom i najmanje osam log-serijskih razrjeđivanja, počevši od najveće prihvatljive koncentracije (npr. 1 mM ili manje, na temelju granice topljivosti) i uočene prisutnosti zamućenja ili taloga (vidjeti i stavak 35. Dodatka 3.). Kada se utvrdi raspon koncentracija za ispitivanje, ispitivanu kemikaliju treba ispitati upotrebom osam primjereno raspoređenih log koncentracija, kako su utvrđene u prethodnom ispitivanju za utvrđivanje raspona. Ako je potrebno, koncentracije ispitane u drugom i trećem pokusu po potrebi treba dodatno prilagoditi kako bi se bolje opisala krivulja koncentracija – odgovor.
|
|
33.
|
Razrjeđivanja ispitivane kemikalije treba pripremiti u odgovarajućem otapalu (vidjeti stavak 25. Dodatka 3.). Ako najviša koncentracija ispitivane kemikalije nije topljiva ni u etanolu ni u DMSO-u te bi dodavanjem još otapala koncentracija otapala u konačnoj epruveti porasla iznad prihvatljivog ograničenja, najviša koncentracija može se smanjiti na sljedeću nižu koncentraciju. U tom se slučaju može dodati dodatna koncentracija na donjem kraju niza koncentracija. Ostale koncentracije u nizu ne smiju se mijenjati.
|
|
34.
|
Otopine ispitivane kemikalije treba pažljivo pratiti kada se dodaju u testnu jažicu jer se ispitivana kemikalija može nataložiti nakon dodavanja u testnu jažicu. Podatke za sve jažice koje sadržavaju talog treba isključiti iz prilagođavanja krivulje i treba evidentirati razlog za isključivanje podataka.
|
|
35.
|
Ako već postoje informacije iz drugih izvora koje pokazuju log(IC50) ispitivane kemikalije, može biti primjereno geometrijski rasporediti razrjeđivanja bliže očekivanoj vrijednosti log(IC50) (tj. polovine log jedinica). Konačni rezultati trebaju pokazivati dovoljnu raspoređenost koncentracija na obje strane log(IC50), uključujući „vrh” i „dno”, tako da se krivulja vezivanja može primjereno opisati.
|
Organizacija testne ploče
|
36.
|
Označene mikrotitracijske ploče treba pripremiti upotrebom inkubacija u šest ponavljanja za kontrolu s otapalom, najviše koncentracije referentnog estrogena (E2) koji služi i kao pokazatelj nespecifičnog vezivanja (NSB), kontrole s puferom, te inkubacije u tri ponavljanja za svaku od osam koncentracija kontrole koja se ne veže (oktil-trietoksisilan), sedam nižih koncentracija za referentni estrogen (E2), osam koncentracija kemikalije koja se slabo veže (noretinodrel ili noretindron) i osam koncentracija svake ispitivane kemikalije (TC). Primjer rasporeda na ploči za cijele krivulje koncentracija referentnog estrogena i kontrola naveden je u tablici 4. u nastavku. Za ispitivanu kemikaliju upotrebljavaju se dodatne mikrotitracijske ploče koje trebaju uključivati kontrole na ploči, tj.: i. visoku (najveće istiskivanje) i srednju (približno IC50) koncentraciju E2 i kemikalije koja se slabo veže u tri ponavljanja; ii. kontrolu s otapalom (kao ukupno vezivanje) i nespecifično vezivanje u šest ponavljanja (tablica 5.). Primjer radnog lista s rasporedom mikrotitracijskih ploča za test konkurentskog vezivanja s tri nepoznate ispitivane kemikalije naveden je u Dodatku 3.3. Koncentracije navedene u radnom listu te u tablicama 4. i 5. odnose se na konačne koncentracije koje se upotrebljavaju u svakoj testnoj jažici. Najveća koncentracija za E2 treba iznositi 1 × 10–7 M, a za kemikaliju koja se slabo veže treba upotrebljavati najvišu koncentraciju koja se upotrebljavala za kemikaliju koja se slabo veže na ploči 1. Laboratorij mora utvrditi koncentraciju IC50 na temelju svoje baze podataka o prijašnjim kontrolama. Očekuje se da će ta vrijednost biti slična vrijednosti uočenoj u validacijskim studijama (vidjeti tablicu 1.).
|
Tablica 4
Raspored na mikrotitracijskoj ploči za test konkurentskog vezivanja (97)
(98), cijele krivulje koncentracija referentnog estrogena i kontrola (ploča 1)
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
|
Kontrola s puferom i pozitivna kontrola (E2)
|
Slabo pozitivna kemikalija (Noretinodrel)
|
Negativna kontrola (OTES)
|
TB i NSB
|
|
A
|
Slijepa proba (*14)
|
1 × 10–9 M
|
1 × 10–10 M
|
TB (kontrola s otapalom) (2,05-postotni DMSO)
|
|
B
|
E2 (1 × 10–11 M)
|
1 × 10–8 M
|
1 × 10–9 M
|
|
C
|
E2 (1 × 10–10 M)
|
1 × 10–7,5 M
|
1 × 10–8 M
|
NSB (10–6 M E2)
|
|
D
|
E2 (1 × 10–9,5 M)
|
1 × 10–7 M
|
1 × 10–7 M
|
|
E
|
E2 (1 × 10–9 M)
|
1 × 10–6,5 M
|
1 × 10–6 M
|
Kontrola s puferom
|
|
F
|
E2 (1 × 10–8,5 M)
|
1 × 10–6 M
|
1 × 10–5 M
|
|
G
|
E2 (1 × 10–8 M)
|
1 × 10–5,5 M
|
1 × 10–4 M
|
Slijepa proba (za radioakt.) (*15)
|
|
H
|
E2 (1 × 10–7 M)
|
1 × 10–4,5 M
|
1 × 10–3 M
|
Tablica 5
Raspored na mikrotitracijskoj ploči za test konkurentskog vezivanja, dodatne ploče za ispitivane kemikalije (TC) i kontrole na ploči
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
|
|
Ispitivana kemikalija 1 (TC-1)
|
Ispitivana kemikalija 2 (TC-2)
|
Ispitivana kemikalija 3 (TC-3)
|
Kontrole
|
|
A
|
TC-1 (1 × 10–10 M)
|
TC-2 (1 × 10–10 M)
|
TC-3 (1 × 10–10 M)
|
E2 (1 × 10–7 M)
|
|
B
|
TC-1 (1 × 10–9 M)
|
TC-2 (1 × 10–9 M)
|
TC-3 (1 × 10–9 M)
|
E2 (IC50)
|
|
C
|
TC-1 (1 × 10–8 M)
|
TC-2 (1 × 10–8 M)
|
TC-3 (1 × 10–8 M)
|
NE (1 × 10–4,5 M)
|
|
D
|
TC-1 (1 × 10–7 M)
|
TC-2 (1 × 10–7 M)
|
TC-3 (1 × 10–7 M)
|
NE (IC50)
|
|
E
|
TC-1 (1 × 10–6 M)
|
TC-2 (1 × 10–6 M)
|
TC-3 (1 × 10–6 M)
|
NSB (10–6 M E2)
|
|
F
|
TC-1 (1 × 10–5 M)
|
TC-2 (1 × 10–5 M)
|
TC-3 (1 × 10–5 M)
|
|
G
|
TC-1 (1 × 10–4 M)
|
TC-2 (1 × 10–4 M)
|
TC-3 (1 × 10–4 M)
|
TB (kontrola s otapalom)
|
|
H
|
TC-1 (1 × 10–3 M)
|
TC-2 (1 × 10–3 M)
|
TC-3 (1 × 10–3 M)
|
|
U ovom se primjeru kao kemikalija koja se slabo veže upotrebljava noretinodrel (NE)
|
Dovršetak testa konkurentskog vezivanja
|
37.
|
Uz iznimku jažica za ukupno vezivanje i slijepe probe (za radioaktivnost), kako je prikazano u tablici 6., u svaku jažicu treba staviti 50 μl testnog pufera i pomiješati s 10 μl kontrole s otapalom, referentnog estrogena (E2), kemikalije koja se slabo veže, kemikalije koja se ne veže ili ispitivanih kemikalija te s 10 μl otopine [3H]-17β-estradiola od 5 nM. Zatim se svakoj ploči dodaje 30 μl vrlo hladne otopine receptora i lagano promiješa. Otopina receptora hrERα trebala bi biti posljednji reagens koji se dodaje. Mikrotitracijske ploče testa treba inkubirati dva sata na sobnoj temperaturi (od 22 do 28 °C).
Tablica 6
Volumen sastavnica testa za test konkurentskog vezivanja na hrER, mikrotitracijske ploče
|
Koraci pripreme
|
Osim jažica za TB
|
Jažice za TB
|
Slijepa proba (za radioakt.)
|
|
Volumen sastavnica za prethodne reakcijske jažice i redoslijed dodavanja
|
Testni pufer sobne temperature
|
50 μl
|
60 μl
|
90 μl
|
|
Neobilježeni E2, kemikalija koja se slabo veže, kemikalija koja se ne veže, otapalo i ispitivane kemikalije (*16)
|
10 μl
|
–
|
–
|
|
[3H]-17β-estradiol koji treba imati konačnu koncentraciju od 0,5 nM (tj. 5 nM)
|
10 μl
|
10 μl
|
10 μl
|
|
Koncentracija receptora hrERα kako je utvrđeno (vidjeti stavke 12. i 13.)
|
30 μl
|
30 μl
|
–
|
|
Ukupni volumen u svakoj testnoj jažici
|
100 μl
|
100 μl
|
100 μl
|
|
|
38.
|
Zatim treba kvantificirati [3H]-17β-estradiol vezan na receptore hrERα, nakon odvajanja [3H]-17β-estradiola vezanog na receptore hrERα od slobodnog [3H]-17β-estradiola dodavanjem 100 μl suspenzije vrlo hladnog DCC-a u svaku jažicu, kako je opisano u stavcima od 21. do 23. Dodatka 3. za test vezivanja do zasićenja.
|
|
39.
|
Jažice G10–12 i H10–12 (utvrđene kao slijepe probe (za radioaktivnost) u tablici 4.) predstavljaju dpm označenog [3H] estradiola u 10 μl. Alikvot od 10 μl treba izravno dodati scintilacijskoj tekućini.
|
Kriteriji prihvatljivosti
Test vezivanja do zasićenja
|
40.
|
Krivulja specifičnog vezivanja treba dosegnuti plato kako se upotrebljavaju povećavajuće koncentracije [3H]-17β-estradiola, što ukazuje na zasićenje receptora hrERα ligandom.
|
|
41.
|
Specifično vezivanje pri 0,5 nM [3H]-17β-estradiola treba biti unutar prihvatljivog raspona od 30 % do 50 % prosječne izmjerene ukupne radioaktivnosti dodane u svim ciklusima. Prihvatljiva su povremena manja odstupanja od tog raspona, ali ako su ciklusi dosljedno izvan tog raspona ili je određeni ciklus znatno izvan tog raspona, koncentraciju proteina treba prilagoditi i treba ponoviti test zasićenja.
|
|
42.
|
Iz podataka bi trebala nastati linearna Scatchardova krivulja.
|
|
43.
|
Nespecifično vezivanje ne bi trebalo biti preveliko. Vrijednost za nespecifično vezivanje obično bi trebala biti <35 % ukupnog vezivanja. Međutim, omjer povremeno može biti veći od tog ograničenja kada se mjere vrlo niski dpm-ovi za najniže koncentracije ispitanog radioaktivno obilježenog 17β-estradiola.
|
Test konkurentskog vezivanja
|
44.
|
Povećavanjem koncentracija neobilježenog 17β-estradiola trebao bi se istisnuti [3H]-17β-estradiol s receptora na način koji je dosljedan konkurentskom vezivanju na jedno mjesto.
|
|
45.
|
Vrijednost IC50 za referentni estrogen (tj. 17β-estradiol) treba biti približno jednaka molarnoj koncentraciji [3H]-17β-estradiola uvećanoj za Kd utvrđen u testu vezivanja do zasićenja.
|
|
46.
|
Ukupno specifično vezivanje dosljedno bi trebalo biti unutar prihvatljivog raspona od 40 ± 10 % ako je prosječna izmjerena koncentracija ukupne radioaktivnosti dodane svakoj jažici iznosila 0,5 nM u svim ciklusima. Prihvatljiva su povremena manja odstupanja od tog raspona, ali ako su ciklusi dosljedno izvan tog raspona ili je određeni ciklus znatno izvan tog raspona, koncentraciju proteina treba prilagoditi.
|
|
47.
|
Otapalo ne bi smjelo promijeniti osjetljivost ili obnovljivost testa. Rezultati kontrole s otapalom (jažice TB) uspoređuju se s kontrolom s puferom kako bi se potvrdilo da otapalo koje se upotrebljava ne utječe na ispitni sustav. Ako otapalo ne utječe na test, rezultati TB-a i kontrole s puferom trebaju biti usporedivi.
|
|
48.
|
Kemikalija koja se ne veže ne bi trebala istisnuti više od 25 % [3H]-17β-estradiola s receptora hrERα ako se ispituje do 10–3 M (OTES) ili 10–4 M (DBP).
|
|
49.
|
Kriteriji uspješnosti razvijeni su za referentni estrogen i dvije kemikalije koje se slabo vežu (npr. noretinodrel, noretindron) upotrebom podataka iz validacijske studije za CERI-jev test vezivanja na hrER (Prilog N literaturi pod 2.). Intervali pouzdanosti od 95 % navode se za srednju vrijednost ±SD (n) svih kontrolnih ciklusa u sva četiri laboratorija koja su sudjelovala u validacijskoj studiji. Intervali pouzdanosti od 95 % izračunani su za parametre prilagođene krivulje (tj. vrh, dno, Hillov nagib, logIC50) za referentni estrogen i kemikalije koje se slabo vežu te za log10RBA kemikalija koje se slabo vežu u odnosu na referentni estrogen. U tablici 1. navedeni su očekivani rasponi za parametre prilagođene krivulje koji se mogu upotrebljavati kao kriteriji uspješnosti. U praksi se raspon vrijednosti IC50 može neznatno razlikovati ovisno o eksperimentalno izvedenoj vrijednosti Kd pripravka receptora i koncentraciji liganda upotrijebljenoj u testu.
|
|
50.
|
Za parametre prilagođene krivulje za ispitivane kemikalije nisu razvijeni kriteriji uspješnosti zbog velikog raspona postojećih potencijalnih ispitivanih kemikalija i varijacije u mogućim afinitetima i ishodima (npr. cijela krivulja, djelomična krivulja, bez prilagođavanja krivulje). Međutim, pri pregledu rezultata iz svakog ciklusa za ispitivanu kemikaliju treba primijeniti stručnu prosudbu. Treba upotrijebiti dovoljan raspon koncentracija ispitivane kemikalije kako bi se jasno utvrdio vrh (npr. od 90 do 100 % vezivanja) konkurentske krivulje. Varijabilnost među ponavljanjima pri svakoj koncentraciji ispitivane kemikalije te među tri neistodobna ciklusa treba biti razumna i znanstveno opravdana. Kontrole iz svakog ciklusa za ispitivanu kemikaliju trebale bi se približiti mjerilima uspješnosti koja su navedena za ovaj CERI-jev test i biti dosljedne podacima o prijašnjim kontrolama iz svakog odgovarajućeg laboratorija.
|
ANALIZA PODATAKA
Test vezivanja do zasićenja
|
51.
|
Mjere se i ukupno i nespecifično vezivanje. Iz tih se vrijednosti računa specifično vezivanje povećavajućih koncentracija [3H]-17β-estradiola u uvjetima ravnoteže tako da se nespecifično vezivanje oduzme od ukupnoga. Grafikon specifičnog vezivanja u odnosu na koncentraciju [3H]-17β-estradiola treba dosegnuti plato za najveće specifično vezivanje koje ukazuje na zasićenje receptora hrERα [3H]-17β-estradiolom. Osim toga, analizom podataka treba evidentirati vezivanje [3H]-17β-estradiola na jedno vezno mjesto s velikim afinitetom. Nespecifično, ukupno i specifično vezivanje treba prikazati na krivulji vezivanja do zasićenja. Za daljnju analizu tih podataka treba upotrijebiti nelinearnu regresijsku analizu (npr. BioSoft; McPherson, 1985.; Motulsky, 1995.), s konačnim prikazom podataka u obliku Scatchardove krivulje.
|
|
52.
|
Analizom podataka treba utvrditi Bmax i Kd samo iz podataka o ukupnom vezivanju uz pretpostavku da je nespecifično vezivanje linearno, osim ako se obrazloži upotreba druge metode. Osim toga, pri utvrđivanju najbolje prilagodbe treba upotrijebiti temeljitu regresiju osim ako se obrazloži drugačiji odabir. Treba navesti metodu odabranu za temeljitu regresiju. Kod utvrđivanja vrijednosti Bmax i Kd iz podataka o vezivanju do zasićenja uvijek treba primijeniti ispravak za potrošnju liganada (npr. upotrebom Swillensove metode iz 1995.).
|
Test konkurentskog vezivanja
|
53.
|
Krivulja konkurentskog vezivanja grafički se prikazuje kao specifično vezivanje [3H]-17β-estradiola u odnosu na koncentraciju (log10 jedinice) konkurenta. Koncentracija ispitivane kemikalije koja inhibira 50 % najvećeg specifičnog vezivanja [3H]-17β-estradiola čini vrijednost IC50.
|
|
54.
|
Procjene za vrijednosti log(IC50) za pozitivne kontrole (npr. referentni estrogen i kemikalija koja se slabo veže) treba utvrditi upotrebom primjerenog softvera za nelinearno prilagođavanje krivulje kako bi se prilagodila Hillova jednadžba s četiri parametra (npr. BioSoft; McPherson, 1985.; Motulsky, 1995.). Vrh, dno, nagib i log(IC50) obično ne bi trebalo ograničavati pri prilagođavanju tih krivulja. Pri utvrđivanju najbolje prilagodbe treba upotrijebiti temeljitu regresiju osim ako se obrazloži drugačiji odabir. Ne treba primijeniti ispravak za potrošnju liganada. Nakon početne analize svaku krivulju vezivanja treba pregledati kako bi se osigurala odgovarajuća prilagodba modelu. Relativni afinitet vezivanja (RBA) za kemikaliju koja se slabo veže treba izračunati kao postotak log (IC50) za kemikaliju koja se slabo veže u odnosu na log (IC50) za 17β-estradiol. Rezultate iz pozitivnih kontrola i kontrola s kemikalijama koje se ne vežu treba procijeniti upotrebom kriterija uspješnosti testa iz stavaka od 44. do 49. ovog Dodatka 3.
|
|
55.
|
Podatke za sve ispitivane kemikalije treba analizirati upotrebom stupnjevitog pristupa kako bi se osiguralo da su podaci primjereno analizirani i da je svaka krivulja konkurentskog vezivanja pravilno razvrstana. Preporučuje se da se svaki ciklus za ispitivanu kemikaliju prvo podvrgne standardiziranoj analizi podataka koja je identična analizi upotrijebljenoj za referentni estrogen i kontrole kemikalije koja se slabo veže (vidjeti stavak 54. ovog Dodatka 3.). Kada se to dovrši, treba izvršiti tehnički pregled parametara prilagođene krivulje i vizualni pregled mjere u kojoj podaci odgovaraju izrađenoj krivulji konkurentskog vezivanja za svaki ciklus. Tijekom tog tehničkog pregleda dobar pokazatelj toga da su test i analiza podataka pravilno provedeni uključuju opažanje smanjenja postotka specifično vezanog [3H]-17β-estradiola koje ovisi o koncentraciji, malu varijabilnost među tehničkim ponavljanjima pri svakoj koncentraciji ispitivane kemikalije i dosljednost u parametrima prilagodbe između tri ciklusa.
|
Tumačenje podataka
|
56.
|
Pod uvjetom da su ispunjeni svi kriteriji prihvatljivosti, ispitivana kemikalija smatra se kemikalijom koja se veže na receptor hrERα ako se krivulja vezivanja može prilagoditi te je najniža točka na krivulji odgovora u rasponu podataka manja od 50 % (slika 1.).
|
|
57.
|
Pod uvjetom da su ispunjeni svi kriteriji prihvatljivosti, ispitivana kemikalija smatra se kemikalijom koja se ne veže na receptor hrERα:
|
—
|
ako se krivulja vezivanja može prilagoditi i ako je najniža točka na prilagođenoj krivulji odgovora u rasponu podataka veća od 75 %, ili
|
|
—
|
ako se krivulja vezivanja ne može prilagoditi i ako je najniži neizglađeni prosječni postotak vezivanja među skupinama koncentracija u podacima veći od 75 %.
|
|
|
58.
|
Smatra se da ispitivane kemikalije daju dvosmislen odgovor ako se ne ispuni nijedan od prethodno navedenih uvjeta (npr. najniža točka na prilagođenoj krivulji odgovora nalazi se između 76 i 51 %).
|
Tablica 7
Kriteriji za dodjelu razvrstavanja na temelju krivulje konkurentskog vezivanja za ispitivanu kemikaliju
|
Razvrstavanje
|
Kriteriji
|
|
Kemikalija koja se vežea
|
Može se prilagoditi krivulja vezivanja.
Najniža točka na krivulji odgovora u rasponu podataka manja je od 50 %.
|
|
Kemikalija koja se ne vežeb
|
Ako se krivulja vezivanja može prilagoditi,
najniža točka na prilagođenoj krivulji odgovora u rasponu podataka veća je od 75 %.
Ako se krivulja vezivanja ne može prilagoditi,
najniži neizglađeni prosječni postotak vezivanja među skupinama koncentracija u podacima veći je od 75 %.
|
|
Daje dvosmislen odgovorc
|
Bilo koji ciklus koji se može ispitati, a nije ni kemikalija koja se veže ni koja se ne veže (npr. najniža točka na prilagođenoj krivulji odgovora nalazi se između 76 i 51 %).
|
Slika 1
Primjeri razvrstavanja ispitivanih kemikalija upotrebom krivulje konkurentskog vezivanja

|
59.
|
Višestruki ciklusi koji se provedu u laboratoriju za ispitivanu kemikaliju kombiniraju se dodjeljivanjem numeričkih vrijednosti svakom ciklusu i određivanjem prosjeka svih ciklusa kako je prikazano u tablici 8. Rezultati za kombinirane cikluse u svakom laboratoriju uspoređuju se s očekivanim razvrstavanjem za svaku ispitivanu kemikaliju.
|
Tablica 8
Metoda za razvrstavanje ispitivane kemikalije upotrebom višestrukih ciklusa unutar laboratorija
|
Za dodjelu vrijednosti svakom ciklusu:
|
|
Razvrstavanje
|
Brojčana vrijednost
|
|
Kemikalija koja se veže
|
2
|
|
Daje dvosmislen odgovor
|
1
|
|
Kemikalija koja se ne veže
|
0
|
|
Za razvrstavanje prosječne brojčane vrijednosti u svim ciklusima:
|
|
Razvrstavanje
|
Brojčana vrijednost
|
|
Kemikalija koja se veže
|
Prosječno ≥ 1,5
|
|
Daje dvosmislen odgovor
|
0,5 ≤ prosječno < 1,5
|
|
Kemikalija koja se ne veže
|
Prosječno < 0,5
|
IZVJEŠĆE O ISPITIVANJU
|
60.
|
Vidjeti stavak 24. u odjeljku „SASTAVNICE TESTA VEZIVANJA NA hrER” ove ispitne metode.
|
Dodatak 3.1.
POPIS TERMINA
[3H]E2
: 17β-estradiol radioaktivno obilježen tricijem.
DCC
: ugljen premazan dekstranom.
E2
: neobilježeni 17β-estradiol (inertni).
Testni pufer
: 10 mM Tris-HCl, pH-vrijednosti 7,4, s 1 mM EDTA-e, 1 mM EGTA-e, 1 mM NaVO3, 10 % glicerola, 0,2 mM leupeptina, 1 mM ditiotreitola i 10 mg/ml goveđeg serumskog albumina.
hrERα
: ljudski rekombinantni estrogenski receptor alfa (domena vezivanja liganda).
Ponavljanje
: jedna od više jažica s istim sadržajem u istoj koncentraciji koje se ispituju istodobno u istom ciklusu. U ovom se protokolu svaka koncentracija ispitivane kemikalije ispituje u tri ponavljanja; drugim riječima, tri se ponavljanja ispituju istovremeno pri svakoj koncentraciji ispitivane kemikalije.
Ciklus
: cijeli skup jažica s istodobno provedenim testovima na mikrotitracijskoj ploči koji daje sve informacije potrebne za opis vezivanja ispitivane kemikalije na receptor hrERα (odnosno ukupni [3H]-17β-estradiol dodan testnoj jažici, najveće vezivanje [3H]-17β-estradiola na receptore hrERα, nespecifično vezivanje i ukupno vezivanje pri različitim koncentracijama ispitivane kemikalije). Ciklus se može sastojati od samo jedne testne jažice (tj. ponovljeni uzorak) po koncentraciji, ali zbog toga što se ovim protokolom zahtijeva ispitivanje u tri ponavljanja, jedan se ciklus sastoji od tri testne jažice po koncentraciji. Osim toga, ovim se protokolom zahtijevaju tri neovisna (tj. neistodobna) ciklusa po kemikaliji.
Dodatak 3.2.
RASPORED JAŽICA ZA TEST KONKURENTSKOG VEZIVANJA
|
Ploča
|
Položaj
|
Ponavljanje
|
Vrsta jažice
|
Šifra jažice
|
Šifra koncentracije
|
Poč. konc. konkurenta (M)
|
Glavni hrER (μl)
|
Vol. pufera (μl)
|
Vol. obilj. (rad. obilj. E2) (μl)
|
Vol. s ploče za razrj. (μl)
|
Konačni volumen (μl)
|
Konačna koncentracija konkurenta (M)
|
|
S
|
A1
|
1
|
slijepa proba
|
BK
|
BK1
|
—
|
—
|
—
|
—
|
—
|
—
|
—
|
|
S
|
A2
|
2
|
slijepa proba
|
BK
|
BK2
|
—
|
—
|
—
|
—
|
—
|
—
|
—
|
|
S
|
A3
|
3
|
slijepa proba
|
BK
|
BK3
|
—
|
—
|
—
|
—
|
—
|
—
|
—
|
|
S
|
B1
|
1
|
neobilježeni E2
|
S
|
S1
|
1,00E-10
|
30
|
50
|
10
|
10
|
100
|
1,0E-11
|
|
S
|
B2
|
2
|
neobilježeni E2
|
S
|
S1
|
1,00E-10
|
30
|
50
|
10
|
10
|
100
|
1,0E-11
|
|
S
|
B3
|
3
|
neobilježeni E2
|
S
|
S1
|
1,00E-10
|
30
|
50
|
10
|
10
|
100
|
1,0E-11
|
|
S
|
C1
|
1
|
neobilježeni E2
|
S
|
S2
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
S
|
C2
|
2
|
neobilježeni E2
|
S
|
S2
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
S
|
C3
|
3
|
neobilježeni E2
|
S
|
S2
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
S
|
D1
|
1
|
neobilježeni E2
|
S
|
S3
|
3,16E-09
|
30
|
50
|
10
|
10
|
100
|
3,2E-10
|
|
S
|
D2
|
2
|
neobilježeni E2
|
S
|
S3
|
3,16E-09
|
30
|
50
|
10
|
10
|
100
|
3,2E-10
|
|
S
|
D3
|
3
|
neobilježeni E2
|
S
|
S3
|
3,16E-09
|
30
|
50
|
10
|
10
|
100
|
3,2E-10
|
|
S
|
E1
|
1
|
neobilježeni E2
|
S
|
S4
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
S
|
E2
|
2
|
neobilježeni E2
|
S
|
S4
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
S
|
E3
|
3
|
neobilježeni E2
|
S
|
S4
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
S
|
F1
|
1
|
neobilježeni E2
|
S
|
S5
|
3,16E-08
|
30
|
50
|
10
|
10
|
100
|
3,2E-09
|
|
S
|
F2
|
2
|
neobilježeni E2
|
S
|
S5
|
3,16E-08
|
30
|
50
|
10
|
10
|
100
|
3,2E-09
|
|
S
|
F3
|
3
|
neobilježeni E2
|
S
|
S5
|
3,16E-08
|
30
|
50
|
10
|
10
|
100
|
3,2E-09
|
|
S
|
G1
|
1
|
neobilježeni E2
|
S
|
S6
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
S
|
G2
|
2
|
neobilježeni E2
|
S
|
S6
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
S
|
G3
|
3
|
neobilježeni E2
|
S
|
S6
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
S
|
H1
|
1
|
neobilježeni E2
|
S
|
S7
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
S
|
H2
|
2
|
neobilježeni E2
|
S
|
S7
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
S
|
H3
|
3
|
neobilježeni E2
|
S
|
S7
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
S
|
A4
|
1
|
noretinodrel
|
NE
|
WP1
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
S
|
A5
|
2
|
noretinodrel
|
NE
|
WP1
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
S
|
A6
|
3
|
noretinodrel
|
NE
|
WP1
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
S
|
B4
|
1
|
noretinodrel
|
NE
|
WP2
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
S
|
B5
|
2
|
noretinodrel
|
NE
|
WP2
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
S
|
B6
|
3
|
noretinodrel
|
NE
|
WP2
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
S
|
C4
|
1
|
noretinodrel
|
NE
|
WP3
|
3,16E-07
|
30
|
50
|
10
|
10
|
100
|
3,2E-08
|
|
S
|
C5
|
2
|
noretinodrel
|
NE
|
WP3
|
3,16E-07
|
30
|
50
|
10
|
10
|
100
|
3,2E-08
|
|
S
|
C6
|
3
|
noretinodrel
|
NE
|
WP3
|
3,16E-07
|
30
|
50
|
10
|
10
|
100
|
3,2E-08
|
|
S
|
D4
|
1
|
noretinodrel
|
NE
|
WP4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
S
|
D5
|
2
|
noretinodrel
|
NE
|
WP4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
S
|
D6
|
3
|
noretinodrel
|
NE
|
WP4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
S
|
E4
|
1
|
noretinodrel
|
NE
|
WP5
|
3,16E-06
|
30
|
50
|
10
|
10
|
100
|
3,2E-07
|
|
S
|
E5
|
2
|
noretinodrel
|
NE
|
WP5
|
3,16E-06
|
30
|
50
|
10
|
10
|
100
|
3,2E-07
|
|
S
|
E6
|
3
|
noretinodrel
|
NE
|
WP5
|
3,16E-06
|
30
|
50
|
10
|
10
|
100
|
3,2E-07
|
|
S
|
F4
|
1
|
noretinodrel
|
NE
|
WP6
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
S
|
F5
|
2
|
noretinodrel
|
NE
|
WP6
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
S
|
F6
|
3
|
noretinodrel
|
NE
|
WP6
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
S
|
G4
|
1
|
noretinodrel
|
NE
|
WP7
|
3,16E-05
|
30
|
50
|
10
|
10
|
100
|
3,2E-06
|
|
S
|
G5
|
2
|
noretinodrel
|
NE
|
WP7
|
3,16E-05
|
30
|
50
|
10
|
10
|
100
|
3,2E-06
|
|
S
|
G6
|
3
|
noretinodrel
|
NE
|
WP7
|
3,16E-05
|
30
|
50
|
10
|
10
|
100
|
3,2E-06
|
|
S
|
H4
|
1
|
noretinodrel
|
NE
|
WP8
|
3,16E-04
|
30
|
50
|
10
|
10
|
100
|
3,2E-05
|
|
S
|
H5
|
2
|
noretinodrel
|
NE
|
WP8
|
3,16E-04
|
30
|
50
|
10
|
10
|
100
|
3,2E-05
|
|
S
|
H6
|
3
|
noretinodrel
|
NE
|
WP8
|
3,16E-04
|
30
|
50
|
10
|
10
|
100
|
3,2E-05
|
|
S
|
A7
|
1
|
OTES
|
N
|
OTES1
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
S
|
A8
|
2
|
OTES
|
N
|
OTES1
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
S
|
A9
|
3
|
OTES
|
N
|
OTES1
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
S
|
B7
|
1
|
OTES
|
N
|
OTES2
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
S
|
B8
|
2
|
OTES
|
N
|
OTES2
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
S
|
B9
|
3
|
OTES
|
N
|
OTES2
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
S
|
C7
|
1
|
OTES
|
N
|
OTES3
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
S
|
C8
|
2
|
OTES
|
N
|
OTES3
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
S
|
C9
|
3
|
OTES
|
N
|
OTES3
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
S
|
D7
|
1
|
OTES
|
N
|
OTES4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
S
|
D8
|
2
|
OTES
|
N
|
OTES4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
S
|
D9
|
3
|
OTES
|
N
|
OTES4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
S
|
E7
|
1
|
OTES
|
N
|
OTES5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
S
|
E8
|
2
|
OTES
|
N
|
OTES5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
S
|
E9
|
3
|
OTES
|
N
|
OTES5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
S
|
F7
|
1
|
OTES
|
N
|
OTES6
|
1,00E-04
|
30
|
50
|
10
|
10
|
100
|
1,0E-05
|
|
S
|
F8
|
2
|
OTES
|
N
|
OTES6
|
1,00E-04
|
30
|
50
|
10
|
10
|
100
|
1,0E-05
|
|
S
|
F9
|
3
|
OTES
|
N
|
OTES6
|
1,00E-04
|
30
|
50
|
10
|
10
|
100
|
1,0E-05
|
|
S
|
G7
|
1
|
OTES
|
N
|
OTES7
|
1,00E-03
|
30
|
50
|
10
|
10
|
100
|
1,0E-04
|
|
S
|
G8
|
2
|
OTES
|
N
|
OTES7
|
1,00E-03
|
30
|
50
|
10
|
10
|
100
|
1,0E-04
|
|
S
|
G9
|
3
|
OTES
|
N
|
OTES7
|
1,00E-03
|
30
|
50
|
10
|
10
|
100
|
1,0E-04
|
|
S
|
H7
|
1
|
OTES
|
N
|
OTES8DBP7
|
1,00E-02
|
30
|
50
|
10
|
10
|
100
|
1,0E-03
|
|
S
|
H8
|
2
|
OTES
|
N
|
OTES88
|
1,00E-02
|
30
|
50
|
10
|
10
|
100
|
1,0E-03
|
|
S
|
H9
|
3
|
OTES
|
N
|
OTES8
|
1,00E-02
|
30
|
50
|
10
|
10
|
100
|
1,0E-03
|
|
S
|
A10
|
1
|
ukupno vezivanje
|
TB
|
TB1
|
—
|
30
|
60
|
10
|
—
|
100
|
—
|
|
S
|
A11
|
2
|
ukupno vezivanje
|
TB
|
TB2
|
—
|
30
|
60
|
10
|
—
|
100
|
—
|
|
S
|
A12
|
3
|
ukupno vezivanje
|
TB
|
TB3
|
—
|
30
|
60
|
10
|
—
|
100
|
—
|
|
S
|
B10
|
4
|
ukupno vezivanje
|
TB
|
TB4
|
—
|
30
|
60
|
10
|
—
|
100
|
—
|
|
S
|
B11
|
5
|
ukupno vezivanje
|
TB
|
TB5
|
—
|
30
|
60
|
10
|
—
|
100
|
—
|
|
S
|
B12
|
6
|
ukupno vezivanje
|
TB
|
TB6
|
—
|
30
|
60
|
10
|
—
|
100
|
—
|
|
S
|
C10
|
1
|
neob. E2 (visoki)
|
NSB
|
S1
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
S
|
C11
|
2
|
neob. E2 (visoki)
|
NSB
|
S2
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
S
|
C12
|
3
|
neob. E2 (visoki)
|
NSB
|
S3
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
S
|
D10
|
4
|
neob. E2 (visoki)
|
NSB
|
S4
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
S
|
D11
|
5
|
neob. E2 (visoki)
|
NSB
|
S5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
S
|
D12
|
6
|
neob. E2 (visoki)
|
NSB
|
S6
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
S
|
E10
|
1
|
kontr. s puferom
|
BC
|
BC1
|
—
|
—
|
100
|
—
|
—
|
100
|
—
|
|
S
|
E11
|
2
|
kontr. s puferom
|
BC
|
BC2
|
—
|
—
|
100
|
—
|
—
|
100
|
—
|
|
S
|
E12
|
3
|
kontr. s puferom
|
BC
|
BC3
|
—
|
—
|
100
|
—
|
—
|
100
|
—
|
|
S
|
F10
|
4
|
kontr. s puferom
|
BC
|
BC4
|
—
|
—
|
100
|
—
|
—
|
100
|
—
|
|
S
|
F11
|
5
|
kontr. s puferom
|
BC
|
BC5
|
—
|
—
|
100
|
—
|
—
|
100
|
—
|
|
S
|
F12
|
6
|
kontr. s puferom
|
BC
|
BC6
|
—
|
—
|
100
|
—
|
—
|
100
|
—
|
|
S
|
G10 (*17)
|
1
|
sl. proba (za rad.)
|
radioakt.
|
H1
|
—
|
90
|
—
|
10
|
—
|
100
|
—
|
|
S
|
G11 (*17)
|
2
|
sl. proba (za rad.)
|
radioakt.
|
H2
|
—
|
90
|
—
|
10
|
—
|
100
|
—
|
|
S
|
G12 (*17)
|
3
|
sl. proba (za rad.)
|
radioakt.
|
H3
|
—
|
90
|
—
|
10
|
—
|
100
|
—
|
|
S
|
H10 (*17)
|
4
|
sl. proba (za rad.)
|
radioakt.
|
H4
|
—
|
90
|
—
|
10
|
—
|
100
|
—
|
|
S
|
H11 (*17)
|
5
|
sl. proba (za rad.)
|
radioakt.
|
H5
|
—
|
90
|
—
|
10
|
—
|
100
|
—
|
|
S
|
H12
|
6
|
sl. proba (za rad.)
|
radioakt.
|
H6
|
—
|
90
|
—
|
10
|
—
|
100
|
—
|
|
P1
|
A1
|
1
|
nepoznato 1
|
U1
|
1
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
P1
|
A2
|
2
|
nepoznato 1
|
U1
|
1
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
P1
|
A3
|
3
|
nepoznato 1
|
U1
|
1
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
P1
|
B1
|
1
|
nepoznato 1
|
U1
|
2
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
P1
|
B2
|
2
|
nepoznato 1
|
U1
|
2
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
P1
|
B3
|
3
|
nepoznato 1
|
U1
|
2
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
P1
|
C1
|
1
|
nepoznato 1
|
U1
|
3
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
P1
|
C2
|
2
|
nepoznato 1
|
U1
|
3
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
P1
|
C3
|
3
|
nepoznato 1
|
U1
|
3
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
P1
|
D1
|
1
|
nepoznato 1
|
U1
|
4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
P1
|
D2
|
2
|
nepoznato 1
|
U1
|
4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
P1
|
D3
|
3
|
nepoznato 1
|
U1
|
4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
P1
|
E1
|
1
|
nepoznato 1
|
U1
|
5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
E2
|
2
|
nepoznato 1
|
U1
|
5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
E3
|
3
|
nepoznato 1
|
U1
|
5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
F1
|
1
|
nepoznato 1
|
U1
|
6
|
1,00E-04
|
30
|
50
|
10
|
10
|
100
|
1,0E-05
|
|
P1
|
F2
|
2
|
nepoznato 1
|
U1
|
6
|
1,00E-04
|
30
|
50
|
10
|
10
|
100
|
1,0E-05
|
|
P1
|
F3
|
3
|
nepoznato 1
|
U1
|
6
|
1,00E-04
|
30
|
50
|
10
|
10
|
100
|
1,0E-05
|
|
P1
|
G1
|
1
|
nepoznato 1
|
U1
|
7
|
1,00E-03
|
30
|
50
|
10
|
10
|
100
|
1,0E-04
|
|
P1
|
G2
|
2
|
nepoznato 1
|
U1
|
7
|
1,00E-03
|
30
|
50
|
10
|
10
|
100
|
1,0E-04
|
|
P1
|
G3
|
3
|
nepoznato 1
|
U1
|
7
|
1,00E-03
|
30
|
50
|
10
|
10
|
100
|
1,0E-04
|
|
P1
|
H1
|
1
|
nepoznato 1
|
U1
|
8
|
1,00E-02
|
30
|
50
|
10
|
10
|
100
|
1,0E-03
|
|
P1
|
H2
|
2
|
nepoznato 1
|
U1
|
8
|
1,00E-02
|
30
|
50
|
10
|
10
|
100
|
1,0E-03
|
|
P1
|
H3
|
3
|
nepoznato 1
|
U1
|
8
|
1,00E-02
|
30
|
50
|
10
|
10
|
100
|
1,0E-03
|
|
P1
|
A4
|
1
|
nepoznato 2
|
U2
|
1
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
P1
|
A5
|
2
|
nepoznato 2
|
U2
|
1
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
P1
|
A6
|
3
|
nepoznato 2
|
U2
|
1
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
P1
|
B4
|
1
|
nepoznato 2
|
U2
|
2
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
P1
|
B5
|
2
|
nepoznato 2
|
U2
|
2
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
P1
|
B6
|
3
|
nepoznato 2
|
U2
|
2
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
P1
|
C4
|
1
|
nepoznato 2
|
U2
|
3
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
P1
|
C5
|
2
|
nepoznato 2
|
U2
|
3
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
P1
|
C6
|
3
|
nepoznato 2
|
U2
|
3
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
P1
|
D4
|
1
|
nepoznato 2
|
U2
|
4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
P1
|
D5
|
2
|
nepoznato 2
|
U2
|
4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
P1
|
D6
|
3
|
nepoznato 2
|
U2
|
4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
P1
|
E4
|
1
|
nepoznato 2
|
U2
|
5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
E5
|
2
|
nepoznato 2
|
U2
|
5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
E6
|
3
|
nepoznato 2
|
U2
|
5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
F4
|
1
|
nepoznato 2
|
U2
|
6
|
1,00E-04
|
30
|
50
|
10
|
10
|
100
|
1,0E-05
|
|
P1
|
F5
|
2
|
nepoznato 2
|
U2
|
6
|
1,00E-04
|
30
|
50
|
10
|
10
|
100
|
1,0E-05
|
|
P1
|
F6
|
3
|
nepoznato 2
|
U2
|
6
|
1,00E-04
|
30
|
50
|
10
|
10
|
100
|
1,0E-05
|
|
P1
|
G4
|
1
|
nepoznato 2
|
U2
|
7
|
1,00E-03
|
30
|
50
|
10
|
10
|
100
|
1,0E-04
|
|
P1
|
G5
|
2
|
nepoznato 2
|
U2
|
7
|
1,00E-03
|
30
|
50
|
10
|
10
|
100
|
1,0E-04
|
|
P1
|
G6
|
3
|
nepoznato 2
|
U2
|
7
|
1,00E-03
|
30
|
50
|
10
|
10
|
100
|
1,0E-04
|
|
P1
|
H4
|
1
|
nepoznato 2
|
U2
|
8
|
1,00E-02
|
30
|
50
|
10
|
10
|
100
|
1,0E-03
|
|
P1
|
H5
|
2
|
nepoznato 2
|
U2
|
8
|
1,00E-02
|
30
|
50
|
10
|
10
|
100
|
1,0E-03
|
|
P1
|
H6
|
3
|
nepoznato 2
|
U2
|
8
|
1,00E-02
|
30
|
50
|
10
|
10
|
100
|
1,0E-03
|
|
P1
|
A7
|
1
|
nepoznato 3
|
U3
|
1
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
P1
|
A8
|
2
|
nepoznato 3
|
U3
|
1
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
P1
|
A9
|
3
|
nepoznato 3
|
U3
|
1
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
P1
|
B7
|
1
|
nepoznato 3
|
U3
|
2
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
P1
|
B8
|
2
|
nepoznato 3
|
U3
|
2
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
P1
|
B9
|
3
|
nepoznato 3
|
U3
|
2
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
P1
|
C7
|
1
|
nepoznato 3
|
U3
|
3
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
P1
|
C8
|
2
|
nepoznato 3
|
U3
|
3
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
P1
|
C9
|
3
|
nepoznato 3
|
U3
|
3
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
P1
|
D7
|
1
|
nepoznato 3
|
U3
|
4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
P1
|
D8
|
2
|
nepoznato 3
|
U3
|
4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
P1
|
D9
|
3
|
nepoznato 3
|
U3
|
4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
P1
|
E7
|
1
|
nepoznato 3
|
U3
|
5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
E8
|
2
|
nepoznato 3
|
U3
|
5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
E9
|
3
|
nepoznato 3
|
U3
|
5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
F7
|
1
|
nepoznato 3
|
U3
|
6
|
1,00E-04
|
30
|
50
|
10
|
10
|
100
|
1,0E-05
|
|
P1
|
F8
|
2
|
nepoznato 3
|
U3
|
6
|
1,00E-04
|
30
|
50
|
10
|
10
|
100
|
1,0E-05
|
|
P1
|
F9
|
3
|
nepoznato 3
|
U3
|
6
|
1,00E-04
|
30
|
50
|
10
|
10
|
100
|
1,0E-05
|
|
P1
|
G7
|
1
|
nepoznato 3
|
U3
|
7
|
1,00E-03
|
30
|
50
|
10
|
10
|
100
|
1,0E-04
|
|
P1
|
G8
|
2
|
nepoznato 3
|
U3
|
7
|
1,00E-03
|
30
|
50
|
10
|
10
|
100
|
1,0E-04
|
|
P1
|
G9
|
3
|
nepoznato 3
|
U3
|
7
|
1,00E-03
|
30
|
50
|
10
|
10
|
100
|
1,0E-04
|
|
P1
|
H7
|
1
|
nepoznato 3
|
U3
|
8
|
1,00E-02
|
30
|
50
|
10
|
10
|
100
|
1,0E-03
|
|
P1
|
H8
|
2
|
nepoznato 3
|
U3
|
8
|
1,00E-02
|
30
|
50
|
10
|
10
|
100
|
1,0E-03
|
|
P1
|
H9
|
3
|
nepoznato 3
|
U3
|
8
|
1,00E-02
|
30
|
50
|
10
|
10
|
100
|
1,0E-03
|
|
P1
|
A10
|
1
|
kontr. E2 (max)
|
S
|
E2max1
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,00E-07
|
|
P1
|
A11
|
2
|
kontr. E2 (max)
|
S
|
E2max2
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,00E-07
|
|
P1
|
A12
|
3
|
kontr. E2 (max)
|
S
|
E2max3
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,00E-07
|
|
P1
|
B10
|
1
|
kontr. E2 (IC50)
|
S
|
E2IC501
|
E2IC50x10
|
30
|
50
|
10
|
10
|
100
|
E2IC50
|
|
P1
|
B11
|
2
|
kontr. E2 (IC50)
|
S
|
E2IC502
|
E2IC50x10
|
30
|
50
|
10
|
10
|
100
|
E2IC50
|
|
P1
|
B12
|
3
|
kontr. E2 (IC50)
|
S
|
E2IC503
|
E2IC50x10
|
30
|
50
|
10
|
10
|
100
|
E2IC50
|
|
P1
|
C10
|
1
|
kontr. NE (max)
|
S
|
Nemax1
|
1,00E-3,5
|
30
|
50
|
10
|
10
|
100
|
1,00E-4,5
|
|
P1
|
C11
|
2
|
kontr. NE (max)
|
S
|
Nemax2
|
1,00E-3,5
|
30
|
50
|
10
|
10
|
100
|
1,00E-4,5
|
|
P1
|
C12
|
3
|
kontr. NE (max)
|
S
|
Nemax3
|
1,00E-3,5
|
30
|
50
|
10
|
10
|
100
|
1,00E-4,5
|
|
P1
|
D10
|
1
|
kontr. NE (IC50)
|
S
|
NEIC501
|
NEIC50 x10
|
30
|
50
|
10
|
10
|
100
|
NEIC50
|
|
P1
|
D11
|
2
|
kontr. NE (IC50)
|
S
|
NEIC502
|
NEIC50 x10
|
30
|
50
|
10
|
10
|
100
|
NEIC50
|
|
P1
|
D12
|
3
|
kontr. NE (IC50)
|
S
|
NEIC503
|
NEIC50 x10
|
30
|
50
|
10
|
10
|
100
|
NEIC50
|
|
P1
|
E10
|
1
|
neob. E2 (visoki)
|
NSB
|
S1
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
E11
|
2
|
neob. E2 (visoki)
|
NSB
|
S2
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
E12
|
3
|
neob. E2 (visoki)
|
NSB
|
S3
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
F10
|
4
|
neob. E2 (visoki)
|
NSB
|
S4
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
F11
|
5
|
neob. E2 (visoki)
|
NSB
|
S5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
F12
|
6
|
neob. E2 (visoki)
|
NSB
|
S6
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
G10
|
1
|
ukupno vezivanje
|
TB
|
TB1
|
—
|
30
|
60
|
10
|
—
|
100
|
—
|
|
P1
|
G11
|
2
|
ukupno vezivanje
|
TB
|
TB2
|
—
|
30
|
60
|
10
|
—
|
100
|
—
|
|
P1
|
G12
|
3
|
ukupno vezivanje
|
TB
|
TB3
|
—
|
30
|
60
|
10
|
—
|
100
|
—
|
|
P1
|
H10
|
4
|
ukupno vezivanje
|
TB
|
TB4
|
—
|
30
|
60
|
10
|
—
|
100
|
—
|
|
P1
|
H11
|
5
|
ukupno vezivanje
|
TB
|
TB5
|
—
|
30
|
60
|
10
|
—
|
100
|
—
|
|
P1
|
H12
|
6
|
ukupno vezivanje
|
TB
|
TB6
|
—
|
30
|
60
|
10
|
—
|
100
|
—
|
Dodatak 4.
RAZMATRANJA ZA ANALIZU PODATAKA IZ TESTA KONKURENTSKOG VEZIVANJA NA hrER
|
1.
|
Testom konkurentskog vezivanja na hrERα mjeri se vezivanje jedne koncentracije [3H]-17β-estradiola u prisutnosti povećavajućih koncentracija ispitivane kemikalije. Krivulja konkurentskog vezivanja grafički se prikazuje kao specifično vezivanje [3H]-17β-estradiola u odnosu na koncentraciju (log10 jedinice) konkurenta. Koncentracija ispitivane kemikalije koja inhibira 50 % najvećeg specifičnog vezivanja [3H]-17β-estradiola čini IC50.
|
Analiza podataka za referentni estrogen i kemikaliju koja se slabo veže (1.)
|
2.
|
Podaci iz kontrolnih ciklusa transformiraju se (tj. postotak specifičnog vezivanja [3H]-17β-estradiola i log koncentracija kontrolne kemikalije) radi daljnje analize. Procjene za vrijednosti log(IC50) za pozitivne kontrole (npr. referentni estrogen i kemikalija koja se slabo veže) treba utvrditi upotrebom primjerenog softvera za nelinearno prilagođavanje krivulje kako bi se prilagodila Hillova jednadžba s četiri parametra (npr. BioSoft; GraphPad Prism) (2.). Vrh, dno, nagib i log(IC50) obično se mogu ostaviti neograničenima pri prilagođavanju tih krivulja. Pri utvrđivanju najbolje prilagodbe treba upotrijebiti temeljitu regresiju osim ako se obrazloži drugačiji odabir. Treba navesti metodu odabranu za temeljitu regresiju. Za FW i CERI-jev test nije bio potreban ispravak za potrošnju liganada, ali po potrebi može se razmotriti njegova upotreba. Nakon početne analize svaku krivulju vezivanja treba pregledati kako bi se osigurala odgovarajuća prilagodba modelu. Relativni afinitet vezivanja (RBA) za kemikaliju koja se slabo veže može se izračunati kao postotak log (IC50) za kemikaliju koja se slabo veže u odnosu na log (IC50) za 17β-estradiol. Rezultate za pozitivne kontrole i kontrolu s kemikalijom koja se ne veže treba procijeniti upotrebom kriterija uspješnosti testa i kriterija prihvatljivosti kako je opisano u ovoj ispitnoj metodi (stavak 20.), Dodatku 2. (FW test, stavci od 41. do 51.) i Dodatku 3. (CERI-jev test, stavci od 41. do 51.). Primjeri tri ciklusa za referentni estrogen i kemikaliju koja se slabo veže prikazani su na slici 1.
|
Slika 1.
Primjeri krivulja konkurentskog vezivanja za referentni estrogen i kontrolnu kemikaliju koja se slabo veže

Analiza podataka za ispitivane kemikalije
|
3.
|
Podatke za sve ispitivane kemikalije treba analizirati upotrebom stupnjevitog pristupa kako bi se osiguralo da su podaci primjereno analizirani i da je svaka krivulja konkurentskog vezivanja pravilno razvrstana. Svaki ciklus za ispitivanu kemikaliju prvo treba podvrgnuti standardiziranoj analizi podataka koja je identična analizi upotrijebljenoj za referentni estrogen i kontrolne kemikalije koje se slabo vežu. Kada se to dovrši, treba izvršiti tehnički pregled parametara prilagođene krivulje i vizualni pregled mjere u kojoj podaci odgovaraju izrađenoj krivulji konkurentskog vezivanja za svaki ciklus. Tijekom tog tehničkog pregleda dobar pokazatelj toga da su test i analiza podataka pravilno provedeni uključuju opažanje smanjenja postotka specifično vezanog [3H]-17β-estradiola koje ovisi o koncentraciji, malu varijabilnost među tehničkim ponavljanjima pri svakoj koncentraciji kemikalije i dosljednost u parametrima prilagodbe među tri ciklusa. Pri pregledu rezultata iz svakog ciklusa za ispitivanu kemikaliju treba primijeniti stručnu prosudbu, a podaci upotrijebljeni za razvrstavanje ispitivane kemikalije kao kemikalije koja se veže ili koja se ne veže trebaju biti znanstveno opravdani.
|
|
4.
|
Povremeno se mogu pojaviti primjeri podataka za koje je potrebna posebna pozornost kako bi se pravilno analizirali i protumačili podaci o vezivanju na hrER. U prethodnim studijama uočeno je da postoje slučajevi u kojima analiza i tumačenje podataka o konkurentskom vezivanju na receptore mogu biti složeni zbog povećanja postotka specifičnog vezivanja kod ispitivanja kemikalija pri najvišim koncentracijama (slika 2.). To je poznata poteškoća do koje dolazi kod upotrebe protokola za niz testova konkurentskog vezivanja na receptore (3). U tim se slučajevima pri nižim koncentracijama uočava odgovor koji ovisi o koncentraciji, ali kako se koncentracija ispitivane kemikalije približava granici topljivosti prestaje se smanjivati istiskivanje [3H]17β-estradiola. U tim slučajevima podaci za više koncentracije pokazuju da je dosegnuto biološko ograničenje testa. Na primjer, ta je pojava često povezana s netopljivošću kemikalije i taloženjem pri visokim koncentracijama ili može odražavati i prekoračenje sposobnosti ugljena premazanog dekstranom da veže slobodni radioaktivno obilježeni ligand tijekom postupka odvajanja pri najvišim koncentracijama kemikalija. Zadržavanje tih podatkovnih točaka tijekom prilagođavanja podataka o konkurentskom vezivanju u sigmoidnu krivulju ponekad može dovesti do pogrešnog razvrstavanja ispitivane kemikalije u pogledu potencijala vezivanja na estrogenski receptor (slika 2.). Kako bi se to izbjeglo, protokol za FW i CERI-jev test vezivanja na hrER uključuje opciju da se iz analize isključe podatkovne točke kod kojih je srednja vrijednost ponovljenih uzoraka za postotak specifično vezanog [3H]17β-estradiola za 10 % ili više veća iznad srednje vrijednosti uočene pri nižoj koncentraciji (to se obično naziva pravilo od 10 %). Ovo se pravilo može upotrijebiti samo jednom za određenu krivulju i mora ostati dovoljno podataka za najmanje šest koncentracija tako da se krivulju može točno razvrstati.
|
Slika 2.
Primjeri, krivulje konkurentskog vezivanja s upotrebom pravila od 10 % i bez te upotrebe

|
5.
|
Primjerenu upotrebu pravila od 10 % za ispravak tih krivulja treba pažljivo razmotriti i sačuvati za slučajeve u kojima postoji snažna indikacija da je riječ o kemikaliji koja se veže na receptor hrER. Tijekom provedbe pokusa za validacijsku studiju FW testa vezivanja na hrER uočeno je da pravilo od 10 % ponekad ima neplaniranu i nepredviđenu posljedicu. Kemikalije koje nisu bile u interakciji s receptorom (tj. prave kemikalije koje se ne vežu) često su pokazivale varijabilnost u pogledu 100-postotnog vezivanja radioaktivno označenog liganda koja je bila veća od 10 % u cijelom rasponu ispitanih koncentracija. Ako se najniža vrijednost javila pri niskoj koncentraciji, upotrebom pravila od 10 % iz analize bi se potencijalno mogli izbrisati podaci iz svih viših koncentracija iako bi te koncentracije mogle biti korisne u utvrđivanju toga da se kemikalija ne veže. Na slici 3. prikazani su primjeri slučajeva u kojima upotreba pravila od 10 % nije primjerena.
|
Slika 3.
Primjeri, podaci o konkurentskom vezivanju gdje nije primjerena upotreba pravila od 10 %


Referentni dokumenti
|
1.
|
OECD (2015). Integrated Summary Report: Validation of Two Binding Assays Using Human Recombinant Estrogen Receptor Alpha (hrERα), Health and Safety Publications, Series on Testing and Assessment (No 226), Organizacija za gospodarsku suradnju i razvoj, Pariz.
|
|
2.
|
Motulsky H. and Christopoulos A. (2003). The law of mass action, In Fitting Models to Biological Data Using Linear and Non-linear Regression. GraphPad Software Inc., San Diego, CA, str. 187.–191. Www.graphpad.com/manuals/Prism4/RegressionBook.pdf.
|
|
3.
|
Laws SC, Yavanhxay S, Cooper RL, Eldridge JC. (2006). Nature of the Binding Interaction for 50 Structurally Diverse Chemicals with Rat Estrogen Receptors. Toxicological Sci. 94(1):46.–56.
|
B.71.
IN VITRO TESTOVI IZAZIVANJA PREOSJETLJIVOSTI KOŽE KOJIMA SE ISPITUJE KLJUČNI DOGAĐAJ AKTIVIRANJA DENDRITIČNIH STANICA U PUTU NASTANKA ŠTETNOG ISHODA (AOP) IZAZIVANJA PREOSJETLJIVOSTI KOŽE
OPĆI UVOD
Ispitna metoda koja se temelji na ključnom događaju aktiviranja dendritičnih stanica
|
1.
|
Tvar koja izaziva preosjetljivost kože tvar je koja dovodi do alergijske reakcije nakon dodira s kožom, kako je definirana u Globalno usklađenom sustavu razvrstavanja i označivanja kemikalija Ujedinjenih naroda (UN GHS) (1.) te u Uredbi Europske unije (EU) 1272/2008 o razvrstavanju, označivanju i pakiranju tvari i smjesa (Uredba o CLP-u) (99). Postoji opća suglasnost o ključnim biološkim događajima koji izazivaju preosjetljivost kože. Postojeće spoznaje o kemijskim i biološkim mehanizmima koji su povezani s izazivanjem preosjetljivosti kože sažeto su prikazane u obliku puta nastanka štetnog ishoda (engl. Adverse Outcome Pathway – AOP), u okviru OECD-ova programa za AOP (2.), koji se kreće od početnog molekularnog događaja preko međudogađaja do štetnog učinka, tj. alergijskog kontaktnog dermatitisa. U ovom je slučaju početni molekularni događaj (tj. prvi ključni događaj) stvaranje kovalentne veze između elektrofilnih tvari i nukleofilnih središta u proteinima kože. Drugi se ključni događaj u ovom AOP-u odvija u keratinocitima i uključuje upalne odgovore te promjene u genskoj ekspresiji povezane sa specifičnim staničnim signalnim putovima kao što su putovi koji ovise o elementu antioksidacijskog/elektrofilnog odgovora (engl. antioxidant/electrophile response element, ARE). Treći je ključni događaj aktiviranje dendritičnih stanica (DC), koje se obično ocjenjuje prema ekspresiji specifičnih staničnih površinskih biljega, kemokina i citokina. Četvrti je ključni događaj aktiviranje i proliferacija T-stanica, koji se neizravno ocjenjuju analizom lokalnih limfnih čvorova na miševima (LLNA) (3.).
|
|
2.
|
Ova ispitna metoda odgovara Smjernici OECD-a za ispitivanje 442E (2017.). U njoj se opisuju in vitro analize kojima se ispituju mehanizmi opisani u okviru ključnog događaja aktiviranja dendritičnih stanica u AOP-u izazivanja preosjetljivosti kože (2.). Ispitna metoda sastoji se od ispitivanja koja treba primijeniti kao pomoć u razlikovanju tvari koje izazivaju preosjetljivost kože od tvari koje ne izazivaju preosjetljivost kože u skladu sa sustavom UN GHS i Uredbom o CLP-u.
|
|
U ovoj su ispitnoj metodi opisana sljedeća ispitivanja:
|
—
|
test aktiviranja ljudske stanične linije (h-CLAT),
|
|
—
|
test aktiviranja stanične linije U937 (U-SENS™),
|
|
—
|
test reporterskog gena interleukin 8 (test IL-8 Luc).
|
|
|
|
3.
|
Ispitivanja uključena u ovu ispitnu metodu i odgovarajuću smjernicu OECD-a za ispitivanje mogu se razlikovati u odnosu na postupak koji se upotrebljava za dobivanje podataka i izmjerenih očitanja, ali se mogu neselektivno upotrebljavati za ispunjavanje zahtjeva zemalja u pogledu rezultata ispitivanja o ključnom događaju aktiviranja dendritičnih stanica u AOP-u izazivanja preosjetljivosti kože, uz ostvarivanje koristi od OECD-ova uzajamnog prihvaćanja podataka.
|
Kontekst i načela ispitivanja uključenih u ispitnu metodu koja se temelji na ključnom događaju
|
4.
|
U procjenama izazivanja preosjetljivosti kože tradicionalno se upotrebljavaju laboratorijske životinje. Klasičnim metodama u kojima se upotrebljavaju zamorci, a to su Magnusson–Kligmanov maksimizacijski test sa zamorcima (GMPT) i Buehlerov test (ispitna metoda B.6. (4.)), ocjenjuje se i faza indukcije i faza elicitacije izazivanja preosjetljivosti kože. Ispitivanjima na miševima, tj. analizom LLNA (ispitna metoda B.42. (3.)) i njezinim dvjema inačicama u kojima se ne upotrebljavaju radioaktivni izotopi, LLNA: DA (ispitna metoda B.50. (5.)) te LLNA: BrdU-ELISA (ispitna metoda B.51. (6.)), ispituje se isključivo odgovor u fazi indukcije i isto su tako prihvaćene jer omogućuju prednost u odnosu na ispitivanja na zamorcima u smislu dobrobiti životinja s objektivnim mjerenjem faze indukcije izazivanja preosjetljivosti kože.
|
|
5.
|
Nedavno su prihvaćene in chemico i in vitro ispitne metode koje se temelje na mehanističkom pristupu kojima se ispituje prvi ključni događaj (ispitna metoda B.59.; test izravne reaktivnosti peptida (7.)) i drugi ključni događaj (ispitna metoda B.60.; test luciferaze ARE-Nrf2 (8.)) u AOP-u izazivanja preosjetljivosti kože kako bi se pridonijelo ocjenjivanju potencijala opasnosti kemikalija da izazovu preosjetljivost kože.
|
|
6.
|
Ispitivanjima opisanima u ovoj ispitnoj metodi kvantificira se promjena u ekspresiji staničnih površinskih biljega povezanih s procesom aktiviranja monocita i dendritičnih stanica nakon izlaganja tvarima koje izazivaju preosjetljivost (npr. CD54, CD86) ili promjene ekspresije IL-8, citokina povezanog s aktiviranjem dendritičnih stanica. Postoje izvješća o tome da tvari koje izazivaju preosjetljivost kože induciraju ekspresiju staničnih membranskih biljega, kao što su CD40, CD54, CD80, CD83 i CD86, povrh induciranja proupalnih citokina, kao što su IL-1β i TNF-α, i nekoliko kemokina, uključujući IL-8 (CXCL8) i CCL3 (9., 10, 11. i 12.), povezanih s aktiviranjem dendritičnih stanica (2.).
|
|
7.
|
Međutim, budući da je aktiviranje dendritičnih stanica samo jedan ključni događaj AOP-a izazivanja preosjetljivosti kože (2. i 13.), informacije dobivene ispitivanjima kojima se mjere samo biljezi aktiviranja dendritičnih stanica možda neće biti dovoljne za donošenje zaključka o prisustvu ili odsustvu potencijala kemikalija da izazovu preosjetljivost kože. Stoga se predlaže da podaci dobiveni ispitivanjima opisanima u ovoj ispitnoj metodi služe kao pomoć u razlikovanju tvari koje izazivaju preosjetljivost kože (kategorija 1. prema sustavu UN GHS/Uredbi o CLP-u) od tvari koje ne izazivaju preosjetljivost kože kada se upotrebljavaju u okviru integriranih pristupa ispitivanju i procjeni (IATA), zajedno s ostalim relevantnim dodatnim informacijama, npr. onima dobivenima in vitro analizama kojima se ispituju drugi ključni događaji AOP-a izazivanja preosjetljivosti kože te metodama koje ne uključuju ispitivanje, kao i primjenom analogije s kemijski analognim tvarima (13.). Primjeri upotrebe podataka dobivenih ovim ispitivanjima u okviru utvrđenih pristupa, tj. pristupa standardiziranih i u pogledu skupa korištenih izvora informacija i postupka primijenjenog na podatke kako bi se dobila predviđanja, objavljeni su (13.) i mogu se upotrebljavati kao korisni elementi u okviru IATA-e.
|
|
8.
|
Ispitivanja opisana u ovoj ispitnoj metodi ne mogu se upotrijebiti kao jedina metoda za razvrstavanje tvari koje izazivaju preosjetljivost kože u potkategorije 1.A i 1.B kako su definirane u sustavu UN GHS/Uredbi o CLP-u (u slučaju tijela koja primjenjuju te dvije neobavezne potkategorije) ni za predviđanje njihove jakosti pri donošenju odluka o ocjeni sigurnosti. Međutim, ovisno o regulatornom okviru pozitivni rezultati dobiveni ovim metodama mogu se samostalno upotrijebiti za razvrstavanje kemikalije u kategoriju 1. prema sustavu UN GHS/Uredbi o CLP-u.
|
|
9.
|
U ovoj se ispitnoj metodi izraz „ispitivana kemikalija” upotrebljava za označivanje onoga što se ispituje (100) te se ne odnosi na primjenjivost ispitivanja na ispitivanje tvari s jednim sastojkom, tvari s više sastojaka i/ili smjesa. Trenutačno su dostupne ograničene informacije o primjenjivosti ispitivanja na tvari s više sastojaka/smjese (14. i 15.). Unatoč tomu, ispitivanja su tehnički primjenjiva i za ispitivanje tvari s više sastojaka i smjesa. Međutim, prije nego što se ova ispitna metoda primijeni na smjesi radi dobivanja podataka za predviđenu regulatornu svrhu, potrebno je razmotriti mogu li se njome dobiti primjereni rezultati za tu svrhu te ako mogu, zašto (101). Ta razmatranja nisu potrebna ako postoji regulatorni zahtjev za ispitivanje smjese. Osim toga, kada se ispituju tvari s više sastojaka ili smjese, trebalo bi razmotriti moguću interferenciju citotoksične komponente s uočenim odgovorima.
|
LITERATURA
|
1.
|
Ujedinjeni narodi (UN) (2015). Globally Harmonized System of Classification and Labelling of Chemicals (GHS). Sixth revised edition. New York & Geneva: United Nations Publications. ISBN: 978-92-1-117006-1. Dostupno na: https://www.unece.org/trans/danger/publi/ghs/ghs_rev06/06files_e.html.
|
|
2.
|
OECD (2012). The Adverse Outcome Pathway for Skin Sensitisation Initiated by Covalent Binding to Proteins. Part 1: Scientific Evidence. Series on Testing and Assessment No. 168. Dostupno na: http://www.oecd.org/officialdocuments/publicdisplaydocumentpdf/?cote=ENV/JM/MONO(2012)10/PART1&docLanguage=En.
|
|
3.
|
Poglavlje B.42. ovog Priloga: Analiza lokalnih limfnih čvorova.
|
|
4.
|
Poglavlje B.6. ovog Priloga: Izazivanje preosjetljivosti kože.
|
|
5.
|
Poglavlje B.50. ovog Priloga: Izazivanje preosjetljivosti kože: analiza lokalnih limfnih čvorova: DA.
|
|
6.
|
Poglavlje B.51. ovog Priloga: Izazivanje preosjetljivosti kože: analiza lokalnih limfnih čvorova: BrdU-ELISA.
|
|
7.
|
Poglavlje B.59. ovog Priloga: Izazivanje preosjetljivosti kože in chemico: test izravne reaktivnosti peptida (Direct Peptide Reactivity Assay – DPRA).
|
|
8.
|
Poglavlje B.60. ovog Priloga: Izazivanje preosjetljivosti kože in vitro: test luciferaze ARE-Nrf2.
|
|
9.
|
Steinman RM. (1991). The dendritic cell system and its role in immunogenicity. Annu Rev Immunol 9:271.–96.
|
|
10.
|
Caux C, Vanbervliet B, Massacrier C, Azuma M, Okumura K, Lanier LL, and Banchereau J. (1994). B70/B7-2 is identical to CD86 and is the major functional ligand for CD28 expressed on human dendritic cells. J Exp Med 180:1841.–7.
|
|
11.
|
Aiba S, Terunuma A, Manome H, and Tagami H. (1997). Dendritic cells differently respond to haptens and irritants by their production of cytokines and expression of co-stimulatory molecules. Eur J Immunol 27:3031.–8.
|
|
12.
|
Aiba S, Manome H, Nakagawa S, Mollah ZU, Mizuashi M, Ohtani T, Yoshino Y, and Tagami. H. (2003). p38 mitogen-activated protein kinase and extracellular signal-regulated kinases play distinct roles in the activation of dendritic cells by two representative haptens, NiCl2 and DNCB. J Invest Dermatol 120:390.–8.
|
|
13.
|
OECD (2016). Series on Testing & Assessment No 256: Guidance Document On The Reporting Of Defined Approaches And Individual Information Sources To Be Used Within Integrated Approaches To Testing And Assessment (IATA) For Skin Sensitisation, Annex 1 and Annex 2. ENV/JM/HA(2016)29. Organizacija za gospodarsku suradnju i razvoj, Pariz. Dostupno na: https://community.oecd.org/community/iatass.
|
|
14.
|
Ashikaga T, Sakaguchi H, Sono S, Kosaka N, Ishikawa M, Nukada Y, Miyazawa M, Ito Y, NishiyamaN, Itagaki H. (2010). A comparative evaluation of in vitro skin sensitisation tests: the human cell-line activation test (h-CLAT) versus the local lymph node assay (LLNA). Altern. Lab. Anim. 38, 275.–284.
|
|
15.
|
Piroird, C., Ovigne, J.M., Rousset, F., Martinozzi-Teissier, S., Gomes, C., Cotovio, J., Alépée, N. (2015). The Myeloid U937 Skin Sensitization Test (U-SENS) addresses the activation of dendritic cell event in the adverse outcome pathway for skin sensitization. Toxicol. In Vitro 29, 901.–916.
|
Dodatak 1.
IZAZIVANJE PREOSJETLJIVOSTI KOŽE IN VITRO: TEST AKTIVIRANJA LJUDSKE STANIČNE LINIJE (H-CLAT)
POČETNA RAZMATRANJA I OGRANIČENJA
|
1.
|
Testom h-CLAT kvantificiraju se promjene u ekspresiji staničnih površinskih biljega povezanih s procesom aktiviranja monocita i dendritičnih stanica (DC) (tj. CD86 i CD54) kod ljudske stanične linije monocitne leukemije THP-1 nakon izlaganja tvarima koje izazivaju preosjetljivost (1. i 2.). Izmjerene razine ekspresije staničnih površinskih biljega CD86 i CD54 zatim se upotrebljavaju kao pomoć u razlikovanju tvari koje izazivaju preosjetljivost kože od tvari koje ne izazivaju preosjetljivost kože.
|
|
2.
|
Test h-CLAT ocijenjen je u validacijskoj studiji kojom je koordinirao Referentni laboratorij Europske unije za alternative ispitivanju na životinjama (EURL ECVAM) i kasnijem neovisnom stručnom pregledu koji je proveo EURL ECVAM-ov Znanstveni savjetodavni odbor (ESAC). Uzimajući u obzir sve dostupne dokaze i informacije regulatornih tijela i dionika, EURL ECVAM preporučio je da se test h-CLAT (3.) primjenjuje u okviru IATA-e kao pomoć u razlikovanju tvari koje izazivaju preosjetljivost od tvari koje ne izazivaju preosjetljivost u svrhu razvrstavanja i označivanja prema opasnosti. U literaturi su navedeni primjeri upotrebe podataka dobivenih testom h-CLAT u kombinaciji s ostalim informacijama (4., 5., 6., 7., 8., 9., 10. i 11.).
|
|
3.
|
Pokazalo se da se test h-CLAT može prenijeti u laboratorije koji imaju iskustva s tehnikama staničnih kultura i analizom protočnom citometrijom. Može se očekivati da će za predviđanja donesena s pomoću ovog testa razina obnovljivosti unutar jednog laboratorija i između više laboratorija biti reda veličine 80 % (3. i 12.). Rezultati dobiveni u validacijskoj studiji (13.) i drugim objavljenim studijama (14.) ukupno pokazuju da, u usporedbi s rezultatima analize LLNA, točnost u razlikovanju tvari koje izazivaju preosjetljivost kože (tj. kategorija 1. prema sustavu UN GHS/Uredbi o CLP-u) od tvari koje ne izazivaju preosjetljivost iznosi 85 % (N = 142), uz osjetljivost od 93 % (94/101) i specifičnost od 66 % (27/41) (na temelju ponovne analize EURL ECVAM-a (12.), uzimajući u obzir sve postojeće podatke i ne uzimajući u obzir negativne rezultate za kemikalije čiji je Log Kow veći od 3,5, kako je opisano u stavku 4.). Veća je vjerojatnost da će se testom h-CLAT dobiti lažno negativna predviđanja za kemikalije koje pokazuju nisku do umjerenu jakost u izazivanju preosjetljivosti kože (tj. potkategorija 1.B prema sustavu UN GHS/Uredbi o CLP-u) nego za kemikalije koje pokazuju visoku jakost u izazivanju preosjetljivosti kože (tj. potkategorija 1.A prema sustavu UN GHS/Uredbi o CLP-u) (4., 13. i 15.). Prethodno navedene informacije upućuju na korisnost metode h-CLAT kao elementa koji pridonosi identifikaciji opasnosti od izazivanja preosjetljivosti kože. Međutim, navedene vrijednosti koje se odnose na točnost metode h-CLAT kao samostalnog testa samo su okvirne jer je tu metodu potrebno kombinirati s drugim izvorima informacija u kontekstu IATA-e te u skladu s odredbama stavaka 7. i 8. iz odjeljka „Opći uvod”. Nadalje, pri ocjenjivanju metoda ispitivanja preosjetljivosti kože koje ne uključuju pokuse na životinjama potrebno je imati na umu da ispitivanje LLNA i druga ispitivanja na životinjama možda neće u potpunosti odražavati situaciju kod ljudi.
|
|
4.
|
Trenutačno dostupni podaci pokazuju da se metoda h-CLAT može primijeniti za ispitivanje kemikalija koje obuhvaćaju različite organske funkcionalne skupine, mehanizme reakcije, jakost u izazivanju preosjetljivosti kože (kako je utvrđena istraživanjima in vivo) te fizikalno-kemijska svojstva (3., 14. i 15.). Metoda h-CLAT primjenjiva je na ispitivane kemikalije koje su topljive ili tvore stabilnu disperziju (tj. koloid ili suspenziju u kojoj se ispitivana kemikalija ne taloži ili ne odvaja od otapala/nosača stvarajući različite faze) u odgovarajućem otapalu/nosaču (vidjeti stavak 14.) Ispitivane kemikalije čiji je Log Kow veći od 3,5 obično daju lažno negativne rezultate (14.). Stoga negativne rezultate s ispitivanim kemikalijama čiji je Log Kow veći od 3,5 ne treba razmatrati. Međutim, pozitivni rezultati dobiveni s ispitivanim kemikalijama čiji je Log Kow veći od 3,5 ipak se mogu upotrijebiti kao pomoć u identifikaciji ispitivane kemikalije kao tvari koja izaziva preosjetljivost kože. Nadalje, zbog ograničene metaboličke sposobnosti upotrijebljene stanične linije (16.) i uvjeta pokusa prohapteni (tj. tvari koje zahtijevaju enzimsku aktivaciju, na primjer enzimima P450) i prehapteni (tj. tvari koje se aktiviraju oksidacijom), posebno oni sa sporom stopom oksidacije, isto tako mogu dati negativne rezultate u testu h-CLAT (15.). Testom h-CLAT mogu se ocijeniti fluorescentne ispitivane kemikalije (17.), ali snažne fluorescentne ispitivane kemikalije koje emitiraju na istoj valnoj duljini kao i fluorescein izotiocijanat (FITC) ili propidijev jodid (PI) ometat će otkrivanje protočnom citometrijom i stoga se ne mogu točno ocijeniti upotrebom protutijela konjugiranih FITC-om ili propidijeva jodida. U tom se slučaju mogu upotrijebiti druga protutijela označena fluorokromom ili drugi biljezi citotoksičnosti pod uvjetom da se može dokazati da daju slične rezultate kao i protutijela označena FITC-om (vidjeti stavak 24.) ili propidijev jodid (vidjeti stavak 18.), npr. ispitivanjem tvari za dokazivanje tehničke osposobljenosti u Dodatku 1.2. S obzirom na navedeno, negativne rezultate trebalo bi tumačiti u kontekstu navedenih ograničenja i zajedno s drugim izvorima informacija u okviru IATA-e. U slučajevima u kojima postoje dokazi da se metoda h-CLAT ne može primijeniti za ispitivanje drugih specifičnih kategorija ispitivanih kemikalija, tu metodu ne bi trebalo upotrebljavati za te specifične kategorije.
|
|
5.
|
Kao što je opisano, metoda h-CLAT pomaže u razlikovanju tvari koje izazivaju preosjetljivost kože od tvari koje ne izazivaju preosjetljivost. Međutim, ako se upotrebljava u okviru integriranih pristupa kao što je IATA, mogla bi pridonijeti i procjeni jačine izazivanja preosjetljivosti (4., 5. i 9.). Ipak, kako bi se moglo utvrditi na koji bi način rezultati dobiveni metodom h-CLAT mogli pomoći u toj procjeni, potreban je dodatan rad koji će se po mogućnosti temeljiti na podacima dobivenima na ljudima.
|
|
6.
|
Definicije su navedene u Dodatku 1.1.
|
NAČELO ISPITIVANJA
|
7.
|
Metoda h-CLAT je in vitro analiza kojom se kvantificiraju promjene u ekspresiji staničnih površinskih biljega (tj. CD86 i CD54) na ljudskoj staničnoj liniji monocitne leukemije, stanicama THP-1, nakon 24-satnog izlaganja ispitivanoj kemikaliji. Te površinske molekule tipični su biljezi aktiviranja monocitnog THP-1 i mogu oponašati aktiviranje dendritičnih stanica, koje ima ključnu ulogu u stimulaciji T-stanica. Promjene u ekspresiji površinskih biljega mjere se protočnom citometrijom nakon bojenja stanica protutijelima označenima fluorokromom. Istodobno se provodi i mjerenje citotoksičnosti kako bi se procijenilo dolazi li do povećanja ekspresije površinskih biljega pri subcitotoksičnim koncentracijama. Računa se relativni intenzitet fluorescencije površinskih biljega u usporedbi s kontrolom s otapalom/nosačem te se on upotrebljava u modelu predviđanja (vidjeti stavak 26.) kao pomoć u razlikovanju tvari koje izazivaju preosjetljivost od tvari koje ne izazivaju preosjetljivost.
|
DOKAZIVANJE OSPOSOBLJENOSTI
|
8.
|
Prije rutinske primjene ispitivanja opisanog u ovom Dodatku ispitnoj metodi B.71. laboratoriji bi trebali dokazati svoju tehničku osposobljenost upotrebom deset tvari za dokazivanje tehničke osposobljenosti navedenih u Dodatku 1.2. Osim toga, korisnici ispitivanja trebaju održavati bazu prijašnjih podataka dobivenih provjerama reaktivnosti (vidjeti stavak 11.) te s pozitivnim kontrolama i kontrolama s otapalom/nosačem (vidjeti stavke od 20. do 22.) i trebaju se koristiti tim podacima kako bi potvrdili da je njihov laboratorij održao obnovljivost ispitivanja tijekom vremena.
|
POSTUPAK
|
9.
|
Ovaj se test temelji na protokolu h-CLAT DB-ALM (usluga baze podataka o alternativnim metodama pokusima na životinjama) br. 158 (18.), koji je upotrijebljen u validacijskoj studiji kojom je koordinirao EURL ECVAM. Preporučuje se primjena tog protokola pri provedbi i primjeni metode h-CLAT u laboratoriju. U nastavku su opisane glavne sastavnice i postupci za metodu h-CLAT, koja se sastoji od dva koraka: testa za utvrđivanje doze i mjerenja ekspresije CD86/CD54.
|
Priprema stanica
|
10.
|
Za provođenje metode h-CLAT treba upotrebljavati THP-1, ljudsku staničnu liniju monocitne leukemije. Preporučuje se da se stanice (TIB-202™) nabave iz kompetentne banke stanica kao što je American Type Culture Collection.
|
|
11.
|
Stanice THP-1 uzgajaju se na 37°C s 5 % CO2 i u vlažnim atmosferskim uvjetima u mediju RPMI-1640 obogaćenom s 10 % fetalnog goveđeg seruma (FBS), 0,05 mM 2-merkaptoetanola, 100 jedinica/ml penicilina i 100 μg/ml streptomicina. Može se izbjeći upotreba penicilina i streptomicina u mediju za uzgoj kulture. Međutim, korisnici u tim slučajevima trebaju potvrditi da izostanak antibiotika u mediju za uzgoj kulture ne utječe na rezultate, na primjer, ispitivanjem tvari za dokazivanje tehničke osposobljenosti navedenih u Dodatku 1.2. U svakom slučaju, dobru praksu za održavanje staničnih kultura treba poštovati neovisno o prisustvu ili odsustvu antibiotika u mediju za uzgoj kultura kako bi se smanjio rizik od kontaminacije. Stanice THP-1 rutinski se nasađuju svaka 2–3 dana pri gustoći od 0,1 do 0,2 × 106 stanica/ml. Trebaju se održavati pri gustoći od 0,1 do 1,0 × 106 stanica/ml. Prije njihove upotrebe za ispitivanje treba provjeriti ispunjavaju li stanice zadane kriterije provjerom reaktivnosti. Reaktivnost stanica treba provjeriti upotrebom pozitivnih kontrola, 2,4-dinitroklorbenzena (DNCB) (CAS br. 97-00-7, čistoće ≥ 99 %) i niklova sulfata (NiSO4) (CAS br. 10101-97-0, čistoće ≥ 99 %) te negativne kontrole, mliječne kiseline (LA) (CAS br. 50-21-5, čistoće ≥ 85 %), dva tjedna nakon odmrzavanja. I DNCB i NiSO4 trebaju dati pozitivan odgovor za stanične površinske biljege CD86 i CD54, a LA treba dati negativan odgovor za stanične površinske biljege CD86 i CD54. Za test se upotrebljavaju samo stanice koje su prošle provjeru reaktivnosti. Stanice se mogu razmnožavati do dva mjeseca nakon odmrzavanja. Broj pasaža ne bi trebao biti veći od 30. Reaktivnost treba provjeriti u skladu s postupcima opisanima u stavcima od 20. do 24.
|
|
12.
|
Za ispitivanje se stanice THP-1 nasađuju pri gustoći od 0,1 × 106 stanica/ml ili 0,2 × 106 stanica/ml te se prethodno uzgajaju u tikvicama s kulturom 72 sata ili 48 sati. Važno je da gustoća stanica u tikvici s kulturom neposredno nakon razdoblja pretkulture bude što dosljednija u svim pokusima (upotrebom jednog od dva prethodno opisana uvjeta za pretkulturu) jer bi gustoća stanica u tikvici s kulturom neposredno nakon pretkulture mogla utjecati na ekspresiju CD86/CD54 koju induciraju alergeni (19.). Na dan ispitivanja stanice izdvojene iz tikvice s kulturom ponovno se suspendiraju svježim medijem za uzgoj kultura pri gustoći od 2 × 106 stanica/ml. Stanice se zatim distribuiraju na ploču s 24 jažice s ravnim dnom (500 μl, 1 × 106 stanica/jažici) ili ploču s 96 jažica s ravnim dnom (80 μl, 1,6 × 105 stanica/jažici).
|
Test za utvrđivanje doze
|
13.
|
Test za utvrđivanje doze provodi se kako bi se utvrdio CV75, odnosno koncentracija ispitivane kemikalije koja dovodi do vijabilnosti stanica od 75 % (CV) u usporedbi s kontrolom s otapalom/nosačem. Vrijednost CV75 upotrebljava se za utvrđivanje koncentracije ispitivane kemikalije za mjerenje ekspresije CD86/CD54 (vidjeti stavke od 20. do 24.).
|
Priprema ispitivanih kemikalija i kontrolnih tvari
|
14.
|
Ispitivane kemikalije i kontrolne tvari pripremaju se na dan ispitivanja. Za metodu h-CLAT ispitivane kemikalije otapaju se ili se stabilno dispergiraju (vidjeti i stavak 4.) u fiziološkoj otopini ili mediju kao prvoj opciji za otapalo/nosač ili dimetil sulfoksidu (DMSO, čistoće ≥ 99 %) kao drugoj opciji za otapalo/nosač ako ispitivana kemikalija nije topljiva ili ne tvori stabilnu disperziju u prethodna dva otapala/nosača, tako da se dobije konačna koncentracija od 100 mg/ml (u fiziološkoj otopini ili mediju) ili 500 mg/ml (u DMSO-u). Mogu se upotrebljavati i druga otapala/nosači ako se navede dovoljno dobro znanstveno obrazloženje. Treba uzeti u obzir stabilnost ispitivane kemikalije u konačnom otapalu/nosaču.
|
|
15.
|
Počevši od 100 mg/ml (u fiziološkoj otopini ili mediju) ili 500 mg/ml (u DMSO-u) glavnih otopina ispitivanih kemikalija, treba provesti sljedeće korake razrjeđivanja:
|
—
|
ako se kao otapalo/nosač upotrebljava fiziološka otopina ili medij: priprema se osam glavnih otopina (osam koncentracija) upotrebom odgovarajućeg otapala/nosača u dvostrukim serijskim razrjeđivanjima. Te glavne otopine zatim se dodatno razrjeđuju 50 puta u mediju za uzgoj kulture (radne otopine). Ako najveća konačna koncentracija na ploči od 1 000 μg/ml nije toksična, najveću koncentraciju treba ponovno utvrditi provođenjem novog ispitivanja citotoksičnosti. Konačna koncentracija na ploči ne bi trebala biti veća od 5 000 μg/ml za ispitivane kemikalije otopljene ili stabilno dispergirane u fiziološkoj otopini ili mediju,
|
|
—
|
ako se kao otapalo/nosač upotrebljava DMSO: priprema se osam glavnih otopina (osam koncentracija) upotrebom odgovarajućeg otapala/nosača u dvostrukim serijskim razrjeđivanjima. Te glavne otopine zatim se dodatno razrjeđuju 250 puta u mediju za uzgoj kulture (radne otopine). Konačna koncentracija na ploči ne bi trebala biti veća od 1 000 μg/ml čak i ako ta koncentracija nije toksična.
|
Radne otopine naposljetku se koriste za izlaganje dodavanjem volumena radne otopine koji je jednak volumenu suspenzije stanica THP-1 na ploči (vidjeti i stavak 17.) kako bi se dobilo dodatno dvostruko razrjeđenje (konačni raspon koncentracija na ploči obično iznosi 7,81–1 000 μg/ml).
|
|
16.
|
Kao kontrola s otapalom/nosačem u metodi h-CLAT upotrebljava se medij za uzgoj kulture (za ispitivane kemikalije otopljene ili stabilno dispergirane (vidjeti stavak 4.) u mediju ili fiziološkoj otopini) ili DMSO (za ispitivane kemikalije otopljene ili stabilno dispergirane u DMSO-u) ispitani pri jednoj konačnoj koncentraciji na ploči od 0,2 %. Kontrola se podvrgava istom razrjeđivanju kao što je ono opisano za radne otopine u stavku 15.
|
Primjena ispitivanih kemikalija i kontrolnih tvari
|
17.
|
Medij za uzgoj kulture ili radne otopine opisane u stavcima 15. i 16. miješaju se u omjeru 1: 1 (v/v) sa suspenzijama stanica pripremljenima na ploči s 24 jažice ili s 96 jažica s ravnim dnom (vidjeti stavak 12.). Tretirane se ploče potom inkubiraju 24 ± 0,5 h na temperaturi od 37°C s 5 % CO2. Treba paziti da ne dođe do isparavanja hlapljivih ispitivanih kemikalija te unakrsne kontaminacije jažica ispitivanim kemikalijama, npr. zatvaranjem ploče prije inkubacije s ispitivanim kemikalijama (20.).
|
Bojenje propidijevim jodidom (PI)
|
18.
|
Nakon izlaganja od 24 ± 0,5 h stanice se prenose u epruvete za uzorke i prikupljaju centrifugiranjem. Supernatanti se odbacuju, a preostale stanice ponovno se suspendiraju s 200 μl (u slučaju upotrebe 96 jažica) ili 600 μl (u slučaju upotrebe 24 jažice) fiziološke otopine puferirane fosfatnim puferom koja sadržava 0,1 % goveđeg serumskog albumina (pufer za bojenje). 200 μl suspenzije stanica prenosi se na ploču s 96 jažica s okruglim dnom (u slučaju upotrebe 96 jažica) ili mikroepruvetu (u slučaju upotrebe 24 jažice) te se dvaput ispire s 200 μl (u slučaju upotrebe 96 jažica) ili 600 μl (u slučaju upotrebe 24 jažice) pufera za bojenje. Stanice se naposljetku ponovno suspendiraju u puferu za bojenje (npr. 400 μl) i dodaje se otopina propidijeva jodida (npr. 20 μl) (na primjer, konačna koncentracija propidijeva jodida iznosi 0,625 μg/ml). Mogu se koristiti i drugi biljezi citotoksičnosti, kao što su 7-aminoaktinomicin D (7-AAD), tripansko modrilo ili drugi, ako se može pokazati da alternativna bojila daju slične rezultate kao i propidijev jodid, na primjer, ispitivanjem tvari za dokazivanje tehničke osposobljenosti iz Dodatka 1.2.
|
Mjerenje citotoksičnosti protočnom citometrijom i procjena vrijednosti CV75
|
19.
|
Apsorbancija propidijeva jodida analizira se upotrebom protočne citometrije s kanalom očitanja FL-3. Očitava se ukupno 10 000 živih stanica (negativnih na PI). Vijabilnost stanica može se izračunati tako da se u programu za analizu citometra upotrijebi sljedeća jednadžba. Ako je vijabilnost stanica niska, treba se očitati do 30 000 stanica, uključujući mrtve stanice. Umjesto toga, podaci se mogu očitavati jednu minutu nakon početka analize.
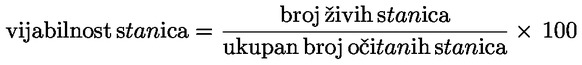
Vrijednost CV75 (vidjeti stavak 13.), tj. koncentracija koja pokazuje preživljavanje stanica THP-1 od 75 % (citotoksičnost od 25 %), računa se log-linearnom interpolacijom, upotrebom sljedeće jednadžbe:

pri čemu je:
a najmanja vrijednost vijabilnosti stanica koja je veća od 75 %;
c najveća vrijednost vijabilnosti stanica koja je manja od 75 %;
b i d su koncentracije koje pokazuju vrijednost vijabilnosti stanica a odnosno c.
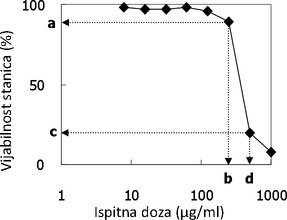
Mogu se upotrebljavati i drugi pristupi za izvođenje vrijednosti CV75 pod uvjetom da se dokaže da to ne utječe na rezultate (npr. ispitivanjem tvari za dokazivanje tehničke osposobljenosti).
|
Mjerenje ekspresije CD86/CD54
Priprema ispitivanih kemikalija i kontrolnih tvari
|
20.
|
Za otapanje ili stabilno dispergiranje ispitivanih kemikalija upotrebljava se odgovarajuće otapalo/nosač (fiziološka otopina, medij ili DMSO; vidjeti stavak 14.). Ispitivane kemikalije prvo se razrjeđuju na koncentraciju koja odgovara vrijednosti koja je 100 puta (za fiziološku otopinu ili medij) ili 500 puta (za DMSO) veća od 1,2 × CV75 utvrđenom u testu za utvrđivanje doze (vidjeti stavak 19.). Ako se CV75 ne može utvrditi (tj. u testu za utvrđivanje doze nije uočena dovoljna citotoksičnost), kao početnu koncentraciju treba upotrijebiti najvišu koncentraciju ispitivane kemikalije pripremljenu sa svakim otapalom/nosačem koja se može otopiti ili stabilno dispergirati. Napominje se da konačna koncentracija na ploči ne bi trebala biti veća od 5 000 μg/ml (u slučaju fiziološke otopine ili medija) ili 1 000 μg/ml (u slučaju DMSO-a). Zatim se prave serijska razrjeđivanja s faktorom razrjeđivanja od 1,2 upotrebom odgovarajućeg otapala/nosača kako bi se dobile glavne otopine (osam koncentracija u rasponu od 100 × 1,2 × CV75 do 100 × 0,335 × CV75 (za fiziološku otopinu ili medij) ili od 500 × 1,2 × CV75 do 500 × 0,335 × CV75 (za DMSO)) koje se ispituju metodom h-CLAT (primjer plana doziranja vidjeti u protokolu DB-ALM br. 158). Glavne otopine zatim se dodatno razrjeđuju 50 puta (za fiziološku otopinu ili medij) ili 250 puta (za DMSO) u mediju za uzgoj kulture (radne otopine). Te radne otopine naposljetku se upotrebljavaju za izlaganje uz dodatni faktor dvostrukog konačnog razrjeđivanja na ploči. Ako rezultati ne ispunjavaju kriterije prihvatljivosti opisane u stavcima 29. i 30. u pogledu vijabilnosti stanica, test za utvrđivanje doze može se ponoviti kako bi se utvrdila preciznija vrijednost CV75. Napominje se da se za mjerenje ekspresije CD86/CD54 mogu upotrebljavati samo ploče s 24 jažice.
|
|
21.
|
Kontrola s otapalom/nosačem priprema se kako je opisano u stavku 16. U metodi h-CLAT kao pozitivna kontrola upotrebljava se DNCB (vidjeti stavak 11.), za koji se glavne otopine pripremaju u DMSO-u i razrjeđuju kako je opisano za glavne otopine u stavku 20. DNCB treba upotrebljavati kao pozitivnu kontrolu za mjerenje ekspresije CD86/CD54 pri jednoj konačnoj koncentraciji na ploči (obično 4,0 μg/ml). Kako bi se na ploči dobila koncentracija DNCB-a od 4,0 μg/ml, priprema se glavna otopina DNCB-a u DMSO-u od 2 mg/ml, koja se dodatno razrjeđuje 250 puta medijem za uzgoj kulture kako bi se dobila radna otopina od 8 μg/ml. Umjesto toga, kao koncentracija pozitivne kontrole može se upotrebljavati i CV75 DNCB-a, koji se utvrđuje u svakoj ustanovi koja provodi ispitivanje. Mogu se upotrijebiti druge prikladne pozitivne kontrole, pod uvjetom da su dostupni prijašnji podaci na temelju kojih se mogu odrediti usporedivi kriteriji prihvatljivosti ciklusa. Kod pozitivnih kontrola jedna konačna koncentracija na ploči ne bi trebala biti veća od 5 000 μg/ml (u slučaju fiziološke otopine ili medija) ili 1 000 μg/ml (u slučaju DMSO-a). Kriteriji prihvatljivosti ciklusa isti su kao i oni opisani za ispitivanu kemikaliju (vidjeti stavak 29.), osim u slučaju posljednjeg kriterija prihvatljivosti jer se pozitivna kontrola ispituje u samo jednoj koncentraciji.
|
Primjena ispitivanih kemikalija i kontrolnih tvari
|
22.
|
Za svaku ispitivanu kemikaliju i kontrolnu tvar potreban je jedan pokus kako bi se dobilo predviđanje. Svaki se pokus sastoji od najmanje dva neovisna ciklusa za mjerenje ekspresije CD86/CD54 (vidjeti stavke od 26. do 28.). Svaki se neovisni ciklus provodi na različite dane ili na isti dan ako su za svaki ciklus ispunjeni sljedeći uvjeti: a) pripremljene su svježe glavne i radne otopine ispitivane kemikalije i otopine s protutijelima i b) upotrebljavaju se neovisno izdvojene stanice (tj. stanice su prikupljene iz različitih tikvica s kulturom); međutim, stanice mogu biti iz iste pasaže. Ispitivane kemikalije i kontrolne tvari pripremljene kao radne otopine (500 μl) miješaju se s 500 μl suspendiranih stanica (1 x 106 stanica) u omjeru 1: 1 te se stanice inkubiraju 24 ± 0,5 h kako je opisano u stavcima 20. i 21. U svakom je ciklusu dovoljno jedno ponavljanje za svaku koncentraciju ispitivane kemikalije i kontrolne tvari jer se predviđanje izvodi na temelju najmanje dva neovisna ciklusa.
|
Bojenje i analiza stanica
|
23.
|
Nakon 24 ± 0,5 h izlaganja stanice se prenose s ploče s 24 jažice u epruvete za uzorke, prikupljaju se centrifugiranjem i zatim dvaput ispiru s 1 ml pufera za bojenje (ako je potrebno, mogu se provesti dodatni koraci ispiranja). Nakon ispiranja stanice se blokiraju sa 600 μl otopine za blokiranje (pufer za bojenje koji sadržava 0,01 % (w/v) globulina (Cohnova frakcija II, III, humana; SIGMA, #G2388-10G ili ekvivalentno)) i inkubiraju 15 minuta na 4°C. Nakon blokiranja stanice se podijele u tri alikvota od 180 μl na ploču s 96 jažica s okruglim dnom ili u mikroepruvetu.
|
|
24.
|
Nakon centrifugiranja stanice se boje s 50 μl protutijela anti-CD86, anti-CD54 ili mišjih protutijela IgG1 (izotip) označenih FITC-om na 4°C u trajanju od 30 minuta. Trebaju se upotrebljavati protutijela opisana u protokolu h-CLAT DB-ALM br. 158 (18.) razrjeđivanjem u omjeru 3: 25 v/v (za CD86 (BD-PharMingen, #555657; klon: Fun-1)) ili 3: 50 v/v (za CD54 (DAKO, #F7143; klon: 6.5B5) i IgG1 (DAKO, #X0927)) puferom za bojenje. Subjekti koji su razvili ispitivanje utvrdili su da ti faktori razrjeđenja protutijela daju najbolji omjer signala i šuma. Na temelju iskustva subjekata koji su razvili ispitivanje intenzitet fluorescencije protutijela obično je dosljedan među različitim serijama. Međutim, korisnici mogu razmotriti titraciju protutijela u uvjetima svojeg laboratorija kako bi utvrdili koje je koncentracije najbolje upotrebljavati. Mogu se koristiti i druga protutijela anti-CD86 i/ili anti-CD54 označena fluorokromom ako se može pokazati da ona daju slične rezultate kao i protutijela konjugirana FITC-om, na primjer, ispitivanjem tvari za dokazivanje tehničke osposobljenosti iz Dodatka 1.2. Treba napomenuti da promjena klona ili dobavljača protutijela, kako je opisano u protokolu h-CLAT DB-ALM br. 158 (18.), može utjecati na rezultate. Nakon ispiranja sa 150 μl pufera za bojenje dva ili više puta stanice se ponovno suspendiraju u puferu za bojenje (npr. 400 μl) i dodaje se otopina propidijeva jodida (npr. 20 μl kako bi se dobila konačna koncentracija od 0,625 μg/ml) ili otopina drugog biljega citotoksičnosti (vidjeti stavak 18.). Razine ekspresije CD86 i CD54 te vijabilnost stanica analiziraju se upotrebom protočne citometrije.
|
PODACI I IZVJEŠĆIVANJE
Procjena podataka
|
25.
|
Ekspresija CD86 i CD54 analiza se protočnom citometrijom s kanalom očitanja FL-1. Na temelju geometrijske sredine intenziteta fluorescencije (MFI) relativni intenzitet fluorescencije (RFI) za CD86 i CD54 za stanice pozitivne kontrole (ctrl) i stanice tretirane kemikalijama računa se u skladu sa sljedećom jednadžbom:

Vijabilnost stanica iz stanica kontrole izotipa (ctrl) (koje se boje mišjim protutijelima IgG1 (izotip)) isto se računa prema jednadžbi opisanoj u stavku 19.
|
Model predviđanja
|
26.
|
Kod mjerenja ekspresije CD86/CD54 svaka ispitivana kemikalija ispituje se u najmanje dva neovisna ciklusa kako bi se izvelo jedno predviđanje (POZITIVNO ili NEGATIVNO). Predviđanje na temelju testa h-CLAT smatra se POZITIVNIM ako je ispunjen barem jedan od sljedećih uvjeta u dva od dva neovisna ciklusa ili u barem dva od tri neovisna ciklusa; u protivnom se predviđanje na temelju testa h-CLAT smatra NEGATIVNIM (slika 1.):
|
—
|
RFI za CD86 jednak je ili veći od 150 % pri svim ispitanim koncentracijama (uz vijabilnost stanica ≥ 50 %),
|
|
—
|
RFI za CD54 jednak je ili veći od 200 % pri svim ispitanim koncentracijama (uz vijabilnost stanica ≥ 50 %).
|
|
|
27.
|
Na temelju prethodno navedenoga, ako su prva dva ciklusa pozitivna za CD86 i/ili su oba pozitivna za CD54, predviđanje na temelju testa h-CLAT smatra se POZITIVNIM i ne mora se provoditi treći ciklus. Slično tomu, ako su prva dva ciklusa negativna za oba biljega, predviđanje na temelju testa h-CLAT smatra se NEGATIVNIM (uzimajući u obzir odredbe stavka 30.) i nije potreban treći ciklus. Međutim, ako prva dva ciklusa nisu usklađena za barem jedan od biljega (CD54 ili CD86), potreban je treći ciklus i konačno predviđanje temeljit će se na većinskom rezultatu triju neovisnih ciklusa (tj. na dva ciklusa od tri provedena). Kad je riječ o tome, treba napomenuti da je potreban treći ciklus ako se provode dva neovisna ciklusa i jedan je pozitivan samo za CD86 (dalje u tekstu „P1”), a drugi je pozitivan samo za CD54 (dalje u tekstu „P2”). Ako je treći ciklus negativan za oba biljega (dalje u tekstu „N”), predviđanje na temelju testa h-CLAT smatra se NEGATIVNIM. S druge strane, ako je treći ciklus pozitivan za bilo koji biljeg (P1 ili P2) ili za oba biljega (dalje u tekstu „P12”), predviđanje na temelju testa h-CLAT smatra se POZITIVNIM.

Slika 1.: Model predviđanja koji se upotrebljava u metodi h-CLAT. Predviđanje na temelju testa h-CLAT trebalo bi razmatrati u okviru IATA-e te u skladu s odredbama stavaka 7. i 8. iz odjeljka „Opći uvod”.
P1: ciklus u kojem je samo CD86 pozitivan; P2: ciklus u kojem je samo CD54 pozitivan; P12: ciklus u kojem su i CD86 i CD54 pozitivni; N: ciklus u kojem ni CD86 ni CD54 nisu pozitivni.
* U okvirima su prikazane relevantne kombinacije rezultata iz prva dva ciklusa, neovisno o redoslijedu kojim se mogu dobiti.
# U okvirima su prikazane relevantne kombinacije rezultata iz tri ciklusa na temelju rezultata dobivenih u prva dva ciklusa prikazana u prethodnom okviru, ali ne odražavaju redoslijed kojim se mogu dobiti.
|
|
28.
|
Za ispitivane kemikalije koje se testom h-CLAT predvide kao POZITIVNE mogu se utvrditi dvije vrijednosti učinkovite koncentracije (EC), EC150 za CD86 i EC200 za CD54, tj. koncentracije pri kojima su ispitivane kemikalije inducirale RFI od 150 ili 200. Te bi vrijednosti EC potencijalno mogle pridonijeti procjeni jačine izazivanja preosjetljivosti (9.) ako se upotrebljavaju u okviru integriranih pristupa kao što je IATA (4., 5., 6., 7. i 8.). Mogu se izračunati prema sljedećim jednadžbama:
EC 150 (za CD86) = Bconc
+ [(150 - BRFI
)/ARFI - BRFI
) × (Aconc - Bconc
)]
EC 200 (za CD54) = Bconc
+ [(200 - BRFI
)/ARFI - BRFI
) × (Aconc - Bconc
)]
pri čemu je:
Aconc = najniža koncentracija u μg/ml kod koje je RFI > 150 (CD86) ili 200 (CD54)
Bconc = najviša koncentracija u μg/ml kod koje je RFI < 150 (CD86) ili 200 (CD54)
ARFI = RFI pri najnižoj koncentraciji kod koje je RFI > 150 (CD86) ili 200 (CD54)
BRFI = RFI pri najvišoj koncentraciji kod koje je RFI< 150 (CD86) ili 200 (CD54)
Radi preciznijeg izvođenja vrijednosti EC150 i EC200 možda će biti potrebna tri neovisna ciklusa za mjerenje ekspresije CD86/CD54. Konačne vrijednosti EC150 i EC200 zatim se određuju kao srednja vrijednost EC-ova izračunanih iz tri neovisna ciklusa. Ako samo dva od tri neovisna ciklusa ispunjavaju kriterije za pozitivan rezultat (vidjeti stavke 26. i 27.), prihvaća se viša vrijednost od dviju izračunanih vrijednosti EC150 ili EC200.
|
Kriteriji prihvatljivosti
|
29.
|
Sljedeći bi kriteriji prihvatljivosti trebali biti ispunjeni kada se primjenjuje metoda h-CLAT (22. i 27.).
|
—
|
Vijabilnost stanica u kontroli s medijem i kontrolama s otapalom/nosačem trebala bi biti veća od 90 %.
|
|
—
|
Kod kontrole s otapalom/nosačem, vrijednosti RFI i za CD86 i za CD54 ne bi trebale biti veće od pozitivnog kriterija (RFI za CD86 ≥ 150 % i RFI za CD54 ≥ 200 %). Vrijednosti RFI kontrole s otapalom/nosačem računaju se upotrebom formula opisanih u stavku 25. („MFI kemikalije” treba zamijeniti „MFI-jem otapala/nosača”, a „MFI otapala/nosača” treba zamijeniti „MFI-jem kontrole (s medijem)”).
|
|
—
|
I za kontrole s medijem i kontrole s otapalom/nosačem omjer MFI-ja i za CD86 i za CD54 u odnosu na kontrolu izotipa treba biti > 105 %.
|
|
—
|
Kod pozitivne kontrole (DNCB), vrijednosti RFI i za CD86 i za CD54 trebaju ispuniti pozitivne kriterije (RFI za CD86 ≥ 150 i RFI za CD54 ≥ 200), a vijabilnost stanica treba biti veća od 50 %.
|
|
—
|
Kod ispitivane kemikalije vijabilnost stanica treba biti veća od 50 % u najmanje četiri ispitane koncentracije u svakom ciklusu.
|
|
|
30.
|
Negativni rezultati prihvatljivi su samo za ispitivane kemikalije koje pokazuju vijabilnost stanica manju od 90 % pri najvišoj ispitanoj koncentraciji (tj. 1,2 × CV75 u skladu s planom razrjeđivanja opisanim u stavku 20.). Ako vijabilnost stanica pri koncentraciji od 1,2 × CV75 iznosi 90 % ili više, negativan rezultat treba odbaciti. U tom se slučaju preporučuje da se pokuša preciznije odrediti odabir doze ponovnim utvrđivanjem vrijednosti CV75. Treba napomenuti da je negativan rezultat prihvatljiv čak i ako je vijabilnost stanica veća od 90 % ako se kao najveća ispitivana koncentracija ispitivane kemikalije upotrebljava 5 000 μg/ml u fiziološkoj otopini (ili mediju ili drugim otapalima/nosačima), 1 000 μg/ml u DMSO-u ili najviša topljiva koncentracija.
|
Izvješće o ispitivanju
|
31.
|
Izvješće o ispitivanju trebalo bi sadržavati sljedeće informacije:
|
Ispitivana kemikalija
|
Tvar s jednim sastojkom:
|
kemijske identifikacijske oznake, kao što su IUPAC ili CAS naziv(i), CAS broj(evi), SMILES ili InChI oznaka, strukturna formula i/ili druge identifikacijske oznake,
|
|
fizički izgled, Log Kow, topljivost u vodi, topljivost u DMSO-u, molekularna masa te dodatna relevantna fizikalno-kemijska svojstva, u mjeri u kojoj su podaci dostupni,
|
|
čistoća, kemijski identitet nečistoća prema potrebi i ako je izvedivo u praksi itd.,
|
|
obrada prije ispitivanja, prema potrebi (npr. zagrijavanje, usitnjavanje),
|
|
ispitana koncentracija (ispitane koncentracije),
|
|
uvjeti skladištenja i stabilnost, u mjeri u kojoj su podaci dostupni,
|
|
obrazloženje za odabir otapala/nosača za svaku ispitivanu kemikaliju.
|
|
|
Tvar s više sastojaka, UVCB tvar i smjesa:
|
opisane koliko god je to moguće npr. kemijskim identitetom (vidjeti prethodno), čistoćom, količinskom zastupljenošću i relevantnim fizikalno-kemijskim svojstvima sastojaka (vidjeti prethodno), u mjeri u kojoj su podaci dostupni,
|
|
fizički izgled, topljivost u vodi, topljivost u DMSO-u te dodatna relevantna fizikalno-kemijska svojstva, u mjeri u kojoj su podaci dostupni,
|
|
molekularna masa ili prividna molekularna masa u slučaju smjesa/polimera poznatog sastava ili druge informacije koje su relevantne za provođenje studije,
|
|
obrada prije ispitivanja, prema potrebi (npr. zagrijavanje, usitnjavanje),
|
|
ispitana koncentracija (ispitane koncentracije),
|
|
uvjeti skladištenja i stabilnost, u mjeri u kojoj su podaci dostupni,
|
|
obrazloženje za odabir otapala/nosača za svaku ispitivanu kemikaliju.
|
|
|
|
Kontrole
|
Pozitivna kontrola:
|
kemijske identifikacijske oznake, kao što su IUPAC ili CAS naziv(i), CAS broj(evi), SMILES ili InChI oznaka, strukturna formula i/ili druge identifikacijske oznake,
|
|
fizički izgled, Log Kow, topljivost u vodi, topljivost u DMSO-u, molekularna masa te dodatna relevantna fizikalno-kemijska svojstva, u mjeri u kojoj su podaci dostupni i ako je primjenjivo,
|
|
čistoća, kemijski identitet nečistoća prema potrebi i ako je izvedivo u praksi itd.,
|
|
obrada prije ispitivanja, prema potrebi (npr. zagrijavanje, usitnjavanje),
|
|
ispitana koncentracija (ispitane koncentracije),
|
|
uvjeti skladištenja i stabilnost, u mjeri u kojoj su podaci dostupni,
|
|
upućivanje na rezultate koji se odnose na prijašnje pozitivne kontrole i pokazuju primjerenost kriterija prihvatljivosti ciklusa, ako je primjenjivo.
|
|
|
|
Negativna kontrola i kontrola s otapalom/nosačem:
|
kemijske identifikacijske oznake, kao što su IUPAC ili CAS naziv(i), CAS broj(evi), SMILES ili InChI oznaka, strukturna formula i/ili druge identifikacijske oznake,
|
|
čistoća, kemijski identitet nečistoća prema potrebi i ako je izvedivo u praksi itd.,
|
|
fizički izgled, molekularna masa te dodatna relevantna fizikalno-kemijska svojstva u slučaju da su upotrijebljene kontrole s otapalom/nosačem koje nisu navedene u smjernici za ispitivanje, u mjeri u kojoj su podaci dostupni,
|
|
uvjeti skladištenja i stabilnost, u mjeri u kojoj su podaci dostupni,
|
|
obrazloženje za odabir otapala/nosača za svaku ispitivanu kemikaliju.
|
|
|
Ispitni uvjeti:
|
naziv i adresa naručitelja, ustanove koja provodi ispitivanje i voditelja istraživanja,
|
|
opis upotrijebljenog ispitivanja,
|
|
upotrijebljena stanična linija, uvjeti njezina skladištenja i izvor (npr. objekt iz kojeg su dobiveni),
|
|
upotrijebljena protočna citometrija (npr. model), uključujući upotrijebljene postavke instrumenta, globulin, protutijela i biljege citotoksičnosti,
|
|
postupak koji je primijenjen za dokazivanje osposobljenosti laboratorija za izvođenje ispitivanja ispitivanjem tvari koje služe za dokazivanje osposobljenosti te postupak koji je primijenjen za dokazivanje obnovljive primjene ispitivanja tijekom vremena, npr. podaci o prijašnjim kontrolama i/ili prijašnjim provjerama reaktivnosti.
|
|
|
Kriteriji prihvatljivosti ispitivanja:
|
vijabilnost stanica, vrijednosti MFI i RFI dobivene kontrolom s otapalom/nosačem u usporedbi s rasponima prihvatljivosti,
|
|
vijabilnost stanica i vrijednosti RFI dobivene pozitivnom kontrolom u usporedbi s rasponima prihvatljivosti,
|
|
vijabilnost stanica svih ispitanih koncentracija ispitane kemikalije.
|
|
|
Ispitni postupak:
|
broj upotrijebljenih ciklusa,
|
|
koncentracije ispitivane kemikalije, primjena i vrijeme izloženosti (ako je drukčije od preporučenog),
|
|
opis primijenjenih kriterija ocjenjivanja i odlučivanja,
|
|
opis mogućih izmjena ispitnog postupka.
|
|
|
Rezultati:
|
tablični prikaz podataka, uključujući CV75 (ako je primjenjivo), geometrijski MFI, RFI, vrijednosti vijabilnosti stanica, vrijednosti EC150/EC200 (ako je primjenjivo) dobivene za ispitivanu kemikaliju i za pozitivnu kontrolu u svakom ciklusu te klasifikacija ispitivane kemikalije prema modelu predviđanja,
|
|
opis svih drugih relevantnih opažanja, ako je primjenjivo.
|
|
|
Rasprava o rezultatima:
|
rasprava o rezultatima dobivenima metodom h-CLAT,
|
|
rasprava o rezultatima ispitivanja u kontekstu IATA-e ako su dostupni drugi relevantni podaci.
|
|
|
LITERATURA
|
1.
|
Ashikaga T, Yoshida Y, Hirota M, Yoneyama K, Itagaki H, Sakaguchi H, Miyazawa M, Ito Y, Suzuki H, Toyoda H. (2006). Development of an in vitro skin sensitization test using human cell lines: The human Cell Line Activation Test (h-CLAT) I. Optimization of the h-CLAT protocol. Toxicol. In Vitro 20, 767.–773.
|
|
2.
|
Miyazawa M, Ito Y, Yoshida Y, Sakaguchi H, Suzuki H. (2007). Phenotypic alterations and cytokine production in THP-1 cells in response to allergens. Toxicol. In Vitro 21, 428.–437.
|
|
3.
|
EC EURL-ECVAM (2013). Recommendation on the human Cell Line Activation Test (h-CLAT) for skin sensitisation testing. Dostupno na: https://eurl-ecvam.jrc.ec.europa.eu/eurl-ecvam-recommendations.
|
|
4.
|
Takenouchi O, Fukui S, Okamoto K, Kurotani S, Imai N, Fujishiro M, Kyotani D, Kato Y, Kasahara T, Fujita M, Toyoda A, Sekiya D, Watanabe S, Seto H, Hirota M, Ashikaga T, Miyazawa M. (2015). Test battery with the human cell line activation test, direct peptide reactivity assay and DEREK based on a 139 chemical data set for predicting skin sensitizing potential and potency of chemicals. J Appl Toxicol. 35, 1318.–1332.
|
|
5.
|
Hirota M, Fukui S, Okamoto K, Kurotani S, Imai N, Fujishiro M, Kyotani D, Kato Y, Kasahara T, Fujita M, Toyoda A, Sekiya D, Watanabe S, Seto H, Takenouchi O, Ashikaga T, Miyazawa M. (2015). Evaluation of combinations of in vitro sensitization test descriptors for the artificial neural network-based risk assessment model of skin sensitization. J Appl Toxicol. 35, 1333.–1347.
|
|
6.
|
Bauch C, Kolle SN, Ramirez T, Fabian E, Mehling A, Teubner W, van Ravenzwaay B, Landsiedel R. (2012). Putting the parts together: combining in vitro methods to test for skin sensitizing potencials. Regul Toxicol Parmacol. 63, 489.–504.
|
|
7.
|
Van der Veen JW, Rorije E, Emter R, Natch A, van Loveren H, Ezendam J. (2014). Evaluating the performance of integrated approaches for hazard identification of skin sensitizing chemicals. Regul Toxicol Pharmacol. 69, 371.–379.
|
|
8.
|
Urbisch D, Mehling A, Guth K, Ramirez T, Honarvar N, Kolle S, Landsiedel R, Jaworska J, Kern PS, Gerberick F, Natsch A, Emter R, Ashikaga T, Miyazawa M, Sakaguchi H. (2015). Assessing skin sensitization hazard in mice and men using non-animal test methods. Regul Toxicol Parmacol. 71, 337.–351.
|
|
9.
|
Jaworska JS, Natsch A, Ryan C, Strickland J, Ashikaga T, Miyazawa M. (2015). Bayesian integrated testing strategy (ITS) for skin sensitization potency assessment: a decision support system for quantitative weight of evidence and adaptive testing strategy. Arch Toxicol. 89, 2355.–2383.
|
|
10.
|
Strickland J, Zang Q, Kleinstreuer N, Paris M, Lehmann DM, Choksi N, Matheson J, Jacobs A, Lowit A, Allen D, Casey W. (2016). Integrated decision strategies for skin sensitization hazard. J Appl Toxicol. DOI 10.1002/jat.3281.
|
|
11.
|
Nukada Y, Ashikaga T, Miyazawa M, Hirota M, Sakaguchi H, Sasa H, Nishiyama N. (2012). Prediction of skin sensitization potency of chemicals by human Cell Line Activation Test (h-CLAT) and an attempt at classifying skin sensitization potency. Toxicol. In Vitro 26, 1150.–60.
|
|
12.
|
EC EURL ECVAM (2015). Re-analysis of the within and between laboratory reproducibility of the human Cell Line Activation Test (h-CLAT). Dostupno na: https://eurl-ecvam.jrc.ec.europa.eu/eurl-ecvam-recommendations/eurl-ecvam-recommendation-on-the-human-cell-line-activation-test-h-clat-for-skin-sensitisation-testing.
|
|
13.
|
EC EURL ECVAM (2012). human Cell Line Activation Test (h-CLAT) Validation Study Report. Dostupno na: https://eurl-ecvam.jrc.ec.europa.eu/eurl-ecvam-recommendations.
|
|
14.
|
Takenouchi O, Miyazawa M, Saito K, Ashikaga T, Sakaguchi H. (2013). Predictive performance of the human Cell Line Activation Test (h-CLAT) for lipophilic with high octanol-water partition coefficients. J. Toxicol. Sci. 38, 599.–609.
|
|
15.
|
Ashikaga T, Sakaguchi H, Sono S, Kosaka N, Ishikawa M, Nukada Y, Miyazawa M, Ito Y, NishiyamaN, Itagaki H. (2010). A comparative evaluation of in vitro skin sensitisation tests: the human cell-line activation test (h-CLAT) versus the local lymph node assay (LLNA). Altern. Lab. Anim. 38, 275.–284.
|
|
16.
|
Fabian E., Vogel D., Blatz V., Ramirez T., Kolle S., Eltze T., van Ravenzwaay B., Oesch F., Landsiedel R. (2013). Xenobiotic metabolizin enzyme activities in cells used for testing skin sensitization in vitro. Arch Toxicol 87, 1683.–1969.
|
|
17.
|
Okamoto K, Kato Y, Kosaka N, Mizuno M, Inaba H, Sono S, Ashikaga T, Nakamura T, Okamoto Y, Sakaguchi H, Kishi M, Kuwahara H, Ohno Y. (2010). The Japanese ring study of a human Cell Line Activation Test (h-CLAT) for predicting skin sensitization potential (6th report): A study for evaluating oxidative hair dye sensitization potential using h-CLAT. AATEX 15, 81.–88.
|
|
18.
|
DB-ALM (INVITTOX) (2014). Protocol 158: human Cell Line Activation Test (h-CLAT), 23pp. Dostupno na: http://ecvam-dbalm.jrc.ec.europa.eu/.
|
|
19.
|
Mizuno M, Yoshida M, Kodama T, Kosaka N, Okamato K, Sono S, Yamada T, Hasegawa S, Ashikaga T, Kuwahara H, Sakaguchi H, Sato J, Ota N, Okamoto Y, Ohno Y. (2008). Effects of pre-culture conditions on the human Cell Line Activation Test (h-CLAT) results; Results of the 4th Japanese inter-laboratory study. AATEX 13, 70.–82.
|
|
20.
|
Sono S, Mizuno M, Kosaka N, Okamoto K, Kato Y, Inaba H, Nakamura T, Kishi M, Kuwahara H, Sakaguchi H, Okamoto Y, Ashikaga T, Ohno Y. (2010). The Japanese ring study of a human Cell Line Activation Test (h-CLAT) for predicting skin sensitization potential (7th report): Evaluation of volatile, poorly soluble fragrance materials. AATEX 15, 89.–96.
|
|
21.
|
OECD (2005). Guidance Document No 34 on The Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment. OECD Series on Testing and Assessment. Organizacija za gospodarsku suradnju i razvoj, Pariz, Francuska, 2005., str. 96.
|
|
22.
|
OECD (2012). The Adverse Outcome Pathway for Skin Sensitisation Initiated by Covalent Binding to Proteins. Part 1: Scientific Evidence. Series on Testing and Assessment No 168. Dostupno na: http://www.oecd.org/officialdocuments/publicdisplaydocumentpdf/?cote=ENV/JM/MONO(2012)10/PART1&docLanguage=En.
|
|
23.
|
Ujedinjeni narodi (UN) (2013). Globally Harmonized System of Classification and Labelling of Chemicals (GHS). Fifth revised edition. New York & Geneva: United Nations Publications. ISBN: 978-92-1-117006-1. Dostupno na: http://www.unece.org/trans/danger/publi/ghs/ghs_rev05/05files_e.html.
|
|
24.
|
ECETOC (2003). Contact sensitization: Classification according to potency. European Centre for Ecotoxicology & Toxicology of Chemicals (Technical Report No 87).
|
|
25.
|
Ashikaga T, Sakaguchi H, Okamoto K, Mizuno M, Sato J, Yamada T, Yoshida M, Ota N, Hasegawa S, Kodama T, Okamoto Y, Kuwahara H, Kosaka N, Sono S, Ohno Y. (2008). Assessment of the human Cell Line Activation Test (h-CLAT) for Skin Sensitization; Results of the First Japanese Inter-laboratory Study. AATEX 13, 27.–35.
|
Dodatak 1.1.
DEFINICIJE
Točnost
: stupanj podudarnosti između rezultata ispitivanja i prihvaćenih referentnih vrijednosti. Ona je mjerilo učinkovitosti testa i jedan od aspekata relevantnosti. Pojam je često međusobno zamjenjiv s pojmom „podudarnost” u smislu udjela točnih ishoda testa (21.).
AOP (engl. Adverse Outcome Pathway – put nastanka štetnog ishoda)
: slijed događaja od kemijske strukture ciljne kemikalije ili skupine sličnih kemikalija preko početnog molekularnog događaja do štetnog ishoda in vivo (22.).
Kemikalija
: tvar ili smjesa.
CV75
: procijenjena koncentracija koja pokazuje vijabilnost stanica od 75 %.
EC150
: koncentracije koje pokazuju vrijednosti RFI od 150 u ekspresiji CD86.
EC200
: koncentracije koje pokazuju vrijednosti RFI od 200 u ekspresiji CD54.
Protočna citometrija
: citometrijska tehnika u kojoj stanice suspendirane u tekućini jedna po jedna protječu kroz fokus ekscitacijske svjetlosti koja se raspršuje u uzorcima koji se specifični za stanice i njihove komponente; stanice su često označene fluorescentnim biljezima tako da se svjetlost prvo apsorbira, a zatim emitira pri izmijenjenim frekvencijama.
Opasnost
: intrinzično svojstvo nekog agensa ili stanje koje ima potencijal uzrokovanja štetnih učinaka kada su organizam, sustav ili (sub)populacija izloženi tom agensu.
IATA (engl. Integrated Approach to Testing and Assessment – integrirani pristup ispitivanju i procjeni)
: strukturiran pristup koji se primjenjuje za identifikaciju opasnosti (potencijal), karakterizaciju opasnosti (jakost) i/ili procjenu sigurnosti (potencijal/jakost i izloženost) kemikalije ili skupine kemikalija, kojim se na strateški način objedinjuju i ponderiraju svi relevantni podaci koji će služiti kao podloga za donošenje regulatornih odluka u vezi s potencijalnom opasnošću i/ili rizikom i/ili potrebom za daljnjim ciljnim, a time i minimalnim ispitivanjem.
Kontrola s medijem
: netretirani ponovljeni uzorak koji sadržava sve sastavnice ispitnog sustava. Taj se uzorak obrađuje s uzorcima tretiranima ispitivanom kemikalijom i drugim kontrolnim uzorcima kako bi se utvrdilo je li otapalo/nosač u interakciji s ispitnim sustavom.
Smjesa
: smjesa ili otopina koja se sastoji od dviju ili više tvari.
Tvar s jednim sastojkom
: tvar, definirana količinskim sastavom, u kojoj je jedan glavni sastojak prisutan u koncentraciji od najmanje 80 % (w/w).
Tvar s više sastojaka
: tvar, definirana količinskim sastavom, u kojoj je više od jednog glavnog sastojka prisutno u koncentraciji od 10 % (w/w) ili većoj te manjoj od 80 % (w/w). Tvar s više sastojaka rezultat je procesa proizvodnje. Smjesa i tvar s više sastojaka razlikuju se po tome što se smjesa dobiva miješanjem dviju ili više tvari bez kemijske reakcije. Tvar s više sastojaka rezultat je kemijske reakcije.
Pozitivna kontrola
: ponovljeni uzorak koji sadržava sve komponente ispitnog sustava i tretiran je s tvari za koju je poznato da izaziva pozitivan odgovor. Kako bi se osigurala mogućnost procjene varijabilnosti odgovora pozitivne kontrole tijekom vremena, pozitivan odgovor ne bi smio biti presnažan.
Prehapteni
: kemikalije koje abiotičkom pretvorbom postaju tvari koje izazivaju preosjetljivost.
Prohapteni
: kemikalije kojima je potrebna enzimska aktivacija da bi mogle pokazati potencijal izazivanja preosjetljivosti kože.
Relativni intenzitet fluorescencije (RFI)
: relativne vrijednosti geometrijske sredine intenziteta fluorescencije (MFI) kod stanica tretiranih kemikalijom u usporedbi s MFI-jem stanica tretiranih otapalom/nosačem.
Relevantnost
: opis odnosa između ispitivanja i istraživanog učinka te je li ispitivanje prikladno i korisno za određenu svrhu. Pokazuje u kojoj se mjeri ispitivanjem točno mjeri ili predviđa istraživani biološki učinak. Relevantnost uključuje i razmatranje o točnosti (podudarnosti) ispitivanja (21.).
Pouzdanost
: pokazuje u kojoj se mjeri ispitivanje može obnovljivo primijeniti unutar jednog laboratorija i između više laboratorija tijekom vremena uz primjenu istog protokola. Ocjenjuje se izračunavanjem obnovljivosti unutar jednog laboratorija i između više njih te ponovljivosti unutar jednog laboratorija (21.).
Ciklus
: ciklus se sastoji od jedne ispitivane kemikalije ili više njih koje se ispituju istodobno s kontrolom s otapalom/nosačem i pozitivnom kontrolom.
Osjetljivost
: udio svih pozitivnih/aktivnih kemikalija koje su pravilno razvrstane primjenom ispitivanja. To je mjera točnosti ispitivanja koje daje kategorijske rezultate i važan je čimbenik za ocjenu relevantnosti ispitivanja (21.).
Pufer za bojenje
: fiziološka otopina puferirana fosfatnim puferom koja sadržava 0,1 % goveđeg serumskog albumina.
Kontrola s otapalom/nosačem
: netretirani uzorak koji ne sadržava ispitivanu kemikaliju, ali sadržava sve ostale komponente ispitnog sustava te otapalo/nosač koji se upotrebljava u ispitivanju. Upotrebljava se za utvrđivanje polaznog odgovora za uzorke koji se tretiraju ispitivanom kemikalijom otopljenom ili stabilno dispergiranom u istom otapalu/nosaču. Kada se ispituje s istodobnom kontrolom s medijem, taj uzorak isto tako pokazuje je li otapalo/nosač u interakciji s ispitnim sustavom.
Specifičnost
: udio svih negativnih/neaktivnih kemikalija koje su pravilno razvrstane primjenom ispitivanja. To je mjera točnosti ispitivanja koje daje kategorijske rezultate i važan je čimbenik za ocjenu relevantnosti ispitivanja (21.).
Tvar
: kemijski element i njegovi spojevi u prirodnome stanju ili dobiveni proizvodnim postupkom, što uključuje i aditive koji su nužni za održavanje stabilnosti proizvoda te nečistoće koje proizlaze iz primijenjenoga postupka, ali isključuje otapala koja se mogu izdvojiti bez utjecaja na stabilnost tvari ili promjene njezina sastava.
Ispitivana kemikalija
: svaka tvar ili smjesa koja se ispituje ovom metodom.
Globalno usklađeni sustav Ujedinjenih naroda za razvrstavanje i označivanje kemikalija (UN GHS)
: sustav za razvrstavanje kemikalija (tvari i smjesa) prema standardiziranim vrstama i stupnjevima fizičkih opasnosti i opasnosti za zdravlje i okoliš, kojim su obuhvaćena odgovarajuća komunikacijska sredstva kao što su piktogrami, oznake opasnosti, oznake upozorenja, oznake obavijesti i sigurnosno-tehnički listovi, kojima se prenose informacije o njihovim štetnim učincima u cilju zaštite ljudi (uključujući poslodavce, radnike, prijevoznike, potrošače i interventno osoblje) i okoliša (23.).
UVCB
: tvari nepoznatog ili promjenjivog sastava, složeni reakcijski proizvodi i biološki materijali.
Valjano ispitivanje
: ispitivanje za koje se smatra da je dovoljno relevantno i pouzdano za određenu svrhu te koje se temelji na znanstveno utemeljenim načelima. ispitivanje nikada nije valjano u apsolutnom smislu nego samo u odnosu na određenu svrhu (21.).
Dodatak 1.2.
TVARI ZA DOKAZIVANJE TEHNIČKE OSPOSOBLJENOSTI
Prije rutinske primjene ispitivanja opisanog u ovom Dodatku ispitnoj metodi B.71. laboratoriji bi trebali dokazati svoju tehničku osposobljenost tako što će za deset tvari preporučenih u tablici 1. dobiti očekivano predviđanje na temelju testa h-CLAT te za najmanje osam od deset tvari za dokazivanje tehničke osposobljenosti dobiti vrijednosti CV75, EC150 i EC200 koje su unutar odgovarajućeg referentnog raspona. Tvari za dokazivanje tehničke osposobljenosti izabrane su tako da predstavljaju niz odgovora povezanih s opasnostima od izazivanja preosjetljivosti kože. Ostali kriteriji za odabir uključivali su komercijalnu dostupnost tvari te dostupnost visokokvalitetnih in vivo referentnih podataka i visokokvalitetnih in vitro podataka dobivenih metodom h-CLAT. Isto tako, za metodu h-CLAT dostupni su objavljeni referentni podaci (3. i 14.).
Tablica 1.
Preporučene tvari za dokazivanje tehničke osposobljenosti za provedbu metode h-CLAT
|
Tvari za dokazivanje tehničke osposobljenosti
|
CAS br.
|
Agregatno stanje
|
Predviđanje
in vivo
(102)
|
Referentni raspon za CV75 u μg/ml (103)
|
Rezultati testa h-CLAT za CD86 (referentni raspon za EC150 u μg/ml) (103)
|
Rezultati testa h-CLAT za CD54 (referentni raspon za EC200 u μg/ml) (103)
|
|
2,4-dinitroklorbenzen
|
97-00-7
|
Kruta tvar
|
Tvar koja izaziva preosjetljivost (ekstremno jaka)
|
2–12
|
Pozitivno (0,5–10)
|
Pozitivno (0,5–15)
|
|
4-fenilendiamin
|
106-50-3
|
Kruta tvar
|
Tvar koja izaziva preosjetljivost (jaka)
|
5–95
|
Pozitivno (< 40)
|
Negativno (> 1,5) (104)
|
|
Niklov sulfat
|
10101-97-0
|
Kruta tvar
|
Tvar koja izaziva preosjetljivost (umjerena)
|
30–500
|
Pozitivno (< 100)
|
Pozitivno (10–100)
|
|
2-merkaptobenzotiazol
|
149-30-4
|
Kruta tvar
|
Tvar koja izaziva preosjetljivost (umjerena)
|
30–400
|
Negativno (> 10) (104)
|
Pozitivno (10–140)
|
|
R(+)-limonen
|
5989-27-5
|
Tekućina
|
Tvar koja izaziva preosjetljivost (slaba)
|
> 20
|
Negativno (> 5) (104)
|
Pozitivno (< 250)
|
|
Imidazolidinil urea
|
39236-46-9
|
Kruta tvar
|
Tvar koja izaziva preosjetljivost (slaba)
|
25–100
|
Pozitivno (20–90)
|
Pozitivno (20–75)
|
|
Izopropanol
|
67-63-0
|
Tekućina
|
Tvar koja ne izaziva preosjetljivost
|
> 5 000
|
Negativno (> 5 000 )
|
Negativno (> 5 000 )
|
|
Glicerol
|
56-81-5
|
Tekućina
|
Tvar koja ne izaziva preosjetljivost
|
> 5 000
|
Negativno (> 5 000 )
|
Negativno (> 5 000 )
|
|
Mliječna kiselina
|
50-21-5
|
Tekućina
|
Tvar koja ne izaziva preosjetljivost
|
1500-5 000
|
Negativno (> 5 000 )
|
Negativno (> 5 000 )
|
|
4-aminobenzojeva kiselina
|
150-13-0
|
Kruta tvar
|
Tvar koja ne izaziva preosjetljivost
|
> 1 000
|
Negativno (> 1 000 )
|
Negativno (> 1 000 )
|
|
Kratice: CAS br. = registarski broj Službe za podatke o kemijskim tvarima.
|
Dodatak 2.
IZAZIVANJE PREOSJETLJIVOSTI KOŽE IN VITRO: TEST AKTIVIRANJA STANIČNE LINIJE U937 (U-SENS™)
POČETNA RAZMATRANJA I OGRANIČENJA
|
1.
|
Testom U-SENS™ kvantificiraju se promjene u ekspresiji staničnih površinskih biljega povezanih s procesom aktiviranja monocita i dendritičnih stanica (DC) (tj. CD86) kod ljudske stanične linije histiocitnog limfoma U937, nakon izlaganja tvarima koje izazivaju preosjetljivost (1.). Izmjerene razine ekspresije staničnih površinskih biljega CD86 kod stanične linije U937 zatim se upotrebljavaju kao pomoć u razlikovanju tvari koje izazivaju preosjetljivost kože od tvari koje ne izazivaju preosjetljivost.
|
|
2.
|
Test U-SENS™ ocijenjen je u validacijskoj studiji (2.) kojom je koordinirao L’Oreal te ga je kasnije neovisno stručno pregledao Znanstveni savjetodavni odbor (ESAC) Referentnog laboratorija Europske unije za alternative ispitivanju na životinjama (EURL ECVAM) (3.). Uzimajući u obzir sve dostupne dokaze i informacije regulatornih tijela i dionika, EURL ECVAM je preporučio da se test U-SENS™ (4.) primjenjuje u okviru IATA-e kao pomoć u razlikovanju tvari koje izazivaju preosjetljivost od tvari koje ne izazivaju preosjetljivost u svrhu razvrstavanja i označivanja prema opasnosti. U smjernicama za izvješćivanje o strukturiranim pristupima integraciji podataka i pojedinačnim izvorima informacija koji se upotrebljavaju u okviru IATA-e za preosjetljivost kože OECD trenutačno raspravlja o nizu studija slučaja u kojima se opisuju različite strategije ispitivanja i modeli predviđanja. Jedan od različitih utvrđenih pristupa temelji se na testu U-SENS (5.). Primjeri upotrebe podataka dobivenih testom U-SENS™ u kombinaciji s ostalim informacijama, uključujući prijašnje podatke i postojeće valjane podatke dobivene na ljudima (6.) navode se i u drugoj literaturi (4., 5. i 7.).
|
|
3.
|
Pokazalo se da se test U-SENS™ može prenijeti u laboratorije koji imaju iskustva s tehnikama staničnih kultura i analizom protočnom citometrijom. Može se očekivati da će za predviđanja donesena s pomoću ovog testa razina obnovljivosti unutar jednog laboratorija biti reda veličine 90 %, a između više laboratorija 84 % (8.). Rezultati dobiveni u validacijskoj studiji (8.) i drugim objavljenim studijama (1.) ukupno pokazuju da, u usporedbi s rezultatima analize LLNA, točnost u razlikovanju tvari koje izazivaju preosjetljivost kože (tj. kategorija 1. prema sustavu UN GHS/Uredbi o CLP-u) od tvari koje ne izazivaju preosjetljivost iznosi 86 % (N = 166), uz osjetljivost od 91 % (118/129) i specifičnost od 65 % (24/37). U usporedbi s podacima dobivenima na ljudima, točnost u razlikovanju tvari koje izazivaju preosjetljivost (tj. kategorija 1. prema sustavu UN GHS/Uredbi o CLP-u) od tvari koje ne izazivaju preosjetljivost iznosi 77 % (N = 101) uz osjetljivost od 100 % (58/58) i specifičnost od 47 % (20/43). U usporedbi s analizom LLNA, veća je vjerojatnost da će se metodom U-SENS™ dobiti lažno negativna predviđanja kod kemikalija koje pokazuju nisku do umjerenu jakost u izazivanju preosjetljivosti kože (tj. potkategorija 1.B prema sustavu UN GHS/Uredbi o CLP-u) nego kod kemikalija koje pokazuju veliki potencijal izazivanja preosjetljivosti kože (tj. potkategorija 1.A prema sustavu UN GHS/Uredbi o CLP-u) (1., 8. i 9.). Prethodno navedene informacije upućuju na korisnost testa U-SENS™ kao elementa koji pridonosi identifikaciji opasnosti od izazivanja preosjetljivosti kože. Međutim, navedene vrijednosti koje se odnose na točnost metode U-SENS™ kao samostalnog testa samo su okvirne jer je taj test potrebno kombinirati s drugim izvorima informacija u kontekstu IATA-e te u skladu s odredbama stavaka 7. i 8. iz odjeljka „Opći uvod”. Nadalje, pri ocjenjivanju metoda ispitivanja preosjetljivosti kože koje ne uključuju pokuse na životinjama potrebno je imati na umu da ispitivanje LLNA i druga ispitivanja na životinjama možda neće u potpunosti odražavati situaciju kod ljudi.
|
|
4.
|
Na temelju podataka koji su trenutačno dostupni pokazalo se da je test U-SENS™ primjenjiv na ispitivane kemikalije (uključujući kozmetičke sastojke, npr. konzervanse, površinski aktivne tvari, aktivne tvari, boje) koje obuhvaćaju različite organske funkcionalne skupine, fizikalno-kemijska svojstva, jakost u izazivanju preosjetljivosti kože (kako je utvrđena u istraživanjima in vivo) i spektar mehanizama reakcije za koje je poznato da su povezani s preosjetljivošću kože (tj. Michaelov akceptor, nastanak Schiffovih baza, agens za prijenos acila, bimolekulska nukleofilna supstitucija [SN2] ili nukleofilna aromatska supstitucija [SNAr]) (1., 8., 9. i 10.). Test U-SENS™ primjenjiv je na ispitivane kemikalije koje su topljive ili tvore stabilnu disperziju (tj. koloid ili suspenziju u kojoj se ispitivana kemikalija ne taloži ili ne odvaja od otapala/nosača stvarajući različite faze) u odgovarajućem otapalu/nosaču (vidjeti stavak 13.). Za kemikalije u skupu podataka za koje je navedeno da su prehapteni (tj. tvari koje se aktiviraju oksidacijom) ili prohapteni (tj. tvari koje zahtijevaju enzimsku aktivaciju, na primjer enzimima P450) testom U-SENS™ dobivena su točna predviđanja (1. i 10.). Tvari koje djeluju disruptivno na membranu mogu dovesti do lažno pozitivnih rezultata zbog nespecifičnog povećanja ekspresije CD86, s obzirom na to da su tri lažno pozitivna rezultata od njih sedam, u odnosu na referentno razvrstavanje in vivo, dale površinski aktivne tvari (1.). Stoga bi pozitivne rezultate dobivene s površinski aktivnim tvarima trebalo uzeti u obzir s oprezom, dok bi se negativni rezultati i dalje mogli upotrebljavati kao pomoć u identifikaciji ispitivane kemikalije kao tvari koja ne izaziva preosjetljivost. Testom U-SENS™ mogu se ocijeniti fluorescentne ispitivane kemikalije (1.), ali snažne fluorescentne ispitivane kemikalije koje emitiraju na istoj valnoj duljini kao i fluorescein izotiocijanat (FITC) ili propidijev jodid (PI) ometat će otkrivanje protočnom citometrijom i stoga se ne mogu točno ocijeniti upotrebom protutijela konjugiranih FITC-om (potencijalni lažno negativni rezultati) ili propidijevim jodidom (ne može se izmjeriti vijabilnost). U tom se slučaju mogu upotrijebiti druga protutijela označena fluorokromom ili drugi biljezi citotoksičnosti pod uvjetom da se može dokazati da daju slične rezultate kao i protutijela označena FITC-om ili propidijev jodid (vidjeti stavak 18.), npr. ispitivanjem tvari za dokazivanje tehničke osposobljenosti iz Dodatka 2.2. S obzirom na navedeno, pozitivne rezultate s površinski aktivnim tvarima i negativne rezultate s jako fluorescentnim ispitivanim kemikalijama trebalo bi tumačiti u kontekstu navedenih ograničenja i zajedno s drugim izvorima informacija u okviru IATA-e. U slučajevima u kojima postoje dokazi da se test U-SENS™ ne može primijeniti za ispitivanje drugih specifičnih kategorija ispitivanih kemikalija, taj test ne bi trebalo upotrebljavati za te specifične kategorije.
|
|
5.
|
Kao što je opisano, test U-SENS™ pomaže u razlikovanju tvari koje izazivaju preosjetljivost kože od tvari koje ne izazivaju preosjetljivost. Međutim, ako se upotrebljava u okviru integriranih pristupa kao što je IATA, mogao bi pridonijeti i procjeni jačine izazivanja preosjetljivosti. Ipak, kako bi se moglo utvrditi na koji bi način rezultati dobiveni testom U-SENS™ mogli pomoći u toj procjeni, potreban je dodatan rad, koji će se po mogućnosti temeljiti na podacima dobivenima na ljudima.
|
|
6.
|
Definicije su navedene u Dodatku 2.1.
|
NAČELO ISPITIVANJA
|
7.
|
Test U-SENS™ je analiza in vitro kojom se kvantificiraju promjene u ekspresiji staničnih površinskih biljega CD86 na ljudskoj staničnoj liniji histiocitnog limfoma, stanicama U937, nakon izlaganja ispitivanoj kemikaliji 45 ± 3 h. Površinski biljeg CD86 jedan je tipični biljeg aktivacije stanica U937. Poznato je da je CD86 kostimulacijska molekula koja može oponašati aktiviranje monocita, koje ima ključnu ulogu u stimulaciji T-stanica. Promjene u ekspresiji staničnih površinskih biljega CD86 mjere se protočnom citometrijom nakon bojenja stanica, obično protutijelima označenima fluorescein izotiocijanatom (FITC). Istodobno se provodi i mjerenje citotoksičnosti (npr. upotrebom propidijeva jodida) kako bi se procijenilo dolazi li do povećanja ekspresije staničnih površinskih biljega CD86 pri subcitotoksičnim koncentracijama. Računa se indeks stimulacije (S.I.) staničnih površinskih biljega CD86 u usporedbi s kontrolom s otapalom/nosačem te se on upotrebljava u modelu predviđanja (vidjeti stavak 19.) kao pomoć u razlikovanju tvari koje izazivaju preosjetljivost od tvari koje ne izazivaju preosjetljivost.
|
DOKAZIVANJE OSPOSOBLJENOSTI
|
8.
|
Prije rutinske primjene ispitivanja opisanog u ovom Dodatku ispitnoj metodi B.71. laboratoriji bi trebali dokazati svoju tehničku osposobljenost upotrebom deset tvari za dokazivanje tehničke osposobljenosti navedenih u Dodatku 2.2. u skladu s dobrom praksom za metode in vitro (11.). Osim toga, korisnici ispitivanja trebaju održavati bazu prijašnjih podataka dobivenih provjerama reaktivnosti (vidjeti stavak 11.) te s pozitivnim kontrolama i kontrolama s otapalom/nosačem (vidjeti stavke 15. i 16.) i trebaju se koristiti tim podacima kako bi potvrdili da je njihov laboratorij održao obnovljivost ispitivanja tijekom vremena.
|
POSTUPAK
|
9.
|
Ovaj se test temelji na protokolu U-SENS™ DB-ALM (usluga baze podataka o alternativnim metodama pokusima na životinjama) br. 183 (12.). Pri provedbi i primjeni testa U-SENS™ u laboratoriju treba primjenjivati standardne operativne postupke (SOP). Za provedbu testa U-SENS™ može se koristiti i automatizirani sustav ako se može pokazati da on daje slične rezultate, na primjer, ispitivanjem tvari za dokazivanje tehničke osposobljenosti iz Dodatka 2.2. U nastavku su opisane glavne komponente i postupci za test U-SENS™.
|
Priprema stanica
|
10.
|
Za provedbu testa U-SENS™ treba upotrebljavati U937, ljudsku staničnu liniju histiocitnog limfoma (13.). Stanice (klon CRL1593.2) treba nabaviti iz kompetentne banke stanica kao što je American Type Culture Collection.
|
|
11.
|
Stanice U937 uzgajaju se na 37 °C s 5 % CO2 i u vlažnim atmosferskim uvjetima u mediju RPMI-1640 obogaćenom s 10 % fetalnog telećeg seruma (FCS), 2 mM L-glutamina, 100 jedinica/ml penicilina i 100 μg/ml streptomicina (potpuni medij). Stanice U937 rutinski se pasažiraju svaka 2–3 dana pri gustoći od 1,5 ili 3 × 105 stanica/ml. Gustoća stanica ne bi trebala biti veća od 2 × 106 stanica/ml, a vijabilnost stanica izmjerena izbacivanjem tripanskog modrila treba biti ≥ 90 % (ne primjenjuje se kod prve pasaže nakon odmrzavanja). Prije njihove upotrebe za ispitivanje treba provjeriti ispunjava li svaka šarža stanica, FCS-a ili protutijela zadane kriterije provjerom reaktivnosti. Provjeru reaktivnosti stanica treba provesti upotrebom pozitivne kontrole, 2,4,6-trinitrobenzensulfonske kiseline (TNBS) (CAS br. 2508-19-2, čistoće ≥ 99 %) i negativne kontrole, mliječne kiseline (LA) (CAS br. 50-21-5, čistoće ≥ 85 %), barem jedan tjedan nakon odmrzavanja. U provjeri reaktivnosti treba ispitati šest konačnih koncentracija za svaku od dviju kontrola (TNBS: 1, 12,5, 25, 50, 75, 100 μg/ml te LA: 1, 10, 20, 50, 100, 200 μg/ml). TNBS otopljen u potpunom mediju treba dati pozitivan odgovor za CD86 koji je povezan s koncentracijom (npr. kada pozitivnu koncentraciju, indeks stimulacije za CD86 ≥ 150, prati koncentracija s rastućim indeksom stimulacije za CD86), a mliječna kiselina otopljena u potpunom mediju treba dati negativan odgovor za CD86 (vidjeti stavak 21.). Za test treba upotrebljavati samo šaržu stanica koja je dvaput prošla provjeru reaktivnosti. Stanice se mogu razmnožavati do sedam tjedana nakon odmrzavanja. Broj pasaža ne bi trebao biti veći od 21. Reaktivnost treba provjeriti u skladu s postupcima opisanima u stavcima od 18. do 22.
|
|
12.
|
Za ispitivanje se stanice U937 nasađuju pri gustoći od 3 × 105 stanica/ml ili 6 × 105 stanica/ml te se prethodno uzgajaju u tikvicama s kulturom dva dana ili jedan dan. Mogu se upotrebljavati drugačiji uvjeti za prethodni uzgoj od prethodno opisanih ako se navede dovoljno dobro znanstveno obrazloženje i ako se može pokazati da oni daju slične rezultate, na primjer, ispitivanjem tvari za dokazivanje tehničke osposobljenosti iz Dodatka 2.2. Na dan ispitivanja stanice izdvojene iz tikvice s kulturom ponovno se suspendiraju svježim medijem za uzgoj kultura pri gustoći od 5 × 105 stanica/ml. Stanice se zatim distribuiraju na ploču s 96 jažica s ravnim dnom sa 100 μl (konačna gustoća stanica od 0,5 × 105 stanica/jažici).
|
Priprema ispitivanih kemikalija i kontrolnih tvari
|
13.
|
Prije ispitivanja procjenjuje se topljivost. U tu se svrhu ispitivane kemikalije otapaju ili stabilno dispergiraju pri koncentraciji od 50 mg/ml u potpunom mediju kao prvoj opciji za otapalo ili dimetil sulfoksidu (DMSO, čistoće ≥ 99 %) kao drugoj opciji za otapalo/nosač ako ispitivana kemikalija nije topljiva u potpunom mediju kao otapalu/nosaču. Za ispitivanje se ispitivana kemikalija otapa do konačne koncentracije od 0,4 mg/ml u potpunom mediju ako je kemikalija topljiva u tom otapalu/nosaču. Ako je kemikalija topljiva samo u DMSO-u, kemikalija se otapa do koncentracije od 50 mg/ml. Mogu se upotrebljavati i druga otapala/nosači ako se navede dovoljno dobro znanstveno obrazloženje. Treba uzeti u obzir stabilnost ispitivane kemikalije u konačnom otapalu/nosaču.
|
|
14.
|
Ispitivane kemikalije i kontrolne tvari pripremaju se na dan ispitivanja. Budući da se ne provodi test za utvrđivanje doze, u prvom ciklusu treba ispitati šest konačnih koncentracija (1, 10, 20, 50, 100 i 200 μg/ml) u odgovarajućem otapalu/nosaču, odnosno potpunom mediju ili 0,4-postotnom DMSO-u u mediju. U naknadnim se ciklusima pripremaju barem četiri radne otopine ispitivane kemikalije (tj. barem četiri koncentracije) upotrebom odgovarajućeg otapala/nosača, počevši od 0,4 mg/ml u potpunom mediju ili 50 mg/ml u DMSO-u. Radne otopine naposljetku se koriste za tretiranje dodavanjem volumena suspenzije stanica U937 (vidjeti prethodni stavak 11.) koji je jednak volumenu radne otopine na ploči kako bi se dobilo dodatno dvostruko razrjeđenje (12.). Koncentracije (najmanje četiri koncentracije) za daljnje cikluse odabiru se na temelju pojedinačnih rezultata svih prethodnih ciklusa (8.). Mogu se upotrebljavati konačne koncentracije od 1, 2, 3, 4, 5, 7,5, 10, 12,5, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180 i 200 μg/ml. Najveća konačna koncentracija iznosi 200 μg/ml. Ako se pri koncentraciji od 1 μg/ml uoči pozitivna vrijednost za CD86, ocjenjuje se 0,1 μg/ml kako bi se pronašla koncentracija ispitivane kemikalije koja ne inducira CD86 veći od pozitivnog praga. Za svaki se ciklus računa EC150 (koncentracija pri kojoj kemikalija dosegne pozitivni prag za CD86 od 150 %, vidjeti stavak 19.) ako se uoči pozitivan odgovor na koncentraciju za CD86. Ako ispitivana kemikalija inducira pozitivan odgovor za CD86 koji nije povezan s koncentracijom, izračun vrijednosti EC150 možda neće biti relevantan, kako je opisano u protokolu U-SENS™ DB-ALM br. 183 (12.). Za svaki se ciklus računa CV70 (koncentracija pri kojoj kemikalija dosegne prag citotoksičnosti od 70 %, vidjeti stavak 19.) kad god je to moguće (12.). Kako bi se istražio učinak odgovora na koncentraciju kod povećanja CD86, treba odabrati bilo koje koncentracije od upotrebljivih koncentracija koje su ravnomjerno raspoređene od EC150 (ili najveće koncentracije kod koje je CD86 negativan i koja nije citotoksična) do CV70 (ili najveće dopuštene koncentracije, tj. 200 μg/ml). Treba ispitati najmanje četiri koncentracije po ciklusu pri čemu barem dvije koncentracije trebaju biti iste kao i u prethodnom ciklusu radi usporedbe.
|
|
15.
|
Kao kontrola s otapalom/nosačem u testu U-SENS™ upotrebljava se potpuni medij (za ispitivane kemikalije otopljene ili stabilno dispergirane u potpunom mediju) (vidjeti stavak 4.) ili 0,4-postotni DMSO u potpunom mediju (za ispitivane kemikalije otopljene ili stabilno dispergirane u DMSO-u).
|
|
16.
|
Kao pozitivna kontrola u testu U-SENS™ upotrebljava se TNBS (vidjeti stavak 11.) pripremljen u potpunom mediju. TNBS treba upotrebljavati kao pozitivnu kontrolu za mjerenje ekspresije CD86 pri jednoj konačnoj koncentraciji na ploči (50 μg/ml) koja daje vijabilnost stanica > 70 %. Kako bi se na ploči dobila koncentracija TNBS-a od 50 μg/ml, priprema se glavna otopina TNBS-a od 1 M (tj. 293 mg/ml) u potpunom mediju, koja se dodatno razrjeđuje 2 930 puta potpunim medijem kako bi se dobila radna otopina od 100 μg/ml. Kao negativnu kontrolu treba upotrebljavati mliječnu kiselinu (LA, CAS 50-21-5) koncentracije 200 μg/ml, otopljenu u potpunom mediju (iz glavne otopine od 0,4 mg/ml). Na svakoj ploči svakog ciklusa pripremaju se tri ponavljanja netretirane kontrole s potpunim medijem, kontrole s otapalom/nosačem, negativne i pozitivne kontrole (12.). Mogu se upotrijebiti druge prikladne pozitivne kontrole, pod uvjetom da su dostupni prijašnji podaci na temelju kojih se mogu odrediti usporedivi kriteriji prihvatljivosti ciklusa. Kriteriji prihvatljivosti ciklusa isti su kao i oni opisani za ispitivanu kemikaliju (vidjeti stavak 12.).
|
Primjena ispitivanih kemikalija i kontrolnih tvari
|
17.
|
Kontrola s otapalom/nosačem ili radne otopine opisane u stavcima od 14. do 16. miješaju se u omjeru 1: 1 (v/v) sa suspenzijama stanica pripremljenima na ploči s 96 jažica s ravnim dnom (vidjeti stavak 12.). Tretirane se ploče potom inkubiraju 45 ± 3 h na temperaturi od 37 °C s 5 % CO2. Ploče se prije inkubacije zatvaraju polupropusnom membranom kako bi se spriječilo isparavanje hlapljivih ispitivanih kemikalija i unakrsna kontaminacija stanica tretiranih ispitivanim kemikalijama (12.).
|
Bojenje stanica
|
18.
|
Nakon izlaganja od 45 ± 3 h stanice se prenose u mikrotitracijsku ploču u obliku slova „v” i prikupljaju centrifugiranjem. Interferencija s topljivošću definira se kao uočavanje kristala ili kapljica upotrebom mikroskopa 45 ± 3 h nakon tretiranja (prije bojenja stanica). Supernatanti se odbacuju, a preostale stanice ispiru se jednom sa 100 μl vrlo hladne fiziološke otopine puferirane fosfatnim puferom (PBS) koja sadržava 5 % fetalnog telećeg seruma (pufer za bojenje). Nakon centrifugiranja stanice se ponovno suspendiraju sa 100 μl pufera za bojenje i boje s 5 μl (npr. 0,25 μg) protutijela anti-CD86 ili mišjih protutijela IgG1 (izotip) označenih FITC-om na 4 °C u trajanju od 30 minuta, zaštićeno od svjetla. Treba upotrebljavati protutijela opisana u protokolu U-SENS™ DB-ALM br. 183 (12.) (za CD86: BD-PharMingen #5556 57 klon: Fun-1, ili Caltag/Invitrogen # MHCD8601 klon: BU63; a za IgG1: BD-PharMingen #5557 48 ili Caltag/Invitrogen # GM4992). Na temelju iskustva subjekata koji su razvili ispitivanje intenzitet fluorescencije protutijela obično je dosljedan među različitim serijama. Za test se mogu upotrebljavati i drugi klonovi ili dobavljači protutijela koji su prošli provjeru reaktivnosti (vidjeti stavak 11.). Međutim, korisnici mogu razmotriti titraciju protutijela u uvjetima svojeg laboratorija kako bi utvrdili koju je koncentraciju najbolje upotrebljavati. Mogu se koristiti i drugi detekcijski sustavi, npr. protutijela anti-CD86 označena fluorokromom, ako se može pokazati da daju slične rezultate kao i protutijela konjugirana FITC-om, na primjer, ispitivanjem tvari za dokazivanje tehničke osposobljenosti iz Dodatka 2.2. Nakon ispiranja sa 100 μl pufera za bojenje dva puta i jednom sa 100 μl vrlo hladnog PBS-a, stanice se ponovno suspendiraju u vrlo hladnom PBS-u (npr. 125 μl za uzorke koji se analiziraju ručno u pojedinačnim epruvetama ili 50 μl ako se upotrebljava ploča za automatsko uzorkovanje) i dodaje se otopina propidijeva jodida (konačna koncentracija od 3 μg/ml). Mogu se koristiti i drugi biljezi citotoksičnosti, kao što su 7-aminoaktinomicin D (7-AAD) ili tripansko modrilo, ako se može pokazati da alternativna bojila daju slične rezultate kao i propidijev jodid, na primjer, ispitivanjem tvari za dokazivanje tehničke osposobljenosti iz Dodatka 2.2.
|
Analiza protočnom citometrijom
|
19.
|
Razina ekspresije CD86 i vijabilnost stanica analiziraju se upotrebom protočne citometrije. Stanice se prikazuju u točkastom dijagramu s veličinom (FSC) i granularnošću (SSC) na logaritamskoj skali kako bi se jasno identificirala populacija u prvim vratima R1 i uklonili ostaci. Za svaku se jažicu nastoji očitati ukupno 10 000 stanica u vratima R1. Stanice iz istih vrata R1 prikazuju se u FL3 ili FL4/SSC točkastom dijagramu. Žive stanice ograničavaju se postavljanjem drugih vrata R2 kojima se odabire populacija stanica negativnih na propidijev jodid (kanal FL3 ili FL4). Vijabilnost stanica može se izračunati tako da se u programu za analizu citometra upotrijebi sljedeća jednadžba. Ako je vijabilnost stanica niska, može se očitati do 20 000 stanica, uključujući mrtve stanice. Umjesto toga, podaci se mogu očitavati jednu minutu nakon početka analize.
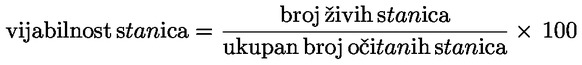
Zatim se među tim živim stanicama ograničenima na vratima R2 (unutar R1) mjeri postotak pozitivnih stanica u kanalu FL1. Stanična površinska ekspresija za CD86 analizira se u FL1/SSC točkastom dijagramu ograničenom na žive stanice (R2).
Za jažice koje sadržavaju potpuni medij/IgG1 marker za analizu postavlja se blizu glavne populacije tako da je IgG1 kontrola s potpunim medijem unutar ciljanog područja od 0,6 do 0,9 %.
Interferencija s bojom definira se kao pomak u točkastom dijagramu za IgG1 označen FITC-om (IgG1 FL1 Geo srednja vrijednost S.I. ≥ 150 %).
Indeks stimulacije (S.I.) za CD86 za kontrolne stanice (netretirane ili u 0,4-postotnom DMSO-u) i stanice tretirane kemikalijama računa se u skladu sa sljedećom jednadžbom:.

% IgG1+ netretiranih kontrolnih stanica: odnosi se na postotak pozitivnih stanica IgG1 u kanalu FL1 koje se definiraju markerom za analizu (prihvaćeni raspon od ≥ 0,6 % do < 1,5 %, vidjeti stavak 22.) među živim netretiranim stanicama.
% IgG1+/CD86+ kontrolnih/tretiranih stanica: odnosi se na postotak pozitivnih stanica IgG1/CD86 u kanalu FL1 koji se mjeri bez pomicanja markera za analizu među živim kontrolnim/tretiranim stanicama.
|
PODACI I IZVJEŠĆIVANJE
Procjena podataka
|
20.
|
U testu U-SENS™ računaju se sljedeći parametri: vrijednost CV70, tj. koncentracija koja pokazuje preživljavanje stanica U937 od 70 % (citotoksičnost od 30 %), i vrijednost EC150, tj. koncentracija pri kojoj su ispitivane kemikalije inducirale indeks stimulacije (S.I.) za CD86 od 150 %.
CV70 se računa log-linearnom interpolacijom, upotrebom sljedeće jednadžbe:
CV70 = C1 + [(V1 – 70) / (V1 – V2) * (C2 – C1)]
pri čemu je:
V1 najmanja vrijednost vijabilnosti stanica koja je veća od 70 %;
V2 najveća vrijednost vijabilnosti stanica koja je manja od 70 %;
C1 i C2 su koncentracije koje pokazuju vrijednost vijabilnosti stanica V1 odnosno V2.

Mogu se upotrebljavati i drugi pristupi za izvođenje vrijednosti CV70 pod uvjetom da se dokaže da to ne utječe na rezultate (npr. ispitivanjem tvari za dokazivanje tehničke osposobljenosti).
EC150 se računa log-linearnom interpolacijom, upotrebom sljedeće jednadžbe:
EC150 = C1 + [(150 – S.I.1) / (S.I.2 – S.I.1) * (C2 – C1)]
pri čemu je:
C1 = najviša koncentracija u μg/ml kod koje je S.I. za CD86 < 150 % (S.I. 1)
C2 = najniža koncentracija u μg/ml kod koje je S.I. za CD86 ≥ 150 % (S.I. 2).
Vrijednosti EC150 i CV70 računaju se:
|
—
|
za svaki ciklus: pojedinačne vrijednosti EC150 i CV70 upotrebljavaju se kao alati za ispitivanje učinka odgovora na koncentraciju kod povećanja CD86 (vidjeti stavak 14.),
|
|
—
|
na temelju prosječnih vijabilnosti utvrđuje se ukupni CV70 (12.),
|
|
—
|
na temelju prosječnog indeksa stimulacije vrijednosti CD86 utvrđuje se ukupni EC150 za ispitivanu kemikaliju za koju se testom U-SENS™ predvidi da je POZITIVNA (vidjeti stavak 21.) (12.).
|
|
Model predviđanja
|
21.
|
Kod mjerenja ekspresije CD86 svaka ispitivana kemikalija ispituje se primjenom najmanje četiri koncentracije i u najmanje dva neovisna ciklusa (koji se provode na različite dane) kako bi se izvelo jedno predviđanje (NEGATIVNO ili POZITIVNO).
|
—
|
Pojedinačni zaključak ciklusa U-SENS™ smatra se negativnim (dalje u tekstu „N”) ako je indeks stimulacije za CD86 manji od 150 % pri svim koncentracijama koje nisu citotoksične (vijabilnost stanica ≥ 70 %) i ako se ne uoči nikakva interferencija (citotoksičnost, topljivost: vidjeti stavak 18. ili boja: vidjeti stavak 19., neovisno o necitotoksičnim koncentracijama pri kojima se opazi interferencija). U svim ostalim slučajevima: pojedinačni zaključak ciklusa U-SENS™ smatra se pozitivnim (dalje u tekstu „P”) ako je indeks stimulacije za CD86 jednak ili veći od 150 % i/ili ako se uoče interferencije.
|
|
—
|
Predviđanje na temelju testa U-SENS™ smatra se NEGATIVNIM ako su negativna (N) barem dva neovisna ciklusa (slika 1.). Ako su prva dva ciklusa negativna (N), predviđanje na temelju testa U-SENS™ smatra se NEGATIVNIM i ne mora se provoditi treći ciklus.
|
|
—
|
Predviđanje na temelju testa U-SENS™ smatra se POZITIVNIM ako su pozitivna (P) barem dva neovisna ciklusa (slika 1.). Ako su prva dva ciklusa pozitivna (P), predviđanje na temelju testa U-SENS™ smatra se POZITIVNIM i ne mora se provoditi treći ciklus.
|
|
—
|
Budući da se ne provodi test za utvrđivanje doze primjenjuje se iznimka ako je u prvom ciklusu indeks stimulacije za CD86 jednak ili veći od 150 % samo pri najvišoj necitotoksičnoj koncentraciji. Smatra se da ciklus tada NIJE JEDNOZNAČAN (NC) i u dodatnim ciklusima treba ispitati dodatne koncentracije (između najviše koncentracije koja ne uzrokuje citotoksičnost i najniže koncentracije koja uzrokuje citotoksičnost – vidjeti stavak 20.). Ako se ciklus identificira kao NC, treba provesti barem dva dodatna ciklusa, a i četvrti ciklus ako drugi i treći nisu usklađeni (neovisno N i/ili P) (slika 1.). Naknadni ciklusi smatrat će se pozitivnima čak i ako samo jedna necitotoksična koncentracija pokaže CD86 jednak ili veći od 150 % jer je postavka koncentracije prilagođena za specifičnu ispitivanu kemikaliju. Konačno predviđanje temeljit će se na većinskom rezultatu iz tri ili četiri pojedinačna ciklusa (tj. dva od tri ili dva od četiri) (slika 1.).
|

Slika 1.: Model predviđanja koji se upotrebljava u testu U-SENS™. Predviđanje na temelju testa U-SENS™ trebalo bi razmatrati u okviru IATA-e i u skladu s odredbama stavka 4. te stavaka 7., 8. i 9. iz odjeljka „Opći uvod”.
N: ciklus u kojem nije uočen pozitivan CD86 ili interferencija.
P: ciklus u kojem je uočen pozitivan CD86 i/ili interferencija.
NC: nije jednoznačno. Nije jednoznačno u prvom ciklusu ako je CD86 pozitivan samo pri najvišoj koncentraciji koja nije citotoksična.
#: pojedinačni zaključak koji nije jednoznačan (NC) koji se pripiše samo prvom ciklusu automatski podrazumijeva da je potreban treći ciklus kako bi se dobio većinski pozitivan (P) ili negativan (N) zaključak u barem dva od tri neovisna ciklusa.
$: u okvirima su prikazane relevantne kombinacije rezultata iz tri ciklusa na temelju rezultata dobivenih u prva dva ciklusa prikazana u prethodnom okviru.
°: u okvirima su prikazane relevantne kombinacije rezultata iz četiri ciklusa na temelju rezultata dobivenih u prva tri ciklusa prikazana u prethodnom okviru.
|
Kriteriji prihvatljivosti
|
22.
|
Sljedeći bi kriteriji prihvatljivosti trebali biti ispunjeni kada se primjenjuje test U-SENS™ (12.).
|
—
|
Na kraju razdoblja izlaganja od 45 ± 3 h srednja vijabilnost kod tri ponavljanja netretiranih stanica U937 morala je biti > 90 % i bez uočenog pomaka u ekspresiji CD86. Bazalna ekspresija CD86 kod netretiranih stanica U937 morala je biti u rasponu od ≥ 2 % do ≤ 25 %.
|
|
—
|
Ako se kao otapalo upotrebljava DMSO, valjanost kontrole s nosačem DMSO procjenjuje se računanjem indeksa stimulacije za DMSO u usporedbi s netretiranim stanicama i srednja vijabilnost u tri ponavljanja stanica morala je biti > 90 %. Kontrola s nosačem DMSO valjana je ako je srednja vrijednost S.I. za CD86 u tri ponavljanja bila manja od 250 % srednje vrijednosti S.I. u tri ponavljanja za CD86 netretiranih stanica U937.
|
|
—
|
Ciklusi se smatraju valjanima ako su barem dvije od tri vrijednosti IgG1 netretiranih stanica U937 bile u rasponu od ≥ 0,6 % do< 1,5 %.
|
|
—
|
Istodobno ispitana negativna kontrola (mliječna kiselina) smatra se valjanom ako su barem dva od tri ponavljanja bila negativna (S.I. za CD86 < 150 %) i necitotoksična (vijabilnost stanica ≥ 70 %).
|
|
—
|
Pozitivna kontrola (TNBS) smatrala se valjanom ako su barem dva od tri ponavljanja bila pozitivna (S.I. za CD86 ≥ 150 %) i necitotoksična (vijabilnost stanica ≥ 70 %).
|
|
Izvješće o ispitivanju
|
23.
|
Izvješće o ispitivanju trebalo bi sadržavati sljedeće informacije:
|
Ispitivana kemikalija
Tvar s jednim sastojkom:
|
kemijske identifikacijske oznake, kao što su IUPAC ili CAS naziv(i), CAS broj(evi), SMILES ili InChI oznaka, strukturna formula i/ili druge identifikacijske oznake,
|
|
fizički izgled, topljivost u potpunom mediju, topljivost u DMSO-u, molekularna masa te dodatna relevantna fizikalno-kemijska svojstva, u mjeri u kojoj su podaci dostupni,
|
|
čistoća, kemijski identitet nečistoća prema potrebi i ako je izvedivo u praksi itd.,
|
|
obrada prije ispitivanja, prema potrebi (npr. zagrijavanje, usitnjavanje),
|
|
ispitana koncentracija (ispitane koncentracije),
|
|
uvjeti skladištenja i stabilnost, u mjeri u kojoj su podaci dostupni,
|
|
obrazloženje za odabir otapala/nosača za svaku ispitivanu kemikaliju.
|
Tvar s više sastojaka, UVCB tvar i smjesa:
|
opisane koliko god je to moguće npr. kemijskim identitetom (vidjeti prethodno), čistoćom, količinskom zastupljenošću i relevantnim fizikalno-kemijskim svojstvima sastojaka (vidjeti prethodno), u mjeri u kojoj su podaci dostupni,
|
|
fizički izgled, topljivost u potpunom mediju, topljivost u DMSO-u te dodatna relevantna fizikalno-kemijska svojstva, u mjeri u kojoj su podaci dostupni,
|
|
molekularna masa ili prividna molekularna masa u slučaju smjesa/polimera poznatog sastava ili druge informacije koje su relevantne za provođenje studije,
|
|
obrada prije ispitivanja, prema potrebi (npr. zagrijavanje, usitnjavanje),
|
|
ispitana koncentracija (ispitane koncentracije),
|
|
uvjeti skladištenja i stabilnost, u mjeri u kojoj su podaci dostupni,
|
|
obrazloženje za odabir otapala/nosača za svaku ispitivanu kemikaliju.
|
|
|
Kontrole
Pozitivna kontrola:
|
kemijske identifikacijske oznake, kao što su IUPAC ili CAS naziv(i), CAS broj(evi), SMILES ili InChI oznaka, strukturna formula i/ili druge identifikacijske oznake,
|
|
fizički izgled, topljivost u DMSO-u, molekularna masa te dodatna relevantna fizikalno-kemijska svojstva, u mjeri u kojoj su podaci dostupni i ako je primjenjivo,
|
|
čistoća, kemijski identitet nečistoća prema potrebi i ako je izvedivo u praksi itd.,
|
|
obrada prije ispitivanja, prema potrebi (npr. zagrijavanje, usitnjavanje),
|
|
ispitana koncentracija (ispitane koncentracije),
|
|
uvjeti skladištenja i stabilnost, u mjeri u kojoj su podaci dostupni,
|
|
upućivanje na rezultate koji se odnose na prijašnje pozitivne kontrole i pokazuju primjerenost kriterija prihvatljivosti ciklusa, ako je primjenjivo.
|
Negativna kontrola i kontrola s otapalom/nosačem:
|
kemijske identifikacijske oznake, kao što su IUPAC ili CAS naziv(i), CAS broj(evi), SMILES ili InChI oznaka, strukturna formula i/ili druge identifikacijske oznake,
|
|
čistoća, kemijski identitet nečistoća prema potrebi i ako je izvedivo u praksi itd.,
|
|
fizički izgled, molekularna masa te dodatna relevantna fizikalno-kemijska svojstva u slučaju da su upotrijebljene kontrole s otapalom/nosačem koje nisu navedene u smjernici za ispitivanje, u mjeri u kojoj su podaci dostupni,
|
|
uvjeti skladištenja i stabilnost, u mjeri u kojoj su podaci dostupni,
|
|
obrazloženje za odabir otapala/nosača za svaku ispitivanu kemikaliju.
|
|
|
Ispitni uvjeti:
|
naziv i adresa naručitelja, ustanove koja provodi ispitivanje i voditelja istraživanja,
|
|
opis upotrijebljenog ispitivanja,
|
|
upotrijebljena stanična linija, uvjeti njezina skladištenja i izvor (npr. objekt iz kojeg su dobiveni),
|
|
upotrijebljena protočna citometrija (npr. model), uključujući upotrijebljene postavke instrumenta, protutijela i biljege citotoksičnosti,
|
|
postupak koji je primijenjen za dokazivanje osposobljenosti laboratorija za izvođenje ispitivanja ispitivanjem tvari koje služe za dokazivanje osposobljenosti te postupak koji je primijenjen za dokazivanje obnovljive primjene ispitivanja tijekom vremena, npr. podaci o prijašnjim kontrolama i/ili prijašnjim provjerama reaktivnosti.
|
|
|
Kriteriji prihvatljivosti ispitivanja:
|
vijabilnost stanica i vrijednosti indeksa stimulacije za CD86 dobivene kontrolom s otapalom/nosačem u usporedbi s rasponima prihvatljivosti,
|
|
vijabilnost stanica i vrijednosti indeksa stimulacije dobivene pozitivnom kontrolom u usporedbi s rasponima prihvatljivosti,
|
|
vijabilnost stanica svih ispitanih koncentracija ispitane kemikalije.
|
|
|
Ispitni postupak:
|
broj upotrijebljenih ciklusa,
|
|
koncentracije ispitivane kemikalije, primjena i vrijeme izloženosti (ako je drukčije od preporučenog),
|
|
opis primijenjenih kriterija ocjenjivanja i odlučivanja,
|
|
opis mogućih izmjena ispitnog postupka.
|
|
|
Rezultati:
|
tablični prikaz podataka, uključujući CV70 (ako je primjenjivo), indeks stimulacije, vrijednosti vijabilnosti stanica, vrijednosti EC150 (ako je primjenjivo) dobivene za ispitivanu kemikaliju i za pozitivnu kontrolu u svakom ciklusu te klasifikacija ispitivane kemikalije prema modelu predviđanja,
|
|
opis svih drugih relevantnih opažanja, ako je primjenjivo.
|
|
|
Rasprava o rezultatima:
|
rasprava o rezultatima dobivenima testom U-SENS™,
|
|
rasprava o rezultatima ispitivanja u kontekstu IATA-e ako su dostupni drugi relevantni podaci.
|
|
Zaključci
|
LITERATURA
|
1.
|
Piroird, C., Ovigne, J.M., Rousset, F., Martinozzi-Teissier, S., Gomes, C., Cotovio, J., Alépée, N. (2015). The Myeloid U937 Skin Sensitization Test (U-SENS) addresses the activation of dendritic cell event in the adverse outcome pathway for skin sensitization. Toxicol. In Vitro 29, 901.–916.
|
|
2.
|
EURL ECVAM (2017). The U-SENS™ test method Validation Study Report. Dostupno na: http://ihcp.jrc.ec.europa.eu/our_labs/eurl-ecvam/eurl-ecvam-recommendations.
|
|
3.
|
EC EURL ECVAM (2016). ESAC Opinion No 2016-03 on the L'Oréal-coordinated study on the transferability and reliability of the U-SENS™ test method for skin sensitisation testing. EUR 28 178 EN; doi 10.2787/815737. Dostupno na: [http://publications.jrc.ec.europa.eu/repository/handle/JRC103705].
|
|
4.
|
EC EURL ECVAM (2017). EURL ECVAM Recommendation on the use of non-animal approaches for skin sensitisation testing. EUR 28 553 EN; doi 10.2760/588955. Dostupno na: https://ec.europa.eu/jrc/en/publication/eur-scientific-and-technical-research-reports/eurl-ecvam-recommendation-use-non-animal-approaches-skin-sensitisation-testing.
|
|
5.
|
Steiling, W. (2016). Safety Evaluation of Cosmetic Ingredients Regarding their Skin Sensitization Potential. doi:10.3390/cosmetics3020014.Cosmetics 3, 14.
|
|
6.
|
OECD (2016). Guidance Document on The Reporting of Defined Approaches and Individual Information Sources to be Used Within Integrated Approaches to Testing and Assessment (IATA) For Skin Sensitisation, Series on Testing & Assessment No 256, ENV/JM/MONO(2016)29. Organizacija za gospodarsku suradnju i razvoj, Pariz. Dostupno na: [http://www.oecd.org/env/ehs/testing/series-testing-assessment-publications-number.htm.
|
|
7.
|
Urbisch, D., Mehling, A., Guth, K., Ramirez, T., Honarvar, N., Kolle, S., Landsiedel, R., Jaworska, J., Kern, P.S., Gerberick, F., Natsch, A., Emter, R., Ashikaga, T., Miyazawa, M., Sakaguchi, H. (2015). Assessing skin sensitization hazard in mice and men using non-animal test methods. Regul. Toxicol. Pharmacol. 71, 337.–351.
|
|
8.
|
Alépée, N., Piroird, C., Aujoulat, M., Dreyfuss, S., Hoffmann, S., Hohenstein, A., Meloni, M., Nardelli, L., Gerbeix, C., Cotovio, J. (2015). Prospective multicentre study of the U-SENS test method for skin sensitization testing. Toxicol In Vitro 30, 373.–382.
|
|
9.
|
Reisinger, K., Hoffmann, S., Alépée, N., Ashikaga, T., Barroso, J., Elcombe, C., Gellatly, N., Galbiati, V., Gibbs, S., Groux, H., Hibatallah, J., Keller, D., Kern, P., Klaric, M., Kolle, S., Kuehnl, J., Lambrechts, N., Lindstedt, M., Millet, M., Martinozzi-Teissier, S., Natsch, A., Petersohn, D., Pike, I., Sakaguchi, H., Schepky, A., Tailhardat, M., Templier, M., van Vliet, E., Maxwell, G. (2014). Systematic evaluation of non-animal test methods for skin sensitisation safety assessment. Toxicol. In Vitro 29, 259.–270.
|
|
10.
|
Fabian, E., Vogel, D., Blatz, V., Ramirez, T., Kolle, S., Eltze, T., van Ravenzwaay, B., Oesch, F., Landsiedel, R. (2013). Xenobiotic metabolizin enzyme activities in cells used for testing skin sensitization in vitro. Arch. Toxicol. 87, 1683.–1696.
|
|
11.
|
OECD. (2018). Draft Guidance document: Good In Vitro Method Practices (GIVIMP) for the Development and Implementation of In Vitro Methods for Regulatory Use in Human Safety Assessment. Organizacija za gospodarsku suradnju i razvoj, Pariz. Dostupno na: http://www.oecd.org/env/ehs/testing/OECD Final Draft GIVIMP.pdf.
|
|
12.
|
DB-ALM (2016). Protocol no 183: Myeloid U937 Skin Sensitization Test (U-SENS™), 33pp. Dostupno na: [http://ecvam-dbalm.jrc.ec.europa.eu/].
|
|
13.
|
Sundström, C., Nilsson, K. (1976). Establishment and characterization of a human histiocytic lymphoma cell line (U-937). Int. J. Cancer 17, 565.–577.
|
|
14.
|
OECD (2005). Series on Testing and Assessment No. 34: Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment. Organizacija za gospodarsku suradnju i razvoj, Pariz. Dostupno na: http://www.oecd.org/env/ehs/testing/series-testing-assessment-publications-number.htm.
|
|
15.
|
Ujedinjeni narodi (UN) (2015). Globally Harmonized System of Classification and Labelling of Chemicals (GHS). ST/SG/AC.10/30/Rev.6, Sixth Revised Edition, New York & Geneva: United Nations Publications. Dostupno na: http://www.unece.org/fileadmin/DAM/trans/danger/publi/ghs/ghs_rev06/English/ST-SG-AC10-30-Rev6e.pdf.
|
|
16.
|
OECD (2012). Series on Testing and Assessment No 168: The Adverse Outcome Pathway for Skin Sensitisation Initiated by Covalent Binding to Proteins. Part 1: Scientific Evidence. Organizacija za gospodarsku suradnju i razvoj, Pariz. Dostupno na: http://www.oecd.org/env/ehs/testing/series-testing-assessment-publications-number.htm.
|
|
17.
|
ECETOC (2003). Technical Report No 87: Contact sensitization: Classification according to potency. European Centre for Ecotoxicology & Toxicology of Chemicals, Bruxelles. Dostupno na: https://ftp.cdc.gov/pub/Documents/OEL/06.%20Dotson/References/ECETOC_2003-TR87.pdf.
|
Dodatak 2.1.
DEFINICIJE
Točnost
: stupanj podudarnosti između rezultata ispitivanja i prihvaćenih referentnih vrijednosti. Ona je mjerilo učinkovitosti ispitivanja i jedan od aspekata relevantnosti. Pojam je često međusobno zamjenjiv s pojmom „podudarnost” u smislu udjela točnih ishoda ispitivanja (14.).
AOP (engl. Adverse Outcome Pathway put nastanka štetnog ishoda)
: slijed događaja od kemijske strukture ciljne kemikalije ili skupine sličnih kemikalija preko početnog molekularnog događaja do in vivo štetnog ishoda (15.).
Odgovor na koncentraciju CD86
: ovisnost o koncentraciji (ili odgovor na koncentraciju) postoji ako pozitivnu koncentraciju (S.I. za CD86 ≥ 150) prati koncentracija s rastućim indeksom stimulacije za CD86.
Kemikalija
: tvar ili smjesa.
CV70
: procijenjena koncentracija koja pokazuje vijabilnost stanica od 70 %.
Pomak
: pomak se definira na sljedeći način i. ispravljena vrijednost % CD86+ netretiranog kontrolnog ponavljanja 3 manja je od 50 % srednje ispravljene vrijednosti % CD86+ netretiranih kontrolnih ponavljanja 1 i 2 i ii. ispravljena vrijednost % CD86+ negativnog kontrolnog ponavljanja 3 manja je od 50 % srednje ispravljene vrijednosti % CD86+ negativnih kontrolnih ponavljanja 1 i 2.
EC150
: procijenjene koncentracije koje pokazuju 150 % indeksa stimulacije ekspresije CD86.
Protočna citometrija
: citometrijska tehnika u kojoj stanice suspendirane u tekućini jedna po jedna protječu kroz fokus ekscitacijske svjetlosti koja se raspršuje u uzorcima koji se specifični za stanice i njihove komponente; stanice su često označene fluorescentnim biljezima tako da se svjetlost prvo apsorbira, a zatim emitira pri izmijenjenim frekvencijama.
Opasnost
: intrinzično svojstvo nekog agensa ili stanje koje ima potencijal uzrokovanja štetnih učinaka kada su organizam, sustav ili (sub)populacija izloženi tom agensu.
IATA (engl. Integrated Approach to Testing and Assessment integrirani pristup ispitivanju i procjeni)
: strukturiran pristup koji se primjenjuje za identifikaciju opasnosti (potencijal), karakterizaciju opasnosti (jakost) i/ili procjenu sigurnosti (potencijal/jakost i izloženost) kemikalije ili skupine kemikalija, kojim se na strateški način objedinjuju i ponderiraju svi relevantni podaci koji će služiti kao podloga za donošenje regulatornih odluka u vezi s potencijalnom opasnošću i/ili rizikom i/ili potrebom za daljnjim ciljnim, a time i minimalnim ispitivanjem.
Smjesa
: smjesa ili otopina koja se sastoji od dviju ili više tvari.
Tvar s jednim sastojkom
: tvar, definirana količinskim sastavom, u kojoj je jedan glavni sastojak prisutan u koncentraciji od najmanje 80 % (w/w).
Tvar s više sastojaka
: tvar, definirana količinskim sastavom, u kojoj je više od jednog glavnog sastojka prisutno u koncentraciji od 10 % (w/w) ili većoj te manjoj od 80 % (w/w). Tvar s više sastojaka rezultat je procesa proizvodnje. Smjesa i tvar s više sastojaka razlikuju se po tome što se smjesa dobiva miješanjem dviju ili više tvari bez kemijske reakcije. Tvar s više sastojaka rezultat je kemijske reakcije.
Pozitivna kontrola
: ponovljeni uzorak koji sadržava sve komponente ispitnog sustava i tretiran je s tvari za koju je poznato da izaziva pozitivan odgovor. Kako bi se osigurala mogućnost procjene varijabilnosti odgovora pozitivne kontrole tijekom vremena, pozitivan odgovor ne bi smio biti presnažan.
Prehapteni
: kemikalije koje abiotičkom pretvorbom postaju tvari koje izazivaju preosjetljivost, npr. oksidacijom.
Prohapteni
: kemikalije kojima je potrebna enzimska aktivacija da bi mogle pokazati potencijal izazivanja preosjetljivosti kože.
Relevantnost
: opis odnosa između ispitivanja i istraživanog učinka te je li ispitivanje prikladno i korisno za određenu svrhu. Pokazuje u kojoj se mjeri ispitivanjem točno mjeri ili predviđa istraživani biološki učinak. Relevantnost uključuje i razmatranje o točnosti (podudarnosti) ispitivanja (14.).
Pouzdanost
: pokazuje u kojoj se mjeri ispitivanje može obnovljivo primijeniti unutar jednog laboratorija i između više laboratorija tijekom vremena uz primjenu istog protokola. Ocjenjuje se izračunavanjem obnovljivosti unutar jednog laboratorija i između više njih te ponovljivosti unutar jednog laboratorija (14.).
Ciklus
: ciklus se sastoji od jedne ispitivane kemikalije ili više njih koje se ispituju istodobno s kontrolom s otapalom/nosačem i pozitivnom kontrolom.
Osjetljivost
: udio svih pozitivnih/aktivnih kemikalija koje su pravilno razvrstane primjenom ispitivanja. To je mjera točnosti ispitivanja koje daje kategorijske rezultate i važan je čimbenik za ocjenu relevantnosti ispitivanja (14.).
S.I.
: indeks stimulacije. Relativne vrijednosti geometrijske sredine intenziteta fluorescencije kod stanica tretiranih kemikalijom u usporedbi sa stanicama tretiranima otapalom.
Kontrola s otapalom/nosačem
: netretirani uzorak koji ne sadržava ispitivanu kemikaliju, ali sadržava sve ostale komponente ispitnog sustava te otapalo/nosač koji se upotrebljava u ispitivanju. Upotrebljava se za utvrđivanje polaznog odgovora za uzorke koji se tretiraju ispitivanom kemikalijom otopljenom ili stabilno dispergiranom u istom otapalu/nosaču. Kada se ispituje s istodobnom kontrolom s medijem, taj uzorak isto tako pokazuje je li otapalo/nosač u interakciji s ispitnim sustavom.
Specifičnost
: udio svih negativnih/neaktivnih kemikalija koje su pravilno razvrstane primjenom ispitivanja. To je mjera točnosti ispitivanja koje daje kategorijske rezultate i važan je čimbenik za ocjenu relevantnosti ispitivanja (14.).
Pufer za bojenje
: fiziološka otopina puferirana fosfatnim puferom koja sadržava 5 % fetalnog telećeg seruma.
Tvar
: kemijski element i njegovi spojevi u prirodnome stanju ili dobiveni proizvodnim postupkom, što uključuje i aditive koji su nužni za održavanje stabilnosti proizvoda te nečistoće koje proizlaze iz primijenjenoga postupka, ali isključuje otapala koja se mogu izdvojiti bez utjecaja na stabilnost tvari ili promjene njezina sastava.
Ispitivana kemikalija
: svaka tvar ili smjesa koja se ispituje ovim ispitivanjem.
Globalno usklađeni sustav Ujedinjenih naroda za razvrstavanje i označivanje kemikalija (UN GHS)
: sustav za razvrstavanje kemikalija (tvari i smjesa) prema standardiziranim vrstama i stupnjevima fizičkih opasnosti i opasnosti za zdravlje i okoliš, kojim su obuhvaćena odgovarajuća komunikacijska sredstva kao što su piktogrami, oznake opasnosti, oznake upozorenja, oznake obavijesti i sigurnosno-tehnički listovi, kojima se prenose informacije o njihovim štetnim učincima u cilju zaštite ljudi (uključujući poslodavce, radnike, prijevoznike, potrošače i interventno osoblje) i okoliša (16.).
UVCB
: tvari nepoznatog ili promjenjivog sastava, složeni reakcijski proizvodi i biološki materijali.
Valjano ispitivanje
: ispitivanje za koje se smatra da je dovoljno relevantno i pouzdano za određenu svrhu te koje se temelji na znanstveno utemeljenim načelima. ispitivanje nikada nije valjano u apsolutnom smislu nego samo u odnosu na određenu svrhu (14.).
Dodatak 2.2.
TVARI ZA DOKAZIVANJE TEHNIČKE OSPOSOBLJENOSTI
Prije rutinske primjene ispitivanja opisanog u ovom Dodatku ispitnoj metodi B.71. laboratoriji bi trebali dokazati svoju tehničku osposobljenost tako što će za deset tvari preporučenih u tablici 1. dobiti očekivano predviđanje na temelju testa U-SENS™ te za najmanje osam od deset tvari za dokazivanje tehničke osposobljenosti dobiti vrijednosti CV70 i EC150 koje su unutar odgovarajućeg referentnog raspona. Tvari za dokazivanje tehničke osposobljenosti izabrane su tako da predstavljaju niz odgovora povezanih s opasnostima od izazivanja preosjetljivosti kože. Ostali kriteriji za odabir uključivali su to da je tvar komercijalno dostupna te da su dostupni visokokvalitetni in vivo referentni podaci i visokokvalitetni in vitro podaci dobiveni testom U-SENS™. Isto tako, za test U-SENS™ dostupni su objavljeni referentni podaci (1. i 8.).
Tablica 1. 1
Preporučene tvari za dokazivanje tehničke osposobljenosti za izvođenje testa U-SENS™
|
Tvari za dokazivanje tehničke osposobljenosti
|
CAS br.
|
Agregatno stanje
|
Predviđanje in vivo
(105)
|
U-SENS Otapalo/nosač
|
U-SENS Referentni raspon za CV70 u μg/ml (106)
|
U-SENS Referentni raspon za EC150 u μg/ml (106)
|
|
4-fenilendiamin
|
106-50-3
|
Kruta tvar
|
Tvar koja izaziva preosjetljivost (jaka)
|
Potpuni medij (107)
|
< 30
|
Pozitivno (≤ 10)
|
|
2,4,6-trinitrobenzensulfonska kiselina
|
2508-19-2
|
Tekućina
|
Tvar koja izaziva preosjetljivost (jaka)
|
Potpuni medij
|
> 50
|
Pozitivno (≤ 50)
|
|
Dietil-maleat
|
141-05-9
|
Tekućina
|
Tvar koja izaziva preosjetljivost (umjerena)
|
DMSO
|
10–100
|
Pozitivno (≤ 20)
|
|
Rezorcinol
|
108-46-3
|
Kruta tvar
|
Tvar koja izaziva preosjetljivost (umjerena)
|
Potpuni medij
|
> 100
|
Pozitivno (≤ 50)
|
|
Cinaminski alkohol
|
104-54-1
|
Kruta tvar
|
Tvar koja izaziva preosjetljivost (slaba)
|
DMSO
|
> 100
|
Pozitivno (10–100)
|
|
4-alilanisol
|
140-67-0
|
Tekućina
|
Tvar koja izaziva preosjetljivost (slaba)
|
DMSO
|
> 100
|
Pozitivno (< 200)
|
|
Saharin
|
81-07-2
|
Kruta tvar
|
Tvar koja ne izaziva preosjetljivost
|
DMSO
|
> 200
|
Negativno (> 200)
|
|
Glicerol
|
56-81-5
|
Tekućina
|
Tvar koja ne izaziva preosjetljivost
|
Potpuni medij
|
> 200
|
Negativno (> 200)
|
|
Mliječna kiselina
|
50-21-5
|
Tekućina
|
Tvar koja ne izaziva preosjetljivost
|
Potpuni medij
|
> 200
|
Negativno (> 200)
|
|
Salicilna kiselina
|
69-72-7
|
Kruta tvar
|
Tvar koja ne izaziva preosjetljivost
|
DMSO
|
> 200
|
Negativno (> 200)
|
|
Kratice: CAS br. = registarski broj Službe za podatke o kemijskim tvarima
|
Dodatak 3.
IZAZIVANJE PREOSJETLJIVOSTI KOŽE IN VITRO: TEST IL-8 LUC
POČETNA RAZMATRANJA I OGRANIČENJA
|
1.
|
Za razliku od testova u kojima se analizira ekspresija staničnih površinskih biljega, testom IL8-Luc kvantificiraju se promjene u ekspresiji IL-8, citokina povezanog s aktiviranjem dendritičnih stanica (DC). Kod IL-8 reporterske stanične linije dobivene iz THP-1 (THP-G8, dobivena iz ljudske stanične linije akutne monocitne leukemije THP-1) ekspresija IL-8 mjeri se nakon izlaganja tvarima koje izazivaju preosjetljivost (1.). Ekspresija luciferaze zatim se upotrebljava kao pomoć u razlikovanju tvari koje izazivaju preosjetljivost kože od tvari koje ne izazivaju preosjetljivost.
|
|
2.
|
Test IL-8 Luc ocijenjen je u validacijskoj studiji (2.) koju su proveli JaCVAM (Japanski centar za validaciju alternativnih metoda), METI (Ministarstvo gospodarstva, trgovine i industrije) i JSAAE (Japansko društvo za alternative pokusima na životinjama) te je kasnije podvrgnut neovisnom stručnom pregledu (3.) pod pokroviteljstvom JaCVAM-a i Ministarstva zdravlja, rada i dobrobiti, uz potporu Međunarodne suradnje u području alternativnih metoda ispitivanja (ICATM). Uzimajući u obzir sve dostupne dokaze i informacije regulatornih tijela i dionika, test IL-8 Luc smatra se korisnim kao dio IATA-e kao pomoć u razlikovanju tvari koje izazivaju preosjetljivost od tvari koje ne izazivaju preosjetljivost u svrhu razvrstavanja i označivanja prema opasnosti. U literaturi su navedeni primjeri upotrebe podataka dobivenih testom IL-8 Luc u kombinaciji s ostalim informacijama (4., 5. i 6.).
|
|
3.
|
Pokazalo se da se test IL-8 Luc može prenijeti u laboratorije koji imaju iskustva sa staničnim kulturama i mjerenjem luciferaze. Obnovljivost unutar jednog laboratorija iznosila je 87,7 %, a između laboratorija 87,5 % (2.). Podaci dobiveni u validacijskoj studiji (2.) i drugim objavljenim radovima (1. i 6.) pokazuju da je testom IL-8 Luc, u usporedbi s analizom LLNA, 118 kemikalija od njih 143 procijenjeno kao pozitivno ili negativno, a 25 kemikalija kao nejednoznačno te točnost testa IL-8 Luc u razlikovanju tvari koje izazivaju preosjetljivost kože (kategorija 1. prema sustavu UN GHS/Uredbi o CLP-u) od tvari koje ne izazivaju preosjetljivost (bez kategorije prema sustavu UN GHS/Uredbi o CLP-u) iznosi 86 % (101/118), uz osjetljivost od 96 % (92/96) i specifičnost od 41 % (9/22). Isključujući tvari izvan područja primjene opisane u nastavku (stavak 5.), testom IL-8 Luc 113 kemikalija od njih 136 procijenjeno je kao pozitivno ili negativno, a 23 kemikalije kao nejednoznačno te točnost testa IL-8 Luc iznosi 89 % (101/113), uz osjetljivost od 96 % (92/96) i specifičnost od 53 % (9/17). Upotrebom podataka dobivenih na ljudima koji su navedeni u Urbisch i dr. (7.), testom IL-8 Luc 76 kemikalija od njih 90 procijenjeno je kao pozitivno ili negativno, a 14 kemikalija kao nejednoznačno te točnost testa iznosi 80 % (61/76), osjetljivost 93 % (54/58), a specifičnost 39 % (7/18). Isključujući tvari izvan područja primjene, testom IL-8 Luc 71 kemikalija od njih 84 procijenjeno je kao pozitivno ili negativno, a 13 kemikalija kao nejednoznačno te točnost testa iznosi 86 % (61/71), uz osjetljivost od 93 % (54/58) i specifičnost od 54 % (7/13). Veća je vjerojatnost da će se testom IL-8 Luc dobiti lažno negativna predviđanja za kemikalije koje pokazuju nisku/umjerenu jakost u izazivanju preosjetljivosti kože (potkategorija 1.B prema sustavu UN GHS/Uredbi o CLP-u) nego za kemikalije koje pokazuju visoku jakost (potkategorija 1.A prema sustavu UN GHS/Uredbi o CLP-u) (6.). Navedene informacije idu u prilog upotrebi testa IL-8 Luc kao elementa koji pridonosi identifikaciji opasnosti od izazivanja preosjetljivosti kože. Točnost navedena za test IL-8 Luc kao samostalno ispitivanje služi samo kao smjernica jer je ispitivanje potrebno kombinirati s drugim izvorima informacija u kontekstu IATA-e te u skladu s odredbama stavaka 7. i 8. iz odjeljka „Opći uvod”. Nadalje, pri ocjenjivanju ispitivanja izazivanja preosjetljivosti kože koje ne uključuju pokuse na životinjama potrebno je imati na umu da analiza LLNA i druga ispitivanja na životinjama možda neće u potpunosti odražavati situaciju kod ljudi.
|
|
4.
|
Trenutačno dostupni podaci pokazuju da se test IL-8 Luc može primijeniti za ispitivanje kemikalija koje obuhvaćaju različite organske funkcionalne skupine, mehanizme reakcije, jakosti u izazivanju preosjetljivosti kože (kako su utvrđene istraživanjima in vivo) te fizikalno-kemijska svojstva (2. i 6.).
|
|
5.
|
Iako se u testu IL-8 Luc kao otapalo upotrebljava X-VIVOTM 15, njime su točno ocijenjene kemikalije čija je vrijednost Log Kow > 3,5 i čija je topljivost u vodi približno 100 μg/ ml, kako je izračunano programom EPI SuiteTM, te je njegova uspješnost u otkrivanju tvari koje izazivaju preosjetljivost kože i koje su slabo topljive u vodi bolja nego kod testa IL-8 Luc u kojem se kao otapalo upotrebljava dimetil sulfoksid (DMSO) (2.). Međutim, negativni rezultati za ispitivane kemikalije koje se ne otapaju pri koncentraciji od 20 mg/ml mogu dati lažno negativne rezultate jer se one ne mogu otopiti u otapalu X-VIVOTM 15. Stoga negativne rezultate za te ispitivane kemikalije ne treba razmatrati. U validacijskoj studiji uočen je visok udio lažno negativnih rezultata za anhidride. Nadalje, zbog ograničene metaboličke sposobnosti stanične linije (8.) i uvjeta pokusa prohapteni (tj. tvari koje zahtijevaju metaboličku aktivaciju) i prehapteni (tj. tvari koje se aktiviraju zračnom oksidacijom) mogu dati negativne rezultate u testu. Međutim, iako negativne rezultate za tvari za koje se sumnja da su prehapteni ili prohapteni treba tumačiti s oprezom, testom IL-8 Luc točno je procijenjeno 11 prehaptena od njih 11, šest od šest prohaptena te šest od osam prehaptena i prohaptena u podatkovnom skupu testa IL-8 Luc (2.). Na temelju nedavnog sveobuhvatnog pregleda triju ispitivanja koja ne uključuju pokuse na životinjama (DPRA, KeratinoSens™ i h-CLAT) za otkrivanje prehaptena i prohaptena (9.) te na temelju činjenice da su stanice THP-G8 koje se upotrebljavaju u testu IL-8 Luc stanična linija izvedena iz stanične linije THP-1 koja se upotrebljava u testu h-CLAT, test IL-8 Luc može pridonijeti i povećanju osjetljivosti ispitivanja koja ne uključuju pokuse na životinjama za otkrivanje prehaptena i prohaptena u kombinaciji s drugim ispitivanjima. Površinski aktivne tvari koje su dosad ispitane dale su (lažno) pozitivne rezultate neovisno o njihovoj vrsti (npr. kationske, anionske ili neionske). Naposljetku, kemikalije koje ometaju luciferazu mogu poremetiti njezinu aktivnost/mjerenje tako da uzrokuju prividnu inhibiciju ili povećanu luminiscenciju (10.). Na primjer, postoje izvješća o tome da su koncentracije fitoestrogena veće od 1 μM u drugim luciferaznim testovima ometale signale luminiscencije zbog pretjerane aktivacije reporterskog gena za luciferazu. Stoga je potrebno pažljivo ispitati ekspresiju luciferaze dobivenu pri visokim koncentracijama fitoestrogena ili spojeva za koje se pretpostavlja da dovode do aktivacije reporterskog gena za luciferazu slične aktivaciji fitoestrogenom (11.). Na temelju prethodno navedenog, površinski aktivne tvari, anhidridi i kemikalije koje ometaju luciferazu izvan su područja primjene ovog testa. U slučajevima u kojima se može dokazati da se test IL-8 Luc ne može primijeniti za ispitivanje drugih specifičnih kategorija kemikalija, taj test ne bi trebalo upotrebljavati za te specifične kategorije.
|
|
6.
|
Kao što je opisano, test IL-8 Luc pomaže u razlikovanju tvari koje izazivaju preosjetljivost kože od tvari koje ne izazivaju preosjetljivost. Potreban je dodatan rad, po mogućnosti na temelju podataka dobivenih na ljudima, da bi se moglo utvrditi mogu li rezultati dobiveni testom IL-8 Luc pridonijeti procjeni jakosti ako se kombiniraju s drugim izvorima informacija.
|
|
7.
|
Definicije su navedene u Dodatku 3.1.
|
NAČELO ISPITIVANJA
|
8.
|
U testu IL-8 Luc upotrebljava se ljudska stanična linija monocitne leukemije THP-1, koja se nabavlja iz banke stanica American Type Culture Collection (Manassas, VA, SAD). Upotrebom te stanične linije na Odjelu za dermatologiju Medicinskog fakulteta Sveučilišta u Tohokuu (Dept. of Dermatology, Tohoku University School of Medicine) stvorena je stanična linija THP-G8, IL-8 reporterska stanična linija izvedena iz THP-1, koja nosi gene za stabilnu narančastu luciferazu (Stable Luciferase Orange; SLO) i stabilnu crvenu luciferazu (Stable Luciferase Red; SLR) koji su pod kontrolom promotora gena za IL-8 odnosno za gliceraldehid-3-fosfat-dehidrogenazu (GAPDH) (1.). To omogućuje kvantitativno mjerenje indukcije gena za luciferazu određivanjem luminiscencije iz supstrata luciferaze za koje je poznato da stvaraju svjetlost, kao pokazatelja aktivnosti IL-8 i GAPDH-a u stanicama nakon izlaganja kemikalijama koje izazivaju preosjetljivost.
|
|
9.
|
Ispitni sustav s dvije boje sastoji se od luciferaze koja emitira narančastu boju (SLO; λmax = 580 nm) (12.) za gensku ekspresiju s promotora gena za IL-8 te luciferaze koja emitira crvenu boju (SLR; λmax = 630 nm) (13.) za gensku ekspresiju s promotora gena za GAPDH kao interne kontrole. Dvije luciferaze emitiraju različite boje nakon reakcije s d-luciferinom krijesnice i njihova se luminiscencija mjeri istovremeno u reakciji u jednom koraku tako da se emisija iz smjese za testiranje podijeli upotrebom optičkog filtra (14.) (Dodatak 3.2.).
|
|
10.
|
Stanice THP-G8 tretiraju se ispitivanom kemikalijom 16 sati, nakon čega se mjeri aktivnost SLO luciferaze (SLO-LA), koja odražava aktivnost promotora gena za IL-8, te aktivnost SLR luciferaze (SLR-LA), koja odražava aktivnost promotora gena za GAPDH. Kako bi se kratice lakše razumjele, SLO-LA i SLR-LA određuju se kao IL8LA odnosno GAPLA. U tablici 1. naveden je opis termina povezanih s aktivnošću luciferaze u testu IL-8 Luc. Izmjerene vrijednosti upotrebljavaju se za izračun normalizirane IL8LA (nIL8LA), odnosno omjera IL8LA i GAPLA, indukcije nIL8LA (Ind-IL8LA), odnosno omjera aritmetičke sredine četverostruko izmjerenih vrijednosti nIL8LA stanica THP-G8 tretiranih ispitivanom kemikalijom i vrijednosti nIL8LA netretiranih stanica THP-G8, te inhibicije GAPLA (Inh-GAPLA), odnosno omjera aritmetičke sredine četverostruko izmjerenih vrijednosti GAPLA stanica THP-G8 tretiranih ispitivanom kemikalijom i vrijednosti GAPLA netretiranih stanica THP-G8 te se upotrebljavaju kao pokazatelj citotoksičnosti.
Tablica 1.
Opis termina povezanih s aktivnošću luciferaze u testu IL-8 Luc
|
Kratice
|
Definicija
|
|
GAPLA
|
aktivnost SLR luciferaze koja odražava aktivnost promotora gena za GAPDH
|
|
IL8LA
|
aktivnost SLO luciferaze koja odražava aktivnost promotora gena za IL-8
|
|
nIL8LA
|
IL8LA/GAPLA
|
|
Ind-IL8LA
|
nIL8LA stanica THP-G8 tretiranih kemikalijama / nIL8LA netretiranih stanica
|
|
Inh-GAPLA
|
GAPLA stanica THP-G8 tretiranih kemikalijama / GAPLA netretiranih stanica
|
|
CV05
|
najniža koncentracija kemikalije pri kojoj Inh-GAPLA postaje < 0,05
|
|
|
11.
|
Dostupni su zahtjevi izvedbe (15.) radi olakšavanja validacije izmijenjenih in vitro testova IL-8 s luciferazom sličnih testu IL-8 Luc te omogućivanja pravovremene izmjene Smjernice OECD-a za ispitivanje 442E radi njihova uključivanja. OECD-ovo uzajamno prihvaćanje podataka jamči se samo za ispitivanja koja su validirana u skladu sa zahtjevima izvedbe ako je OECD pregledao ta ispitivanja i uključio ih u Smjernicu OECD-a za ispitivanje 442E (16.).
|
DOKAZIVANJE OSPOSOBLJENOSTI
|
12.
|
Prije rutinske primjene ispitivanja opisanog u ovom Dodatku ispitnoj metodi B.71. laboratoriji bi trebali dokazati svoju tehničku osposobljenost upotrebom deset tvari za dokazivanje tehničke osposobljenosti navedenih u Dodatku 3.3. u skladu s dobrom praksom za in vitro metode (17.). Osim toga, korisnici ispitivanja trebaju održavati bazu prijašnjih podataka dobivenih provjerama reaktivnosti (vidjeti stavak 15.) te s pozitivnim kontrolama i kontrolama s otapalom/nosačem (vidjeti stavke od 21. do 24.) i trebaju se koristiti tim podacima kako bi potvrdili da je njihov laboratorij održao obnovljivost ispitivanja tijekom vremena.
|
POSTUPAK
|
13.
|
Dostupni su standardni operativni postupci (SOP) za test IL-8 Luc te bi ih trebalo primjenjivati pri provedbi ispitivanja (18.). Laboratoriji koji su spremni provoditi ispitivanje mogu nabaviti rekombinantnu staničnu liniju THP-G8 od laboratorija GPC Lab. Co. Ltd., Tottori, Japan, nakon što potpišu sporazum o prijenosu materijala (MTA) u skladu s uvjetima iz OECD-ova predloška. U sljedećim stavcima opisuju se glavne sastavnice i postupci testa.
|
Priprema stanica
|
14.
|
Za provedbu testa IL-8 Luc treba upotrebljavati staničnu liniju THP-G8 iz laboratorija GPC Lab. Co. Ltd., Tottori, Japan (vidjeti stavke 8. i 13.). Nakon primitka stanice se razmnožavaju (od dvije do četiri pasaže) te čuvaju zamrznute kao homogena zaliha. Stanice iz te zalihe mogu se razmnožavati do najviše 12 pasaža ili najdulje šest tjedana. Za razmnožavanje se kao medij upotrebljava RPMI-1640, medij za uzgoj kulture koji sadržava 10 % fetalnog goveđeg seruma (FBS), otopinu antibiotika/antimikotika (100 jedinica/ml penicilina G, 100 μg/ml streptomicina i 0,25 μg/ml amfotericina B u 0,85-postotnoj fiziološkoj otopini) (npr. GIBCO Cat#15240-062), 0,15 μg/ml puromicina (npr. CAS: 58-58-2) i 300 μg/ml G418 (npr. CAS: 108321-42-2).
|
|
15.
|
Prije upotrebe za ispitivanje treba provjeriti ispunjavaju li stanice zadane kriterije provjerom reaktivnosti. Tu provjeru treba provesti od jedan do dva tjedna ili od dvije do četiri pasaže nakon odmrzavanja, upotrebom pozitivne kontrole, 4-nitrobenzil bromida (4-NBB) (CAS: 100-11-8, čistoća ≥ 99 %) i negativne kontrole, mliječne kiseline (LA) (CAS: 50-21-5, čistoća ≥ 85 %). 4-NBB trebao bi dati pozitivan odgovor na Ind-IL8LA (≥ 1,4), dok bi LA trebao dati negativan odgovor na Ind-IL8LA (< 1,4). Za test se upotrebljavaju samo stanice koje su prošle provjeru reaktivnosti. Provjeru treba provesti u skladu s postupcima opisanima u stavcima od 22. do 24.
|
|
16.
|
Za ispitivanje se stanice THP-G8 nasađuju pri gustoći od 2 do 5 × 105 stanica/ml te se prethodno uzgajaju u tikvicama s kulturom od 48 do 96 sati. Na dan ispitivanja stanice izdvojene iz tikvice s kulturom ispiru se medijem RPMI-1640 koji sadržava 10 % FBS-a bez antibiotika, a zatim se ponovno suspendiraju medijem RPMI-1640 koji sadržava 10 % FBS-a bez antibiotika pri gustoći od 1 × 106 stanica/ml. Stanice se zatim distribuiraju na crnu ploču s 96 jažica s ravnim dnom (npr. Costar Cat#3603) s 50 μl (5 × 104 stanica/jažici).
|
Priprema ispitivane kemikalije i kontrolnih tvari
|
17.
|
Ispitivana kemikalija i kontrolne tvari pripremaju se na dan ispitivanja. Za test IL-8 Luc ispitivane kemikalije otapaju se u mediju X-VIVOTM 15, komercijalno dostupnom mediju bez seruma (Lonza, 04-418Q), tako da se dobije konačna koncentracija od 20 mg/ml. X-VIVOTM 15 dodaje se u 20 mg ispitivane kemikalije (neovisno o topljivosti kemikalije) u epruvetu za mikrocentrifugu i dovodi do volumena od 1 ml, a zatim se snažno vrtložno protresa i trese u rotoru pri najvećoj brzini od 8 o/min 30 minuta na sobnoj temperaturi od približno 20 oC. Nadalje, ako su kemikalije u krutom stanju i dalje netopljive, epruveta se ultrazvučno obrađuje dok se kemikalija potpuno ne otopi ili stabilno dispergira. Ako su ispitivane kemikalije topljive u mediju X-VIVOTM 15, otopina se razrjeđuje medijem X-VIVOTM 15 primjenom faktora razrjeđivanja od pet te se upotrebljava kao glavna otopina X-VIVOTM 15 ispitivane kemikalije (4 mg/ml). Ako ispitivana kemikalija nije topljiva u mediju X-VIVOTM 15, smjesa se ponovno protresa najmanje 30 minuta, a zatim se centrifugira pri 15000 o/min (≈ 20 000g) u trajanju od pet minuta; supernatant koji nastane upotrebljava se kao glavna otopina X-VIVOTM 15 ispitivane kemikalije. Upotrebu drugih otapala, kao što su DMSO, voda ili medij za uzgoj kulture, treba znanstveno obrazložiti. Podroban postupak za otapanje kemikalija prikazan je u Dodatku 3.5. Otopine medija X-VIVOTM 15 opisane u stavcima od 18. do 23. miješaju se u omjeru 1: 1 (v/v) sa suspenzijama stanica pripremljenima na crnoj ploči s 96 jažica s ravnim dnom (vidjeti stavak 16.).
|
|
18.
|
Prvi ciklus ispitivanja usmjeren je na utvrđivanje citotoksične koncentracije i ispitivanje potencijala kemikalija da izazovu preosjetljivost kože. Upotrebom medija X-VIVOTM 15, serijska razrjeđivanja glavne otopine X-VIVOTM 15 ispitivanih kemikalija prave se s faktorom razrjeđivanja od dva (vidjeti Dodatak 3.5.) upotrebom ploče za test s 96 jažica (npr. Costar Cat#EW-01729-03). Zatim se 50 μl/jažici razrijeđene otopine dodaje u 50 μl suspenzije stanica na crnoj ploči s 96 jažica s ravnim dnom. Stoga su konačne koncentracije ispitivanih kemikalija koje su topljive u mediju X-VIVO TM 15 u rasponu od 0,002 do 2 mg/ml (Dodatak 3.5.). U slučaju ispitivanih kemikalija koje nisu topljive u mediju X-VIVO TM 15 pri 20 mg/ml utvrđuju se samo faktori razrjeđivanja u rasponu od 2 do 210, iako stvarne konačne koncentracije ispitivanih kemikalija ostaju nesigurne i ovise o zasićenoj koncentraciji ispitivane kemikalije u glavnoj otopini medija X-VIVO TM 15.
|
|
19.
|
U kasnijim ciklusima ispitivanja (tj. drugom, trećem i četvrtom ponavljanju), glavna otopina medija X-VIVOTM 15 pravi se pri koncentraciji koja je četiri puta viša od koncentracije vijabilnosti stanica 05 (CV05; najniža koncentracija pri kojoj Inh-GAPLA postaje < 0,05) u prvom pokusu. Ako Inh-GAPLA ne postane manji od 0,05 pri najvišoj koncentraciji u prvom ciklusu, glavna otopina medija X-VIVOTM 15 pravi se upotrebom najviše koncentracije prvog ciklusa. Koncentracija CV05 računa se tako da se koncentracija glavne otopine u prvom ciklusu podijeli faktorom razrjeđivanja za CV05 (X) (faktor razrjeđivanja CV05 (X); faktor razrjeđivanja potreban za razrjeđivanje glavne otopine na CV05) (vidjeti Dodatak 3.5.). Za ispitivane tvari koje nisu topljive u mediju X-VIVO pri 20 mg/ml, CV05 se utvrđuje koncentracijom glavne otopine × 1/X. Za cikluse od drugog do četvrtog priprema se druga glavna otopina kao 4 × CV05 (Dodatak 3.5.).
|
|
20.
|
Serijska razrjeđivanja drugih glavnih otopina X-VIVOTM 15 prave se upotrebom faktora razrjeđivanja od 1,5 upotrebom ploče za test s 96 jažica. Zatim se 50 μl/jažici razrijeđene otopine dodaje u 50 μl suspenzije stanica u jažicama crne ploče s 96 jažica s ravnim dnom. Svaku koncentraciju svake ispitivane kemikalije treba ispitati u četiri jažice. Uzorci se zatim miješaju u jedinici za miješanje za ploče i inkubiraju 16 sati na 37 oC i s 5 % CO2, nakon čega se mjeri aktivnost luciferaze kako je opisano u nastavku.
|
|
21.
|
Kontrolu s otapalom čini smjesa 50 μl/jažici medija X-VIVOTM 15 i 50 μl/jažici suspenzije stanica u mediju RPMI-1640 koji sadržava 10 % FBS-a.
|
|
22.
|
Kao pozitivna kontrola preporučuje se 4-NBB. Priprema se 20 mg 4-NBB-a u epruveti za mikrocentrifugu od 1,5 ml, u koju se dodaje medij X-VIVOTM 15 do volumena od 1 ml. Epruveta se snažno vrtložno protresa i trese u rotoru pri najvećoj brzini od 8 o/min najmanje 30 minuta. Nakon centrifugiranja pri 20 000 g tijekom pet minuta supernatant se razrjeđuje faktorom od 4 medijem X-VIVOTM 15 i 500 μl razrijeđenog supernatanta prenosi se u jažicu na ploči za test s 96 jažica. Razrijeđeni supernatant dodatno se razrjeđuje medijem X-VIVOTM 15 s faktorima razrjeđivanja od 2 i 4 te se 50 μl otopine dodaje u 50 μl suspenzije stanica THP-G8 u jažicama crne ploče s 96 jažica s ravnim dnom (Dodatak 3.6.). Svaku koncentraciju pozitivne kontrole treba ispitati u četiri jažice. Ploča se trese u jedinici za miješanje za ploče i inkubira 16 sati u inkubatoru CO2 (37 oC, 5 % CO2), nakon čega se mjeri aktivnost luciferaze kako je opisano u stavku 29.
|
|
23.
|
Kao negativna kontrola preporučuje se mliječna kiselina. Priprema se 20 mg mliječne kiseline u epruveti za mikrocentrifugu od 1,5 ml, u koju se dodaje medij X-VIVOTM 15 do volumena od 1 ml (20 mg/ml). Dvadeset mg/ml otopine mliječne kiseline razrjeđuje se medijem X-VIVOTM 15 primjenom faktora od 5 (4 mg/ml); 500 μl od tih 4 mg/ml otopine mliječne kiseline prenosi se u jažicu ploče za test s 96 jažica. Ta se otopina razrjeđuje medijem X-VIVOTM 15 primjenom faktora od 2 te se ponovno razrjeđuje primjenom faktora od 2 kako bi se dobile otopine od 2 mg/ml i 1 mg/ml. 50 μl tih triju otopina i kontrole s nosačem (X-VIVOTM 15) dodaje se u 50 μl suspenzije stanica THP-G8 u jažicama crne ploče s 96 jažica s ravnim dnom. Svaka koncentracija negativne kontrole ispituje se u četiri jažice. Ploča se trese u jedinici za miješanje za ploče i inkubira 16 sati u inkubatoru s CO2 (37 oC, 5 % CO2), nakon čega se mjeri aktivnost luciferaze kako je opisano u stavku 29.
|
|
24.
|
Mogu se upotrijebiti druge prikladne pozitivne ili negativne kontrole pod uvjetom da su dostupni prijašnji podaci na temelju kojih se mogu odrediti usporedivi kriteriji prihvatljivosti ciklusa.
|
|
25.
|
Treba paziti da ne dođe do isparavanja hlapljivih ispitivanih kemikalija te unakrsne kontaminacije jažica ispitivanim kemikalijama, npr. zatvaranjem ploče prije inkubacije s ispitivanim kemikalijama.
|
|
26.
|
Za ispitivane kemikalije i kontrolu s otapalom potrebna su od dva do četiri ciklusa kako bi se došlo do pozitivnog ili negativnog predviđanja (vidjeti tablicu 2.). Svaki ciklus provodi se na različite dane sa svježom glavnom otopinom medija X-VIVOTM 15 ispitivanih kemikalija i neovisno izdvojenim stanicama. Stanice mogu biti iz iste pasaže.
|
Mjerenja aktivnosti luciferaze
|
27.
|
Luminiscencija se mjeri luminometrom za mikrotitracijsku ploču s 96 jažica s optičkim filtrima, npr. Phelios (ATTO, Tokio, Japan), Tristan 941 (Berthold, Bad Wildbad, Njemačka) i serijom ARVO (PerkinElmer, Waltham, MA, SAD). Luminometar se mora kalibrirati za svako ispitivanje kako bi se osigurala obnovljivost (19.). Za tu su kalibraciju dostupne rekombinantne luciferaze koje emitiraju narančastu i crvenu svjetlost.
|
|
28.
|
U svaku jažicu ploče na kojoj se nalazi suspenzija stanica tretirana kemikalijama ili bez kemikalija prenosi se 100 μl prethodno zagrijanog reagensa za test luciferaze Tripluc® (Tripluc). Ploča se protresa deset minuta na sobnoj temperaturi od približno 20 oC. Ploča se stavlja u luminometar kako bi se izmjerila aktivnost luciferaze. Bioluminiscencija se mjeri tri sekunde bez optičkog filtra (F0) i tri sekunde s optičkim filtrom (F1). Treba pružiti obrazloženje za upotrebu drugačijih postavki, npr. ovisno o modelu luminometra koji se upotrebljava.
|
|
29.
|
Parametri za svaku koncentraciju računaju se iz izmjerenih vrijednosti, npr. IL8LA, GAPLA, nIL8LA, Ind-IL8LA, Inh-GAPLA, srednja vrijednost ± SD za IL8LA, srednja vrijednost ± SD za GAPLA, srednja vrijednost ± SD za nIL8LA, srednja vrijednost ± SD za Ind-IL8LA, srednja vrijednost ± SD za Inh-GAPLA i interval pouzdanosti od 95 % za Ind-IL8LA. Definicije parametara upotrijebljenih u ovom stavku navedene su u dodacima 3.1. i 3.4.
|
|
30.
|
Prije mjerenja razlikovanje boja u reporterskim testovima s više boja obično se postiže upotrebom detektora (luminometar i čitač ploča) koji imaju optičke filtre, kao što su filtri s oštrom graničnom crtom valne duljine (dugo ili kratko prolazni) ili pojasno propusni filtri. Koeficijente prijenosa filtara za svaku signalnu boju bioluminiscencije treba kalibrirati prije ispitivanja, u skladu s Dodatkom 3.2.
|
PODACI I IZVJEŠĆIVANJE
Procjena podataka
|
31.
|
Sljedeći kriteriji moraju se ispuniti u svakom ciklusu da bi se donijela pozitivna/negativna odluka:
|
—
|
predviđanje na temelju testa IL-8 Luc smatra se pozitivnim ako je Ind-IL8LA ispitivane kemikalije ≥ 1,4 i donja granica intervala pouzdanosti od 95 % za Ind-IL8LA ≥ 1,0,
|
|
—
|
predviđanje na temelju testa IL-8 Luc smatra se negativnim ako je Ind-IL8LA ispitivane kemikalije < 1,4 i/ili donja granica intervala pouzdanosti od 95 % za Ind-IL8LA < 1,0.
|
|
Model predviđanja
|
32.
|
Ispitivane kemikalije koje daju dva pozitivna rezultata u 1., 2., 3. i 4. ciklusu identificiraju se kao pozitivne, dok se one koje daju tri negativna rezultata u 1., 2., 3. i 4. ciklusu identificiraju kao kemikalije za koje se pretpostavlja da su negativne (tablica 2.). Među kemikalijama za koje se pretpostavlja da su negativne, kemikalije koje se otapaju pri 20 mg/ml medija X-VIVOTM 15 procjenjuju se kao negativne, dok kemikalije koje se ne otapaju pri 20 mg/ml medija X-VIVOTM 15 ne treba razmatrati (slika 1.).
Tablica 2.
Kriteriji za identifikaciju pozitivnih i pretpostavljenih negativnih rezultata
|
1. ciklus
|
2. ciklus
|
3. ciklus
|
4. ciklus
|
Konačno predviđanje
|
|
Pozitivno
|
Pozitivno
|
–
|
–
|
Pozitivno
|
|
Negativno
|
Pozitivno
|
–
|
Pozitivno
|
|
Negativno
|
Pozitivno
|
Pozitivno
|
|
Negativno
|
Pretpostavlja se da je negativno
|
|
Negativno
|
Pozitivno
|
Pozitivno
|
–
|
Pozitivno
|
|
Negativno
|
Pozitivno
|
Pozitivno
|
|
Negativno
|
Pretpostavlja se da je negativno
|
|
Negativno
|
Pozitivno
|
Pozitivno
|
Pozitivno
|
|
Negativno
|
Pretpostavlja se da je negativno
|
|
Negativno
|
–
|
Pretpostavlja se da je negativno
|
|
Slika 1.
Model predviđanja za konačnu odluku
Kriteriji prihvatljivosti
|
33.
|
Sljedeći bi kriteriji prihvatljivosti trebali biti ispunjeni kada se primjenjuje test IL-8 Luc:
|
—
|
Ind-IL8LA treba biti veći od 5,0 pri barem jednoj koncentraciji pozitivne kontrole, 4-NBB-a, u svakom ciklusu,
|
|
—
|
Ind-IL8LA treba biti manji od 1,4 pri bilo kojoj koncentraciji negativne kontrole, mliječne kiseline, u svakom ciklusu,
|
|
—
|
treba odbaciti podatke s ploča za koje je GAPLA kontrolnih jažica sa stanicama i Triplucom, ali bez kemikalija, za manje od pet puta veća od GAPLA jažica koje sadržavaju samo ispitni medij (50 μl/jažici medija RPMI-1640 koji sadržava 10 % FBS-a i 50 μl/jažici medija X-VIVOTM 15),
|
|
—
|
treba odbaciti podatke s ploča za koje je Inh-GAPLA svih koncentracija ispitivanih ili kontrolnih kemikalija manja od 0,05. U tom slučaju treba ponoviti prvo ispitivanje tako da se kao najviša konačna koncentracija ponovljenog ispitivanja upotrijebi najniža konačna koncentracija prethodnog ispitivanja.
|
|
Izvješće o ispitivanju
|
34.
|
Izvješće o ispitivanju trebalo bi sadržavati sljedeće informacije:
|
Ispitivane kemikalije
Tvar s jednim sastojkom:
|
kemijske identifikacijske oznake, kao što su IUPAC ili CAS naziv(i), CAS broj(evi), SMILES ili InChI oznaka, strukturna formula i/ili druge identifikacijske oznake,
|
|
fizički izgled, topljivost u vodi, molekularna masa te dodatna relevantna fizikalno-kemijska svojstva, u mjeri u kojoj su podaci dostupni,
|
|
čistoća, kemijski identitet nečistoća prema potrebi i ako je izvedivo u praksi itd.,
|
|
obrada prije ispitivanja, prema potrebi (npr. zagrijavanje, usitnjavanje),
|
|
topljivost u mediju X-VIVOTM 15. U slučaju kemikalija koje nisu topljive u mediju X-VIVOTM 15, je li nakon centrifugiranja uočeno taloženje ili plutanje,
|
|
ispitana koncentracija (ispitane koncentracije),
|
|
uvjeti skladištenja i stabilnost, u mjeri u kojoj su podaci dostupni,
|
|
obrazloženje za odabir otapala/nosača za svaku ispitivanu kemikaliju ako nije upotrijebljen X-VIVOTM 15.
|
Tvar s više sastojaka, UVCB tvar i smjesa:
|
opisane koliko god je to moguće npr. kemijskim identitetom (vidjeti prethodno), čistoćom, količinskom zastupljenošću i relevantnim fizikalno-kemijskim svojstvima sastojaka (vidjeti prethodno), u mjeri u kojoj su podaci dostupni,
|
|
fizički izgled, topljivost u vodi te dodatna relevantna fizikalno-kemijska svojstva, u mjeri u kojoj su podaci dostupni,
|
|
molekularna masa ili prividna molekularna masa u slučaju smjesa/polimera poznatog sastava ili druge informacije koje su relevantne za provođenje studije,
|
|
obrada prije ispitivanja, prema potrebi (npr. zagrijavanje, usitnjavanje),
|
|
topljivost u mediju X-VIVOTM 15. U slučaju kemikalija koje nisu topljive u mediju X-VIVOTM 15, je li nakon centrifugiranja uočeno taloženje ili plutanje,
|
|
ispitana koncentracija (ispitane koncentracije),
|
|
uvjeti skladištenja i stabilnost, u mjeri u kojoj su podaci dostupni,
|
|
obrazloženje za odabir otapala/nosača za svaku ispitivanu kemikaliju ako nije upotrijebljen X-VIVOTM 15.
|
|
|
Kontrole
Pozitivna kontrola:
|
kemijske identifikacijske oznake, kao što su IUPAC ili CAS naziv(i), CAS broj(evi), SMILES ili InChI oznaka, strukturna formula i/ili druge identifikacijske oznake,
|
|
fizički izgled, topljivost u vodi, molekularna masa te dodatna relevantna fizikalno-kemijska svojstva, u mjeri u kojoj su podaci dostupni i ako je primjenjivo,
|
|
čistoća, kemijski identitet nečistoća prema potrebi i ako je izvedivo u praksi itd.,
|
|
obrada prije ispitivanja, prema potrebi (npr. zagrijavanje, usitnjavanje),
|
|
ispitana koncentracija (ispitane koncentracije),
|
|
uvjeti skladištenja i stabilnost, u mjeri u kojoj su podaci dostupni,
|
|
upućivanje na rezultate koji se odnose na prijašnje pozitivne kontrole i pokazuju primjerenost kriterija prihvatljivosti, ako je primjenjivo.
|
Negativna kontrola:
|
kemijske identifikacijske oznake, kao što su IUPAC ili CAS naziv(i), CAS broj(evi) i/ili druge identifikacijske oznake,
|
|
čistoća, kemijski identitet nečistoća prema potrebi i ako je izvedivo u praksi itd.,
|
|
fizički izgled, molekularna masa te dodatna relevantna fizikalno-kemijska svojstva u slučaju da su upotrijebljene negativne kontrole koje nisu navedene u smjernici za ispitivanje, u mjeri u kojoj su podaci dostupni,
|
|
uvjeti skladištenja i stabilnost, u mjeri u kojoj su podaci dostupni,
|
|
obrazloženje za odabir otapala za svaku ispitivanu kemikaliju.
|
|
|
Ispitni uvjeti:
|
naziv i adresa naručitelja, ustanove koja provodi ispitivanje i voditelja istraživanja,
|
|
opis upotrijebljenog ispitivanja,
|
|
upotrijebljena stanična linija, uvjeti njezina skladištenja i izvor (npr. objekt iz kojeg je dobivena),
|
|
broj serije i podrijetlo FBS-a, naziv dobavljača, broj serije crne ploče s 96 jažica s ravnim dnom te broj serije reagensa Tripluc,
|
|
broj pasaža i gustoća stanica upotrijebljenih za ispitivanje,
|
|
metoda brojenja stanica koja je upotrijebljena za nasađivanje prije ispitivanja i mjere koje su poduzete kako bi se osigurala ujednačena distribucija broja stanica,
|
|
upotrijebljeni luminometar (npr. model), uključujući postavke instrumenta, upotrijebljeni supstrat luciferaze te dokaz o primjerenom mjerenju luminiscencije na temelju kontrolnog ispitivanja opisanog u Dodatku 3.2.,
|
|
postupak koji je primijenjen za dokazivanje osposobljenosti laboratorija za izvođenje ispitivanja (npr. ispitivanjem tvari koje služe za dokazivanje osposobljenosti) ili za dokazivanje obnovljive primjene ispitivanja tijekom vremena.
|
|
|
Ispitni postupak:
|
broj provedenih ponavljanja i ciklusa,
|
|
koncentracije ispitivane kemikalije, postupci primjene i vrijeme izloženosti (ako je drukčije od preporučenog),
|
|
opis primijenjenih kriterija ocjenjivanja i odlučivanja,
|
|
opis primijenjenih kriterija prihvatljivosti istraživanja,
|
|
opis mogućih izmjena ispitnog postupka.
|
|
|
Rezultati:
|
izračuni za nIL8LA, Ind-IL8LA i Inh-GAPLA,
|
|
interval pouzdanosti od 95 % za Ind-IL8LA,
|
|
grafički prikaz krivulja doza – odgovor za indukciju aktivnosti luciferaze i vijabilnost,
|
|
opis svih drugih relevantnih opažanja, ako je primjenjivo.
|
|
|
Rasprava o rezultatima:
|
rasprava o rezultatima dobivenima testom IL-8 Luc,
|
|
rasprava o rezultatima testa u kontekstu IATA-e ako su dostupni drugi relevantni podaci.
|
|
Zaključak
|
LITERATURA
|
1.
|
Takahashi T, Kimura Y, Saito R, Nakajima Y, Ohmiya Y, Yamasaki K, and Aiba S. (2011). An in vitro test to screen skin sensitizers using a stable THP-1-derived IL-8 reporter cell line, THP-G8. Toxicol Sci 124:359-69.
|
|
2.
|
OECD (2017). Validation report for the international validation study on the IL-8 Luc assay as a test evaluating the skin sensitizing potential of chemicals conducted by the IL-8 Luc Assay. Series on Testing and Assessment No 267, ENV/JM/MONO(2017)19. Organizacija za gospodarsku suradnju i razvoj, Pariz. Dostupno na: http://www.oecd.org/env/ehs/testing/series-testing-assessment-publications-number.htm.
|
|
3.
|
OECD (2017). Report of the Peer Review Panel for the IL-8 Luciferase (IL-8 Luc) Assay for in vitro skin sensitisation. Series on Testing and Assessment No 258, ENV/JM/MONO(2017)20. Organizacija za gospodarsku suradnju i razvoj, Pariz. Dostupno na: http://www.oecd.org/env/ehs/testing/series-testing-assessment-publications-number.htm.
|
|
4.
|
OECD (2016) Guidance Document On The Reporting Of Defined Approaches And Individual Information Sources To Be Used Within Integrated Approaches To Testing And Assessment (IATA) For Skin Sensitisation, Series on Testing & Assessment No 256, ENV/JM/MONO(2016)29. Organizacija za gospodarsku suradnju i razvoj, Pariz. Dostupno na: http://www.oecd.org/env/ehs/testing/series-testing-assessment-publications-number.htm.
|
|
5.
|
van der Veen JW, Rorije E, Emter R, Natsch A, van Loveren H, and Ezendam J. (2014). Evaluating the performance of integrated approaches for hazard identification of skin sensitizing chemicals. Regul Toxicol Pharmacol 69:371.–9.
|
|
6.
|
Kimura Y, Fujimura C, Ito Y, Takahashi T, Nakajima Y, Ohmiya Y, and Aiba S. (2015). Optimization of the IL-8 Luc assay as an in vitro test for skin sensitization. Toxicol In Vitro 29:1816.–30.
|
|
7.
|
Urbisch D, Mehling A, Guth K, Ramirez T, Honarvar N, Kolle S, Landsiedel R, Jaworska J, Kern PS, Gerberick F, et al. (2015). Assessing skin sensitization hazard in mice and men using non-animal test methods. Regul Toxicol Pharmacol 71:337.–51.
|
|
8.
|
Ashikaga T, Sakaguchi H, Sono S, Kosaka N, Ishikawa M, Nukada Y, Miyazawa M, Ito Y, Nishiyama N, and Itagaki H. (2010). A comparative evaluation of in vitro skin sensitisation tests: the human cell-line activation test (h-CLAT) versus the local lymph node assay (LLNA). Alternatives to laboratory animals: ATLA 38:275.–84.
|
|
9.
|
Patlewicz G, Casati S, Basketter DA, Asturiol D, Roberts DW, Lepoittevin J-P, Worth A and Aschberger K (2016) Can currently available non-animal methods detect pre and pro haptens relevant for skin sensitisation? Regul Toxicol Pharmacol, 82:147.–155.
|
|
10.
|
Thorne N, Inglese J, and Auld DS. (2010). Illuminating insights into firefly luciferase and other bioluminescent reporters used in chemical biology. Chem Biol 17:646.–57.
|
|
11.
|
OECD (2016). Test No 455: Performance-Based Test Guideline for Stably Transfected Transactivation In Vitro Assays to Detect Estrogen Receptor Agonists and Antagonists, OECD Publishing, Pariz. http://dx.doi.org/10.1787/9789264265295-en.
|
|
12.
|
Viviani V, Uchida A, Suenaga N, Ryufuku M, and Ohmiya Y. (2001). Thr226 is a key residue for bioluminescence spectra determination in beetle luciferases. Biochem Biophys Res Commun 280:1286.–91.
|
|
13.
|
Viviani VR, Bechara EJ, and Ohmiya Y. (1999). Cloning, sequence analysis, and expression of active Phrixothrix railroad-worms luciferases: relationship between bioluminescence spectra and primary structures. Biochemistry 38:8271.–9.
|
|
14.
|
Nakajima Y, Kimura T, Sugata K, Enomoto T, Asakawa A, Kubota H, Ikeda M, and Ohmiya Y. (2005). Multicolor luciferase assay system: one-step monitoring of multiple gene expressions with a single substrate. Biotechniques 38:891.–4.
|
|
15.
|
OECD (2017). Objavit će se – Performance Standards for the assessment of proposed similar or modified in vitro skin sensitisation IL-8 luc test methods. OECD Environment, Health and Safety Publications, Series on Testing and Assessment. OECD, Pariz, Francuska.
|
|
16.
|
OECD (2005). Guidance Document the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment. OECD Environment, Health and Safety publications, OECD Series on Testing and Assessment No 34. OECD, Pariz, Francuska.
|
|
17.
|
OECD (2018). Draft Guidance document: Good In Vitro Method Practices (GIVIMP) for the Development and Implementation of In Vitro Methods for Regulatory Use in Human Safety Assessment. Organizacija za gospodarsku suradnju i razvoj, Pariz. Dostupno na: http://www.oecd.org/env/ehs/testing/OECD Final Draft GIVIMP.pdf.
|
|
18.
|
JaCVAM (2016). IL-8 Luc assay protocol, Dostupno na: http://www.jacvam.jp/en_effort/effort02.html.
|
|
19.
|
Niwa K, Ichino Y, Kumata S, Nakajima Y, Hiraishi Y, Kato D, Viviani VR, and Ohmiya Y. (2010). Quantum yields and kinetics of the firefly bioluminescence reaction of beetle luciferases. Photochem Photobiol 86:1046.–9.
|
|
20.
|
OECD (2012). The Adverse Outcome Pathway for Skin Sensitisation Initiated by Covalent Binding to Proteins, Part 1: Scientific Evidence. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No 168. OECD, Pariz, Francuska.
|
|
21.
|
Ujedinjeni narodi (2015.). Globally Harmonized System of Classification and Labelling of Chemicals (GHS). Sixth revised edition. New York & Geneva: United Nations Publications. ISBN: 978-92-1-117006-1. Dostupno na: http://www.unece.org/trans/danger/publi/ghs/ghs_rev05/05files_e.html.
|
Dodatak 3.1.
DEFINICIJE
Točnost
: stupanj podudarnosti između rezultata ispitivanja i prihvaćenih referentnih vrijednosti. Ona je mjerilo učinkovitosti ispitivanja i jedan od aspekata relevantnosti. Pojam je često međusobno zamjenjiv s pojmom „podudarnost” u smislu udjela točnih ishoda ispitivanja (16.).
AOP (engl. Adverse Outcome Pathway – put nastanka štetnog ishoda)
: slijed događaja od kemijske strukture ciljne kemikalije ili skupine sličnih kemikalija preko početnog molekularnog događaja do in vivo štetnog ishoda (20.).
Kemikalija
: tvar ili smjesa.
CV05
: vijabilnost stanica 05, tj. najmanja koncentracija pri kojoj kemikalije pokažu Inh-GAPLA manji od 0,05.
FInSLO-LA
: kratica koja se upotrebljava u validacijskom izvješću i prethodnim publikacijama o testu IL-8 Luc za označivanje Ind-IL8LA. Vidjeti „Ind-IL8LA” za definiciju.
GAPLA
: aktivnost stabilne crvene luciferaze (SLR) (λmax = 630 nm), koju regulira promotor gena za GAPDH i koja pokazuje vijabilnost stanica i broj živih stanica.
Opasnost
: intrinzično svojstvo nekog agensa ili stanje koje ima potencijal uzrokovanja štetnih učinaka kada su organizam, sustav ili (sub)populacija izloženi tom agensu.
IATA (engl. Integrated Approach to Testing and Assessment integrirani pristup ispitivanju i procjeni)
: strukturiran pristup koji se primjenjuje za identifikaciju opasnosti (potencijal), karakterizaciju opasnosti (jakost) i/ili procjenu sigurnosti (potencijal/jakost i izloženost) kemikalije ili skupine kemikalija, kojim se na strateški način objedinjuju i ponderiraju svi relevantni podaci koji će služiti kao podloga za donošenje regulatornih odluka u vezi s potencijalnom opasnošću i/ili rizikom i/ili potrebom za daljnjim ciljnim, a time i minimalnim ispitivanjem.
II-SLR-LA
: kratica koja se upotrebljava u validacijskom izvješću i prethodnim publikacijama o testu IL-8 Luc za označivanje Inh-GAPLA. Vidjeti „Inh-GAPLA” za definiciju.
IL-8 (Interleukin-8)
: citokin izveden iz endotelnih stanica, fibroblasta, keratinocita, makrofaga i monocita koji uzrokuje kemotaksiju neutrofila i limfocita T-stanica.
IL8LA
: aktivnost stabilne narančaste luciferaze (SLO) (λmax = 580 nm), koju regulira promotor gena za IL-8.
Ind-IL8LA
: multiplikacijski faktor indukcije nIL8LA. Dobiva se tako da se nIL8LA stanica THP-G8 tretiranih kemikalijama podijeli s nIL8LA stanica THP-G8 koje nisu stimulirane te predstavlja aktivnost promotora gena za IL-8 koju induciraju kemikalije.
Inh-GAPLA
: inhibicija GAPLA. Dobiva se tako da se GAPLA stanica THP-G8 tretiranih kemikalijama podijeli s GAPLA stanica THP-G8 koje nisu tretirane te predstavlja citotoksičnost kemikalija.
Prag najmanje indukcije (MIT)
: najniža koncentracija pri kojoj kemikalija ispunjava pozitivne kriterije.
Smjesa
: smjesa ili otopina koja se sastoji od dviju ili više tvari.
Tvar s jednim sastojkom
: tvar, definirana količinskim sastavom, u kojoj je jedan glavni sastojak prisutan u koncentraciji od najmanje 80 % (w/w).
Tvar s više sastojaka
: tvar, definirana količinskim sastavom, u kojoj je više od jednog glavnog sastojka prisutno u koncentraciji od 10 % ili većoj (w/w) te manjoj od 80 % (w/w). Tvar s više sastojaka rezultat je procesa proizvodnje. Smjesa i tvar s više sastojaka razlikuju se po tome što se smjesa dobiva miješanjem dviju ili više tvari bez kemijske reakcije. Tvar s više sastojaka rezultat je kemijske reakcije.
nIL8LA
: aktivnost luciferaze SLO koja odražava aktivnost promotora gena za IL-8 (IL8LA) normalizirana aktivnošću luciferaze SLR koja odražava aktivnost promotora gena za GAPDH (GAPLA). To je aktivnost promotora gena za IL-8 nakon što se uzme u obzir vijabilnost stanica ili broj stanica.
nSLO-LA
: kratica koja se upotrebljava u validacijskom izvješću i prethodnim publikacijama o testu IL-8 Luc za označivanje nIL8LA. Vidjeti „nIL8LA” za definiciju.
Pozitivna kontrola
: ponovljeni uzorak koji sadržava sve komponente ispitnog sustava i tretiran je s tvari za koju je poznato da izaziva pozitivan odgovor. Kako bi se osigurala mogućnost procjene varijabilnosti odgovora pozitivne kontrole tijekom vremena, pozitivan odgovor ne bi smio biti presnažan.
Prehapteni
: kemikalije koje abiotičkom pretvorbom postaju tvari koje izazivaju preosjetljivost.
Prohapteni
: kemikalije kojima je potrebna enzimska aktivacija da bi mogle pokazati potencijal izazivanja preosjetljivosti kože.
Relevantnost
: opis odnosa između ispitivanja i istraživanog učinka te je li ispitivanje prikladno i korisno za određenu svrhu. Pokazuje u kojoj se mjeri ispitivanjem točno mjeri ili predviđa istraživani biološki učinak. Relevantnost uključuje i razmatranje o točnosti (podudarnosti) ispitivanja (16.).
Pouzdanost
: pokazuje u kojoj se mjeri ispitivanje može obnovljivo primijeniti unutar jednog laboratorija i između više laboratorija tijekom vremena uz primjenu istog protokola. Ocjenjuje se izračunavanjem obnovljivosti unutar jednog laboratorija i između više njih te ponovljivosti unutar jednog laboratorija (16.).
Ciklus
: ciklus se sastoji od jedne ispitivane kemikalije ili više njih koje se ispituju istodobno s kontrolom s otapalom/nosačem i pozitivnom kontrolom.
Osjetljivost
: udio svih pozitivnih/aktivnih kemikalija koje su pravilno razvrstane primjenom ispitivanja. To je mjera točnosti ispitivanja koje daje kategorijske rezultate i važan je čimbenik za ocjenu relevantnosti ispitivanja (16.).
SLO-LA
: kratica koja se upotrebljava u validacijskom izvješću i prethodnim publikacijama o testu IL-8 Luc za označivanje IL8LA. Vidjeti „IL8LA” za definiciju.
SLR-LA
: kratica koja se upotrebljava u validacijskom izvješću i prethodnim publikacijama o testu IL-8 Luc za označivanje GAPLA. Vidjeti „GAPLA” za definiciju.
Kontrola s otapalom/nosačem
: netretirani uzorak koji ne sadržava ispitivanu kemikaliju, ali sadržava sve ostale komponente ispitnog sustava te otapalo/nosač koji se upotrebljava u ispitivanju. Upotrebljava se za utvrđivanje polaznog odgovora za uzorke koji se tretiraju ispitivanom kemikalijom otopljenom ili stabilno dispergiranom u istom otapalu/nosaču. Kada se ispituje s istodobnom kontrolom s medijem, taj uzorak isto tako pokazuje je li otapalo/nosač u interakciji s ispitnim sustavom.
Specifičnost
: udio svih negativnih/neaktivnih kemikalija koje su pravilno razvrstane primjenom ispitivanja. To je mjera točnosti ispitivanja koje daje kategorijske rezultate i važan je čimbenik za ocjenu relevantnosti ispitivanja (16.).
Tvar
: kemijski elementi i njihovi spojevi u prirodnom stanju ili dobiveni proizvodnim postupkom, uključujući i dodatke (aditive) koji su nužni za održavanje stabilnosti proizvoda te nečistoće koje proizlaze iz primijenjenog postupka, ali isključujući otapala koja se mogu izdvojiti bez utjecaja na stabilnost tvari ili promjene njezina sastava.
Površinski aktivna tvar
: tvar, kao npr. deterdžent, koju se naziva i površinski aktivnim agensom, kojom se može smanjiti površinska napetost tekućine i time omogućiti pjenjenje i prodiranje u krute tvari; poznata je i kao sredstvo za vlaženje (TG437).
Ispitivana kemikalija
: svaka tvar ili smjesa koja se ispituje ovom metodom.
THP-G8
: reporterska stanična linija IL-8 koja se upotrebljava u testu IL-8 Luc. Ljudska stanična linija THP-1 slična makrofagima transficirana je genima za luciferaze SLO i SLR pod kontrolom promotora gena za IL-8 i GAPDH.
Globalno usklađeni sustav Ujedinjenih naroda za razvrstavanje i označivanje kemikalija (UN GHS)
: sustav za razvrstavanje kemikalija (tvari i smjesa) prema standardiziranim vrstama i stupnjevima fizičkih opasnosti i opasnosti za zdravlje i okoliš, kojim su obuhvaćena odgovarajuća komunikacijska sredstva kao što su piktogrami, oznake opasnosti, oznake upozorenja, oznake obavijesti i sigurnosno-tehnički listovi, kojima se prenose informacije o njihovim štetnim učincima u cilju zaštite ljudi (uključujući poslodavce, radnike, prijevoznike, potrošače i interventno osoblje) i okoliša (21.).
UVCB
: tvari nepoznatog ili promjenjivog sastava, složeni reakcijski proizvodi i biološki materijali.
Valjana ispitna metoda
: ispitivanje za koje se smatra da je dovoljno relevantno i pouzdano za određenu svrhu te koje se temelji na znanstveno utemeljenim načelima. Ispitivanje nikada nije valjano u apsolutnom smislu nego samo u odnosu na određenu svrhu.
Dodatak 3.2.
NAČELO MJERENJA AKTIVNOSTI LUCIFERAZE I UTVRĐIVANJE KOEFICIJENATA PRIJENOSA OPTIČKOG FILTRA ZA SLO I SLR
Može se upotrijebiti višereporterski ispitni sustav – Tripluc – s luminometrom za mikrotitracijske ploče koji ima višebojni detekcijski sustav na koji se može montirati optički filtar (npr. Phelios AB-2350 (ATTO), ARVO (PerkinElmer), Tristar LB941 (Berthold)). Kao optički filtar za mjerenje može se upotrijebiti dugo ili kratko prolazni filtar od 600 do 620 nm ili pojasno propusni filtar od 600 do 700 nm.
Mjerenje dvobojnih luciferaza optičkim filtrom
U ovom se primjeru upotrebljava Phelios AB-2350 (ATTO). Taj je luminometar opremljen dugo prolaznim filtrom od 600 nm (R60 HOYA Co., 600 nm LP, filtar 1) za razdvajanje luminiscencije SLO (λmax = 580 nm) i SLR (λmax = 630 nm).
Kako bi se utvrdili koeficijenti prijenosa kroz dugo prolazni filtar od 600 nm, prvo se upotrebom pročišćenih enzima luciferaze SLO i SLR mjeri: i. intenzitet bioluminiscencije SLO i SLR bez filtra (F0), ii. intenzitet bioluminiscencije SLO i SLR koja je prošla kroz dugo prolazni filtar od 600 nm (filtar 1) te se iii. računaju koeficijenti prijenosa kroz dugo prolazni filtar od 600 nm za SLO i SLR navedeni u nastavku.
|
Transmission coefficients
|
Abbreviation
|
Definition
|
|
SLO
|
Filter 1 Transmission coefficients
|
=κOR60
|
The filter’s transmission coefficient for the SLO
|
|
SLR
|
Filter 1 Transmission coefficients
|
κRR60
|
The filter’s transmission coefficient for the SLR
|
Ako se intenzitet SLO i SLR u ispitnom uzorku definiraju kao O i R: i. intenzitet svjetlosti bez filtra (potpuno optički) F0 i ii. intenzitet svjetlosti koja se emitira kroz dugo prolazni filtar od 600 nm (filtar 1) F1 opisuju se kako je prikazano u nastavku.
F0 = O + R
F1 = κOR60 x O + κRR60 x R
Te se formule mogu preoblikovati na sljedeći način:

Zatim se upotrebom izračunanih faktora propusnosti (κOR60 i κRR60) te izmjerenih vrijednosti F0 i F1 mogu izračunati vrijednosti O i R na sljedeći način:

Materijali i metode za utvrđivanje faktora propusnosti
|
1.
|
Reagensi
Jedinstveni pročišćeni enzimi luciferaze:
|
liofilizirani pročišćeni enzim SLO;
|
|
liofilizirani pročišćeni enzim SLR;
|
|
(koji su za validacijsku studiju dobiveni od laboratorija GPC Lab. Co. Ltd., Tottori, Japan sa staničnom linijom THP-G8).
|
Reagens za test:
|
reagens za test luciferaze Tripluc® (na primjer od TOYOBO Cat#MRA-301).
|
Medij: za test luciferaze (30 ml, pohranjeno na temperaturi od 2 do 8 °C)
|
|
Reagens
|
Konc.
|
Konačna konc. u mediju
|
Potrebna količina
|
|
RPMI-1640
|
–
|
–
|
27 ml
|
|
FBS
|
–
|
10 %
|
3 ml
|
|
2.
|
Priprema otopine enzima
Otopiti liofilizirani pročišćeni enzim luciferaze u epruveti dodavanjem 200 μl pufera Tris/HCl od 10 ~ 100 mM ili Hepes/HCl (pH 7,5 ~ 8,0) obogaćenog s 10 % (w/v) glicerola, podijeliti otopinu enzima u alikvote od 10 μl u epruvetama za jednokratnu upotrebu od 1,5 ml i pohraniti ih u zamrzivač na temperaturi od – 80 °C. Zamrznuta otopina enzima može se upotrebljavati do najviše šest mjeseci. Pri upotrebi dodati 1 ml medija za test luciferaze (RPMI-1640 s 10 % FBS-a) u sve epruvete u kojima se nalaze otopine enzima (razrijeđena otopina enzima) i držati ih na ledu kako bi se spriječila deaktivacija.
|
|
3.
|
Mjerenje bioluminiscencije
Odmrznuti reagens za test luciferaze Tripluc® (Tripluc) i držati ga na sobnoj temperaturi u vodenoj kupelji ili na sobnoj temperaturi. Uključiti luminometar 30 minuta prije početka mjerenja kako bi se omogućila stabilizacija fotomultiplikatora. Prenijeti 100 μl razrijeđene otopine enzima na crnu ploču s 96 jažica (s ravnim dnom) (referentni uzorak SLO u #B1, #B2, #B3, a referentni uzorak SLR u #D1, #D2, #D3). Zatim pipetom prenijeti 100 μl unaprijed zagrijanog Tripluca u svaku jažicu ploče koja sadržava razrijeđenu otopinu enzima. Ploču protresati deset minuta na sobnoj temperaturi (približno 25 °C) u jedinici za miješanje. Ako se u otopini u jažicama pojave mjehurići, treba ih ukloniti. Ploču staviti u luminometar kako bi se izmjerila aktivnost luciferaze. Bioluminiscencija se mjeri tri sekunde bez optičkog filtra (F0) i tri sekunde s optičkim filtrom (F1).
Koeficijent prijenosa optičkog filtra izračunan je na sljedeći način:
Koeficijent prijenosa (SLO (κOR60)) = (#B1 od F1 + #B2 od F1 + #B3 od F1) / (#B1 od F0 + #B2 od F0 + #B3 od F0)
Koeficijent prijenosa (SLR (κRR60)) = (#D1 od F1 + #D2 od F1 + #D3 od F1) / (#D1 od F0 + #D2 od F0 + #D3 od F0)
Izračunani faktori propusnosti upotrebljavaju se za sva mjerenja koja se obavljaju istim luminometrom.
|
Kontrola kvalitete opreme
Treba upotrebljavati postupke opisane u protokolu za IL-8 Luc (18.).
Dodatak 3.3.
TVARI ZA DOKAZIVANJE TEHNIČKE OSPOSOBLJENOSTI
Prije rutinske primjene ispitivanja opisanog u ovom Dodatku ispitnoj metodi B.71. laboratoriji bi trebali dokazati svoju tehničku osposobljenost tako što će za devet tvari preporučenih u tablici 1. dobiti očekivano predviđanje na temelju testa IL-8 Luc te za najmanje osam od devet tvari za dokazivanje tehničke osposobljenosti (izabrane tako da predstavljaju niz odgovora povezanih s opasnostima od izazivanja preosjetljivosti kože) dobiti vrijednosti koje su unutar odgovarajućeg referentnog raspona. Ostali kriteriji za odabir uključivali su to da je tvar komercijalno dostupna te da su dostupni visokokvalitetni in vivo referentni podaci i visokokvalitetni in vitro podaci dobiveni testom IL-8 Luc. Isto tako, za test IL-8 Luc dostupni su objavljeni referentni podaci (6. i 1.).
Tablica 1.:
Preporučene tvari za dokazivanje tehničke osposobljenosti za izvođenje testa IL-8 Luc
|
Tvari za dokazivanje tehničke osposobljenosti
|
CAS br.
|
Agregatno stanje
|
Topljivost u mediju X-VIVO15 pri 20 mg/ml
|
Predviđanje in vivo
(108)
|
Predviđanje testom IL-8 Luc (109)
|
Referentni raspon (μg/ml) (110)
|
|
|
CV05
(111)
|
MIT u testu IL-8 Luc (112)
|
|
2,4-dinitroklorbenzen
|
97-00-7
|
Kruta tvar
|
Netopljivo
|
Tvar koja izaziva preosjetljivost (ekstremno jaka)
|
Pozitivno
|
2,3–3,9
|
0,5–2,3
|
|
Formaldehid
|
50-00-0
|
Tekućina
|
Topljivo
|
Tvar koja izaziva preosjetljivost (jaka)
|
Pozitivno
|
9–30
|
4–9
|
|
2-merkaptobenzotiazol
|
149-30-4
|
Kruta tvar
|
Netopljivo
|
Tvar koja izaziva preosjetljivost (umjerena)
|
Pozitivno
|
250–290
|
60–250
|
|
Etilendiamin
|
107-15-3
|
Tekućina
|
Topljivo
|
Tvar koja izaziva preosjetljivost (umjerena)
|
Pozitivno
|
500–700
|
0,1–0,4
|
|
Etilenglikol-dimetakrilat
|
97-90-5
|
Tekućina
|
Netopljivo
|
Tvar koja izaziva preosjetljivost (slaba)
|
Pozitivno
|
> 2000
|
0,04–0,1
|
|
4-alilanisol (estragol)
|
140-67-0
|
Tekućina
|
Netopljivo
|
Tvar koja izaziva preosjetljivost (slaba)
|
Pozitivno
|
> 2 000
|
0,01–0,07
|
|
Streptomicin sulfat
|
3810-74-0
|
Kruta tvar
|
Topljivo
|
Tvar koja ne izaziva preosjetljivost
|
Negativno
|
> 2 000
|
> 2 000
|
|
Glicerol
|
56-81-5
|
Tekućina
|
Topljivo
|
Tvar koja ne izaziva preosjetljivost
|
Negativno
|
> 2 000
|
> 2 000
|
|
Izopropanol
|
67-63-0
|
Tekućina
|
Topljivo
|
Tvar koja ne izaziva preosjetljivost
|
Negativno
|
> 2 000
|
> 2 000
|
|
Kratice: CAS br. = registarski broj Službe za podatke o kemijskim tvarima
|
Dodatak 3.4.
INDEKSI L KRITERIJI PROSUDBE
nIL8LA (nSLO-LA)
J-to ponavljanje (j = 1 – 4) i-te koncentracije (i = 0 – 11) mjeri se za IL8LA (SLO-LA) i GAPLA (SLR-LA). Normalizirana IL8LA, koja se naziva nIL8LA (nSLO-LA), definira se kao:
nIL8LAij = IL8LAij/GAPLAij
To je osnovna mjerna jedinica u ovom testu.
Ind-IL8LA (FInSLO-LA)
Multiplikacijski faktor povećanja uprosječene nIL8LA (nSLO-LA) za ponavljanje i-te koncentracije u usporedbi s vrijednošću pri koncentraciji od 0, Ind-IL8LA, primarna je mjera ovog testa. Taj se omjer bilježi sljedećom formulom:

Glavni laboratorij predložio je da vrijednost od 1,4 odgovara pozitivnom rezultatu za ispitanu kemikaliju. Ta se vrijednost temelji na istraživanju prijašnjih podataka glavnog laboratorija. Tim za upravljanje podacima zatim je upotrebljavao tu vrijednost u svim fazama validacijske studije. Primarni ishod, Ind-IL8LA, omjer je dvije aritmetičke sredine, kako je prikazano u jednadžbi.
Interval pouzdanosti od 95 % (95 % CI)
Interval pouzdanosti od 95 % (95 % CI) koji se temelji na omjeru može se procijeniti kako bi se pokazala preciznost te mjere primarnog ishoda. Donja granica intervala pouzdanosti od 95 % ≥ 1 ukazuje na to da je nIL8LA s i-tom koncentracijom značajno veća od vrijednosti u kontroli s otapalom. Interval pouzdanosti od 95 % može se izvesti na nekoliko načina. U ovoj je studiji upotrijebljena metoda poznata kao Fiellerov teorem. Taj se teorem intervala pouzdanosti od 95 % dobiva prema sljedećoj formuli:

pri čemu je.







t0.975(ν) je percentil od 97,5 centralne t-distribucije s vrijednošću ν stupnja slobode, pri čemu je

Inh-GAPLA (II-SLR-LA)
Inh-GAPLA je omjer uprosječene GAPLA (SLR-LA) za ponavljanje i-te koncentracije u usporedbi s vrijednošću za kontrolu s otapalom, a bilježi se kao:
Budući da je GAPLA nazivnik vrijednosti nIL8LA, iznimno male vrijednosti uzrokuju velike varijacije vrijednosti nIL8LA. Stoga se vrijednosti Ind-IL8LA s iznimno malom vrijednosti Inh-GAPLA (manja od 0,05) mogu smatrati slabom preciznošću.
Dodatak 3.5.
PLAN METODA ZA OTAPANJE KEMIKALIJA ZA TEST IL-8 LUC
|
(a)
|
Za kemikalije koje se otapaju u mediju X-VIVOTM 15 pri 20 mg/ml
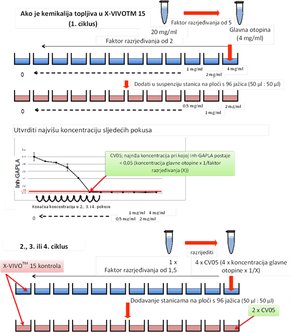
|
|
(b)
|
Za kemikalije koje nisu topljive u mediju X-VIVOTM 15 pri 20 mg/ml

|
Dodatak 3.6.
PLAN METODE ZA OTAPANJE 4-NBB-A ZA POZITIVNU KONTROLU U TESTU IL-8 LUC;
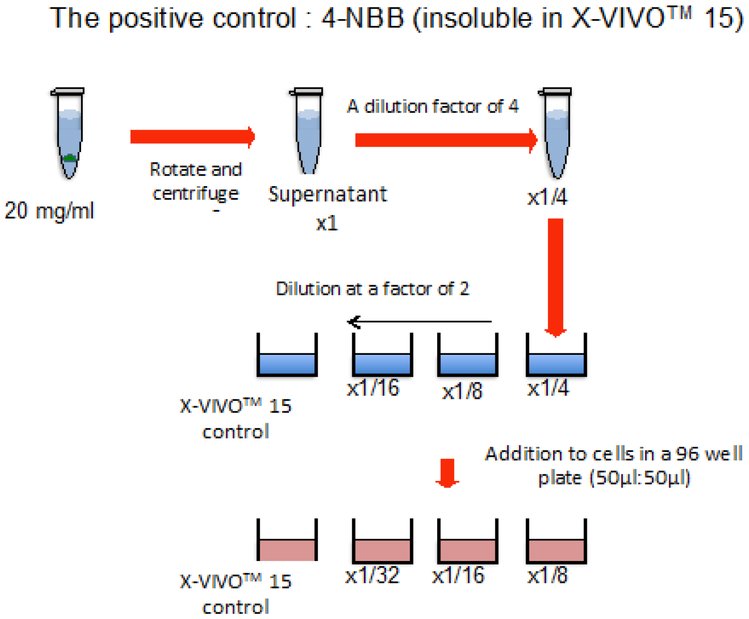
” |


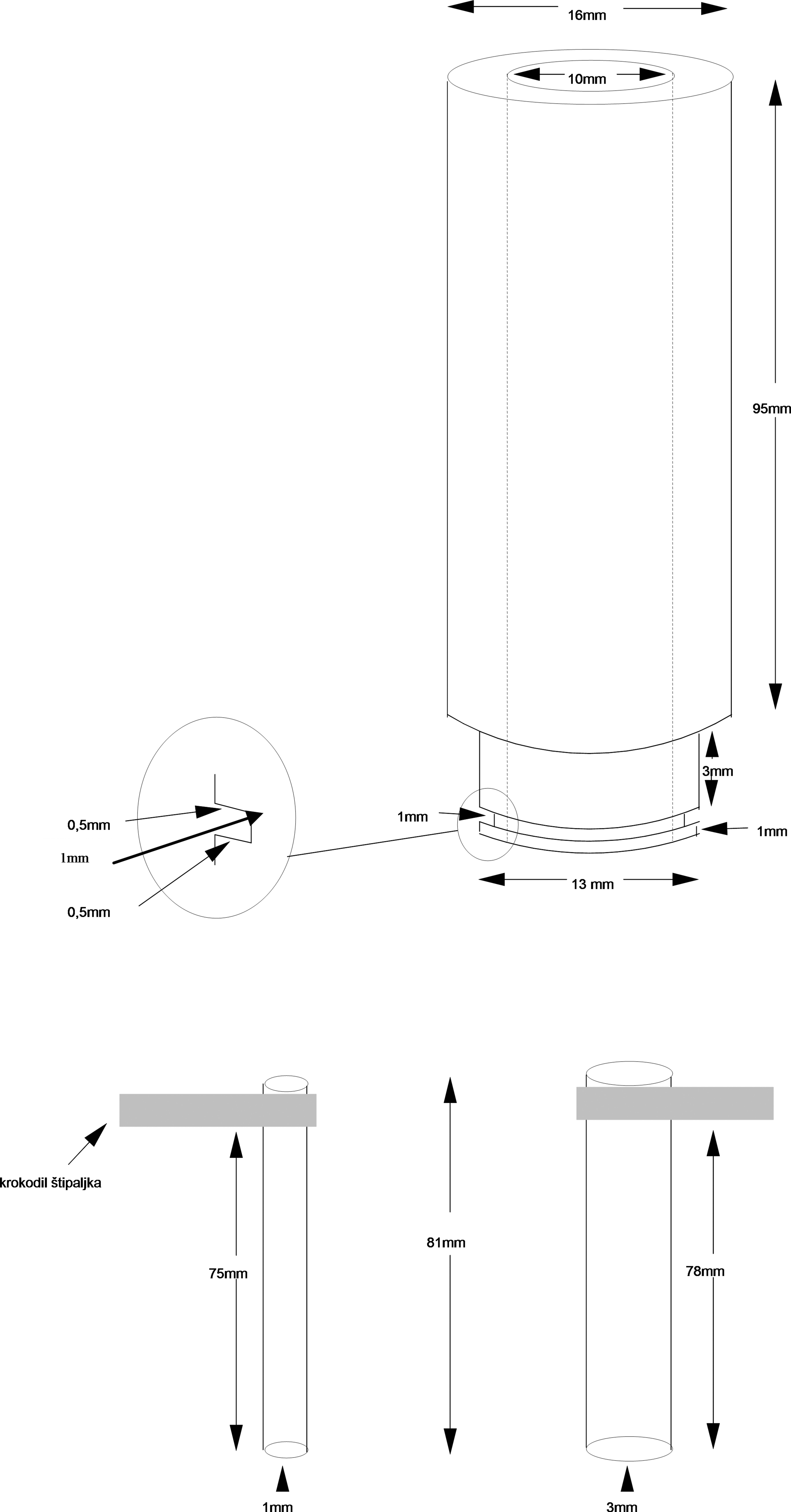




































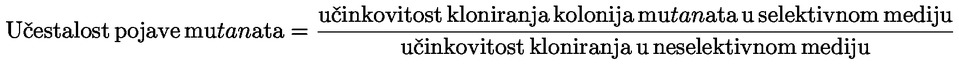












 ako je OD ispitivane kemikalije pri 570 ± 20 nm, nakon što se oduzme OD za izopropanol ili vodu, > 0,08 (što odgovara približno 5 % srednjeg OD-a negativne kontrole), trebalo bi provesti prilagođene kontrole na živom tkivu
ako je OD ispitivane kemikalije pri 570 ± 20 nm, nakon što se oduzme OD za izopropanol ili vodu, > 0,08 (što odgovara približno 5 % srednjeg OD-a negativne kontrole), trebalo bi provesti prilagođene kontrole na živom tkivu ako je OD ispitivane kemikalije pri 570 ± 20 nm, nakon što se oduzme OD za izopropanol ili vodu, > 0,08 (što odgovara približno 5 % srednjeg OD-a negativne kontrole), trebalo bi provesti prilagođene kontrole na živom tkivu
ako je OD ispitivane kemikalije pri 570 ± 20 nm, nakon što se oduzme OD za izopropanol ili vodu, > 0,08 (što odgovara približno 5 % srednjeg OD-a negativne kontrole), trebalo bi provesti prilagođene kontrole na živom tkivu ako je ispitivana kemikalija obojena, trebalo bi provesti prilagođene kontrole na živom tkivu
ako je ispitivana kemikalija obojena, trebalo bi provesti prilagođene kontrole na živom tkivu ako je ispitivana kemikalija obojena, trebalo bi provesti prilagođene kontrole na živom tkivu
ako je ispitivana kemikalija obojena, trebalo bi provesti prilagođene kontrole na živom tkivu ako otopina postane plava/ljubičasta, treba provesti prilagođene kontrole usmrćivanjem zamrzavanjem
ako otopina postane plava/ljubičasta, treba provesti prilagođene kontrole usmrćivanjem zamrzavanjem ako otopina postane plava/ljubičasta, treba provesti prilagođene kontrole usmrćivanjem zamrzavanjem
ako otopina postane plava/ljubičasta, treba provesti prilagođene kontrole usmrćivanjem zamrzavanjem ako otopina postane plava/ljubičasta, treba provesti prilagođene kontrole usmrćivanjem vodom
ako otopina postane plava/ljubičasta, treba provesti prilagođene kontrole usmrćivanjem vodom ako otopina postane plava/ljubičasta, treba provesti prilagođene kontrole usmrćivanjem vodom
ako otopina postane plava/ljubičasta, treba provesti prilagođene kontrole usmrćivanjem vodom