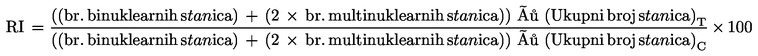3.
Dodaju se sljedeća poglavlja:
„B.49. IN VITRO MIKRONUKLEUS TEST STANICE SISAVCA
UVOD
|
1. |
Mikronukleus test in vitro je test genotoksičnosti za otkrivanje mikronukleusa (MN) u citoplazmi interfaznih stanica. Mikronukleusi mogu nastati iz acentričnih kromosomskih fragmenata (tj. nedostatka centromera) ili cijelih kromosoma koji tijekom anafaze razdiobe stanice nisu sposobni putovati na polove. Testom se otkriva aktivnost klastogenih i aneugenih kemikalija (tvari i smjesa) (1) (2) u stanicama u kojima je tijekom ili nakon izloženosti ispitivanoj tvari došlo do razdiobe. Ova ispitna metoda dopušta uporabu protokola s citohalazinom B (citoB), inhibitorom polimerizacije aktina, ili bez njega. Dodavanje citohalazina B prije ciljane mitoze omogućuje identifikaciju i selektivnu analizu učestalosti mikronukleusa u stanicama koje su dovršile jednu mitozu, budući da takve stanice imaju dvije jezgre (3) (4). Ova ispitna metoda također omogućuje uporabu protokola bez blokirane citokineze pod uvjetom da postoje dokazi da je u analiziranoj staničnoj populaciji mitoza već dovršena. |
|
2. |
Pored analize mikronukleusa in vitro za određivanje kemikalija (tvari i smjesa) koje uzrokuju nastajanje mikronukleusa, uporabom blokirane citokineze, imunokemijskog označivanja kinetohora ili hibridizacije centromernim/telomernim sondama (fluorescentna in situ hibridizacija (FISH)) mogu se također dobiti podaci o mehanizmima oštećenja kromosoma i nastajanja mikronukleusa (5) (6) (7) (8) (9) (10) (11) (12) (13) (14) (15) (16). Postupci označivanja i hibridizacije mogu se koristiti u slučaju povećanog nastajanja mikronukleusa kada istraživač želi utvrditi je li povećanje posljedica klastogenih i/ili aneugenih djelovanja. |
|
3. |
Mikronukleusi predstavljaju oštećenje koje je preneseno na stanice kćeri, dok se kromosomske aberacije u metafaznim stanicama ne moraju nužno prenijeti. Budući da se mikronukleusi u interfaznim stanicama mogu ocijeniti relativno objektivno, laboratorijsko osoblje treba utvrditi samo je li došlo do razdiobe stanica i koliko stanica sadrži mikronukleus. Pripravci se stoga mogu vrednovati relativno brzo i analiza može biti automatizirana, zbog čega je postalo praktično pri svakom tretiranju vrednovati na tisuće umjesto na stotine stanica povećavajući moć analize. Budući da mikronukleusi mogu nastati iz zaostalih kromosoma, postoji mogućnost otkrivanja tvari koje uzrokuju aneuploidiju i koje se teško proučavaju u klasičnim ispitivanjima kromosomskih aberacija, npr. Smjernica OECD-a 473 (poglavlje B.10 ovog Priloga) (17). Međutim, analiza mikronukleusa in vitro ne omogućuje razlikovanje kemikalija koje uzrokuju poliploidiju od onih koje uzrokuju klastogenost bez posebnih tehnika kao što je fluorescentna in situ hibridizacija (FISH), opisana u stavku 2. |
|
4. |
Analiza mikronukleusa in vitro je metoda in vitro koja obično koristi uzgojene ljudske stanice ili stanice glodavaca. Pruža sveobuhvatnu osnovu za istraživanje potencijala kromosomskog oštećenja in vitro budući da se mogu otkriti aneugeni i klastogeni agensi. |
|
5. |
Analiza mikronukleusa in vitro je pouzdana i učinkovita za različite vrste stanica u prisutnosti ili odsutnosti citohalazina B. Postoje opširni podaci koji podupiru valjanost analize mikronukleusa in vitro kod različitih staničnih linija glodavaca (CHO, V79, CHL/IU, and L5178Y) i ljudskih limfocita (18) (19) (20) (21) (22) (23) (24) (25) (26) (27) (28) (29) (30) (31). Oni posebno uključuju međunarodne validacijske studije kojima koordinira Société Française de Toxicologie Génétique (SFTG) (18) (19) (20) (21) (22) i izvješća International Workshop on Genotoxicity Testing (4) (16). Dostupni podaci su, također, bili ponovno ocijenjeni u retrospektivnoj validacijskoj studiji s obzirom na težinu dokaza, koju je proveo Europski centar za validaciju alternativnih metoda (ECVAM) Europske komisije, dok je Znanstveni savjetodavni odbor ECVAM-a (ESAC) ispitnu metodu potvrdio kao znanstveno valjanu (32) (33) (34). Opisana je uporaba ljudske limfoblastične stanične linije TK6 (35), stanica HepG2 (36) (37) i primarnih embrionalnih stanica sirijskog hrčka (38), iako one nisu bile korištene u validacijskim studijama. |
DEFINICIJE
|
6. |
Korištene definicije navedene su u Dodatku 1. |
POČETNA RAZMATRANJA
|
7. |
Za izvođenje testova in vitro obično se koristi egzogeni izvor metaboličke aktivacije, osim ako stanice imaju metaboličko djelovanje u odnosu na tvari koje se ispituju. Egzogeni sustav metaboličke aktivacije ne oponaša u cijelosti uvjete in vivo. Potrebno je paziti da se izbjegnu uvjeti koji bi mogli dovesti do neprirodnih pozitivnih rezultata koji ne ukazuju na intrinzičnu mutagenost, a mogu nastati zbog značajnih promjena pH ili osmolalnosti ili zbog visoke razine citotoksičnosti (39) (40) (41). Ako dodavanjem ispitivane kemikalije dođe do promjene pH medija, potrebno je prilagoditi pH, po mogućnosti dodavanjem pufera u koncentriranu otopinu tako da svi obujmi za sve ispitane koncentracije i za sve kontrole ostanu isti. |
|
8. |
Za analizu nastanka mikronukleusa ključno je da je došlo do mitoze u tretiranim i netretiranim kulturama. Najviše podataka za vrednovanje mikronukleusa dobije se u stanicama koje su dovršile jednu mitozu tijekom ili nakon tretiranja ispitivanom tvari. |
NAČELO ISPITIVANJA
|
9. |
Stanične kulture ljudskog podrijetla ili stanične kulture sisavaca izlažu se ispitivanoj tvari s egzogenim izvorom metaboličke aktivacije i bez njega, osim ako se koriste stanice s odgovarajućim metaboličkim djelovanjem. U sve testove uključuju se paralelne kemikalije s otapalom/nosačem (VC) i pozitivne kontrolne kemikalije. |
|
10. |
Tijekom ili nakon izlaganja ispitivanoj tvari stanice se uzgajaju dovoljno dugo da zbog oštećenja kromosoma ili vretena dođe do nastajanja mikronukleusa u interfaznim stanicama. Za nastanak aneuploidije ispitivana tvar obično mora biti prisutna tijekom mitoze. Dobivene i obojane interfazne stanice analiziraju se s obzirom na prisutnost mikronukleusa. Idealno bi se mikronukleusi trebali vrednovati isključivo u stanicama koje su dovršile mitozu tijekom izloženosti ispitivanoj tvari ili u razdoblju nakon izloženosti, ako se koristi. U kulturama koje su tretirane blokatorom citokineze to se postiže vrednovanjem isključivo stanica s dvije jezgre. U nedostatku blokatora citokineze važno je dokazati da je u analiziranim stanicama vjerojatno došlo do razdiobe stanica tijekom ili nakon izlaganja ispitivanoj tvari. Za sve protokole važno je dokazati da je došlo do proliferacije stanica i u kontrolnim i u tretiranim kulturama, dok je u kulturama (ili paralelnim kulturama) u kojima se vrednuju mikronukleusi potrebno ocijeniti opseg citotoksičnosti ili citostaze uzrokovanih ispitivanom tvari. |
OPIS ANALIZE
Pripravci
|
11. |
Mogu se koristiti uzgojeni primarni ljudski limfociti periferne krvi (5) (19) (42) (43) i određeni broj staničnih linija glodavaca kao što su CHO, V79, CHL/IU i L5178Y (18) (19) (20) (21) (22) (25) (26) (27) (28) (30). Uporaba drugih staničnih linija i vrsta mora se opravdati na temelju njihove dokazane učinkovitosti u analizi, kako je opisano u odjeljku Kriteriji prihvatljivosti. Budući da učestalost mikronukleusa u pozadini utječe na osjetljivost analize, preporučuje se uporaba staničnih vrsta s niskom i stabilnom učestalosti nastajanja mikronukleusa u pozadini. |
|
12. |
Ljudski limfociti periferne krvi dobivaju se od mladih (približno 18-35 godina starosti), zdravih pojedinaca nepušača koji nisu nedavno bili izloženi genotoksičnim kemikalijama ili zračenju. Ako se za uporabu ujedinjuju stanice više donora, potrebno je odrediti broj donora. Učestalost mikronukleusa raste s dobi, i taj je trend izraženiji kod žena nego kod muškaraca (44), što treba uzeti u obzir kod odabira donorskih stanica. |
Mediji i uvjeti uzgajanja
|
13. |
Za održavanje kultura koriste se odgovarajući mediji i uvjeti inkubacije (posude za kulture, koncentracija CO2, temperatura i vlažnost). Kontinuirane stanične linije i sojevi se redovito provjeravaju s obzirom na stabilnost modalnog kromosomskog broja i odsutnost kontaminacije mikoplazme i ne smiju se koristiti ako su kontaminirane ili ako dođe do promjene u modalnom broju kromosoma. Uobičajeno trajanje staničnog ciklusa za uvjete uzgajanja koji se koriste u ispitnom laboratoriju treba biti poznato. Ako se koristi metoda blokiranja citokineze, koncentracija citokinetskog inhibitora mora biti optimizirana za određenu vrstu stanica i mora biti dokazana njegova sposobnost da proizvede dobar broj stanica s dvije jezgre za vrednovanje. |
Priprema kultura
|
14. |
Kontinuirane stanične linije i sojevi: stanice se razmnažaju iz primarnih kultura, nacijepe na medij takvom gustoćom da se izbjegne konfluencija kultura u jednom sloju i da kulture suspenzije ne dosegnu preveliku gustoću prije ubiranja, i inkubiraju se pri 37 °C. |
|
15. |
Limfociti: cjelokupna krv, tretirana antikoagulansom (npr. heparinom), ili izdvojeni limfociti, kultiviraju se u prisutnosti mitogena, npr. fitohemaglutinina (PHA) prije izlaganja ispitivanoj tvari i citohalazinu B. |
Metabolička aktivacija
|
16. |
Kod uporabe stanica s neodgovarajućom endogenom sposobnošću metabolizma potrebno je koristiti egzogene sustave metaboliziranja. Najčešće korišteni sustav je postmitohondrijska frakcija s dodanim kofaktorom (S9), pripravljena iz jetre glodavaca, koja je bila tretirana sredstvima za enzimsku indukciju, kao što je Aroclor 1254 (45) (46), ili smjesom fenobarbitona i β-naftoflavona (46) (47) (48) (49). Posljednja kombinacija nije u suprotnosti sa Stockholmskom konvencijom o postojanim organskim onečišćujućim tvarima (50) i Uredbom (EZ) br. 850/2004 o postojanim organskim onečišćujućim tvarima (66), i dokazano je da je za nastanak oksidaza s miješanom funkcijom jednako učinkovita kao Aroclor 1254 (46) (47) (48) (49). Frakcija S9 se obično uporablja u koncentracijama 1–10 % (v/v) u konačnom ispitivanom mediju. Uvjeti sustava za aktivaciju metabolizma mogu ovisiti o razredu ispitivane kemikalije i u nekim slučajevima može biti primjereno uporabiti više od jedne koncentracije S9. |
|
17. |
Stanične linije modificirane genetskim inženjeringom, koje izražavaju specifične aktivirajuće enzime ljudi ili glodavaca, mogu ukloniti potrebu za egzogenim sustavom aktivacije metabolizma i mogu se koristiti kao ispitivane stanice. U takvim slučajevima odabir uporabljenih staničnih linija mora biti znanstveno utemeljen, npr. zbog važnosti oksidaze s miješanom funkcijom za metabolizam ispitivane tvari (51) i njihove reaktivnosti na poznate aneugene i klastogene tvari (vidjeti zasebni odjeljak o kriterijima prihvatljivosti). Treba priznati da postoji mogućnost da izražene oksidaze s miješanom funkcijom ne metaboliziraju ispitivanu tvar; u tom slučaju negativni rezultati ne znače da ispitivana tvar ne može uzrokovati nastanak mikronukleusa. |
Priprema ispitivane tvari
|
18. |
Prije tretiranja stanica krute kemikalije se otapaju u odgovarajućim otapalima ili nosačima i prema potrebi razrjeđuju. Tekuće se kemikalije mogu dodati neposredno u ispitivane sustave i/ili razrijediti prije tretiranja. Plinovite ili hlapive kemikalije ispituju se nakon što se prikladno izmijene standardni protokoli, kao što je tretiranje u hermetički zatvorenim posudama (52) (53). Koriste se svježi pripravci ispitivane tvari, osim ako podaci o stabilnosti dokažu da je pohranjivanje prihvatljivo. |
Uvjeti testiranja
Otapala/nosači
|
19. |
Otapalo/nosač ne smije reagirati u dodiru s ispitivanom tvari i mora biti kompatibilan s preživljavanjem stanica ili održavanjem djelovanja S9 pri uporabljenoj koncentraciji. Ako se koriste manje poznata otapala/nosači (npr. voda, medij za kultiviranje stanica, dimetil sulfoksid), njihovu uporabu trebaju podupirati podaci koji ukazuju na njihovu kompatibilnost s ispitivanom tvari i nepostojanje genotoksičnosti. Preporučuje se da se, kada god je to moguće, prvo uzme u obzir uporaba vodenog otapala/nosača. |
Uporaba citohalazina B kao blokatora citokineze
|
20. |
Za učinkovitost analize mikronukleusa in vitro vrlo je važno osigurati da u stanicama koje se vrednuju mitoza bude dovršena tijekom tretiranja ili u razdoblju inkubacije nakon tretiranja, ako se koristi. Citohalazin B je agens koji se najčešće koristi za blokadu citokineze budući da sprječava sastavljanje aktina i time onemogućava odvajanje stanica kćeri nakon mitoze, zbog čega nastaju stanice s dvije jezgre (5) (54) (55). Vrednovanje mikronukleusa stoga se može ograničiti na stanice u kojima je došlo do mitoze tijekom tretiranja ili nakon njega. Učinak ispitivane tvari na kinetiku proliferacija stanica može se mjeriti istodobno. Citohalazin B koristi se kao blokator citokineze kada se koriste ljudski limfociti, budući da se trajanje staničnih ciklusa razlikuje od kulture do kulture i između donora, te budući da svi limfociti ne reagiraju na fitohemaglutinin (PHA). Kod ispitivanja staničnih linija koriste se i druge metode za određivanje jesu li se stanice koje se vrednuju podijelile; te su metode opisane u nastavku (vidjeti stavak 26.). |
|
21. |
Za svaku vrstu stanica laboratorij određuje prikladnu koncentraciju citohalazina B kako bi se postigla optimalna učestalost stanica s dvije jezgre u kontrolnim kulturama s otapalom/nosačem. Prikladna koncentracija citohalazina B je obično između 3 i 6 μg/ml. |
Mjerenje proliferacija stanica i citotoksičnosti te odabir koncentracija izloženosti
|
22. |
Kod određivanja najviše koncentracije tvari koja se ispituje, treba izbjegavati koncentracije koje imaju sposobnost izazivanja nepravilnih pozitivnih reakcija, kao što su koncentracije koje izazivaju pretjeranu citotoksičnost, oborine u mediju kultiviranja i značajne promjene pH ili osmolalnosti (39) (40) (41). |
|
23. |
Proliferacija stanica se mjeri kako bi se osiguralo da je u tretiranim stanicama tijekom analize došlo do mitoze i da se stanice tretiraju na odgovarajućim razinama citotoksičnosti (vidjeti stavak 29.). Citotoksičnost se određuje sa i bez aktivacije metabolizma u stanicama koje zahtijevaju aktivaciju metabolizma uporabom relativnog povećanja broja stanica (relative increase in cell counts, RICC) ili relativnog udvostručenja populacije (relative population doubling, RPD) (vidjeti Dodatak 2. za formule), osim ako se koristi citohalazin B. Ako se koristi citohalazin B, citotoksičnost se može odrediti indeksom ponavljanja (RI) (vidjeti Dodatak 2. za formulu). |
|
24. |
Tretiranje kultura citohalazinom B i mjerenje relativne učestalosti stanica s jednom, dvije ili više jezgri u kulturi predstavlja preciznu metodu za kvantificiranje učinka na proliferaciju stanica i citotoksično ili citostatično djelovanje tretiranja (5) i osigurava da se vrednuju samo one stanice u kojima je došlo do razdiobe tijekom ili nakon tretiranja. |
|
25. |
U studijama s citohalazinom B citostaza/citotoksičnost mogu se kvantificirati pomoću indeksa proliferacije s blokiranom citokinezom (cytokinesis-block proliferation index, CBPI) (5) (26) (56) ili se mogu dobiti pomoću indeksa ponavljanja iz najmanje 500 stanica po kulturi (vidjeti Dodatak 2. za formule). Kada se za ocjenu proliferacija stanica koristi citohalazin B, CBPI ili RI se trebaju odrediti na temelju najmanje 500 stanica po kulturi. Ta se mjerenja, među ostalim, mogu koristiti za ocjenu citotoksičnosti usporedbom vrijednosti u tretiranim i kontrolnim kulturama. Ocjenjivanje drugih markera citotoksičnosti (npr. konfluentnost, broj stanica, apoptoza, nekroza, broj metafazi) može pružiti korisne informacije. |
|
26. |
U studijama bez citohalazina B potrebno je dokazati da je tijekom ili nakon tretiranja ispitivanom tvari došlo do razdiobe stanica koje se vrednuju u kulturi, jer se u suprotnome mogu dobiti lažni negativni rezultati. Metode koje su bile uporabljene kako bi se osiguralo da se vrednuju podijeljene stanice uključuju ugradnju i naknadno otkrivanje bromdeoksiuridina (BrdU) za određivanje stanica koje se udvostručile (57), stvaranje klonova kada su stanice iz stalnih staničnih linija tretirane i vrednovane in situ na mikroskopskom stakalcu (indeks proliferacije (PI)) (25) (26) (27) (28), ili mjerenje relativnog udvostručenja populacije (RPD) ili relativnog povećanja broja stanica (RICC) ili druge provjerene metode (16) (56) (58) (59) (vidjeti Dodatak 2. za formule). Ocjenjivanje drugih markera citotoksičnosti ili citostaze (npr. konfluentnost, broj stanica, apoptoza, nekroza, broj metafazi) može pružiti korisne informacije. |
|
27. |
Potrebno je ocijeniti najmanje tri koncentracije koje se mogu analizirati. Da bi se to postiglo, može biti potrebno izvesti pokus koristeći veći broj koncentracija u bliskom slijedu i analizirati nastajanje mikronukleusa u tim koncentracijama koje osiguravaju odgovarajući opseg citotoksičnosti. Druga strategija je izvođenje preliminarnog testa citotoksičnosti kako bi se suzio raspon za konačni test. |
|
28. |
Najviša koncentracija trebala bi proizvesti 55 ± 5 % citotoksičnosti. Više bi razine mogle uzrokovati oštećenja kromosoma kao sekundarni učinak citotoksičnosti (60). Ako se pojavi citotoksičnost, odabrane ispitivane koncentracije trebale bi pokriti raspon od one koja proizvede 55 ± 5 % citotoksičnosti do one koja proizvede malu citotoksičnost ili je uopće ne proizvodi. |
|
29. |
Ako se ne uoči toksičnost niti oborina, najviša ispitivana koncentracija trebala bi iznositi 0,01 M, 5 mg/ml ili 5 μl/ml, koja god je niža. Razmak između koncentracija koje su odabrane za analizu obično ne bi trebao biti veći od 10. Za ispitivane tvari koje pokažu strmu krivulju reakcije na koncentraciju, može biti potrebno smanjiti razmak između koncentracija tako da se vrednuju i kulture u umjerenom i niskom rasponu toksičnosti. |
|
30. |
Kada je topljivost ograničujući faktor, najviša koncentracija, ako nije ograničena citotoksičnošću, treba biti najniža koncentracija pri kojoj je u kulturama vidljiva minimalna oborina, pod uvjetom da nema nikakvih ometanja pri vrednovanju. Oborina se ocjenjuje metodama kao što je svjetlosno mikroskopiranje, kojim se opaža oborina koja je postojana ili se pojavi tijekom kultiviranja (do kraja tretiranja). |
Kontrole
|
31. |
U svaki pokus se uvode paralelne pozitivne kontrole i kontrole s otapalom/nosačem s aktivacijom metabolizma ili bez nje.. |
|
32. |
Pozitivne kontrole su potrebne za dokazivanje sposobnosti uporabljenih stanica, i protokola ispitivanja, za određivanje klastogenih i aneugenih tvari te za potvrđivanje metaboličke sposobnosti pripravka S9. Pozitivne kontrole trebaju koristiti poznate pokretače tvorbe mikronukleusa pri koncentracijama za koje se očekuje malo, ali ponovljivo povećanje s obzirom na pozadinu, i pokazuju osjetljivost sustava ispitivanja. Koncentracije pozitivne kontrole odabiru se tako da su učinci jasni, ali prilikom čitanja ne otkrivaju odmah identitet kodiranih slajdova. |
|
33. |
Za dokazivanje metaboličke kompetencije i sposobnosti sustava da otkriva klastogene potrebno je koristiti klastogen koji zahtijeva aktivaciju metabolizma (npr. ciklofosfamid; benzo[a]piren). Mogu se koristiti i druge pozitivne kontrole, ako je to utemeljeno. Budući da u određenim uvjetima tretiranja ili određenim staničnim linijama neke pozitivne kontrole, kojima je potrebna aktivacija metabolizma, mogu biti aktivne bez egzogene aktivacije metabolizma, potrebno je ispitati potrebu za aktivacijom metabolizma i djelovanje pripravka S9 na odabranoj staničnoj liniji i uz odabrane koncentracije. |
|
34. |
Trenutačno nisu poznati aneugeni koji za svoje genotoksično djelovanje zahtijevaju aktivaciju metabolizma (16). Pozitivne kontrole koje su trenutačno prihvaćene za aneugeno djelovanje su, na primjer, kolhicin i vinblastin. Mogu se koristiti i druge kemikalije ako utječu na nastanak mikronukleusa isključivo ili prvenstveno kroz aneugeno djelovanje. Da bi se izbjegla potreba za dvjema pozitivnim kontrolama (za klastogenost i aneugenost) bez aktivacije metabolizma, kontrola aneugenosti može poslužiti kao pozitivna kontrola bez S9, dok se kontrola klastogenosti može upotrijebiti za ispitivanje prikladnosti uporabljenog sustava za aktivaciju metabolizma. Pozitivna kontrola za klastogenost i aneugenost treba se koristiti u stanicama koje ne zahtijevaju S9. Preporučene pozitivne kontrole su navedene u Dodatku 3. |
|
35. |
Ako su dostupne prikladne kemikalije, može se razmotriti mogućnost uporabe pozitivnih kontrola povezanih s razredom kemikalija. Sve uporabljene pozitivne kontrole trebaju biti prikladne za vrstu stanica i uvjete aktivacije. |
|
36. |
Za svaku fazu prikupljanja potrebno je uključiti kontrole s otapalom/nosačem. Pored toga, koriste se također i netretirane kontrole, osim ako objavljeni ili laboratorijski povijesni kontrolni podaci dokazuju da odabrano otapalo pri uporabljenim koncentracijama ne izaziva nikakve genotoksične niti druge štetne učinke. |
ISPITNI POSTUPAK
Program tretiranja
|
37. |
Kako bi vjerojatnost otkrivanja aneugenih ili klastogenih tvari koje djeluju u određenoj fazi staničnog ciklusa bila što veća, važno je da u svim fazama njihovih staničnih ciklusa dovoljan broj stanica bude tretiran ispitivanom tvari. Program tretiranja staničnih linija i primarnih staničnih kultura može se, stoga, nešto razlikovati od onoga za limfocite koji zahtijevaju mitogensku stimulaciju za započinjanje staničnog ciklusa, kako se razmatra u stavcima 41.–43. (16). |
|
38. |
Teoretska razmatranja zajedno s objavljenim podacima (18) ukazuju da će većina aneugenih i klastogenih tvari biti otkrivene kratkotrajnim tretiranjem u trajanju od 3 do 6 sati s dodanim pripravkom S9 ili bez njega, nakon čega slijedi odstranjivanje ispitivane tvari i razdoblje rasta 1,5–2,0 staničnih ciklusa (6). Stanice se uzorkuju u vremenu koje je ekvivalentno približno 1,5–2,0 puta uobičajenog (tj. netretiranog) staničnog ciklusa nakon početka ili na kraju tretiranja (vidjeti tablicu 1.). Vrijeme uzorkovanja ili obnavljanja se može produljiti ako je poznato ili se sumnja da ispitivana tvar utječe na duljinu staničnog ciklusa (npr. pri ispitivanju analognih nukleozida). |
|
39. |
Zbog moguće citotoksičnosti pripravaka S9 za kultivirane stanice sisavca, produljena izloženost u trajanju od 1,5–2,0 puta uobičajenih staničnih ciklusa se uporablja isključivo ako nije prisutan S9. Kod produljenog tretiranja nudi se mogućnost tretiranja stanica s ispitivanom kemikalijom u odsutnosti ili prisutnosti citohalazina B. Ta se mogućnosti odnosi na situacije gdje se može javiti zabrinutost zbog mogućih interakcija između ispitivane tvari i citohalazina B. |
|
40. |
U tablici 1. su predstavljeni preporučeni programi tretiranja stanica. Ti se opći programi tretiranja mogu izmijeniti ovisno o stabilnosti ili reaktivnosti ispitivane tvari ili posebnim značajkama rasta uporabljenih stanica. Sva tretiranja moraju početi i završiti tijekom eksponencijalnog rasta stanica. Ti programi su detaljnije predstavljeni u stavcima 41.-47. u nastavku. Tablica 1. Razdoblja tretiranja i prikupljanja stanica za analizu mikronukleusa in vitro
|
||||||||||
Limfociti, primarne stanice i stanične linije s citohalazinom B
|
41. |
Najučinkovitiji pristup za limfocite je započeti s izlaganjem ispitivanoj tvari 44-48 sati nakon stimulacije PHA, kada više nema sinkronizacije ciklusa (5). U početnoj analizi stanice se tretiraju 3 do 6 sati ispitivanom tvari u prisutnosti ili odsutnosti S9. Hranjiva podloga se odstranjuje i zamjenjuje svježom podlogom koja sadrži citohalazin B i stanice se prikupljaju nakon 1,5–2,0 uobičajenih staničnih ciklusa. |
|
42. |
Ako su oba početna testa kratkoročnog tretiranja (3–6 sati) negativna ili dvojbena, izvodi se naknadno tretiranje s duljom izloženosti bez S9. Postoje dvije opcije tretiranja koje su jednako prihvatljive. Međutim, ako se eksponencijalni rast nakon 96 sati od stimulacije smanjuje, za stimulirane limfocite može biti primjerenija opcija A. U opciji B, također, stanične kulture ne smiju konfluirati prije konačnog uzorkovanja.
|
|
43. |
Primarne stanice i stanične linije tretiraju se na sličan način kao i limfociti, osim što ih nije potrebno stimulirati s PHA 44-48 sati. Stanice koje nisu limfociti, izlažu se tako da na kraju studije budu još uvijek u fazi logaritamskog rasta. |
Stanične linije bez citohalazina B
|
44. |
Stanice se tretiraju 3-6 sati u prisutnosti ili odsutnosti S9. Hranjiva podloga se odstranjuje i zamjenjuje svježom podlogom i stanice se prikupljaju nakon 1,5–2,0 uobičajenih staničnih ciklusa |
|
45. |
Ako su oba početna testa kratkotrajnog tretiranja (3–6 sati) negativna ili dvojbena, izvodi se naknadno tretiranje s duljom izloženosti (bez S9). Postoje dvije opcije tretiranja koje su jednako prihvatljive.
|
|
46. |
Na kraju tretiranja u trajanju od 3 do 6 sati u monoslojevima mogu biti prisutne mitotičke stanice (prepoznatljive kao okrugle i odvajaju se od površine). Budući da se te mitotičke stanice lako odvajaju, mogu se izgubiti prilikom odstranjivanja podloge s ispitivanom tvari. Te se stanice pažljivo prikupljaju prilikom ispiranja kultura i potom pažljivo vraćaju u kulture, kako se u trenutku prikupljanja ne bi izgubile stanice koje se nalaze u fazi mitoze i koje su rizične za nastajanje mikronukleusa. |
Broj kultura
|
47. |
Za svaku koncentraciju ispitivane tvari i kulture s nosačem/otapalom i kulture negativne kontrole koriste se dvojne kulture. Ako se na temelju povijesnih laboratorijskih podataka može dokazati da su razlike između dvojih kultura minimalne, prihvatljiva je uporaba jedne kulture. Ako se koristi jedna kultura, preporučuje se analiza većeg broja koncentracija. |
Prikupljanje stanica i priprema stakalca
|
48. |
Svaka kultura se prikuplja i obrađuje zasebno. Priprema stanica može uključiti hipotonično tretiranje, iako taj korak nije potreban ako se na drugi način može ostvariti primjereno širenje stanica. U pripremi stakalca mogu se koristiti različite tehnike, pod uvjetom da se za vrednovanje dobiju pripravci sa stanicama visoke kakvoće. Potrebno je zadržati citoplazmu stanica kako bi se omogućilo otkrivanje mikronukleusa i (u metodi blokirane citokineze) pouzdana identifikacija binuklearnih stanica. |
|
49. |
Stakalca se mogu obojiti različitim metodama, kao što su Giemsa ili DNA-specifična fluorescentna bojila (59). Uporaba DNA-specifičnog bojila (npr. akridin oranž (61) ili Hoechst 33258 plus pyronin-Y (62)) može ukloniti neke artefakte povezane s uporabom bojila koja nisu specifična za DNA. Za određivanje sadržaja (kromosom/kromosomski fragment) mikronukleusa, ako se žele dobiti mehanicističke informacije o njihovom nastajanju, mogu se koristiti antikinetohorna antitijela, fluorescentna in situ hibridizacija (FISH) pancentromernim sondama DNA ili primarno označivanje in situ početnicama specifičnim za centromere zajedno s odgovarajućim bojanjem DNA (15) (16). Za razlikovanje između klastogenih i aneugenih tvari mogu se koristiti i druge metode, ako su dokazano učinkovite. |
Analiza
|
50. |
Sva stakalca, uključujući one s otapalom/nosačem i kontrolna, neovisno se kodiraju prije mikroskopske analize. Umjesto toga, kodirani uzorci mogu se analizirati validiranim, automatiziranim sustavom analize protočnom citometrijom ili slikovnom analizom. |
|
51. |
U kulturama tretiranim s citohalazinom B potrebno je analizirati učestalost mikronukleusa u najmanje 2 000 binuklearnih stanica po koncentraciji (najmanje 1 000 binuklearnih stanica po kulturi; dvije kulture po koncentraciji). Ako se koristi jedna kultura, potrebno je vrednovati najmanje 2 000 binuklearnih stanica po koncentraciji iz te kulture. Ako je za vrednovanje pri svakoj koncentraciji dostupno znatno manje od 1 000 binuklearnih stanica po kulturi ili 2 000 binuklearnih stanica ako se koristi jedna kultura te ako nije utvrđeno značajno povećanje mikronukleusa, potrebno je ponoviti ispitivanje koristeći više stanica ili pri manje toksičnim koncentracijama, koje god je primjerenije. Treba paziti da se ne vrednuju binuklearne stanice nepravilnog oblika ili ako postoji velika razlika u veličini jezgre; isto tako binuklearne stanice se ne smiju zamijeniti sa slabo raširenim multinuklearnim stanicama. Stanice koje imaju više od dvije glavne jezgre ne analiziraju se u vezi s mikronukleusima, budući da osnovna učestalost mikronukleusa u tim stanicama može biti veća (63) (64). Vrednovanje mononuklearnih stanica je prihvatljivo, ako je dokazano da ispitivana tvar utječe na djelovanje citohalazina B. |
|
52. |
U staničnim linijama, analiziranim bez tretiranja citohalazinom B, mikronukleusi se vrednuju u najmanje 2 000 stanica po koncentraciji (najmanje 1 000 stanica po kulturi; dvije kulture po koncentraciji). Ako se koristi samo jedna kultura po koncentraciji, potrebno je vrednovati najmanje 2 000 stanica iz te kulture. |
|
53. |
Ako se koristi citohalazin B, za ocjenu proliferacije stanica potrebno je odrediti CBPI ili RI (vidjeti Dodatak 2.) koristeći najmanje 500 stanica po kulturi. Ako se tretiranje izvodi bez dodanog citohalazina B, ključno je dostaviti dokaz da je došlo do proliferacije stanica koje se vrednuju, kako je raspravljeno u stavcima 24.–27. |
Kriteriji prihvatljivosti
|
54. |
Laboratorij koji predlaže uporabu analize mikronukleusa in vitro, opisane u ovoj ispitnoj metodi, uporabom referentnih kemikalija iz Dodatka 3. mora dokazati svoju sposobnost da pouzdano i precizno otkriva kemikalije s poznatim aneugenim i klastogenim djelovanjem, s metaboličkom aktivacijom ili bez nje, kao i poznate negativne kemikalije. Kao dokaz svoje sposobnosti da pravilno izvodi ovu ispitnu metodu laboratorij dostavlja dokaz da su stanice koje su predmet vrednovanja s obzirom na nastanak mikronukleusa dovršile jednu diobu jezgre ako se ispitivanje izvodi bez uporabe citohalazina B. |
|
55. |
Preporučuje se uporaba kemikalija iz Dodatka 3. kao referentnih kemikalija. Mogu se uključiti zamjenske ili dodatne kemikalije, ako je njihovo djelovanje poznato, ako induciraju mikronukleuse istim mehanizmima djelovanja i ako se pokaže da su relevantne za kemikalije koje će se ispitivati postupkom analize mikronukleusa in vitro. Obrazloženje može uključiti validacijsku studiju u kojoj su uporabljene različite tvari ili studiju usmjerenu na uži spektar koji se temelji na kemijskom razredu ispitivane tvari ili mehanizmu oštećivanja koji se proučava. |
|
56. |
Kontrolne kulture s otapalom/nosačem i netretirane kulture moraju ponovljivo dati nisku i dosljednu učestalost mikronukleusa (obično 5–25 mikronukleusa/1 000 stanica za vrste stanica iz stavka 11.). Druge vrste stanica mogu imati različne raspone reakcija koje se trebaju odrediti prilikom njihove validacije za uporabu u analizi mikronukleusa in vitro. Podaci dobiveni negativnom kontrolom, kontrolom s otapalom i pozitivnom kontrolom koriste se za utvrđivanje povijesnih kontrolnih raspona. Te se vrijednosti koriste kod odlučivanja o prikladnosti paralelne negativne/pozitivne kontrole za ispitivanje. |
|
57. |
Ako se za analizu predlažu manje izmjene protokola (npr. uporaba automatizirane umjesto ručne tehnike brojanja; uporaba nove vrste stanica), učinkovitost izmjene se mora dokazati prije nego što se izmijenjeni protokol može smatrati prihvatljivim za uporabu. Dokazivanje učinkovitosti uključuje dokaz da se mogu otkriti glavni mehanizmi loma kromosoma i dodavanje ili gubitak, i da se za razred pojedinačne tvari ili širi opseg tvari koje će se ispitivati, mogu dobiti odgovarajući pozitivni i negativni rezultati. |
PODACI I IZVJEŠĆIVANJE
Obrada rezultata
|
58. |
Ako se koristi tehnika blokirane citokineze, za ocjenjivanje indukcije mikronukleusa koristi se isključivo učestalost binuklearnih stanica s mikronukleusima (bez obzira na broj mikronukleusa po stanici). Brojanje stanica s jednim, dvama ili više mikronukleusa može pružiti korisne informacije, ali nije obvezno. |
|
59. |
Potrebno je odrediti paralelna mjerenja citotoksičnosti i/ili citostaze za sve tretirane kulture i kontrolne kulture s otapalom/nosačem (58). Za sve tretirane i kontrolne kulture potrebno je izračunati CBPI ili RI kao mjerenja kašnjenja staničnog ciklusa, ako se koristi metoda blokirane citokineze. U odsutnosti citohalazina B koristi se RPD, RICC ili PI (vidjeti Dodatak 2.). |
|
60. |
Potrebno je dostaviti podatke o pojedinačnoj kulturi. Pored toga, svi se podaci sažimaju u obliku tablice. |
|
61. |
U analizi mikronukleusa in vitro kemikalije mogu inducirati mikronukleuse zato što uzrokuju lom kromosoma, gubitak kromosoma ili njihovu kombinaciju. Za određivanje je li mehanizam indukcije mikronukleusa posljedica klastogenog i/ili aneugenog djelovanja, može se koristiti daljnja analiza uporabom antikinetohornih antitijela, in situ sonda specifičnih za centromere ili drugih metoda. |
Ocjenjivanje i tumačenje rezultata
|
62. |
Jasnu pozitivnu ili negativnu reakciju nije potrebno provjeravati dodatnim ispitivanjem. Dvosmisleni rezultati se mogu pojasniti analizom dodatnih 1 000 stanica iz svih kultura kako se ne bi izgubili slijepi uzorci. Ako takav pristup ne riješi pitanje dvosmislenosti rezultata, potrebno je provesti dodatno ispitivanje. U daljnjim pokusima potrebno je razmotriti mogućnost izmjene parametara studije u proširenom ili suženom rasponu uvjeta, kako je primjereno. Mogu se izmijeniti sljedeći parametri: razmak između ispitnih koncentracija, raspored tretiranja i prikupljanja stanica i/ili uvjeti metaboličke aktivacije. |
|
63. |
Postoji nekoliko kriterija za određivanje pozitivnog rezultata, kao što je na primjer povećanje povezano s koncentracijom ili statistički značajno povećanje broja stanica s mikronukleusima. Najprije se treba razmotriti biološka relevantnost rezultata. Ovisno o tome smatraju li se opažene vrijednosti unutar ili izvan povijesnog raspona kontrola, pružaju se smjernice kod ocjenjivanja biološke važnosti reakcije. Kod ocjenjivanja rezultata ispitivanja mogu se kao pomoć koristiti odgovarajuće statističke metode (65). Međutim, rezultati statističkog ispitivanja trebaju se ocijeniti s obzirom na odnos između doze i reakcije. Potrebno je, također, uzeti u obzir ponovljivost i povijesne podatke. |
|
64. |
Iako većina pokusa daje jasne pozitivne ili negativne rezultate, u nekim slučajevima dobiveni podaci onemogućavaju donošenje konačne ocjene o djelovanju ispitivane tvari. Te dvosmislene ili upitne reakcije se mogu javiti bez obzira na broj ponavljanja pokusa. |
|
65. |
Pozitivni rezultati analize mikronukleusa in vitro ukazuju da u kultiviranim stanicama sisavca ispitivana tvar uzrokuje lom ili gubitak kromosoma. Negativni rezultati ukazuju da u primijenjenim uvjetima ispitivana tvar ne uzrokuje lom i/ili gubitak ili udvostručenje kromosoma u kultiviranim stanicama sisavca. |
Izvješće o ispitivanju
|
66. |
Izvješće o ispitivanju uključuje najmanje sljedeće informacije, ako su relevantne za provođenje studije:
|
REFERENCE
|
1. |
Kirsch-Volders, M. (1997.), Towards a validation of the micronucleus test. Mutation Res., 392, str. 1-4. |
|
2. |
Parry, J.M. and Sors, A. (1993.), The detection and assessment of the aneugenic potential of environmental chemicals: the European Community aneuploidy project, Mutation Res., 287, str. 3-15. |
|
3. |
Fenech, M. and Morley, A.A. (1985.), Solutions to the kinetic problem in the micronucleus assay, Cytobios., 43, str. 233-246. |
|
4. |
Kirsch-Volders, M., Sofuni, T., Aardema, M., Albertini, S., Eastmond, D., Fenech, M., Ishidate, M. Jr, Lorge, E., Norppa, H., Surralles, J., von der Hude, W. and Wakata, A. (2000.), Report from the In Vitro Micronucleus Assay Working Group, Environ. Mol. Mutagen., 35, str. 167-172. |
|
5. |
Fenech, M. (2007.), Cytokinesis-block micronucleus cytome assay, Nature Protocols, 2(5), str. 1084-1104. |
|
6. |
Fenech, M. and Morley, A.A. (1986.), Cytokinesis-block micronucleus method in human lymphocytes: effect of in-vivo ageing and low dose X-irradiation, Mutation Res., 161, str. 193-198. |
|
7. |
Eastmond, D.A. and Tucker, J.D. (1989.), Identification of aneuploidy-inducing agents using cytokinesis-blocked human lymphocytes and an antikinetochore antibody, Environ. Mol. Mutagen., 13, str. 34-43. |
|
8. |
Eastmond, D.A. and Pinkel, D. (1990.), Detection of aneuploidy and aneuploidy-inducing agents in human lymphocytes using fluorescence in-situ hybridisation with chromosome-specific DNA probes, Mutation Res., 234, str. 9-20. |
|
9. |
Miller, B.M., Zitzelsberger, H.F., Weier, H.U. and Adler, I.D. (1991.), Classification of micronuclei in murine erythrocytes: immunofluorescent staining using CREST antibodies compared to in situ hybridization with biotinylated gamma satellite DNA, Mutagenesis, 6, str. 297-302. |
|
10. |
Farooqi, Z., Darroudi, F. and Natarajan, A.T. (1993.), The use of fluorescence in-situ hybridisation for the detection of aneugens in cytokinesis-blocked mouse splenocytes, Mutagenesis, 8, str. 329-334. |
|
11. |
Migliore, L., Bocciardi, R., Macri, C. and Lo Jacono, F. (1993.), Cytogenetic damage induced in human lymphocytes by four vanadium compounds and micronucleus analysis by fluorescence in situ hybridization with a centromeric probe, Mutation Res., 319, str. 205-213. |
|
12. |
Norppa, H., Renzi, L. and Lindholm, C. (1993.), Detection of whole chromosomes in micronuclei of cytokinesis-blocked human lymphocytes by antikinetochore staining and in situ hybridization, Mutagenesis, 8, str. 519-525. |
|
13. |
Eastmond, D.A, Rupa, D.S. and Hasegawa, L.S. (1994.), Detection of hyperdiploidy and chromosome breakage in interphase human lymphocytes following exposure to the benzene metabolite hydroquinone using multicolor fluorescence in situ hybridization with DNA probes, Mutation Res., 322, str. 9-20. |
|
14. |
Marshall, R.R., Murphy, M., Kirkland, D.J. and Bentley, K.S. (1996.), Fluorescence in situ hybridisation (FISH) with chromosome-specific centromeric probes: a sensitive method to detect aneuploidy, Mutation Res., 372, str. 233-245. |
|
15. |
Zijno, P., Leopardi, F., Marcon, R. and Crebelli, R. (1996.), Analysis of chromosome segregation by means of fluorescence in situ hybridization: application to cytokinesis-blocked human lymphocytes, Mutation Res., 372, str. 211-219. |
|
16. |
Kirsch-Volders, M., Sofuni, T., Aardema, M., Albertini, S., Eastmond, D., Fenech, M., Ishidate Jr., M., Lorge, E., Norppa, H., Surrallés, J., von der Hude, W. and Wakata, A. (2003.), Report from the in vitro micronucleus assay working group. Mutation Res., 540, str. 153-163. |
|
17. |
OECD (1997.), In Vitro Mammalian Chromosome Aberration Test, Test Guideline No 473, OECD Guidelines for Testing of Chemicals, OECD, Pariz. Dostupno na: [www.oecd.org/env/testguidelines] |
|
18. |
Lorge, E., Thybaud, V., Aardema, M.J., Oliver, J., Wakata, A., Lorenzon G. and Marzin, D. (2006.), SFTG International collaborative Study on in vitro micronucleus test. I. General conditions and overall conclusions of the study, Mutation Res., 607, str. 13-36. |
|
19. |
Clare, G., Lorenzon, G., Akhurst, L.C., Marzin, D., van Delft, J., Montero, R., Botta, A., Bertens, A., Cinelli, S., Thybaud, V. and Lorge, E. (2006.), SFTG International collaborative study on the in vitro micronucleus test. II. Using human lymphocytes, Mutation Res., 607, str. 37-60. |
|
20. |
Aardema, M.J., Snyder, R.D., Spicer, C., Divi, K., Morita, T., Mauthe, R.J., Gibson, D.P., Soelter, S., Curry, P.T., Thybaud, V., Lorenzon, G., Marzin, D. and Lorge, E. (2006.), SFTG International collaborative study on the in vitro micronucleus test, III. Using CHO cells, Mutation Res., 607, str. 61-87. |
|
21. |
Wakata, A., Matsuoka, A., Yamakage, K., Yoshida, J., Kubo, K., Kobayashi, K., Senjyu, N., Itoh, S., Miyajima, H., Hamada, S., Nishida, S., Araki, H., Yamamura, E., Matsui, A., Thybaud, V., Lorenzon, G., Marzin, D. and Lorge, E. (2006.), SFTG International collaborative study on the in vitro micronucleus test, IV. Using CHO/IU cells, Mutation Res., 607, str. 88-124. |
|
22. |
Oliver, J., Meunier, J.-R., Awogi, T., Elhajouji, A., Ouldelhkim, M.-C., Bichet, N., Thybaud, V., Lorenzon, G., Marzin, D. and Lorge, E. (2006.), SFTG International collaborative study on the in vitro micronucleus test, V. Using L5178Y cells, Mutation Res., 607, str. 125-152. |
|
23. |
Albertini, S., Miller, B., Chetelat, A.A. and Locher, F. (1997.), Detailed data on in vitro MNT and in vitro CA: industrial experience, Mutation Res., 392, str. 187-208. |
|
24. |
Miller, B., Albertini, S., Locher, F., Thybaud, V. and Lorge, E. (1997.), Comparative evaluation of the in vitro micronucleus test and the in vitro chromosome aberration test: industrial experience, Mutation Res., 392, str. 45-59. |
|
25. |
Miller, B., Potter-Locher, F., Seelbach, A., Stopper, H., Utesch, D. and Madle, S. (1998.), Evaluation of the in vitro micronucleus test as an alternative to the in vitro chromosomal aberration assay: position of the GUM Working Group on the in vitro micronucleus test. Gesellschaft fur Umwelt-Mutations-forschung, Mutation Res., 410, str. 81-116. |
|
26. |
Kalweit, S., Utesch, U., von der Hude, W. and Madle, S. (1999.), Chemically induced micronucleus formation in V79 cells — comparison of three different test approaches, Mutation Res. 439, str. 183-190. |
|
27. |
Kersten, B., Zhang, J., Brendler Schwaab, S.Y., Kasper, P. and Müller, L. (1999.), The application of the micronucleus test in Chinese hamster V79 cells to detect drug-induced photogenotoxicity, Mutation Res. 445, str. 55-71. |
|
28. |
von der Hude, W., Kalweit, S., Engelhardt, G., McKiernan, S., Kasper, P., Slacik-Erben, R., Miltenburger, H.G., Honarvar, N., Fahrig, R., Gorlitz, B., Albertini, S., Kirchner, S., Utesch, D., Potter-Locher, F., Stopper, H. and Madle, S. (2000.), In vitro micronucleus assay with Chinese hamster V79 cells — results of a collaborative study with in situ exposure to 26 chemical substances, Mutation Res., 468, str. 137-163. |
|
29. |
Garriott, M.L., Phelps, J.B. and Hoffman, W.P. (2002.), A protocol for the in vitro micronucleus test, I. Contributions to the development of a protocol suitable for regulatory submissions from an examination of 16 chemicals with different mechanisms of action and different levels of activity, Mutation Res., 517, str. 123-134. |
|
30. |
Matsushima, T., Hayashi, M., Matsuoka, A., Ishidate, M. Jr., Miura, K.F., Shimizu, H., Suzuki, Y., Morimoto, K., Ogura, H., Mure, K., Koshi, K. and Sofuni, T. (1999.), Validation study of the in vitro micronucleus test in a Chinese hamster lung cell line (CHL/IU), Mutagenesis, 14, str. 569-580. |
|
31. |
Elhajouji, A., and Lorge, E. (2006.), Special Issue: SFTG International collaborative study on in vitro micronucleus test, Mutation Res., 607, str. 1-152. |
|
32. |
ECVAM (2006.), Statement by the European Centre for the Validation of Alternative Methods (ECVAM) Scientific Advisory Committee (ESAC) on the scientific validity of the in vitro micronucleus test as an alternative to the in vitro chromosome aberration assay for genotoxicity testing. ESAC 25th meeting, 16- 17 November, 2006, Dostupno na: [http://ecvam.jrc.it/index.htm] |
|
33. |
ESAC (2006.), ECVAM Scientific Advisory Committee (ESAC) Peer Review, Retrospective Validation of the In Vitro Micronucleus Test, Summary and Conclusions of the Peer Review Panel, Dostupno na: [http://ecvam.jrc.it/index.htm] |
|
34. |
Corvi, R., Albertini, S., Hartung, T., Hoffmann, S., Maurici, D., Pfuhler, S, van Benthem, J., Vanparys P. (2008.), ECVAM Retrospective Validation of in vitro Micronucleus Test (MNT), Mutagenesis, 23, str. 271-283. |
|
35. |
Zhang, L.S., Honma, M., Hayashi, M., Suzuki, T., Matsuoka, A. and Sofuni, T. (1995.), A comparative study of TK6 human lymphoblastoid and L5178Y mouse lymphoma cell lines in the in vitro micronucleus test, Mutation Res., 347, str. 105-115. |
|
36. |
Ehrlich, V., Darroudi, F., Uhl, M., Steinkellner, S., Zsivkovits, M. and Knasmeuller, S. (2002.), Fumonisin B1 is genotoxic in human derived hepatoma (HepG2) cells, Mutagenesis, 17, str. 257-260. |
|
37. |
Knasmüller, S., Mersch-Sundermann, V., Kevekordes, S., Darroudi, F., Huber, W.W., Hoelzl, C., Bichler, J. and Majer, B.J. (2004.), Use of human-derived liver cell lines for the detection of environmental and dietary genotoxicants; current state of knowledge, Toxicol., 198, str. 315-328. |
|
38. |
Gibson, D.P., Brauninger, R., Shaffi, H.S., Kerckaert, G.A., LeBoeuf, R.A., Isfort, R.J. and Aardema, M.J. (1997.), Induction of micronuclei in Syrian hamster embryo cells: comparison to results in the SHE cell transformation assay for National Toxicology Program test chemicals, Mutation Res., 392, str. 61-70. |
|
39. |
Scott, D., Galloway, S.M., Marshall, R.R., Ishidate, M. Jr., Brusick, D., Ashby, J. and Myhr, B.C. (1991.), International Commission for Protection Against Environmental Mutagens and Carcinogens, Genotoxicity under extreme culture conditions. A report from ICPEMC Task Group 9, Mutation Res., 257, str. 147-205. |
|
40. |
Morita, T., Nagaki, T., Fukuda, I. and Okumura, K. (1992.), Clastogenicity of low pH to various cultured mammalian cells, Mutation Res., 268, str. 297-305. |
|
41. |
Brusick, D. (1986.), Genotoxic effects in cultured mammalian cells produced by low pH treatment conditions and increased ion concentrations, Environ. Mutagen., 8, str. 789-886. |
|
42. |
Fenech, M. and Morley, A.A. (1985.), Measurement of micronuclei in lymphocytes, Mutation Res., 147, str. 29-36. |
|
43. |
Fenech, M. (1997.), The advantages and disadvantages of cytokinesis-blood micronucleus method, Mutation Res., 392, str. 11-18. |
|
44. |
Bonassi, S., Fenech, M., Lando, C., Lin, Y.P., Ceppi, M., Chang, W.P., Holland, N., Kirsch-Volders, M., Zeiger, E., Ban, S., Barale, R., Bigatti, M.P., Bolognesi, C., Jia, C., Di Giorgio, M., Ferguson, L.R., Fucic, A., Lima, O.G., Hrelia, P., Krishnaja, A.P., Lee, T.K., Migliore, L., Mikhalevich, L., Mirkova, E., Mosesso, P., Muller, W.U., Odagiri, Y., Scarffi, M.R., Szabova, E., Vorobtsova, I., Vral, A. and Zijno, A. (2001.), HUman MicroNucleus Project: international database comparison for results with the cytokinesis-block micronucleus assay in human lymphocytes, I. Effect of laboratory protocol, scoring criteria and host factors on the frequency of micronuclei, Environ. Mol. Mutagen. 37, str. 31-45. |
|
45. |
Maron, D.M. and Ames, B.N. (1983.), Revised methods for the Salmonella mutagenicity test, Mutation Res., 113, str. 173-215. |
|
46. |
Ong, T.-m., Mukhtar, M., Wolf, C.R. and Zeiger, E. (1980.), Differential effects of cytochrome P450-inducers on promutagen activation capabilities and enzymatic activities of S-9 from rat liver, J. Environ. Pathol. Toxicol., 4, str. 55-65. |
|
47. |
Elliott, B.M., Combes, R.D., Elcombe, C.R., Gatehouse, D.G., Gibson, G.G., Mackay, J.M. and Wolf, R.C. (1992.), Alternatives to Aroclor 1254-induced S9 in in-vitro genotoxicity assays. Mutagenesis, 7, str. 175-177. |
|
48. |
Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T. (1976.), A safe substitute for Polychlorinated Biphenyls as an Inducer of Metabolic Activation Systems, In: de Serres, F.J., Fouts, J. R., Bend, J.R. and Philpot, R.M. (eds), In Vitro Metabolic Activation in Mutagenesis Testing, Elsevier, North-Holland, str. 85-88. |
|
49. |
Johnson, T.E., Umbenhauer, D.R. and Galloway, S.M. (1996.), Human liver S-9 metabolic activation: proficiency in cytogenetic assays and comparison with phenobarbital/beta-naphthoflavone or Aroclor 1254 induced rat S-9, Environ. Mol. Mutagen., 28, str. 51-59. |
|
50. |
UNEP (2001.), Stockholm Convention on Persistent Organic Pollutants, United Nations Environment Programme (UNEP). Dostupno na: [http://www.pops.int/] |
|
51. |
Doherty, A.T., Ellard, S., Parry, E.M. and Parry, J.M. (1996.), An investigation into the activation and deactivation of chlorinated hydrocarbons to genotoxins in metabolically competent human cells, Mutagenesis, 11, str. 247-274. |
|
52. |
Krahn, D.F., Barsky, F.C. and McCooey, K.T. (1982.), CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids, In: Tice, R.R., Costa, D.L. and Schaich, K.M. (eds), Genotoxic Effects of Airborne Agents. New York, Plenum, str. 91-103. |
|
53. |
Zamora, P.O., Benson, J.M., Li, A.P. and Brooks, A.L. (1983.), Evaluation of an exposure system using cells grown on collagen gels for detecting highly volatile mutagens in the CHO/HGPRT mutation assay, Environ. Mutagenesis 5, str. 795-801. |
|
54. |
Fenech, M. (1993.), The cytokinesis-block micronucleus technique: a detailed description of the method and its application to genotoxicity studies in human populations, Mutation Res., 285, str. 35-44. |
|
55. |
Phelps, J.B., Garriott, M.L., and Hoffman, W.P. (2002.), A protocol for the in vitro micronucleus test. II. Contributions to the validation of a protocol suitable for regulatory submissions from an examination of 10 chemicals with different mechanisms of action and different levels of activity, Mutation Res., 521, str. 103-112. |
|
56. |
Kirsch-Volders, M., Sofuni, T., Aardema, M., Albertini, S., Eastmond, D., Fenech, M., Ishidate, M. Jr., Kirchner, S., Lorge, E., Morita, T., Norppa, H., Surralles, J., Vanhauwaert, A. and Wakata, A. (2004.), Corrigendum to ‚Report from the in vitro micronucleus assay working group’, Mutation Res., 564, str. 97-100. |
|
57. |
Pincu, M., Bass, D. and Norman, A. (1984.), An improved micronuclear assay in lymphocytes, Mutation Res., 139, str. 61-65. |
|
58. |
Lorge, E., Hayashi, M., Albertini, S. and Kirkland, D. (2008.), Comparison of different methods for an accurate assessment of cytotoxicity in the in vitro micronucleus test. I. Theoretical aspects, Mutation Res., 655, str. 1-3. |
|
59. |
Surralles, J., Xamena, N., Creus, A., Catalan, J., Norppa, H. and Marcos, R. (1995.), Induction of micronuclei by five pyrethroid insecticides in whole-blood and isolated human lymphocyte cultures, Mutation Res., 341, str. 169-184. |
|
60. |
Galloway, S. (2000.), Cytotoxicity and chromosome aberrations in vitro: Experience in industry and the case for an upper limit on toxicity in the aberration assay, Environ. Molec. Mutagenesis 35, str. 191-201. |
|
61. |
Hayashi, M., Sofuni, T., and Ishidate, M. Jr. (1983.), An Application of Acridine Orange Fluorescent Staining to the Micronucleus Test, Mutation Res., 120, str. 241-247. |
|
62. |
MacGregor, J. T., Wehr, C. M., and Langlois, R. G. (1983.), A Simple Fluorescent Staining Procedure for Micronuclei and RNA in Erythrocytes Using Hoechst 33258 and Pyronin Y, Mutation Res., 120, str. 269-275. |
|
63. |
Hayashi, M., Sofuni, T. and Ishidate, M. Jr. (1983.), An application of acridine orange fluorescent staining to the micronucleus test, Mutation Res., 120, str. 241-247. |
|
64. |
Fenech, M., Chang, W.P., Kirsch-Volders, M., Holland, N., Bonassi, S. and Zeiger, E. (2003.), HUMN project: detailed description of the scoring criteria for the cytokinesis-block micronucleus assay using isolated human lymphocyte cultures, Mutation Res., 534, str. 65-75. |
|
65. |
Hoffman, W.P., Garriott, M.L. and Lee, C. (2003.), In vitro micronucleus test, In: Encyclopedia of Biopharmaceutical Statistics, Second edition. S. Chow (ed.), Marcel Dekker, Inc. New York, NY, str. 463-467. |
|
66. |
Regulation (EC) No 850/2004 of the European Parliament and of the Council of 29 April 2004 on persistent organic pollutants and amending Directive 79/117/EEZ, SL L 229, 30.4.2004., str. 5. |
Dodatak 1.
Definicije
Aneugen: svaka tvar ili postupak koji u interakciji s elementima mitotičkog i meiotičkog ciklusa diobe stanice uzrokuje aneuploidiju u stanicama ili organizmima.
Aneuploidija: odstupanje od normalnog diploidnog (ili haploidnog) broja kromosoma u jednom kromosomu ili više od jednog kromosoma, ali ne u cijeloj skupini ili skupinama kromosoma (poliploidija).
Apoptoza: programirana smrt stanice koju obilježava niz koraka što vode do razgradnje stanica u čestice vezane na membranu, koje se potom odstranjuju fagocitozom ili rasipanjem.
Proliferacija stanica: povećanje broja stanica kao posljedica mitotičke diobe stanice.
Centromer: DNK sekvenca kromosoma gdje su spojena oba kromatida i na kojoj su na obje strane pričvršćena oba kinetohora.
Klastogen: svaka tvar ili postupak koji uzrokuje strukturne kromosomske aberacije u populacijama stanica ili organizama.
Citokineza: postupak diobe stanice koji slijedi odmah nakon mitoze i kojim nastaju dvije stanice kćeri od kojih svaka sadrži jednu jezgru.
Indeks proliferacije s blokiranom citokinezom (CBPI): udio stanica u fazi druge diobe u tretiranoj populaciji u odnosu na netretiranu kontrolu (vidjeti Dodatak 2. za formulu).
Citostaza: sprečavanje rasta stanica (vidjeti Dodatak 2. za formulu).
Citotoksičnost: štetni učinci na staničnu strukturu ili funkciju koji na kraju uzrokuju smrt stanice.
Genotoksičnost: opći izraz koji obuhvaća sve vrste oštećenja DNA ili kromosoma uključujući lomove, preuređivanje adukata, mutacije, aberacije kromosoma i aneuploidiju. Sve vrste genotoksičnih učinaka ne dovode do mutacija ili trajnog oštećenja kromosoma.
Interfazne stanice: stanice koje nisu u fazi mitoze.
Kinetohor: proteinska struktura koja nastaje na centromeru kromosoma na koju se tijekom diobe stanice prihvaćaju niti vretena, čime se omogućuje pravilno kretanje kromosoma kćeri prema polovima stanica kćeri.
Mikronukleusi: male jezgre, dodatne i odvojene od glavne stanične jezgre, koje nastanu tijekom telofaze mitoze ili mejoze iz zaostalih fragmenata kromosoma ili cijelih kromosoma.
Mitoza: dioba stanične jezgre koja je obično podijeljena na profazu, prometafazu, metafazu, anafazu i telofazu.
Mitotički indeks: omjer između stanica u metafazi i ukupnog broja stanica opaženih u populaciji stanica; pokazatelj stupnja proliferacije stanice te populacije.
Mutagen: uzrokuje nasljednu promjenu sekvence osnovnih parova DNA u genima ili strukture kromosoma (kromosomske aberacije).
Nerazdvajanje: nesposobnost para kromatida da se razdvoji i pravilno odvoji u razvijajuće stanice kćeri, zbog čega nastaju stanice kćeri s nenormalnim brojem kromosoma.
Poliploidija: brojčane kromosomske aberacije u stanicama ili organizmima koje utječu na cijeli set kromosoma, za razliku od pojedinačnih kromosoma ili više kromosoma kod aneuploidije.
Indeks proliferacije (PI): metoda mjerenja citotoksičnosti kada se ne koristi citohalazin B (vidjeti Dodatak 2. za formulu).
Relativno povećanje broja stanica (RICC): metoda mjerenja citotoksičnosti kada se ne koristi citohalazin B (vidjeti Dodatak 2. za formulu).
Relativno udvostručenje populacije (RPD): metoda mjerenja citotoksičnosti kada se ne koristi citohalazin B (vidjeti Dodatak 2. za formulu).
Indeks ponavljanja (RI): udio dovršenih ciklusa stanične diobe u tretiranoj kulturi u odnosu na netretiranu kulturu, tijekom razdoblja izloženosti i obnavljanja (vidjeti Dodatak 2. za formulu).
Ispitivana kemikalija (navodi se i kao ispitivana tvar): svaka tvar ili smjesa koja se ispituje ovom ispitnom metodom.
Dodatak 2.
Formule za ocjenjivanje citotoksičnosti
|
1. |
Kod uporabe citohalazina B ocjena citotoksičnosti se temelji na indeksu proliferacije s blokiranom citokinezom (CBPI) ili indeksu ponavljanja (RI) (16) (58). CBPI pokazuje prosječni broj staničnih ciklusa po stanici tijekom razdoblja izloženosti citohalazinu B i može se koristiti za izračun proliferacije stanica. RI pokazuje relativni broj jezgri u tretiranim kulturama u usporedbi s kontrolnim kulturama i može se koristiti za izračun % citostaze: % citostaze = 100 – 100{(CBPIT – 1) ÷ (CBPIC – 1)} i:
pri čemu:
Stoga, CBPI koji je jednak 1 (sve stanice su mononuklearne) odgovara 100 % citostaze. Citostaza = 100 – RI
|
|
2. |
Stoga, RI od 53 % znači da u usporedbi s brojem stanica koje su se podijelile u binuklearne i multinuklearne stanice u kontrolnoj kulturi, samo 53 % od tog broja stanica podijelilo se u tretiranoj kulturi, tj. 47 % citostaze. |
|
3. |
Kada se ne koristi citohalazin B, preporučuje se ocjena citotoksičnosti na temelju relativnog povećanja broja stanica (RICC) ili relativnog udvostručenja populacije (RPD) (58), budući da obje metode uzimaju u obzir omjer stanične populacije koja se podijelila.
pri čemu: udvostručenje populacije = (log (broj stanica nakon tretiranja ÷ početni broj stanica)) ÷ log 2 |
|
4. |
Stoga, RICC ili RPD od 53 % pokazuje 47 % citotoksičnosti/citostaze. |
|
5. |
Uporabom indeksa proliferacije (PI) citotoksičnost se može ocijeniti brojanjem klonova koji se sastoje od 1 stanice (cl1), 2 stanice (cl2), 3 do 4 stanice (cl4) i 5 do 8 stanica (cl8)
|
|
6. |
Indeks proliferacije se koristi kao značajan i pouzdan parametar citotoksičnosti također i za stanične linije kultivirane in situ bez citohalazina B (25) (26) (27) (28). |
Dodatak 3.
Referentne kemikalije preporučene za ocjenjivanje učinkovitosti (16)
|
Kategorija |
Kemikalija |
Br. CAS |
Br. EZ |
| 1. Klastogeni, aktivni bez metaboličke aktivacije |
|||
|
|
Citozin arabinozid |
147-94-4 |
205-705-9 |
|
|
Mitomicin C |
50-07-7 |
200-008-6 |
| 2. Klastogeni koji zahtijevaju metaboličku aktivaciju |
|||
|
|
Benzo(a)piren |
50-32-8 |
200-028-5 |
|
|
Ciklofosfamid |
50-18-0 |
200-015-4 |
| 3. Aneugeni |
|||
|
|
Kolhicin |
64-86-8 |
200-598-5 |
|
|
Vinblastin |
143-67-9 |
205-606-0 |
| 4. Negativne tvari |
|||
|
|
Di(2-etilhexil)ftalat |
117-81-7 |
204-211-0 |
|
|
Nalidiksinska kiselina |
389-08-2 |
206-864-7 |
|
|
Piren |
129-00-0 |
204-927-3 |
|
|
Natrijev klorid |
7647-14-5 |
231-598-3 |
B.50. PREOSJETLJIVOST KOŽE: ANALIZA LOKALNIH LIMFNIH ČVOROVA: DA
UVOD
|
1. |
Smjernice OECD-a za ispitivanje kemijskih tvari i ispitne metode EU-a periodički se preispituju u svjetlu znanstvenog napretka, promjene regulatornih potreba i razmatranja o dobrobiti životinja. Prva ispitna metoda (TM) (B.42) za utvrđivanje preosjetljivosti kože kod miševa, analiza lokalnih limfnih čvorova (LLNA; Smjernica za ispitivanje OECD-a 429) je revidirana (1). Objavljeni su detalji validacije metode LLNA i pregled povezanog djelovanja (2) (3) (4) (5) (6) (7) (8) (9). Kod LLNA se za mjerenje proliferacije limfocita uporablja radioizotopni timidin ili jod te je, stoga, uporaba ove analize ograničena ako je nabava, uporaba ili odlaganje radioaktivnosti problematična. LLNA: DA (razvio ju je Daicel Chemical Industries, Ltd) je neradioaktivna inačica LLNA, koja količinski određuje sadržaj adenozin-trifosfata (ATP) pomoću bioluminiscencije kao pokazatelja proliferacije limfocita. Ispitnu metodu LNNA: DA je validirao i pregledao međunarodni odbor za stručnu reviziju koji ju je preporučio kao korisnu za utvrđivanje kemikalija koje izazivaju preosjetljivost i kemikalija koje ne izazivaju preosjetljivost, uz određena ograničenja (10) (11) (12) (13). Svrha ove ispitne metode je procjena potencijala kemikalija da senzibiliziraju kožu kod životinja (tvari i smjese). Poglavlje B.6. ovog Priloga i Smjernica za ispitivanje OECD-a 406 koriste testove na zamorcima, konkretnije maksimizacijski test sa zamorcima i Buehlerov test (13). Metoda LLNA ima određene prednosti u odnosu na B.6 i Smjernicu za ispitivanje OECD-a 406 (14). Metoda LLNA (poglavlje B.42 ovog Priloga; Smjernica za ispitivanje OECD-a 429) i dvije neradioaktivne inačice, analiza LLNA: DA (poglavlje B.50 ovog Priloga; Smjernica za ispitivanje OECD-a 442 A) i LLNA: BrdU-ELISA (poglavlje B.51 ovog Priloga; Smjernica za ispitivanje OECD-a 442 B), sve imaju prednosti u odnosu na testove na zamorcima iz metode B.6. i Smjernice za ispitivanje OECD-a 406 (14) u smislu manje i usavršene uporabe životinja. |
|
2. |
Slično kao i metodom LLNA, LLNA: DA proučava indukcijsku fazu senzibilizacije kože i pruža kvantitativne podatke pogodne za procjenjivanje reakcije na dozu. Pored toga, sposobnost otkrivanja senzibilizatora kože bez uporabe radioaktivne oznake za DNA isključuje mogućnost profesionalne izloženosti radioaktivnosti i pitanja odlaganja otpada. To zauzvrat može omogućiti povećanu uporabu miševa za otkrivanje senzibilizatora kože, čime se može dodatno smanjiti uporaba zamoraca za ispitivanje potencijala preosjetljivosti kože (tj. B.6; Smjernica za ispitivanje OECD-a 406) (14). |
DEFINICIJE
|
3. |
Korištene definicije navedene su u Dodatku 1. |
POČETNA RAZMATRANJA I OGRANIČENJA
|
4. |
Metoda LLNA: DA je inačica metode LLNA za utvrđivanje kemikalija koje imaju potencijal za uzrokovanje senzibilizacije kože uz posebna ograničenja. To nužno ne znači da u svim slučajevima metodu LLNA: DA treba primijeniti umjesto metode LLNA ili testa sa zamorcima (tj. B.6; Smjernica za ispitivanje OECD-a 406) (14), već da je pokus jednakovrijedan i da se može koristiti kao alternativa kod koje za pozitivne i negativne rezultate obično nije potrebna daljnja potvrda (10) (11). Ispitni laboratoriji trebaju uzeti u obzir sve dostupne podatke o ispitivanoj tvari prije provođenja studije. Spomenuti podaci uključuju identitet i kemijsku strukturu ispitivane tvari, njezina fizikalno-kemijska svojstva, rezultate svih in vitro ili in vivo ispitivanja toksičnosti i toksikološke podatke o strukturno povezanim kemikalijama. Ti se podaci uzimaju u obzir radi utvrđivanja prikladnosti metode LLNA: DA za odnosnu tvar (s obzirom na nekompatibilnost određenih vrsta kemikalija s metodom LLNA: DA - vidjeti stavak 5.) i pomoći kod odabira doze. |
|
5. |
Metoda LLNA: DA je metoda in vivo, pa kao takva ne isključuje upotrebu životinja u procjeni kontaktne senzibilizacijske aktivnosti. Međutim, ona ima potencijala smanjiti uporabu životinja u tu svrhu u usporedbi s testovima na zamorcima (B.6; Smjernica za ispitivanje OECD-a 406) (14). Nadalje, metoda LLNA: DA nudi znatno finiji način upotrebe životinja (manje boli i patnje) u ispitivanju kontaktne senzibilizacije, budući da za razliku od B.6 i Smjernice OECD-a 406 nije potrebno izazivati provokacijski inducirane hipersenzibilizirane dermalne reakcije. Unatoč prednostima metode LLNA: DA u odnosu na B.6 i Smjernicu OECD-a 406, postoje neka ograničenja zbog kojih može biti potrebno primijeniti B.6 ili Smjernicu OECD-a 406 (13) (npr. ispitivanje određenih metala, lažni pozitivni nalazi kod nekih sredstava s nadražujućim djelovanjem na kožu (kao što su neke površinski aktivne tvari) (6) (1. i Poglavlje B.42 iz ovog Priloga), topivost ispitivane tvari). Povrh toga, ispitivanja na zamorcima mogu biti potrebna za kemijske razrede ili tvari koje sadrže funkcionalne skupine za koje je dokazano da djeluju kao potencijalni zbunjujući faktori (16) (tj. B.6; Smjernica za ispitivanje OECD-a 406 (14)). Preporučuje se da se ograničenja koja su utvrđena za metodu LLNA (1. i Poglavlje B.42 iz ovog Priloga) primjenjuju i na metodu LLNA: DA (10). Pored toga, uporaba metode LLNA: DA možda nije primjerena za ispitivanje tvari koje utječu na razine adenozin-trifosfata (ATP) (tj. tvari koje djeluju kao inhibitori ATP-a) ili tvari koje utječu na precizno mjerenje ATP-a u stanicama (npr. prisutnost enzima koji razgrađuju ATP, prisutnost izvanstaničnog ATP-a u limfnom čvoru). Pored takvih utvrđenih ograničenja metoda LLNA: DA se može primjenjivati za ispitivanje bilo koje tvari, osim ako ne postoji mogućnost da bi njezina svojstva mogla utjecati na točnost metode LLNA: DA. Pored toga, potrebno je uzeti u obzir mogućnost graničnih pozitivnih rezultata kada se dobiju vrijednosti stimulacijskog indeksa (SI) između 1,8 i 2,5 (vidjeti stavke 31–32.). To se temelji na bazi podataka za validaciju s 44 tvari s indeksom stimulacije ≥ 1,8 (vidjeti stavak 6.), za koje su metodom LLNA: DA pravilno određena sva 32 senzibilizatora pri LLNA, ali su nepravilno određene tri od 12 tvari koje pri LLNA ne izazivaju preosjetljivost s vrijednostima stimulacijskog indeksa između 1,8 i 2,5 (tj. granično pozitivna vrijednost) (10). Međutim, budući da je za određivanje vrijednosti stimulacijskog indeksa i izračun predvidljivih svojstava ispitivanja uporabljen isti set podataka, navedeni rezultati mogu precijeniti stvarna predvidljiva svojstva. |
NAČELO ISPITIVANJA
|
6. |
Metoda LLNA: DA počiva na temeljnom načelu prema kojem senzibilizatori induciraju proliferaciju limfocita u limfnom čvoru čime dolazi do drenaže mjesta kemijske primjene. Ta je proliferacija proporcionalna primijenjenoj dozi i potencijalu primijenjenog alergena te predstavlja jednostavan način za dobivanje kvantitativno izmjerene senzibilizacije. Proliferacija se mjeri usporedbom prosječne proliferacije svake ispitivane skupine s prosječnom proliferacijom u kontrolama tretiranim nosačem. Određuje se omjer prosječne proliferacije u svakoj tretiranoj skupini i proliferacije u kontrolama s nosačem, nazvan indeks stimulacije, koji mora biti ≥ 1,8 da bi se ispitivana tvar mogla dalje vrednovati kao potencijalni senzibilizator kože. Ovdje opisane metode temelje se na mjerenju sadržaja ATP-a bioluminiscencijom (za koju je poznato da je povezana s brojem živućih stanica) (17), kako bi se pokazao povećani broj stanica koje proliferiraju u aurikularnim limfnim čvorovima koji uzrokuju drenažu (18) (19). Metoda bioluminiscencije koristi enzim luciferaze za kataliziranje nastanka svjetlosti iz ATP-a i luciferin u skladu sa sljedećom reakcijom:
ATP + luciferină + O
2
Emitirani intenzitet svjetlosti je linearno povezan s koncentracijom ATP-a i mjeri se luminometrom. Analiza reakcije između luciferina i luciferaze je osjetljiva metoda za određivanje ATP-a koji se koristi u širokom opsegu primjena (20). |
OPIS ANALIZE
Odabir životinjskih vrsta
|
7. |
Za ovaj test odabrana vrsta su miševi. Validacijske studije za LLNA: DA provedene su isključivo sa sojem CBA/J, koji se stoga smatra preporučenim sojem (12) (13). Koriste se mlade odrasle ženke koje još nisu imale potomstvo i nisu skotne. Na početku studije životinje trebaju biti stare između osam do 12 tjedana, a odstupanje mase životinja treba biti minimalno i ne smije prelaziti 20 % srednje mase. Drugi sojevi i mužjaci mogu se koristiti ako postoji dovoljno podataka da u reakciji prema metodi LLNA: DA nema značajnih razlika specifičnih za soj i/ili spol. |
Uvjeti smještaja i prehrane
|
8. |
Miševi trebaju biti smješteni u skupinama (21), osim ako se ne dokaže prikladna znanstvena utemeljenost za pojedinačni smještaj. Temperatura u prostoriji u kojoj se drže pokusne životinje treba biti 22 °C (± 3 °C). Iako bi relativna vlaga trebala biti najmanje 30 %, a poželjno je da ne prijeđe 70 % osim tijekom čišćenja prostorije, cilj bi trebao biti 50–60 %. Svjetlost treba biti umjetna, s tim da je redoslijed 12 sati svjetla, 12 sati tame. Za hranjenje se može koristiti konvencionalna laboratorijska hrana s neograničenom količinom vode za piće. |
Priprema životinja
|
9. |
Životinje se nasumice biraju, jednoznačno identificiraju (ali ne bilo kojim oblikom označavanja ušiju) i drže u kavezima najmanje pet dana prije početka doziranja kako bi se aklimatizirale na laboratorijske uvjete. Prije početka tretiranja sve životinje treba pregledati kako bi se potvrdilo da nemaju zapaženih lezija kože. |
Priprema ispitnih otopina
|
10. |
Tvrde kemikalije se prije primjene na uho miša trebaju rastopiti ili suspendirati u otapalima/nosačima i prema potrebi razrijediti. Tekuće kemikalije se mogu nanijeti čiste ili razrijeđene prije doziranja. Netopive kemikalije, koje se obično koriste u medicinskim uređajima, trebaju se podvrgnuti postupku pretjerane ekstrakcije u odgovarajućem otapalu kako bi se prije primjene na uho miša otkrili svi ekstraktibilni sastojci za ispitivanje. Ispitivane tvari se pripremaju svakodnevno osim ako podaci o stabilnosti ne dokažu prihvatljivost njihova skladištenja. |
Provjera pouzdanosti
|
11. |
Kemikalije pozitivne kontrole koriste se kako bi se dokazalo da se pokus provodi na odgovarajući način tako što reagiraju prikladnom i ponovljivom preosjetljivošću na ispitivanu tvar koja uzrokuje preosjetljivost, čiji je stupanj reakcije točno utvrđen. Preporučuje se uvođenje paralelne pozitivne kontrole radi dokazivanja sposobnosti laboratorija da uspješno izvede svaku analizu i da se omogući ocjenjivanje ponovljivosti i usporedivosti unutar jednog ili između više laboratorija. Određena regulatorna tijela zahtijevaju pozitivnu kontrolu za svaku studiju te se, stoga, korisnici pozivaju da prije izvođenja metode LLNA: DA kontaktiraju relevantna tijela. Sukladno tomu, potiče se rutinska uporaba paralelne pozitivne kontrole kako bi se izbjeglo dodatno ispitivanje na životinjama radi ispunjavanja zahtjeva koji se mogu javiti zbog periodičke uporabe paralelne kontrole (vidjeti stavak 12.). Pozitivna kontrola treba proizvesti pozitivnu reakciju na metodu LLNA: DA kod razine izlaganja za koju se očekuje da će dati porast indeksa stimulacije (SI) ≥ 1,8 u odnosu na negativnu kontrolnu skupinu. Dozu pozitivne kontrole treba odabrati tako da ne uzrokuje prekomjernu nadraženost kože ili sustavnu toksičnost i da je indukcija ponovljiva, ali ne prekomjerna (tj. SI > 10 se smatra pretjeranim). Poželjne pozitivne kontrole su 25 %-tni heksilcinamaldehid (CAS br. 101-86-0) i 25 %-tni eugenol (CAS br. 97-53-0) u acetonu: maslinovo ulje (4:1; v/v). Moguće su okolnosti u kojima se, uz odgovarajuće obrazloženje, mogu koristiti druge pozitivne kontrole koje ispunjavaju gore navedene kriterije. |
|
12. |
Iako se preporučuje uvođenje paralelne skupine pozitivne kontrole, u određenim situacijama periodičko ispitivanje (tj. u intervalima ≤ 6 mjeseci) pozitivne kontrole može biti prikladno za laboratorije koji redovito izvode metodu LLNA: DA (tj. najmanje jednom mjesečno) i imaju povijesnu bazu podataka pozitivne kontrole koja dokazuje sposobnost laboratorija da dobiva ponovljive i točne rezultate pozitivnih kontrola. Odgovarajuća osposobljenost za metodu LLNA: DA može se uspješno dokazati dobivanjem dosljednih pozitivnih rezultata pozitivne kontrole u najmanje deset neovisnih ispitivanja provedenih u razumnom vremenskom razdoblju (manje od jedne godine). |
|
13. |
Paralelnu skupinu pozitivne kontrole potrebno je uvesti svaki put kada dođe do proceduralne promjene metode LLNA: DA (zamjena stručnog osoblja, promjena materijala i/ili reagensa ispitne metode, promjena opreme, promjena izvora ispitivanih životinja) i te se promjene moraju navesti u laboratorijskim izvješćima. Potrebno je uzeti u obzir učinak tih promjena na primjerenost prethodno uspostavljene baze podataka prilikom utvrđivanja potrebe za uspostavom nove baze povijesnih podataka radi dokazivanja dosljednosti rezultata pozitivne kontrole. |
|
14. |
Istraživači trebaju biti svjesni da odluka o provođenju periodičke umjesto paralelne studije pozitivne kontrole utječe na prikladnost i prihvatljivost negativnih rezultata dobivenih bez paralelne pozitivne kontrole u razdoblju između svake periodičke pozitivne kontrole. Na primjer, ako se periodičkom pozitivnom kontrolom dobije lažni negativni rezultat, mogu se dovesti u pitanje negativni rezultati ispitivane tvari dobiveni u razdoblju između posljednje prihvatljive periodičke pozitivne kontrolne studije i neprihvatljive periodičke pozitivne kontrolne studije. Kod odlučivanja o uvođenju paralelne pozitivne kontrole ili provođenju samo periodičkih pozitivnih kontrola potrebno je pažljivo uzeti u obzir posljedice tih rezultata. Također je potrebno razmotriti mogućnost uporabe manjeg broja životinja u skupini paralelne pozitivne kontrole ako je to opravdano sa znanstvenog stajališta i ako laboratorij na temelju svojih posebnih povijesnih podataka dokaže da se može koristiti manje miševa (22). |
|
15. |
Iako pozitivnu kontrolnu tvar treba ispitati u nosaču za koji je poznato da izaziva dosljednu reakciju (npr. aceton; maslinovo ulje; 4:1, v/v), u nekim regulatornim situacijama bit će potrebno i ispitivanje u nestandardnom nosaču (klinički/kemijski relevantnoj formulaciji) (23). Ako se paralelna pozitivna kontrola ispituje u drugačijem nosaču od ispitivane tvari, potrebno je uključiti posebnu kontrolu s nosačem za paralelnu pozitivnu kontrolu. |
|
16. |
U slučajevima kada se ocjenjuju tvari iz posebnog kemijskog razreda ili raspona reakcija, referentne tvari mogu također biti korisne za dokazivanje ispravnosti ispitne metode za otkrivanje potencijala preosjetljivosti kože tih vrsta ispitivanih tvari. Prikladne referentne tvari moraju imati sljedeće značajke:
|
ISPITNI POSTUPAK
Broj životinja i visine doze
|
17. |
Po jednoj dozirnoj skupini koriste se najmanje četiri životinje, s najmanje tri koncentracije ispitivane tvari, plus paralelna negativna kontrolna skupina tretirana samo nosačem za ispitivanu tvar i jedna pozitivna kontrola (paralelna ili nedavno provedena, na temelju laboratorijske politike uzimajući u obzir stavke 11.-15.). Potrebno je razmotriti ispitivanje višestrukih doza pozitivne kontrole, posebno ako se ispitivanje pozitivne kontrole izvodi s prekidima. Osim tretiranja ispitivanom tvari, sa životinjama u kontrolnim skupinama treba postupati i tretirati ih jednako kao i životinje u tretiranim skupinama. |
|
18. |
Odabir doze i nosača treba se temeljiti na preporukama navedenim u referencama (2) i (24). Uzastopne doze se obično odabiru iz odgovarajućih serija koncentracija kao što su 100 %, 50 %, 25 %, 10 %, 5 %, 2,5 %, 1 %, 0,5 % itd. Odabir uporabljene serije koncentracija mora biti popraćen odgovarajućim znanstvenim obrazloženjem. Kod odabira tri uzastopne koncentracije treba uzeti u obzir sve postojeće toksikološke podatke (o akutnoj toksičnosti i nadraživanju kože) te strukturne i fizikalno-kemijske podatke o odnosnoj ispitivanoj tvari (i/ili strukturno povezanim tvarima), ako su dostupne, kako bi se najvišom koncentracijom maksimaliziralo izlaganje, ali istodobno izbjegla sustavna toksičnost i/ili prekomjerno lokalno nadraživanje kože (24)(25). U nedostatku tih podataka može biti potrebno provesti početno predprobiranje (vidjeti stavke 21.-24.). |
|
19. |
Nosač ne smije ometati niti utjecati na rezultate ispitivanja i treba se odabrati na temelju povećanja topljivosti s ciljem postizanja što viših koncentracija, a da se istodobno proizvede otopina/suspenzija pogodna za primjenu ispitivane tvari. Kao nosači preporučuju se aceton: maslinovo ulje (4:1 v/v), N,N-dimetilformamid, metil etil keton, propilen glikol i dimetil sulfoksid (6), ali mogu se koristiti i drugi ako se to dostatno znanstveno obrazloži. U nekim situacijama može biti potrebno primijeniti klinički relevantno otapalo ili komercijalnu formulaciju u kojoj se ispitivana tvar prodaje, kao dodatnu kontrolu. Posebno treba paziti da u sustav nosača budu ugrađene hidrofilne ispitivane tvari koje vlaže kožu i ne isušuju se odmah, uključivanjem odgovarajućih sredstava za otapanje (npr. 1 %-tnim Pluronic® L92). Znači, nosače koji su u potpunosti vodeni treba izbjegavati. |
|
20. |
Obrada limfnih čvorova pojedinačnih miševa omogućuje ocjenjivanje promjenljivosti među životinjama i statističku usporedbu razlika između mjerenja ispitivanom tvari i kontrolnom skupinom s nosačem (vidjeti stavak 33.). Pored toga, ocjenjivanje mogućnosti smanjenja broja miševa u skupini pozitivne kontrole je izvedivo nakon što se prikupe pojedinačni podaci o životinjama (22). Određena regulatorna tijela nadalje zahtijevaju da se prikupe pojedinačni podaci o životinjama. Redovito prikupljanje pojedinačnih podataka o životinjama osigurava prednosti za dobrobit životinja, tako što se izbjegava dvostruko ispitivanje koje bi bilo potrebno, ako bi regulatorna tijela kasnije razmatrala rezultate izvorno prikupljene na jedan način (npr. preko grupnih podataka o životinjama), zajedno s drugim zahtjevima (npr. pojedinačni podaci o životinjama). |
Predprobiranje
|
21. |
Ako nisu dostupne informacije za određivanje najviše doze za ispitivanje (vidjeti stavak 18.) potrebno je obaviti predprobiranje kako bi se odredila odgovarajuća visina doze za ispitivanje u LLNA: DA. Svrha predprobiranja je pružiti smjernice za odabir najviše doze za uporabu u glavnoj studiji LLNA: DA, ako nisu dostupne informacije o koncentraciji koja uzrokuje sustavnu toksičnost (vidjeti stavak 24.) i/ili prekomjerno lokalno nadraživanje kože (vidjeti stavak 23.). Najveća ispitana visina doze je 100 %-tna ispitivana tvar za tekućine ili najveća moguća koncentracija za krute tvari ili suspenzije. |
|
22. |
Predprobiranje se izvodi u uvjetima koji su identični glavnoj studiji LLNA: DA, s razlikom da se ne ocjenjuje proliferacija limfnih čvorova i može se koristiti manje životinja po dozirnoj skupini. Preporučuje se uporaba jedne ili dvije životinja po dozirnoj skupini. Svi miševi se svakodnevno prate s ciljem otkrivanja kliničkih znakova sustavne toksičnosti ili lokalnog nadraživanja na mjestu primjene. Tjelesna masa se bilježi prije ispitivanja i prije završetka (8. dan). Oba uha svakog miša se pregledavaju radi otkrivanja eritema i boduju prema tablici 1. (25). Debljina uha se mjeri posebnim mjernim instrumentom (pr. digitalnim mikrometrom ili mjeračem debljine Peacock Dial) prvi dan (prije doze), treći dan (otprilike 48 sati nakon prve doze), sedmi dan (24 sata prije završetka) i osmi dan. Pored toga, osmi dan se debljina uha može odrediti mjerenjem mase uzorka uha dobivenog probijanjem, što se izvodi nakon humanog usmrćenja. Prekomjerno lokalno nadraživanje kože se označuje bodovima za eriteme ≥ 3 i/ili povećanjem debljine uha za ≥ 25 % na bilo koji dan mjerenja (26) (27). Najviša odabrana doza za glavnu studiju LLNA: DA je sljedeća niža doza iz serije koncentracija u predprobiranju (vidjeti stavak 18.) koja ne uzrokuje sustavnu toksičnost i/ili prekomjerno lokalno nadraživanje kože. Tablica 1. Bodovanje eritema
|
|
23. |
Pored 25 %-tnog povećanja debljine uha (26)(27), statistički značajno povećanje debljine uha kod tretiranih miševa u odnosu na kontrolne miševe se, također, koristi za određivanje nadražujućih tvari u LLNA (28) (29) (30) (31) (32) (33) (34). Međutim, iako se statistički značajna povećanja debljine uha mogu javiti, ona se posebno ne povezuju s prekomjernim nadraživanjem kada su manja od 25 % (30) (32) (33) (34). |
|
24. |
Sljedeća klinička opažanja mogu ukazivati na sustavnu toksičnost (35) kada se koriste u okviru cjelokupne ocjene te, stoga, mogu naznačiti najvišu dozu za uporabu u glavnoj LLNA: DA: promjene u djelovanju živčanog sustava (npr. piloerekcija, ataksija, tremori i grčevi); promjene u ponašanju (npr. agresivnost, promjene u njezi, značajna promjena u stupnju aktivnosti); promjene u disanju (npr. promjene učestalosti i intenziteta disanja kao što su dispneja, zadihanost i hroptanje) i promjene u konzumaciji hrane i vode. Prilikom ocjenjivanja treba uzeti u obzir znakove letargije i/ili nereagiranja, sve kliničke znakove boli i patnje koji nisu blagi ili trenutačni, ili gubitak težine > 5 % od prvog do osmog dana i smrtnost. Životinje koje su pred uginućem ili pokazuju znakove teške boli i patnje trebaju se humano usmrtiti (36). |
Plan pokusa glavne studije
|
25. |
Plan pokusa je sljedeći: — Prvi dan: Pojedinačno identificirati životinje i zabilježiti masu svake životinje i sva klinička opažanja. Primijeniti 1 %-tnu vodenu otopinu natrijevog laurel sulfata (SLS) na stražnju stranu svakog uha koristeći četkicu umočenu u otopinu SLS za premaz stražnje strane svakog uha u četiri do pet poteza. Sat vremena nakon tretiranja SLS-om primijeniti 25 μl odgovarajuće otopine ispitivane tvari, samog nosača ili pozitivne kontrole (paralelna ili nedavno provedena, ovisno o laboratorijskoj politici uzimajući u obzir stavke 11.-15.) na stražnji dio svakog uha. — Drugi, treći i sedmi dan: Ponoviti predtretman 1 %-tnom vodenom otopinomu SLS-a i postupak primjene proveden prvog dana. — Četvrti, peti i šesti dan: Bez tretiranja. — Osmi dan: Zabilježiti masu svake životinje i sva klinička opažanja. Otprilike 24 do 30 sati nakon početka primjene sedmog dana životinje humano usmrtiti. Izrezati drenažne aurikularne limfne čvorove iz svakog uha i staviti odvojeno u pufer PBS za svaku životinju. Pojedinosti i sheme za identifikaciju i disekciju limfnih čvorova mogu se naći u referenci (22). Za daljnje praćenje lokalne reakcije kože u glavnoj studiji mogu se u protokol studije uključiti dodatni parametri kao što su ocjenjivanje eritema ušiju ili mjerenja debljine uha (dobiveni uređajem za mjerenje debljine ili određivanjem mase uzorka uha pri obdukciji). |
Priprema suspenzije stanica
|
26. |
Suspenzija pojedinačnih stanica limfnih čvorova (LNC) svakog miša, odstranjenih bilateralno, priprema se tako da se limfni čvorovi stave između dva predmetna stakalca koja se lagano pritisnu kako bi se zdrobili čvorovi. Nakon provjere da se tkivo raširilo u tanki sloj, stakalca se odvajaju. Tkivo na oba stakalca se suspendira u PBS-u tako da se svako stakalce drži pod kutom nad Petrijevom zdjelicom i ispere PBS-om istodobno strugajući tkivo sa stakalca odgovarajućim priborom. Limfni čvorovi životinja u negativnoj kontroli su mali te je stoga važno njima pažljivo rukovati da ne dođe do umjetnog učinka na vrijednosti SI. Za ispiranje oba stakalca koristi se ukupno 1 ml PBS. Suspenzija iz stanica limfnih čvorova u Petrijevoj zdjelici se lagano homogenizira strugalom za stanice. Potom se mikropipetom prikupi 20 μL alikvota suspenzije LNC-a pazeći da se ne pobere membrana koja je vidljiva okom, i naknadno se pomiješa s 1,98 ml PBS kako bi se dobilo 2 ml uzorka. Istim postupkom se pripremi drugi uzorak od 2 ml, tako da za svaku životinju budu pripravljena dva uzorka. |
Određivanje proliferacije stanica (mjerenje sadržaja ATP-a u limfocitima)
|
27. |
Povećanje sadržaja ATP-a u limfnim čvorovima mjeri se metodom luciferin/luciferaza koristeći komplet za mjerenje ATP-a, koji mjeri bioluminiscenciju u relativnim luminiscentnim jedinicama (RLU). Trajanje analize od trenutka usmrćenja životinja do mjerenja sadržaja ATP-a za svaku pojedinačnu životinju mora biti jednako, otprilike 30 minuta, budući da se smatra da sadržaj ATP-a postupno opada po usmrćenju životinja (12). Stoga se serija postupaka od izrezivanja aurikularnih limfnih čvorova do mjerenja ATP-a mora dovršiti u 20 minuta prema unaprijed određenom rasporedu koji je jednak za svaku životinju. Luminiscencija ATP-a se mjeri u svakom uzorku od 2 ml tako da se za svaku životinju prikupe dva mjerenja ATP-a. Potom se određuje prosječna luminiscencija ATP-a koja se koristi u daljnjim izračunima (vidjeti stavak 30.). |
OPAŽANJA
Klinička opažanja
|
28. |
Sve miševe treba pomno opažati najmanje jednom dnevno s obzirom na sve kliničke znakove lokalnog nadraživanja na mjestu primjene ili sustavne toksičnosti. Sva opažanja sustavno se bilježe za svaku životinju. Programi praćenja uključuju kriterije za pravodobno identificiranje miševa koji pokazuju znakove sustavne toksičnosti, prekomjernog lokalnog nadraživanja kože ili korozije kože za eutanaziju (36). |
Tjelesne mase
|
29. |
Kao što je navedeno u stavku 25., pojedinačne tjelesne mase treba mjeriti na početku testa i u vrijeme planiranog usmrćivanja životinja. |
IZRAČUN REZULTATA
|
30. |
Rezultati za svaku tretiranu skupinu su izraženi kao prosječni indeks stimulacije (SI). SI se dobiva dijeljenjem prosječne RLU po životinji unutar svake skupine tretirane ispitivanom tvari i pozitivne kontrolne skupine s prosječnim RLU po životinji za kontrolnu skupinu otopine/nosača. Prosječan SI za kontrolne skupine tretirane nosačem tada iznosi 1. |
|
31. |
U postupku odlučivanja rezultat se smatra pozitivnim kada je SI ≥ 1,8 (10). Međutim, kod odlučivanja da se neki granični rezultat (tj. vrijednost SI između 1,8 i 2,5) proglasi pozitivnim može se, također, koristiti snaga učinka na dozu, statistički značaj i dosljednost reakcija u otapalu/nosaču i pozitivnoj kontroli (2) (3) (37). |
|
32. |
U slučaju graničnog pozitivnog rezultata s vrijednošću SI između 1,8 i 2,5, za potvrđivanje pozitivnog rezultata korisnici mogu, pored vrijednosti SI, uzeti u obzir i dodatne podatke kao što je odnos između doze i reakcije, dokaz sustavne toksičnosti ili prekomjerne nadraženosti i, prema potrebi, statistički značaj (10). Također je potrebno uzeti u obzir razna svojstva ispitivane tvari, uključujući i to ima li strukturne veze s poznatim senzibilizatorima kože, uzrokuje li pretjerano nadraživanje kože kod miševa i prirodu odnosa reakcije na dozu koja je opažena. Ova i druga pitanja detaljno su razmotrena drugdje (4). |
|
33. |
Prikupljanje podataka na razini pojedinačnog miša omogućit će statističku analizu prisutnosti i stupnja odnosa između doze i učinka. Svaka statistička procjena može uključiti ocjenu odnosa između doze i učinka te odgovarajući prilagođene usporedbe ispitnih skupina (npr. skupina s doziranjem u parovima u odnosu na paralelne kontrolne skupine s otapalom/nosačem). Statističke analize mogu uključiti linearnu regresiju ili Williamsov test za ocjenu trendova odnosa doza-učinak i Dunnettov test za usporedbe u parovima. Prilikom odabira prikladne metode statističke analize istraživač treba biti svjestan eventualnih razlika između varijanata kao i drugih problema s tim u vezi, zbog kojih može biti neophodna transformacija podataka ili neparametarska statistička analiza. U svakom slučaju istraživač će možda morati izvršiti izračune SI i statističke analize sa sigurnim točkama podataka (koji se ponekad nazivaju ‚netipične vrijednosti’) i bez njih. |
PODACI I IZVJEŠĆIVANJE
Podaci
|
34. |
Podatke treba sažeti u tabličnom obliku koji pokazuje vrijednosti relativne luminiscentne jedinice za pojedinačnu životinju, prosječnu relativnu luminiscentnu jedinicu po životinji za skupinu, s tim povezane pogreške (npr. SD, SEM) i prosječni SI za svaku dozirnu skupinu u odnosu na paralelnu kontrolnu skupinu s otapalom/nosačem. |
Izvješće o ispitivanju
|
35. |
Izvješće o ispitivanju treba sadržavati sljedeće informacije:
|
REFERENCE
|
1. |
OECD (2010.), Skin Sensitisation: Local Lymph Node Assay, Test Guideline No 429, Guidelines for the Testing of Chemicals, OECD, Pariz. Dostupno na: [http://www.oecd.org/env/testguidelines] |
|
2. |
Chamberlain, M. and Basketter, D.A. (1996.), The local lymph node assay: status of validation. Food Chem, Toxicol., 34, str. 999-1002. |
|
3. |
Basketter, D.A., Gerberick, G.F., Kimber, I. and Loveless, S.E. (1996.), The local lymph node assay: A viable alternative to currently accepted skin sensitisation tests. Food Chem, Toxicol., 34, str. 985-997. |
|
4. |
Basketter, D.A., Gerberick, G.F. and Kimber, I. (1998.), Strategies for identifying false positive responses in predictive sensitisation tests. Food Chem. Toxicol., 36, str. 327-333. |
|
5. |
Van Och, F.M.M., Slob, W., De Jong, W.H., Vandebriel, R.J. and Van Loveren, H. (2000.), A quantitative method for assessing the sensitising potency of low molecular weight chemicals using a local lymph node assay: employment of a regression method that includes determination of uncertainty margins. Toxicol., 146, str. 49-59. |
|
6. |
ICCVAM (1999.), The murine local lymph node Assay: A test method for assessing the allergic contact dermatitis potential of chemicals/compounds: The results of an independent peer review evaluation coordinated by the Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program Center for the Evaluation of Alternative Toxicological Methods (NICETAM). NIH Publication No: 99-4494. Research Triangle Park, N.C. Dostupno na: [http://iccvam.niehs.nih.gov/docs/immunotox_docs/llna/llnarep.pdf] |
|
7. |
Dean, J.H., Twerdok, L.E., Tice, R.R., Sailstad, D.M., Hattan, D.G., Stokes, W.S. (2001.), ICCVAM evaluation of the murine local lymph node assay: II. Conclusions and recommendations of an independent scientific peer review panel. Reg. Toxicol. Pharmacol. 34, str. 258-273. |
|
8. |
Haneke, K.E., Tice, R.R., Carson, B.L., Margolin, B.H., Stokes, W.S. (2001.), ICCVAM evaluation of the murine local lymph node assay: III. Data analyses completed by the national toxicology program interagency center for the evaluation of alternative toxicological methods. Reg. Toxicol. Pharmacol. 34, str. 274-286. |
|
9. |
Sailstad, D.M., Hattan, D., Hill, R.N., Stokes, W.S. (2001.), ICCVAM evaluation of the murine local lymph node assay: I. The ICCVAM review process. Reg. Toxicol. Pharmacol. 34, str. 249-257. |
|
10. |
ICCVAM (2010.), ICCVAM Test Method Evaluation Report. Nonradioactive local lymph node assay: modified by Daicel Chemical Industries, Ltd, based on ATP content test method protocol (LLNA: DA). NIH Publication No 10-7551A/B. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Dostupno na: [http://iccvam.niehs.nih.gov/methods/immunotox/llna-DA/TMER.htm] |
|
11. |
ICCVAM (2009.), Independent Scientific Peer Review Panel Report: Updated validation status of new versions and applications of the murine local lymph node assay: a test method for assessing the allergic contact dermatitis potential of chemicals and products. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Dostupno na: [http://iccvam.niehs.nih.gov/docs/immunotox_docs/LLNAPRPRept2009.pdf]. |
|
12. |
Idehara, K., Yamagishi, G., Yamashita, K. and Ito, M. (2008.), Characterization and evaluation of a modified local lymph node assay using ATP content as a non-radio isotopic endpoint. J. Pharmacol. Toxicol. Meth., 58, str. 1-10. |
|
13. |
Omori, T., Idehara, K., Kojima, H., Sozu, T., Arima, K., Goto, H., Hanada, T., Ikarashi, Y., Inoda, T., Kanazawa, Y., Kosaka, T., Maki, E., Morimoto, T., Shinoda, S., Shinoda, N., Takeyoshi, M., Tanaka, M., Uratani, M., Usami, M., Yamanaka, A., Yoneda, T., Yoshimura, I. and Yuasa, A. (2008.), Interlaboratory validation of the modified murine local lymph node assay based on adenosine triphosphate measurement. J. Pharmacol. Toxicol. Meth., 58, str. 11-26. |
|
14. |
OECD (1992.), Skin Sensitisation, Test Guideline No 406, Guidelines for Testing of Chemicals, OECD, Pariz. Dostupno na: [http://www.oecd.org/env/testguidelines] |
|
15. |
Kreiling, R., Hollnagel, H.M., Hareng, L., Eigler, L., Lee, M.S., Griem, P., Dreessen, B., Kleber, M., Albrecht, A., Garcia, C. and Wendel, A. (2008.), Comparison of the skin sensitising potential of unsaturated compounds as assessed by the murine local lymph node assay (LLNA) and the guinea pig maximization test (GPMT). Food Chem. Toxicol., 46, str. 1896-1904. |
|
16. |
Basketter, D., Ball, N., Cagen, S., Carrillo, J.C., Certa, H., Eigler, D., Garcia, C., Esch, H., Graham, C., Haux, C., Kreiling, R. and Mehling, A. (2009.), Application of a weight of evidence approach to assessing discordant sensitisation datasets: implications for REACH. Reg. Toxicol. Pharmacol., 55, str. 90-96. |
|
17. |
Crouch, S.P., Kozlowski, R., Slater, K.J. and Fletcher J. (1993.), The use of ATP bioluminescence as a measure of cell proliferation and cytotoxicity. J. Immunol. Meth., 160, 81-88. |
|
18. |
Ishizaka, A., Tono-oka, T. and Matsumoto, S. (1984.), Evaluation of the proliferative response of lymphocytes by measurement of intracellular ATP. J. Immunol. Meth., 72, str. 127-132. |
|
19. |
Dexter, S.J., Cámara, M., Davies, M. and Shakesheff, K.M. (2003.), Development of a bioluminescent ATP assay to quantify mammalian and bacterial cell number from a mixed population. Biomat., 24, str. 27-34. |
|
20. |
Lundin A. (2000.), Use of firefly luciferase in ATP-related assays of biomass, enzymes, and metabolites. Meth. Enzymol., 305, str. 346-370. |
|
21. |
ILAR (1996.), Institute of Laboratory Animal Research (ILAR) Guide for the Care and Use of Laboratory Animals. 7th ed. Washington, DC: National Academies Press. |
|
22. |
ICCVAM (2009.), Recommended Performance Standards: Murine Local Lymph Node Assay, NIH Publication Number 09-7357, Research Triangle Park, NC: National Institute of Environmental Health Science. Dostupno na: [http://iccvam.niehs.nih.gov/docs/immunotox_docs/llna-ps/LLNAPerfStds.pdf] |
|
23. |
McGarry, H.F. (2007.), The murine local lymph node assay: regulatory and potency considerations under REACH. Toxicol., 238, str. 71-89. |
|
24. |
Kimber, I., Dearman, R.J., Scholes E.W. and Basketter, D.A. (1994.), The local lymph node assay: developments and applications. Toxicol., 93, str. 13-31. |
|
25. |
OECD (2002.), Acute Dermal Irritation/Corrosion, Test Guideline No 404, Guidelines for Testing of Chemicals, OECD, Pariz. Dostupno na: [http://www.oecd.org/env/testguidelines] |
|
26. |
Reeder, M.K., Broomhead, Y.L., DiDonato, L. and DeGeorge, G.L. (2007.), Use of an enhanced local lymph node assay to correctly classify irritants and false positive substances. Toxicologist, 96, str. 235. |
|
27. |
ICCVAM (2009.), Nonradioactive Murine Local Lymph Node Assay: Flow Cytometry Test Method Protocol (LLNA: BrdU-FC) Revised Draft Background Review Document. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Dostupno na: [http://iccvam.niehs.nih.gov/methods/immunotox/fcLLNA/BRDcomplete.pdf]. |
|
28. |
Hayes, B.B., Gerber, P.C., Griffey, S.S. and Meade, B.J. (1998.), Contact hypersensitivity to dicyclohexylcarbodiimide and diisopropylcarbodiimide in female B6C3F1 mice. Drug. Chem. Toxicol., 21, str. 195-206. |
|
29. |
Homey, B., von Schilling, C., Blumel, J., Schuppe, H.C., Ruzicka, T., Ahr, H.J., Lehmann, P. and Vohr, V.W. (1998.), An integrated model for the differentiation of chemical-induced allergic and irritant skin reactions. Toxicol. Appl. Pharmacol., 153, str. 83-94. |
|
30. |
Woolhiser, M.R., Hayes, B.B. and Meade, B.J. (1998.), A combined murine local lymph node and irritancy assay to predict sensitisation and irritancy potential of chemicals. Toxicol. Meth., 8, str. 245-256. |
|
31. |
Hayes, B.B. and Meade, B.J. (1999.), Contact sensitivity to selected acrylate compounds in B6C3F1 mice: relative potency, cross reactivity, and comparison of test methods. Drug Chem. Toxicol., 22, str. 491-506. |
|
32. |
Ehling, G., Hecht, M., Heusener, A., Huesler, J., Gamer, A.O., van Loveren, H., Maurer, T., Riecke, K., Ullmann, L., Ulrich, P., Vandebriel, R. and Vohr, H.W. (2005.), A European inter-laboratory validation of alternative endpoints of the murine local lymph node assay: first round. Toxicol., 212, str. 60-68. |
|
33. |
Vohr, H.W. and Ahr, H.J. (2005.), The local lymph node assay being too sensitive? Arch. Toxicol., 79, str. 721-728. |
|
34. |
Patterson, R.M., Noga, E. and Germolec, D. (2007.), Lack of evidence for contact sensitisation by Pfiesteria extract. Environ. Health Perspect., 115, str. 1023-1028. |
|
35. |
ICCVAM (2009.), Report on the ICCVAM-NICEATM/ECVAM/JaCVAM Scientific Workshop on Acute Chemical Safety Testing: Advancing In Vitro Approaches and Humane Endpoints for Systemic Toxicity Evaluations. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Dostupno na: [http://iccvam.niehs.nih.gov/methods/acutetox/Tox_workshop.htm] |
|
36. |
OECD (2000.), Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation, Environmental Health and Safety Monograph Series on Testing and Assessment No 19, ENV/JM/MONO(2000)7, OECD, Pariz. Dostupno na: [http://www.oecd.org/env/testguidelines] |
|
37. |
Kimber, I., Hilton, J., Dearman, R.J., Gerberick, G.F., Ryan, C.A., Basketter, D.A., Lea, L., House, R.V., Ladies, G.S., Loveless, S.E. and Hastings, K.L. (1998.), Assessment of the skin sensitisation potential of topical medicaments using the local lymph node assay: An interlaboratory exercise. J. Toxicol. Environ. Health, 53 str. 563-79. |
|
38. |
OECD (2005.), Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment, Environment, Health and Safety Monograph Series on Testing and Assessment No 34, ENV/JM/MONO (2005)14, OECD, Pariz. Dostupno na: [http://www.oecd.org/env/testguidelines] |
Dodatak 1.
DEFINICIJE
Točnost: stupanj podudarnosti između rezultata ispitne metode i prihvaćenih referentnih vrijednosti. To je mjerilo učinkovitosti ispitne metode i jedan od aspekata relevantnosti. Ovaj se termin često koristi umjesto ‚podudarnosti’ kako bi se označio udio točnih rezultata ispitne metode (38).
Referentna tvar: tvar koja uzrokuje ili ne uzrokuje preosjetljivost i koja se koristi kao standard za usporedbu s ispitivanom tvari. Referentna tvar treba imati sljedeće svojstva: i. dosljedni i pouzdani izvor(i); ii. strukturna i funkcionalna sličnost s razredom tvari koje se ispituju; iii. poznate fizikalno-kemijske značajke; iv. popratni podaci o poznatim učincima; i v. poznata učinkovitost u okviru željene reakcije.
Lažno negativna tvar: tvar koja je ispitnom metodom netočno određena kao negativna ili neaktivna kada je u stvari pozitivna ili aktivna.
Lažno pozitivna tvar: tvar koja je ispitivanjem netočno određena kao pozitivna ili aktivna kada je u stvari negativna ili neaktivna.
Opasnost: potencijal štetnog učinka na zdravlje ili okoliš. Štetni učinak se javlja samo ako je stupanj izloženosti dovoljno visok.
Ponovljivost između laboratorija: mjera u kojoj različiti kvalificirani laboratoriji koji koriste isti protokol i ispituju istu tvar, mogu proizvesti kvalitativno i kvantitativno slične rezultate. Ponovljivost između laboratorija se određuje prije i tijekom validacijskog postupka i pokazuje u kojoj se mjeri neko ispitivanje može uspješno prenijeti iz jednog laboratorija u drugi, također navedena kao međulaboratorijska ponovljivost (38).
Ponovljivost u laboratoriju: određivanje u kojoj mjeri stručno osoblje u okviru istog laboratorija može uspješno ponoviti rezultate koristeći određeni protokol u različitim trenucima. Također se navodi kao unutarlaboratorijska ponovljivost (38).
Netipična vrijednost: netipična vrijednost je zapažanje koje značajno odstupa od ostalih vrijednosti u nasumičnom uzorku populacije.
Osiguranje kvalitete: postupak upravljanja pri kojem pojedinci neovisni od osoba koje provode ispitivanje, ocjenjuju ispunjavanje standarda laboratorijskog ispitivanja, zahtjeve i postupke vođenja evidencije te točnost prijenosa podataka.
Pouzdanost: mjera u kojoj se ispitna metoda može ponoviti unutar i između laboratorija tijekom vremena uporabom istog protokola. Ocjenjuje se izračunavanjem unutarlaboratorijske i međulaboratorijske ponovljivosti (38).
Preosjetljivost kože: imunološki proces koji se javlja kada je osjetljivi pojedinac lokalno izložen kemijskom alergenu koji uzrokuje imunosnu reakciju kože koja može dovesti do kontaktne preosjetljivosti.
Indeks stimulacije (SI): izračunana vrijednost za ocjenjivanje potencijala preosjetljivosti kože koju može uzrokovati ispitivana tvar, koja je omjer proliferacije u tretiranim skupinama i paralelnoj kontrolnoj skupini s nosačem.
Ispitivana tvar (navodi se također kao i ispitivana kemikalija): svaka tvar ili smjesa koja je ispitana ovom metodom.
B.51. PREOSJETLJIVOST KOŽE: ANALIZA LOKALNIH LIMFNIH ČVOROVA: BrdU-ELISA
UVOD
|
1. |
Smjernice OECD-a za ispitivanje kemijskih tvari i ispitnih metoda EU-a se periodički preispituju u svjetlu znanstvenog napretka, promjene regulatornih potreba i razmatranja o dobrobiti životinja. Prva ispitna metoda (TM) (B.42) za utvrđivanje preosjetljivosti kože kod miševa, analiza lokalnih limfnih čvorova (LLNA; Smjernica za ispitivanje OECD-a 429) je revidirana (1. i poglavlje B.42. u ovome Prilogu). Objavljeni su detalji validacije metode LLNA i pregled povezanog djelovanja (2) (3) (4) (5) (6) (7) (8) (9). Kod LLNA se za mjerenje proliferacije limfocita uporablja radioizotopni timidin ili jod te je stoga uporaba ove analize ograničena ako je nabava, uporaba ili odlaganje radioaktivnosti problematična. LLNA: BrdU-ELISA (Enzyme-Linked Immunosorbent Assay) je neradioaktivna inačica metode LLNA, u kojoj se koristi radioaktivno neoznačeni 5-bromo 2-deoksiuridin (BrdU) (CAS br. 59-14-3) u sustavu ispitivanja koji se temelji na ELISA za mjerenje proliferacije limfocita. Ispitnu metodu LNNA: BrdU-ELISA je validirao i pregledao međunarodni nezavisni odbor za stručnu reviziju koji ju je preporučio kao korisnu za utvrđivanje kemikalija koje izazivaju preosjetljivost i kemikalija koje ne izazivaju preosjetljivost, uz određena ograničenja (10) (11) (12). Svrha ove ispitne metode je procjena potencijala kemikalija da senzibiliziraju kožu kod životinja (tvari i smjese). Poglavlje B.6. ovog Priloga i Smjernica za ispitivanje OECD-a 406 koriste testove na zamorcima, konkretnije maksimizacijski test sa zamorcima i Buehlerov test (13). Metoda LLNA (poglavlje B.42 ovog Priloga; Smjernica za ispitivanje OECD-a 429) i dvije neradioaktivne inačice, analiza LLNA: BrdU-ELISA (poglavlje B.51 ovog Priloga; Smjernica za ispitivanje OECD-a 442 B) i LLNA: DA (poglavlje B.50 ovog Priloga; Smjernica za ispitivanje OECD-a 442 A), sve imaju prednosti u odnosu na testove na zamorcima iz metode B.6. i Smjernica za ispitivanje OECD-a 406 (13) u smislu manje i usavršene uporabe životinja. |
|
2. |
Slično kao i metodom LLNA, LLNA: BrdU-ELISA proučava indukcijsku fazu senzibilizacije kože i pruža kvantitativne podatke pogodne za procjenjivanje reakcije na dozu. Pored toga, sposobnost otkrivanja senzibilizatora kože bez uporabe radioaktivne oznake za DNA isključuje mogućnost profesionalne izloženosti radioaktivnosti i pitanja odlaganja otpada. To zauzvrat može omogućiti povećanu uporabu miševa za otkrivanje senzibilizatora kože, čime se može dodatno smanjiti uporaba zamoraca za ispitivanje potencijala preosjetljivosti kože (tj. B.6; Smjernica za ispitivanje OECD-a 406) (13). |
DEFINICIJE
|
3. |
Korištene definicije navedene su u Dodatku 1. |
POČETNA RAZMATRANJA I OGRANIČENJA
|
4. |
Metoda LLNA: BrdU-ELISA je inačica metode LLNA za utvrđivanje kemikalija koje imaju potencijal za uzrokovanje senzibilizacije kože uz posebna ograničenja. To nužno ne znači da u svim slučajevima metodu LLNA: BrdU-ELISA treba primijeniti umjesto metode LLNA ili testa sa zamorcima (tj. B.6; Smjernica za ispitivanje OECD-a 406) (13), već da je pokus jednakovrijedan i da se može koristiti kao alternativa kod koje za pozitivne i negativne rezultate obično nije potrebna daljnja potvrda (10) (11). Ispitni laboratoriji trebaju uzeti u obzir sve dostupne podatke o ispitivanoj tvari prije provođenja studije. Spomenuti podaci uključuju identitet i kemijsku strukturu ispitivane tvari, njezina fizikalno-kemijska svojstva, rezultate svih in vitro ili in vivo ispitivanja toksičnosti i toksikološke podatke o strukturno povezanim kemikalijama. Ti se podaci uzimaju u obzir radi utvrđivanja prikladnosti metode LLNA: BrdU-ELISA za odnosnu tvar (s obzirom na nekompatibilnost određenih vrsta kemikalija s metodom LLNA: BrdU-ELISA - vidjeti stavak 5.) i pomoći kod odabira doze. |
|
5. |
Metoda LLNA: BrdU-ELISA je metoda in vivo, pa kao takva ne isključuje uporabu životinja u procjeni kontaktne senzibilizacijske aktivnosti. Ona, međutim, ima potencijala smanjiti uporabu životinja u tu svrhu u usporedbi s testovima na zamorcima (B.6; Smjernica za ispitivanje OECD-a 406) (13). Nadalje, metoda LLNA: BrdU-ELISA nudi znatno finiji način uporabe životinja u ispitivanju kontaktne senzibilizacije, budući da za razliku od B.6 i Smjernice OECD-a 406 nije potrebno izazivati provokacijski inducirane hipersenzibilizirane dermalne reakcije. Nadalje, za metodu LLNA: BrdU-ELISA nije potrebno koristiti adjuvans, kao što je to slučaj s maksimizacijskim testom sa zamorcima (poglavlje B.6 ovog Priloga, 13). Metoda LLNA: BrdU-ELISA smanjuje patnju životinja. Unatoč prednostima metode LLNA: BrdU-ELISA u odnosu na B.6 i Smjernicu OECD-a 406 (13), postoje neka ograničenja zbog kojih može biti potrebno primijeniti B.6 ili Smjernicu OECD-a 406 (npr. ispitivanje određenih metala, lažni pozitivni nalazi kod nekih sredstava s nadražujućim djelovanjem na kožu (kao što su neke površinski aktivne tvari) (6) (1. i poglavlje B.42 iz ovog Priloga), topivost ispitivane tvari). Povrh toga, ispitivanja na zamorcima mogu biti potrebna za kemijske razrede ili tvari koje sadrže funkcionalne skupine za koje je dokazano da djeluju kao potencijalni zbunjujući faktori (15) (tj. B.6; Smjernica za ispitivanje OECD-a 406 (13). Preporučuje se da se ograničenja koja su utvrđena za metodu LLNA) (1. i poglavlje B.42 iz ovog Priloga) primjenjuju i na metodu LLNA: BrdU-ELISA (10). Pored takvih utvrđenih ograničenja metoda LLNA: BrdU-ELISA se može primjenjivati za ispitivanje bilo koje kemikalije, osim ako ne postoji mogućnost da bi njezina svojstva mogla utjecati na točnost metode LLNA: BrdU-ELISA. Pored toga, potrebno je uzeti u obzir mogućnost graničnih pozitivnih rezultata kada se dobiju vrijednosti stimulacijskog indeksa (SI) između 1,6 i 1,9 (vidjeti stavke 31–32.). To se temelji na bazi podataka za validaciju s 43 tvari s indeksom stimulacije ≥ 1,6 (vidjeti stavak 6.), za koje su metodom LLNA: BrdU-ELISA pravilno određena sva 32 senzibilizatora pri LLNA, ali su nepravilno određene dvije od 11 tvari koje pri LLNA ne izazivaju preosjetljivost s vrijednostima stimulacijskog indeksa između 1,6 i 1,9 (tj. granično pozitivna vrijednost) (10). Međutim, budući da je za određivanje vrijednosti stimulacijskog indeksa i izračun predvidljivih svojstava ispitivanja uporabljen isti set podataka, navedeni rezultati mogu precijeniti stvarna predvidljiva svojstva. |
NAČELO ISPITIVANJA
|
6. |
Metoda LLNA: BrdU-ELISA počiva na temeljnom načelu prema kojem senzibilizatori induciraju proliferaciju limfocita u limfnom čvoru čime dolazi do drenaže mjesta kemijske primjene. Ta je proliferacija proporcionalna primijenjenoj dozi i potencijalu primijenjenog alergena te predstavlja jednostavan način za dobivanje kvantitativno izmjerene senzibilizacije. Proliferacija se mjeri usporedbom prosječne proliferacije svake ispitivane skupine s prosječnom proliferacijom u kontrolnoj skupini tretiranoj nosačem. Određuje se omjer prosječne proliferacije u svakoj tretiranoj skupini i proliferacije u paralelnoj kontrolnoj skupini s nosačem, nazvan indeks stimulacije, koji mora biti ≥ 1,6 da bi se ispitivana tvar mogla dalje vrednovati kao potencijalni senzibilizator kože. Ovdje opisane metode temelje se na mjerenju sadržaja BrdU kako bi se pokazao povećani broj stanica koje proliferiraju u aurikularnin limfnim čvorovima koji uzrokuju drenažu. BrdU je analogan timidinu i slično se uključuje u proliferirajuće stanice DNA. Uključivanje BrdU se mjeri testom ELISA koji koristi specifično protutijelo za BrdU, koje je također označeno peroksidazom. Ako se doda supstrat, peroksidaza reagira sa supstratom i nastane obojani produkt koji se količinski određuje pri određenoj apsorbanci koristeći čitač mikrotitarskih pločica. |
OPIS ANALIZE
Odabir životinjskih vrsta
|
7. |
Za ovaj test odabrana vrsta su miševi. Validacijske studije za LLNA: BrdU-ELISA provedene su isključivo sa sojem CBA/JN, koji se stoga smatra preporučenim sojem (10) (12). Koriste se mlade odrasle ženke koje još nisu imale potomstvo i nisu skotne. Na početku studije životinje trebaju biti stare između osam do 12 tjedana, a odstupanje mase životinja treba biti minimalno i ne smije prelaziti 20 % srednje mase. Drugi sojevi i mužjaci mogu se koristiti ako postoji dovoljno podataka da u reakciji prema metodi LLNA: BrdU-ELISA nema značajnih razlika specifičnih za soj i/ili spol. |
Uvjeti smještaja i prehrane
|
8. |
Miševi trebaju biti smješteni u skupinama (16), osim ako se ne dokaže prikladna znanstvena utemeljenost za pojedinačni smještaj. Temperatura u prostoriji u kojoj se drže pokusne životinje treba biti 22 °C (± 3 °C). Iako bi relativna vlaga trebala biti najmanje 30 %, a poželjno je da ne prijeđe 70 % osim tijekom čišćenja prostorije, cilj bi trebao biti 50–60 %. Svjetlost treba biti umjetna, s tim da je redoslijed 12 sati svjetla, 12 sati tame. Za hranjenje se može koristiti konvencionalna laboratorijska hrana s neograničenom količinom vode za piće. |
Priprema životinja
|
9. |
Životinje se nasumice biraju, jednoznačno identificiraju (ali ne bilo kojim oblikom označavanja ušiju) i drže u kavezima najmanje pet dana prije početka doziranja kako bi se aklimatizirale na laboratorijske uvjete. Prije početka tretiranja sve životinje treba pregledati kako bi se potvrdilo da nemaju zapaženih lezija kože. |
Priprema ispitnih otopina
|
10. |
Tvrde kemikalije se prije primjene na uho miša trebaju rastopiti ili suspendirati u otapalima/nosačima i prema potrebi razrijediti. Tekuće kemikalije se mogu nanijeti čiste ili razrijeđene prije doziranja. Netopive kemikalije, koje se obično koriste u medicinskim uređajima, trebaju se podvrgnuti postupku pretjerane ekstrakcije u odgovarajućem otapalu kako bi se prije primjene na uho miša otkrili svi ekstraktibilni sastojci za ispitivanje. Ispitivane tvari se pripremaju svakodnevno osim ako podaci o stabilnosti ne dokažu prihvatljivost njihova skladištenja. |
Provjera pouzdanosti
|
11. |
Kemikalije pozitivne kontrole koriste se kako bi se dokazalo da se pokus provodi na odgovarajući način tako što reagiraju prikladnom i ponovljivom preosjetljivošću kao ispitivana tvar koja uzrokuje preosjetljivost, čiji je stupanj reakcije točno utvrđen. Preporučuje se uvođenje paralelne pozitivne kontrole radi dokazivanja sposobnosti laboratorija da uspješno izvede svaku analizu i da se omogući ocjenjivanje ponovljivosti i usporedivosti unutar jednog ili između više laboratorija. Određena regulatorna tijela zahtijevaju pozitivnu kontrolu za svaku studiju te se, stoga, korisnici pozivaju da prije izvođenja metode LLNA: BrdU-ELISA kontaktiraju relevantna tijela. Sukladno tomu, potiče se rutinska uporaba paralelne pozitivne kontrole kako bi se izbjeglo dodatno ispitivanje na životinjama radi ispunjavanja zahtjeva koji se mogu javiti zbog periodičke uporabe paralelne kontrole (vidjeti stavak 12.). Pozitivna kontrola treba proizvesti pozitivnu reakciju na metodu LLNA: BrdU-ELISA kod razine izlaganja za koju se očekuje da će dati porast indeksa stimulacije (SI) ≥ 1,6 u odnosu na negativnu kontrolnu skupinu. Dozu pozitivne kontrole treba odabrati tako da ne uzrokuje prekomjerno nadraživanje kože ili sustavnu toksičnost i da je indukcija ponovljiva, ali ne prekomjerna (tj. SI > 14 se smatra pretjeranim). Poželjne pozitivne kontrole su 25 %-tni heksilcinamaldehid (CAS br. 101-86-0) i 25 %-tni eugenol (CAS br. 97-53-0) u acetonu: maslinovo ulje (4:1; v/v). Moguće su okolnosti u kojima se, uz odgovarajuće obrazloženje, mogu koristiti druge pozitivne kontrole koje ispunjavaju gore navedene kriterije. |
|
12. |
Iako se preporučuje uvođenje paralelne skupine pozitivne kontrole, u određenim situacijama periodičko ispitivanje (tj. u intervalima ≤ 6 mjeseci) pozitivne kontrole može biti prikladno za laboratorije koji redovito izvode metodu LLNA: BrdU-ELISA (tj. najmanje jednom mjesečno) i imaju povijesnu bazu podataka pozitivne kontrole koja dokazuje sposobnost laboratorija da dobiva ponovljive i točne rezultate pozitivnih kontrola. Odgovarajuća osposobljenost za metodu LLNA: BrdU-ELISA može se uspješno dokazati dobivanjem dosljednih pozitivnih rezultata pozitivne kontrole u najmanje deset neovisnih ispitivanja provedenih u razumnom vremenskom razdoblju (manje od jedne godine). |
|
13. |
Paralelnu skupinu pozitivne kontrole potrebno je uvesti svaki put kada dođe do proceduralne promjene metode LLNA: BrdU-ELISA (npr. zamjena stručnog osoblja, promjena materijala i/ili reagensa ispitne metode, promjena opreme, promjena izvora ispitivanih životinja) i te se promjene moraju navesti u laboratorijskim izvješćima. Potrebno je uzeti u obzir učinak tih promjena na primjerenost prethodno uspostavljene povijesne baze podataka prilikom utvrđivanja potrebe za uspostavom nove baze povijesnih podataka radi dokazivanja dosljednosti rezultata pozitivne kontrole. |
|
14. |
Istraživači trebaju biti svjesni da odluka o provođenju periodičke umjesto paralelne studije pozitivne kontrole utječe na prikladnost i prihvatljivost negativnih rezultata dobivenih bez paralelne pozitivne kontrole u razdoblju između svake periodičke pozitivne kontrole. Na primjer, ako se periodičkom pozitivnom kontrolom dobije lažni negativni rezultat, mogu se dovesti u pitanje negativni rezultati ispitivane tvari dobiveni u razdoblju između posljednje prihvatljive periodičke pozitivne kontrolne studije i neprihvatljive periodičke pozitivne kontrolne studije. Kod odlučivanja o uvođenju paralelne pozitivne kontrole ili provođenju samo periodičkih pozitivnih kontrola potrebno je pažljivo uzeti u obzir posljedice tih rezultata. Također je potrebno razmotriti mogućnost uporabe manjeg broja životinja u skupini paralelne pozitivne kontrole ako je to opravdano sa znanstvenog stajališta i ako laboratorij na temelju svojih posebnih povijesnih podataka dokaže da se može koristiti manje miševa (17). |
|
15. |
Iako pozitivnu kontrolnu tvar treba ispitati u nosaču za koji je poznato da izaziva dosljednu reakciju (npr. aceton; maslinovo ulje; 4:1, v/v), u nekim regulatornim situacijama bit će potrebno i ispitivanje u nestandardnom nosaču (klinički/kemijski relevantnoj formulaciji) (18). Ako se paralelna pozitivna kontrola ispituje u drugačijem nosaču od ispitivane tvari, potrebno je uključiti posebnu kontrolu s nosačem za paralelnu pozitivnu kontrolu. |
|
16. |
U slučajevima kada se ocjenjuju tvari iz posebnog kemijskog razreda ili raspona reakcija, referentne tvari mogu također biti korisne za dokazivanje ispravnosti ispitne metode za otkrivanje potencijala preosjetljivosti kože tih vrsta ispitivanih tvari. Prikladne referentne tvari moraju imati sljedeće značajke:
|
ISPITNI POSTUPAK
Broj životinja i visine doze
|
17. |
Po jednoj dozirnoj skupini koriste se najmanje četiri životinje s najmanje tri koncentracije ispitivane tvari, plus paralelna negativna kontrolna skupina tretirana samo nosačem za ispitivanu tvar i jedna pozitivna kontrola (paralelna ili nedavno provedena, na temelju laboratorijske politike uzimajući u obzir stavke 11.-15.). Potrebno je razmotriti ispitivanje višestrukih doza pozitivne kontrole, posebno ako se ispitivanje pozitivne kontrole izvodi s prekidima. Osim tretiranja ispitivanom tvari, sa životinjama u kontrolnim skupinama treba postupati i tretirati ih jednako kao i životinje u tretiranim skupinama. |
|
18. |
Odabir doze i nosača treba se temeljiti na preporukama navedenim u referencama (2) i (19). Uzastopne doze se obično odabiru iz odgovarajućih serija koncentracija kao što su 100 %, 50 %, 25 %, 10 %, 5 %, 2,5 %, 1 %, 0,5 % itd. Odabir uporabljene serije koncentracija mora biti popraćen odgovarajućim znanstvenim obrazloženjem. Kod odabira tri uzastopne koncentracije treba uzeti u obzir sve postojeće toksikološke podatke (o akutnoj toksičnosti i nadraživanju kože) te strukturne i fizikalno-kemijske podatke o odnosnoj ispitivanoj tvari (i/ili strukturno povezanim tvarima), ako dostupne, kako bi se najvišom koncentracijom maksimaliziralo izlaganje, ali istodobno izbjegla sustavna toksičnost i/ili prekomjerno lokalno nadraživanje kože (19) (20 i poglavlje B.4 iz ovog Priloga). U nedostatku tih podataka može biti potrebno provesti početno predprobiranje (vidjeti stavke 21.-24.). |
|
19. |
Nosač ne smije ometati niti utjecati na rezultate ispitivanja i treba se odabrati na temelju povećanja topljivosti s ciljem postizanja što viših koncentracija, a da se istodobno proizvede otopina/suspenzija pogodna za primjenu ispitivane tvari. Kao nosači preporučuju se aceton: maslinovo ulje (4:1 v/v), N,N-dimetilformamid, metil etil keton, propilen glikol i dimetil sulfoksid (6), ali mogu se koristiti i drugi ako se to dostatno znanstveno obrazloži. U nekim situacijama može biti potrebno primijeniti klinički relevantno otapalo ili komercijalnu formulaciju u kojoj se ispitivana tvar prodaje, kao dodatnu kontrolu. Posebno treba paziti da u sustav nosača budu ugrađene hidrofilne ispitivane tvari koje vlaže kožu i ne isušuju se odmah, uključivanjem odgovarajućih sredstava za otapanje (npr. 1 %-tnim Pluronic® L92). Znači, nosače koji su u potpunosti vodeni treba izbjegavati. |
|
20. |
Obrada limfnih čvorova pojedinačnih miševa omogućuje ocjenjivanje promjenljivosti među životinjama i statističku usporedbu razlika između mjerenja ispitivanom tvari i kontrolnom skupinom s nosačem (vidjeti stavak 33.). Pored toga, ocjenjivanje mogućnosti smanjenja broja miševa u skupini pozitivne kontrole je izvedivo nakon što se prikupe pojedinačni podaci o životinjama (17). Određena regulatorna tijela zahtijevaju da se prikupe pojedinačni podaci o životinjama. Redovito prikupljanje pojedinačnih podataka o životinjama osigurava prednosti za dobrobit životinja, tako što se izbjegava dvostruko ispitivanje koje bi bilo potrebno, ako bi regulatorna tijela kasnije razmatrala rezultate, izvorno prikupljene na jedan način (npr. preko grupnih podataka o životinjama), zajedno s drugim zahtjevima (npr. pojedinačni podaci o životinjama). |
Predprobiranje
|
21. |
Ako nisu dostupne informacije za određivanje najviše doze za ispitivanje (vidjeti stavak 18.) potrebno je obaviti predprobiranje kako bi se odredila odgovarajuća visina doze za ispitivanje u LLNA: BrdU-ELISA. Svrha predprobiranja je pružiti smjernice za odabir najviše doze za uporabu u glavnoj studiji LLNA: BrdU-ELISA, ako nisu dostupne informacije o koncentraciji koja uzrokuje sustavnu toksičnost (vidjeti stavak 24.) i/ili prekomjerno lokalno nadraživanje kože (vidjeti stavak 23.). Najveća ispitana visina doze je 100 %-tna koncentracija ispitivane tvari za tekućine ili najveća moguća koncentracija za krute tvari ili suspenzije. |
|
22. |
Predprobiranje se izvodi u uvjetima koji su identični glavnoj studiji LLNA: BrdU-ELISA, s razlikom da se ne ocjenjuje proliferacija limfnih čvorova i može se koristiti manje životinja po dozirnoj skupini. Preporučuje se uporaba jedne ili dvije životinje po dozirnoj skupini. Svi miševi se svakodnevno prate s ciljem otkrivanja kliničkih znakova sustavne toksičnosti ili lokalnog nadraživanja na mjestu primjene. Tjelesna masa se bilježi prije ispitivanja i prije završetka (6. dan). Oba uha svakog miša se pregledavaju radi otkrivanja eritema i boduju prema tablici 1. (20 i poglavlje B.4 iz ovog Priloga). Debljina uha se mjeri posebnim mjernim instrumentom (npr. digitalnim mikrometrom ili mjeračem debljine Peacock Dial) prvi dan (prije doze), treći dan (otprilike 48 sati nakon prve doze) i šesti dan. Pored toga, šesti dan se debljina uha može odrediti mjerenjem mase uzorka uha dobivenog probijanjem, što se izvodi nakon humanog usmrćenja. Prekomjerno lokalno nadraživanje kože se označuje bodovima za eriteme ≥ 3 i/ili povećanjem debljine uha za ≥ 25 % na bilo koji dan mjerenja (21) (22). Najviša odabrana doza za glavnu studiju LLNA: BrdU-ELISA je sljedeća niža doza iz serije koncentracija u predprobiranju (vidjeti stavak 18.) koja ne uzrokuje sustavnu toksičnost i/ili prekomjerno lokalno nadraživanje kože. Tablica 1. Bodovanje eritema
|
|
23. |
Pored 25 %-tnog povećanja debljine uha (21)(22), statistički značajno povećanje debljine uha kod tretiranih miševa u odnosu na kontrolne miševe se, također, koristi za određivanje nadražujućih tvari u LLNA (22) (23) (24) (25) (26) (27) (28). Međutim, iako se statistički značajna povećanja debljine uha mogu javiti, ona se posebno ne povezuju s prekomjernim nadraživanjem kada su manja od 25 % (25) (26) (27) (28) (29). |
|
24. |
Sljedeća klinička opažanja mogu ukazivati na sustavnu toksičnost (30) kada se koriste u okviru cjelokupne ocjene te stoga mogu naznačiti najvišu dozu za uporabu u glavnoj LLNA: BrdU-ELISA: promjene u djelovanju živčanog sustava (npr. piloerekcija, ataksija, tremori i grčevi); promjene u ponašanju (npr. agresivnost, promjene u njezi, značajna promjena u stupnju aktivnosti); promjene u disanju (npr. promjene učestalosti i intenziteta disanja kao što su dispneja, zadihanost i hroptanje) i promjene u konzumaciji hrane i vode. Prilikom ocjenjivanja treba uzeti u obzir znakove letargije i/ili nereagiranja, sve kliničke znakove boli i patnje koji nisu blagi ili trenutačni, ili gubitak težine > 5 % od prvog do šestog dana i smrtnost. Životinje koje su pred uginućem ili pokazuju znakove teške boli i patnje trebaju se humano usmrtiti (31). |
Plan pokusa glavne studije
|
25. |
Plan pokusa je sljedeći: — Prvi dan: Pojedinačno identificirati životinje i zabilježiti masu svake životinje i sva klinička opažanja. Primijeniti 25 μl odgovarajuće otopine ispitivane tvari, samog nosača ili pozitivne kontrole (paralelna ili nedavno provedena, ovisno o laboratorijskoj politici uzimajući u obzir stavke 11.-15.) na stražnji dio svakog uha. — Drugi i treći dan: Ponoviti postupak primjene proveden prvog dana. — Četvrti dan: Bez tretiranja. — Peti dan: Intraperitonealno ubrizgavanje 0,5 ml (5 mg/miš) otopine BrdU (10 mg/ml). — Šesti dan: Zabilježiti masu svake životinje i sva klinička opažanja. Otprilike 24 sata (24 h) nakon ubrizgavanja BrdU životinje humano usmrtiti. Izrezati drenažne aurikularne limfne čvorove iz svakog uha i staviti odvojeno u pufer PBS za svaku životinju. Pojedinosti i sheme za identifikaciju i disekciju limfnih čvorova mogu se naći u referenci (17). Za daljnje praćenje lokalne reakcije kože u glavnoj studiji mogu se u protokol studije uključiti dodatni parametri kao što su ocjenjivanje eritema ušiju ili mjerenja debljine uha (dobiveni uređajem za mjerenje debljine ili određivanjem mase uzorka uha pri obdukciji). |
Priprema suspenzije stanica
|
26. |
Suspenzija pojedinačnih stanica limfnih čvorova (LNC) svakog miša, odstranjenih bilateralno, priprema se blagom mehaničkom dezagregacijom kroz žičanu mrežu od nehrđajućeg čelika s otvorima od 200 mikrona ili drugom prihvatljivom tehnikom za dobivanje suspenzije pojedinačne stanice (npr. uporabom plastičnog tučka za jednokratnu uporabu za drobljenje limfnih čvorova, nakon čega slijedi filtriranje kroz najlonsku mrežu s otvorima od 70 mikrona). Postupak pripreme suspenzije LNC je kritičan za ovu analizu te, stoga, svaki izvođač mora prethodno steći tu vještinu. Limfni čvorovi životinja u negativnoj kontroli su mali te je, stoga, s njima važno pažljivo rukovati da ne dođe do umjetnog učinka na vrijednosti SI. U svakom slučaju ciljani obujam suspenzije LNC treba se prilagoditi utvrđenom optimiziranom obujmu (približno 15 ml). Optimizirani obujam temelji se na postizanju prosječne apsorbance negativne kontrolne skupine u rasponu 0,1–0,2. |
Određivanje proliferacije stanica (mjerenje sadržaja BrdU u DNA limfocita)
|
27. |
BrdU se mjeri testom ELISA koristeći trgovački komplet (npr. Roche Applied Science, Mannheim, Njemačka, br. u katalogu 11 647 229 001). Ukratko u jažice mikroploča s ravnim dnom doda se 100 μL suspenzije LNC u tri primjerka. Nakon fiksacije i denaturacije LNC u svaku se jažicu dodaje anti-BrdU protutijelo i omogući reakcija. Potom se anti-BrdU protutijelo ukloni ispiranjem, doda se otopina supstrata i omogući nastanak kromogena. Potom se izmjeri apsorbanca pri 370 nm s referentnom valnom duljinom 492 nm. U svakom slučaju ispitni uvjeti analize moraju biti optimizirani (vidjeti stavak 26.). |
OPAŽANJA
Klinička opažanja
|
28. |
Sve miševe treba pomno opažati najmanje jednom dnevno s obzirom na sve kliničke znakove bilo lokalnog nadraživanja na mjestu primjene ili sustavne toksičnosti. Sva opažanja sustavno se bilježe za svaku životinju. Programi praćenja uključuju kriterije za pravodobno identificiranje miševa koji pokazuju znakove sustavne toksičnosti, prekomjernog lokalnog nadraživanja kože ili korozije kože za eutanaziju (31). |
Tjelesne mase
|
29. |
Kao što je navedeno u stavku 25., pojedinačne tjelesne mase treba mjeriti na početku testa i u vrijeme planiranog usmrćivanja životinja. |
IZRAČUN REZULTATA
|
30. |
Rezultati za svaku tretiranu skupinu su izraženi kao prosječni indeks stimulacije (SI). SI se dobiva dijeljenjem prosječnog indeksa označivanja BrdU po životinji unutar svake skupine tretirane ispitivanom tvari i pozitivne kontrolne skupine s prosječnim indeksom označivanja BrdU za kontrolnu skupinu otopine/nosača. Prosječan SI za kontrolne skupine tretirane nosačem tada iznosi 1. Indeks označivanja BrdU se određuje kako slijedi: indeks označivanja BrdU = (ABSem – ABS blankem) – (ABSref – ABS blankref) pri čemu: em = valna duljina emisije; i ref = referentna valna duljina. |
|
31. |
U postupku odlučivanja rezultat se smatra pozitivnim kada je SI ≥ 1,6 (10). Međutim, kod odlučivanja da se neki granični rezultat (tj. vrijednost SI između 1,6 i 1,9) proglasi pozitivnim može se također koristiti snaga učinka na dozu, statistički značaj i dosljednost reakcija u otapalu/nosaču i pozitivnoj kontroli (3 (6) (32). |
|
32. |
U slučaju graničnog pozitivnog rezultata s vrijednošću SI između 1,6 i 1,9, za potvrđivanje pozitivnog rezultata korisnici mogu, pored vrijednosti SI, uzeti u obzir i dodatne podatke kao što je odnos između doze i reakcije, dokaz sustavne toksičnosti ili prekomjerne nadraženosti i, prema potrebi, statistički značaj (10). Potrebno je također uzeti u obzir razna svojstva ispitivane tvari, uključujući i to ima li strukturne veze s poznatim senzibilizatorima kože, uzrokuje li pretjerano nadraživanje kože kod miševa i prirodu odnosa opažene reakcije na dozu. Ova i druga pitanja detaljno su razmotrena drugdje (4). |
|
33. |
Prikupljanje podataka na razini pojedinačnog miša omogućit će statističku analizu prisutnosti i stupnja odnosa između doze i učinka. Svaka statistička procjena može uključiti ocjenu odnosa između doze i učinka te odgovarajući prilagođene usporedbe ispitnih skupina (npr. skupina s doziranjem u parovima u odnosu na paralelne kontrolne skupine s otapalom/nosačem). Statističke analize mogu uključiti linearnu regresiju ili Williamsov test za ocjenu trendova odnosa doza-učinak i Dunnettov test za usporedbe u parovima. Prilikom odabira prikladne metode statističke analize istraživač treba biti svjestan eventualnih razlika između varijanata kao i drugih problema s tim u vezi, zbog kojih može biti neophodna transformacija podataka ili neparametarska statistička analiza. U svakom slučaju istraživač će možda morati izvršiti izračune SI i statističke analize sa i bez sigurnih točaka podataka (koji se ponekad nazivaju ‚netipične vrijednosti’). |
PODACI I IZVJEŠĆIVANJE
Podaci
|
34. |
Podatke treba sažeti u tabličnom obliku koji pokazuje vrijednosti indeksa označivanja BrdU za pojedinačnu životinju, prosječni indeks označivanja BrdU po životinji za skupinu, s tim povezane pogreške (npr. SD, SEM) i prosječni SI za svaku dozirnu skupinu u odnosu na paralelnu kontrolnu skupinu s otapalom/nosačem. |
Izvješće o ispitivanju
|
35. |
Izvješće o ispitivanju treba sadržavati sljedeće informacije:
|
REFERENCE
|
1. |
OECD (2010.), Skin Sensitisation: Local Lymph Node Assay, Test Guideline No 429, Guidelines for the Testing of Chemicals, OECD, Pariz. Dostupno na: [http://www.oecd.org/env/testguidelines] |
|
2. |
Chamberlain, M. and Basketter, D.A. (1996.), The local lymph node assay: status of validation. Food Chem. Toxicol., 34, str. 999-1002. |
|
3. |
Basketter, D.A., Gerberick, G.F., Kimber, I. and Loveless, S.E. (1996.), The local lymph node assay: A viable alternative to currently accepted skin sensitisation tests. Food Chem. Toxicol., 34, str. 985-997. |
|
4. |
Basketter, D.A., Gerberick, G.F. and Kimber, I. (1998.), Strategies for identifying false positive responses in predictive sensitisation tests. Food Chem. Toxicol., 36, str. 327-33. |
|
5. |
Van Och, F.M.M., Slob, W., De Jong, W.H., Vandebriel, R.J. and Van Loveren, H. (2000.), A quantitative method for assessing the sensitising potency of low molecular weight chemicals using a local lymph node assay: employment of a regression method that includes determination of uncertainty margins. Toxicol., 146, str. 49-59. |
|
6. |
ICCVAM (1999.), The murine local lymph node Assay: A test method for assessing the allergic contact dermatitis potential of chemicals/compounds: The results of an independent peer review evaluation coordinated by the Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program Center for the Evaluation of Alternative Toxicological Methods (NICETAM). NIH Publication No: 99-4494. Research Triangle Park, N.C. Dostupno na: [http://iccvam.niehs.nih.gov/docs/immunotox_docs/llna/llnarep.pdf] |
|
7. |
Dean, J.H., Twerdok, L.E., Tice, R.R., Sailstad, D.M., Hattan, D.G., Stokes, W.S. (2001.), ICCVAM evaluation of the murine local lymph node assay: II. Conclusions and recommendations of an independent scientific peer review panel. Reg. Toxicol. Pharmacol., 34(3), str. 258-273. |
|
8. |
Haneke, K.E., Tice, R.R., Carson, B.L., Margolin, B.H., Stokes, W.S. (2001.), ICCVAM evaluation of the murine local lymph node assay: III. Data analyses completed by the national toxicology program interagency center for the evaluation of alternative toxicological methods. Reg. Toxicol. Pharmacol., 34(3), str. 274-286. |
|
9. |
Sailstad, D.M., Hattan, D., Hill, R.N., Stokes, W.S. (2001.), ICCVAM evaluation of the murine local lymph node assay: I. The ICCVAM review process. Reg. Toxicol. Pharmacol., 34(3), str. 249-257. |
|
10. |
ICCVAM (2010.), ICCVAM Test Method Evaluation Report. Nonradioactive local lymph node assay: BrdU-ELISA Test Method Protocol (LLNA: BrdU-ELISA). NIH Publication No 10-7552A/B. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Dostupno na: [http://iccvam.niehs.nih.gov/methods/immunotox/llna-ELISA/TMER.htm] |
|
11. |
ICCVAM (2009.), Independent Scientific Peer Review Panel Report: Updated validation status of new versions and applications of the murine local lymph node assay: a test method for assessing the allergic contact dermatitis potential of chemicals and products. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Dostupno na: [http://iccvam.niehs.nih.gov/docs/immunotox_docs/LLNAPRPRept2009.pdf] |
|
12. |
Takeyoshi, M., Iida, K., Shiraishi, K. and Hoshuyama, S. (2005.), Novel approach for classifying chemicals according to skin sensitising potency by non-radioisotopic modification of the local lymph node assay. J. Appl. Toxicol., 25, str. 129-134. |
|
13. |
OECD (1992.), Skin Sensitisation, Test Guideline No 406, Guidelines for Testing of Chemicals, OECD, Pariz. Dostupno na: [http://www.oecd.org/env/testguidelines] |
|
14. |
Kreiling, R., Hollnagel, H.M., Hareng, L., Eigler, L., Lee, M.S., Griem, P., Dreessen, B., Kleber, M., Albrecht, A., Garcia, C. and Wendel, A. (2008.), Comparison of the skin sensitising potential of unsaturated compounds as assessed by the murine local lymph node assay (LLNA) and the guinea pig maximization test (GPMT). Food Chem. Toxicol., 46, str. 1896-1904. |
|
15. |
Basketter, D., Ball, N., Cagen, S., Carrilo, J.C., Certa, H., Eigler, D., Garcia, C., Esch, H., Graham, C., Haux, C., Kreiling, R. and Mehling, A. (2009.), Application of a weight of evidence approach to assessing discordant sensitisation datasets: implications for REACH. Reg. Toxicol. Pharmacol., 55, str. 90-96. |
|
16. |
ILAR (1996.), Institute of Laboratory Animal Research (ILAR) Guide for the Care and Use of Laboratory Animals. 7th ed. Washington, DC: National Academies Press. |
|
17. |
ICCVAM (2009.), Recommended Performance Standards: Murine Local Lymph Node Assay. NIH Publication Number 09-7357. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Dostupno na: [http://iccvam.niehs.nih.gov/docs/immunotox_docs/llna-ps/LLNAPerfStds.pdf] |
|
18. |
McGarry, H.F. (2007.), The murine local lymph node assay: regulatory and potency considerations under REACH. Toxicol., 238, str. 71-89. |
|
19. |
Kimber, I., Dearman, R.J., Scholes E.W. and Basketter, D.A. (1994.), The local lymph node assay: developments and applications. Toxicol., 93, str. 13-31. |
|
20. |
OECD (2002.), Acute Dermal Irritation/Corrosion, Test Guideline No 404, Guidelines for Testing of Chemicals, OECD, Pariz. Dostupno na: [http://www.oecd.org/env/testguidelines] |
|
21. |
Reeder, M.K., Broomhead, Y.L., DiDonato, L. and DeGeorge, G.L. (2007.), Use of an enhanced local lymph node assay to correctly classify irritants and false positive substances. Toxicologist, 96, str. 235. |
|
22. |
ICCVAM (2009.), Nonradioactive Murine Local Lymph Node Assay: Flow Cytometry Test Method Protocol (LLNA: BrdU-FC) Revised Draft Background Review Document. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Dostupno na: [http://iccvam.niehs.nih.gov/methods/immunotox/fcLLNA/BRDcomplete.pdf]. |
|
23. |
Hayes, B.B., Gerber, P.C., Griffey, S.S. and Meade, B.J. (1998.), Contact hypersensitivity to dicyclohexylcarbodiimide and diisopropylcarbodiimide in female B6C3F1 mice. Drug Chem. Toxicol., 21, str. 195-206. |
|
24. |
Homey, B., von Schilling, C., Blumel, J., Schuppe, H.C., Ruzicka, T., Ahr, H.J., Lehmann, P. and Vohr, V.W. (1998.), An integrated model for the differentiation of chemical-induced allergic and irritant skin reactions. Toxicol. Appl. Pharmacol., 153, str. 83-94. |
|
25. |
Woolhiser, M.R., Hayes, B.B. and Meade, B.J. (1998.), A combined murine local lymph node and irritancy assay to predict sensitisation and irritancy potential of chemicals. Toxicol. Meth., 8, str. 245-256. |
|
26. |
Hayes, B.B. and Meade, B.J. (1999.), Contact sensitivity to selected acrylate compounds in B6C3F1 mice: relative potency, cross reactivity, and comparison of test methods. Drug. Chem. Toxicol., 22, str. 491-506. |
|
27. |
Ehling, G., Hecht, M., Heusener, A., Huesler, J., Gamer, A.O., van Loveren, H., Maurer, T., Riecke, K., Ullmann, L., Ulrich, P., Vandebriel, R. and Vohr, H.W. (2005.), A European inter- laboratory validation of alternative endpoints of the murine local lymph node assay: first round. Toxicol., 212, str. 60-68. |
|
28. |
Vohr, H.W. and Ahr, H.J. (2005.), The local lymph node assay being too sensitive? Arch. Toxicol., 79, str. 721-728. |
|
29. |
Patterson, R.M., Noga, E. and Germolec D. (2007.), Lack of evidence for contact sensitisation by Pfiesteria extract. Environ. Health Perspect., 115, str. 1023-1028. |
|
30. |
ICCVAM (2009.), Report on the ICCVAM-NICEATM/ECVAM/JaCVAM Scientific Workshop on Acute Chemical Safety Testing: Advancing In Vitro Approaches and Humane Endpoints for Systemic Toxicity Evaluations. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Dostupno na: [http://iccvam.niehs.nih.gov/methods/acutetox/Tox_workshop.htm]. |
|
31. |
OECD (2000.), Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation, Environmental Health and Safety Monograph Series on Testing and Assessment No 19, ENV/JM/MONO(2000)7, OECD, Pariz. Dostupno na: [http://www.oecd.org/env/testguidelines] |
|
32. |
Kimber, I., Hilton, J., Dearman, R.J., Gerberick, G.F., Ryan, C.A., Basketter, D.A., Lea, L., House, R.V., Ladies, G.S., Loveless, S.E. and Hastings, K.L. (1998.), Assessment of the skin sensitisation potential of topical medicaments using the local lymph node assay: An interlaboratory exercise. J. Toxicol. Environ.l Health, 53, str. 563-79. |
|
33. |
OECD (2005.), Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment, Environment, Health and Safety Monograph Series on Testing and Assessment No 34, ENV/JM/MONO(2005)14, OECD, Pariz. Dostupno na: [http://www.oecd.org/env/testguidelines] |
Dodatak 1.
DEFINICIJE
Točnost: stupanj podudarnosti između rezultata ispitne metode i prihvaćenih referentnih vrijednosti. To je mjerilo učinkovitosti ispitne metode i jedan od aspekata relevantnosti. Ovaj se termin često koristi umjesto ‚podudarnosti’ kako bi se označio udio točnih rezultata ispitne metode (33).
Referentna tvar: tvar koja uzrokuje ili ne uzrokuje preosjetljivost i koja se koristi kao standard za usporedbu s ispitivanom tvari. Referentna tvar treba imati sljedeće svojstva: i. dosljedni i pouzdani izvor(i); ii. strukturna i funkcionalna sličnost s razredom tvari koje se ispituju; iii. poznate fizikalno-kemijske značajke; iv. popratni podaci o poznatim učincima; i v. poznata učinkovitost u okviru željene reakcije.
Lažno negativna tvar: tvar koja je ispitnom metodom netočno određena kao negativna ili neaktivna kada je u stvari pozitivna ili aktivna (33).
Lažno pozitivna tvar: tvar koja je ispitivanjem netočno određena kao pozitivna ili aktivna kada je u stvari negativna ili neaktivna (33).
Opasnost: potencijal štetnog učinka na zdravlje ili okoliš. Štetni učinak se javlja samo ako je stupanj izloženosti dovoljno visok.
Ponovljivost između laboratorija: mjera u kojoj različiti kvalificirani laboratoriji koji koriste isti protokol i ispituju istu tvar, mogu proizvesti kvalitativno i kvantitativno slične rezultate. Ponovljivost između laboratorija određuje se prije i tijekom validacijskog postupka i pokazuje u kojoj se mjeri neko ispitivanje može uspješno prenijeti iz jednog laboratorija u drugi, također navedena kao međulaboratorijska ponovljivost (33).
Ponovljivost u laboratoriju: određivanje u kojoj mjeri stručno osoblje u okviru istog laboratorija može uspješno ponoviti rezultate koristeći određeni protokol u različitim trenucima. Također se navodi kao unutarlaboratorijska ponovljivost (33).
Netipična vrijednost: netipična vrijednost je zapažanje koje značajno odstupa od ostalih vrijednosti u nasumičnom uzorku populacije.
Osiguranje kvalitete: postupak upravljanja pri kojem pojedinci neovisni od osoba koje provode ispitivanje, ocjenjuju ispunjavanje standarda laboratorijskog ispitivanja, zahtjeve i postupke vođenja evidencije te točnost prijenosa podataka.
Pouzdanost: mjera u kojoj se ispitna metoda može ponoviti unutar i između laboratorija tijekom vremena uporabom istog protokola. Ocjenjuje se izračunavanjem unutarlaboratorijske i međulaboratorijske ponovljivosti (33).
Preosjetljivost kože: imunološki proces koji se javlja kada je osjetljivi pojedinac lokalno izložen kemijskom alergenu koji uzrokuje imunosnu reakciju kože koja može dovesti do kontaktne preosjetljivosti.
Indeks stimulacije (SI): izračunana vrijednost za ocjenjivanje potencijala preosjetljivosti kože koju može uzrokovati ispitivana tvar, koja je omjer proliferacije u tretiranim skupinama i paralelnoj kontrolnoj skupini s nosačem.
Ispitivana tvar (navodi se također kao i ispitivana kemikalija): svaka tvar ili smjesa koja je ispitana ovom metodom.”
”