
|
13/Sv. 033 |
HR |
Službeni list Europske unije |
3 |
32008R0440
|
L 142/1 |
SLUŽBENI LIST EUROPSKE UNIJE |
30.05.2008. |
UREDBA KOMISIJE (EZ) br. 440/2008
od 30. svibnja 2008.
o utvrđivanju ispitnih metoda u skladu s Uredbom (EZ) br. 1907/2006 Europskog parlamenta i Vijeća o registraciji, evaluaciji, autorizaciji i ograničavanju kemikalija (REACH)
(Tekst značajan za EGP)
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Uredbu (EZ) br. 1907/2006 od 18. prosinca 2006. Europskog parlamenta i Vijeća o registraciji, evaluaciji, autorizaciji i ograničavanju kemikalija (REACH) i osnivanju Europske agencije za kemikalije te o izmjeni Direktive 1999/45/EZ i stavljanju izvan snage Uredbe Vijeća (EEZ) br. 793/93 i Uredbe Komisije (EZ) br. 1488/94 kao i Direktive Vijeća 76/769/EEZ i direktiva Komisije 91/155/EEZ, 93/67/EEZ, 93/105/EZ i 2000/21/EZ (1), a posebno njezin članak 13. stavak 3.,
budući da:
|
(1) |
U skladu s Uredbom (EZ) br. 1907/2006, na razini Zajednice treba usvojiti ispitne metode u svrhu ispitivanja tvari kad su ta ispitivanja potrebna za dobivanje podataka o unutarnjim svojstvima tvari. |
|
(2) |
U Prilogu V. Direktivi Vijeća 67/548/EEZ od 27. lipnja 1967. o usklađivanju zakona i ostalih propisa o razvrstavanju, pakiranju i označivanju opasnih tvari (2) utvrđene su metode za određivanje fizikalno-kemijskih svojstava, toksičnosti i ekotoksičnosti tvari i pripravaka. Prilog V. Direktivi 67/548/EEZ brisao se Direktivom 2006/121/EZ Europskog parlamenta i Vijeća s učinkom od 1. lipnja 2008. |
|
(3) |
Ispitne metode sadržane u Prilogu V. Direktivi 67/548/EEZ treba ugraditi u ovu Uredbu. |
|
(4) |
Ovom se Uredbom ne isključuje primjena drugih ispitnih metoda pod uvjetom da se primjenjuju u skladu s člankom 13. stavkom 3. Uredbe 1907/2006. |
|
(5) |
U oblikovanju ispitnih metoda u potpunosti treba uzeti u obzir načela zamjene, smanjenja broja i usavršavanja postupaka u kojima se rabe životinje, posebno kad postanu dostupne valjane metode za zamjenu, smanjenje broja ili usavršavanje pokusa na životinjama. |
|
(6) |
Odredbe ove Uredbe u skladu su s mišljenjem Odbora osnovanog na temelju članka 133. Uredbe (EZ) br. 1907/2006, |
DONIJELA JE OVU UREDBU:
Članak 1.
Ispitne metode koje se trebaju primjenjivati u svrhe Uredbe 1907/2006/EZ utvrđuju se u Prilogu ovoj Uredbi.
Članak 2.
Komisija prema potrebi preispituje ispitne metode obuhvaćene ovom Uredbom s ciljem zamjene, smanjenja broja ili usavršavanja pokusa na kralježnjacima.
Članak 3.
Sva upućivanja na Prilog V. Direktivi 67/548/EEZ smatraju se upućivanjima na ovu Uredbu.
Članak 4.
Ova Uredba stupa na snagu sljedećeg dana od dana objave u Službenom listu Europske unije.
Ona se primjenjuje od 1. lipnja 2008.
Sastavljeno u Bruxellesu 30. svibnja 2008.
Za Komisiju
Stavros DIMAS
Član Komisije
(1) SL L 396, 30.12.2006., str. 1. kako je ispravljena u SL L 136, 29.5.2007., str. 3.
(2) SL L 196, 16.8.1967., str. 1. Direktiva kako je zadnje izmijenjena Direktivom 2006/121/EZ Europskog parlamenta i Vijeća (SL L 396, 30.12.2006., str. 850. kako je ispravljena u SL L 136, 29.5.2007., str. 281.
PRILOG
DIO A: METODE ZA ODREĐIVANJE FIZIKALNO-KEMIJSKIH SVOJSTAVA
SADRŽAJ
|
A.1. |
TEMPERATURA TALJENJA/SKRUĆIVANJA |
|
A.2. |
TEMPERATURA VRENJA |
|
A.3. |
RELATIVNA GUSTOĆA |
|
A.4. |
TLAK PARE |
|
A.5. |
POVRŠINSKA NAPETOST |
|
A.6. |
TOPLJIVOST U VODI |
|
A.8. |
KOEFICIJENT RAZDJELJENJA |
|
A.9. |
PLAMIŠTE |
|
A.10. |
ZAPALJIVOST (KRUTINE) |
|
A.11. |
ZAPALJIVOST (PLINOVI) |
|
A.12. |
ZAPALJIVOST (U DODIRU S VODOM) |
|
A.13. |
PIROFORNA SVOJSTVA KRUTINA I TEKUĆINA |
|
A.14. |
EKSPLOZIVNA SVOJSTVA |
|
A.15. |
TEMPERATURA SAMOZAPALJENJA (TEKUĆINE I PLINOVI) |
|
A.16. |
RELATIVNA TEMPERATURA SAMOZAPALJENJA ZA KRUTINE |
|
A.17. |
SVOJSTVA OKSIDACIJE (KRUTINE) |
|
A.18. |
OPĆI PROSJEK MOLEKULSKE TEŽINE I RASPODJELA MOLEKULSKE TEŽINE POLIMERA |
|
A.19. |
SADRŽAJ MALE MOLEKULSKE TEŽINE U POLIMERIMA |
|
A.20. |
PONAŠANJE POLIMERA U VODI - OTAPANJE/EKSTRAKCIJA |
|
A.21. |
SVOJSTVA OKSIDACIJE (TEKUĆINE) |
A.1. TEMPERATURA TALJENJA/SKRUĆIVANJA
1. METODA
Većina opisanih metoda zasniva se na Smjernici za ispitivanje OECD-a (1). Temeljna načela navedena su u referencama (2) i (3).
1.1. UVOD
Opisane metode i uređaji koristit će se za određivanje temperature taljenja tvari, bez ikakvih ograničenja s obzirom na stupanj njihove čistoće.
Izbor metode ovisi o naravi tvari koja se ispituje. Stoga će ograničavajući čimbenik biti činjenica može li se tvar fino usitniti lako, teško ili nikako.
Za neke je tvari primjerenije određivati temperature skrućivanja ili očvršćivanja te su u ovu metodu uključene i norme za njihovo određivanje.
Ako, zbog posebnih svojstava tvari, niti jedan od navedenih parametara nije prikladan za mjerenje, može biti prikladno izmjeriti točku stinjavanja.
1.2. DEFINICIJE I JEDINICE
Temperatura taljenja definira se kao temperatura kod koje dolazi do faznog prijelaza iz krutog u tekuće stanje pod atmosferskim tlakom, a ta temperatura idealno odgovara temperaturi skrućivanja.
Kako do faznog prijelaza mnogih tvari dolazi unutar temperaturnog područja, često se definira kao područje taljenja.
Pretvaranje jedinica (K u °C)
t = T – 273,15
|
t |
: |
temperatura u Celzijusima, stupanj Celzijusa (°C) |
|
T |
: |
Termodinamička temperatura, kelvin (K) |
1.3. REFERENTNE TVARI
Referentne tvari nije potrebno upotrebljavati kod svakog istraživanja nove tvari. One bi trebale služiti prvenstveno za povremenu provjeru primijenjene metode i omogućiti usporedbu s rezultatima dobivenim drugim metodama.
Neke tvari za kalibraciju navedene su u referencama (4).
1.4. NAČELO ISPITNE METODE
Određuje se temperatura (temperaturno područje) faznog prijelaza iz krutog u tekuće stanje ili iz tekućeg u kruto stanje. U praksi, kad se uzorak ispitivane tvari zagrijava/hladi pod atmosferskim tlakom, određuju se temperature početne faze taljenja/skrućivanja i konačne faze taljenja/skrućivanja. Opisano je pet vrsta metoda, poimence: metoda kapilare, metode vrućih faza, određivanja temperature skrućivanja, metode termičke analize i određivanje točke stinjavanja (metoda razvijena za naftne derivate).
U određenim slučajevima možda je prikladnije mjeriti temperaturu skrućivanja nego temperaturu taljenja.
1.4.1. Metoda kapilare
1.4.1.1. Uređaji za mjerenje temperature taljenja u kupki
Mala količina fino usitnjene tvari stavlja se u kapilarnu cjevčicu i čvrsto sabije. Cjevčica se zagrijava zajedno s termometrom, a kad taljenje zaista započne, porast temperature podešava se na manje od oko 1 K/min. Utvrđuju se početna i konačna temperatura taljenja.
1.4.1.2. Uređaji za mjerenje temperature taljenja u metalnom bloku
Kao što je opisano u 1.4.1.1., osim što se kapilarna cjevčica i termometar stavljaju u zagrijani metalni blok i mogu se promatrati kroz otvore u bloku.
1.4.1.3. Detekcija pomoću fotoćelija
Uzorak u kapilarnoj cjevčici automatski se zagrijava u metalnom cilindru. Zraka svjetlosti usmjerava se kroz tvar, putem otvora u cilindru, na precizno kalibriranu fotoćeliju. Optička svojstva većine tvari taljenjem se mijenjaju iz mutnih u prozirne. Jakost svjetlosti koja dolazi na fotoćeliju povećava se i šalje signal za zaustavljanje digitalnom pokazivaču na kojem se temperatura očitava na otporničkom termometru izvedenom od platine koji se nalazi u komori za zagrijavanje. Ova metoda nije prikladna za neke jako obojene tvari.
1.4.2. Vruće faze
1.4.2.1. Koflerov vrući štap
Koflerov vrući štap ima dva komada metala različite termičke provodljivosti, koji se zagrijavaju električki, s tim da je štap izveden na način da je temperaturni gradijent cijelom svojom dužinom gotovo linearan. Temperatura vrućeg štapa može se kretati u području od 283 do 573 K zahvaljujući spravi za očitavanje temperature koja je posebno konstruirana za takav štap, a koja sadrži klizni pokazivač sa strelicom na skali. Kako bi se odredila temperatura taljenja, tvar se postavlja u tankom sloju izravno na površinu vrućega štapa. Za nekoliko sekundi razvija se oštra crta koja razdvaja tekuću od krute faze. Temperatura u visini razdjelne crte očitava se podešavanjem pokazivača na tu crtu.
1.4.2.2. Mikroskop za taljenje
Za određivanje temperatura taljenja vrlo malih količina materijala u uporabi je nekoliko mikroskopskih vrućih faza. U većini se vrućih faza temperatura mjeri osjetljivim termoparom, iako se ponekad koriste živini termometri. Tipični uređaj za mjerenje temperature taljenja mikroskopskom vrućom fazom ima komoru za zagrijavanje koja sadrži metalnu pločicu na koju se postavlja uzorak na stakalcu. Na sredini metalne pločice nalazi se otvor koji omogućava prolaz svjetla sa zrcala za osvjetljavanje na mikroskopu. Kad je u upotrebi, komora se zatvara staklenom pločom kako zrak ne bi ulazio u područje na kojem se nalazi uzorak.
Zagrijavanje uzorka regulirano je reostatom. Za vrlo precizna mjerenja optički anizotropnih tvari može se koristiti polarizirano svjetlo.
1.4.2.3. Metoda meniska
Ova se metoda koristi posebno za poliamide.
Temperatura na kojoj dolazi do pomaka meniska silikonskog ulja, zatvorenog između vruće faze i staklenog poklopca postavljenog iznad uzorka poliamida koji se ispituje, određuje se vizualno.
1.4.3. Metoda određivanja temperature skrućivanja
Uzorak se stavlja u posebnu epruvetu i zatim u uređaj za određivanje temperature skrućivanja. Uzorak se lagano miješa tijekom cijelog postupka hlađenja, a temperatura se mjeri u odgovarajućim intervalima. Čim temperatura postane stalna u nekoliko očitavanja, ta se temperatura (uz ispravak greške termometra) bilježi kao temperatura skrućivanja.
Obvezno treba izbjegavati pretjerano hlađenje kako bi se održala ravnoteža između krute i tekuće faze.
1.4.4. Termička analiza
1.4.4.1. Diferencijalna termička analiza (DTA)
Ovom se tehnikom bilježi razlika između temperature tvari i temperature referentnog materijala kao funkcije temperature, dok su tvar i referentni materijal podvrgnuti istom kontroliranom temperaturnom programu. Kad na uzorku dođe do prijelaza koji obuhvaća promjenu entalpije, ta se promjena pokazuje endotermnim (taljenje) ili egzotermnim (skrućivanje) odstupanjem od osnovne crte zabilježene temperature.
1.4.4.2. Diferencijalna pretražna kalorimetrija (DSC)
Ovom se tehnikom bilježi razlika između ulaza energije u tvar i u referentni materijal, kao funkcije temperature, dok su tvar i referentni materijal podvrgnuti istom kontroliranom temperaturnom programu. Ta energija predstavlja energiju koja je potrebna kako bi se između tvari i referentnog materijala postigla nulta temperaturna razlika. Kad na uzorku dođe do prijelaza koji obuhvaća promjenu entalpije, ta se promjena pokazuje endotermnim (taljenje) ili egzotermnim (skrućivanje) odstupanjem od osnovne crte zabilježenog protoka topline.
1.4.5. Točka stinjavanja
Ova je metoda razvijena za primjenu kod naftnih derivata i pogodna je za primjenu kod naftnih tvari niskih temperatura taljenja.
Nakon predgrijavanja, uzorak se hladi određenom brzinom i karakteristike protoka ispituju se u intervalima od 3 K. Najniža temperatura na kojoj se uočava gibanje tvari bilježi se kao točka stinjavanja.
1.5. KRITERIJI KVALITETE
Primjenljivost i točnost različitih metoda koje se rabe za određivanje temperature taljenja/područja taljenja navedene su u sljedećoj tablici:
TABLICA: PRIMJENLJIVOST METODA
A. Metode kapilare
|
Metoda mjerenja |
Tvari koje je moguće fino usitniti |
Tvari koje je teško fino usitniti |
Temperaturno područje |
Procijenjena točnost (1) |
Postojeće norme |
|
Uređaji za mjerenje temperature taljenja u kupki |
da |
samo na neke |
273 do 573 K |
± 0,3 K |
JIS K 0064 |
|
Mjerenje temperature taljenja metalnim blokom |
da |
samo na neke |
293 do > 573 K |
± 0,5 K |
ISO 1218 (E) |
|
Detekcija pomoću fotoćelija |
da |
nekoliko uz primjenu uređaja |
253 do 573 K |
± 0,5 K |
|
B. Metode vrućih faza i metode skrućivanja
|
Metoda mjerenja |
Tvari koje je moguće fino usitniti |
Tvari koje je teško fino usitniti |
Temperaturno područje |
Procijenjena točnost (2) |
Postojeće norme |
|
Koflerov vrući štap |
da |
ne |
283 do > 573 K |
± 1 K |
ANSI/ASTM D 3451-76 |
|
Mikroskop za taljenje |
da |
samo na neke |
273 do > 573 K |
± 0,5 K |
DIN 53736 |
|
Metoda meniska |
ne |
posebno za poliamide |
293 do > 573 K |
± 0,5 K |
ISO 1218 (E) |
|
Temperatura skrućivanja |
da |
da |
223 do 573 K |
± 0,5 K |
Npr. BS 4695 |
C. Termička analiza
|
Metoda mjerenja |
Tvari koje je moguće fino usitniti |
Tvari koje je teško fino usitniti |
Temperaturno područje |
Procijenjena točnost (3) |
Postojeće norme |
|
Diferencijalna termička analiza |
da |
da |
173 do 1 273 K |
do 600 K ± 0,5 K do 1 273 K ± 2,0 K |
ASTM E 537-76 |
|
Diferencijalna pretražna kalorimetrija |
da |
da |
173 do 1 273 K |
do 600 K ± 0,5 K do 1 273 K ± 2,0 K |
ASTM E 537-76 |
D. Točka stinjavanja
|
Metoda mjerenja |
Tvari koje je moguće usitniti |
Tvari koje je teško fino usitniti |
Temperaturno područje |
Procijenjena točnost (4) |
Postojeće norme |
|
Točka stinjavanja |
Za naftne derivate i naftne tvari |
Za naftne derivate i naftne tvari |
223 do 323 K |
± 0,3 K |
ASTM D 97-66 |
1.6. OPIS METODA
Postupci gotovo svih ispitnih metoda opisani su međunarodnim i nacionalnim normama (vidjeti Dodatak 1.).
1.6.1. Metode s kapilarnom cjevčicom
Kad su izložene polaganom rastu temperature, za fino usitnjene tvari obično vrijede faze taljenja prikazane na slici 1.
Slika 1.

Tijekom određivanja temperature taljenja, temperature se bilježe na početku taljenja i u konačnoj fazi.
1.6.1.1. Uređaji za mjerenje temperature taljenja u kupki
Slika 2. prikazuje standardizirani uređaj za mjerenje temperature taljenja izrađen od stakla (JIS K 0064); sve dimenzije izražene su u milimetrima.
Slika 2.
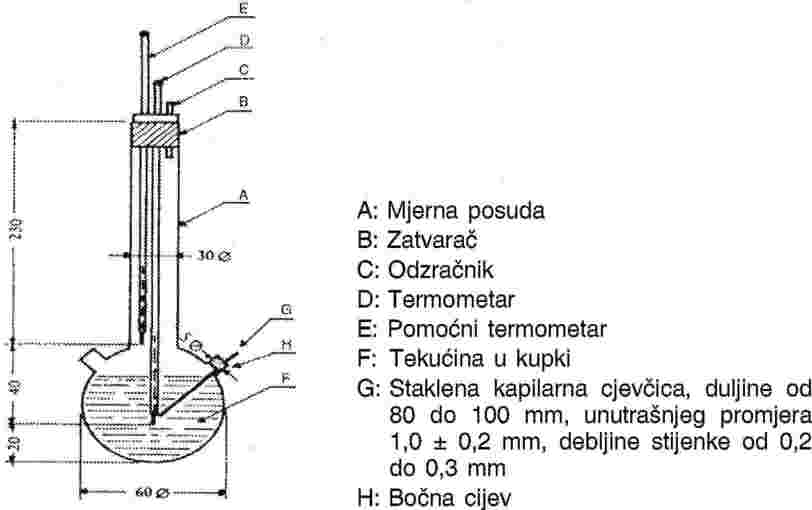
Tekućina u kupki:
Treba odabrati odgovarajuću tekućinu. Izbor tekućine ovisi o temperaturi taljenja koja se određuje, npr. tekući parafin za temperature taljenja do 473 K, silikonsko ulje za temperature taljenja do 573 K.
Za temperature taljenja iznad 523 K može se upotrijebiti mješavina koja se sastoji od tri dijela sumporne kiseline i dva dijela kalijevog sulfata (u masenom omjeru). Ako se upotrebljava takva mješavina, treba poduzeti odgovarajuće mjere opreza.
Termometar:
Treba koristiti samo termometre koji zadovoljavaju uvjete sljedećih ili ekvivalentnih normi:
ASTM E 1-71, DIN 12770, JIS K 8001.
Postupak:
Suha tvar fino se usitni u tarioniku, stavlja se u kapilarnu cjevčicu koja je stopljena na jednom kraju, na način da je nakon čvrstog sabijanja razina punjenja otprilike 3 mm. Kako bi se dobio jednolično sabijen uzorak, kapilarnu cjevčicu treba spustiti s visine od otprilike 700 mm kroz staklenu cijev vertikalno na pokazno staklo.
Napunjena kapilarna cjevčica postavlja se u posudu na način da srednji dio kuglice termometra ispunjene živom dodiruje kapilarnu cjevčicu u dijelu u kojem je smješten uzorak. Kapilarna cjevčica obično se uvodi u uređaj oko 10 K ispod temperature taljenja.
Tekućina u posudi zagrijava se na način da temperatura raste otprilike 3 K/min. Tekućinu treba miješati. Na oko 10 K ispod očekivane temperature taljenja, brzina porasta temperature podešava se do maksimalno 1 K/min.
Izračun:
Izračun temperature taljenja je sljedeći:
T = TD + 0,00016 (TD - TE) n
gdje je:
|
T |
= |
ispravljena temperatura tališta u K |
|
TD |
= |
očitanje temperature na termometru D u K |
|
TE |
= |
očitanje temperature na termometru E u K |
|
n |
= |
broj stupnjeva žive na termometru D u pari koja se pojavljuje na površini |
1.6.1.2. Uređaj za određivanje temperature taljenja u metalnom bloku
Uređaj:
Dijelovi uređaja:
|
— |
cilindrični metalni blok čiji je gornji dio šupalj i oblikuje komoru (vidjeti sliku 3.), |
|
— |
metalni čep, s dva ili više otvora, za umetanje cjevčica u metalni blok, |
|
— |
sustav za zagrijavanje metalnog bloka, koji se uspostavlja primjerice električnim otpornikom ugrađenim u kućištu bloka, |
|
— |
reostat za regulaciju ulaza energije, ako se rabi električno grijanje, |
|
— |
četiri prozora od termootpornog stakla na bočnim stijenkama komore, međusobno dijametralno raspoređena pod pravim kutem. Ispred jednog od tih prozora ugrađen je okular za promatranje kapilarne cjevčice. Druga tri prozora služe za osvjetljavanje unutrašnjosti kućišta pomoću svjetiljki. |
|
— |
kapilarna cjevčica od termootpornog stakla zatvorena na jednom kraju (vidjeti 1.6.1.1.). |
Termometar:
Vidjeti norme spomenute u 1.6.1.1. Mogu se primijeniti i termoelektrični mjerni uređaji usporedive točnosti.
Slika 3.
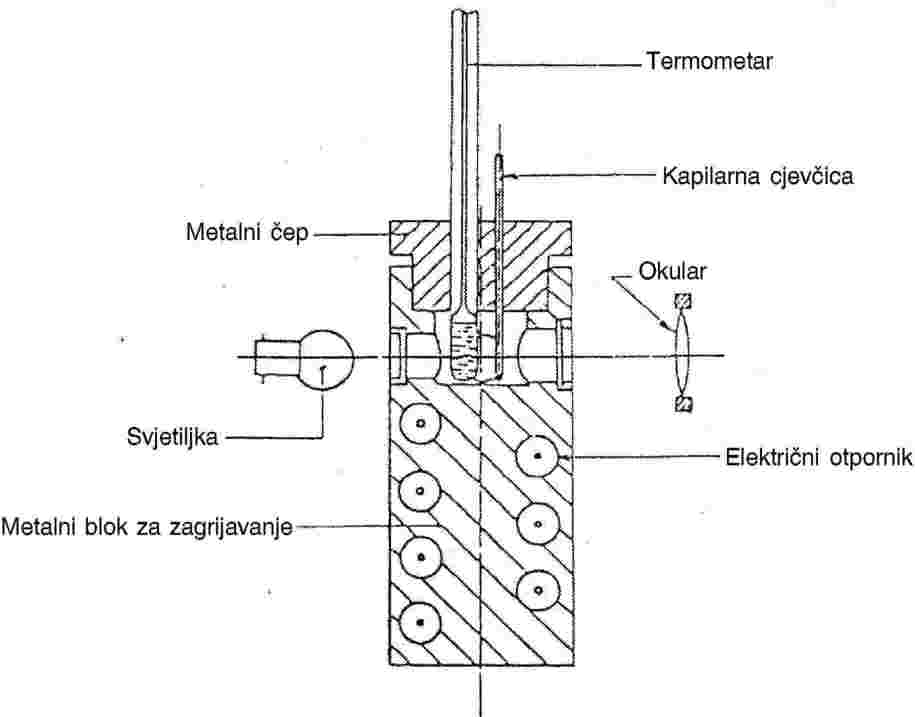
1.6.1.3. Detekcija pomoću fotoćelije
Uređaj i postupak:
Uređaj se sastoji od metalne komore s automatiziranim sustavom zagrijavanja. Tri kapilare pune se kako je opisano u 1.6.1.1. i postavljaju u peć.
Kalibracija uređaja postiže se u nekoliko lineranih povećanja temperature, a odgovarajući porast temperature ugađa se na prethodno odabranu stalnu linearnu brzinu, zapisivači pokazuju stvarnu temperaturu peći i temperaturu tvari u kapilarnim cjevčicama.
1.6.2. Vruće faze
1.6.2.1. Koflerov vrući štap
Vidjeti Dodatak.
1.6.2.2. Mikroskop za taljenje
Vidjeti Dodatak.
1.6.2.3. Metoda meniska (poliamidi)
Vidjeti Dodatak.
Brzina zagrijavanja u postupku određivanja temperature tališta trebala bi biti manja od 1 K/min.
1.6.3. Metode za određivanje temperature skrućivanja
Vidjeti Dodatak.
1.6.4. Termička analiza
1.6.4.1. Diferencijalna termička analiza
Vidjeti Dodatak.
1.6.4.2. Diferencijalna pretražna kalorimetrija
Vidjeti Dodatak.
1.6.5. Određivanje točke stinjavanja
Vidjeti Dodatak.
2. PODACI
U nekim slučajevima potrebna je korekcija termometra.
3. IZVJEŠĆIVANJE
U izvješću o ispitivanju treba, ako je moguće, navesti sljedeće informacije:
|
— |
primijenjena metoda, |
|
— |
precizna specifikacija tvari (identitet i nečistoće) i prethodne mjere pročišćivanja ako su poduzete, |
|
— |
procjena točnosti. |
Kao temperatura taljenja u izvješću se navodi srednja vrijednost najmanje dvije izmjere koje se nalaze u području procijenjene točnosti.
Ako je razlika između temperatura u početnoj i konačnoj fazi taljenja unutar granica točnosti metode, temperatura u konačnoj fazi uzima se kao temperatura taljenja; u protivnom u izvješću se navode obje temperature.
Ako se tvar razloži ili sublimira prije nego je postignuta temperatura taljenja, u izvješće se unosi temperatura na kojoj je taj učinak opažen.
U izvješće treba unijeti sve podatke i napomene relevantne za tumačenje rezultata, posebno s obzirom na nečistoće i fizikalno stanje tvari.
4. REFERENCE
|
(1) |
OECD, Paris, 1981, Test Guideline 102, Decision of the Council C(81) 30 final. |
|
(2) |
IUPAC, B. Le Neindre, B. Vodar, eds. Experimental thermodynamics, Butterworths, London 1975, vol. II, str. 803-834. |
|
(3) |
R. Weissberger ed.: Technique of organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Interscience Publ., New York, 1959, vol. I, Part I, Chapter VII. |
|
(4) |
IUPAC, Physicochemical measurements: Catalogue of reference materials from national laboratories, Pure and applied chemistry, 1976, vol. 48, str. 505-515. |
Dodatak
Dodatne tehničke pojedinosti moguće je naći npr. u sljedećim normama:
1. Metode kapilara
1.1. Uređaj za određivanje temperature taljenja u kupki
|
ASTM E 324–69 |
Standard test method for relative initial and final melting points and the melting range of organic chemicals |
|
BS 4634 |
Method for the determination of melting point and/or melting range |
|
DIN 53181 |
Bestimmung des Schmelzintervalles von Harzen nach Kapilarverfarehn |
|
JIS K 00–64 |
Testing methods for melting point of chemical products |
1.2. Uređaj za određivanje temperature taljenja u metalnom bloku
|
DIN 53736 |
Visuelle Bestimmung der Schmelztemperatur von teilkristallinen Kunststoffen |
|
ISO 1218 (E) |
Plastics – polyamides – determination of „melting point” |
2. Vruće faze
2.1. Koflerov vrući štap
|
ANSI/ASTM D 3451–76 |
Standard recommended practices for testing polymeric powder coatings |
2.2. Mikroskop za taljenje
|
DIN 53736 |
Visuelle Bestimmung der Schmelztemperatur von teilkristallinen Kunststoffen |
2.3. Metoda meniska (poliamidi)
|
ISO 1218 (E) |
Plastics – polyamides – determination of „melting point” |
|
ANSI/ASTM D 2133–66 |
Standard specification for acetal resin injection moulding and extrusion materials |
|
NF T 51–050 |
Resines de polyamides. Détermination du „point de fusion” méthode du menisque |
3. Metode određivanja temperature skrućivanja
|
BS 4633 |
Method for the determination of crystallizing |
|
BS 4695 |
Method for Determination of Melting Point of petroleum wax (Cooling Curve) |
|
DIN 51421 |
Bestimmung des Gefrierpunktes von Flugkraftstoffen, Ottokraftstoffen und Motorenbenzolen |
|
ISO 2207 |
Cires de pétrole: détermination de la température de figeage |
|
DIN 53175 |
Bestimmung des Erstarrungspunktes von Fettsiiuren |
|
NF T 60–114 |
Point de fusion des paraffines |
|
NF T 20–051 |
Méthode de détermination du point de cristallisation (point de congélation) |
|
ISO 1392 |
Method for the determination of the freezing point |
4. Termička analiza
4.1. Diferencijalna termička analiza
|
ASTM E 537–76 |
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis |
|
ASTM E 473–85 |
Standard definitions of terms relating to thermal analysis |
|
ASTM E 472–86 |
Standard practice for reporting thermoanalytical data |
|
DIN 51005 |
Thermische Analyse, Begriffe |
4.2. Diferencijalna pretražna kalorimetrija
|
ASTM E 537–76 |
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis |
|
ASTM E 473–85 |
Standard definitions of terms relating to thermal analysis |
|
ASTM E 472–86 |
Standard practice for reporting thermoanalytical data |
|
DIN 51005 |
Thermische Analyse, Begriffe |
5. Određivanje točke stinjavanja
|
NBN 52014 |
Echantillonnage et analyse des produits du pétrole: Point de trouble et point d’écoulement limite – Monsterneming en ontleding van aardolieproducten: Troebelingspunt en vloeipunt |
|
ASTM D 97-66 |
Standard test method for pour point of petroleum oils |
|
ISO 3016 |
Petroleum oils – Determination of pour point |
A.2. TEMPERATURA VRENJA
1. METODA
Većina opisanih metoda zasniva se na Smjernici za ispitivanje OECD-a (1). Temeljna načela navedena su u referencama (2) i (3).
1.1. UVOD
Ovdje opisane metode i uređaji mogu se primijeniti na tekućine i tvari s niskim talištem, pod uvjetom da kod njih ne dolazi do kemijske reakcije ispod temperature vrenja (na primjer: auto-oksidacija, premještanje grupa, degradacija itd.). Metode se mogu primijeniti na čiste i nečiste tekuće tvari.
Naglasak se stavlja na metode kod kojih se primjenjuje detekcija pomoću fotoćelije i termičke analize jer te metode omogućuju određivanje ne samo temperatura taljenja nego i temperatura vrenja. Osim toga, mjerenja se mogu obavljati automatski.
Prednost „dinamičke metode” je i u tome što pruža mogućnost određivanja tlaka pare bez nužne korekcije temperature vrenja prema standardnom tlaku (101,325 kPa) jer se standardan tlak tijekom mjerenja može održavati pomoću manostata.
Napomene:
Utjecaj nečistoća na određivanje temperature vrenja uvelike ovisi o naravi nečistoće. Ako u uzorku postoje hlapljive nečistoće, što bi moglo utjecati na rezultat, tvar se može pročistiti.
1.2. DEFINICIJE I JEDINICE
Standardna temperatura vrenja definira se kao temperatura kod koje je tlak pare tekućine 101,325 kPa.
Ako se temperatura vrenja ne mjeri kod standardnog atmosferskog tlaka, zavisnost tlaka pare o temperaturi može se opisati Clausius-Clapeyronovom jednadžbom:

gdje je:
|
p |
= |
tlak pare tvari u paskalima |
|
Δ Hv |
= |
njezina toplina isparavanja u J mol-1 |
|
R |
= |
univerzalna molarna plinska konstanta = 8,314 J mol-1 K-1 |
|
T |
= |
termodinamička temperatura u K |
Temperatura vrenja iskazuje se s obzirom na tlak okoline tijekom mjerenja.
Pretvaranje jedinica
Tlak (jedinice: kPa)
|
100 kPa |
= |
1 bar = 0,1 Mpa („bar” je još dozvoljen, ali se ne preporuča) |
|
133 Pa |
= |
1 mm Hg = 1 Torr (jedinice „mm Hg” i „Torr” nisu dozvoljene) |
|
1 atm |
= |
standardna atmosfera = 101 325 Pa (jedinica „atm” nije dozvoljena) |
Temperatura (jedinice: K)
t = T – 273,15
|
t |
: |
temperatura u Celzijusima, stupanj Celzijusa (°C) |
|
T |
: |
Termodinamička temperatura, kelvin (K) |
1.3. REFERENTNE TVARI
Referentne tvari nije potrebno rabiti kod svakog istraživanja nove tvari. One bi trebale služiti prvenstveno za povremenu provjeru primijenjene metode i omogućiti usporedbu s rezultatima dobivenim drugim metodama.
Neke tvari za kalibraciju mogu se pronaći u metodama navedenim u Dodatku.
1.4. NAČELO ISPITNE METODE
Pet metoda za određivanje temperature vrenja (područja vrenja) temelji se na mjerenju temperature vrenja, preostale dvije temelje se na termičkoj analizi.
1.4.1. Određivanje pomoću ebuliometra
Ebuliometri su prvobitno konstruirani za određivanje molekulske težine podizanjem temperature vrenja, ali su prikladni i za točna mjerenja temperature vrenja. Vrlo jednostavan uređaj opisan je u normi ASTM D 1120-72 (vidjeti Dodatak). U tom uređaju tekućina se zagrijava u uvjetima ravnoteže kod atmosferskog tlaka dok ne zavri.
1.4.2. Dinamička metoda
Ova se metoda zasniva na mjerenju temperature na kojoj dolazi do ponovne kondenzacije pare, pomoću odgovarajućeg termometra u refluksu za vrijeme vrenja. U ovoj metodi tlak se može mijenjati.
1.4.3. Određivanje temperature vrenja metodom destilacije
Ova se metoda zasniva na destilaciji tekućine i mjerenju temperature na kojoj dolazi do ponovne kondenzacije pare, te određivanju količine destilata.
1.4.4. Metoda prema Siwoloboffu
Uzorak se zagrijava u epruveti koja je uronjena u tekućinu toplinske kupke. Zataljena kapilarna cjevčica, koja ima zračni mjehurić u donjem dijelu, uroni se u epruvetu s uzorkom.
1.4.5. Detekcija fotoćelijom
Primjenjujući načelo prema Siwoloboffu, automatsko foto-električno mjerenje vrši se pomoću mjehurića koji se dižu.
1.4.6. Diferencijalna termička analiza
Ovom se tehnikom bilježi razlika između temperature tvari i temperature referentnog materijala kao funkcije temperature, dok su tvar i referentni materijal podvrgnuti istom kontroliranom temperaturnom programu. Kad na uzorku dođe do prijelaza koji obuhvaća promjenu entalpije, ta se promjena pokazuje endotermnim odstupanjem (vrenje) od osnovne crte zabilježene temperature.
1.4.7. Diferencijalna pretražna kalorimetrija
Ovom se tehnikom bilježi razlika između ulaza energije u tvar i u referentni materijal, kao funkcije temperature, dok su tvar i referentni materijal podvrgnuti istom kontroliranom temperaturnom programu. Ta energija predstavlja energiju koja je potrebna kako bi se između tvari i referentnog materijala postigla nulta temperaturna razlika. Kad na uzorku dođe do prijelaza koji obuhvaća promjenu entalpije, ta se promjena pokazuje endotermnim odstupanjem (vrenje) od osnovne crte zabilježenog protoka topline.
1.5. KRITERIJI KVALITETE
Primjenljivost i točnost različitih metoda koje se rabe za određivanje temperature vrenja/područja vrenja navedene su u tablici 1.
Tablica 1.:
Usporedba metoda
|
Metoda mjerenja |
Procijenjena točnost |
Postojeća norma |
|
Ebuliometar |
ASTM D 1120-72 (5) |
|
|
Dinamička metoda |
± 0,5 K (do 600 K) (6) |
|
|
Postupak destilacije (područje vrenja) |
± 0,5 K (do 600 K) |
ISO/R 918, DIN 53171, BS 4591/71 |
|
Prema Siwoloboffu |
± 2 K (do 600 K) (6) |
|
|
Detekcija pomoću fotoćelije |
± 0,3 K (do 373 K) (6) |
|
|
Diferencijalna termička kalorimetrija |
± 0,5 K (do 600 K) ± 2,0 K (do 1 273 K) |
ASTM E 537-76 |
|
Diferencijalna pretražna kalorimetrija |
± 0,5 K (do 600 K) ± 2,0 K (do 1 273 K) |
ASTM E 537-76 |
1.6. OPIS METODA
Postupci nekih ispitnih metoda opisani su u međunarodnim i nacionalnim normama (vidjeti Dodatak).
1.6.1. Ebuliometar
Vidjeti Dodatak.
1.6.2. Dinamička metoda
Vidjeti ispitnu metodu A.4. za određivanje tlaka pare.
Bilježi se temperatura vrenja koja se opaža kod primijenjenog tlaka od 101,325 kPa.
1.6.3. Postupak destilacije (područje vrenja)
Vidjeti Dodatak.
1.6.4. Metoda prema Siwoloboffu
Uzorak se zagrijava u uređaju za mjerenje temperature taljenja u epruveti promjera približno 5 mm (Slika 1.).
Slika 1. prikazuje tip standardiziranog uređaja za određivanje temperature taljenja i vrenja (izrađenog od stakla, sve dimenzije izražene su u milimetrima).
Slika 1.
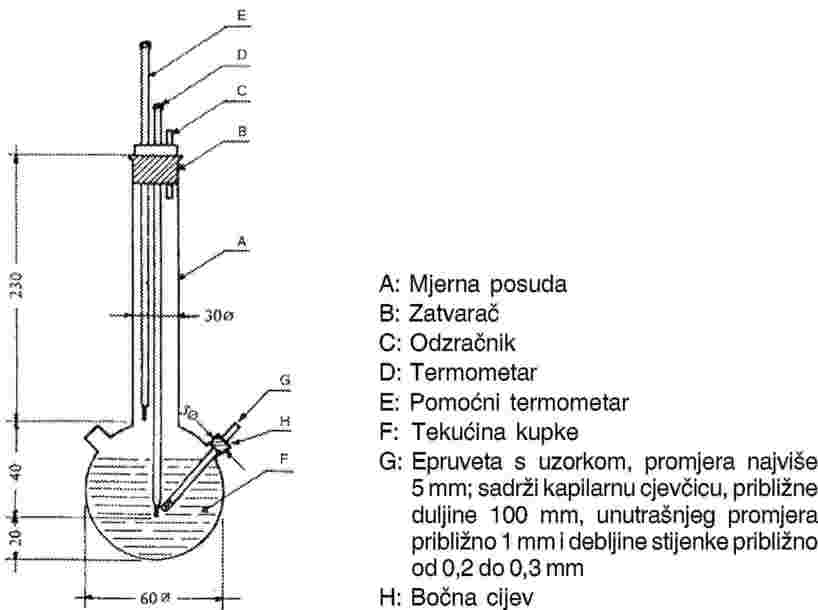
Kapilarna cjevčica (kapilara za određivanje vrelišta), zataljena oko 1 cm iznad donjeg kraja, stavlja se u epruvetu s uzorkom. Ispitivana tvar dodaje se do razine na kojoj je zataljeni dio kapilare ispod površine tekućine. Epruveta s uzorkom koja sadrži kapilaru za određivanje vrelišta pričvršćena je za termometar gumenom trakom ili je učvršćena pomoću bočnog nosača (vidjeti sliku 2).
|
Slika 2. Načelo prema Siwoloboffu |
Slika 3. Izmijenjeno načelo |
|
|
|
Tekućina kupke odabire se prema temperaturi vrenja. Na temperaturama do 573 K, može se koristiti silikonsko ulje. Tekući parafin može se koristiti do 473 K. Tekućina u posudi zagrijava se na način da temperatura najprije raste otprilike 3 K/min. Tekućinu treba miješati. Na oko 10 K ispod očekivane temperature vrenja zagrijavanje se smanjuje na način da temperatura raste brzinom manjom od 1 K/min. Približavanjem temperaturi vrenja, iz kapilare za određivanje vrelišta brzo počinju izlaziti mjehurići.
Temperatura vrenja je temperatura na kojoj se, kod momentalnog hlađenja, niz mjehurića zaustavlja, a tekućina u kapilari naglo počinje rasti. Odgovarajuće očitanje na termometru temperatura je vrelišta dotične tvari.
Kod izmijenjenog načela (Slika 3.), temperatura vrenja određuje se u kapilari za određivanje temperature taljenja. Kapilara je izdužena u tanki vrh duljine oko 2 cm (a) i u nju se usisa mala količina uzorka. Otvoreni kraj te kapilare zatvara se kad dođe do taljenja na način da se na kraju stvara mali zračni mjehurić. Tijekom zagrijavanja u uređaju za mjerenje temperature taljenja (b), zračni se mjehurić širi. Temperatura vrenja odgovara temperaturi kod koje uzorak tvari dostiže razinu površine tekućine kupke (c).
1.6.5. Detekcija pomoću fotoćelije
Uzorak se zagrijava u kapilarnoj cjevčici unutar zagrijavanog metalnog bloka.
Zraka svjetlosti usmjerava se odgovarajućim otvorima u bloku kroz tvar na precizno kalibriranu fotoćeliju.
Tijekom porasta temperature uzorka pojedinačni mjehurići zraka izlaze iz kapilare za određivanje vrelišta. Kad je dostignuta temperatura vrenja, broj mjehurića jako se poveća. To uzrokuje promjenu jakosti svjetla koju bilježi fotoćelija i šalje signal za zaustavljanje pokazivaču na kojem se očitava temperatura na otporničkom termometru s platinom koji se nalazi u bloku.
Ova je metoda posebno korisna jer omogućuje određivanje temperatura od sobne temperature prema dolje sve do 253,15 K (- 20 °C) bez ikakvih izmjena na uređaju. Uređaj samo treba uroniti u posudu za hlađenje.
1.6.6. Termička analiza
1.6.6.1. Diferencijalna termička analiza
Vidjeti Dodatak.
1.6.6.2. Diferencijalna pretražna kalorimetrija
Vidjeti Dodatak.
2. PODACI
Kod malih odstupanja od standardnog tlaka (maksimalno ± 5 kPa), temperature vrenja normaliziraju se na Tn pomoću sljedeće jednadžbe Sidneya Younga:
Tn = T + (fT × Δp)
gdje je:
|
Δp |
= |
(101,325 – p) (obratiti pozornost na znak) |
|
P |
= |
izmjereni tlak u kPa |
|
fT |
= |
brzina promjene temperature vrenja u zavisnosti od tlaka u K/kPa |
|
T |
= |
izmjerena temperatura vrenja u K |
|
Tn |
= |
temperatura vrenja ispravljena na standardni tlak u K |
Za mnoge tvari, faktori korekcije temperature, fT, i jednadžbe za njihovo usklađivanje obuhvaćene su gore navedenim međunarodnim i nacionalnim normama.
Na primjer, u metodi prema normi DIN 53171 spominju se sljedeće grube korekcije za otapala koja su sadržana u bojama:
Tablica 2.
Faktori korekcije temperature fT
|
Temperatura T (K) |
Korektivni faktor fT (K/kPa) |
|
323,15 |
0,26 |
|
348,15 |
0,28 |
|
373,15 |
0,31 |
|
398,15 |
0,33 |
|
423,15 |
0,35 |
|
448,15 |
0,37 |
|
473,15 |
0,39 |
|
498,15 |
0,41 |
|
523,15 |
0,4 |
|
548,15 |
0,45 |
|
573,15 |
0,47 |
3. IZVJEŠĆIVANJE
U izvješću o ispitivanju treba, ako je moguće, navesti sljedeće informacije:
|
— |
primijenjena metoda, |
|
— |
precizna specifikacija tvari (identitet i nečistoće) i prethodne mjere pročišćavanja ako su poduzete, |
|
— |
procjena točnosti. |
Kao temperatura vrenja u izvješću se navodi srednja vrijednost najmanje dvije izmjere koje se nalaze u području procijenjene točnosti (vidjeti tablicu 1.).
Treba navesti izmjerene temperature vrenja i njihovu srednju vrijednost, a podatke o tlaku ili tlakovima kod kojih su mjerenja izvršena navesti u kPa. Tlak bi trebao biti blizak standardnom atmosferskom tlaku.
U izvješće treba unijeti sve podatke i napomene relevantne za tumačenje rezultata, posebno s obzirom na nečistoće i fizikalno stanje tvari.
4. REFERENCE
|
(1) |
OECD, Paris, 1981, Test Guideline 102, Decision of the Council C(81) 30 final. |
|
(2) |
IUPAC, B. Le Neindre, B. Vodar, eds. Experimental thermodynamics, Butterworths, London 1975, vol. II. |
|
(3) |
R. Weissberger edition: Technique of organic chemistry, Physical methods of organic chemistry, Third Edition, Interscience Publ., New York, 1959, vol. I, Part I, Chapter VIII. |
Dodatak
Dodatne tehničke pojedinosti moguće je naći npr. u sljedećim normama:
1. Ebuliometar
|
1.1. |
Uređaji za mjerenje temperature taljenja u kupki |
|
ASTM D 1120-72 |
Standard test method for boiling point of engine anti-freezes |
2. Postupak destilacije (područje vrenja)
|
ISO/R 918 |
Test Method for Distillation (Distillation Yield and Distillation Range) |
|
BS 4349/68 |
Method for determination of distillation of petroleum products |
|
BS 4591/71 |
Method for the determination of distillation characteristics |
|
DIN 53171 |
Losungsmittel fur Anstrichstoffe, Bestimmung des Siedeverlaufes |
|
NF T 20-608 |
Distillation: détermination du rendement et de l’intervalle de distillation |
3. Diferencijalna termička analiza i diferencijalna pretražna kalorimetrija
|
ASTM E 537-76 |
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis |
|
ASTM E 473-85 |
Standard definitions of terms relating to thermal analysis |
|
ASTM E 472-86 |
Standard practice for reporting thermoanalytical data |
|
DIN 51005 |
Thermische Analyse: Begriffe |
A.3. RELATIVNA GUSTOĆA
1. METODA
Opisane metode zasnivaju se na Smjernici za ispitivanje OECD-a (1). Temeljna načela navedena su u referenci (2).
1.1. UVOD
Opisane metode za određivanje relativne gustoće mogu se koristiti za krute i za tekuće tvari, bez ikakvih ograničenja s obzirom na stupanj njihove čistoće. Rabe se različite metode navedene u tablici 1.
1.2. DEFINICIJE I JEDINICE
Relativna gustoća D20 4 krutina ili tekućina omjer je mase volumena tvari koja se ispituje, određene na 20 °C, i mase istog volumena vode, određene na 4 °C. Relativna gustoća nema jedinice.
Gustoća, ρ, neke tvari kvocijent je mase, m, i njezinog volumena, v.
Gustoća, ρ, u SI mjernom sustavu iskazuje se u kg/m3.
1.3. REFERENTNE TVARI (1)(3)
Referentne tvari nije potrebno rabiti kod svakog istraživanja nove tvari. One bi trebale služiti prvenstveno za povremenu provjeru primijenjene metode i omogućiti usporedbu s rezultatima dobivenim drugim metodama.
1.4. NAČELO METODA
Koriste se četiri kategorije metoda.
1.4.1. Metode uzgona
1.4.1.1. Hidrometar (za tekuće tvari)
Zadovoljavajuće točno i brzo određivanje gustoće može se postići plutajućim hidrometrima, pomoću kojih se gustoća neke tekućine može utvrditi prema dubini uranjanja očitanjem na stupnjevanoj ljestvici.
1.4.1.2. Hidrostatska vaga (za tekuće i krute tvari)
Za određivanje gustoće uzorka može se iskoristiti razlika između težine ispitivanog uzorka mjerene na zraku i u odgovarajućoj tekućini (npr. vodi).
Za krutine, izmjerena gustoća reprezentativna je samo za određeni uzorak koji je korišten. Za određivanje gustoće tekućina, tijelo poznatog volumena, v, važe se prvo na zraku, a zatim u tekućini.
1.4.1.3. Metoda uranjanja tijela (za tekuće tvari) (4)
U ovoj metodi, gustoća tekućine određuje se iz razlike između rezultata vaganja tekućine prije i nakon uranjanja tijela poznatog volumena u tekućinu koja se ispituje.
1.4.2. Metode pomoću piknometra
Za krutine ili tekućine mogu se koristiti piknometri raznih oblika i poznatih volumena.
Gustoća se izračunava iz razlike u težini punog i praznog piknometra i njegovog poznatog volumena.
1.4.3. Usporedba sa zrakom pomoću piknometra (za krutine)
Gustoća krutine u bilo kojem obliku može se mjeriti na sobnoj temperaturi usporedbom plinova piknometrom. Volumen tvari mjeri se na zraku ili u inertnom plinu u cilindru varijabilnog kalibriranog volumena. Za izračun gustoće uzima se jedno mjerenje mase nakon završetka mjerenja volumena.
1.4.4. Oscilirajući denzitometar (5)(6)(7)
Gustoća tekućine može se izmjeriti oscilirajućim denzitometrom. Mehanički oscilator konstruiran u obliku U-cijevi vibrira rezonantnom frekvencijom oscilatora koja ovisi o njegovoj masi. Uvođenjem uzorka mijenja se rezonantna frekvencija oscilatora. Uređaj mora biti kalibriran pomoću dvije tekućine poznatih gustoća. Poželjno je odabrati tvari čije su gustoće u rasponu područja koje se mjeri.
1.5. KRITERIJI KVALITETE
Primjenljivost različitih metoda koje se rabe za određivanje relativne gustoće navedene su u tablici.
1.6. OPIS METODA
Norme koje se navode kao primjeri, u kojima se mogu pronaći dodatne tehničke pojedinosti, navedene su u Dodatku.
Ispitivanja treba provoditi na 20 °C, uz najmanje dva mjerenja.
2. PODACI
Vidjeti norme.
3. IZVJEŠĆIVANJE
U izvješću o ispitivanju treba, ako je moguće, navesti sljedeće informacije:
|
— |
primijenjena metoda, |
|
— |
precizna specifikacija tvari (identitet i nečistoće) i prethodne mjere pročišćivanja ako su poduzete. |
Relativna gustoća 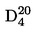 u izvješću se bilježi kako je utvrđeno u 1.2., zajedno s fizikalnim stanjem mjerene tvari.
u izvješću se bilježi kako je utvrđeno u 1.2., zajedno s fizikalnim stanjem mjerene tvari.
U izvješće treba unijeti sve informacije i napomene relevantne za tumačenje rezultata, posebno s obzirom na nečistoće i fizikalno stanje tvari.
Tablica:
Primjenljivost metoda
|
Metoda mjerenja |
Gustoća |
Najveći mogući dinamički viskozitet |
Postojeće norme |
|||
|
krutina |
tekućina |
|||||
|
|
da |
5 Pa s |
ISO 387, ISO 649-2, NF T 20-050 |
||
|
|
|
|
|
||
|
da |
|
|
ISO 1183 (A) |
||
|
|
da |
5 Pa s |
ISO 901 i 758 |
||
|
|
da |
20 Pa s |
DIN 53217 |
||
|
|
|
|
ISO 3507 |
||
|
da |
|
|
ISO 1183 (B), NF T 20-053 |
||
|
|
da |
500 Pa s |
ISO 758 |
||
|
da |
|
|
DIN 55990 dio 3. DIN 53243 |
||
|
|
da |
5 Pa s |
|
||
4. REFERENCE
|
(1) |
OECD, Paris, 1981, Testing Guideline 109, Decision of the Council C(81) 30 final. |
|
(2) |
R. Weissberger ed., Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Chapter IV, Interscience Publ., New York, 1959, vol. I, Part 1. |
|
(3) |
IUPAC, Recommended reference materials for realization of physico-chemical properties, Pure and applied chemistry, 1976, vol. 48, str. 508. |
|
(4) |
Wagenbreth, H., Die Tauchkugel zur Bestimmung der Dichte von Flüssigkeiten, Technisches Messen tm, 1979, vol.ll, str. 427-430. |
|
(5) |
Leopold, H., Die digitale Messung von Flüssigkeiten, Elektronik, 1970, vol. 19, str. 297-302. |
|
(6) |
Baumgarten, D., Füllmengenkontrolle bei vorgepackten Erzeugnissen -Verfahren zur Dichtebestimmung bei flüssigen Produkten und ihre praktische Anwendung, Die Pharmazeutische Industrie, 1975, vol. 37, str. 717 -726. |
|
(7) |
Riemann, J., Der Einsatz der digitalen Dichtemessung im Brauereilaboratorium, Brauwissenschaft, 1976, vol. 9, str. 253-255. |
Dodatak
Dodatne tehničke pojedinosti moguće je naći npr. u sljedećim normama:
1. Metode uzgona
1.1. Hidrometar
|
DIN 12790, ISO 387 |
Hydrometer; general instructions |
|
DIN 12791 |
Part I: Density hydrometers; construction, adjustment and use Part II: Density hydrometers; standardised sizes, designation Part III: Use and test |
|
ISO 649-2 |
Laboratory glassware: Density hydrometers for general purpose |
|
NF T 20-050 |
Chemical products for industrial use – Determination of density of liquids – Areometric method |
|
DIN 12793 |
Laboratory glassware: range find hydrometers |
1.2. Hidrostatska vaga
Za krute tvari
|
ISO 1183 |
Method A: Methods for determining the density and relative density of plastics excluding cellular plastics |
|
NF T 20-049 |
Chemical products for industrial use – Determination of the density of solids other than powders and cellular products – Hydrostatic balance method |
|
ASTM-D-792 |
Specific gravity and density of plastics by displacement |
|
DIN 53479 |
Testing of plastics and elastomers; determination of density |
Za tekuće tvari
|
ISO 901 |
ISO 758 |
|
DIN 51757 |
Testing of mineral oils and related materials; determination of density |
|
ASTM D 941-55, ASTM D 1296-67 i ASTM D 1481-62 |
|
|
ASTM D 1298 |
Density, specific gravity or API gravity of crude petroleum and liquid petroleum products by hydrometer method |
|
BS 4714 |
Density, specific gravity or API gravity of crude petroleum and liquid petroleum products by hydrometer method |
1.3. Metoda uronjenog tijela
|
DIN 53217 |
Testing of paints, varnishes and similar coating materials; determination of density; immersed body method |
2. Metode piknometrom
2.1. Za tekuće tvari
|
ISO 3507 |
Pycnometers |
|
ISO 758 |
Liquid chemical products; determination of density at 20 °C |
|
DIN 12797 |
Gay-Lussac pycnometer (for non-volatile liquids which are not too viscous) |
|
DIN 12798 |
Lipkin pycnometer (for liquids with a kinematic viscosity of less than l00. 10-6 m2 s-1 at 15 °C) |
|
DIN 12800 |
Sprengel pycnometer (for liquids as DIN 12798) |
|
DIN 12801 |
Reischauer pycnometer (for liquids with a kinematic viscosity of less than l00. 10-6 m2 s-1 at 15 °C applicable in particular also to hydrocarbons and aqueous solutions as well as to liquids with higher vapour pressure, approximately 1 bar at 90 °C) |
|
DIN 12806 |
Hubbard pycnometer (for viscous liquids of all types which do not have too high a vapour pressure, in particular also for paints, varnishes and bitumen) |
|
DIN 12807 |
Bingham pycnometer (for liquids, as in DIN 12801) |
|
DIN 12808 |
Jaulmes pycnometer (in particular for ethanol – water mixture) |
|
DIN 12809 |
Pycnometer with ground-in thermometer and capillary side tube (for liquids which are not too viscous) |
|
DIN 53217 |
Testing of paints, varnishes and similar products; determination of density by pycnometer |
|
DIN 51757 |
Point 7: Testing of min eral oils and related materials; determination of density |
|
ASTM D 297 |
Section 15: Rubber products – chemical analysis |
|
ASTM D 2111 |
Method C: Halogenated organic compounds |
|
BS 4699 |
Method for determination of specific gravity and density of petroleum products (graduated bicapillary pycnometer method) |
|
BS 5903 |
Method for determination of relative density and density of petroleum products by the capillary – stoppered pycnometer method |
|
NF T 20-053 |
Chemical products for industrial use – Determination of density of solids in powder and liquids – Pyknometric method |
2.2. Za krute tvari
|
ISO 1183 |
Method B: Methods for determining the density and relative density of plastics excluding cellular plastics. |
|
NF T 20-053 |
Chemical products for industrial use – Determination of density of solidsin powder and liquids – Pyknometric method |
|
DIN 19683 |
Determination of the density of soils |
3. Usporedba sa zrakom pomoću piknometra
|
DIN 55990 |
Part 3: Prüfung von Anstrichstoffen und ähnlichen Beschichrungsstoffen; Pulverlack; Bestimmung der Dichte |
|
DIN 53243 |
Anstrichstoffe; Chlorhaltige Polymere; Prüfung |
A.4. TLAK PARE
1. METODA
Većina opisanih metoda zasniva se na Smjernici za ispitivanje OECD-a (1). Temeljna načela navedena su u referencama (2) i (3).
1.1. UVOD
Prije provođenja ovog ispitivanja korisno je za tvar koja se ispituje raspolagati preliminarnim podacima o strukturi, temperaturi taljenja i temperaturi vrenja.
Ne postoji jedinstveni postupak mjerenja koji bi bio primjenljiv na cijelo područje tlakova pare. Stoga se preporuča nekoliko metoda za mjerenje tlaka pare od < 10-4 do 105 Pa.
Nečistoće obično imaju utjecaja na tlak pare, i to do mjere koja uvelike ovisi o vrsti nečistoće.
Ako u uzorku postoje hlapljive nečistoće, što bi moglo utjecati na rezultat, tvar se može pročistiti. Isto tako može biti prikladno navesti tlak pare za tehničke materijale.
Kod nekih metoda koje su ovdje opisane koriste se uređaji s metalnim dijelovima; to treba uzeti u obzir kad se ispituju korozivne tvari.
1.2. DEFINICIJE I JEDINICE
Tlak pare neke tvari definira se kao tlak zasićenja iznad krute ili tekuće tvari. U termodinamičkoj ravnoteži, tlak pare čiste tvari isključivo je funkcija temperature.
Treba koristiti jedinicu pascal (Pa) koja se za tlak koristi u SI mjernom sustavu.
U prošlosti su se koristile sljedeće jedinice s pripadajućim faktorima pretvorbe:
|
1 Torr (= 1 mm Hg) |
= 1,333 × 102 Pa |
|
1 atmosfera |
= 1,013 × 105 Pa |
|
1 bar |
= 105 Pa |
Jedinica za temperaturu u SI sustavu je kelvin (K).
Univerzalna molarna plinska konstanta R je 8,314 J mol-1 K-1.
Zavisnost tlaka pare o temperaturi opisana je Clausius-Clapeyronovom jednadžbom:

gdje je:
|
p |
= |
tlak pare tvari u paskalima |
|
ΔΗν |
= |
njezina toplina isparavanja u Jmol-1 |
|
R |
= |
univerzalna molarna plinska konstanta u Jmol-1 K-1 |
|
T |
= |
termodinamička temperatura u K |
1.3. REFERENTNE TVARI
Referentne tvari nije potrebno upotrebljavati kod svakog istraživanja nove tvari. One bi trebale služiti prvenstveno za povremenu provjeru primijenjene metode i omogućiti usporedbu s rezultatima dobivenim drugim metodama.
1.4. NAČELO ISPITNIH METODA
Za određivanje tlaka pare predlaže se sedam metoda koje se primjenjuju u različitim područjima tlaka pare. Kod svake metode tlak pare određuje se na raznim temperaturama. U ograničenom temperaturnom području, logaritam tlaka pare čiste tvari linearna je funkcija recipročne temperature.
1.4.1. Dinamička metoda
Dinamičkom metodom mjeri se temperatura vrenja koja pripada određenom tlaku.
Preporučeno područje:
103 do 105 Pa.
Ova se metoda preporuča i za određivanje standardne temperature vrenja i korisna je za tu svrhu do temperature od 600 K.
1.4.2. Statička metoda
Kod statičkog postupka, u termodinamičkoj ravnoteži, tlak pare uspostavljen u zatvorenom sustavu određuje se kod određene temperature. Ta je metoda prikladna za jednokomponentne i višekomponentne krutine i tekućine.
Preporučeno područje:
10 do 105 Pa.
Ova se metoda može koristiti i u području 1 do 10 Pa, uz potreban oprez.
1.4.3. Izoteniskop
Ova standardizirana metoda također je statička metoda, ali obično nije prikladna za višekomponentne sustave. Dodatne informacije dostupne su u metodi D-2879-86 norme ASTM.
Preporučeno područje:
100 do 105 Pa.
1.4.4. Metoda efuzije: vaganje tlaka pare
Količina tvari koja u jedinici vremena napusti ćeliju kroz otvor poznate veličine određuje se u takvim uvjetima vakuuma da je povrat tvari u ćeliju zanemariv (npr. mjerenjem pulsa koji nastaje na osjetljivoj vagi vaganjem mlaza pare ili mjerenjem gubitka težine).
Preporučeno područje:
10-3 do 1 Pa.
1.4.5. Metoda efuzije: gubitkom težine ili skupljanjem isparenog dijela
Ova se metoda temelji na procjeni mase ispitivane tvari koja u jedinici vremena istječe iz Knudsenove ćelije (4) u obliku pare, kroz mikrootvor u uvjetima ultra-vakuuma. Masa pare može se dobiti određivanjem gubitka mase ćelije ili kondenziranjem pare na niskoj temperaturi i određivanjem količine hlapljive tvari primjenom kromatografske analize. Tlak pare izračunava se primjenom Hertz-Knudsenove jednadžbe.
Preporučeno područje:
10-3 do 1 Pa.
1.4.6. Metoda zasićenjem plina
Mlaz inertnog nosivog plina usmjeri se preko tvari na način da postane zasićen parom te tvari. Količina materijala koju nosi poznata količina nosivog plina može se izmjeriti skupljanjem u odgovarajuću posudu ili procijeniti izravnom analitičkom tehnikom. Dobiveni se rezultat zatim koristi za izračun tlaka pare kod zadane temperature.
Preporučeno područje:
10-4 do 1 Pa.
Ova se metoda može koristiti i u području od 1 do 10 Pa, uz potreban oprez.
1.4.7. Vrtnja rotora
U uređaju s rotorom koji se vrti, mjerni element ustvari je mala čelična kuglica koja lebdi u magnetskom polju i vrti se velikom brzinom. Tlak plina utvrđuje se prema tlakom uvjetovanom usporavanju čelične kuglice.
Preporučeno područje:
10-4 do 0,5 Pa.
1.5. KRITERIJI KVALITETE
Različite metode određivanja tlaka pare uspoređuju se s obzirom na primjenljivost, ponovljivost, mjernu obnovljivost, područje mjerenja, postojeću normu. To je prikazano u sljedećoj tablici:
Tablica:
Kriteriji kvalitete
|
Metoda mjerenja |
Tvari |
Procijenjena ponovljivost (7) |
Procijenjena mjerna obnovljivost (7) |
Preporučeno područje |
Postojeća norma |
|||
|
krutina |
tekućina |
|||||||
|
s niskim talištem |
da |
do 25 % |
do 25 % |
103 Pa do 2 × 103 Pa |
– |
||
|
|
|
|
1 do 5 % |
1 do 5 % |
2 × 103 Pa do 105 Pa |
– |
||
|
da |
da |
5 do 10 % |
5 do 10 % |
10 Pa do 105 Pa (8) |
NFT 20-048 (5) |
||
|
da |
da |
5 do 10 % |
5 do 10 % |
102 Pa do 105 Pa |
ASTM-D 2879-86 |
||
|
da |
da |
5 do 20 % |
5 do 50 % |
10-3 Pa do 1 Pa |
NFT 20-047 (6) |
||
|
da |
da |
10 do 30 % |
– |
10-3 Pa do 1 Pa |
– |
||
|
da |
da |
10 do 30 % |
do 50 % |
10-4 Pa do 1 Pa (8) |
– |
||
|
da |
da |
10 do 20 % |
– |
10-4 Pa do 0,5 Pa |
– |
||
1.6. OPIS METODA
1.6.1. Dinamičko mjerenje
1.6.1.1. Uređaj
Tipični mjerni uređaj sastoji se od staklene ili metalne posude za vrenje s prigrađenim hladnjakom (Slika 1.), opreme za mjerenje temperature i opreme za regulaciju i mjerenje tlaka. Tipični mjerni uređaj prikazan na slici izrađen je od vatrostalnog stakla i sastoji se od pet dijelova:
Velika cijev djelomično dvostrukih stijenki sastoji se od brušene ovojne spojke, hladnjaka, rashladne posude i ulaznog otvora.
Stakleni cilindar s „crpkom” Cottrell ugrađen je na dio cijevi u kojem dolazi do vrenja i ima grubu površinu od lomljenog stakla kako bi se izbjeglo „poskakivanje” u postupku vrenja.
Temperatura se mjeri odgovarajućim temperaturnim osjetnikom (npr. otpornički termometar, termopar s plaštom) uronjenim u uređaj do točke mjerenja (br. 5 na slici 1.) kroz odgovarajući ulazni otvor (npr. muški ubrušeni spoj).
Izvedeni su potrebni priključci na opremu za regulaciju i mjerenje tlaka.
Balon, koji ima ulogu puferskog spremnika, spojen je na mjerni uređaj pomoću kapilarne cijevi.
Posuda za vrenje zagrijava se grijaćim elementom (npr. uložnim grijačem) koji se umeće u stakleni uređaj s donje strane. Potrebna jačina zagrijavanja postavlja se i regulira preko termopara.
Potrebni vakuum između 102 Pa i približno 105 Pa osigurava se vakuum crpkom.
Odgovarajući ventil koristi se za mjerenje zraka ili dušika za regulaciju tlaka (područje mjerenja približno 102 do 105 Pa) i ventilaciju.
Tlak se mjeri manometrom.
1.6.1.2. Postupak mjerenja
Tlak pare mjeri se određivanjem temperature vrenja uzorka na raznim specificiranim tlakovima između približno 103 i 105Pa. Stabilna temperatura pod stalnim tlakom pokazuje da je dostignuta temperatura vrenja. Ovom metodom ne mogu se mjeriti tvari koje se pjene.
Tvar se stavlja u čistu suhu ispitnu posudu. Krutine koje se ne mogu fino usitniti mogu predstavljati problem, što je ponekad moguće riješiti zagrijavanjem plašta za hlađenje. Kad je posuda napunjena, uređaj se nepropusno zatvori na prirubnici i tvar se otplinjuje. Zatim se postavlja najniži željeni tlak i uključuje zagrijavanje. Istodobno, temperaturni osjetnik priključuje se na pisač.
Ravnoteža je postignuta kad se kod stalnog tlaka bilježi stalna temperatura. Posebnu pozornost treba obratiti na sprečavanje poskakivanja tijekom vrenja. Osim toga, na hladnjaku mora doći do potpune kondenzacije. Kod određivanja tlaka pare krutina s niskim talištem treba voditi računa da se izbjegne začepljenje kondenzatora.
Nakon što je zabilježena točka ravnoteže, namješta se veći tlak. Postupak se nastavlja na taj način dok se ne postigne 105 Pa (sveukupno približno 5 do 10 mjernih točaka). Za provjeru, točke ravnoteže treba ponoviti i kod smanjivanja tlaka.
1.6.2. Statičko mjerenje
1.6.2.1. Uređaj
Uređaj se sastoji od posude za uzorak, sustava za hlađenje i grijanje koji služi za regulaciju temperature uzorka i mjerenje temperature. Uređaj također obuhvaća instrumente za namještanje i mjerenje tlaka. Osnovna načela rada prikazana su na slikama 2.a i 2.b.
Komora s uzorkom (Slika 2.a) omeđena je s jedne strane odgovarajućim vakuum ventilom. S druge strane prigrađena je U-cijev koja sadrži odgovarajući fluid za mjerenje tlaka. Jedan kraj U-cijevi grana se na vakuum crpku, bocu s dušikom ili ventil za ventilaciju, i manometar.
Umjesto U-cijevi može se upotrijebiti mjerač tlaka s pokazivačem tlaka (Slika 2.b).
Za regulaciju temperature uzorka, posuda s uzorkom zajedno s ventilom i U-cijevi ili mjeračem tlaka postavlja se u kupku koja se drži na stalnoj temperaturi od ± 0,2 K. Temperatura se mjeri na vanjskoj stijenci posude s uzorkom ili u samoj posudi.
Uzvodno od vakuumske crpke predviđen je prihvat i hlađenje pare koja se odvodi iz uređaja.
U metodi 2.a tlak pare tvari mjeri se posredno pomoću nultog pokazivača. Pri tomu se uzima u obzir činjenica da se kod velikih promjena temperatura gustoća fluida u U-cijevi mijenja.
Za upotrebu kao nulti pokazivači za U-cijevi, u zavisnosti od područja tlaka i kemijskog ponašanja ispitivane tvari, pogodni su sljedeći fluidi: silikonski fluidi, ftalati. Ispitivana tvar ne smije se primjetno otapati u fluidu U-cijevi niti s njom reagirati.
Za manometre, živa se može koristiti u području standardnog tlaka zraka do 102 Pa, dok su silikonski fluidi i ftalati prikladni za upotrebu ispod 102 Pa na niže do 10 Pa. Manometri s membranom koja se može grijati mogu se koristiti čak i ispod 10-1 Pa. Postoje i drugi mjerači tlaka koji se mogu koristiti ispod 102 Pa.
1.6.2.2. Postupak mjerenja
Prije mjerenja, svi dijelovi uređaja prikazanog na slici 2. moraju biti potpuno čisti i suhi.
Za metodu 2., U-cijev treba napuniti odabranom tekućinom koju je prije očitavanja potrebno otpliniti kod povišene temperature
Ispitivana tvar stavi se u uređaj, uređaj se zatvori, a temperatura se smanjuje koliko je potrebno za otplinjavanje. Temperatura mora biti dovoljno niska kako bi se osiguralo isisavanje zraka, ali – kod višekomponentnog sustava – ne smije mijenjati sastav materijala. Ako je potrebno, ravnotežu je moguće brže uspostaviti miješanjem.
Uzorak se može jače ohladiti npr. tekućim dušikom (paziti da se izbjegne kondenzacija zraka ili fluida crpke) ili mješavinom etanola i suhog leda. Za mjerenja kod niskih temperatura primijeniti kupku s reguliranom temperaturom koja je spojena na ultra-kriomat.
Kod otvorenog ventila iznad posude s uzorkom, nekoliko minuta provodi se usisavanje kako bi se uklonio zrak. Zatim se ventil zatvara, a temperatura uzorka smanjuje na najnižu potrebnu razinu. Ako je potrebno, postupak otplinjavanja treba ponoviti nekoliko puta.
Kad se uzorak zagrijava, tlak pare se povećava. To mijenja ravnotežu fluida u U-cijevi. Da bi se utjecaj tog umanjio, u uređaj se kroz ventil uvodi dušik ili zrak sve dok se fluid pokazivača tlaka ne vrati na nulu. Tlak koji je za to potreban može se očitati s preciznog manometra na sobnoj temperaturi. Taj tlak odgovara tlaku pare tvari na toj određenoj temperaturi mjerenja.
Metoda 2.b slična je, samo se tlak pare očitava izravno.
Zavisnost tlaka pare o temperaturi određuje se u odgovarajuće malim intervalima (sveukupno približno 5 do 10 mjernih točaka) do željene maksimalne vrijednosti. Očitanja na niskim temperaturama treba ponoviti u svrhu provjere.
Ako se vrijednosti dobivene ponovljenim očitanjem ne podudaraju s krivuljom dobivenom porastom temperature, razlog može biti jedno od sljedećeg:
|
1. |
uzorak još uvijek sadrži zrak (npr. jako viskozni materijali) ili jedna ili više tvari s niskim talištem koje se oslobađaju tijekom zagrijavanja, a moguće ih je ukloniti usisavanjem nakon dodatnog pothlađivanja; |
|
2. |
temperatura hlađenja nije dovoljno niska. U tom slučaju kao rashladno sredstvo koristi se tekući dušik. U bilo kojem od navedena dva slučaja, mjerenje se mora ponoviti; |
|
3. |
tvar kemijski reagira u temperaturom području koje se istražuje (npr. razlaganje, polimerizacija). |
1.6.3. Izoteniskop
Cjelovit opis ove metode može se naći u referenci 7. Načelo mjernog uređaja prikazuje slika 3. Slično statičkoj metodi opisanoj u 1.6.2., izoteniskop je prikladan za istraživanje krutina i tekućina.
Kad se radi o tekućinama, sama tvar služi kao fluid u pomoćnom manometru. Količina tekućine, dostatna da se napuni balon, i kraći krak manometarskog dijela stavlja se u izoteniskop. Izoteniskop se spaja na vakuumski sustav i evakuira, zatim puni dušikom. Evakuacija i čišćenje sustava ponavlja se dvaput kako bi se odstranio preostali kisik. Puni izoteniskop postavlja se u horizontalni položaj kako bi se uzorak raširio u tankom sloju u balonu s uzorkom i odjeljku manometra (U-dio). Tlak sustava smanjuje se na 133 Pa, a uzorak se polagano zagrijava dok ne zavri (uklanjanje otopljenih nekondenzirajućih plinova). Izoteniskop se zatim postavlja u takav položaj da se uzorak vraća u balon i kraći krak manometra, koji se u potpunosti pune tekućinom. Tlak se održava kao za otplinjavanje; izvučen dio balona s uzorkom zagrijava se malim plamenom dok se uzorak pare koja se oslobađa ne raširi dovoljno kako bi istisnuo s mjesta dio uzorka s gornjeg dijela balona i kraka manometra u manometarski dio izoteniskopa, stvarajući tako prostor ispunjen parom bez prisutnosti dušika.
Izoteniskop se zatim postavlja u kupku stalne temperature, a tlak dušika podešava se sve dok se ne izjednači s tlakom uzorka. Manometarski dio izoteniskopa pokazuje ujednačenost tlakova. U ravnoteži, tlak pare dušika jednak je tlaku pare tvari.
Kad se radi o krutinama, u zavisnosti o području temperature i tlaka, koriste se manometarske tekućine nabrojane u 1.6.2.1. Otplinjena manometarska tekućina puni se u proširenje na dugom kraku izoteniskopa. Zatim se krutina koju treba ispitati stavlja u balon i otplinjuje na povišenoj temperaturi. Nakon tog izotensikop se naginje kako bi manometarska tekućina mogla teći u U-cijev. Mjerenje tlaka pare kao funkcije temperature provodi se prema 1.6.2.
1.6.4. Metoda efuzije: vaganje tlaka pare
1.6.4.1. Uređaj
Različite verzije uređaja opisane su u literaturi (1). Uređaj koji je ovdje opisan primjer je primjene općeg načela (Slika 4.). Slika 4. prikazuje glavne dijelove uređaja koji se sastoji od čelične ili staklene posude za jaki vakuum, opreme za stvaranje i mjerenje vakuuma i ugrađenih dijelova za mjerenje tlaka pare na vagi. U uređaj su ugrađeni sljedeći dijelovi:
|
— |
peć za isparavanje s prirubnicom i okretnim ulaznim otvorom. Peć za isparavanje je cilindrična posuda, izrađena od npr. bakra ili kemijski otporne legure dobre termičke provodljivosti. Može se koristiti i staklena posuda s bakrenom stijenkom. Peć je promjera približno od 3 do 5 cm, visine od 2 do 5 cm. Ima od jedan do tri otvora različitih veličina za protok pare. Peć se zagrijava grijaćom spiralom s vanjske strane. Radi sprečavanja rasapa topline na postolje, grijač je postavljen na postolje preko metala niske termičke provodljivosti (nikal-srebrov čelik ili krom-niklov čelik), npr. cijevi od nikal-srebrovog čelika ugrađene na okretni ulazni otvor ako se koristi peć s nekoliko otvora. Prednost ovakvog sklopa je u tome što omogućuje uvođenje bakrene šipke. Time se omogućuje hlađenje s vanjske strane primjenom hladne kupke, |
|
— |
ako bakreni poklopac peći ima tri otvora različitih promjera međusobno postavljenih na 90°, sveukupnim područjem mjerenja moguće je obuhvatiti različita područja tlaka pare (otvori između približno 0,30 i 4,50 mm u promjeru). Veliki otvori koriste se za niski tlak pare i obrnuto. Okretanjem peći namješta se željeni otvor ili međupoložaj u strujanju pare (otvor na peći – štitnik – posuda vage), pa se strujanje molekula oslobađa ili skreće kroz otvor na peći na posudu vage. Za mjerenje temperature tvari na odgovarajućoj točki postavlja se termopar ili otpornički termometar, |
|
— |
iznad štitnika nalazi se posuda vrlo osjetljive mikrovage (vidjeti dolje). Posuda vage promjera je približno 30 mm. Pogodan materijal je pozlaćeni aluminij, |
|
— |
oko posude vage nalazi se cilindrično kućište za hlađenje od mjedi ili bakra. U zavisnosti od tipa vage, ima otvore za ozib vage i otvor na štitniku za strujanje molekula, te bi trebalo jamčiti potpunu kondenzaciju pare na posudi vage. Širenje topline prema van osigurano je npr. bakrenom šipkom spojenom na kućište za hlađenje. Šipka prolazi kroz postolje i termički je izolirana od njega, npr. pomoću cijevi od krom-niklovog čelika. Šipka je uronjena u Dewarovu posudu s tekućim dušikom ispod postolja ili tekući dušik cirkulira kroz šipku. Kućište za hlađenje time se drži na približno - 120 °C. Posuda vage hladi se isključivo isijavanjem, što je zadovoljavajuće s obzirom na područje tlaka koje se istražuje (hlađenje približno 1 sat prije početka mjerenja), |
|
— |
vaga je smještena iznad kućišta za hlađenje. Prikladne su, npr. vrlo osjetljive elektronske mikrovage s 2 kraka (8) ili vrlo osjetljivi instrument s pomičnim svitkom (vidjeti Smjernicu za ispitivanje OECD-a 104, Izdanje 12.05.81.), |
|
— |
u postolje su ugrađeni i električni priključci za termoparove (ili otpornički termometri) i grijaće spirale, |
|
— |
vakuum se postiže u posudi pomoću crpke za djelomičan ili visoki vakuum (potreban vakuum od približno 1 do 2 × 10-3 Pa postiže se nakon 2 sata rada crpke). Tlak se regulira odgovarajućim ionizacijskim manometrom. |
1.6.4.2. Postupak mjerenja
Posuda se napuni ispitivanom tvari i poklopac se zatvori. Štitnik i kućište za hlađenje povuku se kroz peć. Uređaj se zatvara i vakuum crpke se uključuju. Konačni tlak prije početka mjerenja trebao bi biti približno 10-4 Pa. Hlađenje kućišta za hlađenje počinje na 10-2 Pa.
Čim je postignut potreban vakuum, započinje kalibracijski niz na najnižoj potrebnoj temperaturi. Namješta se odgovarajući otvor na poklopcu, struja pare prolazi kroz štitnik izravno iznad otvora i udara na hlađenu posudu vage. Posuda vage mora biti dovoljno velika kako bi mogla primiti cijelu struju koji na nju upućuje štitnik. Moment strujanja pare djeluje kao sila na posudu vage, a molekule se kondenziraju na njezinoj hladnoj površini.
Moment i istovremena kondenzacija proizvode signal na zapisivaču. Procjenom signala dolazi se do dva podatka:
|
1. |
u gore opisanom uređaju tlak pare određuje se iz momenta na posudi vage (za to nije nužno znati molekulsku težinu (2)). Kod očitanja treba uzeti u obzir geometrijske faktore kao što su otvor peći i kut strujanja molekula; |
|
2. |
istodobno se može mjeriti masa kondenzata, a iz tog se može izračunati brzina isparavanja. Tlak pare može se izračunati iz brzine isparavanja i molekulske težine primjenom Hertzove jednadžbe (2). |
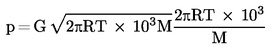
gdje je:
|
G |
= |
brzina isparavanja (kg s-1 m-2) |
|
M |
= |
molekulska masa (g mol-1) |
|
T |
= |
temperatura (K) |
|
R |
= |
univerzalna molarna plinska konstanta (J mol-1 K-1) |
|
p |
= |
tlak pare (Pa) |
Nakon što je postignut potreban vakuum, započinje niz mjerenja na najnižoj željenoj temperaturi mjerenja.
Za daljnja mjerenja temperatura se povećava u malim intervalima sve dok se ne postigne najviša željena vrijednost temperature. Uzorak se zatim ponovno hladi i može se bilježiti druga krivulja tlaka pare. Ako se u drugom pokušaju ne uspiju potvrditi rezultati prvog mjerenja, moguće je da se u području temperature koje se mjeri tvar razlaže.
1.6.5. Metoda efuzije: gubitkom težine
1.6.5.1. Uređaj
Uređaj za efuziju sastoji se od sljedećih osnovnih dijelova:
|
— |
spremnik koji može biti reguliran termostatom i koji je moguće evakuirati, u kojem su smještene ćelije za istjecanje plina, |
|
— |
jaka vakuumska crpka (npr. difuzna pumpa ili turbomolekulska pumpa) s instrumentom za mjerenje vakuuma, |
|
— |
posuda za skupljanje, pomoću ukapljenog dušika ili suhog leda. |
Na slici 5. kao primjer prikazan je jedan električno zagrijavan aluminijski vakuumski spremnik s četiri ćelije za istjecanje od nehrđajućeg čelika. Folija od nehrđajućeg čelika debljine 0,3 mm ima otvor za istjecanje promjera od 0,2 do 1,0 mm i postavljena je na ćeliju za istjecanje pomoću navojnog poklopca.
1.6.5.2. Postupak mjerenja
Svaka ćelija za istjecanje puni se referentnom tvari i ispitivanom tvari. Metalna ploča s otvorom pričvršćuje se navojnim poklopcem, i svaka ćelija se važe u okviru točnosti od 0,1 mg. Ćelija se postavlja u uređaj opremljen termostatom iz kojeg se zatim odvodi tlak do razine ispod jedne desetine očekivanog tlaka. U određenim vremenskim razmacima u rasponu od 5 do 30 sati, u uređaj se upušta zrak, a gubitak mase ćelije određuje se ponovnim vaganjem.
Kako na rezultat ne bi utjecale hlapljive nečistoće, ćelija se ponovno važe u određenim vremenskim razmacima radi provjere da je u najmanje dva takva vremenska razmaka brzina isparavanja stalna.
Tlak pare p u ćeliji za istjecanje izražen je kao:

gdje je:
|
p |
= |
tlak pare (Pa) |
|
m |
= |
masa tvari koja napusti ćeliju u vremenu t (kg) |
|
t |
= |
vrijeme (s) |
|
A |
= |
površina otvora (m2) |
|
K |
= |
korektivni faktor |
|
R |
= |
univerzalna molarna plinska konstanta (J mol-1 K-1) |
|
T |
= |
temperatura (K) |
|
M |
= |
molekulska masa (kg mol-1) |
Korektivni faktor K ovisi o omjeru duljine i promjera cilindričnog otvora.
|
omjer |
0,1 |
0,2 |
0,6 |
1,0 |
2,0 |
|
K |
0,952 |
0,909 |
0,771 |
0,672 |
0,514 |
Gornja se jednadžba može napisati ovako:

gdje je konstanta ćelije za istjecanje:  .
.
Konstanta ćelije za istjecanje E može se odrediti kod referentne tvari (2, 9), primjenom sljedeće jednadžbe:

gdje je:
|
p(r) |
= |
tlak pare referentne tvari (Pa) |
|
M(r) |
= |
molekulska masa referentne tvari (kg × mol–1) |
1.6.6. Metoda zasićenja plina
1.6.6.1. Uređaj
Tipični uređaj koji se koristi za obavljanje ovog ispitivanja sastoji se od dijelova prikazanih na slici 6.a i opisanih u daljnjem tekstu (1).
Inertni plin:
Nosivi plin ne smije kemijski reagirati s ispitivanom tvari. Obično je za tu svrhu dovoljan dušik, ali povremeno se može javiti potreba za drugim plinovima. Plin koji se koristi mora biti suh (vidjeti sliku 6., legenda br. 4: osjetnik relativne vlage).
Regulacija protoka:
Potreban je odgovarajući sustav za regulaciju plina kojim se osigurava stalan i odabrani protok kroz kolonu saturatora.
Skupljanje pare:
Skupljanje pare ovisi o karakteristikama pojedinog uzorka i odabrane analitičke metode. Para se skuplja količinski i u obliku koji omogućuje naknadnu analizu. Za neke ispitivane tvari, pogodne tekućine za skupljanje su heksan ili etilen glikol. Za druge, mogu se koristiti kruti apsorbenti.
Alternativa skupljanju pare i naknadnoj analizi izravne su analitičke tehnike poput kromatografije, u kojima se kvantitativno određuje količina materijala koju prenosi poznata količina nosivog plina. Nadalje, može se mjeriti gubitak mase tvari.
Izmjenjivač topline:
Za mjerenja kod različitih temperatura možda će trebati u sklop uključiti izmjenjivač topline.
Kolona saturatora:
Ispitivana tvar taloži se iz otopine na odgovarajući inertni nosač. Tako obloženim nosačem puni se kolona saturatora koja svojim dimenzijama i brzinom protoka mora osigurati potpunu saturaciju nosivog plina. Kolona saturatora mora biti opremljena termostatom. Za mjerenja iznad sobne temperature, područje između kolone saturatora i skupljanja pare trebalo bi zagrijavati kako bi se spriječila kondenzacija ispitivane tvari.
Radi smanjena prijenosa mase do kojega dolazi uslijed difuzije, iza kolone saturatora može se postaviti kapilara (Slika 6.b).
1.6.6.2. Postupak mjerenja
Priprema kolone saturatora:
Otopina ispitivane tvari u jako hlapljivom otapalu dodaje se odgovarajućem nosaču. Treba dodati dovoljno ispitivane tvari kako bi se zasićenost održala tijekom cijelog ispitivanja. Otapalo u potpunosti ispari na zraku ili u okretnom isparivaču, a potpuno izmiješani materijal stavlja se u kolonu saturatora. Nakon mjerenja uzorka termostatom, kroz uređaj se pušta suhi dušik.
Mjerenje:
Skupljači ili izravni detektori spajaju se na izlazni vod kolone, a vrijeme se bilježi. Brzina protoka provjerava se na početku i u redovnim intervalima tijekom pokusa, pomoću uređaja za ispitivanje nepropusnosti na plin ili kontinuirano mjeračem protoka mase.
Tlak na izlazu iz saturatora mora se mjeriti. To se može učiniti:
|
(a) |
stavljanjem mjerača tlaka između saturatora i skupljača (to može biti nezadovoljavajuće jer se time povećava mrtvi prostor i površina adsorpcije); ili |
|
(b) |
određivanjem padova tlaka u konkretnom sustavu skupljača koji se koristi, kao funkcije brzine protoka u posebnom pokusu (to možda nije dovoljno zadovoljavajuće kod tekućih skupljača). |
Vrijeme potrebno za skupljanje količine ispitivane tvari koja je potrebna za različite analitičke metode određuje se u prethodnim pokusima ili procjenom. Alternativa skupljanju pare i naknadnim analizama izravne su analitičke tehnike (npr. kromatografija). Prije izračunavanja tlaka pare kod dane temperature, potrebno je provesti prethodna ispitivanja za određivanje maksimalne brzina protoka kod koje će nosivi plin biti u potpunosti zasićen parom tvari. To je zajamčeno ako nosivi plin kroz saturator prolazi dovoljno polako kako se izračunom kod manje brzine ne bi dobio veći tlak pare.
Konkretna analitička metoda odredit će se prema naravi tvari koja se ispituje (npr. plinska kromatografija ili gravimetrija).
Određuje se količina tvari koju prenosi poznati volumen nosivog tlaka.
1.6.6.3. Izračun tlaka pare
Tlak pare izračunava se iz gustoće pare, W/V, jednadžbom:

gdje je:
|
p |
= |
tlak pare (Pa) |
|
W |
= |
masa isparene ispitivane tvari (g) |
|
V |
= |
volumen zasićenog plina (m3) |
|
T |
= |
temperatura (K) |
|
M |
= |
molarna masa ispitivane tvari (g mol–1) |
Izmjerene volumene treba ispraviti za razlike u tlaku i temperaturi između mjerača protoka i saturatora s termostatom. Ako je mjerač protoka smješten nizvodno od skupljača pare, korekcije mogu biti nužne kako bi se uzeli u obzir sastojci eventualno ispareni na skupljaču (1).
1.6.7. Vrtnja rotora (8, 11, 13)
1.6.7.1. Uređaj
Tehnika vrtnje rotora može se primijeniti upotrebom viskozimetra na rotoru koji se vrti kako prikazuje slika 8. Shematski prikaz pokusa prikazan je na slici 7.
Tipični mjerni uređaj sastoji se od rotora s mjernom glavom koji se vrti u termostatski reguliranom kućištu (regulacija unutar 0,1 °C). Posuda s uzorkom nalazi se u termostatski reguliranom kućištu (regulacija unutar 0,01 °C), a svi drugi dijelovi sklopa drže se na višoj temperaturi kako bi se spriječila kondenzacija. Jaka vakuumska crpka priključena je na sustav pomoću vakuumskih ventila.
Mjerna glava rotora koji se vrti sastoji se od čelične kuglice (promjera od 4 do 5 mm) u cijevi. Kuglica je stablizirana i lebdi u magnetskom polju koje proizvode stalni magneti i regulacijski svici.
Kuglica se vrti pod utjecajem okretnog magnetskog polja koje stvaraju svici. Svici s davačima, koji mjere uvijek prisutnu malu bočnu magnetiziranost kuglice, omogućuju mjerenje njezine brzine vrtnje.
1.6.7.2. Postupak mjerenja
Kad kuglica dostigne danu brzinu vrtnje v(o) (obično oko 400 okretaja u sekundi), zaustavlja se daljnje dovođenje energije pa, uslijed trenja plinova, dolazi do usporavanja.
Pad brzine vrtnje mjeri se kao funkcija vremena. Kako je trenje koje uzrokuje magnetska suspenzija zanemarivo u usporedbi s trenjem plinova, tlak plina p određen je jednadžbom:
![]()
gdje je:
|
|
= |
prosječna brzina molekula plina |
|
r |
= |
promjer kuglice |
|
ρ |
= |
masena gustoća kuglice |
|
σ |
= |
koeficijent prijenosa tangencijalnog momenta (ε = 1 za idealno sfernu površinu kuglice) |
|
t |
= |
vrijeme |
|
v(t) |
= |
brzina vrtnje nakon vremena t |
|
v(o) |
= |
početna brzina vrtnje |
Tu jednadžbu možemo napisati i ovako:

gdje su tn, tn–1 vremena potrebna za određeni broj, N, okretaja. Ti vremenski razmaci tn i tn–1 slijede jedan iza drugoga, i tn > tn–1.
Prosječna brzina molekule plina  određena je jednadžbom:
određena je jednadžbom:

gdje je:
|
T |
= |
temperatura |
|
R |
= |
univerzalna molarna plinska konstanta |
|
M |
= |
molarna masa |
2. PODACI
Tlak pare iz bilo koje od prethodnih metoda treba odrediti za najmanje dvije temperature. Za provjeru linearnosti krivulje tlaka pare poželjno je tri ili više u području od 0 do 50 °C.
3. IZVJEŠĆIVANJE
U izvješću o ispitivanju treba, ako je moguće, navesti sljedeće informacije:
|
— |
primijenjena metoda, |
|
— |
precizna specifikacija tvari (identitet i nečistoće) i prethodne mjere pročišćivanja ako su poduzete, |
|
— |
najmanje dvije vrijednosti za tlak pare i temperaturu, po mogućnosti u području od 0 do 50 °C, |
|
— |
svi neobrađeni podaci, |
|
— |
krivulja log ρ u odnosu na krivulju l/T, |
|
— |
procjena tlaka pare na 20 ili 25 °C. |
Ako se zamijeti prijelazno stanje (promjena stanja, razlaganje), treba zabilježiti sljedeće informacije:
|
— |
vrsta promjene, |
|
— |
temperatura na kojoj je došlo do promjene atmosferskog tlaka, |
|
— |
tlak pare na 10 i 20 °C ispod temperature prijelaza te na 10 i 20 °C iznad te temperature (ako se ne radi o prijelazu iz krutine u plin). |
U izvješće treba unijeti sve podatke i napomene relevantne za tumačenje rezultata, posebno s obzirom na nečistoće i fizikalno stanje tvari.
4. REFERENCE
|
(1) |
OECD, Paris, 1981, Testing Guideline 104, Decision of the Council C(81) 30 final. |
|
(2) |
Ambrose, D. in B. Le Neindre, B. Vodar, (Eds.): Experimental Thermodynamics, Butterworths, London, 1975, Vol. II. |
|
(3) |
R. Weissberger ed.: Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed. Chapter IX, Interscience Publ., New York, 1959, Vol. I, Part I. |
|
(4) |
Knudsen, M. Ann. Phys. Lpz., 1909, vol. 29, 1979; 1911, vol. 34, str. 593. |
|
(5) |
NF T 20-048 AFNOR (September 85). Chemical products for industrial use – Determination of vapour pressure of solids and liquids within range from 10-1 to 105 Pa – Static method. |
|
(6) |
NF T 20-047 AFNOR (September 85). Chemical products for industrial use – Determination of vapour pressure of solids and liquids within range from 10-3 to 1 Pa – Vapour pressure balance method. |
|
(7) |
ASTM D 2879 -86, Standard test method for vapour pressure-temperature relationship and initial decomposition temperature of liquids by isoteniscope. |
|
(8) |
G. Messer, Rohl, G. Grosse and W. Jitschin. J. Vac. Sci. Technol.(A), 1987, ‚Vol. 5 (4), str. 2440. |
|
(9) |
Ambrose, D.; Lawrenson, I.J.; Sprake, C.H.S. J. Chem. Thermodynamics 1975, vol. 7, str. 1173. |
|
(10) |
B. F. Rordorf. Thermochimica Acta, 1985, vol. 85, str. 435. |
|
(11) |
G. Comsa, J.K. Fremerey and B. Lindenau. J. Vac. Sci. Technol., 1980, vol. 17 (2), str. 642. |
|
(12) |
G. Reich. J. Vac. Sci. Technol., 1982, vol. 20 (4), str. 1148. |
|
(13) |
J.K. Fremerey. J. Vac. Sci. Technol.(A), 1985, vol. 3 (3), str. 1715. |
Dodatak 1.
Metoda procjene
UVOD
Izračunane vrijednosti tlaka pare mogu se primijeniti:
|
— |
za donošenje odluke o tome koja je eksperimentalna metoda primjerena, |
|
— |
za postavljanje procijenjene ili granične vrijednosti ako iz tehničkih razloga eksperimentalna metoda nije primjenljiva (uključujući i slučaj vrlo niskog tlaka pare), |
|
— |
radi lakše identifikacije slučajeva u kojima je opravdano ne provoditi eksperimentalno mjerenje jer je vjerojatno da će tlak pare biti < 10–5 Pa na temperaturi okoline. |
METODA PROCJENE
Tlak pare tekućina i krutina može se procijeniti primjenom modificirane Watsonove korelacije (a). Jedini potreban eksperimentalni podatak je uobičajeno vrelište. Metoda je primjenljiva na cijelo područje tlakova od 105 do 10–5 Pa.
Iscrpne informacije o metodi date su u „Handbook of Chemical Property Estimation Methods” (Priručnik o metodama procjene kemijskih svojstava) (b).
POSTUPAK IZRAČUNA
U skladu s (b), tlak pare izračunava se kako slijedi:

gdje je:
|
T |
= |
odabrana temperatura |
|
Tb |
= |
uobičajeno vrelište |
|
Pvp |
= |
tlak pare kod temperature T |
|
Δ Hvb |
= |
toplina isparavanja |
|
Δ Zb |
= |
faktor kompresije (procijenjen na 0,97) |
|
m |
= |
empirijski faktor koji ovisi o fizikalnom stanju kod odabrane temperature |
nadalje:

gdje je Kf empirijski faktor kojim se uzima u obzir polaritet tvari. Za nekoliko tipova spojeva, Kf faktori nabrojani su u referenci (b).
Često se događa da su dostupni podaci o vrelištu koji su dobiveni kod smanjenog tlaka. U takvim slučaju, u skladu s (b), tlak pare izračunava se kako slijedi.

gdje je T1 vrelište kod smanjenog tlaka P1.
IZVJEŠĆE
Kad se primjenjuje metoda procjene, izvješće treba sadržavati opsežnu dokumentaciju na temelju koje je izračun napravljen.
LITERATURA
|
(a) |
K.M. Watson, Ind. Eng. Chem; 1943, vol. 35, str. 398. |
|
(b) |
W.J. Lyman, W.F. Reehl, D.H. Rosenblatt. Handbook of Chemical Property Estimation Methods, Mc Graw-Hill, 1982. |
Dodatak 2.
Slika 1.
Uređaj za određivanje krivulje tlaka pare prema dinamičkoj metodi

Slika 2.a
Uređaj za određivanje krivulje tlaka pare prema statističkoj metodi (pomoću manometarske U-cijevi)

Slika 2.b
Uređaj za određivanje krivulje tlaka pare prema statičkoj metodi (pomoću pokazivača tlaka)

Slika 3.
Izoteniskop (vidjeti referencu 7.)

Slika 4.
Uređaj za određivanje krivulje tlaka pare prema metodi vaganja tlaka pare
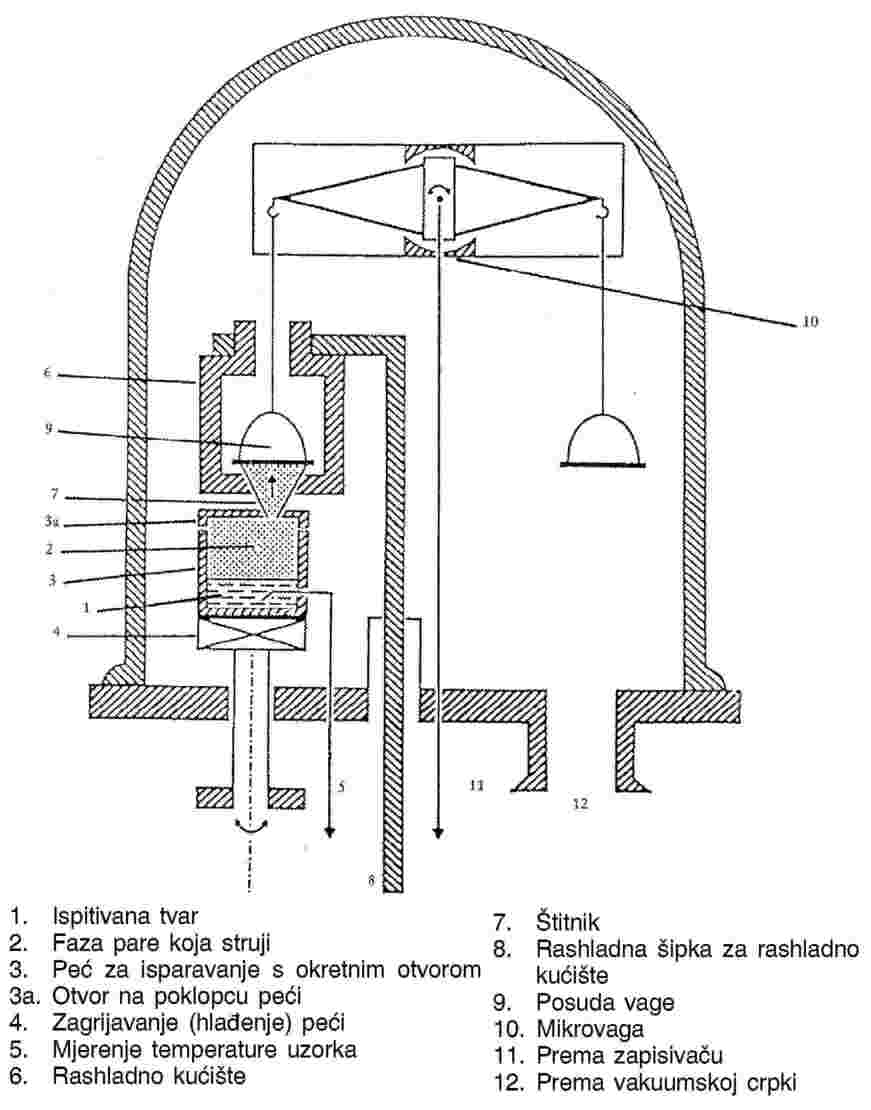
Slika 5.
Primjer uređaja za isparivanje kod niskog tlaka metodom efuzije, s ćelijom za istjecanje zapremnine 8 cm3

Slika 6.a
Primjer sustava protoka za određivanje tlaka pare metodom zasićenja plina
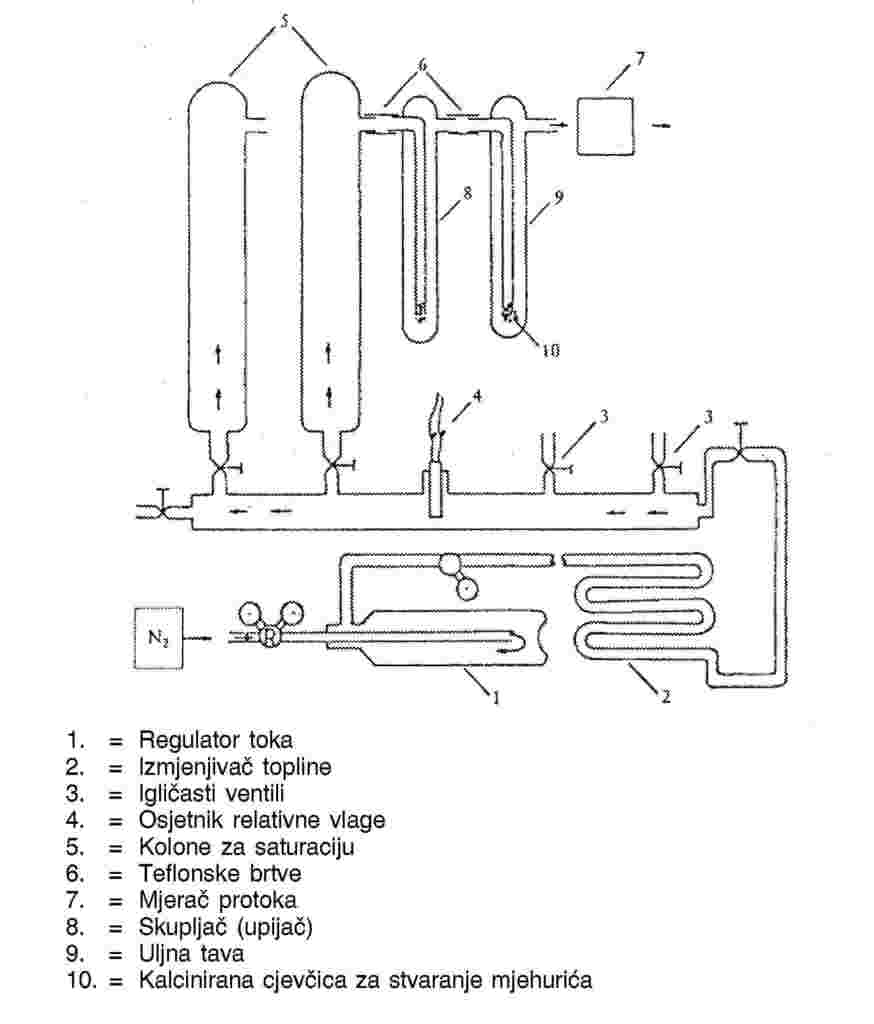
Slika 6.b.
Primjer sustava za određivanje tlaka pare metodom zasićenja plina, s kapilarom postavljenom iza komore za zasićenje

Slika 7.
Primjer eksperimentalne postave za metodu s rotorom koji se vrti

Slika 8.
Primjer mjerne glave na rotoru koji se vrti
A.5. POVRŠINSKA NAPETOST
1. METODA
Opisane metode zasnivaju se na Smjernici za ispitivanje OECD-a (1). Temeljna načela navedena su u referenci (2).
1.1. UVOD
Opisane metode koristit će se za mjerenje površinske napetosti vodenih otopina.
Prije provođenja ovih ispitivanja korisno je raspolagati preliminarnim informacijama o topljivosti tvari u vodi, njezinoj strukturi, hidrolitičkim svojstvima i kritičnim koncentracijama za formiranje micela.
Sljedeće metode primjenljive su na većinu kemijskih tvari, bez ikakvog ograničenja u pogledu stupnja njihove čistoće.
Mjerenje površinske napetosti metodom prstenastog tenzometra ograničeno je na vodene otopine čiji je dinamički viskozitet manji od približno 200 mPa s.
1.2. DEFINICIJE I JEDINICE
Površinskom napetošću smatra se slobodna površinska entalpija po jedinici površine.
Površinska napetost izražava se kao:
N/m (SI jedinica) ili
mN/m (SI pod-jedinica)
1 N/m = 103 din/cm
1 mN/m = 1 din/cm u zastarjelom CGS sustavu
1.3. REFERENTNE TVARI
Referentne tvari nije potrebno upotrebljavati kod svakog istraživanja nove tvari. One bi trebale služiti prvenstveno za povremenu provjeru primijenjene metode i omogućiti usporedbu s rezultatima dobivenim drugim metodama.
Referentne tvari koje obuhvaćaju široko područje površinskih napetosti navedene su u referencama 1. i 3.
1.4. NAČELO METODA
Metode se temelje na mjerenju maksimalne sile kojom je potrebno vertikalno djelovati na stremen ili na prsten u dodiru s površinom ispitivane tekućine koja se nalazi u mjernoj posudi kako bi ga se odvojilo od te površine, ili na pločicu čiji rub dodiruje površinu, kako bi se nastali film izvukao.
Tvari koje su topljive u vodi kod koncentracija od minimalno 1 mg/l ispituju se u vodenoj otopini kod samo jedne koncentracije.
1.5. KRITERIJI KVALITETE
Ovim se metodama može postići veća preciznost nego što se obično zahtijeva za procjenu utjecaja na okoliš.
1.6. OPIS METODA
Pripremi se otopina tvari u destiliranoj vodi. Otopina bi trebala biti koncentracije 90 % zasićene otopine tvari u vodi; ako je ta koncentracija veća od 1 g/l, za ispitivanje se upotrebljava koncentracija od 1 g/l. Tvari čija je topljivost u vodi manja od 1 mg/l nije potrebno ispitivati.
1.6.1. Metoda pločice
Vidjeti norme ISO 304 i NF T 73-060 (Površinski aktivni agensi – određivanje površinske napetosti izvlačenjem tekućeg filma).
1.6.2. Metoda stremena
Vidjeti norme ISO 304 i NF T 73-060 (Površinski aktivni agensi – određivanje površinske napetosti izvlačenjem tekućeg filma).
1.6.3. Metoda prstena
Vidjeti norme ISO 304 i NF T 73-060 (Površinski aktivni agensi – određivanje površinske napetosti izvlačenjem tekućeg filma).
1.6.4. Harmonizirana OECD-ova metoda prstena
1.6.4.1. Uređaj
Za ovo mjerenje prikladni su komercijalno dostupni tenzometri. Tenzometar se sastoji od sljedećih elemenata:
|
— |
pokretni stolić za uzorak, |
|
— |
sustav za mjerenje sile, |
|
— |
mjerno tijelo (prsten), |
|
— |
mjerna posuda. |
1.6.4.1.1.
Pokretni stolić za uzorak koristi se kao nosač mjerne posude s regulacijom temperature koja sadrži tekućinu koju treba ispitati. Montiran je na stalak, zajedno sa sustavom za mjerenje sile.
1.6.4.1.2.
Sustav za mjerenje sile (vidjeti sliku) smješten je iznad stolića za uzorak. Pogreška sustava za mjerenje sile ne smije biti veća od ± 10-6 N, što kod mjerenja mase odgovara ograničenju greške od ± 0,1 mg. U većini slučajeva mjerna ljestvica komercijalno dostupnih tenzometara kalibrirana je u mN/m pa je površinsku napetost moguće očitati izravno u mN/m s točnošću od 0,1 mN/m.
1.6.4.1.3.
Prsten je obično izrađen od platina-iridijeve žice debljine oko 0,4 mm i srednjeg opsega 60 mm. Žičani prsten horizontalno je obješen na metalni zatik i konzolu za montažu preko kojih se povezuje sa sustavom za mjerenje sile (vidjeti sliku).
Slika
Mjerno tijelo
(Sve su dimenzije izražene u milimetrima)

1.6.4.1.4.
Mjerna posuda s ispitnom otopinom koju treba izmjeriti staklena je posuda s regulacijom temperature. Mora biti konstruirana na način da tijekom mjerenja temperatura ispitne otopine i plinske faze iznad njezine površine ostane stalna i da uzorak ne može isparavati. Prihvatljive su cilindrične staklene posude unutarnjeg promjera najmanje 45 mm.
1.6.4.2. Priprema uređaja
1.6.4.2.1.
Staklene posude treba pažljivo očistiti. Po potrebi treba ih oprati vrućom krom-sumpornom kiselinom i zatim gustom tekućom fosfornom kiselinom (od 83 do 98 % težinskog udjela H3PO4), u potpunosti isprati tekućom vodom i na kraju prati dvostruko destiliranom vodom sve dok se ne postigne neutralna reakcija, te zatim osušiti i isprati s dijelom tekućeg uzorka koji će se mjeriti.
Prsten prvo treba potpuno namočiti u vodu kako bi se s njega uklonile sve tvari topljive u vodi, nakratko uroniti u krom-sumpornu kiselinu, prati dvostruko destiliranom vodom sve dok se ne postigne neutralna reakcija, i na kraju kratkotrajno zagrijati iznad plamena metanola.
Napomena:
Kontaminacija tvarima koje se ne tope u krom-sumpornoj ili fosfornoj kiselini niti ih ona uništava, npr silikonima, otklanja se pomoću odgovarajućeg organskog otapala.
1.6.4.2.2.
Validacija uređaja sastoji se od verifikacije nulte točke i njezinog podešavanja na način da indikacija na instrumentu omogućuje pouzdano određivanje vrijednosti u mN/m.
Montaža:
Uređaj mora biti postavljen na postolje tenzometra u ravnini, primjerice pomoću libele i podešavanjem nivelacijskih vijaka na postolju.
Podešavanje nulte točke:
Nakon montaže prstena na uređaj, a prije uranjanja u tekućinu, treba provjeriti da je indikacija tenzometra podešena na nulu, a prsten postavljen paralelno s površinom tekućine. U tu svrhu, površina tekućine može se upotrijebiti kao zrcalo.
Kalibracija:
Kalibracija za određeni pokus može se izvršiti bilo kojim od sljedeća dva postupka:
|
(a) |
Korištenjem mase: postupak pomoću jahača poznate mase između 0,1 i 1,0 g koji se postavljaju na prsten. Faktor kalibracije, Φa, kojim se množe sve očitanja na instrumentu određuje se prema jednadžbi (1).
gdje je:
|
|
(b) |
Korištenjem vode: postupak pomoću čiste vode čija je površinska napetost, primjerice, na 23 °C jednaka 72,3 mN/m. Taj se postupak može provesti brže nego kalibracija utegom, ali uvijek postoji opasnost da površinska napetost vode bude lažno predstavljena zbog tragova kontaminacije surfaktantima. Faktor kalibracije, Φa, kojim se množe sve očitanja na instrumentu, određuje se prema jednadžbi (2):
gdje je:
|
1.6.4.3. Priprema uzoraka
Vodene otopine priređuju se od tvari koje će se ispitivati, u potrebnim koncentracijama u vodi, i ne smiju sadržavati neotopljene tvari.
Otopina se mora održavati na stalnoj temperaturi (± 0,5 °C). Kako se površinska napetost otopine u mjernoj posudi tijekom vremena mijenja, treba provesti nekoliko mjerenja u raznim vremenima, a krivulju koja pokazuje površinsku napetost iscrtati kao funkciju vremena. Kad više nema promjena, postignuto je stanje ravnoteže.
Kontaminacija prašinom i plinovima drugih tvari ometa mjerenje. Posao stoga treba obaviti ispod zaštitnog pokrivača.
1.6.5. Ispitni uvjeti
Mjerenje se provodi na približno 20 °C i kontrolira se unutar ± 0,5 °C.
1.6.6. Provođenje ispitivanja
Otopine na kojima se obavljaju mjerenja prenose se u pažljivo očišćenu mjernu posudu, vodeći računa da se ne zapjene, pa se zatim mjerna posuda stavlja na stolić ispitnog uređaja. Gornji dio stola s mjernom posudom podiže se sve dok se prsten ne uroni ispod površine otopine koja se mjeri. Nakon toga, sve dok se ne postigne maksimalna sila, gornji dio stola se postupno i jednolično spušta (brzinom od oko 0,5 cm/min) kako bi se prsten odvojio od površine. Sloj tekućine koji se drži za prsten ne smije se odvojiti od njega. Kad su mjerenja završena, prsten se ponovno uranja ispod površine i mjerenje se ponavlja sve dok se ne postigne stalna napetost površine. Vrijeme od prenošenja otopine u mjernu posudu bilježi se za svako određivanje. Vrijednosti se očitavaju kod maksimalne sile koja je potrebna da se prsten odvoji od površine tekućine.
2. PODACI
Za izračun površinske napetosti, vrijednost očitanja u mN/m na uređaju prvo se množi s faktorom kalibracije Φa ili Φb (u zavisnosti o tome koji je postupak kalibracije primijenjen). Time se dolazi samo do približne vrijednosti koju stoga treba ispraviti.
Harkins i Jordan (4) empirijski su odredili korektivne faktore za vrijednosti površinske napetosti izmjerene metodom prstena koji ovise o promjerima prstena, gustoći tekućine i njezinoj površinskoj napetosti.
Kako je utvrđivanje korektivnog faktora za svako pojedino mjerenje iz Harkinsovih i Jordanovih tablica mukotrpan posao, za izračun površinske napetosti vodenih otopina može se primijeniti pojednostavnjeni postupak očitavanja ispravljenih vrijednosti površinske napetosti izravno iz tablice. (Za očitanja u područjima između vrijednosti navedenih u tablici primjenjuje se interpolacija.)
Tablica:
Korekcija izmjerene površinske napetosti
Samo za vodene otopine, ρ = 1 g/cm3
|
r |
= 9,55 mm (promjer prosječnog prstena) |
|
r |
= 0,185 mm (promjer žice od koje je prsten izrađen) |
|
Eksperimentalna vrijednost (mN/m) |
Korigirana vrijednost (mN/m) |
|
|
Kalibracija utegom (vidjeti 1.6.4.2.2.(a)) |
Kalibracija vodom (vidjeti 1.6.4.2.2.(b)) |
|
|
20 |
16,9 |
18,1 |
|
22 |
18,7 |
20,1 |
|
24 |
20,6 |
22,1 |
|
26 |
22,4 |
24,1 |
|
28 |
24,3 |
26,1 |
|
30 |
26,2 |
28,1 |
|
32 |
28,1 |
30,1 |
|
34 |
29,9 |
32,1 |
|
36 |
31,8 |
34,1 |
|
38 |
33,7 |
36,1 |
|
40 |
35,6 |
38,2 |
|
42 |
37,6 |
40,3 |
|
44 |
39,5 |
42,3 |
|
46 |
41,4 |
44,4 |
|
48 |
43,4 |
46,5 |
|
50 |
45,3 |
48,6 |
|
52 |
47,3 |
50,7 |
|
54 |
49,3 |
52,8 |
|
56 |
51,2 |
54,9 |
|
58 |
53,2 |
57,0 |
|
60 |
55,2 |
59,1 |
|
62 |
57,2 |
61,3 |
|
64 |
59,2 |
63,4 |
|
66 |
61,2 |
65,5 |
|
68 |
63,2 |
67,7 |
|
70 |
65,2 |
69,9 |
|
72 |
67,2 |
72,0 |
|
74 |
69,2 |
— |
|
76 |
71,2 |
— |
|
78 |
73,2 |
— |
Podaci u ovoj tablici prikupljeni su na temelju Harkins-Jordanove korekcije. Slična je tablici u normi DIN (DIN 53914) za vodu i vodene otopine (gustoća ρ = 1 g/cm3 i za komercijalno dostupan prsten dimenzije R = 9,55 mm (srednji promjer prstena) i r = 0,185 mm (promjer žice od koje je izrađen prsten). U tablici su navedene korigirane vrijednosti za vrijednosti mjerenja površinske napetosti nakon kalibracije s utezima ili kalibracije vodom.
Alternativno, bez prethodne kalibracije, površinska napetost može se izračunati prema sljedećoj formuli:

gdje je:
|
F |
= |
sila izmjerena na dinamometru u točki pucanja filma |
|
R |
= |
promjer prstena |
|
f |
= |
korektivni faktor (1) |
3. IZVJEŠĆIVANJE
3.1 IZVJEŠĆE O ISPITIVANJU
U izvješću o ispitivanju treba, ako je moguće, navesti sljedeće informacije:
|
— |
primijenjena metoda, |
|
— |
tip vode ili otopine koja je upotrijebljena. |
|
— |
precizna specifikacija tvari (identitet i nečistoće), |
|
— |
rezultati mjerenja: (očitanje) površinske napetosti s tim da se navedu i pojedinačna očitanja i njihove aritmetičke sredine kao i korigirana srednja vrijednost (uzimajući u obzir faktor opreme i tablicu s korekcijama), |
|
— |
koncentracija otopine, |
|
— |
ispitna temperatura, |
|
— |
starost otopine koja je upotrijebljena; posebno vrijeme između pripreme i mjerenja otopine, |
|
— |
opis kako površinska napetost zavisi o vremenu nakon prijenosa otopine u mjernu posudu, |
|
— |
sve informacije i opaske relevantne za tumačenje rezultata, posebno s obzirom na nečistoće i fizikalno stanje tvari. |
3.2. TUMAČENJE REZULTATA
Uzimajući u obzir da destilirana voda ima površinsku napetost od 72,75 mN/m na 20 °C, tvari kod kojih je u uvjetima ove metode uočena površinska napetost niža od 60 mN/m treba smatrati površinski aktivnim materijalima.
4. REFERENCE
|
(1) |
OECD, Paris, 1981, Testing Guideline 1152, Decision of the Council C(81) 30 final. |
|
(2) |
R. Weissberger ed.: Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Interscience Publ., New York, 1959, Vol. I, Part I, Chapter XIV. |
|
(3) |
Pure Appl. Chem., 1976, vol. 48, str. 511. |
|
(4) |
Harkins, W.D., Jordan, H.F., J. Amer. Chem. Soc., 1930, vol. 52, str. 1751. |
A.6. TOPLJIVOST U VODI
1. METODA
Opisane metode temelje se na Smjernici za ispitivanje OECD-a (1).
1.1. UVOD
Prije provođenja ovog ispitivanja korisno je za tvar koja se ispituje posjedovati preliminarne informacije o strukturnoj formuli, tlaku pare, konstanti disasocijacije i hidrolizi (kao funkcije pH vrijednosti).
Nema dostupne pojedinačne metode koja bi obuhvatila cijelo područje topljivosti u vodi.
Dvije metode opisane dalje u tekstu obuhvaćaju cijelo područje topljivosti, ali nisu primjenljive na hlapljive tvari:
|
— |
jedna, nazvana „metoda eluiranja kolone”, koja se primjenjuje prvenstveno na čiste tvari niske topljivosti (< 10-2 grama po litri), a koje su stabilne u vodi, |
|
— |
druga, nazvana „metoda tikvice” koja se primjenjuje prvenstveno na čiste tvari visoke topljivosti (> 10-2 grama po litri), a koje su stabilne u vodi. |
Na topljivost ispitivane tvari u vodi prisutnost nečistoća može značajno utjecati.
1.2. DEFINICIJE I JEDINICE
Topljivost neke tvari u vodi određena je masenom koncentracijom zasićene vodene otopine te tvari na određenoj temperaturi. Topljivost u vodi izražava se u jedinicama mase po volumenu otopine. Jedinica u SI sustavu je kg/m3 (može se koristiti i gram po litri).
1.3. REFERENTNE TVARI
Referentne tvari nije potrebno upotrebljavati kod svakog istraživanja nove tvari. One bi trebale služiti prvenstveno za povremenu provjeru primijenjene metode i omogućiti usporedbu s rezultatima dobivenim drugim metodama.
1.4. NAČELO ISPITNE METODE
Približnu količinu uzorka i vrijeme koje je potrebno za postizanje koncentracije zasićenja mase treba odrediti prethodnim ispitivanjem.
1.4.1. Metoda eluiranja kolone
Ova se metoda zasniva na eluiranju vodom ispitivane tvari iz mikro-kolone koja je napunjena inertnim nosivim materijalom, kao što su staklena zrnca ili pijesak, obloženim prekomjernom količinom ispitivane tvari. Topljivost u vodi određuje se kad koncentracija mase eluata postane stalna. To se očituje koncentracijom koja doseže plato u zavisnosti od vremena.
1.4.2. Metoda tikvice
U ovoj se metodi tvar (krutine treba fino usitniti) otapa u vodi na temperaturi nešto iznad temperature ispitivanja. Kad se postigne zasićenje, mješavina se hladi i drži na temperaturi ispitivanja te se miješa koliko je potrebno za postizanje ravnoteže. Alternativno, mjerenje se može provesti izravno na temperaturi ispitivanja ako je odgovarajućim uzorkovanjem zajamčeno postizanje ravnoteže zasićenja. Nakon toga, koncentracija mase tvari u vodenoj otopini, koja ne smije sadržavati neotopljene čestice, određuje se odgovarajućom analitičkom metodom.
1.5. KRITERIJI KVALITETE
1.5.1. Ponovljivost
Kod metode eluiranja kolone može se postići < 30 %; kod metode tikvice trebalo bi se pridržavati ponovljivosti < 15 %.
1.5.2. Osjetljivost
Iako osjetljivost zavisi o metodi analize, moguće je odrediti koncentracije mase ispod 10-6 grama po litri.
1.6. OPIS METODE
1.6.1. Ispitni uvjeti
Poželjno je ispitivanje provoditi na 20 ± 0,5 °C. Ako postoji sumnja da topljivost može ovisiti o temperaturi (> 3 % po °C), ispitivanje treba provesti i kod druge dvije temperature koje će biti najmanje 10 °C iznad i ispod početno izabrane temperature. U takvom slučaju, regulacija temperature treba biti ± 0,1 °C. Izabranu temperaturu treba držati stalnom u svim relevantnim dijelovima opreme.
1.6.2. Preliminarno ispitivanje
Uzorku od približno 0,1 g (krutine treba fino usitniti) u cilindru sa staklenim čepom i gradacijom od 10 ml dodaju se sve veći i veći volumeni destilirane vode sobne temperature prema dinamici kako je navedeno u sljedećoj tablici:
|
0,1 g topljiv u „x” ml vode |
0,1 |
0,5 |
1 |
2 |
10 |
100 |
> 100 |
|
Približna topljivost (grami po litri) |
> 1 000 |
1 000 do 200 |
200 do 100 |
100 do 50 |
50 do 10 |
10 do 1 |
< 1 |
Nakon svakog dodavanja navedene količine vode, mješavinu treba snažno protresati 10 minuta i zatim vizualno provjeriti ima li u uzorku još neotopljenih dijelova. Ako, nakon dodavanja 10 ml vode, uzorak ili dijelovi uzorka ostanu neotopljeni, pokus treba ponoviti u cilindru od 100 ml s većim volumenima vode. Kod nižih topljivosti, vrijeme koje je potrebno da bi se tvar otopila može biti znatno duže (treba omogućiti najmanje 24 sata). Približna topljivost navedena je u tablici pod onim volumenom dodane vode u kojem dolazi do potpunog otapanja uzorka. Ako je očito da je tvar i dalje neotopljena, treba omogućiti vrijeme duže od 24 sata (najviše 96 sati), ili je treba još razrijediti kako bi se utvrdilo treba li primijeniti metodu eluiranja ili metodu tikvice.
1.6.3. Metoda eluiranja kolone
1.6.3.1. Nosivi materijal, otapalo i eluens
Nosivi materijal u metodi eluiranja kolone treba biti inertan. Kao nosivi materijali mogu se upotrijebiti zrnca stakla i pijesak. Za nanošenje ispitivane tvari na nosivi materijal treba upotrijebiti odgovarajuće hlapljivo otapalo kvalitete pogodne za analitičku reakciju. Kao eluens treba upotrijebiti vodu dvostruko destiliranu u uređaju sa staklom ili kvarcom.
Napomena:
Ne smije se koristiti voda izravno s organskog ionskog izmjenjivača.
1.6.3.2. Punjenje nosača
Odmjeri se približno 600 mg nosivog materijala i prenese u tikvicu zaobljenog dna od 50 ml.
Odgovarajuća, izmjerena količina ispitivane tvari otopi se u izabranom otapalu. Prikladna količina te otopine dodaje se nosivom materijalu. Otapalo mora u potpunosti ispariti, primjerice u okretnom isparivaču; u suprotnom zasićenje nosača vodom ne postiže se zbog učinka razdjeljivanja na površini nosivog materijala.
Punjenje nosivog materijala može uzrokovati probleme (pogrešne rezultate) ako se ispitna tvar taloži kao ulje ili neka drugačija kristalna faza. Takav problem treba eksperimentalno ispitati i pojedinosti unijeti u izviješće.
Napunjen nosivi materijal ostavi se namakati otprilike dva sata u približno 5 ml vode, a zatim se otopina dodaje u mikro-kolonu. Alternativno, suhi napunjeni nosivi materijal može se istresti u mikro-kolonu ranije ispunjenu vodom, a zatim se uravnotežuje približno dva sata.
Ispitni postupak:
Eluiranje tvari s nosivog materijala može se odvijati na jedan od sljedeća dva različita načina:
|
— |
recirkulacijskom crpkom (vidjeti sliku 1.), |
|
— |
nivelacijskom posudom (vidjeti sliku 4.) |
1.6.3.3. Metoda eluiranja kolone pomoću recirkulacijske crpke
Uređaj
Tipični sustav shematski je prikazan na slici 1. Odgovarajuća mikro-kolona prikazana je na slici 2., iako je svaka veličina prihvatljiva pod uvjetom da zadovoljava kriterije mjerne obnovljivosti i osjetljivosti. U koloni iznad uzorka mora biti mjesta za najmanje pet volumena vode i kolona mora biti u stanju prihvatiti najmanje pet uzoraka. Alternativno, dimenzija može biti manja ako se koristi svježe otapalo koje zamjenjuje pet početnih volumena vode koji su uklonjeni s nečistoćama.
Kolonu treba spojiti na recirkulacijsku crpku koja je u stanju regulirati protoke od približno 25 ml/h. Crpka je spojena politetrafluoroetilenskim (PTFE) ili staklenim priključcima. Kolona i crpka nakon montaže moraju biti opremljene za uzorkovanje efluensa i uravnoteženje prostora u koloni kod atmosferskog tlaka. Nosač materijala u koloni je mali (5 mm) čep od staklene vune, koji služi i za filtriranje čestica. Recirkulacijska crpka može biti, primjerice peristaltička crpka ili membranska crpka (treba voditi računa da ne dođe do kontaminacije materijalom same cijevi i/ili apsorpcije tog materijala).
Postupak mjerenja
Započinje protok kroz kolonu. Preporuča se primjena brzine protoka od približno 25 ml/sat (što kod opisane kolone odgovara veličini od 10 volumena punjenja/sat). Prvih pet volumena (minimalno) potroše se na uklanjanje nečistoća topljivih u vodi. Nakon toga, recirkulacijska crpka ostavi se u radu dok se ne postigne ravnoteža, nasumice utvrđena s pet uzastopnih uzoraka čije se koncentracije ne razlikuju za više od ± 30 %. Te uzorke treba međusobno odvojiti vremenskim intervalima koji odgovaraju prolazu najmanje 10 volumena punjenja eluensa.
1.6.3.4. Metoda eluiranja kolone s nivelacijskom posudom
Uređaj (vidjeti slike 4. i 3.)
Nivelacijska posuda: priključak na nivelacijsku posudu ostvaren je pomoću ubrušenog staklenog spoja s teflonskim (PTFE) cjevovodom. Preporuča se brzina protoka od približno 25 ml/sat. Uzastopne frakcije eluata treba skupljati i analizirati odabranom metodom.
Postupak mjerenja
Za određivanje topljivosti u vodi koriste se frakcije iz središnjeg područja eluata u kojem su koncentracije stalne (± 30 %) u najmanje pet uzastopnih frakcija.
U oba slučaja (upotrebe recirkulacijske crpke ili nivelacijske posude), drugi krug pokusa treba provesti s pola brzine protoka prvog kruga. Ako se rezultati oba kruga slažu, ispitivanje se smatra zadovoljavajućim; ako je topljivost očito niža kod niže brzine protoka, tada se prepolavljanje brzine protoka mora nastaviti sve dok dva uzastopna kruga ne daju istu topljivost.
U oba slučaja (upotrebe recirkulacijske crpke ili nivelacijske posude), kod frakcija treba provjeriti prisutnost koloidne tvari na način da se provjeri javlja li se Tyndallov efekt (raspršivanje svjetlosti).
Prisutnost takvih čestica rezultate čini nevaljanim te ispitivanje treba ponoviti uz bolje filtriranje kolone.
1.6.4. Metoda tikvice
1.6.4.1. Uređaj
Za metodu tikvice potreban je sljedeći materijal:
|
— |
obične laboratorijske staklene posude i instrumenti, |
|
— |
uređaj pogodan za miješanje otopina na kontroliranim stalnim temperaturama, |
|
— |
centrifuga (poželjno termostatski regulirana), po potrebi s emulzijama, i |
|
— |
oprema za analitičko određivanje. |
1.6.4.2. Postupak mjerenja
Količina materijala koja je potrebna za zasićenje željenog volumena vode procjenjuje se iz preliminarnog ispitivanja. Potreban volumen vode ovisit će o analitičkoj metodi i području topljivosti. U svaku od tri staklene posude opremljene staklenim zatvaračima (npr. cijevi centrifuge, tikvice) odmjerava se peterostruka gore određena količina materijala. Odabrani volumen vode dodaje se u svaku posudu te se posude čvrsto začepe. Zatvorene posude se tada protresaju na 30 °C. (Treba koristiti uređaj za protresanje ili miješanje koji može raditi na stalnoj temperaturi, npr. magnetna miješalica u termostatski reguliranoj vodenoj kupki). Nakon jednog dana jedna od posuda skida se i uravnotežuje 24 sata na temperaturi ispitivanja uz povremeno protresanje. Sadržaj posude se zatim centrifugira na temperaturi ispitivanja, a koncentracija ispitivane tvari u jasnoj vodenoj fazi određuje se odgovarajućom analitičkom metodom. S druge dvije tikvice postupa se na sličan način nakon početnog uravnoteženja na 30 °C tijekom dva odnosno tri dana. Ako rezultati koncentracija iz najmanje posljednje dvije posude odgovaraju zahtijevanoj ponovljivosti mjerenja, ispitivanje se smatra uspješnim. Ispitivanje treba u potpunosti ponoviti s dužim vremenom uravnoteženja ako rezultati iz posuda 1., 2. i 3. imaju tendenciju sve većih vrijednosti.
Postupak mjerenja može se provoditi i bez prethodne inkubacije na 30 °C. Kako bi se procijenila brzina postizanja uravnoteženja zasićenja, uzorci se uzimaju sve do trenutka kada vrijeme miješanja više nema utjecaja na koncentraciju otopine koja se ispituje.
pH vrijednost svakog uzorka treba zabilježiti.
1.6.5. Analiza
Za ova određivanja poželjno je analitičku metodu odrediti točno prema ispitivanoj tvari, jer male količine topljivih nečistoća mogu uzrokovati velike pogreške u izmjerenoj topljivosti. Te metode mogu biti primjerice plinska ili tekuća kromatografija, metode titranja, fotometrijske metode, voltametrijske metode.
2. PODACI
2.1. METODA ELUIRANJA KOLONE
Za svaki krug treba izračunati srednju vrijednost najmanje pet uzastopnih uzoraka izmjerenih kod platoa zasićenja, kao i standardno odstupanje. Rezultate treba izraziti u jedinicama mase po volumenu otopine.
Srednje vrijednosti izračunane u dva ispitivanja u kojima su primijenjena dva različita protoka uspoređuju se, a ponovljivost bi trebala biti manja od 30 %.
2.2. METODA TIKVICE
Za svaku od tri tikvice treba dati pojedinačne rezultate koji će se smatrati stalnim (ponovljivost manja od 15 %), izračunati njihov prosjek i izraziti u jedinicama mase po volumenu otopine. Kad je topljivost visoka (> 100 grama po litri), za to će možda trebati potrebno ponovno pretvoriti jedinice mase u jedinice volumena, primjenom gustoće.
3. IZVJEŠĆIVANJE
3.1. METODA ELUIRANJA KOLONE
U izvješću o ispitivanju treba, ako je moguće, navesti sljedeće informacije:
|
— |
rezultati preliminarnog testa, |
|
— |
precizna specifikacija tvari (identitet i nečistoće), |
|
— |
pojedinačne koncentracije, brzine protoka i pH vrijednosti svakog uzorka, |
|
— |
srednje vrijednosti i standardna odstupanja od najmanje pet uzoraka na platou zasićenja, |
|
— |
prosječna vrijednost dva uzastopna prihvatljiva kruga, |
|
— |
temperatura vode tijekom postupka zasićenja, |
|
— |
primijenjena metoda analize, |
|
— |
narav primijenjenog nosivog materijala, |
|
— |
punjenje nosivog materijala, |
|
— |
primijenjeno otapalo, |
|
— |
dokaz o eventualnoj kemijskoj nestabilnosti tvari tijekom ispitivanja i kod primijenjene metode, |
|
— |
sve podatke i napomene relevantne za tumačenje rezultata, posebno s obzirom na nečistoće i fizikalno stanje tvari. |
3.2. METODA TIKVICE
U izvješću o ispitivanju treba, ako je moguće, navesti sljedeće informacije:
|
— |
rezultati preliminarnog testa, |
|
— |
precizna specifikacija tvari (identitet i nečistoće), |
|
— |
pojedinačna analitička određivanja i prosjek ako je za svaku tikvicu određeno više od jedne vrijednosti, |
|
— |
pH vrijednost svakog uzorka, |
|
— |
prosječna vrijednost za različite tikvice koje su međusobno usklađene |
|
— |
temperatura ispitivanja, |
|
— |
primijenjena analitička metoda, |
|
— |
dokaz o eventualnoj kemijskoj nestabilnosti tvari tijekom ispitivanja i kod primijenjene metode, |
|
— |
sve podatke i napomene relevantne za tumačenje rezultata, posebno s obzirom na nečistoće i fizikalno stanje tvari. |
4. REFERENCE
|
(1) |
OECD, Paris, 1981, Testing Guideline 105, Decision of the Council C(81) 30 final. |
|
(2) |
NF T 20-045 (AFNOR) (September 85) Chemical products for industrial use – Determination of water solubility of solids and liquids with low solubility – Column elution method. |
|
(3) |
NF T 20-046 (AFNOR) (September 85) Chemical products for industrial use – Determination of water solubility of solids and liquids with high solubility – Flask method. |
Dodatak
Slika 1.
Metoda eluiranja kolone pomoću crpke za recirkulaciju

Slika 2.
Tipična mikro-kolona
(Sve dimenzije izražene su u milimetrima)

Slika 3.
Tipična mikro-kolona
(Sve dimenzije izražene su u milimetrima)
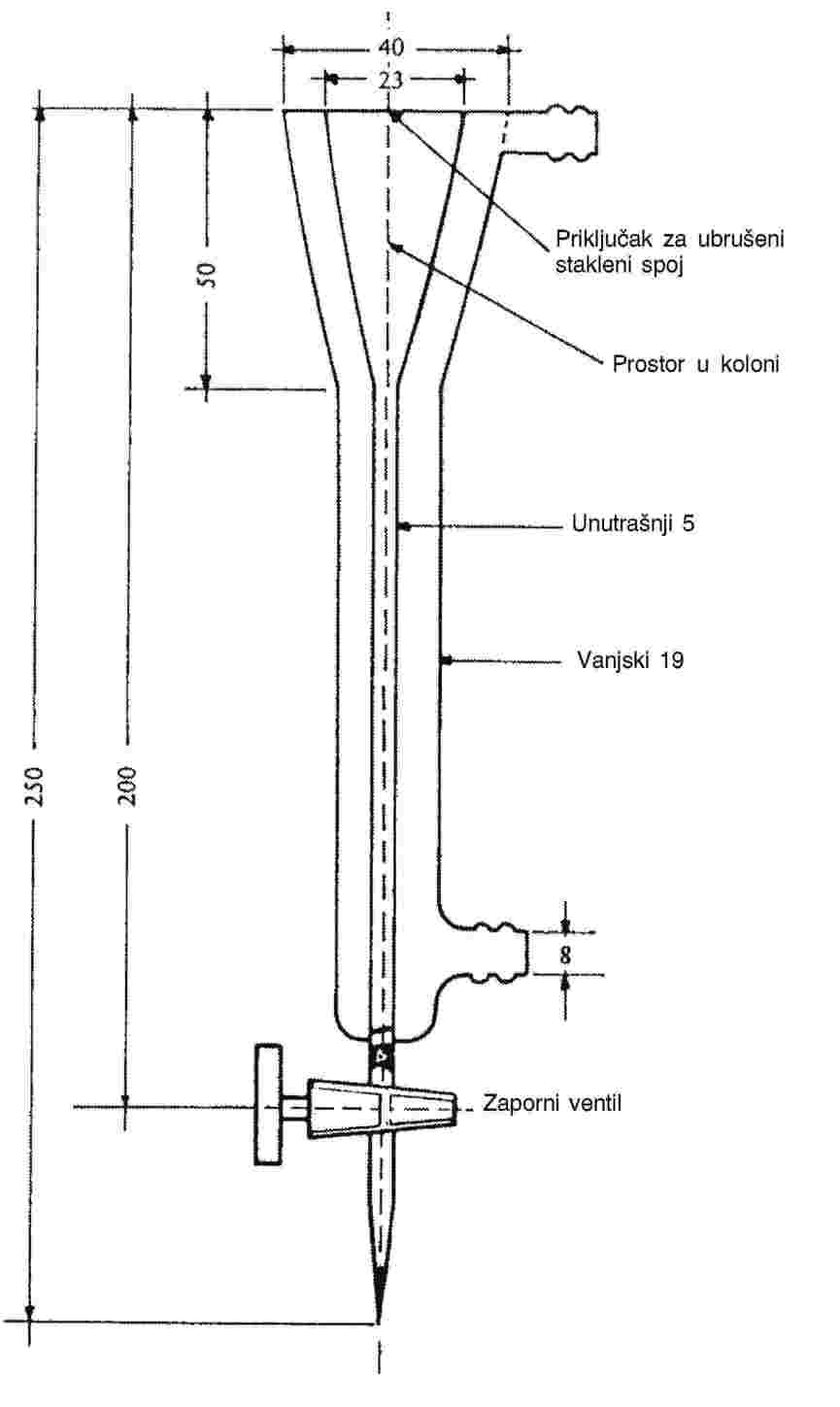
Slika 4.
Metoda eluiranja kolone pomoću nivelacijske posude
A.8. KOEFICIJENT RAZDJELJENJA
1. METODA
Opisana metoda „protresanjem u tikvici” temelji se na Smjernici za ispitivanje OECD-a (1).
1.1. UVOD
Prije provođenja ovog ispitivanja korisno je za tvar koja se ispituje posjedovati preliminarne informacije o strukturnoj formuli, konstanti disasocijacije, topljivosti u vodi, hidrolizi, topljivosti u n-oktanolu i površinskoj napetosti.
Mjerenja treba provoditi na ionizirajućim tvarima samo kad su u neioniziranom obliku (slobodne kiseline ili slobodne lužine) dobivene primjenom odgovarajuće pufer otopine pH vrijednosti najmanje jednu pH jedinicu ispod (za slobodne kiseline) ili iznad (za slobodne lužine) vrijednosti pK.
Ovom ispitnom metodom obuhvaćena su dva odvojena postupka: metoda protresanjem u tikvici i visokoučinkovita tekućinska kromatografija (HPLC). Prvi je primjenljiv kad log Pow (vidjeti definiciju dalje u tekstu) pripada području – 2 do 4, a drugi u području 0 do 6. Prije izvršenja bilo kojega od tih eksperimentalnih postupaka prvo treba dobiti preliminarnu procjenu koeficijenta razdjeljenja.
Metoda protresanjem u tikvici primjenljiva je samo na bitno čiste tvari topljive u vodi i n-oktanolu. Nije primjenljiva na površinski aktivne materijale (za koje treba osigurati izračunanu ili procijenjenu vrijednost na temelju pojedinačnih vrijednosti topljivosti u n-oktanolu i vodi).
Metoda visokoučinkovite tekućinske kromatografije (HPLC) nije primjenljiva na jake kiseline ili lužine, metalne komplekse, površinski aktivne materijale ili tvari koje reagiraju s eluensom. Za te materijale treba osigurati izračunanu ili procijenjenu vrijednost na temelju pojedinačnih vrijednosti topljivosti u n-oktanolu i vodi.
Metoda HPLC manje je osjetljiva na prisutnost nečistoća u ispitivanim spojevima nego metoda protresanjem u tikvici. Bez obzira na to u nekim slučajevima nečistoće mogu otežati tumačenje rezultata jer vršne vrijednosti nije moguće odrediti sa sigurnošću. Za mješavine koje daju nerazlučeni pojas, treba navesti gornju i donju granicu vrijednosti log P.
1.2. DEFINICIJE I JEDINICE
Koeficijent razdjeljenja (P) definira se kao omjer uravnoteženih koncentracija (ci) otopljene tvari u dvofaznom sustavu koji obuhvaća dva otapala koja uglavnom nije moguće miješati. Kad se radi o n-oktanolu i vodi:

Dakle, koeficijent razdjeljenja (P) količnik je dviju koncentracija, a obično se izražava u obliku svojega logaritma na bazu 10 (log P).
1.3. REFERENTNE TVARI
Metoda protresanjem u tikvici
Referentne tvari nije potrebno upotrebljavati kod svakog istraživanja nove tvari. One bi trebale služiti prvenstveno za povremenu provjeru primijenjene metode i omogućiti usporedbu s rezultatima dobivenim drugim metodama.
Metoda HPLC
Radi postavljanja korelacije između podataka koji su metodom HPLC izmjereni o nekom spoju s njegovom vrijednošću koeficijenta razdjeljenja P, treba uspostaviti kalibracijsku krivulju log P u odnosu na podatke dobivene kromatografijom pomoću najmanje šest referentnih točaka. Odgovarajuće referentne tvari odabire sam korisnik. Kad god je to moguće, najmanje jedan referentni spoj treba imati Pow iznad Pow vrijednosti ispitivane tvari, a Pow vrijednost drugog spoja treba biti ispod Pow vrijednosti ispitivane tvari. Za vrijednosti log P ispod 4, kalibracija se može temeljiti na podacima dobivenim metodom protresanjem u tikvici. Za vrijednosti log P veće od 4, kalibracija se može temeljiti na validiranim vrijednostima iz literature ako se te vrijednosti podudaraju s izračunanim vrijednostima. Radi veće točnosti, poželjno je odabrati referentne spojeve koji su strukturno srodni ispitivanoj tvari.
Dostupan je dugi popis vrijednosti log Pow za mnogo skupina kemikalija (2)(3). Ako podaci o koeficijentima razdjeljenja strukturno srodnih spojeva nisu dostupni, može se primijeniti općenitija kalibracija, utvrđena s drugim referentnim spojevima.
Popis preporučenih referentnih tvari i njihovih vrijednosti Pow naveden je u Dodatku 2.
1.4. NAČELO METODE
1.4.1. Metoda protresanjem u tikvici
Kako bi se odredio koeficijent razdjeljenja, između svih sastavnih dijelova sustava treba postići ravnotežu i odrediti koncentracije tvari otopljenih u dvije faze. Proučavanje te teme u literaturi pokazuje da za rješenje tog problema postoji nekoliko raznih tehnika, tj. potpunog miješanja dvije faze nakon kojega slijedi njihovo odvajanje kako bi se odredila koncentracija ravnoteže za tvari koje se ispituju.
1.4.2. Metoda HPLC
HPLC se provodi na analitičkim kolonama punjenim komercijalno dostupnom krutom fazom koja sadrži duge lance ugljikovodika (npr.C8, C18) kemijski vezane na silicijev dioksid. Kemikalije koje se ubrizgavaju u takvu kolonu kreću se duž nje različitim brzinama zbog različitih stupnjeva razdjeljenja između mobilne faze i stacionarne faze ugljikovodika. Mješavine kemikalija eluiraju redom svoje hidrofobičnosti, s tim da kemikalije topljive u vodi eluiraju prve, a kemikalije topljive u ulju posljednje, proporcionalno svojem koeficijentu razdjeljenja ugljikovodik/voda. To omogućuje uspostavljanje veze između vremena zadržavanja na toj koloni (obrnuta faza) i koeficijenta razdjeljenja n-oktanol/voda. Koeficijent razdjeljenja dobiva se iz faktora kapaciteta k izraženog kao:

gdje je tr = vrijeme zadržavanja ispitivane tvari, a to = prosječno vrijeme koje molekuli otapala treba za prolaz kroz kolonu (mrtvo vrijeme).
Kvantitativne analitičke metode nisu potrebne, već treba samo odrediti vremena eluiranja.
1.5. KRITERIJI KVALITETE
1.5.1. Ponovljivost
Metoda protresanjem u tikvici
Kako bi se osigurala točnost koeficijenta razdjeljenja, u tri različita ispitna uvjeta treba provesti dvostruko određivanje, pri čemu količina konkretne tvari kao i omjer volumena otapala mogu biti različiti. Određene vrijednosti koeficijenta razdjeljenja izražene kao njihovi zajednički logaritmi trebaju se kretati u području ± 0,3 log jedinica.
Metoda HPLC
Kako bi se povećala pouzdanost mjerenja, treba provoditi dvostruka određivanja. Vrijednosti log P derivirane iz pojedinačnih mjerenja trebaju se kretati u području ± 0,1 log jedinica.
1.5.2. Osjetljivost
Metoda protresanjem u tikvici
Mjerno područje ove metode određeno je granicom detekcije analitičkog postupka. Taj bi postupak trebao omogućiti procjenu vrijednosti log Pow u području od – 2 do 4 (povremeno, kad to uvjeti dopuštaju, to se područje može proširiti na vrijednosti log Pow do 5) kad koncentracija topljive tvari u jednoj ili drugoj fazi nije veća od 0,01 mol po litri.
Metoda HPLC
Metoda HPLC omogućuje procjenu koeficijenata razdjeljenja vrijednosti log Pow u području od 0 do 6.
Koeficijent razdjeljenja spoja obično se može procijeniti unutar ± 1 log jedinice vrijednosti dobivene metodom protresanjem u tikvici. Tipična korelacija može se naći u literaturi (4)(5)(6)(7)(8). Velika točnost obično se može postići kad se korelacijske krivulje temelje na strukturno srodnim referentnim spojevima (9).
1.5.3. Specifičnost
Metoda protresanjem u tikvici
Nernstov zakon razdjeljenja važi samo kod stalne temperature, tlaka i pH vrijednosti za razrijeđene otopine. Strogo važi za čistu tvar raspršenu između dva čista otapala. Ako se nekoliko različitih topljivih tvari istodobno nađe u jednoj ili obje faze, to može imati utjecaja na rezultate.
Disocijacija ili asocijacija otopljenih molekula vode do odstupanja od Nernstovog zakona razdjeljenja. Na ta odstupanja ukazuje činjenica da koeficijent razdjeljenja postaje ovisan o koncentraciji otopine.
S obzirom da se radi o višestrukim ravnotežama, ovu ispitnu metodu na ionizirajuće spojeve trebalo bi primjenjivati samo uz primjenu korekcije. Za takve spojeve treba razmotriti upotrebu pufer otopina umjesto vode; s tim da se pH vrijednost pufer otopine treba za najmanje 1 pH jedinicu razlikovati od vrijednosti pKa tvari, vodeći računa o relevantnosti te pH vrijednosti za okoliš.
1.6. OPIS METODE
1.6.1. Preliminarna procjena koeficijenta razdjeljenja
Koeficijent razdjeljenja poželjno je procijeniti metodom izračuna (vidjeti Dodatak 1.), ili kad je to primjereno, iz omjera topljivosti ispitivane tvari u čistim otapalima (10).
1.6.2. Metoda protresanjem u tikvici
1.6.2.1. Priprema
n-oktanol: određivanje koeficijenta razdjeljenja treba provesti pomoću reagensa analitičke kvalitete visoke čistoće.
Voda: treba upotrebljavati vodu destiliranu ili dvostruko destiliranu u uređaju sa staklom ili kvarcnim pijeskom. Za ionizirajuće spojeve, kad je to opravdano, treba koristiti pufer otopinu umjesto vode.
Napomena:
Ne bi trebalo koristiti vodu uzetu izravno iz ionskog izmjenjivača.
1.6.2.1.1.
Prije određivanja koeficijenta razdjeljenja, faze sustava otapala obostrano se zasićuju protresanjem na temperaturi pokusa. Za to je praktično tresti dvije velike stock boce n-oktanola analitičke kvalitete visoke čistoće ili vode, i jednog i drugog s dovoljnim količinama drugog otapala, tijekom 24 sata na mehaničkoj miješalici pa ih zatim ostaviti da stoje dovoljno dugo kako bi se faze odvojile i postiglo stanje zasićenja.
1.6.2.1.2.
Čitav volumen dvofaznog sustava treba gotovo ispuniti ispitnu posudu. Time će se spriječiti gubitak materijala uslijed hlapljenja. Omjer volumena i količine tvari koje treba upotrijebiti utvrđuju se na sljedeći način:
|
— |
prethodnom procjenom koeficijenta razdjeljenja (vidjeti gore), |
|
— |
minimalnom količinom ispitivane tvari koja je potrebna za analitički postupak, i |
|
— |
ograničenjem maksimalne koncentracije u svakoj od faza na 0,01 mol po litri. |
Provode se tri ispitivanja. U prvom se primjenjuje izračunani omjer volumena n-oktanola i vode; u drugom se taj omjer dijeli s dva; i u trećem, taj se omjer množi s dva (npr. 1:1, 1:2, 2:1).
1.6.2.1.3.
Matična otopina pripravlja se u n-oktanolu prethodno zasićenom vodom. Koncentraciju matične otopine treba točno utvrditi prije određivanja koeficijenta razdjeljenja. Tu otopinu treba skladištiti u uvjetima koji će osigurati njezinu stabilnost.
1.6.2.2. Ispitni uvjeti
Temperaturu ispitivanja treba držati stalnom (± 1 °C) i u području od 20 do 25 °C.
1.6.2.3. Postupak mjerenja
1.6.2.3.1.
Za svaki od uvjeta ispitivanja treba pripraviti dvostruke ispitne posude koje sadrže potrebnu točno odmjerenu količinu dva otapala zajedno s potrebnom količinom matične otopine. N-oktanol faze treba odmjeriti volumenski. Ispitne posude treba postaviti u odgovarajući uređaj za protresanje ili tresti rukom. Ako se koristi centrifugalna cijev, preporuča se metoda brze vrtnje cijevi kroz 180° oko njezine transverzalne osi kako bi se eventualno zaostali zrak mogao izdići kroz faze. Iskustvo je pokazalo da je 50 takvih rotacija obično dostatno za uspostavljanje ravnoteže razdjeljenja. Radi sigurnosti, preporuča se 100 rotacija u pet minuta.
1.6.2.3.2.
Ako je potrebno, za odvajanje faza potrebno je provesti centrifugiranje mješavine. To se radi u laboratorijskoj centrifugi koja se drži na sobnoj temperaturi ili, ako se rabi centrifuga bez regulacije temperature, radi uravnoteženja, centrifugalne cijevi treba držati na temperaturi ispitivanja najmanje jedan sat prije analize.
1.6.2.4. Analiza
Za određivanje koeficijenta razdjeljenja, potrebno je odrediti koncentracije ispitivanih tvari u obje faze. To se može učiniti na način da se uzme alikvot od svake od dviju faza iz svake cijevi za svaki ispitni uvjet i analizira odabranim postupkom. Ukupna količina tvari prisutna u obje faze izračunava se i uspoređuje s količinom tvari koja je prvobitna uvedena.
Vodenu fazu treba uzorkovati postupkom kojim se minimalizira rizik uključivanja tragova n-oktanola: za uzimanje uzorka vodene faze može se koristiti staklena šprica s izmjenljivom iglom. Šprica mora najprije biti djelomično napunjena zrakom. Zrak treba nježno istiskivati dok se igla uvodi kroz sloj n-oktanola. Odgovarajući volumen vodene faze uvuče se u špricu. Šprica se brzo izvadi iz otopine i igla odvoji. Sadržaj šprice sada se može koristiti kao uzorak vode. Koncentraciju u dvije odvojene faze poželjno je utvrditi metodom koja posebno odgovara za dotičnu tvar. Analitičke metode koje bi mogle biti primjerene su, primjerice:
|
— |
fotometričke metode, |
|
— |
plinska kromatografija, |
|
— |
visokoučinkovita tekućinska kromatografija. |
1.6.3. Metoda HPLC
1.6.3.1. Priprema
Uređaj
Potreban je tekućinski kromatograf opremljen crpkom sa stalnim protokom i odgovarajućim uređajem za detekciju. Preporuča se upotreba ventila za ubrizgavanje s petljama za ubrizgavanje. Prisutnost polarnih grupa u stacionarnoj fazi može ozbiljno ugroziti rad kolone kromotografa. Stoga bi stacionarna faza trebala sadržavati minimalni postotak polarnih grupa (11). Mogu se upotrebljavati trgovačka pakiranja mikro-čestica inverzne faze ili gotove kolone. Između sustava ubrizgavanja i analitičke kolone može se postaviti sigurnosna kolona.
Mobilna faza
Za pripremanje otapala za eluiranje upotrebljavaju se metanol kvalitete predviđene za HPLC i voda kvalitete previđene za HPLC, a otapalo se prije upotrebe otplinjava. Treba primijeniti izokratičnu eluaciju. Treba upotrijebiti omjere metanol/voda s minimalnim sadržajem vode od 25 %. Obično je omjer mješavine metanola i vode 3:1 (v/v) zadovoljavajući za eluiranje spojeva s vrijednošću log P 6 unutar jednog sata kod brzine protoka od 1 ml/min. Za spojeve koji imaju viši log P možda će trebati skratiti vrijeme eluiranja (i vrijeme eluiranja referentnih spojeva) smanjivanjem polariteta mobilne faze ili duljine kolone.
Kod metode HPLC, tvari jako niske topljivosti u n-oktanolu imaju tendenciju dati neuobičajeno male vrijednosti log Pow; vršne vrijednosti takvih spojeva ponekad prate frontu otapala. To je vjerojatno zato što je postupak razdjeljivanja prespor da bi se ravnoteža postigla u vremenu koje obično treba za odvajanje kromatografijom HPLC. Stoga bi se do pouzdane vrijednosti učinkovito moglo doći snižavanjem brzine protoka i/ili smanjivanjem omjera metanol/voda.
Ispitivani i referentni spojevi trebali bi biti topljivi u mobilnoj fazi u koncentracijama koje su dovoljne za njihovu detekciju. Samo u izuzetnim slučajevima s mješavinom metanola i vode smiju se koristiti aditivi, jer aditivi mijenjaju svojstva kolone. Za kromatograme s aditivima obvezno je rabiti posebnu kolonu istog tipa. Ako mješavina metanol-voda nije prikladna, mogu se koristiti mješavine drugih otapala i vode, npr. etanol-voda ili acetonitril-voda.
pH eluensa od kritične je važnosti za ionizirajuće spojeve. pH vrijednost mora biti u radnom području pH vrijednosti kolone, što je obično između 2 i 8. Preporuča se puferiranje. Treba paziti da se izbjegne taloženje soli i propadanje kolone, do čega dolazi kod nekih organskih faza/pufer mješavina. Kod stacionarnih faza koje se temelje na silicijevom dioksidu s pH vrijednošću iznad 8, ne preporuča se mjerenje kromatografijom HPLC jer upotreba alkalne mobilne faze može brzo uzrokovati slabije funkcioniranje kolone.
Rastvori
Referentni spojevi trebali bi biti što je moguće čišći. Spojevi koji se koriste za ispitivanje ili u svrhu kalibracije otapaju se, po mogućnosti, u mobilnoj fazi.
Ispitni uvjeti
Za vrijeme mjerenja, temperatura ne bi smjela varirati za više od ± 2 K.
1.6.3.2. Mjerenje
Izračun mrtvog vremena t o
Mrtvo vrijeme to može se odrediti upotrebom homolognog niza (npr. n-alkil metil ketoni) ili nezadržanih organskih spojeva (npr. tiourea ili formamid). Za izračun mrtvog vremena to primjenom homolognog niza, ubrizgava se set od najmanje sedam članova homolognog niza i utvrđuju se njihova vremena zadržavanja. Sirovi podaci o vremenima zadržavanja tr (nc + 1) ucrtavaju se kao funkcija vremena tr(nc), i određuju se sjecište a i kosina b regresijske jednadžbe:
tr (nc + 1) = a + b tr (nc)
(nc = broj atoma ugljika). Dakle, mrtvo vrijeme to određeno je jednadžbom:
to = a/(1 – b)
Kalibracijska krivulja
Sljedeći je korak konstruiranje korelacijske krivulje vrijednosti log k u odnosu na log p za odgovarajuće referentne spojeve. U praksi, set od 5 do 10 standardnih referentnih spojeva čija je vrijednost log p oko očekivanog područja istodobno se ubrizgava te se određuju vremena zadržavanja, poželjno na integratoru za bilježenje rezultata spojenom na sustav za detekciju. Odgovarajući logaritmi faktora kapaciteta, log k, izračunavaju se i ucrtavaju kao funkcija vrijednosti log p određena metodom protresanja tikvice. Kalibracija se obavlja u redovitim intervalima, najmanje jednom dnevno, kako bi se mogle uzeti u obzir eventualne promjene u funkcioniranju kolone.
Utvrđivanje faktora kapaciteta ispitivane tvari
Ispitivana tvar ubrizga se u najmanju moguću količinu mobilne faze. Odredi se vrijeme zadržavanja (dva puta), čime se omogućuje izračun faktora kapaciteta k. Iz korelacijske krivulje referentnih spojeva može se interpolirati koeficijent razdjeljenja ispitivane tvari. Za jako male i jako velike koeficijente razdjeljenja, ekstrapolacija je neophodna. U tim slučajevima treba voditi računa o granicama pouzdanosti linije regresije.
2. PODACI
Metoda protresanja tikvice
Pouzdanost utvrđenih vrijednosti P može se ispitati uspoređivanjem srednjih vrijednosti dvostrukih određivanja i sveukupne srednje vrijednosti.
3. IZVJEŠĆIVANJE
U izvješću o ispitivanju treba, ako je moguće, navesti sljedeće informacije:
|
— |
precizna specifikacija tvari (identitet i nečistoće), |
|
— |
kad metode nisu primjenljive (npr. površinski aktivni materijali), treba osigurati izračunanu ili procijenjenu vrijednost koja se temelji na pojedinačnim topljivostima n-oktanola i vode |
|
— |
svi podaci i napomene relevantne za tumačenje rezultata, posebno s obzirom na nečistoće i fizikalno stanje tvari. |
Za metodu protresanjem tikvice:
|
— |
rezultat prethodne procjene, ako je provedena, |
|
— |
temperatura određivanja, |
|
— |
podaci o analitičkim postupcima koji su primijenjeni u određivanju koncentracija, |
|
— |
vrijeme i brzina centrifugiranja, ako je primijenjeno, |
|
— |
izmjerene koncentracije u obje faze za svako određivanje (to znači da u izvješće treba unijeti ukupno 12 koncentracija), |
|
— |
težina ispitivane tvari, volumen svake faze koja je upotrijebljena u svakoj ispitnoj posudi i ukupna izračunana količina ispitivane tvari prisutna u svakoj fazi nakon uravnoteženja, |
|
— |
izračunane vrijednosti koeficijenta razdjeljenja (P) i srednja vrijednost za svaki set ispitnih uvjeta kao i srednja vrijednost za sva određivanja. U izvješću treba navesti svaku indikaciju zavisnosti koncentracije o koeficijentu razdjeljenja, |
|
— |
treba navesti standardno odstupanje pojedinačnih vrijednosti P od njihove srednje vrijednosti, |
|
— |
srednja vrijednost P iz svih određivanja mora biti izražena i njezinim logaritmom (baza 10), |
|
— |
izračunati teoretski Pow ako je ta vrijednost utvrđena ili ako je izmjerena vrijednost > 104, |
|
— |
pH vrijednost vode koja je upotrijebljena i pH vodene faze tijekom pokusa, |
|
— |
ako su korišteni puferi, obrazloženje za upotrebu pufera umjesto vode, sastav, koncentracija i pH vrijednost pufera, pH vrijednost vodene faze prije i poslije pokusa. |
Za metodu kromatografijom HPLC:
|
— |
rezultat prethodne procjene, ako je provedena, |
|
— |
ispitivanja i referentne tvari, i njihova čistoća, |
|
— |
temperaturno područje određivanja, |
|
— |
pH vrijednost na kojoj su određivanja provedena, |
|
— |
podaci o analitičkoj i sigurnosnoj koloni, mobilnoj fazi i srednjim vrijednostima detekcije, |
|
— |
podaci o zadržavanju i vrijednosti log P koje se za referentne spojeve upotrijebljene u kalibraciji spominju u literaturi, |
|
— |
pojedinosti o prilagođenoj liniji regresije (log k u odnosu na log P), |
|
— |
podaci o prosječnom zadržavanju i interpolirana vrijednost log P za ispitivani spoj, |
|
— |
opis opreme i radnih uvjeta, |
|
— |
profili eluiranja, |
|
— |
količine ispitivane i referentne tvari uvedene u kolonu, |
|
— |
mrtvo vrijeme i način na koji je mjereno. |
4. REFERENCE
|
(1) |
OECD, Paris, 1981, Testing Guideline 107, Decision of the Council C(81) 30 final. |
|
(2) |
C. Hansch and A.J. Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology, John Wiley, New York, 1979. |
|
(3) |
Log P and Parameter Database, A tool for the quantitative prediction of bioactivity (C. Hansch, chairman, A.J. Leo, dir.) – Available from Pomona College Medical Chemistry Project 1982, Pomona College, Claremont, California 91711. |
|
(4) |
L. Renberg, G. Sundström and K. Sundh-Nygärd, Chemosphere, 1980, vol. 80, str. 683. |
|
(5) |
H. Ellgehausen, C. D’Hondt and R. Fuerer, Pestic. Sci., 1981, vol. 12, str. 219. |
|
(6) |
B. McDuffie, Chemosphere, 1981, vol. 10, str. 73. |
|
(7) |
W.E. Hammers et al., J. Chromatogr., 1982, vol. 247, str. 1. |
|
(8) |
J.E. Haky and A. M. Young, J. Liq. Chromat., 1984, vol. 7, str. 675. |
|
(9) |
S. Fujisawa and E. Masuhara, J. Biomed. Mat. Res., 1981, vol. 15, str. 787. |
|
(10) |
O. Jubermann, Verteilen und Extrahieren, in Methoden der Organischen Chemie (Houben Weyl), Allgemeine Laboratoriumpraxis (edited by E. Muller), Georg Thieme Verlag, Stuttgart, 1958, Band I/1, str. 223-339. |
|
(11) |
R.F. Rekker and H.M. de Kort, Euro. J. Med. Chem., 1979, vol. 14, str. 479. |
|
(12) |
A. Leo, C. Hansch and D. Elkins, Partition coefficients and their uses. Chem. Rev., 1971, vol. 71, str. 525. |
|
(13) |
R.F. Rekker, The Hydrophobic Fragmental Constant, Elsevier, Amsterdam, 1977. |
|
(14) |
NF T 20-043 AFNOR (1985). Chemical products for industrial use – Determination of Partition Coefficients – Flask shaking method. |
|
(15) |
C.V. Eadsforth and P. Moser, Chemosphere, 1983, vol. 12, str. 1459. |
|
(16) |
A.Leo, C. Hansch and D. Elkins, Chem. Rev., 1971, vol. 71, str. 525. |
|
(17) |
C.Hansch, A.Leo, S. H. Unger, K. H. Kim, D. Nikaitani and E. J. Lien, J. Med. Chem., 1973, vol. 16, str. 1207. |
|
(18) |
W.B. Neely, D.R. Branson and G.E. Blau, Environ. Sci. Technol., 1974, vol. 8, str. 1113. |
|
(19) |
D.S. Brown and E.W. Flagg, J. Environ. Qual., 1981, vol. 10, str. 382. |
|
(20) |
J.K. Seydel and K.J. Schaper, Chemische Struktur und biologische Aktivität von Wirkstoffen, Verlag Chemie, Weinheim, New York, 1979. |
|
(21) |
R. Franke, Theoretical Drug Design Methods, Elsevier, Amsterdam 1984. |
|
(22) |
Y.C. Martin, Quantitative Drug Design, Marcel Dekker, New York, Base1, 1978. |
|
(23) |
N.S. Nirrlees, S.J. Noulton, C.T. Murphy, P.J. Taylor; J. Med. Chem., 1976, vol. 19, str. 615. |
Dodatak 1.
Metode izračuna/procjene
UVOD
Općeniti uvod u metode, podaci i primjeri izračuna navedeni su u priručniku o metodama procjene kemijskih svojstava „Handbook of Chemical Property Estimation Methods (a)”
Izračunane vrijednosti Pow mogu se koristiti:
|
— |
za donošenje odluke o tome koja je eksperimentalna metoda primjerena (područje metode protresanjem tikvice: log Pow: – 2 do 4, područje metode HPLC: log Pow: 0 do 6), |
|
— |
za odabir primjerenih ispitnih uvjeta (npr. referentne tvari za postupke kromatografije HPLC, omjer volumena n-oktanol/voda za metodu protresanjem tikvice), |
|
— |
kao vlastita provjera radi otkrivanja eventualnih pogrešaka u pokusu koju provodi sam laboratorij, |
|
— |
kao procijenjene vrijednosti Pow u slučajevima kad iz tehničkih razloga nije moguće primijeniti eksperimentalne metode. |
METODA PROCJENE
Preliminarna procjena koeficijenta razdjeljenja
Vrijednost koeficijenta razdjeljenja može se procijeniti pomoću topljivosti ispitivanih tvari u čistim otapalima.
Tada je:

METODE IZRAČUNA
Načelo metoda izračuna
Sve metode izračuna temelje se na formalnoj fragmentaciji molekule na odgovarajuće pod-strukture za koje su prirasti vrijednosti log Pow poznati. Log Pow cijele molekule tada se izračunava kao zbroj odgovarajućih vrijednosti njezinih fragmenata uvećan za zbroj korektivnih članova za intramolekulske interakcije.
Postoje popisi konstanti fragmenata i korektivnih članova (b)(c)(d)(e) od kojih se neki redovito ažuriraju (b).
Kriteriji kvalitete
Općenito, što je složeniji spoj koji se proučava, pouzdanost metode izračuna je manja. Kad se radi o jednostavnim molekulama male molekulske težine i molekulama koje sadrže jednu ili dvije funkcionalne skupine, između rezultata različitih metoda fragmentacije i izmjerene vrijednosti može se očekivati odstupanje od 0,1 do 0,3 log Pow jedinica. Kad se radi o složenijim molekulama, margina greške može biti veća. To će ovisiti o pouzdanosti i dostupnosti konstanti fragmenata, kao i o sposobnosti prepoznavanja intramolekulskih interakcija (npr. vodikove veze) i pravilne primjene korektivnih članova (nije toliki problem kod računalnog programa CLOGP-3) (b). Kad se radi o ionizirajućim spojevima, važno je uzeti u obzir točan naboj ili stupanj ionizacije.
Postupci izračuna
Hanschova π-metoda
Konstanta originalnog supstituenta, π, koju su uveli Fujira i ostali (f) definira se kao:
πx = log Pow (PhX) – log Pow (PhH)
gdje je Pow (PhX) koeficijent razdjeljenja aromatskog derivata, a Pow (PhH) koeficijent razdjeljenja roditeljskog spoja
(npr. πCl = log Pow (C6H5Cl) – log Pow (C6H6) = 2,84 – 2,13 = 0,71).
Prema definiciji π-metoda primjenljiva je pretežito na aromatsku supstituciju. Prikupljene su π-vrijednosti za velik broj supstituenata (b)(c)(d). Pomoću njih se izračunava log Pow za aromatske molekule i podstrukture.
Rekkerova metoda
Prema Rekkeru (g), vrijednost log Pow izračunava se kako slijedi:

gdje fi predstavlja konstante različitih molekulskih fragmenata, a a1 učestalost njihovog pojavljivanja u molekuli koja se ispituje. Korektivni članovi mogu se izraziti kao integralni višekratnik samo jedne konstante Cm (takozvane magične konstante). Konstante fragmenata, fi i Cm određene su iz popisa koji sadrži 1 054 ekperimentalnu vrijednost Pow (825 spojeva) primjenom višestruke regresijske analize (c)(h). Određivanje faktora interakcije provodi se u skladu s utvrđenim pravilima kako su opisana u literaturi (e)(h)(i).
Hansch-Leova metoda
Prema Hanschu i Leu (c), vrijednost log Pow izračunava se iz:

gdje fi predstavlja konstante različitih molekulskih fragmenata, Fj korektivne faktore, a ai, bj predstavljaju njihovu učestalost pojavljivanja. Izvedeni iz ekperimentalnih vrijednost Pow, popis atomskih i grupnih fragmentiranih vrijednosti i popis korektivnih članova Fj (tzv. faktori) određeni su putem pokušaja i pogreške. Korektivni članovi svrstani su u nekoliko različitih klasa (a)(c). Prilično je složeno i vremenski zahtjevno uzeti u obzir sva pravila i korektivne članove. Razvijeni su programski paketi (b).
Kombinirana metoda
Izračun vrijednost log Pow složenih molekula moguće je znatno unaprijediti ako se molekula rasiječe na veće podstrukture za koje su pouzdane vrijednosti log Pow dostupne bilo iz tablica (b)(c) ili iz vlastitih mjerenja. Takve fragmente (npr. heterocikli, antrakinon, azobenzen) tada je moguće kombinirati s Hanschovim π-vrijednostima ili s Rekkerovim i Leovim konstantama fragmenata.
Napomene
|
i. |
Metode izračuna mogu se primijeniti na djelomično ili potpuno ionizirane spojeve samo kad je moguće uzeti u obzir potrebne korektivne faktore; |
|
ii. |
Ako se može pretpostaviti prisutnost intramolekulske vodikove veze, obvezno treba dodati odgovarajuće korektivne članove (približno + 0,6 do + 1,0 log Pow jedinica) (a). Pokazatelji prisutnosti tih veza dobivaju se stereo modelima ili spektroskopskim podacima o molekuli; |
|
iii. |
Ako je nekoliko tautomernih oblika moguće, najvjerojatniji oblik treba uzeti kao osnovu izračuna; |
|
iv. |
Revizije popisa konstanti fragmenata treba pažljivo pratiti. |
Izvješće
Kad se koriste metode izračuna/procjene, izvješća o ispitivanju, ako je moguće, moraju sadržavati sljedeće informacije:
|
— |
opis tvari (mješavina, nečistoće itd.), |
|
— |
indikaciju eventualne intramolekulske vodikove veze, disocijacije, naboja ili drugih neuobičajenih učinaka (npr. tautomerija), |
|
— |
opis metode izračuna, |
|
— |
identifikacija ili porijeklo baze podataka, |
|
— |
pojedinosti o izboru fragmenata, |
|
— |
sveobuhvatna dokumentacija izračuna. |
LITERATURA
|
(a) |
W.J. Lyman, W.F. Reehl and D.H. Rosenblatt (ed.), Handbook of Chemical Property Estimation Methods, McGraw-Hill, New York, 1983. |
|
(b) |
Pomona College, Medicinal Chemistry Project, Claremont, California 91711, USA, Log P Database and Med. Chem. Software (Program CLOGP-3). |
|
(c) |
C. Hansch, A.J. Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology, John Wiley, New York, 1979. |
|
(d) |
A. Leo, C. Hansch, D. Elkins, Chem. Rev., 1971., vol. 71, str. 525. |
|
(e) |
R.F. Rekker, H.M. de Kort, Eur. J. Med. Chem. -Chill. Ther. 1979., vol. 14, str. 479. |
|
(f) |
T. Fujita, J. Iwasa and C. Hansch, J. Amer. Chem. Soc., 1964., vol. 86, str. 5175. |
|
(g) |
R.F. Rekker, The Hydrophobic Fragmental Constant, Pharmacochemistry Library, Elsevier, NewYork, 1977., vol. 1. |
|
(h) |
C.V. Eadsforth, P. Moser, Chemosphere, 1983., vol. 12, str. 1459. |
|
(i) |
R.A. Scherrer, ACS, American Chemical Society, Washington D.C., 1984., Symposium Series 255, str. 225. |
Dodatak 2.
Preporučene referentne tvari za metodu HLPC
|
Br. |
Referentna tvar |
log Pow |
pKa |
|
1 |
2- butanon |
0,3 |
|
|
2 |
4-acetilpiridin |
0,5 |
|
|
3 |
Anilin |
0,9 |
|
|
4 |
Acetanilid |
1,0 |
|
|
5 |
Benzilalkohol |
1,1 |
|
|
6 |
p-metoksifenol |
1,3 |
pKa = 10,26 |
|
7 |
Fenoksi octena kiselina |
1,4 |
pKa = 3,12 |
|
8 |
Fenol |
1,5 |
pKa = 9,92 |
|
9 |
2,4-dinitrofenol |
1,5 |
pKa = 3,96 |
|
10 |
Benzonitril |
1,6 |
|
|
11 |
Fenilacetonitril |
1,6 |
|
|
12 |
4-metilbenzil alkohol |
1,6 |
|
|
13 |
Acetofenon |
1,7 |
|
|
14 |
2-nitrofenol |
1,8 |
pKa = 7,17 |
|
15 |
3- nitrobenzojeva kiselina |
1,8 |
pKa = 3,47 |
|
16 |
4-kloranilin |
1,8 |
pKa = 4,15 |
|
17 |
Nitrobenzen |
1,9 |
|
|
18 |
Cinaminski alkohol |
1,9 |
|
|
19 |
Benzojeva kiselina |
1,9 |
pKa = 4,19 |
|
20 |
p-krezol |
1,9 |
pKa = 10,17 |
|
21 |
Cinaminska kiselina |
2,1 |
pKa = 3,89 cis 4,44 trans |
|
22 |
Anizol |
2,1 |
|
|
23 |
Metilbenzoat |
2,1 |
|
|
24 |
Benzen |
2,1 |
|
|
25 |
3-metilbenzojeva kiselina |
2,4 |
pKa = 4,27 |
|
26 |
4-klorofenol |
2,4 |
pKa = 9,1 |
|
27 |
Tri-kloretilen |
2,4 |
|
|
28 |
Atrazin |
2,6 |
|
|
29 |
Etilbenzoat |
2,6 |
|
|
30 |
2,6-diklorobenzonitril |
2,6 |
|
|
31 |
3-klorobenzojeva kiselina |
2,7 |
pKa = 3,82 |
|
32 |
Toluen |
2,7 |
|
|
33 |
1-naftol |
2,7 |
pKa = 9,34 |
|
34 |
2,3-dikloroanilin |
2,8 |
|
|
35 |
Klorobenzen |
2,8 |
|
|
36 |
Alil-fenileter |
2,9 |
|
|
37 |
Bromobenzen |
3,0 |
|
|
38 |
Etilbenzen |
3,2 |
|
|
39 |
Benzofenon |
3,2 |
|
|
40 |
4-fenilfenol |
3,2 |
pKa = 9,54 |
|
41 |
Timol |
3,3 |
|
|
42 |
1,4-diklorobenzen |
3,4 |
|
|
43 |
Difenilamin |
3,4 |
pKa = 0,79 |
|
44 |
Naftalen |
3,6 |
|
|
45 |
Fenilbenzoat |
3,6 |
|
|
46 |
Izopropilbenzen |
3,7 |
|
|
47 |
2,4,6-triklorofenol |
3,7 |
pKa = 6 |
|
48 |
Bifenil |
4,0 |
|
|
49 |
Benzilbenzoat |
4,0 |
|
|
50 |
2,4-dinitro-6 sec. butilfenol |
4,1 |
|
|
51 |
1,2,4-triklorobenzen |
4,2 |
|
|
52 |
Dodekanska kiselina |
4,2 |
|
|
53 |
Difenileter |
4,2 |
|
|
54 |
n-butilbenzen |
4,5 |
|
|
55 |
Fenantren |
4,5 |
|
|
56 |
Floranten |
4,7 |
|
|
57 |
Dibenzil |
4,8 |
|
|
58 |
2,6-difenilpiridin |
4,9 |
|
|
59 |
Trifenilamin |
5,7 |
|
|
60 |
DDT |
6,2 |
|
|
Ostale referentne tvari niskog log Pow |
|||
|
1 |
Nikotinska kiselina |
–0,07 |
|
A.9. PLAMIŠTE
1. METODA
1.1. UVOD
Prije provođenja ovog ispitivanja korisno je raspolagati preliminarnim informacijama o zapaljivosti tvari koja se ispituje. Ispitni postupak primjenjuje se na tekuće tvari čije je pare moguće zapaliti izvorom zapaljenja. Ispitne metode navedene u ovom tekstu pouzdane su samo za područja plamišta koja su pojedinačno navedena za svaku metodu.
Kod odabira metode koja će se primijeniti treba uzeti u obzir mogućnost kemijske reakcije između tvari i posude za uzorak.
1.2. DEFINICIJE I JEDINICE
Plamište je najniža temperatura, ispravljena na tlak od 101,325 kPa, kod koje, u uvjetima utvrđenim u ispitnoj metodi, tekućina evolvira toliku količinu para da u ispitnoj posudi nastane zapaljiva mješavina pare i zraka.
Jedinice: °C
t = T – 273,15
(t u °C, a T u K)
1.3. REFERENTNE TVARI
Referentne tvari nije potrebno upotrebljavati kod svakog istraživanja nove tvari. One bi trebale služiti prvenstveno za povremenu provjeru primijenjene metode i omogućiti usporedbu s rezultatima dobivenim drugim metodama.
1.4. NAČELO METODE
Tvar se stavi u ispitnu posudu i zagrijava ili hladi do temperature ispitivanja u skladu s postupkom opisanim u pojedinoj ispitnoj metodi. Probe zapaljenja provode se kako bi se utvrdilo hoće li se uzorak zapaliti na temperaturi ispitivanja ili neće.
1.5. KRITERIJI KVALITETE
1.5.1. Ponovljivost
Ponovljivost varira u skladu s područjem plamišta i primijenjenoj ispitnoj metodi; maksimalno 2 °C.
1.5.2. Osjetljivost
Osjetljivost ovisi o primijenjenoj ispitnoj metodi.
1.5.3. Specifičnost
Posebnost nekih ispitnih metoda ograničena je na određena područja plamišta i ovisi o podacima specifičnim za pojedinu tvar (npr. velika viskoznost).
1.6. OPIS METODE
1.6.1. Pripravci
Uzorak ispitivane tvari stavi se u ispitni uređaj prema 1.6.3.1. i/ili 1.6.3.2.
Radi sigurnosnih razloga, za energetske i toksične tvari preporuča se primjena metode kod koje se koristi mala količina uzorka, približno 2 cm3.
1.6.2. Ispitni uvjeti
Do mjere u kojoj je to moguće iz sigurnosnih razloga, uređaj treba postaviti u položaj zaštićen od strujanja zraka.
1.6.3. Provođenje ispitivanja
1.6.3.1. Metoda ravnoteže
Vidjeti norme: ISO 1516, ISO 3680, ISO 1523, ISO 3679.
1.6.3.2. Metoda neravnoteže
Uređaj Abel:
Vidjeti norme: BS 2000 dio 170., NF M07-011, NF T66-009.
Uređaj Abel-Pensky:
Vidjeti norme: EN 57, DIN 51755 dio 1. (za temperature od 5 do 65 °C), DIN 51755 dio 2. (za temperature ispod 5 °C), NF M07-036.
Uređaj Tag:
Vidjeti normu ASTM D 56.
Uređaj Pensky-Martens:
Vidjeti norme: ISO 2719, EN 11, DIN 51758, ASTM D 93, BS 2000-34, NF M07-019.
Napomene:
Ako se metodom neravnoteže iz 1.6.3.2. utvrdi da je plamište na temperaturi 0 ± 2 °C, 21 ± 2 °C ili 55 ± 2 °C, to treba potvrditi metodom ravnoteže koristeći isti uređaj.
U svrhu prijavljivanja smiju se koristiti samo one metode koje daju temperaturu plamišta.
Za određivanje plamišta viskoznih tekućina (boje, gume i slično) koje sadrže otapala dozvoljeno je koristiti samo uređaj i ispitne metode prikladne za određivanje plamišta viskoznih tekućina.
Vidjeti norme: ISO 3679, ISO 3680, ISO 1523, DIN 53213 dio 1.
|
2. |
PODACI |
3. IZVJEŠĆIVANJE
U izvješću o ispitivanju treba, ako je moguće, navesti sljedeće informacije:
|
— |
precizna specifikacija tvari (identitet i nečistoće), |
|
— |
treba navesti primijenjenu metodu kao i eventualna odstupanja, |
|
— |
rezultate i sve dodatne napomene relevantne za tumačenje rezultata. |
4. REFERENCE
Nema ih.
A.10. ZAPALJIVOST (KRUTINE)
1. METODA
1.1. UVOD
Prije provođenja ovog ispitivanja korisno je raspolagati preliminarnim informacijama o potencijalno eksplozivnim svojstvima tvari.
Ovo ispitivanje treba primjenjivati samo na tvari u obliku praha, granula ili paste.
Kako se ne bi obuhvatile sve tvari koje gore već samo one koje gore brzo ili one čije ponašanje kod zapaljenja je na bilo koji način izrazito opasno, lako zapaljivim tvarima smatraju se samo one tvari čija brzina gorenja premašuje određenu graničnu vrijednost.
Usijanost koja se proširi kroz metalnu prašinu može biti izrazito opasna jer se takav požar teško gasi. Metalnu prašinu treba smatrati lako zapaljivom ako podržava širenje usijanja cijelom masom u određenom vremenu.
1.2. DEFINICIJE I JEDINICE
Vrijeme gorenja izraženo u sekundama
1.3. REFERENTNE TVARI
Nisu navedene.
1.4. NAČELO METODE
Tvar se oblikuje kao neprekinuta traka ili pruga od praha dugačka oko 250 mm, te se provodi preliminarni test probira kako bi se odredilo dolazi li kod zapaljenja na plinskom plamenu do širenja plamena ili do tinjanja. Ako se plamen u određenom vremenu proširi na preko 200 mm u dužinu, treba provesti potpuni program ispitivanja kako bi se odredila brzina gorenja.
1.5. KRITERIJI KVALITETE
Nisu navedeni.
1.6. OPIS METODE
1.6.1. Preliminarni test probira
Tvar se oblikuje na nezapaljivoj, neporoznoj ploči slabe termičke provodljivosti kao neprekinuta traka ili pruga od praha dugačka oko 250 mm, široka 20 mm i visoka 10 mm. Plamen iz plinskoga gorača (minimalnog promjera 5 mm) drži se na jednom kraju pruge od praha sve dok se prah ne zapali ili najduže dvije minute (pet minuta za prah metala ili metalnih legura). Treba pratiti širi li se gorenje uzduž 200 mm dugačke pruge u ispitnom razdoblju od 4 minute (ili 40 minuta za metalnu prašinu). Ako se u ispitnom razdoblju od 4 minute (ili 40 minuta) tvar nije zapalila niti se gorenje nastavilo bilo kao plamen ili kao tinjanje uzduž 200 mm dugačke pruge, tvar ne treba smatrati lako zapaljivom i daljnje ispitivanje nije potrebno. Ako se širenje gorenja tvari nastavi na način da 200 mm dugačka pruga izgori za manje od četiri minute, ili manje od 40 minuta za metalni prah, treba provesti postupak opisan dalje u tekstu (točka 1.6.2. i dalje).
1.6.2. Ispitivanje brzine gorenja
1.6.2.1. Priprema
Praškaste ili zrnate tvari rahlo se napune u kalup dugačak 250 mm, trokutastog presjeka unutarnje visine 10 mm i širine 20 mm. S obje strane kalupa uzdužno su montirana dva metalna lima kao bočni graničnici koji su za 2 mm viši od gornjeg ruba trokutastog presjeka (slika). Kalup se tri puta spusti s visine od 2 cm na čvrstu podlogu. Po potrebi kalup treba nadopuniti. Bočni graničnici se zatim skinu, a višak tvari sastruže. Na vrh kalupa postavi se nezapaljiva, neporozna ploča slabe toplinske provodljivosti, uređaj se preokrene naopako i kalup se odstrani.
Tvari u obliku paste nanesu se na nezapaljivu, neporoznu ploču slabe toplinske provodljivosti u obliku užeta dugačkog 250 mm, poprečnog presjeka oko 1 cm2.
1.6.2.2. Ispitni uvjeti
Kad se radi o tvari koja je osjetljiva na vlagu, ispitivanje treba provesti što je moguće brže nakon što je tvar izvađena iz spremnika.
1.6.2.3. Provođenje ispitivanja
Složite u digestor hrpicu uzorka na način da kroz njega struji zrak.
Brzina strujanja zraka trebala bi biti dovoljna da se spriječi istjecanje para u laboratorij i ne bi je se smjelo mijenjati tijekom ispitivanja. Strujanjem zraka oko uređaja mora se formirati zračna zavjesa.
Plamen iz plinskoga gorača (najmanje 5 mm u promjeru) koristi se za paljenje hrpice s jednog kraja. Kad tvar izgori u duljini od 80 mm, mjeri se brzina gorenja na sljedećih 100 mm.
Ako se pozitivan rezultat ne zamijeti ranije, ispitivanje se provodi šest puta, svaki put na čistom limu za hlađenje.
2. PODACI
Za procjenu relevantno je vrijeme gorenja iz preliminarnog testa probira (1.6.1.) i najkraće vrijeme gorenja u najviše šest ispitivanja (1.6.2.3.)
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
U izvješću o ispitivanju treba, ako je moguće, navesti sljedeće informacije:
|
— |
precizna specifikacija tvari (identitet i nečistoće), |
|
— |
opis tvari koja se ispituje, njezino fizikalno stanje uključujući sadržaj vlage |
|
— |
rezultati iz preliminarnog testa probira i ispitivanja brzine gorenja, ako je to ispitivanje provedeno, |
|
— |
sve dodatne napomene relevantne za tumačenje rezultata. |
3.2. TUMAČENJE REZULTATA
Tvari u obliku praha, granula ili paste smatraju se lako zapaljivima ako je vrijeme gorenja prilikom bilo kojih testiranja provedenih sukladno postupku ispitivanja iz 1.6.2. kraće od 45 sekundi. Prah metala ili metalnih legura smatra se lako zapaljivim ako se može zapaliti a plamen ili zona reakcije se proširi po cijelom uzorku u roku od 10 minuta ili manje.
4. REFERENCE
NF T 20-042 (September 85) Chemical products for industrial use. Determination of the flammability of solids.
Dodatak
Slika
Kalup i pribor za pripremu hrpice
(Sve dimenzije izražene su u milimetrima)
A.11. ZAPALJIVOST (PLINOVI)
1. METODA
1.1. UVOD
Ovom metodom moguće je odrediti jesu li plinovi pomiješani sa zrakom na sobnoj temperaturi (oko 20 °C) i atmosferskom tlaku zapaljivi i, ako jesu, u kojem području koncentracija. Mješavine sve većih koncentracija ispitivanog plina i zraka izlažu se električnoj iskri te se prati dolazi li do zapaljenja.
1.2. DEFINICIJE I JEDINICE
Područje zapaljivosti je područje koncentracija između donje i gornje granice eksplozije. Donja i gornja granica eksplozivnosti su granične koncentracije zapaljivog plina u smjesama sa zrakom na kojima ne dolazi do širenja plamena.
1.3. REFERENTNE TVARI
Nisu navedene.
1.4. NAČELO METODE
Koncentracija plina u zraku postupno se povećava, te se kod svakog povećanja izlaže električnoj iskri.
1.5. KRITERIJI KVALITETE
Nisu navedeni.
1.6. OPIS METODE
1.6.1. Uređaj
Ispitna posuda je uspravni stakleni cilindar unutarnjeg promjera najmanje 50 mm i minimalne visine 300 mm. Elektrode za paljenje međusobno su odvojene od 3 do 5 mm, a postavljene su 60 mm iznad dna cilindra. Cilindar ima otvor za oslobađanje tlaka. Uređaj mora imati zaštitni plašt kako bi se ograničila eventualna šteta od eksplozije.
Kao izvor zapaljenja koristi se indukcijska iskra koja traje 0,5 sek., a nastaje visokonaponskim transformatorom izlaznog napona 10 do 15 kV (maksimalne ulazne snage 300 W). Primjer odgovarajućeg uređaja opisan je u referenci (2).
1.6.2. Ispitni uvjeti
Ispitivanje treba provoditi na sobnoj temperaturi (oko 20 °C).
1.6.3. Provođenje ispitivanja
Dozirnim crpkama u stakleni cilindar uvodi se poznata koncentracija plina u zraku. Kroz mješavinu se pušta iskra i promatra se hoće li se plamen odvojiti od izvora zapaljenja i neovisno širiti ili ne. Koncentracija plina mijenja se po 1 % vol. dok ne dođe do zapaljenja kako je gore opisano.
Ako kemijska struktura plina ukazuje da bi mogao biti nezapaljiv, a sastav stehiometrijske mješavine sa zrakom može se izračunati, tada postupno u rasponu od 1 % treba ispitivati samo mješavine u području od 10 % ispod do 10 % iznad stehiometrijskog sastava.
2. PODACI
Pojava širenja plamena jedini je relevantan podatak za određivanje ovog svojstva.
3. IZVJEŠĆIVANJE
U izvješću o ispitivanju treba, ako je moguće, navesti sljedeće informacije:
|
— |
precizna specifikacija tvari (identitet i nečistoće), |
|
— |
opis i dimenzije uređaja koji se koristi, |
|
— |
temperatura na kojoj je ispitivanje provedeno, |
|
— |
ispitane koncentracije i dobiveni rezultati, |
|
— |
rezultat ispitivanja: nezapaljivi plin ili lako zapaljivi plin, |
|
— |
ako je zaključeno da je plin nezapaljiv, tada treba navesti područje koncentracija u kojem je plin postupno ispitivan po 1 %, |
|
— |
sve informacije i napomene relevantne za tumačenje rezultata. |
4. REFERENCE
|
(1) |
NF T 20-041 (September 85) Chemical products for industrial use. Determination of the flammability of gases. |
|
(2) |
W. Berthold, D. Conrad, T. Grewer, H. Grosse-Wortmann „Entwicklung einer Standard-Apparatur zur Messung von Explosionsgrenzen”. Chem.-Ing.- Tech., 1984, vol. 56, 2, 126-127., T. Redeker und H.Schacke, str. 126-127. |
A.12. ZAPALJIVOST (U DODIRU S VODOM)
1. METODA
1.1. UVOD
Ovom metodom moguće je odrediti razvijaju li se kod reakcije tvari s vodom ili vlažnim zrakom opasne količine plina ili plinova koji mogu biti lako zapaljivi.
Ova se ispitna metoda može primijeniti i na krute i na tekuće tvari. Ova metoda nije primjenljiva na tvari koje se spontano pale u dodiru sa zrakom.
1.2. DEFINICIJE I JEDINICE
Lako zapaljive: tvari koje u dodiru s vodom ili vlažnim zrakom razvijaju lako zapaljive plinove u opasnim količinama brzinom od najmanje 1 litra/kg na sat.
1.3. NAČELO METODE
Tvar se ispituje postupno kako je opisano dalje u tekstu; ako u bilo kojoj fazi dođe do zapaljenja, daljnje ispitivanje nije potrebno. Ako je poznato da tvar ne reagira burno s vodom, treba odmah prijeći na fazu 4. (1.3.4.)
1.3.1. Faza 1.
Ispitivana tvar postavlja se u korito koje sadrži destiliranu vodu na 20 °C i bilježi se hoće li se razvijeni plin zapaliti ili ne.
1.3.2. Faza 2.
Ispitivana tvar postavlja se na filtar papir koji pluta na površini posude koja sadrži destiliranu vodu na 20 °C i bilježi se hoće li se razvijeni plin zapaliti ili ne. Filtar papir služi samo da bi se tvar održala na mjestu, čime se povećava vjerojatnost zapaljenja.
1.3.3. Faza 3.
Ispitivana tvar složi se u hrpicu otprilike 2 cm visoku i 3 cm u promjeru. Na hrpicu se doda nekoliko kapi vode i bilježi se hoće li se razvijeni plin zapaliti ili ne.
1.3.4. Faza 4.
Ispitivana tvar miješa se s destiliranom vodom na 20 °C, brzina razvijanja plina mjeri se u razdoblju od sedam sati, u polusatnim intervalima. Ako se plin razvija nepravilnom brzinom, ili brzinom koja se povećava, trajanje mjerenja nakon sedam sati treba produžiti na maksimalno pet dana. Ako brzina u bilo koje vrijeme premaši 1 litru/kg na sat, ispitivanje treba zaustaviti.
1.4. REFERENTNE TVARI
Nije navedeno.
1.5. KRITERIJI KVALITETE
Nije navedeno.
1.6. OPIS METODA
1.6.1. Faza 1.
1.6.1.1. Ispitni uvjeti
Ispitivanje se provodi na sobnoj temperaturi (oko 20 °C).
1.6.1.2. Provođenje ispitivanja
Malu količinu (približno 2 mm u promjeru) ispitivane tvari treba staviti u korito koje sadrži destiliranu vodu. Treba zabilježiti i. razvija li se plin i ii. dolazi li do zapaljenja. Ako dođe do zapaljenja plina, daljnje ispitivanje tvari nije potrebno jer se tvar smatra opasnom.
1.6.2. Faza 2.
1.6.2.1. Uređaj
Filtar papir pluta na površini destilirane vode u bilo kojoj prikladnoj posudi, npr. posudi za isparavanje promjera 100 mm.
1.6.2.2. Ispitni uvjeti
Ispitivanje se provodi na sobnoj temperaturi (oko 20 °C).
1.6.2.3. Provođenje ispitivanja
Mala količina ispitivane tvari (približno 2 mm u promjeru) stavi se na sredinu filtar papira. Treba zabilježiti i. razvija li se plin i ii. dolazi li do zapaljenja. Ako dođe do zapaljenja plina, daljnje ispitivanje tvari nije potrebno jer se tvar smatra opasnom.
1.6.3. Faza 3.
1.6.3.1. Ispitni uvjeti
Ispitivanje se provodi na sobnoj temperaturi (oko 20 °C).
1.6.3.2. Provođenje ispitivanja
Ispitivana tvar složi se u hrpicu približno 2 cm visoku i 3 cm u promjeru s udubljenjem na vrhu. U udubljenje se doda nekoliko kapi vode i bilježi se i. razvija li se plin i ii. dolazi li do zapaljenja. Ako dođe do zapaljenja plina, daljnje ispitivanje tvari nije potrebno jer se tvar smatra opasnom.
1.6.4. Faza 4.
1.6.4.1. Uređaj
Uređaj se postavlja kako prikazuje slika.
1.6.4.2. Ispitni uvjeti
Pregledati ima li u spremniku za ispitivanu tvar praha < 500 μm (veličina čestice). Ako prah čini više od 1 % (m/m) ukupne količine, ili ako se uzorak mrvi, tada prije ispitivanja cijelu količinu tvari treba samljeti u prah kako bi se uzelo u obzir smanjenje veličine čestica tijekom skladištenja i rukovanja; u protivnom tvar treba ispitati kako je primljena. Ispitivanje treba provesti na sobnoj temperaturi (oko 20 °C) i pod atmosferskim tlakom.
1.6.4.3. Provođenje ispitivanja
10 do 20 ml vode stavi se u lijevak za dokapavanje u uređaju, a 10 g tvari u konusnu tikvicu. Volumen plina koji se razvija može se mjeriti svim prikladnim sredstvima. Slavina lijevka otvori se kako bi voda ušla u konusnu tikvicu i započinje mjerenje vremena štopericom. Nastajanje plina mjeri se svakog sata tijekom sedmosatnog razdoblja. Ako je u tom razdoblju nastajanje plina nepravilno ili ako se brzina nastajanja plina povećava, mjerenja treba nastaviti do najviše pet dana. Ako, u bilo koje vrijeme mjerenja, brzina nastajanja plina prijeđe 1 litru/kg po satu, pokus treba prekinuti. Ovaj se pokus izvodi tri puta.
Ako kemijski identitet plina nije poznat, plin treba analizirati. Ako plin sadrži lako zapaljive komponente, a nije poznato je li cijela mješavina lako zapaljiva, treba pripraviti mješavinu istog sastava i ispitati je ispitnom metodom A.11.
2. PODACI
Smatra se da je tvar opasna ako:
|
— |
u bilo kojoj fazi ispitnog postupka dođe do spontanog zapaljenja, ili |
|
— |
do nastajanja zapaljivog plina dođe brzinom većom od 1 litre/kg tvari na sat. |
3. IZVJEŠĆIVANJE
U izvješću o ispitivanju treba, ako je moguće, navesti sljedeće informacije:
|
— |
precizna specifikacija tvari (identitet i nečistoće), |
|
— |
podatke o eventualnoj početnoj pripremi ispitivane tvari, |
|
— |
rezultati pokusa (faze 1., 2., 3. i 4.), |
|
— |
kemijski sastav nastalog plina, |
|
— |
brzina nastajanja plina ako se provodi faza 4. (1.6.4.), |
|
— |
svi dodatni podaci relevantni za tumačenje rezultata. |
4. REFERENCE
|
(1) |
Recommendations on the transport of dangerous goods, test and criteria, 1990, United Nations, New York. |
|
(2) |
NF T 20-040 (September 85) Chemical products for industrial use. Determination of the flammability of gases formed by the hydrolysis of solid and liquid products. |
Dodatak
Slika
Uređaj

A.13. PIROFORNA SVOJSTVA KRUTINA I TEKUĆINA
1. METODA
1.1. UVOD
Ovaj ispitni postupak primjenljiv je na krute i tekuće tvari koje će se u malim količinama spontano zapaliti ubrzo nakon dodira sa zrakom na sobnoj temperaturi (oko 20 °C).
Tvari koje prije nego se zapale trebaju biti izložene zraku satima ili danima na sobnoj temperaturi ili na povišenim temperaturama nisu obuhvaćene ovom ispitnom metodom.
1.2. DEFINICIJE I JEDINICE
Smatra se da tvari imaju piroforna svojstva ako su zapaljive ili uzrokuju pougljenjivanje u uvjetima opisanim u 1.6.
Možda treba ispitati i samozapaljivost tekućina primjenom metode A.15. Temperatura samozapaljenja (tekućine i plinovi).
1.3. REFERENTNE TVARI
Nije navedeno.
1.4. NAČELO ISPITNE METODE
Tvar, bilo krutina ili tekućina, dodaje se inertnom nosaču i drži u dodiru sa zrakom na sobnoj temperaturi tijekom pet minuta. Tekuće tvari koje se ne zapale upiju se na filtar papir i pet minuta izlažu zraku na temperaturi okoline (oko 20 °C). Ako se krutina ili tekućina zapali, ili ako tekućina zapali ili pougljeni filtar papir, tvar se smatra pirofornom.
1.5. KRITERIJI KVALITETE
Ponovljivost: zbog sigurnosnih razloga, dovoljan je samo jedan rezultat da bi se tvar smatrala pirofornom.
1.6. OPIS METODE
1.6.1. Uređaj
Porculanska šalica od oko 10 cm u promjeru napuni se dijatomejskom zemljom do visine od oko 5 mm na sobnoj temperaturi (oko 20 °C).
Napomena:
Dijatomejska zemlja ili bilo koja druga usporediva inertna tvar koju je jednostavno nabaviti uzima se kao reprezentativni uzorak tla po kojem se u slučaju nezgode može izliti ispitivana tvar.
Za ispitivanje tekućina koje nisu zapaljive u dodiru sa zrakom kada su u dodiru s inertnim nosačem potreban je suhi filtar papir.
1.6.2. Provođenje ispitivanja
(a) Praškaste krutine
1 do 2 cm3 tvari koja se ispituje isipa se s visine od oko 1 m na nezapaljivu površinu, te se promatra hoće li se tvar zapaliti tijekom sipanja ili u roku od pet minuta nakon toga.
Pokus se provodi šest puta ako prije ne dođe do zapaljenja;
(b) tekućine
Oko 5 cm3 tekućine koja se ispituje ulije se u pripremljenu porculansku šalicu, te se promatra hoće li se tvar zapaliti u roku od pet minuta.
Ako u šest pokusa ne dođe do zapaljenja, provode se sljedeći pokusi:
Ispitni uzorak od 0,5 ml štrcaljkom se uvodi na pripremljeni filtar papir, te se promatra hoće li se filtar papir zapaliti ili pougljeniti u roku pet minuta nakon dodavanja tekućine. Pokus se provodi tri puta ako prije ne dođe do zapaljenja ili pougljenjivanja.
2. PODACI
2.1. OBRADA PODATAKA
Ispitivanje se može prekinuti čim se u bilo kojem pokusu dođe do pozitivnog rezultata.
2.2. PROCJENA
Ako se tvar zapali u roku pet minuta nakon što je dodana inertnom nosaču i izložena zraku, ili tekuća tvar zapali ili pougljeni filtar papir u roku pet minuta nakon što je dodana i izložena zraku, smatra se pirofornom.
3. IZVJEŠĆIVANJE
U izvješću o ispitivanju treba, ako je moguće, navesti sljedeće informacije:
|
— |
precizna specifikacija tvari (identitet i nečistoće), |
|
— |
rezultati pokusa, |
|
— |
svi dodatni podaci relevantni za tumačenje rezultata. |
4. REFERENCE
|
(1) |
NF T 20-039 (September 85) Chemical products for industrial use. Determination of the spontaneous flammability of solids and liquids. |
|
(2) |
Recommendations on the Transport of Dangerous Goods, Test and criteria, 1990, United Nations, NewYork. |
A.14. EKSPLOZIVNA SVOJSTVA
1. METODA
1.1. UVOD
Pomoću ove metode može se odrediti predstavlja li kruta tvar ili tvar u obliku paste opasnost od eksplozije ako se izloži djelovanju plamena (termička osjetljivost), ili udarcu ili trenju (osjetljivost na mehaničke podražaje), te predstavlja li tekuća tvar opasnost ako se izloži djelovanju plamena ili udarca.
Metoda obuhvaća tri elementa:
|
(a) |
ispitivanje termičke osjetljivosti (1); |
|
(b) |
ispitivanje mehaničke osjetljivosti s obzirom na udarac (1); |
|
(c) |
ispitivanje mehaničke osjetljivosti s obzirom na trenje (1). |
Ovom se metodom dolazi do podataka na temelju kojih je moguće procijeniti vjerojatnost izazivanja eksplozije pomoću određenih općenitih podražaja. Metoda nije namijenjena za utvrđivanje može li tvar eksplodirati u bilo kojim uvjetima.
Ova je metoda prikladna da se njome odredi hoće li tvar predstavljati opasnost od eksplozije (termička i mehanička osjetljivost) u uvjetima koji su posebno navedeni u Direktivi. Temelji se na velikom broju uređaja koji su u širokoj upotrebi u mnogim zemljama (1) i koji obično daju smislene rezultate. Priznato je da metoda nije definitivna. Osim navedenih uređaja, dozvoljena je upotreba i alternativnih uređaja pod uvjetom da su međunarodno priznati i da se rezultati mogu dovesti u korelaciju s rezultatima dobivenim navedenim uređajima.
Ispitivanja ne treba provoditi ako se na temelju dostupnih termodinamičkih podataka (npr. toplina nastajanja, toplina raspadanja) i/ili nepostojanja određenih reaktivnih skupina (2) u strukturnoj formuli sa sigurnošću može utvrditi da s nastankom plinova ili oslobađanjem topline tvar nije sposobna za brzo razlaganje (npr. materijal ne predstavlja rizik od eksplozije). Ispitivanje mehaničke osjetljivosti s obzirom na trenje nije potrebno za tekućine.
1.2. DEFINICIJE I JEDINICE
Eksplozivne tvari:
Tvari koje mogu eksplodirati pod djelovanjem plamena ili koje su osjetljive na udarac ili trenje u navedenom uređaju (ili su mehanički osjetljivije od 1,3-dinitrobenzena u alternativnom uređaju).
1.3. REFERENTNE TVARI
1,3-dinitrobenzen, tehnički kristalizirani proizvod prosijan kroz sito 0,5 mm, za metode ispitivanja osjetljivosti na trenje i na udarac.
Perhidro-1,3,5-trinitro-1,3,5-triazin (RDX, heksogen, ciklonit – CAS 121-82-4), rekristaliziran iz vodenog cikloheksanona, prosijan na mokro kroz sito od 250 μm i zadržan na situ od 150 μm te sušen na 103 ± 2 °C (u trajanju od četiri sata) za drugi niz ispitivanja osjetljivosti na trenje i na udarac.
1.4. NAČELO METODE
Preliminarni pokusi potrebni su kako bi se uspostavili sigurni uvjeti za provođenje tri pokusa osjetljivosti.
1.4.1. Pokusi sigurnosnog rukovanja (3)
Iz sigurnosnih razloga, prije provođenja glavnog pokusa, vrlo mali uzorci (oko 10 mg) tvari izlažu se zagrijavanju bez zatvaranja u plinskom plamenu, udarcima u bilo kojem uređaju prikladnog oblika i trenju pomoću čekića i nakovnja ili kojeg drugog uređaja za trenje. Cilj je utvrditi je li tvar toliko osjetljiva i eksplozivna da propisana ispitivanja osjetljivosti, posebno termičke osjetljivosti, treba provesti uz posebne mjere opreza kako bi se spriječile ozljede.
1.4.2. Termička osjetljivost
Metoda obuhvaća zagrijavanje tvari u čeličnoj cijevi koju zatvaraju ploče različitih promjera otvora, kako bi se odredilo ima li tvar tendenciju eksplodiranja pod uvjetima intenzivne topline i definiranog zatvaranja.
1.4.3. Mehanička osjetljivost (udarac)
Metoda obuhvaća izlaganje tvari udarcu određene mase koja se baca s određene visine.
1.4.4. Mehanička osjetljivost (trenje)
Metoda obuhvaća izlaganje krute tvari ili paste između uobičajenih površina pod određenim uvjetima opterećenja i relativnoga gibanja.
1.5. KRITERIJI KVALITETE
Nije navedeno.
1.6. OPIS METODE
1.6.1. Termička osjetljivost (djelovanje plamena)
1.6.1.1. Uređaj
Uređaj se sastoji od čelične cijevi za jednokratnu upotrebu s napravom za zatvaranje za višekratnu upotrebu (Slika 1.), koja je montirana u sigurnosnom uređaju za zagrijavanje. Sve su cijevi od vučenog čeličnog lima (vidjeti Dodatak), imaju unutarnji promjer 24 mm, duljinu 75 mm i debljinu stijenke 0,5 mm. Cijevi su spojene prirubnicama na otvorenom kraju kako bi ih se moglo zatvoriti sklopom mjerne prigušnice. Taj se sklop sastoji od mjerne prigušnice otporne na tlak s otvorom u sredini, učvršćene na cijev pomoću dvodijelnog navojnog spoja (matica i navojna obujmica). Vijak i navojna obujmica izrađeni su od krom-manganovog čelika (vidjeti Dodatak) koji do 800 °C ne iskri. Mjerne prigušnice su ploče debljine 6 mm izrađene od čelika otpornog na toplinu (vidjeti Dodatak), i dostupne su s različitim promjerima otvora.
1.6.1.2. Ispitni uvjeti
Obično se tvar ispituje u obliku u kojem je primljena, ali u nekim slučajevima, npr. ako je prešana, lijevana ili na drugi način sažeta, tvar će prije pokusa možda trebati zdrobiti.
Za krutine, masa materijala koji se koristi u svakom pokusu određuje se suhim postupkom u dvije faze. Tarirana cijev puni se s 9 cm3 tvari i sabije silom od 80 N kojom se djeluje na ukupni poprečni presjek cijevi. Iz sigurnosnih razloga ili ako bi se fizikalni oblik uzorka sabijanjem mogao promijeniti, mogu se primijeniti druge metode punjenja; npr. ako je tvar jako osjetljiva na trenje, sabijanje nije primjereno. Ako je materijal moguće sažeti, dodaje se još i sabija sve dok se cijev ne napuni do 55 mm od vrha. Odredi se ukupna masa koja se koristi za punjenje cijevi do razine 55 mm, i dodaju se dva dodatna prirasta te se svaki sabije silom od 80 N. Zatim se kod sabijanja, prema potrebi, materijal dodaje, odnosno izuzima kako bi se cijev napunila do razine od 15 mm od vrha. Provodi se drugi po redu suhi postupak, na način da se počne sa sabijenom količinom trećine ukupne mase utvrđene u prvom suhom postupku. Dodaju se još dva dodatna inkremeta uz sabijanje silom od 80 N, a razina u cijevi podešava se na 15 mm od vrha dodavanjem ili oduzimanjem materijala, prema potrebi. Količina krutine utvrđena u drugom suhom postupku koristi se za svaki pokus, s tim da se punjenje obavlja s tri jednake količine, pojedinačno sabijene na 9 cm3 primjenom za to odgovarajuće sile. (To se može lakše provesti pomoću razdjelnih prstenova).
Cijev se puni tekućinama i gelovima do visine 60 mm s tim da kod gelova treba posebno paziti da se izbjegne stvaranje praznina. Navojna obujmica navuče se na cijev odozdo, umetne se odgovarajuća mjerna prigušnica i nakon što se stavi malo sredstva za podmazivanje na osnovu molibdenovog disulfida, zategne matica. Ključno je provjeriti da se čestice tvari nisu zaglavile između prirubnice i ploče, ili u navojima.
Za zagrijavanje se koristi propan iz boce za industrijsku primjenu koja je opremljena regulatorom tlaka (od 60 do 70 mbara), te se plin preko mjerača jednakomjerno distribuira (što se vizualno opaža promatranjem plamena iz gorača) cjevovodom do četiri gorača. Gorači se nalaze oko ispitne komore kako prikazuje slika 1. Četiri gorača zajedno troše oko 3,2 litre propana u minuti. Mogu se upotrijebiti alternativna plinska goriva i grijači, ali brzina zagrijavanja mora biti kako je navedeno na slici 3. Kod svih uređaja neophodno je provoditi periodičke provjere pomoću cijevi napunjenih dibutil ftalatom kako je prikazano na slici 3.
1.6.1.3. Provođenje ispitivanja
Svako se ispitivanje provodi dok cijev ne fragmentira odnosno cijev se zagrijava pet minuta. U pokusu koji rezultira pucanjem cijevi na tri ili više komada koji u nekim slučajevima mogu biti međusobno povezani uskim trakama metala kako je prikazano na slici 2., smatra se da je došlo do eksplozije. Kod pokusa koji rezultiraju pucanjem na manji broj komada ili bez ijednog komada, smatra se da nije bilo eksplozije.
Prvo se provodi niz od tri testa s mjernom prigušnicom promjera 6,0 mm, pa ako se ne postigne eksplozija, provodi se drugi niz od tri testa s pločom prigušnice promjera 2,0 mm. Ako u bilo kojem od ta dva pokusa dođe do eksplozije, daljnji pokusi nisu potrebni.
1.6.1.4. Procjena
Rezultat pokusa smatra se pozitivnim ako do eksplozije dođe u bilo kojem od gornjih nizova pokusa.
1.6.2. Mehanička osjetljivost (udarac)
1.6.2.1. Uređaj (Slika 4.)
Osnovni dijelovi tipičnog uređaja s padajućim maljem su blok od lijevanog čelika s postoljem, nakovanj, stupac, vodilice, utezi, uređaj za oslobađanje i držač uzorka. Čelični nakovanj 100 mm (promjer) × 70 mm (visina) vijkom je pričvršćen na čelični blok 230 mm (dužina) × 250 mm (širina) × 200 mm (visina) s lijevanim postoljem 450 mm (dužina) × 450 mm (širina) × 60 mm (visina). Stupac, izrađen od bešavne cijevi od vučenog čelika učvršćen je u držaču koji je vijkom pričvršćen na stražnji dio čeličnog bloka. Četiri vijka sidre uređaj na čvrsti betonski blok 60 × 60 × 60 cm na način da su vodilice postavljene potpuno okomito i da uteg pada slobodno. Koriste se utezi od 5 i 10 kg izrađeni od punog čelika. Udarna glava svakog utega izrađena je od otvrdnutog čelika, HRC 60 do 63, i ima minimalno 25 mm u promjeru.
Uzorak koji se ispituje stavi se u uređaj za pokus udarcem, koji se sastoji od dva koaksijalna čvrsta čelična cilindra, jedan iznad drugog, u šupljoj cilindričnoj čeličnoj prstenastoj vodilici. Čvrsti čelični cilindri trebaju biti promjera 10 (– 0,003, – 0,005) mm i visine 10 mm i imati polirane površine, zaobljene rubove (radijus zakrivljenosti 0,5 mm) i tvrdoću od HRC 58 do 65. Šuplji cilindar mora imati vanjski promjer 16 mm, ispolirani provrt 10 (+ 0,005, + 0,010) mm i visinu 13 mm. Uređaj za ispitivanje osjetljivosti na udarac postavlja se na nakovanj (26 mm u promjeru i 26 mm visine) izrađen od čelika i centriran pomoću prstena s perforacijama za istjecanje para.
1.6.2.2. Ispitni uvjeti
Volumen uzorka treba biti 40 mm3, ili volumen koji odgovara alternativnom uređaju. Krute tvari treba ispitati u suhom stanju i pripravljene kako slijedi:
|
(a) |
praškaste tvari se prosiju (veličina sita 0,5 mm); za ispitivanje se koristi sve što prolazi kroz sito; |
|
(b) |
tvari koje su prešane, lijevane ili na drugačiji način sažete, lome se na komadiće i siju; za ispitivanje se koriste prosijani komadići od 0,5 do 1,0 mm u promjeru koji se smatraju reprezentativnim uzorkom izvorne tvari. |
Tvari koje se obično isporučuju kao kreme treba ispitati u suhom stanju ako je to moguće ili svakako nakon što se odstrani što je moguće veća količina razrjeđivača. Tekuće tvari ispituju se s razmakom od 1 mm između gornjeg i donjeg čeličnog cilindra.
1.6.2.3. Provođenje ispitivanja
Provodi se niz od šest pokusa bacanjem mase od 10 kg s visine od 0,40 m (40 J). Ako se tijekom tih šest pokusa postigne eksplozija, provodi se drugi niz od šest pokusa, na način da se baca masa od 5 kg s visine od 0,15 m (7,5 J). U drugom uređaju, uzorak se uspoređuje s izabranom referentnom tvari primjenom utvrđenog postupka (npr. tehnikom gore-dolje itd.).
1.6.2.4. Procjena
Rezultat pokusa smatra se pozitivnim ako do eksplozije (pojava plamena i/ili praska ekvivalentna je eksploziji) dođe najmanje jednom u bilo kojem od pokusa kod navedenog uređaja za ispitivanje osjetljivosti na udarac ili ako je uzorak osjetljiviji od 1,3-dinitrobenzen ili RDX u alternativnom ispitivanju osjetljivosti na udarac.
1.6.3. Mehanička osjetljivost (trenje)
1.6.3.1. Uređaj (Slika 5.)
Uređaj za ispitivanje osjetljivosti na trenje sastoji se od temeljne ploče od lijevanog čelika na koju je postavljena naprava za trenje. Ona se sastoji od fiksnog porculanskog klina/štipaljke i pokretne porculanske ploče. Porculanska ploča nalazi se u klizaču koji se kreće unutar dvije vodilice. Klizač je spojen na elektromotor preko ojnice, ekscentra i odgovarajućeg zupčastog prijenosa na način da se porculanska ploča pomakne natrag i naprijed ispod porculanskog klina samo jednom na udaljenosti od 10 mm. Porculanski klin može se opteretiti silom od, primjerice, 120 ili 360 N.
Ravne porculanske ploče izrađene su od bijelog tehničkog porculana (hrapavost 9 do 32 μm), veličine 25 mm (dužina) × 25 mm (širina) × 5 mm (visina). Cilindrični porculanski klin također je izrađen od bijelog tehničkog porculana, dugačak je 15 mm, ima promjer 10 mm i grube površine sfernih rubova promjera zaobljenosti 10 mm.
1.6.3.2. Ispitni uvjeti
Volumen uzorka treba biti 10 mm3 ili volumen koji odgovara alternativnom uređaju.
Krute tvari ispituju se u suhom stanju i pripravljene kako slijedi:
|
(a) |
praškaste tvari prosiju se (veličina sita 0,5 mm); za ispitivanje se koristi sve što prođe kroz sito; |
|
(b) |
tvari koje su prešane, lijevane ili na drugačiji način sažete, lome se na komadiće i siju; za ispitivanje se koriste prosijani komadići < 0,5 mm u promjeru. |
Tvari koje se obično isporučuju kao paste treba ispitati u suhom stanju ako je to moguće. Ako tvar nije moguće pripraviti u suhom stanju, pasta (nakon što se odstrani što je moguće veća količina razrjeđivača) se ispituje kao 0,5 mm debeli, 2 mm širok, 10 mm dugačak film koji se pripravlja pomoću šablone.
1.6.3.3. Provođenje ispitivanja
Porculanski klin postavlja se na uzorak koji se ispituje, i optereti se. Kod provođenja pokusa, oznake nanesene spužvom na porculansku ploču moraju ležati transverzalno u odnosu na smjer kretanja. Treba paziti da se klin nalazi na uzorku, da ispod klina ima dovoljno materijala koji se ispituje kao i da se ploča ispod klina pomiče propisno. Paste se nanašaju na ploču pomoću 0,5 mm debele šablone s urezom veličine 2 × 10 mm. Porculanska ploča mora se pomaknuti 10 mm naprijed i natrag ispod porculanskog klina u vremenu od 0,44 sekunde. Svaki dio površine ploče i klina smije se koristiti samo jednom; dva kraja svakog klina služe za dva pokusa, a svaka od dvije površine ploče služi za tri pokusa.
Niz od šest pokusa provodi se pod opterećenjem od 360 N. Ako tijekom tih šest pokusa dođe do pozitivnog događaja, provodi se još jedan niz od šest pokusa s opterećenjem od 120 N. U drugom uređaju, uzorak se uspoređuje s odabranom referentnom tvari primjenom utvrđenog postupka (npr. tehnika gore-dolje itd.).
1.6.3.4. Procjena
Rezultat pokusa smatra se pozitivnim ako do eksplozije (pucketanje i/ili prasak ili pojava plamena ekvivalentni su eksploziji) dođe najmanje jednom u bilo kojem pokusu kod navedenog uređaja za ispitivanje trenja ili ako su zadovoljeni ekvivalentni kriteriji u alternativnom ispitivanju osjetljivosti na trenje.
2. PODACI
U načelu smatra se da tvar predstavlja opasnost od eksplozije u smislu Direktive ako je ispitivanje termičke osjetljivosti, osjetljivosti na udarac ili trenje dalo pozitivan rezultat.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE OISPITIVANJU
U izvješću o ispitivanju treba, ako je moguće, navesti sljedeće informacije:
|
— |
identitet, sastav, čistoća, sadržaj vlage itd. ispitivane tvari, |
|
— |
fizikalni oblik uzorka i je li uzorak bio drobljen, lomljen i/ili prosijavan ili ne, |
|
— |
zapažanja tijekom ispitivanja termičke osjetljivosti (npr. masa uzorka, broj komadića itd.), |
|
— |
zapažanja tijekom ispitivanja mehaničke osjetljivosti (npr. nastajanje znatnih količina dima ili potpuna razgradnja bez praska, plamena, iskri, praska, pucketanja itd.), |
|
— |
rezultate svakog tipa ispitivanja, |
|
— |
ako je korišten alternativni uređaj, treba pružiti znanstveno opravdanje za to kao i dokaz o korelaciji između rezultata dobivenih navedenim uređajem i rezultata dobivenih ekvivalentnim uređajem, |
|
— |
sve korisne napomene kao što su upute na pokuse sa sličnim proizvodima koje bi mogle biti relevantne za pravilno tumačenje rezultata, |
|
— |
sve dodatne napomene relevantne za tumačenje rezultata. |
3.2. TUMAČENJE I PROCJENA REZULTATA
U izvješću o ispitivanju treba navesti sve rezultate koji se smatraju lažnim, neuobičajenim, ili nereprezentativnim. Ako bilo koji od rezultata ne bi trebalo uzeti u obzir, za to treba dati objašnjenje i navesti rezultate eventualnog alternativnog ili dodatnog ispitivanja. Ako se neuobičajeni rezultat ne može objasniti, mora se prihvatiti takav kakav jest i primijeniti za klasifikaciju tvari s tim u skladu.
4. REFERENCE
|
(1) |
Recommendations on the Transport of Dangerous Goods: Tests and criteria, 1990, United Nations, New York. |
|
(2) |
Bretherick, L., Handbook of Reactive Chemical Hazards, 4th edition, Butterworths, London, ISBN 0-750 -60103-5, 1990. |
|
(3) |
Koenen, H., Ide, K.H. and Swart, K.H., Explosivstoffe, 1961, vol.3, 6-13 and 30-42. |
|
(4) |
NF T 20-038 (September 85) Chemical products for industrial use — Determination of explosion risk. |
Dodatak
Primjer specifikacije materijala za ispitivanje termičke osjetljivosti (vidjeti normu DIN 1623)
|
(1) |
Cijev: Specifikacija materijala br. 1.0336.505 g |
|
(2) |
Mjerna prigušnica: Specifikacija materijala br. 1.4873 |
|
(3) |
Navojna obujmica i matica: Specifikacija materijala br. 1.3817 |
Slika 1.
Uređaj za ispitivanje termičke osjetljivosti
(sve dimenzije izražene su u milimetrima)

Slika 2.
Ispitivanje termičke osjetljivosti
(primjer fragmentacije)
Slika 3.
Kalibracija brzine zagrijavanja za ispitivanje termičke osjetljivosti
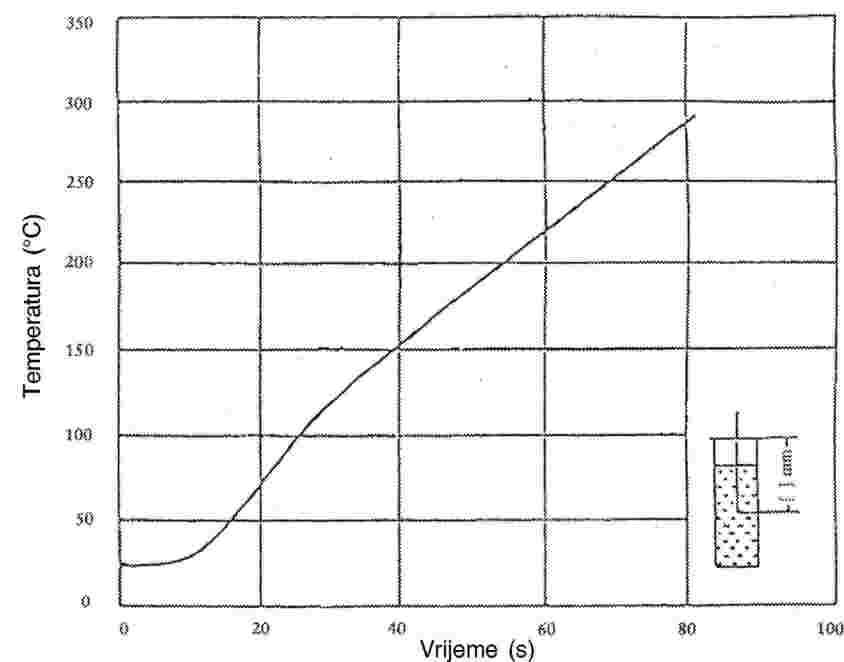
Krivulja temperature u odnosu na vrijeme koja se dobije zagrijavanjem dibutil ftalata (27 cm3) u zatvorenoj (mjerna prigušnica s otvorom 1,5 mm) cijevi kod brzine protoka propana od 3,2 litre/minuti. Temperatura se mjeri termoparom od kromela/alumela u omotaču od nehrđajućeg čelika promjera 1 mm, postavljenim u središte 43 mm ispod ruba cijevi. Brzina zagrijavanja između 135 °C i 285 °C treba biti između 185 i 215 K/minuti.
Slika 4.
Uređaj za ispitivanje osjetljivosti na udarac
(sve dimenzije izražene su u milimetrima)
Slika 4.
Nastavak s prethodne stranice
Slika 5.
Uređaj za ispitivanje osjetljivosti na trenje

A.15. TEMPERATURA SAMOZAPALJENJA (TEKUĆINE I PLINOVI)
1. METODA
1.1. UVOD
Eksplozivne tvari i tvari koje se spontano zapale u dodiru sa zrakom na sobnoj temperaturi ne treba podvrgavati ovom ispitivanju. Ispitni postupak primjenljiv je na plinove, tekućine i pare koje je u prisutnosti zraka moguće upaliti vrućom površinom.
Temperatura samozapaljenja može se znatno smanjiti prisustvom katalitičkih nečistoća, površinskim materijalom ili većim volumenom ispitne posude.
1.2. DEFINICIJE I JEDINICE
Stupanj samozapaljenja izražava se temperaturom samozapaljenja. Temperatura samozapaljenja je najniža temperatura na kojoj će se ispitivana tvar zapaliti ako se pomiješa sa zrakom u uvjetima utvrđenim u ovoj ispitnoj metodi.
1.3. REFERENTNE TVARI
Referentne tvari navedene su u normama (vidjeti 1.6.3.) One prvenstveno služe za povremenu provjeru primijenjene metode te radi usporedbe s rezultatima dobivenim drugim metodama.
1.4. NAČELO METODE
Ovom se metodom određuje minimalna temperatura unutarnje površine kućišta koja će rezultirati zapaljenjem plina, pare ili tekućine ubrizgane u to kućište.
1.5. KRITERIJI KVALITETE
Ponovljivost varira u skladu s područjem temperatura samozapaljenja i primijenjene ispitne metode.
Osjetljivost i specifičnost ovise o primijenjenoj ispitnoj metodi.
1.6. OPIS METODE
1.6.1. Uređaj
Uređaj je opisan u metodi koja se spominje u 1.6.3.
1.6.2. Ispitni uvjeti
Uzorak ispitivane tvari ispituje se u skladu s metodom navedenom u 1.6.3.
1.6.3. Provođenje ispitivanja
Vidjeti norme IEC 79-4, DIN 51794, ASTM-E 659-78, BS 4056, NF T 20-037.
2. PODACI
Bilježi se temperatura ispitivanja, atmosferski tlak, količina uzorka koja se koristi i vremenski pomak do pojave zapaljenja.
3. IZVJEŠĆIVANJE
U izvješću o ispitivanju treba, ako je moguće, navesti sljedeće podatke:
|
— |
precizna specifikacija tvari (identitet i nečistoće), |
|
— |
količina uzorka koja se koristi, atmosferski tlak, |
|
— |
uređaj koji se koristi, |
|
— |
rezultati mjerenja (temperature ispitivanja, rezultati u vezi zapaljenja, odgovarajući vremenski razmaci), |
|
— |
svi dodatni podaci relevantni za tumačenje rezultata. |
4. REFERENCE
Nema ih.
A.16. RELATIVNA TEMPERATURA SAMOZAPALJENJA ZA KRUTINE
1. METODA
1.1. UVOD
Eksplozivne tvari i tvari koje se spontano zapale u dodiru sa zrakom na temperaturi okoline ne treba podvrgavati ovom ispitivanju.
Ovo se ispitivanje provodi sa svrhom dobivanja preliminarnih podataka o samozapaljivosti krutih tvari na povišenim temperaturama.
Ako se toplina koja se razvija bilo reakcijom tvari s kisikom ili egzotermičnim raspadanjem ne gubi dovoljno brzo u okolini, dolazi do samozagrijavanja koje vodi do samozapaljenja. Dakle, do samozapaljenja dolazi kad brzina kojom se toplina razvija premaši brzinu gubitka topline.
Ovaj je ispitni postupak koristan kao preliminarni test probira za krute tvari. Radi složene naravi zapaljenja i izgaranja krutina, temperaturu samozapaljenja koja se odredi prema ovoj ispitnoj metodi treba koristiti samo u svrhe uspoređivanja.
1.2. DEFINICIJE I JEDINICE
Temperatura samozapaljenja koja se dobije ovom metodom minimalna je temperatura okoline izražena u °C na kojoj će se u određenim uvjetima zapaliti određeni volumen tvari.
1.3. REFERENTNA TVAR
Nema je.
1.4. NAČELO METODE
Izvjestan volumen tvari koja se ispituje stavi se u peć na temperaturu okoline; bilježi se krivulja temperature u funkciji vremena s obzirom na uvjete u središtu uzorka dok se temperatura peći povećava brzinom od 0,5 °C/min do 400 °C, ili do tališta ako je ono na nižoj temperaturi. U svrhu ovog ispitivanja, temperatura peći u kojoj temperatura uzorka koji se samozagrijava dostiže 400 °C naziva se temperaturom samozapaljenja.
1.5. KRITERIJI KVALITETE
Nema ih.
1.6. OPIS METODE
1.6.1. Uređaj
1.6.1.1. Peć
Laboratorijska peć (zapremnine oko 2 litre) s ugrađenom regulacijom temperature, prirodnom cirkulacijom zraka i sustavom za rasterećenje. Kako bi se izbjegao eventualan rizik od eksplozije, plinovi koji nastaju razlaganjem ne smiju doći u dodir s električnim grijaćim elementima.
1.6.1.2. Kocka od žičane mrežice
Komad mrežice otvora 0,045 mm izrađene od nehrđajuće čelične žice treba izrezati prema modelu u slici 1. Mrežicu treba složiti savijanjem i pričvrstiti žicom da se dobije kocka s otvorenim gornjim dijelom.
1.6.1.3. Termoparovi
Odgovarajući termoparovi.
1.6.1.4. Zapisivač
Bilo koji dvokanalni zapisivač kalibriran za temperaturu od 0 do 600 °C ili za odgovarajući napon.
1.6.2. Ispitni uvjeti
Tvari se ispituju kako su primljene.
1.6.3. Provođenje ispitivanja
U kocku se stavi tvar koja će se ispitivati, lagano se potapka i dodaje još tvari sve dok kocka nije potpuno puna. Kocka se tada objesi u središtu peći na sobnoj temperaturi. Jedan termopar se postavi u središte kocke, a drugi između kocke i stijenke peći na kojoj se mjeri temperatura peći.
Temperature peći i uzorka mjere se cijelo vrijeme dok se temperatura peći povećava brzinom od 0,5 °C/min do 400 °C ili do tališta ako je ono na nižoj temperaturi.
Kad tvar zapali uzorak, termopar će pokazati nagli porast temperature iznad temperature peći.
2. PODACI
Za procjenu je relevantna temperatura peći na kojoj uzorak samozagrijavanjem dostiže temperaturu od 400 °C (vidjeti sliku 2.).
3. IZVJEŠĆIVANJE
U izvješću o ispitivanju treba, ako je moguće, navesti sljedeće informacije:
|
— |
opis tvari koja se ispituje, |
|
— |
rezultati mjerenja uključujući krivulju temperatura/vrijeme, |
|
— |
svi podaci relevantni za tumačenje rezultata. |
4. REFERENCE
NF T 20-036 (September 85) Chemical products for industrial use. Determination of the relative temperature of the spontaneous flammability of solids.
Slika 1.
Model 20 milimetarske ispitne kocke

Slika 2.
Tipična krivulja temperatura/vrijeme

A.17. SVOJSTVA OKSIDACIJE (KRUTINE)
1. METODA
1.1. UVOD
Prije provođenja ovog ispitivanja korisno je raspolagati preliminarnim informacijama o eventualno eksplozivnim svojstvima tvari.
Ovo ispitivanje nije primjenljivo na tekućine, plinove, eksplozivne ili lako zapaljive tvari, ili perokside.
Ovo ispitivanje ne treba provoditi ako je provjerom strukturne formule sa sigurnošću utvrđeno da tvar nije u stanju egzotermički reagirati sa zapaljivim materijalom.
Kako bi se utvrdilo treba li ispitivanje provesti uz posebne mjere opreza, provodi se preliminarni pokus.
1.2. DEFINICIJE I JEDINICE
Vrijeme gorenja: vrijeme reakcije, u sekundama, uzeto iz zone reakcije potrebno za prolaz kroz hrpicu materijala, prema postupku opisanom u 1.6.
Brzina gorenja: izražena u milimetrima po sekundi.
Maksimalna brzina gorenja: najveća vrijednost brzine gorenja dobivena s mješavinama koje sadrže 10 do 90 % težinskog udjela oksidansa.
1.3. REFERENTNA TVAR
Barijev nitrat (analitičke kvalitete) koristi se kao referentna tvar za ispitivanje i za preliminarni test.
Referentna mješavina je mješavina barijevog nitrata s celulozom u prahu, pripravljena u skladu s 1.6., koja ima maksimalnu brzinu gorenja (obično mješavina koja sadrži 60 % težinskog udjela barijevog nitrata).
1.4. NAČELO METODE
Preliminarni test provodi se radi sigurnosti. Ako je preliminarnim testom jasno pokazano da ispitivana tvar ima svojstva oksidacije, daljnja ispitivanja nisu potrebna. Ako to nije slučaj, tvar zatim treba u potpunosti ispitati.
Kod punog ispitivanja, tvar koja se ispituje miješa se u raznim omjerima s određenom zapaljivom tvari. Od svake se mješavine napravi hrpica koja se s jednog kraja zapali. Maksimalna brzina gorenja koja se odredi uspoređuje se s maksimalnom brzinom gorenja referentne mješavine.
1.5. KRITERIJI KVALITETE
Prema potrebi, svaka metoda mljevenja i miješanja je valjana pod uvjetom da se najveća brzina gorenja u šest odvojenih testova ne razlikuje od aritmetičke srednje vrijednosti za više od 10 %.
1.6. OPIS METODE
1.6.1. Priprema
1.6.1.1. Ispitivana tvar
Smanjiti ispitni uzorak na veličinu čestica < 0,125 mm primjenjujući sljedeći postupak: prosijati ispitnu tvar, samljeti preostali dio, ponoviti postupak sve dok cijela količina ispitnog uzorka ne prođe kroz sito.
Smije se koristiti bilo koja tehnika mljevenja i prosijavanja koja zadovoljava kriterije kvalitete.
Prije pripreme mješavine, tvar se suši na 105 °C sve dok se ne postigne stalna težina. Ako je temperatura razlaganja tvari koja se ispituje ispod 105 °C, tvar treba sušiti na odgovarajućoj nižoj temperaturi.
1.6.1.2. Zapaljiva tvar
Kao zapaljiva tvar koristi se celuloza u prahu. Celuloza mora biti one vrste koja se koristi za kromatografiju u tankom sloju ili kromatografiju u koloni. Za vrstu koja sadrži više od 85 % vlakana u dužinama između 0,020 i 0,075 mm dokazano je da je odgovarajuća. Celuloza u prahu propušta se kroz sito veličine mrežice 0,125 mm. Istu partiju celuloze treba koristiti cijelo vrijeme ispitivanja.
Prije pripreme mješavine, celuloza u prahu suši se na 105 °C sve dok se ne postigne stalna težina.
Ako se u preliminarnom testu koristi piljevina, treba je pripraviti od drveta četinjača skupljanjem dijela koji je prošao kroz sito mrežice 1,6 mm, dobro promiješati, te zatim sušiti na 105 °C tijekom četiri sata u sloju debljine do 25 mm. Ohladiti i do upotrebe, po mogućnosti unutar 24 sata od sušenja, skladištiti u hermetički zatvorenom spremniku koji se puni do mjere koliko je to praktično.
1.6.1.3. Izvor paljenja
Kao izvor paljenja treba koristiti vrući plamen iz plinskoga gorača (minimalnog promjera 5 mm). Ako se koristi neki drugi izvor paljenja (npr. kod ispitivanja u inertnoj atmosferi), taj izvor u izvješću treba opisati i dati obrazloženje upotrebe takvog izvora.
1.6.2. Provođenje ispitivanja
Napomena:
Mješavine oksidansa s celulozom ili piljevinom smatraju se potencijalno eksplozivnim te njima treba oprezno rukovati.
1.6.2.1. Preliminarni test
Osušena tvar dobro se izmiješa s osušenom celulozom ili piljevinom u omjerima 2 težinska udjela ispitivane tvari u odnosu na 1 težinski dio celuloze ili piljevine, te se oblikuje u malu konusnu hrpicu dimenzija 3,5 cm (promjer osnovice) × 2,5 cm (visina) rahlim punjenjem šablone konusnog oblika (npr. laboratorijski stakleni lijevak sa začepljenim otvorom).
Hrpica se postavi na hladnu, nezapaljivu, neporoznu podlogu slabe toplinske provodljivosti. Pokus treba provoditi u digestoru kako je opisano u 1.6.2.2.
Izvor zapaljenja dovede se u dodir s konusnom hrpicom. Promatraju se i bilježe jačina i trajanje rezultirajuće reakcije.
Ako je reakcija snažna, tvar treba smatrati oksidirajućom.
U svakom slučaju u kojem postoji sumnja potrebno je provesti cijeli postupak ispitivanja kako se opisuje dalje u tekstu.
1.6.2.2. Potpuno ispitivanje
Pripraviti mješavine oksidansa i celuloze s težinskim udjelima od 10 do 90 % oksidansa u 10 %-tnim prirastima. Kod graničnih slučajeva treba upotrijebiti gotove mješavine oksidansa i celuloze kako bi se maksimalna brzina gorenja dobila točnije.
Hrpica se oblikuje pomoću kalupa. Kalup je izrađen od metala, duljine je 250 mm i trokutastog poprečnog presjeka unutarnje visine 10 mm i unutarnje širine 20 mm. S obje strane kalupa, u uzdužnom smjeru, postavljene su dvije metalne ploče kao bočni graničnici koji se protežu 2 mm preko gornjega ruba trokutastog poprečnog presjeka (slika). Taj se sklop bez sabijanja puni mješavinom u nešto prekomjernoj količini. Nakon što se kalup spusti s visine od 2 cm na krutu površinu, preostala prekomjerna količina tvari poravna se tupim limom. Bočni graničnici se skinu, a preostali se prah zagladi valjkom. Na vrh kalupa stavi se nezapaljiva, neporozna podloga slabe toplinske provodljivosti, uređaj se preokrene i kalup ukloni.
Hrpicu treba postaviti u smjeru strujanja zraka u digestoru.
Brzina zraka treba biti dostatna da spriječi istjecanje para u laboratorij i ne smije varirati tijekom testa. Strujanjem zraka oko uređaja mora se formirati zračna zavjesa.
Uslijed higroskopičnosti celuloze i nekih tvari koje se ispituju, ispitivanje treba provesti što je moguće brže.
Zapaliti jedan kraj hrpice na način da ga se dotakne plamenom.
Mjeriti vrijeme reakcije u duljini od 200 mm nakon što se područje reakcije proširilo preko početne udaljenosti od 30 mm.
Ispitivanje se provodi s referentnom tvari i najmanje jednom sa svakom mješavinom iz područja mješavina ispitivane tvari s celulozom.
Ako se utvrdi da je maksimalna brzina gorenja znatno veća od brzine referentne mješavine, ispitivanje treba zaustaviti; u suprotnom, pokus treba ponavljati pet puta za svaku od tri mješavine koje daju najveću brzinu gorenja.
Ako se sumnja da bi rezultat mogao biti lažno pozitivan, pokus treba ponoviti s tim da se umjesto celuloze upotrijebi inertna tvar slične dimenzije čestica, kao što je dijatomejska zemlja. Alternativno, celuloznu mješavinu ispitivane tvari koja ima najveću brzinu gorenja treba ponovno ispitati u inertnoj atmosferi (< 2 % v/v udjela sadržaja kisika).
2. PODACI
Iz sigurnosnih razloga, karakterističnim oksidativnim svojstvom tvari koja se ispituje smatra se maksimalna brzina gorenja – a ne srednja vrijednost.
Za procjenu relevantna je najviša vrijednost brzine gorenja određene mješavine u nizu u šest pokusa.
Iscrtati krivulju najviše vrijednosti brzine gorenja za svaku mješavinu u odnosu na koncentraciju oksidansa. S krivulje očitati maksimalnu brzinu gorenja.
Šest izmjerenih vrijednosti u jednom nizu dobivenih od mješavine kod maksimalne brzine gorenja ne smiju se razlikovati od aritmetičke srednje vrijednosti za više od 10 %; u protivnom, treba primijeniti bolje metode mljevenja i miješanja.
Usporediti maksimalnu brzinu gorenja koja je postignuta s maksimalnom brzinom gorenja referentne mješavine (vidjeti 1.3.).
Ako se ispitivanja provode u inertnoj atmosferi, maksimalna brzina reakcije uspoređuje se s maksimalnom brzinom reakcije referentne mješavine u inertnoj atmosferi.
3. IZVJEŠĆE
3.1. IZVJEŠĆE O ISPITIVANJU
U izvješću o ispitivanju treba, ako je moguće, navesti sljedeće informacije:
|
— |
identitet, sastav, čistoća, sadržaj vlage itd. ispitivane tvari, |
|
— |
eventualna obrada ispitivanog uzorka (npr. mljevenje, sušenje), |
|
— |
izvor zapaljenja koji je upotrebljen u ispitivanju, |
|
— |
način reakcije (npr. gorenje uz bljesak na površini, gorenje kroz cijelu masu, sve informacije o zapaljivim proizvodima itd.), |
|
— |
sve dodatne napomene relevantne za tumačenje rezultata, uključujući opis jačine (plamen, iskre, dimne pare, polagano tinjanje itd.) i približno trajanje tijekom preliminarnog sigurnosnog testa/testa probira i za ispitivanu tvar i za referentnu tvar, |
|
— |
rezultati pokusa s inertnom tvari, ako su provedeni, |
|
— |
rezultati pokusa u inertnoj atmosferi, ako su provedeni. |
3.2. TUMAČENJE REZULTATA.
Tvar treba smatrati oksidirajućom tvari ako:
|
(a) |
u preliminarnom pokusu dođe do snažne reakcije; |
|
(b) |
je u punom ispitivanju maksimalna brzina gorenja mješavina veća ili jednaka maksimalnoj brzini gorenja referentne mješavine celuloze i barijevog nitrata. |
Kako bi se izbjegao lažni pozitivni rezultat, kod tumačenja rezultata treba uzeti u obzir i rezultate ispitivanja tvari pomiješane s inertnim materijalom i/ili ispitivanja u inertnoj atmosferi.
4. REFERENCE
NF T 20-035 (September 85) Chemical products for industrial use. Determination of the oxidising properties of solids.
Dodatak
Slika
Kalup i pribor za pripravu hrpice
(Sve dimenzije izražene su u milimetrima)
A.18. OPĆI PROSJEK MOLEKULSKE TEŽINE I RASPODJELA MOLEKULSKE TEŽINE POLIMERA
1. METODA
Metoda kromatografije na permeabilnom gelu preslika je OECD-ove Smjernice za ispitivanje TG 118 (1996.). Temeljna načela i daljnje tehničke informacije navedene su u referenci (1).
1.1. UVOD
Kako su svojstva polimera vrlo raznolika, nemoguće je opisati jednu metodu kojom se precizno utvrđuju uvjeti separacije i procjene koji obuhvaćaju sve slučajnosti i posebnosti do kojih dolazi kod separacije polimera. Posebno, složeni sustavi polimera često nisu pogodni za kromatografiju na permeabilnom gelu (GPC). Kad kromatografija GPC nije u praksi provediva, molekulske mase moguće je određivati drugim metodama (vidjeti Dodatak). U takvim slučajevima treba potanko obrazložiti zašto se koristi baš određena metoda.
Opisana metoda temelji se na normi DIN 55672 (1). Ta DIN norma sadrži iscrpne informacije o načinu na koji treba provoditi pokuse i procjenjivati podatke. Ako su izmjene uvjeta pokusa nužne, takve je promjene potrebno opravdati. Dozvoljeno je koristiti druge norme ako se za njih u potpunosti navedu reference. U opisanoj metodi, za kalibraciju se koriste uzorci polistirena poznate polidisperzivnosti, i možda će je za određene polimere, npr. polimere dugih razgranatih lanaca i topljive u vodi, biti potrebno prilagoditi.
1.2. DEFINICIJE I MJERNE JEDINICE
Opći prosjek molekulske težine Mn i prosječna molekulska težina Mw određuju se sljedećim jednadžbama:
|
|
|
gdje je:
Hi razina detektorskog signala od osnovice za volumen retencije Vi
Mi molekulska težina frakcije polimera kod volumena retencije Vi i
n broj točaka s podacima
Širina raspodjele molekulske težine, kojom se mjeri disperzivnost sustava, određena je omjerom Mw/Mn.
1.3. REFERENTNE TVARI
Kako je kromatografija GPC relativna metoda, neophodno je provesti kalibraciju. Za to se obično koriste etaloni za usko raspodijeljene, linearno strukturirane polistirene poznatih prosječnih molekulskih težina Mn i Mw, te poznate raspodjele molekulske težine. Kalibracijska krivulja može se koristiti za određivanje molekulske težine nepoznatog uzorka samo ako su uvjeti za separaciju uzorka i etaloni odabrani na istovjetan način.
Utvrđena veza između molekulske težine i volumena eluiranja vrijedi jedino pod konkretnim uvjetima svakog pojedinog pokusa. Ti uvjeti uključuju prije svega temperaturu, otapalo (ili mješavinu otapala), uvjete kromatografije i separacijsku kolonu ili sustav kolona.
Na taj način određene molekulske težine uzorka relativne su vrijednosti i opisujemo ih kao „ekvivalentne molekulske težine polistirena”. To znači da u zavisnosti o strukturnim i kemijskim razlikama između uzorka i etalona, molekulska težina može više ili manje odstupati od apsolutnih vrijednosti. Ako se koriste drugi etaloni, npr. polietilen glikol, polietilen oksid, polimetil metakrilat, poliakrilna kiselina, razlog za to treba navesti.
1.4. NAČELO ISPITNE METODE
GPC kromatografijom moguće je odrediti kako raspodjelu molekulske težine uzorka tako i prosječne molekulske težine (Mn, Mw). GPC metoda je poseban tip tekućinske kromatografije kod kojeg se uzorak separira prema hidrodinamičkim volumenima pojedinih komponenata (2).
Do separacije dolazi prolazom uzorka kroz kolonu koja je ispunjena propusnim materijalom, obično organskim gelom. Male molekule mogu penetrirati kroz pore dok se velike molekule isključuju. Dakle, put velikih molekula je kraći i one prve eluiraju. Molekule srednje veličine prolaze kroz neke od pora i eluiraju kasnije. Najmanje molekule, čiji je srednji hidrodinamički promjer manji od pora gela, mogu ući u sve pore. One eluiraju posljednje.
U idealnom slučaju, separaciju u potpunosti regulira veličina molekulskih vrsta, ali u praksi je teško izbjeći međudjelovanje barem nekih učinaka apsorpcije. Nejednoliko punjenje kolone i mrtvi volumeni mogu pogoršati stanje (2).
Detekcija se vrši, npr. refrakcijskim indeksom ili UV apsorpcijom, čime se dobije jednostavna krivulja raspodjele. Međutim, kako bi se krivulji dodale stvarne vrijednosti molekulskih težina, potrebno je kalibrirati kolonu prolaskom polimera poznate molekulske težine i, u idealnom slučaju, u širem smislu slične strukture, npr. raznih etalona polistirena. Tipični rezultati iz Gaussove krivulje ponekad iskrivljene manjim repom prema strani manje molekulske težine, kod koje okomita os pokazuje količinu, izraženu težinom, raznih molekulskih težina koje su eluirane, a vodoravna os logaritamsku molekulsku težinu.
1.5. KRITERIJI KVALITETE
Ponovljivost (relativno odstupanje etalona: RSD) volumena eluiranja treba biti bolja od 0,3 %. Propisana ponovljivost analize mora se osigurati korekcijom putem internog etalona ako se kromatogram procjenjuje u zavisnosti od vremena i ne odgovara gore navedenom kriteriju (1). Polidisperzivnosti ovise o molekulskim težinama etalona. Kod etalona polistirena tipične vrijednosti su:
|
Mp < 2 000 |
Mw/Mn < 1,20 |
|
2 000 ≤ Mp ≤ 106 |
Mw/Mn < 1,05 |
|
Mp > 106 |
Mw/Mn < 1,20 |
(Mp je molekulska težina etalona na tjemenu krivulje eluacije)
1.6. OPIS ISPITNE METODE
1.6.1. Priprema otopina polistirena za etalone
Etaloni polistirena otapaju se opreznim miješanjem u odabranom eluentu. Kod pripreme otopina obvezno treba uzeti u obzir upute proizvođača.
Koncentracije odabranih etalona ovise o raznim čimbenicima, npr. volumenu ubrizgavanja, viskozitetu otopine i osjetljivosti analitičkog detektora. Maksimalni volumen ubrizgavanja mora se prilagoditi duljini kolone, kako bi se spriječilo prekomjerno punjenje. Za analitičke separacije metodom GPC s kolonom dimenzija 30 cm × 7,8 mm, tipični volumeni ubrizgavanja su obično između 40 i 100 μl. Veći volumeni su mogući, ali ne bi trebali prijeći 250 μl. Optimalni omjer između volumena ubrizgavanja i koncentracije mora se utvrditi prije stvarne kalibracije kolone.
1.6.2. Priprema otopine uzorka
U načelu, isti zahtjevi vrijede za pripremu otopina uzorka. Uzorak se otapa u odgovarajućem otapalu, npr. tetrahidrofuranu (THF), na način da se oprezno protrese. Ni u kom slučaju ne treba ga otapati pomoću ultrazvučne kupke. Po potrebi otopinu uzorka treba pročistiti preko membranskog filtra veličine pora između 0,2 i 2 μm.
Prisutnost neotopljenih čestica mora se zabilježiti u konačnom izvješću jer se kod vrsta velike molekulske težine one mogu javiti kao posljedica. Težinski postotak otopljenih čestica određuje se primjenom odgovarajuće metode. Otopine treba upotrijebiti u roku od 24 sata.
1.6.3. Uređaj
|
— |
spremnik za otapalo, |
|
— |
otplinjač (ako je potrebno), |
|
— |
crpka, |
|
— |
ublaživač trzaja (ako je potrebno), |
|
— |
sustav za ubrizgavanje, |
|
— |
kromatografske kolone, |
|
— |
detektor, |
|
— |
mjerač protoka (ako je potrebno), |
|
— |
uređaj za bilježenje i obradu podataka, |
|
— |
posuda za otpad. |
Mora se osigurati inertnost sustava za kromatografiju GPC s obzirom na otapala koja se koriste (što se postiže npr. uporabom čeličnih kapilara za otapalo THF).
1.6.4. Ubrizgavanje i sustav dobave otapala
Utvrđeni volumen otopine uzorka puni se u kolonu bilo uređajem za automatsko uzimanje uzorka ili ručno u točno određeno područje. Prebrzo povlačenje ili otpuštanje klipa brizgaljke, ako se radi ručno, može uzrokovati promjene u raspodjeli molekulske težine koja se promatra. Sustav dobave otapala trebao bi, koliko je to moguće, raditi bez trzaja, što se u idealnim uvjetima osigurava ublaživačem trzaja. Brzina protoka je 1 ml/min.
1.6.5. Kolona
U zavisnosti od uzorka, za karakterizaciju polimera koristi se ili jednostruka kolona ili nekoliko kolona povezanih u niz. Na tržištu postoji cijeli niz poroznih materijala za kolone, koji imaju određena svojstva (npr. veličinu pore, granice isključenja po veličini). Odabir separacijskoga gela ili duljine kolone ovisi kako o svojstvima uzorka (hidrodinamičkim volumenima, raspodjeli molekulske težine) tako i o konkretnim uvjetima separacije, kao što su otapalo, temperatura i brzina protoka (1)(2)(3).
1.6.6. Teoretski stupnjevi
Kolona ili kombinacija kolona koja se koristi za separaciju mora biti karakterizirana brojem teoretskih stupnjeva. To obuhvaća, u slučaju kad se kao otapalo za eluaciju koristi THF, punjenje otopine etil benzena ili neke druge pogodne nepolarne topljive tvari na kolonu poznate duljine. Broj teoretskih stupnjeva određen je sljedećom jednadžbom:
|
|
ili |
|
gdje je:
|
N |
= |
broj teoretskih stupnjeva |
|
Ve |
= |
volumen eluiranja na tjemenu krivulje eluiranja |
|
W |
= |
širina osnovice krivulje |
|
W1/2 |
= |
širina krivulje na pola visine |
1.6.7. Učinkovitost separacije
Osim broja teoretskih stupnjeva, što je količina koja određuje širinu pojasa, važna je učinkovitost separacije, a nju određuje kosina kalibracijske krivulje. Učinkovitost separacije kolone dobiva se iz sljedećeg odnosa:

gdje je:
|
Ve,Mx |
= |
volumen eluiranja za polistiren molekulske težine Mx |
|
Ve,(10.Mx) |
= |
volumen eluiranja za polistiren 10 puta veće molekulske težine |
Rezolucija sustava obično se definira kako slijedi:

gdje je:
|
Ve1, Ve2 |
= |
volumeni eluiranja dva etalona polistirena na tjemenu krivulje eluiranja |
|
W1, W2 |
= |
širine osnovice krivulje |
|
M1, M2 |
= |
molekulske težine na tjemenu krivulje (trebale bi se razlikovati faktorom 10) |
R-vrijednost sustava kolona treba biti veća od 1,7 (4).
1.6.8. Otapala
Sva otapala moraju biti velike čistoće (za THF, uzima se čistoća od 99,5 %). Spremnik za otapalo (ako je potreban u atmosferi inertnog plina) mora biti dovoljno velik za kalibraciju kolona i nekoliko analiza uzorka. Prije nego se crpkom prenosi do kolone, otapalo se mora otpliniti.
1.6.9. Regulacija temperature
Temperatura kritičnih unutarnjih komponenata (petlje ubrizgavanja, kolona, detektora i cjevovoda) mora biti stalna i u skladu s izborom otapala.
1.6.10. Detektor
Svrha detektora količinski je bilježiti koncentraciju uzorka eluiranog iz kolone. Kako bi se izbjeglo nepotrebno širenje krivulje, volumen kivete ćelije detektora mora se držati što je moguće manjim. Ne bi trebao biti veći od 10 μl, osim za detektore koji rade po metodama rasapa svjetlosti i viskozimetrije. Za detekciju se obično koristi diferencijalna refraktometrija. Međutim, ako je to potrebno zbog posebnih svojstava uzorka ili otapala za eluaciju, moguće je koristiti i druge tipove detektora, npr. UV/VIS, IR, viskozimetriju itd.
2. PODACI I IZVJEŠĆIVANJE
2.1. PODACI
Za pojedinosti u vezi s kriterijima procjene kao i za zahtjeve koji se odnose na prikupljanje i obradu podataka treba konzultirati normu DIN (1).
Za svaki je uzorak nužno provesti dva neovisna pokusa. Njih treba analizirati odvojeno.
Za svako mjerenje treba imati vrijednosti Mn, Mw, Mw/Mn i Mp. Potrebno je izričito navesti da su izmjerene vrijednosti relativne vrijednosti ekvivalentne molekulskim težinama etalona koji je upotrijebljen.
Nakon određivanja volumena retencije ili vremena retencije (koje je moguće korigirati upotrebom internog etalona), logaritamske se vrijednosti Mp (s tim da Mp predstavlja najviše točke krivulje kalibracijskog etalona) ucrtavaju u odnosu na jednu od tih količina. Najmanje dvije kalibracijske točke nužne su po dekadi molekulske težine, a najmanje pet mjernih točaka potrebno je za ukupnu krivulju, koja bi trebala obuhvatiti procijenjenu molekulsku težinu uzorka. Krajnja točka kalibracijske krivulje za malu molekulsku težinu definira se n-heksil benzenom ili drugom pogodnom nepolarnom topljivom tvari. Vrijednosti molekulskih težina Mn i Mw obično se utvrđuju elektronskom obradom podataka, koja se temelji na formulama iz odjeljka 1.2. Ako se koristi ručna obrada, upute se mogu naći u normi ASTM D 3536-91 (3).
Krivulja raspodjele mora biti u obliku tablice ili kao slika (diferencijalna frekvencija ili zbroj postotaka u odnosu na logaritamsku vrijednost M). U grafičkom prikazu, jedna dekada molekulske težine obično treba biti oko 4 cm u širinu, a najviša točka krivulje oko 8 cm u visinu. Kod integralnih krivulja raspodjele, razlika na ordinati između 0 i 100 % treba biti oko 10 cm.
2.2. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora sadržavati sljedeće podatke:
2.2.1. Ispitna tvar:
|
— |
dostupne informacije o ispitivanoj tvari (identitet, aditivi, nečistoće), |
|
— |
opis obrade uzorka, opažanja, problemi. |
2.2.2. Instrumentacija:
|
— |
spremnik za eluent, inertni plin, otplinjavanje eluenta, sastav eluenta, nečistoće, |
|
— |
crpka, ublaživač trzaja, sustav ubrizgavanja, |
|
— |
kolone za separaciju (proizvođač, sve informacije o karakteristikama kolona, kao što su veličina pora, vrsta materijala za separaciju itd., broj, duljina i red kolona koje se koriste), |
|
— |
broj teoretskih stupnjeva kolone (ili kombinacije), učinkovitost separacije (rezolucija sustava), |
|
— |
informacije o simetriji tjemena krivulja, |
|
— |
temperatura kolone, vrsta regulacije temperature, |
|
— |
detektor (mjerno načelo, tip, volumen kivete), |
|
— |
mjerač protoka, ako se koristi (proizvođač, mjerno načelo), |
|
— |
sustav za bilježenje i obradu podataka (uređaji i računalni programi). |
2.2.3. Kalibracija sustava:
|
— |
iscrpan opis metode koja se koristi za konstruiranje kalibracijske krivulje, |
|
— |
informacije o kriterijima kvalitete za ovu metodu (npr. koeficijent korelacije, zbroj kvadrata odstupanja itd.), |
|
— |
informacije o svim ekstrapolacijama, pretpostavkama i približavanjima učinjenim tijekom postupka pokusa, kao i o procjeni i obradi podataka, |
|
— |
sva mjerenja poduzeta radi konstruiranja kalibracijske krivulje moraju biti dokumentirana u tablici koja obuhvaća sljedeće informacije o svakoj točki kalibracije:
|
2.2.4. Procjena:
|
— |
procjena na osnovi vremena: sve metode kojima se osigurava propisana mjerna obnovljivost (metoda korekcije, interni etalon itd.), |
|
— |
informacija o tome je li procjena izvršena na temelju volumena eluiranja ili vremena retencije, |
|
— |
informacije o ograničenjima procjene ako tjeme krivulje nije u potpunosti analizirano, |
|
— |
opis metoda poravnavanja (rezultata), ako su korištene, |
|
— |
priprema i postupci prethodne obrade uzorka, |
|
— |
eventualna prisutnost neotopljenih čestica, |
|
— |
volumen ubrizgavanja (μl) i koncentracija ubrizgavanja (mg/ml) |
|
— |
opažanja o učincima koji vode do odstupanja od idealnog profila GPC, |
|
— |
iscrpan opis svih izmjena postupaka ispitivanja, |
|
— |
pojedinosti o područjima greške, |
|
— |
sve ostale informacije i opažanja koja su bitna za tumačenje rezultata. |
3. REFERENCE
|
(1) |
DIN 55672 (1995) Gelpermeationschromatographie (GPC) mit Tetrahydrofuran (THF) als Elutionsmittel, Teil 1. |
|
(2) |
Yau, W.W., Kirkland, J.J., and Bly, D.D. eds, (1979). Modern Size Exclusion Liquid Chromatography, J. Wiley and Sons. |
|
(3) |
ASTM D 3536-91, (1991). Standard Test Method for Molecular Weight Averages and Molecular Weight Distribution by Liquid Exclusion Chromatography (Gel Permeation Chromatography-GPC). American Society for Testing and Materials, Philadelphia, Pennsylvania. |
|
(4) |
ASTM D 5296-92, (1992) Standard Test Method for Molecular Weight Averages and Molecular Weight Distribution of Polystyrene by High Performance Size-Exclusion Chromatography. American Society for Testing and Materials, Philadelphia, Pennsylvania. |
Dodatak
Primjeri ostalih metoda za određivanje prosjeka molekulske težine (Mn) za polimere
Metoda kromatografije na permeabilnom gelu (GPC) poželjna je metoda za određivanje Mn, pogotovo ako je dostupan komplet etalona čija je struktura usporediva sa strukturom polimera. Međutim ako postoje praktične poteškoće u korištenju metode GPC, ili ako se unaprijed očekuje da tvar neće zadovoljiti regulatorni kriterij za Mn (što se mora potvrditi), dostupne su alternativne metode, kao npr.:
1. Metoda koligativnih svojstava
|
1.1. |
Ebulioskopija/Krioskopija obuhvaća mjerenje podizanja vrelišta (ebulioskopija) ili spuštanja ledišta (krioskopija) otapala, ako se dodaje polimer. Metoda se zasniva na činjenici da učinak otopljenog polimera na vrelište/ledište tekućine zavisi o molekulskoj težini polimera (1)(2). Primjenljivost, Mn < 20 000. |
|
1.2. |
Snižavanje tlaka pare obuhvaća mjerenje tlaka pare odabrane referentne tekućine prije i nakon dodavanja poznatih količina polimera (1)(2). Primjenljivost, Mn < 20 000 (teoretski; međutim, njezina je vrijednost u praksi ograničena). |
|
1.3. |
Membranska osmometrija temelji se na načelu osmoze, tj. prirodne sklonosti molekula otapala da prolaze kroz polu-propusnu membranu iz razrijeđene u koncentriranu otopinu radi postizanja ravnoteže. U ispitivanju, razrijeđena otopina je nulte koncentracije, dok koncentrirana otopina sadrži polimer. Učinak provlačenja otapala kroz membranu uzrokuje diferencijalni tlak koji zavisi o koncentraciji i molekulskoj težini polimera (1)(3)(4). Primjenljivost, Mn između 20 000-200 000. |
|
1.4. |
Osmometrija faze pare obuhvaća uspoređivanje brzine isparavanja aerosola čistog otapala do najmanje tri aerosola koji sadrže polimer u različitim koncentracijama (1)(2)(4). Primjenljivost, Mn < 20 000. |
2. Analiza krajne grupe
Za primjenu ove metode potrebno je poznavati i ukupnu strukturu polimera i vrstu lanca kojim završavaju krajnje grupe (koji se mora razlikovati od glavnog kostura po, npr. NMR ili titraciji/derivatizaciji). Određivanje molekulske koncentracije krajnjih grupa koje se nalaze na polimeru može dovesti do vrijednosti molekulske težine (7)(8)(9).
Primjenljivost, Mn do 50 000 (uz smanjenje pouzdanosti).
3. Reference
|
(1) |
Billmeyer, F.W. Jr., (1984) Textbook of Polymer Science, 3rd Edn., John Wiley, New York. |
|
(2) |
Glover, C.A., (1975) Absolute Colligative Property Methods. Chapter 4. In: Polymer Molecular Weights, Part I P.E. Slade, Jr. ed., Marcel Dekker, New York. |
|
(3) |
ASTM D 3750-79, (1979) Standard Practice for Determination of Number-Average Molecular Weight of Polymers by Membrane Osmometry. American Society for Testing and Materials, Philadelphia, Pennsylvania. |
|
(4) |
Coll, H. (1989) Membrane Osmometry. In: Determination of Molecular Weight, A.R. Cooper ed., J. Wiley and Sons, pp. 25-52. |
|
(5) |
ASTM 3592-77, (1977) Standard Recommended Practice for Determination of Molecular Weight by Vapour Pressure, American Society for Testing and Materials, Philadelphia, Pennsylvania. |
|
(6) |
Morris, C.E.M., (1989) Vapour Pressure Osmometry. In: Determinationn of Molecular Weight, A.R. Cooper ed., John Wiley and Sons. |
|
(7) |
Schröder, E., Müller, G., and Arndt, K-F., (1989) Polymer Characterisation, Carl Hanser Verlag, Munich. |
|
(8) |
Garmon, R.G., (1975) End-Group Determinations, Chapter 3 In: Polymer Molecular Weights, Part I, P.E. Slade, Jr. ed. Marcel Dekker, New York. |
|
(9) |
Amiya, S., et al. (1990) Pure and Applied Chemistry, 62, 2139-2146. |
A.19. SADRŽAJ MALE MOLEKULSKE TEŽINE U POLIMERIMA
1. METODA
Metoda kromatografije na permeabilnom gelu preslika je Smjernice OECD-a za ispitivanje TG 119 (1996.) Temeljna načela i daljnje tehničke informacije navedeni su u referencama.
1.1. UVOD
Kako su svojstva polimera veoma raznolika, nemoguće je opisati jednu metodu kojom se precizno utvrđuju uvjeti separacije i procjene koji obuhvaćaju sve slučajnosti i posebnosti do kojih dolazi kod separacije polimera. Posebno, složeni sustavi polimera često nisu pogodni za kromatografiju na permeabilnom gelu (GPC). Kad metoda GPC nije u praksi provediva, molekulske mase moguće je određivati drugim metodama (vidjeti Dodatak). U takvim slučajevima treba potanko obrazložiti zašto se određena metoda koristi.
Opisana metoda temelji se na normi DIN 55672 (1). Ta DIN norma sadrži iscrpne informacije o načinu na koji treba provoditi pokuse i procjenjivati podatke. Ako su izmjene uvjeta pokusa nužne, takve promjene treba opravdati. Dozvoljeno je koristiti druge norme ako se za njih u potpunosti navedu reference. U opisanoj metodi, za kalibraciju se koriste uzorci polistirena poznate polidisperzivnosti, i možda će je za određene polimere, npr. polimere dugih razgranatih lanaca i topljive u vodi, trebati prilagoditi.
1.2. DEFINICIJE I JEDINICE
Mala molekulska težina proizvoljno je definirana kao molekulska težina ispod 1 000 daltona.
Opći prosjek molekulske težine Mn i prosječna molekulska težina Mw određuju se sljedećim jednadžbama:
|
|
|
gdje je:
|
Hi |
= |
razina detektorskog signala od osnovice za volumen retencije Vi |
|
Mi |
= |
molekulska težina frakcije polimera kod volumena retencije Vi, a n je broj točaka s podacima |
Širina raspodjele molekulske težine, kojom se mjeri disperzivnost sustava, određena je omjerom Mw/Mn.
1.3. REFERENTNE TVARI
Kako je kromatografija GPC relativna metoda, neophodno je provesti kalibraciju. Za to se obično koriste etaloni za usko raspodijeljene, linearno strukturirane polistirene poznatih prosječnih molekulskih težina Mn i Mw i poznate raspodjele molekulske težine. Kalibracijska krivulja može se koristiti za određivanje molekulske težine nepoznatog uzorka samo ako su uvjeti za separaciju uzorka i etaloni odabrani na istovjetan način.
Utvrđena veza između molekulske težine i volumena eluiranja vrijedi jedino pod konkretnim uvjetima svakog pojedinog pokusa. Ti uvjeti uključuju prije svega temperaturu, otapalo (ili mješavinu otapala), uvjete kromatografije i separacijsku kolonu ili sustav kolona.
Na taj način određene molekulske težine uzorka relativne su vrijednosti i opisujemo ih kao „ekvivalentne molekulske težine polistirena”. To znači da u ovisnosti o strukturnim i kemijskim razlikama između uzorka i etalona, molekulska težina može više ili manje odstupati od apsolutnih vrijednosti. Ako se koriste drugi etaloni, npr. polietilen glikol, polietilen oksid, polimetil metakrilat, poliakrilna kiselina, razlog za to treba navesti.
1.4. NAČELO ISPITNE METODE
GPC metodom moguće je odrediti kako raspodjelu molekulske težine uzorka tako i prosječne molekulske težine (Mn, Mw). GPC je poseban tip tekućinske kromatografije kod kojeg se uzorak separira prema hidrodinamičkim volumenima pojedinih komponenata (2).
Do separacije dolazi prolazom uzorka kroz kolonu koja je ispunjena poroznim materijalom, obično organskim gelom. Male molekule mogu penetrirati kroz pore dok se velike molekule isključuju. Dakle, put velikih molekula je kraći i one prve eluiraju. Molekule srednje veličine prolaze kroz neke od pora i eluiraju kasnije. Najmanje molekule, čiji je srednji hidrodinamički promjer manji od pora gela, mogu ući u sve pore. One eluiraju posljednje.
U idealnom slučaju, separaciju u potpunosti regulira veličina molekulskih vrsta, ali u praksi je teško izbjeći međudjelovanje barem nekih učinaka apsorpcije. Nejednoliko punjenje kolone i prazni volumeni mogu pogoršati stanje (2).
Detekcija se vrši npr. refrakcijskim indeksom ili UV apsorpcijom, čime se dobije jednostavna krivulja raspodjele. Međutim, kako bi se krivulji dodale stvarne vrijednosti molekulskih težina, potrebno je kalibrirati kolonu prolaskom polimera poznate molekulske težine, i u idealnom slučaju, u širem smislu slične strukture, npr. raznih etalona polistirena. Tipični rezultati iz Gaussove krivulje, ponekad iskrivljene manjim repom prema strani manje molekulske težine, kod koje okomita os pokazuje količinu, izraženu težinom, raznih molekulskih težina koje su eluirane, a vodoravna os logaritamsku molekulsku težinu.
Iz te krivulje izvodi se sadržaj male molekulske težine. Izračun može biti točan samo ako se vrste polimera malih molekulskih težina na isti način odnose prema jedinici mase, kao prema polimeru u cjelini.
1.5. KRITERIJI KVALITETE
Ponovljivost (relativno odstupanje etalona: RSD) volumena eluiranja treba biti bolja od 0,3 %. Propisana ponovljivost analize mora se osigurati korekcijom putem internog etalona ako se kromatogram procjenjuje u zavisnosti od vremena, i ne odgovara gore navedenom kriteriju (1). Polidisperzivnosti ovise o molekulskim težinama etalona. Kod etalona polistirena tipične vrijednosti su:
|
Mp < 2 000 |
Mw/Mn < 1,20 |
|
2 000 ≤ Mp ≤ 106 |
Mw/Mn < 1,05 |
|
Mp > 106 |
Mw/Mn < 1,20 |
(Mp je molekulska težina etalona na tjemenu krivulje eluiranja)
1.6. OPIS ISPITNE METODE
1.6.1. Priprema otopina polistirena za etalone
Etaloni polistirena otapaju se opreznim miješanjem u odabranom eluentu. U pripremi otopina obvezno treba uzeti u obzir upute proizvođača.
Koncentracije odabranih etalona ovise o raznim čimbenicima, npr. volumenu ubrizgavanja, viskoznosti otopine i osjetljivosti analitičkog detektora. Maksimalni volumen ubrizgavanja mora se prilagoditi duljini kolone, radi sprečavanja prekomjernog punjenja. Za analitičke separacije metodom GPC s kolonom dimenzija 30 cm × 7,8 mm, tipični volumeni ubrizgavanja su obično između 40 i 100 μl. Veći volumeni su mogući, ali ne bi trebali prijeći 250 μl. Optimalni omjer između volumena ubrizgavanja i koncentracije mora se utvrditi prije stvarne kalibracije kolone.
1.6.2. Priprema otopine uzorka
U načelu, isti zahtjevi vrijede za pripremu otopina uzorka. Uzorak se otapa u odgovarajućem otapalu, npr. tetrahidrofuranu (THF), na način da se oprezno protrese. Ni u kom slučaju ne treba ga otapati pomoću ultrazvučne kupke. Po potrebi, otopinu uzorka treba pročistiti preko membranskog filtra veličine pora između 0,2 i 2 μm.
Prisutnost neotopljenih čestica mora se zabilježiti u konačnom izvješću jer one mogu biti posljedica vrsta velike molekulske težine. Težinski postotak neotopljenih čestica određuje se primjenom odgovarajuće metode. Otopine treba upotrijebiti u roku od 24 sata.
1.6.3. Korekcija radi sadržaja nečistoća i aditiva
Korekcija sadržaja vrsta koje imaju M < 1 000 za prinos iz prisutnih konkretnih nepolimernih komponenata (npr. nečistoća i/ili aditiva) obično je potrebna, ako izmjereni sadržaj već nije < 1 %. To se postiže neposrednom analizom otopine polimera ili eluata koji se koristi u metodi GPC.
Ako je eluat nakon prolaza kroz kolonu prerazrijeđen za daljnju analizu, potrebno ga je koncentrirati. Možda će eluat trebati prvo u potpunosti ispariti, a zatim ga ponovno otopiti. Koncentriranje eluata mora se vršiti pod uvjetima koji osiguravaju da na eluatu neće doći ni do kakvih promjena. Postupak s eluatom nakon uporabe u GPC-u ovisi o analitičkoj metodi koja je primijenjena za količinsko određivanje.
1.6.4. Uređaj
Uređaj GPC obuhvaća sljedeće komponente:
|
— |
spremnik za otapalo, |
|
— |
otplinjač (ako je potrebno), |
|
— |
crpku, |
|
— |
ublaživač trzaja (ako je potrebno) |
|
— |
sustav za ubrizgavanje, |
|
— |
kromatografske kolone, |
|
— |
detektor, |
|
— |
mjerač protoka (ako je potrebno), |
|
— |
uređaj za bilježenje i obradu podataka – procesor, |
|
— |
posudu za otpad. |
Mora se osigurati inertnost sustava za kromatografiju GPC s obzirom na otapala koja se koriste (što se postiže npr. uporabom čeličnih kapilara za otapalo THF).
1.6.5. Ubrizgavanje i sustav dobave otapala
Utvrđeni volumen otopine uzorka puni se u kolonu bilo uređajem za automatsko uzimanje uzorka ili ručno u točno određeno područje. Prebrzo povlačenje ili otpuštanje klipa brizgaljke, ako se radi ručno, može uzrokovati promjene u raspodjeli molekulske težine koja se promatra. Sustav dobave otapala trebao bi, koliko je to moguće, raditi bez trzaja, što se u idealnim uvjetima osigurava ublaživačem trzaja. Brzina protoka je reda veličine 1 ml/min.
1.6.6. Kolona
U zavisnosti od uzorka, za karakterizaciju polimera koristi se ili jednostruka kolona ili nekoliko kolona povezanih u niz. Na tržištu postoji cijeli niz poroznih materijala za kolone, koji imaju određena svojstva (npr. veličinu pore, granice isključenja po veličini). Odabir separacijskoga gela ili duljine kolone ovisi kako o svojstvima uzorka (hidrodinamičkim volumenima, raspodjeli molekulske težine) tako i o konkretnim uvjetima separacije, kao što su otapalo, temperatura i brzina protoka (1)(2)(3).
1.6.7. Teoretski stupnjevi
Kolona ili kombinacija kolona koja se koristi za separaciju mora biti karakterizirana brojem teoretskih stupnjeva. To obuhvaća, u slučaju kad se kao otapalo za eluaciju koristi THF, punjenje otopine etil benzena ili neke druge pogodne nepolarne topljive tvari na kolonu poznate duljine. Broj teoretskih stupnjeva određen je sljedećom jednadžbom:
|
|
ili |
|
gdje je:
|
N |
= |
broj teoretskih stupnjeva |
|
Ve |
= |
volumen eluiranja na tjemenu krivulje eluiranja |
|
W |
= |
širina osnovice krivulje |
|
W1/2 |
= |
širina krivulje na pola visine |
1.6.8. Učinkovitost separacije
Osim broja teoretskih stupnjeva, što je količina koja određuje širinu pojasa, važna je učinkovitost separacije, a nju određuje kosina kalibracijske krivulje. Učinkovitost separacije kolone dobiva se iz sljedećeg odnosa:

gdje je:
|
Ve,Mx |
= |
volumen eluiranja za polistiren molekulske težine Mx |
|
Ve,(10.Mx) |
= |
volumen eluiranja za polistiren 10 puta veće molekulske težine |
Rezolucija sustava obično se definira kako slijedi:
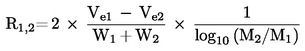
gdje je:
|
Ve1, Ve2 |
= |
volumeni dva etalona polistirena na tjemenu krivulje eluiranja |
|
W1, W2 |
= |
širine osnovice krivulje |
|
M1, M2 |
= |
molekulske težine na tjemenu krivulje (trebali bi se razlikovati faktorom 10) |
R-vrijednost sustava kolona treba biti veća od 1,7 (4).
1.6.9. Otapala
Sva otapala moraju biti velike čistoće (za THF, uzima se čistoća od 99,5 %). Spremnik za otapalo (ako je potreban u atmosferi inertnog plina) mora biti dovoljno velik za kalibraciju kolona i nekoliko analiza uzorka. Prije nego se crpkom prenosi do kolone, otapalo se mora otpliniti.
1.6.10. Regulacija temperature
Temperatura kritičnih unutarnjih komponenata (petlje ubrizgavanja, kolona, detektora i cjevovoda) mora biti stalna, i u skladu s izborom otapala.
1.6.11. Detektor
Svrha detektora je količinski bilježiti koncentraciju uzorka eluiranog iz kolone. Kako bi se izbjeglo nepotrebno širenje krivulje, volumen kivete ćelije detektora mora se držati što je moguće manjim. Ne bi trebao biti veći od 10 μl, osim za detektore koji rade po metodama rasapa svjetlosti i viskozimetrije. Za detekciju se obično koristi diferencijalna refraktometrija. Međutim, ako je to potrebno zbog posebnih svojstava uzorka ili otapala za eluaciju, moguće je koristiti i druge tipove detektora, npr. UV/VIS, IR, viskozimetriju itd.
1. PODACI I IZVJEŠĆIVANJE
2.1. PODACI
Za pojedinosti u vezi s kriterijima procjene kao i za zahtjeve koji se odnose na prikupljanje i obradu podataka treba konzultirati DIN normu (1).
Za svaki je uzorak nužno provesti dva neovisna pokusa. Te pokuse treba analizirati odvojeno. Uvijek je bitno odrediti i podatke iz slijepih proba koje su napravljene pod istim uvjetima kao s uzorkom.
Treba izričito navesti da su izmjerene vrijednosti relativne vrijednosti ekvivalentne molekulskim težinama etalona koji je upotrijebljen.
Nakon određivanja volumena retencije ili vremena retencije (koje je moguće korigirati upotrebom internog etalona), logaritamske se vrijednosti Mp (s tim da Mp predstavlja najviše točke krivulje kalibracijskog etalona) ucrtavaju u odnosu na jednu od tih količina. Barem dvije kalibracijske točke nužne su po dekadi molekulske težine, a barem pet mjernih točaka potrebno je za ukupnu krivulju, koja bi trebala obuhvatiti procijenjenu molekulsku težinu uzorka. Krajnja točka kalibracijske krivulje za malu molekulsku težinu definira se n-heksil benzenom ili drugom pogodnom nepolarnom topljivom tvari. Dio krivulje koji odgovara molekulskim težinama ispod 1 000 određuje se i po potrebi ispravlja za nečistoće i aditive. Krivulje eluacije obično se procjenjuju elektronskom obradom podataka. Ako se koristi ručna obrada, upute se mogu naći u normi ASTM D 3536-91 (3).
Ako se na koloni zadržao koji netopljivi polimer, njegova molekulska težina vjerojatno je veća od težine topljive frakcije, i ako se ne uzme u obzir, sadržaj malih molekulskih težina će biti precijenjen. Smjernice za korekcije sadržaja male molekulske težine za netopljive polimere navedene su u Dodatku.
Krivulja raspodjele mora biti u obliku tablice ili kao slika (diferencijalna frekvencija ili zbroj postotaka naprema logaritamskoj vrijednosti M). U grafičkom prikazu, jedna dekada molekulske težine treba obično biti oko 4 cm u širinu, a najviša točka krivulje oko 8 cm u visinu. Kod integralnih krivulja raspodjele, razlika na ordinati između 0 i 100 % treba biti oko 10 cm.
2.2. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora sadržavati sljedeće informacije:
2.2.1. Ispitivana tvar:
|
— |
dostupne informacije o tvari koja se ispituje (identitet, aditivi, nečistoće), |
|
— |
opis obrade uzorka, opažanja, problemi. |
2.2.2. Instrumentacija:
|
— |
spremnik za eluent, inertni plin, otplinjavanje eluenta, sastav eluenta, nečistoće, |
|
— |
crpka, ublaživač trzaja, sustav ubrizgavanja, |
|
— |
kolone za separaciju (proizvođač, sve informacije o karakteristikama kolona, kao što su veličina pora, vrsta materijala za separaciju itd., broj, duljina i red kolona koje se koriste), |
|
— |
broj teoretskih stupnjeva kolone (ili kombinacije), učinkovitost separacije (rezolucija sustava), |
|
— |
informacije o simetriji krivulja eluiranja, |
|
— |
temperatura kolone, vrsta regulacije temperature, |
|
— |
detektor (mjerno načelo, tip, volumen kivete), |
|
— |
mjerač protoka, ako se koristi (proizvođač, mjerno načelo), |
|
— |
sustav za bilježenje i obradu podataka (uređaji i računalni programi). |
2.2.3. Kalibracija sustava:
|
— |
iscrpan opis metode koja se koristi za konstruiranje kalibracijske krivulje, |
|
— |
informacije o kriterijima kvalitete za ovu metodu (npr. koeficijent korelacije, zbroj kvadrata odstupanja itd.), |
|
— |
informacije o svim ekstrapolacijama, pretpostavkama i približavanjima učinjenim tijekom postupka pokusa, kao i o procjeni i obradi podataka, |
|
— |
sva mjerenja poduzeta radi konstruiranja kalibracijske krivulje moraju biti dokumentirana u tablici koja obuhvaća sljedeće informacije o svakoj točki kalibracije:
|
2.2.4. Informacije o sadržaju male molekulske težine u polimerima:
|
— |
opis metoda koje su primijenjene u analizi i način na koji su pokusi rađeni, |
|
— |
informacije o postotku sadržaja vrsta male molekulske težine, |
|
— |
informacije o nečistoćama, aditivima i ostalim nepolimerskim vrstama u težinskom postotku u odnosu na ukupan uzorak. |
2.2.5. Procjena:
|
— |
procjena na osnovi vremena; sve metode kojima se osigurava propisana mjerna obnovljivost (metoda korekcije, interni etalon itd.), |
|
— |
informacija o tome je li procjena izvršena na temelju volumena eluiranja ili vremena retencije, |
|
— |
informacije o ograničenjima procjene ako krivulja nije u potpunosti analizirana, |
|
— |
opis metoda poravnavanja (rezultata), ako su korištene, |
|
— |
priprema i postupci prethodne obrade uzorka, |
|
— |
eventualna prisutnost neotopljenih čestica, |
|
— |
volumen ubrizgavanja (μl) i koncentracija ubrizgavanja (mg/ml), |
|
— |
opažanja o učincima koji vode do odstupanja od idealnog profila GPC, |
|
— |
iscrpan opis svih izmjena u postupcima ispitivanja, |
|
— |
pojedinosti o područjima greške, |
|
— |
sve ostale informacije i opažanja koja su bitna za tumačenje rezultata. |
3. REFERENCE
|
(1) |
DIN 55672 (1995) Gelpermeationschromatographie (GPC) mit Tetrahydrofuran (THF) als Elutionsmittel, Teil 1. |
|
(2) |
Yau, W.W., Kirkland, J.J., and Bly, D.D. eds. (1979) Modern Size Exclusion Liquid Chromatography, J. Wiley and Sons. |
|
(3) |
ASTM D 3536-91, (1991) Standard Test method for Molecular Weight Averages and Molecular Weight Distribution by Liquid Exclusion Chromatography (Gel Permeation Chromatography-GPC). American Society for Testing and Materials, Philadelphia, Pennsylvania. |
|
(4) |
ASTM D 5296-92, (1992) Standard Test method for Molecular Weight Averages and Molecular Weight Distribution of Polystyrene by High Performance Size-Exclusion Chromatography. American Society for Testing and Materials, Philadelphia, Pennsylvania. |
Dodatak
Smjernice za korekciju sadržaja male molekulske mase s obzirom na prisutnost netopljivih polimera
Prisutnost netopljivog polimera u uzorku ima za posljedicu gubitak mase tijekom analize metodom GPC. Netopljivi polimer trajno se zadržava na koloni ili filtru uzorka dok topljivi dio uzorka prolazi kroz kolonu. Ako je prirast refrakcijskog indeksa (dn/dc) polimera moguće procijeniti ili izmjeriti, moguće je procijeniti i gubitak mase uzorka na koloni. U tom se slučaju radi korekcija putem vanjske kalibracije, a za etalone se uzimaju materijali poznate koncentracije i omjera dn/dc, kako bi se kalibrirala reakcija refraktometra. U primjeru koji slijedi kao etalon upotrijebljen je poli(metil metakrilat) (pMMA).
U vanjskoj kalibraciji, za analizu akrilnih polimera, etalon pMMA poznate koncentracije u tetrahidrofuranu, analiziran je metodom GPC, a dobiveni podaci upotrijebljeni su kako bi se odredila konstanta refraktometra prema jednadžbi:
K = R/(C × V × dn/dc)
gdje je:
|
K |
= |
konstanta refraktometra (u mikrovolt sekundama/ml), |
|
R |
= |
reakcija etalona pMMA (u mikrovolt/sekundi), |
|
C |
= |
koncentracija etalona pMMA (u mg/ml), |
|
V |
= |
volumen ubrizgavanja (u ml), i |
|
dn/dc |
= |
prirast refrakcijskog indeksa za pMMA u tetrahidrofuranu (u ml/mg) |
Sljedeći podaci tipični su za etalon pMMA:
|
R |
= |
2 937 891 |
|
C |
= |
1,07 mg/ml |
|
V |
= |
0,1 ml |
|
dn/dc |
= |
9 × 10-5 ml/mg. |
Dobivena vrijednost K 3,05 × 1011 zatim se koristi za izračun teoretske reakcije detektora ako je 100 % ubrizganog polimera eluiralo kroz detektor.
A.20. PONAŠANJE POLIMERA U VODI - OTAPANJE/EKSTRAKCIJA
1. METODA
Opisana metoda preslika je Smjernice OECD-a za ispitivanje TG 120 (1997.). Daljnje tehničke informacije navedene su u referenci (1).
1.1. UVOD
Za određene polimere, kao što su emulzijski polimeri, prije primjene metode opisane dalje u tekstu možda će trebati izvršiti određene pripremne radnje. Metoda nije primjenljiva na tekuće polimere niti na polimere koji u ispitnim uvjetima reagiraju s vodom.
Kad metoda nije praktična ili nije moguća, ponašanje kod otapanja/ekstrakcije moguće je istražiti drugim metodama. U takvim slučajevima, odabranu metodu treba iscrpno opisati i opravdati.
1.2. REFERENTNE TVARI
Nema ih.
1.3. NAČELO ISPITNE METODE
Ponašanje polimera kod otapanja/ekstrakcije u vodenom mediju utvrđuje se primjenom metode tikvice (vidjeti A.6. Topljivost u vodi, metoda tikvice) uz izmjene opisane u daljnjem tekstu.
1.4. KRITERIJI KVALITETE
Nema ih.
1.5. OPIS ISPITNE METODE
1.5.1. Oprema
Za ovu metodu potrebna je sljedeća oprema:
|
— |
uređaj za drobljenje, npr. mlin za dobivanje čestica poznate veličine, |
|
— |
uređaj za protresanje s mogućnošću regulacije temperature, |
|
— |
membranski sustav za filtriranje, |
|
— |
odgovarajuća analitička oprema, |
|
— |
standardizirana sita. |
1.5.2. Priprema uzorka
Reprezentativni uzorak prvo treba smanjiti na čestice veličine između 0,125 i 0,25 mm upotrebom odgovarajućih sita. Radi održavanja stabilnosti uzorka ili radi postupka mljevenja možda će biti potrebno hlađenje. Gumaste materijale moguće je smrviti na temperaturi tekućeg dušika (1).
Ako nije moguće postići potrebnu veličinu čestica, treba poduzeti radnje da se čestice što je moguće više smanje, te o tome treba izraditi izvješće. U tom izvješću treba navesti na koji je način smrvljeni uzorak bio skladišten prije ispitivanja.
1.5.3. Postupak
Tri uzorka po 10 g ispitne tvari odvagnu se u tri zasebne posude opremljene staklenim čepovima i u svaku se posudu doda 1 000 ml vode. Ako se rukovanje količinom od 10 g polimera pokaže nepraktičnim, treba uzeti prvu sljedeću količinu kojom se može rukovati i njoj prilagođen volumen vode.
Posude se čvrsto začepe i zatim tresu na 20 °C. Treba upotrijebiti uređaj za protresanje ili miješanje koji radi na stalnoj temperaturi. Nakon razdoblja od 24 sata, sadržaj svake posude se centrifugira ili filtrira, a koncentracija polimera u čistoj vodenoj fazi utvrđuje se odgovarajućom analitičkom metodom. Ako odgovarajuće analitičke metode za vodenu fazu nisu dostupne, ukupnu je topljivost/sposobnost ekstrakcije moguće procijeniti iz suhe težine taloga na filtru ili centrifugiranog precipitata.
Obično je potrebno količinski razlikovati nečistoće i aditive s jedne strane i vrste male molekulske težine s druge strane. U slučaju određivanja gravimetrijom, isto tako je važno napraviti slijepu probu bez ispitne tvari radi uzimanja u obzir taloga koji nastaju u postupku pokusa.
Ponašanje polimera kod otapanja/ekstrakcije u vodi na 37 °C kod pH 2 i pH 9 može se utvrditi na isti način kao što je opisano za provođenje pokusa na 20 °C. pH vrijednosti moguće je postići dodavanjem bilo odgovarajućih pufera ili odgovarajućih kiselina ili lužina, kao što su klorovodična kiselina, octena kiselina, natrij analitičke kvalitete, ili kalijev hidroksid, ili NH3.
Ovisno o metodi analize koja se primjenjuje treba provesti jedno ili dva ispitivanja. Ako su dostupne dovoljno konkretne metode za izravnu analizu vodene faze za polimernu komponentu, dovoljno je jedno ispitivanje kao što je opisano u gornjem tekstu. Međutim, ako takve metode nisu dostupne pa se utvrđivanje ponašanja polimera kod otapanja/ekstrakcije ograničava na posredne analize utvrđivanjem samo ukupnog sadržaja organskog ugljika (TOC) vodenog ekstrakta, treba provesti i dodatno ispitivanje. To dodatno ispitivanje treba također provesti tri puta, uporabom 10 puta manjih uzoraka polimera i istih količina vode od onih koje su bile upotrijebljene u prvom ispitivanju.
1.5.4. Analiza
1.5.4.1. Ispitivanje koje se provodi na uzorku jedne veličine
Možda su dostupne metode za neposrednu analizu polimerne komponente u vodenoj fazi. Alternativno, moguće je razmotriti primjenu posredne analize otopljenih/izdvojenih polimernih komponenata utvrđivanjem ukupnog sadržaja topljivih dijelova i korekcijom za komponente koje nisu konkretno polimerne.
Analiza vodene faze ukupnih polimerskih vrsta moguća je:
nekom dovoljno osjetljivom metodom, npr.
|
— |
određivanjem ukupnog sadržaja organskog ugljika digestijom persulfata ili dikromata kojom nastaje CO2, nakon čega se vrši procjena metodom IR ili kemijskom analizom, |
|
— |
spektrometrijom atomske apsorpcije (AAS) ili njenim induktivno spregnutim plazma (ICP) emisijskim ekvivalentom za polimere koji sadrže silicij ili metale, |
|
— |
UV apsorpcijom ili spektrofluorometrijom za aril polimere, |
|
— |
LC-MS (tekućinskom kromatografijom - masenom spektrometrijom) za uzorke male molekulske težine, |
ili evaporacijom u vakuumu do isušivanja vodenog ekstrakta, i spektroskopijom (IR, UV itd.) ili AAS/ICP analizom taloga.
Ako takva analiza vodene faze nije praktična, vodeni ekstrakt treba izdvojiti organskim otapalom koje se ne miješa s vodom, npr. kloriranim ugljikohidratom. Otapalo tada ishlapi, a talog se analizira s obzirom na prijavljeni sadržaj polimera, na način opisan u gornjem tekstu. Komponente koje se u tomu talogu utvrde kao nečistoće ili aditivi treba suptrahirati radi utvrđivanja stupnja otapanja/ekstrakcije samog polimera.
Kad su prisutne relativno velike količine takvih materijala, talog će možda trebati podvrći analizi, npr. HPLC (visokodjelotvornoj tekućinskoj kromatografiji) ili GC (plinskoj kromatografiji), radi razlikovanja nečistoća od monomera i vrsta koje potječu od monomera, kako bi se mogao odrediti sadržaj ovih potonjih.
U nekim slučajevima, obično ishlapljivanje organskog otapala do potpune suhoće i vaganje suhog taloga može biti dovoljno.
1.5.4.2. Ispitivanje koje se provodi na dvije različite veličine uzorka
Svi vodeni ekstrakati analiziraju se s obzirom na ukupni sadržaj organskog ugljika.
Gravimetrijsko određivanje provodi se na neotopljenom/neizdvojenom dijelu uzorka. Ako, nakon centrifugiranja ili filtriranja sadržaja svake posude, talog polimera ostane na stjenkama posude, posudu treba ispirati filtratom sve dok se sav vidljiv talog ne ukloni. Nakon toga, filtrat se ponovno centrifugira ili filtrira. Talog koji preostaje na filtru ili na cijevi centrifuge suši se na 40 °C u vakuumu i važe. Sušenje se nastavlja dok se ne postigne stalna težina.
2. PODACI
2.1. ISPITIVANJE PROVEDENO NA UZORKU JEDNE VELIČINE
Pojedinačne rezultate za svaku od tri tikvice i prosječne vrijednosti treba izraziti u jedinicama mase po volumenu otopine (obično mg/l) ili mase po masi uzorka polimera (obično mg/g). Osim toga, treba navesti i gubitak težine uzorka (koji se izračunava kao težina topljive tvari podijeljena početnom težinom uzorka). Relativna odstupanja etalona (RSD) treba izračunati. Podatke treba dati odvojeno za ukupnu tvar (polimer + glavni aditivi itd.) i odvojeno samo za polimer (tj. nakon oduzimanja udjela aditiva).
2.2. ISPITIVANJE PROVEDENO NA DVIJE RAZLIČITE VELIČINE UZORKA
Pojedinačne vrijednosti ukupnog sadržaja ugljika vodenih ekstrakata iz dvaju trostrukih pokusa i prosječnu vrijednost za svaki pokus treba izraziti u jedinicama mase po volumenu otopine (obično mgC/l), ali i u jedinicama mase po početnoj težini uzorka (obično mgC/g).
Ako nema razlike između rezultata velikih i malih omjera uzorak/voda, to može ukazivati da su sve izdvojive komponente zaista izdvojene. U tom slučaju, izravna analiza obično nije potrebna.
Pojedinačne težine taloga treba izraziti u postotku početnih težina uzoraka. Za svaki pokus treba izračunati prosječnu vrijednost. Razlike između 100 % i utvrđenog postotka predstavljaju topljiv i izdvojiv materijal u prvobitnom uzorku.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora sadržavati sljedeće informacije:
3.1.1. Ispitivana tvar:
|
— |
dostupne informacije o tvari koja se ispituje (identitet, aditivi, nečistoće, sadržaj vrsta male molekulske težine). |
3.1.2. Uvjeti pokusa:
|
— |
opis primijenjenih postupaka i uvjeta pokusa, |
|
— |
opis analitičke metode i metode otkrivanja. |
3.1.3. Rezultati:
|
— |
rezultati topljivosti/sposobnosti ekstrakcije u mg/l; pojedinačne i srednje vrijednosti za ispitivanja ekstrakcije u raznim otopinama, razložene na sadržaj polimera i nečistoće, aditive itd., |
|
— |
rezultati topljivosti/sposobnosti izdvajanja u mg/g polimera, |
|
— |
vrijednosti ukupnog sadržaja ugljika vodenih ekstrakata, težina topljive tvari i izračunani postoci, ako je mjereno, |
|
— |
pH vrijednost svakog uzorka, |
|
— |
informacije o vrijednostima dobivenim u slijepim probama, |
|
— |
po potrebi, upute na kemijsku nestabilnost tvari koja se ispituje, tijekom postupka ispitivanja i postupka analize, |
|
— |
sve informacije koje su važne za tumačenje rezultata. |
4. REFERENCE
|
(1) |
DIN 53733 (1976) Zerkleinerung von Kunststofferzeugnissen für Prüfzwecke. |
A.21. SVOJSTVA OKSIDACIJE (TEKUĆINE)
1. METODA
1.1. UVOD
Ova je ispitna metoda namijenjena za određivanje sposobnosti tekuće tvari da poveća brzinu gorenja ili jačinu gorenja zapaljive tvari, ili da sa zapaljivom tvari formira mješavinu koja će se spontano zapaliti ako se te dvije tvari homogeno izmiješaju. Temelji se na UN-ovom testu za oksidirajuće tekućine (1) i ekvivalentna je tom pokusu. Međutim, budući da je metoda A.21. razvijena prvenstveno kako bi se udovoljilo zahtjevima Uredbe (EZ) br. 1907/2006, propisuje se usporedba sa samo jednom referentnom tvari. Ispitivanje i uspoređivanje s dodatnim referentnim tvarima može biti potrebno ako se očekuje da se rezultati ispitivanja koriste u druge svrhe (9).
Ovaj test ne treba provoditi kad je ispitivanjem strukturne formule sa sigurnošću utvrđeno da tvar nije u stanju egzotermno reagirati sa zapaljivim materijalom.
Prije provođenja ovog ispitivanja korisno je posjedovati preliminarne informacije o mogućim eksplozivnim svojstvima tvari.
Ovo se ispitivanje ne primjenjuje na krutine, plinove, eksplozivne ili lako zapaljive tvari, ili organske perokside.
Ovo ispitivanje nije nužno provoditi ako su za ispitivanu tvar već dostupni rezultati u okviru UN-ovog ispitivanja za oksidirajuće tekućine (1).
1.2. DEFINICIJE I JEDINICE
Srednje vrijeme porasta tlaka je prosječno izmjereno vrijeme u kojem mješavina koja se ispituje proizvede porast tlaka od 690 kPa do 2 070 kPa iznad atmosferskog tlaka.
1.3. REFERENTNA TVAR
Propisano je da referentna tvar bude 65 % (m/m) vodena nitritna kiselina (analitičke kvalitete) (10).
Postoji mogućnost da, ako ispitivač predvidi da bi se rezultati ovog ispitivanja mogli koristiti u druge svrhe 3, je prikladno ispitati i druge referentne tvari (11).
1.4. NAČELO ISPITNE METODE
Tekućina koje se ispituje miješa se s vlaknastom celulozom u omjeru 1 prema 1 masenog udjela i uvodi u tlačnu posudu. Ako tijekom miješanja ili punjenja spontano dođe do zapaljenja, daljnje ispitivanje nije potrebno.
Ako do spontanog zapaljenja ne dođe, provodi se puno ispitivanje. Mješavina se zagrijava u tlačnoj posudi te se određuje srednje vrijeme koje je potrebno da bi se tlak podigao s 690 kPa na 2 070 kPa iznad atmosferskog. To se uspoređuje sa srednjim vremenom porasta temperature za mješavinu 1:1 jedne ili više referentnih tvari i celuloze.
1.5. KRITERIJI KVALITETE
U nizu od pet pokusa s jednom tvari niti jedan rezultat ne bi se smio razlikovati od aritmetičke sredine za više od 30 %. Rezultate koji se od aritmetičke sredine razlikuju za više od 30 % treba odbaciti, poboljšati postupak miješanja i punjenja te ponoviti ispitivanje.
1.6. OPIS METODE
1.6.1. Priprema
1.6.1.1. Zapaljiva tvar
Kao zapaljivi materijal koristi se sušena, vlaknasta celuloza duljine vlakana između 50 i 250 μm i srednjeg promjera vlakana 25 μm (12). Suši se na stalnu težinu u sloju debljine najviše 25 mm na 105 °C tijekom četiri sata i drži u eksikatoru, sa sredstvom za upijanje vlage, dok se ne ohladi i bude potrebna za upotrebu. Sadržaj vode sušene celuloze treba biti manji od 0,5 % suhe mase (13). Po potrebi, vrijeme sušenja treba produžiti kako bi se to postiglo (14). U cijelom ispitivanju treba koristiti istu partiju celuloze.
1.6.1.2. Uređaj
1.6.1.2.1.
Potrebna je tlačna posuda. To je cilindrična čelična tlačna posuda dugačka 89 mm, vanjskog promjera 60 mm (vidjeti sliku 1.). Na suprotnim stranama strojno su obrađene dvije ravnine (koje smanjuju poprečni presjek posude na 50 mm) kako bi se olakšalo držanje prilikom ugradnje mehanizma za paljenje i odzračnika. Posuda, koja ima provrt promjera 20 mm, s unutrašnje strane na oba kraja smanjena je na dubinu od 19 mm i urezan je navoj za cijev 1” prema Britanskom standardu za cijevi (BSP) ili drugoj ekvivalentnoj metričkoj normi. Ventil za oduzimanje tlaka, u obliku bočno postavljenog rukavca, vijkom je pričvršćen za zakrivljenu površinu tlačne posude 35 mm od jednog kraja i na 90° prema strojno obrađenim ravninama. Podloga za to probušena je do dubine od 12 mm i ima urezan navoj za cijev 1/2” prema BSP-u ili drugoj ekvivalentnoj metričkoj normi, u koji se pričvršćuje bočni rukavac. Po potrebi ugrađuje se brtva od inertnog materijala kako bi se osigurala plinonepropusnost. Bočni rukavac izlazi iz tijela tlačne posude u duljinu od 55 mm i ima provrt od 6 mm. Kraj rukavca je smanjen i ima navojni priključak za pretvarač tlaka s dijafragmom. Može se koristiti bilo koja vrsta mjerača tlaka pod uvjetom da na njega ne djeluju vrući plinovi ili proizvodi razlaganja i da je u stanju reagirati na brzine porasta tlaka od 690-2 070 kPa u najviše 5 ms.
Kraj tlačne posude koji je najdalje od bočnog rukavca zatvoren je mehanizmom za paljenje koji ima dvije elektrode, jednu izoliranu od tijela mehanizma, a drugu uzemljenu. Drugi kraj tlačne posude zatvoren je rasprskavajućom pločom (tlak raspsrkavanja približno 2 200 kPa) učvršćen je vijkom s provrtom od 20 mm. Po potrebi, uz mehanizam za paljenje ugrađuje se brtva od inertnog materijala, čime se osigurava plinonepropusnost. Potporni stalak (Slika 2.) drži cijeli sklop u pravilnom položaju tijekom upotrebe. Stalak se obično sastoji od temeljne ploče od mekog čelika veličine 235 mm × 184 mm × 6 mm i šupljeg četvrtastog profila 70 mm × 70 mm × 4 mm, dugačkog 185 mm.
S jednog kraja četvrtastog profila izrezane su po dužini dvije nasuprotne stranice, na način da se iznad dobije konstrukcija dijela netaknutog kućišta dužine 86 mm na dvije noge ravnih stranica. Krajevi tih ravnih stranica odrežu se pod kutom od 60° na horizontalnu ravninu i zavare na temeljnu ploču. Na jednoj strani gornjeg kraja podloge strojno se obradi utor 22 mm širine × 46 mm dubine kako bi se, kad se sklop tlačne posude spusti u potporni stalak dijela kućišta, s tim da prvo ide kraj s mehanizmom za paljenje, bočni rukavac namjestio u utor. Na donju unutarnju površinu dijela kućišta zavari se komad čelika širine 30 mm i debljine 6 mm koji ima ulogu držača razmaka. Dva 7 milimetarska pritezna vijka postavljena u suprotne strane čvrsto drže tlačnu posudu. S donje strane tlačnu posudu nose dvije 12 mm široke čelične trake debljine 6 mm zavarene na bočne strane podnožja kućišta.
1.6.1.2.2.
Sustav paljenja sastoji se od Ni/Cr žice duljine 25 cm promjera 0,6 mm i otpora 3,85 om/m. Žica je namotana na šipku promjera 5 mm, u obliku svitka i prigrađena na elektrode mehanizma za paljenje. Svitak bi trebao imati jedan od oblika prikazanih na slici 3. Razmak između dna posude i donje strane svitka za paljenje treba biti 20 mm. Ako elektrode nisu podesive, krajeve žice za paljenje između svitka i dna posude treba izolirati keramičkom oblogom. Žica se grije stalnim izvorom koji može dati struju jačine najmanje 10 A.
1.6.2. Provođenje ispitivanja (15)
Potpuno montiran uređaj zajedno s pretvornikom tlaka i sustavom zagrijavanja, ali bez postavljenog rasprskavajućeg diska, postavljen je u svoj stalak mehanizmom za paljenje prema dolje. 2,5 g tekućine koja se ispituje miješa se s 2,5 g sušene celuloze u staklenoj čaši pomoću staklenog štapića za miješanje (16). Iz sigurnosnih razloga miješanje treba vršiti na način da između vršitelja pokusa i mješavine postoji sigurnosni štit. Ako se mješavina zapali tijekom miješanja ili punjenja, daljnje ispitivanje nije potrebno. Mješavina se u tlačnu posudu dodaje u malim količinama laganim tapkanjem kako bi se mješavina dobro sabila oko svitka za paljenje i bila u dobrom dodiru s njim. Važno je da se tijekom postupka sabijanja elektroda ne izvije jer to može dovesti do pogrešnih rezultata (17). Rasprskavajuća ploča i vijak koji je drži čvrsto se stegnu. Napunjena posuda prenese se u potporni stalak za paljenje, s tim da je rasprskavajuća ploča u krajnjem gornjem položaju, koji treba biti smješten u odgovarajući obloženi digestor ili ćeliju za paljenje. Izvor napajanja priključi se na vanjske stezaljke mehanizma za paljenje i pusti se struja jačine 10 A. Vrijeme između početka miješanja i uključivanja napajanja ne bi smjelo biti duže od 10 minuta.
Signal koji proizvodi pretvornik tlaka bilježi se u odgovarajućem sustavu koji omogućuje i procjenu i trajnu evidenciju kretanja tlaka u vremenu (npr. zapisivač prijenosa spojen na uređaj za ispisivanje krivulje). Mješavina se zagrijava sve dok se rasprskavajuća ploča ne rasprsne ili do isteka najmanje 60 s. Ako se rasprskavajuća ploča ne rasprsne, mješavinu treba ostaviti da se ohladi prije nego se uređaj oprezno rastavi, uz mjere opreza i vodeći računa o eventualnoj pojavi tlaka. S ispitivanom tvari i jednom ili više referentnih tvari provodi se pet pokusa. Bilježi se vrijeme koje je potrebno da tlak poraste od 690 kPa do 2 070 kPa iznad atmosferskog. Izračunava se srednje vrijeme porasta tlaka.
U nekim slučajevima, tvari mogu proizvesti porast tlaka (prevelik ili premali) uslijed kemijskih reakcija koje nisu karakteristične za oksidativna svojstva tvari. U takvim slučajevima možda će trebati ponoviti ispitivanje s inertnom tvari, npr. dijatomejskom zemljom, umjesto celuloze kako bi se razjasnila priroda reakcije.
2. PODACI
Vremena porasta tlaka i kod ispitivane tvari i kod jedne ili više referentnih tvari. Vremena porasta tlaka za ispitivanja s inertnim tvarima, ako su provedena.
2.1. OBRADA REZULTATA
Izračunavaju se srednja vremena porasta tlaka i za ispitivanu tvar i za jednu ili više referentnih tvari.
Izračunava se srednje vrijeme porasta tlaka za ispitivanja s inertnim tvarima (ako su provedena).
Neki primjeri rezultata prikazani su u tablici 1.
Tablica 1.
Primjeri rezultata (18)
|
Tvar (19) |
Srednje vrijeme porasta tlaka za mješavinu celuloze 1:1 (ms) |
|
Amonijev dikromat, zasićena vodena otopina |
20 800 |
|
Kalcijev nitrat, zasićena vodena otopina |
6 700 |
|
Željezov nitrat, zasićena vodena otopina |
4 133 |
|
Litijev perklorat, zasićena vodena otopina |
1 686 |
|
Magnezijev perklorat, zasićena vodena otopina |
777 |
|
Niklov nitrat, zasićena vodena otopina |
6 250 |
|
Nitratna kiselina, 65 % |
4 767 (20) |
|
Perklorna kiselina, 50 % |
121 (20) |
|
Perklorna kiselina, 55 % |
59 |
|
Kalijev nitrat, 30 % vodena otopina |
26 690 |
|
Srebrov nitrat, zasićena vodena otopina |
|
|
Natrijev klorat, 40 % vodena otopina |
2 555 (20) |
|
Kalijev nitrat, 45 % vodena otopina |
4 133 |
|
Inertna tvar |
|
|
Voda, celuloza |
3. IZVJEŠĆE
3.1. IZVJEŠĆE O ISPITIVANJU
U izvješću o ispitivanju treba, ako je moguće, navesti sljedeće informacije:
|
— |
identitet, sastav, čistoća itd. ispitivane tvari, |
|
— |
koncentracija ispitivane tvari, |
|
— |
primijenjeni postupak sušenja celuloze, |
|
— |
sadržaj vode u celulozi koja je korištena, |
|
— |
rezultati mjerenja, |
|
— |
rezultati ispitivanja s inertnom tvari, ako su provedena, |
|
— |
izračunana srednja vremena porasta tlaka, |
|
— |
eventualna odstupanja od ove metode i razloge za njih, |
|
— |
sve dodatne napomene relevantne za tumačenje rezultata. |
3.2. TUMAČENJE REZULTATA (22)
Rezultati ispitivanja procjenjuju se na temelju:
|
(a) |
činjenice je li se mješavina ispitivane tvari i celuloze spontano zapalila; i |
|
(b) |
uspoređivanja srednjeg vremena koje je potrebno da tlak poraste s 690 kPa na 2 070 kPa i srednjeg vremena jedne ili više referentnih tvari. |
Tekuća tvar smatra se oksidansom ako:
|
(a) |
se mješavina u omjeru 1:1 težinskog udjela tvari i celuloze spontano zapali; ili |
|
(b) |
mješavina tvari i celuloze u omjeru 1:1 masenog udjela tvari i celuloze pokazuje srednje vrijeme porasta temperature koje je manje od ili jednako srednjem vremenu porasta temperature mješavine 1:1 masenog udjela 65 % (m/m) vodene nitratne kiseline i celuloze. |
Kako bi se izbjegli lažni pozitivni rezultati, prilikom tumačenja rezultata po potrebi isto tako treba uzeti u obzir rezultate dobivene kod ispitivanja tvari s inertnim materijalom.
4. REFERENCE
|
(1) |
Recommandations on the Transport of Dangerous Goods, Manual of Tests and Criteria. 3rd revised edition. UN Publication No: ST/SG/AC.10/11/Rev. 3, 1999, str. 342. Test O.2: Test for oxidising liquids. |
Slika 1
Tlačna posuda

Slika 2.
Nosivi stalak
Slika 3.
Sustav paljenja
Napomena: može se koristiti bilo koja od ovih konfiguracija.
(1) Ovisno o tipu instrumenta i stupnju čistoće tvari
(2) Ovisno o tipu instrumenta i stupnju čistoće tvari
(3) Ovisno o tipu instrumenta i stupnju čistoće tvari
(4) Ovisno o tipu instrumenta i stupnju čistoće tvari
(5) Ova točnost vrijedi samo za jednostavan uređaj kakav je, primjerice, opisan u normi ASTM D 1120-72; može se povećati složenijim uređajima s ebuliometrom.
(6) Važi samo za čiste tvari. Uporabu u drugim slučajevima treba posebno opravdati.
(7) U zavisnosti od stupnja čistoće.
(8) Ove se metode mogu koristiti i u području od 1 do 10 Pa, uz potreban oprez.
(9) Primjerice, u okviru UN-ovih propisa o prijevozu.
(10) Kiselinu prije ispitivanja treba podvrći titranju kako bi se potvrdila njezina koncentracija.
(11) Npr.: u referenci 1. rabi se 50 % (m/m) perklorna kiselina i 40 % (m/m) natrijev klorat.
(12) Npr. celuloza u prahu Whatman za kromatografiju na koloni CF 11, kataloški broj 4021 050.
(13) Potvrđeno, npr. Karl-Fisherovom titracijom.
(14) Alternativno, taj sadržaj vode može se postići i npr. grijanjem na 105 °C pod vakuumom tijekom 24 sata.
(15) Mješavine oksidansa s celulozom treba tretirati kao potencijalno eksplozivne i njima rukovati s dužnom pažnjom.
(16) U praksi se to postiže miješanjem mješavine 1:1 tekućine koja se ispituje i celuloze u količini većoj od potrebne za pokus i prijenos 5 ± 0,1 g do tlačne posude. Mješavinu treba pripremiti svježu za svaki pokus.
(17) Posebno, treba izbjegavati dodir između susjednih okretaja svitka.
(18) Vidjeti referencu (1) za klasifikaciju prema UN-ovom sustavu prijevoza.
(19) Zasićene otopine treba pripremati na 20 °C.
(20) Srednja vrijednost iz međulaboratorijskih usporednih pokusa.
(21) Maksimalni tlak od 2 070 kPa nije dostignut.
(22) Vidjeti referencu 1. za tumačenje rezultata prema UN-ovim propisima za prijevoz u kojima se primjenjuje nekoliko referentnih tvari.
DIO B: METODE UTVRĐIVANJA TOKSIČNOSTI I DRUGIH UČINAKA NA ZDRAVLJE
SADRŽAJ
OPĆI UVOD
|
B.1. bis. |
AKUTNA ORALNA TOKSIČNOST – METODA S FIKSNOM DOZOM |
|
B.1. tris. |
AKUTNA ORALNA TOKSIČNOST – METODA UTVRĐIVANJA KLASA AKUTNE TOKSIČNOSTI |
|
B.2. |
AKUTNA TOKSIČNOST (INHALACIJSKA) |
|
B.3. |
AKUTNA TOKSIČNOST (DERMALNA) |
|
B.4. |
AKUTNA TOKSIČNOST: NADRAŽIVANJE/NAGRIZANJE KOŽE |
|
B.5. |
AKUTNA TOKSIČNOST: NADRAŽIVANJE/NAGRIZANJE OČIJU |
|
B.6. |
SENZIBILIZACIJA KOŽE |
|
B.7. |
TOKSIČNOST (ORALNA) PRI PONOVLJENOJ DOZI (28 DANA) |
|
B.8. |
TOKSIČNOST (INHALACIJSKA) PRI PONAVLJANOJ DOZI (28 DANA) |
|
B.9. |
TOKSIČNOST (DERMALNA) PRI PONAVLJANOJ DOZI (28 DANA) |
|
B.10. |
MUTAGENOST – IN VITRO TEST ZA DOKAZIVANJE KROMOSOMSKIH ABERACIJA KOD SISAVACA |
|
B.11. |
MUTAGENOST – IN VIVO TEST ZA DOKAZIVANJE KROMOSOMSKIH ABERACIJA KOŠTANE SRŽI SISAVACA |
|
B.12. |
IN VIVO MIKRONUKLEUS TEST NA ERITROCITIMA SISAVACA |
|
B.13./14. |
MUTAGENOST: TEST ZA DETEKCIJU POVRATNIH MUTACIJA POMOĆU BAKTERIJA |
|
B.15. |
ISPITIVANJE MUTAGENOSTI I PROBIRNI TEST NA GENSKE MUTACIJE KOJE UKAZUJU NA KARCINOGENOST– SACCHAROMYCES CEREVISIAE |
|
B.16. |
MITOTSKA REKOMBINACIJA – SACCHAROMYCES CEREVISIAE |
|
B.17. |
IN VITRO TEST GENSKIH MUTACIJA STANICA SISAVACA |
|
B.18. |
OŠTEĆENJE I POPRAVAK – NEPLANIRANA SINTEZA DNK – STANICE SISAVACA IN VITRO |
|
B.19. |
IN VITRO ANALIZA IZMJENE SESTRINSKIH KROMATIDA |
|
B.20. |
TEST SPOLNO UVJETOVANE RECESIVNE SMRTNOSTI KOD VINSKE MUŠICE DROSOPHILA MELANOGASTER |
|
B.21. |
IN VITRO TESTOVI TRANSFORMACIJA STANICA SISAVACA |
|
B.22. |
ISPITIVANJE UČINAKA DOMINANTNIH LETALNIH GENA NA GLODAVCIMA |
|
B.23. |
TEST KROMOSOMSKIH ABERACIJA U SPERMATOGONIJIMA SISAVACA |
|
B.24. |
TEST POJAVE MRLJA U MIŠA |
|
B.25. |
NASLJEDNA TRANSLOKACIJA U MIŠEVA |
|
B.26. |
TEST SUBKRONIČNE ORALNE TOKSIČNOSTI NA GLODAVCIMA – 90-DNEVNA STUDIJA ORALNE TOKSIČNOSTI UZ PRIMJENU PONAVLJANIH DOZA |
|
B.27. |
TEST SUBKRONIČNE ORALNE TOKSIČNOSTI – 90-DNEVNO ISPITIVANJE ORALNE TOKSIČNOSTI NA NEGLODAVCIMA UZ PRIMJENU PONAVLJANIH DOZA |
|
B.28. |
TEST SUBKRONIČNE DERMALNE TOKSIČNOSTI – 90-DNEVNO ISPITIVANJE DERMALNE TOKSIČNOSTI NA GLODAVCIMA UZ PRIMJENU PONAVLJANIH DOZA |
|
B.29. |
STUDIJA SUBKRONIČNE INHALACIJSKE TOKSIČNOSTI – 90-DNEVNA STUDIJA INHALACIJSKE TOKSIČNOSTI UZ PRIMJENU PONAVLJANIH DOZA NA GLODAVCIMA |
|
B.30. |
TEST KRONIČNE TOKSIČNOSTI |
|
B.31. |
STUDIJA PRENATALNE RAZVOJNE TOKSIČNOSTI |
|
B.32. |
TEST KARCINOGENOSTI |
|
B.33. |
KOMBINIRANI TEST KRONIČNE TOKSIČNOSTI/KARCINOGENOSTI |
|
B.34. |
TEST REPRODUKTIVNE TOKSIČNOSTI NA JEDNOJ GENERACIJI |
|
B.35. |
STUDIJA REPRODUKTIVNE TOKSIČNOSTI NA DVIJE GENERACIJE |
|
B.36. |
TOKSIKOKINETIKA |
|
B.37. |
ODGOĐENA NEUROTOKSIČNOST ORGANOFOSPORNIH TVARI NAKON AKUTNOG IZLAGANJA |
|
B.38. |
STUDIJA ODGOĐENE NEUROTOKSIČNOSTI ORGANOFOSPORNIH TVARI – PONAVLJANO DOZIRANJE TIJEKOM 28 DANA |
|
B.39. |
TEST NEPLANIRANE SINTEZE DNK (UDS) NA STANICAMA JETRE SISAVACA IN VIVO |
|
B.40. |
NAGRIZANJE KOŽE IN VITRO: TEST TRANSKUTANOG ELEKTRIČNOG OTPORA (TER) |
|
B.40.BIS |
NAGRIZANJE KOŽE IN VITRO: TEST NA MODELU LJUDSKE KOŽE |
|
B.41. |
TEST FOTOTOKSIČNOSTI IN VITRO 3T3 NRU |
|
B.42. |
SENZIBILIZACIJA KOŽE: LOKALNA STIMULACIJA LIMFNIH ČVOROVA |
|
B.43. |
STUDIJA NEUROTOKSIČNOSTI KOD GLODAVACA |
|
B.44. |
APSORPCIJA PUTEM KOŽE: METODA IN VIVO |
|
B.45. |
APSORPCIJA PUTEM KOŽE: METODA IN VITRO |
OPĆI UVOD
A. KARAKTERIZACIJA ISPITIVANE TVARI
Prije početka bilo kakve studije toksičnosti treba biti poznat sastav ispitivane tvari, uključujući glavne nečistoće, te njezina relevantna fizikalno-kemijska svojstva koja uključuju i stabilnost.
Fizikalno-kemijska svojstva ispitivane tvari osiguravaju važne informacije za odabir puta primjene, planiranje studije, te rukovanje ispitivanim tvarima i njihovo pohranjivanje.
Početku studije mora prethoditi razvijanje analitičke metode za kvalitativno i kvantitativno određivanje ispitivane tvari (uključujući glavne nečistoće kada je moguće) u sredstvu za doziranje i biološkom materijalu.
Izvješće o ispitivanju treba sadržavati sve informacije vezane uz identifikaciju, fizikalno-kemijska svojstva, čistoću i ponašanje ispitivane tvari.
B. ZAŠTITA ŽIVOTINJA
Kod ispitivanja toksičnosti bitna je stroga kontrola okolišnih uvjeta i pravilne metode zaštite životinja.
i. Smještajni uvjeti
Okolišni uvjeti u prostorijama i ograđenim prostorima za držanje pokusnih životinja moraju odgovarati vrsti kojoj one pripadaju. Za štakore, miševe i zamorce odgovarajući su uvjeti sobna temperatura od 22 °C ± 3 °C uz relativnu vlažnost zraka od 30 do 70 %; za kuniće temperatura treba biti 20 °C ± 3 °C uz relativnu vlažnost zraka od 30 do 70 %.
Neke pokusne tehnike posebno su osjetljive na djelovanje temperature i u takvim su slučajevima pojedinosti o odgovarajućim uvjetima uključeni u opis ispitne metode. Pri svim istraživanjima toksičkih učinaka temperaturu i vlažnost zraka treba pratiti, bilježiti i uključiti u završno izvješće o studiji.
Osvjetljenje treba biti umjetno i mora se u slijedu izmjenjivati 12 sati svjetla i 12 sati mraka. Pojedinosti o svjetlosnom režimu treba zabilježiti i uključiti u završno izvješće o studiji.
Ako u metodi nije predviđeno drugačije, životinje mogu biti smještene pojedinačno ili se u kavezima mogu držati u malim skupinama istog spola; u slučaju skupnog smještaja, u jedan kavez ne smije se staviti više od pet životinja.
U izvješćima o pokusima na životinjama važno je navesti tip kaveza i broj životinja smještenih u svakom kavezu za vrijeme izloženosti kemikaliji, kao i tijekom opažanja koje slijedi nakon toga.
ii. Prehrambeni uvjeti
Prehrana treba zadovoljavati sve nutritivne zahtjeve životinjske vrste koja se koristi u ispitivanju. Kad se ispitivane tvari životinjama daju u hrani, nutritivna se vrijednost može sniziti međusobnim djelovanjem ispitivane tvari i nekog prehrambenog sastojka. Pri tumačenju rezultata ispitivanja treba uzeti u obzir mogućnost takve reakcije. Može se primjenjivati standardna hrana za laboratorijske životinje uz neograničene količine vode za piće. Kad se ispitivana tvar primjenjuje ovom metodom, na izbor hrane može utjecati potreba da se u toj hrani osigura odgovarajuća primjesa ispitivane tvari.
Prehrambeni kontaminanti za koje se zna da utječu na toksičnost ne smiju biti prisutni u koncentracijama u kojima bi utjecali na rezultate.
C. ALTERNATIVNA ISPITIVANJA
Europska unija obvezala se promicati razvoj i validaciju alternativnih tehnika koje mogu osigurati jednaku razinu informacija kao i testovi koji se sada obavljaju na životinjama, ali se pri njihovoj primjeni koristi manji broj životinja, uzrokuje manje patnje ili se u potpunosti izbjegava korištenje životinja.
Kad takve metode postanu dostupne, kad god je moguće mora se razmotriti mogućnost njihove primjene pri karakterizaciji opasnosti na kojoj se temelji klasifikacija kemikalija, označivanje kemikalija s obzirom na intrinzičke opasnosti te procjena njihove sigurnosti.
D. OCJENA I TUMAČENJE REZULTATA
Kod ocjenjivanja i tumačenja rezultata ispitivanja obvezno treba uzeti u obzir granice do kojih se rezultati studija na životinjama i studija in vitro mogu izravno ekstrapolirati na čovjeka, pa se prema tome dokazi o štetnom djelovanju na ljude, kada su dostupni, mogu upotrijebiti za potvrdu rezultata ispitivanja.
E. REFERENTNA LITERATURA
Većina navedenih metoda razvijena je u okviru programa OECD-a za Smjernice za ispitivanja i treba ih primjenjivati u skladu s načelima dobre laboratorijske prakse, kako bi se osiguralo što je moguće šire „međusobno prihvaćanje podataka”.
Dodatne informacije mogu se naći u referencama navedenim u OECD-ovim smjernicama i drugdje objavljenoj relevantnoj literaturi.
B.1 bis. AKUTNA ORALNA TOKSIČNOST – METODA S FIKSNOM DOZOM
1. METODA
Ova je metoda istovjetna metodi OECD TG 420 (2001.)
1.1. UVOD
Kod tradicionalnih metoda za ocjenjivanje akutne toksičnosti, smrt životinje predstavlja krajnji toksički učinak. 1984. Britansko toksikološko društvo predložilo je novi pristup ispitivanju akutne toksičnosti koji se temelji na primjeni niza fiksnih doza (1). Ovaj pristup nije uključivao smrt životinje kao krajnju točku toksičkog učinka već se umjesto toga temeljio na jasnim znakovima toksičnosti kod primjene jedne od niza fiksnih doza. Nakon britanskih (2) i međunarodnih (3) validacijskih studija in vivo, postupak je 1992. prihvaćen kao ispitna metoda. Kasnije su vrednovana statistička svojstva postupka s fiksnim dozama pomoću matematičkih modela upotrijebljenih u nizu studija (4)(5)(6). I modelske studije i studije in vivo pokazale su da je postupak ponovljiv, da je za njegovu primjenu potreban manji broj životinja, da uzrokuje manje trpljenja nego tradicionalne metode, te da omogućuje rangiranje tvari na sličan način kao i druge razvijene metode za ispitivanje akutne toksičnosti.
Upute za odabir najprikladnije ispitne metode za određenu namjenu mogu se naći u Smjernicama za ispitivanje akutne oralne toksičnosti (7). Ovaj dokument isto tako sadrži dodatne informacije o primjeni i tumačenju ispitne metode B.1bis.
Načelo ove metode je da se u glavnoj studiji koriste samo blago toksične doze, a da se izbjegava primjena doza za koje se pretpostavlja da bi mogle biti smrtonosne. Isto tako ne treba primjenjivati doze koje uzrokuju znatnu bol ili stres kod životinja zbog nagrizajućeg ili jakog nadražujućeg djelovanja. Životinje koje su na umoru ili životinje koje očito trpe intenzivnu bol ili pokazuju znakove jakog i dugotrajnog stresa humano se usmrćuju, a pri tumačenju rezultata ispitivanja tretiraju se jednako kao i životinje koje su uginule tijekom ispitivanja. Kriteriji za donošenje odluke o usmrćivanju životinja koje su na umoru ili jako trpe i smjernice za prepoznavanje simptoma predvidive ili neminovne smrti navedeni su u zasebnom dokumentu (8).
Ova metoda osigurava podatke o opasnim svojstvima i omogućuje rangiranje i klasifikaciju tvari prema Globalno usklađenom sustavu (GHS) za klasifikaciju kemikalija koje uzrokuju akutnu toksičnost (9).
Prije početka studije ispitni laboratorij treba razmotriti sve raspoložive podatke o ispitivanoj tvari. Ti podaci uključuju identitet i kemijsku strukturu tvari; njezina fizikalno-kemijska svojstva; rezultate drugih toksikoloških ispitivanja in vitro ili in vivo obavljenih na toj tvari; toksikološke podatke o tvarima koje su joj srodne po strukturi; kao i predviđenu primjenu tvari. Ovi su podaci neophodni kako bi se svim zainteresiranim stranama dokazalo da je ispitivanje važno za zaštitu ljudskog zdravlja, te će pomoći u odabiru odgovarajuće početne doze.
1.2. DEFINICIJE
Akutna oralna toksičnost: odnosi se na štetne učinke koji se javljaju nakon primjene jedne doze ispitivane tvari ili nakon nekoliko doza danih unutar 24 sata.
Odgođena smrt: znači da unutar 48 sati životinja ne ugine niti pokazuje znakove umiranja, već ugine kasnije tijekom 14-dnevnog razdoblja opažanja.
Doza: količina ispitivane tvari koja se primjenjuje. Doza se izražava kao masa ispitivane tvari po jedinici mase pokusne životinje (mg/kg).
Evidentna toksičnost: opći naziv koji opisuje jasne znakove toksičnosti nakon primjene ispitivane tvari (vidjeti (3) za primjere) koji su takvi da se kod sljedeće više fiksne doze kod većine životinja može očekivati ili jaka bol i trajni znaci jakog stresa, stanje umiranja (kriteriji su prikazani u Smjernicama za humano usmrćivanje (8)), ili vjerojatna smrt.
GHS: Globalno usklađeni sustav klasifikacije kemijskih tvari i mješavina. Zajednički projekt OECD-a (ljudsko zdravlje i okoliš), UN-ovog Odbora stručnjaka za prijevoz opasnih tereta (fizikalno-kemijska svojstva), te ILO-a (obavještavanje o opasnostima), koordiniran Međuorganizacijskim programom za pravilno rukovanje kemikalijama (IOMC).
Neminovna smrt: kad se stanje umiranja ili smrt životinje očekuje prije idućeg planiranog vremena opažanja. Simptomi koji ukazuju na ovo stanje kod glodavaca uključuju grčeve, bočni položaj, ležanje i drhtavicu. (Za više pojedinosti vidjeti Smjernice za humano usmrćivanje (8)).
LD50 (srednja smrtonosna doza): statistički određena jednokratna doza tvari za koju se očekuje da će kod 50 posto životinja izazvati smrt ako se primjeni oralnim putem. Vrijednost LD50 izražava se kao masa ispitivane tvari po jedinici mase pokusne životinje (mg/kg).
Granična doza: odnosi se na gornju graničnu dozu koja se primjenjuje u ispitivanju (2 000 ili 5 000 mg/kg).
Stanje umiranja: kad je životinja na umoru, odnosno kad ne bi mogla preživjeti čak ni da se liječi. (Za više pojedinosti vidjeti Smjernice za humano usmrćivanje (8)).
Predvidiva smrt: prisutnost kliničkih znakova koji pokazuju da će smrt nastupiti u znanom budućem vremenu prije planiranog kraja pokusa, na primjer: nesposobnnost životinje da dosegne vodu ili hranu. (Za više pojedinosti vidjeti Smjernice za humano usmrćivanje (8)).
1.3. NAČELO ISPITNE METODE
Na skupine životinja istog spola postupno se primjenjuju fiksne doze od 5, 50, 300 i 2 000 mg/kg (iznimno može doći u obzir i primjena dodatne fiksne doze od 5 000 mg/kg, vidjeti odjeljak 1.6.2). Početna doza odabire se na temelju prethodnih opažanja kao doza za koju se očekuje da će uzrokovati pojavu nekih znakova toksičnosti, ali neće izazvati jaki toksički učinak ili smrtnost. Klinički znakovi i stanja uz koja je vezana izrazita bol, trpljenje i neminovna smrt životinje detaljno su opisani u posebnim Smjernicama OECD-a (8). Na sljedeće skupine životinja mogu se primjenjivati više ili niže fiksne doze, ovisno o prisutnosti ili odsutnosti znakova toksičnsti ili smrtnosti. Ovaj se postupak nastavlja sve dok se ne utvrdi doza koja uzrokuje evidentnu toksičnost ili najviše jednu smrt, odnosno dok se ne utvrdi da nakon primjene najviše doze nema vidljivih toksičkih učinaka, ili pak da najniža doza uzrokuje smrt.
1.4. OPIS ISPITNE METODE
1.4.1. Odabir životinjske vrste
Najčešće korištena vrsta glodavaca je štakor, iako se mogu koristiti i neke druge vrste. Uobičajeno je koristiti ženke (7). Razlog je tome što je pretraživanjem literature o uobičajenim testovima u kojima se primjenjuje LD50 utvrđeno da razlike u osjetljivosti spolova gotovo da i nema, ali u slučajevima gdje su razlike opažene, ženke općenito pokazuju nešto veću osjetljivost (10). Međutim, ako saznanja o toksikološkim ili toksikokinetičkim svojstvima strukturno srodnih kemikalija ukazuju na to da bi osjetljiviji mogli biti mužjaci, treba koristiti mužjake. Ako se ispitivanja provode na mužjacima, potrebno je navesti razloge za to.
U ispitivanjima treba koristiti zdrave mlade odrasle primjerke životinja koje pripadaju najčešće korištenim sojevima laboratorijskih životinja. Treba koristiti ženke koje nisu imale potomstvo i nisu gravidne. Na početku primjene doze svaka životinja treba biti između 8 i 12 tjedana starosti, a njezina masa treba biti u okviru ± 20 % srednje mase životinja kojima je tvar bila dozirana u prijašnjim ispitivanjima.
1.4.2. Uvjeti držanja i hranjenja životinja
Temperatura prostorije za držanje pokusnih životinja treba biti 22 °C (± 3 °C). Iako relativna vlažnost zraka treba biti najmanje 30 % i po mogućnosti ne više 70 %, osim za vrijeme čišćenja prostorije, treba je nastojati održavati na 50-60 %. Osvjetljenje treba biti umjetno i mora se u slijedu izmjenjivati 12 sati svjetla i 12 sati mraka. Što se tiče hranjenja, može se primjenjivati standardna hrana za laboratorijske životinje uz neograničene količine pitke vode. Životinje se mogu u kavezima držati skupno, razvrstane prema dozama, s tim da broj životinja koje se drže u jednom kavezu ne smije ometati nesmetano opažanje svake životinje.
1.4.3. Priprema životinja
Životinje se odabiru nasumce, označavaju se kako bi se mogle pojedinačno razlikovati i drže u kavezima barem 5 dana prije početka primjene doza kako bi se prilagodile laboratorijskim uvjetima.
1.4.4. Priprema doza
Općenito, ispitivane tvari treba primjenjivati u rasponu doza jednakog volumena, a mijenjati treba koncentraciju pripravka koji se dozira. Međutim, pri ispitivanju nekog tekućeg krajnjeg proizvoda ili mješavine, za kasniju ocjenu opasnosti ispitivane tvari može biti relevantnija primjena te tvari u nerazrijeđenom obliku, tj. pri stalnoj koncentraciji, što neka regulatorna tijela postavljaju kao zahtjev. U svakom slučaju ne smije se prekoračiti maksimalni volumen doze određene za primjenu. Maksimalni volumen tekućine koji se smije odjednom primijeniti ovisi o veličini pokusne životinje. Kod glodavaca, taj volumen obično ne smije biti veći od 1ml/100 g mase životinje: međutim, u slučaju primjene vodenih otopina može doći u obzir i doza od 2 ml/100 g mase životinje. Što se tiče formulacije pripravka koji se dozira, gdje god je moguće preporuča se upotreba vodene otopine/suspenzije/emulzije, a tek onda, po prioritetnom redoslijedu, uljne otopine/suspenzije/emulzije (npr. kukuruzno ulje) ili otopine za koje se koriste drugi nosači. Za sve nosače, osim vode, moraju biti poznata njihova toksikološka svojstva. Doze se moraju pripremati neposredno prije primjene, osim ako se radi o pripravku za koji se zna da će tijekom upotrebe zadržati prihvatljivu stabilnost.
1.5. POSTUPAK
1.5.1. Primjena doza
Ispitivana se tvar primjenjuje u jednoj dozi oralnom intubacijom pomoću želučane sonde ili odgovarajuće intubacijske kanile. U izvanrednim okolnostima, kada jednokratna primjena doze nije moguća, jedna se doza može dati i u nekoliko manjih dijelova tijekom vremenskog razdoblja ne dužeg od 24 sata.
Prije primjene doza životinje trebaju postiti (npr. u slučaju štakora, hranu, ali ne i vodu treba uskratiti preko noći; kod miševa, hranu, ali ne i vodu treba uskratiti na 3-4 sata). Nakon posta životinje treba izvagati te primijeniti ispitivanu tvar. Nakon što se tvar primijeni, hrana se može uskratiti sljedeća 3-4 sata kad su u pitanju štakori ili 1-2 sata kad se radi o miševima. U slučajevima kad se doza primjenjuje u nekoliko manjih dijelova kroz određeno vremensko razdoblje, ovisno o dužini tog razdoblja, moguće je da će životinjama trebati dati hranu i vodu.
1.5.2. Inicijalna studija
Svrha inicijalne studije je odabiranje odgovarajuće početne doze za glavnu studiju. Ispitivana tvar se primjenjuje na pojedinačne životinje po redoslijedu prikazanom u dijagramu toka u Dodatku 1. Inicijalna studija završava kada je moguće odrediti početnu dozu (ili ako dođe do smrtnog ishoda već kod najniže fiksne doze).
Početna doza za inicijalnu studiju odabire se među fiksnim koncentracijama od 5, 50, 300 i 2 000 mg/kg kao doza za koju se očekuje da će izazvati evidentnu toksičnost na temelju dokaza koje, ako je moguće, treba temeljiti na podacima dobivenim ispitivanjima iste kemikalije ili strukturno srodnih kemikalija in vivo i in vitro. Ako takvih informacija nema, za početnu dozu uzima se koncentracija od 300 mg/kg.
Između doza koje se primjenjuju na pojedinačne životinje treba napraviti pauzu od najmanje 24 sata. Životinje treba opažati najmanje 14 dana.
Iznimno, i samo u slučajevima kad je to opravdavano posebnim regulatornim potrebama, može se razmotriti primjena dodatne, više fiksne doze od 5 000 mg/kg (vidjeti Dodatak 3). Zbog brige o dobrobiti životinja, ispitivanje na životinjama u okviru GHS kategorije 5 (2 000-5 000 mg/kg) ne preporuča se i može doći u obzir samo u slučajevima kad postoji velika vjerojatnost da će rezultati takvog ispitivanja biti od neposrednog značaja za zaštitu ljudskog zdravlja, zdravlja životinja, ili za zaštitu okoliša.
U slučajevima kad u okviru inicijalne studije pokusna životinja ugine već kod primjene najniže fiksne doze (5 mg/kg), uobičajeni je postupak da se studija prekine, a ispitivana tvar svrsta u GHS kategoriju 1 (kako je prikazano u Dodatku 1). Međutim, ako je za ovakvu klasifikaciju potrebna dodatna potvrda, može se provesti još jedno dodatno neobvezno ispitivanje, na sljedeći način. Doza od 5 mg/kg primijeni se na još jednu životinju. Ako i ta druga životinja ugine, GHS kategorija 1 se potvrđuje i studija se odmah prekida. Ako druga životinja preživi, doza od 5 mg/kg primjenjuje se na još najviše tri životinje. Zbog visokog stupnja opasnosti od smrtnosti, doza se primjenjuje u slijedu na jednu po jednu životinju, radi zaštite njihove dobrobiti. Vremenski interval između davanja doze svakoj životinji treba biti dovoljno dug da se utvrdi vjerojatnost da će prethodna životinja preživjeti. Ako se dogodi i druga smrt, slijed davanja odmah se prekida i doza se više ne smije primijeniti niti na jednu životinju. Budući da pojava drugog smrtnog slučaja (bez obzira na broj životinja koje se testiraju u vrijeme prekida) spada pod ishod A (dvije ili više smrti) za fiksnu dozu od 5 mg/kg primjenjuje se pravilo klasifikacije iz Dodatka 2. (kategorija 1 u slučaju dviju ili više smrti ili kategorija 2 u slučaju najviše jedne smrti). Osim toga, u Dodatku 4. dane su smjernice za klasificiranje u sustavu EU-a dok se ne počne primjenjivati novi GHS.
1.5.3. Glavna studija
1.5.3.1. Broj životinja i visina doza
Na dijagramu toka u Dodatku 2. prikazano je kako nastaviti s ispitivanjem nakon primjene prve fiksne doze. Treba poduzeti jedan od tri koraka: prekinuti ispitivanje i ispitivanu tvar svrstati u odgovarajuću klasu opasnih tvari, nastaviti ispitivanje s višom fiksnom dozom, ili nastaviti ispitivanje s nižom fiksnom dozom. Međutim, radi zaštite životinja, doza koja je u inicijalnoj studiji uzrokovala smrt životinje u glavnoj se studiji neće primjenjivati (vidjeti Dodatak 2). Iskustvo pokazuje da će najvjerojatniji ishod ispitivanja s početnom dozom biti takav da će se tvar moći klasificirati i da daljnja ispitivanja neće biti potrebna.
Za svaku visinu doze koja se ispituje obično se koristi po pet životinja istog spola. Na tu skupinu od pet životinja, koju čini jedna životinja korištena u inicijalnoj studiji i još četiri životinje, primjenjuje se odabrana doza (osim u slučajevima kad neka doza koja se koristi u glavnoj studiji nije bila korištena u inicijalnoj studiji, što nije uobičajeno).
Vremenski interval između primjene doza različitih visina određuje se prema početku, trajanju i jačini znakova toksičnosti. Tretiranje životinja sljedećom dozom treba odgoditi dok se ne utvrdi sigurno preživljavanje svih životinja na koje je primijenjena prethodna doza. Preporuča se da između primjene dvije različite doze prođe tri ili četiri dana, prema potrebi, kako bi se mogli uočiti odgođeni simptomi toksičnosti. Taj se vremenski interval može prilagođavati prema potrebi, npr. u slučaju reakcije na temelju koje se ne može donijeti zaključak.
Kad se razmatra primjena gornje fiksne doze od 5 000 mg/kg, treba slijediti postupak opisan u Dodatku 3. (vidjeti također odjeljak 1.6.2.).
1.5.3.2. Granični test
Granični se test prvenstveno koristi u situacijama kad izvoditelj ispitivanja ima informacije koje kazuju da ispitivani materijal vjerojatno nije toksičan, tj. da postaje toksičan samo iznad regulatornih graničnih doza. Informacije o toksičnosti ispitivanog materijala mogu se temeljiti na saznanjima o sličnim ispitanim spojevima ili sličnim ispitanim mješavinama ili proizvodima, uzimajući u obzir identitet i postotak komponenata za koje se zna da su toksikološki značajne. U situacijama kad podataka o toksičnosti ima malo ili ih uopće nema, ili kad se očekuje da će ispitivani materijal biti toksičan, treba obaviti glavni test.
Kao granični test u okviru ovih smjernica primjenjuje se uobičajeni postupak, odnosno primjena početne doze za inicijalnu studiju od 2 000 mg/kg (ili, iznimno, 5 000 mg/kg) iza čega slijedi primjena jednako visoke doze na još četiri životinje.
1.6. OPAŽANJA
Nakon primjene doze životinje se pojedinačno opažaju barem jedanput tijekom prvih 30 minuta, povremeno tijekom prva 24 sata, uz posebnu pozornost tijekom prva 4 sata, a zatim jednom dnevno u trajanju od ukupno 14 dana, osim u slučajevima kada je životinju potrebno izlučiti iz studije i humano usmrtiti zbog njezine dobrobiti ili ako se utvrdi smrt životinje. Međutim, trajanje opažanja ne bi smjelo biti strogo određeno. Treba ga utvrditi na temelju toksičkih reakcija, početka i trajanja oporavka i prema potrebi ga se može produžiti. Važno je vrijeme pojave i nestajanja prvih znakova toksičnosti, posebno ako postoji tendencija da se znakovi toksičnosti pojave s odgodom (11). Svi rezultati opažanja sustavno se bilježe, pri čemu se za svaku životinju vodi posebna evidencija.
Dodatna opažanja bit će potrebna ako životinje nastave pokazivati znakove toksičnosti. Treba opažati promjene na koži i dlaci, očima i sluznicama, na dišnom i cirkulacijskom sustavu, te na autonomnom i centralnom živčanom sustavu, kao i promjene u somatomotoričkoj aktivnosti i obrascu ponašanja. S posebnom pozornošću treba opažati drhtavicu, grčeve, slinjenje, proljev, otupjelost, san i komu. Treba poštovati načela i kriterije navedene u Smjernicama za humano usmrćivanje (8). Životinje za koje se utvrdi da su u stanju umiranja i životinje koje pokazuju da trpe jake bolove ili dugotrajni stres treba humano usmrtiti. U slučajevima kad se životinja usmrćuje iz humanih razloga, ili se utvrdi njezina smrt, vrijeme smrti treba što točnije zabilježiti.
1.6.1. Tjelesna masa
Pojedinačnu masu životinja treba utvrditi neposredno prije primjene ispitivane tvari, a nakon tog najmanje jednom tjedno. Promjene u masi treba izračunati i zabilježiti. Na kraju ispitivanja preživjele se životinje izvažu i potom humano usmrte.
1.6.2. Patologija
Sve pokusne životinje (uključujući i one koje uginu za vrijeme ispitivanja ili ih se izluči iz studije zbog zaštite dobrobiti životinja) treba podvrgnuti obdukciji. Za svaku životinju treba zabilježiti sve veće patološke promjene. Treba razmotriti i mogućnost obavljanja mikroskopskog pregleda organa životinja koje su nakon primjene prve doze preživjele 24 ili više sati i na kojima su obdukcijom utvrđene velike patološke promjene, budući da se na taj način mogu prikupiti korisne informacije.
2. PODACI
Treba prikupiti podatke o svakoj pojedinačnoj životinji. Osim toga, sve podatke treba rezimirati u obliku tablice u kojoj će za svaku ispitnu skupinu biti naveden broj upotrijebljenih životinja, broj životinja koje su pokazale znakove toksičnosti, broj životinja kod kojih je tijekom ispitivanja utvrđena smrt ili su iz humanih razloga bile usmrćene, vrijeme smrti svake pojedinačne životinje, te opis i vremenski tijek toksičkih učinaka i reverzibilnosti, kao i nalazi obdukcije.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora sadržavati slijedeće informacije, prema potrebi:
|
|
ispitivana tvar:
|
|
|
Nosač (prema potrebi):
|
|
|
Pokusne životinje:
|
|
|
Uvjeti ispitivanja:
|
|
|
Rezultati:
|
|
|
Diskusija i tumačenje rezultata. |
|
|
Zaključci. |
4. REFERENCE:
|
(1) |
British Toxicology Society Working Party on Toxicity (1984) Special report: a new approach to the classification of substances and preparations on the basis of their acute toxicity. Human Toxicol., 3, str. 85-92. |
|
(2) |
Van den Heuvel, M.J., Dayan, A.D. and Shillaker, R.O (1987) Evaluation of the BTS approach to the testing of substances and preparations for their acute toxicity. Human Toxicol.‚ 6, str. 279-291. |
|
(3) |
Van den Heuvel, M.J., Clark, D.G., Fielder, R.J., Koundakjian, P.P., Oliver, G.J.A., Pelling, D., Tomlinson, N.J. and Walker, A.P (1990) The international validation of a fixed-dose procedure as an alternative to the classical LD50 test. Fd. Chem. Toxicol. 28, str. 469-482. |
|
(4) |
Whitehead, A. and Curnow, R.N (1992) Statistical evaluation of the fixed-dose procedure. Fd. Chem. Toxicol., 30, str. 313-324. |
|
(5) |
Stallard, N. and Whitehead, A (1995) Reducing numbers in the fixed-dose procedure. Human Exptl. Toxicol. 14, str. 315-323. |
|
(6) |
Stallard, N., Whitehead, A and Ridgeway, P. (2002) Statistical evaluation of the revised fixed dose procedure. Hum. Exp. Toxicol., 21, str. 183-196. |
|
(7) |
OECD (2001) Guidance Document on Acute Oral Toxicity Testing. Environmental Health and Safety Monograph Series on Testing and Assessment No 24. Paris |
|
(8) |
OECD (2000) Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Monograph Series on Testing and Assesment No 19. |
|
(9) |
OECD (1998) Harmonised Integrated Hazard Classification for Human Health and Environmental Effects of Chemical Substances as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals in November 1998, Part 2, str. 11 [http://webnet1.oecd.org/oecd/pages/ home/displaygeneral/0,3380, EN-documents-521-14-no-24-no-0,FF.html]. |
|
(10) |
Lipnick, R.L., Cotruvo, J.A., Hill, R.N., Bruce, R.D., Stitzel, K.A., Walker, A.P., Chu, I., Goddard, M., Segal, L., Springer, J.A. and Myers, R.C (1995) Comparison of the Up-and-Down, Conventional LD50, and Fixed-Dose Acute Toxicity Procedures. Fd. Chem. Toxicol. 33, str. 223-231. |
|
(11) |
Chan P.K and A. W Hayes (1994) Chapter 16 Acute Toxicity and Eye Irritation. In: Principles and Methods of Toxicology. 3rd Edition. A.W. Hayes, Editor. Raven Press Ltd. New York, USA. |
Dodatak 1.
DIJAGRAM TOKA ZA INICIJALNU STUDIJU

Dodatak 2
DIJAGRAM TOKA ZA GLAVNU STUDIJU

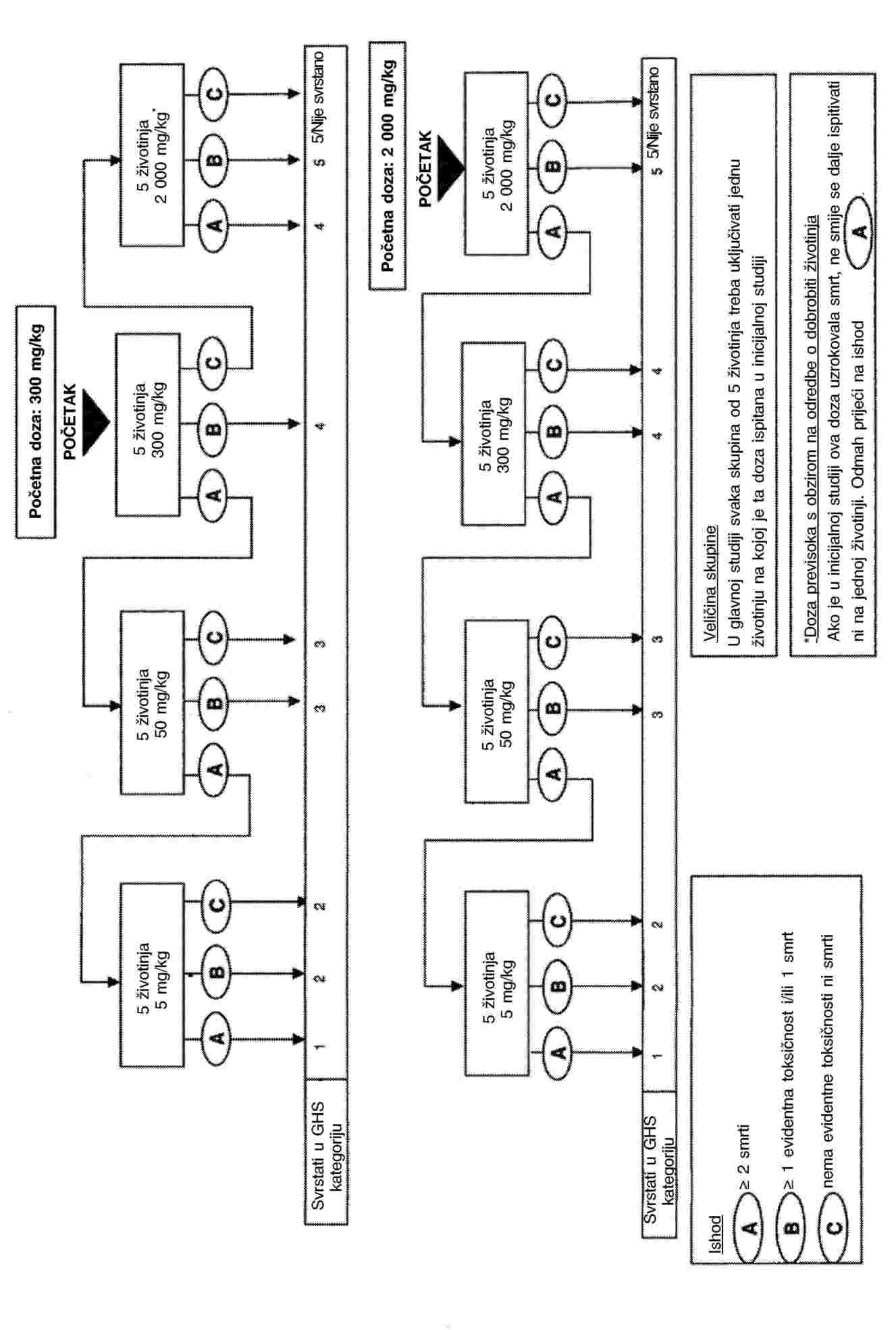
Dodatak 3.
KRITERIJI ZA KLASIFIKACIJU ISPITIVANIH TVARI ČIJA JE OČEKIVANA VRIJEDNOST LD50 VIŠA OD 2 000 MG/KG BEZ POTREBE ZA ISPITIVANJEM
Kriteriji za kategoriju opasnosti 5 omogućuju identifikaciju ispitivanih tvari relativno niske akutne toksičnosti koje, međutim, u određenim uvjetima mogu predstavljati opasnost za osjetljive populacije. Pretpostavlja se da ove tvari imaju oralnu ili dermalnu vrijednost LD50 u rasponu od 2 000-5 000 mg/kg ili ekvivalentne vrijednosti za druge puteve primjene. Ispitivane tvari mogu se svrstati u kategoriju opasnosti koju definira: 2 000 mg/kg < LD50 < 5 000 mg/kg (kategorija 5 u GHS-u) u sljedećim slučajevima:
|
(a) |
ako na ovu kategoriju upućuje bilo koja od ispitnih shema iz Dodatka 2., na temelju incidencije smrtnosti; |
|
(b) |
ako već postoje pouzdani dokazi koji pokazuju da je LD50 u okvirima vrijednosti koje odgovaraju kategoriji 5; ili ako druge toksikološke studije provedene na životinjama ili toksičko djelovanje na ljude izazivaju zabrinutost za ljudsko zdravlje; |
|
(c) |
ako ekstrapolacija, procjena ili prosudba podataka ne opravdavaju svrstavanje u višu klasu opasnosti; i
|
ISPITIVANJA UZ PRIMJENU DOZA IZNAD 2 000 MG/KG
Iznimno, i samo u slučajevima kad je to opravdano zbog posebnih regulatornih potreba, može se razmotriti mogućnost primjene dodatne, više fiksne doze od 5 000 mg/kg. Prepoznajući potrebu da se zaštiti dobrobit životinja, ispitivanje uz primjenu doze od 5 000 mg/kg ne preporuča se i može doći u obzir samo u slučajevima kad postoji velika vjerojatnost da će rezultati takvog ispitivanja biti od neposrednog značaja za zaštitu ljudskog zdravlja ili zdravlja životinja (9).
Inicijalna studija
Pravila prema kojima se primjenjuje sekvencijski postupak prikazan u Dodatku 1. proširuju se kako bi obuhvatila i dozu od 5 000 mg/kg. Prema tome, kad se u inicijalnoj studiji primjenjuje početna doza od 5 000 mg/kg, ishod A (smrt) nalaže ispitivanje još jedne životinje na dozu od 2 000 mg/kg; u slučaju ishoda B i C (očita toksičnost ili nema toksičnosti) dozvoljeno je kao početnu dozu u glavnoj studiji primijeniti dozu od 5 000 mg/kg. Isto tako, ako se primjenjuje početna doza različita od 5 000 mg/kg, u slučaju ishoda B ili C pri dozi od 2 000 mg/kg ispitivanje se nastavlja do 5 000 mg/kg; ishod A kod kasnije primijene doze od 5 000 mg/kg nalaže da početna doza u glavnoj studiji bude 2 000 mg/kg, ishod B ili C nalaže početnu dozu od 5 000 mg/kg u glavnoj studiji.
Glavna studija
Pravila prema kojima se primjenjuje sekvencijski postupak iz Dodatka 2., proširuju se kako bi obuhvatila i dozu od 5 000 mg/kg. Prema tome, kad se u glavnom pokusu koristi početna doza od 5 000 mg/kg, ishod A (≥ 2 smrti) nalaže ispitivanje još jedne skupine životinja na dozu od 2 000 mg/kg; u slučaju ishoda B (evidentna toksičnost i/ili ≤ 1 smrt) ili C (nema toksičnosti) tvar se ne klasificira prema GHS-u. Isto tako, ako se primjenjuje početna doza različita od 5 000 mg/kg, u slučaju ishoda C pri dozi od 2 000 mg/kg ispitivanje se nastavlja do 5 000 mg/kg; u slučaju ishoda A kod primijene doze od 5 000 mg/kg tvar se klasificira u GHS kategoriju 5, a u slučaju ishoda B ili C tvar se ne klasificira prema GHS-u.
Dodatak 4.
ISPITNA METODA B.1. bis
Smjernice za klasifikaciju prema shemi EU-a koju treba primjenjivati tijekom prijelaznog razdoblja do potpune provedbe Globalno usklađenog klasifikacijskog sustava (GHS) (uzeto iz referentnog dokumenta (8))


B.1 tris. AKUTNA ORALNA TOKSIČNOST – METODA UTVRĐIVANJA KLASA AKUTNE TOKSIČNOSTI
1. METODA
Ova je metoda istovjetna metodi OECD TG 423 (2001.)
1.1. UVOD
Metoda utvrđivanja klasa akutne oralne toksičnosti (1) prikazana u ovom ispitivanju fazni je postupak u kojemu se u svakoj fazi koriste po tri životinje istog spola. Za utvrđivanje toksičnosti ispitivane tvari u prosjeku mogu biti potrebne dvije do četiri faze, što ovisi o tome kad će kod životinje nastupiti smrt i/ili stanje umiranja. Ovaj je postupak ponovljiv, za njega se koristi vrlo mali broj životinja i omogućuje rangiranje tvari na sličan način kao i ostale metode ispitivanja akutne toksičnosti. Metoda utvrđivanja klasa akutne toksičnosti temelji se na biometrijskim procjenama (2)(3)(4)(5) s fiksnim dozama, koje su na primjeren način odvojene kako bi se omogućilo rangiranje tvari u svrhu klasifikacije i procjene opasnosti. Nakon usvajanja 1996. provedena je obimna validacija ove metode in vivo uz korištenje usporednih podataka o LD50 dobivenih iz literature, kako na nacionalnoj (6) tako i na međunarodnoj razini (7).
Upute za odabir najprimjerenije ispitne metode za određenu svrhu mogu se pronaći u Smjernicama za ispitivanje akutne oralne toksičnosti (Guidance Document on Acute Oral Toxicity Testing) (8). Taj dokument sadrži i dodatne informacije o provođenju i tumačenju rezultata ispitne metode B.1tris.
Ispitivane tvari ne treba primjenjivati u dozama za koje je poznato da uzrokuju znatnu bol i stres zbog nagrizajućeg i izrazito nadražujućeg djelovanja. Životinje koje su na umoru, odnosno životinje koje očito trpe jake bolove ili pokazuju znakove jakog i dugotrajnog stresa treba humano usmrtiti, a pri tumačenju rezultata ispitivanja tretirati jednako kao i životinje koje su uginule tijekom ispitivanja. Kriteriji za donošenje odluke o usmrćivanju životinja koje su na umoru ili jako trpe i upute o prepoznavanju predvidive ili neminovne smrti, predmet su zasebnog dokumenta sa smjernicama (9).
U metodi se koriste unaprijed određene doze, a rezultati omogućuju da se tvar rangira i klasificira prema Globalnom usklađenom sustavu za razvrstavanje kemikalija koje uzrokuju akutnu toksičnost (10).
U načelu ova metoda nije predviđena za točno izračunavanje LD50, ali ona omogućuje utvrđivanje definiranog raspona izloženosti kod kojega se očekuje smrtnost, budući da smrt određenog broja životinja još uvijek predstavlja glavnu završnu točku ovog ispitivanja. Metoda dozvoljava utvrđivanje vrijednosti LD50 samo u slučajevima kad najmanje dvije doze rezultiraju smrtnošću višom od 0 % i nižom od 100 %. Upotreba odabranih unaprijed utvrđenih doza, neovisno o ispitnoj tvari, uz klasifikaciju koja je izričito povezana s brojem životinja opažanih u različitim stanjima pruža laboratorijima bolje mogućnosti u pogledu ponovljivosti i dosljednosti pri izvještavanju.
Prije početka studije ispitni laboratorij mora razmotriti sve informacije o ispitivanoj tvari. Te informacije uključuju identitet i kemijsku strukturu tvari, njezina fizikalno-kemijska svojstva, rezultate bilo kojih drugih in vivo ili in vitro ispitivanja toksičnosti te tvari, toksikološke podatke o strukturno srodnim tvarima, kao i predviđenu primjenu tvari. Te su informacije neophodne kako bi se sve zainteresirane strane uvjerile da je predmetno ispitivanje relevantno za zaštitu ljudskog zdravlja i da će pomoći pri odabiru najprikladnije početne doze.
1.2. DEFINICIJE
Akutna oralna toksičnost: odnosi se na štetne učinke koji se javljaju nakon primjene prve doze ispitivane tvari ili nakon nekoliko doza danih unutar 24 sata.
Odgođena smrt: znači da životinja ne ugine niti se čini da je na umoru unutar 48 sati, već ugine kasnije tijekom 14-dnevnog razdoblja opažanja.
Doza: količina ispitivane tvari koja se primjenjuje. Doza se izražava kao masa ispitivane tvari po jedinici mase pokusne životinje (mg/kg).
GHS: Globalno usklađeni sustav klasifikacije kemijskih tvari i mješavina. Zajednički projekt OECD-a (ljudsko zdravlje i okoliš), UN-ovog Odbora stručnjaka za prijevoz opasnih tereta (fizikalno-kemijska svojstva), te ILO-a (obavještavanje o opasnostima), koordiniran Međuorganizacijskim programom za pravilno rukovanje kemikalijama (IOMC).
Neminovna smrt: kad se stanje umiranja ili smrt životinje očekuje prije idućeg planiranog vremena opažanja. Simptomi koji ukazuju na ovo stanje kod glodavaca uključuju grčeve, bočni položaj, ležanje i drhtavicu. (Za više pojedinosti vidjeti Smjernice za humano usmrćivanje (9)).
LD50 (srednja smrtonosna doza): statistički određena jednokratna doza tvari za koju se očekuje da će kod 50 posto životinja izazvati smrt ako se primjeni oralnim putem. Vrijednost LD50 izražava se kao masa ispitivane tvari po jedinici mase pokusne životinje (mg/kg).
Granična doza: odnosi se na gornju graničnu dozu koja se primjenjuje u ispitivanju (2 000 ili 5 000 mg/kg).
Stanje umiranja: kad je životinja na umoru, odnosno kad ne može preživjeti čak ni ako se tretira (Za više pojedinosti vidjeti Smjernice za humano usmrćivanje (9)).
Predvidiva smrt: prisutnost kliničkih znakova koji ukazuju na smrt koja će nastupiti u znanom budućem vremenu prije planiranog kraja pokusa, na primjer: nemogućnost životinje da dosegne vodu ili hranu. (Za više pojedinosti vidjeti Smjernice za humano usmrćivanje (9)).
1.3. NAČELO ISPITIVANJA
Načelo ovog ispitivanja je da se na temelju faznog postupka uz upotrebu minimalnog broja životinja u svakoj fazi dobije dovoljna količina informacija o akutnoj toksičnosti ispitivane tvari koja će omogućiti klasifikaciju te tvari. Tvar se oralno daje skupini pokusnih životinja u jednoj od utvrđenih doza. Tvar se ispituje uz primjenu faznog postupka kod kojega se u svakoj fazi koriste po tri životinje istog spola (obično ženke). Izostanak ili prisutnost smrtnosti životinja na koje je doza bila primijenjena u jednoj fazi odredit će sljedeću fazu, npr.:
|
— |
daljnje ispitivanje nije potrebno, |
|
— |
primjena jednake doze na sljedeće tri životinje, |
|
— |
primjena sljedeće više ili sljedeće niže doze na sljedeće tri životinje. |
Pojedinosti o ispitnom postupku navedene su u Dodatku 1. Ova metoda omogućuje procjenu u svrhu klasifikacije ispitivane tvari u jednu od klasa toksičnosti utvrđenih na temelju fiksne granične vrijednosti LD50.
1.4. OPIS METODE
1.4.1. Odabir životinjske vrste
Najprimjerenija vrsta glodavaca je štakor, iako se mogu koristiti i neke druge vrste glodavaca. Uobičajeno je koristiti ženke (9). Razlog je tome što je pretraživanjem literature o uobičajenim testovima u kojima se primjenjuje LD50 utvrđeno da razlike u osjetljivosti spolova gotovo da i nema, ali u slučajevima gdje su razlike opažene, ženke općenito pokazuju nešto veću osjetljivost (11). Međutim, ako saznanja o toksikološkim ili toksikokinetičkim svojstvima strukturno srodnih kemikalija ukazuju na to da bi osjetljiviji mogli biti mužjaci, treba koristiti mužjake. Ako se ispitivanja provode na mužjacima, treba navesti razloge za njihovo korištenje.
U ispitivanjima treba koristiti zdrave mlade odrasle primjerke životinja koje pripadaju najčešće korištenim sojevima laboratorijskih životinja. Treba koristiti ženke koje nisu imale potomstvo i nisu gravidne. Na početku primjene doza svaka životinja treba biti između 8 i 12 tjedana starosti, a njezina masa treba biti u okviru ± 20 % srednje mase svih prethodno testiranih životinja.
1.4.2. Uvjeti držanja i hranjenja životinja
Temperatura prostorije za držanje pokusnih životinja treba biti 22 °C (± 3 °C). Iako relativna vlažnost zraka treba biti barem 30 % i po mogućnosti ne prelaziti 70 %, osim za vrijeme čišćenja prostorije, treba je nastojati održavati na 50-60 %. Osvjetljenje treba biti umjetno i mora se u slijedu izmjenjivati 12 sati svjetla i 12 sati mraka. Što se tiče hranjenja, može se primjenjivati standardna hrana za laboratorijske životinje uz neograničene količine pitke vode. Životinje se mogu u kavezima držati skupno, razvrstane prema primijenjenim dozama, ali broj životinja koji se drži u jednom kavezu ne smije ometati nesmetano opažanje svake životinje.
1.4.3. Priprema životinja
Životinje se nasumce odabiru, označavaju, kako bi se mogle pojedinačno razlikovati, i drže u kavezima barem 5 dana prije početka primjene doza da bi se prilagodile laboratorijskim uvjetima.
1.4.4. Priprema doza
Općenito, ispitivane tvari treba primjenjivati u rasponu doza jednakog volumena, a mijenjati treba koncentraciju pripravka koji se dozira. Međutim, kada treba testirati neki tekući krajnji proizvod ili mješavinu, za kasniju ocjenu opasnosti ispitivane tvari relevantnija može biti primjena te tvari u nerazrijeđenom obliku, tj. pri stalnoj koncentraciji, a neka regulatorna tijela takvu primjenu postavljaju kao zahtjev. U svakom slučaju, kod primjene se ne smije prekoračiti maksimalni volumen doze. Maksimalni volumen tekućine koji se smije odjednom primijeniti ovisi o veličini pokusne životinje. Kod glodavaca, taj volumen obično ne smije biti veći od 1 ml/100 g mase životinje: međutim, u slučaju primjene vodenih otopina može doći u obzir i doza od 2 ml/100 g mase životinje. Što se tiče formulacije pripravka koji se dozira, gdje god je moguće preporuča se upotreba vodene otopine/suspenzije/emulzije, a tek onda, po prioritetnom redoslijedu, uljne otopine/suspenzije/emulzije (npr. kukuruzno ulje) ili otopine za koje se koriste drugi nosači. Za sve nosače, osim vode, moraju biti poznata njihova toksikološka svojstva. Doze se moraju pripremati neposredno prije primjene, osim ako se radi o pripravku za koji se zna da će tijekom upotrebe zadržati prihvatljivu stabilnost.
1.5. POSTUPAK
1.5.1. Primjena doza
Ispitivana se tvar primjenjuje u jednoj dozi oralnom intubacijom pomoću želučane sonde ili odgovarajuće intubacijske kanile. U izvanrednim okolnostima, kad jednokratna primjena doze nije moguća, jedna se doza može dati i razdijeljena u nekoliko manjih dijelova tijekom vremenskog razdoblja ne dužeg od 24 sata.
Prije primjene doza životinje trebaju postiti (npr. u slučaju štakora, hranu, ali ne i vodu treba uskratiti preko noći; kod miševa, hranu, ali ne i vodu treba uskratiti na 3-4 sata). Nakon posta životinje treba izvagati te primijeniti ispitivanu tvar. Nakon što se tvar primijeni, hrana se može uskratiti sljedeća 3-4 sata kod štakora ili 1-2 sata kod miševa. U slučajevima kad se doza primjenjuje u nekoliko manjih dijelova kroz određeno vremensko razdoblje, ovisno o dužini tog razdoblja možda će biti potrebno životinjama dati hranu i vodu.
1.5.2. Broj životinja i visina doza
U svakoj se fazi koriste po tri životinje. Doza koja će se koristiti kao početna doza odabire se između četiri fiksne doze od 5, 50, 300 i 2 000 mg/kg tjelesne mase. Početna doza treba biti ona za koju je najvjerojatnije da će prouzročiti smrtnost nekih od životinja na koje se primijeni. Dijagrami toka iz Dodatka 1. opisuju postupak koji treba provesti za svaku od početnih doza. Osim toga, u Dodatku 4. dane su smjernice za klasifikaciju u sustavu EU-a, dok se ne počne primjenjivati novi GHS.
Kad se iz raspoloživih informacija može zaključiti da smrtnost pri najvišoj početnoj dozi (2 000 mg/kg tjelesne mase) nije vjerojatna, treba obaviti granični test. Ako o tvari koju treba ispitati nema nikakvih informacija, radi dobrobiti životinja preporuča se primjena početne doze od 300 mg/kg tjelesne mase.
Vremenski interval između tretiranja dviju skupina ovisi o nastupu, trajanju i jačini znakova toksičnosti. Tretiranje životinja sljedećom dozom treba odgoditi dok nije sigurno preživljavanje životinja koje su primile prethodnu dozu.
Iznimno, i samo u slučajevima kad je to opravdavano posebnim regulatornim potrebama, može se razmotriti primjena dodatne, više fiksne doze od 5 000 mg/kg (vidjeti Dodatak 2). Zbog brige o dobrobiti životinja, ispitivanje na životinjama u okviru GHS kategorije 5 (2 000-5 000 mg/kg) ne preporuča se i može doći u obzir samo u slučajevima kad postoji velika vjerojatnost da će rezultati takvog ispitivanja biti od neposrednog značaja za zaštitu ljudskog zdravlja, zdravlja životinja, ili za zaštitu okoliša.
1.5.3. Granični test
Granični se test prvenstveno koristi u situacijama kad izvoditelj ispitivanja ima informacije koje kazuju da ispitivani materijal vjerojatno nije toksičan, tj. da postaje toksičan samo iznad regulatornih graničnih doza. Informacije o toksičnosti ispitivanog materijala mogu se temeljiti na saznanjima o sličnim ispitivanim spojevima ili sličnim ispitivanim mješavinama ili proizvodima, uzimajući u obzir identitet i postotak komponenata za koje se zna da su toksikološki značajne. U situacijama kad podataka o toksičnosti ima malo ili ih uopće nema, ili kada se očekuje da će ispitivani materijal biti toksičan, treba obaviti glavni test.
Granični test uz primjenu jedne doze od 2 000 mg/kg tjelesne mase može se obaviti na šest životinja (po tri životinje u svakoj fazi). Iznimno se može obaviti granični test uz primjenu jedne doze od 5 000 mg/kg na tri životinje (vidjeti Dodatak 2.). Ako ispitivana tvar uzrokuje smrt životinje, možda će biti potrebno daljnje ispitivanje sa sljedećom nižom dozom.
1.6. OPAŽANJA
Nakon primjene doze životinje se opažaju pojedinačno, barem jedanput tijekom prvih 30 minuta, periodično tijekom prva 24 sata, uz posebnu pozornost tijekom prva 4 sata, a zatim jednom dnevno u trajanju od ukupno 14 dana, osim u slučajevima kada je životinju potrebno izlučiti iz studije i humano usmrtiti zbog njezine dobrobiti ili ako se utvrdi smrt životinje. Međutim, trajanje opažanja ne bi smjelo biti strogo određeno. Treba ga utvrditi na temelju toksičkih reakcija, početka i trajanja oporavka i prema potrebi ga se može produžiti. Važno je vrijeme pojave i nestajanja prvih znakova toksičnosti, posebno ako postoji tendencija da se znakovi toksičnosti pojave kasnije (12). Svi se rezultati opažanja sustavno bilježe, pri čemu se o svakoj životinji vode posebni zapisi.
Dodatna opažanja bit će potrebna ako životinje nastave pokazivati znakove toksičnosti. Treba opažati promjene na koži i dlaci, očima i sluznicama, na dišnom i cirkulacijskom sustavu, te na autonomnom i centralnom živčanom sustavu, kao i promjene u somatomotoričkoj aktivnosti i ponašanju. S posebnom pozornošću treba opažati drhtavicu, grčeve, slinjenje, proljev, otupjelost, san i komu. Treba poštovati načela i kriterije navedene u Smjernicama za humano usmrćivanje (9). Životinje za koje se utvrdi da su u stanju umiranja i životinje koje pokazuju da trpe jake bolove ili dugotrajni stres treba humano usmrtiti. U slučajevima kad se životinje usmrćuje iz humanih razloga ili se utvrdi njihova smrt, vrijeme smrti treba zabilježiti što točnije.
1.6.1. Tjelesna masa
Pojedinačnu masu životinja treba utvrditi neposredno prije primjene ispitivane tvari, a nakon toga najmanje jednom tjedno. Promjene u masi treba izračunati i zabilježiti. Na kraju ispitivanja preživjele se životinje izvažu i potom humano usmrte.
1.6.2. Patologija
Sve pokusne životinje (uključujući i one koje uginu za vrijeme ispitivanja ili ih se izluči iz studije zbog njihove dobrobiti) treba podvrgnuti obdukciji. Za svaku životinju posebno treba zabilježiti sve veće patološke promjene. Treba razmotriti i mogućnost obavljanja mikroskopskog pregleda organa životinja koje su nakon primjene prve doze preživjele 24 ili više sati i na kojima su obdukcijom utvrđene velike patološke promjene, budući da se na taj način mogu prikupiti korisne informacije.
2. PODACI
Treba prikupiti podatke za svaku pojedinačnu životinju. Osim toga, sve podatke treba rezimirati u obliku tablice u kojoj će za svaku ispitnu skupinu biti naveden broj upotrijebljenih životinja, broj životinja koje su pokazale znakove toksičnosti, broj životinja kod kojih je tijekom ispitivanja utvrđena smrt ili su bile usmrćene iz humanih razloga, vrijeme smrti svake pojedinačne životinje, te opis i vremenski tijek toksičkih učinaka i reverzibilnosti, kao i nalazi obdukcije.
3. IZVJEŠĆIVANJE
3.1. Izvješće o ispitivanju
Izvješće o ispitivanju mora sadržavati slijedeće informacije, prema potrebi:
|
|
ispitivana tvar:
|
|
|
Nosač (prema potrebi):
|
|
|
Pokusne životinje:
|
|
|
Uvjeti ispitivanja:
|
|
|
Rezultati:
|
|
|
Diskusija i tumačenje rezultata. |
|
|
Zaključci. |
4. REFERENCE:
|
(1) |
Roll R., Höfer-Bosse Th. And Kayser D (1986) New Perspectives in Acute Toxicity Testing of Chemicals. Toxicol. Lett., Suppl. 31, str. 86. |
|
(2) |
Roll R., Riebschläger M., Mischke U. and Kayser D (1989) Neue Wege zur Bestimmung der akuten Toxizität von Chemikalien. Bundesgesundheitsblatt 32, str. 336-341. |
|
(3) |
Diener W., Sichha L., Mischke U., Kayser D. and Schlede E (1994) The Biometric Evaluation of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 68, str. 559-610. |
|
(4) |
Diener W., Mischke U., Kayser D. and Schlede E., (1995) The Biometric Evaluation of the OECD Modified Version of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 69, str. 729-734. |
|
(5) |
Diener W., and Schlede E., (1999) Acute Toxicity Class Methods: Alterations to LD/LC50 Tests. ALTEX 16, str. 129-134. |
|
(6) |
Schlede E., Mischke U., Roll R. and Kayser D., (1992). A National Validation Study of the Acute-Toxic-Class Method — An Alternative to the LD50 Test. Arch. Toxicol. 66, 455-470. |
|
(7) |
Schlede E., Mischke U., Diener W. and Kayser D., (1994) The International Validation Study of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 69, str. 659-670. |
|
(8) |
OECD, (2001) Guidance Document on Acute Oral Toxicity Testing. Environmental Health and Safety Monograph Series on Testing and Assessment No 24. Paris. |
|
(9) |
OECD, (2000) Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Monograph Series on Testing and Assessment No 19. |
|
(10) |
OECD, (1998) Harmonised Integrated Hazard Classification System For Human Health And Environmental Effects Of Chemical Substances as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals in November 1998, Part 2, str. 11 [http://webnet1.oecd.org/oecd/pages/home/displaygeneral/0,3380, EN-documents-521-14-no-24-no-0,FF.html]. |
|
(11) |
Lipnick R. L., Cotruvo, J.A., Hill R. N., Bruce R. D., Stitzel K. A., Walker A. P., Chu I.; Goddard M., Segal L., Springer J. A. and Myers R. C. (1995) Comparison of the Up-and Down, Conventional LD50, and Fixed Dose Acute Toxicity Procedures. Fd. Chem. Toxicol 33, str. 223-231. |
|
(12) |
Chan P.K. and A.W. Hayes. (1994). Chap. 16. Acute Toxicity and Eye Irritancy. Principles and Methods of Toxicology. Third Edition. A.W. Hayes, Editor. Raven Press, Ltd., New York, USA. |
Dodatak 1.
POSTUPAK KOJI TREBA SLIJEDITI ZA SVAKU POČETNU DOZU
OPĆE PRIMJEDBE
U ispitnim shemama sadržanim u ovom Dodatku prikazan je postupak koji treba slijediti za svaku početnu dozu.
|
— |
Dodatak 1.A: Početna doza je 5 mg/kg t.m. (tjelesne mase) |
|
— |
Dodatak 1.B: Početna doza je 50 mg/kg t.m. |
|
— |
Dodatak 1.C: Početna doza je 300 mg/kg t.m. |
|
— |
Dodatak 1.D: Početna doza je 2 000 mg/kg t.m. |
Ovisno o broju humano usmrćenih životinja, slijed postupka označavaju strelice.
Dodatak 1.A
ISPITNI POSTUPAK S POČETNOM DOZOM OD 5 MG/KG TJELESNE MASE

Dodatak 1.B
ISPITNI POSTUPAK S POČETNOM DOZOM OD 50 MG/KG TJELESNE MASE

Dodatak 1.C
ISPITNI POSTUPAK S POČETNOM DOZOM OD 300 MG/KG TJELESNE MASE

Dodatak 1.D
ISPITNI POSTUPAK S POČETNOM DOZOM OD 2 000 MG/KG TJELESNE MASE
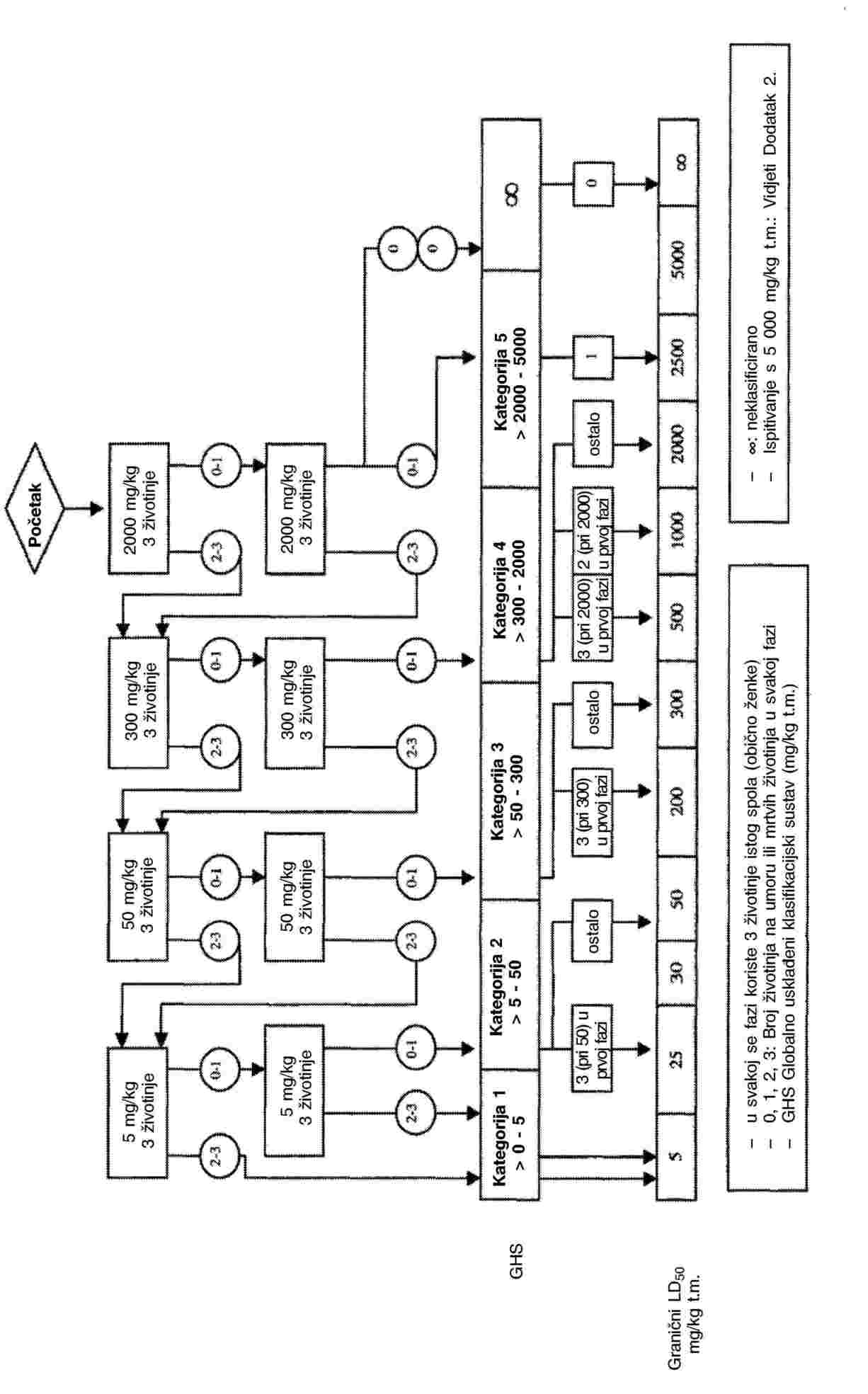
Dodatak 2.
KRITERIJI ZA KLASIFIKACIJU ISPITIVANIH TVARI ČIJA JE OČEKIVANA VRIJEDNOST LD50 VIŠA OD 2 000 MG/KG, BEZ POTREBE ZA ISPITIVANJEM
Kriteriji za kategoriju opasnosti 5 omogućuju identifikaciju ispitivanih tvari relativno niske akutne toksičnosti, koje u određenim uvjetima mogu predstavljati opasnost za osjetljive populacije. Pretpostavlja se da ove tvari imaju LD50 oralno ili dermalno u rasponu od 2 000-5 000 mg/kg ili ekvivalentne doze za druge puteve primjene. Ispitivane tvari mogu se svrstati u kategoriju opasnosti koju definira: 2 000 mg/kg < LD50 < 5 000 mg/kg (kategorija 5 u GHS-u) u sljedećim slučajevima:
|
(a) |
ako na ovu kategoriju upućuje bilo koja od ispitnih shema iz Dodatka 2., na temelju incidencije smrtnosti; |
|
(b) |
ako već postoje pouzdani dokazi koji pokazuju da je LD50 u okvirima vrijednosti koje odgovaraju kategoriji 5; ili ako druge toksikološke studije provedene na životinjama ili toksičko djelovanje na ljude izazivaju zabrinutost za ljudsko zdravlje; |
|
(c) |
ako ekstrapolacija, procjena ili prosudba podataka ne opravdavaju svrstavanje u višu klasu opasnosti; i
|
ISPITIVANJE UZ PRIMJENU DOZA IZNAD 2 000 MG/KG
Prepoznajući potrebu da se zaštiti dobrobit životinja, ispitivanje na životinjama u okviru vrijednosti kategorije 5 (5 000 mg/kg) ne preporuča se i može doći u obzir samo u slučajevima kad postoji velika vjerojatnost da će rezultati takvog ispitivanja biti od neposrednog značaja za zaštitu ljudskog zdravlja ili zdravlja životinja (10). Nikakva druga ispitivanja s višim dozama ne smiju se izvoditi.
Ako je potrebno ispitivanje doze od 5 000 mg/kg, dovoljna je samo jedna faza (tj. tri životinje). Ako prva životinja na koju se primijeni ta doza ugine, ispitivanje se nastavlja uz primjenu doze od 2 000 mg/kg, u skladu s dijagramima toka iz Dodatka 1. Ako prva životinja preživi, doza se primjenjuje na sljedeće dvije životinje. Ako ugine samo jedna od tri životinje, pretpostavlja se da je vrijednost LD50 viša od 5 000 mg/kg. Ako uginu obadvije životinje, ispitivanje se nastavlja uz primjenu doze od 2 000 mg/kg.
Dodatak 3.
ISPITNA METODA B.1 tris: Smjernice za klasifikaciju prema shemi EU-a koja vrijedi tijekom prijelaznog razdoblja do potpune provedbe Globalno usklađenog klasifikacijskog sustava (GHS) (uzeto iz referentnog dokumenta (8))
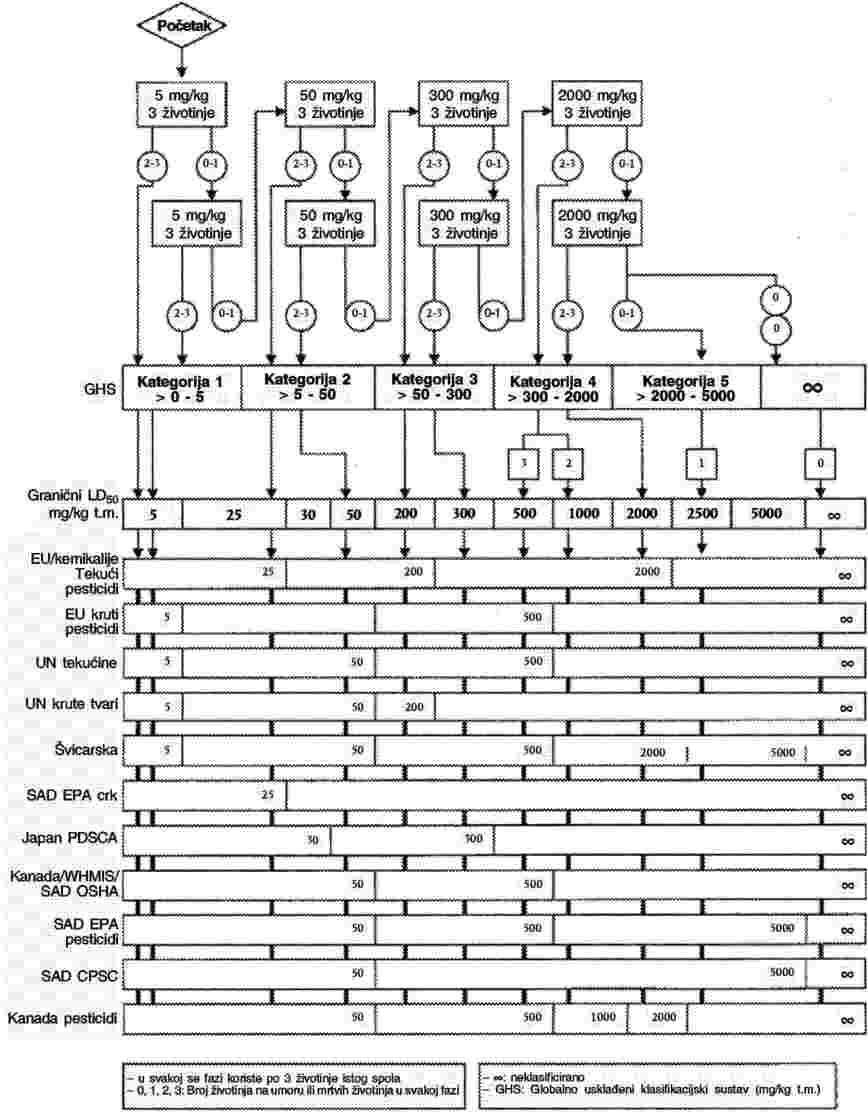
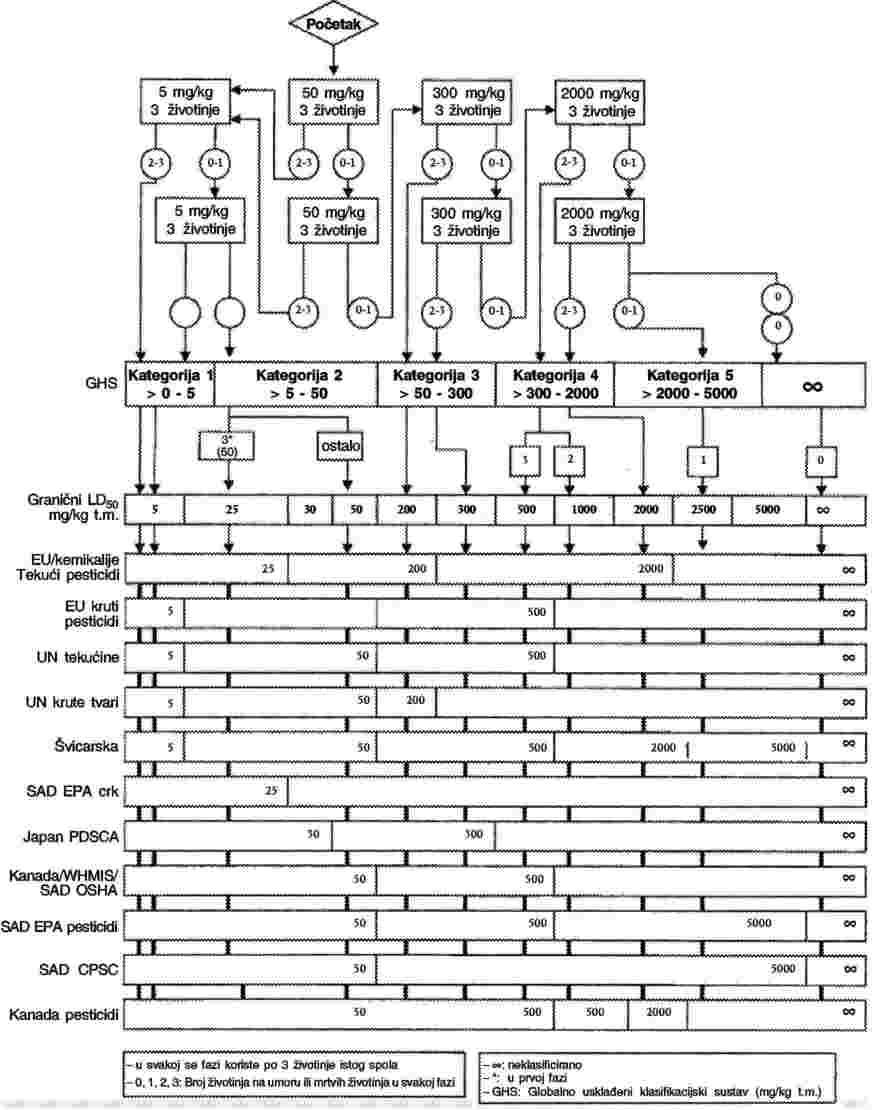

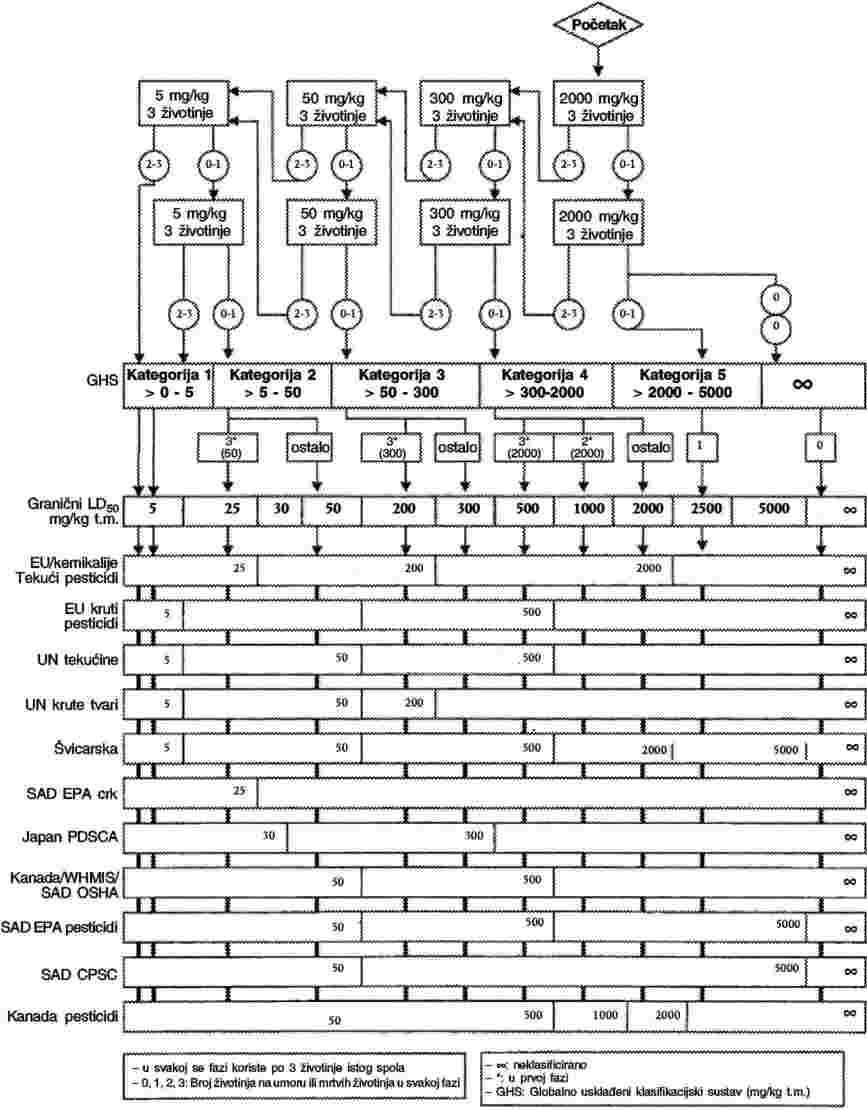
B.2. AKUTNA TOKSIČNOST (INHALACIJSKA)
1. METODA
1.1. UVOD
Korisno je imati preliminarne podatke o tvari kao što su raspored veličine čestica, tlak para, talište, vrelište, točka zapaljenja i eksplozivnost (ako je tvar eksplozivna).
Vidjeti Opći uvod, dio B slovo (A).
1.2. DEFINICIJE
Vidjeti Opći uvod, dio B slovo (B).
1.3. REFERENTNE TVARI
Nema ih.
1.4. NAČELO ISPITNE METODE
Nekoliko se skupina pokusnih životinja izlaže kroz određeno vremensko razdoblje ispitivanoj tvari u postupno sve većim koncentracijama, pri čemu se na jednu skupinu životinja primjenjuje jedna koncentracija. Nakon tog opažaju se učinci i smrtnost. Životinje koje uginu tijekom ispitivanja podvrgavaju se obdukciji, a po završetku ispitivanja životinje koje su preživjele ispitivanja usmrćuju se i obduciraju.
Životinje koje pokazuju izrazite znakove stresa i boli treba na humani način usmrtiti. Ispitivane tvari ne smije se dozirati na način za koji se zna da životinjama uzrokuje znatnu bol i stres zbog snažnih nagrizajućih i nadražujućih svojstava tvari.
1.5. KRITERIJI KVALITETE
Nema ih.
1.6. OPIS ISPITNE METODE
1.6.1. Priprema
Životinje se drže i hrane u pokusnim uvjetima najmanje pet dana prije pokusa. Prije ispitivanja zdrave mlade životinje nasumce se odabiru i raspoređuju u potreban broj skupina. Prethodno ih ne treba podvrgavati simuliranom izlaganju, ako to ne nalaže vrsta izloženosti i aparat koji se pri tom koristi.
Kod krutih ispitivanih tvari može biti potrebna mikronizacija da bi se dobile čestice odgovarajuće veličine.
Tamo gdje je to potrebno ispitivanoj tvari može se dodati odgovarajući nosač koji će omogućiti da se u atmosferi stvori odgovarajuća koncentracija ispitivane tvari, i u tom slučaju se koristi kontrolna skupina životinja za ispitivanje otapala. Ako se radi lakšeg doziranja upotrebljava nosač ili neki drugi dodaci, za njih se mora pouzdano znati da nemaju toksičko djelovanje.
1.6.2. Uvjeti ispitivanja
1.6.2.1. Pokusne životinje
Ako ne postoje kontraindikacije, preporuča se korištenje štakora. Treba koristiti sojeve koji se obično koriste u laboratorijima. Kod svakog spola na početku ispitivanja raspon težina životinja ne smije varirati za više od ± 20 % od odgovarajuće srednje vrijednosti.
1.6.2.2. Broj i spol
Za ispitivanje svake razine koncentracije koristi se barem 10 glodavaca (pet ženki i pet mužjaka). Treba koristiti ženke koje još nisu imale potomstvo i nisu gravidne.
Napomena: kod ispitivanja akutne toksičnosti na životinjama višeg reda od glodavaca, treba razmotriti upotrebu manjeg broja životinja. Treba pažljivo odabrati doze i poduzeti sve što je moguće da se ne premaše umjereno toksične doze. Kod takvih ispitivanja primjenu smrtonosnih doza ispitivane tvari treba izbjegavati.
1.6.2.3. Koncentracije pri izlaganju
Potreban je dovoljan broj izlaganja, najmanje tri, u odgovarajućim vremenskim intervalima, kako bi se dobile ispitne skupine kod kojih se uočavaju različiti toksički učinci i stope smrtnosti. Ti podaci trebaju biti dovoljni da se na temelju njih napravi krivulja smrtnosti u ovisnosti o koncentracijama i, tamo gdje je to moguće, da se utvrdi vrijednost LC50.
1.6.2.4. Granični test
Ako izloženost pokusnih životinja, od kojih je pet mužjaka i pet ženki, dozi od 20 mg po litri plina, ili 5 mg po litri aerosola, ili krutih čestica, u trajanju od četiri sata (ili ako tu koncentraciju nije moguće postići zbog fizikalnih ili kemijskih svojstava ispitivane tvari, koja uključuju i eksplozivnost, nakon izloženosti maksimalnoj koncentraciji koju je moguće postići) ne uzrokuje smrtnost vezanu uz ispitivani spoj u roku 14 dana, daljnje se ispitivanje ne smatra potrebnim (18. ATP, Dir. 93/21/EEZ, Ll10/93).
1.6.2.5. Vrijeme izloženosti
Vrijeme izloženosti treba biti 4 sata.
1.6.2.6. Oprema
Životinje treba testirati pomoću inhalacijske opreme čija konstrukcija omogućuje protok zraka s najmanje 12 potpunih izmjena u jednom satu, kako bi se osigurao odgovarajući sadržaj kisika i atmosfera u kojoj je tvar kojoj se životinja izlaže jednakomjerno raspoređena. Ako se za ispitivanje koristi komora, njezina konstrukcija treba omogućiti minimalnu naguranost životinja i maksimalnu inhalacijsku izloženost ispitivanoj tvari. Da bi se osigurala stabilnost atmosfere u komori, primjenjuje se opće pravilo da ukupan „volumen” pokusne životinje ne smije biti veći od 5 % volumena ispitne komore. Mogu se koristiti različiti tipovi komora koji omogućuju izloženost samo oro-nazalnih (usno-nosnih) otvora, samo glave ili čitavog tijela pojedinačne životinje; prva dva tipa omogućuju da se unošenje ispitivane tvari u organizam životinje drugim putevima svede na minimum.
1.6.2.7. Vrijeme opažanja
Opažanje treba trajati najmanje 14 dana. Međutim, trajanje pojedinačnih opažanja ne treba biti strogo određeno. Treba ga odrediti na temelju toksičkih reakcija, brzine njihova pojavljivanja i vremena potrebnog za oporavak; tako se u slučaju potrebe vrijeme opažanja može produžiti. Vrijeme pojavljivanja ili nestajanja znakova toksičnosti i vrijeme smrti su važni, posebno ako postoji tendencija kasnijeg nastupanja smrti.
1.6.3. Postupak
Neposredno prije izlaganja životinje treba izvagati i potom izložiti ispitnoj koncentraciji u trajanju od četiri sata u za to predviđenoj napravi, nakon uspostavljanja ujednačene koncentracije u komori. Vrijeme ujednačavanja koncentracije mora biti kratko. Temperaturu na kojoj se obavlja ispitivanje treba održavati na 22 ± 3 °C. Relativnu je vlažnost najbolje održavati između 30 % i 70 %, ali u nekim slučajevima (npr. pri ispitivanju nekih aerosola) to može biti neizvedivo. Održavanje laganog podtlaka u komori (≥ 5 mm H2O) spriječit će istjecanje ispitivane tvari u okolni prostor. Za vrijeme izloženosti životinjama se ne smije davati hrana i voda. Za uspostavljanje i praćenje ispitne atmosfere treba koristiti odgovarajuće sustave. Takav sustav treba osigurati postizanje stabilnih uvjeta izloženosti u što kraćem vremenu. Konstrukcija i način upravljanja komorom trebaju omogućiti održavanje homogene distribucije ispitne atmosfere unutar komore:
Treba mjeriti i pratiti:
|
(a) |
brzinu protoka zraka (neprekidno); |
|
(b) |
stvarnu koncentraciju ispitivane tvari koja se mjeri u zoni disanja najmanje tri puta tijekom izlaganja (neke vrste atmosfere, npr. aerosole visokih koncentracija, može biti potrebno mjeriti češće). Tijekom razdoblja izlaganja koncentracija ne smije varirati za više od ± 15 % srednje vrijednosti. Međutim, kod nekih aerosola ovu razinu kontrole može biti nemoguće postići i u takvim je slučajevima prihvatljiv veći raspon. Kod aerosola analizu veličine čestica treba raditi onoliko često koliko je to potrebno (najmanje jednom za svaku pokusnu skupinu); |
|
(c) |
temperaturu i vlažnost, po mogućnosti neprekidno. |
Tijekom izloženosti životinja obavlja se sustavno opažanje i bilježenje rezultata opažanja; za svaku životinju treba voditi zasebnu evidenciju. Tijekom prvog dana opažanja trebaju biti česta. Temeljiti klinički pregled treba obaviti najmanje jednom svakog radnog dana, druga opažanja treba obavljati jednom dnevno, uz poduzimanje odgovarajućih mjera kako bi se gubitak životinja u studiji sveo na minimum, npr. obdukcija ili pohranjivanje uginulih životinja u hladnjak i izolacija ili usmrćivanje slabih životinja i životinja na umoru.
Treba opažati promjene na koži i dlaci, očima i sluznicama, na dišnom i cirkulacijskom sustavu, te na autonomnom i centralnom živčanom sustavu, kao i promjene u somatomotoričkoj aktivnosti i ponašanju. S posebnom pozornošću treba opažati promjene u disanju, drhtavicu, grčeve, slinjenje, proljev, otupjelost, san i komu. Vrijeme smrti treba zabilježiti što preciznije. Pojedinačnu masu životinja treba mjeriti svaki tjedan nakon izlaganja, i kad nastupi smrt.
Životinje koje uginu tijekom ispitivanja i one koje prežive do kraja ispitivanja podvrgavaju se obdukciji, pri čemu se posebna pozornost posvećuje svim promjenama u gornjem i donjem dišnom traktu. Sve veće patološke promjene treba zabilježiti. Kad za to postoje indikacije, treba uzeti uzorak tkiva za histopatološki pregled.
2. PODACI
Podatke treba rezimirati u obliku tablice u kojoj će za svaku ispitnu skupinu biti naveden broj životinja na početku ispitivanja, vrijeme smrti svake životinje, broj životinja koje pokazuju druge znakove toksičnosti, opis toksičkih učinaka i nalazi obdukcije. Ako životinja preživi duže od jednog dana, moraju se izračunati i zabilježiti promjene u masi. Životinje koje se humano usmrte zbog stresa i boli izazvanih ispitivanom tvari svrstavaju se pod slučajeve smrti povezane s tom tvari. LC50 treba utvrditi prema nekoj od priznatih metoda. Ocjena podataka treba uključivati odnos, ako postoji, između izloženosti životinje ispitivanoj tvari i pojave i ozbiljnosti svih abnormalnih pojava, uključujući abnormalnosti u ponašanju i kliničke abnormalnosti, velike lezije, promjene u tjelesnoj masi, smrtnost i druge toksičke učinke.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju treba, ako je moguće, sadržavati slijedeće informacije:
|
— |
vrsta, soj, podrijetlo, okolišni uvjeti, prehrana itd., |
|
— |
uvjeti ispitivanja: opis naprave za izlaganje, uključujući konstrukciju, tip, dimenzije, izvor zraka, sustav za proizvodnju aerosola, metodu kondicioniranja zraka i metodu smještanja životinja u ispitnoj komori u slučaju da se ona koristi. Treba opisati opremu za mjerenje temperature, vlažnosti, te koncentracije i raspoređenosti veličine čestica aerosola. |
Podaci o izlaganju
Ovi podaci trebaju biti navedeni u obliku tablice i prikazani kao srednje vrijednosti i mjera varijabilnosti (npr. standardno odstupanje) i po mogućnosti uključivati sljedeće:
|
(a) |
brzina protoka zraka kroz inhalacijsku opremu; |
|
(b) |
temperatura i vlažnost zraka |
|
(c) |
nazivne koncentracije (ukupna količina ispitivane tvari koja se stavlja u inhalacijsku opremu podijeljena s volumenom zraka); |
|
(d) |
vrsta nosača, ako je upotrijebljen; |
|
(e) |
stvarne koncentracije u ispitnoj zoni disanja; |
|
(f) |
srednji aerodinamični promjer čestica (MMAD) i geometrijska standardna devijacija (GSD); |
|
(g) |
razdoblje ujednačavanja koncentracije; |
|
(h) |
razdoblje izloženosti;
|
3.2. OCJENA I TUMAČENJE REZULTATA
Vidjeti Opći uvod, dio B slovo (D).
4. REFERENCE
Vidjeti Opći uvod, dio B slovo (E).
B.3. AKUTNA TOKSIČNOST (DERMALNA)
1. METODA
1.1. UVOD
Korisno je imati preliminarne podatke o tvari kao što su raspored veličine čestica, tlak para, talište, vrelište, točka zapaljenja i eksplozivnost (ako je tvar eksplozivna).
Vidjeti Opći uvod, dio B slovo (A).
1.2. DEFINICIJE
Vidjeti Opći uvod, dio B slovo (B).
1.3. REFERENTNE TVARI
Nema ih.
1.4. NAČELO ISPITNE METODE
Ispitivana se tvar u stupnjevanim dozama nanosi na kožu nekoliko skupina pokusnih životinja, pri čemu se na svaku skupinu primjenjuje po jedna visina doze. Nakon tog opažaju se učinci i smrtnost. Životinje koje uginu tijekom ispitivanja podvrgavaju se obdukciji, a po završetku ispitivanja životinje koje su preživjele ispitivanje usmrćuju se i obduciraju.
Životinje koje pokazuju izrazite znakove stresa i boli treba humano usmrtiti. Ispitivane tvari ne smiju se primjenjivati na način za koji je poznato da životinjama uzrokuje znatnu bol i stres zbog snažnih nagrizajućih i nadražujućih svojstava.
1.5. KRITERIJI KVALITETE
Nema ih.
1.6. OPIS ISPITNE METODE
1.6.1. Priprema
Životinje se drže u kavezima za obavljanje ispitivanja, u pokusnim uvjetima što se tiče smještaja i hranjenja, najmanje pet dana prije početka pokusa. Prije ispitivanja zdrave mlade životinje nasumce se odabiru i raspoređuju u skupine u kojima će biti tretirane. Približno 24 sata prije ispitivanja na hrptenom dijelu trupa životinja treba ukloniti dlaku šišanjem ili brijanjem. Pri šišanju ili brijanju treba izbjeći struganje kože, jer bi to moglo promijeniti njezinu propusnost. Za nanošenje ispitivane tvari dlaku treba ukloniti s najmanje 10 % tjelesne površine. Pri ispitivanju krutih tvari koje se prema potrebi mogu usitniti u prah, ispitivanu tvar treba u dovoljnoj mjeri navlažiti vodom ili, tamo gdje je to potrebno, odgovarajućim nosačem, kako bi se osigurao dobar kontakt s kožom. Kad se upotrebljava nosač, u obzir treba uzeti utjecaj tog nosača na prodiranje ispitivane tvari u kožu. Tekuće ispitivane tvari općenito se primjenjuju nerazrijeđene.
1.6.2. Uvjeti ispitivanja
1.6.2.1. Pokusne životinje
Mogu se koristiti odrasli štakori ili kunići. Moguće je koristiti i druge vrste, ali je za to potrebno navesti opravdane razloge. Treba koristiti sojeve životinja koji se obično koriste u laboratorijima. Na početku ispitivanja, bez obzira na spol, masa životinja ne smije varirati za više od ± 20 % odgovarajuće srednje vrijednosti.
1.6.2.2. Broj i spol
Za svaku visinu doze treba upotrijebiti najmanje pet životinja. Sve moraju biti istog spola. Ako se koriste ženke, treba koristiti one koje još nisu imale potomstvo i nisu gravidne. U slučajevima kad postoje informacije koje dokazuju da je jedan od spolova izrazito osjetljiviji, doze treba primjenjivati na životinje tog spola.
Napomena: kod ispitivanja akutne toksičnosti na životinjama višeg reda od glodavaca, treba razmotriti mogućnost upotrebe manjeg broja životinja. Treba pažljivo odabirati doze i poduzeti sve mjere da se ne premaše srednje toksične doze. U ovakvim ispitivanjima treba izbjegavati primjenu smrtonosnih doza ispitivane tvari.
1.6.2.3. Visine doza
Treba koristiti dovoljan broj različitih doza, najmanje tri, te ih primjenjivati u odgovarajućim vremenskim intervalima kako bi se na ispitnim skupinama mogli uočiti različiti toksički učinci i različite stope smrtnosti. Kod odabiranja visine doze treba uzeti u obzir nadražujuća i nagrizajuća svojstva ispitivane tvari. Ti podaci moraju biti dostatni da se na temelju njih izradi krivulja doza i reakcija i, kada je izvedivo, da omoguće prihvatljivo utvrđivanje vrijednosti LD50.
1.6.2.4. Granični test
Na skupini od pet mužjaka i pet ženki može se obaviti granični test uz primjenu samo jedne visine doze, najmanje 2 000 mg/kg tjelesne mase, primjenjujući gore opisani postupak. U slučaju pojave smrtnosti povezane s ispitivanom tvari, možda će biti potrebna cijela studija.
1.6.2.5. Razdoblje opažanja
Razdoblje opažanja treba biti najmanje 14 dana. Međutim, trajanje opažanja ne treba biti strogo određeno. Treba ga odrediti na temelju toksičkih reakcija, brzine njihova pojavljivanja i vremena potrebnog za oporavak; ako se smatra potrebnim ono se može produžiti. Vrijeme pojavljivanja ili nestajanja znakova toksičnosti i vrijeme smrti su važni, posebno ako postoji tendencija kasnijeg nastupanja smrti.
1.6.3. Postupak
U kavezu treba držati po jednu životinju. Ispitivanu tvar treba jednakomjerno nanijeti na površinu koja čini oko 10 % ukupne površine tijela. Kad su u pitanju visoko toksične tvari, površina nanošenja može biti i manja, ali i na takvu površinu tvar treba nanijeti u što tanjem i ravnomjernijem sloju.
Ispitivanu tvar treba držati u kontaktu s kožom tijekom cijelog 24-satnog razdoblja izloženosti pomoću poroznog obloga od gaze i samoljepive trake koja ne nadražuje kožu. Ispitnu površinu treba dodatno prekriti na odgovarajući način kako bi oblog i ispitivana tvar ostali na mjestu i kako bi se osiguralo da životinje ne mogu ispitivanu tvar unijeti ingestijom (oralno). Da bi se životinju spriječilo da ispitivanu tvar unese ingestijom (oralnim putem) mogu se upotrijebiti pomagala za sputavanje, ali potpuna imobilizacija nije preporučena metoda.
Na kraju razdoblja izloženosti ostatke ispitivane tvari treba ukloniti, ako je moguće vodom ili primjenom neke druge prikladne metode čišćenja kože.
Rezultate opažanja treba sustavno bilježiti redoslijedom kojim se obavljaju. Za svaku životinju treba voditi zasebnu evidenciju. Tijekom prvog dana životinje treba opažati često. Najmanje jednom svakog radnog dana treba obaviti temeljiti klinički pregled, a ostala opažanja treba obavljati dnevno, uz poduzimanje odgovarajućih mjera kako bi se gubitak životinja tijekom studije sveo na minimum, npr. obdukcija ili pohranjivanje uginulih životinja u hladnjak i izolacija ili usmrćivanje slabih životinja i životinja na umoru.
Opažati treba promjene na dlaci, tretiranoj koži, očima i sluznicama, na dišnom i cirkulacijskom sustavu, te na autonomnom i centralnom živčanom sustavu, kao i promjene u somatomotoričkoj aktivnosti i obrascu ponašanja. S posebnom pozornošću treba opažati drhtavicu, grčeve, slinjenje, proljev, otupjelost, san i komu. Vrijeme smrti mora se zabilježiti što je moguće preciznije. Životinje koje uginu tijekom ispitivanja kao i one koje prežive do kraja ispitivanja podvrgavaju se obdukciji. Treba zabilježiti sve veće patološke promjene. Kad za to postoje indikacije, treba uzeti uzorak tkiva za histopatološki pregled.
Ocjenjivanje toksičnosti kod drugog spola
Po završetku studije na jednom spolu doza se primjenjuje na najmanje jednu skupinu od pet životinja drugog spola kako bi se utvrdilo da životinje tog spola nisu izrazito osjetljivije na ispitivanu tvar. U određenim okolnostima može biti opravdano koristiti manji broj životinja. Ako već postoje odgovarajući podaci koji pokazuju da su životinje ispitanog spola izrazito osjetljivije, ispitivanje na životinjama drugog spola može se izostaviti.
2. PODACI
Podatke treba rezimirati u obliku tablice, u kojoj će za svaku ispitnu skupinu biti naveden broj životinja na početku ispitivanja, vrijeme smrti svake životinje, broj životinja koje pokazuju druge znakove toksičnosti, opis toksičkih učinaka i nalazi obdukcije. Masu svake pojedinačne životinje treba utvrditi i zabilježiti neposredno prije nanošenja ispitivane tvari, a zatim jednom tjedno i nakon smrti; promjene u masi treba izračunavati u slučajevima kad životinja preživi duže od jednog dana. Životinje koje se humano usmrte zbog stresa i boli izazvanih ispitivanom tvari svrstavaju se pod slučajeve smrti povezane s tom tvari. LD50 treba utvrditi prema nekoj od priznatih metoda.
Ocjena podataka treba uključivati eventualni odnos između izloženosti životinje ispitivanoj tvari i pojave i ozbiljnosti svih abnormalnosti, uključujući abnormalnosti u ponašanju, kliničke abnormalnosti, velike lezije, promjene u tjelesnoj masi, smrtnost i druge toksičke učinke.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju treba, po mogućnosti, sadržavati slijedeće informacije:
|
— |
vrsta, soj, podrijetlo, okolišni uvjeti, prehrana itd., |
|
— |
uvjeti ispitivanja (uključujući metodu čišćenja kože i vrstu obloga: okluzivni ili neokluzivni), |
|
— |
visine doza (s otapalom, ako se koristi, i koncentracijama), |
|
— |
spol životinja kojima se tvar dozira, |
|
— |
tabelarni prikaz podataka o reakcijama (tj. broj životinja koje su uginule ili bile usmrćene tijekom ispitivanja, broj životinja koje pokazuju znakove toksičnosti, broj izloženih životinja), |
|
— |
sva opažanja, |
|
— |
vrijednost LD50 za spol na kojem je provedena studija, utvrđena nakon 14 dana prema navedenoj metodi utvrđivanja, |
|
— |
interval 95 %-tne pouzdanosti za LD50 (kad ga je moguće navesti), |
|
— |
krivulja doza/smrtnost i nagib krivulje (gdje to dopušta metoda određivanja), |
|
— |
nalazi obdukcije, |
|
— |
svi histopatološki nalazi, |
|
— |
rezultati svih ispitivanja na drugom spolu, |
|
— |
diskusija o rezultatima (posebnu pozornost treba posvetiti mogućem učinku humanog usmrćivanja životinja tijekom ispitivanja na izračunanu vrijednost LD50), |
|
— |
tumačenje rezultata. |
3.2. OCJENA I TUMAČENJE REZULTATA
Vidjeti Opći uvod, dio B slovo (D).
4. REFERENCE
Vidjeti Opći uvod, dio B slovo (E).
B.4. AKUTNA TOKSIČNOST: NADRAŽIVANJE/NAGRIZANJE KOŽE
1. METODA
Ova je metoda istovjetna metodi OECD TG 404 (2002.).
1.1. UVOD
Kod pripreme ove nove dopunjene metode posebna je pozornost posvećena mogućim poboljšanjima s obzirom na dobrobit životinja, kao i procjeni svih postojećih informacija o ispitivanoj tvari kako bi se izbjegla nepotrebna ispitivanja na laboratorijskim životinjama. Ova metoda sadrži preporuku da se prije provođenja opisanog ispitivanja nagrizajućih/nadražujućih svojstava tvari in vivo, obavi analiza već postojećih relevantnih znanstvenih dokaza. Ako nema dovoljno raspoloživih podataka, moguće ih je dobiti kroz primjenu sekvencijskog ispitivanja (1). Strategija ispitivanja uključuje provođenje validiranih i prihvaćenih ispitivanja in vitro, a opisana je u Dodatku ovoj metodi. Osim toga, prema potrebi, kod inicijalnog ispitivanja in vivo preporuča se postupna, a ne istovremena primjena triju ispitnih krpica (patch test) na životinju.
U interesu ispravnog korištenja znanosti i dobrobiti životinja, ispitivanja in vivo ne bi se smjela obavljati dok se putem analize postojećih znanstvenih dokaza ne procijene svi raspoloživi podaci koji su relevantni za nagrizajuće/nadražujuće djelovanje predmetne tvari na kožu. Takvi će podaci obuhvaćati dokaze koji proizlaze iz postojećih studija provedenih na ljudima i/ili laboratorijskim životinjama, dokaze o nagrizajućim/nadražujućim svojstvima jedne ili više strukturno srodnih tvari ili mješavina tih tvari, podatke koji ukazuju na jaku kiselost ili lužnatost ispitivane tvari (2)(3) i rezultate validiranih i prihvaćenih in vitro ili ex vivo ispitivanja (4)(5)(5a). Ova bi analiza trebala smanjiti potrebu za in vivo ispitivanjima nagrizajućeg/nadražujućeg djelovanja tvari na kožu, za koje u tom smislu postoji već dovoljno dokaza na temelju drugih studija.
Strategija sekvencijskog ispitivanja kojoj se daje prednost i koja uključuje provođenje validiranih i prihvaćenih in vitro i ex vivo ispitivanja nagrizajućih/nadražujućih svojstava tvari sadržana je u Dodatku ovoj metodi. Ova je strategija razvijena u okviru radionice u organizaciji OECD-a (6) i sudionici te radionice jednoglasno je preporučuju, a usvojena je kao preporučena strategija ispitivanja u okviru Globalno usklađenog sustava klasifikacije kemijskih tvari (GHS) (7). Preporuča se primjena ove strategije prije ispitivanja in vivo. Kad su u pitanju nove tvari, za ispitivanja se preporuča fazni pristup, kako bi se o nagrizajućim/nadražujućim svojstvima ispitivane tvari dobili znanstveno ispravni podaci. Kad su u pitanju otprije poznate tvari o čijem nagrizajućem/nadražujućem djelovanju na kožu i oči nema dovoljno podataka, istu strategiju treba primijeniti za dopunu podataka. Za primjenu drugačije strategije ili postupka ispitivanja, odnosno za odluku da se ne primijeni metoda faznog ispitivanja, treba navesti razloge.
Ako se nagrizajuća i nadražujuća svojstva ne mogu utvrditi na temelju analize već postojećih znanstvenih dokaza, u skladu sa strategijom sekvencijskog ispitivanja, treba razmotriti mogućnost provođenja ispitivanja in vivo (vidjeti Dodatak).
1.2. DEFINICIJE
Nadraživanje kože: uzrokovanje reverzibilnog oštećenja kože nakon primjene ispitivane tvari tijekom razdoblja od najviše 4 sata.
Nagrizanje kože: uzrokovanje ireverzibilnog oštećenja kože; točnije, pojava vidljive nekroze epiderme i derme, nakon primjene ispitivane tvari tijekom razdoblja od najviše 4 sata. Za nagrizanje kože tipična je pojava čireva, krvarenja, krvavih krasta te, do kraja opažanja od 14 dana, gubitak boje kože zbog nestajanja pigmenta, čitave površine zahvaćene alopecijom (gubitak dlake) i ožiljci. Za ocjenjivanje sumnjivih lezija treba razmotriti mogućnost histopatoloških pretraga.
1.3. NAČELO ISPITNE METODE
Jedna doza ispitivane tvari nanosi se na kožu pokusne životinje; netretirani dijelovi kože pokusne životinje služe za kontrolu. Stupanj nadraženosti/nagriženosti kože očitava se i bilježi u određenim vremenskim intervalima i zatim se dodatno opisuje kako bi se mogla napraviti kompletna ocjena učinaka. Studija treba trajati dovoljno dugo da bude moguće ocijeniti jesu li opaženi učinci reverzibilni ili ireverzibilni.
Životinje koje pokazuju stalne znakove jakog stresa i/ili boli u bilo kojoj fazi ispitivanja treba humano usmrtiti, a ispitivanu tvar ocijeniti s tim u skladu. Kriteriji za donošenje odluke o humanom usmrćivanju životinja koje su na umoru i koje jako pate mogu se naći u referentnoj literaturi pod brojem (8).
1.4. OPIS ISPITNE METODE
1.4.1. Priprema za ispitivanje in vivo
1.4.1.1. Odabir životinjske vrste
Preporuča se korištenje albino kunića, i to zdravih odraslih primjeraka. U slučaju da se koristi neka druga životinjska vrsta, treba navesti razloge za to.
1.4.1.2. Priprema životinja
Otprilike 24 sata prije ispitivanja životinjama se s leđnog dijela trupa uklanja dlaka šišanjem neposredno uz kožu. Pritom treba paziti da se koža ne ošteti, a treba koristiti samo životinje sa zdravom, netaknutom kožom.
Kod nekih su sojeva kunića određeni dijelovi kože prekriveni vrlo gustom dlakom, što je posebno izraženo u određeno doba godine. Na takvima se gusto obraslim dijelovima kože ispitivanja ne bi smjela obavljati.
1.4.1.3. Uvjeti držanja i hranjenja životinja
Životinje trebaju biti smještene pojedinačno. Temperatura prostorije za držanje pokusnih životinja, kad su u pitanju kunići, treba biti 20 °C (± 3 °C). Iako relativna vlažnost zraka treba biti najmanje 30 % i po mogućnosti ne više od 70 %, osim za vrijeme čišćenja prostorije, treba je nastojati održavati na 50-60 %. Osvjetljenje treba biti umjetno i mora se u slijedu izmjenjivati 12 sati svjetla i 12 sati mraka. Što se tiče hranjenja, može se primjenjivati standardna hrana za laboratorijske životinje uz neograničene količine pitke vode.
1.4.2. Ispitni postupak
1.4.2.1. Nanošenje ispitivane tvari
Ispitivanu tvar treba nanijeti na malu površinu (približno 6 cm2) kože i prekriti gazenom krpicom koju treba pričvrstiti nenadražujućom ljepljivom trakom. U slučajevima kad izravno nanošenje nije moguće (npr. tekućine ili neke paste) ispitivanu tvar treba nanijeti na gazenu krpicu koja se zatim stavi na kožu. Krpicu treba držati labavo u kontaktu s kožom pomoću odgovarajućeg poluokluzivnog obloga tijekom čitavog razdoblja izlaganja. Ako se ispitivana tvar nanese na krpicu, na kožu je treba pričvrstiti na takav način da se ostvari dobar kontakt između tvari i kože i da tvar bude jednoliko raspoređena po koži. Životinju treba spriječiti da dosegne kompresu i tvar unese u organizam kroz usta ili udisanjem.
Tekuće ispitivane tvari općenito se koriste nerazrijeđene. Kad se ispituju krute tvari (koje mogu biti usitnjene u prah (ako se to smatra potrebnim), ispitivanu tvar treba navlažiti najmanjom mogućom količinom vode (ili, prema potrebi, nekim drugim odgovarajućim nosačem) dovoljnom da omogući dobar kontakt s kožom. Kad se koriste drugi nosači, a ne voda, potencijalni utjecaj nosača na nadraženost kože izazvanu ispitivanom tvari treba biti minimalan, ili nikakav.
Na kraju izlaganja koje obično traje četiri sata, ostatke ispitivane tvari treba ukloniti po mogućnosti vodom ili odgovarajućim otapalom, ne mijenjajući nastalu reakciju ili integritet epiderme.
1.4.2.2. Visina doze
Na pripremljeni dio kože nanosi se od 0,5 ml tvari u tekućem obliku ili 0,5 g u krutom obliku ili u obliku paste.
1.4.2.3. Inicijalni test (ispitivanje nadražujućih/nagrizajućih svojstava in vivo na jednoj životinji)
Posebno se preporuča da se ispitivanje in vivo najprije provede na jednoj životinji, posebno ako se pretpostavlja da bi ispitivana tvar mogla imati nagrizajuća svojstva. Ova je preporuka u skladu sa strategijom sekvencijskog ispitivanja (vidjeti Dodatak 1).
Ako se na temelju postojećih znanstvenih dokaza ocijeni da je neka tvar nagrizajuća, daljnja ispitivanja na životinjama nisu potrebna. U načelu, za većinu tvari za koje se sumnja da imaju nagrizajuća svojstva in vivo ispitivanja nisu potrebna. Međutim, u slučajevima kad se zbog nedovoljnih dokaza osjeća da bi trebalo prikupiti dodatne podatke, mogu se provesti ograničena ispitivanja na životinjama primjenjujući sljedeći pristup: na kožu jedne životinje u slijedu se stavljaju najviše tri krpice. Prva se krpica uklanja nakon tri minute. Ako se na koži ne uoči jaka reakcija stavlja se druga krpica koja se uklanja nakon jednog sata. Ako se na temelju opažanja u ovoj fazi može zaključiti da ne bi bilo nehumano produžiti izlaganje, stavlja se treća krpica koja se uklanja nakon četiri sata i utvrđuje stupanj reakcije.
Ako se nakon bilo kojega od tri izlaganja u nizu opazi nagrizajuće djelovanje, ispitivanje se odmah prekida. Ako se nakon uklanjanja prve krpice ne uoči nagrizajuće djelovanje, životinje se opažaju 14 dana, osim u slučaju da do nagrizanja dođe ranije.
U slučajevima kad se ne očekuje da će ispitivana tvar uzrokovati nagrizanje, ali da može biti nadražujuća treba na jednu životinju staviti jednu krpicu i držati je četiri sata.
1.4.2.4. Potvrdni test (ispitivanje nadraživanja kože in vivo na dodatnim životinjama)
Ako se tijekom inicijalnog testa ne opazi nagrizajući učinak, nadražujući učinak ili negativan nalaz treba potvrditi ispitivanjem na najviše dvije dodatne životinje, od kojih na svaku treba primijeniti po jednu krpicu u trajanju od četiri sata. Ako se tijekom inicijalnog testa opazi nadražujući učinak, potvrdni se test može izvesti sekvencijski, ili istovremenim izlaganjem dviju dodatnih životinja. U iznimnim slučajevima kod kojih se inicijalni test ne provodi, može se tretirati dvije ili tri životinje sa po jednom krpicom koja se nakon četiri sata uklanja. Ako pri korištenju dviju životinja obje pokažu istu reakciju, daljnje ispitivanje nije potrebno. U suprotnom se ispitivanju podvrgava i treća životinja. Nejasne reakcije ponekad treba ocijeniti ispitivanjem na dodatnim životinjama.
1.4.2.5. Razdoblje opažanja
Opažanje treba trajati dovoljno dugo da se u potpunosti može utvrditi reverzibilnost opažanih učinaka. Međutim pokus treba prekinuti u bilo kojem trenutku ako životinja pokazuje trajne znakove jake boli ili stresa. Da bi se utvrdila reverzibilnost učinaka, životinje treba opažati do 14 dana nakon uklanjanja krpica. Ako se reverzibilnost utvrdi prije isteka 14 dana, pokus odmah treba prekinuti.
1.4.2.6. Klinička opažanja i stupnjevanje reakcija na koži
Sve životinje treba pregledati kako bi se vidjelo pokazuju li znakove crvenila kože (eritema) ili oteklina (edema) i to nakon 60 minuta, a zatim nakon 24, 48 i 72 sata po skidanju krpice. Stupanj reakcije na koži utvrđuje se i bilježi prema stupnjevima opisanim u donjoj tablici. Ako se na koži pojavi oštećenje koje se nakon 72 sata ne može definirati kao nadraženost ili nagriženost, možda će za utvrđivanje reverzibilnosti učinaka biti potrebno opažanje u trajanju od 14 dana. Uz opažanja vezana uz nadraženost kože treba detaljno opisati i zabilježiti sve lokalne toksičke učinke, kao što je isušivanje kože, i sve sustavne štetne učinke (npr. klinički znakovi toksičnosti i promjene u tjelesnoj masi). U slučaju nejasnih reakcija treba obaviti histopatološki pregled.
Stupnjevanje kožnih reakcija po svojoj je prirodi subjektivno. Da bi se poboljšala usklađenost u stupnjevanju kožnih reakcija te da bi se u tom smislu pomoglo ispitnim laboratorijima i laboratorijima u kojima se obavljaju opažanja i tumače rezultati, osoblje koje obavlja te poslove treba proći odgovarajuću obuku za primjenu sustava ocjenjivanja (vidjeti tablicu dolje). Od pomoći bi mogao biti i ilustrirani priručnik za utvrđivanje stupnja nadraženosti i drugih lezija kože (9).
2. PODACI
2.1. TUMAČENJE REZULTATA
Rezultate studije, koji obuhvaćaju sve stavke iz odjeljka 3.1., treba rezimirati u obliku tablice u konačnom izvješću o ispitivanju.
2.2. OCJENA REZULTATA
Pokazatelje nadraženosti kože treba ocijeniti ovisno o vrsti i stupnju lezija i o njihovoj reverzibilnosti ili ireverzibilnosti. Pojedinačni rezultati ne predstavljaju apsolutni standard za nadražujuća svojstva nekog materijala, budući da se ocjenjuju i njegovi drugi učinci. Umjesto toga, na pojedinačne rezultate treba gledati kao na referentne vrijednosti koje se ocjenjuju u kombinaciji sa svim ostalim opažanjima iz studije.
Kod ocjenjivanja nadraženosti kože treba uzeti u obzir reverzibilnost lezija. Ako reakcije kao što su alopecija (ograničena površina), hiperkeratoza, hiperplazija i perutanje ostanu prisutne do kraja 14-dnevnog razdoblja opažanja, ispitivanu tvar treba smatrati nadražujućom.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora sadržavati sljedeće informacije:
|
|
Razloge za ispitivanje in vivo: analiza postojećih znanstvenih dokaza koji se temelje na ranijim ispitivanjima, uključujući rezultate dobivene primjenom strategije sekvencijskog ispitivanja:
|
|
|
Ispitivana tvar:
|
|
|
Nosač:
|
|
|
Pokusne životinje:
|
|
|
Uvjeti ispitivanja:
|
|
|
Rezultati:
|
4. REFERENCE
|
(1) |
Barratt, M.D., Castell, J.V., Chamberlain, M., Combes, R.D., Dearden, J.C., Fentem, J.H., Gerner, I., Giuliani, A., Gray, T.J.B., Livingston, D.J., Provan, W.M., Rutten, F.A.J.J.L., Verhaar, H.J.M., Zbinden, P. (1995) The Integrated Use of Alternative Approaches for Predicting Toxic Hazard. ECVAM Workshop Report 8. ATLA 23, str. 410-429. |
|
(2) |
Young, J.R., How, M.J., Walker, A.P., Worth W.M.H. (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicollogy In Vitro, 2, str. 19-26. |
|
(3) |
Worth, A.P., Fentem, J.H., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Liebsch, M. (1998) Evaluation of the proposed OECD Testing Strategy for skin corrosion. ATLA 26, str. 709-720. |
|
(4) |
ECETOC (1990) Monograph No 15, „Skin Irritation”, European Chemical Industry, Ecology and Toxicology Centre, Brussels. |
|
(5) |
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Edsail, D.J., Holzhutter, H.G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology In Vitro 12, str. 483-524. |
|
(5a) |
Ispitna metoda B.40 Nagrizanje kože. |
|
(6) |
OECD (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonisation of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22-24 January 1996 (http://www.oecd1.org/ehs/test/background.htm). |
|
(7) |
OECD (1998) Harmonised Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www.oecd1.org/ehs/Class/HCL6.htm). |
|
(8) |
OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. OECD Environmental Health and Safety Publications. Series on Testing and Assessment No 19 (http://www.oecd1.org/ehs/test/monos.htm). |
|
(9) |
EPA (1990). Atlas of Dermal Lesions, (20T-2004). United States Environmental Protection Agency, Office of Pesticides and Toxic Substances, Washington, DC, August 1990. (Mogu se dobiti na zahtjev u tajništvu OECD-a). |
Tablica 1.
UTVRĐIVANJE STUPNJA KOŽNE REAKCIJE
Nastanak eritema i eshara (crvenila kože i krasta)
|
Nema eritema |
0 |
|
Lagano izraženi eritemi (jedva uočljivi) |
1 |
|
Dobro definirani eritemi |
2 |
|
Srednje do jako izraženi eritemi |
3 |
|
Jako izraženi eritemi (tamno crvenilo, poput boje govedine) uz stvaranje eshara koje sprečavaju utvrđivanje stupnja eritema |
4 |
Najviši mogući stupanj: 4
Nastanak edema
|
Nastanak edema |
0 |
|
Nema edema |
1 |
|
Lagani edemi (rubovi površine izdignuti i jasno definirani) |
2 |
|
Srednji edemi (izdignuti približno 1 mm) |
3 |
|
Jaki edemi (izdignuti više od 1 mm i šire se izvan površine izlaganja) |
4 |
Najviši mogući stupanj: 4
U slučaju nejasnih reakcija može se obaviti histopatološki pregled.
Dodatak
A. Strategija sekvencijskog ispitivanja nadraživanja i nagrizanja kože
OPĆENITA RAZMATRANJA
U interesu ispravnog korištenja znanosti i dobrobiti životinja, važno je izbjegavati nepotrebno korištenje životinja i svesti na minimum sva ispitivanja koja bi mogla uzrokovati teške reakcije. Prije razmatranja mogućnosti ispitivanja neke tvari in vivo treba procijeniti sve postojeće informacije koje se odnose na moguća nadražujuća/nagrizajuća svojstva predmetne tvari. Možda već postoji dovoljno dokaza da se tvar može klasificirati s obzirom na njezino nagrizajuće ili nadražujuće djelovanje na kožu, bez potrebe za provođenjem ispitivanja na laboratorijskim životinjama. Prema tome, primjenom analize već postojećih znanstvenih dokaza i strategije sekvencijskog ispitivanja, potreba za ispitivanjima in vivo svest će se na minimum, što je posebno važno ako postoji vjerojatnost da će predmetna tvar izazvati teške reakcije.
Preporuča se korištenje analize postojećih znanstvenih dokaza kako bi se na temelju raspoloživih informacija o nadražujućem i nagrizajućem djelovanju tvari na kožu moglo ocijeniti je li potrebno obaviti neke druge studije koje ne uključuju ispitivanja na koži in vivo, i koje bi pomogle u karakterizaciji takvog potencijala tvari. U slučajevima kad su potrebna daljnja istraživanja preporuča se primjena sekvencijske strategije ispitivanja kako bi se postupno došlo do relevantnih pokusnih podataka. Kad se radi o tvarima koje nisu bile prethodno ispitane, treba primijeniti strategiju sekvencijskog ispitivanja kako bi se dobila skupina podataka koji su relevantni za ocjenjivanje potencijala ispitivane tvari da na kožu djeluje nagrizajuće/nadražujuće. Strategija opisana u ovom Dodatku razvijena je u okviru jedne OECD-ove radionice (1), a kasnije je potvrđena i proširena u sklopu Usklađenog integriranog sustava za klasifikaciju opasnosti od štetnog djelovanja kemijskih tvari na ljudsko zdravlje i okoliš, koji je odobren na 28. zajedničkom sastanku Odbora za kemikalije i radne skupine za kemikalije, u studenome 1998. (2).
Iako ova strategija sekvencijskog ispitivanja nije sastavni dio ispitne metode B.4, ona odražava preporučeni pristup utvrđivanju nadražujućeg/nagrizajućeg djelovanja tvari na kožu. Ovaj pristup predstavlja najbolje praktično i etičko polazište za in vivo ispitivanja vezana uz nadraživanje/nagrizanje kože. Ova ispitna metoda daje smjernice za izvođenje in vivo ispitivanja i sažeti prikaz faktora na koje je potrebno obratiti pozornost prije razmatranja takvog ispitivanja. Strategija sekvencijskog ispitivanja određuje pristup ocjenjivanju postojećih podataka o nadražujućem/nagrizajućem djelovanju ispitivanih tvari na kožu i slojeviti pristup dobivanju relevantnih podataka o tvarima za koje su potrebne dodatne studije, ili za koje studije još nisu provedene. Prema toj se strategiji isto tako preporučuje provođenje validiranih i prihvaćenih in vitro ili ex vivo ispitivanja nagrizajućeg/nadražujućeg djelovanja tvari na kožu u određenim okolnostima.
OPIS STRATEGIJE OCJENJIVANJA I ISPITIVANJA
Prije obavljanja ispitivanja u okviru strategije sekvencijskog ispitivanja (Slika), treba ocijeniti sve raspoložive informacije kako bi se utvrdilo je li in vivo ispitivanje na koži uopće potrebno. Iako se ocjenjivanjem pojedinačnih parametara mogu dobiti značajne informacije (npr. ekstremni pH), treba imati na umu cjelovitost postojećih informacija. Kod donošenja odluke na temelju postojećih znanstvenih dokaza, treba ocijeniti sve relevantne podatke o djelovanju predmetne tvari, ili tvari koje su joj slične, te navesti na čemu se odluka temelji. Naglasak prvenstveno treba staviti na postojeće podatke o djelovanju tvari na ljude i životinje, a odmah iza tog slijede rezultati ispitivanja in vitro ili ex vivo. Kad god je moguće treba izbjegavati studije nagrizajućih tvari in vivo. Čimbenici koje treba uzeti u obzir u strategiji ispitivanja uključuju:
Ocjenjivanje postojećih podataka dobivenih ispitivanjima na ljudima i životinjama (Faza 1.). Najprije treba razmotriti postojeće podatke o djelovanju na ljude npr. kliničke ili profesionalne studije i izvješća o pojedinim slučajevima i/ili podatke o ispitivanjima na životinjama, npr. na temelju ispitivanja toksičkog djelovanja na kožu pri jednokratnoj ili višekratnoj izloženosti, budući da se tako dobiju informacije koje se izravno odnose na djelovanje na kožu. Tvari za koje se zna da djeluju nadražujuće ili nagrizajuće i tvari za koje postoje jasni dokazi da nemaju niti nagrizajuća niti nadražujuća svojstva, ne moraju se ispitivati u in vivo studijama.
Analiza odnosa strukture i djelovanja (SAR) (Faza 2.). Treba uzeti u obzir rezultate ispitivanja strukturno srodnih tvari, ako takvi rezultati postoje. Ako ima dovoljno podataka o djelovanju strukturno srodnih tvari ili mješavina takvih tvari na ljude i/ili životinje, iz kojih je vidljiv njihov potencijal za nagrizanje/nadraživanje kože, može se pretpostaviti da će ispitivana tvar koja je predmet procjene proizvesti iste reakcije. U takvim slučajevima može se utvrditi da predmetnu tvar nije potrebno ispitivati. Negativni rezultati proizašli iz studija strukturno srodnih tvari ili mješavina takvih tvari ne čine dovoljan dokaz da tvar nije nagrizajuća/nadražujuća, u skladu sa strategijom sekvencijskog ispitivanja. Za utvrđivanje nagrizajućeg i nadražujućeg potencijala tvari treba primijeniti validirani i prihvaćeni SAR pristup.
Fizikalno-kemijska svojstva i kemijska reaktivnost (Faza 3.). Tvari koje pokazuju ekstremne pH vrijednosti kao npr. ≤ 2,0 i ≥ 11,5 mogu imati jako lokalno djelovanje. Ako ekstremna pH vrijednost predstavlja osnovu po kojoj se neka tvar svrstava kao nagrizajuća za kožu, onda se isto tako može uzeti u obzir njezina kisela/alkalna rezerva (ili puferski kapacitet) (3)(4). Ako se na temelju puferskog kapaciteta može zaključiti da neka tvar možda ne nagriza kožu, da bi se to potvrdilo treba obaviti daljnja ispitivanja, pri čemu se preporuča primjena nekog validiranog i prihvaćenog in vitro ili ex vivo testa. (vidjeti faze 5. i 6.).
Dermalna toksičnost (Faza 4.) Ako se za neku kemikaliju dokaže da je jako toksična kad se unese u organizam preko kože, in vivo ispitivanje nadražujućeg/nagrizajućeg djelovanja na kožu se ne preporuča budući da količina ispitivane tvari koja se obično nanosi može biti viša od vrlo toksične doze, pa prema tome može uzrokovati smrt ili jako trpljenje životinja. Osim toga, ako su već na albino kunićima provedene studije dermalne toksičnosti do granične visine doze od 2 000 mg/kg tjelesne mase ili više, a da pritom nisu opaženi znakovi nadraženosti ili nagrizanja kože, dodatna ispitivanja nadražujućeg/nagrizajućeg djelovanja mogu biti sasvim nepotrebna. Kod procjene akutne dermalne toksičnosti na temelju prethodnih studija treba imati na umu nekoliko stvari. Na primjer, zabilježeni podaci o kožnim lezijama mogu biti nepotpuni. Ispitivanja i opažanja možda nisu bila provedena na kunićima već na nekoj drugoj životinjskoj vrsti, a vrste se mogu znatno razlikovati po osjetljivosti, odnosno po reakcijama. Isto tako oblik ispitivane tvari primijenjene na životinje možda nije bio prikladan za ocjenjivanje nadražujućeg/nagrizajućeg djelovanja na kožu (npr. tvari za ispitivanje dermalne toksičnosti u razrijeđenom obliku (5)). Međutim, u slučajevima kad su dobro uobličene i provedene studije dermalne toksičnosti bile provedene na kunićima, negativni nalazi mogu se smatrati dovoljnim dokazom da tvar nije nagrizajuća odnosno nadražujuća.
Rezultati in vitro ili ex vivo ispitivanja (faze 5. i 6.). Tvari koje su pokazale nagrizajuća ili jaka nadražujuća svojstva kod validiranih i prihvaćenih ispitivanja in vitro ili ex vivo (6)(7) koja su bila osmišljena za ocjenjivanje upravo tih učinaka, ne treba ispitivati na životinjama. Može se pretpostaviti da će te tvari proizvesti slične učinke in vivo.
In vivo ispitivanja na kunićima (faze 7. i 8.). U slučaju da se na temelju postojećih znanstvenih dokaza donese odluka o provođenju ispitivanja in vivo, ono treba započeti inicijalnim testom na jednoj životinji. Ako rezultati tog testa pokažu da tvar nagriza kožu, daljnja ispitivanja ne treba provoditi. Ako se u inicijalnom testu ne opazi nagrizajuće djelovanje tvari, njezino nadražujuće djelovanje ili negativnu reakciju treba potvrditi na dvije dodatne životinje koje se četiri sata izlažu ispitivanoj tvari. Ako se kod inicijalnog testa opazi nadražujuće djelovanje, potvrdni se test može obaviti sekvencijski ili istovremenim izlaganjem dviju dodatnih životinja.
REFERENCE
|
(1) |
OECD, (1996) Test Guidelines Programme: Final Report on the OECDWorkshop on Harmonisation of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held on Solna, Sweden, 22-24 January 1996 (http://www1.oecd.org/ehs/test/background.htm). |
|
(2) |
OECD, (1998) Harmonised Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www1.oecd.org/ehs/Class/HCL6.htm). |
|
(3) |
Worth, A.P., Fentem J.H., Balls M., Botham P.A., Curren R.D., Earl L.K., Esdaile D.J., Liebsch M., (1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26, str. 709-720. |
|
(4) |
Young, J.R., How, M.J., Walker, A.P., Worth, W.M.H., (1988). Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substances, Without Testing on Animals. Toxicology In Vitro, 2(1), str. 19-26. |
|
(5) |
Patil, S.M., Patrick, E., Maibach, H.I. (1996) Animal, Human, and In Vitro Test Methods for Predicting Skin Irritation, in: Francis N. Marzulli and Howard I. Maibach (editors): Dermatotoxicology. Fifth Edition ISBN 1-56032-356-6, Chapter 31, str. 411-436. |
|
(6) |
Ispitna metoda B.40. |
|
(7) |
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhutter, H.G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology In Vitro 12, str. 483-524. |
Slika
STRATEGIJA ISPITIVANJA I OCJENJIVANJA NADRAŽUJUĆEG/NAGRIZAJUĆEG DJELOVANJA NA KOŽU

B.5. AKUTNA TOKSIČNOST: NADRAŽIVANJE/NAGRIZANJE OČIJU
1. METODA
Ova je metoda istovjetna metodi OECD TG 405 (2002.).
1.1 UVOD
Kod pripreme ove nove dopunjene metode posebna pozornost posvećena je mogućim poboljšanjima u smislu procjenjivanja svih postojećih informacija o ispitivanoj tvari kako bi se izbjeglo nepotrebno ispitivanje na laboratorijskim životinjama i pridonijelo njihovoj dobrobiti. Ova metoda sadrži preporuku da se prije provođenja opisanog in vivo ispitivanja akutnog nagrizajućeg/nadražujućeg djelovanja tvari na oči obavi analiza već postojećih relevantnih znanstvenih dokaza (1). Ako nema dovoljno raspoloživih podataka, preporuča se njihovo prikupljanje kroz primjenu sekvencijskog ispitivanja (2)(3). Strategija ispitivanja uključuje provođenje validiranih i prihvaćenih ispitivanja in vitro, a opisana je u Dodatku ispitnoj metodi. Osim toga, preporuča se primjena testa na nadraživanje/nagrizanje kože kako bi se nagrizajuće djelovanje na oči moglo predvidjeti prije razmatranja mogućnosti provođenja in vivo ispitivanja na očima.
U interesu ispravnog korištenja znanosti i dobrobiti životinja, ispitivanja in vivo ne bi smjela doći u obzir sve dok se primjenom analize postojećih znanstvenih dokaza ne procijene svi raspoloživi podaci koji su relevantni za nagrizajuće/nadražujuće djelovanje predmetne tvari na oči. Takvi će podaci obuhvaćati dokaze koji proizlaze iz postojećih studija provedenih na ljudima i/ili laboratorijskim životinjama, dokaze o nagrizajućim/nadražujućim svojstvima jedne ili više strukturno srodnih tvari ili mješavina tih tvari, podatke koji ukazuju na jaku kiselost ili lužnatost ispitivane tvari (4)(5) i rezultate validiranih i prihvaćenih in vitro ili ex vivo ispitivanja (6)(6a). Te studije mogu se obaviti prije analize postojećih znanstvenih dokaza, ili mogu proizaći iz te analize.
Kod nekih tvari takva analiza može ukazati na potrebu za in vivo ispitivanjem potencijalnog nadražujućeg/nagrizajućeg djelovanja tvari na oči. U svim se takvim slučajevima prije razmatranja primjene in vivo testa na očima preporuča provesti in vivo studiju djelovanja tvari na kožu i ocijeniti je u skladu s Ispitnom metodom B.4. (7). Primjena analize postojećih znanstvenih dokaza i strategija sekvencijskog ispitivanja trebala bi smanjiti potrebu za in vivo ispitivanjem nagrizajućeg/nadražujućeg djelovanja tvari na oči, za koje postoje dostatni dokazi iz drugih studija. Ako se potencijal tvari za nagrizajuće ili nadražujuće djelovanje na oči ne može odrediti primjenom strategije sekvencijskog ispitivanja, čak ni nakon provedene in vivo studije nagrizajućeg i nadražujućeg djelovanja na kožu, in vivo ispitivanje nagrizajućeg/nadražujućeg djelovanja na oči smije se provesti.
Strategija sekvencijskog ispitivanja kojoj se daje prednost i koja uključuje provođenje validiranih i prihvaćenih in vitro i ex vivo ispitivanja nagrizajućih/nadražujućih svojstava tvari sadržana je u Dodatku ovoj metodi. Ova je strategija razvijena u okviru radionice u organizaciji OECD-a (8) i sudionici te radionice jednoglasno je preporučuju, a usvojena je kao preporučena strategija ispitivanja u okviru Globalno usklađenog sustava klasifikacije kemijskih tvari (GHS) (9). Primjena ove strategije preporuča se prije ispitivanja in vivo. Kad su u pitanju nove tvari, za ispitivanja se preporuča fazni pristup, kako bi se o nagrizajućim/nadražujućim svojstvima tih tvari dobili znanstveno ispravni podaci. Kad su u pitanju otprije poznate tvari o čijem nagrizajućem/nadražujućem djelovanju na kožu i oči nema dovoljno podataka, istu strategiju treba primijeniti za dopunu podataka. Za primjenu drugačije strategije ili postupka ispitivanja, odnosno za odluku da se ne primijeni metoda faznog ispitivanja, treba navesti razloge.
1.2. DEFINICIJE
Nadraživanje oka: promjene na oku koje su rezultat primjene ispitivane tvari na vanjsku površinu oka i koje su potpuno reverzibilne u roku 21 dan nakon primjene tvari.
Nagrizanje oka: oštećenja oka, ili ozbiljno fizičko pogoršanje vida, koje je rezultat primjene ispitivane tvari na vanjsku površinu oka i koje nisu u potpunosti reverzibilne u roku 21 dan nakon primjene tvari.
1.3. NAČELO ISPITNE METODE
Jedna doza ispitivane tvari primjenjuje se na jedno oko pokusne životinje; netretirano oko služi za kontrolu. Stupanj nadraženosti/nagriženosti oka ocjenjuje se na temelju zabilježenih lezija očne spojnice (sluznice), rožnice i šarenice u određenim intervalima. Opisuju se i ostale promjene na oku, kao i sustavne promjene, kako bi se osigurala kompletna procjena djelovanja tvari. Studija treba trajati dovoljno dugo da se ocijeni reverzibilnost, odnosno ireverzibilnost učinaka.
Životinje koje pokazuju stalne znakove jakog stresa i/ili boli u bilo kojoj fazi ispitivanja treba humano usmrtiti, a ispitivanu tvar ocijeniti s tim u skladu. Kriteriji za donošenje odluke o humanom usmrćivanju životinja koje su na umoru i koje jako pate mogu se naći u referentnoj literaturi pod brojem (10).
1.4. OPIS ISPITNE METODE
1.4.1. Priprema za ispitivanje in vivo
1.4.1.1. Odabir životinjske vrste
Preporuča se korištenje albino kunića, i to zdravih odraslih primjeraka. U slučaju da se koristi neka druga životinjska vrsta, treba navesti razloge za to.
1.4.1.2. Priprema životinja
Oba oka svake pokusne životinje odabrane za ispitivanje treba pregledati 24 sata prije početka ispitivanja. Životinje kod kojih se utvrdi nadraženost očiju, očni defekti ili već postojeća ozljeda rožnice ne smiju se koristiti.
1.4.1.3. Uvjeti držanja i hranjenja životinja
Životinje trebaju biti smještene pojedinačno. Kad su u pitanju kunići, temperatura prostorije u kojoj se životinje drže treba biti 20 °C (± 3 °C). Iako relativna vlažnost zraka treba biti najmanje 30 % i po mogućnosti ne više od 70 %, osim za vrijeme čišćenja prostorije, treba je nastojati održavati na 50-60 %. Osvjetljenje treba biti umjetno i mora se u slijedu izmjenjivati 12 sati svjetla i 12 sati mraka. Što se tiče hranjenja, može se primjenjivati standardna hrana za laboratorijske životinje uz neograničene količine pitke vode.
1.4.2. Ispitni postupak
1.4.2.1. Primjena ispitivane tvari
Ispitivanu tvar treba staviti u konjunktivalnu vrećicu jednog oka svake životinje, pri čemu donji kapak treba lagano odmaknuti od očne jabučice. Kapke zatim treba lagano držati spojenima oko jedne sekunde da bi se spriječilo istjecanje materijala. Drugo oko koje se ne tretira služi za kontrolu.
1.4.2.2. Ispiranje
Oči pokusnih životinja ne smiju se ispirati najmanje 24 sata od primjene ispitivane tvari, osim ako su u pitanju krute tvari (vidjeti odjeljak 1.4.2.3.2.) te u slučaju da odmah dođe do nagrizajućeg ili nadražujućeg djelovanja. Nakon 24 sata oči se mogu isprati, ako se to smatra potrebnim.
Upotreba satelitske skupine životinja za istraživanje utjecaja ispiranja ne preporučuje se ako za to ne postoji znanstveno opravdanje. Ako je satelitska skupina potrebna, treba upotrijebiti dva kunića. Uvjete ispiranja treba detaljno dokumentirati, npr. vrijeme ispiranja; sastav i temperatura otopine za ispiranje; trajanje, količina i brzina primjene otopine.
1.4.2.3. Visina doze
1.4.2.3.1. Ispitivanje tekućina
Za ispitivanje tekućina koristi se doza od 0,1 ml. Sprejevi na pumpicu ne smiju se koristiti za primjenu tvari izravno na oko. Ako je tekućina u spreju, najprije je treba istisnuti u posudu, iz nje uzeti 0,1 ml i nakapati u oko.
1.4.2.3.2. Ispitivanje krutih tvari
Kad se ispituju krute tvari, paste i tvari u obliku čestica, volumen korištene doze treba iznositi 0,1 ml, odnosno njena masa ne smije biti veća od 100 mg. Ispitni materijal treba biti usitnjen u fini prah. Volumen krutog materijala treba izmjeriti nakon što se lagano natisne, npr. lupkanjem po mjernoj posudi. Ako kruta tvar nije odstranjena iz oka pokusne životinje djelovanjem fizioloških mehanizama kod prvog opažanja, jedan sat nakon tretiranja oko se može isprati fiziološkom otopinom ili destiliranom vodom.
1.4.2.3.3. Ispitivanje aerosola
U slučaju sprejeva na pumpicu i aerosola, prije kapanja u oko preporuča se tekućinu staviti u posudu. Jedini izuzetak čine tvari u obliku aerosola pod tlakom koje se u posudu ne mogu staviti zbog hlapljenja. U takvim slučajevima oko treba držati otvorenim i ispitivanu tvar nanijeti na oko jednostavnim prskanjem u trajanju od oko 1 sekunde, s udaljenosti od oko 10 cm ravno ispred oka. Ova razdaljina može varirati ovisno o tlaku i sadržaju spreja. Mora se paziti da ne dođe do oštećenja oka koje može izazvati tlak spreja. U nekim slučajevima može biti potrebno procijeniti mogućnost „mehaničkih” ozljeda koje bi mogao izazvati jaki mlaz iz spreja.
Procjena doze iz aerosola može se napraviti simuliranjem testa na sljedeći način:tvar se spreja na papir za vaganje kroz otvor veličine oka kunića postavljen ravno ispred papira. Povećanje težine papira približno odgovara količini tekućine koja se naspreja u oko. Kod hlapljivih tvari doza se može utvrditi vaganjem posude u koju se naspreja ispitivana tvar prije i nakon pražnjenja posude.
1.4.2.4. Inicijanli test (ispitivanje nadraživanja/nagrizanja oka in vivo na jednoj životinji).
Kako je navedeno u strategiji sekvencijskog ispitivnja (vidjeti Dodatak 1.), čvrsta je preporuka da se test in vivo na početku provodi samo na jednoj životinji.
Ako rezultati ovog testa pokažu da tvar uz primjenu opisanog postupka djeluje na oko nagrizajuće ili jako nadražujuće, daljnja ispitivanja nadraživanja oka ne smiju se provoditi.
1.4.2.5. Lokalni anestetici
Od slučaja do slučaja mogu se upotrijebiti lokalni anestetici. Ako analiza postojećih znanstvenih dokaza pokaže da bi ispitivana tvar mogla izazvati bol, ili ako inicijalno ispitivanje pokaže da će doći do bolne reakcije, prije primjene ispitivane tvari može se upotrijebiti neki lokalni anestetik. Vrstu, koncentraciju i dozu lokalnog anestetika treba pažljivo odabrati kako bi se osiguralo da njegova upotreba neće izazvati drugačiju reakciju životinje na ispitivanu tvar. Anesteziju treba primijeniti i na kontrolno oko.
1.4.2.6. Potvrdni test (ispitivanje nadraživanja/nagrizanja oka in vivo na dodatnim životinjama)
Ako se nagrizajuće djelovanje ne opazi tijekom inicijalnog testa, nadražujuću ili negativnu reakciju treba potvrditi koristeći do dvije dodatne životinje. Ako se tijekom inicijalnog testa opazi jako nadražujuće djelovanje koje upućuje na mogući jaki (ireverzibilni) učinak kod potvrdnog testa, preporuka je da se potvrdni test obavi sekvencijski, na jednoj po jednoj životinji, a ne da se istodobno izlože dvije dodatne životinje. Ako se na drugoj životinji otkrije nagrizajuće ili jako nadražujuće djelovanje, ispitivanje se ne nastavlja. U slučaju slabih ili srednje jakih nadražujućih učinaka može se ukazati potreba za korištenjem dodatnih životinja.
1.4.2.7. Razdoblje opažanja
Opažanje treba trajati dovoljno dugo da se u potpunosti može utvrditi jačina i reverzibilnost opaženih učinaka. Međutim, pokus treba prekinuti čim životinja počne pokazivati trajne znakove jake boli ili stresa (9). Da bi se utvrdila reverzibilnost učinaka, životinje obično treba opažati 21 dan od primjene ispitivane tvari. Ako se reverzibilnost uoči prije 21. dana, pokus treba odmah prekinuti.
1.4.2.7.1. Klinička opažanja i stupnjevanje reakcija oka
Oči treba pregledati nakon jednog, 24, 48 i 72 sata od primjene ispitivane tvari. Životinje ne treba držati u uvjetima ispitivanja duže nego što je potrebno za dobivanje konačnih rezultata. Životinje koje pokazuju znakove trajne jake boli ili stresa treba bez odlaganja humano usmrtiti, a tvar ocijeniti u skladu s tim. Životinje kod kojih se nakon primjene tvari uoče sljedeće lezije oka treba humano usmrtiti: perforacija ili znatna ulceracija rožnice, uključujući stafilom; krv u prednjoj očnoj komori; zamućenje rožnice 4. stupnja u trajanju od 48 sati; nedostatak svjetlosnog refleksa (reakcija šarenice 2. stupnja) u trajanju od 72 sata; ulceracija konjunktivalne membrane; nekroza očne spojnice (konjunktive) ili trećeg kapka (membrane nictitans); ili ljuštenje. Razlog je tome što takve lezije općenito nisu reverzibilne.
Životinje kod kojih se ne pojave očne lezije mogu se usmrtiti najranije tri dana nakon primjene tvari. Životinje s laganim do srednjim lezijama treba opažati dok lezije ne nestanu ili 21 dan, kada se ispitivanje prekida. Opažanja treba provoditi sedmi, 14., i 21. dan kako bi se utvrdilo stanje lezija i njihova reverzibilnost ili i reverzibilnost.
Kod svakog pregleda treba zabilježiti stupnjeve reakcija oka (očne spojnice, rožnice i šarenice) (Tablica 1.). Isto tako treba zabilježiti bilo kakve druge lezije oka (npr. panus, obojenje), kao i sustavne štetne učinke.
Pregled reakcija može se olakšati upotrebom binokularne lupe, ručne slit-lampe, biomikroskopa i drugih prikladnih pomagala. Nakon bilježenja opažanja nakon 24 sata, oči se mogu dodatno pregledati pomoću fluoroesceina.
Stupnjevanje očnih reakcija po svojoj je prirodi subjektivno. Da bi se poboljšala usklađenost u stupnjevanju kožnih reakcija te da bi se u tom smislu pomoglo ispitnim laboratorijima i laboratorijima u kojima se obavljaju opažanja i tumače rezultati, osoblje koje obavlja te poslove treba proći odgovarajuću obuku za primjenu sustava ocjenjivanja.
2. PODACI
2.2. OCJENA REZULTATA
Pokazatelje nadraženosti očiju treba ocijeniti ovisno o vrsti i stupnju lezija i o njihovoj reverzibilnosti ili ireverzibilnosti. Pojedinačni rezultati ne predstavljaju apsolutni standard za nadražujuća svojstva nekog ispitnog materijala, budući da se ocjenjuju i njegovi drugi učinci. Umjesto toga, na pojedinačne rezultate treba gledati kao na referentne vrijednosti koje imaju značenje samo ako su potkrijepljene potpunim opisom i ocjenom svih opažanja.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora sadržavati sljedeće informacije:
|
|
razlozi za ispitivanje in vivo: analiza postojećih znanstvenih dokaza koji se temelje na ranijim ispitivanjima, uključujući rezultate dobivene primjenom strategije sekvencijskog ispitivanja:
|
|
|
Ispitivana tvar:
|
|
|
Nosač:
|
|
|
Pokusne životinje:
|
|
|
Rezultati:
|
|
|
Diskusija o rezultatima. |
3.2. TUMAČENJE REZULTATA
Ekstrapolacija rezultata studija nadraživanja oka kod laboratorijskih životinja na ljude valjana je samo do određene granice. U mnogim slučajevima albino kunići puno su osjetljiviji na tvari koje nadražuju ili nagrizaju oči.
Pri tumačenju podataka treba paziti da se isključi nadraženost uzrokovana sekundarnom infekcijom.
4. REFERENCE
|
(1) |
Barratt, M.D., Castell, J.V., Chamberlain, M., Combes, R.D., Dearden, J.C., Fentem, J.H., Gerner, I., Giuliani, A., Gray, T.J.B., Livingston, D.J., Provan, W.M., Rutten, F.A.J.J.L., Verhaar, H.J.M., Zbinden, P. (1995) The Integrated Use of Alternative Approaches for Predicting Toxic Hazard. ECVAM Workshop Report 8. ATLA 23, str. 410-429. |
|
(2) |
de Silva, O., Cottin, M., Dami, N., Roguet, R., Catroux, P., Toufic, A., Sicard, C., Dossou, K.G., Gerner, I., Schlede, E., Spielmann, H., Gupta, K.C., Hill, R.N., (1997) Evaluation of Eye Irritation Potential: Statistical Analysis and Tier Testing Strategies. Food Chem. Toxicol 35, str. 159-164. |
|
(3) |
Worth A.P. and Fentem J.H., (1999) A general approach for evaluating stepwise testing strategies ATLA 27, str. 161-177 |
|
(4) |
Young, J.R., How, M.J., Walker, A.P., Worth W.M.H., (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicollogy In Vitro, 2, str. 19-26. |
|
(5) |
Neun, D.J. (1993) Effects of Alkalinity on the Eye Irritation Potential of Solutions Prepared at a Single pH. J. Toxicol. Cut. Ocular Toxicol. 12, str. 227-231. |
|
(6) |
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Edsaile, D.J., Holzhutter, H.G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology In Vitro 12, str. 483-524. |
|
(6a) |
Ispitna metoda B.40 Nagrizanje kože. |
|
(7) |
Ispitna metoda B.4. Akutna toksičnost: nadraživanje/nagrizanje kože. |
|
(8) |
OECD, (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonisation of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22-24 January 1996 (http://www.oecd.org/ehs/test/background.htm). |
|
(9) |
OECD, (1998) Harmonised Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www.oecd.org/ehs/Class/HCL6. htm). |
|
(10) |
OECD, (2000) Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. OECD Environmental Health and Safety Publications. Series on Testing and Assessment No 19 (http://www.oecd.org/ehs/test/monos. htm). |
Tablica 1.
STUPNJEVANJE OČNIH LEZIJA
Rožnica
Zamućenost: stupanj neprozirnosti (treba očitati vrijednosti za najneprozirniji dio rožnice (1)
|
Nema ulceracije ni zamućenosti |
0 |
|
Razbacana ili difuzna područja zamućenosti (osim blagog zamućenja normalnog sjaja); detalji šarenice jasno vidljivi |
1 |
|
Jasno vidljiva prozirna područja; detalji šarenice lagano zasjenjeni |
2 |
|
Sedefasta područja; nisu vidljivi detalji šarenice; veličina zjenice jedva vidljiva |
3 |
|
Zamućena rožnica: šarenica se ne razaznaje zbog zamućenosti |
4 |
Najviši mogući stupanj: 4
NAPOMENE
Šarenica
|
Normalno |
0 |
|
Izrazito produbljeni nabori, kongestija, oteklina, umjerena hiperemija oko rožnice; ili kongestija (proširenje krvnih sudova); šarenica reagira na svjetlo (usporena reakcija smatra se takvim učinkom ispitivane tvari) |
1 |
|
Krvarenje, veliko oštećenje, ili nema reakcije na svjetlo |
2 |
Najviši mogući stupanj: 2
Očna spojnica (konjunktiva)
Crvenilo (odnosi se na palpebralnu i bulbarnu konjunktivu; isključujući rožnicu i šarenicu)
|
Normalno |
0 |
|
Neki krvni sudovi hiperemični (pokazuju abnormalnu akumulaciju krvi) |
1 |
|
Difuzna, skarletno crvena boja; pojedinačni sudovi ne mogu se jasno razaznati |
2 |
|
Difuzno tamno crvenilo (boje mesa) |
3 |
Najviši mogući stupanj: 3
Kemoza
Oteklina (odnosi se na kapak i/ili treći kapak)
|
Normalno |
0 |
|
Oteklina nešto iznad normale |
1 |
|
Očita oteklina, s djelomičnim iskretanjem kapka prema van (everzija) |
2 |
|
Oteklina, kapak napola zatvoren |
3 |
|
Oteklina, kapak više od napola zatvoren |
4 |
Najviši mogući stupanj: 4
Dodatak
Strategija sekvencijskog ispitivanja nadražujućeg i nagrizajućeg djelovanja na oko
OPĆENITA RAZMATRANJA
U interesu ispravne primjene znanosti i dobrobiti životinja važno je izbjegavati nepotrebno korištenje životinja i svesti na minimum ispitivanja koja bi mogla uzrokovati teške reakcije kod životinja. Prije nego bi došlo u obzir ispitivanje in vivo, treba procijeniti sve postojeće informacije o nekoj tvari, vezane uz moguće nadražujuće/nagrizajuće djelovanje te tvari na oči. Možda već postoji dovoljno dokaza da se tvar može klasificirati s obzirom na njezino nagrizajuće ili nadražujuće djelovanje na oči, bez potrebe za provođenjem ispitivanja na laboratorijskim životinjama. Prema tome, primjenom analize postojećih znanstvenih dokaza i strategije sekvencijskog ispitivanja potreba za in vivo ispitivanjima svodi se na minimum, posebno ako postoji vjerojatnost da će tvar izazvati teške reakcije.
Preporuča se korištenje analize postojećih znanstvenih dokaza kako bi se na temelju raspoloživih informacija o nadražujućem i nagrizajućem djelovanju tvari na oči moglo ocijeniti je li potrebno obaviti neke druge studije koje ne uključuju ispitivanja na očima in vivo i koje bi pomogle u karakterizaciji takvog potencijala tvari. Ako su potrebne dodatne studije, za dobivanje relevantnih pokusnih podataka preporuča se primjena strategije sekvencijskog ispitivanja. Kada se radi o tvarima koje nikada nisu bile podvrgnute ispitivanjima, treba primijeniti strategiju sekvencijskog ispitivanja kako bi se dobili relevantni podaci za ocjenjivanje njezinog nagrizajućeg/nadražujućeg djelovanja na oči. Strategija ispitivanja opisana u Dodatku razvijena je u okviru jedne OECD-ove radionice (1). Kasnije je potvrđena i proširena u sklopu Usklađenog integriranog sustava za klasifikaciju opasnosti od štetnog djelovanja kemijskih tvari na ljudsko zdravlje i okoliš, koji je odobren na 28. zajedničkom sastanku Odbora za kemikalije i radne skupine za kemikalije, održanom u studenome 1998. (2).
Iako ova strategija ispitivanja ne čini sastavni dio ispitne metode B.5., ona odražava preporučeni pristup utvrđivanju nadražujućeg/nagrizajućeg djelovanja tvari na oči. Ovaj pristup predstavlja najbolje praktično i etičko polazište za in vivo ispitivanja vezana uz nadraživanje/nagrizanje očiju. Ova ispitna metoda daje smjernice za izvođenje in vivo ispitivanja i sažeti prikaz faktora na koje je potrebno obratiti pozornost prije razmatranja takvog ispitivanja. Strategija sekvencijskog ispitivanja određuje pristup ocjenjivanju postojećih podataka o nadražujućem/nagrizajućem djelovanju ispitivanih tvari na oči i slojeviti pristup dobivanju relevantnih podataka o tvarima za koje su potrebne dodatne studije, ili za koje studije još nisu provedene. Prema toj strategiji najprije se provode validirana i prihvaćena ispitivanja in vitro ili ex vivo, a nakon tog studije nadražujućeg/nagrizajućeg djelovanja na kožu u određenim uvjetima, prema ispitnoj metodi B.4. (3)(4).
OPIS STRATEGIJE FAZNOG ISPITIVANJA
Prije obavljanja ispitivanja u okviru strategije sekvencijskog ispitivanja (Slika), treba procijeniti sve raspoložive informacije kako bi se utvrdilo je li in vivo ispitivanje na očima uopće potrebno. Iako se ocjenjivanjem pojedinačnih parametara mogu dobiti značajne informacije (npr. ekstremni pH), treba procijeniti cjelovitost postojećih informacija. Kod donošenja odluke na temelju postojećih znanstvenih dokaza, treba ocijeniti sve relevantne podatke o djelovanju predmetne tvari, ili tvari koje su joj slične o strukturi, te navesti na čemu se odluka temelji. Naglasak prvenstveno treba staviti na postojeće podatke o djelovanju tvari na ljude i životinje, a odmah iza tog slijede rezultati ispitivanja in vitro ili ex vivo. Studije nagrizajućih tvari in vivo treba izbjegavati kad god je moguće. Čimbenici koje treba uzeti u obzir u strategiji ispitivanja uključuju:
Ocjenjivanje postojećih podataka dobivenih ispitivanjima na ljudima i životinjama (Faza 1.). Najprije treba razmotriti postojeće podatke o djelovanju na ljude npr. kliničke i profesionalne studije i izvješća o pojedinim slučajevima i/ili podatke o ispitivanjima na životinjama u okviru studija o djelovanju na oči, budući da se tako dobiju informacije koje se izravno odnose na djelovanje na oči. Nakon tog treba ocijeniti raspoložive podatke dobivene na temelju studija provedenih na ljudima i/ili životinjama, predmet kojih je bilo istraživanje nagrizajućeg/nadražujućeg djelovanja na kožu. U oči životinja ne smiju se stavljati tvari za koje se zna da djeluju nadražujuće ili nagrizajuće na oči, kao ni tvari koje su pokazale nagrizajuće ili nadražujuće djelovanje na kožu; takve se tvari smatraju nagrizajućima i/ili nadražujućima i za oči. Tvari za koje na temelju prijašnjih studija na očima postoji dovoljno dokaza da nemaju niti nagrizajuća niti nadražujuća svojstva isto se tako ne moraju ispitivati u in vivo studijama.
Analiza odnosa strukture i djelovanja (SAR) (Faza 2.). Treba uzeti u obzir rezultate ispitivanja strukturno srodnih tvari, ako takvi postoje. Ako ima dovoljno podataka o djelovanju strukturno srodnih tvari ili mješavina takvih tvari na ljude i/ili životinje, iz kojih je vidljiv njihov potencijal za nagrizanje/nadraživanje očiju, može se pretpostaviti da će ispitivana tvar proizvesti iste reakcije. U takvim slučajevima može se utvrditi da predmetnu tvar nije potrebno ispitivati. Negativni rezultati proizašli iz studija strukturno srodnih tvari ili mješavina takvih tvari ne čine dovoljan dokaz da tvar nije nagrizajuća/nadražujuća u skladu sa strategijom sekvencijskog ispitivanja. Za utvrđivanje nagrizajućeg i nadražujućeg potencijala tvari, s obzirom na njezino djelovanje i na kožu i oči, treba primijeniti validirani i prihvaćeni SAR pristup.
Fizikalno-kemijska svojstva i kemijska reaktivnost (Faza 3.). Tvari koje pokazuju ekstremne pH vrijednosti kao npr. ≤ 2,0 ili ≥ 11,5 mogu imati jako lokalno djelovanje. Ako ekstremna pH vrijednost predstavlja osnovu po kojoj se neka tvar svrstava kao nagrizajuća ili nadražujuća za oči, onda se isto tako može uzeti u obzir njezina kisela/alkalna rezerva (ili puferski kapacitet) (5)(6). Ako se na temelju puferskog kapaciteta može zaključiti da neka tvar možda ne nagriza oči, da bi se to potvrdilo treba obaviti daljnja ispitivanja, pri čemu se preporuča primjena nekog validiranog i prihvaćenog in vitro ili ex vivo testa. (vidjeti faze 5. i 6.).
Razmatranje drugih postojećih informacija (Faza 4.). U ovoj fazi treba proučiti sve raspoložive informacije o sustavnoj toksičnosti kod primjene dermalnim putem. Isto tako treba uzeti u obzir i akutnu dermalnu toksičnost ispitivane tvari. Ako se ispitivana tvar pokazala vrlo toksičnom kod primjene dermalnim putem, može se zaključiti da je nije potrebno ispitivati na očima. Iako ne mora uvijek postojati povezanost između akutne dermalne toksičnosti i nadraživanja/nagrizanja očiju, može se pretpostaviti da će neko sredstvo koje je vrlo toksično kad se primjenjuje dermalnim putem isto tako pokazati visoku toksičnost ako se nakapa u oko. Takvi se podaci isto tako mogu razmatrati između faza 2. i 3.
Rezultati in vitro ili ex vivo ispitivanja (faze 5. i 6.). Tvari koje su pokazale nagrizajuća ili jaka nadražujuća svojstva kod ispitivanja in vitro ili ex vivo (7)(8) koja su bila validirana i prihvaćena posebno za ocjenjivanje nagrizajućeg/nadražujućeg djelovanja na oči ili kožu, ne treba ispitivati na životinjama. Može se pretpostaviti da će te tvari proizvesti slične učinke in vivo. Ako ne postoje validirani i prihvaćeni testovi in vitro/ex vivo, treba preskočiti faze 5. i 6. i odmah prijeći na fazu 7.
In vivo procjena nadražujućeg ili nagrizajućeg djelovanja tvari (Faza 7.). Ako se analiza postojećih znanstvenih dokaza o potencijalnim nadražujućim/nagrizajućim svojstvima neke tvari, koji se temelje na podacima iz gore navedenih studija ne može napraviti jer nema dovoljno takvih dokaza, najprije treba ocijeniti nadražujući/nagrizajući potencijal tvari ispitivanjem in vivo na koži, primjenjujući ispitnu metodu B.4. (4) i njezin Dodatak (9). Ako se pokaže nagrizajućom ili jako nadražujućom za kožu, treba se smatrati isto tako nagrizajućom i nadražujućom za oči, ako neke druge informacije ne idu u prilog drugačijem zaključku. Tada nema potrebe za provođenjem ispitivanja in vivo. Ako tvar nije nagrizajuća ili jako nadražujuća za kožu, in vivo ispitivanje treba provesti.
In vivo ispitivanje na kunićima (faze 8 i 9): in vivo ispitivanje na očima treba započeti inicijalnim testom na jednoj životinji. Ako rezultati tog testa pokažu da tvar jako nadražuje ili nagriza oči, daljnja ispitivanja ne bi se smjela provoditi. Ako se tim testom ne utvrdi nikakvo nagrizajuće ili nadražujuće djelovanje, provodi se potvrdni test na dvije dodatne životinje.
REFERENCE
|
(1) |
OECD, (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonisation of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22-24 January 1996 (http://www.oecd.org/ehs/test/background.htm). |
|
(2) |
OECD, (1998) Harmonised Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www.oecd.org/ehs/Class/HCL6.htm). |
|
(3) |
Worth, A.P. and Fentem J.H., (1999). A General Approach for Evaluating Stepwise Testing Strategies. ATLA 27, str. 161-177. |
|
(4) |
Ispitna metoda B.4. Akutna toksičnost: nadraživanje/nagrizanje kože. |
|
(5) |
Young, J.R., How, M.J., Walker, A.P., Worth W.M.H., (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicolohy In Vitro, 27, str. 19-26. |
|
(6) |
Neun, D.J., (1993) Effects of Alkalinity on the Eye Irritation Potential of Solutions Prepared at a Single pH. J. Toxicol. Cut. Ocular Toxicol. 12, str. 227-231. |
|
(7) |
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Edsail, D.J., Holzhutter, H.G. and Liebsch, M., (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology In Vitro 12, str. 483-524. |
|
(8) |
Ispitna metoda B.40. Nagrizanje kože. |
|
(9) |
Dodatak ispitnoj metodi B.4: Sekvencijska ispitna strategija za nadraživanje i nagrizanje kože. |
Slika
STRATEGIJA ISPITIVANJA I OCJENJIVANJA NADRAŽUJUĆEG/NAGRIZAJUĆEG DJELOVANJA NA OČI
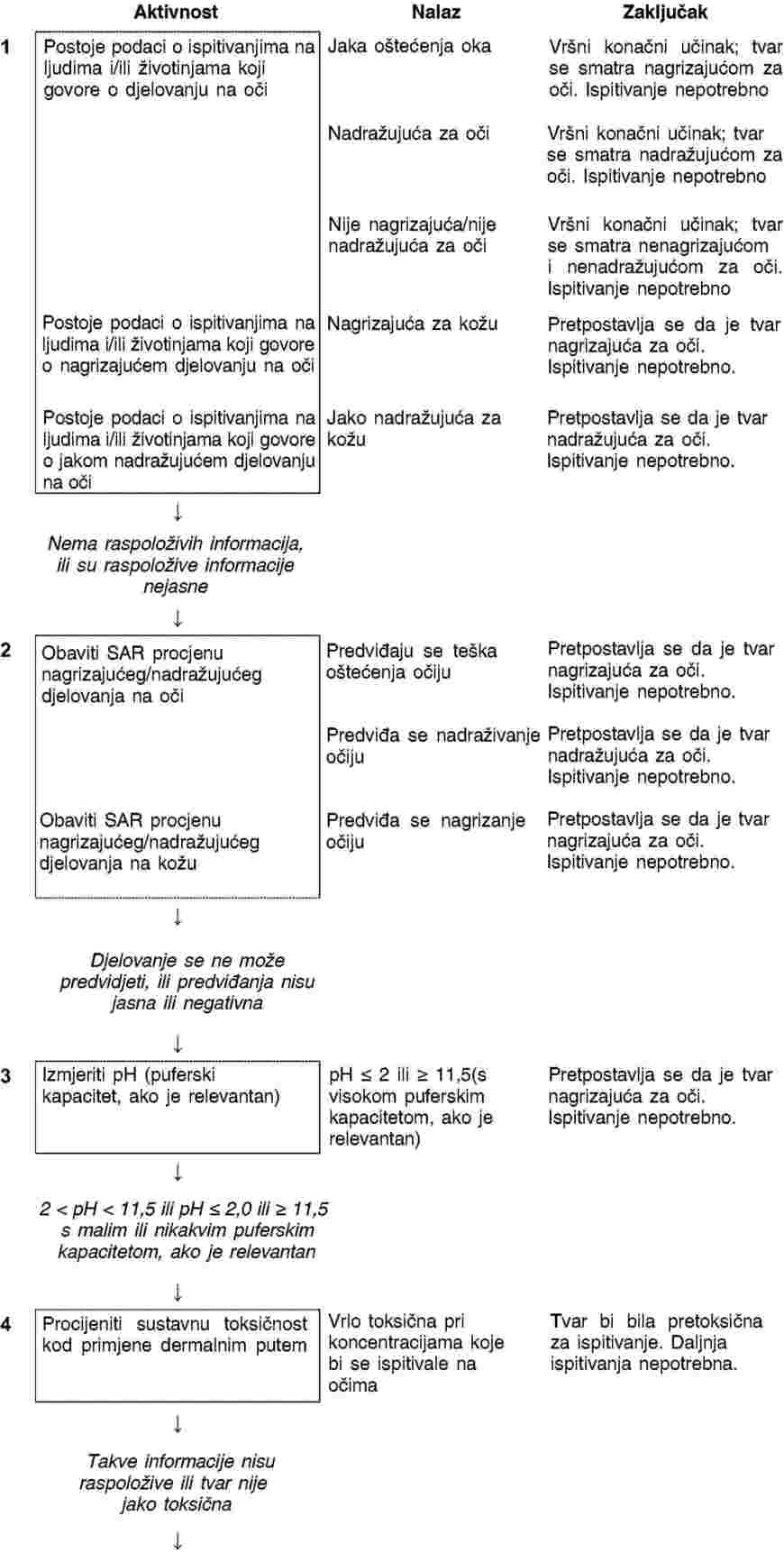

B.6. SENZIBILIZACIJA KOŽE
1. METODA
1.1. UVOD
Napomene:
Osjetljivost testova i njihova sposobnost otkrivanja mogućih senzibilizatora ljudske kože smatraju se važnima u sustavu klasifikacije toksičnosti relevantne za ljudsko zdravlje.
Ne postoji niti jedna ispitna metoda kojom se na primjeren način mogu utvrditi sve tvari koje mogu senzibilizirati ljudsku kožu i koja je relevantna za sve tvari.
Pri odabiru testa treba uzeti u obzir čimbenke kao što su fizikalna svojstva predmetne tvari, uključujući njezinu sposobnost prodiranja u kožu.
Razvijene su dvije vrste testova koji se provode na zamorcima: testovi u kojima se koristi adjuvans, kod kojih se alergijska reakcija pojačava otapanjem ili suspendiranjem ispitivane tvari u Freundovom potpunom adjuvansu (FCA) i testovi u kojima se adjuvans ne koristi.
U načelu su testovi kod kojih se upotrebljava adjuvans točniji u predviđanju vjerojatnog senzibilizacijskog učinka tvari na ljudsku kožu od onih kod kojih se Freundov potpuni adjuvans ne upotrebljava, pa su zato kao metoda primjereniji.
Maksimizacijski test sa zamorcima (GPMT) često je primjenjivani test s adjuvansom. Iako se može koristiti nekoliko drugih metoda za utvrđivanje potencijala tvari da prouzroči senzibilizacijsku reakciju kože, GPMT se smatra najprimjerenijom tehnikom u kojoj se koristi adjuvans.
Za mnoge se kemijske klase manje osjetljivima smatraju testovi u kojima se adjuvans ne koristi (preferira se Buehlerov test).
U određenim slučajevima mogu postojati utemeljeni razlozi za odabir Buehlerovog testa u kojem se ispitivana tvar primjenjuje lokalno, a ne intramedalnom injekcijom koja se koristi u maksimizacijskom testu sa zamorcima. U slučajevima kad se koristi Buehlerov test potrebno je dati znanstveno opravdanje.
Maksimizacijski test na zamorcima (GPMT) i Buehlerov test opisani su u ovoj metodi. Druge se metode mogu koristiti ako su ispravno validirane i znanstveno opravdane.
Ako se kod nekog priznatog testa probira utvrdi pozitivan rezultat, ispitivana se tvar može odrediti kao potencijalni senzibilizator pa nije potrebno provoditi daljnja ispitivanja na zamorcima. Međutim, ako se kod takvog testa utvrdi negativan rezultat, mora se provesti ispitivanje na zamorcima, uz primjenu postupka opisanog u ovoj ispitnoj metodi.
Vidjeti također Opći uvod, dio B.
1.2. DEFINICIJE
Senzibilizacija kože: (alergijski kontaktni dermatitis) imunološki posredovana kožna reakcija na određenu tvar. Kod ljudi reakciju može karakterizirati pruritis (svrbež), eritemi (crvenilo), edemi (otekline), papule (kožne izbočine), vezikule (mjehurići), bule (mjehuri) ili kombinacija navedenog. Kod drugih životinjskih vrsta reakcije se mogu razlikovati, te se mogu javiti samo eritemi i edemi.
Indukcijsko izlaganje: pokusno izlaganje subjekta ispitivanoj tvari s namjerom izazivanja stanja preosjetljivosti.
Indukcijsko razdoblje: razdoblje od najmanje jednog tjedna nakon indukcijske izloženosti tijekom kojega se može razviti stanje preosjetljivosti.
Provokacijsko izlaganje: pokusno izlaganje prethodno tretiranog subjekta ispitivanoj tvari nakon indukcijskog razdoblja, kako bi se utvrdilo javlja li se kod subjekta reakcija preosjetljivosti.
1.3. REFERENTNE TVARI:
Osjetljivost i pouzdanost pokusne tehnike koja se koristi treba ocjenjivati svakih šest mjeseci pomoću tvari za koje se zna da izazivaju blagu do srednju preosjetljivost kože.
Kod pravilno provedenog ispitivanja tvari koje izazivaju blagu do srednju preosjetljivost treba očekivati reakciju od najmanje 30 % u testu u kojem se adjuvans koristi i najmanje 15 % u testu u kojem se adjuvans ne koristi.
Prvenstveno se upotrebljavaju sljedeće tvari:
|
CAS brojevi |
EINECS brojevi |
EINECS nazivi |
Uobičajeni nazivi |
|
101-86-0 |
202-983-3 |
α-heksilcinamaldehid |
α-heksilcinamaldehid |
|
149-30-4 |
205-736-8 |
benzotiazol-2-tiol (merkaptobenzotiazol) |
kaptaks |
|
94-09-7 |
202-303-5 |
benzokain |
norkain |
U nekim se okolnostima, ako za to postoji primjereno opravdanje, mogu koristiti neke druge kontrolne tvari koje ispunjavaju gore navedeni kriterije.
1.4. NAČELO ISPITNE METODE
Na početku se pokusne životinje izlažu ispitivanoj tvari intramedalnim injekcijama i/ili epidermalnim nanošenjem (indukcijsko izlaganje). Nakon razdoblja odmora od 10 do 14 dana (indukcijsko razdoblje), tijekom kojega se može razviti imuna reakcija, životinje se izlažu provokacijskoj dozi. Obim i stupanj kožne reakcije na provokacijsku izloženost kod pokusnih životinja uspoređuje se s reakcijama opaženim kod kontrolnih životinja koje se tijekom indukcije podvrgavaju simuliranom tretiranju i primaju provokacijsku dozu.
1.5. OPIS ISPITNIH METODA
Ako se uklanjanje ispitivane tvari smatra neophodnim, to treba učiniti vodom ili odgovarajućom otopinom, ne izazivajući promjene u postojećoj reakciji i ne narušavajući cjelovitost epiderme.
1.5.1. Maksimizacijski test na zamorcima (GPMT)
1.5.1.1.
Zdravi mladi odrasli albino zamorci prilagođavaju se laboratorijskim uvjetima najmanje pet dana prije ispitivanja. Životinje se prije testa nasumce biraju i raspoređuju u skupine za tretiranje. Dlaka se odstranjuje šišanjem, brijanjem ili eventualno kemijskom depilacijom, ovisno o ispitnoj metodi koja se koristiti. Mora se paziti da se pritom ne ošteti površina kože. Životinje se važu prije nego ispitivanje započne i na kraju ispitivanja.
1.5.1.2.
1.5.1.2.1. Pokusne životinje
Koriste se albino zamorci sojeva koji se obično koriste u laboratorijima.
1.5.1.2.2. Broj i spol
Mogu se koristiti mužjaci i/ili ženke. Ako se koriste ženke, treba koristiti one koje još nisu imale potomstvo i nisu gravidne.
Koristi se najmanje 10 životinja u skupini za tretiranje i najmanje pet životnija u kontrolnoj skupini. Ako se upotrijebi manje od 20 pokusnih i 10 kontrolnih zamoraca i pritom nije moguće zaključiti da ispitivana tvar spada u senzibilizatore, posebno se preporuča ispitivanje na dodatnim životinjama kako bi se dobio ukupan broj od najmanje 20 pokusnih i 10 kontrolnih životinja.
1.5.1.2.3. Visina doza
Koncentracija ispitivane tvari koja se koristi za svako indukcijsko izlaganje treba biti koncentracija koju životinja sustavno dobro podnosi i najviša koncentracija koja izaziva blagu do srednju nadraženost kože. Koncentracija koja se koristi za provokacijsko izlaganje treba odgovarati najvišoj dozi koja ne izaziva nadraženost. Odgovarajuće koncentracije treba utvrditi na temelju pilotske studije provedene na dvije ili tri životinje, ako nisu raspoložive druge informacije. Treba paziti da se za tu svrhu koriste životinje tretirane uz primjenu potpunog Freundovog adjuvansa (FCA).
1.5.1.3.
1.5.1.3.1. Indukcija
Dan 0 – tretirana skupina
U području ramena, s kojega je prethodno odstranjena dlaka, daju se tri para intradermalnih injekcija volumena 0,1 ml, po jedna injekcija iz svakog para sa svake strane zamišljene središnje linije.
Injekcija 1: mješavina 1:1 (v/v) FCA/voda ili fiziološka otopina.
Injekcija 2: ispitivana tvar u odabranoj koncentraciji u odgovarajućoj otopini.
Injekcija 3: ispitivana tvar u odabranoj koncentraciji, formulirana u mješavini 1:1 (v/v) FCA/voda ili fiziološka otopina.
U injekciji 3 tvari topljive u vodi otopljene su u vodenoj fazi prije miješanja s potpunim Freundovim adjuvansom (FCA). Tvari koje su topljive u mastima ili netopljive suspendiraju se u potpunom Freundovom adjuvansu (FCA) prije miješanja s vodenom fazom. Konačna koncentracija ispitivane tvari mora biti jednaka koncentraciji upotrijebljenoj u injekciji 2.
Injekcije 1 i 2 daju se blizu jedna drugoj i najbliže glavi, dok se injekcija 3 daje više prema kaudalnom (zadnjem) kraju ispitne površine.
Dan 0 – kontrolna skupina
Na ista područja kao i kod tretiranih životinja daju se po tri para intradermalnih injekcija volumena 0,1 ml.
Injekcija 1: mješavina 1:1 (v/v) FCA/voda ili fiziološka otopina.
Injekcija 2: nerazrijeđeni nosač.
Injekcija 3: 50 %-tna w/v formulacija nosača u mješavini 1:1 (v/v) FCA/voda ili fiziološka otopina.
Dan 5-7 – tretirana i kontrolna skupina
Oko 24 sata prije lokalne indukcijske primjene, ako tvar ne nadražuje kožu, ispitna se površina nakon šišanja uz kožu i/ili brijanja tretira s 0,5 ml 10 %-tne otopine natrijevog lauril sulfata u vazelinu, kako bi se izazvala lokalna nadraženost.
Dan 6-8 – tretirana skupina
S ispitne površine se ponovo odstranjuje dlaka. Filtarski papir (2 × 4 cm), potpuno se natopi ispitivanom tvari u odgovarajućem nosaču, stavi na ispitnu površinu i drži u kontaktu s kožom 48 sati pomoću okluzivnog obloga. Treba navesti razloge za odabir nosača. Krute se tvari usitne u fini prah i sjedine u odgovarajućem nosaču. Prema potrebi, tekućine se mogu nanositi nerazrijeđene.
Dan 6-8 – kontrolna skupina
S ispitne se površine ponovo odstranjuje dlaka. Na sličan se način na ispitnu površinu nanosi sami nosač i pomoću okluzivnog obloga drži u kontaktu s kožom 48 sati.
1.5.1.3.2. Provokacija
Dan 20-22 – tretirana i kontrolna skupina
Sa slabina tretiranih i kontrolnih životinja odstrani se dlaka. Krpica ili okluzivna komora (HTC) s ispitivanom tvari stavi se na jednu stranu slabina životinje i, ako je to relevantno za pokus, isto se tako može staviti jedna krpica ili okluzivna komora (HTC) koja sadrži samo nosač. Krpice se 24 sata drže u kontaktu s kožom pomoću okluzivnog obloga.
1.5.1.3.3. Opažanje i ocjenjivanje: tretirana i kontrolna skupina
|
— |
oko 21 sat nakon skidanja komprese provokacijska površina se opere i ošiša uz kožu i/ili obrije i, ako je potrebno, depilira, |
|
— |
oko tri sata kasnije (oko 48 sati od početka provokacijske primjene) kožna se reakcija opaža i bilježi prema stupnjevima prikazanim u Dodatku, |
|
— |
oko 24 sata nakon ovog opažanja provodi se drugo opažanje (72 sata), a rezultati se ponovo bilježe. |
Preporuča se slijepa proba na pokusnim i kontrolnim životinjama.
Ako rezultate dobivene u prvoj provokaciji treba pojasniti, treba razmotriti mogućnost izvedbe druge provokacije (tj. ponovne provokacije) na novoj kontrolnoj skupini, tamo gdje je to primjereno, oko tjedan dana nakon prve provokacije. Ponovna provokacija može se jednako tako provesti na istoj kontrolnoj skupini.
Sve kožne reakcije i sve neuobičajene nalaze, uključujući sustavne reakcije, koji proizlaze iz indukcijskog i provokacijskog postupka treba opažati i bilježiti prema skali za stupnjevanje po Magnussonu/Kligmanu (vidjeti Dodatak). U svrhu pojašnjavanja dvojbenih rezultata mogu se provoditi i drugi postupci, npr. histopatološki pregled, mjerenje debljine kožnih nabora.
1.5.2. Buehlerov test
1.5.2.1.
Zdravi mladi odrasli albino zamorci prilagođavaju se laboratorijskim uvjetima najmanje pet dana prije ispitivanja. Životinje se prije testa nasumce biraju i raspoređuju u skupine za tretiranje. Dlaka se odstranjuje šišanjem, brijanjem ili eventualno kemijskom depilacijom, ovisno o ispitnoj metodi koja će se koristiti. Mora se paziti da se pritom ne ošteti površina kože. Životinje se važu prije početka ispitivanja i na kraju ispitivanja.
1.5.2.2.
1.5.2.2.1. Pokusne životinje
Koriste se albino zamorci sojeva koji se obično koriste u laboratorijima.
1.5.2.2.2. Broj i spol
Mogu se koristiti mužjaci i/ili ženke. Ako se koriste ženke, treba koristiti one koje još nisu imale potomstvo i nisu gravidne.
Koristi se najmanje 20 životinja u skupini za tretiranje i najmanje 10 životinja u kontrolnoj skupini.
1.5.2.2.3. Visina doza
Koncentracija ispitivane tvari koja se koristi za svako indukcijsko izlaganje treba biti najviša moguća koncentracija koja izaziva blagu, a ne pretjeranu nadraženost kože. Koncentracija koja se koristi za provokacijsko izlaganje treba odgovarati najvišoj dozi koja ne izaziva nadraženost. Ako je potrebno, odgovarajuće koncentracije mogu se utvrditi na temelju pilotske studije provedene na dvije ili tri životinje.
Kad se radi o tvarima topljivima u vodi, kao nosač je primjereno koristiti vodu ili razrijeđenu nenadražujuću otopinu surfaktanta. Za druge ispitivane tvari primjerenija je 80 %-tna mješavina etanola i vode za indukciju i aceton za provokaciju.
1.5.2.3.
1.5.2.3.1. Indukcija
Dan 0 – tretirana skupina
S jedne strane slabina odstrani se dlaka (šišanjem uz kožu). Ispitni epikutani sustav (patch sustav) treba biti potpuno natopljen ispitivanom tvari u odgovarajućem nosaču (za odabir nosača treba navesti razloge; tekuće ispitivane tvari mogu se prema potrebi primijeniti nerazrijeđene).
Ispitni epikutani sustav stavi se na ispitnu površinu i drži u kontaktu s kožom pomoću okluzivne krpice ili komore (HTC) i odgovarajućeg obloga šest sati.
Ispitni epikutani sustav mora biti okluzivan. Primjereno je upotrijebiti pamučnu blazinicu koja može biti okrugla ili četverokutna, približne površine 4-6 cm2. Da bi se osigurala okluzija preporuča se životinju sputati pomoću odgovarajućeg pomagala za sputavanje. Ako se upotrijebi oblog možda će biti potrebna dodatna izlaganja.
Dan 0 – kontrolna skupina
S jedne strane slabina odstrani se dlaka (šišanjem uz kožu). Na ispitnu se površinu nanese sami nosač, na isti način koji se primjenjuje na tretiranu skupinu. Ispitni epikutani sustav drži se u kontaktu s kožom pomoću okluzivne krpice ili komore (HTC) i odgovarajućeg obloga šest sati. Ako se može dokazati da lažna kontrolna skupina nije potrebna, može se upotrijebiti netretirana kontrolna skupina.
Dan 6-8 i 13-15 – tretirana i kontrolna skupina
Na dan 6-8 i zatim ponovo na dan 13-15 ispitivana tvar se nanese jednako kao na dan 0 na isto područje (s kojeg se prema potrebi odstrani dlaka).
1.5.2.3.2. Provokacija
Dan 27-29 – tretirana i kontrolna skupina
S netretirane strane slabina tretiranih i netretiranih životinja odstrani se dlaka (šišanjem uz kožu). Okluzivna krpica ili komora (HTC) koja sadrži odgovarajuću količinu ispitivane tvari u maksimalnoj koncentraciji koja ne izaziva nadraženost stavi se na stražnji dio netretirane strane slabina tretiranih i kontrolnih životinja.
U slučajevima kad je to relevantno, okluzivna krpica ili komora (HTC) natopljena samo nosačem stavi se na prednji dio netretirane strane slabina kako tretiranih tako i kontrolnih životinja. Krpice ili komore (HTC) drže se u kontaktu s kožom pomoću odgovarajućeg obloga šest sati.
1.5.2.3.3. Opažanje i ocjenjivanje
|
— |
oko 21 sat nakon skidanja komprese s provokacijske se površine odstrani dlaka, |
|
— |
oko tri sata kasnije (oko 30 sati nakon primjene krpice za provokaciju) kožne se reakcije opažaju i bilježe prema stupnjevima prikazanim u Dodatku, |
|
— |
približno 24 sata nakon 30-satnog opažanja (oko 54 sata nakon stavljanja krpice za provokaciju) kožne se reakcije ponovo opažaju i bilježe. |
Preporuča se slijepa proba na pokusnim i kontrolnim životinjama.
Ako je potrebno pojasniti rezultate dobivene u prvoj provokaciji, treba razmotriti mogućnost izvedbe druge provokacije (tj. ponovne provokacije) na novoj kontrolnoj skupini, tamo gdje je to primjereno, oko tjedan dana nakon prve provokacije. Ponovna provokacija može se provesti na istoj kontrolnoj skupini.
Sve kožne reakcije i sve neuobičajene nalaze, uključujući sustavne reakcije, koji proizlaze iz indukcijskog i provokacijskog postupka treba opažati i bilježiti prema skali za stupnjevanje po Magnussonu/Kligmanu (vidjeti Dodatak). U svrhu pojašnjavanja dvojbenih rezultata mogu se provoditi i drugi postupci, npr. histopatološki pregled, mjerenje debljine kožnih nabora.
2. PODACI (GPMT i Buehlerov test)
Podatke treba rezimirati u obliku tablice u kojoj će biti prikazane kožne reakcije za svaku životinju, zabilježene kod svakog opažanja.
3. IZVJEŠĆIVANJE (GPMT i Buehlerov test)
Ako se prije testa na zamorcima provede test probira, pored rezultata dobivenih s ispitivanom i referentnom tvari, mora se dati opis ili uputa na taj test (npr. test oticanja ušiju kod miševa (MEST) uključujući detaljne podatke o postupku.
Izvješće o ispitivanju (GPMT i Buehlerov test)
Izvješće o ispitivanju treba, ako je moguće, sadržavati sljedeće informacije:
|
|
pokusne životinje:
|
|
|
Uvjeti ispitivanja:
|
|
|
Rezultati:
|
|
|
Diskusija o rezultatima. |
|
|
Zaključci. |
4. REFERENCE
Ova je metoda istovjetna metodi OECD TG 406.
Dodatak
TABLICA
Ljestvica stupnjevanja po Magnussonu/Klingmanu za ocjenjivanje reakcija kod provokacijskog epikutanog (patch) testa
0 = nema vidljive promjene
1 = lagani ili nepovezani (u obliku mrlja) eritem
2 = srednji ili konfluentni (povezan u jednu cjelinu) eritem
3 = jaki eritem i oteklina
B.7. TOKSIČNOST (ORALNA) PRI PONOVLJENOJ DOZI (28 DANA)
1. METODA
1.1. UVOD
Vidjeti Opći uvod, dio B.
1.2. DEFINICIJE
Vidjeti Opći uvod, dio B.
1.3. NAČELO ISPITNE METODE
Ispitivana tvar oralno se primjenjuje svaki dan u sve većim dozama na nekoliko skupina pokusnih životinja, jedna visina doze po skupini, tijekom 28 dana. Tijekom razdoblja primjene životinje se svaki dan pozorno opažaju kako bi se otkrili znakovi toksičnosti. Životinje koje uginu ili ih se usmrti tijekom ispitivanja podvrgavaju se obdukciji, a preživjele se životinje na kraju ispitivanja usmrćuju i potom podvrgavaju obdukciji.
Ova metoda jači naglasak stavlja na neurološke reakcije kao specifični konačni učinak, a naglašava i potrebu za pozornim kliničkim opažanjem životinja kako bi se dobilo što je moguće više informacija. Cilj je ove metode identificirati kemikalije koje imaju neuro toksički potencijal, što može zahtijevati daljnja podrobna istraživanja ovog aspekta. Osim toga, ova metoda može pokazati imunološke učinke i reproduktivnu toksičnost.
1.4. OPIS ISPITNE METODE
1.4.1. Priprema
Zdrave mlade odrasle životinje nasumce se raspoređuju u kontrolnu skupine i skupine koja će se tretirati. Kaveze treba tako rasporediti da se učinci do kojih bi moglo doći zbog njihovog položaja svedu na minimum. Životinje treba označiti jedinstvenim oznakama i držati u kavezima najmanje pet dana prije početka studije, kako bi se mogle prilagoditi laboratorijskim uvjetima.
Ispitivana se tvar primjenjuje pomoću želučane sonde ili preko hrane ili vode za piće. Metoda oralne primjene ovisi o namjeni studije i o fizikalnim/kemijskim svojstvima tvari.
Prema potrebi tvar se otopi ili suspendira u odgovarajućem nosaču. Preporuča se, kad god je to moguće, najprije razmotriti mogućnost upotrebe vodene otopine/suspenzije, zatim uljne otopine/suspenzije (npr. kukuruzno ulje) i tek onda mogućnost upotrebe otopina u drugim nosačima. Ako se koriste drugi nosači, a ne voda, moraju biti poznata toksička svojstva tih nosača. Treba utvrditi stabilnost ispitivane tvari u nosaču.
1.4.2. Uvjeti ispitivanja
1.4.2.1. Pokusne životinje
Najčešće korištena vrsta glodavaca je štakor, iako se mogu koristiti i neke druge vrste. Treba koristiti mlade, zdrave, odrasle životinje sojeva koji se obično koriste u laboratoriju. Ženke ne smiju prethodno imati potomstvo i ne smiju biti gravidne. Primjena doza treba započeti čim prije nakon odbijanja od sise i, u svakom slučaju, prije nego što životinje napune devet tjedana starosti.
Na početku studije razlike u masi korištenih životinja trebaju biti minimalne i ne smiju prijeći ± 20 % od srednje mase životinja svakog spola.
Ako se kao preliminarni test za dugoročnu studiju provodi studija s ponavljanjem oralnog doziranja, preporuča se u obje studije koristiti životinje istog soja i istog podrijetla.
1.4.2.2. Broj i spol
Za svaku visinu doze treba upotrijebiti najmanje 10 životinja (pet ženki i pet mužjaka). Ako se planira usmrćivanje životinja u međuvremenu, prije završetka studije, navedeni broj treba povećati za broj životinja predviđen za takvo usmrćivanje.
Osim toga, jedna satelitska skupina od 10 životinja (po pet od svakog spola) može se 28 dana tretirati visokom dozom i sljedećih 14 dana opažati s obzirom na reverzibilnost, trajanje ili odgođenu pojavu toksičkih učinaka. Koristi se i jedna satelitska skupina od 10 kontrolnih životinja (po pet životinja od svakog spola).
1.4.2.3. Visina doza
Općenito, treba upotrijebiti najmanje tri ispitne skupine i jednu kontrolnu skupinu. Izuzimajući tretiranje ispitivanom tvari, sa životinjama u kontrolnoj skupini treba postupati jednako kao sa životinjama u ispitnoj skupini. Ako se kod primjene ispitivane tvari koristi nosač, kontrolna skupina treba primiti nosač u najvećoj količini koja se koristi u ispitivanju.
Ako se na temelju procjene drugih podataka ne očekuju nikakvi učinci pri dozi od 1 000 mg/kg tjelesne mase/dan, može se provesti granični test. Ako nema odgovarajućih podataka, može se provesti studija utvrđivanja količinskog raspona da bi se lakše utvrdile doze koje će se primjenjivati.
Visine doza treba odabrati uzimajući u obzir sve raspoložive podatke o toksičkim i (toksiko-) kinetičkim svojstvima ispitivane tvari ili materijala koji su joj srodni. Treba odabrati najvišu dozu s ciljem da se izazove toksičko djelovanje, ali ne i smrt ili teška patnja. Nakon toga treba odabrati niz sve nižih doza kako bi se dobile sve reakcije vezane uz doziranje i na kraju najniža doza kod koje nema vidljivih toksičkih učinaka (NOAEL). Za utvrđivanje sve nižih razina doza često je najbolje doze primijeniti u dva do četiri kraća intervala te je često bolje dodati četvrtu ispitnu skupinu nego između dva doziranja imati jako dugi interval (npr. gdje je faktor veći od 10).
Ako se ispitivane tvari primjenjuju preko hrane ili vode za piće važno je osigurati da upotrijebljena količina tvari ne utječe na normalnu prehranu ili ravnotežu napajanja. Ako se ispitivana tvar daje s hranom može se upotrijebiti ili u stalnoj koncentraciji u hrani (ppm) ili u stalnoj dozi s obzirom na tjelesnu masu životinje; upotrijebljena alternativa mora se navesti. Ako se tvar primjenjuje pomoću želučane sonde, dozu treba unositi približno u isto vrijeme svaki dan i prema potrebi prilagođavati kako bi se održavala stalna visina doze u odnosu na tjelesnu masu životinje.
Ako se prije dugoročne studije provede studija s ponavljanom dozom, u obje studije treba upotrijebiti sličnu prehranu.
1.4.2.4. Granični test
Ako test pri jednoj visini doze od najmanje 1 000 mg/kg tjelesne mase/dan ili, ako se primjenjuje u hrani ili vodi, pri jednakovrijednoj koncentraciji u hrani ili pitkoj vodi (koja se određuje na temelju tjelesne mase) uz primjenu postupka opisanog za ovu studiju, ne proizvede vidljive toksičke učinke i ako se na temelju podataka o strukturno srodnim tvarima toksičnost ne očekuje, potpuna studija uz primjenu tri visine doza može se smatrati nepotrebnom. Granični test ne vrijedi samo ako ljudska izloženost ukazuje na potrebu za primjenom viših doza.
1.4.2.5. Razdoblje opažanja
Razdoblje opažanja treba trajati 28 dana. Životinje iz satelitske skupine koje su predviđene za dodatna opažanja treba držati najmanje još 14 dana bez tretiranja kako bi se otkrila odgođena pojava, trajnost, ili nestanak toksičkih učinaka.
1.4.3. Postupak
Životinjama se dozira ispitivana tvar svaki dan sedam dana u tjednu tijekom razdoblja od 28 dana; za primjenu petodnevnog tjednog režima doziranja treba navesti razloge. Ako se ispitivana tvar primjenjuje oralnom intubacijom, životinji treba dati jednu dozu koristeći želučanu sondu ili odgovarajuću intubacijsku kanilu. Maksimalni volumen tekućine koji se može primijeniti odjednom ovisi o veličini pokusne životinje. Taj volumen ne smije biti veći od 1 ml/100 g tjelesne mase, osim kad se radi o vodenim otopinama koje dopuštaju primjenu volumena od 2 ml/100 g tjelesne mase. Osim kod nadražujućih i nagrizajućih tvari, koje pri višim koncentracijama odmah izazivaju pogoršanje, variranje ispitnih volumena treba svesti na minimum podešavanjem koncentracije, kako bi se kod svih visina doza osigurao stalni volumen.
1.4.3.1. Opća opažanja
Opća klinička opažanja treba provoditi najmanje jednom dnevno, po mogućnosti svaki dan u isto vrijeme, vodeći računa o razdoblju najvećeg intenziteta očekivanih učinaka nakon primjene doze. Zdravstveno stanje životinja treba bilježiti. Najmanje dva puta dnevno treba provjeravati ima li slučajeva pobolijevanja ili smrti životinja. Životinje u stanju umiranja ili one koje trpe jaki stres ili bol treba odmah po uočavanju izlučiti, humano usmrtiti i podvrgnuti obdukciji.
Jednom prije prvog izlaganja (kako bi se omogućila usporedba na istom subjektu) i najmanje jednom tjedno nakon tog treba obavljati klinička opažanja svih životinja. Ta opažanja treba obavljati izvan kaveza u kojima se životinje drže, u standardnom ograđenom prostoru i, po mogućnosti, svaki put u isto vrijeme. Opažanja treba temeljito zabilježiti, po mogućnosti koristeći sustav stupnjevanja koji jasno definira ispitni laboratorij. Treba učiniti sve što je neophodno da variranje ispitnih uvjeta bude minimalno i da opažanje obavljaju osobe koje nisu upoznate s tretiranjem. Znakovi koji se bilježe trebaju uključivati, ali ne biti ograničeni na, promjene na koži, dlaci, očima, sluznicama, na pojavu iscjedaka, na izlučine i autonomne aktivnosti (lakrimacija (lučenje suza), piloerekcija, veličina zjenica, nepravilnosti u disanju). Promjene u kretanju, držanju i reakcijama na rukovanje, kao i prisutnost kloničnih ili toničnih kretnji, stereotipa (npr. prekomjerno njegovanje dlake, stalno kretanje u krug) ili bizarno ponašanje (npr. samoranjavanje, hodanje unatrag) također treba zabilježiti.
U četvrtom tjednu izlaganja treba provesti ocjenjivanje senzoričke reaktivnosti na različite podražaje (npr. auditorne (slušne), vizualne (vidne) i proprioceptivne podražaje), sposobnost zahvaćanja i motorne aktivnosti. Više pojedinosti o postupcima koji se mogu primijeniti dane su u literaturi (vidjeti Opći uvod, dio B).
Funkcionalna opažanja provedena u četvrtom tjednu izlaganja mogu se izostaviti ako se studija provodi kao preliminarna studija za kasniju studiju subkronične toksičnosti (u trajanju od 90 dana). U tom slučaju funkcionalna opažanja treba uključiti u tu drugu studiju. S druge strane, postojanje podataka o funkcionalnim opažanjima iz studije s ponavljanim dozama može olakšati odabir visine doza za kasniju studiju subkronične toksičnosti.
Iznimno se funkcionalna opažanja mogu izostaviti i kod skupina koje inače pokazuju znakove toksičnosti takvog stupnja da bi to moglo utjecati na izvedbu funkcionalnog ispitivanja.
1.4.3.2. Tjelesna masa i unos hrane/vode
Sve životinje treba vagati najmanje jednom tjedno. Najmanje jednom tjedno treba mjeriti unos hrane i vode. Ako se ispitivana tvar primjenjuje preko vode za piće, unos vode isto tako treba mjeriti najmanje jednom tjedno.
1.4.3.3. Hematologija
Na kraju razdoblja ispitivanja treba obaviti sljedeće hematološke pretrage: hematokrit, koncentracija hemoglobina, broj eritrocita, ukupan i diferencijalni broj leukocita, broj trombocita (krvnih pločica) i vrijeme/mogućnost zgrušavanja.
Uzorke krvi treba uzeti iz određenog područja neposredno prije ili tijekom postupka usmrćivanja životinja i pohraniti u odgovarajućim uvjetima.
1.4.3.4. Klinička biokemija
Kliničke biokemijske pretrage cilj kojih je istražiti toksičko djelovanje na tkiva, a posebno na bubrege i jetru, treba obaviti na uzorcima krvi koji se svim životinjama uzimaju neposredno prije ili tijekom postupka usmrćivanja (osim onih kod kojih se utvrdi stanje umiranja i/ili ih se usmrti tijekom pokusa). Preporuča se da preko noći prije uzimanja uzorka krvi životinje poste (2). Pretrage plazme ili seruma uključuju i određivanje razine natrija, kalija, glukoze, ukupnog kolesterola, ureje, kreatinina, ukupnih proteina i albumina, najmanje dva enzima koja su pokazatelji hepatocelularnih učinaka (kao što su alanin aminotransferaza, aspartat aminotransferaza, alkalna fosfataza, gama glutamil transpeptidaza i sorbitol dehidrogenaza). Mjerenja dodatnih enzima (hepatičkog ili nekog drugog podrijetla) i žučnih kiselina mogu u određenim uvjetima pružiti korisne informacije.
Po izboru se u zadnjem tjednu studije mogu obaviti i analitičke pretrage urina prikupljenog u određenom vremenu, kojima se utvrđuje: izgled, količina, osmolalnost ili specifična težina, pH, protein, glukoza i krv/krvne stanice u urinu.
Osim toga, treba razmotriti i mogućnost provođenja studija s ciljem utvrđivanja serumskih markera koji upućuju na opće oštećenje tkiva. Ostale pretrage, koje bi trebalo obaviti u slučaju da poznata svojstva ispitivane tvari mogu, ili se sumnja da bi mogla, utjecati na povezane metaboličke profile uključuju utvrđivanje razine kalcija, fosfata, triglicerida natašte, razine specifičnih hormona, metemoglobina i aktivnosti kolinesteraze. Sve je ove parametre potrebno odrediti za tvari svrstane u određene klase ili od slučaja do slučaja.
Općenito je potreban fleksibilan pristup koji će ovisiti o vrsti pokusne životinje i o opažanom i/ili očekivanom učinku predmetne tvari.
Ako podaci dobiveni prijašnjim ispitivanjima nisu dovoljni, prije početka primjene doza treba razmotriti mogućnost utvrđivanja hematoloških i kliničko-biokemijskih varijabli.
1.4.3.5. Makroskopska analiza (obdukcija)
Sve životinje korištene u studiji moraju se podvrgnuti kompletnoj, detaljnoj makroskopskoj analizi koja uključuje pažljivi regled vanjske površine tijela, svih otvora te lubanjske, prsne i trbušne šupljine i njihovog sadržaja. S jetre, bubrega, nadbubrežne žlijezde, testisa, sjemenovoda, timusa, slezene, mozga i srca svih životinja treba obrezati svo okolno tkivo, prema potrebi, te ih još mokre izvagati što prije nakon sekcije, kako bi se izbjeglo sušenje organa.
Slijedeća tkiva treba čuvati u sredstvu za fiksiranje koje je najprimjerenije i za vrstu tkiva i za planirani kasniji histopatološki pregled: sva tkiva s velikim lezijama, mozak (reprezentativne regije, uključujući veliki mozak, mali mozak i most), leđnu moždinu, želudac, tanko i debelo crijevo (uključujući Peyerove ploče), jetra, bubrege, nadbubrežne žlijezde, slezenu, srce, timus, štitnjaču, dušnik, pluća (prepariraju se upuhivanjem fiksativa i zatim uranjanjem), spolne žlijezde, pomoćne spolne organe (npr. maternicu, prostatu), mokraćni mjehur, limfne čvorove (po mogućnosti, jedan uzet s puta unosa ispitivane tvari u organizam i drugi, udaljen od puta unosa, kako bi se vidjeli sistemski učinci), periferni živac (bedreni (n. ischiadicus) ili tibijalni (n. tibialis)) po mogućnosti smješten uza sam mišić, i odsječak koštane srži (ili, alternativno, svježi aspirat koštane srži). Klinički i drugi nalazi mogu uputiti na potrebu za ispitivanjem dodatnih tkiva. Treba sačuvati i sve one organe za koje se na temelju saznanja o svojstvima ispitivane tvari smatra da bi mogli biti ciljni.
1.4.3.6. Histopatološki pregled
Na sačuvanim organima i tkivima svih životinja iz kontrolne grupe i grupe izložene visokim dozama treba napraviti kompletan histopatološki pregled. Ako se u životinja na koje su primijenjene visoke doza ispitivane tvari primijete promjene, tada histopatološka ispitivanja treba obaviti i na životinjama iz svih ostalih skupina.
Treba pregledati sve veće lezije.
Ako se koristi satelitska skupina, histopatološkoj obradi treba podvrći ona tkiva i organe na kojima su u tretiranih životinja primijećene promjene.
2. PODACI
Za svaku životinju treba imati zasebne podatke. Osim toga, podatke je najbolje rezimirati u obliku tablice u kojoj je za svaku testiranu skupinu prikazan broj životinja na početku ispitivanja, broj životinja koje su uginule ili su usmrćene iz humanih razloga tijekom ispitivanja i vrijeme smrti ili humanog usmrćivanja, broj životinja kod kojih su opaženi znakovi toksičnosti, opis opažanih znakova toksičnosti, uključujući vrijeme pojavljivanja, trajanje i stupanj svih toksičkih učinaka, broj životinja kod kojih su se javile lezije, vrsta lezija i postotak životinja koje pokazuju određene vrste lezija.
Tamo gdje je to moguće, sve rezultate treba analizirati uz primjenu odgovarajuće opće prihvatljive statističke metode. Statističke metode treba odabrati još u fazi planiranja studije.
3. IZVJEŠĆIVANJE
IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju treba, ako je moguće, sadržavati sljedeće informacije:
|
|
pokusne životinje:
|
|
|
Uvjeti ispitivanja:
|
|
|
Rezultati:
|
|
|
Diskusija o rezultatima. |
|
|
Zaključci. |
4. REFERENCE
Ova je metoda istovjetna metodi OECD TG 407.
B.8. TOKSIČNOST (INHALACIJSKA) PRI PONAVLJANOJ DOZI (28 DANA)
1. METODA
1.1. UVOD
Korisno je imati preliminarne informacije o distribuciji veličine čestica, tlaku para, talištu, vrelištu, točki zapaljenja i eksplozivnosti tvari (prema potrebi).
Isto tako vidjeti Opći uvod, dio B slovo (A).
1.2. DEFINICIJE
Vidjeti Opći uvod, dio B slovo (B).
1.3. REFERENTNE TVARI
Nema ih.
1.4. NAČELO ISPITNE METODE
Nekoliko se skupina pokusnih životinja svakodnevno izlaže ispitivanoj tvari u postupno sve većim koncentracijama kroz vremensko razdoblje od 28 dana, s tim da se na jednu skupinu životinja primjenjuje jedna koncentracija. Ako se za lakše postizanje odgovarajuće koncentracije ispitivane tvari u atmosferi koristi nosač, kontrolnu skupinu životinja treba upotrijebiti i za ispitivanje otapala. Tijekom razdoblja primjene obavlja se svakodnevno opažanje životinja radi otkrivanja znakova toksičnosti. Životinje koje uginu tijekom ispitivanja podvrgavaju se obdukciji, a po završetku ispitivanja životinje koje su preživjele ispitivanje usmrćuju se i obduciraju.
1.5. KRITERIJI KVALITETE
Nema ih.
1.6. OPIS ISPITNE METODE
1.6.1. Priprema
Životinje se drže u pokusnim uvjetima u pogledu smještaja i hranjenja najmanje pet dana prije početka pokusa. Prije ispitivanja zdrave mlade životinje nasumce se biraju i raspoređuju u potreban broj skupina. Prema potrebi se u ispitivanu tvar može dodati odgovarajući nosač koji omogućava postizanje odgovarajuće koncentracije tvari u atmosferi. Ako se nosač ili neki drugi dodatak dodaje radi lakšeg doziranja, mora se za njega znati da ne proizvodi toksičke učinke. Ovisno o slučaju, mogu se upotrijebiti podaci iz prethodnih studija.
1.6.2. Uvjeti ispitivanja
1.6.2.1. Pokusne životinje
Ako nema kontraindikacija, preporuča se korištenje štakora i to onih sojeva koji se najčešće koriste u laboratorijima.
Na početku ispitivanja raspon masa pojedinačnih životinja ne bi smio prelaziti ± 20 % od odgovarajuće srednje vrijednosti.
1.6.2.2. Broj i spol
U svakoj ispitnoj skupini treba biti najmanje 10 životinja (5 ženki i pet mužjaka). Ženke ne smiju prethodno imati potomstvo i ne smiju biti gravidne. Ako se planira usmrćivanje životinja u međuvremenu, prije završetka studije, navedeni broj treba povećati za broj životinja predviđen za takvo usmrćivanje. Osim toga, jedna satelitska skupina od 10 životinja (po pet od svakog spola) može se 28 dana tretirati visokom dozom i nakon tretiranja 14 dana opažati s obzirom na reverzibilnost, trajanje ili odgođenu pojavu toksičkih učinaka. Isto se tako koristi jedna satelitska skupina od 10 kontrolnih životinja (po pet životinja od svakog spola).
1.6.2.3. Visine doza
Potrebne su najmanje tri koncentracije s jednom kontrolom ili, ako se koristi nosač, s kontrolom nosača (čija koncentracija odgovara koncentraciji nosača koji se dodaje kod najviše doze). Izuzimajući tretiranje ispitivanom tvari, sa životinjama iz kontrolne skupine treba postupati na jednak način kao sa životinjama koje se podvrgavaju ispitivanju. Najviša koncentracija treba izazvati toksičke učinke, ali smrtnih ishoda ne smije biti ili se mogu javiti u rijetkim slučajevima. Najniža koncentracija ne bi smjela prouzročiti nikakve toksičke učinke. Tamo gdje postoji primjenljiva procjena razine ljudske izloženosti, najniža koncentracija treba biti malo viša od te procijenjene razine. U idealnom slučaju, srednja koncentracija bi trebala proizvesti minimalne vidljive toksičke učinke. Ako se između najviše i najniže koncentracije koristi više od jedne koncentracije, one se moraju primjenjivati u intervalima kako bi se njihovi toksički učinci mogli stupnjevati. U skupinama tretiranim niskim i srednjim dozama i u kontrolnim skupinama, stopa smrtnosti treba biti niska da bi ocjena rezultata uopće imala smisla.
1.6.2.4. Vrijeme izlaganja
Dnevno izlaganje treba trajati šest sati, ali za ispunjavanje posebnih zahtjeva možda će to razdoblje trebati mijenjati.
1.6.2.5. Oprema
Životinje treba testirati pomoću inhalacijske opreme čija konstrukcija omogućuje protok zraka s najmanje 12 potpunih izmjena u jednom satu, kako bi se osigurao odgovarajući sadržaj kisika i atmosfera u kojoj je tvar kojoj se životinja izlaže jednakomjerno raspoređena. Ako se za ispitivanje koristi komora, njezina konstrukcija treba omogućiti minimalnu naguranost životinja i maksimalnu inhalacijsku izloženost ispitivanoj tvari. Da bi se osigurala stabilnost atmosfere u komori, primjenjuje se opće pravilo da ukupan „volumen” pokusne životinje ne smije biti veći od 5 % volumena ispitne komore. Mogu se koristiti različiti tipovi komora koji omogućuju izloženost samo oro-nazalnih (usno-nosnih) otvora, samo glave ili čitavog tijela pojedinačne životinje; prva dva tipa omogućuju da se unošenje ispitivane tvari u organizam životinje drugim putevima svede na minimum.
1.6.2.6. Razdoblje opažanja
Opažanje pokusnih životinja radi otkrivanja znakova toksičnosti treba provoditi svakodnevno tijekom cijelog razdoblja tretiranja i oporavka. Vrijeme smrti kao i vrijeme pojave i nestanka znakova toksičnosti treba zabilježiti.
1.6.3. Postupak
Životinje se izlažu ispitivanoj tvari svaki dan, pet do sedam dana u tjednu, tijekom razdoblja od 28 dana. Životinje iz bilo koje satelitske skupine predviđene za daljnje opažanje treba držati još 14 dana bez tretiranja, kako bi se mogao uočiti oporavak od, ili postojanost toksičkih učinaka. Temperaturu pri kojoj se provodi ispitivanje treba održavati na 22 ± 3 °C.
Idealno bi bilo relativnu vlažnost zraka održavati između 30 i 70 %, ali u nekim slučajevima (npr. testiranje nekih aerosola) to može biti neizvedivo. Održavanje laganog podtlaka u komori (≤ 5 mm vode) spriječit će istjecanje ispitivane tvari u okolni prostor. Za vrijeme izloženosti životinjama se ne smije davati hrana i voda.
Treba koristiti dinamički inhalacijski sustav s odgovarajućim analitičkim sustavom za kontrolu koncentracije. Za utvrđivanje odgovarajućih koncentracija izlaganja preporuča se provođenje probnog testa. Protok zraka treba podesiti tako da se u cijeloj komori za izlaganje osiguraju ujednačeni uvjeti. Sustav treba u što kraćem vremenu omogućiti postizanje stabilnih uvjeta izlaganja.
Treba mjeriti i pratiti:
|
(a) |
brzinu protoka zraka (neprekidno); |
|
(b) |
stvarnu koncentraciju ispitivane tvari izmjerenu u zoni disanja. Tijekom dnevnog razdoblja izlaganja koncentracija ne smije varirati za više od ± 15 % srednje vrijednosti. Međutim, kad se radi o nekim aerosolima ova se razina kontrole možda neće moći postići pa bi u tom slučaju bio prihvatljiv i veći raspon odstupanja. Tijekom ukupnog trajanja pokusa, dnevne koncentracije treba održavati što je moguće stabilnijima. Kod aerosola treba obaviti barem jednu analizu veličine čestica tjedno za svaku skupinu životinja; |
|
(c) |
temperaturu i vlažnost zraka, po mogućnosti neprekidno. |
Tijekom i nakon izlaganja sustavno se izvode i bilježe opažanja; za svaku životinju treba voditi zasebne bilješke. Sve životinje treba svakodnevno opažati i bilježiti znakove toksičnosti, pri čemu treba navesti vrijeme njihovog pojavljivanja, njihov stupanj i trajanje. Opažanja trebaju obuhvaćati promjene na koži i dlaci, očima i sluznicama, na dišnom i cirkulacijskom sustavu, te na autonomnom i centralnom živčanom sustavu, kao i promjene u somatomotoričkoj aktivnosti i ponašanju. Svaki tjedan treba mjeriti tjelesnu masu životinja. Isto se tako preporuča tjedno mjerenje unosa hrane. Redovito je opažanje životinja neophodno da bi se spriječio gubitak životinja iz razloga kao što su kanibalizam, autoliza tkiva ili stavljanje u krive komore. Na kraju studije sve preživjele životinje osim onih iz satelitskih grupa podvrgavaju se obdukciji. Životinje na umoru i životinje koje trpe jaki stres ili bol treba po uočavanju ukloniti, humano usmrtiti i obducirati.
Na kraju ispitivanja na svim životinjama, uključujući i kontrolne životinje, obavljaju se sljedeće pretrage:
|
i. |
hematološke, koje uključuju najmanje utvrđivanje hematokrita, koncentracije hemoglobina, broj eritrocita, ukupni i diferencijalni broj leukocita i mjerenje sposobnosti zgrušavanja; |
|
ii. |
kliničke biokemijske pretrage krvi koje uključuju najmanje jedan parametar funkcije jetre i bubrega: serumska alanin aminotransferaza (prije poznata pod nazivom glutamat-piruvat transaminaza), serumska aspartat aminotransferaza (prije poznata pod nazivom glutamat-oksaloacetat transaminaza), dušik u ureji, albumin, kreatinin u krvi, ukupni bilirubin i ukupne serumske bjelančevine; |
Druge pretrage koje mogu biti potrebne za adekvatnu toksikološku ocjenu uključuju određivanje kalcija, fosfora, klorida, natrija, kalija, glukoze (natašte), analizu lipida, hormona, ravnoteže kiselina i lužina, metemoglobina i aktivnosti kolinesteraze.
Za detaljnije proučavanje toksičkih učinaka mogu se po potrebi obaviti dodatne kliničke biokemijske analize.
1.6.3.1. Makroskopska obdukcija
Sve životinje iz studije treba podvrgnuti detaljnoj makroskopskoj obdukciji. Jetru, bubrege, nadbubrežne žlijezde, pluća i testise treba izvagati mokre, a da bi se spriječilo njihovo isušivanje to treba učiniti čim prije nakon seciranja. Organe i tkiva, tj. normalnu i tretiranu kožu, jetru, bubrege, slezenu, testise, nadbubrežne žlijezde, srce i ciljne organe (to jest sve organe na kojima su vidljive makroskopske lezije i promjene u veličini) treba čuvati (konzervirati) u odgovarajućem mediju za eventualne daljnje histopatološke pretrage. Pluća treba izvaditi bez oštećenja, izvagati i tretirati odgovarajućim fiksativom kako bi se sačuvala njihova struktura.
1.6.3.2. Histopatološki pregled
Kod skupine tretirane visokim koncentracijama i kod kontrolne(-ih) skupne(-a) treba obaviti histološki pregled sačuvanih organa i tkiva. Organi i tkiva s oštećenjima koja se mogu pripisati visokim koncentracijama ispitivane tvari, moraju se detaljno ispitati i kod životinja iz skupina tretiranih niskim koncentracijama. Životinje iz satelitskih skupina treba histološki obraditi s posebnim naglaskom na one organe i tkiva kod kojih su u drugim tretiranim skupinama bili utvrđeni toksički učinci.
2. PODACI
Podatke je najbolje rezimirati u obliku tablice u kojoj je za svaku testiranu skupinu životinja prikazan broj životinja na početku ispitivanja i broj životinja koje pokazuju pojedine vrste lezija.
Sve dobivene rezultate treba analizirati prema odgovarajućoj statističkoj metodi. Može se koristiti bilo koja priznata statistička metoda.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju treba, ako je moguće, sadržavati sljedeće informacije:
|
— |
vrsta, soj i podrijetlo životinja, okolišni uvjeti, prehrana itd., |
|
— |
uvjeti ispitivanja. Opis aparature za izlaganje koji obuhvaća konstrukciju, tip, dimenzije, izvor zraka, sustav za proizvodnju aerosola, metodu klimatizacije zraka, pročišćavanje ispušnog zraka i način držanja životinja u ispitnoj komori, ako je bila korištena. Treba opisati i opremu za mjerenje temperature, vlažnosti zraka i, tamo gdje je to primjereno, stabilnosti koncentracija ili distribucije veličine čestica aerosola. Podaci o izlaganju: Ti podaci trebaju biti tablično prikazani zajedno sa srednjim vrijednostima i mjerilom varijabilnosti (npr. standardna devijacija) i po mogućnosti uključivati sljedeće:
|
|
— |
podaci o toksičkim reakcijama po spolu i koncentracijama, |
|
— |
vrijeme smrti tijekom studije, odnosno podaci o preživljavanju životinja do usmrćivanja, |
|
— |
opis toksičkih i drugih učinaka, visine doza bez učinaka, |
|
— |
vrijeme opažanja svakog znaka abnormalnosti i kasnije promjene, |
|
— |
podaci o hrani i tjelesnoj masi, |
|
— |
obavljena hematološka ispitivanja i dobiveni rezultati, |
|
— |
obavljena klinička biokemijska ispitivanja i rezultati, |
|
— |
nalazi obdukcije, |
|
— |
detaljni opis svih histopatoloških nalaza, |
|
— |
statistička obrada rezultata tamo gdje je to moguće, |
|
— |
diskusija o rezultatima, |
|
— |
tumačenje rezultata. |
3.2. OCJENA I TUMAČENJE REZULTATA
Vidjeti Opći uvod, dio B slovo (D).
4. REFERENCE
Vidjeti Opći uvod, dio B slovo (E).
B.9. TOKSIČNOST (DERMALNA) PRI PONAVLJANOJ DOZI (28 DANA)
1. METODA
1.1. UVOD
Vidjeti Opći uvod, dio B slovo (A).
1.2. DEFINICIJE
Vidjeti Opći uvod, dio B slovo (B).
1.3. REFERENTNE TVARI
Nema ih.
1.4. NAČELO ISPITNE METODE
Ispitivana se tvar 28 dana svakodnevno nanosi na kožu nekoliko skupina pokusnih životinja u stupnjevanim dozama, pri čemu se na svaku skupinu primjenjuje po jedna visina doze. Tijekom razdoblja nanošenja tvari, životinje se svaki dan opažaju kako bi se otkrili znakovi toksičnosti. Životinje koje uginu tijekom ispitivanja podvrgavaju se obdukciji, a po završetku ispitivanja životinje koje su preživjele ispitivanje usmrćuju se i obduciraju.
1.5. KRITERIJI KVALITETE
Nema ih.
1.6. OPIS ISPITNE METODE
1.6.1. Priprema
Životinje se drže u pokusnim uvjetima u pogledu smještaja i hranjenja najmanje pet dana prije početka pokusa. Prije ispitivanja zdrave mlade životinje nasumce se odabiru i raspoređuju u skupine za tretiranje i u kontrolne skupine. Neposredno prije ispitivanja na hrptenom dijelu trupa pokusnih životinja ošiša se dlaka. Dlaka se može i obrijati, ali to treba napraviti približno 24 sata prije ispitivanja. Šišanje ili brijanje treba ponavljati otprilike svaki tjedan. Pri šišanju ili brijanju dlake treba paziti da se ne ostruže koža. Za nanošenje ispitivane tvari najmanje 10 % tjelesne površine mora biti bez dlake. Pri odlučivanju o površini s koje će odstraniti dlaka i o dimenzijama krpice kojom će se ta površina prekriti treba uzeti u obzir tjelesnu masu životinje. Kad se ispituju krute tvari koje se prema potrebi mogu usitniti u prah, ispitivanu tvar treba u dovoljnoj mjeri navlažiti vodom ili, tamo gdje je to potrebno, odgovarajućim nosačem kako bi se osigurao dobar kontakt s kožom. Tekuće ispitivane tvari općenito se primjenjuju nerazrijeđene. Ispitivana se tvar nanosi jednom na dan, pet do sedam dana u tjednu.
1.6.2. Uvjeti ispitivanja
1.6.2.1. Pokusne životinje
Mogu se koristiti odrasli štakori ili kunići. Moguće je koristiti i druge vrste, ali je za to potrebno navesti opravdane razloge.
Na početku studije tjelesna masa korištenih životinja ne smije varirati za više od ± 20 % odgovarajuće srednje vrijednosti.
1.6.2.2. Broj i spol
Za svaku visinu doze treba upotrijebiti najmanje 10 životinja (pet ženki i pet mužjaka) koji imaju zdravu kožu. Ženke ne smiju prethodno imati potomstvo i ne smiju biti gravidne. Ako se planira usmrćivanje životinja u međuvremenu, prije završetka studije, navedeni broj treba povećati za broj životinja predviđen za takvo usmrćivanje. Osim toga, jednu se satelitsku skupinu od 10 životinja (po pet od svakog spola) može tretirati visokom dozom 28 dana, te nakon tretiranja opažati s obzirom na reverzibilnost, trajanje ili odgođenu pojavu toksičkih učinaka. Koristi se i jedna satelitska skupina od 10 kontrolnih životinja (po pet životinja od svakog spola).
1.6.2.3. Visina doza
Potrebne su najmanje 3 visine doza s jednom kontrolom ili, ako se koristi otapalo, s kontrolom koju čini otapalo. Izlaganje treba trajati najmanje šest sati dnevno. Ispitivanu tvar treba nanositi u približno isto vrijeme svaki dan, uz povremena podešavanja (u tjednim ili dvotjednim intervalima) kako bi se održala stalna visina doze s obzirom na tjelesnu masu životinje. Izuzimajući tretiranje ispitivanom tvari, sa životinjama iz kontrolne skupine treba postupati na jednak način kao sa životinjama koje se podvrgavaju ispitivanju. Ako se radi lakšeg doziranja koristi nosač, kontrolnoj skupini na koju se primjenjuje nosač doze se daju na jednak način kao i tretiranim skupinama i one moraju primiti iste količine kao skupina tretirana najvišom dozom. Najviša koncentracija treba izazvati toksičke učinke, ali smrtnih ishoda ne smije biti ili se mogu javiti u rijetkim slučajevima. Najniža koncentracija ne bi smjela izazvati nikakve znakove toksičkog učinka. Tamo gdje postoji primjenljiva procjena razine ljudske izloženosti, najniža koncentracija treba biti malo viša od te procijenjene razine. U idealnom slučaju, srednja bi koncentracija trebala proizvesti minimalne vidljive toksičke učinke. Ako se između najviše i najniže koncentracije koristi više od jedne koncentracije, one se moraju primjenjivati u intervalima, kako bi se njihovi toksički učinci mogli stupnjevati. U skupinama tretiranim niskim i srednjim dozama i u kontrolnim skupinama, stopa smrtnosti treba biti niska da bi ocjena rezultata uopće imala smisla.
Ako primjena ispitivane tvari izazove tešku nadraženost kože, koncentracije treba smanjiti, što može dovesti do smanjenja ili izostanka drugih toksičkih učinaka kod primjene visokih doza. Štoviše, ako dođe do jakog oštećenja kože, možda će trebati prekinuti studiju i započeti novu s nižim koncentracijama.
1.6.2.4. Granični test
Ako u preliminarnom ispitivanju primjena doze od 1 000 mg/kg ili više, doze vezane uz moguću ljudsku izloženost, ako je poznata, ne proizvede nikakve toksičke učinke, daljnje ispitivanje smatra se nepotrebnim.
1.6.2.5. Razdoblje opažanja
Opažanje pokusnih životinja radi otkrivanja znakova toksičnosti treba provoditi svakodnevno. Vrijeme smrti kao i vrijeme pojave i nestanka znakova toksičnosti treba zabilježiti.
1.6.3. Postupak
Životinje treba smjestiti u kaveze pojedinačno. U idealnim uvjetima, životinje se tretiraju sedam dana u tjednu, kroz vremensko razdoblje od 28 dana. Životinje iz bilo koje satelitske skupine koje su predviđene za dodatna opažanja treba držati dodatnih 14 dana bez tretiranja kako bi se utvrdio oporavak od toksičkih učinaka ili njihova trajnost. Izlaganje treba trajati najmanje šest sati dnevno.
Ispitivanu tvar treba jednakomjerno nanijeti na površinu koja čini približno 10 % ukupne tjelesne površine. Kod jako toksičnih tvari površina na koju se tvar nanosi može biti i manja, ali čim veći dio te površine treba prekriti što tanjim i jednakomjernijim slojem.
Tijekom izlaganja ispitivana tvar se drži u kontaktu s kožom pomoću poroznog obloga od gaze i samoljepljive trake koja ne nadražuje kožu. Ispitnu površinu treba dodatno prekriti na odgovarajući način kako bi oblog i ispitivana tvar ostali na mjestu i kako bi se osiguralo da životinje ne mogu ispitivanu tvar unijeti oralno. Da bi se životinju spriječilo da ispitivanu tvar unese oralnim putem mogu se upotrijebiti pomagala za sputavanje, ali potpuna imobilizacija nije preporučena metoda. Kao alternativno rješenje može se koristiti „zaštitni ovratnik”.
Na kraju razdoblja izloženosti ostatke ispitivane tvari treba ukloniti, ako je moguće vodom ili primjenom neke druge prikladne metode čišćenja kože.
Sve životinje treba opažati svaki dan i bilježiti znakove toksičnosti, navodeći vrijeme njihove pojave, stupanj i trajanje. Opažanje treba obuhvaćati promjene na koži i dlaci, očima i sluznicama, na dišnom i cirkulacijskom sustavu, te na autonomnom i centralnom živčanom sustavu, kao i promjene u somatomotoričkoj aktivnosti i obrascu ponašanja. Svaki tjedan treba mjeriti tjelesnu masu životinja. Isto se tako preporučuje tjedno mjeriti unos hrane. Redovito je opažanje životinja neophodno da bi se spriječio gubitak životinja uslijed kanibalizma, autolize tkiva ili pogrešnog smještanja. Na kraju studije sve preživjele životinje iz nesatelitskih tretiranih skupina podvrgavaju se obdukciji. Životinje na umoru i životinje koje trpe jaki stres ili bol treba po uočavanju ukloniti, humano usmrtiti i obducirati.
Na kraju ispitivanja na svim životinjama, uključujući i kontrolne životinje, obavljaju se sljedeće pretrage:
|
(1) |
hematološke, koje uključuju najmanje utvrđivanje hematokrita, koncentracije hemoglobina, broj eritrocita, ukupni i diferencijalni broj leukocita i mjerenje sposobnosti zgrušavanja; |
|
(2) |
kliničke biokemijske pretrage krvi koje uključuju najmanje jedan parametar funkcije jetre i bubrega: serumsku alanin aminotransferazu (prije poznatu pod nazivom glutamat-piruvat transaminaza), serumsku aspartat aminotransferazu (prije poznatu pod nazivom glutamat-oksaloacetat transaminaza), dušik u ureji, albumin, kreatinin u krvi, ukupni bilirubin i ukupne serumske bjelančevine. |
Druge pretrage koje mogu biti potrebne za adekvatnu toksikološku ocjenu uključuju određivanje kalcija, fosfora, klorida, natrija, kalija, glukoze (natašte), analizu lipida, hormona, ravnoteže kiselina i lužina, metemoglobina i aktivnosti kolinesteraze.
Za detaljnije proučavanje toksičkih učinaka mogu se po potrebi obaviti dodatne kliničke biokemijske analize.
1.6.4. Makroskopska obdukcija
Sve životinje iz studije treba podvrgnuti detaljnoj makroskopskoj obdukciji. Najmanje jetru, bubrege, nadbubrežne žlijezde, pluća i testise treba izvagati mokre, čim prije nakon seciranja, kako bi se spriječilo njihovo isušivanje. Organe i tkiva, tj. normalnu i tretiranu kožu, jetru, bubrege, slezenu, testise, nadbubrežne žlijezde, srce i ciljne organe (to jest sve organe na kojima su vidljive makroskopske lezije i promjene u veličini) treba čuvati u odgovarajućem mediju za eventualne daljnje histopatološke pretrage.
1.6.5. Histopatološki pregled
Kod skupine tretirane visokim koncentracijama i kod kontrolne skupne treba obaviti histološki pregled sačuvanih organa i tkiva. Organi i tkiva s oštećenjima koja se mogu pripisati visokim koncentracijama ispitivane tvari moraju se detaljno ispitati i kod životinja iz skupina tretiranih niskim koncentracijama. Životinje iz satelitskih skupina treba histološki obraditi s posebnim naglaskom na one organe i tkiva kod kojih su u drugim tretiranim skupinama bili utvrđeni toksički učinci.
2. PODACI
Podatke je najbolje rezimirati u obliku tablice u kojoj je za svaku testiranu skupinu životinja prikazan broj životinja na početku ispitivanja i broj životinja koje pokazuju pojedine vrste lezija.
Sve dobivene rezultate treba ocijeniti prema odgovarajućoj statističkoj metodi. Može se koristiti bilo koja priznata statistička metoda.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju treba, ako je moguće, sadržavati sljedeće informacije:
|
— |
podaci o životinjama (vrsta, soj, podrijetlo, okolišni uvjeti, prehrana itd.), |
|
— |
uvjeti ispitivanja (uključujući vrstu obloga: okluzivni ili neokluzivni), |
|
— |
visine doza (uključujući nosač, ako se koristio) i koncentracije, |
|
— |
razina kod koje nema toksičkih učinaka, tamo gdje je to moguće, |
|
— |
podaci o toksičkim reakcijama po spolu i dozi, |
|
— |
vrijeme smrti tijekom studije, odnosno podaci o preživljavanju životinja do kraja ispitivanja, |
|
— |
toksički i drugi učinci, |
|
— |
vrijeme opažanja svakog znaka abnormalnosti i kasnije promjene, |
|
— |
podaci o hrani i tjelesnoj masi, |
|
— |
obavljena hematološka ispitivanja i dobiveni rezultati, |
|
— |
obavljena klinička biokemijska ispitivanja i dobiveni rezultati, |
|
— |
nalazi obdukcije, |
|
— |
detaljni opis svih histopatoloških nalaza, |
|
— |
statistička obrada rezultata tamo gdje je to moguće, |
|
— |
diskusija o rezultatima, |
|
— |
tumačenje rezultata. |
3.2. OCJENA I TUMAČENJE REZULTATA
Vidjeti Opći uvod, dio B slovo (D).
4. REFERENCE
Vidjeti Opći uvod, dio B slovo (E).
B.10. MUTAGENOST – IN VITRO TEST ZA DOKAZIVANJE KROMOSOMSKIH ABERACIJA KOD SISAVACA
1. METODA
Ova je metoda istovjetna metodi OECD TG 473, In vitro ispitivanje kromosomskih aberacija kod sisavaca (1997.)
1.1. UVOD
Svrha in vitro testa za dokazivanje kromosomskih aberacija je utvrđivanje agensa koji uzrokuju strukturne kromosomske aberacije u uzgojenim stanicama sisavaca (1)(2)(3). Postoje dvije vrste strukturnih aberacija, kromosomska i kromatidna. Aberacije koje izaziva većina mutagena kromatidnog su tipa, ali javljaju se i aberacije kromosomskog tipa. Povećanje poliploidnosti može ukazivati na to da kemikalija ima potencijal za izazivanje numeričkih aberacija. Međutim, ta metoda nije namijenjena za mjerenje numeričkih aberacija i rutinski se ne koristi u tu svrhu. Kromosomske mutacije i srodne pojave uzrok su mnogih genetskih oboljenja ljudi i postoje čvrsti dokazi da su kromosomske mutacije i srodne pojave koje uzrokuju promjene u onkogenima i genima supresorima tumora somatskih stanica povezane s pojavom raka kod ljudi i pokusnih životinja.
Kod in vitro testa za dokazivanje kromosomskih aberacija mogu se koristiti kulture trajnih staničnih linija, stanični sojevi ili primarne stanične kulture. Stanice koje se koriste odabiru su na temelju sposobnosti rasta u kulturi, stabilnosti kariotipa, broja kromosoma, raznolikosti kromosoma i spontane učestalosti kromosomskih aberacija.
Ispitivanja koja se obavljaju in vitro općenito zahtijevaju korištenje egzogenih izvora metaboličke aktivacije. Taj sustav metaboličke aktivacije ne može u cijelosti oponašati in vivo uvjete kod sisavaca. Mora se paziti da se izbjegava stvaranje uvjeta koji bi doveli do pozitivnih rezultata koji ne odražavaju suštinsku mutagenost i mogu proizaći iz promjena u pH, osmolalnosti ili iz visokih razina citotoksičnosti (4)(5).
Ovaj se test koristi za pregledavanje tvari koje mogu mutageno i karcinogeno djelovati na sisavce. Mnoge tvari koje su u tom testu pozitivne karcinogene su za sisavce; međutim, ne postoji savršena povezanost između tog testa i karcinogenosti. Ta povezanost ovisi o klasi opasnosti u koju je kemikalija svrstana i sve je više dokaza da postoje karcinogeni koji se ovim testom ne otkrivaju jer izgleda da djeluju kroz druge mehanizme, a ne na način da izravno oštećuju DNA.
Vidjeti i Opći uvod, dio B.
1.2. DEFINICIJE
Aberacija kromatidnog tipa: strukturno oštećenje kromosoma izraženo kao lom pojedinačnih kromatida ili lom i ponovno spajanje kromatida.
Aberacija kromosomskog tipa: strukturno oštećenje kromosoma izraženo kao lom ili lom i ponovno spajanje obiju kromatida na istom mjestu.
Endoreduplikacija: proces kod kojeg nakon S razdoblja DNA replikacije jezgra ne ulazi u mitozu, nego započinje drugo S razdoblje. Rezultat su kromosomi s četiri, osam, 16,... kromatida.
Prekid (tijesni spoj): akromatska lezija manja od širine jedne kromatide i s minimalnim otklonom (neporavnatošću) kromatida.
Mitotski indeks: omjer stanica u metafazi podijeljen s ukupnim brojem stanica opažanih u populaciji stanica; pokazatelj stupnja proliferacije (umnožavanja) te populacije.
Numerička aberacija: promjena u broju kromosoma u odnosu na normalni broj koji je karakterističan za korištene stanice.
Poliploidnost: višekratnik haploidnog broja kromosoma (n) osim diploidnog broja (tj. 3n, 4n itd.).
Strukturna aberacija: promjena u strukturi kromosoma koja se može otkriti mikroskopskim pregledom podjele stanica u metafazi, koja se opaža kao delecije i fragmenti, inverzija ili translokacija.
1.3. NAČELO ISPITNE METODE
Stanične kulture izlažu se ispitivanoj tvari s metaboličkom aktivacijom i bez nje. Nakon izlaganja ispitivanoj tvari stanične se kulture u prethodno određenim vremenskim intervalima tretiraju tvarima za zaustavljanje metafaze (npr. Colcemid® ili kolchicin), izdvoji se i oboji dio staničnog materijala te se metafazne stanice mikroskopski analiziraju na prisutnost kromosomskih aberacija.
1.4. OPIS ISPITNE METODE
1.4.1. Priprema
1.4.1.1. Stanice
Mogu se koristiti različite stanične linije, sojevi ili primarne stanične kulture, ukljujući ljudske stanice (npr. fibroblasti kineskog hrčka, limfociti periferne krvi čovjeka ili drugih sisavaca).
1.4.1.2 Hranjive podloge i uvjeti za uzgoj kultura
Za održavanje kultura treba upotrijebiti hranjive podloge za uzgoj kultura i osigurati uvjete za inkubaciju (posude za kulture, koncentracija CO2, temperatura i vlažnost). Trajne stanične linije i sojevi moraju se rutinski pregledati na stabilnost u modalnom broju kromosoma i odsustvo mikoplazmatske kontaminacije, te se ne smiju koristiti ako su kontaminirane. Mora se znati normalno trajanje staničnog ciklusa i uvjeti za uzgoj kulture koja se koristi.
1.4.1.3. Priprema kultura
Trajne stanične linije i sojevi: stanice se razmnožavaju iz matičnih kultura koje se nasade na hranjivu podlogu za uzgoj kultura tako gusto da kulture ne dosegnu konfluenciju prije izdvajanja stanica, te se inkubiraju na 37 °C.
Limfociti: puna krv tretirana antikoagulantom (npr. heparinom) ili izdvojeni limfociti dobiveni od zdrave životinje stavljaju se u hranjivu podlogu za uzgoj kultura koja sadrži neki mitogen (npr. fitohemaglutinin) te se inkubiraju na 37 °C.
1.4.1.4. Metabolička aktivacija
Stanice treba izložiti ispitivanoj tvari uz prisutnost i bez prisutnosti prikladnog sustava za metaboličku aktivaciju. Najčešće korišteni sustav je post-mitohodrijska frakcija (S9) u kompleksu s kofaktorom, pripremljena od jetre glodavaca tretiranih sredstvima za enzimsku indukciju kao što su: Aroclor 1254 (6)(7)(8)(9), ili mješavina fenobarbitona i ß-naftoflavona (10)(11)(12).
Post-mitohondrijska frakcija obično se koristi u koncentracijama u rasponu od 1-10 % v/v u konačnoj ispitnoj podlozi. Primjena sustava metaboličke aktivacije može ovisiti o klasi opasnosti u koju je svrstana kemikalija koja se ispituje. U nekim slučajevima može biti prikladno koristiti više od jedne koncentracije post-mitohondrijske frakcije.
Više promjena, uključujući genetski uzgojene stanične linije u kojima su izraženi specifični aktivacijski enzimi, može odrediti potencijal za endogenu aktivaciju. Odabir korištenih staničnih linija mora biti znanstveno opravdan (npr. relevantnost citokromnog P450 izoenzima za metabolizam ispitivane tvari).
1.4.1.5. Ispitivana tvar/priprema
Krute ispitivane tvari treba otopiti ili suspendirati u odgovarajućim otapalima ili nosačima i prije tretiranja stanica prema potrebi razrijediti. Tekuće ispitivane tvari mogu se u sustave ispitivanja dodavati izravno i/ili se prije obrade mogu razrijediti. Treba koristiti svježe pripravke ispitivane tvari, osim u slučaju da podaci o stabilnosti pokazuju da ih je prihvatljivo pohranjivati.
1.4.2. Uvjeti ispitivanja
1.4.2.1. Otapalo/nosač
Ne smije postojati sumnja da će otapala/nosači kemijski reagirati s ispitivanim tvarima te oni trebaju biti pogodni za preživljavanje stanica i djelovanje S9. Ako se primjenjuju manje poznata otapala/nosači, njihovo bi uključivanje u ispitivanje trebalo biti potkrijepljeno podacima koji dokazuju njihovu pogodnost. Kad god je to moguće, preporučuje se najprije razmotriti mogućnost primjene vodenog otapala/nosača. Pri ispitivanju tvari koje su u vodi nestabilne, ne smiju se koristiti organska otapala koja sadrže vodu. Voda se može ukloniti pomoću molekularnog sita.
1.4.2.2 Koncentracije izlaganja
Među kriterijima koja treba razmotriti kod određivanja najviših koncentracija su toksičnost, topljivost u ispitnom sustavu i promjene u pH ili osmolalnost.
Citotoksičnost treba odrediti sa i bez metaboličke aktivacije u glavnom pokusu, uz korištenje ogovarajućih pokazatelja staničnog integriteta i rasta, kao što su stupanj konfluencije, broj živih stanica ili mitotski indeks. Može biti korisno preliminarnim pokusom odrediti citotoksičnost i topljivost.
Treba koristiti najmanje tri koncentracije koje se mogu analizirati. U slučajevima gdje se javlja citotoksičnost, te koncentracije moraju pokrivati raspon od maksimalne do male ili nikakve toksičnosti; to obično znači da razlika među koncentracijama ne bi smjela biti veća od faktora između 2 i √10. U vrijeme izdvajanja stanica pri najvišoj koncentraciji treba biti vidljivo znatno smanjenje stupnja konfluencije (stvaranja sloja), broja stanica ili mitotskog indeksa (sve iznad 50 %). Mitotski indeks samo je posredni kriterij citotoksičkih/citostatskih učinaka i ovisi o vremenu koje prođe nakon obrade. Međutim, mitotski indeks prihvatljiv je za suspenzijske kulture, kod kojih bi druga mjerenja toksičnosti mogla biti komplicirana i nepraktična. Informacije o kinetici staničnog ciklusa kao što je prosječno vrijeme generiranja (AGT) može se koristiti kao dodatna informacija. Međutim, AGT je prosječna vrijednost koja ne otkriva uvijek postojanje kasnijih subpopulacija, a čak i mali porast prosječnog vremena generiranja može se povezati sa značajnim kašnjenjem u nastajanju optimalnog broja aberacija.
Za relativno necitotoksične tvari, najviša koncentracija kod ispitivanja treba biti 5 μl/ml, 5 mg/ml ili 0,01 M, ovisno o tome koja je niža.
Za relativno netopljive tvari koje nisu toksične pri koncentracijama nižim od onih u kojima su netopljive, najviša korištena doza treba biti koncentracija iznad granice topljivosti u konačnoj hranjivoj podlozi za uzgoj kultura na kraju razdoblja tretiranja. U nekim slučajevima (npr. kad se toksičnost pojavljuje samo kod koncentracija koje su više od najnižih koncentracija pri kojima tvar nije topljiva), savjetuje se obavljanje ispitivanja na više od jedne koncentracije s vidljivim taloženjem. Moglo bi biti korisno procijeniti topljivost na početku i na kraju tretiranja, jer se ona može za vrijeme izloženosti mijenjati u ispitnom sustavu uslijed prisutnosti stanica, S9, seruma itd. Netopljivost se može otkriti golim okom. Talog ne smije utjecati na određivanje stupnja toksičnosti.
1.4.2.3. Negativne i pozitivne kontrole
U svaki pokus treba istodobno uključiti pozitivne i negativne kontrole (otapala ili nosači) sa i bez metaboličke aktivacije. Kad se primjenjuje metabolička aktivacija kemikalija za pozitivnu kontrolu treba koristiti kemikalije kod kojih je za mutagenu reakciju potrebna aktivacija.
Kod pozitivnih kontrola treba koristiti poznati klastogen na razinama izlaganja kod kojih se očekuje ponovljivo povećanje koje se može uočiti u odnosu na podlogu (pozadinu), koji pokazuje osjetljivost ispitnog sustava.
Koncentracije pozitivne kontrole moraju biti odabrane tako da učinci budu jasni, ali da osoba koja očitava rezultate ne može odmah vidjeti identitet kodiranih mikroskopskih preparata. Treba razmotriti korištenje kemikalija za pozitivnu kontrolu koje spadaju u istu klasu opasnosti kao i ispitivana tvar, ako su takve kemikalije raspoložive. Primjeri tvari za pozitivnu kontrolu obuhvaćaju:
|
Stanje metaboličke aktivacije |
Tvar |
CAS br. |
EINECS br. |
|
Odsutnost egzogene metaboličke aktivacije |
Metil metansulfonat |
66-27-3 |
200-625-0 |
|
Etil metansulfonat |
62-50-0 |
200-536-7 |
|
|
Etil nitrosourea |
759-73-9 |
212-072-2 |
|
|
Mitomicin C |
50-07-7 |
200-008-6 |
|
|
4-Nitrokinolin-N-oksid |
56-57-5 |
200-281-1 |
|
|
Prisutnost egzogene metaboličke aktivacije |
Benzo[a]piren |
50-32-8 |
200-028-5 |
|
Ciklofosfamid Ciklofosfamid monohidrat |
50-18-0 6055-19-2 |
200-015-4 |
Za pozitivnu kontrolu mogu se koristiti i druge tvari. Treba razmotriti mogućnost korištenja kemikalija za pozitivnu kontrolu koje spadaju u istu klasu opasnosti kao i ispitivana tvar, ako su takve kemikalije raspoložive.
Kod svakog izdvajanja stanica treba uključiti i negativne kontrole koje se sastoje samo od otapala ili nosača u hranjivoj podlozi za tretiranje i tretirane su na jednak način kao i kulture. Dodatno treba upotrijebiti i netretirane kontrole, osim ako postoje podaci iz ranijih studija koji dokazuju da odabrano otapalo ne proizvodi nikakve štetne ili mutagene učinke.
1.4.3. Postupak
1.4.3.1. Tretiranje ispitivanom tvari
Stanice koje se razmonožavaju tretiraju se ispitivanom tvari uz prisutnost i odsutnost metaboličkog aktivacijskog sustava. Tretiranje limfocita treba započeti oko 48 sati nakon mitogene stimulacije.
|
1.4.3.2. |
Obično se kod svake koncentracije koriste dvije usporedne kulture, a upotreba dviju usporednih kultura posebno se preporučuje kod negativnih kontrolnih kultura/kultura koje se tretiraju samo s otapalima. Ako se na temelju podataka iz ranijih studija dokaže da su razlike između dviju usporednih kultura minimalne (13)(14), može biti prihvatljiva upotreba samo po jedne kulture za svaku koncentraciju. Plinovite ili hlapive tvari treba ispitivati odgovarajućim metodama, na primjer u nepropusnim posudama za kulture (15)(16). |
1.4.3.3. Vrijeme izdvajanja („ubiranja”) stanica iz kulture
U prvom pokusu stanice treba tri do šest sati izlagati ispitivanoj tvari sa i bez metaboličke aktivacije i uzorkovati ih po isteku vremena koje odgovara vremenu 1,5 normalnog staničnog ciklusa od početka tretiranja (12). Ako se ovim postupkom dobiju negativni rezultati sa i bez aktivacije, treba obaviti još jedan pokus bez aktivacije, uz neprekidno tretiranje sve do uzorkovanja po isteku vremena koje odgovara vremenu 1,5 normalnog staničnog ciklusa. Neke će kemikalije možda biti lakše otkriti ako vrijeme tretiranja/vrijeme do uzorkovanja bude duže od 1,5 dužine ciklusa. Negativne rezultate s metaboličkom aktivacijom treba potvrditi od slučaja do slučaja. U onim slučajevima gdje se potvrda negativnih rezultata ne smatra potrebnom, nužno je navesti razloge za to.
1.4.3.4. Priprema kromosoma
Stanične kulture tretiraju se Colcemidom® ili kolhicinom, obično jedan do tri sata prije izdvajanja stanica. Iz svake stanične kulture zasebno izdvajaju se i obrađuju stanice za pripremu kromosoma. Priprema kromosoma obuhvaća hipotoničku obradu stanica, fiksiranje i bojenje.
1.4.3.5. Analiza
Sve preparate, uključujući i preparate pozitivnih i negativnih kontrola, treba prije mikroskopske analize nezavisno kodirati. Budući da postupak fiksiranja često uzrokuje lomljenje jednog dijela metafaznih stanica uz gubitak kromosoma, stanice koje se očitavaju moraju sadržavati broj centromera koji je jednak modalnom broju ± 2 za sve vrste stanica. Za svaku koncentraciju i kontrolu treba očitati najmanje 200 dobro vidljivih (raširnih) metafaza jednakomjerno raspodijeljenih u usporednim kulturama. Ako se opazi visoki broj aberacija taj se broj može smanjiti.
Iako je svrha ovog testa otkrivanje kromosomskih aberacija, važno je zabilježiti poliploidnost i endoreduplikaciju, u slučaju da se opaze te pojave.
2. PODACI
2.1. OBRADA REZULTATA
Pokusna jedinica je stanica i stoga treba utvrditi postotak stanica sa strukturnim kromosomskim aberacijama. Različite vrste strukturnih kromosomskih aberacija treba zabilježiti zajedno s njihovim brojevima i učestalošću za pokusne i kontrolne kulture. Prekidi (tijesni spojevi) se upisuju odvojeno i navode u izvješću, no općenito nisu uključeni u ukupnu učestalost aberacija.
Isto tako treba zabilježiti i rezultate istodobnog mjerenja citotoksičnosti za sve tretirane i negativne kontrolne kulture u glavnim pokusima za dokazivanje aberacija.
Podaci se navode za svaku kulturu zasebno. Dodatno sve podatke treba rezimirati u tabličnom obliku.
Potvrda jasne pozitivne reakcije nije potrebna. Dvosmislene rezultate treba pojasniti daljnjim ispitivanjem, po mogućnosti uz izmjenu pokusnih uvjeta. O potrebi za potvrđivanjem negativnih rezultata govori se u točki 1.4.3.3. U daljnjim pokusima treba razmotriti mogućnost izmjene ispitnih parametara, kako bi se povećao obim uvjeta koji se analiziraju. Parametri koji bi se mogli izmijeniti uključuju vremenske intervale između primjena različitih koncentracija i uvjete metaboličke aktivacije.
2.2. OCJENA I TUMAČENJE REZULTATA
Postoji više kriterija za utvrđivanje pozitivnog rezultata, kao na primjer koncentracijom uvjetovano ili ponovljivo povećanje broja stanica s kromosomskim aberacijama. Najprije treba razmotriti biološku relevantnost rezultata. Kao pomoć u ocjeni rezultata ispitivanja mogu se koristiti statističke metode (3)(13). Kod utvrđivanja pozitivne reakcije statistički značaj ne može biti jedini odlučujući faktor.
Porast broja poliploidnih stanica može značiti da ispitivana tvar može inhibirati mitotske procese i izazvati numeričke kromosomske aberacije. Povećanje broja stanica s endoredupliciranim kromosomima može značiti da ispitivana tvar može inhibirati progresiju (odvijanje) staničnog ciklusa (17)(18).
Smatra se da ispitivana tvar kod koje rezultati ne udovoljavaju gore navedenim kriterijima u ovom sustavu nije mutagena.
Iako će većina pokusa dati jasne pozitivne ili negativne rezultate, u rijetkim slučajevima određeni će podaci onemogućiti donošenje konačne procjene djelovanja ispitivane tvari. Rezultati mogu ostati dvosmisleni ili upitni bez obzira na to koliko se puta eksperiment ponavlja.
Pozitivni rezultati in vitro testa za dokazivanje kromosomskih aberacija pokazuju da ispitivana tvar izaziva strukturnu aberaciju kromosoma u uzgojenim somatskih stanicama sisavaca. Negativni rezultati pokazuju da ispitivana tvar u ispitnim uvjetima ne izaziva kromosomsku aberaciju u uzgojenim somatskim stanicama sisavaca.
3. IZVJEŠĆIVANJE
IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora sadržavati slijedeće informacije:
|
|
Otapalo/nosač:
|
|
|
Stanice:
|
|
|
Uvjeti ispitivanja:
|
|
|
Rezultati:
|
|
|
Diskusija o rezultatima. |
|
|
Zaključci. |
4. REFERENCE
|
(1) |
Evans, H. J., (1976) Cytological Methods for Detecting Chemical Mutagens. In: Chemical mutagens, Principles and Methods for their Detection, Vol. 4, Hollaender, A. (ed) Plenum Press, New York and London, str. 1-29. |
|
(2) |
Ishidate, M. Jr. and Sofuni, T., (1985). The In Vitro Chromosomal Aberration Test Using Chinese Hamster Lung (CHL) Fibroblast Cells in Culture. In: Progress in Mutation Research, Vol. 5, Ashby, J. et al., (Eds) Elsevier Science Publishers, Amsterdam-New York-Oxford, str. 427-432. |
|
(3) |
Galloway, S.M., Armstrong, M.J., Reuben, C., Colman, S., Brown, B., Cannon, C., Bloom, A.D., Nakamura, F., Ahmed, M., Duk, S., Rimpo, J., Margolin, G.H., Resnick, MA, Anderson, G. and Zeiger, E., (1978). Chromosome aberration and sister chromatic exchanges in Chinese hamster ovary cells: Evaluation of 108 chemicals. Environs. Molec. Mutagen 10 (suppl. 10), str. 1-175. |
|
(4) |
Scott, D., Galloway, S.M., Marshall, R.R., Ishidate, M.Jr., Brusick, D., Ashby, J. and Myhr, B.C., (1991) Genotoxicity under Extreme Culture Conditions. A report from ICPEMC Task Group 9. Mutation Res, 257, str. 147-204. |
|
(5) |
Morita, T., Nagaki, T., Fukuda, I. and Okumura, K., (1992). Clastogenicity of low pH to Various Cultured Mammalian Cells. Mutation Res., 268, str. 297-305. |
|
(6) |
Ames, B.N., McCann, J. and Yamasaki, E., (1975). Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian Microsome Mutagenicity Test. Mutation Res., 31, str. 347-364. |
|
(7) |
Maron, D.M. and Ames, B.N., (1983) Revised Methods for the Salmonella Mutagenicity Test. Mutation Res., 113, str. 173-215. |
|
(8) |
Natarajan, A.T., Tates, A.D., van Buul, P.P.W., Meijers, M. and de Vogel, N., (1976) Cytogenetic Effects of Mutagen/Carcinogens after Activation in a Microsomal System in Vitro, I. Induction of Chromosome Aberrations and Sister Chromatid Exchange by Diethylnitrosamine (DEN) and Dimethylnitrosamine (DMN) in CHO Cells in the Presence of Rat-Liver Microsomes. Mutation Res., 37, str. 83-90. |
|
(9) |
Matsuoka, A., Hayashi, M. and Ishidate, M. Jr., (1979) Chromosomal Aberration Tests on 29 Chemicals Combined with S9 Mix In Vitro. Mutation Res., 66, str. 277-290. |
|
(10) |
Elliot, B.M., Combes, R.D., Elcombe, C.R., Gatehouse, D.G., Gibson, G.G., Mackay, J.M. and Wolf, R.C., (1992). Report of UK Environmental Mutagen Society Working Party. Alternatives to Aroclor 1254-induced S9 in In Vitro Genotoxicity Assays. Mutagenesis, 7, str. 175-177. |
|
(11) |
Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T., (1976) A Safe Substitute for Polychlorinated Biphenyls as an Inducer of Metabolic Activation Systems. In: de Serres, F.J., Fouts, J.R., Bend, J.R. and Philpot, R.M. (eds) In Vitro Metabolic Activation in Mutagenesis Testing, Elsevier, North-Holland, str. 85-88. |
|
(12) |
Galloway, S.M., Aardema, M.J., Ishidate, M.Jr., Ivett, J.L., Kirkland, D.J., Morita, T., Mosesso, P., Sofuni, T., (1994) Report from Working Group on in In Vitro Tests for Chromosomal Aberrations. Mutation Res., 312, str. 241-261. |
|
(13) |
Richardson, C., Williams, D.A., Allen, J.A., Amphlett, G., Chanter, D.O. and Phillips, B., (1989) Analysis of Data from In Vitro Cytogenetic Assays. In: Statistical Evaluation of Mutagenicity Test Data. Kirkland, D.J., (ed) Cambridge University Press, Cambridge, str. 141-154. |
|
(14) |
Soper, K.A. and Galloway, S.M., (1994) Replicate Flasks are not Necessary for In Vitro Chromosome Aberration Assays in CHO Cells. Mutation Res., 312, str. 139-149. |
|
(15) |
Krahn, D.F., Barsky, F.C. and McCooey, K.T., (1982) CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids. In: Tice, R.R., Costa, D.L., Schaich, K.M. (eds). Genotoxic Effects of Airborne Agents. New York, Plenum, str. 91-103. |
|
(16) |
Zamora, P.O., Benson, J.M., Li, A.P. and Brooks, A.L., (1983) Evaluation of an Exposure System Using Cells Grown on Collagen Gels for Detecting Highly Volatile Mutagens in the CHO/HGPRT Mutation Assay. Environmental Mutagenesis, 5, str. 795-801. |
|
(17) |
Locke-Huhle, C., (1983) Endoreduplication in Chinese hamster cells during alpha-radiation induced G2 arrest. Mutation Res., 119, str. 403-413. |
|
(18) |
Huang, Y., Change, C. and Trosko, J.E., (1983) Aphidicolin-induced endoreduplication in Chinese hamster cells. Cancer Res., 43, str. 1362-1364. |
B.11. MUTAGENOST – IN VIVO TEST ZA DOKAZIVANJE KROMOSOMSKIH ABERACIJA KOŠTANE SRŽI SISAVACA
1. METODA
Ova je metoda istovjetna metodi OECD TG 475, Test za dokazivanje kromosomskih aberacija koštane srži sisavaca (1997.).
1.1. UVOD
In vivo test za dokazivanje kromosomskih aberacija sisavaca primjenjuje se za utvrđivanje strukturnih kromosomskih aberacija u stanicama koštane srži životinja, obično glodavaca (1)(2)(3)(4). Postoje dva tipa strukturnih aberacija kromosoma – kromosomski i kromatidni. Povećanje poliploidnosti može značiti da kemikalija ima potencijal za induciranje (izazivanje) numeričkih aberacija. Kod većine kemijskih mutagena inducirane aberacije kromatidnog su tipa, ali javljaju se i aberacije kromosomskog tipa. Kromosomske mutacije i srodne pojave uzrok su mnogih genetskih oboljenja ljudi i postoje dostatni dokazi da su kromosomske mutacije i srodne pojave koje uzrokuju promjene u onkogenima i genima supresorima tumora povezane s pojavom raka kod ljudi i u pokusnim sustavima.
U ovom se ispitivanju rutinski koriste glodavci. Ciljno tkivo u ovom ispitivanju je koštana srž, budući da je to tkivo jako prokrvljeno i sadrži populaciju stanica čiji se ciklus odvija brzo i koje se mogu lako izolirati i obrađivati. Ostale životinjske vrste i ciljna tkiva nisu predmet ove metode.
Ovo ispitivanje kromosomskih aberacija posebno je relevantno za procjenjivanje opasnosti od mutagenosti, budući da omogućuje analizu faktora metabolizma, farmakokonetike i procesa popravljanja DNK in vivo, iako oni kod različitih životinjskih vrsta i tkiva mogu biti različiti. In vivo test također je koristan za daljnja istraživanja mutagenih učinaka koji se otkriju in vitro testovima.
Ako ima dokaza da ispitivana tvar ili reaktivni metabolit neće stići do ciljnog tkiva, ovo ispitivanje nije primjereno provoditi.
Vidjeti i Opći uvod, dio B.
1.2. DEFINICIJE
Aberacija kromatidnog tipa: strukturno oštećenje kromosoma izraženo kao lom samo jedne kromatide ili lom i ponovno spajanje kromatida.
Aberacija kromosomskog tipa: strukturno oštećenje kromosoma izraženo kao lom ili lom i ponovno spajanje obiju kromatida na istom mjestu.
Endoreduplikacija: proces kod kojeg nakon S faze replikacije DNA ne slijedi mitoza (dioba) jezgre, nego započinje druga S faza. Rezultat su kromosomi s četiri, osam, 16,... kromatida.
Prekid (tijesni spoj): akromatska lezija manja od širine jedne kromatide i s minimalnim otklonom (neporavnatošću) kromatida.
Numerička aberacija: promjena u broju kromosoma u odnosu na normalni broj koji je karakterističan za korištene stanice.
Poliploidnost: višekratnik haploidnog broja kromosoma (n) osim diploidnog broja (tj. 3n, 4n itd.).
Strukturna aberacija: promjena u strukturi kromosoma koja se može otkriti mikroskopskim pregledom podjele stanica u metafazi, koja se opaža kao delecije i ulomci, intrakromosomske promjene ili interkromosomske promjene.
1.3. NAČELO ISPITNE METODE
Životinje se na odgovarajući način izlažu ispitivanoj tvari te se u odgovarajuće vrijeme nakon tretiranja usmrćuju. Prije usmrćivanja, životinje se tretiraju agensom za zaustavljanje metafaze (npr. Colcemidom® ili kolhicinom). Nakon toga, naprave se i oboje kromosomski preparati stanica koštane srži te se analizom utvrđuju kromosomske aberacije metafaznih stanica.
1.4. OPIS ISPITNE METODE
1.4.1. Priprema
1.4.1.1. Odabir životinjske vrste
Obično se koriste štakori, miševi i kineski hrčci, iako može poslužiti bilo koja odgovarajuća vrsta sisavaca. Treba koristiti mlade zdrave odrasle životinje sojeva koji su uobičajeni u laboratorijskoj praksi. Na početku studije variranje tjelesne mase životinja treba biti što manje i ne smije prelaziti ± 20 % od odgovarajuće srednje vrijednosti mase svakog spola.
1.4.1.2. Uvjeti držanja i prehrana
Primjenjuju se opći uvjeti iz Općeg uvoda u dijelu B, iako ciljna vlažnost zraka treba biti 50-60 %.
1.4.1.3. Priprema životinja
Zdrave mlade odrasle životinje nasumce se raspoređuju u kontrolne skupine i skupine koje će se tretirati. Kaveze treba smjestiti tako da se učinci do kojih bi moglo doći zbog njihovog položaja svedu na minimum. Životinje se označavaju jedinstvenim oznakama. Životinje se najmanje pet dana prilagođavaju laboratorijskim uvjetima.
1.4.1.4. Priprema doza
Krute ispitivane tvari treba otopiti ili suspendirati u odgovarajućim otapalima ili nosačima i prije doziranja životinjama prema potrebi razrijediti. Tekuće ispitivane tvari može se dozirati izravno i/ili ih se prije obrade može razrijediti. Treba koristiti svježe pripravke ispitivane tvari, osim u slučajevima kad podaci o stabilnosti pokazuju da ih je prihvatljivo pohraniti.
1.4.2. Uvjeti ispitivanja
1.4.2.1. Otapalo/nosač
Otapalo/nosač ne smije proizvesti toksičke učinke pri upotrijebljenim visinama doza i ne smije postojati sumnja da će kemijski reagirati s ispitivanom tvari. Ako se primjenjuju manje poznata otapala/nosači, njihovo bi uključivanje u ispitivanje trebalo biti potkrijepljeno podacima iz kojih je vidljivo da su prikladni. Kad god je to moguće, preporučuje se najprije razmotriti mogućnost primjene vodenog otapala/nosača.
1.4.2.2 Kontrole
U svaki test treba uključiti istovremene pozitivne i negativne kontrole (otapalo/nosač) za svaki spol. Izuzimajući tretiranje ispitivanom tvari, sa životinjama u kontrolnim skupinama treba postupati jednako kao sa životinjama u tretiranim skupinama.
Pozitivne bi kontrole trebale proizvesti strukturne aberacije in vivo pri razinama izlaganja kod kojih se očekuje povećanje koje je vidljivo u odnosu na pozadinu. Doze pozitivnih kontrola treba odabrati tako da učinci budu jasni, ali da osoba koja očitava rezultate ne može odmah vidjeti identitet kodiranih mikroskopskih preparata. Prihvatljivo je pozitivne kontrole primjenjivati na životinje drugim putevima, različitim od puteva korištenih za primjenu ispitivane tvari, te ih uzorkovati samo jednom.
Može se razmotriti korištenje kemikalija za pozitivnu kontrolu koje spadaju u istu klasu opasnosti kao i ispitivana tvar, ako su takve kemikalije raspoložive. Primjeri tvari za pozitivnu kontrolu obuhvaćaju:
|
Tvar |
CAS br. |
EINECS br. |
|
Etil metansulfonat |
62-50-0 |
200-536-7 |
|
Etil nitrosourea |
759-73-9 |
212-072-2 |
|
Mitomicin C |
50-07-7 |
200-008-6 |
|
Ciklofosfamid Ciklofosfamid monohidrat |
50-18-0 6055-19-2 |
200-015-4 |
|
Trietilenmelamin |
51-18-3 |
200-083-5 |
Kod svakog uzorkovanja treba upotrijebiti negativne kontrolne skupine tretirane samo otapalom ili nosačem, s kojima se inače postupa jednako kao i s tretiranim skupinama, osim kad podaci iz prijašnjih studija ukazuju na prihvatljivu varijabilnost i učestalost pojave stanica s kromosomskim aberacijama među drugim životinjama. Dodatno treba upotrijebiti i netretirane kontrolne skupine, osim ako postoje podaci iz ranijih studija koji dokazuju da odabrano otapalo ne proizvodi nikakve štetne niti mutagene učinke.
1.5. POSTUPAK
1.5.1. Broj i spol životinja
Svaka tretirana i kontrolna skupina mora uključivati najmanje pet životinja svakog spola koje je moguće analizirati. Ako su u vrijeme studije raspoloživi podaci iz studija provedenih na istoj životinjskoj vrsti uz primjenu istog puta izlaganja, koji dokazuju da nema znatnih razlika u toksičnosti s obzirom na spol, ispitivanje na jednom spolu bit će dovoljno. U slučajevima kad izloženost ljudi nekoj kemikaliji može biti vezana uz spol, kao što je slučaj s nekim farmaceutskim sredstvima, ispitivanja treba obaviti na životinjama odgovarajućeg spola.
1.5.2. Režim tretiranja
Ispitivane tvari najbolje je primijeniti jednokratno. Ispitivanu je tvar moguće primijeniti u dozi podijeljenoj u dva dijela, tj. dva doziranja isti dan u razmaku od najviše nekoliko sati, kako bi se olakšala primjena velike količine materijala. Za druge režime doziranja treba postojati znanstveno opravdanje.
Kod skupine na koju se primjenjuje najviša doza, nakon tretiranja uzorke treba uzeti dvaput. Prvi interval uzorkovanja nakon tretiranja glodavaca po dužini je jednak 1,5 normalnom staničnom ciklusu (s tim da normalni ciklus obično traje 12-18 sati). Budući da vrijeme potrebno za unos i metabolizam (metaboličku izmjenu) ispitivane tvari, kao i za njezino djelovanje na kinetiku staničnog ciklusa, može utjecati na optimalno vrijeme potrebno za otkrivanje kromosomskih aberacija, preporuča se još jedno uzimanje uzorka 24 sata nakon prvog uzimanja. Ako se koriste režimi kod kojih primjena doza traje duže od jednog dana, nakon posljednjeg tretiranja treba obaviti jedno uzorkovanje s vremenskim odmakom koji po dužini odgovara 1,5 normalnom staničnom ciklusu.
Prije usmrćivanja životinjama se intraperitonealno ubrizga odgovarajuća doza sredstva za zaustavljanje metafaze (npr. Colcemida® ili kolhicina). Životinjama se nakon toga u odgovarajućim vremenskim intervalima uzimaju uzorci. Za miševe taj interval iznosi približno tri do pet sati; za kineske hrčke je to interval od približno 4-5 sati. Stanice se izdvajaju iz koštane srži i analiziraju radi otkrivanja kromosomskih aberacija.
1.5.3. Visina doza
Ako se provodi studija za utvrđivanje raspona doza jer nema raspoloživih odgovarajućih podataka, treba je provesti u istom laboratoriju, koristeći životinje iste vrste, soja i spola, i isti režim tretiranja koji će se koristiti i u glavnoj studiji (5). Ako toksičnost postoji, za prvo uzorkovanje koriste se tri visine doza. Te visine doza trebaju pokriti raspon od maksimalne do male toksičnosti, odnosno netoksičnosti. Za kasnija uzorkovanja treba primjenjivati samo najviše doze. Najviša se doza definira kao doza koja uzrokuje takve znakove toksičnosti da je za očekivati da bi više doze pri istom režimu doziranja prouzročile smrt. Tvari (poput hormona i mitogena) koje u niskim netoksičnim dozama imaju specifično biološko djelovanje mogu biti izuzete od kriterija za utvrđivanje doza te ih se može ocjenjivati od slučaju do slučaja. Najviša se doza isto tako može definirati kao doza koja uzrokuje pojavu nekih pokazatelja toksičnosti u koštanoj srži (npr. smanjenje mitotskog indeksa preko 50 %).
1.5.4. Granični test
Ako test s jednom visinom doze od najmanje 2 000 mg/kg tjelesne mase, koja se primijeni odjednom ili u dva puta u istom danu, ne proizvede nikakve vidljive toksičke učinke i ako se na temelju podataka o strukturno srodnim tvarima ne očekuje genotoksičnost, kompletna studija uz primjenu tri visine doze ne smatra se potrebnom. Granična doza za dugotrajnije studije je 2 000 mg/kg tjelesne mase/dan za tretiranje do 14 dana, odnosno 1 000 mg/kg tjelesne mase/dan za tretiranje koje traje duže od 14 dana. Očekivana izloženost čovjeka može ukazati na potrebu za primjenom viših doza u graničnom testu.
1.5.5. Primjena doza
Ispitivana se tvar obično primjenjuje oralnom intubacijom pomoću želučane sonde ili odgovarajuće intubacijske kanile, ili pomoću intraperitonealne injekcije. Drugi putevi primjene mogu biti prihvatljivi ako za to postoji opravdanje. Maksimalni volumen tekućine koji se odjednom može primijeniti putem sonde ili injekcije ovisi o veličini pokusne životinje. Taj volumen ne smije biti veći od 2 ml/100 g tjelesne mase. Primjenu većih volumena od navedenog treba opravdati. Osim kod nadražujućih i nagrizajućih tvari, koje pri višim koncentracijama obično izazivaju negativne učinke, variranje ispitnih volumena treba podešavanjem koncentracije svesti na minimum kako bi se kod svih koncentracija osigurao stalni volumen.
1.5.6. Kromosomski preparat
Odmah po usmrćivanju životinje koštana se srž uzme, izloži hipotoničkoj otopini i fiksira. Stanice se zatim nanesu na mikroskopsko stakalce i oboje.
1.5.7. Analiza
Kao mjerilo toksičnosti treba odrediti mitotski indeks u najmanje 1 000 stanica po životinji za sve tretirane životinje (uključujući pozitivne kontrole) i netretirane životinje koje služe kao negativna kontrola.
Za svaku životinju treba analizirati najmanje 100 stanica. Ako se opazi veliki broj aberacija ovaj se broj može smanjiti. Sve preparate, uključujući i preparate pozitivnih i negativnih kontrola, treba nezavisno kodirati prije mikroskopske analize. Budući da postupak pripreme preparata često za posljedicu ima lom određenog broja metafaza uz gubitak kromosoma, stanice koje ulaze u očitavanje rezultata trebale bi zato sadržavati broj centromera jednak broju 2n ± 2.
2. PODACI
2.1 OBRADA REZULTATA
Podatke o pojedinačnim životinjama treba prikazati u obliku tablice. Pokusna jedinica je životinja. Za svaku je životinju potrebno odrediti broj vrednovanih (očitanih) stanica, broj aberacija po stanici i postotak stanica sa strukturnim kromosomskim aberacijama. Treba navesti različite vrste strukturnih kromosomskih aberacija zajedno s njihovim brojem i učestalošću za tretirane i kontrolne skupine. Kromosomski se prekidi bilježe odvojeno i navode u izvješću, ali se općenito ne uključuju u ukupnu učestalost aberacija. Ako ne postoje dokazi o razlikama u reakcijama među spolovima, u statističkoj analizi mogu se kombinirati podaci dobiveni ispitivanjima na oba spola.
2.2. OCJENA I TUMAČENJE REZULTATA
Postoji više kriterija za utvrđivanje pozitivnog rezultata, kao što je povećanje relativnog broja stanica s kromosomskim aberacijama vezano uz visinu doze ili jasno povećanje broja stanica s aberacijama u skupini koja je primala istu dozu, uočeno kod jednog uzorkovanja. Najprije treba razmotriti biološku relevantnost rezultata. Statističke metode mogu se primijeniti kao pomoćno sredstvo za vrednovanje rezultata ispitivanja (6). Kod utvrđivanja pozitivne reakcije statistički značaj ne bi trebao biti jedini odlučujući faktor. Dvosmislene rezultate treba pojasniti daljnjim ispitivanjima, najbolje uz izmjene u pokusnim uvjetima.
Porast broja poliploidnih stanica može značiti da ispitivana tvar može inducirati numeričke kromosomske aberacije. Povećanje učestalosti endoreduplikacije može značiti da ispitivana tvar može inhibirati progresiju staničnog ciklusa (7)(8).
Kod ovog se testa smatra da ispitivana tvar kod koje rezultati ne udovoljavaju gore navedenim kriterijima nije mutagena.
Iako će većina pokusa dati jasne pozitivne ili negativne rezultate, u rijetkim slučajevima na temelju dobivenih podataka nije moguće donijeti konačan zaključak o djelovanju ispitivane tvari. Rezultati mogu ostati dvosmisleni ili upitni bez obzira na to koliko se puta pokus ponavlja.
Pozitivni rezultati ispitivanja kromosomske aberacije in vitro pokazuju da ispitivana tvar u koštanoj srži sisavaca izaziva strukturnu aberaciju kromosoma. Negativni rezultati pokazuju da u ispitnim uvjetima ispitivana tvar u koštanoj srži testiranih vrsta ne izaziva kromosomsku aberaciju.
Treba razmotriti koja je vjerojatnost da ispitivana tvar ili njeni metaboliti dopru do glavnog krvotoka ili, konkretno, do ciljnog tkiva (npr. sustavna toksičnost).
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora sadržavati slijedeće informacije:
|
|
otapalo/nosač:
|
|
|
pokusne životinje:
|
|
|
uvjeti ispitivanja:
|
|
|
Rezultati:
|
|
|
Diskusija o rezultatima. |
|
|
Zaključci. |
4. REFERENCE
|
(1) |
Adler, I.D., (1984) Cytogenetic Tests in Mammals. In: Mutagenicity Testing: a Practical Approach. S. Venitt and J.M. Parry (Eds). IRL Press, Oxford, Washington D.C., str. 275-306. |
|
(2) |
Preston, R.J., Dean, B.J., Galloway, S., Holden, H., McFee, A.F. and Shelby, M. (1987). Mammalian In Vivo Cytogenetic Assays: Analysis of Chromosome Aberrations in Bone Marrow Cells. Mutation Res., 189, str. 157-165. |
|
(3) |
Richold, M., Chandley, A., Ashby, J., Gatehouse, D.G., Bootman, J. and Henderson, L., (1990) In Vivo Cytogenetic Assays. In: D.J. Kirkland (Ed.) Basic Mutagenicity Tests, UKEMS Recommended Procedures. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report. Part I revised. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, str. 115-141. |
|
(4) |
Tice, R.R., Hayashi, M., MacGregor, J.T., Anderson, D., Blakey, D.H., Holden, H.E., Kirsch-Volders, M., Oleson Jr., F.B., Pacchierotti, F., Preston, R.J., Romagna, F., Shimada, H., Sutou, S. and Vannier, B., (1994) Report from the Working Group on the In Vivo Mammalian Bone Marrow Chromosomal Aberration Test. Mutation Res., 312, str. 305-312. |
|
(5) |
Fielder, R.J., Allen, J.A., Boobis, A.R., Botham, P.A., Doe, J., Esdaile, D.J., Gatehouse, D.G., Hodson-Walker, G., Morton, D.B., Kirkland, D.J. and Richold, M. (1992). Report of British Toxicology Society/UK Environmental Mutagen Society Working Group: Dose setting in In vivo Mutagenicity Assays. Mutagenesis, 7, str. 313-319. |
|
(6) |
Lovell, D.P., Anderson, D., Albanese, R., Amphlett, G.E., Clare, G., Ferguson, R., Richold, M., Papworth, D.G. and Savage, J.R.K. (1989). Statistical Analysis of In Vivo Cytogenetic Assays. In: UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report Part III. Statistical Evaluation of Mutagenicity Test Data. D.J. Kirkland, (Ed.) Cambridge University Press, Cambridge. str. 184-232. |
|
(7) |
Locke-Huhle, C., (1983) Endoreduplication in Chinese hamster cells during alpha-radiation induced G2 arrest. Mutation Res. 119, str. 403-413. |
|
(8) |
Huang, Y., Change, C. and Trosko, J.E., (1983) Aphidicolin-induced endoreduplication in Chinese hamster cells. Cancer Res., 43, str. 1362-1364. |
B.12. MUTAGENOST – IN VIVO MIKRONUKLEUS TEST NA ERITROCITIMA SISAVACA
1. METODA
Ova je metoda istovjetna metodi OECD TG 474, Mikronukleus test na eritrocitima sisavaca (1997.) (Mammalian Erythrocyte Micronucleus Test (1997)).
1.1. UVOD
In vivo mikronukleus test kod sisavaca koristi se za otkrivanje oštećenja koja ispitivana tvar izaziva na kromosomima ili mitotskom aparatu eritroblasta, na temelju analize eritrocita uzorkovanih iz koštane srži i/ili perifernih krvnih stanica životinja, obično glodavaca.
Svrha mikronukleus testa je identificirati tvari koje izazivaju citogenetska oštećenja zbog kojih dolazi do stvaranja mikronukleusa koji sadrže zaostale fragmente kromosoma ili čitave kromosome.
Kad se eritroblast koštane srži razvije u polikromatski eritrocit, glavni nukleus (stanična jezgra) biva istisnut; bilo koji nastali mikronukleus može zaostati u citoplazmi koja inače nema jezgru. Vidljivost mikronukleusa u ovim je stanicama olakšana s obzirom da im nedostaje glavni nukleus (jezgra). Povećanje učestalosti polikromatskih eritrocita s mikronukleusima kod tretiranih životinja pokazatelj je izazvanih kromosomskih oštećenja.
Za ovo se ispitivanje obično koristi koštana srž glodavaca budući da polikromatski eritrociti nastaju u tom tkivu. Mjerenje nezrelih (polikromatskih) eritrocita s mikronukleusima u perifernoj krvi jednako je prihvatljivo kod bilo koje vrste kod koje je dokazano da slezena ne može ukloniti eritrocite s mikronukleusima, ili koja je pokazala odgovarajuću osjetljivost na otkrivanje agensa koji uzrokuju strukturne ili numeričke kromosomske aberacije. Mikronukleuse je moguće razlikovati na temelju više kriterija. Ti kriteriji obuhvaćaju identifikaciju postojanja ili nepostojanja kinetohore ili centromerne DNA u mikronukleusima. Učestalost nezrelih (polikromatskih) eritrocita s mikronukleusima predstavlja glavnu krajnju točku ispitivanja. Broj zrelih (normokromatskih) eritrocita s mikronukleusima, koji se nalaze u perifernoj krvi uz određeni broj zrelih eritrocita, također je moguće koristiti kao krajnju točku ispitivanja u slučajevima kad se životinje neprekidno tretiraju tijekom 4 tjedna ili duže.
Ovaj in vivo mikronukleus test na sisavcima posebno je relevantan za ocjenjivanje opasnosti od pojave mutagenosti zato što omogućuje sagledavanje faktora in vivo metabolizma, farmakokinetku i procese popravka DNA, iako oni mogu varirati kod različitih životinjskih vrsta, različitih tkiva, kao i kod različitih genetskih konačnih učinaka. Ispitivanje in vivo isto je tako korisno za daljnja istraživanja mutagenih učinaka otkrivenih pomoću nekog sustava in vitro.
Ako se pojave dokazi da ispitivana tvar ili reaktivni metabolit neće stići do ciljnog tkiva, ovo ispitivanje nije primjereno provoditi.
Vidjeti također Opći uvod, dio B.
1.2. DEFINICIJE
Centromer (kinetohora): područje(-a) kromosoma s kojima su tijekom stanične diobe povezane niti diobenog vretena, što omogućuje uredno kretanje kromosoma kćeri prema polovima stanica kćeri.
Mikronukleusi: Maleni nukleusi (jezgre), koji se nalaze uz glavne stanične jezgre i od njih su odvojeni, koje tijekom telofaze mitoze (mejoze) proizvode zaostali fragmenti kromosoma ili čitavi kromosomi.
Normokromatski eritrocit: Zreli eritrocit kojemu nedostaju ribosomi i moguće ga je razlikovati od nezrelih polikromatskih eritrocita pomoću bojila selektivnih za ribosome.
Polikromatski eritrocit: Nezreli eritrocit u prijelaznoj fazi razvoja koji još uvijek sadrži ribosome pa ga je moguće razlikovati od zrelih, normokromatskih eritrocita pomoću bojila selektivnih za ribosome.
1.3. NAČELO ISPITNE METODE
Životinje se na odgovarajući način izlažu ispitivanoj tvari. Ako se koristi koštana srž, životinje se po isteku odgovarajućih vremenskih razdoblja nakon tretiranja usmrćuju, uzima se koštana srž i rade se odgovarajući mikroskopski preparati koji se zatim boje (1)(2)(3)(4)(5)(6)(7). Kad se koristi periferna krv, po isteku odgovarajućih vremenskih razdoblja nakon tretiranja uzima se krv i rade odgovarajući mikroskopski preparati koji se zatim boje (4)(8)(9)(10). Kod studija s perifernom krvi, između zadnjeg izlaganja i izdvajanja stanica treba proći što manje vremena. Preparati se analiziraju na prisutnost mikronukleusa.
1.4. OPIS ISPITNE METODE
1.4.1. Preparati
1.4.1.1. Odabir životinjske vrste
Ako se koristi koštana srž preporučuju se miševi ili štakori, iako se može koristiti bilo koja druga odgovarajuća vrsta sisavaca. Kad se koristi periferna krv, preporučuju se miševi. Međutim, može se koristiti bilo koja druga odgovarajuća vrsta sisavaca, pod uvjetom da se radi o vrsti kod koje slezena ne uklanja eritrocite s mikronukleusima, odnosno o vrsti koja je pokazala primjerenu osjetljivost za otkrivanje agensa koji uzrokuju strukturne ili numeričke aberacije kromosoma. Treba koristiti sojeve mladih zdravih životinja koji se obično koriste u laboratorijima. Na početku studije raspon tjelesnih masa životinja ne smije varirati za više od ± 20 % od odgovarajuće srednje tjelesne mase svakog spola.
1.4.1.2. Uvjeti držanja i hranjenja
Primjenjuju se opći uvjeti iz Općeg uvoda u dijelu B, iako ciljna vlažnost treba iznositi 50-60 %.
1.4.1.3. Priprema životinja
Prije ispitivanja odabiru se zdrave mlade životinje i nasumce raspoređuju u kontrolne skupine i skupine za tretiranje. Životinje se označavaju jedinstvenim oznakama. Životinje se najmanje pet dana prilagođavaju laboratorijskim uvjetima. Kaveze treba tako rasporediti da se učinci do kojih bi moglo doći zbog položaja kaveza svedu na minimum.
1.4.1.4. Priprema doza
Krute ispitivane tvari treba otopiti ili suspendirati u odgovarajućim otapalima ili nosačima i prije doziranja životinjama prema potrebi razrijediti. Tekuće ispitivane tvari mogu se odmah dozirati ili razrijediti prije doziranja. Treba koristiti svježe preparate ispitivane tvari, osim ako podaci o njihovoj stabilnosti dokazuju da je njihovo pohranjivanje prihvatljivo.
1.4.2. Uvjeti ispitivanja
1.4.2.1. Otapalo/nosač
Otapalo/nosač ne smije izazvati toksičke učinke pri dozama koje se primjenjuju, i ne smije postojati sumnja da bi s ispitivanom tvari mogli proizvesti kemijsku reakciju. Ako se koriste otapala/nosači koji nisu dobro poznati, njihovo uključivanje u ispitivanje treba potkrijepiti referentnim podacima koji pokazuju njihovu sukladnost. Preporuka je da se, kad god je to moguće, najprije razmotri mogućnost upotrebe vodenog otapala/nosača.
1.4.2.2. Kontrole
Za svaki spol u svaki test treba uključiti paralelne pozitivne i negativne (otapalo/nosač) kontrole. Izuzimajući tretiranje ispitivanom tvari, sa životinjama u kontrolnoj skupini treba postupati na jednaki način kao sa životinjama u skupinama koje se tretiraju.
Tvari koje se koriste za pozitivnu kontrolu trebale bi, pri razinama izloženosti za koje se očekuje da će izazvati uočljivo povećanje s obzirom na podlogu, trebale prouzročiti nastanak mikronukleusa in vivo. Pozitivne kontrole treba dozirati tako da njihovi učinci budu jasni, ali da osobi koja očitava rezultate ne otkriju odmah identitet kodiranih mikroskopskih preparata. Prihvatljivo je za pozitivne kontrole koristiti puteve primjene različite od onih koji se koriste za primjenu ispitivane tvari, a uzorke uzeti samo jednom. Osim toga, ako su raspoložive, kao pozitivne kontrole smiju se upotrijebiti kemikalije koje su svrstane u istu klasu opasnosti kao i ispitivana kemikalija. Primjeri pozitivnih kontrola uključuju sljedeće tvari:
|
Tvar |
CAS br. |
EINECS br. |
|
Etil metansulfonat |
62-50-0 |
200-536-7 |
|
N-etil-N-nitrozourea |
759-73-9 |
212-072-2 |
|
Mitomicin C |
50-07-7 |
200-008-6 |
|
Ciklofosfamid Ciklofosfamid monohidrat |
50-18-0 6055-19-2 |
200-015-4 |
|
Trietilenmelamin |
51-18-3 |
200-083-5 |
Životinje za negativnu kontrolu koje se tretiraju samo otapalom ili nosačem, a s kojima se inače postupa jednako kao s tretiranim skupinama, treba uključiti u svako uzorkovanje, osim u slučajevima kad podaci o kontrolama u prijašnjim ispitivanjima pokazuju prihvatljivu varijabilnost među životinjama i učestalost stanica s mikronukleusima. Ako se za negativnu kontrolu uzima samo jedan uzorak, najbolje ga je uzeti kod prvog uzorkovanja. Osim toga, treba upotrijebiti i netretirane kontrolne životinje osim ako postoje prijašnji ili objavljeni podaci koji dokazuju da odabrano otapalo/nosač ne izaziva mutagene učinke.
Ako se koristi periferna krv, uzorak koji se uzme prije tretiranja prihvatljiv je kao negativni kontrolni uzorak, ali samo u studijama periferne krvi (npr. 1-3 tretiranja) kad su rezultati u okviru raspona koji se očekuje na temelju prijašnjih kontrola.
1.5. POSTUPAK
1.5.1. Broj i spol životinja
U svakoj tretiranoj i kontrolnoj skupini mora biti najmanje po pet životinja svakog spola koje je moguće analizirati (11). Ako su u vrijeme studije raspoloživi podaci iz studija obavljenih na istim životinjskim vrstama uz upotrebu istog puta primjene, koji dokazuju da među spolovima nema značajnih razlika u toksičnosti, dovoljno će biti testiranje na jednom spolu. U slučajevima kad izloženost kemikalijama može biti vezana uz jedan spol, na primjer kad se radi o određenim farmaceutskim sredstvima, test treba obaviti na životinjama odgovarajućeg spola.
1.5.2. Režim tretiranja
Ne može se preporučiti nijedan standardni režim tretiranja (npr. jedno, dva ili više tretiranja u vremenskim razmacima od 24 sata). Uzorci uzeti nakon primjene produženog režima doziranja prihvatljivi su pod uvjetom da je u toj studiji bio dokazan pozitivan učinak, ili kod negativne studije, pod uvjetom da je bila dokazana toksičnost ili da je bila korištena granična doza, te da je doziranje bilo nastavljeno do uzorkovanja. Ispitivane tvari mogu se primjenjivati i u podijeljenoj dozi koja se daje npr. u dva puta u istom danu, u razmaku od najviše nekoliko sati, kako bi se olakšalo davanje velikog volumena materijala.
Ispitivanje se može obaviti na dva načina:
|
(a) |
životinje se ispitivanom tvari tretiraju jedanput. Uzorci koštane srži uzimaju se najmanje dvaput, prvi put najranije 24 sata nakon tretiranja ili najkasnije 48 sati nakon tretiranja, uz odgovarajuće intervale između uzorkovanja. Ako se prvi uzorak uzme prije isteka 24 sata nakon tretiranja, za to treba navesti opravdane razloge. Uzorci periferne krvi uzimaju se najmanje dvaput, počevši najranije 36 sati nakon tretiranja i nakon tog u odgovarajućim vremenskim razmacima, ali ukupni postupak ne smije biti duži od 72 sata. Ako se kod jednog od uzorkovanja opazi pozitivna reakcija, dodatno uzorkovanje nije potrebno; |
|
(b) |
ako se doza primjenjuje dva ili više puta dnevno (npr. dva ili više tretiranja u vremenskim razmacima od 24 sata) uzorke treba uzeti jedanput u razdoblju između 18 i 24 sata nakon zadnjeg tretiranja kad se radi o koštanoj srži i jedanput u razdoblju između 36 i 48 sati nakon zadnjeg tretiranja kad je u pitanju periferna krv (12). |
Mogu se uzeti i dodatni uzorci u drugim vremenskim razmacima, kada je to relevantno.
1.5.3. Visina doza
Ako je potrebno napraviti studiju radi utvrđivanja raspona doza jer nema raspoloživih odgovarajućih podataka, tu studiju treba provesti u istom laboratoriju, uz korištenje iste životinjske vrste i soja te režima doziranja koji će se koristiti u glavnoj studiji (13). Ako toksičnost postoji, za prvo uzorkovanje upotrebljavaju se tri visine doza. Te doze trebaju pokriti raspon od maksimalne do male toksičnosti ili netoksičnosti. Kod kasnijih uzorkovanja treba koristiti samo najvišu dozu. Najviša doza definira se kao doza koja uzrokuje takve znakove toksičnosti da je za očekivati da će pri istom režimu doziranja više doze prouzročiti smrt. Tvari sa specifičnim biološkim djelovanjem pri niskim netoksičnim dozama (kao što su hormoni i mitogeni) mogu se izuzeti od kriterija za utvrđivanje doza i treba ih ocjenjivati od slučaja do slučaja. Najviša doza može se definirati i kao doza koje izaziva neke znakove toksičnosti u koštanoj srži (npr. smanjenje udjela nezrelih eritrocita u ukupnom broju eritrocita u koštanoj srži ili perifernoj krvi).
1.5.4. Granični test
Ako test s jednom dozom od najmanje 2 000 mg/kg tjelesne mase, koja se primijeni odjednom ili u dva puta isti dan, ne prouzroči primjetljive toksične učinke i ako se na temelju podataka o strukturno srodnim tvarima ne očekuje genotoksičnost, potpuna studija uz primjenu tri razine doza ne smatra se potrebnom. Za dugotrajnije studije granična doza je 2 000 mg/kg tjelesne mase/dan za tretiranje do 14 dana i 1 000 mg/kg tjelesne mase/dan za tretiranje duže od 14 dana. Očekivana izloženost ljudi može ukazati na potrebu za primjenom više doze u graničnom testu.
1.5.5. Primjena doza
Ispitivana se tvar obično primjenjuje oralnom intubacijom pomoću želučane sonde ili odgovarajuće intubacijske kanile ili ubrizgavanjem pomoću intraperitonealne injekcije. Prihvatljivi su i drugi putevi primjene ako za to postoje opravdani razlozi. Maksimalni volumen tekućine koji se odjednom može primijeniti pomoću sonde ili injekcije ovisi o veličini pokusne životinje. Taj volumen ne smije biti veći od 2 ml/100 g tjelesne mase. Za primjenu većih volumena od navedenog moraju postojati opravdani razlozi. Izuzimajući nadražujuće ili nagrizajuće tvari koje pri višim koncentracijama obično djeluju štetno, variranje ispitnih volumena treba svesti na minimum podešavanjem koncentracije i tako osigurati stalni volumen pri svim visinama doza.
1.5.6. Preparati koštane srži/krvi
Stanice koštane srži obično se uzimaju iz femura (bedrene kosti) ili tibije (potkoljenice) odmah nakon usmrćivanja. Stanice se obično iz bedrene kosti ili potkoljenice vade, prepariraju i boje uz primjenu uobičajenih metoda. Periferna krv vadi se iz repne vene ili nekog drugog odgovarajućeg krvnog suda. Krvne stanice odmah se supravitalno oboje (8)(9)(10) ili se naprave preparati razmaza koji se zatim oboje. Upotreba boja koje su specifične za DNK (npr. akridin oranž (14) ili Hoechst 33258 i pironin-Y (15)) može spriječiti stvaranje nekih od artefakta koji se povezuju s upotrebom bojila koja nisu specifična za DNK. Ova prednost ne isključuje upotrebu konvencionalnih bojila (npr. Giemsa). Mogu se upotrebljavati i dodatni sustavi (npr. celuloznih kolona za uklanjanje stanica s jezgrom (16)) pod uvjetom da se pokazalo da navedeni sustavi funkcioniraju na odgovarajući način prilikom izrade mikronukleusnih preparata u laboratoriju.
1.5.7. Analiza
Za svaku se životinju utvrđuje udio nezrelih eritrocita u ukupnom broju (nezrelih + zrelih) eritrocita, tako da se ukupno prebroji najmanje 200 eritrocita kad je u pitanju koštana srž i 1 000 eritrocita kad je u pitanju periferna krv (17). Sve mikroskopske preparate, uključujući i pozitivne i negativne kontrole, treba prije mikroskopske analize nezavisno kodirati. Za utvrđivanje incidencije (učestalosti) eritrocita s mikronukleusima za svaku životinju treba pregledati najmanje 2 000 nezrelih eritrocita. Dodatne informacije mogu se dobiti utvrđivanjem broja zrelih eritrocita s mikronukleusima. Kod analize mikroskopskih preparata, udio nezrelih eritrocita u ukupnom broju eritrocita ne bi smio prijeći 20 % kontrolne vrijednosti. Kad se životinje neprekidno tretiraju četiri tjedna ili više, incidencija mikronukleusa može se utvrditi analizom najmanje 2 000 zrelih eritrocita po životinji. Sustavi za automatsku analizu (slikovna analiza i protočna citometrija staničnih suspenzija) prihvatljiva su alternativa za ručno prebrojavanje, ako su primjereno opravdani i validirani.
2. PODACI
2.1. OBRADA REZULTATA
Podatke za pojedinačne životinje treba prikazati u tabličnom obliku. Pokusna jedinica je životinja. Za svaku analiziranu životinju posebno treba navesti utvrđeni broj nezrelih eritrocita, broj nezrelih eritrocita s mikronukleusima i broj nezrelih eritrocita u ukupnom broju eritrocita. Ako se životinje neprekidno tretiraju četiri ili više tjedana, treba navesti i podatke o zrelim eritrocitima, ako su prikupljeni. Za svaku životinju treba navesti, ako se to smatra primjerenim, udio nezrelih eritrocita u ukupnom broju eritrocita i, postotak eritrocita s mikronukleusima. Ako nema dokaza o razlikama u reakcijama među spolovima, za statističku analizu mogu se kombinirati podaci prikupljeni za oba spola.
2.2. OCJENA I TUMAČENJE REZULTATA
Postoji više kriterija za utvrđivanje pozitivnog rezultata, kao na primjer povećanje broja stanica s mikronukleusima povezano s dozom ili jasni porast broja stanica s mikronukleusima utvrđen na temelju samo jednog uzorkovanja kod skupine na koju je primijenjena samo jedna doza. Najprije treba razmotriti biološku relevantnost rezultata. Kao pomoć pri ocjenjivanju rezultata ispitivanja mogu se koristiti statističke metode (18)(19). Statistički značaj ne može biti jedini odlučujući faktor pri utvrđivanju pozitivne reakcije. Nejasne rezultate treba pojasniti daljnjim ispitivanjima, po mogućnosti uz variranje uvjeta pokusa.
Smatra se da ispitivana tvar za koju rezultati ovog testa ne ispunjavaju gore navedene kriterije nije mutagena.
Iako će većina pokusa dati jasne pozitivne ili negativne rezultate, u rijetkim slučajevima dobiveni podaci neće omogućiti donošenje definitivne ocjene o djelovanju ispitivane tvari. Rezultati mogu ostati nejasni ili upitni bez obzira na broj ponavljanja pokusa.
Pozitivni rezultati u mikronukleus testu znače da tvar uzrokuje stvaranje mikronukleusa, koji su posljedica oštećenja kromosoma ili oštećenja mitotskog aparata kod eritroblasta pokusne vrste. Negativni rezultati znače da ispitivana tvar u ispitnim uvjetima ne uzrokuje stvaranje mikronukleusa u nezrelim eritrocitima pokusne vrste.
Treba razmotriti vjerojatnost da ispitivana tvar ili njezini metaboliti uđu u glavni krvotok i posebno u ciljno tkivo (npr. sustavna toksičnost).
3. IZVJEŠĆIVANJE
IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora sadržavati sljedeće informacije:
|
|
otapalo/nosač:
|
|
|
Pokusne životinje:
|
|
|
Uvjeti ispitivanja:
|
|
|
Rezultati:
|
4. REFERENCE
|
(1) |
Heddle, J.A., (1973) A Rapid In Vivo Test for Chromosomal Damage, Mutation Res., 18, str. 187-190. |
|
(2) |
Schmid, W., (1975) The Micronucleus Test, Mutation Res., 31, str. 9-15. |
|
(3) |
Heddle, J.A., Salamone, M.F., Hite, M., Kirkhart, B., Mavournin, K., MacGregor, J.G. and Newell, G.W. (1983). The Induction of Micronuclei as a Measure of Genotoxicity. Mutation Res., 123, str. 61-118. |
|
(4) |
Mavournin, K.H., Blakey, D.H., Cimino, M.C., Salamone, M.F. and Heddle, J.A., (1990) The In Vivo Micronucleus Assay in Mammalian Bone Marrow and Peripheral Blood. A report of the U.S. Environmental Protection Agency Gene-Tox Program, Mutation Res., 239, str. 29-80. |
|
(5) |
MacGregor, J.T., Schlegel, R. Choy, W.N., and Wehr, C.M., (1983) Micronuclei in Circulating Erythrocytes: A Rapid Screen for Chromosomal Damage During Routine Toxicity Testing in Mice. Iin: „Developments in Science and Practice of Toxicology”, Ed. A.W. Hayes, R.C. Schnell and T.S. Miya, Elsevier, Amsterdam, str. 555-558. |
|
(6) |
MacGregor, J.T., Heddle, J.A. Hite, M., Margolin, G.H., Ramel, C., Salamone, M.F., Tice, R.R., and Wild, D., (1987) Guidelines for the Conduct of Micronucleus Assays in Mammalian Bone Marrow Erytrocytes. Mutation Res., 189, str. 103-112. |
|
(7) |
MacGregor, J.T., Wehr, C.M., Henika, P.R., and Shelby, M.E., (1990) The in vivo Erythrocyte Micronucleus Test: Measurement at Steady State Increases Assay Efficiency and Permits Integration with Toxicity Studies. Fund. Appl. Toxicol., 14, str. 513-522. |
|
(8) |
Hayashi, M., Morita, T., Kodama, Y., Sofuni, T. and Ishidate, M. Jr., (1990) The Micronucleus Assay with Mouse Peripheral Blood Reticulocytes Using Acridine Orange-Coated Slides. Mutation Res., 245, str. 245-249. |
|
(9) |
The Collaborative Study Group for the Micronucleus Test, (1992) Micronucleus Test with Mouse Peripheral Blood Erythrocytes by Acridine Orange Supravital Staining: The Summary Report of the 5th Collaborative Study by CSGMT/JEMMS. MMS. Mutation Res., str. 278, 83-98. |
|
(10) |
The Collaborative Study Group for the Micronucleus Test (CSGMT/JEMMS. MMS: The Mammalian Mutagenesis Study Group of the Environmental Mutagen Society of Japan), (1995) Protocol recommended for the short-term mouse peripheral blood micronucleus test. Mutagenesis, 10, str. 153-159. |
|
(11) |
Hayashi, M., Tice, R.R., MacGregor, J.T., Anderson, D., Blackey, D.H., Kirsch-Volders, M., Oleson, Jr. F. B., Pacchierotti, F., Romagna, F., Shimada, H., Sutou, S. and Vannier, B., (1994) In Vivo Rodent Erythrocyte Micronucleus Assay. Mutation Res., 312, str. 293-304. |
|
(12) |
Higashikuni, N. and Sutou, S., (1995) An optimal, generalised sampling time of 30 ± 6 h after double dosing in the mouse peripheral blood micronucleus test. Mutagenesis, 10, str. 313-319. |
|
(13) |
Fielder, R.J., Allen, J.A., Boobis, A.R., Botham, P.A., Doe, J., Esdaile, D.J., Gatehouse, D.G., Hodson-Walker, G., Morton, D.B., Kirkland, D.J. and Rochold, M., (1992) Report of British Toxicology Society/UK Environmental Mutagen Society Working Group: Dose Setting in In Vivo Mutagenicity Assays. Mutagenesis, 7, str. 313-319. |
|
(14) |
Hayashi, M., Sofuni, T. and Ishidate, M. Jr., (1983) An Application of Acridine Orange Fluorescent Staining to the Micronucleus Test. Mutation Res., 120, str. 241-247. |
|
(15) |
MacGregor, J.T., Wehr, C.M. and Langlois, R.G., (1983) A Simple Fluorescent Staining Procedure for Micronuclei and RNA in Erythrocytes Using Hoechst 33258 and Pyronin Y. Mutation Res., 120, str. 269- 275. |
|
(16) |
Romagna, F. and Staniforth, C.D., (1989) The automated bone marrow micronucleus test. Mutation Res., 213, str. 91-104. |
|
(17) |
Gollapudi, B. and McFadden, L.G., (1995) Sample size for the estimation of polychromatic to normochromatic erythrocyte ratio in the bone marrow micronucleus test. Mutation Res., 347, str. 97-99. |
|
(18) |
Richold, M., Ashby, J., Bootman, J., Chandley, A., Gatehouse, D.G. and Henderson, L., (1990) In Vivo Cytogenetics Assay. In: D.J. Kirkland (Ed.) Basic Mutagenicity tests. UKEMS Recommended Procedures. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report, Part I, revised. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, str. 115-141. |
|
(19) |
Lovell, D.P., Anderson, D., Albanese, R., Amphlett, G.E., Clare, G., Ferguson, R., Richold, M., Papworth, D.G. and Savage, J.R.K., (1989) Statistical Analysis of In Vivo Cytogenetic Assays. In: D.J. Kirkland (Ed.) Statistical Evaluation of Mutagenicity Test Data. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report, Part III. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, str. 184-232. |
B.13./14. MUTAGENOST: TEST ZA OTKRIVANJE POVRATNIH MUTACIJA POMOĆU BAKTERIJA
1. METODA
Ova je metoda istovjetna metodi OECD TG 471, Bakterijski test povratnih mutacija (Bacterial Reverse Mutation Test) (1997.).
1.1. UVOD
Pri ispitivanju povratnih mutacija koriste se sojevi bakterija Salmonella typhimurium i Escherichia coli kojima su potrebne aminokiseline, za otkrivanje točkastih mutacija koje uključuju supstituciju, adiciju ili deleciju jednog ili više baznih parova DNK (1)(2)(3). Načelo ovog bakterijskog testa povratnih mutacija je da test otkriva mutacije koje povratno djeluju na mutacije prisutne kod pokusnih sojeva i ponovo uspostavljaju funkcionalnu sposobnost bakterija da sintetiziraju esencijalne amino kiseline. Povratno mutirane bakterije raspoznaju se po njihovoj sposobnosti rasta u odsutnosti aminokiseline koja je potrebna za rast roditeljskom pokusnom soju.
Točkaste mutacije uzrokuju mnoge genetske bolesti u ljudi i postoje čvrsti dokazi da su povratne mutacije u onkogenima i tumor-supresorskim genima somatskih stanica povezane s nastajanjem tumora kod ljudi i pokusnih životinja. Test bakterijskih povratnih mutacija je brz, jeftin i relativno lako izvediv. Mnogi od pokusnih sojeva imaju nekoliko svojstava koja ih čine osjetljivijima za otkrivanje mutacija, uključujući i osjetljive nizove DNK na mjestima povratnih mutacija, povećanu propusnost stanica za velike molekule i eliminaciju sustava za popravak DNK ili poticanje procesa popravljanja DNK podložnih pojavi grešaka. Na specifičnostima pokusnih sojeva mogu se temeljiti neke korisne informacije o vrstama mutacija koje uzrokuju genotoksični agensi. Za testove bakterijskih povratnih mutacija postoji vrlo velika baza podataka u kojoj su sadržani rezultati za veliki broj različitih struktura, a razvijene su i dobro uhodane metode za ispitivanje kemikalija različitih fizikalno-kemijskih svojstava, uključujući hlapive spojeve.
Vidjeti također Opći uvod, dio B.
1.2. DEFINICIJE
Test povratnih mutacija na bakterijama Salmonella typhimurium ili Escherichia coli otkriva mutacije kod sojeva kojima je potrebna aminokiselina (histidin odnosno triptofan) za stvaranje sojeva koji ne ovise egzogenoj opskrbi aminokiselinom.
Mutageni supstitucije baznih parova su agensi koji uzrokuju zamjenu baza DNK. Kod testa povratnih mutacija ova se zamjena u bakterijskom genomu može javiti na mjestu izvorne mutacije ili na nekom drugom mjestu.
Frameshift mutageni (mutageni pomaka očitavanja) su agensi koji uzrokuju adiciju ili deleciju jednog ili više baznih parova u DNK, mijenjenjući na taj način okvir očitavanja RNK.
1.3. UVODNA RAZMATRANJA
Kod bakterijskog testa povratnih mutacija koriste se prokariotske stanice, koje se razlikuju od stanica sisavaca po faktorima kao što su unos, metabolizam, struktura kromosoma i procesi popravljanja DNK. In vitro testovi općenito zahtijevaju upotrebu egzogenog izvora metaboličke aktivacije. Sustavi metaboličke aktivacije in vitro ne mogu u potpunosti oponašati in vivo uvjete kod sisavaca. Prema tome, ovaj test ne pruža izravne informacije o mutagenom i karcinogenom potencijalu tvari s obzirom na sisavce.
Bakterijski test povratnih mutacija obično se koristi kao inicijalni probir za genotoksičko djelovanje i posebno za djelovanje koje uzrokuje točkaste mutacije. Obimna baza podataka dokazuje da mnoge kemikalije koje su pozitivne na ovaj test pokazuju mutageno djelovanje i u drugim testovima. Postoje primjeri mutagenih agensa koje ovaj test ne otkriva; razlozi za taj nedostatak mogu se pripisati specifičnoj prirodi krajnjeg učinka koji se otkriva, razlike u metaboličkoj aktivaciji ili razlike u bioraspoloživosti. S druge strane, faktori koji pojačavaju osjetljivost bakterijskog testa povratnih mutacija mogu dovesti do precjenjivanja mutagenog djelovanja.
Bakterijski test povratnih mutacija možda nije pogodan za ocjenjivanje nekih klasa kemikalija kao što su spojevi s jakim baktericidnim djelovanjem (npr. neki antibiotici) i spojevi koji posebno utječu na sustav razmnožavanja stanica sisavaca (npr. neki inhibitori topoizomeraze i neki nukleozidni analozi). U takvim slučajevima mogli bi biti prikladniji testovi mutacija koji se provode na sisavcima.
Iako su se mnogi spojevi koji su pozitivni na ovaj test pokazali karcinogenima za sisavce, ova korelacija nije apsolutna. Ona ovisi o kemijskoj klasi, a postoje i karcinogeni koje ovaj test ne otkriva jer djeluju preko drugih, negenotoksičkih mehanizama ili mehanizama kojih u bakterijskim stanicama nema.
1.4. NAČELO ISPITNE METODE
Suspenzije bakterijskih stanica izlažu se ispitivanoj tvari uz prisutnost ili odsutnost egzogenog sustava metaboličke aktivacije. Kod metode inkorporacije u agarnu ploču, te se suspenzije pomiješaju s top agarom i razliju izravno na minimalnu podlogu. Kod metode predinkubacije mješavina za tretiranje najprije se inkubira i potom pomiješa s top agarom, prije razlijevanja na minimalnu podlogu. Kod obje tehnike, nakon dva ili tri dana inkubacije, prebroje se kolonije revertanata (mutanti dobiveni povratnom mutacijom) i uspoređuju s brojem kolonija spontanih revertanata na kontrolnim pločama s otapalom.
Opisano je više postupaka za izvođenje bakterijskog testa povratne mutacije. Među onima koji se obično koriste su metoda inkorporacije u agarnu ploču (1)(2)(3)(4), metoda predinkubacije (2)(3)(5)(6)(7)(8), metoda fluktuacije (9)(10) i metoda suspenzije (11). Opisane su i prilagodbe za ispitivanje plinova ili para (12).
Postupci opisani u ovoj metodi odnose se prvenstveno na metode inkorporacije i predinkubacije. Obje su prihvatljive za izvođenje pokusa sa i bez metaboličke aktivacije. Neke se tvari mogu lakše otkriti primjenom metode predinkubacije. Te tvari spadaju u klase kemikalija koje uključuju kratkolančane alifatske nitrozamine, dvovalentne metale, aldehide, azo-bojila i diazo spojeve, pirolizidinske alkaloide, alilne spojeve i nitro spojeve (3). Priznaje se da neke klase mutagena nije uvijek moguće otkriti standardnim postupcima kao što su metoda inkorporacije u agarnu ploču ili metoda predinkubacije. Njih treba smatrati „posebnim slučajevima” i čvrsto se preporučuje da se za njihovo otkrivanje primijene alternativni postupci. U takve „posebne slučajeve” mogu se svrstati (zajedno s primjerima postupaka koji se mogu upotrijebiti za njihovo otkrivanje): azo-bojila i diazo spojevi (3)(5)(6)(13), plinovi i hlapive kemikalije (12)(14)(15)(16) i glikozidi (17)(18). Odstupanja od standardnog postupka treba znanstveno opravdati.
1.5. OPIS ISPITNE METODE
1.5.1. Priprema
1.5.1.1. Bakterije
Svježe kulture bakterija treba uzgojiti do kasne eksponencijalne ili rane stacionarne faze rasta (oko 109 stanica na ml). Kulture u kasnoj stacionarnoj fazi ne treba koristiti. Bitno je da kulture upotrijebljene u pokusu sadrže visoki titar živih bakterija. Taj se titar može utvrditi ili na temelju kontrolnih podataka o krivuljama rasta iz ranijih ispitivanja ili na temelju svakog ispitivanja kod kojega se utvrđuje broj živih stanica u kulturama uzgojenim na agarnim pločama.
Preporučena temperatura inkubacije je 37 °C.
Treba upotrijebiti najmanje pet sojeva bakterija. Oni trebaju uključivati četiri soja S. typhimurium (TA 1535; TA 1537 ili TA97a ili TA97; TA98 i TA100) koji su u laboratorijskoj praksi pokazali da su pouzdani i da su njihove reakcije ponovljive. Ta četiri soja S. typhimurium imaju na primarnom mjestu povratne mutacije bazne parove GC i poznata je mogućnost da oni neće pokazati neke oksidirajuće mutagene, agense koji stvaraju poprečne veze i hidrazine. Takve tvari mogu se otkriti pomoću sojeva E.coli WP2 ili S. typhimurium TA102 (19) koji na primarnom mjestu povratne mutacije imaju bazni par AT. Prema tome, preporučena kombinacija sojeva je:
|
— |
S. typhimurium TA1535, i |
|
— |
S. typhimurium TA1537 ili TA97 ili TA97a, i |
|
— |
S. typhimurium TA98, i |
|
— |
S. typhimurium TA100, i |
|
— |
E. coli WP2 uvrA, ili E. coli WP2 uvrA (pKM101), ili S. typhimurium TA102. |
Da bi se otkrili mutageni koji stvaraju poprečne veze, možda bi bilo bolje uključiti TA102 ili dodati soj E. coli koji ima sposobnost popravljanja DNA (npr. E. coli WP2 ili E. coli WP2 (pKM101)).
Treba koristiti utvrđene postupke za pripravljanje matičnih kultura, provjeru markera i pohranjivanje. Za svaki pripravak liofilizirane matične kulture treba dokazati da je toj kulturi za rast potrebna aminokiselina (histidin za sojeve S. typhimurium i triptofan za sojeve E. coli). Slično treba provjeriti i druge fenotipske karakteristike, na primjer: prisutnost ili odsutnost r-plazmida, tamo gdje je to primjereno (tj. otpornost na ampicilin kod sojeva TA98, TA100 i TA97a ili TA97, WP2 uvrA i WP2 uvrA (pKM101), te otpornost na ampicilin + tetraciklin kod soja TA 102G); prisutnost karakterističnih mutacija (tj. rfa mutacije kod S. typhimurium kroz osjetljivost na kristal ljubičasto i uvrA mutacije kod S. typhimurium ili uvrB mutacije kod S. typhimurium kroz osjetljivost na ultraljubičasto svjetlo) (2)(3). Ti sojevi također trebaju proizvesti broj kolonija spontanih revertanata (spontanih povratnih mutanata) u okvirima učestalosti koja se očekuje na temelju kontrolnih podataka iz prijašnjih ispitivanja i po mogućnosti unutar okvira navedenih u literaturi.
1.5.1.2. Hranjiva podloga
Koristi se odgovarajući minimalni agar (npr. koji sadrži Vogel-Bonnerovu minimalnu podlogu E i glukozu) i top agar koji sadrži histidin i biotin ili triptofan, koji omogućuju nekoliko staničnih dioba (1)(2)(9).
1.5.1.3. Metabolička aktivacija
Bakterije treba izložiti ispitivanoj tvari uz prisutnost i uz odsutnost odgovarajućeg metaboličkog aktivacijskog sustava. Najčešće upotrebljavani sustav je postmitohondrijska frakcija s dodanim kofaktorom (S9) pripravljena od jetre glodavaca tretiranih agensima za enzimsku indukciju, kao što su Aroclor 1254 (1)(2), ili kombinacija fenobarbitona i β-naftoflavona (18)(20)(21). Postmitohondrijska frakcija obično se upotrebljava u koncentracijama od 5 do 30 % v/v u mješavini S9. Izbor i stanje sustava mataboličke aktivacije može ovisiti o klasi opasnosti kemikalije koja se testira. U nekim slučajevima može biti primjereno upotrijebiti više od jedne koncentracije postmitohondrijske frakcije. Za azo-bojila i diazo spojeve možda je primjerenija upotreba redukcijskog sustava metaboličke aktivacije (6)(13).
1.5.1.4. Ispitivana tvar/priprema
Krute ispitivane tvari treba otopiti ili suspendirati u odgovarajućim otapalima ili nosačima i prema potrebi razrijediti prije tretiranja bakterija. Tekuće ispitivane tvari mogu se izravno dodati u ispitne sustave i/ili razrijediti prije tretiranja. Treba koristiti svježe preparate ispitivane tvari, osim ako podaci o njihovoj stabilnosti dokazuju da je njihovo pohranjivanje prihvatljivo.
Ne smije postojati sumnja da bi otapalo/nosač s ispitivanom tvari moglo/mogao proizvesti kemijsku reakciju i treba biti pogodno/pogodan za preživljavanje bakterija i djelovanje S9 (22). Ako se koriste otapala/nosači koji nisu dobro poznati, njihovo uključivanje u ispitivanje treba potkrijepiti referentnim podacima koji dokazuju njihovu prikladnost. Preporuka je da se, kad god je to moguće, najprije razmotri mogućnost upotrebe vodenog otapala/nosača. Kad se ispituju tvari koje u vodi nisu stabilne, korištena organska otapala ne smiju sadržavati vodu.
1.5.2. Uvjeti ispitivanja
1.5.2.1. Pokusni sojevi (vidjeti 1.5.1.1.)
1.5.2.2. Koncentracije izlaganja
Među kriterijima koje treba uzeti u obzir kod utvrđivanja najveće količine tvari koja će se koristiti su citotoksičnost i topljivost u konačnoj mješavini za tretiranje.
Može biti korisno toksičnost i netopljivost utvrditi preliminarnim pokusom. Citotoksičnost se može otkriti po smanjenju broja kolonija revertanata, po čistim dijelovima ili smanjenju površine podloge, ili po stopi preživljavanja tretiranih kultura. Citotoksičnost tvari može se promijeniti uz prisutnost sustava metaboličke aktivacije. Netopljivost se može ocijeniti kao talog u konačnoj mješavini u stvarnim ispitnim uvjetima koji je vidljiv prostim okom.
Preporučena maksimalna ispitna koncentracija za topljive necitotoksične tvari je 5 mg/ploča ili 5μl/ploča. Za necitotoksične tvari koje nisu topljive pri koncentraciji od 5 mg/ploča ili 5μl/ploča, jedna ili više testiranih koncentracija treba biti netopljiva u konačnoj mješavini za tretiranje. Ispitivane tvari koje su citotoksične već pri koncentracijama ispod 5 mg/ploča ili 5μl/ploča treba testirati do citotoksične koncentracije. Talog ne smije smetati očitavanju.
Za inicijalni pokus treba koristiti najmanje pet različitih koncentracija ispitivane tvari koje je moguće analizirati, s intervalima od približno pola log (tj. √10) između ispitnih točaka. Manji intervali mogu biti primjereni kad se istražuje ovisnost između koncentracija i reakcija. Kad se ocjenjuju tvari koje sadrže značajne količine potencijalno mutagenih nečistoća može se razmotriti mogućnost testiranja s koncentracijama viši od 5 mg/ploča ili 5 μl/ploča.
1.5.2.3. Negativne i pozitivne kontrole
U svaki pokus treba uključiti paralelne pozitivne i negativne kontrole (otapalo ili nosač), specifične za određene sojeve, sa i bez metaboličke aktivacije. Treba odabrati koncentracije pozitivnih kontrola koje dokazuju učinkovitost izvedbe svakog pokusa.
Kod pokusa kod kojih se koristi sustav metaboličke aktivacije, referentna(-e) tvar(-i) treba odabrati na temelju bakterijskih sojeva koji se koriste.
Sljedeće tvari su primjeri odgovarajućih pozitivnih kontrola za pokuse s metaboličkom aktivacijom:
|
CAS broj |
EINECS broj |
Naziv tvari |
|
781-43-1 |
212-308-4 |
9,10-dimetilantracen |
|
57-97-6 |
200-359-5 |
7,12-dimetilbenz [α]antracen |
|
50-32-8 |
200-028-5 |
benzo[a]piren |
|
613-13-8 |
210-330-9 |
2-aminoantracen |
|
50-18-0 |
|
ciklofosfamid |
|
6055-19-2 |
200-015-4 |
ciklofosfamid monohidrat |
Sljedeća tvar je odgovarajuća pozitivna kontrola za metodu redukcijske metaboličke aktivacije:
|
CAS broj |
EINECS broj |
Naziv tvari |
|
573-58-0 |
209-358-4 |
kongo crvenilo |
2-aminoantracen ne treba koristiti kao jedini pokazatelj učinkovitosti mješavine S9. Ako se koristi 2-aminoantracen, svaku šaržu S9 isto tako treba okarakterizirati pomoću mutagena kojemu je potrebna metabolička aktivacija mikrosomskim enzimima, npr. benzo[a]piren, dimetilbenzantracen.
Sljedeće tvari su primjeri pozitivnih kontrola specifičnih za određene sojeve, za pokuse koji se izvode bez egzogenog sustava metaboličke aktivacije:
|
CAS brojevi |
EINECS brojevi |
Naziv tvari |
Soj |
|
26628-22-8 |
247-852-1 |
natrijev azid |
TA 1535 i TA 100 |
|
607-57-8 |
210-138-5 |
2-nitrofluoren |
TA 98 |
|
90-45-9 |
201-995-6 |
9-aminoakridin |
TA 1537, TA 97 i TA 97a |
|
17070-45-0 |
241-129-4 |
ICR 191 |
TA 1537, TA 97 i TA 97a |
|
80-15-9 |
201-254-7 |
kumen hidroperoksid |
TA 102 |
|
50-07-7 |
200-008-6 |
mitomicin C |
WP2 uvrA i TA l02 |
|
70-25-7 |
200-730-1 |
N-metil-N-nitro-N-nitrozogvanidin |
WP2, WP2uvrA i WP2uvrA(pK M101) |
|
56-57-5 |
200-281-1 |
4-nitrokinolin-1-oksid |
WP2, WP2uvrA in WP2uvrA(pK M101) |
|
3688-53-7 |
|
furilfuramid (AF2) |
tvari koje sadrže plazmide |
Mogu se koristiti i druge odgovarajuće referentne tvari pozitivne kontrole. Treba razmotriti mogućnost upotrebe kontrolnih kemikalija svrstanih u istu klasu opasnosti kao ispitivana tvar, ako su takve kemikalije raspoložive.
Treba koristiti i negativne kontrole koje se sastoje samo od otapala ili nosača, bez ispitivane tvari, s kojima se inače postupa jednako kao s tretiranim skupinama. Osim toga treba koristiti i netretirane kontrole osim ako postoje podaci o kontrolama iz ranijih pokusa koji dokazuju da odabrano otapalo ne izaziva nikakve štetne ili mutagene učinke.
1.5.3. Postupak
Kod metode inkorporacije u agarnu ploču (1)(2)(3)(4), bez metaboličke aktivacije, obično se pomiješa 0,05 ml ili 0,1 ml ispitne otopine, 0,1 ml svježe bakterijske kulture (koja sadrži približno 108 živih stanica) i 0,5 ml sterilnog pufera s 2,0 ml top agara. Kod pokusa s metaboličkom aktivacijom obično se 0,5 ml mješavine za metaboličku aktivaciju koja sadrži odgovarajuću količinu post-mitohondrijske frakcije (u rasponu od 5 do 30 % v/v u mješavini za metaboličku aktivaciju) pomiješa se s top agarom (2,0 ml), kao i s bakterijama i ispitivanom tvari/ispitnom otopinom. Sadržaj svake epruvete se promiješa i prelije po površini minimalne agarne podloge. Prije inkubacije top agar treba pustiti da se stvrdne.
Kod predinkubacijske metode (2)(3)(5)(6), uobičajeno je da se ispitivana tvar/ispitna otopina predinkubira zajedno s pokusnim sojem (oko 108 živih stanica) i sterilnim puferom ili sustavom za metaboličku aktivaciju (0,5 ml), obično 20 minuta ili duže na 30-37 °C, prije nego se pomiješa s top agarom i prelije po površini minimalne agarne podloge. Obično se 0,05 ml ili 0,1 ml ispitivane tvari/ispitne otopine, 0,1 ml bakterija i 0,5 ml mješavine S9 ili sterilnog pufera pomiješa s 2,0 ml top agara. Za vrijeme predinkubacije epruvete treba prozračivati pomoću tresilice.
Za adekvatnu procjenu varijacija, za svaku visinu doze treba nasaditi po tri ploče. Upotreba dviju ploča je prihvatljiva ako za to postoji znanstveno opravdanje. Ako se povremeno dogodi da se ploča izgubi, to ne mora nužno značiti da su rezultati pokusa nevažeći.
Plinovite ili hlapive tvari treba ispitivati odgovarajućim metodama, na primjer u nepropusnim posudama (12)(14)(15)(16).
1.5.4. Inkubacija
Sve ploče u određenom pokusu treba inkubirati 48-72 sata na 37 °C. Nakon inkubacije na svakoj se ploči utvrđuje broj kolonija revertanata.
2. PODACI
2.1. OBRADA PODATAKA
Podatke treba prikazati kao broj kolonija revertanata po agarnoj ploči. Treba navesti i broj kolonija revertanata na agarnim pločama negativne kontrole (kontrolni uzorak tretiran otapalom i, ako se koristi, netretirani kontrolni uzorak) i pozitivne kontrole. Treba navesti ukupni broj na pojedinačnim pločama, srednju vrijednost broja kolonija revertanata po ploči i standardnu devijaciju za ispitivanu tvar kao i za pozitivne i negativne kontrole (netretirane i/ili kontrole tretirane otapalom).
Potvrđivanje jasne pozitivne reakcije nije potrebno. Nejasne rezultate treba pojasniti daljnjim ispitivanjima, po mogućnosti uz modifikaciju uvjeta ispitivanja. Negativne rezultate treba potvrđivati od slučaja do slučaja. Kad se smatra da potvrda negativnih rezultata nije potrebna, takvo mišljenje treba znanstveno opravdati. U daljnjim pokusima treba razmotriti mogućnost modifikacije ispitnih parametara kako bi se povećao broj uvjeta koji će se analizirati. Ispitni parametri koji se mogu modificirati uključuju vremenske razmake između primjene različitih koncentracija, metode tretiranja (inkorporacija u ploču ili predinkubacija u tekućini) i uvjete metaboličke aktivacije.
2.2. OCJENA I TUMAČENJE REZULTATA
Ima više kriterija za utvrđivanje pozitivnih rezultata, kao što je povećanje broja kolonija revertanata vezano uz koncentraciju unutar ispitivanog raspona i/ili ponovljivi porast pri jednoj ili više koncentracija po ploči, kod najmanje jednog soja, sa ili bez sustava za metaboličku aktivaciju (23). Najprije treba razmotriti biološku relevantnost rezultata. Kao pomoć pri ocjenjivanju rezultata ispitivanja mogu se koristiti statističke metode (24). Međutim, statistički značaj ne smije biti jedini odlučujući faktor za utvrđivanje pozitivne reakcije.
Kod ovog se testa smatra da ispitivana tvar kod koje rezultati ne udovoljavaju gore navedenim kriterijima nije mutagena.
Iako će većina pokusa dati jasne pozitivne ili negativne rezultate, u rijetkim slučajevima dobiveni podaci neće omogućiti donošenje definitivne ocjene o djelovanju ispitivane tvari. Rezultati mogu ostati nejasni ili upitni bez obzira na broj ponavljanja pokusa.
Pozitivni rezultati testa povratnih mutacija znače da tvar uzrokuje točkaste mutacije zamjenom baza ili pomakom okvira očitavanja u genomu bakterije Salmonella typhimurium i/ili Escherichia coli. Negativni rezultati znače da, u uvjetima pokusa, ispitivana tvar nije mutagena za pokusnu vrstu.
3. IZVJEŠĆIVANJE
IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora sadržavati slijedeće informacije:
|
|
Otapalo/nosač:
|
|
|
Sojevi:
|
|
|
Uvjeti ispitivanja:
|
|
|
Rezultati:
|
|
|
Diskusija o rezultatima. |
|
|
Zaključci. |
4. REFERENCE
|
(1) |
Ames, B.N., McCann, J. and Yamasaki E., (1975) Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian-Microsome Mutagenicity Test. Mutation Res., 31, str. 347-364. |
|
(2) |
Maron, D.M. and Ames, B.N., (1983) Revised Methods for the Salmonella Mutagenicity Test. Mutation Res., 113, str. 173-215. |
|
(3) |
Gatehouse, D., Haworth, S., Cebula, T., Gocke, E., Kier, L., Matsushima, T., Melcion, C., Nohmi, T., Venitt, S. and Zeiger, E., (1994) Recommendations for the Performance of Bacterial Mutation Assays. Mutation Res., 312, str. 217-233. |
|
(4) |
Kier, L.D., Brusick D.J., Auletta, A.E., Von Halle, E.S., Brown, M.M., Simmon, V.F., Dunkel, V., McCann, J., Mortelmans, K., Prival, M., Rao, T.K. and Ray V., (1986) The Salmonella typhimurium/Mammalian Microsomal Assay: A Report of the U.S. Environmental Protection Agency Gene-Tox Program. Mutation Res., 168, str. 69-240. |
|
(5) |
Yahagi, T., Degawa, M., Seino, Y.Y., Matsushima, T., Nagao, M., Sugimura, T. and Hashimoto, Y., (1975) Mutagenicity of Carcinogen Azo Dyes and their Derivatives, Cancer Letters, 1, str. 91-96. |
|
(6) |
Matsushima, M., Sugimura, T., Nagao, M., Yahagi, T., Shirai, A. and Sawamura, M., (1980) Factors Modulating Mutagenicity Microbial Tests. In: Short-term Test Systems for Detecting Carcinogens. Ed. Norpoth K.H. and Garner, R.C., Springer, Berlin-Heidelberg-New York. str. 273-285. |
|
(7) |
Gatehouse, D.G., Rowland, I.R., Wilcox, P., Callender, R.D. and Foster, R., (1980) Bacterial Mutation Assays. In: Basic Mutagenicity Tests: UKEMS Part 1 Revised. Ed. D.J. Kirkland, Cambridge University Press, str. 13-61. |
|
(8) |
Aeschacher, H.U., Wolleb, U. and Porchet, L., (1987) Liquid Preincubation Mutagenicity Test for Foods. J. Food Safety, 8, str. 167-177. |
|
(9) |
Green, M.H.L., Muriel, W.J. and Bridges, B.A., (1976) Use of a simplified fluctuation test to detect low levels of mutagens. Mutation Res., 38, str. 33-42. |
|
(10) |
Hubbard, S.A., Green, M.H.L., Gatehouse, D. and J.W. Bridges (1984) The Fluctuation Test in Bacteria. In: Handbook of Mutagenicity Test Procedures. 2nd Edition. Ed. Kilbey, B.J., Legator, M., Nichols, W. and Ramel, C., Elsevier, Amsterdam-New York-Oxford, str. 141-161. |
|
(11) |
Thompson, E.D. and Melampy, P.J., (1981) An Examination of the Quantitative Suspension Assay for Mutagenesis with Strains of Salmonella typhimurium. Environmental Mutagenesis, 3, str. 453-465. |
|
(12) |
Araki, A., Noguchi, T., Kato, F. and T. Matsushima (1994) Improved Method for Mutagenicity Testing of Gaseous Compounds by Using a Gas Sampling Bag. Mutation Res., 307, str. 335-344. |
|
(13) |
Prival, M.J., Bell, S.J., Mitchell, V.D., Reipert, M.D. and Vaughn, V.L., (1984) Mutagenicity of Benzidine and Benzidine-Congener Dyes and Selected Monoazo Dyes in a Modified Salmonella Assay. Mutation Res., 136, str. 33-47. |
|
(14) |
Zeiger, E., Anderson, B.E., Haworth, S., Lawlor, T. and Mortelmans, K., (1992) Salmonella Mutagenicity Tests. V. Results from the Testing of 311 Chemicals. Environ. Mol. Mutagen., 19, str. 2-141. |
|
(15) |
Simmon, V., Kauhanen, K. and Tardiff, R.G., (1977) Mutagenic Activity of Chemicals Identified in Drinking Water. In Progress in Genetic Toxicology, D. Scott, B. Bridges and F. Sobels (Eds.) Elsevier, Amsterdam, str. 249-258. |
|
(16) |
Hughes, T.J., Simmons, D.M., Monteith, I.G. and Claxton, L.D., (1987) Vaporisation Technique to Measure Mutagenic Activity of Volatile Organic Chemicals in the Ames/Salmonella Assay. Environmental Mutagenesis, 9, str. 421-441. |
|
(17) |
Matsushima, T., Matsumoto, A., Shirai, M., Sawamura, M., and Sugimura, T., (1979) Mutagenicity of the Naturally Occurring Carcinogen Cycasin and Synthetic Methylazoxy Methane Conjugates in Salmonella typhimurium. Cancer Res., 39, str. 3780-3782. |
|
(18) |
Tamura, G., Gold, C., Ferro-Luzzi, A. and Ames, B.N., (1980) Fecalase: A Model for Activation of Dietary Glycosides to Mutagens by Intestinal Flora. Proc. Natl. Acad. Sci. USA, 77, str. 4961-4965. |
|
(19) |
Wilcox, P., Naidoo, A., Wedd, D.J. and Gatehouse, D.G., (1990) Comparison of Salmonella typhimurium TA 102 with Escherichia coli WP2 Tester strains. Mutagenesis, 5, str. 285-291. |
|
(20) |
Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T., (1976) A Safe Substitute for Polychlorinated Biphenyls as an Inducer or Metabolic Activation Systems. In: „In vitro metabolic Activation in Mutagenesis Testing” Eds. F.J. de Serres et al. Elsevier, North Holland, str. 85-88. |
|
(21) |
Elliot, B.M., Combes, R.D., Elcombe, C.R., Gatehouse, D.G., Gibson, G.G., Mackay, J.M. and Wolf, R.C., (1992) Alternatives to Aroclor 1254-induced S9 in in vitro Genotoxicity Assays. Mutagenesis, 7, str. 175-177. |
|
(22) |
Maron, D., Katzenellenbogen, J. and Ames, B.N., (1981) Compatibility of Organic Solvents with the Salmonella/Microsome Test. Mutation Res., str. 88343-350. |
|
(23) |
Claxton, L.D., Allen, J., Auletta, A., Mortelmans, K., Nestmann, E. and Zeiger, E., (1987) Guide for the Salmonella typhimurium/Mammalian Microsome Tests for Bacterial Mutagenicity. Mutation Res. 189, str. 83-91. |
|
(24) |
Mahon, G.A.T., Green, M.H.L., Middleton, B., Mitchell, I., Robinson, W.D. and Tweats, D.J., (1989) Analysis of Data from Microbial Colony Assays. In: UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Part II. Statistical Evaluation of Mutagenicity Test Data. Ed. Kirkland, D.J., Cambridge University Press, str. 28-65. |
B.15. ISPITIVANJE MUTAGENOSTI I PROBIRNI TEST NA GENSKE MUTACIJE KOJE UKAZUJU NA KARCINOGENOST– SACCHAROMYCES CEREVISIAE
1. METODA
1.1. UVOD
Vidjeti Opći uvod, dio B.
1.2. DEFINICIJA
Vidjeti Opći uvod, dio B.
1.3. REFERENTNE TVARI
Nema ih.
1.4. NAČELO ISPITNE METODE
Za mjerenje nastanka genskih mutacija induciranih kemijskim agensima sa ili bez metaboličke aktivacije može se koristiti niz haploidnih i diploidnih sojeva kvasca Saccharomyces cerevisiae.
Koriste se sustavi naprednih mutacija u haploidnim sojevima, kao što je mjerenje mutacije iz crvenih mutanata kojima je potreban adenin (ade-1, ade-2) u dvostruke bijele mutante kojima je potreban adenin i selektivni sustavi kao što je indukcija otpornosti na kanavnain i cikloheksamid.
Najopsežnije validirani sustav povratnih mutacija uključuje upotrebu haploidnog soja XV 185-14C koji nosi oker besmislene mutacije ade 2-1, arg 4-17, lys 1-1 i trp 5-48, koje su povratne pod utjecajem mutagena bazne supstitucije koji induciraju mutacije specifične za mjesto pojavljivanja ili oker supresorske mutacije. XV 185-14C isto tako nosi marker his 1-7, odnosno mutaciju krivog smisla koja postaje povratnom uglavnom mutiranjem na drugom mjestu i marker hom 3-10, mutaciju koja postaje povratnom pod utjecajem frameshift mutagena (mutagena pomaka očitavanja).
Što se tiče diploidnih sojeva S. cerevisiae jedini soj koji se koristi u velikoj mjeri je D7 koji je homozigotan za ilv1-92.
1.5. KRITERIJI KVALITETE
Nema ih.
1.6. OPIS ISPITNE METODE
Priprema
Prije ispitivanja treba pripremiti otopinu ispitivane tvari i kontrole, koristeći odgovarajući nosač. Kad se radi o organskim spojevima koji nisu topljivi u vodi, treba upotrijebiti najviše 2 %-tnu otopinu v/v organskog otapala kao što je etanol, aceton ili dimetilsulfoksid (DMSO). Konačna koncentracija nosača ne smije znatno utjecati na sposobnost preživljavanja stanica i karakteristike rasta.
Stanice treba izlagati ispitivanim kemikalijama u prisutnosti i u odsutnosti odgovarajućih egzogenih sustava metaboličke aktivacije.
Najčešće upotrebljavani sustav je postmitohondrijska frakcija s dodanim kofaktorom, iz jetre glodavaca prethodno tretiranih agensima za enzimsku indukciju. Isto tako za metaboličku aktivaciju može biti primjerena i upotreba drugih vrsta, tkiva, postmitohondrijskih frakcija ili postupaka.
Uvjeti ispitivanja
Haploidni soj XV 185-14C i diploidni soj D7 najčešće se koriste u studijama mutacije gena. Mogu biti pogodni i neki drugi sojevi.
Za utvrđivanje stope preživljavanja i broja mutanata koriste se odgovarajuće hranjive podloge za uzgoj kultura.
Pozitivne kontrole, kontrole bez tretiranja i kontrole uz upotrebu otopina treba obavljati istodobno. Za svaki specifični konačni mutacijski učinak treba upotrijebiti odgovarajuće kemikalije pozitivne kontrole.
U odgovarajućim vremenskim razmacima treba upotrijebiti najmanje pet koncentracija ispitivane tvari. Kad su u pitanju toksične tvari, pri najvišim koncentracijama preživljavanje ne smije pasti ispod 5 do 10 %. Tvari koje su relativno netopljive u vodi treba ispitivati do granice njihove topljivosti primjenjujući odgovarajuće postupke. Za netoksične tvari koje su lako topljive u vodi gornje koncentracije treba utvrđivati od slučaja do slučaja.
Ploče se inkubiraju u mraku četiri do sedam dana na 28 do 30 °C.
Treba koristiti subkulture s učestalošću spontanih mutacija unutar prihvaćenog normalnog raspona.
Za analizu prototrofa nastalih genskom mutacijom i sposobnosti preživljavanja stanica, za svaku koncentraciju treba upotrijebiti najmanje tri jednake ploče (replikata). Kad se radi o pokusima kod kojih se koriste markeri kao što je hom 3-10 s niskom stopom mutacija, broj upotrijebljenih ploča mora biti veći kako bi se osigurali statistički relevantni podaci.
Postupak
Tretiranje sojeva S. cerevisiae obično se izvodi ispitnim postupkim u tekućini, koji se primjenjuje ili na stacionarne ili na rastuće stanice. Inicijalne pokuse treba obaviti na rastućim stanicama: 1-5 × 107 stanica/ml izlaže se ispitivanoj kemikaliji do 18 sati na 28 do 37 °C, uz tresenje. Tijekom tretiranja prema potrebi se dodaju odgovarajuće količine metaboličkog aktivacijskog sustava. Na kraju tretiranja stanice se centrifugiraju, isperu i nasade ne odgovarajuću hranjivu podlogu za uzgoj kultura. Nakon inkubacije ploče se očitavaju radi utvrđivanja stope preživaljavanja i indukcije genskih mutacija. Ako je prvi pokus negativan, treba napraviti drugi pokus za koji se koriste stanice u stacionarnoj fazi rasta (u fazi mirovanja). Ako je prvi pokus pozitivan, potvrđuje se odgovarajućim nezavisnim pokusom.
2. PODACI
Podatke treba prikazati u tabličnom obliku, pri čemu treba navesti broj prebrojenih kolonija, broj mutanata te učestalost preživljavanja i pojave mutanata. Sve rezultate treba potvrditi nezavisnim pokusom. Podatke treba ocijeniti uz primjenu odgovarajućih statističkih metoda.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju treba, ako je moguće, sadržavati sljedeće informacije:
|
— |
upotrijebljeni soj, |
|
— |
uvjeti ispitivanja: stanice u stacionarnoj fazi (u fazi mirovanja) ili fazi rasta, sastav hranjive podloge, temperatura i trajanje inkubacije, sustav metaboličke aktivacije, |
|
— |
uvjeti tretiranja: razine izlaganja, postupak i trajanje tretiranja, temperatura tretiranja, pozitivne i negativne kontrole, |
|
— |
broj prebrojenih kolonija, broj mutanata, učestalost preživljavanja i pojave mutacija, odnos doze i reakcije, ovisno o slučaju, statistička procjena podataka, |
|
— |
diskusija o rezultatima, |
|
— |
tumačenje rezultata. |
3.2. OCJENA I TUMAČENJE
Vidjeti Opći uvod, dio B.
4. REFERENCE
Vidjeti Opći uvod, dio B.
B.16. MITOTSKA REKOMBINACIJA – SACCHAROMYCES CEREVISIAE
1. METODA
1.1. UVOD
Vidjeti Opći uvod dio B.
1.2. DEFINICIJA
Vidjeti Opći uvod dio B.
1.3. REFERENTNE TVARI
Nema ih.
1.4. NAČELO ISPITNE METODE
Mitotska rekombinacija u Saccharomyces Cerevisiae može se otkriti između gena (ili općenitije između gena i njegovog centromera) i unutar gena. Prvi je slučaj poznat kao krosing-over i stvara recipročne produkte, dok je drugi najčešće nerecipročan i naziva se genskom konverzijom. Krosing-over se općenito analizira prema proizvodnji recesivnih homozigotnih kolonija ili sektora koji nastanu u heterozigotnom soju, dok se genska konverzija analizira na temelju proizvodnje prototrofnih revertanata koji nastanu u auksotrofnom heteroalelnom soju koji nosi dva različita defektna alela istoga gena. Najčešće korišteni sojevi za otkrivanje mitotske konverzije gena su sojevi D4 (heteroalelni na ade 2 i trp 5), D7 (heteroalelni na trp 5), BZ34 (heteroalelni na arg 4) i JDl (heteroalelni na his 4 i trp 5). Mitotski krosing-over koji proizvodi crvene i ružičaste homozigotne sektore može se analizirati u D5 ili u D7 (čime se također mjeri mitotska konverzija gena i povratne mutacije na ilv 1-92), pri čemu su oba soja heteroalelna za komplementarne alele ade 2.
1.5. KRITERIJI KVALITETE
Nema ih.
1.6. OPIS ISPITNE METODE
Priprema
Otopine ispitivanih kemikalija i kontrole ili referentne spojeve treba pripremiti neposredno prije ispitivanja, uz upotrebu odgovarajućeg nosača. Kad se radi o organskim spojevima koji nisu topljivi u vodi, treba upotrijebiti najviše 2 %-tnu otopinu v/v organskog otapala kao što je etanol, aceton ili dimetilsulfoksid (DMSO). Konačna koncentracija nosača ne smije znatno utjecati na sposobnost preživljavanja stanica i karakteristike rasta.
Stanice treba izlagati ispitivanim kemikalijama u prisutnosti i u odsutnosti odgovarajućih egzogenih sustava metaboličke aktivacije. Najčešće upotrebljavani sustav je postmitohondrijska frakcija s dodanim kofaktorom iz jetre glodavaca prethodno tretiranih agensima za enzimsku indukciju. Isto tako za metaboličku aktivaciju može biti primjerena i upotreba drugih životinjskih vrsta, tkiva, postmitohondrijskih frakcija ili postupaka.
Uvjeti ispitivanja
Najčešće korišteni sojevi su diploidi D4, D5, D7 i JDl. Mogu biti pogodni i neki drugi sojevi.
Za utvrđivanje stope preživljavanja i učestalosti mitotske rekombinacije koriste se odgovarajuće hranjive podloge za uzgoj kultura.
Pozitivne kontrole, kontrole bez tretiranja i kontrole s otopinama treba obavljati paralelno. Za svaki specifični konačni učinak rekombinacije treba upotrijebiti odgovarajuće kemikalije pozitivne kontrole.
U odgovarajućim vremenskim razmacima treba upotrijebiti najmanje pet koncentracija ispitivane tvari. Najniža koncentracija ne smije utjecati na sposobnost preživljavanja stanica. Kad su u pitanju toksične tvari, pri najvišim koncentracijama preživljavanje ne smije pasti ispod 5 do 10 %. Tvari koje su relativno netopljive u vodi treba ispitivati do granice njihove topljivosti, primjenjujući odgovarajuće postupke. Za netoksične tvari koje su dobro topljive u vodi gornje koncentracije treba utvrđivati od slučaja do slučaja.
Stanice se mogu izlagati ispitivanim kemikalijama ili u stacionarnoj fazi (fazi mirovanja) ili tijekom rasta u trajanju od najviše 18 sati. Međutim, u slučaju dugotrajnijeg tretiranja kulture treba mikroskopski pregledati na stvaranje spora čija prisutnost test čini nevažećim.
Ploče se inkubiraju u mraku četiri do sedam dana na 28 °C do 30 °C. Ploče koje se koriste za analizu crvenih ili ružičastih homozigotnih sektora nastalih mitotskim krosing-overom treba držati u hladnjaku (oko 4 °C) daljnjih dan dva prije očitavanja kako bi se omogućio razvoj odgovarajućih pigmentiranih kolonija.
Treba koristiti subkulture s učestalošću spontanih mitotskih rekombinacija u okviru prihvaćenog normalnog raspona.
Za svaku koncentraciju treba upotrijebiti najmanje tri jednake agarne ploče za analizu prototrofa nastalih mitotskom konverzijom i sposobnosti preživljavanja stanica. U slučaju analize recesivne homozigotnosti nastale mitotskim krosing-overom, broj ploča treba povećati kako bi se dobio adekvatan broj kolonija.
Postupci
Tretiranje sojeva S. cerevisiae obično se provodi u okviru ispitnog postupka u tekućini, uz korištenje stanica u stacionarnoj fazi ili stanica u fazi rasta. Inicijalne pokuse treba provoditi na rastućim stanicama. 1-5 × 107 stanica/ml izlaže se ispitivanoj kemikaliji do 18 sati na 28 °C do 37 °C, uz protresanje; prema potrebi se tijekom tretiranja dodaje odgovarajuća količina sustava za metaboličku aktivaciju.
Na kraju tretiranja stanice se centrifugiraju, peru i nasađuju na odgovarajuću podlogu za uzgoj kultura. Nakon inkubacije ploče se očitavaju s obzirom na stupanj preživljavanja i indukciju mitotske rekombinacije.
Ako je prvi pokus negativan, treba napraviti drugi pokus sa stanicama u stacionarnoj fazi. Ako je prvi pokus pozitivan, potvrđuje ga se neovisnom pokusom.
2. PODACI
Podatke treba prikazati u obliku tablice iz koje se može vidjeti ukupni broj kolonija, broj rekombinanata, stopa preživljavanja i učestalost rekombinanata.
Rezultate treba potvrditi nezavisnim pokusom.
Podatke treba ocijeniti uz primjenu odgovarajućih statističkih metoda.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju treba, ako je moguće, sadržavati sljedeće informacije:
|
— |
upotrijebljeni soj, |
|
— |
uvjeti ispitivanja: stanice u stacionarnoj fazi (u fazi mirovanja) ili fazi rasta, sastav hranjive podloge, temperatura i trajanje inkubacije, sustav metaboličke aktivacije, |
|
— |
uvjeti tretiranja: koncentracije izlaganja, postupak i trajanje tretiranja, temperatura tretiranja, pozitivne i negativne kontrole, |
|
— |
utvrđeni broj kolonija, broj rekombinanata, učestalost preživljavanja i pojave rekombinacija, odnos doze i reakcije, ovisno o slučaju, statistička procjena podataka, |
|
— |
diskusija o rezultatima, |
|
— |
tumačenje rezultata. |
3.2. OCJENA I TUMAČENJE
Vidjeti Opći uvod, dio B.
4. REFERENCE
Vidjeti Opći uvod, dio B.
B.17. IN VITRO TEST GENSKIH MUTACIJA STANICA SISAVACA
1. METODA
Ova je metoda istovjetna metodi OECD TG 476, In Vitro Mammalian Cell Gene Mutation Test (1997) (In vitro test genskih mutacija stanica sisavaca (1997.)).
1.1. UVOD
In vitro test genskih mutacija stanica sisavaca može se koristiti za otkrivanje genskih mutacija induciranih (uzrokovanih) kemijskim tvarima. Odgovarajuće stanične linije uključuju stanice limfoma miša L5178Y, linije stanica kineskog hrčka CHO, CHO-AS52 i V79 i stanice ljudskih limfoblastoidnih stanica TK6 (1). Kod tih staničnih linija na temelju najčešće primjenljivanih konačnih genetskih učinaka mjeri se mutacija na timidin kinazi (TK) i hipoksantin-guanin-fosforibozil-transferazi (HPRT) te na transgenu ksantin-guanin-fosforibozil-transferaze (XPRT). Testovi mutacija TK, HPRT i XPRT otkrivaju različite spektre genetskih pojava. Autosomalna lokacija TK i XPRT može omogućiti otkrivanje genetskih pojava (npr. velike delecije) koje se ne otkriju na lokusu HPRT-a na X-kromosomima (2)(3)(4)(5)(6).
U in vitro testu genskih mutacija stanica sisavaca mogu se koristiti kulture trajnih staničnih linija ili staničnih sojeva. Stanice koje se koriste biraju se na temelju sposobnosti rasta u kulturi i stabilnosti učestalosti spontanih mutacija.
Testovi koji se obavljaju in vitro zahtijevaju primjenu egzogenog (vanjskog) izvora metaboličke aktivacije. Taj sustav metaboličke aktivacije ne može u potpunosti oponašati uvjete in vivo kod sisavaca. Treba paziti da se izbjegavaju uvjeti koji bi doveli do rezultata koji ne odražavaju intrinzičnu mutagenost. Pozitivni rezultati koji ne odražavaju intrinzičnu mutagenost mogu proizaći iz promjena u pH, osmolalnosti ili visoke razine citotoksičnosti (7).
Ovaj se test koristi za probir na moguće mutagene i karcinogene u sisavaca. Mnogi spojevi koji se kod ovog testa pokažu pozitivnim karcinogeni su za sisavce; međutim, ne postoji savršena korelacija između ovog testa i karcinogenosti. Korelacija ovisi o klasi opasnosti kemikalije i sve je više dokaza da postoje karcinogeni koje ovaj test ne otkriva jer izgleda da djeluju kroz druge negenotoksičke mehanizme ili mehanizme kojih nema u bakterijskim stanicama (6).
Vidjeti također Opći uvod, dio B.
1.2. DEFINICIJE
Napredna mutacije: genska mutacija od roditeljskog tipa u mutantni oblik, koja uzrokuje promjenu ili gubitak enzimskog djelovanja kodirane bjelančevine.
Mutageni supstitucije baznih parova: tvari koje uzrokuju supstituciju jednog ili više baznih parova u DNK.
Mutageni pomaka okvira očitavanja (frameshift mutageni): tvari koje uzrokuju adiciju ili deleciju jednog ili više baznih parova u molekuli DNK.
Vrijeme ekspresije fenotipa: razdoblje tijekom kojega se nepromijenjeni genski produkti odstranjuju iz novomutiranih stanica.
Učestalost pojave mutanata: broj opaženih mutiranih stanica podijeljen s brojem živih stanica.
Relativni ukupan rast: povećanje broja stanica tijekom vremena u usporedbi s kontrolnom populacijom stanica; izračunava se kao umnožak rasta u suspenziji u odnosu na negativnu kontrolu i učinkovitosti kloniranja u odnosu na negativnu kontrolu.
Relativni rast u suspenziji: povećanje broja stanica tijekom razdoblja ekspresije u odnosu na negativnu kontrolu.
Sposobnost preživljavanja: učinkovitost kloniranja tretiranih stanica u vrijeme nasađivanja nakon razdoblja ekspresije u selektivnim uvjetima.
Preživljavanje: učinkovitost kloniranja tretiranih stanica kad se nasade na kraju tretiranja; preživljavanje se obično izražava u odnosu na preživljavanje populacije kontrolnih stanica.
1.3. NAČELO ISPITNE METODE
Stanice bez timidin kinaze (TK) su radi mutacije TK +/– →TK+/– otporne na citotoksičko djelovanje analoga primidona, trifluorotimidina (TFT). Stanice koje sadrže dosta timidin kinaze osjetljive su na TFT, što uzrokuje inhibiciju staničnog metabolizma i daljnju diobu stanica. Tako se mutantne stanice uz prisutnost TFT-a mogu razmnožavati dok se normalne stanice koje sadrže timidin kinazu ne mogu. Isto tako, stanice koje nemaju HPRT ili XPRT selektiraju se prema otpornosti na 6-tioguanin (TG) ili 8-azoguanin (AG). Ako se u okviru bilo kojeg testa genskih mutacija stanica sisavaca ispituje neki bazni analog ili spoj srodan selektivnom agensu pažljivo treba razmotriti svojstva ispitivane tvari. Na primjer, treba istražiti svaku pretpostavljenu selektivnu toksičnost ispitivane tvari za mutirane i nemutirane stanice. Prema tome, kad se testiraju kemikalije koje su strukturno srodne selektivnom agensu, mora se potvrditi djelovanje selektivnog sustava/agensa (8).
Stanice u suspenziji ili jednoslojnoj kulturi izlažu se u odgovarajućem trajanju ispitivanoj tvari, sa i bez metaboličke aktivacije, i uzgoji se subkultura na novoj podlozi, da bi se utvrdila citotoksičnost i omogućila ekspresija fenotipa prije selekcije mutanata (9)(10)(11)(12)(13). Citotoksičnost se obično utvrđuje mjerenjem relativne učinkovitosti kloniranja (preživljavanje) ili relativnog ukupnog rasta kultura nakon razdoblja tretiranja. Tretirane se kulture drže u hranjivoj podlozi za rast tijekom dovoljno dugog vremenskog razdoblja koje je karakteristično za svaki odabrani lokus i tip stanice, što omogućuje skoro optimalnu ekspresiju fenotipa induciranih mutacija. Učestalost pojave mutanata utvrđuje se nasađivanjem poznatog broja stanica na hranjivu podlogu koja sadrži selektivni agens za otkrivanje mutantnih stanica, a u podlozi bez selektivnog agensa za određivanje učinkovitosti kloniranja (sposobnosti preživljavanja). Nakon odgovarajućeg razdoblja inkubacije kolonije se prebroje. Učestalost pojave mutanata dobije se iz broja mutiranih kolonija u selektivnoj hranjivoj podlozi i broja kolonija u neselektivnoj hranjivoj podlozi.
1.4. OPIS ISPITNE METODE
1.4.1. Priprema
1.4.1.1. Stanice
Postoji više vrsta stanica koje se mogu koristiti u ovom testu, uključujući i podklonove stanica L5171Y, CHO, CHO-AS52, V79 ili TK6. Vrste stanica koje se koriste u ovom testu trebaju imati dokazanu osjetljivost na kemijske mutagene, visoku učinkovitost kloniranja i stabilnu učestalost spontanih mutacija. Stanice treba provjeriti na prisutnost mikoplazmatske kontaminacije i ako su kontaminirane ne smiju se koristiti.
Test treba biti dizajniran tako da njegova osjetljivost i jakost budu unaprijed određene. Broj stanica, kultura i koncentracije ispitivane tvari koje se koriste trebaju odražavati tako definirane parametre (14). Minimalni broj živih stanica koje se koriste u svakoj fazi ispitivanja a prežive tretiranje treba se temeljiti na učestalosti spontanih mutacija. Opća je uputa da se koristi broj stanica koji je najmanje 10 puta obrnuto proporcionalan s učestalošću spontanih mutacija. Međutim, preporučuje se korištenje najmanje 106 stanica. Kako bi se pokazalo da se test provodi dosljedno, trebali bi biti dostupni odgovarajući povijesni podaci o upotrijebljenom staničnom sustavu.
1.4.1.2. Hranjive podloge i uvjeti za uzgoj kultura
Treba koristiti odgovarajuće hranjive podloge za uzgoj kultura i osigurati odgovarajuće uvjete za inkubaciju (posude za uzgoj kultura, temperatura, koncentracija CO2, vlažnost zraka). Hranjive podloge treba odabrati prema selektivnim sustavima i vrsti stanica koji se koriste u testu. Posebno je važno odabrati uvjete za uzgoj kultura koji osiguravaju optimalni rast stanica tijekom razdoblja ekspresije i sposobnost stvaranja kolonija kako mutiranih tako i nemutiranih stanica.
1.4.1.3. Priprema kultura
Stanice se dobivaju iz matičnih kultura, nasađuju u/na podlogu za uzgoj kultura i inkubiraju na 37 °C. Prije upotrebe u ovom testu iz kultura će možda trebati odstraniti mutirane stanice koje postoje otprije.
1.4.1.4. Metabolička aktivacija
Stanice treba izlagati ispitivanoj tvari u prisutnosti i u odsutnosti odgovarajućeg sustava za aktivaciju metabolizma. Najčešće upotrebljavani sustav je postmitohondrijska frakcija s dodanim kofaktorom (S9) pripravljena od jetre glodavaca tretiranih agensima za enzimsku indukciju, kao što su Aroclor 1254 (15)(16)(17)(18), ili kombinacijom fenobarbitona i β-naftoflavona (19)(20).
Postmitohondrijska frakcija obično se upotrebljava u koncentracijama od 1 do 10 % v/v u konačnoj ispitnoj podlozi. Izbor i stanje sustava mataboličke aktivacije može ovisiti o klasi opasnosti kemikalije koja se testira. U nekim slučajevima može biti primjereno upotrijebiti više od jedne koncentracije postmitohondrijske frakcije.
Više promjena, uključujući stvaranje staničnih linija s izraženim specifičnim aktivacijskim enzimima pomoću genetskog inženjeringa može osigurati potencijal za endogenu aktivaciju. Odabir staničnih linija koje se koriste treba biti znanstveno opravdan (npr. na temelju relevantnosti izoenzima citokrom P450 za metabolizam ispitivane tvari).
1.4.1.5. Ispitivana tvar/priprema
Krute ispitivane tvari treba prije tretiranja stanica otopiti ili suspendirati u odgovarajućim otapalima ili nosačima i prema potrebi razrijediti. Tekuće ispitivane tvari mogu se izravno dodati u ispitne sustave i/ili prije tretiranja razrijediti. Treba koristiti svježe preparate ispitivane tvari, osim ako podaci o njihovoj stabilnosti dokazuju da je njihovo pohranjivanje prihvatljivo.
1.4.2. Uvjeti ispitivanja
1.4.2.1. Otapalo/nosač
Ne smije postojati sumnja da bi otapalo/nosač s ispitivanom tvari moglo/mogao proizvesti kemijsku reakciju i treba biti pogodno/pogodan za preživljavanje bakterija i djelovanje S9. Ako se koriste otapala/nosači koji nisu dobro poznati, njihovo uključivanje u ispitivanje treba potkrijepiti podacima koji ukazuju na njihovu prikladnost. Preporuka je da se, kad god je to moguće, najprije razmotri mogućnost upotrebe vodenog otapala/nosača. Kad se ispituju tvari koje u vodi nisu stabilne, korištena organska otapala ne smiju sadržavati vodu. Voda se može odstraniti pomoću molekularnog sita.
1.4.2.2. Koncentracije izlaganja
Među kriterijima koje treba razmotriti pri utvrđivanju najviše koncentracije su citotoksičnost, topljivost u ispitnom sustavu i promjene u pH ili osmolalnosti.
Citotoksičnost treba utvrditi sa i bez metaboličke aktivacije u glavnom pokusu uz upotrebu odgovarajućih pokazatelja staničnog integriteta i rasta, kao što je relativna učinkovitost kloniranja (preživljavanje) ili relativni ukupni rast. Može biti korisno preliminarnim pokusom utvrditi citotoksičnost i topljivost.
Treba upotrijebiti najmanje četiri koncentracije koje je moguće analizirati. Ako postoji citotoksičnost, te koncentracije trebaju biti u rasponu od maksimalne do male toksičnosti, ili netoksičnosti; to najčešće znači da razlika u razinama koncentracija ne smije biti veća od faktora 2 i √10. Ako se najviša koncentracija temelji na citotoksičnosti, rezultat njezine primjene trebala bi biti relativna stopa preživljavanja (relativna učinkovitost kloniranja) ili relativan ukupni rast od 10-20 % (ali ne ispod 10 %). Za relativno necitotoksične tvari maksimalna ispitna koncentracija treba biti 5 mg/ml, 5μl/ml ili 0,01 M, ovisno o tome koja je od njih najniža.
Tvari koje su relativno netopljive u vodi treba ispitivati do granice njihove topljivosti u uvjetima kultiviranja. Dokaze o netopljivosti treba utvrditi u konačnom sredstvu za tretiranje kojem se stanice izlažu. Može biti korisno procijeniti topljivost na početku i na kraju tretiranja, budući da se ona tijekom izlaganja u ispitnom sustavu može promijeniti zbog prisutnosti stanica, S9, seruma itd. Netopljivost se može otkriti golim okom. Talog ne smije smetati očitavanju.
1.4.2.3. Kontrole
U svaki pokus treba uključiti istovremene pozitivne i negativne (otapalo ili nosač) kontrole, sa i bez metaboličke aktivacije. Kad se koristi metabolička aktivacija, kemikalija pozitivne kontrole treba biti kemikalija kojoj je potrebna aktivacija da bi proizvela mutagenu reakciju.
Primjeri pozitivnih kontrolnih tvari uključuju:
|
Stanje metaboličke aktivacije |
Lokus |
Tvar |
CAS br. |
EINECS br. |
|
Odsutnost egzogene metaboličke aktivacije |
HPRT |
Etil metansulfonat |
62-50-0 |
200-536-7 |
|
Etil-nitrozourea |
759-73-9 |
212-072-2 |
||
|
TK (male i velike kolonije |
Metil metansulfonat |
66-27-3 |
200-625-0 |
|
|
XPRT |
Etil metansulfonat |
62-50-0 |
200-536-7 |
|
|
Etil-nitrozourea |
759-73-9 |
212-072-2 |
||
|
Odsutnost egzogene metaboličke aktivacije |
HPRT |
3-metilkolantren |
56-49-5 |
200-276-4 |
|
N-nitrozodimetilamin |
62-75-9 |
200-549-8 |
||
|
7,12-dimetilbenzantracen |
57-97-6 |
200-359-5 |
||
|
TK (male i velike kolonije |
Ciklofosfamid |
50-18-0 |
200-015-4 |
|
|
Ciklofosfamid monohidrat |
6055-19-2 |
|
||
|
Benzo[a]piren |
50-32-8 |
200-028-5 |
||
|
3-metilkolantren |
56-49-5 |
200-276-5 |
||
|
XPRT |
N-nitrozodimetilamin (za visoke razine S-9) |
62-75-9 |
200-549-8 |
|
|
Benzo[a]piren |
50-32-8 |
200-028-5 |
Mogu se upotrijebiti i druge odgovarajuće referentne tvari pozitivne kontrolne, npr. ako laboratorij ima bazu podataka o ranijim ispitivanjima 5-bromo 2’-deoksiuridina (CAS br. 59-14-3, EINECS br. 200-415-9) može se upotrijebiti i ova referentna tvar. Treba razmotriti mogućnost upotrebe kemikalija pozitivne kontrole koje spadaju u istu klasu opasnosti kao i ispitivana tvar, kad god su raspoložive.
Treba uključiti i negativne kontrole koje se sastoje samo od otapala ili nosača u podlozi za tretiranje i s kojima se postupa na jednaki način kao s tretiranim skupinama. Osim toga, treba koristiti i netretirane kontrole ako ne postoje podaci o prijašnjim kontrolama koji dokazuju da odabrano otapalo ne izaziva nikakve mutagene učinke.
1.4.3. Postupak
1.4.3.1. Tretiranje ispitivanom tvari
Stanice koje se razmnožavaju treba izlagati ispitivanoj tvari sa i bez metaboličke aktivacije. Izlaganje treba trajati odgovarajuće vrijeme (obično je dovoljno tri do šest sati). Vrijeme izlaganja može obuhvatiti jedan ili više staničnih ciklusa.
Za svaku ispitivanu koncentraciju mogu se paralelno koristiti dvije kulture ili samo jedna. Kad se koristi samo jedna kultura, broj koncentracija treba povećati kako bi se osigurao dovoljan broj kultura za analizu (npr. najmanje osam koncentracija koje se mogu analizirati). Treba koristiti dvostruke negativne kontrole (otapalo).
Plinovite ili hlapive tvari treba testirati primjenjujući odgovarajuće metode, npr. u nepropusnim posudama za uzgoj kultura (21)(22).
1.4.3.2. Mjerenje stope preživljavanja, sposobnosti preživljavanja i učestalosti pojave mutanata
Na kraju razdoblja izlaganja stanice se isperu i kultiviraju kako bi se utvrdila stopa preživljavanja i omogućila ekspresija fenotipa mutanata. Mjerenje citotoksičnosti utvrđivanjem relativne učinkovitosti kloniranja (preživljavanja) ili relativnog ukupnog rasta kultura obično započinje nakon tretiranja.
Za svaki lokus utvrđeno je minimalno vrijeme koje je potrebno da bi bila moguća optimalna ekspresija fenotipa novoinduciranih mutacija (za HPRT i XPRT potrebno je najmanje šest do osam dana, a za TK najmanje dva dana). Stanice se uzgajaju u podlozi sa i bez selektivnih agensa za utvrđivanje broja mutanata, odnosno učinkovitosti kloniranja. Mjerenje stope preživljavanja (koja se koristi za izračunavanje učestalosti pojave mutanata) započinje na kraju razdoblja ekspresije nasađivanjem na neselektivnu hranjivu podlogu.
Ako je ispitivana tvar u testu L5178Y TK+/– pozitivna, treba razvrstati po veličini kolonije najmanje jedne od ispitnih kultura (najviša pozitivna koncentracija) kao i negativnih i pozitivnih kontrola. Ako je ispitivana tvar u testu L5178Y TK+/– negativna, po veličini treba razvrstati kolonije negativnih i pozitivnih kontrola. Razvrstavanje kolonija po veličini može se obaviti i u studijama kod kojih se koristi TK6TK+/–.
2. PODACI
2.1. OBRADA REZULTATA
Obrađuju se podaci o mjerenju citotoksičnosti i sposobnosti preživljavanja, broju kolonija i učestalosti pojave mutanata za tretirane i kontrolne kulture. Kad je kod testa L5178Y TK+/– rezultat pozitivan, kolonije se razvrstavaju prema kriterijima za male i velike kolonije kod najmanje jedne koncentracije ispitivane tvari (najviša pozitivna koncentracija) i kod negativnih i pozitivnih kontrola. Molekularna i citogenetska svojstva mutanata u velikim i malim kolonijama detaljno su ispitana (23)(24). Kod testa TK+/– kolonije se razvrstavaju prema kriterijima za kolonije normalnog rasta (velike) i sporog rasta (male) (25). Kod kolonija mutanata koje su pretrpjele najveća genetska oštećenja vrijeme udvostručivanja je duže i zato tvore male kolonije. Tipično je za ova oštećenja da variraju od gubitka čitavoga gena do kariotipski vidljivih kromosomskih aberacija. Indukcija mutanata koji tvore male kolonije povezuje se s kemikalijama koje izazivaju velike kromosomske aberacije (26). Manje oštećene mutirane stanice rastu brzinom sličnom brzini rasta roditeljskih stanica i stvaraju velike kolonije.
Treba navesti stopu preživljavanja (relativnu učinkovitost kloniranja) ili relativni ukupni rast. Učestalost pojave mutanata treba izraziti kao broj mutantnih stanica u odnosu na broj preživjelih stanica.
Treba navesti podatke za pojedinačne kulture. Osim toga, sve podatke treba rezimirati u obliku tablice.
Jasne pozitivne reakcije nije potrebno verificirati. Nejasne rezultate treba pojasniti daljnjim ispitivanjima, po mogućnosti uz promjenu pokusnih uvjeta. Negativne rezultate treba potvrđivati od slučaja do slučaja. U slučajevima kod kojih se smatra da potvrda negativnih rezultata nije potrebna, za to treba navesti opravdane razloge. U daljnjim ispitivanjima koja se obavljaju u slučaju nejasnih ili negativnih rezultata treba razmotriti mogućnost izmjene ispitnih parametara kako bi se povećao obim analiziranih uvjeta. Ispitni parametri koji bi se mogli modificirati uključuju intervale primjene različitih koncentracija i uvjete metaboličke aktivacije.
2.2. OCJENA I TUMAČENJE REZULTATA
Postoji više kriterija za utvrđivanje pozitivnih rezultata, kao na primjer povećanje ili ponovljivo povećanje učestalosti pojave mutanata povezano s koncentracijom. Najprije treba razmotriti biološku relevantnost podataka. Statističke metode mogu se koristiti kao pomoć u ocjenjivanju rezultata ispitivanja. Statistički značaj ne smije biti jedini odlučujući faktor za pozitivnu reakciju.
Ispitivana tvar čija ispitivanja ne ispunjavaju gornje kriterije u ovom se sustavu ne smatra mutagenom.
Iako će većina studija dati jasne pozitivne ili negativne rezultate, u rijetkim slučajevima na temelju dobivenih podataka neće se moći donijeti konačno mišljenje o djelovanju ispitivane tvari. Rezultati mogu ostati nejasni ili upitni bez obzira na broj ponavljanja pokusa.
Pozitivni rezultati in vitro testa genskih mutacija stanica sisavaca pokazuju da ispitivana tvar izaziva genske mutacije u upotrijebljenim uzgojenim stanicama sisavaca. Ponovljiva pozitivna reakcija na određenu koncentraciju je najznačajnija. Negativni rezultati znače da ispitivana tvar u uvjetima ispitivanja ne izaziva genske mutacije kod upotrijebljenih uzgojenih stanica sisavaca.
3. IZVJEŠĆIVANJE
IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora uključivati sljedeće informacije:
|
|
otapalo/nosač:
|
|
|
Stanice:
|
|
|
Uvjeti ispitivanja:
|
|
|
Rezultati:
|
|
|
Diskusija o rezultatima. |
|
|
Zaključci. |
4. REFERENCE
|
(1) |
Moore, M.M., DeMarini, D.M., DeSerres, F.J. and Tindall, K.R. (Eds.), (1987) Banbury Report 28: Mammalian Cell Mutagenesis, Cold Spring Harbor Laboratory, New York. |
|
(2) |
Chu, E.H.Y. and Malling, H.V., (1968) Mammalian Cell Genetics. II. Chemical Induction of Specific Locus Mutations in Chinese Hamster Cells In Vitro, Proc. Natl. Acad. Sci., USA, 61, str. 1306-1312. |
|
(3) |
Liber, H.L. and Thilly, W.G., (1982) Mutation Assay at the Thymidine Kinase Locus in Diploid Human Lymphoblasts. Mutation Res., 94, str. 467-485. |
|
(4) |
Moore, M.M., Harington-Brock, K., Doerr, C.L. and Dearfield, K.L., (1989) Differential Mutant Quantitation at the Mouse Lymphoma TK and CHO HGPRT Loci. Mutagenesis, 4, str. 394-403. |
|
(5) |
Aaron, C.S. and Stankowski, Jr.L.F., (1989) Comparison of the AS52/XPRT and the CHO/HPRT Assays: Evaluation of Six Drug Candidates. Mutation Res., 223, str. 121-128. |
|
(6) |
Aaron, C.S., Bolcsfoldi, G., Glatt, H.R., Moore, M., Nishi, Y., Stankowski, Jr.L.F., Theiss, J. and Thompson, E., (1994) Mammalian Cell Gene Mutation Assays Working Group Report. Report of the International Workshop on Standardisation of Genotoxicity Test Procedures. Mutation Res., 312, str. 235-239. |
|
(7) |
Scott, D., Galloway, S.M., Marshall, R.R., Ishidate, M., Brusick, D., Ashby, J. and Myhr, B.C., (1991) Genotoxicity Under Extreme Culture Conditions. A report from ICPEMC Task Group 9. Mutation Res., 257, str. 147-204. |
|
(8) |
Clive, D., McCuen, R., Spector, J.F.S., Piper, C. and Mavournin, K.H., (1983) Specific Gene Mutations in L5178Y Cells in Culture. A Report of the U.S. Environmental Protection Agency Gene-Tox Program. Mutation Res., 115, str. 225-251. |
|
(9) |
Li, A.P., Gupta, R.S., Heflich, R.H. and Wasson, J.S., (1988) A Review and Analysis of the Chinese Hamster Ovary/Hypoxanthine Guanine Phosphoribosyl Transferase System to Determine the Mutagenicity of Chemical Agents: A Report of Phase III of the U.S. Environmental Protection Agency Gene-Tox Program. Mutation Res., 196, str. 17-36. |
|
(10) |
Li, A.P., Carver, J.H., Choy, W.N., Hsie, A.W., Gupta, R.S., Loveday, K.S., O’Neill, J.P., Riddle, J.C., Stankowski, L.F. Jr. and Yang, L.L., (1987) A Guide for the Performance of the Chinese Hamster Ovary Cell/Hypoxanthine-Guanine Phosphoribosyl Transferase Gene Mutation Assay. Mutation Res., 189, str. 135-141. |
|
(11) |
Liber, H.L., Yandell, D.W and Little, J.B., (1989) A Comparison of Mutation Induction at the TK and HPRT Loci in Human Lymphoblastoid Cells: Quantitative Differences are Due to an Additional Class of Mutations at the Autosomal TK Locus. Mutation Res., 216, str. 9-17. |
|
(12) |
Stankowski, L.F. Jr., Tindall, K.R. and Hsie, A.W., (1986) Quantitative and Molecular Analyses of Ethyl Methanosulphonate -and ICR 191- Induced Molecular Analyses of Ethyl Methanosulphonate -and ICR 191-Induced Mutation in AS52 Cells. Mutation Res., 160, str. 133-147. |
|
(13) |
Turner, N.T., Batson, A.G. and Clive, D., (1984) Procedures for the L5178Y/TK+/- — TK+/- Mouse Lymphoma Cell Mutagenicity Assay. In: Kilbey, B.J. et al (eds.) Handbook of Mutagenicity Test Procedures, Elsevier Science Publishers, New York, str. 239-268. |
|
(14) |
Arlett, C.F., Smith, D.M., Clarke, G.M., Green, M.H.L., Cole, J., McGregor, D.B. and Asquith, J.C., (1989) Mammalian Cell Gene Mutation Assays Based upon Colony Formation. In: Statistical Evaluation of Mutagenicity Test Data, Kirkland, D.J., Ed., Cambridge University Press, str. 66-101. |
|
(15) |
Abbondandolo, A., Bonatti, S., Corti, G., Fiorio, R., Loprieno, N. and Mazzaccaro, A., (1977) Induction of 6-Thioguanine-Resistant Mutants in V79 Chinese Hamster Cells by Mouse-Liver Microsome-Activated Dimethylnitrosamine. Mutation Res., 46, str. 365-373. |
|
(16) |
Ames, B.N., McCann, J. and Yamasaki, E., (1975) Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian-Microsome Mutagenicity Test. Mutation Res., 31, str. 347-364. |
|
(17) |
Clive, D., Johnson, K.O., Spector, J.F.S., Batson, A.G. and Brown M.M.M., (1979) Validation and Characterisation of the L5178Y/TK+/- Mouse Lymphoma Mutagen Assay System. Mutat. Res., 59, str. 61-108. |
|
(18) |
Maron, D.M. and Ames, B.N., (1983) Revised Methods for the Salmonella Mutagenicity Test. Mutation Res., 113, str. 173-215. |
|
(19) |
Elliott, B.M., Combes, R.D., Elcombe, C.R., Gatehouse, D.G., Gibson, G.G., Mackay, J.M. and Wolf, R.C., (1992) Alternatives to Aroclor 1254-Induced S9 in In Vitro Genotoxicity Assays. Mutagenesis, 7, str. 175-177. |
|
(20) |
Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T., (1976) A Safe Substitute for Polychlorinated Biphenyls as an Inducer of Metabolic Activation Systems. In: In vitro Metabolic Activation in Mutagenesis Testing, de Serres, F.J., Fouts, J.R., Bend, J.R. and Philpot, R.M. (eds), Elsevier, North-Holland, str. 85-88. |
|
(21) |
Krahn, D.F., Barsky, F.C. and McCooey, K.T., (1982) CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids. In: Tice, R.R., Costa, D.L., Schaich, K.M. (eds). Genotoxic Effects of Airborne Agents. New York, Plenum, str. 91-103. |
|
(22) |
Zamora, P.O., Benson, J.M., Li, A.P. and Brooks, A.L., (1983) Evaluation of an Exposure System Using Cells Grown on Collagen Gels for Detecting Highly Volatile Mutagens in the CHO/HGPRT Mutation Assay. Environmental Mutagenesis, 5, str. 795-801. |
|
(23) |
Applegate, M.L., Moore, M.M., Broder, C.B., Burrell, A. and Hozier, J.C., (1990) Molecular Dissection of Mutations at the Heterozygous Thymidine Kinase Locus in Mouse Lymphoma Cells. Proc. Natl. Acad. Sci. USA, 87, str. 51-55. |
|
(24) |
Moore, M.M., Clive, D., Hozier, J.C., Howard, B.E., Batson, A.G., Turner, N.T. and Sawyer, J., (1985) Analysis of Trifluorothymidine-Resistant (TFTr) Mutants of L5178Y/TK+/- Mouse Lymphoma Cells. Mutation Res., 151, str. 161-174. |
|
(25) |
Yandell, D.W., Dryja, T.P. and Little, J.B., (1990) Molecular Genetic Analysis of Recessive Mutations at a Heterozygous Autosomal Locus in Human Cells. Mutation Res., 229, str. 89-102. |
|
(26) |
Moore, M.M. and Doerr, C.L., (1990) Comparison of Chromosome Aberration Frequency and Small-Colony TK-Deficient Mutant Frequency in L5178Y/TK+/- - 3.7.2C Mouse Lymphoma Cells. Mutagenesis, 5, str. 609-614. |
B.18. OŠTEĆENJE I POPRAVAK – NEPLANIRANA SINTEZA DNK – STANICE SISAVACA IN VITRO
1. METODA
1.1. UVOD
Vidjeti Opći uvod, dio B.
1.2. DEFINICIJA
Vidjeti Opći uvod, dio B.
1.3. REFERENTNE TVARI
Nema ih.
1.4. NAČELO ISPITNE METODE
Testom neplanirane sinteze DNK (UDS) mjeri se reparaturna sinteza DNK nakon ekscizije (izrezivanja) i odstranjivanja dijela DNK na kojem se nalazi područje oštećenja izazvanog kemijskim i fizikalnim agensima. Test se temelji na inkorporaciji timidina označenog tritijem (3H-TdR) u DNK stanicama sisavaca koje nisu u S-fazi staničnog ciklusa. Unos 3H-TdR može se utvrditi autoradiografijom ili brojenjem DNK iz tretiranih stanica pomoću tekućinskog scintilacijskog brojača (LSC). Stanice sisavaca u kulturi, ako se ne koriste primarni hepatociti štakora, tretiraju se ispitnim agensom sa ili bez egzogene metaboličke aktivacije. UDS se isto tako može mjeriti u in vivo sustavima.
1.5. KRITERIJI KVALITETE
Nema ih.
1.6. OPIS ISPITNE METODE
Priprema
Ispitivane tvari i kontrolne ili referentne tvari treba pripremiti u hranjivoj podlozi za rast, odnosno otopiti ili suspendirati u odgovarajućim nosačima, a zatim za upotrebu u pokusu dodatno razrijediti u hranjivoj podlozi za rast. Konačna koncentracija nosača ne smije utjecati na sposobnost preživljavanja stanica.
U pokusu se mogu koristiti kulture primarnih hepatocita štakora, ljudskih limfocita ili trajnih staničnih linija (npr. ljudski diploidni fibroblasti).
Stanice treba izlagati ispitivanoj kemikaliji u prisutnosti i u odsutnosti odgovarajućeg sustava metaboličke aktivacije.
Uvjeti ispitivanja
Za svaku fazu pokusa potrebne su najmanje dvije stanične kulture za autoradiografiju i šest kultura (ili manje ako je to znanstveno opravdano) za utvrđivanje neplanirane sinteze DNK (UDS) pomoću tekućinskog scintilacijskog brojača (LSC).
U svaki pokus treba uključiti paralelne pozitivne i negativne kontrole (netretirane i/ili tretirane nosačem) sa i bez metaboličke aktivacije.
Primjeri pozitivnih kontrolnih tvari za pokus s hepatocitima štakora uključuju 7,12- dimetilbenzatracen (7,12- DMBA) ili 2-acetilaminofluoren (2-AAF). Kada se radi o trajnim staničnim linijama, 4-nitrokvinolin-N-oksid (4-NQO) je primjer pozitivne kontrolne tvari i za autoradiografske pokuse i za pokuse s tekućinskim scintilacijskim brojačem obavljene bez metaboličke aktivacije; N-dimetilnitrozamin je primjer kontrolnog pozitivnog spoja ako se koriste sustavi metaboličke aktivacije.
Treba upotrijebiti više koncentracija ispitivane tvari u rasponu adekvatnom za definiranje reakcija. Najviše koncentracije bi trebale izazvati neke cititoksičke učinke. Spojeve koji su relativno netopljivi u vodi treba testirati do granice njihove topljivosti. Za netoksične kemikalije koje su lako topljive u vodi gornju ispitnu koncentraciju treba utvrditi za svaki slučaj posebno.
Za održavanje kultura treba upotrijebiti odgovarajuće hranjive podloge za rast, odgovarajuću koncentraciju CO2, temperaturu i vlažnost zraka. Trajne stanične linije treba periodično provjeravati s obzirom na eventualnu kontaminaciju mikoplazmom.
Sustavi metaboličke aktivacije ne upotrebljavaju se kod kultura primarnih hepatocita. Trajne stanične linije i limfociti izlažu se ispitivanoj tvari u prisutnosti i u odsutnosti odgovarajućeg sustava metaboličke aktivacije.
Postupak
Trajne stanične linije dobivaju se iz matičnih kultura (npr. tripsinizacijom ili otresanjem), nasađuju se u odgovarajućoj gustoći u posude za uzgoj kultura i inkubiraju na 37 °C.
Kratkotrajne kulture hepatocita štakora pripremaju se tako da se svježe izdvojeni hepatociti suspendirani u odgovarajućoj podlozi stave na hranjivu podlogu za rast dok se ne pričvrste za njezinu površinu.
Kulture ljudskih limfocita pripremaju se uz primjenu odgovarajućih tehnika.
Primarni hepatociti štakora
Svježe izolirani hepatociti štakora tretiraju se u odgovarajućem vremenskom razdoblju ispitivanom tvari u tekućoj podlozi koja sadrži 3H-TdR. Na kraju razdoblja tretiranja podlogu treba ocijediti sa stanica koje se potom ispiru, fiksiraju i osuše. Mikroskopske preparate treba namočiti u autoradiografsku emulziju (alternativno se preparat može prekriti tankim slojem emulzije („stripping film”)).
Trajne stanične linije i limfociti
Autoradiografske tehnike: stanične kulture izlažu se ispitivanoj tvari tijekom odgovarajućeg vremena, nakon čega se tretiraju 3H-TdR-om. Vrijeme tretiranja ovisit će o vrsti tvari, djelovanju metaboličkih sustava i vrsti stanica. Za otkrivanje vrhunca neplanirane sinteze DNK (UDS) 3H-TdR treba dodati ili istodobno s ispitivanom tvari ili u roku od nekoliko minuta nakon izlaganja ispitivanoj tvari. Na odabir jednog od ova dva postupka utječu moguće interakcije između ispitivane tvari i 3H-TdR. Da bi se mogla razlikovati neplanirana sinteza DNK (UDS) od semikonzervativne replikacije DNK, ova druga se može inhibirati, na primjer primjenom podloge bez arginina, niskog sadržaja seruma ili pomoću hidroksiureje u hranjivoj podlozi za uzgoj kultura.
Mjerenje neplanirane sinteze DNK pomoću tekućinskog scintilacijskog brojača (LSC): prije tretiranja ispitivanom tvari treba blokirati ulazak stanica u S-fazu, kako je opisano gore; stanice zatim treba izložiti ispitivanoj kemikaliji, kako je opisano u slučaju radiografije. Na kraju inkubacije DNK treba ekstrahirati iz stanica i utvrditi njezin ukupni sadržaj, kao i stupanj inkorporacije 3H-TdR.
Treba napomenuti da kod primjene gore opisanih tehnika na ljudske limfocite, u nestimuliranim kulturama supresija semikonzervativne replikacije DNK nije potrebna.
Analiza
Pri utvrđivanju neplanirane sinteze DNK (UDS) stanica u kulturi, za vrijeme S-faze jezgre se ne broje. Treba prebrojiti najmanje 50 stanica po koncentraciji. Prije brojenja preparate treba kodirati. Na svakom preparatu treba prebrojiti nekoliko široko razmaknutih nepravilnih polja. Količinu 3H-TdR inkorporiranog u citoplazmu treba utvrditi prebrojavanjem triju područja veličine jezgre u citoplazmi svake prebrojene stanice.
Kod utvrđivanja neplanirane sinteze DNK (UDS) pomoću tekućinskog scintilacijskog brojača (LSC) pri svakoj koncentraciji treba upotrijebiti odgovarajući broj kultura.
Sve rezultate treba potvrditi nezavisnim pokusima.
2. PODACI
Podatke treba prikazati u obliku tablice.
2.1. AUTORADIOGRAFSKA MJERENJA
Stupanj inkorporacije 3H-TdR u citoplazmi i broj zrnaca nađenih na staničnoj jezgri treba zabilježiti posebno.
Za opis distribucije stupnja inkorporacije 3H-TdR u citoplazmi i broj zrnaca po jezgri mogu se koristiti aritmetička sredina, medijana i modus.
2.2. MJERENJE POMOĆU TEKUĆINSKOG SCINTILACIJSKOG BROJAČA (LSC)
Kod mjerenja pomoću tekućinskog scintilacijskog brojača (LSC) inkorporaciju 3H-TdR treba prikazati kao dpm/μg DNK. Za opis distribucije inkorporacije može se upotrijebiti srednja vrijednost (aritmetička sredina) dpm/μg DNK sa standardnom devijacijom.
Podatke treba ocjenjivati uz primjenu odgovarajućih statističkih metoda.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju treba, ako je moguće, sadržavati sljedeće informacije:
|
— |
upotrijebljene stanice, gustoća i broj pasaža u vrijeme tretiranja, broj staničnih kultura, |
|
— |
metode korištene za održavanje staničnih kultura, uključujući hranjive podloge, temperature i koncentracije CO2, |
|
— |
ispitivana tvar, nosač, koncentracije i obrazloženje za odabir koncentracija korištenih u pokusu, |
|
— |
pojedinosti o sustavima metaboličke aktivacije, |
|
— |
režim tretiranja, |
|
— |
pozitivne i negativne kontrole, |
|
— |
upotrijebljena autoradiografska tehnika, |
|
— |
primijenjeni postupci za blokiranje ulaska stanice u S-fazu, |
|
— |
primijenjeni postupci za ekstrakciju i utvrđivanje ukupnog sadržaja DNK pri mjerenju pomoću tekućinskog scintilacijskog brojača (LSC), |
|
— |
odnos doza/reakcija, gdje je moguće, |
|
— |
statistička procjena, |
|
— |
diskusija o rezultatima, |
|
— |
tumačenje rezultata. |
3.2. OCJENA I TUMAČENJE
Vidjeti Opći uvod, dio B.
4. REFERENCE
Vidjeti Opći uvod, dio B.
B.19. IN VITRO ANALIZA IZMJENE SESTRINSKIH KROMATIDA
1. METODA
1.1. UVOD
Vidjeti Opći uvod, dio B.
1.2. DEFINICIJA
Vidjeti Opći uvod, dio B.
1.3. REFERENTNE TVARI
Nema ih.
1.4. NAČELO ISPITNE METODE
Analiza izmjene sestrinskih kromatida je kratkotrajni test za otkrivanje recipročnih izmjena DNK između dviju sestrinskih kromatida kromosoma koji se udvostručuju. Izmjena sestrinskih kromatida (SCE) predstavlja međusobnu razmjenu produkata replikacije DNK na naizgled homolognim lokusima. Pretpostavka je da proces izmjene uključuje lom i ponovno spajanje DNK, iako se malo zna o njegovoj molekularnoj osnovi. Za otkrivanje izmjena sestrinskih kromatida (SCE) potrebno je imati neko sredstvo za diferencijalno označivanje sestrinskih kromatida, a to se može postići inkorporacijom bromodeoksiuridina (BrdU) u kromosomsku DNK za dva stanična ciklusa.
Stanice sisavaca izlažu se ispitivanoj kemikaliji in vitro sa ili bez egzogenog sustava metaboličke aktivacije za sisavce, ako je primjereno, i kultiviraju dva kruga replikacije u hranjivoj podlozi koja sadrži BrdU. Nakon tretiranja inhibitorom diobenog vretena (npr. kolhicinom), da bi se stanice akumulirale u fazi mitoze koja izgleda poput metafaze (c-metafaza), stanice se izdvajaju iz kulture i pripremaju se kromosomski preparati.
1.5. KRITERIJI KVALITETE
Nema ih.
1.6. OPIS ISPITNE METODE
1.6.1. Priprema
|
— |
U pokusu se mogu upotrijebiti primarne kulture (ljudski limfociti) ili trajne stanične linije (npr. stanice jajnika kineskog hrčka). Stanične linije treba provjeriti na eventualnu kontaminaciju mikoplazmom, |
|
— |
treba primjenjivati odgovarajuće hranjive podloge za uzgoj kultura i odgovarajuće uvjete inkubacije (npr. temperatura, posude za uzgoj kultura, koncentracije CO2 i vlažnost zraka), |
|
— |
ispitivane tvari mogu se pripremiti u hranjivoj podlozi za uzgoj kultura, odnosno otopiti ili suspendirati u odgovarajućim nosačima prije tretiranja stanica. Konačna koncentracija nosača u sustavu kulture ne smije znatno utjecati na sposobnost preživljavanja ili na rast stanica, a djelovanje na izmjenu sestrinskih kromatida (SCE) treba često nadzirati kroz primjenu kontrole pomoću otapala, |
|
— |
stanice treba izlagati ispitivanoj tvari u prisutnosti i u odsutnosti egzogenog sustava metaboličke aktivacije. Alternativno, kad se upotrebljavaju vrste stanica s intrinzičnom (endogenom) metaboličkom aktivacijom, stupanj i vrsta aktivnosti trebaju odgovarati klasi u koju je svrstana kemikalija koja se ispituje. |
1.6.2. Uvjeti ispitivanja
Za svaku pokusnu točku treba upotrijebiti najmanje po dvije jednake kulture.
Pozitivne kontrole, kod kojih se koriste i spojevi direktnog djelovanja i spojevi za koje je potrebna metabolička aktivacija, treba uključiti u svaki pokus: treba primjenjivati i kontrolu pomoću otapala.
Slijede primjeri tvari koje se mogu upotrijebiti kao pozitivne kontrole.
|
— |
spoj direktnog djelovanja:
|
|
— |
spoj indirektnog djelovanja:
|
Prema potrebi se može uključiti i dodatna pozitivna kontrola svrstana u istu klasu opasnosti kao i kemikalija koja se ispituje.
U odgovarajućim vremenskim razmacima treba upotrijebiti najmanje tri koncentracije. Najviša koncentracija treba izazvati značajan toksički učinak, ali ipak mora omogućiti odvijanje odgovarajuće replikacije stanica. Tvari koje su relativno netopljive u vodi treba ispitivati do granice njihove topljivosti, primjenjujući odgovarajuće postupke. Za netoksične ispitivane tvari koje su lako topljive u vodi gornje koncentracije treba utvrđivati od slučaja do slučaja.
1.6.3. Postupak
Trajne stanične linije dobivaju se iz matičnih kultura (npr. tripsinizacijom ili otresanjem), nasađuju se u odgovarajućoj gustoći u posude za uzgoj kultura i inkubiraju na 37 °C. Kad se radi o jednoslojnim kulturama broj stanica po posudi za uzgoj kultura treba prilagoditi tako da kulture u vrijeme izdvajanja stanica ne budu konfluentne za puno više od 50 %. Alternativno se stanice mogu koristiti u suspenzijskoj kulturi. Kulture ljudskih limfocita dobivaju se uz primjenu odgovarajućih tehnika iz heparinizirane krvi i inkubiraju na 37 °C.
Stanice u fazi eksponencijalnog rasta izlažu se ispitivanoj tvari tijekom odgovarajućeg vremenskog razdoblja; u većini slučajeva učinkovito je već izlaganje od jednog do dva sata, ali vrijeme izlaganja može se produžiti do trajanja dva kompletna stanična ciklusa. Stanice čija intrinzična (endogena) metabolička aktivnost nije dovoljna treba izložiti ispitivanoj kemikaliji u prisutnosti ili odsutnosti odgovarajućeg sustava za metaboličku aktivaciju. Na kraju razdoblja izlaganja ispire se ispitivana tvar sa stanica koje se zatim kultiviraju uz prisutnost BrdU-a u trajanju od dva kruga replikacije. Alternativni je postupak da se stanice istodobno izlažu ispitivanoj tvari i BrdU-u tijekom cijele kultivacije u trajanju od dva stanična ciklusa.
Kulture ljudskih limfocita tretiraju se dok su u polusinkronom stanju.
Stanice se analiziraju tijekom njihove druge diobe koja slijedi nakon tretiranja, s tim da se mora paziti da su stanice bile izložene kemikaliji u najosjetljivijim fazama staničnog ciklusa. Svim kulturama kojima se dodaje BrdU sve do izdvajanja stanica treba rukovati u mraku ili uz prigušeno svjetlo lampi sa žarnom niti, kako bi se fotoliza DNK koja sadrži BrdU svela na minimum.
Stanične kulture tretiraju se inhibitorom diobenog vretena (npr. kolhicinom) jedan do četiri sata prije izdvajanja stanica. Iz svake se kulture stanice izdvajaju zasebno i obrađuju za pripravu preparata kromosoma.
Preparati kromosoma pripravljaju se uz primjenu standardnih citogenetskih tehnika. Bojenje preparata radi prikaza izmjene sestrinskih kromatida (SCE) može se izvesti uz primjenu više tehnika (npr. fluorescencija plus Giemsa metoda).
Broj analiziranih stanica temelji se na učestalosti spontane kontrole izmjene sestrinskih kromatida (SCE). Obično se na izmjenu sestrinskih kromatida (SCE) analizira najmanje 25 dobro raširenih metafaza. Prije analize se mikroskopski preparati kodiraju. Kod ljudskih limfocita analiziraju se samo metafaze koje sadrže 46 centromera. Kod trajnih staničnih linija analiziraju se samo metafaze koje sadrže ± 2 centromera. Treba navesti je li centromerna zamjena oznaka zabilježena kao izmjena sestrinskih kromatida. Rezultate treba potvrditi nezavisnim pokusom.
2. PODACI
Podatke treba prikazati u tabličnom obliku. Za svaku tretiranu i kontrolnu kulturu zasebno treba navesti broj izmjena sestrinskih kromatida (SCE).
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju treba, ako je moguće, sadržavati sljedeće informacije:
|
— |
upotrijebljene stanice, metode održavanja staničnih kultura, |
|
— |
uvjeti ispitivanja: sastav hranjive podloge, koncentracija CO2, koncentracija ispitivane tvari, upotrijebljeni nosač, temperatura inkubacije, vrijeme tretiranja, upotrijebljeni inhibitor diobenog vretena, njegova koncentracija i vrijeme tretiranja njime, vrsta upotrijebljenog sustava metaboličke aktivacije, pozitivne i negativne kontrole, |
|
— |
broj staničnih kultura po pokusnoj točki, |
|
— |
pojedinosti o tehnici upotrijebljenoj za pripremu mikroskopskih preparata, |
|
— |
broj analiziranih metafaza (podaci navedeni zasebno za svaku kulturu), |
|
— |
srednji broj izmjena sestrinskih kromatida (SCE) po stanici i po kromosomu (podaci navedeni zasebno za svaku kulturu), |
|
— |
kriteriji za utvrđivanje broja izmjena sestrinskih kromatida (SCE), |
|
— |
obrazloženje za odabir doze, |
|
— |
odnos doze i reakcije, ako je primjereno, |
|
— |
statistička procjena, |
|
— |
diskusija o rezultatima, |
|
— |
tumačenje rezultata. |
3.2. OCJENA I TUMAČENJE
Vidjeti Opći uvod dio B.
4. REFERENCE
Vidjeti Opći uvod, dio B.
B.20. TEST SPOLNO UVJETOVANE RECESIVNE SMRTNOSTI KOD VINSKE MUŠICE DROSOPHILA MELANOGASTER
1. METODA
1.1. UVOD
Vidjeti Opći uvod, dio B.
1.2. DEFINICIJA
Vidjeti Opći uvod, dio B.
1.3. REFERENTNE TVARI
Nema ih.
1.4. NAČELO ISPITNE METODE
Testom spolno uvjetovane recesivne smrtnosti kod kojeg se koristi vinska mušica Drosophila melanogaster, u zametnoj lozi insekta otkriva se pojava mutacija, uključujući točkaste mutacije i male delecije. Ovaj se test sastoji u analizi naprednih mutacija, koja omogućuje probir na mutacije oko 800 lokusa na kromosomu X; oni čine oko 80 % svih lokusa kromosoma X. Kromosom X predstavlja oko jedne petine čitavog haploidnoga genoma.
Mutacije u kromosomu X vinske mušice Drosophila melanogaster fenotipski su izražene kod mužjaka koji nose mutirani gen. Kad je mutacija smrtonosna u hemizigotnom stanju, o njezinoj se prisutnosti zaključuje na temelju izostanka jedne fenotipske klase u muškom potomstvu, od dvije koje obično proizvede heterozigotna ženka. U testu spolno uvjetovane recesivne smrtnosti (SLRL) navedene se činjenice koriste kroz primjenu posebno označenih i strukturiranih kromosoma.
1.5. KRITERIJI KVALITETE
Nema ih.
1.6. OPIS ISPITNE METODE
Priprema
Mogu se upotrijebiti mužjaci iz dobro definiranih matičnih skupina divljeg tipa ili ženke iz matičnih skupina tipa Muller-5. Mogu se upotrijebiti i primjereno označene matične skupine ženki s višestruko invertiranim kromosomom X.
Ispitivanu tvar treba otopiti u vodi. Tvari koje su netopljive u vodi mogu se otopiti ili suspendirati u odgovarajućim nosačima (npr. mješavina etanola i Tween-60 ili 80) i zatim prije primjene razrijediti u vodi ili fiziološkoj otopini. Korištenje dimetilsulfoksida (DMSO) kao nosača treba izbjegavati.
Test treba osmisliti tako da njegova osjetljivost i snaga budu unaprijed određene. Učestalost spontanih mutacija koje se opažaju u odgovarajućim kontrolama snažno će utjecati na broj tretiranih kromosoma koje se mora analizirati.
Izlaganje može biti oralno, putem injekcije, ili se koristi inhalacijski put primjene plinova, ili para. Ispitivana se tvar može davati oralno u šećernoj otopini. Prema potrebi tvari se mogu otopiti u 0,7 %-tnoj otopini soli i ubrizgati u toraks (grudni koš) ili abdomen (trbuh).
U test treba uključiti negativne (nosači) i pozitivne kontrole. Međutim, ako postoje odgovarajući laboratorijski kontrolni podaci iz ranijih ispitivanja, paralelne kontrole nisu potrebne.
Primjenjuju se tri razine izloženosti. Kod preliminarnog ocjenjivanja može se primijeniti jedna razina izloženosti ispitivanoj tvari, s tim da se pritom koriste najviša prihvatljiva koncentracija ili koncentracija koja već izaziva neke znakove toksičnosti. Kad su u pitanju netoksične tvari životinje treba izložiti najvišim koncentracijama koje je moguće primijeniti.
Mužjaci divljeg tipa (stari tri do pet dana) tretiraju se ispitivanom tvari i pojedinačno se pare s brojnim ženkama, koje se prethodno nisu parile, iz matične skupine Muller-5 ili iz neke druge matične skupine, primjereno označene (višestruko invertiranim kromosomima X). Ženke se svaka dva do tri dana zamjenjuju novim ženkama koje se još nisu parile, kako bi se obuhvatio cijeli ciklus zametnih stanica. Kod potomaka tih ženki bilježe se smrtonosni učinci koji odgovaraju učincima na zreloj spermi, spermatidima srednje ili zadnje faze, ranim spermatidima, spermatocitima i spermatogonijima u vrijeme tretiranja.
Heterozigotnim ženkama F1 dobivenim gore navedenim križanjem omogući se pojedinačno parenje (tj. jedna ženka po bočici (fijali)) s njihovom braćom. U generaciji F2 kod svake se kulture bilježi odsutnost mužjaka divljeg tipa. Ako se čini da kultura potječe od ženke F1 koja u roditeljskom kromosomu X nosi smrtonosni gen (tj. ne opaža se nijedan mužjak s tretiranim kromosomom), kćeri te ženke s istim genotipom treba testirati kako bi se utvrdilo ponavlja li se smrtnost u sljedećoj generaciji.
2. PODACI
Podatke treba prikazati u obliku tablice u kojoj će biti naveden broj testiranih kromosoma X, broj sterilnih mužjaka i broj smrtonosnih kromosoma pri svakoj koncentraciji izlaganja i to za svako razdoblje parenja svakog tretiranog mužjaka. Treba navesti i broj klastera (skupina) različitih veličina po mužjaku. Predmetne rezultate treba potvrditi zasebnim pokusom.
Kod ocjenjivanja testa spolno uvjetovane recesivne smrtnosti treba primjenjivati odgovarajuće statističke metode. Statistički treba analizirati i ocijeniti nakupljanje recesivnih smrtonosnih gena koji potječu od jednog mužjaka.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju treba, ako je moguće, sadržavati sljedeće informacije:
|
— |
matične skupine: korištene matične skupine, odnosno sojevi mušice Drosophila, dob insekata, broj tretiranih mužjaka, broj sterilnih mužjaka, broj utvrđenih F2 kultura, broj F2 kultura bez potomstva, broj kromosoma koji nose smrtonosne gene opažene u svakom stadiju zametne stanice, |
|
— |
kriteriji za utvrđivanje veličine tretiranih skupina, |
|
— |
uvjeti ispitivanja, detaljan režim tretiranja i uzorkovanja, razine izlaganja, podaci o toksičnosti, negativne (otapalo) i pozitivne kontrole, ovisno o slučaju, |
|
— |
kriteriji za bilježenje smrtonosnih mutacija, |
|
— |
odnos izloženosti i učinaka, gdje je moguće, |
|
— |
ocjenjivanje podataka, |
|
— |
diskusija o rezultatima, |
|
— |
tumačenje rezultata. |
3.2. OCJENA I TUMAČENJE
Vidjeti Opći uvod, dio B.
4. REFERENCE
Vidjeti Opći uvod, dio B.
B.21. IN VITRO TESTOVI TRANSFORMACIJA STANICA SISAVACA
1. METODA
1.1. UVOD
Vidjeti Opći uvod, dio B.
1.2. DEFINICIJA
Vidjeti Opći uvod, dio B.
1.3. REFERENTNE TVARI
Nema ih.
1.4. NAČELO ISPITNE METODE
Sustavi kultura stanica sisavaca mogu se koristiti za otkrivanje fenotipskih promjena in vitro izazvanih kemijskim tvarima koje su povezane s malignim transformacijama in vivo. Najčešće se koriste stanice C3H10T1/2, 3T3, SHE, te stanice štakora soja Fischer, a testovi se temelje na promjenama u staničnoj morfologiji, formiranju fokusa (guste nakupine stanica koje su izgubile kontaktnu inhibiciju) ili promjenama u ovisnosti rasta stanica o tvrdoj podlozi za prihvaćanje u polukrutom agaru (u kojem inače ne bi rasle). Nijedan od konačnih učinaka in vitro testa nema utvrđenu mehanističku vezu s karcinomom. Neki od ispitnih sustava mogu otkriti promotore tumora. Citotoksičnost se može utvrditi mjerenjem učinka ispitnog materijala na sposobnost stvaranja kolonija (učinkovitost kloniranja) ili na brzinu rasta kultura. Mjerenjem citotoksičnosti treba utvrditi je li izlaganje ispitivanoj kemikaliji bilo toksikološki relevantno, ali se ono ne može upotrijebiti za izračunavanje transformacije učestalosti kod svih analiza s obzirom da neke od njih mogu uključivati produženu inkubaciju i/ili ponovno nasađivanje na agarne ploče.
1.5. KRITERIJI KVALITETE
Nema ih.
1.6. OPIS ISPITNE METODE
Priprema
Ovisno o testu transformacije koji se provodi, raspoloživ je čitav niz različitih staničnih linija ili primarnih stanica. Ispitivač se mora pobrinuti da u testu koji se obavlja stanice pokažu odgovarajuće fenotipske promjene nakon izlaganja poznatim karcinogenima i da za valjanost i pouzdanost testa koji se provodi u laboratoriju ispitivača postoje dokumentirani dokazi.
Treba primjenjivati hranjive podloge i pokusne uvjete koji odgovaraju analizi transformacija koja se primjenjuje.
Ispitivane tvari mogu se pripremiti u hranjivoj podlozi za uzgoj kultura, odnosno otopiti ili suspendirati u odgovarajućim nosačima prije tretiranja stanica. Konačna koncentracija nosača u sustavu kulture ne smije utjecati na sposobnost preživljavanja stanica, brzinu rasta ili pojavu transformacija.
Stanice treba izlagati ispitivanoj tvari u prisutnosti i u odsutnosti odgovarajućeg sustava metaboličke aktivacije. Alternativno, u slučajevima korištenja staničnih tipova s endogenom (intrinzičnom) metaboličkom aktivnošću unaprijed treba biti poznato da ta aktivnost po svojoj prirodi odgovara klasi opasnosti u koju je svrstana kemikalija koja se ispituje.
Uvjeti ispitivanja
U svaki pokus treba uključiti pozitivne kontrole uz primjenu spojeva izravnog djelovanja, kao i spojeva kojima je potrebna metabolička aktivacija; isto tako treba primjenjivati i negativne kontrole (nosač).
Slijede primjeri tvari koje se mogu upotrijebiti kao pozitivne kontrole:
|
— |
Kemikalije izravnog djelovanja:
|
|
— |
Spojevi koji zahtijevaju metaboličku aktivaciju:
|
Prema potrebi u ispitivanje treba uključiti dodatnu pozitivnu kontrolu svrstanu u istu klasu kemikalija kao i spoj koji se ispituje.
Treba upotrijebiti nekoliko koncentracija ispitivane tvari. Navedene koncentracije trebaju prouzročiti toksički učinak razmjeran koncentraciji, pri čemu će pri najvišoj koncentraciji razina preživljavanja biti niska, dok će preživljavanje kod najniže koncentracije biti otprilike jednako onome koje izaziva negativna kontrola. Tvari koje su relativno netopljive u vodi treba ispitivati do granice njihove topljivosti, primjenjujući odgovarajuće postupke. Za netoksične tvari koje su lako topljive u vodi gornje koncentracije treba utvrđivati od slučaja do slučaja.
Postupak
Stanice se izlažu ispitivanoj tvari tijekom odgovarajućeg vremenskog razdoblja, ovisno o ispitnom sustavu koji se primjenjuje, što u slučaju produženog izlaganja može uključivati i ponovljeno doziranje uz promjenu hranjive podloge (te, ako je potrebno, svježu mješavinu za metaboličku aktivaciju). Stanice bez dovoljne endogene (intrinzične) metaboličke aktivnosti treba izlagati ispitivanoj tvari u prisutnosti i odsutnosti odgovarajućeg sustava metaboličke aktivacije. Po završetku razdoblja izlaganja stanice se ispiru radi uklanjanja ostataka ispitivane tvari i kultiviraju u uvjetima koji pogoduju pojavljivanju transformiranog fenotipa koji se promatra, te se utvrđuje pojava transformacija. Svi se rezultati potvrđuju nezavisnim pokusom.
2. PODACI
Podatke treba prikazati u obliku tablice, što se može učiniti na više načina ovisno o provedenom ispitivanju, na primjer, može se navesti ukupan broj stanica, broj pozitivnih agarnih ploča, ili broj transformiranih stanica. Tamo gdje je to primjereno, razina preživljavanja iskazuje se u obliku postotka kontrolnih razina, a učestalost transformacija kao broj transformanata (transformiranih stanica) u odnosu na broj preživjelih stanica. Podatke treba ocijeniti uz primjenu odgovarajućih statističkih metoda.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju treba, ako je moguće, sadržavati sljedeće informacije:
|
— |
upotrijebljena vrsta stanica, broj staničnih kultura, metode održavanja staničnih kultura, |
|
— |
uvjeti ispitivanja: koncentracija ispitivane tvari, upotrijebljeni nosač, vrijeme inkubacije, trajanje i učestalost tretiranja, gustoća stanica tijekom tretiranja, vrsta upotrijebljenog egzogenog sustava metaboličke aktivacije, pozitivne i negativne kontrole, detaljan opis promatranog fenotipa, upotrijebljeni selektivni sustav (ovisno o slučaju), obrazloženje za odabir doze, |
|
— |
metoda upotrijebljena za brojenje živih i transformiranih stanica, |
|
— |
statistička ocjena, |
|
— |
diskusija o rezultatima, |
|
— |
tumačenje rezultata. |
3.2. OCJENA I TUMAČENJE
Vidjeti Opći uvod, dio B.
4. REFERENCE
Vidjeti Opći uvod, dio B.
B.22. TEST DOMINANTNIH LETALNIH GENA NA GLODAVCIMA
1. METODA
1.1. UVOD
Vidjeti Opći uvod, dio B.
1.2. DEFINICIJA
Vidjeti Opći uvod, dio B.
1.3. REFERENTNE TVARI
Nema ih.
1.4. NAČELO ISPITNE METODE
Učinci dominantnih letalnih gena uzrokuju embrionalnu ili fetalnu smrt. Indukcija dominantnih letalnih gena izlaganjem kemijskoj tvari ukazuje na činjenicu da je tvar djelovala na zametno tkivo ispitivane životinjske vrste. Općenito je prihvaćeno mišljenje da su dominantni letalni geni posljedica kromosomskih oštećenja (strukturnih i numeričkih anomalija). Isto tako, ako se tretiraju ženke, toksički učinci mogu dovesti do embrionalne smrti.
Obično se životinje muškog roda izlažu djelovanju ispitivanog spoja te se pare s netretiranim ženkama koje se prethodno nisu parile. Različite stadije zametnih stanica može se odvojeno ispitati primjenom uzastopnih intervala parenja. Povećanje broja mrtvih implanata po ženki u tretiranoj skupini u odnosu na broj mrtvih implanata po ženki u kontrolnoj skupini odražava postimplantacijski gubitak. Predimplantacijski gubitak može se procijeniti na temelju broja žutih tijela ili usporedbom ukupnog broja implanata po ženki u kontrolnoj i tretiranoj skupini. Ukupni učinak dominantnih letalnih gena predstavlja zbroj pred- i post- implantacijskoga gubitka. Izračun ukupnog učinka dominantnih letalnih gena temelji se na usporedbi živih implanata po ženki u ispitnoj skupini i živih implanata po ženki u kontrolnoj skupini. Smanjenje broja implanata u određenim vremenskim razmacima može biti posljedica ubijanja stanica (tj. spermatocita i/ili spermatogonija).
1.5. KRITERIJI KVALITETE
Nema ih.
1.6. OPIS ISPITNE METODE
Priprema
Kada je moguće, ispitivane tvari treba otopiti ili suspendirati u izotoničnoj fiziološkoj otopini. Kemikalije netopljive u vodi mogu se otopiti ili suspendirati u odgovarajućim nosačima. Nosač koji se koristi ne smije utjecati na djelovanje ispitivane kemikalije, niti izazivati toksične učinke. Treba koristiti svježe pripravke ispitivane kemikalije.
Uvjeti ispitivanja
Ispitivani se spoj općenito primjenjuje samo jednom. Na temelju toksikoloških informacija može se primijeniti režim ponavljanog tretiranja. Uobičajeni putevi primjene su oralna intubacija ili intraperitonealna injekcija. Prikladni mogu biti i drugi putevi primjene.
Za pokusne životinje se kao vrsta preporučuju štakori i miševi. Zdrave i potpuno spolno zrele životinje nasumce se biraju i raspoređuju u skupine predviđene za tretiranje, odnosno kontrolu.
Treba koristiti odgovarajući broj tretiranih mužjaka, pri čemu treba uzeti u obzir spontano variranje bioloških svojstava koja se ocjenjuju. Odabrani broj trebao bi se temeljiti na unaprijed utvrđenoj osjetljivosti detekcije i snazi testa koji će proizvesti učinke od statističkog značaja. Na primjer, kod tipičnog testa broj mužjaka u svakoj skupini koja prima određenu dozu trebao bi biti dovoljan da osigura između 30 i 50 gravidnih ženki po intervalu parenja.
Općenito u svaki pokus treba uključiti paralelne pozitivne i negativne (nosač) kontrole. Kad postoje prihvatljivi rezultati pozitivne kontrole, dobiveni nedavno obavljenim pokusima u istom laboratoriju, ti se rezultati mogu upotrijebiti umjesto paralelne pozitivne kontrole. Tvari pozitivne kontrole trebale bi se koristiti u odgovarajućoj niskoj dozi (npr. MMS, intraperitonealno pri 10 mg/kilogram), da bi se dokazala osjetljivost ispitivanja.
Obično se koriste tri visine doza. Visoka doza treba dovesti do pojave znakova toksičnosti ili smanjene plodnosti kod tretiranih životinja. U nekim slučajevima može biti dovoljna samo jedna razina doziranja.
Netoksične tvari treba ispitati pri koncentraciji od 5 g/kilogram nakon jednog doziranja ili pri koncentraciji od 1 g/kilogram/dan nakon ponovljenog doziranja.
Postupak
Postoji više vremenskih režima tretiranja. Najčešće se primjenjuje jednokratno doziranje ispitivane tvari. Moguća je i primjena ostalih vremenskih režima.
Svaki se mužjak u odgovarajućim vremenskim razmacima po tretiranju uzastopno pari s jednom ili dvije netretirane ženke koje se prethodno nisu parile. Ženke treba ostaviti s mužjacima barem tijekom jednog estrusnog ciklusa ili dok ne dođe do parenja, što se utvrđuje na temelju prisutnosti sperme u vagini ili na temelju prisutnosti vaginalnog čepa.
Broj parenja nakon tretiranja ovisi o režimu tretiranja i trebao bi biti dovoljan da se uzmu uzorci zametnih stanica u svim stadijima staničnog ciklusa koji slijede iza tretiranja.
U drugoj polovini gravidnosti ženke se usmrćuju i pregledava se sadržaj maternice kako bi se utvrdio broj mrtvih i živih implanata. Mogu se pregledati jajnici kako bi se utvrdio broj žutih tijela.
2. PODACI
Podatke treba prikazati u obliku tablice iz koje se može vidjeti broj mužjaka, broj gravidnih ženki i broj negravidnih ženki. Rezultate svakog parenja, uključujući identifikacijsku oznaku svakog mužjaka i ženke, treba bilježiti pojedinačno. Za svaku ženku treba zabilježiti tjedan u kojemu je došlo do parenja, visinu doze koju su primili mužjaci, kao i učestalost pojave živih i mrtvih implanata.
Izračun ukupnog učinka dominantnih letalnih gena temelji se na usporedbi živih implanata po ženki u tretiranoj skupini sa živim implantima po ženki u kontrolnoj skupini. Analizira se omjer mrtvih i živih implanata iz tretirane skupine u usporedbi s istim omjerom u kontrolnoj skupini kako bi se utvrdio postimplantacijski gubitak.
Ako se zabilježeni podaci odnose na slučajeve rane i kasne smrti, iz tablica to treba biti jasno vidljivo. Ako su procijenjeni gubici prije implantacije, treba ih zabilježiti. Predimplantacijski gubitak može se izračunati kao razlika između broja žutih tijela i broja implanata, ili kao smanjenje prosječnog broja implanata po maternici u usporedbi s brojem implanata dobivenih parenjima u kontrolnoj skupini.
Podaci se ocjenjuju uz primjenu odgovarajućih statističkih metoda.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju treba, ako je moguće, sadržavati sljedeće informacije:
|
— |
upotrijebljeni soj, starost i tjelesna masa upotrijebljenih životinja, broj životinja svakog spola u pokusnim i kontrolnim skupinama, |
|
— |
ispitivana tvar, nosač, ispitivane visine doza i obrazloženje za njihov odabir, negativne i pozitivne kontrole, podaci o toksičnosti, |
|
— |
put primjene i vremenski režim tretiranja, |
|
— |
vremenski režim parenja, |
|
— |
metoda korištena da bi se utvrdilo da je došlo do parenja, |
|
— |
vrijeme usmrćivanja, |
|
— |
kriteriji za utvrđivanje dominantnih letalnih gena |
|
— |
odnos doze i reakcije, ako je primjereno, |
|
— |
statistička ocjena, |
|
— |
diskusija o rezultatima, |
|
— |
tumačenje rezultata. |
3.2. OCJENA I TUMAČENJE
Vidjeti Opći uvod, dio B.
4. REFERENCE
Vidjeti Opći uvod, dio B.
B.23. TEST KROMOSOMSKIH ABERACIJA U SPERMATOGONIJIMA SISAVACA
1. METODA
Ova je metoda istovjetna metodi OECD TG 483, Mammalian Spermatogonial Chromosome Aberration Test (1997) (Test kromosomskih aberacija na spermatogonijima sisavaca (1997.))
1.1. UVOD
Svrha je in vivo testa kromosomskih aberacija u spermatogonijima sisavaca utvrditi tvari koje uzrokuju strukturne kromosomske aberacije u stanicama spermatogonija sisavaca (1)(2)(3)(4)(5). Razlikujemo dva tipa strukturnih kromosomskih aberacija, kromosomski i kromatidni. Većina kemijskih mutagena uzrokuje aberacije kromatidnog tipa, ali dolazi i do pojave aberacija kromosomskog tipa. Predmetna metoda nije namijenjena mjerenju numeričkih aberacija i obično se u tu svrhu ne upotrebljava. Kromosomske mutacije i s njima povezane pojave uzrok su mnogih genetskih oboljenja kod ljudi.
Ovim se testom mjere kromosomske pojave u zametnim stanicama spermatogonija te se očekuje da se tim testom može predvidjeti indukcija nasljednih mutacija u zametnim stanicama.
Za ovaj se test obično koriste glodavci. Ovim se in vivo citogenetskim testom otkrivaju kromosomske aberacije pri mitozi spermatogonija. Ostale ciljne stanice nisu predmet ove metode.
Kako bi se moglo otkriti aberacije kromatidnog tipa u stanicama spermatogonija treba ispitati prvu mitotsku diobu stanica nakon tretiranja, prije nego se nastale lezije izgube u kasnijim staničnim diobama. Dodatne informacije o tretiranim matičnim stanicama spermatogonija mogu se dobiti analizom aberacija kromosomskog tipa kod kromosoma tijekom mejoze u dijakinezi-metafazi I, kada tretirane stanice postaju spermatociti.
Svrha je ovog in vivo testa ispitati jesu li mutageni somatskih stanica aktivni i u zametnim stanicama. Osim toga, ovaj test na spermatogonijima relevantan je za ocjenjivanje rizika od mutagenosti, zato što omogućuje razmatranje faktora metabolizma, farmakokinetike i procesa popravka DNA in vivo.
U testisu se nalaze brojne generacije spermatogonija različito osjetljivih na tretiranje kemikalijama. Prema tome, opažene aberacije predstavljaju skupnu reakciju tretiranih staničnih populacija spermatogonija, pri čemu prevladavaju brojnije diferencirane stanice spermatogonija. Uslijed fizičke i fiziološke barijere Sertolijevih stanica i barijere između krvi i testisa, različite generacije spermatogonija mogu ili ne moraju biti izložene glavnom krvotoku, ovisno o njihovom položaju unutar testisa.
Ako postoje dokazi da ispitivana tvar ili reaktivni metabolit neće stići do ciljnog tkiva, ovaj oblik ispitivanja nije primjeren.
Vidjeti također Opći uvod, dio B.
1.2. DEFINICIJE
Aberacija kromatidnog tipa: strukturno oštećenje kromosoma izraženo kao lom pojedinačnih kromatida ili lom i ponovno spajanje kromatida.
Aberacija kromosomskog tipa: strukturno oštećenje kromosoma izraženo kao lom ili lom i ponovno spajanje obiju kromatida na istom mjestu.
Prekid (tijesni spoj): akromatska lezija manja od širine jedne kromatide i s minimalnim otklonom (neporavnatošću) kromatida.
Numerička aberacija: promjena u broju kromosoma u odnosu na normalni broj koji je karakterističan za korištene stanice.
Poliploidnost: višekratnik haploidnog broja kromosoma (n) osim diploidnog broja (tj. 3n, 4n itd.).
Strukturne aberacije: promjene u strukturi kromosoma koje se mogu otkriti mikroskopskim pregledom podjele stanica u metafazi, a opažaju se kao delecije (intrakromosomske), inverzije (intrakromosomske), ili translokacije (interkromosomske).
1.3. NAČELO ISPITNE METODE
Životinje se na odgovarajući način izlažu ispitivanoj tvari te se u odgovarajuće vrijeme nakon tretiranja usmrćuju. Prije usmrćivanja, životinje se tretiraju agensom za zaustavljanje metafaze (npr. Colcemidom® ili kolhicinom). Nakon toga naprave se i oboje preparati zametnih stanica, te se analizom utvrđuje je li došlo do kromosomskih aberacija metafaznih stanica.
1.4. OPIS ISPITNE METODE
1.4.1. Priprema
1.4.1.1. Odabir životinjske vrste
Obično se koriste kineski hrčci. Međutim, mogu se koristiti i druge odgovarajuće vrste sisavaca. Treba koristiti mlade zdrave odrasle životinje sojeva koji su uobičajeni u laboratorijskoj praksi. Na početku studije variranje tjelesne mase životinja treba biti što manje i ne smije prelaziti ± 20 % srednje vrijednosti mase.
1.4.1.2. Uvjeti držanja i prehrana
Primjenjuju se opći uvjeti iz Općeg uvoda u dijelu B, iako ciljna vlažnost zraka treba biti 50-60 %.
1.4.1.3. Priprema životinja
Zdrave mlade odrasle životinje nasumce se raspoređuju u kontrolne skupine i skupine koje će se tretirati. Kaveze treba razmjestiti tako da se učinci do kojih bi moglo doći zbog njihovog položaja svedu na minimum. Životinje se označivaju jedinstvenim oznakama. Životinje se prilagođavaju laboratorijskim uvjetima najmanje pet dana prije početka studije.
1.4.1.4. Priprema doza
Krute ispitivane tvari treba otopiti ili suspendirati u odgovarajućim otapalima ili nosačima i prije doziranja životinjama prema potrebi razrijediti. Tekuće ispitivane tvari mogu se dozirati izravno i/ili ih se prije obrade može razrijediti. Treba koristiti svježe pripravke ispitivane tvari, osim u slučajevima kad podaci o stabilnosti pokazuju da ih je prihvatljivo pohraniti.
1.4.2. Uvjeti ispitivanja
1.4.2.1. Otapalo/nosač
Otapalo/nosač ne smije proizvesti toksičke učinke pri upotrijebljenim visinama doza i ne smije postojati sumnja da će kemijski reagirati s ispitivanom tvari. Ako se primjenjuju manje poznata otapala/nosači, njihovo bi uključivanje u ispitivanje trebalo biti potkrijepljeno podacima iz kojih je vidljivo da su prikladni. Kad god je to moguće, preporučuje se najprije razmotriti mogućnost primjene vodenog otapala/nosača.
1.4.2.2. Kontrole
U svaki test treba uključiti istovremene pozitivne i negativne kontrole (otapalo/nosač). Izuzimajući tretiranje ispitivanom tvari, sa životinjama u kontrolnim skupinama treba postupati jednako kao sa životinjama u tretiranim skupinama.
Pozitivne kontrole trebale bi uzrokovati nastanak strukturnih aberacija in vivo u stanicama spermatogonija pri razinama izlaganja kod kojih se očekuje povećanje koje je vidljivo u odnosu na podlogu.
Doze pozitivnih kontrola treba odabrati tako da učinci budu jasni, ali da osoba koja očitava rezultate ne može odmah vidjeti identitet kodiranih mikroskopskih preparata. Prihvatljivo je kontrole dozirati nekim drugim putem primjene, različitim od puta primjene ispitivane tvari, te ih uzorkovati samo jednom. Osim toga, može se razmotriti korištenje kemikalija za pozitivnu kontrolu koje spadaju u istu klasu opasnosti kao i ispitivana tvar, ako su takve kemikalije raspoložive. Primjeri tvari za pozitivnu kontrolu obuhvaćaju:
|
Tvar |
CAS br. |
EINECS br. |
|
Ciklofosfamid Ciklofosfamid monohidrat |
50-18-0 6055-19-2 |
200-015-4 |
|
Cikloheksamin |
108-91-8 |
203-629-0 |
|
Mitomicin C |
50-07-7 |
200-008-6 |
|
Monomerni akrilamid |
79-06-1 |
201-173-7 |
|
Trietilenmelamin |
51-18-3 |
200-083-5 |
Kod svakog uzorkovanja treba upotrijebiti negativne kontrolne skupine tretirane samo otapalom ili nosačem, sa kojima se inače postupa jednako kao i s tretiranim skupinama, osim kad podaci iz prijašnjih studija dokazuju da među životinjama postoji prihvatljiva varijabilnost i učestalost pojave stanica s kromosomskim aberacijama. Dodatno treba upotrijebiti i netretirane kontrolne skupine, osim ako postoje podaci iz ranijih studija koji dokazuju da odabrano otapalo/nosač ne izaziva nikakve štetne niti mutagene učinke.
1.5. POSTUPAK
1.5.1. Broj životinja
U svakoj tretiranoj i kontrolnoj skupina mora biti barem 5 mužjaka na kojima je moguće obaviti analizu.
1.5.2. Režim tretiranja
Ispitivanu tvar najbolje je primijeniti jednom ili dvaput (tj. kao jedno ili dva tretiranja). Isto se tako ispitivana tvar može primijeniti kao podijeljena doza, odnosno doza koja se primjenjuje u dva puta tijekom istog dana u razmaku od najviše nekoliko sati, kako bi se olakšala primjena velike količine materijala. Za druge režime doziranja treba postojati znanstveno opravdanje.
Kod skupine na koju se primjenjuje najviša doza uzorci se uzimaju dvaput nakon tretiranja. S obzirom da ispitivana tvar može utjecati na kinetiku staničnog ciklusa, jedno se uzorkovanje obavlja ranije, oko 24 sata nakon tretiranja, a jedno kasnije, oko 48 sati nakon tretiranja. Kod ostalih doza uzorke treba uzeti nakon tretiranja po isteku 24 sata ili vremena koje odgovara 1,5 dužini staničnog ciklusa, osim ako je poznato da bi drugo vrijeme uzorkovanja bilo prikladnije za otkrivanje učinaka (6).
Mogu se uzeti i dodatni uzorci u neko drugo vrijeme. Na primjer, kad su u pitanju kemikalije koje mogu uzrokovati zaostajanje kromosoma ili učinke neovisne o S-fazi, uzorkovanje bi bilo primjerenije obaviti ranije (1).
Primjerenost režima ponavljanog tretiranja treba utvrditi za svaki slučaj posebno. Ako se slijedi režim ponavljanog tretiranja, životinje treba usmrtiti 24 sata nakon posljednjeg tretiranja (nakon vremena koje odgovara 1,5 dužini staničnog ciklusa). Prema potrebi mogu se uzeti i dodatni uzorci u neko drugo vrijeme.
Prije usmrćivanja životinjama se intraperitonealno ubrizgava odgovarajuća doza tvari za zaustavljanje metafaze (npr. Colcemid® ili kolhicin). Zatim se nakon odgovarajućeg vremena životinje podvrgavaju uzorkovanju. Za miševe navedeni interval iznosi otprilike 3-5 sati, a za kineske hrčke otprilike 4-5 sati.
1.5.3. Visine doza
Ako se obavlja studija za utvrđivanje raspona jer nema prikladnih podataka, treba je obaviti u istom laboratoriju, na istoj životinjskoj vrsti i soju te uz isti režim tretiranja, koji će se koristiti u glavnoj studiji (7). Ako toksičnost postoji, za prvo uzorkovanje koriste se tri visine doza. Te bi doze trebale obuhvatiti raspon od maksimalne do male ili nikakve toksičnosti. Za kasnije uzorkovanje treba upotrijebiti samo najvišu dozu. Najviša se doza definira kao doza koja uzrokuje takve simptome toksičnosti da je za očekivati da bi više doze uz isti režim doziranja prouzročile smrt životinje.
Tvari specifičnog biološkog djelovanja u malenim netoksičnim dozama (poput hormona i mitogena) mogu biti izuzete od kriterija za utvrđivanje doza te ih treba ocjenjivati od slučaja do slučaja. Najviša se doza također može definirati kao doza pri kojoj se javljaju znakovi toksičnosti u stanicama spermatogonija (npr. smanjenje omjera između mitoza spermatogonija u prvoj i drugoj mejotskoj metafazi; navedeno smanjenje ne bi smjelo premašiti 50 %).
1.5.4. Granični test
Ako test pri jednoj visini doze od najmanje 2 000 mg/kg tjelesne mase/dan, koja se primijeni odjednom ili u dva puta tijekom istog dana, ne proizvede vidljive toksičke učinke i ako se na temelju podataka o strukturno srodnim tvarima genotoksičnost ne očekuje, potpuna studija uz primjenu tri visine doza može se smatrati nepotrebnom. Očekivana ljudska izloženost može ukazati na potrebu za primjenom viših doza u graničnom testu.
1.5.5. Primjena doza
Ispitivana se tvar obično primjenjuje oralnom intubacijom pomoću želučane sonde, ili odgovarajuće intubacijske kanile, ili intraperitonealnom injekcijom. Ostali putevi izlaganja mogu biti prihvatljivi u slučajevima kad se može dokazati njihova opravdanost. Maksimalni volumen tekućine koji se odjednom može unijeti u životinju bilo intubacijom ili putem injekcije ovisi o veličini pokusne životinje. Taj volumen ne smije biti veći od 2 ml/100 g tjelesne mase. Za primjenu volumena većih od ovog treba navesti opravdani razlog. Osim kod nadražujućih i nagrizajućih tvari, koje pri višim koncentracijama odmah izazivaju pogoršanje, variranje ispitnih volumena treba podešavanjem koncentracije svesti na minimum kako bi se kod svih visina doza osigurao stalni volumen.
1.5.6. Kromosomski preparat
Odmah po usmrćivanju životinje napravi se suspenzija stanica iz jednog ili oba testisa, koja se izlaže hipotoničkoj otopini i fiksira. Zatim se stanice razmažu po mikroskopskom stakalcu i oboje.
1.5.7. Analiza
Za svaku životinju treba analizirati najmanje 100 dobro vidljivih metafaza (tj. najmanje 500 metafaza po skupini). Ako se opazi visoki broj aberacija taj se broj može smanjiti. Sve preparate, uključujući i preparate pozitivnih i negativnih kontrola, treba prije mikroskopske analize nezavisno kodirati. Budući da postupak fiksiranja često za posljedicu imaju lom jednog dijela metafaza uz gubitak kromosoma, stanice koje se očitavaju moraju sadržavati broj centromera jednak broju 2n ± 2.
2. PODACI
2.1. OBRADA REZULTATA
Podatke o pojedinačnim životinjama treba prikazati u obliku tablice. Pokusna jedinica je životinja. Za svaku životinju treba odrediti broj stanica sa strukturnim kromosomskim aberacijama i broj kromosomskih aberacija po stanici. Treba navesti različite vrste strukturnih kromosomskih aberacija zajedno s njihovim brojem i učestalošću za tretirane i kontrolne skupine. Kromosomski se prekidi bilježe odvojeno i navode u izvješću, ali se općenito ne uključuju u ukupnu učestalost aberacija.
Ako se promatra i mitoza i mejoza, treba kod spermatogonija utvrditi omjer mitoza u odnosu na metafaze prve i druge mejotske diobe, kao mjerilo citotoksičnosti za sve tretirane životinje i životinje negativne kontrole, na ukupnom uzorku od 100 stanica u fazi diobe po životinji, radi utvrđivanja mogućih citotoksičkih učinaka. Ako se promatra samo mitoza, potrebno je utvrditi mitotski indeks u barem 1 000 stanica za svaku životinju.
2.2. OCJENA I TUMAČENJE REZULTATA
Postoji više kriterija za utvrđivanje pozitivnih rezultata, kao na primjer porast relativnog broja stanica s kromosomskim aberacijama povezan s visinom doze, ili jasni porast broja stanica s aberacijama kod primjene jedne doze, utvrđen jednim uzorkovanjem. Najprije treba razmotriti biološku relevantnost rezultata. Statističke metode mogu se primijeniti kao pomoćno sredstvo za ocjenjivanje rezultata ispitivanja (6). Kod utvrđivanja pozitivne reakcije statistički značaj ne bi trebao biti jedini odlučujući faktor. Dvosmislene rezultate treba pojasniti daljnjim ispitivanjima, najbolje u modificiranim uvjetima izvođenja pokusa.
Kod ovog se testa smatra da ispitivana tvar kod koje rezultati ne udovoljavaju gore navedenim kriterijima nije mutagena.
Iako će većina pokusa dati jasne pozitivne ili negativne rezultate, u rijetkim slučajevima dobiveni podaci neće omogućiti donošenje definitivne ocjene o djelovanju ispitivane tvari. Rezultati mogu ostati dvosmisleni ili upitni bez obzira na to koliko se puta pokus ponavlja.
Pozitivni rezultati in vivo testa kromosomskih aberacija u spermatogonijima pokazuju da ispitivana tvar uzrokuje strukturne kromosomske aberacije u zametnim stanicama pokusne vrste. Negativni rezultati pokazuju da u pokusnim uvjetima ispitivana tvar ne izaziva kromosomske aberacije u zametnim stanicama pokusne vrste.
Treba raspraviti je li vjerojatno da će ispitivana tvar ili njeni metaboliti doprijeti do ciljnog tkiva.
3. IZVJEŠĆIVANJE
IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora obuhvaćati sljedeće informacije:
|
|
otapalo/nosač:
|
|
|
Pokusne životinje:
|
|
|
Uvjeti ispitivanja:
|
|
|
Rezultati:
|
|
|
Diskusija o rezultatima. |
|
|
Zaključci. |
4. REFERENCE
|
(1) |
Adler, I.D., (1986) Clastogenic Potential in Mouse Spermatogonia of Chemical Mutagens Related to their Cell-Cycle Specifications. In: Genetic Toxicology of Environmental Chemicals, Part B: Genetic Effects and Applied Mutagenesis, Ramel, C., Lambert, B. and Magnusson, J. (Eds.) Liss, New York, str. 477-484. |
|
(2) |
Adler, I.D., (1984) Cytogenetic tests in Mammals. In: Mutagenicity Testing: a Practical Approach. Ed. S. Venitt and J.M. Parry. IRL Press, Oxford, Washington DC, str. 275-306. |
|
(3) |
Evans, E.P., Breckon, G. and Ford, C.E., (1964) An Air-Drying Method for Meiotic Preparations from Mammalian Testes. Cytogenetics and Cell Genetics, 3, str. 289-294. |
|
(4) |
Richold, M., Ashby, J., Chandley, A., Gatehouse, D.G. and Henderson, L., (1990) In Vivo Cytogenetic Assays, In: D.J. Kirkland (Ed.) Basic Mutagenicity Tests, UKEMS Recommended Procedures. UKEMS Subcommittee on Guidelines for Mutagenicity Testing. Report. Part I revised. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, str. 115-141. |
|
(5) |
Yamamoto, K. and Kikuchi, Y., (1978) A New Method for Preparation of Mammalian Spermatogonial Chromosomes. Mutation Res., 52, str. 207-209. |
|
(6) |
Adler, I.D., Shelby M.D., Bootman, J., Favor, J., Generoso, W., Pacchierotti, F., Shibuya, T. and Tanaka N., (1994) International Workshop on Standardisation of Genotoxicity Test Procedures. Summary Report of the Working Group on Mammalian Germ Cell Tests. Mutation Res., 312, str. 313-318. |
|
(7) |
Fielder, R.J., Allen, J.A., Boobis, A.R., Botham, P.A., Doe, J., Esdaile, D.J., Gatehouse, D.G., Hodson-Walker, G., Morton, D.B., Kirkland, D.J. and Richold, M., (1992) Report of British Toxicology Society/UK Environmental Mutagen Society Working group: Dose setting in In Vivo Mutagenicity Assays. Mutagenesis, 7, str. 313-319. |
|
(8) |
Lovell, D.P., Anderson, D., Albanese, R., Amphlett, G.E., Clare, G., Ferguson, R., Richold, M., Papworth, D.G. and Savage, J.R.K., (1989) Statistical Analysis of In Vivo Cytogenetic Assays In: D.J. Kirkland (Ed.) Statistical Evaluation of Mutagenicity Test Data. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing, report, Part III. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, str. 184-232. |
B.24. TEST POJAVE MRLJA U MIŠEVA
1. METODA
1.1. UVOD
Vidjeti Opći uvod, dio B.
1.2. DEFINICIJA
Vidjeti Opći uvod, dio B.
1.3. REFERENTNE TVARI
Nema ih.
1.4. NAČELO ISPITNE METODE
Ovo je in vivo test na miševima kod kojega se embriji u razvoju izlažu kemikalijama. Ciljne stanice u embrijima u razvoju su melanoblasti, dok su ciljni geni oni koji kontroliraju pigmentaciju dlake krzna. Embriji u razvoju su heterozigotni zbog određenog broja ovih gena koji uvjetuju boju krzna. Mutacija ili gubitak (uslijed niza genetskih promjena) dominantnih alela takvoga gena u melanoblastu za posljedicu ima ekspresiju recesivnog fenotipa u stanicama potomaka, stvarajući mrlju drugačije boje na krznu dobivenog miša. Utvrđuje se broj potomaka s takvim mrljama, odnosno mutacijama, a njihova se učestalost uspoređuje s učestalošću među potomcima koji se razviju iz embrija tretiranih isključivo otapalom. Test pojave mrlja na mišu otkriva pretpostavljene somatske mutacije u fetalnim stanicama.
1.5. KRITERIJI KVALITETE
Nema ih.
1.6. OPIS ISPITNE METODE
Priprema
Kada je moguće, ispitivane tvari treba otopiti ili suspendirati u izotoničnoj fiziološkoj otopini. Kemikalije netopljive u vodi mogu se otopiti ili suspendirati u odgovarajućim nosačima. Nosač koji se koristi ne smije utjecati na djelovanje ispitivane kemikalije, niti izazivati toksične učinke. Treba koristiti svježe pripravke ispitivane kemikalije.
Miševi soja T (nonagouti, a/a; chincilla, pink eye, cchp/cchp; brown, b/b; dilute, short ear, d se/d se; piebald spotting, s/s) pare se ili sa sojem HT (pallid, nonagouti, brachypody, pa a bp/pa a bp; leaden fuzzy, ln fz/ln fz; pearl pe/pe) ili s C57BL (nonagouti, a/a). Mogu se koristiti i drugi odgovarajući križanci kao što su križanci između NMRI (nonagouti, a/a; albino, c/c) i DBA (nonagouti, a/a; brown, b/b; dilute d/d) pod uvjetom da njihovo potomstvo bude nonagouti.
Tretira se dovoljan broj gravidnih ženki kako bi se za svaku primijenjenu visinu doze osigurao odgovarajući broj preživjelih potomaka. Prikladna veličina uzorka utvrđuje se prema broju mrlja opaženih kod tretiranih miševa i opsegu kontrolnih podataka. Negativan rezultat prihvatljiv je tek kad se utvrdi kod najmanje 300 potomaka ženki tretiranih najvišom dozom.
Treba imati na raspolaganju podatke o paralelnim kontrolama obavljenim na miševima tretiranima samo nosačem (negativne kontrole). Da bi se povećala osjetljivost testa, navedenim podacima mogu se dodati i kontrolni podaci iz ranijih ispitivanja obavljenih u istom laboratoriju, pod uvjetom da su ti podaci homogeni. Ako se ne utvrdi mutagenost ispitivane kemikalije, trebaju biti raspoloživi podaci o pozitivnoj kontroli dobiveni nedavno u istom laboratoriju na temelju primjene kemikalije za koju je poznato da u ovome testu pokazuje mutagenost.
Uobičajeni putevi primjene su oralna intubacija ili intraperitonealna injekcija, a kemikalija se daje gravidnim ženkama. Inhalacija i drugi putevi primjene koriste se prema potrebi.
Primjenjuju se barem dvije visine doza, uključujući jednu kod koje se javljaju simptomi toksičnosti ili se smanjuje veličina legla. Što se tiče netoksičnih kemikalija, životinje treba izložiti maksimalnoj dozi koju je moguće primijeniti.
Postupak
Obično se životinje jednom tretiraju u 8. 9. ili 10. danu trudnoće, pri čemu se kao prvi dan računa dan kad se prvi put opazi vaginalni čep. Ti se dani poklapaju s vremenom od 7,25, 8,25 i 9,25 dana nakon začeća. U tim se danima životinje mogu uzastopno tretirati.
Potomstvo se označava kodovima, a između tri i četiri tjedna po rođenju utvrđuje se pojava mrlja. Razlikuju se tri tipa mrlja:
|
(a) |
bijele mrlje unutar područja od 5 mm od središnje ventralne (trbušne) linije, za koje se pretpostavlja da su posljedica uništavanja stanica (WMVS); |
|
(b) |
žute mrlje, nalik boji agutija, obično se nalaze u području grudi, genitalija, grla, pazuha i prepona te na sredini čela, za koje se pretpostavlja da su posljedica pogrešne diferencijacije (MDS); i |
|
(c) |
pigmentirane i bijele mrlje nasumično raspoređene po krznu, za koje se pretpostavlja da su posljedica somatskih mutacija (RS). |
Bilježe se sva tri tipa mrlja, ali samo zadnji, RS, ima genetski značaj. Poteškoće pri razlikovanju između MDS i RS mogu se riješiti fluorescentnom mikroskopijom uzoraka dlake.
Treba zabilježiti makromorfološke abnormalnosti koje su očigledne kod potomstva.
2. PODACI
Podaci prikazuju ukupan broj pregledanih potomaka i broj kod kojega se pojavila jedna ili više mrlja za koje se pretpostavlja da su posljedica somatske mutacije. Podaci o tretiranju uspoređuju se s podacima negativne kontrole uz primjenu odgovarajućih metoda. Podaci se isto tako prikazuju po leglima.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju treba, ako je moguće, sadržavati sljedeće informacije:
|
— |
sojevi upotrijebljeni za križanje, |
|
— |
broj gravidnih ženki u pokusnim i kontrolnim skupinama, |
|
— |
prosječna veličina legla u pokusnim i kontrolnim skupinama kod okota i odbijanja od sise, |
|
— |
visina(-e) doze(-a) ispitivane tvari, |
|
— |
upotrijebljeni nosač, |
|
— |
dan gravidnosti na koji je životinja bila tretirana ispitivanom kemikalijom, |
|
— |
put primjene, |
|
— |
ukupan broj pregledanih mladunaca i broj s mrljama tipa WMVS, MDS i RS u tretiranim i kontrolnim skupinama, |
|
— |
makromorfološke abnormalnosti, |
|
— |
odnos doza/reakcija kod RS-a kad je moguće, |
|
— |
statistička ocjena, |
|
— |
diskusija o rezultatima, |
|
— |
tumačenje rezultata. |
3.2. OCJENA I TUMAČENJE
Vidjeti Opći uvod, dio B.
4. REFERENCE
Vidjeti Opći uvod, dio B.
B.25. NASLJEDNA TRANSLOKACIJA U MIŠEVA
1. METODA
1.1. UVOD
Vidjeti Opći uvod, dio B.
1.2. DEFINICIJA
Vidjeti Opći uvod, dio B.
1.3. REFERENTNE TVARI
Nema ih.
1.4. NAČELO ISPITNE METODE
Test nasljedne translokacije kod miša otkriva strukturne i numeričke kromosomske promjene u zametnim stanicama sisavaca koje se javljaju kod potomstva prve generacije. Vrste otkrivenih kromosomskih promjena obuhvaćaju recipročne translokacije i, ako je uključeno potomstvo ženskog roda, gubitak kromosoma X. Kod nositelja translokacija i XO-ženki javlja se smanjena plodnost koja se koristi kako bi se odabralo potomstvo F1 za citogenetsku analizu. Potpunu sterilnost izazivaju određeni tipovi translokacija (autosom X i tip c-t). Translokacije se citogenetski promatraju u mejotskim stanicama u dijakinezi-metafazi I pojedinih mužjaka, bilo mužjaka F1 ili muških potomaka ženki F1. Ženke tipa XO citogenetski se prepoznaju po prisutnosti samo 39 kromosoma u mitozi koštane srži.
1.5. KRITERIJI KVALITETE
Nema ih.
1.6. OPIS ISPITNE METODE
Priprema
Ispitivane kemikalije otope se u izotoničnoj fiziološkoj otopini. Ako su netopljive u navedenoj otopini, otope se ili suspendiraju u odgovarajućem nosaču. Koriste se svježe pripravljene otopine ispitivane tvari. Ako se radi lakšeg doziranja koristi nosač, on ne smije ometati djelovanje ispitivanog spoja, niti izazvati toksične učinke.
Uobičajeni putevi primjene su oralna intubacija ili intraperitonealna injekcija. Prikladni mogu biti i drugi putevi primjene.
Radi lakšeg razmnožavanja i citološke verifikacije predmetni se pokusi obavljaju na miševima. Nije potreban nikakav specifični mišji soj. Ipak, u prosječno velikom leglu korištenog soja trebalo bi biti više od osam mladunaca i taj bi broj trebao biti relativno postojan.
Koriste se zdrave i spolno zrele životinje.
Potreban broj životinja ovisi o učestalosti spontanih translokacija i najnižem stupnju indukcije koji je potreban za pozitivan rezultat.
Ispitivanje se obično obavlja analizom muškog potomstva F1. Po svakoj skupini koja je primila određenu dozu treba ispitati barem 500 muških potomaka F1. Ako je u ispitivanje uključeno i žensko potomstvo F1, potrebno je 300 mužjaka i 300 ženki.
Trebalo bi imati na raspolaganju odgovarajuće kontrolne podatke dobivene paralelnim kontrolama i kontrolama iz prijašnjih ispitivanja. Kad postoje prihvatljivi rezultati pozitivne kontrole iz pokusa koji su nedavno provedeni u istom laboratoriju, ti se rezultati mogu upotrijebiti umjesto paralelne pozitivne kontrole.
Ispituje se jedna visina doze, obično najviša doza vezana uz izazivanje minimalnih toksičkih učinaka, ali bez utjecaja na reprodukciju ili preživljavanje. Kako bi se utvrdio odnos između doze i reakcije, potrebne su i dvije dodatne niže doze. Kad su u pitanju netoksične tvari životinje treba izložiti najvišim koncentracijama koje je moguće primijeniti.
Postupak
Postoje dva režima tretiranja. Najčešća je jednokratna primjena ispitivane tvari. Ispitivana se tvar isto tako može primjenjivati sedam dana u tjednu tijekom razdoblja od 35 dana. Broj parenja koji slijedi nakon tretiranja određen je režimom tretiranja i trebao bi biti dovoljan da se tretirane zametne stanice mogu uzorkovati u svim fazama. Na kraju razdoblja parenja ženke se u kaveze stavljaju pojedinačno. Kada se ženke okote, bilježi se datum, broj i spol potomaka. Svi se muški potomci odbijaju od sise, dok se svi ženski potomci izlučuju ako nisu obuhvaćeni pokusom.
Koristi se jedna od dvije moguće metode:
|
— |
ispitivanje plodnosti potomstva F1 i naknadna verifikacija mogućih nositelja translokacije citogenetskom analizom, |
|
— |
citogenetska analiza svih potomaka F1 bez prethodne selekcije na temelju ispitivanja plodnosti. |
|
(a) |
Ispitivanje plodnosti Smanjena plodnost jedinke F1 može se utvrditi praćenjem veličine legla i/ili analizom materičnog sadržaja kod parenih ženki. Treba utvrditi kriterije za određivanje normalne i smanjene plodnosti za korišteni soj miševa. Opažanje veličine legla: mužjaci F1 koji će se testirati pojedinačno se stavljaju u kaveze sa ženkama iz istog pokusa ili iz kolonije. Kavezi se svakodnevno provjeravaju, počevši od 18. dana po parenju. Nakon okota bilježi se veličina legla i spol potomaka F2, nakon čega se legla izlučuju. Ako se test provodi na ženskom potomstvu F1, potomstvo F2 iz malih legla zadržava se za daljnja ispitivanja. Ženski nositelji translokacija provjeravaju se citogenetskom analizom translokacije kod bilo kojega od njihovih muških potomaka. Ženke tipa XO prepoznaju se po promjeni omjera jedinki muškog spola naprama jedinkama ženskog spola u njihovom potomstvu iz 1:1 u 1:2. Kod primjene sekvencijskog postupka normalne životinje F1 eliminiraju se iz daljnjeg ispitivanja ako prvo leglo F2 dosegne ili premaši unaprijed određenu normalnu vrijednost, a ako do tog ne dođe opaža se drugo ili treće leglo F2. Životinje F1 koje se po opažanju najviše tri legla F2 ne mogu klasificirati kao normalne, ili se dalje ispituju analizom materičnog sadržaja u ženki ili se izravno podvrgavaju citogenetskoj analizi. Analiza materičnog sadržaja: do smanjenja veličine legla nositelja translokacije dolazi uslijed smrti embrija, pa visoki broj mrtvih implanata ukazuje na prisutnost translokacije kod životinje koja se ispituje. Svaki mužjak F1 na kojemu će se obaviti ispitivanje pari se s dvije do tri ženke. Začeče se utvrđuje pregledom na postojanje vaginalnih čepova koji se obavlja svakog jutra. Ženke se usmrćuju 14 do 16 dana kasnije te se bilježe živi i mrtvi implanti u njihovim maternicama. |
|
(b) |
Citogenetska analiza Preparati testisa pripremaju se tehnikom sušenja na zraku. Nositelji translokacija prepoznaju se po postojanju multivalentnih struktura u primarnim spermatocitima u dijakinezi-metafazi I. Opažanje barem dviju stanica s multivalentnom asocijacijom čini potreban dokaz da je ispitana životinja nositelj translokacije. Ako nije obavljena uzgojna selekcija svi se mužjaci F1 podvrgavaju citogenetskom pregledu. Nužno je mikroskopski utvrditi postojanje barem 25 stanica u dijakinezi-metafazi I po mužjaku. Potreban je pregled mitotskih metafaza u spermatogonijima ili koštanoj srži kod mužjaka F1 s malenim testisima i mejotskom diobom prije dijakineze ili kod ženki F1 za koje se sumnja da su tipa XO. Postojanje neobično dugog i/ili kratkog kromosoma u svakoj od 10 stanica dokaz je posebne translokacije koja izaziva sterilnost u mužjaka (c-t tip). Neke translokacije autosoma X koje uzrokuju sterilnost mužjaka moguće je utvrditi samo analizom uz primjenu metode pruganja mitotskih kromosoma. Postojanje 39 kromosoma u svih 10 mitoza dokaz je postojanja stanja XO kod ženke. |
2. PODACI
Podaci se prikazuju u obliku tablice.
Za svaki interval parenja, nakon parenja roditelja, bilježi se srednja veličina legla i omjer spolova potomaka, odmah po okotu i nakon odbijanja od sise.
Za ocjenu plodnosti životinja F1 navodi se srednja veličina legla nakon parenja svih normalnih jedinki i veličine pojedinačnih legla nositelja translokacija F1. Za analizu materičnog sadržaja navodi se prosječni broj živih i mrtvih implanata nastalih parenjem normalnih jedinki, te broj živih i mrtvih implanata nastalih svakim pojedinačnim parenjem nositelja translokacije F1.
Za citogenetsku analizu dijakineze-metafaze I za svakog se nositelja translokacije bilježi broj tipova multivalentnih struktura i ukupan broj stanica.
Za sterilne jedinke F1 bilježi se ukupan broj parenja i trajanje razdoblja parenja. Navodi se i težina testisa i pojedinosti dobivene citogenetskom analizom.
Za ženke tipa XO bilježi se srednja veličina legla, omjer spolova kod potomaka F1 i rezultati citogenetske analize.
Kad je moguće, nositelji translokacije F1 prethodno se selektiraju na temelju testova plodnosti pa u tablice treba unijeti podatke o tome koliki broj njih su potvrđeni translokacijski heterozigoti.
Treba navesti i podatke dobivene pokusima s pozitivnom i negativnom kontrolom.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju treba, ako je moguće, sadržavati sljedeće informacije:
|
— |
soj miševa, dob životinja, tjelesna masa tretiranih životinja, |
|
— |
broj roditeljskih životinja svakog spola u pokusnim i kontrolnim skupinama, |
|
— |
uvjeti ispitivanja, detaljan opis tretiranja, visine doza, otapala, režim parenja, |
|
— |
broj i spol potomaka svake ženke, broj i spol potomaka uzgojenih za analizu translokacije, |
|
— |
vrijeme i kriteriji analize translokacije, |
|
— |
broj i detaljan opis nositelja translokacije, uključujući podatke o parenju i podatke o materičnom sadržaju, ovisno o slučaju, |
|
— |
citogenetski postupci i pojedinosti o mikroskopskoj analizi, po mogućnosti uz slike, |
|
— |
statistička ocjena, |
|
— |
diskusija o rezultatima, |
|
— |
tumačenje rezultata. |
3.2. OCJENA I TUMAČENJE
Vidjeti Opći uvod, dio B.
4. REFERENCE
Vidjeti Opći uvod, dio B.
B.26. TEST SUBKRONIČNE ORALNE TOKSIČNOSTI NA GLODAVCIMA 90-DNEVNA STUDIJA ORALNE TOKSIČNOSTI UZ PRIMJENU PONAVLJANIH DOZA
1. METODA
Ova je metoda istovjetna metodi OECD TG 408 (1998.)
1.1. UVOD
Pri ocjenjivanju toksičkih svojstava neke kemikalije, subkronična oralna toksičnost može se utvrditi metodom ponavljanih doza nakon što se testom akutne toksičnosti ili 28-dnevnim testom toksičnosti uz primjenu ponavljanih doza dobiju početne informacije o njezinoj toksičnosti. 90-dnevnom studijom dobiju se informacije o mogućim opasnostima za zdravlje za koje je vjerojatno da će se javiti pri ponavljanoj dugotrajnoj izloženosti u razdoblju sazrijevanja i razvoja nakon odbijanja od sise, te dobrim dijelom i u odrasloj dobi. Ta studija omogućuje dobivanje informacija o značajnijim toksičnim učincima, o ciljnim organima i mogućnosti akumulacije, kao i procjenu razine izloženosti kod koje nema vidljivih štetnih učinaka (NOAEL) koja se može upotrijebiti pri odabiru visina doza za studije kronične toksičnosti i za utvrđivanje sigurnosnih kriterija za izloženost čovjeka.
Ova metoda stavlja dodatni naglasak na neurološke krajnje učinke i ukazuje na moguće imunološke i reproduktivne učinke. Isto tako naglašena je i potreba za pažljivim kliničkim opažanjem životinja kako bi se prikupilo što više informacija. Ova bi studija trebala omogućiti prepoznavanje kemikalija koje imaju potencijal za izazivanje neurotoksičkih i imunoloških učinaka, kao i učinaka na reproduktivnim organima, što može opravdati daljnja detaljna istraživanja.
Vidjeti također Opći uvod, dio B.
1.2. DEFINICIJE
Doza: količina ispitivane tvari koja se primjenjuje. Doza se izražava kao masa (g, mg) ili kao masa ispitivane tvari po jedinici tjelesne mase pokusne životinje (npr. mg/kg) ili kao stalna koncentracija u hrani (ppm).
Doziranje: opći pojam koji obuhvaća dozu, njenu učestalost i trajanje doziranja.
NOAEL: skraćenica za visinu doze bez vidljivih štetnih učinaka (No Observed Adverse Effect Level) i najviša je doza pri kojoj se ne opažaju nikakvi štetni učinci vezani uz tretiranje.
1.3. NAČELO ISPITNE METODE
Ispitivana se tvar 90 dana svakodnevno oralno primjenjuje u stupnjevanim dozama na nekoliko skupina pokusnih životinja, po jedna visina doze na svaku skupinu. Tijekom razdoblja primjene životinje se pažljivo promatraju radi uočavanja simptoma toksičnosti. Na životinjama koje uginu ili budu usmrćene tijekom ispitivanja obavlja se obdukcija, s tim da se po završetku ispitivanja preživjele životinje usmrćuju i također obduciraju.
1.4. OPIS ISPITNE METODE
1.4.1. Priprema životinja
Treba koristiti zdrave životinje koje su se barem 5 dana privikavale na laboratorijske uvjete i koje nisu bile podvrgnute prethodnim ispitnim postupcima. Životinje treba okarakterizirati s obzirom na njihovu vrstu, soj, podrijetlo, spol, tjelesnu masu i/ili dob. Životinje se nasumično raspoređuju u kontrolne skupine i skupine koje će se tretirati. Kaveze treba rasporediti na način da se učinci do kojih bi moglo doći zbog položaja kaveza svedu na minimum. Svakoj se životinji dodjeljuje jedinstveni identifikacijski broj.
1.4.2. Priprema doza
Ispitivana se tvar primjenjuje oralnom intubacijom pomoću želučane sonde, odnosno preko hrane ili vode za piće. Metoda oralne primjene ovisi o svrsi studije i fizikalnim/kemijskim svojstvima ispitivanog materijala.
Prema potrebi, ispitivana se tvar otapa ili suspendira u odgovarajućem nosaču. Kad god je moguće, preporuča se najprije razmotriti mogućnost primjene vodene otopine/suspenzije, zatim mogućnost primjene otopine/emulzije u ulju (npr. kukuruzno ulje), i tek na kraju mogućnost otapanja u ostalim nosačima. Za sve nosače, osim vode, moraju biti poznata toksička svojstva. Treba utvrditi stabilnost ispitivane tvari u uvjetima primjene.
1.4.3. Uvjeti ispitivanja
1.4.3.1. Pokusne životinje
Najčešće korištena životinjska vrsta je štakor, iako se mogu koristiti i neke druge vrste glodavaca, npr. miš. Treba upotrijebiti mlade zdrave odrasle životinje sojeva koji su uobičajeni u laboratorijskoj praksi. Odabiru se ženke koje prethodno nisu imale leglo i koje nisu gravidne. S doziranjem treba započeti što je prije moguće nakon odbijanja mladunaca od sise, a u svakom slučaju, prije nego životinje navrše devet tjedana. Na početku ispitivanja razlike u tjelesnoj masi korištenih životinja smiju biti minimalne i ne premašivati ± 20 % prosječne tjelesne mase svakog spola. U slučajevima kad se prije dugotrajne studije kronične toksičnosti provodi preliminarna studija, u obje studije treba koristiti životinje istog soja i istog podrijetla.
1.4.3.2. Broj i spol
Najmanje 20 životinja (10 ženki i 10 mužjaka) treba upotrijebiti za ispitivanje svake visine doze. Ako se planira usmrćivanje životinja u međuvremenu, prije završetka studije, navedeni broj treba povećati za broj životinja predviđen za takvo usmrćivanje. Na temelju prijašnjih saznanja o kemikaliji ili nekom bliskom analogu, treba razmotriti mogućnost uključivanja dodatne satelitske skupine od deset životinja (pet od svakog spola) u kontrolnu skupinu i u skupinu koja će primiti najvišu dozu, radi opažanja reverzibilnosti ili postojanosti bilo kojega od toksičkih učinaka nakon razdoblja tretiranja. Odgovarajuće trajanje ovog razdoblja određuje se s obzirom na učinke koji će se opažati.
1.4.3.3. Visine doza
Treba upotrijebiti najmanje tri visine doza i paralelne kontrole, osim u slučajevima kad se izvodi granični test (vidjeti 1.4.3.4.). Visine doza mogu se utvrđivati na temelju rezultata studija s ponavljanim dozama ili studija za utvrđivanje raspona doza, pri čemu treba uzeti u obzir sve postojeće toksikološke podatke i podatke o toksikokinetici koji se odnose na ispitivanu tvar ili srodne materijale. Ako nije ograničena fizikalno-kemijskim svojstvima ili biološkim djelovanjem ispitivane tvari, najvišu dozu treba odabrati s ciljem da se izazove toksičnost, ali ne i smrt ili velika patnja životinja. Treba odabrati niz sve nižih doza koje će se primjenjivati za utvrđivanje svih reakcija vezanih uz doziranje, kao i dozu kod koje nema vidljivih štetnih učinaka (NOAEL) kao najnižu dozu. Za određivanje sve nižih doza često su najpogodniji dvostruki do četverostruki intervali, i često je bolje dodati četvrtu pokusnu skupinu nego da između doziranja budu jako veliki intervali (npr. iznad faktora 6-10).
Kontrolna skupina je netretirana skupina ili skupina tretirana samo nosačem, ako se kod primjene ispitivane tvari koristi nosač. Osim tretiranja ispitivanom tvari, sa životinjama u kontrolnoj skupini treba postupati na jednak način kao i sa životinjama u tretiranoj skupini. Ako se koristi nosač, volumen nosača koji primi kontrolna skupina treba biti jednak najvećem upotrijebljenom volumenu. Ako se ispitivana tvar daje u hrani i time se prouzroči smanjeni unos hrane, korištenje paralelno hranjene kontrolne skupine životinja može se pokazati korisnim pri razlikovanju smanjenja uzrokovanog okusom od smanjenja uzrokovanog toksikološkim promjenama u ispitnom modelu.
Treba uzeti u obzir sljedeća svojstva nosača i drugih aditiva, ovisno o slučaju: djelovanje na apsorpciju, distribuciju, metabolizam ili retenciju (zadržavanje) ispitivane tvari; djelovanje na kemijska svojstva ispitivane tvari, koje može promijeniti njezina toksička svojstva; i djelovanje na unos hrane i vode ili na stanje uhranjenosti životinja.
1.4.3.4. Granični test
Ako test s jednom visinom doze, koja iznosi najmanje 1 000 mg/kg tjelesne mase/dan uz primjenu postupaka opisanih za ovu studiju, ne izazove vidljive štetne učinke i ako se toksičnost ne očekuje na temelju podataka o strukturno srodnim tvarima, potpuna studija uz primjenu tri visine doza neće se smatrati neophodnom. Granični test ne vrijedi samo u slučajevima kad izloženost ljudi ukazuje na potrebu za primjenom više doze.
1.5. POSTUPAK
1.5.1. Primjena doza
Životinjama se ispitivana tvar dozira svakodnevno, sedam dana u tjednu, u razdoblju od 90 dana. U slučaju bilo kojeg drugog režima doziranja, npr. pet dana u tjednu, treba dokazati njegovu opravdanost. U slučaju primjene oralnom intubacijom, ispitivanu tvar treba dati u jednoj dozi pomoću želučane sonde ili odgovarajuće intubacijske kanile. Maksimalni volumen tekućine koji se može primijeniti odjednom ovisi o veličini pokusne životinje. Taj volumen ne smije biti veći od 1 ml/100 g tjelesne mase, osim u slučaju vodenih otopina gdje je dopušteno upotrijebiti 2 ml/100 g tjelesne mase. Osim u slučaju nadražujućih ili nagrizajućih tvari kod kojih se štetni učinci obično javljaju pri višim koncentracijama, varijabilnost ispitnog volumena treba prilagođavanjem koncentracije svesti na najmanju moguću mjeru, kako bi se zajamčio stalni volumen pri svim visinama doza.
Kod tvari koje se primjenjuju putem hrane ili vode za piće važno je osigurati da količine ispitivane tvari o kojoj je riječ ne utječu na uravnoteženi unos hrane ili vode. Kad se ispitivana tvar daje u hrani, može se koristiti ili stalna koncentracija u odnosu na količinu hrane (ppm) ili stalna visina doze s obzirom na tjelesnu masu životinje; alternativa koja se koristi u pokusu mora se specificirati. U slučajevima kad se ispitivana tvar daje oralnom intubacijom, dozu treba davati svaki dan otprilike u isto vrijeme te je po potrebi prilagođavati kako bi se održala stalna visina doze u odnosu na tjelesnu masu životinje. Kada se prije dugotrajnog ispitivanja kronične toksičnosti radi 90-dnevna preliminarna studija, u obje studije prehrana životinja treba biti slična.
1.5.2. Opažanja
Opažanje bi trebalo trajati najmanje 90 dana. Životinje u satelitskoj skupini za koje se planira naknadno opažanje treba tijekom odgovarajućeg vremenskog razdoblja držati bez tretiranja kako bi se utvrdilo jesu li toksički učinci postojani ili su se životinje od njih oporavile.
Opća bi klinička opažanja trebalo obavljati barem jednom dnevno, nabolje u isto vrijeme svakog dana, uzimajući u obzir vršno razdoblje očekivanih učinaka nakon doziranja. Kliničko stanje životinja treba zabilježiti. Barem dvaput dnevno, obično početkom i krajem svakog dana, sve životinje treba pregledati radi otkrivanja mogućih simptoma morbiditeta i mortaliteta.
Barem jednom prije prvog izlaganja, te jednom tjedno nakon toga, treba obaviti detaljno kliničko opažanje stanja svih životinja (što će omogućiti utvrđivanje promjena u stanju istih subjekata). Ta opažanja treba obaviti izvan kaveza u kojem životinja inače boravi, najbolje u standardnom ograđenom prostoru i svaki put otprilike u isto vrijeme. Rezultate opažanja treba pažljivo zabilježiti, pri čemu je najbolje koristiti sustav vrednovanja jasno definiran od strane laboratorija koji obavlja ispitivanje. Treba poduzeti sve što je potrebno kako bi se osiguralo da odstupanja u uvjetima opažanja budu minimalna. Opažani simptomi trebaju obuhvaćati, ali ne biti ograničeni na, promjene na koži, dlaci, očima, sluznicama, pojavu sekreta i ekskreta te aktivnost autonomnog živčanog sustava (npr. lakrimacija (suzenje), piloerekcija (naježenost dlake), veličina zjenica, nepravilnosti u disanju). Treba zabilježiti i promjene u hodu, držanju i reakcijama na rukovanje, kao i prisutnost kloničkih ili toničkih pokreta, stereotipa (npr. pretjerano njegovanje krzna, ponavljano kretanje u krug) ili neobičnog ponašanja (npr. samoozljeđivanje, hodanje unatrag) (1).
Oftalmološki pregled, pomoću oftalmoskopa ili druge odgovarajuće opreme, treba obaviti prije primjene ispitivane tvari i po završetku studije, najbolje na svim životinjama, ili barem u skupinama koje primaju visoke doze i kontrolnim skupinama. Ako se otkriju promjene na očima, treba pregledati sve životinje.
Prema kraju razdoblja izlaganja, a u svakom slučaju ne ranije od 11. tjedna, treba obaviti ocjenu senzorne reaktivnosti na različite podražaje (1) (npr. zvučne, vizualne i proprioceptivne) (2)(3)(4), ocjenu jakosti stiska (5) te ocjenu motoričke aktivnosti (6). Daljnje pojedinosti o postupcima koji se mogu primjenjivati navedene su u odgovarajućoj referentnoj literaturi. Međutim, osim referentnih, mogu se primjenjivati i alternativni postupci.
Funkcionalna opažanja koja se obavljaju prema kraju ispitivanja mogu se izostaviti kad postoje podaci o funkcionalnim opažanjima iz drugih studija, a dnevnim kliničkim opažanjima nisu otkriveni nikakvi funkcionalni nedostaci.
U izuzetnim slučajevima funkcionalna opažanja mogu izostati i kod skupina koje na drugi način pokazuju simptome toksičnosti do mjere koja bi znatno ometala obavljanje funkcionalnog ispitivanja.
1.5.2.1. Tjelesna masa i unos hrane/vode
Sve životinje treba vagati barem jednom tjedno. Unos hrane treba mjeriti najmanje na tjednoj osnovi. Ako se ispitivana tvar daje s vodom za piće, unos vode isto tako treba mjeriti najmanje na tjednoj osnovi. Unos vode može se pratiti i u studijama koje se odnose na normalno hranjenje ili prisilno hranjenje na sondu, pri čemu može doći do promjena u unosu tekućine.
1.5.2.2. Hematologija i klinička biokemija
Uzorke krvi je potrebno uzeti na specificiranom mjestu i pohraniti u odgovarajućim uvjetima, ovisno o konkretnom slučaju. Na kraju razdoblja ispitivanja uzorci se prikupljaju neposredno prije ili u okviru postupka usmrćivanja životinja.
Na kraju razdoblja ispitivanja kad god se u međuvremenu prikupe bilo kakvi uzorci krvi, treba obaviti sljedeće hematološke pretrage: hematokrit, koncentracija hemoglobina, broj eritrocita, ukupni i diferencijalni broj leukocita, broj trombocita i mjerenje vremena/potencijala zgrušavanja krvi.
Kliničke biokemijske pretrage za utvrđivanje jakog toksičkog djelovanja na tkiva i posebno na bubrege i jetru, treba obaviti na uzorcima krvi uzetim od svake životinje neposredno prije usmrćivanja ili u okviru postupka usmrćivanja, (osim od životinja za koje je utvrđeno da su na umoru i/ili su neplanirano usmrćene tijekom pokusa). Za klinička biološka ispitivanja uzorci se mogu uzimati i u međuvremenu, slično kao kod hematoloških pretraga. Preporuča se da životinje tijekom noći pred uzimanje uzoraka krvi poste (3). Pretrage koje se rade na plazmi ili serumu trebaju obuhvatiti mjerenje natrija, kalija, glukoze, ukupne količine kolesterola, ureje, dušika iz ureje u krvi (BUN), kreatinina, ukupne količine proteina i albumina te više od dva enzima indikativna za hepatocelularna oštećenja (kao što su alanin aminotransferaza, aspartat aminotransferaza, alkalna fosfataza, gama glutamil transpeptidaza i sorbitol dehidrogenaza). Mogu se uključiti i mjerenja dodatnih enzima (jetrenog ili drugog podrijetla) i žučnih kiselina, kojima se pod određenim okolnostima mogu dobiti korisne informacije.
U zadnjem tjednu studije neobvezno se mogu obaviti analize urina dobivenog sabiranjem u određenim vremenskim razmacima: izgled, količina, osmolalnost ili specifična težina, pH, protein, glukoza i krv/krvne stanice.
Osim toga, treba razmisliti i o ispitivanju serumskih markera koji označivaju oštećenja tkiva. Ako poznata svojstva ispitivane tvari mogu, ili se očekuje da će, utjecati na određene metaboličke profile treba obaviti i druge pretrage koje uključuju kalcij, fosfor, trigliceride natašte, specifične hormone, methemoglobin i kolinesterazu. Te vrijednosti treba izmjeriti kod izloženosti kemikalijama određenih klasa opasnosti ili od slučaja do slučaja.
Uglavnom, ovdje je potreban fleksibilan pristup, ovisno o životinjskoj vrsti i opaženim i/ili očekivanim učincima predmetne tvari.
Ako podaci o normalnim vrijednostima korišteni u prijašnjim pokusima nisu adekvatni, treba razmotriti je li potrebno utvrditi hematološke i kliničke biokemijske varijable prije nego se započne s doziranjem; općenito se ne preporuča te podatke utvrđivati prije tretiranja (7).
1.5.2.3. Obdukcija (makroskopska analiza)
Sve životinje korištene u studiji moraju se podvrgnuti kompletnoj, detaljnoj makroskopskoj analizi koja uključuje pažljivi pregled vanjske površine tijela, svih otvora te lubanjske, prsne i trbušne šupljine i njihovog sadržaja. S jetre, bubrega, nadbubrežnih žlijezda, testisa, epididimisa (pasjemenika), maternice, jajnika, timusa, slezene, mozga i srca svih životinja (osim onih za koje je utvrđeno da su na umoru i/ili se neplanirano usmrte tijekom pokusa) treba obrezati svo okolno tkivo, prema potrebi, te ih još mokre izvagati što prije nakon sekcije, kako bi se izbjeglo sušenje organa.
Slijedeća tkiva treba čuvati u sredstvu za fiksiranje koje je najprimjerenije i za vrstu tkiva i za planirani kasniji histopatološki pregled: sve velike lezije, mozak (reprezentativne regije, uključujući veliki mozak, mali mozak i medulu/most), leđnu moždinu (uzetu na tri razine: cervikalnoj (vratnoj), srednjoj torakalnoj (prsnoj) i lumbalnoj (slabinskoj)), hipofizu, štitnjaču, paratiroidnu žlijezdu, timus (prsnu žlijezdu), jednjak, žlijezde slinovnice, želudac, tanko i debelo crijevo (uključujući Peyerove ploče), jetru, gušteraču, bubrege, nadbubrežne žlijezde, slezenu, srce, dušnik i pluća (preparirane upuhivanjem fiksativa i zatim uranjanjem), aortu, spolne žlijezde, maternicu, pomoćne spolne organe, mliječnu žlijezdu ženke, prostatu, mokraćni mjehur, žučni mjehur (miš), limfne čvorove (po mogućnosti, jedan koji pokriva put unosa ispitivane tvari u organizam i drugi koji je udaljen od puta unosa, kako bi se vidjeli sistemski učinci), periferni živac (bedreni (n. ischiadicus) ili tibijalni (n. tibialis)) po mogućnosti smješten uz mišić, odsječak koštane srži (ili, alternativno, svježi aspirat koštane srži), kožu i oči (ako se prilikom oftalmoloških pregleda opaze promjene). Klinički i drugi nalazi mogu ukazati na potrebu za ispitivanjem dodatnih tkiva. Treba sačuvati i sve one organe za koje se na temelju saznanja o svojstvima ispitivane tvari smatra da bi mogli biti ciljni.
1.5.2.4. Histopatologija
Ako se kod životinja na koje su primijenjene visoke doze ispitivane tvari primijete promjene, histopatološki pregled treba obaviti i na životinjama iz svih ostalih skupina.
Treba pregledati sve veće lezije.
Ako se koristi satelitska skupina, treba napraviti histopatološki pregled onih tkiva i organa na kojima su kod tretiranih životinja primijećene promjene.
2. PODACI I IZVJEŠĆIVANJE
2.1. PODACI
Podatke treba prikazati pojedinačno za svaku životinju. Osim toga, najbolje ih je rezimirati u obliku tablice iz koje se za svaku testiranu skupinu vidi broj životinja na početku ispitivanja, broj životinja koje su uginule ili su iz humanih razloga bile usmrćene tijekom ispitivanja, vrijeme smrti ili humanog usmrćivanja, broj životinja kod kojih su opaženi znakovi toksičnosti, opis opažanih znakova toksičnosti, uključujući vrijeme pojavljivanja, trajanje i stupanj svih toksičkih učinaka, broj životinja kod kojih su se javile lezije, vrsta lezija i postotak životinja koje pokazuju određene vrste lezija.
Tamo gdje je to moguće, sve rezultate treba analizirati uz primjenu odgovarajuće opće prihvatljive statističke metode. Statističke metode i podatke koji će se analizirati treba odabrati još u fazi planiranja studije.
2.2. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora sadržavati sljedeće informacije:
2.2.1. Ispitivana tvar:
|
— |
fizikalni oblik (agregatno stanje), čistoća i fizikalno-kemijska svojstva, |
|
— |
identifikacijski podaci, |
|
— |
nosač (ovisno o slučaju): dokaz opravdanosti odabira nosača, ako se ne radi o vodi. |
2.2.2. Vrsta pokusnih životinja:
|
— |
korištena vrsta i soj, |
|
— |
broj, starost i spol životinja, |
|
— |
podrijetlo, uvjeti držanja, prehrana itd., |
|
— |
pojedinačne tjelesne mase životinja na početku ispitivanja. |
2.2.3. Uvjeti ispitivanja:
|
— |
obrazloženje za odabir visina doza, |
|
— |
pojedinosti o formulaciji ispitivane tvari/pripremanju hrane, postignuta koncentracija, stabilnost i homogenost pripravaka, |
|
— |
podaci o primjeni ispitivane tvari, |
|
— |
stvarne doze (mg/kg tjelesne težine/dan) i faktor za preračunavanje koncentracije ispitivane tvari u hrani/vodi za piće (ppm) u stvarnu dozu, prema potrebi, |
|
— |
pojedinosti o kvaliteti hrane i vode. |
2.2.4. Rezultati:
|
— |
tjelesna masa i promjene u tjelesnoj masi, |
|
— |
unos hrane i unos vode, prema potrebi, |
|
— |
podaci o toksičkim reakcijama po spolu i visini doza, uključujući znakove toksičnosti, |
|
— |
vrsta, stupanj i trajanje opaženih kliničkih promjena (jesu li reverzibilne ili nisu), |
|
— |
rezultati oftalmološkog pregleda, |
|
— |
senzorska aktivnost, ocjena jačine stiska i motorne aktivnosti (ako su raspoloživi), |
|
— |
hematološka ispitivanjima s relevantnim normalnim vrijednostima, |
|
— |
klinička biokemijska ispitivanja s relevantnim normalnim vrijednostima, |
|
— |
tjelesna masa nakon smrti, masa organa, te omjer mase organa i tjelesne mase, |
|
— |
nalazi obdukcije, |
|
— |
detaljni opis svih histopatoloških nalaza, |
|
— |
podaci o apsorpciji, ako postoje, |
|
— |
statistička obrada rezultata, prema potrebi. |
Diskusija o rezultatima.
Zaključci.
3. REFERENCE
|
(1) |
IPCS (1986) Principles and Methods for the Assessment of Neurotoxicity Associated with Exposure to Chemicals. Environmental Health Criteria Document No 60. |
|
(2) |
Tupper, D.E., Wallace, R.B., (1980) Utility of the Neurologic Examination in Rats. Acta Neurobiol. Exp., 40, str. 999-1003. |
|
(3) |
Gad, S.C., (1982) A Neuromuscular Screen for Use in Industrial Toxicology. J.Toxicol. Environ. Health, 9, str. 691-704. |
|
(4) |
Moser, V.C., Mc Daniel, K.M., Phillips, P.M., (1991) Rat Strain and Stock Comparisons Using a Functional Observational Battery: Baseline Values and Effects of Amitraz. Toxicol. Appl. Pharmacol., 108, str. 267-283. |
|
(5) |
Meyer O.A., Tilson H.A., Byrd W.C., Riley M.T., (1979) A Method for the Routine Assesment of Fore- and Hind- limb grip Strength of Rats and Mice. Neurobehav. Toxivol., 1, str. 233-236. |
|
(6) |
Crofton K.M., Howard J.L., Moser V.C., Gill M.W., Reiter L.W., Tilson H.A., MacPhail R.C., (1991) Interlaboratory Comparison of Motor Activity Experiments: Implication for Neurotoxicological Assessments. Neurotoxicol. Teratol., 13, str. 599-609. |
|
(7) |
Weingand K., Brown G., Hall R. et al., (1996) „Harmonisation of Animal Clinic Pathology Testing in Toxicity and Safety Studies”, Fundam. & Appl. Toxicol., 29, str. 198-201. |
B.27. TEST SUBKRONIČNE ORALNE TOKSIČNOSTI 90-DNEVNO ISPITIVANJE ORALNE TOKSIČNOSTI NA NEGLODAVCIMA UZ PRIMJENU PONAVLJANIH DOZA
1. METODA
Ova ispitna metoda subkronične oralne toksičnosti istovjetna je metodi OECD TG 409 (1998.).
1.1. UVOD
Kod ocjenjivanja toksičnih svojstava neke kemikalije, utvrđivanje subkronične oralne toksičnosti pomoću ponavljanih doza može uslijediti nakon dobivanja početnih informacija o toksičnosti 28-dnevnim ispitivanjem uz primjenu akutne (jednokratne) doze ili ponavljanih doza. 90-dnevnim ispitivanjem dobivaju se informacije o mogućim opasnostima po zdravlje koje bi mogle proizaći iz ponavljane izloženosti tijekom razdoblja ubrzanog razvoja i ulaska u mlađu odraslu dob. Tim se ispitivanjima dobivaju podaci o značajnim toksičkim učincima, utvrđuju ciljni organi i mogućnost akumulacije, te se procjenjuje razina izloženosti kod koje nema vidljivih štetnih učinaka izlaganja, što se može upotrijebiti kod odabira visina doza za studije kronične toksičnosti i za utvrđivanje sigurnosnih kriterija za izloženost ljudi.
Ispitna metoda omogućuje utvrđivanje štetnih učinaka izlaganja kemikalijama kod neglodavaca te bi je isključivo trebalo koristiti:
|
— |
kad učinci opaženi u drugim studijama ukazuju na potrebu za pojašnjenjem/karakterizacijom uz upotrebu neke druge vrste neglodavaca, ili |
|
— |
kad toksikokinetičke studije pokazuju da određena vrsta neglodavaca predstavlja najrelevantniji izbor laboratorijske životinje, ili |
|
— |
u slučajevima kad drugi specifični razlozi opravdavaju upotrebu određene vrste neglodavaca. |
Vidjeti također Opći uvod, dio B.
1.2. DEFINICIJE
Doza: količina ispitivane tvari koja se primjenjuje. Doza se izražava kao masa (g, mg) ili kao masa ispitivane tvari po jedinici tjelesne mase pokusne životinje (npr. mg/kg) ili kao stalna koncentracija u hrani (ppm).
Doziranje: opći pojam koji obuhvaća dozu, njenu učestalost i trajanje doziranja.
NOAEL: skraćenica za visinu doze bez vidljivih štetnih učinaka (No Observed Adverse Effect Level) i najviša je doza pri kojoj se ne opažaju nikakvi štetni učinci vezani uz tretiranje.
1.3. NAČELO ISPITNE METODE
Ispitivana se tvar 90 dana svakodnevno oralno primjenjuje u stupnjevanim dozama na nekoliko skupina pokusnih životinja, po jedna visina doze na svaku skupinu. Tijekom razdoblja primjene životinje se pažljivo promatraju radi uočavanja simptoma toksičnosti. Na životinjama koje uginu ili budu usmrćene tijekom ispitivanja obavlja se obdukcija, s tim da se po završetku ispitivanja, preživjele životinje usmrćuju i također obduciraju.
1.4. OPIS ISPITNE METODE
1.4.1. Odabir životinjske vrste
Najčešće korištena životinjska vrsta osim glodavaca je pas, koji bi trebao biti određene pasmine; često se koristi bigl. Mogu se koristiti i druge životinjske vrste, npr. svinja i patuljasta svinja. Korištenje primata se ne preporučuje, a njihova eventualna upotreba treba biti znanstveno opravdana. Treba koristiti mlade zdrave životinje i ako se radi o psima doziranje je najbolje započeti kad su životinje stare 4-6 mjeseci, a najviše 9 mjeseci. Kad se studija obavlja kao preliminarna, prije dugotrajne studije kronične toksičnosti, u obje studije treba upotrijebiti istu životinjsku vrstu/pasminu.
1.4.2. Priprema životinja
Treba koristiti mlade zdrave životinje koje su se prilagodile laboratorijskim uvjetima i prethodno nisu bile podvrgavane pokusnim postupcima. Trajanje prilagođavanja ovisit će o odabranoj vrsti pokusnih životinja i njihovom podrijetlu. Preporuča se prilagođavanje u trajanju od najmanje 5 dana za pse ili svinje uzgojene za tu svrhu u okviru kolonije životinja koja trajno obitava na lokaciji ispitivanja, te barem 2 tjedna za istu vrstu životinja ako potječu iz vanjskih izvora. Pokusne životinje treba okarakterizirati s obzirom na njihovu vrstu, soj, podrijetlo, spol, tjelesnu masu i/ili dob. Životinje treba nasumce rasporediti u kontrolne skupine i skupine za tretiranje. Kaveze treba tako rasporediti da se učinci do kojih bi moglo doći zbog položaja kaveza svedu na minimum. Svakoj životinji treba dodijeliti jedinstveni identifikacijski broj.
1.4.3. Priprema doza
Ispitivana se tvar može davati u hrani ili vodi za piće, oralnom intubacijom ili u kapsulama. Metoda oralne primjene ovisi o svrsi studije i fizikalno-kemijskim svojstvima ispitivanog materijala.
Prema potrebi, ispitivana se tvar otapa ili suspendira u odgovarajućem nosaču. Kad god je moguće, preporuča se najprije razmotriti mogućnost primjene vodene otopine/suspenzije, zatim mogućnost primjene otopine/emulzije u ulju (npr. kukuruzno ulje), i tek na kraju mogućnost otapanja u ostalim nosačima. Za sve nosače, osim vode, moraju biti poznata toksička svojstva. Treba utvrditi stabilnost ispitivane tvari u uvjetima primjene.
1.5. POSTUPAK
1.5.1. Broj i spol
Za ispitivanje svake visine doze treba upotrijebiti najmanje osam životinja (četiri ženke i četiri mužjaka). Ako se planira usmrćivanje životinja u međuvremenu, prije završetka studije, navedeni broj treba povećati za broj životinja predviđen za takvo usmrćivanje. Broj životinja na kraju ispitivanja mora biti dovoljan da ocjenjivanje toksičkih učinaka bude od značaja. Na temelju prijašnjih saznanja o kemikaliji ili nekom bliskom analogu, treba razmotriti mogućnost uključivanja dodatne satelitske skupine od osam životinja (po četiri od svakog spola) u kontrolnu skupinu i u skupinu koja će primiti najvišu dozu, radi opažanja reverzibilnosti ili postojanosti bilo kojega od toksičkih učinaka nakon razdoblja tretiranja. Treba utvrditi odgovarajuće trajanje ovog razdoblja s obzirom na učinke koji će se promatrati.
1.5.2. Doziranje
Treba upotrijebiti najmanje tri visine doza i paralelne kontrole, osim u slučajevima kad se izvodi granični test (vidjeti 1.5.3.). Visine doza mogu se utvrđivati na temelju rezultata studija s ponavljanim dozama ili studija za utvrđivanje raspona doza, pri čemu treba uzeti u obzir sve postojeće toksikološke podatke i podatke o toksikokinetici koji se odnose na ispitivanu tvar ili srodne materijale. Ako nije ograničena fizikalno-kemijskim svojstvima ili biološkim djelovanjem ispitivane tvari, najvišu dozu treba odabrati s ciljem da se izazove toksičnost, ali ne i smrt ili velika patnja životinje. Treba odabrati niz sve nižih doza koje će se primjenjivati za utvrđivanje svih reakcija vezanih uz doziranje, kao i dozu kod koje nema vidljivih štetnih učinaka (NOAEL) kao najnižu dozu. Za određivanje sve nižih doza često su najpogodniji dvostruki do četverostruki intervali i često je bolje dodati četvrtu pokusnu skupinu nego između doziranja upotrijebiti jako velike intervale (npr. iznad faktora 6-10).
Kontrolna skupina je netretirana skupina ili skupina tretirana samo nosačem, ako se kod primjene ispitivane tvari koristi nosač. Osim tretiranja ispitivanom tvari, sa životinjama u kontrolnoj skupini treba postupati na jednak način kao i sa životinjama u tretiranoj skupini. Ako se koristi nosač, volumen nosača koji primi kontrolna skupina treba biti jednak najvećem upotrijebljenom volumenu. Ako se ispitivana tvar daje u hrani i time se prouzroči smanjeni unos hrane, korištenje paralelno hranjene kontrolne skupine životinja može se pokazati korisnim pri razlikovanju smanjenja uzrokovanog okusom od smanjenja uzrokovanog toksikološkim promjenama u ispitnom modelu.
Treba uzeti u obzir sljedeća svojstva nosača i drugih aditiva, ovisno o slučaju: djelovanje na apsorpciju, distribuciju, metabolizam ili retenciju (zadržavanje) ispitivane tvari; djelovanje na kemijska svojstva ispitivane tvari, koje može promijeniti njezina toksička svojstva; i djelovanje na unos hrane ili vode ili na stanje uhranjenosti životinja.
1.5.3. Granični test
Ako test s jednom visinom doze koja iznosi najmanje 1 000 mg/kg tjelesne mase/dan, uz primjenu postupaka opisanih za ovu studiju, ne izazove vidljive štetne učinke i ako se toksičnost ne očekuje na temelju podataka o strukturno srodnim tvarima, potpuna studija uz primjenu tri visine doza ne smatra se potrebnom. Granični test ne vrijedi samo u slučajevima kad izloženost ljudi ukazuje na potrebu za primjenom više doze.
1.5.4. Primjena doza
Životinjama se ispitivana tvar dozira svakodnevno, sedam dana u tjednu, u razdoblju od 90 dana. U slučaju bilo kojeg drugog režima doziranja, npr. pet dana u tjednu, treba dokazati njegovu opravdanost. U slučaju primjene oralnom intubacijom, ispitivanu tvar treba primijeniti kao jednu dozu pomoću želučane sonde ili odgovarajuće intubacijske kanile. Maksimalni volumen tekućine koji se može primijeniti odjednom ovisi o veličini pokusne životinje. Taj volumen treba biti što je moguće manji. Osim u slučaju nadražujućih ili nagrizajućih tvari kod kojih se štetni učinci obično javljaju pri višim koncentracijama, varijabilnost ispitnog volumena treba prilagođavanjem koncentracije svesti na najmanju moguću mjeru, kako bi se zajamčio stalni volumen pri svim visinama doza.
Kod tvari koje se primjenjuju putem hrane ili vode za piće važno je osigurati da količine ispitivane tvari o kojoj je riječ ne utječu na uravnoteženi unos hrane ili vode. Kad se ispitivana tvar daje u hrani, može se koristiti ili stalna koncentracija u odnosu na količinu hrane (ppm) ili stalna visina doze s obzirom na tjelesnu masu životinje; alternativa koja se koristi u pokusu mora se specificirati. U slučajevima kad se ispitivana tvar daje oralnom intubacijom ili u kapsulama, dozu treba davati svaki dan otprilike u isto vrijeme te je po potrebi prilagođavati kako bi se održala stalna visina doze u odnosu na tjelesnu masu životinje. Kada se prije dugotrajnog ispitivanja kronične toksičnosti radi 90-dnevna preliminarna studija, u obje studije prehrana životinja treba biti slična.
1.5.5. Opažanja
Opažanje bi trebalo trajati najmanje 90 dana. Životinje u satelitskoj skupini za koje se planira naknadno opažanje treba tijekom odgovarajućeg vremenskog razdoblja držati bez tretiranja kako bi se utvrdilo jesu li toksički učinci postojani ili su se životinje od njih oporavile.
Opća bi klinička opažanja trebalo obavljati barem jednom dnevno, nabolje u isto vrijeme svakog dana, uzimajući u obzir vršno razdoblje očekivanih učinaka nakon doziranja. Kliničko stanje životinja treba zabilježiti. Barem dvaput dnevno, obično početkom i krajem svakog dana, sve životinje treba pregledati radi otkrivanja mogućih simptoma morbiditeta i mortaliteta.
Barem jednom prije prvog izlaganja, te jednom tjedno nakon toga, treba obaviti detaljno kliničko opažanje stanja svih životinja (što će omogućiti utvrđivanje promjena u stanju istih subjekata). Ta opažanja treba obaviti izvan kaveza u kojem životinja inače boravi, najbolje u standardnom ograđenom prostoru i svaki put otprilike u isto vrijeme. Treba poduzeti sve što je potrebno kako bi se osiguralo da odstupanja u uvjetima opažanja budu minimalna. Opažani simptomi trebaju obuhvaćati, ali ne biti ograničeni na, promjene na koži, dlaci, očima, sluznicama, pojavu sekreta i ekskreta te aktivnost autonomnog živčanog sustava (npr. lakrimacija (suzenje), piloerekcija (naježenost dlake), veličina zjenica, nepravilnosti u disanju). Treba zabilježiti i promjene u hodu, držanju i reakcijama na rukovanje, kao i prisutnost kloničkih ili toničkih pokreta, stereotipa (npr. pretjerano njegovanje krzna, ponavljano kretanje u krug) ili bilo kakvog neobičnog ponašanja.
Oftalmološki pregled pomoću oftalmoskopa ili druge odgovarajuće opreme, treba obaviti prije primjene ispitivane tvari i po završetku studije, najbolje na svim životinjama ili barem u skupinama koje primaju visoke doze te u kontrolnim skupinama. Ako se otkriju promjene na očima, treba pregledati sve životinje.
1.5.5.1. Tjelesna masa i unos hrane/vode
Sve životinje treba vagati barem jednom tjedno. Unos hrane treba mjeriti najmanje na tjednoj osnovi. Ako se ispitivana tvar daje s vodom za piće, treba mjeriti i unos vode, i to barem na tjednoj razini. Unos vode može se pratiti i u studijama koje se odnose na normalno hranjenje ili prisilno hranjenje na sondu, pri čemu može doći do promjena u unosu tekućine.
1.5.5.2. Hematologija i klinička biokemija
Uzorke krvi treba uzeti na specificiranom mjestu i, ovisno o slučaju, pohraniti u odgovarajućim uvjetima. Na kraju razdoblja ispitivanja uzorci se prikupljaju neposredno prije ili u okviru postupka usmrćivanja životinja.
Na početku studije, a potom ili u mjesečnim intervalima ili sredinom ispitnog razdoblja i, konačno, na kraju ispitnog razdoblja treba napraviti hematološke pretrage koje uključuju hematokrit, koncentraciju hemoglobina, broj eritrocita, ukupni i diferencijalni broj leukocita, broj trombocita te mjerenje potencijala zgrušavanja, odnosno vremena zgrušavanja, protrombinskog vremena ili tromboplastinskog vremena.
Kliničke biokemijske pretrage za utvrđivanje jakog toksičkog djelovanja na tkiva i posebno na bubrege i jetru, treba obaviti na uzorcima krvi uzetima od svih životinja na početku, a potom ili u mjesečnim intervalima, ili sredinom ispitnog razdoblja i, konačno, na kraju ispitnog razdoblja. Područja koja treba ispitati uključuju ravnotežu elektrolita, metabolizam ugljikohidrata te funkciju jetre i bubrega. Na odabir specifičnih oblika ispitivanja utjecat će zapažanja o načinu djelovanja ispitivane tvari. Prije uzimanja uzoraka krvi preporuča se da životinje poste određeno vrijeme koje će ovisiti o životinjskoj vrsti. Preporučene pretrage obuhvaćaju mjerenje razine kalcija, fosfora, klorida, natrija, kalija, glukoze natašte, alanin aminotransferaze, aspartat aminotransferaze, ornitin dekarboksilaze, gama glutamil transpeptidaze, dušika iz ureje, albumina, kreatinina u krvi, te mjerenje ukupne vrijednosti bilirubina i proteina u serumu.
Analizu urina treba napraviti najmanje na početku, zatim oko sredine i, konačno, na kraju studije uz primjenu metode prikupljanja urina u određenim vremenskim razmacima. Analiza urina uključuje: izgled, količinu, osmolalnost ili specifičnu težinu, pH, protein, glukozu i krv/krvne stanice. Ako istraživanje opaženih učinaka treba proširiti, prema potrebi se mogu uvesti dodatni parametri.
Osim toga, treba razmisliti i o ispitivanju serumskih markera općih tkivnih oštećenja. Ostale pretrage koje mogu biti potrebne radi donošenja odgovarajuće toksikološke ocjene obuhvaćaju analizu lipida, hormona, acido-bazne ravnoteže, methemoglobina i inhibicije kolinesteraze. Ako istraživanje opaženih učinaka treba proširiti, prema potrebi se mogu uvesti dodatne biokemijske pretrage. Njih treba utvrditi za kemikalije svrstane u određene klase opasnosti, ili od slučaja do slučaja.
Uglavnom, ovdje je potreban fleksibilan pristup, ovisno o životinjskoj vrsti i opaženim i/ili očekivanim učincima predmetne tvari.
1.5.5.3. Obdukcija (makroskopska analiza)
Sve životinje korištene u studiji moraju se podvrgnuti kompletnoj, detaljnoj makroskopskoj analizi koja uključuje pažljivi pregled vanjske površine tijela, svih otvora, te lubanjske, prsne i trbušne šupljine i njihovog sadržaja. S jetre, bubrega, nadbubrežnih žlijezda, testisa, epididimisa (pasjemenika), jajnika, maternice, tiroidne žlijezde (štitnjače) (s paratiroidnim žlijezdama) timusa (prsne žlijezde), slezene, mozga i srca svih životinja (osim onih za koje je utvrđeno da su na umoru i/ili se neplanirano usmrte tijekom pokusa) treba obrezati svo okolno tkivo, prema potrebi, te ih još mokre izvagati što prije nakon sekcije, kako bi se izbjeglo sušenje organa.
Slijedeća tkiva treba sačuvati u sredstvu za fiksiranje koje je najprimjerenije i za vrstu tkiva i za planirani kasniji histopatološki pregled: sve velike lezije, mozak (reprezentativne regije, uključujući veliki mozak, mali mozak i medulu/most), leđnu moždinu (s tri područja: cervikalnog (vratnog), srednjeg torakalnog (prsnog) i lumbalnog (slabinskog)), hipofizu, oči, tiroidnu žlijezdu (štitnjaču), paratiroidnu žlijezdu, timus (prsnu žlijezdu), jednjak, žlijezde slinovnice, želudac, tanko i debelo crijevo (uključujući Peyerove ploče), jetru, žučni mjehur, gušteraču, bubrege, nadbubrežne žlijezde, slezenu, srce, dušnik i pluća, aortu, spolne žlijezde, maternicu, pomoćne spolne organe, mliječnu žlijezdu ženke, prostatu, mokraćni mjehur, limfne čvorove (po mogućnosti, jedan koji pokriva put unosa ispitivane tvari u organizam i drugi koji je udaljen od puta unosa, kako bi se vidjeli sistemski učinci), periferni živac (bedreni (n. ischiadicus) ili tibijalni (n. tibialis)) po mogućnosti smješten uz mišić, odsječak koštane srži (ili svježi aspirat koštane srži) i kožu. Klinički i drugi nalazi mogu ukazati na potrebu za ispitivanjem dodatnih tkiva. Treba sačuvati i sve one organe za koje se na temelju saznanja o svojstvima ispitivane tvari smatra da bi mogli biti ciljni.
1.5.5.4. Histopatologija
Na sačuvanim organima i tkivima svih životinja iz kontrolne skupine i skupine tretirane visokim dozama treba napraviti kompletan histopatološki pregled. Ako se kod životinja na koje su primijenjene visoke doze ispitivane tvari primijete promjene, tada histopatološkim pregledom treba obuhvatiti i životinje iz svih ostalih skupina.
Treba pregledati sve veće lezije.
Ako se koristi satelitska skupina, treba napraviti histopatološki pregled onih tkiva i organa na kojima su kod tretiranih životinja primijećene promjene.
2. PODACI I IZVJEŠĆIVANJE
2.1. PODACI
Podatke treba prikazati za svaku životinju pojedinačno. Osim toga, najbolje ih je rezimirati u obliku tablice u kojoj za svaku pokusnu skupinu treba navesti broj životinja na početku ispitivanja, broj životinja koje su uginule ili su iz humanih razloga bile usmrćene tijekom ispitivanja, vrijeme smrti ili humanog usmrćivanja, broj životinja kod kojih su opaženi znakovi toksičnosti, opis opažanih znakova toksičnosti, uključujući vrijeme pojavljivanja, trajanje i stupanj svih toksičkih učinaka, broj životinja kod kojih su se javile lezije, vrsta lezija i postotak životinja koje pokazuju određene vrste lezija.
Tamo gdje je to moguće, sve rezultate treba analizirati uz primjenu odgovarajuće opće prihvatljive statističke metode. Statističke metode i podatke koji će se analizirati treba odabrati još u fazi planiranja studije.
2.2. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora sadržavati sljedeće informacije:
2.2.1. Ispitivana tvar:
|
— |
fizikalni oblik (agregatno stanje), čistoća i fizikalno-kemijska svojstva, |
|
— |
identifikacijski podaci, |
|
— |
nosač (ovisno o slučaju): dokaz opravdanosti odabira nosača, ako se ne radi o vodi. |
2.2.2. Vrsta pokusnih životinja:
|
— |
korištena životinjska vrsta i soj, |
|
— |
broj, starost i spol životinja, |
|
— |
podrijetlo, uvjeti držanja, prehrana itd., |
|
— |
tjelesna masa pojedinačnih životinja na početku ispitivanja. |
2.2.3. Uvjeti ispitivanja:
|
— |
obrazloženje za odabir visina doza, |
|
— |
pojedinosti o formulaciji ispitivane tvari/pripremanju hrane, postignuta koncentracija, stabilnost i homogenost pripravka, |
|
— |
podaci o primjeni ispitivane tvari, |
|
— |
stvarne doze (mg/kg tjelesne težine/dan) i faktor za preračunavanje koncentracije ispitivane tvari u hrani/vodi za piće (ppm) u stvarnu dozu, prema potrebi, |
|
— |
pojedinosti o kvaliteti hrane i vode. |
2.2.4. Rezultati:
|
— |
tjelesna masa i promjene u tjelesnoj masi, |
|
— |
unos hrane i unos vode, prema potrebi, |
|
— |
podaci o toksičkim reakcijama po spolu i visini doza, uključujući znakove toksičnosti, |
|
— |
vrsta, stupanj i trajanje opaženih kliničkih promjena (jesu li reverzibilne ili nisu), |
|
— |
rezultati oftalmološkog pregleda, |
|
— |
hematološka ispitivanja s relevantnim normalnim vrijednostima, |
|
— |
klinička biokemijska ispitivanja s relevantnim normalnim vrijednostima, |
|
— |
tjelesna masa nakon smrti, masa organa, te omjer mase organa i tjelesne mase, |
|
— |
nalazi obdukcije, |
|
— |
detaljni opis svih histopatoloških nalaza, |
|
— |
podaci o apsorpciji, ako postoje, |
|
— |
statistička obrada rezultata, prema potrebi. |
Diskusija o rezultatima.
Zaključci.
B.28. TEST SUBKRONIČNE DERMALNE TOKSIČNOSTI 90-DNEVNO ISPITIVANJE DERMALNE TOKSIČNOSTI NA GLODAVCIMA UZ PRIMJENU PONAVLJANIH DOZA
1. METODA
1.1. UVOD
Vidjeti Opći uvod, dio B.
1.2. DEFINICIJE
Vidjeti Opći uvod, dio B.
1.3. REFERENTNE TVARI
Nema ih.
1.4. NAČELO ISPITNE METODE
Ispitivana se tvar svakodnevno i u sve većim dozama nanosi na kožu nekoliko skupina pokusnih životinja, po jedna doza po skupini tijekom 90 dana. Za vrijeme primjene životinje se svakodnevno promatraju radi uočavanja simptoma toksičnosti. Na životinjama koje uginu tijekom ispitivanja obavlja se obdukcija, a po završetku ispitivanja, preživjele se životinje usmrćuju i također obduciraju.
1.5. KRITERIJI KVALITETE
Nema ih.
1.6. OPIS ISPITNE METODE
1.6.1. Priprema
Životinje se drže u pokusnim uvjetima s obzirom na smještaj i hranu najmanje pet dana prije ispitivanja. Zdrave mlade životinje prije ispitivanja se nasumce odabiru i raspoređuju u skupine koje će se tretirati i u kontrolne skupine. Neposredno prije ispitivanja na leđnom dijelu trupa životinja ošiša se dlaka. Dlaka se može i obrijati, ali to se mora učiniti oko 24 sata prije početka ispitivanja. Šišanje, odnosno brijanje, obično treba ponavljati u tjednim intervalima. Pri šišanju ili brijanju dlake treba paziti da se ne ošteti površina kože. Za nanošenje ispitivane tvari dlaku treba ukloniti s najmanje 10 % tjelesne površine. Kad se odlučuje o veličini površine s koje će biti uklonjena dlaka i o dimenzijama obloga treba uzeti u obzir tjelesnu masu životinje. Pri ispitivanju krutih tvari koje se prema potrebi mogu usitniti u prah, ispitivanu tvar treba u dovoljnoj mjeri navlažiti vodom ili, tamo gdje je to potrebno, odgovarajućim nosačem, kako bi se osigurao dobar kontakt s kožom. Tekuće ispitivane tvari obično se koriste nerazrijeđene. Ispitivana tvar primjenjuje se pet do sedam dana tjedno.
1.6.2. Uvjeti ispitivanja
1.6.2.1.
Može se upotrijebiti odrasli štakor, zec ili zamorac. Mogu se koristiti i druge vrste, ali pod uvjetom da za to postoji znanstveno opravdanje. Kada se prije dugotrajnog ispitivanja preliminarno obavlja ispitivanje subkronične dermalne toksičnosti, u oba ispitivanja treba upotrijebiti životinje iste vrste i istog soja.
1.6.2.2.
Za ispitivanje svake visine doze treba upotrijebiti najmanje 20 životinja (10 ženki i 10 mužjaka). Ženke ne smiju prethodno imati potomstvo i ne smiju biti gravidne. Ako se planira usmrćivanje životinja u međuvremenu, prije završetka studije, navedeni broj treba povećati za broj životinja predviđen za takvo usmrćivanje. Osim toga, jedna satelitska skupina od 20 životinja (10 životinja svakog spola) može se 90 dana tretirati visokom dozom i nakon tretiranja 28 dana opažati s obzirom na reverzibilnost, trajanje ili odgođenu pojavu toksičkih učinaka.
1.6.2.3.
Potrebne su najmanje 3 visine doza s jednom kontrolom ili, ako se koristi otapalo, s kontrolom koju čini otapalo. Izlaganje treba trajati najmanje šest sati dnevno. Ispitivanu tvar treba nanositi u približno isto vrijeme svaki dan, uz povremena podešavanja (u tjednim ili dvotjednim intervalima) kako bi se održala stalna visina doze s obzirom na tjelesnu masu životinje. Izuzimajući tretiranje ispitivanom tvari, sa životinjama iz kontrolne skupine treba postupati na jednak način kao sa životinjama koje se podvrgavaju testiranju. Ako se radi lakšeg doziranja koristi nosač, kontrolnoj skupini na koju se primjenjuje nosač doze se daju na jednak način kao i tretiranim skupinama i one moraju primiti iste količine kao skupina tretirana najvišom dozom. Najviša doza treba izazvati toksičke učinke, ali smrtnih ishoda ne smije biti ili se mogu javiti u rijetkim slučajevima. Najniža doza ne bi smjela izazvati nikakve znakove toksičkog učinka. Tamo gdje postoji primjenljiva procjena razine ljudske izloženosti, najniža koncentracija treba biti malo viša od te procijenjene razine. U idealnom slučaju, srednja bi koncentracija trebala proizvesti minimalne vidljive toksičke učinke. Ako se koristi više od jedne međudoze, one se moraju primjenjivati u intervalima kako bi se njihovi toksički učinci mogli stupnjevati. U skupinama tretiranim niskim i srednjim dozama i u kontrolnim skupinama, stopa smrtnosti treba biti niska da bi ocjena rezultata uopće imala smisla.
Ako primjena ispitivane tvari izazove tešku nadraženost kože, koncentracije treba smanjiti, što može dovesti do smanjenja ili izostanka drugih toksičkih učinaka kod primjene visokih doza. Ako dođe do jakog oštećenja kože, možda će trebati prekinuti studiju i započeti novu s nižim koncentracijama.
1.6.3.
Ako u preliminarnom ispitivanju primjena doze od 1 000 mg/kg ili više doze vezane uz moguću ljudsku izloženost, ako je poznata, ne proizvede nikakve toksičke učinke, daljnje ispitivanje smatra se nepotrebnim.
1.6.4.
Opažanje pokusnih životinja radi otkrivanja znakova toksičnosti treba provoditi svakodnevno. Vrijeme smrti kao i vrijeme pojave i nestanka znakova toksičnosti treba zabilježiti.
1.6.5.
Životinje se u kaveze smještaju pojedinačno. U idealnim uvjetima, životinje se tretiraju sedam dana u tjednu, kroz vremensko razdoblje od 90 dana.
Životinje iz bilo koje satelitske skupine koje su predviđene za dodatna opažanja treba držati dodatnih 28 dana bez tretiranja kako bi se utvrdio oporavak od toksičkih učinaka ili njihova trajnost. Izlaganje treba trajati najmanje šest sati dnevno.
Ispitivanu tvar treba jednakomjerno nanijeti na površinu koja čini približno 10 % ukupne tjelesne površine. Kod jako toksičnih tvari površina na koju se tvar nanosi može biti i manja, ali čim veći dio te površine treba prekriti što tanjim i jednakomjernijim slojem.
Tijekom izlaganja ispitivana tvar se drži u kontaktu s kožom pomoću poroznog obloga od gaze i samoljepive trake koja ne nadražuje kožu. Ispitnu površinu treba dodatno prekriti na odgovarajući način kako bi oblog i ispitivana tvar ostali na mjestu i kako bi se osiguralo da životinje ne mogu ispitivanu tvar unijeti oralno. Da bi se životinju spriječilo da ispitivanu tvar unese oralnim putem mogu se upotrijebiti pomagala za sputavanje, ali potpuna imobilizacija nije preporučena metoda.
Na kraju razdoblja izloženosti ostatke ispitivane tvari treba ukloniti, ako je moguće vodom ili primjenom neke druge prikladne metode čišćenja kože.
Sve životinje treba opažati svaki dan i bilježiti znakove toksičnosti, navodeći vrijeme njihove pojave, stupanj i trajanje. Opažanje životinja u kavezu treba obuhvaćati promjene na koži i dlaci, očima i sluznicama, na dišnom i cirkulacijskom sustavu, te na autonomnom i centralnom živčanom sustavu, kao i promjene u somatomotoričkoj aktivnosti i obrascu ponašanja. Unos hrane treba mjeriti na tjednoj osnovi i životinje treba svaki tjedan vagati. Redovito je opažanje životinja neophodno da bi se spriječio gubitak životinja uslijed kanibalizma, autolize tkiva ili pogrešnog smještanja. Na kraju studije sve se preživjele životinje iz nesatelitskih tretiranih skupina usmrćuju i podvrgavaju obdukciji. Životinje na umoru i životinje koje trpe jaki stres ili bol treba po uočavanju izlučiti, humano usmrtiti i obducirati.
Na kraju ispitivanja na svim životinjama, uključujući i kontrolne životinje, obavljaju se sljedeći pregledi:
|
(a) |
oftalmološki pregled pomoću oftalmoskopa ili druge odgovarajuće opreme, koji treba obaviti prije primjene ispitivane tvari i po završetku studije, najbolje na svim životinjama, ili barem u skupinama koje primaju visoke doze i kontrolnim skupinama. Ako se otkriju promjene na očima, treba pregledati sve životinje; |
|
(b) |
hematološke pretrage koje uključuju hematokrit, koncentraciju hemoglobina, broj eritrocita, ukupni i diferencijalni broj leukocita i mjerenje sposobnosti zgrušavanja koje obuhvaća vrijeme zgrušavanja, protrombinsko vrijeme, tromboplastinsko vrijeme, ili broj tromocita, treba obaviti na kraju ispitnog razdoblja; |
|
(c) |
kliničke biokemijske pretrage krvi treba obaviti na kraju ispitnog razdoblja. Područja ispitivanja koja se smatraju primjerenim za sve studije obuhvaćaju ravnotežu elektrolita, metabolizam ugljikohidrata, funkciju jetre i bubrega. Izbor konkretnih testova koji će se obavljati ovisit će o načinu djelovanja ispitivane tvari. Predlaže se utvrđivanje razina kalcija, fosfora, klorida, natrija, kalija, glukoze natašte (uz trajanje posta primjereno predmetnoj životinjskoj vrsti) serumske glutamat-piruvat transaminaze (4), serumske glutamat-oksaloacetat transaminaze (5), ornitin-dekarboksilaze, gama-glutamil-transpeptidaze, dušika u ureji, albumina, kreatinina u krvi, ukupnog bilirubina i ukupnih serumskih bjelančevina. Ostale pretrage koje mogu biti potrebne radi donošenja odgovarajuće toksikološke ocjene obuhvaćaju analizu lipida, hormona, acido-bazne ravnoteže, methemoglobina i aktivnosti kolinesteraze. Ako istraživanje opaženih učinaka treba proširiti, prema potrebi se mogu uvesti dodatna klinička biokemijska ispitivanja; |
|
(d) |
pretraga urina nije dio uobičajene prakse i obavlja se samo ako je indicirana na temelju očekivane ili opažene toksičnosti. |
Ako podaci o normalnim vrijednostima korišteni u prijašnjim pokusima nisu adekvatni, treba razmotriti koje hematološke i kliničke biokemijske parametre treba utvrditi prije doziranja.
Sve životinje treba podvrgnuti kompletnoj, detaljnoj makroskopskoj analizi koja uključuje pažljivi pregled vanjske površine tijela, svih otvora, te lubanjske, prsne i trbušne šupljine i njihovog sadržaja. S jetre, bubrega, nadbubrežnih žlijezda, testisa, sjemenovoda, timusa, slezene, mozga i srca svih životinja treba obrezati svo okolno tkivo, prema potrebi, te ih još mokre izvagati što prije nakon sekcije, kako bi se izbjeglo sušenje organa. Slijedeće organe i tkiva treba čuvati u odgovarajućem mediju za mogući kasniji histopatološki pregled: sve velike lezije, mozak – uključujući odsječke medule/mosta, kore malog i velikog mozga, hipofize, štitanjače/paratiroidne žlijezde, tkivo prsne žlijezde, (dušnik), pluća, srce, aortu, žlijezde slinovnice, jetru, slezenu, bubrege, nadbubrežne žlijezde, gušteraču, spolne žlijezde, maternicu, pomoćne spolne organe, žučni mjehur (ako postoji), jednjak, želudac, dvanaesnik, tašto crijevo, vito crijevo, slijepo crijevo, debelo crijevo, rektum, mokraćni mjehur, reprezentativni limfni čvor (žensku mliječnu žlijezdu), (muskulaturu bedra), periferni živac, (oči), (prsnu kost s koštanom srži), (bedrenu kost – uključujući površinu zgloba), (leđnu moždinu na tri razine: vratnoj, srednjoj prsnoj i slabinskoj) i (eksorbitalne suzne žlijezde). Tkiva navedena u zagradama treba pregledati samo ako na to ukazuju znakovi toksičnosti ili ako su u pitanju ciljni organi.
|
(a) |
Kompletne histopatološke pretrage treba napraviti na normalnoj i tretiranoj koži i na organima i tkivima životinja iz kontrolne skupine i skupine tretirane visokom dozom. |
|
(b) |
Treba pregledati sve velike lezije. |
|
(c) |
Treba pregledati ciljne organe kod skupina tretiranih ostalim dozama. |
|
(d) |
Ako se koriste štakori, pluća životinja iz skupina tretiranih niskim i srednjim dozama treba podvrgnuti histopatološkim pregledu radi otkrivanja dokaza o mogućim infekcijama, budući da se na taj način može donijeti odgovarajuća ocjena zdravstvenog stanja životinja. Uobičajena praksa ne nalaže daljnje histopatološke pretrage na životinjama iz tih skupina, ali moraju se uvijek obaviti na organima životinja iz skupine tretirane visokom dozom, na kojima su vidljivi znakovi lezija. |
|
(e) |
Ako se koristi satelitska skupina, treba napraviti histopatološki pregled onih tkiva i organa na kojima su kod ostalih tretiranih skupina primijećene promjene. |
2. PODACI
Podatke treba rezimirati u obliku tablice u kojoj će za svaku testiranu skupinu životinja biti naveden broj životinja na početku ispitivanja i broj životinja kod kojih su se javile lezije, vrste lezija i za svaku vrstu lezija postotak životinja kod kojih su utvrđene. Dobivene rezultate treba analizirati prema odgovarajućoj statističkoj metodi. Može se koristiti bilo koja priznata statistička metoda.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju treba, ako je moguće, sadržavati sljedeće informacije:
|
— |
vrsta, soj i podrijetlo životinja, okolišni uvjeti, prehrana, |
|
— |
uvjeti ispitivanja, |
|
— |
visine doza (uključujući nosač, ako se koristio) i koncentracije, |
|
— |
podaci o toksičkim reakcijama po spolu i dozi, |
|
— |
razina kod koje nema toksičkih učinaka, tamo gdje je to moguće, |
|
— |
vrijeme smrti tijekom studije, odnosno podaci o preživljavanju životinja do kraja ispitivanja, |
|
— |
opis toksičkih i drugih učinaka, |
|
— |
vrijeme opažanja svakog znaka abnormalnosti i daljnjih promjena, |
|
— |
podaci o hrani i tjelesnoj masi, |
|
— |
oftalmološki nalazi, |
|
— |
obavljena hematološka ispitivanja i svi rezultati, |
|
— |
obavljena klinička biokemijska ispitivanja i svi rezultati (uključujući rezultate svih analiza urina), |
|
— |
nalazi obdukcije, |
|
— |
detaljni opis svih histopatoloških nalaza, |
|
— |
statistička obrada rezultata tamo gdje je to moguće, |
|
— |
diskusija o rezultatima. |
3.2. OCJENA I TUMAČENJE REZULTATA
Vidjeti Opći uvod, dio B.
4. REFERENCE
Vidjeti Opći uvod, dio B.
B.29. STUDIJA SUBKRONIČNE INHALACIJSKE TOKSIČNOSTI 90-DNEVNA STUDIJA INHALACIJSKE TOKSIČNOSTI NA GLODAVCIMA UZ PRIMJENU PONAVLJANIH DOZA
1. METODA
1.1. UVOD
Vidjeti Opći uvod, dio B.
1.2. DEFINICIJE
Vidjeti Opći uvod, dio B.
1.3. REFERENTNE TVARI
Nema ih.
1.4. NAČELO ISPITNE METODE
Nekoliko se skupina pokusnih životinja 90 dana svakodnevno određeno vrijeme izlaže ispitivanoj tvari u sve većim koncentracijama, pri čemu se na svaku skupinu primjenjuje jedna visina doze. Ako se za lakše postizanje odgovarajuće koncentracije ispitivane tvari u atmosferi koristi nosač, treba upotrijebiti jednu kontrolnu skupinu životinja koja će se tretirati otapalom. Tijekom razdoblja primjene obavlja se svakodnevno opažanje životinja radi otkrivanja znakova toksičnosti. Životinje koje uginu tijekom ispitivanja podvrgavaju se obdukciji, a po završetku ispitivanja životinje koje su preživjele ispitivanja usmrćuju se i također obduciraju.
1.5. KRITERIJI KVALITETE
Nema ih.
1.6. OPIS ISPITNE METODE
1.6.1.
Životinje se drže u pokusnim uvjetima u pogledu smještaja i hranjenja najmanje pet dana prije početka pokusa. Prije ispitivanja zdrave mlade životinje nasumce se odabiru i raspoređuju u kontrolne skupine i skupine za tretiranje. Prema potrebi se u ispitivanu tvar može dodati odgovarajući nosač koji omogućava postizanje odgovarajuće koncentracije tvari u atmosferi. Ako se radi lakšeg doziranja dodaje nosač ili neki drugi dodatak, mora se za njega znati da ne proizvodi toksičke učinke. Ovisno o slučaju, mogu se upotrijebiti podaci iz prethodnih studija.
1.6.2.
1.6.2.1.
Ako nema kontraindikacija, preporuča se korištenje štakora. Treba koristiti mlade zdrave životinje sojeva koji se obično koriste u laboratorijima. Na početku ispitivanja raspon masa pojedinačnih životinja ne smije prelaziti ± 20 % od odgovarajuće srednje vrijednosti. U slučajevima kad se prije dugotrajne studije kronične toksičnosti provodi preliminarna studija subkronične inhalacijske toksičnosti, u obje studije treba koristiti životinje istog soja i istog podrijetla.
1.6.2.2.
Za svaku koncentraciju izlaganja treba upotrijebiti najmanje 20 životinja (10 ženki i 10 mužjaka). Ženke ne smiju prethodno imati potomstvo i ne smiju biti gravidne. Ako se planira usmrćivanje životinja u međuvremenu, prije završetka studije, navedeni broj treba povećati za broj životinja predviđen za takvo usmrćivanje. Osim toga, jedna satelitska skupina od 20 životinja (10 životinja svakog spola) može se 90 dana tretirati visokom dozom i nakon tretiranja 28 dana opažati s obzirom na reverzibilnost, trajanje ili odgođenu pojavu toksičkih učinaka.
1.6.2.3.
Potrebne su najmanje tri koncentracije uz kontrolu ili kontrolu nosača (čija koncentracija odgovara koncentraciji nosača koji se dodaje kod najviše doze) ako se nosač koristi. Izuzimajući tretiranje ispitivanom tvari, sa životinjama iz kontrolne skupine treba postupati na jednak način kao sa životinjama iz tretirane skupine. Najviša koncentracija treba izazvati toksičke učinke, ali smrtnih ishoda ne smije biti ili se mogu javiti u rijetkim slučajevima. Tamo gdje postoji primjenljiva procjena razine ljudske izloženosti, najniža koncentracija primijenjena na životinje treba biti iznad takve procijenjene razine. Ako se koristi više od jedne međukoncentracije, one se moraju primjenjivati u intervalima kako bi se njihovi toksički učinci mogli stupnjevati. U skupinama tretiranima niskim i srednjim dozama i u kontrolnim skupinama, stopa smrtnosti treba biti niska da bi ocjena rezultata uopće imala smisla.
1.6.2.4.
Nakon uravnoteživanja koncentracija u komori, dnevno izlaganje treba trajati šest sati. Ako treba ispuniti posebne zahtjeve, trajanje izlaganja može se promijeniti.
1.6.2.5.
Životinje treba testirati pomoću inhalacijske opreme čija konstrukcija omogućuje protok zraka s najmanje 12 potpunih izmjena u jednom satu, kako bi se osigurao odgovarajući sadržaj kisika i atmosfera u kojoj je tvar kojoj se životinja izlaže jednakomjerno raspoređena. Ako se za ispitivanje koristi komora, njezina konstrukcija treba omogućiti minimalnu naguranost životinja i maksimalnu inhalacijsku izloženost ispitivanoj tvari. Da bi se osigurala stabilnost atmosfere u komori, primjenjuje se opće pravilo da ukupan volumen pokusne životinje ne smije biti veći od 5 % volumena ispitne komore. Mogu se koristiti različiti tipovi komora koji omogućuju izloženost samo oro-nazalnih (usno-nosnih) otvora, samo glave ili čitavog tijela pojedinačne životinje; prva dva tipa omogućuju da se unošenje ispitivane tvari u organizam životinje drugim putevima svede na minimum.
1.6.2.6.
Opažanje pokusnih životinja radi otkrivanja znakova toksičnosti treba provoditi svakodnevno tijekom cijelog razdoblja tretiranja i oporavka. Vrijeme smrti kao i vrijeme pojave i nestanka znakova toksičnosti treba zabilježiti.
1.6.3.
Životinje se izlažu ispitivanoj tvari svaki dan, pet do sedam dana u tjednu, tijekom razdoblja od 90 dana. Životinje iz bilo koje satelitske skupine predviđene za daljnje opažanje treba držati dodatnih 28 dana bez tretiranja, kako bi se mogao uočiti oporavak od, ili postojanost toksičkih učinaka. Temperaturu pri kojoj se provodi ispitivanje treba održavati na 22 ± 3 °C. Idealno bi bilo relativnu vlažnost zraka održavati između 30 i 70 %, ali u nekim slučajevima (npr. testiranje nekih aerosola) to može biti neizvedivo. Za vrijeme izloženosti životinjama se ne smije davati hrana i voda.
Treba koristiti dinamički inhalacijski sustav s odgovarajućim analitičkim sustavom za kontrolu koncentracije. Za utvrđivanje odgovarajućih koncentracija izlaganja preporuča se provođenje probnog testa. Protok zraka treba podesiti tako da se u cijeloj komori za izlaganje osiguraju ujednačeni uvjeti. Sustav treba u što kraćem vremenu omogućiti postizanje stabilnih uvjeta izlaganja.
Treba mjeriti i pratiti:
|
(a) |
brzinu protoka zraka (neprekidno); |
|
(b) |
stvarnu koncentraciju ispitivane tvari izmjerenu u zoni disanja. Tijekom dnevnog razdoblja izlaganja koncentracija ne smije varirati za više od ± 15 % srednje vrijednosti. Međutim, kod prašina i aerosola ova se razina kontrole možda neće moći postići pa bi u tom slučaju bio prihvatljiv i veći raspon odstupanja. Tijekom ukupnog trajanja pokusa, dnevne koncentracije treba održavati što je moguće stabilnijima. Kod razvijanja sustava generiranja treba napraviti analizu veličine čestica kako bi se uspostavila stabilnost koncentracija aerosola. Tijekom izlaganja treba raditi analize, onoliko često koliko bude potrebno, za utvrđivanje postojanosti distribucije veličine čestica; |
|
(c) |
temperaturu i vlažnost zraka; |
|
(d) |
tijekom i nakon izlaganja sustavno se izvode i bilježe opažanja; za svaku životinju treba voditi zasebne bilješke. Sve životinje treba svakodnevno opažati i bilježiti znakove toksičnosti, pri čemu treba navesti vrijeme njihovog pojavljivanja, njihov stupanj i trajanje. Opažanja životinja u kavezima trebaju obuhvaćati promjene na koži i dlaci, očima, sluznicama, na dišnom i cirkulacijskom sustavu, te na autonomnom i centralnom živčanom sustavu, kao i promjene u somatomotoričkoj aktivnosti i ponašanju. Unos hrane treba mjeriti na tjednoj osnovi i životinje treba svaki tjedan vagati. Redovito je opažanje životinja neophodno da bi se spriječio gubitak životinja uslijed kanibalizma, autolize tkiva ili pogrešnog smještanja. Na kraju studije sve preživjele životinje podvrgavaju se obdukciji. Životinje na umoru treba po uočavanju ukloniti i obducirati. |
Na svim životinjama, uključujući i kontrolne životinje, obavljaju se sljedeći pregledi:
|
(a) |
oftalmološki pregled, pomoću oftalmoskopa ili druge odgovarajuće opreme, koji treba obaviti prije izlaganja ispitivanoj tvari i po završetku studije, najbolje na svim životinjama ili barem u skupinama koje primaju visoke doze i kontrolnim skupinama. Ako se otkriju promjene na očima, treba pregledati sve životinje; |
|
(b) |
hematološke pretrage koje uključuju hematokrit, koncentraciju hemoglobina, broj eritrocita, ukupni i diferencijalni broj leukocita i mjerenje sposobnosti zgrušavanja koje obuhvaća vrijeme zgrušavanja, protrombinsko vrijeme, tromboplastinsko vrijeme, ili broj tromocita, treba obaviti na kraju ispitnog razdoblja; |
|
(c) |
kliničke biokemijske pretrage krvi treba obaviti na kraju ispitnog razdoblja. Područja ispitivanja koja se smatraju primjerenim za sve studije obuhvaćaju ravnotežu elektrolita, metabolizam ugljikohidrata, funkciju jetre i bubrega. Izbor konkretnih testova koji će se obavljati ovisit će o načinu djelovanja ispitivane tvari. Predlaže se utvrđivanje razina kalcija, fosfora, klorida, natrija, kalija, glukoze natašte (uz trajanje posta primjereno predmetnoj životinjskoj vrsti) serumske glutamat-piruvat transaminaze (6), serumske glutamat-oksaloacetat transaminaze (7), ornitin-dekarboksilaze, gama-glutamil-transpeptidaze, dušika u ureji, albumina, kreatinina u krvi, ukupnog bilirubina i ukupnih serumskih bjelančevina. Ostale pretrage koje mogu biti potrebne radi donošenja odgovarajuće toksikološke ocjene obuhvaćaju analizu lipida, hormona, acido-bazne ravnoteže, methemoglobina i aktivnosti kolinesteraze. Ako istraživanje opažanih učinaka treba proširiti, prema potrebi se mogu uvesti dodatna klinička biokemijska ispitivanja; |
|
(d) |
pretraga urina nije dio uobičajene prakse i obavlja se samo ako je indicirana na temelju očekivane ili opažene toksičnosti. |
Ako podaci o normalnim vrijednostima korišteni u prijašnjim pokusima nisu adekvatni, treba razmotriti koje hematološke i kliničke biokemijske parametre treba utvrditi prije doziranja.
Sve životinje treba podvrgnuti kompletnoj makroskopskoj analizi koja uključuje pregled vanjske površine tijela, svih otvora, te lubanjske, prsne i trbušne šupljine i njihovog sadržaja. S jetre, bubrega, nadbubrežnih žlijezda, testisa, sjemenovoda, timusa, slezene, mozga i srca svih životinja treba obrezati svo okolno tkivo, prema potrebi, te ih još mokre izvagati što prije nakon sekcije, kako bi se izbjeglo sušenje organa. Slijedeće organe i tkiva treba čuvati u sredstvu za fiksiranje za mogući kasniji histopatološki pregled: sve velike lezije, pluća – koja treba izvaditi bez oštećenja, izvagati i tretirati odgovarajućim fiksativom kako bi se sačuvala njihova struktura (zalijevanje fiksativom smatra se djelotvornim postupkom), nazofaringealna tkiva, mozak – uključujući dijelove medule/mosta, kore malog i velikog mozga, hipofizu, štitnjaču/paratiroidnu žlijezdu i tkivotimusa/prsne žlijezde, dušnik, pluća, srce, aortu, žlijezde slinovnice, jetru, slezenu, bubrege, nadbubrežne žlijezde, gušteraču, spolne žlijezde, maternicu (pomoćne spolne organe), (kožu), žučni mjehur (ako postoji), jednjak, želudac, dvanaesnik, tašto crijevo, vito crijevo, slijepo crijevo, debelo crijevo, rektum, mokraćni mjehur, reprezentativni limfni čvor (ženska mliječna žlijezda), (muskulaturu bedra), periferni živac, (oči), prsnu kost s koštanom srži, (bedrenu kost – uključujući površinu zgloba), (leđnu moždinu na tri razine: cervikalnoj/vratnoj, srednjoj torakalnoj/prsnoj i lumbalnoj/slabinskoj). Tkiva navedena u zagradama treba pregledati samo ako na to ukazuju znakovi toksičnosti ili ako su u pitanju ciljni organi.
|
(a) |
Kompletne histopatološke pretrage treba napraviti na dišnom traktu i drugim organima i tkivima svih životinja iz kontrolne skupine i skupina tretiranih visokim dozama. |
|
(b) |
Treba pregledati sve velike lezije. |
|
(c) |
Treba pregledati ciljne organe kod skupina tretiranih ostalim dozama. |
|
(d) |
Ako se koriste štakori, pluća životinja iz skupina tretiranih niskim i srednjim dozama treba podvrgnuti histopatološkim pregledu, budući da se na taj način može donijeti odgovarajuća ocjena zdravstvenog stanja životinja. Uobičajena praksa ne nalaže daljnje histopatološke pretrage na životinjama iz tih skupina, ali moraju se uvijek obaviti na organima životinja iz skupine tretirane visokom dozom na kojima su vidljivi znakovi lezija. |
|
(e) |
Ako se koristi satelitska skupina, treba napraviti histopatološki pregled onih tkiva i organa na kojima su kod ostalih tretiranih skupina primijećene promjene. |
2. PODACI
Podatke je najbolje rezimirati u obliku tablice u kojoj za svaku testiranu skupinu životinja treba navesti broj životinja na početku ispitivanja, broj životinja kod kojih su se javile lezije, vrste lezija i za svaku vrstu lezija postotak životinja kod kojih su utvrđene. Dobivene rezultate treba analizirati prema odgovarajućoj statističkoj metodi. Može se koristiti bilo koja priznata statistička metoda.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju treba, ako je moguće, sadržavati sljedeće informacije:
|
— |
vrsta, soj i podrijetlo životinja, okolišni uvjeti, prehrana, |
|
— |
uvjeti ispitivanja: opis naprave za izlaganje, uključujući konstrukciju, tip, dimenzije, izvor zraka, sustav za generiranje čestica i aerosola, metodu kondicioniranja zraka, obradu ispušnog zraka i metodu smještanja životinja u ispitnoj komori u slučaju da se ona koristi. Treba opisati opremu za mjerenje temperature i, prema potrebi, vlažnosti zraka, te stabilnosti koncentracija ili veličine čestica aerosola. Podaci o izlaganju: ovi podaci trebaju biti navedeni u obliku tablice i prikazani kao srednje vrijednosti i mjera varijabilnosti (npr. standardno odstupanje) i po mogućnosti uključivati sljedeće:
|
|
— |
podaci o toksičkim reakcijama po spolu i koncentracijama, |
|
— |
visina doze kod koje nema toksičkih učinaka, kad je moguće, |
|
— |
vrijeme smrti tijekom studije, odnosno jesu li životinje preživjele do završetka studije, |
|
— |
opis toksičkih i drugih učinaka, |
|
— |
vrijeme opažanja svih znakova abnormalnosti i daljnjih promjena, |
|
— |
podaci o hrani i tjelesnoj masi, |
|
— |
oftalmološki nalazi, |
|
— |
obavljena hematološka ispitivanja i dobiveni rezultati, |
|
— |
obavljena klinička biokemijska ispitivanja i dobiveni rezultati (uključujući rezultate analize urina), |
|
— |
nalazi obdukcije, |
|
— |
detaljni opis svih histopatoloških nalaza, |
|
— |
statistička obrada rezultata, prema potrebi, |
|
— |
diskusija o rezultatima, |
|
— |
tumačenje rezultata. |
3.2. OCJENA I TUMAČENJE REZULTATA
Vidjeti Opći uvod, dio B.
4. REFERENCE
Vidjeti Opći uvod, dio B.
B.30. TEST KRONIČNE TOKSIČNOSTI
1. METODA
1.1. UVOD
Vidjeti Opći uvod, dio B.
1.2. DEFINICIJA
Vidjeti Opći uvod, dio B.
1.3. REFERENTNE TVARI
Nema ih.
1.4. NAČELO ISPITNE METODE
Obično se ispitivana tvar na odgovarajući način primjenjuje sedam dana tjedno na nekoliko skupina pokusnih životinja, jedna doza po skupini, kroz veći dio njihovog životnog vijeka. Za vrijeme i nakon izloženosti ispitivanoj tvari pokusne se životinje svakodnevno opažaju radi otkrivanja znakova toksičnosti.
1.5. KRITERIJI KVALITETE
Nema ih.
1.6. OPIS ISPITNE METODE
1.6.1. Priprema
Životinje se drže u pokusnim uvjetima s obzirom na smještaj i hranu najmanje pet dana prije ispitivanja. Zdrave mlade životinje prije ispitivanja se nasumce odabiru i raspoređuju u skupine koje će se tretirati i u kontrolne skupine.
1.6.2. Uvjeti ispitivanja
1.6.2.1.
Preporučena životinjska vrsta je štakor.
Na osnovi rezultata prijašnjih studija mogu se koristiti i druge vrste (glodavci ili neglodavci). Treba koristiti mlade zdrave životinje sojeva koji se obično koriste u laboratorijima, a primjena doza treba započeti što prije nakon odbijanja od sise.
Na početku ispitivanja raspon masa pojedinačnih životinja ne smije prelaziti ± 20 % od odgovarajuće srednje vrijednosti. U slučajevima kad se prije dugotrajne studije provodi preliminarna studija subkronične oralne toksičnosti, u obje studije treba koristiti životinje istog soja i istog podrijetla.
1.6.2.2.
Za svaku koncentraciju izlaganja treba upotrijebiti najmanje 40 životinja (20 ženki i 20 mužjaka). Ženke prethodno ne smiju imati potomstvo i ne smiju biti gravidne. Ako se planira usmrćivanje životinja u međuvremenu, prije završetka studije, navedeni broj treba povećati za broj životinja predviđen za takvo usmrćivanje.
Ako se koriste životinje koje ne spadaju u glodavce prihvatljiv je manji broj životinja, ali ih u svakoj skupini mora biti najmanje četiri od svakog spola.
1.6.2.3.
Treba primijeniti barem tri visine doza uz odgovarajuće istovremene kontrole. Najviša doza trebala bi pokazati jasne znakove toksičnosti, ne uzrokujući visoku stopu smrtnosti.
Najniža doza ne bi smjela izazvati nikakve znakove toksičnosti.
Srednja(-e) doza(-e) utvrđuje(-u) se u srednjem rasponu između visoke i niske doze.
Pri utvrđivanju visina doza treba uzeti u obzir podatke iz prijašnjih testova i studija toksičnosti.
Obično se životinje svakodnevno izlažu ispitivanoj tvari. Ako se kemikalija daje u vodi za piće ili se umiješa u hranu, voda i hrana moraju životinji stalno biti na raspolaganju.
1.6.2.4.
Istodobno treba koristiti kontrolnu skupinu koja je, izuzimajući izlaganje ispitivanoj tvari, u svakom pogledu jednaka tretiranoj skupini.
U posebnim okolnostima, kao na primjer kod inhalacijskih studija u kojima se koriste aerosoli ili kod oralnih studija u kojima se koriste emulgatori čije biološko djelovanje nije utvrđeno, istodobno se koristi i negativna kontrolna skupina. Negativna kontrolna skupina tretira se na isti način kao i pokusne skupine, samo što se životinje ne izlažu ispitivanoj tvari niti bilo kakvom nosaču.
1.6.2.5.
Dva glavna puta primjene su oralni i inhalacijski. Odabir puta primjene ovisi o fizikalnim i kemijskim karakteristikama ispitivane tvari i vjerojatnom načinu na koji joj ljudi bivaju izloženi.
Pri korištenju dermalnog puta primjene javljaju se mnogi praktični problemi. O kroničnoj sustavnoj toksičnosti koja bi proizašla iz perkutane apsorpcije ispitivane tvari obično se može izvesti zaključak iz rezultata nekog drugog ispitivanja gdje je korišten oralni put primjene i na temelju znanja o stupnju perkutane apsorpcije proizašlih iz prijašnjih ispitivanja perkutane toksičnosti.
1.6.2.6.
Tamo gdje se ispitivana tvar apsorbira iz gastrointestinalnog trakta, i gdje do izloženosti ljudi može doći ingestijom, najbolje je primijeniti oralni put primjene ako za to ne postoje kontraindikacije. Životinje mogu primiti ispitivanu tvar u hrani, rastopljenu u vodi za piće ili u kapsulama. Idealno bi bilo tvar dozirati svaki dan sedam dana u tjednu, budući da kod petodnevnog doziranja može doći do oporavka životinja ili povlačenja toksičnosti tijekom razdoblja u kojem se ispitivana tvar ne primjenjuje, što može utjecati na rezultate i kasnije ocjenjivanje. Međutim, prvenstveno iz praktičnih razloga, doziranje pet dana u tjednu smatra se prihvatljivim.
1.6.2.7.
Budući da studije u kojima se koristi inhalacijski put primjene uključuju tehničke probleme koji su složeniji od problema koji se javljaju kod studija u kojima se koriste drugi putevi primjene, o ovom načinu primjene ovdje su dane detaljnije smjernice. Mora se također napomenuti da u specifičnim situacijama intratrahealna instilacija (ukapavanje u dušnik) može biti prihvatljiva alternativa.
Režim dugotrajnog izlaganja obično se temelji na projiciranoj izloženosti ljudi, pri čemu se po ujednačenju koncentracija u komori životinje izlažu pet dana u tjednu po šest sati dnevno (izlaganje s prekidima) ili, vezano uz moguću okolišnu izloženost, sedam dana u tjednu po 22 do 24 sata dnevno (neprekidno izlaganje), pri čemu je oko jedan sat dnevno, otprilike u isto vrijeme, namijenjen za hranjenje životinja i održavanje komore.
U oba se slučaja životinje obično izlažu fiksnim koncentracijama ispitivane tvari. Glavna razlika između izlaganja s prekidima i neprekidnog izlaganja je u tome što prvi režim uključuje razdoblje od 17 do 18 sati u kojemu se životinje mogu oporaviti od djelovanja svakodnevnog izlaganja, i još duže razdoblje oporavka tijekom vikenda.
Odabir izlaganja s prekidima ili neprekidnog izlaganja ovisi o ciljevima studije i o izloženosti ljudi koju treba simulirati. Međutim, treba uzeti u obzir i određene teškoće tehničke prirode. Na primjer, prednosti neprekidne izloženosti u svrhu simuliranja okolišnih uvjeta može poništiti potreba za napajanjem i hranjenjem životinja tijekom izlaganja i potreba za složenijim (i pouzdanijim) tehnikama generiranja i praćenja aerosola i para.
1.6.2.8.
Životinje treba testirati u inhalacijskim komorama konstruiranim tako da održavaju dinamičan protok zraka s najmanje 12 izmjena zraka u jednom satu, kako bi se osigurala odgovarajuća koncentracija kisika i ravnomjerna distribucija atmosfere izlaganja. Kontrolne komore i komore za izlaganje moraju po konstrukciji biti jednake kako bi osigurale uvjete izlaganja koji su usporedivi u svakom pogledu, izuzev izloženosti ispitivanoj tvari. Obično se u komori održava lagani podtlak da bi se spriječilo istjecanje ispitivane tvari u okolni prostor. Komore trebaju biti takve da naguravanje životinja u njima bude minimalno. Za osiguravanje stabilnosti atmosfere u komori opće je pravilo da ukupan volumen pokusnih životinja ne smije biti veći od 5 % volumena komore.
Treba mjeriti i pratiti sljedeće parametre:
|
i. |
protok zraka: brzinu protoka zraka kroz komoru najbolje je pratiti neprekidno; |
|
ii. |
koncentracija: tijekom dnevnog izlaganja koncentracija ispitivane tvari ne smije varirati za više od ± 15 % od srednje vrijednosti; |
|
iii. |
temperatura i vlažnost zraka: za glodavce temperaturu u komori treba održavati na 22 ± 2 %, a vlažnost zraka na 30 do 70 %, osim ako se za suspendiranje ispitivane tvari u atmosferi komore koristi voda. Najbolje je i jedno i drugo pratiti bez prekida. |
|
iv. |
mjerenje veličine čestica: ako atmosfera u komori uključuje upotrebu tekućih ili čvrstih aerosola, treba utvrditi distribuciju veličine čestica. Čestice aerosola trebaju biti odgovarajuće veličine da ih pokusna životinja može udahnuti. Uzorke atmosfere u komori treba uzimati u zoni disanja životinja. Uzorak zraka mora biti reprezentativan za distribuciju čestica kojima su životinje izložene i na gravimetrijskoj osnovi mora predstavljati sav suspendirani aerosol, čak i ako se veliki dio aerosola ne može udisati. Veličinu čestica treba često analizirati u početnoj fazi rada sustava za generiranje kako bi se osigurala stabilnost aerosola, a zatim tijekom izlaganja onoliko često koliko je potrebno da bi se pouzdano utvrdila postojanost distribucije čestica kojima se životinje izlažu. |
1.6.2.9.
Razdoblje primjene ispitivane tvari treba trajati najmanje 12 mjeseci.
1.6.3. Postupak
Najmanje jednom dnevno treba obaviti temeljiti klinički pregled. Dodatna opažanja treba obavljati jednom dnevno, uz poduzimanje odgovarajućih mjera kako bi se gubitak životinja u studiji sveo na minimum, npr. obdukcija ili pohranjivanje uginulih životinja u hladnjak i izolacija ili usmrćivanje slabih životinja i životinja na umoru. Životinje treba pozorno opažati da bi se otkrila pojava i razvijanje svih toksičkih učinaka, te da bi se gubitak životinja uslijed bolesti, autolize ili kanibalizma sveo na najmanju moguću mjeru.
Kliničke znakove, uključujući neurološke promjene i promjene na očima, kao i smrtnost, treba zabilježiti za sve životinje. Treba zabilježiti i vrijeme pojavljivanja i razvijanja toksičkog stanja kod životinja, uključujući i sumnju na tumore.
Tjelesnu masu treba bilježiti za svaku životinju pojedinačno, jednom tjedno tijekom prvih 13 tjedana razdoblja ispitivanja, a nakon toga najmanje jednom svaka četiri tjedna. Unos hrane treba mjeriti na tjednoj osnovi tijekom prvih 13 tjedana studije, a potom u intervalima od oko tri mjeseca ako promjene u zdravstvenom stanju i tjelesnoj masi ne nalažu drugačije.
Hematološki pregled (npr. sadržaj hemoglobina; ukupan broj krvnih stanica, ukupan broj eritrocita, ukupan broj leukocita, trombocita ili druga mjerenja za utvrđivanje potencijala za zgrušavanje) obavlja se nakon tri mjeseca, šest mjeseci, a nakon tog u intervalima od oko šest mjeseci i na kraju studije, na uzorcima krvi uzetima od svih neglodavaca i od 10 štakora po spolu iz svih skupina. Ako je moguće, u svakom bi intervalu trebalo uzimati uzorke od istih štakora. Osim toga, od neglodavaca treba uzeti po jedan uzorak prije testiranja.
Ako klinička opažanja tijekom studije ukažu na pogoršanje zdravlja životinja, kod oboljelih jedinki određuje se diferencijalna krvna slika.
Diferencijalna krvna slika određuje se na uzorcima uzetim od životinja u skupini tretiranoj najvišom dozom i na životinjama iz kontrolne skupine. Diferencijalna krvna slika određuje se za sljedeću nižu skupinu ili sljedeće niže skupine samo ako postoji veliko odstupanje između najviše skupine i kontrolnih skupina, ili zbog patoloških nalaza.
Za analizu treba uzeti uzorke urina od svih neglodavaca i od 10 štakora od svakog spola, ako je moguće od istih štakora i to u istim intervalima u kojima se obavljaju i hematološke pretrage. Na uzorcima uzetima od svake životinje pojedinačno ili na skupnom uzorku uzetom po spolu ili skupini treba napraviti sljedeće pretrage:
|
— |
izgled: volumen i gustoća za pojedinačne životinje, |
|
— |
protein, glukoza, ketoni, skriveno krvarenje (polukvantitativno), |
|
— |
mikroskopski pregled sedimenta (polukvantitativno). |
U razmacima od oko šest mjeseci i na kraju, za kliničke kemijske pretrage uzimaju se uzorci krvi svih neglodavaca i 10 štakora od svakog spola iz svih skupina, po mogućnosti svaki put od istih štakora. Osim toga, od neglodavaca se uzimaju uzorci za preliminarne testove. Od tih se uzoraka priprema plazma i obavljaju se slijedeće pretrage:
|
— |
koncentracija ukupnih proteina, |
|
— |
koncentracija albumina, |
|
— |
pretrage jetrenih funkcija (kao što je aktivnost alkalne fosfataze, glutamat-piruvat transaminaze (8) i glutamat-oksaloacetat transaminaze (9), gama-glutamil transpeptidaze, ornitin dekarboksilaze, |
|
— |
metabolizam ugljikohidrata kao što je glukoza u krvi natašte, |
|
— |
pretrage jetrenih funkcija kao što je dušik u ureji. |
Kompletnu obdukciju treba obaviti na svim životinjama, uključujući i one koje su uginule tijekom pokusa ili su bile usmrćene jer su bile na umoru. Prije usmrćivanja od svih životinja treba uzeti uzorke krvi za diferencijalnu krvnu sliku. Sve makroskopski vidljive lezije, tumore ili lezije za koje se sumnja da su tumori, treba sačuvati. Treba pokušati povezati makroskopska opažanja s mikroskopskim nalazima.
Sve organe i tkiva treba sačuvati za histopatološki pregled. To obično vrijedi za sljedeće organe i tkiva: mozak (10) (medula/most, kora malog i velikog mozga) hipofiza, štitnjača (uključujući paratiroidnu žlijezdu), prsna žlijezda, pluća (uključujući dušnik), srce, aorta, žlijezde slinovnice, jetra (10), slezena, bubrezi (10), nadbubrežne žlijezde (10), jednjak, želudac, dvanaesnik, tašto crijevo, vito crijevo, slijepo crijevo, debelo crijevo, rektum, maternica, mokraćni mjehur, limfni čvorovi, gušterača, spolne žlijezde (10), pomoćni spolni organi, ženska mliječna žlijezda, koža, mišići, periferni živac, leđna moždina (vratna, prsna, slabinska), prsna kost s koštanom srži i bedrena kost (uključujući zglob) i oči. Inflacija pluća i mokraćnog mjehura fiksativom (upuhivanje fiksativa u pluća i mokraćni mjehur) najbolji je način za konzerviranje tih tkiva; u inhalacijskim studijama inflacija pluća je ključna za odgovarajući histopatološki pregled. U posebnim studijama kao što su inhalacijske studije, treba proučiti cijeli dišni trakt, uključujući nos, ždrijelo i grkljan.
Ako se obavljaju druge kliničke pretrage, informacije dobivene tim postupcima trebaju biti raspoložive prije mikroskopskog pregleda, budući da patologu mogu poslužiti kao značajne smjernice.
Sve vidljive promjene, posebno tumore i druge lezije koje se pojave na bilo kojem organu, treba mikroskopski pregledati. Osim toga, preporučuju se sljedeći postupci:
|
(a) |
mikroskopski pregled svih sačuvanih organa i tkiva s kompletnim opisom svih lezija nađenih kod:
|
|
(b) |
organi ili tkiva s vidljivim abnormalnostima koje je prouzročila ili vjerojatno prouzročila ispitivana tvar isto se tako pregledavaju i kod životinja iz skupina tretiranih nižim dozama; |
|
(c) |
ako rezultati ispitivanja dokazuju značajno skraćenje normalnog životnog vijeka životinje ili izazivanje učinaka koji bi mogli utjecati na toksičku reakciju, na gore opisani način treba ispitati sljedeću nižu dozu; |
|
(d) |
Podaci o nastanku lezija do kojih obično dolazi, u istim laboratorijskim uvjetima, kod soja životinja koji je bio korišten u pokusu, odnosno kontrolni podaci iz prijašnjih studija, neophodni su za ispravnu procjenu značaja promjena opaženih kod tretiranih životinja. |
2. PODACI
Podatke treba rezimirati u obliku tablice u kojoj će za svaku testiranu skupinu biti naveden broj životinja na početku ispitivanja, broj životinja kod kojih su se javile lezije i postotak životinja koje pokazuju određene vrste lezija. Podatke treba ocijeniti uz primjenu odgovarajućih statističkih metoda. Može se primijeniti bilo koja priznata statistička metoda.
3. IZVJEŠĆIVANJE
IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju treba, ako je moguće, sadržavati sljedeće informacije:
|
— |
vrsta, soj i podrijetlo životinja, okolišni uvjeti, prehrana, |
|
— |
uvjeti ispitivanja: opis naprave za izlaganje: uključujući konstrukciju, tip, dimenzije, izvor zraka, sustav za generiranje čestica i aerosola, metodu kondicioniranja zraka, obradu ispušnog zraka i metodu smještanja životinja u ispitnoj komori u slučaju da se ona koristi. Treba opisati opremu za mjerenje temperature, vlažnosti zraka, te koncentracije i distribucije veličine čestica aerosola. Podaci o izlaganju: ovi podaci trebaju biti navedeni u obliku tablice i prikazani kao srednje vrijednosti i mjera varijabilnosti (npr. standardno odstupanje) i po mogućnosti uključivati sljedeće:
|
|
— |
visine doza (uključujući nosač, ako je korišten) i koncentracije, |
|
— |
podaci o toksičkim reakcijama po spolu i koncentracijama, |
|
— |
visina doze kod koje nema toksičkih učinaka, |
|
— |
vrijeme smrti tijekom studije, odnosno jesu li životinje preživjele do završetka studije, |
|
— |
opis toksičkih i drugih učinaka, |
|
— |
vrijeme opažanja svih znakova abnormalnosti i daljnjih promjena, |
|
— |
podaci o hrani i tjelesnoj masi, |
|
— |
oftalmološki nalazi, |
|
— |
obavljena hematološka ispitivanja i svi rezultati, |
|
— |
obavljena klinička biokemijska ispitivanja i svi rezultati (uključujući rezultate analize urina), |
|
— |
nalazi obdukcije, |
|
— |
detaljni opis svih histopatoloških nalaza, |
|
— |
statistička obrada rezultata, prema potrebi, |
|
— |
diskusija o rezultatima, |
|
— |
tumačenje rezultata. |
3.2. OCJENA I TUMAČENJE REZULTATA
Vidjeti Opći uvod, dio B.
4. REFERENCE
Vidjeti Opći uvod, dio B.
B.31. STUDIJA PRENATALNE RAZVOJNE TOKSIČNOSTI
1. METODA
Ova je metoda istovjetna metodi OECD TG 414 (2001.).
1.1. UVOD
Ova metoda za ispitivanje razvojne toksičnosti namijenjena je za dobivanje općih podataka o učincima prenatalne izloženosti na gravidnu pokusnu životinju i na organizam koji se razvija u maternici; tu može biti uključena procjena učinaka na majku, kao i smrt, strukturne abnormalnosti ili promijenjeni rast fetusa. Funkcionalni nedostaci, iako čine važan dio razvoja, nisu sastavni dio ove ispitne metode. Oni se mogu ispitivati u nekoj drugoj studiji ili kao dodatak ovaj studiji, uz primjenu metode ispitivanja razvojne neurotoksičnosti. Radi informiranja o ispitivanju funkcionalnih nedostataka i drugih postnatalnih učinaka treba razmotriti ispitnu metodu za studiju dvogeneracijske reproduktivne toksičnosti ili studiju razvojne neurotoksičnosti, prema potrebi.
Ova ispitna metoda može u pojedinačnim slučajevima zahtijevati posebne prilagodbe na osnovi posebnih saznanja o npr. fizikalno kemijskim ili toksikološkim svojstvima ispitivane tvari. Takva je prilagodba prihvatljiva ako uvjerljivi znanstveni dokazi pokazuju da će se testom nakon prilagodbe dobiti više informacija. U takvom slučaju, spomenute znanstvene dokaze treba temeljito dokumentirani u studiji.
1.2. DEFINICIJE
Razvojna toksikologija: studija o štetnim učincima na organizam u razvoju, koji mogu biti posljedica izlaganja prije začeća, tijekom prenatalnog razvoja ili postnatalno do vremena spolne zrelosti. Glavne manifestacije razvojne toksičnosti uključuju: 1. smrt organizma, 2. strukturne abnormalnosti, 3. promijenjen rast, 4. funkcionalne nedostatke. Razvojna toksikologija prije se često nazivala teratologijom.
Štetni učinak: svaka promjena normalnih vrijednosti povezana s tretiranjem, koja umanjuje sposobnost organizma za preživljavanje, razmnožavanje ili prilagođavanje okolišu. Kad je povezan s razvojnom toksikologijom, ovaj pojam u najširem smislu obuhvaća svaki učinak koji sprečava normalan razvoj konceptusa prije i nakon rođenja.
Promijenjen rast: promjena mase ili veličine organa ili tijela potomka.
Promjene (anomalije): strukturne promjene u razvoju koje uključuju i malformacije i varijacije.
Malformacija/velika abnormalnost: strukturna promjena koja se smatra štetnom za životinju (može isto tako biti i smrtonosna) koja se obično rijetko javlja.
Varijacija/manja abnormalnost: strukturna promjena za koju se smatra da ima neznatan ili nikakav štetni učinak na životinju; može biti privremena i relativno često se može pojaviti u kontrolnoj populaciji.
Konceptus (zametak): ukupni derivati oplođenog jajašca u bilo kojoj fazi razvoja od oplodnje do rođenja, uključujući izvanembrionalne ovojnice, kao i embrij ili fetus.
Implantacija (nidacija): pričvršćenje blastociste za epitelni sloj maternice, uključujući njezino prodiranje kroz epitel maternice i ugnježđenje u endometrij.
Embrij: rana ili razvojna faza bilo kojeg organizma, posebno razvojni produkt oplodnje jajašca nakon pojave uzdužne osi i do nastanka svih glavnih struktura.
Embriotoksičnost: toksičnost koja ima štetni učinak na normalnu strukturu, razvoj, rast i/ili sposobnost preživljavanja embrija.
Fetus: nerođeni potomak u post-embrionalnoj fazi.
Fetotoksičnost: toksičnost koja ima štetni učinak na normalnu strukturu, razvoj, rast i/ili sposobnost preživljavanja fetusa.
Pobačaj: prijevremeno izbacivanje proizvoda začeća iz maternice: embrija ili fetusa koji nije sposoban za preživljavanje.
Resorpcija: pojava kad se konceptus, koji odumre nakon ugnježđenja u maternicu, resorbira ili je već resorbiran.
Rana resorpcija: dokaz o implantiranju bez prepoznatljivog embrija/fetusa.
Kasna resorpcija: mrtvi embrij ili fetus s vanjskim degenerativnim promjenama.
NOAEL: skraćenica za visinu doze bez vidljivih štetnih učinaka (No Observed Adverse Effect Level) i najviša je doza pri kojoj se ne opažaju nikakvi štetni učinci vezani uz tretiranje.
1.3. REFERENTNE TVARI
Nema ih.
1.4. NAČELO ISPITNE METODE
Obično se ispitivana tvar daje gravidnim životinjama najmanje od implantacije do jednog dana prije dana planiranog usmrćivanja, koji mora biti što bliži danu normalnog poroda bez rizika od gubitka podataka zbog preranog poroda. Ova ispitna metoda nije namijenjena samo za ispitivanje razdoblja organogeneze (tj. 5-15 dana kod glodavaca i 6-18 dana kod kunića), nego i za ispitivanje učinaka od vremena prije implantacije, prema potrebi, kroz cijelo razdoblje gestacije do dana koji prethodi carskom rezu. Neposredno prije carskog reza ženke se usmrćuju, sadržaj maternice pregledava, a kod ploda se traže vanjske vidljive anomalije, kao i promjene na mekim tkivima i kosturu.
1.5. OPIS ISPITNE METODE
1.5.1. Odabir životinjske vrste
Preporuča se da se ispitivanje obavlja na najrelevantnijim vrstama, te da se upotrebljavaju laboratorijske vrste i sojevi koji se obično koriste za ispitivanja prenatalne razvojne toksičnosti. Preporučena vrsta glodavca je štakor, a preporučena vrsta neglodavca je kunić. Kad god se koriste životinje drugih vrsta, treba navesti opravdane razloge.
1.5.2. Uvjeti smještaja i hranjenja životinja
Temperatura u prostoriji gdje se drže pokusne životinje treba biti 22 °C (± 3 °C) za glodavce i 18 °C (± 3 °C) za kuniće. Iako bi relativna vlažnost zraka trebala biti najmanje 30 % i po mogućnosti ne prelaziti 70 % osim za vrijeme čišćenja prostorije, ciljna bi vrijednost trebala biti 50-60 %. Osvjetljenje treba biti umjetno i u slijedu se izmjenjivati 12 sati svjetla i 12 sati mraka. Što se hranjenja tiče, može se primjenjivati uobičajena laboratorijska prehrana uz neograničene količine vode za piće.
Postupak parenja treba provoditi u kavezima koji su prikladni za tu svrhu. Iako je životinje koje su se parile najbolje smjestiti pojedinačno, prihvatljiv je i smještaj u malim skupinama.
1.5.3. Priprema životinja
Treba koristiti zdrave životinje koje su se barem 5 dana privikavale na laboratorijske uvjete i koje prethodno nisu bile podvrgavane ispitnim postupcima. Pokusne životinje treba okarakterizirati s obzirom na njihovu vrstu, soj, podrijetlo, spol, tjelesnu masu i/ili dob. Tjelesna bi masa i starost životinja u svim pokusnim skupinama trebala biti ujednačena u najvećoj mogućoj mjeri. Za svaku visinu doze treba koristiti mlade odrasle ženke koje još nisu imale potomstvo. Ženke se trebaju pariti s mužjacima iste vrste i soja, a parenje između braće i sestara treba izbjegavati. Kod glodavaca nulti dan gestacije je dan kad se opazi vaginalni čep i/ili sperma; za kuniće je nulti dan obično dan koitusa ili umjetne oplodnje, ako se primjenjuje ta tehnika. Parene ženke treba nasumično rasporediti u kontrolne skupine i skupine koje će se tretirati. Kaveze treba rasporediti na način da se učinci do kojih bi moglo doći zbog njihovog položaja svedu na minimum. Svakoj se životinji dodjeljuje jedinstveni identifikacijski broj. Parene ženke se nasumično raspoređuju u kontrolne skupine i skupine koje će se tretirati, a ako su se parile skupno, životinje iz svake skupine jednakomjerno treba rasporediti u skupine za tretiranje i kontrolu. Isto tako, ženke koje je oplodio isti mužjak treba ujednačeno rasporediti po skupinama.
1.6. POSTUPAK
1.6.1. Broj i spol životinja
Svaka ispitivana i kontrolna skupina treba sadržavati dovoljan broj ženki koji će za obdukciju osigurati oko 20 ženki s implantima. Skupine s manje od 16 životinja s implantima mogu biti nedovoljne. Nije nužno da će smrtnost majki ugroziti studiju, pod uvjetom da nije viša od oko 10 %.
1.6.2. Priprema doza
Ako se radi lakšeg doziranja koristi nosač ili neki drugi dodatak, treba obratiti pozornost na sljedeće karakteristike: djelovanje na apsorpciju, distribuciju, metabolizam i zadržavanje ili izlučivanje ispitivane tvari; djelovanje na kemijska svojstva ispitivane tvari koja mogu izmijeniti njene toksičke karakteristike; djelovanje na unos hrane ili vode ili na uhranjenost životinja. Nosač ne smije imati toksično djelovanje u vrijeme razvoja niti smije djelovati na reprodukciju.
1.6.3. Doziranje
Obično se ispitivana tvar primjenjuje svakodnevno, od implantacije (npr. 5. dan nakon parenja) do dana prije planiranog carskog reza. Ako preliminarne studije, kada se rade, ne upućuju na veliku vjerojatnost predimplantacijskoga gubitka, tretiranje se može produžiti kroz cijelo razdoblje gestacije, od parenja do dana koji prethodi planiranom usmrćivanju. Dobro je poznato da neprimjereno postupanje ili stres tijekom gravidnosti mogu dovesti do prenatalnih gubitaka. Radi zaštite od prenatalnoga gubitka uslijed faktora nevezanih uz tretiranje, treba izbjegavati nepotrebno rukovanje gravidnim životinjama, kao i stres izazvan vanjskim faktorima kao što je buka.
Koriste se najmanje tri visine doze i parelelna kontrola. Zdrave životinje nasumce se raspoređuju u kontrolne skupine i skupine za tretiranje. Doze različitih visina treba primijeniti u određenim vremenskim razmacima kako bi se dobila gradacija toksičkog učinka. Ako nije ograničena fizikalno kemijskom prirodom ili biološkim svojstvima ispitivane tvari, najviša doza odabire se s ciljem da izazove određenu razvojnu toksičnost i/ili toksičnost za majku (klinički znakovi ili smanjenje tjelesne mase), ali ne i smrt ili tešku patnju životinja. Najmanje jedna od srednjih doza treba proizvesti minimalne toksične učinke koji se mogu promatrati. Najniža doza ne smije proizvesti nikakav dokaz toksičnosti, niti za majku niti za plod u razvoju. Nakon toga treba odabrati niz sve nižih doza kako bi se pokazale sve reakcije vezane uz doziranje, i na kraju najnižu dozu kod koje nema vidljivih toksičkih učinaka (NOAEL). Za utvrđivanje slijeda silaznih doza često je najbolje doze primijeniti u dva do četiri kraća intervala te je često bolje dodati četvrtu ispitnu skupinu nego između dva doziranja imati jako dugi interval (npr. faktor veći od 10). Iako je cilj utvrđivanje NOAEL-a za majku, studije u kojima se ta visina doze ne utvrđuje mogu isto tako biti prihvatljive (1).
Visine doza treba birati uzimajući u obzir postojeće podatke o toksičnosti, kao i dodatne informacije o metabolizmu i toksikinetici ispitivane tvari ili srodnih materijala. Te će informacije također biti od pomoći kod dokazivanja primjerenosti režima doziranja.
Istodobno treba koristiti i kontrolnu skupinu. Ta skupina treba biti placebo kontrolna skupina ili kontrolna skupina tretirana samo nosačem, ako se kod primjene ispitivane tvari koristi nosač. Svim skupinama treba dozirati isti volumen ispitivane tvari ili nosača. Sa životinjama u kontrolnim skupinama treba postupati na jednak način kao sa životinjama u tretiranim skupinama. Kontrolne skupine tretirane nosačem trebaju primiti najvišu korištenu količinu nosača (kao i skupina tretirana najnižom dozom ispitivane tvari).
1.6.4. Granični test
Ako test pri jednoj visini doze od najmanje 1 000 mg/kg tjelesne mase/dan, koja se primjenjuje oralno prema postupku opisanom za ovu studiju, ne proizvede vidljive toksičke učinke niti kod gravidnih ženki niti kod njihovog potomstva i ako se učinci ne očekuju na temelju postojećih podataka (npr. o strukturno i/ili metabolički srodnim spojevima) potpuna studija uz primjenu tri visine doza može se smatrati nepotrebnom. Očekivana ljudska izloženost može ukazati na potrebu da se u graničnom testu primijeni viša oralna doza. Za druge vrste primjene, kao što su inhalacijska i dermalna, fizikalno-kemijska svojstva ispitivane tvari često mogu indicirati ili ograničavati najvišu moguću razinu izloženosti (na primjer, dermalna primjena ne smije uzrokovati jaku lokalnu toksičnost).
1.6.5. Primjena doza
Ispitivana tvar ili nosač obično se primjenjuje oralno, intubacijom. Ako se koristi drugi put primjene, osoba koja obavlja test mora opravdati i obrazložiti svoj izbor, a možda će biti potrebne i odgovarajuće izmjene (2)(3)(4). Ispitivanu tvar treba primjenjivati svakog dana po prilici u isto vrijeme.
Doza koja se daje pojedinačnim životinjama obično se temelji na zadnje izmjerenoj tjelesnoj masi. Međutim, kod prilagođavanja doze tijekom posljednje trećine gravidnosti potreban je oprez. Kod odabira doze treba koristiti postojeće podatke kako bi se spriječila previsoka toksičnost za majku. Međutim, ako se kod tretiranih ženki opazi previsoka toksičnost, te životinje treba humano usmrtiti. Ako nekolicina gravidnih životinja pokaže znakove previsoke toksičnosti, treba razmotriti prekid pokusa na skupini koja prima tu dozu. Ako se tvar primjenjuje oralnom intubacijom, najbolje je životinjama dati jednu dozu pomoću želučane sonde ili odgovarajuće intubacijske kanile. Maksimalni volumen tekućine koji se može primijeniti odjednom ovisi o veličini pokusne životinje. Taj volumen ne smije biti veći od 1 ml/100 g tjelesne mase, osim kad se radi o vodenim otopinama koje dopuštaju primjenu volumena od 2 ml/100 g tjelesne mase. Ako se kao nosač koristi kukuruzno ulje, taj volumen ne smije biti veći od 0,4 ml/100 g tjelesne mase. Variranje ispitnih volumena treba svesti na minimum podešavanjem koncentracije, kako bi se kod svih visina doza osigurao stalni volumen.
1.6.6. Opažanje ženki
Klinička opažanja treba obavljati i bilježiti barem jednom dnevno, najbolje svaki dan u isto vrijeme, uzimajući u obzir vršno razdoblje predviđenog djelovanja nakon doziranja. Bilježi se stanje životinja, uključujući smrtnost, stanje umiranja, relevantne promjene u ponašanju i sve jasne znakove toksičnosti.
1.6.7. Tjelesna masa i unos hrane
Životinje treba vagati na nulti ili najkasnije treći dan gestacije u slučaju da vanjski uzgajivač isporučuje već parene životinje, zatim prvi dan doziranja, tijekom razdoblja doziranja najmanje svaki treći dan i na dan predviđenog usmrćivanja.
Unos hrane treba bilježiti u trodnevnim intervalima, na iste dane kad se mjeri i tjelesna masa životinja.
1.6.8. Pregled post-mortem
Ženke treba usmrtiti jedan dan prije očekivanog dana koćenja. Ženke koje pokazuju simptome pobačaja ili preranog koćenja prije planiranog usmrćivanja treba usmrtiti i podvrgnuti temeljitom makroskopskom pregledu.
Na kraju studije ili u slučaju smrti u tijeku studije, ženke treba maksroskopski pregledati radi otkrivanja bilo kakvih strukturnih abnormalnosti ili patoloških promjena. Ocjenjivanje stanja majki tijekom carskog reza i naknadne analize fetusa treba po mogućnosti obaviti ne znajući kojoj tretiranoj skupini pripadaju, kako bi se pristranost pri donošenju ocjene svela na minimum.
1.6.9. Pregled sadržaja maternice
Odmah po svršetku studije, odnosno čim je prije moguće nakon smrti, treba odstraniti maternice i utvrditi stanje gravidnosti životinja. Maternice koje ne izgledaju gravidne treba dalje pregledati (npr. bojenje amonijevim sulfidom kod glodavaca i bojenje metodom po Salewskom ili nekom drugom prikladnom metodom kod kunića) kako bi se potvrdilo da nema graviditeta (5).
Gravidne maternice, uključujući cerviks (vrat maternice) treba izvagati. Masa gravidne maternice ne mjeri se kod životinja koje su uginule tijekom studije.
Kod gravidnih životinja utvrđuje se broj žutih tijela (corpora lutea).
Kod sadržaja maternice utvrđuje se broj mrtvih embrija ili fetusa i broj fetusa sposobnih za preživljavanje. Da bi se procijenilo relativno vrijeme smrti zametka (vidjeti odjeljak 1.2.) treba opisati stupanj resorpcije.
1.6.10. Pregled fetusa
Treba utvrditi spol i tjelesnu masu svakog fetusa.
Svaki se fetus pregledava radi utvrđivanja vanjskih promjena (6).
Pregledom se kod fetusa utvrđuju promjene na kosturu i mekim tkivima (npr. varijacije i malformacije ili anomalije) (7)(8)(9)(10)(11)(12)(13)(14)(15)(16)(17)(18)(19)(20)(21)(22) (23)(24). Kategorizacija fetalnih promjena je poželjna, ali se ne zahtijeva. Ako se radi kategorizacija, jasno treba navesti kriterije za utvrđivanje svake kategorije. Posebnu pozornost treba posvetiti reproduktivnom traktu koji se pregledava kako bi se utvrdili mogući znakovi promijenjenog razvoja.
Kod glodavaca treba pripremiti oko polovine svakog legla i pregledom utvrditi promjene na kostima. Na ostatku legla pregledom se utvrđuju promjene na mekim tkivima, uz primjenu prihvaćenih i odgovarajućih metoda serijskih rezova ili tehnika preciznog makroskopskog seciranja.
Kod neglodavaca, npr. kunića, kod svih se fetusa pregledom utvrđuju promjene na mekim tkivima i na kostima. Na tijelima tih fetusa promjene na mekim tkivima utvrđuju se preciznim seciranjem koje može uključivati i postupke za daljnju analizu unutarnje strukture srca (25). Glave polovice fetusa pregledanih na ovaj način treba odstraniti i obraditi za analizu promjena na mekim tkivima (uključujući oči, mozak, nosne šupljine i jezik) uz primjenu standardnih metoda serijskih rezova (26) ili neke druge jednako osjetljive metode. Tijela tih fetusa i preostale cijele fetuse treba obraditi i pregledati radi utvrđivanja promjena na kostima, uz primjenu istih metoda koje su opisane za glodavce.
2. PODACI
2.1. OBRADA REZULTATA
Podaci se bilježe pojedinačno za svaku ženku kao i za njeno potomstvo i rezimiraju u obliku tablice, gdje se za svaku pokusnu skupinu i svaku generaciju navodi broj životinja na početku ispitivanja, broj životinja uginulih tijekom ispitivanja ili usmrćenih iz humanih razloga, vrijeme svake smrti, odnosno svakog humanog usmrćenja, broj gravidnih ženki, broj životinja koje pokazuju znakove toksičnosti, opis opaženih znakova toksičnosti, uključujući vrijeme pojavljivanja, trajanje i težinu svih toksičkih učinaka, vrste opažanja obavljenih na embrijima/fetusima i svi relevantni podaci o leglima.
Brojčani se rezultati ocjenjuju odgovarajućom statističkom metodom, pri čemu je leglo jedinica za analizu podataka. Treba upotrijebiti neku opće prihvaćenu statističku metodu; statističke metode se odabiru u okviru plana studije i njihov odabir treba obrazložiti. Podaci o životinjama koje nisu preživjele do planiranog usmrćivanja također se navode u izviješću. Ti se podaci mogu uključiti u srednje vrijednosti za skupinu tamo gdje je to relevantno. Relevantnost podataka dobivenih od takvih životinja, pa prema tome i uključivanje ili isključivanje iz srednjih vrijednosti za bilo koju skupinu, treba obrazložiti i ocijeniti na individualnoj osnovi.
2.2. OCJENA REZULTATA
Nalazi studije prenatalne razvojne toksičnosti ocjenjuju se u okviru promatranih učinaka. Ocjena obuhvaća slijedeće informacije:
|
— |
rezultate ispitivanja majke i embrija/fetusa, uključujući procjenu ili nepostojanje odnosa između izloženosti životinja ispitivanoj tvari i pojave i težine svih utvrđenih promjena, |
|
— |
kriterije korištene za kategorizaciju vanjskih promjena, promjena na mekim tkivima i kostima fetusa, ako je kategorizacija napravljena, |
|
— |
kad je primjereno, podatke o kontrolama iz ranijih ispitivanja, radi boljeg tumačenja rezultata studije, |
|
— |
brojeve upotrijebljene u izračunu svih postotaka ili indeksa, |
|
— |
odgovarajuću statističku analizu nalaza studije, tamo gdje je primjereno, koja treba obuhvaćati dovoljno informacija o metodi analize kako bi nezavisni revizor/statističar mogao ponovo rekonstruirati i ocijeniti analizu. |
U svakoj studiji koja pokazuje nepostojanje toksičkih učinaka treba razmotriti mogućnost daljnjeg istraživanja s ciljem utvrđivanja apsorpcije i bioraspoloživosti ispitivane tvari.
2.3. TUMAČENJE REZULTATA
Studija prenatalne razvojne toksičnosti dat će informacije o učincima ponavljanog izlaganja ispitivanoj tvari tijekom gravidnosti na ženke i na intrauterini razvoj njihovih potomaka. Rezultate studije treba tumačiti zajedno s nalazima subkroničnih, reprodukcijskih, toksikokinetičkih i drugih studija. Kako je naglasak stavljen i na opću toksičnost, u smislu toksičnosti za majku, i na konačne toksične učinke na razvoj potomstva, rezultati studije omogućuju da se do neke mjere razlikuju razvojni učinci koji se javljaju bez prisutnosti opće toksičnosti i onih koji se javljaju samo kod doza koje su toksične za majku (27).
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora obuhvaćati sljedeće specifične informacije:
|
|
ispitivana tvar:
|
|
|
Nosač (prema potrebi):
|
|
|
Pokusne životinje:
|
|
|
Uvjeti ispitivanja:
|
|
|
Rezultati: |
|
|
Podaci o toksičkim reakcijama majke po dozama, uključujući, no ne ograničavajući se na:
|
|
|
Konačni razvojni toksički učinci po dozama za legla s implantima, uključujući:
|
|
|
Krajnji razvojni učinci po dozama za legla sa živim fetusima, uključujući:
|
|
|
Diskusija o rezultatima. |
|
|
Zaključci. |
4. REFERENCE
|
(1) |
Kavlock R.J. et al., (1996) A Simulation Study of the Influence of Study Design on the Estimation of Benchmark Doses for Developmental Toxicity. Risk Analysis 16; str. 399-410. |
|
(2) |
Kimmel, C.A. and Francis, E.Z., (1990) Proceedings of the Workshop on the Acceptability and Interpretation of Dermal Developmental Toxicity Studies. Fundamental and Applied Toxicology 14; str. 386-398. |
|
(3) |
Wong, B.A., et al., (1997) Developing Specialised Inhalation Exposure Systems to Address Toxicological Problems. CIIT Activities 17; str. 1-8. |
|
(4) |
US Environmental Protection Agency, (1985) Subpart E-Specific Organ/Tissue Toxicity, 40 CFR 798.4350: Inhalation Developmental Toxicity Study. |
|
(5) |
Salewski, E., (1964) Faerbermethode zum Makroskopischen Nachweis von Implantations Stellen am Uterusder Ratte. Naunyn-Schmeidebergs Archiv fur Pharmakologie und Experimentelle Pathologie, 247, 367. |
|
(6) |
Edwards, J.A., (1968) The external Development of the Rabbit and Rat Embryo. In Advances in Teratology. D.H.M. Woolam (ed.) Vol. 3. Academic Press, NY. |
|
(7) |
Inouye, M. (1976) Differential Staining of Cartilage and Bone in Fetal Mouse Skeleton by Alcian Blue and Alizarin Red S. Congenital Anomalies 16, str. 171-173. |
|
(8) |
Igarashi, E. et al., (1992) Frequency Of Spontaneous Axial Skeletal Variations Detected by the Double Staining Techniquefor Ossified and Cartilaginous Skeleton in Rat Foetuses. Congenital Anomalies 32, str. 381-391. |
|
(9) |
Kimmel, C.A. et al. (1993) Skeletal Development Following Heat Exposure in the Rat. Teratology, 47 str. 229-242. |
|
(10) |
Marr, M.C. et al. (1988) Comparison of Single and Double Staining for Evaluation of Skeletal Development: The Effects of Ethylene Glycol (EG) in CD Rats. Teratology 37; 476. |
|
(11) |
Barrow, M.V. and Taylor, W.J. (1969) A Rapid Method for Detecting Malformations in Rat Foetuses. Journal of Morphology, 127, str. 291-306. |
|
(12) |
Fritz, H. (1974) Prenatal Ossification in Rabbits ss Indicative of Foetal Maturity. Teratology, 11 str. 313-320. |
|
(13) |
Gibson, J.P. et al. (1966) Use of the Rabbit in Teratogenicity Studies. Toxicology and Applied Pharmacology, 9, str. 398-408. |
|
(14) |
Kimmel, C.A. and Wilson, J.G. (1973) Skeletal Deviation in Rats: Malformations or Variations? Teratology, 8, str. 309-316. |
|
(15) |
Marr, M.C. et al. (1992) Developmental Stages of the CD (Sprague-Dawley) Rat Skeleton after Maternal Exposure to Ethylene Glycol. Teratology, 46, str. 169-181. |
|
(16) |
Monie, I.W. et al. (1965) Dissection Procedures for Rat Foetuses Permitting Alizarin Red Staining of Skeleton and Histological Study of Viscera. Supplement to Teratology Workshop Manual, str. 163-173. |
|
(17) |
Spark, C. and Dawson, A.B. (1928) The Order and Time of appearance of Centers of Ossification in the Fore and Hind Limbs of the Albino Rat, with Special Reference to the Possible Influence of the Sex Factor. American Journal of Anatomy, 41, str. 411-445. |
|
(18) |
Staples, R.E. and Schnell, V.L. (1964) Refinements in Rapid Clearing Technique in the KOH-Alizarin Red S Method for Fetal Bone. Stain Technology, 39, str. 61-63. |
|
(19) |
Strong, R.M. (1928) The Order Time and Rate of Ossification of the Albino Rat (Mus Norvegicus Albinus) Skeleton. American Journal of Anatomy, 36, str. 313-355. |
|
(20) |
Stuckhardt, J.L. and Poppe, S.M. (1984) Fresh Visceral Examination of Rat and Rabbit Foetuses Used in Teratogenicity Testing. Teratogenesis, Carcinogenesis, and Mutagenesis, 4, str. 181-188. |
|
(21) |
Walker, D.G. and Wirtschafter, Z.T. (1957) The Genesis of the Rat Skeleton. Thomas, Springfield, IL. |
|
(22) |
Wilson, J.G. (1965) Embryological Considerations in Teratology. In Teratology: Principles and Techniques, Wilson J.G. and Warkany J. (eds). University of Chicago, Chicago, IL, str. 251-277. |
|
(23) |
Wilson, J.G. and Fraser, F.C. (eds). (1977) Handbook of Teratology, Vol. 4. Plenum, NY. (24) Varnagy, L. (1980) Use of Recent Fetal Bone Staining Techniques in the Evaluation of Pesticide Teratogenicity. Acta Vet. Acad. Sci. Hung, 28, str. 233-239. |
|
(24) |
Varnagy, L. (1980) Use of Recent Fetal Bone Staining Techniques in the Evaluation of Pesticide Teratogenicity. Acta Vet. Acad. Sci. Hung, 28, str. 233-239. |
|
(25) |
Staples, R.E. (1974) Detection of visceral Alterations in Mammalian Foetuses. Teratology, 9, str. 37-38. |
|
(26) |
Van Julsingha, E.B. and C.G. Bennett (1977) A Dissecting Procedure for the Detection of Anomalies in the Rabbit Foetal Head. In: Methods in Prenatal Toxicology Neubert, D., Merker, H.J. and Kwasigroch, T.E. (eds.). University of Chicago, Chicago, IL, str. 126-144. |
|
(27) |
US Environmental Protection Agency (1991) Guidelines for Developmental Toxicity Risk Assessment. Federal Register, 56, str. 63798-63826. |
|
(28) |
Wise, D.L. et al. (1997) Terminology of Developmental Abnormalities in Common Laboratory Mammals (Version 1) Teratology, 55, str. 249-292. |
B.32. TEST KARCINOGENOSTI
1. METODA
1.1. UVOD
Vidjeti Opći uvod, dio B.
1.2. DEFINICIJE
Vidjeti Opći uvod, dio B.
1.3. REFERENTNE TVARI
Nema ih.
1.4. NAČELO ISPITNE METODE
Obično se ispitivana tvar na odgovarajući način primjenjuje sedam dana u tjednu na nekoliko skupina pokusnih životinja, jedna doza po skupini, veći dio njihovog životnog vijeka. Tijekom i nakon izlaganja ispitivanoj tvari životinje se svakodnevno opažaju kako bi se otkrili znakovi toksičnosti, posebno razvoj tumora.
1.5. KRITERIJI KVALITETE
Nema ih.
1.6. OPIS ISPITNE METODE
Životinje se drže i hrane u pokusnim uvjetima najmanje pet dana prije pokusa. Prije ispitivanja nasumce se odabiru zdrave mlade životinje i raspoređuju u kontrolne skupine i skupine za tretiranje.
1.6.1.
Na temelju rezultata ranije provedenih studija mogu se koristiti druge životinjske vrste (glodavci ili neglodavci). Treba koristiti mlade zdrave životinje sojeva koji se obično koriste u laboratorijima, a primjena doza treba započeti čim prije nakon odbijanja od sise.
Na početku studije raspon tjelesne mase životinja ne smije varirati za više od ± 20 % od srednje vrijednosti. Ako se prije dugotrajne studije preliminarno obavlja studija subkronične oralne toksičnosti, u obje studije treba upotrijebiti životinje iste vrste/pasmine i istog soja.
1.6.2.
Kad se radi o glodavcima, za svaku visinu doze i svaku paralelnu kontrolnu skupinu treba upotrijebiti najmanje 100 životinja (50 ženki i 50 mužjaka). Ženke prethodno ne smiju imati potomstvo i ne smiju biti gravidne. Ako se planira usmrćivanje životinja u međuvremenu, prije završetka studije, navedeni broj treba povećati za broj životinja predviđen za takvo usmrćivanje.
1.6.3.
Treba koristiti najmanje tri visine doza uz istovremene kontrole. Najviša doza treba izazvati znakove minimalne toksičnosti, kao što je lagano smanjenje u dobivanju na tjelesnoj masi (manje od 10 %), bez značajne promjene normalnog životnog vijeka izazvane toksičnim učincima koji ne uključuju tumore.
Najniža doza ne smije ometati normalan rast, razvoj i životni vijek životinje, niti izazvati bilo kakve znakove toksičnosti. Općenito ta doza ne bi smjela biti niža od 10 % visoke doze.
Srednju dozu ili doze treba utvrditi u sredini između visokih i niskih doza.
Pri odabiru visina doza treba uzeti u obzir podatke iz prijašnjih testova i studija toksičnosti.
Životinje se ispitivanoj tvari obično izlažu svaki dan.
Ako se kemikalija daje u vodi za piće ili se umiješa u hranu, voda i hrana moraju životinji stalno biti na raspolaganju.
1.6.4.
Paralelno treba koristiti kontrolnu skupinu koja je identična tretiranoj skupini u svakom pogledu, izuzev izlaganja ispitivanoj tvari.
U posebnim okolnostima, kao na primjer kod inhalacijskih studija u kojima se koriste aerosoli ili kod oralnih studija u kojima se koriste emulgatori čije biološko djelovanje nije poznato, treba koristiti dodatnu kontrolnu skupinu koja se ne izlaže nosaču.
1.6.5.
Tri glavna puta primjene su oralni, dermalni i inhalacijski. Odabir puta primjene ovisi o fizikalnim i kemijskim karakteristikama ispitivane tvari i vjerojatnog puta izlaganja kod ljudi.
1.6.5.1. Oralne studije
Tamo gdje se ispitivana tvar apsorbira iz gastrointestinalnog trakta i gdje do izloženosti ljudi može doći ingestijom, najbolje je primijeniti oralni put primjene ako za to ne postoje kontraindikacije. Životinje mogu primiti ispitivanu tvar u hrani, rastopljenu u vodi za piće ili u kapsulama.
Idealno bi bilo tvar dozirati svaki dan sedam dana u tjednu, budući da kod petodnevnog doziranja može doći do oporavka životinja ili povlačenja toksičnosti tijekom razdoblja u kojem se ispitivana tvar ne primjenjuje, što može utjecati na rezultate i kasnije ocjenjivanje. Međutim, prvenstveno iz praktičnih razloga, doziranje pet dana u tjednu smatra se prihvatljivim.
1.6.5.2. Dermalne studije
Perkutano izlaganje bojenjem kože može se odabrati za simulaciju glavnog puta izlaganja ljudi i kao modelni sustav za indukciju kožnih lezija.
1.6.5.3. Inhalacijske studije
Budući da studije tijekom kojih se koristi inhalacijski put primjene uključuju tehničke probleme koji su složeniji od problema koji se javljaju kod studija u kojima se koriste drugi putevi primjene, ovdje su dane detaljnije smjernice o ovom načinu primjene. Mora se također napomenuti, da u specifičnim situacijama intratrahealna instilacija (ukapavanje u dušnik) može biti prihvatljiva alternativa.
Režim dugotrajnog izlaganja obično se temelji na projiciranoj izloženosti ljudi, pri čemu se po ujednačenju koncentracija u komori životinje izlažu pet dana u tjednu po šest sati dnevno (izlaganje s prekidima) ili, vezano uz moguću okolišnu izloženost, sedam dana u tjednu po 22 do 24 sata dnevno (neprekidno izlaganje), pri čemu je oko jedan sat, otprilike u isto vrijeme svaki dan, namijenjen za hranjenje životinja i održavanje komore. U oba se slučaja životinje obično izlažu fiksnim koncentracijama ispitivane tvari. Glavna razlika između izlaganja s prekidima i neprekidnog izlaganja je u tome što prvi režim uključuje razdoblje od 17 do 18 sati u kojemu se životinje mogu oporaviti od djelovanja svakodnevnog izlaganja i još duže razdoblje oporavka tijekom vikenda.
Odabir izlaganja s prekidima ili neprekidnog izlaganja ovisi o ciljevima studije i o izloženosti ljudi koju treba simulirati. Međutim, treba uzeti u obzir i određene teškoće tehničke prirode. Na primjer, prednosti neprekidne izloženosti u svrhu simuliranja okolišnih uvjeta može poništiti potreba za napajanjem i hranjenjem životinja tijekom izlaganja i potreba za složenijim (i pouzdanijim) tehnikama generiranja i praćenja aerosola i para.
1.6.6.
Životinje treba testirati u inhalacijskim komorama konstruiranim tako da održavaju dinamičan protok zraka s najmanje 12 izmjena zraka u jednom satu, kako bi se osigurala odgovarajuća koncentracija kisika i ravnomjerna distribucija atmosfere izlaganja. Kontrolne komore i komore za izlaganje moraju po konstrukciji biti jednake kako bi osigurale uvjete izlaganja koji su usporedivi u svakom pogledu, izuzev izloženosti ispitivanoj tvari. Obično se u komori održava lagani podtlak da bi se spriječilo istjecanje ispitivane tvari u okolni prostor. Komore trebaju biti takve da naguravanje životinja u njima bude minimalno. Za osiguravanje stabilnosti atmosfere u komori opće je pravilo da ukupan volumen pokusnih životinja ne smije biti veći od 5 % volumena komore.
Treba mjeriti i pratiti sljedeće parametre:
|
i. |
protok zraka: brzinu protoka zraka kroz komoru najbolje je pratiti neprekidno; |
|
ii. |
koncentracija: tijekom dnevnog izlaganja koncentracija ispitivane tvari ne smije varirati za više od ± 15 % od srednje vrijednosti. Tijekom cijele studije dnevne koncentracije treba održavati stalnima koliko god je to praktički izvedivo; |
|
iii. |
temperatura i vlažnost zraka: za glodavce temperaturu u komori treba održavati na 22 ± 2 % °C, a vlažnost zraka na 30 do 70 %, osim ako se za suspendiranje ispitivane tvari u atmosferi komore koristi voda. Najbolje je i jedno i drugo pratiti bez prekida; |
|
iv. |
mjerenje veličine čestica: ako atmosfera u komori uključuje upotrebu tekućih ili čvrstih aerosola, treba utvrditi distribuciju veličine čestica. Čestice aerosola trebaju biti takve veličine da ih pokusna životinja može udahnuti. Uzorke atmosfere u komori treba uzimati u zoni disanja životinja. Uzorak zraka mora biti reprezentativan za distribuciju čestica kojima su životinje izložene i na gravimetrijskoj osnovi mora predstavljati sav suspendirani aerosol, čak i ako se veliki dio aerosola ne može udisati. Veličinu čestica treba često analizirati u početnoj fazi rada sustava za generiranje kako bi se osigurala stabilnost aerosola, a zatim tijekom izlaganja onoliko često koliko je potrebno da bi se pouzdano utvrdila postojanost distribucije čestica kojima se životinje izlažu. |
1.6.7.
Ispitivanje karcinogenosti obuhvaća veći dio normalnog životnog vijeka pokusnih životinja. Ispitivanja na miševima i hrčcima treba završiti nakon 18 mjeseci, a na štakorima nakon 24 mjeseca; međutim kod nekih sojeva životinja s duljim životnim vijekom i/ili niskom stopom pojave spontanih tumora, ispitivanja treba završiti nakon 24 mjeseca kad su u pitanju miševi i hrčci, odnosno nakon 30 mjeseci kad su u pitanju štakori. Druga prihvatljiva mogućnost je da se takva produžena studija okonča kad broj preživjelih životinja u kontrolnoj skupini ili u skupini tretiranoj najnižom dozom dosegne 25 %. Kad se završi ispitivanje kod kojeg postoji očita razlika u reakcijama po spolovima, svaki spol treba razmotriti zasebno. Ako zbog očite toksičnosti prijevremeno ugine samo skupina životinja tretirana najvišom dozom, to ne mora biti povod za prekid ispitivanja ako toksičke manifestacije ne izazivaju probleme u drugim skupinama. Da bi negativan rezultat bio prihvatljiv, nakon 18 mjeseci kad se radi o miševima i hrčcima i nakon 24 mjeseca kad su u pitanju štakori, gubitak uslijed autolize, kanibalizma ili problema pri rukovanju životinjama ne smije ni u jednoj skupini biti veći od 10 %, a stopa preživljavanja u svim skupinama ne smije biti manja od 50 %.
1.6.8. Postupak
1.6.8.1.
Dnevna opažanja životinja u kavezu trebaju obuhvaćati promjene na koži i dlaci, očima i sluznicama, na dišnom i cirkulacijskom sustavu, na autonomnom i centralnom živčanom sustavu, kao i promjene u somatomotoričkoj aktivnosti i obrascu ponašanja.
Redovito je opažanje životinja potrebno kako bi se osiguralo, koliko god je to moguće, da ne dođe do gubitka životinja uslijed kanibalizma, autolize tkiva ili pogrešnog smještanja. Kad se opaze životinje na umoru, treba ih ukloniti i podvrgnuti obdukciji.
Kliničke znakove i mortalitet treba bilježiti za sve životinje. Posebnu pozornost treba obratiti na razvoj tumora: treba zabilježiti vrijeme pojavljivanja; lokaciju, dimenzije, izgled i progresiju svakog tumora koji je vidljiv golim okom ili se može opipati.
Unos hrane treba mjeriti na tjednoj osnovi tijekom prvih 13 tjedana studije, a potom u intervalima od oko tri mjeseca ako promjene u zdravstvenom stanju i tjelesnoj masi ne nalažu drugačije.
Tjelesnu masu treba bilježiti pojedinačno za svaku životinju, jednom tjedno tijekom prvih 13 tjedana razdoblja ispitivanja, a nakon toga najmanje jednom svaka četiri tjedna.
1.6.8.2. Klinički pregledi
Ako se opažanjima životinja u kavezu tijekom studije utvrdi pogoršanje njihovog zdravlja, kod oboljelih životinja određuje se diferencijalna krvna slika.
Nakon 12 mjeseci, 18 mjeseci i neposredno prije usmrćivanja od životinja se uzima bris krvi. Diferencijalna krvna slika radi se na uzorcima uzetim od životinja iz skupine tretirane visokom dozom i od životinja iz kontrolne skupine. Ako se na temelju tih podataka, posebno onih dobivenih prije usmrćivanja, ili podataka dobivenih patološkim pregledom pokaže potrebnim, određuje se diferencijalna krvna slika i za skupinu tretiranu sljedećom nižom dozom.
Kompletnu obdukciju treba obaviti na svim životinjama, uključujući i one koje su uginule tijekom pokusa ili su bile usmrćene jer su bile na umoru. Sve makroskopski vidljive lezije, tumore ili lezije za koje se sumnja da su tumori, treba sačuvati.
Sljedeće organe i tkiva treba sačuvati u odgovarajućem mediju za mogući kasniji histopatološki pregled: mozak (uključujući dijelove medule/mosta, kore malog i velikog mozga), hipofizu, štitnjaču/paratiroidnu žlijezdu, tkivo prsne žlijezde, dušnik i pluća, srce, aortu, žlijezde slinovnice, jetru, slezenu, bubrege, nadbubrežne žlijezde, gušteraču, spolne žlijezde, maternicu, pomoćne spolne organe, kožu, jednjak, želudac, dvanaesnik, tašto crijevo, vito crijevo, slijepo crijevo, debelo crijevo, rektum, mokraćni mjehur, reprezentativni limfni čvor, žensku mliječnu žlijezdu, bedreni mišić, periferni živac, prsnu kost s koštanom srži, leđnu moždinu s tri dijela (vratnog, srednjeg prsnog i slabinskog) i oči.
Inflacija pluća i mokraćnog mjehura fiksativom (upuhivanje fiksativa u pluća i mokraćni mjehur) najbolji je način za konzerviranje tih tkiva. U studijama inhalacijske toksičnosti treba sačuvati cijeli dišni trakt, uključujući nosnu šupljinu, ždrijelo i grkljan.
|
(a) |
Kompletan histopatološki pregled treba obaviti na organima i tkivima svih životinja koje su uginule ili su bile usmrćene tijekom ispitivanja u kontrolnoj skupini i skupini tretiranoj visokom dozom; |
|
(b) |
kod svih skupina mikroskopski treba pregledati sve makroskopski vidljive tumore, odnosno lezije za koje su sumnja da bi mogle biti tumori; |
|
(c) |
ako postoji značajna razlika u incidenciji neoplastičnih lezija između skupine tretirane visokom dozom i kontrolne skupine, histopatološki pregled treba napraviti na istim organima ili tkivima i u drugim skupinama; |
|
(d) |
ako je stopa preživljavanja u skupini tretiranoj visokom dozom značajno niža nego u kontrolnoj skupini, kompletno treba pregledati i skupinu tretiranu sljedećom nižom dozom; |
|
(e) |
ako postoje dokazi o izazivanju toksičkih ili drugih učinaka u skupini tretiranoj visokom dozom koji bi mogli izazvati neoplastičku reakciju, kompletno treba pregledati i skupinu tretiranu sljedećom nižom dozom. |
2. PODACI
Podatke treba rezimirati u obliku tablice u kojoj će za svaku pokusnu skupinu biti naveden broj životinja na početku ispitivanja, broj životinja kod kojih su tijekom ispitivanja opaženi tumori, vrijeme otkrivanja tumora i broj životinja kod kojih su tumori nađeni nakon usmrćenja. Rezultate treba ocijeniti uz primjenu odgovarajućih statističkih metoda. Može se primijeniti bilo koja priznata statistička metoda.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju treba, ako je moguće, sadržavati sljedeće informacije:
|
— |
vrsta, soj i podrijetlo životinja, okolišni uvjeti, prehrana, |
|
— |
uvjeti ispitivanja: 3.1.1. Opis naprave za izlaganje: Uključujući konstrukciju, tip, dimenzije, izvor zraka, sustav za generiranje čestica i aerosola, metodu kondicioniranja zraka, obradu ispušnog zraka i metodu smještanja životinja u ispitnoj komori u slučaju da se ona koristi. Treba opisati opremu za mjerenje temperature, vlažnosti i, temo gdje je primjereno, stabilnosti koncentracije i veličine čestica aerosola. 3.1.2. Podaci o izlaganju: Ovi podaci trebaju biti prikazani u obliku tablice, kao srednje vrijednosti i mjere varijabilnosti (npr. standardno odstupanje) i po mogućnosti uključivati sljedeće:
|
|
— |
visine doza (uključujući nosač, ako je korišten) i koncentracije, |
|
— |
podaci o incidenciji tumora po spolu, dozi i tipu tumora, |
|
— |
vrijeme smrti tijekom studije, odnosno jesu li životinje preživjele do završetka studije, |
|
— |
podaci o toksičkim reakcijama po spolu i dozi, |
|
— |
opis toksičkih i drugih učinaka, |
|
— |
vrijeme opažanja svih znakova abnormalnosti i daljnjih promjena, |
|
— |
podaci o hrani i tjelesnoj masi, |
|
— |
obavljena hematološka ispitivanja i svi rezultati, |
|
— |
nalazi obdukcije, |
|
— |
detaljni opis svih histopatoloških nalaza, |
|
— |
statistička obrada rezultata i opis upotrijebljenih metoda, |
|
— |
diskusija o rezultatima, |
|
— |
tumačenje rezultata. |
3.2. OCJENA I TUMAČENJE REZULTATA
Vidjeti Opći uvod, dio B.
4. REFERENCE
Vidjeti Opći uvod, dio B.
B.33. KOMBINIRANI TEST KRONIČNE TOKSIČNOSTI/KARCINOGENOSTI
1. METODA
1.1. UVOD
Vidjeti Opći uvod, dio B.
1.2. DEFINICIJE
Vidjeti Opći uvod, dio B.
1.3. REFERENTNE TVARI
Nema ih.
1.4. NAČELO ISPITNE METODE
Cilj testa kombinirane kronične toksičnosti i karcinogenosti je utvrditi kronične i karcinogene učinke tvari kod sisavaca nakon produžene izloženosti.
U tu svrhu test karcinogenosti proširuje se najmanje na jednu tretiranu satelitsku skupinu i jednu kontrolnu satelitsku skupinu. Doza primijenjena na satelitsku skupinu za ispitivanje visoke doze može biti viša od doze koja se primjenjuje na skupinu za ispitivanje visoke doze u testu karcinogenosti. Životinje korištene u testu karcinogenosti pregledavaju se radi utvrđivanja znakova opće toksičnosti kao i karcinogenih reakcija. Kod životinja iz tretirane satelitske skupine pregledom se utvrđuju znakovi opće toksičnost.
Obično se ispitivana tvar na odgovarajući način primjenjuje sedam dana tjedno na nekoliko skupina pokusnih životinja, jedna doza po skupini, kroz veći dio njihovog životnog vijeka. Za vrijeme i nakon izloženosti ispitivanoj tvari pokusne se životinje svakodnevno opažaju radi otkrivanja znakova toksičnosti i pojave tumora.
1.5. KRITERIJI KVALITETE
Nema ih.
1.6. OPIS ISPITNE METODE
Životinje se drže u pokusnim uvjetima s obzirom na smještaj i hranu najmanje pet dana prije ispitivanja. Zdrave mlade životinje prije ispitivanja se nasumce odabiru i raspoređuju u skupine koje će se tretirati, kao i u kontrolne skupine.
1.6.1.
Preporučena životinjska vrsta je štakor. Na temelju rezultata prijašnjih studija mogu se koristiti i druge vrste (glodavci ili neglodavci). Treba koristiti mlade zdrave životinje sojeva koji se obično koriste u laboratorijima, a primjena doza treba započeti što prije nakon odbijanja od sise.
Na početku ispitivanja mase pojedinačnih životinja ne smiju varirati za više od ± 20 % od srednje vrijednosti. U slučajevima kad se prije dugotrajne studije provodi preliminarna studija subkronične oralne toksičnosti, u obje studije treba koristiti životinje iste vrste i iste pasmine/soja.
1.6.2.
Kad se radi o glodavcima, za svaku visinu doze i svaku paralelnu kontrolnu skupinu treba upotrijebiti najmanje 100 životinja (50 ženki i 50 mužjaka). Ženke prethodno ne smiju imati potomstvo i ne smiju biti gravidne. Ako se planira usmrćivanje životinja u međuvremenu, prije završetka studije, navedeni broj treba povećati za broj životinja predviđen za takvo usmrćivanje.
U satelitskoj skupini ili skupinama za ocjenjivanje drugih patoloških promjena, osim tumora, treba biti po 20 životinja od svakog spola, dok u satelitskoj kontrolnoj skupini treba biti po 10 životinja od svakog spola.
1.6.3.
Treba koristiti najmanje tri visine doza uz istovremene kontrole. Najviša doza treba izazvati znakove minimalne toksičnosti kao što je lagano smanjenje u dobivanju na tjelesnoj masi (manje od 10 %), bez značajne promjene normalnog životnog vijeka izazvane toksičnim učincima koji ne uključuju tumore.
Najniža doza ne smije ometati normalan rast, razvoj i životni vijek životinje, niti izazvati bilo kakve znakove toksičnosti. Općenito ta doza ne bi smjela biti niža od 10 % visoke doze.
Srednju dozu ili doze treba utvrditi u sredini između visokih i niskih doza.
Pri odabiru visina doza treba uzeti u obzir podatke iz prijašnjih testova i studija toksičnosti.
Za ispitivanje kronične toksičnosti u test se uključuju dodatne skupine koje se tretiraju i jedna paralelna kontrolna satelitska skupina. Visoka doza koja se primjenjuje na životinje u tretiranoj satelitskoj skupini treba izazvati jasne znakove toksičnosti.
Životinje se ispitivanoj tvari obično izlažu svaki dan.
Ako se kemikalija daje u vodi za piće ili umiješana u hranu, voda i hrana moraju životinji stalno biti na raspolaganju.
1.6.4.
Paralelno treba koristiti kontrolnu skupinu koje je identična tretiranoj skupini u svakom pogledu, izuzev izlaganja ispitivanoj tvari.
U posebnim okolnostima, kao na primjer kod inhalacijskih studija u kojima se koriste aerosoli ili kod oralnih studija u kojima se koriste emulgatori čije biološko djelovanje nije poznato, treba koristiti dodatnu kontrolnu skupinu koja se ne izlaže nosaču.
1.6.5.
Tri glavna puta primjene su oralni, dermalni i inhalacijski. Odabir puta primjene ovisi o fizikalnim i kemijskim karakteristikama ispitivane tvari i vjerojatnog puta izlaganja kod ljudi.
1.6.5.1. Oralni testovi
Tamo gdje se ispitivana tvar apsorbira iz gastrointestinalnog trakta, i gdje do izloženosti ljudi može doći ingestijom, najbolje je primijeniti oralni put primjene ako za to ne postoje kontraindikacije. Životinje mogu primiti ispitivanu tvar u hrani, rastopljenu u vodi za piće ili u kapsulama.
Idealno bi bilo tvar dozirati svaki dan sedam dana u tjednu, budući da kod petodnevnog doziranja može doći do oporavka životinja ili povlačenja toksičnosti tijekom razdoblja u kojem se ispitivana tvar ne primjenjuje, što može utjecati na rezultate i kasnije ocjenjivanje. Međutim, prvenstveno iz praktičnih razloga, doziranje pet dana u tjednu smatra se prihvatljivim.
1.6.5.2. Dermalni testovi
Perkutano izlaganje bojenjem kože može se odabrati za simulaciju glavnog puta izlaganja ljudi i kao modelni sustav za indukciju kožnih lezija.
1.6.5.3. Inhalacijski testovi
Budući da testovi kod kojih se koristi inhalacijski put primjene uključuju tehničke probleme koji su složeniji od problema koji se javljaju kod testova u kojima se koriste drugi putevi primjene, ovdje su dane detaljnije smjernice o ovom načinu primjene. Mora se također napomenuti, da u specifičnim situacijama intratrahealna instilacija (ukapavanje u dušnik) može biti prihvatljiva alternativa.
Režim dugotrajnog izlaganja obično se temelji na projiciranoj izloženosti ljudi, pri čemu se po ujednačenju koncentracija u komori životinje izlažu pet dana u tjednu po šest sati dnevno (izlaganje s prekidima) ili, vezano uz moguću okolišnu izloženost, sedam dana u tjednu po 22 do 24 sata dnevno (neprekidno izlaganje), pri čemu je oko jedan sat, otprilike u isto vrijeme svaki dan, namijenjen za hranjenje životinja i održavanje komore. U oba se slučaja životinje obično izlažu fiksnim koncentracijama ispitivane tvari. Glavna razlika između izlaganja s prekidima i neprekidnog izlaganja je u tome što prvi režim uključuje razdoblje od 17 do 18 sati u kojemu se životinje mogu oporaviti od djelovanja svakodnevnog izlaganja te još duže razdoblje oporavka tijekom vikenda.
Odabir izlaganja s prekidima ili neprekidnog izlaganja ovisi o ciljevima studije i o izloženosti ljudi koju treba simulirati. Međutim, treba uzeti u obzir i određene teškoće tehničke prirode. Na primjer, prednosti neprekidne izloženosti u svrhu simuliranja okolišnih uvjeta može poništiti potreba za napajanjem i hranjenjem životinja tijekom izlaganja i potreba za složenijim (i pouzdanijim) tehnikama stvaranja i praćenja aerosola i para.
1.6.6.
Životinje treba testirati u inhalacijskim komorama konstruiranim tako da održavaju dinamičan protok zraka s najmanje 12 izmjena zraka u jednom satu, kako bi se osigurala odgovarajuća koncentracija kisika i ravnomjerna distribucija atmosfere izlaganja. Kontrolne komore i komore za izlaganje moraju po konstrukciji biti jednake kako bi osigurale uvjete izlaganja koji su usporedivi u svakom pogledu, izuzev izloženosti ispitivanoj tvari. Obično se u komori održava lagani podtlak da bi se spriječilo istjecanje ispitivane tvari u okolni prostor. Komore trebaju biti takve da naguravanje životinja u njima bude minimalno. Za osiguravanje stabilnosti atmosfere u komori opće je pravilo da ukupan volumen pokusnih životinja ne smije biti veći od 5 % volumena komore.
Treba mjeriti i pratiti sljedeće parametre:
|
i. |
protok zraka: brzinu protoka zraka kroz komoru najbolje je pratiti neprekidno; |
|
ii. |
koncentracija: tijekom dnevnog izlaganja koncentracija ispitivane tvari ne smije varirati za više od ± 15 % od srednje vrijednosti. Tijekom cijele studije dnevne koncentracije treba održavati stalnima koliko god je to praktički izvedivo; |
|
iii. |
temperatura i vlažnost zraka: za glodavce temperaturu u komori treba održavati na 22 ± 2 °C, a vlažnost zraka na 30 do 70 %, osim ako se za suspendiranje ispitivane tvari u atmosferi komore koristi voda. Najbolje je i jedno i drugo pratiti bez prekida; |
|
iv. |
mjerenje veličine čestica: ako atmosfera u komori uključuje upotrebu tekućih ili čvrstih aerosola, treba utvrditi distribuciju veličine čestica. Čestice aerosola trebaju biti takve veličine da ih pokusna životinja može udahnuti. Uzorke atmosfere u komori treba uzimati u zoni disanja životinja. Uzorak zraka mora biti reprezentativan za distribuciju čestica kojima su životinje izložene i na gravimetrijskoj osnovi mora predstavljati sav suspendirani aerosol, čak i ako se veliki dio aerosola ne može udisati. Veličinu čestica treba često analizirati u početnoj fazi rada sustava za generiranje kako bi se osigurala stabilnost aerosola, a zatim tijekom izlaganja onoliko često koliko je potrebno da bi se pouzdano utvrdila postojanost distribucije čestica kojima se životinje izlažu. |
1.6.7.
Dio ispitivanja koji se odnosi na karcinogenost obuhvaća veći dio normalnog životnog vijeka pokusnih životinja. Ispitivanja na miševima i hrčcima treba završiti nakon 18 mjeseci, a na štakorima nakon 24 mjeseca; međutim, kod nekih sojeva životinja s duljim životnim vijekom i/ili niskom stopom pojave spontanih tumora ispitivanja treba završiti nakon 24 mjeseca, kad su u pitanju miševi i hrčci, odnosno nakon 30 mjeseci kad su u pitanju štakori. Druga prihvatljiva mogućnost je da se takva produžena studija okonča kad broj preživjelih životinja u kontrolnoj skupini ili u skupini tretiranoj najnižom dozom dosegne 25 %. Kad se završi ispitivanje kod kojeg postoji očita razlika u reakcijama po spolovima, svaki spol treba razmotriti zasebno. Ako zbog očite toksičnosti prijevremeno ugine samo skupina životinja tretirana najvišom dozom, to ne mora biti povod za prekid ispitivanja ako toksičke manifestacije ne izazivaju probleme u drugim skupinama. Da bi negativan rezultat bio prihvatljiv, nakon 18 mjeseci kad se radi o miševima i hrčcima i nakon 24 mjeseca kad su u pitanju štakori, gubitak uslijed autolize, kanibalizma ili problema pri rukovanju životinjama ne smije ni u jednoj skupini biti veći od 10 %, a stopa preživljavanja u svim skupinama ne smije biti manja od 50 %.
Satelitske skupine sastavljene od po 20 tretiranih životinja od svakog spola i po 10 kontrolnih životinja od svakog spola koje se koriste za ispitivanje kronične toksičnosti treba ispitivati najmanje 12 mjeseci. Te životinje treba predvidjeti za usmrćivanje radi pregleda patoloških promjena vezanih uz ispitivanu tvar bez komplikacija izazvanih gerontološkim promjenama.
1.6.8. Postupak
1.6.8.1.
Dnevna opažanja životinja u kavezu trebaju obuhvaćati promjene na koži i dlaci, očima i sluznicama, na dišnom i cirkulacijskom sustavu, na autonomnom i centralnom živčanom sustavu, kao i promjene u somatomotoričkoj aktivnosti i obrascu ponašanja.
Na životinjama u tretiranoj satelitskoj skupini ili skupinama u odgovarajućim intervalima treba obavljati kliničke preglede.
Redovito opažanje životinja je potrebno kako bi se osiguralo, koliko god je to moguće, da ne dođe do gubitka životinja uslijed kanibalizma, autolize tkiva ili pogrešnog smještanja. Kad se opaze životinje na umoru, treba ih ukloniti i podvrgnuti obdukciji.
Kliničke znakove, uključujući neurološke promjene i promjene na očima, kao i mortalitet treba bilježiti za sve životinje. Posebnu pozornost treba obratiti na razvoj tumora: treba zabilježiti vrijeme pojavljivanja; lokaciju, dimenzije, izgled i progresiju svakog tumora koji je vidljiv golim okom ili se može opipati; treba zabilježiti i vrijeme nastupanja i razvijanja toksičkih stanja.
Unos hrane (i vode ako se ispitivana tvar daje u vodi za piće) treba mjeriti na tjednoj osnovi tijekom prvih 13 tjedana studije, a potom u intervalima od oko tri mjeseca ako promjene u zdravstvenom stanju i tjelesnoj masi ne nalažu drugačije.
Tjelesnu masu treba bilježiti pojedinačno za svaku životinju, jednom tjedno tijekom prvih 13 tjedana razdoblja ispitivanja, a nakon tog najmanje jednom svaka četiri tjedna.
1.6.8.2. Klinički pregledi
Hematološki pregled (npr. sadržaj hemoglobina; ukupan broj krvnih stanica, ukupan broj eritrocita, ukupan broj leukocita, trombocita i druga mjerenja za utvrđivanje potencijala za zgrušavanje) obavlja se nakon tri mjeseca, šest mjeseci, a nakon tog u intervalima od oko šest mjeseci i na kraju studije, na uzorcima krvi uzetima od 10 štakora po spolu iz svih skupina. Po mogućnosti bi u svakom intervalu trebalo uzimati uzorke od istih štakora.
Ako se opažanjima životinja u kavezu tijekom studije utvrdi pogoršanje njihovog zdravlja, kod oboljelih životinja određuje se diferencijalna krvna slika. Diferencijalna krvna slika radi se na uzorcima uzetim od životinja iz skupine tretirane visokom dozom i od životinja iz kontrolne skupine. Diferencijalna krvna slika radi se i za skupinu ili skupine tretirane sljedećom nižom dozom samo ako se utvrde značajne razlike između skupina tretiranih najvišom dozom i kontrolnih skupina, ili ako je indicirana patološkim nalazima.
Za analizu treba skupiti uzorke urina od 10 štakora svakog spola iz svih skupina, ako je moguće od istih štakora u istim intervalima u kojima se obavljaju i hematološke pretrage. Na uzorcima uzetim od svake životinje pojedinačno ili na skupnom uzorku uzetom po spolu ili skupini treba napraviti sljedeće pretrage:
|
— |
izgled: volumen i gustoća za pojedinačne životinje, |
|
— |
protein, glukoza, ketoni, skriveno krvarenje (polukvantitativno), |
|
— |
mikroskopski pregled sedimenta (polukvantitativno). |
U intervalima od oko šest mjeseci i na kraju, za kliničke kemijske pretrage uzimaju se uzorci krvi svih neglodavaca i 10 štakora od svakog spola iz svih skupina, po mogućnosti u svakom intervalu od istih štakora. Osim toga, od neglodavaca se uzimaju uzorci za preliminarne testove. Od tih se uzoraka priprema plazma i obavljaju se slijedeće pretrage:
|
— |
koncentracija ukupnih proteina, |
|
— |
koncentracija albumina, |
|
— |
pretrage jetrenih funkcija (kao što je aktivnost alkalne fosfataze, glutamat-piruvat transaminaze (11) i glutamat-oksaloacetat transaminaze (12), gama-glutamil transpeptidaze, ornitin dekarboksilaze, |
|
— |
metabolizam ugljikohidrata kao što je glukoza u krvi natašte, |
|
— |
pretrage bubrežnih funkcija kao što je dušik u krvi. |
Kompletnu makroskopsku analizu treba obaviti na svim životinjama, uključujući i one koje su uginule tijekom pokusa ili su bile usmrćene jer su bile na umoru. Prije usmrćivanja od svih životinja treba uzeti uzroke krvi za diferencijalnu krvnu sliku. Sve makroskopski vidljive tumore ili lezije za koje se sumnja da su tumori, treba sačuvati. Treba pokušati povezati makroskopska opažanja s mikroskopskim nalazima.
Sve organe i tkiva treba sačuvati za histopatološki pregled. To obično vrijedi za sljedeće organe i tkiva: mozak (13) (medula/most, kora malog i velikog mozga), hipofiza, štitnjača (uključujući paratiroidnu žlijezdu), prsna žlijezda, pluća (uključujući dušnik), srce, aorta, žlijezde slinovnice, jetra (13), slezena, bubrezi (13), nadbubrežne žlijezde (13), jednjak, želudac, dvanaesnik, tašto crijevo, vito crijevo, slijepo crijevo, debelo crijevo, rektum, mokraćni mjehur, limfni čvorovi, gušterača, spolne žlijezde (13), pomoćni spolni organi, ženska mliječna žlijezda, koža, mišići, periferni živac, leđna moždina (vratna, prsna, slabinska), prsna kost s koštanom srži i bedrena kost (uključujući zglob) i oči.
Iako je inflacija pluća i mokraćnog mjehura fiksativom (upuhivanje fiksativa u pluća i mokraćni mjehur) najbolji način za konzerviranje tih tkiva, u inhalacijskim studijama inflacija pluća je neophodan uvjet za odgovarajući histopatološki pregled. U posebnim studijama kao što su inhalacijske studije, treba proučiti cijeli dišni trakt, uključujući nos, ždrijelo i grkljan.
Ako se obavljaju druge kliničke pretrage, informacije dobivene tim postupcima trebaju biti raspoložive prije mikroskopskog pregleda, budući da bi za patologe mogle predstavljati značajne smjernice.
Pregled vezan uz dio ispitivanja koji se odnosi na kroničnu toksičnost:
treba detaljno pregledati sve sačuvane organe svih životinja iz satelitske skupine tretirane visokom dozom i iz kontrolne skupine. Ako se u satelitskoj skupini tretiranoj visokom dozom pronađu patološke promjene vezane uz ispitivanu tvar, ciljne organe svih drugih životinja iz svih ostalih tretiranih satelitskih skupina treba na kraju ispitivanja podvrgnuti potpunom i detaljnom histološkom pregledu, kao i organe tretiranih skupina na kojima se obavlja dio ispitivanja vezan uz karcinogenost.
Pregled vezan uz dio ispitivanja koji se odnosi na karcinogenost:
|
(a) |
kompletan histopatološki pregled treba obaviti na organima i tkivima svih životinja koje su uginule ili su bile usmrćene tijekom ispitivanja u kontrolnoj skupini i skupini tretiranoj visokom dozom; |
|
(b) |
kod svih skupina mikroskopski treba pregledati sve makroskopski vidljive tumore, odnosno lezije za koje su sumnja da bi mogle biti tumori; |
|
(c) |
ako postoji značajna razlika u incidenciji neoplastičnih lezija između skupine tretirane visokom dozom i kontrolne skupine, histopatološki pregled treba napraviti na istim organima ili tkivima životinja iz drugih skupina; |
|
(d) |
ako je stopa preživljavanja u skupini tretiranoj visokom dozom značajno niža nego u kontrolnoj skupini, kompletno treba pregledati i skupinu tretiranu sljedećom nižom dozom; |
|
(e) |
ako postoje dokazi o izazivanju toksičkih ili drugih učinaka u skupini tretiranoj visokom dozom koji bi mogli utjecati na neoplastičku reakciju, kompletno treba pregledati i skupinu tretiranu sljedećom nižom dozom. |
2. PODACI
Podatke treba rezimirati u obliku tablice u kojoj će za svaku ispitnu skupinu biti naveden broj životinja na početku ispitivanja, broj životinja kod kojih su tijekom ispitivanja opaženi tumori ili toksički učinci, vrijeme otkrivanja tumora i broj životinja kod kojih su tumori nađeni nakon usmrćenja. Rezultate treba ocijeniti uz primjenu odgovarajuće statističke metode. Može se primijeniti bilo koja priznata statistička metoda.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju treba, ako je moguće, sadržavati sljedeće informacije:
|
— |
vrsta, soj i podrijetlo životinja, okolišni uvjeti, prehrana, |
|
— |
uvjeti ispitivanja: 3.1.1. Opis naprave za izlaganje: Uključujući konstrukciju, tip, dimenzije, izvor zraka, sustav za generiranje čestica i aerosola, metodu kondicioniranja zraka, obradu ispušnog zraka i metodu smještanja životinja u ispitnoj komori u slučaju da se ona koristi. Treba opisati opremu za mjerenje temperature, vlažnosti i, temo gdje je primjereno, stabilnosti koncentracije i veličine čestica aerosola. 3.1.2. Podaci o izlaganju: Ovi podaci trebaju biti prikazani u obliku tablice, kao srednje vrijednosti i mjere varijabilnosti (npr. standardno odstupanje) te uključivati sljedeće:
|
|
— |
visine doza (uključujući nosač, ako je korišten) i koncentracije, |
|
— |
podaci o incidenciji tumora po spolu, dozi i tipu tumora, |
|
— |
vrijeme smrti tijekom studije, odnosno jesu li životinje preživjele do završetka studije, |
|
— |
podaci o toksičkim reakcijama po spolu i dozi, |
|
— |
opis toksičkih i drugih učinaka, |
|
— |
vrijeme opažanja svih znakova abnormalnosti i daljnjih promjena, |
|
— |
oftalmološki nalazi, |
|
— |
podaci o hrani i tjelesnoj masi, |
|
— |
obavljena hematološka ispitivanja i svi rezultati, |
|
— |
obavljena klinička biokemijska ispitivanja i svi rezultati (uključujući analizu urina), |
|
— |
nalazi obdukcije, |
|
— |
detaljni opis svih histopatoloških nalaza, |
|
— |
statistička obrada rezultata i opis upotrijebljenih metoda, |
|
— |
diskusija o rezultatima, |
|
— |
tumačenje rezultata. |
3.2. OCJENA I TUMAČENJE REZULTATA
Vidjeti Opći uvod, dio B.
4. REFERENCE
Vidjeti Opći uvod, dio B.
B.34. TEST REPRODUKTIVNE TOKSIČNOSTI NA JEDNOJ GENERACIJI
1. METODA
1.1. UVOD
Vidjeti Opći uvod, dio B.
1.2. DEFINICIJE
Vidjeti Opći uvod, dio B.
1.3. REFERENTNE TVARI
Nema ih.
1.4. NAČELO ISPITNE METODE
Ispitivana tvar primjenjuje se u graduiranim dozama na nekoliko skupina mužjaka i ženki. Mužjacima se doza daje tijekom rasta i tijekom najmanje jednog punog ciklusa spermatogeneze (približno 56 dana kod miševa i 70 dana kod štakora) kako bi izazvala štetne učinke ispitivane tvari na spermatogenezu.
Ženkama roditeljske generacije (P) dozu tvari treba davati najmanje tijekom puna dva ciklusa estrusa kako bi se izazvali štetni učinci ispitivane tvari na estrus. Nakon tog životinje se pare. U razdoblju parenja ispitivana tvar daje se i mužjacima i ženkama, a zatim samo ženkama dok su skotne i u razdoblju dojenja. Za primjenu ispitivane tvari inhalacijom ovu će metodu trebati modificirati.
1.5. KRITERIJI KVALITETE
Nema ih.
1.6. OPIS ISPITNE METODE
1.6.1. Pripreme
Prije ispitivanja, zdrave mlade odrasle životinje biraju se nasumice i raspodjeljuju u skupine za tretiranje i kontrolne skupine. Životinje treba smjestiti i hraniti u uvjetima pokusa najmanje pet dana pred ispitivanje. Preporuča se ispitivanu tvar davati u hrani ili vodi za piće. Prihvatljivi su i drugi putevi primjene. U odgovarajućem pokusnom razdoblju svim životinjama doze se moraju davati na isti način. Ako se, radi jednostavnije primjene, koristi neki nosač ili drugi aditivi, za njih se mora znati da ne proizvode toksične učinke. Doze se daju sedam dana u tjednu.
1.6.2.
Odabir vrsta
Poželjne vrste su štakori ili miševi. Treba koristiti zdrave životinje koje prethodno nisu sudjelovale u pokusima. Sojeve slabe plodnosti ne bi trebalo koristiti. Ispitne životinje treba okarakterizirati u pogledu vrste, soja, spola, mase i/ili dobi.
Za primjerenu procjenu plodnosti, istraživanjem treba obuhvatiti i mužjake i ženke. Sve životinje iz ispitnih i kontrolnih skupina trebaju biti odbijene od sise prije nego što započne primjena doza.
Broj i spol
Svaka tretirana i kontrolna skupina treba sadržavati dovoljan broj životinja kako bi se dobilo oko 20 ženki koje su skotne ili pred okot.
Cilj je dobiti dovoljno skotnih životinja i potomaka kako bi se osigurala valjana procjena potencijala tvari da utječe na plodnost, skotnost i majčinsko ponašanje životinja generacije P te na sisanje, rast i razvoj potomstva F1 od začeća do odbijanja od sise.
1.6.3.
Hranu i vodu treba osigurati ad libitum. Pred parturiciju, skotne ženke treba smjestiti u posebne kaveze za okot ili materinstvo, te im po potrebi treba osigurati materijale za izradu gnijezda.
1.6.3.1.
Treba koristiti najmanje tri tretirane skupine i jednu kontrolnu skupinu. Ako se kod primjene ispitivane tvari koristi neki nosač, kontrolna skupina treba primiti taj nosač u najvećoj količini koja je primijenjena. Ako ispitivana tvar uzrokuje smanjenje unosa ili iskorištenja hrane, treba razmotriti eventualnu potrebu uvođenja kontrolne skupine koja će biti hranjena na isti način. U idealnom slučaju, ako nije ograničena fizikalnim/kemijskim prirodnim svojstvima ili biološkim učincima ispitivane tvari, doza bi trebala biti takve visine koja će dovesti do toksičnosti, ali ne i do smrtnosti roditeljskih životinja (P). Srednja doza ili doze trebale bi uzrokovati minimalne toksične učinke koji se mogu pripisati ispitivanoj tvari, a male doze ne bi trebale dovesti ni do kakvih zamjetnih štetnih učinaka na roditelje ili na potomstvo. Kod primjene pomoću želučane sonde ili u kapsulama, dozu koja se daje svakoj životinji treba temeljiti na masi tijela pojedine životinje i prilagođavati tjedno prema promjenama u masi tijela. Za skotne ženke, doziranje se može temeljiti na masi tijela na dan graviditeta 0 ili 6, po želji.
1.6.3.2.
Kad se radi o tvarima niske toksičnosti, ako se visinom doze od najmanje 1 000 mg/kilogramu ne dokaže utjecaj na reproduktivnu sposobnost, može se smatrati da ispitivanja s drugim visinama doza nisu potrebna. Ako istraživanje s primjenom velike doze i definitivnim dokazom toksičnosti na majci ne pokazuje štetne učinke na plodnost, može se smatrati kako istraživanja s drugim dozama nisu potrebna.
1.6.3.3. Provođenje ispitivanja
Dnevnu primjenu doza kod roditeljskih mužjaka (P) treba početi u dobi od pet do devet tjedana, nakon što su odbijeni od sise i nakon minimalno petodnevne aklimatizacije. Kod štakora, doziranje se nastavlja tijekom 10 tjedana prije razdoblja parenja (za miševe, osam tjedana). Mužjake treba usmrtiti i pregledati ili na kraju razdoblja parenja ili ih, alternativno, zadržati na ispitnom režimu prehrane kako bi se eventualno dobio drugi okot, pa ih onda, negdje pred kraj istraživanja, usmrtiti i pregledati. Kod roditeljskih ženki (P), s doziranjem treba početi nakon najmanje pet dana aklimatizacije i nastaviti još najmanje dva tjedna pred parenje. Dnevnu primjenu doza kod ženki generacije p treba nastaviti tijekom puna tri tjedna razdoblja parenja, trudnoće i sve do odbijanja potomstva F1 od sise. Treba razmotriti eventualne izmjene u rasporedu doziranja na temelju drugih dostupnih informacija o ispitivanoj tvari, primjerice indukciji metabolizma ili bioakumulaciji.
Za studije reproduktivne toksičnosti može se koristiti parenje bilo 1:1 (jedan mužjak na jednu ženku) ili 1:2 (jedan mužjak na dvije ženke).
Na temelju parenja 1:1, jedna ženka ostavlja se s istim mužjakom sve dok ne dođe do oplodnje ili do isteka tri tjedna. Svako jutro ženke treba pregledati s obzirom na prisutnost sperme ili vaginalnih čepova. Danom graviditeta 0 smatra se dan kad je nađen vaginalni čep ili sperma.
Parove koji se nisu uspjeli pariti treba pregledati kako bi se utvrdio uzrok očite neplodnosti.
To može obuhvatiti postupke kao što su pružanje dodatne mogućnosti za parenje s drugim mužjacima i ženkama čije je roditeljstvo dokazano, mikroskopski pregled reproduktivnih organa i preispitivanje ciklusa estrusa ili spermatogeneze.
Životinjama na koje se doze primjenjuju tijekom istraživanja plodnosti dozvoljava se da se normalno okote i da podignu svoje potomstvo do faze odbijanja od sise bez standardizacije legla.
Ako se provodi standardizacija, predlaže se sljedeći postupak. Između 1. i 4. dana nakon okota, veličina svakog legla može se prilagoditi selekcijskim uklanjanjem dodatnih mladunaca na način da se po jednom leglu ostave, po mogućnosti, četiri mužjaka i četiri ženke.
Kad god je broj muških ili ženskih mladunaca takav da nije moguće imati četiri mladunca svakog spola po leglu, prihvatljivo je djelomično prilagođavanje (npr. pet mužjaka i tri ženke).
1.6.4.
Cijelo razdoblje ispitivanja svaku životinju treba opažati najmanje jednom dnevno. Treba bilježiti značajne promjene ponašanja, znakove otežane ili produžene parturicije i sve znakove toksičnosti, uključujući smrtnost. U razdobljima pred parenje i tijekom parenja, potrošnja hrane može se mjeriti svaki dan. Nakon okota i za vrijeme laktacije, potrošnju hrane (i potrošnju vode ako se ispitivana tvar primjenjuje u vodi za piće) treba mjeriti istog dana kad se obavlja vaganje legla. Mužjake i ženke roditeljske generacije P treba vagati prvog dana primjene doze, a zatim jednom tjedno. Ta opažanja treba unijeti u izvješće pojedinačno za svaku odraslu životinju.
Vrijeme gestacije treba računati od nultog dana graviditeta. Svako leglo nakon poroda treba što prije pregledati kako bi se utvrdio broj i spol mladunaca, mrtvorođenih, živorođenih i prisutnost velikih anomalija.
Mladunčad koja je mrtvorođena i usmrćena četvrtog dana treba konzervirati i proučiti kako bi se utvrdili eventualni defekti. Živu mladunčad treba prebrojiti i legla izvagati jutro nakon okota te četvrtog i sedmog dana, a zatim jednom tjedno sve do završetka istraživanja, kad životinje treba izvagati pojedinačno.
Uočene fizičke anomalije ili anomalije u ponašanju roditeljskih ženki ili potomaka treba zabilježiti.
1.6.5.
1.6.5.1.
U vrijeme usmrćenja ili smrti tijekom istraživanja životinje roditeljske generacije P treba pregledati makroskopski radi utvrđivanja eventualnih strukturnih anomalija ili patoloških promjena, s tim da posebnu pozornost treba posvetiti organima reproduktivnog sustava. Mladunčad koja je uginula ili je na umoru treba pregledati kako bi se utvrdile patološke promjene.
1.6.5.2.
Ovarije, uterus, cerviks, vaginu, testise, epididimise, sjemene vezikule, prostatu, prednji režanj prostate, hipofizu i ciljne organe svih roditeljskih životinja P treba konzervirati za mikroskopski pregled. U slučaju da ti organi nisu bili pregledani kod drugih istraživanja s višestrukim dozama, treba ih mikroskopski pregledati po mogućnosti kod svih životinja koje su bile izložene velikim dozama i kontrolnih životinja koje su uginule tijekom istraživanja.
Organe na kojima su kod tih životinjama nađene anomalije zatim treba pregledati kod ostalih roditeljskih životinja P. U takvim slučajevima, mikroskopski treba pregledati sva tkiva kod kojih su utvrđene velike patološke promjene. Kao što je predloženo u stavku o postupcima parenja, reproduktivne organe životinja za koje se sumnja da su neplodne može se podvrgnuti mikroskopskoj pretrazi.
2. PODACI
Podaci se mogu sažeto prikazati u obliku tablice, na način da se za svaku ispitnu skupinu navede broj životinja na početku pokusa, broj plodnih mužjaka, broj skotnih ženki, tipovi promjena i postotak životinja kod kojih je pojedina vrsta promjene primijećena.
Kad je to moguće, numeričke podatke treba vrednovati odgovarajućom statističkom metodom. Može se primijeniti bilo koja opće prihvaćena statistička metoda.
3. IZVJEŠĆIVANJE
IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju treba, ako je moguće, sadržavati slijedeće informacije:
|
— |
vrsta/soj koji je upotrijebljen, |
|
— |
podaci o toksičkoj reakciji po spolu i dozi, uključujući plodnost, gestaciju i sposobnost preživljavanja, |
|
— |
vrijeme smrti tijekom istraživanja ili jesu li životinje preživjele do trenutka planiranog usmrćenja ili završetka istraživanja, |
|
— |
tablica koja prikazuje mase svakog legla, srednje mase mladunčadi i pojedinačne mase mladunčadi na završetku istraživanja, |
|
— |
toksički ili drugi učinci na reprodukciju, potomke i postnatalni rast, |
|
— |
dan opažanja svakog neuobičajenog znaka i njegov daljnji razvoj, |
|
— |
podaci o tjelesnoj masi roditeljskih životinja (P), |
|
— |
nalazi nekropsije, |
|
— |
detaljan opis svih mikroskopskih nalaza, |
|
— |
statistička obrada rezultata, prema potrebi, |
|
— |
rasprava o rezultatima, |
|
— |
tumačenje rezultata. |
3.2. VREDNOVANJE I TUMAČENJE REZULTATA
Vidjeti Opći uvod, dio B.
4. REFERENCE
Vidjeti Opći uvod, dio B.
B.35. STUDIJA REPRODUKTIVNE TOKSIČNOSTI NA DVIJE GENERACIJE
1. METODA
Ova je metoda replika Smjernice za ispitivanje OECD–a TG 416 (2001).
1.1. UVOD
Ova metoda za ispitivanje reprodukcije na dvije generacije namijenjena je za dobivanje općenitih informacija o učincima ispitivane tvari na integritet i funkcioniranje muških i ženskih reproduktivnih sustava, uključujući i funkciju spolnih žlijezda, ciklus estrusa, ponašanje kod parenja, začeće, gestaciju, parturiciju, laktaciju i odbijanje od sise, te rast i razvoj potomaka. Ovom studijom može se doći i do informacija o učincima ispitivane tvari na neonatalni morbiditet, mortalitet kao i do preliminarnih podataka o prenatalnoj i postnatalnoj razvojnoj toksičnosti, pa može služiti kao smjernica za daljnja ispitivanja. Osim za istraživanja rasta i razvoja generacije F1, ova je ispitna metoda namijenjena i procjeni integriteta i funkcioniranja muških i ženskih reproduktivnih sustava kao i rasta i razvoja generacije F2. Za dodatne informacije o razvojnoj toksičnosti i funkcionalnim nedostacima u ovaj protokol mogu se ugraditi dodatna istraživanja, te po potrebi konzultirati metode za ispitivanje razvojne toksičnosti i/ili razvojne neurotoksičnosti, ili se te krajne točke mogu proučavati u odvojenim istraživanjima, primjenom odgovarajućih ispitnih metoda.
1.2. NAČELO ISPITNE METODE
Ispitivana tvar primjenjuje se u graduiranim dozama na nekoliko skupina mužjaka i ženki. Mužjacima generacije P doza se daje tijekom rasta i tijekom najmanje jednog punog ciklusa spermatogeneze (približno 56 dana kod miševa i 70 dana kod štakora) kako bi izazvala štetne učinke ispitivane tvari na spermatogenezu. Učinci na spermu određuju se nizom parametara (npr. morfologija i pokretljivost sperme), i na pripravcima tkiva te detaljnom histopatologijom. Ako su podaci o spermatogenezi poznati iz ranijeg dovoljno dugog istraživanja o ponavljanoj primjeni doze, npr. 90–dnevnog istraživanja, procjenom ne treba obuhvatiti mužjake generacije P. Međutim, uzorke ili digitalna očitanja sperme generacije P preporučljivo je spremiti za kasniju procjenu. Ženkama generacije P dozu treba davati tijekom rasta i nekoliko potpunih ciklusa estrusa kako bi se izazvali štetni učinci ispitivane tvari na normalan ciklus estrusa. Ispitivana tvar dozira se roditeljskim životinjama (P) u razdoblju parenja, tijekom nastale trudnoće i za vrijeme dok se njihovo potomstvo F1 odbija od sise. Nakon odbijanja od sise tvar se potomcima F1 nastavlja davati u razdoblju rasta i odrasle dobi, parenja i produkcije generacije F2, sve dok se generacija F2 ne odbije od sise.
Na svim životinjama provode se klinička opažanja i patološka ispitivanja kako bi se utvrdili znakovi toksičnosti s posebnim naglaskom na integritet i funkcioniranje muških i ženskih reproduktivnih sustava kao i rasta i razvoja potomstva.
1.3. OPIS ISPITNE METODE
1.3.1. Odabir životinjskih vrsta
Poželjna vrsta za ispitivanje su štakori. Ako se koriste druge vrste, opravdanost toga treba dokazati, a bit će potrebne i primjerene modifikacije. Sojeve slabe plodnosti ili poznate po velikoj učestalosti razvojnih defekata ne bi trebalo koristiti. Na početku studije, odstupanje mase životinja koje se koriste treba biti minimalno, odnosno ne veće od 20 % srednje mase za svaki spol.
1.3.2. Uvjeti smještaja i prehrane
Temperatura u prostoriji u kojoj se drže pokusne životinje treba biti 22 °C (± 3 °). Iako bi relativna vlaga trebala biti najmanje 30 %, a poželjno je da ne prijeđe 70 % osim tijekom čišćenja prostorije, cilj bi trebao biti 50–60 %. Svjetlost treba biti umjetna, s tim da je redoslijed 12 sati svjetla, 12 sati tame. Za hranjenje se može koristiti konvencionalna laboratorijska hrana s neograničenom količinom vode za piće. Na izbor hrane može utjecati potreba da se osigura odgovarajuća mješavina s ispitivanom tvari koja se daje u hrani.
Životinje se mogu smjestiti odvojeno ili držati u kavezima u malim skupinama istog spola. Postupci parenja trebaju se odvijati u kavezima koji odgovaraju toj svrsi. Nakon što je očito da je došlo do kopulacije, u kaveze za okot ili potomstvo skotne ženke treba smjestiti same. Štakori se nakon parenja mogu držati u malim skupinama, pa ih onda dan ili dva prije parturicije treba odvojiti. Pred termin parturicije skotnim životinjama treba osigurati odgovarajući i utvrđeni materijal za pravljenje gnijezda.
1.3.3. Priprema životinja
Treba koristiti zdrave mlade životinje koje su najmanje pet dana prilagođavane laboratorijskim uvjetima i koje ranije nisu podvrgavane pokusnim postupcima. Pokusne životinje treba okarakterizirati u pogledu vrste, soja, spola, mase i/ili starosti. Eventualno srodstvo između životinja treba biti poznato kako bi se izbjeglo parenje srodnika. Životinje se nasumice biraju i raspodjeljuju u kontrolnu skupinu i skupinu koja će se tretirati (preporuča se regrupiranje prema masi tijela). Kaveze treba rasporediti na način da se maksimalno umanje mogući učinci boravka u kavezu. Svakoj životinji treba dodijeliti jedinstveni identifikacijski broj. Za generaciju P, to treba učiniti prije početka doziranja. Za generaciju F1, to treba učiniti u trenutku kad se životinje odabrane za parenje odbiju od sise. Za sve odabrane životinje F1 treba voditi evidenciju o početnom leglu. Osim toga, za potrebe pojedinačnog vaganja mladunaca ili provođenja bilo kojeg funkcionalnog ispitivanja preporuča se pojedinačna identifikacija mladunčadi odmah nakon rođenja.
Prije početka doziranja roditeljske životinje (P) moraju biti stare oko pet do devet tjedana. Životinje u svim ispitnim skupinama po mogućnosti trebaju biti podjednake mase i starosti.
1.4. POSTUPAK
1.4.1. Broj i spol životinja
Svaka ispitna i kontrolna skupina treba sadržavati dovoljan broj životinja kako bi se dobio poželjan broj od najmanje 20 ženki koje su skotne ili pred okot. Kod tretiranja tvarima koje uzrokuju neželjene učinke (npr. sterilnost, prekomjernu toksičnost kod velike doze), to možda neće biti moguće. Cilj je proizvesti dovoljno skotnih ženki kako bi se osigurala valjana procjena potencijala tvari da utječe na plodnost, trudnoću i majčinsko ponašanje, te na sisanje, rast i razvoj potomstva F1 od začeća do odbijanja od sise, i na razvoj potomstva (F2) do odbijanja od sise. Stoga nepostizanje željenog broja skotnih životinja (tj. 20) ne znači nužno da istraživanje nije neuspjelo, već procjenu treba provoditi od slučaja do slučaja.
1.4.2. Priprema doza
Preporuča se ispitivanu tvar davati oralno (u hrani, vodi za piće ili sondom) ako se neki drugi način primjene (npr. dermalno ili inhalacijom) ne smatra prikladnijim.
Prema potrebi, ispitivana tvar se otapa ili suspendira u odgovarajućem otapalu ili nosaču. Preporuča se, kad god je to moguće, prvo razmotriti upotrebu vodene otopine/suspenzije, pa onda otopinu/emulziju u ulju (npr. kukuruzno ulje) i na kraju eventualnu otopinu u drugim otapalima. Za sve druge nosače osim vode treba poznavati toksičke karakteristike nosača. Stabilnost ispitivane tvari u pomoćnoj tvari treba odrediti.
1.4.3. Doziranje
Treba koristiti najmanje tri jačine doze i istodobno jednu kontrolnu. Ako nije ograničena fizikalno–kemijskim svojstvima ili biološkim učincima ispitivane tvari, najjaču dozu treba odabrati s ciljem da se izazove toksičnost, a ne smrt ili teška patnja. U slučaju neočekivane smrtnosti, studije sa stopom smrtnosti manjom od oko 10 % kod roditeljskih životinja (P) obično se još smatraju prihvatljivima. Treba odabrati slijed postepenog smanjivanja doze koji će ukazati na sve učinke određenih doza i visine kod kojih se ne opažaju štetni učinci (NOAEL vrijednosti). Za utvrđivanje visine sve slabijih doza često je optimalno doze primijeniti u dva do tri intervala, a može biti bolje dodati i četvrtu ispitnu skupinu nego između primjene doza koristiti veoma velike vremenske intervale (npr. iznad faktora 10). U svrhu prehrambenih istraživanja interval doziranja ne bi smio biti veći od faktora tri. Visinu doze treba odabrati imajući u vidu postojeće podatke o toksičnosti, posebno rezultate istraživanja s ponavljanim dozama. Treba uzeti u obzir sve dostupne informacije o metabolizmu i kinetici ispitivanog spoja ili s njim povezanih materijala. Tim će se informacijama moći opravdati i prikladnost režima doziranja.
Kontrolna skupina je netretirana skupina ili kontrolna skupina za nosač ako se za davanje ispitivane tvari nosač koristi. Osim tretiranja ispitivanom tvari, sa životinjama u kontrolnim skupinama treba postupati jednako kao sa životinjama u ispitnoj skupini. Ako se koristi nosač, kontrolna skupina taj nosač mora primiti u najvećem volumenu koji je upotrijebljen. Ako se ispitivana tvar daje pomiješana s hranom, a uzrokuje smanjeni unos ili iskorištenje hrane, može se smatrati potrebnim uvođenje paralelne kontrolne skupine za prehranu. Alternativno, umjesto takve paralelno hranjene kontrolne skupine mogu se upotrijebiti podaci iz kontrolnih studija koje su provedene s ciljem procjene učinaka smanjene potrošnje hrane na reproduktivne parametre.
Treba uzeti u obzir sljedeće karakteristike nosača i drugih aditiva: učinci na apsorpciju, distribuciju, metabolizam, ili zadržavanje ispitivane tvari; učinci na kemijska svojstva ispitivane tvari koji mogu izmijeniti njezine toksičke karakteristike; i učinci na potrošnju hrane ili vode ili nutritivno stanje životinja.
1.4.4. Granični test
Ako istraživanje provedeno oralnom primjenom jedne doze od najmanje 1 000 mg/kg tjelesne mase/dan, ili kod davanja doze u hrani ili vodi za piće, primjenom doze koja se u ekvivalentnom postotku daje u hrani ili vodi za piće u skladu s postupcima opisanim u ovoj studiji, ne proizvede uočljive toksičke učinke niti kod roditeljskih životinja niti njihovih potomaka, i ako na temelju podataka iz strukturno i/ili metabolički srodnih spojeva ne treba očekivati toksičnost, u takvim slučajevima može se smatrati da provođenje potpune studije s nekoliko visina doza nije neophodno. Granični je test relevantan samo ako izloženost ljudi ne ukazuje na potrebu za primjenom veće oralne doze. Za druge puteve primjene doza, kao što su udisanje ili primjena putem kože, fizikalno–kemijska svojstva ispitivane tvari, npr. topljivost, često mogu određivati i ograničavati najvišu moguću razinu izlaganja koja se smije postići.
1.4.5. Primjena doza
Životinjama treba davati doze ispitivane tvari 7 dana u tjednu. Poželjna je oralna primjena (u hrani, vodi za piće, ili želučanom sondom). Ako se koristi drugi put primjene, za to treba navesti opravdane razloge, a mogu biti potrebne i odgovarajuće modifikacije. U odgovarajućem razdoblju pokusa svim se životinjama doze moraju davati istom metodom. Ako se ispitivana tvar daje na sondu, to treba učiniti primjenom želučane sonde. Volumen tekućine koja se daje odjednom ne smije prijeći 1 ml/100 g tjelesne mase (0,4 ml/100 g tjelesne mase je maksimum za kukuruzno ulje), osim u slučaju vodenih otopina kod kojih se smije koristiti 2 ml/100 g tjelesne mase. Osim kod nadražujućih i nagrizajućih tvari, za koje je normalno da u većim koncentracijama izazivaju intenzivnije učinke, variranje ispitnih volumena treba podešavanjem koncentracije svesti na minimum kako bi se kod svih visina doze osigurao stalni volumen. Kod studija u kojima se primjenjuje hranjenje na sondu, mladunci će, naravno, ispitnu tvar primati samo posredno, u mlijeku, sve dok za njih ne započne izravno doziranje nakon odbijanja od sise. Kod studija u kojima se tvar daje u hrani ili vodi za piće, mladunci će dodatno primati ispitivanu tvar izravno kad sami počnu jesti tijekom posljednjeg tjedna razdoblja laktacije.
Za tvari koje se daju u hrani ili vodi za piće, važno je osigurati da količine ispitivane tvari o kojoj se radi nemaju utjecaja na uobičajen unos hrane ili vode. Ako se ispitivana tvar daje u hrani, može se koristiti stalna koncentracija u hrani (ppm) ili stalna visina doze s obzirom na tjelesnu masu životinje; treba navesti koja se od te dvije mogućnosti koristi. Za tvar koja se daje na sondu, dozu treba davati u podjednako vrijeme svakog dana i prilagoditi je najmanje jednom tjedno kako bi se održala stalna visina doze s obzirom na tjelesnu masu životinje. Kod prilagođavanja doze koja se daje na sondu, a temelji se na masi, treba uzeti u obzir informacije o difuziji kroz posteljicu.
1.4.6. Plan pokusa
Dnevna primjena doza kod roditeljskih mužjaka i ženki (P) treba početi kad su stari pet do devet tjedana. Dnevno davanje doze kod mužjaka i ženki F1 počinje nakon što su odbijeni od sise; treba imati na umu da je u slučajevima kad se ispitivana tvar daje u hrani ili vodi za piće, do izravnog izlaganja mladunaca F1 ispitivanoj tvari već došlo tijekom razdoblja laktacije. Za oba spola (P i F1), doziranje se nastavlja do najmanje 10 tjedana prije razdoblja parenja. Doziranje se nastavlja kod oba spola tijekom dvotjednog razdoblja parenja. Kad više nisu potrebni za procjenu reproduktivnih učinaka, mužjake treba humano usmrtiti i pregledati. Za roditeljske ženke (P), doziranje se nastavlja cijelo vrijeme graviditeta i sve do odbijanja od sise potomaka F1. Na temelju dostupnih informacija o ispitivanoj tvari, uključujući postojeće podatke o toksičnosti, indukciji metabolizma ili bioakumulaciji, treba razmotriti eventualne izmjene u rasporedu doziranja. Doza za svaku životinju svakako se mora temeljiti na najnovijem određivanju pojedinačne tjelesne mase. Međutim, kod prilagođavanja doze u tijeku posljednjeg tromjesečja graviditeta potreban je oprez.
Tretiranje mužjaka i ženki P i F1 nastavlja se do kraja studije. Kad više nisu potrebni za procjenu učinaka na reprodukciju, sve odrasle mužjake i ženke P i F1 treba humano usmrtiti. Potomke F1 koji nisu izabrani za parenje i sve potomke F2 treba humano usmrtiti nakon što su odbijeni od sise.
1.4.7. Postupak parenja
1.4.7.1. Parenje roditeljske generacije (P)
Za svako parenje svaku se ženku stavi s jednim mužjakom iz istog ranga visine doze (parenje 1:1) sve dok ne dođe do kopulacije ili do isteka dva tjedna. Svakog dana ženke treba pregledati s obzirom na prisutnost sperme ili vaginalnih čepova. Danom graviditeta 0 smatra se dan kad je nađen vaginalni čep ili sperma. Ako je parenje neuspješno, može se razmotriti mogućnost ponovnog parenja ženki s dokazanim mužjacima iste skupine. Parove koji se pare treba jasno identificirati u podacima. Parenje srodnika treba izbjegavati.
1.4.7.2. Parenje generacije F1
Za parenje potomaka F1, u trenutku odbijanja od sise iz svakog legla treba odabrati najmanje jednog mužjaka i jednu ženku za parenje s drugim mladuncima tretiranim istom visinom doze, ali iz različitog legla, kako bi se dobila generacija F2. Ako u tjelesnoj masi ili izgledu muških mladunaca u leglu nema znatnih razlika, odabir mladunaca iz svakog legla treba provesti nasumice. Ako se te razlike opažaju, iz svakog legla treba odabrati najbolje predstavnike. To je najbolje provesti na temelju tjelesne mase iako je možda prikladnije na temelju izgleda. Potomke F1 ne treba pariti dok ne postignu punu spolnu zrelost.
Parove koji se nisu uspjeli pariti treba pregledati kako bi se utvrdio uzrok očite neplodnosti. To može obuhvatiti postupke kao što su pružanje dodatne mogućnosti za parenje s drugim mužjacima i ženkama čije je roditeljstvo dokazano, mikroskopski pregled reproduktivnih organa te preispitivanje ciklusa estrusa ili spermatogeneze.
1.4.7.3. Drugo parenje
U nekim slučajevima, primjerice kad su zbog tretiranja u prvom parenju učinjene određene promjene u veličini legla ili je opažen dvosmislen učinak, preporuča se ponovno parenje odraslih životinja P ili F1 kako bi se dobilo drugo leglo. Preporuča se ženke ili mužjake koji nisu dali leglo ponovno pariti s dokazanom rasplodnom životinjom suprotnog spola. Ako se proizvodnja drugog legla u bilo kojoj generaciji smatra neophodnom, životinje treba pariti približno tjedan dana nakon odbijanja od sise prvog legla.
1.4.7.4. Veličina legla
Životinjama se dozvoljava da se normalno okote i da podignu svoje potomstvo do faze odbijanja od sise. Standardizacija veličine legla nije obvezna. Kad se standardizacija poduzima, metodu koja se rabi treba iscrpno opisati.
1.5. OPAŽANJA
1.5.1. Klinička opažanja
Opća klinička opažanja treba provoditi svakog dana, a u slučaju davanja doze putem sonde, kod određivanja u koje će se vrijeme opažanje obavljati treba uzeti u obzir vrijeme u koje se predviđa da će učinci imati maksimalnu jačinu nakon doziranja. Promjene ponašanja, znakove otežane ili produžene parturicije i sve znakove toksičnosti treba bilježiti. Uz to, svaku životinju treba detaljnije pregledati najmanje jednom tjedno, što je prikladno učiniti kod vaganja životinja. Dvaput dnevno, i ako je primjereno jednom dnevno tijekom vikenda, sve životinje treba opažati s obzirom na morbiditet i mortalitet.
1.5.2. Tjelesna masa i potrošnja vode/hrane roditeljskih životinja
Roditeljske životinje (P i F1) važu se prvog dana primjene doze, a zatim najmanje jednom tjedno. Roditeljske ženke (P i F1) treba vagati najmanje 0., 7., 14. i 20. ili 21. dana gestacije i tijekom laktacije na iste dane na koje se obavlja vaganje legla i na dan kad se životinje usmrćuju. Ta opažanja treba unijeti u izvješće za svaku odraslu životinju posebno. Za vrijeme razdoblja pred parenje i tijekom gestacije potrošnju hrane treba mjeriti najmanje jednom tjedno. Ako se ispitivana tvar daje u vodi, potrošnju vode treba mjeriti najmanje jednom tjedno.
1.5.3. Ciklus estrusa
Duljina i normalno odvijanje ciklusa estrusa procjenjuje se kod ženki P i F1 na temelju vaginalnog brisa prije parenja, i neobvezno tijekom parenja, sve dok se ne dokaže da je došlo do parenja. Ako se uzimaju vaginalne/cervikalne stanice, treba paziti da se ne poremeti mukoza, i kasnije, ne izazove lažna trudnoća (1).
1.5.4. Parametri sperme
Po završetku studije, za sve mužjake generacija P i F1 bilježi se masa testisa i epididimisa, i po jedan organ od svakog čuva se za histopatološki pregled (vidjeti odjeljak 1.5.7., 1.5.8.1.). Preostali testisi i epididimisi podskupine od najmanje 10 mužjaka iz svake skupine mužjaka generacija P i F1, koriste se kako bi se pobrojali spermatidi otporni na homogenizaciju, odnosno zalihe sperme iz repa epididimisa. Za tu istu podskupinu mužjaka treba sakupiti zalihu sperme iz repa epididimisa ili sjemenovoda za procjenu pokretljivosti i morfologije sperme. Ako se opaze učinci povezani s tretiranjem ili na temelju drugih studija u kojima su dokazani mogući učinci na spermatogenezu, procjenu sperme treba provesti na svim mužjacima u svakoj tretiranoj skupini; u protivnom brojanje se može ograničiti na mužjake generacija P i F1 iz kontrolne skupine i skupine izložene velikim dozama.
Treba pobrojati ukupan broj spermatida iz testisa koji su otporni na homogenizaciju, odnosno iz zalihe sperme iz repa epididimisa (2)(3). Zalihe sperme iz repa epididimisa mogu se izračunati iz koncentracije i volumena sperme u suspenziji koja se rabi za kvalitativne procjene, a broj rekuperirane sperme naknadnim seciranjem i/ili homogenizacijom preostalog tkiva repića. Brojanje se provodi na odabranoj podskupini mužjaka iz svih tretiranih skupina odmah nakon što su životinje usmrćene, ako se ne provodi video ili digitalno snimanje ili ako se uzorci ne zamrzavaju za kasniju analizu. U tim slučajevima, prvo se mogu analizirati kontrolna skupina i skupina izložena velikim dozama. Ako nema vidljivih učinaka tretiranja (npr. učinaka na broj, pokretljivost ili morfologiju sperme), druge skupine ne treba analizirati. Ako su učinci koji se javljaju kao posljedica tretiranja zabilježeni u skupini izloženoj velikim dozama, treba procijeniti i skupine koje su primale manje doze.
Pokretljivost sperme iz epididimisa (ili iz ductus deferens) treba procijeniti ili snimiti video snimkom odmah nakon što je životinja usmrćena. Spermu treba izvaditi uz minimalna oštećenja i razrijediti za analizu pokretljivosti primjenjujući prihvatljive metode (4). Postotak progresivno pokretljive sperme treba odrediti subjektivno ili objektivno. Ako se analiza pokretljivosti radi pomoću računala (5)(6)(7)(8)(9)(10), progresivna pokretljivost vrednuje se prema graničnim vrijednostima koje odredi korisnik za prosječnu brzinu puta i pravocrtnost ili indeks linearnosti. Ako se kod nekropsije uzorci snimaju video kamerom (11) ili na drugi način slikaju, naknadnom analizom mogu se obuhvatiti samo mužjaci generacija P i F1 iz kontrolne skupine i skupine izložene velikim dozama, osim ako se ne opažaju učinci uzrokovani tretiranjem; u tom slučaju, skupine s nižim dozama također treba procijeniti. U nedostatku video ili digitalnog zapisa, kod nekropsije treba analizirati sve uzorke u svim tretiranim skupinama.
Potrebno je izvršiti procjenu morfologije sperme iz epididimisa (ili iz vas deferens). Spermu (najmanje 200 spermatozoida po uzorku) treba pregledati kao fiksirane mokre pripravke (12) i klasificirati je kao normalnu ili ne. Primjeri morfoloških anomalija spermatozoida obuhvaćaju fuziju, odvojene glave i deformirane glave i/ili repove. Procjenu treba provesti na odabranoj podskupini mužjaka iz svih skupina različitih visina doze odmah nakon usmrćenja životinja ili kasnije, na temelju video ili digitalnog zapisa. Brisove, koji se jednom fiksiraju, moguće je očitavati i kasnije. U tim slučajevima, prvo se mogu analizirati kontrolna skupina i skupina izložena velikim dozama. Ako nema vidljivih učinaka tretiranja (npr. učinaka na morfologiju sperme), druge tretirane skupine ne treba analizirati. Ako su učinci koji se javljaju kao posljedica tretiranja zabilježeni u skupini izloženoj velikim dozama, treba procijeniti i skupine koje su primale manje doze.
Ako je bilo koji od gore spomenutih parametara za procjenu sperme već ranije bio ispitan u okviru sustavne studije toksičnosti u trajanju od najmanje 90 dana, nije ga nužno ponavljati u ovom istraživanju koje se provodi na dvije generacije. Međutim, preporuča se uzorke ili digitalne zapise sperme generacije P pohraniti radi eventualne kasnije analize.
1.5.5. Potomstvo
Svako leglo treba pregledati što je prije moguće nakon okota (nulti dan laktacije) i utvrditi broj i spol mladunaca, broj mrtvorođenih, broj živorođenih, prisutnost velikih anomalija. Mladunce koji su nultog dana nađeni mrtvi, ako nisu macerirani, svakako bi trebalo pregledati s obzirom na postojanje nepravilnosti i uzrok smrti, te konzervirati. Živu mladunčad treba prebrojiti i pojedinačno izvagati kod okota (nulti dan laktacije) ili na dan 1., a zatim redovito na dane vaganja, npr. 4., 7., 14. i 21. dan laktacije. Fizičke anomalije ili anomalije u ponašanju opažene kod ženki ili potomaka treba zabilježiti.
Fizički razvoj potomaka treba bilježiti uglavnom kroz dobivanje tjelesne mase. Drugi fizički parametri (npr. otvaranje ušiju i očiju, izbijanje zuba, rast kose) mogu dati dodatne informacije, ali njih je poželjno vrednovati u kontekstu podataka o spolnom sazrijevanju (npr. dob i tjelesna masa kod otvaranja vagine ili razdvajanja prepucija na glavici penisa) (13). Ako takva istraživanja nisu obuhvaćena posebnim studijama, preporučaju se funkcionalna istraživanja (npr. motorna aktivnost, osjetilne funkcije, ontogeneza refleksa) potomaka generacije F1 prije i/ili nakon odbijanja od sise, posebno istraživanja koja se odnose na spolno sazrijevanje. Za generaciju F1 upravo odbijenu od sise koja je odabrana za parenje treba utvrditi dob u kojoj je došlo do otvaranja vagine ili razdvajanja prepucija. Ako je utvrđeno da je u generaciji F1 došlo do izmjene u omjeru mužjaka i ženki ili dobi spolne zrelosti, u postnatalnom danu 0 kod mladunaca generacije F2 treba izmjeriti anogenitalni razmak.
Funkcionalna opažanja nisu neophodna u skupinama koje inače pokazuju jasne znakove štetnih učinaka (npr. znatno smanjenje porasta tjelesne mase itd.). Ako se uopće provode, funkcionalna istraživanja ne treba provoditi na mladuncima odabranim za parenje.
1.5.6. Makroskopska nekropsija
Na završetku studije ili u slučaju smrti tijekom studije sve roditeljske životinje (P i F1), sve mladunce s vanjskim anomalijama ili kliničkim znakovima, kao i nasumice odabrane mladunce/spol/leglo iz generacija F1 i F2 treba makroskopski pregledati s obzirom na strukturne anomalije ili patološke promjene. Posebnu pozornost treba obratiti na organe reproduktivnog sustava. Mladunce koji su humano usmrćeni, na samrti ili mrtvi, ako nisu macerirani, treba pregledati s obzirom na moguće patološke promjene i/ili uzrok smrti, i konzervirati.
Treba pregledati uteruse svih prvorotki, na način koji neće dovesti u pitanje histološku analizu, kako bi se utvrdilo ima li i koliki je broj mjesta za implantaciju embrija.
1.5.7. Mase organa
Na kraju istraživanja određuje se tjelesna masa i masa sljedećih organa roditeljskih životinja generacija P i F1 (organe u paru treba vagati pojedinačno):
|
— |
uterus, ovariji, |
|
— |
testisi, epididimisi (ukupno i kaudalni), |
|
— |
prostata, |
|
— |
sjemene vezikule s prednjim režnjem prostate i njihovim fluidima i prostatom (kao jedna cjelina), |
|
— |
mozak, jetra, bubrezi, slezena, hipofiza, tiroidna žlijezda, nadbubrežna žlijezda i poznati ciljni organi. |
Kod mladunaca generacije F1 i F2 koji su odabrani za nekropsiju treba odrediti tjelesne mase kod usmrćenja. Treba izvagati sljedeće organe nasumice izabranog mladunca/spola/legla (vidjeti odjeljak 1.5.6.): mozak, slezena i timus.
Kad je to izvedivo, rezultate makroskopske nekropsije i vaganja organa treba procijeniti u svjetlu opažanja dobivenih u drugim studijama.
1.5.8. Histopatologija
1.5.8.1. Roditeljske životinje
Sljedeće organe i tkiva roditeljskih životinja (generacije P i F1), ili njihove reprezentativne uzorke, treba fiksirati i pohraniti u odgovarajućem mediju za histopatološki pregled.
|
— |
Vagina, uterus s cerviksom, i ovariji (konzervirani u odgovarajućem sredstvu), |
|
— |
jedan testis (konzerviran u Bouinovom ili sličnom fiksativu), jedan epididimis, sjemene vezikule, prostata, i prednji režanj prostate, |
|
— |
ranije identificirani ciljni organ(i) životinja generacija P i F1 odabranih za parenje. |
Gore navedene konzervirane organe i tkiva treba potpuno histopatološki obraditi kod svih životinja generacija P i F1 koje su odabrane za parenje iz skupine izložene visokim dozama i kontrolne skupine. Pregled jajnika roditeljskih životinja P nije obvezan. Organe kod kojih se uočavaju promjene uzrokovane tretiranjem treba pregledati i kod skupina koje su primale male ili srednje doze, a kod kojih se sumnja na smanjenu plodnost, npr. kod životinja koje se nisu parile, nisu začele, proizvele ni porodile zdravo potomstvo, ili kod kojih je bilo utjecaja na javljanje ciklusa estrusa ili broj, pokretljivost ili morfologiju spermatozoida, treba histopatološki obraditi. Obvezno treba ispitati sve makro lezije kao što su atropija ili tumori.
Treba obaviti detaljni histopatološki pregled testisa (npr. upotrebom Bouinovog fiksativa, uklapanjem u parafin i poprečnim rezovima debljine 4–5 μm) kako bi se utvrdili učinci vezani uz tretiranje, primjerice zadržani spermatidi, nepostojanje određenih slojeva ili tipova zametnih stanica, divovske stanice s više jezgri ili odbacivanje spermatogenih stanica u lumen (14). Pregledom intaktnog epididimisa treba obuhvatiti glavu, tijelo i rep, što se može postići analizom uzdužnog presjeka. Epididimis treba pregledati s obzirom na infiltraciju leukocita, promjenu prevladavajućih tipova stanica, atipične tipove stanica i fagocitozu spermatozoida. Za pregled muških reproduktivnih organa može se koristiti bojenje Periodic Acid–Schiff (PAS) metodom ili bojenje hematoksilinom.
Nakon razdoblja laktacije jajnik bi trebao sadržavati primordijalne folikule i folikule u rastu kao i velika žuta tijela iz laktacije. Histopatološkim pregledom treba otkriti kvalitativno pražnjenje populacije primordijalnih folikula. Kvantitativnu procjenu primordijalnih folikula treba provesti za ženke generacije F1; broj životinja, odabir presjeka jajnika i veličina presjeka koji se koristi kao uzorak trebaju statistički odgovarati postupku procjene koji se koristi. Radi usporedbe tretiranih i kontrolnih jajnika, pregled treba obuhvatiti brojanje primordijalnih folikula, kombinirano s malim folikulima u rastu (15)(16)(17 (18)(19).
1.5.8.2. Životinje upravo odbijene od sise
Kod svih mladunaca s vanjskim anomalijama ili kliničkim znakovima, kao i od nasumice odabranog mladunca/spola/legla iz obje generacije F1 i F2, koji nisu bili odabrani za parenje, treba fiksirati tkivo i ciljne organe s makro anomalijama i pohraniti u odgovarajući medij za histopatološki pregled. Potpunu histopatološku karakterizaciju konzerviranog tkiva treba obaviti s posebnim naglaskom na organe reproduktivnog sustava.
2. PODACI
2.1. OBRADA REZULTATA
U izvješću treba navesti pojedinačne podatke, sažete u obliku tablice, o broju životinja na početku ispitivanja, broju životinja koje su uginule tijekom ispitivanja ili su usmrćene iz humanih razloga, vrijeme smrti ili humanog usmrćenja, broj plodnih životinja, broj skotnih ženki, broj životinja koje pokazuju znakove toksičnosti, opis opaženih znakova toksičnosti, uključujući vrijeme prve pojave, trajanje i ozbiljnost toksičkih učinaka, vrste opažanja generacija roditelja i potomaka, vrste histopatoloških promjena i sve relevantne podatke o leglu, za svaku ispitnu skupinu i svaku generaciju.
Numeričke rezultate treba procijeniti primjerenom, opće prihvaćenom statističkom metodom; odabir statističke metode obavlja se u okviru planiranja studije i njegovu opravdanost treba dokazati. Za analiziranje podataka mogu biti korisni statistički modeli doza–reakcija. Izvješće treba sadržavati dovoljno informacija o analitičkoj metodi i računalnom programu koji je korišten, kako bi neovisni revizor/statističar mogao procijeniti i rekonstruirati analizu.
2.2. VREDNOVANJE REZULTATA
Nalaze studije reproduktivne toksičnosti na dvije generacije treba vrednovati s obzirom na opažene učinke uključujući nekropsiju i mikroskopske nalaze. Vrednovanje treba obuhvatiti postojanje ili izostanak odnosa između doze ispitivane tvari i prisutnosti ili izostanka, učestalosti ili ozbiljnosti anomalija, uključujući makro lezije, identificirane ciljne organe, promjene u pogledu plodnosti, kliničke anomalije, promjene sposobnosti reprodukcije i legla, promjene tjelesne mase, učinke na smrtnost i sve ostale toksičke učinke. Kod vrednovanja rezultata ispitivanja treba uzeti u obzir fizikalno–kemijska svojstva ispitivane tvari i, ako su dostupni, toksikokinetičke podatke.
Pravilno provedeno ispitivanje reproduktivne toksičnosti treba osigurati zadovoljavajuću procjenu visine doze bez štetnog djelovanja i razumijevanje štetnih učinaka na reprodukciju, parturiciju, laktaciju, postnatalni razvoj uključujući rast i spolni razvoj.
2.3. TUMAČENJE REZULTATA
Studija reproduktivne toksičnosti na dvije generacije dat će informacije o učincima ponavljanog izlaganja nekoj tvari tijekom svih faza reproduktivnog ciklusa. Studija će dati informacije posebno o reproduktivnim parametrima, i o razvoju, rastu, sazrijevanju i preživljavanju potomaka. Rezultate studije treba tumačiti u vezi s nalazima subkroničnih studija, studija o prenatalnom razvoju, toksikokinetičkim i drugim dostupnim studijama. Rezultati ove studije mogu se iskoristiti za procjenu potrebe daljnjeg ispitivanja kemikalije. Ekstrapolacija rezultata ove studije na čovjeka vrijedi u ograničenoj mjeri. Najbolje ih je iskoristiti kao informacije o visinama bez štetnih učinaka i dozvoljenom izlaganju ljudi (20)(21)(22)(23).
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju treba, ako je moguće, sadržavati slijedeće informacije:
|
|
ispitivana tvar:
|
|
|
Nosač (ako je primjereno):
|
|
|
Ispitne životinje:
|
|
|
Uvjeti ispitivanja:
|
|
|
Rezultati:
|
|
|
Rasprava o rezultatima |
|
|
Zaključci, uključujući vrijednosti kod kojih nisu zamijećeni štetni učinci (NOAEL) na roditelje i potomstvo. |
4. REFERENCE
|
(1) |
Sadleir, R.M.F.S., (1979) Cycles and Seasons, In: Reproduction in Mammals: I. Germ Cells and Fertilisation, C.R. Auston and R.V. Short (eds.), Cambridge, New York. |
|
(2) |
Gray, L.E. et al., (1989) A Dose-Response Analysis of Methoxychlor-Induced Alterations of Reproductive Development and Function in the Rat. Fundamental and Applied Toxicology, 12, str. 92-108. |
|
(3) |
Robb, G.W. et al., (1978). Daily Sperm Production and Epididymal Sperm Reserves of Pubertal and Adult Rats. Journal of Reproduction and Fertility 54:103-107. |
|
(4) |
Klinefelter, G.R. et al., (1991) The Method of Sperm Collection Significantly Influences Sperm Motion Parameters Following Ethane Dimethanesulfonate Administration in the Rat. Reproductive Toxicology, 5, str. 39-44. |
|
(5) |
Seed, J. et al., (1996). Methods for Assessing Sperm Motility, Morphology, and Counts in the Rat, Rabbit, and Dog: a Consensus Report. Reproductive Toxicology, 10(3), str. 237-244. |
|
(6) |
Chapin, R.E. et al., (1992) Methods for Assessing Rat Sperm Motility. Reproductive Toxicology, 6, str. 267-273 |
|
(7) |
Klinefelter, G.R. et al., (1992) Direct Effects of Ethane Dimethanesulphonate on Epididymal Function in Adult Rats: an In Vitro Demonstration. Journal of Andrology, 13, str. 409-421. |
|
(8) |
Slott, V.L. et al., (1991) Rat Sperm Motility Analysis: Methodologic Considerations. Reproductive Toxicology, 5, str. 449-458. |
|
(9) |
Slott, V.L. and Perreault, S.D., (1993) Computer-Assisted Sperm Analysis of Rodent Epididymal Sperm Motility Using the Hamilton-Thorn Motility Analyzer. In: Methods in Toxicology, Part A., Academic, Orlando, Florida, str. 319-333. |
|
(10) |
Toth, G.P. et al., (1989) The Automated Analysis of Rat Sperm Motility Following Subchronic Epichlorhydrin Administration: Methodologic and Statistical Considerations. Journal of Andrology, 10, str. 401-415. |
|
(11) |
Working, P.K. and M. Hurtt, (1987) Computerised Videomicrographic Analysis of Rat Sperm Motility. Journal of Andrology, 8, str. 330-337. |
|
(12) |
Linder, R.E. et al., (1992) Endpoints of Spermatoxicity in the Rat After Short Duration Exposures to Fourteen Reproductive Toxicants. Reproductive Toxicology, 6, str. 491-505. |
|
(13) |
Korenbrot, C.C. et al., (1977) Preputial Separation as an External Sign of Pubertal Development in the Male Rat. Biological Reproduction, 17, str. 298-303. |
|
(14) |
Russell, L.D. et al., (1990) Histological and Histopathological Evaluation of the Testis, Cache River Press, Clearwater, Florida. |
|
(15) |
Heindel, J.J. and R.E. Chapin, (eds.) (1993) Part B. Female Reproductive Systems, Methods in Toxicology, Academic, Orlando, Florida. |
|
(16) |
Heindel, J.J. et al., (1989) Histological Assessment of Ovarian Follicle Number in Mice As a Screen of Ovarian Toxicity. In: Growth Factors and the Ovary, A.N. Hirshfield (ed.), Plenum, New York, str. 421-426. |
|
(17) |
Manson, J.M. and Y.J. Kang, (1989) Test Methods for Assessing Female Reproductive and Developmental Toxicology. In: Principles and Methods of Toxicology, A.W. Hayes (ed.), Raven, New York. |
|
(18) |
Smith, B.J. et al., (1991) Comparison of Random and Serial Sections in Assessment of Ovarian Toxicity. Reproductive Toxicology, 5, str. 379-383. |
|
(19) |
Heindel, J.J., (1999) Oocyte Quantitation and Ovarian Histology. In: An Evaluation and Interpretation of Reproductive Endpoints for Human Health Risk Assessment, G. Daston,. and C.A. Kimmel, (eds.), ILSI Press, Washington, DC. |
|
(20) |
Thomas, J. A., (1991) Toxic Responses of the Reproductive System. In: Casarett and Doull’s Toxicology, M.O. Amdur, J. Doull, and C.D. Klaassen (eds.), Pergamon, New York. |
|
(21) |
Zenick, H. and E.D. Clegg, (1989) Assessment of Male Reproductive Toxicity: A Risk Assessment Approach. In: Principles and Methods of Toxicology, A.W. Hayes (ed.), Raven Press, New York. |
|
(22) |
Palmer, A.K., (1981) In: Developmental Toxicology, Kimmel, C.A. and J. Buelke-Sam (eds.), Raven Press, New York. |
|
(23) |
Palmer, A.K., (1978) In Handbook of Teratology, Vol. 4, J.G. Wilson and F.C. Fraser (eds.), Plenum Press, New York. |
B.36. TOKSIKOKINETIKA
1. METODA
1.1. UVOD
Vidjeti Opći uvod, dio B.
1.2. DEFINICIJE
Vidjeti Opći uvod, dio B.
1.3. REFERENTNE TVARI
Nema ih.
1.4. NAČELO ISPITNE METODE
Ispitivana tvar primjenjuje se odgovarajućim putem. Ovisno u svrsi studije, tvar se tijekom određenog razdoblja može primijeniti u jednoj ili ponavljanim dozama na jednu ili nekoliko skupina pokusnih životinja. Nakon toga, ovisno o vrsti studije, ta se tvar i/ili njezini metaboliti utvrđuju u tjelesnim tekućinama, tkivu i/ili izlučevinama.
Studije se mogu provoditi s „neobilježenim” ili „obilježenim” oblicima ispitivane tvari. Ako se koristi „obilježena tvar”, položaj razlikovnog elementa ili izotopa u tvari mora biti takav da omogući prikupljanje što je moguće više informacija o sudbini spoja.
1.5. KRITERIJI KVALITETE
Nema ih.
1.6. OPIS ISPITNE METODE
1.6.1. Pripreme
Zdrave mlade odrasle životinje prilagođavaju se laboratorijskim uvjetima najmanje pet dana pred ispitivanje. Prije ispitivanja životinje se nasumice odabiru i razmještaju u skupine za tretiranje. U posebnim situacijama moguće je koristiti vrlo mlade, skotne ili ranije tretirane životinje.
1.6.2. Uvjeti ispitivanja
1.6.2.1. Pokusne životinje
Toksikokinetička istraživanja moguće je provoditi kod jedne ili nekoliko odgovarajućih životinjskih vrsta, s tim da treba voditi računa o vrstama koje se koriste ili se namjerava koristiti u drugim toksikološkim istraživanjima iste ispitivane tvari. Ako se ispitivanje obavlja na glodavcima, odstupanje mase ne bi trebalo biti veće od ± 20 % srednje mase.
1.6.2.2. Broj i spol
Za studije apsorpcije i ekskrecije u svakoj tretiranoj skupini u početku treba imati četiri životinje. Izbor određenog spola nije obvezan, ali u nekim okolnostima možda će biti potrebno proučiti oba spola. Ako u reakciji ima razlika na temelju spola, treba ispitati četiri životinje svakog spola. U slučaju studija sa svim ostalim životinjama osim glodavaca, moguće je koristiti manji broj životinja. Ako se istražuje distribucija u tkivu, kod početne veličine skupine treba voditi računa i o broju životinja koje će trebati usmrtiti u svakoj vremenskoj fazi studije i o broju faza koje se ispituju.
Ako se proučava metabolizam, veličina skupine prilagođava se potrebama studije. Za studije s višestrukim dozama i nekoliko međufaza, kod određivanja veličine skupine treba voditi računa o broju faza i planiranom usmrćivanju, s tim da ne smije biti manje od dvije životinje. Skupina mora biti dovoljno velika kako bi osigurala prihvatljivo vrednovanje (prema potrebi) unosa, platoa i opadanja količine ispitivane tvari i/ili njezinih metabolita.
1.6.3. Visine doze
U slučaju jednostruke primjene doze, primjenjuju se najmanje dvije visine doze. To treba biti mala doza kod koje se ne opažaju toksički učinci i velika doza kod koje dolazi do promjena toksikokinetičkih parametara ili do toksičkih učinaka.
U slučaju višestruke primjene doze, obično je dostatna mala doza, ali u određenim okolnostima možda će biti potrebna i velika.
1.6.4. Put primjene
Toksikokinetička istraživanja treba provoditi služeći se istim putem primjene i, prema potrebi, istim nosačem koji se koristi ili se planira koristiti u drugim istraživanjima toksičnosti. Ispitivana se tvar u određenom razdoblju na skupine pokusnih životinja obično primjenjuje oralno, putem sonde ili u hrani, primjenom na kožu, ili udisanjem. Intravenozna primjena ispitivane tvari može biti korisna za utvrđivanje relativne apsorpcije drugim putevima primjene. Osim toga, do korisnih informacija o modelu difuzije dolazi se brzo nakon intravenozne primjene tvari.
Treba uzeti u obzir mogućnost međudjelovanja nosača s ostatkom tvari. Treba obratiti pozornost na razlike između apsorpcije kod primjene ispitivane tvari putem sonde i primjene u hrani te paziti da doza bude točno određena posebno ako se ispitivana tvar daje u hrani.
1.6.5. Razdoblje opažanja
Sve životinje treba opažati svakodnevno te bilježiti znakove toksičnosti i druga relevantna klinička svojstva, uključujući vrijeme prve pojave, stupanj i trajanje.
1.6.6. Postupak
Nakon vaganja životinja, ispitna se tvar primjenjuje odgovarajućim putem. Ako se to smatra relevantnim, prije primjene ispitivane tvari životinje se mogu izgladniti.
Apsorpcija
Brzina i stupanj apsorpcije primijenjene tvari može se procijeniti korištenjem raznih metoda, sa ili bez referentnih skupina (14), primjerice:
|
— |
određivanjem količine ispitivane tvari i/ili njezinih metabolita u izlučevinama, kao što su urin, žuč, izmet, izdahnuti zrak i zrak preostao u truplu, |
|
— |
usporedbom biološke reakcije (npr. istraživanja akutne toksičnosti) između ispitne i kontrolne i/ili referentne grupe, |
|
— |
usporedbom količine tvari i/ili njezinih metabolita izlučenih putem bubrega kod ispitne i referentne skupine, |
|
— |
određivanjem površine ispitivane tvari i/ili njezinih metabolita ispod krivulje koja predstavlja razine plazme u vremenu i usporedbom s podacima dobivenim za referentnu skupinu. |
Difuzija
Za sada su dostupna dva pristupa, od kojih se jedan ili oba mogu koristiti za analizu modela difuzije:
|
— |
do korisnih kvalitativnih informacija dolazi se tehnikama autoradiografije cijelog tijela, |
|
— |
do kvantitativnih informacija dolazi se usmrćivanjem životinja u različito vrijeme nakon izlaganja i određivanjem koncentracije i količine ispitivane tvari i/ili njezinih metabolita u tkivima i organima. |
Ekskrecija
U istraživanjima ekskrecije, skuplja se urin, izmet, izdahnuti zrak i, u nekim okolnostima, zrak preostao u truplu. Količina ispitivane tvari i/ili metabolita u tim izlučevinama mjeri se nekoliko puta nakon izlaganja, sve dok se ne izluči 95 % primijenjene doze ili u trajanju od sedam dana, ako se taj postotak ne dostigne.
U posebnim slučajevima može biti potrebno uzeti u obzir izlučivanje ispitivane tvari u mlijeku ispitnih životinja koje doje.
Metabolizam
Za utvrđivanje intenziteta i modela metabolizma, odgovarajućim tehnikama treba analizirati biološke uzorke. Treba razjasniti strukture metabolita i predložiti odgovarajuće metaboličke puteve kako bi se dobili odgovori na pitanja proistekla iz prethodnih toksikoloških studija. Za dobivanje informacija o metaboličkim putevima možda će biti korisno istraživanja provesti in vitro.
Dodatne informacije o odnosu između metabolizma i toksičnosti mogu se dobiti iz biokemijskih studija, kao što je određivanje učinaka na enzimske sustave koji sudjeluju u metabolizmu, uništavanje endogenih neproteinskih sulfidrilnih spojeva i vezanje tvari s makromolekulama.
2. PODACI
Prema vrsti istraživanja koje se provodi, podatke treba sažeto prikazati u obliku tablice i, kad kod je to moguće, ilustrirati grafičkim prikazima. Za svaku ispitnu skupinu treba navesti, po mogućnosti, srednje i statističke varijacije mjerenja u odnosu na vrijeme, doziranje, tkiva i organe. Stupanj apsorpcije i količinu i brzinu izlučivanja treba odrediti odgovarajućim metodama. Kad se provode studije metabolizma, treba navesti strukturu identificiranih metabolita i prikazati moguće metaboličke puteve.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Prema vrsti studije koja se provodi, izvješće o ispitivanju treba, ako je moguće, sadržavati slijedeće informacije:
|
— |
vrsta, soj, podrijetlo, okolišni uvjeti, prehrana, |
|
— |
karakterizacija materijala obilježenog razlikovnim elementom ili izotopom, ako se koristi, |
|
— |
upotrijebljene visine doza i intervali, |
|
— |
put(evi) primjene i eventualni nosač koji je upotrijebljen, |
|
— |
opaženi toksički i drugi učinci, |
|
— |
metode za određivanje ispitivane tvari i/ili njezinih metabolita u biološkim uzorcima, uključujući izdahnuti zrak, |
|
— |
tablični prikaz mjerenja po spolu, dozi, režimu doziranja, vremenu, tkivu i organima, |
|
— |
prikaz stupnja apsorpcije i izlučivanja u vremenu, |
|
— |
metode za karakterizaciju i identifikaciju metabolita u biološkim uzorcima, |
|
— |
metode za biokemijska mjerenja koja se odnose na metabolizam, |
|
— |
predloženi putevi za metabolizam, |
|
— |
rasprava o rezultatima, |
|
— |
tumačenje rezultata. |
3.2. VREDNOVANJE I TUMAČENJE
Vidjeti Opći uvod, dio B.
4. REFERENCE
Vidjeti Opći uvod, dio B.
B.37. ODGOĐENA NEUROTOKSIČNOST ORGANOFOSPORNIH TVARI NAKON AKUTNOG IZLAGANJA
1. METODA
1.1. UVOD
Kod procjene i vrednovanja toksičkih učinaka tvari važno je uzeti u obzir potencijal određenih klasa tvari da uzrokuju posebne tipove neurotoksičnosti koje možda nije moguće otkriti u drugim studijama toksičnosti. Za neke organofosforne tvari opaženo je da uzrokuju odgođenu neurotoksičnost pa bi trebale postati predmetom proučavanja.
Za utvrđivanje tvari koje mogu uzrokovati odgođenu polineuoropatiju mogu se upotrijebiti in vitro testovi probira; međutim, negativni nalazi in vitro studija nisu dokaz da ispitivana tvar nije neurotoksična.
Vidjeti Opći uvod, dio B.
1.2. DEFINICIJE
Organofosforne tvari obuhvaćaju organofosforne estere bez naboja, tioestere ili anhidride organofosforne, organofosfonske ili organofosforamidne kiseline ili srodne fosforotio, fosfonotio ili fosforotioamidne kiseline, ili druge tvari koje mogu uzrokovati odgođenu neurotoksičnost koje se ponekad vide u toj klasi tvari.
Odgođena neurotoksičnost je sindrom koji se povezuje s produženim odgođenim vremenom prve pojave ataksije, distalnih aksonopatija u leđnoj moždini i perifernom živcu, i inhibiciju i starenje esteraze koja je povezana s neuropatskim djelovanjem organofosfornih spojeva (neuropathy target esterase — NTE) u neuralnom tkivu.
1.3. REFERENTNE TVARI
Referentna tvar može se ispitati s pozitivnom kontrolnom skupinom te na taj način dokazati da se u laboratorijskim ispitnim uvjetima reakcija ispitivanih vrsta nije značajno promijenila,.
Tri-o-tolil fosfat (CAS 78-30-8, EINECS 201-103-5. CAS nomenklatura: fosforna kiselina, tris(2metilfenil)ester) primjer je neurotoksične tvari široke uporabe, poznate i kao tris-o-kresilfosfat.
1.4. NAČELO ISPITNE METODE
Ispitivana tvar daje se oralno u jednoj dozi domaćim kokošima koje su po potrebi zaštićene od akutnih kolinergičkih učinaka. Životinje se opažaju 21 dan s obzirom na anomalije u ponašanju, ataksiju i paralizu. Biokemijska mjerenja, posebno inhibicija esteraze koja je povezana s neuropatskim djelovanjem organofosfornih spojeva (NTE), provode se na kokošima koje su nasumice odabrane iz svake skupine, obično 24 i 48 sati nakon tretiranja. Dvadeset jedan dan nakon izlaganja, preostali broj kokoši se usmrti i provede se histopatološka pretraga odabranog neuralnog tkiva.
1.5. OPIS ISPITNE METODE
1.5.1. Pripreme
Zdrave mlade odrasle kokoši bez virusnih oboljenja koja bi mogla utjecati na istraživanje, koje ne primaju nikakve lijekove i ne pokazuju nepravilnosti u hodu treba nasumice odabrati i svrstati u tretiranu i kontrolnu skupinu, te prilagođavati laboratorijskim uvjetima najmanje pet dana prije početka studije.
Treba koristiti kaveze ili ograđeni prostor dovoljne veličine da se kokošima omogući slobodno kretanje, te se treba koristiti lako opažanje hoda.
Doziranje ispitivane tvari obično se provodi oralno, sondom, želatinskim kapsulama, ili nekom usporedivom metodom. Tekućine se mogu davati nerazrijeđene ili otopljene u odgovarajućem otapalu kao što je kukuruzno ulje; ako je moguće, krute tvari treba otopiti jer apsorpcija velikih doza krute tvari u želatinskim kapsulama može biti nedovoljno učinkovita. Za sve nosače i otapala osim vode, toksičke karakteristike moraju biti poznate, a ako nisu, treba ih utvrditi prije ispitivanja.
1.5.2. Uvjeti ispitivanja
1.5.2.1. Ispitne životinje
Preporuča se koristiti mlade odrasle domaće nesilice (Gallus gallus domesticus), stare do 12 mjeseci. Treba koristiti pasmine i sojeve standardne veličine i kokoši koje su odrasle u uvjetima koji su im omogućivali slobodno kretanje.
1.5.2.2. Broj i spol
Uz tretiranu skupinu, treba rabiti i kontrolnu skupinu za nosač i pozitivnu kontrolnu skupinu. Kontrolnu skupinu za nosač treba tretirati na identičan način kao i tretiranu skupinu, osim što se ispitivana tvar ne daje.
U svakoj skupini treba biti dovoljan broj kokoši kako bi ih se najmanje šest moglo usmrtiti za biokemijsku analizu (tri u svakoj od dvije vremenske točke), a šest može preživjeti 21-dnevno razdoblje opažanja patologije.
Pozitivna kontrolna skupina može se voditi istodobno, ili kao kontrolna skupina na temelju nedavnih iskustava. Ta skupina treba sadržavati najmanje šest kokoši tretiranih poznatom tvari s odgođenim neurotoksičkim djelovanjem, tri kokoši za biokemijsku analizu i tri kokoši za patologiju. Preporuča se periodično ažuriranje prethodno prikupljenih podataka. Ako laboratorij koji provodi ispitivanje mijenja neke od bitnih elemenata (npr. soj, prehranu, uvjete smještaja), treba razviti nove pozitivne kontrolne podatke.
1.5.2.3. Visine doza
Za utvrđivanje visine doze koja će se koristiti u glavnoj studiji treba provesti preliminarnu studiju u kojoj će se koristiti odgovarajući broj kokoši i skupina tretiranih različitim visinama doze. U preliminarnoj studiji obično je nužna određena smrtnost kako bi se odredila odgovarajuća doza za glavnu studiju. Međutim, za prevenciju smrti uslijed akutnih kolinergičkih učinaka, mogu se primijeniti atropin ili neki drugi zaštitni agens za koji je poznato da ne ometa odgođene neurotoksičke reakcije. Za procjenu maksimalne doze ispitivane tvari koja ne dovodi do smrtnosti može se upotrijebiti čitav niz ispitnih metoda (vidjeti metodu B.1.bis). U odabiru doze isto tako mogu biti korisni i ranije prikupljeni podaci o kokošima ili druge toksikološke informacije.
Visina doze ispitivane tvari u glavnoj studiji treba biti što je moguća viša uzimajući u obzir rezultate preliminarne studije za odabir doze i gornju granicu visine doze od 2 000 mg/kg tjelesne mase. Eventualna smrtnost do koje može doći ne bi smjela utjecati na preživljavanje dostatnog broja životinja za biokemijsku analizu (šest) i histološku analizu (šest) nakon 21 dan. Za prevenciju smrti uslijed akutnih kolinergičkih učinaka treba koristiti atropin ili neki drugi zaštitni agens za koji se zna da ne ometa odgođene neurotoksičke reakcije.
1.5.2.4. Granični test
Ako test pri visini doze od najmanje 2 000 mg/kg tjelesne mase/dan, uz primjenu postupaka opisanih za ovu studiju, ne proizvede vidljive toksičke učinke i ako se na temelju podataka o strukturno srodnim tvarima toksičnost ne očekuje, studija uz primjenu više doze može se smatrati nepotrebnom. Granični je test relevantan samo ako izloženost ljudi ne ukazuje na potrebu za primjenom više doze.
1.5.3. Razdoblje opažanja
Razdoblje opažanja treba biti 21 dan.
1.5.4. Postupak
Nakon primjene zaštitnog agensa kojim se sprečava smrt uslijed akutnog kolinergičkog učinka, ispitivana tvar daje se u jednoj dozi.
Opća opažanja
Opažanja trebaju početi odmah nakon izlaganja. Sve kokoši treba pomno opažati nekoliko puta tijekom prva dva dana, a zatim najmanje jednom dnevno tijekom razdoblja od 21 dan ili do planiranog usmrćenja. Treba bilježiti sve znakove toksičnosti, uključujući vrijeme prve pojave, vrstu, ozbiljnost i trajanje anomalija u ponašanju. Ataksiju treba mjeriti na uobičajenoj ljestvici koja obuhvaća četiri razine, a paralizu treba zabilježiti. Najmanje dvaput tjedno kokoši odabrane za patologiju treba izvaditi iz kaveza i određeno vrijeme podvrgnuti prisilnoj motornoj aktivnosti, kao što je penjanje po ljestvama, čime će se olakšati opažanje minimalnih toksičnih učinaka. Životinje na umoru i životinje u stanju teške patnje ili bola treba ukloniti čim su uočene, humano usmrtiti i izvršiti nekropsiju.
Tjelesna masa
Sve kokoši treba vagati neposredno pred primjenu ispitivane tvari i najmanje jednom tjedno nakon toga.
Biokemijska analiza
Šest nasumice izabranih kokoši iz svake tretirane skupine i kontrolne skupine za nosač, i tri kokoši iz pozitivne kontrolne skupine (ako se ta skupina vodi istodobno), treba usmrtiti nekoliko dana nakon doziranja, a mozak i lumbarnu leđnu moždinu preparirati i procijeniti s obzirom na aktivnost inhibicije esteraze povezane s neuropatskim djelovanjem. Povrh toga, može biti korisno preparirati i analizirati tkivo bedrenog živca s obzirom na aktivnost inhibicije esteraze povezane s neuropatskim djelovanjem. Obično se po tri kokoši iz kontrolne i svake tretirane skupine usmrti nakon 24 sata, a tri nakon 48 sati, dok se po tri kokoši iz pozitivnih kontrolnih skupina usmrti nakon 24 sata. Ako opažanje kliničkih znakova intoksikacije (koja se često procjenjuje opažanjem vremena prve pojave kolinergičkih znakova) ukazuje na to da se toksični agens razgrađuje vrlo sporo, u tom slučaju možda je bolje uzorkovati tkivo iz tri kokoši dvaput u vremenu između 24 i tek 72 sata nakon doziranja.
Na tim uzorcima, ako se smatraju prikladnim, mogu se provoditi i analize acetilkolinesteraze (AChE). Međutim, do spontane reaktivacije AChE može doći in vivo, i time dovesti do podcijenjenog potencijala tvari kao inhibitora esteraze AchE.
Makroskopska nekropsija
Makroskopska nekropsija svih životinja (planirano usmrćenih i usmrćenih zato što su bile na umoru) treba obuhvatiti opažanje izgleda mozga i leđne moždine.
Histopatološki pregled
Živčano tkivo životinja koje su preživjele razdoblje opažanja i nisu upotrijebljene za biokemijske analize treba mikroskopski pregledati. Tkiva treba fiksirati in situ, tehnikama perfuzije. Sekcijom treba obuhvatiti cerebellum (srednju uzdužnu razinu), medulla oblongata, leđnu moždinu i periferne živce. Sekcije leđne moždine uzimaju se iz gornjeg cervikalnog segmenta, regije srednjeg toraksa i lumbo-sakralne regije. Treba uzeti sekcije distalne regije tibijalnog živca i njegovih grana prema gastrocnemiusu, i sekcije bedrenog živca. Sekcije treba obojiti odgovarajućim bojilima za mijelin i aksone.
2. PODACI
Negativni rezultati analiza odabranih u ovoj metodi (biokemijske pretrage, histopatološke pretrage i opažanje ponašanja) u pravilu ne znače potrebu daljnjeg ispitivanja odgođene toksičnosti. Za dvosmislene rezultate ili rezultate iz kojih nije moguće proizvesti zaključke može biti potrebno dodatno vrednovanje.
Treba osigurati pojedinačne podatke. Dodatno, sve podatke treba sažeti u tablici u kojoj treba prikazati broj životinja u svakoj skupini na početku ispitivanja, broj životinja s lezijama, učincima na ponašanje ili biokemijskim učincima, tipove i ozbiljnost tih lezija ili učinaka te postotak životinja po vrsti i ozbiljnosti lezije ili učinka.
Nalaze ove studije treba vrednovati s obzirom na učestalost, ozbiljnost i korelaciju učinaka na ponašanje te biokemijskih i histopatoloških učinaka i eventualnih drugih opaženih učinaka kod tretiranih i kontrolnih skupina.
Numeričke rezultate treba vrednovati odgovarajućim opće prihvatljivim statističkim metodama. Odabir statističke metode koja će se koristiti obavlja se u okviru planiranja studije.
3. IZVJEŠĆIVANJE
IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju treba, ako je moguće, sadržavati slijedeće informacije:
|
|
3.1. Ispitne životinje:
|
|
|
3.2. Uvjeti ispitivanja:
|
|
|
3.3. Rezultati:
|
|
|
Rasprava o rezultatima. |
|
|
Zaključci. |
4. REFERENCE
Ova je metoda analogna Smjernici za ispitivanje OECD–a TG 418.
B.38. STUDIJA ODGOĐENE NEUROTOKSIČNOSTI ORGANOFOSPORNIH TVARI – PONAVLJANO DOZIRANJE TIJEKOM 28 DANA
1. METODA
1.1. UVOD
Kod procjene i vrednovanja toksičkih učinaka tvari važno je uzeti u obzir potencijal određenih klasa tvari da uzrokuju posebne tipove neurotoksičnosti koje možda nije moguće otkriti u drugim studijama toksičnosti. Za neke organofosforne tvari opaženo je da uzrokuju odgođenu neurotoksičnost pa bi trebale postati predmetom vrednovanja.
Za utvrđivanje tvari koje mogu uzrokovati odgođenu polineuoropatiju mogu se upotrijebiti testovi probira in vitro; međutim, negativni nalazi in vitro studija nisu dokaz da ispitivana tvar nije neurotoksična.
Ovim 28-dnevnim ispitivanjem odgođene neurotoksičnosti dobivaju se informacije o mogućim opasnostima po zdravlje koje bi mogle biti izazvane ponavljanim izlaganjem u ograničenom vremenskom razdoblju. Dobivaju se informacije o reakciji na dozu, a može se dobiti i procjena visine kod koje se ne opaža štetni učinak, što može biti korisno za utvrđivanje sigurnosnih kriterija u pogledu izlaganja.
Vidjeti također Opći uvod, dio B.
1.2. DEFINICIJE
Organofosforne tvari obuhvaćaju organofosforne estere bez naboja, tioestere ili anhidride organofosforne, organofosfonske ili organofosforamidne kiseline ili srodne fosforotio, fosfonotio ili fosforotioamidne kiseline, ili druge tvari koje mogu uzrokovati odgođenu neurotoksičnost koje se ponekad vide u toj klasi tvari.
Odgođena neurotoksičnost je sindrom koji se povezuje s produženim odgođenim vremenom prve pojave ataksije, distalnih aksonopatija u leđnoj moždini i perifernom živcu, i inhibiciju i starenje esteraze koja je povezana s neuropatskim djelovanjem (neuropathy target esterase — NTE) u neuralnom tkivu.
1.3. NAČELO ISPITNE METODE
Dnevne doze ispitivane tvari daju se oralno domaćim kokošima kontinuirano 28 dana Životinje se opažaju najmanje jednom dnevno s obzirom na anomalije u ponašanju, ataksiju i paralizu tijekom 14 dana nakon posljednje doze. Biokemijska mjerenja, posebno inhibicija esteraze koja je povezana s neuropatskim djelovanjem (NTE), provode se na kokošima koje su nasumice odabrane iz svake skupine, obično 24 i 48 sati nakon posljednje doze. Dva tjedna nakon posljednje doze, preostali broj kokoši se usmrti i provede se histopatološka pretraga odabranog neuralnog tkiva.
1.4. OPIS ISPITNE METODE
1.4.1. Pripreme
Zdrave mlade odrasle kokoši bez virusnih oboljenja koja bi mogla utjecati na istraživanje, koje ne primaju nikakve lijekove i ne pokazuju nepravilnosti u hodu treba nasumice odabrati i svrstati u tretirane i kontrolne skupine, te prilagođavati laboratorijskim uvjetima najmanje pet dana prije početka istraživanja.
Treba koristiti kaveze ili ograđeni prostor dovoljne veličine da se kokošima omogući slobodno kretanje te treba koristiti lako opažanje hoda.
Svakodnevno oralno doziranje ispitivane tvari, sedam dana u tjednu, poželjno je provoditi sondom ili primjenom želatinskih kapsula. Tekućine se mogu davati nerazrijeđene ili otopljene u odgovarajućem otapalu kao što je kukuruzno ulje; ako je moguće, krute tvari treba otopiti jer apsorpcija velikih doza krute tvari u želatinskim kapsulama može biti nedovoljno učinkovita. Za sva otapala osim vode, toksičke karakteristike moraju biti poznate, a ako nisu, treba ih utvrditi prije ispitivanja.
1.4.2. Uvjeti ispitivanja
1.4.2.1. Ispitne životinje
Preporuča se koristiti mlade odrasle domaće nesilice (Gallus gallus domesticus), stare do 12 mjeseci. Treba koristiti pasmine i sojeve standardne veličine i kokoši koje su odrasle u uvjetima koji su im omogućivali slobodno kretanje.
1.4.2.2. Broj i spol
Obično se koriste tri tretirane skupine i kontrolna skupina za nosač. Kontrolnu skupinu za nosač treba tretirati na identičan način kao i tretiranu skupinu, osim što se ispitivana tvar ne daje.
U svakoj skupini treba biti dovoljan broj kokoši kako bi ih se najmanje šest moglo usmrtiti za biokemijsku analizu (tri u svakoj od dvije vremenske točke), a šest može preživjeti 14-dnevno razdoblje opažanja patologije nakon tretiranja.
1.4.2.3. Visine doza
Visine doza treba odabrati uzimajući u obzir rezultate iz testa odgođene neurotoksičnosti nakon akutnog izlaganja i drugih postojećih podataka o toksičnosti ili kinetici ispitivanog spoja. Najvišu dozu treba odabrati s ciljem da se izazove toksičko djelovanje, poželjno odgođena neurotoksičnost, ali ne i smrt ili očita patnja. Nakon toga treba odabirati sve niže doze kako bi se dobile sve reakcije vezane uz dozu, i na kraju najniža doza kod koje nema opaženih štetnih učinaka.
1.4.2.4. Granični test
Ako test pri visini doze od najmanje 1 000 mg/kg tjelesne mase/dan, uz primjenu postupaka opisanih za ovu studiju, ne proizvede vidljive toksičke učinke i ako se na temelju podataka o strukturno srodnim tvarima toksičnost ne očekuje, studija uz primjenu više visine doze može se smatrati nepotrebnom. Granični je test relevantan samo ako izloženost ljudi ne ukazuje na potrebu za primjenom više doze.
1.4.2.5. Razdoblje opažanja
Sve životinje treba opažati najmanje jednom dnevno tijekom razdoblja izlaganja i 14 dana nakon toga, osim u slučajevima planirane nekropsije.
1.4.3. Postupak
Životinjama se ispitivana tvar daje svakodnevno tijekom 28 dana.
Opća opažanja
Opažanja trebaju početi odmah nakon početka tretiranja. Sve kokoši treba pomno opažati najmanje jednom dnevno svakog dana 28-dnevnog tretiranja i 14 dana nakon doziranja ili do planiranog usmrćenja. Treba bilježiti sve znakove toksičnosti, uključujući vrijeme prve pojave, vrstu, ozbiljnost i trajanje anomalija u ponašanju. Opažanjima treba obuhvatiti anomalije u ponašanju, ali se ne smiju ograničiti na njih. Ataksiju treba mjeriti na uobičajenoj ljestvici koja obuhvaća četiri razine, a paralizu treba zabilježiti. Najmanje dvaput tjedno kokoši treba izvaditi iz kaveza i određeno vrijeme podvrgnuti prisilnoj motornoj aktivnosti, kao što je penjanje po ljestvama, čime će se olakšati opažanje minimalnih toksičnih učinaka. Životinje na umoru, u stanju teške patnje ili bola treba ukloniti čim su uočene, humano usmrtiti i izvršiti nekropsiju.
Tjelesna masa
Sve kokoši treba vagati neposredno pred prvu primjenu ispitivane tvari i najmanje jednom tjedno nakon toga.
Biokemijska analiza
Šest nasumice izabranih kokoši iz svake tretirane skupine i kontrolne skupine za nosač treba usmrtiti nekoliko dana nakon posljednje doze, a mozak i lumbarnu leđnu moždinu preparirati i analizirati s obzirom na aktivnost inhibicije esteraze povezane s neuropatskim djelovanjem (NTE). Povrh toga, može biti korisno preparirati i analizirati tkivo bedrenog živca s obzirom na aktivnost inhibicije esteraze povezane s neuropatskim djelovanjem (NTE). Obično se po tri kokoši iz kontrolne i svake tretirane skupine usmrti nakon 24 sata, a po tri 48 sati nakon posljednje doze. Ako rezultati studije akutnog djelovanja ili drugih studija (npr. toksikokinetičkih) ukazuju da je poželjno odrediti drugačije rokove usmrćivanja nakon posljednjeg doziranja, tada te rokove treba primijeniti i dokumentirati razloge.
Na tih uzorcima, ako se smatraju prikladnim, mogu se provoditi i analize acetilkolinesteraze (AChE). Međutim, spontana reaktivacija AChE može se dogoditi in vivo, zbog čega se potencijal tvari da djeluje kao inhibitor esteraze AchE može podcijeniti.
Makroskopska nekropsija
Makroskopska nekropsija svih životinja (planirano usmrćenih i usmrćenih zato što su bile na umoru) treba obuhvatiti opažanje izgleda mozga i leđne moždine.
Histopatološki pregled
Živčano tkivo životinja koje su preživjele razdoblje opažanja i nisu upotrijebljene za biokemijske analize treba mikroskopski pregledati. Tkiva treba fiksirati in situ, tehnikama perfuzije. Sekcijom treba obuhvatiti cerebellum (mali mozak) (srednju uzdužnu razinu), medullu oblongatu (produljenu moždinu), leđnu moždinu i periferne živce. Sekcije leđne moždine uzimaju se iz gornjeg cervikalnog segmenta, regije srednjeg toraksa i lumbo-sakralne regije. Treba uzeti sekcije distalne regije tibijalnog živca i njegovih grana prema gastrocnemiusu, i sekcije bedrenog živca. Sekcije treba obojiti odgovarajućim bojama za mijelin i aksone. U početku, mikroskopski pregled treba provoditi na konzerviranom tkivu svih životinja u kontrolnoj skupini i skupini koja je tretirana velikom dozom. Ako se učinci utvrde u skupini koja je primala velike doze, mikroskopsku pretragu treba provesti i na kokošima iz skupina koje su primale srednju i malu dozu.
2. PODACI
Negativni rezultati analiza odabranih u ovoj metodi (biokemijske pretrage, histopatološke pretrage i opažanje ponašanja) u pravilu znače da dodatno ispitivanje odgođene toksičnosti nije potrebno nastaviti. Kod dvosmislenih rezultata ili rezultata iz kojih nije moguće proizvesti zaključke može biti potrebno dodatno vrednovanje.
Treba osigurati pojedinačne podatke. Dodatno, sve podatke treba sažeti u tablici u kojoj treba navesti broj životinja u svakoj skupini na početku ispitivanja, broj životinja s lezijama, učincima na ponašanje ili biokemijskim učincima, tipove i ozbiljnost tih lezija ili učinaka, i postotak životinja po vrsti i ozbiljnosti lezije ili učinka.
Nalaze ove studije treba vrednovati s obzirom na učestalost, ozbiljnost i korelaciju učinaka na ponašanje, te biokemijskih i histopatoloških učinaka i eventualnih drugih opaženih učinaka kod tretiranih ili kontrolnih skupina.
Numeričke rezultate treba vrednovati odgovarajućim opće prihvatljivim statističkim metodama. Odabir statističke metode koja će se koristiti obavlja se u okviru planiranja studije.
3. IZVJEŠĆIVANJE
IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju treba, ako je moguće, sadržavati slijedeće informacije:
|
|
3.1. Ispitne životinje:
|
|
|
3.2. Uvjeti ispitivanja:
|
|
|
3.3. Rezultati:
|
|
|
Rasprava o rezultatima. |
|
|
Zaključci. |
4. REFERENCE
Ova je metoda analogna Smjernici za ispitivanje OECD–a TG 419.
B.39. TEST NEPLANIRANE SINTEZE DNK (UDS) NA STANICAMA JETRE SISAVACA IN VIVO
1. METODA
Ova je metoda replika Smjernice za ispitivanje OECD–a TG 486, Test neplanirane sinteze DNK (UDS) na stanicama jetre sisavaca in vivo (1997.)
1.1. UVOD
Test neplanirane sinteze DNK (Unscheduled DNA Synthesis, UDS) na stanicama jetre sisavaca in vivo provodi se kako bi se utvrdilo koje ispitivane tvari u stanicama jetre tretiranih životinja induciraju popravak DNK (vidjeti 1., 2., 3., 4.).
Ovaj in vivo test predstavlja metodu za istraživanje genotoksičkih učinaka kemikalija u jetri. Izmjereni učinak pokazatelj je oštećenja i naknadnog popravka DNK u stanicama jetre. Jetra je obično glavno mjesto metabolizma apsorbiranih spojeva. Stoga je prikladna za mjerenje oštećenja DNK in vivo.
Ovaj test nije primjeren ako je očito da ispitivana tvar neće stići do ciljnog tkiva.
Neplanirana sinteza DNK (UDS) mjeri se određivanjem ugradnje obilježenih nukleozida u stanice u kojima se ne odvija planirana sinteza DNK (S-faza). Najčešće primjenjivana tehnika je određivanje ugradnje timidina obilježenog tritijem (3H-TdR) autoradiografijom. Za ispitivanja neplanirane sinteze DNK in vivo poželjno je koristiti jetru štakora. Mogu se koristiti i druga tkiva osim jetre, ali ona nisu predmet ove metode.
Otkrivanje neplanirane sinteze DNK (UDS) ovisi o broju baza DNK odstranjenih ekscizijom i zamijenjenih na mjestu oštećenja. Stoga je test neplanirane sinteze DNK (UDS) posebno koristan za otkrivanje popravaka dugih sekvenci (20-30 baza). Suprotno tomu, popravak kratkih sekvenci (1-3 baze) otkriva se uz znatno nižu osjetljivost. Nadalje, uslijed izostanka popravka, pogrešnog popravka ili pogrešnog repliciranja DNK lezija može doći do mutagenih događanja. Jačina neplanirane sinteze DNK (UDS) nije pokazatelj da je postupak popravka vjeran. Nadalje, moguće je da mutagen reagira s DNK, ali da se oštećenje DNK ne popravi postupkom ekscizije. Izostanak posebnih informacija o aktivnosti mutagena u testu neplanirane sinteze DNK (UDS) nadoknađuje se potencijalnom osjetljivošću tog kriterija jer se isti mjeri u cijelom genomu.
Vidjeti također Opći uvod, dio B.
1.2. DEFINICIJE
Stanice u tijeku popravka: neto broj zrnaca u jezgri (NNG) veći od unaprijed postavljene vrijednosti, razlog čega treba utvrditi u laboratoriju koji provodi test.
Neto broj zrnaca u jezgri (NNG): količinski izmjerena aktivnost neplanirane sinteze DNK stanica u autoradiografskom UDS testu, koja se izračunava oduzimanjem prosječnog broja zrnaca na površinama citoplazme koje su ekvivalentne jezgri (CG) od broja zrnaca u jezgri (NG): NNG = NG – CG. Iznosi NNG izračunavaju se za pojedinačne stanice i zatim objedinjuju za stanice u kulturi, paralelnim kulturama itd.
Neplanirana sinteza DNK (UDS): sinteza za popravak DNK nakon ekscizije i odstranjenja onog niza DNK koji obuhvaća područje oštećenja koje je izazvano kemijskim tvarima ili fizičkim agensom.
1.3. NAČELO ISPITNE METODE
Ispitivanje neplanirane sinteze DNK (UDS) u stanicama jetre sisavaca in vivo pokazatelj je sinteze za popravak DNK nakon ekscizije i odstranjenja niza DNK koji sadrži područje oštećenja izazvanog kemijskim tvarima ili fizičkim agensom. Pokus se obično temelji na ugradnji 3H-TdR u DNK stanica jetre koje imaju nisku frekvenciju stanica u S fazi staničnog ciklusa. Ugradnja 3H-TdR obično se određuje autoradijografijom, jer ta tehnika nije toliko osjetljiva na interferenciju uslijed stanica S-faze kao, primjerice, scintilacijski brojači.
1.4. OPIS METODE
1.4.1. Pripreme
1.4.1.1. Odabir životinjskih vrsta
Obično se koriste štakori, iako se može koristiti bilo koja prikladna vrsta sisavaca. Treba koristiti mlade zdrave odrasle životinje sojeva koji se obično koriste u laboratorijskim istraživanjima. Na početku studije odstupanje mase životinja treba biti minimalno i ne smije prelaziti ± 20 % srednje mase za svaki spol.
1.4.1.2. Uvjeti smještaja i prehrane
Primjenjuju se opći uvjeti navedeni u Općem uvodu, dio B, iako bi ciljna vrijednost vlage trebala biti 50-60 %.
1.4.1.3. Priprema životinja
Zdrave mlade odrasle životinje biraju se nasumice i raspodjeljuju u kontrolne skupine i skupine koje će se tretirati. Kaveze treba urediti na način da se eventualni učinci držanja u kavezu svedu na minimum. Životinje se jednoznačno identificiraju i drže u kavezima najmanje pet dana prije početka studije kako bi se prilagodile laboratorijskim uvjetima.
1.4.1.4. Ispitivana tvar/Pripravak
Prije no što se doza daje životinjama, krute ispitivane tvari po potrebi treba otopiti ili suspendirati u odgovarajućim otapalima ili nosačima i razrijediti. Tekuće ispitivane tvari mogu se dozirati izravno ili razrijediti prije doziranja. Ako prema podacima o stabilnosti skladištenje nije prihvatljivo, pripravke ispitivane tvari treba koristiti svježe.
1.4.2. Uvjeti ispitivanja
1.4.2.1. Otapalo/Nosač
Pri visinama doza koje se koriste, otapalo/nosač ne smije imati toksičke učinke i ne smije postojati sumnja da bi mogao kemijski reagirati s ispitivanim tvarima. Ako se primjenjuju manje poznata otapala/nosači, njihovo bi uključivanje u ispitivanje trebalo biti potkrijepljeno podacima koji dokazuju njihovu pogodnost. Kad god je to moguće preporuča se najprije razmotriti mogućnost primjene vodenog otapala/nosača.
1.4.2.2. Kontrole
U svaki dio pokusa koji se provodi neovisno, treba uključiti paralelne pozitivne i negativne kontrole (otapalo/nosač). Osim tretiranja ispitivanom tvari, sa životinjama u kontrolnim skupinama treba postupati jednako kao sa životinjama u tretiranim skupinama.
Pozitivne kontrole su tvari za koje je poznato da izazivaju neplaniranu sintezu DNK (UDS) ako se primjenjuju na razinama izlaganja kod kojih se očekuje uočljivo povećanje u odnosu na podlogu. Pozitivne kontrole za koje je potrebna metabolička aktivacija treba koristiti u dozama koje izazivaju umjerenu reakciju (4). Doze se mogu birati na način da učinci budu jasni, ali da osoba koja očitava rezultate ipak ne može odmah vidjeti identitet kodiranih mikroskopskih preparata. Primjeri tvari za pozitivnu kontrolu obuhvaćaju:
|
Vrijeme uzorkovanja |
Tvar |
CAS br. |
EINECS br. |
|
Rano uzorkovanje (2-4 sata) |
N-Nitrosodimetilamin |
62-75-9 |
200-249-8 |
|
Kasno uzorkovanje (12-16 sati) |
N-2-Fluorenilacetamid (2-AAF) |
53-96-3 |
200-188-6 |
Za pozitivnu kontrolu mogu se koristiti i druge tvari. Prihvatljivo je tvari za pozitivnu kontrolu primijeniti putem koji se razlikuje od puta primjene ispitivane tvari.
1.5. POSTUPAK
1.5.1. Broj i spol životinja
Treba koristiti odgovarajući broj životinja kako bi se mogle uzeti u obzir prirodne biološke razlike u pojedinoj ispitivanoj reakciji. Broj životinja treba odrediti na način da po skupini bude najmanje tri životinje pogodne za analizu. Ako iz ranijih studija postoji značajna baza podataka, u paralelnim negativnim i pozitivnim kontrolnim skupinama dovoljno je imati samo jednu ili dvije životinje.
Ako su u vrijeme provođenja studije dostupni podaci iz studija provedenih na istoj životinjskoj vrsti uz primjenu istog puta izlaganja, koji dokazuju da nema znatnih razlika u toksičnosti s obzirom na spol, ispitivanje na jednom spolu, po mogućnosti mužjacima, bit će dovoljno. U slučajevima kad izloženost ljudi nekoj kemikaliji može biti vezana uz spol, kao što je slučaj s nekim farmaceutskim sredstvima, test treba obaviti na životinjama odgovarajućeg spola.
1.5.2. Plan tretiranja
Ispitivane tvari obično se primjenjuju jednokratno.
1.5.3. Visine doze
Obično se koriste barem dvije visine doze. Najviša se doza definira kao doza koja uzrokuje takve znakove toksičnosti da je za očekivati da bi više doze pri istom režimu doziranja prouzročile smrt. Općenito, niža doza treba iznositi 50 % do 25 % visoke doze.
Tvari koje u niskim netoksičnim dozama imaju specifično biološko djelovanje (poput hormona i mitogena) mogu biti izuzete od kriterija za utvrđivanje doza te ih se treba ocjenjivati od slučaju do slučaja. Ako se u nedostatku odgovarajućih podataka provodi studija za utvrđivanje raspona, studiju treba provesti isti laboratorij, na istoj vrsti, soju, spolu i s istim režimom tretiranja kao i u glavnoj studiji.
Najviša se doza isto tako može definirati kao doza koja uzrokuje pojavu nekih pokazatelja toksičnosti u jetri (npr. piknotiza jezgre).
1.5.4. Granični test
Ako test pri jednoj visini doze od najmanje 2 000 mg/kg tjelesne mase, primijenjenoj jednokratno ili u dva tretiranja istog dana, ne proizvede vidljive toksičke učinke i ako se na temelju podataka o strukturno srodnim tvarima genotoksičnost ne očekuje, potpuna studija možda nije potrebna. Očekivana izloženost ljudi može ukazati na potrebu da se u graničnom testu primijeni viša doza.
1.5.5. Primjena doza
Ispitivana se tvar obično primjenjuje unošenjem pomoću želučane sonde ili odgovarajuće intubacijske kanile. Drugi putevi primjene mogu biti prihvatljivi ako se za njih može dokazati da su opravdani. Međutim, intraperiotonealni put primjene ne preporuča se jer bi na taj način jetra bila izložena ispitivanoj tvari izravno, a ne preko sustava cirkulacije. Maksimalni volumen tekućine koji se odjednom može primijeniti putem sonde ili injekcije ovisi o veličini pokusne životinje. Taj volumen ne bi smio biti veći od 2 ml/100 g tjelesne mase. Opravdanost primjene većih volumena od navedenog treba dokazati. Osim kod nadražujućih i nagrizajućih tvari, koje pri višim koncentracijama obično izazivaju negativne učinke, variranje ispitnih volumena treba podešavanjem koncentracije svesti na minimum kako bi se kod svih koncentracija osigurao stalni volumen.
1.5.6. Pripravci stanica jetre
Stanice jetre tretiranih životinja prepariraju se 12-16 sati nakon doziranja. Dodatno ranije uzorkovanje (najčešće dva do četiri sata nakon tretiranja) obično je potrebno ako u tom roku 12-16 sati izostane jasna pozitivna reakcija. Međutim, moguće je primijeniti i alternativne rokove uzorkovanja ako je to opravdano na temelju toksikokinetičkih podataka.
Kratkotrajne kulture stanica jetre sisavaca obično se dobivaju perfuzijom jetre in situ kolagenazom nakon čega se pusti da se svježe odvojene stanice jetre priljube uz prikladnu površinu. Stanice jetre životinja iz negativne kontrolne skupine životinja trebaju imati preživljavanje (5) od najmanje 50 %.
1.5.7. Određivanje neplanirane sinteze DNK (UDS)
Svježe izolirane stanice jetre sisavaca obično se dovoljno dugo, npr. 3-8 sati, inkubiraju medijem koji sadrži 3H-TdR. Na kraju razdoblja inkubacije, medij treba odstraniti iz stanica koje zatim treba inkubirati medijem koji sadrži prekomjernu količinu neobilježenog timidina kako bi se umanjila radioaktivnost preostala nakon ugradnje („cold chase”). Stanice se zatim isperu, fiksiraju i osuše. Za produžena vremena inkubacije postupak „cold chase” možda neće biti potreban. Preparati se umoče u emulziju za autoradiografiju i ostave izloženi u mraku (npr. hlađeni tijekom 7-14 dana), razviju se, boje, te se zatim prebrojavaju izložena srebrna zrnca. Za svaku životinju pripreme se dva do tri preparata.
1.5.8. Analiza
Pripremljeni preparati moraju sadržavati dovoljan broj stanica normalne morfologije kako bi se omogućila smislena procjene neplanirane sinteze DNK (UDS). Preparati se pregledavaju mikroskopski kako bi se utvrdili znakovi otvorene citotoksičnosti (npr. piknoza, smanjene razine obilježavanja radioaktivnim izotopom).
Prije brojanja zrnca preparate treba kodirati. Obično se analizira 100 stanica svake životinje na temelju najmanje dva preparata; ako se analizira manje od 100 stanica/životinji, za to treba navesti opravdani razlog. Broj zrnaca ne analizira se za jezgru S-faze, ali omjer stanica S-faze može se zabilježiti.
Količinu 3H-TdR ugrađenu u jezgru i citoplazmu morfološki normalnih stanica, koja se uočava deponiranim srebrnim zrncima, treba utvrditi prikladnim metodama.
Broj zrnaca određuje se u jezgri (zrnca jezgre, NG) i na površinama citoplazme koje su ekvivalentne jezgri (zrnca citoplazme, CG). Broj zrnaca CG određuje se bilo na temelju najjače obilježene površine citoplazme, ili iz prosjeka od dva do tri broja zrnaca citoplazme iz nasumice odabranih površina u blizini jezgre. Mogu se primijeniti i druge metode brojanja (npr. brojanje cijele stanice), ako se njihova opravdanost može dokazati (6).
2. PODACI
2.1. OBRADA REZULTATA
Treba osigurati preparate i podatke za svaku životinju pojedinačno. Dodatno, podatke treba sažeti u tabličnom obliku. Neto broj zrnaca jezgre (NNG) izračunava se za svaku stanicu, svaku životinju i za svaku dozu i vrijeme oduzimanjem broja CG od broja NG. Ako se broje „stanice u tijeku popravka”, opravdanost kriterija za njihovo definiranje treba dokazati i temeljiti na ranije poznatim podacima ili podacima iz paralelne negativne kontrolne skupine. Ako se primjenjuju, statističke testove treba odabrati i njihovu opravdanost dokazati prije provođenja studije.
2.2. VREDNOVANJE I TUMAČENJE REZULTATA
Primjeri kriterija na temelju kojih se može donijeti zaključak o pozitivnoj/negativnoj reakciji uključuju:
|
pozitivna |
i. |
vrijednosti NNG iznad unaprijed postavljenog praga čija je opravdanost dokazana na temelju povijesnih laboratorijskih podataka; ili |
|
|
ii. |
vrijednosti NNG znatno veće od paralelne kontrole; |
|
negativna |
i. |
vrijednosti NNG unutar/ispod povijesnog praga kontrole; ili |
|
|
ii. |
vrijednosti NNG koje nisu znatno veće od paralelne kontrole. |
Treba razmotriti biološku relevantnost podataka: tj. uzeti u obzir parametre kao što su varijacije između pojedinih životinja, odnos doza-reakcija i citotoksičnost. Kao pomoć u vrednovanju rezultata testa mogu se koristiti statističke metode. Međutim, statistički značaj ne bi smio biti jedini čimbenik na temelju kojeg se zaključuje da je reakcija pozitivna.
Iako će većina pokusa dati jasne pozitivne ili negativne rezultate, u rijetkim slučajevima set prikupljenih podataka neće omogućiti donošenje kategoričkog zaključka o aktivnosti ispitivane tvari. Bez obzir na broj ponavljanja pokusa, rezultati mogu ostati dvosmisleni ili upitni.
Pozitivan rezultat testa neplanirane sinteze DNK (UDS) na stanicama jetre sisavaca in vivo pokazuje da ispitivana tvar inducira oštećenje DNK u stanicama jetre sisavaca in vivo koje se može popraviti neplaniranom sintezom DNK in vitro. Negativan rezultat pokazuje da, u ispitnim uvjetima, ispitivana tvar ne inducira oštećenje DNK koje se može otkriti ovim pokusom.
Vjerojatnost da je ispitivana tvar stigla do glavnog krvotoka ili konkretno do ciljnog tkiva (npr. sustavna toksičnost) treba raspraviti.
3. IZVJEŠĆIVANJE
IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora, sadržavati slijedeće informacije:
|
|
Otapalo/nosač:
|
|
|
Ispitne životinje:
|
|
|
Uvjeti ispitivanja:
|
|
|
Rezultati:
|
|
|
Rasprava o rezultatima. |
|
|
Zaključci. |
4. REFERENCE
|
(1) |
Ashby, J., Lefevre, P.A., Burlinson, B. and Penman, M.G., (1985) An Assessment of the In Vivo Rat Hepatocyte DNA Repair Assay. Mutation Res., 156, str. 1-18. |
|
(2) |
Butterworth, B.E., Ashby, J., Bermudez, E., Casciano, D., Mirsalis, J., Probst, G. and Williams, G., (1987) A Protocol and Guide for the In Vivo Rat Hepatocyte DNA-Repair Assay. Mutation Res., 189, str. 123-133. |
|
(3) |
Kennelly, J.C., Waters, R., Ashby, J., Lefevre, P.A., Burlinson, B., Benford, D.J., Dean, S.W. and Mitchell, I. de G., (1993) In Vivo Rat Liver UDS Assay. In: Kirkland D.J. and Fox M., (Eds) Supplementary Mutagenicity Tests: UKEM Recommended Procedures. UKEMS Subcommittee on Guidelines for Mutagenicity Testing. Report. Part II revised. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, str. 52-77. |
|
(4) |
Madle, S., Dean, S.W., Andrae, U., Brambilla, G., Burlinson, B., Doolittle, D.J., Furihata, C., Hertner, T., McQueen, C.A. and Mori, H., (1993) Recommendations for the Performance of UDS Tests In Vitro and In Vivo. Mutation Res., 312, str. 263-285. |
|
(5) |
Fautz, R., Hussain, B., Efstathiou, E. and Hechenberger-Freudl, C., (1993) Assessment of the Relation Between the Initial Viability and the Attachment of Freshly Isolated Rat Hepatocytes Used for the In Vivo/In Vitro DNA Repair Assay (UDS). Mutation Res., 291, str. 21-27. |
|
(6) |
Mirsalis, J.C., Tyson, C.K. and Butterworth, B.E., (1982) Detection of Genotoxic Carcinogens in the In Vivo/In Vitro Hepatocyte DNA Repair Assay. Environ. Mutagen, 4, str. 553-562. |
B.40. NAGRIZANJE KOŽE IN VITRO: TEST TRANSKUTANOG ELEKTRIČNOG OTPORA (TER)
1. METODA
Ova je ispitna metoda ekvivalentna metodi iz Smjernice za ispitivanje OECD–a TG 430 (2004.).
1.1. UVOD
Nagrizanje kože odnosi se na uzrokovanje ireverzibilnog oštećenja kože nakon primjene ispitivanog materijala (prema definiciji iz Globalno usklađenog sustava razvrstavanja i označavanja kemijskih tvari i mješavina (GHS)) (1). Ova metoda predviđa postupak kojim se procjena nagrizajućeg djelovanja ne provodi na živim životinjama.
U procjenama nagrizajućeg djelovanja na kožu tradicionalno se upotrebljavaju laboratorijske životinje (2). U brizi za životinje i u nastojanju da se životinjama u tom postupku ne nanosi bol i patnja, ispitna metoda B.4. revidirana je kako bi se njome omogućilo određivanje nagrizajućeg djelovanja na kožu alternativnim, in vitro metodama.
Prvi korak prema definiranju alternativnih pokusa koji se mogu koristiti za ispitivanje nagrizajućeg djelovanja na kožu u regulatorne svrhe bilo je provođenje predvalidacijskih studija (3). Nakon toga, za in vitro metode za procjenu nagrizajućeg djelovanja na kožu (4)(5) provedena je formalna validacijska studija (6)(7)(8). Na temelju rezultata tih istraživanja i druge objavljene literature dana je preporuka da se za procjenu nagrizajućeg djelovanja na kožu in vivo mogu koristiti sljedeći testovi (9)(10)(11): test na modelu ljudske kože (vidjeti metodu B.40.bis) i test transkutanog električnog otpora (ova metoda).
U validacijskoj studiji i drugim objavljenim studijama utvrđeno je da je testom transkutanog električnog otpora (TER) na koži štakora (12)(13) moguće pouzdano razlikovati poznata i nepoznata sredstva s nagrizajućim djelovanjem na kožu (5)(9).
U ovoj metodi opisuje se pokus koji omogućuje identifikaciju nagrizajućih kemijskih tvari i mješavina. Osim toga, oslanjajući se na druge elemente za određivanje utemeljene na postojećim informacijama (npr. pH vrijednost, odnos između strukture i aktivnosti, podaci za ljude/životinje) (1)(2)(11)(14), metoda omogućuje identifikaciju i nenagrizajućih tvari i mješavina. Ne pruža informacije o nadražujućem djelovanju na kožu niti omogućuje daljnje razvrstavanje nagrizajućih tvari prema Globalno usklađenom sustavu razvrstavanja (GHS) (1).
Za potpuno vrednovanje lokalnih učinaka na kožu nakon jednostrukog dermalnog izlaganja, preporuča se poštivati strategiju sekvencijalnog ispitivanja predstavljenu u Dodatku ispitnoj metodi B.4. (2) i predviđenu Globalno usklađenim sustavom (1). Ta ispitna strategija obuhvaća provođenje in vitro pokusa za dokazivanje nagrizajućeg (kao što se opisuje u ovoj metodi) i nadražujućeg djelovanja na kožu prije eventualnog provođenja ispitivanja na živim životinjama.
1.2. DEFINICIJE
Nagrizanje kože in vivo: uzrokovanje ireverzibilnog oštećenja kože; točnije, pojava vidljive nekroze epiderme i derme nakon što je ispitivana tvar primjenjivana u trajanju od najviše 4 sata. Za nagrizanje kože tipična je pojava čireva, krvarenja, krvavih krasta te, na kraju 14-dnevnog opažanja, gubitak boje kože zbog nestajanja pigmenta, čitave površine zahvaćene alopecijom i ožiljci. Za ocjenjivanje sumnjivih lezija treba razmotriti mogućnost histopatoloških pretraga.
Transkutani električni otpor (TER): mjera električne impedancije kože, izražena kao vrijednost otpora u kilo omima. Jednostavna, robusna metoda za procjenu zaštitne funkcije bilježenjem prolaza iona kroz kožu primjenom Wheatstoneovog mosta.
1.3. REFERENTNE TVARI
Tablica 1.
Referentne kemikalije
|
Naziv |
EINECS br. |
CAS br. |
|
|
1,2-diaminopropan |
201-155-9 |
78-90-0 |
Jako nagrizajuća tvar |
|
Akrilna kiselina |
201-177-9 |
79-10-7 |
Jako nagrizajuća tvar |
|
2-tert. butilfenol |
201-807-2 |
88-18-6 |
Nagrizajuća tvar |
|
Kalijev hidroksid (10 %) |
215-181-3 |
1310-58-3 |
Nagrizajuća tvar |
|
Sumporna kiselina (10 %) |
231-639-5 |
7664-93-9 |
Nagrizajuća tvar |
|
Oktanska kiselina (kaprilna kiselina) |
204-677-5 |
124-07-02 |
Nagrizajuća tvar |
|
4-amino-1,2,4-triazol |
209-533-5 |
584-13-4 |
Nije nagrizajuća tvar |
|
Eugenol |
202-589-1 |
97-53-0 |
Nije nagrizajuća tvar |
|
Fenetil bromid |
203-130-8 |
103-63-9 |
Nije nagrizajuća tvar |
|
Tetrakloroetilen |
204-825-9 |
27-18-4 |
Nije nagrizajuća tvar |
|
Izostearinska kiselina |
250-178-0 |
30399-84-9 |
Nije nagrizajuća tvar |
|
4-(metiltio)-benzaldehid |
222-365-7 |
3446-89-7 |
Nije nagrizajuća tvar |
Većina navedenih kemikalija uzeta je iz popisa kemikalija odabranih za međunarodnu validacijsku studiju Europskog centra za validaciju alternativnih metoda (ECVAM). Odabrane su na temelju sljedećih kriterija:
|
i. |
jednak broj tvari koje imaju nagrizajuće djelovanje i tvari bez nagrizajućeg djelovanja; |
|
ii. |
komercijalno dostupne tvari iz većine relevantnih kemijskih klasa; |
|
iii. |
uključivanje jako nagrizajućih kao i manje nagrizajućih tvari kako bi se omogućilo razlikovanje na temelju sposobnosti nagrizanja; |
|
iv. |
izbor kemikalija kojima se može rukovati u laboratoriju jer ne predstavljaju druge velike opasnosti osim nagrizanja. |
1.4. NAČELO ISPITNE METODE
Ispitivani materijal primjenjuje se u trajanju od 24 sata na epidermalne površine diskova kože u dvodjelnom ispitnom sustavu u kojem diskovi kože djeluju kao pregrada između dva odjeljka. Diskovi kože uzeti su od humano usmrćenih štakora u dobi 28-30 dana. Nagrizajući materijali identificirani su prema sposobnosti da dovedu do gubitka integriteta i zaštitne funkcije normalnog stratum corrneum, koja se mjeri kao smanjenje TER vrijednosti ispod razine praga (12). Za TER vrijednosti za štakore, vrijednost praga u iznosu od 5 κΩ odabrana je na temelju mnogobrojnih podataka za široki niz kemikalija kod kojih je velika većina vrijednosti jasno bila ili znatno iznad (često > 10 κΩ), ili znatno ispod (često < 3 κΩ) te vrijednosti (12). Općenito, materijali koji na životinje ne djeluju nagrizajuće već su nadražujući ili nenadražujući ne smanjuju TER ispod te vrijednosti praga. Nadalje, uporaba drugih pripravaka kože ili druge opreme može modificirati vrijednost praga, što znači da je potrebna dodatna validacija.
U ispitni postupak ugrađena je i faza vezanja boje kojom se potvrđuju pozitivni rezultati za TER u vrijednostima oko 5 κΩ. Postupkom vezanja boje određuje se može li se povećanje ionske permeabilnosti pripisati fizičkom uništenju stratum corrneum. Pokazalo se da se TER metodom uz primjenu kože štakora može predvidjeti nagrizajuće djelovanje in vivo kod zečeva koji su procjenjivani ispitnom metodom B.4. (2). U tom smislu, treba napomenuti da je pokus koji se provodi in vivo na zečevima izuzetno konzervativan s obzirom na nagrizanje kože i na nadraživanje kože u usporedbi s testom krpice na modelu ljudske kože (human skin patch test) (15).
1.5. OPIS ISPITNE METODE
1.5.1. Životinje
Štakori su najprikladnije životinje za ovu metodu jer je osjetljivost njihove kože na kemikalije u ovom testu prethodno dokazana (10). Dob (u kojoj se koža prikuplja) i soj štakora posebno su važni kako bi se osiguralo da folikuli dlake budu u latentnoj fazi prije početka rasta odraslih dlaka.
Dlaka na leđima i bokovima mladih, približno 22 dana starih mužjaka ili ženki štakora (soja Wistar ili nekog usporedivog soja) pažljivo se ukloni malim škarama. Životinje se zatim operu nježnim brisanjem dok se ošišana površina umoči u antibiotsku otopinu (koja sadrži, primjerice, streptomicim, penicilin, kloramfenikol i amfotericin u koncentracijama koje su učinkovite u inhibiciji rasta bakterija). Životinje se ponovno operu antibioticima trećeg ili četvrtog dana nakon prvog pranja i koriste u roku tri dana nakon drugog pranja, kad se stratum corrneum oporavio od odstranjivanja dlake.
1.5.2. Priprema diskova kože
Životinje se humano usmrte kad su stare 28-30 dana; ta je dob veoma važna. Sa svake životinje odstrani se bočna koža na leđima s koje se opreznim ljuštenjem oguli prekomjerna potkožna mast. Odstrane se diskovi kože, u promjeru približno 20 mm svaki. Prije uporabe diskova koža se može skladištiti ako se pokaže da su rezultati za pozitivnu i negativnu skupinu istovjetni rezultatima dobivenim sa svježom kožom.
Po jedan disk stavi se preko jednog kraja teflonske (politetrafluoroetilenske) cijevi, osiguravajući da je epidermalna površina u dodiru s cijevi. Gumeni O-prsten pritisne se preko ruba cijevi kako bi se učvrstila koža, a višak tkiva se odreže. Dimenzije cijevi i O-prstenova prikazane su na slici 2. Gumeni O-prsten zatim se dužinom ruba teflonske cijevi oprezno zabrtvi petrolejskim gelom. Cijev se uvede u prihvatnu komoru koja sadrži otopinu MgSO4 (154 mM) u kojoj je pridržava opružna štipaljka (Slika 1.). Disk kože treba potpuno potopiti u otopinu MgSO4. Od kože jednog štakora može se dobiti čak 10-15 diskova kože za pokus.
Prije početka pokusa, mjeri se električni otpor dva kožna diska kao postupak kojim se kontrolira kvaliteta kože svake životinje. Kako bi se preostali diskovi te kože mogli koristiti u pokusu, oba kontrolna diska moraju dati vrijednosti otpora iznad 10 κΩ. Ako je vrijednost otpora ispod 10 κΩ, preostale diskove te kože treba baciti.
1.5.3. Primjena ispitivanih i kontrolnih tvari
Kako bi se osigurala odgovarajuća učinkovitost pokusnog modela, za svaku studiju treba koristiti paralelne pozitivne i negativne kontrole. Treba koristiti diskove kože jedne životinje. Kao pozitivne i negativne kontrolne tvari predlaže se 10 M klorovodična kiselina, odnosno destilirana voda.
Tekuće ispitivane tvari (150 μL) primjenjuju se ravnomjerno na epidermalnu površinu unutar cijevi. Kod ispitivanja krutih materijala, dovoljna količina krute tvari primjenjuje se ravnomjerno na disk kako bi se osigurala pokrivenost cijele epiderme. Na krutu tvar dodaje se deionizirana voda (150 μL), i cijev se pažljivo protrese. Za postizanje maksimalnog dodira s kožom, krute tvari možda treba zagrijati na 30 °C kako bi se ispitivana tvar rastopila ili omekšala, ili samljeti kako bi se dobio zrnati materijal ili prah.
Za svaki pokus i kontrolnu tvar koriste se tri diska kože. Ispitivane tvari primjenjuju se 24 sata na 20-23 °C. Ispitivana tvar uklanja se ispiranjem pod mlazom vode iz vodovoda temperature do 30 °C sve dok sav materijal nije odstranjen.
1.5.4. Mjerenja transkutanog električnog otpora (TER)
Impedancija kože, odnosno transkutani električni otpor (TER) mjeri se Wheatstoneovim mjernim mostom na niskonaponsku izmjeničnu struju (13). Opće specifikacije mosta su radni napon 1-3 Volti, izmjenična struja sinusnog ili pravokutnog oblika 50 – 1 000 Hz, i mjerno područje od najmanje 0,1 – 30 κΩ. Mjerni most koji je korišten u validacijskoj studiji mjerio je indukciju, kapacitet i otpor do vrijednosti 2 000 H, 2 000 μF, odnosno 2 ΜΩ, kod frekvencija od 100 Hz ili 1 kHz, primjenom serijskih ili paralelnih vrijednosti. U svrhu pokusa otkrivanja nagrizajućeg djelovanja, mjerenja transkutanog električnog otpora bilježena su kod frekvencije 100 Hz primjenom serijskih vrijednosti. Prije mjerenja električnog otpora, površinska napetost kože smanjuje se dodavanjem dovoljnog volumena 70 %-tnog etanola koji se nanosi na epidermu. Nakon nekoliko sekundi, etanol se uklanja iz cijevi, a tkivo se hidratizira dodavanjem 3 ml otopine MgSO4 (154 mM). Elektrode mjernog mosta postavljaju se na drugu stranu diska kože i mjeri se otpor u κΩ/disku kože (Slika 1.). Dimenzije elektrode i duljina elektrode izložena ispod krokodilskih štipaljki prikazane su na slici 2. Štipaljka na unutarnjoj elektrodi za vrijeme mjerenja stoji na vrhu teflonske cijevi kako bi se osiguralo da u otopinu MgSO4 bude uronjena stalno ista duljina elektrode. Vanjska elektroda postavlja se unutar komore na način da stoji na dnu komore. Razmak između opružne štipaljke i dna teflonske cijevi održava se stalnim (Slika 2.), jer ta udaljenost utječe na dobivene vrijednosti otpora. Zbog toga, razmak između unutarnje elektrode i diska kože treba biti stalan i minimalan (1-2 mm).
Ako je izmjerena vrijednost otpora veća od 20 κΩ, to može biti posljedica preostalog sloja ispitivane tvari na epidermalnoj površini diska kože. Ponovno treba pokušati ukloniti taj sloj, primjerice, na način da se teflonska cijev zatvori pritiskom prsta zaštićenog rukavicom i protresa približno 10 sekundi; otopina MgSO4 baca se i mjerenje otpora ponavlja se s novom otopinom MgSO4.
Svojstva i dimenzije ispitnog uređaja i primijenjen ispitni postupak mogu utjecati na dobivene vrijednosti transkutanog električnog otpora. Prag od 5 κΩ za nagrizajuće djelovanje određen je iz podataka dobivenih konkretnim uređajem i postupkom opisanim u ovoj metodi. Ako se ispitni uvjeti izmijene ili se primijeni drugačiji uređaj, mogu vrijediti drugačiji pragovi i kontrolne vrijednosti. Stoga je potrebno kalibrirati metodologiju i vrijednosti praga otpora ispitivanjem niza referentnih etalona odabranih između kemikalija koje su korištene u validacijskoj studiji (4)(5), ili kemikalija koje su iz kemijski sličnih klasa kao kemikalije koje se istražuju. Niz odgovarajućih referentnih kemikalija naveden je u tablici 1.
1.5.5. Metode vezanja boje
Izlaganje određenih nenagrizajućih materijala može rezultirati smanjenjem otpora na vrijednost ispod praga od 5 κΩ koja dozvoljava prolaz iona kroz stratum corneum, čime se električni otpor smanjuje (5). Na primjer, neutralne organske kemikalije i kemikalije koje imaju površinski aktivna svojstva (uključujući deterdžente, emulgatore i druge surfaktante) mogu iz kože odstraniti lipide i time povećati propusnost zaštite za ione. Znači, ako su vrijednosti transkutanog električnog otpora (TER) ispitivanih tvari manje od ili oko 5 κΩ bez vidljivog oštećenja, na kontrolnom i tretiranom tkivu treba provesti procjenu penetracije boje kako bi se odredilo jesu li te dobivene vrijednosti TER rezultat povećane propusnosti kože, ili nagrizanja kože (3)(5). Ako se radi o nagrizajućem djelovanju, odnosno o pucanju stratum corneum, boja sulfo-rodamin B, kad se nanese na površinu kože, brzo prodire i boji potkožno tkivo. Ta konkretna boja stabilna je na širok raspon kemikalija i na nju ne utječe postupak ekstrakcije opisan dalje u tekstu.
1.5.5.1. Primjena i odstranjivanje boje sumpor-rodamin B
Nakon procjene vrijednosti TER, magnezijev se sulfat evakuira iz cijevi i koža se pažljivo pregleda s obzirom na vidljiva oštećenja. Ako očitih velikih oštećenja nema, 150 μl 10 %-tne (w/v) otopine boje sulfo-rodamin B (Acid Red 52; C.I. 45100; EINECS broj 222-529-8; CAS broj 3520-42-1) u destiliranoj vodi primjenjuje se na epidermalnu površinu svakog diska kože tijekom dva sata. Zatim se ti diskovi kože približno 10 sekundi ispiru vodom iz slavine čija temperatura nije viša od temperature okoline kako bi se time uklonio višak boje ili nevezana boja. Svaki se disk kože oprezno skine s teflonske cijevi i stavi u tikvicu (npr. tikvicu od 20 ml za scintilaciju koja sadrži deioniziranu vodu (8 ml). Tikvice se nježno tresu pet minuta kako bi se odstranila eventualna preostala nevezana boja. Zatim se ponavlja postupak ispiranja, nakon kojega se diskovi kože skidaju i stavljaju u tikvice koje sadrže 5 ml 30 %-tnog (w/v) natrijevog dodecil sulfata (SDS) u destiliranoj vodi i ostave se inkubirati preko noći na 60 °C.
Nakon inkubacije, svaki disk kože skida se i baca, a preostala otopina centrifugira se osam minuta na 21 °C (relativna centrifugalna snaga ~175 × g). Uzorak od 1 ml supernatanta razrijedi se u omjeru 1:5 (v/v) (tj. 1 ml + 4 ml) s 30 %-tnim (w/v) natrijevim dodecil sulfatom (SDS) u destiliranoj vodi. Optička gustoća (OD) otopine mjeri se na 565 nm.
1.5.5.2. Izračun sadržaja boje
Sadržaj boje sulfo-rodamin B po disku izračunava se iz vrijednosti optičke gustoće (OD) (5) (koeficijent molarne ekstinkcije sulfo-rodamina B na 565 nm = 8,7 × 104; molekulska masa = 580). Sadržaj boje određuje se za svaki disk kože primjenom odgovarajuće kalibracijske krivulje, zatim se za ponovljene pokuse izračunava srednji sadržaj boje.
2. PODACI
Po mogućnosti, vrijednosti otpora (κΩ) i srednje vrijednosti sadržaja boje (μg/disku) za ispitivani materijal, kao i za pozitivne i negativne kontrole, treba zabilježiti u tabličnom obliku (podaci pojedinačnih pokusa ± standardno odstupanje), uključujući podatke za ponovljene pokuse, srednje i pojedinačne vrijednosti.
2.1. TUMAČENJE REZULTATA
Srednji rezultati TER vrijednosti prihvatljivi su ako su vrijednosti paralelne pozitivne i negativne kontrole unutar prihvatljivog područja za dotičnu laboratorijsku metodu ispitivanja. Prihvatljivo područje otpora za metodologiju i uređaj opisano u gornjem tekstu navedeno je u sljedećoj tablici:
|
Kontrola |
Tvar |
Područje otpora (κΩ) |
|
Pozitivna |
10M klorovodična kiselina |
0,5-1,0 |
|
Negativna |
Destilirana voda |
10-25 |
Srednji rezultati vezanja boje prihvatljivi su pod uvjetom da su vrijednosti paralelne kontrole unutar područja za dotičnu metodu. Predloženi prihvatljivi rasponi sadržaja boje za kontrolne tvari za metodologiju i uređaj opisan u gornjem tekstu navedeni su u sljedećoj tablici:
|
Kontrola |
Tvar |
Raspon sadržaja boje (μg/disku) |
|
Pozitivna |
10M klorovodična kiselina |
40-100 |
|
Negativna |
Destilirana voda |
15-35 |
Ispitivana tvar ne smatra se nagrizajućom za kožu:
|
i. |
ako je za ispitivanu tvar postignuta srednja vrijednost TER veća od 5 κΩ; ili |
|
ii. |
je srednja vrijednost TER manja od ili jednaka 5 κΩ; i
|
Ispitivana tvar smatra se nagrizajućom za kožu:
|
i. |
ako je srednja vrijednost TER manja od ili jednaka 5 κΩ i disk kože je vidljivo oštećen; ili |
|
ii. |
je srednja vrijednost TER manja od ili jednaka 5 κΩ; i
|
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora sadržavati slijedeće informacije:
|
|
Ispitivana i kontrolna tvar:
|
|
|
Ispitne životinje:
|
|
|
Uvjeti ispitivanja:
|
|
|
Rezultati:
|
|
|
Rasprava o rezultatima. |
|
|
Zaključci. |
4. REFERENCE
|
(1) |
OECD, (2001) Harmonised Integrated Classification System for Human Health and Environmental Hazards of Chemical Substances and Mixtures. OECD Series on Testing and Assessment Number 33. ENV/JM/MONO(2001)6, Paris. http://www.olis.oecd.org/olis/2001doc.nsf/LinkTo/env-jm-mono(2001)6. |
|
(2) |
Ispitna metoda B.4. Akutna toksičnost: nadraživanje/nagrizanje kože. |
|
(3) |
Botham, P.A., Chamberlain, M., Barratt, M.D., Curren, R.D., Esdaile, D.J., Gardner, J.R., Gordon, V.C., Hildebrand, B., Lewis, R.W., Liebsch, M., Logemann, P., Osborne, R., Ponec, M., Regnier, J.F., Steiling, W., Walker, A.P., and Balls, M., (1995) A prevalidation study on in vitro skin corrosivity testing. The report and recommendations of ECVAM Workshop 6. ATLA 23, str. 219-255. |
|
(4) |
Barratt, M.D., Brantom, P.G., Fentem, J.H., Gerner, I., Walker, A.P., and Worth, A.P. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 1. Selection and distribution of the test chemicals. Toxicology. In Vitro 12, str. 471-482. |
|
(5) |
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhütter, H.-G., and Liebsch, M., (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology. In Vitro 12, str. 483- 524. |
|
(6) |
OECD, (1996) Final Report of the OECD Workshop on Harmonisation of Validation and Acceptance Criteria for Alternative Toxicological Test Methods, str. 62. |
|
(7) |
Balls, M., Blaauboer, B.J., Fentem. J.H., Bruner. L., Combes, R.D., Ekwall, B., Fielder. R.J., Guillouzo, A., Lewis, R.W., Lovell, D.P., Reinhardt, C.A., Repetto, G., Sladowski. D., Spielmann, H., and Zucco, F., (1995) Practical aspects of the validation of toxicity test procedures. The report and recommendations of ECVAM workshops. ATLA 23, str. 129-147. |
|
(8) |
ICCVAM, (Interagency Coordinating Committee on the Validation of Alternative Methods)., (1997) Validation and Regulatory Acceptance of Toxicological Test Methods. NIH Publication No 97-3981. National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/docs/guidelines/validate.pdf. |
|
(9) |
ECVAM, (1998) ECVAM News & Views. ATLA 26, 275-280. |
|
(10) |
ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods)., (2002) ICCVAM evaluation of EpiDermTM, EPISKINTM (EPI-200), and the Rat Skin Transcutaneous Electrical Resistance (TER) assay: In Vitro test methods for assessing dermal corrosivity potential of chemicals. NIH Publication No 02-4502. National Toxicology Program Interagency Center for the Evaluation of Alternative Toxicological Methods, National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/methods/epiddocs/epis_brd.pdf. |
|
(11) |
OECD (2002) Extended Expert Consultation Meeting on The In Vitro Skin Corrosion Test Guideline Proposal, Berlin, 1st–2nd November 2001, Secretariat’s Final Summary Report, 27th March 2002, OECD ENV/EHS, available upon request from the Secretariat. |
|
(12) |
Oliver, G.J.A., Pemberton, M.A., and Rhodes, C., (1986) An in vitro skin corrosivity test – modifications and validation. Fd. Chem. Toxicol. 24, 507-512. |
|
(13) |
Botham, P.A., Hall, T.J., Dennett, R., McCall, J.C., Basketter, D.A., Whittle, E., Cheeseman, M., Esdaile, D.J., and Gardner, J., (1992) The skin corrosivity test in vitro: results of an interlaboratory trial. Toxic. In Vitro 6, str. 191-194. |
|
(14) |
Worth A.P., Fentem J.H., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile D.J., Liebsch, M., (1998) An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26, str. 709-720 |
|
(15) |
Basketter, D.A., Chamberlain, M., Griffiths, H.A., Rowson, M., Whittle, E., York, M., (1997) The classification of skin irritants by human patch test. Fd. Chem. Toxicol. 35, str. 845-852. |
|
(16) |
Oliver G.J.A, Pemberton M.A and Rhodes C., (1988) An In Vitro model for identifying skin-corrosive chemicals. I. Initial Validation. Toxicology In Vitro. 2, str. 7-17. |
Slika 1.
Uređaj za pokus transkutanog električnog otpora (TER) na koži štakora

Slika 2.
Dimenzije upotrijebljene teflonske (politetrafluoroetilenske – PTFE) i prihvatne cijevi i elektroda

Kritični faktori uređaja prikazanog na gornjoj slici:
|
— |
unutarnji promjer teflonske (PTFE) cijevi, |
|
— |
duljina elektroda u odnosu na teflonsku i prihvatnu cijev: duljina treba biti takva da elektrode ne dodiruju disk kože i da je duljina elektrode u dodiru s otopinom MgSO4 standardna, |
|
— |
količina otopine MgSO4 u prihvatnoj cijevi: dubina tekućine u odnosu na razinu u teflonskoj cijevi treba biti kao što prikazuje slika 1., |
|
— |
disk kože treba biti dobro pričvršćen na teflonsku cijev, kako bi izmjereni električni otpor vjerno odražavao svojstva kože. |
B.40.BIS NAGRIZANJE KOŽE IN VITRO: TEST NA MODELU LJUDSKE KOŽE
1. METODA
Ova je ispitna metoda ekvivalentna metodi iz Smjernice za ispitivanje OECD–a TG 431 (2004).
1.1. UVOD
Nagrizanje kože odnosi se na uzrokovanje ireverzibilnog oštećenja kože nakon primjene ispitivanog materijala (prema definiciji iz Globalno usklađenog sustava razvrstavanja i označavanja kemijskih tvari i mješavina (GHS)) (1). Kod ove ispitne metode, za procjenu nagrizajućeg djelovanja na kožu nije potrebno upotrebljavati žive životinje ni životinjsko tkivo.
U procjenama nagrizajućeg djelovanja na kožu tradicionalno se upotrebljavaju laboratorijske životinje (2). U brizi za životinje i u nastojanju da se u tom postupku izbjegne bol i patnja životinja, ispitna metoda B.4. revidirana je kako bi se njome omogućilo određivanje nagrizajućeg djelovanja na kožu alternativnim in vitro metodama kojima se životinjama ne nanosi bol ni patnja.
Prvi korak prema definiranju alternativnih pokusa koji se mogu koristiti za ispitivanje nagrizajućeg djelovanja na kožu u regulatorne svrhe bilo je provođenje predvalidacijskih studija (3). Nakon toga, za metode za procjenu nagrizajućeg djelovanja na kožu in vitro (4)(5), provedena je formalna validacijska studija (6)(7)(8). Na temelju rezultata tih studija i druge objavljene literature (9) dana je preporuka da se za procjenu nagrizajućeg djelovanja na kožu in vivo mogu koristiti sljedeći testovi (10)(11)(12)(13): test na modelu ljudske kože (ova metoda) i test transkutanog električnog otpora (vidjeti ispitnu metodu B.40.).
Validacijske studije pokazale su da je testovima na modelima ljudske kože (3)(4)(5)(9) moguće pouzdano razlikovati poznata sredstva s nagrizajućim djelovanjem na kožu od sredstava koja na kožu ne djeluju nagrizajuće. Ispitni protokol također može sadržavati pokazatelje na temelju kojih je moguće razlikovati sredstva s jakim nagrizajućim djelovanjem od sredstava sa slabijim nagrizajućim djelovanjem.
U ovoj metodi opisuje se pokus koji omogućuje identifikaciju nagrizajućih kemijskih tvari i mješavina. Osim toga, oslanjajući se na druge elemente za određivanje utemeljene na postojećim informacijama (npr. pH vrijednost, odnos između strukture i aktivnosti, podaci za ljude i/ili životinje) (1)(2)(13)(14), metoda dodatno omogućuje identifikaciju i nenagrizajućih tvari i mješavina. Obično ne pruža adekvatne informacije o nadražujućem djelovanju na kožu niti omogućuje daljnje razvrstavanje nagrizajućih tvari prema Globalno usklađenom sustavu razvrstavanja (GHS) (1).
Za potpuno vrednovanje lokalnih učinaka na kožu nakon jednostrukog dermalnog izlaganja, preporuča se poštivati strategiju sekvencijskog ispitivanja predstavljenu u Dodatku ispitnoj metodi B.4. (2) i predviđenu Globalno usklađenim sustavom (GHS) (1). Ta ispitna strategija obuhvaća provođenje in vitro pokusa za dokazivanje nagrizajućeg (kao što se opisuje u ovoj metodi) i nadražujućeg djelovanja na kožu prije eventualnog provođenja ispitivanja na živim životinjama.
1.2. DEFINICIJE
Nagrizanje kože in vivo: uzrokovanje ireverzibilnog oštećenja kože; točnije, vidljive nekroze epiderme i derme nakon što je ispitivana tvar primjenjivana u trajanju od najviše 4 sata. Za nagrizanje kože tipična je pojava čireva, krvarenja, krvavih krasta te, na kraju 14-dnevnog opažanja, gubitak boje kože zbog nestajanja pigmenta, čitave površine zahvaćene alopecijom i ožiljci. Za ocjenjivanje sumnjivih lezija treba razmotriti mogućnost histopatoloških pretraga.
Preživljavanje stanica: parametar koji mjeri ukupnu aktivnost populacije stanica (npr. sposobnost staničnih mitohondrijskih dehidrogenaza da reduciraju vitalnu boju MTT) i koji, u zavisnosti o mjerenom kriteriju i izvedbi testa koji se upotrebljava, korelira s ukupnim brojem i/ili vitalnošću stanica.
1.3. REFERENTNE TVARI
Tablica 1.
Referentne kemikalije
|
Naziv |
EINECS br. |
CAS br. |
|
|
1,2-diaminopropan |
201-155-9 |
78-90-0 |
Jako nagrizajuća tvar |
|
Akrilna kiselina |
201-177-9 |
79-10-7 |
Jako nagrizajuća tvar |
|
2-tert. butilfenol |
201-807-2 |
88-18-6 |
Nagrizajuća tvar |
|
Kalijev hidroksid (10 %) |
215-181-3 |
1310-58-3 |
Nagrizajuća tvar |
|
Sumporna kiselina (10 %) |
231-639-5 |
7664-93-9 |
Nagrizajuća tvar |
|
Oktanska kiselina (kaprilna kiselina) |
204-677-5 |
124-07-02 |
Nagrizajuća tvar |
|
4-amino-1,2,4-triazol |
209-533-5 |
584-13-4 |
Nije nagrizajuća tvar |
|
Eugenol |
202-589-1 |
97-53-0 |
Nije nagrizajuća tvar |
|
Fenetil bromid |
203-130-8 |
103-63-9 |
Nije nagrizajuća tvar |
|
Tetrakloroetilen |
204-825-9 |
27-18-4 |
Nije nagrizajuća tvar |
|
Izostearinska kiselina |
250-178-0 |
30399-84-9 |
Nije nagrizajuća tvar |
|
4-(metiltio)-benzaldehid |
222-365-7 |
3446-89-7 |
Nije nagrizajuća tvar |
Većina navedenih kemikalija preuzeta je iz popisa kemikalija odabranih za međunarodnu validacijsku studiju Europskog centra za validaciju alternativnih metoda (ECVAM) (4). Odabrane su na temelju sljedećih kriterija:
|
i. |
jednak broj nagrizajućih i nenagrizajućih tvari; |
|
ii. |
komercijalno dostupne tvari iz većine relevantnih kemijskih klasa; |
|
iii. |
uključivanje jako nagrizajućih kao i slabije nagrizajućih tvari kako bi se omogućilo razlikovanje na temelju potencijala nagrizanja; |
|
iv. |
izbor kemikalija kojima se može rukovati u laboratoriju, a da ne predstavljaju druge velike opasnosti osim nagrizanja. |
1.4. NAČELO ISPITNE METODE
Ispitni materijal primjenjuje se lokalno na trodimenzionalni model ljudske kože koji minimalno obuhvaća rekonstruiranu epidermu s funkcionalnim stratum corneum. Nagrizajući materijali utvrđuju se na temelju toga koliko su sposobni smanjiti preživljavanje stanica (kako se utvrđuje, primjerice, pokusom MTT redukcije (15)) ispod utvrđene granične vrijednosti kod određenih razdoblja izlaganja. Načelo testa s modelom ljudske kože temelji se na pretpostavci da nagrizajuće kemikalije mogu penetrirati kroz stratum corneum putem difuzije ili erozije, i citotoksične su za slojeve stanice ispod tog sloja.
1.4.1. Postupak
1.4.1.1. Modeli ljudske kože
Modeli ljudske kože mogu se izraditi ili komercijalno nabaviti (npr. modeli EpiDerm™ i EPISKIN™) (16)(17)(18)(19) ili se mogu razviti ili izraditi u ispitnom laboratoriju (20)(21). Uvažava se da upotreba ljudske kože podliježe nacionalnim i međunarodnim etičkim načelima i okolnostima. Svaki novi model treba validirati (najmanje do mjere opisane u 1.4.1.1.2.). Modeli ljudske kože koji se upotrebljavaju za ovo ispitivanje moraju ispunjavati sljedeće uvjete:
1.4.1.1.1.
Za izgradnju epitela treba koristiti ljudske keratinocite. Model kože mora sadržavati funkcionalni stratum corneum ispod kojega se nalaze višestruki slojevi živih epitelnih stanica. Model kože mora imati i stromalni sloj. Stratum corneum mora biti višeslojni s takvim profilom lipida koji je potreban kako bi funkcionirao kao robusna zaštita protiv brze penetracije citotoksičnih markera. Model mora imati svojstvo izolacije kako bi spriječio prolaz materijala oko stratum corneum na živo tkivo. Prolaz ispitivanih kemikalija oko stratum corneum dovest će do lošeg modela izlaganja kože. Model kože ne smije pokazivati nikakav oblik kontaminacije bakterijama (uključujući mikoplazmu) ili gljivicama.
1.4.1.1.2.
Razina preživljavanja obično se određuje bojom MTT ili drugim metabolički pretvorenim vitalnim bojama. U ovim primjerima optička gustoća (OD) boje koja je ekstrahirana (otopljena) iz negativnog kontrolnog tkiva treba biti najmanje 20 puta veća od optičke gustoće ekstrakcijskog otapala (za pregled, vidjeti (22)). Negativno kontrolno tkivo mora biti stabilno u kulturi (tj. treba dati slične rezultate mjerenja preživljavanja) za vrijeme trajanja izlaganja za potrebe testa. Stratum corneum treba biti dovoljno čvrst kako bi onemogućio brzu penetraciju određenih citotoksičnih markera (npr. 1 % Triton X-100). Ovo je svojstvo moguće procijeniti na temelju vremena izlaganja koje je potrebno da bi se preživljavanje stanice umanjilo 50 % (ET50) (npr. za modele EpiDerm™ i EPISKIN™, to je > 2 sata). Za tkivo mora postojati dokaz sposobnosti reprodukcije u vremenu, a poželjno je da ti dokazi potječu iz različitih laboratorija. Osim toga, kad se koristi u odabranom ispitnom protokolu, mora omogućiti predviđanje potencijalnog nagrizajućeg djelovanja referentnih kemikalija (vidjeti tablicu 1.).
1.4.1.2. Primjena ispitivanih i kontrolnih tvari
Za svako tretiranje (vrijeme izlaganja), uključujući i kontrole, koriste se dva identična primjerka tkiva. Za tekuće materijale, dovoljna količina ispitivane tvari primjenjuju se ravnomjerno na površinu kože: treba upotrijebiti minimalno 25 μl/cm2. Kod ispitivanja krutih materijala, koža se ravnomjerno prekrije dovoljnom količinom krute tvari i navlaži deioniziranom ili destiliranom vodom kako bi se osiguralo dobro prianjanje s kožom. Prema potrebi, krutine prije primjene treba samljeti u prah. Metodu primjene treba prilagoditi ispitivanoj tvari (vidjeti npr. referencu 5). Na kraju razdoblja izlaganja ispitivanu tvar treba pažljivo oprati s površine kože odgovarajućom puferskom otopinom, ili 0,9 % NaCl.
Za svaku studiju treba koristiti paralelne pozitivne i negativne kontrole kako bi se postigao odgovarajući učinak pokusnog modela. Kao pozitivna kontrolna tvar predlaže se ledena octena kiselina ili 8N KOH. Kao negativna kontrolna tvar predlaže se 0,9 % NaCl ili voda.
1.4.1.3. Mjerenja preživljavanja stanica
Za mjerenje preživljavanja stanica mogu se koristiti samo validirane kvantitativne metode. Osim toga, mjerilo preživljavanja mora biti kompatibilno upotrebi u trodimenzionalnom uzroku tkiva. Nespecifično vezanje boje ne smije biti prepreka za mjerenje preživljavanja. Stoga boje koje za vezivanje koriste protein i boje koje ne prolaze metaboličku pretvorbu (npr. neutralno crvena) nisu prikladne. U pokusu se najčešće upotrebljava redukcija MTT (3-(4,5-dimetiltiazol-2il)-2,5-difeniltetrazolijev bromid, tiazolil plavi: EINECS br. 206-069-5, CAS br. 298-93-1)), za koju je dokazano da daje točne i ponovljive rezultate (5), ali se mogu koristiti i druge. Uzorak kože ostavi se u otopini MTT odgovarajuće koncentracije (npr. 0,3-1 mg/ml) na primjerenoj temperaturi inkubacije tijekom tri sata. Talog plavog formazona zatim se ekstrahira upotrebom otapala (izopropanol), a koncentracija formazona mjeri se određivanjem optičke gustoće OD na valnim duljinama između 540 i 595 nm.
Kemijsko djelovanje ovog ispitivanog materijala na vitalnu boju može oponašati djelovanje staničnog metabolizma, što može dovesti do pogrešne procjene preživljavanja. Dokazano je da se to događa ako taj ispitivani materijal nije u potpunosti odstranjen s kože ispiranjem (9). Ako ispitivani materijal izravno djeluje na vitalnu boju, treba primijeniti dodatne kontrole kako bi se otkrio i ispravio utjecaj ispitivanih tvari na mjerenje preživljavanja (9)(23).
2. PODACI
Za svako tkivo treba navesti u tabličnom obliku vrijednosti optičke gustoće i izračunati prosjek podataka o staničnom preživljavanju za ispitivani materijal, pozitivne i negativne kontrole, uključujući podatke o srednjim i pojedinačnim vrijednostima iz istovjetnih ponovljenih pokusa.
2.1. TUMAČENJE REZULTATA
Vrijednosti optičke gustoće OD mogu se koristiti za izračun postotka preživljavanja koji se odnosi na negativnu kontrolu, a proizvoljno je postavljen na 100 %. Graničnu vrijednost preživljavanja stanica, izraženu postotkom, koja služi za razlikovanje nagrizajućih od nenagrizajućih ispitivanih materijala (ili za razlikovanje između raznih klasa nagrizajućeg djelovanja), ili statistički postupak ili postupke koji se koriste za vrednovanje rezultata i identifikaciju nagrizajućih materijala treba jasno definirati i dokumentirati, te dokazati da su odgovarajući. Općenito, te se granične vrijednosti utvrđuju tijekom optimalizacije pokusa, ispituju u predvalidacijskoj fazi i potvrđuju u validacijskoj studiji. Primjeri predviđanja nagrizajućeg djelovanja na kožu koje se dovodi u vezu s modelom EpiDerm™ su (9):
Ispitivana tvar smatra se nagrizajućom za kožu:
|
i. |
ako je preživljavanje nakon tri minute izlaganja manje od 50 %; ili |
|
ii. |
ako je preživljavanje nakon tri minute izlaganja veće od ili jednako 50 %, a preživljavanje nakon izlaganja od 1 sat manje od 15 %. |
Ispitivana tvar ne smatra se nagrizajućom za kožu:
|
i. |
ako je preživljavanje nakon tri minute izlaganja veće od ili jednako 50 %, a preživljavanje nakon izlaganja od 1 sat veće od ili jednako 15 %. |
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora sadržavati slijedeće informacije:
|
|
Ispitivana i kontrolna tvar:
|
|
|
Dokazivanje opravdanosti odabranog modela kože i protokola koji su upotrijebljeni. |
|
|
Uvjeti ispitivanja:
|
|
|
Rezultati:
|
|
|
Rasprava o rezultatima. |
|
|
Zaključak. |
4. REFERENCE
|
(1) |
OECD (2001) Harmonised Integrated Classification System for Human Health and Environmental Hazards of Chemical Substances and Mixtures. OECD Series on Testing and Assessment Number 33. ENV/JM/MONO(2001)6, Paris. http://www.olis.oecd.org/olis/2001doc.nsf/LinkTo/env-jm-mono(2001)6. |
|
(2) |
Ispitna metoda B.4. Akutna toksičnost: nadraživanje/nagrizanje kože. |
|
(3) |
Botham, P.A., Chamberlain, M., Barratt, M.D., Curren, R.D., Esdaile, D.J., Gardner, J.R., Gordon, V.C., Hildebrand, B., Lewis, R.W., Liebsch, M., Logemann, P., Osborne, R., Ponec, M., Regnier, J.F., Steiling, W., Walker, A.P., and Balls, M., (1995) A prevalidation study on in vitro skin corrosivity testing. The report recommendations of ECVAM Workshop 6 ATLA 23, str. 219-255. |
|
(4) |
Barratt, M.D., Brantom, P.G., Fentem, J.H., Gerner, I., Walker, A.P., and Worth, A.P. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 1. Selection and distribution of the test chemicals. Toxicology In Vitro 12, str. 471-482. |
|
(5) |
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhutter, H.G. and Liebsch, M., (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology In Vitro 12, str. 483-524. |
|
(6) |
OECD, (1996) Final Report of the OECD Workshop on Harmonisation of Validation and Acceptance Criteria for Alternative Toxicological Test Methods, str. 62. |
|
(7) |
Balls, M., Blaauboer, B.J., Fentem, J.H., Bruner, L., Combes, R.D., Ekwall, B., Fielder, R.J., Guillouzo, A., Lewis, R.W., Lovell, D.P., Reinhardt, C.A., Repetto, G., Sladowski, D., Spielmann, H., and Zucco, F., (1995) Practical aspects of the validation of toxicity test procedures. Test report and recommendations of ECVAM workshops. ATLA 23, str. 129-147. |
|
(8) |
ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods)., (1997) Validation and Regulatory Acceptance of Toxicological Test Methods. NIH Publication No 97-3981. National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/docs/guidelines/validate.pdf. |
|
(9) |
Liebsch, M., Traue, D., Barrabas, C., Spielmann, H., Uphill, P., Wilkins, S., McPherson, J.P., Wiemann, C., Kaufmann, T., Remmele, M. and Holzhutter, H.G., (2000) The ECVAM prevalidation study on the use of EpiDerm for skin Corrosivity testing. ATLA 28, str. 371-401. |
|
(10) |
ECVAM, (1998) ECVAM News & Views. ATLA 26, str. 275-280. |
|
(11) |
ECVAM, (2000) ECVAM News & Views. ATLA 28, str. 365-67. |
|
(12) |
ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods)., (2002) ICCVAM evaluation of EpiDermTM, EPISKINTM (EPI-200), and the Rat Skin Transcutaneous Electrical Resistance (TER) assay: In Vitro test methods for assessing dermal corrosivity potential of chemicals. NIH Publication No 02-4502. National Toxicology Program Interagency Center for the Evaluation of Alternative Toxicological Methods, National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/methods/epiddocs/epis_brd.pdf. |
|
(13) |
OECD, (2002) Extended Expert Consultation Meeting on The In Vitro Skin Corrosion Test Guideline Proposal, Berlin, 1st–2nd November 2001, Secretariat’s Final Summary Report, 27th March 2002, OECD ENV/EHS, available upon request from the Secretariat |
|
(14) |
Worth, A.P., Fentem, J.H., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Liebsch, M., (1998) An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26, str. 709-720. |
|
(15) |
Mosmann, T., (1983) Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity asssays. J.Immunol. Meth. 65, str. 55-63. |
|
(16) |
Cannon, C.L., Neal, P.J., Southee, J.A., Kubilus, J., and Klausner, M., 1994. New epidermal model for dermal irritancy testing. Toxicology In Vitro 8, str. 889-891. |
|
(17) |
Ponec, M., Boelsma, E., Weerheim, A., Mulder, A., Boutwstra, J., and Mommaas, M., 2000. Lipid and ultrastructural characterisation of reconstructed skin models. International Journal of Pharmaceutics. 203, str. 211-225. |
|
(18) |
Tinois, E., Gaetani, Q., Gayraud, B., Dupont, D., Rougier, A., Pouradier, D.X., (1994) The Episkin model: Successful reconstruction of human epidermis in vitro. In In vitro Skin Toxicology. Edited by A Rougier, AM Goldberg and HI Maibach, str. 133-140 |
|
(19) |
Tinois E, Tiollier J, Gaucherand M, Dumas H, Tardy M, Thivolet J (1991). In vitro and post–transplantation differentiation of human keratinocytes grown on the human type IV collagen film of a bilayered dermal substitute. Experimental Cell Research 193, str. 310-319 |
|
(20) |
Parentau, N.L., Bilbo, P., Molte, C.J., Mason, V.S., and Rosenberg, H., (1992) The organotypic culture of human skin keratinocytes and fibroblasts to achieve form and function. Cytotechnology 9, str. 163-171. |
|
(21) |
Wilkins, L.M., Watson, S.R., Prosky, S.J., Meunier, S.F., Parentau, N.L., (1994) Development of a bilayered living skin construct for clinical applications. Biotechnology and Bioengineering 43/8, str. 747-756. |
|
(22) |
Marshall, N.J., Goodwin, C.J., Holt, S.J., (1995) A critical assessment of the use of microculture tetrazolium assays to measure cell growth and function. Growth Regulation 5, str. 69-84. |
|
(23) |
Fentem, J.H., Briggs, D. „Chesne”, C., Elliot, G.R., Harbell, J.W., Heylings, J.R., Portes, P., Rouget, R., and van de Sandt, J.J.M., and Botham, P.A., (2001) A prevalidation study on in vitro tests for acute skin irritation: results and evaluation by the Management Team. Toxicology In Vitro 15, str. 57-93. |
B.41. TEST FOTOTOKSIČNOSTI IN VITRO 3T3 NRU
1. METODA
Ova je metoda ekvivalentna metodi iz Smjernice za ispitivanje OECD–a TG 432 (2004).
1.1. UVOD
Fototoksičnost je definirana kao toksička reakcija uslijed primjene tvari na tijelo, koja je ili izazvana ili povećana (očita kod nižih razina doze) nakon naknadnog izlaganja svjetlu, ili koja je inducirana izlaganjem kože zračenju nakon sustavne primjene tvari.
Test fototoksičnosti in vitro 3T3 NRU koristi se za utvrđivanje fototoksičnog potencijala ispitivane tvari koji inducira pobuđena kemikalija nakon izlaganja svjetlu. Ovim se testom foto-citotoksičnost procjenjuje relativnim smanjenjem preživljavanja stanica koje su izložene kemikaliji u prisutnosti odnosno izostanku svjetla. Tvari identificirane ovim testom vjerojatno su fototoksične in vivo nakon sustavne primjene na kožu i difuzije u kožu, ili nakon lokalne primjene.
Za mnoge vrste kemikalija navedeno je da izazivaju fototoksične učinke (1)(2)(3)(4). Zajednička im je osobina sposobnost apsorpcije svjetlosne energije u spektru sunčeve svjetlosti. Prema prvom zakonu fotokemije (Grotthaus-Draperov zakon), za fotoreakciju potrebna je apsorpcija dovoljnog broja kvanata svjetla. Stoga, prije nego što se razmišlja o provođenju biološkog ispitivanja, za ispitivanu tvar treba odrediti UV/vidljivi spektar apsorpcije prema Smjernici o ispitivanju OECD-a 101. Ako je koeficijent molarne ekstinkcije/apsorpcije manji od 10 litara × mol-1 × cm-1, smatra se da kemikalija nema fotoreaktivni potencijal. Takvu kemikaliju nije potrebno podvrći testu fototoksičnosti in vitro 3T3 NRU niti bilo kojem drugom biološkom ispitivanju s ciljem utvrđivanja štetnih fotokemijskih učinaka (1)(5). Također vidjeti Dodatak 1.
Pouzdanost i relevantnost testa fototoksičnosti in vitro 3T3 NRU vrednovana je nedavno (6)(7)(8)(9). Pokazalo se da je testom fototoksičnosti in vitro 3T3 NRU moguće predvidjeti učinke akutne fototoksičnosti kod životinja i ljudi in vivo. Test nije namijenjen za predviđanje drugih štetnih učinaka do kojih može doći kombiniranim djelovanjem kemikalije i svjetla, tj. test ne ispituje fotogenotoksičnost, fotoalergiju i fotokarcinogenost niti omogućuje procjenu fototoksičnog potencijala. Osim toga, ovaj je test namijenjen ispitivanju posrednih mehanizama fototoksičnosti, učinaka metabolita ispitivane tvari, ili učinaka smjesa.
Dok je upotreba metaboličkih sustava opći uvjet kod svih pokusa in vitro koji se koriste za predviđanje genotoksičkog i karcinogenog potencijala, kad se radi o fototoksikologiji, do sada je poznat tek poneki rijetki primjer kemikalije kojoj je potrebna metabolička transformacija kako bi mogla djelovati kao fototoksin in vivo ili in vitro. Stoga se smatra da u prisutnosti sustava metaboličke aktivacije ovaj test nije potrebno niti je znanstveno opravdano provoditi.
1.2. DEFINICIJE
Zračenje: jakost pojave ultraljubičastog (UV) ili vidljivog svjetla na nekoj površini, mjerena u W/m2 ili mW/cm2.
Doza svjetla: količina (= jakost × vrijeme) pojave ultraljubičastog (UV) ili vidljivog zračenja na nekoj površini, izražena u džulima (= W × s) po jedinici površine, npr. J/m2 ili J/cm2.
Valne duljine UV svjetla: oznake koje preporuča Međunarodna komisija za osvjetljenje, CIE (Commission International de l’Eclairage) su: UVA (315-400 nm), UVB (280-315 nm) i UVC (100-280 nm). Koriste se i druge oznake; podjela između UVB i UVA obično se postavlja na 320 nm, a UVA se može podijeliti na UV-A1 i UV-A2 s podjelom na oko 340 nm.
Preživljavanje stanica: parametar za mjerenje ukupne aktivnosti populacije stanica (npr. ugradnja vitalne boje Neutral Red u stanične lizosome) koji, u zavisnosti o mjerenom kriteriju i izvedbi testa koji se upotrebljava, korelira s ukupnim brojem i/ili vitalnošću stanica.
Relativno preživljavanje stanica: preživljavanje stanica izraženo u odnosu na kontrole otapala (negativne) tijekom cijelog ispitnog postupka (bilo + Irr ili –Irr), ali bez tretiranja ispitivanom kemikalijom.
PIF (Photo Irritation Factor – faktor foto-nadražujućeg djelovanja): faktor koji se dobije usporedbom dvije jednako učinkovite citotoksične koncentracije (IC50) ispitivane kemikalije dobivene bez prisutnosti (-Irr) i u prisutnosti (+ Irr) necitotoksičnog zračenja UVA/vidljivog svjetla.
IC50: koncentracija ispitivane kemikalije kod koje je preživljavanje stanice smanjeno 50 %.
MPE (Mean Photo Effect – srednji foto učinak): mjerenje izvedeno iz matematičke analize krivulja reakcija na koncentracije dobivene bez prisutnosti (-Irr) i u prisutnosti (+ Irr) necitotoksičnog zračenja UVA/vidljivog svjetla.
Fototoksičnost: akutna toksička reakcija koja je izazvana nakon prvog izlaganja kože određenim kemikalijama i naknadnog izlaganja svjetlu, ili koja je inducirana na sličan način zračenjem kože nakon sustavne primjene tvari.
1.3. NAČELO ISPITNE METODE
Test fototoksičnosti in vitro 3T3 NRU temelji se na usporedbi citotoksičnosti kemikalije kad se testira sa i bez izlaganja necitotoksičnoj dozi simuliranog sunčevog svjetla. Citotoksičnost se u ovom testu izražava kao redukcija, u zavisnosti od koncentracije, ugradnje vitalne boje Neutral Red mjerena 24 sata nakon tretiranja ispitivanom kemikalijom i zračenja (10). NR je slaba kationska boja koja brzo penetrira kroz stanične membrane nedifuzno i nakuplja se međustanično u lizosomima. Promjenama na površini osjetljive lizosomske membrane, lizosomi postaju krhki i nastaju druge promjene koje postupno postaju nepopravljive. Te promjene izazvane djelovanjem ksenobiotika rezultiraju smanjenom ugradnjom i vezivanjem NR. Stoga je moguće razlikovati žive, oštećene ili mrtve stanice, na čemu se temelji ovaj test.
Stanice Balb/c 3T3 održavaju se u kulturi 24 sata radi formiranja monoslojeva. Za svaku ispitivanu tvar, dvije ploče s 96 bunarića prethodno se inkubira s osam različitih koncentracija ispitivane tvari u trajanju od 1 h. Nakon toga se jedna od te dvije ploče izlože najvišoj dozi necitotoksičnog zračenja, dok se druga ploča drži na tamnom mjestu. U obje ploče tretirani medij zatim se zamijeni hranjivom podlogom za uzgoj kultura i nakon sljedećih 24 sata inkubacije, određuje se preživljavanje stanica ugradnjom boje Neutral Red. Preživljavanje stanica izražava se kao postotak netretiranih kontrola otapala i izračunava se za svaku ispitnu koncentraciju. Za predviđanje fototoksičnog potencijala, reakcije na koncentracije dobivene sa i bez zračenja uspoređuju se, obično na razini IC50, s tim da se koncentracija koja smanjuje preživljavanje stanica na 50 % uspoređuje s netretiranim kontrolama.
1.4. OPIS ISPITNE METODE
1.4.1. Pripravci
1.4.1.1. Stanice
U validacijskoj studiji upotrijebljena je stalna stanična linija mišjih fibroblasta, Balb/c 3T3, klon 31, bilo iz zbirke American Type Culture Collection (ATCC), Manassas, VA, SAD, ili iz zbirke European Collection of Cell Cultures (ECACC), Salisbury, Wiltshire, Ujedinjena Kraljevina, pa se stoga preporuča nabaviti stanice iz dobro kvalificiranog depozitorija stanica. Uz isti ispitni postupak mogu se koristiti druge stanice i stanične linije ako su uvjeti kulture prilagođeni posebnim potrebama stanica, ali ekvivalentnost se mora dokazati.
Stanice treba redovito provjeravati kako bi se potvrdilo da nisu kontaminirane mikoplazmama i koristiti samo ako nijedna nije utvrđena (11).
Važno je redovito provjeravati osjetljivost stanica na UV zračenje u skladu s postupkom kontrole kvalitete opisanoj u ovoj metodi. Kako osjetljivost stanica na UVA zrake može porasti s brojem prolaza, treba upotrebljavati stanice Balb/c 3T3 s najnižim brojem prolaza koji se može postići, poželjno manjim od 100. (Vidjeti odjeljak 1.4.2.2.2. i Dodatak 2.).
1.4.1.2. Uvjeti koje moraju zadovoljavati mediji i kulture
Za rutinski prolaz kroz stanice i tijekom ispitnog postupka treba koristiti odgovarajuće hranjive podloge za uzgoj kulture i odgovarajuće uvjete inkubacije, npr. za stanice Balb/c 3T3 to je podloga DMEM (Dulbecco’s Modified Eagles’s Medium) obogaćena 10 %-tnim serumom novorođenog teleta, 4 nM glutamina, pencilinom (100 JU), i streptomicinom (100 μg/ml), te vlažnu inkubaciju na 37 °C, sa sadržajem CO2 od 5 do 7,5 % u zavisnosti od puferske otopine (vidjeti odjeljak 1.4.1.4., drugi stavak). Posebno je važno da uvjeti uzgoja stanične kulture dozvole da se trajanje staničnog ciklusa održi u normalnim povijesnim granicama za stanice ili stanične linije.
1.4.1.3. Priprema kultura
Stanice iz zamrznutih matičnih kultura nasade se na hranjivu podlogu za uzgoj kultura odgovarajućom gustoćom i ponovno presiju najmanje jednom prije nego se upotrijebe u testu fototoksičnosti in vitro 3T3 NRU.
Stanice koje se koriste za test fototoksičnosti nasade se na hranjivu podlogu za uzgoj kultura tolikom gustoćom da kulture ne dosegnu konfluenciju do kraja ispitivanja, tj. kad se utvrđuje preživljavanje stanica, 48 sati nakon sijanja stanica. Za stanice Balb/c 3T3 koje se uzgajaju na pločama s 96 bunarića, preporuča se gustoća nasada 1 × 104 stanica po bunariću.
Za svaku ispitivanu kemikaliju stanice se na isti način nasade u dvije odvojene ploče s 96 bunarića koje se zatim paralelno koriste tijekom cijelog ispitnog postupka, u identičnim uvjetima kulture osim za vrijeme u kojem je jedna ploča izložena zračenju (+ Irr), a druga je držana u mraku (-Irr).
1.4.1.4. Priprema ispitivane tvari
Ispitivane se tvari moraju pripremati svježe, neposredno prije uporabe, osim ako postoje podaci o njihovoj stabilnosti kod skladištenja. Preporuča se da se svako rukovanje kemikalijom i početna obrada stanica provedu u takvim uvjetima svjetla kojima će se izbjeći fotoaktivacija ili razgradnja ispitivane tvari prije izlaganja zračenju.
Ispitivane kemikalije treba otopiti u slanim puferskim otopinama, npr. Earle’s Balanced Salt Solution (EBSS), ili drugim fiziološki uravnoteženim puferskim otopinama koje ne smiju sadržavati sastojke bjelančevina, sastojke koji apsorbiraju svjetlo (npr. ph-indikatorske boje i vitamine) kako bi se izbjegla interferencija tijekom izlaganja zračenju. Kako se tijekom izlaganja zračenju stanice otprilike 50 minuta drže izvan inkubatora CO2, treba paziti da se izbjegne alkalizacija. Ako se koriste slabi puferi poput EBSS, to se može postići inkubiranjem stanica na 7,5 % CO2. Ako se stanice inkubiraju na samo 5 % CO2, treba odabrati jači pufer.
Ispitivane kemikalije ograničene topljivosti treba otopiti u odgovarajućem otapalu. Ako se koristi otapalo, ono mora u svim kulturama biti prisutno u stalnom volumenu, tj. u negativnim kontrolama (otapalo) kao i u svim koncentracijama ispitivane kemikalije, i kod tih koncentracija ne smije biti toksično. Koncentracije ispitivane tvari treba odabrati na način da se izbjegne nastajanje taloga ili mutnih otopina.
Kao otapala preporučaju se dimetilsulfoksid (DMSO) i etanol (ETOH). I druga otapala male citotoksičnosti mogu biti primjerena. Prije uporabe, za svako otapalo treba procijeniti posebna svojstva, npr. reakciju s ispitivanom kemikalijom, ublažavanje fototoksičnog učinka, svojstva fiksiranja radikala i/ili kemijsku stabilnost u otapalu.
Ako to ne utječe na stabilnost ispitivane kemikalije, za bolju topljivost može se primijeniti vrtložno miješanje i/ili sonikacija i/ili zagrijavanje na odgovarajuće temperature
1.4.1.5. Uvjeti izlaganja zračenju
1.4.1.5.1.
Izbor odgovarajućeg izvora svjetlosti i filtra ključni je čimbenik kod ispitivanja fototoksičnosti. Svjetlo iz UVA i vidljivog područja obično se povezuje s fototoksičkim reakcijama in vivo (3)(12), budući da je svjetlo iz UVB područja obično manje važno, ali jako citotoksično; između vrijednosti valne duljine od 313 do 280 nm (13), citotoksičnost se povećava 1 000 puta. Jedan od kriterija za odabir odgovarajućeg izbora svjetla mora biti uvjet da izvor svjetlosti emitira valne duljine koje ispitivana kemikalija apsorbira (spektar apsorpcije) i da je doza svjetla (koju je moguće postići u razumnom vremenu izlaganja) bude dovoljna za utvrđivanje poznatih fototoksičnih kemikalija. Nadalje, valne duljine i doze koje se primjenjuju ne smiju nepotrebno štetno djelovati na ispitni sustav, npr. emisija topline (infracrveno područje).
Simulacija sunčeve svjetlosti solarnim simulatorima smatra se optimalnim izvorom umjetnog svjetla. Distribucija snage filtriranog zračenja solarnog simulatora treba biti slična distribuciji vanjskog dnevnog svjetla navedenog u (14). Kao solarni simulatori (15) koriste se i ksenonovi lukovi i lukovi (dopirani) metalnog halida žive. Prednost ovog potonjeg je u tome što emitira manje topline i jeftiniji je, ali sličnost sa sunčevom svjetlošću je manja nego kod ksenonovog luka. Budući da svi solarni simulatori emitiraju znatne količine UVB zraka treba ih opremiti odgovarajućim filtrima kako bi se ublažile njihove jako toksične UVB valne duljine. Kako plastični materijali za stanične kulture sadrže UV stabilizatore, spektar treba mjeriti kroz poklopac ploče s 96 bunarića istog tipa koji će se koristiti u pokusu. Neovisno o mjerama koje se poduzimaju za ublažavanje dijelova spektra filtriranjem ili neizbježnim filtar djelovanjem opreme, spektar koji se bilježi ispod tih filtara ne bi trebao odstupati od standardnog dnevnog svjetla (14). Primjer distribucije filtriranog zračenja spektra solarnog simulatora koji se koristi u validacijskoj studiji testa fototoksičnosti in vitro 3T3 NRU naveden je u (8)(16). Vidjeti također Dodatak 2., sliku 1.
1.4.1.5.2.
Prije svakog testa fototoksičnosti, jakost svjetla (zračenje) treba redovito provjeravati pomoću odgovarajućeg širokopojasnog UV-metra. Jakost treba mjeriti kroz poklopac ploče s 96 bunarića istog tipa koji će se koristiti u pokusu. UV-metar mora biti kalibriran prema izvoru. Rad UV-metra treba provjeravati, a u tu svrhu preporuča se rabiti drugi, referentni UV-metar istog tipa i identične kalibracije. Idealno je, u većim intervalima, za mjerenje zračenja spektra filtriranog izvora svjetla i za kalibriranje širokopojasnog UV-metra koristiti spektroradiometar.
Doza od 5 J/cm2 (izmjerena u UVA području) određena je kao netoksična za stanice Balb/c 3T3, ali s dovoljnim potencijalom da pobudi kemikalije da izazovu fototoksične reakcije, (6)(17) npr. kako bi se postiglo 5 J/cm2 u vremenu od 50 min, zračenje je podešeno na 1,7 mW/cm2. Vidjeti Dodatak 2., sliku 2. Ako se koristi druga stanična linija ili drugačiji izvor svjetla, dozu zračenja možda će trebati kalibrirati kako bi se mogao odabrati režim doziranja koji ne djeluje štetno na stanice, ali je dostatan za pobudu standardnih fototoksina. Vrijeme izlaganja svjetlu izračunava se na sljedeći način:
|
|
(1 J = 1 Ws) |
1.4.2. Uvjeti ispitivanja
1.4.2.1. Koncentracije ispitivane tvari
Raspon koncentracija tvari ispitivane u prisutnosti (+ Irr) i bez prisutnosti (-Irr) svjetla određuje se na odgovarajući način u pokusima za određivanje raspona doze. Topljivost može biti korisno procijeniti na početku i nakon 60 min (ili već prema vremenu tretiranja koje se će se koristiti), jer se topljivost može promijeniti u vremenu ili tijekom izlaganja. Kako bi se izbjegla toksičnost inducirana držanjem kulture u nepravilnim uvjetima ili uzrokovana jako kiselim ili alkalnim kemikalijama, pH vrijednost staničnih kultura kojima se dodaje ispitivana tvari treba biti u području 6,5 – 7,8.
Najviša koncentracija ispitivane tvari treba biti unutar fizioloških uvjeta ispitivanja, npr. osmotički i pH šok treba izbjegavati. Ovisno o ispitivanoj tvari, kao čimbenike koji ograničavaju najvišu ispitnu koncentraciju možda će trebati uzeti u obzir druga fizikalno-kemijska svojstva. Za relativno netopljive tvari koje nisu toksične u koncentracijama do točke zasićenja treba testirati najvišu koncentraciju koja se može postići. Općenito, u svim ispitnim koncentracijama treba izbjeći taloženje ispitivane kemikalije. Maksimalna koncentracija ispitivane tvari ne bi smjela biti veća od 1 000 μg/ml; osmolarnost ne smije prijeći 10 mmolar. Treba koristiti geometrijski niz od osam koncentracija ispitivane tvari stalnog faktora razrjeđenja (vidjeti odjeljak 2.1., drugi stavak).
Ako postoji informacija (iz pokusa za određivanje raspona doze) da ispitivana kemikalija do granične koncentracije nije citotoksična u pokusu u mraku (-Irr), ali je jako citotoksična kad je izložena zračenju (+ Irr), kako bi se zadovoljio uvjet za odgovarajućom kvalitetom podataka, rasponi koncentracija koji se odabiru za pokus u mraku (+ Irr) mogu se razlikovati od raspona koncentracija odabranih za pokus s izlaganjem zračenju (-Irr).
1.4.2.2. Kontrole
1.4.2.2.1.
Kod stanica redovito (otprilike svaki peti prolaz) treba provjeravati osjetljivost na izvor svjetla procjenom njihovog preživljavanja nakon izlaganju povećanim dozama zračenja. U toj procjeni treba koristiti nekoliko doza zračenja, uključujući i razine znatno veće od razina koje se koriste u testu fototoksičnosti 3T3 NRU. Količina tih doza najlakše se odredi mjerenjem UV dijelova izvora svjetla. Stanice se nasade gustoćom koja se rabi u testu fototoksičnosti in vitro 3T3 NRU i sljedeći dan izlože se zračenju. Dan kasnije određuje se preživljavanje stanica na temelju apsorpcije boje Neutral Red. Treba dokazati da je najviša netoksična doza koja je dobivena kao rezultat (npr. u validacijskoj studiji: 5 J/cm2 (UVA)) dovoljna za ispravnu klasifikaciju referentnih kemikalija (Tablica 1.).
1.4.2.2.2.
Test zadovoljava kriterije kvalitete ako se u ozračenim negativnim kontrolama (otapalima) postiže preživljavanje veće od 80 % u usporedbi s neozračenim negativnim kontrolama (otapalima).
1.4.2.2.3.
Apsolutna optička gustoća (OD540 NRU) boje Neutral Red ekstrahirane iz negativnih kontrola pokazuje je li 1 × 104 stanica nasađenih po bunariću naraslo s normalnim vremenom dupliciranja u dvodnevnom razdoblju provođenja testa. Test zadovoljava kriterije prihvatljivosti ako je srednja optička gustoća OD540 NRU netretiranih kontrola ≥ 0,4 (tj. približno 20 puta veća od osnovne apsorbancije otapala).
1.4.2.2.4.
Istodobno sa svakim testom fototoksičnosti in vitro 3T3 NRU treba ispitati neku poznatu fototoksičnu kemikaliju. Preporuča se da to bude klorpromazin (CPZ). Za CPZ koji se u testu fototoksičnosti in vitro 3T3 NRU testira standardnim protokolom definirani su sljedeći kriteriji prihvatljivosti testa: CPZ izložen zračenju (+ Irr): IC50 = 0,1 do 2,0 μg/ml, CPZ koji nije izložen zračenju (-Irr): IC50 = 7,0 do 90,0 μg/ml. Faktor foto-nadražujućeg djelovanja Photo Irritation Factor (PIF) treba biti > 6. Treba pratiti povijesne podatke pozitivne kontrole.
Kao paralelne pozitivne kontrole umjesto klorpromazina mogu se koristiti druge kemikalije koje u pogledu kemijske klase ili karakteristika topljivosti odgovaraju kemikaliji koja se procjenjuje.
1.4.3. Ispitni postupak (6)(7)(8)(16)(17):
1.4.3.1. Prvi dan:
Uliti 100 μL hranjive podloge za uzgoj kultura u periferne bunariće mikrotiter ploče s 96 bunarića s tkivom kulture (= slijepe probe). U preostale bunariće uliti 100 μL stanične suspenzije sa sadržajem 1 × 105 stanica/ml u hranjivoj podlozi za uzgoj stanica (= 1 × 104 stanica/bunariću). Za svaki niz koncentracija pojedine ispitivane kemikalije i za otapalo i pozitivne kontrole treba pripremiti dvije ploče.
Inkubirati stanice 24 sata (vidjeti odjeljak 1.4.1.2.) dok se ne združe u polu-konfluentan monosloj. Takvo vrijeme inkubacije osigurava rekuperaciju, prianjanje i eksponencijalni rast stanica.
1.4.3.2. Drugi dan:
Nakon inkubacije, dekantirati hranjivu podlogu iz stanica i oprezno oprati s 150 μL puferske otopine koja je korištena za inkubaciju. Dodati 100 μL pufera koji sadrži odgovarajuću koncentraciju ispitivane kemikalije ili otapala (kontrola otapala). Primijeniti osam različitih koncentracija ispitivane kemikalije. Inkubirati stanice s ispitivanom kemikalijom u mraku 60 minuta (vidjeti odjeljak 1.4.1.2. i 1.4.1.4., drugi stavak).
Od dvije ploče priređene za svaki niz koncentracija ispitivane tvari i kontrola, izabrati jednu, obično nasumice, za određivanje citotoksičnosti (-Irr) (tj. kontrolnu ploču), i jednu (tretiranu ploču) za određivanje citotoksičnosti (+ Irr).
Za provođenje izlaganja + Irr, izložiti zračenju stanice na sobnoj temperaturi tijekom 50 minuta, kroz poklopac ploče s 96 bunarića s najvišom dozom zračenja koja nije citotoksična (vidjeti također Dodatak 2.). Držati neozračene ploče (-Irr) na sobnoj temperaturi u mračnoj kutiji tijekom 50 min (= vrijeme izlaganja svjetlu).
Dekantirati ispitnu otopinu i pažljivo oprati dva puta sa 150 μl puferske otopine koja je korištena za inkubaciju, ali koja ne sadrži ispitivani materijal. Zamijeniti pufer s hranjivom podlogom i inkubirati (vidjeti odjeljak 1.4.1.2.) preko noći (18-22 h).
1.4.3.3. Treći dan:
1.4.3.3.1.
Rast i morfologiju stanica te integritet monosloja treba pregledati faznim kontrastnim mikroskopom. Promjene u morfologiji stanica i učinke na rast stanica treba zabilježiti.
1.4.3.3.2.
Oprati stanice s 150 μl prethodno zagrijane puferske otopine. Odstraniti otopinu za pranje nježnim tapkanjem. Dodati 100 μl 50 μg/ml boje Neutral Red (NR) (3-amino-7-dimetilamino-2-metilfenazin hidroklorida, EINECS br. 209-035-8; CAS br. 553-24-2; C.I. 50040) u medij bez seruma (16) i 3 sata inkubirati kako je opisano u stavku 1.4.1.2. Nakon inkubacije, odstraniti medij NR, oprati stanice s 150 μl puferske otopine. Dekantirati i odstraniti preostali pufer blotiranjem ili centrifugiranjem.
Dodati točno 150 μl pufer otopine boje NR (svježe pripremljene od 49 dijelova vode + 50 dijelova etanola + 1 dio octene kiseline).
Nježno tresti mikrotiter ploču na tresalici mikrotiter ploče u trajanju od 10 minuta dok se NR ne ekstrahira iz stanica i ne formira homogenu otopinu.
Izmjeriti optičku gustoću ekstrakta NR na 540 nm u spektrofotometru, koristeći slijepe probe kao referencu. Pohraniti podatke u odgovarajućem formatu elektronske datoteke za naknadnu analizu.
2. PODACI
2.1. KVALITETA I KVANTITETA PODATAKA
Rezultati testa trebaju omogućiti smislenu analizu odnosa koncentracije-reakcije u prisutnosti i bez prisutnosti zračenja, i po mogućnosti koncentracije ispitivane kemikalije kod koje se preživljavanje stanica smanjuje na 50 % (IC50). Ako se utvrdi citotoksičnost, treba podesiti i raspon koncentracija i interval između svake koncentracije, kako bi krivulja bila u skladu s eksperimentalnim podacima.
I za jasno pozitivne i jasno negativne rezultate (vidjeti odjeljak 2.3., prvi stavak), možda je dovoljan samo primarni pokus, uz jedan ili više pokusa provedenih s ciljem utvrđivanja raspona preliminarne doze).
Dvosmislene, granične ili nejasne rezultate treba pojasniti daljnjim ispitivanjem (također vidjeti odjeljak 2.4., drugi stavak). U takvim slučajevima treba razmisliti o eventualnim modifikacijama pokusnih uvjeta. Među pokusnim uvjetima koji se mogu mijenjati su raspon koncentracija ili interval između dvije koncentracije, vrijeme predinkubacije i vrijeme izlaganja zračenju. Za kemikalije nestabilne u vodi može biti prikladno kraće vrijeme izlaganja.
2.2. VREDNOVANJE REZULTATA
U svrhu vrednovanja podataka mogu se izračunati faktor foto-nadražujućeg djelovanja (Photo Irritation Factor - PIF) ili srednji foto učinak (Mean Photo Effect – MPE).
Za izračun mjerila fototoksičnosti (vidjeti dolje), set proizvoljnih vrijednosti koncentracija-reakcija treba uskladiti na temelju odgovarajuće stalne krivulje koncentracija-reakcija (model). Usklađivanje krivulje prema podacima provodi se metodom nelinearne regresije (18). Za procjenu kako varijabilnost podataka utječe na usklađenu krivulju preporuča se samodopunjujući, tzv. „bootstrap” postupak.
Faktor foto-nadražujućeg djelovanja (Photo Irritation Factor - PIF) izračunava se na temelju sljedeće formule:
![]()
Ako IC50 u ili bez prisutnosti svjetla nije moguće izračunati, za ispitivani materijal nije moguće odrediti faktor PIF. Srednji foto učinak (MPE) temelji se na usporedbi svih krivulja koncentracija-reakcija (19). On se definira kao ponderirani prosjek reprezentativnog seta vrijednosti foto učinaka.

Foto učinak PEC kod neke koncentracije C definira se kao produkt učinka reakcije REC i učinka doze DEC, tj. PEC = REC × DEC. Učinak reakcije REC razlika je između reakcija zapaženih bez i u prisutnosti svjetla tj. REC = RC (-Irr) – RC (+ Irr). Odnos doza-učinak izračunava se iz:
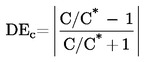
gdje C* predstavlja koncentraciju ekvivalencije tj. koncentraciju na kojoj je reakcija + Irr jednaka reakciji –Irr kod koncentracije C. Ako C* nije moguće odrediti jer su vrijednosti reakcije krivulje + Irr sustavno više ili niže od RC (-Irr), učinak doze se podešava na 1. Faktori ponderiranja wi određeni su vrijednošću najveće reakcije, tj. wi = MAX {Ri (+ Irr), Ri (-Irr)}. Mreža koncentracija Ci odabrana je na način da isti broj točaka pada u svaki od intervala koncentracija definiran vrijednostima koncentracija koje se rabe u pokusu. Izračun srednjeg foto učinka MPE ograničen je na maksimalnu vrijednost koncentracije na kojoj najmanje jedna od dvije krivulje i dalje pokazuje vrijednost reakcije od najmanje 10 %. Ako je ta maksimalna vrijednost koncentracije veća od najveće koncentracije koja je upotrijebljena u pokusu + Irr, preostali dio krivulje + Irr podešava se na vrijednost reakcije „0”. Ovisno o tomu je li vrijednost MPE veća od pravilno odabrane granične vrijednosti (MPEC = 0,15) ili nije, kemikalija se klasificira kao fototoksična.
Računalni programski paket za izračun vrijednosti PIF i MPE dostupan je iz (20).
2.3. TUMAČENJE REZULTATA
Na temelju validacijske studije (8), za ispitivanu tvar čije su vrijednosti PIF < 2 ili MPE < 0,1 smatra se da „fototoksičnosti nema”. PIF > 2 i < 5 ili MPE > 0,1 i < 0,15 pokazatelji su „vjerojatne fototoksičnosti”; a PIF > 5 ili MPE > 0,15 predviđaju „fototoksičnost”.
Tablica 1.
|
Naziv kemikalije |
EINECS br. |
CAS br. |
PIF |
MPE |
Granična vrijednost apsorpcije |
Otapalo (15) |
|
Amiodaron HCL |
243-293-2 |
[19774-82-4] |
> 3,25 |
0,2-0,54 |
242 nm 300 nm (zakrivljeni dio krivulje) |
etanol |
|
Kloropromazin HCL |
200-701-3 |
[69-09-0] |
> 14,4 |
0,33-0,63 |
309 nm |
etanol |
|
Norfloksacin |
274-614-4 |
[70458-96-7] |
> 71,6 |
0,34-0,90 |
316 nm |
acetonitril |
|
Antracen |
204-371-1 |
[120-12-7] |
> 18,5 |
0,19-0,81 |
356 nm |
acetonitril |
|
Protoporfirin IX, dinatrij |
256-815-9 |
[50865-01-5] |
> 45,3 |
0,54-0,74 |
402 nm |
etanol |
|
L-histidin |
|
[7006-35-1] |
nema faktora PIF |
0,05-0,10 |
211 nm |
voda |
|
Heksaklorofen |
200-733-8 |
[70-30-4] |
1,1-1,7 |
0,00-0,05 |
299 nm 317 nm (zakrivljeni dio krivulje) |
etanol |
|
Natrijev lauril sulfat |
205-788-1 |
[151-21-3] |
1,0-1,9 |
0,00-0,05 |
nema apsorpcije |
voda |
2.4. TUMAČENJE PODATAKA
Ako su fototoksični učinci opaženi samo kod najviše ispitne koncentracije (posebno za ispitivane kemikalije koje su topljive u vodi), za procjenu rizika mogu biti potrebna dodatne analize. To može uključivati podatke o apsorpciji kože, i akumulaciji kemikalije u koži i/ili podatke iz drugih testova, npr. ispitivanja kemikalije in vitro na koži životinja i ljudi, ili modelima kože.
Ako toksičnost nije dokazana (+ Irr i –Irr) i ako je slaba topljivost ograničila koncentracije koje su mogle biti ispitane, možda je prikladnost testa za dotičnu ispitivanu tvar upitna, pa treba predvidjeti potvrdno ispitivanje, npr. upotrebom nekog drugog modela.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora sadržavati slijedeće informacije:
|
|
ispitivana tvar:
|
|
|
Otapalo:
|
|
|
Stanice:
|
|
|
Uvjeti ispitivanja (1); inkubacija prije i nakon tretiranja:
|
|
|
Uvjeti ispitivanja (2); tretiranje kemikalijom:
|
|
|
Uvjeti ispitivanja (3); izlaganje zračenju:
|
|
|
Uvjeti ispitivanja (4); test preživljavanja pomoću boje Neutral Red:
|
|
|
Rezultati:
|
|
|
Rasprava o rezultatima. |
|
|
Zaključci. |
4. REFERENCE
|
(1) |
Lovell W.W., (1993) A scheme for in vitro screening of substances for photoallergenic potential. Toxicology In Vitro 7, str. 95-102. |
|
(2) |
Santamaria, L. and Prino, G., (1972) List of the photodynamic substances. In „Research Progress in Organic, Biological and Medicinal Chemistry” Vol. 3 part 1. North Holland Publishing Co. Amsterdam. p. XI-XXXV. |
|
(3) |
Spielmann, H., Lovell, W.W., Hölzle, E., Johnson, B.E., Maurer, T., Miranda, M.A., Pape, W.J.W., Sapora, O., and Sladowski, D., (1994) In vitro phototoxicity testing: The report and recommendations of ECVAM Workshop 2. ATLA, 22, str. 314-348. |
|
(4) |
Spikes, J.D., (1989) Photosensitisation. In „The science of Photobiology” Edited by K.C. Smith. Plenum Press, New York. 2nd edition, str. 79-110. |
|
(5) |
OECD, (1997) Environmental Health and Safety Publications, Series on Testing and Assessment No 7 „Guidance Document On Direct Phototransformation Of Chemicals In Water” Environment Directorate, OECD, Paris. |
|
(6) |
Spielmann, H., Balls, M., Döring, B., Holzhütter, H.G., Kalweit, S., Klecak, G., L’Eplattenier, H., Liebsch, M., Lovell, W.W., Maurer, T., Moldenhauer. F. Moore. L., Pape, W., Pfannbecker, U., Potthast, J., De Silva, O., Steiling, W., and Willshaw, A., (1994) EEC/COLIPA project on in vitro phototoxicity testing: First results obtained with a Balb/c 3T3 cell phototoxicity assay. Toxic. In Vitro 8, str. 793-796. |
|
(7) |
Anon, (1998) Statement on the scientific validity of the 3T3 NRU PT test (an in vitro test for phototoxicity), European Commission, Joint Research Centre: ECVAM and DGXI/E/2, 3 November 1997, ATLA, 26, str. 7-8. |
|
(8) |
Spielmann, H., Balls, M., Dupuis, J., Pape, W.J.W., Pechovitch, G. De Silva, O., Holzhütter, H.G., Clothier, R., Desolle, P., Gerberick, F., Liebsch, M., Lovell, W.W., Maurer, T., Pfannenbecker, U., Potthast, J. M., Csato, M., Sladowski, D., Steiling, W., and Brantom, P., (1998) The international EU/COLIPA In vitro phototoxicity validation study: results of phase II (blind trial), part 1: the 3T3 NRU phototoxicity test. Toxicology In Vitro 12, str. 305-327. |
|
(9) |
OECD, (2002) Extended Expert Consultation Meeting on The In Vitro 3T3 NRU Phototoxicity Test Guideline Proposal, Berlin, 30th-31th October 2001, Secretariat’s Final Summary Report, 15th March 2002, OECD ENV/EHS, available upon request from the Secretariat. |
|
(10) |
Borenfreund, E., and Puerner, J.A., (1985) Toxicity determination in vitro by morphological alterations and neutral red absorption. Toxicology Lett., 24, str. 119-124. |
|
(11) |
Hay, R.J., (1988) The seed stock concept and quality control for cell lines. Analytical Biochemistry 171, str. 225-237. |
|
(12) |
Lambert L.A, Warner W.G., and Kornhauser A., (1996) Animal models for phototoxicity testing. In „Dermatotoxicology”, edited by F.N. Marzulli and H.I. Maibach. Taylor & Francis, Washington DC. 5th Edition, str. 515-530. |
|
(13) |
Tyrrell R.M., Pidoux M., (1987) Action spectra for human skin cells: estimates of the relative cytotoxicity of the middle ultraviolet, near ultraviolet and violet regions of sunlight on epidermal keratinocytes. Cancer Res., 47, str. 1825-1829. |
|
(14) |
ISO 10977., (1993) Photography — Processed photographic colour films and paper prints — Methods for measuring image stability. |
|
(15) |
Sunscreen Testing (UV.B) TECHNICALREPORT, CIE, International Commission on Illumnation, Publication No 90, Vienna, 1993, ISBN 3 900 734 275 |
|
(16) |
ZEBET/ECVAM/COLIPA — Standard Operating Procedure: In Vitro 3T3 NRU Phototoxicity Test. Final Version, 7 September, 1998. str. 18. |
|
(17) |
Spielmann, H., Balls, M., Dupuis, J., Pape, W.J.W., De Silva, O., Holzhütter, H.G., Gerberick, F., Liebsch, M., Lovell, W.W., and Pfannenbecker, U., (1998) A study on UV filter chemicals from Annex VII of the European Union Directive 76/768/EEC, in the in vitro 3T3 NRU phototoxicity test. ATLA 26, str. 679-708. |
|
(18) |
Holzhütter, H.G., and Quedenau, J., (1995) Mathematical modeling of cellular responses to external signals. J. Biol. Systems 3, str. 127-138. |
|
(19) |
Holzhütter, H.G., (1997) A general measure of in vitro phototoxicity derived from pairs of dose-response curves and its use for predicting the in vivo phototoxicity of chemicals. ATLA, 25, str. 445-462. |
|
(20) |
http://www.oecd.org/document/55/0,2340,en_2649_34377_2349687_1_1_1_1,00.html |
Dodatak 1.
Uloga testa fototoksičnosti 3T3 NRU u sekvencijalnom pristupu ispitivanju fototoksičnosti kemikalija

Dodatak 2.
Slika 1.
Spektralna distribucija energije na solarnom simulatoru opremljenom filtrom
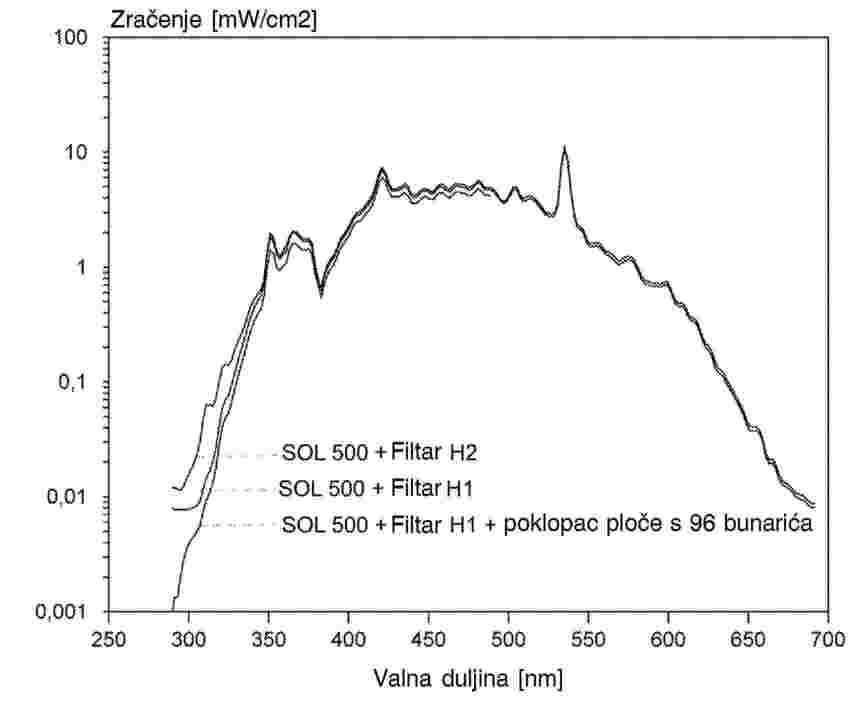
(vidjeti odjeljak 1.4.1.5., drugi stavak)
Slika 1. prikazuje primjer prihvatljive distribucije spektralnog zračenja na solarnom simulatoru opremljenom filtrom. Zračenje dolazi iz izvora dopiranog metalnog halida koji je korišten u validacijskom pokusu testa fototoksičnosti 3T3 NRU (6)(8)(17). Prikazan je učinak dva različita filtra i učinak dodatnog filtriranja poklopca ploče s 96 bunarića za stanične kulture. Filtar H2 koristi se samo kod ispitnih sustava koji podržavaju veću količinu zračenja UVB (test na modelu kože i test fotohemolize stanica crvenih krvnih zrnaca. U testu fototoksičnosti 3T3 NRU korišten je filtar H1. Slika prikazuje da se učinak dodatnog filtriranja poklopca ploče uglavnom opaža u UVB području, s tim da u spektru ostaje još uvijek dovoljno UVB zračenja za pobuđivanje kemikalija koje obično apsorbiraju svjetlo u UVB području, kao što je amiodaron (vidjeti tablicu 1.).
Slika 2.
Osjetljivost stanica Balb/c 3T3 na zračenje (mjerena u području UVA)
Sposobnost preživljavanja stanice (% postotak apsorpcije neutralnog crvenila za kontrole u mraku)

(vidjeti odjeljke 1.4.1.5.2., drugi stavak; 1.4.2.2.1., 1.4.2.2.2.)
Osjetljivost stanica Balb/c 3T3 na izloženost zračenju iz solarnog simulatora opremljenog filtrom koji je korišten u validacijskom pokusu testa fototoksičnosti 3T3 NRU, mjerena u području UVA. Slika prikazuje rezultate dobivene u sedam različitih laboratorija u predvalidacijskog studiji (1). Dok su dvije krivulje s prozirnim simbolima dobivene sa starijim stanicama (veliki broj prolaza) koje su morale biti zamijenjene novim staničnim materijalom, krivulje s masno otisnutim simbolima prikazuju stanice s dopuštenom tolerancijom izlaganja zračenju.
Iz tih podataka izvedena je najveća necitotoksična doza zračenja od 5 J/cm2 (vertikalna isprekidana crta). Horizontalna isprekidana crta prikazuje još i maksimalno prihvatljiv učinak zračenja naveden u stavku 1.4.2.2.
B.42. SENZIBILIZACIJA KOŽE: LOKALNA STIMULACIJA LIMFNIH ČVOROVA
1. METODA
Ova je ispitna metoda ekvivalentna metodi iz Smjernice za ispitivanje OECD–a TG 429 (2002.).
1.1. UVOD
Metoda lokalne stimulacije limfnih čvorova (LLNA) dovoljno je validirana i prihvaćena te je opravdano usvojena kao nova metoda (1)(2)(3). To je još jedna od metoda za procjenu potencijala kemikalija da senzibiliziraju kožu kod životinja. U drugoj metodi (B.6.) primjenjuju se testovi na zamorcima, konkretnije maksimizacijski test sa zamorcima (GPMT) i Buehlerov test (4).
Metoda LLNA alternativna je metoda za utvrđivanje kemikalija koje senzibiliziraju kožu i za potvrđivanje da određene kemikalije nemaju značajnijeg potencijala za uzrokovanje senzibilizacije kože. To nužno ne znači da u svim slučajevima metodu LLNA treba primijeniti umjesto testa sa zamorcima, već da je pokus jednakovrijedan i da se može koristiti kao alternativa kod koje za pozitivne i negativne rezultate obično nije potrebna daljnja potvrda.
Metoda LLNA ima određene prednosti s obzirom kako na znanstveni napredak tako i na dobrobit životinja. Tom se metodom proučava indukcijska faza senzibilizacije kože i dobivaju kvantitativni podaci pogodni za procjenjivanje reakcije na dozu. Pojedinosti o validaciji metode LLNA i pregled relevantnih radova objavljeni su (5)(6)(7)(8). Osim toga, treba napomenuti da su blagi/umjereni senzibilizatori, koji se preporučaju kao prikladne pozitivne kontrolne tvari za test sa zamorcima m, prikladni i za upotrebu kod metode LLNA (6)(8)(9).
Metoda LLNA je metoda in vivo, pa kao takva ne isključuje upotrebu životinja u procjeni kontaktne senzibilizacijske aktivnosti. Međutim, ona ima potencijala smanjiti broj životinja koje su za to potrebne. Nadalje, metoda LLNA nudi znatno finiji način upotrebe životinja u ispitivanju kontaktne senzibilizacije. Metoda LLNA temelji se na analizi imunoloških događanja koje stimulira kemikalija za vrijeme indukcijske faze senzibilizacije. Za razliku od testa sa zamorcima, kod metode LLNA nije potrebno izazivati provokacijski inducirane hipersenzibilizirane dermalne reakcije. Nadalje, za metodu LLNA nije potrebno koristiti adjuvans, kao što je to slučaj s maksimizacijskim testom sa zamorcima. Metoda LLNA stoga smanjuje patnju životinja. Usprkos prednostima metode LLNA u odnosu na tradicionalne testove sa zamorcima, treba priznati da postoje neka ograničenja zbog kojih može biti potrebno primijeniti tradicionalne testove sa zamorcima (npr. lažni negativni nalazi metode LLNA kod određenih metala, lažni pozitivni nalazi kod nekih sredstava s nadražujućim djelovanjem na kožu) (10).
Vidjeti također Uvod, dio B.
1.2. NAČELO ISPITNE METODE
Metoda LLNA počiva na temeljnom načelu prema kojem senzibilizatori induciraju primarnu proliferaciju limfocita u limfnom čvoru čime dolazi do drenaže mjesta kemijske primjene. Ta je proliferacija proporcionalna primijenjenoj dozi (i potencijalu alergena) i predstavlja jednostavan način za dobivanje objektivne kvantitativno izmjerene senzibilizacije. Metodom LLNA ta se proliferacija procjenjuje kao odnose doza-reakcija u kojem se proliferacija u ispitivanim skupinama uspoređuje s proliferacijom u kontrolama tretiranim nosačem. Određuje se omjer proliferacije u tretiranim skupinama i proliferacije u kontrolama s nosačem, nazvan indeks stimulacije, koji mora biti najmanje tri da bi se ispitivana tvar mogla dalje vrednovati kao potencijalni senzibilizator kože. Ovdje opisane metode temelje se na mjerenju proliferacije stanice primjenom obilježavanja radioaktivnim izotopom. Međutim, za procjenu proliferacije mogu se primijeniti drugi kriteriji pod uvjetom da za to postoji dokazana opravdanost i odgovarajuća znanstvena podloga, s cjelovitim citatima i opisom metodologije.
1.3. OPIS ISPITNE METODE
1.3.1. Pripravci
1.3.1.1. Uvjeti smještaja i prehrane
Životinje treba smjestiti pojedinačno. Temperatura u prostoriji u kojoj se drže pokusne životinje treba biti 22 °C (± 3 °C). Iako bi relativna vlaga trebala biti najmanje 30 %, a poželjno je da ne prijeđe 70 % osim tijekom čišćenja prostorije, cilj bi trebao biti 50–60 %. Svjetlost treba biti umjetna, s tim da je redoslijed 12 sati svjetla, 12 sati tame. Za hranjenje se može koristiti konvencionalna laboratorijska hrana s neograničenom količinom vode za piće.
1.3.1.2. Priprema životinja
Životinje se nasumice biraju, jednoznačno identificiraju (ali ne bilo kojim oblikom označavanja ušiju) i drže u kavezima najmanje pet dana prije početka ispitivanja kako bi se aklimatizirale na laboratorijske uvjete. Prije početka tretiranja sve životinje treba pregledati kako bi se potvrdilo da nemaju zapaženih lezija kože.
1.3.2. Uvjeti ispitivanja
1.3.2.1. Pokusne životinje
Za ovaj test poželjna vrsta su miševi. Koriste se mlade odrasle ženke soja CBA/Ca ili CBA/J koje još nisu imale potomstvo i nisu skotne. Na početku studije životinje trebaju biti stare između osam do 12 tjedana, a odstupanje mase životinja treba biti minimalno i ne smije prelaziti 20 % srednje mase. Drugi sojevi i mužjaci mogu se koristiti ako postoji dovoljno podataka da u reakciji prema metodi LLNA nema razlika specifičnih za soj i/ili spol.
1.3.2.2. Provjera pouzdanosti
Pozitivne kontrole koriste se kako bi se dokazalo da se pokus provodi na odgovarajući način i da je laboratorij sposoban pokus provesti uspješno. Pozitivna kontrola treba proizvesti pozitivnu reakciju na metodu LLNA kod razine izlaganja za koju se očekuje da će dati porast indeksa stimulacije (SI) > 3 u odnosu na negativnu kontrolnu skupinu. Dozu pozitivne kontrole treba tako odabrati da je indukcija jasna, ali ne prekomjerna. Poželjne tvari su heksilcinamaldehid (CAS br. 101-86-0, EINECS br. 202-983-3) i merkaptobenzotiazol (CAS br. 149-30-4 (CAS br. 149-30-4, EINECS br. 205-736-8). U nekim okolnostima mogu se koristiti i druge kontrolne tvari koje udovoljavaju gornjim kriterijima, pod uvjetom da je to na odgovarajući način dokazano kao opravdano. Iako je pozitivna kontrolna skupina obično obvezna u svakom pokusu, može doći i do situacija u kojima će ispitni laboratoriji imati na raspolaganju povijesne podatke o pozitivnoj kontroli koji pokazuju dosljednu zadovoljavajuću reakciju u razdoblju od šest mjeseci ili duže. U takvim situacijama pozitivne kontrole ne treba provoditi često, prikladan je maksimalni interval od šest mjeseci. Iako pozitivnu kontrolnu tvar treba ispitati u nosaču za koji je poznato da izaziva dosljednu reakciju (npr. aceton; maslinovo ulje), u nekim regulatornim situacijama bit će potrebno i ispitivanje u nestandardnom nosaču (klinički/kemijski relevantnoj formulaciji). U takvim okolnostima moguću interakciju između pozitivne kontrole i nekonvencionalnog nosača treba ispitati.
1.3.2.3. Broj životinja, visine doze i odabir nosača
Po jednoj dozirnoj skupini koriste se najmanje četiri životinje, s najmanje tri koncentracije ispitivane tvari, plus negativna kontrolna skupina tretirana samo nosačem za ispitivanu tvar i, prema potrebi, jedna pozitivna kontrola. Ako treba prikupiti podatke za životinje pojedinačno, koristi se pet životinja po skupini doze. Osim tretiranja ispitivanom tvari, sa životinjama u kontrolnim skupinama treba postupati jednako kao sa životinjama u tretiranim skupinama.
Odabir doze i nosača treba se temeljiti na preporukama navedenim u referenci (1). Doze se odabiru iz serija koncentracija 100 %, 50 %, 25 %, 10 %, 5 %, 2,5 %, 1 %, 0,5 % itd. Kod odabira te tri uzastopne koncentracije, po mogućnosti treba uzeti u obzir postojeće podatke o akutnoj toksičnosti i nadraživanju kože kako bi se najvišom koncentracijom maksimaliziralo izlaganje, ali istodobno izbjegla sustavna toksičnost i prekomjerno lokalno nadraživanje kože (2)(11).
Nosač treba odabrati s ciljem postizanja što viših ispitnih koncentracija i topljivosti, a da se istodobno proizvede otopina/suspenzija pogodna za primjenu ispitivane tvari. Kao nosači preporučuju se, redom poželjnosti, aceton/maslinovo ulje (4:1 v/v), dimetilformamid, metil etil keton, propilen glikol i dimetil sulfoksid (2)(10), ali mogu se koristiti i drugi ako se to dostatno znanstveno obrazloži. U nekim situacijama može biti potrebno primijeniti klinički relevantno otapalo ili komercijalnu formulaciju u kojoj se ispitivana tvar prodaje, kao dodatnu kontrolu. Posebno treba paziti da u sustav nosača budu ugrađeni hidrofilni materijali, koji vlaže kožu i ne isušuju se odmah. Znači, nosače koji su u potpunosti vodeni treba izbjegavati.
1.3.3. Ispitni postupak
1.3.3.1. Plan pokusa
Plan pokusa je sljedeći:
|
|
Prvi dan: Pojedinačno identificirati životinje i zabilježiti masu svake. Otvorena primjena 25 μl odgovarajuće otopine ispitivane tvari, samog nosača ili pozitivne kontrole (prema potrebi), na stražnji dio uha. |
|
|
Drugi i treći dan: Ponoviti postupak primjene proveden prvog dana. |
|
|
Četvrti i peti dan: Bez tretiranja. |
|
|
Šesti dan: Zabilježiti masu svake životinje. Svim miševima u ispitnoj i kontrolnoj skupini u venu na repu ubrizgati 250 μl fosfatnog pufera (PBS) sa sadržajem 20 μCi (7,4e + 8 Bq) 3H-metil timidina. Alternativno svim miševima u venu na repu ubrizgati 250 μl fosfatnog pufera (PBS) sa sadržajem 20 μCi (7,4e + 7 Bq) 125I-jododeoksiuridina i 10-5 M fluorodeoksiuridina. Nakon pet sati, životinje usmrtiti. Izrezati drenažne aurikularne limfne čvorove iz svakog uha i potopiti u pufer PBS za svaku pokusnu skupinu (skupni pristup); alternativno uzeti parove limfnih čvorova pojedine životinje i svaki par zasebno staviti u pufer PBS (individualan pristup). Pojedinosti i sheme za identifikaciju i disekciju mogu se naći u Dodatku 1. reference 10. |
1.3.3.2. Priprema suspenzije stanica
Suspenzija stanica limfnih čvorova (LNC) bilo iz tretiranih skupina ili obostrano od pojedinačnih životinja priprema se nježnom mehaničkom disagregacijom kroz mrežicu od 200 μm od nehrđajućeg čelika. Stanice limfnog čvora dva se puta peru preostalim puferom PBS i ostave 18 sati taložiti s 5 % trikloroctenom kiselinom (TCA) pri 4 °C (2). Peleti se ponovno suspendiraju u 1 ml TCA i prenose u scintilacijske bočice koje sadrže 10 ml scintilacijske tekućine za brojanje 3H, ili se prenose izravno u kušalice za brojenje joda 125I pomoću gama zraka.
1.3.3.3. Određivanje proliferacije stanica (ugrađena radioaktivnost)
Ugradnja 3H-metil timidina mjeri se β-scintilacijskim brojačem kao raspadanje u minuti (DPM). Ugradnja 125I-jododeoksiuridina mjeri se brojanjem joda 125I i također se izražava kao DPM. Ovisno o pristupu, ugradnja će se izražavati kao DPM/tretiranoj skupini (skupni pristup) ili DPM/životinji (individualni pristup).
1.3.3.4. Opažanja
1.3.3.4.1.
Životinje treba pomno opažati jednom dnevno s obzirom na sve kliničke znakove bilo lokalnog nadraživanja na mjestu primjene ili sustavne toksičnosti. Sva opažanja sustavno se bilježe te se za svaku životinju bilješke vode pojedinačno.
1.3.3.4.2.
Kao što je navedeno u odjeljku 1.3.3.1., pojedinačne tjelesne mase treba mjeriti na početku testa i u vrijeme planiranog usmrćivanja životinja.
1.3.4. Izračun rezultata
Rezultati su izraženi kao indeks stimulacije (SI). Ako se primjenjuje skupni pristup, SI se dobiva na način da se za svaku tretirani skupinu skupno ugrađena radioaktivnost podijeli sa skupnom ugradnjom kontrolne skupine za otapalo; tako se dobiva prosječni indeks SI. Ako se primjenjuje individualni pristup, SI se dobiva dijeljenjem prosječnog raspadanja u minuti (DPM) po životinji unutar svake skupine tretirane ispitivanom tvari i pozitivne kontrolne skupine s prosječnim DPM po životinji za kontrolnu skupinu otopine/nosača. Prosječan SI za kontrolne skupine tretirane nosačem tada iznosi 1.
Primjena individualnog pristupa za izračun indeksa SI omogućit će statističku analizu podataka. Prilikom odabira prikladne metode statističke analize istraživač treba biti svjestan eventualnih razlika između varijanata kao i drugih problema s tim u vezi, zbog kojih može biti neophodna transformacija podataka ili neparametarska statistička analiza. Odgovarajućim pristupom tumačenju podataka smatra se ocjena svih pojedinačnih podataka za tretirane kontrole i kontrole nosača, iz koje se zatim izvodi najprimjerenija krivulja reakcije na dozu, s tim da se uzimaju u obzir granice pouzdanosti (8)(12)(13). Međutim, istraživač mora biti spreman na moguće „nepodobne” reakcije kod pojedinih životinja unutar skupine, zbog kojih može biti potrebno primijeniti alternativno mjerenje reakcije (primjerice, medijan, a ne prosjek) ili eliminaciju nepodobnih.
Kako bi se za neku reakciju mogla donijeti odluka da je pozitivna, indeks stimulacije treba biti ≥ 3, pri čemu treba uzeti u obzir odnos doza-učinak, i po potrebi, statistički značaji (3)(6)(8)(12)(14).
Ako je potrebno razjasniti dobivene rezultate, valja uzeti u obzir razna svojstva ispitivane tvari, uključujući i to ima li strukturne veze s poznatim senzibilizatorima kože, uzrokuje li pretjerano nadraživanje kože i prirodu reakcije na dozu koja je opažena. Ova i druga pitanja detaljno su razmotrena drugdje (7).
2. PODACI
Podatke treba sažeti u tabličnom obliku i navesti srednje i pojedinačne vrijednosti DPM kao i indekse stimulacije za svaku tretiranu skupinu (uključujući i kontrolnu skupinu za otapalo).
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju treba sadržavati slijedeće informacije:
|
|
ispitivana tvar:
|
|
|
Nosač:
|
|
|
Ispitne životinje:
|
|
|
Uvjeti ispitivanja:
|
|
|
Provjera pouzdanosti:
|
|
|
Rezultati:
|
|
|
Rasprava o rezultatima:
|
4. REFERENCE
|
(1) |
Kimber, I. and Basketter, D.A., (1992) The murine local lymph node assay; collaborative studies and new directions: A commentary. Food and Chemical Toxicology 30, str. 165-169. |
|
(2) |
Kimber, I, Derman, R.J., Scholes E.W, and Basketter, D.A. (1994). The local lymph node assay: developments and applications. Toxicology, 93, str. 13-31. |
|
(3) |
Kimber, I., Hilton, J., Dearman, R.J., Gerberick, G.F., Ryan, C.A., Basketter, D.A., Lea, L., House, R.V., Ladies, G.S., Loveless, S.E., Hastings, K.L., (1998) Assessment of the skin sensitisation potential of topical medicaments using the local lymph node assay: An interlaboratory exercise. Journal of Toxicology and Environmental Health, 53, str. 563-79. |
|
(4) |
Ispitna metoda B.6. |
|
(5) |
Chamberlain, M. and Basketter, D.A., (1996) The local lymph node assay: status of validation. Food and Chemical Toxicology, 34, str. 999-1002. |
|
(6) |
Basketter, D.A., Gerberick, G.F., Kimber, I. and Loveless, S.E., (1996) The local lymph node assay- A viable alternative to currently accepted skin sensitisation tests. Food and Chemical Toxicology, 34, str. 985-997. |
|
(7) |
Basketter, D.A., Gerberick, G.F. and Kimber, I., (1998) Strategies for identifying false positive responses in predictive sensitisation tests. Food and Chemical Toxicology. 36, str. 327-33. |
|
(8) |
Van Och, F.M.M, Slob, W., De Jong, W.H., Vandebriel, R.J., Van Loveren, H., (2000) A quantitative method for assessing the sensitising potency of low molecular weight chemicals using a local lymph node assay: employement of a regression method that includes determination of uncertainty margins. Toxicology, 146, str. 49-59. |
|
(9) |
Dearman, R.J., Hilton, J., Evans, P., Harvey, P., Basketter, D.A. and Kimber, I., (1998) Temporal stability of local lymph node assay responses to hexyl cinnamic aldehyde. Journal of Applied Toxicology, 18, str. 281-4. |
|
(10) |
National Institute of Environmental Health Sciences, (1999) The Murine Local Lymph Node Assay: A Test Method for Assessing the Allergic Contact Dermatitis Potential of Chemicals/Compounds: The Results of an Independent Peer Review Evaluation Coordinated by the Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program Center for the Evaluation of Alternative Toxicological Methods (NICETAM). NIH Publication No: 99-4494, Research Triangle Park, N.C. (http://iccvam.niehs.nih.gov). |
|
(11) |
Ispitna metoda B.4. |
|
(12) |
Basketter, D.A., Selbie, E., Scholes, E.W. Lees, D. Kimber, I. and Botham, P.A., (1993) Results with OECD recommended positive control sensitisers in the maximisation, Buehler and local lymph node assays. Food and Chemical Toxicology, 31, str. 63-67. |
|
(13) |
Basketter D.A., Lea L.J., Dickens A., Briggs D., Pate I., Dearman R.J., Kimber I., (1999) A comparison of statistical approaches to the derivation of EC3 values from local lymph node assay dose responses. J. Appl. Toxicology, 19, str. 261-266. |
|
(14) |
Basketter D.A., Blaikie L., Derman R.J., Kimber I., Ryan C.A., Gerberick G.F., Harvey P., Evans P., White I.R. and Rycroft R.T.G., (2000) Use of local lymph node assay for the estimation of relative contact allergenic potency. Contact Dermatitis 42, str. 344-48. |
B.43. STUDIJA NEUROTOKSIČNOSTI KOD GLODAVACA
1. METODA
Ova je metoda ekvivalentna metodi iz Smjernice za ispitivanje OECD–a TG 424 (1997.).
Ova je ispitna metoda razvijena s ciljem dobivanja informacija koje su potrebne kako bi se potvrdila ili detaljnije okarakterizirala potencijalna neurotoksičnost kemikalija kod odraslih životinja. Može se kombinirati s postojećim ispitnim metodama za studije toksičnosti s ponavljanim dozama ili provesti kao zasebna studija. Kod planiranja studija koje se temelje na ovoj metodi preporuča se konzultirati smjernice OECD-a o strategijama i metodama za ispitivanje neurotoksičnosti (1). To je posebno važno ako se razmišlja o modifikacijama preporučenih opažanja i ispitnih postupaka koji se rutinski koriste u ovoj metodi. Smjernice su isto tako korisne za odabir drugih ispitnih postupaka za uporabu u specifičnim okolnostima.
Procjena razvojne neurotoksičnosti nije predmet ove metode.
1.1. UVOD
U procjeni i vrednovanju toksičnih karakteristika kemikalija važno je uzeti u obzir potencijal za izazivanje neurotoksičnih učinaka. Opažanja kojima se provodi probir na potencijalnu neurotoksičnost već su obuhvaćena metodom za ispitivanje sustavne toksičnosti primjenom ponavljanih doza. Ova ispitna metoda može se primijeniti za planiranje studija s ciljem dobivanja dodatnih informacija o neurotoksičnim učincima opaženim u studijama sustavne toksičnosti kod primjene ponavljanih doza, ili za potvrđivanje tih učinaka. Međutim, analizom potencijalne neurotoksičnosti određenih klasa kemikalija može se pretpostaviti da bi se ti učinci mogli primjerenije vrednovati ako se ova metoda primijeni izravno, bez prethodnih pokazatelja potencijalne neurotoksičnosti dobivenih u studijama sustavne neurotoksičnosti s ponavljanom dozom. To je, primjerice, slučaj:
|
— |
opažanja neuroloških znakova ili neuropatoloških lezija u toksikološkim studijama koje nisu studije sustavne toksičnosti kod primjene ponavljane doze, ili |
|
— |
strukturnog odnosa ili drugih informacija koje ih povezuju s poznatim neurotoksičnim tvarima. |
Osim toga, može biti i drugih primjera primjerene uporabe ove ispitne metode; za dodatne pojedinosti vidjeti (1).
Ova je metoda razvijena na takav način da se može prilagođavati kako bi zadovoljila posebne potrebe potvrđivanja specifične histopatološke neurotoksičnosti kemikalije i neurotoksičnog učinka kemikalije na ponašanje te kako bi omogućila karakterizaciju i kvantifikaciju neurotoksičnih reakcija.
Neurotoksičnost su u prošlosti poistovjećivali s neuropatijom, odnosno neuropatološkim lezijama ili neurološkim disfunkcijama, kao što su napadi, paraliza ili tremor. Iako je neuropatija važna manifestacija neurotoksičnosti, danas je jasno da postoji mnogo drugih znakova toksičnosti živčanog sustava (npr. gubitak motorike, smanjene osjetilne funkcije, disfunkcije učenja i pamćenja), koji se ne moraju manifestirati u neuropatološkim i drugim vrstama studija.
Ova metoda ispitivanja neurotoksičnosti razvijena je s ciljem otkrivanja jakih neuropatoloških učinaka i neuroloških učinaka na ponašanje odraslih glodavaca. Dok učinci na ponašanje, čak i kod izostanka morfoloških promjena, mogu biti odraz negativnog učinka na organizam, nisu sve promjene ponašanja vezane isključivo za živčani sustav. Stoga svaku opaženu promjenu treba vrednovati u korelaciji s histološkim, hematološkim ili biokemijskim podacima kao i s podacima o drugim vrstama sustavne toksičnosti. Ispitivanje koje se u ovoj metodi zahtijeva za karakterizaciju i kvantifikaciju neurotoksičnih reakcija obuhvaća posebne histopatološke i behaviorističke postupke koje je moguće dopuniti elektrofiziološkim i/ili biokemijskim istraživanjima (1)(2)(3)(4).
Neurotoksične tvari mogu različitim mehanizmima djelovati na čitav niz točaka u živčanom sustavu. Budući da niti jedan jedinstveni test nije u stanju u potpunosti procijeniti neurotoksični potencijal svih tvari, može biti potrebno primijeniti druge in vivo ili in vitro testove specifične za vrstu neurotoksičnosti koja se opaža ili se pridviđa.
Ova ispitna metoda može poslužiti, zajedno sa smjernicama OECD-a o strategijama i metodama za ispitivanje neurotoksičnosti (1), kao pomoć kod planiranja studija namijenjenih dodatnoj karakterizaciji odnosa doza-reakcija ili većoj osjetljivosti kvantifikacije tog odnosa, kako bi se dobila bolja procjena razine kod koje se ne opažaju štetni učinci ili kako bi se dokazali poznati ili očekivani rizici kemikalije. Primjerice, mogu se planirati studije namijenjene identifikaciji i vrednovanju jednog ili više neurotoksičnih mehanizama ili dopuni već postojećih podataka dobivenih iz primjene osnovnih postupaka opažanja ponašanja i neuropatoloških opažanja. U tim studijama ne treba duplicirati podatke do kojih bi se ionako došlo primjenom standardnih postupaka preporučenih ovom metodom, ako su ti podaci već dostupni i ne smatraju se nužnim za tumačenje rezultata studije.
Studijom neurotoksičnosti, kad se primjenjuje sama ili u kombinaciji, dolazi se do podataka pomoću kojih je moguće:
|
— |
utvrditi ima li ispitivana kemikalija na živčani sustav trajni ili reverzibilni učinak, |
|
— |
doprinijeti karakterizaciji promjena živčanog sustava koje se dovode u vezu s izlaganjem kemikaliji, i boljem razumijevanju mehanizma koji na to utječe, |
|
— |
odrediti odnose doza-reakcija i vrijeme-reakcija radi procjene razine kod koje nema opaženog štetnog učinka (razina koja se može primijeniti za utvrđivanje kriterija u pogledu sigurnosti kemikalije). |
U ovoj ispitnoj metodi ispitivana tvar primjenjuje se oralno. Drugi putevi primjene (npr. dermalno ili inhalacijom) mogu biti prikladniji i za njih će možda trebati modificirati preporučene postupke. Odluka o izboru puta primjene uvjetovana je okolnostima izlaganja ljudi i dostupnim toksikološkim ili kinetičkim informacijama.
1.2. DEFINICIJE
Štetni učinak: svaka alteracija u odnosu na referentno stanje koja se pripisuje tretiranju, a koja umanjuje sposobnost organizma da preživi, da se razmnožava ili prilagodi okolišu.
Doza: količina primijenjene ispitivane tvari. Doza se izražava kao masa (g, mg) ili kao masa ispitivane tvari po jedinici mase pokusne životinje (npr. mg/kg) ili kao konstantne koncentracije u hrani (ppm).
Doziranje: općeniti pojam koji obuhvaća dozu, učestalost primjene doze i trajanje doziranja.
Neurotoksičnost: štetna promjena strukture ili funkcije živčanog sustava do koje dolazi uslijed izlaganja kemikaliji, biološkom ili fizikalnom agensu.
Neurotoksična tvar: svaka kemikalija, biološki ili fizikalni agens koji ima potencijal uzrokovanja neurotoksičnosti.
NOAEL: kratica za engleski izraz „no-observed-adverse-effects level” koji označava najvišu razinu doze kod koje se ne opažaju štetni učinci tretiranja.
1.3. NAČELO ISPITNE METODE
Ispitivana tvar primjenjuje se na nekoliko skupina laboratorijskih glodavaca oralnim putem u cijelom rasponu doza. Obično se traži ponavljanje doze, a režim doziranja može biti 28-dnevni, subkronični (90 dana) ili kronični (1 godina ili dulje). Postupci utvrđeni u ovoj ispitnoj metodi mogu se primijeniti i za studiju akutne neurotoksičnosti. Životinje se ispituju kako bi se omogućilo otkrivanje ili karakterizacija neutroloških anomalija ili anomalija u ponašanju. Tijekom svakog razdoblja opažanja procjenjuju se razni aspekti ponašanja koji bi mogli biti posljedica neurotoksičnih tvari. Na kraju testa, na dijelu životinja svakog spola iz svake skupine provodi se perfuzija in situ, a od sekcija mozga, leđne moždine i perifernih živaca prave se pripravci koji se pregledavaju.
Ako se studija provodi kao samostalna studija radi probira na neurotoksičnost ili radi karakterizacije neurotoksičnih učinaka, životinje iz svih skupina koje nisu upotrijebljene za perfuziju i naknadnu histopatologiju (vidjeti tablicu 1.) mogu se upotrijebiti za specifična ispitivanja ponašanja, te posebne neuropatološke, neurokemijske ili elektrofiziološke postupke koji mogu dopuniti podatke dobivene standardnim opažanjima predviđenim ovom metodom (1). Ti dodatni postupci mogu biti posebno korisni ako empirijska opažanja ili očekivani učinci ukazuju na posebno ciljno tkivo ili posebnu vrstu neurotoksičnosti neke kemikalije. Druga je mogućnost da se preostale životinje iskoriste za vrednovanja kao što su ona predviđena u metodama ispitivanja toksičnosti uslijed primjene ponavljanih doza na glodavcima.
Kad se postupci ove ispitne metode kombiniraju s postupcima drugih ispitnih metoda, treba imati dovoljan broj životinja kako bi se zadovoljili zahtjevi opažanja u obje studije.
1.4. OPIS ISPITNE METODE
1.4.1. Odabir životinjskih vrsta
Poželjna vrsta glodavaca su štakori iako se mogu koristiti i druge vrste glodavaca ako se za to navede opravdani razlog. Treba koristiti mlade zdrave odrasle životinje sojeva koji se obično koriste u laboratorijskim istraživanjima. Ženke ne smiju prethodno imati potomstvo i ne smiju biti skotne. Primjena doza treba započeti čim prije nakon odbijanja od sise, najbolje prije nego što životinje napune šest tjedana a, u svakom slučaju, prije nego napune devet tjedana starosti. Međutim, ako se studija kombinira s drugim studijama, uvjet u pogledu starosti životinja možda će trebati prilagoditi. Na početku studije razlike u masi korištenih životinja trebaju biti minimalne i ne smiju prijeći ± 20 % od srednje mase životinja svakog spola. Ako se kao preliminarni test za dugoročnu studiju provodi studija s ponavljanjem doze, preporuča se u obje studije koristiti životinje istog soja i istog podrijetla.
1.4.2. Uvjeti smještaja i prehrane
Temperatura u prostoriji u kojoj se drže pokusne životinje treba biti 22 °C (± 3 °C). Iako bi relativna vlaga trebala biti najmanje 30 %, a poželjno je da ne prijeđe 70 % osim tijekom čišćenja prostorije, cilj bi trebao biti 50–60 %. Svjetlost treba biti umjetna, s tim da je redoslijed 12 sati svjetla, 12 sati tame. Glasnu povremenu buku treba maksimalno smanjiti. Za hranjenje se može koristiti konvencionalna laboratorijska hrana s neograničenom količinom vode za piće. Na izbor hrane može utjecati potreba da se osigura odgovarajuća mješavina ispitivane tvari ako se ona daje u hrani. Životinje se mogu smjestiti odvojeno ili držati u kavezima u malim skupinama istog spola.
1.4.3. Priprema životinja
Zdrave mlade odrasle životinje biraju se nasumice i raspodjeljuju u kontrolne skupine i skupine koje će se tretirati. Kaveze treba urediti na način da se eventualni učinci držanja u kavezu svedu na minimum. Životinje se jednoznačno identificiraju i drže u kavezima najmanje pet dana prije početka ispitivanja kako bi se prilagodile laboratorijskim uvjetima.
1.4.4. Put primjene i priprema doza
Ova ispitna metoda bavi se posebno primjenom ispitivane tvari oralnim putem. Oralna primjena podrazumijeva primjenu želučanom sondom, u hrani, u vodi za piće ili kapsulama. Mogu se primijeniti i drugi putevi (npr. dermalno ili inhalacijom), ali za to će možda trebati modificirati preporučene postupke. Odluka o izboru puta primjene uvjetovana je o okolnostima izlaganja ljudi i dostupnim toksikološkim ili kinetičkim informacijama. Opravdanost odabira određenog puta primjene kao i eventualnih modifikacija postupaka ove ispitne metode treba dokazati.
Prema potrebi, ispitivana tvar može se otopiti ili suspendirati u odgovarajućem nosaču. Preporuča se kad god je to moguće prvo razmotriti upotrebu vodene otopine/suspenzije, pa onda otopinu/emulziju u ulju (npr. kukuruzno ulje), i na kraju eventualnu otopinu/suspenziju u drugom nosaču. Toksičke karakteristike nosača moraju biti poznate. Osim toga, treba uzeti u obzir sljedeće karakteristike nosača: učinci nosača na apsorpciju, distribuciju, metabolizam, ili zadržavanje ispitivane tvari; učinci na kemijska svojstva ispitivane tvari koji mogu modificirati njezine toksičke karakteristike; i učinci na potrošnju hrane ili vode ili nutritivno stanje životinja.
1.5. POSTUPCI
1.5.1. Broj i spol životinja
Kad se studija provodi kao zasebna, za vrednovanje detaljnih kliničkih i funkcionalnih opažanja treba koristiti najmanje 20 životinja (10 ženki i 10 mužjaka) u svakoj tretiranoj i kontrolnoj skupini. Na kraju studije, najmanje pet mužjaka i pet ženki odabranih od tih 10 mužjaka i 10 ženki uzima se za perfuziju in situ radi detaljne neurohistopatološke obrade. U slučajevima u kojima se znakovi neurotoksičnih učinaka opažaju na samo ograničenom broju životinja, treba razmotriti treba li te životinje uključiti među životinje koje se odabiru za perfuziju. Ako se ova studija provodi u kombinaciji sa studijom toksičnosti kod primjene ponavljane doze, treba imati dovoljan broj životinja kako bi se mogli zadovoljiti ciljevi obje studije. Minimalni broj životinja po skupini za razne kombinacije studija naveden je u tablici 1. Ako se planiraju usmrćenja u tijeku studije ili formiranje skupina namijenjenih opažanju reverzibilnosti učinaka, njihovog trajanja ili odgođene pojave toksičkih učinaka nakon tretiranja ili ako se predviđaju dodatna opažanja, broj životinja treba biti veći kako bi se osiguralo dovoljno životinja za opažanje i histopatologiju.
1.5.2. Tretirana i kontrolna skupina
Obično se koriste najmanje tri skupine na koje se primjenjuje doza i jedna kontrolna skupina, ali ako se iz procjene drugih podataka učinci ne očekuju kod ponavljane doze od 1 000 mg/kg tjelesne mase/dan, može se provesti granični test. Ako odgovarajući podaci nisu dostupni, kao pomoć za određivanje doza može se provesti studija za utvrđivanje raspona doze. Osim tretiranja ispitivanom tvari, sa životinjama u kontrolnim skupinama treba postupati jednako kao sa životinjama u ispitnoj skupini. Ako se u primjeni doze koristi nosač, kontrolna skupina mora primiti taj nosač u najvećem upotrijebljenom obimu.
1.5.3. Provjera pouzdanosti
Laboratorij koji provodi studiju treba predočiti podatke kojima dokazuje svoju sposobnost za provođenje studije i osjetljivost postupaka koje koristi. Ti podaci trebaju osigurati očiti dokaz sposobnosti detekcije i kvantifikacije, prema potrebi, izmjena različitih kriterija koji se preporučaju za opažanje, kao što se autonomni znaci, osjetilna reaktivnost, jačina stiska ekstremiteta i motorna aktivnost. Informacije o kemikalijama koje uzrokuju razne tipove neurotoksičnih reakcija i mogu se upotrijebiti kao tvari za pozitivnu kontrolu mogu se naći u referencama od 2 do 9. Povijesni podaci mogu se upotrijebiti ako bitni aspekti pokusnih postupaka ostaju isti. Preporuča se periodično ažuriranje povijesnih podataka. Kad laboratorij koji provodi studiju izmijeni neki od bitnih elemenata provođenja testa ili postupaka, novim podacima treba dokazati da je osjetljivost postupaka održana.
1.5.4. Odabir doze
Visinu doze treba odabrati uzimajući u obzir eventualnu ranije opaženu toksičnost i kinetičke podatke dostupne za ispitivani spoj ili s njim povezane materijale. Najjaču dozu treba odabrati s ciljem da se izazovu neurotoksični učinci ili jasni sustavni toksični učinci. Nakon toga, treba odabrati slijed postepenog smanjivanja visine doze koji će dokazati reakcije na sve doze i najnižu dozu kod koje se ne opažaju štetni učinci (NOAEL vrijednosti). U načelu, visine doza treba tako odrediti da je primarne toksičke učinke na živčani sustav moguće razlikovati od učinaka koji se povezuju sa sustavnom toksičnošću. Često je optimalno doze primijeniti u dva do tri intervala, a možda je bolje dodati i četvrtu ispitnu skupinu nego između primjene doza koristiti veoma velike vremenske intervale (npr. iznad faktora 10). Ako postoji razumna procjena izloženosti ljudi, to treba također uzeti u obzir.
1.5.5. Granični test
Ako istraživanje provedeno primjenom jedne doze od najmanje 1 000 mg/kg tjelesne mase/dan u skladu s postupcima opisanim u ovoj studiji ne proizvede opažene toksičke učinke i ako na temelju podataka iz strukturno srodnih spojeva ne treba očekivati toksičnost, u takvim slučajevima može se smatrati da provođenje potpunog istraživanja s nekoliko visina doza nije neophodno. Očekivana izloženost ljudi može ukazati na potrebu da se u graničnom testu primijeni viša doza. Za druge puteve primjene doza, kao što su inhalacija ili dermalna primjena, fizikalno–kemijska svojstva ispitivane tvari često mogu određivati i ograničavati najvišu moguću razinu izlaganja koja se može postići. Za provođenje studije akutne oralne toksičnosti, doza za granični test treba biti najmanje 2 000 mg/kg.
1.5.6. Primjena doza
Životinjama treba davati doze ispitivane tvari svakodnevno, 7 dana u tjednu, tijekom 28 dana; opravdanost primjene petodnevnog režima doziranja ili kraćeg razdoblja izlaganja potrebno je dokazati. Ako se ispitivana tvar daje na sondu, to treba učiniti primjenom jednokratne doze pomoću želučane sonde ili odgovarajuće intubacijske kanile. Maksimalni volumen tekućine koja se daje odjednom ovisi o veličini ispitnih životinja. Taj volumen ne smije prijeći 1 ml/100 g tjelesne mase. Međutim kod vodenih otopina moglo bi se koristiti do 2 ml/100 g tjelesne mase. Osim kod nadražujućih i nagrizajućih tvari, za koje je normalno da u većim koncentracijama izazivaju intenzivnije učinke, variranje ispitnih volumena treba podešavanjem koncentracije svesti na minimum kako bi se kod svih visina doze osigurao stalni volumen.
Za tvari koje se daju u hrani ili vodi za piće, važno je osigurati da količine ispitivane tvari o kojoj se radi nemaju utjecaja na uobičajen unos hrane ili vode. Ako se ispitivana tvar daje u hrani, može se koristiti stalna koncentracija u hrani (ppm) ili stalna visina doze s obzirom na tjelesnu masu životinje; treba navesti koja se od te dvije mogućnosti koristi. Za tvar koja se daje na sondu, dozu treba davati u podjednako vrijeme svakog dana i prilagoditi je najmanje jednom tjedno kako bi se održala stalna visina doze s obzirom na tjelesnu masu životinje. Ako se studija s ponavljanom primjenom doze koristi kao preliminarna za dugoročnu studiju, preporuča se u obje studije primijeniti sličnu prehranu. Za studije akutnih učinaka, ako nije moguća primjena jedne doze, doza se može davati u malim frakcijama tijekom najviše 24 sata.
1.6. OPAŽANJA
1.6.1. Učestalost opažanja i testova
U studijama s ponavljanim dozama, razdoblje opažanja treba obuhvatiti razdoblje doziranja. U studijama akutne toksičnosti treba opažati 14-dnevno razdoblje nakon tretiranja. Za životinje u satelitskim skupinama koje se u razdoblju nakon tretiranja drže bez izlaganja, opažanjima treba obuhvatiti i to razdoblje.
Opažanja treba provoditi dovoljno često kako bi se postigla maksimalna vjerojatnost otkrivanja anomalija u ponašanju i/ili neuroloških anomalija. Opažanja je poželjno provoditi u isto vrijeme svakog dana vodeći računa o razdoblju najvećeg intenziteta očekivanih učinaka nakon doziranja. Učestalost kliničkih opažanja i funkcionalnih testova sažeto je prikazana u tablici 2. Ako kinetički ili drugi podaci dobiveni iz prethodnih studija ukazuju na potrebu uporabe drugačijih vremenskih rokova za opažanja, testove ili razdoblja nakon opažanja, treba donijeti alternativni plan, kako bi se prikupio maksimalan broj informacija. Opravdanost izmjene plana treba dokazati.
1.6.1.1. Opažanja općeg zdravstvenog stanja i mortalitet/morbiditet
Opažanja s obzirom na zdravstveno stanje treba provoditi na svim životinjama najmanje jednom dnevno, a najmanje dva puta dnevno treba provjeravati ima li slučajeva pobolijevanja ili smrti.
1.6.1.2. Detaljna klinička opažanja
Detaljna klinička opažanja svih životinja odabranih u tu svrhu (vidjeti tablicu 1.) treba provoditi jednom prije prvog izlaganja (kako bi se omogućila usporedba na istom subjektu), a nakon tog u različitim intervalima, u zavisnosti od trajanja studije (vidjeti tablicu 2.). Detaljna klinička opažanja na satelitskim skupinama namijenjenim opažanju reverzibilnosti učinaka treba provesti na kraju razdoblja rekuperacije. Detaljna klinička opažanja treba provoditi izvan kaveza u kojima se životinje drže, u standardnom ograđenom prostoru. Opažanja treba pažljivo bilježiti, koristeći sustav određivanja rezultata koji obuhvaća kriterije ili skale za svako mjerenje u okviru opažanja. Te kriterije ili skale jasno definira ispitni laboratorij. Treba učiniti sve što je potrebno da variranje ispitnih uvjeta bude minimalno (da nije sustavno povezano s tretiranjem) i da opažanja obavljaju osposobljene osobe koje nemaju saznanja da se tretiranje zaista provodi.
Preporuča se opažanja provoditi strukturirano, sustavnom primjenom dobro utvrđenih kriterija (uključujući definiranje što je to standardni „raspon”) na svaku životinju prilikom svakog pojedinog opažanja. „Standardni raspon” treba odgovarajuće dokumentirati. Sve opažene znakove treba bilježiti. Kad kod je to moguće, treba zabilježiti i značaj opaženih znakova. Kliničkim opažanjima treba obuhvatiti, a ne ih ograničiti na promjene na koži, dlaci, očima, sluznici, na pojavu iscjedaka i izlučina, i autonomne aktivnosti (npr. lakrimacija, piloerekcija, veličina zjenica, nepravilnosti u disanju i/ili disanje na usta, svi neuobičajeni znaci uriniranja ili defekacije te urin bez boje),
Također treba zabilježiti i sve neuobičajene reakcije s obzirom na položaj tijela, razinu aktivnosti (npr. povećano ili smanjeno iskorištavanje standardnog prostora izvan kaveza) i koordinaciju pokreta. Treba zabilježiti i promjene u hodu (npr. šepanje, ataksija), držanju (primjerice zgrbljenost) i reakciju na manipulaciju, postavljanje ili druge podražaje okoline kao i pojavu kloničnih ili toničnih pokreta, konvulzija ili tremora, stereotipnog ponašanja (npr. prekomjerno njegovanje dlake, neobični pokreti glave, stalno kretanje u krug) ili čudnog ponašanja (npr. griženje ili pretjerano lizanje, samoranjavanje, hodanje unatrag, vokalizacija) ili agresiju.
1.6.1.3. Funkcionalna ispitivanja
Slično detaljnim kliničkim opažanjima, i funkcionalne pokuse na životinjama odabranim u tu svrhu (vidjeti tablicu 1.) treba provesti jednom prije izlaganja i zatim provoditi često. Učestalost funkcionalnih pokusa ovisi i o trajanju studije (vidjeti tablicu 2.). Osim u razdobljima kliničkih opažanja kako su navedena u tablici 2., funkcionalna opažanja na satelitskim skupinama namijenjenim opažanju reverzibilnosti učinaka treba provesti što neposrednije pred planirano usmrćivanje na kraju pokusa. Funkcionalnim pokusima treba obuhvatiti osjetilnu reakciju na podražaje raznih vrsta (npr. auditivne, vizualne i proprioceptivne podražaje (5)(6)(7)), procjenu sposobnosti stiska ekstremiteta (8) i procjenu motorne aktivnosti. Motornu aktivnost treba mjeriti automatskim uređajem koji je u stanju detektirati i smanjenja i povećanja aktivnosti. Ako se koristi neki drugi definirani sustav, isti mora biti kvantitativan, a njegovu pouzdanost i osjetljivost treba dokazati. Svaki uređaj treba ispitati kako bi se kod svih osigurala trajna pouzdanost i međusobna usklađenost. Dodatni detalji o postupcima koji se mogu primijeniti nalaze se u referencama. U nedostatku pokazatelja potencijalnih neurotoksičnih učinaka (npr. podataka o odnosu struktura-aktivnost, epidemioloških podataka, drugih toksikoloških studija), treba predvidjeti specijalizirane testove osjetilnih i motornih funkcija ili pamćenja i sposobnosti učenja kojima bi se ti mogući učinci mogli još detaljnije proučiti. Više informacija o tim specijaliziranim testovima i njihovoj primjeni navedeno je u (1).
Iznimno se funkcionalna ispitivanja mogu izostaviti kod životinja koje inače pokazuju znakove toksičnosti takvog stupnja da bi to moglo utjecati na izvedbu ispitivanja. Opravdanost odluke da se životinje isključe iz funkcionalnog ispitivanja treba dokazati.
1.6.2. Tjelesna masa i potrošnja hrane/vode
Kod studija u trajanju do 90 dana, sve životinje treba vagati najmanje jednom tjedno i najmanje jednom tjedno treba mjeriti potrošnju hrane (potrošnju vode, ako se ispitivana tvar primjenjuje tim putem). Kod dugoročnih studija, sve životinje treba vagati najmanje jednom tjedno prvih 13 tjedana, a nakon toga najmanje jednom svaka četiri tjedna. Mjerenje potrošnje hrane (i potrošnje vode ako se ispitivana tvar primjenjuje tim putem) treba provoditi najmanje jednom tjedno prvih 13 tjedana, a zatim u otprilike tromjesečnim intervalima, ako zdravstveno stanje ili promjene tjelesne mase ne zahtijevaju drugačije.
1.6.3. Oftalmologija
Za studije dulje od 28 dana oftalmološki pregled uz korištenje oftalmoskopa ili sličnog odgovarajućeg instrumenta treba obaviti prije primjene ispitivane tvari i po završetku studije, poželjno na svim životinjama, ili barem na životinjama iz skupina kod koje je primjenjivana velika doza i na životinjama iz kontrolne skupine. Ako se primijete promjene u očima ili ako klinički znakovi ukazuju da je to potrebno, treba pregledati sve životinje. Kod dugoročnih studija, oftalmološki pregled također treba obavljati nakon 13 tjedana. Oftalmološke preglede ne treba obavljati ako su ovi podaci već dostupni iz drugih studija sličnog trajanja i sličnih visina doze.
1.6.4. Hematologija i klinička biokemija
Ako se studija neurotoksičnosti provodi u kombinaciji sa studijom sustavne toksičnosti kod ponavljanih doza, treba provesti hematološke preglede i klinička biokemijska određivanja utvrđena u odgovarajućoj metodi studije sustavne toksičnosti. Prikupljanje uzoraka treba obaviti na način da eventualni potencijalni učinci neurotoksičnosti na ponašanje budu minimalni.
1.6.5. Histopatologija
Neuropatološkim pregledom treba dopuniti i proširiti opažanja provedena u in vivo fazi studije. Tkiva najmanje pet životinja/spolu/skupini (vidjeti tablicu 1. i slijedeći stavak) treba fiksirati in situ, korištenjem opće priznatih tehnika perfuzije i fiksiranja (vidjeti referencu 3. poglavlje 5. i referencu 4. poglavlje 50.). Sve uočljive velike promjene treba zabilježiti. Ako se studija provodi kao samostalna studija radi probira na neurotoksičnost ili radi karakterizacije neurotoksičnih učinaka, preostale životinje mogu se upotrijebiti za specifična ispitivanja ponašanja (10)(11), te posebne neuropatološke (10)(11)(12)(13), neurokemijske (10)(11)(14)(15), ili elektrofiziološke postupke (10)(11)(16)(17) koji mogu dopuniti ovdje opisane podatke i ispitivanja, ili kao dodatni broj životinja za histopatološku analizu. Ti dodatni postupci posebno su korisni ako empirijska opažanja ili očekivani učinci ukazuju na posebnu vrstu ili poseban cilj neurotoksičnosti (2)(3). Druga je mogućnost da se preostale životinje iskoriste za rutinska patološka vrednovanja opisana u metodama za studije s ponavljanim dozama.
Na svim uzorcima tkiva uklopljenim u parafin treba provesti opći postupak bojenja, npr. hematoksilin i eozin (H&E) i mikroskopski ih pregledati. Ako se opaze znakovi periferne neuropatije ili se na njih sumnja, treba pregledati uzorke perifernog živčanog tkiva uklopljene u plastiku. Klinički znakovi isto tako mogu ukazati da je potrebno pregledati i dodatne lokacije ili primijeniti posebne postupke bojenja. Smjernice o dodatnim lokacijama koje treba pregledati mogu se naći u (3)(4). Odgovarajuće posebne boje mogu biti od pomoći i za dokazivanje posebnih tipova patoloških promjena (18).
Reprezentativne sekcije središnjeg i perifernog živčanog sustava treba histopatološki pregledati (vidjeti referencu 3. poglavlje 5. i referencu 4. poglavlje 50.). Pregledom treba obuhvatiti sljedeća područja: veliki mozak, središnji dio cerebruma, uključujući sekciju hipokampusa, srednji mozak, cerebellum, Varolijev most, mendulla oblongata, oko s vidnim živcem i mrežnicom, leđnu moždinu na cervikalnom i lumbarnom zadebljanju, spinalne ganglije, dorsalne bazalne ganglije, dorsalno i ventralno bazalno tkivo, proksimalni bedreni živac, proksimalni tibijalni živac (na koljenu) i ogranke tibijalnog živca u lisnom mišiću. Sekcije leđne moždine i perifernog živca trebaju obuhvatiti kako poprečne ili dijagonalne tako i uzdužne sekcije. Pozornost treba obratiti na krvne žile živčanog sustava. Treba pregledati i jedan uzorak skeletnog mišića, posebno lisnog mišića. Posebno treba paziti na lokacije stanične ili vlaknaste strukture i uzorka u središnjem živčanom sustavu (CNS) i perifernom živčanom sustavu (PNS) za koje se zna da su posebno podložni učincima neurotoksičnih tvari.
Smjernice u pogledu neuropatoloških alteracija koje su obično rezultat izlaganja toksičnoj tvari mogu se naći u referencama (3)(4). Preporuča se stupnjevani pregled uzoraka tkiva, na način da se sa sekcijama iz kontrolne skupine prvo uspoređuju sekcije iz skupine koja je primala veliku dozu. Ako u uzorcima iz tih skupina nisu opažene neuropatološke alteracije, daljnje analize nisu potrebne. Ako su u skupini koja je primala veliku dozu neuropatološke alteracije opažene, uzorak svakog od potencijalno ugroženog tkiva iz skupina koje su primale srednju i malu dozu treba kodirati i naknadno pregledati.
Ako je prisutnost neuropatoloških alteracija utvrđena u kvalitativnom ispitivanju, sve regije živčanog sustava u kojima su prisutne alteracije treba još jednom pregledati. U svim dozirnim skupinama, sekcije svake potencijalno ugrožene regije treba šifrirati i nasumice pregledati bez saznanja o šiframa. Učestalost i težinu svake lezije treba zabilježiti. Nakon što je provedena procjena svih regija iz svih dozirnih skupina, kodovi se dešifriraju i provodi se statistička analiza kojom se vrednuju odnosi doza-reakcija. Primjere različitih stupnjeva težine svake lezije treba opisati.
Neuropatološke nalaze treba vrednovati u kontekstu opažanja i mjerenja ponašanja, kao i drugih podataka iz prethodnih ili paralelnih studija sustavne toksičnosti ispitivane tvari.
2. PODACI
2.1. OBRADA PODATAKA
Treba osigurati pojedinačne podatke. Dodatno, sve podatke treba sažeti u tablici u kojoj treba navesti broj životinja u svakoj tretiranoj ili kontrolnoj skupini na početku ispitivanja, broj životinja koje su uginule tijekom pokusa ili su usmrćene iz humanih razloga i vrijeme smrti ili humanog usmrćenja, broj životinja koje pokazuju znakove toksičnosti, opis opaženih znakova toksičnosti, uključujući vrijeme prve pojave, trajanje i težinu toksičkih učinaka, broj životinjama s lezijama, uključujući vrstu i težini lezije ili lezija.
2.2. VREDNOVANJE I TUMAČENJE REZULTATA
Nalaze ovog istraživanja treba vrednovati s obzirom na učestalost, težinu i korelaciju učinaka neurotoksičnih tvari na ponašanje i neuropatoloških učinaka (i neurokemijskih ili elektrofizioloških učinaka ako su dodatna ispitivanja uključena) i svih ostalih uočenih štetnih učinaka. Kad je to moguće, numeričke rezultate treba vrednovati odgovarajućom opće prihvaćenom statističkom metodom. Odabir statističke metode provodi se u vrijeme planiranja studije.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora sadržavati slijedeće informacije:
|
|
ispitivana tvar:
|
|
|
Nosač (ako je primjenljivo):
|
|
|
Pokusne životinje:
|
|
|
Uvjeti ispitivanja:
|
|
|
Opažanja i ispitni postupci:
|
|
|
Rezultati:
|
|
|
Rasprava o rezultatima:
|
|
|
Zaključci:
|
4. REFERENCE
|
(1) |
OECD Giudance Document on Neurotoxicity Testing Strategies and Test Methods. OECD, Paris, In Preparation. |
|
(2) |
Test Guideline for a Developmental Neurotoxicity Study, OECD Guidelines for the Testing of Chemicals. In preparation. |
|
(3) |
World Health Organisation (WHO) (1986) Environmental Health Criteria document 60: Principles and Methods for the Assessment of Neurotoxicity associated with Exposure to Chemicals. |
|
(4) |
Spencer, P.S. and Schaumburg, H.H. (1980) Experimental and Clinical Neurotoxicology. Eds. Spencer, P.S. and Schaumburg, H.H. eds. Williams and Wilkins, Baltimore/London. |
|
(5) |
Tupper, D.E. and Wallace, R.B., (1980) Utility of the Neurological Examination in Rats. Acta Neurobiol. Exp., 40, str. 999-1003. |
|
(6) |
Gad, S.C., (1982) A Neuromuscular Screen for Use in Industrial Toxicology. J. Toxicol. Environ. Health, 9, str. 691-704. |
|
(7) |
Moser, V.C., McDaniel, K.M. and Phillips, P.M., (1991) Rat Strain and Stock Comparisons Using a Functional Observational Battery: Baseline Values and Effects of amitraz. Toxic. Appl. Pharmacol., 108, str. 267-283. |
|
(8) |
Meyer, O.A., Tilson, H.A., Byrd, W.C. and Riley, M.T., (1979) A Method for the Routine Assessment of Fore- and Hind- limb Grip Strength of Rats and Mice. Neurobehav. Toxicol., 1, str. 233-236. |
|
(9) |
Crofton, K.M., Haward, J.L., Moser, V.C., Gill, M.W., Reirer, L.W., Tilson, H.A. and MacPhail, R.C. (1991) Interlaboratory Comparison of Motor Activity Experiments: Implication for Neurotoxicological Assessments. Neurotoxicol. Teratol., 13, str. 599-609. |
|
(10) |
Tilson, H.A., and Mitchell, C.L. eds., (1992) Neurotoxicology Target Organ Toxicology Series. Raven Press, New York. |
|
(11) |
Chang, L.W., ed., (1995) Principles of Neurotoxicology. Marcel Dekker, New York. |
|
(12) |
Broxup, B., (1991) Neuopathology as a screen for Neurotoxicity Assessment. J. Amer. Coll. Toxicol., 10, str. 689-695. |
|
(13) |
Moser, V.C., Anthony, D.C., Sette, W.F. and MacPhail, R.C., (1992) Comparison of Subchronic Neurotoxicity of 2-Hydroxyethyl Acrylate and Acrylamide in Rats. Fund. Appl.Toxicol., 18, str. 343-352. |
|
(14) |
O’Callaghan, J.P. (1988). Neurotypic and Gliotypic Proteins as Biochemical Markers of Neurotoxicity. Eurotoxicol. Teratol., 10, str. 445-452. |
|
(15) |
O’Callaghan J.P. and Miller, D.B., (1988) Acute Exposure of the Neonatal Rat to Triethyltin Results in Persistent Changes in Neurotypic and Gliotypic Proteins. J. Pharmacol. Exp. Ther., 244, str. 368-378. |
|
(16) |
Fox. D.A., Lowndes, H.E. and Birkamper, G.G., (1982) Electrophysiological Techniques in Neurotoxicology. In: Nervous System Toxicology. Mitchell, C.L. ed. Raven Press, New York, str. 299-335. |
|
(17) |
Johnson, B.L., (1980) Electrophysiological Methods in neurotoxicity Testing. In: Experimental and Clinical Neurotoxicology. Spencer, P.S. and Schaumburg, H.H. eds., Williams and Wilkins Co.,. Baltimore/London, str. 726-742. |
|
(18) |
Bancroft, J.D. and Steven A., (1990) Theory and Pratice of Histological Techniques. Chapter 17, Neuropathological Techniques. Lowe, James and Cox, Gordon eds. Churchill Livingstone. |
Tablica 1.
Minimalni broj životinja po skupini za studije neurotoksičnosti koje se provode zasebno ili u kombinaciji s drugim studijama
|
|
STUDIJA NEUROTOKSIČNOSTI PROVEDENA KAO: |
|||
|
Zasebna studija |
Studija kombinirana s 28-dnevnom studijom |
Studija kombinirana s 90-dnevnom studijom |
Studija kombinirana sa studijom kronične toksičnosti |
|
|
Ukupan broj životinja po skupini |
10 mužjaka i 10 ženki |
10 mužjaka i 10 ženki |
15 mužjaka i 15 ženki |
25 mužjaka i 25 ženki |
|
Broj životinja odabranih za funkcionalno ispitivanje uključujući detaljna klinička opažanja |
10 mužjaka i 10 ženki |
10 mužjaka i 10 ženki |
10 mužjaka i 10 ženki |
10 mužjaka i 10 ženki |
|
Broj životinja odabranih za perfuziju in situ i neurohistopatologiju |
5 mužjaka i 5 ženki |
5 mužjaka i 5 ženki |
5 mužjaka i 5 ženki |
5 mužjaka i 5 ženki |
|
Broj životinja odabranih za opažanja toksičnosti kod primjene ponavljane doze/subkronične toksičnosti/kronične toksičnosti, hematologiju, medicinsku biokemiju, histopatologiju itd. kako je navedeno u odgovarajućim smjernicama |
|
5 mužjaka i 5 ženki |
||
|
Dodatna opažanja, prema potrebi |
5 mužjaka i 5 ženki |
|
|
|
Tablica 2.
Učestalost kliničkog opažanja i funkcionalnih pokusa
|
Vrsta opažanja |
Trajanje studije |
||||||||||||||||||||||||||
|
Akutni učinci |
28-dana |
90-dana |
Kronični učinci |
||||||||||||||||||||||||
|
Kod svih životinja |
Opće zdravstveno stanje |
dnevno |
dnevno |
dnevno |
dnevno |
||||||||||||||||||||||
|
Mortalitet/morbiditet |
Dva puta dnevno |
Dva puta dnevno |
Dva puta dnevno |
Dva puta dnevno |
|||||||||||||||||||||||
|
Kod životinja odabranih za funkcionalna opažanja |
Detaljna klinička opažanja |
|
|
|
|
||||||||||||||||||||||
|
Funkcionalna ispitivanja |
|
|
|
|
|||||||||||||||||||||||
B.44. APSORPCIJA PUTEM KOŽE: METODA IN VIVO
1. METODA
Ova je ispitna metoda ekvivalentna metodi iz Smjernice za ispitivanje OECD–a TG 427 (2004.).
1.1. UVOD
Izlaganje mnogim kemikalijama događa se uglavnom putem kože dok se u većini toksikoloških studija koje se provode na laboratorijskim životinjama koristi oralni put primjene. Studija perkutane apsorpcije in vivo opisana u ovoj smjernici nudi poveznice potrebne za ekstrapolaciju rezultata iz studija s oralnim putem primjene, prilikom procjenjivanja sigurnosti nakon izlaganja dermalnim putem.
Prije nego dođe do krvotoka, tvar mora proći kroz čitav niz slojeva stanice kože. Sloj koji se kod većine kemikalija uzima za određivanje brzine prolaza je stratum corneum koji se sastoji od mrtvih stanica. Permeabilnost kože ovisi kako o lipofilnosti kemikalije tako i o debljini vanjskog sloja epiderme i čimbenicima kao što su molekulska masa i koncentracija tvari. Općenito, koža štakora i zečeva permeabilnija je nego koža čovjeka, dok je permeabilnost kože zamoraca i majmuna sličnija permeabilnosti ljudske kože.
Metode za mjerenje perkutane apsorpcije mogu se podijeliti u dvije kategorije: in vivo i in vitro. Metodom in vivo dobivaju se dobre informacije o apsorpciji putem kože kod raznih laboratorijskih vrsta. Metode in vitro razvijene su u novije vrijeme. U njima se primjenjuje prijenos kroz punu ili djelomičnu debljinu životinjske ili ljudske kože na spremnik fluida. Metoda in vitro opisana je u posebnoj metodi ispitivanja (1). Za pomoć pri odabiru najprimjerenije metode u određenoj situaciji, preporuča se konzultirati smjernice OECD-a za provođenje studija apsorpcije putem kože (2), koje daju više pojedinosti o prikladnim in vivo i in vitro metodama.
Ovdje opisana metoda in vivo omogućuje određivanje penetracije ispitivane tvari kroz kožu u segment sustava. Tehnika je u širokoj primjeni niz godina (3)(4)(5)(6)(7). Iako studija perkutane apsorpcije in vitro može biti primjerena u mnogim slučajevima, ima situacija u kojima je do potrebnih podataka moguće doći samo studijom in vivo.
Prednosti metode in vivo su u tome što se u njoj koristi sustav koji je intaktni u pogledu fiziologije i metabolizma, što se koriste vrste koje se koriste i u mnogim drugim studijama toksičnosti i što se može modificirati za primjenu drugih vrsta. Nedostaci su korištenje živih životinja, potreba da se radi dobivanja pouzdanih rezultata koristi materijal obilježen radioaktivnim izotopom, poteškoće u određivanju rane faze apsorpcije i razlike u permeabilnosti kože poželjnih vrsta (štakori) i ljudske kože. Životinjska koža općenito je permeabilnija, pa se uslijed tog može dogoditi da se procijeni veća perkutana apsorpcija kod čovjeka (6)(8)(9). Kaustične/nagrizajuće tvari ne treba ispitivati na živim životinjama.
1.2. DEFINICIJE
Neapsorbirana doza: predstavlja količinu opranu s površine kože nakon izlaganja, i eventualno prisutnu količinu na neokluzivnom oblogu te svaku količinu za koju se dokaže da je ishlapila iz kože tijekom izlaganja.
Apsorbirana doza (in vivo): obuhvaća količine prisutne u urinu, tekućini s kojom je opran kavez, fekalijama, izdahnutom zraku (ako se mjeri), krvi, tkivu (ako se skuplja) i preostalim truplima, nakon uklanjanja s kože na mjestu primjene.
Doza koja se može apsorbirati: predstavlja dozu prisutnu na ili u koži nakon pranja.
1.3. NAČELO ISPITNE METODE
Ispitivana tvar za koju je poželjno da bude obilježena radioaktivnim izotopom primjenjuje se na životinjsku kožu s koje je skinuta dlaka, u jednoj ili više odgovarajućih jačina doze u obliku reprezentativnog pripravka koji je u općoj upotrebi. Ispitni pripravak ostavi se u dodiru s kožom točno utvrđeno vrijeme pod oblogom (neokluzivnim, poluokluzivnim, ili okluzivnim) kako ga životinja ne bi progutala. Prije, za vrijeme i nakon izlaganja životinje se smještaju u zasebne metaboličke kaveze, a izlučevine i izdahnuti zrak se u tom razdoblju skupljaju za analizu. Skupljanje izdahnutog zraka može se izostaviti ako postoji dovoljno informacija koje potvrđuju da hlapljivih radioaktivnih metabolita nema ili da nastaju u malom broju. Svaka studija obično obuhvaća nekoliko skupina životinja koje se izlažu ispitnom pripravku. Jedna skupina se na kraju razdoblja izlaganja usmrćuje. Druge se skupine usmrćuju u planiranim vremenskim intervalima nakon toga (2). Na kraju uzorkovanja, preostale životinje se usmrćuju, krv se skuplja za analizu, mjesto primjene se odstranjuje za analizu, a truplo se analizira na prisutnost neočekivanog materijala. Uzorci se analiziraju odgovarajućim metodama i procjenjuje se stupanj perkutane apsorpcije (6)(8)(9).
1.4. OPIS METODE
1.4.1. Odabir životinjskih vrsta
Najčešće upotrebljavana vrsta su štakori, ali mogu se koristi i druge vrste i sojevi bez dlake čija je brzina apsorpcije u koži sličnija apsorpciji kod ljudi (3)(6)(7)(8)(9). Treba upotrebljavati mlade zdrave životinje samo jednog spola (zadani spol je muški) iz sojeva koji se obično koriste u laboratoriju. Na početku studije razlike u masi korištenih životinja ne smiju prijeći ± 20 % vrijednosti srednje mase. Pogodni su npr. štakori muškog spola, težine 200 g – 250 g, posebno u gornjoj polovici tog područja.
1.4.2. Broj i spol životinja
Za svaki ispitni pripravak i svako planirano vrijeme završetka treba koristiti skupinu od najmanje četiri životinje jednog spola. Pojedinačne skupine životinja usmrtit će se u različitim vremenskim intervalima, npr. na kraju razdoblja izlaganja (obično 6 ili 24 sata) i zatim u daljnjim rokovima (npr. 48 i 72 sata). Ako su dostupni podaci koji dokazuju značajne razlike dermalne toksičnosti između mužjaka i ženki, treba odabrati osjetljiviji spol. Ako takvi podaci ne postoje, može se upotrijebiti bilo koji spol.
1.4.3. Uvjeti smještaja i prehrane
Temperatura u prostoriji u kojoj se drže pokusne životinje treba biti 22 °C (± 3 °C). Iako bi relativna vlaga trebala biti najmanje 30 %, a poželjno je da ne prijeđe 70 % osim tijekom čišćenja prostorije, cilj bi trebao biti 50–60 %. Svjetlost treba biti umjetna, s tim da je redoslijed 12 sati svjetla, 12 sati tame. Za hranjenje se može koristiti konvencionalna laboratorijska hrana koja treba biti dostupna po volji i s neograničenom količinom vode za piće. Za vrijeme studije, a poželjno je i tijekom aklimatizacije, životinje se smještaju pojedinačno u metaboličke kaveze. Budući da bi rasipanje hrane i vode moglo dovesti do sumnjivih rezultata, vjerojatnost takvih događaja treba minimalizirati.
1.4.4. Priprema životinja
Životinje se označavaju radi pojedinačne identifikacije i drže u kavezima najmanje pet dana prije početka studije kako bi se prilagodile laboratorijskim uvjetima.
Nakon razdoblja aklimatizacije i približno 24 sata prije doziranja, na leđnom i hrptenom dijelu trupa životinja treba ukloniti dlaku šišanjem. Pri tome treba izbjeći struganje kože, jer se karakteristike propusnosti oštećene kože razlikuju od propusnosti intaktne kože. Nakon šišanja i približno 24 sata prije primjene ispitivane tvari na kožu (vidjeti odjeljak 1.4.7.), površinu kože treba obrisati acetonom kako bi se odstranio sebum. Dodatno pranje vodom i sapunom ne preporuča se jer eventualni talog sapuna može povećati apsorpciju ispitivane tvari. Površina mora biti dovoljno velika kako bi omogućila pouzdan izračun apsorbirane količine ispitivane tvari po cm2, a poželjno je da bude najmanje 10 cm2. Takvu je površinu moguće postići kod štakora tjelesne mase 200-250 g. Nakon pripreme, životinje se vraćaju u metaboličke kaveze.
1.4.5. Ispitivana tvar
Ispitivana tvar je proizvod čije karakteristike penetracije se proučavaju. U idealnom slučaju, ispitivana tvar treba biti obilježena radioaktivnim izotopom.
1.4.6. Priprema ispitivanja
Pripravak ispitivane tvari (npr. čisti, razrijeđeni ili formulirani materijal koji sadrži ispitivanu kemikaliju koja se primjenjuje na kožu) treba biti isti (ili predstavljati realističan surogat) kao i pripravak kojem bi mogli biti izloženi ljudi ili druge potencijalne ciljne vrste. Prema potrebi, ispitivana se tvar otapa ili suspendira u odgovarajućem otapalu ili nosaču. Za sve nosače osim vode trebaju biti poznate karakteristike apsorpcije i potencijalna interakcija s ispitivanom tvari.
1.4.7. Primjena na kožu
Na površini kože odredi se mjesto primjene određene veličine. Poznata količina pripravka ravnomjerno se nanese na mjesto primjene. Ta bi količina trebala odgovarati količini kojoj bi potencijalno mogli biti izloženi ljudi, obično 1-5 mg/cm2 za krute tvari ili do 10 μl/cm2 za tekućine. Opravdanost svih drugih količina treba dokazati očekivanim uvjetima upotrebe, ciljevima studije ili fizikalnim karakteristikama ispitnog pripravka. Nakon primjene, tretirano mjesto treba zaštiti kako ga životinja ne bi lizala. Primjer tipičnog uređaja prikazan je na slici 1. Mjesto primjene obično se zaštiti neokluzivnim oblogom (npr. propusnim najlonskim oblogom). Međutim, kod neograničene primjene mjesto primjene treba biti okluzivno zaštićeno. U slučaju kad isparavanje poluhlapljivih ispitivanih tvari u neprihvatljivoj mjeri smanjuje brzinu rekuperacije ispitivane tvari (vidjeti također odjeljak 1.4.10., prvi stavak), isparenu tvar treba sakupljati na ugljenom filtru na poklopcu uređaja (vidjeti sliku 1.). Važno je da niti jedan uređaj ne oštećuje kožu, da ne apsorbira ispitni pripravak i da ne reagira s njim. Životinje se vraćaju svaka u svoj kavez kako bi se sakupile njihove izlučevine.
1.4.8. Trajanje izlaganja i uzorkovanje
Trajanje izlaganja vremenski je interval između primjene i odstranjivanja ispitnog pripravka ispiranjem kože. Treba primijeniti relevantno razdoblje izlaganja (obično 6 ili 24 sata), temeljeno na očekivanom trajanju izlaganja ljudi. Nakon razdoblja izlaganja, životinje se drže u metaboličkim kavezima do planiranog uništenja. U redovitim intervalima tijekom cijelog trajanja studije životinje treba opažati na znakove toksičnosti/abnormalne reakcije. Na kraju razdoblja izlaganja tretiranu kožu treba opažati na vidljive znakove nadraženosti.
Metabolički kavezi trebaju omogućiti zasebno skupljanje urina i fekalija cijelo vrijeme studije. Isto tako trebaju omogućiti skupljanje ugljikovog dioksida obilježenog izotopom 14C i hlapljivih ugljikovih spojeva obilježenih izotopom 14C, koje treba analizirati ako se jave u količinama > 5 %. Urin, fekalije i isparene fluide (npr. ugljikov dioksid obilježen izotopom 14C i hlapljive ugljikove spojeve obilježene izotopom 14C) treba skupljati pojedinačno iz svake skupine u svako vrijeme uzorkovanja. Ako postoji dovoljno informacija koje potvrđuju da hlapljivi radioaktivni metaboliti nastaju u malom broju ili da ih nema, mogu se koristiti otvoreni kavezi.
Izlučevine se skupljaju tijekom razdoblja izlaganja, do 24 sata nakon prvog dodira s kožom, a zatim svakodnevno do završetka pokusa. Iako su tri intervala skupljanja izlučevina obično dovoljna, za konkretnu studiju mogu se odrediti dodatne ili primjerenije vremenske točke skupljanja izlučevina, prema predviđenoj svrsi ispitnog pripravka ili postojećim kinetičkim podacima.
Na kraju razdoblja izlaganja, zaštita se skida sa životinja i pojedinačno pohranjuje za analizu. Tretiranu kožu životinja treba isprati najmanje tri puta agensom za čišćenje i odgovarajućim sredstvima za brisanje. Treba paziti da se ne onečiste drugi dijelovi tijela. Agens za čišćenje treba biti reprezentativan za uobičajene postupke obavljanja higijene, npr. vodena otopina sapuna. Na kraju kožu treba osušiti. Sva sredstva za brisanje i sredstva kojima je pranje provedeno treba sačuvati za analizu. Životinjama u posljednjim skupinama koje su sudjelovale u pokusu, prije povratka u pojedinačne kaveze na tretirano mjesto treba staviti svježi zavoj.
1.4.9. Postupci usmrćenja
U svakoj skupini, životinje treba usmrtiti pojedinačno, u planirano vrijeme i skupiti krv za analizu. Zaštitno sredstvo ili oblog treba skinuti za analizu. Sa svake životinje, za posebnu analizu treba skinuti kožu s mjesta primjene i sličnu površinu netretirane, ošišane kože. Mjesto primjene može se frakcionirati kako bi se stratum corneum odvojio od epidermalne podloge i na taj način dobilo više informacija o tome kako je ispitivana kemikalija raspoređena. Analiza tog razmještaja u vremenu nakon razdoblja izlaganja treba pokazati sudbinu ispitivane tvari u stratum corneum. Radi lakšeg frakcioniranja kože (nakon završnog pranja kože i usmrćivanja životinja) skida se svaki zaštitni oblog. Koža na mjestu primjene, zajedno s prstenastim pojasom okolne kože, izreže se iz životinje i pribadačama pričvrsti na ploču. Na površinu kože lagano se pritisne ljepljiva traka koja se zatim skine zajedno s dijelom stratum corneum. Taj se postupak ponavlja sve dok se traka više ne lijepi za površinu, što znači da je stratum corneum u potpunosti odstranjen. Sve ljepljive trake za svaku životinju mogu se držati u jednoj posudi u koju se doda stimulator digestije tkiva kako bi se stratum corneum otopio. Sva potencijalna ciljna tkiva mogu se odstraniti za zasebna mjerenja prije nego se preostalo truplo analizira s obzirom na dozu apsorbiranu u truplu. Trupla pojedinačnih životinja treba zadržati za analizu. Obično će biti dostatna analiza sveukupnog sadržaja. Ciljni organi mogu se izvaditi za zasebnu analizu (ako je indicirana drugim studijama). Urin koji se nalazi u mjehuru u vrijeme planiranog usmrćenja treba dodati ranije skupljenom urinu. Nakon skupljanja izlučina iz metaboličkih kaveza u vrijeme planiranog usmrćenja, kaveze i posude za skupljanje treba oprati odgovarajućim otapalom. I drugu potencijalno kontaminiranu opremu isto tako treba analizirati.
1.4.10. Analiza
U svim studijama treba postići određenu razinu rekuperacije (tj. srednju vrijednost radioaktivnosti od 100 ± 10 %). Za rekuperaciju izvan tog područja treba navesti razlog. Količinu primijenjene doze u svakom uzorku treba analizirati postupcima koji su vrednovani na odgovarajući način.
U statističke podatke treba uključiti stupanj odstupanja ponovljenih pokusa kod svake primjene.
2. PODACI
Sljedeća mjerenja treba provesti za svaku životinju, kod svakog uzorkovanja ispitne kemikalije i/ili metabolita. Uz pojedinačne podatke, u izviješće treba unijeti i podatke grupirane prema vremenskim točkama uzorkovanja, kao srednje vrijednosti.
|
— |
količina koja se povezuje sa zaštitnim sredstvima, |
|
— |
količina koju je moguće ukloniti s kože, |
|
— |
količina u/na koži koju nije moguće isprati s kože, |
|
— |
količina u uzorkovanoj krvi, |
|
— |
količina u izlučevini i izdahnutom zraku (prema potrebi), |
|
— |
količina preostala u truplu i organima odstranjenim za zasebnu analizu. |
Količina ispitivane tvari i/ili metabolita u izlučevinama, izdahnutom zraku i truplu omogućuje određivanje ukupne količine koja je apsorbirana u svakoj točki vremena. Može se doći i do izračuna količine ispitivane tvari apsorbirane po cm2 kože izložene ispitivanoj tvari tijekom razdoblja izlaganja.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora sadržavati uvjete navedene u protokolu, uključujući dokaze o opravdanosti primijenjenog ispitnog sustava, kao i sljedeće informacije:
|
|
ispitivana tvar:
|
|
|
Ispitni pripravak:
|
|
|
Pokusna životinja:
|
|
|
Uvjeti ispitivanja:
|
|
|
Rezultati:
|
|
|
Rasprava o rezultatima. |
|
|
Zaključci. |
4. REFERENCE
|
(1) |
Testing Method B.45. Skin Absorption: In vitro Method. |
|
(2) |
OECD (2002). Guidance Document for the Conduct of Skin Absorption Studies. OECD, Paris. |
|
(3) |
ECETOC, (1993) Percutaneous Absorption. European Centre for Ecotoxicology and Toxicology of Chemicals, Monograph No 20. |
|
(4) |
Zendzian R.P. (1989) Skin Penetration Method suggested for Environmental Protection Agency Requirements. J. Am. Coll. Toxicol. 8(5), str. 829-835. |
|
(5) |
Kemppainen, B.W., Reifenrath WG (1990) Methods for skin absorption. CRC Press Boca Raton, FL, USA. |
|
(6) |
EPA, (1992) Dermal Exposure Assessment: Principles and Applications. Exposure Assessment Group, Office of Health and Environmental Assessment. |
|
(7) |
EPA, (1998) Health Effects Test Guidelines, OPPTS 870-7600, Dermal Penetration. Office of Prevention, Pedsticides and Toxic Substances. |
|
(8) |
Bronaugh, R.L., Wester, R.C., Bucks, D., Maibach H.I. and Sarason, R., (1990) In vivo percutaneous absorption of fragrance ingredients in reshus monkeys and humans. Fd. Chem. Toxic. 28, str. 369-373. |
|
(9) |
Feldman, R.J. and Maibach, H.I., (1970) Absorption of some organic compounds through the skin in man. J. Invest Dermatol. 54, str. 399-404. |
Slika 1.
Primjer konstrukcije tipičnog uređaja koji se koristi za omeđivanje i zaštitu mjesta dermalnog puta primjene tijekom studija perkutane apsorpcije in vivo

B.45. APSORPCIJA PUTEM KOŽE: METODA IN VITRO
1. METODA
Ova je ispitna metoda ekvivalentna metodi iz Smjernice za ispitivanje OECD–a TG 428 (2004.).
1.1. UVOD
Ova je metoda razvijena s ciljem dobivanja informacija o apsorpciji ispitivane tvari primijenjene na isječak kože. Može se kombinirati s metodom apsorpcije putem kože: metodom in vivo (1), ili provoditi odvojeno. Kao pomoć kod planiranja studija koje se temelje na ovoj metodi preporuča se konzultirati smjernice OECD-a za provođenje studija apsorpcije putem kože (2). Smjernice su izrađene kako bi se olakšao odabir primjerenih postupaka in vitro u konkretnim okolnostima i osigurala pouzdanost rezultata dobivenih ovom metodom.
Metode za mjerenje apsorpcije putem kože i difuzije dermalnim putem mogu se podijeliti u dvije kategorije: in vivo i in vitro. Metode in vivo za istraživanje apsorpcije putem kože daju farmakološko-kinetičke informacije kod velikog broja životinjskih vrsta i dobro su poznate. Metoda in vivo opisana je zasebno u drugoj ispitnoj metodi (1). Metode in vitro također se godinama koriste za mjerenje apsorpcije putem kože. Iako za metode in vitro obuhvaćene ovom ispitnom metodom nisu provedene formalne validacijske studije, stručnjaci OECD-a procijenili su 1999. da je količina vrednovanih podataka dovoljna za dokumentiranje metode in vitro (3). Dodatne pojedinosti koje podupiru takvu odluku, uključujući i značajan broj izravnih usporedbi metoda in vivo i in vitro, navedene su u Smjernicama (2). Postoji čitav niz monografija koje obrađuju tu temu i daju iscrpne podloge o primjeni metode in vitro (4)(5)(6)(7)(8)(9)(10)(11)(12). Metodama in vitro mjeri se difuzija kemikalija u i kroz kožu u spremnik fluida i u njima se za mjerenje samo difuzije može rabiti neaktivna koža, a svježa, metabolički aktivna koža, za istodobno mjerenje difuzije i metabolizma kože. Ove su metode posebno našle primjenu kao metode probira za usporedbu kutane i perkutane dobave kemikalija iz različitih formulacija i mogu dati korisne modele za procjenu perkutane apsorpcije kod ljudi.
Metoda in vitro ne mora biti primjenljiva u svim situacijama i na sve klase kemikalija. Ispitna metoda in vitro može se primijeniti za inicijalno kvalitativno vrednovanje penetracije kroz kožu. U nekim slučajevima, možda će to trebati potvrditi podacima dobivenim metodom in vivo. Za dodatne pojedinosti o situacijama u kojima bi primjena metode in vitro bila odgovarajuća treba konzultirati smjernice (2). Dodatne iscrpne informacije koje mogu biti od pomoći kod donošenja odluke navedene su u (3).
U ovoj metodi navode se opća načela za mjerenje dermalne apsorpcije i difuzije ispitivane tvari na isječku kože. Za to se može upotrijebiti koža velikog broja vrsta sisavaca, uključujući i ljude. Svojstva permeabilnosti kože očuvana su i nakon ekscizije uzorka s tijela jer neaktivan stratum corneum predstavlja glavnu prepreku za difuziju; nikakav oblik aktivnog prijenosa kemikalija kroz kožu nije utvrđen. S druge strane, dokazano je da koža ima sposobnost metaboliziranja nekih kemikalija tijekom perkutane apsorpcije (6), čime se stvarna apsorbirana doza ne ograničava, iako to može utjecati na prirodna svojstva materijala koji ulazi u krvotok.
1.2. DEFINICIJE
Neapsorbirana doza: predstavlja količinu opranu s površine kože nakon izlaganja i eventualno prisutnu količinu na neokluzivnom oblogu te svaku količinu za koju se dokaže da je ishlapila iz kože tijekom izlaganja.
Apsorbirana doza (in vitro): masa ispitivane tvari koja u navedenom vremenu dopre do fluida- receptora ili sustavnog krvotoka.
Doza koja se može apsorbirati (in vitro): predstavlja dozu prisutnu na ili u koži nakon pranja.
1.3. NAČELO ISPITNE METODE
Ispitivana tvar, koja može biti obilježena radioaktivnim izotopom, primjenjuje se na površinu uzorka kože koja odvaja dvije komore ćelije za difuziju. Kemikalija određeno vrijeme ostaje na koži pod određenim uvjetima te se zatim odstranjuje odgovarajućim postupkom čišćenja. Uzorci prihvatnog fluida uzimaju se u određenim vremenskim rokovima cijelo vrijeme trajanja pokusa i analiziraju se s obzirom na prisutnost ispitivane kemikalije i/ili njezinih metabolita.
Ako se upotrebljavaju metabolički aktivni sustavi, metabolite ispitivane kemikalije moguće je analizirati odgovarajućim metodama. Na završetku pokusa određuje se distribucija ispitivane kemikalije i količinski se određuju njezini metaboliti, prema potrebi.
Primjenom odgovarajućih uvjeta opisanih u ovoj metodi i smjernicama (2), apsorpcija ispitivane tvari u danom vremenu određuje se analizom prihvatnog fluida i tretirane kože. Ispitivanu tvar preostalu u koži treba smatrati apsorbiranom ako se ne može dokazati da je apsorpciju moguće odrediti samo iz vrijednosti u prihvatnom fluidu. Analiza drugih sastojaka (materijal ispran s kože i zadržan unutar slojeva kože) omogućuje vrednovanje dodatnih podataka, uključujući točno određivanje razmještaja ukupne ispitivane tvari i postotka rekuperacije.
Kako bi se dokazala učinkovitost i pouzdanost ispitnog sustava u laboratoriju koji provodi ovaj pokus trebaju biti dostupni rezultati za relevantne referentne kemikalije koji moraju biti u skladu s literaturom objavljenom za primijenjenu metodu. Taj je uvjet moguće zadovoljiti na način da se odgovarajuća referentna tvar (za čiju je lipofilnost poželjno da bude slična lipofilnosti ispitivane tvari) ispituje istodobno s ispitivanom tvari ili da se navedu odgovarajući povijesni podaci za izvjestan broj referentnih tvari različite lipofilnosti (npr. kafein, benzojeva kiselina i testosteron).
1.4. OPIS ISPITNE METODE
1.4.1. Difuzijska ćelija
Difuzijska ćelija sastoji se od donorske komore i receptorske komore između kojih se postavlja koža (primjer tipične konstrukcije prikazan je na slici 1.). Ćelija ima više zadaća: treba osigurati da koža bude dobro zabrtvljena po rubovima, treba omogućiti jednostavno uzorkovanje i dobro miješanje otopine koja je u dodiru s donjom stranom kože te dobru regulaciju temperature ćelije i njezinog sadržaja. Prihvatljive su i statičke i protočne difuzijske ćelije. Obično se donorske komore tijekom izlaganja konačnoj dozi ispitnog pripravka ostavljaju nepokrivene. Međutim kod beskonačnih primjena i određenih scenarija za konačne doze, donorske komore mogu se pokriti.
1.4.2. Receptorski fluid
Poželjno je upotrijebiti fiziološki provodljiv prihvatni fluid iako se i drugi mogu koristiti pod uvjetom da se dokaže opravdanost njihove primjene. Sastav prihvatnog fluida treba precizno navesti. Treba dokazati odgovarajuću topljivost ispitivane tvari u prihvatnom fluidu kako ne bi predstavljao prepreku za apsorpciju. Osim toga, prihvatni fluid ne smije utjecati na integritet pripravka kože. U protočnom sustavu, brzina protoka ne smije biti prepreka difuziji ispitivane tvari u prihvatni fluid. U sustavu statične ćelije, fluid stalno treba miješati i redovito uzorkovati. Ako se proučava metabolizam, prihvatni fluid mora podržavati aktivnost kože tijekom cijelog pokusa.
1.4.3. Pripravci kože
Može se koristiti koža ljudskog ili životinjskog porijekla. Podrazumijeva se da upotreba ljudske kože podliježe nacionalnim i međunarodnim etničkim pitanjima i uvjetima. Iako je poželjna aktivna koža, može se upotrijebiti i neaktivna, pod uvjetom da se integritet kože može dokazati. Prihvatljive su obje epidermalne membrane (odvojene enzimski, toplinski ili kemijski) ili određeni slojevi kože (debljine obično 200-400 μm) pripremljeni pomoću dermatoma. Može se koristiti koža pune debljine, ali prekomjernu debljinu (približno > 1 mm) treba izbjegavati, osim ako se to posebno zahtijeva za određivanje ispitivane kemikalije po slojevima kože. Opravdanost odabira vrste, anatomskog mjesta i tehnike pripravljanja treba dokazati. Potrebno je pokus ponoviti najmanje četiri puta za svaki ispitni pripravak.
1.4.4. Integritet pripravka kože
Pravilna je priprema kože od presudne važnosti. Neodgovarajuće rukovanje može rezultirati oštećenjem sloja stratum corneum, pa je zato provjera integriteta pripravka neophodna. Ako se istražuje metabolizam kože, svježi isječak kože treba što je moguće brže upotrijebiti, i to pod uvjetima za koje je poznato da podržavaju metaboličku aktivnost. Općenito se smatra da svježi isječak kože treba upotrijebiti u roku 24 sata, ali prihvatljivo vrijeme skladištenja može varirati u zavisnosti o kojem se enzimskom sustavu u metabolizmu radi i o temperaturama skladištenja (13). Ako su pripravci kože prije upotrebe bili uskladišteni, treba podastrijeti dokaze da je funkcija zaštite sačuvana.
1.4.5. Ispitivana tvar
Ispitivana tvar je proizvod čije se karakteristike penetracije proučavaju. U idealnom slučaju, ispitivana tvar treba biti obilježena radioaktivnim izotopom.
1.4.6. Ispitni pripravak
Pripravak ispitivane tvari (npr. čisti, razrijeđeni ili formulirani materijal koji sadrži ispitivanu tvar koja se primjenjuje na kožu) treba biti isti (ili predstavljati realističan surogat) kao i pripravak kojem bi mogli biti izloženi ljudi ili druge potencijalne ciljne vrste. Opravdanost svakog odstupanja od pripravka koji se obično rabi treba dokazati.
1.4.7. Koncentracije i formulacije ispitivanih tvari
Obično se ispitivana tvar primjenjuje u nekoliko koncentracija koje obuhvaćaju gornje vrijednosti potencijalnog izlaganja ljudi. Isto tako, studija se može proširiti na cijeli niz tipičnih formulacija.
1.4.8. Primjena na kožu
U redovnim uvjetima u kojima su ljudi izloženi kemikalijama, obično se sreću konačne doze. Stoga treba upotrijebiti primjenu koja oponaša izlaganje ljudi, obično 1-5 mg/cm2 kože za krutu tvar i do 10 μl/cm2 za tekućine. Količinu treba opravdati očekivanim uvjetima upotrebe ili fizikalnim karakteristikama ispitnog pripravka. Na primjer, primjene na površinu kože mogu biti beskonačne ako se primjenjuju veliki volumeni po jedinici površine.
1.4.9. Temperatura
Pasivna difuzija kemikalija (pa stoga i apsorpcija putem kože) pod utjecajem je temperature. Komoru za difuziju i kožu treba održavati na stalnoj temperaturi bliskoj temperaturi normalne kože od 32 ± 1 °C. Za različite konstrukcije ćelija bit će potrebne različite temperature vodene kupke ili zagrijanog bloka, kako bi se osiguralo da prihvatna komora/koža budu u razini fiziološke norme. Poželjno je da vlažnost bude između 30 i 70 %.
1.4.10. Trajanje izlaganja i uzrokovanje
Koža se može ispitnom pripravku izlagati cijelo vrijeme trajanja pokusa ili u kraćim rokovima (tj. treba oponašati posebnu vrstu izlaganja kojem su podvrgnuti ljudi). S kože treba isprati višak ispitivane tvari odgovarajućim sredstvom za čišćenje, a ispranu tekućinu sakupiti za analizu. Postupak uklanjanja ispitnog pripravka ovisit će o očekivanom uvjetu upotrebe i njegovu opravdanost treba dokazati. Za odgovarajuću karakterizaciju profila apsorpcije obično je potrebno razdoblje uzorkovanja od 24 sata. Budući da se po isteku tih 24 sata integritet kože može početi pogoršavati, uzorkovanje treba provesti unutar 24 sata. Za tvari koje brzo prodiru u kožu to možda neće biti potrebno, ali za ispitivane tvari koje prodiru polagano, možda će trebati duže vrijeme. Učestalo uzimanje uzorka prihvatnog fluida treba omogućiti izradu grafičkog prikaza profila apsorpcije ispitivane tvari.
1.4.11. Zaključni postupci
Sve sastavne dijelove ispitnog sustava treba analizirati i odrediti razinu rekuperacije. Sustav obuhvaća donorsku komoru, ispiranje površine kože, pripravak kože i prihvatni fluid/komoru. U nekim slučajevima, koža se može frakcionirati na površinu kože koja se izlaže i površinu kože ispod ruba ćelije te na sloj stratum corneum, epidermu i dermu, za zasebnu analizu.
1.4.12. Analiza
U svim studijama treba postići odgovarajuću razinu rekuperacije (cilj bi trebao biti srednja vrijednost od 100 ± 10 % radioaktivnosti, a svako odstupanje od toga treba opravdati). Količinu ispitivane tvari u prihvatnom fluidu, pripravku kože, sredstvu s kojim se ispire površina kože i uređaj treba analizirati odgovarajućom tehnikom.
2. PODACI
Treba predočiti analizu prihvatnog fluida, distribuciju ispitivane kemikalije u ispitnom sustavu i profil apsorpcije s obzirom na vrijeme. Ako se primjenjuju uvjeti izlaganja s konačnom dozom, treba izračunati količinu ispranu s kože, količinu u koži (i različitim slojevima kože, ako se analiziraju), te količinu prisutnu u prihvatnom fluidu (stopa i količina ili postotak primijenjene doze). Apsorpcija putem kože se ponekad može izraziti samo pomoću podataka o prihvatnom fluidu. Međutim, ako na kraju studije ispitivana tvar ostaje u koži, možda će je trebati uključiti u ukupnu apsorbiranu količinu (vidjeti stavak 66. u referenci (3)). Ako se primjenjuju uvjeti izlaganja s beskonačnom dozom, podaci mogu omogućiti izračun konstante permeabilnosti (Kp). Pod uvjetima izlaganja s beskonačnom dozom, apsorbirani postotak nije relevantan.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
U izvješću o ispitivanju moraju biti navedeni uvjeti propisani u protokolu, uključujući dokaz o opravdanosti primijenjenog ispitnog sustava, kao i sljedeće informacije:
|
|
ispitivana tvar:
|
|
|
Ispitni pripravak:
|
|
|
Uvjeti ispitivanja:
|
|
|
Rezultati:
|
|
|
Rasprava o rezultatima. |
|
|
Zaključci. |
4. REFERENCE
|
(1) |
Testing Method B.44. Skin Absorption: In Vivo Method. |
|
(2) |
OECD, (2002) Guidance Document for the Conduct of Skin Absorption Studies. OECD, Paris. |
|
(3) |
OECD, (2000) Report of the Meeting of the OECD Extended Steering Committee for Percutaneous Absorption Testing, Annex 1 to ENV/JM/TG(2000)5. OECD, Paris. |
|
(4) |
Kemppainen B.W. and Reifenrath W.G., (1990) Methods for skin absorption. CRC Press, Boca Raton. |
|
(5) |
Bronaugh R.L. and Collier, S.W., (1991) Protocol for In vitro Percutaneous Absorption Studies, in In vitro Percutaneous Absorption: Principles, Fundamentals and Applications, RL Bronaugh and HI Maibach, Eds., CRC Press, Boca Raton, str. 237-241. |
|
(6) |
Bronaugh R.L. and Maibach H.I., (1991) In vitro Percutaneous Absorption: Principles, Fundamentals and Applications. CRC Press, Boca Raton. |
|
(7) |
European Centre for Ecotoxicology and Toxicology of Chemicals, (1993) Monograph No 20, Percutaneous Absorption, ECETOC, Brussels. |
|
(8) |
Diembeck W, Beck H, Benech-Kieffer F, Courtellemont P, Dupuis J, Lovell W, Paye M, Spengler J, Steiling W., (1999) Test Guidelines for In Vitro Assessment of Dermal Absorption and Percutaneous Penetration of Cosmetic Ingredients, Fd Chem Tox, 37, str. 191-205. |
|
(9) |
Recommended Protocol for In vitro Percutaneous Absorption Rate Studies (1996). US Federal Register, Vol. 61, No 65. |
|
(10) |
Howes, D., Guy, R., Hadgraft, J., Heylings, J.R. et al. (1996). Methods for assessing Percutaneous absorption. ECVAM Workshop Report ATLA 24, 81 R10. |
|
(11) |
Schaefer, H. and Redelmeier, T.E., (1996). Skin barrier: principles of percutaneous absorption. Karger, Basel. |
|
(12) |
Roberts, M.S. and Walters, K.A., (1998). Dermal absorption and toxicity assessment. Marcel Dekker, New York. |
|
(13) |
Jewell, C., Heylings, J.R., Clowes, H.M. and Williams, F.M. (2000). Percutaneous absorption and metabolism of dinitrochlorobenzene in vitro. Arch Toxicol 74, str. 356-365. |
Slika 1.
Primjer tipične konstrukcije statičke difuzijske ćelije za studije perkutane apsorpcije in vitro

(1) Područje zamućenosti rožnice treba zabilježiti
(2) Za određeni broj pretraga seruma i plazme, osobito za mjerenje glukoze, najbolje je da životinje preko noći poste. Glavni je razlog tome što bi povećana varijabilnost, do koje bi neminovno došlo kad životinja ne bi postila, dovela do prikrivanja manje izraženih učinaka i do teškoća u tumačenju. S druge strane, međutim, post preko noći mogao bi utjecati na opći metabolizam životinja i, osobito kod studija prehrane, može poremetiti dnevnu izloženost ispitivanoj tvari. Ako se odluči za post, kliničko-biokemijske pretrage treba obaviti nakon provođenja funkcionalnih opažanja u 4. tjednu studije.
(3) Kod niza mjerenja u serumu i plazmi, osobito kad se mjeri glukoza, preporuča se post životinja preko noći. Glavni razlog tome je činjenica da povećana varijabilnost, do koje bi neminovno došlo u slučaju da se životinjama hrana ne uskrati, vjerojatno bi prikrila suptilnije učinke i otežala tumačenje rezultata. S druge strane, međutim, post tijekom noći može omesti opći metabolizam životinje i, osobito u studijama čiji je predmet prehrana, može utjecati na dnevnu izloženost ispitivanoj tvari. Ako se odluči za post tijekom noći, klinička biokemijska ispitivanja treba obaviti nakon provođenja funkcionalnih opažanja u okviru studije.
(4) Sada poznata kao serumska alanin aminotransferaza.
(5) Sada poznata kao aspartat aminotransferaza.
(6) Sada poznata kao serumska alanin aminotransferaza.
(7) Sada poznata kao aspartat aminotransferaza.
(8) Sada poznata pod nazivom serumska alanin aminotransferaza.
(9) Sada poznata pod nazivom serumska aspartat aminotransferaza.
(10) Ove organe, od po 10 životinja od svakoga spola po skupini u slučaju glodavaca i neglodavaca, plus štitnjaču (s paratiroidnim žlijezdama) treba izvagati.
(11) Sada poznata pod nazivom serumska alanin aminotransferaza.
(12) Sada poznata pod nazivom serumska aspartat aminotransferaza.
(13) Ove organe od po 10 životinja od svakoga spola po skupini, u slučaju glodavaca, treba izvagati.
(14) Kod ove metode, referentna skupina je skupina na kojoj se ispitivana tvar primjenjuje nekim drugim putem primjene koji osigurava potpunu biodostupnost doze.
(15) Otapalo koje se koristi za mjerenje apsorpcije.
|
† |
Uključuje pet životinja odabranih za funkcionalno ispitivanje i detaljna klinička opažanja kao dio studije neurotoksičnosti. |
DIO C: METODE ZA ODREĐIVANJE EKOTOKSIČNOSTI
SADRŽAJ
|
C.1. |
AKUTNA TOKSIČNOST ZA RIBE |
|
C.2. |
TEST AKUTNE IMOBILIZACIJE DAPHNIA SP. |
|
C.3. |
TEST INHIBICIJE RASTA ALGI |
|
C.4. |
ODREĐIVANJE „LAKE” BIORAZGRADIVOSTI |
|
I. DIO |
OPĆENITO |
|
II. DIO |
TEST OPADANJA DOC-a (metoda C.4.-A) |
|
DIO III. |
IZMIJENJENI TEST PRETRAŽIVANJA OECD (metoda C.4.-B) |
|
IV. DIO |
TEST RAZVIJANJA CO2 (metoda C.4.-C) |
|
V. DIO |
MANOMETRIJSKO-RESPIROMETRIJSKI TEST (metoda C.4.-D) |
|
DIO VI. |
TEST SA ZATVORENIM BOCAMA (metoda C.4.-E) |
|
DIO VII. |
TEST M.I.T.I. (metoda C.4.-F) |
|
C.5. |
RAZGRADNJA – BIOKEMIJSKA POTROŠNJA KISIKA |
|
C.6. |
RAZGRADNJA – KEMIJSKA POTROŠNJA KISIKA |
|
C.7. |
RAZGRADNJA – ABIOTIČKA RAZGRADNJA: HIDROLIZA KAO FUNKCIJA PH |
|
C.8. |
TOKSIČNOST ZA GUJAVICE |
|
C.9. |
BIORAZGRADNJA – ZAHN-WELLENSOV TEST |
|
C.10. |
BIORAZGRADNJA – SIMULACIJSKI TESTOVI S AKTIVNIM MULJEM |
|
C.11. |
BIORAZGRADNJA – TEST INHIBICIJE DISANJA AKTIVNOG MULJA |
|
C.12. |
BIORAZGRADNJA – IZMIJENJENI TEST SCAS |
|
C.13. |
BIOKONCENTRACIJA: TEST S RIBAMA U PROTOČNOM POSTUPKU |
|
C.14. |
TEST RASTA JUVENILNIH RIBA |
|
C.15. |
TEST KRATKOTRAJNE TOKSIČNOSTI NA RIBAMA U STADIJU EMBRIJA I MLAĐI SA ŽUMANJČANOM VREĆICOM |
|
C.16. |
MEDONOSNE PČELE – ISPITIVANJE AKUTNE ORALNE TOKSIČNOSTI |
|
C.17. |
MEDONOSNE PČELE – ISPITIVANJE AKUTNE KONTAKTNE TOKSIČNOSTI |
|
C.18. |
ŠARŽNO ISPITIVANJE ADSORPCIJE/DESORPCIJE U RAVNOTEŽI |
|
C.19. |
PROCJENA KOEFICIJENTA ADSORPCIJE (KCO) NA TLO I KANALIZACIJSKI MULJ PRIMJENOM TEKUĆINSKE KROMATOLOGIJE VISOKE DJELOTVORNOSTI (HPLC) |
|
C.20. |
TEST REPRODUKTIVNE TOKSIČNOSTI NA VRSTI DAPHNIA MAGNA |
|
C.21. |
MIKROORGANIZMI KOJI ŽIVE U TLU: TEST PRETVORBE DUŠIKA |
|
C.22. |
MIKROORGANIZMI KOJI ŽIVE U TLU: TEST PRETVORBE UGLJIKA |
|
C.23. |
AEROBNA I ANAEROBNA PRETVORBA U TLU |
|
C.24. |
AEROBNA I ANAEROBNA PRETVORBA U SUSTAVIMA VODENOG SEDIMENTA |
C.1. AKUTNA TOKSIČNOST ZA RIBE
1. METODA
1.1. UVOD
Svrha ovog testa je odrediti akutnu letalnu toksičnost tvari za ribe u slatkoj vodi. Kao pomoć u odabiru najprikladnije ispitne metode (statička, polustatička ili protočna) poželjno je imati informacije o topljivosti u vodi, tlaku pare, kemijskoj stabilnosti, konstantama disocijacije i biorazgradivosti tvari, u mjeri u kojoj je to moguće, kako bi se osigurala zadovoljavajuća stabilnost koncentracija ispitivane tvari u razdoblju ispitivanja.
Kod planiranja ispitivanja i tumačenja rezultata treba uzeti u obzir i dodatne informacije (npr. strukturna formula, stupanj čistoće, vrsta i postotak značajnih nečistoća, prisutnost i količine dodataka (aditiva) i podjelni koeficijent n-oktanol/voda).
1.2. DEFINICIJE I JEDINICE
Akutna toksičnost je raspoznatljiv štetni učinak izazvana u organizmu u kratkom vremenu (dani) izlaganja tvari. U ovom se testu akutna toksičnost izražava kao medijan smrtonosne koncentracije (LC50), a to je koncentracija u vodi koja ubija 50 % ispitne serije riba u neprekinutom vremenu izlaganja koje treba navesti.
Sve koncentracije ispitivane tvari navode se kao omjer masa/volumen (miligrami po litri). One se također mogu izraziti i kao maseni udjeli (mg/kg-1).
1.3. REFERENTNE TVARI
Ispitivanjem referentne tvari može se dokazati da se odgovor ispitivane vrste nije značajno promijenio u uvjetima laboratorijskog ispitivanja.
Za ovo ispitivanje nisu utvrđene referentne tvari.
1.4. NAČELO ISPITNE METODE
Granično se ispitivanje može provesti sa 100 mg po litri da bi se dokazalo da je LC50 viši od te koncentracije.
Ribe se tijekom 96 sati izlažu ispitivanoj tvari, koja se dodaje u vodu u određenom rasponu koncentracija. Smrtnost se bilježi barem u razmacima od 24 sata i, ako je to moguće, izračunaju se koncentracije koje ubijaju 50 % riba (LCSO) u svakom vremenu promatranja.
1.5. KRITERIJI KAKVOĆE
Kriteriji kakvoće vrijede za granično ispitivanje i za potpunu ispitnu metodu.
Smrtnost u kontrolama do kraja ispitivanja ne smije biti viša od 10 % (ili jedna riba ako se koristi manje od deset).
Koncentracija otopljenog kisika mora stalno biti iznad 60 % vrijednosti zasićenja kisikom.
Koncentracije ispitivane tvari se tijekom ukupnog trajanja ispitivanja moraju održavati na razini 80 % početnih koncentracija.
Za tvari koje se lako otapaju u ispitnom mediju dajući stabilne otopine, tj. tvari koje neće u značajnoj mjeri ishlapiti, razgraditi se, hidrolizirati ili adsorbirati, može se uzeti da je početna koncentracija istovjetna nazivnoj koncentraciji. Treba dokazati da su koncentracije tijekom ispitivanja u svakom trenutku bile na predviđenoj razini i da su zadovoljeni kriteriji kakvoće.
Kod tvari koje:
|
i. |
su slabo topljive u ispitnom mediju; ili |
|
ii. |
mogu tvoriti stabilne emulzije ili disperzije; ili |
|
iii. |
nisu stabilne u vodenim otopinama, |
uzet će se da je početna koncentracija ona koncentracija koja je izmjerena u otopini (odnosno, ako to tehnički nije izvedivo, u vodenom stupcu) na početku ispitivanja. Koncentracija se određuje nakon razdoblja uravnoteženja, ali prije uvođenja ispitnih riba.
U svakom od ovih slučajeva treba za vrijeme ispitivanja provesti dodatna mjerenja kako bi se potvrdile stvarne koncentracije izlaganja odnosno usklađenost s kriterijima kakvoće.
Odstupanja pH vrijednosti ne smiju biti viša od 1 jedinice.
1.6. OPIS ISPITNE METODE
Mogu se koristiti tri vrste postupka:
Statičko ispitivanje:
ispitivanje toksičnosti gdje nema protoka ispitne otopine. (Otopine ostaju nepromijenjene tijekom ukupnog trajanja ispitivanja.)
Polustatičko ispitivanje:
ispitivanje bez protoka ispitne otopine, ali uz redovito obnavljanje čitave količine ispitne otopine nakon dužih razdoblja (npr. 24 sata).
Protočno ispitivanje:
toksikološko ispitivanje gdje se voda u ispitnim komorama stalno obnavlja i ispitivana se kemikalija prenosi s vodom koja sa koristi za obnavljanje ispitnog medija.
1.6.1. Reagensi
1.6.1.1. Otopine ispitivanih tvari
Radne otopine potrebne jakosti pripremaju se otapanjem tvari u deioniziranoj vodi odnosno vodi u skladu s 1.6.1.2.
Odabrane ispitne koncentracije pripremaju se razrjeđivanjem radne otopine. Ako se ispituju visoke koncentracije, tvar se može izravno otopiti u vodi za razrjeđivanje.
Tvari u pravilu treba ispitivati samo do granice topljivosti. Kod nekih tvari (npr. tvari koje imaju nisku topljivost u vodi ili visoki Pow i tvari koje u vodi ne tvore pravu otopinu već stabilnu disperziju) prihvatljivo je korištenje ispitne koncentracije iznad granice topljivosti kako bi se dobila najviša topljiva/stabilna koncentracija. Ipak, važno je da ta koncentracija inače ne remeti ispitni sustav (npr. film tvari na površini vode koji sprečava oksigenaciju vode itd.).
Kao pomoć u pripremi radnih otopina tvari niske topljivosti u vodi odnosno da bi se olakšalo dispergiranje tih tvari u ispitnom mediju, može se koristiti ultrazvučno raspršivanje, organska otapala, emulgatori ili dispergenti. Ako se koriste ovakve pomoćne tvari, sve ispitne koncentracije moraju sadržavati istu količinu pomoćne tvari i treba uvesti dodatne kontrolne ribe i izložiti ih istoj koncentraciji pomoćne tvari kao ribe u ispitnom nizu. Koncentracija tih pomoćnih tvari treba biti što je moguće niža, a u svakom slučaju ne smije prelaziti 100 mg po litri ispitnog medija.
Ispitivanje treba provesti bez podešavanja pH vrijednosti. Ako ima naznaka da je došlo do značajne promjene pH, savjetuje se da se ispitivanje ponovi uz podešavanje pH i navedu rezultati. U tom slučaju pH vrijednost radne otopine treba podesiti na pH vrijednost vode za razrjeđivanje, osim ako postoje posebni razlozi da se to ne učini. Pritom treba po mogućnosti koristiti HCl i NaOH. Podešavanje pH vrijednosti treba obaviti na način da ne dođe do značajne promjene koncentracije ispitivane tvari u radnoj otopini. Ako podešavanje izazove kemijsku reakciju ili fizičko taloženje ispitivanog spoja, to treba navesti u izvješću o ispitivanju.
1.6.1.2. Voda za držanje i voda za razrjeđivanje
Može se koristiti tekuća voda za piće (koja nije onečišćena potencijalno štetnim koncentracijama klora, teških metala i drugih tvari), kvalitetna prirodna voda ili obrađena voda (vidjeti Dodatak 1.). Prednost se daje vodi ukupne tvrdoće između 10 i 250 mg po litri (kao CaCO3) s pH od 6,0 do 8,5.
1.6.2. Aparatura
Sva aparatura mora biti izrađena od kemijski inertnog materijala:
|
— |
automatski sustav razrjeđivanja (za protočno ispitivanje), |
|
— |
mjerač kisika, |
|
— |
oprema za određivanje tvrdoće vode, |
|
— |
odgovarajući uređaj za regulaciju temperature, |
|
— |
mjerač pH vrijednosti. |
1.6.3. Ispitne ribe
Ribe trebaju biti zdrave i ne smiju pokazivati vidljive malformacije.
Vrstu treba odabrati na temelju praktičnih kriterija, kao što su dobra raspoloživost tijekom čitave godine, lakoća održavanja, prikladnost za ispitivanje, relativna osjetljivost na kemikalije te svi bitni ekonomski, biološki i okolišni čimbenici. Prilikom odabira riblje vrste treba također voditi računa o potrebi za usporedivošću dobivenih podataka i postojećem međunarodnom usklađivanju (1).
Popis preporučenih ribljih vrsta za provedbu ovog testa nalazi se u Dodatku 2.; preferirane vrste su zebrica i kalifornijska pastrva.
1.6.3.1. Držanje
Sve ispitne ribe trebaju po mogućnosti potjecati iz istog nasada i biti slične dužine i dobi. Ribe treba držati najmanje 12 dana u sljedećim uvjetima:
punjenje:
ovisno o postupku (recirkulacija ili protok) i ribljoj vrsti,
voda:
vidjeti 1.6.1.2.,
svjetlost:
osvjetljenje od 12 do 16 sati dnevno,
koncentracija otopljenog kisika:
najmanje 80 % vrijednosti zasićenja kisikom,
hranjenje:
tri puta tjedno ili svakog dana – prestaje 24 sata prije početka ispitivanja.
1.6.3.2. Smrtnost
Smrtnost se bilježi nakon 48-satnog razdoblja prilagodbe, uz primjenu sljedećih kriterija:
|
— |
iznad 10 % populacije u sedam dana: čitava serija se odbacuje, |
|
— |
između 5 i 10 % populacije: razdoblje držanja produžuje se na još sedam dana. Ako se nakon tog više ne zabilježi smrtnost, serija je prihvatljiva; u protivnome se mora odbaciti, |
|
— |
manje od 5 % populacije: prihvaćanje serije. |
1.6.4. Prilagodba
Sve ribe moraju prije korištenja biti najmanje sedam dana izložene vodi iste kakvoće i temperature kakva će se koristiti u ispitivanju.
1.6.5. Ispitni postupak
Prije glavnog ispitivanja može se provesti preliminarno ispitivanje za određivanje raspona kako bi se pribavile informacije o rasponu koncentracija koji će se koristiti u glavnom ispitivanju.
Uz ispitni niz treba provesti jednu kontrolu s vodom za razrjeđivanje te, prema potrebi, jednu kontrolu s pomoćnom tvari.
Ovisno o fizikalnim i kemijskim svojstvima ispitivanog spoja, treba odabrati statičko, polustatičko ili protočno ispitivanje, kako bi kriteriji kakvoće bili zadovoljeni.
Ribe se izlažu tvari kako je ovdje opisano:
|
— |
trajanje: 96 sati, |
|
— |
broj životinja: najmanje sedam po koncentraciji, |
|
— |
bazeni: prikladne zapremnine s obzirom na preporučeno punjenje, |
|
— |
punjenje: za statičko i polustatičko ispitivanje preporučuje se maksimalna količina punjenja od 1 g po litri; kod protočnih sustava prihvatljiva je i veća količina punjenja, |
|
— |
ispitna koncentracija: najmanje pet koncentracija koje se razlikuju za stalni faktor ne viši od 2,2 i koje u najvećoj mogućoj mjeri obuhvaćaju područje od 0 do 100 % smrtnosti, |
|
— |
voda: vidjeti 1.6.1.2., |
|
— |
svjetlost: osvjetljenje od 12 do 16 sati dnevno, |
|
— |
temperatura: ovisno o vrsti (Dodatak 2.), ali u granicama ± 1 °C tijekom jednog ispitivanja, |
|
— |
koncentracija otopljenog kisika: najmanje 60 % vrijednosti zasićenja kisikom pri odabranoj temperaturi, |
|
— |
hranjenje: nema. |
Ribe se pregledavaju nakon prva dva do četiri sata te barem u razmacima od 24 sata. Ribe se smatraju mrtvima ako ne reagiraju na dodir u području korijena repa i ako nisu vidljivi pokreti disanja. Mrtve ribe treba ukloniti čim se uoče i zabilježiti smrtnost. Treba voditi evidenciju vidljivih anomalija (npr. gubitak ravnoteže, promjene u načinu plivanja, disanju, pigmentaciji itd.).
Mjerenja pH vrijednosti, otopljenog kisika i temperature treba provoditi svakodnevno.
Granično ispitivanje
Granično se ispitivanje može provesti sa 100 mg po litri primjenom postupaka opisanih u ovoj ispitnoj metodi da bi se dokazalo da je LC50 viši od te koncentracije.
Ako se zbog prirode tvari ne može postići koncentracija od 100 mg po litri u ispitnoj vodi, granično ispitivanje treba provesti s koncentracijom koja je jednaka topljivosti tvari (ili najvišoj koncentraciji koja daje stabilnu disperziju) u mediju koji se koristi (vidjeti također točku 1.6.1.1.).
Granično ispitivanje treba provesti na 7 do 10 riba, uz isti broj riba u kontroli odnosno kontrolama. (Prema binomnom poučku, ako se koristi 10 riba s nultom smrtnošću, tada je pouzdanost da je LC50 viši od koncentracije primijenjene u graničnom ispitivanju jednaka 99,9 %. Odustnost smrtnosti kod 7, 8 ili 9 riba ukazuje na to da je LC50 viši od primijenjene koncentracije s pouzdanošću od najmanje 99 %.)
Kod pojave smrtnosti treba provesti potpuno istraživanje. Treba zabilježiti sve uočene subletalne učinke.
2. PODACI I VREDNOVANJE
Postotak smrtnosti u svakom vremenu u kojemu se bilježe zapažanja (24, 48, 72 i 96 sati) treba prikazati na logaritamskom papiru vjerojatnosti u ovisnosti o koncentraciji i to za svako preporučeno vrijeme izlaganja.
Kad god je to moguće, za svako vrijeme promatranja treba procijeniti LC50 i granice pouzdanosti (p = 0,05) primjenom standardnih postupaka; te vrijednosti treba zaokružiti na jedno ili najviše dva značajna mjesta (primjeri zaokruživanja na dva mjesta: 170 za 173,5; 0,13 za 0,127; 1,2 za 1,21).
U slučaju da je nagib krivulje koncentracija/odgovor preoštar za izračun LC50, dovoljna je grafička procjena te vrijednosti.
Ako dvije uzastopne koncentracije u omjeru 2,2 daju samo 0 i 100 % smrtnosti, te su dvije vrijednosti dovoljne da se pokaže područje u kojemu se nalazi LC50.
Ako je primijećeno da se stabilnost ili homogenost ispitivane tvari ne može održati, to treba navesti u izvješću o ispitivanju i rezultate tumačiti s oprezom.
3. IZVJEŠĆIVANJE
Izvješće o ispitivanju po mogućnosti sadrži sljedeće informacije:
|
— |
podaci o ispitnim ribama (znanstveni naziv, soj, dobavljač, moguće prethodne obrade, veličina i broj riba pri svakoj ispitnoj koncentraciji), |
|
— |
izvor vode za razrjeđivanje i značajna kemijska svojstva (pH, tvrdoća, temperatura), |
|
— |
u slučaju tvari koje su slabo topljive u vodi: metoda pripreme radne i ispitnih otopina, |
|
— |
koncentracija pomoćnih tvari, |
|
— |
popis korištenih koncentracija i sve raspoložive informacije o stabilnosti ispitivane kemikalije u ispitnoj otopini u tim koncentracijama, |
|
— |
ako se provode kemijske analize, primijenjene metode i dobiveni rezultati, |
|
— |
rezultati graničnog ispitivanja, ako se provodi, |
|
— |
razlozi za odabir ispitnog postupka i pojedinosti tog postupka (npr. statički, polustatički, doziranje, brzina protoka, dozračivanje, količina punjenja itd.), |
|
— |
opis ispitne opreme, |
|
— |
režim rasvjete, |
|
— |
koncentracije otopljenog kisika, pH vrijednosti i temperature ispitnih otopina svaka 24 sata, |
|
— |
dokazi da su ispunjeni kriteriji kakvoće, |
|
— |
tablica iz koje je vidljiva kumulativna smrtnost pri svakoj koncentraciji i u kontroli (i u kontroli s pomoćnom tvari, ako je potrebna) u svakom preporučenom vremenu promatranja, |
|
— |
graf krivulje koncentracija/odgovor na kraju ispitivanja, |
|
— |
po mogućnosti, vrijednosti LC50 u svakom preporučenom vremenu promatranja (s granicama pouzdanosti 95 %), |
|
— |
statistički postupci primijenjeni za određivanje vrijednosti LC50, |
|
— |
ako se koristi referentna tvar, rezultati koji su dobiveni, |
|
— |
najviša ispitna koncentracija koja ne izaziva smrtnost u razdoblju ispitivanja, |
|
— |
najniža ispitna koncentracija koja je izazvala 100 %-tnu smrtnost u razdoblju ispitivanja. |
4. REFERENCE
|
(1) |
OECD, Paris, 1981, Test Guideline 203, Decision of the Council C(81) 30 final and updates. |
|
(2) |
AFNOR – Determination of the acute toxicity of a substance to Brachydanio rerio – Static and Flow Through methods – NFT 90-303 June 1985. |
|
(3) |
AFNOR – Determination of the acute toxicity of a substance to Salmo gairdneri – Static and Flow – Through methods – NFT 90-305 June 1985. |
|
(4) |
ISO 7346/1,/2 and/3 – Water Quality – Determination of the acute lethal toxicity of substances to a fresh water fish (Brachydanio rerio Hamilton-Buchanan-Teleostei, Cyprinidae). Part 1: Static method. Part 2: Semi-static method. Part 3: Flow-through method. |
|
(5) |
Eidgenössisches Department des Innern, Schweiz: Richtlinien fur Probenahme und Normung von Wasseruntersuchungsmethoden -Part II 1974. |
|
(6) |
DIN Testverfahren mit Wasserorganismen, 38 412 (11) und 1 (15). |
|
(7) |
JIS K 0102, Acute toxicity test for fish. |
|
(8) |
NEN 6506- Water -Bepaling van de akute toxiciteit met behulp van Poecilia reticulata, 1980. |
|
(9) |
Environmental Protection Agency, Methods for the acute toxicity tests with fish, macroinvertebrates and amphibians. The Committee on Methods for Toxicity Tests with Aquatic Organisms, Ecological Research Series EPA-660-75-009, 1975. |
|
(10) |
Environmental Protection Agency, Environmental monitoring and support laboratory, Office of Research and Development, EPA-600/4-78-012, January 1978. |
|
(11) |
Environmental Protection Agency, Toxic Substance Control, Part IV, 16 March 1979. |
|
(12) |
Standard methods for the examination of water and wastewater, fourteen edition, APHA-AWWA-WPCF, 1975. |
|
(13) |
Commission of the European Communities, Inter-laboratory test programme concerning the study of the ecotoxicityof a chemical substance with respect to the fish. EEC Study D.8368, 22 March 1979. |
|
(14) |
Verfahrensvorschlag des Umweltbundesamtes zum akuten Fisch-Test. Rudolph, P. und Boje, R. Okotoxikologie, Grundlagen fur die okotoxikologische Bewertung von Umweltchemikalien nach dem Chemikaliengesetz, ecomed 1986. |
|
(15) |
Litchfield, J. T.and Wilcoxon, F., A simplified method for evaluating dose effects experiments, J. Pharm, tExp. Therap., 1949, vol. 96,99. |
|
(16) |
Finney, D.J. Statistical Methods in Biological Assay. Griffin, Weycombe, U.K., 1978. |
|
(17) |
Sprague, J.B. Measurement of pollutant toxicity to fish. Bioassay methods for acute toxicity. Water Res., 1969, vol. 3,793-821. |
|
(18) |
Sprague, J.B. Measurement of pollutant toxicity to fish. II Utilising and applying bioassay results. Water Res. 1970, vol. 4, 3-32. |
|
(19) |
Stephan, C.E. Methods for calculating an LC50. In Aquatic Toxicology and Hazard Evaluation (edited by F.I. Mayer and J.L. Hamelink). American Society for Testing and Materials, ASTM STP 634,1977, 65-84. |
|
(20) |
Stephan, C.E., Busch, K.A., Smith, R., Burke, J. and Andrews, R.W. A computer program for calculating an LC50. US EPA. |
Dodatak 1.
Obrađena voda
Primjer prikladne vode za razrjeđivanje
Sve kemikalije moraju biti analitički čiste.
Voda treba biti kvalitetna destilirana voda ili deionizirana voda vodljivosti manje od 5 μScm–1.
Aparatura za destilaciju vode ne smije sadržavati bakrene dijelove.
Radne otopine
|
CaCl2. 2H2O (kalcijev klorid dihidrat): otopiti u vodi i nadopuniti vodom do 1 litre. |
11,76 g |
|
MgSO4. 7H2O (magnezijev sulfat heptahidrat): otopiti u vodi i nadopuniti vodom do 1 litre. |
4,93 g |
|
NaHCO3 (natrijev hidrogenkarbonat): otopiti u vodi i nadopuniti vodom do 1 litre. |
2,59 g |
|
KCl (kalijev klorid): otopiti u vodi i nadopuniti vodom do 1 litre. |
0,23 g |
Obrađena voda za razrjeđivanje
Pomiješati po 25 ml svake od četiri radne otopine i nadopuniti vodom do 1 litre.
Dozračivati dok koncentracija otopljenog kisika ne dosegne vrijednost zasićenja kisikom.
pH treba biti 7,8 ± 0,2.
pH se prema potrebi podešava uz pomoć NaOH (natrijev hidroksid) ili HCl (klorovodična kiselina).
Ovako pripremljena voda za razrjeđivanje ostavi se da stoji 12 sati i ne smije se više dozračivati.
Zbroj iona Ca i Mg u ovoj otopini je 2,5 mmol po litri. Omjer iona Ca i Mg je 4:1, a iona Na i K je 10:1. Ukupni alkalitet ove otopine je 0,8 mmol po litri.
Moguća odstupanja u pripremi vode za razrjeđivanje ne smiju promijeniti sastav i svojstva vode.
Dodatak 2.
Preporučene riblje vrste za ispitivanje
|
Preporučene vrste |
Preporučeno područje ispitnih temperatura (°C) |
Preporučena ukupna dužina ispitne životinje (cm) |
|
Brachydanio rerio (Teleostei, Cyprinidae) (Hamilton-Buchanan) zebrica |
20 do 24 |
3,0 ± 0,5 |
|
Pimephales promelas (Teleostei, Cyprinidae) (Rafinesque) debeloglava gaovica |
20 do 24 |
5,0 ± 2,5 |
|
Cyprinus carpio (Teleostei, Cyprinidae) (Linneaus 1758) šaran |
20 do 24 |
6,0 ± 2,0 |
|
Oryzias latipes (Teleostei, Poeciliidae) Cyprinodontidae (Tomminck i Schlege 1850) medaka |
20 do 24 |
3,0 ± 1,0 |
|
Poecilia reticulata (Teleostei, Poeciliidae) (Peters 1859) gupi |
20 do 24 |
3,0 ± 1,0 |
|
Lepomis macrochirus (Teleostei, Centrarchidae) (Rafinesque Linneaus 1758) plavoškrga sunčanica |
20 do 24 |
5,0 ± 2,0 |
|
Onchorhynchus mykiss (Teleostei, Salmonidae) (Walbaum 1988) kalifornijska pastrva |
12 do 17 |
6,0 ± 2,0 |
|
Leuciscus idus (Teleostei, Cyprinidae) (Linneaus 1758) jez |
20 do 24 |
6,0 ± 2,0 |
Skupljanje
Gore navedene ribe su jednostavne za uzgoj i/ili su široko raspoložive tijekom čitave godine. One se mogu uzgajati i kultivirati na ribljim farmama ili u laboratorijskim uvjetima, uz nadzor bolesti i nametnika, kako bi se dobile zdrave ispitne životinje poznatog podrijetla. Ove su ribe raspoložive u mnogim dijelovima svijeta.
Dodatak 3.
Primjer krivulje koncentracija – postotak smrtnosti
Primjer određivanja LC50 uz pomoć logaritamskog papira vjerojatnosti

C.2. TEST AKUTNE IMOBILIZACIJE DAPHNIA SP.
1. METODA
Ova metoda ispitivanja akutne imobilizacije istovjetna je smjernici OECD TG 202 (2004.).
1.1. UVOD
U ovoj je metodi opisan test akutne toksičnosti za ocjenjivanje učinaka kemikalija na dafnije. Postojeće ispitne metode korištene su u mjeri u kojoj je to bilo moguće (1)(2)(3).
1.2. DEFINICIJE
U kontekstu ove metode koriste se sljedeće definicije:
|
|
EC50: procijenjena koncentracija koja izaziva nepokretnost 50 % dafnija unutar navedenog vremena izlaganja. Ako se koristi druga definicija, treba je navesti zajedno s izvorom. |
|
|
Nepokretnost: smatra se da su životinje nepokretne ako nisu sposobne plivati unutar 15 sekundi od nježnog mućkanja ispitne posude (čak i onda ako još uvijek mogu micati antenama). |
1.3. NAČELO ISPITNE METODE
Mlade dafnije, koje su na početku ispitivanja mlađe od 24 sata, izlažu se nizu koncentracija ispitivane tvari u razdoblju od 48 sati. Nepokretnost se bilježi nakon 24 sata i 48 sati i uspoređuje s kontrolnim vrijednostima. Rezultati se analiziraju da bi se izračunao EC50 nakon 48 sati (za definicije vidjeti odjeljak 1.2.). Određivanje EC50 nakon 24 sata je fakultativno.
1.4. INFORMACIJE O ISPITIVANOJ TVARI
Treba biti poznata topljivost u vodi i tlak pare ispitivane tvari i biti raspoloživa pouzdana analitička metoda za kvantifikaciju tvari u ispitnim otopinama s dokumentiranim iskorištenjem i granicom određivanja. Osim toga, korisno je imati informacije o strukturnoj formuli, čistoći tvari, stabilnosti u vodi ili na svjetlosti, Pow i rezultatima ispitivanja na laku biorazgradivost (vidjeti metodu C.4.).
Napomena: smjernice za ispitivanje tvari koje se teško ispituju zbog svojih fizikalno-kemijskih svojstava navode se u (4).
1.5. REFERENTNA TVAR
Ispitivanjem referentne tvari na EC50 može se provjeriti pouzdanost ispitnih uvjeta. Za to se preporučuju toksikanti koji se koriste u međunarodnim prstenastim testovima (1)(5) (1). Test(ove) s referentnom tvari trebalo bi provoditi po mogućnosti svaki mjesec, a najmanje dvaput godišnje.
1.6. KRITERIJI KAKVOĆE
Da bi ispitivanje bilo valjano, trebaju biti zadovoljeni sljedeći provedbeni kriteriji:
|
— |
u kontrolama, uključujući kontrolu sa sredstvom za otapanje, ne smije biti nepokretno više od 10 % dafnija, |
|
— |
koncentracija otopljenog kisika u kontrolnim i ispitnim posudama na kraju ispitivanja treba biti ≥ 3 mg/l. |
Napomena: Da bi bio zadovoljen prvi kriterij, nepokretnost i drugi znakovi bolesti odnosno stresa, primjerice promjena boje, neobično ponašanje kao što je zarobljenost na površini vode, ne bi smjeli biti vidljivi kod više od 10 % kontrolnih dafnija.
1.7. OPIS ISPITNE METODE
1.7.1. Aparatura
Ispitne posude i druga aparatura koja dolazi u dodir s ispitnim otopinama treba biti u cijelosti izrađena od stakla ili drugog kemijski inertnog materijala. Ispitne posude su u pravilu staklene epruvete ili laboratorijske čaše; njih treba očistiti prije svake uporabe primjenom standardnih laboratorijskih postupaka. Ispitne posude treba lagano prekriti kako bi se smanjio gubitak vode uslijed isparavanja i spriječio ulazak prašine u otopine. Hlapljive tvari treba ispitivati u potpuno napunjenim zatvorenim posudama koje su dovoljno velike da razina kisika ne postane ograničavajuća odnosno preniska (vidjeti odjeljak 1.6. i prvi stavak odjeljka 1.8.3.).
Osim toga, treba koristiti sljedeću opremu, djelomično ili u cijelosti: mjerač kisika (s mikroelektrodom ili drugim prikladnim uređajem za mjerenje otopljenog kisika u uzorcima malog volumena); mjerač pH vrijednosti; odgovarajući uređaj za regulaciju temperature; oprema za određivanje koncentracije ukupnog organskog ugljika (TOC); oprema za određivanje kemijske potrošnje kisika (KPK); oprema za određivanje tvrdoće itd.
1.7.2. Ispitni organizam
Daphnia magna Straus je preferirana ispitna vrsta, iako se u ovom testu mogu koristiti i druge prikladne vrste Daphnia (npr. Daphnia pulex). Na početku ispitivanja životinje trebaju biti mlađe od 24 sata; da bi se ograničila varijabilnost, nikako se ne preporučuje korištenje potomstva iz prvog legla. Dafnije trebaju potjecati iz zdravog nasada (tj. ne smiju pokazivati znakove stresa, kao što je visoka smrtnost, prisutnost mužjaka i efipija, zakašnjelo davanje prvog potomstva, životinje promijenjene boje itd.). Svi organizmi koji se koriste u određenom ispitivanju trebaju potjecati iz kultura dobivenih iz istog nasada dafnija. Matične životinje treba držati u uzgojnim uvjetima (svjetlost, temperatura, medij) koji su slični uvjetima ispitivanja. Ako će se u ispitivanju koristiti uzgojni medij koji se ne koristi u uobičajenom uzgoju dafnija, treba predvidjeti razdoblje aklimatizacije uoči ispitivanja. U tu se svrhu uzgojne dafnije prije početka ispitivanja drže u vodi za razrjeđivanje na ispitnoj temperaturi najmanje 48 sati.
1.7.3. Voda za držanje i voda za razrjeđivanje
Prirodna voda (površinska ili podzemna voda), obrađena voda i deklorirana voda iz slavine prihvatljive su kao voda za držanje odnosno voda za razrjeđivanje ako dafinije u njima mogu preživjeti vrijeme trajanja uzgoja, aklimatizacije i ispitivanja bez znakova stresa. Prikladna ispitna voda je svaka voda koja ima kemijska svojstva prihvatljive vode za razrjeđivanje iz Dodatka 1. Kakvoća vode mora ostati nepromijenjena u razdoblju ispitivanja. Obrađena se voda može pripremiti dodavanjem određenih količina reagensa priznate analitičke čistoće deioniziranoj ili destiliranoj vodi. Primjeri obrađene vode navode se u (1)(6) i u Dodatku 2. Valja napomenuti da kod ispitivanja tvari koje sadrže metale treba izbjegavati medije koji sadrže poznata kelatna sredstva, kao što su mediji M4 i M7 iz Dodatka 2. pH vrijednost treba biti u području od 6 do 9. Za vrstu Daphnia magna preporučuje se tvrdoća između 140 i 250 mg/l (kao CaCO3), dok kod drugih vrsta Daphnia može biti prikladna i manja tvrdoća. Voda za razrjeđivanje se prije uporabe u ispitivanju može dozračivati dok koncentracija otopljenog kisika ne dosegne točku zasićenja.
Ako se koristi prirodna voda, parametre kakvoće treba mjeriti najmanje dvaput godišnje odnosno svaki put kad se posumnja da su se ta svojstva značajno promijenila (vidjeti prethodni stavak i Dodatak 1.). Osim toga, treba obavljati mjerenja teških metala (npr. Cu, Pb, Zn, Hg, Cd, Ni). Ako se koristi deklorirana voda iz slavine, poželjna je dnevna analiza klora. Ako se voda za razrjeđivanje uzima iz izvora površinske ili podzemne vode, treba mjeriti vodljivost i ukupni organski ugljik (TOC) odnosno kemijsku potrošnju kisika (KPK).
1.7.4. Ispitne otopine
Ispitne otopine odabranih koncentracija obično se pripremaju razrjeđivanjem radne otopine. Radne otopine treba po mogućnosti pripremiti otapanjem ispitivane tvari u vodi za razrjeđivanje. Uporabu otapala, emulgatora i dispergenata treba što je moguće više izbjegavati. Ipak, takvi su spojevi u određenim slučajevima nužni da bi se dobila prikladna koncentracija radne otopine. Smjernice za prikladna otapala, emulgatore i dispergente navode se u (4). U svakom slučaju, ispitivana tvar u ispitnim otopinama ne smije prijeći granicu topljivosti u vodi za razrjeđivanje.
Ispitivanje treba provesti bez podešavanja pH vrijednosti. Ako pH ne ostane u području 6 – 9, treba provesti drugo ispitivanje i pritom pH vrijednost radne otopine podesiti na pH vode za razrjeđivanje prije dodavanja ispitne tvari. Podešavanje pH treba obaviti na način da ne dođe do značajne promjene koncentracije radne otopine i da se ne izazove kemijska reakcija ili taloženje ispitivane tvari. Prednost se daje HCl i NaOH.
1.8. POSTUPAK
1.8.1. Uvjeti izlaganja
1.8.1.1. Ispitne skupine i kontrole
Ispitne posude se napune odgovarajućom količinom vode za razrjeđivanje i otopina ispitivane tvari. Omjer volumena zraka i vode u posudama u ispitnoj i kontrolnoj skupini treba biti jednak. Nakon toga se dafnije stavljaju u ispitne posude. Treba upotrijebiti najmanje 20 životinja po ispitnoj koncentraciji i za kontrole, po mogućnosti podijeljenih u četiri skupine po pet životinja. Potrebno je najmanje 2 ml ispitne otopine po životinji (tj. 10 ml za pet dafnija po ispitnoj posudi). Ako koncentracija ispitivane tvari nije stabilna, ispitivanje se može provesti uz pomoć polustatičkog sustava s obnavljanjem ili protočnog sustava.
Uz ispitni niz treba ispitati jedan kontrolni niz s vodom za razrjeđivanje te, prema potrebi, jedan kontrolni niz sa sredstvom za otapanje.
1.8.1.2. Ispitne koncentracije
Ako nisu raspoloživi podaci o toksičnosti ispitivane tvari, može se provesti preliminarno ispitivanje kako bi se odredio raspon koncentracija za glavno ispitivanje. U tu se svrhu dafnije izlože nizu koncentracija ispitivane tvari s velikim razmakom između koncentracija. Svakoj ispitnoj koncentraciji treba izložiti 5 dafnija u trajanju od 48 sati ili manje, a ponavljanja nisu potrebna. Vrijeme izlaganja se može skratiti (npr. 24 sata ili manje) ako se prikladni podaci za određivanje raspona mogu dobiti u kraćem vremenu.
Treba koristiti najmanje pet ispitnih koncentracija. Koncentracije trebaju biti raspoređene u geometrijskom nizu uz faktor koji po mogućnosti nije viši od 2,2. Ako se koristi manje od pet koncentracija, treba navesti obrazloženje. Poželjno je da se pri najvišoj ispitanoj koncentraciji postigne 100 %-tna nepokretnost i da najniža ispitana koncentracija ne pokaže vidljiv učinak.
1.8.1.3. Uvjeti inkubacije
Temperatura treba biti u području između 18 °C i 22 °C i tijekom jednog ispitivanja ne smije odstupati više od ± 1 °C. Preporučuje se ciklus od 16 sati svjetlosti i 8 sati tame. Prihvatljiva je i potpuna tama, posebno ako je ispitivana tvar nestabilna na svjetlosti.
Ispitne posude se tijekom ispitivanja ne smiju dozračivati. Ispitivanje se obavlja bez podešavanja pH. Dafnije se za vrijeme ispitivanja ne smiju hraniti.
1.8.1.4. Trajanje
Ispitivanje traje 48 sati.
1.8.2. Promatranja
Svaku ispitnu posudu treba provjeriti na prisutnost nepokretnih dafnija 24 i 48 sati nakon početka ispitivanja (za definicije vidjeti odjeljak 1.2.). Osim nepokretnosti, treba navesti svako neuobičajeno ponašanje ili izgled.
1.8.3. Analitička mjerenja
Otopljeni kisik i pH mjere se na početku i kraju ispitivanja u kontroli odnosno kontrolama te u najvišoj koncentraciji ispitivane tvari. Koncentracija otopljenog kisika u kontrolama mora zadovoljavati kriterij valjanosti (vidjeti odjeljak 1.6.). U pravilu, pH tijekom jednog ispitivanja ne bi smio odstupati više od 1,5 jedinica. Temperatura se obično mjeri u kontrolnim posudama ili u okolnom zraku i treba je po mogućnosti neprekidno bilježiti za vrijeme ispitivanja, a barem na početku i kraju ispitivanja.
Koncentraciju ispitivane tvari treba mjeriti barem u najnižoj i najvišoj ispitnoj koncentraciji na početku i kraju ispitivanja (4). Preporučuje se da se rezultati temelje na izmjerenim koncentracijama. Ipak, ako se može dokazati da se koncentracija ispitivane tvari tijekom ukupnog trajanja ispitivanja na zadovoljavajući način održava u granicama ± 20 % nazivne ili izmjerene početne koncentracije, rezultati se mogu temeljiti i na nazivnim ili izmjerenim početnim vrijednostima.
1.9. GRANIČNO ISPITIVANJE
Granično se ispitivanje može provesti sa 100 mg/l ispitivane tvari ili do granice topljivosti ispitivane tvari u ispitnom mediju (ovisno o tome što je manje) primjenom postupaka opisanih u ovoj metodi da bi se dokazalo da je EC50 viši od te koncentracije. Granično ispitivanje treba provesti na 20 dafnija (po mogućnosti podijeljenih u četiri skupine po pet) uz isti broj životinja u kontroli odnosno kontrolama. Kod pojave nepokretnosti treba provesti potpuno istraživanje. Treba zabilježiti svako uočeno neuobičajeno ponašanje.
2. PODACI
Podatke treba sažeto prikazati u tabličnom obliku, navodeći za svaku ispitnu skupinu i kontrolu broj dafnija koji je korišten i nepokretnost pri svakom promatranju. Postotak nepokretnih životinja nakon 24 i 48 sati se grafički prikaže u ovisnosti o ispitnim koncentracijama. Podaci se analiziraju odgovarajućim statističkim metodama (npr. analiza vjerojatnosti itd.) kako bi se mogli izračunati nagibi krivulja i EC50 s granicama pouzdanosti 95 % (p = 0,05) (7)(8).
Ako se na dobivene podatke na mogu primijeniti standardne metode za izračunavanje EC50, treba koristiti najvišu koncentraciju koja ne izaziva nepokretnost i najnižu koncentraciju koja izaziva 100 %-tnu nepokretnost kao aproksimaciju za EC50 (koji se smatra geometrijskom sredinom tih dviju koncentracija).
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora sadržavati sljedeće:
ispitivana tvar:
|
— |
fizikalno stanje i relevantna fizikalno-kemijska svojstva, |
|
— |
podaci za identifikaciju kemikalije, uključujući čistoću. |
Ispitna vrsta:
|
— |
izvor i vrsta Daphnia, izvorni dobavljač (ako je poznat) i uvjeti uzgoja (uključujući izvor, vrstu i količinu hrane, učestalost hranjenja). |
Ispitni uvjeti:
|
— |
opis ispitnih posuda: vrsta posuda, volumen otopine, broj dafnija po ispitnoj posudi, broj ispitnih posuda (ponavljanja) po koncentraciji, |
|
— |
metode pripreme radnih i ispitnih otopina, uključujući korištenje otapala i dispergenata, upotrijebljene koncentracije, |
|
— |
podaci o vodi za razrjeđivanje: izvor i značajke kakvoće (pH, tvrdoća, omjer Ca/Mg, omjer Na/K, alkalitet, vodljivost itd.); sastav obrađene vode (ako se koristi), |
|
— |
uvjeti inkubacije: temperatura, intenzitet svjetlosti i ciklusi, otopljeni kisik, pH itd. |
Rezultati:
|
— |
broj i postotak dafnija koje su postale nepokretne odnosno pokazuju bilo kakve štetne učinke (uključujući neuobičajeno ponašanje) u kontrolama i svim ispitnim skupinama u svakom vremenu promatranja i priroda zapaženih učinaka, |
|
— |
rezultati i datum ispitivanja s referentnom tvari, ako su raspoloživi, |
|
— |
nazivne ispitne koncentracije i rezultat svih analiza za određivanje koncentracije ispitivane tvari u ispitnim posudama; također treba navesti iskorištenje metode i granicu određivanja, |
|
— |
sva fizikalno-kemijska mjerenja temperature, pH i otopljenog kisika tijekom ispitivanja, |
|
— |
EC50 za nepokretnost nakon 48 sati s intervalima pouzdanosti i grafovima prilagođenog modela koji je korišten za izračun, nagibi krivulja doza-odgovor i njihova standardna greška; statistički postupci primijenjeni za određivanje EC50; (ove podatke treba navesti i za nepokretnost nakon 24 sata, ako se mjeri), |
|
— |
objašnjenje svakog odstupanja od ispitne metode i je li ono utjecalo na rezultate. |
4. REFERENCE
|
(1) |
ISO 6341. (1996). Water quality – Determination of the inhibition of the mobility of Daphnia magna Straus (Cladocera, Crustacea) – Acute toxicity test. Third edition, 1996. |
|
(2) |
EPA OPPTS 850.1010. (1996). Ecological Effects Test Guidelines – Aquatic Invertebrate Acute Toxicity Test, Freshwater Daphnids. |
|
(3) |
Environment Canada. (1996) Biological test method. Acute Lethality Test Using Daphnia spp. EPS 1/RM/11. Environment Canada, Ottawa, Ontario, Canada. |
|
(4) |
Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environmental Health and Safety Publication. Series on Testing and Assessment. No 23. Paris 2000. |
|
(5) |
Commission of the European Communities. Study D8369. (1979). Inter-laboratory Test Programme concerning the study of the ecotoxicity of a chemical substance with respect to Daphnia. |
|
(6) |
OECD Guidelines for the Testing of Chemicals. Guideline 211: Daphnia magna Reproduction Test, adopted September 1998. |
|
(7) |
Stephan C.E. (1977). Methods for calculating an LC50. In Aquatic Toxicology and Hazard Evaluation (edited by F.I. Mayer and J.L. Hamelink). ASTM STP 634 – American Society for Testing and Materials. str. 65-84. |
|
(8) |
Finney D.J. (1978). Statistical Methods in Biological Assay. 3rd ed. London. Griffin, Weycombe, UK. |
Dodatak 1.
NEKA KEMIJSKA SVOJSTVA PRIHVATLJIVE VODE ZA RAZRJEĐIVANJE
|
Tvar |
Koncentracija |
|
Lebdeće čestice |
< 20 mg/l |
|
Ukupni organski ugljik |
< 2 mg/l |
|
Neionizirani amonijak |
< 1 μg/l |
|
Rezidualni klor |
< 10 μg/l |
|
Ukupni organofosforni pesticidi |
< 50 ng/l |
|
Ukupni organoklorni pesticidi plus poliklorirani bifenili |
< 50 ng/l |
|
Ukupni organski klor |
< 25 ng/l |
Dodatak 2.
PRIMJERI PRIKLADNE OBRAĐENE ISPITNE VODE
Ispitna voda ISO (1)
|
Radne otopine (pojedinačna tvar) |
Za pripremu obrađene vode u 1 litru vode (2) treba dodati sljedeće količine radnih otopina |
|
|
Tvar |
Količina koja se dodaje u 1 litru vode (2) |
|
|
Kalcijev klorid CaCl2, 2H2O |
11,76 g |
25 ml |
|
Magnezijev sulfat MgSO4, 7H2O |
4,93 g |
25 ml |
|
Natrijev bikarbonat NaHCO3 |
2,59 g |
25 ml |
|
Kalijev klorid KCl |
0,23 g |
25 ml |
Medij Elendt M7 i M4
Aklimatizacija na medij Elendt M7 i M4
Neki su laboratoriji imali problema s izravnim prenošenjem dafnija u medije M 4 i M7. Ipak, određeni je uspjeh postignut s postupnom aklimatizacijom tj. premještanjem iz vlastitog medija u 30 %-tni Elendt, zatim u 60 %-tni Elendt i zatim u 100 %-tni Elendt. Ponekad je potrebno razdoblje aklimatizacije i do jednog mjeseca.
Priprema
Element u tragovima
Najprije se pripreme odvojene radne otopine (I) pojedinih elemenata u tragovima u vodi prikladne čistoće npr. deionizirana, destilirana ili pročišćena obrnutom osmozom. Iz tih različitih radnih otopina (I) pripremi se druga pojedinačna radna otopina (II) koja sadrži sve elemente u tragovima (kombinirana otopina) tj.:
|
Radna(-e) otopina(-e) I (pojedinačna tvar) |
Količina koja se dodaje u vodu (mg/l) |
Koncentracija (u odnosu na medij M4) |
Za pripremu kombinirane radne otopine II u vodu treba dodati sljedeću količinu radne otopine I (ml/l) |
|
|
M4 |
M7 |
|||
|
H3 BO3 |
57 190 |
20000-struko |
1,0 |
0,25 |
|
MnCl2.4H2O |
7 210 |
20000-struko |
1,0 |
0,25 |
|
LiCl |
6 120 |
20000-struko |
1,0 |
0,25 |
|
RbCl |
1 420 |
20000-struko |
1,0 |
0,25 |
|
SrCl2.6H2O |
3 040 |
20000-struko |
1,0 |
0,25 |
|
NaBr |
320 |
20000-struko |
1,0 |
0,25 |
|
Na2 MoO4.2H2O |
1 230 |
20000-struko |
1,0 |
0,25 |
|
CuCl2.2H2O |
335 |
20000-struko |
1,0 |
0,25 |
|
ZnCl2 |
260 |
20000-struko |
1,0 |
1,0 |
|
CoCl2.6H2O |
200 |
20000-struko |
1,0 |
1,0 |
|
Kl |
65 |
20000-struko |
1,0 |
1,0 |
|
Na2 SeO3 |
43,8 |
20000-struko |
1,0 |
1,0 |
|
NH4 VO3 |
11,5 |
20000-struko |
1,0 |
1,0 |
|
Na2 EDTA.2H2O |
5 000 |
2000-struko |
— |
— |
|
FeSO4.7H2O |
1 991 |
2000-struko |
— |
— |
|
Otopine Na 2 EDTA i FeSO4 pripreme se odvojeno, sjedine i odmah obrade u autoklavu. |
||||
|
Pritom nastaje: |
||||
|
2 l otopine Fe-EDTA |
|
1000-struko |
20,0 |
5,0 |
Medij M4 i M7
Mediji M4 i M7 pripremaju se pomoću radne otopine II, makronutrijenata i vitamina na sljedeći način:
|
|
Količina koja se dodaje u vodu (mg/l) |
Koncentracija (u odnosu na medij M4) |
Količina radne otopine II koja se dodaje kod pripreme medija (ml/l) |
|
|
M4 |
M7 |
|||
|
Radna otopina II (kombinirani elementi u tragovima) |
|
20-struko |
50 |
50 |
|
Radne otopine makronutrijenata (pojedinačna tvar) |
|
|
|
|
|
CaCl2 · 2H2O |
293 800 |
1000-struko |
1,0 |
1,0 |
|
MgSO4 · 7H2O |
246 600 |
2000-struko |
0,5 |
0,5 |
|
KCl |
58 000 |
10000-struko |
0,1 |
0,1 |
|
NaHCO3 |
64 800 |
1000-struko |
1,0 |
1,0 |
|
Na2 SiO3 · 9H2O |
50 000 |
5000-struko |
0,2 |
0,2 |
|
NaNO3 |
2 740 |
10000-struko |
0,1 |
0,1 |
|
KH2 PO4 |
1 430 |
10000-struko |
0,1 |
0,1 |
|
K2HPO4 |
1 840 |
10000-struko |
0,1 |
0,1 |
|
Kombinirana vitaminska radna otopina |
— |
10000-struko |
0,1 |
0,1 |
|
Kombinirana vitaminska radna otopina priprema se dodavanjem 3 vitamina u 1 litru vode, kako je ovdje prikazano: |
||||
|
Tiamin-hidroklorid |
750 |
10000-struko |
|
|
|
Cijanokobalamin (B12) |
10 |
10000-struko |
|
|
|
Biotin |
7,5 |
10000-struko |
|
|
Kombinirana vitaminska radna otopina čuva se zamrznuta u malim alikvotima. Vitamini se dodaju u medij neposredno prije uporabe.
|
N.B. |
: |
Da bi se izbjeglo taloženje soli kod pripreme kompletnog medija, alikvote radnih otopina treba dodati u oko 500 – 800 ml deionizirane vode i zatim nadopuniti do 1 litre. |
|
N. B. |
: |
Medij M4 prvi se puta navodi u Elendt, B. P. (1990). Selenium deficiency in crustacea; an ultrastructual approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, str. 25-33. |
C.3. TEST INHIBICIJE RASTA ALGI
1. METODA
1.1. UVOD
Svrha ovog testa je odrediti učinke tvari na rast vrsta jednostaničnih zelenih algi. Relativno kratkim (72 sata) ispitivanjima mogu se ocijeniti učinci kroz nekoliko generacija. Ova se metoda može prilagoditi za primjenu na nekoliko vrsta jednostaničnih algi, u tom slučaju izvješću o ispitivanju treba priložiti opis primijenjene metode.
Ova se metoda najlakše primjenjuje kod tvari topljivih u vodi za koje se može pretpostaviti da će u ispitnim uvjetima ostati u vodi.
Ona se ne može koristiti kod tvari koje izravno ometaju mjerenje rasta algi.
Bilo bi poželjno da prije početka ispitivanja budu, u mjeri u kojoj je to moguće, raspoloživi podaci o topljivosti u vodi, tlaku pare, kemijskoj stabilnosti, konstantama disocijacije i biorazgradivosti tvari.
Kod planiranja ispitivanja i tumačenja rezultata treba uzeti u obzir i dodatne informacije (npr. stukturna formula, stupanj čistoće, vrsta i postotak značajnih nečistoća, prisutnost i količina dodataka (aditiva) i podjelni koeficijent n-oktanol/voda).
1.2. DEFINICIJE I JEDINICE
Gustoća stanica: broj stanica po milimetru.
Rast: povećanje gustoće stanica tijekom ispitnog razdoblja.
Brzina rasta: povećanje gustoće stanica po jedinici vremena.
EC50: kod ove metode, koncentracija ispitivane tvari koja rezultira 50 %-tnim smanjenjem rasta (EbC50) ili brzine rasta (ErC50) u odnosu na kontrolu.
NOEC (najviša koncentracija bez vidljivog učinka): kod ove metode, najviša ispitana koncentracija kod koje nije uočena značajna inhibicija rasta u odnosu na kontrolu.
Sve koncentracije ispitivane tvari navode se kao omjer masa/volumen (miligrami po litri). One se također mogu izraziti i kao maseni udjeli (mg./kg-1).
1.3. REFERENTNE TVARI
Ispitivanjem referentne tvari može se dokazati da se osjetljivost ispitivane vrste nije značajno promijenila u uvjetima laboratorijskog ispitivanja.
Ako se koristi referentna tvar, rezultate treba navesti u izvješću o ispitivanju. Kao referentna tvar može se koristiti kalijev dikromat, ali njegova boja može utjecati na kakvoću i intenzitet svjetlosti raspoložive stanicama, a i na spektrofotometrijska određivanja, ako se koriste. Kalijev dikromat je korišten u međunarodnom međulaboratorijskom ispitivanju (vidjeti literaturu (3) i Dodatak 2.).
1.4. NAČELO ISPITNE METODE
Granično ispitivanje se može provesti sa 100 mg po litri da bi se dokazalo da je LC50 viši od te koncentracije.
Eksponencijalno rastuće kulture odabranih zelenih algi izlažu se različitim koncentracijama ispitivane tvari kroz nekoliko generacija u definiranim uvjetima.
Ispitne otopine se inkubiraju 72 sata, tijekom kojih se barem svaka 24 sata mjeri gustoća stanica u svakoj otopini. Odredi se inhibicija rasta u odnosu na kontrolnu kulturu.
1.5. KRITERIJI KAKVOĆE
Kriteriji kakvoće vrijede za granično ispitivanje i za potpunu ispitnu metodu.
Gustoća stanica u kontrolnim kulturama treba se povećati najmanje za faktor 16 u tri dana.
Koncentracije ispitivane tvari se u čitavom vremenu koje odgovara trajanju ispitivanja moraju održavati na razini 80 % početnih koncentracija.
Za tvari koje se lako otapaju u ispitnom mediju dajući stabilne otopine, tj. tvari koje neće u značajnoj mjeri ishlapiti, razgraditi se, hidrolizirati ili adsorbirati, može se uzeti da je početna koncentracija istovjetna nazivnoj koncentraciji. Treba dokazati da su koncentracije tijekom ispitivanja u svakom trenutku bile na predviđenoj razini i da su zadovoljeni kriteriji kakvoće.
Kod tvari koje:
|
i. |
su slabo topljive u ispitnom mediju; ili |
|
ii. |
mogu tvoriti stabilne emulzije ili disperzije; ili |
|
iii. |
nisu stabilne u vodenim otopinama, |
uzet će se da je početna koncentracija koncentracija izmjerena na početku ispitivanja. Koncentracija se određuje nakon razdoblja uravnoteženja.
U svakom od ovih slučajeva za vrijeme ispitivanja treba provesti dodatna mjerenja kako bi se potvrdile stvarne koncentracije izlaganja odnosno usklađenost s kriterijima kakvoće.
Poznato je da se za vrijeme ispitivanja u biomasu algi mogu unijeti značajne količine ispitivane tvari. Stoga, da bi se dokazala usklađenost s gornjim kriterijima kakvoće, treba uzeti u obzir količinu tvari unesenu u biomasu algi i količinu tvari u otopini (odnosno, ako to nije tehnički izvedivo, izmjerenu u vodenom stupcu). Međutim, budući da određivanje koncentracije tvari u biomasi algi može predstavljati značajan tehnički problem, usklađenost s kriterijima kakvoće može se dokazati uvođenjem dodatne ispitne posude s najvišom koncentracijom tvari, ali bez algi, i mjerenjem koncentracija u otopini (odnosno, ako to nije tehnički izvedivo, u vodenom stupcu) na početku i na kraju razdoblja ispitivanja.
1.6. OPIS ISPITNOG POSTUPKA
1.6.1. Reagensi
1.6.1.1. Otopine ispitivanih tvari
Radne otopine potrebne jakosti pripremaju se otapanjem tvari u deioniziranoj vodi odnosno vodi u skladu s 1.6.1.2.
Odabrane ispitne koncentracije pripremaju se dodavanjem prikladnih alikvota u predkulture algi (vidjeti Dodatak 1.).
Tvari u pravilu treba ispitivati samo do granice topljivosti. Kod nekih tvari (npr. tvari koje imaju nisku topljivost u vodi ili visoki Pow i tvari koje u vodi ne tvore pravu otopinu već stabilnu disperziju) prihvatljivo je korištenje ispitne koncentracije iznad granice topljivosti tvari kako bi se dobila najviša topljiva koncentracija koja je stabilna. Ipak, važno je da ta koncentracija inače ne remeti ispitni sustav (npr. film tvari na površini vode koji sprečava oksigenaciju vode itd.).
Kao pomoć u pripremi radnih otopina tvari niske topljivosti u vodi odnosno da bi se olakšalo dispergiranje tih tvari u ispitnom mediju, može se koristiti ultrazvučno raspršivanje, organska otapala, emulgatori ili dispergenti. Ako se koriste ovakve pomoćne tvari, sve ispitne koncentracije trebaju sadržavati istu količinu pomoćne tvari i treba uvesti dodatne kontrole i izložiti ih istoj koncentraciji pomoćne tvari kao ispitni niz. Koncentracija tih pomoćnih tvari treba biti što je moguće niža, a u svakom slučaju ne smije prelaziti 100 mg po litri ispitnog medija.
Ispitivanje treba provesti bez podešavanja pH vrijednosti. Ako ima naznaka da je došlo do značajne promjene pH, savjetuje se da se ispitivanje ponovi uz podešavanje pH i navedu rezultati. U tom slučaju pH vrijednost radne otopine treba podesiti na pH vrijednost vode za razrjeđivanje, osim ako postoje posebni razlozi da se to ne učini. Pritom treba po mogućnosti koristiti HCl i NaOH. Podešavanje pH vrijednosti treba obaviti na način da ne dođe do značajne promjene koncentracije ispitivane tvari u radnoj otopini. Ako podešavanje izazove kemijsku reakciju ili fizičko taloženje ispitivanog spoja, to treba navesti u izvješću o ispitivanju.
1.6.1.2. Ispitni medij
Voda treba biti kvalitetna destilirana voda ili deionizirana voda vodljivosti manje od 5 μS.cm-1. Oprema za destilaciju vode ne smije sadržavati bakrene dijelove.
Preporučuje se sljedeći ispitni medij.
Pripreme se četiri radne otopine u skladu s tablicom u nastavku. Radne otopine se steriliziraju membranskom filtracijom ili obradom u autoklavu i pohrane u mraku na 4 °C. Radna otopina br. 4 sterilizira se samo membranskom filtracijom. Radne otopine se razrijede kako bi se postigle konačne koncentracije nutrijenata u ispitnim otopinama.
|
Nutrijent |
Koncentracija u radnoj otopini |
Konačna koncentracija u ispitnoj otopini |
|
Radna otopina 1: makronutrijenti |
||
|
NH4Cl |
1,5 g/l |
15 mg/l |
|
MgCl2.6H2O |
1,2 g/l |
12 mg/l |
|
CaCl2.2H2O |
1,8 g/l |
18 mg/l |
|
MgSO4.7H2O |
1,5 g/l |
15 mg/l |
|
KH2PO4 |
0,16 g/l |
1,6 mg/l |
|
Radna otopina 2: Fe-EDTA |
||
|
FeCl3.6H2O |
80 mg/l |
0,08 mg/l |
|
Na2EDTA.2H2O |
100 mg/l |
0,1 mg/l |
|
Radna otopina 3: elementi u tragovima |
||
|
H3BO3 |
185 mg/l |
0,185 mg/l |
|
MnCl2.4H2O |
415 mg/l |
0,415 mg/l |
|
ZnCl2 |
3 mg/l |
3 × 10-3 mg/l |
|
CoCl2.6H2O |
1,5 mg/l |
1,5 × 10-3 mg/l |
|
CuCl2.2H2O |
0,01 mg/l |
10-5 mg/l |
|
Na2MoO4.2H2O |
7 mg/l |
7 × 10-3 mg/l |
|
Radna otopina 4: NaHCO3 |
||
|
NaHCO3 |
50 g/l |
50 mg/l |
pH medija nakon ekvilibracije sa zrakom je približno 8.
1.6.2. Aparatura
|
— |
uobičajena laboratorijska oprema, |
|
— |
ispitne tikvice prikladnog volumena (npr. ako je volumen ispitne otopine 100 ml, prikladne su stožaste tikvice od 250 ml). Sve ispitne tikvice trebaju biti jednake s obzirom na materijal i dimenzije, |
|
— |
inkubator za uzgoj: ormar ili komora u kojoj se može održavati temperatura u području od 21 °C i 25 °C uz toleranciju ± 2 °C i osigurati neprekidno ravnomjerno osvjetljenje u spektralnom području od 400 do 700 nm. Ako alge u kontrolnim kulturama dosegnu preporučene brzine rasta, može se pretpostaviti da su uvjeti za rast bili zadovoljavajući, uključujući intenzitet svjetlosti. Za ispitne tekućine prosječne koncentracije preporučuje se intenzitet svjetlosti u području 60 do 120 μΕ.m-2.s-1 (35 do 70 × 1018 fotona.m-2.s-1), mjeren u području od 400 do 700 nm uz pomoć odgovarajućeg detektora. Kod instrumenata za mjerenje svjetlosti baždarenih u luksima prihvatljivo je istovjetno područje od 6 000 do 10 000 lx. Ovaj intenzitet svjetlosti može se postići primjenom četiri do sedam univerzalno bijelih fluorescentnih svjetiljki od 30 W (temperatura boje približno 4 300 K) na udaljenosti od 0,35 m od kulture algi. |
|
— |
Gustoću stanica treba mjeriti metodom izravnog brojenja živih stanica, npr. mikroskop s komorama za brojenje. Ipak, mogu se koristiti i drugi postupci (fotometrija, turbidimetrija …) ako su dovoljno osjetljivi i ako je dokazana dovoljno dobra korelacija s gustoćom stanica. |
1.6.3. Ispitni organizmi
Preporučuje se korištenje brzorastućih vrsta zelenih algi koje su prikladne za uzgoj i ispitivanje. Prednost se daje sljedećim vrstama:
|
— |
Selenastrum capricornutum, npr. ATCC 22662 ili CCAP 278/4, |
|
— |
Scenedesmus subspicatus, npr. 86.81 SAG. |
Napomena:
|
ATCC |
= |
American Type Culture Collection (S.A.D.) |
|
CCAP |
= |
Culture Centre of Algae and Protozoa (U.K.) |
|
SAG |
= |
Sammlung Algenkulturen (Göttingen, S.R.NJ.) |
Ako se koriste druge vrste, treba navesti soj.
1.6.4. Ispitni postupak
Raspon koncentracija unutar kojega mogu nastupiti učinci određuje se na temelju rezultata ispitivanja za određivanje raspona.
Dva parametra rasta (biomasa i brzina rasta) mogu dati vrlo različite vrijednosti inhibicije rasta: kod ispitivanja za određivanje raspona treba koristiti oba parametra kako bi se dobio geometrijski niz koncentracija koji omogućuje procjenu EbC50 i ErC50.
Početna gustoća stanica
Preporučuje se da početna gustoća stanica u ispitnim kulturama bude približno 104 stanica/ml za Selenastrum capricornutum i Scenedesmus subspicatus. Ako se koriste druge vrste, biomasa treba biti usporediva.
Koncentracije ispivane tvari
Za ispitivanje treba pripremiti najmanje pet koncentracija u geometrijskom nizu s omjerom koncentracija ne višim od 2,2. Najniža ispitana koncentracija ne smije imati vidljivi učinak na rast algi. Najviša ispitana koncentracija trebala bi usporiti rast barem za 50 % u odnosu na kontrolu, a po mogućnosti ga i potpuno zaustaviti.
Ponavljanja i kontrole
Planom ispitivanja treba predvidjeti tri ponavljanja pri svakoj ispitnoj koncentraciji. Osim toga, potrebne su tri kontrole bez ispitivane tvari i, prema potrebi, tri kontrole s pomoćnom tvari. U opravdanom slučaju plan ispitivanja može se izmijeniti na način da se poveća broj koncentracija i smanji broj ponavljanja po koncentraciji.
Provođenje ispitivanja
Ispitne kulture koje sadrže željene koncentracije ispitivane tvari i željenu količinu inokuluma algi pripremaju se dodavanjem alikvota radnih otopina ispitivane tvari u prikladnu količinu predkultura algi (vidjeti Dodatak 1.).
Tikvice s kulturom se protresu i stave u inkubator. Stanice algi drže se u suspenziji tresenjem, miješanjem ili upuhivanjem mjehurića zraka kako bi se poboljšala izmjena plinova i smanjilo kolebanje pH vrijednosti u ispitnim otopinama. Kulture treba održavati na temperaturi između 21 i 25 °C uz toleranciju ± 2 °C.
Gustoća stanica se u svim tikvicama određuje barem nakon 24, 48 i 72 sati od početka ispitivanja. Ako se za mjerenje gustoće stanica ne koristi metoda izravnog brojenja, za određivanje temeljne vrijednosti koristi se filtrirani medij algi koji sadrži odgovarajuću koncentraciju ispitivane kemikalije.
pH se mjeri na početku ispitivanja i nakon 72 sata.
pH u kontrolama općenito ne bi smio odstupati više od 1,5 jedinica tijekom ispitivanja.
Ispitivanje hlapljivih tvari
Još uvijek ne postoji opće prihvaćen način ispitivanja hlapljivih tvari. Ako je poznato da je tvar sklona isparavanju, mogu se koristiti zatvorene ispitne tikvice s povećanim plinskim prostorom. Kod izračunavanja volumena plinskog prostora kod zatvorenih tikvica treba uzeti u obzir mogućnost pomanjkanja CO2. Postoje prijedlozi inačica ove metode (vidjeti literaturu (4)).
Treba pokušati odrediti količinu tvari koja ostaje u otopini; kod tumačenja rezultata ispitivanja s hlapljivim kemikalijama u zatvorenim sustavima potreban je maksimalni oprez.
Granično ispitivanje
Granično ispitivanje može se provesti sa 100 mg po litri primjenom postupaka opisanih u ovoj metodi da bi se dokazalo da je EC50 viši od te koncentracije.
Ako se zbog prirode tvari ne može postići koncentracija od 100 mg po litri u ispitnoj vodi, granično ispitivanje se provodi s koncentracijom koja je jednaka topljivosti tvari (ili najvišoj koncentraciji koja tvori stabilnu disperziju) u mediju koji se koristi (vidjeti također točku 1.6.1.1.).
Granično ispitivanje treba provesti barem u tri ponavljanja, uz isti broj kontrola. Kod graničnog ispitivanja treba koristiti oba parametra rasta (biomasa i brzina rasta).
Ako se kod graničnog ispitivanja utvrdi srednje smanjenje biomase ili brzine rasta za 25 % ili više u usporedbi s kontrolom, treba provesti potpuno ispitivanje.
2. PODACI I VREDNOVANJE
Izmjerena gustoća stanica u ispitnim kulturama i kontrolama prikazuje se u tabličnom obliku zajedno s koncentracijama ispitivane tvari i vremenima mjerenja. Srednju vrijednost gustoće stanica za svaku koncentraciju ispitivane tvari i za kontrole treba grafički prikazati u ovisnosti o vremenu (0-72 sata) da bi se dobile krivulje rasta.
Za određivanje odnosa koncentracija/učinak koriste se dva pristupa u nastavku. Neke tvari mogu u malim koncentracijama stimulirati rast. Treba uzeti u obzir samo točke podataka koje pokazuju inhibiciju između 0 i 100 %.
2.1. USPOREĐIVANJE PROSTORA ISPOD KRIVULJA RASTA
Prostor između krivulja rasta i vodoravne crte N = N0 može se izračunati pomoću sljedeće formule:
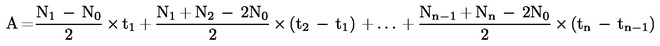
gdje je:
|
A |
= |
prostor |
|
No |
= |
broj stanica/ml u vremenu t0 (početak ispitivanja) |
|
N1 |
= |
izmjereni broj stanica/ml u t1 |
|
Nn |
= |
izmjereni broj stanica/ml u vremenu |
|
t1 |
= |
vrijeme prvog mjerenja nakon početka ispitivanja |
|
tn |
= |
vrijeme ntog mjerenja nakon početka ispitivanja |
|
n |
= |
broj mjerenja nakon početka ispitivanja |
Postotak inhibicije rasta stanica pri svakoj koncentraciji ispitivane tvari (IA) izračunava se pomoću sljedeće formule:
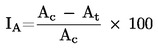
gdje je:
|
Ac |
= |
prostor između kontrolne krivulje rasta i vodoravne crte N = No |
|
At |
= |
prostor između krivulje rasta pri koncentraciji t i vodoravne crte N = No |
|
IA |
= |
vrijednosti se grafički prikazuju na polulogaritamskom papiru ili polulogaritamskom papiru vjerojatnosti u ovisnosti o odgovarajućim koncentracijama. Ako se prikazuju na papiru vjerojatnosti, točkama se prilagođava pravac prostim okom ili izračunom regresije |
EC50 se procjenjuje iz regresijskog pravca očitavanjem koncentracije koja odgovara 50 %-tnoj inhibiciji (IA = 50 %). Da bi se nedvosmisleno označilo da je vrijednost dobivena ovom računskom metodom, predlaže se korištenje simbola EbC50. Bitno je da se uz EbC50 navede odgovarajuće vrijeme izlaganja npr. EbC50 (0-72 h).
2.2. USPOREĐIVANJE BRZINA RASTA
Prosječna specifična brzina rasta (μ) za eksponencijalno rastuće kulture izračunava se kao

gdje je to vrijeme na početku ispitivanja.
Druga mogućnost je da se prosječna specifična brzina rasta izvede iz nagiba regresijskog pravca grafičkog prikaza ln N u ovisnosti o vremenu.
Postotak inhibicije specifične brzine rasta pri pojedinoj koncentraciji ispitivane tvari (Iμt) izračunava se pomoću sljedeće formule:

gdje je:
|
μc |
= |
srednja specifična brzina rasta u kontroli |
|
μt |
= |
srednja specifična brzina rasta za ispitnu koncentraciju t |
Postotak smanjenja prosječne specifične brzine rasta pri svakoj koncentraciji tvari u odnosu na kontrolnu vrijednost prikaže se grafički u ovisnosti o logaritmu koncentracije. S dobivenog se grafa može očitati EC50. Za nedvosmisleno označivanje EC50 dobivenog ovom metodom predlaže se korištenje simbola ErC50. Potrebno je navesti vremena mjerenja npr. ako se vrijednost odnosi na vremena 0 i 72 sata, simbol postaje ErC50 (0-72 h).
Napomena: Specifična brzina rasta je logaritamski izraz i male promjene brzine rasta mogu rezultirati velikim promjenama biomase. Stoga vrijednosti EbC i ErC nisu numerički usporedive.
2.3. IZRAČUNAVANJE NOEC-a
Najviša koncentracija bez vidljivog učinka određuje se prikladnim statističkim postupkom za višestruku usporedbu uzoraka (npr. analiza varijance i Dunnettov test), koristeći vrijednosti prostora ispod krivulja rasta A (vidjeti točku 2.1.) ili specifične brzine rasta μ (vidjeti točku 2.2.) iz pojedinih ponavljanja.
3. IZVJEŠĆIVANJE
Izvješće o ispitivanju po mogućnosti sadrži sljedeće informacije:
|
— |
ispitivana tvar: podaci za identifikaciju kemikalije, |
|
— |
ispitni organizmi: podrijetlo, laboratorijska kultura, broj soja, način kultiviranja, |
|
— |
ispitni uvjeti:
|
|
— |
rezultati:
|
4. REFERENCE
|
(1) |
OECD, Paris, 1981, Test Guideline 201, Decision of the Council C(81) 30 Final. |
|
(2) |
Umweltbundesamt, Berlin, 1984, Verfahrensvorschlag „Hemmung der Zellvermehrung bei der Grünalge Scenedesmus subspicatus”, in: Rudolph/Boje: bkotoxikologie, ecomed, Landsberg, 1986. |
|
(3) |
ISO 8692 – Water quality – Fresh water algal growth inhibition test with Scenedesmus subspicatus and Selenastrum capricornutum. |
|
(4) |
S.Galassi and M.Vighi – Chemosphere, 1981, vol.10, 1123-1126. |
Dodatak 1.
Primjer postupka za uzgoj kulture algi
Opće napomene
Uzgoj kultura u skladu s ovim postupkom provodi se radi dobivanja kultura algi za toksikološka ispitivanja.
Treba koristiti prikladne metode kako kulture algi ne bi bile inficirane bakterijama (ISO 4833). Aksenične kulture su poželjne, ali su u svakom slučaju nužne kulture koje sadrže samo jednu vrstu algi.
Sve postupke treba provoditi u sterilnim uvjetima kako bi se izbjegla kontaminacija bakterijama i drugim algama. Kontaminarane kulture treba odbaciti.
Postupci za dobivanje kultura algi
Priprema hranjivih otopina (medija):
Medij se može pripremiti razrjeđivanjem koncentriranih radnih otopina nutrijenata. Kod krutih medija dodaje se 0,8 % agara. Medij koji se koristi mora biti sterilan. Sterilizacija u autoklavu može dovesti do gubitka NH3.
Radna kultura:
Radne kulture su male kulture algi koje se redovito prenose u svježi medij i koriste kao polazni ispitni materijal. Ako se kulture ne koriste redovito, one se nanose na kosi agar. Kulture se prenose u svježi medij najmanje jedanput u dva mjeseca.
Radne se kulture uzgajaju u stožastim tikvicama koje sadrže odgovarajući medij (oko 100 ml). Kad se alge inkubiraju na 20 °C uz neprekidno osvjetljenje, potrebno je tjedno prenošenje.
Kod prenošenja se određena količina „stare” kulture prenese sterilnim pipetama u tikvicu sa svježim medijem tako da kod brzorastućih vrsta početna koncentracija bude oko 100 puta niža nego u staroj kulturi.
Brzina rasta vrste može se odrediti iz krivulje rasta. Ako je ona poznata, moguće je procijeniti gustoću pri kojoj kulturu treba prenijeti u novi medij. To se mora učiniti prije nego što kultura dosegne fazu odumiranja.
Predkultura:
Predkultura treba dati određenu količinu algi koje su prikladne za inokulaciju ispitnih kultura. Predkultura se inkubira u uvjetima ispitivanja i koristi dok još eksponencijalno raste, u pravilu nakon razdoblja inkubacije od oko tri dana. Kulture algi koje sadrže deformirane ili abnormalne stanice treba odbaciti.
Dodatak 2.
Norma ISO 8692 – Kakvoća vode – Test inhibicije rasta slatkovodnih algi Scenedesmus subspicatus i Selenastrum capricornutum navodi sljedeće rezultate međulaboratorijskog ispitivanja s kalijevim dikromatom u kojemu je sudjelovalo 16 laboratorija:
|
|
Srednje vrijednosti (mg/l) |
Raspon (mg/l) |
|
ErC50 (0-72 h) |
0,84 |
0,60 do 1,03 |
|
EbC50 (0-72 h) |
0,53 |
0,20 do 0,75 |
C.4. ODREĐIVANJE „LAKE” BIORAZGRADIVOSTI
I. DIO OPĆENITO
I.1. UVOD
Opisano je šest ispitnih metoda koje omogućuju pretraživanje kemikalija na laku biorazgradivost u aerobnom vodenom mediju:
|
(a) |
test opadanja otopljenog organskog ugljika (DOC) (metoda C.4.-A); |
|
(b) |
izmijenjeni test pretraživanja OECD – opadanje DOC-a (metoda C.4.-B); |
|
(c) |
test razvijanja ugljikovog dioksida (CO2) (izmijenjeni Sturmov test) (metoda C.4.-C); |
|
(d) |
manometrijsko-respirometrijski test (metoda C.4.-D); |
|
(e) |
test sa zatvorenim bocama (metoda C.4.-E); |
|
(f) |
MITI (Ministry of International Trade and Industry – Japan) (metoda C.4.-F) |
U dijelu I. metode nalaze se opće napomene za svih šest testova. Specifičnosti pojedinih metoda navedene su u dijelovima od II. do VII. Dodaci sadrže definicije, formule i smjernice.
Međulaboratorijsko poredbeno ispitivanje OECD-a iz 1988. pokazalo je da metode daju dosljedne rezultate. Ipak, određenoj se metodi može dati prednost ovisno o fizikalnim svojstvima tvari koja se ispituje.
I.2. ODABIR ODGOVARAJUĆE METODE
Informacije o topljivosti kemikalije, tlaku pare i adsorpcijskim svojstvima ključne su za odabir najprikladnije metode. Za izračunavanje teoretskih vrijednosti i/ili provjeru izmjerenih vrijednosti parametara npr. TPK, ThCO2, DOC, TOC, KPK treba biti poznata kemijska struktura ili formula (vidjeti dodatke 1. i 2.).
Ispitivane kemikalije koje su topljive u vodi do najmanje 100 mg/l mogu se ocijeniti svim metodama pod uvjetom da nisu hlapljive i nisu adsorptivne. Prikladne metode za kemikalije koje su slabo topljive u vodi, hlapljive ili adsorptivne navedene su u tablici 1. Postupanje s kemikalijama koje su slabo topljive u vodi i hlapljivim kemikalijama opisan je u Dodatku 3. Umjereno hlapljive kemikalije mogu se ispitivati metodom opadanja DOC-a ako u ispitnim posudama (koje moraju biti dobro začepljene) ima dovoljno plinskog prostora. U tom slučaju treba predvidjeti abiotičku kontrolu da bi se mogli uzeti u obzir mogući fizički gubici.
Tablica 1.:
Primjenljivost ispitnih metoda
|
Test |
Analitička metoda |
Prikladnost za tvari koje su: |
||
|
slabo topljive |
hlapljive |
adsorptivne |
||
|
Test opadanja DOC-a |
Otopljeni organski ugljik |
— |
— |
+/– |
|
Izmijenjeni test pretraživanja OECD |
Otopljeni organski ugljik |
— |
— |
+/– |
|
Test razvijanja CO2 |
Respirometrija: razvijanje CO2 |
+ |
— |
+ |
|
Manometrijsko-respirometrijski test |
Manometrijska respirometrija: potrošnja kisika |
+ |
+/– |
+ |
|
Test sa zatvorenim bocama |
Respirometrija: otopljeni kisik |
+/– |
+ |
+ |
|
MITI |
Respirometrija: potrošnja kisika |
+ |
+/– |
+ |
Za tumačenje dobivenih rezultata potrebne su informacije o čistoći ili relativnim udjelima glavnih komponenti ispitivane tvari, posebno ako su vrijednosti niske ili granične.
Informacije o toksičnosti ispitivane kemikalije za bakterije (Dodatak 4.) mogu biti vrlo korisne za odabir prikladnih ispitnih koncentracija te mogu biti ključne za pravilno tumačenje niskih vrijednosti biorazgradnje.
I.3. REFERENTNE TVARI
Za provjeru postupka koriste se referentne kemikalije koje ispunjavaju kriterije za laku biorazgradivost; prikladnu tikvicu s referentnom tvari treba postaviti paralelno uz obični ispitni niz.
Prikladne kemikalije su anilin (svježe destiliran), natrijev acetat i natrijev benzoat. Sve se te referentne kemikalije razgrađuju u ovim postupcima, čak i bez dodavanja inokuluma.
Predloženo je da se pronađe referentna kemikalija koja je lako biorazgradiva, ali ipak zahtijeva dodavanje inokuluma. Predložen je kalijev hidrogenftalat; međutim, da bi on bio prihvaćen kao referentna tvar, potrebno je pribaviti još dokaza.
Spojevi koji sadrže dušik mogu u respirometrijskim ispitivanjima utjecati na potrošnju kisika nitrifikacijom (vidjeti dodatke 2. i 5.).
I.4. NAČELO ISPITNIH METODA
Otopina ili suspenzija ispitivane tvari u mineralnom mediju se inokulira i inkubira u aerobnim uvjetima u mraku ili na difuznoj svjetlosti. Količina DOC-a u ispitnoj otopini koja potječe od inokuluma treba biti što manja u odnosu na količinu DOC-a koja potječe od ispitivane tvari. Kako bi se uzela u obzir endogena aktivnost inokuluma, izvode se paralelne slijepe probe s inokulumom bez ispitivane tvari, iako endogena aktivnost stanica u prisutnosti tvari neće točno odgovarati aktivnosti u endogenoj kontroli. Paralelno se izvodi ispitivanje s referentnom tvari radi provjere postupaka.
Općenito, razgradnja se prati određivanjem parametara kao što su DOC, nastajanje CO2 i potrošnja kisika, uz provedbu mjerenja u dovoljno učestalim razmacima da se može odrediti početak i kraj biorazgradnje. Automatski spirometri omogućuju neprekidno mjerenje. DOC se ponekad mjeri dodatno uz neki drugi parametar, ali se to obično čini samo na početku i na kraju ispitivanja. Za ocjenjivanje primarne razgradnje ispitivane tvari i određivanje koncentracije nastalih intermedijera može se koristiti i specifična kemijska analiza (obvezatno kod testa MITI).
Ispitivanje u pravilu traje 28 dana. Ipak, ispitivanje se može završiti i prije 28. dana tj. čim krivulja biorazgradnje dosegne plato, na temelju najmanje tri određivanja. Ispitivanja se mogu nastaviti i nakon 28. dana ako krivulja pokazuje da je biorazgradnja započela, ali 28. dana nije postignut plato.
I.5. KRITERIJI KAKVOĆE
I.5.1. Obnovljivost
Zbog prirode biorazgradnje i miješanih populacija bakterija koje se koriste kao inokulumi određivanja treba provoditi najmanje dvostruko.
Iskustva pokazuju da što je veća koncentracija mikroorganizama koji se na početku dodaju u ispitni medij, to su manje razlike između višestrukih određivanja. Osim toga, prstenasti testovi su pokazali da mogu postojati velike razlike između rezultata različitih laboratorija, ali se kod spojeva koji se lako biološki razgrađuju uglavnom postiže dobra podudarnost.
I.5.2. Valjanost ispitivanja
Ispitivanje se smatra valjanim ako su razlike između krajnjih vrijednosti višestrukih određivanja opadanja ispitivane kemikalije na platou, na kraju ispitivanja odnosno na kraju roka od 10 dana manje od 20 % i ako je postotak razgradnje referentne tvari do 14. dana dosegao razinu za laku biorazgradivost. Ako bilo koji od ovih uvjeta nije zadovoljen, ispitivanje treba ponoviti. Zbog strogosti metoda niske vrijednosti ne znače nužno da ispitivana tvar nije biorazgradiva u okolišnim uvjetima, ali ukazuju na to da su za utvrđivanje biorazgradivosti potrebna dodatna ispitivanja.
Ako je u toksikološkom testu s ispitivanom tvari i referentnom kemikalijom razgradnja u 14 dana niža od 35 % (na temelju DOC-a) ili niža od 25 % (na temelju TPK ili ThCO2), može se pretpostaviti da ispitivane kemikalije imaju inhibitorni učinak (vidjeti također Dodatak 4.). Niz ispitivanja treba ponoviti, po mogućnosti s nižom koncentracijom ispitivane kemikalije i/ili višom koncentracijom inokuluma, ali ne iznad 30 mg krute tvari po litri.
I.6. OPĆI POSTUPCI I PRIPREME
Opći uvjeti ispitivanja sažeto su prikazani u tablici 2. Aparatura i drugi pokusni uvjeti koji su specifični za pojedine testove opisani su u nastavku u pripadajućim poglavljima.
Tablica 2.
Ispitni uvjeti
|
Test |
Test opadanja DOC-a |
Test razvijanja CO2 |
Manometrijsko- respirometrijski test |
Izmijenjeni test pretraživanja OECD |
Test sa zatvorenim bocama |
MITI (I) |
|||||||||
|
Koncentracija ispitivane tvari |
|
|
|
|
|
|
|||||||||
|
u mg/l |
|
|
100 |
|
2 – 10 |
100 |
|||||||||
|
mg DOC/l |
10 – 40 |
10 – 20 |
|
10 – 40 |
|
|
|||||||||
|
mg TPK/l |
|
|
50 – 100 |
|
5 – 10 |
|
|||||||||
|
Koncentracija inokuluma (u stanicama/l, približno) |
≤ 30 mg/l SK ili ≤ 100 ml otpadne vode/l (107 – 108) |
0,5 ml sekundarne otpadne vode/l (105) |
≤ 5 ml otpadne vode/l (104 – 106) |
30 mg/l SK (107 – 108) |
|||||||||||
|
Koncentracija elemenata u mineralnom mediju (u mg/l): |
|
|
|
|
|
|
|||||||||
|
P |
116 |
11,6 |
29 |
||||||||||||
|
N |
1,3 |
0,13 |
1,3 |
||||||||||||
|
Na |
86 |
8,6 |
17,2 |
||||||||||||
|
K |
122 |
12,2 |
36,5 |
||||||||||||
|
Mg |
2,2 |
2,2 |
6,6 |
||||||||||||
|
Ca |
9,9 |
9,9 |
29,7 |
||||||||||||
|
Fe |
0,05-0,1 |
0,05-0,1 |
0,15 |
||||||||||||
|
pH |
7,4 ±0,2 |
po mogućnosti 7,0 |
|||||||||||||
|
Temperatura |
22 ± 2 °C |
25 ± 1 °C |
|||||||||||||
|
|
|
|||||||||||||
I.6.1. Voda za razrjeđivanje
Koristi se deionizirana ili destilirana voda koja ne sadrži inhibitorne koncentracije toksičnih tvari (npr. ioni Cu ++). Ona ne smije sadržavati više od 10 % organskog ugljika uvedenog putem ispitivanog materijala. Visoka čistoća ispitne vode nužna je kako bi se izbjegle visoke vrijednosti slijepih proba. Onečišćenje može proizlaziti iz unutarnjih nečistoća, ali i ionskih izmjenjivačkih smola te liziranog materijala iz bakterija i algi. Za svaki niz ispitivanja treba koristiti vodu iz iste šarže, koja je prethodno provjerena analizom DOC-a. Ova provjera nije nužna kod testa sa zatvorenim bocama, ali potrošnja kisika vode mora biti niska.
I.6.2. Radne otopine mineralnih komponenti
Za pripremu ispitnih otopina potrebno je pripremiti radne otopine s odgovarajućim koncentracijama mineralnih komponenti. Radne otopine u nastavku mogu se koristiti (uz različite faktore razrjeđenja) za test opadanja DOC-a, izmijenjeni test pretraživanja OECD, test razvijanja CO2, manometrijsko-respirometrijski test i test sa zatvorenim bocama.
Faktori razrjeđenja i posebna priprema mineralnog medija za test MITI nalaze se u poglavljima koja se odnose na pojedine testove.
Radne otopine:
Pripreme se sljedeće radne otopine s analitički čistim reagensima.
|
(a) |
monokalijev dihidrogen ortofosfat, KH2PO4 |
8,50 g |
|
dikalijev monohidrogen ortofosfat, K2HPO4 |
21,75 g |
|
|
dinatrijev monohidrogen ortofosfat dihidrat, Na2HPO4. 2 H2O |
33,40 g |
|
|
amonijev klorid, NH4Cl |
0,50 g |
|
|
Otopiti u vodi i nadopuniti do 1 litre. pH otopine treba biti 7,4. |
|
|
|
(b) |
kalcijev klorid, bezvodni, CaCl2 |
27,50 g |
|
ili kalcijev klorid dihidrat, CaCl2, 2 H2O |
36,40 g |
|
|
Otopiti u vodi i nadopuniti do 1 litre. |
|
|
|
(c) |
magnezijev sulfat heptahidrat, MgSO4. 7 H2O |
22,50 g |
|
Otopiti u vodi i nadopuniti do 1 litre. |
|
|
|
(d) |
željezo (III) klorid heksahidrat, FeCl3. 6H2O |
0,25 g |
|
Otopiti u vodi i nadopuniti do 1 litre. |
|
Napomena: Kako se ova otopina ne bi morala pripremati neposredno prije uporabe, može se dodati jedna kap konc. HCl ili 0,4 g dinatrijeve soli etilendiamintetraoctene kiseline (EDTA) po litri.
I.6.3. Radne otopine kemikalija
Na primjer, ako je topljivost viša od 1 g/l, 1 – 10 g (prema potrebi) ispitivane odnosno referentne kemikalije se otopi u deioniziranoj vodi i nadopuni do 1 litre. U protivnom se radne otopine pripremaju u mineralnom mediju, ili se kemikalija izravno dodaje u mineralni medij. Za postupanje s manje topljivim tvarima vidjeti Dodatak 3., s time da se kod testa MITI (metoda C.4.-F) ne smiju koristiti ni otapala ni emulgatori.
I.6.4. Inokulumi
Inokulum se može dobiti iz različitih izvora: aktivni mulj, otpadne vode (neklorirane), površinske vode i tla ili iz kombinacije tih izvora. Ako se kod provedbe testa opadanja DOC-a, testa razvijanja CO2 ili manometrijsko-respirometrijskog testa koristi aktivni mulj, treba ga uzeti iz postrojenja za pročišćavanje ili laboratorijske jedinice u koju pretežito ulazi komunalna otpadna voda. Pokazalo se da se korištenjem inokuluma iz drugih izvora dobiva veće raspršenje rezultata. Za izmijenjeni test pretraživanja OECD i test sa zatvorenim bocama potreban je razrjeđeniji inokulum bez pahuljica mulja, po mogućnosti dobiven iz sekundarne otpadne vode postrojenja ili laboratorijske jedinice za pročišćavanje komunalnih otpadnih voda. Inokulum za test MITI dobiva se iz kombinacije izvora, a opisan je u poglavlju koje se odnosi na taj test.
I.6.4.1. Inokulum iz aktivnog mulja
Uzme se svježi uzorak aktivnog mulja iz aeracijskog bazena postrojenja za pročišćavanje otpadnih voda ili laboratorijske jedinice koja pretežito pročišćava komunalne otpadne vode. Grube čestice se prema potrebi uklone filtriranjem kroz fino sito te se mulj nakon tog održava aerobnim.
Kao druga mogućnost, mulj se nakon uklanjanja grubih čestica može istaložiti ili centrifugirati (npr. 10 minuta na 100 g). Supernatant se baca. Mulj se može oprati u mineralnom mediju. Koncentrirani se mulj suspendira u mineralnom mediju tako da se dobije koncentracija od 3 – 5 g suspendirane krute tvari/l i dozračuje do uporabe.
Mulj treba uzeti iz ispravnog konvencionalnog uređaja. Ako se mulj mora uzeti iz brzih pročišćivača ili se sumnja da sadrži inhibitore, treba ga oprati. Resuspendirani mulj se nakon temeljitog miješanja pusti da se istaloži ili centrifugira, supernatant se baci i oprani mulj ponovno resuspendira u dodatnoj količini mineralnog medija. Ovaj se postupak ponavlja sve dok u mulju ima viška supstrata ili inhibitora.
Nakon što se postigne potpuna resuspenzija kao i u slučaju neobrađenog mulja, neposredno prije uporabe treba uzeti uzorak i odrediti suhu masu suspendirane krute tvari.
Još jedna od mogućnosti je homogenizacija aktivnog mulja (3 – 5 g suspendirane krute tvari/l). Mulj se obradi u mehaničkoj mješalici dvije minute na srednjoj brzini. Izmiješani se mulj pusti da se istaloži 30 minuta, prema potrebi i duže, nakon čega se tekućina koja će se koristiti kao inokulum pretače u omjeru 10 ml po litri mineralnog medija.
I.6.4.2. Ostali izvori inokuluma
Inokulum se može dobiti iz sekundarne otpadne vode postrojenja za pročišćavanje ili laboratorijske jedinice u koju pretežito ulaze komunalne otpadne vode. Uzme se svježi uzorak i održava aerobnim tijekom prijenosa. Pusti se da se istaloži 1 sat ili profiltrira kroz grubi filtar-papir i pretočena otpadna voda odnosno filtrat održava aerobnim do uporabe. Ova vrsta inokuluma može se koristiti u omjeru do 100 ml po litri medija.
Jedan od izvora inokuluma je i površinska voda. U tom se slučaju uzorak uzme iz prikladne površinske vode, npr. rijeka, jezero te se održava aerobnim do uporabe. Inokulum se prema potrebi može koncentrirati filtracijom ili centrifugiranjem.
I.6.5. Prethodno kondicioniranje inokuluma
Inokulum se može prethodno kondicionirati radi prilagodbe na pokusne uvjete, ali se ne smije prilagođavati na ispitivanu kemikaliju. Kondicioniranje se sastoji u dozračivanju aktivnog mulja u mineralnom mediju odnosno sekundarne otpadne vode pet do sedam dana na ispitnoj temperaturi. Kondicioniranje ponekad može povećati preciznost ispitnih metoda smanjivanjem vrijednosti slijepih proba. Smatra se da je nepotrebno kondicionirati inokulum za test MITI.
I.6.6. Abiotičke kontrole
Kad je to potrebno, obavlja se provjera abiotičke razgradnje ispitivane tvari određivanjem opadanja DOC-a, potrošnje kisika odnosno razvijanja ugljikovog dioksida u sterilnim kontrolama bez inokuluma. Sterilizacija se provodi filtriranjem kroz membranu (0,2 – 0,45 mikrometara) ili dodavanjem prikladne toksične tvari u odgovarajućoj koncentraciji. Ako se koristi membranska filtracija, uzorci se uzimaju aseptički kako bi se održala sterilnost. Ako adsorpcija ispitivane kemikalije nije unaprijed isključena, u ispitivanja kod kojih se biorazgradnja mjeri kao opadanje DOC-a treba uključiti inokuliranu i otrovanu abiotičku kontrolu, posebno ako se kao inokulum koristi aktivni mulj.
I.6.7. Broj tikvica
Broj tikvica u tipičnom ispitivanju naveden je u poglavljima koja se odnose na pojedine testove.
Mogu se koristiti sljedeće vrste tikvica:
|
— |
ispitna suspenzija: sadrži ispitivanu tvar i inokulum, |
|
— |
slijepa proba inokuluma: sadrži samo inokulum, |
|
— |
kontrola postupka: sadrži referentnu tvar i inokulum, |
|
— |
abiotička sterilna kontrola: sterilna, sadrži ispitivanu tvar (vidjeti 1.6.6.), |
|
— |
kontrola adsorpcije: sadrži ispitivanu tvar, inokulum i sredstvo za sterilizaciju, |
|
— |
kontrola toksičnosti: sadrži ispitivanu tvar, referentnu tvar i inokulum. |
Određivanje u ispitnoj suspenziji i slijepoj probi inokuluma mora se obavezno provoditi paralelno. Preporučljivo je da se i određivanja u drugim tikvicama provode paralelno.
Ipak, to nije uvijek moguće. Treba voditi računa da se uzme dovoljno uzoraka odnosno da se napravi dovoljno očitavanja kako bi se mogao odrediti postotak opadanja unutar roka od 10 dana.
I.7. PODACI I VREDNOVANJE
Za izračunavanje Dt (postotak razgradnje) koriste se srednje vrijednosti dvostrukog mjerenja parametra u ispitnim posudama i slijepoj probi inokuluma. Formule su navedene u nastavku u odjeljcima koji se odnose na pojedine testove. Tijek razgradnje treba prikazati grafički i označiti rok od 10 dana. Treba izračunati i navesti postotak opadanja na kraju roka od 10 dana i vrijednost na platou odnosno na kraju ispitivanja, ovisno o slučaju.
Spojevi koji sadrže dušik mogu kod respirometrijskih ispitivanja utjecati na potrošnju kisika nitrifikacijom (vidjeti dodatke 2. i 5.).
I.7.1. Mjerenje razgradnje putem određivanja DOC-a
Da bi se mogla ocijeniti valjanost ispitivanja (vidjeti I.5.2.), za tikvice koje sadrže ispitivanu tvar treba zasebno izračunati postotak razgradnje Dt u svakom vremenu uzorkovanja, koristeći srednje vrijednosti dvostrukog mjerenja DOC-a. On se izračunava pomoću sljedeće jednadžbe:
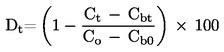
gdje je:
|
Dt |
= |
% razgradnje u vremenu t |
|
Co |
= |
srednja početna koncentracija DOC-a u inokuliranom mediju koji sadrži ispitivanu tvar (mg DOC/l) |
|
Ct |
= |
srednja koncentracija DOC-a u inokuliranom mediju koji sadrži ispitivanu tvar u vremenu t (mg DOC/l) |
|
Cbo |
= |
srednja početna koncentracija DOC-a u inokuliranom mineralnom mediju slijepe probe (mg DOC/l) |
|
Cbt |
= |
srednja koncentracija DOC-a u inokuliranom mineralnom mediju slijepe probe u vremenu t (mg DOC/l) |
Sve se koncentracije mjere pokusom.
I.7.2. Mjerenje razgradnje putem specifične analize
Ako su raspoloživi specifični analitički podaci, primarna se biorazgradnja izračunava kao:
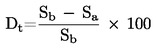
gdje je:
|
Dt |
= |
% razgradnje u vremenu t, obično 28 dana |
|
Sa |
= |
preostala količina ispitivane tvari u inokuliranom mediju na kraju ispitivanja (mg) |
|
Sb |
= |
preostala količina ispitivane tvari u slijepoj probi s vodom/medijem kojemu je dodana samo ispitivana tvar (mg) |
I.7.3. Abiotička razgradnja
Ako se koristi abiotička sterilna kontrola, postotak abiotičke razgradnje izračunava se kao:

gdje je:
|
Cs(o) |
= |
koncentracija DOC-a u sterilnoj kontroli na dan 0 |
|
Cs(t) |
= |
koncentracija DOC-a u sterilnoj kontroli na dan t |
I.8. IZVJEŠĆIVANJE
Izvješće o ispitivanju po mogućnosti sadrži sljedeće:
|
— |
ispitivana i referentna kemikalija i njihova čistoća, |
|
— |
ispitni uvjeti, |
|
— |
inokulum: vrsta i mjesto(-a) uzimanja uzoraka, koncentracija i prethodno kondicioniranje, |
|
— |
udio i vrsta industrijskog otpada koji je prisutan u otpadnoj vodi, ako je poznato, |
|
— |
trajanje ispitivanja i temperatura, |
|
— |
ako se ispituju slabo topljive kemikalije, provedena obrada, |
|
— |
primijenjena ispitna metoda; kod svih promjena postupka treba navesti znanstvene argumente i objašnjenje, |
|
— |
obrazac za dostavu podataka, |
|
— |
sve uočene pojave inhibicije, |
|
— |
abiotička razgradnja (ako je uočena), |
|
— |
podaci iz specifične kemijske analize, ako su raspoloživi, |
|
— |
analitički podaci o intermedijerima, ako su raspoloživi, |
|
— |
graf postotka razgradnje u vremenu za ispitivanu i referentnu tvar; treba jasno označiti fazu prilagodbe („lag” fazu), fazu razgradnje, rok od 10 dana i nagib (Dodatak 1.). Ako je ispitivanje zadovoljilo kriterije valjanosti, za graf se može koristiti srednja vrijednost postotaka razgradnje tikvica koje sadrže ispitivanu tvar, |
|
— |
postotak opadanja nakon roka od 10 dana i na platou odnosno na kraju ispitivanja. |
II. DIO TEST OPADANJA DOC-a (metoda C.4.-A)
II.1. NAČELO METODE
Izmjereni volumen inokuliranog mineralnog medija koji sadrži poznatu koncentraciju ispitivane tvari (10 – 40 mg DOC/l) kao jedini nominalni izvor organskog ugljika dozračuje se u mraku ili na difuznoj svjetlosti na 22 ± 2 °C.
Razgradnja se prati analizom DOC-a, koja se provodi u učestalim razmacima tijekom razdoblja od 28 dana. Stupanj biorazgradnje izračunava se kao opadanje koncentracije DOC-a (ispravljeno za vrijednost slijepe probe s inokulumom), izraženo u postotku početne koncentracije. Stupanj primarne biorazgradnje može se izračunati iz dopunske kemijske analize učinjene na početku i kraju inkubacije.
II.2. OPIS METODE
II.2.1. Aparatura
|
(a) |
stožaste tikvice npr. 250 ml do 2 l, ovisno o volumenu koji je potreban za analizu DOC-a; |
|
(b) |
tresilica za stožaste tikvice s automatskom regulacijom temperature, ili smještena u prostoru sa stalnom temperaturom, koja ima dovoljnu snagu za održavanje aerobnih uvjeta u svim tikvicama; |
|
(c) |
uređaj za filtraciju, s prikladnim membranama; |
|
(d) |
analizator DOC-a; |
|
(e) |
uređaj za određivanje otopljenog kisika; |
|
(f) |
centrifuga. |
II.2.2. Priprema mineralnog medija
Za pripremu radnih otopina vidjeti I.6.2.
Pomiješa se 10 ml otopine (a) s 800 ml vode za razrjeđivanje, doda 1 ml otopina (b) do (d) i nadopuni vodom za razrjeđivanje do 1 l.
II.2.3. Priprema i prethodno kondicioniranje inokuluma
Inokulum se može dobiti iz različitih izvora: aktivni mulj, otpadne vode, površinske vode, tla ili iz kombinacije tih izvora.
Vidjeti I.6.4., I.6.4.1., I.6.4.2. i I.6.5.
II.2.4. Priprema tikvica
Na primjer, u stožaste tikvice od 2 l uvede se po 800 ml mineralnog medija i doda dovoljna količina radne otopine ispitivane odnosno referentne tvari da se dobije koncentracija kemikalije koja odgovara 10 – 40 mg DOC/l. Provjere se pH vrijednosti i prema potrebi podese na 7,4. Tikvice se inokuliraju aktivnim muljem ili drugim izvorom inokuluma (vidjeti I.6.4.) tako da se dobije konačna koncentracija do najviše 30 mg suspendirane krute tvari po litri. Usto se pripreme kontrole s inokulumom u mineralnom mediju bez ispitivane i referentne kemikalije.
Jedna se posuda prema potrebi koristi za provjeru mogućeg inhibitornog učinka ispitivane kemikalije; u tu se svrhu inokulira otopina koja sadrži usporedive koncentracije ispitivane i referentne kemikalije u mineralnom mediju.
Ako je to potrebno, treba pripremiti još jednu sterilnu tikvicu za provjeru abiotičke razgradnje ispitivane kemikalije, koja sadrži neinokuliranu otopinu kemikalije (vidjeti I.6.6.).
Osim toga, ako se sumnja da se ispitivana kemikalija značajno adsorbira na staklo, mulj itd., treba provesti preliminarno ispitivanje kako bi se odredio vjerojatni obim adsorpcije, a time i prikladnost testa za tu kemikaliju (vidjeti tablicu 1.). Pripremi se tikvica koja sadrži ispitivanu kemikaliju, inokulum i sredstvo za sterilizaciju.
Sve se tikvice nadopune mineralnim medijem do 1 l te se nakon miješanja iz svake tikvice uzme uzorak za određivanje početne koncentracije DOC-a (vidjeti Dodatak 2.4.). Otvori tikvica se prekriju npr. aluminijskom folijom na način koji omogućuje slobodnu izmjenu zraka između tikvice i okolnog zraka. Zatim se posude stave u tresilicu i započinje se s ispitivanjem.
II.2.5. Broj tikvica u tipičnom ispitivanju
Tikvica 1 i 2: ispitna suspenzija
Tikvica 3 i 4: slijepa proba inokuluma
Tikvica 5: kontrola postupka
po mogućnosti odnosno prema potrebi:
Tikvica 6: abiotička sterilna kontrola
Tikvica 7: kontrola adsorpcije
Tikvica 8: kontrola toksičnosti
Vidjeti također I.6.7.
II.2.6. Provođenje ispitivanja
Koncentracije DOC-a se tijekom ispitivanja određuju dvostruko u svim tikvicama u poznatim vremenskim razmacima, koji moraju biti dovoljno učestali da se može odrediti početak roka od 10 dana i postotak opadanja na kraju roka od 10 dana. Kod svakog određivanja treba uzeti samo nužnu količinu ispitne suspenzije.
Prije uzimanja uzorka, u tikvicama se prema potrebi nadoknade gubici uslijed isparavanja dodavanjem potrebne količine vode za razrjeđivanje (I.6.1.). Medij se prije uzimanja uzorka temeljito promiješa, pazeći da se materijal koji prianja uz stijenke posuda prije uzorkovanja otopi odnosno suspendira. Uzorak se odmah nakon uzorkovanja filtrira kroz membranski filtar ili centrifugira (vidjeti Dodatak 2.4.). Filtrirane odnosno centrifugirane uzorke treba analizirati istog dana; u protivnome ih treba pohraniti na temperaturi od 2 – 4 °C do najviše 48 sati ili, u dužem vremenu, ispod -18 °C.
II.3. PODACI I IZVJEŠĆIVANJE
II.3.1. Obrada rezultata
Izračuna se postotak razgradnje u vremenu t, kako je navedeno u I.7.1. (određivanje DOC-a) i, fakultativno, u I.7.2. (specifična analiza).
Svi se rezultati upišu u odgovarajuće obrasce za dostavu podataka.
II.3.2. Valjanost rezultata
Vidjeti I.5.2.
II.3.3. Izvješćivanje
Vidjeti I.8.
II.4. OBRAZAC ZA DOSTAVU PODATAKA
Primjer obrasca nalazi se u nastavku.
TEST OPADANJA DOC-a
|
1. |
LABORATORIJ |
|
2. |
DATUM POČETKA ISPITIVANJA |
3. ISPITIVANA TVAR
Naziv:
Koncentracija radne otopine: … mg/l kao kemikalija
Početna koncentracija u mediju, t0: … mg/l kao kemikalija
4. INOKULUM
Izvor:
Obrada:
Prethodno kondicioniranje, ako se provodi:
Koncentracija suspendirane krute tvari u reakcijskoj smjesi: mg/l
5. ODREĐIVANJA UGLJIKA
Analizator ugljika:
|
|
Tikvica br. |
|
DOC nakon n dana (mg/l) |
||||
|
0 |
n1 |
n2 |
n3 |
nx |
|||
|
Ispitivana kemikalija plus inokulum |
1 |
a1 |
|
|
|
|
|
|
a2 |
|
|
|
|
|
||
|
a, srednja vrijednost Ca(t) |
|
|
|
|
|
||
|
2 |
b1 |
|
|
|
|
|
|
|
b2 |
|
|
|
|
|
||
|
b, srednja vrijednost Cb(t) |
|
|
|
|
|
||
|
Slijepa proba s inokulumom bez ispitivane kemikalije |
3 |
C1 |
|
|
|
|
|
|
C2 |
|
|
|
|
|
||
|
C, srednja vrijednost Cc(t) |
|
|
|
|
|
||
|
4 |
d1 |
|
|
|
|
|
|
|
d2 |
|
|
|
|
|
||
|
d, srednja vrijednost Cd(t) |
|
|
|
|
|
||
|
|
|
|
|
|
|
||
6. VREDNOVANJE SIROVIH PODATAKA
|
Tikvica br. |
|
% razgradnje nakon n dana |
||||
|
0 |
n1 |
n2 |
n3 |
nx |
||
|
1 |
|
0 |
|
|
|
|
|
2 |
|
0 |
|
|
|
|
|
Srednja vrijednost (3) |
|
0 |
|
|
|
|
Napomena: Slični se obrasci mogu koristiti za referentnu kemikaliju i kontrolu toksičnosti.
7. ABIOTIČKA KONTROLA (fakultativno)
|
|
Vrijeme (dani) |
|
|
0 |
t |
|
|
Konc. DOC (mg/l) u sterilnoj kontroli |
Cs(o) |
Cs(t) |

8. SPECIFIČNA KEMIJSKA ANALIZA (fakultativno)
|
|
preostala količina ispitivane kemikalije na kraju ispitivanja (mg/l) |
% primarne razgradnje |
|
Sterilna kontrola |
Sb |
|
|
Inokulirani ispitni medij |
Sa |
|
DIO III. IZMIJENJENI TEST PRETRAŽIVANJA OECD (metoda C.4.-B)
III.1. NAČELO METODE
Izmjereni volumen mineralnog medija koji sadrži poznatu koncentraciju ispitivane tvari (10 – 40 mg DOC/l) kao jedini nominalni izvor organskog ugljika inokulira se s 0,5 ml otpadne vode po litri medija. Smjesa se dozračuje u mraku ili na difuznoj svjetlosti na 22 ± 2 °C.
Razgradnja se prati analizom DOC-a, koja se provodi u učestalim razmacima tijekom razdoblja od 28 dana. Stupanj biorazgradnje izračunava se kao opadanje koncentracije DOC-a (ispravljeno za vrijednost slijepe probe s inokulumom), izraženo u postotku početne koncentracije. Stupanj primarne biorazgradnje može se izračunati iz dopunske kemijske analize učinjene na početku i kraju inkubacije.
III.2. OPIS METODE
III.2.1. Aparatura
|
(a) |
stožaste tikvice npr. od 250 ml do 2 l, ovisno o volumenu koji je potreban za analizu DOC-a; |
|
(b) |
tresilica – za stožaste tikvice, s automatskom regulacijom temperature ili smještena u prostoriji sa stalnom temperaturom, koja ima dovoljnu snagu za održavanje aerobnih uvjeta u svim tikvicama; |
|
(c) |
uređaj za filtraciju, s prikladnim membranama; |
|
(d) |
analizator DOC-a; |
|
(e) |
uređaj za određivanje otopljenog kisika; |
|
(f) |
centrifuga. |
II.2.2. Priprema mineralnog medija
Za pripremu radnih otopina vidjeti I.6.2.
Pomiješa se 10 ml otopine (a) s 80 ml vode za razrjeđivanje, doda 1 ml otopina (b) do (d) i nadopuni vodom za razrjeđivanje do 1 l.
Kod ove se metode kao inokulum koristi samo 0,5 ml otpadne vode po litri, tako da je medij ponekad potrebno pojačati elementima u tragovima i faktorima rasta. To se može učiniti dodavanjem 1 ml svake od ovih otopina po litri konačnog medija:
otopina elemenata u tragovima:
|
manganov sulfat tetrahidrat, MnSO4. 4H2O |
39,9 mg |
|
borna kiselina, H3BO3 |
57,2 mg |
|
cinkov sulfat heptahidrat, ZnSO4. 7H2O |
42,8 mg |
|
amonijev heptamolibdat (NH4)6 Mo7O24 |
34,7 mg |
|
Fe kelat (FeCl3 etilendiamintetraoctena kiselina) |
100,0 mg |
|
Otopiti u vodi za razrjeđivanje i nadopuniti vodom za razrjeđivanje do 1 000 ml. |
|
|
Vitaminska otopina: |
|
|
ekstrakt kvasca |
15,0 mg |
Ekstrakt kvasca otopi se u 100 ml vode. Sterilizira se propuštanjem kroz membranski filtar od 0,2 mikrona ili svježe pripremi.
III.2.3. Priprema i prethodno kondicioniranje inokuluma
Inokulum se dobiva iz sekundarne otpadne vode postrojenja za pročišćavanje ili laboratorijske jedinice u koju pretežito ulaze komunalne otpadne vode. Vidjeti I.6.4.2. i I.6.5.
Koristi se 0,5 ml po litri mineralnog medija.
III.2.4. Priprema tikvica
Na primjer, u stožaste tikvice od 2 l uvede se po 800 ml mineralnog medija i doda dovoljna količina radne otopine ispitivane odnosno referentne tvari da se dobije koncentracija kemikalije koja odgovara 10 – 40 mg DOC/l. Provjeri se pH vrijednost i prema potrebi podesi na 7,4. Tikvice se inokuliraju otpadnom vodom u omjeru 0,5 ml/l (vidjeti I.6.4.2.). Usto se pripreme kontrole s inokulumom u mineralnom mediju bez ispitivane i referentne kemikalije.
Jedna se posuda prema potrebi koristi za provjeru mogućeg inhibitornog učinka ispitivane kemikalije; u tu se svrhu inokulira otopina koja sadrži usporedive koncentracije ispitivane i referentne kemikalije u mineralnom mediju.
Ako je to potrebno, treba pripremiti još jednu sterilnu tikvicu za provjeru abiotičke razgradnje ispitivane kemikalije, koja sadrži neinokuliranu otopinu kemikalije (vidjeti I.6.6.).
Osim toga, ako se sumnja da se ispitivana kemikalija značajno adsorbira na staklo, mulj itd., treba provesti preliminarno ispitivanje kako bi se odredio vjerojatni obim adsorpcije, a time i prikladnost testa za tu kemikaliju (vidjeti tablicu 1.). Pripremi se tikvica koja sadrži ispitivanu kemikaliju, inokulum i sredstvo za sterilizaciju.
Sve se tikvice nadopune mineralnim medijem do 1 l te se nakon miješanja iz svake tikvice uzme uzorak za određivanje početne koncentracije DOC-a (vidjeti Dodatak 2.4.). Otvori tikvica prekriju se npr. aluminijskom folijom na način koji omogućuje slobodnu izmjenu zraka između tikvice i okolnog zraka. Zatim se posude stave u tresilicu i započinje s ispitivanjem.
III.2.5. Broj tikvica u tipičnom ispitivanju
Tikvica 1 i 2: ispitna suspenzija
Tikvica 3 i 4: slijepa proba inokuluma
Tikvica 5: kontrola postupka
te po mogućnosti odnosno prema potrebi:
Tikvica 6: abiotička sterilna kontrola
Tikvica 7: kontrola adsorpcije
Tikvica 8: kontrola toksičnosti
Vidjeti također 1.6.7.
III.2.6. Provođenje ispitivanja
Koncentracije DOC-a se tijekom ispitivanja određuju dvostruko u svim tikvicama u poznatim vremenskim razmacima, koji moraju biti dovoljno učestali da se može odrediti početak roka od 10 dana i postotak opadanja na kraju roka od 10 dana. Kod svakog određivanja treba uzeti samo nužnu količinu ispitne suspenzije.
Prije uzimanja uzorka, u tikvicama se prema potrebi nadoknade gubici uslijed isparavanja dodavanjem potrebne količine vode za razrjeđivanje (I.6.1.). Medij se prije uzimanja uzorka temeljito promiješa, pazeći da se materijal koji prianja uz stijenke posuda prije uzorkovanja otopi odnosno suspendira. Uzorak se odmah nakon uzorkovanja filtrira kroz membranski filtar ili centrifugira (vidjeti Dodatak 2.4.). Filtrirane odnosno centrifugirane uzorke treba analizirati istog dana; u protivnome ih treba pohraniti na temperaturi od 2 – 4 °C do najviše 48 sati ili, u dužem vremenu, ispod – 18 °C.
III.3. PODACI I IZVJEŠĆIVANJE
III.3.1. Obrada rezultata
Izračuna se postotak razgradnje u vremenu t, kako je navedeno u I.7.1. (određivanje DOC-a) i, fakultativno, u 1.7.2. (specifična analiza).
Svi se rezultati upišu u odgovarajuće obrasce za dostavu podataka.
III.3.2. Valjanost rezultata
Vidjeti I.5.2.
III.3.3. Izvješćivanje
Vidjeti I.8.
III.4. OBRAZAC ZA DOSTAVU PODATAKA
Primjer obrasca nalazi se u nastavku
IZMIJENJENI TEST PRETRAŽIVANJA OECD
|
1. |
LABORATORIJ |
|
2. |
DATUM POČETKA ISPITIVANJA |
3. ISPITIVANA TVAR
Naziv:
Koncentracija radne otopine: … mg/l kao kemikalija
Početna koncentracija u mediju, t0: … mg/l kao kemikalija
4. INOKULUM
Izvor:
Obrada:
Prethodno kondicioniranje, ako se provodi:
Koncentracija suspendirane krute tvari u reakcijskoj smjesi: mg/l
5. ODREĐIVANJA UGLJIKA
Analizator ugljika:
|
|
Tikvica br. |
|
DOC nakon n dana (mg/l) |
||||
|
0 |
n1 |
n2 |
n3 |
nx |
|||
|
Ispitivana kemikalija plus inokulum |
1 |
a1 |
|
|
|
|
|
|
a2 |
|
|
|
|
|
||
|
a, srednja vrijednost Ca(t) |
|
|
|
|
|
||
|
2 |
b1 |
|
|
|
|
|
|
|
b2 |
|
|
|
|
|
||
|
b, srednja vrijednost Cb(t) |
|
|
|
|
|
||
|
Slijepa proba s inokulumom bez ispitivane kemikalije |
3 |
C1 |
|
|
|
|
|
|
C2 |
|
|
|
|
|
||
|
C, srednja vrijednost Cc(t) |
|
|
|
|
|
||
|
4 |
d1 |
|
|
|
|
|
|
|
d2 |
|
|
|
|
|
||
|
d, srednja vrijednost Cd(t) |
|
|
|
|
|
||
|
|
|
|
|
|
|
||
6. VREDNOVANJE SIROVIH PODATAKA
|
Tikvica br. |
|
% razgradnje nakon n dana |
||||
|
0 |
n1 |
n2 |
n3 |
nx |
||
|
1 |
|
0 |
|
|
|
|
|
2 |
|
0 |
|
|
|
|
|
Srednja vrijednost (4) |
|
0 |
|
|
|
|
Napomena: Slični se obrasci mogu koristiti za referentnu kemikaliju i kontrolu toksičnosti.
7. ABIOTIČKA KONTROLA (fakultativno)
|
|
Vrijeme (dani) |
|
|
0 |
t |
|
|
Konc. DOC (mg/l) u sterilnoj kontroli |
Cs(o) |
Cs(t) |

8. SPECIFIČNA KEMIJSKA ANALIZA (fakultativno)
|
|
preostala količina ispitivane kemikalije na kraju ispitivanja (mg/l) |
% primarne razgradnje |
|
Sterilna kontrola |
Sb |
|
|
Inokulirani ispitni medij |
Sa |
|
IV. DIO TEST RAZVIJANJA CO2 (metoda C.4.-C)
IV.1. NAČELO METODE
Izmjereni volumen inokuliranog mineralnog medija koji sadrži poznatu koncentraciju ispitivane kemikalije (10 – 20 mg DOC ili TOC/l) kao jedini nominalni izvor organskog ugljika dozračuje se uvođenjem zraka bez ugljikovog dioksida kontroliranom brzinom u mraku ili na difuznoj svjetlosti. Razgradnja se prati tijekom 28 dana određivanjem nastalog ugljikovog dioksida koji je vezan u barijevom ili natrijevom hidroksidu i koji se mjeri titracijom preostalog hidroksida ili kao anorganski ugljik. Količina ugljikovog dioksida oslobođena iz ispitivane kemikalije (ispravljena za vrijednost slijepe probe inokuluma) izražava se kao postotak ThCO2. Stupanj biorazgradnje može se izračunati i iz dopunske analize DOC-a učinjene na početku i kraju inkubacije.
IV.2. OPIS METODE
IV.2.1. Aparatura
|
(a) |
tikvice 2 – 5 litara s cjevčicom za dozračivanje koja seže gotovo do dna posude i ispustom; |
|
(b) |
magnetske mješalice, kod ocjenjivanja slabo topljivih kemikalija; |
|
(c) |
boce za apsorpciju plina; |
|
(d) |
uređaj za regulaciju i mjerenje protoka zraka; |
|
(e) |
uređaj za ispiranje ugljikovog dioksida, za pripremu zraka bez ugljikovog dioksida; umjesto tog može se koristiti smjesa kisika bez CO2 i dušika bez CO2 iz plinskih boca u odgovarajućem omjeru (20 % O2: 80 % N2); |
|
(f) |
uređaj za određivanje ugljikovog dioksida, bilo titracijom ili putem analizatora organskog ugljika; |
|
(g) |
uređaj za membransku filtraciju (prema izboru); |
|
(h) |
analizator DOC-a (prema izboru). |
IV.2.2. Priprema mineralnog medija
Za pripremu radnih otopina vidjeti I.6.2.
Pomiješa se 10 ml otopine (a) s 800 ml vode za razrjeđivanje, doda 1 ml otopina (b) do (d) i nadopuni vodom za razrjeđivanje do 1 l.
IV.2.3. Priprema i prethodno kondicioniranje inokuluma
Inokulum se može dobiti iz različitih izvora: aktivni mulj, otpadne vode, površinske vode, tla ili iz kombinacije tih izvora.
Vidjeti I.6.4., I.6.4.1., I.6.4.2. i I.6.5.
IV.2.4. Priprema tikvica
Volumeni i mase navedeni u nastavku vrijede za 5-litarske tikvice koje sadrže 3 l suspenzije. Ako se koriste manji volumeni, vrijednosti treba proporcionalno izmijeniti, vodeći računa da se nastali ugljikov dioksid mora točno mjeriti.
U svaku tikvicu od 5 litara stavi se 2 400 ml mineralnog medija. Doda se odgovarajući volumen pripremljenog aktivnog mulja (vidjeti I.6.4.1. i I.6.5.), tako da se u konačnoj inokuliranoj smjesi od 3 l dobije koncentracija suspendirane krute tvari do najviše 30 mg/l. Druga je mogućnost da se pripremljeni mulj prvo razrijedi, tako da se dobije suspenzija u mineralnom mediju od 500 – 1 000 mg/l, i alikvot doda sadržaju 5-litarske tikvice kako bi se dobila koncentracija od 30 mg/l; ovo osigurava veću preciznost. Mogu se koristiti i drugi izvori inokuluma (vidjeti I.6.4.2.).
Inokulirane smjese se preko noći dozračuju zrakom bez CO2 kako bi se sustav očistio od ugljikovog dioksida.
Ispitivana i referentna tvar dodaju se odvojeno u paralelne tikvice kao radne otopine poznatog volumena tako da se dobiju koncentracije dodanih kemikalija od 10 do 20 mg DOC ili TOC/l; nekoliko tikvica bez kemikalija koristi se za kontrolu inokuluma. Slabo topljive ispitivane tvari treba dodati izravno u tikvice na bazi mase ili volumena ili s njima postupati kako je opisano u Dodatku 3.
Jedna se tikvica prema potrebi koristi za provjeru mogućeg inhibitornog učinka ispitivane kemikalije; za to u posudu treba dodati ispitivanu i referentnu kemikaliju u koncentracijama koje se koriste u ostalim tikvicama.
Ako je to potrebno, jednu sterilnu tikvicu koja sadrži neinokuliranu otopinu kemikalije treba upotrijebiti za provjeru abiotičke razgradnje ispitivane kemikalije (vidjeti I.6.6.). Sterilizacija se provodi dodavanjem toksične tvari u odgovarajućoj koncentraciji.
Volumeni suspenzija u svim tikvicama nadopune se do 3 l dodavanjem mineralnog medija koji je prethodno dozračen zrakom bez CO2. Uzorci se po izboru mogu uzeti za analizu DOC-a (vidjeti Dodatak 2.4.) i/ili specifičnu analizu. Apsorpcijske boce treba spojiti na ispuste tikvica.
Ako se koristi barijev hidroksid, na svaku se 5-litarsku tikvicu spoje tri apsorpcijske boce u nizu, od kojih svaka sadrži 100 ml 0,0125 M otopine barijevog hidroksida. Otopina ne smije sadržavati nataloženi sulfat i karbonat i njezinu jakost treba odrediti neposredno prije uporabe. Ako se koristi natrijev hidroksid, priključe se dva odvajača, od kojih drugi služi kao kontrola kako bi se pokazalo da je prvi odvajač apsorbirao sav ugljikov dioksid. Prikladne su apsorpcijske boce sa zatvaračem za serumske bočice. U svaku se bocu doda 200 ml 0,05 M natrijevog hidroksida, što je dovoljno da se apsorbira čitava količina ugljikovog dioksida koja nastaje kod potpune razgradnje ispitivane kemikalije. Otopina natrijevog dioksida, čak i onda ako je svježe pripremljena, sadrži tragove karbonata; stoga je potrebno učiniti ispravak oduzimanjem karbonata u slijepoj probi.
IV.2.5. Broj tikvica u tipičnom ispitivanju
Tikvica 1 i 2: ispitna suspenzija
Tikvica 3 i 4: slijepa proba inokuluma
Tikvica 5: kontrola postupka
te po mogućnosti odnosno prema potrebi:
Tikvica 6: abiotička sterilna kontrola
Tikvica 7: kontrola toksičnosti
Vidjeti također I.6.7.
IV.2.6. Provođenje ispitivanja
Ispitivanje započinje propuhivanjem zraka bez CO2 kroz suspenzije brzinom od 30 – 100 ml/min. Uzorci apsorbensa ugljikovog dioksida uzimaju se periodički radi analize sadržaja CO2. Preporučuje se da se tijekom prvih deset dana analiza provodi svaki drugi ili treći dan, a nakon toga svaki peti dan sve do 28. dana, kako bi se mogao utvrditi rok od 10 dana.
28. dana uzmu se uzorci za analizu DOC-a i/ili specifičnu analizu (po izboru), izmjeri se pH suspenzija i u svaku tikvicu doda 1 ml koncentrirane klorovodične kiseline; tikvice se dozračuju preko noći kako bi se iz ispitnih suspenzija istjerao ugljikov dioksid. 29. dana se provede zadnja analiza razvijenog ugljikovog dioksida.
U dane mjerenja CO2 apsorber s barijevim hidroksidom najbliži tikvici odspoji se i hidroksidna se otopina titrira s HCl 0,05 M, koristeći fenolftalein kao indikator. Ostali apsorberi se pomaknu za jedno mjesto bliže tikvici i na kraj niza postavi novi apsorber koji sadrži 100 ml svježeg 0,0125 M barijevog hidroksida. Titracija se provodi prema potrebi, npr. kad se uoči znatno taloženje u prvom odvajaču, ali prije nego što ono postane vidljivo u drugom odvajaču, a najmanje jedanput tjedno. Druga mogućnost, ako se kao apsorbens koristi NaOH, je da se u apsorberu bliže tikvici špricom uzme mali uzorak (ovisno o svojstvima analizatora ugljika koji se koristi) otopine natrijevog hidroksida. Uzorak se uštrca u dio analizatora ugljika za anorganski ugljik i izravno analizira razvijeni ugljikovog dioksid.
Sadržaj drugog odvajača analizira se samo na kraju ispitivanja, kako bi se mogao učiniti ispravak za mogući prijenos ugljikovog dioksida.
IV.3. PODACI I IZVJEŠĆIVANJE
IV.3.1. Obrada rezultata
Količina CO2 vezana u apsorberu određuje se kod titracije kao:

gdje je:
|
V |
= |
volumen HCl upotrijebljen za titraciju 100 ml u apsorberu (ml) |
|
CB |
= |
koncentracija otopine barijevog hidroksida (M) |
|
CA |
= |
koncentracija otopine klorovodične kiseline (M) |
ako je CB 0,0125 M i CA je 0,05 M, za titraciju 100 ml barijevog hidroksida potrebno je 50 ml, a masa CO2 je:
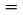
Dakle, u ovom slučaju, faktor za pretvorbu volumena HCl upotrijebljenog u titraciji u mg CO2 je 1,1.
Masa CO2 oslobođena iz samog inokuluma i masa CO2 oslobođena iz inokuluma s ispitivanom kemikalijom izračunava se uz pomoć odgovarajućih titracijskih vrijednosti, a razlika je masa CO2 oslobođena iz same ispitivane kemikalije.
Na primjer, ako se titracijom samog inokuluma dobije vrijednost 48 ml, a inokuluma s ispitivanom kemikalijom 45 ml,
CO2 iz inokuluma = 1,1 × (50 – 48) = 2,2 mg
CO2 iz inokuluma s ispitivanom kemikalijom = 1,1 × (50 – 45) = 5,5 mg
te je, prema tomu, masa CO2 oslobođena iz ispitivane kemikalije 3,3 mg.
Postotak biorazgradnje izračunava se kao:
![]()
ili
![]()
pri čemu je 3,67 faktor konverzije (44/12) ugljika u ugljikov dioksid.
Postotak razgradnje nakon bilo kojeg vremena dobije se zbrajanjem postotnih vrijednosti ThCO2 izračunanih za svaki dan mjerenja do tog vremena.
Kod apsorbera s natrijevim hidroksidom količina oslobođenog ugljikovog dioksida, izražena kao IC (mg), izračunava se množenjem koncentracije IC u apsorbensu volumenom apsorbensa.
Postotak razgradnje izračunava se kao:
![]()
Opadanja DOC-a (fakultativno) izračunava se kako je opisano u I.7. Te i sve druge rezultate treba upisati u odgovarajuće obrasce.
IV.3.2. Valjanost rezultata
Sadržaj IC u suspenziji ispitivane kemikalije u mineralnom mediju na početku ispitivanja mora biti ispod 5 % TC, a ukupni CO2 razvijen u slijepoj probi inokuluma na kraju ispitivanja u pravilu ne bi smio biti viši od 40 mg/l medija. Ako se dobiju vrijednosti iznad 70 mg CO2/l, treba kritički preispitati podatke i pokusnu tehniku.
Vidjeti također I.5.2.
IV.3.3. Izvješćivanje
Vidjeti I.8.
IV.4. OBRAZAC ZA DOSTAVU PODATAKA
Primjer obrasca nalazi se u nastavku.
TEST RAZVIJANJA UGLJIKOVOG DIOKSIDA
|
1. |
LABORATORIJ |
|
2. |
DATUM POČETKA ISPITIVANJA |
3. ISPITIVANA TVAR
Naziv:
Koncentracija radne otopine: … mg/l kao kemikalija
Početna koncentracija u mediju: … mg/l kao kemikalija
Ukupni C dodan u tikvicu: … mg C
ThCO2: mg CO2
4. INOKULUM
Izvor:
Obrada:
Prethodno kondicioniranje, ako se provodi:
Koncentracija suspendirane krute tvari u reakcijskoj smjesi: mg/l
|
Vrijeme (dan) |
Oslobođeni CO2 Ispitivanje (mg) |
Oslobođeni CO2 Slijepa proba (mg) |
Oslobođeni CO2 kumulativno (mg) (ispitivanje minus slijepa proba, srednja vrijednost) |
ThCO2
|
|||||
|
1 2 |
srednja vrijednost |
3 4 |
srednja vrijednost |
1 |
2 |
1 |
2 |
srednja vrijednost |
|
|
0 |
|
|
|
|
|
|
|
|
|
|
n1 |
|
|
|
|
|
|
|
|
|
|
n2 |
|
|
|
|
|
|
|
|
|
|
n3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
28 |
|
|
|
|
|
|
|
|
|
Napomena: Slični se obrasci mogu koristiti za referentnu kemikaliju i kontrolu toksičnosti.
6. ANALIZA UGLJIKA (fakultativno)
Analizator ugljika:
|
Vrijeme (dan) |
Slijepa proba mg/l |
Ispitivana kemikalija mg/l |
|
0 |
Cb(o) |
Co |
|
28 (5) |
Cb(t) |
Ct |

7. ABIOTIČKA RAZGRADNJA (fakultativno)
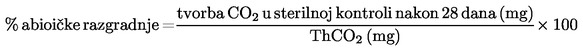
V. DIO MANOMETRIJSKO-RESPIROMETRIJSKI TEST (metoda C.4.-D)
V.1. NAČELO METODE
Izmjereni volumen inokuliranog mineralnog medija koji sadrži poznatu koncentraciju ispitivane kemikalije (100 mg/l ispitivane tvari tako da se dobije najmanje 50 – 100 mg TPK/l) kao jedini nominalni izvor organskog ugljika miješa se u zatvorenoj tikvici na stalnoj temperaturi (± 1 °C ili manje) do najviše 28 dana. Potrošnja kisika određuje se mjerenjem količine kisika (dobivenog elektrolitički) koja je potrebna za održavanje stalnog volumena plina u respirometarskoj tikvici ili iz promjene volumena ili tlaka (ili jednog i drugog) u aparaturi. Nastali ugljikov dioksid apsorbira se u otopini kalijevog hidroksida ili drugom prikladnon apsorbensu. Količina kisika koju je potrošila ispitivana kemikalija (ispravljena za vrijednost slijepe probe inokuluma, koja se izvodi paralelno) izražava se kao postotak ThCO2 ili KPK. Fakultativno se može izračunati i primarna biorazgradnja iz dopunske specifične analize učinjene na početku i kraju inkubacije te potpuna biorazgradnja analizom DOC-a.
V.2. OPIS METODE
V.2.1. Aparatura
|
(a) |
prikladan respirometar; |
|
(b) |
termostat koji održava temperaturu na ± 1 °C ili bolji; |
|
(c) |
uređaj za membransku filtraciju (fakultativno); |
|
(d) |
analizator ugljika (fakultativno). |
V.2.2. Priprema mineralnog medija
Za pripremu radnih otopina vidjeti I.6.2.
Pomiješa se 10 ml otopine (a) s 800 ml vode za razrjeđivanje, doda 1 ml otopina (b) do (d) i nadopuni vodom za razrjeđivanje do 1 l.
V.2.3. Priprema i prethodno kondicioniranje inokuluma
Inokulum se može dobiti iz različitih izvora: aktivni mulj, otpadne vode, površinske vode i tla ili iz kombinacije tih izvora.
Vidjeti I.6.4., I.6.4.1., I.6.4.2. i I.6.5.
V.2.4. Priprema tikvica
Iz radnih otopina se odvojeno pripreme otopine ispitivane i referentne kemikalije u mineralnom mediju, u pravilu u koncentraciji od 100 mg kemikalije po litri (tako da se dobije najmanje 50 – 100 mg TPK/l).
TPK se izračunava na temelju tvorbe amonijevih soli, osim ako se očekuje nitrifikacija, u kom se slučaju izračun temelji na tvorbi nitrata (vidjeti Dodatak 2.2.).
Odrede se pH vrijednosti i prema potrebi podese na 7,4 ± 0,2.
Slabo topljive tvari treba dodati u kasnijoj fazi (vidjeti u nastavku).
Ako treba odrediti toksičnost ispitivane kemikalije, pripremi se još jedna otopina u mineralnom mediju koja sadrži istu koncentraciju ispitivane i referentne kemikalije kao pojedinačne otopine.
Ako je potrebno mjerenje fizikalno-kemijske potrošnje kisika, pripremi se otopina ispitivane kemikalije, u pravilu u koncentraciji 100 mg TPK/l, sterilizirana dodavanjem prikladne toksične tvari (vidjeti I.6.6.).
Potrebne količine otopine ispitivane i referentne kemikalije uvode se u najmanje po dvije paralelne tikvice. Osim toga, treba pripremiti tikvice koje sadrže samo mineralni medij (za kontrolu inokuluma) te, prema potrebi, miješanu otopinu ispitivane i referentne kemikalije i sterilnu otopinu.
Ako je ispitivana kemikalija slabo topljiva, ona se u ovoj fazi dodaje izravno na bazi mase ili volumena ili se s njom postupa kako je opisano u Dodatku 3. U odjeljke apsorbera CO2 stavi se kalijev hidroksid, pelete natronskog vapna ili drugi apsorbens.
V.2.5. Broj tikvica u tipičnom ispitivanju
Tikvica 1 i 2: ispitna suspenzija
Tikvica 3 i 4: slijepa proba inokuluma
Tikvica 5: kontrola postupka
po mogućnosti odnosno prema potrebi:
Tikvica 6: sterilna kontrola
Tikvica 7: kontrola toksičnosti
Vidjeti također I.6.7.
V.2.6. Provođenje ispitivanja
Kada se postigne željena temperatura, posude se inokuliraju pripremljenim aktivnim muljem ili drugim izvorom inokuluma da se dobije koncentracija suspendirane krute tvari do najviše 30 mg/l. Sastavi se oprema, pokrene mješač i provjeri zrakonepropusnost te započne s mjerenjem potrošnje kisika. Nakon toga je obično dovoljno obavljati redovita očitavanja i svakodnevno nadzirati temperaturu i miješanje.
Potrošnja kisika izračunava se iz vrijednosti koje se očitavaju u učestalim i redovitim razmacima metodama koje navodi proizvođač opreme. Na kraju inkubacije, u pravilu 28 dana, izmjeri se pH sadržaja tikvica, posebno ako je potrošnja kisika niska ili viša od TPKNH4 (kod spojeva koji sadrže dušik).
Ako je to potrebno, na početku i na kraju se iz respirometarskih tikvica uzmu uzorci za analizu DOC-a ili specifičnu kemijsku analizu (vidjeti Dodatak 2.4.). Kod početnog uzimanja uzorka treba voditi računa da u tikvici ostane poznati volumen ispitne suspenzije. Ako kisik troši ispitivana tvar koja sadrži dušik, odredi se povećanje koncentracije nitrita i nitrata u razdoblju od 28 dana i napravi ispravak za kisik potrošen nitrifikacijom (Dodatak 5.).
V.3. PODACI I IZVJEŠĆIVANJE
V.3.1. Obrada rezultata
Potrošnja kisika (mg) ispitivane kemikalije nakon određenog vremena (ispravljena za vrijednost slijepe probe inokuluma nakon istog vremena) podijeli se s upotrijebljenom masom ispitivane kemikalije. Tako se dobije BPK izražen u mg kisika po mg ispitivane kemikalije tj.:

= mg O2 po mg ispitivane kemikalije
izračuna se postotak biorazgradnje kao:

ili
![]()
Valja napomenuti da ove dvije metode ne daju nužno isti rezultat; prednost se daje prvoj metodi.
Kod ispitivanih tvari koje sadrže dušik treba koristiti odgovarajući TPK (NH4 ili NO3), ovisno o tomu da li se očekuje pojava nitrifikacije (Dodatak 2.2.). Ako je došlo do nepotpune nitrifikacije, izračuna se ispravak za kisik potrošen nitrifikacijom iz promjene koncentracije nitrita i nitrata (Dodatak 5.).
Ako se provode fakultativna određivanja organskog ugljika i/ili specifična kemijska analiza, postotak razgradnje izračunava se kako je opisano u I.7.
Sve rezultate treba upisati u priložene obrasce za dostavu podataka.
V.3.2. Valjanost rezultata
Potrošnja kisika slijepe probe inokuluma u pravilu iznosi 20 – 30 mg O2/l i ne bi smjela biti viša od 60 mg/l u 28 dana. Kod vrijednosti iznad 60 mg/l potrebno je kritički preispitati podatke i pokusne tehnike. Ako je pH vrijednost izvan područja 6 – 8,5 i ako je potrošnja kisika ispitivane kemikalije manja od 60 %, ispitivanje treba ponoviti s nižom koncentracijom ispitivane kemikalije.
Vidjeti također I.5.2.
V.3.3. Izvješćivanje
Vidjeti I.8.
V.4. OBRAZAC ZA DOSTAVU PODATAKA
Primjer obrasca za dostavu podataka nalazi se u nastavku.
MANOMETRIJSKO-RESPIROMETRIJSKI TEST
|
1. |
LABORATORIJ |
|
2. |
DATUM POČETKA ISPITIVANJA |
3. ISPITIVANA TVAR
Naziv:
Koncentracija radne otopine: … mg/l
Početna koncentracija u mediju, Co: … mg/l
Volumen u ispitnoj tikvici (V): … ml
TPK ili KPK: … mg O2/mg ispitivane tvari (NH4 ili NO3)
4. INOKULUM
Izvor:
Obrada:
Prethodno kondicioniranje, ako se provodi:
Koncentracija suspendirane krute tvari u reakcijskoj smjesi: … mg/l
5. POTROŠNJA KISIKA: BIORAZGRADIVOST
|
|
Vrijeme (dani) |
||||||||||||
|
0 |
|
7 |
|
14 |
|
|
21 |
|
|
28 |
|
||
|
Potrošnja O2 (mg) ispitivna kemikalija |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a, srednja vrijednost |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Potrošnja O2 (mg) slijepa proba |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
b, srednja vrijednost |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ispravljeni BPK (mg) |
(a1 – bm) |
|
|
|
|
|
|
|
|
|
|
|
|
|
(a2 – bm) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
BPK po mg ispitivane kemikalije |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
% razgradnje
|
D1 (a1) |
|
|
|
|
|
|
|
|
|
|
|
|
|
D2 (a2) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Srednja vrijednost (6) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V = volumen medija u ispitnoj tikvici |
|||||||||||||
Napomena: Slični se obrasci mogu koristiti za referentnu kemikaliju i kontrolu toksičnosti.
6. ISPRAVAK ZA NITRIFIKACIJU (vidjeti Prilog V.)
|
Dan |
0 |
28 |
Razlika |
||
|
|
|
(N) |
||
|
— |
— |
|
||
|
|
|
(N) |
||
|
— |
— |
|
||
|
— |
— |
|
7. ANALIZA UGLJIKA (fakultativno)
Analizator ugljika:
|
Vrijeme (dan) |
Slijepa proba mg/l |
Ispitivana kemikalija mg/l |
|
0 |
(Cblo) |
(Co) |
|
28 (7) |
(Cblt) |
(Ct) |

8. SPECIFIČNA KEMIJSKA ANALIZA (fakultativno)
|
Sb |
= |
koncentracija u fizikalno-kemijskoj (sterilnoj) kontroli nakon 28 dana |
|
Sa |
= |
koncentracija u inokuliranoj tikvici nakon 28 dana |
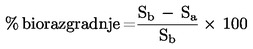
9. ABIOTIČKA RAZGRADNJA (fakultativno)
|
a |
= |
potrošnja kisika u sterilnim tikvicama nakon 28 dana, (mg) |

(vidjeti odjeljke 1. i 3.)
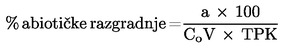
DIO VI. TEST SA ZATVORENIM BOCAMA (metoda C.4.-E)
VI.1. NAČELO ISPITNE METODE
Otopina ispitivane kemikalije u mineralnom mediju, obično 2 – 5 mg/l, inokulira se relativno malim brojem mikroorganizama iz miješane populacije i drži u potpuno napunjenim zatvorenim bocama u mraku na stalnoj temperaturi. Razgradnja se prati putem analize otopljenog kisika tijekom razdoblja od 28 dana. Potrošnja kisika ispitivane kemikalije, ispravljena za potrošnju kisika paralelne slijepe probe inokuluma, izražava se kao postotak TPK ili KPK.
VI.2. OPIS METODE
VI.2.1. Aparatura
|
(a) |
boce BPK sa staklenim čepovima, npr. 250 – 300 ml; |
|
(b) |
vodena kupelj ili inkubator za držanje boca na stalnoj temperaturi (± 1 °C ili bolji) bez pristupa svjetlosti; |
|
(c) |
velike staklene boce (2 – 5 litara) za pripremu medija i punjenje boca BPK; |
|
(d) |
kisikova elektroda i mjerač kisika odnosno oprema i reagensi za Winklerovu titraciju. |
VI.2.2. Priprema mineralnog medija
Za pripremu radnih otopina vidjeti I.6.2.
Promiješa se 1 (jedan) ml otopine (a) do (d) i nadopuni vodom za razrjeđivanje do 1 litre.
VI.2.3. Priprema inokuluma
Inokulum se u pravilu dobiva iz sekundarne otpadne vode postrojenja za pročišćavanje ili laboratorijske jedinice u koju pretežito ulaze komunalne otpadne vode. Drugi mogući izvor inokuluma je površinska voda. Uglavnom se koristi jedna kap (0,05 ml) do 5 ml filtrata po litri medija; ponekad je potrebno izvesti pokuse kako bi se utvrdio optimalni volumen za pojedinu otpadnu vodu (vidjeti I.6.4.2. i I.6.5.).
VI.2.4. Priprema tikvica
Mineralni medij se intenzivno dozračuje najmanje 20 min. Svaki niz ispitivanja treba provesti s mineralnim medijem iz iste šarže. Općenito, medij je spreman za uporabu nakon što odstoji 20 sati na ispitnoj temperaturi. Odredi se koncentracija otopljenog kisika u svrhu kontrole; vrijednost bi trebala biti oko 9 mg/l na 20 °C. U svim postupcima prijenosa i punjenja zrakom zasićenog medija treba izbjeći stvaranje mjehurića, na primjer uporabom sifona.
Pripreme se paralelne skupine boca BPK za određivanje BPK ispitivane i referentne kemikalije u simultanim pokusnim nizovima. Postavi se dovoljan broj boca BPK, uključujući slijepe probe inokuluma, kako bi se u željenim vremenskim razmacima, npr. nakon 0, 7, 14, 21 i 28 dana, mogla obaviti najmanje dvostruka mjerenja potrošnje kisika. Ponekad je za utvrđivanje roka od 10 dana potrebno i više boca.
Potpuno dozračeni mineralni medij ulije se u velike boce tako da ispuni oko 1/3 njihove zapremnine. Zatim se u boce doda dovoljna količina radne otopine ispitivane ili referentne kemikalije tako da konačna koncentracija kemikalija uglavnom ne bude viša od 10 mg/l. Kemikalije se ne dodaju u veliku bocu s medijem koji služi kao slijepa proba.
Koncentracija otopljenog kisika u bocama BPK ne smije pasti ispod 0,5 mg/l kako se ne bi ograničila aktivnost inokuluma. Time je koncentracija ispitivane kemikalije ograničena na otprilike 2 mg/l. Ipak, kod slabo razgradivih spojeva i spojeva s niskim TPK može se upotrijebiti i 5 – 10 mg/l. U određenim je slučajevima preporučljivo provesti paralelna ispitivanja s dvije različite koncentracije ispitivane kemikalije, npr. 2 i 5 mg/l. TPK se u pravilu izračunava na temelju tvorbe amonijevih soli, s time da se u očekivanim odnosno poznatim slučajevima nitrifikacije izračun temelji na tvorbi nitrata (TPKNO3: vidjeti Dodatak 2.2.). Ako nastupi nepotpuna nitrifikacija, treba učiniti ispravak za promjene koncentracije nitrita i nitrata utvrđene analizom (vidjeti Dodatak 5.).
Ako se ispituje toksičnost ispitivane kemikalije (npr. ako je prethodno utvrđena niska vrijednost biorazgradnje), potreban je još jedan niz boca.
Potrebno je pripremiti još jednu veliku bocu koja sadrži dozračeni mineralni medij (do oko jedne trećine zapremnine) s ispitivanom i referentnom kemikalijom, čija je konačna koncentracija u pravilu jednaka koncentraciji u drugim velikim bocama.
Otopine u velikim bocama inokuliraju se sekundarnom otpadnom vodom (jedna kap ili oko 0,05 ml do 5 ml/l) ili drugim izvorom, kao što je rječna voda (vidjeti I.6.4.2.). Otopine se na kraju nadopune dozračenim mineralnim medijem uz pomoć crijeva koje seže do dna boce kako bi se postiglo potrebno miješanje.
VI.2.5. Broj boca u tipičnom ispitivanju
U tipičnom se ispitivanju koriste sljedeće boce:
|
— |
najmanje 10 boca koje sadrže ispitivanu kemikaliju i inokulum (ispitna suspenzija), |
|
— |
najmanje 10 boca koje sadrže samo inokulum (slijepa proba inokuluma), |
|
— |
najmanje 10 boca koje sadrže referentnu kemikaliju i inokulum (kontrola postupka), |
|
— |
prema potrebi, šest boca koje sadrže ispitivanu kemikaliju, referentnu kemikaliju i inokulum (kontrola toksičnosti). Ipak, ponekad je za određivanje roka od 10 dana potrebno otprilike dvostruko više boca. |
VI.2.6. Provođenje ispitivanja
Pripremljene otopine se odmah pretoče u odgovarajuće skupine boca BPK pomoću crijeva iz donje četvrtine (ne dna) velikih boca, tako da sve boce BPK budu potpuno napunjene. Nježnim kvrckanjem po stijenki iz boca se uklone mogući mjehurići zraka. Boce se odmah analiziraju na otopljeni kisik u nultom vremenu Winklerovom metodom ili elektrodom. Sadržaj boca može se konzervirati za naknadnu analizu Winklerovom metodom dodavanjem mangan (II) sulfata i natrijevog hidroksida (prvi Winklerov reagens). Pažljivo začepljene boce, koje sadrže kisik fiksiran kao smeđi mangan (III) hidratizirani oksid, treba do nastavka Winklerovog postupka pohraniti u mraku na 10 – 20 °C do najviše 24 sata. Preostale paralelne boce se začepe, pazeći da u njima ne ostanu zarobljeni mjehurići zraka, i inkubiraju u mraku na 20 °C. Na svaki ispitni niz dolazi kompletan paralelni niz za određivanje vrijednosti slijepe probe inokuluma. Tijekom 28-dnevne inkubacije se iz svakog niza u određenim vremenskim razmacima (najmanje jedanput tjedno) uzimaju najmanje po dvije boce radi analize otopljenog kisika.
Tjedni uzorci omogućuju ocjenu postotka opadanja unutar roka od 14 dana, dok bi uzorkovanje svaka 3 do 4 dana trebalo omogućiti da se utvrdi rok od 10 dana, što zahtijeva otprilike dvostruko više boca.
Kod ispitivanih tvari koje sadrže dušik treba učiniti ispravak za potrošnju kisika uslijed nitrifikacije. Za to je potrebno odrediti koncentraciju otopljenog kisika uz pomoć kisikove elektrode i nakon tog uzeti uzorak iz boce BPK za analizu nitrita i nitrata. Potrošnja kisika izračunava se iz povećanja koncentracije nitrita i nitrata (vidjeti Prilog V.).
VI.3. PODACI I IZVJEŠĆIVANJE
VI.3.1. Obrada rezultata
Prvo se izračuna BPK nakon svakog vremenskog razdoblja oduzimanjem potrošnje kisika (mg O2/l) slijepe probe inokuluma od potrošnje kisika ispitivane kemikalije. Ispravljena vrijednost potrošnje podijeli se koncentracijom (mg/l) ispitivane kemikalije da bi se dobio specifični BPK u mg kisika po mg ispitivane kemikalije. Postotak biorazgradivosti izračuna se tako da se specifični BPK podijeli specifičnim TPK (izračunan u skladu s Dodatkom 2.2.) ili KPK (određen analizom, vidjeti Dodatak 2.3.). Dakle:

= mg O2 po mg ispitivane kemikalije
![]()
ili
![]()
Valja napomenuti da ove dvije metode ne daju nužno isti rezultat; prednost se daje prvoj metodi.
Kod ispitivanih tvari koje sadrže dušik treba koristiti odgovarajući TPK (NH4 ili NO3), ovisno o tomu da li se očekuje pojava nitrifikacije (Dodatak 2.2.). Ako je došlo do nepotpune nitrifikacije, izračuna se ispravak za kisik potrošen nitrifikacijom iz promjene koncentracije nitrita i nitrata (Dodatak 5.).
VI.3.2. Valjanost rezultata
Potrošnja kisika u slijepoj probi inokuluma ne bi smjela biti viša od 1,5 mg otopljenog kisika po litri nakon 28 dana. Kod viših vrijednosti treba preispitati pokusne tehnike. Preostala koncentracija kisika u ispitnim bocama niti u jednom trenutku ne smije pasti ispod 0,5 mg/l. Tako niske koncentracije kisika dopuštene su samo ako se primjenjuje metoda određivanja otopljenog kisika kojom se mogu točno mjeriti takve vrijednosti.
Vidjeti također I.5.2.
VI.3.3. Izvješćivanje
Vidjeti I.8.
VI.4. OBRAZAC ZA DOSTAVU PODATAKA
Primjer obrasca za dostavu podataka nalazi se u nastavku.
TEST SA ZATVORENIM BOCAMA
|
1. |
LABORATORIJ |
|
2. |
DATUM POČETKA ISPITIVANJA |
3. ISPITIVANA TVAR
Naziv:
Koncentracija radne otopine: … mg/l
Početna koncentracija u boci: … mg/l
TPK ili KPK: … mg O2/mg ispitivane tvari
4. INOKULUM
Izvor:
Obrada:
Prethodno kondicioniranje, ako se provodi:
Koncentracija u reakcijskoj smjesi: … mg/l
5. ODREĐIVANJE DO
Metoda: Winkler/elektroda
Analize tikvica
|
Vrijeme inkubacije (d) |
DO (mg/l) |
|||||
|
0 |
n1 |
n2 |
|
|||
|
Slijepa proba (bez kemikalije) |
1 |
C1 |
|
|
|
|
|
2 |
C2 |
|
|
|
|
|
|
Srednja vrijednost |
|
|
|
|
|
|
|
Ispitivana kemikalija |
1 |
a1 |
|
|
|
|
|
|
2 |
a2 |
|
|
|
|
|
Srednja vrijednost |
|
|
|
|
|
|
Napomena: Sličan obrazac se može koristiti za referentnu kemikaliju i kontrolu toksičnosti.
6. ISPRAVAK ZA NITRIFIKACIJU (vidjeti Prilog V.)
|
Vrijeme inkubacije (d) |
0 |
n1 |
n2 |
n3 |
||
|
|
|
|
|
||
|
— |
|
|
|
||
|
— |
|
|
|
||
|
|
|
|
|
||
|
— |
|
|
|
||
|
— |
|
|
|
||
|
— |
|
|
|
7. POTROŠNJA DO: % RAZGRADNJE
|
|
Potrošnja nakon n dana (mg/l) |
|||
|
n1 |
n2 |
n3 |
|
|
|
TIKVICA 1: (mto – mtx) – (mbo – mbx) |
|
|
|
|
|
TIKVICA 2: (mto – mtx) – (mbo – mbx) |
|
|
|
|
|
TIKVICA 1:
|
|
|
|
|
|
TIKVICA 2:
|
|
|
|
|
| % D srednja vrijednost (8) =
|
|
|
|
|
|
mto |
= |
vrijednost u tikvici u vremenu 0 |
|
mtx |
= |
vrijednost u tikvici u vremenu x |
|
mbo |
= |
srednja vrijednost slijepe probe u vremenu 0 |
|
mbx |
= |
srednja vrijednost slijepe probe u vremenu x |
Treba primijeniti i ispravak za nitrifikaciju iz iii. + vi. u odjeljku 6.
8. POTROŠNJA DO U SLIJEPOJ PROBI
Potrošnja kisika slijepe probe: (mbo – mb28) mg/l. Ova je potrošnja važna za valjanost ispitivanja. Ona treba biti niža od 1,5 mg/l.
DIO VII. TEST M.I.T.I. (metoda C.4.-F)
VII.1. NAČELO METODE
Potrošnja kisika otopine ili suspenzije ispitivane kemikalije u mineralnom mediju, inokuliranom posebno uzgojenim neprilagođenim mikroorganizmima, mjeri se automatski tijekom 28 dana u zamračenom zatvorenom respirometru na 25 ± 1 °C, uz stalno miješanje. Nastali ugljikov dioksid apsorbira natronsko vapno. Biorazgradivost se izražava kao postotak potrošnje kisika (ispravljen za vrijednost slijepe probe) u odnosu na teoretsku potrošnju (TPK). Osim toga, postotak primarne biorazgradivosti izračunava se iz dopunske specifične kemijske analize učinjene na početku i kraju inkubacije te, fakultativno, analizom DOC-a.
VII.2. OPIS METODE
VII.2.1. Aparatura
|
(a) |
automatski elektrolitički mjerač BPK ili respirometar, u pravilu opremljen sa šest boca po 300 ml s čašama za apsorbens CO2; |
|
(b) |
prostor sa stalnom temperaturom i/ili vodena kupelj 25 ± 1 °C ili bolja; |
|
(c) |
uređaj za membransku filtraciju (fakultativno); |
|
(d) |
analizator ugljika (fakultativno). |
VII.2.2. Priprema mineralnog medija
Pripreme se sljedeće radne otopine s analitički čistim reagensima i vodom (I.6.1.);
|
(a) |
monokalijev dihidrogen ortofosfat, KH2PO4 |
8,50 g |
|
dikalijev monohidrogen ortofosfat, K2HPO4 |
21,75 g |
|
|
dinatrijev monohidrogen ortofosfat dodekahidrat Na2HPO4 12 H2O |
44,60 g |
|
|
amonijev klorid, NH4Cl |
1,70 g |
|
|
Otopiti u vodi i nadopuniti do 1 litre. |
|
|
|
pH vrijednost otopine treba biti 7,2. |
|
|
|
(b) |
magnezijev sulfat heptahidrat, MgSO4 7 H2O |
22,50 g |
|
Otopiti u vodi i nadopuniti do 1 litre. |
|
|
|
(c) |
kalcijev klorid bezvodni, CaCl2 |
27,50 g |
|
Otopiti u vodi i nadopuniti do 1 litre. |
|
|
|
(d) |
Željezo (III) klorid heksahidrat, FeCl3 6 H2O |
0,25 g |
|
Otopiti u vodi i nadopuniti do 1 litre. |
|
Uzme se po 3 ml otopine (a), (b), (c) i (d) i nadopuni do 1 litre.
VII.2.3. Priprema inokuluma
Treba prikupiti svježe uzorke s najmanje deset mjesta, uglavnom s područja gdje se koriste i ispuštaju različite kemikalije. Uzmu se 1-litarski uzorci mulja, površinskog tla, vode itd. s mjesta kao što su postrojenja za pročišćavanje komunalnih i industrijskih otpadnih voda, rijeke, jezera, mora i sve zajedno dobro izmiješa. Nakon uklanjanja plutajućih čestica smjesa se pusti da odstoji i supernatat podesi na pH 7 ± 1 pomoću natrijevog hidroksida ili fosforne kiseline.
Posuda za aktivni mulj sa sistemom punjenja i pražnjenja napuni se odgovarajućom količinom filtriranog supernatata i tekućina dozračuje oko 23 ½ sata. 30 minuta nakon prekida dozračivanja baci se otprilike jedna trećina ukupnog volumena supernatanta i istaloženom materijalu doda isti volumen otopine (pH 7) koja sadrži po 0,1 % glukoze, peptona i monokalijevog ortofosfata te ponovno započne s dozračivanjem. Ovaj se postupak ponavlja jedanput dnevno. Uređajem za mulj treba upravljati u skladu s dobrom praksom: voda treba biti bistra, temperaturu treba održavati na 25 ± 2 °C, pH treba biti 7 ± 1, mulj se mora dobro taložiti, treba osigurati dostatno dozračivanje kako bi smjesa u svakom trenutku bila aerobna, trebaju biti prisutne praživotinje, aktivnost mulja treba provjeravati najmanje jedanput u tri mjeseca uz pomoć referentne tvari. Mulj se može koristiti kao inokulum tek nakon jednog mjeseca rada uređaja te najviše četiri mjeseca od početka rada. Nakon toga treba svaka tri mjeseca, u pravilnim razmacima, uzimati uzorke s najmanje 10 mjesta.
Da bi se svježi i stari mulj održali na istoj razini aktivnosti, filtrirani supernatant aktivnog mulja u uporabi pomiješa se s jednakim volumenom filtriranog supernatanta svježe prikupljene smjese iz deset izvora te se dobivena kombinirana tekućina uzgaja na način kako je opisano gore. Mulj se može upotrijebiti kao inokulum 18 – 24 sata nakon punjenja uređaja.
VII.2.4. Priprema tikvica
Pripremi se šest tikvica:
br. 1: ispitivana kemikalija u vodi za razrjeđivanje 100 mg/l
br. 2, 3 i 4: ispitivana kemikalija u mineralnom mediju 100 mg/l
br. 5: referentna kemikalija (npr. anilin) u mineralnom mediju 100 mg/l
br. 6: samo mineralni medij.
Ispitivane tvari koje su slabo topljive treba izravno dodati u tikvicu na bazi mase ili volumena ili s njima postupati kako je opisano u Dodatku 3., s time da se pritom ne smiju koristiti otapala niti emulgatori. Apsorbens CO2 treba dodati u sve tikvice u čašama koje su za to posebno predviđene. pH u tikvicama br. 2, 3 i 4 treba podesiti na 7,0.
VII.2.5. Provođenje ispitivanja
Tikvice br. 2, 3 i 4 (ispitne suspenzije), br. 5 (kontrola aktivnosti) i br. 6 (slijepa proba inokuluma) inokuliraju se malom količinom inokuluma tako da se dobije koncentracija suspendirane krute tvari od 30 mg/l. Inokulum se ne dodaje u tikvicu br. 1, koja se koristi kao abiotička kontrola. Sastavi se oprema, provjeri zrakonepropusnost, pokrenu mješači i započne s mjerenjem potrošnje kisika u mraku. Temperaturu, mješač i kulometrijski detektor potrošnje kisika treba provjeravati svakodnevno te bilježiti sve promjene u boji sadržaja tikvica. Potrošnju kisika šest tikvica treba izravno očitavati prikladnom metodom, npr. s pisača sa 6 ulaza koji daje krivulju BPK. Na kraju inkubacije, u pravilu 28 dana, izmjeri se pH sadržaja tikvica i odredi koncentracija preostale ispitivane kemikalije i mogućih intermedijera te, u slučaju tvari topljivih u vodi, koncentracija DOC-a (Dodatak 2.4.). Kod hlapljivih je kemikalija nužan poseban oprez. Ako se očekuje nitrifikacija, odredi se koncentracija nitrata i nitrita, ako je to moguće.
VII.3. PODACI I IZVJEŠĆIVANJE
VII.3.1. Obrada rezultata
Potrošnja kisika (mg) ispitivane kemikalije nakon određenog vremena, ispravljena za vrijednost slijepe probe inokuluma nakon istog vremena, podijeli se upotrijebljenom masom ispitivane kemikalije. Na taj se način dobije BPK izražen u mg kisika/mg ispitivane kemikalije tj.:

= mg O2 po mg ispitivane kemikalije
Postotak biorazgradnje se zatim dobije kao:

TPK za smjese izračunava se iz elementarne analize kao kod jednostavnih spojeva. Pritom se koristi odgovarajući TPK (TPKNH4 ili TPKNO3), ovisno o tome je li nitrifikacija izostala ili je nastupila potpuna nitrifikacija (Dodatak 2.2.). Ako je došlo do nepotpune nitrifikacije, izračuna se ispravak za kisik potrošen nitrifikacijom iz promjene koncentracija nitrita i nitrata (Dodatak 5.).
Postotak primarne biorazgradnje izračunava se iz gubitka specifične (polazne) kemikalije (vidjeti I.7.2.).

Ako je u tikvici br. 1, u kojoj se mjeri fizikalno-kemijska razgradnja, došlo do gubitka ispitivane kemikalije, to treba navesti u izvješću i izračunati postotak biorazgradnje iz koncentracije ispitivane kemikalije (Sb) u ovoj tikvici nakon 28 dana.
Ako se određuje DOC (fakultativno), postotak potpune biorazgradnje izračunava se kao:

kako je opisano u točki I.7.1. Ako je u tikvici br. 1, u kojoj se mjeri fizikalno-kemijska razgradnja, došlo do gubitka DOC-a, postotak biorazgradnje izračunava se iz koncentracije DOC-a u ovoj tikvici.
Sve rezultate treba upisati u priložene obrasce za dostavu podataka.
VII.3.2. Valjanost rezultata
Potrošnja kisika slijepe probe inokuluma u pravilu iznosi 20 – 30 mg O2/l i ne bi smjela biti viša od 60 mg/l u 28 dana. Kod vrijednosti iznad 60 mg/l treba kritički preispitati podatke i pokusne tehnike. Ako je pH vrijednost izvan područja 6 – 8,5 i ako je potrošnja kisika ispitivane kemikalije manja od 60 %, ispitivanje treba ponoviti s nižom koncentracijom ispitivane kemikalije.
Vidjeti također I.5.2.
Ispitivanje nije valjano ako postotak razgradnje anilina izračunan iz potrošnje kisika nije viši od 40 % nakon 7 dana i nije viši od 65 % nakon 14 dana.
VII.3.3. Izvješćivanje
Vidjeti I.8.
VII.4. OBRAZAC ZA DOSTAVU PODATAKA
Primjer obrasca nalazi se u nastavku.
TEST MITI (I)
|
1. |
LABORATORIJ |
|
2. |
DATUM POČETKA ISPITIVANJA |
3. ISPITIVANA TVAR
Naziv:
Koncentracija radne otopine: mg/l kao kemikalija
Početna koncentracija u mediju, Co: … mg/l kao kemikalija
Volumen reakcijske smjese, V: … ml
TPK: … mg O2/l
4. INOKULUM
Mjesta uzorkovanja:
|
|
||||
|
|
||||
|
|
||||
|
|
||||
|
|
Koncentracija suspendirane krute tvari u aktivnom mulju nakon aklimatizacije sa sintetičkom otpadnom vodom = … mg/l
Volumen aktivnog mulja po litri konačnog medija = … ml
Koncentracija mulja u konačnom mediju = … mg/l
5. POTROŠNJA KISIKA: BIORAZGRADIVOST
Vrsta respirometra:
|
|
Vrijeme (dani) |
||||||
|
0 |
7 |
14 |
21 |
28 |
|||
|
Potrošnja O2 (mg) ispitivana kemikalija |
a1 |
|
|
|
|
|
|
|
a2 |
|
|
|
|
|
||
|
a3 |
|
|
|
|
|
||
|
Potrošnja O2 (mg) slijepa proba |
b |
|
|
|
|
|
|
|
Ispravljeni BPK (mg) |
(a1 – b1) (a1 – b1) (a1 – b1) |
|
|
|
|
|
|
|
BPK po mg ispitivane kemikalije |
|
Tikvica 1 |
|
|
|
|
|
|
Tikvica 2 |
|
|
|
|
|
||
|
Tikvica 3 |
|
|
|
|
|
||
|
% razgradnje
|
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
||
|
3 |
|
|
|
|
|
||
|
Srednja vrijednost (9) |
|
|
|
|
|
||
Napomena: Slični obrasci se mogu koristiti za referentni spoj.
6. ANALIZA UGLJIKA (fakultativno)
Analizator ugljika:
|
Tikvica |
DOC |
% opadanja DOC-a |
Srednja vrijednost |
|||
|
Izmjereni |
Ispravljeni |
|||||
|
Voda + ispitivana tvar |
a |
|
|
|
— |
— |
|
Mulj + ispitivana tvar |
b1 |
|
b1 – c |
|
|
|
|
Mulj + ispitivana tvar |
b2 |
|
b2 – c |
|
|
|
|
Mulj + ispitivana tvar |
b3 |
|
b3 – c |
|
|
|
|
Slijepa proba |
c |
|
— |
|
— |
— |
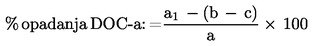
7. PODACI IZ SPECIFIČNE KEMIJSKE ANALIZE
|
|
Preostala količina ispitivane kemikalije na kraju ispitivanja |
% razgradnje |
|
slijepa proba s vodom |
Sb |
|
|
inokulirani medij |
Sa1 |
|
|
Sa2 |
|
|
|
Sa3 |
|
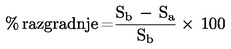
Izračuna se % razgradnje za tikvicu a1 odnosno a3.
8. NAPOMENE
Treba priložiti krivulju BPK u ovisnosti o vremenu, ako je raspoloživa.
Dodatak 1.
SKRAĆENICE I DEFINICIJE
|
DO (Dissolved Oxygen) |
: |
Xotopljeni kisik (mg/l) – koncentracija kisika otopljenog u vodenom uzorku. |
|
BPK |
: |
biokemijska potrošnja kisika (g) – količina kisika koju potroše mikroorganizmi za razgradnju ispitivanog spoja; izražava se i kao g potrošnje kisika po g ispitivanog spoja (vidjeti metodu C.5.). |
|
KPK |
: |
kemijska potrošnja kisika (g) – količina kisika koja se potroši za vrijeme oksidacije ispitivanog spoja vrućim kiselim dikromatom; ona predstavlja mjeru prisutne količine oksidativne tvari; izražava se i kao g potrošenog kisika po g ispitivanog spoja (vidjeti metodu C.6.). |
|
DOC (Dissolved Organic Carbon) |
: |
otopljeni organski ugljik – organski ugljik koji je prisutan u otopini odnosno koji prolazi kroz 0,45-mikrometarski filtar ili ostaje u supernatantu nakon 15-minutnog centrifugiranja na 40 000 m.s–2 (± 4 000 g). |
|
TPK |
: |
Teoretska potrošnja kisika (mg) – ukupna količina kisika potrebna za potpunu oksidaciju kemikalije; izračunava se iz molekulske formule (vidjeti Dodatak 2.2.) i izražava se i kao mg potrebnog kisika po mg ispitivanog spoja. |
|
ThCO2 (Theoretical Carbon Dioxide) |
: |
teoretski ugljikov dioksid (mg) – izračunana količina ugljikovog dioksida koja se dobije iz poznatog ili izmjerenog sadržaja ugljika ispitivanog spoja kod potpune mineralizacije; izražava se i kao mg razvijenog ugljikovog dioksida po mg ispitivanog spoja. |
|
TOC (Total Organic Carbon) |
: |
ukupni organski ugljik – ukupni organski ugljik uzorka je zbroj organskog ugljika u otopini i suspenziji. |
|
IC (Inorganic Carbon) |
: |
anorganski ugljik. |
|
TC (Total Carbon) |
: |
ukupni ugljik – zbroj organskog i anorganskog ugljika u uzorku. |
Primarna biorazgradnja:
promjena kemijske strukture tvari nastala uslijed biološkog djelovanja, koja dovodi do gubitka određenog svojstva tvari.
Potpuna biorazgradnja (aerobna):
stupanj razgradnje koji se postigne kad mikroorganizmi u cijelosti potroše ispitivani spoj, pri čemu nastaje ugljikov dioksid, voda, mineralne soli i novi mikrobni stanični sastojci (biomasa).
Lako biorazgradiv:
proizvoljno razvrstavanje kemikalija koje su prošle utvrđene testove pretraživanja na potpunu biorazradivost; ti su testovi toliko strogi da se može pretpostaviti da će se ti spojevi brzo i potpuno biološki razgraditi u vodnom okolišu u aerobnim uvjetima.
Kojemu je svojstvena biorazgradnja:
razvrstavanje kemikalija čija je biorazgradnja (primarna ili potpuna) nedvojbeno dokazana bilo kojim priznatim testom biorazgradivosti.
Pročistivost:
svojstvo koje pokazuju spojevi koji se daju ukloniti tijekom biološkog pročišćavanja otpadnih voda bez štetnog utjecaja na uobičajeni tijek postupaka pročišćavanja. Općenito, lako biorazgradivi spojevi su pročistivi, ali to ne vrijedi za sve spojeve kojima je svojstvena biorazgradnja. Ovdje mogu djelovati i abiotički procesi.
Vrijeme prilagodbe („lag” faza):
kod testa opadanja, vrijeme od inokulacije do trenutka kad postotak razgradnje dosegne najmanje 10 %. Vrijeme prilagodbe je često jako promjenljivo i slabo obnovljivo.
Vrijeme razgradnje:
vrijeme od kraja vremena prilagodbe do trenutka kad se dosegne 90 % maksimalnog stupnja razgradnje.
Rok od 10 dana:
deset dana neposredno nakon što se postigne 10 %-tna razgradnja.
Dodatak 2.
IZRAČUNAVANJE I ODREĐIVANJE PRIKLADNIH ZBIRNIH PARAMETARA
Potrebni su određeni zbirni parametri, ovisno o odabranoj metodi. U nastavku je opisano kako se izvode te vrijednosti. Korištenje parametara opisano je u okviru pojedinih metoda.
1. Sadržaj ugljika
Sadržaj ugljika izračunava se iz poznatog sastava elemenata ili se određuje elementarnom analizom ispitivane tvari.
2. Teoretska potrošnja kisika (TPK)
Teoretska potrošnja kisika (TPK) može se izračunati, ako je poznat sastav elemenata, ili odrediti elementarnom analizom. Ona je za spoj:
CcHhClclNnNanaOoPpSs
bez nitrifikacije

ili s nitrifikacijom

3. Kemijska potrošnja kisika (KPK)
Kemijska potrošnja kisika (KPK) određuje se u skladu s metodom C.6.
4. Otopljeni organski ugljik (DOC)
Otopljeni organski ugljik (DOC) je prema definiciji organski ugljik bilo koje kemikalije ili smjese u vodi koji prolazi kroz 0,45-mikrometarski filtar.
Uzmu se uzorci iz ispitnih posuda i odmah filtriraju u uređaju za filtraciju uz primjenu odgovarajućeg membranskog filtra. Prvih 20 ml (količina se može smanjiti ako se koriste mali filtri) filtrata se baca. Količine od 10 – 20 ml ili manje, u slučaju ubrizgavanja (volumen ovisi o količini potrebnoj za analizator ugljika), zadržavaju se za analizu ugljika. Koncentracija DOC-a određuje se pomoću analizatora organskog ugljika koji točno mjeri koncentraciju ugljika jednaku ili manju od 10 % početne koncentracije DOC-a koja se koristi u ispitivanju.
Filtrirani uzorci koji se ne mogu analizirati isti radni dan mogu se 48 sati čuvati u hladnjaku na 2 – 4 °C ili ispod – 18 °C u dužem vremenu.
Napomene:
Membranski se filtri često impregniraju površinski aktivnim tvarima kako bi se učinili hidrofilnima. Stoga filtar može sadržavati do nekoliko mg topljivog organskog ugljika koji može ometati određivanje biorazgradivosti. Površinski aktivne tvari i drugi topljivi organski spojevi uklanjaju se iz filtra iskuhavanjem u deioniziranoj vodi tri puta po jedan sat. Filtri se zatim mogu pohraniti u vodi jedan tjedan. Ako se koriste jednokratni filtarski ulošci, kod svake se serije treba uvjeriti da ulošci ne otpuštaju topljivi organski ugljik.
Kod nekih vrsta membranskih filtra može doći do adsorpcije ispitivane kemikalije. Stoga je preporučljivo uvjeriti se da se ispitivana kemikalija ne zadržava na filtru.
Za razlikovanje TOC-a od DOC-a se umjesto filtriranja može koristiti 15-minutno centrifugiranje na 40 000 m.sec–2 (4 000 g). Ova metoda nije pouzdana kod početne koncentracije od < 10 mg DOC/l jer se tada ne uklone sve bakterije ili se ugljik ponovno otopi kao dio bakterijske plazme.
BIBLIOGRAFIJA
|
— |
Standard Methods for the Examination of Water and Wastewater, 12th ed, Am. Pub. Hlth. Ass., Am. Wat. Poll. Control Fed., Oxygen Demand, 1965, P 65. |
|
— |
Wagner, R., Von Wasser, 1976, vol. 46, 139. |
|
— |
DIN-Entwurf 38 409 Teil 41 Deutsche Einheitsverfahren zur Wasser-, Abwasser- und Schlammuntersuchung, Summarische Wirkungs- und Stoffkenngrößen (Gruppe H). Bestimmung des Chemischen Sauerstoffbedarfs (CSB) (H 41), Normenausschuß Wasserwesen (NAW) in DIN Deutsches Institut für Normung e. V. |
|
— |
Gerike, P., The biodegradability testing of poorly water soluble compounds. Chemosphere, 1984, vol 13 (1), 169. |
Dodatak 3.
OCJENJIVANJE BIORAZGRADIVOSTI SLABO TOPLJIVIH TVARI
Kod ispitivanja biorazgradivosti slabo topljivih tvari posebnu pozornost treba obratiti na sljedeće aspekte.
Dok se kod uzorkovanja homogenih tekućina rijetko javljaju problemi, kod krutih se tvari preporučuje homogenizacija odgovarajućim sredstvima kako bi se izbjegle greške zbog nehomogenosti. Posebno treba paziti kad su potrebni reprezentativni uzorci od nekoliko miligrama iz smjesa kemikalija ili tvari s velikim količinama nečistoća.
Tijekom ispitivanja mogu se koristiti različiti oblici miješanja. Važno je miješati samo onoliko koliko je potrebno da kemikalija ostane dispergirana te izbjegavati pregrijavanje, pretjerano pjenjenje i pretjerane smične sile.
Može se koristiti emulgator koji tvori stabilnu disperziju kemikalije. On ne smije biti toksičan za bakterije i ne smije se biološki razgraditi niti izazivati pjenjenje u ispitnim uvjetima.
Za otapala vrijede isti kriteriji kao za emulgatore.
Kod krutih se tvari ne preporučuje uporaba krutih nosača, iako oni mogu biti prikladni za uljaste tvari.
Ako se koriste pomoćne tvari, kao što su emulgatori, otapala i nosači, treba izvesti slijepu probu s pomoćnom tvari.
Kod istraživanja biorazgradivosti slabo topljivih spojeva može se koristiti bilo koji od tri respirometrijska testa: CO2, BPK ili MITI.
LITERATURA
|
— |
de Morsier, A. et al., Biodegradation tests for poorly soluble compounds. Chemosphere, 1987, vol. 16, 833. |
|
— |
Gerike, P, The Biodegradability testing of poorly water soluble compounds. Chemosphere, 1984, vol. 13, 169. |
Dodatak 4.
OCJENJIVANJE BIORAZGRADIVOSTI KEMIKALIJA ZA KOJE SE SUMNJA DA SU TOKSIČNE ZA INOKULUM
Ako se kemikalija podvrgne ispitivanju na laku biorazgradivost i čini se da nije biorazgradiva, preporučuje se da se provede sljedeći postupak, ako se želi utvrditi razlika između inhibicije i inertnosti (Reynolds i sur., 1987.).
Kod toksikoloških testova i testova biorazgradnje treba koristiti slične ili istovjetne inokulume.
Čini se da je za ocjenjivanje toksičnosti kemikalija koje se ispituju na laku biorazgradivost primjereno koristiti jednu od sljedećih metoda: test inhibicije disanja aktivnog mulja – Direktiva 87/302/EEZ, BPK ili test inhibicije rasta ili kombinaciju tih metoda.
Da bi se izbjegla inhibicija zbog toksičnosti, predlaže se da se kod ispitivanja lake biorazgradivosti koriste koncentracije ispitivane tvari ispod 1/10 vrijednosti EC50 (odnosno manje od vrijednosti EC20) dobivenih kod toksikoloških ispitivanja. Spojevi čija je vrijednost EC50 viša od 300 mg/l ne bi trebali imati toksične učinke kod ispitivanja lake biorazgradivosti.
Vrijednosti EC50 ispod 20 mg/l mogu stvarati ozbiljne probleme u kasnijem tijeku ispitivanja. Treba koristiti niske ispitne koncentracije, koje zahtijevaju primjenu strogog i osjetljivog testa sa zatvorenim bocama ili korištenje 14C obilježenog materijala. Aklimatizirani inokulum pruža mogućnost korištenja viših koncentracija ispitivane tvari. Ipak, u ovom posljednjem slučaju gubi se specifični kriterij lake biorazgradivosti.
BIBLIOGRAFIJA
Reynolds, L. et al., Evaluation of the toxicity of substances to be assessed for biodegradability. Chemosphere, 1987, vol. 16, 2259.
Dodatak 5.
ISPRAVAK ZA POTROŠNJU KISIKA ZBOG UTJECAJA NITRIFIKACIJE
Ako se kod ocjenjivanja biorazgradivosti na temelju potrošnje kisika ne uzme u obzir nitrifikacija, kod ispitivanih tvari koje ne sadrže kisik nastat će tek zanemarive greške (ne više od 5 %), čak i ako je oksidacija amonijskog dušika u mediju ispitnih posuda i posuda slijepe probe nepredvidiva. Međutim, ako ispitivana tvar sadrži dušik, mogu nastati ozbiljne greške.
Ako je došlo do nepotpune nitrifikacije, utvrđena potrošnja kisika reakcijske smjese može se ispraviti za količinu kisika koja je upotrijebljena pri oksidaciji amonijaka u nitrit i nitrat, ako se promjene koncentracije nitrita i nitrata tijekom inkubacije određuju pomoću sljedećih jednadžbi:
|
2 NH4Cl + 3 O2 = 2 HNO2 + 2 HCl + 2 H2O |
(1) |
|
2 HNO2 + O2 = 2 HNO3 |
(2) |
|
Ukupno: |
|
|
2 NH4Cl + 4 O2 = 2 HNO3 + 2 HCl + 2 H2O |
(3) |
Iz jednadžbe (1) proizlazi da potrošnja kisika kod oksidacije 28 g dušika iz amonijevog klorida (NH4Cl) u nitrit iznosi 96 g, što odgovara faktoru 3,43 (96/28). Isto tako, iz jednadžbe (3) proizlazi da je potrošnja kisika kod oksidacije 28 g dušika u nitrat 128 g tj. faktor je 4,57 (128/28).
Budući da se radi o slijedu reakcija koje provode različite vrste bakterija, koncentracija nitrita može se povećati ili smanjiti; u ovom posljednjem slučaju nastala bi ekvivalentna koncentracija nitrata. Prema tomu, kisik potrošen u tvorbi nitrata iznosi 4,57 puta povećanje koncentracije nitrata, dok je kisik povezan s tvorbom nitrita 3,43 puta povećanje koncentracije nitrita ili, u slučaju smanjenja koncentracije, gubitak kisika je – 3,43 puta smanjenje koncentracije.
To jest:
|
O2 potrošen u tvorbi nitrata = 4,57 × povećanje koncentracije nitrata |
(4) |
|
i |
|
|
O2 potrošen u tvorbi nitrata = 3,43 × povećanje koncentracije nitrita |
(5) |
|
i |
|
|
O2 izgubljen s nestankom nitrita = – 3,43 × smanjenje koncentracije nitrata |
(6) |
|
tako da je |
|
|
potrošnja O2 uslijed nitrifikacije = ± 3,43 × promjena konc. nitrita + 4,57 × povećanje konc. nitrata |
(7) |
|
i prema tomu |
|
|
potrošnja O2 uslijed oksidacije C = ukupna utvrđena potrošnja – potrošnja uslijed nitrifikacije |
(8). |
Ako se umjesto toga određuje samo ukupni oksidirani N, može se uzeti da je potrošnja kisika uslijed nitrifikacije, kao prva aproksimacija, 4,57 × povećanje oksidiranog N.
Vrijednost ispravljena za potrošnju kisika uslijed oksidacije C se zatim uspoređuje s TPK NH3 izračunanim u skladu s Dodatkom 2.
C.5. RAZGRADNJA – BIOKEMIJSKA POTROŠNJA KISIKA
1. METODA
1.1. UVOD
Svrha metode je mjerenje biokemijske potrošnje kisika (BPK) krutih i tekućih organskih tvari.
Podaci koji se dobivaju ovim testom vrijede za spojeve topljive u vodi; ipak, mogu se, barem načelno, ispitivati i hlapljivi spojevi i spojevi koji su slabo topljivi u vodi.
Metoda je primjenljiva samo kod organskih tvari koje u koncentraciji koja se koristi u ispitivanju nemaju inhibitorni učinak na bakterije. Ako ispitivana tvar nije topljiva u ispitnoj koncentraciji, ponekad je potrebno primijeniti posebne mjere, kao što je ultrazvučno raspršivanje, kako bi se postigla dobra disperzija ispitivane tvari.
Informacije o toksičnosti kemikalije mogu biti korisne za tumačenje niskih vrijednosti i odabir odgovarajućih ispitnih koncentracija.
1.2. DEFINICIJA I JEDINICE
BPK je definiran kao masa otopljenog kisika koja je potrebna za biokemijsku oksidaciju određenog volumena otopine tvari u propisanim uvjetima.
Rezultati se izražavaju u gramima BPK po gramu ispitivane tvari.
1.3. REFERENTNE TVARI
Poželjno je koristiti prikladnu referentnu tvar za provjeru aktivnosti inokuluma.
1.4. NAČELO ISPITNE METODE
Unaprijed određena količina tvari, otopljena ili dispergirana u dobro dozračenom prikladnom mediju, inokulira se mikroorganizmima i inkubira u mraku na definiranoj stalnoj temperaturi okolnog zraka.
BPK se određuje na temelju razlike između sadržaja otopljenog kisika na početku i kraju ispitivanja. Ispitivanje traje najmanje 5 i najviše 28 dana.
Paralelno treba izvesti slijepu probu bez ispitivane tvari.
1.5. KRITERIJI KAKVOĆE
Određivanje BPK ne može se smatrati valjanim određivanjem biorazgradivosti tvari. Ovaj se test može smatrati tek testom pretraživanja.
1.6. OPIS ISPITNE METODE
Pripremi se preliminarna otopina ili disperzija tvari tako da se dobije koncentracija BPK u skladu s metodom koja se primjenjuje. BPK se zatim odredi pomoću bilo koje prikladne nacionalne ili međunarodne normirane metode.
2. PODACI I VREDNOVANJE
BPK sadržan u preliminarnoj otopini izračunava se u skladu s odabranom standardnom metodom i pretvara u grame BPK po gramu ispitivane tvari.
3. IZVJEŠĆIVANJE
Treba navesti primijenjenu metodu.
Biokemijska potrošnja kisika predstavlja srednju vrijednost najmanje tri valjana mjerenja.
Potrebno je navesti sve podatke i napomene bitne za tumačenje rezultata, posebno u pogledu nečistoća, fizikalnog stanja, toksičnih učinaka i svojstvenog sastava tvari koji mogu utjecati na rezultate.
Ako se koristi dodatak za inhibiciju biološke nitrifikacije, to također treba navesti.
4. REFERENCE
Popis normiranih metoda, npr.:
|
|
NF T 90-103: Determination of the biochemical oxygen demand. |
|
|
NBN 407: Biochemical oxygen demand. |
|
|
NEN 32355.4: Bepaling van het biochemish zuurstofverbruik (BZV). |
|
|
The determination of biochemical oxygen demand, Methods for the examination of water and associated materials, HMSO, London. |
|
|
ISO 5815: Determination of biochemical oxygen demand after n days. |
C.6. RAZGRADNJA – KEMIJSKA POTROŠNJA KISIKA
1. METODA
1.1. UVOD
Svrha metode je mjerenje kemijske potrošnje kisika (KPK) krutih i tekućih organskih tvari na standardni proizvoljan način u definiranim laboratorijskim uvjetima.
Za provedbu ovog testa i tumačenje dobivenih rezultata korisno je imati podatke o formuli tvari (npr. halogene soli, željezove soli organskih spojeva, organoklorovi spojevi).
1.2. DEFINICIJE I JEDINICE
Kemijska potrošnja kisika je mjera oksidativnosti tvari, izražena kao ekvivalentna količina kisika iz oksidirajućeg reagensa koju potroši tvar u definiranim laboratorijskim uvjetima.
Rezultat se izražava u gramima KPK po gramu ispitivane tvari.
1.3. REFERENTNE TVARI
Kod ispitivanja novih tvari nije uvijek potrebno koristiti referentne tvari. One prvenstveno služe za povremeno baždarenje metode i trebaju omogućiti usporedbu rezultata kod primjene neke druge metode.
1.4. NAČELO ISPITNE METODE
Unaprijed određena količina tvari, otopljena ili dispergirana u vodi, oksidira se kalijevim dikromatom u jakom mediju sumporne kiseline pod refluksom uz primjenu srebrovog sulfata kao katalizatora u trajanju od dva sata. Preostali dikromat određuje se titracijom sa standardiziranim željezovim amonijevim sulfatom.
U slučaju tvari koje sadrže klor dodaje se živin sulfat (10) kako bi se smanjo utjecaj klora.
1.5. KRITERIJI KAKVOĆE
Zbog proizvoljnog načina određivanja KPK je „pokazatelj oksidativnosti” te se kao takav koristi kao praktična metoda mjerenja organske tvari.
Kloridi mogu ometati ovo ispitivanje; anorganska redukcijska i oksidacijska sredstva mogu također ometati određivanje KPK.
Neki ciklički spojevi i mnoge hlapljive tvari (npr. niže masne kiseline) ne oksidiraju se u potpunosti u ovom testu.
1.6. OPIS ISPITNE METODE
Pripremi se preliminarna otopina ili disperzija tvari tako da se dobije KPK između 250 i 600 mg po litri.
Napomene:
U slučaju slabo topljivih i nedisperzivnih tvari može se izvagati određena količina fine praškaste ili tekuće tvari koja otprilike odgovara 5 mg KPK i staviti u pokusnu aparaturu s vodom.
Kemijska potrošnja kisika (KPK) često se određuje pomoću inačice metode tj. u zatvorenom sustavu s izjednačavanjem tlaka (H. Kelkenberg, 1975.), koja je posebno korisna kod slabo topljivih tvari. Ovom se inačicom spojevi koji se teško određuju konvencionalnim postupkom, npr. octena kiselina, često uspješno kvantificiraju. Ipak, ni ova metoda nije uspješna u slučaju piridina. Povećanjem koncentracije kalijevog dikromata na 0,25 N (0,0416 M), kako je propisano u (1), olakšava se izravnu odvagu 5 – 10 mg tvari, što je jako važno kod određivanja KPK tvari koje su slabo topljive u vodi (2).
U protivnom se KPK određuje bilo kojom prikladnom nacionalnom ili međunarodnom normiranom metodom.
2. PODACI I OCJENJIVANJE
KPK u pokusnoj tikvici izračunava se pomoću odabrane standardizirane metode i pretvara u grame KPK po gramu ispitivane tvari.
3. IZVJEŠĆIVANJE
Treba navesti primijenjenu metodu.
Kemijska potrošnja kisika predstavlja srednju vrijednost najmanje tri mjerenja. Potrebno je navesti sve informacije i napomene bitne za tumačenje rezultata, posebno u pogledu nečistoća, fizikalnog stanja i unutarnjih svojstava tvari (ako su poznata) koja mogu utjecati na rezultate.
Ako se koristi živin sulfat za smanjivanje utjecaja klorida, to također treba navesti.
4. REFERENCE
|
(1) |
Kelkenberg, H.,Z. von Wasser und Abwasserforschung, 1975, vol. 8, 146. |
|
(2) |
Gerike, P. The biodegradability testing of poorly water soluble compounds. Chemosphere, 1984, vol. 13,169. Popis normiranih metoda npr.:
|
C.7. RAZGRADNJA – ABIOTIČKA RAZGRADNJA: HIDROLIZA KAO FUNKCIJA PH
1. METODA
Ova ispitna metoda istovjetna je smjernici OECD TG 111 (2004.).
1.1. UVOD
Kemikalije mogu ući u površinske vode različitim putevima, kao što je izravna primjena, rasap, otjecanje, ocjeđivanje, odlaganje otpada, poljoprivredne, industrijske i komunalne otpadne vode ili atmosfersko taloženje, i u tim vodama sudjelovati u procesima kemijske (npr. hidroliza, oksidacija), fotokemijske i/ili mikrobe pretvorbe. Ova smjernica opisuje laboratorijsku ispitnu metodu za ocjenjivanje abiotičkih hidrolitičkih pretvorbi kemikalija u vodenim sustavima pri pH vrijednostima koje se obično javljaju u okolišu (pH 4 – 9), a temelji se na postojećim smjernicama (1)(2)(3)(4)(5)(6)(7).
Pokusima se određuje i. brzina hidrolize ispitivane tvari kao funkcija pH i ii. identitet odnosno vrsta i brzina tvorbe i razgradnje proizvoda hidrolize kojima organizmi mogu biti izloženi. Ovakva se istraživanja mogu zahtijevati za kemikalije koje se izravno unose u vodu ili koje mogu dospjeti u okoliš nekim drugim od gore navedenih puteva.
1.2. DEFINICIJE I JEDINICE
Vidjeti Dodatak 2.
1.3. PRIMJENLJIVOST METODE
Metoda se općenito primjenjuje kod kemikalija (neobilježene i obilježene) za koje postoji dovoljno točna i osjetljiva analitička metoda. Ona se može primijeniti na blago hlapljive i nehlapljive spojeve koji su dovoljno topljivi u vodi. Test ne treba primjenjivati u slučaju kemikalija koje su jako hlapljive iz vode (npr. fumiganti, organska otapala) te se stoga ne mogu zadržati u otopini u pokusnim uvjetima ovog testa. Provedba ispitivanja može biti otežana ako se ispituju tvari koje su minimalno topljive u vodi (8).
1.4. NAČELO ISPITNE METODE
Sterilne vodene puferske otopine različitih pH vrijednosti (pH 4, 7 i 9) obrade se ispitivanom tvari i inkubiraju u mraku u kontroliranim laboratorijskim uvjetima (pri stalnim temperaturama). Puferske se otopine u odgovarajućim vremenskim razmacima analiziraju na ispitivanu tvar i proizvode hidrolize. Bilancu mase lakše je utvrditi kod obilježenih ispitivanih tvari (npr. 14C).
Ova se metoda ispitivanja temelji na višerazinskom pristupu, koji je prikazan i objašnjen u Dodatku 1. Svaka razina uvjetovana je rezultatima prethodne razine.
1.5. INFORMACIJE O ISPITIVANOJ TVARI
Za mjerenje brzine hidrolize mogu se koristiti neobilježene ili obilježene ispitivane tvari. Obilježenom se materijalu općenito daje prednost kod proučavanja puta hidrolize i određivanja bilance mase, iako u posebnim slučajevima označivanje nije bezuvjetno potrebno. Preporučuje se 14C obilježavanje, ali korisna je i primjena drugih izotopa kao što su 13C, 15N, 3H. Ako je to moguće, oznaku treba staviti na najstabilni dio odnosno dijelove molekule. Primjerice, ako ispitivana tvar sadrži jedan prsten, oznaka se mora staviti na taj prsten; ako ispitivana tvar sadrži dva ili više prstenova, ponekad je potrebno provesti posebna istraživanja kako bi se ocijenila sudbina svakog obilježenog prstena i dobile potrebne informacije o tvorbi proizvoda hidrolize. Čistoća ispitivane tvari treba biti najmanje 95 %.
Prije hidrolitičkog ispitivanja trebaju biti raspoložive sljedeće informacije o ispitivanoj tvari:
|
(a) |
topljivost u vodi (ispitna metoda A.6.); |
|
(b) |
topljivost u organskim otapalima; |
|
(c) |
tlak pare (ispitna metoda A.4.) i/ili konstanta Henryjevog zakona; |
|
(d) |
podjelni koeficijent n-oktanol/voda (ispitna metoda A.8.); |
|
(e) |
konstanta disocijacije (pKa) (smjernica OECD 112) (9); |
|
(f) |
brzina izravne i neizravne fotokemijske pretvorbe u vodi, prema potrebi. |
Trebaju biti raspoložive analitičke metode za kvantifikaciju ispitivane tvari te, prema potrebi, identificiranje i kvantifikaciju proizvoda hidrolize u vodenim otopinama (vidjeti također odjeljak 1.7.2.).
1.6. REFERENTNE TVARI
Gdje god je to moguće, treba koristiti referentne tvari za identificiranje i kvantifikaciju proizvoda hidrolize spektroskopskim i kromatografskim metodama ili drugim metodama prikladne osjetljivosti.
1.7. KRITERIJI KAKVOĆE
1.7.1. Iskorištenje
Prve naznake ponovljivosti analitičke metode i uspješnosti jednolike primjene ispitivane tvari mogu se dobiti analizom najmanje dvije paralelne puferske otopine ili njihovih ekstrakata neposredno nakon dodavanja ispitivane tvari. Iskorištenje u kasnijim fazama pokusa proizlazi iz odgovarajućih bilanci mase (ako se koristi obilježeni materijal). Iskorištenje bi se kod obilježenih i neobilježenih kemikalija trebalo kretati u području od 90 % do 110 % (7). Ako je ovo područje tehnički teško postići, kod neobilježenih je kemikalija prihvatljivo iskorištenje od 70 %, ali u tom slučaju treba navesti odgovarajuće obrazloženje.
1.7.2. Ponovljivost i osjetljivost analitičke metode
Ponovljivost analitičke metode odnosno metoda koje se koriste za kvantifikaciju ispitivane tvari i proizvoda hidrolize u kasnijim fazama može se provjeriti dvostrukom analizom istih puferskih otopina (ili njihovih ekstrakata) nakon što nastanu dovoljne količine proizvoda hidrolize za kvantifikaciju.
Analitička metoda treba biti dovoljno osjetljiva za kvantifikaciju koncentracija ispitivane tvari na razini 10 % ili manje početne koncentracije. Ako je to relevantno, analitičke metode također trebaju biti dovoljno osjetljive za kvantifikaciju svih proizvoda hidrolize koji čine 10 % ili više primijenjene koncentracije (u bilo kom trenutku tijekom istraživanja) na razini 25 % ili manje njihove vršne koncentracije.
1.7.3. Intervali pouzdanosti za kinetičke podatke o hidrolizi
Intervale pouzdanosti treba izračunati i prikazati za sve koeficijente regresije, konstante brzine, vremena poluraspada i sve duge kinetičke parametre (npr. DT50).
1.8. OPIS ISPITNE METODE
1.8.1. Oprema i aparatura
Istraživanje treba provesti u staklenim posudama (npr. epruvete, male tikvice), po potrebi u mraku i u sterilnim uvjetima, osim ako preliminarni podaci (kao što je podjelni koeficijent n-oktanol/voda) ukazuju na to da ispitivana tvar prianja na staklo. U tom slučaju treba razmisliti o primjeni alternativnih materijala (kao što je teflon). Problem prianjanja na staklo se osim toga može ublažiti primjenom jedne ili više sljedećih metoda:
|
— |
određivanjem mase ispitivane tvari i proizvoda hidrolize sorbiranih na ispitnu posudu, |
|
— |
korištenjem ultrazvučne kupelji, |
|
— |
pranjem svog staklenog posuđa otapalom u svakom intervalu uzorkovanja, |
|
— |
korišenjem formuliranih proizvoda, |
|
— |
korištenjem veće količine suotapala za dodavanje ispitivane tvari u sustav; ako se koristi suotapalo, to treba biti otapalo koje ne hidrolizira ispitivanu tvar. |
Za inkubaciju različitih ispitnih otopina uglavnom su potrebne tresilice u vodenoj kupelji s regulacijom temperature ili inkubatori s termostatom.
Potrebna je standardna laboratorijska oprema, posebno:
|
— |
mjerač pH vrijednosti, |
|
— |
analitički instrumenti, kao što su oprema za GC, HPLC, TLC, uključujući odgovarajuće detekcijske sustave za analiziranje radioaktivno obilježenih i neobilježenih tvari ili inverznu metodu razrjeđenja izotopa, |
|
— |
instrumenti za potrebe identifikacije (npr. MS, GC-MS, HPLC-MS, NMR itd.), |
|
— |
tekućinski scintilacijski brojač, |
|
— |
ljevci za odjeljivanje kod ekstrakcije tekuće-tekuće, |
|
— |
instrumenti za koncentriranje otopina i ekstrakata (npr. rotacijski isparivač), |
|
— |
uređaj za regulaciju temperature (npr. vodena kupelj). |
Kemijski reagensi, uključuju npr.:
|
— |
organska otapala, analitički čista, npr. heksan, diklormetan itd., |
|
— |
scintilacijsku tekućinu, |
|
— |
puferske otopine (za pojedinosti vidjeti odjeljak 1.8.3.). |
Svo stakleno posuđe, analitički čista voda i puferske otopine koje se koriste kod hidrolitičkih ispitivanja trebaju biti sterilizirani.
1.8.2. Primjena ispitivane tvari
Ispitivana se tvar dodaje u različite puferske otopine u obliku vodene otopine (vidjeti Dodatak 3.). Ako je to nužno za postizanje dostatnog otapanja, dopuštena je uporaba malih količina otapala mješljivih s vodom (kao što je acetonitril, aceton, etanol) za primjenu i razdiobu ispitivane tvari, ali ona u pravilu ne bi smjela prijeći 1 % v/v. Ako se razmatra uporaba više koncentracije otapala (npr. u slučaju slabo topljivih ispitivanih tvari), ona se može dopustiti samo ako se dokaže da otapalo nema utjecaja na hidrolizu ispitivane tvari.
Korištenje formuliranih proizvoda načelno se ne preporučuje, budući da se ne može isključiti utjecaj sastojaka formulacije na proces hidrolize. Ipak, u slučaju ispitivanih tvari koje su slabo topljive u vodi i tvari koje prianjaju na staklo (vidjeti odjeljak 1.8.1.) korištenje formuliranog materijala može biti prikladna alternativa.
Treba koristiti jednu koncentraciju ispitivane tvari; ona ne smije biti viša od 0,01 M ili pola koncentracije zasićenja (vidjeti Dodatak 1.).
1.8.3. Puferske otopine
Hidrolitičko ispitivanje treba provoditi pri pH vrijednosti 4, 7 i 9. U tu svrhu treba pripremiti puferske otopine s analitički čistim kemikalijama i vodom. Neki korisni puferski sustavi prikazani su u Dodatku 3. Valja napomenuti da primijenjeni puferski sustav može utjecati na brzinu hidrolize; ako se uoče ovakve pojave, treba primijeniti alternativni puferski sustav (11).
pH svake puferske otopine treba provjeriti baždarenim mjeračem pH vrijednosti s preciznošću od najmanje 0,1 na traženoj temperaturi.
1.8.4. Ispitni uvjeti
1.8.4.1. Ispitna temperatura
Hidrolitičke pokuse treba provoditi na stalnoj temperaturi. Za potrebe ekstrapolacije važno je održavati temperaturu barem u granicama ± 0,5 °C.
Ako je hidrolitičko ponašanje ispitivane tvari nepoznato, treba obaviti preliminarno ispitivanje (1. razina) na temperaturi od 50 °C. Kinetička ispitivanja više razine treba provoditi na najmanje tri temperature (uključujući ispitivanje na 50 °C), osim ako je ispitivanje 1. razine pokazalo da je ispitivana tvar hidrolitički stabilna. Preporučeno temperaturno područje je 10 – 70 °C (po mogućnosti s najmanje jednom temperaturom ispod 25 °C), što obuhvaća temperaturu izvješćivanja od 25 °C i većinu temperatura koje se pojavljuju u praksi.
1.8.4.2. Svjetlost i kisik
Sva hidrolitička ispitivanja treba obaviti prikladnim metodama kako bi se izbjegli fotolitički učinci. Osim toga, treba provesti sve prikladne mjere da se izbjegne stvaranje kisika (npr. 5-minutno upuhivanje helija, dušika ili argona prije pripreme otopine).
1.8.4.3. Trajanje ispitivanja
Preliminarno ispitivanje treba trajati 5 dana, dok ispitivanja više razine treba provoditi dok se ne postigne 90 %-tna hidroliza ispitivane tvari ili 30 dana, ovisno o tome što je kraće.
1.8.5. Provođenje ispitivanja
1.8.5.1. Preliminarno ispitivanje (1. razina)
Preliminarno se ispitivanje provodi na temperaturi 50 ± 0,5 °C i uz pH 4,0, 7,0 i 9,0. Ako je nakon 5 dana hidroliza manja od 10 % (t0,5 25 °C > 1 godina), ispitivana se tvar smatra hidrolitički stabilnom i u pravilu nije potrebno dodatno ispitivanje. Ako je poznato da je tvar nestabilna na okolišno relevantnim temperaturama (12), preliminarno ispitivanje nije potrebno. Analitička metoda mora biti dovoljno precizna i osjetljiva da može otkriti 10 %-tno smanjenje početne koncentracije.
1.8.5.2. Hidroliza nestabilnih tvari (2. razina)
Ispitivanje više razine (napredno ispitivanje) treba provesti s pH vrijednostima pri kojima se ispitivana tvar pokazala nestabilnom u preliminarnom ispitivanju. Puferske otopine ispitivane tvari treba termostatski održavati na odabranim temperaturama. Kod ispitivanja reakcija prvog reda svaku reakcijsku otopinu treba analizirati u vremenskim razmacima koji omogućuju da se dobije najmanje šest razmaknutih točaka podataka, u pravilu između 10 % i 90 % hidrolize ispitivane tvari. Treba uzeti paralelne ispitne uzorke (najmanje dva uzorka iz odvojenih reakcijskih posuda) i sadržaj analizirati u najmanje šest vremena uzorkovanja (za najmanje dvanaest točaka podataka ponavljanja). Smatra se da nije dovoljno koristiti jedan zbirni uzorak iz kojega se vade pojedinačni alikvoti ispitne otopine u svakom intervalu uzorkovanja jer u tom slučaju nije moguća analiza varijabilnosti podataka, a usto se može pojaviti i problem onečišćenja ispitne otopine. Ispitivanja za potvrdu sterilnosti treba provesti na kraju ispitivanja više razine (tj. na 90 % hidrolize ili 30 dana). Ipak, ako nije uočena razgradnja (tj. pretvorba), smatra se da ispitivanja sterilnosti nisu potrebna.
1.8.5.3. Identifikacija proizvoda hidrolize (3. razina)
Odgovarajućim analitičkim metodama treba identificirati sve značajne proizvode hidrolize, a barem one koji čine > 10 % primijenjene doze.
1.8.5.4. Dodatna ispitivanja
Kod ispitivanja hidrolitički nestabilnih tvari ponekad je potrebno provesti dodatna ispitivanja uz pH vrijednosti različite od 4, 7 i 9. Primjerice, kod ispitivanja u fiziološke svrhe ponekad su potrebni kiseliji uvjeti (npr. pH 1,2), uz primjenu jedne fiziološki relevantne temperature (37 °C).
2. PODACI
Količine ispitivane tvari i hidrolitičkih proizvoda (ako je to relevantno) navode se u postocima primijenjene početne koncentracije te, prema potrebi, u mg/l za svaki interval uzorkovanja i za svaki pH i ispitnu temperaturu. Osim toga, ako se koristi obilježena ispitivana tvar, treba navesti bilancu mase u postotku primijenjene početne koncentracije.
U izvješću treba dati grafički prikaz logaritamski transformiranih podataka koncentracija ispitivane tvari u vremenu. Potrebno je identificirati sve značajne proizvode hidrolize, ili barem one koji čine ≥ 10 % primijenjene doze te dati grafički prikaz njihovih logaritamski transformiranih koncentracija na isti način kao za polaznu tvar tako da budu vidljive brzine tvorbe i razgradnje.
2.1. OBRADA REZULTATA
Točnije određivanje vremena poluraspada i vrijednosti DT50 trebalo bi se postići izračunima uz pomoć odgovarajućih kinetičkih modela. U izvješću treba navesti vrijeme poluraspada i/ili vrijednosti DT50 (uključujući granice pouzdanosti) za svaki pH i temperaturu, zajedno s opisom primijenjenog modela, redom kinetike i koeficijentom određivanja (r2). Prema potrebi, te izračune treba provesti i za proizvode hidrolize.
U slučaju istraživanja brzine na različitim temperaturama, konstante brzine hidrolize pseudo prvog reda (kobs) treba opisati kao funkciju temperature. Izračun se temelji na podjeli kobs na konstante brzine za kiselinski kataliziranu, neutralnu i bazično kataliziranu hidrolizu (kH, kneutral i kOH) i na Arrheniusovoj jednadžbi:

gdje su Ai i Bi regresijske konstante odsječka odnosno nagiba najboljih pravaca dobivenih linearnom regresijom ln ki prema recipročnoj vrijednosti apsolutne temperature u kelvinima (T). Primjenom Arhheniusovih odnosa za kiselinski kataliziranu, neutralnu i bazično kataliziranu hidrolizu mogu se izračunati konstante brzine pseudo prvog reda, a time i vrijeme poluraspada za druge temperature kod kojih nije moguće izravno određivanje konstante brzine pokusom (10).
2.2. VREDNOVANJE I TUMAČENJE REZULTATA
Većina hidrolitičkih reakcija prati prividne brzine reakcije prvog reda te je prema tomu vrijeme poluraspada neovisno o koncentraciji (vidjeti jednadžbu 4 u Dodatku 2.). To obično omogućava primjenu laboratorijskih rezultata dobivenih pri 10-2 do 10-3 M na uvjete okoliša (≤ 10-6 M) (10). Mabey i Mill dali su nekoliko primjera dobre podudarnosti između brzina hidrolize za različite kemikalije izmjerenih u čistim i prirodnim vodama (11), ako su izmjereni i pH i temperatura.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju sadrži barem sljedeće informacije:
ispitivana tvar:
|
— |
trivijalni naziv, kemijski naziv, CAS broj, strukturna formula (uz naznaku položaja oznake, ako se koristi radioaktivno obilježeni materijal) i relevantna fizikalno-kemijska svojstva (vidjeti odjeljak 1.5.), |
|
— |
čistoća (nečistoće) ispitivane tvari, |
|
— |
čistoća oznake obilježene kemikalije i molarna aktivnost (prema potrebi). |
|
— |
Puferske otopine: |
|
— |
datumi i pojedinosti pripreme, |
|
— |
upotrijebljeni puferi i voda, |
|
— |
molarnost i pH puferskih otopina. |
Ispitni uvjeti:
|
— |
datumi provođenja istraživanja, |
|
— |
primijenjena količina ispitivane tvari, |
|
— |
metoda primjene i otapala (vrsta i količina) korištena za primjenu ispitivane tvari, |
|
— |
volumen inkubiranih puferiranih otopina ispitivane tvari, |
|
— |
opis korištenog inkubacijskog sustava, |
|
— |
pH i temperatura tijekom istraživanja, |
|
— |
vremena uzorkovanja, |
|
— |
metoda(-e) ekstrakcije, |
|
— |
metode kvantifikacije i identifikacije ispitivane tvari i njezinih proizvoda hidrolize u puferskim otopinama, |
|
— |
broj ponavljanja. |
Rezultati:
|
— |
ponovljivost i osjetljivost primijenjenih analitičkih metoda, |
|
— |
iskorištenje (% za valjano istraživanje navedeni su u odjeljku 1.7.1.), |
|
— |
podaci ponavljanja i srednje vrijednosti u tabličnom obliku, |
|
— |
bilanca mase za vrijeme i na kraju istraživanja (ako se koristi obilježena ispitivana tvar), |
|
— |
rezultati preliminarnog ispitivanja, |
|
— |
rasprava i tumačenje rezultata, |
|
— |
svi izvorni podaci i slike. |
Sljedeće su informacije potrebne samo ako se određuje brzina hidrolize:
|
— |
grafički prikazi koncentracije u vremenu za ispitivane tvari te, prema potrebi, za proizvode hidrolize pri svakoj pH vrijednosti i temperaturi, |
|
— |
tablice rezultata Arrheniusove jednadžbe za temperaturu 20 °C/25 °C s pH, konstantom brzine (h-1 ili dan-1), vremenom poluraspada ili DT50, temperaturama (°C), uključujući granice pouzdanosti i koeficijente korelacije (r2) ili usporedive podatke, |
|
— |
predloženi put hidrolize. |
4. REFERENCE
|
(1) |
OECD, (1981) Hydrolysis as a Function of pH. OECD Guideline for Testing of Chemicals No 111, adopted 12 May 1981. |
|
(2) |
US-Environmental Protection Agency, (1982) 40 CFR 796.3500, Hydrolysis as a Function of pH at 25 °C. Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate. |
|
(3) |
Agriculture Canada, (1987) Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada. |
|
(4) |
Europska Unija (EU), (1995) Direktiva Komisije 95/36/EZ o izmjeni Direktive Vijeća 91/414/EEZ o stavljanju na tržišta proizvoda za zaštitu biljaka. Prilog V.: Opstanak i ponašanje u okolišu. |
|
(5) |
Dutch Commission for Registration of Pesticides, (1991) Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air. |
|
(6) |
BBA, (1980) Merkblatt No 55, Teil I und II: Prüfung des Verhaltens von Pflanzenbehandlungsmitteln im Wasser (October 1980). |
|
(7) |
SETAC, (1995) Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed. |
|
(8) |
OECD, (2000) Guidance document on aquatic toxicity testing of difficult substances and mixtures, OECD Environmental Health and Safety Publications Series on Testing and Assessment No 23. |
|
(9) |
OECD, (1993) Guidelines for the Testing of Chemicals. Paris. OECD (1994-2000): Addenda 6-11 to Guidelines for the Testing of Chemicals. |
|
(10) |
Nelson, H, Laskowski D, Thermes S, and Hendley P., (1997) Recommended changes in pesticide fate study guidelines for improving input to computer models. (Text version of oral presentation at the 14th Annual Meeting of the Society of Environmental Toxicology and Chemistry, Dallas TX, November 1993). |
|
(11) |
Mabey, W. and Mill, T., (1978) Critical review of hydrolysis of organic compounds in water under environmental conditions. J. Phys. Chem. Ref. Data 7, str. 383-415. |
Dodatak 1.
Višerazinska shema hidrolitičkog testa

Dodatak 2.
Definicije i jedinice
U svim slučajevima treba koristiti jedinice Međunarodnog sustava jedinica (SI).
Ispitivana tvar: bilo koja tvar, bilo da se radi o polaznom spoju ili relevantnim proizvodima pretvorbe.
Proizvodi pretvorbe: sve tvari koje nastaju u biotičkim ili abiotičkim reakcijama pretvorbe ispitivane tvari.
Proizvodi hidrolize: sve tvari koje nastaju u reakcijama hidrolitičke pretvorbe ispitivane tvari.
Hidroliza: reakcija ispitivane tvari RX s vodom kod koje u središtu reakcije dolazi do neto zamjene skupine X s OH:
|
RX + HOH → ROH + HX |
[1] |
Brzina opadanja koncentracije RX u ovom pojednostavnjenom procesu izražava se kao
|
brzina = k [H2O] [RX] |
reakcija drugog reda |
|
ili |
|
|
brzina = k [RX] reakcija prvog reda |
ovisno o koraku koji određuje brzinu. |
Budući da količina vode obilato premašuje količinu ispitivane tvari, ova se vrsta reakcije obično opisuje kao reakcija pseudo prvog reda, gdje se utvrđena konstanta brzine izražava kao odnos
|
kobs = k [H2O] |
[2] |
i može se odrediti iz izraza (13)
|
|
[3] |
gdje je:
|
t |
= |
vrijeme |
|
Co, Ct |
= |
koncentracije RX u vremenu 0 i t. |
Jedinice ove konstante imaju dimenzije (vrijeme)-1, a vrijeme poluraspada reakcije (vrijeme potrebno za reakciju 50 % RX) izražava se kao
|
|
[4] |
Vrijeme poluraspada: (t0,5) vrijeme potrebno za 50 %-tnu hidrolizu ispitivane tvari, ako se reakcija može opisati kinetikom prvog reda; ono je neovisno o koncentraciji.
DT50 (vrijeme nestajanja 50): vrijeme u kojemu se koncentracija ispitivane tvari smanji za 50 %; ono je različito od vremena poluraspada t0,5 ako reakcija ne prati kinetiku prvog reda.
Procjena k na različitim temperaturama
Ako su konstante brzine poznate za dvije temperature, konstante brzine pri drugim temperaturama mogu se izračunati pomoću Arrheniusove jednadžbe:
![]() sau
sau 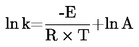
Grafičkim prikazom ln k u ovisnosti o 1/T dobije se pravac s nagibom - E/R
gdje je:
|
k |
= |
konstanta brzine, mjerena na različitim temperaturama |
|
E |
= |
energija aktivacije [kJ/mol] |
|
T |
= |
apsolutna temperatura [K] |
|
R |
= |
plinska konstanta [8,314 J/mol.K] |
Energija aktivacije izračunana je regresijskom analizom ili pomoću sljedeće jednadžbe:
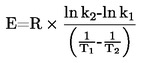
gdje je T2 > T1.
Dodatak 3.
Puferski sustavi
A. CLARK I LUBS:
Puferske smjese po Clarku i Lubsu (14)
|
Sastav |
pH |
|
0,2 N HCl i 0,2 N KCl na 20 °C |
|
|
47,5 ml HCl + 25 ml KCl razr. do 100 ml |
1,0 |
|
32,25 ml HCl + 25 ml KCl razr. do 100 ml |
1,2 |
|
20,75 ml HCl + 25 ml KCl razr. do 100 ml |
1,4 |
|
13,15 ml HCl + 25 ml KCl razr. do 100 ml |
1,6 |
|
8,3 ml HCl + 25 ml KCl razr. do 100 ml |
1,8 |
|
5,3 ml HCl + 25 ml KCl razr. do 100 ml |
2,0 |
|
3,35 ml HCl + 25 ml KCl razr. do 100 ml |
2,2 |
|
0,1 M kalijev biftalat + 0,1 N HCl na 20 °C |
|
|
46,70 ml 0,1 N HCl + 50 ml biftalat do 100 ml |
2,2 |
|
39,60 ml 0,1 N HCl + 50 ml biftalat do 100 ml |
2,4 |
|
32,95 ml 0,1 N HCl + 50 ml biftalat do 100 ml |
2,6 |
|
26,42 ml 0,1 N HCl + 50 ml biftalat do 100 ml |
2,8 |
|
20,32 ml 0,1 N HCl + 50 ml biftalat do 100 ml |
3,0 |
|
14,70 ml 0,1 N HCl + 50 ml biftalat do 100 ml |
3,2 |
|
9,90 ml 0,1 N HCl + 50 ml biftalat do 100 ml |
3,4 |
|
5,97 ml 0,1 N HCl + 50 ml biftalat do 100 ml |
3,6 |
|
2,63 ml 0,1 N HCl + 50 ml biftalat do 100 ml |
3,8 |
|
0,1 M kalijev biftalat + 0,1 N NaOH na 20 °C |
|
|
0,40 ml 0,1 N NaOH + 50 ml biftalat do 100 ml |
4,0 |
|
3,70 ml 0,1 N NaOH + 50 ml biftalat do 100 ml |
4,2 |
|
7,50 ml 0,1 N NaOH + 50 ml biftalat do 100 ml |
4,4 |
|
12,15 ml 0,1 N NaOH + 50 ml biftalat do 100 ml |
4,6 |
|
17,70 ml 0,1 N NaOH + 50 ml biftalat do 100 ml |
4,8 |
|
23,85 ml 0,1 N NaOH + 50 ml biftalat do 100 ml |
5,0 |
|
29,95 ml 0,1 N NaOH + 50 ml biftalat do 100 ml |
5,2 |
|
35,45 ml 0,1 N NaOH + 50 ml biftalat do 100 ml |
5,4 |
|
39,85 ml 0,1 N NaOH + 50 ml biftalat do 100 ml |
5,6 |
|
43,00 ml 0,1 N NaOH + 50 ml biftalat do 100 ml |
5,8 |
|
45,45 ml 0,1 N NaOH + 50 ml biftalat do 100 ml |
6,0 |
Puferske smjese po Clarku i Lubsu (nastavak)
|
0,1 M monokalijev fosfat + 0,1 N NaOH na 20 °C |
|
|
5,70 ml 0,1 N NaOH + 50 ml fosfat do 100 ml |
6,0 |
|
8,60 ml 0,1 N NaOH + 50 ml fosfat do 100 ml |
6,2 |
|
12,60 ml 0,1 N NaOH + 50 ml fosfat do 100 ml |
6,4 |
|
17,80 ml 0,1 N NaOH + 50 ml fosfat do 100 ml |
6,6 |
|
23,45 ml 0,1 N NaOH + 50 ml fosfat do 100 ml |
6,8 |
|
29,63 ml 0,1 N NaOH + 50 ml fosfat do 100 ml |
7,0 |
|
35,00 ml 0,1 N NaOH + 50 ml fosfat do 100 ml |
7,2 |
|
39,50 ml 0,1 N NaOH + 50 ml fosfat do 100 ml |
7,4 |
|
42,80 ml 0,1 N NaOH + 50 ml fosfat do 100 ml |
7,6 |
|
45,20 ml 0,1 N NaOH + 50 ml fosfat do 100 ml |
7,8 |
|
46,80 ml 0,1 N NaOH + 50 ml fosfat do 100 ml |
8,0 |
|
0,1 M H3BO3 u 0,1 M KCl + 0,1 N NaOH na 20 °C |
|
|
2,61 ml 0,1 N NaOH + 50 ml borna kiselina do 100 ml |
7,8 |
|
3,97 ml 0,1 N NaOH + 50 ml borna kiselina do 100 ml |
8,0 |
|
5,90 ml 0,1 N NaOH + 50 ml borna kiselina do 100 ml |
8,2 |
|
8,50 ml 0,1 N NaOH + 50 ml borna kiselina do 100 ml |
8,4 |
|
12,00 ml 0,1 N NaOH + 50 ml borna kiselina do 100 ml |
8,6 |
|
16,30 ml 0,1 N NaOH + 50 ml borna kiselina do 100 ml |
8,8 |
|
21,30 ml 0,1 N NaOH + 50 ml borna kiselina do 100 ml |
9,0 |
|
26,70 ml 0,1 N NaOH + 50 ml borna kiselina do 100 ml |
9,2 |
|
32,00 ml 0,1 N NaOH + 50 ml borna kiselina do 100 ml |
9,4 |
|
36,85 ml 0,1 N NaOH + 50 ml borna kiselina do 100 ml |
9,6 |
|
40,80 ml 0,1 N NaOH + 50 ml borna kiselina do 100 ml |
9,8 |
|
43,90 ml 0,1 N NaOH + 50 ml borna kiselina do 100 ml |
10,0 |
B. KALTHOFF I VLEESCHHOUWER:
Citratni puferi po Kalthoffu i Vleeschhouweru
|
Sastav |
pH |
|
0,1 M monokalijev citrat i 0,1 N HCl na 18 °C (15) |
|
|
49,7 ml 0,1 N HCl + 50 ml citrat do 100 ml |
2,2 |
|
43,4 ml 0,1 N HCl + 50 ml citrat do 100 ml |
2,4 |
|
36,8 ml 0,1 N HCl + 50 ml citrat do 100 ml |
2,6 |
|
30,2 ml 0,1 N HCl + 50 ml citrat do 100 ml |
2,8 |
|
23,6 ml 0,1 N HCl + 50 ml citrat do 100 ml |
3,0 |
|
17,2 ml 0,1 N HCl + 50 ml citrat do 100 ml |
3,2 |
|
10,7 ml 0,1 N HCl + 50 ml citrat do 100 ml |
3,4 |
|
4,2 ml 0,1 N HCl + 50 ml citrat do 100 ml |
3,6 |
|
0,1 M monokalijev citrat i 0,1 N NaOH na 18 °C (15) |
|
|
2,0 ml 0,1 N NaOH + 50 ml citrat do 100 ml |
3,8 |
|
9,0 ml 0,1 N NaOH + 50 ml citrat do 100 ml |
4,0 |
|
16,3 ml 0,1 N NaOH + 50 ml citrat do 100 ml |
4,2 |
|
23,7 ml 0,1 N NaOH + 50 ml citrat do 100 ml |
4,4 |
|
31,5 ml 0,1 N NaOH + 50 ml citrat do 100 ml |
4,6 |
|
39,2 ml 0,1 N NaOH + 50 ml citrat do 100 ml |
4,8 |
|
46,7 ml 0,1 N NaOH + 50 ml citrat do 100 ml |
5,0 |
|
54,2 ml 0,1 N NaOH + 50 ml citrat do 100 ml |
5,2 |
|
61,0 ml 0,1 N NaOH + 50 ml citrat do 100 ml |
5,4 |
|
68,0 ml 0,1 N NaOH + 50 ml citrat do 100 ml |
5,6 |
|
74,4 ml 0,1 N NaOH + 50 ml citrat do 100 ml |
5,8 |
|
81,2 ml 0,1 N NaOH + 50 ml citrat do 100 ml |
6,0 |
C. SÖRENSEN:
Boratne smjese po Sörensenu
|
Sastav |
Sörensen 18 °C |
Walbum, pH na |
|||
|
ml boraks |
ml HCl/NaOH |
10 °C |
40 °C |
70 °C |
|
|
0,05 M boraks + 0,1 N HCl |
|||||
|
5,25 |
4,75 |
7,62 |
7,64 |
7,55 |
7,47 |
|
5,50 |
4,50 |
7,94 |
7,98 |
7,86 |
7,76 |
|
5,75 |
4,25 |
8,14 |
8,17 |
8,06 |
7,95 |
|
6,00 |
4,00 |
8,29 |
8,32 |
8,19 |
8,08 |
|
6,50 |
3,50 |
8,51 |
8,54 |
8,40 |
8,28 |
|
7,00 |
3,00 |
8,08 |
8,72 |
8,56 |
8,40 |
|
7,50 |
2,50 |
8,80 |
8,84 |
8,67 |
8,50 |
|
8,00 |
2,00 |
8,91 |
8,96 |
8,77 |
8,59 |
|
8,50 |
1,50 |
9,01 |
9,06 |
8,86 |
8,67 |
|
9,00 |
1,00 |
9,09 |
9,14 |
8,94 |
8,74 |
|
9,50 |
0,50 |
9,17 |
9,22 |
9,01 |
8,80 |
|
10,00 |
0,00 |
9,24 |
9,30 |
9,08 |
8,86 |
|
0,05 M boraks + 0,1 N NaOH |
|||||
|
10,0 |
0,0 |
9,24 |
9,30 |
9,08 |
8,86 |
|
9,0 |
1,0 |
9,36 |
9,42 |
9,18 |
8,94 |
|
8,0 |
2,0 |
9,50 |
9,57 |
9,30 |
9,02 |
|
7,0 |
3,0 |
9,68 |
9,76 |
9,44 |
9,12 |
|
6,0 |
4,0 |
9,97 |
10,06 |
9,67 |
9,28 |
Fosfatne smjese po Sörensenu
|
Sastav |
pH |
|
0,0667 M monokalijev fosfat + 0,0667 M dinatrijev fosfat na 20 °C |
|
|
99,2 ml KH2PO4 + 0,8 ml Na2HPO4 |
5,0 |
|
98,4 ml KH2PO4 + 1,6 ml Na2HPO4 |
5,2 |
|
97,3 ml KH2PO4 + 2,7 ml Na2HPO4 |
5,4 |
|
95,5 ml KH2PO4 + 4,5 ml Na2HPO4 |
5,6 |
|
92,8 ml KH2PO4 + 7,2 ml Na2HPO4 |
5,8 |
|
88,9 ml KH2PO4 + 11,1 ml Na2HPO4 |
6,0 |
|
83,0 ml KH2PO4 + 17,0 ml Na2HPO4 |
6,2 |
|
75,4 ml KH2PO4 + 24,6 ml Na2HPO4 |
6,4 |
|
65,3 ml KH2PO4 + 34,7 ml Na2HPO4 |
6,6 |
|
53,4 ml KH2PO4 + 46,6 ml Na2HPO4 |
6,8 |
|
41,3 ml KH2PO4 + 58,7 ml Na2HPO4 |
7,0 |
|
29,6 ml KH2PO4 + 70,4 ml Na2HPO4 |
7,2 |
|
19,7 ml KH2PO4 + 80,3 ml Na2HPO4 |
7,4 |
|
12,8 ml KH2PO4 + 87,2 ml Na2HPO4 |
7,6 |
|
7,4 ml KH2PO4 + 92,6 ml Na2HPO4 |
7,8 |
|
3,7 ml KH2PO4 + 96,3 ml Na2HPO4 |
8,0 |
C.8. TOKSIČNOST ZA GUJAVICE
TEST S UMJETNIM TLOM
1. METODA
1.1. UVOD
U ovom se laboratorijskom testu ispitivana tvar dodaje u umjetno tlo i u njemu drže gujavice tijekom 14 dana. Nakon tog vremena (i fakultativno nakon sedam dana) provjerava se letalni učinak tvari na gujavice. Ovaj test je relativno brz način provjere učinka kemikalija na gujavice kod unosa kroz kožu i putem hrane.
1.2. DEFINICIJA I JEDINICA
LC50: procijenjena koncentracija tvari koja ubija 50 % ispitanih životinja u razdoblju ispitivanja.
1.3. REFERENTNA TVAR
Periodičnim korištenjem referentne tvari treba se uvjeriti da se osjetljivost ispitnog sustava nije značajno promijenila.
Preporučena referentna tvar je analitički čisti kloracetamid.
1.4. NAČELO ISPITIVANJA
Tlo je promjenljiv medij; stoga se u ovom testu koristi pažljivo definirano umjetno ilovasto tlo. Odrasle gujavice vrste Eisenia foetida (vidjeti napomenu u Dodatku) drže se u definiranom umjetnom tlu obrađenom različitim koncentracijama ispitivane tvari. 14 dana (i fakultativno 7 dana) nakon početka ispitivanja sadržaj spremnika se rasprostre na podložak i prebroje gujavice koje su preživjele pri svakoj koncentraciji.
1.5. KRITERIJI KAKVOĆE
Plan ispitivanja treba osigurati maksimalnu obnovljivost s obzirom na ispitni supstrat i organizam. Da bi ispitivanje bilo valjano, smrtnost u kontrolama na kraju ispitivanja ne smije biti viša od 10 %.
1.6. OPIS ISPITNE METODE
1.6.1. Materijali
1.6.1.1.
Kao osnovni ispitni supstrat koristi se definirano umjetno tlo.
|
(a) |
Osnovni supstrat (postoci su na bazi suhe mase)
|
|
(b) |
Ispitni supstrat Ispitni supstrat sadrži osnovni supstrat, ispitivanu tvar i deioniziranu vodu. Sadržaj vode treba iznositi oko 25 do 42 % suhe mase osnovnog supstrata. Sadržaj vode supstrata određuje se sušenjem uzorka na 105 °C dok se ne postigne stalna masa. Ključni je kriterij da umjetno tlo bude dobro natopljeno, ali ne prekriveno vodom. Kod miješanja treba paziti da se postigne ravnomjerna razdioba ispitivane tvari i supstrata. U izvješću o ispitivanju treba navesti kako je ispitivana tvar uvedena u supstrat. |
|
(c) |
Kontrolni supstrat Kontrolni supstrat sadrži osnovni supstrat i vodu. Ako se koristi dodatak, treba predvidjeti još jedan kontrolni supstrat koji sadrži istu količinu dodatka. |
1.6.1.2.
Stakleni spremnici zapremnine oko jedne litre (prekriveni odgovarajućim plastičnim poklopcima, zdjelicama ili plastičnom folijom s rupama za ventilaciju) napunjeni mokrim ispitnim ili kontrolnim supstratom u količini koja odgovara 500 g suhe mase supstrata.
1.6.2. Ispitni uvjeti
Spremnike treba držati u klima komorama na temperaturi od 20 ± 2 °C uz neprekidno osvjetljenje. Jakost svjetlosti treba biti 400 do 800 luksa.
Razdoblje ispitivanja je 14 dana, ali se smrtnost može fakultativno odrediti i sedam dana nakon početka ispitivanja.
1.6.3. Ispitni postupak
Koncentracije ispitivane tvari izražavaju se kao masa tvari po suhoj masi osnovnog supstrata (mg/kg).
Ovim se ispitivanjem može odrediti raspon koncentracija u kojemu nastupa smrtnost od 0 do 100 % i tako pribaviti informacije o rasponu koncentracija koje treba koristiti u glavnom ispitivanju.
Tvar treba ispitati u sljedećim koncentracijama: 1 000; 100; 10; 1; 0,1 mg tvari po kilogramu ispitnog supstrata (suha masa).
Ako će se provesti potpuno glavno ispitivanje, za preliminarno ispitivanje je dovoljno uzeti po jednu ispitnu seriju po koncentraciji i jednu neobrađenu kontrolnu seriju, svaka po 10 gujavica.
Na temelju rezultata preliminarnog ispitivanja treba odabrati najmanje pet koncentracija u geometrijskom nizu koje obuhvaćaju područje smrtnosti od 0 do 100 % i koje se razlikuju za stalni faktor koji nije viši od 1,8.
Ispitivanja s tim nizom koncentracija moraju omogućiti što precizniju procjenu vrijednosti LC50 i njezinih granica pouzdanosti.
U glavnom se ispitivanju koriste najmanje četiri ispitne serije po koncentraciji i četiri neobrađene kontrolne serije, svaka po 10 gujavica. Rezultati ponavljanja navode se kao srednja vrijednost i standardna devijacija.
Ako dvije uzastopne koncentracije u omjeru 1,8 daju samo 0 % i 100 % smrtnosti, te su dvije vrijednosti dovoljne da se pokaže raspon unutar kojega se nalazi LC50.
Ispitni supstrat bi kad god je to moguće trebalo pripremiti bez ikakvih dodataka, osim vode. Ispitivana tvar emulgirana ili dispergirana u deioniziranoj vodi ili drugom otapalu se neposredno prije početka ispitvanja pomiješa s osnovnim ispitnim supstratom ili ravnomjerno poprska finim kromatografskim ili sličnim raspršivačem.
Ako je ispitivana tvar netopljiva u vodi, ona se može otopiti u što manjoj količini prikladnog organskog otapala (npr. heksan, aceton ili kloroform).
Za otapanje, dispergiranje odnosno emulgiranje ispitivane tvari smiju se koristiti samo lako hlapljiva sredstva. Ispitni supstrat treba prozračiti prije uporabe. Količinu isparene vode treba nadomjestiti. Kontrolni supstrat mora sadržavati istu količinu aditiva.
Ako se ispitivana tvar ne otapa, ne dispergira i ne emulgira u organskom otapalu, 10 g smjese fino usitnjenog kremenog pijeska i ispitivane tvari u količini koja je potrebna za obradu 500 g suhe mase umjetnog tla treba pomiješati s 490 g suhe mase ispitnog supstrata.
Za svaku se ispitnu seriju pripremi stakleni spremnik s količinom mokrog ispitnog supstrata koja odgovara 500 g suhe mase i na površinu ispitnog supstrata stavi se 10 gujavica, koje su prije toga 24 sata aklimatizirane u sličnom mokrom osnovnom supstratu i zatim kratko oprane i osušene filtar-papirom.
Spremnici se prekriju peforiranim plastičnim poklopcima, zdjelicama ili folijom kako bi se spriječilo isušivanje supstrata i drže se u ispitnim uvjetima 14 dana.
Ocjenjivanje se provodi 14 dana (i fakultativno 7 dana) nakon početka ispitivanja. Supstrat se raširi na ploči od stakla ili nehrđajućeg čelika. Gujavice se pregledaju i odredi broj preživjelih gujavica. Gujavice se smatraju mrtvima ako ne reagiraju na nježni mehanički podražaj na prednjem kraju.
Ako se obavlja pregled nakon sedam dana, supstrat se vrati u spremnik i preživjele se gujavice ponovno stave na isti ispitni supstrat.
1.6.4. Ispitni organizmi
Ispitni organizmi su odrasle gujavice Eisenia foetida (vidjeti napomenu u Dodatku) (najmanje dva mjeseca stare, s klitelumom) mokre mase 300 do 600 mg. (Za način uzgoja vidjeti Dodatak).
2. PODACI
2.1. OBRADA I VREDNOVANJE REZULTATA
Navedu se ispitane koncentracije tvari s odgovarajućim postocima mrtvih gujavica.
Ako se dobiju odgovarajući podaci, treba izračunati LC50 i granice pouzdanosti (p = 0,05) primjenom standardnih metoda (Litchfield i Wilcoxon, 1949., ili istovjetna metoda). LC50 treba navesti u mg ispitne tvari po kilogramu ispitnog supstrata (suha masa).
Ako je nagib krivulje koncentracije prevelik za izračun LC50, dovoljna je grafička procjena te vrijednosti.
Ako dvije uzastopne koncentracije u omjeru 1,8 daju samo 0 % i 100 % smrtnosti, te su dvije vrijednosti dovoljne da se pokaže raspon unutar kojega se nalazi LC50.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju po mogućnosti sadrži sljedeće informacije:
|
— |
izjavu da je ispitivanje obavljeno u skladu s gore navedenim kriterijima kakvoće, |
|
— |
vrstu ispitivanja (ispitivanje za određivanje raspona i/ili glavno ispitivanje), |
|
— |
točan opis ispitnih uvjeta ili izjava da je ispitivanje obavljeno u skladu s metodom; treba navesti sva odstupanja, |
|
— |
točan opis kako je ispitivana tvar uvedena u osnovni ispitni supstrat, |
|
— |
informacije o ispitnim organizmima (vrsta, dob, srednja masa i raspon mase, uvjeti držanja i uzgoja, dobavljač), |
|
— |
metoda određivanja LC50, |
|
— |
rezultate ispitivanja, uključujući sve korištene podatke, |
|
— |
opis uočenih simptoma i promjena u ponašanju ispitnih organizama, |
|
— |
smrtnost u kontrolama, |
|
— |
LC50 ili najvišu ispitanu koncentraciju bez smrtnosti i najnižu ispitanu koncentraciju sa 100 %-nom smrtnošću 14 dana (i fakultativno 7 dana) nakon početka ispitivanja, |
|
— |
prikaz krivulje koncentracija/odgovor, |
|
— |
rezultate dobivene s referentnom tvari, bilo u vezi s ovim ispitivanjem ili iz ranijih ispitivanja u svrhu kontrole kakvoće. |
4. REFERENCE
|
(1) |
OECD, Paris, 1981, Test Guideline 207, Decision of the Council C(81)30 final. |
|
(2) |
Edwards, C. A. and Lofty, J. R., 1977, Biology of Earthworms, Chapman and Hall, London, str. 331. |
|
(3) |
Bouche. M. B., 1972, Lombriciens de France, Ecologie et Systematique, Institut National de la Recherche Agronomique, str. 671. |
|
(4) |
Litchfield, J. T. andWilcoxon, F., A simplified method of evaluation dose effect experiments. I. Pharm. Exp. Therap., vol. 96, 1949, str. 99. |
|
(5) |
Commission of the European Communities, Development of a standardised laboratory method for assessing the toxicity of chemical substances to earthworms, Report EUR 8714 EN, 1983. |
|
(6) |
Umweltbundesamt/Biologische Bundesanstalt für land- und Forstwirtschaft, Berlin, 1984, Verfahrensvorschlag „Toxizitätstest am Regenwurm Eisenia foetida in künstlichem Boden”, in: Rudolph/Boje, Ökotoxikologie, ecomed, Landsberg, 1986. |
Dodatak
Uzgoj i držanje gujavica prije ispitivanja
30 do 50 odraslih gujavica stavi se u uzgojnu kutiju sa svježim supstratom i izvadi nakon 14 dana. Te se životinje mogu koristiti za daljnje uzgojne serije. Gujavice koje se izvale iz kokona koriste se u ispitivanjima kad budu zrele (u propisanim uvjetima nakon dva do tri mjeseca).
Uvjeti držanja i uzgoja
|
Klima komora |
: |
temperatura 20 ± 2 °C, po mogućnosti uz neprekidno osvjetljenje (intenzitet 400 do 800 luksa). |
|
Uzgojne kutije |
: |
prikladni plitki spremnici zapremnine od 10 do 20 l. |
|
Supstrat |
: |
Eisenia foetida se može uzgajati u različitim vrstama životinjskih izlučevina. Preporučuje se da se kao uzgojni medij koristi smjesa koja sadrži 50 % volumnog udjela treseta i 50 % kravljeg ili konjskoga gnoja. Medij treba imati pH vrijednost oko 6 do 7 (podešava se kalcijevim karbonatom) i nisku ionsku vodljivost (manje od 6 mmho ili 0,5 % koncentracije soli). Supstrat treba biti vlažan, ali ne premokar. Osim gornje metode mogu se primijeniti i drugi uspješni postupci. |
Napomena: Postoje dvije pasmine Eisenia foetida, koje su neki taksonomi podijelili u dvije vrste (Bouche, 1972). One su morfološki slične, ali jedna od njih, Eisenia foetida foetida, ima tipične poprečne pruge ili prstenove na segmentima, dok ih druga, Eisenia foetida andrei, nema i prošarana je crvenim pjegama. Ako je to moguće, treba koristiti Eisenia foetida andrei. Mogu se koristiti i druge vrste ako je raspoloživa potrebna metodologija.
C.9. BIORAZGRADNJA
ZAHN-WELLENSOV TEST
1. METODA
1.1. UVOD
Svrha je ove metode ocijeniti potencijalnu potpunu biorazgradivost vodotopljivih nehlapljivih organskih tvari kod izlaganja relativno visokim koncentracijama mikroorganizama u statičkom ispitivanju.
Pritom može doći do fizikalno-kemijske adsorpcije na suspendiranu krutu tvar, što treba uzeti u obzir kod tumačenja rezultata (vidjeti 3.2.).
Ispitivane se tvari koriste u koncentracijama koje odgovaraju vrijednostima DOC-a u području od 50 do 400 mg/l odnosno vrijednostima KPK u području od 100 do 1 000 mg/l (DOC = Dissolved Organic Oxygen, otopljeni organski ugljik; KPK = kemijska potrošnja kisika). Prednost ovih relativno visokih koncentracija je njihova analitička pouzdanost. Spojevi s toksičnim svojstvima mogu odgoditi odnosno kočiti proces razgradnje.
U ovoj se metodi mjera koncentracije otopljenog organskog ugljika odnosno kemijske potrošnje kisika koristi za ocjenjivanje potpune biorazgradivosti.
Istovremenom primjenom specifične analitičke metode moguće je ocijeniti i primarnu biorazgradnju tvari (nestajanje polazne kemijske strukture).
Metoda se primjenjuje samo na one organske ispitivane tvari koje su u koncentraciji koja se koristi u ispitivanju:
|
— |
topljive u vodi u ispitnim uvjetima, |
|
— |
imaju zanemariv tlak pare u ispitnim uvjetima, |
|
— |
nemaju inhibitorni učinak na bakterije, |
|
— |
adsorbiraju se tek u ograničenoj mjeri unutar ispitnog sustava, |
|
— |
ne gube se iz ispitne otopine pjenjenjem. |
Kod tumačenja dobivenih rezultata korisno je imati informacije o relativnim udjelima glavnih komponenti ispitivanog materijala, posebno ako su dobivene vrijednosti niske ili granične.
Informacije o toksičnosti tvari za mikroorganizme poželjne su za tumačenje niskih vrijednosti i odabir odgovarajućih ispitnih koncentracija.
1.2. DEFINICIJE I JEDINICE
Vrijednost razgradnje dobivena na kraju ispitivanja navodi se kao „biorazgradivost iz Zahn-Wellensovog testa”:
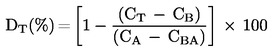
gdje je:
|
DT |
= |
biorazgradnja (%) u vremenu T |
|
CA |
= |
vrijednosti DOC-a (ili KPK) u ispitnoj smjesi izmjerene tri sata nakon početka ispitivanja (mg/l) (DOC = Dissolved Organic Oxygen, otopljeni organski ugljik; KPK = kemijska potrošnja kisika) |
|
CT |
= |
vrijednosti DOC-a ili KPK u ispitnoj smjesi u vremenu uzorkovanja (mg/l) |
|
CB |
= |
vrijednost DOC-a ili KPK slijepe probe u vremenu uzorkovanja (mg/l) |
|
CBA |
= |
vrijednost DOC-a ili KPK slijepe probe izmjerena tri sata nakon početka ispitivanja (mg/l) |
Stupanj razgradnje zaokružuje se na najbliži puni postotak.
Postotak razgradnje navodi se kao postotak opadanja DOC-a (ili KPK) ispitivane tvari.
Razlika između izmjerene vrijednosti nakon tri sata i izračunane odnosno, po mogućnosti, izmjerene početne vrijednosti može pružiti korisne informacije o eliminaciji tvari (vidjeti 3.2. Tumačenje rezultata).
1.3. REFERENTNE TVARI
Referentne tvari mogu biti korisne kod ispitivanja novih tvari; međutim, još se ne mogu preporučiti određene referentne tvari.
1.4. NAČELO ISPITNE METODE
U staklenu posudu zapremnine od jedne do četiri litre, opremljenu mješalicom i napravom za dozračivanje, stave se zajedno, u vodenoj otopini, aktivni mulj, mineralni nutrijenti i ispitivani materijal kao jedini izvor ugljika. Smjesa se miješa i dozračuje na 20 do 25 °C pod difuznim osvjetljenjem ili u mračnom prostoru do 28 dana. Proces razgradnje prati se određivanjem vrijednosti DOC-a (ili KPK) u filtriranoj otopini u dnevnim ili u drugim odgovarajućim redovitim vremenskim razmacima. Omjer eliminiranog DOC-a (ili KPK) nakon svakog intervala i vrijednosti tri sata nakon početka ispitivanja izražava se kao postotak biorazgradnje i služi kao mjera stupnja razgradnje u tom trenutku. Dobiveni se rezultati grafički prikazuju u ovisnosti o vremenu kako bi se dobila krivulja razgradnje.
Ako se koristi specifična analitička metoda, mogu se izmjeriti promjene koncentracije polazne molekule uslijed biorazgradnje (primarna biorazgradivost).
1.5. KRITERIJI KAKVOĆE
U prstenastom je testu dokazana zadovoljavajuća obnovljivost ovog testa.
Osjetljivost metode u velikoj je mjeri ovisna o varijabilnosti slijepe probe te, u manjoj mjeri, o preciznosti određivanja otopljenog organskog ugljika i koncentraciji ispitivanog spoja u otopini.
1.6. OPIS ISPITNOG POSTUPKA
1.6.1. Priprema
1.6.1.1.
Ispitna voda: voda za piće sa sadržajem organskog ugljika < 5 mg/l. Koncentracija kalcijevih i magnezijevih iona zajedno ne smije biti viša od 2,7 mmol/l; u protivnome je treba dostatno razrijediti deioniziranom ili destiliranom vodom.
|
Sumporna kiselina, analitički reagens (A.R.): |
50 g/l |
|
Otopina natrijevog hidroksida A.R.: |
40 g/l |
|
Mineralna hranjiva otopina: u jednoj litri deionizirane vode se otopi: |
|
|
amonijev klorid, NH4Cl, A.R.: |
38,5 g |
|
natrijev dihidrogenfosfat, NaH2PO4.2H2O, A.R.: |
33,4 g |
|
kalijev dihidrogenfosfat, KH2PO4, A.R.: |
8,5 g |
|
dikalijev monohidrogenfosfat, K2HPO4, A.R.: |
21,75 g |
Smjesa istodobno služi kao nutrijent i kao puferski sustav.
1.6.1.2.
Staklene posude zapremnine od jedne do četiri litre (npr. cilindrične posude).
Mješalica sa staklenim ili metalnim mješačem na odgovarajućoj osovini (mješač se treba vrtiti oko 5 do 10 cm iznad dna posude). Umjesto toga može se koristiti magnetska mješalica s polugom dužine od 7 do 10 cm.
Staklena cjevčica unutarnjeg promjera od 2 do 4 mm za uvođenje zraka. Otvor cjevčice treba biti oko 1 cm iznad dna posude.
Centrifuga (oko 3 550 g).
Mjerač pH vrijednosti.
Mjerač otopljenog kisika.
Papirni filtri.
Uređaj za membransku filtraciju.
Membranski filtri, veličina pora 0,45 μm. Membranski filtri su prikladni pod uvjetom da ne otpuštaju ugljik i ne apsorbiraju tvar tijekom filtracije.
Analitička oprema za određivanje sadržaja organskog ugljika i kemijske potrošnje kisika.
1.6.1.3.
Aktivni mulj iz postrojenja za biološko pročišćavanje pere se (višekratnim) centrifugiranjem ili taloženjem s ispitnom vodom (gore).
Aktivni mulj mora biti u prikladnom stanju. Takav se mulj može dobiti iz ispravnog postrojenja za pročišćavanje otpadnih voda. Da bi se dobilo što je moguće više različitih vrsta ili sojeva bakterija mogu se pomiješati inokulumi iz različitih izvora (npr. različita postrojenja za pročišćavanje, ekstrakti tla, rječna voda itd.). Smjesu treba obraditi na način kako je gore opisano.
Za provjeru aktivnosti aktivnog mulja vidjeti odjeljak „Funkcionalna kontrola” u nastavku.
1.6.1.4.
U ispitnu se posudu stavi 500 ml ispitne vode, 2,5 ml/l mineralne hranjive otopine i aktivni mulj u količini koja odgovara 0,2 do 1,0 g/l suhe tvari u konačnoj smjesi. Doda se dovoljna količina radne otopine ispitivane tvari tako da se u konačnoj smjesi dobije koncentracija DOC-a od 50 do 400 mg/l. Odgovarajuće vrijednosti KPK iznose 100 do 1 000 mg/l. Zatim se nadopuni ispitnom vodom do ukupnog volumena od jedne do četiri litre. Ukupni se volumen odabire ovisno o broju uzoraka koji će se uzeti za određivanje DOC-a ili KPK i količinama koje su potrebne za analitički postupak.
U pravilu je dovoljan volumen od dvije litre. Na svaki ispitni niz dolazi barem po jedna kontrolna posuda (slijepa proba), koja se paralelno ispituje; ona sadrži samo aktivni mulj i mineralnu hranjivu otopinu nadopunjenu ispitnom vodom do istog ukupnog volumena kao ispitne posude.
1.6.2. Provođenje ispitivanja
Ispitne se posude miješaju magnetskim mješalicama ili propelerima pod difuznim osvjetljenjem ili u mračnom prostoru na 20 do 25 °C. Dozračivanje se provodi komprimiranim zrakom očišćenim kroz pamučni filtar i, prema potrebi, u boci za pranje plina. Treba voditi računa da se mulj ne taloži i da koncentracija kisika ne padne ispod 2 mg/l.
pH vrijednost treba provjeravati u redovitim razmacima (npr. dnevno) i prema potrebi podesiti na pH 7 do 8.
Gubici uslijed isparavanja nadoknađuju se neposredno prije uzorkovanja odgovarajućim količinama deionizirane ili destilirane vode. Ispravan postupak je označiti razinu tekućine na posudi prije početka ispitivanja. Nakon svakog se uzorkovanja stavljaju nove oznake (bez dozračivanja i miješanja). Prvi se uzorci uvijek uzimaju tri sata nakon početka ispitivanja kako bi se utvrdila adsorpcija ispitivanog materijala na aktivni mulj.
Eliminacija ispitivanog materijala prati se određivanjem DOC-a odnosno KPK u dnevnim ili drugim redovitim razmacima. Uzorci iz ispitne posude i slijepe probe filtriraju se kroz pažljivo oprani papirni filtar. Prvih 5 ml filtrata ispitne se otopine baca. Muljevi koji se teško filtriraju mogu se prethodno ukloniti 10-minutnim centrifugiranjem. Provode se barem dva paralelna određivanja DOC-a i KPK. Ispitivanje traje do 28 dana.
Napomena: uzorci koji ostanu mutni filtriraju se kroz membranske filtre. Membranski filtri ne smiju otpuštati niti adsorbirati organski materijal.
Na svaki ispitni niz dolazi po jedna posuda u kojoj se paralelno ispituje poznata tvar za provjeru funkcionalne sposobnosti aktivnog mulja. Pokazalo se da je za to prikladan dietilenglikol.
Ako se analize provode u relativno kratkim razmacima (npr. dnevno), prilagodba se može jasno prepoznati iz krivulje razgradnje (vidjeti sliku 2.). Ispitivanje stoga ne treba započinjati neposredno prije vikenda.
Ako prilagodba nastupi na kraju razdoblja, ispitivanje se može produžiti dok se razgradnja ne završi.
Napomena: ako je potrebno šire poznavanje ponašanja prilagođenog mulja, isti se aktivni mulj još jedanput izloži istom ispitivanom materijalu u skladu sa sljedećim postupkom:
isključi se mješalica i naprava za dozračivanje i pričeka da se aktivni mulj istaloži. Ukloni se supernatant, nadopuni do dvije litre ispitnom vodom, miješa 15 minuta i ponovno pusti da se mulj istaloži. Nakon što se supernatant ponovno ukloni, preostali se mulj koristi za ponovljeno ispitivanje s istim materijalom u skladu s 1.6.1.4. i 1.6.2. gore. Aktivni mulj se umjesto taloženjem može izolirati i centrifugiranjem.
Prilagođeni se mulj može pomiješati sa svježim muljem da se dobije koncentracija od 0,2 do 1 g suhe mase po litri.
Uzorci se u pravilu filtriraju kroz pažljivo oprani papirni filtar (za pranje treba koristiti deioniziranu vodu).
Uzorci koji ostanu mutni filtriraju se kroz membranske filtre (0,45 μm).
Koncentracija DOC-a u filtratima uzorka određuje se dvostruko (prvih se 5 ml baca) pomoću instrumenta za TOC. Ako se filtrat ne može analizirati istog dana, treba ga čuvati u hladnjaku do sljedećeg dana. Duže se skladištenje ne preporučuje.
Koncentracija KPK u filtratima uzorka određuje se analitički postupkom opisanim u (2) u nastavku.
2. PODACI I VREDNOVANJE
Koncentracije DOC-a i/ili KPK u uzorcima određuju se barem dvostruko u skladu s 1.6.2. gore. Razgradnja u vremenu T izračunava se pomoću formule (s definicijama) iz 1.2. gore.
Stupanj razgradnje zaokružuje se na najbliži puni postotak. Opseg razgradnje postignut na kraju ispitivanja navodi se kao „biorazgradivost iz Zahn-Wellensovog testa”.
Napomena: Ako se potpuna razgradnja postigne prije isteka predviđenog vremena ispitivanja i ako taj rezultat potvrdi druga analiza sljedećeg dana, ispitivanje se može okončati.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju po mogućnosti sadrži sljedeće:
|
— |
početnu koncentracija tvari, |
|
— |
sve ostale informacije i rezultate pokusa u vezi s ispitivanom tvari, referentnom tvari (ako se koristi) i slijepom probom, |
|
— |
koncentraciju nakon tri sata, |
|
— |
biorazgradnjom: krivulja s opisom, |
|
— |
datumom i mjestom skupljanja ispitnih organizama, stanje prilagodbe, upotrijebljena koncentracija itd., |
|
— |
znanstveni razlozi mogućih izmjena ispitnog postupka. |
3.2. TUMAČENJE REZULTATA
Postupno opadanje DOC-a (KPK) tijekom više dana ili tjedana ukazuje na to da se ispitivana tvar biološki razgrađuje.
Ipak, u pojedinim slučajevima može imati utjecaja i fizikalno-kemijska adsorpcije, na što ukazuje potpuno ili djelomično opadanje na samom početku ispitivanja, unutar prva tri sata, i neočekivano mala razlika između kontrolnog i ispitnog supernatanta.
Ako je potrebno razlikovati biorazgradnju (ili djelomičnu biorazgradnju) od adsorpcije, treba provesti dodatna ispitivanja.
To se može učiniti na više načina, ali najpouzdaniji način je provesti ispitivanje osnovne razine koristeći supernatant ili mulj kao inokulum (po mogućnosti respirometrijski test).
Ispitivane tvari koje u ovom testu pokazuju značajno smanjenje DOC-a (KPK) koje nije uvjetovano adsorpcijom mogu se smatrati potencijalno biorazgradivim. Djelomično neadsorptivno opadanje ukazuje na to da je kemikalija barem donekle podložna biorazgradnji. Malo opadanje ili nepromijenjena razina DOC-a (KPK) može biti posljedica inhibitornog učinka ispitivane tvari na mikroorganizme, što se također može očitovati razlaganjem i gubitkom mulja i zamućenjem supernatanta. Ispitivanje treba ponoviti s nižom koncentracijom ispitivane tvari.
Primjenom specifične analitičke metode za spoj ili 14C obilježene ispitivane tvari može se povećati osjetljivost. U slučaju 14C obilježenog spoja, pojava biorazgradnje se može potvrditi izdvajanjem 14CO2.
Ako se rezultati navode i kao primarna biorazgradnja, treba po mogućnosti objasniti promjenu kemijske strukture zbog koje izostaje odgovor polazne ispitivane tvari.
Potrebno je navesti validaciju analitičke metode zajedno s odgovorom medija slijepe probe.
4. REFERENCE
|
(1) |
OECD, Paris, 1981, Test Guideline 302 B, Decision of the Council C(81) 30 final. |
|
(2) |
Prilog V C.9 Razgradivost: kemijska potreba za kisikom, Direktiva Komisije 84/449/EEZ, (SL L 251,19.9.1984., str. 1.). |
Dodatak
PRIMJER VREDNOVANJA
|
Organski spoj: |
4-etoksibenzojeva kiselina |
|
Teoretska ispitna koncentracija: |
600 mg/l |
|
Teoretski DOC: |
390 mg/l |
|
Inokulum: |
postrojenje za pročišćavanje otpadnih voda … |
|
Koncentracija: |
1 gram suhe tvari/l |
|
Stanje prilagodbe: |
nije prilagođen |
|
Analiza: |
određivanje DOC-a |
|
Količina uzorka: |
3 ml |
|
Kontrolna tvar: |
dietilenglikol |
|
Toksičnost spoja: |
nema toksičnih učinaka ispod 1 000 mg/l Primijenjeni test: |
|
Vrijeme ispitivanja |
Kontrolna tvar |
Ispitivana tvar |
|||||
|
Slijepa proba DOC (16) mg/l |
DOC (16) mg/l |
DOC neto mg/l |
Razgradnja % |
DOC (16) mg/l |
DOC neto mg/l |
Razgradnja % |
|
|
0 |
— |
— |
300,0 |
— |
— |
390,0 |
— |
|
3 sata |
4,0 |
298,0 |
294,0 |
2 |
371,6 |
367,6 |
6 |
|
1 dan |
6,1 |
288,3 |
282,2 |
6 |
373,3 |
367,2 |
6 |
|
2 dana |
5,0 |
281,2 |
276,2 |
8 |
360,0 |
355,0 |
9 |
|
5 dana |
6,3 |
270,5 |
264,2 |
12 |
193,8 |
187,5 |
52 |
|
6 dana |
7,4 |
253,3 |
245,9 |
18 |
143,9 |
136,5 |
65 |
|
7 dana |
11,3 |
212,5 |
201,2 |
33 |
104,5 |
93,2 |
76 |
|
8 dana |
7,8 |
142,5 |
134,7 |
55 |
58,9 |
51,1 |
87 |
|
9 dana |
7,0 |
35,0 |
28,0 |
91 |
18,1 |
11,1 |
97 |
|
10 dana |
18,0 |
37,0 |
19,0 |
94 |
20,0 |
2,0 |
99 |
Slika 1.
Primjeri krivulja biorazgradnje

Slika 2.
Primjeri prilagodbe mulja
C.10. BIORAZGRADNJA
SIMULACIJSKI TESTOVI S AKTIVNIM MULJEM
1. METODA
1.1. UVOD
1.1.1. Opće napomene
Metoda se može primijeniti samo na one organske tvari koje su u koncentraciji koja se koristi u ispitivanju:
|
— |
topljive u vodi u mjeri potrebnoj za pripremu ispitnih otopina, |
|
— |
imaju zanemariv tlak pare u ispitnim uvjetima, |
|
— |
nemaju inhibitorni učinak na bakterije. |
Kod tumačenja dobivenih rezultata korisno je imati informacije o relativnim udjelima glavnih komponenti ispitivanog materijala, posebno ako su dobivene vrijednosti niske ili granične.
Informacije o toksičnosti tvari za mikroorganizme poželjne su za tumačenje niskih vrijednosti i odabir odgovarajućih ispitnih koncentracija.
1.1.2. Određivanje potpune biorazgradivosti (analiza DOC/KPK)
Svrha metode je odrediti potpunu biorazgradivost mjerenjem opadanja tvari i metobolita u modelu postrojenja s aktivnim muljem pri koncentraciji koja odgovara > 12 mg DOC/l (ili približno 40 mg KPK/l); čini se da je optimalna koncentracija 20 mg DOC/l (DOC = Dissolved Organic Oxygen, otopljeni organski ugljik; KPK = kemijska potrošnja kisika).
Treba biti poznat sadržaj organskog ugljika (ili kemijska potrošnja kisika) ispitivanog materijala.
1.1.3. Određivanje primarne biorazgradivosti (specifična analiza)
Svrha metode je odrediti primarnu biorazgradivost tvari u modelu postrojenja s aktivnim muljem pri koncentraciji od oko 20 mg/l primjenom specifične analitičke metode (ako analitička metoda i toksičnost to dopuštaju, može se koristiti i niža ili viša koncentracija). Na taj se način može ocijeniti primarna biorazgradivost tvari (nestanak polazne kemijske strukture).
Svrha ove metode nije određivanje mineralizacije ispitivane tvari.
Mora biti raspoloživa prikladna analitička metoda za određivanje ispitivane tvari.
1.2. DEFINICIJE I JEDINICE
1.2.1. Analiza DOC/KPK
Stupanj opadanja tvari izražava se kao:
|
|
[1(a)] |
gdje je:
|
DR |
= |
stupanj opadanja DOC-a (ili KPK) u % unutar danog srednjeg vremena zadržavanja, u odnosu na ispitivani materijal |
|
T |
= |
koncentracija ispitivanog materijala u ulaznoj vodi u mg DOC/l (ili mg KPK/l) |
|
E |
= |
koncentracija DOC-a (ili KPK) u izlaznoj vodi ispitne jedinice u mg DOC/l (ili mg KPK/l) |
|
Eo |
= |
koncentracija DOC-a (ili KPK) u izlaznoj vodi jedinice za slijepu probu u mg DOC/l (ili mg KPK/l) |
Razgradnja se navodi kao postotak opadanja DOC-a (ili KPK) unutar danog vremena zadržavanja u odnosu na ispitivani materijal.
1.2.2. Specifična analiza
Postotak eliminacije ispitivane tvari iz vodene faze (Rw) unutar danog srednjeg vremena zadržavanja izražava se kao:
|
|
[1(b)] |
gdje je:
|
Cl |
= |
koncentracija tvari u ulaznoj vodi ispitnog uređaja (mg tvari/l, utvrđena specifičnom analizom) |
|
Co |
= |
koncentracija tvari u izlaznoj vodi ispitnog uređaja (mg tvari/l, utvrđena specifičnom analizom). |
1.3. REFERENTNE TVARI
Referentne tvari mogu biti korisne kod ispitivanja novih tvari; međutim, još se ne mogu preporučiti određene referentne tvari.
1.4. NAČELO ISPITNIH METODA
Kod određivanja potpune biorazgradivosti provodi se paralelno ispitivanje u dvije pilot jedinice s aktivnim muljem (jedinice iz potvrdnog testa OECD ili jedinice s propusnom posudom). Ispitivana tvar se doda u ulaznu vodu (sintetička ili komunalna otpadna voda) jedne od jedinica, dok u drugu jedinicu ulazi otpadna voda bez ispitivane tvari. Za određivanje primarne biorazgradnje u ulaznoj i izlaznoj vodi putem specifične analize koristi se samo jedan uređaj.
Provodi se mjerenje koncentracija DOC-a (ili KPK) u izlaznoj vodi, ili se određuju koncentracije tvari putem specifične analize.
DOC iz ispitivanog materijala ne mjeri se, već se samo navede.
Ako se mjeri DOC (ili KPK), razlika između srednjih koncentracija ispitne i kontrolne otpadne vode pripisuje se nerazgrađenom ispitivanom materijalu.
Ako se provode specifične analize, može se izmjeriti promjena koncentracije polazne molekule (primarna biorazgradnja).
Jedinicama se može upravljati kao „povezanim jedinicama” u transinokulacijskom postupku.
1.5. KRITERIJI KAKVOĆE
Početna koncentracija tvari ovisi o vrsti analize koja se provodi i njezinim ograničenjima.
1.6. OPIS ISPITNE METODE
1.6.1. Priprema
1.6.1.1.
Potreban je par jedinica iste vrste, osim ako se provode specifične analize. Mogu se koristiti dvije vrste jedinica:
Jedinica iz potvrdnog testa OECD
Oprema (Dodatak 1.) se sastoji od spremnika (A) za sintetičku otpadnu vodu, dozirne crpke (B), posude za dozračivanje (C), separatora (D), „air-lift” crpke (E) za recirkuliranje aktivnog mulja i posude (F) za skupljanje obrađene otpadne vode.
Posude (A) i (F) moraju biti izrađene od stakla ili prikladnog plastičnog materijala i imati zapremninu od barem 24 litre. Crpka (B) mora osiguravati stalni dotok sintetičke otpadne vode u posudu za dozračivanje; može se koristiti bilo koji prikladan sustav koji može osigurati odgovarajući dotok i koncentraciju. Tijekom uobičajenog rada visina separatora (D) je podešena na način da volumen miješane suspenzije u posudi za dozračivanje bude tri litre. U stožastom vrhu posude (C) nalazi se sinterirani zračni kamen (G). Količina zraka koja se upuhuje kroz dozračivač može se nadzirati pomoću mjerača protoka.
„Air-lift” crpka (E) podešava se tako da se aktivni mulj iz separatora neprekidno i redovito vraća u posudu za dozračivanje (C).
Jedinica s „propusnom posudom”
Propusna posuda se sastoji od ploča poroznog polietilena (2 mm debljine, maksimalna veličina pora 95 μm) koje se oblikuju u cilindre promjera 14 cm sa stožastim dnom pod kutom od 45° (Slika 1. i 2. Dodatka 2.). Propusna se posuda nalazi u nepropusnoj posudi od prikladnog plastičnog materijala promjera 15 cm, s ispustom u cilindričnom dijelu na visini od 17,2 cm, koji određuje volumen u posudi (3 litre). Oko gornjeg dijela unutarnje posude postavljen je kruti potporni prsten od prikladnog plastičnog materijala tako da se između unutarnje i vanjske posude nalazi odljevni prostor od 0,5 cm.
Propusne se posude mogu postaviti u vodenu kupelj s termostatom. Zrak se dovodi u dno unutarnje posude na kojemu su smješteni prikladni difuzori.
Posude (A) i (E) moraju biti izrađene od stakla ili prikladnog plastičnog materijala i imati zapremninu od barem 24 litre. Crpka (B) mora osiguravati stalni protok sintetičke otpadne vode do posude za dozračivanje; može se koristiti bilo koji prikladan sustav koji može osigurati odgovarajući dotok i koncentraciju.
Moraju biti raspoložive rezervne propusne posude kako bi se mogle zamijeniti posude koje sa začepe tijekom uporabe; začepljene se posude čiste tako da se 24 sata ostave uronjene u otopinu hipoklorita i zatim temeljito operu vodom iz slavine.
1.6.1.2.
Oprema za membransku filtraciju i membranski filtri veličine pora 45 μm. Prikladni su membranski filtri koji ne otpuštaju ugljik i ne apsorbiraju tvar tijekom filtracije.
1.6.1.3.
Može se korstiti prikladna sintetička hranjiva otopina ili komunalna otpadna voda.
Primjer sintetičke hranjive otopine
Po litri vode iz slavine otopi se:
|
pepton: |
160 mg, |
|
mesni ekstrakt: |
10 mg, |
|
urea: |
30 mg, |
|
NaCl: |
7 mg, |
|
CaCl2.2H2O: |
4 mg, |
|
MgSO4.7H2O: |
2 mg |
|
K2HPO4: |
28 mg. |
Komunalna otpadna voda
Ovu otpadnu vodu treba skupljati svaki dan iz preljeva primarne taložnice postrojenja za pročišćavanje koje pretežito pročišćava komunalne otpadne vode.
1.6.1.4.
Treba pripremiti otopinu ispitivane tvari npr. 1 %, koja će se dodavati u ispitnu jedinicu. Potrebno je odrediti koncentraciju tvari da bi se mogao utvrditi volumen koji treba dodati u otpadnu vodu ili izravno u jedinicu putem druge crpke kako bi se dobila potrebna ispitna koncentracija.
1.6.1.5.
Napomena: Ako se koristi komunalna otpadna voda, nema smisla koristiti inokulum s niskom koncentracijom bakterija, ali se može koristiti aktivni mulj.
Mogu se koristiti različiti inokulumi.
Ovdje se nalaze tri primjera prikladnog inokuluma:
|
(a) |
Inokulum iz sekundarne otpadne vode Inokulum treba pripremiti iz kvalitetne sekundarne otpadne vode iz postrojenja za pročišćavanje koje pretežito obrađuje komunalne otpadne vode. U vremenu između uzorkovanja i uporabe otpadnu vodu treba držati u aerobnim uvjetima. Da bi se dobio inokulum, uzorak se profiltrira kroz grubi filtar i prvih se 200 ml filtrata baci. Filtrat do uporabe treba održavati aerobnim. Inokulum se mora upotrijebiti istog dana. Za inokulaciju je potrebno barem 3 ml. |
|
(b) |
Složeni inokulum Inokulum iz sekundarne otpadne vode: Vidjeti opis gore. Inokulum iz tla: 100 g vrtne zemlje (plodna, ne sterilna) suspendira se u 1 000 ml vode za piće koja ne sadrži klor. (Tla s jako velikim udjelom gline, pijeska ili humusa nisu prikladna). Suspenzija se promiješa i ostavi 30 minuta da se istaloži. Supernatant se profiltrira kroz grubi filtar-papir i prvih se 200 ml baci. Filtrat se odmah počne dozračivati i dozračuje se do uporabe. Inokulum se mora upotrijebiti istog dana. Inokulum iz površinske vode: Treći dio inokuluma uzima se iz mezosaprobne površinske vode. Uzorak se profiltrira kroz grubi papir i prvih se 200 ml baci. Filtrat se održava aerobnim do uporabe. Inokulum se mora upotrijebiti istog dana. Uzmu se jednaki volumeni sva tri uzorka inokuluma, sjedine se, dobro promiješaju i iz smjese uzme konačni inokulum. Za inokulaciju je potrebno barem 3 ml. |
|
(c) |
Inokulum iz aktivnog mulja Kao inokulum se može upotrijebiti određeni volumen (ne više od tri litre) aktivnog mulja (sadržaj suspendirane krute tvari do 2,5 g/l) iz aeracijskog bazena postrojenja za pročišćavanje koje pretežito pročišćava komunalne otpadne vode. |
1.6.2. Postupak
Ispitivanje se provodi na sobnoj temperaturi, koju treba održavati između 18 i 25 °C.
Ispitivanje se, tamo gdje je to primjereno, može provesti i na nižoj temperaturi (do 10 °C); ako se tvar razgradi, u pravilu nije potrebno provoditi daljnja ispitivanja. Međutim, ako se tvar ne razgradi, ispitivanje se mora provesti na stabilnoj temperaturi između 18 i 25 °C.
1.6.2.1.
Faza rasta mulja/stabilizacije je vrijeme u kojemu koncentracija suspendirane krute tvari u aktivnom mulju i rad jedinica dolaze u stabilno stanje u radnim uvjetima.
Faza ustaljenja je vrijeme koje traje od trenutka prvog dodavanja ispitivane tvari do trenutka kad njezino opadanje dosegne plato (relativno stalnu vrijednost). Ovo razdoblje ne smije biti duže od šest tjedana.
Faza ocjenjivanja je razdoblje od tri tjedna od trenutka kad opadanje ispitivane tvari dosegne relativno stalnu i obično visoku vrijednost. Kod tvari koje se u prvih šest tjedana slabo razgrađuju ili se uopće ne razgrađuju, za fazu ocjenjivanja uzimaju se sljedeća tri tjedna.
Prvo se jedinica odnosno jedinice potrebne za jedno ispitivanje napune smjesom inokuluma i otpadne vode.
Zatim se pokrene uređaj za dozračivanje (i „air-lift” crpka (E), u slučaju jedinica iz potvrdnog testa OECD) i uređaj za doziranje (B).
Ulazna struja otpadne vode bez ispitivane tvari mora prolaziti kroz posudu za dozračivanje (C) brzinom od jedne litre na sat ili pola litre na sat, čime se dobiva srednje vrijeme zadržavanja od tri ili šest sati.
Intenzitet dozračivanja treba podesiti na način da sadržaj posude (C) bude stalno suspendiran i da sadržaj otopljenog kisika ne padne ispod 2 mg/l.
Pjenjenje treba spriječiti prikladnim sredstvima. Ne smiju se koristiti sredstva protiv pjenjenja koja imaju inhibitorni učinak na aktivni mulj.
Mulj koji se nakuplja na vrhu posude za dozračivanje (C) (u slučaju jedinica iz potvrdnog testa OECD, također i na dnu taložne posude (D) i u sustavu za recirkulaciju) mora se vratiti u miješanu suspenziju najmanje jedanput dnevno četkanjem ili na neki drugi prikladan način.
Ako se mulj ne taloži, njegova se gustoća može povećati dodavanjem (prema potrebi i višekratnim) 2 ml 5 %-tne otopine željezovog klorida.
Izlazna se voda skuplja u posudi (E ili F) 20 do 24 sata, a uzorak se uzima nakon temeljitog miješanja. Posuda (E odnosno F) mora se pažljivo očistiti.
U svrhu praćenja i kontrole učinkovitosti postupka, kemijska potrošnja kisika (KPK) odnosno otopljeni organski ugljik (DOC) filtrata akumulirane izlazne vode kao i filtrirane ulazne vode mjeri se najmanje dvaput tjedno (uz pomoć membrane veličine pora 0,45 μm, pri čemu se prvih 20 ml (približno) filtrata baca).
Opadanje KPK odnosno DOC-a trebalo bi se ujednačiti kad se postigne manje-više pravilna dnevna razgradnja.
Sadržaj suhe tvari aktivnog mulja u aeracijskom bazenu određuje se dvaput tjedno (u g/l). Jedinicama se može upravljati na jedan od ova dva načina: sadržaj suhe tvari u aktivnom mulju određuje se dvaput tjedno i ako je on viši od 2,5 g/l, višak se aktivnog mulja baca, ili se iz posuda svakog dana vadi po 500 ml miješane suspenzije tako da se dobije srednje vrijeme zadržavanja mulja od šest dana.
Kad su izmjereni i procijenjeni parametri (učinkovitost postupka (opadanje KPK ili DOC-a), mulj, koncentracija, taloženje mulja, zamućenje izlazne vode itd.) dviju jedinica dovoljno stabilni, ispitivana se tvar može uvesti u ulaznu struju jedne od jedinica u skladu s 1.6.2.2.
Druga je mogućnost da se ispitivana tvar doda na početku faze rasta mulja (1.6.2.1.), posebno kad se mulj dodaje kao inokulum.
1.6.2.2.
Održavajući radne uvjete faze ustaljenja, u ulaznu struju ispitne jedinice doda se dovoljna količina radne otopine ispitivane tvari (približno 1 %) da se dobije željena koncentracija ispitivane tvari (približno 10 do 20 mg DOC/l ili 40 mg KPK/l) u otpadnoj vodi. To se može postići dnevnim primješavanjem radne otopine mulju ili pomoću zasebnog crpnog sustava. Ova se koncentracija može postići postupno. Ako ispitivana tvar nema toksične učinke na aktivni mulj, mogu se ispitivati i više koncentracije.
Jedinica za slijepu probu puni se samo otpadnom vodom, bez dodavanja tvari. Potrebne se količine izlazne vode uzmu na analizu i profiltriraju kroz membranske filtre (0,45 μm), pri čemu se prvih 20 ml (približno) filtrata baca.
Filtrirani se uzorci moraju analizirati isti dan, u protivnome se moraju konzervirati prikladnom metodom, primjerice primjenom 0,05 ml 1 %-tne otopine živinog klorida (HgCl2) na 10 ml filtrata, ili pohraniti na temperaturi od 2 do 4 °C do 24 sata ili, u dužem vremenu, na – 18 °C.
Faza ustaljenja od dodavanja ispitivane tvari ne smije trajati duže od šest tjedana, a faza ocjenjivanja ne smije biti kraća od tri tjedna tj. za izračun konačnog rezultata trebalo bi biti na raspolaganju oko 14 do 20 određivanja.
Način rada „s povezanim jedinicama”
Povezivanje jedinica postiže se na način da se jedanput dnevno između jedinca razmijeni 1,5 litara miješane suspenzije (uključujući mulj) iz posuda za dozračivanje. Ako se ispitivani materijal jako apsorbira, uzme se samo 1,5 litara supernatanta iz taložnih posuda i ulije u posudu s aktivnim muljem druge jedinice.
1.6.2.3.
Za praćenje ponašanja tvari mogu se provesti dvije vrste analize.
DOC i KPK
Provodi se dvostruko mjerenje koncentracije DOC-a pomoću analizatora ugljika i/ili se određuju vrijednosti KPK u skladu s (2).
Specifična analiza
Koncentracije ispitivane tvari određuju se prikladnom analitičkom metodom. Ako je to moguće, treba provesti specifično određivanje tvari apsorbirane na mulj.
2. PODACI I VREDNOVANJE
2.1. NAČIN RADA „S POVEZANIM JEDINICAMA”
Ako se primjenjuje postupak „s povezanim jedinicama”, izračunava se dnevni stupanj opadanja (DR) u skladu s 1.2.1.
Dnevni stupanj opadanja (DR) ispravlja se u DRc, s obzirom na prijenos materijala u postupku transinokulacije, pomoću jednadžbe [2] za srednje vrijeme zadržavanja od tri sata odnosno pomoću jednadžbe [3] za srednje vrijeme zadržavanja od šest sati.
|
|
[2] |
|
|
[3] |
Izračuna se srednja vrijednost niza vrijednosti DRc te standardna devijacija pomoću jednadžbe [4]:
|
|
[4] |
gdje je:
|
SDRc |
= |
standardna devijacija niza vrijednosti DRc |
|
|
= |
srednja vrijednost DRc |
|
n |
= |
broj određivanja |
Stršeće vrijednosti iz niza DRc eliminiraju se prikladnim statističkim postupkom, npr. Nalimov (6), na razini vjerojatnosti 95 % te se ponovno izračuna srednja vrijednost i standardna devijacija skupa podataka DRc bez stršećih vrijednosti.
Konačni se rezultat zatim izračuna pomoću jednadžbe [5] kao
|
|
[5] |
gdje je:
|
tn–1;α |
= |
tablična vrijednost t za n parova vrijednosti E i Eo i statističku pouzdanost P (P = 1 – α), pri čemu je P = 95 % (1). |
Rezultat se navodi kao srednja vrijednost s granicama tolerancije na razini vjerojatnosti 95 %, pripadajuća standardna devijacija i broj podataka u skupu podataka DRc bez stršećih vrijednosti te broj stršećih vrijednosti, npr.
|
DRc |
= |
98,6 ± 2,3 % opadanja DOC |
|
s |
= |
4,65 % opadanja DOC |
|
n |
= |
18 |
|
x |
= |
broj stršećih vrijednosti. |
2.2. NAČIN RADA „S NEPOVEZANIM JEDINICAMA”
Radne značajke jedinica mogu se provjeriti na sljedeći način:
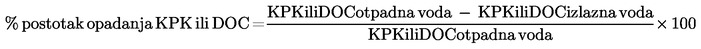
Grafičkim prikazom dnevnog opadanja mogu se otkriti mogući trendovi npr. aklimatizacija.
2.2.1. Postupak s određivanjem KPK/DOC
Dnevni stupanj opadanja (DR) izračunava se u skladu s 1.2.1.
Izračuna se srednja vrijednost niza vrijednosti DR; usto se izračuna standardna devijacija u skladu s:
|
|
[6] |
gdje je:
|
SDR |
= |
standardna devijacija niza vrijednosti DRi |
|
DR— |
= |
srednja vrijednost DRi |
|
n |
= |
broj određivanja. |
Stršeće vrijednosti iz niza DR eliminiraju se prikladnim statističkim postupkom, npr. Nalimov (6), na razini vjerojatnosti 95 % te se ponovno izračuna srednja vrijednost i standardna devijacija skupa podataka DR bez stršećih vrijednosti.
Konačni se rezultat zatim izračuna pomoću jednadžbe [7] kao:
|
|
[7] |
gdje je:
|
tn-1;α |
= |
tablična vrijednost t za n parova vrijednosti E i Eo i statističku pouzdanost P (P = 1 – α), pri čemu je P = 95 % (1). |
Rezultat se navodi kao srednja vrijednost s granicama tolerancije na razini vjerojatnosti 95 %, pripadajuća standardna devijacija i broj podataka u skupu podataka DR bez stršećih vrijednosti te broj stršećih vrijednosti, npr.
|
DR |
= |
(98,6 ± 2,3) % opadanja DOC |
|
s |
= |
(4,65) % opadanja DOC |
|
n |
= |
18 |
|
x |
= |
broj stršećih vrijednosti. |
2.2.2. Postupak sa specifičnom analizom
Postotak eliminacije ispitivane tvari iz vodene faze (Rw) izračunava se u skladu s 1.2.2.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju po mogućnosti sadrži sljedeće:
|
— |
obrazac iz Dodatka 3. iz kojega su vidljivi radni uvjeti ispitivanja, |
|
— |
odabrana aparatura (potvrdni test OECD ili propusna posuda), |
|
— |
odabrani način rada: s povezanim ili nepovezanim jedinicama, |
|
— |
vrsta otpadne vode: sintetička ili komunalna – u slučaju komunalne otpadne vode: datum i mjesto uzorkovanja, |
|
— |
vrsta inokuluma, s datumom i mjestom uzorkovanja, |
|
— |
primijenjena analitička metoda s opisom, ako se provode specifične analize, |
|
— |
grafički prikaz opadanja KPK ili DOC-a u vremenu, uključujući fazu ustaljenja i fazu ocjenjivanja, |
|
— |
analitičko iskorištenje ispitivane tvari kao KPK ili DOC u radnoj otopini, |
|
— |
ako se provode specifične analize, grafički prikaz postotka opadanja ispitivane tvari u vodenoj fazi u vremenu (faza ustaljenja i faza ocjenjivanja), |
|
— |
srednja vrijednost opadanja DOC-a ili KPK ispitivane tvari i standardna devijacija izračunavaju se iz rezultata faze ocjenjivanja tj. kad se opadanje ispitivane tvari stabilizira odnosno uspostavi razdoblje stabilnog rada, |
|
— |
grafički prikaz koncentracije aktivnog mulja u ovisnosti o vremenu, |
|
— |
napomene vezane uz aktivni mulj (bacanje viška mulja, prisutnost bubrenja, FeCl3 itd.), |
|
— |
koncentracija tvari koja se koristi u ispitivanju, |
|
— |
rezultati analize mulja, |
|
— |
sve informacije i rezultati pokusa u vezi s ispitivanom tvari i referentnom tvari, ako se koristi, |
|
— |
znanstveni razlozi mogućih izmjena postupka. |
3.2. TUMAČENJE REZULTATA
Niske vrijednosti opadanja ispitivane tvari u vodenoj fazi mogu biti posljedica inhibitornog učinka ispitivane tvari na mikroorganizme. To se također može očitovati razlaganjem i gubitkom mulja i zamućenjem supernatanta te smanjivanjem učinkovitosti opadanja KPK (ili DOC-a) u pilot postrojenju.
Ovdje ponekad može imati utjecaja i fizikalno-kemijska adsorpcija. Razlike između biološkog djelovanja na molekulu i fizikalno-kemijske adsorpcije mogu se utvrditi analizom mulja nakon odgovarajuće desorpcije.
Ako je potrebno razlikovati biorazgradnju (ili djelomičnu biorazgradnju) od adsorpcije, treba provesti dodatna ispitivanja.
To se može učiniti na više načina, ali najpouzdaniji način je provesti ispitivanje osnovne razine koristeći supernatant kao inokulum (po mogućnosti respirometrijski test).
Visoko opadanje DOC-a odnosno KPK može se pripisati biorazgradnji, dok se kod niskog opadanja biorazgradnja ne može razlikovati od eliminacije. Na primjer, ako topljivi spoj ima visoku konstantu adsorpcije od 98 % i ako se dnevno ukloni 10 % viška mulja, moguća je eliminacija do 40 %; ako se dnevno ukloni 30 % viška mulja, eliminacija zbog adsorpcije na višak mulja i uklanjanja s viškom mulja može iznositi i do 65 % (4).
Kod primjene specifične analize treba voditi računa o odnosu između strukture tvari i primijenjene analitičke metode. U ovom se slučaju uočena pojava ne može tumačiti kao mineralizacija tvari.
4. REFERENCE
|
(1) |
OECD, Paris, 1981, Test Guideline 303 A, Decision of the Council C(81) 30 final. |
|
(2) |
Prilog V C9 Test razgradivosti – kemijska potreba za kisikom, Direktiva Komisije 84/449/EEZ, (SL L 251, 19.9.1984., str. 1). |
|
(3) |
Painter, H. A., King, E. F., WRC Porous-Pot method for assessing biodegradability, Technical Report TR70, June 1978, Water Research Centre, United Kingdom. |
|
(4) |
Wierich, P., Gerike, P., The fate of soluble, recalcitrant, and adsorbing compounds in activated sludge plants, Ecotoxicology and Environmental Safety, vol. 5, No 2, June 1981, str. 161-171. |
|
(5) |
Direktive Vijeća 82/242/EEZ i 82/243/EEZ, (SL br. L 109, 22.4.1982., str. 1), o izmjeni direktiva Vijeća 73/404/EEZ i 73/405/EEZ o biorazgradivosti deterdženata, (SL L 347, 17.12.1973., str. 51). |
|
(6) |
Streuli, H., Fehlerhafte Interpretation und Anwendung von Ausreßertests, insbesondere bei Ringversuchen zur Oberprüfung analytisch-chemischer Untersuchungsmethoden, Fresenius-Zeitschrift für Analytische Chemie, 303 (1980), str. 406-408. |
Dodatak 1.
Slika 1.

Slika 2.

Dodatak 2.
Slika 1.
Oprema za ocjenjivanje biorazgradivosti
Slika 2.
Detalji jedinice za dozračivanje s propusnom posudom zapremnine 3 litre

Dodatak 3.
Radni uvjeti za simulacijski test s aktivnim muljem
Staviti kvačicu u svakoj grupi
Aparatura
|
Potvrdni test OECD |
|
|
Propusna posuda |
|
Način rada
|
Jedna jedinica |
|
|
Povezane jedinice |
|
|
Nepovezane jedinice |
|
Transinokulacija
|
Nema |
|
|
Aktivni mulj |
|
|
Supernatant |
|
Srednje vrijeme zadržavanja
|
Tri sata |
|
|
Šest sati |
|
Osnovni hranjivi medij
|
Komunalna otpadna voda |
|
|
Sintetička otpadna voda |
|
Inokulum
|
Sekundarna otpadna voda |
|
|
Složeni |
|
|
Aktivni mulj |
|
Uvođenje ispitivanog materijala
|
Od početka |
|
|
Postupno povećanje |
|
|
Nakon formiranja mulja |
|
Analiza
|
Specifična |
|
|
KPK |
|
|
DOC |
|
C.11. BIORAZGRADNJA
TEST INHIBICIJE DISANJA AKTIVNOG MULJA
1. METODA
1.1. UVOD
Opisanom metodom ocjenjuje se učinak ispitivane tvari na mikroorganizme mjerenjem stope disanja u definiranim uvjetima u prisutnosti različitih koncentracija ispitivane tvari.
Svrha ove metode je osigurati brzu orijentacijsku metodu kojom se mogu utvrditi tvari koje mogu imati štetni učinak na postrojenja za pročišćavanje s aerobnim mikroorganizmima te navesti prikladne neinhibitorne koncentracije ispitivanih tvari koje se mogu koristiti u ispitivanjima biorazgradivosti.
Prije glavnog ispitivanja može se provesti ispitivanje za određivanje raspona. Ono pruža informacije o rasponu koncentracija koje će se koristiti u glavnom ispitivanju.
Planom ispitivanja predviđene su dvije kontrole bez ispitivane tvari, jedna na početku i jedna na kraju ispitnog niza. Osim toga, svaku šaržu aktivnog mulja treba provjeriti uz pomoć referentne tvari.
Ovu je metodu najlakše primijeniti na tvari kod kojih se na temelju topljivosti u vodi i niske hlapljivosti može očekivati da će ostati u vodi.
Kod tvari ograničene topljivosti u ispitnom mediju nije uvijek moguće odrediti EC50.
Ako je ispitivana tvar sklona rasprezanju oksidativne fosforilacije, iz rezultata na temelju potrošnje kisika mogu se izvesti pogrešni zaključci.
Korisne informacije za provedbu ispitivanja:
|
— |
topljivost u vodi, |
|
— |
tlak pare, |
|
— |
strukturna formula, |
|
— |
čistoća ispitivane tvari. |
Preporuka
Aktivni mulj može sadržavati potencijalno patogene organizme i stoga njime treba pažljivo rukovati.
1.2. DEFINICIJE I JEDINICE
Stopa disanja je potrošnja kisika mikroorganizama otpadnih voda u aerobnom mulju, koja se općenito izražava u mg O2 po mg mulja na sat.
Kod izračunavanja inhibitornog učinka ispitivane tvari pri određenoj koncentraciji stopa disanja se iskazuje kao postotak srednje vrijednosti dviju kontrolnih stopa disanja:

gdje je:
|
Rs |
= |
stopa potrošnje kisika u ispitanoj koncentraciji ispitivane tvari |
|
R1 |
= |
stopa potrošnje kisika, kontrola 1 |
|
R2 |
= |
stopa potrošnje kisika, kontrola 2. |
EC50 kod ove metode je koncentracija ispitivane tvari pri kojoj stopa disanja iznosi 50 % stope disanja zabilježene u kontroli u uvjetima koji su opisani u ovoj metodi.
1.3. REFERENTNE TVARI
Preporučuje se da se kao referentna tvar koristi 3,5-diklorfenol, kao poznati inhibitor disanja, te da se njime ispita EC50 svake šarže aktivnog mulja kako bi se isključila neuobičajena osjetljivost mulja.
1.4. NAČELO ISPITNE METODE
Stopa disanja aktivnog mulja koji se hrani standardnom količinom sintetičke otpadne vode mjeri se nakon vremena kontakta od 30 minuta ili tri sata ili oboje. Osim toga, mjeri se stopa disanja tog istog aktivnog mulja u prisutnosti različitih koncentracija ispitivane tvari u inače istovjetnim uvjetima. Inhibitorni učinak ispitivane tvari u određenoj koncentraciji izražava se kao postotak srednjih stopa disanja dviju kontrola. Vrijednost EC50 izračunava se na temelju određivanja pri različitim koncentracijama.
1.5. KRITERIJI KAKVOĆE
Rezultati ispitivanja su valjani ako:
|
— |
se dvije kontrolne stope disanja ne razlikuju za više od 15 %, |
|
— |
se EC50 (30 minuta i/ili tri sata) 3,5-diklorfenola nalazi u prihvaćenom području od 5 do 30 mg/l. |
1.6. OPIS ISPITNE METODE
1.6.1. Reagensi
1.6.1.1.
Otopine ispitivane tvari treba svježe pripremiti na početku istraživanja uz pomoć radne otopine. Ako se slijedi preporučeni postupak u nastavku, prikladna je koncentracija radne otopine od 0,5 g/l.
1.6.1.2.
Otopina 5,5-diklorfenola može se pripremiti npr. na način da se 0,5 g 3,5-diklorfenola otopi u 10 ml 1M NaOH, razrijedi destiliranom vodom na približno 30 ml i uz miješanje dodaje 0,5M H2SO4 do točke početka taloženja – potrebno je približno 8 ml 0,5M H2SO4 – i na kraju dobivena smjesa razrijedi destiliranom vodom do jedne litre. pH bi tada trebao biti u području između 7 i 8.
1.6.1.3.
Sintetička otpadna voda priprema se otapanjem sljedećih količina tvari u jednoj litri vode:
|
— |
16 g peptona, |
|
— |
11 g mesnog ekstrakta, |
|
— |
3 g uree, |
|
— |
0,7 g NaCl, |
|
— |
0,4 g CaCl2.2H2O, |
|
— |
0,2 g MgSO4.7H2O, |
|
— |
2,8 g K2HPO4. |
Napomena 1.: Ova sintetička otpadna voda predstavlja 100-struki koncentrat vode opisane u tehničkom izvješću OECD „Predložena metoda za određivanje biorazgradivosti surfaktanata koji se koriste u sintetičkim deterdžentima” (11. lipnja 1976.) s dodatkom dikalijevog hidrogenfosfata.
Napomena 2.: Ako se pripremljeni medij ne upotrijebi odmah, treba ga čuvati u mraku na 0 do 4 °C do najviše jednog tjedna u uvjetima koji neće izazvati promjenu njegovog sastava. Medij se prije skladištenja može sterilizirati, ili se pepton i mesni ekstrakt mogu dodati neposredno prije ispitivanja. Prije uporabe ga treba temeljito promiješati i podesiti pH.
1.6.2. Aparatura
Mjerna aparatura: točan oblik aparature nije od presudnog značaja. Ipak, posuda ne smije biti puna i sonda mora točno pristajati u vrat odmjerne tikvice.
Potrebna je uobičajena laboratorijska oprema, a posebno:
|
— |
mjerna aparatura, |
|
— |
uređaj za dozračivanje, |
|
— |
pH elektroda i mjerna oprema, |
|
— |
elektroda O2. |
1.6.3. Priprema inokuluma
Kao mikrobni inokulum za ispitivanje koristi se aktivni mulj iz postrojenja za pročišćavanje koje pretežito pročišćava komunalni mulj.
Prema potrebi se grube čestice mogu ukloniti u laboratoriju kratkim taloženjem, npr. 15 minuta, i pretakanjem gornjeg sloja koji sadrži finije čestice za uporabu. Kao druga mogućnost, mulj se može kratko promiješati pomoću mješalice (nekoliko sekundi).
Osim toga, ako se sumnja da je prisutan inhibitorni materijal, mulj treba oprati vodom iz slavine ili izotoničnom otopinom. Supernatant se nakon centrifugiranja pretoči (ovaj se postupak ponavlja tri puta).
Izvaže se mala količina mulja i osuši. Iz rezultata se može izračunati količina mokrog mulja koju treba suspendirati u vodi da se dobije aktivni mulj sa sadržajem suspendirane krute tvari u miješanoj suspenziji u području između 2 i 4 g/l. Na taj se način, ako se slijedi preporučeni postupak u nastavku, dobije koncentracija između 0,8 i 1,6 g/l u ispitnom mediju.
Ako se mulj ne može upotrijebiti istog dana, na svaku litru aktivnog mulja pripremljenog na gore opisani način treba dodati 50 ml sintetičke otpadne vode i dozračivati preko noći na 20 ± 2 °C. Mulj se nastavlja dozračivati za uporabu tijekom dana. Prije uporabe se provjeri pH i prema potrebi podesi na pH od 6 do 8. Suspendirana kruta tvar u miješanoj suspenziji određuje se na način kako je opisano u prethodnom stavku.
Ako se ista šarža mulja mora koristiti i sljedećih dana (najviše četiri dana), na kraju svakog radnog dana doda se još 50 ml sintetičke otpadne vode po litri mulja.
1.6.4. Provođenje ispitivanja
|
Trajanje/vrijeme kontakta: |
30 minuta i/ili tri sata, tijekom kojih se provodi dozračivanje |
|
Voda: |
voda za piće (prema potrebi deklorirana) |
|
Dovod zraka: |
čisti zrak bez ulja, protok zraka 0,5 do 1 l/min |
|
Mjerna aparatura: |
tikvica s ravnim dnom, potput tikvice BPK |
|
Mjerač kisika: |
prikadna kisikova elektroda s rekorderom |
|
Hranjiva otopina: |
sintetička otpadna voda (vidjeti gore) |
|
Ispitivana tvar: |
ispitna otopina se svježe pripremi na početku ispitivanja |
|
Referentna tvar: |
npr. 3,5-diklorfenol (najmanje tri koncentracije) |
|
Kontrole: |
inokulirani uzorak bez ispitivane tvari |
|
Temperatura: |
20 ± 2 °C |
U nastavku je opisan predloženi pokusni postupak za vrijeme kontakta od 3 sata, koji se može primijeniti kako na ispitivanu tako i na referentnu tvar.
Koristi se nekoliko posuda (npr. laboratorijske čaše od jedne litre).
Treba koristiti najmanje pet koncentracija koje se razlikuju za stalni faktor, po mogućnosti ne viši od 3,2.
U vremenu „0” se 16 ml sintetičke otpadne vode nadopuni vodom do 300 ml. Doda se 200 ml mikrobnog inokuluma i čitava smjesa (500 ml) ulije u prvu posudu (prvi kontrolni uzorak C1).
Ispitne posude treba neprekidno dozračivati tako da otopljeni O2 ne padne ispod 2,5 mg/l i da koncentracija O2 neposredno prije mjerenja stope disanja bude oko 6,5 mg/l.
Gornji se postupak ponovi u vremenu „15 minuta” (15 minuta je proizvoljan, ali praktičan interval), ali se pritom u 16 ml sintetičke otpadne vode prvo doda 100 ml radne otopine ispitivane tvari i zatim nadopuni vodom do 300 ml i doda mikrobni inokulum da se dobije volumen od 500 ml. Ova se smjesa zatim ulije u drugu posudu i dozračuje kako je opisano gore. Ovaj se postupak ponavlja svakih 15 minuta s različitim volumenima radne otopine ispitivane tvari da se dobije niz posuda koje sadrže različite koncentracije ispitivane tvari. Na kraju se pripremi drugi kontrolni uzorak (C2).
Nakon tri sata zabilježi se pH i dobro promiješani uzorak sadržaja prve posude ulije se u mjernu aparaturu te se mjeri stopa disanja u trajanju do 10 minuta.
Ovo se određivanje ponavlja na sadržaju svake posude u razmacima od 15 minuta na način da vrijeme kontakta u svakoj posudi bude tri sata.
Ispitivanje s referentnom tvari provodi se na isti način na svakoj šarži mikrobnog inokuluma.
Ako se mjerenja provode nakon 30-minutnog kontakta, treba primijeniti drukčiji režim (npr. više mjerača kisika).
Ako je potrebno mjerenje kemijske potrošnje kisika, pripreme se dodatne posude s ispitivanom tvari, sintetičkom otpadnom vodom i vodom, ali bez aktivnog mulja. Potrošnja kisika mjeri se i bilježi nakon vremena dozračivanja od 30 minuta i/ili tri sata (vrijeme kontakta).
2. PODACI I OCJENJIVANJE
Stopa disanja izračunava se iz zapisa rekordera između približno 6,5 mg O2/l i 2,5 mg O2/l ili tijekom 10-minutnog razdoblja, ako je stopa disanja niska. Dio krivulje disanja u kojemu se mjeri stopa disanja trebao bi biti linearan.
Ako je razlika između stopa disanja dviju kontrola viša od 15 %, ili ako EC50 (30 minuta i/ili tri sata) referentne tvari nije unutar prihvaćenog područja (od 5 do 30 mg/l za 3,5- diklorfenol), ispitivanje nije valjano i treba ga ponoviti.
Postotak inhibicije izračunava se za svaku ispitnu koncentraciju (vidjeti 1.2.). Postotak inhibicije treba grafički prikazati u ovisnosti o koncentraciji na običnom logaritamskom papiru (ili logaritamskom papiru vjerojatnosti) i odrediti EC50.
Granice pouzdanosti 95 % za vrijednosti EC50 mogu se odrediti standardnim postupcima.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju po mogućnosti sadrži sljedeće:
|
— |
ispitivana tvar: podaci za identifikaciju kemikalije, |
|
— |
ispitni sustav: izvor, koncentracija i prethodna obrada aktivnog mulja, |
|
— |
ispitni uvjeti:
|
|
— |
rezultati:
|
3.2. TUMAČENJE PODATAKA
Vrijednost EC50 treba gledati samo kao pokazatelj koji ukazuje na vjerojatnu toksičnost ispitivane tvari za aktivni mulj u postupku pročišćavanja otpadnih voda ili za mikroorganizme otpadnih voda, budući da se složene interakcije koje se odvijaju u okolišu ne mogu točno simulirati u laboratorijskom ispitivanju. Osim toga, tvari koje imaju inhibitorni učinak na oksidaciju amonijaka mogu dati atipične krivulje inhibicije. Stoga te krivulje treba tumačiti s oprezom.
4. REFERENCE:
|
(1) |
International Standard ISO 8192-1986. |
|
(2) |
Broecker, B., Zahn, R., Water Research 11,1977, str. 165. |
|
(3) |
Brown, D., Hitz, H. R., Schaefer, L., Chemosphere 10, 1981, str. 245. |
|
(4) |
ETAD (Ecological and Tox.icological Association of Dyestuffs Manufacturing Industries), Recommended Method No 103, also described by: |
|
(5) |
Robra, B., Wasserl Abwasser 117, 1976, str. 80. |
|
(6) |
Schefer, W., Textilveredlung 6,1977, str. 247. |
|
(7) |
OECD, Paris, 1981, Test Guideline 209, Decision of the Council C(84) 30 final. |
C.12. BIORAZGRADNJA
IZMIJENJENI TEST SCAS
1. METODA
1.1. UVOD
Svrha metode je ocijeniti potencijalnu potpunu biorazgradivost vodotopljivih nehlapljivih organskih tvari kod izlaganja relativno visokim koncentracijama mikroorganizama tijekom dužeg vremenskog razdoblja. Mikroorganizmi se u tom razdoblju održavaju na životu svakodnevnim dodavanjem istaložene otpadne vode kao hranjive otopine. (Preko vikenda se otpadna voda može čuvati na 4 °C. Kao druga mogućnost, može se koristiti sintetička otpadna voda iz potvrdnog testa OECD.)
Kod tumačenja rezultata treba uzeti u obzir moguću fizikalno-kemijsku adsorpciju na suspendiranu krutu tvar (vidjeti 3.2.).
Zbog dugog vremena zadržavanja tekuće faze (36 sati) i periodičnog dodavanja nutrijenata ispitivanje ne oponaša uvjete koji vladaju u postrojenju za pročišćavanje otpadnih voda. Rezultati dobiveni s različitim ispitivanim tvarima ukazuju na to da test ima visok potencijal biorazgradnje.
Uvjeti ispitivanja su izrazito povoljni za selekciju i/ili prilagodbu mikroorganizama koji imaju sposobnost razgradnje ispitivanog spoja. (Postupak se može koristiti i za dobivanje aklimatiziranih inokuluma za druga ispitivanja.)
U ovoj se metodi mjera koncentracije otopljenog organskog ugljika koristi za ocjenjivanje potpune biorazgradivosti ispitivane tvari. DOC je najbolje odrediti nakon zakiseljavanja i pročišćavanja, a ne kao razliku Cukupni – Canorganski.
Istovremenom primjenom specifične analitičke metode moguće je ocijeniti i primarnu biorazgradnju tvari (nestajanje polazne kemijske strukture).
Metoda se primjenjuje samo na one organske ispitivane tvari koje su u koncentraciji koja se koristi u ispitivanju:
|
— |
topljive u vodi (najmanje 20 mg otopljenog organskog ugljika/l), |
|
— |
imaju zanemariv tlak pare, |
|
— |
nemaju inhibitorni učinak na bakterije, |
|
— |
ne adsorbiraju se u značajnoj mjeri unutar ispitnog sustava, |
|
— |
ne gube se iz ispitne otopine pjenjenjem. |
Mora biti poznat sadržaj organskog ugljika ispitivanog materijala.
Kod tumačenja dobivenih rezultata korisno je imati informacije o relativnim udjelima glavnih komponenti ispitivanog materijala, posebno ako su dobivene vrijednosti niske ili granične.
Informacije o toksičnosti tvari za mikroorganizme korisne su za tumačenje niskih vrijednosti i odabir odgovarajuće ispitne koncentracije.
1.2. DEFINICIJE I JEDINICE
|
CT |
= |
koncentracija ispitivanog spoja kao organski ugljik koji je prisutan u istaloženoj otpadnoj vodi ili dodan na početku razdoblja dozračivanja (mg/l), |
|
Ct |
= |
koncentracija otopljenog organskog ugljika u supernatantu ispitne jedinice na kraju razdoblja dozračivanja (mg/l), |
|
Cc |
= |
koncentracija otopljenog organskog ugljika u supernatantu kontrolne jedinice na kraju razdoblja dozračivanja (mg/l). |
U ovoj se metodi biorazgradnja definira kao nestajanje organskog ugljika. Biorazgradnja se može izraziti kao:
|
1. |
Postotak opadanja (Dda) količine tvari koja se dnevno dodaje:
gdje je:
|
|
2. |
Postotak opadanja (Dssd) količine tvari koja je prisutna na početku svakog dana:
gdje je
Indeksi i i (i + 1) odnose se na dan mjerenja. Jednadžba 2(a) preporučuje se ako se DOC izlazne otpadne vode mijenja iz dana u dan, dok se jednadžba 2(b) može koristiti kad DOC izlazne otpadne vode iz dana u dan ostaje relativno stalan. |
1.3. REFERENTNE TVARI
Referentne tvari mogu biti korisne kod ispitivanja novih tvari; ipak, ovdje se ne preporučuje određena referentna tvar.
Navedeni su podaci za nekoliko spojeva koji su ocijenjeni u prstenastim testovima (vidjeti Dodatak 1.); oni su prvenstveno predviđeni za povremeno baždarenje metode te za usporedbu rezultata kod primjene neke druge metode.
1.4. NAČELO ISPITNE METODE
Aktivni mulj iz postrojenja za pročišćavanje otpadnih voda stavi se u jedinicu aktivnog mulja s polukontinuiranim režimom (Semi-Continuous Activated Sludge unit, SCAS). Doda se ispitivani spoj i istaložena komunalna otpadna voda i smjesa dozračuje 23 sata. Dozračivanje se zatim prekida, pusti se da se mulj istaloži i ukloni supernatant.
Mulj koji preostane u komori za dozračivanje se zatim pomiješa s još jednim alikvotom ispitivanog spoja i otpadnom vodom i ciklus ponovi.
Biorazgradnja se utvrđuje određivanjem sadržaja otopljenog organskog ugljika u supernatantu. Ova se vrijednost uspoređuje s vrijednošću supernatanta iz kontrolne epruvete koja sadrži samo istaloženu otpadnu vodu.
U slučaju primjene specifične analitičke metode mogu se izmjeriti promjene koncentracije polazne molekule uslijed biorazgradnje (primarna biorazgradivost).
1.5. KRITERIJI KAKVOĆE
Obnovljivost ove metode, koja se temelji na opadanju otopljenog organskog ugljika, još nije utvrđena. (Ako se uzme u obzir primarna biorazgradnja, dobivaju se vrlo precizni podaci za tvari koje se opsežno razgrađuju.)
Osjetljivost metode u velikoj je mjeri ovisna o varijabilnosti slijepe probe te, u manjoj mjeri, o preciznosti određivanja otopljenog organskog ugljika i koncentraciji ispitivanog spoja u suspenziji na početku svakog ciklusa.
1.6. OPIS ISPITNOG POSTUPKA
1.6.1. Priprema
Uzme se dovoljan broj čistih jedinica za dozračivanje (može se koristiti i izvorna ispitna jedinica SCAS od 1,5 litara) i postave cijevi za dovod zraka (Slika 1.) za svaku ispitivanu tvar i kontrole. Komprimirani zrak koji se dovodi u ispitne jedinice pročišćava se kroz pamučni filtar; on ne smije sadržavati organski ugljik i treba ga prethodno zasititi vodom kako bi se smanjili gubici uslijed isparavanja.
Uzorak miješane suspenzije, koja sadrži od 1 do 4 g suspendirane krute tvari po litri, dobiva se iz postrojenja s aktivnim muljem u kojemu se pretežito pročišćava komunalna otpadna voda. Potrebno je približno 150 ml suspenzije po jedinici za dozračivanje.
Pripreme se radne otopine ispitivane tvari u destiliranoj vodi; u pravilu je potrebna koncentracija od 400 mg organskog ugljika po litri, čime se dobiva koncentracija ispitivanog spoja od 20 mg ugljika po litri na početku svakog ciklusa dozračivanja, ako ne dolazi do biorazgradnje.
Ako to dopušta toksičnost za mikroorganizme, dozvoljene su i više koncentracije.
Izmjeri se sadržaj organskog ugljika radnih otopina.
1.6.2. Ispitni uvjeti
Ispitivanje se provodi na 20 do 25 °C.
Koristi se visoka koncentracija aerobnih mikroorganizama (od 1 do 4 g/l suspendirane krute tvari), a efektivno razdoblje zadržavanja iznosi 36 sati. Ugljični materijal u otpadnoj vodi koja se koristi kao hranjivi medij se obilato oksidira, u pravilu tijekom osam sati nakon početka svakog ciklusa dozračivanja. Nakon toga mulj endogeno diše do kraja razdoblja dozračivanja, u kom je vremenu ispitivana tvar jedini raspoloživi supstrat, ako se i ona sama brzo ne razgradi. Ove značajke, uz svakodnevno ponovno inokuliranje kada se kao hranjivi medij koristi komunalna otpadna voda, osiguravaju izrazito povoljne uvjete za aklimatizaciju i visok stupanj biorazgradnje.
1.6.3. Provođenje ispitivanja
Iz prikladnog postrojenja s aktivnim muljem koje pretežito pročišćava komunalne otpadne vode ili laboratorijske jedinice uzme se uzorak miješane suspenzije i održava aerobnim do uporabe u laboratoriju. Sve jedinice za dozračivanje i kontrolna jedinica napune se sa 150 ml miješane suspenzije (ako se koristi izvorna ispitna jedinica SCAS ove količine treba pomnožiti s 10) i započne s dozračivanjem. Nakon 23 sata dozračivanje se prekida i pusti da se mulj istaloži u vremenu od 45 minuta. Zatim se otvori slavina i iz svake posude ispusti po 100 ml supernatanta. Uzme se svježi uzorak istaložene komunalne otpadne vode neposredno prije uporabe i 100 ml doda u preostali mulj svake jedinice za dozračivanje. Zatim se ponovno započne s dozračivanjem. U ovoj se fazi ne dodaje ispitivani materijal i jedinice se svakodnevno pune isključivo komunalnom otpadnom vodom dok se nakon taloženja ne dobije bistri supernatant. Za ovo su obično potrebna dva tjedna, do kada se otopljeni organski ugljik u supernatantu na kraju svakog ciklusa dozračivanja približi stalnoj vrijednosti.
Na kraju tog razdoblja se pojedinačni istaloženi muljevi pomiješaju i u svaku jedinicu doda 50 ml dobivenog složenog mulja.
U kontrolne se jedinice doda 95 ml istaložene otpadne vode i 5 ml vode, a u ispitne jedinice 95 ml istaložene otpadne vode i 5 ml odgovarajuće radne otopine ispitivanog spoja (400 mg/l). Ponovno se započne s dozračivanjem i dozračuje 23 sata. Zatim se pusti da se mulj istaloži 45 minuta, nakon čega se ispusti supernatant i analizira na sadržaj otopljenog organskog ugljika.
Gornji postupak punjenja i pražnjenja ponavlja se svakodnevno za vrijeme cjelokupnog trajanja ispitivanja.
Prije taloženja se prema potrebi očiste stijenke jedinica kako bi se spriječilo nakupljanje krute tvari iznad razine tekućine. Kako ne bi došlo do unakrsne kontaminacije, za svaku jedinicu treba koristiti zasebni strugač ili četkicu.
U idealnom se slučaju otopljeni organski ugljik u supernatantu određuje svakodnevno, ali dopuštene su i manje učestale analize. Suspenzije se prije analize filtriraju kroz oprane membranske filtre 0,45 μm ili centrifugiraju. Membranski filtri su prikladni pod uvjetom da ne otpuštaju ugljik i ne apsorbiraju tvar tijekom filtracije. Temperatura uzorka u centrifugi ne smije biti viša od 40 °C.
Trajanje ispitivanja kod spojeva koji se slabo biološki razgrađuju ili se ne razgrađuju nije određeno, ali iskustvo pokazuje da bi ispitivanje općenito trebalo trajati najmanje 12 tjedana, ali ne duže od 26 tjedana.
2. PODACI I OCJENJIVANJE
Izradi se grafički prikaz vrijednosti otopljenog organskog ugljika u supernatantu ispitnih i kontrolnih jedinica u ovisnosti vremenu.
Kad se ostvari biorazgradnja, vrijednosti ispitnih jedinica približit će se kontrolnim vrijednostima. Kad razlika između ispitnih i kontrolnih vrijednosti ostane na stalnoj razini u tri uzastopna mjerenja, provede se još toliko mjerenja koliko je potrebno za statističku obradu podataka i izračuna postotak biorazgradnje ispitivanog spoja (Dda ili Dssd, vidjeti 1.2.).
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju po mogućnosti sadrži sljedeće:
|
— |
sve informacije o vrsti otpadne vode, vrsti jedinica koje se koriste i rezultatima pokusa za ispitivanu tvar, referentnu tvar (ako se koristi) i slijepu probu, |
|
— |
temperaturu, |
|
— |
krivulju opadanja s opisom, način izračuna (vidjeti 1.2.), |
|
— |
datum i mjesto uzorkovanja aktivnog mulja i otpadne vode, stanje prilagodbe, koncentraciju itd., |
|
— |
znanstvene razloge mogućih izmjena ispitnog postupka, |
|
— |
potpis i datum. |
3.2. TUMAČENJE REZULTATA
Budući da tvari koje se ispituju ovom metodom nisu lako biorazgradive, svako opadanje DOC-a koje se isključivo može pripisati biorazgradnji u pravilu će se odvijati postupno tijekom više dana ili tjedana, osim ako aklimatizacija nastupi iznenada, što se očituje naglim nestankom DOC-a nakon nekoliko tjedana.
Međutim, ponekad važnu ulogu može imati i fizikalno-kemijska adsorpcija, na što ukazuje potpuno ili djelomično nestajanje dodanog DOC-a na samom početku. Daljnji slijed ovisi o čimbenicima kao što su stupanj adsorpcije i koncentracija suspendirane krute tvari u izvađenoj suspenziji. Razlika između koncentracije DOC-a u kontrolnom i ispitnom supernatantu obično se nakon niske početne vrijednosti postupno povećava i zatim ostaje na stalnoj razini do kraja pokusa, osim ako nastupi aklimatizacija.
Ako je potrebno razlikovati biorazgradnju (ili djelomičnu biorazgradnju) od adsorpcije, treba provesti dodatna ispitivanja. To se može učiniti na više načina, ali najpouzdaniji način je provesti ispitivanje osnovne razine koristeći supernatant ili mulj kao inokulum (po mogućnosti respirometrijski test).
Ispitivane tvari koje u ovom testu pokazuju značajno opadanje DOC-a koje nije uvjetovano adsorpcijom mogu se smatrati potencijalno biorazgradivima. Djelomično neadsorptivno opadanje ukazuje na to da je kemikalija barem donekle podložna biorazgradnji.
Malo opadanje ili nepromijenjena razina DOC-a može biti posljedica inhibitornog učinka ispitivane tvari na mikroorganizme, što se također može očitovati razlaganjem i gubitkom mulja i zamućenjem supernatanta. Ispitivanje treba ponoviti s nižom koncentracijom ispitivane tvari.
Primjenom specifične analitičke metode ili 14C obilježene ispitivane tvari može se povećati osjetljivost. U slučaju 14C obilježenog spoja, pojava biorazgradnje može se potvrditi izdvajanjem 14CO2.
Ako se rezultati navode i kao primarna biorazgradnja, treba po mogućnosti objasniti promjenu kemijske strukture zbog koje izostaje odgovor polazne ispitivane tvari.
Potrebno je navesti validaciju analitičke metode zajedno s odgovorom medija slijepe probe.
4. REFERENCE
|
(1) |
OECD, Paris, 1981, Test Guideline 302 A, Decision of the Council C(81) 30 final. |
Dodatak 1.
Test SCAS: primjer rezultata
|
Tvar |
CT (mg/l) |
Ct - Cc (mg/l) |
Postotak biorazgradnje Dda |
Trajanje ispitivanja (dani) |
|
4-acetil aminobenzen sulfonat |
17,2 |
2,0 |
85 |
40 |
|
Tetrapropilen benzen sulfonat |
17,3 |
8,4 |
51,4 |
40 |
|
4-nitrofenol |
16,9 |
0,8 |
95,3 |
40 |
|
Dietilen glikol |
16,5 |
0,2 |
98,8 |
40 |
|
Anilin |
16,9 |
1,7 |
95,9 |
40 |
|
Ciklopentan tetrakarboksilat |
17,9 |
3,2 |
81,1 |
120 |
Dodatak 2.
Primjer ispitne aparature
Slika 1.

C.13. BIOKONCENTRACIJA: TEST S RIBAMA U PROTOČNOM POSTUPKU
1. METODA
Ova metoda ispitivanja biokoncentracije odgovara smjernici OECD TG 305 (1996.).
1.1. UVOD
U ovoj je metodi opisan postupak pomoću kojega se može opisati biokoncentracijski potencijal tvari u ribama u protočnim uvjetima. Iako se protočnom ispitnom režimu uvelike daje prednost, dopušteni su i polustatički režimi, pod uvjetom da su zadovoljeni kriteriji valjanosti.
Metoda pruža dovoljno detalja za provedbu ispitivanja, ali istodobno ostavlja dovoljno slobode za prilagođavanje plana pokusa uvjetima pojedinih laboratorija i variranje svojstava ispitivane tvari. Metodu je najprimjerenije koristiti kod stabilnih organskih kemikalija s vrijednostima log Pow između 1,5 i 6,0 (1), ali može se primijeniti i na superlipofilne tvari (s log Pow > 6,0). Prethodna procjena faktora biokoncentracije (BCF), koja se ponekad označuje kao KB, će kod takvih superlipofilnih tvari vjerojatno biti viša od očekivane vrijednosti faktora biokoncentracije stabilnog stanja (BCFSS) iz laboratorijskih pokusa. Prethodne procjene faktora biokoncentracije za organske kemikalije s vrijednostima log Pow do oko 9,0 mogu se dobiti pomoću jednadžbe Bintein i sur. (2). Parametri značajni za biokoncentracijski potencijal su konstanta brzine apsorpcije (k1), konstanta brzine izlučivanja (k2) i BCFss.
Radioaktivno obilježene ispitivane tvari mogu olakšati analizu uzoraka vode i ribljih uzoraka te pomoći u definiranju potrebe za identifikacijom i kvantifikacijom proizvoda razgradnje. Ako se mjere ukupni radioaktivni ostaci (npr. izgaranjem ili otapanjem tkiva), BCF se temelji na polaznom spoju, zadržanim metabolitima i asimiliranom ugljiku. Vrijednosti BCF na temelju ukupnih radioaktivnih ostataka stoga ne moraju biti izravno usporedive s BCF-om dobivenim specifičnom kemijskom analizom samog polaznog spoja.
U istraživanjima s radioaktivno obilježenim tvarima se za određivanje BCF-a na temelju polaznog spoja mogu primijeniti postupci pročišćavanja, a prema potrebi se mogu opisati i glavni metaboliti. Analizom i identifikacijom ostataka u tkivima mogu se kombinirati istraživanja biokoncentracije s istraživanjima ribljeg metabolizma.
1.2. DEFINICIJE I JEDINICE
Biokoncentracija/bioakumulacija je povećanje koncentracije ispitivane tvari u ili na organizmu (navedenim tkivima) s povećanjem koncentracije ispitivane tvari u okolnom mediju.
Faktor biokoncentracije (BCF ili KB) u bilo kom trenutku u fazi apsorpcije ovog akumulacijskog testa je koncentracija ispitivane tvari u/na ribi odnosno njezinim navedenim tkivima (Cf kao μg/g (ppm)) podijeljena koncentracijom kemikalije u okolnom mediju (Cw kao μg/ml (ppm)).
Faktor biokoncentracije stabilnog stanja (BCFss ili KB) ne mijenja se značajno u dužem vremenskom razdoblju, a koncentracija ispitivane tvari u okolnom mediju za to vrijeme ostaje stalna.
Na grafičkom prikazu ispitivane tvari u ribi (Cf) u ovisnosti o vremenu smatra se da je plato odnosno stabilno stanje postignuto kad krivulja postane paralelna s vremenskom osi i kad se tri uzastopne analize Cf na uzorcima uzetim u razmacima od najmanje dva dana razlikuju za najviše ± 20 % odnosno kad nema značajnih razlika između ta tri vremena uzorkovanja. Kad se analiziraju objedinjeni uzorci, potrebne su najmanje četiri uzastopne analize. Kod ispitivanih tvari koje se sporo apsorbiraju, prikladniji su razmaci od sedam dana.
Faktori biokoncentracije koji se izravno izračunavaju iz kinetičkih konstanti brzine (k1/k2) nazivaju se kinetičkim faktorima koncentracije, BCFK.
Podjelni koeficijent oktanol-voda (Pow) je omjer topljivosti kemikalije u n-oktanolu i vodi u ravnoteži (metoda A.8.), koji se također izražava kao Kow. Logaritam Pow služi kao pokazatelj biokoncentracijskog potencijala kemikalije u vodenim organizmima.
Faza izlaganja ili apsorpcije je vrijeme u kojemu su ribe izložene ispitivanoj kemikaliji.
Konstanta brzine apsorpcije (k1) je numerička vrijednost kojom se definira brzina povećavanja koncentracije ispitivane tvari u/na ispitivanoj ribi (odnosno njezinim navedenim tkivima) kad je riba izložena toj kemikaliji (k1 se iskazuje u danima-1).
Faza nakon izlaganja ili faza izlučivanja (gubitka) je vrijeme nakon prijenosa ispitivane ribe iz medija koji sadrži ispitivanu tvar u medij bez te tvari, tijekom kojega se proučava izlučivanje (odnosno neto gubitak) tvari iz ispitivane ribe (odnosno njezinog navedenog tkiva).
Konstanta brzine izlučivanja (gubitka) (k2) je numerička vrijednost kojom se definira brzina smanjivanja koncentracije ispitivane tvari u ispitivanoj ribi (odnosno njezinim navedenim tkivima) nakon prijenosa ispitivane ribe iz medija koji sadrži ispitivanu tvar u medij bez te tvari (k2 se iskazuje u danima-1).
1.3. NAČELO ISPITNE METODE
Ispitivanje obuhvaća dvije faze: fazu izlaganja (apsorpcije) i fazu nakon izlaganja (izlučivanja). Tijekom faze apsorpcije odvojene skupine riba iste vrste izlažu se najmanje dvjema koncentracijama ispitivane tvari. Zatim se prenesu u medij bez ispitivane tvari na fazu izlučivanja. Faza izlučivanja je uvijek nužna, osim ako je apsorpcija ispitivane tvari tijekom faze apsorpcije bila beznačajna (npr. BCF manji od 10). Koncentracija ispitivane tvari u/na ribi (odnosno njezinom navedenom tkivu) prati se tijekom obje faze ispitivanja. Uz dvije ispitne koncentracije, ispitivanje uključuje i kontrolnu skupinu riba, koje se drže u istovjetnim uvjetima, ali bez prisutnosti ispitivane tvari, kako bi se mogući štetni učinci uočeni kod ispitivanja biokoncentracije mogli usporediti s odgovarajućom kontrolnom skupinom te da bi se dobile temeljne vrijednosti koncentracija ispitivane tvari.
Faza apsorpcije traje 28 dana, osim ako se dokaže da je ravnoteža uspostavljena prije toga. Trajanje faze apsorpcije i vrijeme potrebno da se postigne stabilno stanje može se predvidjeti uz pomoć jednadžbe iz Dodatka 3. Nakon toga slijedi razdoblje izlučivanja, koje započinje prijenosom riba u drugu čistu posudu s istim medijem, ali bez ispitivane tvari. Faktor biokoncentracije se po mogućnosti izračunava i kao omjer (BCFss) koncentracije u ribi (Cf) i vodi (Cw) u prividnom stabilnom stanju i kao kinetički faktor biokoncentracije BCFK, tj. omjer konstanti brzine apsorpcije (k1) i brzine izlučivanja (k2) uz pretpostavku kinetike prvog reda. Ako je očito da ne vrijedi kinetika prvog reda, treba primijeniti složenije modele (Dodatak 5.).
Ako se u 28 dana ne postigne stabilno stanje, fazu apsorpcije treba produžiti dok se ono ne postigne ili 60 dana, ovisno o tome što je kraće; zatim se prelazi na fazu izlučivanja.
Konstanta brzine apsorpcije, konstanta brzine izlučivanja (gubitka) (odnosno konstante, ako se koriste složeniji modeli), faktor biokoncentracije te, po mogućnosti, granice pouzdanosti svakog od tih parametara izračunavaju se uz pomoć modela koji najbolje opisuje izmjerene koncentracije ispitivane tvari u ribama i vodi.
BCF se izražava kao funkcija ukupne mokre mase ribe. Ipak, za određene se potrebe mogu koristiti određena tkiva ili organi (npr. mišići, jetra), ako je riba dovoljno velika odnosno ako se može podijeliti u jestive (file) i nejestive frakcije (utroba). Budući da kod mnogih organskih tvari postoji jasna veza između biokoncentracijskog potencijala i lipofilnosti, isto tako postoji i odgovarajuća povezanost između sadržaja lipida ispitivane ribe i zabilježene biokoncentracije tih tvari. Stoga, da bi se umanjio taj izvor varijabilnosti ispitnih rezultata kod visoko lipofilnih tvari (tj. s log Pow > 3), biokoncentraciju treba izraziti i u odnosu prema sadržaju lipida, a ne samo prema ukupnoj tjelesnoj masi.
Ako je to izvedivo, sadržaj lipida treba odrediti na biološkom materijalu koji se koristi za određivanje koncentracije ispitivane tvari.
1.4. PODACI O ISPITIVANOJ TVARI
Prije provedbe ispitivanja biokoncentracije trebaju biti poznati sljedeći podaci o ispitivanoj tvari:
|
— |
topljivost u vodi, |
|
— |
podjelni koeficijent oktanol-voda Pow (koji se označava i kao Kow, određen metodom HPLC iz A.8.), |
|
— |
hidroliza, |
|
— |
fotokemijska pretvorba u vodi određena u stvarnim ili simuliranim uvjetima sunčevog zračenja te u uvjetima zračenja biokoncentracijskog testa (3), |
|
— |
površinska napetost (tj. kod tvari gdje se ne može odrediti log Pow), |
|
— |
tlak pare, |
|
— |
laka biorazgradivost (prema potrebi). |
Osim toga, potrebne su informacije o toksičnosti za riblju vrstu koja će se koristiti u ispitivanju, po mogućnosti asimptotski LC50 (tj. neovisan o vremenu). Mora biti raspoloživa odgovarajuća analitička metoda poznate točnosti, preciznosti i osjetljivosti za kvantifikaciju ispitivane tvari u ispitnim otopinama i biološkom materijalu, zajedno s podacima o pripremi i čuvanju uzorka. Osim toga, trebaju biti poznate analitičke granice detekcije ispitivane tvari u vodi i ribljim tkivima. Ako se koristi 14C obilježena ispitivana tvar, treba biti poznat postotak radioaktivnosti povezan s nečistoćama.
1.5. VALJANOST ISPITIVANJA
Da bi ispitivanje bilo valjano, moraju biti zadovoljeni sljedeći uvjeti:
|
— |
promjene temperature ispod ± 2 °C, |
|
— |
koncentracija otopljenog kisika ne smije pasti ispod 60 % zasićenosti, |
|
— |
koncentracija ispitivane tvari u komorama održava se u granicama ± 20 % srednje vrijednosti izmjerene u fazi apsorpcije, |
|
— |
smrtnost i drugi štetni učinci/bolest kod kontrolnih i obrađenih riba na kraju ispitivanja je ispod 10 %; ako ispitivanje traje više tjedana ili mjeseci, smrtnost i drugi štetni učinci u oba skupa riba trebaju biti ispod 5 % mjesečno i ukupno ne smiju prijeći 30 %. |
1.6. REFERENTNI SPOJEVI
Kad je to potrebno, za provjeru pokusnog postupka mogu se koristiti referentni spojevi poznatog biokoncentracijskog potencijala. Međutim, još uvijek se ne mogu preporučiti određene tvari.
1.7. OPIS ISPITNE METODE
1.7.1. Aparatura
Treba voditi računa da dijelovi opreme ne sadrže materijale koji se mogu otapati, sorbirati ili ispirati i imati štetni učinak na ribe. Mogu se koristiti standardni četvrtasti ili cilindrični bazeni od kemijski inertnog materijala, prikladne zapremnine s obzirom na količinu punjenja. Uporabu mekanih plastičnih cijevi treba svesti na najmanju moguću mjeru. Prednost treba dati cijevima od Teflona®, nehrđajućeg čelika i/ili stakla. Iskustvo je pokazalo da tvari s visokim koeficijentima adsorpcije, kao što su sintetički piretroidi, ponekad zahtijevaju korištenje silaniziranog stakla. U tom se slučaju oprema mora baciti nakon uporabe.
1.7.2. Voda
U testu se općenito koristi prirodna voda dobivena iz neonečišćenog izvora ujednačene kakvoće. Kakvoća vode za razrjeđivanje mora omogućavati preživljavanje odabrane riblje vrste tijekom razdoblja aklimatizacije i ispitivanja bez pojave anomalija u izgledu i ponašanju riba. U idealnom slučaju treba dokazati da ispitna vrsta može preživjeti, rasti i razmnožavati se u vodi za razrjeđivanje (npr. u laboratorijskoj kulturi ili toksikološkom ispitivanju unutar životnog ciklusa). Vodu treba opisati barem s obzirom na pH, tvrdoću, ukupni sadržaj krute tvari, ukupni organski ugljik i, po mogućnosti, amonijak, nitrit i alkalitet te, kod morskih vrsta, salinitet. Parametri važni za optimalnu dobrobit riba su u cijelosti poznati, ali u Dodatku 1. navedne su preporučene maksimalne koncentracije za niz parametara za slatkovodnu i morsku ispitnu vodu.
Voda u razdoblju ispitivanja mora biti stalne kakvoće. pH vrijednost treba biti u području od 6,0 do 8,5, s time da za vrijeme jednog ispitivanja ne smije odstupati više od ± 0,5 pH jedinica. Kako voda za razrjeđivanje ne bi neprimjereno utjecala na rezultat ispitivanja (npr. kompleksiranjem ispitivane tvari) ili štetno utjecala na riblju populaciju, treba u određenim razmacima uzimati uzorke na analizu. Određivanje teških metala (npr. Cu, Pb, Zn, Hg, Cd, Ni), glavnih aniona i kationa (npr. Ca, Mg, Na, K, Cl, SO4), pesticida (npr. ukupni organofosforni i ukupni organoklorni pesticidi), ukupnog organskog ugljika i suspendirane krute tvari treba provoditi npr. svaka tri mjeseca ako se zna da je voda za razrjeđivanje relativno stalne kakvoće. Ako se dokaže da je kakvoća vode ujednačena tijekom najmanje jedne godine, određivanja se mogu prorijediti i razmaci povećati (npr. svakih šest mjeseci).
Prirodni sadržaj čestica i ukupni organski ugljik (TOC) vode za razrjeđivanje trebaju biti što niži kako ne bi došlo do adsorpcije ispitivane tvari na organsku tvar, što može smanjiti njezinu bioraspoloživost (4). Maksimalna prihvatljiva vrijednost je 5 mg/l za lebdeće čestice (suha tvar koja ne prolazi kroz filtar od 0,45 μm) i 2 mg/l za ukupni organski ugljik (vidjeti Dodatak 1.). Voda se prema potrebi filtrira prije uporabe. Doprinos ispitivanih riba (izlučevine) i ostataka hrane sadržaju organskog ugljika treba biti što je moguće manji. Za vrijeme ukupnog trajanja ispitivanja koncentracija organskog ugljika u ispitnoj posudi ne smije biti više od 10 mg/l (± 20 %) veća od koncentracije organskog ugljika koji potječe od ispitivane tvari i sredstva za otapanje (ako se koristi).
1.7.3. Ispitne otopine
Pripremi se radna otopina koja sadrži prikladnu koncentraciju ispitivane tvari. Radnu otopinu po mogućnosti treba pripremiti jednostavnim miješanjem ili mućkanjem ispitivane tvari u vodi za razrjeđivanje. Uporaba otapala i dispergenata (sredstava za otapanje) ne preporučuje se, ali su ona u nekim slučajevima ipak potrebna da bi se dobila prikladna koncentracija radne otopine. Otapala koja se mogu koristiti su etanol, metanol, etilen-glikol-monometil eter, etilen-glikol-dimetil eter, dimetilformamid i trietilenglikol. Dispergenti koji se mogu koristiti su Cremophor RH40, Tween 80, metilceluloza 0,01 % i HCO-40. Kod primjene lako biorazgradivih sredstava potreban je poseban oprez budući da ona u protočnim ispitivanjima mogu izazvati problem rasta bakterija. Ispitivana tvar može biti radioaktivno obilježena i mora biti najviše čistoće (npr. po mogućnosti > 98 %).
Kod protočnih je ispitivanja za dopremanje ispitnih koncentracija u ispitne komore potreban sustav koji stalno odmjerava i razrjeđuje radnu otopinu ispitivane tvari (npr. dozirna crpka, proporcionalni razrjeđivač, zasićivač). Poželjno je najmanje pet izmjena volumena dnevno u svim komorama. Prednost treba dati protočnoj metodi, ali ako to nije moguće (npr. u slučaju štetnog učinka na ispitne organizme), može se koristiti i polustatička tehnika, pod uvjetom da su zadovoljeni kriteriji valjanosti. Brzinu protoka radnih otopina i vode za razrjeđivanje treba provjeriti 48 sati prije ispitivanja i zatim barem jedanput dnevno tijekom ispitvanja. Prilikom te provjere treba odrediti brzinu protoka kroz svaku ispitnu komoru i pobrinuti se da odstupanja unutar jedne komore i između komora ne budu veća od 20 %.
1.7.4. Odabir vrste
Važan kriterij za odabir vrste je laka dostupnost, raspoloživost u praktičnim veličinama i prikladnost za držanje u laboratorijskim uvjetima. Ostali kriteriji za odabir ribljih vrsta su njihov rekreacijski, trgovački i okolišni značaj i usporediva osjetljivost, ranije uspješno korištenje itd.
Preporučene ispitne vrste navedene su u Dodatku 2. Mogu se koristiti i druge vrste, ali to može zahtijevati prilagodbu ispitnog postupka kako bi se osigurali prikladni ispitni uvjeti. U tom slučaju treba navesti razloge za odabir vrste i pokusnu metodu.
1.7.5. Držanje riba
Matična riblja populacija aklimatizira se u vodi na ispitnoj temperaturi najmanje dva tjedna i čitavo vrijeme hrani dovoljnom količinom hrane koja će se koristiti kod ispitivanja.
Nakon vremena prilagodbe od 48 sati bilježi se smrtnost uz primjenu sljedećih kriterija:
|
— |
smrtnost iznad 10 % populacije u sedam dana: odbacuje se čitava serija, |
|
— |
smrtnost između 5 i 10 % populacije u sedam dana: aklimatizacija se nastavlja još sedam dana, |
|
— |
smrtnost ispod 5 % populacije u sedam dana: serija se prihvaća – ako je smrtnost tijekom drugih sedam dana iznad 5 %, čitava se serija odbacuje. |
Treba se uvjeriti da kod riba koje se koriste u ispitivanjima nema vidljivih bolesti i anomalija. Sve bolesne ribe treba odbaciti. Ribe se ne smiju liječiti dva tjedna prije ispitivanja niti tijekom ispitivanja.
1.8. PROVOĐENJE ISPITIVANJA
1.8.1. Preliminarno ispitivanje
Preliminarni pokus može biti koristan za optimizaciju ispitnih uvjeta za glavno ispitivanje, npr. odabir koncentracije odnosno koncentracija ispitivane tvari, trajanje faze apsorpcije i izlučivanja.
1.8.2. Uvjeti izlaganja
1.8.2.1.
Trajanje faze apsorpcije može se predvidjeti na temelju praktičnog iskustva (npr. ranije istraživanje ili akumulacija srodne kemikalije) ili na temelju određenih empirijskih odnosa, koristeći saznanja o topljivosti u vodi ili podjelnom koeficijentu oktanol/voda ispitivane tvari (vidjeti Dodatak 3.).
Faza apsorpcije trebala bi trajati 28 dana, osim ako se može dokazati da je ravnoteža uspostavljena prije toga. Ako se do 28. dana ne postigne stabilno stanje, fazu apsorpcije treba produžiti, uz dodatna mjerenja, do uspostave stabilnog stanja ili 60 dana, ovisno o tome što je kraće.
1.8.2.2.
Polovica vremena trajanja faze apsorpcije obično je dovoljna za potrebno smanjenje (npr. 95 %) tjelesnog opterećenja tvari (za objašnjenje procjene vidjeti Dodatak 3.). Ako je vrijeme potrebno da se postigne 95 % gubitka pretjerano dugo, primjerice ako je dvostruko duže od uobičajenog trajanja faze apsorpcije (tj. duže od 56 dana), može se koristiti kraće razdoblje (tj. dok koncentracija ispitivane tvari ne padne ispod 10 % koncentracije stabilnog stanja). Ipak, kod tvari sa složenijim obrascima apsorpcije i izlučivanja koji se ne mogu predočiti jednodjelnim modelima riba koji daju kinetiku prvog reda, treba predvidjeti duže faze izlučivanja za određivanje konstanti brzine gubitka. Međutim, to vrijeme može biti uvjetovano razdobljem tijekom kojega se koncentracija ispitivane tvari u ribama zadržava iznad analitičke granice detekcije.
1.8.2.3.
Odabere se odgovarajući broj riba po ispitnoj koncentraciji tako da kod svakog uzorkovanja budu raspoložive najmanje četiri ribe po uzorku. Ako je potrebna veća statistička snaga, bit će potrebno više riba po uzorku.
Ako se koriste odrasle ribe, treba navesti koriste li se u pokusu mužjaci ili ženke ili jedni i drugi. Ako se koriste oba spola, razlike u sadržaju lipida između spolova prije početka izlaganja moraju biti dokumentirane kao beznačajne; prema potrebi treba objediniti sve mužjake i sve ženke riba.
Kod svih ispitivanja treba odabrati ribe slične mase, tako da najmanja riba ne bude manja od dvije trećine mase najveće ribe. Sve ribe trebaju biti istoga godišta i istog podrijetla. Kako se čini da masa i dob riba ponekad imaju značajan utjecaj na vrijednosti BCF (1), te podatke treba točno dokumentirati. Preporučuje se da se prije ispitivanja izvaže poduzorak ribe radi procjene prosječne mase.
1.8.2.4.
Koriste se visoki omjeri voda-riba kako bi se smanjenje Cw zbog uvođenja riba na početku ispitivanja svelo na najmanju moguću mjeru te da bi se spriječilo opadanje koncentracije otopljenog kisika. Važno je da količina punjenja bude prilagođena ispitnoj vrsti. U svakom slučaju, obično se preporučuje količina punjenja od 0,1 – 1,0 g ribe (mokre mase) po litri vode po danu. Veće količine punjenja mogu se koristiti ako se dokaže da se tražena koncentracija ispitivane tvari može održavati u granicama ± 20 % i da koncentracija otopljenog kisika ne pada ispod 60 % zasićenosti.
Kod odabira odgovarajućeg režima punjenja treba voditi računa o uobičajenom staništu riblje vrste. Primjerice, ribe koje žive na dnu obično zahtijevaju više podnog prostora u akvariju kod istog volumena vode nego pelagičke vrste.
1.8.2.5.
Ribe se tijekom razdoblja aklimatizacije i ispitivanja hrane odgovarajućom hranom s poznatnim sadržajem lipida i proteina u količini koja je dovoljna da ostanu zdrave i zadrže tjelesnu masu. Hrana se tijekom čitavog razdoblja aklimatizacije i ispitivanja ribama daje jedanput dnevno u količini koja približno odgovara 1 do 2 % tjelesne mase po danu; to kod većine ribljih vrsta koncentraciju lipida održava na relativno stalnoj razini za vrijeme ispitivanja. Količinu hrane treba preračunavati npr. jedanput tjedno, kako bi tjelesna masa i sadržaj lipida ostali stalni. Za potrebe ovog izračuna masa riba u pojedinoj ispitnoj komori može se procijeniti iz mase posljednjeg ribljeg uzorka uzetog iz te komore. Ribe koje ostanu u komori ne važu se.
Nepojedena hrana i izmet se svakodnevno ispuštaju iz ispitnih komora ubrzo nakon hranjenja (30 minuta do 1 sat). Komore treba tijekom ispitivanja održavati što čišćima kako bi koncentracija organske tvari bila što je moguće niža, budući da prisutnost organskog ugljika može ograničiti bioraspoloživost ispitivane tvari (1).
Budući da se mnoge vrste hrane dobivaju iz ribljeg brašna, hranu treba analizirati na ispitivanu tvar. Hranu je također poželjno analizirati na pesticide i teške metale.
1.8.2.6.
Fotoperiod je obično od 12 do 16 sati, a temperaturu treba prilagoditi ispitnoj vrsti (± 2 °C) (vidjeti Dodatak 2.). Vrsta i značajke osvjetljenja trebaju biti poznati. Treba uzeti u obzir mogućnost fotokemijske pretvorbe ispitivanih tvari u uvjetima zračenja istraživanja. Treba koristiti odgovarajuće osvjetljenje kako ribe ne bi bile izložene neprirodnim fotoproduktima. U nekim je slučajevima potrebno koristiti filtar koji ne propušta UV zračenje ispod 290 nm.
1.8.2.7.
Ribe se u protočnim uvjetima izlažu najmanje dvjema koncentracijama ispitivane tvari u vodi. Obično se kao viša (ili najviša) koncentracija ispitivane tvari uzima koncentracija koja odgovara oko 1 % vrijednosti njezinog akutnog asimptotskog LC50 i koja je najmanje deset puta viša od granice detekcije u vodi primijenjene analitičke metode.
Najviša ispitna koncentracija također se može odrediti dijeljenjem akutne vrijednosti LC50 96 h odgovarajućim omjerom akutno/kronično (omjeri za neke kemikalije mogu biti oko 3 do 100). Druga odabrana koncentracija odnosno koncentracije trebaju se od gore spomenute koncentracije po mogućnosti razlikovati za faktor deset. Ako to nije moguće zbog kriterija 1 % LC50 i analitičke granice, može se koristiti niži faktor od deset ili razmisliti o primjeni 14C obilježene ispitivane tvari. Niti jedna koncentracija ne smije biti viša od topljivosti ispitivane tvari.
Ako se koristi sredstvo za otapanje, njegova koncentracija ne smije biti viša od 0,1 ml/l i treba biti ista u svim ispitnim posudama. Njegov doprinos ukupnom sadržaju organskog ugljika u ispitnoj vodi (zajedno s ispitivanom tvari) treba biti poznat. U svakom slučaju, treba nastojati izbjeći korištenje takvih materijala gdje god je to moguće.
1.8.2.8.
Uz ispitni niz treba provesti jednu kontrolu s vodom za razrjeđivanje odnosno, prema potrebi, jednu kontrolu sa sredstvom za otapanje, pod uvjetom da je utvrđeno da sredstvo nema učinak na ribe. U protivnom, treba postaviti obje kontrole.
1.8.3. Učestalost mjerenja kakvoće vode
Tijekom ispitivanja treba u svim posudama mjeriti otopljeni kisik, TOC, pH i temperaturu. Ukupnu tvrdoću i salinitet (prema potrebi) treba mjeriti u kontrolnim posudama i jednoj posudi s višom (odnosno najvišom) koncentracijom. Otopljeni kisik i salinitet (prema potrebi) treba mjeriti barem tri puta – na početku, oko sredine i na kraju razdoblja apsorpcije – te jedanput tjedno u razdoblju izlučivanja. TOC se mjeri na početku ispitivanja (24 sata i 48 sati prije početka faze apsorpcije) prije uvođenja riba i najmanje jedanput tjedno u fazi apsorpcije i izlučivanja. Temperatura se mjeri svakodnevno, pH na početku i kraju svakog razdoblja, a tvrdoća jedanput tijekom ispitivanja. Temperaturu po mogućnosti treba neprekidno pratiti u najmanje jednoj posudi.
1.8.4. Uzorkovanje i analiza riba i vode
1.8.4.1.
Uzorci vode iz ispitnih komora za određivanje koncentracije ispitivane tvari uzimaju se prije uvođenja riba te tijekom faze apsorpcije i izlučivanja. Vodu treba uzorkovati barem u isto vrijeme kad i ribe te prije hranjenja. Koncentracije ispitivane tvari u fazi apsorpcije određuju se radi provjere usklađenosti s kriterijima valjanosti.
Ribe se uzorkuju najmanje pet puta u fazi apsorpcije i najmanje četiri puta u fazi izlučivanja. Budući da je u pojedinim slučajevima na temelju tog broja uzoraka teško napraviti dovoljno preciznu procjenu vrijednosti BCF, posebno ako ne vrijedi jednostavna kinetika izlučivanja prvog reda, preporučljivo je da se uzorci uzimaju češće u oba razdoblja (vidjeti Dodatak 4.). Dodatne uzorke treba spremiti i analizirati ih samo ako se pokaže da rezultati prvog kruga analiza nisu dostatni da se BCF izračuna sa željenom preciznošću.
Primjer prihvatljivog rasporeda uzorkovanja prikazan je u Dodatku 4. Drugi se rasporedi mogu lako izračunati primjenom drugih pretpostavljenih vrijednosti Pow za izračun vremena izlaganja potrebnog za 95 %-tnu apsorpciju.
Uzorkovanje se nastavlja tijekom faze apsorpcije dok se ne utvrdi stabilno stanje ili 28 dana, ovisno o tome što je kraće. Ako se stabilno stanje ne postigne niti 28. dana, uzorkovanje se nastavlja dok se ne postigne stabilno stanje ili 60 dana, ovisno o tome što je kraće. Prije početka faze izlučivanja ribe treba premjestiti u čiste bazene.
1.8.4.2.
Uzorci vode za analizu dobivaju se npr. isisavanjem kroz inertnu cijev iz središta ispitne komore. Čini se da se ni filtracijom niti centrifugiranjem ne može uvijek postići odvajanje bioraspoložive frakcije ispitivane tvari od one koja nije bioraspoloživa (posebno kod superlipofilnih kemikalija tj. kemikalija koje imaju log Pow > 5) (1)(5); stoga uzorke nije potrebno podvrgavati tim postupcima.
Umjesto toga, treba poduzeti mjere da bazeni budu što čišći te pratiti sadržaj organskog ugljika tijekom faze apsorpcije i izlučivanja.
U svakom vremenu uzorkovanja se iz ispitnih komora izvadi odgovarajući broj riba (u pravilu najmanje četiri). Ribe se kratko isperu vodom, osuše upijajućim materijalom i trenutačno usmrte na naprikladniji i najhumaniji način i zatim izvažu.
Ribe i vodu treba po mogućnosti analizirati odmah nakon uzorkovanja kako bi se spriječila razgradnja i drugi gubici te kako bi se još dok ispitivanje traje mogla izračunati približna brzina apsorpcije i izlučivanja. Osim toga, trenutačnom se analizom izbjegava kašnjenje u određivanju platoa.
Ako se analiza ne obavi odmah, uzorke treba uskladištiti na prikladan način. Prije početka istraživanja treba pribaviti informacije o pravilnom načinu skladištenja ispitivane tvari u pitanju – npr. duboko zamrzavanje, držanje na 4 °C, trajanje skladištenja, ekstrakcija itd.
1.8.4.3.
Budući da čitav postupak uglavnom ovisi o točnosti, preciznosti i osjetljivosti analitičke metode koja se primjenjuje u odnosu na ispitivanu tvar, treba pokusima provjeriti jesu li preciznost i obnovljivost kemijske analize te izdvajanje ispitivane tvari iz vode i ribe zadovoljavajući za metodu u pitanju. Također se treba uvjeriti da ispitivana tvar nije prisutna u vodi za razrjeđivanje.
Vrijednosti Cw i Cf dobivene ispitivanjem treba prema potrebi ispraviti za iskorištenje i temeljne vrijednosti kontrola. Kod rukovanja ribama i vodom treba stalno voditi računa da se onečišćenje i gubici (npr. uslijed adsorpcije uređaja za uzorkovanje) svedu na najmanju moguću mjeru.
1.8.4.4.
Ako se u ispitivanju koriste radioaktivno obilježeni materijali, uzorci se mogu analizirati na ukupnu radioaktivnu oznaku (tj. polazni spoj i metaboliti) ili pročistiti tako da se polazni spoj može zasebno analizirati. Osim toga, glavni se metaboliti mogu opisati u stabilnom stanju ili na kraju faze apsorpcije, ovisno o tome što je ranije. Ako BCF u odnosu na ukupne radioaktivno obilježene ostatake iznosi ≥ 1 000 %, bilo bi uputno identificirati i kvantificirati proizvode razgradnje koji čine ≥ 10 % ukupnih ostataka u ribljim tkivima u stabilnom stanju; to se u svakom slučaju preporučuje kod određenih kategorija kemikalija kao što su pesticidi. Ako se identificiraju i kvantificiraju proizvodi razgradnje koji čine ≥ 10 % ukupnih radioaktivno obilježenih ostataka u ribljim tkivima, preporučuje se da se ti proizvodi razgradnje identificiraju i kvantificiraju i u ispitnoj vodi.
Koncentraciju ispitivane tvari obično treba odrediti za svaku pojedinačnu izvaganu ribu. Ako to nije moguće, uzorci se mogu kod svakog uzorkovanja objediniti, ali treba znati da objedinjavanje ograničava mogućnosti primjene statističkih postupaka na podatke. Ako su određeni statistički postupak i snaga bitni, u ispitivanje treba uključiti dovoljan broj riba, vodeći računa o željenom postupku objedinjavanja i snazi (6)(7).
BCF treba iskazati i kao funkciju ukupne mokre mase i, kod visoko lipofilnih tvari, kao funkciju sadržaja lipida. Sadržaj lipida kod riba treba po mogućnosti odrediti prilikom svakog uzorkovanja. Kod određivanja sadržaja lipida treba primjenjivati prikladne metode (reference (8) i (2) u Dodatku 3.). Ekstrakcijski postupak kloroform/metanol može se preporučiti kao standardna metoda (9). Različite metode ne daju jednake vrijednosti (10) i stoga je važno navesti podatke o primijenjenoj metodi. Ako je to moguće, analizu lipida treba obaviti na ekstraktu pripremljenom za analizu ispitivane tvari, budući da se lipidi često moraju ukloniti iz ekstrakta prije kromatografske analize. Sadržaj lipida kod riba (kao mg/kg mokre mase) se na kraju pokusa ne bi smio razlikovati više od ± 25 % od sadržaja s početka ispitivanja. Također treba navesti postotak krute tvari u tkivu kako bi se koncentracija lipida mogla prevesti iz mokre u suhu masu.
2. PODACI
2.1. OBRADA REZULTATA
Krivulja apsorpcije ispitivane tvari dobije se grafičkim prikazom njezine koncentracije u/na ribi (ili navedenim tkivima) u fazi apsorpcije u ovisnosti o vremenu na aritmetičkoj skali. Ako krivulja dosegne plato tj. postane približno asimptotična u odnosu na vremensku os, BCFss u stabilnom stanju izračunava se iz:
![]()
Ako stabilno stanje nije postignuto, BCFss za ocjenu opasnosti ponekad se može dovoljno precizno izračunati iz „stabilnog stanja” pri 80 % (1,6/k2) ili 95 % (3,0/k2) ravnoteže.
Također se odredi faktor koncentracije (BCFK) kao omjer dviju konstanti kinetike prvog reda k1/k2. Konstanta brzine izlučivanja (k2) obično se određuje iz krivulje izlučivanja (tj. graf opadanja koncentracije ispitivane tvari u ribi u vremenu). Konstanta brzine apsorpcije (k1) se zatim izračunava iz k2 i vrijednosti Cf, koja se izvodi iz krivulje apsorpcije (vidjeti i Dodatak 5.). Kod određivanja BCFK i konstanti brzine k1 i k2 prednost treba dati računalnim metodama nelinearne procjene parametara (11). U protivnom se za izračun k1 i k2 mogu koristiti grafičke metode. Ako je očito da krivulja izlučivanja nije prvog reda, treba primijeniti složenije metode (vidjeti reference u Dodatku 3.) i potražiti savjet biostatističara.
2.2. TUMAČENJE REZULTATA
Rezultate treba tumačiti s oprezom ako se izmjerene koncentracije ispitnih otopina kreću u blizini granice detekcije analitičke metode.
Jasno definirane krivulje apsorpcije i gubitka znak su dobre kakvoće podataka o biokoncentraciji. Odstupanja konstanti apsorpcije/izlučivanja kod dviju ispitnih koncentracija trebala bi biti manja od 20 %. Ako se uoče značajne razlike u brzini apsorpcije/izlučivanja između dvije primijenjene ispitne koncentracije, to treba navesti i dati moguća objašnjenja. Općenito, granica pouzdanosti BCFs kod dobro strukturiranih istraživanja je blizu ± 20 %.
3. IZVJEŠĆIVANJE
Izvješće o ispitivanju mora sadržavati sljedeće informacije:
3.1. ISPITIVANA TVAR:
|
— |
fizikalno stanje i, prema potrebi, fizikalno-kemijska svojstva, |
|
— |
podaci za identifikaciju kemikalije (uključujući sadržaj organskog ugljika, prema potrebi), |
|
— |
kod radioaktivno obilježenih tvari: točan položaj obilježenog(-ih) atoma i postotak radioaktivnosti povezan s nečistoćama, |
3.2. ISPITNA VRSTA
|
— |
znanstveni naziv, soj, izvor, moguća prethodna obrada, aklimatizacija, dob, raspon veličina itd. |
3.3. ISPITNI UVJETI:
|
— |
ispitni postupak (npr. protočni ili polustatički), |
|
— |
vrsta i značajke osvjetljenja i fotoperiod(i), |
|
— |
plan ispitivanja (npr. broj i veličina ispitnih komora, brzina izmjene vode, broj ponavljanja, broj riba po ponavljanju, broj ispitnih koncentracija, trajanje faze apsorpcije i izlučivanja, učestalost uzorkovanja riba i vode, |
|
— |
način pripreme radnih otopina i učestalost obnavljanja (ako se koristi sredstvo za otapanje, treba navesti njegovu koncentraciju i doprinos sadržaju organskog ugljika ispitne vode), |
|
— |
nazivne ispitne koncentracije, srednje izmjerene vrijednosti i njihove standardne devijacije u ispitnim posudama te metoda kojom su dobivene, |
|
— |
izvor vode za razrjeđivanje, opis mogućih prethodnih obrada, rezultati svih postupaka kojima se dokazuje da ispitivane ribe mogu živjeti u vodi i svojstva vode: pH, tvrdoća, temperatura, koncentracija otopljenog kisika, rezidualni klor (ako se mjeri), ukupni ogranski ugljik, suspendirana kruta tvar, salinitet ispitnog medija (prema potrebi) i sva ostala mjerenja, |
|
— |
kakvoća vode u ispitnim posudama, pH, tvrdoća, TOC, temperatura i koncentracija otopljenog kisika, |
|
— |
detaljne informacije o hranjenju (npr. vrsta hrane, izvor, sastav – po mogućnosti barem sadržaj lipida i proteina, količina i učestalost hranjenja), |
|
— |
informacije o obradi ribljih uzoraka i uzoraka vode, uključujući podatke o pripremi, skladištenju, ekstrakciji i analitičkim postupcima (i preciznosti) za ispitivanu tvar i sadržaj lipida (ako se mjeri), |
3.4. REZULTATI:
|
— |
rezultati svih preliminarnih istraživanja, |
|
— |
smrtnost kontrolnih riba i riba u svakoj komori s ispitivanom tvari te sva uočena neuobičajena ponašanja, |
|
— |
sadržaj lipida kod riba (ako se određuje kod ispitivanja), |
|
— |
krivulje (uključujući sve mjerne podatke) iz kojih je vidljiva apsorpcija i izlučivanje ispitivane kemikalije kod riba, vrijeme do stabilnog stanja, |
|
— |
Cf i Cw (sa standardnom devijacijom i rasponom, prema potrebi) za svako vrijeme uzorkovanja (Cf izražen u μg/g mokre mase (ppm) čitavog tijela ili navedenih tkiva npr. lipid i Cw u μg/ml (ppm). Vrijednosti Cw treba navesti i za kontrolni niz (temeljna vrijednost), |
|
— |
faktor biokoncentracije stabilnog stanja (BCFss) i/ili kinetički faktor koncentracije (BCFK) te, prema potrebi, granice pouzdanosti 95 % za konstante brzine apsorpcije i izlučivanja (gubitka) (sve izraženo u odnosu na čitavo tijelo i ukupni sadržaj lipida životinje, ako se mjeri, ili navedeno tkivo), granice pouzdanosti i standardna devijacija (ako su raspoloživi) i metode izračunavanja/analize podataka za svaku koncentraciju ispitivane tvari, |
|
— |
ako se koriste radioaktivno obilježene tvari i ako je to potrebno, može se prikazati akumulacija svih utvrđenih metabolita, |
|
— |
sve posebnosti ispitivanja, moguća odstupanja od ovih postupaka i sve druge relevantne informacije, |
rezultate tipa „nije utvrđeno na granici detekcije” treba svesti na najmanju moguću mjeru razradom metode prije ispitivanja i planom pokusa, budući da se ti rezultati ne mogu koristiti za izračun konstanti brzine.
4. REFERENCE
|
(1) |
Connell D.W. (1988) Bioaccumulation behaviour of persistent chemicals with aquatic organisms. Rev. Environ. Contam. Toxicol. 102, str. 117-156. |
|
(2) |
Bintein S., Devillers J. and Karcher W. (1993) Nonlinear dependence of fish bioconcentration on n-octanol/water partition coefficient. SAR and QSAR in Environmental Research, 1, str. 29-390. |
|
(3) |
OECD, Paris (1996) Direct Phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals. No 3. |
|
(4) |
Kristensen P. (1991) Bioconcentration in fish: Comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate organic matter to the bioavailability of chemicals. Water Quality Institute, Denmark. |
|
(5) |
US EPA 822-R-94-002 (1994) Great Lake Water Quality Initiative Technical Support Document for the Procedure to Determine Bioaccumulation Factors. July 1994. |
|
(6) |
US FDA, (Food and Drug Administration) Revision. Pesticide analytical manual, 1, 5600 Fisher’s Lane, Rockville, MD 20852, July 1975. |
|
(7) |
US EPA (1974). Section 5, A(1) Analysis of Human or Animal Adipose Tissue, in Analysis of Pesticide Residues in Human and Environmental Samples, Thompson J.F. (ed.) Research Triangle Park, N.C. 27711. |
|
(8) |
Compaan H. (1980) in „The determination of the possible effects of chemicals and wastes on the aquatic environment: degradation, toxicity, bioaccumulation” Ch. 2.3, Part II. Government Publishing Office, The Hague, The Netherlands. |
|
(9) |
Gardner et al, (1995) Limn. & Oceanogr. 30, str. 1099-1105. |
|
(10) |
Randall R.C., Lee H., Ozretich R.J., Lake J.L. and Pruell R.J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Envir. Toxicol. Chem. 10, str. 1431-1436. |
|
(11) |
CEC, Bioconcentration of chemical substances in fish: the flow-through method-Ring Test Programme, 1984 to 1985. Final report March 1987. Authors: P. Kristensen and N. Nyholm. |
|
(12) |
ASTM E-1022-84 (Reapproved 1988) Standard Practice for conducting Bioconcentration Tests with Fishes and Saltwater Bivalve Molluscs. |
Dodatak 1.
Kemijska svojstva prihvatljive vode za razrjeđivanje
|
|
Tvar |
Granična koncentracija |
|
1 |
Lebdeće čestice |
5 mg/l |
|
2 |
Ukupni organski ugljik |
2 mg/l |
|
3 |
Neionizirani amonijak |
1 μg/l |
|
4 |
Rezidualni klor |
10 μg/l |
|
5 |
Ukupni organofosforni pesticidi |
50 ng/l |
|
6 |
Ukupni organoklorni pesticidi plus poliklorirani bifenili |
50 ng/l |
|
7 |
Ukupni organski klor |
25 ng/l |
|
8 |
Aluminij |
1 μg/l |
|
9 |
Arsen |
1 μg/l |
|
10 |
Krom |
1 μg/l |
|
11 |
Kobalt |
1 μg/l |
|
12 |
Bakar |
1 μg/l |
|
13 |
Željezo |
1 μg/l |
|
14 |
Olovo |
1 μg/l |
|
15 |
Nikal |
1 μg/l |
|
16 |
Cink |
1 μg/l |
|
17 |
Kadmij |
100 ng/l |
|
18 |
Živa |
100 ng/l |
|
19 |
Srebro |
100 ng/l |
Dodatak 2.
Preporučene riblje vrste za ispitivanje
|
|
Preporučene vrste |
Preporučeno područje ispitnih temperatura (°C) |
Preporučena ukupna dužina ispitne životinje (cm) |
|
1 |
Danio rerio (17) (Teleostei, Cyprinidae) (Hamilton-Buchanan) zebrica |
20 – 25 |
3,0 ± 0,5 |
|
2 |
Pimephales promelas (Teleostei, Cyprinidae) (Rafinesque) debeloglava gaovica |
20 – 25 |
5,0 ± 2,0 |
|
3 |
Cyprinus carpio (Teleostei, Cyprinidae) (Linnaeus) šaran |
20 – 25 |
5,0 ± 3,0 |
|
4 |
Oryzias latipes (Teleostei, Poeciliidae) (Temminck i Schlegel) medaka |
20 – 25 |
4,0 ± 1,0 |
|
5 |
Poecilia reticulata (Teleostei, Poeciliidae) (Peters) gupi |
20 – 25 |
3,0 ± 1,0 |
|
6 |
Lepomis macrochirus (Teleostei, Centrarchidae) (Rafinesque) plavoškrga sunčanica |
20 – 25 |
5,0 ± 2,0 |
|
7 |
Oncorhynchus mykiss (Teleostei, Salmonidae) (Walbaum) kalifornijska pastrva |
13 – 17 |
8,0 ± 4,0 |
|
8 |
Gasterosteus aculeatus (Teleostei, Gasterosteidae) (Linnaeus) koljuška |
18 – 20 |
3,0 ± 1,0 |
U raznim se zemljama koriste različite estuarijske i morske vrste, primjerice:
|
Riba iz porodice sjenica |
Leiostomus xanthurus |
|
Ovčjeglava gavčica |
Cyprinodon variegatus |
|
Gavun |
Menidia beryllina |
|
Svjetlucavi grgeč |
Cymatogaster aggregata |
|
Engleski list |
Parophrys vetulus |
|
Tihomorska škrpina |
Leptocottus armatus |
|
Koljuška |
Gasterosteus aculeatus |
|
Lubin |
Dicentracus labrax |
|
Uklija |
Alburnus alburnus |
Skupljanje
Slatkovodne ribe navedene u tablici gore jednostavne su za uzgoj i/ili su široko raspoložive tijekom čitave godine, dok je raspoloživost morskih i estuarijskih vrsta djelomično ograničena na pojedine zemlje. One se mogu uzgajati i kultivirati na ribljim farmama ili u laboratorijskim uvjetima, uz nadzor bolesti i nametnika, kako bi se dobile zdrave ispitne životinje poznatog podrijetla. Ove su ribe raspoložive u mnogim dijelovima svijeta.
Dodatak 3.
Predviđanje trajanja faze apsorpcije i izlučivanja
1. Predviđanje trajanja faze apsorpcije
Vrijednost k2, a time i određeni postotak vremena potrebnog da se postigne stabilno stanje, može se procijeniti prije provedbe ispitivanja iz empirijskih odnosa između k2 i podjelnog koeficijenta n-oktanol/voda (Pow) ili k2 i topljivosti u vodi (s).
Procjena k2 (dani–1) može se primjerice izvesti iz sljedećega empirijskog odnosa (1):
|
log10k2 = 0,414 log10(Pow) + 1,47 (r2 = 0,95) |
[jednadžba 1] |
Za druge odnose vidjeti literaturu (2).
Ako podjelni koeficijent (Pow) nije poznat, procjena se može napraviti (3) na temelju znanja o topljivosti tvari u vodi (s) uz pomoć sljedeće jednadžbe:
|
log10(Pow) = 0,862 log10(s) + 0,710 (r2 = 0,994) |
[jednadžba 2] |
gdje je:
s = topljivost (mol/l): (n = 36)
Ovi odnosi vrijede samo za kemikalije s vrijednostima log Pow između 2 i 6,5 (4).
Vrijeme potrebno da se postigne određeni postotak stabilnog stanja može se dobiti iz opće kinetičke jednadžbe koja opisuje apsorpciju i izlučivanje (kinetika prvog reda) primjenom procjene k2:
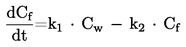
ili, ako je Cw stalan:
|
|
[jednadžba 3] |
Približavanjem stabilnom stanju (t → ∞) jednadžba 3 se može svesti (5)(6) na:
 sau Cf/Cw = k1/k2
= BCF
sau Cf/Cw = k1/k2
= BCF
Tada k1/k2 · Cw predstavlja približenje koncentraciji u ribama u „stabilnom stanju” (Cf,s).
Jednadžba 3 može se preurediti u:
|
|
[jednadžba 4] |
Primjenom jednadžbe 4, vrijeme potrebno da se postigne određeni postotak stabilnog stanja može se predvidjeti ako se prije toga procijeni k2 uz pomoć jednadžbe 1 ili 2.
Za orijentaciju, statistički optimalno trajanje faze apsorpcije za dobivanje statistički prihvatljivih podataka (BCFK) je vrijeme koje je potrebno da logaritamska krivulja koncentracije ispitivane tvari u ribama u ovisnosti o linearnom vremenu dosegne srednju točku odnosno 1,6/k2 ili 80 % stabilnog stanja, ali ne više od 3,0/k2 odnosno 95 % stabilnog stanja (7).
Vrijeme potrebno da se postigne 80 % stabilnog stanja je (jednadžba 4):
|
|
[jednadžba 5] |
Slično tomu, 95 % stabilnog stanja je:
|
|
[jednadžba 6] |
Primjerice, trajanje faze apsorpcije (up) za ispitivanu tvar s log Pow = 4 bilo bi (primjenom jednadžbi 1, 5, 6):
|
log10k2 = – 0,414. (4) + 1,47 |
k2 = 0,652 dana–1 |
up (80 %) = 1,6/0,652 tj. 2,45 dana (59 sati)
ili up (95 %) = 3,0/0,652 tj. 4,60 dana (110 sati)
Isto tako, za ispitivanu tvar kod koje je s = 10–5 mol/l (log(s) = – 5,0) trajanje faze apsorpcije bilo bi (primjenom jednadžbi 1, 2, 5, 6):
log10(Pow) = 0,862 (– 5,0) + 0,710 = 5,02
log10 K2 = 0,414 (5,02) + 1,47
k2 = 0,246 dana–1
up (80 %) = 1,6/0,246 tj. 6,5 dana (156 sati)
ili up (95 %) = 3,0/0,246 tj. 12,2 dana (293 sata)
Druga je mogućnost da se izraz:
teq = 6,54 × 103 Pow + 55,31 (sati)
upotrijebi za izračun vremena do uspostave efektivnog stabilnog stanja (4)
2. Predviđanje trajanja faze izlučivanja
Predviđanje vremena potrebnog da se tjelesno opterećenje smanji na određeni postotak početne koncentracije može se dobiti i iz opće jednadžbe koja opisuje apsporpciju i izlučivanje (kinetika prvog reda) (1)(8).
Uzima se da je Cw za fazu izlučivanja jednak nuli. Jednadžba se može svesti na:
 sau
sau 
gdje je C f,o koncentracija na početku razdoblja izlučivanja. 50 %-tno izlučivanje će se tada postići u vremenu (t50):
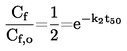 sau
sau 
Isto tako, 95 %-tno izlučivanje postiže se u:

Ako je u prvom razdoblju apsorpcija 80 % (1,6/k2) i ako je u fazi izlučivanja gubitak 95 % (3,0/k2), tada će faza izlučivanja trajati otprilike dvostruko duže od faze apsorpcije.
Ipak, važno je napomenuti da se procjene temelje na pretpostavci da obrasci apsorpcije i izlučivanja prate kinetiku prvog reda. Ako je očito da ne vrijedi kinetika prvog reda, treba primijeniti složenije modele (npr. (1)).
Literatura (za Dodatak 3.)
|
(1) |
Spacie A. and Hamelink J.L. (1982) Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. and Chem. 1, str. 309-320. |
|
(2) |
Kristensen P. (1991) Bioconcentration in fish: comparison of BCF’s derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Danish Water Quality Institute. |
|
(3) |
Chiou C.T. and Schmedding D.W. (1982) Partitioning of organic compounds in octanol-water systems. Environ. Sci. Technol. 16 (1), str. 4-10. |
|
(4) |
Hawker D.W. and Connell D.W. (1988) Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22 (6), str. 701-707. |
|
(5) |
Branson D.R., Blau G.E., Alexander H.C. and Neely W.B. (1975) Transactions of the American Fisheries Society, 104 (4), str. 785-792. |
|
(6) |
Ernst W. (1985) Accumulation in Aquatic organisms. In: Appraisal of tests to predict the environmental behaviour of chemicals. Ed. by Sheehman P., Korte F., Klein W. and Bourdeau P.H. Part 4.4 pp 243-255. SCOPE, 1985, John Wiley & Sons Ltd. N.Y. |
|
(7) |
Reilly P.M., Bajramovic R., Blau G.E., Branson D.R. and Sauerhoff M.W. (1977) Guidelines for the optimal design of experiments to estimate parameters in first order kinetic models, Can. J. Chem. Eng. 55, str. 614-622. |
|
(8) |
Könemann H. and Van Leeuwen K. (1980) Toxicokinetics in fish: Accumulation and Elimination of six Chlorobenzenes by Guppies. Chemosphere, 9, str. 3-19. |
Dodatak 4.
Teoretski primjer rasporeda uzorkovanja za ispitivanja biokoncentracije tvari s log Pow = 4
|
Uzorkovanje riba |
Vremenski raspored uzorkovanja |
Br. uzoraka vode |
Br. riba po uzorku |
||||
|
Minimalna učestalost (dani) |
Dodatno uzorkovanje |
||||||
|
Faza apsorpcije |
-1 0 |
|
2 (18) 2 |
uvesti 45 – 80 riba |
|||
|
1. |
0,3 |
0,4 |
2 (2) |
4 (4) |
|||
|
2. |
0,6 |
0,9 |
2 (2) |
4 (4) |
|||
|
3. |
1,2 |
1,7 |
2 (2) |
4 (4) |
|||
|
4. |
2,4 |
3,3 |
2 (2) |
4 (4) |
|||
|
5. |
4,7 |
|
2 |
6 |
|||
|
Faza izlučivanja |
|
|
|
prenijeti ribe u vodu bez ispitivane kemikalije |
|||
|
6. |
5,0 |
5,3 |
|
4 (4) |
|||
|
7. |
5,9 |
7,0 |
|
4 (4) |
|||
|
8. |
9,3 |
11,2 |
|
4 (4) |
|||
|
9. |
14,0 |
17,5 |
|
6 (4) |
|||
|
Vrijednosti u zagradama su količine uzoraka (voda, riba) koje treba uzeti ako se provodi dodatno uzorkovanje.
|
|||||||
Dodatak 5.
Razlikovanje modela
Polazi se od pretpostavke da se većina podataka o biokoncentraciji može "prilično" dobro opisati jednostavnim dvodjelnim/dvoparametarskim modelom, na što ukazuje pravocrtna krivulja koja se približava točkama koncentracija u ribama tijekom faze izlučivanja, ako se one prikazuju na polulogaritamskom papiru. (Ako se te točke ne mogu opisati pravocrtnom krivuljom, treba primijeniti složenije modele, vidjeti npr. Spacie and Hammelink, referenca (1) u Dodatku 3.).
Grafička metoda za određivanja konstante brzine izlučivanja (gubitka) k2
Koncentracija ispitivane tvari utvrđena u svakom ribljem uzorku prikaže se na polulogaritamskom papiru u ovisnosti o vremenu uzorkovanja. Nagib te crte je k2.


Treba napomenuti da odstupanja od ravne crte mogu ukazivati na složeniji obrazac izlučivanja od kinetike prvog reda. Grafičkom se metodom mogu razlučiti obrasci izlučivanja koji odstupaju od kinetike prvog reda.
Grafička metoda za određivanje konstante brzine apsorpcije k1
Ako je K2 zadan, k1 se izračunava na sljedeći način:
|
|
[jednadžba 1] |
Vrijednost Cf očita se iz srednje točke glatke krivulje apsorpcije koja se dobije grafičkim prikazom log koncentracije u ovisnosti o vremenu (na aritmetičkoj skali).
Računalna metoda za izračun konstanti brzine apsorpcije i izlučivanja (gubitka)
Kod određivanja faktora biokoncentracije i konstante brzine k1 i k2 prednost se daje računalnim metodama nelinearne procjene parametara. Ti programi pronalaze vrijednosti za k1 i k2 na temelju zadanog skupa podataka o koncentracijama u vremenskom slijedu i modela:
|
|
[jednadžba 2] |
|
|
[jednadžba 3] |
gdje je tc = vrijeme na kraju faze apsorpcije
Ovaj pristup omogućuje procjene standardne devijacije k1 i k2.
Budući da se k2 u većini slučajeva može prilično precizno procijeniti iz krivulje izlučivanja i budući da postoji snažna korelacija između parametara k1 i k2, ako se procjenjuju istodobno, ponekad je možda bolje prvo izračunati k2 samo iz podataka o izlučivanju i onda izračunati k1 iz podataka o apsorpciji pomoću nelinearne regresije.
C.14. TEST RASTA JUVENILNIH RIBA
1. METODA
Ova metoda ispitivanja toksičnih učinaka na rast odgovara smjernici OECD TG 215 (2000.).
1.1. UVOD
Ovaj je test namijenjen ocjenjivanju učinaka dugotrajnog izlaganja kemikalijama na rast juvenilnih riba. On se temelji na metodi za ocjenjivanje učinaka kemikalija na rast juvenilne kalifornijske pastrve (Oncorynchus mykiss) u protočnim uvjetima, koja je izrađena i ispitana u prstenastom testu (1)(2) unutar Europske unije. Mogu se koristiti i druge dobro dokumentirane vrste. Primjerice, postoje iskustva s testovima rasta sa zebricom (Danio rerio) (19) (3)(4) i medakom (Oryzias latipes) (5)(6)(7).
Vidjeti također Opći uvod, dio C.
1.2. DEFINICIJE
Najniža koncentracija s vidljivim učinkom (LOEC): najniža ispitana koncentracija kod koje je uočen značajan učinak ispitivane tvari (pri p < 0,05) u usporedbi s kontrolom. Ipak, sve ispitne koncentracije iznad LOEC-a moraju imati jednak ili veći štetan učinak od onog koji je zabilježen pri LOEC-u.
Najviša koncentracija bez vidljivog učinka (NOEC): ispitna koncentracija neposredno ispod LOEC-a.
ECx : kod ove ispitne metode, koncentracija ispitivane tvari koja izaziva x %-tnu promjenu brzine rasta riba u usporedbi s kontrolama.
Količina punjenja: mokra masa ribe po volumenu vode.
Gustoća nasada: broj riba po volumenu vode.
Pojedinačna specifična brzina rasta ribe: brzina rasta jedne jedinke na temelju početne mase.
Prosječna specifična brzina rasta po bazenu: srednja brzina rasta populacije bazena pri određenoj koncentraciji.
Pseudospecifična brzina rasta: brzina rasta pojedine ribe u odnosu na početnu srednju masu populacije bazena.
1.3. NAČELO ISPITNE METODE
Juvenilne ribe u fazi eksponencijalnog rasta se izvažu, stave u ispitne komore i izlože nizu subletalnih koncentracija ispitivane tvari otopljene u vodi, po mogućnosti u protočnim uvjetima ili, ako to nije moguće, u odgovarajućim polustatičkim uvjetima (statičko s obnavljanjem vode). Ispitivanje traje 28 dana. Ribe se hrane jedanput dnevno. Količina hrane temelji se na početnoj masi riba i može se preračunati nakon 14 dana. Na kraju ispitivanja se ribe ponovno izvažu. Učinci na brzinu rasta analiziraju se uz pomoć regresijskog modela da bi se dobila procjena koncentracije koja izaziva x %-tnu promjenu brzine rasta tj. ECx (npr. EC10, EC20 ili EC30). Druga je mogućnost da se podaci usporede s kontrolnim vrijednostima i odredi najniža koncentracija s vidljivim učinkom (LOEC), a time i najviša koncentracija bez vidljivog učinka (NOEC).
1.4. INFORMACIJE O ISPITIVANOJ TVARI
Trebaju biti raspoloživi rezultati ispitivanja akutne toksičnosti (vidjeti metodu C.1.), po mogućnosti na vrsti odabranoj za ovo ispitivanje. To znači da mora biti poznata topljivost u vodi i tlak pare ispitivane tvari i da mora biti raspoloživa pouzdana analitička metoda za kvantifikaciju tvari u ispitnim otopinama s poznatom i dokumentiranom točnošću i granicom detekcije.
Osim toga, korisno je imati informacije o strukturnoj formuli, čistoći tvari, stabilnosti u vodi i na svjetlosti, pKa, Pow i rezultate ispitivanja na laku biorazgradivost (vidjeti ispitnu metodu C.4.).
1.5. VALJANOST ISPITIVANJA
Da bi ispitivanje bilo valjano, moraju biti zadovoljeni sljedeći uvjeti:
|
— |
smrtnost u kontrolnoj skupini odnosno skupinama na kraju ispitivanja ne smije biti viša od 10 %, |
|
— |
povećanje srednje mase riba u kontrolnoj skupini odnosno skupinama mora biti dovoljno veliko da se može utvrditi najmanja promjena brzine rasta koja se smatra značajnom. Prstenasti je test (2) pokazao da se kod kalifornijske pastrve srednja masa riba u kontrolnim skupinama u 28 dana mora povećati najmanje za pola (tj. 50 %) njihove početne srednje mase; npr. početna masa: 1 g/riba (= 100 %), konačna masa nakon 28 dana: ≥ 1,5 g/riba (≥ 150 %), |
|
— |
u čitavom tijeku ispitivanja koncentracija otopljenog kisika mora iznositi barem 60 % vrijednosti zasićenja kisikom (ASV), |
|
— |
razlike u temperaturi vode između ispitnih komora ne smiju niti u jednom trenutku tijekom ispitivanja biti veće od ± 1 °C; temperaturu vode treba održavati unutar utvrđenog područja za ispitnu vrstu u pitanju (Dodatak 1.) uz maksimalna odstupanja od 2 °C unutar tog područja. |
1.6. OPIS ISPITNE METODE
1.6.1. Aparatura
Uobičajena laboratorijska oprema, posebno:
|
— |
mjerači kisika i pH vrijednosti, |
|
— |
oprema za određivanje tvrdoće vode i alkaliteta, |
|
— |
prikladni uređaji za regulaciju temperature i po mogućnosti neprekidno praćenje, |
|
— |
bazeni izrađeni od kemijski inertnog materijala i prikladne zapremnine s obzirom na preporučeno punjenje i gustoću nasada (vidjeti odjeljak 1.8.5. i Dodatak 1.), |
|
— |
vaga prikladne točnosti (tj. točnost ± 0,5 %). |
1.6.2. Voda
Kao ispitna voda može se koristiti svaka voda koja je prikladna za preživljavanje i rast ispitne vrste u dovoljno dugom razdoblju. pH vode treba biti u području od 6,5 do 8,5, ali tijekom jednog ispitivanja ne smije odstupati za više od ± 0,5 pH jedinica. Preporučuje se tvrdoća vode iznad 140 mg/l (kao CaCO3). Kako voda za razrjeđivanje ne bi neprimjereno utjecala na rezultat ispitivanja (npr. kompleksiranjem ispitivane tvari), potrebno je u određenim razmacima uzimati uzorke na analizu. Mjerenja teških metala (npr. Cu, Pb, Zn, Hg, Cd i Ni), glavnih aniona i kationa (npr. Ca, Mg, Na, K, Cl i SO4), pesticida (npr. ukupni organofosforni i ukupni organoklorni pesticidi), ukupnog organskog ugljika i suspendirane krute tvari treba obavljati npr. svaka tri mjeseca ako se zna da je voda za razrjeđivanje relativno stalne kakvoće. Ako se dokaže da je kakvoća vode ujednačena tijekom najmanje jedne godine, određivanja se mogu prorijediti i razmaci povećati (npr. svakih šest mjeseci). Neka kemijska svojstva prihvatljive vode za razrjeđivanje navedena su u Dodatku 2.
1.6.3. Ispitne otopine
Ispitne otopine odabranih koncentracija pripremaju se razrjeđivanjem radne otopine.
Radnu otopinu treba po mogućnosti pripremiti jednostavnim miješanjem ili mućkanjem ispitivane tvari u vodi za razrjeđivanje mehaničkim sredstvima (npr. mješač ili ultrazvuk). Da bi se postigla prikladna koncentracija radne otopine mogu se koristiti kolone za zasićivanje („kolone za topljivost”).
Ponekad je za dobivanje prikladne koncentracije radne otopine potrebno koristiti otapala ili dispergente (sredstava za otapanje). Primjeri prikladnih otapala su aceton etanol, metanol, dimetilsulfoksid, dimetilformamid i trietilenglikol. Primjeri prikladnih dispergenata su Cremophor RH40, Tween 80, metilceluloza 0,01 % i HCO-40. Kod primjene lako biorazgradivih sredstava (npr. aceton) i/ili visoko hlapljivih spojeva potreban je poseban oprez budući da oni kod protočnih ispitivanja mogu izazvati problem rasta bakterija. Ako se koristi sredstvo za otapanje, ono ne smije imati značajne učinke na riblji rast niti vidljive štetne učinke na juvenilne ribe, što mora potvrditi kontrola s otapalom bez ispitivane tvari.
Kod protočnih je ispitivanja za dopremanje niza koncentracija u ispitne komore potreban sustav koji stalno odmjerava i razrjeđuje radnu otopinu ispitivane tvari (npr. dozirna crpka, proporcionalni razrjeđivač, zasićivač). Brzine protoka radnih otopina i vode za razrjeđivanje treba provjeravati u određenim razmacima tijekom ispitivanja, po mogućnosti jedanput dnevno, i one za vrijeme ukupnog trajanja ispitivanja ne smiju odstupati više od 10 %. Prstenasti test (2) je pokazao da je za kalifornijsku pastrvu prihvatljiva dinamika izmjene vode od šest litara/g ribe/dan tijekom ispitivanja (vidjeti odjeljak 1.8.2.2.).
Kod polustatičkih ispitivanja (s obnavljanjem) učestalost obnavljanja medija ovisi o stabilnosti ispitivane tvari, ali se u svakom slučaju preporučuje dnevno obnavljanje vode. Ako iz preliminarnih ispitivanja stabilnosti (vidjeti odjeljak 1.4.) proizlazi da koncentracija ispitivane tvari nije stabilna u razdoblju obnavljanja medija (tj. izvan raspona 80 – 120 % nazivne vrijednosti ili pada ispod 80 % izmjerene početne koncentracije), treba ramisliti o provedbi protočnog ispitivanja.
1.6.4. Odabir vrste
Preporučena vrsta za ovo ispitivanje je kalifornijska pastrva (Oncorynchus mykiss), budući da najveći dio iskustava počiva na prstenastom testu s tom vrstom (1)(2). Mogu se koristiti i druge dobro dokumentirane vrste, ali to može zahtijevati prilagodbu ispitnog postupka kako bi se osigurali prikladni ispitni uvjeti. Na primjer, postoje iskustva sa zebricom (Danio rerio) (3)(4) i medakom (Oryzias latipes) (5)(6)(7). U tom slučaju treba navesti razloge za odabir vrste i pokusnu metodu.
1.6.5. Držanje riba
Ribe za ispitivanje treba odabrati među populacijom iz istog nasada, a po mogućnosti i iz istog legla, koja je najmanje dva tjedna prije ispitivanja držana u uvjetima koji su slični ispitnim uvjetima u smislu kakvoće vode i osvjetljenja. Količina hrane koja se daje ribama u ukupnom razdoblju držanja i tijekom ispitivanja iznosi najmanje 2 % tjelesne mase dnevno, a po mogućnosti i 4 % tjelesne mase dnevno.
Nakon vremena prilagodbe od 48 sati bilježi se smrtnost, uz primjenu sljedećih kriterija:
|
— |
smrtnost iznad 10 % populacije u sedam dana: odbacuje se čitava serija, |
|
— |
smrtnost između 5 i 10 % populacije: aklimatizacija se nastavlja još sedam dana; ako je smrtnost tijekom drugih sedam dana viša od 5 %, čitava se serija odbacuje, |
|
— |
smrtnost ispod 5 % populacije u sedam dana: serija se prihvaća. |
Ribe se ne smiju liječiti dva tjedna prije ispitivanja niti za vrijeme ispitivanja.
1.7. PLAN ISPITIVANJA
„Plan ispitivanja” odnosi se na odabir broja ispitnih koncentracija i razmaka među koncentracijama, broja bazena za svaku koncentraciju i broja riba po bazenu. U idealnom slučaju plan ispitivanja treba odabrati s obzirom na:
|
— |
cilj istraživanja, |
|
— |
metodu statističke analize koja će se primijeniti, |
|
— |
raspoloživost i troškove sredstava potrebnih za pokus. |
U obrazloženju cilja treba po mogućnosti navesti s kojom statističkom snagom treba utvrditi razliku određenog reda veličine (npr. brzina rasta) ili, kao druga mogućnost, s kojom preciznošću treba procijeniti ECx (npr. x = 10, 20 ili 30 i po mogućnosti ne manji od 10). Bez tog se ne može točno predvidjeti opseg istraživanja.
Važno je znati da plan ispitivanja koji je optimalan (tj. omogućuje najbolje iskorištenje sredstava) za jednu metodu statističke analize nije nužno optimalan za drugu. Stoga će preporučeni plan za procjenu LOEC/NOEC biti različit od preporučenog plana za regresijsku analizu.
U većini se slučajeva regresijskoj analizi daje prednost u odnosu na analizu varijance iz razloga koje navode Stephan i Rogers (8). Ipak, ako se ne pronađe prikladan regresijski model (r2 < 0,9) treba koristiti NOEC/LOEC.
1.7.1. Plan ispitivanja za regresijsku analizu
Kod planiranja ispitivanja koje će se analizirati regresijskom analizom važno je uzeti u obzir sljedeće:
|
— |
Ispitne koncentracije moraju obavezno obuhvaćati koncentraciju s učinkom (npr. EC10,20,30) i područje koncentracija unutar kojega je učinak ispitivane tvari od interesa. Najveća preciznost procjene koncentracija s učinkom postiže se kad se koncentracija s učinkom nalazi u sredini raspona koncentracija koje se ispituju. Preliminarno ispitivanje za određivanje raspona može pomoći u odabiru najprikladnijih ispitnih koncentracija. |
|
— |
U interesu zadovoljavajućeg statističkog modeliranja, u ispitivanje treba uključiti najmanje jedan kontrolni bazen i još pet bazena s različitim koncentracijama. Prema potrebi, kada se koristi sredstvo za otapanje, uz ispitni niz treba predvidjeti i jednu kontrolu sa sredstvom za otapanje u najvišoj koncentraciji koja se ispituje (vidjeti odjeljak 1.8.3. i 1.8.4.). |
|
— |
Može se koristiti odgovarajući geometrijski niz ili logaritamski niz (9) (vidjeti Dodatak 3.). Prednost se daje logaritamskom razmaku između ispitnih koncentracija. |
|
— |
Ako je raspoloživo više od šest bazena, dodatne bazene treba koristiti za ponavljanja ili ih rasporediti unutar raspona koncentracija tako da se dobiju manji razmaci među njima. Obje su mjere jednako poželjne. |
1.7.2. Plan ispitivanja za procjenu NOEC/LOEC primjenom analize varijance (ANOVA)
Poželjno je predvidjeti bazene ponavljanja pri svim koncentracijama; statističku analizu treba provesti na razini bazena (10). Bez ponavljanja nije moguće uzeti u obzir varijabilnost među bazenima osim one koja se može pripisati pojedinačnim ribama. Ipak, iskustvo je pokazalo (11) da je, u promatranom slučaju, varijabilnost među bazenima bila vrlo malena u odnosu na varijabilnost unutar bazena (tj. između riba). Stoga je provedba statističke analize na razini pojedinačnih riba relativno prihvatljiva alternativa.
Obično se koristi najmanje pet ispitnih koncentracija u geometrijskom nizu, po mogućnosti uz faktor koji nije viši od 3,2.
Općenito, kad se ispitivanje provodi s ponavljanjima, broj ponavljanja kontrolnih bazena, a time i broj riba, treba biti dvostruko veći od broja koji se koristi pri pojedinim ispitnim koncentracijama, koji mora biti jednak za sve koncentracije. (12)(13)(14). Naprotiv, ako nema ponavljanja, broj riba u kontrolnoj skupini treba biti jednak broju u pojedinim ispitnim koncentracijama.
Ako će se ANOVA temeljiti na bazenima, a ne na pojedinačnim ribama (što bi povlačilo za sobom pojedinačno obilježavanje riba ili korištenje „pseudo” specifičnih brzina rasta (vidjeti odjeljak 2.1.2.)), potreban je dovoljan broj ponavljanja bazena da se može odrediti standardna devijacija „bazena unutar koncentracija”). To znači da stupnjevi slobode za grešku kod analize varijance trebaju biti najmanje 5 (10). Ako se ponavljaju samo kontrole, postoji opasnost da će varijabilnost greške biti pristrana, jer ona može rasti sa srednjom vrijednošću brzine rasta u pitanju. Budući da brzina rasta uglavnom opada s povećanjem koncentracije, varijabilnost može biti precijenjena.
1.8. POSTUPAK
1.8.1. Odabir i vaganje riba za ispitivanje
Važno je da razlike u masi riba na početku ispitivanja budu što manje. Prikladni rasponi veličina za različite vrste preporučene za ovo ispitivanje navedeni su u Dodatku 1. U idealnom slučaju, pojedinačne mase riba u čitavoj seriji koja se koristi u ispitivanju trebale bi se na početku ispitivanja nalaziti u granicama ± 10 % aritmetičke srednje mase, a u svakom slučaju ne bi smjele prelaziti 25 %. Preporučuje se da se prije početka ispitivanja izvaže poduzorak riba radi procjene srednje mase.
Matičnoj populaciji treba uskratiti hranu 24 sata prije početka ispitivanja. Nakon toga ribe treba nasumično odabrati. Koristeći opći anestetik (npr. vodena otopina 100 mg/l trikain- metansulfonata (MS 222) neutraliziranog dodavanjem dva dijela natrijevog bikarbonata po dijelu MS 222), ribe (osušene upijajućim materijalom) treba pojedinačno izvagati da bi se odredila mokra masa s preciznošću navedenom u Dodatku 1. Ribe čija se masa nalazi unutar predviđenog raspona treba zadržati i nasumično ih rasporediti po ispitnim posudama. Treba zabilježiti ukupnu mokru masu riba u svakoj ispitnoj posudi. Uporaba anestetika i rukovanje (uključujući sušenje i vaganje) može kod juvenilnih riba izazvati stres i ozljede, posebno kod vrsta koje su malog rasta. Stoga juvenilnim ribama treba krajnje oprezno rukovati kako bi se izbjegao stres i ozljede životinja.
Ribe se ponovno važu 28. dana ispitivanja (vidjeti odjeljak 1.8.6.). Ipak, ako se smatra da je potrebno preračunati količinu hrane, ribe se mogu ponovno izvagati 14. dana ispitivanja (vidjeti odjeljak 1.8.2.3.). Za određivanje promjena veličine riba za potrebe prilagodbe količine hrane mogu se koristiti i druge metode, kao što je fotografska metoda.
1.8.2. Uvjeti izlaganja
1.8.2.1. Trajanje
Vrijeme ispitivanja je ≥ 28 dana.
1.8.2.2. Količine punjenja i gustoće nasada
Važno je da količina punjenja i gustoća nasada bude prilagođena ispitnoj vrsti (vidjeti Dodatak 1.). Ako je gustoća nasada previsoka, dolazi do stresa uslijed prenapučenosti, što dovodi do smanjenja brzina rasta pa čak i bolesti. Preniska gustoća nasada može potaknuti teritorijalno ponašanje, što također može utjecati na rast. U svakom slučaju, količina punjenja treba biti dovoljno niska da se koncentracija otopljenog kisika može održati barem na razini 60 % ASV bez dozračivanja. Prstenasti je test (2) pokazao da je za kalifornijsku pastrvu prihvatljiva količina punjenja od 16 pastrva od 3 – 5 g na 40 litara. Preporučena dinamika izmjene vode tijekom ispitivanja je 6 litara/g ribe/dan.
1.8.2.3. Hranjenje
Ribe treba hraniti odgovarajućom hranom (Dodatak 1.), u dovoljnoj količini da se dobije prihvatljiva brzina rasta. Treba paziti da ne dođe do rasta mikroba i zamućenja vode. Kod kalifornijske pastrve te bi uvjete trebala zadovoljiti dnevna količina hrane od 4 % njihove tjelesne mase (2)(15)(16)(17). Dnevna se količina hrane može podijeliti u dva jednaka dijela i dati ribama u dva hranjenja na dan u razmaku od najmanje 5 sati. Količina se hrane temelji na početnoj ukupnoj masi riba u svakoj ispitnoj posudi. Ako se ribe ponovno važu 14. dana, količina se hrane može preračunati. Ribama treba uskratiti hranu 24 sata prije vaganja.
Nepojedena hrana i izmet se svakodnevno uklanjaju iz ispitnih posuda opreznim usisavanjem dna bazena.
1.8.2.4. Svjetlost i temperatura
Fotoperiod i temperaturu vode treba prilagoditi ribljoj vrsti (Dodatak 1.).
1.8.3. Ispitne koncentracije
U pravilu je potrebno pet koncentracija ispitivane tvari, bez obzira na plan ispitivanja (vidjeti odjeljak 1.7.2.). U odabiru odgovarajućih ispitnih koncentracija može pomoći prethodno znanje o toksičnosti ispitivane tvari (npr. iz ispitivanja akutne toksičnosti i/ili istraživanja za određivanje raspona). Ako se koristi manje od pet koncentracija, treba navesti obrazloženje. Najviša ispitivana koncentracija ne smije biti viša od granice topljivosti tvari u vodi.
Ako se kao pomoć u pripremi radne otopine koristi sredstvo za otapanje, njegova konačna koncentracija ne smije biti viša od 0,1 ml/l i treba po mogućnosti biti jednaka u svim ispitnim posudama (vidjeti odjeljak 1.6.3.). Ipak, treba nastojati izbjeći korištenje takvih materijala gdje god je to moguće.
1.8.4. Kontrole
Broj kontrola s vodom za razrjeđivanje ovisi o planu ispitivanja (vidjeti odjeljke 1.7. – 1.7.2.). Ako se koristi sredstvo za otapanje, u ispitivanje treba uključiti isti broj kontrola sa sredstvom za otapanje.
1.8.5. Učestalost analitičkog određivanja i mjerenja
Koncentracije ispitivane tvari određuju se u redovitim razmacima tijekom ispitivanja (vidjeti dolje).
Kod protočnih ispitivanja brzine protoka sredstva za razrjeđivanje i radne otopine toksikanta treba provjeravati u određenim razmacima, po mogućnosti jedanput dnevno; one tijekom ispitivanja ne bi smjele odstupati više od 10 %. Ako se očekuje da će koncentracije ispitivane tvari biti u granicama ± 20 % nazivnih vrijednosti (tj. unutar područja 80 – 120 %; vidjeti odjeljke 1.6.2. i 1.6.3.), preporučuje se da se na početku ispitivanja, i zatim u tjednim razmacima, analiziraju barem najviše i najniže ispitne koncentracije. Kod ispitivanja gdje se ne očekuje da će koncentracija ispitivane tvari ostati u granicama ± 20 % nazivne vrijednosti (na temelju podataka o stabilnosti ispitivane tvari), potrebno je prema istom režimu analizirati sve ispitne koncentracije.
U slučaju polustatičkih ispitivanja (s obnavljanjem), ako se očekuje da će koncentracija ispitivane tvari ostati u granicama ± 20 % nazivnih vrijednosti, preporučuje se da se na početku istraživanja odmah nakon pripreme otopine i neposredno prije obnavljanja te u tjednim razmacima nakon tog analiziraju barem najviše i najniže ispitne koncentracije. Ako se ne očekuje da će koncentracija ispitivane tvari ostati u granicama ± 20 % nazivne vrijednosti, treba analizirati sve ispitne koncentracije prema istom režimu kao kod stabilnijih tvari.
Preporučuje se da se rezultati temelje na izmjerenim koncentracijama. Ipak, ako se može dokazati da se koncentracija ispitivane tvari u otopini u čitavom tijeku ispitivanja na zadovoljavajući način održava u granicama ± 20 % nazivne ili izmjerene početne koncentracije, rezultati se mogu temeljiti na nazivnim ili izmjerenim vrijednostima.
U pojedinim je slučajevima uzorke potrebno filtrirati (npr. uz primjenu veličine pora 0,45 μm) ili centrifugirati. Centrifugiranje je preporučeni postupak. Ipak, ako se ispitivani materijal ne adsorbira na filtre, prihvatljivo je i filtriranje.
Otopljeni kisik, pH i temperaturu treba mjeriti u svim ispitnim posudama tijekom ispitivanja. Ukupnu tvrdoću, alkalitet i salinitet (prema potrebi) treba mjeriti u kontrolnim posudama i jednoj posudi s najvišom koncentracijom. Otopljeni kisik i salinitet (prema potrebi) treba mjeriti barem tri puta (na početku, u sredini i na kraju ispitivanja). Kod polustatičkih se ispitivanja preporučuje češće mjerenje otopljenog kisika, po mogućnosti prije i nakon svakog obnavljanja vode ili barem jedanput tjedno. pH kod statičkog ispitivanja s obnavljanjem treba mjeriti na početku i na kraju svakog obnavljanja vode, a kod protočnih ispitivanja barem jedanput tjedno. Tvrdoću i alkalitet treba mjeriti jedanput kod svakog ispitivanja. Temperaturu po mogućnosti treba neprekidno pratiti u najmanje jednoj ispitnoj posudi.
1.8.6. Promatranja
Masa: na kraju ispitivanja treba izvagati sve preživjele ribe na bazi mokre mase (osušene upijajućim materijalom) bilo u skupinama po ispitnoj posudi ili pojedinačno. Vaganju životinja po ispitnim posudama daje se prednost u odnosu na pojedinačno vaganje, kod kojega je potrebno ribe pojedinačno obilježiti. U slučaju mjerenja pojedinačne mase radi određivanja pojedinačne specifične brzine rasta ribe, treba odabrati tehniku obilježavanja koja ne izaziva stres kod životinja (mogu se razmotriti sredstva obilježavanja različita od ledenog biljega npr. uporaba obojene tanke ribolovne strune).
U razdoblju ispitivanja ribe treba svakodnevno pregledavati i zabilježiti sve vanjske anomalije (kao što su krvarenje, promjena boje) i neuobičajena ponašanja. Treba evidentirati smrtnost i što prije ukloniti mrtve ribe. Mrtve se ribe ne nadomještaju jer su količina punjenja i gustoća nasada dovoljni da se izbjegnu učinci na rast uslijed promjena broja riba po bazenima. Ipak, potrebno je prilagoditi količinu hrane.
2. PODACI I IZVJEŠĆIVANJE
2.1. OBRADA REZULTATA
Preporučuje se da se u planiranje ispitivanja i analizu rezultata uključi statističar, budući da ova ispitna metoda pruža široke mogućnosti variranja koncepcije pokusa npr. u odnosu na broj ispitnih komora, broj ispitnih koncentracija, broj riba itd. S obzirom na raspoložive opcije u okviru plana ispitivanja, ovdje se ne navode posebne smjernice za statistički postupak.
Za ispitne posude gdje je smrtnost veća od 10 % ne treba računati brzine rasta. Ipak, stopu smrtnosti treba navesti za sve ispitne koncentracije.
Neovisno o tome koja se metoda koristi za analizu podataka, središnji pojam je specifična brzina rasta r između vremena t1 i t2. Ona se može definirati na više načina, ovisno o tome obilježavaju li se ribe pojedinačno ili ne i je li potreban prosjek bazena.

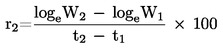

gdje je:
|
r1 |
= |
pojedinačna specifična brzina rasta ribe |
|
r2 |
= |
prosječna specifična brzina rasta po bazenu |
|
r3 |
= |
„pseudo” specifična brzina rasta |
|
w1, w2 |
= |
masa određene ribe u vremenu t1 odnosno t2 |
|
loge w1 |
= |
logaritam mase pojedinačne ribe na početku razdoblja istraživanja |
|
loge w2 |
= |
logaritam mase pojedinačne ribe na kraju razdoblja istraživanja |
|
logew1 |
= |
prosjek logaritama vrijednosti w1 za ribe u bazenu na početku razdoblja istraživanja |
|
logew2 |
= |
prosjek logaritama vrijednosti w2 za ribe u bazenu na kraju razdoblja istraživanja |
|
t1, t2 |
= |
vrijeme (dani) na početku i kraju razdoblja istraživanja |
r1, r2, r3 mogu se izračunati za razdoblje od 0. – 28. dana te, prema potrebi (tj. ako je provedeno mjerenje 14. dana) za razdoblja od 0. – 14. i 14. – 28. dana.
2.1.1. Regresijska analiza rezultata (modeliranje koncentracija-odgovor)
Ova analitička metoda uspostavlja prikladan matematički odnos između specifične brzine rasta i koncentracije i tako omogućuje procjenu „ECx” tj. svih potrebnih vrijednosti EC. Primjenom ove metode nije potrebno izračunavati r za pojedinačnu ribu (r1), već se umjesto toga analiza može temeljiti na prosječnoj vrijednosti r po bazenima (r2). Ovoj posljednjoj metodi se daje prednost. Ona je također primjerenija kad se koriste najsitnije vrste.
Za provjeru odnosa koncentracija-odgovor treba izraditi grafički prikaz specifičnih brzina rasta po bazenima (r2) u ovisnosti o koncentraciji.
Treba odabrati prikladan model za izražavanje odnosa između r2 i koncentracije i izbor potkrijepiti odgovarajućim argumentima.
Ako je broj preživjelih riba po bazenima različit, postupak prilagođavanja modela, bilo da je jednostavan ili nelinearan, treba ponderirati kako bi se uzela u obzir nejednakost u veličinama skupina.
Metoda prilagođavanja modela mora omogućiti procjenu npr. EC20 i njegovog raspršenja (bilo standardna greška ili interval pouzdanosti). Graf prilagođenog modela treba prikazati u odnosu prema podacima tako da bude vidljiva valjanost podudaranja (8)(18)(19)(20).
2.1.2. Analiza rezultata za procjenu LOEC-a
Ako ispitivanje uključuje bazene ponavljanja pri svim koncentracijama, procjena LOEC-a može se temeljiti na analizi varijance (ANOVA) prosječne specifične brzine rasta po bazenima (vidjeti odjeljak 2.1.), nakon čega se uz pomoć prikladne metode (npr. Dunnettov ili Williamsov test (12)(13)(14)(21)) prosječni r za svaku koncentraciju uspoređuje s prosječnim r kontrola kako bi se odredila najniža koncentracija za koju je ta razlika značajna na razini vjerojatnosti 0,05. Ako nisu zadovoljene tražene pretpostavke za parametarske metode – nenormalna distribucija (npr. Shapiro-Wilkov test) ili heterogena varijanca (Bartlettov test), treba razmotriti mogućnost da se prije provedbe ANOVA-e podaci preoblikuju radi homogenizacije varijanci ili provesti ponderiranu ANOVA-u.
Ako ispitivanje ne uključuje ponavljanja pri svim koncentracijama, ANOVA na temelju bazena će biti neosjetljiva ili uopće neće biti moguća. U tom se slučaju, kao prihvatljivo kompromisno rješenje, ANOVA može temeljiti na „pseudo” specifičnoj brzini rasta r3 za pojedinačne ribe.
Prosječni r3 za svaku ispitnu koncentraciju se tada može usporediti s prosječnim r3 kontrola. LOEC se zatim može odrediti kako je opisano gore. Treba imati na umu da ova metoda ne uzima u obzir nikakvu drugu varijabilnost između bazena osim one koja se može pripisati pojedinačnim ribama niti pruža bilo kakvu zaštitu od te varijabilnosti. Ipak, iskustvo je pokazalo (8) da je varijabilnost među bazenima vrlo malena u odnosu na varijabilnost unutar bazena (tj. između riba). Ako u analizu nisu uključene pojedinačne ribe, treba navesti metodu koja je korištena za određivanje stršećih vrijednosti i obrazložiti njezin odabir.
2.2. TUMAČENJE REZULTATA
Rezultate treba tumačiti s oprezom ako se izmjerene koncentracije toksikanta u ispitnim otopinama nalaze u blizini granice detekcije analitičke metode odnosno, kod poluststatičkih ispitivanja, ako se koncentracija ispitivane tvari smanji u vremenu između pripreme otopine i obnavljanja.
2.3. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora sadržavati sljedeće informacije:
2.3.1. Ispitivana tvar:
|
— |
fizikalno stanje i relevantna fizikalno-kemijska svojstva, |
|
— |
podaci za identifikaciju kemikalije, uključujući čistoću i analitičku metodu za kvantifikaciju ispitivane tvari, prema potrebi. |
2.3.2. Ispitne vrste:
|
— |
znanstveni naziv (po mogućnosti), |
|
— |
soj, veličina, dobavljač, moguća prethodna obrada itd. |
2.3.3. Ispitni uvjeti
|
— |
ispitni postupak (npr. polustatički/obnavljanje, protočni, punjenje, gustoća nasada itd.), |
|
— |
plan ispitivanja (npr. broj ispitnih posuda, ispitnih koncentracija i ponavljanja, broj riba po posudi), |
|
— |
način pripreme radnih otopina i učestalost obnavljanja (ako se koristi sredstvo za otapanje, treba ga navesti zajedno s koncentracijom), |
|
— |
nazivne ispitne koncentracije, srednje izmjerene vrijednosti i njihove standardne devijacije u ispitnim posudama i metoda kojom su dobivene, dokazi da se mjerenja odnose na koncentracije ispitivane tvari u pravoj otopini, |
|
— |
svojstva vode za razrjeđivanje: pH, tvrdoća, alkalitet, temperatura, koncentracija otopljenog kisika, rezidualni klor (ako se mjeri), ukupni ogranski ugljik, suspendirana kruta tvar, salinitet ispitnog medija (ako se mjeri) i ostala mjerenja, |
|
— |
kakvoća vode unutar ispitnih posuda: pH, tvrdoća, temperatura i koncentracija otopljenog kisika, |
|
— |
detaljne informacije o hranjenju (npr. vrsta(-e) hrane, izvor, količina hrane i učestalost hranjenja). |
2.3.4. Rezultati:
|
— |
dokazi da kontrole zadovoljavaju kriterij valjanosti za preživljavanje i podaci o smrtnosti u svim ispitnim koncentracijama, |
|
— |
primijenjene statističko-analitičke tehnike, statistika na bazi ponavljanja ili riba, obrada podataka i obrazloženje primijenjenih tehnika, |
|
— |
tablični podaci o pojedinačnim i srednjim masama riba 0., 14. (ako se mjeri) i 28. dana, vrijednosti prosječnih specifičnih brzina rasta po bazenima odnosno pseudospecifičnih brzina rasta (ovisno o slučaju) za razdoblje od 0. – 28. odnosno od 0. – 14. i 14. – 28. dana, |
|
— |
rezultati statističke analize (tj. regresijska analiza ili ANOVA), po mogućnosti u tabličnom i grafičkom obliku, te LOEC (p = 0,05) i NOEC odnosno ECx, po mogućnosti sa standardnim greškama, |
|
— |
pojavnost neobičnih reakcija riba i svi vidljivi učinci ispitivane tvari. |
3. REFERENCE
|
(1) |
Solbe J.F. de LG (1987) Environmental Effects of Chemicals (CFM 9350 SLD). Report on a UK Ring Test of a Method for Studying the Effects of Chemicals on the Growth rate of Fish. WRc Report No PRD 1388-M/2. |
|
(2) |
Ashley S., Mallett M.J. and Grandy N.J., (1990) EEC Ring Test of a Method for Determining the Effects of Chemicals on the Growth Rate of Fish. Final Report to the Commission of the European Communities. WRc Report No EEC 2600-M. |
|
(3) |
Crossland N.O. (1985) A method to evaluate effects of toxic chemicals on fish growth. Chemosphere, 14, str. 1855-1870. |
|
(4) |
Nagel R., Bresh H., Caspers N., Hansen P.D., Market M., Munk R., Scholz N. and Höfte B.B., (1991) Effect of 3,4-dichloroaniline on the early life stages of the Zebrafish (Brachydanio rerio): results of a comparative laboratory study. Ecotox. Environ. Safety, 21, str. 157-164. |
|
(5) |
Yamamoto, Tokio., (1975) Series of stock cultures in biological field. Medaka (killifish) biology and strains. Keigaku Publish. Tokio, Japan. |
|
(6) |
Holcombe, G.W., Benoit D.A., Hammermeister, D.E., Leonard, E.N. and Johnson, R.D., (1995) Acute and long-term effects of nine chemicals on the Japanese medaka (Oryzias latipes).Arch. Environ. Conta. Toxicol. 28, str. 287-297. |
|
(7) |
Benoit, D.A., Holcombe, G.W. and Spehar, R.L., (1991) Guidelines for conducting early life toxicity tests with Japanese medaka (Oryzias latipes). Ecological Research Series EPA-600/3-91-063. U.S. Environmental Protection Agency, Duluth, Minesota. |
|
(8) |
Stephan C.E. and Rogers J.W., (1985) Advantages of using regression analysis to calculate results of chronic toxicity tests. Aquatic Toxicology and Hazard Assessment: Eighth Symposium, ASTM STP 891, R C Bahner and D J Hansen, Eds., American Society for Testing and Materials, Philadelphia, str. 328-338. |
|
(9) |
Environment Canada, (1992) Biological test method: toxicity tests using early life stages of salmonid fish (rainbow trout, coho salmon, or Atlantic salmon). Conservation and Protection, Ontario, Report EPS 1/RM/28, str. 81. |
|
(10) |
Cox D.R., (1958) Planning of experiments. Wiley Edt. |
|
(11) |
Pack S., (1991) Statistical issues concerning the design of tests for determining the effects of chemicals on the growth rate of fish. Room Document 4, OECD Ad Hoc Meeting of Experts on Aquatic Toxicology, WRc Medmenham, UK, 10-12 December 1991. |
|
(12) |
Dunnett C.W., (1955) A Multiple Comparisons Procedure for Comparing Several Treatments with a Control, J. Amer. Statist. Assoc., 50, str. 1096-1121. |
|
(13) |
Dunnett C.W., (1964) New tables for multiple comparisons with a control. Biometrics, 20, str. 482-491. |
|
(14) |
Williams D.A., (1971) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, str. 103-117. |
|
(15) |
Johnston, W.L., Atkinson, J.L., Glanville N.T., (1994) A technique using sequential feedings of different coloured food to determine food intake by individual rainbow trout, Oncorhynchus mykiss: effect of feeding level. Aquaculture 120, str. 123-133. |
|
(16) |
Quinton, J. C. and Blake, R.W., (1990) The effect of feed cycling and ration level on the compensatory growth response in rainbow trout, Oncorhynchus mykiss. Journal of Fish Biology, 37, str. 33-41. |
|
(17) |
Post, G., (1987) Nutrition and Nutritional Diseases of Fish. Chapter IX in Testbook of Fish Health. T.F.H. Publications, Inc. Neptune City, New Jersey, USA. str. 288. |
|
(18) |
Bruce, R.D. and Versteeg D.J., (1992) A statistical procedure for modelling continuous toxicity data. Environ. Toxicol. Chem. 11, str. 1485-1494. |
|
(19) |
DeGraeve, G.M., Cooney, J.M., Pollock, T.L., Reichenbach, J.H., Dean, Marcus, M.D. and McIntyre, D.O., (1989) Precision of EPA seven-day fathead minnow larval survival and growth test; intra and interlaboratory study. report EA-6189 (American Petroleum Institute Publication, No 4468). Electric Power Research Institute, Palo alto, CA. |
|
(20) |
Norbert-King T.J., (1988) An interpolation estimate for chronic toxicity: the ICp approach. US Environmental Protection Agency. Environmental Research Lab., Duluth, Minesota. Tech. Rep. No 05-88 of National Effluent Toxicity Assesment Center. Sept. 1988. str. 12. |
|
(21) |
Williams D.A., (1972) The comparison of several dose levels with a zero dose control. Biometrics 28, str. 510-531. |
Dodatak 1.
PREPORUČENE RIBLJE VRSTE ZA ISPITIVANJE I PRIKLADNI ISPITNI UVJETI
|
Vrste |
Preporučni raspon temperatura (°C) |
Fotoperiod (sati) |
Preporučeni raspon početnih masa riba (g) |
Potrebna preciznost mjerenja |
Količna punjenja (g/l) |
Gustoća nasada (po litri) |
Hrana |
Trajanje ispitivanja (dani) |
|
Preporučene vrste: |
|
|
|
|
|
|
|
|
|
Oncorhynchus mykiss kalifornijska pastrva |
12,5–16,0 |
12–16 |
1–5 |
na najbližih 100 g |
1,2–2,0 |
4 |
Suha gotova hrana za mlađ salmonida |
≥ 28 |
|
Druge dobro dokumentirane vrste: |
|
|
|
|
|
|
|
|
|
Danio rerio zebrica |
21–25 |
12–16 |
0,050–0,100 |
na najbliži 1 mg |
0,2–1,0 |
5–10 |
Živa hrana (Brachionus Artemia) |
≥ 28 |
|
Oryzias latipes (Medaka) medaka |
21–25 |
12–16 |
0,050–0,100 |
na najbliži 1 mg |
0,2–1,0 |
5–20 |
Živa hrana (Brachionus Artemia) |
≥ 28 |
Dodatak 2.
NEKA KEMIJSKA SVOJSTVA PRIHVATLJIVE VODE ZA RAZRJEĐIVANJE
|
Tvar |
Koncentracije |
|
Lebdeće čestice |
< 20 mg/l |
|
Ukupni organski ugljik |
< 2 mg/l |
|
Neionizirani amonijak |
< 1 μg/l |
|
Rezidualni klor |
< 10 μg/l |
|
Ukupni organofosforni pesticidi |
< 50 ng/l |
|
Ukupni organoklorni pesticidi plus poliklorirani bifenili |
< 50 ng/l |
|
Ukupni organski klor |
< 25 ng/l |
Dodatak 3.
Logaritamski niz prikladnih koncentracija za toksikološko ispitivanje (9)
|
Stupac (broj koncentracija između 100 i 10 ili između 10 i 1) (20) |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
100 |
100 |
100 |
100 |
100 |
100 |
100 |
|
32 |
46 |
56 |
63 |
68 |
72 |
75 |
|
10 |
22 |
32 |
40 |
46 |
52 |
56 |
|
3,2 |
10 |
18 |
25 |
32 |
37 |
42 |
|
1,0 |
4,6 |
10 |
16 |
22 |
27 |
32 |
|
|
2,2 |
5,6 |
10 |
15 |
19 |
24 |
|
|
1,0 |
3,2 |
6,3 |
10 |
14 |
18 |
|
|
|
1,8 |
4,0 |
6,8 |
10 |
13 |
|
|
|
1,0 |
2,5 |
4,6 |
7,2 |
10 |
|
|
|
|
1,6 |
3,2 |
5,2 |
7,5 |
|
|
|
|
1,0 |
2,2 |
3,7 |
5,6 |
|
|
|
|
|
1,5 |
2,7 |
4,2 |
|
|
|
|
|
1,0 |
1,9 |
3,2 |
|
|
|
|
|
|
1,4 |
2,4 |
|
|
|
|
|
|
1,0 |
1,8 |
|
|
|
|
|
|
|
1,3 |
|
|
|
|
|
|
|
1,0 |
C.15. TEST KRATKOTRAJNE TOKSIČNOSTI NA RIBAMA U STADIJU EMBRIJA I MLAĐI SA ŽUMANJČANOM VREĆICOM
1. METODA
Ova metoda ispitivanja kratkotrajne toksičnosti odgovara smjernici OECD TG 212 (1998.).
1.1. UVOD
Ovaj test kratkotrajne toksičnosti na stadiju ribljeg embrija i mlađi sa žumanjčanom vrećicom je kratkotrajni test kojemu se podvrgavaju svježe oplođena jaja do kraja stadija sa žumanjčanom vrećicom. Za vrijeme ispitivanja embrija i mlađi sa žumanjčanom vrećicom nije predviđeno hranjenje i stoga ispitivanje treba prekinuti dok se mlađ još hrani iz žumanjčane vrećice.
Test je namijenjem utvrđivanju letalnih, a u ograničenoj mjeri i subletalnih učinaka kemikalija na ispitivane stadije i vrstu. On bi mogao pružiti korisne informacije utoliko što bi (a) mogao poslužiti kao most između letalnih i subletalnih ispitivanja, (b) se mogao koristiti kao test pretraživanja za provedbu potpunog ispitivanja ranog životnog stadija ili ispitivanja kronične toksičnosti i (c) se mogao koristiti za ispitivanje vrsta gdje uzgojne tehnike još nisu dovoljno napredne da obuhvate razdoblje prijelaza s endogenog na egzogeno hranjenje.
Treba imati na umu da općenito samo ispitivanja koja uključuju sve stadije životnog ciklusa riba mogu dati točnu procjenu kronične toksičnosti kemikalija za ribe i da svako skraćeno izlaganje u smislu životnih stadija može smanjiti osjetljivost i tako potcijeniti kroničnu toksičnost. Stoga se očekuje da će ispitivanje provedeno na ribama u embrionalnom stadiju i stadiju žumanjčane vrećice biti manje osjetljivo od potpunog ispitivanja ranih životnih stadija, posebno u slučaju kemikalija visoke lipofilnosti (log Pow > 4) i kemikalija sa specifičnim toksičnim djelovanjem. Ipak, kod kemikalija s nespecifičnim narkotičkim djelovanjem mogu se očekivati manje razlike u osjetljivosti između te dvije vrste ispitivanja (1).
Prije objave ovog testa najviše iskustava s ispitvanjem embrionalnog stadija i stadija žumanjčane vrećice bilo je vezano uz slatkovodnu ribu Danio rerio Hamilton-Buchanan (Telostei, Cyprinidae – narodno ime zebrica). Zbog tog su u Dodatku 1. navedene detaljnije smjernice za provođenje ispitivanja na toj vrsti. To ne isključuje korištenje ostalih vrsta s kojima također postoje iskustva (Tablica 1.).
1.2. DEFINICIJE
Najniža koncentracija s vidljivim učinkom (LOEC): najniža ispitana koncentracija kod koje je uočen značajan učinak ispitivane tvari (pri p < 0,05) u usporedbi s kontrolom. Ipak, sve ispitne koncentracije iznad LOEC-a moraju imati jednak ili veći štetan učinak od onog koji je zabilježen pri LOEC-u.
Najviša koncentracija bez vidljivog učinka (NOEC): ispitna koncentracija neposredno ispod LOEC-a.
1.3. NAČELO ISPITNE METODE
Riblji embriji i mlađ sa žumanjčanom vrećicom izlažu se nizu koncentracija ispitivane tvari otopljene u vodi. U okviru protokola postoji mogućnost izbora polustatičkog ili protočnog postupka. Izbor ovisi o vrsti ispitivane tvari. Ispitivanje počinje polaganjem oplođenih jaja u ispitne komore i prestaje neposredno prije nego što ijedna ličinka u bilo kojoj ispitnoj komori u potpunosti apsorbira svoju žumanjčanu vrećicu odnosno prije nego što se u kontrolama zabilježi smrtnost zbog izgladnjelosti. Ocjenjuju se letalni i subletalni učinci i uspoređuju s kontrolnim vrijednostima kako bi se utvrdila najniža koncentracija s vidljivim učinkom, a time i najviša koncentracija bez vidljivog učinka. Oni se umjesto toga mogu analizirati i uz pomoć regresijskog modela radi procjene koncentracije koja bi izazvala učinak u određenom postotku (tj. LC/ECx gdje je x definirani % učinka).
1.4. PODACI O ISPITIVANOJ TVARI
Trebaju biti raspoloživi rezultati ispitivanja akutne toksičnosti (vidjeti metodu C.1.), po mogućnosti provedenog na vrsti odabranoj za ovo ispitivanje. Ti rezultati mogu biti korisni za odabir odgovarajućeg raspona ispitnih koncentracija kod ispitivanja ranih životnih stadija. Treba biti poznata topljivost u vodi (uključujući topljivost u ispitnoj vodi) i tlak pare ispitivane tvari. Osim toga, treba biti raspoloživa pouzdana analitička metoda za kvantifikaciju tvari u ispitnim otopinama s poznatom i dokumentiranom točnošću i granicom detekcije.
Informacije o ispitivanoj tvari koje mogu biti korisne kod određivanja ispitnih uvjeta su strukturna formula, čistoća tvari, stabilnost na svjetlosti, stabilnost u uvjetima ispitivanja, pKa, Pow i rezultati ispitivanja na laku biorazgradivost (vidjeti metodu C.4.).
1.5. VALJANOST ISPITIVANJA
Da bi ispitivanje bilo valjano, moraju biti zadovoljeni sljedeći uvjeti:
|
— |
ukupno preživljavanje oplođenih jaja u kontrolama i posudama s otapalom bez ispitivane tvari (prema potrebi) mora biti veća ili jednaka graničnim vrijednostima definiranim u dodacima 2. i 3., |
|
— |
u čitavom tijeku ispitivanja koncentracija otopljenog kisika mora biti između 60 i 100 % vrijednosti zasićenja kisikom (ASV), |
|
— |
razlike u temperaturi vode između ispitnih komora odnosno između uzastopnih dana ne smiju niti u jednom trenutku tijekom ispitivanja biti veće od ± 1,5 °C i trebaju biti unutar temperaturnih područja utvrđenih za ispitnu vrstu u pitanju (dodaci 2. i 3.). |
1.6. OPIS ISPITNE METODE
1.6.1. Ispitne komore
Mogu se koristiti bilo kakve staklene ili druge kemijski inertne posude. Posude trebaju biti dovoljno velike da se mogu zadovoljiti količne punjenja (vidjeti odjeljak 1.7.1.2.). Preporučuje se da se ispitne posude nasumično smjeste unutar ispitnog prostora. Ako u laboratoriju postoje sustavni učinci koji se mogu kontrolirati formiranjem blokova, slučajnom bloknom rasporedu gdje su sve obrade prisutne u svim blokovima treba dati prednost u odnosu na potpuno slučajni raspored. Ako se primjenjuje blokni raspored, to treba uzeti u obzir kod kasnije analize podataka. Ispitne posude treba zaštititi od neželjenog uznemiravanja.
1.6.2. Odabir ribljih vrsta
Preporučene riblje vrste navedene su u tablici 1.A. To ne isključuje druge vrste (primjeri su navedeni u tablici 1.B), ali njihovo korištenje može zahtijevati prilagodbu ispitnog postupka kako bi se osigurali prikladni ispitni uvjeti. U tom slučaju treba navesti razloge za odabir vrste i pokusnu metodu.
1.6.3. Držanje uzgojnih riba
Podaci o prikladnim uvjetima za držanje uzgojnog jata mogu se naći u smjernici OECD TG 210 (21) i u referencama (2)(3)(4)(5)(6).
1.6.4. Rukovanje embrijima i ličinkama
Kod izlaganja ispitnoj otopini embriji i ličinke se mogu položiti u manje posude smještene unutar glavne posude, koje imaju mrežaste stranice odnosno krajeve koji omogućuju protok otopine kroz posudu. Neturbulentno strujanje kroz male posude može se postići na način da se posude objese o polugu koja posude njiše gore-dolje, ali tako da ispitni organizmi ostanu čitavo vrijeme uronjeni; može se koristiti i sustav sifonskog ispiranja. Oplođena jaja salmonida mogu se položiti na stalke ili mreže s otvorima koji su dovoljno veliki da ličinke nakon što se izvale mogu kroz njih propasti. Kod polustatičkih ispitivanja sa svakodnevnim potpunim obnavljanjem medija (vidjeti stavak 1.6.6.) se za uklanjanje embrija i ličinki mogu koristiti Pasteurove pipete.
Ako se za držanje jaja unutar glavne ispitne posude koriste spremnici za jaja, rešetke ili mreže, njih treba ukloniti nakon što se ličinke izvale (21), osim mreža, koje treba zadržati kako bi se onemogućio bijeg riba. Ako ličinke treba premjestiti, one se ne smiju izložiti zraku; ribe se iz spremnika za jaja ne smiju vaditi mrežicom (takav oprez nije nužan kod nekih manje osjetljivih vrsta, kao što je šaran). Vrijeme prijenosa je različito ovisno o vrsti, s time da prijenos nije uvijek niti potreban. Kod polustatičkog se postupka mogu koristiti laboratorijske čaše ili plitki spremnici koji prema potrebi mogu biti opremljeni sitom blago izdignutim iznad dna čaše. Ako je zapremnina tih spremnika dovoljna da se zadovolje zahtjevi punjenja (vidjeti 1.7.1.2.), ličinke i embrije nije nužno premještati.
1.6.5. Voda
Prikladna ispitna voda je svaka voda koja ima kemijska svojstva prihvatljive vode za razrjeđivanje, kako je navedeno u Dodatku 4., i u kojoj je kontrolna vrijednost preživljavanja ispitne vrste barem na razini kako je navedeno u dodacima 2. i 3. Ona treba biti stalne kakvoće tijekom razdoblja ispitivanja. pH treba održavati unutar područja ± 0,5 pH jedinica. Kako voda za razrjeđivanje ne bi neprimjereno utjecala na rezultat ispitivanja (npr. kompleksiranjem ispitivane tvari) ili imala negativan utjecaj na uspješnost uzgojnog jata, potrebno je u određenim razmacima uzimati uzorke na analizu. Mjerenja teških metala (npr. Cu, Pb, Zn, Hg, Cd i Ni), glavnih aniona i kationa (npr. Ca, Mg, Na, K, Cl i SO4), pesticida (npr. ukupni organofosforni i ukupni organoklorni pesticidi), ukupnog organskog ugljika i suspendirane krute tvari treba obavljati npr. svaka tri mjeseca ako se zna da je voda za razrjeđivanje relativno stalne kakvoće. Ako se dokaže da je kakvoća vode ujednačena tijekom najmanje jedne godine, određivanja se mogu prorijediti i razmaci povećati (npr. svakih šest mjeseci).
1.6.6. Ispitne otopine
Ispitne otopine odabranih koncentracija pripremaju se razrjeđivanjem radne otopine.
Radnu otopinu treba po mogućnosti pripremiti jednostavnim miješanjem ili mućkanjem ispitivane tvari u vodi za razrjeđivanje mehaničkim sredstvima (npr. mješač ili ultrazvuk). Za postizanje prikladne koncentracije radne otopine mogu se koristiti kolone za zasićivanje („kolone za topljivost”). Uporabu otapala i dispergenata (sredstava za otapanje) treba što je moguće više izbjegavati; ipak, ti su spojevi u nekim slučajevima nužni da bi se dobila radna otopina prikladne koncentracije. Primjeri prikladnih otapala su aceton, etanol, metanol, dimetilformamid i trietilenglikol. Primjeri prikladnih dispergenata su Cremophor RH40, Tween 80, metilceluloza 0,01 % i HCO-40. Kod primjene lako biorazgradivih sredstava (npr. aceton) i/ili visoko hlapljivih spojeva potreban je poseban oprez budući da oni kod protočnih ispitivanja mogu izazvati problem rasta bakterija. Ako se koristi sredstvo za otapanje, ono ne smije imati značajan učinak na preživljavanje niti vidljiv štetni učinak na rane životne stadije, što mora potvrditi kontrola s otapalom bez ispitivane tvari. Ipak, treba nastojati izbjeći korištenje takvih materijala gdje god je to moguće.
Kod polustatičkog postupka mogu se koristiti dva različita postupka obnavljanja: i. pripreme se nove ispitne otopine u čistim posudama i preživjela jaja i ličinke se nježno prenesu u nove posude u maloj količini stare otopine, izbjegavajući izlaganje zraku, ili ii. ispitni organizmi se zadrže u posudama dok se dio ispitne vode (najmanje tri četvrtine) mijenja. Učestalost obnavljanja medija ovisi o stabilnosti ispitivane tvari, ali se u svakom slučaju preporučuje dnevno obnavljanje vode. Ako iz preliminarnih ispitivanja stabilnosti (vidjeti odjeljak 1.4.) proizlazi da koncentracija ispitivane tvari nije stabilna u razdoblju obnavljanja medija (tj. izvan raspona 80 – 120 % nazivne ili pada ispod 80 % izmjerene početne koncentracije), treba ramisliti o provedbi protočnog ispitivanja. U svakom slučaju treba paziti da se tijekom postupka obnavljanja vode ličinke ne izlože stresu.
Kod protočnih je ispitivanja za dopremanje niza koncentracija u ispitne komore potreban sustav koji stalno odmjerava i razrjeđuje radnu otopinu ispitivane tvari (npr. dozirna crpka, proporcionalni razrjeđivač, zasićivač). Brzine protoka radnih otopina i vode za razrjeđivanje treba provjeravati u određenim razmacima, po mogućnosti jedanput dnevno, i one za vrijeme ukupnog trajanja ispitivanja ne bi smjele odstupati više od 10 %. Pokazalo se da je prikladna brzina protoka koja odgovara barem peterostrukom volumenu ispitne komore u 24 sata (2).
1.7. POSTUPAK
Korisne informacije o provedbi toksikoloških ispitivanja na ribljim embrijima i mlađi sa žumanjčanom vrećicom mogu se pronaći u literaturi, a neki od primjera nalaze se na popisu literature za ovaj tekst (7)(8)(9).
1.7.1. Uvjeti izlaganja
1.7.1.1. Trajanje
Ispitivanje treba po mogućnosti početi u roku 30 minuta nakon oplodnje jaja. Embriji se uranjaju u ispitnu otopinu prije ili što brže nakon početka stadija cijepanja blastodiska, a u svakom slučaju prije ulaska u stadij gastrule. Ako se jaja nabavljaju od trgovca, ispitivanje ponekad nije moguće započeti odmah nakon oplodnje. Budući da odgoda početka ispitivanja može ozbiljno utjecati na osjetljivost ispitivanja, ispitivanje se mora započeti u roku osam sati od oplodnje. S obzirom da se ličinke ne hrane u razdoblju izlaganja, ispitivanje treba prekinuti prije nego što ijedna ličinka u bilo kojoj ispitnoj komori u potpunosti apsorbira svoju žumanjčanu vrećicu odnosno prije nego što se u kontrolama zabilježi smrtnost zbog izgladnjelosti. Trajanje ovisi o vrsti koja se koristi. U dodacima 2. i 3. navedena su neka preporučena trajanja ispitivanja.
1.7.1.2. Punjenje
Broj oplođenih jaja na početku ispitivanja treba biti dovoljan da se zadovolje statistički zahtjevi. Jaja treba nasumično podijeliti po obradama koristeći najmanje 30 oplođenih jaja po koncentraciji, ravnomjerno raspoređenih (odnosno što ravnomjernije, budući da je kod nekih vrsta teško dobiti jednake serije) u najmanje tri paralelne ispitne komore (ponavljanja). Količna punjenja (biomasa po volumenu ispitne otopine) treba biti dovoljno niska da se koncentracija otopljenog kisika može održati barem na razini 60 % ASV-a bez dozračivanja. Preporučena količna punjenja kod protočnih ispitivanja iznosi najviše 0,5 g/l u 24 sata i najviše 5 g/l otopine u bilo kojem trenutku (2).
1.7.1.3. Svjetlost i temperatura
Fotoperiod i temperaturu ispitne vode treba prilagoditi ispitnoj vrsti (dodaci 2. i 3.). Prema potrebi treba dodati jednu ispitnu posudu za praćenje temperature.
1.7.2. Ispitne koncentracije
U pravilu je potrebno pet koncentracija ispitivane tvari koje se razlikuju za stalni faktor ne viši od 3,2. Pri odabiru raspona ispitnih koncentracija treba uzeti u obzir krivulju ovisnosti LC50 o vremenu izlaganja kod istraživanja akutne toksičnosti. U pojedinim se slučajevima može koristiti manje od pet koncentracija, primjerice kod graničnih ispitivanja, i uži interval koncentracija. Ako se koristi manje od pet koncentracija, treba navesti obrazloženje. Ne treba ispitivati koncentracije tvari iznad LC50 nakon 96 sati ili 100 mg/l, ovisno o tome što je manje. Tvari ne treba ispitivati iznad granice topljivosti u ispitnoj vodi.
Ako se kao pomoć u pripremi ispitnih otopina koristi sredstvo za otapanje (vidjeti odjeljak 1.6.6.), njegova konačna koncentracija u ispitnim posudama ne smije biti viša od 0,1 ml/l i mora biti jednaka u svim ispitnim posudama.
1.7.3. Kontrole
Uz ispitni niz treba provesti jednu kontrolu s vodom za razrjeđivanje (s ponavljanjima prema potrebi) i, ako se koristi sredstvo za otapanje, jednu kontrolu sa sredstvom za otapanje (s ponavljanjima prema potrebi).
1.7.4. Učestalost analitičkih određivanja i mjerenja
Koncentracije ispitivane tvari određuju se u redovitim razmacima za vrijeme ispitivanja.
U slučaju polustatičkih ispitivanja, ako se očekuje da će koncentracija ispitivane tvari ostati u granicama ± 20 % nazivnih vrijednosti (tj. u rasponu 80 – 120 %; vidjeti odjeljke 1.4. i 1.6.6.), preporučuje se da se u pravilnim razmacima najmanje tri puta tijekom ispitivanja analiziraju barem najviša i najniža ispitna koncentracija, i to odmah nakon pripreme i neposredno prije obnavljanja (tj. analize treba napraviti na uzorku iz iste otopine – odmah nakon pripreme i kod obnavljanja).
Kod ispitivanja gdje se ne očekuje da će koncentracija ispitivane tvari ostati u granicama ± 20 % nazivne vrijednosti (na temelju podataka o stabilnosti ispitivane tvari), potrebno je analizirati sve ispitne koncentracije odmah nakon pripreme i prije obnavljanja prema istom režimu (tj. najmanje tri puta tijekom ispitivanja u pravilnim razmacima). Određivanje koncentracija ispitivane tvari prije obnavljanja treba provesti samo na jednoj posudi po ispitnoj koncentraciji. Između dva određivanja ne smije proći više od sedam dana. Preporučuje se da se rezultati temelje na izmjerenim koncentracijama. Ipak, ako se može dokazati da se koncentracija ispitivane tvari u otopini u čitavom tijeku ispitivanja na zadovoljavajući način održava u granicama ± 20 % nazivne ili izmjerene početne koncentracije, rezultati se mogu temeljiti na nazivnim ili izmjerenim početnim vrijednostima.
Kod protočnih ispitivanja treba koristiti sličan režim uzorkovanja kao što je opisano za polustatička ispitivanja (s time da u ovom slučaju ne vrijedi mjerenje „starih” otopina). Ipak, ako ispitivanje traje duže od sedam dana, dobro je povećati broj uzorkovanja u prvom tjednu (npr. tri seta mjerenja) kako bi se provjerila stabilnost ispitnih koncentracija.
Uzorci se ponekad moraju centrifugirati ili filtrirati (npr. uz primjenu veličine pora 0,45 μm). Ipak, čini se da se ni filtracijom niti centrifugiranjem ne može uvijek postići odvajanje bioraspoložive frakcije ispitivane tvari od one koja nije bioraspoloživa; stoga uzorke nije potrebno podvrgavati tim postupcima.
Otopljeni kisik, pH i temperaturu treba mjeriti u svim ispitnim posudama tijekom ispitivanja. Ukupnu tvrdoću i salinitet (prema potrebi) treba mjeriti u kontrolnim posudama i jednoj posudi s najvišom koncentracijom. Otopljeni kisik i salinitet (prema potrebi) treba mjeriti barem tri puta (na početku, u sredini i na kraju ispitivanja). Kod polustatičkih se ispitivanja preporučuje češće mjerenje otopljenog kisika, po mogućnosti prije i nakon svakog obnavljanja vode ili barem jedanput tjedno. pH kod polustatičkog ispitivanja treba mjeriti na početku i na kraju svakog obnavljanja vode, a kod protočnih ispitivanja barem jedanput tjedno. Tvrdoću treba mjeriti jedanput kod svakog ispitivanja. Temperaturu treba mjeriti dnevno i po mogućnosti neprekidno pratiti u najmanje jednoj ispitnoj posudi.
1.7.5. Promatranja
1.7.5.1. Stadij embrionalnog razvoja
Embrionalni stadij (tj. stadij gastrule) na početku izlaganja ispitivanoj tvari treba što preciznije provjeriti. To se može učiniti pomoću reprezentativnog uzorka jajašaca koja su na prikladan način konzervirana i očišćena. Opis i prikaz embrionalnog stadija može se pogledati i u literaturi (2)(5)(10)(11).
1.7.5.2. Valjenje i preživljavanje
Valjenje i preživljavanje treba promatrati najmanje jedanput dnevno i relevantne brojke dokumentirati. Na početku ispitivanja poželjna su i češća promatranja (npr. svakih 30 minuta tijekom prva tri sata), budući da u nekim slučajevima vremena preživljavanja mogu biti značajnija od samog broja smrti (npr. u slučaju akutnih toksičnih učinaka). Mrtve embrije i ličinke treba ukloniti čim se uoče, budući da se oni mogu brzo raspasti. Kod uklanjanja mrtvih jedinki nužan je krajnji oprez kako bi se izbjegli udarci i fizičko ozljeđivanje susjednih jaja/ličinki, koji su izuzetno nježni i osjetljivi. Kriteriji za utvrđivanje smrti razlikuju se ovisno o životnom stadiju:
|
— |
kod jajašaca: posebno u ranim stadijima, vidan gubitak prozirnosti i promjena boje zbog koagulacije i/ili taloženja proteina, što rezultira bijelkasto-mutnim izgledom, |
|
— |
kod embrija: odsutnost kretanja tijela i/ili odsutnost bila i/ili mutno obojenje kod vrsta čiji su embriji inače prozirni, |
|
— |
kod ličinki: nepomičnost i/ili odsutnost pokreta disanja i/ili odsutnost bila i/ili bijela mutna boja središnjeg živčanog sustava i/ili izostanak reakcije na mehaničke podražaje. |
1.7.5.3. Neuobičajeni izgled
Broj ličinki kod kojih su vidljive anomalije u obliku tijela i/ili pigmentacija kao i stadij apsorpcije žumanjčane vrećice treba bilježiti u primjerenim razmacima, ovisno o trajanju ispitivanja i vrsti opisane anomalije. Važno je napomenuti da je pojava abnormalnih embrija i ličinki prirodna i da ih kod nekih vrsta u kontroli odnosno kontrolama može biti i više postotaka. Abnormalne životinje treba ukloniti iz ispitnih posuda tek nakon smrti.
1.7.5.4. Neuobičajeno ponašanje
Anomalije, npr. hiperventilacija, nekoordinirano plivanje i atipična mirnoća, treba bilježiti u primjerenim razmacima, ovisno o trajanju ispitivanja. Ako se uoče takvi učinci, oni mogu, iako ih je teško kvantificirati, pomoći u tumačenju podataka o smrtnosti, tj. pružiti informacije o načinu toksičnog djelovanja tvari.
1.7.5.5. Dužina
Preporučuje se da se na kraju ispitivanja izmjere pojedinačne dužine; može se koristiti standardna, vilična ili ukupna dužina. Međutim, u slučaju truleži repne peraje ili erozije peraje treba koristiti standardne dužine. Općenito, kod dobro provedenih ispitivanja koeficijent varijacije dužine među ponavljanjima u kontrolama trebao bi biti ≤ 20 %.
1.7.5.6. Masa
Na kraju ispitivanja mogu se izmjeriti pojedinačne mase; suhoj masi (24 sata na 60 °C) se daje prednost u odnosu na mokru masu (osušeno upijajućim materijalom). Općenito, kod dobro provedenih ispitivanja koeficijent varijacije mase među ponavljanjima u kontrolama trebao bi biti ≤ 20 %.
Na temelju tih zapažanja mogu se dobiti svi ili neki od sljedećih podataka koji se koriste u statističkoj analizi:
|
— |
kumulativna smrtnost, |
|
— |
broj zdravih ličinki na kraju ispitivanja, |
|
— |
vrijeme do početka valjenja i kraja valjenja (tj. 90 % valjenja u svakom ponavljanju), |
|
— |
broj izvaljenih ličinki svakog dana, |
|
— |
dužina (i masa) preživjelih životinja na kraju ispitivanja, |
|
— |
broj deformiranih ličinki odnosno broj ličinki neuobičajenog izgleda, |
|
— |
broj ličinki koje pokazuju neuobičajeno ponašanje. |
2. PODACI I IZVJEŠĆIVANJE
2.1. OBRADA REZULTATA
Preporučuje se da se u planiranje ispitivanja i analizu rezultata uključi statističar, budući da ova metoda pruža široke mogućnosti variranja koncepcije pokusa npr. u odnosu na broj ispitnih komora, broj ispitnih koncentracija, početni broj oplođenih jaja i mjerene parametre. S obzirom na raspoložive opcije u okviru plana ispitivanja, ovdje se ne navode posebne smjernice u pogledu statističkih postupaka.
Ako se procjenjuje LOEC/NOEC, potrebno je analizirati varijacije unutar svakog seta ponavljanja primjenom analize varijance (ANOVA) ili tablica kontingencije. Za višestruku usporedbu rezultata pojedinačnih koncentracija i kontrola može biti korisna Dunnettova metoda (12)(13). Postoje i drugi korisni primjeri (14)(15). Potrebno je izračunati i navesti veličinu učinka koja se može utvrditi primjenom ANOVA-e ili drugih postupaka (tj. snaga testa). Valja napomenuti da zapažanja navedena u odjeljku 1.7.5.6. nisu sva prikladna za statističku analizu uz pomoć ANOVA-e. Primjerice, kumulativna smrtnost i brojevi zdravih ličinki na kraju ispitivanja mogu se analizirati metodama vjerojatnosti.
Ako se procjenjuju LC/ECx, relevantnim podacima treba prilagoditi odgovarajuću krivulju odnosno krivulje, npr. logističku krivulju, primjenom statističke metode kao što je metoda najmanjih kvadrata ili nelinearna metoda najmanjih kvadrata. Krivulja(-e) treba parametrizirati tako da se relevantni LC/ECx i njegova standardna greška može izravno procijeniti. To u velikoj mjeri olakšava izračun granica pouzdanosti oko LC/ECx. Treba navesti dvostranu pouzdanost na razini 95 %, osim ako postoje dobri razlozi za primjenu drugih razina pouzdanosti. Poželjno je da postupak prilagođavanja obuhvaća metodu za ocjenjivanje značajnosti nepodudaranja („lack of fit”). Mogu se koristiti grafičke metode prilagođavanja krivulje. Regresijska analiza prikladna je za sva zapažanja navedena u odjeljku 1.7.5.6.
2.2. TUMAČENJE REZULTATA
Rezultate treba tumačiti s oprezom ako se izmjerene koncentracije toksikanta u ispitnim otopinama nalaze u blizini granice detekcije analitičke metode. Oprez je nužan i kod tumačenja rezultata za koncentracije iznad topljivosti tvari u vodi.
2.3. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora sadržavati sljedeće informacije:
2.3.1. Ispitivana tvar:
|
— |
fizikalno stanje i relevantna fizikalno-kemijska svojstva, |
|
— |
podaci za identifikaciju kemikalije, uključujući čistoću i analitičku metodu za kvantifikaciju ispitivane tvari (prema potrebi). |
2.3.2. Ispitne vrste:
|
— |
znanstveni naziv, soj, broj roditeljskih riba (tj. koliko je ženki upotrijebljeno kako bi se osigurao potreban broj jajašaca za ispitivanje), izvor i metoda skupljanja oplođenih jaja i kasnije rukovanje. |
2.3.3. Ispitni uvjeti
|
— |
ispitni postupak (npr. polustatički ili protočni, vrijeme od oplodnje do početka ispitivanja, punjenje itd.), |
|
— |
fotoperiod(i), |
|
— |
plan ispitivanja (npr. broj ispitnih komora i ponavljanja, broj embrija po ponavljanju), |
|
— |
način pripreme radnih otopina i učestalost obnavljanja (ako se koristi sredstvo za otapanje, treba ga navesti zajedno s koncentracijom), |
|
— |
nazivne ispitne koncentracije, izmjerene vrijednosti, njihove srednje vrijednosti i standardne devijacije u ispitnim posudama te metoda kojom su dobivene; ako je ispitivana tvar topljiva u vodi u koncentracijama ispod ispitanih, treba pružiti dokaz da se mjerenja odnose na koncentracije ispitivane tvari u otopini, |
|
— |
svojstva vode za razrjeđivanje: pH, tvrdoća, temperatura, koncentracija otopljenog kisika, rezidualni klor (ako se mjeri), ukupni organski ugljik, suspendirana kruta tvar, salinitet ispitnog medija (ako se mjeri) i ostala provedena mjerenja, |
|
— |
kakvoća vode u ispitnim posudama: pH, tvrdoća, temperatura i koncentracija otopljenog kisika. |
2.3.4. Rezultati:
|
— |
rezultati preliminarnih istraživanja stabilnosti ispitivane tvari, |
|
— |
dokaz da kontrole zadovoljavaju opći standard prihvatljivosti stopa preživljavanja za ispitnu vrstu (dodaci 2. i 3.), |
|
— |
podaci o smrtnosti/preživljavanju u embrionalnom stadiju i stadiju ličinke i ukupna smrtnost/preživljavanje, |
|
— |
broj dana do valjenja i broj izvaljenih životinja, |
|
— |
podaci o dužini (i masi), |
|
— |
pojavnost i opis morfoloških anomalija, ako ih ima, |
|
— |
pojavnost i opis učinaka na ponašanje, ako ih ima, |
|
— |
statistička analiza i obrada podataka, |
|
— |
kod ispitivanja koja se analiziraju pomoću ANOVA-e, najniža koncentracija s vidljivim učinkom (LOEC) pri p = 0,05 i najviša koncentracija bez vidljivog učinka (NOEC) za svaki ocijenjeni odgovor, uključujući opis primijenjenih statističkih postupaka i naznaku koju je veličinu učinka bilo moguće utvrditi, |
|
— |
kod ispitivanja koja se analiziraju regresijskim tehnikama, LC/ECx i intervali pouzdanosti te graf prilagođenog modela koji je korišten za izračun, |
|
— |
obrazloženje svih odstupanja od ove ispitne metode. |
3. REFERENCE
|
(1) |
Kristensen P., (1990) Evaluation of the Sensitivity of Short Term Fish Early Life Stage Tests in Relation to other FELS Test Methods. Final report to the Commission of the European Communities, str. 60. June 1990. |
|
(2) |
ASTM (1988) Standard Guide for Conducting Early Life-Stage Toxicity Tests with Fishes. American Society for Testing and Materials. E 1241-88. str. 26 |
|
(3) |
Brauhn J.L. and Schoettger R.A., (1975) Acquisition and Culture of Research Fish: Rainbow trout, Fathead minnows, Channel Catfish and Bluegills. str. 54, Ecological Research Series, EPA-660/3-75-011, Duluth, Minnesota. |
|
(4) |
Brungs W.A. and Jones B.R., (1977) Temperature Criteria for Freshwater Fish: Protocol and Procedures str. 128, Ecological Research Series EPA-600/3-77-061, Duluth, Minnesota. |
|
(5) |
Laale H.W., (1977) The Biology and Use of the Zebrafish (Brachydanio rerio) in Fisheries Research. A Literature Review. J. Biol. 10, str. 121-173. |
|
(6) |
Legault R. (1958) A Technique for Controlling the Time of Daily Spawning and Collecting Eggs of the Zebrafish, Brachydanio rerio (Hamilton-Buchanan) Copeia, 4, str. 328-330. |
|
(7) |
Dave G., Damgaard B., Grande M., Martelin J.E., Rosander B. and Viktor T., (1987) Ring Test of an Embryo-larval Toxicity Test with Zebrafish (Brachydanio rerio) Using Chromium and Zinc as Toxicants. Environmental Toxicology and Chemistry, 6, str. 61-71. |
|
(8) |
Birge J.W., Black J.A. and Westerman A.G., (1985) Short-term Fish and Amphibian Embryo-larval Tests for Determining the Effects of Toxicant Stress on Early Life Stages and Estimating Chronic Values for Single Compounds and Complex Effluents. Environmental Toxicology and Chemistry 4, str. 807-821. |
|
(9) |
Van Leeuwen C.J., Espeldoorn A. and Mol F. (1986) Aquatic Toxicological Aspects of Dithiocarbamates and Related Compounds. III. Embryolarval Studies with Rainbow Trout (Salmo gairdneri). J. Aquatic Toxicology, 9, str. 129-145. |
|
(10) |
Kirchen R.V. and W. R. West (1969) Teleostean Development. Carolina Tips 32(4): 1-4. Carolina Biological Supply Company. |
|
(11) |
Kirchen R.V. and W. R. West (1976) The Japanese Medaka. Its care and Development. Carolina Biological Supply Company, North Carolina. str. 36. |
|
(12) |
Dunnett C.W., (1955) A Multiple Comparisons Procedure for Comparing Several Treatments with Control. J. Amer. Statist. Assoc., 50, str. 1096-1121. |
|
(13) |
Dunnett C.W. (1964) New Tables for Multiple Comparisons with a Control. Biometrics, 20, str. 482-491. |
|
(14) |
Mc Clave J.T., Sullivan J.H. and Pearson J.G., (1980) Statistical Analysis of Fish Chronic Toxicity Test Data. Proceedings of 4th Aquatic Toxicology Symposium, ASTM, Philadelphia. |
|
(15) |
Van Leeuwen C.J., Adema D.M.M. and Hermes J., (1990) Quantitative Structure-Activity Relationships for Fish Early Life Stage Toxicity. Aquatic Toxicology, 16, str. 321-334. |
|
(16) |
Environment Canada., (1992) Toxicity Tests Using Early Life Stages of Salmonid Fish (Rainbow Trout, Coho Salmon or Atlantic Salmon). Biological Test Method Series. Report EPS 1/RM/28, December 1992, str. 81. |
|
(17) |
Dave G. and Xiu R., (1991) Toxicity of Mercury, Nickel, Lead and Cobalt to Embryos and Larvae of Zebrafish, Brachydanio rerio. Arch. of Environmental Contamination and Toxicology, 21, str. 126-134. |
|
(18) |
Meyer A., Bierman C.H. and Orti G., (1993) The phylogenetic position of the Zebrafish (Danio rerio), a model system in developmental biology — an invitation to the comperative methods. Proc. Royal Society of London, Series B, 252: 231-236. |
|
(19) |
Ghillebaert F., Chaillou C., Deschamps F. and Roubaud P., (1995) Toxic Effects, at Three pH Levels, of Two Reference Molecules on Common Carp Embryo. Ecotoxicology and Environmental Safety 32, str. 19-28. |
|
(20) |
US EPA, (1991) Guidelines for Culturing the Japanese Medaka, Oryzias latipes. EPA report EPA/600/3-91/064, Dec. 1991, EPA, Duluth. |
|
(21) |
US EPA, (1991) Guidelines for Conducting Early Life Stage Toxicity Tests with Japanese Medaka, (Oryzias latipes). EPA report EPA/600/3-91/063, Dec. 1991, EPA, Duluth. |
|
(22) |
De Graeve G.M., Cooney J.D., McIntyre D.O., Poccocic T.L., Reichenbach N.G., Dean J.H. and Marcus M.D., (1991) Validity in the performance of the seven-day Fathead minnow (Pimephales promelas) larval survival and growth test: an intra- and interlaboratory study. Environ. Tox. Chem. 10, str. 1189-1203. |
|
(23) |
Calow P., (1993) Handbook of Ecotoxicology, Blackwells, Oxford. Vol. 1, chapter 10: Methods for spawning, culturing and conducting toxicity tests with Early Life stages of Estuarine and Marine fish. |
|
(24) |
Balon E.K., (1985) Early life history of fishes: New developmental, ecological and evolutionary perspectives, Junk Publ., Dordrecht, str. 280. |
|
(25) |
Blaxter J.H.S., (1988) Pattern and variety in development, In: W.S. Hoar and D.J. Randall Eds., Fish Physiology, vol. XIA, Academic press, str. 1-58. |
Tablica 1.A
Preporučene riblje vrste za ispitivanje
|
SLATKOVODNE |
|
Oncorhynchus mykiss Kalifornijska pastrva (9)(16) |
|
Danio rerio Zebrica (7)(17)(18) |
|
Cyprinus caprio Šaran (8)(19) |
|
Oryzias latipes Medaka (20)(21) |
|
Pimephales promelas Debeloglava gaovica (8)(22) |
Tablica 1.B
Primjeri drugih dobro dokumentiranih vrsta koje su također korištene
|
SLATKOVODNE |
MORSKE |
|
Carassius auratus Zlatna ribica (8) |
Menidia peninsulae Tidewater silverside (23)(24)(25) |
|
Lepomis macrochirus Plavoškrga sunčanica (8) |
Clupea harengus Haringa (24)(25) |
|
Gadus morhua Bakalar (24)(25) |
|
|
Cyprinodon variegatus Sheepshead minnow (23)(24)(25) |
Dodatak 1.
SMJERNICE ZA PROVOĐENJE TOKSIKOLOŠKOG ISPITIVANJA NA EMBRIJIMA I MLAĐI SA ŽUMANJČANOM VREĆICOM ZEBRICE (BRACHIDANYIO RERIO)
UVOD
Zebrica potječe s obale Coromandel u Indiji, gdje nastanjuje brzace. To je rasprostranjena akvarijska riba iz porodice šarana i informacije o njezinom održavanju i uzgoju mogu se naći u standardnim priručnicima o tropskim ribama. O njezinoj biologiju i uporabi u ribarstvenim istraživanjima govori Laale (1).
Ova riba rijetko prelazi dužinu od 45 mm. Tijelo joj je cilindrično sa 7 – 9 tamnoplavih vodoravnih srebrenkastih pruga. Te se pruge protežu do repne i podrepne peraje. Leđa su joj maslinastozelena. Mužjaci su vitkiji od ženki. Kod ženki je srebrena boja izraženija i trbuh im je nadut, posebno prije mriještenja.
Odrasle ribe mogu podnijeti velike fluktuacije u temperaturi, pH i tvrdoći. Međutim, da bi se dobile zdrave ribe koje daju kvalitetna jaja, treba osigurati optimalne uvjete.
Kod mriještenja mužjak snubi ženku i nasrće na nju, a čim ona izbaci jaja, on ih oplođava. Jaja, koja su prozirna i neljepljiva, padaju na dno, gdje ih mogu pojesti roditelji. Na mriještenje utječe svjetlost. Ako je jutarnja svjetlost dostatna, ribe se obično mrijeste u ranim jutarnjim satima nakon svitanja.
Ženka može proizvesti serije od po nekoliko stotina jaja u tjednim razmacima.
UVJETI ZA RODITELJSKE RIBE, REPRODUKCIJU I RANE ŽIVOTNE STADIJE
Odabere se odgovarajući broj zdravih riba i drži u prikladnoj vodi (npr. Prilog 4.) najmanje dva tjedna prije planiranog mriještenja. Skupinu riba treba pustiti da se barem jedanput omrijesti prije nego što daju jaja koja će se koristiti za ispitivanje. Gustoća riba u tom razdoblju ne smije prijeći 1 gram ribe po litri. Ako se voda redovito mijenja odnosno ako se koriste sustavi za pročišćavanje, gustoća može biti i veća. Temperaturu u bazenima treba održavati na 25 ± 2 °C. Ribama treba osigurati raznovrsnu ishranu, koja se može sastojati npr. od odgovarajuće suhe industrijske hrane, živih novoizvaljenih artemija, trzalaca, dafnija, bijelih crvi (Enchytraeidae).
U nastavku su opisana dva postupka, koji su u praksi dali dostatne serije zdravih oplođenih jaja za provedbu ispitivanja:
|
i. |
8 ženki i 16 mužjaka stavi se u bazen s 50 litara vode za razrjeđivanje, zakloni od izravne svjetlosti i ostavi tako najmanje 48 sati, izbjegavajući svako uznemiravanje. U poslijepodnevnim satima na dan prije početka ispitivanja na dno se akvarija stavi podložak za polijeganje jaja. Podložak za polijeganje jaja sastoji se od okvira (od pleksi-stakla ili drugog prikladnog materijala) visine 5 – 7 cm na čiji je vrh pričvršćena gruba mreža 2 – 5 mm, dok se na dnu nalazi fina mreža 10 – 30 μm. Određeni broj „stabala za mriještenje”, koja se sastoje od nesukanog najlonskog užeta, pričvrsti se na grubu mrežu na okviru. Ribe se ostave u mraku 12 sati, nakon čega se uključi slabo svjetlo koje potiče mriještenje. Dva do četiri sata nakon mriještenja ukloni se podložak i skupe jaja. Podložak za polijeganje jaja sprečava ribe da pojedu jaja i istodobno olakšava skupljanje jaja. Skupina riba mora imati barem jedan mrijest prije mrijesta koji se koristi u ispitivanju. |
|
ii. |
5 do 10 mužjaka i ženki drži se pojedinačno najmanje dva tjedna prije predviđenog mriještenja. Nakon 5 – 10 dana trbusi ženki se napuhnu i njihove genitalne papile postanu vidljive. Mužjaci nemaju papile. Mriještenje se provodi u mrijesnim bazenima koji imaju lažno mrežasto dno (kao gore). Bazen se napuni vodom za razrjeđivanje, tako da dubina vode iznad mreže bude 5 – 10 cm. U bazen se stavi jedna ženka i dva mužjaka dan prije predviđenog mriještenja. Temperatura vode se postupno povisi za jedan stupanj iznad temperature aklimatizacije. Isključi se svjetlo i bazen ostavi što je moguće više u miru. Ujutro se uključi slabo svjetlo koje potiče mriještenje. Nakon dva do četiri sata ribe se uklone i skupe se jaja. Ako su potrebne veće serije jaja koje se ne mogu dobiti od jedne ženke, može se postaviti dovoljan broj paralelnih mrijesnih bazena. Bilježenjem pojedinačne reproduktivne uspješnosti ženki prije ispitivanja (veličina serije i kakvoća) mogu se za uzgoj odabrati ženke koje su reproduktivno najuspješnije. |
Jaja se prenose u ispitne posude pomoću staklenih cjevčica (čiji unutanji promjer ne smije biti manji od 4 mm) koje su opremljene fleksibilnom pumpicom. Količina vode koja se prenosi s jajima treba biti što manja. Jaja su teža od vode i propadaju kroz cjevčicu. Treba paziti da jaja (i ličinke) ne dođu u dodir sa zrakom. Mikroskopskim pregledom uzor(a)ka serije odnosno serija treba se uvjeriti da u prvim razvojnim stadijima nema nepravilnosti. Dezifinciranje jaja nije dopušteno.
Stopa smrtnosti jaja najviša je unutar prva 24 sata nakon oplodnje. U tom se razdoblju često može uočiti smrtnost 5 – 40 %. Do degeneracije jaja dolazi zbog neuspješne oplodnje ili grešaka u razvoju. Čini se da kakvoća serije jaja ovisi o ženki, budući da neke ženke stalno poliježu jaja dobre kakvoće, a druge nikada. Osim toga, brzina razvoja i stopa valjenja razlikuju se od serije do serije. Uspješno oplođena jaja i ličinke sa žumanjčanom vrećicom dobro preživljavaju, uglavnom iznad 90 %. Na 25 °C do valjenja dolazi tri do pet dana nakon oplodnje, a žumanjčana se vrećica apsorbira približno 13 dana nakon oplodnje.
Embrionalni razvoj su dobro definirali Hisaoka i Battle (2). Zahvaljujući prozirnosti jaja i ličinki može se pratiti razvoj riba i uočiti prisutnost malformacija. Neoplođena se jaja mogu razlikovati od oplođenih oko četiri sata nakon mriještenja (3). Za ovaj pregled jaja i ličinke treba staviti u ispitne posude male zapremnine i proučiti pod mikroskopom.
Ispitni uvjeti koji se odnose na rane životne stadije navedeni su u Dodatku 2. Optimalne vrijednosti pH i tvrdoće vode za razrjeđivanje su 7,8 odnosno 250 mg CaCO3/l.
IZRAČUNI I STATISTIKA
Preporučuje se pristup u dvije faze. Prvo se provede statistička analiza podataka o smrtnosti, razvojnim anomalijama i vremenu valjenja. Zatim se statistički ocijeni dužina tijela za koncentracije kod kojih nisu otkriveni štetni učinci niti na jedan od ovih parametara. Ovaj je pristup preporučljiv, budući da toksikant može selektivno ubijati manje ribe, odgoditi vrijeme valjenja i izazvati grube malformacije i tako dovesti do pristranosti u mjerenjima dužine. Nadalje, potrebno je izmjeriti približno isti broj riba u svakoj obradi kako bi se osigurala valjanost statistike ispitivanja.
ODREĐIVANJE LC50 I EC50
Izračuna se postotak preživjelih jaja i ličinki i ispravi za smrtnost u kontroli u skladu s Abbottovom formulom (4):
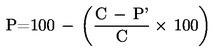
gdje je:
|
P |
= |
ispravljeni % preživljavanja |
|
P’ |
= |
% preživljavanja u ispitnoj koncentraciji |
|
C |
= |
% preživljavanja u kontroli |
Ako je to moguće, LC50 se određuje prikladnom metodom na kraju ispitivanja.
Ako se u statistiku EC50 žele uključiti morfološke anomalije, odgovarajuće se smjernice mogu pronaći kod Stephana (5).
PROCJENA LOEC-a I NOEC-a
Cilj ispitivanja jaja i mlađi sa žumanjčanom vrećicom je usporediti koncentracije s učinkom s kontrolom tj. odrediti LOEC. Stoga je potrebno primijeniti postupke višestruke usporedbe (6)(7)(8)(9)(10).
REFERENCE
|
(1) |
Laale H.W., (1977) The Biology and Use of the Zebrafish (Brachydanio rerio) in Fisheries Research. A Literature Review. J. Fish Biol. 10, str. 121-173. |
|
(2) |
Hisaoka K.K. and Battle H.I., (1958). The Normal Development Stages of the Zebrafish Brachydanio rerio (Hamilton-Buchanan) J. Morph., 102, str. 311. |
|
(3) |
Nagel R., (1986). Untersuchungen zur Eiproduktion beim Zebrabärbling (Brachydanio rerio Hamilton-Buchanan). Journal of Applied Ichthyology, 2, str. 173-181. |
|
(4) |
Finney D.J., (1971). Probit Analysis, 3rd ed., Cambridge University Press, Great Britain, str. 1-333. |
|
(5) |
Stephan C.E., (1982). Increasing the Usefulness of Acute Toxicity Tests. Aquatic Toxicology and Hazard Assessment: Fifth Conference, ASTM STP 766, J.G. Pearson, R.B. Foster and W.E. Bishop, Eds., American Society for Testing and Materials, str. 69-81. |
|
(6) |
Dunnett C.W. (1955). A Multiple Comparisons Procedure for Comparing Several Treatments with a Control. J. Amer. Statist. Assoc., 50, str. 1096-1121. |
|
(7) |
Dunnett C.W., (1964) New Tables for Multiple Comparisons with a Control. Biometrics, 20, str. 482-491. |
|
(8) |
Williams D.A., (1971). A Test for Differences Between Treatment Means when Several Dose Levels are Compared with a Zero Dose Control. Biometrics, 27, str. 103-117. |
|
(9) |
Williams D.A., (1972). The Comparison of Several Dose Levels with a Zero Dose Control. Biometrics 28, str. 519-531. |
|
(10) |
Sokal R.R. and Rohlf F.J., (1981). Biometry, the Principles and Practice of Statistics in Biological Research, W.H. Freeman and Co., San Francisco. |
Dodatak 2.
ISPITNI UVJETI, TRAJANJE I KRITERIJI PREŽIVLJAVANJA ZA PREPORUČENE VRSTE
|
Vrste |
Temp. (°C) |
Salinitet (0/00) |
Fotoperiod (sati) |
Trajanje stadija (dani) |
Tipično trajanje ispitivanja |
Preživljavanje u kontroli (najmanje %) |
||
|
Embrij |
Žumanjčana vrećica |
Uspješnost valjenja |
Nakon valjenja |
|||||
|
SLATKOVODNE |
||||||||
|
Brachydanio rerio Zebrica |
25 ± 1 |
— |
12 – 16 |
3 – 5 |
8 – 10 |
Što prije nakon oplodnje (rani stadij gastrule) do 5 dana nakon valjenja (8 – 10 dana) |
80 |
90 |
|
Oncorhynchus mykiss Kalifornijska pastrva |
10 ± 1 (22) 12 ± 1 (23) |
— |
0 (24) |
30 – 35 |
25 – 30 |
Što prije nakon oplodnje (rani stadij gastrule) do 20 dana nakon valjenja (50 – 55 dana) |
66 |
70 |
|
Cyprinus caprio Šaran |
21 – 25 |
— |
12 – 16 |
5 |
> 4 |
Što prije nakon oplodnje (rani stadij gastrule) do 4 dana nakon valjenja (8 – 9 dana) |
80 |
75 |
|
Oryzias latipes Medaka |
24 ± 1 (22) 23 ± 1 (23) |
— |
12 – 16 |
8 – 11 |
4 – 8 |
Što prije nakon oplodnje (rani stadij gastrule) do 5 dana nakon valjenja (13 – 16 dana) |
80 |
80 |
|
Pimephales promelas Debeloglava gaovica |
25 ± 2 |
— |
16 |
4 – 5 |
5 |
Što prije nakon oplodnje (rani stadij gastrule) do 4 dana nakon valjenja (8 – 9 dana) |
60 |
70 |
Dodatak 3.
Ispitni uvjeti, trajanje i kriteriji preživljavanja za ostale dobro dokumentirane vrste
|
Vrste |
Temp. (°C) |
Salinitet (0/00) |
Fotoperiod (sati) |
Trajanje stadija (dani) |
Tipično trajanje ispitivanja na embrijima i mlađi sa žumanjčanom vrećicom |
Preživljavanje u kontroli (najmanje %) |
||
|
|
|
|
|
Embrij |
Žumanjčana vrećica |
Uspješnost valjenja |
Nakon valjenja |
|
|
SLATKOVODNE |
||||||||
|
Carassius auratus Zlatna ribica |
24 ± 1 |
— |
— |
3 – 4 |
> 4 |
Što prije nakon oplodnje (rani stadij gastrule) do 4 dana nakon valjenja (7 dana) |
— |
80 |
|
Lepomis macrochirus Plavoškrga sunčanica |
21 ± 1 |
— |
16 |
3 |
> 4 |
Što prije nakon oplodnje (rani stadij gastrule) do 4 dana nakon valjenja (7 dana) |
— |
75 |
|
MORSKE |
||||||||
|
Menidia peninsulae Tidewater silverside |
22 – 25 |
15 – 22 |
12 |
1,5 |
10 |
Što prije nakon oplodnje (rani stadij gastrule) do 5 dana nakon valjenja (6 – 7 dana) |
80 |
60 |
|
Clupea harengus Haringa |
10 ± 1 |
8 – 15 |
12 |
20 – 25 |
3 – 5 |
Što prije nakon oplodnje (rani stadij gastrule) do 3 dana nakon valjenja (23 – 27 dana) |
60 |
80 |
|
Gadus morhua Bakalar |
5 ± 1 |
5 – 30 |
12 |
14 – 16 |
3 – 5 |
Što prije nakon oplodnje (rani stadij gastrule) do 3 dana nakon valjenja (18 dana) |
60 |
80 |
|
Cyprinodon variegatus Sheepshead minnow |
25 ± 21 |
15 – 30 |
12 |
— |
— |
Što prije nakon oplodnje (rani stadij gastrule) do 4/7 dana nakon valjenja (28 dana) |
> 75 |
80 |
Dodatak 4.
NEKA KEMIJSKA SVOJSTVA PRIHVATLJIVE VODE ZA RAZRJEĐIVANJE
|
Tvar |
Koncentracije |
|
Lebdeće čestice |
< 20 mg/l |
|
Ukupni organski ugljik |
< 2 mg/l |
|
Neionizirani amonijak |
< 1 μg/l |
|
Rezidualni klor |
< 10 μg/l |
|
Ukupni organofosforni pesticidi |
< 50 ng/l |
|
Ukupni organoklorni pesticidi plus poliklorirani bifenili |
< 50 ng/l |
|
Ukupni organski klor |
< 25 ng/l |
C.16. MEDONOSNE PČELE – ISPITIVANJE AKUTNE ORALNE TOKSIČNOSTI
1. METODA
Ova metoda ispitivanja akutne toksičnosti odgovara smjernici OECD TG 213 (1998.).
1.1. UVOD
Ovaj toksikološki test je laboratorijska metoda namijenjena ocjenjivanju akutne oralne toksičnosti sredstava za zaštitu bilja i drugih kemikalija za odrasle medonosne pčele radilice.
Prilikom ocjenjivanja toksičnih svojstava tvari ponekad je potrebno odrediti akutnu oralnu toksičnost na medonosnim pčelama, npr. kad je vjerojatno izlaganje pčela kemikaliji. Test akutne oralne toksičnosti provodi se kako bi se odredila svojstvena toksičnost pesticida i drugih kemikalija za pčele. Na temelju rezultata ovog testa treba definirati potrebu za daljnjim ocjenjivanjem. Ova se metoda može koristiti posebno u stupnjevitim programima za ocjenjivanje opasnosti pesticida za pčele, koji se temelje na postupnom prijelazu s laboratorijskih toksikoloških ispitivanja na poluterenske i terenske pokuse (1). Pesticidi se mogu ispitivati kao aktivne tvari (a.s.) ili kao formulirani proizvodi.
Za provjeru osjetljivosti pčela i preciznosti ispitnog postupka treba koristiti toksični standard.
1.2. DEFINICIJE
Akutna oralna toksičnost: štetni učinak koji nastupa unutar najviše 96 sati nakon oralne primjene jedne doze ispitivane tvari.
Doza: unesena količina ispitivane tvari. Doza se izražava kao masa (μg) ispitivane tvari po ispitnoj životinji (μg/pčela). Stvarna doza za svaku pojedinu pčelu ne može se izračunati budući da se pčele hrane skupno, ali se može procijeniti prosječna doza (ukupno unesena ispitivana tvar/broj ispitivanih pčela u jednom kavezu).
Oralni LD50 (medijan letalne doze): statistički izvedena pojedinačna doza tvari koja može izazvati smrt 50 % životinja kod primjene oralnim putem. Vrijednost LD50 izražava se u μg ispitivane tvari po pčeli. Kod pesticida ispitivana tvar može biti aktivna tvar (a.s.) ili formulirani proizvod koji sadrži jednu ili više aktivnih tvari.
Smrtnost: životinja se bilježi kao mrtva kad je potpuno nepomična.
1.3. NAČELO ISPITNE METODE
Odrasle medonosne pčele radilice (Apis mellifera) izlažu se nizu doza ispitivane tvari dispergirane u šećernoj otopini. Pčele se zatim hrane istom hranom bez ispitivane tvari. Smrtnost se bilježi dnevno tijekom najmanje 48 sati i uspoređuje s kontrolnim vrijednostima. Ako se stopa smrtnosti poveća između 24 i 48 sati, a kontrolna smrtnost ostane na prihvaćenoj razini tj. ≤ 10 %, vrijeme ispitivanja treba produžiti na najviše 96 sati. Rezultati se analiziraju kako bi se izračunao LD50 nakon 24 i 48 sati te, u slučaju produžetka istraživanja, nakon 72 i 96 sati.
1.4. VALJANOST ISPITIVANJA
Da bi ispitivanje bilo valjano, treba zadovoljiti sljedeće uvjete:
|
— |
prosječna smrtnost u ukupnom broju kontrola na kraju ispitivanja ne smije biti viša od 10 %, |
|
— |
LD50 toksičnog standarda odgovara utvrđenom području. |
1.5. OPIS ISPITNE METODE
1.5.1. Skupljanje pčela
Treba koristiti mlade odrasle pčele radilice iste pasmine tj. pčele iste dobi, stanja uhranjenosti itd. Pčele trebaju potjecati iz dobro hranjenih, zdravih zajednica s maticom, u kojima nema pojava bolesti (u mjeri u kojoj je to moguće) i čija je povijest i fiziološki status poznat. Treba ih skupiti u jutro uporabe ili večer prije ispitivanja i držati u ispitnim uvjetima do sljedećeg dana. Prikladne su pčele skupljene s okvira bez legla. Skupljanje u rano proljeće i kasnu jesen treba izbjegavati budući da pčele u tom razdoblju imaju promijenjenu fiziologiju. Ako se ispitivanja moraju provoditi u rano proljeće ili kasnu jesen, pčele se mogu pustiti da se izlegu u inkubatoru i jedan tjedan uzgajati na „pčelinjoj hrani” (pelud prikupljena iz saća) i šećernoj otopini. Pčele liječene kemikalijama kao što su antibiotici, sredstva protiv varooze itd. ne smiju se koristiti u toksikološkim ispitivanjima četiri tjedna nakon prestanka zadnjeg liječenja.
1.5.2. Uvjeti smještaja i hranjenja
Koriste se dobro zračeni kavezi koji se lako čiste. Mogu se koristiti svi prikladni materijali npr. nehrđajući čelik, žičana mreža, plastični ili jednokratni drveni kavezi itd. Poželjno je koristiti skupine od 10 pčela po kavezu. Veličina ispitnih kaveza treba biti prilagođena broju pčela tj. treba im osiguravati dovoljno prostora.
Pčele se u pokusnoj prostoriji drže u mraku na temperaturi od 25 ± 2 °C. Za vrijeme ukupnog trajanja ispitivanja treba bilježiti relativnu vlažnost, u pravilu oko 50 – 70 %. Svi postupci, uključujući obradu i promatranja, mogu se provoditi na (dnevnom) svjetlu. Kao hrana se koristi šećerna otopina u vodi s konačnom koncentracijom 500 g/l (50 % w/v). Nakon primjene ispitnih doza hranu treba davati ad libitum. Sustav hranjenja treba omogućivati bilježenje unosa hrane za svaki kavez (vidjeti odjeljak 1.6.3.1.). Može se koristiti staklena cjevčica (oko 50 mm dužine i 10 mm širine čiji je otvoreni kraj sužen na oko 2 mm promjera).
1.5.3. Priprema pčela
Skupljene se pčele nasumično rasporede u ispitne kaveze, koji su nasumično smješteni u pokusnoj prostoriji.
Pčele se mogu izgladnjivati najviše 2 sata prije početka ispitivanja. Preporučuje se da se pčelama uskrati hrana prije obrade kako bi sve pčele imale jednak crijevni sadržaj na početku ispitivanja. Prije početka ispitivanja moribundne pčele treba odbaciti i zamijeniti zdravim pčelama.
1.5.4. Priprema doza
Ako je ispitivana tvar mješljiva s vodom, ona se može izravno dispergirati u 50 %-tnoj šećernoj otopini. U slučaju tehničkih proizvoda i tvari koje su slabo topljive u vodi mogu se koristiti nosači, kao što je organsko otapalo, emulgatori ili dispergenti niske toksičnosti za pčele (npr. aceton, dimetilformamid, dimetilsulfoksid). Koncentracija nosača ovisi o topljivosti ispitivane tvari i treba biti jednaka u svim ispitnim koncentracijama. Ipak, koncentracija nosača od 1 % je općenito primjerena i ne bi se smjela prekoračiti.
Treba pripremiti odgovarajuće kontrolne otopine, tj. ako se za otapanje ispitivane tvari koristi otapalo ili dispergent, treba koristiti dvije odvojene kontrolne skupine: otopina u vodi i šećerna otopina s otapalom/nosačem u koncentraciji koja se koristi u otopinama za doziranje.
1.6. POSTUPAK
1.6.1. Ispitne i kontrolne skupine
Broj doza i ponavljanja treba zadovoljavati statističke zahtjeve za određivanje LD50 s granicama pouzdanosti 95 %. U pravilu je za test potrebno pet doza u geometrijskom nizu s faktorom do najviše 2,2, koje obuvaćaju područje LD50. Ipak, faktor razrjeđenja i broj koncentracija za doziranje treba odrediti s obzirom na nagib krivulje toksičnosti (doza – smrtnost) i vodeći računa o statističkoj metodi odabranoj za analizu rezultata. Ispitivanje za određivanje raspona omogućuje odabir odgovarajućih koncentracija za doziranje.
Svakoj ispitnoj koncentraciji treba izložiti najmanje tri paralelne ispitne skupine od po 10 pčela. Uz ispitni niz potrebne su još najmanje tri kontrolne serije, svaka po 10 pčela. Za primijenjena otapala/nosače treba predvidjeti dodatne kontrolne serije (vidjeti odjeljak 1.5.4).
1.6.2. Toksični standard
U ispitne nizove treba uključiti toksični standard. Treba odabrati barem tri doze koje obuhvaćaju očekivanu vrijednost LD50. Potrebna su najmanje tri paralelna kaveza s po 10 pčela po ispitnoj dozi. Poželjno je da se kao toksični standard koristi dimetoat, čiji se utvrđeni oralni LD50 za 24 sata kreće u području 0,10 – 0,35 μg a.s. po pčeli (2). Ipak, prihvatljivi su i drugi toksični standardi ako se može osigurati dovoljno podataka za provjeru očekivanog odgovora na dozu (npr. paration).
1.6.3. Izlaganje
1.6.3.1. Primjena doza
Svakoj ispitnoj skupini pčela treba dati 100 – 200 μl 50 %-tne šećerne otopine u vodi koja sadrži odgovarajuću koncentraciju ispitivane tvari. Kod proizvoda niske topljivosti, niske toksičnosti ili niske koncentracije u formulaciji potrebna je veća količina jer se moraju koristiti veći udjeli u šećernoj otopini. Treba pratiti količinu unosa obrađene hrane po skupinama. Kad se hrana potroši (obično unutar 3 – 4 sata) hranilica se uklanja iz kaveza i zamjenjuje hranilicom koja sadrži samo šećernu otopinu. Šećerne otopine se zatim daju ad libitum. Kod nekih se spojeva kod većih koncentracija može dogoditi da zbog odbijanja ispitne doze dođe do slabog unosa hrane ili potpunog izostanka unosa. Nakon najviše 6 sati nepotrošenu obrađenu hranu treba zamijeniti čistom šećernom otopinom. Treba procijeniti unesenu količinu obrađene hrane (npr. mjerenje volumena/mase preostale obrađene hrane).
1.6.3.2. Trajanje
Ispitivanje po mogućnosti treba trajati 48 sati nakon što se ispitna otopina zamijeni čistom šećernom otopinom. Ako smrtnost nastavi rasti više od 10 % nakon prva 24 sata, vrijeme ispitivanje treba produžiti do najviše 96 sati, pod uvjetom da kontrolna smrtnost nije viša od 10 %.
1.6.4. Promatranja
Smrtnost se bilježi 4 sata nakon početka ispitivanja i zatim nakon 24 i 48 sati (tj. nakon davanja doze). Ako je potrebno duže razdoblje promatranja, ocjenjivanje se nastavlja u razmacima od 24 sati do najviše 96 sati, pod uvjetom da kontrolna smrtnost ne prelazi 10 %.
Treba procijeniti količinu unosa hrane po skupinama. Usporedbom količine unosa obrađene i neobrađene hrane unutar predviđenih 6 sati mogu se dobiti informacije o ukusnosti obrađene hrane.
Tijekom razdoblja ispitivanja treba bilježiti sva uočena neuobičajena ponašanja.
1.6.5. Granično ispitivanje
U pojedinim se slučajevima (npr. kad se očekuje da ispitivana tvar ima nisku toksičnost) može provesti granično ispitivanje uz primjenu 100 μg a.s. po pčeli kako bi se dokazalo da je LD50 viši od te vrijednosti. Treba primijeniti isti postupak, uključujući tri paralelne ispitne skupine po ispitnoj dozi, relevantne kontrole, procjenu količine unosa obrađene hrane i korištenje toksičnog standarda. Ako se pojavi smrtnost, treba provesti potpuno istraživanje. Treba zabilježiti sve uočene subletalne učinke (vidjeti odjeljak 1.6.4.).
2. PODACI I IZVJEŠĆIVANJE
2.1. PODACI
Podatke treba sažeto prikazati u tabličnom obliku, navodeći za svaku ispitnu i kontrolnu skupinu kao i skupinu toksičnog standarda broj pčela i smrtnost u svakom vremenu promatranja te broj pčela promijenjenog ponašanja. Podaci o smrtnosti analiziraju se prikladnim statističkim metodama (npr. analiza vjerojatnosti, pomični prosjek, binomna vjerojatnost) (3)(4). Izrade se krivulje doza-odgovor u svakom preporučenom vremenu promatranja i izračunaju nagibi krivulja te medijan letalnih doza (LD50) s granicama pouzdanosti 95 %. Ispravci s obzirom na kontrolnu smrtnost mogu se učiniti pomoću Abbottove korekcije (4)(5). Ako obrađena hrana nije u cijelosti potrošena, treba odrediti unesenu dozu ispitivane tvari po skupinama. LD50 treba izraziti u μg ispitivane tvari po pčeli.
2.2. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora sadržavati sljedeće informacije:
2.2.1. Ispitivana tvar:
|
— |
fizikalno stanje i relevantna fizikalno-kemijska svojstva (npr. stabilnost u vodi, tlak pare), |
|
— |
podaci za identifikaciju kemikalije, uključujući strukturnu formulu, čistoću (tj. za pesticide: identitet i koncentraciju aktivne(-ih) tvari). |
2.2.2. Ispitna vrsta:
|
— |
znanstveni naziv, pasmina, približna dob (u tjednima), način skupljanja, datum skupljanja, |
|
— |
informacije o zajednicama iz kojih potječu ispitne pčele, uključujući zdravstveno stanje, eventualne bolesti odraslih i prethodne obrade itd. |
2.2.3. Ispitni uvjeti
|
— |
temperatura i relativna vlažnost pokusne prostorije, |
|
— |
uvjeti smještaja, uključujući vrstu, veličinu i materijal kaveza, |
|
— |
način pripreme radnih i ispitnih otopina (ako se koristi otapalo, otapalo i koncentracija), |
|
— |
plan ispitivanja, npr. broj i ispitne koncentracije, broj kontrola; za svaku ispitnu koncentraciju i kontrolu: broj paralelnih kaveza i broj pčela po kavezu, |
|
— |
datum ispitivanja. |
2.3.4. Rezultati:
|
— |
rezultati preliminarnog istraživanja za određivanje raspona, ako se provodi, |
|
— |
sirovi podaci: smrtnost pri svakoj ispitanoj dozi u svakom vremenu promatranja, |
|
— |
graf krivulja doza-odgovor na kraju ispitivanja, |
|
— |
vrijednosti LD50 s granicama pouzdanosti 95 % u svakom preporučenom vremenu promatranja, za ispitivanu tvar i toksični standard, |
|
— |
statistički postupci primijenjeni za određivanje LD50, |
|
— |
smrtnost u kontrolama, |
|
— |
drugi zapaženi ili izmjereni biološki učinci npr. neuobičajeno ponašanje pčela (uključujući odbijanje ispitne doze), količina unosa hrane u obrađenim i neobrađenim skupinama, |
|
— |
sva odstupanja od ovdje opisanih ispitnih postupaka i sve druge relevantne informacije. |
3. REFERENCE
|
(1) |
EPPO/Council of Europe (1993) Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Products – Honeybees. EPPO bulletin, vol. 23, N.1, 151-165. March 1993. |
|
(2) |
Gough, H. J., McIndoe, E.C., Lewis, G.B., (1994) The use of dimethoate as a reference compound in laboratory acute toxicity tests on honeybees (Apis mellifera L.) 1981-1992. Journal of Apicultural Research, 22, str. 119-125. |
|
(3) |
Litchfield, J.T. and Wilcoxon, F., (1949) A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, str. 99-113. |
|
(4) |
Finney, D.J., (1971) Probit Analysis. 3rd ed., Cambridge, London and New-York. |
|
(5) |
Abbott, W.S., (1925) A method for computing the effectiveness of an insecticide. Jour. Econ. Entomol., 18, str. 265-267. |
C.17. MEDONOSNE PČELE – ISPITIVANJE AKUTNE KONTAKTNE TOKSIČNOSTI
1. METODA
Ova metoda ispitivanja akutne toksičnosti odgovara smjernici OECD TG 214 (1998.).
1.1. UVOD
Ovaj toksikološki test je laboratorijska metoda namijenjena ocjenjivanju akutne kontaktne toksičnosti sredstava za zaštitu bilja i drugih kemikalija za odrasle medonosne pčele radilice.
Prilikom ocjenjivanja toksičnih svojstava tvari ponekad je potrebno odrediti akutnu kontaktnu toksičnost kod medonosnih pčela, npr. kad je vjerojatno izlaganje pčela kemikaliji. Test akutne kontaktne toksičnosti provodi se kako bi se odredila svojstvena toksičnost pesticida i drugih kemikalija za pčele. Na temelju rezultata ovog testa treba definirati potrebu za daljnjim ocjenjivanjem. Ova se metoda može koristiti posebno u stupnjevitim programima za ocjenjivanje opasnosti pesticida za pčele, koji se temelje na postupnom prijelazu s laboratorijskih toksikoloških ispitivanja na poluterenske i terenske pokuse (1). Pesticidi se mogu ispitivati kao aktivne tvari (a.s.) ili kao formulirani proizvodi.
Za provjeru osjetljivosti pčela i preciznosti ispitnog postupka treba koristiti toksični standard.
1.2. DEFINICIJE
Akutna kontaktna toksičnost: štetni učinci koji nastupaju unutar najviše 96 sati nakon topikalne primjene jedne doze tvari.
Doza: primijenjena količina ispitivane tvari. Doza se izražava kao masa (μg) ispitivane tvari po ispitnoj životinji (μg/pčela).
Kontaktni LD50 (medijan letalne doze): statistički izvedena pojedinačna doza tvari koja može izazvati smrt 50 % životinja kod kontaktne primjene. Vrijednost LD50 izražava se u μg ispitivane tvari po pčeli. Kod pesticida ispitivana tvar može biti aktivna tvar (a.s.) ili formulirani proizvod koji sadrži jednu ili više aktivnih tvari.
Smrtnost: životinja se bilježi kao mrtva kad je potpuno nepomična.
1.3. NAČELO ISPITNE METODE
Odrasle medonosne pčele radilice (Apis mellifera) izlažu se nizu doza ispitivane tvari otopljene u odgovarajućem nosaču izravnim nanošenjem na prsni koš (kapljice). Ispitivanje traje 48 sati. Ako se stopa smrtnosti povećava između 24. i 48. sata, a kontrolna smrtnost ostane na prihvaćenoj razini tj. ≤ 10 %, vrijeme ispitivanja treba produžiti na najviše 96 sati. Smrtnost se bilježi dnevno i uspoređuje s kontrolnim vrijednostima. Rezultati se analiziraju kako bi se izračunao LD50 nakon 24 i 48 sati te, u slučaju produžetka istraživanja, nakon 72 i 96 sati.
1.4. VALJANOST ISPITIVANJA
Da bi ispitivanje bilo valjano, treba zadovoljiti sljedeće uvjete:
|
— |
prosječna smrtnost u ukupnom broju kontrola na kraju ispitivanja ne smije biti viša od 10 %, |
|
— |
LD50 toksičnog standarda odgovara utvrđenom području. |
1.5. OPIS ISPITNE METODE
1.5.1. Skupljanje pčela
Treba koristiti mlade odrasle pčele radilice tj. pčele iste dobi, stanja uhranjenosti, pasmine itd. Pčele trebaju potjecati iz dobro hranjenih, zdravih zajednica s maticom, u kojima nema pojava bolesti (u mjeri u kojoj je to moguće) i čija je povijest i fiziološki status poznat. Treba ih skupiti u jutro uporabe ili večer prije ispitivanja i držati u ispitnim uvjetima do sljedećeg dana. Prikladne su pčele skupljene s okvira bez legla. Skupljanje u rano proljeće i kasnu jesen treba izbjegavati budući da pčele u tom razdoblju imaju promijenjenu fiziologiju. Ako se ispitivanja moraju provoditi u rano proljeće ili kasnu jesen, pčele se mogu pustiti da se izlegu i jedan tjedan uzgajati na „pčelinjoj hrani” (pelud prikupljena iz saća) i šećernoj otopini. Pčele liječene kemikalijama kao što su antibiotici, sredstva protiv varooze itd. ne smiju se koristiti u toksikološkim ispitivanjima četiri tjedna nakon prestanka zadnjeg liječenja.
1.5.2. Uvjeti smještaja i hranjenja
Koriste se dobro zračeni kavezi koji se lako čiste. Mogu se koristiti svi prikladni materijali npr. nehrđajući čelik, žičana mreža, plastični, jednokratni drveni kavezi itd. Veličina ispitnih kaveza treba biti prilagođena broju pčela tj. treba im osiguravati dovoljno prostora. Poželjno je koristiti skupine od 10 pčela po kavezu.
Pčele se u pokusnoj prostoriji drže u mraku na temperaturi od 25 ± 2 °C. Za vrijeme ukupnog trajanja ispitivanja treba bilježiti relativnu vlažnost, u pravilu oko 50 – 70 %. Svi postupci, uključujući obradu i promatranje, mogu se provoditi na (dnevnom) svjetlu. Kao hrana se koristi šećerna otopina u vodi s konačnom koncentracijom 500 g/l (50 % w/v), koju treba davati ad libitum tijekom razdoblja ispitivanja putem hranilice za pčele. To može biti staklena cjevčica (približno 50 mm dužine i 10 mm širine čiji je otvoreni kraj sužen na oko 2 mm promjera).
1.5.3. Priprema pčela
Skupljene pčele se prije primjene ispitivane tvari mogu anestetizirati ugljikovim dioksidom ili dušikom. Količinu anestetika i vrijeme izlaganja treba svesti na najmanju moguću mjeru. Prije početka ispitivanja moribundne pčele treba odbaciti i zamijeniti zdravim pčelama.
1.5.4. Priprema doza
Ispitivana se tvar primjenjuje kao otopina u nosaču tj. organskom otapalu ili vodenoj otopini sa sredstvom za vlaženje. Poželjno je da se kao organsko otapalo koristi aceton, ali mogu se koristiti i druga organska otapala niske toksičnosti za pčele (npr. dimetilformamid, dimetilsulfoksid). U slučaju formuliranih proizvoda dispergiranih u vodi i jako polarnih organskih tvari koje nisu topljive u organskim otapalima, primjena otopina može se olakšati pripremom u slaboj otopini komercijalnog sredstva za vlaženje (npr. Agral, Cittowett, Lubrol, Triton, Tween).
Treba pripremiti odgovarajuće kontrolne otopine tj. ako se za otapanje ispitivane tvari koristi otapalo ili dispergent, treba koristiti dvije odvojene kontrolne skupine, jednu obrađenu vodom i jednu obrađenu otapalom/dispergentom.
1.6. POSTUPAK
1.6.1. Ispitne i kontrolne skupine
Broj doza i ponavljanja treba zadovoljavati statističke zahtjeve za određivanje LD50 s granicama pouzdanosti 95 %. U pravilu je za test potrebno pet doza u geometrijskom nizu s faktorom do najviše 2,2, koje obuvaćaju područje LD50. Ipak, broj doza treba odrediti s obzirom na nagib krivulje toksičnosti (doza – smrtnost) i vodeći računa o statističkoj metodi odabranoj za analizu rezultata. Ispitivanje za određivanje raspona omogućuje odabir odgovarajućih doza.
Svakom ispitnom koncentracijom treba dozirati najmanje tri paralelne ispitne skupine od po 10 pčela.
Uz ispitni niz potrebne su još najmanje tri kontrolne serije, svaka po 10 pčela. Ako se koristi organsko otapalo ili sredstvo za vlaženje, treba uvesti tri dodatne kontrolne serije s po 10 pčela za otapalo odnosno sredstvo za vlaženje.
1.6.2. Toksični standard
U ispitne nizove treba uključiti toksični standard. Treba odabrati barem tri doze koje obuhvaćaju očekivanu vrijednost LD50. Potrebna su najmanje tri paralelna kaveza s po 10 pčela po ispitnoj dozi. Poželjno je da se kao toksični standard koristi dimetoat, čiji se utvrđeni oralni LD50 za 24 sata kreće u području 0,10 – 0,30 μg a.s. po pčeli (2). Ipak, prihvatljivi su i drugi toksični standardi ako se može osigurati dovoljno podataka za provjeru očekivanog odgovora na dozu (npr. paration).
1.6.3. Izlaganje
1.6.3.1. Primjena doza
Anestetizirane se pčele obrađuju pojedinačno topikalnom primjenom. Pčele se nasumično raspoređuju po ispitnim dozama i kontrolama. 1 μl otopine koja sadrži odgovarajuću koncentraciju ispitivane tvari treba primijeniti na stražnju stranu prsnog koša svake pčele pomoću mikroaplikatora. U opravdanom se slučaju mogu koristiti i drugi volumeni. Nakon toga se pčele rasporede po ispitnim kavezima i daje im se šećerna otopina.
1.6.3.2. Trajanje
Ispitivanje po mogućnosti traje 48 sati. Ako se između 24. i 48. sata smrtnost poveća za više od 10 %, vrijeme ispitivanja treba produžiti do najviše 96 sati, pod uvjetom da kontrolna smrtnost nije viša od 10 %.
1.6.4. Promatranja
Smrtnost se bilježi 4 sata nakon doziranja i zatim nakon 24 i 48 sati. Ako je potrebno duže razdoblje promatranja, ocjenjivanje se nastavlja u razmacima od 24 sati do najviše 96 sati, pod uvjetom da kontrolna smrtnost ne prelazi 10 %.
Tijekom razdoblja ispitivanja treba bilježiti sva uočena neuobičajena ponašanja.
1.6.5. Granično ispitivanje
U pojedinim se slučajevima (npr. kad se očekuje da ispitivana tvar ima nisku toksičnost) može provesti granično ispitivanje uz primjenu 100 μg a.s. po pčeli kako bi se dokazalo da je LD50 viši od te vrijednosti. Treba primijeniti isti postupak, uključujući tri paralelne ispitne skupine po ispitnoj dozi, relevantne kontrole i korištenje toksičnog standarda. Ako se pojavi smrtnost, treba provesti potpuno istraživanje. Treba zabilježiti sve uočene subletalne učinke (vidjeti odjeljak 1.6.4.).
2. PODACI I IZVJEŠĆIVANJE
2.1. PODACI
Podatke treba sažeto prikazati u tabličnom obliku, navodeći za svaku ispitnu i kontrolnu skupinu kao i skupinu toksičnog standarda broj pčela i smrtnost u svakom vremenu promatranja te broj pčela promijenjenog ponašanja. Podaci o smrtnosti analiziraju se prikladnim statističkim metodama (npr. analiza vjerojatnosti, pomični prosjek, binomna vjerojatnost) (3)(4). Izrade se krivulje doza-odgovor u svakom preporučenom vremenu promatranja (tj. 24 sata, 48 sati i, prema potrebi, 72 i 96 sati) i izračunaju nagibi krivulja te medijan letalnih doza (LD50) s granicama pouzdanosti 95 %. Ispravci s obzirom na kontrolnu smrtnost mogu se učiniti pomoću Abbottove korekcije (4)(5). LD50 treba izraziti u μg ispitivane tvari po pčeli.
2.2. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora sadržavati sljedeće informacije:
2.2.1. Ispitivana tvar:
|
— |
fizikalno stanje i relevantna fizikalno-kemijska svojstva (npr. stabilnost u vodi, tlak pare), |
|
— |
podaci za identifikaciju kemikalije, uključujući strukturnu formulu, čistoću (tj. za pesticide: identitet i koncentraciju aktivne(-ih) tvari). |
2.2.2. Ispitna vrsta:
|
— |
znanstveni naziv, pasmina, približna dob (u tjednima), način skupljanja, datum skupljanja, |
|
— |
informacije o zajednicama iz kojih potječu ispitne pčele, uključujući zdravstveno stanje, eventualne bolesti odraslih i prethodne obrade itd. |
2.2.3. Ispitni uvjeti
|
— |
temperatura i relativna vlažnost pokusne prostorije, |
|
— |
uvjeti smještaja, uključujući vrstu, veličinu i materijal kaveza, |
|
— |
način primjene ispitivane tvari npr. otapalo nosač, volumen ispitne otopine, primijenjeni anestetici, |
|
— |
plan ispitivanja, npr. broj i ispitne doze, broj kontrola; za svaku ispitnu dozu i kontrolu: broj paralelnih kaveza i broj pčela po kavezu, |
|
— |
datum ispitivanja. |
2.2.4. Rezultati:
|
— |
rezultati preliminarnog istraživanja za određivanje raspona, ako se provodi, |
|
— |
sirovi podaci: smrtnost pri svakoj ispitanoj koncentraciji u svakom vremenu promatranja, |
|
— |
graf krivulja doza-odgovor na kraju ispitivanja, |
|
— |
vrijednosti LD50 s granicama pouzdanosti 95 % u svakom preporučenom vremenu promatranja, za ispitivanu tvar i toksični standard; |
|
— |
statistički postupci primijenjeni za određivanje LD50, |
|
— |
smrtnost u kontrolama, |
|
— |
drugi zapaženi ili izmjereni biološki učinci i svi neuobičajeni odgovori pčela, |
|
— |
sva odstupanja od ovdje opisanih ispitnih postupaka i sve druge relevantne informacije. |
3. REFERENCE
|
(1) |
EPPO/Council of Europe (1993) Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Products – Honeybees. EPPO bulletin, vol. 23, N.1, str. 151-165. March, 1993. |
|
(2) |
Gough, H. J., McIndoe, E.C., Lewis, G.B., (1994) The use of dimethoate as a reference compound in laboratory acute toxicity tests on honeybees (Apis mellifera L.), 1981-1992. Journal of Apicultural Research 22, str. 119-125. |
|
(3) |
Litchfield, J.T. and Wilcoxon, F., (1949) A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, str. 99-113. |
|
(4) |
Finney, D.J., (1971) Probit Analysis. 3rd ed., Cambridge, London and New-York. |
|
(5) |
Abbott, W.S., (1925) A method for computing the effectiveness of an insecticide. Jour. Econ. Entomol. 18, str. 265-267. |
C.18. ŠARŽNO ISPITIVANJE ADSORPCIJE/DESORPCIJE U RAVNOTEŽI
1. METODA
Ova metoda odgovara smjernici OECD TG 106 za određivanje adsorpcije/desorpcije u tlu metodom šaržnog ispitivanja u ravnoteži.
1.1. UVOD
Ova metoda uzima u obzir prstenasti test i radionicu o odabiru tala za izradu adsorpcijskog testa (1)(2)(3)(4) kao i postojeće smjernice na nacionalnoj razini (5)(6)(7)(8)(9)(10)(11).
Istraživanja adsorpcije/desorpcije korisna su za dobivanje potrebnih informacija o pokretljivosti kemikalija i njihovoj razdiobi u zemnim, vodnim i zračnim segmentima biosfere (12)(13)(14)(15)(16)(17)(18)(19)(20)(21). Te se informacije mogu koristiti za predviđanje odnosno procjenu npr. raspoloživosti kemikalije za razgradnju (22)(23), pretvorbe i unosa u organizme (24), ispiranja kroz profil tla (16)(18)(19)(21)(25)(26)(27)(28), hlapljivosti iz tla (21)(29)(30), otjecanja s kompnenih površina u prirodne vode (18)(31)(32). Podaci o adsorpciji mogu se koristiti u poredbene svrhe i za modeliranje (19)(33)(34)(35).
Razdioba kemikalije između faze tla i vodene faze je složen proces koji ovisi o nizu različitih faktora: kemijska svojstva tvari (12)(36)(37)(38)(39)(40), svojstva tla (4)(12)(13)(14)(41)(42) (43)(44)(45)(46)(47)(48)(49) i klimatski faktori kao što su padaline, temperatura, sunčeva svjetlost i vjetar. Stoga se brojne pojave i mehanizmi koji sudjeluju u procesu adsorpcije kemikalije na tlo ne mogu u potpunosti definirati pojednostavnjenim laboratorijskim modelom kao što je ova metoda. Ipak, čak i ako ovaj pokušaj ne može obuhvatiti sve moguće slučajeve u okolišu, on daje vrijedne informacije o okolišnoj relevantnosti adsorpcije kemikalije.
Vidjeti također Opći uvod.
1.2. PODRUČJE PRIMJENE
Svrha ove metode je procijeniti adsorpcijsko/desorpcijsko ponašanje tvari na tlima. Cilj je dobiti sorpcijsku vrijednost koja se može koristiti za predviđanje razdiobe u različitim uvjetima okoliša; u tu se svrhu ravnotežni koeficijenti adsorpcije za kemikaliju na različitim tlima određuju kao funkcija svojstava tla (npr. sadržaj organskog ugljika, sadržaj gline, tekstura tla i pH). Treba koristiti različite vrste tla kako bi se što šire obuhvatile interakcije pojedine tvari s tlima koja se pojavljuju u prirodi.
U ovoj metodi adsorpcija predstavlja proces vezanja kemikalije na površinu tla; ona ne razlikuje različite adsorpcijske procese (fizikalna i kemijska adsorpcija) i procese kao što su površinski katalizirana razgradnja, slojna adsorpcija ili kemijska reakcija. Osim toga, ona ne uzima u obzir adsorpciju koja se javlja na koloidnim česticama (promjera < 0,2 μm) koje stvara tlo.
Smatra se da su najvažniji parametri tla za adsorpciju sadržaj organskog ugljika (3)(4)(12)(13)(14)(41)(43)(44)(45)(46)(47)(48), sadržaj gline i tekstura tla (3)(4)(41)(42)(43)(44)(45)(46)(47)(48) te pH za ionizirajuće spojeve (3)(4)(42). Ostali parametri tla koji mogu imati utjecaja na adsorpciju/desorpciju određene tvari su efektivni kapacitet izmjene kationa (ECEC), sadržaj amorfnog željeza i aluminijevih oksida, posebno kod vulkanskih i tropskih tala (4) kao i specifična površina (49).
Test je namijenjen ocjenjivanju adsorpcije kemikalije na različitim vrstama tla s različitim sadržajem organskog ugljika i gline i različitom teksturom tla i pH. On obuhvaća tri razine:
|
1. razina: |
preliminarno istraživanje za određivanje:
|
|
2. razina: |
test pretraživanja: proučavanje adsorpcije na pet različitih vrsta tla pri jednoj koncentraciji uz pomoć kinetike adsorpcije i određivanja koeficijenta razdiobe Kd i Koc. |
|
3. razina: |
određivanje Freundlichovih adsorpcijskih izotermi u svrhu određivanja utjecaja koncentracije na obim adsorpcije na tlo. Proučavanje desorpcije uz pomoć kinetike desorpcije/Freundlichovih desorpcijskih izotermi (Dodatak 1.). |
1.3. DEFINICIJE I JEDINICE
|
Symbol |
Definicija |
Jedinice |
|
|
postotak adsorpcije u vremenu ti |
% |
|
Aeq |
postotak adsorpcije u adsorpcijskoj ravnoteži |
% |
|
|
masa ispitivane tvari adsorbirana na tlo u vremenu ti |
μg |
|
|
masa ispitivane tvari adsorbirana na tlo u vremenskom intervalu Δti |
μg |
|
|
masa ispitivane tvari adsorbirana na tlo u adsorpcijskoj ravnoteži |
μg |
|
m0 |
masa ispitivane tvari u epruveti na početku adsorpcijskog testa |
μg |
|
|
masa ispitivane tvari izmjerena u alikvotu
|
μg |
|
|
masa tvari u otopini u adsorpcijskoj ravnoteži |
μg |
|
msoil |
količina faze tla, izražena u suhoj masi tla |
g |
|
Cst |
masena koncentracija radne otopine tvari |
μg cm-3 |
|
C0 |
početna masena koncentracija ispitne otopine u dodiru s tlom |
μg cm-3 |
|
|
masena koncentracija tvari u vodenoj fazi u vremenu ti u kojemu se provodi analiza |
μg cm-3 |
|
|
sadržaj tvari adsorbiran na tlo u adsorpcijskoj ravnoteži |
μg g-1 |
|
|
masena koncentracija tvari u vodenoj fazi u adsorpcijskoj ravnoteži |
μg cm-3 |
|
V0 |
početni volumen vodene faze u dodiru s tlom tijekom adsorpcijskog testa |
cm3 |
|
|
volumen alikvota u kojemu se mjeri ispitivana tvar |
cm3 |
|
Kd |
koeficijent razdiobe za adsorpciju |
cm3 g-1 |
|
Koc |
koeficijent adsorpcije normiran na organski ugljik |
cm3 g-1 |
|
Kso |
koeficijent razdiobe normiran na organsku tvar |
cm3 g-1 |
|
|
Freundlichov koeficijent adsorpcije |
μg 1-1/n (cm3) 1/n g-1 |
|
1/n |
Freundlichov eksponent |
|
|
|
postotak desorpcije u vremenu ti |
% |
|
|
postotak desorpcije u vremenskom intervalu Δti |
% |
|
Kdes |
prividni koeficijent desorpcije |
cm3 g-1 |
|
|
Freundlichov koeficijent desorpcije |
μg 1-1/n (cm3) 1/n g-1 |
|
|
masa ispitivane tvari desorbirana iz tla u vremenu ti |
μg |
|
|
masa ispitivane tvari desorbirana iz tla u intervalu Δti |
μg |
|
|
masa tvari određena analitički u vodenoj fazi u desorpcijskoj ravnoteži |
μg |
|
|
ukupna masa ispitivane tvari desorbirana u desorpcijskoj ravnoteži |
μg |
|
|
masa tvari koja ostaje adsorbirana na tlu nakon vremenskog intervala Δti |
μg |
|
|
masa tvari preostala nakon uspostave adsorpcijske ravnoteže zbog nepotpune zamjene volumena |
μg |
|
|
sadržaj ispitivane tvari koji ostaje adsorbiran na tlu u desorpcijskoj ravnoteži |
μg g-1 |
|
|
masena koncentracija ispitivane tvari u vodenoj fazi u desorpcijskoj ravnoteži |
μg cm-3 |
|
VT |
ukupni volumen vodene faze u dodiru s tlom tijekom pokusa s kinetikom desorpcije koji se izvodi serijskom metodom |
cm3 |
|
VR |
volumen supernatanta uklonjen iz epruvete nakon uspostave adsorpcijske ravnoteže i zamijenjen istim volumenom otopine 0,01 M CaCl2 |
cm3 |
|
|
volumen alikvota uzetog na analizu od vremena (i) tijekom pokusa s kinetikom desorpcije koji se izvodi serijskom metodom |
cm3 |
|
|
volumen otopine uzet iz epruvete (i) u svrhu mjerenja ispitivane tvari u pokusu s kinetikom desorpcije (paralelna metoda) |
cm3 |
|
|
volumen otopine uzet iz epruvete u svrhu mjerenja ispitivane tvari u desorpcijskoj ravnoteži |
cm3 |
|
MB |
bilanca mase |
% |
|
mE |
ukupna masa ispitivane tvari ekstrahirana iz tla i sa stijenki ispitne posude u dva koraka |
μg |
|
Vrec |
volumen supernatanta dobiven nakon adsorpcijske ravnoteže |
cm3 |
|
Pow |
podjelni koeficijent oktanol/voda |
|
|
pKa |
konstanta disocijacije |
|
|
Sw |
topljivost u vodi |
g l-1 |
1.4. NAČELO ISPITNE METODE
Poznati volumeni otopina ispitivane tvari (koja može biti neobilježena ili radioaktivno obilježena) u 0,01 M CaCl2 u poznatoj koncentraciji dodaju se uzorcima tla poznate suhe mase koji su prethodno ekvilibrirani u 0,01 M CaCl2. Smjesa se trese koliko je potrebno. Suspenzije tla se zatim odvoje centrifugiranjem i, po želji, filtracijom te se analizira vodena faza. Količina ispitivane tvari adsorbirana na uzorku tla izračunava se kao razlika između količine ispitivane tvari koja je prvobitno bila prisutna u otopini i količine preostale na kraju pokusa (neizravna metoda).
Osim toga, adsorbirana količina ispitivane tvari može se odrediti i izravno analizom tla (izravna metoda). Ovaj postupak, koji uključuje postupnu ekstrakciju iz tla odgovarajućim otapalom, preporučuje se u slučajevima kad se razlika koncentracije tvari u otopini ne može točno odrediti. Primjeri takvih slučajeva su: adsorpcija ispitivane tvari na površini ispitnih posuda, nestabilnost ispitivane tvari u vremenskom okviru pokusa, slaba adsorpcija koja rezultira tek neznatnom promjenom koncentracije otopine i jaka adsorpcija kojom se dobiva niska koncentracija koja se ne može točno odrediti. Ako se koristi radioaktivno obilježena tvar, ekstrakcija iz tla može se izbjeći analizom faze tla izgaranjem i brojenjem metodom tekućinske scintilacije. Međutim, brojenje metodom tekućinske scintilacije je nespecifična tehnika koja ne razlikuje polazne proizvode od proizvoda pretvorbe; stoga ga treba koristiti samo ako je ispitivana kemikalija stabilna u razdoblju ispitivanja.
1.5. INFORMACIJE O ISPITIVANOJ TVARI
Kemijski reagensi trebaju biti analitički čisti. Preporučuje se uporaba neobilježenih ispitivanih tvari poznatog sastava i po mogućnosti barem 95 %-tne čistoće ili radioaktivno obilježenih ispitivanih tvari poznatog sastava i radioaktivne čistoće. U slučaju obilježivača s kratkim vremenom poluraspada, treba primijeniti korekcije za raspadanje.
Prije provedbe ispitivanja adsorpcije/desorpcije trebaju biti raspoložive sljedeće informacije o ispitivanoj tvari:
|
(a) |
topljivost u vodi (A.6.); |
|
(b) |
tlak pare (A.4.) i/ili konstanta Henryjevog zakona; |
|
(c) |
abiotička razgradnja: hidroliza kao funkcija pH (C.7.); |
|
(d) |
podjelni koeficijent (A.8.); |
|
(e) |
laka biorazgradivost (C.4.) ili aerobna i anaerobna pretvorba u tlu; |
|
(f) |
pKa ionizirajućih tvari; |
|
(g) |
izravna fotoliza u vodi (tj. apsorpcijski spektar UV-VIS u vodi, kvantni prinos) i fotokemijska razgradnja na tlu. |
1.6. PRIMJENLJIVOST TESTA
Test se može primijeniti kod kemikalija za koje je raspoloživa dovoljno točna analitička metoda. Važan parametar koji može utjecati na pouzdanost rezultata, posebno ako se primjenjuje neizravna metoda, je stabilnost ispitivane tvari u vremenskom okviru ispitivanja. Prema tomu, treba obavezno provjeriti stabilnost tvari u preliminarnom istraživanju; ako je unutar vremenskog okvira ispitivanja uočena pretvorba, preporučuje se da se u glavnom istraživanju analizira i faza tla i tekuća faza.
Poteškoće u provedbi ovog ispitivanja mogu se javiti kod ispitivanih tvari koje su slabo topljive u vodi (Sw < 10-4 g l-1) kao i kod tvari visokog naboja jer se koncentracija u vodenoj fazi ne može analitički izmjeriti s dovoljnom točnošću. U tom slučaju treba poduzeti dodatne korake. Smjernice za prevladavanje tih problema mogu se naći u odgovarajućim odjeljcima ove metode.
Kod ispitivanja hlapljivih tvari treba voditi računa da se izbjegnu gubici tijekom istraživanja.
1.7. OPIS METODE
1.7.1. Aparatura i kemijski reagensi
Standardna laboratorijska oprema, posebno:
|
(a) |
epruvete odnosno posude za izvođenje pokusa. Važno je da se te epruvete odnosno posude
|
|
(b) |
naprava za tresenje: rotacijska tresilica ili istovjetna oprema; naprava za tresenje treba za vrijeme tresenja održavati tlo u suspenziji; |
|
(c) |
centrifuga: po mogućnosti velike brzine, npr. centrifugalne sile > 3 000 g, s regulacijom temperature, koja iz vodene otopine može ukloniti čestice promjera većeg od 0,2 μm. Za vrijeme miješanja i centrifugiranja posude trebaju biti poklopljene kako bi se izbjeglo hlapljenje i gubici vode; da bi se smanjila adsorpcija, treba koristiti inaktivirane poklopce kao što su poklopci s navojem obloženi teflonom; |
|
(d) |
fakultativno: naprava za filtriranje; filtri poroznosti 0,2 μm, sterilni, jednokratni. Kod filtara posebnu pažnju treba posvetiti izboru materijala kako bi se izbjegli gubici ispitivane tvari na filtru; kod slabo topljivih ispitivanih tvari ne preporučuju se filtri od organskog materijala; |
|
(e) |
analitički instrumenti prikladni za mjerenje koncentracije ispitivane kemikalije; |
|
(f) |
laboratorijski sušionik koja može održavati temperaturu od 103 °C do 110 °C. |
1.7.2. Opisivanje i odabir tala
Tla treba opisati pomoću tri parametra koji se smatraju najvećim dijelom odgovornima za adsorpcijsku sposobnost: organski ugljik, sadržaj gline i tekstura tla te pH. Kao što je već spomenuto (vidjeti Područje primjene), i druga fizikalno-kemijska svojstva tla mogu imati utjecaja na adsorpciju/desorpciju određene tvari pa ih treba uzeti u obzir prema potrebi.
Vrlo je važno koje će se metode koristiti za opisivanje tla jer one mogu imati značajan utjecaj na rezultate. Stoga se preporučuje da se pH tla mjeri u otopini 0,01 M CaCl2 (to je otopina koja se koristi kod ispitivanja adsorpcije/desorpcije) u skladu s odgovarajućom metodom ISO (ISO-10390-1). Preporučuje se da se odrede i druga relevantna svojstva tla u skladu sa standardnim metodama (primjerice ISO „Handbook of Soil Analysis”); to omogućuje da se analiza podataka o sorpciji temelji na jedinstvenim međunarodnim parametrima tla. Neke smjernice za postojeće standardne analitičke metode i opisivanja tla navedene su u literaturi (50-52). Za baždarenje metoda za ispitivanje tla preporučuje se korištenje referentnih tala.
Smjernice za odabir tala za adsorpcijske/desorpcijske pokuse nalaze se u tablici 1. Sedam odabranih tala obuhvaćaju vrste tla koje se susreću u umjerenim geografskim zonama. U slučaju ionizirajućih ispitivanih tvari, odabrana tla trebaju obuhvaćati širok raspon pH vrijednosti kako bi se mogla ocijeniti adsorpcija tvari u njezinom ioniziranom i neioniziranom obliku. Smjernice za broj tala koji treba koristiti u različitim fazama ispitivanja nalaze se u odjeljku 1.9. „Provođenje ispitivanja”.
Ako se ipak koriste druge vrste tla, ona se moraju opisati na temelju istih parametara i trebaju imati sličan raspon svojstava kao tla opisana u tablici 1., čak i onda ako u potpunosti ne ispunjavaju kriterije.
Tablica 1.:
Smjernice za odabir uzoraka tla za ispitivanje adsorpcije/desorpcije
|
Vrsta tla |
Područje pH (u 0,01 M CaCl2) |
Sadržaj organskog ugljika (%) |
Sadržaj gline (%) |
Tekstura tla (25) |
|
1 |
4,5 – 5,5 |
1,0 – 2,0 |
65 – 80 |
glina |
|
2 |
> 7,5 |
3,5 – 5,0 |
20 – 40 |
glinasta ilovača |
|
3 |
5,5 – 7,0 |
1,5 – 3,0 |
15 – 25 |
praškasta ilovača |
|
4 |
4,0 – 5,5 |
3,0 – 4,0 |
15 – 30 |
ilovača |
|
5 |
< 4,0 – 6,0 (26) |
< 10 – 15 (26) |
ilovasti pijesak |
|
|
6 |
> 7,0 |
40 – 65 |
glinasta ilovača/glina |
|
|
7 |
< 4,5 |
> 10 |
< 10 |
pijesak/ilovasti pijesak |
1.7.3. Skupljanje i čuvanje uzoraka tla
1.7.3.1. Skupljanje
Ne postoje preporučene tehnike niti alati za uzorkovanje: tehnika uzorkovanja ovisi o svrsi istraživanja (53)(54)(55)(56)(57)(58).
Treba uzeti u obzir sljedeće:
|
(a) |
potrebne su detaljne informacije o povijesti lokaliteta, uključujući mjesto, vegetacijski pokrov, tretiranje pesticidima i/ili gnojivima, biološke dodatke i slučajna onečišćenja. Treba poštovati preporuke standarda ISO za uzorkovanje tla (ISO 10381-6) s obzirom na opis mjesta uzorkovanja; |
|
(b) |
mjesto uzorkovanja mora biti definirano UTM-om (univerzalna poprečna Mercatorova projekcija/European Horizontal Datum) ili geografskim koordinatama; to omogućuje ponovno skupljanje određenog tla u budućnosti i može pomoći da se tlo definira u okviru različitih sustava razvrstavanja koji se koriste u različitim zemljama. Osim toga, treba skupljati samo horizont A do dubine od najviše 20 cm. Ako je kao dio tla prisutan horizont Oh, njega treba uključiti u uzorak, posebno kod vrste tla pod br. 7. |
Uzorke tla treba prenositi u spremnicima u temperaturnim uvjetima koji jamče da se početna svojstva tla neće značajno promijeniti.
1.7.3.2. Skladištenje
Poželjno je koristiti tla koja su svježe skupljena na terenu. Samo ako to nije moguće, tlo se može skladištiti na okolnoj temperaturi i treba ga održavati zrakosuhim. Ne postoji preporučeno ograničenje vremena skladištenja, ali tla koja se skladište duže od tri godine treba prije uporabe ponovno analizirati s obzirom na sadržaj organskog ugljika, pH i kapacitet izmjene kationa.
1.7.3.3. Rukovanje i priprema uzoraka tla za ispitivanje
Tla se suše na zraku na okolnoj temperaturi (po mogućnosti između 20 – 25 °C). Rahljenje treba obaviti uz minimalnu primjenu sile kako bi se što bolje sačuvala izvorna tekstura tla. Tla se prosijavaju na veličinu čestica ≤ 2 mm; što se tiče postupka prosijavanja, treba poštovati preporuke standarda ISO za uzorkovanje tla (ISO 10381-6). Preporučuje se pažljiva homogenizacija jer to povećava obnovljivost rezultata. Sadržaj vlage pojedinog tla određuje se na tri alikvota uz zagrijavanje na 105 °C do trenutka kad više nema značajnih promjena mase (približno 12 sati). Masa tla se kod svih izračuna odnosi na suhu masu nakon sušenja u sušioniku tj. masa tla ispravljena za sadržaj vlage.
1.7.4. Priprema ispitivane tvari za primjenu na tlo
Ispitivana tvar se otopi u otopini 0,01 M CaCl2 u destiliranoj ili deioniziranoj vodi; otopina CaCl2 se koristi kao faza vodenog otapala radi poboljšanja centrifugiranja i smanjenja izmjene kationa. Poželjno je da koncentracija radne otopine bude tri reda veličine viša od granice detekcije primijenjene analitičke metode. Ovaj prag jamči točna mjerenja s obzirom na metodologiju koja se primjenjuje kod ove metode; osim toga, koncentracija radne otopine treba biti niža od topljivosti ispitivane tvari u vodi.
Radnu otopinu po mogućnosti treba pripremiti neposredno prije primjene na uzorke tla i treba je držati zatvorenu u mraku na 4 °C. Vrijeme skladištenja ovisi o stabilnosti ispitivane tvari i njezinoj koncentraciji u otopini.
Ako se ispitivana tvar teško otapa, ponekad je potrebno primijeniti sredstvo za otapanje, ali samo u slučaju slabo topljivih tvari (Sw < 10-4 g l-1). To sredstvo za otapanje: (a) treba biti mješljivo s vodom, npr. metanol ili acetonitril; (b) njegova koncentracija ne smije biti viša od 1 % ukupnog volumena radne otopine i treba biti manja od toga u otopini ispitivane tvari koja dolazi u dodir s tlom (po mogućnosti manja od 0,1 %); i (c) ne smije biti površinski aktivna tvar niti ulaziti u solvolitičke reakcije s ispitivanom kemikalijom. Uporabu sredstva za otapanje treba navesti zajedno s ostalim podacima i obrazložiti.
Druga mogućnost kod slabo topljivih tvari je dodavanje ispitivane tvari u ispitni sustav spikingom: ispitivana se tvar otopi u organskom otapalu i alikvot doda u sustav tla i otopine 0,01 M CaCl2 u destiliranoj ili deioniziranoj vodi. Treba nastojati da sadržaj organskog otapala u vodenoj fazi bude što niži, u pravilu ne viši od 0,1 %. Kod spikinga iz organske otopine može se pojaviti problem neobnovljivosti volumena. To može rezultirati dodatnom greškom budući da koncentracija ispitivane tvari i pomoćnog otapala neće biti jednaka kod svih ispitivanja.
1.8. PREDUVJETI ZA PROVOĐENJE ISPITIVANJA ADSORPCIJE/DESORPCIJE
1.8.1. Analitička metoda
Ključni parametri koji mogu utjecati na točnost sorpcijskih mjerenja su točnost analitičke metode kod analiziranja faze otopine i adsorbiranih faza, stabilnost i čistoća ispitivane tvari, uspostava sorpcijske ravnoteže, veličina promjene koncentracije otopine, omjer tlo/otopina i promjene u strukturi tla tijekom postupka za uspostavljanje ravnoteže (35)(59-62). Neki primjeri vezani uz problematiku točnosti navedeni su u Dodatku 2.
Pouzdanost analitičke metode treba provjeriti u rasponu koncentracija koji se očekuje tijekom ispitivanja. Izvođaču pokusa ostavljena je sloboda da sam izradi prikladnu metodu koja ima potrebnu točnost, preciznost, obnovljivost, granice detekcije i iskorištenje. Određene smjernice za provođenje takvog ispitivanja daje pokus u nastavku.
Prikladan volumen 0,01 M CaCl2, npr. 100 cm3, trese se s određenom masom jako adsorptivnog tla (tj. s visokim sadržajem organskog ugljika i gline), npr. 20 g, u vremenu od 4 sata; te mase i volumeni mogu biti različiti ovisno o analitičkim potrebama, s time da se kao praktično polazište može uzeti omjer tlo/otopina 1:5. Smjesa se centrifugira, a vodena faza se može i filtrirati. U vodenu se fazu doda određeni volumen radne otopine ispitivane tvari kako bi se postigla nazivna koncentracija unutar očekivanog raspona koncentracija tijekom ispitivanja. Taj volumen ne smije biti viši od 10 % konačnog volumena vodene faze kako bi se promjene svojstava otopine prije uspostave ravnoteže svele na najmanju moguću mjeru. Otopina se analizira.
U ispitivanje treba uključiti jednu slijepu probu sa sustavom tlo + otopina CaCl2 (bez ispitivane tvari) radi otkrivanja mogućih artefakata u analitičkoj metodi i utjecaja matriksa koji potječu od tla.
Analitičke metode koje se mogu koristiti za sorpcijska mjerenja uključuju plinsko-tekućinsku kromatografiju (GLC), tekućinsku kromatografiju visoke djelotvornosti (HPLC), spektrometriju (npr. GC/spektrometrija masa, HPLC/spektrometrija masa) i brojenje metodom tekućinske scintilacije (za radioaktivno obilježene tvari). Analitička metoda se smatra prikladnom ako se iskorištenje kreće između 90 % i 110 % nazivne vrijednosti, neovisno o tome koja se analitička metoda koristi. Da bi se omogućila detekcija i ocjenjivanje nakon razdiobe, granice detekcije analitičke metode moraju biti barem dva reda veličine niže od nazivne koncentracije.
Kod provođenja adsorpcijskih istraživanja svojstva i granice detekcije raspoložive analitičke metode igraju važnu ulogu u definiranju ispitnih uvjeta i općenito provođenju čitavog postupka ispitivanja. Ova metoda zacrtava opći okvir pokusnog postupka te donosi preporuke i smjernice u pogledu alternativnih rješenja u slučaju ograničenja analitičke metode ili laboratorijskih sredstava.
1.8.2. Odabir optimalnih omjera tlo/otopina
Odabir omjera tlo/otopina za sorpcijska istraživanja ovisi o koeficijentu razdiobe Kd i željenom relativnom stupnju adsorpcije. S obzirom na oblik jednadžbe adsorpcije i ograničenja analitičke metodologije vezana uz određivanje koncentracije kemikalije u otopini, promjena koncentracije tvari u otopini određuje statističku točnost mjerenja. Stoga je u praksi općenito korisno odabrati nekoliko fiksnih omjera kod kojih je postotak adsorpcije viši od 20 %, a po mogućnosti i viši od 50 % (62), pazeći da koncentracija ispitivane tvari u vodenoj fazi ostane dovoljno visoka da se može točno izmjeriti. Ovo je posebno važno u slučaju visokih postotaka adsorpcije.
Praktičan pristup odabiru omjera tlo/otopina je pristup utemeljen na procjeni vrijednosti Kd, koja se može procijeniti u preliminarnom istraživanju ili putem prihvaćenih tehnika procjene (Dodatak 3.). Prikladan omjer se zatim može odabrati na temelju grafičkog prikaza omjera tlo/otopina u ovisnosti o Kd za fiksne postotke adsorpcije (Slika 1.). Pretpostavka ovoga grafičkog prikaza je da je jednadžba adsorpcije linearna (28). Primjenljivi se odnos dobije preuređivanjem jednadžbe (4) Kd u obliku jednadžbe (1):
|
|
(1) |
ili u njezinom logaritamskom obliku uz pretpostavku da je R = msoil/V0 and 
|
|
(2) |
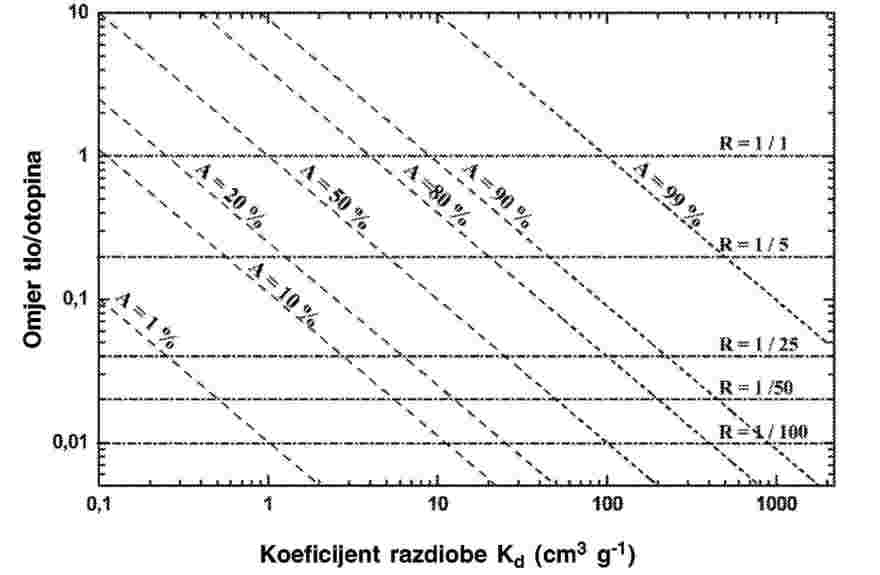
Na slici 1. prikazani su potrebni omjeri tlo/otopina kao funkcija Kd za različite razine adsorpcije. Primjerice, ako je omjer tlo/otopina 1:5 i Kd je 20, dobije se adsorpcija od približno 80 %. Da bi se dobila 50 %-tna adsorpcija, za isti Kd, treba koristiti omjer 1:25. Ovaj pristup istraživaču pruža slobodu da odabere omjer tlo/otopina u skladu s potrebama pokusa.
Nešto veći problem predstavlja situacija kad se kemikalija jako ili tek neznatno adsorbira. U slučaju niske adsorpcije, preporučuje se omjer tlo/otopina 1:1, iako su kod nekih vrsta izrazito organskih tala potrebni manji omjeri da bi se dobila kaša. Analitička metodologija mora omogućivati mjerenje malih promjena koncentracije otopine; u protivnom će mjerenje adsorpcije biti netočno. S druge strane, kod jako visokih koeficijenata razdiobe Kd mogu se uzeti i omjeri tlo/otopina do čak 1:100, kako bi u otopini ostala značajna količina kemikalije. Međutim, treba voditi računa da se postigne dobro miješanje i ostaviti dovoljno vremena za uspostavu ravnoteže u sustavu. Alternativni pristup u ovim ekstremnim slučajevima kada ne postoji odgovarajuća analitička metodologija je predviđanje vrijednosti Kd primjenom tehnika procjene npr. na temelju vrijednosti Pow (Dodatak 3.). To može biti korisno posebno kod slabo apsorbiranih/polarnih kemikalija s Pow < 20 i kod lipofilnih/visoko sorptivnih kemikalija s Pow > 104.
1.9. PROVOĐENJE ISPITIVANJA
1.9.1. Ispitni uvjeti
Svi se pokusi provode na okolnoj temperaturi i to po mogućnosti na stalnoj temperaturi između 20 °C i 25 °C.
Uvjeti centrifugiranja trebaju omogućivati uklanjanje čestica većih od 0,2 μm iz otopine. Ta vrijednost predstavlja veličinu najsitnije čestice koja se smatra krutom česticom i čini granicu između krutih i koloidnih čestica. Smjernice za određivanje uvjeta centrifugiranja dane su u Dodatku 4.
Ako naprave za centrifugiranje ne mogu zajamčiti uklanjanje čestica većih od 0,2 μm, treba primjenjivati kombinaciju centrifugiranja i filtriranja s filtrima od 0,2 μm. Ti filtri trebaju biti izrađeni od prikladnog inertnog materijala kako bi se izbjegli gubici ispitivane tvari na njima. U svakom slučaju, treba dokazati da tijekom filtriranja ne dolazi do gubitaka ispitivane tvari.
1.9.2. 1. razina – preliminarno istraživanje
Svrha provedbe preliminarnog istraživanja već je navedena u odjeljku Područje primjene. Smjernice za postavljanje takvih ispitivanja nalaze se u prijedlogu pokusa u nastavku.
1.9.2.1. Odabir optimalnih omjera tlo/otopina
Koriste se dvije vrste tla i tri omjera tlo/otopina (šest pokusa). Jedna vrsta tla ima visok sadržaj organskog ugljika i nizak sadržaj gline, a druga ima nizak sadržaj organskog ugljika i visok sadržaj gline. Predlažu se sljedeći omjeri tla i otopine:
|
— |
50 g tla i 50 cm3 vodene otopine ispitivane tvari (omjer 1/1), |
|
— |
10 g tla i 50 cm3 vodene otopine ispitivane tvari (omjer 1/5), |
|
— |
2 g tla i 50 cm3 vodene otopine ispitivane tvari (omjer 1/25). |
Najmanja količina tla na kojoj se može izvesti pokus ovisi o laboratorijskim sredstvima i učinkovitosti analitičkih metoda koje se primjenjuju. Ipak, preporučuje se korištenje najmanje 1 g, a po mogućnosti i 2 g, kako bi se ispitivanjem dobili pouzdani rezultati.
Jedan kontrolni uzorak koji sadrži samo ispitivanu tvar u otopini 0,01 M CaCl2 (bez tla) podvrgava se potpuno istim postupcima kao ispitni sustavi kako bi se provjerila stabilnost ispitivane tvari u otopini CaCl2 i njezina moguća adsorpcija na površinu ispitnih posuda.
Istom ispitnom postupku podvrgava se po jednu slijepu probu za svako tlo s istom količinom tla i ukupnim volumenom otopine 0,01 M CaCl2 od 50 cm3 (bez ispitivane tvari). Ona kod analize služi kao temeljna kontrola za utvrđivanje interferirajućih tvari i onečišćenih tala.
Sve pokuse, uključujući kontrole i slijepe probe, treba provoditi barem u dva ponavljanja. Ukupni broj uzoraka koje je potrebno pripremiti za istraživanje može se izračunati s obzirom na metodologiju koja se primjenjuje.
Metode za preliminarno i glavno istraživanje su općenito iste, a izuzeci se navode tamo gdje se primjenjuju.
Zrakom sušeni uzorci tla se u noći prije pokusa (12 sati) ekvilibriraju tresenjem s najmanje 45 cm3 0,01 M CaCl2. Zatim se doda količina radne otopine ispitivane tvari potrebna da se dobije konačni volumen od 50 cm3. Volumen radne otopine koji se dodaje (a) ne smije biti viši od 10 % konačnog volumena vodene faze od 50 cm3, kako bi se promjene svojstava otopine prije uspostave ravnoteže svele na najmanju moguću mjeru; i (b) treba omogućiti da početna koncentracije ispitivane tvari u dodiru s tlom (C0) bude najmanje dva reda veličine viša od granice detekcije analitičke metode; ovaj prag osigurava provedbu točnih mjerenja čak i u slučaju snažne adsorpcije (> 90 %), a kasnije i određivanje adsorpcijskih izotermi. Također se preporučuje da početna koncentracija tvari (C0) po mogućnosti ne bude viša od polovice njezine granice topljivosti.
U nastavku se nalazi primjer izračuna koncentracije radne otopine (Cst). Pretpostavlja se granica detekcije 0,01 μg cm-3 i 90 %-tna adsorpcija; prema tomu, bilo bi poželjno da početna koncentracija ispitivane tvari u dodiru s tlom bude 1 μg cm-3 (dva reda veličine viša od granice detekcije). Ako se doda najviši preporučeni volumen radne otopine tj. od 5 do 45 cm3 ekvilibracijske otopine 0,01 M CaCl2 (= 10 % radne otopine na ukupni volumen vodene faze od 50 cm3), koncentracija radne otopine trebala bi biti 10 μg cm-3; to je tri reda veličine više od granice detekcije analitičke metode.
pH vodene faze treba izmjeriti prije i nakon dodira s tlom, budući da on igra važnu ulogu u čitavom procesu adsorpcije, posebno kod ionizirajućih tvari.
Smjesa se trese dok se ne postigne adsorpcijska ravnoteža. Ravnotežno vrijeme je vrlo promjenljivo, ovisno o kemikaliji i tlu; općenito je dostatno vrijeme od 24 sata (77). U preliminarnom istraživanju uzorci se mogu uzimati u određenom slijedu u razdoblju miješanja od 48 sati (primjerice nakon 4, 8, 24, 48 sati). Ipak, vremena analize treba odrediti fleksibilno, ovisno o radnom rasporedu laboratorija.
Za analiziranje ispitivane tvari u vodenoj otopini raspoložive su dvije mogućnosti: (a) paralelna metoda i (b) serijska metoda. Treba naglasiti da je paralelna metoda doduše sporija u pokusnom dijelu, ali je matematička obrada rezultata jednostavnija (Dodatak 5.). Ipak, izbor metodologije ovisi o izvođaču pokusa, koji mora uzeti u obzir raspoloživa laboratorijska sredstva i resurse.
|
(a) |
Paralelna metoda: pripremi se potreban broj uzoraka s jednakim omjerom tlo/otopina, koji odgovara broju vremenskih intervala u kojima se želi proučavati kinetika adsorpcije. Nakon centrifugiranja i, po želji, filtriranja treba što potpunije povratiti vodenu fazu iz prve epruvete i izmjeriti nakon npr. 4 sata; vodena faza iz druge epruvete mjeri se nakon 8 sati, treću nakon 24 sata itd. |
|
(b) |
Serijska metoda: pripreme se samo po dva uzorka za svaki omjer tlo/otopina. Smjesa se u definiranim vremenskim razmacima centrifugira radi odvajanja faza. Mali alikvot vodene faze se odmah analizira na ispitivanu tvar; pokus se zatim nastavlja s prvobitnom smjesom. Ako se nakon centrifugiranja primjenjuje filtracija, laboratrij mora imati opremu za filtriranje malih vodenih alikvota. Preporučuje se da ukupni volumen alikvota ne bude viši od 1 % ukupnog volumena otopine, kako ne bi došlo do značajne promjene omjera tlo/otopina i kako se ne bi smanjila masa otopljene tvari raspoloživa za adsorpciju tijekom ispitivanja. |
Izračuna se postotak adsorpcije  u svakom vremenu (ti) na temelju početne nazivne koncentracije i izmjerene koncentracije u vremenu uzorkovanja (ti), ispravljen za vrijednost slijepe probe. Izrade se grafički prikazi
u svakom vremenu (ti) na temelju početne nazivne koncentracije i izmjerene koncentracije u vremenu uzorkovanja (ti), ispravljen za vrijednost slijepe probe. Izrade se grafički prikazi  u ovisnosti o vremenu (Dodatak 5. Slika 1.) kako bi se mogla procijeniti uspostava ravnotežnog platoa (29). Također se izračuna vrijednost Kd u ravnoteži. Na temelju te vrijednosti Kd se iz slike 1. odaberu odgovarajući omjeri tlo/otopina tako da postotak adsorpcije bude viši od 20 %, a po mogućnosti i > 50 % (61). Sve primjenljive jednadžbe i načela grafičkog prikazivanja navedeni su u odjeljku Podaci i izvješćivanje i u Dodatku 5.
u ovisnosti o vremenu (Dodatak 5. Slika 1.) kako bi se mogla procijeniti uspostava ravnotežnog platoa (29). Također se izračuna vrijednost Kd u ravnoteži. Na temelju te vrijednosti Kd se iz slike 1. odaberu odgovarajući omjeri tlo/otopina tako da postotak adsorpcije bude viši od 20 %, a po mogućnosti i > 50 % (61). Sve primjenljive jednadžbe i načela grafičkog prikazivanja navedeni su u odjeljku Podaci i izvješćivanje i u Dodatku 5.
1.9.2.2. Određivanje vremena do uspostavljanja adsorpcijske ravnoteže i količine ispitivane tvari adsorbirane u ravnoteži
Kao što je već spomenuto, grafički prikazi  ili
ili  u vremenu omogućuju procjenu uspostave adsorpcijske ravnoteže i količine ispitivane tvar adsorbirane u ravnoteži. Primjeri takvih grafičkih prikaza su slika 1. i 2. u Dodatku 5. Vrijeme do uspostavljanja ravnoteže je vrijeme potrebno da sustav dosegne plato.
u vremenu omogućuju procjenu uspostave adsorpcijske ravnoteže i količine ispitivane tvar adsorbirane u ravnoteži. Primjeri takvih grafičkih prikaza su slika 1. i 2. u Dodatku 5. Vrijeme do uspostavljanja ravnoteže je vrijeme potrebno da sustav dosegne plato.
Ako se kod određenog tla ne može utvrditi plato, već je vidljivo stalno povećanje, to može biti zbog otežavajućih čimbenika, kao što je biorazgradnja ili spora difuzija. Biorazgradnja se može dokazati ponavljanjem pokusa sa steriliziranim uzorkom tla. Ako se ni u tom slučaju ne dosegne plato, izvođač pokusa treba potražiti druge specifične pojave koje bi mogle biti prisutne u njegovom istraživanju; to se može učiniti odgovarajućim izmjenama pokusnih uvjeta (temperatura, vrijeme tresenja, omjeri tlo/otopina). Odluka o nastavku ispitnog postupka unatoč eventualnom izostanku ravnoteže prepuštena je izvođaču pokusa.
1.9.2.3. Adsorpcija na površini ispitne posude i stabilnost ispitivane tvari
Neke informacije o adsorpciji ispitivane tvari na površini ispitnih posuda i njezinoj stabilnosti mogu se dobiti analizom kontrolnih uzoraka. Ako se uoči gubitak viši od standardne greške analitičke metode, to može značiti da je došlo do abiotičke razgradnje i/ili adsorpcije na površinu ispitne posude. Razlika između tih dviju pojava može se utvrditi temeljitim pranjem stijenki posude poznatim volumenom prikladnog otapala i analiziranjem otopine od pranja na ispitivanu tvar. Ako nije uočena adsorpcija na površini ispitnih posuda, gubitak ukazuje na abiotičku nestabilnost ispitivane tvari. Ako se utvrdi adsorpcija, treba promijeniti materijal ispitnih posuda. Ipak, podaci o adsorpciji na površinu ispitnih posuda dobiveni ovim pokusom ne mogu se izravno ekstrapolirati na pokus tlo/otopina. Na ovu adsorpciju će utjecati prisutnost tla.
Dodatne informacije o stabilnosti ispitivane tvari mogu se dobiti određivanjem bilance mase polazne tvari u vremenu. To podrazumijeva analizu vodene faze, ekstrakata tla i stijenki ispitne posude na ispitivanu tvar. Razlika između upotrijebljene mase ispitivane kemikalije i zbroja masa ispitivane kemikalije u vodenoj fazi, ekstraktima tla i stijenki ispitne posude jednaka je razgrađenoj i/ili ishlapjeloj i/ili neekstrahiranoj masi. Da bi se odredila bilanca mase, u razdoblju pokusa mora biti postignuta adsorpcijska ravnoteža.
Bilanca mase određuje se na oba tla za jedan omjer tlo/otopina po tlu koji u ravnoteži pokazuje gubitak iznad 20 %, a po mogućnosti i > 50 %. Po završetku pokusa za određivanje omjera analizom zadnjeg uzorka vodene faze nakon 48 sati faze se odvajaju centrifugiranjem te, po želji, filtriranjem. Vodena faza se što je moguće više povrati i tlu doda prikladno ekstrakcijsko otapalo (koeficijent ekstrakcije najmanje 95 %) za ekstrakciju ispitivane tvari. Preporučuju se najmanje dvije uzastopne ekstrakcije. Zatim se odredi količina ispitivane tvari u ekstraktima tla i ispitnih posuda i izračuna bilanca mase (jednadžba 10, Podaci i izvješćivanje). Ako je ona manja od 90 %, smatra se da je ispitivana tvar nestabilna u vremenskom okviru ispitivanja. Istraživanje se unatoč tomu može nastaviti, ali pritom treba uzeti u obzir nestabilnost ispitivane tvari; u tom se slučaju preporučuje da se u sklopu glavnog istraživanja analiziraju obje faze.
1.9.3. 2. razina – kinetika adsorpcije s jednom koncentracijom ispitivane tvari
Koristi se pet tala odabranih iz tablice 1. Ovdje je dobro uključiti neka ili sva tla koja su korištena u preliminarnom istraživanju, ako je to primjereno. U tom slučaju nije potrebno ponavljati 2. razinu za tla koja su korištena u preliminarnom istraživanju.
Vrijeme do uspostavljanja ravnoteže, omjer tlo/otopina, masa uzorka tla, volumen vodene faze u dodiru s tlom i koncentracija ispitivane tvari u otopini odabiru se na temelju rezultata preliminarnog istraživanja. Analizu treba po mogućnosti provesti nakon vremena kontakta od približno 2, 4, 6, 8 (eventualno i 10) te 24 sata; vrijeme tresenja može se produžiti na najviše 48 sati u slučaju kemikalija koje zahtijevaju duže vrijeme do uspostavljanja ravnoteže, na temelju rezultata određivanja omjera. Ipak, vremena analize mogu se odrediti fleksibilno.
Svaki pokus (jedno tlo i jedna otopina) izvodi se najmanje u dva ponavljanja kako bi se mogla procijeniti varijanca rezultata. U svaki pokus treba uključiti po jednu slijepu probu. Ona se sastoji od tla i otopine 0,01 M CaCl2 (bez ispitivane tvari) jednake mase odnosno volumena kao u pokusu. Kontrolni uzorak koji sadrži samo ispitivanu tvar u otopini 0,01 M CaCl2 (bez tla) treba podvrgnuti istom ispitnom postupku radi zaštite u slučaju neočekivanih ishoda.
Postotak adsorpcije izračunava se u svakom vremenu  i/ili vremenskom intervalu
i/ili vremenskom intervalu 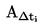 (ovisno o potrebi) i treba ga grafički prikazati u ovisnosti o vremenu. Osim toga, izračunava se i koeficijent razdiobe Kd u ravnoteži kao i koeficijent adsorpcije normiran na organski ugljik Koc (za nepolarne organske kemikalije).
(ovisno o potrebi) i treba ga grafički prikazati u ovisnosti o vremenu. Osim toga, izračunava se i koeficijent razdiobe Kd u ravnoteži kao i koeficijent adsorpcije normiran na organski ugljik Koc (za nepolarne organske kemikalije).
Rezultati ispitivanja kinetike adsorpcije
Linearna vrijednost Kd općenito točno opisuje sorpcijsko ponašanje u tlu (35)(78) i predstavlja izraz svojstvene pokretljivosti kemikalije u tlu. Primjerice, kemikalije s Kd ≤ 1 cm3 g-1 općenito se smatraju kvalitativno pokretljivima. MacCall i sur. (16) izradili su sličan sustav razvrstavanja prema pokretljivosti na temelju vrijednosti Koc. Osim toga, postoje i sustavi razvrstavanja s obzirom na ispiranje na temelju odnosa između Koc i DT-50 (30) (32)(79).
Istraživanja u kojima je provedena analiza pogrešaka (61) pokazala su da se vrijednosti Kd ispod 0,3 cm3 g-1 ne mogu točno procijeniti iz smanjenja koncentracije u vodenoj fazi, čak i ako se primijeni najpovoljniji (s gledišta točnosti) omjer tlo/otopina tj. 1:1. U tom slučaju se preporučuje analiza obiju faza, tla i otopine.
Uzimajući u obzir gornje napomene, preporučuje se da se istraživanje adsorpcijskog ponašanja kemikalije u tlu i njezinog potencijala pokretljivosti nastavi određivanjem Freundlichovih adsorpcijskih izotermi za ove sustave kod kojih je moguće točno odrediti Kd u skladu s pokusnim protokolom ove ispitne metode. Točno je određivanje moguće ako je vrijednost koja se dobije množenjem Kd s omjerom tlo/otopina > 0,3, ako se mjerenja temelje na smanjenju koncentracije u vodenoj fazi (neizravna metoda), ili > 0,1, ako se analiziraju obje faze (izravna metoda) (61).
1.9.4. 3. razina – adsorpcijske izoterme i kinetika desorpcije/desorpcijske izoterme
1.9.4.1.
Koristi se pet koncentracija ispitivane tvari, koje po mogućnosti obuhvaćaju dva reda veličine; kod izbora tih koncentracija treba uzeti u obzir topljivost u vodi i ravnotežne koncentracije u vodi koje iz tog proizlaze. Omjer tlo/otopina po tlu ne smije se promijeniti tijekom istraživanja. Ispitivanje adsorpcije provodi se na način kako je gore opisano, uz jedinu razliku što se vodena faza analizira samo jedanput u vremenu koje je potrebno da se postigne ravnoteža, kako je određeno gore u 2. razini. Odrede se ravnotežne koncentracije u otopini i izračuna adsorbirana količina na temelju gubitaka ispitivane tvari u otopini ili izravnom metodom. Adsorbirana masa po jedinici mase tla grafički se prikaže kao funkcija ravnotežne koncentracije ispitvane tvari (vidjeti Podaci i izvješćivanje).
Rezultati pokusa s adsorpcijskim izotermama
Freundlichova izoterma je model koji se od svih do sada predloženih matematičkih modela adsorpcije najčešće koristi za opisivanje adsorpcijskih procesa. Detaljnije informacije o tumačenju i važnosti modela adsorpcije mogu se naći u referencama (41)(45)(80)(81)(82).
Napomena: Valja spomenuti da je usporedba vrijednosti KF (Freundlichov koeficijent adsorpcije) za različite tvari moguća samo ako su vrijednosti KF izražene u istim jedinicama (83).
1.9.4.2.
Svrha ovog pokusa je utvrditi je li adsorpcija kemikalije na tlo reverzibilna ili ireverzibilna. Ovaj je podatak važan jer proces desorpcije također igra važnu ulogu u ponašanju kemikalije u tlu. Osim toga, podaci o desorpciji korisni su kod računalnog modeliranja ispiranja i simulacije otjecanja otopljenih tvari. Ako se želi provesti istraživanje desorpcije, preporučuje se da se niže opisano istraživanje provede na svakom sustavu za koji je bilo moguće točno odrediti Kd u prethodnom pokusu s kinetikom adsorpcije.
Kao kod istraživanja kinetike adsorpcije, postoje dvije mogućnosti izvođenja pokusa s kinetikom desorpcije: (a) paralelna metoda i (b) serijska metoda. Izbor metodologije prepušten je izvođaču pokusa, koji treba uzeti u obzir raspoloživa laboratorijska sredstva i resurse.
|
(a) |
Paralelna metoda: za svako odabrano tlo na kojemu će se provesti istraživanje desorpcije pripremi se potreban broj uzoraka s jednakim omjerom tlo/otopina koji odgovara broju vremenskih intervala u kojima će se proučavati kinetika desorpcije. Po mogućnosti treba koristiti iste vremenske intervale kao kod pokusa s kinetikom adsorpcije; ipak, ukupno se vrijeme može prema potrebi produžiti kako bi sustav postigao desorpcijsku ravnotežu. U svaki pokus (jedno tlo, jedna otopina) treba uključiti po jednu slijepu probu. Ona se sastoji od tla i otopine 0,01 M CaCl2, bez ispitivane tvari, jednake mase i volumena kao u pokusu. Kontrolni uzorak s ispitivanom tvari u otopini 0,01 M CaCl2 (bez tla) podvrgava se istom ispitnom postupku. Sve smjese tla i otopine tresu se dok se ne postigne adsorpcijska ravnoteža (kako je određeno gore u 2. razini). Zatim se faze odvoje centrifugiranjem i vodene faze se što je moguće više uklone. Volumen uklonjene otopine zamijeni se jednakim volumenom 0,01 M CaCl2 bez ispitivane tvari i nove se smjese ponovno tresu. Vodena faza iz prve epruvete se što potpunije povrati i izmjeri nakon npr. 2 sata, vodena faza iz druge epruvete mjeri se nakon 4 sata, treće nakon 6 sati itd. dok se ne postigne desorpcijska ravnoteža. |
|
(b) |
Serijska metoda: smjesa se nakon pokusa s kinetikom adsorpcije centrifugira i vodena faza se što je moguće više ukloni. Volumen uklonjene otopine zamijeni se jednakim volumenom 0,01 M CaCl2 bez ispitivane tvari. Nova se smjesa trese do uspostave desorpcijske ravnoteže. Za to se vrijeme smjesa u definiranim vremenskim razmacima centrifugira radi odvajanja faza. Mali alikvot vodene faze se odmah analizira na ispitivanu tvar; zatim se pokus nastavlja s izvornom smjesom. Volumen pojedinačnih alikvota treba biti manji od 1 % ukupnog volumena. Smjesi se doda ista količina svježe otopine 0,01 M CaCl2 radi održavanja omjera tla i otopine te se nastavi s tresenjem do sljedećeg intervala. |
Postotak desorpcije izračuna se u svakom vremenu  i/ili vremenskom intervalu
i/ili vremenskom intervalu 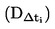 (ovisno o potrebama istraživanja) i grafički se prikaže u ovisnosti o vremenu. Osim toga, izračuna se i koeficijent desorpcije Kdes u ravnoteži. Sve primjenljive jednadžbe navedene su u odjeljku Podaci i izvješćivanje i Dodatku 5.
(ovisno o potrebama istraživanja) i grafički se prikaže u ovisnosti o vremenu. Osim toga, izračuna se i koeficijent desorpcije Kdes u ravnoteži. Sve primjenljive jednadžbe navedene su u odjeljku Podaci i izvješćivanje i Dodatku 5.
Rezultati pokusa s kinetikom desorpcije
Zajednički grafički prikaz postotka desorpcije  i adsorpcije
i adsorpcije  u ovisnosti o vremenu omogućuje procjenu reverzibilnosti procesa adsorpcije. Ako se postigne desorpcijska ravnoteža, makar i u dvostruko dužem vremenu u odnosu na adsorpcijske ravnoteže, i ako je ukupna desorpcija viša od 75 % adsorbirane količine, adsorpcija se smatra reverzibilnom.
u ovisnosti o vremenu omogućuje procjenu reverzibilnosti procesa adsorpcije. Ako se postigne desorpcijska ravnoteža, makar i u dvostruko dužem vremenu u odnosu na adsorpcijske ravnoteže, i ako je ukupna desorpcija viša od 75 % adsorbirane količine, adsorpcija se smatra reverzibilnom.
1.9.4.3.
Freundlichove desorpcijske izoterme određuju se na tlima koja su korištena u pokusu za određivanje adsorpcijskih izotermi. Ispitivanje desorpcije provodi se na način kako je opisano u odjeljku „Kinetika desorpcije”, s jedinom razlikom što se vodena faza analizira samo jedanput – u desorpcijskoj ravnoteži. Izračuna se desorbirana količina ispitivane tvari. Sadržaj ispitivane tvari koji ostane adsorbiran na tlu u desorpcijskoj ravnoteži grafički se prikazuje kao funkcija ravnotežne koncentracije ispitivane tvari u otopini (vidjeti odjeljak Podaci i izvješćivanje i Dodatak 5.).
2. PODACI I IZVJEŠĆIVANJE
Analitički se podaci prikažu u tabličnom obliku (vidjeti Dodatak 6.). Navedu se pojedinačna mjerenja i izračunane prosječne vrijednosti. Prilože se grafički prikazi adsorpcijskih izotermi. Izračuni se provode na način kako je opisano u nastavku.
Za potrebe ovog ispitivanja smatra se da je masa 1 cm3 vodene otopine 1 g. Omjer tlo/otopina može se izraziti u jedinicama w/w ili w/v na istom grafu.
2.1. ADSORPCIJA
Adsorpcija  definirana je kao postotak tvari adsorbiran na tlo u ispitnim uvjetima u odnosu na količinu koja je bila prisutna na početku ispitivanja. Ako je ispitivana tvar stabilna i ne adsorbira se značajno na stijenki posude,
definirana je kao postotak tvari adsorbiran na tlo u ispitnim uvjetima u odnosu na količinu koja je bila prisutna na početku ispitivanja. Ako je ispitivana tvar stabilna i ne adsorbira se značajno na stijenki posude, 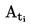 u svakom vremenu ti izračunava se pomoću sljedeće jednadžbe:
u svakom vremenu ti izračunava se pomoću sljedeće jednadžbe:
|
|
(3) |
gdje je:
|
|
= |
postotak adsorpcije u vremenu ti (%); |
|
|
= |
masa ispitivane tvari adsorbirana na tlo u vremenu ti (μg); |
|
m0 |
= |
masa ispitivane tvari u epruveti na početku ispitivanja (μg). |
Detaljne informacije za izračunavanje postotka adsorpcije 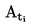 za paralelnu i serijsku metodu nalaze se u Dodatku 5.
za paralelnu i serijsku metodu nalaze se u Dodatku 5.
Koeficijent razdiobe Kd je omjer sadržaja tvari u fazi tla i masene koncentracije tvari u vodenoj otopini u ispitnim uvjetima kad se postigne adsorpcijska ravnoteža.
|
|
(4) |
gdje je:
|
|
= |
sadržaj tvari adsorbiran na tlo u adsorpcijskoj ravnoteži (μg g-1) |
|
|
= |
masena koncentracija tvari u vodenoj fazi u adsorpcijskoj ravnoteži (μg cm-3). Ova se koncentracija određuje analitički, uzimajući u obzir vrijednosti slijepih proba |
|
|
= |
masa tvari adsorbirana na tlo u adsorpcijskoj ravnoteži (μg) |
|
|
= |
masa tvari u otopini u adsorpcijskoj ravnoteži (μg) |
|
msoil |
= |
količina faze tla, izražena u suhoj masi tla (g) |
|
V0 |
= |
početni volumen vodene faze u dodiru s tlom (cm3) |
Odnos između Aeq i Kd iskazuje se kao:
|
|
(5) |
gdje je:
|
Aeq |
= |
postotak adsorpcije u adsorpcijskoj ravnoteži (%) |
Koeficijent adsorpcije normiran na organski ugljik Koc uspostavlja odnos između koeficijenta razdiobe Kd i sadržaja organskog ugljika u uzorku tla:
|
|
(6) |
gdje je:
|
%OC |
= |
postotak organskog ugljika u uzorku tla (g g-1) |
Koeficijent Koc je pojedinačna vrijednost koja opisuje razdiobu uglavnom nepolarnih organskih kemikalija između organskog ugljika u tlu ili sedimentu i vode. Adsorpcija tih kemikalija stavlja se u korelaciju s organskim sadržajem sorbirajuće krute tvari (7); prema tomu, vrijednosti Koc ovise o specifičnim svojstvima huminskih frakcija koje se značajno razlikuju po sorpcijskoj sposobnosti zbog razlika u podrijetlu, genezi itd.
2.1.1. Adsorpcijske izoterme
Jednadžba Freundlichovih adsorpcijskih izotermi uspostavlja odnos između adsorbirane količine ispitivane tvari i koncentracije ispitivane tvari u otopini u ravnoteži (jednadžba (8)).
Podaci se obrade kako je prikazano u odjeljku „Adsorpcija” i za svaku se epruvetu izračuna sadržaj ispitivane tvari adsorbiran na tlo nakon adsorpcijskog testa 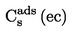 , koji se drugdje označava kao x/m). Pretpostavlja se da je ravnoteža uspostavljena i da
, koji se drugdje označava kao x/m). Pretpostavlja se da je ravnoteža uspostavljena i da  predstavlja ravnotežnu vrijednost:
predstavlja ravnotežnu vrijednost:
|
|
(7) |
Freundlichova adsorpcijska jednadžba prikazana je u (8):
|
|
(8) |
ili u linearnom obliku:
|
|
(9) |
gdje je:
|
|
= |
Freundlichov koeficijent adsorpcije; njegova je dimenzija cm3 g-1, ali samo ako je 1/n = 1; u svim drugim slučajevima u dimenziju |
|
n |
= |
regresijska konstanta; 1/n se obično kreće u području od 0,7 – 1,0 i ukazuje na to da su podaci o sorpciji često blago nelinearni |
Jednadžbe (8) i (9) prikažu se grafički te se izračunaju vrijednosti  i 1/n regresijskom analizom pomoću jednadžbe (9). Također se izračuna koeficijent korelacije r2 logaritamske jednadžbe. Primjer takvoga grafa prikazan je na slici 2.
i 1/n regresijskom analizom pomoću jednadžbe (9). Također se izračuna koeficijent korelacije r2 logaritamske jednadžbe. Primjer takvoga grafa prikazan je na slici 2.

2.1.2. Bilanca mase
Bilanca mase (MB) definirana je kao postotak tvari koji se može analitički izdvojiti nakon adsorpcijskog testa u odnosu na nazivnu količinu tvari na početku ispitivanja.
Obrada podataka razlikuje se ovisno o tomu je li otapalo u potpunosti mješljivo s vodom ili ne. U slučaju otapala mješljivih s vodom, za određivanje količine tvari izdvojene putem ekstrakcije otapalom može se primijeniti obrada podataka opisana u odjeljku „Desorpcija”. Ako je otapalo manje mješljivo s vodom, potrebno je odrediti izdvojenu količinu.
Bilanca mase MB za adsoprciju izračunava se kako je opisano u nastavku; polazi se od pretpostavke da izraz (mE) odgovara zbroju masa ispitivane kemikalije ekstrahiranih iz tla i s površine ispitne posude organskim otapalom:
|
|
(10) |
gdje je:
|
MB |
= |
bilanca mase (%) |
|
mE |
= |
ukupna masa ispitivane tvari ekstrahirana iz tla i sa stijenki ispitne posude u dva koraka (μg) |
|
C0 |
= |
početna masena koncentracija ispitne otopine u dodiru s tlom (μg cm-3) |
|
Vrec |
= |
volumen supernatanta dobiven nakon adsorpcijske ravnoteže (cm-3) |
2.2. DESORPCIJA
Desorpcija (D) se definira kao postotak ispitivane tvari desorbiran u ispitnim uvjetima u odnosu na količinu tvari koja je prethodno adsorbirana:
|
|
(11) |
gdje je:
|
|
= |
postotak desorpcije u vremenu ti (%) |
|
|
= |
masa ispitivane tvari desorbirana iz tla u vremenu ti (μg) |
|
|
= |
masa ispitivane tvari adsorbirana na tlu u adsorpcijskoj ravnoteži (μg) |
Detaljne informacije za izračunavanje postotka desorpcije  za paralelnu i serijsku metodu nalaze se u Dodatku 5.
za paralelnu i serijsku metodu nalaze se u Dodatku 5.
Prividni koeficijent desorpcije (Kdes) u ispitnim uvjetima je omjer sadržaja tvari koji je ostao u fazi tla i masene koncentracije desorbirane tvari u vodenoj otopini kad je postignuta desorpcijska ravnoteža:
|
|
(12) |
gdje je:
|
Kdes |
= |
koeficijent desorpcije (cm3 g-1) |
|
|
= |
ukupna masa ispitivane tvari desorbirana iz tla u desorpcijskoj ravnoteži (μg) |
|
VT |
= |
ukupni volumen vodene faze u dodiru s tlom tijekom ispitivanja kinetike desorpcije (cm3) |
Smjernice za izračun 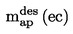 navedene su u Dodatku 5. u rubrici „Desorpcija”.
navedene su u Dodatku 5. u rubrici „Desorpcija”.
Napomena:
Ako je prethodno ispitivanje adsorpcije provedeno paralelnom metodom, smatra se da je volumen VT u jednadžbi (12) jednak V0.
2.2.1. Desorpcijske izoterme
Jednadžba Freundlichovih desorpcijskih izotermi uspostavlja odnos između sadržaja ispitivane tvari koji ostaje adsorbiran na tlu i koncentracije ispitivane tvari u otopini u desorpcijskoj ravnoteži (jednadžba (16)).
Sadržaj tvari koji ostaje adsorbiran na tlu u desorpcijskoj ravnoteži izračunava se za svaku epruvetu na sljedeći način:
|
|
(13) |
 je definiran kao:
je definiran kao:
|
|
(14) |
gdje je:
|
|
= |
sadržaj ispitivane tvari koji ostaje adsorbiran na tlu u desorpcijskoj ravnoteži (μg g-1) |
|
|
= |
masa tvari određena analitički u vodenoj fazi u desorpcijskoj ravnoteži (μg) |
|
|
= |
masa ispitivane tvari preostala nakon adsorpcijske ravnoteže zbog nepotpune zamjene volumena (μg) |
|
|
= |
masa tvari u otopini u adsorpcijskoj ravnoteži (μg) |
|
|
(15) |
|
|
= |
volumen otopine uzet iz epruvete u svrhu mjerenja ispitivane tvari u desorpcijskoj ravnoteži (cm3) |
|
VR |
= |
volumen supernatanta uklonjen iz epruvete nakon uspostave adsorpcijske ravnoteže i zamijenjen istim volumenom otopine 0,01 M CaCl2 (cm3) |
Freundlichova jednadžba desorpcije prikazana je u (16):
|
|
(16) |
ili u linearnom obliku:
|
|
(17) |
gdje je:
|
|
= |
Freundlichov koeficijent desorpcije |
|
n |
= |
regresijska konstanta |
|
|
= |
masena koncentracija tvari u vodenoj fazi u desorpcijskoj ravnoteži (μg cm-3) |
Jednadžbe (16) i (17) mogu se prikazati grafički, a vrijednosti  i 1/n izračunavaju se regresijskom analizom uz pomoć jednadžbe (17).
i 1/n izračunavaju se regresijskom analizom uz pomoć jednadžbe (17).
Napomena:
Ako je Freundlichov eksponent adsorpcije ili desorpcije 1/n jednak 1, tada će Freundlichova adsorpcijska odnosno desorpcijska konstanta vezanja ( i
i  ) biti jednaka konstanti adsorpcijske odnosno desorpcijske ravnoteže (Kd i Kdes) i grafovi Cs u ovisnosti o Caq bit će linearni. Ako eksponenti nisu jednaki 1, grafovi Cs u ovisnosti o Caq bit će nelinearni i konstante adsorpcije i desorpcije će varirati duž izotermi.
) biti jednaka konstanti adsorpcijske odnosno desorpcijske ravnoteže (Kd i Kdes) i grafovi Cs u ovisnosti o Caq bit će linearni. Ako eksponenti nisu jednaki 1, grafovi Cs u ovisnosti o Caq bit će nelinearni i konstante adsorpcije i desorpcije će varirati duž izotermi.
2.2.2. Izvješće o ispitivanju
Izvješće o ispitivanju treba sadržavati sljedeće informacije:
|
— |
potpune podatke o uzorcima tla, uključujući: |
|
— |
geografske koordinate lokaliteta (širina, dužina), |
|
— |
datum uzorkovanja, |
|
— |
način korištenja (npr. poljoprivredno zemljište, šuma itd.), |
|
— |
dubinu uzorkovanja, |
|
— |
sadržaj pijeska/praha/gline, |
|
— |
pH vrijednosti (u 0,01 M CaCl2), |
|
— |
sadržaj organskog ugljika, |
|
— |
sadržaj organske tvari, |
|
— |
sadržaj dušika, |
|
— |
omjer C/N, |
|
— |
kapacitet izmjene kationa (mmol/kg), |
|
— |
sve informacije vezane uz skupljanje i skladištenje uzoraka tla, |
|
— |
prema potrebi, sve relevantne informacije za tumačenje adsorpcije – desorpcije ispitivane tvari, |
|
— |
uputu na metode korištene za određivanje pojedinih parametara, |
|
— |
podatke o ispitivanoj tvari, prema potrebi, |
|
— |
temperaturu pokusa, |
|
— |
uvjete centrifugiranja, |
|
— |
analitički postupak primijenjen za analizu ispitivane tvari, |
|
— |
obrazloženje primjene sredstva za otapanje u pripremi radne otopine ispitivane tvari, |
|
— |
objašnjenje korekcija izračuna, prema potrebi, |
|
— |
podatke iz obrasca za dostavu podataka (Dodatak 6.) i grafičke prikaze, |
|
— |
sve informacije i zapažanja korisna za tumačenje rezultata ispitivanja. |
3. REFERENCE
|
(1) |
Kukowski H. and Brümmer G., (1987) Investigations on the Adsorption and Desorption of Selected Chemicals in Soils. UBA Report 106 02 045, Part II. |
|
(2) |
Fränzle O., Kuhnt G. and Vetter L., (1987) Selection of Representative Soils in the EC-Territory. UBA Report 106 02 045, Part I. |
|
(3) |
Kuhnt G. and Muntau H. (Eds.) EURO-Soils: Identification, Collection, Treatment, Characterisation. Special Publication No 1.94.60, Joint Research Centre. European Commission, ISPRA, December 1994. |
|
(4) |
OECD Test Guidelines Programme, Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italy, 18-20 January 1995 (June 1995). |
|
(5) |
US-Environment Protection Agency: Pesticide Assessment Guidelines, Subdivision N, Chemistry: Environmental Fate, Series 163-1, Leaching and Adsorption/Desorption Studies, Addendum 6 on Data Reporting, 540/09-88-096, Date: 1/1988. |
|
(6) |
US-Environment Protection Agency: Prevention, Pesticides and Toxic Substances, OPPTS Harmonized Test Guidelines, Series 835-Fate, Transport and Transformation Test Guidelines, 0PPTS No: 835.1220 Sediment and Soil Adsorption/Desorption Isotherm. EPA No: 712-C-96-048, April 1996. |
|
(7) |
ASTM Standards, E 1195-85, Standard Test Method for Determining a Sorption Constant (Koc) for an Organic Chemical in Soil and Sediments. |
|
(8) |
Agriculture Canada: Environmental Chemistry and Fate. Guidelines for registration of pesticides in Canada, 15 July 1987. |
|
(9) |
Netherlands Commission Registration Pesticides (1995): Application for registration of a pesticide. Section G. Behaviour of the product and its metabolites in soil, water and air. |
|
(10) |
Danish National Agency of Environmental Protection (October 1988): Criteria for registration of pesticides as especially dangerous to health or especially harmful to the environment. |
|
(11) |
BBA (1990) Guidelines for the Official Testing of Plant Protection Products, Biological Research Centre for Agriculture and Forestry, Braunschweig, Germany. |
|
(12) |
Calvet R., (1989) „Evaluation of adsorption coefficients and the prediction of the mobilities of pesticides in soils”, in Methodological Aspects of the Study of Pesticide Behaviour in Soil (ed. P. Jamet), INRA, Paris, (Review). |
|
(13) |
Calvet R., (1980) „Adsorption-Desorption Phenomena” in Interactions between herbicides and the soil. (R.J. Hance ed.), Academic Press, London, str. 83-122. |
|
(14) |
Hasset J.J., and Banwart W.L., (1989), „The sorption of nonpolar organics by soils and sediments” in Reactions and Movement of Organic Chemicals in Soils. Soil Science Society of America (S.S.S.A), Special Publication No 22, str. 31-44. |
|
(15) |
van Genuchten M. Th., Davidson J.M., and Wierenga P.J., (1974) „An evaluation of kinetic and equilibrium equations for the prediction of pesticide movement through porous media”. Soil Sci. Soc. Am. Proc., Vol. 38(1), str. 29-35. |
|
(16) |
McCall P.J., Laskowski D.A., Swann R.L., and Dishburger H.J., (1981) „Measurement of sorption coefficients of organic chemicals and their use, in environmental fate analysis”, in Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington DC. |
|
(17) |
Lambert S.M., Porter P.E., and Schieferrstein R.H., (1965) „Movement and sorption of chemicals applied to the soil”. Weeds, 13, str. 185-190. |
|
(18) |
Rhodes R.C., Belasco I.J., and Pease H.L., (1970) „Determination of mobility and adsorption of agrochemicals in soils”. J.Agric.Food Chem., 18, str. 524-528. |
|
(19) |
Russell M.H., (1995), „Recommended approaches to assess pesticide mobility in soil” in Environmental Behavior of Agrochemicals (ed. T.R. Roberts and P.C. Kearney). John Wiley & Sons Ltd. |
|
(20) |
Esser H.O., Hemingway R.J., Klein W., Sharp D.B., Vonk J.W. and Holland P.T., (1988) „Recommended approach to the evaluation of the environmental behavior of pesticides”, IUPAC Reports on Pesticides (24). Pure Appl. Chem., 60, str. 901-932. |
|
(21) |
Guth J.A., Burkhard N., and D.O. Eberle, (1976) „Experimental models for studying the persistence of pesticides in soils”. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides, str. 137-157, BCPC, Surrey, UK. |
|
(22) |
Furminge C.G.L., and Osgerby J.M., (1967) „Persistence of herbicides in soil”. J. Sci. Food Agric., 18, str. 269-273. |
|
(23) |
Burkhard N., and Guth J.A., (1981) „Chemical hydrolysis of 2-Chloro-4,6-bis(alkylamino)-1,3,5-triazine herbicides and their breakdown in soil under the influence of adsorption”. Pestic. Sci. 12, str. 45-52. |
|
(24) |
Guth J.A., Gerber H.R., and Schlaepfer T., (1977) „Effect of adsorption, movement and persistence on the biological availability of soil-applied pesticides”. Proc. Br. Crop Prot. Conf., 3, str. 961-971. |
|
(25) |
Osgerby J.M., (1973) „Process affecting herbicide action in soil”. Pestic. Sci., 4, str. 247-258. |
|
(26) |
Guth J.A., (1972) „Adsorptions- und Einwascheverhalten von Pflanzenschutzmitteln in Böden”. Schr. Reihe Ver. Wass. -Boden-Lufthyg. Berlin-Dahlem, Heft 37, str. 143-154. |
|
(27) |
Hamaker J.W., (1975) „The interpretation of soil leaching experiments”, in Environmental Dynamics of Pesticides (eds R. Haque and V.H. freed), str. 135-172, Plenum Press, NY. |
|
(28) |
Helling C.S., (1971) „Pesticide mobility in soils”. Soil Sci. Soc. Amer. Proc., 35, str. 732-210. |
|
(29) |
Hamaker J.W., (1972) „Diffusion and volatilization” in Organic chemicals in the soil environment (C.A.I. Goring and J.W. Hamaker eds), Vol. I, str. 49-143. |
|
(30) |
Burkhard N. and Guth J.A., (1981) „Rate of volatilisation of pesticides from soil surfaces; Comparison of calculated results with those determined in a laboratory model system”. Pestic. Sci. 12, str. 37-44. |
|
(31) |
Cohen S.Z., Creeger S.M., Carsel R.F., and Enfield C.G., (1984) „Potential pesticide contamination of groundwater from agricultural uses”, in Treatment and Disposal of Pesticide Wastes, str. 297-325, Acs Symp. Ser. 259, American Chemical Society, Washington, DC. |
|
(32) |
Gustafson D.I., (1989) „Groundwater ubiquity score: a simple method for assessing pesticide leachability”. J. Environ. Toxic. Chem., 8(4), str. 339-357. |
|
(33) |
Leistra M., and Dekkers W.A., (1976) „Computed effects of adsorption kinetics on pesticide movement in soils”. J. of Soil Sci., 28, str. 340-350. |
|
(34) |
Bromilov R.H., and Leistra M., (1980) „Measured and simulated behavior of aldicarb and its oxydation products in fallow soils”. Pest. Sci., 11, str. 389-395. |
|
(35) |
Green R.E., and Karickoff S.W., (1990) „Sorption estimates for modeling”, in Pesticides in the Soil Environment: Process, Impacts and Modeling (ed. H.H. Cheng). Soil Sci. Soc. Am., Book Series No 2, str. 80-101, |
|
(36) |
Lambert S.M., (1967) „Functional relationship between sorption in soil and chemical structure”. J. Agri. Food Chem., 15, str. 572-576. |
|
(37) |
Hance R.J., (1969) „An empirical relationship between chemical structure and the sorption of some herbicides by soils”. J. Agri. Food Chem., 17, str. 667-668. |
|
(38) |
Briggs G.G. (1969) „Molecular structure of herbicides and their sorption by soils”. Nature, 223, str. 1288. |
|
(39) |
Briggs G.G. (1981) „Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficients, water solubilities, bioconcentration factors, and the parachor”. J. Agric. Food Chem., 29, str. 1050-1059. |
|
(40) |
Sabljic A., (1984) „Predictions of the nature and strength of soil sorption of organic polutance by molecular topology”. J. Agric. Food Chem., 32, str. 243-246. |
|
(41) |
Bailey G.W., and White J.L., (1970) „Factors influencing the adsorption, desorption, and movement of pesticides in soil”. Residue Rev., 32, str. 29-92. |
|
(42) |
Bailey G.W., J.L. White and Y. Rothberg., (1968) „Adsorption of organic herbicides by montomorillonite: Role of pH and chemical character of adsorbate”. Soil Sci. Soc. Amer. Proc. 32, str. 222-234. |
|
(43) |
Karickhoff S.W., (1981) „Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils”. Chemosphere 10, str. 833-846. |
|
(44) |
Paya-Perez A., Riaz M. and Larsen B., (1989) „Soil Sorption of 6 Chlorobenzenes and 20 PCB Congeners”. Environ. Toxicol. Safety 21, str. 1-17. |
|
(45) |
Hamaker J.W., and Thompson J.M., (1972) „Adsorption in organic chemicals” in Organic Chemicals in the Soil Environment (Goring C.A.I. and Hamaker J.W., eds), Vol I and II, Marcel Dekker, Inc., New York, NY, 1972, str. 49-143. |
|
(46) |
Deli J., and Warren G.F., 1971 „Adsorption, desorption and leaching of diphenamid in soils”. Weed Sci. 19, str. 67-69. |
|
(47) |
Chu-Huang Wu, Buehring N., Davinson J.M. and Santelmann, (1975) „Napropamide Adsorption, desorption and Movement in soils”. Weed Science, Vol. 23, str. 454-457. |
|
(48) |
Haues M.H.B., Stacey M., and Thompson J.M., (1968) „Adsorption of s-triazine herbicides by soil organic preparations” in Isotopes and Radiation in Soil Organic Studies, str. 75, International. Atomic Energy Agency, Vienna. |
|
(49) |
Pionke H.B., and Deangelis R.J., (1980) „Methods for distributing pesticide loss in field run-off between the solution and adsorbed phase”, CREAMS, in A Field Scale Model for Chemicals, Run-off and Erosion from Agricultural Management Systems, Chapter 19, Vol. III: Supporting Documentation, USDA Conservation Research report. |
|
(50) |
ISO Standard Compendium Environment: Soil Quality – General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition (1994). |
|
(51) |
Scheffer F., and Schachtschabel, Lehrbuch der Bodenkunde, F. Enke Verlag, Stuttgart (1982) 11th edition. |
|
(52) |
Black, Evans D.D., White J.L., Ensminger L.E., and Clark F.E., eds. „Methods of Soil Analysis”, Vol 1 and 2, American Society of Agronomy, Madison, WI, 1982. |
|
(53) |
ISO/DIS 10381-1 Soil Quality – Sampling – Part 1: Guidance on the design of sampling programmes. |
|
(54) |
ISO/DIS 10381-2 Soil Quality – Sampling – Part 2: Guidance on sampling techniques. |
|
(55) |
ISO/DIS 10381-3 Soil Quality – Sampling – Part 3: Guidance on safety of sampling. |
|
(56) |
ISO/DIS 10381-4 Soil Quality – Sampling – Part 4: Guidance on the investigation of natural and cultivated soils. |
|
(57) |
ISO/DIS 10381-5 Soil Quality – Sampling – Part 5: Guidance on the investigation of soil contamination of urban and industrial sites. |
|
(58) |
ISO 10381-6, 1993: Soil Quality – Sampling – Part 6: Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory. |
|
(59) |
Green R.E., and Yamane V.K., (1970) „Precision in pesticide adsorption measurements”. Soil Sci. Am. Proc., 34, 353-354. |
|
(60) |
Grover R., and Hance R.J. (1970) „Effect of ratio of soil to water on adsorption of linuron and atrazine”. Soil Sci., str. 109-138. |
|
(61) |
Boesten, J.J.T.I, „Influence of soil/liquid ratio on the experimental error of sorption coefficients in pesticide/soil system”. Pest. Sci. 1990, 30, str. 31-41. |
|
(62) |
Boesten, J.J.T.I. „Influence of soil/liquid ratio on the experimental error of sorption coefficients in relation to OECD guideline 106” Proceedings of 5th international workshop on environmental behaviour of pesticides and regulatory aspects, Brussels, 26-29 April 1994. |
|
(63) |
Bastide J., Cantier J.M., et Coste C., (1980) „Comportement de substances herbicides dans le sol en fonction de leur structure chimique”. Weed Res. 21, str. 227-231. |
|
(64) |
Brown D.S., and Flagg E.W., (1981) „Empirical prediction of organic pollutants sorption in natural sediments”. J. Environ.Qual., 10(3), str. 382-386. |
|
(65) |
Chiou C.T., Porter P.E., and Schmedding D.W., (1983) „Partition equilibria of non-ionic organic compounds between soil organic matter and water”. Environ. Sci. Technol., 17(4), str. 227-231. |
|
(66) |
Gerstl Z., and Mingelgrin U., (1984) „Sorption of organic substances by soils and sediments”. J. Environm. Sci. Health, B19 (3), str. 297-312. |
|
(67) |
Vowles P.D., and Mantoura R.F.C., (1987), „Sediment-water partition coefficient and HPLC retention factors of aromatic hydrocarbons”. Chemosphere, 16(1), str. 109-116. |
|
(68) |
Lyman W.J., Reehl W.F.and Rosenblatt D.H. (1990) Handbook of Chemical Property Estimation Methods. Environmental Behaviour of Organic Compounds. American Chemical Society, Washington DC. |
|
(69) |
Keniga E.E., and Goring, C.A.I. (1980) „Relationship between water solubility, soil sorption, octanol-water partitioning and concentration of chemicals in the biota” in Aquatic Toxicology (eds J.G. Eaton, et al.), str. 78-115, ASTM STP 707, Philadelphia. |
|
(70) |
Chiou C.T., Peters L.J., and Freed V.H., (1979) „A physical concept of soil-water equilibria for non-ionic organic compounds”. Science, Vol. 206, str. 831-832. |
|
(71) |
Hassett J.J., Banwart W.I., Wood S.G., and Means J.C., (1981) „Sorption of/-Naphtol: implications concerning the limits of hydrophobic sorption”. Soil Sci. Soc. Am. J. 45, str. 38-42. |
|
(72) |
Karickhoff S.W., (1981), „Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils”. Chemosphere, Vol. 10(8), str. 833-846. |
|
(73) |
Moreale A., van Bladel R., (1981), „Adsorption de 13 herbicides et insecticides par le sol. Relation solubilité – reactivité”. Revue de l’Agric., 34 (4), str. 319-322. |
|
(74) |
Müller M., Kördel W. (1996) „Comparison of screening methods for the determination/estimation of adsorption coefficients on soil”. Chemosphere, 32(12), str. 2493-2504. |
|
(75) |
Kördel W., Kotthoff G., Müller M. (1995) „HPLC – screening method for the determination of the adsorption coefficient on soil – results of a ring test”. Chemosphere 30 (7), str. 1373-1384. |
|
(76) |
Kördel W., Stutte J., Kotthoff G. (1993), „HPLC – screening method for the determination of the adsorption coefficient on soil – comparison of different stationary phases”. Chemosphere 27 (12), str. 2341-2352. |
|
(77) |
Hance, R.J., (1967), „The speed of Attainment of Sorption Equilibria in Some Systems Involving Herbicides”. Weed Research, Vol. 7, str. 29-36. |
|
(78) |
Koskinen W.C., and Harper S.S., (1990), „The retention processes: mechanisms” in Pesticides in the Soil Environment: Processes, Impacts and Modelling (ed. H.H. Cheng). Soil Sci. Soc. Am. Book Series, No 2, Madison, Wisconsin. |
|
(79) |
Cohen S.Z., Creeger S.M., Carsel R.F., and Enfield C.G. (1984), „Potential pesticide contamination of groundwater from agricultural uses”, in Treatment and Disposal of Pesticide Wastes, str. 297-325, ACS Symp. Ser. 259, American Chemical Society, Washington, DC. |
|
(80) |
Giles C.H., (1970) „Interpretation and use of sorption isotherms” in Sorption and Transport Processes in Soils. S.C.I. Monograph No. 37, str. 14-32. |
|
(81) |
Giles, C.H.; McEwan J.H.; Nakhwa, S.N. and Smith, D, (1960) „Studies in adsorption: XI. A system of classification of solution adsorption isotherms and its use in the diagnosis of adsorption mechanisms and in measurements of pesticides surface areas of soils”. J. Chem. Soc., str. 3973-93. |
|
(82) |
Calvet R., Tercé M., and Arvien J.C., (1980) „Adsorption des pesticides par les sols et leurs constituants: 3. Caractéristiques générales de l’adsorption”. Ann. Agron. 31, str. 239-251. |
|
(83) |
Bedbur E., (1996) „Anomalies in the Freundlich equation”, Proc. COST 66 Workshop, Pesticides in soil and the environment, 13-15 May 1996, Stratford-upon-Avon, U.K. |
|
(84) |
Guth, J.A., (1985) „Adsorption/desorption”, in Joint International Symposium, Physicochemical Properties and their Role in Environmental Hazard Assessment, July 1-3, Canterbury, UK. |
|
(85) |
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26, str. 305 (1962). |
Dodatak 1.
Plan ispitivanja
Dodatak 2.
UTJECAJ TOČNOSTI ANALITIČKE METODE I PROMJENE KONCENTRACIJE NA TOČNOST REZULTATA ADSORPCIJE
Iz tablice u nastavku (84) vidljivo je da u slučaju kad je razlika između početne mase (m0 = 110 μg) i ravnotežne mase [ = 100 μg] ispitivane tvari u otopini vrlo mala, 5 %-tna greška u mjerenju ravnotežne koncentracije rezultira 50 %-tnom greškom u izračunu mase tvari adsorbirane u tlu [
= 100 μg] ispitivane tvari u otopini vrlo mala, 5 %-tna greška u mjerenju ravnotežne koncentracije rezultira 50 %-tnom greškom u izračunu mase tvari adsorbirane u tlu [ ] i 52,4 %-tnom greškom u izračunu Kd.
] i 52,4 %-tnom greškom u izračunu Kd.
|
Količina tla |
msoil |
= 10 g |
|
Volumen otopine |
V0 |
= 100 cm3 |
|
|
(μg) |
(μg cm-3) |
R |
(μg) |
(μg g-1) |
R‡ |
Kd* |
R‡ |
|
ZA A = 9 % |
||||||||
|
m0 = 110 μg ili C0 = 1,100 μg/cm3 |
100 |
1,000 |
istinita vrijednost |
10 |
1,00 |
istinita vrijednost |
1 |
|
|
101 |
1,010 |
1 % |
9 |
0,90 |
10 % |
0,891 |
10,9 % |
|
|
105 |
1,050 |
5 % |
5 |
0,50 |
50 % |
0,476 |
52,4 % |
|
|
109 |
1,090 |
9 % |
1 |
0,10 |
90 % |
0,092 |
90,8 % |
|
|
ZA A = 55 % |
||||||||
|
m0 = 110 μg ili C0 = 1,100 μg/cm3 |
50,0 |
0,500 |
istinita vrijednost |
60,0 |
6,00 |
istinita vrijednost |
12,00 |
|
|
50,5 |
0,505 |
1 % |
59,5 |
5,95 |
0,8 % |
11,78 |
1,8 % |
|
|
52,5 |
0,525 |
5 % |
57,5 |
5,75 |
4,0 % |
10,95 |
8,8 % |
|
|
55,0 |
0,550 |
10 % |
55,0 |
5,50 |
8,3 % |
10,00 |
16,7 % |
|
|
ZA A = 99 % |
||||||||
|
m0 = 110 μg ili C0 = 1,100 μg/cm3 |
1,100 |
0,011 |
istinita vrijednost |
108,9 |
10,89 |
istinita vrijednost |
990 |
|
|
1,111 |
0,01111 |
1 % |
108,889 |
10,8889 |
0,01 % |
980 |
1,0 % |
|
|
1,155 |
0,01155 |
5 % |
108,845 |
10,8845 |
0,05 % |
942 |
4,8 % |
|
|
1,21 |
0,0121 |
10 % |
108,790 |
10,8790 |
0,10 |
899 |
9,2 % |
|
|
|
= |
|
|
|
= |
masa ispitivane tvari u fazi tla u ravnoteži, μg |
|
|
= |
masa ispitivane tvari u vodenoj fazi u ravnoteži, μg |
|
|
= |
sadržaj ispitivane tvari u fazi tla u ravnoteži, μg g -1 |
|
|
= |
masena koncentracija ispitivane tvari u vodenoj fazi u ravnoteži, μg cm-3 |
|
R |
= |
analitička greška u određivanju |
|
R‡ |
= |
računska greška zbog analitičke greške R |
Dodatak 3.
TEHNIKE PROCJENE ZA KD
|
1. |
Tehnike procjene omogućuju predviđanje Kd na temelju korelacija npr. s vrijednostima Pow (12)(39)(63-68), podacima o topljivosti u vodi (12)(19)(21)(39)(68-73), podacima o polaritetu dobivenim primjenom HPLC-a na obrnutu fazu (74-76). Koc odnosno Kom izračunavaju se iz jednadžbi kako je prikazano u tablicama 1. i 2., a zatim posredno i Kd iz jednadžbi:
|
|
2. |
Koncept tih korelacija temelji se na dvije pretpostavke: (1) na adsorpciju tvari prvenstveno utječe organska tvar u tlu; i (2) interakcije koje pritom nastaju uglavnom su nepolarne prirode. Prema tomu, ove korelacije: (1) ne mogu se primijeniti ili se mogu samo djelomično primijeniti na polarne tvari i (2) nisu primjenljive u slučajevima kad je sadržaj organske tvari u tlu vrlo malen (12). Osim toga, iako su pronađene zadovoljavajuće korelacije između Pow i adsorpcije (19), to ne vrijedi i za odnos između topljivosti u vodi i obima adsorpcije (19)(21); zasada su istraživanja vrlo kontradiktorna. |
|
3. |
U tablicama 1. i 2. dani su neki primjeri korelacija između koeficijenta adsorpcije i podjelnog koeficijenta oktanol-voda te topljivosti u vodi. Tablica 1. Primjer korelacija između adsorpcijskog koeficijenta razdiobe i podjelnog koefiijenta oktanol-voda; za dodatne primjere vidjeti (12) (68).
Tablica 2. Primjeri korelacija između adsorpcijskog koeficijenta razdiobe i topljivosti u vodi; za dodatne primjere vidjeti (68) (69).
|
Dodatak 4.
IZRAČUNI ZA DEFINIRANJE UVJETA CENTRIFUGIRANJA
|
1. |
Vrijeme centrifugiranja proizlazi iz sljedeće formule, uz pretpostavku sferičnih čestica:
U interesu jednostavnosti svi su parametri opisani u jedinicama različitim od SI jedinica (g, cm). gdje je:
U praksi se općenito primjenjuju dva puta duža vremena od izračunanih kako bi se zajamčilo potpuno odvajanje. |
|
2. |
Jednadžba (1) može se dodatno pojednostavniti ako pretpostavimo da su viskozitet (η) i gustoća (ρaq) otopine jednaki viskozitetu i gustoći vode na 25 °C; prema tomu, η = 8,95 × 10-3 g s-1 cm-1 i ρaq = 1,0 g. cm-3. Tada vrijeme centrifugiranja proizlazi iz jednadžbe (2):
|
|
3. |
Iz jednadžbe (2) vidljivo je da su za definiranje uvjeta centrifugiranja tj. vremena (t) i brzine (rpm tj. o/min), kako bi se postiglo odvajanje čestica određene veličine (u našem slučaju polumjera 0,1 μm), važna dva parametra: (1) gustoća tla i (2) dužina smjese u epruveti za centrifugiranje (Rb-Rt) tj. udaljenost koju čestica tla prelazi od vrha otopine do dna epruvete; očito je da u slučaju definiranog volumena dužina smjese u epruveti ovisi o kvadratu polumjera epruvete. |
|
4. |
Na slici 1. prikazane su promjene vremena centrifugiranja (t) u ovisnosti o brzini centrifugiranja (rpm tj. o/min) za različite gustoće tla (ρs) (Slika 1.a) i različite dužine smjese u epruvetama za centrifugiranje (Slika 2.a). Iz slike 1.a jasno je vidljiv utjecaj gustoće tla; primjerice, kod klasičnog centrifugiranja na 3 000 o/min vrijeme centrifugiranja kod gustoće tla od 1,2 g cm3 je približno 240 minuta, dok kod gustoće tla od 2,0 g cm3 ono iznosi samo 50 minuta. Isto tako, iz slike 1.b vidljivo je da je kod klasičnog centrifugiranja na 3 000 o/min vrijeme centrifugiranja za dužinu smjese od 10 cm približno 50 minuta, dok za dužinu od 1 cm ono iznosi samo 7 minuta. Ipak, važno je pronaći optimalan odnos između centrifugiranja, koje zahtijeva što manju dužinu, i jednostavnosti rukovanja za izvođača pokusa prilikom odvajanja faza nakon centrifugiranja. |
|
5. |
Povrh toga, kod definiranja pokusnih uvjeta za odvajanje faza tlo/otopina važno je uzeti u obzir moguću prisutnost treće „pseudo” faze tj. koloida. Ove čestice veličine ispod 0,2 μm mogu imati važan utjecaj na čitav mehanizam adsorpcije tvari u suspenziji tla. Kad se centrifugiranje provodi na način kako je gore opisano, koloidi ostaju u vodenoj fazi i analiziraju se zajedno s vodenom fazom. Time se gube informacije o njihovom utjecaju. Ako laboratorij ima opremu za ultracentrifugiranje ili ultrafiltraciju, adsorpcija/desorpcija tvari u tlu može se podrobnije ispitati, uključujući adsorpciju tvari na koloide. U tom slučaju treba primijeniti ultracentrifugiranje na 60 000 o/min/min ili ultrafiltraciju uz poroznost filtara od 100 000 daltona kako bi se odijelile sve tri faze: tlo, koloidi i otopina. Ispitni protokol treba u skladu s tim izmijeniti kako bi sve tri faze bile podvrgnute analizi tvari. |
Slika 1.a
Slika 1.b

Dodatak 5.
IZRAČUN ADSOPRCIJE A (%) I DESORPCIJE D (%)
Vremenska shema postupka je:

Kod svih se izračuna polazi od pretpostavke da je ispitivana tvar stabilna i da se ne adsorbira u značajnoj mjeri na stijenkama posude.
ADSORPCIJA A (A %)
(a) Paralelna metoda
Postotak adsorpcije izračunava se za svaku epruvetu (i) u svakom vremenu (ti) prema sljedećoj jednadžbi:
|
|
(1) |
Izrazi iz ove jednadžbe mogu se izračunati ovako:
|
m0 = C0 · V0 (μg) |
(2) |
|
|
(3) |
gdje je:
|
|
= |
postotak adsorpcije (%) u vremenu ti |
|
|
= |
masa ispitivane tvari na tlu u vremenu ti u kojemu se provodi analiza (μg) |
|
m0 |
= |
masa ispitivane tvari u epruveti na početku ispitivanja (μg) |
|
C0 |
= |
početna masena koncentracija ispitne otopine u dodiru s tlom (μg cm-3) |
|
|
= |
masena koncentracija tvari u vodenoj fazi u vremenu ti u kojemu se provodi analiza (μg cm-3); ova se koncentracija određuje analitički, uzimajući u obzir vrijednosti slijepih proba |
|
V0 |
= |
početni volumen ispitne otopine u dodiru s tlom (cm3) |
Vrijednosti postotaka adsorpcije Ati odnosno 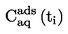 prikažu se grafički u ovisnosti o vremenu i odredi vrijeme nakon kojega je postignuta sorpcijska ravnoteža. Primjeri takvih grafova prikazani se na slikama 1. i 2.
prikažu se grafički u ovisnosti o vremenu i odredi vrijeme nakon kojega je postignuta sorpcijska ravnoteža. Primjeri takvih grafova prikazani se na slikama 1. i 2.


(b) Serijska metoda
Kod jednadžbi u nastavku uzeto je u obzir da se postupak ispitivanja adsorpcije provodi mjerenjima ispitivane tvari u malim alikvotima vodene faze u određenim vremenskim intervalima.
|
Količina tvari adsorbirana na tlo izračunava se u svakom vremenskom intervalu na sljedeći način:
|
Postotak adsorpcije u svakom vremenskom intervalu

izračunava se pomoću sljedeće jednadžbe:
|
|
dok postotak adsorpcije (
Vrijednosti asorpcije |
|
|
U ravnotežnom vremenu teq:
|
Gornji parametri definirani su kao:
|
|
= |
masa tvari adsorbirana na tlo u vremenskim intervalima Δt1, Δt2, …, Δtn (μg) |
|
|
= |
masa tvari izmjerena u alikvotu |
|
|
= |
masa tvari adsorbirana na tlo u adsorpcijskoj ravnoteži (μg) |
|
|
= |
masa tvari u otopini u adsorpcijskoj ravnoteži (μg) |
|
|
= |
volumen alikvota u kojemu se mjeri ispitivana tvar (cm3) |
|
ΑΔti |
= |
postotak adsorpcije koji odgovara vremenskom intervalu Δti (%) |
|
Aeq |
= |
postotak adsorpcije u adsorpcijskoj ravnoteži (%) |
DESORPCIJA D (A %)
Vremenom početka pokusa s kinetikom desorpcije (t0) smatra se trenutak kad se maksimalni dobiveni volumen otopine ispitivane tvari (nakon uspostave adsorpcijske ravnoteže) zamijeni jednakim volumenom otopine 0,01 M CaCl2.
(a) Paralelna metoda
U vremenu ti izmjeri se masa ispitivane tvari u vodenoj fazi uzetoj iz epruvete i ![]() i izračuna desorbirana masa prema sljedećoj jednadžbi:
i izračuna desorbirana masa prema sljedećoj jednadžbi:
|
|
(13) |
U desorpcijskoj ravnoteži ti = teq te je prema tomu
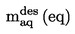
Masa ispitivane tvari desorbirana u vremenskom intervalu (Δti) proizlazi iz sljedeće jednadžbe:
|
|
(14) |
Postotak desorpcije izračunava se:
u vremenu ti pomoću jednadžbe:
|
|
(15) |
a u vremenskom intervalu (Δti) pomoću jednadžbe:
|
|
(16) |
gdje je:
|
|
= |
postotak desorpcije u vremenu ti (%) |
|
|
= |
postotak desorpcije koji odgovara vremenskom intervalu Δti (%) |
|
|
= |
masa ispitivane tvari desorbirana u vremenu ti (μg) |
|
|
= |
masa ispitivane tvari desorbirana u vremenskom intervalu Δti (μg) |
|
|
= |
masa ispitivane tvari izmjerena analitički u vremenu ti u volumenu otopine |
|
|
= |
masa ispitivane tvari preostala nakon adsorpcijske ravnoteže zbog nepotpune zamjene volumena (μg) |
|
|
(17) |
|
|
= |
masa ispitivane tvari u otopini u adsorpcijskoj ravnoteži (μg) |
|
VR |
= |
volumen supernatanta uklonjen iz epruvete nakon uspostave adsorpcijske ravnoteže i zamijenjen istim volumenom otopine 0,01 M CaCl2 (cm3) |
|
|
= |
volumen otopine uzet iz epruvete (i) u svrhu mjerenja ispitivane tvari u pokusu s kinetikom desorpcije (cm3) |
Vrijednosti desorpcije Dti odnosno DΔti (ovisno o potrebama istraživanja) prikažu se grafički u ovisnosti o vremenu i odredi vrijeme nakon kojega je postignuta desorpcijska ravnoteža.
(b) Serijska metoda
Kod jednadžbi u nastavku uzeto je u obzir da je prethodni postupak ispitivanja adsorpcije proveden mjerenjem ispitivane tvari u malim alikvotima  vodene faze (serijska metoda u odjeljku 1.9. „Provođenje ispitivanja”). Polazi se od pretpostavke da: (a) je volumen supernatanta uklonjen iz epruvete nakon pokusa s kinetikom adsorpcije zamijenjen istim volumenom otopine 0,01 M CaCl2 (VR) i (b) ukupni volumen vodene faze u dodiru s tlom (VT) tijekom pokusa s kinetikom desorpcije ostaje nepromijenjen; on proizlazi iz sljedeće jednadžbe:
vodene faze (serijska metoda u odjeljku 1.9. „Provođenje ispitivanja”). Polazi se od pretpostavke da: (a) je volumen supernatanta uklonjen iz epruvete nakon pokusa s kinetikom adsorpcije zamijenjen istim volumenom otopine 0,01 M CaCl2 (VR) i (b) ukupni volumen vodene faze u dodiru s tlom (VT) tijekom pokusa s kinetikom desorpcije ostaje nepromijenjen; on proizlazi iz sljedeće jednadžbe:
|
|
(18) |
U vremenu ti:
|
— |
izmjeri se masa ispitivane tvari u malom alikvotu
|
|
— |
u desorpcijskoj ravnoteži ti = teq te je prema tomu. |
|
— |
postotak desorpcije Dti izračunava se pomoću sljedeće jednadžbe:
|
U vremenskom intervalu (Δti):
u svakom vremenskom intervalu izračuna se desorbirana količina tvari na sljedeći način:
|
— |
za prvi vremenski interval Δt1 = t1 – t0
|
|
— |
za drugi vremenski interval Δt2 = t2 – t1
|
|
— |
za n-ti interval Δtn = tn – tn-1
|
Na kraju se izračuna postotak desorpcije u svakom vremenskom intervalu DΔti prema sljedećoj jednadžbi:
|
|
(24) |
dok postotak desorpcije  u vremenu ti proizlazi iz sljedeće jednadžbe:
u vremenu ti proizlazi iz sljedeće jednadžbe:
|
|
(25) |
gdje su gornji parametri definirani kao:
|
|
= |
masa tvari koja ostaje adsorbirana na tlu nakon vremenskih intervala Δt1, Δt2, …, Δtn (μg) |
||
|
|
= |
masa ispitivane tvari desorbirana u vremenskim intervalima Δt1, Δt2, …, Δtn (μg) |
||
|
|
= |
masa tvari izmjerena u alikvotu |
||
|
VT |
= |
ukupni volumen vodene faze u dodiru s tlom tijekom pokusa s kinetikom desorpcije izvedenog serijskom metodom (cm3) |
||
|
|
= |
masa ispitivane tvari preostala nakon adsorpcijske ravnoteže zbog nepotpune zamjene volumena (μg)
|
||
|
VR |
= |
volumen supernatanta uklonjen iz epruvete nakon uspostave adsorpcijske ravnoteže i zamijenjen istom količinom otopine 0,01 M CaCl2 (cm3) |
||
|
|
= |
volumen alikvota uzetog na analizu iz epruvete (i) tijekom pokusa s kinetikom desorpcije izvedenog serijskom metodom (cm3)
|
Dodatak 6.
ADSORPCIJA/DESORPCIJA U TLIMA: OBRASCI ZA DOSTAVU PODATAKA
Ispitivana tvar:
Ispitivano tlo:
Sadržaj suhe mase tla (105 °C, 12 h): … %
Temperatura: … °C
Prikladnost analitičke metode
|
Izvagana masa tla |
g |
|
|
Tlo: suha masa |
g |
|
|
Volumen otopine CaCl2 |
cm3 |
|
|
Nazivna konc. konačne otopine |
μg cm-3 |
|
|
Analitička konc. konačne otopine |
μg cm-3 |
|
Načelo analitičke metode:
Baždarenje analitičke metode:
Ispitivana tvar:
Ispitivano tlo:
Sadržaj suhe mase tla (105 °C, 12 sati): … %
Temperatura: … °C
|
Primijenjena analitička metodologija: |
Neizravna |
|
Paralelna |
|
Serijska |
|
|
|
Izravna |
|
|
|
|
|
Adsorpcijski test: ispitni uzorci
|
|
Simbol |
Jedinice |
Vrijeme do uspostavljanja ravnoteže |
Vrijeme do uspostavljanja ravnoteže |
Vrijeme do uspostavljanja ravnoteže |
Vrijeme do uspostavljanja ravnoteže |
||||
|
Epruveta br. |
|
|
|
|
|
|
|
|
|
|
|
Izvagana masa tla |
— |
g |
|
|
|
|
|
|
|
|
|
Tlo: suha masa |
msoil |
g |
|
|
|
|
|
|
|
|
|
Volumen vode u izvaganoj masi tla (izračunani) |
VWS |
cm3 |
|
|
|
|
|
|
|
|
|
Volumen otopine 0,01 M CaCl2 za ekvilibraciju tla |
|
cm3 |
|
|
|
|
|
|
|
|
|
Volumen radne otopine |
|
cm3 |
|
|
|
|
|
|
|
|
|
Ukupni volumen vodene faze u dodiru s tlom |
V0 |
cm3 |
|
|
|
|
|
|
|
|
|
Početna koncentracija ispitne otopine |
C0 |
μg cm-3 |
|
|
|
|
|
|
|
|
|
Masa ispitivane tvari na početku ispitivanja |
m 0 |
μg |
|
|
|
|
|
|
|
|
|
Nakon tresenja i centrifugiranja |
||||||||||
|
NEIZRAVNA METODA |
||||||||||
|
Paralelna metoda |
||||||||||
|
Koncentracija ispitivane tvari u vodenoj fazi, uklj. ispravak za vrijednost slijepe probe |
|
μg cm-3 |
|
|
|
|
|
|
|
|
|
Serijska metoda |
||||||||||
| Izmjerena masa ispitivane tvari u alikvotu
|
|
μg |
|
|
|
|
|
|
|
|
|
IZRAVNA METODA |
||||||||||
|
Masa ispitivane tvari adsorbirana na tlo |
|
μg |
|
|
|
|
|
|
|
|
|
Izračun adsorpcije |
||||||||||
|
Adsorpcija |
|
% |
|
|
|
|
|
|
|
|
|
|
|
% |
|
|
|
|
|
|
|
|
|
Srednje vrijednosti |
|
|
|
|
|
|
||||
|
Koeficijent adsorpcije |
Kd |
cm3 g-1 |
|
|
|
|
|
|
|
|
|
Srednje vrijednosti |
|
|
|
|
|
|
||||
|
Koeficijent adsorpcije |
Kco |
cm3 g-1 |
|
|
|
|
|
|
|
|
|
Srednje vrijednosti |
|
|
|
|
|
|
||||
Ispitivana tvar:
Ispitivano tlo:
Sadržaj suhe mase tla (105 °C, 12 sati): … %
Temperatura: … °C
Adsorpcijski test: slijepe probe i kontrola
|
|
Simbol |
Jedinice |
Slijepa proba |
Slijepa proba |
Kontrola |
|||
|
Epruveta br. |
|
|
|
|
|
|
|
|
|
Izvagana masa tla |
|
g |
|
|
|
|
0 |
0 |
|
Količina vode u izvaganoj masi tla (izračunana) |
|
cm3 |
|
|
|
|
— |
— |
|
Dodani volumen otopine 0,01 M CaCl2 |
|
cm3 |
|
|
|
|
|
|
|
Dodani volumen radne otopine ispitivane tvari |
|
cm3 |
0 |
0 |
|
|
|
|
|
Ukupni volumen vodene faze (izračunani) |
|
cm3 |
|
|
|
|
— |
— |
|
Početna koncentracija ispitivane tvari u vodenoj fazi |
|
μg cm-3 |
|
|
|
|
|
|
|
Nakon tresenja i centrifugiranja |
||||||||
|
Koncentracija u vodenoj fazi |
|
μg cm-3 |
|
|
|
|
|
|
Napomena: prema potrebi dodati stupce
Ispitivana tvar:
Ispitivano tlo:
Sadržaj suhe mase tla (105 °C, 12 sati): … %
Temperatura: … °C
Bilanca mase
|
|
Simbol |
Jedinice |
|
|
|
|
|
Epruveta br. |
|
|
|
|
|
|
|
Izvagana masa tla |
— |
g |
|
|
|
|
|
Tlo: suha masa |
msoil |
g |
|
|
|
|
|
Volumen vode u izvaganoj masi tla (izračunani) |
VWS |
ml |
|
|
|
|
|
Volumen otopine 0,01 M CaCl2 za ekvilibraciju tla |
|
ml |
|
|
|
|
|
Volumen radne otopine |
|
cm3 |
|
|
|
|
|
Ukupni volumen vodene faze u dodiru s tlom |
V0 |
cm3 |
|
|
|
|
|
Početna koncentracija ispitne otopine |
C0 |
μg cm-3 |
|
|
|
|
|
Vrijeme do uspostavljanja ravnoteže |
— |
h |
|
|
|
|
|
Nakon tresenja i centrifugiranja |
||||||
|
Koncentracija ispitivane tvari u vodenoj fazi u adsorpcijskoj ravnoteži, uklj. ispravak za vrijednost slijepe probe |
|
μg cm-3 |
|
|
|
|
|
Vrijeme do uspostavljanja ravnoteže |
teq |
h |
|
|
|
|
|
1. razrjeđivanje otapalom |
||||||
|
Uklonjeni volumen vodene faze |
Vrec |
cm3 |
|
|
|
|
|
Dodani volumen otapala |
ΔV |
cm3 |
|
|
|
|
|
1. ekstrakcija otapalom |
||||||
|
Signal analiziran u otapalu |
SE1 |
var. |
|
|
|
|
|
Konc. ispitivane tvari u otapalu |
CE1 |
μg cm-3 |
|
|
|
|
|
Masa tvari ekstrahirana iz tla i sa stijenki posude |
mE1 |
μg |
|
|
|
|
|
2. razrjeđivanje otapalom |
||||||
|
Uklonjeni volumen otapala |
ΔVs |
cm3 |
|
|
|
|
|
Dodani volumen otapala |
ΔV’ |
cm3 |
|
|
|
|
|
2. ekstrakcija otapalom |
||||||
|
Signal analiziran u fazi otapala |
SE2 |
var. |
|
|
|
|
|
Konc. ispitivane tvari u otapalu |
CE2 |
μg cm-3 |
|
|
|
|
|
Masa tvari ekstrahirana iz tla i sa stijenki posude |
mE2 |
μg |
|
|
|
|
|
Ukupna masa ispitivane tvari ekstrahirana u dva koraka |
mE |
μg |
|
|
|
|
|
Bilanca mase |
MB |
% |
|
|
|
|
Ispitivana tvar:
Ispitivano tlo:
Sadržaj suhe mase tla (105 °C, 12 sati): … %
Temperatura: … °C
Adsorpcijske izoterme
|
|
Simbol |
Jedinice |
|
|
|
|
|
|
|
|
|
Epruveta br. |
|
|
|
|
|
|
|
|
|
|
|
Izvagana masa tla |
— |
g |
|
|
|
|
|
|
|
|
|
Tlo: suha masa |
E |
g |
|
|
|
|
|
|
|
|
|
Volumen vode u izvaganoj masi tla (izračunani) |
VWS |
cm3 |
|
|
|
|
|
|
|
|
|
Volumen otopine 0,01 M CaCl2 za ekvilibraciju tla |
|
cm3 |
|
|
|
|
|
|
|
|
|
Dodani volumen radne otopine |
|
cm3 |
|
|
|
|
|
|
|
|
|
Ukupni volumen vodene faze u dodiru s tlom (izračunani) |
V0 |
cm3 |
|
|
|
|
|
|
|
|
|
Koncentracija otopine |
C0 |
μg cm-3 |
|
|
|
|
|
|
|
|
|
Vrijeme do uspostavljanja ravnoteže |
— |
h |
|
|
|
|
|
|
|
|
|
Nakon tresenja i centrifugiranja |
||||||||||
|
Koncentracija tvari u vodenoj fazi, uklj. ispravak za vrijednost slijepe probe |
|
μg cm-3 |
|
|
|
|
|
|
|
|
|
Temperatura |
|
°C |
|
|
|
|
|
|
|
|
|
Adsorbirana masa po jedinici tla |
|
μg g-1 |
|
|
|
|
|
|
|
|
Regresijska analiza:
KF ads vrijednost:
vrijednost 1/n:
regresijski koeficijent r2:
Ispitivana tvar:
Ispitivano tlo:
Sadržaj suhe mase tla (105 °C, 12 sati): … %
Temperatura: … °C
|
Primijenjena analitička metodologija: |
Neizravna |
|
Paralelna |
|
Serijska |
|
Desorpcijski test
|
|
Simbol |
Jedinice |
Vremenski interval |
Vremenski interval |
Vremenski interval |
Vremenski interval |
|
|
Broj epruvete iz adsorpcijskog koraka |
|
|
|
|
|
|
|
|
Masa tvari adsorbirana na tlo u adsorpcijskoj ravnoteži |
|
μg |
|
|
|
|
|
|
Uklonjeni volumen vodene faze zamijenjen s 0,01 M CaCl2 |
VR |
cm3 |
|
|
|
|
|
|
Ukupni volumen vodene faze u dodiru s tlom |
PM |
V0 |
cm3 |
|
|
|
|
|
SM |
VT |
cm3 |
|
|
|
|
|
|
Masa ispitivane tvari preostala nakon adsorpcijske ravnoteže zbog nepotpune zamjene volumena |
|
μg |
|
|
|
|
|
|
Kinetika desorpcije |
|||||||
|
Izmjerena masa tvari desorbirana iz tla u vremenu ti |
|
μg |
|
|
|
|
|
|
Volumen otopine uzet iz epruvete (i) u svrhu mjerenja ispitivane tvari |
PM |
Vr i |
cm3 |
|
|
|
|
|
SM |
Va D |
cm3 |
|
|
|
|
|
|
Masa tvari desorbirana iz tla u vremenu ti (izračunana) |
|
μg |
|
|
|
|
|
|
Masa tvari desorbirana iz tla u vremenskom intervalu Δti (izračunana) |
|
μg |
|
|
|
|
|
|
Postotak desorpcije |
|||||||
|
Desorpcija u vremenu ti |
Dti |
% |
|
|
|
|
|
|
Desorpcija u vremenskom intervalu Δti |
|
% |
|
|
|
|
|
|
Prividni koeficijent desorpcije |
Kdes |
|
|
|
|
|
|
PM: paralelna metoda
SM: serijska metoda
C.19. PROCJENA KOEFICIJENTA ADSORPCIJE (Koc) NA TLO I KANALIZACIJSKI MULJ PRIMJENOM TEKUĆINSKE KROMATOLOGIJE VISOKE DJELOTVORNOSTI (HPLC)
1. METODA
Ova metoda odgovara smjernici OECD TG121 (2001.).
1.1. UVOD
Sorpcijsko ponašanje tvari u tlu i kanalizacijskom mulju može se opisati parametrima koji se određuju pokusima u skladu s ispitnom metodom C.18. Važan parametar je koeficijent adsorpcije, koji se definira kao omjer koncentracije tvari u tlu/mulju i koncentracije tvari u vodenoj fazi u adsorpcijskoj ravnoteži. Koeficijent adsorpcije normiran na sadržaj organskog ugljika tla Koc koristan je pokazatelj sposobnosti vezanja kemikalije na organsku tvar u tlu i kanalizacijskom mulju i omogućuje usporedbe između različitih kemikalija. Ovaj se parametar može procijeniti korelacijama s topljivošću u vodi i podjelnim koeficijentom n-oktanol/voda (1)(2)(3)(4)(5)(6)(7).
HPLC se u pokusnoj metodi iz ovog testa koristi za procjenu koeficijenta adsorpcije Koc u tlu i kanalizacijskom mulju (8). Procjene pokazuju veću pouzdanost od onih koje se dobiju izračunima QSAR (9). Kao metoda procjene on ne može u potpunosti zamijeniti šaržne pokuse u ravnoteži koji se koriste u ispitnoj metodi C.18. Ipak, procijenjeni Koc može biti koristan za odabir ispitnih parametara za istraživanja adsorpcije/desorpcije u skladu s ispitnom metodom C.18. primjenom jednadžbe (3) za izračuavanje Kd (koeficijent razdiobe) ili Kf (Freundlichov koeficijent adsorpcije) (vidjeti odjeljak 1.2.).
1.2. DEFINICIJE
Kd: koeficijent razdiobe definiran je kao omjer ravnotežnih koncentracija C ispitivane tvari otopljene u dvofaznom sustavu koji se sastoji od sorbensa (tlo ili kanalizacijski mulj) i vodene faze; to je bezdimenzionalna vrijednost ako se koncentracije u obje faze izražavaju kao omjer masa/masa. Ako se koncentracija u vodenoj fazi izražava kao omjer masa/volumen, jedinice su ml· g-1. Kd može biti različit ovisno o svojstvima sorbensa i može ovisiti o koncentraciji.
|
|
(1) |
gdje je:
|
Csoil |
= |
koncentracija ispitivane tvari u tlu u ravnoteži (μg· g-1) |
|
Csludge |
= |
koncentracija ispitivane tvari u mulju u ravnoteži (μg· g-1) |
|
Caq |
= |
koncentracija ispitivane tvari u vodenoj razi u ravnoteži (μg· g-1, μg· ml-1). |
Kf: Freundlichov koeficijent adsorpcije definiran je kao koncentracija ispitivane tvari u tlu odnosno kanalizacijskom mulju (x/m) kad je ravnotežna koncentracija Caq u vodenoj fazi jednaka jedan; jedinice su μg·g-1 sorbensa. Vrijednost se može razlikovati ovisno o svojstvima sorbensa.
|
|
(2) |
gdje je:
|
x/m |
= |
količina ispitivane tvari x (μg) adsorbirana na količinu sorbensa m (g) u ravnoteži |
|
1/n |
= |
nagib Freundlichove adsorpcijske izoterme |
|
Caq |
= |
koncentracija ispitivane tvari u vodenoj fazi u ravnoteži (μg· ml- 1) |

Koc: koeficijent razdiobe (Kd) ili Freundlichov koeficijent adsorpcije (Kf) normiran na sadržaj organskog ugljika (foc) sorbensa; on je, posebno kod neioniziranih kemikalija, približni pokazatelj obima adsorpcije između tvari i sorbensa i omogućuje usporedbe između različitih kemikalija. Ovisno o dimenzijama Kd i Kf, Koc može biti bezdimenzionalan ili se izražavati u jedinicama ml· g-1 ili μg· g-1 organske tvari.
|
|
(3) |
Odnos između Koc i Kd nije uvijek linearan, tako da se vrijednosti Koc mogu razlikovati ovisno o vrsti tla, ali je njihova varijabilnost znatno smanjena u odnosu na vrijednosti Kd i Kf.
Koeficijent adsorpcije (Koc) izvodi se iz faktora kapaciteta (k’) uz pomoć baždarnoga grafa log k’ u ovisnosti o log Koc odabranih referentnih spojeva.
|
|
(4) |
gdje je:
|
tR |
= |
vrijeme zadržavanja ispitivane i referentne tvari iz HPLC-a (minute) |
|
t0 |
= |
mrtvo vrijeme HPLC-a (minute) (vidjeti odjeljak 1.8.2.) |
Pow: Podjelni koeficijent oktanol-voda definiran je kao omjer koncentracija tvari otopljene u n-oktanolu i vodi; to je bezdimenzionalna vrijednost.
|
|
(5) |
1.3. REFERENTNE TVARI
Prije primjene metode treba biti poznata strukturna formula, čistoća i konstanta disocijacije (prema potrebi). Također su korisne informacije o topljivosti u vodi i organskim otapalima, podjelnom koeficijentu oktanol-voda i hidrolitičkim svojstvima.
Za uspostavu korelacije između izmjerenih podataka o zadržavanju ispitivane tvari iz HPLC-a i njezinog koeficijenta adsorpcije Koc treba izraditi baždarni graf log Koc u ovisnosti o log k’. Potrebno je najmanje šest referentnih točaka, od čega najmanje jedna iznad i jedna ispod očekivane vrijednosti za ispitivanu tvar. Točnost metode se značajno poboljšava ako su referentne tvari strukturno srodne s ispitivanom tvari. Ako ti podaci nisu raspoloživi, korisnik sam treba odabrati odgovarajuće baždarne tvari. U tom slučaju treba odabrati općenitiji skup strukturno heterogenih tvari. Tvari i vrijednosti Koc koje se mogu koristiti navedene su u Dodatku, i to u tablici 1. za kanalizacijski mulj i u tablici 3. za tlo. Ako se koriste druge baždarne tvari, treba navesti obrazloženje.
1.4. NAČELO ISPITNE METODE
HPLC se provodi na analitičkim kolonama koje su napunjene komercijalno dostupnom krutom fazom cijanopropila koja sadrži lipofilne i polarne dijelove. Koristi se umjereno polarna nepokretna faza sa silika matricom:
|
— O — Si |
— CH2 — CH2 — CH2 |
— CN |
|
silika |
nepolarna razmaknica |
polarni dio |
Načelo ispitne metode slično je kao kod ispitne metode A.8. (podjelni koeficijent, metoda HPLC). Dok ispitivana tvar prolazi kroz kolonu s pokretnom fazom dolazi do interakcije između ispitivane tvari i nepokretne faze. Uslijed podjele između pokretne i nepokretne faze ispitivana tvar zaostaje. Dvojni sastav nepokretne faze, s polarnim i nepolarnim mjestima, omogućuje interakciju polarnih i nepolarnih skupina molekule na sličan način kao što je to slučaj kod organske tvari u matricama tla ili kanalizacijskog mulja. To omogućuje utvrđivanje odnosa između vremena zadržavanja na koloni i koeficijenta adsorpcije na organsku tvar.
pH ima značajan utjecaj na sorpcijsko ponašanje, posebno kod polarnih tvari. Kod poljoprivrednih tala i spremnika postrojenja za pročišćivanje otpadnih voda pH se obično kreće između 5,5 i 7,5. Kod ionizirajućih tvari treba provesti dva ispitivanja, s ioniziranim i neioniziranim oblikom u odgovarajućim puferskim otopinama, ali samo u slučajevima kad najmanje 10 % ispitivanog spoja disocira u području pH 5,5 do 7,5.
Budući da se za ocjenjivanje koristi samo odnos između zadržavanja na koloni HPLC i koeficijenta adsorpcije, nije potrebna kvantitativna analitička metoda, već samo treba odrediti vrijeme zadržavanja. Ako je raspoloživ prikladan skup referentnih tvari i ako se mogu primijeniti standardni pokusni uvjeti, ova metoda omogućuje brzu i učinkovitu procjenu koeficijenta adsorpcije Koc.
1.5. PRIMJENLJIVOST TESTA
Metoda HPLC može se primijeniti na kemikalije (neobilježene i obilježene) za koje je raspoloživ odgovarajući detekcijski sustav (npr. spektrofotometar, detektor radioaktivnosti) i koje su dovoljno stabilne u vremenu trajanja pokusa. Ona posebno može biti korisna u slučaju kemikalija koje se teško ispituju u drugim pokusnim sustavima (tj. hlapljive tvari, tvari koje nisu topljive u vodi u koncentraciji koja se može analitički mjeriti, tvari s visokim afinitetom prema površini inkubacijskih sustava). Metoda se može koristiti u slučaju smjesa koje daju nerazlučljive eluacijske pikove. U tom slučaju treba navesti gornje i donje granice vrijednosti log Koc spojeva ispitne smjese.
Nečistoće ponekad mogu stvarati poteškoće kod tumačenja rezultata HPLC-a, ali one nisu posebno značajne dok god se ispitivana tvar može analitički jasno identificirati i odijeliti od nečistoća.
Ova je metoda validirana za tvari iz tablice 1. u Dodatku, a korištena je i kod raznih drugih kemikalija iz sljedećih razreda kemikalija:
|
— |
aromatski amini (npr. trifluralin, 4-kloranilin, 3,5-dinitroanilin, 4-metilanilin, N-metilanilin, 1-naftilamin), |
|
— |
aromatski esteri karboksilne kiseline (npr. metilni ester benzojeve kiseline, etilni ester 3,5-dinitrobenzojeve kiseline), |
|
— |
aromatski ugljikovodici (npr. toluen, ksilen, etilbenzen, nitrobenzen), |
|
— |
esteri ariloksifenoksipropionske kiseline (npr. diklofop-metil, fenoksaprop-etil, fenoksaprop-P-etil), |
|
— |
fungicidi iz skupine benzimidazola i imidazola (npr. karbendazim, fuberidazol, triazoksid), |
|
— |
amidi karboksilne kiseline (npr. 2-klorobenzamid, N,N-dimetilbenzamid, 3,5-dinitrobenzamid, N-metilbenzamid, 2-nitrobenzamid, 3-nitrobenzamid), |
|
— |
klorirani ugljikovodici (npr. endosulfan, DDT, heksaklorbenzen, kvintozen, 1,2,3-triklorbenzen), |
|
— |
organofosforni insekticidi (npr. azinfos-metil, disulfoton, fenamifos, izofenfos, pirazofos, sulprofos, triazofos), |
|
— |
fenoli (npr. fenol, 2-nitrofenol, 4-nitrofenol, pentaklorfenol, 2,4,6-triklorfenol, 1-naftol), |
|
— |
derivati feniluree (npr. izoproturon, monolinuron, pencikuron), |
|
— |
pigmentna bojila (npr. Acid Yellow 219, Basic Blue 41, Direct Red 81), |
|
— |
poliaromatski ugljikovodici (npr. acenaftalen, naftalen), |
|
— |
1,3,5-triazinski herbicidi (npr. prometrin, propazin, simazin, terbutrin), |
|
— |
derivati triazola (npr. tebukonazol, triadimefon, tradimenol, triapentenol). |
Metoda se ne može primijeniti kod tvari koje reagiraju s eluentom ili nepokretnom fazom. Osim toga, nije primjenljiva niti na tvari kod kojih se javljaju specifične interakcije s anorganskim komponentama (npr. stvaranje „klaster” kompleksa s mineralima glina). Ona se također može pokazati nedjelotvornom kod površinski aktivnih tvari, anorganskih spojeva i umjerenih ili jakih organskih kiselina i baza. Mogu se odrediti vrijednosti log Koc u području od 1,5 do 5,0. Ionizirajuće se tvari moraju mjeriti pomoću puferirane pokretne faze, ali treba paziti da ne dođe do taloženja puferskih komponenti i ispitivane tvari.
1.6. KRITERIJI KAKVOĆE
1.6.1. Točnost
Koeficijent adsorpcije ispitivane tvari se u pravilu može procijeniti u granicama +/- 0,5 log jedinica vrijednosti određene metodom šaržnog ispitivanja u ravnoteži (vidjeti tablicu 1. u Dodatku). Veća se točnost može postići korištenjem referentnih tvari koje su strukturno srodne s ispitivanom tvari.
1.6.2. Ponovljivost
Potrebna su barem dvostruka određivanja. Vrijednosti log Koc izvedene iz pojedinih mjerenja moraju se kretati unutar područja od 0,25 log jedinica.
1.6.3. Obnovljivost
Dosadašnja iskustva s primjenom metode podupiru njezinu valjanost. Ispitivanjem metode HPLC uz primjenu 48 tvari (većinom pesticidi) za koje su bili raspoloživi pouzdani podaci o Koc na tlo dobiven je koeficijent korelacije R = 0,95 (10)(11).
U svrhu poboljšanja i validacije metode provedeno je međulaboratorijsko poredbeno ispitivanje u kojemu je sudjelovalo 11 laboratorija (12). Rezultati su navedeni u tablici 2. u Dodatku.
1.7. OPIS ISPITNE METODE
1.7.1. Preliminarna procjena koeficijenta adsorpcije
Podjelni koeficijent oktanol-voda Pow (= Kow) i, u određenoj mjeri, topljivost u vodi mogu poslužiti kao pokazatelji obima adsorpcije, posebno kod neioniziranih tvari, te se stoga mogu koristiti za preliminarno određivanje raspona. Objavljene su različite korisne korelacije za nekoliko skupina kemikalija (1)(2)(3)(4)(5)(6)(7).
1.7.2. Aparatura
Potreban je tekućinski kromatograf opremljen bespulsnom pumpom i prikladnim detektorom. Preporučuje se korištenje ventila za ubrizgavanje s injekcijskom petljom. Treba koristiti komercijalne kemijski vezane cijanopropilne smole na bazi silike (npr. Hypersil i Zorbax CN). Između sustava za ubrizgavanje i analitičke kolone može se postaviti predkolona od istog materijala. Kolone različitih dobavljača mogu se značajno razlikovati prema učinkovitosti odvajanja. Za orijentaciju, kad se kao pokretna faza koristi metanol/voda 55/45 %, treba postići sljedeće faktore kapaciteta k’: log k’ > 0,0 za log Koc = 3,0 i log k’ > — 0,4 za log Koc = 2,0.
1.7.3. Pokretne faze
Ispitano je više pokretnih faza, a preporučuju se ove dvije:
|
— |
metanol/voda (55/45 % v/v), |
|
— |
metanol/0,01 M citratni pufer pH 6,0 (55/45 % v/v). |
Za pripremu eluacijskog otapala koristi se metanol kromatografske čistoće (HPLC) i destilirana voda ili citratni pufer. Smjesa se prije uporabe otplini. Treba primijeniti izokratičku eluaciju. Ako smjese metanol/voda nisu prikladne, mogu se iskušati druge smjese organsko otapalo/voda, npr. etanol/voda ili acetonitril/voda. Kod ionizirajućih se tvari preporučuje korištenje puferske otopine za stabilizaciju pH. Treba paziti da ne dođe do taloženja soli i propadanja kolone, što se može dogoditi kod nekih smjesa organska faza/pufer.
Ne smiju se koristi dodaci kao što su reagensi s ionskim parovima jer oni mogu utjecati na sorpcijska svojstva nepokretne faze. Takve promjene nepokretne faze mogu biti ireverzibilne. Stoga se pokusi u kojima se koriste dodaci moraju obvezatno provoditi na zasebnim kolonama.
1.7.4. Otopljene tvari
Ispitivane i referentne tvari treba otopiti u pokretnoj fazi.
1.8. PROVOĐENJE ISPITIVANJA
1.8.1. Ispitni uvjeti
Tijekom mjerenja treba bilježiti temperaturu. Preporučuje se korištenje uređaja s termostatiranom dijelom za kolone kako bi se zajamčili stalni uvjeti za vrijeme baždarenja, procjena i mjerenja ispitivane tvari.
1.8.2. Određivanje mrtvog vremena to
Za određivanje mrtvog vremena to mogu se koristiti dvije različite metode (vidjeti i odjeljak 1.2.).
1.8.2.1. Određivanje mrtvog vremena to putem homolognog niza
Pokazalo se da ovaj postupak daje pouzdane i standardizirane vrijednosti to. Za detalje vidjeti ispitnu metodu A.8.: Podjelni koeficijent (n-oktanol/voda), metoda HPLC.
1.8.2.2. Određivanje mrtvog vremena pomoću inertnih tvari koje kolona ne zadržava
Ova se tehnika temelji na ubrizgavanju otopina formamida, uree ili natrijevog nitrata. Potrebna su barem dvostruka mjerenja.
1.8.3. Određivanje vremena zadržavanja tR
Referentne tvari treba odabrati na način kako je opisano u odjeljku 1.3. One se za potrebe određivanja vremena zadržavanja mogu ubrizgati kao miješani standard, ako je potvrđeno da na vrijeme zadržavanja pojedinačnih referentnih standarda ne utječe prisutnost drugih referentnih standarda. Baždarenje treba provoditi najmanje dvaput dnevno u redovitim razmacima, kako bi se mogle objasniti neočekivane promjene u radu kolone. Baždarna ubrizgavanja je najbolje provoditi prije i nakon ubrizgavanja ispitivane tvari, kako bi se isključili pomaci u vremenu zadržavanja. Ispitivane se tvari ubrizgaju odvojeno u što manjim količinama (kako bi se izbjeglo preopterećenje kolone) te se odrede njihova vremena zadržavanja.
Da bi se povećala pouzdanost mjerenja, treba provoditi barem dvostruka određivanja. Vrijednosti log Koc izvedene iz pojedinih mjerenja moraju se kretati unutar područja od 0,25 log jedinica.
1.8.4. Ocjenjivanje
Faktori kapaciteta k’ izračunavaju se iz mrtvog vremena to i vremena zadržavanja tR odabranih referentnih tvari pomoću jednadžbe 4 (vidjeti odjeljak 1.2.). Zatim se podaci log k’ referentnih tvari prikažu grafički u odnosu prema vrijednostima log Koc iz šaržnih pokusa u ravnoteži, koje su navedene u tablici 1. i 3. u Dodatku. Nakon toga se uz pomoć dobivenoga grafa vrijednost log Koc određuje iz vrijednosti log k’ ispitivane tvari. Ako stvarni rezultati pokazuju da se log Koc ispitivane tvari nalazi izvan baždarnog područja, ispitivanje treba ponoviti koristeći druge, primjerenije referentne tvari.
2. PODACI I IZVJEŠĆIVANJE
Izvješće o ispitivanju mora sadržavati sljedeće informacije:
|
— |
identitet i čistoću ispitivanih i referentnih tvari te, prema potrebi, vrijednosti pKa, |
|
— |
opis opreme i radnih uvjeta, npr. tip i dimenzije analitičke kolone (i predkolone), detekcijsko sredstvo, pokretnu fazu (omjer komponenti i pH), temperaturno područje tijekom mjerenja, |
|
— |
mrtvo vrijeme i metodu pomoću koje je određeno, |
|
— |
količine ispitivanih i referentnih tvari uvedene u kolonu, |
|
— |
vremena zadržavanja referentnih spojeva koji su korišteni za baždarenje, |
|
— |
podatke o prilagođenom regresijskom pravcu (log k’/log Koc) i graf regresijskog pravca, |
|
— |
prosječne podatke o zadržavanju i procijenjenu vrijednost d log Koc za ispitivani spoj, |
|
— |
kromatograme. |
3. REFERENCE
|
(1) |
W.J. Lyman, W.F. Reehl, D.H. Rosenblatt (ed), (1990) Handbook of chemical property estimation methods, chapt. 4, McGraw-Hill, New York. |
|
(2) |
J. Hodson, N.A. Williams, (1988) The estimation of the adsorption coefficient (Koc) for soils by HPLC. Chemosphere, 17, str. 167. |
|
(3) |
G.G. Briggs, (1981) Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficients, water solubilities, bioconcentration factors, and the parachor. J. Agric. Food Chem., 29, str. 1050-1059. |
|
(4) |
C.T. Chiou, P.E. Porter, D.W. Schmedding, (1983) Partition equilibria of nonionic organic compounds between soil organic matter and water. Environ. Sci. Technol., 17, str. 227-231. |
|
(5) |
Z. Gerstl, U. Mingelgrin (1984) Sorption of organic substances by soils and sediment. J. Environm. Sci. Health, B19, str. 297-312. |
|
(6) |
C.T. Chiou, L.J. Peters, V. H. Freed, (1979) A physical concept of soil water equilibria for nonionic organic compounds, Science, 106, str. 831-832. |
|
(7) |
S.W. Karickhoff, (1981) Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils. Chemosphere, 10, str. 833-846. |
|
(8) |
W. Kördel, D. Hennecke, M. Herrmann, (1997) Application of the HPLC-screening method for the determination of the adsorption coefficient on sewage sludges. Chemosphere, 35(1/2), str. 121-128. |
|
(9) |
M. Mueller, W. Kördel (1996) Comparison of screening methods for the estimation of adsorption coefficients on soil. Chemosphere, 32(12), str. 2493-2504. |
|
(10) |
W. Kördel, J. Stutte, G. Kotthoff (1993) HPLC-screening method for the determination of the adsorption coefficient in soil-comparison of different stationary phases, Chemosphere, 27(12), str. 2341-2352. |
|
(11) |
B. von Oepen, W. Kördel, W. Klein (1991) Sorption of nonpolar and polar compounds to soils: Processes, measurements and experience with the applicability of the modified OECD Guideline 106, Chemosphere, 22, str. 285-304. |
|
(12) |
W. Kördel, G. Kotthoff, J. Müller (1995) HPLC-screening method for the determination of the adsorption coefficient on soil-results of a ring test. Chemosphere, 30(7), str. 1373-1384. |
Dodatak
Tablica 1.
Usporedba vrijednosti Koc za tla i kanalizacijske muljeve i vrijednosti izračunanih pomoću orijentacijske („screening”) metode HPLC (31) (32)
|
tvar |
CAS br. |
log Koc kanalizacijski muljevi |
log Koc HPLC |
Δ |
log Koc tla |
log Koc HPLC |
Δ |
|
Atrazin |
1912-24-9 |
1,66 |
2,14 |
0,48 |
1,81 |
2,20 |
0,39 |
|
Linuron |
330-55-2 |
2,43 |
2,96 |
0,53 |
2,59 |
2,89 |
0,30 |
|
Fention |
55-38-9 |
3,75 |
3,58 |
0,17 |
3,31 |
3,40 |
0,09 |
|
Monuron |
150-68-5 |
1,46 |
2,21 |
0,75 |
1,99 |
2,26 |
0,27 |
|
Fenantren |
85-01-8 |
4,35 |
3,72 |
0,63 |
4,09 |
3,52 |
0,57 |
|
Fenilester benzojeve kiseline |
93-99-2 |
3,26 |
3,03 |
0,23 |
2,87 |
2,94 |
0,07 |
|
Benzamid |
55-21-0 |
1,60 |
1,00 |
0,60 |
1,26 |
1,25 |
0,01 |
|
4-nitrobenzamid |
619-80-7 |
1,52 |
1,49 |
0,03 |
1,93 |
1,66 |
0,27 |
|
Acetanilid |
103-84-4 |
1,52 |
1,53 |
0,01 |
1,26 |
1,69 |
0,08 |
|
Anilin |
62-53-3 |
1,74 |
1,47 |
0,27 |
2,07 |
1,64 |
0,43 |
|
2,5-dikloranilin |
95-82-9 |
2,45 |
2,59 |
0,14 |
2,55 |
2,58 |
0,03 |
Tablica 2.
Rezultati međulaboratorijskog poredbenog ispitivanja (uz sudjelovanje 11 laboratorija) provedenog u svrhu poboljšanja i validacije metode HPLC (33)
|
tvar |
CAS br. |
log Koc |
Koc |
log Koc |
|
[OECD 106] |
[metoda HPLC] |
|||
|
Atrazin |
1912-24-9 |
1,81 |
78 ± 16 |
1,89 |
|
Monuron |
150-68-5 |
1,99 |
100 ± 8 |
2,00 |
|
Triapentenol |
77608-88-3 |
2,37 |
292 ± 58 |
2,47 |
|
Linuron |
330-55-2 |
2,59 |
465 ± 62 |
2,67 |
|
Fention |
55-38-9 |
3,31 |
2062 ± 648 |
3,31 |
Tablica 3.
Preporučene referentne tvari za orijentacijsku („screening”) metodu HPLC na temelju podataka o adsorpciji na tlo
|
Referentna tvar |
CAS br. |
srednje vrijednosti log Koc iz šaržnog ispitivanja u ravnoteži |
broj podataka Koc |
log S.D. |
izvor |
|
Acetanilid |
103-84-4 |
1,25 |
4 |
0,48 |
|
|
Fenol |
108-95-2 |
1,32 |
4 |
0,70 |
|
|
2-nitrobenzamid |
610-15-1 |
1,45 |
3 |
0,90 |
|
|
N.N-dimetilbenzamid |
611-74-5 |
1,52 |
2 |
0,45 |
|
|
4-metilbenzamid |
619-55-6 |
1,78 |
3 |
1,76 |
|
|
Metilbenzoat |
93-58-3 |
1,80 |
4 |
1,08 |
|
|
Atrazin |
1912-24-9 |
1,81 |
3 |
1,08 |
|
|
Izoproturon |
34123-59-6 |
1,86 |
5 |
1,53 |
|
|
3-nitrobenzamid |
645-09-0 |
1,95 |
3 |
1,31 |
|
|
Anilin |
62-53-3 |
2,07 |
4 |
1,73 |
|
|
3,5-dinitrobenzamid |
121-81-3 |
2,31 |
3 |
1,27 |
|
|
Karbendazim |
10605-21-7 |
2,35 |
3 |
1,37 |
|
|
Triadimenol |
55219-65-3 |
2,40 |
3 |
1,85 |
|
|
Triazoksid |
72459-58-6 |
2,44 |
3 |
1,66 |
|
|
Triazofos |
24017-47-8 |
2,55 |
3 |
1,78 |
|
|
Linuron |
330-55-2 |
2,59 |
3 |
1,97 |
|
|
Naftalen |
91-20-3 |
2,75 |
4 |
2,20 |
|
|
Endosulfan-diol |
2157-19-9 |
3,02 |
5 |
2,29 |
|
|
Metiokarb |
2032-65-7 |
3,10 |
4 |
2,39 |
|
|
Acid Yellow 219 |
63405-85-6 |
3,16 |
4 |
2,83 |
|
|
1,2,3-triklorbenzen |
87-61-6 |
3,16 |
4 |
1,40 |
|
|
γ-HCH |
58-89-9 |
3,23 |
5 |
2,94 |
|
|
Fention |
55-38-9 |
3,31 |
3 |
2,49 |
|
|
Direct Red 81 |
2610-11-9 |
3,43 |
4 |
2,68 |
|
|
Pirazofos |
13457-18-6 |
3,65 |
3 |
2,70 |
|
|
α-endosulfan |
959-98-8 |
4,09 |
5 |
3,74 |
|
|
Diklofop-metil |
51338-27-3 |
4,20 |
3 |
3,77 |
|
|
Fenantren |
85-01-8 |
4,09 |
4 |
3,83 |
|
|
Basic Blue 41 (smjesa) |
26850-47-5 12270-13-2 |
4,89 |
4 |
4,46 |
|
|
DDT |
50-29-3 |
5,63 |
1 |
— |
C.20. TEST REPRODUKTIVNE TOKSIČNOSTI NA VRSTI DAPHNIA MAGNA
1. METODA
Ova metoda ispitivanja reproduktivne toksičnosti odgovara smjernici OECD TG 211 (1998.).
1.1. UVOD
Primarni cilj ovog testa je ocijeniti učinak kemikalija na reprodukcijsku uspješnost vrste Daphnia magna.
1.2. DEFINICIJE I JEDINICE
Roditeljska životinja: ženke Daphnia koje su prisutne na početku ispitivanja i čija je reprodukcijska uspješnost predmet istraživanja.
Potomstvo: mlade dafnije dobivene od roditeljskih životinja u tijeku ispitivanja.
Najniža koncentracija s vidljivim učinkom (LOEC): najniža ispitana koncentracija kod koje je unutar navedenog razdoblja izlaganja zabilježen statistički značajan učinak tvari na reprodukciju i roditeljsku smrtnost (pri p < 0,05) u usporedbi s kontrolom. Ipak, sve ispitne koncentracije iznad LOEC-a moraju imati jednak ili veći štetan učinak od onog koji je zabilježen pri LOEC-u. Ako se ova dva uvjeta ne mogu zadovoljiti, treba detaljno objasniti kako je odabran LOEC (a prema tomu i NOEC).
Najviša koncentracija bez vidljivog učinka (NOEC): ispitna koncentracija neposredno ispod LOEC-a koja unutar navedenog razdoblja izlaganja nema statistički značajan učinak (p < 0,05) u usporedbi s kontrolom.
ECx: koncentracija ispitivane tvari otopljene u vodi koja rezultira x %-tnim smanjenjem reprodukcije Daphnia magna unutar navedenog razdoblja izlaganja.
Prirodni prirast: mjera rasta populacije koja objedinjuje reprodukcijsku uspješnost i dobno specifičnu smrtnost (20)(21)(22). On će kod populacija u stabilnom stanju biti jednak nuli. Kod rastućih populacija bit će pozitivan, a kod populacija koje se smanjuju negativan. Jasno je da ova posljednja situacija nije održiva i vodi ka izumiranju.
Granica detekcije: najniža koncentracija koja se može utvrditi, ali ne i kvantificirati.
Granica određivanja: najniža koncentracija koja se može kvantitativno izmjeriti.
Smrtnost: životinja se bilježi kao mrtva kad je nepomična tj. kad ne može plivati odnosno ako nema vidljivih kretnji privjesaka ili postabdomena unutar 15 sekundi nakon nježnog mućkanja ispitnog spremnika. (Ako se koristi druga definicija, treba je navesti zajedno s izvorom.)
1.3. NAČELO ISPITNE METODE
Mlade ženke Daphnia (roditeljske životinje), koje su na početku ispitivanja mlađe od 24 sata, izlažu se ispitivanoj tvari dodanoj u vodu u određenom rasponu koncentracija. Ispitivanje traje 21 dan. Na kraju ispitivanja ocjenjuje se ukupni broj živih potomaka po roditeljskoj životinji koja je živa na kraju ispitivanja. To znači da se potomci odraslih životinja koje uginu tijekom ispitivanja izuzima iz obračuna. Reprodukcijska uspješnost roditeljskih životinja može se izraziti i na druge načine (npr. broj živih potomaka po životinji i danu od prvog dana kad je zabilježeno potomstvo), ali to treba navesti dodatno uz ukupni broj mladih po roditeljskoj životinji koja je živa na kraju ispitivanja. Reprodukcijska uspješnost životinja izloženih ispitivanoj tvari uspoređuje se s kontrolom odnosno kontrolama da bi se odredila najniža koncentracija s vidljivim učinkom (LOEC), a time i najviša koncentracija bez vidljivog učinka (NOEC). Ako je to moguće, ti se podaci analiziraju i uz pomoć regresijskog modela radi procjene koncentracije koja bi izazvala x %-tno smanjenje reprodukcijske uspješnosti (tj. EC50, EC20 odnosno EC10).
Osim toga, potrebno je navesti preživljavanje roditeljskih životinja i vrijeme do pojave prvog legla. Mogu se ispitati i drugi učinci tvari na parametre kao što je rast (npr. dužina) i eventualno prirodni prirast.
1.4. INFORMACIJE O ISPITIVANOJ TVARI
Trebaju biti raspoloživi rezultati ispitivanja akutne toksičnosti (vidjeti metodu C.2. dio I.) provedenog na vrsti Daphnia magna. Taj rezultat može biti koristan za odabir odgovarajućeg raspona ispitnih koncentracija u ispitivanjima reproduktivne toksičnosti. Treba biti poznata topljivost u vodi i tlak pare ispitivane tvari i biti raspoloživa pouzdana analitička metoda za kvantifikaciju tvari u ispitnim otopinama s dokumentiranim iskorištenjem i granicom određivanja.
Informacije o ispitivanoj tvari koje mogu biti korisne kod određivanja ispitnih uvjeta su strukturna formula, čistoća tvari, stabilnost na svjetlosti, stabilnost u uvjetima ispitivanja, pKa, Pow i rezultati ispitivanja na laku biorazgradivost (vidjeti metodu C.4.).
1.5. VALJANOST ISPITIVANJA
Da bi ispitivanje bilo valjano, kontrole moraju zadovoljavati sljedeće provedbene kriterije:
|
— |
smrtnost roditeljskih životinja (ženke Daphnia) na kraju ispitivanja ne smije biti viša od 20 %, |
|
— |
prosječni broj živih potomaka po roditeljskoj životinji koja je živa na kraju ispitivanja je ≥ 60. |
1.6. OPIS ISPITNE METODE
1.6.1. Aparatura
Ispitne posude i druga aparatura koja dolazi u dodir s ispitnim otopinama mora biti u cijelosti izrađena od stakla ili drugog kemijski inertnog materijala. Ispitne posude su u pravilu staklene laboratorijske čaše.
Osim toga, potrebna je sljedeća oprema (djelomično ili u cijelosti):
|
— |
mjerač kisika (s mikroelektrodom ili drugom prikladnim uređajem za mjerenje otopljenog kisika u uzorcima malog volumena), |
|
— |
odgovarajući uređaj za regulaciju temperature, |
|
— |
mjerač pH vrijednosti, |
|
— |
oprema za određivanje tvrdoće vode, |
|
— |
oprema za određivanje koncentracije ukupnog organskog ugljika (TOC) u vodi ili oprema za određivanje kemijske potrošnje kisika (KPK), |
|
— |
odgovarajući uređaji za regulaciju režima rasvjete i mjerenje intenziteta svjetlosti. |
1.6.2. Ispitni organizmi
U testu se koristi vrsta Daphnia magna Straus. Mogu se koristiti i druge vrste Daphnia pod uvjetom da zadovoljavaju odgovarajuće kriterije valjanosti (kriterij valjanosti koji se odnosi na reprodukcijsku uspješnost u kontrolama treba biti značajan za vrstu). Ako se koriste druge vrste dafnija, njih treba jasno identificirati i obrazložiti njihovo korištenje.
Poželjno je da klon bude identificiran genotipizacijom. Istraživanja (1) su pokazala da reprodukcijska uspješnost klona A (koji je potekao od IRCHA u Francuskoj) (3) redovito zadovoljava uvjet valjanosti od prosječno ≥ 60 potomaka po preživjeloj roditeljskoj životinji ako se uzgaja u uvjetima opisanim u ovoj metodi. Ipak, prihvatljivi su i drugi klonovi ako se dokaže da kultura dafnija zadovoljava kriterije valjanosti ispitivanja.
Na početku ispitivanja životinje moraju biti mlađe od 24 sata i ne smiju biti potomstvo iz prvog legla. One trebaju potjecati iz zdravog nasada (tj. ne smiju pokazivati znakove stresa, kao što je visoka smrtnost, prisutnost mužjaka i efipija, zakašnjelo davanje prvog potomstva, životinje promijenjene boje itd.). Matične životinje treba držati u uzgojnim uvjetima (svjetlost, temperatura, medij, hranjenje i broj životinja po jedinici volumena) koji su sličini uvjetima ispitivanja. Ako će se u ispitivanju koristiti uzgojni medij koji se ne koristi u uobičajenom uzgoju dafnija, treba predvidjeti razdoblje aklimatizacije uoči ispitivanja, u pravilu od oko tri tjedna (tj. jedna generacija), kako roditeljske životinje ne bi bile izložene stresu.
1.6.3. Ispitni medij
Preporučuje se da se kod ovog ispitivanja koristi potpuno definirani medij. Time se može izbjeći korištenje dodataka (npr. morske trave, ekstrakt tla itd.) koje je teško opisati i tako poboljšati izgledi za standardizaciju između laboratorija. Pokazalo se da su za to prikladni mediji Elendt M4 (4) i M7 (vidjeti Dodatak 1.). Ipak, prihvatljivi su i drugi mediji (npr. (5)(6)) pod uvjetom da se dokaže da značajke kulture dafnija zadovoljavaju kriterije valjanosti ispitivanja.
Ako se koriste mediji koji sadrže nedefinirane dodatke, te dodatke treba jasno specificirati i u izvješću o ispitivanju navesti podatke o sastavu, posebno s obzirom na sadržaj ugljika budući da on može sudjelovati u ishrani. Preporučuje se da se odredi ukupni organski ugljik (TOC) i/ili kemijska potrošnja kisika (KPK) radnog pripravka organskog dodatka i napravi procjena doprinosa TOC-u/KPK-u u ispitnom mediju. Preporučuje se da razine TOC-a u mediju (tj. prije dodavanja algi) budu ispod 2 mg/l (7).
Kod ispitivanja tvari koje sadrže metale treba imati na umu da svojstva ispitnog medija (npr. tvrdoća, sposobnost kelatiranja) mogu utjecati na toksičnost ispitivane tvari. Iz tog je razloga poželjno koristiti potpuno definirani medij. Međutim, trenutačno su jedini poznati potpuno definirani mediji koji su prikladni za dugoročni uzgoj Daphnia magna Elendt M4 i M7. Oba medija sadrže kelatno sredstvo EDTA. Ispitivanja su pokazala (2) da je „prividna toksičnost” kadmija općenito niža kad se ispitivanje reproduktivne toksičnosti provodi u mediju M4 i M7 nego u medijima koji ne sadrže EDTA. Stoga se M4 i M7 ne preporučuju za ispitivanje tvari koje sadrže metale, a treba izbjegavati i druge medije koji sadrže poznata kelatna sredstva. Kod tvari koje sadrže metale možda bi bilo uputno koristiti alternativni medij, kao što je npr. obrađena tvrda slatka voda po ASTM-u (7) s dodatkom ekstrakta morskih trava koja ne sadrži EDTA (8). Ova kombinacija obrađene tvrde slatke vode po ASTM-u i ekstrakta morskih trava prikladna je i za dugoročni uzgoj i ispitivanje Daphnia magna (2), iako još uvijek pokazuje blago kelatno djelovanje zbog organske komponente u dodanom ekstraktu morskih trava.
Na početku i tijekom ispitivanja koncentracija otopljenog kisika treba biti iznad 3 mg/l. pH vrijednost treba biti u području 6 – 9 i u pravilu ne bi smjela odstupati više od 1,5 jedinica tijekom jednog ispitivanja. Preporučuje se tvrdoća iznad 140 mg/l (kao CaCO3). Kod ispitivanja s ovim i višim vrijednostima postignuta je reproduktivna uspješnost u skladu s kriterijima valjanosti (9)(10).
1.6.4. Ispitne otopine
Ispitne otopine odabranih koncentracija obično se pripremaju razrjeđivanjem radne otopine. Poželjno je da se radne otopine pripreme otapanjem tvari u ispitnom mediju.
U pojedinim je slučajevima potrebno koristiti organska otapala i dispergente da bi se dobila prikladna koncentracija radne otopine; ipak, treba na sve načine nastojati izbjeći korištenje tih materijala. Primjeri prikladnih otapala su aceton, etanol, metanol, dimetilformamid i trietilenglikol. Primjeri prikladnih dispergenata su Cremophor RH40, metilceluloza 0,01 % i HCO-40. U svakom slučaju, ispitivana tvar u ispitnim otopinama ne smije prijeći granicu topljivosti u ispitnom mediju.
Otapala se koriste za dobivanje radne otopine koja se može točno dozirati u vodu. U preporučenoj koncentraciji otapala u konačnom ispitnom mediju (tj. ≤ 0,1 ml/l) gore navedena otapala neće biti toksična i neće povećati vodotopljivost tvari.
Dispergenti mogu pomoći da se postigne točno doziranje i disperzija. U preporučenoj koncentraciji u konačnom ispitnom mediju (tj. ≤ 0,1 ml/l) gore navedeni dispergenti neće biti toksični i neće povećati vodotopljivost tvari.
1.7. PLAN ISPITIVANJA
Nakon što se obrade podijele po ispitnim posudama svako postupanje s ispitnim posudama treba se odvijati na slučajan način. U protivnome se može javiti pristranost koja bi se mogla tumačiti kao učinak koncentracije. Konkretno, ako se pokusnim jedinicama rukuje po redu obrade odnosno koncentracije, neki vremenski utjecaj, kao što je zamor ispitivača ili neka druga greška, može dovesti do većih učinaka pri višim koncentracijama. Nadalje, ako bi na rezultate ispitivanja mogao utjecati neki početni uvjet ili uvjet okoline, kao što je položaj u laboratoriju, treba ramisliti o formiranju blokova.
1.8. POSTUPAK
1.8.1. Uvjeti izlaganja
1.8.1.1. Trajanje
Ispitivanje traje 21 dan.
1.8.1.2. Punjenje
Roditeljske se životinje drže pojedinačno tj. po jedna u svakoj ispitnoj posudi s 50-100 ml medija.
Ponekad su potrebni i veći volumeni da bi se ispunili zahtjevi analitičkog postupka koji se koristi za određivanje koncentracije ispitivane tvari, iako je za kemijsku analizu dopušteno i objedinjavanje ponavljanja. Ako se koriste volumeni iznad 100 ml, treba povećati količinu hrane koja se daje dafnijama da bi se osigurala primjerena raspoloživost hrane i usklađenost s kriterijima valjanosti. Kod protočnih ispitivanja mogu se iz tehničkih razloga razmotriti i alternativne koncepcije (npr. četiri skupine po 10 životinja u većem volumenu), s time da sve promjene plana ispitivanja treba dokumentirati.
1.8.1.3. Broj životinja
Kod polustatičkih ispitivanja treba pojedinačno držati najmanje 10 životinja po ispitnoj koncentraciji i još najmanje 10 životinja u kontrolnim nizovima.
Pokazalo se da je kod protočnih ispitivanja prikladno koristiti 40 životinja podijeljenih u četiri skupine po 10 životinja pri svakoj ispitnoj koncentraciji (1). Može se koristiti i manji broj ispitnih organizama, a preporučuje se najmanje 20 životinja po koncentraciji, podijeljenih u dva ili više ponavljanja s jednakim brojem životinja (npr. četiri ponavljanja s po pet dafnija). Treba napomenuti da u slučaju ispitivanja gdje se životinje drže u skupinama reprodukcijsku uspješnost nije moguće izraziti kao ukupni broj živih potomaka po roditeljskoj životinji koja je živa na kraju ispitivanja ako dođe do uginuća roditeljskih životinja. U tom slučaju reprodukcijsku uspješnost treba izraziti kao „ukupni broj živih potomaka po roditeljskoj životinji koja je prisutna na početku ispitivanja”.
1.8.1.4. Hranjenje
Poželjno je da se kod polustatičkih ispitivanja hranjenje obavlja svakodnevno, a najmanje triput tjedno (tj. u skladu s promjenama medija). Svako odstupanje (npr. kod protočnih ispitivanja) treba dokumentirati.
Ishrana roditeljskih životinja tijekom ispitivanja treba se po mogućnosti sastojati od živih stanica algi jedne ili više od sljedećih vrsta: Chlorella sp, Selenastrum capricornutum (sada Pseudokirchneriella subcapitata (11)) i Scenedesmus subspicatus. Ishranu treba temeljiti na količini organskog ugljika (C) koja se osigurava svakoj roditeljskoj životinji. Istraživanja (12) su pokazala da su za vrstu Daphnia magna količine hrane između 0,1 i 0,2 mg C/dafnija/dan dovoljne da se postigne broj potomaka koji je potreban da se ispune kriteriji valjanosti ispitivanja. Količina hrane može biti ujednačena tijekom čitavog razdoblja ispitivanja ili se, po želji, na početku može davati manja količina i zatim povećavati tijekom ispitivanja, uzimajući u obzir rast roditeljskih životinja. Ipak, i u tom slučaju količina hrane treba u svakom trenutku biti unutar preporučenog raspona od 0,1 – 0,2 mg C/dafnija/dan.
Ako se za određivanje potrebne količine hrane koriste zamjenske mjere, kao što je broj stanica algi ili apsorbancija svjetlosti (iz praktičnih razloga, jer mjerenje sadržaja ugljika zahtijeva dosta vremena), svaki laboratorij mora izraditi vlastiti nomogram odnosa zamjenske mjere i sadržaja ugljika u kulturi algi (za savjet u pogledu izrade nomograma vidjeti Dodatak 2.). Nomograme treba provjeravati najmanje jedanput godišnje odnosno češće ako je došlo do promjene uvjeta u uzgoju kulture algi. Pokazalo se da je apsorbancija svjetlosti bolja zamjena za sadržaj ugljika od broja stanica (13).
Dafnije treba hraniti koncentriranom suspenzijom algi kako bi volumen medija kulture algi koji se prenosi u ispitne posude bio što manji. Koncentracija algi može se postići centrifugiranjem i resuspendiranjem u destiliranoj vodi, deioniziranoj vodi ili uzgojnom mediju za dafnije.
1.8.1.5. Svjetlost
16-satno osvjetljenje intenziteta do najviše 15 – 20 μΕ· m-2·s-1.
1.8.1.6. Temperatura
Temperatura ispitnog medija treba biti unutar područja 18–22 °C. Ipak, odstupanja temperature tijekom jednog ispitivanja ne bi smjela biti viša od 2 °C unutar tih granica (npr. 18–20, 19–21 ili 20–22 °C). Ponekad je potrebno uvesti dodatnu ispitnu posudu za praćenje temperature.
1.8.1.7. Dozračivanje
Ispitne posude se tijekom ispitivanja ne smiju dozračivati.
1.8.2. Ispitna koncentracija
U pravilu treba biti najmanje pet ispitnih koncentracija raspoređenih u geometrijskom nizu uz faktor koji po mogućnosti nije viši od 3,2. te treba koristiti odgovarajući broj ponavljanja za svaku ispitnu koncentraciju (vidjeti odjeljak 1.8.1.3.). Ako se koristi manje od pet koncentracija, treba navesti obrazloženje. Tvari se ne smiju ispitivati iznad granice topljivosti u ispitnom mediju.
Kod određivanja raspona koncentracija treba voditi računa o sljedećemu:
|
Ako je cilj dobiti LOEC/NOEC, najniža ispitna koncentracija mora biti dovoljno niska da plodnost pri toj koncentraciji ne bude značajno niža od kontrolne. Ako to nije slučaj, ispitivanje se mora ponoviti sa sniženom najnižom koncentracijom. |
|
Ako je cilj dobiti LOEC/NOEC, najviša ispitna koncentracija mora biti dovoljno visoka da plodnost pri toj koncentraciji bude značajno niža od kontrolne. Ako to nije slučaj, ispitivanje se mora ponoviti s povišenom najvišom koncentracijom. |
|
Ako se procjenjuje ECx za učinke na reprodukciju, preporučljivo je koristiti dovoljne koncentracije kako bi se ECx mogao definirati s potrebnom razinom pouzdanosti. Ako se procjenjuje EC50 za učinke na reprodukciju, preporučljivo je da najviša ispitna koncentracija bude viša od tog EC50. U protivnome će interval pouzdanosti za EC50 biti vrlo širok (iako će se još uvijek moći procijeniti) pa možda neće biti moguće na zadovoljavajući način ocijeniti prikladnost prilagođenog modela. |
|
Raspon ispitnih koncentracija po mogućnosti ne bi smio obuhvaćati koncentracije koje imaju statistički značajan učinak na preživljavanje odraslih životinja jer bi se time jednostavni test reproduktivne toksičnosti pretvorio u kombinirani test reproduktivne toksičnosti i smrtnosti, koji zahtijeva mnogo složeniju statističku analizu. |
Prethodno znanje o toksičnosti ispitivane tvari (npr. iz ispitivanja akutne toksičnosti i/ili istraživanja za određivanje raspona) trebalo bi pomoći u odabiru odgovarajućih ispitnih koncentracija.
Ako se kao pomoć u pripremi ispitnih otopina koristi otapalo ili dispergent (vidjeti odjeljak 1.6.4.), njegova konačna koncentracija u ispitnim posudama ne smije biti viša od 0,1 ml/l i treba biti jednaka u svim ispitnim posudama.
1.8.3. Kontrole
Uz ispitni niz potreban je jedan kontrolni niz s isptinim medijem te, prema potrebi, jedan kontrolni niz koji sadrži otapalo ili dispergent. Ako se koristi otapalo ili dispergent, njihova koncentracija treba biti ista kao u posudama koje sadrže ispitivanu tvar. Treba koristiti odgovarajući broj ponavljanja (vidjeti odjeljak 1.8.1.3.).
Općenito, kod dobro provedenog ispitivanja koeficijent varijacije oko srednje vrijednosti broja živih potomaka po roditeljskoj životinji u kontroli odnosno kontrolama treba biti ≤ 25 % i to treba dokumentirati kod planova ispitivanja gdje se životinje drže pojedinačno.
1.8.4. Obnavljanje ispitnog medija
Učestalost obnavljanja medija ovisi o stabilnosti ispitivane tvari, ali ga u svakom slučaju treba obnoviti najmanje tri puta tjedno. Ako su preliminarna ispitivanja stabilnosti (vidjeti odjeljak 1.4.) pokazala da koncentracija ispitivane tvari nije stabilna (tj. izvan područja 80–120 % nazivne koncentracije ili pada ispod 80 % izmjerene početne koncentracije) u najdužem roku obnavljanja (tj. 3 dana), treba razmotriti mogućnost češćeg obnavljanja medija ili primjene protočnog ispitivanja.
Kod obnavljanja medija u polustatičkim ispitivanjima treba pripremiti drugi niz ispitnih posuda i u njih premjestiti roditeljske životinje, primjerice staklenom pipetom prikladnog promjera. Volumen medija koji se prenosi s dafnijama treba biti što je moguće manji.
1.8.5. Promatranja
Rezultate promatranja tijekom ispitivanja treba upisati u obrasce za dostavu podataka (vidjeti primjere u dodacima 3. i 4.). Ako su potrebna druga mjerenja (vidjeti 1.3. i 1.8.8.), možda će biti potrebna i dodatna promatranja.
1.8.6. Potomstvo
Potomke svake roditeljske životinje treba po mogućnosti uklanjati i brojiti svakog dana nakon pojave prvog legla kako ne bi potrošili hranu namijenjenu odrasloj životinji. Kod ove se metode broje samo živi potomci, ali treba zabilježiti i prisutnost propalih jajašaca i mrtvih potomaka.
1.8.7. Smrtnost
Poželjno je da se smrtnost roditeljskih životinja bilježi svakodnevno, a najmanje u vrijeme brojenja potomstva.
1.8.8. Ostali parametri
Iako je ova metoda prvenstveno namijenjena ocjenjivanju učinaka na reprodukciju, ponekad se i drugi učinci mogu dovoljno dobro kvantificirati za statističku analizu. Mjerenja rasta su vrlo poželjna jer ona pružaju informacije o mogućim subletalnim učincima, što može biti korisnije od samih mjerenja reprodukcije; preporučuje se da se na kraju ispitivanja izmjeri dužina roditeljskih životinja (tj. dužina tijela bez analne bodlje). Ostali parametri koji se mogu mjeriti ili izračunati su vrijeme do pojave prvog legla (i kasnijih legla), broj i veličina legla po životinji, broj propalih legla, prisutnost mužjaka ili efipija i prirodni prirast populacije.
1.8.9. Učestalost analitičkih određivanja i mjerenja
Koncentraciju kisika, temperaturu, tvrdoću i pH vrijednost treba mjeriti najmanje jedanput tjedno u svježem i starom mediju, u kontroli odnosno kontrolama i u najvišoj koncentraciji ispitivane tvari.
Koncentracije ispitivane tvari treba određivati u redovitim razmacima tijekom ispitivanja.
U slučaju polustatičkih ispitivanja, ako se očekuje da će koncentracija ispitivane tvari ostati u granicama ± 20 % nazivnih vrijednosti (tj. u rasponu 80–120 % – vidjeti 1.4. i 1.8.4.), preporučuje se da se u prvom tjednu ispitivanja barem najviša i najniža ispitna koncentracija analiziraju jedanput odmah nakon pripreme i kod obnavljanja (tj. analize treba napraviti na uzorku iz iste otopine – odmah nakon pripreme i kod obnavljanja). Ova određivanja zatim treba ponavljati barem u tjednim razmacima.
Kod ispitivanja gdje se ne očekuje da će koncentracija ispitivane tvari ostati u granicama ± 20 % nazivne vrijednosti potrebno je analizirati sve ispitne koncentracije odmah nakon pripreme i kod obnavljanja. Ipak, kod ispitivanja gdje izmjerena početna koncentracija ispitivane tvari nije u granicama ± 20 % nazivne koncentracije, ali ima dovoljno dokaza da su početne koncentracije ponovljive i stabilne (tj. unutar područja 80–120 % početnih koncentracija), kemijska određivanja se u 2. i 3. tjednu ispitivanja mogu ograničiti na najvišu i najnižu ispitnu koncentraciju. U svakom slučaju, određivanje koncentracija ispitivane tvari prije obnavljanja treba provesti samo na jednoj posudi po ispitnoj koncentraciji.
Kod protočnih ispitivanja treba koristiti sličan režim uzorkovanja kao što je opisano za polustatičko ispitivanje (s time da u ovom slučaju ne vrijedi mjerenje „starih” otopina). Ipak, možda bi bilo dobro povećati broj uzorkovanja u prvom tjednu (npr. tri seta mjerenja) kako bi se provjerila stabilnost ispitnih koncentracija. Kod ovakvih ispitivanja treba svakodnevno provjeravati brzinu protoka sredstva za razrjeđivanje i ispitivane tvari.
Ako se može dokazati da se koncentracija ispitivane tvari u čitavom tijeku ispitivanja na zadovoljavajući način održava u granicama ± 20 % nazivne ili izmjerene početne koncentracije, rezultati se mogu temeljiti na nazivnim ili izmjerenim početnim vrijednostima. Ako je odstupanje od nazivne ili izmjerene početne koncentracije više od ± 20 %, rezultate treba izraziti kao vremenski ponderiranu sredinu (vidjeti Dodatak 5.).
2. PODACI I IZVJEŠĆIVANJE
2.1. OBRADA PODATAKA
Svrha ovog testa je odrediti učinak ispitivane tvari na ukupan broj živih potomaka po roditeljskoj životinji koja je živa na kraju ispitivanja. Ukupni broj potomaka po roditeljskoj životinji treba izračunati za svaku ispitnu posudu (tj. ponavljanje). Ako u bilo kojem ponavljanju roditeljska životinja ugine tijekom ispitivanja ili se pokaže da je mužjak, to ponavljanje se isključuje iz analize. U tom se slučaju analiza temelji na smanjenom broju ponavljanja.
Za procjenu LOEC-a, a time i NOEC-a, u vezi s učincima kemikalije na reprodukcijsku uspješnost, potrebno je izračunati srednju reprodukcijsku uspješnost po ponavljanjima za svaku koncentraciju i objedinjenu standardnu devijaciju reziduala, što se može učiniti uz pomoć analize varijance (ANOVA). Zatim srednju vrijednost za svaku koncentraciju treba usporediti s kontrolnom srednjom vrijednošću primjenom odgovarajuće metode višestruke usporedbe. Ovdje može biti koristan Dunnettov ili Williamsov test (14)(15)(16)(17). Treba provjeriti vrijedi li pretpostavka homogenosti varijance ANOVA-e. Ovo je bolje učiniti grafički nego formalnim testom značajnosti (18); druga prikladna mogućnost je provedba Bartlettovog testa. Ako ta pretpostavka ne vrijedi, treba razmotriti mogućnost da se prije provedbe ANOVA-e podaci preoblikuju radi homogenizacije varijanci ili provesti ponderiranu ANOVA-u. Potrebno je izračunati i navesti veličinu učinka koja se može utvrditi primjenom ANOVA-e (tj. najmanju značajnu razliku).
Za procjenu koncentracije koja bi izazvala 50 %-tno smanjenje reprodukcijske uspješnosti (tj. EC50) podacima treba prilagoditi odgovarajuću krivulju, npr. logističku krivulju, primjenom statističke metode, kao što je metoda najmanjih kvadrata. Krivulju treba parametrizirati tako da se EC50 i njegova standardna greška mogu izravno procijeniti. To bi u velikoj mjeri olakšalo izračun granica pouzdanosti oko EC50. Treba navesti dvostrane granice pouzdanosti 95 %, osim ako postoje dobri razlozi za primjenu drugih razina pouzdanosti. Poželjno je da postupak prilagođavanja obuhvaća metodu za ocjenjivanje značajnosti nepodudaranja („lack of fit”). To se može učiniti grafički ili podjelom zbroja kvadrata reziduala na „nepodudaranje” i „čiste komponente greške” i provedbom testa značajnosti nepodudaranja. Budući da će obrade koje daju visoku plodnost vjerojatno imati veću varijancu u broju mladih životinja nego obrade s niskom plodnošću, treba razmisliti o ponderiranju utvrđenih vrijednosti kako bi se uzele u obzir različite varijance u skupinama podvrgnutim različitim obradama (za temeljne informacije vidjeti referencu (18)).
Kod analize podataka iz konačnog prstenastog testa (2) logistička krivulja je prilagođena uz pomoć sljedećega modela, iako se mogu se koristiti i drugi prikladni modeli:
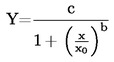
gdje je:
|
Y |
= |
ukupni broj mladih po roditeljskoj životinji koja je živa na kraju ispitivanja (izračunano za svaku posudu) |
|
x |
= |
koncentracija tvari |
|
c |
= |
očekivani broj mladih ako je x = 0 |
|
x0 |
= |
EC50 u populaciji |
|
b |
= |
parametar nagiba |
Ovaj će se model vjerojatno pokazati prikladnim u velikom broju situacija, ali će uvijek biti ispitivanja gdje neće biti primjenljiv. Valjanost modela treba provjeriti kako je predloženo gore. U pojedinim se slučajevima može koristiti model hormeze, u kojemu niske koncentracije daju povećane učinke (19).
Mogu se procijeniti i druge koncentracije s učinkom, kao što je EC10 ili EC20, iako bi možda bilo bolje koristiti drukčiju parametrizaciju modela od one koja se koristi za procjenu EC50.
2.2. IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora sadržavati sljedeće:
2.2.1. Ispitivana tvar:
|
— |
fizikalno stanje i relevantna fizikalno-kemijska svojstva, |
|
— |
podaci za identifikaciju kemikalije, uključujući čistoću. |
2.2.2. Ispitne vrste:
|
— |
klon (je li genetski tipiziran), dobavljač odnosno izvor (ako je poznat) i uvjeti uzgoja. Ako se koristi vrsta različita od Daphnia magna, to treba navesti i obrazložiti. |
2.2.3. Ispitni uvjeti:
|
— |
ispitni postupak koji se primjenjuje (npr. polustatički ili protočni, volumen, količina punjenja kao broj dafnija po litri), |
|
— |
fotoperiod i intenzitet svjetlosti, |
|
— |
plan ispitivanja (npr. broj ponavljanja, broj roditeljskih životinja po ponavljanju), |
|
— |
podaci o uzgojnom mediju, |
|
— |
dodaci organskog materijala (ako se koriste), uključujući sastav, izvor, način pripreme, TOC/KPK radnih pripravaka, procjenu TOC/KPK u ispitnom mediju, |
|
— |
detaljne informacije o hranjenju, uključujući količinu (u mg C/dafnija/dan) i raspored (npr. vrsta(-e) hrane, u slučaju algi također: specifični naziv (vrsta) te, ako je poznato, soj, uvjeti uzgoja kulture), |
|
— |
način pripreme radnih otopina i učestalost obnavljanja (ako se koristi otapalo ili dispergent, treba ih navesti zajedno s koncentracijom). |
2.2.4. Rezultati:
|
— |
rezultati svih preliminarnih istraživanja stabilnosti ispitivane tvari, |
|
— |
nazivne ispitne koncentracije i rezultati svih analiza za određivanje koncentracije ispitivane tvari u ispitnim posudama (vidjeti primjere obrazaca za dostavu podataka u Dodatku 4.); također treba navesti iskorištenje metode i granicu određivanja, |
|
— |
kakvoća vode u ispitnim posudama (tj. pH, temperatura i koncentracija otopljenog kisika, TOC i/ili KPK i tvrdoća, prema potrebi) (vidjeti primjer obrasca za dostavu podataka u Dodatku 3.), |
|
— |
potpuna evidencija živih potomaka za svaku roditeljsku životinju (vidjeti primjer obrasca za dostavu podataka u Dodatku 3.), |
|
— |
broj smrti među roditeljskim životinjama i dan kad je smrt nastupila (vidjeti primjer obrasca za dostavu podataka u Dodatku 3.), |
|
— |
koeficijent varijacije za kontrolnu plodnost (na temelju ukupnog broja živih potomaka po roditeljskoj životinji koja je živa na kraju ispitivanja), |
|
— |
grafički prikaz ukupnog broja živih potomaka po roditeljskoj životinji (za svako ponavljanje) koja je živa na kraju ispitivanja u ovisnosti o koncentraciji ispitivane tvari, |
|
— |
najniža koncentracija s vidljivim učinkom (LOEC) za reprodukciju, uključujući opis primijenjenih statističkih postupaka i naznaku koju je veličinu učinka bilo moguće utvrditi, i najviša koncentracija bez vidljivog učinka (NOEC) za reprodukciju; prema potrebi treba navesti LOEC/NOEC za smrtnost roditeljskih životinja, |
|
— |
prema potrebi, ECx za reprodukciju i intervali pouzdanosti te graf prilagođenog modela koji je korišten za izračun, nagib krivulje doza-odgovor i njezina standardna greška, |
|
— |
drugi uočeni biološki učinci i mjerenja: treba navesti sve druge uočene ili izmjerene biološke učinke (npr. rast roditeljskih životinja), uključujući sva potrebna obrazloženja, |
|
— |
objašnjenje svih odstupanja od ispitne metode. |
3. REFERENCE
|
(1) |
OECD Test Guideline Programme, Report of the Workshop on the Daphnia magna Pilot Ring Test, Sheffield University, UK, 20-21 March 1993. |
|
(2) |
OECD Environmental Health and Safety Publications. Series on Testing and Assessment No6. Report of the Final Ring Test of the Daphnia magna Reproduction Test Paris. 1997. |
|
(3) |
Baird D.J., Barber J., Bradley M.C., Soares A.M.V.M. and Calow P. (1991) A comparative study of genotype sensitivity to acute toxic stress using clones of Daphnia magna Strauss. Ecotoxicology and Environmental Safety, 21, str. 257-265. |
|
(4) |
Elendt B.P., (1990) Selenium deficiency in Crustacea; An ultrastructural approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, str. 25-33. |
|
(5) |
EPA (1993) Methods for Measuring the Acute Toxicity of Effluents and Receiving Waters to Freshwater and Marine Organisms. (Fourth ed.). EPA/600/4-90/027F. C. I. Weber (ed), USEPA, Cincinnati, Ohio. |
|
(6) |
Vigano L., (1991) Suitability of commercially available spring waters as standard medium for culturing Daphnia magna. Bull. Environ. Contam. Toxicol., 47, str. 775-782. |
|
(7) |
ASTM (1988) Standard Guide for Conducting Acute Toxicity Tests with Fishes, Macroinvertebrates and Amphibians. E729-88a. American Society for Testing and Materials, Philadelphia P.A. str. 20. |
|
(8) |
Baird D.J., Soares A.M.V.M., Girling A., Barber J., Bradley M.C. and Calow P., (1989) The long term maintenance of Daphnia magna Straus for use in ecotoxicological tests; problems and prospects. In: Proceedings of the 1st European Conference on Ecotoxicology. Copenhagen 1988 (H.Løkke, H. Tyle & F. Bro-Rasmussen. Eds.) str. 144-148. |
|
(9) |
Parkhurst B.R., Forte J.L. and Wright G.P., (1981) Reproducibility of a life-cycle toxicity test with Daphnia magna. Bull. Environ. Contam. and Toxicol., 26, str. 1-8. |
|
(10) |
Cowgill U.M. and Milazzo D.P., (1990) The sensitivity of two cladocerans to water quality variables: salinity and hardness. Arch. Hydrobiol., 120(2), str. 185-196. |
|
(11) |
Korshikov (1990) Pseudokirchneriella subcapitata Hindak, F-1990. Biologice Prace, 36, str. 209. |
|
(12) |
Sims I.R., Watson S. and Holmes D., (1993) Toward a standard Daphnia juvenile production test. Environmental Toxicology and Chemistry, 12, str. 2053-2058. |
|
(13) |
Sims I., (1993) Measuring the growth of phytoplankton: the relationship between total organic carbon with three commonly used parameters of algal growth. Arch. Hydrobiol., 128, 459-466. |
|
(14) |
Dunnett C.W., (1955) A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc., 50, str. 1096-1121. |
|
(15) |
Dunnett C.W., (1964) New tables for multiple comparisons with a control. Biometrics, 20, str. 482-491. |
|
(16) |
Williams D.A., (1971) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, str. 103-117. |
|
(17) |
Williams D.A., (1972) The comparison of several dose levels with a zero dose control. Biometrics, 28, str. 510-531. |
|
(18) |
Draper N.R. and Smith H., (1981) Applied Regression Analysis, second edition, Wiley, N.Y. |
|
(19) |
Brain P. and Cousens R., (1989) An equation to describe dose responses where there is stimulation of growth at low doses. Weed Research, 29, str. 93-96. |
|
(20) |
Wilson E.O. and Bossert, W.H., (1971) A Primer of Population Biology. Sinauer Associates Inc. Publishers. |
|
(21) |
Poole R.W., (1974) An Introduction to quantitative Ecology. Mc Graw Hill Series in Population Biology, New York, str. 532. |
|
(22) |
Meyer J.S., Ingersoll C.G., McDonald L.L. and Boyce M.S., (1986) Estimating uncertainty in population growth rates: Jackknife vs bootstrap techniques. Ecology, 67, str. 1156-1166. |
Dodatak 1.
PRIPREMA POTPUNO DEFINIRANIH MEDIJA ELENDT M7 I M4
Aklimatizacija na medij Elendt M7 i M4
Neki su laboratoriji imali problema s izravnim prenošenjem dafnija u medije M 4 (1) i M7. Ipak, određeni je uspjeh postignut s postupnom aklimatizacijom tj. premještanjem iz vlastitog medija u 30 %-tni Elendt, zatim u 60 %-tni Elendt i zatim u 100 %-tni Elendt. Ponekad je potrebno razdoblje aklimatizacije i do jednog mjeseca.
PRIPREMA
Elementi u tragovima
Najprije se pripreme odvojene radne otopine (I) pojedinih elemenata u tragovima u vodi prikladne čistoće npr. deionizirana, destilirana ili pročišćena obrnutom osmozom. Iz tih različitih radnih otopina (I) pripremi se druga pojedinačna radna otopina (II) koja sadrži sve elemente u tragovima (kombinirana otopina) tj.:
|
Radne otopine I (pojedinačna tvar) |
Količina koja se dodaje u vodu mg/l |
Koncentracija (u odnosu na medij M4) struko |
Za pripremu kombinirane radne otopine II u vodu treba dodati sljedeću količinu radne otopine I ml/l |
|
|
M 4 |
M 7 |
|||
|
H3BO3 |
57 190 |
20 000 |
1,0 |
0,25 |
|
MnCl2 * 4 H2O |
7 210 |
20 000 |
1,0 |
0,25 |
|
LiCl |
6 120 |
20 000 |
1,0 |
0,25 |
|
RbCl |
1 420 |
20 000 |
1,0 |
0,25 |
|
SrCl2 * 6 H2O |
3 040 |
20 000 |
1,0 |
0,25 |
|
NaBr |
320 |
20 000 |
1,0 |
0,25 |
|
Na2MoO4 * 2 H2O |
1 260 |
20 000 |
1,0 |
0,25 |
|
CuCl2 * 2 H2O |
335 |
20 000 |
1,0 |
0,25 |
|
ZnCl2 |
260 |
20 000 |
1,0 |
1,0 |
|
CoCl2 * 6 H2O |
200 |
20 000 |
1,0 |
1,0 |
|
KI |
65 |
20 000 |
1,0 |
1,0 |
|
Na2SeO3 |
43,8 |
20 000 |
1,0 |
1,0 |
|
NH4VO3 |
11,5 |
20 000 |
1,0 |
1,0 |
|
Na2EDTA * 2 H2O |
5 000 |
2 000 |
— |
— |
|
FeSO4 * 7 H2O |
1 991 |
2 000 |
— |
— |
|
Otopine Na2EDTA i FeSO4 pripreme se odvojeno, sjedine i odmah obrade u autoklavu. Pritom nastaje: |
||||
|
Otopina 21 Fe-EDTA |
|
1000-struko |
20,0 |
5,0 |
Medij M4 i M7
Mediji M4 i M7 pripremaju se pomoću radne otopine II, makronutrijenata i vitamina na sljedeći način:
|
|
Količina koja se dodaje u vodu mg/l |
Koncentracija (u odnosu na medij M4) struko |
Količina radne otopine koja se dodaje kod pripreme medija ml/l |
|||||||
|
M 4 |
M 7 |
|||||||||
|
Radna otopina II kombinirani elementi u tragovima |
|
20 |
50 |
50 |
||||||
|
Radna otopina makronutrijenata (pojedinačna tvar) |
||||||||||
|
CaCl2 * 2 H2O |
293 800 |
1 000 |
1,0 |
1,0 |
||||||
|
MgSO4 * 7 H2O |
246 600 |
2 000 |
0,5 |
0,5 |
||||||
|
KCl |
58 000 |
10 000 |
0,1 |
0,1 |
||||||
|
NaHCO3 |
64 800 |
1 000 |
1,0 |
1,0 |
||||||
|
Na2SiO3 * 9 H2O |
50 000 |
5 000 |
0,2 |
0,2 |
||||||
|
NaNO3 |
2 740 |
10 000 |
0,1 |
0,1 |
||||||
|
KH2PO4 |
1 430 |
10 000 |
0,1 |
0,1 |
||||||
|
K2HPO4 |
1 840 |
10 000 |
0,1 |
0,1 |
||||||
|
Kombinirana vitaminska radna otopina |
— |
10 000 |
0,1 |
0,1 |
||||||
|
Kombinirana vitaminska radna otopina priprema se dodavanjem 3 vitamina u 1 litru vode kako je ovdje prikazano: |
||||||||||
|
Tiamin-hidroklorid |
750 |
10 000 |
— |
— |
||||||
|
Cijanokobalamin (B12) |
10 |
10 000 |
— |
— |
||||||
|
Biotin |
7,5 |
10 000 |
— |
— |
||||||
|
Kombinirana vitaminska radna otopina čuva se zamrznuta u malim alikvotima. Vitamini se dodaju u medij neposredno prije uporabe.
|
||||||||||
Dodatak 2.
ANALIZA UKUPNOG ORGANSKOG UGLJIKA (TOC) I IZRADA NOMOGRAMA SADRŽAJA TOC-a U HRANI OD ALGI
U pravilu se ne očekuje da se sadržaj ugljika u hrani od algi mjeri izravno, već iz korelacija (tj. nomograma) sa zamjenskim mjerama, kao što je broj stanica algi i apsorbancija svjetlosti).
TOC treba mjeriti visokotemperaturnom oksidacijom, a ne UV metodom ili metodom persulfata (vidjeti: The Instrumental Determination of Total Organic Carbon, Total Oxygen Demand and Related Determinands 1979, HMSO 1980; 49 High Holborn, London WC1V 6HB).
Za izradu nomograma alge treba odvojiti od uzgojnog medija centrifugiranjem i resuspenidranjem u destiliranoj vodi. U svakom uzorku treba triput izmjeriti zamjenski parametar i koncentraciju TOC-a. Treba analizirati slijepe probe s destiliranom vodom i oduzeti kocentraciju TOC-a od koncentracije TOC-a u uzorku algi.
Nomogram treba biti linearan unutar traženog raspona koncentracija ugljika. Primjeri su prikazani u nastavku.
N.B.: Ovi se primjeri ne smiju koristiti za preračunavanje; važno je da laboratoriji izrade vlastite nomograme.


Dodatak 3.
PRIMJER OBRASCA ZA DOSTAVU PODATAKA O OBNAVLJANJU MEDIJA, FIZIKALNO-KEMIJSKOM PRAĆENJU, HRANJENJU, REPRODUKCIJI DAFNIJA I SMRTNOSTI ODRASLIH ŽIVOTINJA
|
Pokus br.: |
Datum početka: |
Klon: |
Medij: |
Vrsta hrane: |
Ispitivana tvar: |
Nazivna konc.: |
||||||||||||||||||
|
Dan |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
|
|
|
Obnavljanje medija (staviti kvačicu) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PH (37) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
novi |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
stari |
|
|
|
O2 mg/l (37) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
novi |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
stari |
|
|
|
Temp. (°C) (37) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
novi |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
stari |
|
|
|
Hranjenje (staviti kvačicu) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br. živih potomaka (38) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ukupno |
|
Posuda 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ukupno |
|
|
Kumulativna smrtnost odraslih životinja (39) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Dodatak 4.
PRIMJER OBRASCA ZA DOSTAVU PODATAKA O REZULTATIMA KEMIJSKE ANALIZE
(a) Izmjerene koncentracije
|
Nazivna konc. |
Uzorak 1. tjedan |
Uzorak 2. tjedan |
Uzorak 3. tjedan |
|||
|
Svježe |
Staro |
Svježe |
Staro |
Svježe |
Staro |
|
|
|
|
|
|
|
|
|
(b) Izmjerene koncentracije kao postotak nazivne koncentracije
|
Nazivna konc. |
Uzorak 1. tjedan |
Uzorak 2. tjedan |
Uzorak 3. tjedan |
|||
|
Svježe |
Staro |
Svježe |
Staro |
Svježe |
Staro |
|
|
|
|
|
|
|
|
|
Dodatak 5.
IZRAČUN VREMENSKI PONDERIRANE SREDINE
Vremenski ponderirana sredina
Budući da koncentracija ispitivane tvari može pasti u vremenu između obnavljanja medija, treba razmisliti koja će se koncentracija uzeti kao reprezentativna za raspon koncentracija kojima su izložene dafnije roditelji. Odabir se treba temeljiti kako na biološkim tako i na statističkim čimbenicima. Primjerice, ako se smatra da na razmnožavanje najviše utječe vršna koncentracija, treba koristiti maksimalnu koncentraciju. Međutim, ako se smatra da je važniji akumulirani ili dugoročniji učinak toksične tvari, tada je relevantnija prosječna koncentracija. Prosječna koncentracija koja se u tom slučaju koristi je vremenski ponderirana srednja koncentracija, budući da ona uzima u obzir kolebanje trenutne koncentracije u vremenu.
Slika 1.:
Primjer vremenski ponderirane sredine

Na slici 1. prikazan je primjer (pojednostavnjenog) ispitivanja u trajanju od sedam dana s obnavljanjem medija 0., 2. i 4. dana.
|
— |
Tanka cik-cak crta predstavlja koncentraciju u bilo kojoj točki u vremenu. Polazi se od pretpostavke da opadanje koncentracije slijedi eksponencijalni proces raspadanja. |
|
— |
Šest ucrtanih točaka predstavljaju utvrđene koncentracije izmjerene na početku i kraju svakog razdoblja obnavljanja. |
|
— |
Masno otisnuta crta označava položaj vremenski ponderirane sredine. |
Vremenski ponderirana sredina izračunava se tako da prostor ispod vremenski ponderirane sredine bude jednak prostoru ispod krivulje koncentracije. Izračun za gornji primjer prikazan je u tablici 1.
Tablica 1.:
izračun vremenski ponderirane sredine
|
Obnavljanje br. |
Dani |
Konc0 |
Konc1 |
Ln(Konc0) |
Ln(Konc1) |
Prostor |
|
1 |
2 |
10,000 |
4,493 |
2,303 |
1,503 |
13,767 |
|
2 |
2 |
11,000 |
6,037 |
2,398 |
1,798 |
16,544 |
|
3 |
3 |
10,000 |
4,066 |
2,303 |
1,403 |
19,781 |
|
Ukupno dana: 7 |
Ukupni prostor |
50,091 |
||||
|
VP sredina |
7,156 |
|||||
|
Dani su broj dana u razdoblju obnavljanja. Konc0 je izmjerena koncentracija na početku svakog razdoblja obnavljanja. Konc1 je izmjerena koncentracija na kraju svakog razdoblja obnavljanja. Ln(Konc0) je prirodni logaritam Konc0. Ln(Konc1) je prirodni logaritam Konc1. Prostor je prostor ispod eksponencijalne krivulje za svako razdoblje obnavljanja. Izračunava se kao:
|
||||||
Vremenski ponderirana sredina (VP sredina) je ukupni prostor podijeljen ukupnim danima.
Naravno, kod ispitivanja reproduktivne toksičnosti za dafnije tablicu bi trebalo proširiti na 21 dan.
Jasno je da u slučaju kad se promatranja obavljaju samo na početku i na kraju svakog razdoblja obnavljanja nije moguće potvrditi da je proces raspadanja doista eksponencijalan. Drukčija krivulja rezultirala bi drukčijim izračunom za prostor. Ipak, eksponencijalni proces raspadanja se čini uvjerljivim pa je u nedostatku drugih informacija vjerojatno najbolje koristiti ovu krivulju.
Ipak, treba biti oprezan ako se kemijskom analizom na kraju razdoblja obnavljanja ne utvrdi prisutnost tvari. Ako se ne može procijeniti koliko je brzo tvar nestala iz otopine, bit će nemoguće dobiti realan prostor ispod krivulje, a time i smislenu vremenski ponderiranu sredinu.
C.21. MIKROORGANIZMI KOJI ŽIVE U TLU: TEST PRETVORBE DUŠIKA
1. METODA
Ova ispitna metoda odgovara smjernici OECD TG 216 (2000.).
1.1. UVOD
U ovoj ispitnoj metodi opisana je laboratorijska metoda za ispitivanje dugotrajnih učinaka kemikalija na aktivnost pretvorbe dušika mikoorganizama koji žive u tlu nakon jednokratnog izlaganja. Test se prvenstveno temelji na preporukama Europske i mediteranske organizacije za zaštitu bilja (1). Ipak, uzete su u obzir i druge smjernice, uključujući smjernice njemačke Biologische Bundesanstalt (2), Američke agencije za zaštitu okoliša (3), SETAC-a (4) i Međunarodne organizacije za normizaciju (5). Na radionici OECD-a o odabiru tala/sedimenata održanoj u talijanskom Belgiratu 1995. (6) dogovoreni su broj i vrste tla koje će se koristiti u ovom testu. Preporuke za skupljanje, rukovanje i skladištenje uzoraka tla temelje se na smjernici ISO (7) i preporukama radionice iz Belgirata. Kod ocjenjivanja i vrednovanja toksičnih svojstava ispitivanih tvari ponekad je potrebno odrediti učinke na mikrobnu aktivnost tla, npr. ako su potrebni podaci o mogućim nuspojavama sredstava za zaštitu bilja u mikroflori tla ili, kod drugih kemikalija, ako se očekuje izlaganje mikroorganizama kemikaliji. Test pretvorbe dušika provodi se u svrhu određivanja učinaka tih kemikalija na mikrofloru tla. Ako se ispituju agrokemikalije (npr. sredstva za zaštitu bilja, gnojiva, kemikalije koje se koriste u šumarstvu), provodi se i test pretvorbe dušika i test pretvorbe ugljika. Ako se ispituju druge kemikalije, dovoljno je provesti test pretvorbe dušika. Ipak, ako se testom pretvorbe dušika kod tih kemikalija dobiju vrijednosti EC50 unutar područja utvrđenog za komercijalno dostupne inhibitore nitrifikacije (npr. nitrapirin), može se provesti i test pretvorbe ugljika kako bi se dobile dodatne informacije.
Tla se sastoje od živih i neživih komponenti koje se javljaju u složenim i heterogenim mješavinama. Mikroorganizmi igraju važnu ulogu u razlaganju i pretvorbi organske tvari u plodnim tlima, a njihove brojne vrste doprinose različitim aspektima plodnosti tla. Bilo kakvo dugotrajno uplitanje u te biokemijske procese može utjecati na kruženje nutrijenata i tako promijeniti plodnost tla. Pretvorba ugljika i dušika odvija se u svim plodnim tlima. Iako su u različitim tlima za te procese odgovorne različite mikrobne zajednice, putevi pretvorbe su uglavnom isti.
Opisana ispitna metoda namijenjena je utvrđivanju dugotrajnih štetnih učinaka tvari na proces pretvorbe dušika u aerobnim površinskim tlima. Ona također omogućuje procjenu učinaka tvari na pretvorbu ugljika koju obavlja mikroflora tla. Tvorba nitrata odvija se nakon raspadanja ugljično-dušičnih veza. Stoga, ako se u obrađenim i kontrolnim tlima utvrde jednake stope proizvodnje nitrata, velika je vjerojatnost da su glavni putevi razgradnje ugljika netaknuti i u funkciji. Supstrat odabran za ovaj test (lucernino brašno u prahu) ima povoljan omjer ugljika i dušika (obično između 12/1 i 16/1). Zahvaljujući tomu, smanjen je nedostatak ugljika tijekom ispitivanja tako da se mikrobne zajednice koje ošteti kemikalija mogu se oporaviti u roku 100 dana.
Testovi iz kojih je izvedena ova ispitna metoda bili su prvenstveno namijenjeni tvarima kod kojih se može predvidjeti količina koja će dospjeti u tlo. To je primjerice slučaj kod sredstava za zaštitu bilja kod kojih je poznata količina primjene u polju. Kod agrokemikalija je dovoljno ispitati dvije relevantne doze s obzirom na očekivanu odnosno predviđenu količinu primjene. Agrokemikalije se mogu ispitivati kao aktivne tvari (a.i.) ili kao formulirani proizvodi. Ipak, test nije ograničen na agrokemikalije. Promjenom količina ispitivane tvari koje se primijenjuju na tlo i načina vrednovanja podataka test se može koristiti i kod kemikalija kod kojih nije poznata očekivana količina tvari koja će dospjeti u tlo. Tako se kod kemikalija različitih od agrokemikalija određuju učinci niza koncentracija na pretvorbu dušika. Podaci iz tih ispitivanja koriste se za izradu krivulje doza-odgovor i izračunavanje vrijednosti ECx, gdje je x definirani % učinka.
1.2. DEFINICIJE
Pretvorba dušika: potpuna razgradnja organske tvari koja sadrži dušik djelovanjem mikroorganizama u procesu amonifikacije i nitrifikacije u odgovarajući anorganski krajnji proizvod, nitrat.
ECx (učinkovita koncentracija): koncentracija ispitivane tvari u tlu koja rezultira x-postotnom inhibicijom pretvorbe dušika u nitrat.
EC50 (medijan učinkovite koncentracije): koncentracija ispitivane tvari u tlu koja rezultira 50-postotnom (50 %) inhibicijom pretvorbe dušika u nitrat.
1.3. REFERENTNE TVARI
Nema.
1.4. NAČELO ISPITNE METODE
Prosijano se tlo obogati biljnim brašnom u prahu i obradi ispitivanom tvari ili ostavi neobrađeno (kontrola). Ako se ispituju agrokemikalije, preporučuju se najmanje dvije ispitne koncentracije, koje treba odabrati s obzirom na najvišu očekivanu koncentraciju u polju. Nakon 0, 7, 14 i 28 dana inkubacije uzorci obrađenih i kontrolnih tala ekstrahiraju se odgovarajućim otapalom te se odrede količine nitrata u ekstraktima. Stopa tvorbe nitrata obrađenih uzoraka usporedi se sa stopom kontrolnih uzoraka i izračuna se postotak odstupanja obrađenih uzoraka od kontrolne vrijednosti. Sva ispitivanja traju najmanje 28 dana. Ako su 28. dana razlike između obrađenih i neobrađenih tala jednake ili veće od 25 %, mjerenja se nastavljaju do najviše 100 dana. Ako se ispituju kemikalije različite od agrokemikalija, uzorcima tla doda se niz koncentracija ispitivane tvari i nakon 28 dana inkubacije izmjere se količine nitrata nastale u obrađenim i kontrolnim uzorcima. Rezultati ispitivanja s više koncentracija analiziraju se pomoću regresijskog modela i izračunaju vrijednosti ECx (tj. EC50, EC25 i/ili EC10). Vidjeti definicije.
1.5. VALJANOST ISPITIVANJA
Vrednovanja rezultata ispitivanja s agrokemikalijama temelje se na relativno malim razlikama (tj. prosječna vrijednost ± 25 %) između koncentracija nitrata u kontrolnim i obrađenim uzorcima tla, tako da velike razlike u kontrolama mogu dovesti do pogrešnih rezultata. Stoga razlike između ponavljanja u kontroli trebaju biti manje od ± 15 %.
1.6. OPIS ISPITNE METODE
1.6.1. Aparatura
Koriste se ispitne posude izrađene od kemijski inertnog materijala. Njihova zapremnina treba biti prikladna za postupak koji se primjenjuje kod inkubacije tla tj. inkubacija zbirnog uzorka ili inkubacija niza pojedinačnih uzoraka tla (vidjeti odjeljak 1.7.1.2.). Treba paziti da se gubitak vode svede na najmanju moguću mjeru i da se omogući izmjena plinova za vrijeme ispitivanja (npr. ispitne se posude mogu prekriti perforiranom polietilenskom folijom). Ako se ispituju hlapljive tvari, treba koristiti plinonepropusne posude koje se mogu hermetički zatvoriti. Njihova veličina treba biti takva da uzorak tla ispuni približno jednu četvrtinu njihove zapremnine.
Koristi se standardna laboratorijska oprema, uključujući:
|
— |
uređaj za tresenje: mehanička tresilica ili istovjetna oprema, |
|
— |
centrifugu (3 000 g) ili uređaj za filtriranje (s filtar-papirom bez nitrata), |
|
— |
instrument odgovarajuće osjetljivosti i obnovljivosti za analizu nitrata. |
1.6.2. Odabir i broj tala
Koristi se jedno tlo. Preporučena svojstva tla su:
|
— |
sadržaj pijeska: najmanje 50 % i najviše 75 %, |
|
— |
pH: 5,5–7,5, |
|
— |
sadržaj organskog ugljika: 0,5–1,5 %, |
|
— |
treba izmjeriti mikrobnu biomasu (8)(9) i njezin sadržaj ugljika treba iznositi najmanje 1 % ukupnog organskog ugljika tla. |
U većini slučajeva tlo s ovakvim svojstvima predstavlja najgori mogući slučaj, budući da je adsorpcija ispitivane kemikalije minimalna i njezina raspoloživost za mikrofloru maksimalna. Stoga općenito nisu potrebna ispitivanja s drugim tlima. Ipak, pod određenim okolnostima, npr. ako se očekuje da će se ispitivana tvar uglavnom koristiti u određenim vrstama tla, kao što su kisela šumska tla, ili kod elektrostatički nabijenih kemikalija ponekad je potrebno upotrijebiti dodatno tlo.
1.6.3. Skupljanje i skladištenje uzoraka tla
1.6.3.1. Skupljanje
Trebaju biti raspoložive detaljne informacije o povijesti lokaliteta gdje se uzima tlo za ispitivanje. To uključuje točno mjesto, vegetacijski pokrov, datume tretiranja sredstvima za zaštitu bilja i organskim i anorganskim gnojivima, dodatke biološkog materijala i slučajna onečišćenja. Mjesto odabrano za uzimanje tla treba biti prikladno za dugotrajno korištenje. Prikladni su trajni pašnjaci, polja s godišnjim kulturama žitarica (osim kukuruza) ili gusto posijanom zelenom gnojidbom. Odabrano mjesto ne smije biti tretirano sredstvima za zaštitu bilja najmanje jednu godinu prije uzimanja uzorka. Osim toga, organska gnojiva se ne smiju primjenjivati najmanje šest mjeseci prije uzorkovanja. Uporaba mineralnih gnojiva prihvatljiva je samo ako je to u skladu sa zahtjevima kulture, a uzorci tla ne smiju se uzimati najmanje tri mjeseca nakon primjene gnojiva. Treba izbjegavati korištenje tla tretiranoga gnojivima s poznatim biocidnim učincima (npr. kalcijev cijanamid).
Treba izbjegavati uzorkovanje tijekom ili neposredno nakon dugih razdoblja suše (duže od 30 dana) ili poplave. Kod oranih tala uzorke treba uzeti na dubini od 0 do 20 cm. Kod travnatih površina (pašnjaka) i drugih tala koja se ne oru u dužim razdobljima (najmanje jedna sezona) maksimalna dubina uzorkovanja može biti malo veća od 20 cm (npr. do 25 cm).
Uzorke tla treba prenositi u spremnicima u temperaturnim uvjetima koji jamče da se početna svojstva tla neće značajno promijeniti.
1.6.3.2. Skladištenje
Poželjno je koristiti tla koja su svježe skupljena na terenu. Ako se ne može izbjeći skladištenje u laboratoriju, tla se mogu skladištiti u mraku na 4 ± 2 °C najviše tri mjeseca. Za vrijeme skladištenja tla treba osigurati aerobne uvjete. Ako se uzorci tla uzimaju s površina koje su zamrznute najmanje tri mjeseca godišnje, može doći u obzir i skladištenje na minus 18 °C do minus 22 °C u trajanju od šest mjeseci. Mikrobna biomasa uskladištenih tala mjeri se prije svakog pokusa, a sadržaj ugljika u biomasi treba iznositi najmanje 1 % ukupnog sadržaja organskog ugljika tla (vidjeti odjeljak 1.6.2.).
1.6.4. Rukovanje i priprema tla za ispitivanje
1.6.4.1. Predinkubacija
Ako je tlo bilo uskladišteno (vidjeti odjeljak 1.6.3.2.), preporučuje se predinkubacija u trajanju između 2 i 28 dana. Temperatura i sadržaj vlage tla tijekom predinkubacije trebaju biti slični temperaturi i sadržaju vlage kod ispitivanja (vidjeti odjeljak 1.6.4.2. i 1.7.1.3.).
1.6.4.2. Fizikalno-kemijska svojstva
Tlo se ručno očisti od krupnih predmeta (npr. kamenje, dijelovi biljaka itd.) i zatim se vlažno prosije bez pretjeranog isušivanja na veličinu čestica do najviše 2 mm. Sadržaj vlage uzorka tla treba podesiti pomoću destilirane ili deionizirane vode na vrijednost između 40 % i 60 % maksimalnog vodnog kapaciteta.
1.6.4.3. Obogaćivanje organskim supstratom
Tlo treba obogatiti prikladnim organskim supstratom npr. travnatozelenim brašnom lucerne u prahu (glavni sastojak: Medicago sativa) s omjerom C/N između 12/1 i 16/1. Preporučeni omjer lucerna – tlo je 5 g lucerne na kilogram tla (suhe mase).
1.6.5. Priprema ispitivane tvari za primjenu na tlo
Ispitivana se tvar u pravilu primjenjuje pomoću nosača. Nosač može biti voda (kod tvari topljivih u vodi) ili inertna kruta tvar, kao što je sitni kremeni pijesak (veličina čestica: 0,1–0,5 mm). Treba izbjegavati sve tekuće nosače osim vode (npr. organska otapala kao što je aceton, kloroform) jer oni mogu oštetiti mikrofloru. Ako se kao nosač koristi pijesak, on se može obložiti ispitivanom tvari otopljenom ili suspendiranom u odgovarajućem otapalu. U tom slučaju otapalo treba ukloniti isparavanjem prije miješanja s tlom. Za optimalnu razdiobu ispitivane tvari u tlu preporučuje se omjer od 10 g pijeska po kilogramu tla (suhe mase). Kontrolni se uzorci obrađuju samo odgovarajućom količinom vode i/ili kremenog pijeska.
Kod ispitivanja hlapljivih kemikalija treba izbjegavati gubitke tijekom obrade, u mjeri u kojoj je to moguće, te nastojati osigurati homogenu razdiobu u tlu (npr. ispitivanu tvar treba ubrizgati u tlo na nekoliko mjesta).
1.6.6. Ispitne koncentracije
Ako se ispituju agrokemikalije, treba koristiti najmanje dvije koncentracije. Niža koncentracija ne smije biti manja od očekivane maksimalne količine koja će dospjeti u tlo u stvarnim uvjetima primjene, dok viša koncentracija treba biti višekratnik niže koncentracije. Koncentracije ispitivane tvari koje se dodaju u tlo izračunavaju se uz pretpostavku jednolikog ulaganja do dubine od 5 cm i nasipne gustoće tla od 1,5. Kod agrokemikalija koje se izravno primjenjuju na tlo i kod kemikalija kod kojih se može predvidjeti količina koja će dospjeti u tlo preporučene ispitne koncentracije su maksimalna predviđena koncentracija u okolišu (Predicted Environmental Concentraction, PEC) i njezina peterostruka vrijednost. Tvari kod kojih se očekuje više primjena u jednoj sezoni treba ispitati u koncentracijama koje se dobiju množenjem PEC-a maksimalnim očekivanim brojem primjena. Ipak, gornja koncentracija koja se ispituje smije biti najviše 10 puta veća od maksimalne količine jedne primjene. Ako se ispituju kemikalije različite od agrokemikalija, koristi se geometrijski niz od najmanje pet koncentracija. Ispitne koncentracije trebaju obuhvaćati područje potrebno za određivanje vrijednosti ECx.
1.7. PROVOĐENJE ISPITIVANJA
1.7.1. Uvjeti izlaganja
1.7.1.1. Obrada i kontrola
Ako se ispituju agrokemikalije, tlo se podijeli u tri dijela jednake mase. Dva se dijela pomiješaju s nosačem koji sadrži proizvod, a treći se pomiješa s nosačem bez proizvoda (kontrola). Preporučuju se najmanje po tri ponavljanja, kako kod obrađenog tako i kod neobrađenog tla. Ako se ispituju kemikalije različite od agrokemikalija, tlo se podijeli u šest dijelova jednake mase. Pet se uzoraka pomiješa s nosačem koji sadrži ispitivanu tvar, a šesti se pomiješa s nosačem bez kemikalije. Preporučuju se po tri ponavljanja za obrađene uzorke i kontrolu. Treba paziti da se osigura homogena razdioba ispitivane tvari u obrađenim uzorcima tla. Kod miješanja treba izbjegavati zbijanje i grudanje tla.
1.7.1.2. Inkubacija uzoraka tla
Inkubacija uzoraka tla može se provesti na dva načina: u zbirnim uzorcima svakog obrađenog i neobrađenog tla ili kao niz pojedinačnih poduzoraka jednake veličine svakog obrađenog i neobrađenog tla. Ipak, ako se ispituju hlapljive tvari, ispitivanje se uvijek provodi s nizom pojedinačnih poduzoraka. Ako se tla inkubiraju zbirno, pripreme se velike količine svakog obrađenog i neobrađenog tla i tijekom ispitivanja uzimaju poduzorci za analizu prema potrebi. Početna količina koju treba pripremiti za sve obrade i kontrolu ovisi o veličini poduzoraka, broju ponavljanja koja se koriste u analizi i očekivanom maksimalnom broju uzorkovanja. Tla koja se inkubiraju zbirno treba dobro promiješati prije uzimanja poduzoraka. Ako se tla inkubiraju kao niz pojedinačnih uzoraka tla, svako se obrađeno i neobrađeno zbirno tlo podijeli u potreban broj poduzoraka, koji se koriste prema potrebi. Kod pokusa gdje se očekuje više od dva vremena uzorkovanja treba pripremiti dovoljno poduzoraka za sva ponavljanja i sva vremena uzorkovanja. Treba inkubirati najmanje tri paralelna uzorka ispitivanog tla u aerobnim uvjetima (vidjeti odjeljak 1.7.1.1.). Kod svih ispitivanja treba koristiti prikladne posude s dovoljno plinskog prostora kako ne bi nastali anaerobni uvjeti. Ako se ispituju hlapljive tvari, ispitivanje se uvijek provodi s nizom pojedinačnih poduzoraka.
1.7.1.3. Ispitni uvjeti i trajanje
Ispitivanje se provodi u mraku na sobnoj temperaturi od 20 ± 2 C°. Sadržaj vlage u uzorcima tla za vrijeme ispitivanja treba održavati između 40 % i 60 % maksimalnog vodnog kapaciteta tla (vidjeti odjeljak 1.6.4.2.) uz toleranciju od ± 5 %. Prema potrebi se može dodati destilirana ili deionizirana voda.
Ispitivanje traje najmanje 28 dana. Ako se ispituju agrokemikalije, uspoređuju se stope tvorbe nitrata u obrađenim i kontrolnim uzorcima. Ako se one 28. dana razlikuju za više od 25 %, ispitivanje se nastavlja dok se ne dobije razlika od 25 % ili manja ili najviše 100 dana, ovisno o tome što je kraće. Kod ostalih se kemikalija ispitivanje prekida nakon 28 dana. 28. dana se odrede količine nitrata u obrađenim i kontrolnim uzorcima tla i izračunaju vrijednosti ECx.
1.7.2. Uzorkovanje i analiziranje tala
1.7.2.1. Raspored uzorkovanja tla
Ako se ispituju agrokemikalije, uzorci tla se analiziraju na nitrat 0., 7., 14. i 28. dana. Ako je potrebno duže ispitivanje, daljnja mjerenja nakon 28. dana treba obavljati u razmacima od 14 dana.
Ako se ispituju kemikalije različite od agrokemikalija, koristi se najmanje pet ispitnih koncentracija i uzorci tla se analiziraju na nitrat na početku (0. dan) i kraju razdoblja izlaganja (28 dana). Prema potrebi se može dodati i međumjerenje, npr. 7. dana. Podaci dobiveni 28. dana koriste se za određivanje vrijednosti ECx kemikalije. Podaci kontrolnih uzoraka 0. dana mogu se, po želji, navesti u izvješću kao početna količina nitrata u tlu.
1.7.2.2. Analiza uzoraka tla
Nastala količina nitrata u svakom obrađenom i kontrolnom uzorku određuje se u svakom vremenu uzorkovanja. Nitrat se ekstrahira iz tla tresenjem uzoraka s odgovarajućim ekstrakcijskim otapalom npr. otopina 0,1 M kalijevog klorida. Preporučuje se omjer 5 ml otopine KCl na gram ekvivalenta suhe mase tla. Da bi se postigla optimalna ekstrakcija, posude u kojima se nalazi tlo i ekstrakcijska otopina smiju biti napunjene najviše do pola. Smjese se tresu 60 minuta na 150 o/min. Smjese se centrifugiraju ili filtriraju i tekuće faze analiziraju na nitrat. Tekući ekstrakti bez čestica mogu se prije analize pohraniti na minus 20 ± 5 °C do najviše šest mjeseci.
2. PODACI
2.1. OBRADA REZULTATA
Kod ispitivanja s agrokemikalijama treba zabilježiti nastalu količinu nitrata u svakom uzorku tla i u tabličnom obliku navesti srednje vrijednosti svih ponavljanja. Stope pretvorbe dušika treba ocijeniti odgovarajućim opće prihvaćenim statističkim metodama (npr. F test, razina značajnosti 5 %). Nastale količine nitrata izražavaju se u mg nitrata po kg suhe mase tla po danu. Stope tvorbe nitrata u svakoj obradi usporede se s kontrolom i izračuna se postotak odstupanja od kontrolne vrijednosti.
Ako se ispitivanja provode s kemikalijama različitim od agrokemikalija, odredi se nastala količina nitrata u svakom ponavljanju i izradi krivulja doza-odgovor za procjenu vrijednosti ECx. Količine nitrata (tj. mg nitrata/kg suhe mase tla) utvrđene u obrađenim uzorcima nakon 28 dana usporede se s kontrolom. Iz tih se podataka izračunaju postoci inhibicije za svaku ispitnu koncentraciju. Ti se postoci grafički prikažu u ovisnosti o koncentraciji i primijene statistički postupci za izračun vrijednosti ECx. Granice pouzdanosti (p = 0,95) za izračunani ECx također se određuju primjenom standardnih postupaka (10)(11)(12).
Ispitivane tvari koje sadrže velike količine dušika mogu doprinijeti tvorbi nitrata tijekom ispitivanja. Ako se te tvari ispituju u visokoj koncentraciji (npr. kemikalije kod kojih se očekuju ponovljene primjene) u ispitivanje treba uključiti odgovarajuće kontrole (tj. tlo s ispitivanom tvari, ali bez biljnog brašna). Podatke tih kontrola treba uzeti u obzir kod izračuna ECx.
2.2. TUMAČENJE REZULTATA
Ako se kod vrednovanja rezultata ispitivanja s agrokemikalijama pokaže da je u bilo kojem vremenu uzorkovanja nakon 28. dana razlika u stopama tvorbe nitrata između niže obrade (tj. maksimalne predviđene koncentracije) i kontrole jednaka ili manja od 25 %, može se ocijeniti da proizvod nema dugotrajni utjecaj na pretvorbu dušika u tlu. Kad se vrednuju rezultati ispitivanja s drugim kemikalijama koriste se vrijednosti EC50, EC25 i/ili EC10.
3. IZVJEŠĆIVANJE
Izvješće o ispitivanju mora sadržavati sljedeće informacije:
|
|
potpune podatke o upotrijebljenom tlu, uključujući:
|
|
|
Ispitivana tvar:
|
|
|
Supstrat:
|
|
|
Uvjeti ispitivanja:
|
|
|
Rezultati:
|
4. REFERENCE
|
(1) |
EPPO, (1994) Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Chemicals. Chapter 7: Soil Microflora. EPPO Bulletin 24: 1-16, 1994. |
|
(2) |
BBA, (1990) Effects on the Activity of the Soil Microflora. BBA Guidelines for the Official Testing of Plant Protection Products, VI, 1-1 (2nd eds., 1990). |
|
(3) |
EPA (1987) Soil Microbial Community Toxicity Test. EPA 40 CFR Part 797.3700. Toxic Substances Control Act Test Guidelines; Proposed rule. September 28, 1987. |
|
(4) |
SETAC-Europe, (1995) Procedures for assessing the environmental fate and ecotoxicity of pesticides, Ed. M.R. Lynch, Pub. SETAC-Europe, Brussels. |
|
(5) |
ISO/DIS 14238 (1995) Soil Quality – Determination of Nitrogen Mineralisation and Nitrification in Soils and the Influence of Chemicals on these Processes. Technical Committee ISO/TC 190/SC 4: Soil Quality – Biological Methods. |
|
(6) |
OECD, (1995) Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italy, 18-20 January 1995. |
|
(7) |
ISO 10381-6 (1993) Soil quality – Sampling. Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory. |
|
(8) |
ISO 14240-1, (1997) Soil quality – Determination of soil microbial biomass – Part 1: Substrate-induced respiration method. |
|
(9) |
ISO 14240-2, (1997) Soil quality – Determination of soil microbial biomass – Part 2: Fumigation-extraction method. |
|
(10) |
Litchfield, J.T. and Wilcoxon F., (1949) A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, str. 99-113. |
|
(11) |
Finney, D.J., (1971) Probit Analysis. 3rd ed., Cambridge, London and New-York. |
|
(12) |
Finney, D.J., (1978) Statistical Methods in biological Assay. Griffin, Weycombe, UK. |
C.22. MIKROORGANIZMI KOJI ŽIVE U TLU: TEST PRETVORBE UGLJIKA
1. METODA
Ova metoda odgovara smjernici OECD TG 217 (2000.).
1.1. UVOD
U ovoj ispitnoj metodi opisana je laboratorijska metoda za ispitivanje potencijalnih dugotrajnih učinaka sredstava za zaštitu bilja i mogućih drugih kemikalija na aktivnost pretvorbe ugljika mikoorganizama koji žive u tlu kod jednokratnog izlaganja. Test se prvenstveno temelji na preporukama Europske i mediteranske organizacije za zaštitu bilja (1). Ipak, uzete su u obzir i druge smjernice, uključujući smjernice njemačke Biologische Bundesanstalt (2), Američke agencije za zaštitu okoliša (3) i SETAC-a (4). Na radionici OECD-a o odabiru tala/sedimenata održanoj u talijanskom Belgiratu 1995. (5) dogovoreni su broj i vrste tla koje će se koristiti u ovom testu. Preporuke za skupljanje, rukovanje i skladištenje uzoraka tla temelje se na smjernici ISO (6) i preporukama radionice iz Belgirata.
Kod ocjenjivanja i vrednovanja toksičnih svojstava ispitivanih tvari ponekad je potrebno odrediti učinke na mikrobnu aktivnost tla, npr. ako su potrebni podaci o mogućim nuspojavama sredstava za zaštitu bilja u mikroflori tla ili, kod drugih kemikalija, ako se očekuje izlaganje mikroorganizama kemikaliji. Test pretvorbe ugljika provodi se u svrhu određivanja učinaka tih kemikalija na mikrofloru tla. Ako se ispituju agrokemikalije (npr. sredstva za zaštitu bilja, gnojiva, kemikalije koje se koriste u šumarstvu), provodi se i test pretvorbe ugljika i test pretvorbe dušika. Ako se ispituju druge kemikalije, dovoljno je provesti test pretvorbe dušika. Ipak, ako se testom pretvorbe dušika kod tih kemikalija dobiju vrijednosti EC50 unutar područja utvrđenog za komercijalno dostupne inhibitore nitrifikacije (npr. nitrapirin), može se provesti i test pretvorbe ugljika kako bi se dobile dodatne informacije.
Tla se sastoje od živih i neživih komponenti koje se javljaju u složenim i heterogenim mješavinama. Mikroorganizmi igraju važnu ulogu u razlaganju i pretvorbi organske tvari u plodnim tlima, a njihove brojne vrste doprinose različitim aspektima plodnosti tla. Bilo kakvo dugotrajno uplitanje u te biokemijske procese može ometati kruženje nutrijenata i tako promijeniti plodnost tla. Pretvorba ugljika i dušika odvija se u svim plodnim tlima. Iako su u različitim tlima za te procese odgovorne različite mikrobne zajednice, putevi pretvorbe su uglavnom isti.
Ova ispitna metoda namijenjena je utvrđivanju dugotrajnih štetnih učinaka tvari na proces pretvorbe ugljika u aerobnim površinskim tlima. Test je osjetljiv na promjene veličine i aktivnosti mikrobnih zajednica odgovornih za pretvorbu ugljika budući da ih on istodobno izlaže kemijskom stresu i nedostatku ugljika. Koristi se pjeskovito tlo siromašno organskim tvarima. Tlo se obrađuje ispitivanom tvari i inkubira u uvjetima koji omogućuju brzi mikrobni metabolizam. U tim se uvjetima izvori lako dostupnog ugljika brzo troše. Uslijed toga dolazi do pomanjkanja ugljika, što ubija stanice mikroorganizama i izaziva dormanciju i/ili sporulaciju. Ako ispitivanje traje više od 28 dana, zbroj tih reakcija može se izmjeriti u kontrolama (s neobrađenim tlom) kao progresivni gubitak metabolički aktivne mikrobne biomase (7). Ako u ispitnim uvjetima na biomasu tla koje je izloženo ugljičnom stresu utječe i prisutnost kemikalije, ona se možda neće vratiti na istu razinu kao u kontroli. Stoga poremećaji koje izazove ispitivana tvar u bilo kom trenutku za vrijeme ispitivanja često traju do kraja ispitivanja.
Testovi iz kojih je izvedena ova ispitna metoda bili su prvenstveno namijenjeni tvarima kod kojih se može predvidjeti količina koja će dospjeti u tlo. To je primjerice slučaj kod sredstava za zaštitu bilja kod kojih je poznata količina primjene u polju. Kod agrokemikalija je dovoljno ispitati dvije relevantne doze s obzirom na očekivanu odnosno predviđenu količinu primjene. Agrokemikalije se mogu ispitivati kao aktivne tvari (a.i.) ili kao formulirani proizvodi. Ipak, test nije ograničen na kemikalije s predvidivim koncentracijama u okolišu. Promjenom količina ispitivane tvari koje se primijenjuju na tlo i načina vrednovanja podataka test se može koristiti i kod kemikalija kod kojih nije poznata očekivana količina tvari koja će dospjeti u tlo. Tako se kod kemikalija različitih od agrokemikalija određuju učinci niza koncentracija na pretvorbu ugljika. Podaci iz tih ispitivanja koriste se za izradu krivulje doza-odgovor i izračunavanje vrijednosti ECx, gdje je x definirani % učinka.
1.2. DEFINICIJE
Pretvorba ugljika: razgradnja organske tvari djelovanjem mikroorganizama pri kojoj nastaje anorganski krajnji proizvod, ugljikov dioksid.
ECx (učinkovita koncentracija): koncentracija ispitivane tvari u tlu koja rezultira x %-tnom inhibicijom pretvorbe ugljika u ugljikov dioksid.
EC50 (medijan učinkovite koncentracije): koncentracija ispitivane tvari u tlu koja rezultira 50 %-tnom inhibicijom pretvorbe ugljika u ugljikov dioksid.
1.3. REFERENTNE TVARI
Nema.
1.4. NAČELO ISPITNE METODE
Prosijano se tlo obradi ispitivanom tvari ili ostavi neobrađeno (kontrola). Ako se ispituju agrokemikalije, preporučuju se najmanje dvije ispitne koncentracije, koje treba odabrati s obzirom na najvišu očekivanu koncentraciju u polju. Nakon 0, 7, 14 i 28 dana inkubacije uzorci obrađenih i kontrolnih tala pomiješaju se s glukozom i mjere se stope disanja induciranoga glukozom tijekom 12 uzastopnih sati. Stope disanja izražavaju se kao oslobođeni ugljikov dioksid (mg ugljikovog dioksida/kg suhog tla/h) ili potrošeni kisik (mg kisika/kg suhog tla/h). Srednja stopa disanja obrađenih uzoraka tla usporedi se s kontrolom i izračuna se postotak odstupanja obrađenih uzoraka od kontrolne vrijednosti. Sva ispitivanja traju najmanje 28 dana. Ako su 28. dana razlike između obrađenih i neobrađenih tala jednake ili veće od 25 %, mjerenja se nastavljaju u razmacima od 14 dana do najviše 100 dana. Ako se ispituju kemikalije različite od agrokemikalija, uzorcima tla doda se niz koncentracija ispitivane tvari i nakon 28 dana izmjere se stope disanja induciranoga glukozom (tj. srednja vrijednost količina nastalog ugljikovog dioksida odnosno potrošenog kisika). Rezultati ispitivanja s nizom koncentracija analiziraju se pomoću regresijskog modela i izračunaju se vrijednosti ECx (tj. EC50, EC25 i/ili EC10). Vidjeti definicije.
1.5. VALJANOST ISPITIVANJA
Vrednovanja rezultata ispitivanja s agrokemikalijama temelje se na relativno malim razlikama (tj. prosječna vrijednost ± 25 %) između količina oslobođenog ugljikovog dioksida odnosno potrošenog kisika u kontrolnim i obrađenim uzorcima tla, tako da velike razlike u kontrolama mogu dovesti do pogrešnih rezultata. Stoga razlike između ponavljanja u kontroli trebaju biti manje od ± 15 %.
1.6. OPIS ISPITNE METODE
1.6.1. Aparatura
Koriste se ispitne posude izrađene od kemijski inertnog materijala. Njihova zapremnina treba biti prikladna za postupak koji se primjenjuje kod inkubacije tla tj. inkubacija zbirnog uzorka ili inkubacija niza pojedinačnih uzoraka tla (vidjeti odjeljak 1.7.1.2.). Treba paziti da se gubitak vode svede na najmanju moguću mjeru i da se omogući izmjena plinova za vrijeme ispitivanja (npr. ispitne se posude mogu prekriti perforiranom polietilenskom folijom). Ako se ispituju hlapljive tvari, treba koristiti plinonepropusne posude koje se mogu hermetički zatvoriti. Njihova veličina treba biti takva da uzorak tla ispuni približno jednu četvrtinu njihove zapremnine.
Za određivanje disanja induciranoga glukozom potrebni su inkubacijski sustavi i instrumenti za mjerenje proizvodnje ugljikovog dioksida ili potrošnje kisika. Primjeri takvih sustava i instrumenata mogu se pronaći u literaturi (8)(9)(10)(11).
1.6.2. Odabir i broj tala
Koristi se jedno tlo. Preporučena svojstva tla su:
|
— |
sadržaj pijeska: najmanje 50 % i najviše 75 %, |
|
— |
pH: 5,5–7,5, |
|
— |
sadržaj organskog ugljika: 0,5–1,5 %, |
|
— |
treba izmjeriti mikrobnu biomasu (12)(13) i njezin sadržaj ugljika treba iznositi najmanje 1 % ukupnog organskog ugljika tla. |
U većini slučajeva tlo s ovakvim svojstvima predstavlja najgori mogući slučaj, budući da je adsorpcija ispitivane kemikalije minimalna i njezina raspoloživost za mikrofloru maksimalna. Stoga općenito nisu potrebna ispitivanja s drugim tlima. Ipak, pod određenim okolnostima, npr. ako je predviđeno da se ispitivana tvar uglavnom koristi u određenim vrstama tla, kao što su kisela šumska tla, ili kod elektrostatički nabijenih kemikalija ponekad je potrebno upotrijebiti dodatno tlo.
1.6.3. Skupljanje i skladištenje uzoraka tla
1.6.3.1. Skupljanje
Trebaju biti raspoložive detaljne informacije o povijesti lokaliteta gdje se uzima tlo za ispitivanje. To uključuje točno mjesto, vegetacijski pokrov, datume tretiranja sredstvima za zaštitu bilja i organskim i anorganskim gnojivima, dodatke biološkog materijala i slučajna onečišćenja. Mjesto odabrano za uzimanje tla treba biti prikladno za dugotrajno korištenje. Prikladni su trajni pašnjaci, polja s godišnjim kulturama žitarica (osim kukuruza) ili gusto posijanom zelenom gnojidbom. Odabrano mjesto ne smije biti tretirano sredstvima za zaštitu bilja najmanje jednu godinu prije uzimanja uzorka. Osim toga, organska gnojiva ne smiju se primjenjivati najmanje šest mjeseci prije uzorkovanja. Uporaba mineralnih gnojiva prihvatljiva je samo ako je to u skladu sa zahtjevima kulture, a uzorci tla ne smiju se uzimati najmanje tri mjeseca nakon primjene gnojiva. Treba izbjegavati korištenje tla tretiranoga gnojivima s poznatim biocidnim učincima (npr. kalcijev cijanamid).
Treba izbjegavati uzorkovanje tijekom ili neposredno nakon dugih razdoblja suše (duže od 30 dana) ili poplave. Kod oranih tala uzorke treba uzeti na dubini od 0 do 20 cm. Kod travnatih površina (pašnjaka) i drugih tala koja se ne oru u dužim razdobljima (najmanje jedna sezona) maksimalna dubina uzorkovanja može biti malo veća od 20 cm (npr. do 25 cm). Uzorke tla treba prenositi u spremnicima u temperaturnim uvjetima koji jamče da se početna svojstva tla neće značajno promijeniti.
1.6.3.2. Skladištenje
Poželjno je koristiti tla koja su svježe skupljena na terenu. Ako se ne može izbjeći skladištenje u laboratoriju, tla se mogu skladištiti u mraku na 4 ± 2 °C najviše tri mjeseca. Za vrijeme skladištenja tla treba osigurati aerobne uvjete. Ako se uzorci tla uzimaju s površina koje su zamrznute najmanje tri mjeseca godišnje, može doći u obzir i skladištenje na minus 18 °C u trajanju od šest mjeseci. Mikrobna biomasa uskladištenih tala mjeri se prije svakog pokusa, a sadržaj ugljika u biomasi treba iznositi najmanje 1 % ukupnog sadržaja organskog ugljika tla (vidjeti odjeljak 1.6.2.).
1.6.4. Rukovanje i priprema tla za ispitivanje
1.6.4.1. Predinkubacija
Ako je tlo bilo uskladišteno (vidjeti odjeljak 1.6.3.2. i 1.7.1.3.), preporučuje se predinkubacija u trajanju između 2 i 28 dana. Temperatura i sadržaj vlage tla tijekom predinkubacije trebaju biti slični temperaturi i sadržaju vlage kod ispitivanja (vidjeti odjeljak 1.6.4.2. i 1.7.1.3.).
1.6.4.2. Fizikalno-kemijska svojstva
Tlo se ručno očisti od krupnih predmeta (npr. kamenje, dijelovi biljaka itd.) i zatim se vlažno prosije bez pretjeranog isušivanja na veličinu čestica do najviše 2 mm. Sadržaj vlage uzorka tla treba podesiti pomoću destilirane ili deionizirane vode na vrijednost između 40 % i 60 % maksimalnog vodnog kapaciteta.
1.6.5. Priprema ispitivane tvari za primjenu na tlo
Ispitivana se tvar u pravilu primjenjuje pomoću nosača. Nosač može biti voda (kod tvari topljivih u vodi) ili inertna kruta tvar, kao što je sitni kremeni pijesak (veličina čestica: 0,1–0,5 mm). Treba izbjegavati sve tekuće nosače osim vode (npr. organska otapala kao što je aceton, kloroform) jer oni mogu oštetiti mikrofloru. Ako se kao nosač koristi pijesak, on se može obložiti ispitivanom tvari otopljenom ili suspendiranom u odgovarajućem otapalu. U tom slučaju otapalo treba ukloniti isparavanjem prije miješanja s tlom. Za optimalnu razdiobu ispitivane tvari u tlu preporučuje se omjer od 10 g pijeska po kilogramu tla (suhe mase). Kontrolni se uzorci obrađuju samo odgovarajućom količinom vode i/ili kremenog pijeska.
Kod ispitivanja hlapljivih kemikalija treba izbjegavati gubitke tijekom obrade te nastojati osigurati homogenu razdiobu u tlu (npr. ispitivanu tvar treba ubrizgati u tlo na nekoliko mjesta).
1.6.6. Ispitne koncentracije
Ako se ispituju sredstva za zaštitu bilja ili druge kemikalije s predvidivim koncentracijama u okolišu, treba koristiti najmanje dvije koncentracije. Niža koncentracija ne smije biti manja od očekivane maksimalne količine koja će dospjeti u tlo u stvarnim uvjetima primjene, dok viša koncentracija treba biti višekratnik niže koncentracije. Koncentracije ispitivane tvari koje se dodaju u tlo izračunavaju se uz pretpostavku jednolikog ulaganja do dubine od 5 cm i nasipne gustoće tla od 1,5. Kod agrokemikalija koje se izravno primjenjuju na tlo i kod kemikalija kod kojih se može predvidjeti količina koja će dospjeti u tlo preporučene ispitne koncentracije su maksimalna predvidiva koncentracija u okolišu (Predictable Environmental Concentraction, PEC) i njezina peterostruka vrijednost. Tvari kod kojih se očekuje više primjena u jednoj sezoni treba ispitati u koncentracijama koje se dobiju množenjem PEC-a maksimalnim očekivanim brojem primjena. Ipak, gornja koncentracija koja se ispituje smije biti najviše 10 puta veća od maksimalne količine jedne primjene.
Ako se ispituju kemikalije različite od agrokemikalija, koristi se geometrijski niz od najmanje pet koncentracija. Ispitne koncentracije trebaju obuhvaćati područje potrebno za određivanje vrijednosti ECx.
1.7. PROVOĐENJE ISPITIVANJA
1.7.1. Uvjeti izlaganja
1.7.1.1. Obrada i kontrola
Ako se ispituju agrokemikalije, tlo se podijeli u tri dijela jednake mase. Dva se dijela pomiješaju s nosačem koji sadrži proizvod, a treći se pomiješa s nosačem bez proizvoda (kontrola). Preporučuju se najmanje po tri ponavljanja, kako kod obrađenog tako i kod neobrađenog tla. Ako se ispituju kemikalije različite od agrokemikalija, tlo se podijeli u šest dijelova jednake mase. Pet se uzoraka pomiješa s nosačem koji sadrži ispitivanu tvar, a šesti se pomiješa s nosačem bez kemikalije. Preporučuju se po tri ponavljanja za obrađene uzorke i kontrolu. Treba paziti da se osigura homogena razdioba ispitivane tvari u obrađenim uzorcima tla. Kod miješanja treba izbjegavati zbijanje i grudanje tla.
1.7.1.2. Inkubacija uzoraka tla
Inkubacija uzoraka tla može se provesti na dva načina: u zbirnim uzorcima svakog obrađenog i neobrađenog tla ili kao niz pojedinačnih poduzoraka jednake veličine svakog obrađenog i neobrađenog tla. Ipak, ako se ispituju hlapljive tvari, ispitivanje se uvijek provodi s nizom pojedinačnih poduzoraka. Ako se tla inkubiraju zbirno, pripreme se velike količine svakog obrađenog i neobrađenog tla i tijekom ispitivanja uzimaju poduzorci za analizu prema potrebi. Početna količina koju treba pripremiti za sve obrade i kontrolu ovisi o veličini poduzoraka, broju ponavljanja koja se koriste u analizi i očekivanom maksimalnom broju uzorkovanja. Tla koja se inkubiraju zbirno treba dobro promiješati prije uzimanja poduzoraka. Ako se tla inkubiraju kao niz pojedinačnih uzoraka tla, svako se obrađeno i neobrađeno zbirno tlo podijeli u potreban broj poduzoraka, koji se koriste prema potrebi. Kod pokusa gdje se očekuje više od dva vremena uzorkovanja treba pripremiti dovoljno poduzoraka za sva ponavljanja i sva vremena uzorkovanja. Treba inkubirati najmanje tri paralelna uzorka ispitivanog tla u aerobnim uvjetima (vidjeti odjeljak 1.7.1.1.). Kod svih ispitivanja treba koristiti prikladne posude s dovoljno plinskog prostora kako ne bi nastali anaerobni uvjeti. Ako se ispituju hlapljive tvari, ispitivanje se uvijek provodi s nizom pojedinačnih poduzoraka.
1.7.1.3. Ispitni uvjeti i trajanje
Ispitivanje se provodi u mraku na sobnoj temperaturi od 20 ± 2 C°. Sadržaj vlage u uzorcima tla za vrijeme ispitivanja treba održavati između 40 % i 60 % maksimalnog vodnog kapaciteta tla (vidjeti odjeljak 1.6.4.2.) uz toleranciju od ± 5 %. Prema potrebi se može dodati destilirana ili deionizirana voda.
Ispitivanje traje najmanje 28 dana. Ako se ispituju agrokemikalije, usporede se količine oslobođenog ugljikovog dioksida odnosno potrošenog kisika u obrađenim i kontrolnim uzorcima. Ako se one 28. dana razlikuju za više od 25 %, ispitivanje se nastavlja dok se ne dobije razlika od 25 % ili manja ili najviše 100 dana, ovisno o tome što je kraće. Kod ostalih se kemikalija ispitivanje prekida nakon 28 dana. 28. dana se odrede količine oslobođenog ugljikovog dioksida odnosno potrošenog kisika u obrađenim i kontrolnim uzorcima tla i izračunaju vrijednosti ECx.
1.7.2. Uzorkovanje i analiziranje tala
1.7.2.1. Raspored uzorkovanja tla
Ako se ispituju agrokemikalije, uzorci se tla analiziraju s obzirom na stope disanja induciranoga glukozom 0., 7., 14. i 28. dana. Ako je potrebno duže ispitivanje, daljnja mjerenja nakon 28. dana treba obavljati u razmacima od 14 dana.
Ako se ispituju kemikalije različite od agrokemikalija, koristi se najmanje pet ispitnih koncentracija i uzorci tla analiziraju se na disanje inducirano glukozom na početku (0. dan) i kraju razdoblja izlaganja (28 dana). Prema potrebi može se dodati i međumjerenje, npr. 7. dana. Podaci dobiveni 28. dana koriste se za određivanje vrijednosti ECx kemikalije. Podaci kontrolnih uzoraka 0. dana mogu se, po želji, upotrijebiti za procjenu početnih količina metabolički aktivne mikrobne biomase u tlu (12).
1.7.2.2. Mjerenje stopa disanja induciranoga glukozom
Stopa disanja induciranoga glukozom određuje se u svakom vremenu uzorkovanja u svim obrađenim i kontrolnim uzorcima. Uzorci tla pomiješaju se s dovoljnom količinom glukoze da se trenutačno postigne maksimalni respiratorni odgovor. Količina glukoze potrebna da se postigne maksimalni respiratorni odgovor pojedinog tla može se odrediti u preliminarnom ispitivanju s nizom koncentracija glukoze (14). Ipak, kod pjeskovitih tala s 0,5–1,5 % organskog ugljika obično je dovoljno 2 000 mg do 4 000 mg glukoze po kg suhe mase tla. Glukoza se može samljeti u prah s čistim kremenim pijeskom (10 g pijeska/kg suhe mase tla) i homogeno pomiješati s tlom.
Uzorci tla obogaćeni glukozom inkubiraju se na 20 ± 2 °C u prikladnoj aparaturi u kojoj se stope disanja mjere neprekidno, svakog sata ili svaka dva sata (vidjeti odjeljak 1.6.1.). Oslobođeni ugljikov dioksid odnosno potrošeni kisik mjeri se tijekom 12 uzastopnih sati; mjerenja treba započeti što prije tj. u roku jednog do dva sata nakon dodavanja glukoze. Izmjere se ukupne količine ugljikovog dioksida koji je oslobođen ili kisika koji je potrošen tijekom 12 sati i odrede srednje stope disanja.
2. PODACI
2.1. OBRADA REZULTATA
Kod ispitivanja s agrokemikalijama treba zabilježiti količinu oslobođenog ugljikovog dioksida odnosno potrošenog kisika za svaki uzorak tla i u tabličnom obliku navesti srednje vrijednosti svih ponavljanja. Rezultate treba vrednovati odgovarajućim opće prihvatljivim statističkim metodama (npr. F test, razina značajnosti 5 %). Stope disanja induciranoga glukozom izražavaju se u mg ugljikovog dioksida/kg suhe mase tla/h odnosno mg kisika/suha masa tla/h. Srednja stopa tvorbe ugljikovog dioksida odnosno srednja stopa potrošnje kisika u svakoj obradi usporedi se s kontrolom i izračuna se postotak odstupanja od kontrolne vrijednosti.
Ako se ispitivanja provode s kemikalijama različitim od agrokemikalija, odrede se količine oslobođenog ugljikovog dioksida odnosno potrošenog kisika u svakom ponavljanju i izradi krivulja doza-odgovor za procjenu vrijednosti ECx. Stope disanja induciranoga glukozom (tj. mg ugljikovog dioksida/kg suhe mase tla/h odnosno mg kisika/suha masa tla/h) utvrđene u obrađenim uzorcima nakon 28 dana usporede se s kontrolom. Iz tih se podataka izračunaju postoci inhibicije za svaku ispitnu koncentraciju. Ti se postoci grafički prikažu u ovisnosti o koncentraciji i primijene se statistički postupci za izračun vrijednosti ECx. Granice pouzdanosti (p = 0,95) za izračunani ECx također se određuju primjenom standardnih postupaka (15)(16)(17).
2.2. TUMAČENJE REZULTATA
Ako se kod vrednovanja rezultata ispitivanja s agrokemikalijama pokaže da je u bilo kojem vremenu uzorkovanja nakon 28. dana razlika u stopama disanja između niže obrade (tj. maksimalne predviđene koncentracije) i kontrole jednaka ili manja od 25 %, može se ocijeniti da proizvod nema dugotrajni utjecaj na pretvorbu ugljika u tlu. Kad se vrednuju rezultati ispitivanja s drugim kemikalijama koriste se vrijednosti EC50, EC25 i/ili EC10.
3. IZVJEŠĆIVANJE
IZVJEŠĆE O ISPITIVANJU
Izvješće o ispitivanju mora sadržavati sljedeće informacije:
|
|
potpuni podaci o upotrijebljenom tlu, uključujući:
|
|
|
Ispitivana tvar:
|
|
|
Uvjeti ispitivanja:
|
|
|
Rezultati:
|
4. REFERENCE
|
(1) |
EPPO, (1994) Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Chemicals. Chapter 7: Soil Microflora. EPPO Bulletin 24: 1-16, 1994. |
|
(2) |
BBA, (1990) Effects on the Activity of the Soil Microflora. BBA Guidelines for the Official Testing of Plant Protection Products, VI, 1-1 (2nd eds., 1990). |
|
(3) |
EPA, (1987) Soil Microbial Community Toxicity Test. EPA 40 CFR Part 797.3700. Toxic Substances Control Act Test Guidelines; Proposed rule. September 28, 1987. |
|
(4) |
SETAC-Europe, (1995) Procedures for assessing the environmental fate and ecotoxicity of pesticides, Ed. M.R. Lynch, Pub. SETAC-Europe, Brussels. |
|
(5) |
OECD, (1995) Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italy, 18-20 January 1995. |
|
(6) |
ISO 10381-6, (1993) Soil quality – Sampling. Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory. |
|
(7) |
Anderson, J.P.E., (1987) Handling and Storage of Soils for Pesticide Experiments, in „Pesticide Effects on Soil Microflora”. Eds. L. Somerville and M.P. Greaves, Chap. 3: 45-60. |
|
(8) |
Anderson, J.P.E., (1982) Soil Respiration, in „Methods of Soil Analysis – Part 2: Chemical and Microbiological Properties”. Agronomy Monograph No 9. Eds. A.L. Page, R.H. Miller and D.R. Keeney. 41: 831- 871. |
|
(9) |
ISO 11266-1, (1993) Soil Quality – Guidance on Laboratory Tests for Biodegradation in Soil: Part 1. Aerobic Conditions. |
|
(10) |
ISO 14239, (1997E) Soil Quality – Laboratory incubation systems for measuring the mineralisation of organic chemicals in soil under aerobic conditions. |
|
(11) |
Heinemeye r O., Insam, H., Kaiser, E.A, and Walenzik, G., (1989) Soil microbial biomass and respiration measurements; an automated technique based on infrared gas analyses. Plant and Soil, 116: 77-81. |
|
(12) |
ISO 14240-1, (1997) Soil quality – Determination of soil microbial biomass – Part 1: Substrate-induced respiration method. |
|
(13) |
ISO 14240-2, (1997) Soil quality – Determination of soil microbial biomass – Part 2: Fumigation-extraction method. |
|
(14) |
Malkomes, H.-P., (1986) Einfluß von Glukosemenge auf die Reaktion der Kurzzeit-Atmung im Boden Gegenüber Pflanzenschutzmitteln, Dargestellt am Beispiel eines Herbizide. (Influence of the Amount of Glucose Added to the Soil on the Effect of Pesticides in Short-Term Respiration, using a Herbicide as an Example). Nachrichtenbl. Deut. Pflanzenschutzd., Braunschweig, 38: 113-120. |
|
(15) |
Litchfield, J.T. and Wilcoxon, F., (1949) A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, 99-113. |
|
(16) |
Finney, D.J., (1971) Probit Analysis. 3rd ed., Cambridge, London and New-York. |
|
(17) |
Finney D.J., (1978) Statistical Methods in biological Assay. Griffin, Weycombe, UK. |
C.23. AEROBNA I ANAEROBNA PRETVORBA U TLU
1. METODA
Ova ispitna metoda odgovara smjernici OECD TG 307 (2002)
1.1. UVOD
Ova se ispitna metoda temelji na postojećim smjernicama (1)(2)(3)(4)(5)(6)(7)(8)(9). Postupak opisan u ovoj ispitnoj metodi namijenjen je ocjenjivanju aerobne i anaerobne pretvorbe kemikalija u tlu. Pokusi se izvode u svrhu određivanja i. brzine pretvorbe ispitivane tvari te ii. vrste i brzine tvorbe i razgradnje proizvoda pretvorbe kojima mogu biti izložene biljke i organizmi koji žive u tlu. Ova su istraživanja potrebna kod kemikalija koje se izravno primjenjuju na tlo i kemikalija koje mogu dospjeti u zemni okoliš. Rezultati tih laboratorijskih istraživanja mogu se koristiti i za izradu protokola uzorkovanja i analize za srodna terenska istraživanja.
Za ocjenjivanje puteva pretvorbe (8)(10)(11) uglavnom su dovoljna aerobna i anaerobna istraživanja s jednom vrstom tla. Brzine pretvorbe treba odrediti u još najmanje tri tla. (8)(10).
Na radionici OECD-a o odabiru tala i sedimenata održanoj u talijanskom Belgiratu 1995. (10) posebno su dogovoreni broj i vrste tla koja će se koristiti u ovom testu. Vrste tla koje se ispituju trebaju biti reprezentativne za uvjete okoliša u kojima će se tvar koristiti odnosno ispuštati. Primjerice, kemikalije koje bi se mogle ispuštati u suptropskim do tropskim klimama treba ispitivati s ferasolima ili nitosolima (sustav FAO). Na radionici su također dane preporuke u vezi sa skupljanjem, rukovanjem i skladištenjem uzoraka tla na temelju smjernice ISO (15). Ova metoda također uzima u obzir uporabu tala rižišta.
1.2. DEFINICIJE
Ispitivana tvar: bilo koja tvar, bilo polazni spoj ili relevantni proizvodi pretvorbe.
Proizvodi pretvorbe: sve tvari koje nastaju u biotičkim ili abiotičkim reakcijama pretvorbe ispitivane tvari, uključujući CO2 i proizvode u vezanim ostacima.
Vezani ostaci:„vezani ostaci” predstavljaju spojeve u tlu, biljki ili životinji koji nakon ekstrakcije ostaju u matrici u obliku polazne tvari ili njezinog/ih metabolita/proizvoda pretvorbe. Metoda ekstrakcije ne smije znatno promijeniti same spojeve niti strukturu matrice. Vrsta veze može se djelomično razjasniti ekstrakcijskim metodama koje mijenjaju matricu i sofisticiranim analitičkim tehnikama. Do sada su na taj način utvrđene npr. kovalentne ionske i sorpcijske veze te uklapanja. Općenito, tvorba vezanih ostataka značajno smanjuje biodostupnost i bioraspoloživost (12) [prilagođeno na temelju IUPAC 1984 (13)].
Aerobna pretvorba: reakcije koje se odvijaju u prisutnosti molekularnog kisika (14).
Anaerobna pretvorba: reakcije koje se odvijaju bez pristupa molekularnog kisika (14).
Tlo: mješavina mineralnih sastojaka i organsko-kemijskih sastojaka koji sadrže spojeve velike molekulske mase s visokim sadržajem ugljika i dušika, oživljena sitnim (uglavnom mikro) organizmima. Tlom se može rukovati u dva stanja:
|
(a) |
neporemećeno: onako kako je nastalo s vremenom, s karakterističnim slojevima različitih vrsta tla; |
|
(b) |
poremećeno: kakvo se obično nalazi na poljoprivrednim zemljištima odnosno kakvo je u ovoj metodi prisutno u uzorcima koji se uzimaju kopanjem (14). |
Mineralizacija: potpuna razgradnja organskog spoja u CO2 i H2O u aerobnim uvjetima i CH4, CO2 i H2O u anaerobnim uvjetima. Ako se u kontekstu ove ispitne metode koristi 14C obilježeni spoj, mineralizacija znači opsežnu razgradnju tijekom koje obilježeni atom ugljika oksidira uz otpuštanje odgovarajuće količine 14CO2 (14).
Vrijeme poluraspada: t0,5 je vrijeme koje je potrebno za 50 %-tnu pretvorbu ispitivane tvari, ako se pretvorba može opisati kinetikom prvog reda; ono je neovisno o koncentraciji.
DT50 (vrijeme nestajanja 50): vrijeme u kojemu se koncentracija ispitivane tvari smanji za 50 %; ono se razlikuje od vremena poluraspada t0,5 ako pretvorba ne prati kinetiku prvog reda.
DT75 (vrijeme nestajanja 75): vrijeme u kojemu se koncentracija ispitivane tvari smanji za 75 %.
DT90 (vrijeme nestajanja 90): vrijeme u kojemu se koncentracija ispitivane tvari smanji za 90 %.
1.3. REFERENTNE TVARI
Referentne tvari treba koristiti za opisivanje i/ili identificiranje proizvoda pretvorbe spektroskopskim i kromatografskim metodama.
1.4. PRIMJENJIVOST TESTA
Metoda se može primijeniti na sve kemikalije (neobilježene i radioaktivno obilježene) za koje je raspoloživa dovoljno točna i osjetljiva analitička metoda. Ona se može primijeniti na blago hlapljive i nehlapljive spojeve kao i na vodotopljive spojeve i spojeve netopljive u vodi. Test ne treba primjenjivati u slučaju kemikalija koje su jako hlapljive iz tla (npr. fumiganti, organska otapala) te se stoga ne mogu zadržati u tlu u pokusnim uvjetima ovog testa.
1.5. INFORMACIJE O TVARI
Za mjerenje brzine pretvorbe mogu se koristiti neobilježene i obilježene ispitivane tvari. Za proučavanje puta pretvorbe i utvrđivanje bilance mase potreban je obilježeni materijal. Preporučuje se 14C obilježavanje, ali korisna je i primjena drugih izotopa, kao što su 13C, 15N, 3H, 32P. Ako je to moguće, oznaku treba staviti na najstabilni dio odnosno dijelove molekule (40). Čistoća ispitivane tvari treba biti najmanje 95 %.
Prije provedbe testa aerobne i anaerobne pretvorbe u tlu trebaju biti raspoložive sljedeće informacije o ispitivanoj tvari:
|
(a) |
topljivost u vodi (metoda A.6.) |
|
(b) |
topljivost u organskim otapalima; |
|
(c) |
tlak pare (metoda A.4.) i konstanta Henryjevog zakona; |
|
(d) |
podjelni koeficijent n-oktanol/voda (metoda A.8.); |
|
(e) |
kemijska stabilnost u mraku (hidroliza) (metoda C.7.); |
|
(f) |
pKa, ako je molekula sklona protonaciji ili deprotonaciji [smjernica OECD 112] (16). |
Osim toga, korisno je imati podatke o toksičnosti ispitivane tvari za mikroorganizme koji žive u tlu [ispitne metode C.21. i C 22.] (16).
Trebaju biti raspoložive analitičke metode (uključujući metodu ekstrakcije i pročišćavanja) za kvantifikaciju i identifikaciju ispitivane tvari i njezinih proizvoda pretvorbe.
1.6. NAČELO ISPITNE METODE
Uzorci tla se obrade ispitivanom tvari i inkubiraju u mraku u tikvicama biometarskog tipa ili protočnim sustavima u kontroliranim laboratorijskim uvjetima (stalna temperatura i vlažnost tla). Uzorci tla se u odgovarajućim vremenskim razmacima ekstrahiraju i analiziraju na polaznu tvar i proizvode pretvorbe. Hlapljivi se proizvodi također skupljaju za analizu pomoću odgovarajućih apsorpcijskih uređaja. Primjenom 14C obilježenog materijala mogu se izmjeriti različite brzine mineralizacije ispitivane tvari odvajanjem razvijenog 14CO2 i utvrditi bilanca mase, uključujući tvorbu vezanih ostataka u tlu.
1.7. KRITERIJI KAKVOĆE
1.7.1. Iskorištenje
Prve naznake ponovljivosti analitičke metode i uspješnosti jednolike primjene ispitivane tvari mogu se dobiti ekstrakcijom i analizom najmanje dva paralelna uzorka tla neposredno nakon dodavanja ispitivane tvari. Iskorištenja u kasnijim fazama pokusa proizlaze iz odgovarajućih bilanci mase. Iskorištenje se treba kretati u području od 90 % do 110 % kod obilježenih kemikalija (8) i od 70 % do 110 % kod neobilježenih kemikalija (3).
1.7.2. Ponovljivost i osjetljivost analitičke metode
Ponovljivost analitičke metode (bez početne učinkovitosti ekstrakcije) kod kvantifikacije ispitivane tvari i proizvoda pretvorbe može se provjeriti dvostrukom analizom istog ekstrakta tla koje je inkubirano dovoljno dugo da nastanu proizvodi pretvorbe.
Granica detekcije (limit of detection, LOD) analitičke metode za ispitivanu tvar i proizvode pretvorbe treba biti najmanje 0,01 mg· kg-1 tla (kao ispitivana tvar) ili 1 % primijenjene doze, ovisno o tome što je manje. Također je potrebno navesti granicu kvantifikacije (limit of quantification, LOQ).
1.7.3. Točnost podataka o pretvorbi
Regresijska analiza koncentracija ispitivane tvari kao funkcije vremena daje odgovarajuće informacije o pouzdanosti krivulje pretvorbe i omogućuje izračun granica pouzdanosti za vremena poluraspada (u slučaju kinetike pseudoprvog reda) odnosno vrijednosti DT50 i, prema potrebi, DT75 i DT90.
1.8. OPIS METODE
1.8.1. Oprema i kemijski reagensi
Inkubacijski sustavi se sastoje od statičkih zatvorenih sustava ili prikladnih protočnih sustava (7)(17). Primjeri prikladne protočne aparature za inkubaciju tla i tikvice biometarskog tipa prikazani su na slici 1. i 2. Obje vrste inkubacijskih sustava imaju prednosti i ograničenja (7)(17).
Potrebna je standardna laboratorijska oprema, posebno:
|
— |
analitički instrumenti, kao što su oprema za GLC, HPLC, TLC, uključujući odgovarajuće detekcijske sustave za analiziranje radioaktivno obilježenih i neobilježenih tvari ili inverznu metodu razrjeđenja izotopa, |
|
— |
instrumenti za potrebe identifikacije (npr. MS, GC-MS, HPLC-MS, NMR itd.), |
|
— |
tekućinski scintilacijski brojač, |
|
— |
oksidator za izgaranje radioakivnog materijala, |
|
— |
centrifuga, |
|
— |
aparatura za ekstrakciju (npr. epruvete za centrifugiranje za hladnu ekstrakciju i aparatura po Soxhletu za kontinuiranu ekstrakciju pod refluksom), |
|
— |
instrumenti za koncentriranje otopina i ekstrakata (npr. rotacijski isparivač), |
|
— |
vodena kupelj, |
|
— |
mehanički uređaj za miješanje (npr. uređaj za gnjetenje, rotacijska mješalica). |
Kemijski reagensi koji se koriste su npr.:
|
— |
NaOH, analitički čist, 2 mol· dm-3 ili druga odgovarajuća baza (npr. KOH, etanolamin), |
|
— |
H2SO4, analitički čista, 0,05 mol· dm-3, |
|
— |
etilen-glikol, analitički čist, |
|
— |
kruti apsorpcijski materijali, kao što je natronsko vapno i poliuretanski čepovi. |
|
— |
organska otapala, analitički čista, kao što je aceton, metanol itd., |
|
— |
scintilacijska tekućina. |
1.8.2. Primjena ispitivane tvari
Da bi se olakšalo uvođenje ispitivane tvari u tlo i njezina razdioba u tlu, ispitivana tvar se može otopiti u vodi (deionizirana ili destilirana) ili, prema potrebi, u minimalnoj količini acetona ili drugog organskog otapala (6) u kojemu je ispitivana tvar dovoljno topljiva i stabilna. Ipak, količina odabranog otapala ne smije imati značajan utjecaj na mikrobnu aktivnost tla (vidjeti odjeljak 1.5. i 1.9.2. – 1.9.3.). Treba izbjegavati uporabu otapala koja inhibiraju mikrobnu aktivnost, kao što je kloroform, diklormetan i druga halogenirana otapala.
Ispitivana tvar se može dodati i u krutom stanju npr. umiješana u kremeni pijesak (6) ili u malom poduzorku ispitivanog tla koji je prethodno osušen na zraku i steriliziran. Ako se ispitivana tvar dodaje uz pomoć otapala, otapalo treba pustiti da ispari prije dodavanja obrađenog poduzorka izvornom nesterilnom uzorku tla.
U slučaju kemikalija u općoj uporabi čiji su glavni putevi ulaska u tlo kanalizacijski mulj/primjena u poljoprivredi, ispitivanu tvar treba prvo dodati u mulj i zatim mulj uvesti u uzorak tla (vidjeti odjeljak 1.9.2. i 1.9.3.).
U pravilu se ne preporučuje uporaba formuliranih proizvoda. Ipak, uporaba formuliranog materijala može biti prikladna alternativa npr. kod slabo topljivih ispitivanih tvari.
1.8.3. Tla
1.8.1.3. Odabir tla
Za određivanje puta pretvorbe treba koristiti reprezentativno tlo; preporučuje se pjeskovita ilovača ili praškasta ilovača ili ilovača ili ilovasti pijesak (prema klasifikaciji FAO i USDA (18)) s pH 5,5 – 8,0, sadržajem organskog ugljika 0,5 – 2,5 % i mikrobnom biomasom od najmanje 1 % ukupnog organskog ugljika (10).
Kod istraživanja brzine pretvorbe treba koristiti još najmanje tri tla koja predstavljaju područje relevantnih tala. Tla trebaju imati različiti sadržaj organskog ugljika, pH, sadržaj gline i mikrobnu biomasu (10).
Sva tla treba opisati barem s obzirom na teksturu (% pijeska, % praha, % gline) [prema klasifikaciji FAO i USDA (18)], pH, kapacitet izmjene kationa, organski ugljik, nasipnu gustoću, svojstvo zadržavanja vode (41) i mikrobnu biomasu (samo kod aerobnih istraživanja). Za tumačenje rezultata mogu biti korisne i druge informacije o svojstvima tla. Za određivanje svojstava tla mogu se koristiti metode preporučene u literaturi (19)(20)(21)(22)(23). Mikrobna biomasa se može odrediti metodom disanja induciranog supstratom (substrate-induced respiration, SIR) (25)(26) ili alternativnim metodama (20).
1.8.3.2. Skupljanje, rukovanje i skladištenje tala
Trebaju biti raspoložive detaljne informacije o povijesti lokaliteta gdje se uzima tlo za ispitivanje. To uključuje točno mjesto, vegetacijski pokrov, tretiranja kemikalijama, tretiranja organskim i anorganskim gnojivima, dodatke biološkog materijala i druga onečišćenja. Tla koja su u prethodne četiri godine tretirana ispitivanom tvari ili njezinim strukturnim analozima ne smiju se koristiti u istraživanjima pretvorbe (10)(15).
Treba uzeti svježe tlo s polja (iz horizonta A ili gornjeg sloja od 20 cm) čiji je sadržaj vode povoljan za prosijavanje. Treba izbjegavati uzimanje uzoraka tijekom ili neposredno nakon dugih razdoblja (> 30 dana) suše, smrzavanja ili poplave (14), osim u slučaju tala s rižišta. Uzorke tla treba prenositi tako da promjene sadržaja vode budu što manje i treba ih po mogućnosti držati u mraku uz slobodan pristup zraka. Za to je općenito prikladna labavo povezana polietilenska vreća.
Tlo treba obraditi što prije nakon uzorkovanja. Prije prosijavanja tla kroz 2-milimetarsko sito koje uklanja sitno kamenje, faunu i biljne ostatke treba ukloniti vegetaciju, krupniju faunu i kamenje. Treba izbjegavati pretjerano isušivanje i drobljenje tla prije prosijavanja (15).
Ako je zimi otežano uzorkovanje na terenu (tlo zamrznuto ili prekriveno slojevima snijega), uzorak se može uzeti iz tla pohranjenog u stakleniku ispod biljnog pokrova (npr. trava ili mješavina trave i djeteline). Prednost se u svakom slučaju daje tlima koja su svježe uzeta na terenu, ali ako se već skupljeno i obrađeno tlo mora uskladištiti prije početka istraživanja, treba osigurati prikladne uvjete i ograničiti vrijeme skladištenja (4 ± 2 °C najduže tri mjeseca) kako bi se održala mikrobna aktivnost (42). Detaljne upute za skupljanje, rukovanje i skladištenje tala koja se koriste u pokusima biološke pretvorbe mogu se naći u (8)(10 (15)(26)(27).
Obrađeno tlo treba prije uporabe u ovom testu predinkubirati kako bi se omogućilo klijanje i uklanjanje sjemenja te kako bi se povratila ravnoteža mikrobnog metabolizma nakon prelaska s uvjeta uzorkovanja odnosno skladištenja na uvjete inkubacije. Uglavnom je dovoljno razdoblje predinkubacije između 2 i 28 dana u uvjetima temperature i vlage koji približno odgovaraju ispitnim uvjetima (15). Ukupno vrijeme skladištenja i predinkubacije zajedno ne smije biti duže od tri mjeseca.
1.9. PROVOĐENJE ISPITIVANJA
1.9.1. Ispitni uvjeti
1.9.1.1. Ispitna temperatura
Tijekom cjelokupnog razdoblja ispitivanja tla treba inkubirati u mraku na stalnoj temperaturi koja je reprezentativna za klimatske uvjete u kojima će se tvar koristiti odnosno ispuštati. Za sve ispitivane tvari koje mogu dospjeti u tlo u umjerenim klimama preporučuje se temperatura od 20 ± 2 °C. Temperaturu treba nadzirati.
Kod kemikalija koje se primjenjuju ili ispuštaju u hladnijim klimama (npr. u sjevernim krajevima, u jesenskom/zimskom razdoblju) treba inkubirati dodatne uzorke tla, ali na nižoj temperaturi (npr. 10 ± 2 °C).
1.9.1.2. Sadržaj vlage
Kod testova pretvorbe u aerobnim uvjetima sadržaj vlage u tlu (43) treba podesiti i održavati na pF između 2,0 i 2,5 (3). Sadržaj vlage u tlu izražava se kao masa vode po masi suhog tla; sadržaj vlage treba redovito kontrolirati (npr. u razmacima od 2 tjedna) vaganjem inkubacijskih tikvica i gubitke vode nadoknaditi dodavanjem vode (po mogućnosti sterilno filtrirana voda iz slavine). Kod dodavanja vlage treba paziti da se gubici ispitivane tvari i/ili proizvoda pretvorbe ishlapljivanjem i/ili eventualnom fotokemijskom razgradnjom izbjegnu odnosno svedu na najmanju moguću mjeru.
Kod testova pretvorbe u anaerobnim uvjetima i uvjetima rižinog polja tlo treba zasititi vodom plavljenjem.
1.9.1.3. Aerobni uvjeti inkubacije
U protočnim se sustavima aerobni uvjeti održavaju periodičnim ispiranjem ili neprekidnim zračenjem vlažnim zrakom. U biometarskim tikvicama osigurana je izmjena zraka difuzijom.
1.9.1.4. Sterilni aerobni uvjeti
Da bi se dobile informacije o relevantnosti abiotičke pretvorbe ispitivane tvari, uzorci tla se mogu sterilizirati (za metode sterilizacije vidjeti (16) i (29)), obraditi sterilnom ispitivanom tvari (npr. dodavanje otopine kroz sterilni filtar) i dozračivati vlažnim sterilnim zrakom, kako je opisano u odjeljku 1.9.1.3. U slučaju tala rižišta, tlo i vodu treba sterilizirati i provesti inkubaciju kako je opisano u odjeljku 1.9.1.6.
1.9.1.5. Anaerobni uvjeti inkubacije
Da bi se uspostavili i održali anaerobni uvjeti, tlo obrađeno ispitivanom tvari i inkubirano u aerobnim uvjetima u trajanju od 30 dana ili jednom vremenu poluraspada ili DT50 (ovisno o tome što je kraće) se preplavi vodom (sloj vode 1 – 3 cm) i inkubacijski sustav ispire inertnim plinom (npr. dušik ili argon) (44). Ispitni sustav mora omogućavati mjerenja npr. pH, koncentracije kisika i redoks potencijala i biti opremljen uređajima za odvajanje hlapljivih proizvoda. Biometarski sustav mora biti zatvoren kako bi se spriječio ulazak zraka difuzijom.
1.9.1.6. Inkubacija u uvjetima rižinog polja
Kod istraživanja pretvorbe tvari u tlima rižišta tlo se naplavi slojem vode od oko 1 – 5 cm i ispitivana tvar primijeni na vodenu fazu (9). Preporučuje se dubina tla od najmanje 5 cm. Sustav se prozračuje zrakom kao u aerobnim uvjetima. Treba pratiti i dokumentirati pH, koncentraciju kisika i redoks potencijal vodenog sloja. Prije početka istraživanja pretvorbe potrebno je razdoblje preinkubacije od najmanje dva tjedna (vidjeti odjeljak 1.8.3.2.).
1.9.1.7. Trajanje ispitivanja
Istraživanje brzine i puta pretvorbe u pravilu ne bi trebalo trajati duže od 120 dana (45) (3)(6)(8), budući da se nakon tog može očekivati postupno smanjenje mikrobne aktivnosti tla u umjetnom laboratorijskom sustavu odsječenom od prirodnih procesa obnavljanja. Istraživanje može trajati i duže (npr. 6 ili 12 mjeseci), ako je to potrebno za opisivanje razgradnje ispitivane tvari i tvorbe i razgradnje glavnih proizvoda pretvorbe (8). Duža razdoblja inkubacije treba obrazložiti u izvješću o ispitivanju i navesti mjerenja biomase za vrijeme i na kraju tih razdoblja.
1.9.2. Provođenje ispitivanja
U svaku se inkubacijsku tikvicu stavi oko 50 do 200 g tla (na bazi suhe mase) (vidjeti sliku 1. i 2. u Dodatku 3.) i tlo obradi ispitivanom tvari jednom od metoda opisanih u odjeljku 1.8.2. Ako se za primjenu ispitivane tvari koriste organska otapala, njih treba ukloniti iz tla isparavanjem. Tlo se zatim dobro promiješa spatulom i/ili tresenjem tikvice. Ako se istraživanje provodi u uvjetima rižinog polja, tlo i vodu treba temeljito promiješati nakon primjene ispitivane tvari. Male alikvote obrađenog tla (npr. 1 g) treba analizirati na ispitivanu tvar radi provjere jednolike razdiobe tvari. Za alternativnu metodu vidjeti dolje.
Ispitna koncentracija treba odgovarati maksimalnoj preporučenoj količini primjene sredstva za zaštitu bilja iz uputa za uporabu i ravnomjernom ulaganju do odgovarajuće dubine u polju (npr. gornji sloj od 10 cm) (46). Primjerice, u slučaju kemikalija koje se primjenjuju na lišće ili tlo bez ulaganja, primjerena dubina za izračun količine kemikalije koju treba dodati u tikvicu je 2,5 cm. Primjerena dubina za kemikalije koje se ulažu u tlo je dubina ulaganja navedena u uputama za uporabu. Kod kemikalija u općoj uporabi količinu primjene treba procijeniti na temelju najrelevantijeg puta unosa; primjerice, ako je glavni put unosa u tlo kanalizacijski mulj, kemikaliju treba dozirati u mulj u koncentraciji koja odgovara očekivanoj koncentraciji u mulju, a količina mulja dodana u tlo treba odgovarati uobičajenoj količini mulja u poljoprivrednim zemljištima. Ako ova koncentracija nije dovoljno visoka za identifikaciju glavnih proizvoda pretvorbe, ponekad je korisno inkubirati zasebne uzorke tla koji sadrže veće količine, ali treba izbjegavati pretjerane količine koje utječu na mikrobne funkcije tla (vidjeti odjeljak 1.5. i 1.8.2.).
Druga je mogućnost da se veća šarža tla (tj. 1 do 2 kg) obradi ispitivanom tvari, pažljivo promiješa u odgovarajućoj mješalici, podijeli u male dijelove od 50 do 200 g i prenese u inkubacijske tikvice (primjerice uz pomoć razdjeljivača uzoraka). Male alikvote obrađenog tla (npr. 1 g) treba analizirati na ispitivanu tvar radi provjere jednolike razdiobe tvari. Ovom se postupku daje prednost budući da omogućuje ravnomjerniju razdiobu ispitivane tvari u tlu.
Neobrađene uzorke tla treba inkubirati u istim uvjetima (aerobni) kao uzorke obrađene ispitivanom tvari. Ti se uzorci koriste za mjerenja biomase tijekom i na kraju istraživanja.
Ako se ispitivana tvar primjenjuje na tlo otopljena u organskom otapalu odnosno otapalima, uzorci tla obrađeni istom količinom otapala inkubiraju se u istim uvjetima (aerobni) kao uzorci obrađeni ispitivanom tvari. Ti se uzorci koriste za mjerenja biomase na početku, tijekom i na kraju istraživanja radi provjere učinaka otapala na mikrobnu biomasu.
Tikvice koje sadrže obrađeno tlo se priključuju na protočni sustav opisan na slici 1. ili se zatvore apsorpcijskom kolonom prikazanom na slici 2. (vidjeti Dodatak 3.).
1.9.3. Uzorkovanje i mjerenje
U odgovarajućim vremenskim razmacima vade se po dvije paralelne tikvice i uzorci tla ekstrahiraju odgovarajućim otapalima različitog polariteta i analiziraju na ispitivanu tvar i/ili proizvode pretvorbe. Dobar plan istraživanja predviđa dovoljan broj tikvica da se prilikom svakog uzorkovanja mogu žrtvovati po dvije tikvice. Osim toga, apsorpcijske otopine odnosno kruti apsorpcijski materijali se u različitim vremenskim razmacima (razmaci od 7 dana u prvom mjesecu, nakon prvog mjeseca u razmacima od 17 dana) tijekom inkubacije i na kraju inkubacije svakog uzorka tla uklanjaju i analiziraju na hlapljive proizvode. Uz uzorak tla koji se uzima neposredno nakon primjene (uzorak 0. dana) treba predvidjeti još najmanje pet vremena uzorkovanja. Vremenske razmake treba odabrati na način da se mogu utvrditi obrasci razgradnje ispitivane tvari i obrasci tvorbe i razgradnje proizvoda pretvorbe (npr. 0, 1, 3, 7 dana; 2, 3 tjedna, 1, 2, 3 mjeseca itd.).
Ako se koristi 14C obilježena ispitivana tvar, neizlučljiva radioaktivnost se kvantificira izgaranjem i izračuna bilanca mase za svaki interval uzorkovanja.
U slučaju anaerobne inkubacije i inkubacije u uvjetima rižinog polja, faza tla i vodena faza se zajedno analiziraju na ispitivanu tvar i proizvode pretvorbe, ili se prije ekstrakcije i analize odvoje filtriranjem ili centrifugiranjem.
1.9.4. Fakultativna ispitivanja
Aerobna nesterilna istraživanja pri dodatnim temperaturama i vlažnostima tla mogu biti korisna za procjenu utjecaja temperature i vlažnosti tla na brzinu pretvorbe ispitivane tvari i/ili njezinih proizvoda pretvorbe u tlu.
Neizlučljiva radioaktivnost može se pokušati detaljnije opisati npr. putem ekstrakcije superkritičnim fluidima.
2. PODACI
2.1. OBRADA REZULTATA
Količine ispitivane tvari, proizvoda pretvorbe, hlapljivih tvari (samo u %) i neizlučljivih tvari treba navesti u % primijenjene početne koncentracije te, prema potrebi, u mg· kg-1 tla (na bazi suhe mase tla) za svaki interval uzorkovanja. Bilancu mase treba prikazati u postotku primijenjene početne koncentracije za svaki interval uzorkovanja. Grafički prikaz koncentracija ispitivane tvari u vremenu omogućit će procjenu vremena poluraspada pretvorbe odnosno DT50. Potrebno je identificirati glavne proizvode pretvorbe i izraditi grafički prikaz njihovih koncentracija u ovisnosti o vremenu tako da bude vidljiva brzina njihove tvorbe i razgradnje. Glavni proizvod pretvorbe je bilo koji proizvod koji u bilo kojem trenutku tijekom istraživanja čini ≥ 10 % primijenjene doze.
Odvojeni hlapljivi proizvodi daju određeni uvid u potencijal hlapljivosti ispitivane tvari i njezinih proizvoda pretvorbe iz tla.
Točnije određivanje vremena poluraspada odnosno vrijednosti DT50 i, prema potrebi, DT75 i DT90 trebalo bi se postići izračunima uz pomoć odgovarajućih kinetičkih modela. Vrijeme poluraspada i vrijednost DT50 treba navesti zajedno s opisom primijenjenog modela, redom kinetike i koeficijentom determinacije (r2). Prednost se daje kinetici prvog reda, osim ako je r2 < 0,7. Te izračune treba prema potrebi primijeniti i na glavne proizvode pretvorbe. Primjeri odgovarajućih modela opisani su u (31) do (35).
Ako se istraživanja za određivanje brzine provode na različitim temperaturama, brzine pretvorbe treba opisati kao funkciju temperature unutar temperaturnog područja pokusa primjenom Arrheniusovog odnosa u obliku:
 sau
sau 
gdje su ln A i B regresijske konstante odsječka odnosno nagiba najboljeg pravca dobivenog linearnom regresijom ln k prema 1/T, k je konstanta brzine na temperaturi T i T je temperatura u kelvinima. Ako je pretvorba uvjetovana mikrobnom aktivnošću, treba voditi računa o ograničenom temperaturnom području u kojemu vrijedi Arrheniusov odnos.
2.2. VREDNOVANJE I TUMAČENJE REZULTATA
Iako se istraživanja provode u umjetnom laboratorijskom sustavu, rezultati omogućuju procjenu brzine pretvorbe ispitivane tvari te brzine tvorbe i razgradnje proizvoda pretvorbe u stvarnim uvjetima na terenu (36)(37).
Istraživanje puta pretvorbe ispitivane tvari pruža informacije o načinu na koji se primijenjena tvar strukturno mijenja u tlu kemijskim i mikrobnim reakcijama.
3. IZVJEŠĆIVANJE
Izvješće o ispitivanju mora sadržavati:
|
|
ispitivana tvar:
|
|
|
Referentne tvari:
|
|
|
Ispitivana tla:
|
|
|
Ispitni uvjeti:
|
|
|
Rezultati:
|
4. REFERENCE
|
(1) |
US – Environmental Protection Agency, (1982) Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate. |
|
(2) |
Agriculture Canada, (1987) Environmental Chemistry and Fate. Guidelines for registration of pesticides in Canada. |
|
(3) |
Europska Unija (EU), (1995) Direktiva Komisije 95/36/EZ od 14. srpnja 1995. o izmjeni Direktive Vijeća 91/414/EEZ o stavljanju na tržište proizvoda za zaštitu biljaka Prilog II., Dio A i Prilog III., Dio A: Opstanak i ponašanje u okolišu. |
|
(4) |
Dutch Commission for Registration of Pesticides, (1995) Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air. |
|
(5) |
BBA, (1986) Richtlinie für die amtliche Prüfung von Pflanzenschutzmitteln, Teil IV, 4-1. Verbleib von Pflanzenschutzmitteln im Boden – Abbau, Umwandlung und Metabolismus. |
|
(6) |
ISO/DIS 11266-1, (1994) Soil Quality – Guidance on laboratory tests for biodegradation of organic chemicals in soil – Part 1: Aerobic conditions. |
|
(7) |
ISO 14239, (1997) Soil Quality – Laboratory incubation systems for measuring the mineralisation of organic chemicals in soil under aerobic conditions. |
|
(8) |
SETAC, (1995) Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed. |
|
(9) |
MAFF – Japan 2000 – Draft Guidelines for transformation studies of pesticides in soil – Aerobic metabolism study in soil under paddy field conditions (flooded). |
|
(10) |
OECD, (1995) Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italy, 18-20 January 1995. |
|
(11) |
Guth, J.A., (1980) The study of transformations. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, str. 123-157. |
|
(12) |
DFG: Pesticide Bound Residues in Soil. Wiley – VCH (1998). |
|
(13) |
T.R. Roberts: Non-extractable pesticide residue in soils and plants. Pure Appl. Chem. 56, 945-956 (IUPAC 1984). |
|
(14) |
OECD Test Guideline 304 A: Inherent Biodegradability in Soil (adopted 12 May 1981). |
|
(15) |
ISO 10381-6 (1993) Soil Quality – Sampling – Part 6: Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory. |
|
(16) |
Dodatak V. Direktivi 67/548/EEZ. |
|
(17) |
Guth, J.A., (1981) Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry. D.H. Hutson, T.R. Roberts, Eds. J. Wiley & Sons. Vol 1, 85-114. |
|
(18) |
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26:305 (1962). |
|
(19) |
Methods of Soil Analysis (1986) Part 1, Physical and Mineralogical Methods. A. Klute, Ed.) Agronomy Series No 9, 2nd Edition. |
|
(20) |
Methods of Soil Analysis (1982) Part 2, Chemical and Microbiological Properties. A.L. Page, R.H. Miller and D.R. Kelney, Eds. Agronomy Series No 9, 2nd Edition. |
|
(21) |
ISO Standard Compendium Environment (1994) Soil Quality – General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition. |
|
(22) |
Mückenhausen, E., (1975) Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt, Main. |
|
(23) |
Scheffer, F., Schachtschabel, P., (1975) Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart. |
|
(24) |
Anderson, J.P.E., Domsch, K.H., (1978) A physiological method for the quantitative measurement of microbial biomass in soils. Soil Biol. Biochem. 10, str. 215-221. |
|
(25) |
ISO 14240-1 and 2 (1997) Soil Quality – Determination of soil microbial biomass – Part 1: Substrate-induced respiration method. Part 2: fumigation-extraction method. |
|
(26) |
Anderson, J.P.E., (1987) Handling and storage of soils for pesticide experiments. In Pesticide Effects on Soil Microflora. L. Somerville, M.P. Greaves, Eds. Taylor & Francis, 45-60. |
|
(27) |
Kato, Yasuhiro. (1998) Mechanism of pesticide transformation in the environment: Aerobic and bio-transformation of pesticides in aqueous environment. Proceedings of the 16th Symposium on Environmental Science of Pesticide, str. 105-120. |
|
(28) |
Keuken O., Anderson J.P.E., (1996) Influence of storage on biochemical processes in soil. In Pesticides, Soil Microbiology and Soil Quality, 59-63 (SETAC-Europe). |
|
(29) |
Stenberg B., Johansson M., Pell M., Sjödahl-Svensson K., Stenström J., Torstensson L. (1996) Effect of freeze and cold storage of soil on microbial activities and biomass. In Pesticides, Soil Microbiology and Soil Quality, 68-69 (SETAC-Europe). |
|
(30) |
Gennari, M., Negre, M., Ambrosoli, R., (1987) Effects of ethylene oxide on soil microbial content and some chemical characteristics. Plant and Soil 102, str. 197-200. |
|
(31) |
Anderson, J.P.E. (1975) Einfluss von Temperatur und Feuchte auf Verdampfung, Abbau und Festlegung von Diallat im Boden. Z. PflKrankh Pflschutz, Sonderheft VII, str. 141-146. |
|
(32) |
Hamaker, J.W., (1976) The application of mathematical modelling to the soil persistence and accumulation of pesticides. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides, str. 181-199. |
|
(33) |
Goring, C.A.I., Laskowski, D.A., Hamaker, J.W., Meikle, R.W., (1975) Principles of pesticide degradation in soil. In „Environmental Dynamics of Pesticides”. R. Haque and V.H. Freed, Eds., str. 135-172. |
|
(34) |
Timme, G., Frehse, H., Laska, V., (1986) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues. II. Pflanzenschutz – Nachrichten Bayer 39, str. 188-204. |
|
(35) |
Timme, G., Frehse, H., (1980) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues. I. Pflanzenschutz – Nachrichten Bayer 33, str. 47-60. |
|
(36) |
Gustafson D.I., Holden L.R., (1990) Non-linear pesticide dissipation in soil; a new model based on spatial variability. Environm. Sci. Technol. 24, str. 1032-1041. |
|
(37) |
Hurle K., Walker A., (1980) Persistence and its prediction. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, str. 83-122. |
Dodatak 1.
VODNI TLAK, POLJSKI KAPACITET (FC) I VODNI KAPACITET (WHC) (47)
|
Visina vodenog stupca [cm] |
pF (48) |
bar (49) |
Napomene |
|
107 |
7 |
104 |
suho tlo |
|
1,6 · 104 |
4,2 |
16 |
točka venuća |
|
104 |
4 |
10 |
|
|
103 |
3 |
1 |
|
|
6 · 102 |
2,8 |
0,6 |
|
|
3,3 · 102 |
2,5 |
0,33 (50) |
područje poljskog kapaciteta (51) |
|
102 |
2 |
0,1 |
|
|
60 |
1,8 |
0,06 |
|
|
33 |
1,5 |
0,033 |
|
|
10 |
1 |
0,01 |
WHC (aproksimacija) |
|
1 |
0 |
0,001 |
tlo zasićeno vodom |
Vodni tlak mjeri se u cm vodenog stupca ili barima. Zbog širokog raspona napona vlažnosti izražava se jednostavno kao vrijednost pF koja je istovjetna logaritmu cm vodenog stupca.
Poljski kapacitet definira se kao količina vode koju može pohraniti prirodno tlo protiv gravitacije dva dana nakon dužeg kišnog razdoblja ili nakon dostatnog navodnjavanja. Određuje se u neporemećenim tlima in situ u polju. Dakle, mjerenje nije primjenljivo u slučaju poremećenih laboratorijskih uzoraka tla. Vrijednosti FC određene u poremećenim tlima mogu pokazivati velike sustavne varijance.
Vodni kapacitet (WHC) određuje se u laboratoriju na neporemećenom i poremećenom tlu zasićenjem stupca tla vodom kapilarnim transportom. Posebno je koristan kod poremećenih tala i može biti i do 30 % viši od poljskog kapaciteta (1). Osim toga, pokusom ga je lakše odrediti nego pouzdane vrijednosti FC.
Napomene:
Dodatak 2.
SADRŽAJI VLAGE (g vode na 100 g suhog tla) U RAZLIČITIM VRSTAMA TLA IZ RAZLIČITIH ZEMALJA
|
Vrsta tla |
Zemlja |
Sadržaj vlage tla pri |
||
|
|
|
WHC (52) |
pF = 1,8 |
pF = 2,5 |
|
Pijesak |
Njemačka |
28,7 |
8,8 |
3,9 |
|
Ilovasti pijesak |
Njemačka |
50,4 |
17,9 |
12,1 |
|
Ilovasti pijesak |
Švicarska |
44,0 |
35,3 |
9,2 |
|
Praškasta ilovača |
Švicarska |
72,8 |
56,6 |
28,4 |
|
Glinasta ilovača |
Brazil |
69,7 |
38,4 |
27,3 |
|
Glinasta ilovača |
Japan |
74,4 |
57,8 |
31,4 |
|
Pjeskasta ilovača |
Japan |
82,4 |
59,2 |
36,0 |
|
Praškasta ilovača |
SAD |
47,2 |
33,2 |
18,8 |
|
Pjeskasta ilovača |
SAD |
40,4 |
25,2 |
13,3 |
Dodatak 3.
Slika 1.
Primjer protočne aparature za proučavanje pretvorbe kemikalija u tlu (53) (54)

Slika 2.
Primjer tikvice biometarskog tipa za proučavanje pretvorbe kemikalija u tlu (55)

C.24. AEROBNA I ANAEROBNA PRETVORBA U SUSTAVIMA VODENOG SEDIMENTA
1. METODA
Ova ispitna metoda odgovara smjernici OECD TG 308 (2002.).
1.1. UVOD
Kemikalije mogu ući u plitke i duboke površinske vode različitim putevima, kao što je izravna primjena, rasap, otjecanje, ocjeđivanje, odlaganje otpada, industrijske, komunalne i poljoprivredne otpadne vode ili atmosfersko taloženje. U ovoj ispitnoj metodi opisana je laboratorijska metoda za ocjenjivanje aerobne i anaerobne pretvorbe organskih kemikalija u sustavima vodenog sedimenta. Ona se temelji na postojećim smjernicama (1)(2)(3)(4)(5)(6). Na radionici OECD-a o odabiru tala/sedimenata održanoj u talijanskom Belgiratu 1995. (7) posebno su dogovoreni broj i vrste sedimenata koje će se koristiti u ovom testu. Osim toga, dane su preporuke u vezi sa skupljanjem, rukovanjem i skladištenjem uzoraka sedimenta na temelju smjernice ISO (8). Ovakva su istraživanja potrebna u slučaju kemikalija koje se izravno primjenjuju u vodu odnosno koje bi mogle dospjeti u vodni okoliš gore navedenim putevima.
Uvjeti u prirodnim sustavima vodenog sedimenta često su aerobni u gornjoj vodenoj fazi. Površinski sloj sedimenta može biti aeroban ili anaeroban, dok je dublji sediment obično anaeroban. Kako bi se obuhvatile sve te mogućnosti, u ovom su dokumentu opisani aerobni i anaerobni testovi. Aerobni test simulira aerobni vodeni stupac iznad aerobnog sloja sedimenta koji je podložen anaerobnm gradijentom. Anaerobni test simulira potpuno anaerobni sustav voda-sediment. Ako okolnosti zahtijevaju da se značajno odstupi od tih preporuka, primjerice korištenjem netaknutih sedimentnih jezgri ili sedimenata koji su možda već bili izloženi ispitivanoj tvari, za to su raspoložive druge metode (9).
1.2. DEFINICIJE
U svakom slučaju treba koristiti jedinice Međunarodnog sustava jedinica (SI).
Ispitivana tvar: bilo koja tvar, bilo polazni spoj ili relevantni proizvodi pretvorbe.
Proizvodi pretvorbe: sve tvari koje nastaju u biotičkim i abiotičkim reakcijama pretvorbe ispitivane tvari, uključujući CO2 i vezane ostatke.
Vezani ostaci: „vezani ostaci” predstavljaju spojeve u tlu, biljki ili životinji koji nakon ekstrakcija ostaju u matrici u obliku polazne tvari ili njezinog(-ih) metabolita. Metoda ekstrakcije ne smije znatno promijeniti same spojeve niti strukturu matrice. Vrsta veze može se djelomično razjasniti ekstrakcijskim metodama koje mijenjaju matricu i sofisticiranim analitičkim tehnikama. Do sada su na taj način utvrđene npr. kovalentne ionske i sorpcijske veze te uklapanja. Općenito, tvorba vezanih ostataka značajno smanjuje biodostupnost i bioraspoloživost (10) (prilagođeno na temelju IUPAC-a 1984. (11)).
Aerobna pretvorba: (oksidacijska): reakcije koje se odvijaju u prisutnosti molekularnog kisika (12).
Anaerobna pretvorba: (redukcijska): reakcije koje se odvijaju bez pristupa molekularnog kisika (12).
Prirodne vode: površinske vode dobivene iz jezeraca, rijeka, potoka itd.
Sediment: mješavina mineralnih sastojaka i organsko-kemijskih sastojaka koji sadrže spojeve velike molekulske mase s visokim sadržajem ugljika i dušika. Nastaje taloženjem iz vode i čini sučelje s vodom.
Mineralizacija: potpuna razgradnja organskog spoja u CO2 i H2O u aerobnim uvjetima i CH4, CO2 i H2O u anaerobnim uvjetima. Ako se u kontekstu ove ispitne metode koristi radioaktivno obilježeni spoj, mineralizacija znači opsežnu razgradnju molekule tijekom koje se obilježeni atom ugljika kvantitativno oksidira ili reducira uz otpuštanje odgovarajuće količine 14CO2 odnosno 14CH4.
Vrijeme poluraspada, t0,5: vrijeme koje je potrebno za 50 %-tnu pretvorbu ispitivane tvari, ako se pretvorba može opisati kinetikom prvog reda; ono je neovisno o početnoj koncentraciji.
DT50 (vrijeme nestajanja 50): vrijeme u kojemu se početna koncentracija ispitivane tvari smanji za 50 %.
DT75 (VRIJEME NESTAJANJA 75): VRIJEME U KOJEMU SE POČETNA KONCENTRACIJA ISPITIVANE TVARI SMANJI ZA 75 %.
DT90 (vrijeme nestajanja 90): vrijeme u kojemu se početna koncentracija ispitivane tvari smanji za 90 %.
1.3. REFERENTNE TVARI
Referentne tvari treba koristiti za identifikaciju i kvantifikaciju proizvoda pretvorbe spektroskopskim i kromatografskim metodama.
1.4. INFORMACIJE O ISPITIVANOJ TVARI
Za mjerenje brzine pretvorbe mogu se koristiti neobilježene ispitivane tvari i ispitivane tvari obilježene radioaktivnim izotopom, s time da se prednost daje obilježenom materijalu. Za proučavanje puta pretvorbe i utvrđivanje bilance mase potreban je obilježeni materijal. Preporučuje se 14C obilježavanje, ali korisna je i primjena drugih izotopa, kao što su 13C, 15N, 3H, 32P. Ako je to moguće, oznaku treba staviti na najstabilni dio odnosno dijelove molekule (56). Kemijska i/ili radiokemijska čistoća ispitivane tvari treba biti najmanje 95 %.
Prije ispitivanja trebaju biti raspoložive sljedeće informacije o ispitivanoj tvari:
|
(a) |
topljivost u vodi (metoda A.6.); |
|
(b) |
topljivost u organskim otapalima; |
|
(c) |
tlak pare (metoda A.4.) i konstanta Henryjevog zakona; |
|
(d) |
podjelni koeficijent n-oktanol/voda (metoda A.8.); |
|
(e) |
koeficijent adsorpcije (Kd, Kf ili Koc, prema potrebi) (metoda C.18.); |
|
(f) |
hidroliza (metoda C.7.); |
|
(g) |
konstanta disocijacije (pKa) (smjernica OECD 112) (13); |
|
(h) |
kemijska struktura ispitivane tvari i položaj izotopne oznake odnosno oznaka (prema potrebi). |
Napomena: treba navesti temperaturu na kojoj su provedena ta mjerenja.
Osim toga, korisno je imati podatke o toksičnosti ispitivane tvari za mikroorganizme, podatke o lakoj i/ili svojstvenoj biorazgradivosti i podatke o aerobnoj i anaerobnoj pretvorbi u tlu.
Trebaju biti raspoložive analitičke metode (uključujući metodu ekstrakcije i pročišćavanja) za identifikaciju i kvantifikaciju ispitivane tvari i njezinih proizvoda pretvorbe u vodi i sedimentu (vidjeti odjeljak 1.7.2.).
1.5. NAČELO ISPITNE METODE
U metodi koja je ovdje opisana koristi se sustav aerobnog i anaerobnog vodenog sedimenta (vidjeti Dodatak 1.) koji omogućuje:
|
|
mjerenje brzine pretvorbe ispitivane tvari u sustavu voda-sediment, |
|
|
mjerenje brzine pretvorbe ispitivane tvari u sedimentu, |
|
|
mjerenje brzine mineralizacije ispitivane tvari i/ili proizvoda pretvorbe (ako se koristi 14C obilježena ispitivana tvar), |
|
|
identifikaciju i kvantifikaciju proizvoda pretvorbe u vodenoj i sedimentnoj fazi, uključujući bilancu mase (ako se koristi obilježena ispitivana tvar), |
|
|
mjerenje razdiobe ispitivane tvari i njezinih proizvoda pretvorbe između dviju faza u razdoblju inkubacije u mraku (npr. kako bi se izbjeglo cvjetanje algi) na stalnoj temperaturi. Ako podaci na to upućuju, određuju se vremena poluraspada, vrijednosti DT50, DT75 i DT90, ali se ne smiju ekstrapolirati daleko izvan pokusnog razdoblja (vidjeti odjeljak 1.2.). |
Potrebna su najmanje dva sedimenta i pripadajuća voda, kako za aerobna tako i za anaerobna istraživanja (7). Ipak, ponekad je potrebno koristiti više od dva vodena sedimenta, primjerice kod kemikalija koje mogu biti prisutne u slatkovodnoj i/ili morskoj sredini.
1.6. PRIMJENLJIVOST TESTA
Metoda se općenito može primijeniti na sve kemikalije (neobilježene i obilježene) za koje je raspoloživa dovoljno točna i osjetljiva analitička metoda. Ona se može primijeniti na blago hlapljive i nehlapljive spojeve kao i na vodotopljive spojeve i spojeve koji su slabo topljivi u vodi. Ovaj test ne treba primjenjivati u slučaju kemikalija koje su jako hlapljive iz vode (npr. fumiganti, organska otapala) te se stoga ne mogu zadržati u vodi i/ili sedimentu u pokusnim uvjetima ovog testa.
Metoda je do sada korištena za proučavanje pretvorbe kemikalija u slatkim vodama i sedimentima, ali se u načelu može primijeniti i na estuarijske/morske sustave. Nije prikladna za simulaciju uvjeta u tekućicama (npr. rijeke) ili otvorenom moru.
1.7. KRITERIJI KAKVOĆE
1.7.1. Iskorištenje
Prve naznake ponovljivosti analitičke metode i uspješnosti jednolike primjene ispitivane tvari mogu se dobiti ekstrakcijom i analizom najmanje dva paralelna uzorka vode i sedimenta neposredno nakon dodavanja ispitivane tvari. Iskorištenja u kasnijim fazama pokusa proizlaze iz odgovarajućih bilanci mase (ako se koristi obilježeni materijal). Iskorištenje se treba kretati u području od 90 % do 110 % kod obilježenih kemikalija (6) i od 70 % do 110 % kod neobilježenih kemikalija.
1.7.2. Ponovljivost i osjetljivost analitičke metode
Ponovljivost analitičke metode (bez početne učinkovitosti ekstrakcije) kod kvantifikacije ispitivane tvari i proizvoda pretvorbe može se provjeriti dvostrukom analizom istog ekstrakta uzoraka vode odnosno sedimenta koji su inkubirani dovoljno dugo da nastanu proizvodi pretvorbe.
Granica detekcije (limit of detection, LOD) analitičke metode za ispitivanu tvar i proizvode pretvorbe treba biti najmanje 0,01 mg· kg-1 u vodi odnosno sedimentu (kao ispitivana tvar) ili 1 % početne količine primijenjene na ispitni sustav, ovisno o tome što je manje. Također je potrebno navesti granicu kvantifikacije (limit of quantification, LOQ).
1.7.3. Točnost podataka o pretvorbi
Regresijska analiza koncentracija ispitivane tvari kao funkcije vremena daje odgovarajuće informacije o točnosti krivulje pretvorbe i omogućuje izračun granica pouzdanosti za vremena poluraspada (u slučaju primjene kinetike pseudoprvog reda) odnosno vrijednosti DT50 i, prema potrebi, DT75 i DT90.
1.8. OPIS METODE
1.8.1. Ispitni sustav i aparatura
Istraživanje se provodi u staklenim posudama (npr. boce, epruvete za centrifugiranje), osim ako preliminarne informacije (kao što je podjelni koeficijent n-oktanol-voda, podaci o sorpciji itd.) ukazuju na to da ispitivana tvar prianja na staklo, u kom slučaju treba razmisliti o alternativnom materijalu (kao što je teflon). Ako je poznato da ispitivana tvar prianja na staklo, problem se može ublažiti primjenom jedne ili više sljedećih metoda:
|
— |
određivanje mase ispitivane tvari i proizvoda pretvorbe sorbiranih na staklo, |
|
— |
pranje svog staklenog posuđa otapalom na kraju ispitivanja, |
|
— |
korištenje formuliranih proizvoda (vidjeti i odjeljak 1.9.2.), |
|
— |
korištenje veće količine pomoćnog otapala za dodavanje ispitivane tvari u sustav; ako se koristi pomoćno otapalo, to treba biti otapalo koje ne solvolizira ispitivanu tvar. |
Primjeri tipične ispitne aparature tj. plinski protočni sustav i sustav biometarskog tipa prikazani su u Dodatku 2. odnosno 3. (14). Drugi korisni inkubacijski sustavi opisani su u literaturi (15). Pokusna aparatura treba omogućavati izmjenu zraka odnosno dušika i odvajanje hlapljivih proizvoda. Dimenzije aparature moraju zadovoljavati zahtjeve ispitivanja (vidjeti odjeljak 1.9.1.). Zračenje se može postići nježnim upuhivanjem ili prevođenjem zraka odnosno dušika preko površine vode. U ovom posljednjem slučaju preporučuje se nježno miješati vodu odozgora radi bolje razdiobe kisika odnosno dušika u vodi. Ne smije se koristiti zrak bez CO2 jer on može dovesti do povećanja pH vrijednosti vode. U svakom slučaju, remećenje sedimenta nepoželjno je i treba ga što je moguće više izbjegavati. Blago hlapljive kemikalije treba ispitati u sustavu biometarskog tipa uz nježno miješanje vodene površine. Mogu se koristiti i zatvorene posude u kojima je prostor iznad uzroka ispunjen atmosferskim zrakom ili dušikom, unutar kojih su smještene bočice za odvajanje hlapljivih proizvoda (16). Kod aerobnog ispitivanja potrebno je osigurati redovitu izmjenu plina iznad uzorka kako bi se kompenzirala potrošnja kisika biomase.
Prikladni odvajači za skupljanje hlapljivih proizvoda pretvorbe su, između ostaloga, otopine kalijevog hidroksida ili natrijevog hidroksida (1 mol· dm-3) za ugljikov dioksid (57) i etilenglikol, etanolamin ili 2 %-tni parafin u ksilenu za organske spojeve. Hlapljive tvari koje nastaju u anaerobnim uvjetima, kao što je metan, mogu se primjerice skupljati na molekulskim sitima. Te se hlapljive tvari mogu npr. sagorjeti u CO2 provođenjem plina kroz kremenu cjevčicu napunjenu CuO na temperaturi od 900 °C i odvajanjem nastalog CO2 u apsorberu s lužinom (17).
Potrebni su laboratorijski instrumenti za kemijsku analizu ispitivane tvari i proizvoda pretvorbe (npr. plinsko-tekućinska kromatografija (GLC), tekućinska kromatografija visoke djelotvornosti (HPLC), tankoslojna kromatografija (TLC), spektroskopija masa (MS), plinska kromatografija – spektroskopija masa (GC-MS), tekućinska kromatografija – spektrometrija masa (LC-MS), nuklearna magnetska rezonanca (NMR) itd.), uključujući odgovarajuće detektcijske sustave za radioaktivno obilježene i neobilježene kemikalije. Ako se koristi radioaktivno obilježeni materijal, također je potreban tekućinski scintilacijski brojač i oksidacijsko sredstvo (za izgaranje uzoraka sedimenta prije analize radioaktivnosti).
Prema potrebi treba koristiti i drugu standardnu laboratorijsku opremu za fizikalno-kemijska i biološka određivanja (vidjeti odjeljak 1.8.2.2. tablicu 1.), stakleno posuđe, kemikalije i reagense.
1.8.2. Odabir i broj vodenih sedimenata
Mjesta uzorkovanja treba odabrati u skladu sa svrhom ispitivanja. Kod odabira mjesta uzorkovanja treba uzeti u obzir moguću povijest unosa materijala iz poljoprivrede, industrije i kućnanstava u sliv i vode uzvodno. Sedimenti se ne smiju koristiti ako su u posljednje četiri godine onečišćeni ispitivanom tvari ili njezinim strukturnim analozima.
1.8.1.2. Odabir sedimenata
Kod aerobnih se istraživanja uglavnom koriste dva sedimenta (7). Dva odabrana sedimenta trebaju biti različita s obzirom na sadržaj organskog ugljika i teksturu. Jedan sediment treba imati visok sadržaj organskog ugljika (2,5–7,5 %) i finu teksturu, a drugi sediment treba imati nizak sadržaj organskog ugljika (0,5–2,5 %) i grubu teksturu. Razlika u sadržaju organskog ugljika u pravilu treba biti najmanje 2 %. „Fina tekstura” je definirana kao sadržaj (glina + prah) (58) > 50 %, a „gruba tekstura” kao sadržaj (glina + prah) < 50 %. Razlika u sadržaju (glina + prah) između dva sedimenta treba u pravilu biti najmanje 20 %. Ako kemikalija može dospjeti i u morske vode, barem jedan sustav voda-sediment treba biti morskog podrijetla.
Kod strogo anaerobnog istraživanja treba uzeti dva uzorka sedimenta (uključujući pripadajuću vodu) iz anaerobnih zona površinskih vodnih cjelina (7). Sedimentnom i vodenom fazom treba pažljivo rukovati i pažljivo ih prenositi bez pristupa kisika.
Za odabir sedimenata mogu biti važni i drugi parametri, koje treba uzeti u obzir ovisno o slučaju. Primjerice, područje pH vrijednosti sedimenata važno je kod ispitivanja kemikalija kod kojih pretvorba i/ili sorpcija ovisi o pH. Ovisnost sorpcije o pH može se očitovati u vrijednosti pKa ispitivane tvari.
1.8.2.2. Opisivanje uzoraka voda-sediment
Pregled ključnih parametara za vodu i sediment koje treba mjeriti i navesti u izvješću (s uputom na primijenjenu metodu) dan je u tablici u nastavku zajedno s fazom ispitivanja u kojoj se ti parametri određuju. Informacije o metodama za određivanje tih parametara mogu se pronaći u referencama (18)(19)(20)(21).
Osim toga, u pojedinim je slučajevima potrebno izmjeriti i navesti i druge parametre (npr. za slatke vode: čestice, alkalitet, tvrdoća, vodljivost, NO3/PO4 (omjer i pojedinačne vrijednosti); za sedimente: kapacitet izmjene kationa, vodni kapacitet, karbonat, ukupni dušik i fosfor; za morske sustave: salinitet). Kod ocjenjivanja redoks uvjeta, posebno kod anaerobne pretvorbe, također je korisno napraviti analizu sedimenata i vode na nitrat, sulfat, bioraspoloživo željezo i moguće druge akceptore elektrona.
Mjerenje parametara za opisivanje uzoraka voda-sediment (7)(22)(23)
|
Parametar |
Faza ispitnog postupka |
|||||
|
uzorkovanje na terenu |
rukovanje |
početak aklimatizacije |
početak ispitivanja |
tijekom ispitivanja |
kraj ispitivanja |
|
|
Voda |
||||||
|
Podrijetlo/izvor |
x |
|
|
|
|
|
|
Temperatura |
x |
|
|
|
|
|
|
pH |
x |
|
x |
x |
x |
x |
|
TOC |
|
|
x |
x |
|
x |
|
Koncentracija O2* |
x |
|
x |
x |
x |
x |
|
Redoks potencijal* |
|
|
x |
x |
x |
x |
|
Sediment |
||||||
|
Podrijetlo/izvor |
x |
|
|
|
|
|
|
Dubina sloja |
x |
|
|
|
|
|
|
pH |
|
x |
x |
x |
x |
x |
|
Razdioba veličina čestica |
|
x |
|
|
|
|
|
TOC |
|
x |
x |
x |
|
x |
|
Mikrobna biomasa (59) |
|
x |
|
x |
|
x |
|
Redoks potencijal (60) |
Promatranje (boja/miris) |
|
x |
x |
x |
x |
1.8.3. Skupljanje, rukovanje i skladištenje
1.8.3.1. Skupljanje
Kod uzorkovanja sedimenta treba koristiti nacrt smjernice ISO o uzorkovanju sedimenta s dna (8). Uzorke sedimenata treba uzeti iz čitavoga gornjeg sloja sedimenta debljine od 5 do 10 cm. Pripadajuću vodu treba uzeti na istoj lokaciji odnosno mjestu i u isto vrijeme kad i sediment. Kod anaerobnih istraživanja sedimente i pripadajuću vodu treba uzorkovati i prenositi bez pristupa kisika (28) (vidjeti odjeljak 1.8.2.1.). Neki uređaji za uzorkovanje opisani su u literaturi (8)(23).
1.8.3.2. Rukovanje
Sediment se odvoji od vode filtriranjem i mokro prosije kroz 2-milimetarsko sito koristeći višak vode s mjesta uzorkovanja, koja se nakon tog baca. Zatim se poznate količine sedimenata i vode pomiješaju u željenom omjeru (vidjeti odjeljak 1.9.1.) u inkubacijskim tikvicama i pripreme za aklimatizaciju (vidjeti odjeljak 1.8.4.). Kod anaerobnih istraživanja sva se rukovanja trebaju odvijati bez pristupa kisika (29)(30)(31)(32)(33).
1.8.3.3. Skladištenje
U svakom se slučaju preporučuje korištenje svježe skupljenih uzoraka sedimenta i vode; međutim, ako je skladištenje nužno, sediment i vodu treba prosijati na način kako je opisano gore i zajedno uskladištiti (sediment mora biti natopljen vodom, sloj vode 6–10 cm) u mraku na 4 ± 2 °C4 najduže četiri tjedna (7)(8)(23). Uzorke koji se koriste u aerobnim istraživanjima treba pohraniti uz slobodan dotok zraka (npr. u otvorenim spremnicima), dok se uzorci za anaerobna istraživanja skladište bez pristupa kisika. Sediment i voda se tijekom prijenosa i skladištenja ne smiju zamrznuti i ne smije doći do isušivanja sedimenta.
1.8.4. Priprema uzoraka sediment/voda za ispitivanje
Prije dodavanja ispitivane tvari treba provesti aklimatizaciju, pri čemu svaki uzorak sediment/voda treba smjestiti u inkubacijsku posudu koja će se koristiti u glavnom ispitivanju; aklimatizacija se mora odvijati u potpuno istim uvjetima kao inkubacija za vrijeme ispitivanja (vidjeti odjeljak 1.9.1.). Razdoblje aklimatizacije je vrijeme potrebno da se postigne potrebna stabilnost sustava, na što ukazuje pH, koncentracija kisika u vodi, redoks potencijal sedimenta i vode i makroskopsko odvajanje faza. Razdoblje aklimatizacije u pravilu treba trajati između jednog i dva tjedna i ne smije biti duže od četiri tjedna. Rezultate određivanja provedenih u tom razdoblju treba navesti u izvješću o ispitivanju.
1.9. PROVOĐENJE ISPITIVANJA
1.9.1. Ispitni uvjeti
Ispitivanje se provodi u aparaturi za inkubaciju (vidjeti odjeljak 1.8.1.) uz omjer volumena vode i sedimenta između 3:1 i 4:1 i sloj sedimenta od 2,5 cm (± 0,5 cm). (61) Preporučuje se korištenje najmanje 50 g sedimenta (na bazi suhe mase) po inkubacijskoj posudi.
Ispitivanje se provodi u mraku na stalnoj temperaturi u području od 10 do 30 C°. Prikladna je temperatura (20 ± 2)°C. U pojedinim slučajevima, ovisno o informacijama koje treba pribaviti ispitivanjem, može se uvesti još jedna, niža temperatura (npr. 10 C°). Temperaturu inkubacije treba pratiti i dokumentirati.
1.9.2. Obrada i primjena ispitivane tvari
Koristi se jedna ispitna kocentracija kemikalije (62). U slučaju sredstava za zaštitu bilja koja se primjenjuju izravno u vodne cjeline, treba koristiti najvišu dozu navedenu na etiketi kao maksimalnu količinu primjene, koju treba preračunati s obzirom na površinu vode u ispitnoj posudi. U svim drugim slučajevima treba koristiti koncentraciju na temelju predviđanja iz emisija u okoliš. Treba voditi računa da koncentracija ispitivane tvari bude dovoljna za opisivanje puta pretvorbe i tvorbe i razgradnje proizvoda pretvorbe. Ponekad je potrebno primijeniti i više doze (npr. 10 puta više), ako se na početku istraživanja koncentracije ispitivane tvari nalaze u blizini granica detekcije i/ili ako se glavni proizvodi pretvorbe koji čine 10 % količine primjene ispitivane tvari teško utvrđuju. Ipak, ako se koriste više ispitne koncentracije, one ne smiju imati značajan štetni učinak na mikrobnu aktivnost sustava voda-sediment. Da bi se postigla stalna koncentracija ispitivane tvari u posudama različitih dimenzija, u pojedinim je slučajevima preporučljivo prilagoditi količinu tvari na temelju dubine vodenog stupca u posudi u odnosu na dubinu vode na terenu (za koju se uzima da iznosi 100 cm, ali mogu se koristiti i druge dubine). Za primjer izračuna vidjeti Dodatak 4.
U idealnom slučaju ispitivanu tvar treba dodati u vodenu fazu ispitnog sustava u obliku vodene otopine. Uporaba malih količina otapala mješljivih s vodom (kao što je aceton, etanol) dopuštena je ako je to nužno za primjenu i razdiobu ispitivane tvari, ali njihova koncentracija ne smije biti viša od 1 % v/v i ona ne smiju imati štetni učinak na mikrobnu aktivnost ispitnog sustava. Vodenu otopinu ispitivane tvari treba pažljivo pripremiti – u odgovarajućim slučajevima treba razmisliti o korištenju generatorskih kolona ili prethodnom miješanju kako bi se osigurala potpuna homogenost. Nakon dodavanja vodene otopine u ispitni sustav preporučuje se nježno miješanje vodene faze uz što manje remećenja sedimenta.
Uporaba formuliranih proizvoda se u pravilu ne preporučuje, budući da sastojci formulacije mogu utjecati na razdiobu ispitivane tvari i/ili proizvoda pretvorbe između vodene i sedimentne faze. Ipak, kod ispitivanih tvari koje su slabo topljive u vodi uporaba formuliranog materijala može biti prikladna alternativa.
Broj inkubacijskih posuda ovisi o broju vremena uzorkovanja (vidjeti odjeljak 1.9.3.). Treba predvidjeti dovoljan broj ispitnih sustava kako bi se kod svakog uzorkovanja mogla žrtvovati po dva sustava. Ako se koriste kontrolne jedinice za svaki vodeni sediment, one se ne obrađuju ispitivanom tvari. Kontrolne jedinice mogu se koristiti za određivanje mikrobne biomase sedimenta i ukupnog organskog ugljika vode i sedimenta na kraju istraživanja. Dvije kontrolne jedinice (tj. po jedna za svaki vodeni sediment) mogu se koristiti za praćenje traženih parametara u sedimentu i vodi u razdoblju aklimatizacije (vidjeti tablicu u odjeljku 1.8.2.2.). Ako se ispitivana tvar primjenjuje uz pomoć otapala, potrebno je uvesti dvije dodatne kontrolne jedinice za mjerenje štetnih učinaka na mikrobnu aktivnost ispitnog sustava.
1.9.3. Trajanje ispitivanja i uzorkovanje
Pokus u pravilu ne bi smio trajati duže od 100 dana (6), a treba ga provoditi dok se ne utvrdi put razgradnje i obrazac razdiobe voda/sediment odnosno dok se 90 % ispitivane tvari ne izgubi pretvorbom i/ili hlapljenjem. Treba predvidjeti najmanje šest vremena uzorkovanja (uključujući nulto vrijeme), a fakultativno se može provesti i preliminarno istraživanje (vidjeti odjeljak 1.9.4.) radi utvrđivanja odgovarajućeg režima uzorkovanja i trajanja ispitivanja, osim ako o ispitivanoj tvari već ima dovoljno podataka iz ranijih istraživanja. Kod ispitivanja hidrofobnih tvari ponekad je potrebno uvesti dodatna uzorkovanja u početnoj fazi istraživanja kako bi se odredila stopa razdiobe između vodene faze i faze sedimenta.
U odgovarajućim vremenima uzorkovanja uzimaju se na analizu čitave inkubacijske posude (s ponavljanjima). Sediment i voda iznad sedimenta analiziraju se odvojeno (63). Površinsku vodu treba pažljivo ukloniti uz minimalno remećenje sedimenta. Prilikom ekstrakcije i opisivanja ispitivane tvari i proizvoda pretvorbe treba primjenjivati odgovarajuće analitičke postupke. Osim toga, treba paziti da se ukloni materijal adsorbiran na inkubacijsku posudu ili spojne cijevi koje služe za hvatanje hlapljivih tvari.
1.9.4. Fakultativno preliminarno ispitivanje
Ako se trajanje i režim uzorkovanja ne mogu procijeniti na temelju drugih relevantnih istraživanja o ispitivanoj tvari, treba razmisliti o provedbi fakultativnog preliminarnog ispitivanja, koje se provodi u istim ispitnim uvjetima kao glavno istraživanje. Ako se provodi preliminarno ispitivanje, treba ukratko navesti odgovarajuće pokusne uvjete i rezultate ispitivanja.
1.9.5. Mjerenja i analiza
Kod svakog uzorkovanja treba izmjeriti i navesti koncentraciju ispitivane tvari i proizvoda pretvorbe u vodi i sedimentu (kao koncentracija i kao postotak primijenjene doze). Općenito, treba identificirati proizvode pretvorbe koji u bilo kojem vremenu uzorkovanja pokazuju ≥ 10 % primijenjene radioaktivnosti u čitavom sustavu voda-sediment, osim ako postoje opravdani razlozi da se to ne učini. Također treba razmisliti o identifikaciji proizvoda pretvorbe čije se koncentracije stalno povećavaju tijekom istraživanja, čak i ako njihove koncentracije ne prelaze gore spomenute granice, budući da to može ukazivati na njihovu postojanost. O tome treba odlučiti ovisno o slučaju i u izvješću navesti odgovarajuće obrazloženje.
Potrebno je navesti rezultate iz sustava za odvajanje plinova/hlapljivih tvari (CO2 i drugi tj. hlapljivi organski spojevi) u svakom vremenu uzorkovanja. Treba navesti brzine mineralizacije. Osim toga, treba navesti neizlučljive (vezane) ostatke u svakom vremenu uzorkovanja.
2. PODACI
2.1. OBRADA REZULTATA
Za svako vrijeme uzorkovanja treba izračunati ukupnu bilancu mase ili iskorištenje (vidjeti odjeljak 1.7.1.) dodane radioaktivnosti. Rezultate treba navesti kao postotak dodane radioaktivnosti. Osim toga, treba navesti razdiobu radioaktivnosti između vode i sedimenta kao koncentraciju i postotak u svakom vremenu uzorkovanja.
Treba izračunati vrijeme poluraspada, DT50 te, prema potrebi, DT75 i DT90 ispitivane tvari, zajedno s granicama pouzdanosti (vidjeti odjeljak 1.7.3.). Podaci o gubicima ispitivane tvari u vodi i sedimentu mogu se dobiti primjenom odgovarajućih alata za ocjenjivanje. Ti alati mogu biti vrlo različiti, od kinetike pseudoprvog reda i tehnika empirijskog prilagođavanja krivulje uz primjenu grafičkih i numeričkih rješenja do složenijih proračuna npr. uz primjenu jednodjelnih i višedjelnih modela. Dodatne informacije mogu se pronaći u relevantnoj literaturi (35)(36)(37).
Svi pristupi imaju prednosti i nedostatke i znatno se razlikuju prema složenosti. Pretpostavka kinetike prvog reda može značiti pretjerano pojednostavnjivanje procesa razgradnje i razdiobe, ali tamo gdje je moguća daje vrijednost (konstanta brzine ili vrijeme poluraspada) koja je lako razumljiva i od značaja za simulacijsko modeliranje i izračune predviđenih koncentracija u okolišu. Empirijskim pristupima i linearnim transformacijama može se postići bolje prilagođavanje krivulja podacima, a time i bolja procjena vremena poluraspada, vrijednosti DT50 te, prema potrebi, DT75 i DT90. Ipak, primjena tih izvedenih konstanti ograničena je. Modeli s odjeljcima mogu dati niz korisnih konstanti značajnjih za ocjenjivanje rizika koje opisuju brzinu razgradnje u različitim odjeljcima i razdiobu kemikalije. Njih također treba koristiti za procjenu konstanti brzine tvorbe i razgradnje glavnih proizvoda pretvorbe. U svakom slučaju, odabranu metodu treba obrazložiti i izvođač pokusa treba grafički i/ili statistički dokazati valjanost podudaranja.
3. IZVJEŠĆIVANJE
3.1. IZVJEŠĆE O ISPITIVANJU
Izvješće mora sadržavati sljedeće informacije:
|
|
ispitivana tvar:
|
|
|
Referentne tvari:
|
|
|
Ispitni sedimenti i voda:
|
|
|
Ispitni uvjeti:
|
|
|
Rezultati:
|
4. REFERENCE
|
(1) |
BBA-Guidelines for the examination of plant protectors in the registration process., (1990) Part IV, Section 5-1: Degradability and fate of plant protectors in the water/sediment system. Germany. |
|
(2) |
Commission for registration of pesticides: Application for registration of a pesticide., (1991) Part G. Behaviour of the product and its metabolites in soil, water and air, Section G.2.1 (a). The Netherlands. |
|
(3) |
MAFF Pesticides Safety Directorate., (1992) Preliminary guideline for the conduct of biodegradability tests on pesticides in natural sediment/water systems. Ref No SC 9046. United-Kingdom. |
|
(4) |
Agriculture Canada: Environmental chemistry and fate., (1987) Guidelines for registration of pesticides in Canada. Aquatic (Laboratory) – Anaerobic and aerobic. Canada. str. 35-37. |
|
(5) |
US-EPA: Pesticide assessment guidelines, Subdivision N. Chemistry: Environmental fate (1982) Section 162-3, Anaerobic aquatic metabolism. |
|
(6) |
SETAC-Europe publication., (1995) Procedures for assessing the environmental fate and ecotoxicity of pesticides. Ed. Dr. Mark R. Lynch. SETAC-Europe, Brussels. |
|
(7) |
OECD Test Guidelines Programme., (1995) Final Report of the OECD Workshop on Selection of Soils/sediments, Belgirate, Italy, 18-20 January 1995. |
|
(8) |
ISO/DIS 5667-12., (1994) Water quality – Sampling – Part 12: Guidance on sampling of bottom sediments. |
|
(9) |
US-EPA (1998a) Sediment/water microcosm biodegradation test. Harmonised Test Guidelines (OPPTS 835.3180). EPA 712-C-98-080. |
|
(10) |
DFG: Pesticide Bound Residues in Soil. Wiley-VCH (1998). |
|
(11) |
T.R. Roberts: Non-extractable pesticide residues in soils and plants. Pure Appl. Chem. 56, 945-956 (IUPAC 1984). |
|
(12) |
OECD Test Guideline 304A: Inherent Biodegradability in Soil (adopted 12 May 1981). |
|
(13) |
OECD (1993): Guidelines for Testing of Chemicals. Paris. OECD (1994-2000): Addenda 6-11 to Guidelines for the Testing of Chemicals. |
|
(14) |
Scholz, K., Fritz R., Anderson C. and Spiteller M. (1988) Degradation of pesticides in an aquatic model ecosystem. BCPC – Pests and Diseases, 3B-4, str. 149-158. |
|
(15) |
Guth, J.A., (1981) Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry (D.H. Hutson, T.R. Roberts, Eds.), Vol. 1, 85-114. J. Wiley & Sons. |
|
(16) |
Madsen, T., Kristensen, P. (1997) Effects of bacterial inoculation and non-ionic surfactants on degradation of polycyclic aromatic hydrocarbons in soil. Environ. Toxicol. Chem. 16, str. 631-637. |
|
(17) |
Steber, J., Wierich, P. (1987) The anaerobic degradation of detergent range fatty alcohol ethoxylates. Studies with 14C-labelled model surfactants. Water Research 21, str. 661-667. |
|
(18) |
Black, C.A. (1965). Methods of Soil Analysis. Agronomy Monograph No 9. American Society of Agronomy, Madison. |
|
(19) |
APHA (1989) Standard Methods for Examination of Water and Wastewater (17th edition). American Public Health Association, American Water Works Association and Water Pollution Control Federation, Washington D.C. |
|
(20) |
Rowell, D.L. (1994) Soil Science Methods and Applications. Longman. |
|
(21) |
Light, T.S., (1972). Standard solution for redox potential measurements. Anal. Chemistry 44, str. 1038-1039. |
|
(22) |
SETAC-Europe publication (1991) Guidance document on testing procedures for pesticides in freshwater mesocosms. From the Workshop „A Meeting of Experts on Guidelines for Static Field Mesocosms Tests”, 3-4 July 1991. |
|
(23) |
SETAC-Europe publication. (1993) Guidance document on sediment toxicity tests and bioassays for freshwater and marine environments. From the Workshop on Sediment Toxicity Assessment (WOSTA), 8-10 November 1993. Eds.: I.R. Hill, P. Matthiessen and F. Heimbach. |
|
(24) |
Vink, J.P.M., van der Zee, S.E.A.T.M. (1997) Pesticide biotransformation in surface waters: multivariate analyses of environmental factors at field sites. Water Research 31, str. 2858-2868. |
|
(25) |
Vink, J.P.M., Schraa, G., van der Zee, S.E.A.T.M. (1999) Nutrient effects on microbial transformation of pesticides in nitrifying waters. Environ. Toxicol, str. 329-338. |
|
(26) |
Anderson, T.H., Domsch, K.H. (1985) Maintenance carbon requirements of actively-metabolising microbial populations under in-situ conditions. Soil Biol. Biochem. 17, str. 197-203. |
|
(27) |
ISO-14240-2., (1997) Soil quality – Determination of soil microbial biomass – Part 2: Fumigation-extraction method. |
|
(28) |
Beelen, P. Van and F. Van Keulen., (1990), The Kinetics of the Degradation of Chloroform and Benzene in Anaerobic Sediment from the River Rhine. Hydrobiol. Bull. 24 (1), str. 13-21. |
|
(29) |
Shelton, D.R. and Tiedje, J.M. (1984) General method for determining anaerobic biodegradation potential. App. Environ. Microbiol. 47, str. 850-857. |
|
(30) |
Birch, R.R., Biver, C., Campagna, R., Gledhill, W.E., Pagga, U., Steber, J., Reust, H. and Bontinck, W.J. (1989) Screening of chemicals for anaerobic biodegradation. Chemosphere 19, str. 1527-1550. |
|
(31) |
Pagga, U. and Beimborn, D.B. (1993) Anaerobic biodegradation tests for organic compounds. Chemoshpere 27, str. 1499-1509. |
|
(32) |
Nuck, B.A. and Federle, T.W., (1986) A batch test for assessing the mineralisation of 14C-radiolabelled compounds under realistic anaerobic conditions. Environ. Sci. Technol. 30, str. 3597-3603. |
|
(33) |
US-EPA (1998b). Anaerobic biodegradability of organic chemicals. Harmonised Test Guidelines (OPPTS 835.3400). EPA 712-C-98-090. |
|
(34) |
Sijm, Haller and Schrap (1997) Influence of storage on sediment characteristics and drying sediment on sorption coefficients of organic contaminants. Bulletin Environ. Contam. Toxicol. 58, str. 961-968. |
|
(35) |
Timme, G., Frehse H. and Laska V. (1986) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues II. Pflanzenschutz – Nachrichten Bayer, 39, str. 187-203. |
|
(36) |
Timme, G., Frehse, H. (1980) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues I. Pflanzenschutz – Nachrichten Bayer, 33, str. 47-60. |
|
(37) |
Carlton, R.R., and Allen, R., (1994) The use of a compartment model for evaluating the fate of pesticides in sediment/water systems. Brighton Crop Protection Conference – Pest and Diseases, str. 1349-1354. |
Dodatak 1.
SMJERNICE ZA AEROBNE I ANAEROBNE ISPITNE SUSTAVE
Aerobni ispitni sustav
Aerobni ispitni sustav opisan u ovoj ispitnoj metodi sastoji se od aerobnog vodenog sloja (tipični raspon koncentracija kisika od 7 do 10 mg·l–1) i sedimentnog sloja, koji je aeroban na površini i anaeroban ispod površine (tipični prosječni redoks potencijali (Eh) u anaerobnoj zoni sedimenta kreću se u području između – 80 i – 190 mV). Ovlaženi zrak prevodi se preko površine vode u svakoj inkubacijskoj jedinici kako bi se osigurala dovoljna količina kisika u prostoru iznad uzorka.
Anaerobni ispitni sustav
Kod anaerobnog ispitnog sustava ispitni postupak je uglavnom isti kao kod aerobnog sustava, ali se u svakoj inkubacijskoj jedinici preko površine vode prevodi ovlaženi dušik radi osiguravanja potrebnog dušika u prostoru iznad uzorka. Sediment i voda smatraju se anaerobnim kad je redoks potencijal (Eh) niži od – 100 mV.
Kod anaerobnog ispitivanja ocjenjivanje mineralizacije uključuje mjerenje razvijenog ugljikovog dioksida i metana.
Dodatak 2.
PRIMJER PLINSKE PROTOČNE APARATURE

Dodatak 3.
PRIMJER BIOMETARSKE APARATURE

Dodatak 4.
PRIMJER IZRAČUNA DOZE PRIMJENE ZA ISPITNE POSUDE
|
Unutarnji promjer cilindra: |
= 8 cm |
|
Dubina vodenog stupca bez sedimenta: |
= 12 cm |
|
Površina: 3,142 × 42 |
= 50,3 cm2 |
|
Količina primjene: 500 g ispitivane tvari/ha odgovara 5 μg/cm2 |
|
|
Ukupno μg: 5 × 50,3 |
= 251,5 μg |
|
Prilagođavanje količine u odnosu na dubinu od 100 cm: |
|
|
12 × 251,5 ÷ 100 |
= 30,18 μg |
|
Volumen vodenog stupca: 50,3 × 12 |
= 603 ml |
|
Koncentracija u vodi: 30,18 ÷ 603 |
= 0,050 μg/ml ili 50 μg/l |
(1) Prema rezultatima tih međulaboratorijskih ispitivanja i u skladu s tehničkim ispravkom ISO 6341 EC50 – 24 h kalijevog dikromata (K2Cr2O7) nalazi se u području između 0,6 mg/l i 1,7 mg/l.
(2) Voda prikladne čistoće npr. deionizirana, destilirana ili pročišćena obrnutom osmozom, čija vodljivost po mogućnosti ne prelazi 10 μS.cm–1.
(3) D1 i D2 se ne uprosječuju ako se vrijednosti znatno razlikuju.
(4) D1 i D2 se ne uprosječuju ako se vrijednosti znatno razlikuju.
(5) Ili na kraju inkubacije.
(6) D1 i D2 se ne uprosječuju ako se vrijednosti znatno razlikuju.
(7) Ili na kraju inkubacije.
(8) Srednja se vrijednost ne primjenjuje u slučaju velikih razlika između ponavljanja.
(9) Srednja vrijednost ne primjenjuje se u slučaju velikih razlika između ponavljanja.
(10) Otopine koje sadrže živine soli treba nakon uporabe obraditi kako bi se izbjeglo oslobađanje žive u okoliš.
(11) Mabey i Mill preporučuju uporabu boratnih ili acetatnih pufera umjesto fosfatnih (11).
(12) Ove informacije mogu potjecati i iz drugih izvora, kao što su hidrolitički podaci za strukturno slične spojeve iz literature ili iz drugih preliminarnih polukvantitativnih hidrolitičkih ispitivanja s ispitivanom tvari u ranijoj razvojnoj fazi.
(13) Ako grafički prikaz logaritamski transformiranih podataka u ovisnosti o vremenu ne ukazuje na linearnu funkciju (izjednačeni s brzinom reakcije prvog reda), tada za određivanje konstante brzine hidrolize ispitivanog spoja nije primjereno koristiti jednadžbu.
(14) pH vrijednosti navedene u ovim tablicama izračunane su na temelju mjerenja potencijala primjenom Sörensenovih standardnih jednadžbi (1909.). Odgovarajuće pH vrijednosti su za 0,04 jedinice više od vrijednosti u tablici.
(15) Doda se kristalić timola ili slične tvari kako bi se spriječio rast plijesni.
(16) Srednje vrijednosti trostrukog određivanja.
(17) Meyer A., Orti G. (1993), Proc. Royal Society of London, Series B., Vol. 252, str. 231.
(18) Vodu uzorkovati nakon dopremanja najmanje 3 „volumena komore”.
Vrijednosti u zagradama su količine uzoraka (voda, riba) koje treba uzeti ako se provodi dodatno uzorkovanje.
|
Napomena |
: |
prethodna procjena (prije ispitivanja) k2 za log Pow4,0 je 0,652 dana-1. Ukupno trajanje pokusa određeno je kao 3 × up = 3 × 4,6 dana tj. 14 dana. Za procjenu „up” vidjeti Dodatak 3. |
(19) Meyer, A., Bierman, C.H. and Orti, G. (1993). The phylogenetic position of the zebrafish (Danio rerio), a model system in developmental biology: an invitation to the comparative method. Proc. R. Soc. Lond. B. 252, 231-236.
(20) Iz stupca se može odabrati niz od pet (ili više) uzastopnih koncentracija. Srednje točke između koncentracija u stupcu (x) nalaze se u stupcu (2x + 1). Navedene vrijednosti koncentracija mogu predstavljati volumne ili masene postotke (mg/l ili μg/l). Vrijednosti se prema potrebi mogu množiti ili dijeliti bilo kojom potencijom broja 10. Stupac 1 može se koristiti ako postoji velika nesigurnost u pogledu razine toksičnosti.
(21) OECD. Paris, 1992, Test Guideline 210, „Fish, Early-life Stage Toxicity Test”.
(22) Za embrije.
(23) Za ličinke.
(24) Tama za embrije i ličinke do jednog tjedna nakon valjenja, osim kod pregledavanja. Zatim prigušeno svjetlo u čitavom tijeku ispitivaja.
(25) U skladu sa sustavom FAO i američkim sustavom (85).
(26) Vrijedosti varijabli trebaju se po mogućnosti nalaziti unutar zadanog područja. Ipak, ako pronalaženje odgovarajućeg materijala predstavlja problem, prihvaćaju se i vrijednosti ispod navedenog minimuma.
(27) Tla s manje od 0,3 % organskog ugljika mogu poremetiti korelaciju između organskog sadržaja i adsorpcije. Stoga se preporučuje koristiti tla sa sadržajem organskog ugljika od najmanje 0,3 %.
(29) Za procjenu uspostave ravnotežnog platoa također se mogu koristiti grafički prikazi koncentracije ispitivane tvari u vodenoj fazi  u ovisnosti o vremenu (vidjeti Dodatak 5. Sliku 2.).
u ovisnosti o vremenu (vidjeti Dodatak 5. Sliku 2.).
(30) DT-50: vrijeme razgradnje 50 % ispitivane tvari.
(31) W. Kördel, D. Hennecke, M. Herrmann, (1997) Application of the HPLC-screening method for the determination of the adsorption coefficient on sewage sludges. Chemosphere, 35(1/2), str. 121-128.
(32) W. Kördel, D. Hennecke, C. Franke, (1997) Determination of the adsorption-coefficients of organic substances on sewage sludges. Chemosphere, 35 (1/2), str. 107-119.
(33) W. Kördel, G. Kotthoff, J. Müller (1995). HPLC-screening method for the determination of the adsorption coefficient on soil-results of a ring test. Chemosphere, 30(7), 1373-1384.
(34) W. Kördel, J. Müller (1994). Bestimmung des Adsorptionskoeffizienten organischer Chemikalien mit der HPLC. UBA R & D Report No. 106 01 044 (1994).
(35) B.V. Oepen, W. Kördel, W. Klein., (1991) Chemosphere, 22, str. 285-304.
(36) Podaci iz industrije.
(37) Navesti koja je posuda korištena za pokus.
(38) Upisati smrtnost odraslih životinja u odgovarajuću kućicu kao „M”.
(39) Upisati propala legla u odgovarajuću kućicu kao „AB”.
(40) Primjerice, ako ispitivana tvar sadrži jedan prsten, oznaka se mora staviti na taj prsten; ako ispitivana tvar sadrži dva ili više prstenova, ponekad je potrebno provesti posebna istraživanja kako bi se ocijenila sudbina svakog obilježenog prstena i dobile potrebne informacije o nastajanju proizvoda pretvorbe.
(41) Svojstvo zadržavanja vode tla može se mjeriti kao poljski kapacitet, kao vodni kapacitet ili kao napon vlažnosti (pF). Za objašnjenje vidjeti Dodatak 1. U izvješću o ispitivanju treba navesti jesu li svojstvo zadržavanja vode i nasipna gustoća tala određeni na neporemećenim uzrocima s polja ili na poremećenim (obrađenim) uzorcima.
(42) Noviji rezultati istraživanja pokazuju da se tla iz umjerenih zona mogu skladištiti na – 20 °C i duže od tri mjeseca (28) (29) bez značajnih gubitaka mikrobne aktivnosti.
(43) Tlo ne smije biti premokro niti presuho kako bi se osiguralo dostatno dozračivanje i hranjenje mikroflore. Preporučeni sadržaj vlage za optimalni mikrobni rast kreće se u području od 40 – 60 % vodnog kapaciteta (WHC) i od 0,1 – 0,33 bar (6). Ovo posljednje područje istovjetno je području pF 2,0 – 2,5. Tipični sadržaji vlage za različite vrste tla navedeni su u Dodatku 2.
(44) Aerobni uvjeti vladaju u površinskim tlima, pa čak i u dubljim slojevima tla, kako je pokazao istraživački projekt pod pokroviteljstvom EU-a [K. Takagi et al. (1992). Microbial diversity and activity in subsoils: Methods, field site, seasonal variation in subsoil temperatures and oxygen contents. Proc. Internat. Symp. Environm. Aspects Pesticides Microbiol., 270-277, 17-21 August 1992, Sigtuna, Sweden]. Anaerobni uvjeti se javljaju tek povremeno kod plavljenja tla nakon obilnih kiša ili kad se u rižištu uspostave uvjeti rižinog polja.
(45) Aerobna se istraživanja mogu prekinuti znatno prije 120. dana pod uvjetom da je jasno utvrđen konačni put pretvorbe i potpuna mineralizacija. Ispitivanje se može prekinuti nakon 120 dana, ili kad se postigne pretvorba najmanje 90 % ispitivane tvari, ali samo ako je stvoreno najmanje 5 % CO2.
(46) Izračun početne koncentracije na bazi površine uz pomoć jednadžbe:

|
Csoil |
= |
početna koncentracija u tlu [mg·kg-1] |
|
A |
= |
količina primjene [kg· ha-1]; 1 = debljina sloja tla u polju [m]; d = suha nasipna gustoća tla [kg ·m-3] |
Iskustveno pravilo kaže da količina primjene od 1 kg· ha-1 rezultira koncentracijom u tlu od približno 1 mg· kg-1 u sloju od 10 cm (uz pretpostavku nasipne gustoće od 1 g· cm-3).
(47) Mückenhausen, E., (1975) Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt, Main.
(48) pF = log cm vodenog stupca.
(49) 1 bar = 105 Pa.
(50) Odgovara približnom sadržaju vode od 10 % u pijesku, 35 % u ilovači i 45 % u glini.
(51) Poljski kapacitet nije stalan i kreće se između pF 1,5 i 2,5 ovisno o vrsti tla.
(52) Vodni kapacitet.
(53) Guth, J.A., (1980) The study of transformations. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, str. 123-157.
(54) Guth, J.A., (1981) Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry. D.H. Hutson, T.R. Roberts, Eds. J. Wiley & Sons. Vol 1, str. 85-114.
(55) Anderson, J.P.E., (1975) Einfluss von Temperatur und Feuchte auf Verdampfung, Abbau und Festlegung von Diallat im Boden. Z. PflKrankh Pflschutz, Sonderheft VII, str. 141-146.
(56) Primjerice, ako tvar sadrži jedan prsten, oznaka se mora staviti na taj prsten; ako ispitivana tvar sadrži dva ili više prstenova, ponekad je potrebno provesti posebna istraživanja kako bi se ocijenila sudbina svakog obilježenog prstena i dobile potrebne informacije o nastajanju proizvoda pretvorbe.
(57) Budući da ove lužnate apsorpcijske otopine također apsorbiraju ugljikov dioksid iz ventilacijskog zraka kao i ugljikov dioksid nastao disanjem u aerobnim pokusima, one se moraju redovito mijenjati kako bi se izbjeglo zasićenje, a time i gubitak njihove apsorpcijske sposobnosti.
(58) (Glina + prah) je mineralna frakcija sedimenta veličine čestica < 50 μm.
(59) Metoda stope mikrobnog disanja (26), metoda fumigacije (27) ili brojenje na pločama (npr. bakterije, aktinomicete, gljivice i ukupne kolonije) kod aerobnih istraživanja; brzina metanogeneze kod anaerobnih istraživanja.
(60) Noviji rezultati istraživanja pokazuju da mjerenja koncentracije kisika u vodi i redoks potencijala nemaju mehanističku niti prognostičku vrijednost za rast i razvoj mikrobnih populacija u površinskim vodama (24)(25). Određivanje biokemijske potrošnje kisika (BPK) (kod uzorkovanja na terenu, na početku i kraju ispitivanja) i koncentracija mikro/makronutrijenata Ca, Mg i Mn (na početku i kraju ispitivanja) u vodi te mjerenje ukupnog N i ukupnog P u sedimentima (kod uzorkovanja na terenu i na kraju ispitivanja) mogu biti bolji alati za tumačenje i ocjenjivanje brzina i puteva aerobne biološke pretvorbe.
(61) Novija istraživanja pokazuju da skladištenje na 4 °C može dovesti do smanjenja sadržaja organskog ugljika u sedimentu, što može rezultirati smanjenjem mikrobne aktivnosti (34).
(62) Ispitivanje s drugom koncentracijom može biti korisno kod kemikalija koje dospijevaju u površinske vode različitim putevima te zbog nastaju značajne razlike u koncentracijama, ali samo ako se donja koncentracija može analizirati s dostatnom točnošću.
(63) U slučajevima kad može doći do brze reoksidacije proizvoda anaerobne pretvorbe, za vrijeme uzorkovanja i analize treba održavati anaerobne uvjete.