|
03/Sv. 035 |
HR |
Službeni list Europske unije |
64 |
32008R0429
|
L 133/1 |
SLUŽBENI LIST EUROPSKE UNIJE |
25.04.2008. |
UREDBA KOMISIJE (EZ) br. 429/2008
od 25. travnja 2008.
o detaljnim pravilima za provedbu Uredbe (EZ) br. 1831/2003 Europskog parlamenta i Vijeća u pogledu pripreme i podnošenja zahtjeva te procjene i odobravanja dodataka hrani za životinje
(Tekst značajan za EGP)
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Uredbu (EZ) br. 1831/2003 Europskog parlamenta i Vijeća od 22. rujna 2003. o dodacima hrani za životinje za korištenje u hranidbi životinja (1), a posebno njezin članak 7. stavke 4. i 5.,
nakon savjetovanja s Europskom agencijom za sigurnost hrane u skladu s člankom 7. stavcima 4. i 5. Uredbe (EZ) br. 1831/2003,
budući da:
|
(1) |
Treba utvrditi provedbena pravila za postupak odobravanja dodataka hrani za životinje na temelju Uredbe (EZ) br. 1831/2003, koja će uključivati i pravila za pripremanje i podnošenje zahtjeva te za procjenu i odobravanje tih dodataka. Ta bi pravila trebala zamijeniti odredbe Priloga Direktivi Vijeća 87/153/EEZ (2) o smjernicama za procjenu dodataka hrani za životinje za korištenje u hranidbi životinja. |
|
(2) |
Ta bi pravila trebala sadržavati zahtjeve koje mora ispunjavati dokumentacija koja se dostavlja uz zahtjev. Njima bi se posebno trebalo odrediti koji znanstveni podaci moraju biti dostavljeni za određivanje i karakterizaciju dotičnog dodatka te studije koje se moraju obaviti kako bi se dokazala njegova učinkovitost i sigurnost za ljude, životinje i okoliš, a na temelju kojih bi Europska agencija za sigurnost hrane (Agencija) mogla provjeriti i ocijeniti zahtjeve za odobravanje. |
|
(3) |
Ovisno o vrsti dodatka i traženim uvjetima njegova korištenja, opseg studija potrebnih za ocjenjivanje njegovih obilježja ili učinaka može varirati. Nositeljima djelatnosti trebalo bi stoga omogućiti određenu fleksibilnost u pogledu vrste studija i materijala koje treba dostaviti kako bi se dokazala sigurnost i učinkovitost dotičnog dodatka. Nositelji djelatnosti koji odluče iskoristiti tu fleksibilnost trebaju svoju odluku obrazložiti u dokumentaciji. |
|
(4) |
Agencija bi trebala imati mogućnost zatražiti, prema potrebi, dodatne podatke kako bi utvrdila ispunjava li dodatak uvjete za odobravanje koji su utvrđeni člankom 5. Uredbe (EZ) br. 1831/2003. |
|
(5) |
Pri izradi dokumentacije za dodatke namijenjene korištenju u hrani za životinje ili vodi prijeko je potrebno primjenjivati odgovarajuće standarde kvalitete kako bi se osiguralo da su rezultati laboratorijskih ispitivanja nesporni. |
|
(6) |
Trebalo bi, prema potrebi, utvrditi posebne zahtjeve za svaku kategoriju dodataka iz članka 6. stavka 1. Uredbe (EZ) br. 1831/2003. |
|
(7) |
Kako bi se potakli napori na dobivanju odobrenja za manje zastupljene vrste životinja i istodobno sačuvala potrebna razina sigurnosti, trebalo bi predvidjeti posebne uvjete uzimajući u obzir mogućnost ekstrapolacije (prenošenja) rezultata studija, provedenih na zastupljenijim vrstama, na manje zastupljene vrste. |
|
(8) |
Provedbena pravila o zahtjevima za odobravanje trebaju uzeti u obzir različite uvjete, za životinje koje se koriste za proizvodnju hrane i druge životinje za koje aspekti vezani uz ocjenu sigurnosti za potrošača nisu važni. |
|
(9) |
Trebalo bi u najvećoj mogućoj mjeri smanjiti primjenu postupaka koji uključuju korištenje laboratorijskih životinja u pokusne ili druge znanstvene svrhe i ispitivanja na životinjama u skladu s Direktivom Vijeća 86/609/EEZ od 24. studenoga 1986. o usklađivanju zakona i drugih propisa država članica o zaštiti životinja koje se koriste u pokusne i druge znanstvene svrhe (3). |
|
(10) |
Kako bi se izbjeglo nepotrebno ponavljanje studija, trebalo bi predvidjeti jednostavnije postupke za odobravanje onih dodataka koji su već odobreni za korištenje u hrani. |
|
(11) |
Što se tiče dodataka koji su već odobreni bez vremenskog ograničenja sukladno Direktivi Vijeća 70/524/EEZ (4), kada je to prikladno, trebalo bi predvidjeti mogućnost da podnositelj zahtjeva, u slučaju kada odgovarajuće studije nisu dostupne, dokaže učinkovitost drugim dostupnim materijalima, posebno materijalima o dugotrajnom korištenju dotičnog dodatka. |
|
(12) |
Trebalo bi utvrditi pravila o zahtjevima za izmjenama odobrenja u skladu s člankom 13. stavkom 3. Uredbe (EZ) br. 1831/2003. |
|
(13) |
Trebalo bi utvrditi i pravila o zahtjevima za produljenje odobrenja u skladu s člankom 14. Uredbe (EZ) br. 1831/2003. |
|
(14) |
Što se tiče odredaba o ispitivanjima sigurnosti i učinkovitosti koja se trebaju provesti kao potpora zahtjevu, treba predvidjeti prijelazno razdoblje u kojemu će se i dalje primjenjivati sadašnja pravila. Prema zahtjevima podnesenim prije stupanja na snagu ove Uredbe trebalo bi i dalje postupati u skladu s Prilogom Direktivi 87/153/EEZ. Što se tiče zahtjeva podnesenih u određenom razdoblju nakon stupanja na snagu, uzimajući u obzir da je za neka ispitivanja potrebno dugo vremensko razdoblje, podnositelji zahtjeva trebali bi imati mogućnost izabrati ili pravila predviđena ovom Uredbom ili ona iz Priloga Direktivi 87/153/EEZ. Provedbena su pravila pripremljena na temelju sadašnjeg znanstvenog i tehničkog znanja i trebalo bi ih prema potrebi prilagoditi novim spoznajama u tom području. |
|
(15) |
Mjere predviđene u ovoj Uredbi u skladu su s mišljenjem Stalnog odbora za prehrambeni lanac i zdravlje životinja, |
DONIJELA JE OVU UREDBU:
Članak 1.
Definicije
Za potrebe ove Uredbe primjenjuju se sljedeće definicije:
|
1. |
„kućni ljubimci i druge životinje koje se ne koriste za proizvodnju hrane” znači životinje koje pripadaju vrstama koje čovjek obično hrani, uzgaja ili drži, ali ne za vlastitu prehranu, osim konja. |
|
2. |
„manje zastupljene vrste” znači životinje koje se koriste za proizvodnju hrane, osim goveda (grla za proizvodnju mlijeka i onih za proizvodnju mesa, uključujući telad), ovaca (grla za proizvodnju mesa) svinja, kokoši (uključujući kokoši nesilice), purana i riba koje pripadaju porodici Salmonidae. |
Članak 2.
Zahtjev
1. Zahtjev za odobravanje dodataka hrani za životinje, kako je predviđen člankom 7. Uredbe (EZ) br. 1831/2003, dostavlja se na obrascu iz Priloga I.
Prilaže mu se dokumentacija predviđena člankom 3. (dalje u tekstu „dokumentacija”), koja sadrži detaljne podatke i dokumente iz članka 7. stavka 3. Uredbe (EZ) br. 1831/2003.
2. Ako u skladu s člankom 18. Uredbe (EZ) br. 1831/2003 podnositelj zahtjeva zatraži da se neki dijelovi dokumentacije iz stavka 1. čuvaju kao povjerljivi, on mora za svaki dokument ili dio dokumenta navesti provjerljivo obrazloženje da bi otkrivanje tih podataka moglo bitno ugroziti njegov konkurentni položaj. Povjerljivi se dijelovi dostavljaju odvojeno od ostatka dokumentacije i ne uključuju se u sažetak iz članka 7. stavka 3. točke (h) Uredbe (EZ) br. 1831/2003. Podnositelj zahtjeva šalje Komisiji presliku onih dijelova dokumentacije za koje traži da ostanu povjerljivi kao i presliku popratnog obrazloženja.
Članak 3.
Dokumentacija
1. Dokumentacija mora pružiti odgovarajuće i dostatne dokaze da dodatak za hranu za životinje ispunjava uvjete za odobravanje iz članka 5. Uredbe (EZ) br. 1831/2003.
2. Opći uvjeti za pripremanje i podnošenje dokumentacije navedeni su u Prilogu II.
Posebni uvjeti koje u dotičnom slučaju mora ispunjavati dokumentacija navedeni su u Prilogu III.
Minimalno trajanje dugoročnih studija navedeno je u Prilogu IV.
3. Odstupajući od stavka 2., podnositelj zahtjeva može dostaviti dokumentaciju koja ne ispunjava uvjete iz stavka 2. pod uvjetom da dostavi obrazloženje za svaki element koji nije u skladu s tim uvjetima.
Članak 4.
Prijelazne mjere
1. Na zahtjeve za odobravanje podnesene prije datuma stupanja na snagu ove Uredbe i dalje se primjenjuje Prilog Direktivi 87/153/EEZ.
2. Što se tiče zahtjeva za odobravanje podnesenih prije 11. lipnja 2009. podnositelj zahtjeva može odlučiti da se umjesto točaka 1.3, 1.4, 2.1.3, 2.1.4, 2.2.3, 2.2.4, 3.3, 3.4, 4.1.3, 4.1.4, 4.2.3, 4.2.4, 5.3, 5.4, 6.3, 6.4, 7.3, 7.4, 8.3 i 8.4 Priloga III. i umjesto odredaba utvrđenih u stupcu „Minimalno trajanje dugoročnih studija učinkovitosti” u tablicama u Prilogu IV. i dalje primjenjuju odjeljak III. i odjeljak IV. dijela I. i dijela II. Priloga Direktivi 87/153/EEZ.
Članak 5.
Stupanje na snagu
Ova Uredba stupa na snagu dvadesetog dana od dana objave u Službenom listu Europske unije.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 25. travnja 2008.
Za Komisiju
Androulla VASSILIOU
Članica Komisije
(1) SL L 268, 18.10.2003., str. 29. Uredba kako je izmijenjena Uredbom Komisije (EZ) br. 378/2005 (SL L 59, 5.3.2005., str. 68.).
(2) SL L 64, 7.3.1987., str. 19. Stavljena izvan snage Uredbom (EZ) br. 1831/2003.
(3) SL L 358, 18.12.1986., str. 1. Direktiva kako je izmijenjena Direktivom 2003/65/EZ Europskog parlamenta i Vijeća (SL L 230, 16.9.2003., str. 32.).
(4) SL L 270, 14.12.1970., str. 1. Direktiva kako je zadnje izmijenjena Uredbom Komisije (EZ) br. 1800/2004 (SL L 317, 16.10.2004., str. 37.).
PRILOG I.
OBRAZAC ZAHTJEVA IZ ČLANKA 2. STAVKA 1. I ADMINISTRATIVNI PODACI
1. OBRAZAC ZAHTJEVA
EUROPSKA KOMISIJA
GLAVNA UPRAVA ZA ZDRAVLJE I ZAŠTITU POTROŠAČA
(Adresa)
Datum: …
|
Predmet |
: |
Zahtjev za odobravanje dodatka za hranu za životinje u skladu s Uredbom (EZ) br. 1831/2003 |
|
|
Odobravanje dodatka za hranu za životinje ili za novo korištenje dodatka za hranu za životinje (članak 4. stavak 1. Uredbe (EZ) br. 1831/2003) |
|
|
Odobravanje postojećeg proizvoda (članak 10. stavak 2. ili članak 10. stavak 7. Uredbe (EZ) br. 1831/2003) |
|
|
Izmjena postojećeg odobrenja (članak 13. stavak 3. Uredbe (EZ) br. 1831/2003) |
|
|
Produljenje odobrenja dodatka za hranu za životinje (članak 14. Uredbe (EZ) br. 1831/2003) |
|
|
Žurno odobravanje (članak 15. Uredbe (EZ) br. 1831/2003) |
(Jasno označite jedno od polja)
Podnositelj(i) zahtjeva i/ili njegov/njihov predstavnik(-ci) u Zajednici (članak 4. stavak 3. Uredbe (EZ) br. 1831/2003), u skladu s uvjetima propisanim člankom 7. stavkom 3. točkom (a) Uredbe (EZ) br. 1831/2003 (ime, adresa ….)
…
…
dostavlja(ju) ovaj zahtjev u svrhu dobivanja odobrenja za sljedeći proizvod kao dodatak za hranu za životinje:
1.1. Identifikacija i karakterizacija dodatka
Naziv dodatka (karakterizacija aktivne(-ih) tvari ili sredstva(-ava) kako su definirani u pododjeljcima 2.2.1.1 i 2.2.1.2 Priloga II):
…
…
Trgovački naziv (prema potrebi, za odobrenja povezana s nositeljem):
…
…
spada u kategoriju/e i funkcionalnu skupinu/e dodataka (1) (popisati):
…
…
ciljane vrste:
…
…
…
Ime nositelja odobrenja (članak 9. stavak 6. Uredbe (EZ) br. 1831/2003):
…
…
Ovaj je dodatak već odobren propisima o hrani za životinje, i to Direktivom …/…/(E)EZ ili Uredbom (EZ) br. …/… pod brojem … kao (kategorija dodatka)
…
Ovaj je dodatak već odobren propisima o hrani za životinje, i to Direktivom …/…/(E)EZ ili Uredbom (EZ) br. …/… pod brojem … kao
…
za korištenje u
…
Ako se proizvod sastoji od genetski modificiranih organizama (GMO-a), sadrži takve organizme ili je od njih proizveden, navedite sljedeće podatke:
|
|
jedinstveni identifikator (Uredba Komisije (EZ) br. 65/2004 (2)) (prema potrebi): … |
|
|
podaci o mogućim odobrenjima izdanim u skladu s Uredbom (EZ) br. 1829/2003 Europskog parlamenta i Vijeća (3): … |
|
|
ili podaci o mogućim neriješenim zahtjevima za odobravanje u skladu s Uredbom (EZ) br. 1829/2003: … |
1.2. Uvjeti korištenja
1.2.1. Korištenje u potpunim krmnim smjesama
Vrsta ili kategorija životinja:
…
…
Gornja dobna granica ili masa:
…
…
Najmanja doza (prema potrebi): mg ili jedinice aktivnosti (4) ili jedinice koje stvaraju kolonije (CFU) ili ml/kg potpune krmne smjese s udjelom vlage od 12 %
…
…
Najveća doza (prema potrebi): mg ili jedinice aktivnosti ili CFU ili ml/kg potpune krmne smjese s udjelom vlage od 12 %
…
…
Za tekuću hranu za životinje najmanja i najveća doza mogu se izraziti po litri.
1.2.2. Korištenje u vodi
Najmanja doza (prema potrebi): mg ili jedinice aktivnosti ili CFU ili ml/l vode
…
…
Najveća doza (prema potrebi): mg ili jedinice aktivnosti ili CFU ili ml/l vode
…
…
1.2.3. Posebni uvjeti korištenja (prema potrebi)
Vrsta ili kategorija životinja:
…
…
Najveća starost:
…
…
Najmanja doza (prema potrebi): mg ili jedinice aktivnosti ili CFU/kg dopunske krmne smjese s udjelom vlage od 12 %
…
…
Najveća doza (prema potrebi): mg ili jedinice aktivnosti ili CFU/kg dopunske krmne smjese s udjelom vlage od 12 %
…
…
Za tekuću hranu za životinje najmanja i najveća doza mogu se izraziti po litri.
Uvjeti ili ograničenja korištenja (prema potrebi):
…
…
…
Posebni uvjeti ili ograničenja u odnosu na rukovanje (prema potrebi):
…
…
…
…
Najveća dopuštena količina rezidua (prema potrebi):
vrsta ili kategorija životinja:
…
…
marker rezidua:
…
…
ciljana tkiva ili proizvodi:
…
…
…
Najveća količina rezidua u tkivima ili proizvodima (μg/kg):
…
…
…
Karencija:
…
1.3. Referentni uzorci
Broj uzorka referentnog laboratorija Zajednice (CRL) (prema potrebi):
…
Broj/šifra serije:
…
Datum proizvodnje:
…
Rok trajanja:
…
Koncentracija:
…
Masa:
…
Opis fizikalnih svojstava:
…
Opis spremnika:
…
Zahtjevi u pogledu skladištenja:
…
1.4. Tražene izmjene (prema potrebi)
…
…
…
…
Preslika ovog zahtjeva poslana je izravno Agenciji zajedno s dokumentacijom i CRL-u zajedno s referentnim uzorcima.
Potpis …
1.5. Prilozi
|
|
potpuna dokumentacija (samo za Agenciju); |
|
|
javni sažetak dokumentacije; |
|
|
detaljni sažetak dokumentacije; |
|
|
popis dijelova dokumentacije za koje se traži da se s njima postupa kao s povjerljivim podacima te preslika dotičnih dijelova dokumentacije (samo za Komisiju i Agenciju); |
|
|
preslika administrativnih podataka o podnositelju(-ima) zahtjeva; |
|
|
tri uzorka dodatka za hranu za životinje CRL-u sukladno članku 7. stavku 3. točki (f) Uredbe (EZ) br. 1831/2003 (samo za CRL); |
|
|
sigurnosni list za dotični materijal (samo za CRL); |
|
|
potvrda o identifikaciji i analizi (samo za CRL); i |
|
|
potvrda o plaćenoj pristojbi CRL-u (članak 4. Uredbe (EZ) br. 378/2005 (5). |
Popunite odgovarajuće dijelove obrasca i precrtajte one koji nisu bitni. Izvornik obrasca zahtjeva (s ostalim potrebnim prilozima) šalje se izravno Europskoj komisiji.
2. ADMINISTRATIVNI PODACI O PODNOSITELJU(-IMA) ZAHTJEVA
Podaci o kontaktu potrebni pri podnošenju zahtjeva za odobravanje dodatka za hranu za životinje u skladu s Uredbom (EZ) br. 1831/2003
|
(1) |
Poduzeće ili osoba koja podnosi zahtjev
|
|
(2) |
Osoba za kontakt (za svu prepisku s Komisijom, Agencijom i CRL-om)
|
(1) Za funkcionalnu skupinu „Ostali zootehnički dodaci” u kategoriji zootehničkih dodataka treba jasno odrediti koja se funkcija traži za određeni dodatak.
(2) SL L 10, 16.1.2004., str. 5.
(3) SL L 268, 18.10.2003., str. 1. Uredba kako je zadnje izmijenjena Uredbom (EZ) br. 298/2008 (SL L 97, 9.4.2008., str. 64.).
(4) „Jedinicu” definira podnositelj zahtjeva.
(5) Uredba Komisije (EZ) br. 378/2005 od 4. ožujka 2005. o detaljnim pravilima za provedbu Uredbe (EZ) br. 1831/2003 Europskog parlamenta i Vijeća u pogledu dužnosti i zadaća referentnog laboratorija Zajednice koje se odnose na zahtjeve za odobravanje dodatka za hranu za životinje (SL L 59, 5.3.2005., str. 8.). Uredba kako je izmijenjena Uredbom (EZ) br. 850/2007 (SL L 188, 20.7.2007., str. 3.).
PRILOG II.
OPĆI UVJETI KOJE MORA ISPUNJAVATI DOKUMENTACIJA IZ ČLANKA 3.
OPĆI ASPEKTI
Ovim se Prilogom utvrđuju uvjeti za sastavljanje popisa i obilježja studija i podataka o tvarima, mikroorganizmima i pripravcima, koji se moraju dostaviti s dokumentacijom u skladu s člankom 7. Uredbe (EZ) br. 1831/2003 za:
|
— |
odobravanje novog dodatka za hranu za životinje, |
|
— |
odobravanje novog korištenja dodatka za hranu za životinje, |
|
— |
izmjenu postojećeg odobrenja za dodatak za hranu za životinje, ili |
|
— |
produljenje odobrenja za dodatak za hranu za životinje. |
Dokumentacija mora omogućiti procjenu dodataka na temelju postojećih znanstvenih spoznaja i provjeru sukladnosti tih dodataka s temeljnim načelima za odobravanje, koja su utvrđena člankom 5. Uredbe (EZ) br. 1831/2003.
Studije koje treba dostaviti i njihov opseg ovisit će o vrsti dodatka, kategoriji i funkcionalnoj skupini, vrsti odobrenja (glasi li na određenog nositelja ili ne), samoj tvari, ciljanim životinjama i uvjetima korištenja. Da bi procijenio koje studije i podatke treba dostaviti uz zahtjev, podnositelj zahtjeva poziva se na ovaj Prilog i na Prilog III.
Podnositelj zahtjeva jasno navodi razloge za svako izostavljanje podataka propisanih ovim Prilogom, Prilogom II. i Prilogom IV. i svako njihovo odstupanje u dokumentaciji.
Dokumentacija sadrži detaljna izvješća o svim provedenim ispitivanjima, predočena u skladu sa sustavom obrojčivanja koji je predložen u ovom Prilogu. U njoj se navode izvori i prilaže preslika odgovarajućeg teksta za sve objavljene znanstvene podatke koji se spominju, kao i preslika svih drugih relevantnih mišljenja koja je već donijelo neko priznato znanstveno tijelo. Ako je europsko znanstveno tijelo već ocijenilo te studije u skladu s važećim zakonodavstvom Zajednice, dovoljno je uputiti na rezultat tog ocjenjivanja. Podaci iz studija koje su već provedene i objavljene ili su prošle stručnu recenziju moraju se jasno odnositi na isti onaj dodatak koji je predmet zahtjeva za odobravanje.
Studije, uključujući i one koje su već provedene i objavljene ili su prošle stručnu recenziju, moraju biti provedene i dokumentirane prema odgovarajućim normama kvalitete (kao što je dobra laboratorijska praksa – DLP) u skladu s Direktivom 2004/10/EZ Europskog parlamenta i Vijeća od 11. veljače 2004. o usklađivanju zakona i ostalih propisa u vezi s primjenom načela dobre laboratorijske prakse i provjeri njihove primjene u ispitivanju kemijskih tvari (1) ili normama Međunarodne organizacije za normizaciju (ISO).
Ako se ispitivanja in vivo ili in vitro provode izvan Zajednice, podnositelj zahtjeva mora dokazati da dotični objekti udovoljavaju načelima dobre laboratorijske prakse Organizacije za ekonomsku suradnju i razvoj (OECD) ili ISO normama.
Fizikalno-kemijska, toksikološka i ekotoksikološka svojstva moraju se odrediti u skladu s metodama koje su utvrđene Direktivom Vijeća 67/548/EEZ od 27. lipnja 1967. o usklađivanju zakona i drugih propisa u odnosu na razvrstavanje, pakiranje i označivanje opasnih tvari (2), kako je zadnje izmijenjena Direktivom Komisije 2004/73/EZ (3), ili u skladu s najnovijim metodama koje su priznate od strane međunarodnih znanstvenih tijela. Korištenje drugih metoda mora se opravdati.
Potiče se korištenje metoda in vitro ili metoda koje poboljšavaju ili zamjenjuju uobičajena ispitivanja na laboratorijskim životinjama ili smanjuju broj životinja korištenih u tim ispitivanjima. Te metode moraju biti iste kvalitete i pružati jednaku razinu sigurnosti kao i metoda koju zamjenjuju.
Opis analitičkih metoda za hranu za životinje i vodu mora biti u skladu s pravilima dobre laboratorijske prakse koja su utvrđena Direktivom 2004/10/EZ i/ili u skladu s normom EN ISO/IEC 17025. Te metode moraju udovoljavati zahtjevima koji su utvrđeni člankom 11. Uredbe (EZ) br. 882/2004 Europskog parlamenta i Vijeća od 29. travnja 2004. o službenim kontrolama koje se provode radi provjere sukladnosti sa zakonom o hrani i hrani za životinje te propisima o zdravlju i dobrobiti životinja (4).
Svaka dokumentacija mora sadržavati javni sažetak i detaljni znanstveni sažetak kako bi se dotični dodatak mogao identificirati i karakterizirati.
Svaka dokumentacija mora sadržavati prijedlog praćenja nakon stavljanja na tržište, ako to zahtijeva članak 7. stavak 3. točka (g) Uredbe (EZ) br. 1831/2003, i prijedlog označivanja iz članka 7. stavka 3. točke (e) Uredbe (EZ) br. 1831/2003.
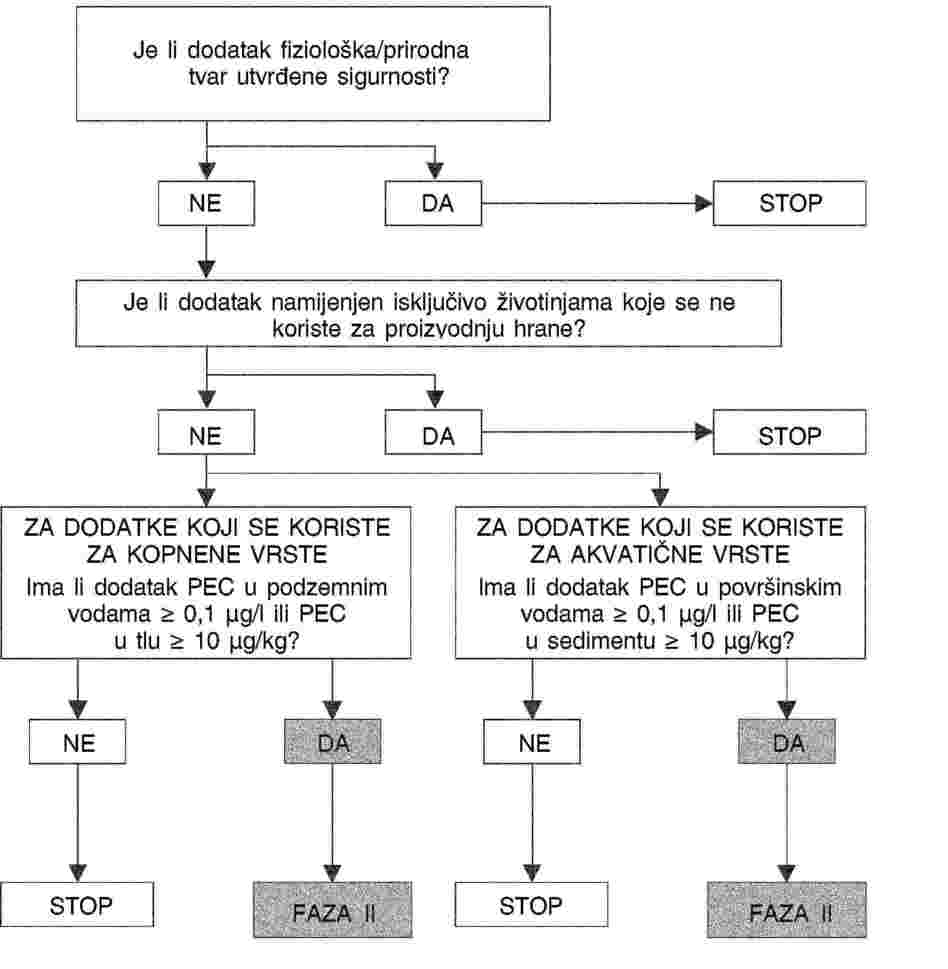
Ocjena sigurnosti
Temelji se na studijama čiji je cilj dokazati sigurnost korištenja dodatka za:
|
(a) |
ciljane vrste pri najvećim predloženim dozama sadržanim uhrani za životinje ili vodi i pri višestrukim dozama, kako bi se utvrdila granica sigurnosti; |
|
(b) |
potrošače koji jedu hranu dobivenu od životinja koje su dobile dodatak, njegove rezidue ili njihove metabolite. U ovom se slučaju sigurnost osigurava tako da se odrede najveće dopuštene količine rezidua (MRL) i razdoblja karencije na temelju prihvatljivog dnevnog unosa (ADI) ili podnošljive gornje razine unosa (UL); |
|
(c) |
osobe koje bi, pri rukovanju dodatkom ili pri umješavanju dodatka u premikse ili potpunu krmnu smjesu ili vodu ili pri korištenju hrane za životinje ili vode koja sadrži određeni dodatak, mogle biti izložene dotičnom dodatku dišnim putem, preko sluznica, očiju ili kože; |
|
(d) |
životinje i ljude, s obzirom na odabir i širenje gena za antimikrobnu otpornost; i |
|
(e) |
okoliš, zbog utjecaja samog dodatka ili zbog proizvoda dobivenih od dodatka, bilo izravno i/ili preko životinjskih izlučina. |
Ako dodatak ima više sastojaka, svaki se od njih može posebno ocijeniti što se tiče sigurnosti za potrošača i potom se uzima u obzir kumulativni učinak (ako se može dokazati da ne postoje interakcije među sastojcima). Druga mogućnost je ocijeniti cijelu smjesu.
Ocjena učinkovitosti
Temelji se na studijama čiji je cilj dokazati učinkovitost dodatka u odnosu na ciljeve njegove predviđene uporabe kako je definirano u članku 6. stavku 1. i Prilogu I. Uredbi (EZ) br. 1831/2003.
1. ODJELJAK I: SAŽETAK DOKUMENTACIJE
1.1. Javni sažetak u skladu s člankom 7. stavkom 3. točkom (h) Uredbe (EZ) br. 1831/2003
Podnositelj zahtjeva dostavlja sažetak u kojem se navode glavna obilježja dotičnog dodatka. Sažetak ne smije sadržavati povjerljive podatke i mora biti strukturiran na sljedeći način:
1.1.1. Sadržaj
|
(a) |
ime podnositelja zahtjeva; |
|
(b) |
identifikacija dodatka; |
|
(c) |
proizvodni postupak i analitička metoda; |
|
(d) |
studije sigurnosti i učinkovitosti dodatka; |
|
(e) |
predloženi uvjeti korištenja; i |
|
(f) |
prijedlog praćenja nakon stavljanja na tržište. |
1.1.2. Opis
|
(a) |
ime i adresa podnositelja zahtjeva Ovaj se podatak mora uvijek navesti, bez obzira na vrstu odobrenja dodatka za hranu za životinje (glasi li na određenog nositelja ili ne). Ako dokumentaciju dostavlja skupina podnositelja zahtjeva, navodi se ime svakog od njih. |
|
(b) |
identifikacija dodatka Identifikacija dodatka sadrži sažetak podataka koji se zahtijevaju u skladu s Prilogom II. ili III., ovisno o vrsti traženog odobrenja dodatka za hranu za životinje. Posebno treba navesti naziv dodatka, prijedlog za njegovu kategorizaciju i raspoređivanje u funkcionalnu skupinu, ciljane vrste/kategorije životinja i doze. |
|
(c) |
proizvodni postupak i analitička metoda Proizvodni postupak mora biti opisan. Moraju biti opisani opći postupci analitičkih metoda koje se koriste za analizu u okviru službenih kontrola dodatka kao takvog, u premiksima i u hrani za životinje, kako je propisano ovim Prilogom i Prilogom III. Ovisno o slučaju, a na temelju podataka dostavljenih u skladu s ovim Prilogom i Prilogom III., opisuje se i postupak metode ili metoda koje se koriste za analizu u okviru službenih kontrola dodataka ili njihovih metabolita u hrani životinjskog podrijetla. |
|
(d) |
studije sigurnosti i učinkovitosti dodataka Moraju se navesti zaključci u pogledu sigurnosti i učinkovitosti dodatka, koji se temelje na različitim obavljenim studijama. Rezultati studija mogu se navesti u obliku tablice kao prilog zaključcima koje navodi podnositelj zahtjeva. U sažetku se navode samo one studije koje su propisane Prilogom III. |
|
(e) |
predloženi uvjeti korištenja Uvjete korištenja predlaže(-u) podnositelj(i) zahtjeva. Podnositelj zahtjeva mora posebno navesti doziranje pri korištenju u vodi ili hrani za životinje, kao i detaljne uvjete korištenja u dopunskim krmnim smjesama. Potrebne su informacije i u slučajevima kad se koriste druge metode primjene ili umješavanja u hranu za životinje ili vodu. Moraju se opisati i svi posebni uvjeti korištenja (npr. inkompatibilnosti), posebni zahtjevi u pogledu označivanja i vrste životinja kojima je dodatak namijenjen. |
|
(f) |
prijedlog praćenja nakon stavljanja na tržište Ovaj se dio odnosi samo na one dodatke koji sukladno točki (g) članka 7. stavka 3. Uredbe (EZ) br. 1831/2003 ne spadaju u kategoriju (a) ili (b) iz članka 6. stavka 1. te Uredbe i na dodatke obuhvaćene zakonodavstvom Zajednice koje se odnosi na stavljanje na tržište proizvoda koji se sastoje od GMO-a, sadrže GMO ili su proizvedeni od GMO-a. |
1.2. Znanstveni sažetak dokumentacije
Mora biti dostavljen znanstveni sažetak koji sadrži podatke iz svakog dijela dokumentacije dostavljene u prilog zahtjevu u skladu s ovim Prilogom i Prilogom III. U sažetku se navode zaključci podnositelja zahtjeva.
Sažetak mora biti sastavljen prema redoslijedu koji je naveden u ovom Prilogu i kod svakog se dijela mora uputiti na odgovarajuću stranicu dokumentacije.
1.3. Popis dokumenata i drugi podaci
Podnositelj zahtjeva mora navesti broj i naslove svezaka dokumentacije koju prilaže kao potporu zahtjevu. Dodaje se i detaljno kazalo u kojem su navedeni odgovarajući svesci i stranice.
1.4. Popis dijelova dokumentacije za koje se traži da se s njima postupa kao s povjerljivim podacima, prema potrebi
U popisu se moraju navesti odgovarajući svesci i stranice dokumentacije.
2. ODJELJAK II: IDENTITET, OPIS OBILJEŽJA I UVJETI KORIŠTENJA DODATAKA; ANALITIČKE METODE
Dodatak se mora u cijelosti identificirati i moraju se opisati njegova obilježja.
2.1. Identitet dodatka
2.1.1. Naziv dodatka
Prema potrebi, daje se prijedlog trgovačkog naziva za dodatke čija odobrenja glase na određenog nositelja.
2.1.2. Prijedlog za klasifikaciju
Daje se prijedlog za klasifikaciju dodatka u jednu ili više kategorija i funkcionalnih skupina, ovisno o njegovim glavnim djelovanjima, u skladu s člankom 6. i Prilogom I. Uredbi (EZ) br. 1831/2003.
Moraju se navesti svi podaci o drugim poznatim načinima korištenja jednakih aktivnih tvari ili organizama (npr. korištenje u hrani, humanoj ili veterinarskoj medicini, poljoprivredi i industriji). Moraju se navesti sva ostala odobrenja aktivne tvari kao dodatka hrani, dodatka hrani za životinje ili veterinarskog lijeka ili druge vrste odobrenja.
2.1.3. Kvalitativni i kvantitativni sastav (aktivna tvar/organizam, ostali sastojci, nečistoće, odstupanja među pojedinim serijama)
Popisuju se aktivna(-e) tvar(i) /organizam(-mi) i svi ostali sastojci dodatka te se navode njihovi maseni udjeli u konačnom proizvodu. Određuju se kvalitativna i kvantitativna odstupanja aktivne(-ih) tvari/organizma(-ama) među pojedinim serijama.
Za mikroorganizme: određuje se broj živih stanica ili spora izražen kao CFU po gramu.
Za enzime: opisuje se svaka deklarirana (glavna) aktivnost i navodi se broj jedinica svake aktivnosti u konačnom proizvodu. Navode se i relevantne popratne aktivnosti. Jedinice aktivnosti pobliže se određuju, po mogućnosti kao μmoli proizvoda koji se oslobađa iz supstrata po minuti te se navode pH vrijednost i temperatura.
Ako je aktivni sastojak dodatka smjesa aktivnih tvari ili organizama od kojih se svaki može jasno odrediti (kvalitativno i kvantitativno), tu aktivnu(-a) tvar(i) /organizam(-me) treba opisati odvojeno i navesti njihove udjele u smjesi.
Ostale smjese čiji se sastojci ne mogu opisati jednom kemijskom formulom i/ili kod kojih se svi sastojci ne mogu identificirati, karakteriziraju se prema sastojku(-cima) koji pridonose aktivnosti smjese i/ili prema tipičnom glavnom sastojku(-cima).
Ne dovodeći u pitanje bilo koji zahtjev za dodatnim informacijama koje postavi Agencija u skladu s člankom 8. stavkom 2. Uredbe (EZ) br. 1831/2003, podnositelj zahtjeva ne mora opisati ostale sastojke koji ne predstavljaju sigurnosni rizik, osim aktivnih tvari ili organizama za dodatke koji ne spadaju u kategoriju zootehničkih dodataka, kokcidiostatika i histomonostatika i koji nisu obuhvaćeni Uredbom (EZ) br. 1829/2003. U svakom slučaju, sve studije koje su navedene u dokumentaciji moraju se temeljiti na stvarnom dodatku za koji se traži odobrenje, a mogu sadržavati informacije o drugim mogućim različitim pripravcima koji bi se mogli proizvesti. Mogu se dopustiti interni identifikacijski brojevi koji su uključeni u dokumente trećih strana, ali je potrebna izjava u kojoj se popisuju ti identifikacijski brojevi i potvrđuje da se oni odnose na formulaciju(-e) za koju(-e) se traži odobrenje.
2.1.4. Čistoća
Podnositelj zahtjeva mora identificirati i količinski odrediti kemijske i mikrobne nečistoće, tvari koje imaju toksična ili druga neželjena svojstva, a koje nisu namjerno dodane i ne pridonose aktivnosti dodatka. Osim toga, za proizvode fermentacije, podnositelj zahtjeva mora dokazati da u dodatku nisu prisutni proizvodni organizmi. Mora se opisati protokol koji se koristi za rutinsko pregledavanje proizvodnih serija u svrhu otkrivanja onečišćivača i nečistoća.
Svi dostavljeni podaci moraju podupirati prijedlog za specifikaciju dodatka.
U daljnjem su tekstu navedeni posebni zahtjevi, koji ovise o postupku proizvodnje i u skladu su s važećim zakonodavstvom Zajednice.
2.1.4.1. Dodaci čije je odobrenje vezano uz određenog nositelja odobrenja
Za dodatke čije je odobrenje vezano uz određenog nositelja odobrenja treba dostaviti bitne informacije koje se odnose na posebni postupak koji koristi proizvođač, i to na temelju postojećih normi koje se koriste u druge slične svrhe. Mogu se koristiti specifikacije Zajedničkog stručnog povjerenstva FAO-a i WHO-a za prehrambene dodatke (JECFA) ili specifikacije iz odobrenja Europske zajednice za prehrambene dodatke.
2.1.4.2. Dodaci čije odobrenje nije vezano uz određenog nositelja odobrenja
Za dodatke čije odobrenje nije vezano uz određenog nositelja odobrenja, mogu se koristiti postojeće norme koje se koriste u druge slične svrhe ili koje uključuju specifikacije za prehrambene dodatke odobrene u Europskoj zajednici ili specifikacije JECFA-e. Ako te norme nisu na raspolaganju, ili ako je to bitno za proizvodni proces, moraju se opisati najmanje sljedeći elementi i odrediti njihove koncentracije:
|
— |
za mikroorganizme: mikrobiološko onečišćenje, mikotoksini, teški metali; |
|
— |
za proizvode fermentacije (koji ne sadrže mikroorganizme kao aktivna sredstva): za njih vrijede isti zahtjevi kao i za proizvode mikroorganizma (vidjeti gore). Navodi se i u kojoj je mjeri iskorištena hranjiva pologa uključena u konačni proizvod; |
|
— |
za tvari biljnog podrijetla: mikrobiološko i botaničko onečišćenje (npr. posebno ricinus, sjeme korova, ražena snijet), mikotoksini, onečišćenje pesticidima, najveće vrijednosti za otapala i, prema potrebi, tvari koje izazivaju zabrinutost zbog svojih toksikoloških obilježja, a za koje je poznato da se javljaju u izvornoj biljci; |
|
— |
za tvari životinjskog podrijetla: mikrobiološko onečišćenje, teški metali i najveće vrijednosti za otapala, prema potrebi; |
|
— |
za mineralne tvari: teški metali, dioksini i poliklorirani bifenili (PCB); |
|
— |
za proizvode dobivene kemijskom sintezom i kemijskim procesima: moraju se identificirati sve kemikalije korištene u procesima sinteze kao i svi međuproizvodi koji ostaju u konačnom proizvodu te se moraju navesti njihove koncentracije. |
Mikotoksini za analizu odabiru se prema različitim matricama, ovisno o slučaju.
2.1.5. Fizičko stanje svakog oblika proizvoda
Za krute pripravke navode se podaci o raspodjeli veličina čestica, obliku čestica, gustoći, gustoći rasutih čestica, prašnosti i korištenju postupaka koji utječu na fizikalna svojstva. Za tekuće pripravke navode se podaci o viskoznosti i površinskoj napetosti. Ako je dodatak namijenjen korištenju u vodi, mora se dokazati topljivost i stupanj raspršenosti.
2.2. Karakterizacija aktivne(-ih) tvari/organizma(-ama)
2.2.1. Opis
Opisuju se svojstva aktivne tvari ili organizma. To uključuje čistoću i podrijetlo tvari ili organizma kao i sva druga bitna obilježja.
2.2.1.1. Kemijske tvari
Kemijski jasno definirane tvari opisuju se generičkim imenom, kemijskim imenom prema nomenklaturi Međunarodne unije za čistu i primijenjenu kemiju (IUPAC), drugim generičkim međunarodnim imenima i kraticama i/ili brojem CAS (Chemical Abstract Service). Mora se također navesti strukturna i molekulska formula te molekulska masa.
Za kemijski definirane spojeve koji se koriste kao arome navodi se broj FLAVIS koji odgovara dotičnoj kemijskoj skupini. Za biljne ekstrakte moraju se navesti fitokemijski biljezi.
Smjese čiji se sastojci ne mogu opisati jednom kemijskom formulom i/ili kod kojih se svi sastojci ne mogu identificirati, karakteriziraju se prema sastojku(-cima) koji pridonose aktivnosti smjese i/ili prema tipičnom glavnom sastojku(-cima). Identificira se spoj koji se koristi kao biljeg kako bi se mogla ocijeniti stabilnost i osigurati sredstvo za sljedivost.
Kod enzima i enzimskih pripravaka za svaku se deklariranu aktivnost mora navesti broj i sustavno ime koje je predložila Međunarodna unija za biokemiju (IUB) u najnovijem izdanju „Nomenklature enzima”. Za aktivnosti koje još nisu uključene, koristi se sustavno ime koje je u skladu s IUB-ovim pravilima o nomenklaturi. Trivijalni nazivi su prihvatljivi pod uvjetom da su nedvosmisleni, da se dosljedno koriste u cijeloj dokumentaciji i da se kod prvog spominjanja mogu jasno povezati sa sustavnim imenom i brojem IUB. Mora se navesti biološko podrijetlo svake enzimske aktivnosti.
Mora se opisati i mikrobno podrijetlo kemijskih tvari koje nastaju fermentacijom (vidjeti 2.2.1.2. Mikroorganizmi).
2.2.1.2. Mikroorganizmi
Za sve mikroorganizme, bez obzira na to koriste li se kao proizvod ili kao proizvodni soj, treba navesti podrijetlo.
Za mikroorganizme koji se koriste kao proizvod ili kao proizvodni soj navode se sve prethodne modifikacije. Za svaki se mikroorganizam navodi njegov naziv i taksonomska klasifikacija u skladu s najnovijim informacijama objavljenim u Međunarodnim nomenklaturnim kodeksima (ICN). Mikrobni sojevi pohranjuju se u međunarodno priznatoj zbirci kultura (po mogućnosti u Europskoj uniji), u kojoj se čuvaju za vrijeme trajanja odobrenja dodatka. Mora se priložiti potvrda o pohrani, u kojoj je naveden registracijski broj pod kojim se soj čuva u zbirci. Moraju se također opisati sva bitna morfološka, fiziološka i molekularna obilježja koja su potrebna za jedinstvenu identifikaciju soja i omogućuju potvrdu njegove genetske stabilnosti. Kod GMO-a se moraju opisati genetske modifikacije. Za svaki se GMO mora navesti i jedinstvena identifikacijska oznaka kako je predviđeno Uredbom Komisije (EZ) br. 65/2004 od 14. siječnja 2004. o uspostavi sustava za razvoj i dodjeljivanje jedinstvenih identifikacijskih oznaka za genetski modificirane organizme.
2.2.2. Bitna svojstva
2.2.2.1. Kemijske tvari
Opisuju se fizikalna i kemijska svojstva. Ovisno o slučaju, navodi se: konstanta disocijacije, pKa, elektrostatička svojstva, talište, vrelište, gustoća, tlak para, topljivost u vodi i organskim otapalima, Kow i Kd/Koc, masena spektometrija i spektri apsorpcije, podaci NMR, mogući izomeri i sva druga odgovarajuća fizikalna svojstva.
Tvari dobivene fermentacijom ne smiju imati nikakvu antimikrobnu aktivnost koja je povezana s korištenjem antibiotika kod ljudi i životinja.
2.2.2.2. Mikroorganizmi
|
— |
Toksini i čimbenici virulencije Mora se dokazati da toksini ili čimbenici virulencije nisu prisutni ili da ne izazivaju zabrinutost. Za sojeve bakterija iz taksonomske skupine u koju spadaju organizmi za koje je poznato da proizvode toksine ili druge čimbenike virulencije moraju se obaviti odgovarajuća ispitivanjima kako bi se na molekularnoj i, prema potrebi, staničnoj razini dokazalo da nema razloga za zabrinutost. Za sojeve mikroorganizama čije sigurno korištenje nije dokazano u prošlosti i čija je biologija još uvijek slabo poznata potrebno je obaviti kompletna toksikološka ispitivanja. |
|
— |
Proizvodnja antibiotika i otpornost na antibiotike Mikroorganizmi koji se koriste kao dodaci ili kao proizvodni soj ne smiju djelovati antibiotski i ne smiju proizvoditi antibiotske tvari koje se koriste kao antibiotici za ljude i životinje. Sojevi mikroorganizama koji su namijenjeni korištenju kao dodaci ne smiju dodatno povećavati zalihu gena za otpornost na antibiotike, koja je već prisutna u crijevnoj flori životinja i u okolišu. Stoga se kod svih sojeva bakterija mora ispitati otpornost na antibiotike koji se koriste u humanoj i veterinarskoj medicini. Ako se otkrije otpornost, mora se utvrditi njezina genska osnova i vjerojatnost njezina prijenosa na ostale organizme u crijevnoj flori. Sojevi mikroorganizama koji su stekli otpornost na antimikrobno(-a) sredstvo(-a) ne smiju se koristiti kao dodaci hrani za životinje, osim ako se može dokazati da je otpornost rezultat kromosomske(ih) mutacije(-a) i da nije prenosiva. |
2.3. Postupak proizvodnje, uključujući i sve posebne postupke obrade
Treba opisati postupak proizvodnje kako bi se odredile kritične točke postupka koje bi mogle utjecati na čistoću aktivne tvari/organizma(-ama) ili dodatka. Mora se dostaviti sigurnosni list za kemikalije korištene u postupku proizvodnje.
2.3.1. Aktivna(-e) tvar(i)/organizam(-mi)
Opisuje se, prema potrebi pomoću dijagrama toka, postupak proizvodnje (npr. kemijska sinteza, fermentacija, uzgoj, ekstrakcija iz organskog materijala ili destilacija) koji se koristi za pripremu aktivne(-ih) tvari/organizma(-ama) u dodatku. Navodi se sastav hranjive podloge za fermentaciju/uzgoj. Detaljno se opisuju metode pročišćavanja.
Za genetski modificirane mikroorganizme (GMM) koji se koriste kao izvor dodatka i uzgajaju se u kontroliranim uvjetima primjenjuje se Direktiva Vijeća 90/219/EZ (5). Opisuju se i postupci fermentacije (hranjiva podloga, uvjeti fermentacije te izdvajanje i pročišćavanje proizvoda fermentacije).
2.3.2. Dodatak
Dostavlja se detaljan opis postupka proizvodnje dodatka. Navode se, prema potrebi pomoću dijagrama toka, ključne faze u pripremi dodatka, uključujući točku(-e) uvođenja aktivne(-ih) tvari/organizma(-ama) i drugih sastojaka te sve kasnije faze obrade koje utječu na pripremu dodatka.
2.4. Fizikalno-kemijska i tehnološka svojstva dodatka
2.4.1. Stabilnost
Stabilnost se općenito mjeri analitičkim praćenjem aktivne(-ih) tvari/organizma(-ama) ili njezine/njegove aktivnosti/sposobnosti preživljavanja. Za enzime, stabilnost se može definirati u smislu gubitka katalitičke aktivnosti; za mikroorganizme u smislu gubitka sposobnosti preživljavanja; za aromatske tvari u smislu gubitka arome. Za ostale kemijske smjese/ekstrakte stabilnost se može procijeniti praćenjem koncentracije jednog ili više odgovarajućih biljega.
Stabilnost dodatka
Mora se ispitati stabilnost svake formulacije dodatka pri izloženosti različitim uvjetima okoliša (svjetlost, temperatura, pH, vlaga, kisik i ambalaža). Očekivani rok valjanosti dodatka stavljenog na tržište trebao bi se temeljiti na najmanje dva scenarija koji obuhvaćaju vjerojatni raspon uvjeta korištenja (npr. 25 °C i relativna vlažnost zraka od 60 % te 40 °C i relativna vlažnost zraka od 75 %).
Stabilnost dodatka koji se koristi u premiksima i hrani za životinje
U slučaju dodataka koji se koriste u premiksima i hrani za životinje, osim aromatskih spojeva, treba ispitati stabilnost svake formulacije dodatka u uobičajenim uvjetima proizvodnje i skladištenja premiksa i hrane za životinje. Studije stabilnosti u premiksima moraju trajati najmanje šest mjeseci. Poželjno je da se pri ispitivanju stabilnosti koriste premiksi koji sadrže elemente u tragovima; u protivnom, na deklaraciji dodatka mora se navesti tekst „ne miješati s elementima u tragovima”.
Studije stabilnosti u hrani za životinje obično trebaju trajati tri mjeseca. Stabilnost se općenito treba ispitivati u smjesi ili peletiranoj (pri čemu treba uzeti u obzir utjecaj peletiranja ili drugih oblika obrade) hrani za životinje namijenjenoj zastupljenijim životinjskim vrstama koje su navedene u zahtjevu.
Što se tiče dodataka namijenjenih korištenju u vodi, stabilnost svake formulacije dodatka mora se ispitati u vodi pod uvjetima koji simuliraju praktičnu uporabu.
U slučaju gubitka stabilnosti, prema potrebi, se opisuju svojstva mogućih produkata raspadanja ili razgradnje.
Moraju se dostaviti podaci iz analiza koje uključuju najmanje jedno promatranje na početku i jedno promatranje na kraju razdoblja skladištenja.
Prema potrebi, u studijama se navodi detaljni kvantitativni i kvalitativni sastav premiksa ili hrane za životinje korištene u ispitivanjima.
2.4.2. Homogenost
Mora se dokazati mogućnost homogene raspodjele dodatka za hranu životinje (osim aromatskih spojeva) u premiksima, hrani za životinje ili vodi.
2.4.3. Ostala obilježja
Moraju se opisati ostala obilježja kao što su prašnost, elektrostatička svojstva ili disperzivnost u tekućinama.
2.4.4. Fizikalna i kemijska inkompatibilnost ili interakcije
Mora se ukazati na moguće fizikalno-kemijske inkompatibilnosti ili interakcije s hranom za životinje, tvarima koje služe kao nosači, drugim odobrenim dodacima ili medicinskim proizvodima.
2.5. Uvjeti korištenja dodatka
2.5.1. Predloženi način korištenja u hranidbi životinja
Vrste ili kategorije životinja, dobne skupine ili faze u proizvodnji životinja navode se u skladu s kategorijama koje su popisane u Prilogu IV. ovoj Uredbi. Moraju se navesti moguće kontraindikacije. Mora se protumačiti predloženo korištenje u hrani za životinje ili vodi.
Moraju se navesti detaljni podaci o predloženom načinu primjene i količini koja se dodaje u premikse, hranu za životinje ili vodu za piće. Prema potrebi se mora navesti i predložena doza u potpunim krmnim smjesama te predloženo trajanje primjene i predložena karencija. Ako se predlaže posebna uporaba dodatka u dopunskim krmnim smjesama, mora se navesti obrazloženje.
2.5.2. Informacije vezane uz sigurnost primjenitelja/radnika
2.5.2.1. Kemijske tvari
Mora se dostaviti sigurnosni list sastavljen u skladu sa zahtjevima Direktive Komisije 91/155/EEZ od 5. ožujka 1991. o određivanju i utvrđivanju detaljnih rješenja za sustav posebnih informacija koje se odnose na opasne pripravke u svrhu provedbe članka 10. Direktive 88/379/EEZ (6). Ako je potrebno, predlažu se mjere za sprečavanje opasnosti na radu i način zaštite tijekom proizvodnje, rukovanja, korištenja te odlaganja i uništavanja.
2.5.2.2. Mikroorganizmi
Mora se navesti klasifikacija u skladu s Direktivom 2000/54/EZ Europskog parlamenta i Vijeća od 18. rujna 2000. o zaštiti radnika od rizika povezanih s izlaganjem biološkim agensima na radu (sedma pojedinačna direktiva u smislu članka 16. stavka 1. Direktive 89/391/EEZ) (7). Za mikroorganizme koji u toj Direktivi nisu svrstani u 1. skupinu, potrošačima se moraju dati informacije kako bi mogli poduzeti odgovarajuće mjere zaštite svojih radnika, kako je utvrđeno u članku 3. stavku 2. navedene Direktive.
2.5.2.3. Zahtjevi u pogledu označivanja
Ne dovodeći u pitanje odredbe o označivanju i pakiranju koje su utvrđene člankom 16. Uredbe (EZ) br. 1831/2003, moraju se navesti svi posebni zahtjevi u pogledu označivanja i, prema potrebi, posebni uvjeti korištenja i rukovanja (uključujući poznate inkompatibilnosti i kontraindikacije) te upute za pravilno korištenje.
2.6. Analitičke metode i referentni uzorci
Analitičke metode navode se prema standardnom obliku koji preporučuje ISO (npr. ISO 78-2).
Sukladno Uredbi (EZ) br. 1831/2003 i Uredbi (EZ) br. 378/2005, analitičke metode obuhvaćene ovim odjeljkom ocjenjuje CRL. CRL dostavlja Agenciji izvješće o ocjeni u kojem se navodi jesu li te metode prikladne za korištenje u okviru službenih kontrola dodatka u hrani za životinje koji je predmet zahtjeva za odobrenje. CRL usredotočuje svoju ocjenu na metode navedene u odjeljcima 2.6.1. i 2.6.2.
Ako je Uredbom Vijeća (EEZ) br. 2377/90 od 26. lipnja 1990. o utvrđivanju postupka Zajednice za određivanje najvećih dopuštenih količina rezidua veterinarsko-medicinskih proizvoda u hrani životinjskog podrijetla (8) određena najveća dopuštena količina rezidua za tvar koja je predmet zahtjeva, metode navedene u odjeljku 2.6.2. ne podliježu ocjenjivanju od strane CRL-a. Podnositelj zahtjeva sastavlja odjeljak 2.6.2. navodeći istu metodu, informacije i pojedinosti (zajedno s odgovarajućim ažuriranim podacima) koje dostavlja Europskoj agenciji za lijekove (EMEA) u skladu s Prilogom V. Uredbi (EEZ) br. 2377/90 i u skladu sa sveskom 8. serije „Pravila o medicinskim proizvodima u Europskoj uniji” (Rules governing medicinal products in the European Union), „Obavijest podnositeljima zahtjeva i Smjernice” (Notice to Applicants and Guidelines).
Mogu se ocijeniti i analitičke metode opisane u odjeljku 2.6.3. ako CRL, Agencija ili Komisija smatraju da je to potrebno.
U skladu s Uredbom (EZ) br. 378/2005 podnositelj zahtjeva mora dostaviti referentne uzorke izravno CRL-u prije ocjenjivanja tehničke dokumentacije i zamjenske uzorke prije isteka valjanosti.
Podnositelji zahtjeva moraju slijediti detaljne smjernice koje je izdao CRL u skladu s člankom 12. Uredbe (EZ) br. 378/2005.
2.6.1. Metode za analizu aktivne tvari
Detaljno se opisuju obilježja kvalitativne(-ih) i, prema potrebi, kvantitativne(-ih) analitičke(-ih) metode(-a) za određivanje sukladnosti s najvećim ili najmanjim predloženim razinama aktivne(-ih) tvari/organizma(-ama) u dodatku, premiksima, hrani za životinje i, prema potrebi, vodi.
2.6.1.1. Te metode moraju udovoljavati istim onim zahtjevima koji su u članku 11. Uredbe (EZ) br. 882/2004 propisani za analitičke metode koje se koriste u svrhu službenih kontrola. One posebno moraju ispunjavati najmanje jedan od sljedećih uvjeta:
|
— |
moraju biti u skladu s odgovarajućim pravilima Zajednice (npr. analitičke metode Zajednice), ako ta pravila postoje; |
|
— |
moraju biti u skladu s međunarodno priznatim pravilima ili protokolima, npr. onima koje je prihvatio Europski odbor za normizaciju (CEN) ili onima koji su doneseni u nacionalnom zakonodavstvu (npr. Standardne metode CEN-a); |
|
— |
moraju biti prikladne za predviđenu namjenu te razvijene u skladu sa znanstvenim protokolima i validirane u međulaboratorijskom ispitivanju u skladu s međunarodno priznatim protokolom o međulaboratorijskim pokusima (npr. ISO 5725 ili IUPAC); ili |
|
— |
moraju biti podvrgnute internoj validaciji u skladu s međunarodno usklađenim smjernicama za internu validaciju analitičkih metoda (9), i to prema parametrima za određivanje obilježja spomenutih u točki 2.6.1.2. |
2.6.1.2. Detaljnim opisom metoda moraju se obuhvatiti odgovarajuća obilježja navedena u Prilogu III. Uredbi (EZ) br. 882/2004.
2.6.1.3. Radna obilježja interno validiranih metoda moraju se provjeriti ispitivanjem metode u drugom, akreditiranom i neovisnom laboratoriju. Rezultati tih ispitivanja dostavljaju se zajedno sa svim ostalim podacima koji potvrđuju mogućnost primjene metode u laboratoriju za službenu kontrolu. Ako taj drugi laboratorij pripada konzorciju nacionalnih referentnih laboratorija (NRL) koji pomažu CRL-u u skladu s Uredbom (EZ) br. 378/2005, on mora poslati CRL-u, čim CRL primi zahtjev, izjavu o interesu u kojoj opisuje svoje poslove vezane uz dotični zahtjev i ne smije sudjelovati u ocjenjivanju tog zahtjeva, a sve to zbog neovisnosti i uključenosti u ocjenjivanje dokumentacije koju je dostavio podnositelj zahtjeva.
2.6.1.4. U svom evaluacijskom izvješću koje dostavlja Agenciji CRL može odabrati odgovarajuća obilježja koja su navedena u Prilogu III. Uredbi (EZ) br. 882/2004.
2.6.1.5. U detaljnim smjernicama koje daje CRL u skladu s člankom 12. Uredbe (EZ) br. 378/2005 mogu se utvrditi kriteriji učinkovitosti za metode za posebne skupine tvari (npr. enzime).
2.6.2. Analitičke metode za određivanje rezidua dodatka ili njegovih metabolita u hrani
Detaljno se opisuju obilježja kvalitativne(-ih) i kvantitativne(-ih) analitičke(-ih) metodemetoda(-a) za određivanje markerskih rezidua i/ili metabolita dodatka u ciljanim tkivima i proizvodima životinjskog podrijetla.
2.6.2.1. Te metode moraju udovoljavati istim onim zahtjevima koji su člankom 11. Uredbe (EZ) br. 882/2004 propisani za analitičke metode koje se koriste u svrhu službenih kontrola. One posebno moraju ispunjavati najmanje jedan od zahtjeva navedenih u točki 2.6.1.1.
2.6.2.2. Detaljnim opisom metode(-a) moraju se obuhvatiti odgovarajuća obilježja navedena u Prilogu III. Uredbe (EZ) br. 882/2004 i uzeti u obzir zahtjevi propisani Odlukom Komisije 2002/657/EZ (10). Prema potrebi se uzimaju u obzir isti kriteriji učinkovitosti koji su propisani Odlukom Komisije o analitičkim metodama za otkrivanje određenih tvari i njihovih rezidua u proizvodima živih životinja sukladno Direktivi Vijeća 96/23/EZ.
Kod nijedne metode granica kvantifikacije (LOQ) ne smije prijeći polovicu odgovarajućeg NDKR-a i mora se validirati za vrijednosti najmanje u rasponu od polovice NDKR-a do dvostrukog NDKR-a.
2.6.2.3. Radna obilježja interno validiranih metoda moraju se provjeriti ispitivanjem metode u drugom, akreditiranom i neovisnom laboratoriju. Moraju se dostaviti rezultati tih ispitivanja. Ako taj drugi laboratorij pripada konzorciju nacionalnih referentnih laboratorija (NRL) koji pomažu CRL-u u skladu s Uredbom (EZ) br. 378/2005, on mora poslati CRL-u, čim CRL primi zahtjev, izjavu o interesu u kojoj opisuje svoje poslove vezane uz dotični zahtjev i ne smije sudjelovati u ocjenjivanju tog zahtjeva, a sve to zbog neovisnosti i uključenosti u ocjenjivanje dokumentacije koju je dostavio podnositelj zahtjeva.
2.6.2.4. U svom evaluacijskom izvješću koje dostavlja Agenciji CRL može odabrati odgovarajuća obilježja među onima koja su spomenuta u točki 2.6.2.2.
2.6.2.5. U detaljnim smjernicama koje daje CRL u skladu s člankom 12. Uredbe (EZ) br. 378/2005 mogu se utvrditi kriteriji učinkovitosti za metode za posebne skupine tvari (npr. enzime).
2.6.3. Analitičke metode za identifikaciju i određivanje obilježja dodatka
Podnositelj zahtjeva dostavlja opis metoda koje se koriste za određivanje obilježja navedenih u točkama 2.1.3, 2.1.4, 2.1.5, 2.2.2, 2.4.1, 2.4.2, 2.4.3 i 2.4.4.
U skladu s Prilogom II. Uredbi (EZ) br. 1831/2003, kako je izmijenjena Uredbom (EZ) br. 378/2005, mogu se ocijeniti i metode opisane u okviru ovog odjeljka ako Agencija ili Komisija smatraju da je to bitno za ocjenu zahtjeva.
Preporučuje se da metode opisane u okviru ovog odjeljka budu međunarodno priznate. Metode koje nisu međunarodno priznate moraju biti u cijelosti opisane. U tim slučajevima studije moraju obaviti akreditirani i neovisni laboratoriji i one moraju biti dokumentirane u skladu s odgovarajućim standardima kvalitete (npr. DLP u skladu s Direktivom 2004/10/EZ ili norme ISO).
Metode za identifikaciju i određivanje obilježja dodatka moraju udovoljavati istim onim zahtjevima koji su člankom 11. Uredbe (EZ) br. 882/2004 propisani za metode analize koje se koriste u svrhu službenih kontrola, posebno ako postoje zakonom propisani zahtjevi (npr. u pogledu nečistoća, nepoželjnih tvari).
3. ODJELJAK III: STUDIJE O SIGURNOSTI DODATKA
Studije obuhvaćene ovim odjeljkom i posebnim prilozima imaju za cilj omogućiti procjenu:
|
— |
sigurnosti korištenja dodatka kod ciljanih vrsta; |
|
— |
svih rizika povezanih sa selekcijom i/ili prijenosom otpornosti na antimikrobna sredstva te povećanom postojanošću i širenjem enteropatogena; |
|
— |
rizika za potrošača koji konzumira hranu podrijetlom od životinja kojima je davana hrana za životinje koja sadrži dodatak ili je bila tretirana dodatkom ili rizika koji nastaju zbog konzumiranja hrane koja sadrži rezidue dodatka ili njegovih metabolita; |
|
— |
rizika zbog kontakta s dišnim organima, drugim sluznicama, očima ili kožom u osoba koje bi mogle rukovati dodatkom kao takvim ili uključenim u premikse ili hranu za životinje; i |
|
— |
opasnosti od štetnih učinaka na okoliš koje izravno i/ili preko životinjskih izlučevina, uzrokuje sam dodatak ili proizvodi dobiveni od dodatka. |
3.1. Studije koje se odnose na sigurnost korištenja dodatka za ciljane životinje
Studije obuhvaćene ovim odjeljkom imaju za cilj procijeniti:
|
— |
sigurnost samog korištenja dodatka kod ciljanih vrsta životinja; i |
|
— |
sve rizike povezane sa selekcijom i/ili prijenosom otpornosti na antimikrobna sredstva te povećanom postojanošću i širenjem enteropatogena. |
3.1.1. Studije podnošljivosti kod ciljanih vrsta životinja
Ispitivanje podnošljivosti ima za cilj pružiti ograničenu ocjenu kratkoročne toksičnosti dodatka za ciljane životinje. Ono se također koristi i za određivanje granice sigurnosti za slučajeve kad se dodatak konzumira u dozama većim od preporučenih. Ispitivanja podnošljivosti moraju se obaviti kako bi se dokazalo da je dodatak siguran za svaku ciljanu vrstu/kategoriju životinja za koju se podnosi zahtjev. U nekim se slučajevima određeni elementi ispitivanja podnošljivosti mogu uključiti u jedan od pokusa učinkovitosti, pod uvjetom da su ispunjeni zahtjevi koji su za ta ispitivanja navedeni dalje u tekstu. Sve studije opisane u ovom odjeljku moraju se odnositi na dodatak opisan u odjeljku II.
3.1.1.1. Ispitivanje podnošljivosti mora se obaviti na najmanje tri skupine:
|
— |
na skupini kojoj se neće davati dodatak; |
|
— |
na skupini kojoj će se davati najveća preporučena doza; i |
|
— |
na pokusnoj skupini kojoj će se davati doza koja je višestruko veća od najveće preporučene doze. |
U pokusnoj se skupini dodatak općenito daje u dozi koja je deset puta veća od najveće preporučene doze. Pokusne se životinje moraju redovito kontrolirati kako bi se uočili vidljivi znakovi kliničkih učinaka, utvrdila učinkovitost i prema potrebi ocijenila kvaliteta proizvoda te obavile hematološke i redovite biokemijske pretrage krvi te ispitali ostali parametri koji su vjerojatno povezani s biološkim svojstvima dodatka. Moraju se uzeti u obzir kritične krajnje točke poznate iz toksikoloških studija obavljenih na laboratorijskim životinjama. U ovom se odjeljku izvještava i o svim negativnim učincima otkrivenim tijekom ispitivanja djelotvornosti. Neobjašnjiva uginuća do kojih dođe tijekom ispitivanja podnošljivosti moraju se istražiti obdukcijom i, prema potrebi, histološkom pretragom.
Ako se može dokazati da je doza koja je 100 veća od najveće preporučene doze podnošljiva, nisu potrebne hematološke i redovite biokemijske pretrage krvi. Ako je proizvod podnošljiv samo u količini koja je manja od deseterostruke najveće preporučene doze, studija treba biti postavljena tako da se može izračunati granica sigurnosti za dodatak i moraju se odrediti dodatne krajnje točke (pomoću obdukcije, histološke pretrage ako je potrebno, i na temelju drugih odgovarajućih kriterija).
Za neke dodatke, s obzirom na njihovu toksikologiju, metabolizam ili korištenje, nije potrebno ispitivanje podnošljivosti.
U korištenom planu pokusa mora se uzeti u obzir odgovarajuća statistička snaga.
3.1.1.2. Trajanje ispitivanja podnošljivosti
Tablica 1.
Trajanje ispitivanja podnošljivosti: svinje
|
Ciljane životinje |
Trajanje studija |
Obilježja ciljanih životinja |
|
Sisajuća prasad |
14 dana |
Po mogućnosti u dobi od 14 dana do odbijanja |
|
Odbijena prasad |
42 dana |
Do 42 dana nakon odbijanja |
|
Svinje za tov |
42 dana |
Tjelesna masa na početku studije ≤ 35 kg |
|
Krmače za rasplod |
1 ciklus |
Od osjemenjivanja do kraja razdoblja odbijanja |
Ako se zahtjev podnosi za sisajuću i odbijenu prasad, kombinirana studija (14 dana sisajuća prasad i 28 dana odbijena prasad) smatra se dovoljnom. Ako se dokaže podnošljivost za odbijenu prasad, nije potrebno posebno ispitivanje za svinje za tov.
Tablica 2.
Trajanje ispitivanja podnošljivosti: perad
|
Ciljane životinje |
Trajanje studija |
Obilježja ciljanih životinja |
|
Pilići/pilenke za tov |
35 dana |
Od valenja |
|
Kokoši nesilice |
56 dana |
Po mogućnosti tijekom prve trećine razdoblja nesenja |
|
Purani |
42 dana |
Od valenja |
Podaci o podnošljivosti kod pilića za tov ili purana za tov mogu se koristiti kako bi se dokazala podnošljivost kod kokoši odnosno pura koje se uzgajaju za nesenje/reprodukciju.
Tablica 3.
Trajanje ispitivanja podnošljivosti: goveda
|
Ciljane životinje |
Trajanje studija |
Obilježja ciljanih životinja |
|
Telad za tov |
28 dana |
Početna tjelesna masa ≤ 70 kg |
|
Telad za uzgoj; goveda za tov ili reprodukciju |
42 dana |
|
|
Mliječne krave |
56 dana |
|
Ako se zahtjev podnosi za telad za uzgoj i goveda za tov, kombinirana studija (28 dana za svako razdoblje) smatra se dovoljnom.
Tablica 4.
Trajanje ispitivanja podnošljivosti: ovce
|
Ciljane životinje |
Trajanje studija |
Obilježja ciljanih životinja |
|
Janjci za uzgoj i tov |
28 dana |
|
Tablica 5.
Trajanje ispitivanja podnošljivosti: Salmonidae i ostala riba
|
Ciljane životinje |
Trajanje studija |
Obilježja ciljanih životinja |
|
Losos i pastrva |
90 dana |
|
Umjesto studije u trajanju od 90 dana, može se obaviti studija u kojoj se početna tjelesna masa ribe na početku ispitivanja poveća najmanje dvostruko.
Ako se dodatak namjerava koristiti samo za matični fond, ispitivanja podnošljivosti obavljaju se što je moguće bliže razdoblju mrijesta. Ispitivanja podnošljivosti moraju trajati 90 dana i pozornost se mora obratiti na kakvoću i preživljavanje ikre.
Tablica 6.
Trajanje ispitivanja podnošljivosti: kućni ljubimci i ostale životinje koje ne služe za proizvodnju hrane
|
Ciljane životinje |
Trajanje studija |
Obilježja ciljanih životinja |
|
Psi i mačke |
28 dana |
|
Tablica 7.
Trajanje ispitivanja podnošljivosti: kunići
|
Ciljane životinje |
Trajanje studija |
Obilježja ciljanih životinja |
|
Kunići za tov |
28 dana |
|
|
Kunići za rasplod |
1 ciklus |
Od osjemenjivanja do kraja razdoblja odbijanja |
Ako se zahtjev podnosi za sisajuće i odbijene kuniće, razdoblje od 49 dana (koje počinje tjedan dana nakon rođenja) smatra se dovoljnim i mora uključivati i ženke kunića do odbića.
Ako se dodatak primjenjuje u određenom razdoblju koje je kraće od onog koje je navedeno u definiciji kategorije životinja, primjenjuje se u skladu s predloženim uvjetima korištenja. Međutim, razdoblje promatranja ne smije biti kraće od 28 dana i mora uključivati odgovarajuće krajnje točke (npr. za krmače za rasplod, broj živorođene prasadi ako se uzima u obzir razdoblje suprasnosti, ili broj i tjelesna masa odbijene prasadi ako se uzima u obzir razdoblje laktacije).
3.1.1.3. Uvjeti pokusa
Za svaku studiju dostavlja se pojedinačno izvješće s detaljnim podacima o pokusnim skupinama. Protokol ispitivanja mora biti pažljivo sastavljen što se tiče općih opisnih podataka. Posebno se moraju zabilježiti sljedeći podaci:
|
1. |
stado ili jato: lokacija i veličina; uvjeti hranidbe i uzgoja; način hranidbe; za akvatične vrste, veličina i broj bazena ili boksova na gospodarstvu, svjetlosni uvjeti i kakvoća vode, uključujući temperaturu i slanost vode; |
|
2. |
životinje: vrste (za akvatične vrste namijenjene prehrani ljudi, navodi se njihovo uobičajeno ime a nakon njega, u zagradama, latinsko dvodijelno ime), pasmina, dob (veličina za akvatične vrste), spol, postupak identifikacije, fiziološki stadij i opće zdravstveno stanje; |
|
3. |
datum i točno trajanje ispitivanja: datum i vrsta obavljenih ispitivanja; |
|
4. |
režim prehrane: opis proizvodnje i kvantitativni sastav obroka u smislu korištenih sastojaka, hranjivih tvari (analizirane vrijednosti) i energije; evidencija o unosu hrane za životinje; |
|
5. |
koncentracija aktivne(-ih) tvariili organizma(-ama) (i, ovisno o slučaju, tvari korištenih u komparativne svrhe) u hrani za životinje utvrđuje se kontrolnom analizom korištenjem odgovarajućih priznatih metoda: referentni broj(evi) serija; |
|
6. |
broj ispitnih i kontrolnih skupina, broj životinja u svakoj skupini: broj životinja obuhvaćenih pokusom mora omogućiti statističku analizu. Treba navesti korištene metode statističke prosudbe. Izvješće mora obuhvaćati sve životinje i/ili pokusne jedinice uključene u ispitivanja. Treba izvijestiti o slučajevima koje nije moguće ocijeniti zbog nedostatka ili gubitka podataka, kao i o njihovoj raspodjeli unutar pojedinih skupina životinja; |
|
7. |
treba izvijestiti o vremenu pojavljivanja i prevalenciji svih neželjenih posljedica uporabe kod pojedinih životinja ili skupina (navode se podaci o programu promatranja korištenom u studiji); i |
|
8. |
terapeutska/preventivna uporaba, ako je potrebna, ne smije utjecati na predloženi način djelovanja dodatka i o njoj se mora pojedinačno izvijestiti. |
3.1.2. Mikrobiološke studije
Moraju se obaviti studije za određivanje sposobnosti dodatka da izazove križnu otpornost na antibiotike koji se koriste u humanoj i veterinarskoj medicini, da pod terenskim uvjetima obavi selekciju otpornih bakterijskih sojeva kod ciljanih vrsta, da utječe na oportunističke patogene koji su prisutni u probavnom traktu te da prouzroči širenje ili izlučivanje zoonotskih mikroorganizama.
Ako pri koncentraciji koja se koristi u hrani za životinje aktivna(-e) tvar(i) ima(ju) antimikrobno djelovanje, mora se, u skladu sa standardiziranim postupkom, odrediti minimalna inhibicijska koncentracija (MIK) za relevantne bakterijske vrste. Ako se dokaže relevantno antimikrobno djelovanje, mora se utvrditi sposobnost dodatka da izvrši selekciju otpornih bakterijskih sojeva in vitro i u ciljanih vrsta te da izazove križnu otpornost na odgovarajuće antibiotike (11).
Ispitivanja pri preporučenoj dozi korištenja moraju se obaviti za sve mikrobne dodatke kao i za sve ostale dodatke za koje se može očekivati da će utjecati na crijevnu floru. Te studije moraju dokazati da korištenje dodatka ne stvara uvjete koji omogućuju pretjerani rast i širenje potencijalno patogenih mikroorganizama.
Mikroorganizmi koji će se promatrati biraju se ovisno o ciljanim vrstama, ali moraju uključivati odgovarajuće zoonotske vrste, bez obzira na to izazivaju li ili ne izazivaju simptome kod ciljanih vrsta.
3.2. Studije koje se odnose na sigurnost korištenja dodatka za potrošače
Cilj je ocijeniti sigurnost dodatka za potrošače i utvrditi moguće rezidue dodatka ili njegovih metabolita u hrani dobivenoj od životinja kojima je davana hrana za životinje ili voda koja sadrži dodatak ili je tretirana dodatkom.
3.2.1. Studije metabolizma i rezidua
Utvrđivanje metaboličke sudbine dodatka kod ciljanih vrsta odlučujući je korak pri identifikaciji i kvantifikaciji rezidua u jestivim tkivima ili proizvodima dobivenim od životinja kojima je davana hrana ili voda koja sadrži dodatak. Moraju se dostaviti studije o apsorpciji, distribuciji, metabolizmu i izlučivanju tvari (i njezinih metabolita).
Studije se moraju provesti korištenjem međunarodno validiranih metoda ispitivanja i u skladu s važećim zakonodavstvom EU-a ili OECD-ovim mjernicama o metodologiji te u skladu s načelima DLP-a. Studija mora poštovati pravila o dobrobiti životinja koja su utvrđena zakonodavstvom Europske zajednice i ne smije se bespotrebno ponavljati.
Studije metabolizma i rezidua na ciljanoj(-im) životinji(-ama) provode se korištenjem aktivne tvari koja je uključena u hranu za životinje (koja se ne daje šopanjem, osim u opravdanim slučajevima).
Mora se utvrditi struktura metabolita koji predstavljaju više od 10 % ukupnih rezidua u jestivim tkivima i proizvodima i više od 20 % ukupnih rezidua u izlučevinama. Ako metabolički put aktivne tvari izaziva bilo kakvu zabrinutost zbog toksikoloških razloga, moraju se identificirati i metaboliti čije su vrijednosti ispod gore navedenih granica.
Studije kinetike rezidua bit će osnova za izračunavanje izloženosti potrošača i, prema potrebi, za utvrđivanje razdoblja karencije i NDKR-a. Markerska rezidua mora biti predložena.
Za neke dodatke, ovisno o njihovoj prirodi i korištenju, možda neće uvijek biti potrebno obaviti studije metabolizma i rezidua.
3.2.1.1. Studije metabolizma
Svrha metaboličkih studija je procijeniti apsorpciju, distribuciju, biotransformaciju i izlučivanje dodatka kod ciljanih vrsta.
Sljedeće studije su obvezne:
|
1. |
studija metaboličke ravnoteže nakon primjene jedne doze aktivne tvari, u dozi predloženoj za korištenje (pri čemu ukupna količina odgovara dnevnom unosu) i po mogućnosti nakon višekratne doze (ako je opravdano) kako bi se procijenila približna brzina i stupanj apsorpcije, distribucije (plazma/krv) i izlučivanja (urin, žuč, izmet, mlijeko ili jaja, izdahnuti zrak, izlučivanje kroz škrge) kod životinja muškog i ženskog spola, prema potrebi; i |
|
2. |
metabolički profil, metaboliti u izlučinama i tkivima te distribucija u tkivima i proizvodima utvrđuju se nakon primjene ponovljenih doza označenog spoja kod životinja do postizanja stanja stabilnosti (metaboličke ravnoteže), koje se utvrđuje prema razinama u plazmi. Primijenjena doza mora odgovarati najvećoj dozi predloženoj za korištenje i mora biti umiješana u hranu za životinje. |
3.2.1.2. Studije rezidua
Mora se ispitati količina i priroda neizlučivih rezidua u jestivim tkivima ili proizvodima.
Studije rezidua obvezne su za sve tvari za koje se zahtijevaju metaboličke studije.
Ako je tvar prirodni sastojak tjelesnih tekućina ili tkiva ili je prirodno prisutna u značajnim količinama u hrani za ljude ili životinje, studije rezidua ograničavaju se na usporedbu razina u tkivima/proizvodima u netretiranoj skupini i u skupini kojoj je davana najveća predviđena doza.
Za zastupljenije vrste, studijama se istodobno ocjenjuju ukupne toksikološki značajne rezidue i identificira markerska rezidua aktivne tvari u jestivim tkivima (jetrima, bubrezima, mišićima, koži, koži + masnoći) i proizvodima (mlijeku, jajima i medu). Markerska rezidua je rezidua odabrana za ispitivanje čija je koncentracija u poznatom odnosu prema ukupnim toksikološki značajnim reziduama u tkivima. Studijama se također mora dokazati postojanost rezidua u tkivima ili proizvodima kako bi se odredila odgovarajuća karencija.
Za određivanje karencije predlaže se uzorkovanje od najmanje sljedećeg broja životinja i/ili proizvoda u svakoj vremenskoj točki:
|
— |
jestiva tkiva:
|
|
— |
proizvodi:
|
Treba voditi računa o primjerenoj raspodjeli po spolu.
Rezidue se mjere na početku karencije (stabilno stanje) i u još najmanje tri vremenske točke uzorkovanja.
Mora se predložiti markerska rezidua.
Studije apsorpcije, distribucije i izlučivanja te identifikacija glavnih metabolita moraju se obaviti na onim vrstama laboratorijskih životinja kod kojih je postignuta najniža vrijednost NOAEL-a ili, inače, na štakorima (oba spola). Ako ciljane vrste proizvode određene metabolite koji ne nastaju u značajnim količinama kod laboratorijskih životinja, potrebne su dodatne studije o tim metabolitima.
3.2.1.3. Ispitivanja metabolizma i raspodjele
Mora se provesti studija metabolizma te utvrditi metabolička ravnoteža, metabolički profil i identifikacija glavnih metabolita u urinu i izmetu. Ako se pokaže da je stupanj osjetljivosti kod nekih drugih laboratorijskih vrsta znatno drugačiji od onog u štakora, potrebne su dodatne informacije.
3.2.1.4. Bioraspoloživost rezidua
Pri procjeni rizika za potrošače povezanih s vezanim reziduama u životinjskim proizvodima može se uzeti u obzir dodatni faktor sigurnosti koji se temelji na određivanju bioraspoloživosti rezidua korištenjem odgovarajućih laboratorijskih životinja i priznatih metoda.
3.2.2. Toksikološka ispitivanja
Sigurnost dodatka ocjenjuje se na temelju toksikoloških studija koje se obavljaju in vitro i in vivo na laboratorijskim životinjama. One obično uključuju mjerenje:
|
1. |
akutne toksičnosti; |
|
2. |
genotoksičnosti (mutagenost, klastogenost); |
|
3. |
subkronične oralne toksičnosti; |
|
4. |
kronične oralne toksičnosti/karcinogenosti; |
|
5. |
reprodukcijske toksičnosti, uključujući teratogenost; i |
|
6. |
druge studije. |
Ako postoji bilo kakav razlog za zabrinutost, moraju se obaviti dodatne studije koje će dati dodatne informacije potrebne za procjenu sigurnosti aktivne tvari i njezinih rezidua.
Na temelju rezultata tih studija mora se odrediti toksikološki NOAEL.
Ako ciljane vrste proizvode određene metabolite koji ne nastaju u značajnim količinama kod laboratorijskih životinja, potrebne su dodatne studije o tim metabolitima. Ako su na raspolaganju metaboličke studije kod ljudi, ti se podaci uzimaju u obzir pri donošenju odluke o vrsti mogućih dodatnih studija.
Toksikološke studije moraju se obaviti korištenjem aktivne tvari. Ako je aktivna tvar prisutna u proizvodu fermentacije, taj proizvod fermentacije mora biti ispitan. Ispitani proizvod fermentacije mora biti jednak onom koji se koristi kod komercijalnog proizvoda.
Studije se moraju provesti korištenjem međunarodno validiranih metoda ispitivanja i u skladu s važećim zakonodavstvom EU-a ili OECD-ovim smjernicama o metodologiji te u skladu s načelima DLP-a. Studije u kojima se koriste laboratorijske životinje moraju poštovati pravila o dobrobiti životinja koja su utvrđena zakonodavstvom Europske zajednice, i ne smiju se bespotrebno ponavljati.
3.2.2.1. Akutna toksičnost
Studije akutne toksičnosti potrebne su radi klasifikacije i ograničene karakterizacije toksičnosti spoja.
Studije akutne toksičnosti moraju se obaviti na najmanje dvije vrste sisavaca. Jedna laboratorijska vrsta može se, prema potrebi, zamijeniti ciljanom vrstom.
Nije potrebno odrediti preciznu vrijednost LD50; približno određivanje najmanje smrtonosne doze smatra se dovoljnim. Najveća doza ne smije biti veća od 2 000 mg/kg tjelesne mase.
Kako bi se smanjio broj i patnja životinja uključenih u studiju, neprestano se razvijaju novi protokoli za ispitivanje akutne toksičnosti doze. Ispitivanja obavljena prema tim novim postupcima bit će prihvaćena ako su pravilno validirana.
Moraju se slijediti OECD-ove smjernice 402 (akutna dermalna toksičnost), 420 (metoda određivanja stalne doze), 423 (metoda određivanja razreda akutne toksičnosti) i 425 (postupak prilagođavanja doze).
3.2.2.2. Studije genotoksičnosti, uključujući i mutagenost
Kako bi se identificirale aktivne tvari i, prema potrebi, njihovi metaboliti i proizvodi razgradnje koji imaju mutagena i gentoksična svojstva, mora se provesti izabrani niz različitih testova genotoksičnosti. Testovi se prema potrebi moraju provesti uz metaboličku aktivaciju kod sisavaca ili bez nje i mora se uzeti u obzir kompatibilnost ispitivanog materijala i sustava ispitivanja.
Osnovni niz obuhvaća sljedeće testove:
|
1. |
indukcija genskih mutacija u bakterijama i/ili u stanicama sisavaca (po mogućnosti stanicama limfoma miša na lokusu tk); |
|
2. |
indukcija kromosomskih aberacija u stanicama sisavaca; i |
|
3. |
ispitivanje in vivo na sisavcima. |
Mogu biti potrebni dodatni testovi ovisno o rezultatima gore navedenih testova i uzimajući u obzir ukupni toksični profil dotične tvari i njezinu predviđenu uporabu.
Protokoli trebaju biti u skladu s OECD-ovom smjernicom 471 (test za dokazivanje povratnih mutacija na bakteriji Salmonella typhimurium), 472 (test za dokazivanje povratnih mutacija na bakteriji Escherichia coli), 473 (in vitro test za otkrivanje kromosomskih aberacija u sisavaca), 474 (mikronukleusni test na eritrocitima sisavaca), 475 (test za otkrivanje kromosomskih aberacija u koštanoj srži sisavaca), 476 (in vitro test za dokazivanje genskih mutacija u stanicama sisavaca) ili 482 (neprogramirana sinteza DNA u stanicama sisavaca – in vitro), kao i s ostalim relevantnim OECD-ovim smjernicama za pokuse in vitro i in vivo.
3.2.2.3. Studije subkronične oralne toksičnosti ponovljenih doza
Kako bi se istražila subkronična toksičnost aktivne tvari, mora se obaviti najmanje jedna studija na glodavcima u trajanju od najmanje 90 dana. Ako se smatra potrebnim, mora se obaviti još jedna studija na vrsti životinja koje nisu glodavci. Ispitivana se tvar mora primijeniti peroralno uz najmanje tri razine doziranja, osim onih u kontrolnoj skupini, kako bi se utvrdila reakcija na različite doze. Obično bi trebalo očekivati da će najveća doza izazvati štetne učinke. Kod najmanje doze ne bi se trebali očekivati znakovi toksičnosti.
Protokoli za ove studije trebaju biti u skladu s OECD-ovom smjernicom 408 (glodavci) ili 409 (vrste životinja koje nisu glodavci).
3.2.2.4. Studije kronične oralne toksičnosti (uključujući studije karcinogenosti)
Kako bi se istražila kronična toksičnost i karcinogeni potencijal, mora se obaviti studija kronične oralne toksičnosti na najmanje jednoj vrsti životinja u trajanju od najmanje 12 mjeseci. Odabire se vrsta koja se na temelju raspoloživih znanstvenih podataka i rezultata 90-dnevnih studija smatra najprikladnijom. Uobičajena vrsta je štakor. Ako je potrebna još jedna studija, koristi se glodavac ili neka druga vrsta sisavaca koji nisu glodavci. Ispitivana se tvar mora primijeniti peroralno uz najmanje tri razine doziranja, osim onih u kontrolnoj skupini, kako bi se utvrdila reakcija na različite doze.
Ako se studija kronične toksičnosti kombinira s istraživanjem karcinogenosti, trajanje ispitivanja produljuje se na 18 mjeseci za miševe i hrčke i na 24 mjeseca za štakore.
Studije karcinogenosti nisu potrebne ako aktivna tvar i njezini metaboliti:
|
1. |
daju isključivo negativne rezultate u testovima genotoksičnosti; |
|
2. |
nisu strukturno srodni poznatim karcinogenima; i |
|
3. |
u testovima kronične toksičnosti ne proizvode učinke koji ukazuju na mogući razvoj (pred)neoplazija. |
Protokoli trebaju biti u skladu s OECD-ovom smjernicom 452 (studija kronične toksičnosti) ili 453 (kombinirana studija kronične toksičnosti i karcinogenosti).
3.2.2.5. Studije reprodukcijske toksičnosti (uključujući toksičnost tijekom prenatalnog razvoja)
Kako bi se utvrdila moguća oštećenja reprodukcijskih funkcija kod mužjaka ili ženki ili štetni učinci na potomstvo koji su posljedica primjene aktivne tvari, moraju se ispitati reprodukcijske funkcije, i to:
|
1. |
studija reprodukcijske toksičnosti na dvjema generacijama; i |
|
2. |
studija toksičnosti tijekom prenatalnog razvoja (studija teratogenosti). |
Za nove se pokuse mogu primjenjivati validirane alternativne metode kojima se smanjuje korištenje životinja.
3.2.2.5.1. Studija reprodukcijske toksičnosti na dvjema generacijama
Studije reprodukcijskih funkcija moraju se provesti na najmanje dvije generacije potomaka (F1, F2) najmanje jedne životinjske vrste, obično glodavca, i mogu se kombinirati sa studijom teratogenosti. Tvar koja se ispituje daje se peroralno mužjacima i ženkama u odgovarajuće vrijeme prije parenja. Primjena treba trajati do odbića generacije F2.
Svi bitni podaci o plodnosti, gravidnosti, porodu, majčinskom ponašanju, sisanju, rastu i razvoju potomstva F1 od začeća do zrelosti kao i o razvoju potomstva F2 do odbića moraju se pomno pratiti i dokumentirati. Protokoli za studiju reprodukcijske toksičnosti trebaju biti u skladu s OECD-ovom smjernicom 416.
3.2.2.5.2. Studija toksičnosti tijekom prenatalnog razvoja (studija teratogenosti)
Cilj ispitivanja je otkriti moguće štetne učinke na gravidnu ženku i na razvoj zametka i ploda nakon izlaganja ženke, od implantacije i tijekom cijelog razdoblja gravidnosti. Ti učinci obuhvaćaju pojačanu toksičnost kod gravidnih ženki, smrt zametka ili ploda, promjene u rastu ploda te strukturne promjene i anomalije ploda.
Vrsta izbora za prvu studiju obično je štakor. Ako se dobije negativan ili sumnjiv rezultat za teratogenost, obavlja se još jedna studija razvojne toksičnosti, i to na drugoj vrsti životinja, po mogućnosti na kuniću. Ako se studijom na štakoru potvrdi teratogenost, studija na drugoj životinjskoj vrsti nije potrebna, osim ako pregled rezultata svih osnovnih studija ukazuje da bi se vrijednost ADI trebala temeljiti na teratogenosti kod štakora. U tom bi slučaju bila potrebna studija na drugoj vrsti životinja, kako bi se odredila najosjetljivija vrsta za ovaj parametar. Protokoli bi trebali biti u skladu s OECD-ovom smjernicom 414.
3.2.2.6. Druge posebne toksikološke i farmakološke studije
Ako postoje razlozi za zabrinutost, provode se daljnje studije kako bi se dobile dodatne informacije korisne za ocjenjivanje sigurnosti aktivne tvari i njezinih rezidua. Te studije mogu uključivati ispitivanje farmakoloških učinaka, učinaka kod mladih životinja (u pretpubertetskom razdoblju), imunotoksičnosti ili neurotoksičnosti.
3.2.2.7. Određivanje doza kod kojih se ne uočavaju štetni učinci (NOAEL)
NOAEL se općenito temelji na toksikološkim učincima, iako su ponekad kao osnova primjereniji farmakološki učinci.
Mora se izabrati najniža vrijednost NOAEL-a. Pri određivanju najniže vrijednosti NOAEL-a, izražene kao mg na kg tjelesne mase dnevno, uzimaju se u obzir svi rezultati iz prethodnih odjeljaka kao i svi ostali relevantni objavljeni podaci (uključujući i sve bitne informacije o učincima aktivne tvari na ljude) te, prema potrebi, informacije o kemikalijama koje imaju veoma sličnu kemijsku strukturu.
3.2.3. Procjena sigurnosti za potrošača
Neškodljivost za potrošača ocjenjuje se usporedbom utvrđene vrijednosti ADI (prihvatljivog dnevnog unosa) i izračunatog teoretskog unosa dodatka ili njegovih metabolita putem hrane. Ako se radi o vitaminima i elementima u tragovima, umjesto vrijednosti ADI može se koristiti vrijednost UL (najveći dopušteni unos).
3.2.3.1. Predloženi prihvatljivi dnevni unos (ADI) za aktivnu(-e) tvar(i)
Prihvatljivi dnevni unos (ADI) (izražen kao mg dodatka ili materijala srodnog dodatku po osobi dnevno) dobije se tako da se najniža vrijednost NOAEL-a (mg/kg tjelesne mase) podijeli s odgovarajućim faktorom sigurnosti te pomnoži s prosječnom tjelesnom masom osobe od 60 kg.
Ako je potrebno, mora se predložiti ADI. Ako ispitivanja na životinjama ukažu na nisku toksičnost, za ADI se može navesti da „nije određen”. ADI se ne predlaže ako tvar pokazuje genotoksična ili karcinogena svojstva bitna za ljude.
Da bi se mogao odrediti ADI, aktivna tvar mora imati sličnu metaboličku sudbinu kod ciljanih životinja i laboratorijskih životinja (vidjeti 3.2.1.4. Bioraspoloživost rezidua), što jamči da će potrošači biti izloženi istim reziduama kao i laboratorijske životinje koje su korištene pri toksikološkim studijama. Ako to nije slučaj, ADI se ipak može odrediti na temelju dodatnih studija na drugoj vrsti laboratorijskih životinja ili s metabolitima koji su specifični za ciljane vrste.
Pri utvrđivanju faktora sigurnosti, koji se koristi za određivanje vrijednosti ADI za određeni dodatak, uzima se u obzir priroda bioloških učinaka i kvaliteta podataka korištenih za određivanje NOAEL-a, relevantnost tih učinaka za čovjeka i njihova reverzibilnost te sve spoznaje o izravnim učincima rezidua na ljude.
Pri određivanju vrijednosti ADI koristi se faktor sigurnosti od najmanje 100 (ako je obavljena kompletna serija toksikoloških ispitivanja). Ako su na raspolaganju podaci o aktivnoj tvari u odnosu na ljude, može se prihvatiti manji faktor sigurnosti. Mogu se primijeniti veći faktori sigurnosti kako bi se uzeli u obzir dodatni izvori nesigurnosti u podacima ili ako je NOAEL utvrđen na temelju posebne kritične krajnje točke kao što je teratogenost.
3.2.3.2. Najveći dopušteni unos (UL)
Za neke je dodatke primjerenije da se ocjena sigurnosti temelji na vrijednosti UL, koja predstavlja najveću razinu ukupnog kroničnog dnevnog unosa hranjive tvari (iz svih izvora) za koju je ocijenjeno (od strane nacionalnih ili međunarodnih znanstvenih tijela) da vjerojatno ne predstavlja opasnost od štetnih učinaka na zdravlje potrošača ili posebnih skupina potrošača.
Dokumentacija mora sadržavati podatke koji dokazuju da korištenje dodatka neće dovesti do situacije u kojoj će se prekoračiti vrijednost UL, uzimajući u obzir sve moguće izvore hranjive tvari.
Ako su količine rezidua hranidbenog dodatka ili njegovih metabolita u proizvodima životinjskog podrijetla veće od onih koje se smatraju uobičajenim ili očekivanim za te proizvode, to se mora jasno navesti.
3.2.3.3. Izloženost potrošača
Ukupna količina dodatka i/ili njegovih metabolita koja se unese u organizam potrošača iz svih izvora mora biti manja od vrijednosti ADI ili UL.
Teoretski unos putem hrane životinjskog podrijetla izračunava se uzimajući u obzir koncentraciju (ukupne rezidue kao aritmetička sredina i najveća pojedinačna vrijednost) izmjerenu u tkivima i proizvodima po okončanju korištenja dodatka. Osim toga, prema potrebi se, za različita razdoblja karencije, određuju vrijednosti dnevne potrošnje hrane kod ljudi, polazeći od najgoreg mogućeg slučaja.
Za dodatke namijenjene većem broju vrsta, izloženost preko tkiva izračunava se odvojeno za sisavce, ptice i ribe, i kao rezultat se uzima najveća vrijednost. Prema potrebi, toj se brojci dodaje izloženost preko mlijeka i jaja. Primjerice, ako se dodatak primjenjuje za sisavce u laktaciji i nesilice, najveće vrijednosti koje se odnose na jestiva tkiva dodaju se vrijednostima koje se odnose na potrošnju mlijeka i jaja. Ako se dodatak primjenjuje za ribe i nesilice te sisavce u laktaciji, najveće vrijednosti koje se odnose na jestiva tkiva dodaju se vrijednostima koje se odnose na potrošnju mlijeka i jaja. Na isti se način predviđaju i druge kombinacije.
U određenim slučajevima (npr. kod nekih nutritivnih i osjetilnih dodataka ili dodataka namijenjenih manje zastupljenim vrstama) može biti potrebna naknadna preciznija procjena izloženosti ljudi, i to na temelju stvarnih podataka o potrošnji hrane, pri čemu se i dalje mora zadržati najkonzervativniji pristup. U tu se svrhu, po mogućnosti, koriste podaci Zajednice.
Tablica 1.
Podaci o teoretskoj dnevnoj ljudskoj potrošnji (u g tkiva ili proizvoda)
|
|
Sisavci |
Ptice |
Ribe |
Ostalo |
|
Mišić |
300 |
300 |
300 (12) |
|
|
Jetra |
100 |
100 |
— |
|
|
Bubreg |
50 |
10 |
— |
|
|
Masnoća |
50 (13) |
90 (14) |
— |
|
|
+ Mlijeko |
1 500 |
— |
— |
|
|
+ Jaja |
— |
100 |
— |
|
|
+ Med |
|
|
|
20 |
3.2.3.4. Predložene najveće dopuštene količine rezidua (NDKR)
Najveća dopuštena količina rezidua je najveća koncentracija rezidua (izražena kao μg markerske rezidue po kg jestivog mokrog tkiva ili proizvoda) koju Zajednica može prihvatiti kao zakonski dopuštenu ili priznatu kao prihvatljivu u hrani. Ona se temelji na vrsti i količini rezidua za koje se smatra da ne predstavljaju nikakvu toksikološku opasnost za zdravlje ljudi, izraženu kao ADI. NDKR se ne može odrediti ako ne postoji ADI.
Pri određivanju NDKR-a za dodatke u hrani za životinje također se uzimaju u obzir rezidue iz drugih izvora (npr. iz hrane biljnog podrijetla). Osim toga, NDKR se može smanjiti kako bi se uskladio s uvjetima korištenja dodataka hrani za životinje i do mjere do koje su dostupne praktične metode analize.
Prema potrebi, za različita tkiva ciljanih vrsta životinja ili proizvode dobivene od tih vrsta utvrđuju se pojedinačni NDKR-ovi (izraženi kao mg markerske rezidue po kg jestivog prirodnog tkiva ili proizvoda). Pojedinačni NDKR-ovi u različitim tkivima ili proizvodima odražavaju kinetiku eliminacije rezidua i promjenjivost razina rezidua u tim tkivima/proizvodima kod vrsta životinja kojima je dodatak namijenjen. Promjenjivost se obično izražava korištenjem 95 %-tne razine povjerenja oko srednje vrijednosti. Ako se interval povjerenja ne može izračunati zbog malog broja uzoraka, promjenjivost se izražava uzimajući najveću pojedinačnu vrijednost.
Studije o najvećim dopuštenim količinama rezidua za kokcidiostatike i histomonostatike moraju se provoditi u skladu s odgovarajućim važećim propisima za veterinarsko-medicinske proizvode (svezak 8. „Pravila o lijekovima u Europskoj uniji – Obavijest podnositeljima zahtjeva i smjernice. Veterinarsko-medicinski proizvodi. Utvrđivanje najvećih dopuštenih količina rezidua (NDKR) veterinarsko-medicinskih proizvoda u hrani životinjskog podrijetla”. Listopad 2005).
Studije za utvrđivanje najvećih dopuštenih količina rezidua za kategorije dodataka koje nisu kokcidiostatici i histomonostatici, provode se, ako je potrebno, u skladu s ovim Prilogom.
Kako bi se odredila izloženost potrošača ukupnim reziduama (izračunatim u skladu s točkom 3.2.3.3.), kod NDKR-ova predloženih za različita tkiva ili proizvode uzima se u obzir omjer između markerske rezidue i ukupnih rezidua.
Tablica 2.
Definicije koje se koriste pri izračunu NDKR-a
|
i-j |
Pojedinačna tkiva/proizvodi (jetra, bubreg, mišić, koža + masnoća, mlijeko, jaja, med) u različitim razdobljima |
|
NDKRi-j |
Najveća dopuštena količina rezidua u tkivima/proizvodima (mg markerske tvari kg–1) |
|
Qti-j |
Dnevna potrošnja pojedinačnih tkiva/proizvoda (kg) kod ljudi, utvrđena u tablici 1. ili na temelju njezine detaljnije razrade |
|
UKRi-j |
Ukupna koncentracija rezidua u pojedinačnim tkivima/proizvodima (mg kg–1) |
|
KMRi-j |
Koncentracija markerske rezidue u pojedinačnim tkivima/proizvodima (mg kg–1) |
|
MRURi-j |
Omjer između KMRi-j i UKRi-j za pojedinačna tkiva/proizvode |
|
UHURi-j |
Unos putem hrane za pojedinačna tkiva/proizvode, izračunan iz ukupnih rezidua (mg) UHURi-j = Qt i-j × UKRi-j |
|
UHURNDKRi-j |
Unos putem hrane, izračunan iz NDKR-ova (mg) za pojedinačna tkiva/proizvode UHURMRLi-j = Qt i-j × NDKRi-j × MRUR i-j –1 |
Izmjerene vrijednosti za UKR i KMR unose se u odgovarajuće rubrike na obrascu tablice 3., a ostale se vrijednosti izračunavaju. Ako nisu na raspolaganju svi podaci jer su vrijednosti ispod granice detekcije (LOD), dopuštena je ekstrapolacija MRUR-a.
NDKR se može odrediti jedino ako je zbroj pojedinačnih UHUR-a manji od ADI-ja. Ako je on veći od ADI-ja, mogu se, kao alternativa, koristiti podaci dobiveni s duljom karencijom ili manjim dozama. Početni prijedlog za NDKR može se dobiti tako da se kao smjernica koristi vrijednost KMR te da se uzme u obzir LOQ analitičke metode. Zbroj UHURNDKR dobiven iz predloženih NDKR-ova mora biti manji od ADI-ja i blizu zbroja pojedinačnih UHUR-ova. Ako je on veći od ADI-ja, predlaže se manji NDKR i uspoređivanje se ponavlja.
Kod nekih dodataka rezidue mogu biti prisutne u mlijeku, jajima ili mesu u količinama koje su manje od NDKR-a, ali koje svejedno utječu na kvalitetu hrane pri određenim postupcima njezine prerade. Osim utvrđivanja vrijednosti NDKR-a, za te dodatke može biti korisno uzeti u obzir i „najveću količinu rezidua koja ne utječe na preradu (prehrambenih proizvoda)”.
Tablica 3.
Obrazac za izračun predloženog NDKR-a
|
|
Jetra |
Bubreg |
Mišić |
Koža + masnoća |
Mlijeko |
Jaja |
Med |
Zbroj |
|
UKR (15) (mg kg–1) |
|
|
|
|
|
|
|
— |
|
KMR (16) (mg kg–1) |
|
|
|
|
|
|
|
— |
|
MRUR (16) |
|
|
|
|
|
|
|
— |
|
UHUR (17) (mg) |
|
|
|
|
|
|
|
— |
|
Predloženi NDKR(mg kg–1) |
|
|
|
|
|
|
|
|
|
UHURNDKR(mg) |
|
|
|
|
|
|
|
|
3.2.3.5. Predložena karencija
Karencija obuhvaća razdoblje nakon prestanka primjene dodatka, koje je potrebno da količine rezidua padnu ispod NDKR-a.
3.3. Studije koje se odnose na sigurnost korištenja dodatka za primjenitelje/radnike
Pri proizvodnji dodatka ili pri njegovom rukovanju ili korištenju radnici mogu biti izloženi uglavnom putem udisanja ili dodira s kožom ili sluznicom. Primjerice, radnici na poljoprivrednom gospodarstvu mogu biti izloženi pri rukovanju dodatkom ili pri njegovom miješanju. Moraju se navesti dodatne informacije o načinu rukovanja tvarima.
Mora se priložiti i procjena rizika za radnike. Iskustvo iz proizvodnog pogona, ako takvo iskustvo postoji, često je važan izvor informacija za procjenu rizika od izloženosti radnika putem zraka ili dodira s kožom ili sluznicom. Posebnu pozornost treba obratiti na dodatke/hranu za životinje tretiranu dodatkom i/ili životinjske izlučine koji su u suhom praškastom obliku ili se mogu pretvoriti u takav oblik, kao i na dodatke hrani za životinje koji mogu imati alergenski potencijal.
3.3.1. Procjena toksikološkog rizika za sigurnost primjenitelja/radnika
Rizici za radnike procjenjuju se kroz niz studija u kojima se koristi dodatak u obliku za koji se podnosi zahtjev. Mora se ispitati akutna inhalacijska toksičnost, osim ako ne postoji vjerojatnost da će proizvod stvarati prah ili isparinu koji se mogu udahnuti. Moraju se obaviti studije o nadražajnim reakcijama kože i, u slučaju negativnih rezultata, procjena nadražaja membrana sluznice (npr. oka). Također se mora procijeniti alergenski potencijal/sposobnost izazivanja reakcija preosjetljivosti kože. Za procjenu moguće sustavne toksičnosti dodatka koriste se podaci o toksičnosti dobiveni u svrhu ispunjavanja zahtjeva u pogledu sigurnosti potrošača (vidjeti 3.2.2.). Svi se ovi parametri prema potrebi procjenjuju izravnim mjerenjem i posebnim studijama.
3.3.1.1. Učinci na dišni sustav
Moraju se dostaviti dokazi da zrakom nošene količine praha ili isparina dodatka neće predstavljati opasnost za zdravlje primjenitelja/radnika. Ti dokazi prema potrebi uključuju:
|
— |
inhalacijske testove na laboratorijskim životinjama; |
|
— |
objavljene epidemiološke podatke i/ili podatke koje su sami podnositelji zahtjeva dobili u vlastitim proizvodnim pogonima i/ili o nadražljivosti (iritaciji); i |
|
— |
testove o preosjetljivosti (senzibilizaciji) dišnog sustava. |
Ako je maseni udio čestica ili kapljica promjera manjeg od 50 μm u proizvodu veći od 1 %, mora se ispitati akutna inhalacijska toksičnost.
Protokoli za studije akutne inhalacijske toksičnosti trebaju biti u skladu s OECD-ovom smjernicom 403. Ako se smatra da je potrebno ispitati subkroničnu toksičnost, to se mora obaviti u skladu s OECD-ovom smjernicom 412 (Inhalacijska toksičnost kod ponavljane doze: 28-dnevna ili 14-dnevna studija) ili smjernicom 413 (Subkronična inhalacijska toksičnost: 90-dnevna studija).
3.3.1.2. Učinci na oči i kožu
Ako su dostupni, dostavljaju se izravni dokazi o tome da u poznatim situacijama kod ljudi ne dolazi do nadražljivosti (iritacije) i/ili preosjetljivosti (senzibilizacije). Tim se dokazima dodaju i rezultati validiranih testova nadražljivosti kože i očiju koji su obavljeni na životinjama i u kojima je korišten odgovarajući dodatak. Također se mora procijeniti alergenski potencijal – sposobnost izazivanja reakcija preosjetljivosti kože. Protokoli za ove studije trebaju biti u skladu s OECD-ovim smjernicama 404 (Nadražljivost/nagrizanje kože), 405 (Nadražljivost/nagrizanje očiju), 406 (Preosjetljivost kože), 429 (Preosjetljivost kože – ispitivanje lokalnih limfnih čvorova).
Ako je poznato da postoje nagrizajuća svojstva, bilo na temelju objavljenih podataka ili posebnih testova in vitro, ne obavljaju se dodatna ispitivanja in vivo.
Ako je dodatak toksičan prilikom udisanja, mora se ispitati dermalna toskičnost. Studije moraju biti u skladu s OECD-ovom smjernicom 402 (Akutna dermalna toksičnost).
3.3.1.3. Sustavna toksičnost
Za procjenu sustavne toksičnosti koriste se podaci o toksičnosti dobiveni u svrhu ispunjavanja zahtjeva u pogledu sigurnosti potrošača kao i drugih zahtjeva (između ostalog, podaci o toksičnosti kod ponavljane doze, mutagenosti, karcinogenosti, reprodukcijskoj toksičnosti i metaboličkoj sudbini).
3.3.1.4. Procjena izloženosti
Moraju se dostaviti informacije o načinu na koji korištenje dodatka može dovesti do izloženosti (udisanjem, preko kože ili oralnim unosom). Te informacije moraju uključivati i kvantitativnu procjenu, ako ona postoji, kao što su tipična koncentracija u zraku, kontaminacija kroz kožu ili oralnim unosom). Ako ne postoje kvantitativni podaci, mora se dati dovoljno informacija na temelju kojih se može obaviti odgovarajuća procjena izloženosti.
3.3.2. Mjere za kontrolu izloženosti
Koristeći podatke iz procjene toksičnosti i izloženosti, izvodi se zaključak o rizicima za zdravlje primjenitelja/radnika (inhalacijska toksičnost, nadražljivost, preosjetljivost, sustavna toksičnost). Mogu se predložiti mjere predostrožnosti kako bi se smanjila ili otklonila mogućnost izloženosti. Međutim, korištenje osobne zaštitne opreme smatra se isključivo krajnjom mjerom zaštite od rizika preostalih nakon što su uvedene mjere kontrole. Preporučljivije je, primjerice, uzeti u obzir novu formulaciju proizvoda.
3.4. Studije koje se odnose na sigurnost korištenja dodatka za okoliš
Važno je ispitati utjecaj dodatka na okoliš budući da je primjena dodatka obično dugotrajna, često uključuje velike skupine životinja, a aktivna tvar ili tvari mogu se izlučivati u velikim količinama bilo kao izvorni spoj ili njegovi metaboliti.
Utjecaj dodatka na okoliš ocjenjuje se u fazama. Svi dodaci moraju proći kroz prvu fazu procjene (faza I.) kako bi se odredili oni za koje nisu potrebna daljnja ispitivanja. Preostali dodaci moraju proći kroz drugu fazu procjene (faza II.) kako bi se dobile dodatne informacije na temelju kojih se određuje jesu li potrebne daljnje studije. Te se studije obavljaju u skladu s Direktivom 67/548/EEZ.
3.4.1. Procjena – faza I.
Svrha procjene u fazi I. je odrediti postoji li vjerojatnost da će dodatak ili njegovi metaboliti značajno utjecati na okoliš te je li potrebno provoditi procjenu u fazi II. (vidjeti stablo odlučivanja).
Odluka o neprovođenju procjene u fazi II. može se donijeti na temelju jednog od sljedeća dva kriterija, osim ako na temelju znanstvenih dokaza postoje razlozi za zabrinutost:
|
(a) |
kemijska priroda i biološki učinak dodatka i uvjeti njegovog korištenja ukazuju da će utjecaj biti zanemariv, tj. dodatak je:
|
|
(b) |
u najgorem slučaju, predviđena koncentracija u okolišu (PEC) preniska je da bi izazivala zabrinutost. PEC se ocjenjuje za svaki dotični dio okoliša (vidjeti dolje), pod pretpostavkom da se 100 % unesene doze izlučuje kao izvorni spoj. |
Ako podnositelj zahtjeva ne može dokazati da dodatak spada u jednu od ove dvije kategorije izuzeća, potrebna je procjena u fazi II.
3.4.1.1. Dodaci za kopnene životinje
Ako se izlučevine domaćih životinja primjenjuju na zemljištu, korištenje dodataka može dovesti do onečišćenja tla te podzemnih i površinskih voda (putem odvoda i površinskog ispiranja).
Najveći PEC u tlu (PECsoil) nastao bi kad bi se svi izlučeni spojevi rasuli po zemljištu. Ako je PECsoil (standardna dubina: 5 cm) manji od 10 μg/kg, nije potrebna dodatna procjena.
Ako je PEC za onečišćenje podzemnih voda (PECgw) manji od 0,1 μg/l, ekološki utjecaj dodataka na podzemne vode nije potrebno procjenjivati u fazi II.
3.4.1.2. Dodaci za akvatične životinje
Dodaci hrani za životinje koji se koriste u akvakulturi mogu dovesti do onečišćenja sedimenta i vode. U slučaju riba koje se uzgajaju u kavezima, smatra se da je sediment onaj dio okoliša koji bi pri procjeni rizika za okoliš trebalo uzeti kao najugroženiji. U slučaju ribe koja se uzgaja u kopnenim sustavima, smatra se da najveću opasnost za okoliš predstavljaju otpadne vode koje se ulijevaju u površinske vode.
Najveći PEC u sedimentu (PECsediment) nastao bi kad bi se svi izlučeni spojevi nataložili u sedimentu. Ako je PECsediment (standardna dubina: 20 cm) manji od 10 μg/kg mokre mase, nije potrebna dodatna procjena.
Ako je PEC u površinskim vodama (PECsw) manji od 0,1 μg/l, nije potrebna dodatna procjena.
Faza I – stablo odlučivanja

3.4.2. Ocjenjivanje – faza II.
Cilj faze II. je procjeniti kolika je mogućnost da dodaci utječu na vrste u okolišu koje ne pripadaju ciljanoj skupini, kako vodene tako i kopnene vrste, ili da u neprihvatljivim količinama dospiju u podzemne vode. U praksi je nemoguće ocijeniti učinke dodatka na svaku vrstu u okolišu koja može biti izložena dodatku nakon njegove primjene kod ciljane vrste. Ispitane taksonomske razine služe kao nadomjesci ili indikatori za cijeli niz vrsta koje su prisutne u okolišu.
Procjena u fazi II. temelji se na kvocijentu rizika, pri čemu se uspoređuju vrijednosti izračunatog PEC-a i predviđene koncentracije bez učinka (PNEC) za svaki dio okoliša. PNEC se određuje na temelju eksperimentalno utvrđenih krajnjih točaka podijeljenih s odgovarajućim faktorom procjene. PNEC se izračunava za svaki dio okoliša.
Procjena u fazi II. počinje tako da se preciznije izračuna PEC, ako je to moguće, a procjena rizika za okoliš obavlja se u dvije etape.
U prvoj etapi, ili fazi II.A, koristi se ograničeni broj studija o farmakokinetici (ishodu) i učincima kako bi se došlo do konzervativne procjene rizika na temelju izloženosti i učinaka u promatranom dijelu okoliša. Ako je omjer između PEC-a i PNEC-a manji od jedan (1), nisu potrebne daljnje procjene, osim ako se očekuje bioakumulacija.
Ako omjer između PEC-a i PNEC-a ukazuje na neprihvatljivi rizik (omjer > 1), podnositelj zahtjeva prelazi na fazu II.B kako bi točnije procijenio rizik za okoliš.
3.4.2.1. Faza II.A
Osim za dijelove okoliša promatrane u fazi I., PEC se mora izračunati i za površinske vode, pri čemu se uzima u obzir površinsko ispiranje i odvodnja.
Na temelju podataka koji nisu razmatrani u fazi I., može se preciznije izračunati PEC za svaki promatrani dio okoliša. Pri tome se uzimaju u obzir sljedeći elementi:
|
(a) |
koncentracija dotičnih aktivnih tvari/metabolita u gnoju/ribljim fekalijama nakon davanja dodatka životinjama u predloženoj dozi. Pri izračunu se uzimaju u obzir doze i količina izlučevina; |
|
(b) |
moguća razgradnja izlučene aktivne tvari ili aktivnih tvari/metabolita tijekom uobičajenog postupka obrade gnoja i njegovog skladištenja prije gnojidbe zemljišta; |
|
(c) |
adsorpcija/desorpcija dotične(-ih) aktivne(-ih) tvari/metabolita u tlu ili, u slučaju akvakulture, u sedimentu, po mogućnosti utvrđena studijama u tlu/sedimentu (OECD 106); |
|
(d) |
razgradnja u tlu i sustavima voda/sediment (OECD 307 odnosno 308); i |
|
(e) |
ostali čimbenici kao što su hidroliza, fotoliza, isparavanje, razrjeđivanje oranjem. |
Za procjenu rizika u fazi II. uzimaju se najveće vrijednosti PEC-a koje su dobivene tim izračunima za svaki promatrani dio okoliša.
Ako se očekuje visoka postojanost u tlu ili sedimentu (vrijeme razgradnje 90 % izvorne koncentracije spoja: DT90 > 1 godine), mora se ispitati akumulacijski potencijal.
Moraju se odrediti koncentracije dodatka (ili metabolita) koje imaju ozbiljne štetne učinke na različite trofičke razine u promatranim dijelovima okoliša. Tu se uglavom radi o ispitivanju akutne toksičnosti koje bi se trebalo provoditi u skladu s OECD-ovim smjernicama ili sličnim ustaljenim smjernicama. Za kopneni okoliš, studije obuhvaćaju: toksičnost za gujavice, tri kopnene biljke i mikroorganizme u tlu (npr. učinci na vezanje dušika). Za slatkovodni okoliš, studije obuhvaćaju: toksičnost za ribe, organizme Daphnia magna, alge i organizme koji žive u sedimentima. U slučaju uzgojnih kaveza u moru, treba ispitati tri vrste različitih taksonomskih skupina organizama koji žive u sedimentima.
Vrijednost PNEC-a mora se izračunati za svaki promatrani dio okoliša. PNEC se obično izračunava tako da se najmanja vrijednost toksičnosti koja je uočena u gore navedenim ispitivanjima podijeli s faktorom sigurnosti, koji iznosi najmanje 100, ovisno o krajnjoj točki i broju korištenih pokusnih vrsta.
Bioakumulacijski potencijal može se ocijeniti na temelju vrijednosti koeficijenta raspodjele n-oktanol/voda, Log Kow. Vrijednosti ≥ 3 ukazuju da se tvar može bioakumulirati. Kako bi se procijenila opasnost od sekundarnog trovanja, utvrđuje se treba li u fazi II.B obaviti studiju u svrhu utvrđivanja biokoncentracijskog faktora (BCF).
3.4.2.2. Faza II.B (detaljnije toksikološke studije)
Za one dodatke kod kojih se nakon procjene u fazi II.A ne može isključiti opasnost za okoliš, potrebno je prikupiti više informacija o učincima na biološke vrste u onim dijelovima okoliša za koje studije u fazi II.A ukazuju na moguće rizike. U tom su slučaju potrebna dodatna ispitivanja kako bi se utvrdili kronični i specifičniji učinci na odgovarajuće mikrobne, biljne i životinjske vrste. Te će dodatne informacije omogućiti primjenu nižeg faktora sigurnosti.
Prikladni dodatni testovi ekotoksičnosti opisani su u brojnim publikacijama, npr. u OECD-ovim smjernicama. Te testove treba pomno izabrati kako bi se osiguralo da odgovaraju okolnostima u kojima se dodatak i/ili njegovi metaboliti mogu ispustiti u okoliš i raširiti po njemu. Detaljnija procjena utjecaja na tlo (PNECsoil) mogla bi se temeljiti na studijama kroničnih učinaka na gujavice, dodatnim studijama o mikroflori u tlu i nizu odgovarajućih biljnih vrsta, studijama na beskralježnjacima koji nastanuju travnata staništa (uključujući kukce) i o divljim pticama.
Detaljnija procjena utjecaja na vodu/sedimente mogla bi se temeljiti na ispitivanjima kronične toksičnosti kod najosjetljivijih vodenih/bentičkih organizama utvrđenih pri procjeni u fazi II.A.
Studije bioakumulacije, ako su potrebne, trebale bi se obavljati u skladu s OECD-ovom smjernicom 305.
4. ODJELJAK IV: STUDIJE UČINKOVITOSTI DODATKA
Studijama se mora pokazati da je dodatak učinkovit pri svakoj predloženoj uporabi i da ima najmanje jedno od obilježja navedenih u članku 5. stavku 3. Uredbe (EZ) br. 1831/2003, prema kategorijama i funkcionalnim skupinama dodataka hrani za životinje iz članka 6. i Priloga I. navedenoj Uredbi. Osim toga, te studije moraju omogućiti ocjenjivanje učinkovitosti dodataka u skladu s uobičajenom poljoprivrednom praksom u EU-u.
Korišteni plan pokusa mora biti opravdan s obzirom na uporabu dodatka te vrstu i kategoriju životinja. Ako se koriste životinje, pokusi se moraju obavljati tako da zdravstveno stanje životinja i uvjeti njihovog uzgoja ne djeluju negativno na tumačenje rezultata. Za svaki se pokus moraju opisati pozitivni i negativni učinci, kako tehnološki tako i biološki. Mora se također dokazati nepostojanje učinaka koji mijenjaju specifična obilježja proizvoda životinjskog podrijetla. U idealnom slučaju pokusi bi morali biti u skladu s kriterijima priznatog sustava osiguranja kvalitete koji je bio podvrgnut vanjskoj reviziji. Ako ne postoje takvi sustavi, dostavljaju se dokazi da je posao obavilo kvalificirano osoblje koje je koristilo odgovarajuće prostore i opremu i radilo pod nadzorom imenovanog voditelja studije.
Voditelj ispitivanja mora pažljivo sastaviti protokol studije, koji mora sadržavati opće opisne podatke, kao što su korištene metode, oprema i materijali, podaci o vrsti, pasmini ili soju životinja te njihovom broju i uvjetima u kojima su bile smještene i hranjene. Za sva ispitivanja koja uključuju životinje, uvjeti pokusa se moraju opisati u skladu s točkom 3.1.1.3. Konačna izvješća, neobrađeni podaci, planovi studije te dobro opisane i identificirane testne tvari moraju se arhivirati kao referentni materijal za kasniju uporabu.
Studije moraju biti tako osmišljene da dokažu učinkovitost najniže preporučene doze dodatka, ciljajući osjetljive parametre i uspoređujući ih s negativnom i, po želji, pozitivnom kontrolnom skupinom. Te studije moraju uključivati i najveću preporučenu dozu, ako se ona predlaže. Kako bi se osigurala fleksibilnost koja omogućuje znanstvenu prosudbu u planiranju i izvođenju studija, ne preporučuje se jedna vrsta studije.
Mora se obratiti pozornost na poznate ili potencijalne biološke ili kemijske interakcije između dotičnog dodatka i drugih dodataka i/ili veterinarskih lijekova i/ili sastojaka obroka, ako je to bitno za učinkovitost dotičnog dodatka (npr. kompatibilnost mikrobnog dodatka s kokcidiostaticima i histomonostaticima ili organskom kiselinom).
4.1. Studije in vitro
Za sve tehnološke i neke osjetilne dodatke koji utječu na svojstva hrane za životinje, učinkovitost se mora dokazati ispitivanjima koja se temelje na laboratorijskim studijama. Studija se postavlja tako da obuhvati reprezentativni spektar materijala u kojima će se dodatak primjenjivati. Rezultati se po mogućnosti ocjenjuju testovima bez parametara i moraju pokazati očekivane promjene s vjerojatnošću P ≤ 0,05.
Studije in vitro, posebno one pri kojima se simulira način rada gastrointestinalnog trakta, mogu se koristiti za druge vrste dodataka kako bi se dodatno dokazala učinkovitost. Te studije moraju omogućiti statističko ocjenjivanje.
4.2. Kratkoročne studije učinkovitosti na životinjama
Kako bi se dokazalo u kojoj mjeri neka hranjiva tvar ili bojilo u novom obliku ili iz novog izvora može zamijeniti ekvivalentni dodatak koji je već odobren ili se duže vrijeme koristi, mogu se koristiti studije bioraspoloživosti.
Studije probave/bilance mogu se koristit kao potpora studijama proizvodnih obilježja životinja kako bi se dokazao način djelovanja. U nekim slučajevima, posebno u vezi s pozitivnim utjecajima na okoliš, učinkovitost se može bolje dokazati studijama bilance, koje se mogu koristiti umjesto dugoročnih studija učinkovitosti. Broj i vrste/kategorije životinja koje se koriste u tim pokusima moraju biti primjereni predloženim uvjetima korištenja.
Prema potrebi se mogu predložiti druge kratkoročne studije učinkovitosti, koje mogu zamijeniti dugoročne studije učinkovitosti na životinjama, pod uvjetom da je to u cijelosti opravdano.
4.3. Dugoročne studije učinkovitosti na životinjama
Ove se studije provode na najmanje dvije različite lokacije.
U korištenom načinu ostavljanja pokusa mora se uzeti u obzir odgovarajuća statistička snaga i rizici tipa 1 i 2. Protokol mora biti dovoljno osjetljiv da otkrije bilo koji učinak dodatka kod najmanje preporučene doze (rizik tipa 1 α, P ≤ 0,05 općenito i P ≤ 0,1 za preživače, manje zastupljene vrste, kućne ljubimce i životinje koje se ne koriste za proizvodnju hrane) te mora imati dovoljnu statističku snagu da jamči da pokusni protokol ispunjava cilj studije. Rizik tipa 2 β mora biti manji ili jednak 20 % općenito i 25 % u pokusima s preživačima, manje zastupljenim vrstama, kućnim ljubimcima i životinjama koje se ne koriste za proizvodnju hrane, te stoga imati statističku snagu (1- β) veću ili jednaku 80 % (75 % za preživače, manje zastupljene vrste, kućne ljubimce i životinje koje se ne koriste za proizvodnju hrane).
Poznato je da je zbog prirode nekih dodataka teško odrediti uvjete pokusa pod kojima se mogu postići optimalni rezultati. Treba stoga predvidjeti mogućnost korištenja meta-analize ako su na raspolaganju rezultati iz više od tri pokusa. Stoga se za sve pokuse moraju koristiti slični protokoli kako bi se na kraju mogla provjeriti homogenost podataka i kako bi se podaci mogli združiti (ako to zahtijevaju ispitivanja) u svrhu statističke ocjene na razini P ≤ 0,05.
4.4. Trajanje dugoročnih studija učinkovitosti na ciljanim životinjama
Trajanje pokusa učinkovitosti mora općenito odgovarati traženom razdoblju primjene.
Pokusi učinkovitosti izvode se u skladu s poljoprivrednom praksom u Europskoj uniji i moraju trajati najmanje onoliko koliko je navedeno u Prilogu IV.
Ako se dodatak primjenjuje u određenom razdoblju koje je kraće od onog koje je navedeno u definiciji kategorije životinja, primjenjuje se u skladu s predloženim uvjetima korištenja. Međutim, razdoblje promatranja ne smije biti kraće od 28 dana i mora uključivati odgovarajuće krajnje točke (npr. za rasplodne krmače broj živorođene prasadi ako se uzima u obzir razdoblje suprasnosti, ili broj i masa odbijene prasadi ako se uzima u obzir razdoblje laktacije).
Za ostale vrste i kategorije životinja za koje u Prilogu IV. nije utvrđeno minimalno trajanje studija, uzima se u obzir razdoblje primjene dodatka u skladu s predloženim uvjetima korištenja.
4.5. Zahtjevi u pogledu učinkovitosti za kategorije i funkcionalne skupine dodataka
Za sve dodatke za koje se smatra da će imati učinak na životinje moraju se provesti studije in vivo.
Učinkovitost kategorija zootehničkih dodataka, kokcidiostatika i histomonostatika dokazuje se kroz najmanje tri dugoročna ispitivanja učinkovitosti. Međutim, za neke zootehničke dodatke i ostale kategorije dodataka koji imaju učinak na životinje prihvatljive su kratkoročne studije učinkovitosti ako se učinkovitost može nesumnjivo dokazati.
Za ostale kategorije dodataka koji nemaju izravan učinak na životinje provodi se najmanje jedna studija učinkovitosti in vivo.
4.6. Studije kakvoće životinjskih proizvoda ako učinak nije predmet zahtjeva
Kako bi se dokazalo da dodatak nema negativan učinak ili drugi neželjeni učinak na organoleptička i prehrambena (prema potrebi higijenska i tehnološka) svojstva hrane dobivene od životinja hranjenih dodatkom (ako to nije željeni učinak), uzimaju se odgovarajući uzorci tijekom jednog pokusa učinkovitosti. Promatraju se dvije skupine: skupina kojoj nije davan dodatak i skupina kojoj je davan dodatak u najvećoj predloženoj dozi. Podaci moraju omogućiti statističku ocjenu. Neobavljanje ovih ispitivanja mora se na odgovarajući način opravdati.
5. ODJELJAK V: PLAN PRAĆENJA NAKON STAVLJANJA NA TRŽIŠTE
Sukladno članku 7. stavku 3. točki (g) Uredbe (EZ) br. 1831/2003 i ovisno o obilježjima dotičnih proizvoda, za određene se kategorije dodataka mora dostaviti prijedlog praćenja nakon stavljanja na tržište kako bi se pratili i prepoznali svi izravni ili neizravni, neposredni, odgođeni ili nepredviđeni učinci na zdravlje ljudi i životinja ili na okoliš do kojih dolazi zbog uporabe dodataka.
Plan praćenja se razrađuje za svaki slučaj pojedinačno i u njemu se utvrđuje tko će (npr. podnositelj zahtjeva, primjenitelji) obavljati pojedine zadatke koji su njime propisani, tko je odgovoran osigurati pravilno uspostavljanje i izvođenje plana praćenja te se njime osigurava postojanje postupka u skladu s kojima će se nadležna nadzorna tijela, Komisija i Agencija obavješćivati o svim uočenim štetnim učincima, ne dovodeći u pitanje odredbe o nadzoru koje su utvrđene člankom 12. Uredbe (EZ) br. 1831/2003.
U slučajevima kada je aktivna tvar i priznati antibiotik i ako je dokazano da pri količinama u kojima se koristi u hrani za životinje obavlja selekciju otpornih bakterijskih sojeva, moraju se, u okviru praćenja nakon stavljanja na tržište, obaviti studije na terenu kako bi se pratila bakterijska otpornost na dodatak.
Za kokcidiostatike i histomonostatike mora se obaviti terensko praćenje otpornosti Eimeria spp. odnosno Histomonas meleagridis, po mogućnosti u drugom dijelu razdoblja trajanja odobrenja.
(1) SL L 50, 20.2.2004., str. 44.
(2) SL L 196, 16.8.1967., str. 1. Direktiva kako je zadnje izmijenjena Direktivom 2006/121 Europskog parlamenta i Vijeća (SL L 396, 30.12.2006., str. 852.; ispravljena u SL L 136, 29.5.2007., str. 281.).
(3) SL L 152, 30.4.2004., str. 1.; ispravljena u SL L 216, 16.6.2004., str. 3.
(4) SL L 165, 30.4.2004.; ispravljena u SL L 191, 28.5.2004., str. 1.
(5) SL L 117, 8.5.1990., str. 1. Direktiva kako je zadnje izmijenjena Odlukom Komisije 2005/174/EZ (SL L 59, 5.3.2005., str. 20.).
(6) SL L 76, 22.3.1991., str. 35. Direktiva kako je zadnje izmijenjena Direktivom 2001/58/EZ (SL L 212, 7.8.2001., str. 24.).
(7) SL L 262, 17.10.2000., str. 21.
(8) SL L 224, 18.8.1990., str. 1. Uredba kako je zadnje izmijenjena Uredbom Komisije (EZ) br. 203/2008 (SL L 60, 5.3.2008., str. 18.).
(9) M. Thompson et al.: Harmonized Guidelines For Single Laboratory Validation Of Methods Of Analysis (IUPAC Technical Report) Pure Appl. Chem., svezak 74., br. 5, str. 835-855, 2002.
(10) SL L 221, 17.8.2002., str. 8. Odluka kako je zadnje izmijenjena Odlukom 2004/25/EZ (SL L 6, 10.1.2004., str. 38.).
(11) Nepotpuni popis može se pronaći na internetskoj stranici www.efsa.europa.eu/en/science/feedap/feedap_opinion/993.html
(12) Mišići i koža u prirodnom omjeru.
(13) Za svinje, 50 g masnoće i kože u prirodnom omjeru.
(14) Masnoća i koža u prirodnom omjeru.
(15) Uzimajući u obzir predloženu karenciju.
(16) Bilo bi najbolje da se odredi istodobno kad i UKR.
(17) Izračunato na temelju vrijednosti UKR.
PRILOG III.
POSEBNI ZAHTJEVI KOJE MORA ISPUNJAVATI DOKUMENTACIJA IZ ČLANKA 3. ZA ODREĐENE KATEGORIJE DODATAKA ILI ODREĐENE SPECIFIČNE SITUACIJE, KAKO JE PREDVIĐENO ČLANKOM 7. STAVKOM 5. UREDBE (EZ) br. 1831/2003
Uredbom (EZ) br. 1831/2003 predviđa se pružanje dodatne pomoći u pripremi dokumentacije, ako je ta pomoć potrebna, za svaku kategoriju dodataka ili za druge posebne ciljeve sukladno članku 7. stavku 5. Uredbe (EZ) br. 1831/2003.
Popis posebnih zahtjeva za pripremu dokumentacije za:
|
1. |
tehnološke dodatke |
|
2. |
osjetilne dodatke |
|
3. |
hranidbene dodatke |
|
4. |
zootehničke dodatke |
|
5. |
kokcidiostatike i histomonostatike |
|
6. |
ekstrapolaciju sa zastupljenijih vrsta na manje zastupljene vrste |
|
7. |
kućne ljubimce i ostale životinje koje se ne koriste za proizvodnju hrane |
|
8. |
dodatke koji su već odobreni za korištenje u hrani |
|
9. |
izmjene odobrenja |
|
10. |
produljenje odobrenja |
|
11. |
ponovno ocjenjivanje određenih dodataka koji su već odobreni na temelju Direktive 70/524/EEZ. |
Svaki podneseni zahtjev može se odnositi na više od jednog gore navedenog posebnog zahtjeva.
Opći uvjeti
Ako se u dokumentaciji izostavi bilo koji podatak koji je propisan ovim odjeljcima, moraju se navesti razlozi izostavljanja.
1. TEHNOLOŠKI DODACI
1.1. Odjeljak I: sažetak dokumentacije
Primjenjuje se cijeli odjeljak I. Priloga II.
1.2. Odjeljak II: identifikacija, opis obilježja i uvjeti korištenja dodatka; metode analize
Odjeljak II. Priloga II. primjenjuje se kako slijedi:
|
— |
za dodatke čije odobrenje ne glasi na određenog nositelja primjenjuju se stavci 2.1.2., 2.1.3., 2.1.4., 2.1.4.2., 2.2., 2.3.1., 2.3.2., 2.4.1., 2.4.2., 2.4.4., 2.5., 2.6.; |
|
— |
za ostale dodatke čije odobrenje glasi na određenog nositelja primjenjuje se cijeli odjeljak II. |
1.3. Odjeljak III: studije sigurnosti dodataka
Pododjeljci 3.1., 3.2. i 3.4. Priloga II. ne primjenjuju se na dodatke za siliranje ako se može dokazati:
|
— |
da odredive količine aktivne(-ih) tvari ili relevantnih metabolita ili aktivnog(-ih) organizma(-ama) neće preživjeti u konačnom obliku hrane za životinje; ili |
|
— |
da se aktivna tvar(i) i organizam(-mi) javljaju kao uobičajeni sastojci silaže i da se zbog korištenja dodatka njihova koncentracija neće značajno povećati u usporedbi sa silažom pripremljenom bez korištenja dodatka (tj. ako nema bitne promjene u izloženosti). |
U ostalim se slučajevima primjenjuje cijeli odjeljak 3. Priloga II.
1.3.1. Studije sigurnosti korištenja dodatka za ciljane životinje
Za ksenobiotike (1): primjenjuje se cijeli pododjeljak 3.1. Priloga II.
1.3.1.1. Studije podnošljivosti kod ciljanih vrsta
Za dodatke za siliranje:
|
— |
proizvod se dodaje osnovnoj hrani i rezultati se uspoređuju s negativnom kontrolom s istom hranom. Osnovna hrana može sadržavati samo jedan izvor silaže pripremljene bez korištenja dodatka; |
|
— |
doza izabrana za studije podnošljivosti mora biti višekratnik vrijednosti koncentracije prisutne u siliranom materijalu pri uobičajenoj uporabi, ako se ta vrijednost može sa sigurnošću utvrditi. Posebna se pozornost mora obratiti na proizvode koji sadrže održive mikroorganizme i njihovu sposobnost preživljavanja i umnožavanja tijekom siliranja. |
Studije podnošljivosti mogu se obično ograničiti na preživače, u pravilu na mliječne krave. Studije na drugim vrstama životinja zahtijevaju se jedino ako je zbog svojstava siliranog materijala on prikladniji za korištenje kod nepreživača.
Ostale tvari:
za ostale tvari za koje se u zahtjevu traži da se odobre kao tehnološki dodaci koji još nisu odobreni za korištenje u hrani za životinje, mora se dokazati da pri najvećoj predloženoj dozi neće imati štetne učinke na životinje. To se dokazivanje može ograničiti na jedan pokus na jednoj od najosjetljivijih ciljanih vrsta ili na jednoj laboratorijskoj vrsti životinja.
1.3.1.2. Mikrobiološke studije
Primjenjuje se cijeli pododjeljak 3.1.2. Priloga II.
1.3.2. Studije koje se odnose na sigurnost korištenja dodatka za potrošače
1.3.2.1. Studije metabolizma i rezidua
Studije metabolizma i rezidua nisu potrebne ako:
|
1. |
tvar ili njezini metaboliti nisu prisutni u hrani za životinje u trenutku hranjenja; ili |
|
2. |
tvar se izlučuje neizmijenjena ili se može dokazati da se njezini metaboliti uglavnom ne apsorbiraju; ili |
|
3. |
tvar se apsorbira u obliku fizioloških spojeva; ili |
|
4. |
aktivna(-e) komponenta(-e) dodatka sastoje se isključivo od mikroorganizama ili enzima. |
Ispitivanja metabolizma nisu potrebna ako je tvar prirodno prisutna u značajnim količinama u hrani za ljude ili hrani za životinje ili je uobičajeni sastojak tjelesnih tekućina ili tkiva. Međutim, u tim se slučajevima zahtijevaju studije rezidua, koje se mogu ograničiti na usporedbu razina u tkivima/proizvodima u netretiranoj skupini i u skupini kojoj je davana najveća preporučena doza.
1.3.2.2. Toksikološke studije
Toksikološke studije nisu potrebne ako:
|
1. |
tvar ili njezini metaboliti nisu prisutni u hrani za životinje u trenutku hranjenja; ili |
|
2. |
tvar se apsorbira u obliku jednog ili više fizioloških spojeva; ili |
|
3. |
proizvod se sastoji od mikroorganizama koji su obično prisutni u siliranom materijalu ili onih koji se već koriste u hrani; ili |
|
4. |
proizvod se sastoji od enzima visokog stupnja čistoće, dobivenih iz mikroorganizama čija je sigurna uporaba već dugo poznata i dokumentirana. |
Za mikroorganizme i enzime koji nisu obuhvaćeni gore navedenim izuzećima zahtijevaju se studije genotoksičnosti (uključujući mutagenost) i studije subkronične oralne toksičnosti. Studije genotoksičnosti ne smiju se provoditi u prisutnosti živih stanica.
Za ksenobiotike, koji nisu obuhvaćeni gore navedenim izuzećima, primjenjuje se cijeli pododjeljak 3.2.2. Priloga II.
Kod ostalih tvari, o postupanju se odlučuje od slučaja do slučaja uzimajući u obzir stupanj i način izloženosti.
1.3.2.3. Procjena neškodljivosti za potrošača
Za dodatke za koje se traži odobrenje za uporabu kod životinja koje se koriste za proizvodnju hrane primjenjuje se cijeli pododjeljak 3.3 Priloga II.
1.3.3. Studije koje se odnose na sigurnost korištenja dodatka za primjenitelje/radnike
Primjenjuje se cijeli pododjeljak 3.3. Priloga II. Smatra se da dodaci koji sadrže enzime i mikroorganizme izazivaju preosjetljivost dišnih putova, osim ako se dostave uvjerljivi dokazi koji govore suprotno.
1.3.4. Studije koje se odnose na sigurnost korištenja dodatka za okoliš
Primjenjuje se cijeli pododjeljak 3.4. Priloga II. U slučaju dodataka za siliranje moraju se ispitati učinci dodatka na nastajanje silažnih sokova iz silažne hrpe ili silosa tijekom siliranja.
1.4. Odjeljak IV: studije učinkovitosti dodatka
Tehnološki dodaci su namijenjeni poboljšanju ili stabiliziranju svojstava hrane za životinje, ali općenito nemaju izravan biološki učinak na proizvodnju životinja. Učinkovitost dodatka mora se dokazati prema odgovarajućim kriterijima sukladno priznatim, prihvatljivim metodama, u predviđenim konkretnim uvjetima korištenja, u usporedbi s odgovarajućom kontrolnom hranom za životinje.
Učinkovitost se procjenjuje u studijama in vitro, osim ako je riječ o tvarima za kontrolu kontaminacije radionuklidima. U sljedećoj su tablici navedene odgovarajuće krajnje točke za pojedine funkcionalne skupine.
Krajnje točke za pojedine tehnološke dodatke
|
Funkcionalna skupina |
Krajnje točke za dokazivanje učinkovitosti |
||||||||||
|
Inhibicija mikrobnog rasta, posebno rasta biotičkih organizama i organizama koji uzrokuju kvarenje hrane. Mora se dokazati razdoblje u kojem, prema tvrdnji u zahtjevu, postoji učinak konzerviranja. |
||||||||||
|
Zaštita od oksidativnih oštećenja ključnih hranjivih tvari/sastojaka tijekom obrade i/ili skladištenja hrane za životinje. Mora se dokazati razdoblje u kojem, prema tvrdnji u zahtjevu, postoji zaštitni učinak. |
||||||||||
|
Stvaranje/održavanje stabilne emulzije sastojaka u hrani za životinje koji se inače ne bi mogli, ili bi se mogli veoma slabo, homogeno izmiješati. |
||||||||||
|
Održavanje fizikalno-kemijskih svojstava hrane za životinje. |
||||||||||
|
Viskoznost krmiva ili hrane za životinje. |
||||||||||
|
Stvaranje gela, čime se mijenja tekstura hrane za životinje. |
||||||||||
|
Trajnost peleta ili uspješnost nastajanja peleta. |
||||||||||
|
Dokaz o smanjenoj kontaminaciji hrane životinjskog podrijetla. |
||||||||||
|
Sipkost. Mora se dokazati razdoblje u kojem, prema tvrdnji u zahtjevu, postoji učinak sprečavanja stvaranja gruda. |
||||||||||
|
pH i/ili sposobnost puferiranja u hrani za životinje. |
||||||||||
|
|
||||||||||
|
Trajna identifikacija krmiva. |
Dodaci za siliranje
Izvode se posebni pokusi kako bi se dokazao zahtijevani učinak na proces siliranja (2). Pokusi se izvode na jednom primjerku materijala iz svake od sljedećih kategorija (ako se radi o svim ili neodređenim vrstama krmnog bilja):
|
— |
krmno bilje koje se lako silira: > 3 % topivih ugljikohidrata u svježem materijalu (npr. cijela biljka kukuruza, ljulj, stoklasa ili pulpa šećerne repe), |
|
— |
krmno bilje koje se umjereno teško silira: 1,5 – 3,0 % topivih ugljikohidrata u svježem materijalu (npr. livadna vlasnjača, vlasulja livadna ili uvela lucerna), |
|
— |
krmno bilje koje se teško silira: < 1,5 % topivih ugljikohidrata u svježem materijalu (npr. klupčasta oštrica ili lepirnjače). |
Ako se zahtjev ograničava na potkategorije krmnog bilja koje se opisuju s obzirom na suhu tvar (ST), mora se jasno definirati raspon suhe tvari. Potom se izvode tri pokusa s materijalom koji je reprezentativan za taj raspon, koristeći po mogućnosti primjerke različitog botaničkog podrijetla.
Za posebne vrste hrane za životinje potrebno je obaviti posebne pokuse.
Studija obično traje 90 ili više dana i provodi se pri stalnoj temperaturi (preporučeni raspon 15 – 25 °C). Kraće trajanje ispitivanja mora se opravdati.
U pravilu se moraju dostaviti rezultati mjerenja sljedećih parametara, uspoređeni s negativnom kontrolom:
|
— |
suha tvar i izračunati gubici u masi suhe tvari (korigirani za hlapljive tvari), |
|
— |
smanjenje vrijednosti pH, |
|
— |
koncentracija hlapljivih masnih kiselina (npr. octene, maslačne i propionske kiseline) te mliječne kiseline, |
|
— |
koncentracija alkohola (etanola), |
|
— |
koncentracija amonijaka (g/kg ukupnog dušika), i |
|
— |
sadržaj ugljikohidrata topivih u vodi. |
Kako bi se potkrijepile tvrdnje navedene u zahtjevu dodaju se, ovisno o slučaju, i ostali mikrobiološki i kemijski parametri (npr. broj kvasaca koji asimiliraju laktate, broj klostridija, broj listerija i biogeni amini).
Željeni učinak u vezi sa smanjenjem otjecanja silažnog soka odnosno tekućina, ocjenjuje se u odnosu na ukupnu količinu silažnih sokova nastalih u cijelom pokusnom razdoblju, uzimajući pri tom u obzir mogući utjecaj na okoliš (npr. ekotoksičnost silažnih tekućina ili biološka potreba za kisikom). Smanjeno stvaranje silažnih sokova mora se izravno dokazati. Silos mora imati toliki kapacitet da silažni sok može otjecati uz primjenu tlaka. Studija mora obično trajati 50 dana. Primjena drugačijeg razdoblja mora se opravdati.
Poboljšana aerobna stabilnost dokazuje se usporedbom s negativnom kontrolom. Studije stabilnosti moraju trajati najmanje sedam dana nakon izloženosti zraku i dodatak mora pokazivati znakove stabilnosti najmanje dva dana dulje nego u slučaju netretirane kontrole. Preporučuje se da se pokus izvede pri temperaturi okoliša od 20 °C i da se povećanje temperature za 3 °C ili više smatra znakom nestabilnosti. Mjerenje temperature može se zamijeniti mjerenjem proizvodnje CO2.
1.5. Odjeljak V: plan praćenja nakon stavljanja na tržište
Ovaj se odjeljak primjenjuje u skladu s odredbama članka 7. stavka 3. točke (g) Uredbe (EZ) br. 1831/2003. To znači da se plan praćenja nakon stavljanja na tržište zahtijeva samo za dodatke koji su GMO ili su proizvedeni od GMO-a.
2. OSJETILNI DODACI
2.1. Bojila
2.1.1. Odjeljak I: sažetak dokumentacije
Primjenjuje se cijeli odjeljak I. Priloga II.
2.1.2. Odjeljak II: identifikacija, opis svojstava i uvjeti korištenja dodatka; metode analize
Odjeljak II. Priloga II. primjenjuje se kako slijedi:
|
— |
za dodatke čije odobrenje ne glasi na određenog nositelja primjenjuju se stavci 2.1.2., 2.1.3., 2.1.4., 2.1.4.2., 2.2., 2.3.1., 2.3.2., 2.4.1., 2.4.2., 2.4.4., 2.5., 2.6.; |
|
— |
za ostale dodatke čije odobrenje glasi na određenog nositelja primjenjuje se cijeli odjeljak II. |
2.1.3. Odjeljak III: Studije sigurnosti korištenja dodatka
Pododjeljak 3.3. u cijelosti se primjenjuje za sve dodatke.
|
1. |
Za tvari koje, kada se njima hrane životinje, dodaju boju hrani životinjskog podrijetla u cijelosti se primjenjuju pododjeljci 3.1., 3.2. i 3.4. odjeljka III. Priloga II. |
|
2. |
Za tvari koje dodaju ili obnavljaju boju u hrani za životinje provode se studije, u skladu s pododjeljkom 3.1. odjeljka III., na životinjama kojima je davan dodatak u preporučenoj dozi. Dokazi se mogu predočiti i upućivanjem na postojeću znanstvenu literaturu. Primjenjuje se odjeljak III. pododjeljci 3.2. i 3.4. Priloga II. |
|
3. |
Za tvari koje povoljno utječu na obojenost ukrasnih riba ili ptica zahtijevaju se studije koje se odnose na pododjeljak 3.1. odjeljka III. Priloga II., koje se provode na životinjama kojima je davan dodatak u preporučenoj dozi. Dokazi se mogu predočiti i upućivanjem na postojeću znanstvenu literaturu. Međutim, ispitivanja iz odjeljaka 3.2. i 3.4. nisu potrebna. |
2.1.4. Odjeljak IV: Studije učinkovitosti dodatka
Primjenjuje se cijeli odjeljak IV. Priloga II.
|
(a) |
Za tvari koje, kada se njima hrane životinje, dodaju boju hrani životinjskog podrijetla: primjenom odgovarajuće metodologije mjere se promjene boje proizvoda dobivenih od životinja kojima je davan dodatak u preporučenim uvjetima korištenja. Mora se dokazati da korištenje dodatka ne utječe štetno na stabilnost proizvoda ili na organoleptička ili hranjiva svojstva hrane. U načelu, ako su učinci određene tvari na sastav/svojstva životinjskog proizvoda dobro dokumentirani, učinkovitost se može dostatno dokazati i drugim studijama (npr. studije bioraspoloživosti). |
|
(b) |
Za tvari koje dodaju ili obnavljaju boju u hrani za životinje: učinkovitost se dokazuje odgovarajućim laboratorijskim studijama koje odražavaju predviđene uvjete korištenja u usporedbi s kontrolnom hranom za životinje. |
|
(c) |
Za tvari koje povoljno utječu na obojenost ukrasnih riba i ptica: studije za dokazivanje učinka ili učinaka provode se na životinjama kojima je davan dodatak u preporučenoj dozi. Promjene boje mjere se odgovarajućom metodologijom. Učinkovitost se može dokazati i drugim eksperimentalnim studijama (npr. studije bioraspoloživosti) ili upućivanjem na znanstvenu literaturu. |
2.1.5. Odjeljak V: plan praćenja nakon stavljanja na tržište
Ovaj se odjeljak primjenjuje u skladu s odredbama članka 7. stavka 3. točke (g) Uredbe (EZ) br. 1831/2003. To znači da se plan praćenja nakon stavljanja na tržište zahtijeva samo za dodatke koji su GMO ili su proizvedeni od GMO-a.
2.2. Aromatski spojevi
2.2.1. Odjeljak I: sažetak dokumentacije
Primjenjuje se cijeli odjeljak I. Priloga II.
2.2.2. Odjeljak II: identifikacija, opis svojstava i uvjeti korištenja dodatka; metode analize
U slučaju skupine „prirodni proizvodi”, općenito se smatra da cijele biljke, životinje i drugi organizmi i njihovi dijelovi ili proizvodi od njih, koji su rezultat veoma ograničene obrade kao što je drobljenje, mljevenje ili sušenje (npr. mnoge ljekovite biljke i začini), ne spadaju u ovu funkcionalnu skupinu aroma kategorije osjetilnih dodataka.
U svrhu ocjenjivanja zahtjeva koji se odnose na ove proizvode, arome se razvrstavaju kako slijedi:
|
1. |
Prirodni proizvodi:
|
|
2. |
Prirodne ili odgovarajuće sintetičke, kemijski definirane arome. |
|
3. |
Umjetne tvari. Mora se navesti skupina kojoj pripada proizvod koji je predmet zahtjeva. Ako se proizvod ne može svrstati ni u jednu od gore navedenih skupina, to se mora navesti i obrazložiti. |
2.2.2.1. Opis obilježja aktivne(-ih) tvari/organizma(-ama)
Primjenjuje se cijeli pododjeljak 2.2. Priloga II.
Osim toga:
Za sve skupine aroma mora se uvijek navesti, ako postoji, odgovarajući identifikacijski broj(evi) koji se koristi(-e) posebno za identifikaciju aromatskih proizvoda u hrani i hrani za životinje (kao što je broj FLAVIS (3), broj Vijeća Europe (4), broj JECFA, broj CAS (5) ili neki drugi međunarodno prihvaćeni sustav numeriranja).
|
1. |
Prirodni proizvodi – botanički definirani Opis obilježja prirodnih, botanički definiranih proizvoda uključuje znanstveno ime izvorne biljke, njezinu botaničku klasifikaciju (porodicu, rod, vrstu, prema potrebi podvrstu i sortu) te uobičajena imena i sinonime na što je moguće više europskih jezika ili na jednom ili više drugih jezika (kao što je/su jezik(-ci) mjesta uzgoja ili podrijetla), ako postoje. Moraju se navesti dijelovi korištene biljke (listovi, cvjetovi, sjeme, plodovi, gomolji itd.) kao i mjesto uzgoja ako je riječ o manje poznatim biljkama, kriteriji identifikacije te drugi bitni podaci o tim biljkama. Moraju se identificirati glavni sastojci ekstrakta te navesti njihova količina, spektar i varijabilnost. Posebna se pozornost mora posvetiti nečistoćama, kako je navedeno u pododjeljku 2.1.4. Priloga II. Treba također navesti koncentracije tvari koje predstavljaju toksikološki rizik (6) za ljude ili životinje, a koje mogu prisutne u biljci iz koje se proizvodi ekstrakt. Moraju se u cijelosti ispitati farmakološka ili srodna svojstva izvorne biljke, njezinih dijelova ili proizvoda dobivenih od nje. |
|
2. |
Prirodni proizvodi – koji nisu biljnog podrijetla Može se primijeniti isti pristup kao i kod gore navedenih proizvoda. |
|
3. |
Prirodne ili odgovarajuće sintetičke, kemijski definirane arome Osim općih zahtjeva iz pododjeljka 2.2.1.1. Priloga II., mora se detaljno navesti podrijetlo arome. |
2.2.2.2. Postupak proizvodnje i izrade
Primjenjuje se cijeli pododjeljak 2.3. Priloga II.
U slučaju prirodnih proizvoda koji nisu kemijski jasno definirani, a to su obično složene smjese brojnih spojeva dobivene postupkom ekstrakcije, postupak ekstrakcije treba detaljno opisati. Preporučljivo je da se pri opisivanju koristi odgovarajuća terminologija npr. eterično ulje, apsolut, tinktura, ekstrakt i srodni izrazi (7), koja se najčešće koristi za botanički definirane aromatske proizvode pri opisivanju postupka ekstrakcije. Moraju se navesti korištena otapala za ekstrakciju, mjere predostrožnosti koje su poduzete kako bi se spriječile rezidue otapala te količine rezidua koje predstavljaju toksikološki rizik u slučaju da je njihova prisutnost neizbježna. Izrazi korišteni za opis obilježja ekstrakta mogu uključivati upućivanje na metodu ekstrakcije.
2.2.2.3. Analitičke metode
|
1. |
Za prirodne proizvode (botanički definirane ili one koji nisu biljnog podrijetla) koji ne sadrže tvari koje predstavljaju toksikološki rizik za ljude ili životinje, standardne metode analize koje se zahtijevaju pododjeljkom 2.6. Priloga II. mogu se zamijeniti jednostavnijom kvalitativnom metodom analize prikladnom za glavne ili karakteristične sastojke proizvoda. |
|
2. |
Za prirodne ili odgovarajuće sintetičke, kemijski definirane arome koje nisu tvari koje predstavljaju toksikološki rizik za ljude ili životinje, standardne metode analize koje se zahtijevaju pododjeljkom 2.6. Priloga II. mogu se zamijeniti prikladnom jednostavnijom kvalitativnom metodom analize. |
Za sve ostale arome, kao što su prirodni ekstrakti koji sadrže tvari koje predstavljaju toksikološki rizik, prirodne ili odgovarajuće sintetičke, kemijski definirane arome koje su same po sebi tvari koje predstavljaju toksikološki rizik i umjetne arome, primjenjuje se cijeli pododjeljak 2.6. Priloga II.
2.2.3. Odjeljak III: studije sigurnosti dodatka
Za sve se arome mora izračunati i navesti izloženost životinja i doze koje su one unijele u organizam, kako nakon prirodne izloženosti tako i nakon dodavanja arome hrani za životinje.
Za arome koje spadaju u skupinu umjetnih tvari primjenjuje se cijeli odjeljak III. Priloga II.
2.2.3.1. Studije koje se odnose na sigurnost korištenja dodatka za ciljane životinje
|
1. |
Prirodni proizvodi (botanički definirani ili oni koji nisu biljnog podrijetla) Sigurnost ovih proizvoda može se procjeniti na temelju njihovih glavnih i karakterističnih sastojaka te uzimajući u obzir poznate tvari koje predstavljaju toksikološki rizik. Ako glavni ili karakteristični sastojci još nisu odobreni kao kemijski definirane arome ili kao dodaci hrani za životinje, mora se provjeriti jesu li oni tvari koje predstavljaju toksikološki rizik za ljude ili životinje te se moraju odrediti i navesti njihova toksikološka svojstva u skladu s pododjeljkom 3.1. Priloga II. |
|
2. |
Prirodne ili odgovarajuće sintetičke, kemijski definirane arome Ako su ove tvari arome odobrene za uporabu u hrani za ljude, sigurnost za ciljane životinje može se ocijeniti tako da se količina unosa putem hrane za životinje, koju za ciljane vrste predlaže podnositelj zahtjeva, usporedi s količinom koju putem hrane unose ljudi. Moraju se navesti podaci o metabolizmu i toksičnosti na temelju kojih je procjenjeno korištenje u hrani za ljude. U svim slučajevima u kojima količina unosa kod životinja i ljudi nije slična, primjerice ako je količina unosa koju za ciljane životinje predlaže podnositelj zahtjeva znatno veća od količine koju ljudi unose putem hrane ili ako tvar nije odobrena za uporabu u hrani, sigurnost za ciljane životinje može se procjeniti tako da se uzmu u obzir sljedeći podaci: načelo praga toksikološkog rizika (8), dostupni podaci o toksičnosti i metabolizmu za srodne spojeve, upozoravajuće kemijske strukture (analogno Uredbi Komisije (EZ) br. 1565/2000 od 18. srpnja 2000. o uvođenju mjera potrebnih za donošenje programa ocjenjivanja u primjeni Uredbe (EZ) br. 2232/96 Europskog parlamenta i Vijeća (9). Studije podnošljivosti potrebne su jedino ako su granične vrijednosti prekoračene ili ih nije moguće odrediti. |
2.2.3.2. Studije koje se odnose na sigurnost korištenja dodatka za potrošače
Moraju se dostaviti dokazi da metaboliti arome ne uzrokuju u životinjama akumulaciju proizvoda koji predstavljaju toksikološki rizik za ljude. Ako zbog njegova dodavanja hrani za životinje aromatski proizvod koji je predmet zahtjeva dovodi do prisutnosti rezidua u hrani životinjskog podrijetla, mora se detaljno izračunati izloženost potrošača.
|
(a) |
Studije metabolizma i rezidua
|
|
(b) |
Toksikološke studije
|
2.2.3.3. Studije koje se odnose na sigurnost korištenja dodatka za primjenitelje/radnike
Primjenjuje se cijeli pododjeljak 3.3. Priloga II.
2.2.3.4. Studije koje se odnose na sigurnost korištenja dodatka za okoliš
Primjenjuje se cijeli pododjeljak 3.4. Priloga II.
2.2.4. Odjeljak IV: Studije učinkovitosti dodatka
Moraju se dokazati aromatska svojstva dodatka, obično na temelju objavljene literature. Ona se mogu dokazati i na temelju iskustva u praktičnoj primjeni, ako takvo iskustvo postoji; u protivnom su možda potrebne studije na životinjama.
Mora se u cijelosti istražiti i navesti ima li proizvod koji je predmet zahtjeva i druge funkcije u hrani za životinje, u životinjama ili u hrani životinjskog podrijetla, osim funkcija navedenih u definiciji aromatskih spojeva u Prilogu I. Uredbi (EZ) br. 1831/2003.
2.2.5. Odjeljak V: plan praćenja nakon stavljanja na tržište
Ovaj se odjeljak primjenjuje u skladu s odredbama članka 7. stavka 3. točke (g) Uredbe (EZ) br. 1831/2003. To znači da se plan praćenja nakon stavljanja na tržište zahtijeva samo za dodatke koji su GMO ili su proizvedeni od GMO-a.
3. HRANIDBENI DODACI
3.1. Odjeljak I: sažetak dokumentacije
Primjenjuje se cijeli odjeljak I. Priloga II.
3.2. Odjeljak II: identifikacija, opis svojstava i uvjeti korištenja dodatka; metode analize
Odjeljak II. Priloga II. primjenjuje se kako slijedi:
|
— |
za dodatke čije odobrenje ne glasi na određenog nositelja primjenjuju se stavci 2.1.2., 2.1.3., 2.1.4., 2.1.4.2., 2.2., 2.3.1., 2.3.2., 2.4.1., 2.4.2., 2.4.4., 2.5., 2.6.; |
|
— |
za ostale dodatke čije odobrenje glasi na određenog nositelja primjenjuje se cijeli odjeljak II. |
3.3. Odjeljak III: Studije sigurnosti dodatka
3.3.1. Studije koje se odnose na sigurnost korištenja dodatka za ciljane životinje
3.3.1.1. Podnošljivost kodciljanih vrsta
|
1. |
Studije nisu potrebne za ureu i aminokiseline, njihove soli i analogne tvari odobrene Direktivom 82/471/EEZ te mješavine elemenata u tragovima i vitamine, provitamine i kemijski jasno definirane tvari koje imaju sličan učinak, koje nemaju akumulacijski potencijal i koje su Direktivom 70/524/EEZ već odobrene kao dodaci hrani za životinje. |
|
2. |
Za one dodatke koji spadaju u funkcionalnu skupinu „vitamini, provitamini i kemijski jasno definirane tvari koje imaju sličan učinak” i imaju akumulacijski potencijal, podnošljivost se mora dokazati jedino za spojeve za koje se očekuje da će djelovati ili je dokazano da djeluju drukčije od ustaljenih za vitamin€. U određenim bi se slučajevima elementi testa podnošljivosti (plan provedbe ili kriteriji) mogli kombinirati s jednim od testova učinkovitosti. |
|
3. |
Podnošljivost se dokazuje za derivate uree, tvari analogne aminokiselinama i mješavine elemenata u tragovima koji još nisu odobreni. Podnošljivost se mora dokazati i za proizvode fermentacije, osim ako je aktivna tvar odvojena od sirovog proizvoda fermentacije i visoko pročišćena ili je riječ o proizvodnom organizmu čije je sigurno korištenje dokazano u prošlosti i čija je biologija dobro poznata tako da se može isključiti mogućnost stvaranja toksičnih metabolita. |
|
4. |
Ako se zahtjev odnosi na sve vrste/kategorije životinja, dovoljno je obaviti jednu studiju podnošljivosti na najosjetljivijoj vrsti (ili čak na odgovarajućoj laboratorijskoj životinji) u skladu s najnovijim spoznajama. |
3.3.1.2. Mikrobiološke studije
Primjenjuje se cijeli pododjeljak 3.1.2. Priloga II.
3.3.2. Studije koje se odnose na sigurnost korištenja dodatka za potrošače
3.3.2.1. Studije metabolizma i rezidua
Studije metabolizma obično nisu potrebne. Za derivate uree, metabolizam u buragu proučava se tijekom pokusa učinkovitosti.
Studije rezidua i taloženja potrebne su jedino za one dodatke iz funkcionalne skupine „vitamini, provitamini i kemijski jasno definirane tvari koje imaju sličan učinak”, koji imaju potencijal za akumulaciju u tijelu, te za funkcionalnu skupinu mješavina elemenata u tragovima, kada je povećana njihova bioraspoloživost. U tom se slučaju ne primjenjuje postupak opisan u pododjeljku 3.2.1. Priloga II. Moraju se samo usporediti razine u tkivima ili proizvodima između skupine kojoj je davana najveća doza tvari na koju se odnosi zahtjev i pozitivne kontrole (referentni spoj).
3.3.2.2. Toksikološke studije
Ova se ispitivanja zahtijevaju za proizvode fermentacije i dodatke koji još nisu odobreni. Za proizvode fermentacije moraju se dostaviti rezultati studija genotoksičnosti i subkronične toksičnosti, osim ako je:
|
1. |
aktivna tvar odvojena od sirovog proizvoda fermentacije i visoko pročišćena; ili |
|
2. |
riječ je o proizvodnom organizmu čije je sigurno korištenje dokazano u prošlosti i čija je biologija dobro poznata tako da se može isključiti mogućnost stvaranja toksičnih metabolita. |
Ako proizvodni organizam spada u skupinu kojoj pripadaju i sojevi za koje se zna da proizvode toksine, njihova se prisutnost mora posebno isključiti.
3.3.2.3. Procjena neškodljivosti za potrošača
Primjenjuje se cijeli pododjeljak 3.2.3. Priloga II.
3.3.3. Studije koje se odnose na sigurnost korištenja dodatka za primjenitelje/radnike
Primjenjuje se cijeli pododjeljak 3.3. Priloga II.
3.3.4. Studije koje se odnose na sigurnost korištenja dodatka za okoliš
Za nove aktivne tvari koje spadaju u skupinu „mješavine elemenata u tragovima” primjenjuje se cijeli pododjeljak 3.4. Priloga II.
3.4. Odjeljak IV: studije učinkovitosti dodatka
Studije učinkovitosti nisu potrebne za ureu, aminokiseline, soli aminokiselina i tvari analogne aminokiselinama, koje su već odobrene kao dodaci hrani za životinje, za mješavine elemenata u tragovima koje su već odobrene kao dodaci hrani za životinje, te za vitamine, provitamine i kemijski jasno definirane tvari koje imaju sličan učinak, koji su već odobreni kao dodaci hrani za životinje.
Kratkoročna studija učinkovitosti potrebna je za derivate uree, soli aminokiselina i tvari analogne aminokiselinama koje još nisu odobrene kao dodaci hrani za životinje, za mješavine elemenata u tragovima koje još nisu odobrene kao dodaci hrani za životinje, te za vitamine, provitamine i kemijski jasno definirane tvari koje imaju sličan učinak, koji još nisu odobreni kao dodaci hrani za životinje.
Za ostale tvari od kojih se očekuje da imaju nutritivni učinak mora se obaviti najmanje jedna dugoročna studija učinkovitosti u skladu s odredbama odjeljka 4. Priloga II.
Studijama se prema potrebi dokazuje da dodatak može zadovoljiti hranidbene potrebe životinja. Pokusi moraju uključivati ispitnu skupinu kojoj se daje hrana koja sadrži hranjivu tvar u koncentracijama koje su manje od potreba životinja. Treba, međutim, izbjegavati pokuse u kojima se koristi kontrolna skupina s teškim nutritivnim deficitom. Općenito, dovoljno je dokazati učinkovitost kod jedne vrste ili kategorije životinja, uključujući laboratorijske životinje.
3.5. Odjeljak V: plan praćenja nakon stavljanja na tržište
Ovaj se odjeljak primjenjuje u skladu s odredbama članka 7. stavka 3. točke (g) Uredbe (EZ) br. 1831/2003.
4. ZOOTEHNIČKI DODACI
4.1. Zootehnički dodaci, osim enzima i mikroorganizama
4.1.1. Odjeljak I: sažetak dokumentacije
Primjenjuje se cijeli odjeljak I. Priloga II.
4.1.2. Odjeljak II: identifikacija, opis svojstava i uvjeti korištenja dodatka; metode analize
Primjenjuje se cijeli odjeljak II. Priloga II.
4.1.3. Odjeljak III: studije sigurnosti korištenja dodatka
4.1.3.1. Studije koje se odnose na sigurnost korištenja dodatka za ciljane životinje
Primjenjuje se cijeli pododjeljak 3.1. Priloga II.
4.1.3.2. Studije koje se odnose na sigurnost korištenja dodatka za potrošače
|
1. |
Studije metabolizma i rezidua Ove studije nisu potrebne ako se:
Studije metabolizma nisu potrebne ako je tvar prirodno prisutna u značajnim količinama u hrani za ljude ili životinje ili je uobičajeni sastojak tjelesnih tekućina ili tkiva. Međutim, u tim se slučajevima zahtijevaju studije rezidua, koje se mogu ograničiti na usporedbu razina u tkivima ili proizvodima u netretiranoj skupini i u skupini kojoj je davana najveća preporučena doza. U svim se ostalim slučajevima primjenjuje cijeli pododjeljak 3.2.1. Priloga II. |
|
2. |
Toksikološke studije Toksikološke studije nisu potrebne ako se tvar apsorbira u obliku jednog ili više fizioloških spojeva. Ako je riječ o ksenobioticima, primjenjuje se cijeli pododjeljak 3.2.2. Priloga II. Kod ostalih tvari, o postupanju se odlučuje od slučaja do slučaja uzimajući u obzir stupanj i način izloženosti; ako se izostavi bilo koji podatak koji je propisan ovim odjeljkom, moraju se navesti razlozi izostavljanja. |
|
3. |
Procjena neškodljivosti za potrošača Kad je riječ o životinjama koje se koriste za proizvodnju hrane, pododjeljak 3.2.3. Priloga II. primjenjuje se u cijelosti. |
4.1.3.3. Studije koje se odnose na sigurnost korištenja dodatka za primjenitelje/radnike
Primjenjuje se cijeli pododjeljak 3.3. Priloga II.
4.1.3.4. Studije koje se odnose na sigurnost korištenja dodatka za okoliš
Primjenjuje se cijeli pododjeljak 3.4. Priloga II.
4.1.4. Odjeljak IV: studije učinkovitosti dodatka
Primjenjuje se cijeli odjeljak IV. Priloga II.
|
1. |
Dodaci koji povoljno utječu na proizvodnju, osobine i dobrobit životinja te funkcionalna skupina „ostali zootehnički dodaci” Učinci se mogu dokazati samo za svaku pojedinačnu ciljanu vrstu ili kategoriju životinja. Ovisno o svojstvima dodatka, rezultati se mogu mjeriti na temelju obilježja učinkovitosti (npr. učinkovitost hrane za životinje, prosječni dnevni prirast, povećanje životinjskih proizvoda), sastava trupa, proizvodnosti stada, reprodukcijskih parametara ili dobrobiti životinja. Način djelovanja može se dokazati kratkoročnim studijama učinkovitosti ili laboratorijskim studijama pri kojima se mjeri odgovarajuća krajnja točka. |
|
2. |
Dodaci koji povoljno utječu na ekološke posljedice uzgoja životinja Za dodatke koji povoljno utječu na okoliš (npr. manje izlučivanje dušika ili fosfora ili manja proizvodnja metana, nepoželjni okusi), učinkovitost za ciljane vrste može se dokazati na temelju tri kratkoročne studije učinkovitosti u kojima su životinje pokazale značajne pozitivne učinke. Pri tim se studijama mora uzeti u obzir mogućnost adaptivnog odgovora na dodatak. |
|
4.1.5. |
Odjeljak V: plan praćenja nakon stavljanja na tržište |
Ovaj se odjeljak primjenjuje u skladu s odredbama članka 7. stavka 3. točke (g) Uredbe (EZ) br. 1831/2003.
4.2. Zootehnički dodaci: enzimi i mikroorganizmi
4.2.1. Odjeljak I: sažetak dokumentacije
Primjenjuje se cijeli odjeljak I. Priloga II.
4.2.2. Odjeljak II: identifikacija, opis svojstava i uvjeti korištenja dodatka; metode analize
Primjenjuje se cijeli odjeljak II. Priloga II.
4.2.3. Odjeljak III: studije sigurnosti dodatka
4.2.3.1. Studije koje se odnose na sigurnost korištenja dodatka za ciljane životinje
Primjenjuje se cijeli pododjeljak 3.1.1. Priloga II.
Podnositelji zahtjeva se potiču da, kad god je to moguće, u pokusnoj skupini koriste dozu koja je najmanje 100 puta veća od najveće preporučene doze te da potom smanje broj potrebnih krajnjih točaka. U tu se svrhu može koristiti koncentrirani oblik dodatka. Koncentracija se prilagođava smanjivanjem količine prisutnih nosača, ali omjer između aktivnog(-ih) organizma(-ama)/tvari i ostalih proizvoda fermentacije mora ostati ista kao i u konačnom proizvodu. U slučaju enzima, hrana mora sadržavati odgovarajući supstrat ili supstrate.
Cijeli pododjeljak 3.1.2. Priloga II. primjenjuje se za sve mikroorganizme kao i za one enzime koji imaju izravan katalitički učinak na elemente mikrobiote ili za koje se tvrdi da utječu na crijevnu mikrobiotu.
Ako se radi o novoj vrsti izloženosti ili značajnom povećanju stupnja izloženosti mikroorganizmima, mogu biti potrebne dodatne studije kako bi se dokazalo nepostojanje štetnih učinaka na komenzalnu mikrobiotu probavnog trakta. Za preživače, izravno brojanje mikroorganizama bit će potrebno jedino ako postoje dokazi da štetno utječu na funkciju buraga (izmjereno in vitro kao promjena koncentracija hlapljivih masnih kiselina, smanjenje koncentracije propionata ili smanjena hidroliza celuloze).
4.2.3.2. Studije koje se odnose na sigurnost korištenja dodatka za potrošače
|
1. |
Nisu potrebne studije metabolizma i rezidua. |
|
2. |
Toksikološke studije u skladu s pododjeljkom 3.2.2. Priloga II. |
Enzimi i mikroorganizmi samo su dio čitavog dodatka, koji u većini slučajeva može sadržavati i druge sastojke koji potječu iz procesa fermentacije. Dodatak stoga treba ispitati kako bi se utvrdilo da ne sadrži mutagene ili druge materijale koji mogu biti štetni za potrošače koji konzumiraju hranu dobivenu od životinja kojima je davana hrana ili voda tretirana tim dodacima.
Međutim, većina živih bakterija namijenjenih izravnom ili neizravnom unosu putem hrane od strane sisavaca (uključujući i ljude) bira se iz skupina organizama čija je sigurna uporaba u prošlosti već dokazana ili iz skupina kod kojih su toksični rizici dobro poznati. Slično tomu, opasnosti povezane s mikroorganizmima koji se trenutno koriste za proizvodnju enzima općenito su poznate i značajno smanjene zahvaljujući suvremenim metodama proizvodnje. Stoga se smatra da testovi toksičnosti (npr. ispitivanje oralne toksičnosti ili genotoksičnosti) nisu potrebni za enzime mikrobnog podrijetla i za mikroorganizme čija je sigurna uporaba u prošlosti već dokazana i kod kojih su sastojci nastali procesom fermentacije jasno definirani i dobro poznati. Međutim, kada je riječ o živim organizmima kao i organizmima korištenim za proizvodnju enzima, uvijek se moraju razmotriti specifični rizici navedeni u odjeljku 2.2.2.2. Priloga II.
Ako se radi o novom organizmu ili o novoj primjeni organizma, a biologija (proizvodnog) organizma nije dovoljno poznata da bi se mogao isključiti potencijal za stvaranje toksičnih metabolita, moraju se uvesti studije genotoksičnosti i oralne toksičnosti, i to s dodacima koji sadrže žive mikroorganizme ili enzime. U tom se slučaju provode studije genotoksičnosti, uključujući mutagenost, i studija subkronične oralne toksičnosti. Preporučljivo je da se te studije obave korištenjem fermentacijske komine koja ne sadrži stanice ili, u slučaju fermentacije na čvrstoj podlozi, korištenjem odgovarajućeg ekstrakta.
4.2.3.3. Studije koje se odnose na sigurnost korištenja dodatka za primjenitelje/radnike
Primjenjuje se cijeli pododjeljak 3.3. Priloga II., uz sljedeće iznimke:
|
— |
smatra se da enzimi i mikroorganizmi, kao proteinske tvari, izazivaju preosjetljivost dišnih putova, osim ako se dostave uvjerljivi dokazi koji govore suprotno. Stoga nije potrebno izravno testiranje; |
|
— |
formulacija proizvoda (npr. mikroinkapsulacija) može isključiti potrebu za nekim ili svim testovima. U tim se slučajevima mora dostaviti odgovarajuće obrazloženje. |
4.2.3.4. Studije koje se odnose na sigurnost korištenja dodatka za okoliš
Čitav pododjeljak 3.4. Priloga II. u cijelosti se primjenjuje za mikroorganizme koji nisu intestinalnog podrijetla ili nisu sveprisutni u okolišu.
4.2.4. Odjeljak IV: studije učinkovitosti dodatka
Primjenjuje se cijeli odjeljak IV. Priloga II.
|
1. |
Dodaci koji povoljno utječu na proizvodnju, osobine i dobrobit životinja te funkcionalna skupina „ostali zootehnički dodaci”. Učinci se mogu dokazati samo za svaku pojedinačnu ciljanu vrstu ili kategoriju životinja. Ovisno o svojstvima dodatka, rezultati se mogu mjeriti na temelju obilježja učinkovitosti (npr. učinkovitost hrane za životinje, prosječni dnevni prirast, povećanje životinjskih proizvoda), sastava trupa, proizvodnosti stada, reprodukcijskih parametara ili dobrobiti životinja. Način djelovanja može se dokazati kratkoročnim studijama učinkovitosti ili laboratorijskim studijama pri kojima se mjeri odgovarajuća krajnja točka. |
|
2. |
Dodaci koji povoljno utječu na ekološke posljedice uzgoja životinja Za dodatke koji povoljno utječu na okoliš (npr. manje izlučivanje dušika ili fosfora ili manja proizvodnja metana, nepoželjni okusi), učinkovitost za ciljane vrste može se dokazati na temelju tri kratkoročne studije učinkovitosti u kojima su životinje pokazale značajne pozitivne učinke. Pri tim se studijama mora uzeti u obzir mogućnost adaptivnog odgovora na dodatak. |
4.2.5. Odjeljak V: plan praćenja nakon stavljanja na tržište
Ovaj se odjeljak primjenjuje u skladu s odredbama članka 7. stavka 3. točke (g) Uredbe (EZ) br. 1831/2003.
5. KOKCIDIOSTATICI I HISTOMONOSTATICI
5.1. Odjeljak I: sažetak dokumentacije
Primjenjuje se cijeli odjeljak I. Priloga II.
5.2. Odjeljak II: identifikacija, opis svojstava i uvjeti korištenja dodatka; metode analize
Primjenjuje se cijeli odjeljak II. Priloga II.
5.3. Odjeljak III: studije sigurnosti dodatka
5.3.1. Studije koje se odnose na sigurnost korištenja dodatka za ciljane životinje
Primjenjuje se cijeli pododjeljak 3.1. Priloga II.
5.3.2. Studije koje se odnose na sigurnost korištenja dodatka za potrošače
Primjenjuje se cijeli pododjeljak 3.2. Priloga II.
5.3.3. Studije koje se odnose na sigurnost korištenja dodatka za primjenitelje/radnike
Primjenjuje se cijeli pododjeljak 3.3. Priloga II.
5.3.4. Studije koje se odnose na sigurnost korištenja dodatka za okoliš
Primjenjuje se cijeli pododjeljak 3.4. Priloga II.
5.4. Odjeljak IV: studije učinkovitosti dodatka
Ovi dodaci štite životinje od posljedica invazije Eimeria spp. ili Histomonas meleagridis. Mora se pridati važnost dokazima o posebnim učincima dodatka (npr. kontrolirane vrste) i njegovim profilaktičkim svojstvima (npr. smanjenje morbiditeta, mortaliteta, broja oocista i koliko ima ozljeda). Prema potrebi se navode podaci o učincima na rast i iskoristivost hrane (perad za tov, podmladak nesilica i kunići) i učincima na valivost (rasplodna perad).
Potrebni podaci o učinkovitosti moraju proizlaziti iz tri tipa pokusa na ciljanim životinjama:
|
— |
umjetne pojedinačne i miješane infekcije |
|
— |
prirodna/umjetna infekcija za simulaciju uvjeta korištenja |
|
— |
stvarni uvjeti korištenja u pokusima na terenu. |
Pokusi s umjetnim pojedinačnim i miješanim infekcijama (npr. baterijski kavezi za perad) imaju za cilj dokazati relativnu učinkovitost protiv parazita i ne trebaju se ponavljati. Za studije kojima se simuliraju uvjeti korištenja (npr. studije na peradi iz podnog uzgoja, studije na kunićima koji se drže u baterijskim kavezima) potrebna su tri značajna rezultata. Također su potrebna tri ispitivanja na terenu u kojima je prisutan određeni stupanj prirodne infekcije.
5.5. Odjeljak V: plan praćenja nakon stavljanja na tržište
Ovaj odjeljak Priloga II. primjenjuje se u skladu s odredbama članka 7. stavka 3. točke (g) Uredbe (EZ) br. 1831/2003.
6. EKSTRAPOLACIJA SA ZASTUPLJENIJIH VRSTA NA MANJE ZASTUPLJENE VRSTE
Manje zastupljene vrste definirane su člankom 1. stavkom 2. ove Uredbe.
Ako se predlaže proširenje odobrenog korištenja na vrstu koja je fiziološki usporediva s vrstom kod koje je korištenje dodatka već odobreno, u pravilu će se prihvatiti manje opsežna dokumentacija.
Sljedeći se zahtjevi primjenjuju jedino na zahtjeve za odobravanje onih dodataka za manje zastupljene vrste koji su već odobreni za zastupljenije vrste. Na zahtjeve za odobravanje novih dodataka hrani za životinje namijenjenih jedino manje zastupljenim vrstama, svi se odjeljci u cijelosti primjenjuju, ovisno o kategoriji/funkcionalnoj skupini dodatka (vidjeti odgovarajuće posebne zahtjeve u Prilogu III.).
6.1. Odjeljak I: sažetak dokumentacije
Primjenjuje se cijeli odjeljak I. Priloga II.
6.2. Odjeljak II: identifikacija, opis svojstava i uvjeti korištenja dodatka; metode analize
Odjeljak II. Priloga II. primjenjuje se kako slijedi:
|
— |
za dodatke čije odobrenje glasi na određenog nositelja primjenjuje se cijeli odjeljak II.; |
|
— |
za ostale se dodatke primjenjuju stavci 2.1.2., 2.1.3., 2.1.4., 2.1.4.2., 2.2., 2.3.1., 2.3.2., 2.4.1., 2.4.2., 2.4.4., 2.5., 2.6. |
6.3. Odjeljak III: studije sigurnosti korištenja dodatka
6.3.1. Studije koje se odnose na sigurnost korištenja dodatka za ciljane životinje
6.3.1.1. Podnošljivost kod ciljanih vrsta
Primjenjuju se zahtjevi koji se odnose na pojedine kategorije/funkcionalne skupine dodatka.
U načelu, studije podnošljivosti kod manje zastupljenih vrsta nisu potrebne ako je utvrđena široka granica sigurnosti dodatka (najmanje faktor 10) u odgovarajuće, fiziološki slične zastupljenije vrste.
Ako je u tri zastupljenije ciljane vrste (uključujući monogastrične sisavce, sisavce preživače te perad) utvrđena slična i široka granica sigurnosti, nisu potrebne dodatne studije podnošljivosti za manje zastupljene vrste koje im nisu fiziološki slične (npr. konje ili kuniće). Ako su studije podnošljivosti potrebne, one, za manje zastupljene vrste (osim kunića), moraju trajati najmanje 28 dana ako je riječ o životinjama koje još rastu i 42 dana ako je riječ o odraslim životinjama. Za kuniće, trajanje studija je sljedeće: kunići za tov: 28 dana; rasplodne ženke: jedan ciklus (od osjemenjivanja do kraja razdoblja odbića). Ako se zahtjev podnosi za kuniće koji sišu i odbijene kuniće, razdoblje od 49 dana (koje počinje tjedan dana nakon rođenja) smatra se dovoljnim i mora uključivati i ženke kunića do odbića. Za ribu (osim Salmonidae), potrebno je 90-dnevno razdoblje.
6.3.2. Studije koje se odnose na sigurnost korištenja dodatka za potrošače
6.3.2.1. Studije metabolizma
Primjenjuju se zahtjevi koji se odnose na različite kategorije/funkcionalne skupine dodatka.
Osim toga, studije metabolizma nisu potrebne ako je dodatak već odobren za korištenje kod vrste koja je fiziološki usporediva s manje zastupljenim vrstama za koje se traži odobrenje. Ako ne postoji fiziološka sličnost, usporedba metaboličkog profila na temelju ispitivanja in vitro (npr. obavljenih na hepatocitima pomoću obilježenih spojeva) smatra se dovoljnom za ocjenu metaboličke sličnosti.
Ako manje zastupljena vrsta nije fiziološki slična zastupljenijoj vrsti, mora se utvrditi metabolička sudbina dodatka u manje zastupljenoj vrsti.
6.3.2.2. Studije rezidua
Ako je metabolička sličnost utvrđena ili dokazana, potrebna je jedino kvantifikacija markerske rezidue u jestivim tkivima i proizvodima. U svim se ostalim slučajevima u cijelosti primjenjuje pododjeljak 3.2.1.2. Priloga II.
6.3.2.3. Procjena sigurnosti potrošača
Prijedlog najveće dopuštene količine rezidua (NDKR)
NDKR se može odrediti pod pretpostavkom da se količine rezidua u jestivim tkivima manje zastupljenih vrsta ne razlikuju značajno od onih kod zastupljenijih vrsta.
NDKR se može ekstrapolirati unutar životinjskih razreda kako slijedi:
|
— |
sa zastupljenijeg preživača u fazi rasta na sve preživače u fazi rasta; |
|
— |
s mlijeka muznih krava na mlijeko ostalih preživača koji daju mlijeko; |
|
— |
sa svinja na sve monogastrične sisavce, osim konja; |
|
— |
s pilića ili purana na ostalu perad; |
|
— |
s kokoši nesilica na ostale ptice nesilice; i |
|
— |
s riba iz porodice Salmonidae na sve ostale ribe. |
NDKR za konje može se ekstrapolirati ako postoji NDKR za zastupljenijeg preživača i zastupljenijeg monogastričnog sisavca.
Ako su utvrđeni jednaki NDKR-ovi za goveda (ili ovce), svinje i piliće (ili perad), koji predstavljaju zastupljenije vrste s različitim metaboličkim sposobnostima i sastavom tkiva, isti se NDKR-ovi mogu utvrditi i za koze, kopitare i kuniće, što znači da se smatra da je moguća ekstrapolacija na sve životinje koje se koriste za proizvodnju hrane, osim na ribe. Uzimajući u obzir smjernicu Odbora za medicinske proizvode za veterinarsku uporabu (OVMP) (10) o utvrđivanju NDKR-a u ribama iz porodice Salmonidae i drugim ribama, koja već dopušta ekstrapolaciju s NDKR-a u mišićima neke zastupljenije vrste na ribe iz porodice Salmonidae i druge ribe pod uvjetom da su izvorne tvari prihvatljive kao markerska rezidua za NDKR u mišićima i koži, NDKR se može ekstrapolirati na sve životinje koje se koriste za proizvodnju hrane.
Moraju biti na raspolaganju analitičke metode za praćenje rezidua u jestivim tkivima i proizvodima svih životinja koje se koriste za proizvodnju hrane.
6.3.3. Studije koje se odnose na sigurnost korištenja dodatka za primjenitelje/radnike
Primjenjuje se cijeli pododjeljak 3.3. Priloga II.
6.3.4. Studije koje se odnose na sigurnost korištenja dodatka za okoliš
Procjena rizika za okoliš može se ekstrapolirati iz procjene obavljene za fiziološki usporedive zastupljenije vrste. Za dodatke koji su namijenjeni korištenju kod kunića, primjenjuje se cijeli odjeljak uzimajući u obzir zahtjeve koji se odnose na svaku pojedinu kategoriju/funkcionalnu skupinu dodatka.
6.4. Odjeljak IV: studije učinkovitosti dodatka
Ako je dodatak već odobren za fiziološki usporedivu zastupljeniju vrstu, i to za istu funkciju, i ako je način djelovanja dodatka poznat ili dokazan, dokaz o istom načinu djelovanja kod manje zastupljenih vrsta može se smatrati dokazom učinkovitosti. Ako se takva povezanost ne može uspostaviti, učinkovitost se mora dokazati u skladu s općim pravilima iz odjeljka IV. Priloga II. U nekim slučajevima može biti korisno kombinirati vrste životinja u istoj proizvodnoj fazi (npr. koze i ovce koje se koriste za proizvodnju mlijeka). Značajnost se mora dokazati u svakoj studiji (P ≤ 0,1) ili, ako je moguće, metaanalizom (P ≤ 0,05).
Ako treba dokazati učinkovitost, trajanje studija učinkovitosti mora odgovarati proizvodnim fazama fiziološki usporedivih zastupljenijih vrsta. U ostalim slučajevima, minimalno trajanje studije mora biti u skladu s odgovarajućim odredbama pododjeljka 4.4. Priloga II. i Priloga IV.
6.5. Odjeljak V: plan praćenja nakon stavljanja na tržište
Ovaj odjeljak Priloga II. primjenjuje se u skladu s odredbama članka 7. stavka 3. točke (g) Uredbe (EZ) br. 1831/2003.
7. KUĆNI LJUBIMCI I DRUGE ŽIVOTINJE KOJE SE NE KORISTE ZA PROIZVODNJU HRANE
Kućni ljubimci i druge životinje koje se ne koriste za proizvodnju hrane definirani su člankom 1. stavkom 1. ove Uredbe.
7.1. Odjeljak I: sažetak dokumentacije
Primjenjuje se cijeli odjeljak I. Priloga II.
7.2. Odjeljak II: identifikacija, opis svojstava i uvjeti korištenja dodatka; metode analize
Odjeljak II. Priloga II. primjenjuje se kako slijedi:
|
— |
za dodatke čije odobrenje glasi na određenog nositelja primjenjuje se cijeli odjeljak II.; |
|
— |
za ostale se dodatke primjenjuju stavci 2.1.2., 2.1.3., 2.1.4., 2.1.4.2., 2.2., 2.3.1., 2.3.2., 2.4.1., 2.4.2., 2.4.4., 2.5., 2.6. |
7.3. Odjeljak III: studije sigurnosti korištenja dodatka
7.3.1. Studije koje se odnose na sigurnost korištenja dodatka za ciljane životinje
Primjenjuju se zahtjevi koji se odnose na različite kategorije/funkcionalne skupine dodatka. Ako je potrebno obaviti studiju podnošljivosti, ona mora trajati najmanje 28 dana.
Studija podnošljivosti nije potrebna ako je dodatak pokazao usporedivu i široku granicu sigurnosti u tri zastupljenije vrste (uključujući monogastrične sisavce, sisavce preživače i perad).
7.3.2. Studije koje se odnose na sigurnost korištenja dodatka za potrošače
Ovaj se pododjeljak obično ne primjenjuje. Mora se uzeti u obzir sigurnost vlasnika.
7.3.3. Studije koje se odnose na sigurnost korištenja dodatka za primjenitelje/radnike
Primjenjuje se cijeli pododjeljak 3.3. Priloga II.
7.3.4. Studije koje se odnose na sigurnost korištenja dodatka za okoliš
Pododjeljak 3.4. Priloga II. nije potreban.
7.4. Odjeljak IV: studije učinkovitosti dodatka
Primjenjuju se zahtjevi koji se odnose na različite kategorije/funkcionalne skupine dodatka.
Ako je dodatak, za koji su potrebne studije na životinjama, već ranije odobren za druge fiziološki slične vrste, nije potrebno dodatno dokazivanje učinkovitosti pod uvjetom da su predviđeni učinak i način djelovanja isti. Ako dodatak nije već ranije odobren ili ako su predviđeni učinak ili način djelovanja drugačiji od onog iz prethodnog odobrenja, učinkovitost se dokazuje u skladu s općim pravilima iz odjeljka IV. Priloga II.
Dugoročni pokusi učinkovitosti moraju trajati najmanje 28 dana.
7.5. Odjeljak V: plan praćenja nakon stavljanja na tržište
Ovaj odjeljak Priloga II. primjenjuje se u skladu s odredbama članka 7. stavka 3. točke (g) Uredbe (EZ) br. 1831/2003.
8. DODACI KOJI SU VEĆ ODOBRENI ZA KORIŠTENJE U HRANI
8.1. Odjeljak I: sažetak dokumentacije
Primjenjuje se cijeli odjeljak I. Priloga II.
8.2. Odjeljak II: identifikacija, opis svojstava i uvjeti korištenja dodatka; metode analize
Odjeljak II. Priloga II. primjenjuje se kako slijedi:
|
— |
za dodatke čije odobrenje glasi na određenog nositelja primjenjuje se cijeli odjeljak II.; |
|
— |
za ostale se dodatke primjenjuju stavci 2.1.2., 2.1.3., 2.1.4., 2.1.4.2., 2.2., 2.3.1., 2.3.2., 2.4.1., 2.4.2., 2.4.4., 2.5., 2.6. |
8.3. Odjeljak III: studije sigurnosti korištenja dodatka
Dostavlja se najnovija službena procjena sigurnosti prehrambenog aditiva, dopunjena svim kasnije dobivenim podacima.
Za one dodatke koji su odobreni kao prehrambeni aditivi ili koji se u Europskoj uniji smiju bez ograničenja koristiti kao sastojci prehrambenih proizvoda, općenito nisu potrebne studije sigurnosti za potrošače i radnike.
Moraju se dostaviti svi elementi obuhvaćeni pododjeljcima 3.1., 3.2. i 3.3. Priloga II., uzimajući u obzir sadašnje spoznaje o sigurnosti tih tvari pri njihovom korištenju u hrani. Takve tvari, koje se koriste i u hrani, mogu se u skladu s tim razvrstati na sljedeći način:
|
— |
ADI nije određen (bez izričitog navođenja gornje granice unosa za tvari veoma niske toksičnosti), |
|
— |
ADI ili UL utvrđen, ili |
|
— |
ADI nije dodijeljen (primjenjuje se na tvari za koje se na temelju dostupnih informacija ne može utvrditi njihova sigurnost). |
8.3.1. Studije koje se odnose na sigurnost korištenja dodatka za ciljane životinje
Ako je količina dodatka koja se koristi u hrani za životinje slična količini koja se koristi u hrani, sigurnost za ciljane životinje može se procjeniti na temelju dostupnih podataka dobivenih toksikološkim istraživanjem in vivo te uzimajući u obzir kemijsku strukturu kao i metaboličku sposobnost ciljanih vrsta. Ako je količina dodatka koja se koristi u hrani za životinje znatno veća od one koja se koristi u hrani, može biti potrebno obaviti studiju podnošljivosti na ciljanim životinjama, ovisno o svojstvima tvari.
8.3.2. Ispitivanja koja se odnose na sigurnost korištenja dodatka za potrošače
Ako korištenje dodatka kao dodatka u hrani za životinje dovodi do veće izloženosti potrošača ili do strukture metabolita koja je drugačija od one koja se javlja pri njegovom korištenju u hrani, potrebni su dodatni podaci o toksičnosti i reziduama.
8.3.2.1. Prehrambeni aditivi za koje nije određen ADI
Ne treba se procjenjivati sigurnost za potrošača, osim ako korištenje dodatka u hrani za životinje dovodi do strukture metabolita koja je drugačija od one koja se javlja pri njegovom korištenju u hrani.
8.3.2.2. Prehrambeni aditivi za koje je utvrđen ADI ili UL
Sigurnost potrošača mora se ocijeniti uzimajući u obzir dodatnu izloženost zbog korištenja u hrani za životinje ili posebnu izloženost povezanu s metabolitima podrijetlom iz ciljanih vrsta. U tu se svrhu mogu ekstrapolirati podaci iz literature koji se odnose na rezidue.
Ako su potrebne studije rezidua, one se ograničavaju na usporedbu razina u tkivima ili proizvodima u netretiranoj skupini i u skupini kojoj je davana najveća predviđena doza.
8.3.2.3. Prehrambeni aditivi kojima nije dodijeljen ADI
Moraju se jasno navesti razlozi za nedodjeljivanje ADI-a. Ako to izaziva zabrinutost i ako bi korištenje dodatka u hrani za životinje pridonijelo znatnom povećanju izloženosti potrošača, potrebna je potpuna ocjena toksičnosti.
Dodatna izloženost zbog korištenja u hrani za životinje može se ekstrapolirati iz podataka iz literature koji se odnose na rezidue.
Ako su potrebne studije rezidua, one se ograničavaju na usporedbu razina u tkivima ili proizvodima u netretiranoj skupini i u skupini kojoj je davana najveća predviđena doza.
8.3.3. Studije koje se odnose na sigurnost korištenja dodatka za primjenitelje/radnike
Primjenjuje se cijeli pododjeljak 3.3. Priloga II.
Pri ispitivanju sigurnosti korisnika u slučaju dodatka u hrani za životinje moraju se uzeti u obzir mjere predostrožnosti koje su utvrđene za rukovanje tim tvarima korištenim u hrani.
8.3.4. Studije koje se odnose na sigurnost korištenja dodatka za okoliš
Primjenjuje se pododjeljak 3.4. Priloga II.
8.4. Odjeljak IV: studije učinkovitosti dodatka
Ako je funkcija koja se predviđa za hranu za životinje jednaka onoj u hrani, možda dodatno dokazivanje učinkovitosti neće biti potrebno. U protivnom, zahtjevi u pogledu učinkovitosti jednaki su onima iz odjeljka IV. Priloga II.
8.5. Odjeljak V: plan praćenja nakon stavljanja na tržište
Ovaj odjeljak Priloga II. primjenjuje se u skladu s odredbama članka 7. stavka 3. točke (g) Uredbe (EZ) br. 1831/2003.
9. IZMJENE ODOBRENJA
Budući da se ocjena podataka dostavljenih za prethodna odobravanja može smatrati pouzdanom, dokumentacija koja se priprema za zahtjev na temelju članka 13. stavka 3. Uredbe (EZ) br. 1831/2003 treba ispunjavati samo dolje navedene zahtjeve.
U zahtjevu za izmjenom uvjeta postojećeg odobrenja, kao što su identifikacija, opis svojstava ili uvjeti korištenja dodatka, mora se dokazati da izmjena nema štetnih učinaka na ciljane vrste, potrošača, korisnika ili okoliš. U tu se svrhu može smatrati da se radi o identičnom dodatku ako su aktivna(-e) tvar(i), organizam(-mi) i uvjeti korištenja jednaki, ako je njegova čistoća u osnovi slična i nisu uvedeni novi sastojci koji izazivaju zabrinutost. Za takve se proizvode može dostaviti skraćeni zahtjev, budući da obično ne treba ponavljati studije kako bi se dokazala sigurnost za ciljane vrste, potrošača i okoliš te učinkovitost.
Zahtjev mora ispunjavati sljedeće uvjete:
|
1. |
primjenjuje se cijeli Prilog I. – to uključuje i podatke o traženim izmjenama; |
|
2. |
primjenjuje se cijeli odjeljak II. Priloga II.; |
|
3. |
moraju se dostaviti podaci koji pokazuju da su kemijska i biološka svojstva dodatka u biti jednaka svojstvima već dobro poznatog proizvoda; |
|
4. |
prema potrebi se mora dokazati bioekvivalencija, bilo pomoću specifikacije bilo pomoću objavljene literature ili na temelju posebnih ispitivanja. Ako se bioekvivalencija ne dokaže u potpunosti, mora se dokazati da je karencija u skladu s NDKR-om; |
|
5. |
moraju se dostaviti dokazi da je u svjetlu sadašnjih znanstvenih spoznaja i pod odobrenim uvjetima dodatak i dalje siguran za ciljane vrste, potrošače, radnike i okoliš; |
|
6. |
mora se dostaviti izvješće o rezultatima praćenja nakon stavljanja na tržište, ako odobrenje zahtijeva provođenje takvog praćenja; i |
|
7. |
konkretni podaci kojim se potkrepljuje zahtjev za izmjenama moraju se dostaviti u skladu s odgovarajućim dijelovima odjeljaka III., IV. i V. Priloga II. |
10. PRODULJENJE ODOBRENJA
Zahtjevi za produljenjem odobrenja na temelju članka 14. Uredbe (EZ) br. 1831/2003 moraju ispunjavati sljedeće zahtjeve:
10.1. Odjeljak I: sažetak dokumentacije
Primjenjuje se cijeli odjeljak I. Priloga II. Dostavlja se preslika izvornog odobrenja Zajednice za stavljanje na tržište dodatka u hrani za životinje ili zadnjeg produljenja odobrenja. Mora se pripremiti ažurirana dokumentacija u skladu s najnovijim zahtjevima te dostaviti popis svih izmjena nakon izvornog odobrenja ili nakon zadnjeg produljenja odobrenja. Podnositelj zahtjeva mora dostaviti sažetak dokumentacije u kojem obrazlaže opseg zahtjeva i navodi sve nove informacije u pogledu identiteta i sigurnosti dodatka, koje su postale dostupne nakon prethodnog odobrenja/produljenja.
10.2. Odjeljak II: identifikacija, opis svojstava i uvjeti korištenja dodatka; metode analize
Odjeljak II. Priloga II. primjenjuje se kako slijedi:
|
— |
za dodatke čije odobrenje glasi na određenog nositelja primjenjuje se cijeli odjeljak II.; |
|
— |
za ostale se dodatke primjenjuju stavci 2.1.2., 2.1.3., 2.1.4., 2.1.4.2., 2.2., 2.3.1., 2.3.2., 2.4.1., 2.4.2., 2.4.4., 2.5., 2.6. |
Moraju se navesti dokazi o tome da se sastav, čistoća ili djelovanje dodatka nisu bitno promijenili u odnosu na dodatak koji je odobren. Mora se ukazati na svaku promjenu u procesu proizvodnje.
10.3. Odjeljak III: studije sigurnosti korištenja dodatka
Moraju se dostaviti dokazi da je u svjetlu sadašnjih znanstvenih spoznaja i pod odobrenim uvjetima dodatak i dalje siguran za ciljane vrste, potrošače, radnike i okoliš. Moraju se dostaviti ažurirani podaci o sigurnosti za razdoblje od izvornog odobrenja ili zadnjeg produljenja odobrenja, koji će obuhvaćati sljedeće:
|
— |
izvješća o štetnim učincima i nesrećama (prethodno nepoznati učinci, značajni učinci bilo koje vrste, povećana pojava poznatih učinaka) kod ciljanih životinja, potrošača, korisnika i u okolišu. U izvješću o štetnim učincima navodi se vrsta učinka, broj zahvaćenih životinja/osoba/organizama, posljedice, uvjeti korištenja i procjena uzroka; |
|
— |
izvješća o prethodno nepoznatim interakcijama i unakrsnoj kontaminaciji; |
|
— |
prema potrebi, podatke iz praćenja rezidua; |
|
— |
podatke iz epidemioloških i/ili toksikoloških studija; |
|
— |
sve ostale informacije o sigurnosti dodatka i rizicima koje on predstavlja za životinje, ljude i okoliš. |
Ako se ne dostave dodatne informacije za bilo koji od ovih elemenata, moraju se jasno navesti razlozi.
Mora se dostaviti izvješće o rezultatima praćenja nakon stavljanja na tržište, ako prethodno odobrenje zahtijeva provođenje takvog praćenja.
Ako sukladno članku 14. stavku 2. točki (d) Uredbe (EZ) br. 1831/2003 zahtjev za produljenje odobrenja sadrži prijedlog za izmjenu ili dopunu uvjeta izvornog odobrenja, između ostalog i uvjeta u vezi s budućim praćenjem, konkretni podaci kojim se potkrepljuje zahtjev za izmjenama moraju se dostaviti u skladu s odgovarajućim dijelovima odjeljaka III., IV. i V. Priloga II.
11. PONOVNO OCJENJIVANJE ODREĐENIH DODATAKA KOJI SU VEĆ ODOBRENI NA TEMELJU DIREKTIVE 70/524/EEZ
Dodaci na koje se odnosi ova točka 11. jesu dodaci koji su bili odobreni na temelju Direktive 70/524/EEZ i moraju se ponovno ocijeniti u skladu s člankom 10. stavkom 2. Uredbe (EZ) br. 1831/2003, a pripadaju sljedećim skupinama:
|
— |
antioksidansi, |
|
— |
arome i tvari za poticanje teka, |
|
— |
emulgatori i stabilizatori, zgušnjivači i tvari za želiranje, |
|
— |
bojila, uključujući i pigmente, |
|
— |
konzervansi, |
|
— |
vitamini, provitamini i kemijski jasno definirane tvari koje imaju sličan učinak, |
|
— |
elementi u tragovima, |
|
— |
veziva, tvari za sprečavanje stvaranja gruda i koagulanti, |
|
— |
regulatori kiselosti, i |
|
— |
radionuklidna veziva. |
Opseg i kvaliteta ocjene rizika za ove dodatke slična je kao i kod ostalih dodataka. Međutim, s obzirom na to da je njihovo sigurno korištenje već dugo poznato, mogu su koristiti podaci iz već objavljenih studija, u skladu s odredbama ove Uredbe, kako bi se dokazalo da je pod odobrenim uvjetima dodatak i dalje siguran za ciljane vrste, potrošače, korisnike i okoliš.
11.1. Odjeljak I: sažetak dokumentacije
Primjenjuje se cijeli odjeljak I. Priloga II.
11.2. Odjeljak II: identifikacija, opis svojstava i uvjeti korištenja dodatka; metode analize
Odjeljak II. Priloga II. primjenjuje se kako slijedi:
|
— |
za dodatke čije odobrenje ne glasi na određenog nositelja primjenjuju se stavci 2.1.2., 2.1.3., 2.1.4., 2.1.4.2., 2.2., 2.3.1., 2.3.2., 2.4.1., 2.4.2., 2.4.4., 2.5., 2.6.; |
|
— |
za ostale dodatke čije odobrenje glasi na određenog nositelja primjenjuje se cijeli odjeljak II. |
11.3. Odjeljak III: studije sigurnosti korištenja dodatka
Ako je sigurnost dodatka za ciljane vrste, potrošače, primjenitelje/radnike i okoliš već procjenjena, dostavlja se sažetak studija o sigurnosti koje su dostavljene za prethodno odobrenje, zajedno sa svim novim informacijama do kojih se došlo u razdoblju nakon prethodnog odobrenja. Ako još nije obavljena formalna procjena sigurnosti korištenja tvari kao dodatka u hrani za životinje, mogu se koristiti studije i podaci iz znanstvene literature pod uvjetom da odgovaraju informacijama koje bi se zahtijevale za novi zahtjev. U protivnom se mora obaviti kompletna serija studija sigurnosti.
11.4. Odjeljak IV: studije učinkovitosti dodatka
Ispunjavanje zahtjeva u pogledu učinkovitosti, koji su predviđeni člankom 5. stavkom 3. Uredbe (EZ) br. 1831/2003, može se prema potrebi dokazati dostavljanjem i drugih materijala, osim studija, posebno onih koji se odnose na dugotrajno korištenje dodatka.
11.5. Odjeljak V: plan praćenja nakon stavljanja na tržište
Ovaj odjeljak Priloga II. primjenjuje se u skladu s odredbama članka 7. stavka 3. točke (g) Uredbe (EZ) br. 1831/2003.
(1) Ksenobiotik je kemijska tvar koja nije prirodni sastojak organizma koji joj je izložen. Može obuhvaćati i tvari koje su prisutne u mnogo većim koncentracijama od uobičajenih.
(2) Za potrebe ove Uredbe, „proces siliranja” je proces u kojem se prirodna razgradnja organske tvari kontrolira zakiseljavanjem u anaerobnim uvjetima do kojih dolazi zbog prirodne fermentacije i/ili dodavanja dodatka za siliranje.
(3) Identifikacijski broj za kemijski definirane aromatske tvari koji se koristi u FLAVIS-u, informacijskom sustavu EU-a o aromatskim tvarima; radi se o bazi podataka koja se koristi u okviru Uredbe Komisije (EZ) br. 1565/2000 od 18. srpnja 2000. (SL L 180, 19.7.2000., str. 8.) o uvođenju mjera potrebnih za donošenje plana ocjenjivanja u skladu s Uredbom (EZ) br. 2232/96 Europskog parlamenta i Vijeća (SL L 299, 23.11.1996., str. 1.).
(4) Br. CoE: Broj koji Vijeće Europe koristi za botanički definirane aromatske tvari u svom Izvješću br. 1. „Natural sources of flavourings” (Prirodni izvori aroma), svezak I., Strasbourg 2000. i u kasnijim svescima.
(5) Broj CAS (CAS No) je broj iz registra službe Chemical Abstracts Service; to je jedinstveni identifikator kemijskih tvari koji je u širokoj uporabi u popisima kemijskih tvari.
(6) Za potrebe ovog odjeljka ove Uredbe „tvar koja predstavlja toksikološki rizik” znači tvar za koju je utvrđen dopušteni dnevni ili tjedni unos (TDI ili TWI) ili ADI, ili tvar za koju je utvrđeno ograničenje u vezi s uporabom, ili tvar koja ima aktivno djelovanje kako je definirano Direktivom Vijeća 88/388/EEZ o aromama za uporabu u prehrambenim proizvodima i sirovinama za njihovu proizvodnju, ili neželjena tvar.
(7) Definirani u Dodatku 4. Izvješću br. 1. Vijeća Europe „Natural sources of flavourings” (Prirodni izvori aroma), svezak I., Strasbourg 2000.
(8) Odgovarajući prag koji predlaže JECFA (FAO/WHO, 1996., Food additive series 35, IPCS, WHO, Ženeva) treba prilagoditi za ciljane životinje tako da se uzme u obzir masa životinja i unos hrane.
(9) SL L 180, 19.7.2000., str. 8.
(10) Smjernica za utvrđivanje najvećih dopuštenih količina rezidua u ribama iz porodice Salmonidae i drugim ribama. Europska agencija za ocjenu medicinskih proizvoda. Jedinica za ocjenu veterinarskih lijekova. EMEA/CVMP/153b/97-FINAL.
PRILOG IV.
Kategorije i definicije ciljanih životinja i minimalno trajanje ispitivanja učinkovitosti
1. tablica. Kategorija životinja: svinje
|
Kategorija |
Definicija kategorije životinja |
Približno razdoblje (masa/dob) |
Minimalno trajanje dugoročnih studija učinkovitosti |
||
|
Razdoblje/dob |
Dob |
Masa |
|||
|
Prasad (koja siše) |
Mlade svinje koje dobivaju mlijeko od krmača |
Od rođenja |
Do 21 – 42 dana |
Do 6 – 11 kg |
14 dana |
|
Prasad (odbijena) |
Mlade svinje koje su završile razdoblje sisanja i uzgajaju se za rasplod ili proizvodnju mesa |
Od 21 – 42 dana |
Do 120 dana |
Do 35 kg |
42 dana |
|
Prasad (koja siše i odbijena prasad) |
Mlada svinja od rođenja, koja se uzgaja za rasplod ili proizvodnju mesa |
Od rođenja |
Do 120 dana |
Do 35 kg |
58 dana |
|
Svinje za tov |
Svinje koje su završile razdoblje odbića i namijenjene su za proizvodnju mesa, do dana prijevoza u klaonicu |
Od 60 – 120 dana |
Do 120 – 250 dana (ili prema lokalnom običaju) |
80 – 150 kg (ili prema lokalnom običaju) |
Do postizanja mase za klanje, ali ne kraće od 70 dana |
|
Krmače za rasplod |
Ženke svinja koje su najmanje jednom osjemenjene/pripuštene |
Od prvog osjemenjivanja |
|
|
Od osjemenjivanja do kraja drugog razdoblja odbića (dva ciklusa) |
|
Krmače, za postizanje pozitivnih učinaka kod prasadi |
Ženke svinja koje su najmanje jednom osjemenjene/pripuštene |
|
|
|
Najmanje dva tjedna prije prasenja do kraja razdoblja odbića |
2. tablica. Kategorija životinja: perad
|
Kategorija |
Definicija kategorije životinja |
Približno razdoblje (masa/dob) |
Minimalno trajanje dugoročnih studija učinkovitosti |
||
|
Razdoblje/dob |
Dob |
Masa |
|||
|
Pilići za tov |
Životinje koje se uzgajaju za tov |
Od valenja |
Do 35 dana |
Do oko 1 600 g (do 2 kg) |
35 dana |
|
Pilenke |
Ženke koje se uzgajaju za proizvodnju konzumnih jaja ili za rasplod |
Od valenja |
Do oko 16 tjedana (do 20 tjedana) |
— |
112 dana (ako nisu dostupni podaci o učinkovitosti za tovne piliće) |
|
Nesilice |
Kokoši koje se drže za proizvodnju jaja |
Od 16 – 21 tjedna |
Do oko 13 mjeseci (do 18 mjeseci) |
Od 1 200 g (bijele), 1 400 g (smeđe) |
168 dana |
|
Purani za tov |
Životinje koje se uzgajaju za tov |
Od valenja |
Do 14 tjedana (do 20 tjedana) Do oko 16 tjedana (do 24 tjedna) |
Pure: do oko 7 000 g (do 10 000 g) Purani: do oko 12 000 g (do 20 000 g) |
84 dana |
|
Purani za rasplod |
Mužjaci i ženke koji se drže za rasplod |
Cijelo razdoblje |
Od 30 do oko 60 tjedana |
Pure: od oko 15 000 g Purani: od oko 30 000 g |
Najmanje šest mjeseci |
|
Purani koji se uzgajaju za rasplod |
Mladi mužjaci i ženke koji se uzgajaju za rasplod |
Od valenja |
Do 30 tjedana |
Pure: do oko 15 000 g Purani: do oko 30 000 g |
Cijelo razdoblje (ako nisu dostupni podaci o učinkovitosti za purane za tov) |
3. tablica. Kategorija životinja: goveda (domaća goveda, uključujući vrste Bubalus i Bison)
|
Kategorija |
Definicija kategorije životinja |
Približno razdoblje (masa/dob) |
Minimalno trajanje dugoročnih studija učinkovitosti |
||
|
Razdoblje/dob |
Dob |
Masa |
|||
|
Telad za uzgoj |
Telad koja se uzgaja za rasplod ili za proizvodnju govedine |
Od rođenja |
Do 4 mjeseca |
Do 60–80 kg (do 145 kg) |
56 dana |
|
Telad za tov |
Telad za proizvodnju teletine |
Od rođenja |
Do 6 mjeseci |
Do 180 kg (do 250 kg) |
Do klanja, ali ne kraće od 84 dana |
|
Goveda za tov |
Goveda koja su završila razdoblje odbića i namijenjena su za proizvodnju mesa, do dana prijevoza u klaonicu |
Od potpunog razvoja predželuca |
Do 10–36 mjeseci |
Do 350–700 kg |
168 dana |
|
Mliječne krave za proizvodnju mlijeka |
Ženke goveda koje su otelile najmanje jedno tele |
|
|
|
84 dana (izvještava se o cijelom razdoblju laktacije) |
|
Krave za rasplod |
Ženke goveda koje su najmanje jednom osjemenjene/pripuštene |
Od prvog osjemenjivanja do kraja drugog razdoblja odbića |
|
|
Dva ciklusa (ako su potrebni reprodukcijski parametri) |
4. tablica. Kategorija životinja: ovce
|
Kategorija |
Definicija kategorije životinja |
Približno razdoblje (masa/dob) |
Minimalno trajanje dugoročnih studija učinkovitosti |
||
|
Razdoblje/dob |
Dob |
Masa |
|||
|
Janjci za uzgoj |
Janjci koji se uzgajaju za budući rasplod |
Od rođenja |
Do 3 mjeseca |
15–20 kg |
56 dana |
|
Janjci za tov |
Janjci koji se uzgajaju za proizvodnju janjetine |
Od rođenja |
Do 6 mjeseci (ili stariji) |
Do 55 kg |
Do postizanja mase za klanje, ali ne kraće od 56 dana |
|
Mliječne ovce (za proizvodnju mlijeka) |
Ovce koje su ojanjile najmanje jedno janje |
|
|
|
84 dana (izvještava se o cijelom razdoblju laktacije) |
|
Ovce za rasplod |
Ovce koje su najmanje jednom osjemenjene/pripuštene |
Od prvog osjemenjivanja do kraja drugog razdoblja odbića |
|
|
Dva ciklusa (ako su potrebni reprodukcijski parametri) |
5. tablica. Kategorija životinja: koze
|
Kategorija |
Definicija kategorije životinja |
Približno razdoblje (masa/dob) |
Minimalno trajanje dugoročnih studija učinkovitosti |
||
|
Razdoblje/dob |
Dob |
Masa |
|||
|
Jarad za uzgoj |
Mlade koze koje se uzgajaju za budući rasplod |
Od rođenja |
Do 3 mjeseca |
15–20 kg |
Najmanje 56 dana |
|
Jarad za tov |
Mlade koze koje se uzgajaju za proizvodnju jaretine |
Od rođenja |
Do 6 mjeseci |
|
Najmanje 56 dana |
|
Mliječne koze (za proizvodnju mlijeka) |
Koze koje su ojarile najmanje jedno jare |
|
|
|
84 dana (izvještava se o cijelom razdoblju laktacije) |
|
Koze za rasplod |
Koze koje su najmanje jednom osjemenjene/pripuštene |
Od prvog osjemenjivanja do kraja drugog razdoblja odbića |
|
|
Dva ciklusa (ako su potrebni reprodukcijski parametri) |
6. tablica. Kategorija životinja: ribe
|
Kategorija |
Definicija kategorije životinja |
Približno razdoblje (masa/dob) |
Minimalno trajanje dugoročnih studija učinkovitosti |
||
|
Razdoblje/dob |
Dob |
Masa |
|||
|
Losos i pastrva |
|
|
|
200–300 g |
90 dana ili dok se početna masa tijela ne udvostruči |
|
Losos i pastrva |
Matični fond |
Što je moguće bliže razdoblju mrijesta |
|
|
90 dana |
7. tablica. Kategorija životinja: kunići
|
Kategorija |
Definicija kategorije životinja |
Približno razdoblje (masa/dob) |
Minimalno trajanje dugoročnih studija učinkovitosti |
||
|
Razdoblje/dob |
Dob |
Masa |
|||
|
Kunići koji sišu i odbijeni kunići |
|
Počevši tjedan dana nakon rođenja |
|
|
56 dana |
|
Kunići za tov |
Kunići koji se uzgajaju za proizvodnju mesa |
Nakon odbića |
Do 8–11 tjedana |
|
42 dana |
|
Ženke kunića (za rasplod) |
Ženke kunića koje su najmanje jednom osjemenjene/pripuštene |
Od osjemenjivanja do kraja drugog razdoblja odbića |
|
|
Dva ciklusa (ako su potrebni reprodukcijski parametri) |
|
Ženke kunića (za postizanje pozitivnih učinaka kod mladih kunića) |
Ženke kunića koje su najmanje jednom osjemenjene |
Od osjemenjivanja |
|
|
Najmanje dva tjedna prije poroda do kraja razdoblja odbića (npr. za proizvod s mikroorganizmima) |
8. tablica. Kategorija životinja: konji
|
Kategorija |
Definicija kategorije životinja |
Približno razdoblje (masa/dob) |
Minimalno trajanje dugoročnih studija učinkovitosti |
||
|
Razdoblje/dob |
Dob |
Masa |
|||
|
Konji |
Sve kategorije |
|
|
|
56 dana |