PRILOG I.
SHEMA TESTIRANJA ZA DIJAGNOSTICIRANJE, DETEKCIJU I IDENTIFIKACIJU UZROČNIKA PRSTENASTE TRULEŽI, BAKTERIJE CLAVIBACTER MICHIGANENSIS (Smith) Davis et al. ssp. SEPEDONICUS (Spieckermann et Kotthoff) Davis et al.
OPSEG SHEME TESTIRANJA
Prikazana shema opisuje različite postupke za:
|
i. |
dijagnosticiranje prstenaste truleži u gomoljima ili biljkama krumpira; |
|
ii. |
detekciju bakterije Clavibacter michiganensis ssp. sepedonicus u uzorcima gomolja ili biljaka krumpira; |
|
iii. |
identifikaciju bakterije Clavibacter michiganensis ssp. sepedonicus (C. m. subsp. sepedonicus). |
OPĆA NAČELA
U dodacima su navedeni optimizirani protokoli za različite metode, validirani reagensi i pojedinosti za pripremu materijala za testiranje i kontrolnih materijala. U Dodatku 1. naveden je popis laboratorija koji su uključeni u optimizaciju i validaciju protokola.
S obzirom da protokoli uključuju detekciju karantenskog organizma i uključivat će uporabu vijabilnih kultura C. m. subsp. sepedonicus kao kontrolnih materijala, postupci će se morati provoditi u primjerenim karantenskim uvjetima s prikladnim objektima za zbrinjavanje otpada i prema uvjetima prikladnih dozvola koje izdaju službena nadležna tijela za biljnu karantenu.
Parametri testiranja moraju osigurati dosljednu i ponovljivu detekciju razina C. m. subsp. sepedonicus prema navedenim pragovima detekcije za odabrane metode.
Precizna priprema pozitivnih kontrola je nužna.
Testiranje u skladu sa zahtijevanim pragovima detekcije također podrazumijeva pravilno postavljanje, održavanje i kalibriranje opreme, pažljivo rukovanje i pohranjivanje reagensa i sve mjere za sprečavanje kontaminacije među uzorcima, npr. razdvajanje pozitivnih kontrola od uzoraka za testiranje. Moraju se primijeniti standardi kontrole kvalitete kako bi se izbjegle administrativne i druge pogreške, posebno u vezi označivanja i dokumentacije.
Sumnja na zarazu, kako je navedeno u članku 4. stavku 2. Direktive 93/85/EEZ, podrazumijeva pozitivan rezultat testa za dijagnosticiranje ili testova provjere koji se provode na uzorku kao što je prikazano u dijagramima toka.
Ako je prvi test provjere (IF ili PCR/FISH) pozitivan, tada se sumnja na zarazu bakterijom Cms i mora se provesti drugi test provjere. Ako je drugi test provjere pozitivan, tada je sumnja potvrđena (sumnja na zarazu) i mora se nastaviti testiranje u skladu sa shemom testiranja. Ako je drugi test provjere negativan, tada se smatra da uzorak nije zaražen bakterijom Cms.
Stoga se, pozitivan test IF, kako je navedeno u članku 4. stavku 2., određuje pozitivnim očitanjem IF testa koje je potvrđeno drugim testom provjere (PCR/FISH).
Potvrđena nazočnost, kako je navedeno u članku 5. stavku 1. Direktive 93/85/EEZ, podrazumijeva izolaciju i identifikaciju čiste kulture C. m. subsp. sepedonicus s potvrdom patogenosti.
1. PRIKAZ DIJAGRAMA TOKA
1.1. Shema za detekciju i dijagnosticiranje uzročnika prstenaste truleži u gomoljima i biljkama krumpira sa simptomima prstenaste truleži
Postupak testiranja je namijenjen za gomolje i biljke krumpira sa simptomima tipičnim za ili simptomima koji pobuđuju sumnju na prstenastu trulež. Uključuje brzi test provjere, izolaciju patogena iz zaraženoga provodnog tkiva na dijagnostičkoj hranjivoj podlozi i, u slučaju pozitivnog rezultata, identifikaciju kulture kao bakterije C. m. subsp. sepedonicus.
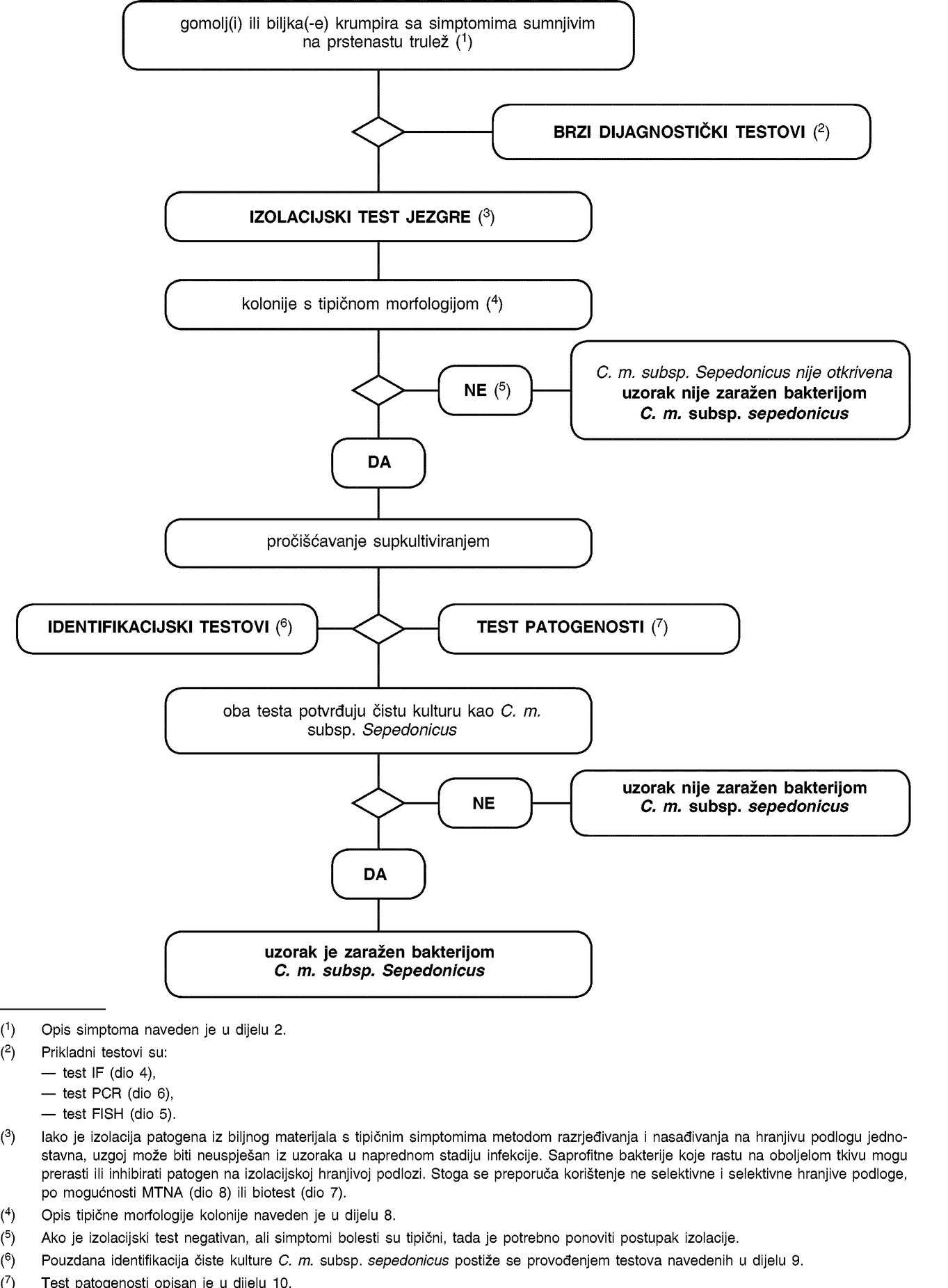
1.2. Shema za detekciju i identifikaciju bakterije Clavibacter michiganensis ssp. sepedonicus u uzorcima gomolja krumpira bez simptoma
Načelo
Postupak testiranja namijenjen je za detekciju skrivene zaraze u gomoljima krumpira. Pozitivan rezultat iz najmanje dva testa provjere, koji se temelje na različitim biološkim načelima, mora se dopuniti izolacijom patogena, nakon kojeg slijedi, u slučaju izolacije tipičnih kolonija, potvrda čiste kulture kao C. m. subsp. sepedonicus. Pozitivan rezultat samo jednog od testova provjere nije dovoljan da bi se uzorak smatrao sumnjivim.
Testovi provjere i izolacija moraju dopuštati prag otkrivanja od 103 do 104 stanica/ml resuspendiranog taloga, uključenog kao pozitivne kontrole u svakoj seriji testova.


1.3. Shema za detekciju i identifikaciju bakterije Clavibacter michiganensis ssp. sepedonicus u uzorcima biljaka krumpira bez simptoma


2. VIZUALNI PREGLED ZA OTKRIVANJE SIMPTOMA PRSTENASTE TRULEŽI
2.1. Biljke krumpira
U europskim vremenskim uvjetima simptomi se rijetko pronalaze u polju i često tek na kraju sezone. Osim toga, simptomi su često prikriveni ili se zamjenjuju s drugim bolestima, starenjem ili mehaničkim oštećenjima. Stoga možemo vrlo lako previdjeti simptome prilikom pregleda u polju. Simptomi venuća vrlo su različiti od simptoma smeđe truleži; venuće je obično polagano i u početku ograničeno na rubove listova. Mladi zaraženi listovi često se nastavljaju razvijati iako manje u zaraženim dijelovima. To uzrokuje listove neobičnih oblika. Listovi pogođeni blokadom provodnog tkiva u donjem dijelu stabljike često imaju klorotične, žuto-narančaste dijelove između lisnih žila. Zaraženi listići, listovi, čak i stabljike mogu s vremenom odumrijeti. Često su listovi i gomolji samo manje veličine. Povremeno su biljke zakržljale. Slike u boji različitih simptoma mogu se pronaći na mrežnoj stranici: http://forum.europa.eu.int/Public/irc/sanco/Home/main
2.2. Gomolji krumpira
Najraniji simptomi su lagana staklenost ili prozirnost tkiva bez omekšanja oko provodnog sustava, posebno u blizini pupka. Provodni prsten na pupku može biti malo tamnije boje od uobičajene. Prvi lako uočljivi simptom je žućkasta boja provodnog prstena, a kada se gomolj nježno stisne, iz žila se iscijede male količine sirastog materijala. Taj iscjedak sadrži milijune bakterija. Provodno tkivo može posmeđiti i simptomi gomolja u ovom stadiju slični su simptomima smeđe truleži koju uzrokuje Ralstonia solanacearum. U početku, ti simptomi mogu biti ograničeni na jedan dio prstena, ne nužno blizu pupka, i mogu se postupno proširiti na cijeli prsten. Kako infekcija napreduje, dolazi do propadanja provodnog tkiva; vanjska kora može se odvojiti od unutarnje kore. U naprednim stadijima infekcije, na površini gomolja pojavljuju se pukotine, koje su često crvenkasto-smeđe po rubovima. Nedavno se u Europi pojavilo nekoliko slučajeva u kojima je središte gomolja trunulo istodobno s provodnim prstenom što je dovelo do sekundarnog napada s unutarnjim stvaranjem šupljina i nekrozom. Sekundarni gljivični ili bakterijski napad može prikriti simptome i može biti teško, čak nemoguće, razlikovati uznapredovale simptome prstenaste truleži od drugih truleži gomolja. Mogući su netipični simptomi. Slike u boji različitih simptoma mogu se pronaći na mrežnoj stranici: http://forum.europa.eu.int/Public/irc/sanco/Home/main
3. PRIPREMA UZORAKA
3.1. Gomolji krumpira
Napomena:
|
— |
Standardna veličina uzorka je 200 gomolja po testu. Intenzivnije uzorkovanje zahtijeva više testova na uzorcima te veličine. Veći brojevi gomolja u uzorku dovest će do inhibicije ili će otežati tumačenje rezultata. Međutim, postupak se može prikladno primijeniti za uzorke s manje od 200 gomolja, kada je na raspolaganju manje gomolja. |
|
— |
Validacija svih metoda za detekciju, opisanih dalje u tekstu, temelji se na testiranju uzoraka od 200 gomolja. |
|
— |
Ekstrakt krumpira, opisan dalje u tekstu, također se može koristiti za detekciju uzročnika smeđe truleži krumpira, bakterije Ralstonia solanacearum. |
Neobavezna obrada prije pripreme uzorka:
Operite gomolje. Upotrijebite prikladna dezinfekcijska sredstva (spojeve klora kada će se provoditi test PCR kako bi se uklonila moguća DNK patogena) i deterdžente između svakog uzorka. Osušite gomolje na zraku. Taj postupak pranja je posebno koristan (ali ne obvezan) za uzorke s previše zemlje i ako će se provesti test PCR ili direktna izolacija.
3.1.1. Čistim i dezinficiranim skalpelom ili nožem za povrće uklonite kožu na krajevima pupka svakoga gomolja tako da provodno tkivo postane vidljivo. Pažljivo izrežite malu jezgru provodnog tkiva na kraju pupka i pazite da zahvatite što manje neprovodnog tkiva (vidjeti mrežnu stranicu: http://forum.europa.eu.int/Public/irc/sanco/Home/main)
Napomena:
Stavite na stranu sve gomolje s mogućim simptomima prstenaste truleži i testirajte posebno.
Ako tijekom odstranjivanja jezgre pupka opazite moguće simptome prstenaste truleži, gomolj treba vizualno pregledati nakon što se prereže blizu pupka. Svaki prerezani gomolj s mogućim simptomima treba ostaviti na sobnoj temperaturi dva dana da subverzira i zatim pohraniti u karantenskim uvjetima (na 4 do 10 °C) sve dok se ne dovrše svi testovi. Svi gomolji u uzorku (uključujući i one s mogućim simptomima) trebaju se čuvati u skladu s Prilogom II.
3.1.2. Stavite jezgre pupka u neupotrijebljene posude za jednokratnu uporabu koje se mogu zatvoriti i/ili zapečatiti (u slučaju da se posude koriste više puta, potrebno ih je temeljito očistiti i dezinficirati spojevima klora). Poželjno je da se jezgre pupka odmah obrade. Ako to nije moguće, čuvajte ih u posudi, bez dodavanja pufera, u hladnjaku najdulje 72 sata ili na sobnoj temperaturi najdulje 24 sata. Sušenje i suberizacija jezgri, kao i rast saprofita tijekom pohrane mogu ometati detekciju bakterije uzročnika prstenaste truleži.
3.1.3. Obradite jezgre pupka jednim od sljedećih postupaka: ili,
|
(a) |
prekrijte jezgre dovoljnom količinom (približno 40 ml) ekstrakcijskog pufera (Dodatak 3) i tresite na rotacijskoj tresilici (50 do 100 okretaja/min) četiri sata na temperaturi ispod 24 °C ili 16 do 24 sati uz hlađenje, ili |
|
(b) |
homogenizirajte jezgre dovoljnom količinom (približno 40 ml) ekstrakcijskog pufera (Dodatak 3), bilo u miješalici (npr. Waring ili Ultra Thurax) bilo drobljenjem u dobro zatvorenoj maceracijskoj vrećici za jednokratnu uporabu (npr. vrećice Stomacher ili Bioreba od čvrstog politena, 150 mm × 250 mm; sterilizirane zračenjem) pri čemu koristite gumeni bat ili prikladan aparat za mljevenje (npr. Homex). |
Napomena:
Opasnost od unakrsne kontaminacije uzoraka je velika kada se uzorci homogeniziraju miješalicom. Poduzmite mjere opreza kako biste spriječili nastanjenje aerosola ili razlijevanje tijekom postupka ekstrakcije. Pobrinite se da se za svaki uzorak koriste svježi sterilizirani rezači i posude miješalice. Ako provodite test PCR, izbjegavajte prijenos DNK na spremnike ili aparate za mljevenje. Preporuča se drobljenje u vrećicama za jednokratnu uporabu i korištenje epruveta za jednokratnu uporabu prilikom testa PCR.
3.1.4. Odlijte supernatant. Ako je previše mutan, razbistrite ga sporim centrifugiranjem na maloj brzini (ne više od 180 g za 10 minuta na temperaturi od 4 do 10 °C) ili vakuumskom filtracijom (40 do 100 μm), pri čemu filtar operite dodatnim (10 ml) ekstrakcijskim puferom (Dodatak 3).
3.1.5. Koncentrirajte bakterijsku frakciju centrifugiranjem na 7 000 g 15 minuta (ili 10 000 g 10 minuta) na temperaturi od 4 do 10 °C i odlijte supernatant pazeći pri tom da se ne pomiješa talog.
3.1.6. Resuspendirajte pelet u 1,5 ml pufera za talog (Dodatak 3). Upotrijebite 500 μl za testiranje na C. m. subsp. sepedonicus, 500 μl za Ralstonia solanacearum i 500 μl kao referentni materijal. Dodajte sterilni glicerol konačnoj koncentraciji od 10 do 25 % (v/v) 500 μl referentnog alikvota i preostalom testnom alikvotu, promiješajte na vrtložnoj miješalici i uskladištite na temperaturi od – 16 do – 24 °C (tjednima) ili na – 68 do – 86 °C (mjesecima). Testne alikvote čuvajte na 4 do 10 °C tijekom testiranja.
Ne preporuča se višekratno zamrzavanje i otapanje.
Ako je potreban transport ekstrakta, osigurajte dostavu u prijenosnome hladnjaku u roku od 24 do 48 sati.
3.1.7. Krajnje je nužno da se sve pozitivne kontrole i uzorci bakterije C. m. subsp. sepedonicus tretiraju odvojeno kako bi se izbjegla zaraza. To se primjenjuje na stakalca za IF i sve ostale testove.
3.2. Biljke krumpira
Napomena:
Za detekciju latentnih populacija bakterije C. m. subsp. sepedonicus preporuča se testiranje sastavljenih uzoraka. Postupak se može prikladno primijeniti na sastavljene uzorke s do 200 dijelova stabljike. (Kada se provode istraživanja, trebaju se temeljiti na statistički reprezentativnom uzorku biljne populacije koja se ispituje).
3.2.1. Čistim dezinficiranim nožem ili vrtlarskim škarama odrežite dio dug 1 do 2 cm s donjeg dijela svake stabljike, odmah iznad površine zemlje.
Kratko dezinficirajte dijelove stabljike 70 %-tnim etanolom i odmah posušite papirnatim ručnikom.
Stavite dijelove stabljike u zatvorenu sterilnu posudu prema jednom od sljedećih postupaka uzorkovanja:
3.2.2. Obradite dijelove stabljike pomoću jednog od sljedećih postupaka: ili,
|
(a) |
prekrijte dijelove dovoljnom količinom (približno 40 ml) ekstrakcijskog pufera (Dodatak 3) i protresite na rotacijskoj tresilici (50 do 100 okretaja/min) četiri sata na temperaturi ispod 24 °C ili 16 do 24 sata uz hlađenje, ili |
|
(b) |
obradite odmah drobljenjem u čvrstoj vrećici za maceraciju (npr. Stomacher ili Bioreba) s primjerenom količinom ekstrakcijskog pufera (Dodatak 3) pri čemu koristite gumeni bat ili prikladan aparat za mljevenje (npr. Homex). Ako to nije moguće, dijelove stabljike čuvajte u hladnjaku najdulje 72 sata ili na sobnoj temperaturi nadulje 24 sata. |
3.2.3. Odlijte supernatant nakon što se taložio 15 minuta.
3.2.4. Dodatno bistrenje ekstrakta ili koncentracije bakterijske frakcije obično nije potrebno, ali može se postići filtriranjem i/ili centrifugiranjem kao što je opisano u dijelu 3.1.4 do 3.1.6.
3.2.5. Podijelite čisti ili koncentrirani ekstrakt na dva jednaka dijela. Jednu polovicu čuvajte na temperaturi od 4 do 10 °C tijekom testiranja i pohranite drugu polovicu s 10 do 25 % (v/v) sterilnoga glicerola na temperaturi od – 16 do – 24 °C (tjednima) ili na – 68 do – 86 °C (mjesecima) u slučaju da je potrebno daljnje testiranje.
4. IF TEST
Načelo
Uporaba testa IF kao glavnog testa provjere preporuča se zbog njegove dokazane dosljednosti pri postizanju zahtijevanih pragova detekcije.
Kada se test IF koristi kao glavni test provjere i ako je očitanje IF pozitivno, mora se izvršiti test PCR ili test FISH kao drugi test provjere. Kada se test IF koristi kao drugi test provjere i očitanje IF je pozitivno, potrebno je daljnje testiranje prema dijagramu toka kako bi se dovršila analiza.
Napomena:
Uvijek koristite poliklonsko antitijelo kada se test IF koristi kao glavni test provjere. U slučaju pozitivnog očitanja IF s poliklonskim antitijelom, daljnja provjera uzorka s monoklonskim antitijelom može omogućiti veću specifičnost, ali može biti manje osjetljiva.
Upotrijebite antitijela na referentni soj C. m. subsp. sepedonicus. Preporuča se da se titar odredi za svaku novu seriju antitijela. Titar se definira kao najveće razrjeđenje kod kojeg dolazi do optimalne reakcije kada se testira suspenzija koja sadrži 105 do 106 stanica po ml homolognog soja C. m. subsp. sepedonicus i korištenjem prikladnog fluorescein-izotiocijanat (FITC) konjugiranih antitijela u skladu s preporukama proizvođača. Nerazrjeđena poliklonska i monoklonska antitijela trebaju imati titar IF najmanje 1:2 000. Tijekom testiranja treba koristiti radna razrjeđenja (WD) antitijela, koja su blizu ili jednaka titru. Koristite validirana antitijela (vidjeti mrežnu stranicu: http://forum.europa.eu.int/Public/irc/sanco/Home/main).
Test treba provesti na svježe pripremljenim ekstraktima uzorka. Ako je potrebno, može se uspješno provesti na ekstraktima pohranjenim na temperaturi od – 68 do – 86 °C s dodatkom glicerola. Glicerol se može ukloniti s uzorka dodavanjem 1 ml pufera za talog (Dodatak 4), ponovnim centrifugiranjem 15 minuta na 7 000 g i resuspendiranjem u jednakom volumenu pufera za talog. To često nije potrebno, posebno ako su uzorci plamenom fiksirani na stakalca (vidjeti 2.2).
Za pozitivnu kontrolu pripremite odvojena stakalca s homolognim sojem ili nekim drugim referentnim sojem C. m. subsp. sepedonicus, suspendiranog u ekstraktu krumpira, kako je navedeno u Dodatku 2, ili po izboru u puferu.
Kada je to moguće, potrebno je koristiti prirodno zaraženo tkivo (održavano liofilizacijom ili zamrzavanjem na –16 to –24 °C) kao sličnu kontrolu na istom stakalcu.
Za negativne kontrole, upotrijebite alikvote ekstrakta uzorka koji je u ranijem testiranju pokazao negativan rezultat.
Koristite predmetna stakalca s više jažica, po mogućnosti s 10 jažica promjera najmanje 6 mm.
Kontrolni materijal testirajte na isti način kao i uzorak (uzorke).
4.1. Pripremite stakalca za testiranje prema jednom od sljedećih postupaka:
|
i. |
Za taloge s relativno malo škroba: U prvu jažicu pipetom odmjerite standardni volumen (15 μl je prikladno za jažice promjera 6 mm – povećajte volumen za veće jažice) razrjeđenja od 1/100 resuspendiranog taloga krumpira. Potom pipetom odmjerite slični volumen nerazrijeđene suspenzije taloga (1/1) na preostale jažice u redu. Drugi red se može upotrijebiti kao duplikat ili za drugi uzorak kako je prikazano na slici 1. |
|
ii. |
Za druge suspenzije taloga: Pripremite decimalna razrijeđenja (1/10 i 1/100) resuspendiranog taloga u puferu za talog. Pipetom odmjerite standardni volumen (15 μl je prikladno za jažice promjera 6 mm – povećajte volumen za veće jažice) resuspendiranog taloga i svakog razrjeđenja na red jažica. Drugi red se može upotrijebiti kao duplikat ili za drugi uzorak kao što je prikazano na slici 2. |
4.2. Posušite kapljice na sobnoj temperaturi ili zagrijavanjem na temperaturi od 40 do 45 °C. Fiksirajte bakterijske stanice na stakalce ili zagrijavanjem (15 minuta na 60 °C), provlačenjem kroz plamen, s 95 %-tnim etanolom ili u skladu s posebnim uputama dobavljača antitijela.
Ako je potrebno, fiksirana stakalca se zatim mogu čuvati zamrznuta u suhom spremniku što je moguće kraće vrijeme (do najviše 3 mjeseca) prije daljnjeg testiranja.
4.3. Postupak IF:
|
i. |
U skladu s pripremom testnih stakalca u 4.1.i.: Pripremite niz dvostrukih razrjeđenja antitijela u puferu IF. Prva jažica treba imati 1/2 titra (T/2), a ostale 1/4 titra (T/4), 1/2 titra (T/2), titar (T) i dvostruki titar (2T). |
|
ii. |
U skladu s pripremom testnih stakalca 4.1.ii.: Pripremite radno razrjeđenje (WD) antitijela u puferu IF. Radno razrjeđenje utječe na specifičnost. 

|
4.3.1. Rasporedite stakalca na vlažni papir. Potpuno pokrijte svaku jažicu razrjeđenjem antitijela. Volumen antitijela koji se stavlja u pojedinu jažicu mora bit barem jednak volumenu upotrijebljenog ekstrakta.
Ako nema posebnih uputa dobavljača antitijela, potrebno je provesti sljedeći postupak:
4.3.2. Inkubirajte stakalca na vlažnom papiru, pokrivena, 30 minuta na sobnoj temperaturi (18 do 25 °C).
4.3.3. Otresite kapljice sa svakog stakalca i pažljivo ih isperite puferom IF. Operite ih tako da uronite 5 minuta u IF pufer - Tween (Dodatak 3) i zatim 5 minuta u pufer IF. Izbjegavajte stvaranje aerosola ili prijenosa kapljica, što bi moglo dovesti do unakrsne kontaminacije. Pažljivo osušite upijajućim papirom.
4.3.4. Rasporedite stakalca na vlažnom papiru. Prekrijte jažice razrjeđenjem konjugata FITC koji se koristi za određivanje titra. Volumen konjugata koji se nanosi na jažice mora biti jednak volumenu nanesenog antitijela.
4.3.5. Inkubirajte stakalca na vlažnom papiru, pokrivena, 30 minuta na sobnoj temperaturi (18 do 25 °C).
4.3.6. Otresite kapljice konjugata sa stakalca. Isplahnite i operite kako je prethodno opisano (4.3.3).
Pažljivo osušite.
4.3.7. Pipetom nanesite 5 do 10 μl 0,1M glicerola s fosfatnim puferom (Dodatak 3) ili sredstvo protiv izbjeljivanja koje je dostupno na tržištu na svaku jažicu i stavite pokrivno stakalce.
4.4. Očitavanje testa IF:
4.4.1. Pregledajte stakalca za testiranje pod epifluorescentnim mikroskopom s odgovarajućim filtrima za ekstrakciju FITC-a, za imerziju u ulju ili vodi pri povećanju od 500 do 1 000. Pregledajte jažice preko dva međusobno okomita promjera i duž vanjskog ruba. Za uzorke u kojima je vidljiv mali broj stanica ili ih uopće nema pregledajte najmanje 40 mikroskopskih vidnih polja.
Prvo pregledajte stakalce s pozitivnom kontrolom. Stanice moraju snažno fluorescirati i biti potpuno obojene na određenom titru antitijela ili radnog razrjeđenja. Test IF (dio 4) mora se ponoviti u slučaju da kod obojenosti dođe do odstupanja.
4.4.2. Tražite jasno fluorescirajuće stanice s tipičnom morfologijom C. m. subsp. sepedonicus u jažicama stakalca za testiranje (vidjeti mrežne stranice: http://forum.europa.eu.int/Public/irc/sanco/Home/main). Intenzitet fluorescencije mora biti jednak ili bolji kao i kod pozitivnog kontrolnog soja pri jednakom razrjeđenju antitijela. Stanice s nepotpunim obojenjem ili sa slabom fluorescencijom moraju se zanemariti.
Ako se sumnja na bilo kakvu kontaminaciju, test se mora ponoviti. To se može dogoditi u slučaju ako sva stakalca u seriji pokazuju pozitivne stanice zbog kontaminacije pufera ili ako su pronađene pozitivne stanice (izvan jažica) na površini stakalca.
4.4.3. Postoji nekoliko problema svojstvenih za specifičnosti testa imunofluorescencije. Pozadinske populacije flourescirajućih stanica netipične morfologije i saprofitne bakterije s kojima dolazi do unakrsne reakcije i koje su veličinom i morfologijom slične C. m. sepedonicus mogle bi se pojaviti u koncentriranom ekstraktu jezgri pupaka i dijelovima stabljika krumpira.
4.4.4. Uzmite u obzir samo fluorescirajuće stanice tipične veličine i morfologije u titru ili radnom razrjeđenju antitijela kao u 4.3.
4.4.5. Tumačenje očitanja IF:
|
i. |
Ako nađete svjetlo fluorescirajuće stanice karakteristične morfologije, procijenite prosječan broj tipičnih stanica po mikroskopskom vidnom polju i izračunajte broj tipičnih stanica po ml resuspendiranog taloga (Dodatak 4). Očitanje testa IF je pozitivno za uzorke s najmanje 5 × 103 tipičnih stanica po ml resuspendiranog taloga. Uzorak se smatra potencijalno kontaminiranim i potrebno je daljnje testiranje. |
|
ii. |
Očitanje testa IF je negativno za uzorke s manje od 5 × 103 stanica po ml resuspendiranog taloga i uzorak se smatra negativnim. Daljnje testiranje nije potrebno. |
5. TEST FISH
Načelo
Kada se test FISH koristi kao prvi test provjere i dobije se pozitivan rezultat, mora se provesti test IF kao drugi obavezni test provjere. Kada se test FISH koristi kao drugi test provjere i dobije se pozitivan rezultat, potrebno je daljnje testiranje prema dijagramu toka kako bi se dovršila dijagnoza.
Napomena:
Koristite validirane oligo-probe specifične za C. m. subsp. Sepedonicus (Dodatak 7). Preliminarno testiranje ovom metodom mora omogućiti ponovljivu detekciju najmanje 103 do 104 stanica C. m. subsp. sepedonicus po ml dodane ekstraktima uzorka koji su u ranijim testiranjima bili negativni.
Sljedeći postupak bi se po mogućnosti trebao izvesti na svježe pripremljenom ekstraktu uzorka, ali može se uspješno primijeniti i na ekstraktu uzorka pohranjenog s glicerolom na – 16 to – 24 °C ili – 68 do – 86 °C.
Za negativne kontrole, upotrijebite alikvote ekstrakta uzorka koji je u ranijem testiranju na C. m. subsp. Sepedonicus bio negativan.
Za pozitivne kontrole pripremite suspenzije koje sadrže 105 do 106 stanica po ml C. m. subsp. sepedonicus (npr. soj NCPPB 4053, ili PD 406) u 0,01M fosfatnog pufera (PB) iz kulture stare tri do pet dana (za pripremu vidjeti Dodatak 2). Pripremite odvojena stakalca za pozitivnu kontrolu s homolognim sojem ili nekim drugim referentnim sojem C. m. subsp. sepedonicus, suspendiranim u ekstraktu krumpira, kao što je navedeno u Dodatku 2.
Korištenje eubakterijske oligo-probe obilježene FITC-om omogućuje kontrolu procesa hibridizacije, jer će obojiti sve eubakterije koje su prisutne u uzorku.
Testirajte kontrolni materijal na jednaki način kao i uzorak ili uzorke.
5.1. Fiksacija ekstrakta krumpira
Sljedeći protokol temelji se na Wullings et al., (1998):
5.1.1. Pripremite otopinu za fiksiranje (vidjeti Dodatak 7).
5.1.2. Pipetom odmjerite 100 μl svakog ekstrakta uzorka u Eppendorfovu epruvetu i centrifugirajte 8 minuta na 7 000 g.
5.1.3. Odlijte supernatant i otopite talog u 500 μl fiksativa pripremljenog prije manje od 24 sata. Promiješajte na vrtložnoj miješalici i inkubirajte preko noći na 4 °C.
Alternativni fiksativ je 96 %-tni etanol. Pri tome je potrebno otopiti talog iz točke 5.1.2. u 50 μl 0,01M PB i 50 μl 96 %-tnog etanola. Promiješajte na vrtložnoj miješalici i inkubirajte na 4 °C 30 do 60 minuta.
5.1.4. Centrifugirajte 8 minuta na 7 000 g, odlijte supernatant i resuspendirajte talog u 75 μl 0,01M PB (vidjeti Dodatak 3).
5.1.5. Odmjerite 16 μl fiksiranih suspenzija u jažice čistog stakalca kao što je prikazano na slici 3. Za svako stakalce upotrijebite dva različita nerazrijeđena uzorka i upotrijebite 10 μl za pripremu razrjeđenja 1:100 (u 0,01M PB). Preostala otopina uzorka (49 μl) može se pohraniti na –20 °C nakon dodavanja jednog volumena 96 %-tnog etanola. U slučaju da treba ponoviti test FISH, uklonite etanol centrifugiranjem i dodajte jednak volumen 0,01M PB (promiješajte na vrtložnoj mješalici).

5.1.6. Stakalca osušite na zraku (ili u sušioniku na 37 °C) i fiksirajte ih provlačenjem kroz plamen.
Na ovom se koraku postupak može prekinuti i hibridizacija se može nastaviti sljedeći dan. Stakalca se trebaju u suhom pohraniti u prostoru bez prašine na sobnoj temperaturi.
5.2. Predhibridizacija i hibridizacija
5.2.1. Pripremite otopinu lizozima koja sadrži 10 mg lizozima (Sigma L–6876) u 10 ml pufera (100 mM Tris-HCl, 50 mM EDTA, pH 8,0). Ta se otopina može pohraniti, ali se smije samo jednom odmrznuti i otopiti. Dobro pokrijte svaki uzorak s približno 50 μl otopine lizozima i inkubirajte 10 minuta na sobnoj temperaturi. Zatim samo jednom umočite objektna stakalca u demineraliziranu vodu i posušite filtar papirom.
Alternativno, umjesto lizozima dodajte 50 μl od 40 do 400μg ml–1 proteinaze K u puferu (20 mM Tris-HCl, 2 mM CaCl2, pH 7,4) na svaku jažicu i inkubirajte na 37 °C 30 minuta.
5.2.2. Dehidrirajte stanice uzastopnim uranjanjem u 50 %, 80 % i 96 %-tni etanol, u svaki po jednu minutu. Stakalca postavite na držač i osušite na zraku.
5.2.3. Pripremite vlažnu komoru za inkubaciju tako da pokrijete dno hermetične posude upijajućim ili filtar papirom, namočenim u 1x hybmix (Dodatak 7). Prethodno inkubirajte posudu u hibridizacijskoj pećnici na 55 °C najmanje 10 minuta.
5.2.4. Pripremite hibridizacijsku otopinu (Dodatak 7), po 45 μl po stakalcu i prethodno inkubirajte pet minuta na 55 °C.
5.2.5. Stavite stakalca na grijaću podlogu na 45 °C i nanesite 10 μl hibridizacijske otopine na svaku od četiri jažice na staklacu ili stakalcima.
5.2.6. Stavite dva pokrovna stakalca (24 × 24 mm) na svako stakalce i pri tome pazite da u jažicama ne ostane zraka. Stakalca stavite u unaprijed zagrijanu vlažnu komoru i preko noći u mraku hibridizirajte u pećnici na 55 °C.
5.2.7. Pripremite tri posude koje sadrže 1 l ultra čiste vode (UPW), 1 l 1x hybmixa (334 ml 3x hybmixa i 666 ml UPW) i 1 l 1/2x hybmixa (167 ml 3x hybmixa i 833 ml UPW). Svaku prethodno inkubirajte u vodenoj kupki na 55 °C.
5.2.8. Skinite pokrovna stakalca sa stakalaca i stavite predmetna stakalca na držač.
5.2.9. Isperite višak probe inkubiranjem 15 minuta u posudi s 1x hybmixom na 55 °C.
5.2.10. Prenesite držač stakalaca u otopinu za pranje s 1/2 hybmixa i inkubirajte daljnjih 15 minuta.
5.2.11. Nakratko uronite stakalca u UPW i stavite ih na filtar papir. Uklonite višak vlage tako da površinu lagano pokrijete filtar papirom. Pipetom odmjerite 5 do 10 μl zaštitne otopine protiv izbljeđivanja (npr. Vectashield, Vecta Laboratories, CA, USA ili jednakovrijednu) na svaku jažicu i cijelo predmetno stakalce prekrijte velikim pokrovnim stakalcem (24 × 60 mm).
5.3. Očitavanje testa FISH
5.3.1. Odmah pregledajte stakalca epifluorescentnim mikroskopom pri povećanju od 630 ili 1 000x povećanjem u uljnoj imerziji. S filtrom koji je prikladan za fluorescein-izotiocijanat (FITC), eubakterijske stanice (uključujući većinu gram negativnih stanica) u uzorku se oboje fluorescentno zeleno. Uporabom filtra za tetrametilrodamin-5-izotiocijanat, stanice C. m. subsp. sepedonicus obojene s Cy3 vide se kao fluorescentno crvene. Usporedite morfologiju stanica s onom pozitivnih kontrola. Stanice moraju biti jasno fluorescentne i u cjelosti obojene. U slučaju odstupanja u obojenosti, potrebno je ponoviti test FISH (dio 9.4.). Pregledajte jažice duž dva međusobno okomita promjera i duž vanjskog ruba. Za uzorke u kojima je vidljiv mali broj stanica ili ih uopće nema, pregledajte najmanje 40 mikroskopskih vidnih polja.
5.3.2. Tražite jasno fluorescirajuće stanice karakteristične morfologije za C. m. subsp. sepedonicus u jažicama stakalca za testiranje (vidjeti mrežne stranice: http://forum.europa.eu.int/Public/irc/sanco/Home/main). Intenzitet fluorescencije mora biti jednak ili bolji nego na soju pozitivne kontrole. Stanice koje nisu u potpunosti obojene ili su slabe fluorescencije moraju se zanemariti.
5.3.3. Ako se sumnja na bilo kakvu kontaminaciju, test se mora ponoviti. To se može dogoditi u slučaju kada sva stakalca u seriji pokazuju pozitivne stanice zbog kontaminacije pufera ili ako su pronađene pozitivne stanice (izvan jažica) na površini stakalca.
5.3.4. Postoji nekoliko problema svojstvenih za specifičnost testa FISH. Pozadinske populacije fluorescirajućih stanica netipične morfologije i saprofitne bakterije s kojima dolazi do unakrsne reakcije i koje su veličinom i morfologijom slične C. m. sepedonicus mogle bi se pojaviti u koncentriranom ekstraktu jezgre pupka i dijela stabljike krumpira, iako mnogo rjeđe nego kod testa IF.
5.3.5. Uzmite u obzir samo fluorescirajuće stanice tipične veličine i morfologije, vidjeti 5.3.2.
5.3.6. Tumačenje rezultata testa FISH:
|
i. |
Rezultati testa FISH smatraju se valjanim ako se primjenom filtra FITC opaze snažno zelene fluorescirajuće stanice, veličine i morfologije tipične za C. m. subsp. sepedonicus i snažno crvene fluorescirajuće stanice primjenom filtra za rodamin u svim pozitivnim kontrolama i u nijednoj negativnoj kontroli. Ako pronađete jasno fluorescirajuće stanice karakteristične morfologije, procijenite prosječan broj tipičnih stanica po mikroskopskom vidnom polju i izračunajte broj tipičnih stanica po ml resuspendiranog taloga (Dodatak 4). Uzorci s najmanje 5 × 103 tipičnih stanica po ml resuspendiranog taloga smatraju se potencijalno kontaminiranima. Potrebno je daljnje testiranje. Uzorci s manje od 5 × 103 stanica po ml resuspendiranog taloga smatraju se negativnima. |
|
ii. |
Test FISH je negativan ako se primjenom filtra za rodamin ne opaze snažno crvene fluorescirajuće stanice veličine i morfologije tipične za C. m. subsp. sepedonicus, pod uvjetom da se tipične snažno crvene fluorescentne stanice opaze u preparatima za pozitivne kontrole kod primjene filtra za rodamin. |
6. TEST PCR
Načela
Kada se test PCR koristi kao glavni test provjere i rezultat je pozitivan, mora se provesti test IF kao drugi obavezni test provjere. Kada se test PCR koristi kao drugi test provjere i rezultat je pozitivan, potrebno je daljnje testiranje prema dijagramu toka kako bi se postavila konačna dijagnoza.
Korištenje ove metode kao glavnog testa provjere preporuča se samo nakon što se stekne specijalističko stručno znanje.
Napomena:
Preliminarno testiranje ovom metodom mora omogućiti ponovljivu detekciju 103 do 104 stanica C. m. subsp. sepedonicus po ml, dodane ekstraktima uzorka koji su u prethodnim testiranjima dali negativan rezultat. Pokusi za optimizaciju metode mogu biti potrebni kako bi se postigli najveći stupnjevi osjetljivosti i specifičnosti u svim laboratorijima.
Koristite validirane reagense i protokole za PCR. Poželjno je odabrati metodu s internom kontrolom.
Poduzmite odgovarajuće mjere opreza kako bi se izbjegla kontaminacija uzorka ciljnom DNK. Test PCR trebaju izvoditi iskusni tehničari u specijaliziranim laboratorijima za molekularnu biologiju, kako bi se minimalizirala mogućnost kontaminacije ciljnom DNK.
Negativne kontrole (za ekstrakciju DNK i postupke PCR) moraju se uvijek obraditi kao zadnje uzorke u postupku, kako bi se vidjelo je li došlo do prijenosa DNK.
U test PCR moraju se uključiti sljedeće negativne kontrole:
|
— |
ekstrakt uzorka koji je u ranijem testiranju na C. m. subsp. Sepedonicus bio negativan, |
|
— |
kontrole pufera koje se koriste za ekstrakciju bakterije i DNK iz uzorka, |
|
— |
reakcijska smjesa za PCR. |
Moraju se uključiti sljedeće pozitivne kontrole:
|
— |
alikvoti resuspendiranih taloga kojima je bila dodana C. m. subsp. sepedonicus (za pripremu vidjeti Dodatak 2), |
|
— |
suspenzija 106 stanica po ml C. m. subsp. sepedonicus u vodi virulentnog izolata (npr. NCPPB 2140 ili NCPPB 4053), |
|
— |
ako je moguće, također koristite DNK ekstrahiranu iz pozitivnih kontrolnih uzoraka u testu PCR. |
Kako bi izbjegli potencijalnu kontaminaciju, pripremite pozitivne kontrole u prostoru koji je odvojen od uzoraka za testiranje.
Ekstrakti uzoraka moraju sadržavati što je moguće manje tla. Zato je u nekim slučajevima preporučljivo pripremiti ekstrakte iz opranih krumpira ako se namjeravaju koristiti protokoli PCR.
6.1. Metode pročišćavanja DNK
Upotrijebite uzorke za pozitivnu i negativnu kontrolu kao što je opisano gore u tekstu.
Pripremite kontrolni materijal na jednak način kao i uzorak ili uzorke.
Na raspolaganju je više metoda pročišćavanja ciljne DNK iz kompleksnih supstrata uzorka, pri čemu se uklanjaju inhibitori PCR-a i drugih enzimskih reakcija i u ekstraktu uzorka se koncentrira ciljna DNK.
Sljedeće je metoda optimizirana za uporabu s validiranom metodom PCR, prikazanom u Dodatku 6.
6.1.(a) Metoda prema Pastriku (2000)
|
1. |
Pipetom odmjerite 220 μl pufera za lizu (100 mM NaCl, 10 mM Tris-HCl [pH 8,0], 1 mM EDTA [pH 8,0]) u 1,5 ml Eppendorfovu epruvetu. |
|
2. |
Dodajte 100 μl ekstrakta uzorka i stavite u blok za zagrijavanje ili u vodenu kupelj na 95 °C 10 minuta. |
|
3. |
Stavite epruvetu na led na pet minuta. |
|
4. |
Dodajte 80 μl osnovne otopine lizozima (50 mg lizozima po ml u 10 mM Tris HCl, pH 8,0) i inkubirajte na 37 °C 30 minuta. |
|
5. |
Dodajte 220 μl Easy DNA® otopine A (Invitrogen), dobro promiješajte na vrtložnoj miješalici i inkubirajte na 65 °C 30 minuta. |
|
6. |
Dodajte 100 μl Easy DNA® otopine B (Invitrogen), snažno promiješajte na vrtložnoj miješalici sve dok talog ne počne slobodno plivati u epruveti i uzorak je jednolično viskozan. |
|
7. |
Dodajte 500 μl kloroforma i miješajte na vrtložnoj miješalici sve dok se viskoznost ne smanji i smjesa postane homogena. |
|
8. |
Centrifugirajte na 15 000 g 20 minuta na 4 °C kako bi odvojili faze i stvorili interfazu. |
|
9. |
Prenesite gornju fazu u novu Eppendorfovu epruvetu. |
|
10. |
Dodajte 1 ml 100 %-tnog etanola (–20 °C), kratko promiješajte na vrtložnoj miješalici i inkubirajte na ledu 10 minuta. |
|
11. |
Centrifugirajte na 15 000 g 20 minuta na 4 °C i uklonite etanol iz taloga. |
|
12. |
Dodajte 500 μl 80 %-tnog etanola (– 20 °C) i promiješajte okretanjem epruvete. |
|
13. |
Centrifugirajte na 15 000 g 10 minuta na 4 °C, sačuvajte talog i uklonite etanol. |
|
14. |
Ostavite talog da se suši na zraku ili u vakuumskoj centrifugi DNK. |
|
15. |
Resuspendirajte talog u 100 μl sterilne UPW i ostavite na sobnoj temperaturi najmanje 20 minuta. |
|
16. |
Pohranite na –20 °C sve dok nije potreban za PCR. |
|
17. |
Centrifugiranjem izdvojite sav bijeli precipitat i upotrijebite 5 μl supernatanta koji sadrži DNK za PCR. |
6.1.(b) Druge metode
Mogu se primijeniti druge metode za ekstrakciju DNK (npr. Qiagen DNeasy Plant Kit) ako su dokazano jednako učinkovite u pročišćavanju DNK iz kontrolnih uzoraka koji sadrže 103 do 104 patogenih stanica po ml.
6.2. PCR
6.2.1. Pripremite kalupe za testiranje i kontrolu za PCR u skladu s validiranim protokolom (Dodatak 6). Pripremite jedno decimalno razrjeđenje ekstrakta DNK iz uzorka (1:10 u UPW).
6.2.2. Pripremite prikladnu reakcijsku smjesu za PCR u nekontaminiranom prostoru u skladu s objavljenim protokolom (Dodatak 6). Validirani protokol za PCR je multipleks reakcija koja također uključuje unutarnju kontrolu PCR.
6.2.3. Dodajte 5 μl ekstrakta DNK na 25 μl reakcijske smjese PCR u sterilne epruvete za PCR.
6.2.4. Uključite uzorak za negativnu kontrolu koji sadrži samo reakcijsku smjesu za PCR i dodajte isti izvor UPW kakav je korišten za smjesu PCR umjesto uzorka.
6.2.5. Stavite epruvete u uređaj za PCR (thermal cycler) kakav je korišten u preliminarnom testiranju i pokrenite približno optimizirani program PCR (Dodatak 6).
6.3. Analiza produkta PCR
6.3.1. Razdvojite umnožene produkte PCR elektroforzerom u agaroznom gelu. Odlijte najmanje 12 μl reakcijske smjese umnožene DNK iz svakog uzorka, pomiješane s 3 μl pufera za nanošenje (Dodatak 6), u 2,0 % (w/v) agaroznih gelova u tris-acetat-EDTA (TAE) puferu (Dodatak 6) uz napon od 5 do 8 V po cm. Upotrijebite odgovarajući DNK standard, npr. ljestvicu 100 bp.
6.3.2. Otkrivajte pruge DNK bojenjem u etidij bromidu (0,5 mg po L) 30 do 45 minuta, poduzimajući prikladne mjere opreza za rukovanje ovim mutagenom.
6.3.3. Pregledajte obojeni gel na kratkovalnom UV transmutilatoru (npr. λ = 302 nm) i tražite umnožene produkte PCR očekivane veličine (Dodatak 6) i dokumentirajte ih.
6.3.4. Za sve nove nalaze/slučajeve provjerite autentičnost umnoženog produkata PCR analizom restrikcijskim enzimima na uzorku preostale umnožene DNK inkubacijom pri optimalnoj temperaturi i vremenu s prikladnim enzimom i puferom (vidjeti Dodatak 6). Razdvojite pocijepane fragmente elektroforzerom u agaroznom gelu kao i prije i promatrajte karakterističan restrikcijski obrazac fragmenta na UV transiluminatoru nakon bojenja s etidij bromidom i usporedite s nepocijepanom i pocijepanom pozitivnom kontrolom.
Tumačenje rezultata testa PCR:
Test PCR je negativan ako u testiranom uzorku nije vidljiv za C. m. subsp. sepedonicus specifičan produkt PCR očekivane veličine, ali je vidljiv u svim pozitivnim kontrolama uzoraka (u slučaju multipleks PCR-a s početnicama za unutarnju kontrolu koje su specifične za biljku domaćina: drugi produkt PCR očekivane veličine mora se umnožiti u testiranom uzorku).
Test PCR je pozitivan ako je u zadanom uzorku vidljiv za C. m. subsp. sepedonicus specifičan produkt PCR očekivane veličine i restrikcijskog obrasca (ako je potrebno), pod uvjetom da nije umnožen u nijednom uzorku negativne kontrole. Pouzdana potvrda pozitivnog rezultata može se također postići ponavljanjem testa drugim parom početnica PCR-a (dio 9.3).
Napomena:
Može se posumnjati na inhibiciju PCR-a ako se očekivani produkt dobije iz uzorka pozitivne kontrole koji sadrži C. m. subsp. sepedonicus u vodi, a negativni rezultati se dobiju iz pozitivnih kontrola s C. m. subsp. sepedonicus u ekstraktu krumpira. U multipleks protokolima PCR s unutarnjim kontrolama PCR, inhibicija reakcije je indicirana kada nije dobiven niti jedan od dva produkta.
Može se posumnjati na kontaminaciju ako se očekivani produkt dobije iz jedne ili više negativnih kontrola.
7. BIOTEST
Napomena:
Preliminarno testiranje ovom metodom mora omogućiti ponovljivu detekciju 103 do 104 jedinica C. m. subsp. sepedonicus koje stvaraju kolonije po ml dodane ekstraktima uzorka koji su u ranijim testiranjima bili negativni (za pripremu vidjeti Dodatak 2).
Najveća osjetljivost detekcije može se očekivati kada se koriste svježe pripremljeni ekstrakti uzorka i u optimalnim uvjetima rasta. Međutim, ova se metoda može uspješno primijeniti na ekstraktima koji su bili pohranjeni s glicerolom na – 68 to – 86 °C.
Neke sorte patlidžana odlične su kao selektivni medij obogaćivanja za rast C. m. subsp. sepedonicus čak i kad nema simptoma, a također su odlične kao domaćini za test potvrde.
Uvjeti rasta trebaju biti optimalni kako bi se smanjio rizik od lažno negativnih rezultata.
Za detalje o uzgoju, vidjeti Dodatak 8.
7.1. Na patlidžane rasporedite sav preostali alikvot resuspendiranog taloga ostavljen za testiranje iz dijela 3.1.6. ili 3.2.5. pomoću jedne od metoda koje su navedene niže u tekstu (7.3. ili 7.4.). Koristite samo biljke u stadiju dva do tri prava lista do potpune razvijenosti trećeg pravog lista. Kako bi se osigurala potpuna iskoristivost resuspendiranog taloga kao i učinkovita inokulacija, za postupke navedene niže u tekstu bit će potrebno 15 do 25 patlidžana po uzorku.
7.2. Nemojte zalijevati patlidžane jedan do dva dana prije inokulacije kako bi se smanjio turgor.
7.3. Inokulacija zarezivanjem
7.3.1. Dok držite biljku među prstima, nanesite pipetom kapljicu (približno 5 do 10 μl) suspendiranog taloga na stabljiku između supki i prvog lista.
7.3.2. Sterilnim skalpelom napravite dijagonalni rez od nanesene kapljice taloga, pri čemu je rez dugačak oko 1,0 cm i dubok približno 2/3 debljine stabljike.
7.3.3. Čvrsto zatvorite rez sterilnim vazelinom iz injekcije.
7.4. Inokulacija injekcijom
Inokulirajte stabljike patlidžana neposredno iznad supki koristeći injekciju s potkožnom iglom (ne manje od 23 G). Raspodijelite uzorak na patlidžane.
7.5. Za pozitivnu kontrolu, inokulirajte 5 biljaka suspenzijom u vodi od 105 do 106 stanica po ml poznate kulture C. m. subsp. sepedonicus i, kada je to moguće, prirodno zaraženim tkivom gomolja (vidjeti dio 4) istom metodom inokulacije (7.3. ili 7.4.).
7.6. Za negativnu kontrolu, inokulirajte 5 biljaka sterilnim puferom za talog istom metodom inokulacije (7.3. ili 7.4.).
7.7. Inkubirajte biljke u karantenskim prostorijama do četiri tjedna na 18 do 24 °C. Inkubirajte biljke uz visoku količinu svjetla i visoku vlagu (70 do 80 %) i zalijevajte kako bi spriječili nakupljanje vode ili uvenuće zbog nedostatka vode. Stanice C. m. sepedonicus ugibaju na temperaturama iznad 30 °C, a optimalna temperatura je 21 °C. Kako bi izbjegli unakrsnu kontaminaciju, inkubirajte biljke pozitivne i negativne kontrole na jasno odvojenim stolovima u stakleniku ili komori za rast ili, u slučaju da je prostor ograničen, pobrinite se da su strogo odvojene između pojedinih postupaka. Ako se biljke za različite uzorke moraju inkubirati blizu jedna drugoj, razdvojite ih prikladnim zaslonima. Kod prihrane, zalijevanja, pregledavanja ili bilo kojeg drugog postupka, dobro pazite da izbjegnete unakrsnu kontaminaciju. Od ključne je važnosti da u staklenicima i komorama za rast nema nikakvih insekata nametnika, jer oni mogu prenijeti bakteriju s jednog uzorka na drugi.
7.8. Nakon jednog tjedna redovito provjeravajte simptome. Prebrojite biljke koje pokazuju simptome. C. m. subsp. sepedonicus uzrokuje uvenuće lišća kod patlidžana koje može početi kao uvenulost rubova ili između žila listova. Uvenulo tkivo može u početku izgledati tamnozeleno ili prošarano, ali postaje blijedo prije nego što postane nekrotično. Uvenulost između lisnih žila često izgleda masno, kao da su natopljeni vodom. Nekrotično tkivo često ima svjetložuti rub. Biljke nužno ne ugibaju; što je duže razdoblje prije nego što se simptomi razviju, to je veća mogućnost preživljavanja. Biljke mogu prerasti zarazu. Mlade biljke patlidžana mnogo su prijemljivije na niske populacije C. m. subsp. sepedonicus nego starije biljke; zbog toga se koriste biljke u ili neposredno prije faze prva tri lista.
Uvenuća također mogu biti uzrokovana populacijama drugih bakterija ili gljivica koje su prisutne u ekstraktu tkiva gomolja. To su: Ralstonia solanacearum, Erwinia carotovora subsp. carotovora i E. carotovora subsp. atroseptica, Erwinia chrysanthemi, Phoma exigua var. foveata, kao i velike populacije saprofitskih bakterija. Posebice Erwinia chrysanthemi može uzrokovati simptome na listovima i uvenuće koje je vrlo slično simptomima C. m. subsp. Sepedonicus. Jedina razlika je crnjenje stabljika u slučaju infekcija bakterijom Erwinia chrysanthemi. Druga uvenuća mogu se razlikovati od onih koje uzrokuje C. m. subsp. Sepedonicus s obzirom da cijeli listovi ili cijele biljke brzo venu. Može se pripremiti i bojenje po Gramu: s tim će se testom razlučiti C. m. subsp. sepedonicus od Erwinia spp.
7.9. Čim primijetite simptome kod patlidžana, potrebno je izvršiti ponovnu izolaciju, koristeći dijelove uvenulog tkiva lišća ili tkiva stabljike biljaka (vidjeti 3.1.3. za maceraciju tkiva). Površinski dezinficirajte lišće i stabljike patlidžana tako da ih obrišete 70 %-tnim etanolom. Izvedite test IF ili PCR na biljnom soku patlidžana i izolirajte na prikladnoj (selektivnoj) hranjivoj podlozi (vidjeti dio 8). Može se pripremiti i bojenje po Gramu (Dodatak 9). Identificirajte pročišćene kulture vjerojatne C. m. subsp. sepedonicus i potvrdite patogenost (vidjeti dio 9 i 10).
7.10. U određenim okolnostima, posebno kad uvjeti za rast nisu optimalni, moguće je da C. m. subsp. sepedonicus postoji kao latentna infekcija u patlidžanima čak nakon razdoblja inkubacije do 4 tjedna. Ako se simptomi ne primijete nakon 4 tjedna, izvedite test IF/PCR na sastavljenom uzorku dijela stabljike od 1 cm svake teste biljke, koji se uzimaju iznad mjesta inokulacije. Ako je test pozitivan, potrebno je provesti ponovnu izolaciju na prikladnoj (selektivnoj) hranjivoj podlozi, prema postupku iz dijela 8. Identificirajte pročišćene kulture vjerojatne C. m. subsp. sepedonicus i potvrdite patogenost (vidjeti dio 9 i 10).
Tumačenje rezultata biotesta.
Valjani rezultati biotesta dobiveni su kada biljke pozitivne kontrole pokazuju tipične simptome, kada se bakterija može ponovno izolirati iz tih biljaka i kada nisu pronađeni simptomi na negativnim kontrolama.
Biotest je negativan ako testne biljke nisu zaražene bakterijom C. m. subsp. sepedonicus i pod uvjetom da je C. m. subsp. sepedonicus detektirana u pozitivnim kontrolama.
Biotest je pozitivan ako su testne biljke zaražene bakterijom C. m. subsp. sepedonicus.
8. IZOLACIJA C. M. SUBSP. SEPEDONICUS
Napomena:
Dijagnoza se može potvrditi samo ako se C. m. subsp. sepedonicus izolira i zatim identificira (vidjeti dio 9), te ako se potvrdi test patogenosti (dio 10). Iako je C. m. subsp. sepedonicus zahtjevan organizam, može se izolirati iz simptomatskog tkiva.
Međutim, mogu ga prerasti brzo rastuće saprofitske bakterije te su stoga izolacije izravno iz ekstrakta tkiva gomolja ili stabljike teške (dio 3.1.6. ili 3.2.5.). Selektivnom hranjivom podlogom i prikladnim razrjeđenjem resuspendiranog taloga iz jezgre pupka ili stabljika krumpira moguća je izravna izolacija C. m. subsp. sepedonicus.
Izolacije je potrebno izvršiti iz svih gomolja ili dijelova stabljike krumpira sa simptomima te iz patlidžana kod kojih nisu primijećeni simptomi ali je test IF/PCR iz sastavljenog uzorka bio pozitivan (vidjeti dio 7.10). Maceriranje stabljika patlidžana treba se, prema potrebi, provoditi kako je navedeno u dijelu 3.1.3.
Za pozitivne kontrole, pripremite decimalna razrjeđenja suspenzije 106 cfu po ml C. m. subsp. sepedonicus (npr. NCPPB 4053 ili PD 406). Kako bi izbjegli svaku mogućnost kontaminacije, pripremite pozitivne kontrole potpuno odvojeno od uzoraka koji se testiraju.
Za svaku svježe pripremljenu seriju selektivne hranjive podloge potrebno je provjeriti njezinu prikladnost za rast patogena prije nego što se upotrijebi za testiranje rutinskih uzoraka.
Testirajte kontrolni materijal na isti način kao i uzorak ili uzorke.
8.1. Uzgoj na selektivnoj hranjivoj podlozi
8.1.1. Iz 100 μl alikvota iz uzorka resuspendiranog taloga krumpira ili biljnog soka patlidžana pripremite 10-struka razrjeđenja u puferu za talog (Dodatak 3).
8.1.2. Izolacija iz nerazrijeđenog taloga krumpira obično ne uspije zbog teškog uzgoja Cms i kompeticije saprofita. S obzirom da je bakterija obično prisutna u visokim populacijama u zaraženom tkivu, saprofiti se obično mogu odstraniti razrjeđivanjem, dok patogen ostaje. Stoga se preporuča raširiti 100 μl iz svakog uzorka, 1/100 do 1/10 000 razrjeđenja na hranjivu podlogu MTNA ili na podlogu NCP-88 (Dodatak 5) (kod upotrebe petrijevih zdjelica promjera 90 mm – prilagodite količinu za petrijeve zdjelice drugih veličina), koristeći raširivače (hokejske palice) i tehniku razmaza.
Napomena:
Alternativna strategija je da razmažete početni alikvot po 100 μl taloga krumpira na prvu podlogu raširivačem i zatim pomaknete raširivač na drugu podlogu, pri čemu razmazivanjem odstranite sve ostatke koji su preostali na raširivaču; na kraju to ponovite s trećom podlogom, stvarajući tako efekt razrjeđenja putem raširivača.
8.1.3. Inkubirajte podloge u mraku na 21 do 23 °C.
8.1.4. Prva provjera podloga, uključujući procjenu kolonija sličnih C. m. subsp. sepedonicus, u usporedbi s kontrolnim podlogama, vrši se nakon 3 dana, a daljnje procjene nakon 5, 7, zatim 10 dana.
8.2. Pročišćavanje sumnjivih kolonija
Napomena:
Precjepljivanje kolonija sličnih C. m. subsp. sepedonicus treba se provesti na hranjivoj podlozi YGM za inokulaciju patlidžana i/ili daljnju identifikaciju; to se treba učiniti prije nego podloge postanu previše zaraštene, tj. najbolje nakon tri do pet dana.
8.2.1. Razmažite kolonije slične C. m. subsp. sepedonicus na jednu od sljedećih hranjivih podloga (sastavi su navedeni u Dodatku 5):
hranjivi agar s dodatkom dekstroze (koristi se samo za precjepljivanje),
agar s dodatkom kvasca, peptona i glukoze,
agar s dodatkom ekstrakta kvasca i mineralnih soli.
Inkubirajte na 21 °C do 24 °C do 10 dana.
C. m. subsp. sepedonicus sporo raste, obično stvarajući kremaste, kupolaste kolonije sa šiljatim vrhom unutar 10 dana. Fotografije tipičnih kolonija C. m. subsp. sepedonicus (vidjeti mrežnu stranicu: http://forum.europa.eu.int/Public/irc/sanco/Home/main).
8.2.2. Ponovno razmažite kako bi postigli čistoću.
Stope rasta se poboljšavaju precjepljivanjem. Tipične kolonije su kremasto-bijele ili poput bjelokosti, ponekad žute, zaokružene, glatke, povišene, konveksno-kupolaste, sluzavo- tekuće, s cijelim rubovima i obično 1 do 3 mm u promjeru.
Jednostavno bojenje po Gramu (Dodatak 9) može pomoći pri odabiru kolonija za daljnje testiranje.
8.2.3. Identificirajte vjerojatne kulture (vidjeti dio 9) i provedite test patogenosti (vidjeti dio 10).
9. IDENTIFIKACIJA
Identificirajte čiste kulture vjerojatnih izolata C. m. subsp. sepedonicus uporabom najmanje dva od sljedećih testova koji se temelje na različitim biološkim načelima.
Uključite poznate referentne sojeve za svaki izvedeni test, kada je to prikladno.
9.1. Nutricioni i enzimski testovi za identifikaciju
Odredite sljedeća fenotipska svojstva koja su univerzalno prisutna ili odsutna u C. m. subsp. sepedonicus, prema metodama iz Lelliott i Stead (1987.), Klement et al. (1990.), Schaad (2001.), nepoznati autor (1987.).
Sve se hranjive podloge trebaju inkubirati na 21 °C i pregledati nakon šest dana. Ako ne dođe do rasta, inkubirajte do 20 dana.
Svi testovi trebaju uključivati poznatu kontrolu C. m. subsp. sepedonicus. Nutricioni i fiziološki testovi trebaju se provesti koristeći inokulume iz subkultura na hranjivom agaru. Morfološke usporedbe trebaju se napraviti iz kultura na hranjivom agaru s dodatkom dekstroze.
|
Testovi |
Očekivani rezultati |
|
Test oksidacije/fermentacije (O/F) |
inertan ili slabo oksidativan |
|
Aktivnost oksidaze |
– |
|
Rast na 37 °C |
– |
|
Aktivnost ureaze |
– |
|
Hidroliza eskulina |
+ |
|
Hidroliza škroba |
– ili slaba |
|
Tolerancija 7 % otopine NaCl |
– |
|
Stvaranje indola |
– |
|
Aktivnost kataleze |
+ |
|
Stvaranje H2S |
– |
|
Iskorištavanje citrata |
– |
|
Likvefakcija želatine |
– |
|
Kiselina iz glicerola |
– |
|
Kiselina iz laktoze |
– ili slaba |
|
Kiselina iz ramnoze |
– |
|
Kiselina iz salicina |
– |
|
Bojenje po Gramu (Dodatak 9) |
+ |
9.2. Test IF
|
(a) |
Pripremite suspenziju od približno 106 stanica po ml u puferu IF (Dodatak 3). |
|
(b) |
Pripremite dvostruka razrjeđenja otopine prikladnog antiseruma. |
|
(c) |
Primijenite postupak IF (dio 4). |
|
(d) |
Test IF je pozitivan ako je titar IF kulture jednak titru pozitivne kontrole. |
9.3. Test PCR
|
(a) |
Pripremite suspenziju od približno 106 stanica po ml u ultra čistoj vodi (UPW). |
|
(b) |
Zagrijte 100 μl stanične suspenzije u zatvorenim epruvetama u bloku za zagrijavanje ili kipućoj vodenoj kupelji na 100 °C četiri minute. Prema potrebi, dodavanje svježe pripremljenog NaOH do konačne koncentracije 0,05M može pomoći lizi stanica. Uzorci se zatim mogu pohraniti na –16 do –24 °C do uporabe. |
|
(c) |
Upotrijebite prikladne postupke PCR za umnožavanje specifičnih fragmenata C. m. subsp. sepedonicus (npr. Pastrik, 2000; vidjeti Dodatak 4; Li i de Boer, 1995; Mills et al., 1997; Pastrik i Rainey, 1999; Schaad et al., 1999). |
|
(d) |
Pozitivna identifikacija C. m. subsp. sepedonicus postiže se ako su produkti PCR iste veličine i imaju iste polimorfizme dužina restrikcijskih fragmenata kao i pozitivni kontrolni soj. |
9.4. Test FISH
|
(a) |
Pripremite suspenziju od približno 106 stanica po ml u UPW. |
|
(b) |
Primijenite postupak FISH (dio 5). |
|
(c) |
Pozitivan test FISH postiže se ako su postignute iste reakcije iz kulture i pozitivne kontrole. |
9.5. Profiliranje masnih kiselina (FAP)
|
(a) |
Uzgajajte kulturu na triptikaza-soja-agaru (Oxoid) 72 sata na 21 °C (+/– 1°). |
|
(b) |
Primijenite prikladan postupak FAP (Janse, 1991; Stead, 1992). |
|
(c) |
Pozitivan test FAP postiže se ako je profil vjerojatne kulture identičan profilu pozitivne kulture. Prisutnost karakterističnih masnih kiselina: 15:1 Anteiso A, 15:0 Iso, 15:0 Anteiso, 16:0 Iso, 16:0 i 17:0 Anteiso, snažno ukazuje na C. m. sepedonicus. Drugi rodovi kao što su Curtobacterium, Arthrobacter i Micrococcus također imaju neke od ovih kiselina, ali 15:1 Anteiso A je rijetka kiselina u tim bakterijama, ali se pojavljuje u svim bakterijama Clavibacter spp. između 1 do 5 %. Kod C. m. sepedonicus vrijednost je obično oko 5 %. |
9.6. BOX-PCR
|
(a) |
Pripremite suspenziju od približno 106 stanica po ml u UPW. |
|
(b) |
Primijenite test u skladu s postupkom (Smith et al., 2001). |
10. TEST POTVRDE
Test patogenosti mora se provesti kao konačna potvrda dijagnoze C. m. subsp. sepedonicus i za procjenu virulentnosti kultura identificiranih kao C. m. subsp. sepedonicus:
10.1. Pripremite inokulum od približno 106 stanica po ml iz trodnevnih kultura izolata koji se testira i prikladan soj pozitivne kontrole C. m. subsp. sepedonicus.
10.2. Inokulirajte stabljike 5 do 10 mladih sadnica patlidžana u fazi 3 prva lista (dio 7.3. ili 7.4.).
10.3. Inkubirajte na 18 do 24 °C uz dovoljnu količinu svjetla i visoku relativnu vlagu te prikladno zalijevajte kako bi izbjegli nakupljanje vode ili stres od suše (dio 7.7.). Kod čistih kultura, tipično bi se uvenuće trebalo pojaviti u roku od dva tjedna, ali biljke koje ne pokazuju simptome (vidjeti dio 7.8.) nakon tog vremena trebaju se inkubirati do tri tjedna na temperaturama koje su povoljne za rast patlidžana, ali ne više od 25 °C (Dodatak 8). Ako simptomi nisu prisutni ni nakon tri tjedna, kultura se ne može potvrditi kao patogeni oblik C. m. subsp. sepedonicus.
10.4. Izolirajte iz biljaka sa simptomima tako da odstranite dio stabljike 2 cm iznad mjesta inokulacije. Usitnite i suspendirajte u maloj količini sterilne destilirane vode ili 50 mM fosfatnog pufera (Dodatak 3). Izolirajte iz suspenzije razmazivanjem razrjeđenja na MTNA i YPGA (Dodatak 5), inkubirajte tri do pet dana na 21 do 23 °C i pregledajte jesu li nastale tipične kolonija bakterije C. m. subsp. sepedonicus.
Dodatak 1.
Laboratoriji koji su uključeni u optimizaciju i validaciju protokola
|
Laboratorij (1) |
Lokacija |
Država |
|
Agentur für Gesundheit und Ernährungssicherheit |
Beč i Linz |
Austrija |
|
Departement Gewasbescherming |
Merelbeke |
Belgija |
|
Plantedirektoratet |
Lyngby |
Danska |
|
Central Science Laboratory |
York |
Engleska |
|
Scottish Agricultural Science Agency |
Edinburgh |
Škotska |
|
Laboratoire National de la Protection des Végétaux, Unité de Bactériologie |
Angers |
Francuska |
|
Laboratoire National de la Protection des Végétaux, Station de Quarantaine de la Pomme de Terre |
Le Rheu |
Francuska |
|
Biologische Bundesanstalt |
Kleinmachnow |
Njemačka |
|
Pflanzenschutzamt Hannover |
Hannover |
Njemačka |
|
State Laboratory |
Dublin |
Irska |
|
Plantenziektenkundige Dienst |
Wageningen |
Nizozemska |
|
Norwegian Crop Research Institute, Plant Protection Centre |
Aas |
Norveška |
|
Direcção-Geral de Protecção das Culturas |
Lisbon |
Portugal |
|
Nacionalni institut za biologijo |
Ljubljana |
Slovenija |
|
Centro de Diagnostico de Aldearrubia |
Salamanca |
Španjolska |
Dodatak 2.
Priprema pozitivnih i negativnih kontrola za osnovne testove provjere PCR/IF i FISH
Uzgojite 72-satnu kulturu virulentnog soja bakterije C. m. subsp. sepedonicus (NCPPB 4053 ili PD 406) na osnovnoj hranjivoj podlozi MTNA i suspendirajte u 10 mM fosfatnom puferu da dobijete gustoću stanica od približno 1 do 2 × 108 cfu po ml. To je obično slabo mutna suspenzija, ekvivalentne optičke gustoće od 0,20 na 600 nm.
Odstranite jezgre pupka iz 200 gomolja sorte s bijelom korom za koje je poznato da nisu zaraženi bakterijom C. m. subsp. sepedonicus.
Obradite pupke uobičajenom metodom i resuspendirajte talog u 10 ml.
Pripremite 10 sterilnih mikroepruveta od 1,5 ml s 900 μl resuspendiranog taloga.
Dodajte 100 μl suspenzije C. m. subsp. sepedonicus u prvu mikroepruvetu. Promiješajte na vrtložnoj miješalici.
Pripremite decimalne stupnjeve kontaminacije daljnjim razrjeđivanjem u sljedećih pet mikroepruveta.
Šest kontaminiranih mikroepruveta koristit će se za pozitivnu kontrolu. Četiri nekontaminirane mikroepruvete koristit će se za negativnu kontrolu. U skladu s tim označite mikroepruvete.
Pripremite alikvote od 100 μl u sterilnim mikroepruvetama od 1,5 ml tako da dobijete devet kopija svakog kontrolnog uzorka. Pohranite ih na –16 do –24 °C do uporabe.
Prisutnost i količina C. m. subsp. sepedonicus u kontrolnim uzorcima trebaju se prvo potvrditi testom IF.
Za test PCR napravite ekstrakciju DNK iz pozitivnih i negativnih kontrolnih uzoraka za svaku seriju uzoraka za testiranje.
Za testove IF i FISH napravite analize pozitivnih i negativnih kontrolnih uzoraka za svaku seriju uzoraka za testiranje.
Za testove IF, FISH i PCR, bakterija C. m. subsp. sepedonicus mora se detektirati u najmanje 106 i 104 stanica/ml pozitivnih kontrola i u nijednoj negativnoj kontroli.
Dodatak 3.
Puferi za postupke testiranja
OPĆENITO: Neotvoreni sterilizirani puferi mogu se čuvati do jedne godine.
1. Puferi za postupak ekstrakcije
1.1. Ekstrakcijski pufer (50 mM fosfatni pufer, pH 7,0)
Ovaj se pufer koristi za ekstrakciju bakterije iz biljnih tkiva homogenizacijom ili tresenjem.
|
Na2HPO4 (bezvodni) |
4,26 g |
|
KH2PO4 |
2,72 g |
|
Destilirana voda |
1,00 L |
Otopite sastojke, provjerite pH i sterilizirajte u autoklavu na 121 °C 15 minuta.
Dodatni sastojci mogu biti korisni kako slijedi:
|
|
Namjena |
Količina (po L) |
|
Pahuljice Lubrol |
Deflokulant (*) |
0,5 g |
|
DC silikon protiv pjenjenja |
Sredstvo protiv pjenjenja (*) |
1,0 ml |
|
Tetranatrijev pirofosfat |
Antioksidans |
1,0 g |
|
Polivinilpirolidon-40 000 (PVP-40) |
Vezivanje inhibitora PCR |
50 g |
1.2. Pufer za talog (10 mM fosfatni pufer, pH 7,2)
Ovaj se pufer koristi za resuspendiranje i razrjeđivanje ekstrakta jezgre pupka gomolja krumpira, koji slijedi nakon koncentriranja u talogu centrifugiranjem.
|
Na2HPO4.12H2O |
2,7 g |
|
NaH2PO4.2H2O |
0,4 g |
|
Destilirana voda |
1,00 L |
Otopite sastojke, provjerite pH i sterilizirajte u autoklavu na 121 °C 15 minuta.
2. Puferi za test IF
2.1. Pufer IF (10 mM fosfatni pufer s dodatkom soli (PBS), pH 7,2)
Ovaj se pufer koristi za razrjeđivanje antitijela.
|
Na2HPO4.12H2O |
2,7 g |
|
NaH2PO4.2H2O |
0,4 g |
|
NaCl |
8,0 g |
|
Destilirana voda |
1,0 L |
Otopite sastojke, provjerite pH i sterilizirajte u autoklavu na 121 °C 15 minuta.
2.2. Pufer IF-Tween
Ovaj se pufer koristi za ispiranje stakalca.
Puferu IF dodajte 0,1 % Tweena 20.
2.3. Glicerol s fosfatnim puferom, pH 7,6
Ovaj se pufer koristi kao tekućina za prekrivanje jažica u testu IF kako bi se pojačala fluorescencija.
|
Na2HPO4.12H2O |
3,2 g |
|
NaH2PO4.2H2O |
0,15 g |
|
Glicerol |
50 ml |
|
Destilirana voda |
100 ml |
Pokrivne otopine protiv izblijeđivanja dostupne su na tržištu, npr. Vectashield® (Vector Laboratories) ili Citifluor® (Leica).
Dodatak 4.
Određivanje stupnja kontaminacije u testovima IF i FISH
|
1. |
Izračunajte srednji broj tipičnih fluorescentnih stanica po vidnom polju (c) |
|
2. |
Izračunajte broj tipičnih fluorescentnih stanica po jažici mikroskopskog stakalca (C) 
|
|
3. |
Izračunajte broj tipičnih fluorescentnih stanica po ml resuspendiranog taloga (N) 
|
Dodatak 5.
Hranjive podloge za izolaciju i uzgoj C. m. subsp. sepedonicus
|
(a) |
Opće hranjive podloge Hranjivi agar (NA)
Otopite sastojke i sterilizirajte u autoklavu na 121 °C 15 minuta. Hranjivi agar s dekstozom (NDA) Hranjivi agar Difco bacto koji sadrži 1 % D(+) glukoze (monohidrata). Sterilizirajte u autoklavu na 115 °C 20 minuta. Agar s kvascem, peptonom i glukozom (YPGA)
Otopite sastojke i sterilizirajte u autoklavu na 121 °C 15 minuta. Podloga s ekstraktom kvasca i mineralnih soli (YGM)
Otopite sastojke i sterilizirajte 0,5 litara volumena hranjive podloge u autoklavu na 121 °C 15 minuta. |
|
(b) |
Validirane selektivne hranjive podloge Podloga MTNA Osim ako nije drukčije navedeno, svi sastojci hranjive podloge su iz BDH.
Otopite sastojke, podesite pH na 7,2. Nakon sterilizacije u autoklavu (na 121 °C 15 minuta) i hlađenja na 50 °C, dodajte antibiotike: trimetoprim 0,06 g, nalidiksičnu kiselinu 0,002 g, amfotericin B 0,01 g. Osnovne otopine antibiotika: trimetoprim (Sigma) i nalidiksična kiselina (Sigma) (oboje na 5 mg/ml), u 96 %-tnom metanolu, amfotericin B (Sigma) (1 mg/ml) u dimetilsulfoksidu. Osnovne otopine su sterilizirane filtriranjem. Napomena: Rok trajanja osnovne hranjive podloge je tri mjeseca. Nakon što se dodaju antibiotici, rok trajanja je jedan mjesec kada se čuva u hladnjaku. Podloga NCP-88
Otopite sastojke, podesite pH na 7,2. Nakon sterilizacije u autoklavu (na 121 °C 15 minuta) i hlađenja na 50 °C, dodajte sljedeće antibiotike: Polimiksin B sulfat (Sigma) 0,003 g, nalidiksičnu kiselinu (Sigma) 0,008 g, Cikloheksimid (Sigma) 0,2 g. Pripremite osnovne otopine antibiotika kako slijedi: nalidiksičnu kiselinu u 0,01 M NaOH, cikloheksimid u 50 %-tnom etanolu, polimiksin B sulfat u destiliranoj vodi. Osnovne otopine su sterilizirane filtriranjem. Napomena: Rok trajanja osnovne hranjive podloge je tri mjeseca. Nakon što se dodaju antibiotici, rok trajanja je jedan mjesec kada se čuva u hladnjaku. |
Dodatak 6.
Validirani protokol i potvrđeni reagensi za PCR
Napomena:
Preliminarno testiranje trebalo bi omogućiti ponovljivu detekciju najmanje 103 do 104 stanica C. m. subsp. sepedonicus po ml ekstrakta uzorka.
Preliminarno testiranje također ne bi trebalo dati lažno pozitivne rezultate kod panela odabranih bakterijskih sojeva.
1. Protokol za multipleks PCR s unutarnjom kontrolom PCR (Pastrik, 2000)
1.1. Oligonukleotidne početnice
|
Uzvodna početnica PSA-1 |
5′- ctc ctt gtg ggg tgg gaa aa -3′ |
|
Nizvodna početnica PSA-R |
5′- tac tga gat gtt tca ctt ccc c -3′| |
|
Uzvodna početnica NS-7-F |
5′- gag gca ata aca ggt ctg tga tgc -3′ |
|
Nizvodna početnica NS-8-R |
5’- tcc gca ggt tca cct acg ga -3’ |
Očekivana veličina umnoženog produkta iz kalupa DNK C. m. subsp. sepedonicus = 502 bp (par početnica PSA).
Očekivana veličina umnoženog produkta iz 18S rRNA unutarnje kontrole PCR = 377 bp (par početnica NS).
1.2. Reakcijska smjesa za PCR
|
Reagens |
Količina po reakciji |
Konačna koncentracija |
|
Sterilna UPW |
15,725 μl |
|
|
10x pufer PCR (2) (15 mM MgCl2) |
2,5 μl |
1x (1,5 mM MgCl2) |
|
BSA (frakcija V) (10 %) |
0,25 μl |
0,1 % |
|
Smjesa d-nTP (20 mM) |
0,125 μl |
0,1 mM |
|
Početnica PSA-1 (10 μM) |
0,5 μl |
0,2 μM |
|
Početnica PSA-R (10 μM) |
0,5 μl |
0,2 μM |
|
Početni oligonukleotidi NS-7-F (10 μM) (3) |
0,1 μl |
0,04 μM |
|
Početnica NS-8-R (10 μM) (3) |
0,1 μl |
0,04 μM |
|
Taq polimeraza (5 U/μl) (2) |
0,2 μl |
1,0 U |
|
Volumen uzorka |
5,0 μl |
|
|
Ukupni volumen |
25,0 μl |
|
1.3. Uvjeti reakcije PCR
Izvedite sljedeći program:
|
1 ciklus: |
i. |
3 minute na 95 °C (denaturacija kalupa DNK) |
|
10 ciklusa: |
ii. |
1 minutu na 95 °C (denaturacija kalupa DNK) |
|
iii. |
1 minuta na 64 °C (sparivanje početnica) |
|
|
iv. |
1 minuta na 72 °C (produljivanje kopije) |
|
|
25 ciklusa: |
v. |
30 sekundi na 95 °C (denaturacija kalupa DNK) |
|
vi. |
30 sekundi na 62 °C (sparivanje početnica) |
|
|
vii. |
1 minuta na 72 °C (produljivanje kopije) |
|
|
1 ciklus: |
viii. |
5 minuta na 72 °C (konačno produljivanje) |
|
ix. |
držati na 4 °C. |
Napomena:
Ovaj je program optimiziran za uporabu s uređajem za PCR MJ Research PTC 200. Kod uporabe s drugim modelima vjerojatno će biti potrebno prilagoditi trajanje stupnjeva ciklusa ii., iii., iv., v., vi. i vii.
1.4. Analiza produkata umnožavanja restrikcijskim enzimom
Produkti PCR umnoženi iz DNK bakterije C. m. subsp. sepedonicus daju karakteristični obrazac polimorfizma duljine restrikcijskih fragmenata s enzimom Bgl II nakon inkubacije na 37 °C 30 minuta. Restrikcijski fragmenti dobiveni iz specifičnoga fragmenta C. m. subsp. sepedonicus su veličine 282 bp i 220 bp.
2. Priprema pufera za nanošenje
2.1. Bromfenol plavilo (10 %-tna osnovna otopina)
|
Bromfenol plavilo |
5 g |
|
Destilirana voda (bidestilirana) |
50 ml |
2.2. Pufer za nanošenje
|
Glicerol (86 %) |
3,5 ml |
|
Bromfenol plavilo (5.1) |
300 μl |
|
Destilirana voda (bidestilirana) |
6,2 ml |
3. 10x Tris acetatni EDTA pufer (TAE), pH 8,0
|
Tris pufer |
48,4 g |
|
Ledena octena kiselina |
11,42 ml |
|
EDTA (dinatrijeva sol) |
3,72 g |
|
Destilirana voda |
1,00 L |
Razrijedite do 1x prije uporabe.
Dostupno i na tržištu (npr. Invitrogen ili jednakovrijedan).
Dodatak 7.
Validirani reagensi za test FISH
1. Oligo-probe
|
Specifična proba za Cms CMS-CY3-01: |
5′- ttg cgg ggc gca cat ctc tgc acg -3′ |
|
Nespecifična eubakterijska proba EUB-338-FITC: |
5′- gct gcc tcc cgt agg agt -3′ |
2. Otopina za fiksiranje
[UPOZORENJE! OTOPINA ZA FIKSIRANJE SADRŽI PARAFORMALDEHID KOJI JE TOKSIČAN. NOSITE RUKAVICE I NE UDIŠITE GA. PREPORUČLJIVO JE RADITI U DIGESTORU.]
|
i. |
Zagrijte 9 ml vode za molekularnu biologiju (npr. ultra čiste vode (UPW)) na približno 60 °C i dodajte 0,4 g paraformaldehida. Paraformaldehid se otapa nakon dodavanja 5 kapi 1N NaOH i miješanja na magnetskoj miješalici. |
|
ii. |
Podesite pH na 7,0 dodavanjem 1 ml 0,1 M fosfatnog pufera (PB; pH 7,0) i 5 kapi 1 N HCl. Provjerite pH indikatorskim papirom i podesite, ako je potrebno, pomoću HCl ili NaOH. [UPOZORENJE! NEMOJTE KORISTITI PH METAR U OTOPINAMA S PARAFORMALEDHIDOM.] |
|
iii. |
profiltrirajte otopinu kroz membranski filtar od 0,22 μm i pohranite, na 4 °C i zaštitite od prašine do daljnje uporabe. |
|
iv. |
Napomena: Alternativna otopina za fiksiranje: 96 %-tni etanol. |
3. 3x Hybmix
|
NaCl |
2,7 M |
|
Tris-HCl |
60 mM (pH 7,4) |
|
EDTA (sterilizirana filtriranjem i u autoklavu) |
15 mM |
Razrijedite do 1x prema potrebi.
4. Otopina za hibridizaciju
1x Hybmix
|
Natrijev dodecil sulfat (SDS) |
0,01 % |
|
Proba EUB 338 |
5 ng/μl |
|
Proba CMSCY301 |
5 ng/μl |
Pripremite količine otopine za hibridizaciju u skladu s izračunima u Tablici. Za svako stakalce (koje sadrži dva različita uzorka u duplikatu) potrebno je 90 μl otopine za hibridizaciju.
Tablica: Predložene količine za pripremu smjese za hibridizaciju
|
|
2 stakalca |
8 stakalaca |
|
Sterilna UPW |
50,1 |
200,4 |
|
3x hybmix |
30,0 |
120,0 |
|
1 % SDS |
0,9 |
3,6 |
|
Proba EUB 338 (100 ng/μl) |
4,5 |
18,0 |
|
Proba CMSCY301 (100 ng/μl) |
4,5 |
18,0 |
|
Ukupni volumen (μl) |
90,0 |
360,0 |
Napomena:
Pohranite sve otopine koje sadrže oligo-probe osjetljive na svjetlost u mraku na – 20 °C. Zaštitite ih od direktne sunčeve svjetlosti ili električne rasvjete tijekom uporabe.
5. 0,1M fosfatni pufer, pH 7,0
|
Na2HPO4 |
8,52 g |
|
KH2PO4 |
5,44 g |
|
Destilirana voda |
1,00 L |
Otopite sastojke, provjerite pH i sterilizirajte u autoklavu na 121 °C 15 minuta.
Dodatak 8.
Uzgoj patlidžana
Posijte sjeme patlidžana (Solanum melongena) u pasteriziranom kompostu za sjeme. Presadite sadnice s potpuno razvijenim proširenim supkama (10 do 14 dana) u pasteriziran kompost za lončanice.
Patlidžani se trebaju uzgajati u stakleniku pod sljedećim okolišnim uvjetima:
|
Dužina dana: |
|
14 sati ili prirodna dužina dana, ako je dulja; |
|
Temperatura: |
dan: |
21 do 24 °C, |
|
noć: |
15 °C. |
|
Prijemljive sorte patlidžana: |
„Black Beauty”, |
|
„Long Tom”, |
|
|
„Rima”, |
|
|
„Balsas” |
Dobavljač: vidjeti mrežnu stranicu http://forum.europa.eu.int/Public/irc/sanco/Home/main
Dodatak 9.
Postupak bojenja po Gramu (Huckerova modifikacija) (Doetsch, 1981.) (4)
Otopina kristal violeta
Otopite 2 g kristal violeta u 20 ml 95 % etanola.
Otopite 0,8 g amonij-oksalata u 80 ml destilirane vode.
Promiješajte dvije otopine.
Lugolova otopina
|
Jod |
1 g |
|
Kalij-jodid |
2 g |
|
Destilirana voda |
300 ml |
Usitnite krute tvari zajedno koristeći tučak i mužar. Dodajte vodi i promućkajte da se otopi u zatvorenoj posudi.
Otopina safranina za protubojenje
Osnovna otopina:
|
Safranin O |
2,5 g |
|
95 %-tni etanol |
100 ml |
Promiješajte i pohranite.
Razrijedite: 1:10 da bi dobili radnu otopinu.
Postupak bojenja
|
1. |
Pripremite razmaze, posušite na zraku i fiksirajte zagrijavanjem. |
|
2. |
Prelijevajte stakalce otopinom kristal violeta jednu minutu. |
|
3. |
Kratko isperite tekućom vodom. |
|
4. |
Zalijevajte Lugolovom otopinom jednu minutu. |
|
5. |
Isperite tekućom vodom i posušite filtar papirom. |
|
6. |
Uklonite boju 95 %-tnim etanolom, koji se dodaje kap po kap, dok se sva boja ne ukloni ili uronite razmaz na 30 sekundi i lagano tresite. |
|
7. |
Isperite tekućom vodom i posušite filtar papirom. |
|
8. |
Zalijevajte otopinom safranina 10 sekundi. |
|
9. |
Isperite tekućom vodom i posušite filtar papirom. |
Gram pozitivne bakterije oboje se ljubičasto-plavo; Gram negativne bakterije oboje se ružičasto-crveno.
LITERATURA
|
1. |
Anonymous, 1987. Scheme of the detection and diagnosis of the ring rot bacterium Corynebacterium sepedonicum in batches of potato tubers. Commission of the European Communities, Luxembourg. Publ EUR 11288 EN, 21 str. |
|
2. |
Bradbury, J. F., 1970. Isolation and preliminary study of bacteria from plants. Rev. Pl. Path., 49, 213-218. |
|
3. |
Dinesen, I. G., 1984. The extraction and diagnosis of Corynebacterium sepedonicum from diseased potato tubers. EPPO Bull. 14 (2), 147-152. |
|
4. |
Doetsch, R. N., 1981. Determinative methods of light microscopy. In: Manual of methods for general bacteriology, American Society for Microbiology, Washington, 21-23. |
|
5. |
Hugh, R. and Leifson, F., 1953. The taxonomic significance of fermentative versus oxidative metabolism of carbohydrates by various gram-negative bacteria. J. Bact., 66, 24-26. |
|
6. |
Janse, J. D., 1991. Infra- and intra-specific classification of Pseudomonas solanacearum strains using whole cell fatty-acid analysis. Systematic and Applied Microbiology 14; 335-345. |
|
7. |
Janse, J. D. and J. Van Vaerenbergh. The interpretation of the EC method for the detection of latent ring rot infections (Corynebacterium sepedonicum) in potato. EPPO Bull., No 17, 1987, str. 1-10. |
|
8. |
Jansing, H. and K. Rudolph, 1998. Physiological capabilities of Clavibacter michiganensis ssp. sepedonicus and development of a semi-selective medium. Journal of Plant Diseases and Protection, 105, 590-601. |
|
9. |
Kovacs, N., 1956. Identification of Pseudomonas pyocyanea by the oxidase reaction. Nature, Lond., 178, 703. |
|
10. |
Klement Z.; Rudolph, K and D. C. Sands, 1990. Methods in Phytobacteriology. Akadémiai Kiadó, Budapest, 568 str. |
|
11. |
Lelliott, R. A., 1966. The plant pathogenic coryneform bacteria. J. appl. Bact., 29, 114-118. |
|
12. |
Lelliott, R. A., E. Billing and A. C. Hayward, 1966. A determinative scheme for the fluorescent plant pathogenic pseudomonads J. appl. Bact., 29, 470-489. |
|
13. |
Lelliott, R. A. and P. W., Sellar, 1976. The detection of latent ring rot (Corynebacterium sepedonicum (Spiek. et Kotth.) Skapt. et Burkh.) in potato stocks. EPPO Bull., 6 (2), 101-106. |
|
14. |
Li, X. and S.H. de Boer, 1995. Selection of Polymerase Chain Reaction primers from RNA intergenic spacer region for specific detection of Clavibacter michiganensis ssp. sepedonicus. Phytopathology, 85, 837-842. |
|
15. |
Mills, D., Russell, B., W. and J., W. Hanus, 1997. Specific detection of Clavibacter michiganensis ssp. sepedonicus by amplification of three unique DNA sequences isolated by subtraction hybridization. Phytopathology, 87, 8, 853-861. |
|
16. |
Pastrik, K.-H. and R.A. Rainey. 1999. Identification and differentiation of Clavibacter michiganensis subspecies by polymerase chain reaction-based techniques. J. Phytopathology 147; 687-693. |
|
17. |
Pastrik, K.-H., 2000. Detection of Clavibacter michiganensis ssp. sepedonicus in potato tubers by multiplex PCR with coamplification of host DNA. European Journal of Plant Pathology, 106, 155-165. |
|
18. |
Ramamurthi, C. S., 1959. Comparative studies on some Gram-positive phytopathogenic bacteria and their relationship to the Corynebacteria. Mem. Cornell agric. Exp. Sta., 366, 52 str. |
|
19. |
Schaad, W., Berthier-Schaad, Y., Sechler, A. and Knorr, D. (1999) Detection of Clavibacter michiganensis subsp. sepedonicus in potato tubers by BIO-PCR and an automated real-time fluorescence detection system. Plant Disease 83; 1095–1100. |
|
20. |
Schaad, W. 2001. Laboratory guide for identification of plant pathogenic bacteria. Schaad [Hrsg.]. — 3. ed.; St. Paul, Minnesota:, 373 str. |
|
21. |
Skerman, V. B. D., 1967. A guide to the identification of the genera of bacteria. 2nd ed., William and Wilkins Company, Baltimore. |
|
22. |
Smith, N. C.; Hennesy, J; Stead, D.E., 2001. Repetetive sequence-derived PCR profiling using the BOX-A1Ralstonia solanacearum primer for rapid identification of plant pathogen Clavibacter michiganensis ssp. sepedonicus. European Journal of Plant Pathology, 107 (7), 739-748. |
|
23. |
Sneath, P. H. A. and V. G. Collins, 1974. A study in test reproductibility between laboratories: report of Pseudomonas working party. Antonie van Leeuwenhoek, 40, 481-527. |
|
24. |
Stead, D.E. 1992. Grouping of plant pathogenic and some other Pseudomonas spp. using cellular fatty-acid profiles. International Journal of Systematic Bacteriology 42; 281-295. |
|
25. |
Wullings, B. A.; van Beuningen, A. R.; Janse, J. D. and A. D. L. Akkermans, 1998. Detection of Ralstonia solanacearum, which causes brown rot of potato, by fluorescent in situ hybridization with 23s rRNA-targeted probes. Appl. Environ. Microbiol. 64, 4546–4554. |
(1) Za kontakt sa znanstvenicima: vidjeti mrežnu stranicu http://forum.europa.eu.int/Public/irc/sanco/Home/main
(*) Za uporabu kod metode ekstrakcije homogenizacijom
(2) Metode su validirane Taq polimerazom iz Perkin Elmer (AmpliTaq ili Gold) i Gibco BRL.
(3) Koncentracija početnica NS-7 F i NS-8-R je bila optimizirana za ekstrakciju jezgre pupka krumpira metodom homogenizacije i pročišćavanja DNK prema Pastriku (2000) (vidjeti dio 6.1.a) i 6.2.). Ponovna optimizacija koncentracija reagensa bit će potrebna ako se upotrijebi ekstrakcija tresenjem ili druga metoda izolacije DNK.
(4) Mogu se upotrijebiti otopine i pribori za bojenje dostupne na tržištu.
