
|
13/Sv. 012 |
HR |
Službeni list Europske unije |
145 |
31999L0045
|
L 200/1 |
SLUŽBENI LIST EUROPSKE UNIJE |
31.05.1999. |
DIREKTIVA 1999/45/EZ EUROPSKOG PARLAMENTA I VIJEĆA
od 31. svibnja 1999.
o usklađivanju zakona i drugih propisa država članica u odnosu na razvrstavanje, pakiranje i označivanje opasnih pripravaka
EUROPSKI PARLAMENT I VIJEĆE EUROPSKE UNIJE,
uzimajući u obzir Ugovor o osnivanju Europske zajednice, a posebno njegov članak 95.,
uzimajući u obzir prijedlog Komisije (1),
uzimajući u obzir mišljenje Gospodarskog i socijalnog odbora (2),
djelujući u skladu s postupkom predviđenim u članku 251. Ugovora (3),
|
(1) |
Budući da je Direktiva Vijeća 88/379/EEZ od 7. lipnja 1988. o usklađivanju zakona i drugih propisa država članica o razvrstavanju, pakiranju i označivanju opasnih pripravaka (4) bila nekoliko puta mijenjana; budući da je s ciljem jasnoće navedenu Direktivu prilikom daljnjih izmjena potrebno potpuno preinačiti. |
|
(2) |
Budući da propisi koji se u državama članicama primjenjuju na određene opasne pripravke unatoč odredbama Zajednice pokazuju značajne razlike u pogledu razvrstavanja, pakiranja i označivanja; budući da ove razlike predstavljaju prepreku trgovini, stvaraju nejednake uvjete tržišnog natjecanja i direktno utječu na funkcioniranje unutarnjega tržišta; budući da je stoga potrebno ukloniti ovu prepreku trgovini usklađivanjem relevantnog zakonodavstva država članica. |
|
(3) |
Budući da mjere usklađivanja odredbi država članica koje imaju utjecaja na uspostavu i funkcioniranje unutarnjega tržišta moraju, ako se tiču zdravlja, sigurnosti i zaštite ljudi i okoliša, u svojoj osnovi sadržavati visoku razinu zaštite; budući da ova Direktiva mora istovremeno osigurati zaštitu javnosti, a posebno osoba koje dolaze u dodir s opasnim pripravcima na radnom mjestu ili prilikom bavljenja slobodnim aktivnostima, te zaštitu potrošača i okoliša. |
|
(4) |
Budući da spremnici koji sadrže određene kategorije opasnih pripravaka koji se nude ili prodaju kao predmeti za opću uporabu moraju biti opremljeni posebnim zatvaračima koji onemogućuju otvaranje djeci i/ili nositi taktilno upozorenje na opasnost; budući da određeni pripravci koji ne spadaju u ove kategorije opasnosti mogu ipak zbog svog sastava predstavljati opasnost za djecu; budući da pakiranje ovakvih pripravaka stoga treba biti opremljeno posebnim zatvaračima koji djeci onemogućuju otvaranje. |
|
(5) |
Budući da je kod pripravaka koji se stavljaju na tržište u plinovitom obliku potrebno predvidjeti granične vrijednosti koncentracije izražene u postotku volumnog udjela. |
|
(6) |
Budući da su u ovoj Direktivi sadržane posebne odredbe o označivanju koje se primjenjuju na određene pripravke; budući da je, kako bi se osigurala odgovarajuća razina zaštite ljudi i okoliša, potrebno uvesti posebne odredbe o označivanju i za određene pripravke koji, iako nisu opasni u smislu ove Direktive, ipak mogu predstavljati opasnost za korisnika. |
|
(7) |
Budući da je 30. travnja 1992. Vijeće donijelo Direktivu 92/32/EEZ o sedmoj izmjeni Direktive 67/548/EEZ o usklađivanju zakona i drugih propisa u odnosu na razvrstavanje, pakiranje i označivanje opasnih tvari (5); budući da je 27. travnja 1993. Komisija donijela Direktivu 93/21/EEZ (6) kojom se osamnaesti put tehničkom napretku prilagođava Direktiva Vijeća 67/548/EEZ; budući da su ovim direktivama uvedeni novi kriteriji razvrstavanja i označivanja tvari opasnih za okoliš, zajedno s odgovarajućim simbolima, oznakama opasnosti, oznakama upozorenja i oznakama obavijesti koji se moraju nalaziti na deklaraciji; budući da je na razini Zajednice potrebno donijeti odredbe o razvrstavanju i označivanju pripravaka s obzirom na njihove učinke na okoliš te budući da je stoga potrebno uvesti metodu procjenjivanja opasnosti za okoliš koje proizlaze iz određenog pripravka, i to računskom metodom ili utvrđivanjem ekotoksikoloških svojstava metodama ispitivanja u određenim uvjetima. |
|
(8) |
Budući da je broj životinja na kojima se provode pokusi potrebno svesti na najmanju mjeru, u skladu s odredbama Direktive Vijeća 86/609/EEZ od 24. studenoga 1986. o usklađivanju zakona i drugih propisa država članica u odnosu na zaštitu životinja koje se koriste u pokusne i druge znanstvene svrhe (7); budući da se člankom 7. stavkom 2. te Direktive određuje da se pokus ne provodi ako je dostupna druga znanstveno prihvatljiva metoda dobivanja traženog rezultata koja ne zahtijeva korištenje životinja; budući da se ova Direktiva stoga koristi rezultatima procjena toksikoloških i ekotoksikoloških svojstava samo kada su ovi već poznati, i ne sadrži obvezu provođenja daljnjih pokusa na životinjama. |
|
(9) |
Budući da je potrebno utvrditi koje se ljudsko iskustvo može uzeti u obzir pri ocjenjivanju opasnosti za zdravlje koje proizlaze iz pripravka; budući da se u slučajevima u kojima se mogu prihvatiti klinička istraživanja smatra neprijepornim da su ova istraživanja u skladu s Helsinškom deklaracijom i Smjernicama dobre kliničke prakse OECD-a. |
|
(10) |
Budući da s obzirom na osobine legura ponekad nije moguće točno utvrditi njihova svojstva pomoću trenutačno raspoloživih konvencionalnih metoda; budući da je stoga potrebno razraditi posebnu metodu razvrstavanja koja uzima u obzir njihova specifična kemijska svojstva; budući da će Komisija, uz savjetovanje s državama članicama, ispitati ovu potrebu i prema potrebi predati svoj prijedlog prije roka za provedbu ove Direktive. |
|
(11) |
Budući da je razvrstavanje, pakiranje i označivanje sredstava za zaštitu bilja obuhvaćenih Direktivom Vijeća 78/631/EEZ od 26. lipnja 1978. o usklađivanju zakona država članica u odnosu na razvrstavanje, pakiranje i označivanje opasnih pripravaka (pesticida) (8) potrebno revidirati uzimajući u obzir tehnički i znanstveni razvoj te razvoj zakonodavstva nakon provedbe Direktive Vijeća 91/414/EEZ od 15. srpnja 1991. o stavljanju sredstava za zaštitu bilja na tržište (9). |
|
(12) |
Budući da se Direktivom 91/414/EEZ i Direktivom 98/8/EZ Europskog parlamenta i Vijeća od 16. veljače 1998. o stavljanju biocidnih pripravaka na tržište (10), za razliku od odredbi koje se primjenjuju na kemijske pripravke obuhvaćene ovom Direktivom, predviđa postupak odobravanja svakog proizvoda na temelju spisa koji predočava podnositelj zahtjeva te procjene koju provodi nadležno tijelo u svakoj državi članici; budući da postupak odobravanja nadalje uključuje nadzor koji se izričito odnosi na razvrstavanje, pakiranje i označivanje svakog proizvoda prije stavljanja na tržište; budući da je u okviru jasnog i transparentnog procesa informiranja primjereno sredstva za zaštitu bilja razvrstavati i označiti sukladno odredbama ove Direktive, ali i osigurati upute za rukovanje u skladu s rezultatima ocjenjivanja provedenog u okviru Direktive 91/414/EEZ, vodeći računa da oznake zadovoljavaju visoku razinu zaštite koju se zahtijeva ovom Direktivom kao i Direktivom 91/414/EEZ; budući da je, osim toga, potrebno ustanoviti sigurnosno-tehnički list za sredstva za zaštitu bilja u skladu s ovom Direktivom. |
|
(13) |
Budući da je u pogledu označivanja proizvoda s obzirom na njihove učinke na okoliš primjereno omogućiti donošenje odluke o određenim izuzećima ili donijeti posebne odredbe u određenim slučajevima ako se može dokazati da je ukupni utjecaj na okoliš odnosne vrste proizvoda manji nego kod drugih odgovarajućih vrsta proizvoda. |
|
(14) |
Budući da, iako streljivo nije obuhvaćeno ovom Direktivom, eksplozivi koji se stavljaju na tržište radi stvaranja eksplozivnog ili pirotehničkog učinka mogu zbog svog kemijskog sastava predstavljati opasnost za zdravlje; budući da ih je stoga u sklopu transparentnog procesa informiranja potrebno razvrstati i dodijeliti im sigurnosno-tehnički list u skladu s odredbama ove Direktive te ih označiti u skladu s međunarodnim pravilima o prijevozu opasne robe. |
|
(15) |
Budući da je s obzirom na određene pripravke, koji iako se ne smatraju opasnim u smislu ove Direktive ipak mogu predstavljati opasnost za korisnike, potrebno proširiti određene odredbe ove Direktive kako bi se obuhvatili i ovakvi pripravci. |
|
(16) |
Budući da je deklaracija osnovno sredstvo korisnika opasnih pripravaka s obzirom da im na sažet način pruža početne bitne informacije; budući da ju je unatoč tomu potrebno nadopuniti dvostrukim sustavom detaljnijih informacija koji se s jedne strane sastoji od sigurnosno-tehničkog lista namijenjenog profesionalnim korisnicima u smislu Direktive Komisije 91/155/EEZ od 5. ožujka 1991. o određivanju i uspostavljanju detaljnih rješenja za sustav posebnih informacija koje se odnose na opasne pripravke u provedbi članka 10. Direktive 88/379/EEZ (11), a s druge strane od tijela koja odrede države članice i koja će biti odgovorna za pružanje informacija isključivo u medicinske svrhe, i to preventivne i kurativne. |
|
(17) |
Budući da će na temelju informacija koje dostave države članice i različite zainteresirane strane Komisija u roku od dvije godine od stupanja na snagu ove Direktive podnijeti izvješće Europskom parlamentu i Vijeću o iskustvima sa sadašnjim cjelokupnim pristupom označivanju opasnih pripravaka, a posebno o njegovom razumijevanju i primjeni od strane korisnika, iskustvima s javnim kampanjama te programima edukacije i izobrazbe; budući da će na temelju ovog izvješća Komisija podnijeti potrebne prijedloge ako je to primjereno. |
|
(18) |
Budući da je potrebno zahtijevati sigurnosno-tehničke listove koji pružaju razmjerne podatke o opasnostima za čovjeka i okoliš, a koje proizlaze iz pripravaka koji se ne razvrstavaju kao opasni u smislu ove Direktive, ali sadrže tvari koje se razvrstavaju kao opasne ili je za njih u Zajednici predviđena granična vrijednost izlaganja; budući da će Komisija na temelju informacija koje dostave države članice preispitati Direktivu 91/155/EEZ i prema potrebi podnijeti prijedloge prije isteka roka za provedbu ove Direktive. |
|
(19) |
Budući da je kod pripravaka koji se u smislu ove Direktive razvrstavaju kao opasni primjereno dopustiti državama članicama da omoguće određena odstupanja u pogledu označivanja u slučajevima kada je pakiranje premaleno ili na drugi način neprikladno za označivanje, ili kada se radi o tako malom pakiranju ili tako malim količinama da nema razloga strahovati od opasnosti za ljude i okoliš; budući da bi u ovakvim slučajevima bilo prikladno razmotriti usklađivanje odgovarajućih odredbi na razini Zajednice; budući da će Komisija stoga ispitati potrebe za usklađivanjem te prema potrebi podnijeti prijedloge. |
|
(20) |
Budući da je potrebno zajamčiti tajnost određenih tvari sadržanih u pripravcima te je stoga potrebno uspostaviti sustav koji osobi odgovornoj za stavljanje pripravka na tržište omogućuje da zahtijeva tajnost ovakvih tvari. |
|
(21) |
Budući da će odredbe ove Direktive uzeti u obzir obvezu koju su Zajednica i njezine države članice preuzele, u skladu s ciljevima održivog razvoja postavljenima u okviru Agende 21, poglavlja 19. na konferenciji UNCED-a održanoj u lipnju 1992. u Rio de Janeiru, u nastojanju da se u budućnosti uspostave usklađeni sustavi razvrstavanja opasnih tvari i pripravaka. |
|
(22) |
Budući da Komisiji treba dati ovlasti potrebne da se svi prilozi ove Direktive prilagode tehničkom napretku. |
|
(23) |
Budući da donošenje ove Direktive ne smije utjecati na obveze država članica glede rokova za prijenos u nacionalno zakonodavstvo i primjenu direktiva navedenih u Prilogu VIII. |
|
(24) |
Budući da je direktive navedene u Prilogu VIII. potrebno staviti izvan snage pod određenim uvjetima; budući da je za Austriju, Finsku i Švedsku potrebno odrediti uvjete stavljanja izvan snage direktiva navedenih u Prilogu VIII., uzimajući u obzir sadašnju razinu njihovog zakonodavstva, posebno u pogledu zaštite zdravlja i zaštite okoliša, |
DONIJELI SU OVU DIREKTIVU:
Članak 1.
Ciljevi i opseg primjene
1. Ova Direktiva ima za cilj usklađivanje zakona i drugih propisa država članica u pogledu:
|
— |
razvrstavanja, pakiranja i označivanja opasnih pripravaka, i |
|
— |
usklađivanja posebnih odredbi za određene pripravke koji mogu predstavljati opasnost bez obzira na to jesu li razvrstani kao opasni u smislu ove Direktive, |
kada se ovi pripravci stavljaju na tržište u državama članicama.
2. Ova se Direktiva primjenjuje na pripravke koji:
|
— |
sadrže najmanje jednu opasnu tvar u smislu članka 2, i |
|
— |
smatraju se opasnima u smislu članaka 5., 6. ili 7. |
3. Posebne odredbe navedene:
|
— |
u članku 9. i utvrđene u Prilogu IV., |
|
— |
u članku 10. i utvrđene u Prilogu V., i |
|
— |
u članku 14. |
također se primjenjuju na pripravke koji se ne smatraju opasnima u smislu članaka 5., 6. ili 7., ali unatoč tomu mogu predstavljati određenu opasnost.
4. Ne dovodeći u pitanje Direktivu 91/414/EEZ, članci o razvrstavanju, pakiranju, označivanju i sigurnosno-tehničkim listovima iz ove Direktive primjenjuju se na sredstva za zaštitu bilja.
5. Ova se Direktiva ne primjenjuje na sljedeće pripravke u konačnom stanju, namijenjene krajnjem korisniku:
|
(a) |
medicinski proizvodi namijenjeni ljudima ili za veterinarsku upotrebu, kako su određeni u Direktivi 65/65/EEZ (12); |
|
(b) |
kozmetički proizvodi kako su određeni u Direktivi 76/768/EEZ (13); |
|
(c) |
smjese tvari u obliku otpada koje su obuhvaćene Direktivom 75/442/EEZ (14) i 78/319/EEZ (15); |
|
(d) |
hrana; |
|
(e) |
hrana za životinje; |
|
(f) |
pripravci koji sadrže radioaktivne tvari kako su određeni u Direktivi 80/836/Euratom (16); |
|
(g) |
medicinski uređaji koji su invazivni ili se koriste u direktnom fizičkom dodiru s ljudskim tijelom ako se mjerama Zajednice utvrđuju odredbe za razvrstavanje i označivanje opasnih tvari i pripravaka koje osiguravaju istu razinu informiranosti i zaštite kao ova Direktiva. |
6. Ova se Direktiva ne primjenjuje na:
|
— |
prijevoz opasnih pripravaka željeznicom, cestovnim, unutarnjim vodnim i morskim putom te zrakom, |
|
— |
pripravke u provozu koji se nalaze pod carinskim nadzorom, pod uvjetom da se ne podvrgavaju nikakvoj obradi ni preradi. |
Članak 2.
Definicije
1. U smislu ove Direktive:
|
(a) |
„tvari” su kemijski elementi i njihovi spojevi u prirodnom stanju ili dobiveni proizvodnim postupkom, uključujući i aditive koji su nužni za održavanje stabilnosti proizvoda te nečistoće koje proizlaze iz primijenjenog postupka, ali isključujući otapala koja se mogu izdvojiti bez utjecaja na stabilnost tvari i promjene njezinog sastava; |
|
(b) |
„pripravci” su smjese ili otopine koje su sastavljene od dvije ili više tvari; |
|
(c) |
„polimer” je tvar sastavljena od molekula koje karakterizira niz (za koje je značajan poredak) jedne ili više vrsta monomernih jedinica, gdje je maseni udio molekula koje sadrže najmanje tri monomerne jedinice koje su kovalentnom vezom povezane s jednom ili više drugih monomernih jedinica ili drugim reaktantom ili reaktantima veći od pola, a maseni udio molekula iste molekulske mase manji od pola. Molekulske mase ovih molekula moraju se kretati unutar raspona u kojemu se razlike u molekulskoj masi mogu prvenstveno pripisati razlikama u broju monomernih jedinica. U kontekstu ove definicije „monomerna jedinica” je izreagirani oblik monomera u polimeru; |
|
(d) |
(………); |
|
(e) |
„staviti na tržište” znači učiniti raspoloživim za treće strane. Uvoz na carinsko područje Zajednice se u smislu ove Direktive smatra stavljanjem na tržište; |
|
(f) |
„znanstveno istraživanje i razvoj” znači provođenje znanstvenih pokusa, analiza ili kemijskog istraživanja u kontroliranim uvjetima; uključuje utvrđivanje unutarnjih svojstava, radnih osobina i učinkovitosti te znanstveno istraživanje u vezi s razvojem proizvoda; |
|
(g) |
„procesno usmjereno istraživanje i razvoj” znači daljnji razvoj tvari tijekom kojega se ustrojavaju probna postrojenja ili vrši pokusna proizvodnja u svrhu ispitivanja područja primjene tvari; |
|
(h) |
„Einecs” znači Europski popis postojećih trgovačkih kemijskih tvari. Sadrži konačni popis svih kemijskih tvari za koje se smatra da se nalaze na tržištu u Zajednici na dan 18. rujna 1981. godine. |
2. U smislu ove Direktive „opasnima” se smatraju:
|
(a) |
eksplozivne tvari i pripravci: krute i tekuće tvari i pripravci te tvari i pripravci u obliku paste i želatine koji mogu egzotermno reagirati i u odsutnosti kisika iz atmosfere, pri čemu se velikom brzinom razvijaju plinovi, te koji u utvrđenim ispitnim uvjetima detoniraju, naglo se zapale ili zbog zagrijavanja eksplodiraju ako su ograničeni prostorom; |
|
(b) |
oksidirajuće tvari i pripravci: tvari i pripravci koji izazivaju snažnu egzotermnu reakciju u dodiru s drugim tvarima, posebno zapaljivim tvarima; |
|
(c) |
vrlo lako zapaljive tvari i pripravci: tekuće tvari i pripravci koji imaju iznimno nisko plamište i nisko vrelište te plinovite tvari i pripravci koji su zapaljivi u dodiru sa zrakom pri normalnoj temperaturi i tlaku; |
|
(d) |
lako zapaljive tvari i pripravci:
|
|
(e) |
zapaljive tvari i pripravci: tekuće tvari i pripravci koji imaju nisko plamište; |
|
(f) |
vrlo otrovne tvari i pripravci: tvari i pripravci koji već u vrlo malim količinama dovode do smrti ili do akutnog ili kroničnog oštećenja zdravlja ako se udišu, progutaju ili apsorbiraju kroz kožu; |
|
(g) |
otrovne tvari i pripravci: tvari i pripravci koji već u malim količinama dovode do smrti ili do akutnog ili kroničnog oštećenja zdravlja ako se udišu, progutaju ili apsorbiraju kroz kožu; |
|
(h) |
štetne tvari i pripravci: tvari i pripravci koji mogu dovesti do smrti ili do akutnog ili kroničnog oštećenja zdravlja ako se udišu, progutaju ili apsorbiraju kroz kožu; |
|
(i) |
nagrizajuće tvari i pripravci: tvari i pripravci koji mogu uništiti živa tkiva ako dođu s njima u dodir; |
|
(j) |
nadražujuće tvari i pripravci: tvari i pripravci koji nisu nagrizajući, ali koji u neposrednom, duljem ili ponavljanom dodiru s kožom ili sluznicom mogu prouzročiti upalu; |
|
(k) |
tvari i pripravci koji dovode do preosjetljivosti: tvari i pripravci koji udisanjem ili prolaskom kroz kožu mogu izazvati reakciju preosjetljivosti tako da zbog daljnjega izlaganja toj tvari ili pripravku nastupaju karakteristične štetne posljedice; |
|
(l) |
karcinogene tvari i pripravci: tvari i pripravci koji udisanjem, gutanjem ili prolaskom kroz kožu mogu izazvati rak ili povećati učestalost njegove pojave; |
|
(m) |
mutagene tvari i pripravci: tvari i pripravci koji udisanjem, gutanjem ili prolaskom kroz kožu mogu izazvati nasljedna genetska oštećenja ili povećati učestalost njihove pojave; |
|
(n) |
reproduktivno otrovne tvari i pripravci: tvari i pripravci koji udisanjem, gutanjem ili prolaskom kroz kožu mogu izazvati nenasljedne štetne posljedice kod potomstva i/ili oštećenja ženske ili muške reproduktivne funkcije ili reproduktivne sposobnosti ili povećati učestalost njihove pojave; |
|
(o) |
tvari i pripravci koji su opasni za okoliš: tvari i pripravci koji bi ulaskom u okoliš predstavljali ili mogli predstavljati trenutačnu ili odgođenu opasnost za jedan ili više dijelova okoliša. |
Članak 3.
Određivanje opasnih svojstava pripravaka
1. Ocjena opasnosti pripravka se temelji na određivanju:
|
— |
fizikalno-kemijskih svojstava, |
|
— |
svojstava koja utječu na zdravlje ljudi, |
|
— |
svojstava koja utječu na okoliš. |
Ova se različita svojstva određuju u skladu s odredbama utvrđenim u člancima 5., 6. i 7.
Ako se provode laboratorijska ispitivanja, provode se na pripravku kakav se stavlja na tržište.
2. Ako se provodi utvrđivanje opasnih svojstava u skladu s člancima 5., 6. i 7, u obzir se uzimaju sve opasne tvari u smislu članka 2., a posebno one koje:
|
— |
su navedene u Prilogu I. Direktivi 67/548/EEZ, |
|
— |
su navedene u Elincsu u skladu s člankom 21. Direktive 67/548/EEZ, |
|
— |
je osoba odgovorna za njihovo stavljanje na tržište privremeno razvrstala i označila u skladu s člankom 6. Direktive 67/548/EEZ, |
|
— |
se razvrstavaju i označuju u skladu s člankom 7. Direktive 67/548/EEZ, a još nisu uključene u Elincs, |
|
— |
su obuhvaćena člankom 8. Direktive 67/548/EEZ, |
|
— |
se razvrstavaju i označuju u skladu s člankom 13. Direktive 67/548/EEZ, |
i to u skladu s odredbama utvrđenima u metodi koja se koristi.
3. Kod pripravaka obuhvaćenih ovom Direktivom u obzir se uzimaju opasne tvari iz stavka 2. koje se razvrstavaju kao opasne na temelju njihovih učinaka na zdravlje ljudi i/ili okoliš, bez obzira na to jesu li prisutne kao nečistoće ili kao aditivi, ako su njihove koncentracije jednake ili veće od onih koje su definirane u tablici koja slijedi, osim ako su u Prilogu I. Direktivi 67/548/EEZ ili u dijelu B Priloga II. ili u dijelu B Priloga III. ovoj Direktivi predviđene niže vrijednosti, ukoliko u Prilogu V. ovoj Direktivi nije određeno drukčije.
|
Kategorija opasnosti tvari |
Koncentracija koja se uzima u obzir kod |
|
|
plinovitih pripravaka % volumnog udjela |
ostalih pripravaka % masenog udjela |
|
|
Jako otrovno |
≥ 0,02 |
≥ 0,1 |
|
Otrovno |
≥ 0,02 |
≥ 0,1 |
|
Karcinogeno 1. ili 2. kategorija |
≥ 0,02 |
≥ 0,1 |
|
Mutageno 1. ili 2. kategorija |
≥ 0,02 |
≥ 0,1 |
|
Reproduktivno otrovno 1. ili 2. kategorija |
≥ 0,02 |
≥ 0,1 |
|
Štetno |
≥ 0,2 |
≥ 1 |
|
Nagrizajuće |
≥ 0,02 |
≥ 1 |
|
Nadražujuće |
≥ 0,2 |
≥ 1 |
|
Dovodi do preosjetljivosti |
≥ 0,2 |
≥ 1 |
|
Karcinogeno 3. kategorija |
≥ 0,2 |
≥ 1 |
|
Mutageno 3. kategorija |
≥ 0,2 |
≥ 1 |
|
Reproduktivno otrovno 3. kategorija |
≥ 0,2 |
≥ 1 |
|
Opasno za okoliš N |
|
≥ 0,1 |
|
Opasno za okoliš ozon |
≥ 0,1 |
≥ 0,1 |
|
Opasno za okoliš |
|
≥ 1 |
Članak 4.
Opća načela razvrstavanja i označivanja
1. Razvrstavanje opasnih pripravaka prema stupnju i specifičnoj prirodi opasnosti koje iz njih proizlaze temelji se na definicijama kategorija opasnosti utvrđenima u članku 2.
2. Opća se načela razvrstavanja i označivanja pripravaka primjenjuju u skladu s kriterijima utvrđenim u Prilogu VI. Direktivi 67/548/EEZ, osim u slučajevima gdje se primjenjuju alternativni kriteriji iz članaka 5., 6., 7. ili 10. i odgovarajući prilozi ovoj Direktivi.
Članak 5.
Ocjenjivanje opasnosti koje proizlaze iz fizikalno-kemijskih svojstava
1. Opasnosti pripravka koje proizlaze iz njegovih fizikalno-kemijskih svojstava procjenjuju se određivanjem fizikalno-kemijskih svojstava pripravka, primjenom metoda utvrđenih u dijelu A Priloga V. Direktivi 67/548/EEZ, koji su potrebna za pravilno razvrstavanje i označivanje u skladu s kriterijima utvrđenim u Prilogu VI. toj Direktivi.
2. Odstupajući od stavka 1.:
|
|
određivanje eksplozivnih, oksidirajućih, vrlo lako zapaljivih, lako zapaljivih ili zapaljivih svojstava nije potrebno pod uvjetom da:
|
3. Za određene slučajeve u kojima metode utvrđene u dijelu A Priloga V. Direktivi 67/548/EEZ nisu primjerene, alternativne računske metode utvrđene su u dijelu B Priloga I. ovoj Direktivi.
4. U dijelu A Priloga I. ovoj Direktivi navode se određena izuzeća u odnosu na primjenu metoda utvrđenih u dijelu A Priloga V. Direktivi 67/548/EEZ.
5. Opasnosti koje proizlaze iz fizikalno-kemijskih svojstava pripravka obuhvaćenog Direktivom 91/414/EEZ procjenjuju se određivanjem fizikalno-kemijskih svojstava pripravka koja su potrebna za pravilno razvrstavanje u skladu s kriterijima određenim u Prilogu VI. Direktivi 67/548/EEZ. Ta se svojstva određuju primjenom metoda utvrđenih u dijelu A Priloga V. Direktivi 67/548/EEZ, osim ako su prihvatljive druge međunarodno priznate metode u skladu s odredbama Priloga II. i III. Direktivi 91/414/EEZ.
Članak 6.
Ocjenjivanje opasnosti za zdravlje
1. Opasnosti pripravka za zdravlje procjenjuju se pomoću jednog ili više postupaka kako slijedi:
|
(a) |
konvencionalnom metodom opisanom u Prilogu II.; |
|
(b) |
određivanjem toksikoloških svojstava pripravka koja su potrebna za njegovo pravilno razvrstavanje u skladu s kriterijima iz Priloga VI. Direktivi 67/548/EEZ. Ova se svojstva određuju primjenom metoda utvrđenih u dijelu B Priloga V. Direktivi 67/548/EEZ, osim ako su u slučaju sredstava za zaštitu bilja prihvatljive druge međunarodno priznate metode u skladu s odredbama Priloga II. i III. Direktivi 91/414/EEZ. |
2. Ne dovodeći u pitanje zahtjeve Direktive 91/414/EEZ, mogu se koristiti metode opisane u stavku 1. točki (b), pod uvjetom da su opravdane ili izričito odobrene prema članku 12. Direktive 86/609/EEZ, ali samo ako osoba odgovorna za stavljanje pripravka na tržište može pružiti znanstveni dokaz da se toksikološka svojstva pripravka ne mogu točno odrediti metodom opisanom u stavku 1. točki (a) ili na temelju postojećih rezultata ispitivanja na životinjama.
Ako se toksikološko svojstvo utvrđuje metodama opisanim u stavku 1. točki (b) radi dobivanja novih podataka, ispitivanje se provodi sukladno principima dobre laboratorijske prakse ustanovljenim u Direktivi Vijeća 87/18/EEZ od 18. prosinca 1986. o usklađivanju zakona i drugih propisa u odnosu na primjenu načela dobre laboratorijske prakse i potvrđivanje njihove primjene za testove na kemijskim tvarima (18) te odredbama Direktive 86/609/EEZ, posebno njezinim člancima 7. i 12.
Sukladno odredbama stavka 3., ako je toksikološko svojstvo utvrđeno primjenom metoda opisanih u stavku 1. točkama (a) i (b), tada se kod razvrstavanja pripravka koriste rezultati metoda opisanih u stavku 1. točki (b), osim u slučaju karcinogenih, mutagenih ili reproduktivno otrovnih učinaka kada se koristi samo metoda opisana u stavku 1. točki (a).
Sva toksikološka svojstva pripravka koja nisu procijenjena metodom opisanom u stavku 1. točki (b) procjenjuju se u skladu s metodom opisanom u stavku 1. točki (a).
3. Nadalje, ako se može pružiti dokaz:
|
— |
na temelju epidemioloških studija, znanstveno valjanih analiza pojedinačnih slučajeva, kao što je navedeno u Prilogu VI. Direktivi 67/548/EEZ, ili statistički potkrijepljenog iskustva, kao što je procjena podataka dobivenih od toksikoloških centara ili podataka u vezi s profesionalnim bolestima, da se toksikološki učinci pripravka na ljude razlikuju od onih na koje ukazuje primjena metoda opisanih u stavku 1., pripravak se razvrstava u skladu s njegovim učincima na ljude, |
|
— |
da bi se konvencionalnom metodom procjene, zbog učinaka kao što je potencijacija, podcijenila toksikološka opasnost, ovi se učinci uzimaju u obzir kod razvrstavanja pripravka, |
|
— |
da bi se konvencionalnom metodom procjene, zbog učinaka kao što je antagonizam, precijenila toksikološka opasnost, ovi se učinci uzimaju u obzir kod razvrstavanja pripravka. |
4. Kod pripravaka poznatog sastava, osim onih koji su obuhvaćeni Direktivom 91/414/EEZ razvrstanih u skladu sa stavkom 1. točkom (b), potrebno je provesti ponovljeni postupak ocjenjivanja opasnosti za zdravlje, primjenom metoda opisanih u stavku 1. točki (a) ili (b) uvijek kada:
|
— |
proizvođač promijeni sastav prvobitne koncentracije s obzirom na postotak masenog ili volumnog udjela jedne ili više opasnih komponenti, u skladu sa sljedećom tablicom:
|
|
— |
proizvođač promijeni sastav pripravka zamjenom ili dodavanjem jedne ili više komponenti koje mogu, ali ne moraju biti opasne u smislu definicija utvrđenih u članku 2. |
Ponovljeni se postupak ocjenjivanja ne provodi jedino u slučajevima kada postoji valjano, znanstveno utemeljeno opravdanje za pretpostavku da novom ocjenom opasnosti neće doći do promjene u razvrstavanju pripravka.
Članak 7.
Ocjenjivanje opasnosti za okoliš
1. Opasnosti pripravka za okoliš procjenjuju se pomoću jednog ili više postupaka kako slijedi:
|
(a) |
konvencionalnom metodom opisanom u Prilogu III. ovoj Direktivi; |
|
(b) |
određivanjem svojstava pripravka opasnih za okoliš koja su potrebna za njegovo pravilno razvrstavanje u skladu s kriterijima utvrđenim u Prilogu VI. Direktivi 67/548/EEZ. Ova se svojstva određuju primjenom metoda utvrđenih u dijelu C Priloga V. Direktivi 67/548/EEZ, osim ako su u slučaju sredstava za zaštitu bilja prihvatljive druge međunarodno priznate metode u skladu s odredbama Priloga II. i III. Direktivi 91/414/EEZ. Ne dovodeći u pitanje zahtjeve ispitivanja utvrđene u Direktivi 91/414/EEZ, uvjeti primjene ispitnih metoda opisani su u dijelu C Priloga III. ovoj Direktivi. |
2. Ako se ekotoksikološko svojstvo utvrđuje jednom od metoda opisanih u stavku 1. točki (b) radi dobivanja novih podataka, ispitivanje se provodi sukladno principima dobre laboratorijske prakse ustanovljenim u Direktivi 87/18/EEZ i odredbama Direktive 86/609/EEZ.
Ako su opasnosti za okoliš procijenjene na temelju oba gore navedena postupka, kod razvrstavanja pripravka koriste se rezultati metoda iz stavka 1. točke (b).
3. Kod pripravaka poznatog sastava, osim onih koji su obuhvaćeni Direktivom 91/414/EEZ, razvrstanih u skladu s metodom opisanom u stavku 1. točki (b), potrebno je provesti ponovljeni postupak ocjenjivanja opasnosti za okoliš primjenom metode opisane u stavku 1. točki (a) ili metode opisane u stavku 1. točki (b) uvijek kada:
|
— |
proizvođač promijeni sastav prvobitne koncentracije s obzirom na postotak masenog ili volumnog udjela jedne ili više opasnih komponenti, u skladu sa sljedećom tablicom:
|
|
— |
proizvođač promijeni sastav pripravka zamjenom ili dodavanjem jedne ili više komponenti koje mogu, ali ne moraju biti opasne u smislu definicija utvrđenih u članku 2. |
Ponovljeni se postupak ocjenjivanja ne provodi jedino u slučajevima kada postoji valjano, znanstveno utemeljeno opravdanje za pretpostavku da novom ocjenom opasnosti neće doći do promjene u razvrstavanju pripravka
Članak 8.
Obveze i dužnosti država članica
1. Države članice poduzimaju sve potrebne mjere kako bi spriječile stavljanje na tržište pripravaka obuhvaćenih ovom Direktivom koji nisu u skladu s njezinim odredbama.
2. S ciljem pridržavanja odredbi ove Direktive, tijela država članica mogu od bilo koje osobe odgovorne za stavljanje pripravka na tržište zahtijevati informacije o sastavu pripravka i druge relevantne informacije.
3. Države članice poduzimaju sve potrebne mjere kako bi osigurale da osobe koje su odgovorne za stavljanje pripravka na tržište tijelima države članice omoguće uvid u:
|
— |
podatke koji se koriste za razvrstavanje i označivanje pripravka, |
|
— |
sve relevantne informacije u vezi sa zahtjevima u pogledu pakiranja u skladu s člankom 9. stavkom 1.3, uključujući potvrdu o provedenom ispitivanju izdanu u skladu s dijelom A Priloga IX. Direktivi 67/548/EEZ, |
|
— |
podatke koji se koriste za sastavljanje sigurnosno-tehničkog lista, u skladu s člankom 14. |
4. Države članice i Komisija razmjenjuju informacije u vezi s nazivom i punom adresom državnog tijela (državnih tijela) odgovornog(-ih) za priopćavanje i razmjenu informacija koje se odnose na praktičnu primjenu ove Direktive.
Članak 9.
Pakiranje
1. Države članice poduzimaju sve potrebne mjere kako bi osigurale da:
|
1.1. |
se pripravci u smislu članka 1. stavka 2. te pripravci obuhvaćeni Prilogom IV. sukladno članku 1. stavku 3. ne stavljaju na tržište ako njihovo pakiranje ne udovoljava sljedećim zahtjevima:
|
|
1.2. |
spremnici koji sadrže pripravke u smislu članka 1. stavka 2. i pripravke obuhvaćene Prilogom IV. sukladno članku 1. stavku 3., a koji se nude ili prodaju kao predmeti za opću uporabu, nemaju:
|
|
1.3. |
spremnici koji sadrže određene pripravke koji se nude ili prodaju kao predmeti za opću uporabu, a obuhvaćeni su Prilogom IV. ovoj Direktivi:
Uređaji moraju biti u skladu s tehničkim specifikacijama danim u dijelovima A i B Priloga IX. Direktivi 67/548/EEZ. |
2. Smatra se da pakiranje pripravaka udovoljava zahtjevima stavka 1.1 prve, druge i treće alineje, ako je u skladu sa zahtjevima prijevoza opasnih roba željeznicom, cestovnim, unutarnjim vodnim i morskim putovima te zrakom.
Članak 10.
Označivanje
1.1. Države članice poduzimaju sve potrebne mjere kako bi spriječile da:
|
(a) |
se pripravci u smislu članka 1. stavka 2. stave na tržište ako označivanje na njihovom pakiranju ne udovoljava svim zahtjevima ovog članka te odgovarajućim odredbama iz dijelova A i B Priloga V.; |
|
(b) |
se pripravci u smislu članka 1. stavka 3., prema definiciji iz dijelova B i C Priloga V. stave na tržište ako označivanje na njihovom pakiranju ne udovoljava zahtjevima stavaka 2.1. i 2.2. te odgovarajućim odredbama iz dijelova B i C Priloga V. |
1.2. U vezi sa sredstvima za zaštitu bilja podložnim Direktivi 91/414/EEZ, zahtjevima u pogledu označivanja u skladu s ovom Direktivom treba pridodati i sljedeću formulaciju:
„Da bi se izbjegli rizici za ljude i okoliš potrebno je pridržavati se uputa za uporabu.”
Ovakvo označivanje nema utjecaja na informacije koje se zahtijevaju u skladu s člankom 16. i Prilogom V. Direktivi 91/414/EEZ.
2. Na svakom je pakiranju potrebno jasno i neizbrisivo navesti sljedeće podatke:
|
2.1. |
trgovački naziv ili oznaka pripravka; |
|
2.2 |
naziv, puna adresa i telefonski broj osobe s poslovnim nastanom u Zajednici koja je odgovorna za stavljanje pripravka na tržište, bez obzira radi li se o proizvođaču, uvozniku ili distributeru; |
|
2.3. |
kemijski naziv tvari koja je prisutna ili tvari koje su prisutne u pripravku u skladu sa sljedećim detaljnim pravilima:
|
|
2.3.4. |
Kao posljedica gore navedenih odredbi, naziv bilo koje tvari koja je dovela do razvrstavanja pripravka u sljedeće kategorije opasnosti:
nije potrebno navoditi na deklaraciji, osim ako je tvar potrebno navesti sukladno stavcima 2.3.1., 2.3.2. ili 2.3.3. |
|
2.3.5. |
Općenito su dovoljna najviše četiri kemijska naziva za označivanje tvari koje su prvenstveno odgovorne za nastanak većih opasnosti za zdravlje zbog kojih je došlo do razvrstavanja i izbora odgovarajućih oznaka koje se odnose na rizik koji je s njima povezan. U nekim je slučajevima potrebno i više od četiri kemijska naziva. |
2.4. Simbol(i) i oznaka(-e) opasnosti
Simboli opasnosti, kada su određeni ovom Direktivom, i oznake opasnosti koje su povezane s uporabom pripravka moraju biti u skladu s formulacijom iz priloga II. i VI. Direktivi 67/548/EEZ i primjenjuju se u skladu s ocjenom opasnosti koja se provodi u skladu s prilozima I., II. i III. ovoj Direktivi.
Ako se pripravku mora dodijeliti više od jednog simbola opasnosti:
|
— |
u slučaju primjene simbola T, simboli C i X su neobvezni osim ako je drukčije određeno u Prilogu I. Direktivi 67/548/EEZ, |
|
— |
u slučaju primjene simbola C, simbol X je neobvezan, |
|
— |
u slučaju primjene simbola E, simboli F i O su neobvezni, |
|
— |
u slučaju primjene simbola Xn, simbol Xi je neobvezan. |
Simbol(i) moraju biti otisnuti crnom bojom na narančastožutoj podlozi.
2.5. Oznake upozorenja (oznake R)
Upozorenja koja se tiču posebnih rizika (oznake R) moraju biti u skladu s formulacijom iz priloga III. i VI. Direktivi 67/548/EEZ i dodjeljuju se u skladu s rezultatima postupka ocjenjivanja opasnosti provedenog u skladu s prilozima I., II. i III. ovoj Direktivi.
Općenito je za opis rizika dovoljno najviše šest oznaka R; u ovom se smislu kombinirane oznake navedene u Prilogu III. Direktivi 67/548/EEZ smatraju jednom oznakom. Ipak, ako pripravak spada u više od jedne kategorije opasnosti, te standardne oznake moraju obuhvaćati sve glavne opasnosti povezane s pripravkom. U nekim je slučajevima potrebno i više od šest oznaka R.
Standardne oznake „vrlo lako zapaljivo” ili „lako zapaljivo” ne moraju se koristiti ako označuju opasnosti u skladu sa stavkom 2.4.
2.6. Oznake obavijesti (oznake S)
Oznake koje pružaju obavijest o mjerama sigurnosti (oznake S) moraju biti u skladu s formulacijom iz Priloga IV. te s Prilogom VI. Direktivi 67/548/EEZ, a dodjeljuju se u skladu s rezultatima postupka ocjenjivanja opasnosti provedenog u skladu s prilozima I., II. i III. ovoj Direktivi.
Općenito je dovoljno najviše šest oznaka S da bi se formulirala najprimjerenija obavijest o mjerama sigurnosti; u ovom se smislu kombinirane oznake navedene u Prilogu IV. Direktivi 67/548/EEZ smatraju jednom oznakom. Ipak, u nekim je slučajevima potrebno i više od šest oznaka S.
Ako je fizički nemoguće staviti obavijest na samu deklaraciju ili pakiranje, pakiranju je potrebno priložiti obavijest o mjerama sigurnosti pri uporabi pripravka.
2.7. Nazivna količina (nazivna masa ili nazivni volumen) sadržaja kod pripravaka koji se nude ili prodaju kao predmeti za opću uporabu.
3. Kod određenih pripravaka koji se razvrstavaju kao opasni u smislu članka 7., odstupajući od stavaka 2.4., 2.5. i 2.6. ovog članka, moguće je odrediti izuzeća u odnosu na određene odredbe o označivanju s obzirom na utjecaj na okoliš ili utvrditi posebne odredbe o takvom označivanju u skladu s postupkom iz članka 20., ako se može pružiti dokaz da će se njihov utjecaj na okoliš smanjiti. Ova su izuzeća ili posebne odredbe definirane i predviđene u dijelu A ili B Priloga V.
4. Ako sadržaj pakiranja ne prelazi 125 ml:
|
— |
kod pripravaka koji se razvrstavaju kao lako zapaljivi, oksidirajući i nadražujući, osim onih kojima se dodjeljuje oznaka R41, ili kao opasni za okoliš, i kojima se dodjeljuje simbol N, nije potrebno navoditi oznake R i oznake S, |
|
— |
kod pripravaka koji se razvrstavaju kao zapaljivi ili opasni za okoliš, a kojima se ne dodjeljuje simbol N, potrebno je navesti oznake R, ali nije potrebno navoditi oznake S. |
5. Ne dovodeći u pitanje članak 16. stavak 4. Direktive 91/414/EZ, označivanje riječima kao što su „nije otrovno”, „nije štetno”, „nije štetno za okoliš”, „ekološki” ili bilo kojom drugom tvrdnjom koja ukazuje na to da pripravak nije opasan ili koja bi mogla dovesti do podcjenjivanja opasnosti pripravka ne smije se nalaziti na pakiranju ili deklaraciji pripravaka na koje se primjenjuje ova Direktiva.
Članak 11.
Provedba zahtjeva vezanih uz označivanje
1. Ako se podaci predviđeni člankom 10. nalaze na deklaraciji, istu je potrebno dobro pričvrstiti na jednu ili više površina pakiranja tako da se podaci mogu vodoravno pročitati kada je pakiranje normalno položeno. Dimenzije deklaracije utvrđene su u Prilogu VI. Direktivi 67/548/EEZ, a deklaracija je namijenjena isključivo pružanju informacija koje zahtijeva ova Direktiva i, prema potrebi, dodatnih informacija vezanih uz zdravlje i sigurnost.
2. Deklaracija nije potrebna ako su podaci jasno istaknuti na samom pakiranju kao što je navedeno u stavku 1.
3. Boja i izgled deklaracije – ili, u slučaju iz stavka 2., pakiranja – moraju biti takvi da se simbol opasnosti i njegova podloga jasno ističu u odnosu na samu deklaraciju, ili pakiranje.
4. Informacije koje je potrebno navesti na deklaraciji prema članku 10. moraju se jasno isticati u odnosu na podlogu te njihova veličina i razmak moraju biti takvi da ih je moguće lako čitati.
Posebne odredbe u vezi s izgledom i formatom ovih informacija utvrđuju se u Prilogu VI. Direktivi 67/548/EEZ.
5. Države članice mogu stavljanje na tržište pripravaka obuhvaćenih ovom Direktivom na svome teritoriju uvjetovati označivanjem pripravaka na vlastitom službenom jeziku ili jezicima.
6. Smatra se da su zahtjevi u pogledu označivanja ispunjeni u smislu ove Direktive:
|
(a) |
kod vanjskog pakiranja koje sadrži jedno ili više unutarnjih pakiranja, ako je vanjsko pakiranje označeno u skladu s međunarodnim propisima o prijevozu opasnih roba, a unutarnje pakiranje ili pakiranja u skladu s ovom Direktivom; |
|
(b) |
kod pojedinačnog pakiranja:
Ako opasni pripravci ne napuštaju državno područje države članice, može se dopustiti označivanje u skladu s nacionalnim propisima umjesto međunarodnih propisa o prijevozu opasnih roba. |
Članak 12.
Izuzeća u odnosu na zahtjeve vezane uz označivanje i pakiranje
1. Članci 9., 10. i 11. se ne primjenjuju na eksplozive koji se stavljaju na tržište u svrhu postizanja eksplozivnog ili pirotehničkog učinka.
2. Članci 9., 10. i 11. se ne primjenjuju kod određenih opasnih pripravaka u smislu članaka 5., 6. ili 7., definiranih u Prilogu VII., koji u obliku u kojem se stavljaju na tržište ne predstavljaju fizikalno-kemijski rizik niti rizik za zdravlje i okoliš.
3. Države članice također mogu:
|
(a) |
omogućiti da se označivanje predviđeno člankom 10. primjenjuje na neki drugi primjeren način na pakiranja koja su premalena ili na drugi način neprikladna za označivanje u skladu s člankom 11. stavcima 1. i 2.; |
|
(b) |
odstupajući od članaka 10. i 11., omogućiti da se pakiranje opasnih pripravaka koji se razvrstavaju kao štetni za zdravlje, vrlo lako zapaljivi, lako zapaljivi, zapaljivi, nadražujući ili oksidirajući ne označuje, ili da se označuje na neki drugi način ako sadrži tako male količine da nema razloga strahovati od opasnosti za osobe koje rukuju ovim pripravcima ili za druge osobe; |
|
(c) |
odstupajući od članaka 10. i 11., kod pripravaka razvrstanih prema članku 7., omogućiti da se pakiranje opasnih pripravaka ne označuje ili da se označuje na neki drugi način ako sadrži tako male količine da nema razloga strahovati od opasnosti za okoliš; |
|
(d) |
odstupajući od članaka 10. i 11., omogućiti da se pakiranje opasnih pripravaka koji nisu spomenuti u točki (b) ili (c) gore označuje na neki drugi primjeren način ako je pakiranje premaleno za označivanje predviđeno člancima 10. i 11., a nema razloga strahovati od opasnosti za osobe koje rukuju ovim pripravcima ili druge osobe. |
Ako se primjenjuje ovaj stavak, nije dopušteno korištenje simbola, oznaka opasnosti, oznaka upozorenja (R) ili oznaka obavijesti (S) na drukčiji način od onog koji je utvrđen u ovoj Direktivi.
4. Ako država članica koristi opcije koje su predviđene u stavku 3., o tome mora odmah obavijestiti Komisiju i države članice. O mjerama se, tamo gdje je to potrebno, odlučuje u okviru Priloga V. i u skladu s odredbama članka 20.
Članak 13.
Prodaja na daljinu
Pri svakom oglašavanju pripravka u smislu ove Direktive koje svakoj zainteresiranoj osobi omogućava da zaključi ugovor o kupoprodaji bez prethodnog uvida u deklaraciju pripravka, potrebno je spomenuti vrstu ili vrste opasnosti koje su navedene na deklaraciji. Ovaj zahtjev ne dovodi u pitanje odredbe Direktive 97/7/EZ Europskog parlamenta i Vijeća od 20. svibnja 1997. o zaštiti potrošača s obzirom na sklapanje ugovora na daljinu (19).
Članak 14.
Sigurnosno-tehnički list
1. Informacije iz sigurnosno-tehničkog lista prvenstveno su namijenjene profesionalnim korisnicima, a moraju im omogućiti poduzimanje potrebnih mjera u pogledu zaštite zdravlja, sigurnosti i okoliša na radnom mjestu.
2.1. Države članice poduzimaju sve mjere koje su potrebne kako bi osigurale da:
|
(a) |
osoba koja je odgovorna za stavljanje pripravka na tržište u smislu članka 1. stavka 2. ima sigurnosno-tehnički list; |
|
(b) |
osoba koja je odgovorna za stavljanje pripravka na tržište dostavi na zahtjev profesionalnog korisnika sigurnosno-tehnički list koji pruža razmjerne informacije o pripravcima koji se ne razvrstavaju kao opasni u smislu članaka 5., 6. i 7., ali sadrže u pojedinačnoj koncentraciji koja je ≥ 1 % masenog udjela kod neplinovitih pripravaka ili ≥ 0,2 % volumnog udjela kod plinovitih pripravaka najmanje:
|
2.2. Sigurnosno-tehnički list i njegova dostava moraju biti u skladu s odredbama Direktive 91/155/EEZ.
2.3. Izmjene koje su potrebne kako bi se Direktiva 91/155/EEZ prilagodila tehničkom napretku donose se u skladu s postupkom utvrđenim u članku 20. ove Direktive.
Posebno, izmjene koje su potrebne s obzirom na odredbe stavka 2.1. točke (b) donose se prije datuma određenog u članku 22. stavku 1.
2.4. Sigurnosno-tehnički list se može dostaviti na papiru ili elektronski, pod uvjetom da primatelj raspolaže sredstvima koja su potrebna za njegov primitak.
Članak 15.
Tajnost kemijskih naziva
Ako osoba odgovorna za stavljanje pripravka na tržište može dokazati da će, otkrije li na deklaraciji kemijski identitet tvari koja je isključivo razvrstana kao:
|
— |
nadražujuća, osim onih kojima se dodjeljuje znak R41, ili nadražujuća u kombinaciji s jednim ili više drugih svojstava navedenih u stavku 2.3.4. članka 10., ili |
|
— |
štetna za zdravlje ili štetna za zdravlje u kombinaciji s jednim ili više svojstava navedenih u stavku 2.3.4. članka 10. koja sama imaju akutno smrtonosno djelovanje, |
ugroziti povjerljivost u odnosu na svoje intelektualno vlasništvo, ovoj se može, u skladu s odredbama Priloga VI., omogućiti da ovu tvar označi nazivom kojim se označuju najvažnije funkcionalne kemijske skupine ili alternativnim nazivom. Ovaj se postupak ne primjenjuje ako je u Zajednici odnosnoj tvari dodijeljena granična vrijednost izlaganja.
Ako osoba koja je odgovorna za stavljanje pripravka na tržište želi iskoristiti prava iz odredbi o tajnosti kemijskih naziva, dužna je podnijeti zahtjev nadležnom tijelu države članice u kojoj će se prvoj pripravak staviti na tržište.
Zahtjev treba podnijeti u skladu s odredbama Priloga VI., a ovaj mora pružati informacije koje se zahtijevaju u obrascu iz dijela A tog Priloga. Nadležno tijelo može unatoč tomu od osobe koja je odgovorna za stavljanje pripravka na tržište zahtijevati dodatne informacije, ako joj se čini da su ove potrebne za ocjenu valjanosti zahtjeva.
Tijelo države članice koje zaprimi zahtjev za odobrenje tajnosti obavješćuje podnositelja zahtjeva o svojoj odluci. Osoba koja je odgovorna za stavljanje pripravka na tržište prosljeđuje preslik ove odluke svim državama članicama u kojima želi staviti proizvod na tržište.
S povjerljivim informacijama koje se priopće tijelima države članice ili Komisiji postupa se u skladu s člankom 19. stavkom 4. Direktive 67/548/EEZ.
Članak 16.
Prava država članica u vezi sa sigurnošću radnika
Ova Direktiva ne utječe na pravo država članica da u skladu s Ugovorom odrede zahtjeve koje smatraju nužnima, kako bi se osigurala zaštita radnika prilikom uporabe predmetnih opasnih pripravaka, pod uvjetom da se pritom razvrstavanje, pakiranje i označivanje opasnih pripravaka ne mijenja na način koji nije predviđen ovom Direktivom.
Članak 17.
Tijela zadužena za zaprimanje informacija vezanih uz zdravlje
Države članice određuju tijelo ili tijela koja će biti zadužena za zaprimanje informacija, uključujući i informacije o kemijskom sastavu, vezanih uz pripravke koji se stavljaju na tržište, a smatraju se opasnim na temelju njihovih učinaka na zdravlje ili na temelju fizikalno-kemijskih učinaka.
Države članice poduzimaju potrebne mjere kako bi ta tijela pružila sva nužna jamstva za očuvanje povjerljivosti zaprimljenih informacija. Ove se informacije mogu koristiti samo u medicinske svrhe, formuliranjem preventivnih ili kurativnih mjera, posebno u hitnim slučajevima.
Države članice osiguravaju da se informacije ne koriste u druge svrhe.
Države članice vode računa da tim tijelima budu dostupne sve informacije koje se zahtijevaju od proizvođača ili osoba koje su odgovorne za stavljanje pripravka na tržište, a koje su im potrebne za ispunjenje zadaća za koje su odgovorne.
Članak 18.
Klauzula o slobodnom kretanju
Ne dovodeći u pitanje odredbe utvrđene drugdje u zakonodavstvu Zajednice, države članice ne mogu zabraniti, ograničiti niti otežati stavljanje pripravaka na tržište zbog njihovog razvrstavanja, pakiranja, označivanja ili sigurnosno-tehničkih listova, ako su ovi pripravci u skladu s odredbama ove Direktive.
Članak 19.
Zaštitna klauzula
1. Ako država članica ima detaljne dokaze da pripravak, iako je u skladu s odredbama ove Direktive, predstavlja opasnost za ljude ili okoliš zbog razloga koji se tiču odredbi ove Direktive, ova može privremeno zabraniti stavljanje na tržište tog pripravka ili za njega propisati posebne uvjete za svoje državno područje. O tome odmah obavješćuje Komisiju i ostale države članice i daje razloge svoje odluke.
2. U slučaju iz stavka 1., Komisija se u najkraćem mogućem roku savjetuje s državom članicom.
3. Komisija donosi odluku u skladu s postupkom utvrđenim u članku 20.
Članak 20.
Prilagodba tehničkom napretku
Izmjene koje su potrebne da se prilozi ovoj Direktivi prilagode tehničkom napretku donose se u skladu s postupkom utvrđenim u članku 29. stavku 4. točki (a) Direktive 67/548/EEZ.
Komisiji pomaže odbor sastavljen od predstavnika država članica pod predsjedavanjem predstavnika Komisije.
Predstavnik Komisije odboru podnosi nacrt mjera koje treba poduzeti. Odbor daje svoje mišljenje o nacrtu u roku koji može odrediti predsjednik ovisno o hitnosti predmeta. Mišljenje se donosi većinom glasova utvrđenom u članku 205. stavku 2. Ugovora u slučaju odluka koje treba donijeti Vijeće na prijedlog Komisije. Glasovi predstavnika država članica unutar odbora vrednuju se na način utvrđen u tom članku. Predsjednik ne glasa.
Komisija donosi predviđene mjere ako su ove u skladu s mišljenjem odbora.
Ako predviđene mjere nisu u skladu s mišljenjem odbora, ili ako odbor ne da svoje mišljenje, Komisija bez odlaganja podnosi prijedlog Vijeću u pogledu mjera koje treba poduzeti. Vijeće odlučuje kvalificiranom većinom glasova.
Ako Vijeće ne donese odluku u roku od tri mjeseca od datuma upućivanja prijedloga, predložene mjere donosi Komisija.
Članak 21.
Stavljanje direktiva izvan snage
1. Direktive navedene u dijelu A Priloga VIII. ovime se stavljaju izvan snage, ne dovodeći u pitanje obvezu država članica u pogledu rokova za prenošenje u nacionalna zakonodavstva i primjenu Direktiva navedenih u dijelu B Priloga VIII.
2. Direktive navedene u dijelu A Priloga VIII. primjenjuju se na Austriju, Finsku i Švedsku, prema odredbama utvrđenima u dijelu C tog Priloga i sukladno Ugovoru.
3. Upućivanja na Direktive stavljene izvan snage smatraju se upućivanjima na ovu Direktivu i čitaju se u skladu s korelacijskom tablicom utvrđenom u Prilogu IX.
Članak 22.
Prenošenje
1. Prije 30. srpnja 2002. države članice donose i objavljuju zakone i druge propise potrebne za usklađivanje s ovom Direktivom. One o tome odmah obavješćuju Komisiju.
2. Države članice primjenjuju zakone i druge propise iz stavka 1.:
|
(a) |
na pripravke koji nisu obuhvaćeni Direktivom 91/414/EEZ ili Direktivom 98/8/EZ od 30. srpnja 2002.; te |
|
(b) |
na pripravke koji su obuhvaćeni Direktivom 91/414/EEZ ili Direktivom 98/8/EZ od 30. srpnja 2004. |
3. Kada države članice donose ove mjere, te mjere prilikom njihove službene objave sadržavaju uputu na ovu Direktivu ili se uz njih navodi takva uputa. Načine tog upućivanja utvrđuju države članice.
Članak 23.
Stupanje na snagu
Ova Direktiva stupa na snagu na dan objave u Službenom listu Europskih zajednica.
Članak 21. stavak 2. primjenjuje se od 1. siječnja 1999.
Članak 24.
Adresati
Ova je Direktiva upućena državama članicama.
Sastavljeno u Bruxellesu 31. svibnja 1999.
Za Europski parlament
Predsjednik
J. M. GIL-ROBLES
Za Vijeće
Predsjednik
J. FISCHER
(1) SL C 283, 26.9.1996., str. 1. i
SL C 337, 7.11. 1997., str. 45.
(2) SL C 158, 26.5.1997., str. 76.
(3) Mišljenje Europskog parlamenta od 26. lipnja 1997. (SL C 222, 21.7.1997., str. 26.), Zajedničko stajalište Vijeća od 24. rujna 1998. (SL C 360, 23.11.1998., str. 1.) i Odluka Europskog parlamenta od 10. veljače 1999. (SL C 150, 28.5.1999.). Odluka Vijeća od 11. svibnja 1999.
(4) SL L 187, 16.7.1988., str. 14. Direktiva kako je zadnje izmijenjena Direktivom Komisije 96/65/EZ (SL L 265, 18.10.1996., str. 15.).
(5) SL L 154, 5.6.1992., str. 1.
(6) SL L 110, 4.5.1993., str. 20.
(7) SL L 358, 18.12.1986., str. 1.
(8) SL L 206, 29.7.1978., str. 13. Direktiva kako je zadnje izmijenjena Direktivom Vijeća 92/32/EEZ
(9) SL L 230, 19.8.1991., str. 1. Direktiva kako je zadnje izmijenjena Direktivom Komisije 96/68/EZ (SL L 277, 30.10.1996., str. 25.).
(10) SL L 123, 24.4.1998., str. 1.
(11) SL L 76, 22.3.1991., str. 35. Direktiva kako je zadnje izmijenjena Direktivom Komisije 93/112/EEZ (SL L 314, 16.12.1993., str. 38.).
(12) SL L 22, 9.2.1965., str. 369. Direktiva kako je zadnje izmijenjena Direktivom 93/39/EEZ (SL L 214, 24.8.1993., str. 22.).
(13) SL L 262, 27.9.1976., str. 169. Direktiva kako je zadnje izmijenjena Direktivom 97/18/EZ (SL L 114, 1.5.1997., str. 43.).
(14) SL L 194, 25.7.1975., str. 39. Direktiva kako je zadnje izmijenjena Odlukom Komisije 96/350/EZ (SL L 135, 6.6.1996., str. 32.).
(15) SL L 84, 31.3.1978., str. 43.
(16) SL L 246, 17.9.1980., str. 1. Direktiva kako je izmijenjena Direktivom 84/467/Euratom (SL L 265, 5.10.1984., str. 4.).
(17) SL L 147, 9.6.1975., str. 40. Direktiva kako je zadnje izmijenjena Direktivom 94/1/EZ (SL L 23, 28.1.1994., str. 28.).
(18) SL L 15, 17.1.1987., str. 29.
(19) SL L 144, 4.6.1997., str. 19.
PRILOG I.
METODE OCJENJIVANJA FIZIKALNO-KEMIJSKIH SVOJSTAVA PRIPRAVAKA U SKLADU S ČLANKOM 5.
DIO A
Izuzeća u odnosu na ispitne metode iz dijela A Priloga V. Direktivi 67/548/EEZ
Vidjeti točku 2.2.5. Priloga VI. Direktivi 67/548/EEZ.
DIO B
Alternativne računske metode
B.1. Neplinoviti pripravci
|
1. |
Metoda određivanja oksidirajućih svojstava pripravaka koji sadrže organske perokside. Vidjeti 2.2.2.1. Priloga VI. Direktivi 67/548/EEZ. |
B.2. Plinoviti pripravci
|
1. |
Metoda određivanja oksidirajućih svojstava Vidjeti 9.1.1.2. Priloga VI. Direktivi 67/548/EEZ. |
|
2. |
Metoda određivanja zapaljivih svojstava Vidjeti 9.1.1.1. Priloga VI. Direktivi 67/548/EEZ. |
PRILOG II.
METODE OCJENJIVANJA OPASNOSTI PRIPRAVAKA NA ZDRAVLJE U SKLADU S ČLANKOM 6.
Uvod
Procjena se mora izvršiti za sve učinke koje proizvode tvari sadržane u pripravku. Ova konvencionalna metoda opisana u dijelovima A i B ovog Priloga je računska metoda koja je primjenjiva na sve pripravke i kojom se uzimaju u obzir sve opasnosti tvari sadržanih u pripravku na zdravlje. U ovom su smislu opasni učinci na zdravlje podijeljeni kako slijedi:
|
1. |
akutno smrtonosno djelovanje; |
|
2. |
ireverzibilne posljedice nakon jednokratnog izlaganja koje nisu smrtonosne; |
|
3. |
teške posljedice nakon višekratnog ili duljeg izlaganja; |
|
4. |
nagrizajuće djelovanje, nadražujuće djelovanje; |
|
5. |
izazivanje preosjetljivosti; |
|
6. |
karcinogeno djelovanje, mutageno djelovanje, reproduktivno otrovno djelovanje. |
Učinci pripravka na zdravlje ljudi se procjenjuju u skladu s člankom 6. stavkom 1., točkom (a) konvencionalnom metodom opisanom u dijelovima A i B ovog Priloga koristeći pojedinačne granične vrijednosti koncentracije.
|
(a) |
ako su opasnim tvarima navedenima u Prilogu I. Direktivi 67/548/EEZ dodijeljene granične vrijednosti koncentracije koje su potrebne za primjenu metode procjene opisane u dijelu A ovog Priloga, tada se moraju koristiti ove granične vrijednosti; |
|
(b) |
ako se opasne tvari ne spominju u Prilogu I. Direktivi 67/548/EEZ ili se ondje spominju bez graničnih vrijednosti koncentracije koje su potrebne za primjenu metode ocjenjivanja opisane u dijelu A ovog Priloga, tada se granične vrijednosti moraju dodijeliti u skladu s odrednicama iz dijela B ovog Priloga. |
Postupak razvrstavanja utvrđen je u dijelu A ovog Priloga.
Razvrstavanje tvari te posljedično razvrstavanje pripravka izražava se:
|
— |
simbolom i jednom ili više oznaka upozorenja ili |
|
— |
kategorijama (1. kategorija, 2. kategorija ili 3. kategorija) kojima se također dodjeljuju oznake upozorenja ako su tvari i pripravci prikazani kao karcinogeni, mutageni ili reproduktivno otrovni. Stoga je važno, osim simbola, uzeti u obzir sve oznake kojima se označuju pojedinačni rizici pripisani svakoj od tvari koja se razmatra. |
Sustavna procjena svih opasnih učinaka na zdravlje se iskazuje graničnim vrijednostima koncentracije koje se izražavaju u postotku masenog udjela, osim kod plinovitih pripravaka kod kojih se izražavaju u postotku volumnog udjela i u vezi s razvrstavanjem tvari.
Ako pojedine granične vrijednosti koncentracije nisu dane u Prilogu I. Direktivi 67/548/EEZ, kod primjene ove konvencionalne metode u obzir se uzimaju vrijednosti utvrđene u dijelu B ovog Priloga.
DIO A
Postupak ocjenjivanja opasnosti za zdravlje
Postupak ocjenjivanja se odvija stupnjevito kako slijedi:
1. Sljedeći se pripravci razvrstavaju kao vrlo otrovni:
1.1. zbog svog akutnog smrtonosnog djelovanja i dodjeljuje im se simbol „T+”, oznaka opasnosti „vrlo jak otrov” i oznaka upozorenja R26, R27 ili R28;
1.1.1. pripravci koji sadrže jednu ili više tvari koje su razvrstane kao vrlo otrovne i koje imaju ovakvo djelovanje, u pojedinačnim koncentracijama koje su jednake ili veće od:
|
(a) |
koncentracije određene u Prilogu I. Direktivi 67/548/EEZ za tvar ili tvari koje se razmatraju; ili |
|
(b) |
koncentracije određene u točki 1. dijela B ovog Priloga (tablica I. i I. A) ako se tvar ili tvari ne spominju u Prilogu I. Direktivi 67/548/EEZ ili se u njemu spominju bez graničnih vrijednosti koncentracije; |
1.1.2. pripravci koji sadrže više od jedne tvari koja je razvrstana kao vrlo otrovna u pojedinačnim koncentracijama nižim od graničnih vrijednosti određenih u stavku 1.1.1. točki (a) ili (b) ako:

gdje je:
|
PT+ |
= |
postotak masenog ili volumnog udjela svake vrlo otrovne tvari u pripravku, |
|
LT+ |
= |
granična vrijednost za vrlo jaku otrovnost određena za svaku vrlo otrovnu tvar, izražena u postotku masenog, ili volumnog udjela; |
1.2. zbog ireverzibilnih posljedica koje izazivaju nakon jednokratnog izlaganja koje nisu smrtonosne i dodjeljuje im se simbol „T+”, oznaka opasnosti „vrlo jak otrov” i oznaka upozorenja R39/put izlaganja.
|
|
Pripravci koji sadrže najmanje jednu opasnu tvar ovakvog djelovanja u pojedinačnim koncentracijama koje su jednake ili veće od:
|
2. Sljedeći se pripravci razvrstavaju kao otrovni:
2.1. zbog svog akutnog smrtonosnog djelovanja i dodjeljuje im se simbol „T”, oznaka opasnosti „otrov” i oznaka upozorenja R23, R24 ili R25;
2.1.1. pripravci koji sadrže jednu ili više tvari koje su razvrstane kao vrlo otrovne ili otrovne i imaju ovakvo djelovanje u pojedinačnim koncentracijama koje su jednake ili veće od:
|
(a) |
koncentracije određene u Prilogu I. Direktivi 67/548/EEZ za tvar ili tvari koje se razmatraju; ili |
|
(b) |
koncentracije određene u točki 1. dijela B ovog Priloga (tablica I. i I.A) ako se tvar ili tvari ne spominju u Prilogu I. Direktivi 67/548/EEZ ili se u njemu spominju bez graničnih vrijednosti koncentracije; |
2.1.2. pripravci koji sadrže više od jedne tvari koja je razvrstana kao vrlo otrovna ili otrovna u pojedinačnima koncentracijama nižim od graničnih vrijednosti određenih u stavku 2.1.1. točki (a) ili (b) ako:

gdje je:
|
PT+ |
= |
postotak masenog ili volumnog udjela svake vrlo otrovne tvari u pripravku, |
|
PT |
= |
postotak masenog ili volumnog udjela svake otrovne tvari u pripravku, |
|
LT |
= |
odgovarajuća granična vrijednost za otrovnost određena za svaku vrlo otrovnu ili otrovnu tvar, izražena u postotku masenog ili volumnog udjela; |
2.2. zbog ireverzibilnih posljedica koje izazivaju nakon jednokratnog izlaganja koje nisu smrtonosne i dodjeljuje im se simbol „T”, oznaka opasnosti „otrov” i oznaka upozorenja R39/put izlaganja.
|
|
Pripravci koji sadrže najmanje jednu opasnu tvar koja je razvrstana kao vrlo otrovna ili otrovna i ima ovakvo djelovanje u pojedinačnim koncentracijama koje su jednake ili veće od:
|
2.3. zbog svog dugotrajnog djelovanja i dodjeljuje im se simbol „T”, oznaka opasnosti „otrov” i oznaka upozorenja R48/put izlaganja.
|
|
Pripravci koji sadrže najmanje jednu opasnu tvar ovakvog djelovanja u pojedinačnim koncentracijama koje su jednake ili veće od:
|
3. Sljedeći se pripravci razvrstavaju kao štetni za zdravlje:
3.1. zbog svog akutnog smrtonosnog djelovanja i dodjeljuje im se simbol „Xn”, oznaka opasnosti „štetno za zdravlje” i oznaka upozorenja R20, R21 ili R22;
3.1.1. pripravci koji sadrže jednu ili više tvari koje su razvrstane kao vrlo otrovne, otrovne ili štetne za zdravlje i imaju ovakvo djelovanje u pojedinačnim koncentracijama koje su jednake ili veće od:
|
(a) |
koncentracije određene u Prilogu I. Direktivi 67/548/EEZ za tvar ili tvari koje se razmatraju; ili |
|
(b) |
koncentracije određene u točki 1. dijela B ovog Priloga (tablica I. i I.A) ako se tvar ili tvari ne spominju u Prilogu I. Direktivi 67/548/EEZ ili se u njemu spominju bez graničnih vrijednosti koncentracije. |
3.1.2. pripravci koji sadrže više od jedne tvari koja je razvrstana kao vrlo otrovna, otrovna ili štetna za zdravlje u pojedinačnim koncentracijama nižim od graničnih vrijednosti određenih u stavku 3.1.1. točki (a) ili (b) ako:

gdje je:
|
PT+ |
= |
postotak masenog ili volumnog udjela svake vrlo otrovne tvari u pripravku, |
|
PT |
= |
postotak masenog ili volumnog udjela svake otrovne tvari u pripravku, |
|
PXn |
= |
postotak masenog ili volumnog udjela svake tvari u pripravku štetne za zdravlje, |
|
LXn |
= |
odgovarajuća granična vrijednost za štetnost za zdravlje određena za svaku vrlo otrovnu, otrovnu tvar ili tvar štetnu za zdravlje, izražena u postotku masenog ili volumnog udjela; |
3.2. zbog akutnog djelovanja na pluća ako se progutaju i dodjeljuje im se simbol „Xn”, oznaka opasnosti „štetno za zdravlje” i oznaka upozorenja R65.
|
|
Pripravci koji su razvrstani kao štetni za zdravlje prema kriterijima određenim u točki 3.2.3 Priloga VI. Direktivi 67/548/EEZ. Kod primjene konvencionalne metode prema točki 3.1. gore, ne uzima se u obzir razvrstavanje tvari kao R65; |
3.3. zbog ireverzibilnih posljedica koje izazivaju nakon jednokratnog izlaganja koje nisu smrtonosne i dodjeljuje im se simbol „Xn”, oznaka opasnosti „štetno za zdravlje” i oznaka upozorenja R40/put izlaganja.
|
|
Pripravci koji sadrže najmanje jednu opasnu tvar koja je razvrstana kao vrlo otrovna, otrovna ili štetna za zdravlje i ima ovakvo djelovanje u pojedinačnim koncentracijama koje su jednake ili veće od:
|
3.4. zbog svog dugotrajnog djelovanja i dodjeljuje im se simbol „Xn”, oznaka opasnosti „štetno za zdravlje” i oznaka upozorenja R48/put izlaganja.
|
|
Pripravci koji sadrže najmanje jednu opasnu tvar koja je razvrstana kao otrovna ili štetna za zdravlje i ima ovakvo djelovanje u pojedinačnim koncentracijama koje su jednake ili veće od:
|
4. Sljedeći se pripravci razvrstavaju kao nagrizajući:
4.1. i dodjeljuje im se simbol „C”, oznaka opasnosti „nagrizajuće” i oznaka upozorenja R35;
4.1.1. pripravci koji sadrže jednu ili više tvari koje su razvrstane kao nagrizajuće i kojima je dodijeljena oznaka upozorenja R35 u pojedinačnim koncentracijama koje su jednake ili veće od:
|
(a) |
koncentracije određene u Prilogu I. Direktivi 67/548/EEZ za tvar ili tvari koje se razmatraju; ili |
|
(b) |
koncentracije određene u točki 4. dijela B ovog Priloga (tablica IV. i IV.A) ako se tvar ili tvari ne spominju u Prilogu I. Direktivi 67/548/EEZ ili se u njemu spominju bez graničnih vrijednosti koncentracije. |
4.1.2. pripravci koji sadrže više od jedne tvari koja je razvrstana kao nagrizajuća i kojoj je dodijeljena oznaka R35 u pojedinačnim koncentracijama nižim od graničnih vrijednosti određenih u stavku 4.1.1. točki (a) ili (b) ako:

gdje je:
|
PC, R35 |
= |
postotak masenog ili volumnog udjela u pripravku svake nagrizajuće tvari kojoj je dodijeljena oznaka upozorenja R35, |
|
LC, R35 |
= |
granična vrijednost R35 za nagrizajuće djelovanje određena za svaku nagrizajuću tvar kojoj je dodijeljena oznaka upozorenja R35, izražena u postotku masenog ili volumnog udjela; |
i dodjeljuje im se simbol „C”, oznaka opasnosti „nagrizajuće” i oznaka upozorenja R34;
4.2.1. pripravci koji sadrže jednu ili više tvari koje su razvrstane kao nagrizajuće i kojima je dodijeljena oznaka upozorenja R35 ili R34 u pojedinačnim koncentracijama koje su jednake ili veće od:
|
(a) |
koncentracije određene u Prilogu I. Direktivi 67/548/EEZ za tvar ili tvari koje se razmatraju; ili |
|
(b) |
koncentracije određene u točki 4. dijela B ovog Priloga (tablica IV. i IV.A) ako se tvar ili tvari ne spominju u Prilogu I. Direktivi 67/548/EEZ ili se u njemu spominju bez graničnih vrijednosti koncentracije; |
4.2.2. pripravci koji sadrže više od jedne tvari koja je razvrstana kao nagrizajuća i kojoj je dodijeljena oznaka upozorenja R35 ili R34 u pojedinačnim koncentracijama nižim od graničnih vrijednosti određenih u stavku 4.2.1. točki (a) ili (b) ako:
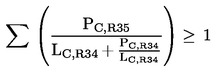
gdje je:
|
PC, R35 |
= |
postotak masenog ili volumnog udjela u pripravku svake nagrizajuće tvari kojoj je dodijeljena oznaka upozorenja R35, |
|
PC, R34 |
= |
postotak masenog ili volumnog udjela u pripravku svake nagrizajuće tvari kojoj je dodijeljena oznaka upozorenja R34, |
|
LC, R34 |
= |
odgovarajuća granična vrijednost R34 za nagrizajuće djelovanje određena za svaku nagrizajuću tvar kojoj je dodijeljena oznaka upozorenja R35 ili R34, izražena u postotku masenog ili volumnog udjela; |
5. Sljedeći se pripravci razvrstavaju kao nadražujući:
5.1. oni koji bi mogli izazvati ozbiljno oštećenje oka i dodjeljuje im se simbol „Xi”, oznaka opasnosti „nadražujuće” i oznaka upozorenja R41;
5.1.1. pripravci koji sadrže jednu ili više tvari koje su razvrstane kao nadražujuće i kojima je dodijeljena oznaka upozorenja R41 u pojedinačnim koncentracijama koje su jednake ili veće od:
|
(a) |
koncentracije određene u Prilogu I. Direktivi 67/548/EEZ za tvar ili tvari koje se razmatraju; ili |
|
(b) |
koncentracije određene u točki 4. dijela B ovog Priloga (tablica IV. i IV.A), ako se tvar ili tvari ne spominju u Prilogu I. Direktivi 67/548/EEZ ili se u njemu spominju bez graničnih vrijednosti koncentracije; |
5.1.2. pripravci koji sadrže više od jedne tvari koja je razvrstana kao nadražujuća i dodijeljena joj je oznaka upozorenja R41, ili koja je razvrstana kao nagrizajuća i dodijeljena joj je oznaka upozorenja R35 ili R34, u pojedinačnim koncentracijama nižim od graničnih vrijednosti određenih u stavku 5.1.1, točki (a) ili (b) ako:

gdje je:
|
PC, R35 |
= |
postotak masenog ili volumnog udjela u pripravku svake nagrizajuće tvari kojoj je dodijeljena oznaka upozorenja R35, |
|
PC, R34 |
= |
postotak masenog ili volumnog udjela u pripravku svake nagrizajuće tvari kojoj je dodijeljena oznaka upozorenja R34, |
|
PXi, R41 |
= |
postotak masenog ili volumnog udjela u pripravku svake nadražujuće tvari kojoj je dodijeljena oznaka upozorenja R41, |
|
LXi, R41 |
= |
odgovarajuća granična vrijednost R41 za nadražljivost određena za svaku nagrizajuću tvar kojoj je dodijeljena oznaka upozorenja R35 ili R34 ili nadražujuću tvar kojoj je dodijeljena oznaka upozorenja R41, izražena u postotku masenog ili volumnog udjela; |
5.2. oni koji nadražuju oči i dodjeljuje im se simbol „Xi”, oznaka opasnosti „nadražujuće” i oznaka upozorenja R36;
5.2.1. pripravci koji sadrže jednu ili više tvari koje su razvrstane kao nagrizajuće i dodijeljena im je oznaka upozorenja R35 ili R34, ili koje su razvrstane kao nadražujuće i dodijeljena im je oznaka upozorenja R41 ili R36 u pojedinačnim koncentracijama koje su jednake ili veće od:
|
(a) |
koncentracije određene u Prilogu I. Direktivi 67/548/EEZ za tvar ili tvari koje se razmatraju; ili |
|
(b) |
koncentracije određene u točki 4. dijela B ovog Priloga (tablica IV. i IV. A) ako se tvar ili tvari ne spominju u Prilogu I. Direktivi 67/548/EEZ ili se u njemu spominju bez graničnih vrijednosti koncentracije; |
5.2.2. pripravci koji sadrže više od jedne tvari koja je razvrstana kao nadražujuća i dodijeljena joj je oznaka upozorenja R41 ili R36, ili koja je razvrstana kao nagrizajuća i dodijeljena joj je oznaka upozorenja R35 ili R34, u pojedinačnim koncentracijama nižim od graničnih vrijednosti određenih u stavku 5.2.1, točki (a) ili (b) ako:

gdje je:
|
PC, R35 |
= |
postotak masenog ili volumnog udjela u pripravku svake nagrizajuće tvari kojoj je dodijeljena oznaka upozorenja R35, |
|
PC, R34 |
= |
postotak masenog ili volumnog udjela u pripravku svake nagrizajuće tvari kojoj je dodijeljena oznaka upozorenja R34, |
|
PXi, R41 |
= |
postotak masenog ili volumnog udjela u pripravku svake nadražujuće tvari kojoj je dodijeljena oznaka upozorenja R41, |
|
PXi, R36 |
= |
postotak masenog ili volumnog udjela u pripravku svake nadražujuće tvari kojoj je dodijeljena oznaka upozorenja R36, |
|
LXi, R36 |
= |
odgovarajuća granična vrijednost R36 za nadražujuće djelovanje određena za svaku nagrizajuću tvar kojoj je dodijeljena oznaka upozorenja R35 ili R34 ili za svaku nadražujuću tvar kojoj je dodijeljena oznaka upozorenja R41 ili R36, izražena u postotku masenog ili volumnog udjela; |
5.3. oni koji nadražuju kožu i dodjeljuje im se simbol „Xi”, oznaka opasnosti „nadražujuće” i oznaka upozorenja R38;
5.3.1. pripravci koji sadrže jednu ili više tvari koje su razvrstane kao nadražujuće i dodijeljena im je oznaka upozorenja R38, ili kao nagrizajuće i dodijeljena im je oznaka upozorenja R35 ili R34, u pojedinačnim koncentracijama koje su jednake ili veće od:
|
(a) |
koncentracije određene u Prilogu I. Direktivi 67/548/EEZ za tvar ili tvari koje se uzimaju razmatraju; ili |
|
(b) |
koncentracije određene u točki 4. dijela B ovog Priloga (tablica IV. i IV.A) ako se tvar ili tvari ne spominju u Prilogu I. Direktivi 67/548/EEZ ili se u njemu spominju bez graničnih vrijednosti koncentracije; |
5.3.2. pripravci koji sadrže više od jedne tvari koja je razvrstana kao nadražujuća i dodijeljena joj je oznaka upozorenja R38, ili kao nagrizajuća i dodijeljena joj je oznaka upozorenja R35 ili R34, u pojedinačnim koncentracijama nižim od graničnih vrijednosti određenih u stavku 5.3.1, točki (a) ili (b) ako:

gdje je:
|
PC, R35 |
= |
postotak masenog ili volumnog udjela u pripravku svake nagrizajuće tvari kojoj je dodijeljena oznaka upozorenja R35, |
|
PC, R35 |
= |
postotak masenog ili volumnog udjela u pripravku svake nagrizajuće tvari kojoj je dodijeljena oznaka upozorenja R34, |
|
PXi, R38 |
= |
postotak masenog ili volumnog udjela u pripravku svake nadražujuće tvari kojoj je dodijeljena oznaka upozorenja R38, |
|
LXi, R38 |
= |
odgovarajuća granična vrijednost R38 za nadražujuće djelovanje određena za svaku nagrizajuću tvar kojoj je dodijeljena oznaka upozorenja R35 ili R34 ili nadražujuću tvar kojoj je dodijeljena oznaka upozorenja R38, izražena u postotku masenog ili volumnog udjela; |
5.4. oni koji nadražuju dišni sustav i dodjeljuje im se simbol „Xi”, oznaka opasnosti „nadražujuće” i oznaka upozorenja R37;
5.4.1. pripravci koji sadrže jednu ili više tvari koje su razvrstane kao nadražujuće i dodijeljena im je oznaka upozorenja R37 u pojedinačnim koncentracijama koje su jednake ili veće od:
|
(a) |
koncentracije određene u Prilogu I. Direktivi 67/548/EEZ za tvar ili tvari koje se razmatraju; ili |
|
(b) |
koncentracije određene u točki 4. Dijela B ovog Priloga (tablica IV. i IV.A) ako se tvar ili tvari ne spominju u Prilogu I. Direktivi 67/548/EEZ ili se u njemu spominju bez graničnih vrijednosti koncentracije; |
5.4.2. pripravci koji sadrže više od jedne tvari koja je razvrstana kao nadražujuća i dodijeljena joj je oznaka upozorenja R37 u pojedinačnim koncentracijama nižim od graničnih vrijednosti određenih u stavku 5.4.1., točki (a) ili (b) ako:
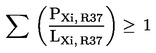
gdje je:
|
PXi, R37 |
= |
postotak masenog ili volumnog udjela u pripravku svake nadražujuće tvari kojoj je dodijeljena oznaka upozorenja R37, |
|
LXi, R37 |
= |
granična vrijednost R37 za nadražujuće djelovanje određena za svaku nadražujuću tvar kojoj je dodijeljena oznaka upozorenja R37, izražena u postotku masenog ili volumnog udjela; |
5.4.3. plinoviti pripravci koji sadrže više od jedne tvari koja je razvrstana kao nadražujuća i dodijeljena joj je oznaka upozorenja R37, ili kao nagrizajuća i dodijeljena joj je oznaka upozorenja R35 ili R34, u pojedinačnim koncentracijama nižim od graničnih vrijednosti određenih u stavku 5.4.1., točki (a) ili (b) ako:
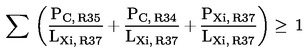
gdje je:
|
PC, R35 |
= |
postotak volumnog udjela u pripravku svake nagrizajuće tvari kojoj je dodijeljena oznaka upozorenja R35, |
|
PC, R34 |
= |
postotak volumnog udjela u pripravku svake nagrizajuće tvari kojoj je dodijeljena oznaka upozorenja R34, |
|
PXi, R37 |
= |
postotak volumnog udjela u pripravku svake nadražujuće tvari kojoj je dodijeljena oznaka upozorenja R37, |
|
LXi, R37 |
= |
odgovarajuća granična vrijednost R37 za nadražujuće djelovanje određena za svaku plinovitu nagrizajuću tvar kojoj je dodijeljena oznaka upozorenja R35 ili R34, ili plinovitu nadražujuću tvar kojoj je dodijeljena oznaka upozorenja R37, izražena u postotku masenog ili volumnog udjela. |
6. Sljedeći se pripravci razvrstavaju kao pripravci koji dovode do preosjetljivosti:
6.1. u dodiru s kožom i dodjeljuje im se simbol „Xi”, oznaka opasnosti „nadražujuće” i oznaka upozorenja R43.
|
|
Pripravci koji sadrže najmanje jednu tvar koja je razvrstana kao tvar koja dovodi do preosjetljivosti i dodijeljena joj je oznaka upozorenja R43, te ima ovakvo djelovanje, u pojedinačnim koncentracijama koje su jednake ili veće od:
|
6.2. ako se udišu i dodjeljuje im se simbol „Xn”, oznaka opasnosti „štetno za zdravlje” i oznaka upozorenja R42.
|
|
Pripravci koji sadrže najmanje jednu tvar koja je razvrstana kao tvar koja dovodi do preosjetljivosti i dodijeljena joj je oznaka upozorenja R42, te ima ovakvo djelovanje, u pojedinačnim koncentracijama koje su jednake ili veće od:
|
7. Sljedeći se pripravci razvrstavaju kao karcinogeni:
7.1. pripravci 1. ili 2. kategorije kojima je dodijeljen simbol „T” i oznaka upozorenja R45 ili R49.
|
|
Pripravci koji sadrže najmanje jednu tvar ovakvog djelovanja koja je razvrstana kao karcinogena i dodijeljena joj je oznaka upozorenja R45 ili R49 kojom se označuju karcinogene tvari 1. i 2. kategorije, u pojedinačnim koncentracijama koje su jednake ili veće od:
|
7.2. pripravci 3. kategorije kojima je dodijeljen simbol „Xn” i oznaka upozorenja R40.
|
|
Pripravci koji sadrže najmanje jednu tvar ovakvog djelovanja koja je razvrstana kao karcinogena i dodijeljena joj je oznaka upozorenja R40 kojom se označuju karcinogene tvari 3. kategorije, u pojedinačnim koncentracijama koje su jednake ili veće od:
|
8. Sljedeći se pripravci razvrstavaju kao mutageni:
8.1. pripravci 1. i 2. kategorije kojima je dodijeljen simbol „T” i oznaka upozorenja R46.
|
|
Pripravci koji sadrže najmanje jednu tvar ovakvog djelovanja koja je razvrstana kao mutagena i dodijeljena joj je oznaka upozorenja R46 kojom se označuju mutagene tvari 1. i 2. kategorije u pojedinačnim koncentracijama koje su jednake ili veće od:
|
8.2. pripravci 3. kategorije kojima je dodijeljen simbol „Xn” i oznaka upozorenja R40.
|
|
Pripravci koji sadrže najmanje jednu tvar ovakvog djelovanja, koja je razvrstana kao mutagena i dodijeljena joj je oznaka upozorenja R40 kojom se označuju mutagene tvari 3. kategorije, u pojedinačnim koncentracijama koje su jednake ili veće od:
|
9. Sljedeći se pripravci razvrstavaju kao reproduktivno otrovni:
9.1. pripravci 1. i 2. kategorije kojima je dodijeljen simbol „T” i oznaka upozorenja R60 (plodnost).
|
|
Pripravci koji sadrže najmanje jednu tvar ovakvog djelovanja, koja je razvrstana kao reproduktivno otrovna i dodijeljena joj je oznaka upozorenja R60 kojom se označuju reproduktivno otrovne tvari 1. i 2. kategorije, u pojedinačnim koncentracijama koje su jednake ili veće od:
|
9.2. pripravci 3. kategorije kojima je dodijeljen simbol „Xn” i oznaka upozorenja R62 (plodnost).
|
|
Pripravci koji sadrže najmanje jednu tvar ovakvog djelovanja, koja je razvrstana kao reproduktivno otrovna i dodijeljena joj je oznaka upozorenja R62 kojom se označuju reproduktivno otrovne tvari 3. kategorije, u pojedinačnim koncentracijama koje su jednake ili veće od:
|
9.3. pripravci 1. i 2. kategorije kojima je dodijeljen simbol „T” i oznaka upozorenja R61 (razvoj).
|
|
Pripravci koji sadrže najmanje jednu tvar ovakvog djelovanja, koja je razvrstana kao reproduktivno otrovna i dodijeljena joj je oznaka upozorenja R61 kojom se označuju reproduktivno otrovne tvari 1. i 2. kategorije, u pojedinačnim koncentracijama koje su jednake ili veće od:
|
9.4. pripravci 3. kategorije kojima je dodijeljen simbol „Xn” i oznaka upozorenja R63 (razvoj).
|
|
Pripravci koji sadrže najmanje jednu tvar ovakvog djelovanja, koja je razvrstana kao reproduktivno otrovna i dodijeljena joj je oznaka upozorenja R63 kojom se označuju reproduktivno otrovne tvari 3. kategorije, u pojedinačnim koncentracijama koje su jednake ili veće od:
|
DIO B
Granične vrijednosti koncentracije koje se koriste kod ocjenjivanja opasnosti na zdravlje
U prvoj se tablici (tablice od I. do VI.) utvrđuju granične vrijednosti koncentracije (izražene u postotku masenog udjela) koje se koriste kod neplinovitih pripravaka, a u drugoj tablici (tablice od I. A do VI.A) granične vrijednosti koncentracije (izražene u postotku volumnog udjela) koje se koriste kod plinovitih pripravaka, i to po vrstama učinaka na zdravlje ljudi. Ove se granične vrijednosti koncentracije koriste ako u Prilogu I. Direktivi 67/548/EEZ nisu predviđene posebne granične vrijednosti koncentracije za tvar koja se razmatra.
1. Akutno smrtonosno djelovanje
1.1.
Granične vrijednosti koncentracije utvrđene u tablici I., izražene u postotku masenog udjela, određuju razvrstavanje pripravka u odnosu prema pojedinačnoj koncentraciji prisutne tvari (prisutnih tvari) čije je razvrstavanje također prikazano.
Tablica I.
|
Razvrstavanje tvari |
Razvrstavanje pripravka |
||
|
T+ |
T |
Xn |
|
|
T+ s R26, R27, R28 |
koncentracija ≥ 7 % |
1 % ≤ koncentracija < 7 % |
0,1 % ≤ koncentracija < 1 % |
|
T s R23, R24, R25 |
|
koncentracija ≥ 25 % |
3 % ≤ koncentracija < 25 % |
|
Xn s R20, R21, R22 |
|
|
koncentracija ≥ 25 % |
Oznake R kojima se označuje rizik treba dodijeliti pripravku u skladu sa sljedećim kriterijima:
|
— |
deklaracija mora uključivati jedno ili više gore spomenutih upozorenja R ovisno o razvrstavanju koje se koristi, |
|
— |
općenito treba odabrati upozorenja R koja su primjenjiva na tvar(i) koje su prisutne u koncentraciji koja dovodi do razvrstavanja u najvišu kategoriju opasnosti. |
1.2.
Granične vrijednosti koncentracije izražene u postotku volumnog udjela u Tablici I. A dolje određuju razvrstavanje plinovitih pripravaka u odnosu prema pojedinačnoj koncentraciji prisutnog plina (prisutnih plinova) čije je razvrstavanje također prikazano.
Tablica I.A
|
Razvrstavanje tvari (plina) |
Razvrstavanje plinovitog pripravka |
||
|
T+ |
T |
Xn |
|
|
T+ s R26, R27, R28 |
koncentracija ≥ 1 % |
0,2 % ≤ koncentracija < 1 % |
0,02 % ≤ koncentracija < 0,2 % |
|
T s R23, R24, R25 |
|
koncentracija ≥ 5 % |
0,5 % ≤ koncentracija < 5 % |
|
Xn s R20, R21, R22 |
|
|
koncentracija ≥ 5 % |
Oznake R kojima se označuje rizik treba dodijeliti pripravku u skladu sa sljedećim kriterijima:
|
— |
deklaracija mora uključivati jedno ili više gore spomenutih upozorenja R ovisno o razvrstavanju koje se koristi, |
|
— |
općenito treba odabrati upozorenja R koja su primjenjiva na tvar(i) koje su prisutne u koncentraciji koja dovodi do razvrstavanja u najvišu kategoriju opasnosti. |
2. Ireverzibilne posljedice nakon jednokratnog izlaganja koje nisu smrtonosne
2.1.
Kod tvari koje izazivaju ireverzibilne posljedice nakon jednokratnog izlaganja koje nisu smrtonosne (R39/put izlaganja, R40/put izlaganja), razvrstavanje pripravka određuju, tamo gdje je to primjereno, pojedinačne granične vrijednosti koncentracije određene u tablici II., izražene u postotku masenog udjela.
Tablica II.
|
Razvrstavanje tvari |
Razvrstavanje pripravka |
||
|
T+ |
T |
Xn |
|
|
T+ s R39/put izlaganja |
koncentracija ≥ 10 % R39 (1) obvezno |
1 % ≤ koncentracija < 10 % R39 (1) obvezno |
0,1 % ≤ koncentracija < 1 % R40 (1) obvezno |
|
T s R39/put izlaganja |
|
koncentracija ≥ 10 % R39 (1) obvezno |
1 % ≤ koncentracija < 10 % R40 (1) obvezno |
|
Xn s R40/put izlaganja |
|
|
koncentracija ≥ 10 % R40 (1) obvezno |
2.2.
Kod plinova koji izazivaju ireverzibilne posljedice nakon jednokratnog izlaganja koje nisu smrtonosne (R39/put izlaganja, R40/put izlaganja), razvrstavanje pripravka određuju, tamo gdje je to primjereno, pojedinačne granične vrijednosti koncentracije određene u tablici II. A, izražene u postotku volumnog udjela.
Tablica II.A
|
Razvrstavanje tvari (plina) |
Razvrstavanje plinovitog pripravka |
||
|
T+ |
T |
Xn |
|
|
T+ s R39/put izlaganja |
koncentracija ≥ 1 % R39 (2) obvezno |
0,2 % ≤ koncentracija < 1 % R39 (2) obvezno |
0,02 % ≤ koncentracija < 0,2 % R40(**) obvezno |
|
T s R39/put izlaganja |
|
koncentracija ≥ 5 % R39 (2) obvezno |
0,5 % ≤ koncentracija < 5 % R40 (2) obvezno |
|
Xn s R40/put izlaganja |
|
|
koncentracija ≥ 5 % R40 (2) obvezno |
3. Teške posljedice nakon višekratnog ili duljeg izlaganja
3.1.
Kod tvari koje dovode do teških posljedica nakon višekratnog ili duljeg izlaganja (R48/put izlaganja), razvrstavanje pripravka određuju, tamo gdje je to primjereno, pojedinačne granične vrijednosti koncentracije određene u Tablici III., izražene u postotku masenog udjela.
Tablica III.
|
Razvrstavanje tvari |
Razvrstavanje pripravka |
|
|
T |
Xn |
|
|
T s R48/put izlaganja |
koncentracija ≥ 10 % R48 (3) obvezno |
1 % ≤ koncentracija < 10 % R48 (3) obvezno |
|
Xn s R48/put izlaganja |
|
koncentracija ≥ 10 % R48 (3) obvezno |
3.2.
Kod plinova koji dovode do teških posljedica nakon višekratnog ili duljeg izlaganja (R48/put izlaganja), razvrstavanje pripravka određuju, tamo gdje je to primjereno, pojedinačne granične vrijednosti koncentracije određene u tablici III.A dolje, izražene u postotku volumnog udjela.
Tablica III.A
|
Razvrstavanje tvari (plina) |
Razvrstavanje plinovitog pripravka |
|
|
T |
Xn |
|
|
T s R48/put izlaganja |
koncentracija ≥ 5 % R48 (4) obvezno |
0,5 % ≤ koncentracija < 5 % R48 (4) obvezno |
|
Xn s R48/put izlaganja |
|
koncentracija ≥ 5 % R48 (4) obvezno |
4. Nagrizajuće i nadražujuće djelovanje uključujući teško oštećenje oka
4.1.
Kod tvari nagrizajućega djelovanja (R34, R35) ili nadražujućega djelovanja (R36, R37, R38, R41) razvrstavanje pripravka određuju, tamo gdje je to primjereno, pojedinačne granične vrijednosti koncentracije određene u tablici IV., izražene u postotku masenog udjela.
Tablica IV.
|
Razvrstavanje tvari |
Razvrstavanje pripravka |
|||
|
C s R35 |
C s R34 |
Xi s R41 |
Xi s R36, R37, R38 |
|
|
C s R35 |
koncentracija ≥ 10 % R35 obvezno |
5 % ≤ koncentracija < 10 % R34 obvezno |
5 % (5) |
1 % ≤ koncentracija < 5 % R36/38 obvezno |
|
C s R34 |
|
koncentracija ≥ 10 % R34 obvezno |
10 % (5) |
5 % ≤ koncentracija < 10 % R36/38 obvezno |
|
Xi s R41 |
|
|
koncentracija ≥ 10 % R41 obvezno |
5 % ≤ koncentracija < 10 % R36 obvezno |
|
Xi s R36, R37, R38 |
|
|
|
koncentracija ≥ 20 % R36, R37, R38 su obvezni s obzirom na prisutnu koncentraciju ako se odnose na tvari koje se razmatraju |
4.2.
Kod plinova ovakvog djelovanja (R34, R35 ili R36, R37, R38, R41), razvrstavanje pripravka određuju, tamo gdje je to primjereno, pojedinačne granične vrijednosti koncentracije određene u tablici IV. A dolje, izražene u postotku volumnog udjela.
Tablica IV.A
|
Razvrstavanje tvari (plina) |
Razvrstavanje plinovitog pripravka |
|||
|
C s R35 |
C s R34 |
Xi s R41 |
Xi s R36, R37, R38 |
|
|
C s R35 |
koncentracija ≥ 1 % R35 obvezno |
0,2 % ≤ koncentracija <1 % R34 obvezno |
0,2 % (6) |
0,02 % ≤ koncentracija < 0,2 % R36/37/38 obvezno |
|
C s R34 |
|
koncentracija ≥ 5 % R34 obvezno |
5 % (6) |
0,5 % ≤ koncentracija < 5 % R36/37/38 obvezno |
|
Xi s R41 |
|
|
koncentracija ≥ 5 % R41 obvezno |
0,5 % ≤ koncentracija < 5 % R36 obvezno |
|
Xi s R36, R37, R38 |
|
|
|
koncentracija ≥ 5 % R36, R37, R38 su obvezni tamo gdje je to primjereno |
5. Nastanak preosjetljivosti
5.1.
Pripravci ovakvog djelovanja se razvrstavaju kao pripravci koji dovode do preosjetljivosti i dodjeljuje im se:
|
— |
simbol Xn i oznaka upozorenja R42 ako ovakvo djelovanje može nastati udisanjem, |
|
— |
simbol Xi i oznaka upozorenja R43 ako ovakvo djelovanje može nastati u dodiru s kožom. |
Razvrstavanje pripravka, tamo gdje je to primjereno, određuju pojedinačne granične vrijednosti koncentracije određene u tablici V., izražene u postotku masenog udjela.
Tablica V.
|
Razvrstavanje tvari |
Razvrstavanje pripravka |
|
|
Dovodi do preosjetljivosti s R42 |
Dovodi do preosjetljivosti s R43 |
|
|
Dovodi do preosjetljivosti s R42 |
koncentracija ≥ 1 % R42 obvezno |
|
|
Dovodi do preosjetljivosti s R43 |
|
koncentracija ≥ 1 % R43 obvezno |
5.2.
Plinoviti pripravci ovakvog djelovanja razvrstavaju se kao pripravci koji dovode do preosjetljivosti i dodjeljuje im se:
|
— |
simbol Xn i oznaka upozorenja R42 ako ovakvo djelovanje može nastati udisanjem, |
|
— |
simbol Xi i oznaka upozorenja R43 ako ovakvo djelovanje može nastati u dodiru s kožom. |
Razvrstavanje pripravka određuju, tamo gdje je to primjereno, pojedinačne granične vrijednosti koncentracije određene u tablici V.A dolje, izražene u postotku volumnog udjela.
Tablica V.A
|
Razvrstavanje tvari (plina) |
Razvrstavanje plinovitog pripravka |
|
|
Dovodi do preosjetljivosti s R42 |
Dovodi do preosjetljivosti s R43 |
|
|
Dovodi do preosjetljivosti s R42 |
koncentracija ≥ 0,2 % R42 obvezno |
|
|
Dovodi do preosjetljivosti s R43 |
|
koncentracija ≥ 0,2 % R43 obvezno |
6. Karcinogeno/mutageno/reproduktivno otrovno djelovanje
6.1.
Kod tvari ovakvog djelovanja razvrstavanje pripravka određuju, tamo gdje je to primjereno, granične vrijednosti koncentracije utvrđene u tablici VI., izražene u postotku masenog udjela. Dodjeljuju se sljedeći simboli i oznake upozorenja:
|
Karcinogeno 1. i 2. kategorija: |
T; R45 ili R49 |
|
Karcinogeno 3. kategorija: |
Xn; R40 |
|
Mutageno 1. i 2. kategorija: |
T; R46 |
|
Mutageno 3. kategorija: |
Xn; R40 |
|
Reproduktivno otrovno 1. i 2. kategorija (plodnost): |
T; R60 |
|
Reproduktivno otrovno 1. i 2. kategorija (razvoj): |
T; R61 |
|
Reproduktivno otrovno 3. kategorija (plodnost): |
Xn; R62 |
|
Reproduktivno otrovno 3. kategorija (razvoj): |
Xn; R63 |
Tablica VI.
|
Razvrstavanje tvari |
Razvrstavanje pripravka |
|
|
1. i 2. kategorija |
3. kategorija |
|
|
karcinogene tvari 1. i 2. kategorije s R45 ili R49 |
koncentracija ≥ 0,1 % karcinogeno R45, R49 obvezno tamo gdje je to primjereno |
|
|
karcinogene tvari 3. kategorije s R40 |
|
koncentracija ≥ 1 % karcinogeno R40 obvezno |
|
mutagene tvari 1. i 2. kategorije s R46 |
koncentracija ≥ 0,1 % mutageno R46 obvezno |
|
|
mutagene tvari 3. kategorije s R40 |
|
koncentracija ≥ 1 % mutageno R40 obvezno |
|
reproduktivno otrovne tvari 1. i 2. kategorije s R60 (plodnost) |
koncentracija ≥ 0,5 % reproduktivno otrovno (plodnost) R60 obvezno |
|
|
reproduktivno otrovne tvari 3. kategorije s R62 (plodnost) |
|
koncentracija ≥ 5 % reproduktivno otrovno (plodnost) R62 obvezno |
|
reproduktivno otrovne tvari 1. i 2. kategorije s R61 (razvoj) |
koncentracija ≥ 0,5 % reproduktivno otrovno (razvoj) R61 obvezno |
|
|
reproduktivno otrovne tvari 3. kategorije s R63 (razvoj) |
|
koncentracija ≥ 5 % reproduktivno otrovno (razvoj) R63 obvezno |
6.2.
Kod plinova ovakvog djelovanja razvrstavanje pripravka određuju, tamo gdje je to primjereno, granične vrijednosti koncentracije utvrđene u tablici VI.A, izražene u postotku volumnog udjela. Dodjeljuju se sljedeći simboli i oznake upozorenja:
|
Karcinogeno 1. i 2. kategorija: |
T; R45 ili R49 |
|
Karcinogeno 3. kategorija: |
Xn; R40 |
|
Mutageno 1. i 2. kategorija: |
T; R46 |
|
Mutageno 3. kategorija: |
Xn; R40 |
|
Reproduktivno otrovno 1. i 2. kategorija (plodnost): |
T; R60 |
|
Reproduktivno otrovno 1. i 2. kategorija (razvoj): |
T; R61 |
|
Reproduktivno otrovno 3. kategorija (plodnost): |
Xn; R62 |
|
Reproduktivno otrovno 3. kategorija (razvoj): |
Xn; R63 |
Tablica VI.A
|
Razvrstavanje tvari (plina) |
Razvrstavanje plinovitog pripravka |
|
|
1. i 2. kategorija |
3. kategorija |
|
|
karcinogene tvari 1. i 2. kategorije s R45 ili R49 |
koncentracija ≥ 0,1 % karcinogeno R45, R49 obvezno tamo gdje je to primjereno |
|
|
karcinogene tvari 3. kategorije s R40 |
|
koncentracija ≥ 1 % karcinogeno R40 obvezno |
|
mutagene tvari 1. i 2. kategorije s R46 |
koncentracija ≥ 0,1 % mutageno R46 obvezno |
|
|
mutagene tvari 3. kategorije s R40 |
|
koncentracija ≥ 1 % mutageno R40 obvezno |
|
reproduktivno otrovne tvari 1. i 2. kategorije s R60 (plodnost) |
koncentracija ≥ 0,2 % reproduktivno otrovno (plodnost) R60 obvezno |
|
|
reproduktivno otrovne tvari 3. kategorije s R62 (plodnost) |
|
koncentracija ≥ 1 % reproduktivno otrovno (plodnost) R62 obvezno |
|
reproduktivno otrovne tvari 1. i 2. kategorije s R61 (razvoj) |
koncentracija ≥ 0,2 % reproduktivno otrovno (razvoj) R61 obvezno |
|
|
reproduktivno otrovne tvari 3. kategorije s R63 (razvoj) |
|
koncentracija ≥ 1 % reproduktivno otrovno (razvoj) R63 obvezno |
(1) Za označivanje puta ulaska/izlaganja (put izlaganja) koriste se kombinirane oznake R navedene u točkama 3.2.1., 3.2.2. i 3.2.3. vodiča za označivanje (Prilog VI. Direktivi 67/548/EEZ).
(2) Za označivanje puta ulaska/izlaganja (put izlaganja) koriste se kombinirane oznake R navedene u točkama 3.2.1., 3.2.2. i 3.2.3. vodiča za označivanje (Prilog VI. Direktivi 67/548/EEZ).
(3) Za označivanje puta ulaska/ izlaganja (put izlaganja) koriste se kombinirane oznake R navedene u točkama 3.2.1., 3.2.2. i 3.2.3. vodiča za označivanje (Prilog VI. Direktivi 67/548/EEZ).
(4) Za označivanje puta ulaska/ izlaganja (put izlaganja) koriste se kombinirane oznake R navedene u točkama 3.2.1., 3.2.2. i 3.2.3. vodiča za označivanje (Prilog VI. Direktivi 67/548/EEZ).
(5) Prema vodiču za označivanje (Prilog VI. Direktivi 67/548/EEZ) smatra se da je nagrizajućim tvarima kojima je dodijeljena oznaka upozorenja R35 ili R34 dodijeljena i oznaka upozorenja R41. Stoga, ako pripravak sadrži nagrizajuće tvari s R35 ili R34 ispod graničnih vrijednosti određenih za razvrstavanje pripravaka u kategoriju pripravaka nagrizajućeg djelovanja, ove tvari mogu doprinijeti razvrstavanju pripravka u kategoriju nadražujuće s R41 ili nadražujuće s R36.
(6) Prema vodiču za označivanje (Prilog VI. Direktivi 67/548/EEZ) smatra se da je nagrizajućim tvarima kojima je dodijeljena oznaka upozorenja R35 ili R34 dodijeljena i oznaka upozorenja R41. Stoga, ako pripravak sadrži nagrizajuće tvari s R35 ili R34 ispod graničnih vrijednosti određenih za razvrstavanje pripravaka u kategoriju pripravaka nagrizajućeg djelovanja, ove tvari mogu doprinijeti razvrstavanju pripravka u kategoriju nadražujuće s R41 ili nadražujuće s R36.
PRILOG III.
METODE OCJENJIVANJA OPASNOSTI PRIPRAVAKA U ODNOSU NA OKOLIŠ U SKLADU S ČLANKOM 7.
Uvod
Sustavna procjena svih svojstava opasnih za okoliš iskazuje se graničnim vrijednostima koncentracije, izraženih u postotku masenog udjela, osim kod plinovitih pripravaka gdje se izražavaju u postotku volumnog udjela i u vezi s razvrstavanjem tvari.
U dijelu A je dan računski postupak prema članku 7. stavku 1. točki (a) te oznake R koje trebaju dodijeliti razvrstavanju pripravka.
U dijelu B su dane granične vrijednosti koncentracije koje se koriste kod primjene konvencionalne metode te odgovarajući simboli i oznake R za razvrstavanje.
U skladu s člankom 7. stavkom 1. točkom (a), opasnosti pripravka za okoliš procjenjuju se konvencionalnom metodom opisanom u dijelovima A i B ovog Priloga, uz uporabu pojedinačnih graničnih vrijednosti koncentracije.
|
(a) |
Ako su opasnim tvarima navedenima u Prilogu I. Direktivi 67/548/EEZ dodijeljene granične vrijednosti koncentracije koje su potrebne za primjenu metode procjene opisane u dijelu A ovog Priloga, tada se moraju koristiti ove granične vrijednosti. |
|
(b) |
Ako se opasne tvari ne spominju u Prilogu I. Direktivi 67/548/EEZ ili se ondje spominju bez graničnih vrijednosti koncentracije koje su potrebne za primjenu metode ocjenjivanja opisane u dijelu A ovog Priloga, ove se granične vrijednosti moraju dodijeliti u skladu s odrednicom iz dijela B ovog Priloga. |
U dijelu C su dane ispitne metode kojima se ocjenjuju opasnosti za vodeni okoliš.
DIO A
Postupak ocjenjivanja opasnosti za okoliš
(a) Vodeni okoliš
I.
Konvencionalna metoda ocjenjivanja opasnosti za vodeni okoliš uzima u obzir sve opasnosti koje mogu proizići za ovu sredinu od određenog pripravka prema sljedećim odrednicama.
Sljedeći se pripravci razvrstavaju kao opasni za okoliš:
1. i dodjeljuje im se simbol „N”, oznaka opasnosti „opasno za okoliš” i oznake upozorenja R50 i R53 (R50—53):
1.1. pripravci koji sadrže jednu ili više tvari koje su razvrstane kao opasne za okoliš i dodijeljene su im oznake upozorenja R50—53 u pojedinačnim koncentracijama koje su jednake ili veće od:
|
(a) |
koncentracije određene u Prilogu I. Direktivi 67/548/EEZ za tvar ili tvari koje se razmatraju; ili |
|
(b) |
koncentracije određene u dijelu B ovog Priloga (tablica 1.) ako se tvar ili tvari ne spominju u Prilogu I. Direktivi 67/548/EEZ ili se u njemu spominju bez graničnih vrijednosti koncentracije; |
1.2. pripravci koji sadrže više od jedne tvari koja je razvrstana kao opasna za okoliš i dodijeljene su joj oznake upozorenja R50—53 u pojedinačnim koncentracijama nižim od graničnih vrijednosti određenih u točki I.1.1. (a) ili (b) ako:

gdje je:
|
PN, R50—53 |
= |
postotak masenog udjela u pripravku svake tvari opasne za okoliš kojoj su dodijeljene oznake upozorenja R50—53, |
|
LN, R50—53 |
= |
granična vrijednost R50—53 za svaku tvar opasnu za okoliš kojoj su dodijeljene oznake upozorenja R50—53, izražena u postotku masenog udjela |
2. i dodjeljuje im se simbol „N”, oznaka opasnosti „opasno za okoliš” i oznake upozorenja R51 i R53 (R51—53), osim ako je pripravak već razvrstan prema točki I.1. gore:
2.1. pripravci koji sadrže jednu ili više tvari koje su razvrstane kao opasne za okoliš i dodijeljene su im oznake upozorenja R50—53 ili R51—53 u pojedinačnim koncentracijama koje su jednake ili veće od:
|
(a) |
koncentracije određene u Prilogu I. Direktivi 67/548/EEZ za tvar ili tvari koje se razmatraju; ili |
|
(b) |
koncentracije određene u dijelu B ovog Priloga (tablica 1.) ako se tvar ilu tvari ne spominju u Prilogu I. Direktivi 67/548/EEZ ili se u njemu spominju bez graničnih vrijednosti koncentracije; |
2.2. pripravci koji sadrže više od jedne tvari koja je razvrstana kao opasna za okoliš i dodijeljene su joj oznake upozorenja R50—53 ili R51—53 u pojedinačnim koncentracijama nižim od graničnih vrijednosti određenih u točki I.2. (a) ili (b) ako:

gdje je:
|
PN, R50—53 |
= |
postotak masenog udjela u pripravku svake tvari opasne za okoliš kojoj su dodijeljene oznake upozorenja R50—53, |
|
PN, R51—53 |
= |
postotak masenog udjela u pripravku svake tvari opasne za okoliš kojoj su dodijeljene oznake upozorenja R51—53, |
|
LN, R51—53 |
= |
odgovarajuća granična vrijednost R51—53 za svaku tvar opasnu za okoliš kojoj su dodijeljene oznake upozorenja R50—53 ili R51—53, izražena u postotku masenog udjela |
3. i dodjeljuju im se oznake upozorenja R52 i R53 (R52—53), osim ako je pripravak već razvrstan prema točki I.1., ili točki I.2. gore;
3.1. pripravci koji sadrže jednu ili više tvari koje su razvrstane kao opasne za okoliš i dodijeljene su im oznake upozorenja R50—53, R51—53 ili R52-53 u pojedinačnim koncentracijama koje su jednake ili veće od:
|
(a) |
koncentracije određene u Prilogu I. Direktivi 67/548/EEZ za tvar ili tvari koje se razmatraju; ili |
|
(b) |
koncentracije određene u dijelu B ovog Priloga (tablica 1.) ako se tvar ili tvari ne spominju u Prilogu I. Direktivi 67/548/EEZ ili se u njemu spominju bez graničnih vrijednosti koncentracije; |
3.2. pripravci koji sadrže više od jedne tvari koja je razvrstana kao opasna za okoliš i dodijeljene su joj oznake upozorenja R51—53, R50—53 ili R52—53 u pojedinačnim koncentracijama nižim od graničnih vrijednosti određenih u točki I.3.1. (a) ili (b) ako:

gdje je:
|
PN, R50—53 |
= |
postotak masenog udjela u pripravku svake tvari opasne za okoliš kojoj su dodijeljene oznake upozorenja R50—53, |
|
PN, R51—53 |
= |
postotak masenog udjela u pripravku svake tvari opasne za okoliš kojoj su dodijeljene oznake upozorenja R51—53, |
|
PR52—53 |
= |
postotak masenog udjela u pripravku svake tvari opasne za okoliš kojoj su dodijeljene oznake upozorenja R52—53, |
|
LR52—53 |
= |
odgovarajuća granična vrijednost R52—53 za svaku tvar opasnu za okoliš kojoj su dodijeljene oznake upozorenja R50—53, R51—53 ili R52—53, izražena u postotku masenog udjela; |
4. i dodjeljuje im se simbol „N”, oznaka opasnosti „opasno za okoliš” i oznaka upozorenja R50, osim ako je pripravak već razvrstan prema točki I.1. gore:
4.1. pripravci koji sadrže jednu ili više tvari koje su razvrstane kao opasne za okoliš i dodijeljena im je oznaka upozorenja R50 u pojedinačnim koncentracijama koje su jednake ili veće od:
|
(a) |
koncentracije određene u Prilogu I. Direktivi 67/548/EEZ za tvar ili tvari koje se razmatraju; ili |
|
(b) |
koncentracije određene u dijelu B ovog Priloga (tablica 2.) ako se tvar ili tvari ne spominju u Prilogu I. Direktivi 67/548/EEZ ili se u njemu spominju bez graničnih vrijednosti koncentracije; |
4.2. pripravci koji sadrže više od jedne tvari koja je razvrstana kao opasna za okoliš i dodijeljena joj je oznaka upozorenja R50 u pojedinačnim koncentracijama nižim od graničnih vrijednosti određenih u točki I.4.1. (a) ili (b) ako:
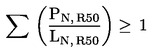
gdje je:
|
PN, R50 |
= |
postotak masenog udjela u pripravku svake tvari opasne za okoliš kojoj je dodijeljena oznaka upozorenja R50, |
|
LN, R50 |
= |
granična vrijednost R50 za svaku tvar opasnu za okoliš kojoj je dodijeljena oznaka upozorenja R50, izražena u postotku masenog udjela. |
4.3. pripravci koji sadrže jednu ili više tvari koje su razvrstane kao opasne za okoliš i dodijeljena im je oznaka upozorenja R50, a koje ne zadovoljavaju kriterije pod I.4.1. ili I.4.2. i sadrže jednu ili više tvari koje su razvrstane kao opasne za okoliš i dodijeljene su im oznake upozorenja R50—53 ako:

gdje je:
|
PN, R50 |
= |
postotak masenog udjela u pripravku svake tvari opasne za okoliš kojoj je dodijeljena oznaka upozorenja R50, |
|
PN, R50—53 |
= |
postotak masenog udjela u pripravku svake tvari opasne za okoliš kojoj su dodijeljene oznake upozorenja R50—53, |
|
LN, R50 |
= |
odgovarajuća granična vrijednost R50 za svaku tvar opasnu za okoliš kojoj su dodijeljene oznake upozorenja R50 ili R50—53, izražena u postotku masenog udjela; |
5. i dodjeljuje im se oznaka upozorenja R52, osim ako je pripravak već razvrstan prema točki I.1., I.2., I.3. ili I. 4. gore:
5.1. pripravci koji sadrže jednu ili više tvari koje su razvrstane kao opasne za okoliš i dodijeljena im je oznaka upozorenja R52 u pojedinačnim koncentracijama koje su jednake ili veće od:
|
(a) |
koncentracije određene u Prilogu I. Direktivi 67/548/EEZ za tvar ili tvari koje se razmatraju; ili |
|
(b) |
koncentracije određene u dijelu B ovog Priloga (tablica 3.) ako se tvar ili tvari ne spominju u Prilogu I. Direktivi 67/548/EEZ ili se u njemu spominju bez graničnih vrijednosti koncentracije; |
5.2. pripravci koji sadrže više od jedne tvari koja je razvrstana kao opasna za okoliš i dodijeljena joj je oznaka upozorenja R52 u pojedinačnim koncentracijama nižim od graničnih vrijednosti određenih u točki I.5.1. (a) ili (b) ako:

gdje je:
|
PR52 |
= |
postotak masenog udjela u pripravku svake tvari opasne za okoliš kojoj je dodijeljena oznaka upozorenja R52, |
|
LR52 |
= |
granična vrijednost R52 za svaku tvar opasnu za okoliš kojoj je dodijeljena oznaka upozorenja R52, izražena u postotku masenog udjela; |
6. i dodjeljuje im se oznaka upozorenja R53, osim ako je pripravak već razvrstan prema točki I.1., I.2. ili I.3. gore:
6.1. pripravci koji sadrže jednu ili više tvari koje su razvrstane kao opasne za okoliš i dodijeljena im je oznaka upozorenja R53 u pojedinačnim koncentracijama koje su jednake ili veće od:
|
(a) |
koncentracije određene u Prilogu I. Direktivi 67/548/EEZ za tvar ili tvari koje se razmatraju; ili |
|
(b) |
koncentracije određene u dijelu B ovog Priloga (tablica 4.) ako se tvar ili tvari ne spominju u Prilogu I. Direktivi 67/548/EEZ ili se u njemu spominju bez graničnih vrijednosti koncentracije; |
6.2. pripravci koji sadrže više od jedne tvari koja je razvrstana kao opasna za okoliš i dodijeljena joj je oznaka upozorenja R53 u pojedinačnim koncentracijama nižim od graničnih vrijednosti određenih u točki I.6.1. (a) ili (b) ako:

gdje je:
|
PR53 |
= |
postotak masenog udjela u pripravku svake tvari opasne za okoliš kojoj je dodijeljena oznaka upozorenja R53, |
|
LR53 |
= |
granična vrijednost R53 za svaku tvar opasnu za okoliš kojoj je dodijeljena oznaka upozorenja R53, izražena u postotku masenog udjela; |
6.3. pripravci koji sadrže jednu ili više tvari koje su razvrstane kao opasne za okoliš i dodijeljena im je oznaka upozorenja R53, a koje ne zadovoljavaju kriterije pod I.6.2. i sadrže jednu ili više tvari koje su razvrstane kao opasne za okoliš i dodijeljeni su im oznake upozorenja R50—53, R51—53 ili R52—53 ako:

gdje je:
|
PR53 |
= |
postotak masenog udjela u pripravku svake tvari opasne za okoliš kojoj je dodijeljena oznaka upozorenja R53, |
|
PN, R50—53 |
= |
postotak masenog udjela u pripravku svake tvari opasne za okoliš kojoj je dodijeljena oznaka upozorenja R50—53, |
|
PN, R51—53 |
= |
postotak masenog udjela u pripravku svake tvari opasne za okoliš kojoj je dodijeljena oznaka upozorenja R51—53, |
|
PR52—53 |
= |
postotak masenog udjela u pripravku svake tvari opasne za okoliš kojoj je dodijeljena oznaka upozorenja R52—53, |
|
LR53 |
= |
odgovarajuća granična vrijednost R53 za svaku tvar opasnu za okoliš kojoj je dodijeljena oznaka upozorenja R53, R50—53, R51—53 ili R52—53, izražena u postotku masenog udjela. |
(b) Nevodeni okoliš
(1) OZONSKI SLOJ
I.
Sljedeći se pripravci razvrstavaju kao opasni za okoliš:
1. i dodjeljuje im se simbol „N”, oznaka opasnosti „opasno za okoliš” i oznaka upozorenja R59;
1.1. pripravci koji sadrže jednu ili više tvari koje su razvrstane kao opasne za okoliš i dodijeljen im je simbol „N” i oznaka upozorenja R59 u pojedinačnim koncentracijama koje su jednake ili veće od:
|
(a) |
koncentracije određene u Prilogu I. Direktivi 67/548/EEZ za tvar ili tvari koje se razmatraju ili |
|
(b) |
koncentracije određene u dijelu B ovog Priloga (Tablica 5.) ako se tvar ili tvari ne spominju u Prilogu I. Direktivi 67/548/EEZ ili se u njemu spominju bez graničnih vrijednosti koncentracije; |
2. i dodjeljuje im se oznaka upozorenja R59:
2.1. pripravci koji sadrže jednu ili više tvari koje su razvrstane kao opasne za okoliš i dodijeljena im je oznaka upozorenja R59 u pojedinačnim koncentracijama koje su jednake ili veće od:
|
(a) |
koncentracije određene u Prilogu I. Direktivi 67/548/EEZ za tvar ili tvari koje se razmatraju ili |
|
(b) |
koncentracije određene u dijelu B ovog Priloga (Tablica 5.) ako se tvar ili tvari ne spominju u Prilogu I. Direktivi 67/548/EEZ ili se u njemu spominju bez graničnih vrijednosti koncentracije; |
(2) KOPNENI OKOLIŠ
I.
Razvrstavanje pripravaka kod kojih se koriste niže navedeni znakovi upozorenja uslijedit će nakon što se detaljni kriteriji uporabe ovih znakova uključe u Prilog VI. Direktivi 67/548/EEZ.
|
R54 |
Otrovno za biljke |
|
R55 |
Otrovno za životinje |
|
R56 |
Otrovno za organizme u tlu |
|
R57 |
Otrovno za pčele |
|
R58 |
Može dugotrajno štetno djelovati na okoliš. |
DIO B
Granične vrijednosti koncentracije koje se koriste kod ocjenjivanja opasnosti za okoliš
I. Vodeni okoliš
Granične vrijednosti koncentracije utvrđene u tablicama koje slijede, izražene u postotku masenog udjela, određuju razvrstavanje pripravka u odnosu prema pojedinačnoj koncentraciji prisutne tvari (prisutnih tvari) čije je razvrstavanje također prikazano.
Tablica 1.
Akutna otrovnost za vodeni okoliš i dugotrajno štetno djelovanje
|
Razvrstavanje tvari |
Razvrstavanje pripravka |
||
|
N, R50—53 |
N, R51—53 |
R52—53 |
|
|
N, R50—53 |
Cn ≥ 25 % |
2,5 % ≤ Cn < 25 % |
0,25 % ≤ Cn < 2,5 % |
|
N, R51—53 |
|
Cn ≥ 25 % |
2,5 % ≤ Cn < 25 % |
|
R52—53 |
|
|
Cn ≥ 25 % |
Tablica 2.
Akutna otrovnost za vodeni okoliš
|
Razvrstavanje tvari |
Razvrstavanje pripravka N, R50 |
|
N, R50 |
Cn ≥ 25 % |
|
N, R50—53 |
Cn ≥ 25 % |
Tablica 3.
Otrovnost za vodeni okoliš
|
Razvrstavanje tvari |
Razvrstavanje pripravka R52 R52 |
|
R52 |
Cn ≥ 25 % |
Tablica 4.
Dugotrajno štetno djelovanje
|
Razvrstavanje tvari |
Razvrstavanje pripravka R53 R53 |
|
R53 |
Cn ≥ 25 % |
|
N, R50—53 |
Cn ≥ 25 % |
|
N, R51—53 |
Cn ≥ 25 % |
|
R52—53 |
Cn ≥ 25 % |
II. Nevodeni okoliš
Granične vrijednosti koncentracije utvrđene u tablicama koje slijede, izražene u postotku masenog udjela, ili kod plinovitih pripravaka u postotku volumnog udjela, određuju razvrstavanje pripravka u odnosu prema pojedinačnoj koncentraciji prisutne tvari (prisutnih tvari) čije je razvrstavanje također prikazano.
Tablica 5.
Opasno za ozonski sloj
|
Razvrstavanje tvari |
Razvrstavanje pripravka N, R59 |
|
N s R59 |
C ≥ 0,1 % |
|
Razvrstavanje tvari |
Razvrstavanje pripravka R59 |
|
R59 |
C ≥ 0,1 % |
DIO C
Ispitne metode kojima se ocjenjuju opasnosti za vodeni okoliš
Razvrstavanje se pripravka obično provodi konvencionalnom metodom. Ipak, kod određivanja akutne otrovnosti za vodeni okoliš u pojedinim je slučajevima primjereno provesti ispitivanja pripravka.
Na temelju rezultata ovih ispitivanja pripravka moguće je samo modificirati razvrstavanje s obzirom na akutnu otrovnost za vodeni okoliš koje bi se dobilo primjenom konvencionalne metode.
Ako se za ova ispitivanja odluči osoba koja je odgovorna za stavljanje pripravka na tržište, treba voditi računa o zadovoljenju kvalitativnih kriterija ispitnih metoda iz dijela C Priloga V. Direktivi 67/548/EEZ.
Nadalje, ispitivanja treba provesti na svim trima vrstama sukladno kriterijima iz Priloga VI. Direktivi 67/548/EEZ (alge, dafnije i ribe), osim ako je nakon ispitivanja provedenog na jednoj od vrsta pripravku dodijeljen najviši razred opasnosti s obzirom na akutnu otrovnost za vodeni okoliš ili je rezultat ispitivanja već bio poznat prije stupanja ove Direktive na snagu.
PRILOG IV.
POSEBNE ODREDBE ZA SPREMNIKE S PRIPRAVCIMA KOJI SE NUDE ILI PRODAJU KAO PREDMETI ZA OPĆU UPORABU
DIO A
Spremnici koji se opremaju posebnim zatvaračima koji onemogućavaju otvaranje djeci
1. Spremnici s pripravcima koji se nude ili prodaju kao predmeti za opću uporabu i označuju kao vrlo otrovni, otrovni ili nagrizajući u skladu s člankom 10. i prema uvjetima utvrđenim u članku 6. ove Direktive moraju, neovisno o kapacitetu, biti opremljeni posebnim zatvaračima koji onemogućavaju otvaranje djeci.
2. Neovisno o kapacitetu, spremnici s pripravcima koji predstavljaju opasnost ako se udišu (Xn, R65) i koji se razvrstavaju i označuju prema stavku 3.2.3. Priloga VI. Direktivi 67/548/EEZ, osim pripravaka koji se stavljaju na tržište u obliku aerosola ili u spremniku koji je opremljen hermetičkim raspršivačem.
3. Spremnici koji sadrže najmanje jednu od dolje navedenih tvari u koncentraciji koja je jednaka ili veća od određene maksimalne pojedinačne koncentracije,
|
Br. |
Oznaka tvari |
Granična vrijednost koncentracije |
||
|
CAS br. |
Naziv |
Einecs br. |
||
|
1. |
67-56-1 |
Metanol |
2006596 |
≥ 3 % |
|
2. |
75-09-2 |
Diklormetan |
2008389 |
≥ 1 % |
koji se nude ili prodaju kao predmeti za opću uporabu moraju, neovisno o kapacitetu, biti opremljeni posebnim zatvaračima koji onemogućavaju otvaranje djeci.
DIO B
Spremnici koji moraju nositi taktilno upozorenje na opasnost
Spremnici s pripravcima koji se nude ili prodaju kao predmeti za opću uporabu i označuju kao vrlo otrovni, otrovni, nagrizajući, štetni za zdravlje, vrlo lako zapaljivi ili lako zapaljivi u skladu s člankom 10. i prema uvjetima utvrđenima u člancima 5. i 6. ove Direktive moraju, neovisno o kapacitetu, nositi taktilno upozorenje na opasnost.
Ova se odredba ne primjenjuje na aerosole koji se razvrstavaju i označuju samo kao vrlo lako zapaljivi ili lako zapaljivi.
PRILOG V.
POSEBNE ODREDBE U VEZI S OZNAČIVANJEM ODREĐENIH PRIPRAVAKA
A. Pripravci koji su razvrstani kao opasni u smislu članaka 5., 6. i 7.
1. Pripravci koji se prodaju kao predmeti za opću uporabu
1.1. Deklaracije na pakiranju koje sadrži ovakve pripravke moraju uz specifične oznake obavijesti biti označene i odgovarajućom oznakom obavijesti S1, S2, S45 ili S46 u skladu s kriterijima utvrđenima u Prilogu VI. Direktivi 67/548/EEZ.
1.2. Ako su ovi pripravci razvrstani kao vrlo otrovni (T+), otrovni (T) ili nagrizajući (C), a fizički je nemoguće navesti ove informacije na samom pakiranju, pakiranju ovakvih pripravaka je potrebno priložiti preciznu i lako razumljivu uputu za uporabu, uključujući i uputu za uništenje praznog pakiranja tamo gdje je to potrebno.
2. Pripravci namijenjeni uporabi raspršivanjem
Deklaracija na pakiranju ovih pripravaka mora obvezno sadržavati oznaku obavijesti S23 uz oznaku obavijesti S38 ili S51 koja mu se dodjeljuje u skladu s kriterijima utvrđenim u Prilogu VI. Direktivi 67/548/EEZ.
3. Pripravci koji sadrže tvar kojoj je dodijeljena oznaka upozorenja R33: Opasnost od učinka nakupljanja
Ako pripravak sadrži najmanje jednu tvar kojoj je dodijeljena oznaka R33, deklaracija pripravka mora sadržavati formulaciju vezanu uz ovaj znak utvrđenu u Prilogu III. Direktivi 67/548/EEZ ako je koncentracija ove tvari u pripravku jednaka ili veća od 1 %, osim ako su u Prilogu I. Direktivi 67/548/EEZ predviđene druge vrijednosti.
4. Pripravci koji sadrže tvar kojoj je dodijeljena oznaka upozorenja R64: Može štetno djelovati na dojenčad preko mlijeka
Ako pripravak sadrži najmanje jednu tvar kojoj je dodijeljen znak upozorenja R64, deklaracija pripravka mora sadržavati formulaciju vezanu uz ovaj znak utvrđenu u Prilogu III. Direktivi 67/548/EEZ ako je koncentracija ove tvari u pripravku jednaka ili veća od 1 %, osim ako su u Prilogu I. Direktivi 67/548/EEZ predviđene druge vrijednosti.
B. Pripravci bez obzira na njihovo razvrstavanje u smislu članaka 5., 6. i 7.
1. Pripravci koji sadrže olovo
1.1.
Deklaracije na pakiranju boja i lakova koji sadrže olovo u količinama koje prelaze 0,15 % (izraženo masom metala) ukupne mase pripravka, kao što je utvrđeno u skladu sa standardom ISO 6503/1984, moraju sadržavati sljedeće podatke:
„Sadrži olovo. Ne koristiti na površinama koje djeca mogu žvakati ili sisati.”
U slučaju pakiranja čiji je sadržaj manji od 125 milimetara, mogu se navesti sljedeći podaci:
„Upozorenje! Sadrži olovo.”
2. Pripravci koji sadrže cijanoakrilate
2.1
Neposredno pakiranje ljepila na bazi cijanoakrilata mora nositi sljedeće natpise:
„Cijanoakrilat
Opasnost
Trenutačno lijepi kožu i oči
Držati izvan dohvata djece.”
Pakiranju mora biti priložena odgovarajuća obavijest o mjerama sigurnosti.
3. Pripravci koji sadrže izocijanate
Deklaracije na pakiranju pripravaka koje sadrže izocijanate (u obliku monomera, oligomera, prepolimera itd. ili njihovih smjesa) moraju nositi sljedeće natpise:
„Sadrži izocijanate.
Vidi obavijest proizvođača.”
4. Pripravci koji sadrže epoksidne komponente prosječne molekulske mase ≤ 700
Deklaracije na pakiranju pripravaka koji sadrže epoksidne komponente prosječne molekulske mase ≤ 700 moraju nositi sljedeće natpise:
„Sadrži epoksidne komponente.
Vidi obavijest proizvođača.”
5. Pripravci koji sadrže aktivni klor, a prodaju se kao predmeti za opću uporabu
Pakiranje pripravaka koji sadrže više od 1 % aktivnog klora mora nositi sljedeće posebne natpise:
„Upozorenje! Ne koristiti s drugim proizvodima. Mogućnost oslobađanja opasnih plinova (klor).”
6. Pripravci koji sadrže kadmij (legure), a namijenjeni su lemljenju
Pakiranje gore navedenih pripravaka mora nositi sljedeći natpis ispisan jasno čitljivim i neizbrisivim slovima:
„Upozorenje! Sadrži kadmij.
Tijekom uporabe se stvaraju opasni dimovi.
Vidi obavijest proizvođača.
Slijedi upute o mjerama sigurnosti.”
7. Pripravci raspoloživi u obliku aerosola
Ne dovodeći u pitanje odredbe ove Direktive, na pripravke raspoložive u obliku aerosola također se primjenjuju odredbe o označivanju u skladu s točkama 2.2 i 2.3 Priloga Direktivi 75/324/EEZ kako je zadnje izmijenjena Direktivom 94/1/EZ.
8. Pripravci koji sadrže tvari koje nisu u potpunosti ispitane
Ako pripravak sadrži najmanje jednu tvar koja u skladu s člankom 13. točkom 3. Direktive 67/548/EEZ nosi natpis „Oprez – tvar nije u potpunosti ispitana”, deklaracija pripravka mora nositi natpis „Upozorenje – ovaj pripravak sadrži tvar koja još nije u potpunosti ispitana” ako je ova tvar prisutna u koncentraciji ≥ 1 %.
9. Pripravci koji nisu razvrstani kao pripravci koji dovode do preosjetljivosti, ali sadrže najmanje jednu tvar koja dovodi do preosjetljivosti
Pakiranje pripravaka koji sadrže najmanje jednu tvar koja je razvrstana kao tvar koja dovodi do preosjetljivosti, a prisutna je u koncentraciji koja je jednaka ili veća od 0,1 % ili u koncentraciji koja je jednaka ili veća od one koja je određena u posebnoj napomeni za ovu tvar u Prilogu I. Direktivi 67/548/EEZ mora nositi natpis:
„Sadrži (naziv tvari koja dovodi do preosjetljivosti). Može izazvati alergijsku reakciju.”
10. Tekući pripravci koji sadrže halogenirane ugljikovodike
Kod tekućih pripravka koji nemaju plamište ili imaju plamište iznad 55 °C, a sadrže halogenirani ugljikovodik i više od 5 % zapaljivih ili lako zapaljivih tvari, pakiranje mora nositi sljedeći natpis:
„Može postati lako zapaljivo tijekom uporabe” ili „Može postati zapaljivo tijekom uporabe.”
C. Pripravci koji nisu razvrstani u smislu članaka 5., 6. i 7., ali sadrže najmanje jednu opasnu tvar
1. Pripravci koji nisu predmeti za opću uporabu
Deklaracija na pakiranju pripravaka na koje se odnosi članak 14. stavak 2.1. točka (b) mora nositi sljedeći natpis:
„Sigurnosno-tehnički list raspoloživ na zahtjev profesionalnog korisnika.”
PRILOG VI.
TAJNOST KEMIJSKOG IDENTITETA TVARI
DIO A
Podaci koje je potrebno dostaviti u zahtjevu za odobrenje tajnosti
Uvodne napomene
|
A. |
U članku 15. naznačeni su uvjeti pod kojima osoba koja je odgovorna za stavljanje pripravka na tržište može iskoristiti pravo na tajnost. |
|
B. |
Kako bi se izbjegli višestruki zahtjevi za odobrenje tajnosti iste tvari koja se koristi u različitim pripravcima dovoljan je jedan zahtjev za odobrenje tajnosti ako određeni broj pripravaka ima:
Za prikrivanje kemijskog identiteta pojedine tvari u odnosnim pripravcima mora se koristiti isti alternativni naziv. Nadalje, zahtjev za odobrenje tajnosti mora sadržavati sve informacije naznačene u zahtjevu koji slijedi, pri čemu je obavezno navesti naziv ili trgovački naziv svakog pripravka. |
|
C. |
Alternativni naziv koja se koristi na deklaraciji mora biti istovjetan onom koji je dan u rubrici 2. „Sastav/informacije o sastojcima” Priloga Direktivi 91/155/EEZ kako je zadnje izmijenjena Direktivom 93/112/EEZ. Ovime se podrazumijeva da će alternativni naziv sadržavati dovoljno informacija o tvari kako bi se osigurala sigurnost prilikom rukovanja. |
|
D. |
Kod podnošenja zahtjeva za korištenje alternativnog naziva, osoba koja je odgovorna za stavljanje na tržište mora uzeti u obzir potrebu za pružanjem dovoljne količine informacija koje su nužne za provođenje mjera predostrožnosti koje se odnose na zdravlje i zaštitu na radnom mjestu te osigurati da se rizici rukovanja smanje na najmanju moguću mjeru. |
Zahtjev za odobrenje tajnosti
U skladu s člankom 15. zahtjev za odobrenje tajnosti mora obvezno sadržavati sljedeće informacije:
|
1. |
Naziv i puna adresa (uključujući telefonski broj) osobe s poslovnim nastanom u Zajednici koja je odgovorna za stavljanje pripravka na tržište (proizvođač, uvoznik ili distributer). |
|
2. |
Precizni identifikacijski podaci tvari u odnosu na koju(-e) se predlaže odobrenje tajnosti i alternativni naziv.
|
||||||||||||||||||||||
|
3. |
Opravdanje tajnosti (vjerojatnost – uvjerljivost). |
|
4. |
Naziv(i) ili trgovački naziv(i) priprav(a)ka. |
|
5. |
Je li naziv ili trgovački naziv isti u čitavoj Zajednici?
Ako ne, navesti naziv(e) ili trgovački naziv (trgovačke nazive) u različitim državama članicama:
|
|
6. |
Sastav priprav(a)ka definiran u točki 2. Priloga Direktivi 91/155/EEZ kako je zadnje izmijenjena Direktivom 93/112/EEZ. |
|
7. |
Razvrstavanje priprav(a)ka prema članku 6. ove Direktive. |
|
8. |
Označivanje priprav(a)ka prema članku 10. ove Direktive. |
|
9. |
Namijenjene uporabe priprav(a)ka. |
|
10. |
Sigurnosno-tehnički list(ovi) sukladno Direktivi 91/155/EEZ kako je zadnje izmijenjena Direktivom 93/112/EEZ. |
DIO B
Leksički vodič za određivanje alternativnih naziva (generičkih naziva)
1. Uvodna napomena
Leksički se vodič temelji na postupku razvrstavanja opasnih tvari (podjela tvari u porodice) koja se nalazi u Prilogu I. Direktivi 67/548/EEZ.
Mogu se koristiti i alternativni nazivi u odnosu na one koji se temelje na ovom vodiču. Ipak, odabrani nazivi moraju u svakom slučaju pružati dovoljno informacija kako bi se osiguralo da se pripravcima može rukovati bez rizika i da se potrebne zdravstvene i zaštitne mjere predostrožnosti mogu poduzeti na radnom mjestu.
Porodice se definiraju na sljedeći način:
|
— |
anorganske ili organske tvari čija se svojstva raspoznaju na temelju prisutnosti zajedničkog kemijskog elementa koji im je glavna karakteristika. Naziv porodice se izvodi iz naziva kemijskog elementa. Ove se porodice označuju kao u Prilogu I. atomskim brojem kemijskog elementa (001 do 103), |
|
— |
organske tvari čija se svojstva raspoznaju na temelju zajedničke funkcionalne skupine koja im je glavna karakteristika. |
Naziv porodice izvodi se iz naziva funkcionalne skupine.
Ove se porodice označuju konvencionalnim brojem koji se nalazi u Prilogu I. (601-650).
U određenim su slučajevima dodane potporodice koje povezuju tvari zajedničkog specifičnog karaktera.
2. Utvrđivanje generičkog naziva
Opća načela
Za potrebe utvrđivanja generičkog naziva usvaja se sljedeći opći pristup koji uključuje dvije uzastopne faze:
|
i. |
utvrđivanje funkcionalnih skupina i kemijskih elemenata koji su prisutni u molekuli; |
|
ii. |
određivanje u kojoj mjeri treba uzeti u obzir najvažnije funkcionalne skupine i kemijske elemente. |
Utvrđene funkcionalne skupine i elementi koji su uzeti u obzir su nazivi porodica i potporodica utvrđeni u točki 3. u obliku neograničavajućeg popisa.
3. Podjela tvari u porodice i potporodice
|
Porodica br. Prilog I. Direktivi 67/548/EEZ |
Porodice Potporodice |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
001 |
Spojevi vodika
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
002 |
Spojevi helija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
003 |
Spojevi litija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
004 |
Spojevi berilija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
005 |
Spojevi bora
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
006 |
Spojevi ugljika
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
007 |
Spojevi dušika
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
008 |
Spojevi kisika |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
009 |
Spojevi fluora
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
010 |
Spojevi neona |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
011 |
Spojevi natrija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
012 |
Spojevi magnezija
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
013 |
Spojevi aluminija
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
014 |
Spojevi silicija
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
015 |
Spojevi fosfora
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
016 |
Spojevi sumpora
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
017 |
Spojevi klora
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
018 |
Spojevi argona |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
019 |
Spojevi kalija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
020 |
Spojevi kalcija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
021 |
Spojevi skandija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
022 |
Spojevi titana |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
023 |
Spojevi vanadija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
024 |
Spojevi kroma
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
025 |
Spojevi mangana |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
026 |
Spojevi željeza |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
027 |
Spojevi kobalta |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
028 |
Spojevi nikla |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
029 |
Spojevi bakra |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
030 |
Spojevi cinka
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
031 |
Spojevi galija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
032 |
Spojevi germanija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
033 |
Spojevi arsena |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
034 |
Spojevi selena |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
035 |
Spojevi broma |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
036 |
Spojevi kriptona |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
037 |
Spojevi rubidija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
038 |
Spojevi stroncija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
039 |
Spojevi itrija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
040 |
Spojevi cirkonija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
041 |
Spojevi niobija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
042 |
Spojevi molibdena |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
043 |
Spojevi tehnecija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
044 |
Spojevi rutenija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
045 |
Spojevi rodija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
046 |
Spojevi paladija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
047 |
Spojevi srebra |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
048 |
Spojevi kadmija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
049 |
Spojevi indija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
050 |
Spojevi kositra
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
051 |
Spojevi antimona |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
052 |
Spojevi telurija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
053 |
Spojevi joda |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
054 |
Spojevi ksenona |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
055 |
Spojevi cezija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
056 |
Spojevi barija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
057 |
Spojevi lantanija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
058 |
Spojevi cerija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
059 |
Spojevi praseodija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
060 |
Spojevi neodija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
061 |
Spojevi prometija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
062 |
Spojevi samarija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
063 |
Spojevi europija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
064 |
Spojevi gadolinija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
065 |
Spojevi terbija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
066 |
Spojevi disprozija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
067 |
Spojevi holmija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
068 |
Spojevi erbija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
069 |
Spojevi tulija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
070 |
Spojevi iterbija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
071 |
Spojevi lutecija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
072 |
Spojevi hafnija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
073 |
Spojevi tantala |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
074 |
Spojevi volframa |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
075 |
Spojevi renija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
076 |
Spojevi osmija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
077 |
Spojevi iridija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
078 |
Spojevi platine |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
079 |
Spojevi zlata |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
080 |
Spojevi žive
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
081 |
Spojevi talija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
082 |
Spojevi olova
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
083 |
Spojevi bizmuta |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
084 |
Spojevi polonija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
085 |
Spojevi astata |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
086 |
Spojevi radona |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
087 |
Spojevi francija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
088 |
Spojevi radija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
089 |
Spojevi aktinija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
090 |
Spojevi torija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
091 |
Spojevi protaktinija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
092 |
Spojevi urana |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
093 |
Spojevi neptunija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
094 |
Spojevi plutonija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
095 |
Spojevi americija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
096 |
Spojevi kirija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
097 |
Spojevi berkelija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
098 |
Spojevi kalifornija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
099 |
Spojevi anštajnija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
100 |
Spojevi fermija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
101 |
Spojevi mendeljevija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
102 |
Spojevi nobelija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
103 |
Spojevi lavrencija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
601 |
Ugljikovodici
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
602 |
Halogenirani ugljikovodici (1)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
603 |
Alkoholi i derivati
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
604 |
Fenoli i derivati
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
605 |
Aldehidi i derivati
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
606 |
Ketoni i derivati
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
607 |
Organske kiseline i derivati
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
608 |
Nitrili i derivati |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
609 |
Nitro-spojevi |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
610 |
Klornitro-spojevi |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
611 |
Azoksi- i azo-spojevi |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
612 |
Spojevi amina
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
613 |
Heterocikličke baze i derivati
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
614 |
Glikozidi i alkaloidi
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
615 |
Cijanati i izocijanati
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
616 |
Amidi i derivati
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
617 |
Organski peroksidi |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
647 |
Enzimi |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
648 |
Kompleksni ugljeni derivati
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
649 |
Kompleksni naftni derivati
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
650 |
Razne tvari
|
4. Praktična primjena:
Nakon pretraživanja popisa, pri čemu se utvrđuje pripada li tvar jednoj ili više porodica ili potporodica s popisa, može se pristupiti utvrđivanju generičkog naziva i to na sljedeći način:
4.1. Ako je naziv porodice ili potporodice dovoljan za karakterizaciju kemijskih elemenata ili važnih funkcionalnih skupina, ovaj će se naziv odabrati kao generički naziv.
Primjeri:
|
— |
1,4 dihidroksibenzen
|
|
— |
butanol
|
|
— |
2-izopropoksietanol
|
|
— |
metakrilat
|
4.2. Ako naziv porodice ili potporodice nije dovoljan za karakterizaciju kemijskih elemenata važnih funkcionalnih skupina, generički će se naziv sastojati od kombinacije odgovarajućih naziva različitih porodica ili potporodica:
Primjeri:
|
— |
klorbenzen
|
|
— |
2,3,6-triklorofenoksiacetatna kiselina
|
|
— |
1-kloro-1-nitropropan
|
|
— |
tetrapropil-ditio-pirofosfat
|
|
Napomena: |
Kod određenih elemenata, uglavnom metala, naziv porodice ili potporodice se može označiti riječima „organski” ili „anorganski”. |
Primjeri:
|
— |
živin klorid
|
|
— |
barijev acetat
|
|
— |
etilnitrit
|
|
— |
natrijev hidrosulfit
|
(Gornji su primjeri tvari preuzete iz Priloga I. Direktivi 67/548/EEZ (19. prilagodba) u pogledu kojih se može podnijeti zahtjev za odobrenje tajnosti).
(1) Navesti prema porodici kojoj pripada halogen.
(2) Uključujući kinone.
PRILOG VII.
PRIPRAVCI OBUHVAĆENI ČLANKOM 12. STAVKOM 2.
Pripravci kako su određeni u točki 9.3. Priloga VI. Direktivi 67/548/EEZ.
PRILOG VIII.
DIO A
Direktive koje se stavljaju izvan snage u skladu s člankom 21.
|
— |
Direktiva 78/631/EEZ o usklađivanju zakonodavstava država članica u odnosu na razvrstavanje, pakiranje i označivanje opasnih pripravaka (pesticida) |
|
— |
Direktiva 88/379/EEZ o usklađivanju zakonodavstava država članica u odnosu na razvrstavanje, pakiranje i označivanje opasnih pripravaka i njezine sljedeće prilagodbe tehničkom napretku:
|
|
— |
Direktiva 90/35/EEZ o definiranju, u skladu s člankom 6. Direktive 88/379/EEZ, kategorije pripravaka čije pakiranje mora biti opremljeno posebnim zatvaračima koji onemogućavaju otvaranje djeci i/ili nositi taktilno upozorenje na opasnost |
|
— |
Direktiva 91/442/EEZ o opasnim pripravcima čije pakiranje mora biti opremljeno posebnim zatvaračima koji onemogućavaju otvaranje djeci |
DIO B
Rokovi za prenošenje u nacionalna zakonodavstva i primjenu u skladu s člankom 22.
|
Direktiva |
Rok za prijenos |
Rok za primjenu |
|
78/631/EEZ |
1. siječnja 1981. |
1. siječnja 1981. |
|
88/379/EEZ |
7. lipnja 1991. |
7. lipnja 1991. |
|
89/178/EEZ |
1. prosinca 1990. |
1. lipnja 1991. |
|
90/492/EEZ |
1. lipnja 1991. |
8. lipnja 1991. |
|
93/18/EEZ |
1. srpnja 1994. |
1. srpnja 1994. |
|
90/35/EEZ |
1. kolovoza 1992. |
1. studenoga 1992. |
|
91/442/EEZ |
1. kolovoza 1992. |
1. studenoga 1992. |
|
96/65/EZ |
31. svibnja 1998. |
31. svibnja 1998. |
DIO C
Posebne odredbe za Austriju, Finsku i Švedsku u vezi s primjenom sljedećih direktiva u skladu s člankom 21.
1. Austrija, Finska i Švedska ne prenose niti primjenjuju Direktivu Vijeća 78/631/EEZ od 26. lipnja 1978. o usklađivanju zakonodavstava država članica u odnosu na razvrstavanje, pakiranje i označivanje opasnih pripravaka (pesticida) kako je zadnje izmijenjena Direktivom Vijeća 92/32/EEZ od 30. travnja 1992.
2. Austrija primjenjuje Direktivu Vijeća 88/379/EEZ od 7. lipnja 1988. o usklađivanju zakona i drugih propisa u odnosu na razvrstavanje, pakiranje i označivanje opasnih pripravaka, kako je zadnje izmijenjena Direktivom 96/65/EZ od 11. listopada 1996. prema sljedećim uvjetima:
Sljedeće se odredbe Direktive 88/379/EEZ ne primjenjuju na Austriju:
|
(a) |
članak 13. u vezi s člancima 3. i 7. s obzirom na pripravke koji sadrže tvari navedene u Dodatku 1.; |
|
(b) |
članak 13. u vezi s člankom 7. s obzirom na označivanje, poštujući austrijske odredbe o:
|
|
(c) |
članak 13. u vezi s člankom 7. stavkom 1. točkom (c) s obzirom na kemijske nazive opasnih tvari koje su prisutne u opasnim pripravcima, do dvije godine nakon stupanja ove Direktive na snagu. |
3. Švedska primjenjuje Direktivu Vijeća 88/379/EEZ od 7. lipnja 1988. o usklađivanju zakona i drugih propisa u odnosu na razvrstavanje, pakiranje i označivanje opasnih pripravaka, kako je zadnje izmijenjena Direktivom 96/65/EZ od 11. listopada 1996. prema sljedećim uvjetima:
Sljedeće se odredbe Direktive 88/379/ne primjenjuju na Švedsku:
|
(a) |
članak 13. u vezi s člancima 3. i 7. s obzirom na pripravke
|
|
(b) |
članak 13. u vezi s člancima 3. i 7. s obzirom na
|
Dodatak 1.
Tvari na koje se odnosi Prilog VIII. dio C, stavak 2. (Austrija)
|
Naziv tvari |
Indeksni broj iz Priloga I. Direktivi 67/548/EEZ |
|
Linuron |
006-021-00-1 |
|
Triklorosilan |
014-001-00-9 |
|
Fosforov triklorid |
015-007-00-4 |
|
Fosforov pentaklorid |
015-008-00-X |
|
Fosforov oksiklorid |
015-009-00-5 |
|
Natrijevi polisulfidi |
016-010-00-3 |
|
Disumporov diklorid |
016-012-00-4 |
|
Tionil-klorid |
016-015-00-0 |
|
Kalcijev hipoklorit |
017-012-00-7 |
|
Kalijev hidroksid |
019-002-00-8 |
|
2-dimetil-aminoetanol |
603-047-00-0 |
|
2-dietil-aminoetanol |
603-048-00-6 |
|
Dietanolamin |
603-071-00-1 |
|
N-metil-2-etanolamin |
603-080-00-0 |
|
2-etil-heksan-1,3-diol |
603-087-00-9 |
|
Izoforon |
606-012-00-8 |
|
6-metil-1,3-ditiolo(4,5-b)kinoksalin-2-on |
606-036-00-9 |
|
Acetanhidrid |
607-008-00-9 |
|
Metil-format |
607-014-00-1 |
|
Etil-format |
607-015-00-7 |
|
Akrilna kiselina |
607-061-00-8 |
|
Kloracetil-klorid |
607-080-00-1 |
|
Nitrofen |
609-040-00-9 |
|
Kintozen; pentakloronitrobenzen |
609-043-00-5 |
|
Diklofluanid |
616-006-00-7 |
|
Kumen hidroperoksid |
617-002-00-8 |
|
Monokrotofos |
015-072-00-9 |
|
Edifenfos |
015-121-00-4 |
|
Triazofos |
015-140-00-8 |
|
Metanol |
603-001-00-X |
|
Trifenmorf; 4-tritilmorfolin |
613-052-00-X |
|
Diuron |
006-015-00-9 |
|
Fenbutakositrov-oksid |
050-017-00-2 |
|
1-butanol, 2-butanol, izobutanol |
603-004-00-6 |
Dodatak 2.
Tvari na koje se odnosi Prilog VIII. dio C stavak 3. (Švedska)
|
Naziv tvari |
Indeksni broj iz Priloga I. Direktivi 67/548/EEZ |
|
Aceton |
606-001-00-8 |
|
Butanon |
606-002-00-3 |
|
Amil-format |
607-018-00-3 |
|
Etil-acetat |
607-022-00-5 |
|
n-butil-acetat |
607-025-00-1 |
|
s-butil-acetat |
607-026-00-7 |
|
t-butil-acetat |
607-026-00-7 |
|
i-butil-acetat |
607-026-00-7 |
|
Butil-format |
607-017-00-8 |
|
Cikloheksan |
601-017-00-1 |
|
1,4-dimetilcikloheksan |
601-019-00-2 |
|
Dietil-eter |
603-022-00-4 |
|
Etil-metil eter |
603-020-00-3 |
|
Amil-acetat |
607-130-00-2 |
|
Etil-laktat |
607-129-00-7 |
|
Amilpropionat |
607-131-00-8 |
|
2,4-dimetil-pentan-3-on |
606-028-00-5 |
|
Di-n-propil-eter |
603-045-00-X |
|
Di-n-propil-keton |
606-027-00-X |
|
Etil-propionat |
607-028-00-8 |
|
Heptan |
601-008-00-2 |
|
Heksan (smjesa izomera) koji sadrži manje od 5 % n-heksana |
601-007-00-7 |
|
Izopropil-acetat |
607-024-00-6 |
|
Izopropilni alkohol |
603-003-00-0 |
|
4-metoksi-4-metil-pentan-2-on |
606-023-00-8 |
|
Metil-acetat |
607-021-00-X |
|
Metilcikloheksan |
601-018-00-7 |
|
5-metil-heksan-2-on |
606-026-00-4 |
|
Metil-laktat |
607-092-00-7 |
|
4-metil-pentan-2-on |
606-004-00-4 |
|
Metil-propionat |
607-027-00-2 |
|
Oktan |
601-009-00-8 |
|
Pentan |
601-006-00-1 |
|
Pentan-3-on |
606-006-00-5 |
|
Propan-1-ol |
603-003-00-0 |
|
Propil-acetat |
607-024-00-6 |
|
Propil-formjat |
607-016-00-2 |
|
Propil-propionat |
607-030-00-9 |
|
Natrijev bisulfit = polisulfit |
016-010-00-3 |
|
Toluen-2,4-diizocijanat |
615-006-00-4 |
|
Toluen-2,6-diizocijanat |
615-006-00-4 |
|
Kadmijev flourid |
048-006-00-2 |
|
1,2-epoksi-3(toliloksi)-propan |
603-056-00-X |
|
Difenilmetan-2,2'-diizocijanat |
615-005-00-9 |
|
Difenilmetan-2,4'-diizocijanat |
615-005-00-9 |
|
Difenilmetan-4,4'-diizocijanat |
615-005-00-9 |
|
Hidrokinon |
604-005-00-4 |
|
Hidroksipropil-akrilat |
607-108-00-2 |
|
Terpentin |
650-002-00-6 |
|
Butil-metil-keton (2-heksanon) |
606-030-00-6 |
|
Heksan |
601-007-00-7 |
|
Vanadijev pentoksid |
023-001-00-8 |
|
Natrijev nitrat |
|
|
Cinkov oksid |
|
PRILOG IX.
KORELACIJSKA TABLICA
|
Ova Direktiva |
88/379/EEZ |
|
Članak 1. |
Članak 1. |
|
stavak 1. |
stavak 1. |
|
stavak 2. |
stavak 2. |
|
stavak 3. |
|
|
stavak 4. |
|
|
stavak 5. |
stavak 3. |
|
Članak 2. |
Članak 2. |
|
Članak 3. |
Članak 3. stavak 6. |
|
Članak 4. |
Članak 3. stavak 1. |
|
Članak 4. |
|
|
Članak 5. |
Članak 3. stavak 2. |
|
stavak 1. |
stavak 2. |
|
stavak 1. treća alineja |
stavak 2. treći podstavak, točka (b) |
|
stavci 2. — 3. |
|
|
stavak 4. |
|
|
Članak 6. |
Članak 3. stavak 3. |
|
stavak 1. |
točke (a) i (b) |
|
stavak 2. |
|
|
stavak 3. |
treći i četvrti podstavak |
|
stavak 4. |
stavak 4. |
|
stavak 5. |
stavak 5. podstavci od prvog do trećeg |
|
Članak 7. |
|
|
Članak 8. |
Članak 5. |
|
stavak 1. |
stavak 1. |
|
stavak 2. |
stavak 2. |
|
stavak 3. |
stavak 3. |
|
stavak 4. |
|
|
Članak 9. |
Članak 6. |
|
stavak 1. |
stavak 1. točka (a) |
|
stavak 2. |
stavak 1. točka (b) |
|
stavak 3. |
stavci 2. i 3. drugi podstavak |
|
Članak 10. |
Članak 7. |
|
stavci 1.1 — 1.2 |
|
|
stavak 2. |
stavak 1. |
|
stavak 2.3. |
stavak 1. točka (c) |
|
stavak 2.4. |
stavak 1. točka (d) |
|
stavak 2.5. |
stavak 4. |
|
Članak 11. |
Članak 8. |
|
Članak 12. |
Članak 9. |
|
Članak 13. |
|
|
Članak 14. |
Članak 10. |
|
Članak 15. |
Članak 7. |
|
Članak 16. |
Članak 11. |
|
Članak 17. |
Članak 12. |
|
Članak 18. |
Članak 13. |
|
Članak 19. |
Članak 14. |
|
Članak 20. |
Članak 15. |
|
Članak 21. |
|
|
Članak 22. |
Članak 16. |
|
Članak 23. |
Članak 16. stavak 3. |
|
Članak 24. |
Članak 17. |
KORELACIJSKA TABLICA
|
Ova Direktiva |
88/379/EEZ |
90/35/EEZ |
91/442/EEZ |
93/18/EEZ |
|
Prilog I.A |
članak 3. stavak 2. drugi podstavak |
|
|
|
|
Prilog I.B |
|
|
|
|
|
Prilog II.A, uvod, stavci 1. — 3. |
|
|
|
Prilog I. uvod |
|
Prilog II.A, uvod, stavak 4. |
|
|
|
|
|
Prilog II.A, 1. |
članak 3. stavak 5. točka (a) |
|
|
|
|
Prilog II.A, 1.1.1. |
članak 3. stavak 5. točka (a) i. |
|
|
|
|
Prilog II.A, 1.1.2. |
članak 3. stavak 5. točka (a) ii. |
|
|
|
|
Prilog II.A, 1.2. |
članak 3. stavak 5. točka (a) iii. |
|
|
|
|
Prilog II.A, 2. |
članak 3. stavak 5. točka (b) |
|
|
|
|
Prilog II.A, 2.1.1. |
članak 3. stavak 5. točka (b) i. |
|
|
|
|
Prilog II.A, 2.1.2. |
članak 3. stavak 5. točka (b) ii. |
|
|
|
|
Prilog II.A, 2.2. |
članak 3. stavak 5. točka (b) iii. |
|
|
|
|
Prilog II.A, 2.3. |
članak 3. stavak 5. točka (b) iv. |
|
|
|
|
Prilog II.A, 3. |
članak 3. stavak 5. točka (c) |
|
|
|
|
Prilog II.A, 3.1.1. |
članak 3. stavak 5. točka (c) i. |
|
|
|
|
Prilog II.A, 3.1.2. |
članak 3. stavak 5. točka (c) ii. |
|
|
|
|
Prilog II.A, 3.2. |
članak 3. stavak 5. točka (c) iii. |
|
|
|
|
Prilog II.A, 3.3. |
članak 3. stavak 5. točka (c) iv. |
|
|
|
|
Prilog II.A, 4. |
članak 3. stavak 5. točka (d) |
|
|
|
|
Prilog II.A, 4.1.1. |
članak 3. stavak 5. (d) i. |
|
|
|
|
Prilog II.A, 4.1.2. |
članak 3. stavak 5. točka (d) ii. |
|
|
|
|
Prilog II.A, 4.2.1. |
članak 3. stavak 5. točka (e) i. |
|
|
|
|
Prilog II.A, 4.2.2. |
članak 3. stavak 5. točka (e) ii. |
|
|
|
|
Prilog II.A, 5. |
članak 3. stavak 5. točka (f) |
|
|
|
|
Prilog II.A, 5.1.1. |
članak 3. stavak 5. točka (f) i. |
|
|
|
|
Prilog II.A, 5.1.2. |
članak 3. stavak 5. stavak (f) ii. |
|
|
|
|
Prilog II.A, 5.2.1. |
članak 3. stavak 5. točka (h) i. |
|
|
|
|
Prilog II.A, 5.2.2. |
članak 3. stavak 5. točka (h) ii. |
|
|
|
|
Prilog II.A, 5.3.1. |
članak 3. stavak 5. točka (g) i. |
|
|
|
|
Prilog II.A, 5.3.2. |
članak 3. stavak 5. točka (g) ii. |
|
|
|
|
Prilog II.A, 5.4.1. |
članak 3. stavak 5. točka (i) i. |
|
|
|
|
Prilog II.A, 5.4.2. |
članak 3. stavak 5. točka (i) ii. |
|
|
|
|
Prilog II.A, 6. |
|
|
|
|
|
Prilog II.A, 6.1. |
članak 3. stavak 5. točka (g) iii. |
|
|
|
|
Prilog II.A, 6.2. |
članak 3. stavak 5. točka (c) v. |
|
|
|
|
Prilog II.A, 7.1. |
članak 3. stavak 5. točka (j) |
|
|
Prilog I. točka 6. |
|
Prilog II.A, 7.2. |
članak 3. stavak 5. točka (k) |
|
|
|
|
Prilog II.A, 8.1. |
članak 3. stavak 5. točke (l) i (m) |
|
|
|
|
Prilog II.A, 8.2. |
članak 3. stavak 5. točka (n), članak 3. stavak 5. točke (o) i (p) |
|
|
|
|
Prilog II.A, 9.1 – 9.4 |
|
|
|
|
|
Prilog II.B uvod |
|
|
|
Prilog I. uvod |
|
Prilog II.B, 1. |
|
|
|
Prilog I. točka 1. |
|
Prilog II.B, 1.1. |
|
|
|
Prilog I. točka 1.1. |
|
Prilog II.B, 1.2. |
|
|
|
Prilog I. točka 1.2. |
|
Prilog II.B, 2. |
|
|
|
Prilog I. točka 2. |
|
Prilog II.B, 2.1. |
|
|
|
Prilog I. točka 2.1. |
|
Prilog II.B, 2.2. |
|
|
|
Prilog I. točka 2.2. |
|
Prilog II.B, 3. |
|
|
|
Prilog I. točka 3. |
|
Prilog II.B, 3.1. |
|
|
|
Prilog I. točka 3.1 |
|
Prilog II.B, 3.2. |
|
|
|
Prilog I. točka 3.2. |
|
Prilog II.B, 4. |
|
|
|
Prilog I. točka 4. |
|
Prilog II.B, 4.1. |
|
|
|
Prilog I. točka 4.1. |
|
Prilog II.B, 4.2. |
|
|
|
Prilog I. točka 4.2. |
|
Prilog II.B, 5. |
|
|
|
Prilog I. točka 5. |
|
Prilog II.B, 5.1. |
|
|
|
Prilog I. točka 5.1. |
|
Prilog II. B, 5.2. |
|
|
|
Prilog I. točka 5.2. |
|
Prilog II.B, 6. |
|
|
|
Prilog I. točka 6. |
|
Prilog II.B, 6.1. |
|
|
|
Prilog I. točka 6.1. |
|
Prilog II.B, 6.2. |
|
|
|
Prilog I. točka 6.2. |
|
Prilog III.A |
|
|
|
|
|
Prilog III.B |
|
|
|
|
|
Prilog III.C |
|
|
|
|
|
Prilog IV.B |
|
Članci 1. i 2. |
|
|
|
Prilog IV.A, 1. |
|
Članak 1. stavak 1. |
|
|
|
Prilog IV.A, 2. |
|
|
Članak 2.; Prilog točka (a) |
|
|
Prilog IV.A, 3. |
|
|
Članak 1.; Prilog točka (b) |
|
|
Prilog V.A, 1. |
|
|
|
Prilog II.A,1. |
|
Prilog V.A, 2. |
|
|
|
Prilog II.A, 2. |
|
Prilog V.A, 3. |
|
|
|
Prilog II.A, 3. |
|
Prilog V.A, 4. |
|
|
|
Prilog II.A, 4. |
|
Prilog V.B, 1. |
|
|
|
Prilog II.B, 1. |
|
Prilog V.B, 2. |
|
|
|
Prilog II.B, 2. |
|
Prilog V.B, 3. |
|
|
|
Prilog II.B, 3. |
|
Prilog V.B, 4. |
|
|
|
Prilog II.B, 4. |
|
Prilog V.B, 5. |
|
|
|
Prilog II.B, 5. |
|
Prilog V.B, 6. |
|
|
|
Prilog II.B, 6. |
|
Prilog V.B, 7. |
članak 3. stavak 2. treći podstavak, točka (b) |
|
|
|
|
Prilog V.B, 8. |
članak 3. stavak 5. četvrti podstavak |
|
|
|
|
Prilog V.C |
|
|
|
|
|
Prilog VI. |
|
|
|
|
|
Prilog VII. |
|
|
|
|
|
Prilog VIII. |
|
|
|
|
|
Prilog IX. |
|
|
|
|