EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 32006L0063
Commission Directive 2006/63/CE of 14 July 2006 amending Annexes II to VII to Council Directive 98/57/EC on the control of Ralstonia solanacearum (Smith) Yabuuchi et al.
Direktiva Komisije 2006/63/EZ od 14. srpnja 2006. o izmjeni priloga II. do VII. Direktivi Vijeća 98/57/EZ o suzbijanju bakterije Ralstonia solanacearum (Smith) Yabuuchi et al .
Direktiva Komisije 2006/63/EZ od 14. srpnja 2006. o izmjeni priloga II. do VII. Direktivi Vijeća 98/57/EZ o suzbijanju bakterije Ralstonia solanacearum (Smith) Yabuuchi et al .
OJ L 206, 27.7.2006, p. 36–106
(ES, CS, DA, DE, ET, EL, EN, FR, IT, LV, LT, HU, MT, NL, PL, PT, SK, SL, FI, SV)
Special edition in Bulgarian: Chapter 03 Volume 074 P. 57 - 127
Special edition in Romanian: Chapter 03 Volume 074 P. 57 - 127
Special edition in Croatian: Chapter 03 Volume 003 P. 206 - 276
 No longer in force, Date of end of validity: 31/12/2021; Implicitno stavljeno izvan snage 32016R2031
No longer in force, Date of end of validity: 31/12/2021; Implicitno stavljeno izvan snage 32016R2031
|
03/Sv. 003 |
HR |
Službeni list Europske unije |
206 |
32006L0063
|
L 206/36 |
SLUŽBENI LIST EUROPSKE UNIJE |
14.07.2006. |
DIREKTIVA KOMISIJE 2006/63/EZ
od 14. srpnja 2006.
o izmjeni priloga II. do VII. Direktivi Vijeća 98/57/EZ o suzbijanju bakterije Ralstonia solanacearum (Smith) Yabuuchi et al.
KOMISIJA EUROPSKIH ZAJEDNICA,
uzimajući u obzir Ugovor o osnivanju Europske zajednice,
uzimajući u obzir Direktivu Vijeća 98/57/EZ od 20. srpnja 1998. (1) o suzbijanju bakterije Ralstonia solanacearum (Smith) Yabuuchi et al., a posebno njezin članak 11.,
budući da:
|
(1) |
Jedan od značajnih štetnih organizama koji napadaju krumpir i rajčicu je Ralstonia solanacearum (Smith) Yabuuchi et al., patogeni uzročnik smeđe truleži gomolja krumpira te bakterijskog venuća krumpira i rajčice (dalje u tekstu: organizam). |
|
(2) |
Organizam se još uvijek pojavljuje u nekim dijelovima Zajednice. |
|
(3) |
Direktivom 98/57/EZ utvrđene su podrobne mjere koje države članice poduzimaju protiv organizma kako bi ga otkrile i utvrdile njegovu rasprostranjenost, spriječile njegovu pojavu i širenje te, u slučaju njegove pojave, spriječile njegovo širenje i suzbijale ga s ciljem njegovog iskorjenjivanja. |
|
(4) |
U međuvremenu je došlo do značajnih novih spoznaja o biologiji organizma i postupcima za njegovo otkrivanje i identifikaciju; pored toga, praktična iskustva do kojih se došlo pri suzbijanju organizma zahtijevaju preispitivanje nekih tehničkih odredbi vezanih uz mjere suzbijanja. |
|
(5) |
S obzirom na te spoznaje čini se potrebnim preispitati i ažurirati mjere iz nekih priloga Direktivi 98/57/EZ. |
|
(6) |
Što se tiče postupaka otkrivanja i identifikacije, uključena je suvremena tehnika otkrivanja - fluorescencijska in situ hibridizacija (FISH). Uključena su i poboljšanja metode lančane reakcije polimeraze kao i poboljšanja različitih tehničkih elemenata sadašnjih postupaka otkrivanja i identifikacije te metode za otkrivanje i identifikaciju organizma u drugim biljkama domaćinima osim krumpira te u vodi i tlu. |
|
(7) |
Što se tiče tehničkih elemenata mjera suzbijanja, poboljšane su odredbe za: način čuvanja ispitanih uzoraka kako bi se osigurala sljedivost organizma, elemente potrebne za utvrđivanje opsega vjerojatne kontaminacije, podrobnosti o obavješćivanju o svakoj potvrđenoj prisutnosti organizma i o kontaminiranoj zoni, mjere koje treba provoditi na mjestima proizvodnje koja su proglašena kontaminiranim i koja se nalaze unutar razgraničenih zona. Pored toga, uvrštene su i neke odredbe za rajčicu kako bi se više uzela u obzir važnost ove biljke kao domaćina organizma. |
|
(8) |
Mjere utvrđene ovom Direktivom u skladu su s mišljenjem Stalnog odbora za biljno zdravstvo, |
DONIJELA JE OVU DIREKTIVU:
Članak 1.
Prilozi II. do VII. Direktivi 98/57/EZ zamjenjuju se odgovarajućim tekstovima iz Priloga ovoj Direktivi.
Članak 2.
1. Države članice donose i objavljuju zakone te druge propise potrebne za usklađivanje s ovom Direktivom najkasnije do 31. ožujka 2007. One Komisiji odmah dostavljaju tekst tih odredaba i korelacijsku tablicu između tih odredaba i ove Direktive.
One primjenjuju te odredbe od 1. travnja 2007.
Kada države članice donose ove odredbe, te odredbe prilikom njihove službene objave sadržavaju uputu na ovu Direktivu ili se uz njih navodi takva uputa. Načine tog upućivanja određuju države članice.
2. Države članice Komisiji dostavljaju tekst glavnih odredaba nacionalnog prava koje donesu u području na koje se odnosi ova Direktiva.
Članak 3.
Ova Direktiva stupa na snagu trećeg dana od dana objave u Službenom listu Europske unije.
Članak 4.
Ova je Direktiva upućena državama članicama.
Sastavljeno u Bruxellesu 14. srpnja 2006.
Za Komisiju
Markos KYPRIANOU
Član Komisije
(1) SL L 235, 21.8.1998., str. 1.
PRILOG
PRILOG II.
POSTUPAK ISPITIVANJA U SVRHU DIJAGNOSTICIRANJA, OTKRIVANJA I IDENTIFIKACIJE BAKTERIJE RALSTONIA SOLANACEARUM (SMITH) YABUUCHI ET AL.
PODRUČJE PRIMJENE POSTUPKA ISPITIVANJA
Ovim se postupkom opisuju različiti koraci koje treba poduzeti pri:
|
i. |
dijagnosticiranju smeđe truleži gomolja krumpira i bakterijskog venuća krumpira, rajčice i drugih biljaka domaćina; |
|
ii. |
otkrivanju bakterije Ralstonia solanacearum u uzorcima gomolja krumpira i biljaka krumpira i rajčice kao i drugih biljaka domaćina te u vodi i tlu; |
|
iii. |
identifikaciji bakterije Ralstonia solanacearum (R. solanacearum). |
SADRŽAJ
Opća načela
|
ODJELJAK I: |
Primjena postupka ispitivanja |
1. Postupak otkrivanja u svrhu dijagnosticiranja smeđe truleži i bakterijskog venuća (Ralstonia solanacearum) u gomoljima krumpira te biljkama krumpira i rajčice te drugim biljkama domaćinima sa simptomima smeđe truleži ili bakterijskog venuća
2. Postupak za otkrivanje i identifikaciju bakterije Ralstonia solanacearum u uzorcima asimptomatskih gomolja krumpira
3. Postupak za otkrivanje i identifikaciju bakterije Ralstonia solanacearum u uzorcima asimptomatskih biljaka krumpira, rajčice ili drugih biljaka domaćina
|
ODJELJAK II. |
Podrobne metode za otkrivanje bakterije Ralstonia solanacearum u gomoljima krumpira i na biljkama krumpira, rajčice ili drugih biljaka domaćina sa simptomima smeđe truleži odnosno bakterijskog venuća |
1. Simptomi
2. Brzi testovi probira
3. Postupak izdvajanja
4. Identifikacijski testovi za R. solanacearum
|
ODJELJAK III. |
1. Podrobne metode za otkrivanje i identifikaciju bakterije Ralstonia solanacearum u uzorcima asimptomatskih gomolja krumpira |
1.1. Pripremanje uzorka
1.2. Testiranje
2. Podrobne metode za otkrivanje i identifikaciju bakterije R. solanacearum u uzorcima asimptomatskih biljaka krumpira, rajčice ili drugih biljaka domaćina
2.1. Pripremanje uzorka
2.2. Testiranje
|
ODJELJAK IV. |
1. Postupak za otkrivanje i identifikaciju bakterije R. solanacearum u vodi |
2. Metode za otkrivanje i identifikaciju bakterije R. solanacearum u vodi
2.1. Pripremanje uzorka
2.2. Testiranje
|
ODJELJAK V. |
1. Postupak za otkrivanje i identifikaciju bakterije R. solanacearum u tlu |
2. Metode za otkrivanje i identifikaciju bakterije R. solanacearum u tlu
2.1. Pripremanje uzorka
2.2.Testiranje
|
ODJELJAK VI. |
Optimizirani protokoli za otkrivanje i identifikaciju bakterije R. solanacearum |
A. Dijagnostički testovi i testovi za otkrivanje
1. Test eksudacije na stabljici
2. Otkrivanje zrnaca poli-β-hidroksibutirata
3. Serološki test aglutinacije
4. Selektivno izdvajanje
4.1. Nasađivanje na selektivnu podlogu
4.2. Postupak obogaćivanja
5. Test imunofluorescencije (test IF)
6. Lančana reakcija polimerazom (test PCR)
6.1. Metode pročišćavanja DNK
(a) Metoda prema Pastriku (2000)
(b) Druge metode
6.2. PCR
6.3. Analiza produkta PCR-a
7. Fluorescencijska in situ hibridizacija (test FISH)
8. Imunoenzimni test (ELISA)
(a) Neizravna ELISA
(b) DASI (neizravni dvojni sendvič) ELISA
9. Biološki test
B Identifikacijski testovi
1. Identifikacijski testovi pomoću hranjive podloge i enzimski testovi
2. Test IF
3. Test ELISA
4. Test PCR
5. Test FISH
6. Profiliranje masnih kiselina (FAP)
7. Metode karakterizacije soja
7.1. Određivanje biovara
7.2. Genomski otisak
7.3. Metode PCR
C Potvrdni test
Dodatak 1.Laboratoriji uključeni u optimizaciju i validaciju protokola
Dodatak 2.Podloge za izdvajanje i uzgoj bakterije R. solanacearum
Dodatak 3.(A) Standardizirani kontrolni materijali dostupni na tržištu
(B) Pripremanje kontrola
Dodatak 4.Puferi za postupke ispitivanja
Dodatak 5.Određivanje stupnja kontaminacije u testovima IF i FISH
Dodatak 6.Validirani protokoli i reagensi za PCR
Dodatak 7.Validirani reagensi za test FISH
Dodatak 8.Uvjeti uzgoja patlidžana i rajčice
Popis literature
OPĆA NAČELA
Optimizirani protokoli za pojedine metode, validirani reagensi i pojedinosti za pripremu ispitnih i kontrolnih materijala navedeni su u dodacima. Popis laboratorija koji su sudjelovali u optimizaciji i validaciji protokola nalaze se u Dodatku 1.
S obzirom da protokoli obuhvaćaju otkrivanje karantenskog organizma i uključivat će uporabu živih kultura R. solanacearum kao kontrolnih materijala, bit će potrebno obavljati postupke u primjerenim karantenskim uvjetima s odgovarajućom opremom za uklanjanje otpada te pod uvjetima odgovarajućih dozvola koje izdaju službena tijela za karantenu bilja.
Parametri ispitivanja moraju osiguravati dosljedno i ponovljivo otkrivanje razina bakterije R. solanacearum na pragovima utvrđenim za izabrane metode.
Obvezna je precizna priprema pozitivnih kontrola.
Ispitivanje prema zahtijevanim pragovima podrazumijeva korištenje ispravnih parametara, održavanje i baždarenje opreme, pažljivo rukovanje reagensima i njihovo čuvanje te poduzimanje svih mjera kojima se sprečava kontaminacija među uzorcima, npr. odvajanje pozitivnih kontrola od ispitivanih uzoraka. Treba primjenjivati norme kontrole kvalitete kako bi se izbjegle administrativne i druge pogreške, posebno pri označivanju i dokumentiranju.
Sumnja na prisutnost, u smislu članka 4. stavka 2. Direktive 98/57/EZ, podrazumijeva da se dobio pozitivan rezultat pri dijagnostičkim testovima i testovima probira obavljenim na uzorku kako je prikazano na sljedećim dijagramima. Pozitivan rezultat dobiven u prvom testu probira (IF test, PCR/FISH, selektivno izdvajanje) mora se potvrditi drugim testom probira koji se temelji na drugačijem biološkom načelu.
Ako se prvim testom probira dobije pozitivan rezultat, sumnja se na kontaminaciju bakterijom R. solanacearum te se mora obaviti drugi test probira. Ako se i drugim testom probira dobije pozitivan rezultat, sumnja je potvrđena (sumnja na prisutnost) i ispitivanje se mora nastaviti u skladu s postupkom ispitivanja. Ako se drugim testom probira dobije negativan rezultat, smatra se da uzorak nije kontaminiran bakterijom R. solanacearum.
Potvrđena prisutnost u smislu članka 5. stavka 1. Direktive 98/57/EZ podrazumijeva izoliranje i identificiranje čiste kulture R. solanacearum i potvrđivanje patogenosti.
ODJELJAK I.
PRIMJENA POSTUPKA ISPITIVANJA
1. Postupak otkrivanja u svrhu dijagnosticiranja smeđe truleži i bakterijskog venuća (Ralstonia solanacearum) u gomoljima krumpira te biljkama krumpira i rajčice te drugim biljkama domaćinima sa simptomima smeđe truleži ili bakterijskog venuća.
Postupak ispitivanja se primjenjuje na gomolje krumpira i biljke sa simptomima koji su tipični za smeđu trulež ili bakterijsko venuće ili koji navode na sumnju na njihovu prisutnost. Ovaj postupak uključuje brzi test probira, izdvajanje patogena iz zaraženog vaskularnog tkiva na (selektivnu) podlogu i, u slučaju pozitivnog rezultata, identifikaciju kulture kao bakterije Ralstonia solanacearum.


2. Postupak za otkrivanje i identifikaciju bakterije Ralstonia solanacearum u uzorcima asimptomatskih gomolja krumpira
Načelo:
Svrha ispitivanja je otkriti latentne infekcije u gomoljima krumpira. Pozitivni rezultat najmanje dva testa probira (3), koji se temelje na različitim biološkim načelima, mora se dopuniti izdvajanjem patogena nakon čega slijedi, u slučaju izdvajanja tipičnih kolonija, potvrda čiste kulture kao R. solanacearum. Pozitivni rezultat dobiven samo jednim testom probira nije dostatan da se uzorak smatra zaraženim.
Testovi probira i testovi izdvajanja moraju omogućiti otkrivanje 103 do 104 stanica/ml resuspendiranog taloga uključenog kao pozitivna kontrola u svakoj seriji testova.


3. Postupak za otkrivanje i identifikaciju bakterije Ralstonia solanacearum u uzorcima asimptomatskih biljaka krumpira, rajčice ili drugih biljaka domaćina


ODJELJAK II.
PODROBNE METODE ZA OTKRIVANJE BAKTERIJE RALSTONIA SOLANACEARUM U GOMOLJIMA KRUMPIRA I NA BILJKAMA KRUMPIRA, RAJČICE ILI DRUGIH BILJAKA DOMAĆINA SA SIMPTOMIMA SMEĐE TRULEŽI ODNOSNO BAKTERIJSKOG VENUĆA
1. Simptomi (vidjeti internetsku stranicu http://forum.europa.eu.int/Public/irc/sanco/Home/main)
1.1.
Biljka krumpira. Početna faza infekcije u polju prepoznaje se po venuću lišća pri vrhu biljke na visokim temperaturama tijekom dana ali koje se oporavlja tijekom noći. U ranim fazama venuća lišće ostaje zeleno ali kasnije počinje žutjeti i razvija se smeđa nekroza. Javlja se i epinastija. Vrlo brzo dolazi do nepovratnog venuća izdanka ili cijele biljke što dovodi do propadanja i odumiranja biljke. Provodno tkivo poprečno prerezanih stabljika uvenule biljke obično je smeđe boje, a iz prerezane površine curi ili se lako može gnječenjem istisnuti mliječni bakterijski iscjedak. Kad se prerezana stabljika stavi uspravno u vodu, vlakna sluzi će izlaziti iz žilnih snopova.
Gomolj krumpira. Gomolje krumpira treba prerezati poprečno u blizini baznog dijela (stolone) ili uzdužno preko stolone. Početna faza infekcije prepoznaje se po staklasto-žutoj do svijetlosmeđoj obojenosti žilnog prstena iz kojeg se, nakon nekoliko minuta, spontano pojavljuje blijedi kremasti bakterijski iscjedak. Kasnije, provodno tkivo postaje izražajnije smeđe i nekroza se može proširiti na parenhimsko tkivo. U uznapredovalim fazama infekcija izbija prema van od kraja stolone i okaca iz kojih može istjecati bakterijska sluz na koju se lijepe čestice zemlje. Zbog unutarnjeg odumiranja provodnog tkiva na pokožici se mogu pojaviti crvenkasto-smeđe, blago upale lezije. U uznapredovalim fazama bolesti uobičajen je i sekundarni razvoj gljivične i bakterijske gnjiloće.
1.2.
Biljka rajčice. Prvi vidljivi simptom je mlohavost najmlađih listova. U okolišnim uvjetima koji su povoljni za patogen (temperatura tla oko 25 °C; zasićenost vlagom) u roku od nekoliko dana dolazi do epinastije i venuća jedne strane biljke ili cijele biljke što dovodi do potpunog propadanja biljke. U nepovoljnijim uvjetima (temperatura tla manja od 21 °C) venuće je manje ali se na stabljici može razviti veliki broj adventivnog korijenja. Moguće je uočiti vodom natopljene pruge koje se protežu duž stabljike, od njenog podnožja, a dokaz su nekroze u provodnom ustavu. Ako se stabljika poprečno prereže, iz provodnih tkiva čija je boja primijenjena u smeđe curi bijeli ili žućkasti bakterijski iscjedak.
1.3.
Biljke Solanum dulcamara i S. nigrum. U prirodnim uvjetima rijetko se uočavaju simptomi venuća kod ovih biljaka domaćina, osim ako temperatura tla prelazi 25 °C ili ako su razine inokuluma izuzetno visoke (kao npr. za S. nigrum koji raste blizu oboljele biljke krumpira ili rajčice). Ako dođe do venuća, simptomi su isti kao i kod rajčice. Kod biljaka S. dulcamara koje ne venu i koje rastu sa stabljikama i korijenjem u vodi može doći do svijetlosmeđe obojenosti provodnih tkiva na poprečnom dijelu dna stabljike ili dijelovima stabljike koji su pod vodom. Bakterije mogu izbijati u obliku iscjetka iz prerezanih provodnih tkiva ili tvoriti vlakna sluzi ako prerezanu stabljiku stavimo uspravno u vodu, čak i ako nema simptoma venuća.
2. Brzi testovi probira
Brzi testovi probira omogućuju postavljanje vjerojatne dijagnoze, ali nisu presudni. Primijenite jedan ili više sljedećih validiranih testova:
2.1.
(vidjeti odjeljak VI.A.1.)
2.2.
Karakteristična zrnca PHB-a u stanicama R. solanacearum postaju vidljiva pri bojanju termički fiksiranog razmaza bakterijskog iscjetka iz zaraženog tkiva na mikroskopskom stakalcu nilskim plavilom A i sudanskim crnilom B. (vidjeti odjeljak VI.A.2.).
2.3.
(vidjeti odjeljak VI.A.3.)
2.4. Ostali testovi
U ostale prikladne brze testove probira spadaju test IF (vidjeti odjeljak VI.A.5.), test FISH (vidjeti odjeljak VI.A.7.), testovi ELISA (vidjeti odjeljak VI.A.8.) i testovi PCR (vidjeti odjeljak VI.A.6.).
3. Postupak izdvajanja
|
(a) |
Uzmite iscjedak ili dijelove tkiva promijenjene boje sa žilnog prstena gomolja krumpira ili iz žilnih snopića stabljike krumpira, rajčice ili drugih venućih biljaka domaćina. Suspendirajte u manjoj količini sterilne destilirane vode ili u 50 mM fosfatnog pufera (Dodatak 4.) te ostavite 5 do 10 minuta. |
|
(b) |
Pripremite niz decimalnih razrjeđenja suspenzije. |
|
(c) |
Prenesite 50-100 μl suspenzije i razrjeđenja na uobičajenu hranjivu podlogu (NA, YPGA ili SPA; vidjeti Dodatak 2.) i/ili na Kelmanovu tetrazol-podlogu (Dodatak 2.) i/ili na validiranu selektivnu podlogu (npr. SMSA; vidjeti Dodatak 2.). Razmažite ili razvucite u tanke pruge primjenjujući odgovarajuću tehniku nanošenja razrjeđenja na podlogu. Ako se smatra korisnim, pripremite odvojene ploče s razrijeđenom staničnom suspenzijom bakterije R. solanacearum biovar 2 za pozitivnu kontrolu. |
|
(d) |
Inkubirajte ploče dva do šest dana na 28 °C.
|
4. Identifikacijski testovi za R. solanacearum
Testovi za potvrđivanje identifikacije pretpostavljenih izolata R. solanacearum navedeni su u odjeljku VI.B.
ODJELJAK III.
1. Podrobne metode za otkrivanje i identifikaciju bakterije Ralstonia solanacearum u uzorcima asimptomatskih gomolja krumpira
1.1.
Napomena:
|
— |
Standardna veličina uzorka je 200 gomolja po testu. Intenzivnije uzorkovanje znači da se na uzorcima ove veličine obavlja više testova. Veći broj gomolja u uzorku dovest će do inhibicije ili će otežati tumačenje rezultata. Međutim, ako je na raspolaganju manje gomolja, postupak se može primijeniti i na uzorcima s manje od 200 gomolja. |
|
— |
Validacija svih metoda otkrivanja, koje su opisane u daljnjem tekstu, temelji se na ispitivanju uzoraka s 200 gomolja. |
|
— |
Ekstrakt krumpira koji je opisan u daljnjem tekstu može se koristiti i za otkrivanje bakterije Clavibacter michiganensis subsp. sepedonicus koja uzrokuje prstenastu trulež gomolja krumpira. |
Neobvezna obrada prije pripremanja uzorka:
|
(a) |
Inkubirajte uzorak na 25-30 °C u razdoblju do dva tjedna prije izvođenja testova, kako bi se potaklo umnožavanje populacija bakterije R.-solanacearum. |
|
(b) |
Operite gomolje. Upotrijebite odgovarajuća dezinfekcijska sredstva (spojeve klora u slučaju testa PCR, kako bi se uklonila patogena DNK) i deterdžente između svakog uzorka. Osušite gomolje na zraku. Ovaj je postupak pranja naročito koristan (ali ne i obvezatan) za uzorke na kojima je previše čestica tla i ako će se obavljati test PCR ili postupak neposrednog izdvajanja. |
1.1.1. Čistim i dezinficiranim skalpelom ili nožem za povrće uklonite pokožicu na krajevima stolone gomolja tako da provodno tkivo bude vidljivo. Pažljivo izrežite malu stožastu jezgru provodnog tkiva na kraju stolone pazeći da količina neprovodnog tkiva bude što je moguće manja. (vidjeti internetsku stranicu http://forum.europa.eu.int/Public/irc/sanco/Home/main).
Napomena: Odvojite sve (trule) gomolje sa simptomima koji ukazuju na moguću smeđu trulež i testirajte ih posebno.
Ako se pri uklanjanju jezgre stolone uoče simptomi koji ukazuju na moguću smeđu trulež, taj se gomolj mora vizualno pregledati i prerezati blizu stolone. Svaki prerezani gomolj sa sumnjivim simptomima treba držati najmanje dva dana na sobnoj temperaturi kako bi se omogućila suberizacija te čuvati u hladnjaku (na temperaturi od 4 do 10 °C) u odgovarajućim karantenskim uvjetima. Svi se gomolji, uključujući i one sa sumnjivim simptomima, trebaju čuvati u skladu s Prilogom III.
1.1.2. Jezgre stolona sakupite u neupotrebljavane spremnike za jednokratnu uporabu koji se mogu zatvoriti i/ili zapečatiti (ako se radi o spremnicima koji su već upotrebljavani, oni se moraju temeljito očistiti i dezinficirati spojevima klora). Poželjno ih je odmah obraditi. Ako to nije moguće, čuvajte ih u spremniku, bez dodatka pufera, i to najdulje 72 sata u hladnjaku ili najdulje 24 sata na sobnoj temperaturi.
Obradite jezgre stolona jednim od sljedećih postupaka:
ili
|
(a) |
dodajte dovoljnu količinu (oko 40 ml) ekstrakcijskog pufera (Dodatak 4.) tako da se pokriju jezgre stolona i tresti na rotacijskoj tresilici (50-100 o/min) 4 sata na temperaturi ispod 24 °C ili 16 do 24 sata u hladnjaku, ili |
|
(b) |
homogenizirajte jezgre stolona dovoljnom količinom (oko 40 ml) ekstrakcijskog pufera (Dodatak 4.), bilo u miješalici (npr. Waring ili Ultra Thurax) bilo drobljenjem u dobro zatvorenoj vrećici za maceraciju za jednokratnu uporabu (npr. vrećice Stomacher ili Bioreba od čvrstog politena, 150 mm × 250 mm, sterilizirane zračenjem) koristeći gumeni bat ili prikladnu drobilicu (npr. Homex). |
Napomena: Ako se uzorci homogeniziraju u miješalici, postoji velika opasnost od njihove unakrsne kontaminacije. Poduzmite mjere opreza kako biste spriječili nastajanje aerosola ili istjecanje tijekom postupka ekstrakcije. Pobrinite se da za svaki uzorak upotrijebite svježe sterilizirane lopatice i posude miješalice. Ako će se primijeniti test PCR, spriječite prijenos DNK na spremnike ili drobilicu. Za test PCR preporučuje se drobljenje u vrećicama za jednokratnu uporabu i korištenje cijevi za jednokratnu uporabu.
1.1.3. Odlijte supernatant. Ako je previše mutan, razbistrite ga sporim centrifugiranjem (na najviše 180 g 10 minuta na temperaturi od 4 do 10 °C) ili vakuumskom filtracijom (40 do 100 μm), opravši filtar s dodatnim ekstrakcijskim puferom (oko 10 ml).
1.1.4. Koncentrirajte bakterijsku frakciju centrifugiranjem na 7 000 g 15 minuta (ili 10 000 g 10 minuta) na temperaturi od 4 do 10 °C te odlijte supernatant pazeći pri tom da se ne pomiješa talog.
1.1.5. Resuspendirajte talog u 1,5 ml pufera za talog (Dodatak 4.) Upotrijebite 500 μl za testiranje na R. solanacearum, 500 μl za Clavibacter michiganensis subsp. sepedonicus i 500 μl kao referentni materijal. U referentni alikvot od 500 μl i u preostale alikvote koji se ispituju dodajte sterilni glicerol do konačne koncentracije od 10 do 25 % (v/v), snažno promiješati (vortex) te pohranite na temperaturi od – 16 do – 24 °C (tjednima) ili od – 68 do – 86 °C (mjesecima). Tijekom testiranja, alikvote koji se ispituju čuvajte na temperaturi od 4 do 10 °C.
Ne preporučuje se višekratno zamrzavanje i odmrzavanje.
Ako se ekstrakt mora prevoziti, treba osigurati da se on dostavi u prijenosnome hladnjaku i da se prijevoz obavi u roku od 24 do 48 sati.
1.1.6. Sve pozitivne kontrole i uzorci R. solanacearum moraju se odvojeno obrađivati kako bi se izbjegla kontaminacija. To vrijedi i za stakalca za imunofluorescenciju kao i za sve testove.
1.2.
Vidjeti dijagram te opis testova i optimizirane protokole u odgovarajućim dodacima:
|
|
Selektivno izdvajanje (vidjeti odjeljak VI.A.4.) |
|
|
Test IF (vidjeti odjeljak VI.A.5.) |
|
|
Testovi PCR (vidjeti odjeljak VI.A.6.) |
|
|
Test FISH (vidjeti odjeljak VI.A.7.) |
|
|
Testovi ELISA (vidjeti odjeljak VI.A.8.) |
|
|
Biološki test (vidjeti odjeljak VI.A.9.) |
2. Podrobne metode za otkrivanje i identifikaciju bakterije R. solanacearum u uzorcima asimptomatskih biljaka krumpira, rajčice ili drugih biljaka domaćina
2.1.
Napomena: Za otkrivanje latentnih populacija bakterije R. solanacearum preporučuje se testiranje kompozitnih uzoraka. Postupak se može prikladno primijeniti na kompozitne uzorke s najviše 200 dijelova stabljike. Ako se provode istraživanja, ona se moraju temeljiti na statistički reprezentativnom uzorku biljne populacije koja se ispituje.
2.1.1. Sakupite dijelove stabljike veličine 1 do 2 cm u zatvoreni sterilni spremnik u skladu sa sljedećim postupcima uzorkovanja:
Sadnice rajčice iz rasadnika. Čistim dezinficiranim nožem odrežite dio veličine 1 cm s dna svake stabljike, neposredno iznad razine tla.
Odrasle biljke rajčice iz polja ili staklenika. Čistim, dezinficiranim nožem odrežite najniži izdanak na svakoj biljci režući tik iznad spoja s osnovnom stabljikom. Sa svakog bočnog izdanka odrežite donji dio veličine 1 cm.
Ostale biljke domaćini. Čistim, dezinficiranim nožem ili škarama za rezidbu odrežite dio veličine 1 cm s dna svake stabljike, neposredno iznad razine tla. Ako se radi o S. dulcamara ili drugim biljkama domaćinima koje rastu u vodi, odrežite dio veličine 1-2 cm s podzemnog dijela stabljike ili sa stolona s vodenim korijenjem.
Pri uzorkovanju na određenoj lokaciji, preporučuje se testirati statistički reprezentativni uzorak od najmanje 10 biljaka po mjestu uzorkovanja za svaku vrstu samoniklog bilja koja je potencijalni domaćin. Otkrivanje patogena najpouzdanije je krajem proljeća, ljeta i jeseni, iako se prirodne infekcije mogu otkriti tijekom cijele godine kod višegodišnje biljke Solanum dulcamara koja raste u tekućicama. Među poznate domaćine spadaju samonikle biljke krumpira (gomolji ostali u tlu), Solanum dulcamara, S. nigrum, Datura stramonium i drugi pripadnici porodice Solanaceae. Ostale biljke domaćini su Pelargonium spp. i Portulaca oleracea. Među europske vrste samoniklog bilja koje u specifičnim okolišnim uvjetima mogu biti potencijalni domaćini populacija R. solanacearum biovar 2/rasa 3 u korijenju i/ili rizosferama spadaju Atriplex hastata, Bidens pilosa, Cerastium glomeratum, Chenopodium album, Eupatorium cannabinum, Galinsoga parviflora, Ranunculus scleratus, Rorippa spp, Rumex spp., Silene alba, S. nutans., Tussilago farfarra i Urtica dioica.
Napomena: U ovoj se fazi može obaviti vizualni pregled kako bi se utvrdili unutarnji simptomi (obojenost žila ili bakterijski iscjedak). Odvojite na stranu sve dijelove stabljike sa simptomima i testirajte ih posebno. (vidjeti odjeljak II.).
2.1.2. Kratko dezinficirajte dijelove stabljike 70 %-tnim etanolom i odmah ih osušite na upijajućem papiru. Dijelove stabljike potom obradite jednim od sljedećih postupaka:
ili
|
(a) |
prekrijte ih dovoljnom količinom (oko 40 ml) ekstrakcijskog pufera (Dodatak 4.) i tresite na rotacijskoj tresilici (50-100 o/min) četiri sata na temperaturi ispod 24 °C ili 16 do 24 sata u hladnjaku, ili |
|
(b) |
odmah ih obradite drobljenjem u čvrstoj vrećici za maceraciju (npr. Stomacher ili Bioreba) s odgovarajućom količinom ekstrakcijskog pufera (Dodatak 4.) koristeći gumeni bat ili prikladnu drobilicu (npr. Homex). Ako to nije moguće, dijelove stabljike čuvajte u hladnjaku najdulje 72 sata ili na sobnoj temperaturi najdulje 24 sata. |
2.1.3. Nakon 15 minuta taloženja, izlijte supernatant.
2.1.4. Dodatno bistrenje ekstrakta ili koncentrata bakterijske frakcije obično nije potrebno, ali se može postići filtriranjem i/ili centrifugiranjem kako je opisano u odjeljku III.1.1.3. – 1.1.5.
2.1.5. Podijelite čisti ili koncentrirani ekstrakt uzorka na dva jednaka dijela. Jednu polovicu održavajte na temperaturi od 4 do 10 °C tijekom testiranja, a drugu polovicu pohraniti s 10-25 %-tnim (v/v) sterilnim glicerolom na temperaturi od – 16 do – 24 °C (tjednima) ili od – 68 do – 86 °C (mjesecima).
2.2.
Vidjeti dijagram te opis testova i optimizirane protokole u odgovarajućim dodacima:
|
|
Selektivno izdvajanje (vidjeti odjeljak VI.A.4.) |
|
|
Test IF (vidjeti odjeljak VI.A.5.) |
|
|
Testovi PCR (vidjeti odjeljak VI.A.6.) |
|
|
Test FISH (vidjeti odjeljak VI.A.7.) |
|
|
Testovi ELISA (vidjeti odjeljak VI.A.8.) |
|
|
Biološki test (vidjeti odjeljak VI.A.9.) |
ODJELJAK IV.
1. Postupak za otkrivanje i identifikaciju bakterije R. solanacearum u vodi
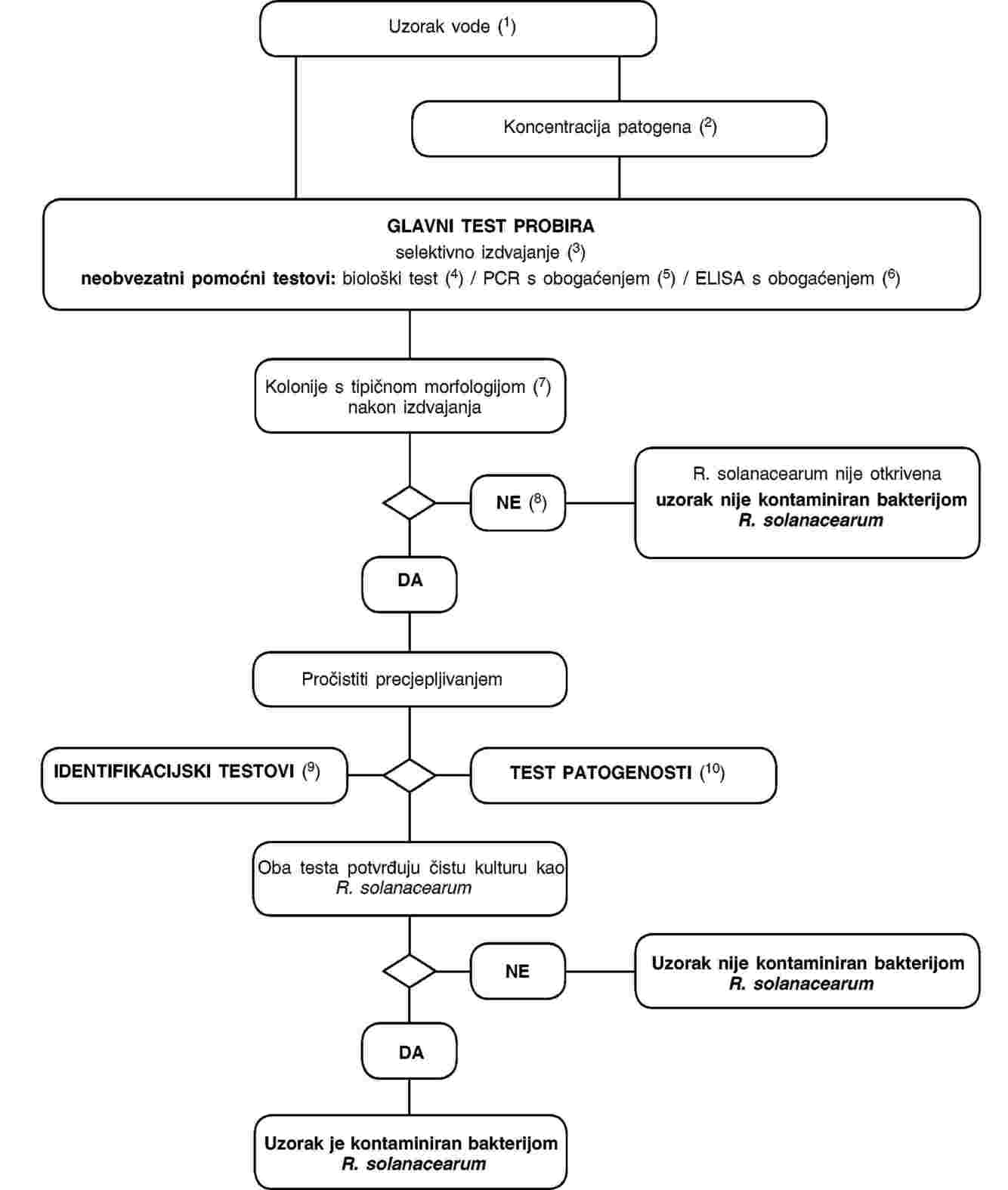

2. Metode za otkrivanje i identifikaciju bakterije R. solanacearum u vodi
Načelo
Validirani postupak opisan u ovom odjeljku može se primijeniti za otkrivanje patogena u uzorcima površinske vode kao i za ispitivanje uzoraka tekućeg otpada nastalog pri preradi krumpira ili otpadnih voda. Međutim, važno je napomenuti da će očekivana osjetljivost detekcije ovisiti o supstratu. Na osjetljivost testa izdvajanja utječu populacije konkurentnih saprofitnih bakterija koje su općenito veće u otpadnim vodama nastalim pri preradi i obradi krumpira nego u površinskim vodama. Dok se može očekivati da će se dolje opisanim postupkom otkriti tek 103 stanica po litru površinske vode, osjetljivost otkrivanja u tekućem otpadu nastalom pri preradi krumpira i u otpadnim vodama bit će vjerojatno znatno niža. Stoga se preporučuje testirati otpadne vode poslije svakog postupka pročišćavanja (npr. sedimentiranja ili filtriranja) tijekom kojega se smanjuju populacije saprofitnih bakterija. Kada ocjenjujemo pouzdanost dobivenih negativnih rezultata, treba uzeti u obzir ograničenja u osjetljivosti postupka ispitivanja. Iako se ovaj postupak uspješno primjenjuje u istraživanjima čiji je cilj utvrditi prisutnost ili odsutnost patogena u površinskim vodama, treba biti svjestan njegovog ograničenja ako se koristi u sličnim istraživanjima tekućeg otpada nastalog pri preradi krumpira ili otpadnih voda.
2.1.
Napomena:
|
— |
Otkrivanje bakterije R. solanacearum u površinskim vodama najpouzdanije je u kasno proljeće, ljeto i jesen kada je temperatura vode iznad 15 °C. |
|
— |
Ponovljena uzorkovanja u različitim trenucima tijekom gore navedenih razdoblja na određenim mjestima uzorkovanja povećat će pouzdanost otkrivanja jer će se smanjiti učinci vremenskih promjena. |
|
— |
Treba uzeti u obzir učinke obilnih padalina te zemljopisna obilježja tekućice kako bi se izbjegli značajni učinci razrjeđenja koji mogu prikriti prisutnost patogena. |
|
— |
Uzorke površinske vode treba uzeti blizu biljaka domaćina ako one postoje. |
2.1.1. Na odabranim mjestima uzorkovanja uzmite uzorke vode u sterilne cijevi ili boce za jednokratnu uporabu, po mogućnosti na dubini većoj od 30 cm i na udaljenosti od najviše 2 m od obale. U slučaju tekućeg otpada nastalog pri preradi krumpira i otpadnih voda, uzorke uzmite na mjestu njihovog ispusta. Preporučena veličina uzorka je 500 ml po mjestu uzorkovanja. Ako se žele manji uzorci, preporučuje se uzimanje uzoraka najmanje tri puta na svakom mjestu uzorkovanja, pri čemu se svaki uzorak sastoji od dva poduzorka od najmanje 30 ml. Za intenzivno istraživanje odaberite najmanje tri mjesta uzorkovanja na 3 km tekućice te osigurajte uzimanje uzoraka i iz pritoka te tekućice.
2.1.2. Uzorke prevozite u tamnim uvjetima pri niskim temperaturama (4 do 10 °C) i testirajte ih u roku od 24 sata.
2.1.3. Bakterijska frakcija može se, po potrebi, koncentrirati pomoću jedne od sljedećih metoda:
|
(a) |
centrifugirajte 30 do 50 ml poduzorka na 10 000 g 10 minuta (ili 7 000 g 15 minuta) po mogućnosti na temperaturi od 4 do 10 °C, uklonite supernatant i resuspendirajte talog u 1 ml pufera za talog (Dodatak 4.). |
|
(b) |
Membranskom filtracijom (najmanja veličina pora 0,45 μm) nakon koje se filtar ispire u 5 do 10 ml pufera za talog te ispirak zadržava. Ova je metoda prikladna za veće količine vode koja sadrži mali broj saprofita. |
Koncentriranje se obično ne preporučuje za uzorke tekućeg otpada nastalog pri preradi krumpira ili uzorke otpadnih voda jer će veće populacije konkurentnih saprofitnih bakterija spriječiti otkrivanje bakterije Ralstonia solanacearum.
2.2.
Vidjeti dijagram te opis testova i optimizirane protokole u odgovarajućim dodacima.
ODJELJAK V.
1. Postupak za otkrivanje i identifikaciju bakterije R. solanacearum u tlu
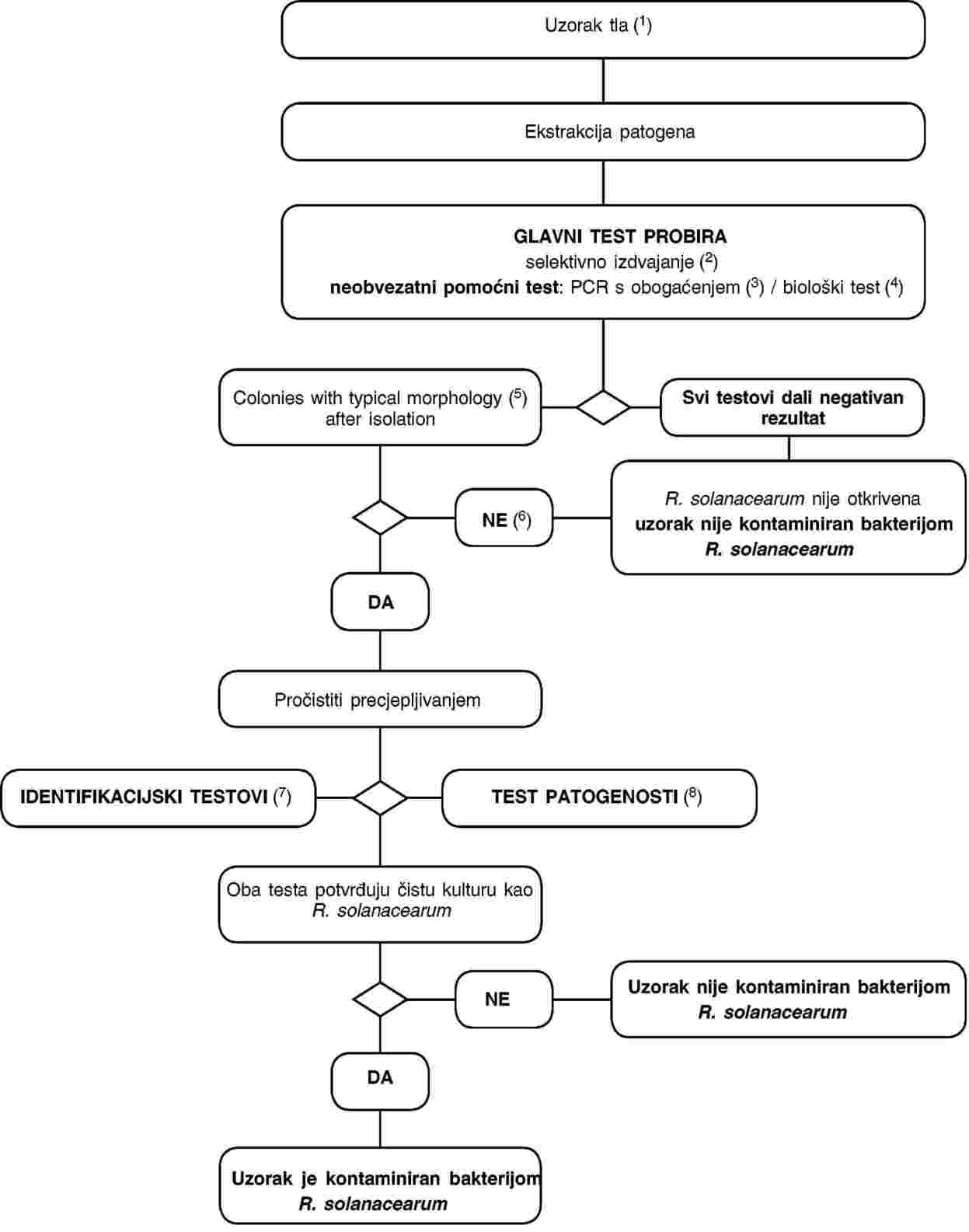

2. Metode za otkrivanje i identifikaciju bakterije R. solanacearum u tlu
Načela
Validirani postupak opisan u ovom odjeljku može se primijeniti za otkrivanje patogena u uzorcima tla kao i za ispitivanje uzoraka krutog otpada nastalog pri preradi krumpira ili uzoraka kanalizacijskog mulja. Međutim, važno je napomenuti da ove metode nisu dovoljno osjetljive da bi jamčile otkrivanje manjih i/ili neravnomjerno raspršenih populacija bakterije Ralstonia solanacearum koje se mogu javljati u prirodno zaraženim uzorcima tih supstrata.
Treba uzeti u obzir ograničenja u osjetljivosti ovog postupka ispitivanja pri ocjenjivanju pouzdanosti dobivenih negativnih rezultata kao i kada ovaj postupak primjenjujemo u istraživanjima čiji je cilj utvrditi prisutnost ili odsutnost patogena u tlu ili mulju. Najpouzdaniji način utvrđivanja prisutnosti patogena u tlu na polju je taj da posadimo biljku domaćina koja je osjetljiva na taj patogen te pratimo hoće li doći do infekcije, ali čak ni ovom metodom neće se otkriti niske razine kontaminacije.
2.1.
2.1.1. Uzorkovanje tla u polju treba obavljati u skladu s osnovnim načelima koja se primjenjuju kod uzorkovanja za ispitivanje nematoda. Sa 60 mjesta na svaka 0,3 ha uzmite 0,5 do 1 kg tla po uzorku, s dubine od 10 do 20 cm (ili na mreži od 7 × 7 metara). Ako se sumnja na prisutnost patogena, povećajte broj mjesta uzorkovanja na 120 na svakih 0,3 ha. Prije testiranja uzorke čuvajte na temperaturi od 12 do 15 °C. Uzorkovanje krutog otpada nastalog pri preradi krumpira ili uzorkovanje kanalizacijskog mulja obavite tako što ćete uzeti ukupno 1 kg na mjestima koja predstavljaju ukupnu količinu mulja koje treba ispitati. Svaki uzorak dobro promiješajte prije testiranja.
2.1.2. Dispergirajte poduzorke od 10 do 25 g tla ili mulja na rotacijskoj tresilici (250 o/min) u ekstrakcijskom puferu (Dodatak 4.) najdulje dva sata. Dodavanje 0,02 %-tnog sterilnog Tween-20 i 10 do 20 g sterilnog pijeska može, po potrebi, pridonijeti dispergiranju.
2.1.3. Suspenziju održavajte na temperaturi od 4 °C tijekom testiranja.
2.2.
Vidjeti dijagram i opis testova u odgovarajućim dodacima.
ODJELJAK VI.
OPTIMIZIRANI PROTOKOLI ZA OTKRIVANJE I IDENTIFIKACIJU BAKTERIJE R. SOLANACEARUM
A. DIJAGNOSTIČKI TESTOVI I TESTOVI ZA OTKRIVANJE
1. Test eksudacije na stabljici
Vjerojatna prisutnost bakterije R. solanacearum u stabljikama uvelih biljaka krumpira, rajčice ili drugih biljaka domaćina može se utvrditi sljedećim jednostavnim testom: odrežite stabljiku neposredno iznad razine tla. Odrezani kraj stavite u epruvetu s čistom vodom. Pratite hoće li nakon nekoliko minuta iz prerezanih žilnih snopića početi spontano curiti karakteristične niti bakterijske sluzi.
2. Otkrivanje zrnaca poli-β-hidroksibutirata (PHB)
|
1. |
Na mikroskopskom stakalcu pripremite razmaz bakterijskog iscjetka iz zaraženog tkiva ili iz 48-satne kulture na hranjivoj podlozi YPGA ili SPA. |
|
2. |
Za pozitivnu kontrolu pripremite razmaze soja biovara 2 bakterije R. solanacearum i, ako smatrate korisnim, za negativnu kontrolu razmaz soja za koji je poznato da je negativan na PHB. |
|
3. |
Razmaze ostavite da se osuše na zraku i donju stranu svakog stakalca brzo povucite iznad plamena da se razmazi fiksiraju. |
|
4. |
Obojite preparat ili nilskim plavilom (Nile Blue) ili sudanskim crnilom (Sudan Black) te promatrajte pod mikroskopom kako je opisano u daljnjem tekstu: |
Test s nilskim plavilom:
|
(a) |
Prelijte svako stakalce s 1 %-tnom vodenom otopinom nilskog plavila A i inkubirajte 10 minuta na 55 °C. |
|
(b) |
Ocijedite otopinu boje. Isperite kratko pod blagim mlazom vode iz slavine. Višak vode uklonite upijajućim papirom. |
|
(c) |
Prelijte razmaz 8 %-tnom vodenom otopinom octene kiseline i inkubirajte jednu minutu na sobnoj temperaturi. |
|
(d) |
Isperite kratko pod blagim mlazom vode iz slavine. Višak vode uklonite upijajućim papirom. |
|
(e) |
Ponovo navlažite kapljicom vode i pokrijte pokrovnim stakalcem. |
|
(f) |
Pregledajte obojeni razmaz pomoću epifluorescentnog mikroskopa na 450 nm, u imerzijskom ulju, uz povećanje od 600 do 1 000, koristeći imerzijski objektiv za ulje ili vodu. |
|
(g) |
Promatrajte je li došlo do svijetlonarančaste fluorescencije zrnaca PHB-a. Također promatrajte pod normalnim svjetlom kako biste se uvjerili da su zrnca intracelularna i da je stanična morfologija tipična za bakteriju R. solanacearum. |
Test sa sudanskim crnilom
|
(a) |
Prelijte svako stakalce 0,3 %-tnom otopinom sudanskog crnila B u 70 %-tnom etanolu i inkubirajte 10 minuta na sobnoj temperaturi. |
|
(b) |
Ocijedite otopinu boje, kratko isperite pod mlazom vode iz slavine i višak vode uklonite upijajućim papirom. |
|
(c) |
Stakalca nakratko umočite u ksilol te ih osušite na upijajućem papiru. Oprez! Ksilol je opasan za zdravlje. Poduzmite potrebne sigurnosne mjere i radite u digestoru. |
|
(d) |
Prelijte stakalca 0,5 %-tnom (w/v) vodenom otopinom safranina i ostavite 10 sekundi na sobnoj temperaturi. Oprez! Safranin je opasan za zdravlje. Poduzmite potrebne sigurnosne mjere i radite u digestoru. |
|
(e) |
Isperite pod blagim mlazom vode iz slavine, osušite na upijajućem papiru te pokrijte pokrovnim stakalcem. |
|
(f) |
Pregledajte obojene razmaze pod mikroskopom koji koristi prolazno svjetlo, u uljnoj imerziji, uz povećanje od 1 000, koristeći imerzijski objektiv za ulje. |
|
(g) |
Promatrajte uočavaju li se plavo-crno obojena zrnca PHB-a u stanicama R. solanacearum s ružičasto obojenim staničnim stjenkama. |
3. Serološki test aglutinacije
Aglutinacija stanica bakterije R. solanacearum u bakterijskom iscjetku ili simptomatskim ekstraktima tkiva najbolje se opaža korištenjem validiranih protutijela (vidjeti Dodatak 3.) obilježenih odgovarajućim obojenim oznakama kao što su crvene stanice Staphylococcus aureus ili obojene čestice lateksa. Ako koristite pribor koji je dostupan na tržištu (vidjeti Dodatak 3.), slijedite upute proizvođača. U protivnom, primijenite sljedeći postupak:
|
(a) |
Pomiješajte kapljice suspenzije obilježenog protutijela i bakterijskog iscjetka (oko 5 μl svakog) na predmetnim stakalcima s više jažica. |
|
(b) |
Pripremite pozitivne i negativne kontrole koristeći suspenzije R. solanacearum biovar 2 i heterolognog soja. |
|
(c) |
Promatrajte hoće li doći do aglutinacije u pozitivnim uzorcima nakon 15 sekundi laganog miješanja. |
4. Selektivno izdvajanje
4.1.
Napomena: Prije nego ovu metodu prvi put primijenite, obavite prethodne testove kako biste osigurali ponovljivo otkrivanje 103 do 104 jedinica koje stvaraju kolonije bakterije R. solanacearum po ml, a koje su dodane ekstraktima uzoraka koji su ranije testirani s negativnim rezultatom.
Koristite primjereno validiranu selektivnu hranjivu podlogu kao što je SMSA (prilagođenu prema Elphinstone et al., 1996; vidjeti Dodatak 2.).
Trebate dobro paziti da razlikujete R. solanacearum od drugih bakterija koje su sposobne stvarati kolonije na toj hranjivoj podlozi. Nadalje, kolonije R. solanacearum mogu pokazivati atipičnu morfologiju ako su ploče prenaseljene ili ako su prisutne antagonističke bakterije. Ako se sumnja na učinke kompeticije ili antagonizma, uzorak treba ponovno ispitati drugačijim testom.
Najveća osjetljivost detekcije ovom metodom može se očekivati ako se koriste svježe pripremljeni ekstrakti uzoraka. Međutim, ova se metoda može primjenjivati i na ekstraktima koji su bili pohranjeni pod glicerolom na temperaturi od – 68 do – 86 °C.
Za pozitivnu kontrolu pripremite decimalna razrjeđenja suspenzije od 106 CFU/ml virulentnog soja biovara 2 R. solanacearum (npr. NCPPB 4156 = PD 2762 = CFBP 3857). Kako bi se spriječila svaka mogućnost kontaminacije, pozitivne kontrole pripremite potpuno odvojeno od uzoraka koje ćete ispitivati.
Za svaku novopripremljenu seriju selektivne hranjive podloge treba, prije nego se upotrijebi za ispitivanje rutinskih uzoraka, provjeriti je li ona prikladna za rast patogena.
Kontrolni materijal testirajte na isti način kao i uzorke.
4.1.1. Primijenite odgovarajuću tehniku nasađivanja razrjeđenja kako biste osigurali da sve populacije saprofitnih bakterija koje stvaraju kolonije budu razrijeđene. Nanesite 50 – 100 μl po ploči ekstrakta uzorka i po svakom razrjeđenju.
4.1.2. Inkubirajte ploče na 28 °C. Očitajte ploče nakon 48 sati, a nakon toga svaki dan u razdoblju do šest dana. Tipične kolonije R. solanacearum na hranjivoj podlozi SMSA mliječno-bijele su boje, plosnate, nepravilnog oblika i tekuće, a nakon tri dana inkubacije sredina im postaje ružičasta do krvavo-crvena s unutarnjim prugama ili spiralama (vidjeti internetsku stranicu http://forum.europa.eu.int/Public/irc/sanco/Home/main).
Napomena: Na ovoj se hranjivoj podlozi ponekad stvaraju i atipične kolonije R. solanacearum. One mogu biti malene, okrugle, potpuno crvene boje i netekuće ili samo djelomično tekuće te ih je, stoga, teško razlikovati od saprofitnih bakterija koje stvaraju kolonije.
4.1.3. Pretpostavljene kolonije R. solanacearum, nakon što ste ih nanijeli ili razrijedili i nasadili na uobičajenu hranjivu podlogu, pročistite kako biste dobili izdvojene kolonije (vidjeti Dodatak 2.).
4.1.4. Kulture se kratko vrijeme mogu čuvati u sterilnoj vodi (pH 6 do 8, bez klora) na sobnoj temperaturi u tami ili duže vrijeme u prikladnom krioprotektoru na temperaturi od – 68 do – 86 °C ili liofilizirane.
4.1.5. Identificirajte pretpostavljene kulture (vidjeti odjeljak VI.B) i obavite test patogenosti (vidjeti odjeljak VI.C).
Tumačenje rezultata testa s nasađivanjem na selektivnu podlogu
Test s nasađivanjem na selektivnu podlogu je negativan ako se nakon šest dana ne uočavaju nikakve bakterijske kolonije ili ako se ne pronađu sumnjive kolonije tipične za R. solanacearum, pod uvjetom da se ne sumnja na inhibiciju zbog konkurencije ili antagonizma drugih bakterija i da su tipične kolonije R. solanacearum pronađene u pozitivnim kontrolama.
Test s nasađivanjem na selektivnu podlogu je pozitivan ako se izdvoje sumnjive kolonije R. solanacearum.
4.2.
Upotrijebite validirano sredstvo za obogaćivanje kao što je modificirani bujon Wilbrink (vidjeti Dodatak 2.).
Ovaj se postupak može primijeniti da se selektivno povećaju populacije R. solanacearum u ekstraktima uzoraka te da se poveća osjetljivost detekcije. Ovim se postupkom, također, učinkovito razrjeđuju inhibitori reakcije PCR (1:100). Treba, međutim, napomenuti da obogaćivanje R. solanacearum može biti neuspješno zbog kompeticije ili antagonizma saprofitnih organizama koji se često istodobno obogaćuju. Zbog toga može biti teško izdvojiti R. solanacearum iz kultura obogaćenih u bujonu. Pored toga, s obzirom da se populacije serološki srodnih saprofita mogu povećati, preporučuje se uporaba specifičnih monoklonskih protutijela umjesto poliklonskih protutijela ako će se primjenjivati test ELISA.
4.2.1. Za obogaćivanje za test PCR prenesite 100 μl ekstrakta uzorka u 10 ml bujona za obogaćivanje (Dodatak 2.) koji je prethodno podijeljen u alikvote u epruvete ili staklenke bez DNK. Za obogaćivanje za test ELISA mogu se koristiti veći udjeli ekstrakta uzorka u bujonu (npr. 100 μl u 1,0 ml bujona za obogaćivanje).
4.2.2. Inkubirajte 72 sata na temperaturi od 27 do 30 °C sa ili bez protresivanja, s labavim poklopcem da se omogući prozračivanje.
4.2.3. Dobro promiješajte prije korištenja u testovima ELISA ili PCR.
4.2.4. S obogaćenim bujonom postupajte isto kao i s uzorkom(-cima) u gornjim testovima.
Napomena: Ako očekujete da će obogaćivanje R. solanacearum biti onemogućeno zbog velikih populacija određenih konkurentnih saprofitnih bakterija, bolje rezultate ćete možda dobiti ako ekstrakte uzoraka obogatite prije centrifugiranja ili drugih postupaka koncentriranja.
5. Test IF
Načelo
Test IF se preporučuje kao glavni test probira zbog njegove dokazane sposobnosti postizanja zahtijevanih pragova,.
Ako se test IF primjenjuje kao glavni test probira i ako se njime dobije pozitivan rezultat, mora se obaviti test izdvajanja, test PCR ili test FISH kao drugi test probira. Ako se test IF primjenjuje kao drugi test probira i ako se njime dobije pozitivan rezultat, potrebno je obaviti daljnje testove prema dijagramu da bi se analiza završila.
Napomena: Koristite potvrđeni izvor protutijela za R. solanacearum (vidjeti internetsku stranicu http://forum.europa.eu.int/Public/irc/sanco/Home/main). Preporučljivo je da se titar odredi za svaku novu seriju protutijela. Titar se definira kao najveće razrjeđenje kod kojeg dolazi do optimalne reakcije pri testiranju suspenzije koja sadrži 105 do 106 stanica po ml homolognog soja bakterije R. solanacearum uz korištenje konjugata fluorescein-izotiocijanata (FITC) prema preporukama proizvođača. Svi potvrđeni poliklonski antiserumi imali su titar IF najmanje 1:2 000. Tijekom testiranja, treba koristiti protutijela u radnim razrjeđenjima koja su blizu ili jednaka titru.
Test treba obaviti na svježe pripremljenim ekstraktima uzoraka. On se, po potrebi, može uspješno obaviti i na ekstraktima koji su bili pohranjeni na temperaturi od – 68 do – 86 °C pod glicerolom. Glicerol se može ukloniti sa uzorka dodavanjem 1 ml pufera za talog (Dodatak 4.), ponovnim 15-minutnim centrifugiranjem na 7 000 g i resuspendiranjem u jednakom volumenu pufera za talog. To je rijetko potrebno, naročito ako su uzorci plamenom fiksirani na stakalca.
Za pozitivnu kontrolu pripremite odvojena stakalca s homolognim sojem ili nekim drugim referentnim sojem bakterije R. solanacearum suspendiranim u ekstraktu krumpira kako je navedeno u Dodatku 3B te, po slobodnoj volji, u puferu.
Kao sličnu kontrolu na istom stakalcu trebalo bi, po mogućnosti, koristiti prirodno zaraženo tkivo (održavano liofilizacijom ili zamrzavanjem na – 16 do – 24 °C).
Za negativnu kontrolu mogu se upotrijebiti alikvote ekstrakta uzoraka koji su u ranijem testiranju na R. solanacearum pokazali negativan rezultat.
U Dodatku 3. navedeni su standardizirani pozitivni i negativni kontrolni materijali koji se mogu upotrebljavati u ovom testu.
Koristite predmetna stakalca s više jažica, po mogućnosti s 10 jažica promjera najmanje 6 mm.
Kontrolni materijal testirajte jednako kao i uzorke.
5.1.
|
i. |
Za talog s relativno malo škroba U prvu jažicu pipetom odmjerite standardni volumen (15 μl je dovoljno za jažice promjera 6 mm – za veće jažice povećajte volumen) razrjeđenja od 1/100 resuspendiranog taloga krumpira. Potom u ostale jažice u istom redu pipetom odmjerite slični volumen nerazrijeđenog (1/1) taloga. Drugi se red može koristiti kao duplikat ili za drugi uzorak kako je prikazano na slici 1. |
|
ii. |
Za ostali talog: Pripremite decimalna razrjeđenja (1/10, 1/100) resuspendiranog taloga u puferu za talog. U jedan red jažica pipetom odmjerite standardni volumen (15 μl je dovoljno za jažice promjera 6 mm – za veće jažice povećajte volumen) resuspendiranog taloga i svakog razrjeđenja. Drugi se red može koristiti kao duplikat ili za drugi uzorak kako je prikazano na slici 2. |
5.2 Ostavite da se kapljice osuše na sobnoj temperaturi ili ih zagrijavajte do temperature od 40 do 45 °C. Fiksirajte bakterijske stanice na stakalce bilo zagrijavanjem (15 minuta na 60 °C), plamenom, 95 %-tnim etanolom ili prema posebnim uputama dobavljača protutijela.
Prije daljnjih testiranja, fiksirana se stakalca mogu, po potrebi, kratko vrijeme (najviše do tri mjeseca) čuvati zamrznuta u suhom spremniku.
5.3.
|
i. |
U skladu s postupkom za pripremu stakalaca za testiranje kako je opisan pod 5.1.i.: Pripremite niz dvostrukih razrjeđenja. Prva jažica mora imati 1/2 titra (T/2), a ostale 1/4 titra (T/4), 1/2 titra (T/2), titar (T) i dvostruki titar (2T). |
|
ii. |
U skladu s postupkom za pripremu stakalaca za testiranje kako je opisan pod 5.1.ii.: Pripremite radno razrjeđenje (RR) antiseruma u IF puferu. Radno razrjeđenje utječe na specifičnost. Slika 1. Priprema stakalca u skladu s točkama 5.1.i. i 5.3.i.
Slika 2. Priprema stakalca u skladu s točkama 5.1.ii. i 5.3.ii.
|
5.3.1. Posložite stakalca na navlaženi upijajući papir. Svaku jažicu prekrijte razrjeđenjem protutijela. Volumen protutijela koji se stavlja u pojedinu jažicu mora biti jednak volumenu stavljenog ekstrakta.
Slijedite sljedeći postupak ako nema posebnih uputa dobavljača protutijela:
5.3.2. Inkubirajte stakalca na vlažnom papiru pod pokrivalom 30 minuta na sobnoj temperaturi (18 do 25 °C).
5.3.3. Otresite kapljice sa svakog stakalca i pažljivo ih isperite IF puferom. Namočite ih na 5 minuta u IF pufer-Tween (Dodatak 4.) i nakon toga u IF pufer. Pazite da ne dođe do stvaranja aerosola ili prijenosa kapljica jer bi to moglo dovesti do unakrsne kontaminacije. Suvišnu vlagu lagano uklonite upijajućim papirom.
5.3.4. Posložite stakalca na navlaženi papir. Pretraživane jažice prekrijte razrijeđenim FITC konjugatom koji se koristi za određivanje titra. Volumen konjugata nanesenog u jažice mora biti jednak volumenu nanesenog antitijela.
5.3.5. Inkubirajte pokrivena stakalca na vlažnom papiru 30 minuta na sobnoj temperaturi (18 do 25 °C).
5.3.6. Otresite kapljice konjugata sa stakalca. Isplahnite i operite kako je gore opisano (5.3.3).
Pažljivo uklonite višak vlage.
5.3.7. U svaku jažicu pipetom nanesite 5-10 μl 0,1 M glicerola s fosfatnim puferom (Dodatak 4.) ili sredstvo protiv blijeđenja koje je dostupno na tržištu te stavite pokrovno stakalce.
5.4.
5.4.1. Pregledajte pretraživana stakalca pod epifluorescentnim mikroskopom s odgovarajućim filtarima za pobuđivanje FITC, u uljnoj imerziji uz povećanje od 500-1 000. Pregledajte svaku jažicu duž dva okomita promjera i duž vanjskog ruba. Za uzorke koji pokazuju mali broj stanica ili ih uopće ne pokazuju pregledajte najmanje 40 mikroskopskih polja.
Najprije pregledajte stakalce s pozitivnom kontrolom. Stanice moraju snažno fluorescirati i moraju biti potpuno obojene na utvrđenom titru protutijela ili radnog razrjeđenja. U slučaju da kod obojenosti dođe do odstupanja, mora se ponoviti test IF (odjeljak VI.A.5).
5.4.2. Pregledajte postoje li u jažicama svijetle fluorescirajuće stanice s karakterističnom morfologijom bakterije R. solanacearum (vidjeti internetsku stranicu http://forum.europa.eu.int/Public/irc/sanco/Home/main). Jačina fluorescencije mora biti jednaka kao i kod pozitivnog kontrolnog soja pri jednakom razrjeđenju protutijela. Stanice s nepotpunim obojenjem ili sa slabom fluorescencijom moraju se zanemariti.
Test se mora ponoviti kad god se sumnja na kontaminaciju. Sumnja se može javiti ako sva stakalca u seriji pokazuju pozitivne stanice zbog kontaminacije pufera ili ako su pozitivne stanice pronađene (izvan jažica) na površini stakalca.
5.4.3. Postoji nekoliko problema vezanih uz specifičnost testa imunofluorescencije. U koncentriranom ekstraktu krumpirovih stolona ili dijelova stabljika mogu se pojaviti populacije fluorescirajućih stanica s atipičnom morfologijom i saprofitne bakterije koje izazivaju unakrsnu reakciju i koje su po veličini i morfologiji slične bakteriji R. solanacearum.
5.4.4. U obzir uzmite samo fluorescirajuće stanice tipične veličine i morfologije u titru ili radnom razrjeđenju protutijela kako je opisan u točki 5.3.
5.4.5. Tumačenje rezultata testa IF
|
i. |
Ako nađete svijetle fluorescirajuće stanice s karakterističnom morfologijom, odredite prosječni broj tipičnih stanica po mikroskopskom polju i izračunajte broj tipičnih stanica po ml resuspendiranog taloga (Dodatak 5.). Nalaz testa IF je pozitivan za uzorke koji imaju najmanje 5 × 103 tipičnih stanica po ml resuspendiranog taloga. Uzorak se smatra potencijalno kontaminiranim i potrebni su daljnji testovi. |
|
ii. |
Nalaz testa IF je negativan za uzorke koji imaju manje od 5 × 103 stanica po ml resuspendiranog taloga te se uzorak smatra negativnim. Nisu potrebni daljnji testovi. |
6. Testovi PCR
Načela
Ako se test PCR primjenjuje kao glavni test probira i ako se njime dobije pozitivan rezultat, mora se obaviti test izdvajanja ili test IF kao drugi obvezni test probira. Ako se test PCR primjenjuje kao drugi test probira i ako se njime dobije pozitivan rezultat, za postavljanje konačne dijagnoze treba obaviti daljnje testove prema dijagramu.
Potpuna primjena ove metode kao glavnog testa probira preporučuje se samo ako ste stručno osposobljeni.
Napomena: Preliminarna ispitivanja pomoću ove metode trebaju omogućiti ponovljivo otkrivanje 103 do 104 stanica bakterije R. solanacearum po ml, koje su dodane ekstraktima uzoraka koji su ranije testirani s negativnim rezultatom. Kako bi se postigao najveći stupanj osjetljivosti i specifičnosti u svim laboratorijima, mogu biti potrebni pokusi za optimizaciju.
Koristite potvrđene reagense i protokole za PCR (vidjeti Dodatak 6.). Poželjno je odabrati metodu s unutarnjom kontrolom.
Poduzmite odgovarajuće mjere opreza kako biste spriječili kontaminacija uzorka ciljnom DNK. Da bi se spriječila kontaminacija ciljnom DNK, test PCR trebali bi obavljati iskusni stručnjaci u specijaliziranim laboratorijima za molekularnu biologiju.
Negativne kontrole (za ekstrakciju DNK i postupke PCR) treba uvijek obrađivati kao zadnje uzorke u postupku kako bi se vidjelo je li došlo do prijenosa DNK.
U PCR test treba uključiti sljedeće negativne kontrole:
|
— |
ekstrakt uzorka koji je u ranijem testiranju na R. solanacearum pokazao negativan rezultat |
|
— |
kontrole pufera korištenog za ekstrakciju bakterije i DNK iz uzorka |
|
— |
reakcijsku smjesu za PCR |
Treba uključiti sljedeće pozitivne kontrole:
|
— |
Alikvote resuspendiranih taloga u koje je dodana bakterija R. solanacearum (za pripremu vidjeti Dodatak 3. B). |
|
— |
Suspenziju od 106 stanica/ml bakterije R. solanacearum u vodi iz virulentnog izolata (npr. NCPPB 4156 = PD 2762 = CFBP 3857; vidjeti Dodatak 3. B). |
|
— |
Ako je moguće, u testu PCR upotrijebite i DNK ekstrahiranu iz pozitivnih kontrolnih uzoraka. |
Da bi se izbjegla moguća kontaminacija, pozitivne kontrole pripremite prostorno odvojeno od pretraživanih uzoraka.
Ekstrakti uzoraka moraju sadržavati što je moguće manje zemlje. Ako namjeravate primjenjivati protokole PCR, u nekim bi slučajevima, stoga, bilo bi preporučljivo pripremiti ekstrakte od opranih krumpira.
U Dodatku 3. navedeni su standardizirani pozitivni i negativni kontrolni materijali koji se mogu koristiti u ovim testovima.
6.1.
Upotrijebite uzorke za pozitivnu i negativnu kontrolu kako je gore opisano (vidjeti Dodatak 3.).
Testirajte kontrolni materijal na isti način kao i uzorak(-ke).
Postoje različite metode za pročišćavanje ciljne DNK iz supstrata složenih uzoraka, kojima se uklanjaju inhibitori PCR-a i druge enzimske reakcije te se u ekstraktu uzorka koncentrira ciljna DNK. Sljedeća je metoda optimizirana za korištenje s validiranim metodama PCR koje su navedene u Dodatku 6.
(a) Metoda prema Pastriku (2000)
|
1) |
Pipetom odmjerite 220 μl pufera za lizu (100 mM NaCl, 10 mM Tris-HCl [pH 8,0[, 1 mM EDTA [pH 8,0]) u epruvetu Eppendorf od 1,5 ml. |
|
2) |
Dodajte 100 μl ekstrakta uzorka i stavite u blok za zagrijavanje ili vodenu kupelj na 95 °C 10 minuta. |
|
3) |
Stavite na led 5 minuta. |
|
4) |
Dodajte 80 μl osnovne otopine lizozima (50 mg lizozima na ml u 10 mM Tris-HCl, pH 8,0) te inkubirajte 30 minuta na 37 °C. |
|
5) |
Dodajte 220 μl otopine A Easy DNA® (Invitrogen), dobro promiješajte na vortex miješalici i inkubirajte 30 minuta na 65 °C. |
|
6) |
Dodajte 100 μl otopine B Easy DNA® (Invitrogen), snažno miješajte na vortex miješalici sve dok precipitat ne bude slobodno kružio po epruveti i dok uzorak ne bude potpuno viskozan. |
|
7) |
Dodajte 500 μl kloroforma te miješajte na vortex miješalici dok se viskoznost ne poveća i smjesa postane homogena. |
|
8) |
Centrifugirajte na 15 000 g 20 minuta na 4 °C da se odijele faze i stvori interfaza. |
|
9) |
Gornju fazu prenesite u novu epruvetu Eppendorf. |
|
10) |
Dodajte 1 ml 100 %-tnog etanola (– 20 °C), kratko promiješajte na vortex miješalici i inkubirajte na ledu 10 minuta. |
|
11) |
Centrifugirajte na 15 000 g 20 minuta na 4 °C te uklonite etanol iz taloga. |
|
12) |
Dodajte 500 μl 80 %-tnog etanola (– 20 °C) te promiješajte tako da okrenete epruvetu. |
|
13) |
Centrifugirajte na 15 000 g 10 minuta na 4 °C, sačuvajte talog, a etanol uklonite. |
|
14) |
Ostavite talog da se suši na zraku ili u vakuumskoj centrifugi (DNA speed vac). |
|
15) |
Resuspendirajte talog u 100 μl ultra čiste vode i ostavite na sobnoj temperaturi najmanje 20 minuta. |
|
16) |
Pohranite na – 20 °C dok ne bude potrebno za PCR. |
|
17) |
Centrifugiranjem izdvojite mogući bijeli precipitat te za PCR upotrijebite 5 μl supernatanta koji sadrži DNK. |
(b) Druge metode
Mogu se primijeniti i druge metode ekstrakcije DNK, npr. Qiagen DNeasy Plant Kit, pod uvjetom da je dokazano da su jednako učinkovite u pročišćavanju DNK iz kontrolnih uzoraka koji sadrže 103 do 104 patogenih stanica na ml.
6.2.
6.2.1. Pripremite kalupe (template) za ispitivanje i kontrolu za PCR prema potvrđenim protokolima (odjeljak VI.A.6). Pripremite jedno decimalno razrjeđenje ekstrakta DNK iz uzorka (1:10 u ultra čistoj vodi).
6.2.2. U nekontaminiranom prostoru pripremite odgovarajuću reakcijsku smjesu za PCR prema objavljenim protokolima (Dodatak 6.). Preporučuje se da, ako je moguće, koristite protokol za multipleks PCR koji uključuje i unutarnju kontrolu PCR-a.
6.2.3. Prema protokolu za PCR (Dodatak 6.) dodajte 2-5 μl ekstrakta DNK na 25 μl reakcijske smjese za PCR u sterilne epruvete za PCR.
6.2.4. Uključite i uzorak za negativnu kontrolu koji sadrži samo reakcijsku smjesu za PCR te, umjesto uzorka, dodajte isti izvor ultra čiste vode koji je korišten za pripremu reakcijske smjese za PCR.
6.2.5. Stavite epruvete u uređaj za PCR (thermal cycler) koji je korišten u preliminarnom ispitivanju te primijenite optimizirani program PCR (Dodatak 6.).
6.3.
6.3.1. Elektroforezom na agaroznom gelu razdvojite umnožene produkte PCR-a. Najmanje 12 μl reakcijske smjese umnožene DNK iz svakog uzorka, pomiješane s 3 μl pufera za nanošenje (Dodatak 6.), nanesite na 2,0 %-tni (w/v) agarozni gel u tris-acetatnom EDTA puferu (TAE) (Dodatak 6.), uz napon od 5 do 8 V na cm. Upotrijebite odgovarajući biljeg DNK, npr. ljestvicu 100 bp.
6.3.2. Otkrijte vrpce DNK bojenjem etidijevim bromidom (0,5 mg/l) 30 do 60 minuta poduzimajući pri tomu odgovarajuće mjere opreza za rad s mutagenim tvarima.
6.3.3. Obojeni gel promatrajte pod kratkovalnom UV transiluminacijom (λ = 302 nm) i tražite umnožene produkte PCR-a očekivane veličine (Dodatak 6.) te ih dokumentirajte.
6.3.4. Za svaki novi nalaz/slučaj provjerite autentičnost umnoženog produkta PCR-a analizom s restrikcijskim enzimima na uzorku preostalih umnoženih DNK i to inkubacijom pri optimalnoj temperaturi i u optimalnom vremenu s odgovarajućim enzimom i puferom (vidjeti Dodatak 6.). Razgrađene fragmente razdvojite elektroforezom na agaroznom gelu kako je gore navedeno te pod UV transiluminacijom, nakon bojenja etidijevim bromidom, promatrajte karakteristični uzorak fragmenta nakon restrikcije te usporedite s pozitivnom kontrolom prije i poslije digestije.
Tumačenje rezultata testa PCR
Test PCR je negativan ako u pretraživanom uzorku nije otkriven produkt PCR-a očekivane veličine koji je specifičan za bakteriju R. solanacearum, ali je otkriven u svim pozitivnim kontrolnim uzorcima (kod multipleks PCR-a s početnicama unutarnje kontrole koje su specifične za biljku: u dotičnom se uzorku mora umnožiti drugi produkt PCR-a očekivane veličine).
Test PCR je pozitivan ako je otkriven produkt PCR-a koji je specifičan za bakteriju R. solanacearum i koji je očekivane veličine i restrikcijskog uzorka, pod uvjetom da nije umnožen ni iz jednog uzorka za negativnu kontrolu. Pouzdanu potvrdu pozitivnog rezultata možete dobiti i ponavljanjem testa s drugim skupom početnica za PCR (Dodatak 6.).
Napomena: Može se sumnjati da je došlo do inhibicije PCR-a ako se iz uzorka za pozitivnu kontrolu koji sadrži R. solanacearum u vodi dobije očekivani produkt, a iz pozitivnih kontrola s R. solanacearum u ekstraktu krumpira dobiju negativni rezultati. U multipleks PCR protokolima s unutarnjim kontrolama za PCR, inhibicija reakcije je indicirana ako nije dobiven nijedan od dva produkta.
Ako se iz jedne ili više negativnih kontrola dobije očekivani produkt umnažanja, može se sumnjati da je došlo do kontaminacije.
7. Test FISH
Načelo
Ako se test FISH primjenjuje kao prvi test probira i ako se njime dobije pozitivan rezultat, mora se obaviti test izdvajanja ili test IF kao drugi obvezni test probira. Ako se test FISH primjenjuje kao drugi test probira i ako se njime dobije pozitivan rezultat, za postavljanje konačne dijagnoze treba obaviti daljnje testove prema dijagramu.
Napomena: Koristite potvrđene oligo-sonde specifične za bakteriju R. solanacearum (vidjeti Dodatak 7.). Preliminarna ispitivanja pomoću ove metode trebaju omogućiti ponovljivo otkrivanje najmanje 103 do 104 stanica bakterije R. solanacearum po ml koje su dodane ekstraktima uzoraka koji su ranije testirani s negativnim rezultatom.
Sljedeći je postupak najbolje obavljati na svježe pripremljenim ekstraktima uzoraka, ali se može uspješno primijeniti i na ekstraktu uzorka koji je bio pohranjeni pod glicerolom na temperaturi od – 16 do – 24 °C ili od – 68 do – 86 °C.
Za negativnu kontrolu upotrijebite alikvote ekstrakta uzoraka koji su u ranijem testiranju na R. solanacearum pokazali negativan rezultat.
Za pozitivnu kontrolu pripremite suspenzije koje sadrže 105 do 106 stanica/ml bakterije R. solanacearum biovar 2 (npr. soj NCPPB 4156 = PD 2762 = CFBP 3857; vidjeti Dodatak 3.) iz kulture stare 3 – 5 dana. Pripremite odvojena stakalca za pozitivnu kontrolu s homolognim sojem ili nekim drugim referentnim sojem bakterije R. solanacearum suspendiranim u ekstraktu krumpira kako je navedeno u Dodatku 3. B.
Korištenje eubakterijske oligo-sonde obilježene FITC-om omogućuje kontrolu procesa hibridizacije jer će se obojiti sve eubakterije koje su prisutne u uzorku.
U Dodatku 3. A navedeni su standardizirani pozitivni i negativni kontrolni materijali koji se mogu upotrebljavati u ovom testu.
Kontrolni materijal testirajte jednako kao i uzorke.
7.1.
Sljedeći se protokol temelji na Wullings et al. (1998):
7.1.1. Pripremite otopinu za fiksiranje (vidjeti Dodatak 7.).
7.1.2. Pipetom odmjerite 100 μl svakog ekstrakta uzorka u epruvetu Eppendorf te centrifugirajte 7 minuta na 7 000 g.
7.1.3. Uklonite supernatant i rastopite talog u 200 μl fiksativa pripremljenog prije manje od 24 sata. Promiješajte na vortex miješalici i inkubirajte jedan sat u hladnjaku.
7.1.4. Centrifugirajte 7 minuta na 7 000 g, uklonite supernatant te resuspendirajte talog u 75 μl 0,01 PB (vidjeti Dodatak 7.).
7.1.5. U jažice čistog stakalca nanesite 16 μl fiksiranih suspenzija kako je prikazano na slici 7.1. Na svako stakalce nanesite dva različita uzorka, nerazrijeđena i upotrijebite 10 μl za pripremanje razrjeđenja 1:100 (u 0,01 M PB). Preostalu otopinu uzorka (49 μl) možete pohraniti na – 20 °C nakon dodavanja jednog volumena 96 %-tnog etanola. Ako test FISH trebate ponoviti, centrifugiranjem uklonite etanol i dodajte jednaki volumen 0,01 PB (promiješati u vortex miješalici).
Slika 7.1. Shema stakalca za test FISH

7.1.6 Stakalca osušite na zraku (ili u sušioniku na 37 °C) te ih fiksirajte plamenom.
U ovoj se fazi postupak može prekinuti i nastaviti sljedeći dan. Stakalca se trebaju pohraniti na sobnoj temperaturi u suhom prostoru bez prašine.
7.2.
7.2.1. Dehidrirajte stanice uzastopnim jednominutnim uranjanjem u 50 %-tni, 80 %-tni i 90 %-tni etanol. Stakalca postavite na držač i osušite na zraku.
7.2.2. Pripremite vlažnu inkubacijsku komoru tako što ćete dno hermetičke kutije prekriti upijajućim ili filtrirnim papirom namočenim u 1x hybmix (Dodatak 7.). Kutiju prethodno inkubirajte u hibridizacijskoj peći najmanje 10 minuta na 45 °C.
7.2.3. Nanesite 10 μl otopine za hibridizaciju (Dodatak 7.) u osam jažica (jažice 1, 2, 4, 5, 6, 7, 9 i 10; vidjeti sliku 7.1) svakog stakalca, a dvije središnje jažice (3 i 8) ostavite prazne.
7.2.4. Prve i zadnje četiri jažice pokrijte pokrovnim stakalcem (24 × 24 mm) pazeći pri tom da u jažicama ne ostane zraka. Stavite stakalca u prethodno zagrijanu vlažnu komoru i hibridizirajte pet sati u pećnici na 45 °C u tami.
7.2.5. Pripremite tri posude koje sadrže 1 l Milli Q vode (za uporabu u molekularnoj biologiji), 1 l 1x hybmixa (334 ml 3x hybmixa i 666 ml Milli Q vode) i 1 l 1/8x hybmixa (42 ml 3x hybmixa i 958 ml Milli Q vode). Svaku posudu prethodno inkubirajte u vodenoj kupelji na 45 °C.
7.2.6. Uklonite pokrovna stakalca, a predmetna stakalca stavite na držač.
7.2.7. Višak sonde isperite inkubiranjem 15 minuta na 45 °C u posudi s 1x hybmixa.
7.2.8. Prenesite držač stakalaca u otopinu za pranje od 1/8 hybmixa i inkubirajte još 15 minuta.
7.2.9. Stakalca nakratko uronite u vodu Milli Q te ih stavite na filtrirni papir. Višak vlage uklonite tako što ćete površinu lagano pokriti filtrirnim papirom. U svaku jažicu pipetom odmjerite 5 do 10 μl zaštitne otopine protiv blijeđenja (npr. Vectashield, Vecta Laboratories, CA, USA ili ekvivalentni) te cijelo predmetno stakalce pokrijte velikim pokrovnim stakalcem (24 × 60 mm).
7.3.
7.3.1. Stakalca odmah promatrajte pomoću epifluorescentnog mikroskopa u uljnoj imerziji, uz povećanje od 639 ili 1 000 ×. S filtrom prikladnim za fluorescein-izotiocijanat (FITC), eubakterijske stanice (uključujući većinu gram negativnih stanica) u uzorku se vide kao fluorescentno zelene. Uporabom filtra za tetrametilrodamin-5-izotiocijanat stanice bakterije R. solanacearum, obojene s Cy3, vide se kao fluorescentno crvene. Usporedite morfologiju stanice s morfologijom pozitivnih kontrola. Stanice moraju biti svijetlo flourescentne i u cijelosti obojene. Ako dođe do odstupanja u obojenosti, test FISH (odjeljak VI.A.7) mora se ponoviti. Pregledajte svaku jažicu duž dva okomita promjera i duž vanjskog ruba. Za uzorke koji pokazuju mali broj stanica ili ih uopće ne pokazuju pregledajte najmanje 40 mikroskopskih polja.
7.3.2. Pregledajte postoje li u pretraživanim jažicama svijetle fluorescirajuće stanice s karakterističnom morfologijom bakterije R. solanacearum (vidjeti internetsku stranicu http://forum.europa.eu.int/Public/irc/sanco/Home/main). Jačina fluorescencije mora biti jednaka ili bolja nego kod pozitivnog kontrolnog soja. Stanice s nepotpunim obojenjem ili sa slabom fluorescencijom moraju se zanemariti.
7.3.3. Test se mora ponoviti kad god se sumnja na kontaminaciju. Sumnja se može javiti ako sva stakalca u seriji pokazuju pozitivne stanice zbog kontaminacije pufera ili ako su pozitivne stanice pronađene (izvan jažica) na površini stakalca.
7.3.4. Postoji nekoliko problema vezanih uz specifičnost testa FISH. U koncentriranom ekstraktu krumpirovih stolona i dijelova stabljika mogu se pojaviti, iako rjeđe nego kod testa IF, populacije fluorescirajućih stanica s atipičnom morfologijom i saprofitne bakterije koje su po veličini i morfologiji slične bakteriji R. solanacearum.
7.3.5. U obzir uzmite samo fluorescirajuće stanice tipične veličine i morfologije.
7.3.6. Tumačenje rezultata testa FISH
|
i. |
Rezultati testa FISH smatraju se valjanim ako se primjenom filtra FITC opaze zeleno fluorescirajuće stanice čija je veličina i morfologija tipična za bakteriju R. solanacearum i ako se primjenom filtra za rodamin opaze zeleno fluorescirajuće stanice, i to u svim pozitivnim kontrolama i ni u jednoj negativnoj kontroli. Ako se pronađu svijetle fluorescirajuće stanice s karakterističnom morfologijom, odredite prosječni broj tipičnih stanica po mikroskopskom polju i izračunajte broj tipičnih stanica po ml resuspendiranog taloga (Dodatak 4.). Uzorci s najmanje 5 × 103 tipičnih stanica po ml resuspendiranog taloga smatraju se potencijalno kontaminiranima. Potrebni su daljnji testovi. Uzorci s manje od 5 × 103 tipičnih stanica po ml resuspendiranog taloga smatraju se negativnima. |
|
ii. |
Test FISH je negativan ako se primjenom filtra za rodamin ne uoče snažno fluorescirajuće crvene stanice čija je veličina i morfologija tipična za bakteriju R. solanacearum, pod uvjetom da se primjenom filtra za rodamin uoče tipične snažno fluorescirajuće crvene stanice u preparatima pozitivne kontrole. |
8. Testovi ELISA
Načelo
Zbog relativno niske osjetljivosti, ELISA se može primijeniti samo kao neobavezni dodatni test pored testova IF, PCR ili FISH. Ako se primjenjuje DAS ELISA, obvezno je obogaćivanje i uporaba monoklonskih protutijela (vidjeti internetsku stranicu http://forum.europa.eu.int/Public/irc/sanco/Home/main). Obogaćivanje uzoraka prije primjene testa ELISA može biti korisno u svrhu povećanja osjetljivosti testa, ali može biti neuspješno zbog kompeticije ostalih organizama u uzorku.
Napomena: Koristite potvrđeni izvor protutijela za R. solanacearum (vidjeti internetsku stranicu http://forum.europa.eu.int/Public/irc/sanco/Home/main). Preporučljivo je da se titar odredi za svaku novu seriju protutijela. Titar se definira kao najveće razrjeđenje kod kojeg dolazi do optimalne reakcije pri testiranju suspenzije koja sadrži 105 do 106 stanica/ml homolognog soja bakterije R. solanacearum uz korištenje odgovarajućih konjugata sekundarnih protutijela prema preporukama proizvođača. Tijekom testiranja, treba koristiti protutijela u radnim razrjeđenjima koja su blizu ili jednaka titru formulacije dostupne na tržištu.
Odredite titar protutijela na suspenziji od 105 do 106 stanica po ml homolognog soja bakterije R. solanacearum.
Za negativnu kontrolu koristite ekstrakt uzorka koji je u ranijem testiranju na R. solanacearum pokazao negativan rezultat i suspenziju bakterije, koja ne izaziva unakrsnu reakciju, u fiziološkoj otopini puferiranoj fosfatnim puferom (PBS).
Za pozitivnu kontrolu koristite alikvote ekstrakta uzorka koji je u ranijem testiranju pokazao pozitivan rezultat, pomiješane s 103 do 104 stanica/ml bakterije R. solanacearum biovar 2 (npr. soj NCPPB 4156 = PD 2762 = CFBP 3857; vidjeti Dodatak 2. A i B). Za usporedbu rezultata na obje ploče koristite standardnu suspenziju od 105 do 106 stanica/ml bakterije R. solanacearum u PBS-s. Pobrinite se da pozitivne kontrole na mikrotitarskoj ploči budu dobro odvojene od uzorka(-aka) koji se pretražuju.
U Dodatku 3 A navedeni su standardizirani pozitivni i negativni kontrolni materijali koji se mogu upotrebljavati u ovom testu.
Kontrolni materijal testirajte jednako kao i uzorke.
Potvrđena su dva protokola za test ELISA.
(a) Neizravna ELISA (Robinson Smith et al., 1995)
|
1) |
Upotrijebite alikvote od 100 do 200 μl ekstrakta uzorka. (Zagrijavanjem četiri minute na 100 °C u vodenoj kupelji ili bloku za zagrijavanje u nekim se slučajevima mogu smanjiti nespecifični rezultati). |
|
2) |
Dodajte jednaki volumen premaznog pufera dvostruke jačine (Dodatak 4.) i promiješajte na vortex miješalici. |
|
3) |
Nanesite alikvote od 100 μl u svaku od najmanje dvije jažice na mikrotitarskoj ploči (npr. Nunc-Polysorp ili ekvivalentna ploča) i inkubirajte jedan sat na 37 °C ili preko noći na 4 °C. |
|
4) |
Uklonite ekstrakte iz jažica. Isperite jažice tri puta otopinom PBS-Tween (Dodatak 4.), a zadnju otopinu za ispiranje ostavite u jažicama najmanje pet minuta. |
|
5) |
Pripremite odgovarajuće razrjeđenje protutijela za R. solanacearum u blokirajućem puferu (Dodatak 4.). Za potvrđena protutijela koja su dostupna na tržištu koristite preporučena razrjeđenja (obično dvostruko jača koncentracija nego titar). |
|
6) |
Dodajte 100 μl u svaku jažicu i inkubirajte jedan sat na 37 °C. |
|
7) |
Uklonite otopinu protutijela iz jažica i operite jažice kao prije (4). |
|
8) |
Pripremite odgovarajuće razrjeđenje konjugata alkalne fosfataze sekundarnih protutijela u blokirajućem puferu. Dodajte 100 μl u svaku jažicu i inkubirajte jedan sat na 37 °C. |
|
9) |
Uklonite konjugat protutijela iz jažica i operite jažice kao prije (4). |
|
10) |
U svaku jažicu dodajte 100 μl otopine supstrata alkalne fosfataze (Dodatak 4.), inkubirajte u tami na sobnoj temperaturi i očitavajte apsorbanciju pri 405 nm u redovitim razmacima tijekom 90 minuta. |
(b) DASI ELISA
|
1) |
Pripremite odgovarajuće razrjeđenje poliklonskih imunoglobulina koji djeluju protiv bakterije R. solanacearum u premaznom puferu pH 9,6 (Dodatak 4.). Nanesite 200 μl u svaku jažicu. Inkubirajte četiri do pet sati na 37 °C ili 16 sati na 4 °C. |
|
2) |
Jažice isperite tri puta otopinom PBS-Tween (Dodatak 4.). U najmanje dvije jažice nanesite 190 μl ekstrakta uzorka. Na svakoj ploči dodajte pozitivnu i negativnu kontrolu, i to svaku u po dvije jažice. Inkubirajte 16 sati na 4 °C. |
|
3) |
Jažice isperite tri puta otopinom PBS-Tween (Dodatak 4.). |
|
4) |
Pripremite odgovarajuće razrjeđenje monoklonskih protutijela specifičnih za bakteriju R. solanacearum u PBS-u (Dodatak 4.) koji sadrži i 0,5 % goveđeg serumskog albumina (BSA) te nanesite 190 μl u svaku jažicu. Inkubirajte dva sata na 37 °C. |
|
5) |
Jažice isperite tri puta otopinom PBS-Tween (Dodatak 4.). |
|
6) |
Pripremite odgovarajuće razrjeđenje protumišjih imunoglobulina konjugiranih s alkalnom fosfatazom u PBS-u. Nanesite 190 μl u svaku jažicu. Inkubirajte dva sata na 37 °C. |
|
7) |
Jažice isperite tri puta otopinom PBS-Tween (Dodatak 4.). |
|
8) |
Pripremite otopinu supstrata alkalne fosfataze koja sadrži 1 mg p-nitrofenil fosfata na ml pufera supstrata (Dodatak 4.). Nanesite 200 μl u svaku jažicu. Inkubirajte u tami na sobnoj temperaturi i očitavajte apsorbanciju pri 40 nm u redovitim razmacima tijekom 90 minuta. |
Tumačenje rezultata testova ELISA
Test ELISA je negativan ako je prosječna optička gustoća (OD) u jažicama s duplikatom uzorka < 2x OD u jažici s negativnom kontrolom ekstrakta uzorka, pod uvjetom da su sve vrijednosti OD pozitivnih kontrola iznad 1,0 (nakon 90 minuta inkubacije sa supstratom) i da su veće od dvostruke vrijednosti OD dobivene za negativne ekstrakte uzorka.
Test ELISA je pozitivan ako je prosječna optička gustoća (OD) u jažicama s duplikatom uzorka > 2x OD u jažici s negativnom kontrolom ekstrakta uzorka, pod uvjetom da su vrijednosti OD za sve jažice s negativnom kontrolom < 2x OD u jažicama s pozitivnom kontrolom.
Ako se u ELISA testu očitaju negativni rezultati u jažicama s pozitivnom kontrolom, to ukazuje da test nije pravilno obavljen ili da je došlo do inhibicije. Ako se u ELISA testu očitaju pozitivni rezultati u jažicama s negativnom kontrolom, to ukazuje da je došlo do unakrsne kontaminacije ili do nespecifičnog vezanja protutijela.
9. Biološki test
Napomena: Preliminarna ispitivanja pomoću ove metode trebaju omogućiti ponovljivo otkrivanje 103 do 104 jedinica koje stvaraju kolonije bakterije R. solanacearum po ml, a koje su dodane ekstraktima uzoraka koji su ranije testirani s negativnim rezultatom.
Najveća osjetljivost detekcije može se očekivati ako se koriste svježe pripremljeni ekstrakti uzoraka te optimalni uvjeti rasta. Međutim, ova se metoda može uspješno primjenjivati i na ekstraktima koji su bili pohranjeni pod glicerolom na temperaturi od – 68 do – 86 °C.
Sljedeći se protokol temelji na Janse (1988).
9.1. Za svaki uzorak koji ćete pretraživati uzmite 10 biljaka osjetljivog kultivara rajčice (npr. Moneymaker ili kultivar za koji je ispitni laboratorij utvrdio da ima ekvivalentnu osjetljivost) u fazi trećeg pravog lista. Za pojedinosti o uzgoju, vidjeti Dodatak 8. Moguće je upotrijebiti i patlidžane (npr. kultivar Black Beauty ili kultivar ekvivalentne osjetljivosti), ali samo biljke u fazi 2-3 lista do potpunog razvoja trećeg pravog lista. Pokazalo se da su kod patlidžana simptomi manje ozbiljni i da se sporije razvijaju. Preporučuje se, stoga, po mogućnosti koristiti sadnice rajčice.
100 μl ekstrakta uzorka rasporedite na pretraživane biljke.
9.2.1. Inokulacija ubrizgavanjem
Inokulirajte u stabljiku neposredno iznad kotiledona pomoću injekcije s iglom za potkožno ubrizgavanje (najmanje 23G). Uzorak rasporedite na pretraživane biljke.
9.2.2. Inokulacija zarezivanjem
Držeći biljku među prstima, pipetom nanesite kapljicu (oko 5-10 μl) suspendiranog taloga na stabljiku između kotiledona i prvog lista.
Pomoću sterilnog skalpela napravite dijagonalni rez, dug oko 1,0 cm i dubok oko 2/3 debljine stabljike, počevši zarezivati od kapljice taloga.
Rez zatvorite sterilnim vazelinom pomoći brizgalice.
9.3. Koristeći istu tehniku, inokulirajte pet sadnica vodenom suspenzijom 105 do 106 stanica/ml pripremljenom iz 48-satne kulture virulentnog biovara 2 soja bakterije R. solanacearum za pozitivnu kontrolu, a puferom za talog za negativnu kontrolu (Dodatak 4.). Da ne bi došlo do unakrsne kontaminacije, odvojite biljke za pozitivnu i negativnu kontrolu od ostalih biljaka.
9.4. Pretraživane biljke uzgajajte u karanteni do četiri tjedna na temperaturi od 25 do 30 °C i uz visoku relativnu vlažnost te ih primjereno zalijevajte pazeći da ne dođe do zasićenja vodom ili venuća zbog nedostatka vode. Kako ne bi došlo do kontaminacije, biljke za pozitivnu i negativnu kontrolu inkubirajte na jasno odvojenim policama u stakleniku ili komori za uzgoj ili, ako je prostor ograničen, osigurajte da pojedini postupci budu jasno odvojeni. Ako se biljke za različite uzorke moraju inkubirati jedne blizu drugih, odvojite ih prikladnim zaslonima. Pri gnojenju, zalijevanju, pregledavanju i svakom drugom postupku s biljkama dobro pazite da ne dođe do unakrsne kontaminacije. Od ključne je važnosti da u staklenicima i komorama za uzgoj ne bude nikakvih insekata jer oni mogu prenijeti bakteriju s uzorka na uzorak.
Pratite javljaju li se simptomi venuća, epinastije, kloroze i/ili zaostajanja u rastu.
9.5. Iz inficiranih biljaka izolirajte (odjeljak II.3) i identificirajte pročišćene kulture pretpostavljene bakterije R. solanacearum (odjeljak VI.B).
9.6. Ako se nakon tri tjedna ne uoče nikakvi simptomi, obavite test IF/PCR/izdvajanja na kompozitnom uzorku dijelova stabljike dugih 1 cm i uzetih iznad točke inokulacije na svakoj pretraživanoj biljci. Ako test bude pozitivan, primijenite metodu nasađivanja razrjeđenja (odjeljak 4.1.)
9.7. Identificirajte sve pročišćene kulture pretpostavljene bakterije R. solanacearum (odjeljak VI.B).
Rezultati biološkog testa smatraju se valjanim ako biljke pozitivne kontrole pokazuju tipične simptome, ako se iz tih biljaka može ponovno izdvojiti bakterija, i ako se na negativnim kontrolama ne pronađu nikakvi simptomi.
Biološki test je negativan ako pretraživane biljke nisu zaražene bakterijom R. solanacearum, pod uvjetom da je bakterija R. solanacearum otkrivena u pozitivnim kontrolama.
Biološki test je pozitivan ako su pretraživane biljke zaražene bakterijom R. solanacearum.
B. IDENTIFIKACIJSKI TESTOVI
Identificirajte čiste kulture pretpostavljenih izolata bakterije R. solanacearum pomoću najmanje dva sljedeća testa koja se temelje na različitim biološkim načelima.
Prema potrebi, u svaki korišteni test uključite poznate referentne sojeve (vidjeti Dodatak 3.).
1. Identifikacijski testovi pomoću hranjive podloge i enzimski testovi
Odredite sljedeće fenotipske osobine koje su sustavno prisutne ili odsutne kod bakterije R. solanacearum, prema metodama Lelliott i Stead (1987), Klement et al. (1990), Schaad (2001).
|
Test |
Očekivani rezultat |
|
Stvaranje fluorescentnog pigmenta |
– |
|
Inkluzije poli-β-hidroksibutirata |
+ |
|
Oksidacijski/fermentacijski (O/F) test |
O+/F– |
|
Aktivnost katalaze |
+ |
|
Test oksidaze po Kovacu |
+ |
|
Redukcija nitrata |
+ |
|
Iskorištavanje citrata |
+ |
|
Rast na 40 °C |
– |
|
Rast u 1 % NaCl |
+ |
|
Rast u 2 % NaCl |
– |
|
Aktivnost arginin-dihidrolaze |
– |
|
Likvefakcija želatine |
– |
|
Hidroliza škroba |
– |
|
Hidroliza eskulina |
– |
|
Stvaranje levana |
– |
2. Test IF
2.1. Pripremite suspenziju od oko 106 stanica/ml u puferu za test IF (Dodatak 4.).
2.2. Pripremite niz dvostrukih razrjeđenja odgovarajućeg antiseruma (vidjeti internetsku stranicu http://forum.europa.eu.int/Public/irc/sanco/Home/main).
2.3. Primijenite test IF (odjeljak VI.A.5).
2.4. Test IF je pozitivan ako je IF-titar kulture jednak titru pozitivne kontrole.
3. Test ELISA
Napomena: Ako primjenjujete samo 2 identifikacijska testa, ne primjenjujte drugi serološki test pored ove metode.
3.1. Pripremite suspenziju od oko 108 stanica/ml u 1 X PBS (Dodatak 4.).
3.2. Izvedite odgovarajući postupak ELISA s monoklonskim protutijelom specifičnim za bakteriju R. solanacearum.
3.3. Test ELISA je pozitivan ako je ELISA-vrijednost kulture jednaka najmanje polovici vrijednosti pozitivne kontrole.
4. Testovi PCR
4.1. Pripremite suspenziju od oko 106 stanica/ml u sterilnoj vodi namijenjenoj uporabi u molekularnoj biologiji.
4.2. Zagrijte 100 μl stanične suspenzije u zatvorenim epruvetama u bloku za zagrijavanje ili vreloj vodenoj kupelji četiri minute na 100 °C. Uzorci se mogu potom, do njihove uporabe, pohraniti na – 16 do – 24 °C.
4.3. Primijenite odgovarajuće postupke PCR kako biste umnožili fragmente specifične za R. solanacearum [npr. Seal et al. (1993); Pastrik i Maiss (2000); Pastrik et al. (2002); Boudazin et al. (1999); Opina et al. (1997), Weller et al. (1999)].
4.4. Smatra se da je R. solanacearum pozitivno identificirana ako su umnoženi produkti PCR-a iste veličine i imaju iste polimorfizme duljine restrikcijskih fragmenata kao i soj pozitivne kontrole.
5. Test FISH
5.1. Pripremite suspenziju od oko 106 stanica/ml u ultra čistoj vodi.
5.2. Primijenite postupak FISH (odjeljak VI.A.7.) s najmanje dvije oligo-sonde specifične za R. solanacearum (Dodatak 7.).
5.3. Test FISH je pozitivan ako se i kod kulture i kod pozitivne kontrole dobiju iste reakcije.
6. Profiliranje masnih kiselina (FAP)
6.1. Uzgajajte kulturu 48 sati na 28 °C na triptikaza-soja-agaru (Oxoid).
6.2. Primijenite odgovarajući postupak FAP (Janse, 1991; Stead, 1992).
6.3. Test FAP je pozitivan ako je profil pretpostavljene kulture identičan profilu pozitivne kontrole. Prisutnost karakterističnih masnih kiselina 14:0 3OH, 16:0 2OH, 16:1 2OH i 18:1 2OH te odsutnost 16:0 3OH u velikoj mjeri ukazuje na Ralstonia sp.
7. Metode karakterizacije soja
Kod svakog novog slučaja izdvajanja R. solanacearum preporučuje se obaviti karakterizaciju soja jednom od sljedećih metoda.
Prema potrebi, u svaki korišteni test uključite poznate referentne sojeve (vidjeti Dodatak 3.).
7.1.
R. solanacearum se dijeli na biovare na temelju sposobnosti iskorištavanja i/ili oksidiranja tri disaharida i tri heksozna alkohola (Hayward, 1964 i Hayward et al., 1990). Hranjive podloge za ispitivanje biovara opisane su u Dodatku 2. Test se može uspješno obaviti inokuliranjem podloge čistim kulturama izolata R. solanacearum te inkubiranjem na 28 °C. Ako se podloga rasporedi u 96 sterilnih jažica na ploči za uzgoj stanica (200 μl po jažici), u roku od 72 sata može se uočiti promjena boje od maslinasto zelene na žutu, što znači da je rezultat testa pozitivan.
|
|
Biovar |
||||
|
1 |
2 |
3 |
4 |
5 |
|
|
Iskorištavanje: |
|
|
|
|
|
|
Maltoza |
– |
+ |
+ |
– |
+ |
|
Laktoza |
– |
+ |
+ |
– |
+ |
|
D (+) celobioza |
– |
+ |
+ |
– |
+ |
|
Manitol |
– |
– |
+ |
+ |
+ |
|
Sorbitol |
– |
– |
+ |
+ |
– |
|
Dulcitol |
– |
– |
+ |
+ |
– |
Biovar 2 se dijeli na podfenotipove pomoću dodatnih testova.
|
|
Biovar 2A (raširen u cijelom svijetu) |
Biovar 2A (u Čileu i Kolumbiji) |
Biovar 2T (u tropskim područjima) |
|
Iskorištavanje trehaloze |
– |
+ |
+ |
|
Iskorištavanje mezo-inozitola |
+ |
– |
+ |
|
Iskorištavanje D-riboze |
– |
– |
+ |
|
Pektolitička aktivnost (1) |
slaba |
slaba |
visoka |
7.2.
Molekularna diferencijacija sojeva u kompleksu R. solanacearum može se postići primjenom nekoliko tehnika, uključujući sljedeće:
7.2.1. Analiza polimorfizma duljine restrikcijskih fragmenata (RFLP) (Cook et al., 1989).
7.2.2. PCR ponavljajućih sljedova, korištenjem početnica REP, BOX i ERIC (Louws et al., 1995; Smith et al., 1995).
7.2.3. Analiza polimorfizma duljine umnoženih fragmenata (AFLP) (Van der Wolf et al., 1998).
7.3.
Specifične PCR početnice (Pastrik et al., 2002; vidjeti Dodatak 6.) mogu se upotrijebiti za razlikovanje sojeva koji pripadaju skupini 1 (biovari 3, 4 i 5) i skupini 2 (biovari 1, 2A i 2T) bakterije R. solanacearum, kako je prvobitno bilo utvrđeno analizom RFLP (Cook et al., 1989) i sekvenciranjem 16S rDNK (Taghavi et al., 1996).
C. POTVRDNI TEST
Test patogenosti mora se obaviti kao konačna potvrda dijagnoze R. solanacearum i da bi se ocijenila virulentnosti kultura identificiranih kao R. solanacearum.
|
1) |
Pripremite inokulum od oko 106 stanica/ml iz 24 do 48 sati stare kulture izolata koji namjeravate testirati te odgovarajući pozitivni kontrolni soj bakterije R. solanacearum (npr. NCPPB 4156 = PD 2762 = CFBP 3857; vidjeti Dodatak 3.). |
|
2) |
Inokulirajte 5 do 10 sadnica osjetljivih rajčica ili patlidžana u fazi trećeg pravog lista (vidjeti odjeljak VI.A.9). |
|
3) |
Inkubirajte do dva tjedna na 25 do 28 °C i uz visoku relativnu vlažnost te ih primjereno zalijevajte pazeći da ne dođe do zasićenja vodom ili venuća zbog nedostatka vode. Kod čistih bi se kultura trebalo pojaviti tipično venuće u roku od 14 dana. Ako nakon ovog razdoblja simptomi nisu prisutni, ne može se potvrditi da je kultura patogeni oblik bakterije R. solanacearum. |
|
4) |
Pratite javljaju li se simptomi venuća i/ili epinastije, kloroze i zaostajanja u rastu. |
|
5) |
Iz simptomatskih biljaka izdvojite dio stabljike oko 2 cm iznad točke inokulacije. Smrvite u prah i suspendirajte u manjem volumenu sterilne destilirane vode ili u 50 mM fosfatnog pufera (Dodatak 4.). Izdvajanje iz suspenzije izvedite tako što ćete razrjeđenje razmazati ili razvući u pruge na prikladnu hranjivu podlogu, po mogućnosti selektivnu (Dodatak 2.), inkubirajte 48 do 72 sata na 28 °C te pratite stvaranje kolonija tipičnih za R. solanacearum. |
Dodatak 1.
Laboratoriji uključeni u optimizaciju i validaciju protokola
|
Laboratorij (2) |
Mjesto |
Država |
|
Agentur für Gesundheit und Ernährungssicherheit |
Beč i Linz |
Austrija |
|
Departement Gewasbescherming |
Merelbeke |
Belgija |
|
Plantedirektoratet |
Lyngby |
Danska |
|
Central Science Laboratory |
York |
Engleska |
|
Scottish Agricultural Science Agency |
Edinburgh |
Škotska |
|
Laboratoire National de la Protection des Végétaux, Unité de Bactériologie |
Angers |
Francuska |
|
Laboratoire National de la Protection des Végétaux, Station de Quarantaine de la Pomme de Terre |
Le Rheu |
Francuska |
|
Biologische Bundesanstalt |
Kleinmachnow |
Njemačka |
|
Pflanzenschutzamt Hannover |
Hannover |
Njemačka |
|
State Laboratory |
Dublin |
Irska |
|
Dipartimento di Scienze e Tecnologie Agroambientali |
Bologna |
Italija |
|
Regione Veneto Unità Periferica per i Servizi Fitosanitari |
Verona |
Italija |
|
Nederlandse Algemene Keuringsdienst |
Emmeloord |
Nizozemska |
|
Plantenziektenkundige Dienst |
Wageningen |
Nizozemska |
|
Direcção-Geral de Protecção das Culturas |
Lisabon |
Portugal |
|
Centro Diagnostico de Aldearrubia |
Salamanca |
Španjolska |
|
Instituto Valenciano de Investigaciones Agrarias |
Valencia |
Španjolska |
|
Swedish University of Agricultural Sciences |
Uppsala |
Švedska |
Dodatak 2.
Podloge za izdvajanje i uzgoj bakterije R. solanacearum
(a) Uobičajene hranjive podloge
Hranjivi agar (NA)
|
Hranjivi agar (Difco) |
23,0 g |
|
Destilirana voda |
1,0 l |
Rastopite sastojke i sterilizirajte u autoklavu na 121 °C 15 minuta.
Agar s kvascem, peptonom i glukozom (YPGA)
|
Ekstrakt kvasca (Difco) |
5,0 g |
|
Bacto pepton (Difco) |
5,0 g |
|
D (+) glukoza (monohidrat) |
10,0 g |
|
Bacto agar (Difco) |
15,0 g |
|
Destilirana voda |
1,0 l |
Rastopite sastojke i sterilizirajte u autoklavu na 121 °C 15 minuta.
Agar od saharoze i peptona (SPA)
|
Saharoza |
20,0 g |
|
Bacto pepton (Difco) |
5,0 g |
|
K2HPO4 |
0,5 g |
|
MgSO4.7H2O |
0,25 g |
|
Bacto agar (Difco) |
15,0 g |
|
Destilirana voda |
1,0 l |
|
pH 7,2 – 7,4 |
|
Rastopite sastojke i sterilizirajte u autoklavu na 121 °C 15 minuta.
Kelmanova tetrazol-podloga
|
Casamino kiseline (Difco) |
1,0 g |
|
Bacto pepton (Difco) |
10,0 g |
|
Dekstroza |
5,0 g |
|
Bacto agar (Difco) |
15,0 g |
|
Destilirana voda |
1,0 l |
Rastopite sastojke i sterilizirajte u autoklavu na 121 °C 15 minuta.
Ohladite na 50 °C i dodajte otopinu 2,3,5-trifenil-tetrazol-klorida (Sigma), steriliziranu filtriranjem, kako biste dobili konačnu koncentraciju od 50 mg/l.
(b) Validirane selektivne hranjive podloge
Podloga SMSA (Englebrecht, 1994, izmijenjena od Elphinstone et al., 1996)
|
Osnovna podloga |
|
|
Casamino kiseline (Difco) |
1,0 g |
|
Bacto pepton (Difco) |
10,0 g |
|
Glicerol |
5,0 g |
|
Bacto agar (Difco); vidjeti napomenu 2 |
15,0 g |
|
Destilirana voda |
1,0 l |
Rastopite sastojke i sterilizirajte u autoklavu na 121 °C 15 minuta.
Ohladite na 50 °C i dodajte osnovne vodene otopine sljedećih sastojaka, sterilizirane filtriranjem, kako biste dobili predviđene konačne koncentracije:
|
Kristal ljubičasto (Sigma) |
5 mg na l |
|
Polimiksin-B-sulfat (Sigma P-1004) |
600 000 U (oko 100 mg) na l |
|
Bacitracin (Sigma B-0125) |
1 250 U (oko 25 mg) na l |
|
Kloramfenikol (Sigma C-3175) |
5 mg na l |
|
Penicilin-G (Sigma P-3032) |
825 U (oko 0,5 mg) na l |
|
2,3,5-trifenil-tetrazol-klorid (Sigma) |
50 mg na l |
Napomena:
|
1. |
Reagensi drugačiji od gore navedenih mogu utjecati na rast bakterije R. solanacearum. |
|
2. |
Umjesto Bacto agara (Difco) može se koristiti Oxoid agar br. 1. U tom će slučaju R. solanacearum sporije rasti, ali se može smanjiti i rast konkurentnih saprofita. Za formiranje tipičnih kolonija bakterije R. solanacearum možda će trebati 1 do 2 dana više, a crveno obojenje može biti svjetlije i difuznije nego na Bacto agaru. |
|
3. |
Povećanjem koncentracije bacitracina na 2 500 U/l mogu se smanjiti populacije konkurentnih bakterija, a da se ne utječe na rast bakterije R. solanacearum. |
Pohranite hranjivu podlogu i osnovnu otopinu antibiotika na 4 °C na tamno mjesto i upotrijebite u roku od jednog mjeseca.
Prije uporabe, s ploča moramo ukloniti površinsku kondenzaciju.
Ploče ne smijete pretjerano osušiti.
Nakon pripremanja svake nove serije hranjive podloge, treba obaviti kontrolu kakvoće tako što se nasadi suspenzija referentne kulture R. solanacearum (vidjeti Dodatak 3.) i prati hoće li doći do stvaranja tipičnih kolonija nakon dva do pet dana inkubacije na 28 °C.
(c) Validirane obogaćene podloge
Bujon SMSA (Elphinstone et al., 1996)
Pripremite kao za selektivnu podlogu SMSA s agarom, ali izostavite Bacto agar i 2,3,5-trifenil-tetrazol-klorid.
Modificirani bujon Wilbrink (Caruso et al., 2002)
|
Saharoza |
10 g |
|
Proteoza-pepton |
5 g |
|
K2HPO4 |
0,5 g |
|
MgSO4 |
0,25 g |
|
NaNO3 |
0,25 g |
|
Destilirana voda |
1 l |
Sterilizirajte u autoklavu na 121 °C 15 minuta te ohladite na 50 °C.
Dodajte osnovne otopine antibiotika kao za bujon SMSA.
Dodatak 3.
A. Standardizirani kontrolni materijali dostupni na tržištu
(a) Bakterijski izolati
Preporučuje se koristiti sljedeće bakterijske izolate kao standardni referentni materijal bilo za pozitivne kontrole (Tablica 1) ili tijekom optimizacije testova u svrhu izbjegavanja unakrsnih reakcija (Tablica 2). Svi su sojevi dostupni na tržištu i mogu se nabaviti kod:
|
1. |
National Collection of Plant Pathogenic Bacteria (NCPPB), Central Science Laboratory, York, Ujedinjena Kraljevina |
|
2. |
Culture Collection of the Plant Protection Service (PD), Wageningen, Nizozemska |
|
3. |
Collection Française de Bactéries Phytopathogènes (CFBP), INRA – Station de Phytobactériologie, Angers, Francuska |
Tablica 1. Referentni popis SMT izolata bakterije R. solanacearum
|
Oznaka NCPPB |
Br. SMT |
Ostale oznake |
Država podrijetla |
Biovar |
|
NCPPB 4153 |
6 |
CFBP 4582, Pr 3020, EURS11 |
Egipat |
2 |
|
NCPPB 4154 |
10 |
CFBP 4585, 550, EURS21 |
Turska |
2 |
|
NCPPB 3857 |
12 |
CFBP 4587, Pr 1140, EURS26 |
Engleska |
2 |
|
NCPPB 1584 |
23 |
CFBP 4598, EURS49 |
Cipar |
2 |
|
NCPPB 2505 |
24 |
CFBP 4599, EURS50 |
Švedska |
2 |
|
NCPPB 4155 |
26 |
CFBP 4601, 502, EURS55 |
Belgija |
2 |
|
NCPPB 4156 (3) |
71 (3) |
PD 2762, CFBP 3857 |
Nizozemska |
2 |
|
NCPPB 4157 |
66 |
LNPV 15.59 |
Francuska |
2 |
|
NCPPB 4158 |
39 |
CFBP 4608, Port 448, EURS80 |
Portugal |
2 |
|
NCPPB 4160 |
69 |
IVIA–1632-2 |
Španjolska |
2 |
|
NCPPB 4161 |
76 |
B3B |
Njemačka |
2 |
|
NCPPB 325 |
41 |
CFBP 2047, KEL60-1, R842 |
SAD |
1 |
|
NCPPB 3967 |
42 |
CFBP 4610, R285, GONg7 |
Kostarika |
1 |
|
NCPPB 4028 |
43 |
CFBP 4611, R303/571, CIP310, SEQ205 |
Kolumbija |
2 |
|
NCPPB 3985 |
44 |
CFBP 4612, R578, CIP312 |
Peru |
2T |
|
NCPPB 3989 |
45 |
CFBP 4613, R568, CIP226 |
Brazil |
2T |
|
NCPPB 3996 |
46 |
CFBP 3928, R276/355, CIP72, SEQ225 |
Peru |
3 |
|
NCPPB 3997 |
47 |
CFBP 4614, R280/363, CIP49, HAY0131a |
Australija |
3 |
|
NCPPB 4029 |
48 |
CFBP 4615, R297/349, CIP121, CMIb2861 |
Sri Lanka |
4 |
|
NCPPB 4005 |
49 |
CFBP 4616, R470 |
Filipini |
4 |
|
NCPPB 4011 |
50 |
CFBP 4617, R288, HEmps2 |
Kina |
5 |
Napomena: Autentičnost gore navedenih sojeva može se jamčiti samo ako su oni dobiveni iz autentične zbirke kultura.
Tablica 2. Referentni popis SMT serološki ili genetski srodnih bakterija za uporabu pri optimizaciji testova otkrivanja
|
Oznaka NCPPB |
Br. SMT |
Ostale oznake |
Identifikacija |
|
NCPPB 4162 |
51 |
CFBP 1954 |
Bacillus polymyxa (4) |
|
NCPPB 4163 |
52 |
CFBP 1538 |
Pseudomonas marginalis pv. marginalis (4) |
|
NCPPB 4164 |
— |
CFBP 2227 |
Burkholderia cepacia (5) |
|
NCPPB 4165 |
— |
CFBP 2459 |
Ralstonia pickettii (5) |
|
NCPPB 4166 |
58 |
CFBP 3567 CSL Pr1150 |
Ralstonia pickettii (4) |
|
NCPPB 4167 |
60 |
CFBP 4618 PD 2778 |
Ralstonia sp. (4) |
|
NCPPB 1127 |
53 |
CFBP 3575 |
Burkholderia andropogonis (4) |
|
NCPPB 353 |
54 |
CFBP 3572 |
Burkholderia caryophylli (4) |
|
NCPPB 945 |
55 |
CFBP 3569 |
Burkholderia cepacia (4) |
|
NCPPB 3708 |
56 |
CFBP 3574 |
Burkholderia glumae (4) |
|
NCPPB 3590 |
57 |
CFBP 3573 |
Burkholderia plantarii (4) |
|
NCPPB 3726 |
59 |
CFBP 3568 |
|
|
NCPPB 4168 |
61 |
CFBP 4619 IPO S339 |
Enterobacter sp. (4) |
|
NCPPB 4169 |
62 |
IPO 1695 |
Enterobacter sp. (4) |
|
NCPPB 4170 |
63 |
CFBP 4621 IPO S306 |
|
|
NCPPB 4171 |
64 |
CFBP 4622 IPO 1693 |
|
|
NCPPB 4172 |
65 |
IPO 1696a |
Pseudomonas sp. (4) |
|
NCPPB 4173 |
— |
PD 2318 |
Aureobacterium sp. (5) |
|
NCPPB 4174 |
81 |
IVIA 1844.06 |
(b) Standardizirani kontrolni materijali dostupni na tržištu
Dolje navedeni standardni kontrolni materijal može se dobiti iz zbirke kultura NCPPB.
Liofilizirane granule krumpirovog ekstrakta iz 200 zdravih krumpirovih gomolja kao negativna kontrola za sve testove.
Liofilizirane granule krumpirovog ekstrakta iz 200 zdravih krumpirovih gomolja s 103 do 104 i 104 do 106 stanica R. solanacearum biovar 2 (soj NCPPB 4156 = PD 2762 = CFBP 3857) kao pozitivna kontrola za serološke testove i testove PCR. S obzirom da liofilizacija utječe na vijabilnost stanica, one nisu prikladne kao standardna kontrola za testove izdvajanja ili biološke testove.
Formalinom fiksirane suspenzije bakterije R. solanacearum biovar 2 (soj NCPPB 4156 = PD 2762 = CFBP 3857) s 106 stanica/ml kao pozitivna kontrola za serološke testove.
B. Pripremanje pozitivnih i negativnih kontrola za glavne testove probira (PCR/IF i FISH)
Uzgojite 48-satnu kulturu virulentnog soja R. solanacearum rasa 3/biovar 2 (npr. soj NCPPB 4156 = PD 2762 = CFBP 3857) na osnovnoj podlozi SMSA i suspendirajte u 10 mM fosfatnom puferu da dobijete gustoću stanica od oko 2 × 108 cfu/ml. Ovo se obično postiže blago zamućenom suspenzijom optičke gustoće 0,15 na 600 nm.
Uklonite jezgre krajeva stolona na 200 gomolja krumpira uzetih od vrste s bijelom korom za koju je poznato da je nije napala bakterija R. solanacearum.
Obradite krajeve stolona uobičajenom metodom i resuspendirajte talog u 10 ml.
Napunite 10 sterilnih mikroepruveta od 1,5 ml s 900 μl resuspendiranog taloga.
U prvu mikroepruvetu ulijte 100 μl suspenzije R. solanacearum. Izmiješajte na vortex miješalici.
Odredite decimalne razine kontaminacije putem daljnjih razrjeđenja u sljedećih pet mikroepruveta.
Ovih šest kontaminiranih mikroepruveta služit će za pozitivnu kontrolu. Četiri nekontaminirane mikroepruvete služit će za negativnu kontrolu. U skladu s tim, označite mikroepruvete.
Pripremite alikvote od 100 μl u mikroepruvetama od 1,5 ml tako da dobijete devet kopija svakog kontrolnog uzorka. Do uporabe ih pohranite na – 16 do – 24 °C.
Prisutnost i količinu R. solanacearum u kontrolnim uzorcima potvrdite najprije testom IF.
Za test PCR, obavite ekstrakciju DNK na pozitivnim i negativnim kontrolnim uzorcima za svaku seriju pretraživanih uzoraka.
Za testove IF i FISH, obavite testove na pozitivnim i negativnim kontrolnim uzorcima za svaku seriju pretraživanih uzoraka.
Kod testova IF, FISH i PCR, R. solanacearum se mora otkriti u najmanje 106 i 104 stanica/ml pozitivnih kontrola i ni u jednoj negativnoj kontroli.
Dodatak 4.
Puferi za postupke ispitivanja
Općenito: Neotvoreni sterilni puferi mogu se pohraniti do godinu dana.
1. Puferi za postupak ekstrakcije
1.1. Ekstrakcijski pufer (50 mM fosfatnog pufera, pH 7,0)
Ovaj se pufer koristi za ekstrakciju bakterije iz biljnog tkiva homogenizacijom ili tresenjem.
|
Na2HPO4 (anhidrid) |
4,26 g |
|
KH2PO4 |
2,72 g |
|
Destilirana voda |
1,00 l |
Rastopite sastojke, provjerite pH i sterilizirajte u autoklavu 15 minuta na 121 °C.
Mogu biti korisni i sljedeći dodatni sastojci:
|
|
Svrha |
Količina (na l) |
|
Pahuljice Lubrol |
deflokulant (7) |
0,5 g |
|
DC silikon protiv pjenjenja |
sredstvo protiv pjenjenja (7) |
1,0 ml |
|
Tetranatrijev pirofosfat |
antoksidant |
1,0 g |
|
Polivinilpirolidon-40000 (PVP-40) |
vezivanje inhibitora PCR-a |
50 g |
1.2. Pufer za talog (10 mM fosfatnog pufera, pH 7,2)
Ovaj se pufer koristi za resuspendiranje i razrjeđivanje ekstrakta krajeva stolona krumpirovih gomolja nakon što su centrifugiranjem koncentrirani u talog.
|
Na2HPO4.12H2O |
2,7 g |
|
NaH2PO4.2H2O |
0,4 g |
|
Destilirana voda |
1,0 l |
Rastopite sastojke, provjerite pH i sterilizirajte u autoklavu 15 minuta na 121 °C.
2. Puferi za test IF
2.1. IF-pufer (10 mM fiziološke otopine puferirane fosfatnim puferom (PBS), pH 7,2)
Ovaj se pufer koristi za razrjeđivanje protutijela
|
Na2HPO4.12H2O |
2,7 g |
|
NaH2PO4.2H2O |
0,4 g |
|
NaCl |
8,0 g |
|
Destilirana voda |
1,0 l |
Rastopite sastojke, provjerite pH i sterilizirajte u autoklavu 15 minuta na 121 °C.
2.2. IF-pufer Tween
Ovaj se pufer koristi za pranje stakalaca.
IF-puferu dodajte 0,1 % Tween 20.
2.3. Glicerol s fosfatnim puferom, pH 7,6
Ovaj se pufer koristi kao tekućina za prekrivanje stakalca u testu IF kako bi se pojačala fluorescencija.
|
Na2HPO4·12H2O |
3,2 g |
|
NaH2PO4·2H2O |
0,15 g |
|
Glicerol |
50 ml |
|
Destilirana voda |
100 ml |
Pokrivne otopine protiv blijeđenja dostupne su na tržištu, npr. Vectashield® (Vector Laboratories) ili Citifluor® (Leica).
3. Puferi za neizravni test ELISA
3.1. Premazni pufer dvostruke jačine, pH 9,6
|
Na2CO3 |
6,36 g |
|
NaHCO3 |
11,72 g |
|
Destilirana voda |
1,00 l |
Rastopite sastojke, provjerite pH i sterilizirajte u autoklavu 15 minuta na 121 °C.
Može se dodati natrijev sulfit (0,2 %) kao antioksidant ako je potrebno spriječiti stvaranje oksidiranih aromatskih spojeva.
3.2. 10X fiziološka otopina puferirana fosfatnim puferom (PBS), pH 7,4
|
NaCl |
80,0 g |
|
KH2PO4 |
2,0 g |
|
Na2HPO4·12H2O |
29,0 g |
|
KCl |
2,0 g |
|
Destilirana voda |
1,0 l |
3.3. PBS-Tween
|
10X PBS |
100 ml |
|
10 % Tween 20 |
5 ml |
|
Destilirana voda |
895 ml |
3.4. Blokirajući pufer (protutijela) (mora biti svježe pripremljen)
|
10X PBS |
10,0 ml |
|
Polivinilpirolidon-44000 (PVP-44) |
2,0 g |
|
10 % Tween 20 |
0,5 ml |
|
Mlijeko u prahu |
0,5 g |
|
Destilirana voda |
dopunite do 100 ml |
3.5. Otopina supstrata alkalne fosfataze, pH 9,8
|
Dietanolamin |
97 ml |
|
Destilirana voda |
800 ml |
Pomiješajte i pomoću koncentriranog HCl postignite pH 9,8.
Dopunite destiliranom vodom do jednog litra.
Dodajte 0,2 g MgCl2.
Rastopite dvije 5-miligramske tablete fosfataznog supstrata (Sigma) na 15 ml otopine.
4. Puferi za test DASI ELISA
4.1. Premazni pufer, pH 9,6
|
Na2CO3 |
1,59 g |
|
NaHCO3 |
2,93 g |
|
Destilirana voda |
1 000 ml |
Rastopite sastojke i provjerite pH.
4.2. 10X fiziološka otopina puferirana fosfatnim puferom (PBS), pH 7,4
|
NaCl |
80,0 g |
|
NaH2PO4·2H2O |
4,0 g |
|
Na2HPO4·12H2O |
27,0 g |
|
Destilirana voda |
1 000 ml |
4.3. PBS-Tween
|
10X PBS |
50 ml |
|
10 % Tween 20 |
5 ml |
|
Destilirana voda |
950 ml |
4.4. Pufer supstrata, pH 9,8
|
Dietanolamin |
100 ml |
|
Destilirana voda |
900 ml |
Pomiješajte i pomoću koncentriranog HCl postignite pH 9,8.
Dodatak 5.
Određivanje stupnja kontaminacije u testovima IF i FISH
|
1. |
Odredite srednji broj tipičnih fluorescentnih stanica po vidnom polju (c). |
|
2. |
Izračunajte broj tipičnih fluorescentnih stanica po jažici mikroskopskog stakalca (C). |
C = c × S/s
|
gdje je |
|
|||
|
i |
|
|
s = πi2/4G2K2 |
gdje je |
|
|||
|
|
|
|
|||
|
|
|
|
|
3. |
Izračunajte broj tipičnih fluorescentnih stanica po ml resuspendiranog taloga (N). |
N = C × 1 000/y × F
|
gdje je |
|
|||
|
i |
|
Dodatak 6.
Validirani protokoli i reagensi za PCR
NB: Preliminarna ispitivanja trebaju omogućiti ponovljivo otkrivanje 103 do 104 stanica bakterije R. solanacearum po ml ekstrakta uzorka.
Preliminarna ispitivanja ne smiju pokazati lažno pozitivne rezultate kod određenih odabranih bakterijskih sojeva (vidjeti Dodatak 3.).
1. Protokol za PCR prema Seal et al. (1993)
1.1. Oligonukleotidne početnice
|
Početnica Forward OLI-1 |
5′-GGG GGT AGC TTG CTA CCT GCC-3′ |
|
Početnica Reverse Y-2 |
5′-CCC ACT GCT GCC TCC CGT AGG AGT-3′ |
Očekivana veličina produkta umnažanja iz kalupa DNK bakterije R. solanacearum = 288 bp.
1.2. Reakcijska smjesa za PCR
|
Reagens |
Količina po reakciji |
Konačna koncentracija |
|
Sterilna ultra čista voda |
17,65 μl |
|
|
10X PCR pufer (8) (15 mM MgCl2) |
2,5 μl |
1X (1,5 mM MgCl2) |
|
dNTP smjesa (20 mM) |
0,25 μl |
0,2 mM |
|
Početnica OLI-1 (20 μM) |
1,25 μl |
1μM |
|
Početnica Y-2 (20 μM) |
1,25 μl |
1μM |
|
Taq polimeraza (5U/μl) (8) |
0,1 μl |
0,5 U |
|
Volumen uzorka |
2,0 μl |
|
|
Ukupni volumen |
25 μl |
|
1.3. Uvjeti za reakciju PCR
Provedite sljedeći program:
|
1 ciklus od: |
i. |
2 minute na 96 °C (denaturacija kalupa DNK) |
|
35 ciklusa od: |
ii. |
20 sekundi na 94 °C (denaturacija kalupa DNK) |
|
iii. |
20 sekundi na 68 °C (prianjanje) |
|
|
iv. |
30 sekundi na 72 °C (produljenje kopije) |
|
|
1 ciklus od: |
v. |
10 minuta na 72 °C (konačno produljenje) |
|
vi. |
držati na 4 °C |
NB: Ovaj je program optimiziran za korištenje s uređajem za PCR (thermal cycler) Perkin Elmer 9600. Za rad s drugim modelima uređaja možda će trebati prilagoditi trajanje ciklusa ii., iii. i iv.
1.4. Analiza produkta umnažanja pomoću restrikcijskog enzima
Produkti PCR-a umnoženi iz DNK bakterije R. solanacearum proizvode karakteristični polimorfizam duljine restrikcijskih fragmenata s enzimom Ava II nakon inkubacije na 37 °C.
2. Protokol za PCR prema Pastrik i Maiss (2000)
2.1. Oligonukleotidne početnice
|
Početnica Forward Ps-1 |
5′- agt cga acg gca gcg ggg g -3′ |
|
Početnica Reverse Ps-2 |
5′- ggg gat ttc aca tcg gtc ttg ca -3′ |
Očekivana veličina produkta umnažanja iz kalupa DNK bakterije R. solanacearum = 553 bp.
2.2. Reakcijska smjesa za PCR
|
Reagens |
Količina po reakciji |
Konačna koncentracija |
|
Sterilna ultra čista voda |
16,025 μl |
|
|
10X PCR pufer (9) |
2,5 μl |
1X (1,5 mM MgCl2) |
|
BSA (frakcija V) (10 %) |
0,25 μl |
0,1 % |
|
d-nTP smjesa (20 mM) |
0,125 μl |
0,1 mM |
|
Početnica Ps-1 (10 μM) |
0,5 μl |
0,2 μM |
|
Početnica Ps-2 (10 μM) |
0,5 μl |
0,2 μM |
|
Taq polimeraza (5U/μl) (9) |
0,1 μl |
0,5 U |
|
Volumen uzorka |
5,0 μl |
|
|
Ukupni volumen |
25,0 μl |
|
|
NB: Prvotno optimizirano za uređaj (thermo cycler) MJ Research PTC 200 s Gibco Taq polimerazom. Pri istim koncentracijama može se koristiti i Perkin Elmer AmpliTaq i pufer |
||
2.3. Uvjeti za reakciju PCR
Provedite sljedeći program:
|
1 ciklus od: |
i. |
5 minuta na 95 °C (denaturacija kalupa DNK) |
|
35 ciklusa od: |
ii. |
30 sekundi na 95 °C (denaturacija kalupa DNK) |
|
iii. |
30 sekundi na 68 °C (prianjanje početnica) |
|
|
iv. |
45 sekundi na 72 °C (produljenje kopije) |
|
|
1 ciklus od: |
v. |
5 minuta na 72 °C (konačno produljenje) |
|
vi. |
držati na 4 °C |
NB: Ovaj je program optimiziran za korištenje s uređajem za PCR (thermal cycler) MJ Research PTC 200. Za rad s drugim modelima uređaja možda će trebati prilagoditi trajanje ciklusa ii., iii. i iv.
2.4. Analiza produkta umnažanja pomoću restrikcijskog enzima
Produkti PCR-a umnoženi iz DNK bakterije R. solanacearum proizvode karakteristični polimorfizam duljine restrikcijskih fragmenata s enzimom Taq I nakon inkubacije od 30 minuta na 65 °C. Restrikcijski fragmenti dobiveni iz fragmenta specifičnog za R. solanacearum veliki su 457 bp i 96 bp.
3. Protokol za multipleks PCR s unutarnjom PCR kontrolom (Pastrik et al., 2002)
3.1. Oligonukleotidne početnice
|
Početnica Forward RS-1-F |
5′-ACT AAC GAA GCA GAG ATG CAT TA-3′ |
|
Početnica Reverse RS-1-R |
5′-CCC AGT CAC GGC AGA GAC T-3′ |
|
Početnica Forward NS-5-F |
5′-AAC TTA AAG GAA TTG ACG GAA G-3′ |
|
Početnica Reverse NS-6-R |
5′-GCA TCA CAG ACC TGT TAT TGC CTC-3′ |
Očekivana veličina produkta umnažanja iz kalupa DNK bakterije R. solanacearum = 718 bp (skup početnica RS).
Očekivana veličina produkta umnažanja iz unutarnje PCR kontrole 18S rRNA = 310 bp (skup početnica NS).
3.2. Reakcijska smjesa za PCR
|
Reagens |
Količina po reakciji |
Konačna koncentracija |
|
Sterilna ultra čista voda |
12,625 μl |
|
|
10X PCR pufer (10) (15 mM MgCl2) |
2,5 μl |
1X (1,5 mM MgCl2) |
|
BSA (frakcija V) (10 %) |
0,25 μl |
0,1 % |
|
d-nTP smjesa (20 mM) |
0,125 μl |
0,1 mM |
|
Početnica RS-1-F (10 μM) |
2,0 μl |
0,8 μM |
|
Početnica RS-1-R (10 μM) |
2,0 μl |
0,8 μM |
|
Početnica NS-5-F (10 μM) (11) |
0,15 μl |
0,06 μM |
|
Početnica NS-6-R (10 μM) (11) |
0,15 μl |
0,06 μM |
|
Taq polimeraza (5U/μl) (10) |
0,2 μl |
1,0 U |
|
Volumen uzorka |
5,0 μl |
|
|
Ukupni volumen |
25,0 μl |
|
3.3. Uvjeti za reakciju PCR
Provedite sljedeći program:
|
1 ciklus od: |
i. |
5 minuta na 95 °C (denaturacija kalupa DNK) |
|
35 ciklusa od: |
ii. |
30 sekundi na 95 °C (denaturacija kalupa DNK) |
|
iii. |
30 sekundi na 58 °C (prianjanje početnica) |
|
|
iv. |
45 sekundi na 72 °C (produljenje kopije) |
|
|
1 ciklus od: |
v. |
5 minuta na 72 °C (konačno produljenje) |
|
vi. |
držati na 4 °C |
NB: Ovaj je program optimiziran za korištenje s uređajem za PCR (thermal cycler) MJ Research PTC 200. Za rad s drugim modelima uređaja možda će trebati prilagoditi trajanje ciklusa ii., iii. i iv.
3.4. Analiza produkta umnažanja pomoću restrikcijskog enzima
Produkti PCR-a umnoženi iz DNK bakterije R. solanacearum proizvode karakteristični polimorfizam duljine restrikcijskih fragmenata s enzimom Bsm I ili izoshizomerom (npr. Mva 1269 I) nakon inkubacije od 30 minuta na 65 °C.
4. Protokol za PCR specifičan za biovar R. solanacearum (Pastrik et al., 2001)
4.1. Oligonukleotidne početnice
|
Početnica Forward Rs-1-F |
5′-ACT AAC GAA GCA GAG ATG CAT TA-3′ |
|
Početnica Reverse Rs-1-R |
5′-CCC AGT CAC GGC AGA GAC T-3′ |
|
Početnica Reverse Rs-3-R |
5′-TTC ACG GCA AGA TCG CTC-3′ |
Očekivana veličina produkta umnažanja iz kalupa DNK bakterije R. solanacearum:
s Rs-1-F/Rs-1-R = 718 bp
s Rs-1-F/Rs-3-R = 716 bp
4.2. Reakcijska smjesa za PCR
|
(a) |
Specifični PCR za biovar 1/2
|
|
(b) |
Specifični PCR za biovar 3/4/5
|
4.3. Uvjeti za reakciju PCR
Provedite sljedeći program za specifične reakcije za biovar 1/2 i biovar 3/4/5:
|
1 ciklus od: |
i. |
5 minuta na 95 °C (denaturacija kalupa DNK) |
|
35 ciklusa od: |
ii. |
30 sekundi na 95 °C (denaturacija kalupa DNK) |
|
iii. |
30 sekundi na 58 °C (prianjanje početnica) |
|
|
iv. |
45 sekundi na 72 °C (produljenje kopije) |
|
|
1 ciklus od: |
v. |
5 minuta na 72 °C (konačno produljenje) |
|
vi. |
držati na 4 °C |
NB: Ovaj je program optimiziran za korištenje s uređajem za PCR (thermal cycler) MJ Research PTC 200. Za rad s drugim modelima uređaja možda će trebati prilagoditi trajanje ciklusa ii., iii. i iv.
4.4. Analiza produkta umnažanja pomoću restrikcijskog enzima
Produkti PCR-a umnoženi iz DNK bakterije R. solanacearum s početnicama Rs-1-F i Rs-1-R proizvode karakteristični polimorfizam duljine restrikcijskih fragmenata s enzimom Bsm I ili izoshizomerom (npr. Mva 1269 I) nakon inkubacije od 30 minuta na 65 °C. Produkti PCR-a umnoženi iz DNK bakterije R. solanacearum s početnicama Rs-1-F i Rs-3-R nemaju mjesta restrikcije.
5. Pripremanje pufera za nanošenje
5.1. Bromfenol plavilo (10 %-tna osnovna otopina)
|
Bromfenol plavilo |
5 g |
|
Destilirana voda (bidest) |
50 ml |
5.2. Pufer za nanošenje
|
Glicerol (86 %) |
3,5 ml |
|
Bromfenol plavilo (5,1) |
300 μl |
|
Destilirana voda (bidest) |
6,2 ml |
6. 10X tris-acetatni EDTA pufer (TAE), pH 8,0
|
Tris pufer |
48,40 g |
|
Ledena octena kiselina |
11,42 ml |
|
EDTA (dinatrijeva sol) |
3,72 g |
|
Destilirana voda |
1,00 l |
Prije uporabe razrijedite do 1X.
Dostupan je i na tržištu (npr. Invitrogen ili ekvivalentni).
Dodatak 7.
Validirani reagensi za test FISH
1. Oligo-sonde
Sonda OLI-1-CY3 specifična za R. solanacearum: 5′-ggc agg tag caa gct acc ccc-3′
Nespecifična eubakterijska sonda EUB-338-FITC: 5′- gct gcc tcc cgt agg agt -3′
2. Otopina za fiksiranje
(UPOZORENJE! OTOPINA ZA FIKSIRANJE SADRŽI PARAFORMALDEHID KOJI JE TOKSIČAN. NOSITE RUKAVICE I NE UDIŠITE GA. PREPORUČUJE SE RADITI U DIGESTORU.)
|
i. |
Zagrijte 9 ml vode za molekularnu biologiju (npr. ultra čiste vode (UPW)) na oko 60 °C i dodajte 0,4 g paraformaldehida. Paraformaldehid se otapa nakon što dodate 5 kapi 1N NaOH i promiješate magnetnom miješalicom. |
|
ii. |
Podesite pH na 7,0 dodajući 1 ml 0,1M fosfatnog pufera (PB; pH 7,0) i 5 kapi 1N HCl. Indikator papirom provjerite vrijednost pH i ako je potrebno podesite je pomoću HCl ili NaOH. (UPOZORENJE! U OTOPINAMA S PARAFORMALDEHIDOM NE UPOTREBLJAVAJTE PH-METAR.) |
|
iii. |
Procijedite otopinu kroz membranski filtar od 0,22 μm te je do daljnje uporabe pohranite na 4 °C i zaštitite od prašine. |
3. 3X Hybmix
|
NaCl |
2,7 M |
|
Tris-HCl |
60 mM (pH 7,4) |
|
EDTA (sterilizirana filtriranjem i u autoklavu) |
15 mM |
Po potrebi razrijedite do 1X.
4. Otopina za hibridizaciju
|
1 X Hybmix |
|
|
Natrijev dodecil sulfat (SDS) |
0,01 % |
|
Formamid |
30 % |
|
Sonda EUB 338 |
5 ng/μl |
|
Sonda OLI-1 ili OLI-2 |
5 ng/μl |
Pripremite količine otopine za hibridizaciju prema izračunima u Tablici 1. Za svako stakalce (s 2 različita uzorka u duplikatu) treba 90 μl otopine za hibridizaciju. VAŽNO: FORMAMID JE VEOMA TOKSIČAN I ZATO NOSITE RUKAVICE I PODUZMITE POTREBNE MJERE OPREZA!
Tablica 1. Predložene količine za pripremanje smjese za hibridizaciju
|
Broj stakalaca |
1 |
4 |
6 |
8 |
10 |
|
Sterilna ultra čista voda |
23,1 |
92,4 |
138,6 |
184,8 |
231,0 |
|
3x hybmix |
30,0 |
120,0 |
180,0 |
240,0 |
300,0 |
|
1 % SDS |
0,9 |
3,6 |
5,4 |
7,2 |
9,0 |
|
Formamid |
27,0 |
108,0 |
162,0 |
216,0 |
270,0 |
|
Sonda EUB 338 (100 ng/μl) |
4,5 |
18,0 |
27,0 |
36,0 |
45,0 |
|
Sonda OLI-1 ili OLI-2 (100 ng/μl) |
4,5 |
18,0 |
27,0 |
36,0 |
45,0 |
|
Ukupni volumen (μl) |
90,0 |
360,0 |
540,0 |
720,0 |
900,0 |
|
NB: Sve otopine koje sadrže oligo-sonde osjetljive na svjetlost pohranite u tami na – 20 °C. Zaštitite ih od izravne sunčeve svjetlosti ili električnog svjetla tijekom uporabe. |
|||||
5. 0,1M fosfatni pufer, pH 7,0
|
Na2HPO4 |
8,52 g |
|
KH2PO4 |
5,44 g |
|
Destilirana voda |
1,00 l |
Rastopite sastojke, provjerite pH i sterilizirajte u autoklavu na 121 °C 15 minuta.
Dodatak 8.
Uzgoj patlidžana i rajčice
Sjeme rajčice (Lycopersicon esculentum) i patlidžana (Solanum melongena) posijte u pasterizirani kompost za sjeme. Sadnice presadite u pasterizirani kompost za lončanice nakon što se kotiledoni u cijelosti razviju (10 do 14 dana).
Prije inokulacije, rajčice i patlidžane treba uzgajati u stakleniku pod sljedećim okolišnim uvjetima:
|
Duljina dana |
14 sati ili prirodna duljina dana ako je veća |
|
Temperatura |
dnevna: 21 do 24 °C noćna: 14 do 18 °C |
|
Osjetljiva vrsta rajčice |
‚Moneymaker’ |
|
Osjetljiva vrsta patlidžana |
‚Black Beauty’ |
|
Dobavljači |
vidjeti internetsku stranicu http://forum.europa.eu.int/Public/irc/sanco/Home/main |
POPIS LITERATURE
|
1. |
Amann, R.I., L. Krumholz and D.A. Stahl. 1990. Fluorescent-oligonucleotide probing of whole cells for determinative, phylogenetic and environmental studies in microbiology. J. Bacteriol. 172: 762-770. |
|
2. |
Anon. 1998. Council Directive 98/57/EC of 20 July 1998 on the control of Ralstonia solanacearum (Smith) Yabuuchi et al. Official Journal of the European Communities L235, 1-39. |
|
3. |
Boudazin, G., A.C. Le Roux, K. Josi, P. Labarre and B. Jouan. 1999. Design of division specific primers of Ralstonia solanacearum and application to the identification of European isolates. European Journal of Plant Pathology 105; 373-380. |
|
4. |
Caruso, P., Gorris, M.T., Cambra, M., Palomo, J.L., Collar, J and Lopez, M.M. 2002. Enrichment Double-Antibody Sandwich Indirect Enzyme-Linked Immunosorbent Assay That Uses a Specific Monoclonal Antibody for sensitive Detection of Ralstonia solanacearum in Asymptomatic Potato Tubers. Applied and Environmental Microbiology, 68, 3634-3638. |
|
5. |
Cook, D., Barlow, E. and Sequeira, L. 1989. Genetic diversity of Pseudomonas solanacearum: detection of restriction fragment length polymorphisms with DNA probes that specify virulence and the hypersensitive response. Molecular Plant-Microbe Interactions 1:113-121. |
|
6. |
Elphinstone, J.G., Hennessy, J., Wilson, J.K. and Stead, D.E. 1996. Sensitivity of detection of Ralstonia solanacearum in potato tuber extracts. EPPO Bulletin 26; 663-678. |
|
7. |
Englebrecht, M.C. (1994) Modification of a semi-selective medium for the isolation and quantification of Pseudomonas solanacearum. In: A.C. Hayward (ed.) Bacterial Wilt Newsletter 10, 3-5. Australian Centre for International Agricultural Research, Canberra, Australia. |
|
8. |
Hayward, A.C. 1964. Characteristics of Pseudomonas solanacearum. Journal of Applied Bacteriology 27; 265-277. |
|
9. |
Hayward, A.C., El-Nashaar, H.M., Nydegger, U. and De Lindo, L. 1990. Variation in nitrate metabolism in biovars of Pseudomonas solanacearum. Journal of Applied Bacteriology 69; 269-280. |
|
10. |
Ito, S., Y. Ushijima, T. Fujii, S. Tanaka, M. Kameya-Iwaki, S. Yoshiwara and F. Kishi. 1998. Detection of viable cells of Ralstonia solanacearum in soil using a semi-selective medium and a PCR technique. J. Phytopathology 146; 379-384. |
|
11. |
Janse, J.D. (1988) A detection method for Pseudomonas solanacearum in symptomless potato tubers and some data on its sensitivity and specificity. Bulletin OEPP/EPPO Bulletin 18, 343-351. |
|
12. |
Janse, J.D. 1991. Infra- and intra-specific classification of Pseudomonas solanacaerum strains using whole cell fatty-acid analysis. Systematic and Applied Microbiology 14; 335-345. |
|
13. |
Kelman, A. 1954. The relationship of pathogenicity of Pseudomonas solanacearum to colony appearance on a tetrazolium medium. Phytopathology 44; 693-695. |
|
14. |
Klement Z.; Rudolph, K and D.C. Sands, 1990. Methods in Phytobacteriology. Akadémiai Kiadó, Budapest, 568 pp. |
|
15. |
Lelliott, R.A. and Stead, D.E. 1987. Methods for the diagnosis of bacterial diseases of plants. Blackwell scientific Publications Ltd., Oxford. 216 pp. |
|
16. |
Lopez, M.M., Gorris, M.T., Llop, P., Cubero, J., Vicedo, B., Cambra, M., 1997. Selective enrichment improves selective isolation, serological and molecular detection of plant pathogenic bacteria. In: H.W. Dehne et al., (eds). Klewer Academic Publishers. pp. 117-121. |
|
17. |
Louws, F.J., Fulbright, D.W., Stephens, C.T. and De Bruijn, F.J., 1994. Specific genomic fingerprints of phytopathogenic Xanthomonas and Pseudomonas pathovars and strains generated with repetitive sequences and PCR. Applied and Environmental Microbiology, 60, 2286-2295. |
|
18. |
Louws, F.J., Fulbright, D.W., Stephens, C.T. and De Bruijn, F.J. 1995. Differentiation of genomic structure by rep-PCR fingerprinting to rapidly classify Xanthomonas campestris pv. vesicatoria. Phytopathology 85; 528-536. |
|
19. |
Opina, N., F. Tavner, G. Holloway, J.-F Wang, T.-H Li, R. Maghirang, M. Fegan, A.C. Hayward, V. Krishnapillai, W.F. Hong, B.W. Holloway, J.N. Timmis. 1997. A novel method for development of species and strain-specific DNA probes and PCR primers for identifying Burkholderia solanacearum (formerly Pseudomonas solanacearum). As Pac. J. Mol. Biol. Biotechnol. 5; 19-33. |
|
20. |
Pastrik, K.H. and Maiss, E. 2000. Detection of R. solanacearum in potato tubers by polymerase chain reaction. J. Phytopathology 148; 619-626. |
|
21. |
Pastrik, K.H., Elphinstone, J.G. and Pukall, R. 2002. Sequence analysis and detection of Ralstonia solanacearum by multiplex PCR amplification of 16S-23S ribosomal intergenic spacer region with internal positive control. European Journal of Plant Pathology 108, 831-842. |
|
22. |
Robinson-Smith, A., Jones, P., Elphinstone, J.G. and Forde, S.M.D. (1995) Production of antibodies to Pseudomonas solanacearum, the causative agent of bacterial wilt. Food and Agricultural Immunology 7, 67-79. |
|
23. |
Schaad, W. 2001. Laboratory guide for identification of plant pathogenic bacteria. Schaad [Hrsg.]. - 3. ed.; St. Paul, Minnesota: 373 pp. |
|
24. |
Seal, S.E., L.A. Jackson, J.P.W. Young, and M.J. Daniels. 1993. Detection of Pseudomonas solanacearum, Pseudomonas syzygii, Pseudomonas pickettii and Blood Disease Bacterium by partial 16S rRNA sequencing: construction of oligonucleotide primers for sensitive detection by polymerase chain reaction. J. Gen. Microbiol. 139: 1587-1594. |
|
25. |
Smith, J.J., Offord, L.C., Holderness, M. and Saddler, G.S. 1995. Genetic diversity of Burkholderia solanacearum (synonym Pseudomonas solanacearum) race 3 in Kenya. Applied and Environmental Microbiology 61; 4262-4268. |
|
26. |
Stead, D.E. 1992. Grouping of plant pathogenic and some other Pseudomonas spp. using cellular fatty-acid profiles. International Journal of Systematic Bacteriology 42; 281-295. |
|
27. |
Taghavi, M., Hayward, A.C., Sly, L.I., Fegan, M. 1996. Analysis of the phylogenetic relationships of strains of Burkholderia solanacearum, Pseudomonas syzygii, and the blood disease bacterium of banana based on 16S rRNA gene sequences. International Journal of Systematic Bacteriology 46; 10-15. |
|
28. |
Van Der Wolf, J.M., Bonants, P.J.M., Smith, J.J., Hagenaar, M., Nijhuis, E., Van Beckhoven, J.R.C., Saddler, G.S., Trigalet, A., Feuillade, R. 1998. Genetic diversity of Ralstonia solanacearum Race 3 in Western Europe as determined by AFLP, RC-PFGE and rep-PCR. In: Prior, P., Allen, C. and Elphinstone, J. (eds.) Bacterial wilt disease: Molecular and Ecological Aspects. Springer (Berlin) pp. 44-49. |
|
29. |
Weller, S.A., Elphinstone, J.G., Smith, N., Stead, D.E. and Boonham, N. 1999. Detection of Ralstonia solanacearum strains using an automated and quantitative flourogenic 5’ nuclease TaqMan assay. Applied and Environmental Microbiology 66; 2853-2858. |
|
30. |
Wullings, B.A., A.R. van Beuningen, J.D. Janse and A.D.L. Akkermans. 1998. Detection of R. solanacearum, which causes brown rot of potato, by fluorescent in situ hybridization with 23s rRNA-targeted probes. Appl. Environ. Microbiol. 64: 4546-4554. |
PRILOG III.
|
1. |
Kod svake sumnje na pojavu, za koju se testom ili testovima probira dobije pozitivan rezultat u skladu s odgovarajućim metodama koje su u Prilogu II. utvrđene za navedeni biljni materijal i za sve druge slučajeve, treba, dok se taj rezultat ne potvrdi ili opovrgne navedenim metodama, zadržati i primjereno čuvati do okončanja tih metoda:
Čuvanje gomolja omogućit će da se, prema potrebi, obavi ispitivanje sorte. |
|
2. |
Ako se potvrdi prisutnost organizma, treba zadržati i primjereno čuvati najmanje još mjesec dana nakon postupka obavješćivanja predviđenog člankom 5. stavkom 2.:
|
PRILOG IV.
Istraživanje iz članka 5. stavka 1. točke (a) podtočke i. obuhvaća, prema potrebi, sljedeće elemente:
|
i. |
mjesta proizvodnje
i |
|
ii. |
površinske vode koje se koriste za navodnjavanje ili prskanje ili su poplavile jedno ili više polja ili mjesta proizvodnje za koje je potvrđeno da su zaraženi organizmom. |
PRILOG V.
|
1. |
Pri određivanju opsega vjerojatne zaraze u skladu s člankom 5. stavkom 1. točkom (a) podtočkom iii. i člankom 5. stavkom 1. točkom (c) podtočkom iii., treba uzeti u obzir i sljedeće elemente:
|
|
2. |
Pri određivanju mogućeg širenja o kojemu se govori u članku 5. stavku 1. točki (a) podtočki iv. i članku 5. stavku 1. točki (c) podtočki iii., treba uzeti u obzir sljedeće elemente:
|
|
3. |
Obavijest iz članka 5. stavka 2. prvog podstavka dostavlja se kako slijedi:
Komisija mora odmah biti obaviještena o slanju ovih podataka. |
|
4. |
Dodatna obavijest iz članka 5. stavka 2. drugog podstavka sadrži sljedeće: nakon završetka svih istraživanja, za svaki pojedini slučaj:
|
PRILOG VI.
|
1. |
Mjere iz članka 6. stavka 1. obuhvaćaju:
Sav preostali otpad koji je povezan s gore navedenim mjerama ili je nastao kao rezultat tih mjera mora biti zbrinut službeno odobrenim metodama u skladu s Prilogom VII. Direktivi. |
|
2. |
Odgovarajuća uporaba ili zbrinjavanje navedenog biljnog materijala iz članka 6. stavka 2. odvija se na dolje opisani način pod nadzorom odgovornih službenih tijela države članice ili država članica, pri čemu ta tijela moraju razmjenjivati informacije kako bi se osigurao stalni nadzor, a odgovorno službeno tijelo države članice u kojoj bi se krumpir trebao pakirati ili prerađivati mora odobriti objekte za zbrinjavanje otpada iz prve i druge alineje:
|
|
3. |
U prikladne načine dekontaminacije predmeta iz članka 6. stavka 3. spadaju čišćenje i, prema potrebi, dezinficiranje, kojima se otklanja svaka prepoznatljiva opasnost od širenja organizma i koji se moraju obavljati pod nadzorom odgovornih službenih tijela država članica. |
|
4 |
U sigurnosnoj zoni čije su granice utvrđene u skladu s člankom 5. stavkom 1. točkom (a) podtočkom iv. i točkom (c) podtočkom iii. i o kojoj se govori u članku 6. stavku 4. države članice moraju provoditi sljedeće mjere: |
|
4.1. |
U slučajevima kada su mjesta proizvodnje označena kao zaražena u skladu s člankom 5. stavkom 1. točkom (a) podtočkom ii.:
|
|
4.2. |
ne dovodeći u pitanje mjere navedene pod 4.1., u sigurnosnom području države članice moraju:
|
PRILOG VII.
Službeno odobrene metode zbrinjavanja otpada o kojima se govori u Prilogu VI. stavku 1. moraju biti u skladu sa sljedećim odredbama tako da se otkloni svaka prepoznatljiva opasnost od širenja organizma:
|
i. |
otpaci krumpira i rajčice (uključujući odbačeni krumpir, koru i rajčicu) i svi drugi kruti otpaci koji su u vezi s krumpirom i rajčicom (uključujući tlo, kamenje i druge ostatke), moraju se:
|
|
ii. |
tekući otpad: tekući otpad koji sadrži raspršene krute čestice mora se prije zbrinjavanja filtrirati ili obraditi postupkom taloženja radi uklanjanja krutih čestica. Krute čestice se nakon toga uklanjaju na način naveden u podstavku i. Tekući se otpad potom:
|
Različiti postupci opisani u ovom Prilogu primjenjuju se i na otpad koji nastaje tijekom rukovanja, zbrinjavanja i prerade zaraženih partija.
(1) Vidjeti Lelliott i Stead (1987)
(2) Znanstvenici za kontakt: vidjeti internetsku stranicu http://forum.europa.eu.int/Public/irc/sanco/Home/main
(3) Upotrebljavati kao standardni referentni soj bakterije R. solanacearum biovar 2 (rasa 3).
(4) Soj koji u serološkim testovima (IF i/ili ELISA) može unakrsno reagirati s poliklonskim antiserumima.
(5) Soj od kojega se u nekim laboratorijima može umnožiti produkt PCR veličine slične veličini koja se očekuje pri uporabi posebnih početnica OLI-1 i Y-2 (vidjeti Dodatak 6.).
(6) U većini testova mogao bi unakrsno reagirati, ali je poznato da se javlja samo na bananama u Indoneziji.
(7) Upotrebljavati s metodom ekstrakcije pomoću homogeniziranja
(8) Metoda je bila validirana Taq polimerazom Perkin Elmer (AmpliTaq) i Gibco BRL
(9) Metoda je bila validirana Taq polimerazom Perkin Elmer (AmpliTaq) i Gibco BRL
NB: Prvotno optimizirano za uređaj (thermo cycler) MJ Research PTC 200 s Gibco Taq polimerazom.
Pri istim koncentracijama može se koristiti i Perkin Elmer AmpliTaq i pufer
(10) Metoda je bila validirana Taq polimerazom Perkin Elmer (AmpliTaq) i Gibco BRL
(11) Koncentracije početnica NS-5-F i NS-6-R bile su optimizirane za ekstrakciju jezgra stolona metodom homogenizacije i pročišćavanjem DNK prema Pastriku (2000) (vidjeti odjeljak VI.A.6.1.a). Ako se ekstrakcija obavlja tresenjem ili ako se primjenjuju druge metode izdvajanja DNK, trebat će ponovno optimizirati koncentracije reagensa.
(12) Metode su validirane Taq polimerazom Perkin Elmer (AmpliTaq) i Gibco BRL
(13) Metode su validirane Taq polimerazom Perkin Elmer (AmpliTaq) i Gibco BRL



