ISSN 1977-0693
Journal officiel
de l'Union européenne
L 126

Édition de langue française
Législation
59e année
14 mai 2016
|
ISSN 1977-0693 |
||
|
Journal officiel de l'Union européenne |
L 126 |
|

|
||
|
Édition de langue française |
Législation |
59e année |
|
|
|
|
|
(1) Texte présentant de l'intérêt pour l'EEE |
|
FR |
Les actes dont les titres sont imprimés en caractères maigres sont des actes de gestion courante pris dans le cadre de la politique agricole et ayant généralement une durée de validité limitée. Les actes dont les titres sont imprimés en caractères gras et précédés d'un astérisque sont tous les autres actes. |
II Actes non législatifs
RÈGLEMENTS
|
14.5.2016 |
FR |
Journal officiel de l'Union européenne |
L 126/1 |
RÈGLEMENT DÉLÉGUÉ (UE) 2016/757 DE LA COMMISSION
du 3 février 2016
déterminant les opérations en rapport avec l'application de la réglementation agricole pour lesquelles des informations doivent être introduites dans le système d'information douanier
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l'Union européenne,
vu le règlement (CE) no 515/97 du Conseil du 13 mars 1997 relatif à l'assistance mutuelle entre les autorités administratives des États membres et à la collaboration entre celles-ci et la Commission en vue d'assurer la bonne application des réglementations douanière et agricole (1), et notamment son article 23, paragraphe 4,
considérant ce qui suit:
|
(1) |
L'objectif du système d'information douanier («SID») est d'aider les autorités compétentes à prévenir, à rechercher et à poursuivre les opérations qui sont contraires aux réglementations douanière et agricole. Afin que le SID continue à répondre aux besoins des autorités compétentes, il est nécessaire de mettre à jour la liste des opérations en rapport avec l'application de la législation agricole qui devraient figurer dans le SID. |
|
(2) |
L'introduction dans le SID de données en rapport avec des opérations liées à l'application de la législation agricole devrait être limitée aux produits relevant des chapitres 1 à 24 de la nomenclature combinée. |
|
(3) |
Afin de garantir que les autorités compétentes sont en mesure de réagir rapidement à des situations d'urgence sanitaire, le suivi et la traçabilité des mouvements de produits soumis à la réglementation agricole sont de la plus haute importance. Afin d'assurer le suivi et la traçabilité à tous les stades du mouvement, il convient que des informations soient fournies en ce qui concerne l'importation, l'exportation, le transit, le stockage temporaire et les mouvements intra-UE de ces marchandises. |
A ADOPTÉ LE PRÉSENT RÈGLEMENT:
Article premier
Les opérations en rapport avec l'application de la réglementation agricole pour lesquelles, conformément à l'article 23, paragraphe 4, du règlement (CE) no 515/97, des informations doivent être introduites dans le SID sont celles concernant:
|
a) |
les importations en provenance de pays tiers de produits soumis aux dispositions arrêtées dans le cadre de la politique agricole commune et des réglementations spécifiques prises à l'égard des marchandises résultant de la transformation de produits agricoles; |
|
b) |
les exportations vers des pays tiers de produits soumis aux dispositions arrêtées dans le cadre de la politique agricole commune et des réglementations spécifiques prises à l'égard des marchandises résultant de la transformation de produits agricoles; |
|
c) |
les mouvements de produits soumis aux dispositions arrêtées dans le cadre de la politique agricole commune et des réglementations spécifiques prises à l'égard des marchandises résultant de la transformation de produits agricoles, sous le couvert d'une procédure de transit commun ou externe et d'opérations de stockage temporaire de ces produits dans l'Union lorsque ceux-ci sont réexportés de l'Union vers un pays tiers; |
|
d) |
les mouvements intra-UE de produits soumis à des restrictions ou à des interdictions fondées sur les dispositions arrêtées dans le cadre de la politique agricole commune et des réglementations spécifiques prises à l'égard des marchandises résultant de la transformation de produits agricoles ou qui bénéficient de l'assistance de l'Union européenne. |
Article 2
Le règlement (CE) no 696/98 de la Comission (2) est abrogé.
Article 3
Le présent règlement entre en vigueur le vingtième jour suivant celui de sa publication au Journal officiel de l'Union européenne.
Il s'applique à partir du 1er septembre 2016.
Le présent règlement est obligatoire dans tous ses éléments et directement applicable dans tout État membre.
Fait à Bruxelles, le 3 février 2016.
Par la Commission
Le président
Jean-Claude JUNCKER
(1) JO L 82 du 22.3.1997, p. 1.
(2) Règlement (CE) no 696/98 de la Commission du 27 mars 1998 portant application du règlement (CE) no 515/97 du Conseil relatif à l'assistance mutuelle entre les autorités administratives des États membres et à la collaboration entre celles-ci et la Commission en vue d'assurer la bonne application des réglementations douanière et agricole (JO L 96 du 28.3.1998, p. 22).
|
14.5.2016 |
FR |
Journal officiel de l'Union européenne |
L 126/3 |
RÈGLEMENT DÉLÉGUÉ (UE) 2016/758 DE LA COMMISSION
du 4 février 2016
modifiant le règlement (UE) no 1315/2013 du Parlement européen et du Conseil en ce qui concerne l'adaptation de son annexe III
(Texte présentant de l'intérêt pour l'EEE)
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l'Union européenne,
vu le règlement (UE) no 1315/2013 du Parlement européen et du Conseil du 11 décembre 2013 sur les orientations de l'Union pour le développement du réseau transeuropéen de transport et abrogeant la décision no 661/2010/UE (1), et en particulier son article 49, paragraphe 6,
considérant ce qui suit:
|
(1) |
Le règlement (UE) no 1315/2013 prévoit la possibilité d'adapter les cartes indicatives du réseau transeuropéen de transport (RTE-T) qui a été élargi à des pays voisins spécifiques sur la base d'accords à haut niveau concernant les réseaux d'infrastructures de transport conclus entre l'Union et les pays voisins concernés. |
|
(2) |
Un accord à haut niveau entre l'Union et des pays des Balkans occidentaux, à savoir l'Albanie, la Bosnie-Herzégovine, le Kosovo, l'ancienne République yougoslave de Macédoine, le Monténégro et la Serbie, a été approuvé le 27 août 2015 à Vienne lors du sommet du groupe des Six des Balkans occidentaux; il concerne l'adaptation de l'extension indicative des cartes du RTE-T global et l'identification des connexions du réseau central sur les cartes du réseau global. L'accord porte sur les lignes des réseaux ferroviaire et routier, ainsi que sur les ports et les aéroports. L'adaptation des cartes indicatives du réseau global et, en particulier, l'identification du réseau central indicatif devrait permettre à l'Union de mieux cibler sa coopération avec les pays des Balkans occidentaux, y compris pour ce qui est de son aide financière. |
|
(3) |
Un accord à haut niveau entre l'Union, l'Islande et la Norvège a été conclu le 30 octobre 2015 dans le cadre du comité mixte institué par l'accord sur l'Espace économique européen, concernant l'adaptation de l'extension indicative des cartes du RTE-T global dans ces pays. Cette adaptation concerne un nombre limité d'adaptations des cartes des réseaux routiers, portuaires et aéroportuaires visant à améliorer la concordance entre les réseaux RTE-T indicatifs et la méthodologie RTE-T (2). |
|
(4) |
Il convient dès lors de modifier en conséquence le règlement (UE) no 1315/2013, |
A ADOPTÉ LE PRÉSENT RÈGLEMENT:
Article premier
L'annexe III du règlement (UE) no 1315/2013 est modifiée conformément à l'annexe du présent règlement.
Article 2
Le présent règlement entre en vigueur le vingtième jour suivant celui de sa publication au Journal officiel de l'Union européenne.
Le présent règlement est obligatoire dans tous ses éléments et directement applicable dans tout État membre.
Fait à Bruxelles, le 4 février 2016.
Par la Commission
Le président
Jean-Claude JUNCKER
(1) JO L 348 du 20.12.2013, p. 1.
(2) SDW(2013) 542 final.
ANNEXE
L'annexe III du règlement (UE) no1315/2013 est modifiée comme suit:
|
1) |
le point 11.1 est remplacé par ce qui suit: «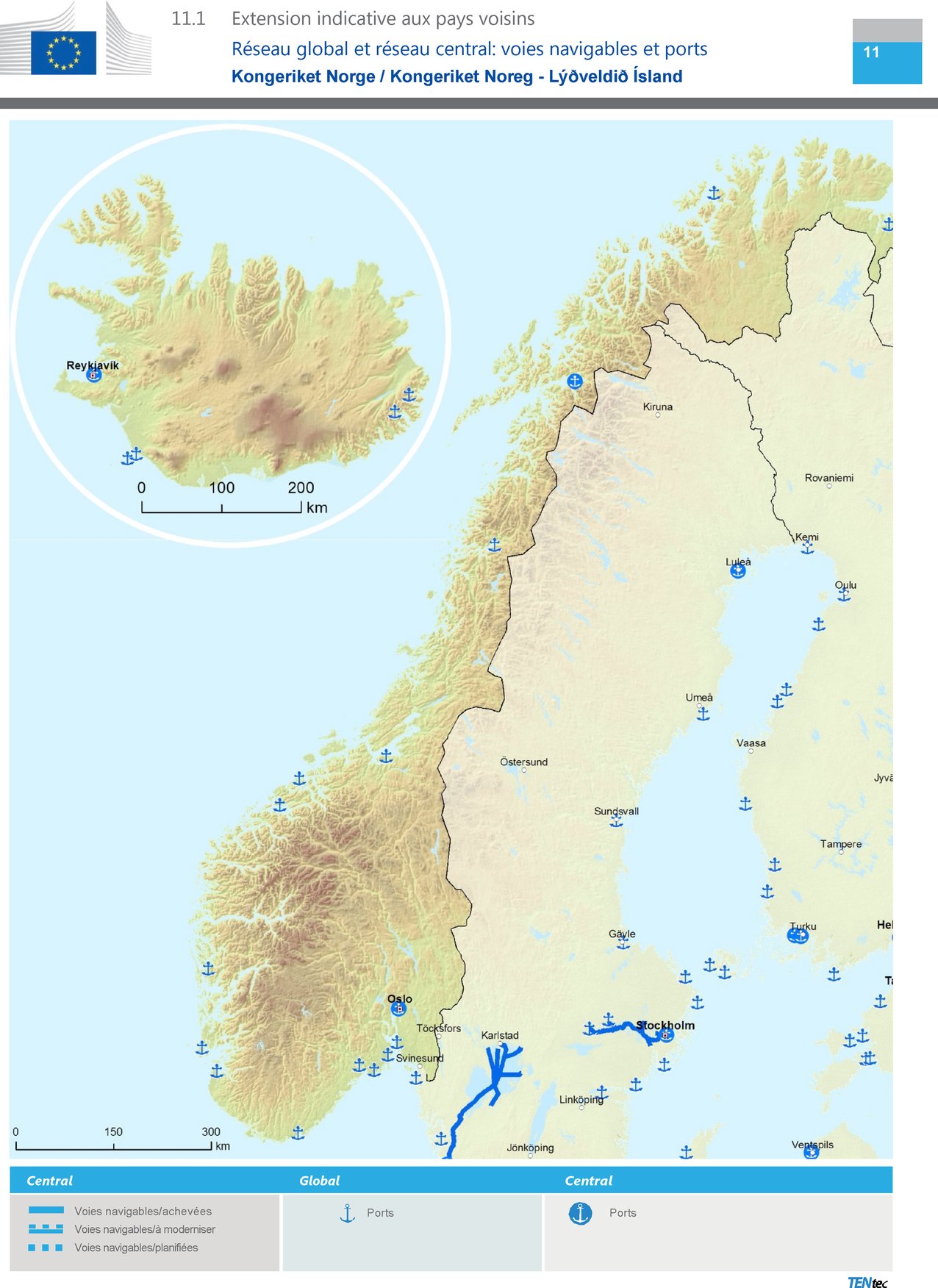 » » |
|
2) |
le point 11.2 est remplacé par ce qui suit: « » » |
|
3) |
le point 11.3 est remplacé par ce qui suit: « » » |
|
4) |
le point 11.4 est remplacé par ce qui suit: « » » |
|
5) |
le point 13.1 est remplacé par ce qui suit: « » » |
|
6) |
le point 13.2 est remplacé par ce qui suit: « » » |
|
7) |
le point 13.3 est remplacé par ce qui suit: « » » |
|
8) |
le point 13.4 est remplacé par ce qui suit: « » » |
|
14.5.2016 |
FR |
Journal officiel de l'Union européenne |
L 126/13 |
RÈGLEMENT D'EXÉCUTION (UE) 2016/759 DE LA COMMISSION
du 28 avril 2016
établissant les listes des pays tiers, parties de pays tiers et territoires en provenance desquels les États membres doivent autoriser l'introduction dans l'Union de certains produits d'origine animale destinés à la consommation humaine, fixant les exigences en matière de certification, modifiant le règlement (CE) no 2074/2005 et abrogeant la décision 2003/812/CE
(Texte présentant de l'intérêt pour l'EEE)
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l'Union européenne,
vu la directive 2002/99/CE du Conseil du 16 décembre 2002 fixant les règles de police sanitaire régissant la production, la transformation, la distribution et l'introduction des produits d'origine animale destinés à la consommation humaine (1), et notamment son article 8, paragraphe 1, et son article 9, paragraphe 4,
vu le règlement (CE) no 854/2004 du Parlement européen et du Conseil du 29 avril 2004 fixant les règles spécifiques d'organisation des contrôles officiels concernant les produits d'origine animale destinés à la consommation humaine (2), et notamment son article 11, paragraphe 1,
considérant ce qui suit:
|
(1) |
En vertu du règlement (CE) no 854/2004, les produits d'origine animale sont importés exclusivement d'un pays tiers ou d'une partie d'un pays tiers figurant sur une liste établie conformément audit règlement. |
|
(2) |
La décision 2003/812/CE de la Commission (3) établit des listes de pays tiers en provenance desquels les États membres doivent autoriser les importations de certains produits destinés à la consommation humaine visés par la directive 92/118/CEE du Conseil (4). Parmi ces listes figure une liste des pays tiers ou des parties de pays tiers en provenance desquels les importations de gélatine destinée à la consommation humaine sont autorisées. Aucune liste n'est toutefois prévue en ce qui concerne le collagène, ou les matières premières servant à la production de gélatine et de collagène, destiné à la consommation humaine. Il convient d'établir de telles listes. |
|
(3) |
Conformément au règlement (CE) no 853/2004 du Parlement européen et du Conseil (5), les exploitants du secteur alimentaire qui importent des produits d'origine animale doivent veiller à ce que les documents accompagnant le lot satisfassent aux exigences de l'article 14 du règlement (CE) no 854/2004. Le règlement (CE) no 2074/2005 de la Commission (6) établit des modèles de certificats pour l'importation de certains produits d'origine animale destinés à la consommation humaine. Ces modèles de certificats comportent des références obsolètes à des instruments législatifs précédents, qui doivent être mises à jour. |
|
(4) |
Les pays tiers, parties de pays tiers et territoires figurant sur les listes de l'annexe II de la décision 2006/766/CE de la Commission (7), de l'annexe I, partie 1, du règlement (CE) no 798/2008 de la Commission (8), de l'annexe I, partie 1, du règlement (CE) no 119/2009 de la Commission (9) ou de l'annexe II, partie 1, du règlement (UE) no 206/2010 de la Commission (10) satisfont aux exigences de l'Union en ce qui concerne les importations de viandes fraîches et de certains produits de la pêche. Ces listes pourraient aussi être utilisées pour les importations de matières premières destinées à la production de gélatine et de collagène. Il y a lieu toutefois d'appliquer des exigences moins strictes lorsque ces matières premières ont subi certains traitements, tels qu'ils sont prévus à l'annexe III, sections XIV et XV, du règlement (CE) no 853/2004. |
|
(5) |
Les matières premières devant servir à la fabrication de gélatine et de collagène, traitées ou non, introduites dans l'Union en vue de leur transit vers un pays tiers, présentent un risque négligeable pour la santé publique. Ces matières premières, même traitées, doivent néanmoins satisfaire aux conditions de police sanitaire applicables. En conséquence, il y a lieu d'établir une liste des pays tiers, parties de pays tiers et territoires et des modèles de certificats pour le transit, et le stockage avant transit, de matières premières et matières premières traitées destinées à la production de gélatine et de collagène. |
|
(6) |
En raison de la situation géographique de Kaliningrad, des conditions spécifiques de police sanitaire doivent être arrêtées pour le transit par l'Union de lots de matières premières et de matières premières traitées destinées à la production de gélatine ou de collagène à destination et en provenance de la Russie, ces conditions étant applicables uniquement au transit par la Lettonie, la Lituanie et la Pologne. |
|
(7) |
Dans un souci de clarté et de simplification de la législation de l'Union, et sans préjudice de la décision 2003/863/CE de la Commission (11), les listes des pays tiers, parties de pays tiers et territoires en provenance desquels les États membres doivent autoriser l'introduction de cuisses de grenouille, d'escargots, de gélatine, de collagène, de matières premières et de matières premières traitées destinées à la production de gélatine et de collagène, ainsi que de miel, de gelée royale et d'autres produits de l'apiculture destinés à la consommation humaine, et les modèles de certificats pour ces produits devraient être établis dans une annexe au présent règlement. Par conséquent, les certificats existants correspondants devraient être supprimés de l'annexe VI du règlement (CE) no 2074/2005. |
|
(8) |
Afin de garantir l'innocuité de certains produits d'origine animale hautement raffinés, des exigences spécifiques ont été insérées à l'annexe III du règlement (CE) no 853/2004. Il convient dès lors de dresser la liste des pays en provenance desquels ces produits peuvent être importés et d'établir un modèle de certificat pour ces produits. |
|
(9) |
Étant donné que les listes des pays tiers, parties de pays tiers et territoires en provenance desquels les États membres doivent autoriser les importations de produits à base de viande de gibier à poils d'élevage et de produits à base de viande de gibier à plumes d'élevage ainsi que de viandes de léporidés (lapins et lièvres) et de produits à base de ces viandes ont été établies respectivement par la décision 2007/777/CE de la Commission (12) et le règlement (CE) no 119/2009, la décision 2003/812/CE, devenue redondante, devrait être abrogée. |
|
(10) |
Il convient de prévoir une période transitoire afin de permettre aux États membres et aux exploitants du secteur alimentaire de s'adapter aux nouvelles exigences fixées par le présent règlement. |
|
(11) |
Les mesures prévues au présent règlement sont conformes à l'avis du comité permanent des végétaux, des animaux, des denrées alimentaires et des aliments pour animaux, |
A ADOPTÉ LE PRÉSENT RÈGLEMENT:
CHAPITRE 1
IMPORTATIONS DE CERTAINS PRODUITS D'ORIGINE ANIMALE
Article premier
Listes de pays tiers, de parties de pays tiers et de territoires
Les pays tiers, parties de pays tiers et territoires en provenance desquels les États membres doivent autoriser l'importation des produits d'origine animale destinés à la consommation humaine ci-après figurent dans les parties de l'annexe I s'y rapportant:
|
a) |
les cuisses de grenouille: la partie I; |
|
b) |
les escargots: la partie II; |
|
c) |
la gélatine et le collagène: la partie III; |
|
d) |
les matières premières destinées à la production de gélatine et de collagène: la partie IV; |
|
e) |
les matières premières traitées destinées à la production de gélatine et de collagène: la partie V; |
|
f) |
le miel, la gelée royale et les autres produits de l'apiculture: la partie VI; |
|
g) |
les produits hautement raffinés suivants: la partie VII:
|
Article 2
Modèles de certificats
1. Les modèles de certificats pour les importations dans l'Union des produits visés à l'article 1er sont établis à l'annexe II comme suit:
|
a) |
les cuisses de grenouille: la partie I; |
|
b) |
les escargots: la partie II; |
|
c) |
la gélatine: la partie III; |
|
d) |
le collagène: la partie IV; |
|
e) |
les matières premières destinées à la production de gélatine et de collagène: la partie V; |
|
f) |
les matières premières traitées destinées à la production de gélatine et de collagène: la partie VI; |
|
g) |
le miel, la gelée royale et les autres produits de l'apiculture: la partie VII; |
|
h) |
les produits hautement raffinés suivants: la partie VIII:
|
Ces certificats doivent être remplis conformément aux notes explicatives figurant à l'annexe IV et aux notes figurant dans le certificat concerné.
2. Le recours à la certification électronique et à d'autres systèmes convenus entre l'Union et le pays tiers concerné est autorisé.
CHAPITRE 2
TRANSIT DE CERTAINS PRODUITS D'ORIGINE ANIMALE
Article 3
Listes de pays tiers, de parties de pays tiers et de territoires
Les pays tiers, parties de pays tiers et territoires en provenance desquels les États membres doivent autoriser le transit par l'Union de matières premières et de matières premières traitées devant servir à la production de gélatine et de collagène destinés à la consommation humaine et acheminées dans un pays tiers après un transit immédiat par l'Union ou après un stockage dans celle-ci conformément à l'article 12, paragraphe 4, et à l'article 13 de la directive 97/78/CE du Conseil (14) figurent respectivement dans les parties IV et V de l'annexe I du présent règlement.
Article 4
Modèle de certificat
1. Le modèle de certificat pour le transit par l'Union des matières premières et matières premières traitées visées à l'article 3 est établi à l'annexe III.
Ce certificat doit être rempli conformément aux notes figurant à l'annexe IV et aux notes figurant dans le modèle de certificat concerné.
2. Le recours à la certification électronique et à d'autres systèmes harmonisés à l'échelle de l'Union est autorisé.
Article 5
Dérogation relative au transit par la Lettonie, la Lituanie et la Pologne
1. Par dérogation à l'article 3, le transit routier ou ferroviaire de lots de matières premières ou de matières premières traitées visées à l'article 3 du présent règlement en provenance et à destination de la Russie, directement ou via un autre pays tiers, est autorisé entre les postes d'inspection frontaliers spécifiques désignés de Lettonie, de Lituanie et de Pologne dont la mention, assortie d'une remarque particulière «13», figure à l'annexe I de la décision 2009/821/CE de la Commission (15), si les conditions suivantes sont remplies:
|
a) |
le lot est scellé par le vétérinaire officiel au poste d'inspection frontalier d'entrée au moyen d'un sceau portant un numéro d'ordre; |
|
b) |
les documents accompagnant le lot conformément à l'article 7 de la directive 97/78/CE portent, sur chaque page, la mention «Uniquement pour le transit par l'Union européenne à destination de la Russie», apposée au moyen d'un cachet par le vétérinaire officiel au poste d'inspection frontalier d'entrée; |
|
c) |
les exigences procédurales prévues à l'article 11 de la directive 97/78/CE sont respectées; |
|
d) |
le lot est certifié acceptable pour le transit dans le document vétérinaire commun d'entrée délivré par le vétérinaire officiel au poste d'inspection frontalier d'entrée. |
2. Les lots visés au paragraphe 1 ne sont ni déchargés ni entreposés, au sens de l'article 12, paragraphe 4, ou de l'article 13 de la directive 97/78/CE, dans l'Union.
3. L'autorité compétente effectue des contrôles à intervalles réguliers afin de vérifier que le nombre des lots visés au paragraphe 1 et les quantités correspondantes de produits quittant l'Union égalent le nombre et les quantités qui y ont été introduits.
CHAPITRE 3
DISPOSITIONS FINALES
Article 6
Modification
L'annexe VI du règlement (CE) no 2074/2005 est modifiée comme suit:
|
1) |
à la section I, les chapitres I, II, III et VI sont supprimés; |
|
2) |
les appendices I, II, III et VI sont supprimés. |
Article 7
Abrogation
La décision 2003/812/CE est abrogée.
Article 8
Dispositions transitoires
Les lots de produits d'origine animale pour lesquels des certificats conformes aux modèles applicables ont été délivrés conformément aux dispositions du règlement (CE) no 2074/2005 peuvent continuer d'être introduits dans l'Union à condition que le certificat concerné ait été signé avant le 3 décembre 2016.
Article 9
Entrée en vigueur
Le présent règlement entre en vigueur le vingtième jour suivant celui de sa publication au Journal officiel de l'Union européenne.
Le présent règlement est obligatoire dans tous ses éléments et directement applicable dans tout État membre.
Fait à Bruxelles, le 28 avril 2016.
Par la Commission
Le président
Jean-Claude JUNCKER
(1) JO L 18 du 23.1.2003, p. 11.
(2) JO L 139 du 30.4.2004, p. 206.
(3) Décision 2003/812/CE de la Commission du 17 novembre 2003 établissant des listes de pays tiers en provenance desquels les États membres doivent autoriser l'importation de certains produits destinés à la consommation humaine visés par la directive 92/118/CEE du Conseil (JO L 305 du 22.11.2003, p. 17).
(4) Directive 92/118/CEE du Conseil du 17 décembre 1992 définissant les conditions de police sanitaire ainsi que les conditions sanitaires régissant les échanges et les importations dans la Communauté de produits non soumis, en ce qui concerne lesdites conditions, aux réglementations communautaires spécifiques visées à l'annexe A, chapitre I, de la directive 89/662/CEE et, en ce qui concerne les pathogènes, de la directive 90/425/CEE (JO L 62 du 15.3.1993, p. 49).
(5) Règlement (CE) no 853/2004 du Parlement européen et du Conseil du 29 avril 2004 fixant des règles spécifiques d'hygiène applicables aux denrées alimentaires d'origine animale (JO L 139 du 30.4.2004, p. 55).
(6) Règlement (CE) no 2074/2005 de la Commission du 5 décembre 2005 établissant les mesures d'application relatives à certains produits régis par le règlement (CE) no 853/2004 du Parlement européen et du Conseil et à l'organisation des contrôles officiels prévus par les règlements (CE) no 854/2004 du Parlement européen et du Conseil et (CE) no 882/2004 du Parlement européen et du Conseil, portant dérogation au règlement (CE) no 852/2004 du Parlement européen et du Conseil et modifiant les règlements (CE) no 853/2004 et (CE) no 854/2004 (JO L 338 du 22.12.2005, p. 27).
(7) Décision 2006/766/CE de la Commission du 6 novembre 2006 établissant les listes des pays tiers et territoires en provenance desquels l'importation de mollusques bivalves, d'échinodermes, de tuniciers, de gastéropodes marins et de produits de la pêche est autorisée (JO L 320 du 18.11.2006, p. 53).
(8) Règlement (CE) no 798/2008 de la Commission du 8 août 2008 établissant une liste des pays tiers, territoires, zones ou compartiments en provenance desquels les volailles et les produits de volailles peuvent être importés dans la Communauté et transiter par celle-ci ainsi que les règles en matière de certification vétérinaire (JO L 226 du 23.8.2008, p. 1).
(9) Règlement (CE) no 119/2009 de la Commission du 9 février 2009 établissant une liste de pays tiers, ou de parties de pays tiers, pour l'importation dans la Communauté ou le transit par celle-ci de viandes de léporidés sauvages, de certains mammifères terrestres sauvages et de lapins d'élevage, ainsi que les exigences applicables à la certification vétérinaire (JO L 39 du 10.2.2009, p. 12).
(10) Règlement (UE) no 206/2010 de la Commission du 12 mars 2010 établissant des listes des pays tiers, territoires ou parties de pays tiers ou territoires en provenance desquels l'introduction dans l'Union européenne de certains animaux et viandes fraîches est autorisée, et définissant les exigences applicables en matière de certification vétérinaire (JO L 73 du 20.3.2010, p. 1).
(11) Décision 2003/863/CE de la Commission du 2 décembre 2003 relative aux certificats de salubrité pour l'importation des produits animaux en provenance des États-Unis d'Amérique (JO L 325 du 12.12.2003, p. 46).
(12) Décision 2007/777/CE de la Commission du 29 novembre 2007 établissant les conditions sanitaires et de police sanitaire ainsi que les modèles de certificats pour l'importation de certains produits à base de viande et d'estomacs, vessies et boyaux traités destinés à la consommation humaine en provenance de pays tiers et abrogeant la décision 2005/432/CE (JO L 312 du 30.11.2007, p. 49).
(13) Règlement (CE) no 1333/2008 du Parlement européen et du Conseil du 16 décembre 2008 sur les additifs alimentaires (JO L 354 du 31.12.2008, p. 16).
(14) Directive 97/78/CE du Conseil du 18 décembre 1997 fixant les principes relatifs à l'organisation des contrôles vétérinaires pour les produits en provenance des pays tiers introduits dans la Communauté (JO L 24 du 30.1.1998, p. 9).
(15) Décision 2009/821/CE de la Commission du 28 septembre 2009 établissant une liste de postes d'inspection frontaliers agréés, fixant certaines règles concernant les inspections réalisées par les experts vétérinaires de la Commission et définissant les unités vétérinaires du système TRACES (JO L 296 du 12.11.2009, p. 1).
ANNEXE I
Listes des pays tiers, parties de pays tiers et territoires visés à l'article 1er
PARTIE I
CUISSES DE GRENOUILLE
Les pays tiers et territoires mentionnés dans la colonne «Pays» de l'annexe II de la décision 2006/766/CE, à l'exception de ceux pour lesquels une restriction est mentionnée dans la colonne «Restrictions» de cette annexe, ainsi que les pays ou territoires suivants:
|
CODE ISO DU PAYS |
PAYS/TERRITOIRE |
|
MK (*1) |
Ancienne République yougoslave de Macédoine |
PARTIE II
ESCARGOTS
Les pays tiers et territoires mentionnés dans la colonne «Pays» de l'annexe II de la décision 2006/766/CE, à l'exception de ceux pour lesquels une restriction est mentionnée dans la colonne «Restrictions» de cette annexe, ainsi que les pays/territoires suivants:
|
CODE ISO DU PAYS |
PAYS/TERRITOIRE |
|
MD |
Moldavie |
|
MK (*2) |
Ancienne République yougoslave de Macédoine |
|
SY |
Syrie |
PARTIE III
GÉLATINE ET COLLAGÈNE DESTINÉS À LA CONSOMMATION HUMAINE
SECTION A
Gélatine et collagène dérivés de bovins, d'ovins, de caprins, de porcins et d'équidés, sauvages ou d'élevage
Les pays tiers et territoires mentionnés dans la colonne 1 de l'annexe II, partie 1, du règlement (UE) no 206/2010 et les pays ou territoires suivants:
|
CODE ISO DU PAYS |
PAYS/TERRITOIRE |
|
KR |
République de Corée |
|
MY |
Malaisie |
|
PK |
Pakistan |
|
TW |
Taïwan |
SECTION B
Gélatine et collagène dérivés de volailles, y compris les ratites et le gibier à plumes
Les pays tiers et territoires mentionnés dans la colonne 1 de l'annexe I, partie 1, du règlement (CE) no 798/2008.
SECTION C
Gélatine et collagène dérivés de produits de la pêche
Tous les pays tiers et territoires mentionnés dans la colonne «Pays» de l'annexe II de la décision 2006/766/CE, qu'une restriction soit ou non prévue dans la colonne «Restrictions» de cette annexe.
SECTION D
Gélatine et collagène dérivés de léporidés et de mammifères terrestres sauvages non visés à la section A
Les pays tiers mentionnés dans la colonne 1 de l'annexe I, partie 1, du règlement (CE) no 119/2009.
PARTIE IV
MATIÈRES PREMIÈRES DEVANT SERVIR À LA PRODUCTION DE GÉLATINE ET DE COLLAGÈNE DESTINÉS À LA CONSOMMATION HUMAINE
SECTION A
Matières premières tirées de bovins, d'ovins, de caprins, de porcins et d'équidés, sauvages ou d'élevage
Les pays tiers, territoires et parties de pays tiers ou territoires mentionnés à l'annexe II, partie 1, du règlement (UE) no 206/2010, en provenance desquels l'introduction dans l'Union de cette catégorie de viandes fraîches des espèces correspondantes est autorisée, comme indiqué dans cette partie de cette annexe, à moins que cette introduction soit limitée par les garanties supplémentaires A ou F (indiquées, le cas échéant, dans la colonne 5).
SECTION B
Matières premières tirées de volailles, y compris les ratites et le gibier à plumes
Les pays tiers, parties de pays tiers et territoires mentionnés à l'annexe I, partie 1, du règlement (CE) no 798/2008, en provenance desquels les importations de viandes fraîches de volaille des espèces correspondantes sont autorisées comme indiqué dans cette partie de cette annexe.
SECTION C
Matières premières tirées de produits de la pêche
Les pays tiers et territoires mentionnés dans la colonne «Pays» de l'annexe II de la décision 2006/766/CE, sous réserve des restrictions mentionnées dans la colonne «Restrictions» de cette annexe.
SECTION D
Matières premières tirées de léporidés et de mammifères terrestres sauvages non visés à la section A
Les pays tiers mentionnés dans la colonne 1 de l'annexe I, partie 1, du règlement (CE) no 119/2009, en provenance desquels les importations de viandes fraîches des espèces correspondantes sont autorisées comme indiqué dans cette partie de cette annexe.
PARTIE V
MATIÈRES PREMIÈRES TRAITÉES DEVANT SERVIR À LA PRODUCTION DE GÉLATINE ET DE COLLAGÈNE DESTINÉS À LA CONSOMMATION HUMAINE
SECTION A
Matières premières traitées tirées de bovins, d'ovins, de caprins, de porcins et d'équidés, sauvages ou d'élevage
Les pays tiers, territoires et parties de pays tiers ou territoires mentionnés dans la colonne 1 de l'annexe II, partie 1, du règlement (UE) no 206/2010 et les pays ou territoires suivants:
|
CODE ISO DU PAYS |
PAYS/TERRITOIRE |
|
KR |
République de Corée |
|
MY |
Malaisie |
|
PK |
Pakistan |
|
TW |
Taïwan |
SECTION B
Matières premières traitées tirées de volailles, y compris les ratites et le gibier à plumes
Les pays tiers et territoires mentionnés dans la colonne 1 de l'annexe I, partie 1, du règlement (CE) no 798/2008.
SECTION C
Matières premières traitées tirées de produits de la pêche
Tous les pays tiers et territoires mentionnés dans la colonne «Pays» de l'annexe II de la décision 2006/766/CE, qu'une restriction soit ou non prévue dans la colonne «Restrictions» de cette annexe.
SECTION D
Matières premières traitées tirées de léporidés et de mammifères terrestres sauvages non visés à la section A
Les pays tiers mentionnés dans la colonne 1 de l'annexe I, partie 1, du règlement (CE) no 119/2009.
SECTION E
Matières premières traitées visées à l'annexe III, section XIV, chapitre I, point 4 b) iii), et section XV, chapitre I, point 4 b) iii), du règlement (CE) no 853/2004
Les pays tiers, parties de pays tiers et territoires visés à la partie IV de la présente annexe.
PARTIE VI
MIEL, GELÉE ROYALE ET AUTRES PRODUITS DE L'APICULTURE DESTINÉS À LA CONSOMMATION HUMAINE
Les pays tiers et territoires mentionnés dans la colonne «Pays» de l'annexe de la décision 2011/163/UE de la Commission (1) au regard desquels figure la mention «X» dans la colonne «Miel» de cette annexe.
PARTIE VII
SULFATE DE CHONDROÏTINE, ACIDE HYALURONIQUE, AUTRES PRODUITS À BASE DE CARTILAGE HYDROLYSÉ, CHITOSANE, GLUCOSAMINE, PRÉSURE, ICHTYOCOLLE ET ACIDES AMINÉS HAUTEMENT RAFFINÉS DESTINÉS À LA CONSOMMATION HUMAINE
|
a) |
Dans le cas de matières premières dérivées d'ongulés, y compris les équidés, les pays tiers et territoires mentionnés dans la colonne 1 de l'annexe II, partie 1, du règlement (UE) no 206/2010 et les pays ou territoires suivants:
|
|
b) |
Dans le cas de matières premières dérivées de produits de la pêche, tous les pays tiers et territoires mentionnés dans la colonne «Pays» de l'annexe II de la décision 2006/766/CE, qu'une restriction soit ou non prévue dans la colonne «Restrictions» de cette annexe. |
|
c) |
Dans le cas de matières premières dérivées de volailles, les pays tiers et territoires mentionnés dans la colonne 1 de l'annexe I, partie 1, du règlement (CE) no 798/2008. |
(*1) Ancienne République yougoslave de Macédoine; code provisoire qui ne préjuge en aucune manière de la nomenclature définitive pour ce pays, laquelle sera adoptée à la suite de la conclusion des négociations en cours à cet égard aux Nations unies.
(*2) Ancienne République yougoslave de Macédoine; code provisoire qui ne préjuge en aucune manière de la nomenclature définitive pour ce pays, laquelle sera adoptée à la suite de la conclusion des négociations en cours à cet égard aux Nations unies.
(1) Décision 2011/163/UE de la Commission du 16 mars 2011 relative à l'approbation des plans soumis par les pays tiers conformément à l'article 29 de la directive 96/23/CE du Conseil (JO L 70 du 17.3.2011, p. 40).
ANNEXE II
Modèles de certificats visés à l'article 2
PARTIE I
MODÈLE DE CERTIFICAT POUR L'IMPORTATION DE CUISSES DE GRENOUILLE RÉFRIGÉRÉES, CONGELÉES OU PRÉPARÉES DESTINÉES À LA CONSOMMATION HUMAINE
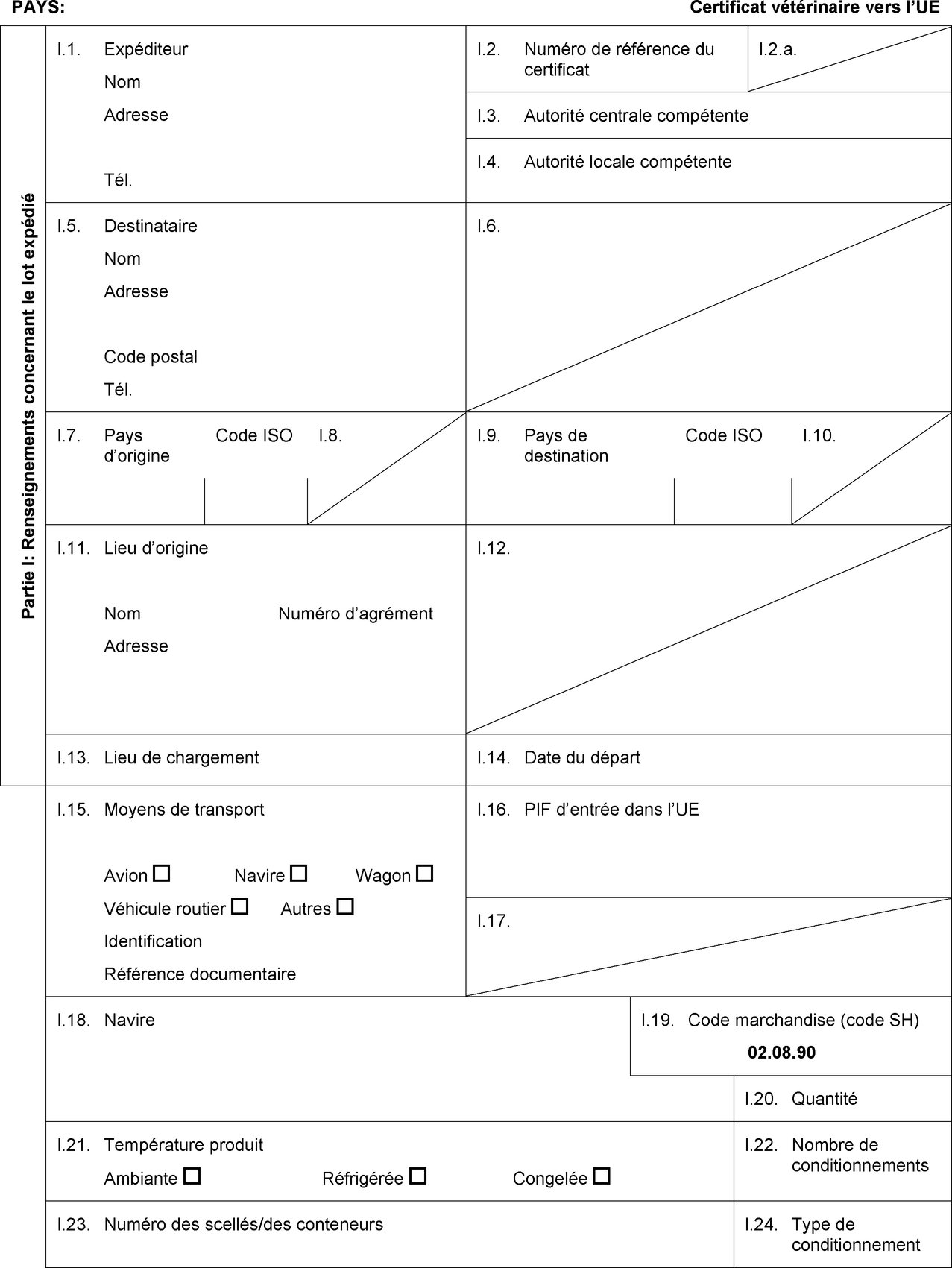
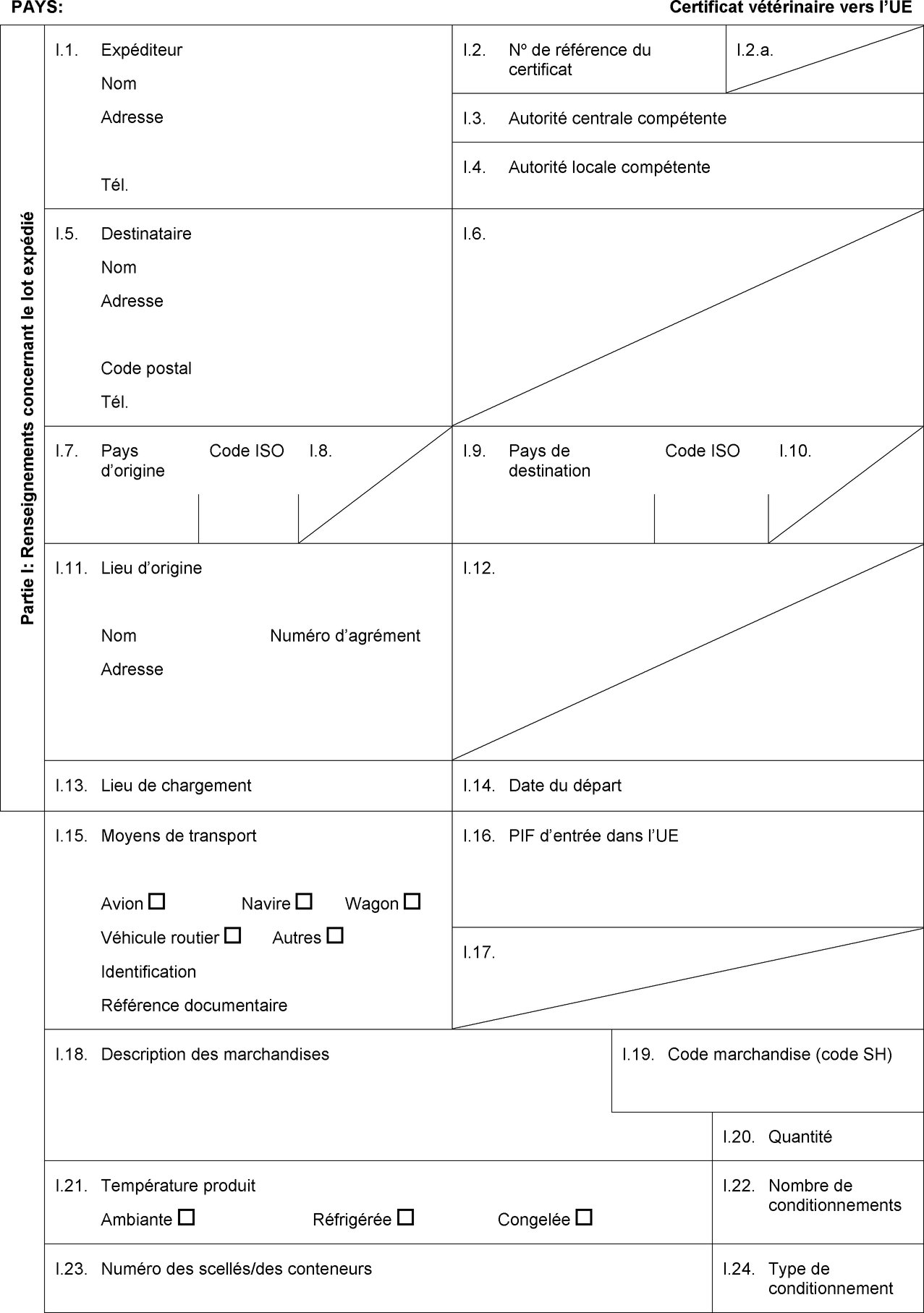
PAYS:
Certificat vétérinaire vers l’UE
Partie I: Renseignements concernant le lot expédié
I.1. Expéditeur
Nom
Adresse
Tél.
I.2. Numéro de référence du certificat
I.2.a.
I.3. Autorité centrale compétente
I.4. Autorité locale compétente
I.5. Destinataire
Nom
Adresse
Code postal
Tél.
I.6.
I.7. Pays d’origine
Code ISO
I.8.
I.9. Pays de destination
Code ISO
I.10.
I.11. Lieu d’origine
Nom Numéro d’agrément
Adresse
I.12.
I.13. Lieu de chargement
I.14. Date du départ
I.15. Moyens de transport
Avion Navire Wagon
Véhicule routier Autres
Identification
Référence documentaire
I.16. PIF d’entrée dans l’UE
I.17.
I.18. Navire
I.19. Code marchandise (code SH)
02.08.90
I.20. Quantité
I.21. Température produit
Ambiante Réfrigérée Congelée
I.22. Nombre de conditionnements
I.23. Numéro des scellés/des conteneurs
I.24. Type de conditionnement

I.25. Marchandises certifiées aux fins de:
Consommation humaine
I.26.
I.27. Pour importation ou admission dans l’UE
I.28. Identification des marchandises
Espèce
(nom scientifique)
Type de traitement
Numéro d’agrément des établissements
Atelier de transformation
Nombre de conditionnements
Poids net

PAYS
Modèle FRG Cuisses de grenouille
II. Information sanitaire
II.a. No de référence du certificat
II.b.
II.1. Attestation de santé publique
Le soussigné déclare avoir connaissance des dispositions applicables du règlement (CE) no 178/2002 du Parlement européen et du Conseil du 28 janvier 2002 établissant les principes généraux et les prescriptions générales de la législation alimentaire, instituant l’Autorité européenne de sécurité des aliments et fixant des procédures relatives à la sécurité des denrées alimentaires (JO L 31 du 1.2.2002, p. 1), du règlement (CE) no 852/2004 du Parlement européen et du Conseil du 29 avril 2004 relatif à l’hygiène des denrées alimentaires (JO L 139 du 30.4.2004, p. 1) et du règlement (CE) no 853/2004 du Parlement européen et du Conseil du 29 avril 2004 fixant des règles spécifiques d’hygiène applicables aux denrées alimentaires d’origine animale (JO L 139 du 30.4.2004, p. 55), et certifie que les cuisses de grenouille décrites ci-dessus ont été produites conformément à ces dispositions, et notamment:
— qu’elles proviennent d’un ou de plusieurs établissements appliquant un programme fondé sur les principes HACCP conformément à l’article 5 du règlement (CE) no 852/2004;
et
— qu’elles proviennent de grenouilles qui ont été saignées, préparées et, selon le cas, réfrigérées, congelées ou transformées, emballées et entreposées de façon hygiénique conformément aux exigences de l’annexe III, section XI, du règlement (CE) no 853/2004.
Notes
Partie I
— Case I.11: lieu d’origine: nom et adresse de l’établissement d’expédition.
— Case I.15: numéro d’immatriculation (wagon ou conteneur et camion), numéro de vol (avion) ou nom (navire). Des informations distinctes doivent être fournies en cas de déchargement et de rechargement.
— Case I.20: indiquer le poids brut total et le poids net total.
— Case I.23: numéro des scellés/des conteneurs: uniquement s’il y a lieu.
— Case I.28: type de traitement: fraîches, traitées.
Partie II
— La couleur du sceau et de la signature doit être différente de celle des autres mentions du certificat.
Partie II: Certification
Inspecteur officiel
Nom (en lettres capitales): Qualification et titre:
Date: Signature:
Sceau:
PARTIE II
MODÈLE DE CERTIFICAT POUR L'IMPORTATION D'ESCARGOTS RÉFRIGÉRÉS, CONGELÉS, DÉCOQUILLÉS, CUITS, PRÉPARÉS OU MIS EN CONSERVE DESTINÉS À LA CONSOMMATION HUMAINE

PAYS:
Certificat vétérinaire vers l’UE
Partie I: Renseignements concernant le lot expédié
I.1. Expéditeur
Nom
Adresse
Tél.
I.2. No de référence du certificat
I.2.a.
I.3. Autorité centrale compétente
I.4. Autorité locale compétente
I.5. Destinataire
Nom
Adresse
Code postal
Tél.
I.6.
I.7. Pays d’origine
Code ISO
I.8.
I.9. Pays de destination
Code ISO
I.10.
I.11. Lieu d’origine
Nom Numéro d’agrément
Adresse
I.12.
I.13. Lieu de chargement
I.14. Date du départ
I.15. Moyens de transport
Avion Navire Wagon
Véhicule routier Autres
Identification
Référence documentaire
I.16. PIF d’entrée dans l’UE
I.17.
I.18. Description des marchandises
I.19. Code marchandise (code SH)
I.20. Quantité
I.21. Température produit
Ambiante Réfrigérée Congelée
I.22. Nombre de conditionnements
I.23. Numéro des scellés/des conteneurs
I.24. Type de conditionnement
I.25. Marchandises certifiées aux fins de:
Consommation humaine
I.26.
I.27. Pour importation ou admission dans l’UE
I.28. Identification des marchandises
Espèce (nom scientifique)
Type de traitement
Numéro d’agrément des établissements
Nombre de conditionnements
Poids net
Atelier de transformation

PAYS
Modèle SNS Escargots
II. Information sanitaire
II.a. No de référence du certificat
II.b.
II.1. Attestation de santé publique
Le soussigné déclare avoir connaissance des dispositions applicables du règlement (CE) no 178/2002 du Parlement européen et du Conseil du 28 janvier 2002 établissant les principes généraux et les prescriptions générales de la législation alimentaire, instituant l’Autorité européenne de sécurité des aliments et fixant des procédures relatives à la sécurité des denrées alimentaires (JO L 31 du 1.2.2002, p. 1), du règlement (CE) no 852/2004 du Parlement européen et du Conseil du 29 avril 2004 relatif à l’hygiène des denrées alimentaires (JO L 139 du 30.4.2004, p. 1) et du règlement (CE) no 853/2004 du Parlement européen et du Conseil du 29 avril 2004 fixant des règles spécifiques d’hygiène applicables aux denrées alimentaires d’origine animale (JO L 139 du 30.4.2004, p. 55), et certifie que les escargots décrits ci-dessus ont été produits conformément à ces dispositions, et notamment:
— qu’ils proviennent d’un ou de plusieurs établissements appliquant un programme fondé sur les principes HACCP conformément à l’article 5 du règlement (CE) no 852/2004;
et
— qu’ils ont été manipulés et, selon le cas, décoquillés, cuits, préparés, mis en conserve, congelés, emballés et entreposés de façon hygiénique conformément aux exigences de l’annexe III, section XI, du règlement (CE) no 853/2004.
Notes
Partie I
— Case I.11: lieu d’origine: nom et adresse de l’établissement d’expédition.
— Case I.15: numéro d’immatriculation (wagon ou conteneur et camion), numéro de vol (avion) ou nom (navire). Des informations distinctes doivent être fournies en cas de déchargement et de rechargement.
— Case I.19: utiliser le code approprié du système harmonisé (SH) sous les rubriques suivantes: 03 07, 16 05.
— Case I.20: indiquer le poids brut total et le poids net total.
— Case I.23: numéro des scellés/des conteneurs: uniquement s’il y a lieu.
— Case I.28: type de traitement: frais, traités.
Partie II
— La couleur du sceau et de la signature doit être différente de celle des autres mentions du certificat.
Partie II: Certification
Inspecteur officiel
Nom (en lettres capitales): Qualification et titre:
Date: Signature:
Sceau:
PARTIE III
MODÈLE DE CERTIFICAT POUR L'IMPORTATION DE GÉLATINE DESTINÉE À LA CONSOMMATION HUMAINE
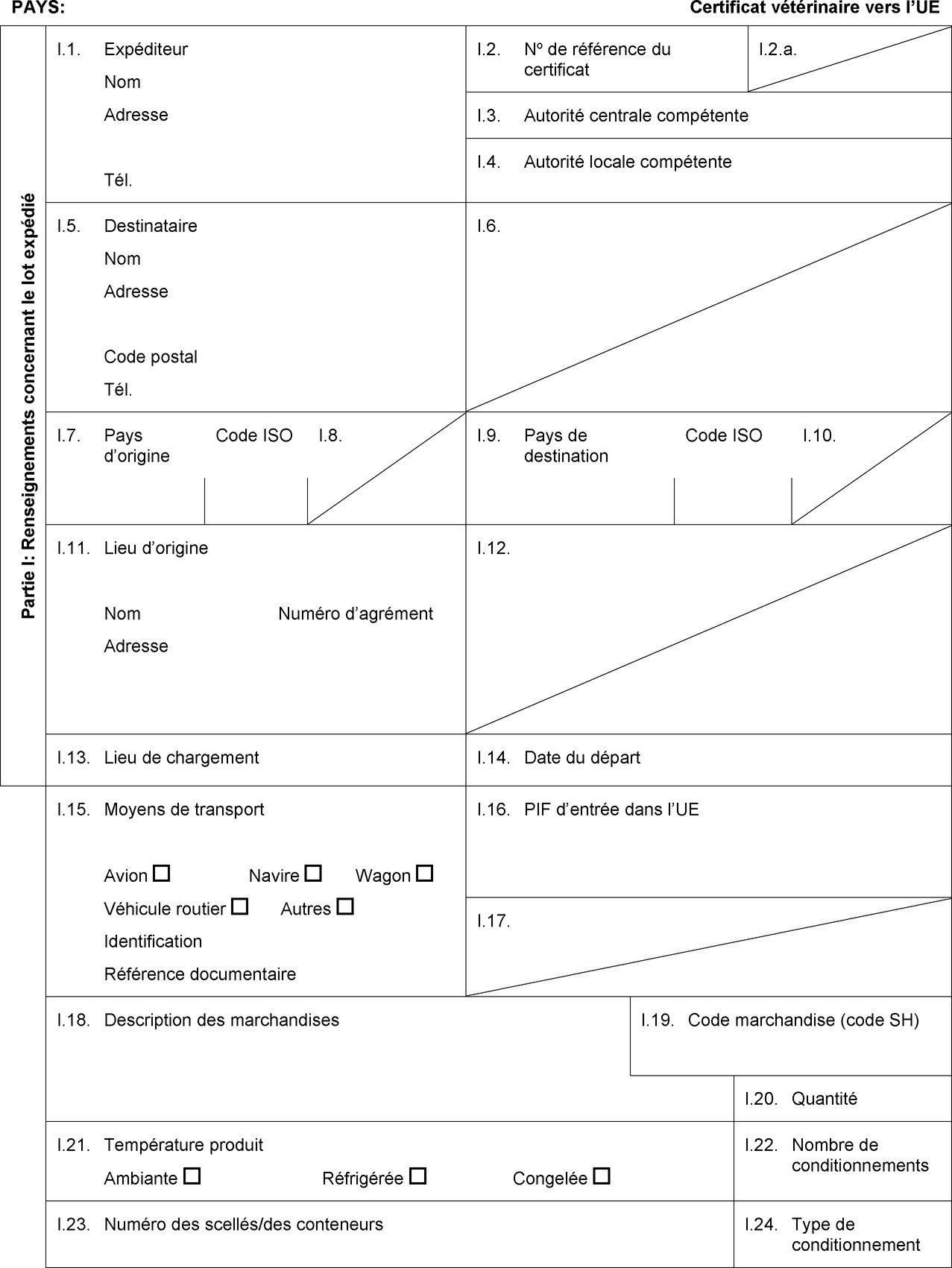
PAYS:
Certificat vétérinaire vers l’UE
Partie I: Renseignements concernant le lot expédié
I.1. Expéditeur
Nom
Adresse
Tél.
I.2. No de référence du certificat
I.2.a.
I.3. Autorité centrale compétente
I.4. Autorité locale compétente
I.5. Destinataire
Nom
Adresse
Code postal
Tél.
I.6.
I.7. Pays d’origine
Code ISO
I.8.
I.9. Pays de destination
Code ISO
I.10.
I.11. Lieu d’origine
Nom Numéro d’agrément
Adresse
I.12.
I.13. Lieu de chargement
I.14. Date du départ
I.15. Moyens de transport
Avion Navire Wagon
Véhicule routier Autres
Identification
Référence documentaire
I.16. PIF d’entrée dans l’UE
I.17.
I.18. Description des marchandises
I.19. Code marchandise (code SH)
I.20. Quantité
I.21. Température produit
Ambiante Réfrigérée Congelée
I.22. Nombre de conditionnements
I.23. Numéro des scellés/des conteneurs
I.24. Type de conditionnement

I.25. Marchandises certifiées aux fins de:
Consommation humaine
I.26.
I.27. Pour importation ou admission dans l’UE
I.28. Identification des marchandises
Espèce
(nom scientifique)
Date de production
(jj/mm/aaaa)
Numéro d’agrément des établissements
Atelier de transformation
Nombre de conditionnements
Poids net

PAYS
Modèle GEL Gélatine destinée à la consommation humaine
II. Information sanitaire
II.a. No de référence du certificat
II.b.
II.1. Attestation de santé publique
Le soussigné déclare avoir connaissance des dispositions applicables du règlement (CE) no 178/2002 du Parlement européen et du Conseil du 28 janvier 2002 établissant les principes généraux et les prescriptions générales de la législation alimentaire, instituant l’Autorité européenne de sécurité des aliments et fixant des procédures relatives à la sécurité des denrées alimentaires (JO L 31 du 1.2.2002, p. 1), du règlement (CE) no 852/2004 du Parlement européen et du Conseil du 29 avril 2004 relatif à l’hygiène des denrées alimentaires (JO L 139 du 30.4.2004, p. 1) et du règlement (CE) no 853/2004 du Parlement européen et du Conseil du 29 avril 2004 fixant des règles spécifiques d’hygiène applicables aux denrées alimentaires d’origine animale (JO L 139 du 30.4.2004, p. 55), et certifie que la gélatine décrite ci-dessus a été produite conformément à ces dispositions, et notamment:
— qu’elle provient d’un ou de plusieurs établissements appliquant un programme fondé sur les principes HACCP conformément à l’article 5 du règlement (CE) no 852/2004;
— qu’elle a été produite à partir de matières premières conformes aux exigences de l’annexe III, section XIV, chapitres I et II, du règlement (CE) no 853/2004;
— qu’elle a été fabriquée dans le respect des exigences fixées à l’annexe III, section XIV, chapitre III, du règlement (CE) no 853/2004;
— qu’elle satisfait aux critères de l’annexe III, section XIV, chapitre IV, du règlement (CE) no 853/2004 et du règlement (CE) no 2073/2005 de la Commission du 15 novembre 2005 concernant les critères microbiologiques applicables aux denrées alimentaires (JO L 338 du 22.12.2005, p. 1);
et, si elle provient de ruminants, à l’exception de la gélatine dérivée de cuirs et de peaux de ruminants,
(1)
— [qu’elle provient d’un pays ou d’une région classés, conformément à l’article 5, paragraphe 2, du règlement (CE) no 999/2001 du Parlement européen et du Conseil du 22 mai 2001 fixant les règles pour la prévention, le contrôle et l’éradication de certaines encéphalopathies spongiformes transmissibles (JO L 147 du 31.5.2001, p. 1), comme pays ou région présentant un risque d’ESB négligeable;
— que les animaux dont est tirée la gélatine sont nés, ont été élevés en permanence et abattus dans le pays à risque d’ESB négligeable et ont été soumis à des inspections ante mortem et post mortem dont les résultats se sont révélés favorables;
— si des cas autochtones d’ESB ont été signalés dans le pays ou la région:
i) qu’elle provient d’animaux nés après la date à partir de laquelle l’interdiction d’alimenter les ruminants avec des farines de viande et d’os et des cretons provenant de ruminants a été appliquée; ou
ii) que les produits d’origine animale provenant de bovins, d’ovins et de caprins ne contiennent pas et ne sont pas tirés de matériels à risque spécifiés définis à l’annexe V du règlement (CE) no 999/2001 ou de viandes séparées mécaniquement obtenues à partir d’os de bovins, d’ovins ou de caprins.]
(1) ou
— [qu’elle provient d’un pays ou d’une région classés, conformément à l’article 5, paragraphe 2, du règlement (CE) no 999/2001, dans la catégorie des pays ou régions présentant un risque d’ESB contrôlé;
— que les animaux dont la gélatine a été tirée ont été soumis à des inspections ante mortem et post mortem dont les résultats se sont révélés favorables;
— que les animaux dont a été tirée la gélatine destinée à l’exportation n’ont pas été abattus après étourdissement par injection d’un gaz dans la cavité crânienne ni mis à mort selon la même méthode et n’ont pas été abattus, après étourdissement, par lacération du tissu nerveux central au moyen d’un instrument allongé en forme de tige introduit dans la cavité crânienne;
— que la gélatine ne contient pas et n’est pas tirée de matériels à risque spécifiés définis à l’annexe V du règlement (CE) no 999/2001 ni de viandes séparées mécaniquement obtenues à partir d’os de bovins, d’ovins ou de caprins.]
Partie II: Certification

PAYS
Modèle GEL Gélatine destinée à la consommation humaine
II. Information sanitaire
II.a. No de référence du certificat
II.b.
(1) ou
— [qu’elle provient d’un pays ou d’une région classés, conformément à l’article 5, paragraphe 2, du règlement (CE) no 999/2001, dans la catégorie des pays ou régions à risque d’ESB négligeable;
— que la gélatine est tirée d’animaux qui ont été soumis à des inspections ante mortem et post mortem dont les résultats se sont révélés favorables;
— que la gélatine est tirée à la fois d’animaux nés, élevés en permanence et abattus dans un pays ou une région à risque d’ESB négligeable conformément à l’article 5, paragraphe 2, du règlement (CE) no 999/2001, et, si des cas autochtones d’ESB ont été signalés dans le pays ou la région, nés après la date à partir de laquelle l’interdiction d’alimenter les ruminants avec des farines de viande et d’os et des cretons provenant de ruminants a été appliquée, et d’animaux nés dans un pays ou une région classés, conformément à l’article 5, paragraphe 2, du règlement (CE) no 999/2001, comme pays ou région présentant un risque d’ESB contrôlé, et qui n’ont pas été abattus, après étourdissement, par injection d’un gaz dans la cavité crânienne ni mis à mort selon la même méthode et n’ont pas été abattus, après étourdissement, par lacération du tissu nerveux central au moyen d’un instrument allongé en forme de tige introduit dans la cavité crânienne;
— que la gélatine ne contient pas et n’est pas tirée de matériels à risque spécifiés définis à l’annexe V du règlement (CE) no 999/2001 ni de viandes séparées mécaniquement obtenues à partir d’os de bovins, d’ovins ou de caprins.]
(1) ou
— [qu’elle provient d’un pays ou d’une région classés, conformément à l’article 5, paragraphe 2, du règlement (CE) no 999/2001, dans la catégorie des pays ou régions présentant un risque d’ESB indéterminé;
— que les animaux dont a été tirée la gélatine n’ont reçu ni farines de viande et d’os ni cretons provenant de ruminants dans leur alimentation et ont été soumis à des inspections ante mortem et post mortem dont les résultats se sont révélés favorables;
— que les animaux dont a été tirée la gélatine n’ont pas été abattus, après étourdissement, par injection d’un gaz dans la cavité crânienne ni mis à mort selon la même méthode et n’ont pas été abattus, après étourdissement, par lacération du tissu nerveux central au moyen d’un instrument allongé en forme de tige introduit dans la cavité crânienne;
— que la gélatine n’est pas tirée:
i) de matériels à risque spécifiés définis à l’annexe V du règlement (CE) no 999/2001;
ii) de tissus nerveux ou lymphatiques rendus apparents durant l’opération de désossage;
iii) de viandes séparées mécaniquement obtenues à partir d’os de bovins, d’ovins ou de caprins.]
Notes
Partie I
— Case I.11: lieu d’origine: nom et adresse de l’établissement d’expédition.
— Case I.15: numéro d’immatriculation (wagon ou conteneur et camion), numéro de vol (avion) ou nom (navire). Des informations distinctes doivent être fournies en cas de déchargement et de rechargement.
— Case I.19: utiliser le code approprié du système harmonisé (SH) sous la rubrique suivante: 35 03.
— Case I.20: indiquer le poids brut total et le poids net total.
— Case I.23: numéro des scellés/des conteneurs: uniquement s’il y a lieu.

PAYS
Modèle GEL Gélatine destinée à la consommation humaine
II. Information sanitaire
II.a. No de référence du certificat
II.b.
Partie II
(1) Supprimer la ou les mentions inutiles.
— La couleur du sceau et de la signature doit être différente de celle des autres mentions du certificat.
Vétérinaire officiel Nom (en lettres capitales):
Qualification et titre:
Date: Signature:
Sceau:
PARTIE IV
MODÈLE DE CERTIFICAT POUR L'IMPORTATION DE COLLAGÈNE DESTINÉ À LA CONSOMMATION HUMAINE
PAYS:
Certificat vétérinaire vers l’UE
Partie I: Renseignements concernant le lot expédié
I.1. Expéditeur
Nom
Adresse
Tél.
I.2. No de référence du certificat
I.2.a.
I.3. Autorité centrale compétente
I.4. Autorité locale compétente
I.5. Destinataire
Nom
Adresse
Code postal
Tél.
I.6.
I.7. Pays d’origine
Code ISO
I.8.
I.9. Pays de destination
Code ISO
I.10.
I.11. Lieu d’origine
Nom Numéro d’agrément
Adresse
I.12.
I.13. Lieu de chargement
I.14. Date du départ
I.15. Moyens de transport
Avion Navire Wagon
Véhicule routier Autres
Identification
Référence documentaire
I.16. PIF d’entrée dans l’UE
I.17.
I.18. Description des marchandises
I.19. Code marchandise (code SH)
I.20. Quantité
I.21. Température produit
Ambiante Réfrigérée Congelée
I.22. Nombre de conditionnements
I.23. Numéro des scellés/des conteneurs
I.24. Type de conditionnement
I.25. Marchandises certifiées aux fins de:
Consommation humaine
I.26.
I.27. Pour importation ou admission dans l’UE
I.28. Identification des marchandises
Espèce
(nom scientifique)
Date de production
(jj/mm/aaaa)
Numéro d’agrément des établissements
Atelier de transformation
Nombre de conditionnements
Poids net

PAYS
Modèle COL Collagène destiné à la consommation humaine
II. Information sanitaire
II.a. No de référence du certificat
II.b.
II.1. Attestation de santé publique
Le soussigné déclare avoir connaissance des dispositions applicables du règlement (CE) no 178/2002 du Parlement européen et du Conseil du 28 janvier 2002 établissant les principes généraux et les prescriptions générales de la législation alimentaire, instituant l’Autorité européenne de sécurité des aliments et fixant des procédures relatives à la sécurité des denrées alimentaires (JO L 31 du 1.2.2002, p. 1), du règlement (CE) no 852/2004 du Parlement européen et du Conseil du 29 avril 2004 relatif à l’hygiène des denrées alimentaires (JO L 139 du 30.4.2004, p. 1) et du règlement (CE) no 853/2004 du Parlement européen et du Conseil du 29 avril 2004 fixant des règles spécifiques d’hygiène applicables aux denrées alimentaires d’origine animale (JO L 139 du 30.4.2004, p. 55), et certifie que le collagène décrit ci-dessus a été produit conformément à ces dispositions, et notamment:
— qu’il provient d’un ou de plusieurs établissements appliquant un programme fondé sur les principes HACCP conformément à l’article 5 du règlement (CE) no 852/2004;
— qu’il a été produit à partir de matières premières conformes aux exigences de l’annexe III, section XV, chapitres I et II, du règlement (CE) no 853/2004;
— qu’il a été fabriqué dans le respect des exigences fixées à l’annexe III, section XV, chapitre III, du règlement (CE) no 853/2004;
— qu’il satisfait aux critères de l’annexe III, section XV, chapitre IV, du règlement (CE) no 853/2004 et du règlement (CE) no 2073/2005 de la Commission du 15 novembre 2005 concernant les critères microbiologiques applicables aux denrées alimentaires (JO L 338 du 22.12.2005, p. 1);
et, s’il provient de ruminants, à l’exception du collagène dérivé de cuirs et de peaux de ruminants,
(1)
— [qu’il provient d’un pays ou d’une région classés, conformément à l’article 5, paragraphe 2, du règlement (CE) no 999/2001 du Parlement européen et du Conseil du 22 mai 2001 fixant les règles pour la prévention, le contrôle et l’éradication de certaines encéphalopathies spongiformes transmissibles (JO L 147 du 31.5.2001, p. 1), comme pays ou région présentant un risque d’ESB négligeable;
— que les animaux dont a été tiré le collagène sont nés, ont été élevés en permanence et abattus dans le pays à risque d’ESB négligeable et ont été soumis à des inspections ante mortem et post mortem dont les résultats se sont révélés favorables;
— si des cas autochtones d’ESB ont été signalés dans le pays ou la région:
i) qu’il provient d’animaux nés après la date à partir de laquelle l’interdiction d’alimenter les ruminants avec des farines de viande et d’os et des cretons provenant de ruminants a été appliquée; ou
ii) que les produits d’origine animale provenant de bovins, d’ovins et de caprins ne contiennent pas et ne sont pas tirés de matériels à risque spécifiés définis à l’annexe V du règlement (CE) no 999/2001 ou de viandes séparées mécaniquement obtenues à partir d’os de bovins, d’ovins ou de caprins.]
(1) ou
— [qu’il provient d’un pays ou d’une région classés, conformément à l’article 5, paragraphe 2, du règlement (CE) no 999/2001, dans la catégorie des pays ou régions présentant un risque d’ESB contrôlé;
— que les animaux dont a été tiré le collagène ont été soumis à des inspections ante mortem et post mortem dont les résultats se sont révélés favorables;
— que les animaux dont a été tiré le collagène destiné à l’exportation n’ont pas été abattus après étourdissement par injection d’un gaz dans la cavité crânienne ni mis à mort selon la même méthode et n’ont pas été abattus, après étourdissement, par lacération du tissu nerveux central au moyen d’un instrument allongé en forme de tige introduit dans la cavité crânienne;
— que le collagène ne contient pas et n’est pas tiré de matériels à risque spécifiés définis à l’annexe V du règlement (CE) n° 999/2001 ni de viandes séparées mécaniquement obtenues à partir d’os de bovins, d’ovins ou de caprins.]
Partie II: Certification

PAYS
Modèle COL Collagène destiné à la consommation humaine
II. Information sanitaire
II.a. No de référence du certificat
II.b.
(1) ou
— [qu’il provient d’un pays ou d’une région classés, conformément à l’article 5, paragraphe 2, du règlement (CE) no 999/2001, dans la catégorie des pays ou régions à risque d’ESB négligeable;
— que le collagène est tiré d’animaux qui ont été soumis à des inspections ante mortem et post mortem dont les résultats se sont révélés favorables;
— que le collagène est tiré la fois d’animaux nés, élevés en permanence et abattus dans un pays ou une région à risque d’ESB négligeable conformément à l’article 5, paragraphe 2, du règlement (CE) no 999/2001, et, si des cas autochtones d’ESB ont été signalés dans le pays ou la région, nés après la date à partir de laquelle l’interdiction d’alimenter les ruminants avec des farines de viande et d’os et des cretons provenant de ruminants a été appliquée, et d’animaux nés dans un pays ou une région classés, conformément à l’article 5, paragraphe 2, du règlement (CE) no 999/2001, comme pays ou région présentant un risque d’ESB contrôlé, et qui n’ont pas été abattus après étourdissement par injection d’un gaz dans la cavité crânienne ni mis à mort selon la même méthode et n’ont pas été abattus, après étourdissement, par lacération du tissu nerveux central au moyen d’un instrument allongé en forme de tige introduit dans la cavité crânienne;
— que le collagène ne contient pas et n’est pas tiré de matériels à risque spécifiés définis à l’annexe V du règlement (CE) n° 999/2001 ni de viandes séparées mécaniquement obtenues à partir d’os de bovins, d’ovins ou de caprins.]
(1) ou
— [qu’il provient d’un pays ou d’une région classés, conformément à l’article 5, paragraphe 2, du règlement (CE) no 999/2001, dans la catégorie des pays ou régions présentant un risque d’ESB indéterminé;
— que les animaux dont le collagène a été tiré n’ont reçu ni farines de viande et d’os ni cretons provenant de ruminants dans leur alimentation et ont été soumis à des inspections ante mortem et post mortem dont les résultats se sont révélés favorables;
— que les animaux dont le collagène a été tiré n’ont pas été abattus après étourdissement par injection d’un gaz dans la cavité crânienne ni mis à mort selon la même méthode et n’ont pas été abattus, après étourdissement, par lacération du tissu nerveux central au moyen d’un instrument allongé en forme de tige introduit dans la cavité crânienne;
— que le collagène n’a pas été tiré:
i) de matériels à risque spécifiés définis à l’annexe V du règlement (CE) no 999/2001;
ii) de tissus nerveux ou lymphatiques rendus apparents durant l’opération de désossage;
iii) de viandes séparées mécaniquement obtenues à partir d’os de bovins, d’ovins ou de caprins.]
Notes
Partie I
— Case I.11: lieu d’origine: nom et adresse de l’établissement d’expédition.
— Case I.15: numéro d’immatriculation (wagon ou conteneur et camion), numéro de vol (avion) ou nom (navire). Des informations distinctes doivent être fournies en cas de déchargement et de rechargement.
— Case I.18: ce certificat peut également être utilisé pour l’importation de boyaux de collagène.
— Case I.19: utiliser le code approprié du système harmonisé (SH) sous les rubriques suivantes: 35 04 ou 39 17.
— Case I.20: indiquer le poids brut total et le poids net total.
— Case I.23: numéro des scellés/des conteneurs: uniquement s’il y a lieu.

PAYS
Modèle COL Collagène destiné à la consommation humaine
II. Information sanitaire
II.a. No de référence du certificat
II.b.
Partie II
(1) Supprimer la ou les mentions inutiles.
— La couleur du sceau et de la signature doit être différente de celle des autres mentions du certificat.
Vétérinaire officiel
Nom (en lettres capitales): Qualification et titre:
Date: Signature:
Sceau:
PARTIE V
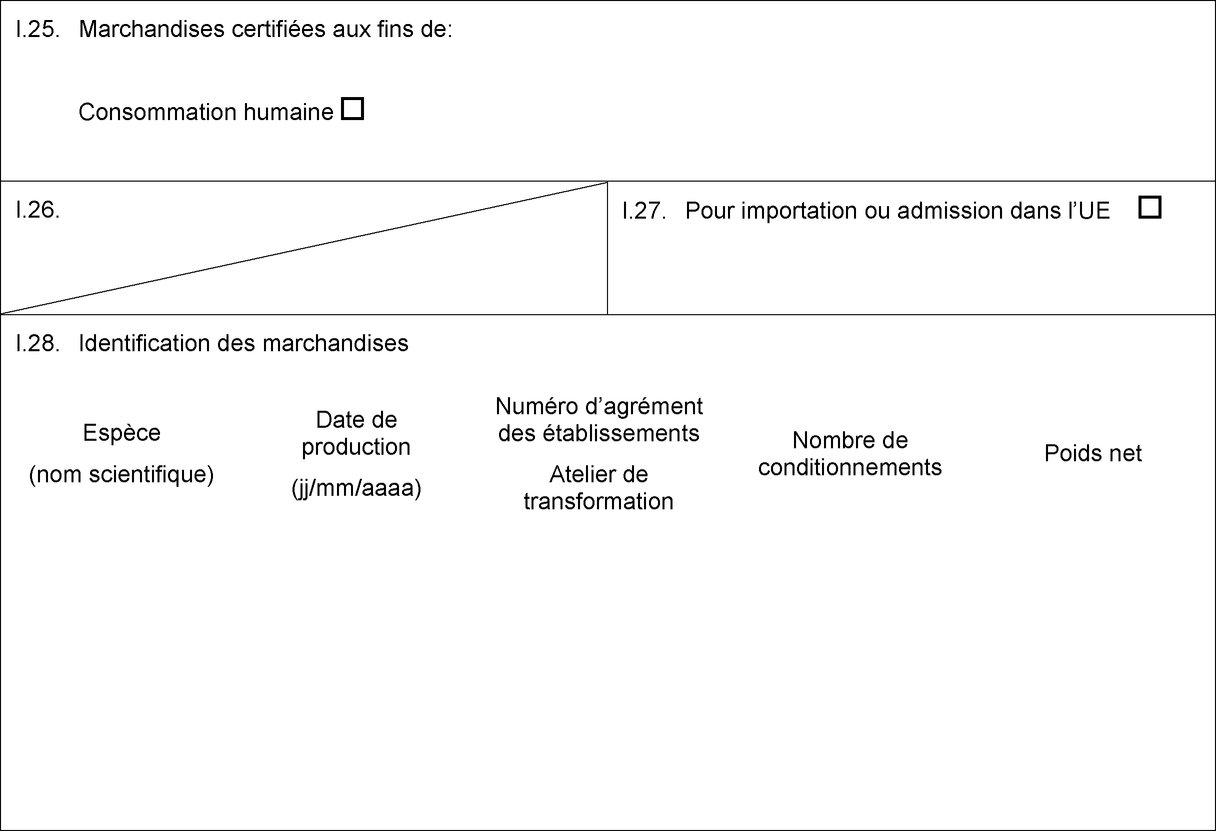
MODÈLE DE CERTIFICAT POUR L'IMPORTATION DE MATIÈRES PREMIÈRES DEVANT SERVIR À LA PRODUCTION DE GÉLATINE/COLLAGÈNE DESTINÉS À LA CONSOMMATION HUMAINE (1)

PAYS:
Certificat vétérinaire vers l’UE
Partie I: Renseignements concernant le lot expédié
I.1. Expéditeur
Nom
Adresse
Tél.
I.2. No de référence du certificat
I.2.a.
I.3. Autorité centrale compétente
I.4. Autorité locale compétente
I.5. Destinataire
Nom
Adresse
Code postal
Tél.
I.6.
I.7. Pays d’origine
Code ISO
I.8. Région d’origine
Code
I.9. Pays de destination
Code ISO
I.10.
I.11. Lieu d’origine
Nom Numéro d’agrément
Adresse
I.12.
I.13. Lieu de chargement
I.14. Date du départ
I.15. Moyens de transport
Avion Navire Wagon
Véhicule routier Autres
Identification
Référence documentaire
I.16. PIF d’entrée dans l’UE
I.17.
I.18. Description des marchandises
I.19. Code marchandise (code SH)
I.20. Quantité
I.21. Température produit
Ambiante Réfrigérée Congelée
I.22. Nombre de conditionnements
I.23. Numéro des scellés/des conteneurs
I.24. Type de conditionnement
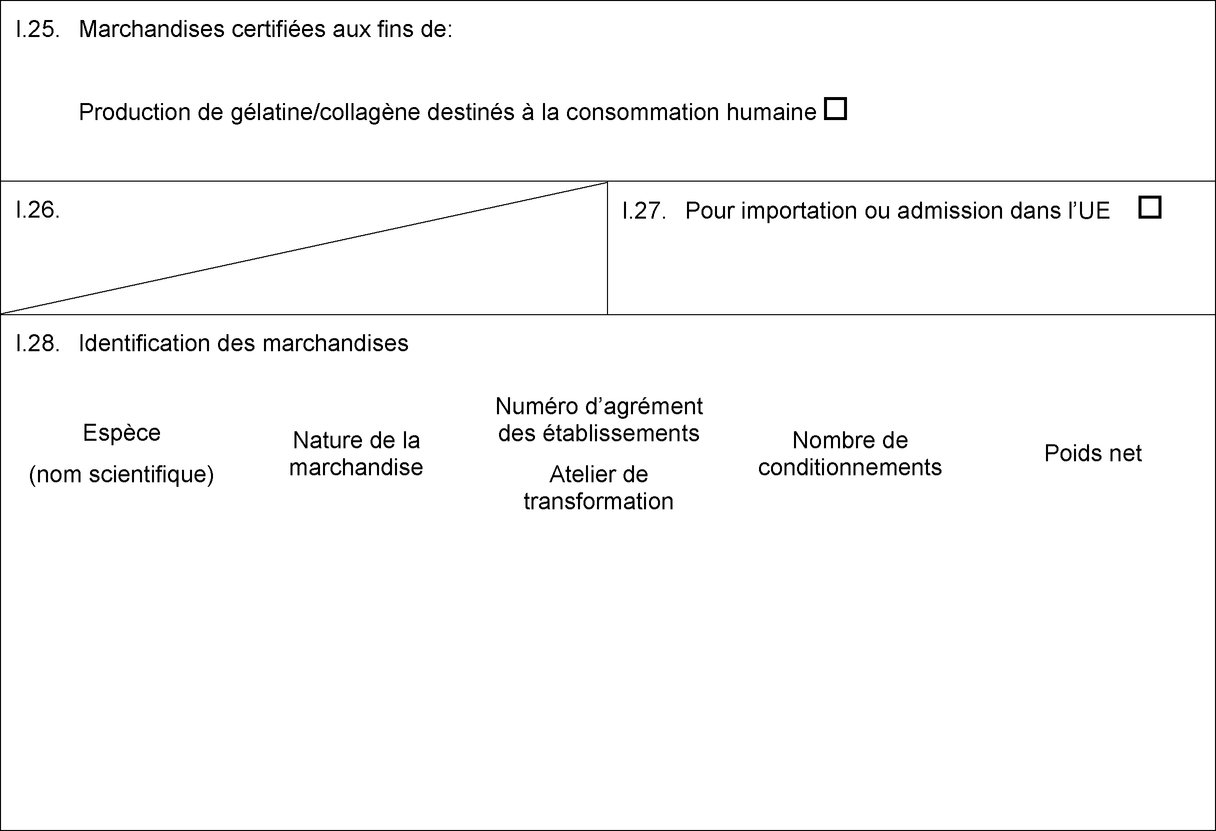
I.25. Marchandises certifiées aux fins de:
Production de gélatine/collagène destinés à la consommation humaine
I.26.
I.27. Pour importation ou admission dans l’UE
I.28. Identification des marchandises
Espèce
(nom scientifique)
Nature de la marchandise
Numéro d’agrément des établissements
Atelier de transformation
Nombre de conditionnements
Poids net

PAYS
Modèle RCG Matières premières devant servir à la production de gélatine/ collagène destinés à la consommation humaine
II. Information sanitaire
II.a. No de référence du certificat
II.b.
II.1. Attestation de santé publique
Le soussigné déclare avoir connaissance des dispositions applicables du règlement (CE) no 178/2002 du Parlement européen et du Conseil du 28 janvier 2002 établissant les principes généraux et les prescriptions générales de la législation alimentaire, instituant l’Autorité européenne de sécurité des aliments et fixant des procédures relatives à la sécurité des denrées alimentaires (JO L 31 du 1.2.2002, p. 1), du règlement (CE) no 852/2004 du Parlement européen et du Conseil du 29 avril 2004 relatif à l’hygiène des denrées alimentaires (JO L 139 du 30.4.2004, p. 1), du règlement (CE) no 853/2004 du Parlement européen et du Conseil du 29 avril 2004 fixant des règles spécifiques d’hygiène applicables aux denrées alimentaires d’origine animale (JO L 139 du 30.4.2004, p. 55) et du règlement (CE) no 854/2004 du Parlement européen et du Conseil du 29 avril 2004 fixant les règles spécifiques d’organisation des contrôles officiels concernant les produits d’origine animale destinés à la consommation humaine (JO L 139 du 30.4.2004, p. 206), et certifie que les matières premières décrites ci-dessus sont conformes à ces dispositions, et notamment:
— (1) [que les os, cuirs et peaux de ruminants, porcs et volaille domestiques et d’élevage ainsi que les tendons et nerfs décrits ci-dessus proviennent d’animaux qui ont été abattus dans un abattoir et dont les carcasses ont été jugées propres à la consommation humaine à l’issue des inspections ante mortem et post mortem;]
et/ou
— (1) [que les cuirs, peaux et os de gibier sauvage décrits ci-dessus proviennent d’animaux mis à mort dont les carcasses ont été jugées propres à la consommation humaine à l’issue des inspections ante mortem et post mortem;]
et/ou
— (1) [que les peaux et arêtes de poisson décrites ci-dessus proviennent d’ateliers agréés pour l’exportation transformant des produits de la pêche destinés à la consommation humaine et dont l’exportation est autorisée;]
(1) et
[si elles proviennent de ruminants, à l’exception des cuirs et peaux de ruminants,
(1)
— [qu’elles proviennent d’un pays ou d’une région classés, conformément à l’article 5, paragraphe 2, du règlement (CE) no 999/2001 du Parlement européen et du Conseil du 22 mai 2001 fixant les règles pour la prévention, le contrôle et l’éradication de certaines encéphalopathies spongiformes transmissibles (JO L 147 du 31.5.2001, p. 1), comme pays ou région présentant un risque d’ESB négligeable;
— que les animaux dont ont été tirées les matières premières d’origine animale provenant de bovins, d’ovins et de caprins sont nés, ont été élevés en permanence et abattus dans le pays à risque d’ESB négligeable et ont été soumis à des inspections ante mort
— si des cas autochtones d’ESB ont été signalés dans le pays ou la région:
i) [que les animaux sont nés après la date à partir de laquelle l’interdiction d’alimenter les ruminants avec des farines de viande et d’os et des cretons provenant de ruminants a été appliquée; ou
ii) que les matières premières d’origine animale provenant de bovins, d’ovins et de caprins ne contiennent pas et ne sont pas tirées de matériels à risque spécifiés définis à l’annexe V du règlement (CE) no 999/2001 ou de viandes séparées mécaniquement obtenues à partir d’os de bovins, d’ovins ou de caprins.]
(1) ou:
— [qu’elles proviennent d’un pays ou d’une région classés, conformément à l’article 5, paragraphe 2, du règlement (CE) no 999/2001, dans la catégorie des pays ou régions présentant un risque d’ESB contrôlé;
— que les animaux dont ont été tirées les matières premières d’origine animale provenant de bovins, d’ovins et de caprins ont été soumis à des inspections ante mortem et post mortem dont les résultats se sont révélés favorables;
Partie II: Certification

PAYS
Modèle RCG Matières premières devant servir à la production de gélatine/ collagène destinés à la consommation humaine
II. Information sanitaire
II.a. No de référence du certificat
II.b.
— que les animaux dont ont été tirées les matières premières d’origine animale provenant de bovins, d’ovins et de caprins destinées à l’exportation n’ont pas été abattus après étourdissement par injection d’un gaz dans la cavité crânienne ni mis à mort selon la même méthode et n’ont pas été abattus, après étourdissement, par lacération du tissu nerveux central au moyen d’un instrument allongé en forme de tige introduit dans la cavité crânienne;
— que les matières premières d’origine animale provenant de bovins, d’ovins et de caprins ne contiennent pas et ne sont pas tirées de matériels à risque spécifiés définis à l’annexe V du règlement (CE) no 999/2001 ou de viandes séparées mécaniquement obtenues à partir d’os de bovins, d’ovins ou de caprins.]
(1) ou
— [qu’elles proviennent d’un pays ou d’une région classés, conformément à l’article 5, paragraphe 2, du règlement (CE) no 999/2001, dans la catégorie des pays ou régions présentant un risque d’ESB négligeable;
— que les animaux dont ont été tirées les matières premières d’origine animale provenant de bovins, d’ovins et de caprins ont été soumis à des inspections ante mortem et post mortem dont les résultats se sont révélés favorables;
— que les matières premières d’origine animale provenant de bovins, d’ovins et de caprins destinées à l’exportation sont tirées à la fois d’animaux nés, élevés en permanence et abattus dans un pays ou une région à risque d’ESB négligeable conformément à l’article 5, paragraphe 2, du règlement (CE) no 999/2001, et, si des cas autochtones d’ESB ont été signalés dans le pays ou la région, nés après la date à partir de laquelle l’interdiction d’alimenter les ruminants avec des farines de viande et d’os et des cretons provenant de ruminants a été appliquée, et d’animaux nés dans un pays ou une région classés, conformément à l’article 5, paragraphe 2, du règlement (CE) no 999/2001, comme pays ou région présentant un risque d’ESB contrôlé, et qui n’ont pas été abattus après étourdissement par injection d’un gaz dans la cavité crânienne ni mis à mort selon la même méthode et n’ont pas été abattus, après étourdissement, par lacération du tissu nerveux central au moyen d’un instrument allongé en forme de tige introduit dans la cavité crânienne;
— que les matières premières d’origine animale provenant de bovins, d’ovins et de caprins ne contiennent pas et ne sont pas tirées de matériels à risque spécifiés définis à l’annexe V du règlement (CE) no 999/2001 ou de viandes séparées mécaniquement obtenues à partir d’os de bovins, d’ovins ou de caprins.]
(1) ou
— [qu’elles proviennent d’un pays ou d’une région classés, conformément à l’article 5, paragraphe 2, du règlement (CE) no 999/2001, dans la catégorie des pays ou régions présentant un risque d’ESB indéterminé;
— que les animaux dont ont été tirées les matières premières d’origine animale provenant de bovins, d’ovins et de caprins n’ont reçu ni farines de viande et d’os ni cretons provenant de ruminants dans leur alimentation et ont été soumis à des inspections ante mortem et post mortem dont les résultats se sont révélés favorables;
— que les animaux dont ont été tirées les matières premières d’origine animale provenant de bovins, d’ovins et de caprins n’ont pas été abattus après étourdissement par injection d’un gaz dans la cavité crânienne ni mis à mort selon la même méthode et n’ont pas été abattus, après étourdissement, par lacération du tissu nerveux central au moyen d’un instrument allongé en forme de tige introduit dans la cavité crânienne;
— que les matières premières d’origine animale provenant de bovins, d’ovins et de caprins ne sont pas tirées:
i) de matériels à risque spécifiés définis à l’annexe V du règlement (CE) no 999/2001;
ii) de tissus nerveux ou lymphatiques rendus apparents durant l’opération de désossage;
iii) de viandes séparées mécaniquement obtenues à partir d’os de bovins, d’ovins ou de caprins.]]

PAYS
Modèle RCG Matières premières devant servir à la production de gélatine/ collagène destinés à la consommation humaine
II. Information sanitaire
II.a. No de référence du certificat
II.b.
(1) [II.2. Attestation de santé animale
Le soussigné, vétérinaire officiel, certifie que les matières premières décrites ci-dessus:
II.2.1. sont constituées de produits animaux qui satisfont aux conditions de police sanitaire ci-dessous;
II.2.2. ont été obtenues, sur le territoire de (1) [ ] (1)ou de [ ](2) (3) (4),
(1) [II.2.2.1. d’animaux qui proviennent d’exploitations et sont restés sur ce territoire depuis leur naissance ou au moins pendant les 3 mois ayant précédé leur abattage] et
(1) [i) qui appartiennent aux espèces visées dans le règlement (UE) no 206/2010 de la Commission du 12 mars 2010 établissant des listes des pays tiers, territoires ou parties de pays tiers ou territoires en provenance desquels l’introduction dans l’Union européenne de certains animaux et viandes fraîches est autorisée, et définissant les exigences applicables en matière de certification vétérinaire (JO L 73 du 20.3.2010, p. 1), répondant à toutes les exigences de police sanitaire applicables à l’importation fixées dans ledit règlement, et ont été abattus à des fins de consommation humaine à une date à laquelle l’importation dans l’Union européenne de viandes fraîches d’animaux de ces espèces en provenance du pays ou du territoire concerné était autorisée conformément à la colonne 8 de l’annexe II, partie I, de ce règlement;]
(1) ou [ii) qui appartiennent aux espèces visées dans le règlement (CE) no 119/2009 de la Commission du 9 février 2009 établissant une liste de pays tiers, ou de parties de pays tiers, pour l’importation dans la Communauté ou le transit par celle-ci de viandes de léporidés sauvages, de certains mammifères terrestres sauvages et de lapins d’élevage, ainsi que les exigences applicables à la certification vétérinaire (JO L 39 du 10.2.2009, p. 12), répondant à toutes les exigences de police sanitaire applicables à l’importation fixées dans ce règlement;]]
(1) ou [II.2.2.1. de volailles qui sont restées sur ce territoire depuis leur éclosion ou qui ont été importées en tant que poussins d’un jour ou que volailles d’abattage en provenance d’un ou de plusieurs pays tiers mentionnés pour ce produit à l’annexe I, partie 1, du règlement (CE) no 798/2008 de la Commission du 8 août 2008 établissant une liste des pays tiers, territoires, zones ou compartiments en provenance desquels les volailles et les produits de volailles peuvent être importés dans la Communauté et transiter par celle-ci ainsi que les règles en matière de certification vétérinaire (JO L 226 du 23.8.2008, p. 1) dans des conditions au moins équivalentes à celles prévues dans ce règlement, appartenant à des espèces visées dans ledit règlement, répondant à toutes les exigences de police sanitaire applicables à l’importation fixées dans le même règlement, et ont été abattues à des fins de consommation humaine à une date à laquelle l’importation dans l’Union européenne de viandes d’animaux de ces espèces en provenance du pays ou du territoire concerné était autorisée conformément à la colonne 6 B de l’annexe I, partie 1, dudit règlement;]
(1) ou [II.2.2.1. d’animaux qui ont été mis à mort dans la nature sur ce territoire (5), la capture et la mise à mort étant intervenues dans une zone:
i) à l’intérieur de laquelle, en ce qui concerne les maladies auxquelles les animaux sont sensibles, aucun cas ou foyer de fièvre aphteuse, de peste bovine, de maladie de Newcastle ou d’influenza aviaire hautement pathogène n’a été constaté au cours des 30 jours précédents, ni aucun cas ou foyer de peste porcine classique ou africaine au cours des 40 jours précédents, et ce dans un rayon de 25 km; et
ii) qui est située à une distance de plus de 20 km des frontières délimitant le territoire d’un autre pays ou d’une partie de celui-ci à partir desquels l’exportation de ce type de matières premières vers l’Union européenne n’est, à ces dates, pas autorisée;
iii) dans laquelle, après leur mise à mort, les animaux ont été transportés dans les 12 heures en vue de leur réfrigération, soit dans un centre de collecte et, immédiatement après, un établissement de gibier, soit directement dans un établissement de gibier;]

PAYS
Modèle RCG Matières premières devant servir à la production de gélatine/ collagène destinés à la consommation humaine
II. Information sanitaire
II.a. No de référence du certificat
II.b.
II.2.3. ont été obtenues dans un établissement autour duquel, dans un rayon de 10 km, en ce qui concerne les maladies auxquelles les animaux sont sensibles, aucun cas ni foyer de fièvre aphteuse, de peste bovine, de maladie de Newcastle, d’influenza aviaire hautement pathogène ou de peste porcine classique ou africaine n’a été constaté au cours des 30 jours précédents ou, en cas d’apparition d’un cas de l’une de ces maladies, la préparation de matières premières destinées à l’exportation vers l’Union européenne n’a été autorisée qu’après l’élimination de toutes les viandes et le nettoyage et la désinfection complets de l’établissement sous le contrôle d’un vétérinaire officiel; et:
II.2.4. ont été obtenues et préparées en l’absence de tout contact avec d’autres matières ne satisfaisant pas aux conditions fixées plus haut et ont été manipulées de manière à éviter une contamination par des agents pathogènes; et
II.2.5. ont été transportées dans des conteneurs ou camions propres et scellés.]
Notes
Partie I
— Case I.8: indiquer le code du territoire tel qu’il apparaît à l’annexe II de la décision 2006/766/CE de la Commission du 6 novembre 2006 établissant les listes des pays tiers et territoires en provenance desquels l’importation de mollusques bivalves, d’échinodermes, de tuniciers, de gastéropodes marins et de produits de la pêche est autorisée (JO L 320 du 18.11.2006, p. 53) et/ou à l’annexe I, partie 1, du règlement (CE) no 798/2008 et/ou à l’annexe I, partie 1, du règlement (CE) no 119/2009 et/ou à l’annexe II, partie 1, du règlement (UE) no 206/2010.
— Case I.11: lieu d’origine: nom et adresse de l’établissement d’expédition; numéro d’enregistrement ou d’agrément, s’il y a lieu.
— Case I.15: numéro d’immatriculation (wagon ou conteneur et camion), numéro de vol (avion) ou nom (navire). Des informations distinctes doivent être fournies en cas de déchargement et de rechargement.
— Case I.19: utiliser le code approprié du système harmonisé (SH) sous les rubriques suivantes: 02 08, 03 05, 05 05, 05 06, 05 11 91, 05 11 99, 41 01, 41 02, 41 03.
— Case I.20: indiquer le poids brut total et le poids net total.
— Case I.23: numéro des scellés/des conteneurs: uniquement s’il y a lieu.
— Case I.28: nature de la marchandise: cuirs, peaux, os, tendons et nerfs;
numéro d’agrément des établissements: numéro d’enregistrement ou d’agrément, selon le cas;
atelier de transformation: y compris les abattoirs, navires-usines, ateliers de découpe, établissements de traitement du gibier et établissements de transformation.
Partie II
(1) Supprimer la ou les mentions inutiles. Dans le cas de produits tirés de produits de la pêche, l’ensemble de la section II.2 doit être supprimé.
(2) Indiquer le nom et le code ISO du pays, du territoire ou de la zone d’exportation comme défini:
— aux annexes de la décision 2006/766/CE,
— à l’annexe I du règlement (CE) no 798/2008,

PAYS
Modèle RCG Matières premières devant servir à la production de gélatine/ collagène destinés à la consommation humaine
II. Information sanitaire
II.a. No de référence du certificat
II.b.
— à l’annexe II, partie 1, du règlement (CE) no 119/2009,
— à l’annexe II, partie 1, du règlement (UE) no 206/2010.
(3) Si certaines parties des matières sont tirées d’animaux originaires d’un ou de plusieurs autres pays tiers mentionnés à l’annexe II du règlement (UE) no 206/2010 pour les importations de ce produit dans l’Union, indiquer le ou les codes du ou des pays ou territoires concernés et du pays tiers d’abattage des animaux (les matières ne peuvent provenir d’un pays ou territoire dont la mention est assortie des garanties supplémentaires A ou F dans la colonne 5 de ladite annexe).
(4) Si les matières sont tirées de volailles d’abattage originaires d’un ou de plusieurs autres pays tiers mentionnés à l’annexe I, partie 1, du règlement (CE) no 798/2008 pour les importations de ce produit dans l’Union, indiquer le ou les codes du ou des pays ou territoires concernés et du pays tiers d’abattage des volailles.
(5) Uniquement pour les pays en provenance desquels l’importation dans l’Union européenne de viandes de gibier de la même espèce animale destinées à la consommation humaine est autorisée.
— La signature et le sceau doivent être d’une couleur différente de celle du texte imprimé.
NB: Note à l’intention de l’intéressé au chargement au sein de l’UE: le présent certificat est établi exclusivement à des fins vétérinaires et doit accompagner le lot jusqu’à son arrivée au poste d’inspection frontalier. Le lot doit être transporté directement jusqu’à l’atelier de transformation de destination.
Vétérinaire officiel
Nom (en lettres capitales): Qualification et titre:
Date: Signature:
Sceau:
PARTIE VI
MODÈLE DE CERTIFICAT POUR L'IMPORTATION DE MATIÈRES PREMIÈRES TRAITÉES DEVANT SERVIR À LA PRODUCTION DE GÉLATINE/COLLAGÈNE DESTINÉS À LA CONSOMMATION HUMAINE

PAYS:
Certificat vétérinaire vers l’UE
Partie I: Renseignements concernant le lot expédié
I.1. Expéditeur
Nom
Adresse
Tél.
I.2. No de référence du certificat
I.2.a.
I.3. Autorité centrale compétente
I.4. Autorité locale compétente
I.5. Destinataire
Nom
Adresse
Code postal
Tél.
I.6.
I.7. Pays d’origine
Code ISO
I.8. Région d’origine
Code
I.9. Pays de destination
Code ISO
I.10.
I.11. Lieu d’origine
Nom Numéro d’agrément
Adresse
I.12.
I.13. Lieu de chargement
I.14. Date du départ
I.15. Moyens de transport
Avion Navire Wagon
Véhicule routier Autres
Identification
Référence documentaire
I.16. PIF d’entrée dans l’UE
I.17.
I.18. Description des marchandises
I.19. Code marchandise (code SH)
I.20. Quantité
I.21. Température produit
Ambiante Réfrigérée Congelée
I.22. Nombre de conditionnements
I.23. Numéro des scellés/des conteneurs
I.24. Type de conditionnement
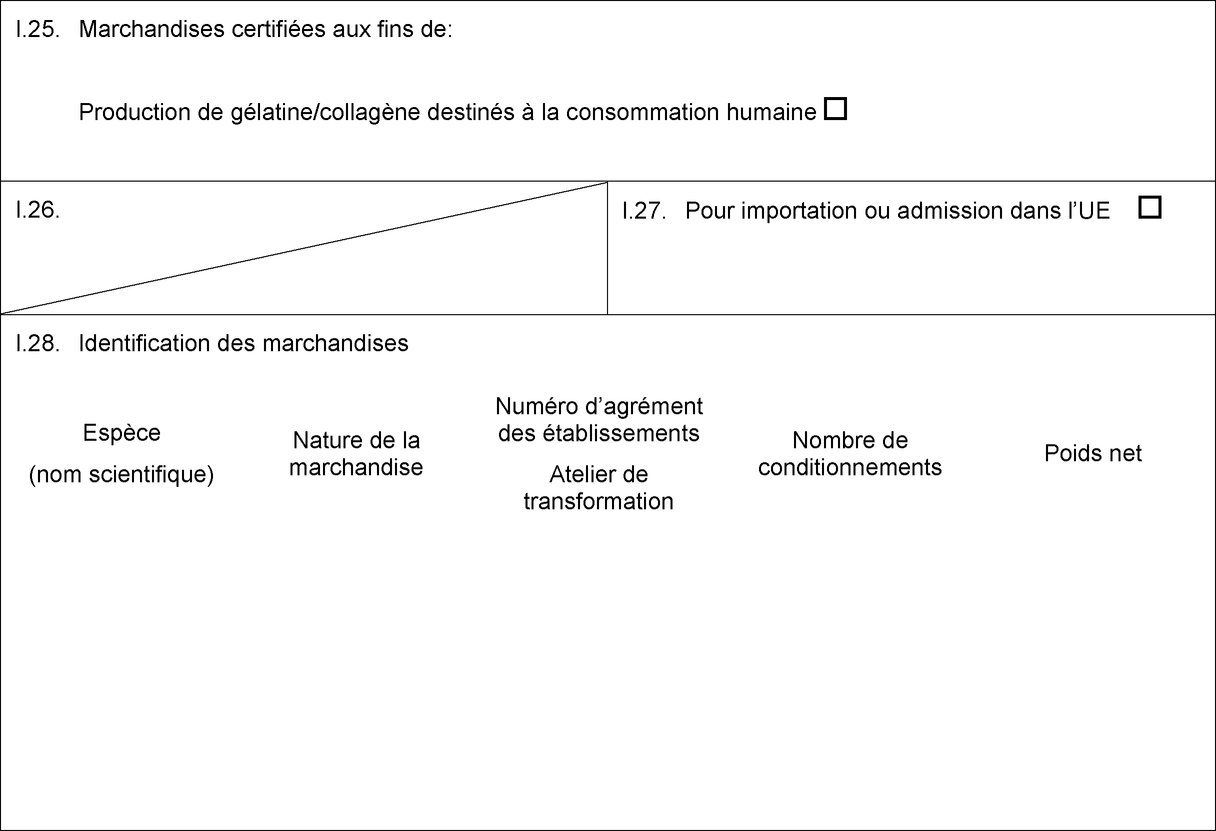
I.25. Marchandises certifiées aux fins de:
Production de gélatine/collagène destinés à la consommation humaine
I.26.
I.27. Pour importation ou admission dans l’UE
I.28. Identification des marchandises
Espèce
(nom scientifique)
Nature de la marchandise
Numéro d’agrément des établissements
Atelier de transformation
Nombre de conditionnements
Poids net

PAYS
Modèle TCG Matières premières traitées devant servir à la production de gélatine/collagène
II. Information sanitaire
II.a. No de référence du certificat
II.b.
II.1. Attestation de santé publique
Le soussigné certifie que les matières premières traitées décrites ci-dessus sont conformes aux exigences suivantes:
— elles proviennent d’établissements placés sous le contrôle de l’autorité compétente et inscrits sur une liste par celle-ci;
et
— (1) [les os, cuirs et peaux de ruminants, de porcs et de volaille domestiques et d’élevage décrits ci-dessus sont tirés d’animaux qui ont été abattus dans un abattoir et dont les carcasses ont été jugées propres à la consommation humaine à l’issue des inspections ante mortem et post mortem;]
(1) et/ou
— [les cuirs, peaux et os de gibier sauvage décrits ci-dessus sont tirés d’animaux mis à mort dont les carcasses ont été jugées propres à la consommation humaine à l’issue des inspections ante mortem et post mortem;]
(1) et/ou
— [les peaux et arêtes de poisson décrites ci-dessus proviennent d’ateliers agréés pour l’exportation transformant des produits de la pêche destinés à la consommation humaine et dont l’exportation est autorisée;]
et
(1) [il s’agit d’os séchés d’animaux des espèces bovine, ovine, caprine, porcine et équine, d’élevage ou sauvage, ou de volailles, y compris les ratites et le gibier à plumes, devant servir à la production de gélatine ou de collagène; ces os proviennent d’animaux sains abattus dans un abattoir et ils ont été traités comme suit:
(1) [ils ont été broyés en morceaux de 15 mm environ et dégraissés à l’eau chaude à une température d’au moins 70 °C pendant au moins 30 minutes, d’au moins 80 °C pendant au moins 15 minutes ou d’au moins 90 °C pendant au moins 10 minutes, puis séparés et ensuite lavés et séchés pendant au moins 20 minutes dans un courant d’air chaud à une température initiale d’au moins 350 °C, ou pendant 15 minutes dans un courant d’air chaud à une température initiale de plus de 700 °C.]
(1) ou [ils ont été séchés au soleil pendant 42 jours au moins à une température moyenne d’au moins 20 °C.]
(1) ou [ils ont subi un traitement acide par lequel le pH à cœur est maintenu à moins de 6 pendant au moins une heure avant séchage.]]
(1) ou [il s’agit de cuirs et de peaux de ruminants d’élevage, de peaux de porcs, de peaux de volailles ou de cuirs et de peaux de gibier sauvage, qui proviennent d’animaux sains et
(1) [qui ont subi un traitement alcalin permettant d’obtenir un pH à cœur > 12, suivi d’un salage pendant au moins sept jours.]
(1) ou [qui ont été séchés pendant 42 jours au moins à une température d’au moins 20 °C.]
(1) ou [qui ont subi un traitement acide permettant d’obtenir un pH à cœur < 5 pendant au moins une heure.]
(1) ou [qui ont subi un traitement alcalin permettant d’obtenir un pH à cœur > 12 pendant au moins 8 heures.]]
(1) ou [il s’agit d’os, de cuirs ou de peaux de ruminants d’élevage, de peaux de porc, de peaux de volailles, de peaux de poissons ou de cuirs ou de peaux de gibier sauvage en provenance de pays tiers, parties de pays tiers et territoires visés à l’annexe I, partie IV, du présent règlement, qui ont subi un autre traitement que les traitements mentionnés ci-dessus et qui proviennent d’établissements enregistrés ou agréés en vertu du règlement (CE) no 852/2004 ou conformément au règlement (CE) no 853/2004
et,
(1) [s’ils proviennent de ruminants, à l’exception des cuirs et peaux de ruminants,
Partie II: Certification

PAYS
Modèle TCG Matières premières traitées devant servir à la production de gélatine/collagène
II. Information sanitaire
II.a. No de référence du certificat
II.b.
(1)
— [ils proviennent d’un pays ou d’une région classés, conformément à l’article 5, paragraphe 2, du règlement (CE) no 999/2001 du Parlement européen et du Conseil du 22 mai 2001 fixant les règles pour la prévention, le contrôle et l’éradication de certaines encéphalopathies spongiformes transmissibles (JO L 147 du 31.5.2001, p. 1), dans la catégorie des pays ou régions présentant un risque d’ESB négligeable;
— les animaux dont ont été tirées les matières premières traitées d’origine animale provenant de bovins, d’ovins et de caprins sont nés, ont été élevés en permanence et abattus dans le pays à risque d’ESB négligeable et ont été soumis à des inspections ante mortem et post mortem dont les résultats se sont révélés favorables;
— si des cas autochtones d’ESB ont été signalés dans le pays ou la région:
i) les animaux sont nés après la date à partir de laquelle l’interdiction d’alimenter les ruminants avec des farines de viande et d’os et des cretons provenant de ruminants a été appliquée; ou
ii) les matières premières traitées d’origine animale provenant de bovins, d’ovins et de caprins ne contiennent pas et ne sont pas tirées de matériels à risque spécifiés définis à l’annexe V du règlement (CE) no 999/2001 ou de viandes séparées mécaniquement obtenues à partir d’os de bovins, d’ovins ou de caprins.]
(1) ou:
— [ils proviennent d’un pays ou d’une région classés, conformément à l’article 5, paragraphe 2, du règlement (CE) no 999/2001, dans la catégorie des pays ou régions présentant un risque d’ESB contrôlé;
— les animaux dont ont été tirées les matières premières traitées d’origine animale provenant de bovins, d’ovins et de caprins ont été soumis à des inspections ante mortem et post mortem dont les résultats se sont révélés favorables;
— les animaux dont ont été tirées les matières premières traitées d’origine animale provenant de bovins, d’ovins et de caprins destinées à l’exportation n’ont pas été abattus après étourdissement par injection d’un gaz dans la cavité crânienne ni mis à mort selon la même méthode et n’ont pas été abattus, après étourdissement, par lacération du tissu nerveux central au moyen d’un instrument allongé en forme de tige introduit dans la cavité crânienne;
— les matières premières traitées d’origine animale provenant de bovins, d’ovins et de caprins ne contiennent pas et ne sont pas tirées de matériels à risque spécifiés définis à l’annexe V du règlement (CE) no 999/2001 ou de viandes séparées mécaniquement obtenues à partir d’os de bovins, d’ovins ou de caprins.]
(1) ou
— [ils proviennent d’un pays ou d’une région classés, conformément à l’article 5, paragraphe 2, du règlement (CE) no 999/2001, dans la catégorie des pays ou régions présentant un risque d’ESB négligeable;
— les animaux dont ont été tirées les matières premières traitées d’origine animale provenant de bovins, d’ovins et de caprins ont été soumis à des inspections ante mortem et post mortem dont les résultats se sont révélés favorables;
— les matières premières traitées d’origine animale provenant de bovins, d’ovins et de caprins destinées à l’exportation sont tirées à la fois d’animaux nés, élevés en permanence et abattus dans un pays ou une région à risque d’ESB négligeable conformément à l’article 5, paragraphe 2, du règlement (CE) no 999/2001, et, si des cas autochtones d’ESB ont été signalés dans le pays ou la région, nés après la date à partir de laquelle l’interdiction d’alimenter les ruminants avec des farines de viande et d’os et des cretons provenant de ruminants a été appliquée, et d’animaux nés dans un pays ou une région classés, conformément à l’article 5, paragraphe 2, du règlement (CE) no 999/2001, comme pays ou région présentant un risque d’ESB contrôlé, et qui n’ont pas été abattus après étourdissement par injection d’un gaz dans la cavité crânienne ni mis à mort selon la même méthode et n’ont pas été abattus, après étourdissement, par lacération du tissu nerveux central au moyen d’un instrument allongé en forme de tige introduit dans la cavité crânienne;

PAYS
Modèle TCG Matières premières traitées devant servir à la production de gélatine/collagène
II. Information sanitaire
II.a. No de référence du certificat
II.b.
— les matières premières traitées d’origine animale provenant de bovins, d’ovins et de caprins ne contiennent pas et ne sont pas tirées de matériels à risque spécifiés définis à l’annexe V du règlement (CE) no 999/2001 ou de viandes séparées mécaniquement obtenues à partir d’os de bovins, d’ovins ou de caprins.]
(1) ou
— [ils proviennent d’un pays ou d’une région classés, conformément à l’article 5, paragraphe 2, du règlement (CE) no 999/2001, dans la catégorie des pays ou régions présentant un risque d’ESB indéterminé;
— les animaux dont ont été tirées les matières premières traitées d’origine animale provenant de bovins, d’ovins et de caprins n’ont reçu ni farines de viande et d’os ni cretons provenant de ruminants dans leur alimentation et ont été soumis à des inspections ante mortem et post mortem dont les résultats se sont révélés favorables;
— les animaux dont ont été tirées les matières premières traitées d’origine animale provenant de bovins, d’ovins et de caprin n’ont pas été abattus après étourdissement par injection d’un gaz dans la cavité crânienne ni mis à mort selon la même méthode et n’ont pas été abattus, après étourdissement, par lacération du tissu nerveux central au moyen d’un instrument allongé en forme de tige introduit dans la cavité crânienne;
— les matières premières traitées d’origine animale provenant de bovins, d’ovins et de caprins ne sont pas tirées:
i) de matériels à risque spécifiés définis à l’annexe V du règlement (CE) no 999/2001;
ii) de tissus nerveux ou lymphatiques rendus apparents durant l’opération de désossage;
iii) de viandes séparées mécaniquement obtenues à partir d’os de bovins, d’ovins ou de caprins.]]
(1) [II.2. Attestation de santé animale
Le soussigné, vétérinaire officiel, certifie que les matières premières traitées décrites ci-dessus:
II.2.1. sont constituées de produits animaux qui satisfont aux conditions de police sanitaire ci-dessous;
II.2.2. ont été obtenues sur le ou les territoires de: (1) [ ] (1)ou de [ ] (2) (3);
II.2.3. ont été obtenues et préparées en l’absence de tout contact avec d’autres matières ne satisfaisant pas aux conditions fixées plus haut et ont été manipulées de manière à éviter une contamination par des agents pathogènes;
II.2.4. ont été transportées dans des conteneurs ou camions propres et scellés.]
Notes
Partie I
— Case I.8: indiquer le code du territoire tel qu’il apparaît à l’annexe II de la décision 2006/766/CE de la Commission du 6 novembre 2006 établissant les listes des pays tiers et territoires en provenance desquels l’importation de mollusques bivalves, d’échinodermes, de tuniciers, de gastéropodes marins et de produits de la pêche est autorisée (JO L 320 du 18.11.2006, p. 53) ou à l’annexe I, partie 1, du règlement (CE) no 798/2008 de la Commission du 8 août 2008 établissant une liste des pays tiers, territoires, zones ou compartiments en provenance desquels les volailles et les produits de volailles peuvent être importés dans la Communauté et transiter par celle-ci ainsi que les règles en matière de certification vétérinaire (JO L 226 du 23.8.2008, p. 1), à l’annexe I, partie 1, du règlement (CE) no 119/2009 de la Commission du 9 février 2009 établissant une liste de pays tiers, ou de parties de pays tiers, pour l’importation dans la Communauté ou le transit par celle-ci de viandes de léporidés sauvages, de certains mammifères terrestres sauvages et de lapins d’élevage, ainsi que les exigences applicables à la certification vétérinaire (JO L 39 du 10.2.2009, p. 12), ou à l’annexe II, partie 1, du règlement (UE) no 206/2010 de la Commission du 12 mars 2010 établissant des listes des pays tiers, territoires ou parties de pays tiers ou territoires en provenance desquels l’introduction dans l’Union européenne de certains animaux et viandes fraîches est autorisée, et définissant les exigences applicables en matière de certification vétérinaire (JO L 73 du 20.3.2010, p. 1).
— Case I.11: lieu d’origine: nom et adresse de l’établissement d’expédition et numéro d’agrément ou numéro d’identification de l’autorité compétente, selon le cas.
— Case I.15: numéro d’immatriculation (wagon ou conteneur et camion), numéro de vol (avion) ou nom (navire). Des informations distinctes doivent être fournies en cas de déchargement et de rechargement.

PAYS
Modèle TCG Matières premières traitées devant servir à la production de gélatine/collagène
II. Information sanitaire
II.a. No de référence du certificat
II.b.
— Case I.19: utiliser le code approprié du système harmonisé (SH) sous les rubriques suivantes: 03 05, 05 05, 05 06, 05 11 91, 05 11 99, 41 01, 41 02, 41 03.
— Case I.20: indiquer le poids brut total et le poids net total.
— Case I.23: numéro des scellés/des conteneurs: uniquement s’il y a lieu.
— Case I.28: nature de la marchandise: cuirs, peaux, os, tendons et nerfs;
numéro d’agrément des établissements: numéro d’agrément ou numéro d’identification de l’autorité compétente, selon le cas;
atelier de transformation: y compris les abattoirs, navires-usines, ateliers de découpe, établissements de traitement du gibier et établissements de transformation.
numéro d’agrément: s’il y a lieu.
Partie II
(1) Supprimer la ou les mentions inutiles. Dans le cas de produits tirés de produits de la pêche, l’ensemble de la section II.2 doit être supprimé.
(2) Indiquer le nom et le code ISO du pays, du territoire ou de la zone d’exportation comme défini à:
— l’annexe II, partie 1, du règlement (UE) no 206/2010,
— à l’annexe I du règlement (CE) no 798/2008,
— l’annexe II, partie 1, du règlement (CE) no 119/2009.
(3) Si certaines parties des matières ont été tirées d’animaux originaires d’un ou de plusieurs autres pays tiers mentionnés à l’annexe I du règlement d’exécution (UE) 2016/759 de la Commission du 28 avril 2016 établissant les listes des pays tiers, parties de pays tiers et territoires en provenance desquels les États membres doivent autoriser l’introduction dans l’Union de certains produits d’origine animale destinés à la consommation humaine, fixant les exigences en matière de certification, modifiant le règlement (CE) n° 2074/2005 et abrogeant la décision 2003/812/CE (JO L 126 du 14.5.2016, p. 13), le ou les codes du ou des pays ou territoires doivent être indiqués.
— La signature et le sceau doivent être d’une couleur différente de celle du texte imprimé.
NB: Note à l’intention de l’intéressé au chargement dans l’UE: le présent certificat est établi exclusivement à des fins vétérinaires et doit accompagner le lot jusqu’à son arrivée au poste d’inspection frontalier. Le lot doit être transporté directement jusqu’à l’atelier de transformation de destination.
— Le temps de transport peut être inclus dans la durée du traitement.
Vétérinaire officiel
Nom (en lettres capitales): Qualification et titre:
Date: Signature:
Sceau:
PARTIE VII
MODÈLE DE CERTIFICAT POUR L'IMPORTATION DE MIEL, DE GELÉE ROYALE ET D'AUTRES PRODUITS DE L'APICULTURE DESTINÉS À LA CONSOMMATION HUMAINE

PAYS:
Certificat vétérinaire vers l’UE
Partie I: Renseignements concernant le lot expédié
I.1. Expéditeur
Nom
Adresse
Tél.
I.2. No de référence du certificat
I.2.a.
I.3. Autorité centrale compétente
I.4. Autorité locale compétente
I.5. Destinataire
Nom
Adresse
Code postal
Tél.
I.6.
I.7. Pays d’origine
Code ISO
I.8.
I.9. Pays de destination
Code ISO
I.10.
I.11. Lieu d’origine
Nom Numéro d’agrément
Adresse
I.12.
I.13. Lieu de chargement
I.14. Date du départ
I.15. Moyens de transport
Avion Navire Wagon
Véhicule routier Autres
Identification
Référence documentaire
I.16. PIF d’entrée dans l’UE
I.17.
I.18. Description des marchandises
I.19. Code marchandise (code SH)
I.20. Quantité
I.21. Température produit
Ambiante Réfrigérée Congelée
I.22. Nombre de conditionnements
I.23. Numéro des scellés/des conteneurs
I.24. Type de conditionnement

I.25. Marchandises certifiées aux fins de:
Consommation humaine
I.26.
I.27. Pour importation ou admission dans l’UE
I.28. Identification des marchandises
Espèce
(nom scientifique)
Type de traitement
Numéro d’agrément des établissements
Atelier de transformation
Nombre de conditionnements
Poids net

PAYS
Modèle HON Miel, gelée royale et autres produits de l’apiculture
II. Information sanitaire
II.a. No de référence du certificat
II.b.
II.1. Attestation de santé publique
Le soussigné déclare avoir connaissance des dispositions applicables du règlement (CE) no 178/2002 du Parlement européen et du Conseil du 28 janvier 2002 établissant les principes généraux et les prescriptions générales de la législation alimentaire, instituant l’Autorité européenne de sécurité des aliments et fixant des procédures relatives à la sécurité des denrées alimentaires (JO L 31 du 1.2.2002, p. 1), du règlement (CE) no 852/2004 du Parlement européen et du Conseil du 29 avril 2004 relatif à l’hygiène des denrées alimentaires (JO L 139 du 30.4.2004, p. 1) et du règlement (CE) no 853/2004 du Parlement européen et du Conseil du 29 avril 2004 fixant des règles spécifiques d’hygiène applicables aux denrées alimentaires d’origine animale (JO L 139 du 30.4.2004, p. 55), et certifie que le miel, la gelée royale et les autres produits de l’apiculture décrits ci-dessus ont été produits conformément à ces dispositions, et notamment:
— qu’ils proviennent d’un ou de plusieurs établissements appliquant un programme fondé sur les principes HACCP conformément au règlement (CE) n° 852/2004;
— qu’ils ont été manipulés et, le cas échéant, préparés, emballés et entreposés de façon hygiénique, conformément aux dispositions de l’annexe II du règlement (CE) no 852/2004;
et
— que les garanties couvrant les animaux vivants et les produits tirés de ces animaux, prévues par les plans relatifs aux résidus présentés conformément à la directive 96/23/CE du Conseil du 29 avril 1996 relative aux mesures de contrôle à mettre en œuvre à l’égard de certaines substances et de leurs résidus dans les animaux vivants et leurs produits et abrogeant les directives 85/358/CEE et 86/469/CEE et les décisions 89/187/CEE et 91/664/CEE (JO L 125 du 23.5.1996, p. 10), et notamment à son article 29, sont réunies.
Notes
Partie I
— Case I.11: lieu d’origine: nom et adresse de l’établissement d’expédition. Par «numéro d’agrément», on entend le numéro d’enregistrement.
— Case I.15: numéro d’immatriculation (wagon ou conteneur et camion), numéro de vol (avion) ou nom (navire). Des informations distinctes doivent être fournies en cas de déchargement et de rechargement.
— Case I.19: utiliser le code approprié du système harmonisé (SH) sous les rubriques suivantes: 04 09, 04 10.
— Case I.20: indiquer le poids brut total et le poids net total.
— Case I.23: numéro des scellés/des conteneurs: uniquement s’il y a lieu.
— Case I.28: type de traitement: indiquer «ultrasons», «homogénéisation», «ultrafiltration», «pasteurisation» ou «aucun traitement thermique».
numéro d’agrément des établissements: numéro d’agrément ou numéro d’identification de l’autorité compétente, selon le cas.
Partie II
— La couleur du sceau et de la signature doit être différente de celle des autres mentions du certificat.
Partie II: Certification
Inspecteur officiel
Nom (en lettres capitales): Qualification et titre:
Date: Signature:
Sceau:
PARTIE VIII
MODÈLE DE CERTIFICAT POUR L'IMPORTATION DE SULFATE DE CHONDROÏTINE, D'ACIDE HYALURONIQUE, D'AUTRES PRODUITS À BASE DE CARTILAGE HYDROLYSÉ, DE CHITOSANE, DE GLUCOSAMINE, DE PRÉSURE, D'ICHTYOCOLLE ET D'ACIDES AMINÉS HAUTEMENT RAFFINÉS DESTINÉS À LA CONSOMMATION HUMAINE

PAYS:
Certificat vétérinaire vers l’UE
Partie I: Renseignements concernant le lot expédié
I.1. Expéditeur
Nom
Adresse
Tél.
I.2. No de référence du certificat
I.2.a.
I.3. Autorité centrale compétente
I.4. Autorité locale compétente
I.5. Destinataire
Nom
Adresse
Code postal
Tél.
I.6.
I.7. Pays d’origine
Code ISO
I.8.
I.9. Pays de destination
Code ISO
I.10.
I.11. Lieu d’origine
Nom Numéro d’agrément
Adresse
I.12.
I.13. Lieu de chargement
I.14. Date du départ
I.15. Moyens de transport
Avion Navire Wagon
Véhicule routier Autres
Identification
Référence documentaire
I.16. PIF d’entrée dans l’UE
I.17.
I.18. Description des marchandises
I.19. Code marchandise (code SH)
I.20. Quantité
I.21. Température produit
Ambiante Réfrigérée Congelée
I.22. Nombre de conditionnements
I.23. Numéro des scellés/des conteneurs
I.24. Type de conditionnement

I.25. Marchandises certifiées aux fins de:
Consommation humaine
I.26.
I.27. Pour importation ou admission dans l’UE
I.28. Identification des marchandises
Espèce
(nom scientifique)
Date de production
(jj/mm/aaaa)
Numéro d’agrément des établissements
Atelier de transformation
Nombre de conditionnements
Poids net

PAYS
Modèle HRP Sulfate de chondroïtine, acide hyaluronique, autres produits à base de cartilage hydrolysé, chitosane, glucosamine, présure, ichtyocolle et acides aminés hautement raffinés destinés à la consommation humaine
II. Information sanitaire
II.a. No de référence du certificat
II.b.
II.1. Attestation de santé publique
Le soussigné déclare avoir connaissance des dispositions applicables du règlement (CE) no 178/2002 du Parlement européen et du Conseil du 28 janvier 2002 établissant les principes généraux et les prescriptions générales de la législation alimentaire, instituant l’Autorité européenne de sécurité des aliments et fixant des procédures relatives à la sécurité des denrées alimentaires (JO L 31 du 1.2.2002, p. 1), du règlement (CE) no 852/2004 du Parlement européen et du Conseil du 29 avril 2004 relatif à l’hygiène des denrées alimentaires (JO L 139 du 30.4.2004, p. 1) et du règlement (CE) no 853/2004 du Parlement européen et du Conseil du 29 avril 2004 fixant des règles spécifiques d’hygiène applicables aux denrées alimentaires d’origine animale (JO L 139 du 30.4.2004, p. 55), et certifie que les produits hautement raffinés décrits ci-dessus ont été produits conformément à ces dispositions, et notamment:
— qu’ils proviennent d’un ou d’établissements appliquant un programme fondé sur les principes HACCP conformément au règlement (CE) no 852/2004;
— qu’ils ont été manipulés et, le cas échéant, préparés, emballés et entreposés de façon hygiénique, conformément aux dispositions de l’annexe II du règlement (CE) no 852/2004;
— qu’ils sont conformes aux exigences de l’annexe III, section XVI, du règlement (CE) no 853/2004;
et
— (1) [s’il s’agit d’acides aminés,
i) que des cheveux humains n’ont pas été utilisés comme source pour leur fabrication, et
ii) qu’ils sont conformes au règlement (CE) no 1333/2008 du Parlement européen et du Conseil du 16 décembre 2008 sur les additifs alimentaires (JO L 354 du 31.12.2008, p. 16).]
Notes
Partie I
— Case I.11: lieu d’origine: nom et adresse de l’établissement d’expédition.
— Case I.15: numéro d’immatriculation (wagon ou conteneur et camion), numéro de vol (avion) ou nom (navire). Des informations distinctes doivent être fournies en cas de déchargement et de rechargement.
— Case I.19: utiliser le code approprié du système harmonisé (SH) sous les rubriques suivantes: 21 06 90, 29 22, 29 30, 29 32, 35 03, 35 07 ou 39 13.
— Case I.20: indiquer le poids brut total et le poids net total.
— Case I.23: numéro des scellés/des conteneurs: uniquement s’il y a lieu.
Partie II
(1) Supprimer la ou les mentions inutiles.
— La couleur du sceau et de la signature doit être différente de celle des autres mentions du certificat.
Partie II: Certification
Vétérinaire officiel Nom (en lettres capitales):
Qualification et titre:
Date: Signature:
Sceau:
(1) Sauf importation relevant de la partie VI.
ANNEXE III
MODÈLE DE CERTIFICAT POUR LE TRANSIT PAR L'UNION (TRANSIT IMMÉDIAT OU APRÈS STOCKAGE) DE MATIÈRES PREMIÈRES OU DE MATIÈRES PREMIÈRES TRAITÉES DEVANT SERVIR À LA PRODUCTION DE GÉLATINE/COLLAGÈNE DESTINÉS À LA CONSOMMATION HUMAINE

PAYS:
Certificat vétérinaire vers l’UE
Partie I: Renseignements concernant le lot expédié
I.1. Expéditeur
Nom
Adresse
Tél.
I.2. No de référence du certificat
I.2.a.
I.3. Autorité centrale compétente
I.4. Autorité locale compétente
I.5. Destinataire
Nom
Adresse
Code postal
Tél.
I.6. Intéressé au chargement au sein de l’Union européenne
Nom
Adresse
Code postal
Tél.
I.7. Pays d’origine
Code ISO
I.8. Région d’origine
Code
I.9. Pays de destination
Code ISO
I.10.
I.11. Lieu d’origine
Nom
Adresse
I.12. Lieu de destination
Entrepôt douanier Avitailleur
Nom Numéro d’agrément
Adresse
Code postal
I.13. Lieu de chargement
I.14. Date du départ
I.15. Moyens de transport
Avion Navire Wagon
Véhicule routier Autres
Identification
Référence documentaire
I.16. PIF d’entrée dans l’UE
I.17.
I.18. Description des marchandises
I.19. Code marchandise (code SH)
I.20. Quantité
I.21. Température produit
Ambiante Réfrigérée Congelée
I.22. Nombre de conditionnements
I.23. Numéro des scellés/des conteneurs
I.24. Type de conditionnement

I.25. Marchandises certifiées aux fins de:
Production de gélatine/collagène destinés à la consommation humaine
I.26. Pour transit par l’UE vers un pays tiers
Pays tiers Code ISO
I.27.
I.28. Identification des marchandises
Espèce
(nom scientifique)
Atelier de transformation
Nombre de conditionnements
Poids net

PAYS
Modèle TRANSIT/STOCKAGE
II. Information sanitaire
II.a. No de référence du certificat
II.b.
II.1. Attestation de santé animale
Le soussigné, vétérinaire officiel, certifie que les matières premières ou matières premières traitées décrites dans la partie I:
II.1.1. proviennent d’un pays ou d’une région en provenance desquels les importations dans l’Union européenne sont autorisées conformément à l’annexe I, partie 1, du règlement (CE) no 798/2008 de la Commission du 8 août 2008 établissant une liste des pays tiers, territoires, zones ou compartiments en provenance desquels les volailles et les produits de volailles peuvent être importés dans la Communauté et transiter par celle-ci ainsi que les règles en matière de certification vétérinaire (JO L 226 du 23.8.2008, p. 1) ou au règlement (CE) no 119/2009 de la Commission du 9 février 2009 établissant une liste de pays tiers, ou de parties de pays tiers, pour l’importation dans la Communauté ou le transit par celle-ci de viandes de léporidés sauvages, de certains mammifères terrestres sauvages et de lapins d’élevage, ainsi que les exigences applicables à la certification vétérinaire (JO L 39 du 10.2.2009, p. 12) ou à l’annexe II, partie 1, du règlement (UE) no 206/2010 de la Commission du 12 mars 2010 établissant des listes des pays tiers, territoires ou parties de pays tiers ou territoires en provenance desquels l’introduction dans l’Union européenne de certains animaux et viandes fraîches est autorisée et définissant les exigences applicables en matière de certification vétérinaire (JO L 73 du 20.3.2010, p. 1); et
II.1.2. satisfont aux conditions de police sanitaire applicables, énoncées dans l’attestation de santé animale du modèle de certificat figurant à l’annexe II, partie V ou VI, du règlement d’exécution (UE) 2016/759 de la Commission du 28 avril 2016 établissant les listes des pays tiers, parties de pays tiers et territoires en provenance desquels les États membres doivent autoriser l’introduction dans l’Union de certains produits d’origine animale destinés à la consommation humaine, fixant les exigences en matière de certification, modifiant le règlement (CE) n° 2074/2005 et abrogeant la décision 2003/812/CE (JO L 126 du 14.5.2016, p. 13).
Notes
Le présent certificat concerne le transit et le stockage, conformément à l’article 12, paragraphe 4, ou à l’article 13 de la directive 97/78/CE du Conseil du 18 décembre 1997 fixant les principes relatifs à l’organisation des contrôles vétérinaires pour les produits en provenance des pays tiers introduits dans la Communauté (JO L 24 du 30.1.1998, p. 9), de matières premières ou de matières premières traitées devant servir à la production de gélatine/collagène destinés à la consommation humaine, et provenant:
1) de bovins domestiques (y compris les espèces des genres Bubalus et Bison ainsi que leurs hybrides);
2) d’ovins (Ovis aries) ou caprins (Capra hircus) domestiques;
3) de porcins domestiques (Sus scrofa);
4) de solipèdes domestiques (Equus caballus, Equus asinus ainsi que leurs hybrides);
5) d’animaux d’élevage d’espèces non domestiques appartenant à l’ordre Artiodactyla [à l’exception des bovins (y compris les espèces des genres Bison et Bubalus ainsi que leurs hybrides), d’Ovis aries, de Capra hircus ainsi que des Suidae et Tayassuidae] et aux familles Rhinocerotidae et Elephantidae;
6) d’animaux sauvages d’espèces non domestiques appartenant à l’ordre Artiodactyla [à l’exception des bovins (y compris les espèces des genres Bison et Bubalus ainsi que leurs hybrides), d’Ovis aries, de Capra hircus ainsi que des Suidae et Tayassuidae] et aux familles Rhinocerotidae et Elephantidae;
7) d’animaux d’élevage d’espèces non domestiques appartenant aux familles Suidae, Tayassuidae ou Tapiridae;
8) d’animaux sauvages d’espèces non domestiques appartenant aux familles Suidae, Tayassuidae ou Tapiridae;
9) de solipèdes sauvages appartenant au sous-genre Hippotigris (zèbre);
10) de léporidés sauvages (lapins et lièvres);
11) de mammifères terrestres sauvages autres que les ongulés et les léporidés;
12) de lapins d’élevage;
13) de volailles;
14) de ratites d’élevage;
15) de gibier sauvage;
16) de poissons.
Partie II: Certification

PAYS
Modèle TRANSIT/STOCKAGE
II. Information sanitaire
II.a. No de référence du certificat
II.b.
Partie I
— Case I.8: indiquer le code du territoire tel qu’il apparaît à l’annexe II, partie 1, du règlement (UE) no 206/2010 ou à l’annexe I, partie 1, du règlement (CE) no 119/2009 ou à l’annexe I, partie 1, du règlement (CE) no 798/2008 ou à l’annexe II de la décision 2006/766/CE de la Commission du 6 novembre 2006 établissant les listes des pays tiers et territoires en provenance desquels l’importation de mollusques bivalves, d’échinodermes, de tuniciers, de gastéropodes marins et de produits de la pêche est autorisée (JO L 320 du 18.11.2006, p. 53).
— Case I.11: lieu d’origine: nom et adresse de l’établissement d’expédition.
— Case I.12: indiquer l’adresse (et le numéro d’agrément s’il est connu) de l’entrepôt en zone franche, de l’entrepôt franc, de l’entrepôt douanier ou du fournisseur de navires.
— Case I.15: indiquer le numéro d’enregistrement ou d’immatriculation (wagon ou conteneur et camion), le numéro de vol (avion) ou le nom (navire). En cas de déchargement et de rechargement, l’expéditeur doit en informer le poste d’inspection frontalier d’entrée dans l’Union européenne.
— Case I.19: utiliser le code du système harmonisé (SH) sous la rubrique 02 08, 03 05, 05 04, 05 05, 05 06, 05 11 91, 05 11 99, 41 01, 41 02, 41 03.
— Case I.20: indiquer le poids brut total et le poids net total.
— Case I.23: en ce qui concerne les conteneurs ou les boîtes, il convient d’indiquer le numéro du conteneur et, le cas échéant, celui des scellés.
— Case I.28: atelier de transformation: indiquer le numéro d’enregistrement, le numéro d’agrément ou le numéro d’identification de l’établissement délivré par l’autorité compétente, selon le cas. Le terme s’applique aussi aux abattoirs, navires-usines, ateliers de découpe, établissements de traitement du gibier et établissements de transformation.
Vétérinaire officiel ou inspecteur officiel
Nom (en lettres capitales): Qualification et titre:
Date: Signature:
Sceau:
ANNEXE IV
NOTES EXPLIQUANT COMMENT REMPLIR LES CERTIFICATS
(visées à l'article 2, paragraphe 1, et à l'article 4, paragraphe 1)
|
a) |
Les certificats sont délivrés par le pays tiers exportateur sur la base des modèles figurant aux annexes II et III et dans le respect de la mise en pages du modèle correspondant aux produits d'origine animale concernés. Ils doivent contenir, numérotées dans l'ordre indiqué sur le modèle, les attestations exigées pour tout pays tiers et, le cas échéant, les garanties supplémentaires requises pour le pays tiers exportateur ou pour une partie de ce dernier. Si l'État membre de destination impose, pour les produits d'origine animale concernés, des conditions de certification supplémentaires, il est également certifié sur le formulaire original du certificat que ces conditions sont remplies. |
|
b) |
Lorsqu'il est précisé dans le modèle de certificat qu'il convient de choisir, parmi une série de mentions, celle qui convient, les mentions inutiles peuvent être biffées par le certificateur, qui doit en outre y apposer son paraphe et son sceau, ou être entièrement supprimées du certificat. |
|
c) |
Un certificat distinct et unique doit être fourni pour les produits d'origine animale exportés à partir d'un ou de plusieurs territoires ou zones du même pays exportateur figurant ou visés à l'annexe I qui ont la même destination et sont transportés dans le même wagon, camion, avion ou navire. |
|
d) |
L'original de chaque certificat se compose d'une seule feuille de papier, ou, si cela ne suffit pas, il doit être présenté de façon à ce que toutes les feuilles de papier nécessaires fassent partie d'un tout intégré et indivisible. |
|
e) |
Le certificat est établi dans au moins une des langues officielles de l'État membre dans lequel se trouve le poste d'inspection frontalier d'entrée du lot dans l'Union et de l'État membre de destination. Néanmoins, ces États membres peuvent autoriser qu'il soit établi dans la langue officielle d'un autre État membre et accompagné, si nécessaire, d'une traduction officielle. |
|
f) |
Si des feuilles supplémentaires sont jointes au certificat pour des raisons liées à l'identification des différents éléments du lot (tableau au point I.28 du modèle de certificat), ces feuilles sont également considérées comme faisant partie de l'original du certificat à condition que la signature et le sceau du certificateur figurent au minimum sur chaque page. |
|
g) |
Lorsque le certificat, y compris les feuilles supplémentaires visées au point f), comporte plus d'une page, chaque page doit être numérotée au bas de la page — (numéro de la page) de (nombre total de pages) — et le numéro de référence du certificat attribué par l'autorité compétente doit figurer en haut des pages. |
|
h) |
Le certificat original doit être rempli et signé par un vétérinaire officiel ou, lorsque le modèle de certificat le prévoit, par un autre inspecteur officiel désigné. Les autorités compétentes du pays tiers exportateur garantissent l'observation de règles de certification équivalentes à celles fixées dans la directive 96/93/CE du Conseil (1). La couleur de la signature est différente de celle du texte imprimé. Cette règle vaut également pour les sceaux, à l'exclusion des reliefs et des filigranes. |
|
i) |
Le numéro de référence du certificat, à mentionner dans les cases I.2 et II.a, doit être attribué par l'autorité compétente. |
(1) Directive 96/93/CE du Conseil du 17 décembre 1996 concernant la certification des animaux et des produits animaux (JO L 13 du 16.1.1997, p. 28).
|
14.5.2016 |
FR |
Journal officiel de l'Union européenne |
L 126/63 |
RÈGLEMENT D'EXÉCUTION (UE) 2016/760 DE LA COMMISSION
du 13 mai 2016
sur des mesures de soutien exceptionnelles pour les secteurs des œufs et de la viande de volaille en Italie
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l'Union européenne,
vu le règlement (UE) no 1308/2013 du Parlement européen et du Conseil du 17 décembre 2013 portant organisation commune des marchés des produits agricoles et abrogeant les règlements (CEE) no 922/72, (CEE) no 234/79, (CE) no 1037/2001 et (CE) no 1234/2007 du Conseil (1), et notamment son article 220, paragraphe 1, point a),
considérant ce qui suit:
|
(1) |
Le 15 décembre 2014, une influenza aviaire hautement pathogène du sous-type H5N8 a été confirmée et notifiée par l'Italie. L'apparition de cette maladie a été confirmée dans une exploitation commerciale de dindons d'engraissement située dans la commune de Porto Viro, dans la province de Rovigo (Vénétie), en Italie. |
|
(2) |
L'Italie a immédiatement et efficacement pris toutes les mesures zoosanitaires et vétérinaires qui s'imposent, conformément à la directive 2005/94/CE du Conseil (2). |
|
(3) |
En particulier, les autorités italiennes ont pris des mesures de lutte, de contrôle et de prévention et ont établi des zones de protection et de surveillance en vertu de la décision d'exécution 2014/936/UE de la Commission (3). Ce faisant, elles ont été en mesure d'éradiquer rapidement la menace. Des mesures zoosanitaires et vétérinaires prises au niveau de l'Union et de l'État membre ont été appliquées jusqu'au 16 février 2015 dans toutes les exploitations, à l'exception de l'exploitation de dindons d'engraissement dans laquelle des mesures ont été appliquées jusqu'au 25 février 2015. |
|
(4) |
Le 23 juin 2015, les autorités italiennes ont informé la Commission que les mesures zoosanitaires et vétérinaires nécessaires, appliquées pour contenir et éradiquer la propagation du virus, avaient affecté certains opérateurs et que ces opérateurs avaient subi des pertes de revenus qui ne peuvent pas donner lieu à une participation financière de l'Union au titre du règlement (UE) no 652/2014 du Parlement européen et du Conseil (4). |
|
(5) |
Le même jour, la Commission a reçu des autorités italiennes une demande officielle de cofinancement de certaines mesures de soutien exceptionnelles, en vertu de l'article 220, paragraphe 3, du règlement (UE) no 1308/2013. Les autorités italiennes ont précisé leur demande les 11 et 27 janvier 2016. |
|
(6) |
À la suite de l'application des mesures zoosanitaires et vétérinaires, le placement des oiseaux dans les exploitations d'engraissement de chapons, de poulets Golden, de poulets et de dindes standards, situées dans les zones de protection et de surveillance ayant été retardé, une exploitation de dindes reproductrices située dans ces zones ne pouvait pas produire d'œufs à couver. Il en a résulté des pertes liées à la production de viande de chapons, de poulets Golden, de poulets et de dindes standards d'engraissement, et à la production d'œufs à couver de dindes reproductrices durant la période où les mesures zoosanitaires et vétérinaires étaient en place. Il y a donc lieu de compenser ces pertes. |
|
(7) |
À la suite de l'application des mesures zoosanitaires et vétérinaires, les poulets en provenance de plusieurs exploitations situées dans la zone de protection ont été immédiatement abattus et la viande obtenue à partir de ces poulets soit a subi un traitement thermique, conformément à l'article 23 de la directive 2005/94/CE, soit a été congelée afin de faciliter la vente progressive de la viande de volaille congelée dans la zone de protection. Les pertes résultant de la différence de valeur entre la viande de volaille fraîche et la viande de volaille ayant subi un traitement thermique ou ayant été congelée devraient donc donner lieu à une compensation. |
|
(8) |
Conformément à l'article 220, paragraphe 5, du règlement (UE) no 1308/2013, l'Union participe au financement à concurrence de 50 % des dépenses supportées par l'Italie pour les mesures de soutien exceptionnelles. Les quantités maximales pouvant faire l'objet d'une compensation financière pour chacune des mesures exceptionnelles de soutien du marché devraient être fixées par la Commission après examen de la demande présentée par l'Italie. |
|
(9) |
Afin d'éviter tout risque de surcompensation, un montant forfaitaire de cofinancement devrait être fixé à un niveau approprié pour chaque produit. |
|
(10) |
Les espèces concernées sont les poulets (chapons, poulets Golden et poulets standards), les dindes et les dindons de chair, les dindes pondeuses et la viande de poulet congelée ou ayant subi un traitement thermique. |
|
(11) |
Afin d'éviter tout risque de double financement, les pertes subies n'auraient pas dû être compensées par des aides d'État ou des assurances, et il y a lieu de limiter le cofinancement de l'Union au titre du présent règlement aux produits admissibles pour lesquels aucune participation financière de l'Union n'a été reçue au titre du règlement (UE) no 652/2014. |
|
(12) |
L'étendue et la durée des mesures de soutien exceptionnelles prévues au présent règlement devraient être limitées à ce qui est strictement nécessaire pour le soutien du marché concerné. |
|
(13) |
Dans un souci de bonne gestion budgétaire de ces mesures de soutien exceptionnelles, seuls les montants versés au plus tard le 30 septembre 2016 par l'Italie aux bénéficiaires seront admissibles au cofinancement de l'Union. Il n'y a pas lieu d'appliquer l'article 5, paragraphe 2, du règlement délégué (UE) no 907/2014 de la Commission (5). |
|
(14) |
Afin de garantir l'admissibilité et l'exactitude des paiements, il importe que les autorités italiennes effectuent des contrôles ex ante. |
|
(15) |
Pour permettre à l'Union de procéder au contrôle financier, les autorités italiennes sont tenues d'informer la Commission de l'apurement des paiements. |
|
(16) |
Afin d'assurer la mise en œuvre immédiate de ces mesures en Italie, il convient que le présent règlement entre en vigueur le jour suivant celui de sa publication. |
|
(17) |
Les mesures prévues au présent règlement sont conformes à l'avis du comité de l'organisation commune des marchés agricoles, |
A ADOPTÉ LE PRÉSENT RÈGLEMENT:
Article premier
L'Union participe au financement des mesures à concurrence de 50 % des dépenses supportées par l'Italie pour soutenir les marchés des œufs à couver et de la viande de volaille, gravement touchés par l'apparition du foyer d'influenza aviaire hautement pathogène de sous-type H5N8, décelée et notifiée par l'Italie le 15 décembre 2014 et pour laquelle des mesures zoosanitaires et vétérinaires prises au niveau de l'Union et de l'État membre étaient applicables jusqu'au 16 février 2015 dans toutes les exploitations, à l'exception de l'exploitation de dindons d'engraissement dans laquelle des mesures ont été appliquées jusqu'au 25 février 2015.
Seuls les montants versés par l'Italie aux bénéficiaires avant le 30 septembre 2016 sont admissibles au cofinancement de l'Union. L'article 5, paragraphe 2, du règlement délégué (UE) no 907/2014 ne s'applique pas.
Article 2
Le niveau maximal du cofinancement de l'Union s'établit comme suit:
|
a) |
pour les pertes liées à la production d'œufs à couver de dindes reproductrices provenant d'exploitations situées dans la zone de surveillance, un montant forfaitaire de 0,42 EUR par œuf à couver «dinde» du code NC 0407 19 11, pour un maximum de 313 560 œufs; |
|
b) |
pour les pertes liées à la production de viande de volaille en raison des retards entraînés par les mesures zoosanitaires et vétérinaires en ce qui concerne les chapons, les poulets Golden, les poulets standards et les dindes et les dindons d'engraissement provenant des exploitations situées dans les zones de protection et de surveillance, un montant forfaitaire de:
|
|
c) |
pour les pertes résultant de la différence de valeur entre la viande de volaille fraîche et la viande de volaille ayant subi un traitement thermique obtenues à partir de poulets standards qui ont été immédiatement abattus dans la zone de protection, le taux forfaitaire est de 0,3761 EUR/kg de poids vif, jusqu'à un montant total de 98 297,50 EUR; |
|
d) |
pour les pertes résultant de la différence de valeur entre la viande de volaille fraîche et la viande de volaille congelée obtenues à partir de poulets standards qui ont été immédiatement abattus dans la zone de protection, le taux forfaitaire est de 0,04 EUR/kg de viande de poulet, jusqu'à un montant total de 3 402,44 EUR. |
Article 3
Le cofinancement de l'Union prévu conformément au présent règlement est limité aux produits ne faisant l'objet d'aucune compensation par des aides d'État ou des assurances et pour lesquels aucune participation financière de l'Union n'a été reçue au titre du règlement (UE) no 652/2014.
Article 4
Avant de procéder au moindre paiement, l'Italie effectue des contrôles administratifs et physiques complets pour s'assurer du respect du présent règlement.
En particulier, les autorités italiennes s'assurent:
|
a) |
de l'admissibilité du bénéficiaire présentant la demande d'aide; |
|
b) |
pour chaque opérateur admissible, de l'admissibilité, de la quantité et de la perte réelle liée à la production d'œufs à couver de dindes reproductrices; |
|
c) |
pour chaque opérateur admissible, de l'admissibilité, de la quantité et de la perte réelle liée à la production de viande de poulet et de dinde en raison des retards dans le placement des chapons, poulets Golden, poulets et dindes standards d'engraissement dans les exploitations situées dans les zones de protection et de surveillance pendant l'application des mesures zoosanitaires et vétérinaires; |
|
d) |
pour chaque opérateur admissible, de l'admissibilité, de la quantité et de la perte réelle de valeur entre la viande de poulet fraîche et la viande de poulet ayant subi un traitement thermique, obtenues à partir de poulets standards qui ont été immédiatement abattus dans la zone de protection pendant l'application des mesures zoosanitaires et vétérinaires; |
|
e) |
pour chaque opérateur admissible, de l'admissibilité, de la quantité et de la perte réelle de valeur entre la viande de poulet fraîche et la viande de poulet congelée, obtenues à partir de poulets standards qui ont été immédiatement abattus dans la zone de protection pendant l'application des mesures zoosanitaires et vétérinaires; |
|
f) |
qu'aucun opérateur admissible n'a obtenu de financement provenant d'une autre source pour compenser les pertes visées à l'article 2. |
Article 5
Les autorités italiennes informent la Commission de l'apurement des paiements.
Article 6
Le présent règlement entre en vigueur le jour suivant celui de sa publication au Journal officiel de l'Union européenne.
Le présent règlement est obligatoire dans tous ses éléments et directement applicable dans tout État membre.
Fait à Bruxelles, le 13 mai 2016.
Par la Commission
Le président
Jean-Claude JUNCKER
(1) JO L 347 du 20.12.2013, p. 671.
(2) Directive 2005/94/CE du Conseil du 20 décembre 2005 concernant des mesures communautaires de lutte contre l'influenza aviaire et abrogeant la directive 92/40/CEE (JO L 10 du 14.1.2006, p. 16).
(3) Décision d'exécution 2014/936/UE de la Commission du 17 décembre 2014 concernant certaines mesures de protection motivées par la détection de l'influenza aviaire hautement pathogène du sous-type H5N8 en Italie (JO L 365 du 19.12.2014, p. 160).
(4) Règlement (UE) no 652/2014 du Parlement européen et du Conseil du 15 mai 2014 fixant des dispositions pour la gestion des dépenses relatives, d'une part, à la chaîne de production des denrées alimentaires, à la santé et au bien-être des animaux et, d'autre part, à la santé et au matériel de reproduction des végétaux, modifiant les directives du Conseil 98/56/CE, 2000/29/CE et 2008/90/CE, les règlements du Parlement européen et du Conseil (CE) no 178/2002, (CE) no 882/2004, (CE) no 396/2005 et (CE) no 1107/2009 ainsi que la directive 2009/128/CE du Parlement européen et du Conseil et abrogeant les décisions du Conseil 66/399/CEE, 76/894/CEE et 2009/470/CE (JO L 189 du 27.6.2014, p. 1).
(5) Règlement délégué (UE) no 907/2014 de la Commission du 11 mars 2014 complétant le règlement (UE) no 1306/2013 du Parlement européen et du Conseil en ce qui concerne les organismes payeurs et autres entités, la gestion financière, l'apurement des comptes, les garanties et l'utilisation de l'euro (JO L 255 du 28.8.2014, p. 18).
|
14.5.2016 |
FR |
Journal officiel de l'Union européenne |
L 126/67 |
RÈGLEMENT D'EXÉCUTION (UE) 2016/761 DE LA COMMISSION
du 13 mai 2016
portant dérogation au règlement d'exécution (UE) no 809/2014 en ce qui concerne la date limite de dépôt de la demande unique, des demandes d'aide ou de paiement, la date limite de notification des modifications apportées à la demande unique ou à la demande de paiement, et la date limite de dépôt des demandes d'attribution de droits au paiement ou d'augmentation de la valeur des droits au paiement au titre du régime de paiement de base pour l'année 2016
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l'Union européenne,
vu le règlement (UE) no 1306/2013 du Parlement européen et du Conseil du 17 décembre 2013 relatif au financement, à la gestion et au suivi de la politique agricole commune et abrogeant les règlements (CEE) no 352/78, (CE) no 165/94, (CE) no 2799/98, (CE) no 814/2000, (CE) no 1290/2005 et (CE) no 485/2008 du Conseil (1), et notamment son article 78, premier alinéa, point b), et deuxième alinéa,
considérant ce qui suit:
|
(1) |
Le règlement d'exécution (UE) no 809/2014 de la Commission (2) prévoit la date limite de dépôt de la demande unique, des demandes d'aide ou de paiement, la date limite de notification des modifications apportées à la demande unique ou à la demande de paiement, et la date limite de dépôt des demandes d'attribution de droits au paiement ou d'augmentation de la valeur des droits au paiement au titre du régime de paiement de base. |
|
(2) |
Compte tenu des difficultés administratives rencontrées au cours de la première année de mise en œuvre du nouveau cadre juridique pour les régimes de paiements directs et les mesures de développement rural et qui persistent dans certains États membres, ainsi que des nouveaux éléments liés à la préparation du processus de demande pour l'année de demande 2016, la gestion de la demande unique, des demandes d'aide et de paiement, ainsi que des demandes d'attribution de droits au paiement ou d'augmentation de la valeur des droits au paiement au titre du régime de paiement de base, est retardée dans certains États membres. Ces difficultés surviennent dans le contexte général de la situation économique préoccupante de certains secteurs agricoles. |
|
(3) |
Cette situation a eu des répercussions sur la possibilité, pour les bénéficiaires, d'introduire une demande unique, des demandes d'aide ou de paiement, ainsi que des demandes d'attribution de droits au paiement ou d'augmentation de la valeur des droits au paiement au titre du régime de paiement de base, dans les délais prévus à l'article 13, paragraphe 1, et à l'article 22, paragraphe 1, du règlement d'exécution (UE) no 809/2014. |
|
(4) |
Compte tenu de cette situation, il convient de prévoir une dérogation aux dispositions de l'article 13, paragraphe 1, et de l'article 22, paragraphe 1, du règlement d'exécution (UE) no 809/2014 pour permettre aux États membres de fixer, pour l'année 2016, la date limite de dépôt de la demande unique, des demandes d'aide ou de paiement, ainsi que la date limite de dépôt des demandes d'attribution de droits au paiement ou d'augmentation de la valeur des droits au paiement au titre du régime de paiement de base, lorsque ces dates sont ultérieures à celles prévues auxdits articles. Étant donné que les dates et les délais visés à l'article 11, paragraphe 4, et à l'article 15, paragraphes 2 et 2 bis, du règlement d'exécution (UE) no 809/2014 sont liés à la date limite prévue à l'article 13, paragraphe 1, du même règlement, une dérogation similaire devrait être prévue pour la notification de modifications relatives à la demande unique ou à la demande de paiement et de contrôles préliminaires. |
|
(5) |
Étant donné que ces dérogations couvrent la demande unique, les demandes d'aide et de paiement, les modifications relatives à la demande unique ou à la demande de paiement, ainsi que les demandes d'attribution de droits au paiement introduites au titre de l'année 2016, il importe que le présent règlement s'applique aux demandes d'aide et de paiement introduites au titre de l'année 2016. |
|
(6) |
Les mesures prévues par le présent règlement sont conformes à l'avis du comité de gestion des paiements directs et du comité pour le développement rural, |
A ADOPTÉ LE PRÉSENT RÈGLEMENT:
Article premier
Par dérogation à l'article 13, paragraphe 1, premier alinéa, du règlement d'exécution (UE) no 809/2014, pour l'année 2016, les dates limites fixées par les États membres pour le dépôt de la demande unique, des demandes d'aide ou des demandes de paiement ne peuvent être postérieures au 15 juin.
Article 2
Par dérogation à l'article 15, paragraphe 2, du règlement d'exécution (UE) no 809/2014 et dans le cas où les États membres font usage de la dérogation telle qu'elle est prévue aux articles 1er et 3 du présent règlement, pour l'année 2016, les modifications apportées à la demande unique ou à la demande de paiement conformément à l'article 15, paragraphe 1, du règlement d'exécution (UE) no 809/2014 sont communiquées à l'autorité compétente au plus tard le 15 juin.
La dérogation prévue à l'article 1er du présent règlement et au premier alinéa du présent article s'applique également pour le calcul des délais de 26, 35 et 10 jours civils, respectivement, après la date limite de dépôt de la demande unique, des demandes d'aide ou de paiement, et la date limite de notification des modifications visées à l'article 11, paragraphe 4, et à l'article 15, paragraphe 2 bis, du règlement d'exécution (UE) no 809/2014.
Article 3
Par dérogation à l'article 22, paragraphe 1, du règlement d'exécution (UE) no 809/2014, pour l'année 2016, la date fixée par les États membres pour le dépôt des demandes d'attribution de droits au paiement ou d'augmentation de la valeur des droits au paiement au titre du régime de paiement de base ne peut être postérieure au 15 juin.
Article 4
Le présent règlement entre en vigueur le jour de sa publication au Journal officiel de l'Union européenne.
Il s'applique aux demandes d'aide et aux demandes de paiement relatives à l'année 2016.
Le présent règlement est obligatoire dans tous ses éléments et directement applicable dans tout État membre.
Fait à Bruxelles, le 13 mai 2016.
Par la Commission
Le président
Jean-Claude JUNCKER
(1) JO L 347 du 20.12.2013, p. 549.
(2) Règlement d'exécution (UE) no 809/2014 de la Commission du 17 juillet 2014 établissant les modalités d'application du règlement (UE) no 1306/2013 du Parlement européen et du Conseil en ce qui concerne le système intégré de gestion et de contrôle, les mesures en faveur du développement rural et la conditionnalité (JO L 227 du 31.7.2014, p. 69).
|
14.5.2016 |
FR |
Journal officiel de l'Union européenne |
L 126/69 |
RÈGLEMENT D'EXÉCUTION (UE) 2016/762 DE LA COMMISSION
du 13 mai 2016
établissant les valeurs forfaitaires à l'importation pour la détermination du prix d'entrée de certains fruits et légumes
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l'Union européenne,
vu le règlement (UE) no 1308/2013 du Parlement européen et du Conseil du 17 décembre 2013 portant organisation commune des marchés des produits agricoles et abrogeant les règlements (CEE) no 922/72, (CEE) no 234/79, (CE) no 1037/2001 et (CE) no 1234/2007 du Conseil (1),
vu le règlement d'exécution (UE) no 543/2011 de la Commission du 7 juin 2011 portant modalités d'application du règlement (CE) no 1234/2007 du Conseil en ce qui concerne les secteurs des fruits et légumes et des fruits et légumes transformés (2), et notamment son article 136, paragraphe 1,
considérant ce qui suit:
|
(1) |
Le règlement d'exécution (UE) no 543/2011 prévoit, en application des résultats des négociations commerciales multilatérales du cycle d'Uruguay, les critères pour la fixation par la Commission des valeurs forfaitaires à l'importation des pays tiers, pour les produits et les périodes figurant à l'annexe XVI, partie A, dudit règlement. |
|
(2) |
La valeur forfaitaire à l'importation est calculée chaque jour ouvrable, conformément à l'article 136, paragraphe 1, du règlement d'exécution (UE) no 543/2011, en tenant compte des données journalières variables. Il importe, par conséquent, que le présent règlement entre en vigueur le jour de sa publication au Journal officiel de l'Union européenne, |
A ADOPTÉ LE PRÉSENT RÈGLEMENT:
Article premier
Les valeurs forfaitaires à l'importation visées à l'article 136 du règlement d'exécution (UE) no 543/2011 sont fixées à l'annexe du présent règlement.
Article 2
Le présent règlement entre en vigueur le jour de sa publication au Journal officiel de l'Union européenne.
Le présent règlement est obligatoire dans tous ses éléments et directement applicable dans tout État membre.
Fait à Bruxelles, le 13 mai 2016.
Par la Commission,
au nom du président,
Jerzy PLEWA
Directeur général de l'agriculture et du développement rural
(1) JO L 347 du 20.12.2013, p. 671.
(2) JO L 157 du 15.6.2011, p. 1.
ANNEXE
Valeurs forfaitaires à l'importation pour la détermination du prix d'entrée de certains fruits et légumes
|
(EUR/100 kg) |
||
|
Code NC |
Code des pays tiers (1) |
Valeur forfaitaire à l'importation |
|
0702 00 00 |
MA |
95,5 |
|
TR |
75,0 |
|
|
ZZ |
85,3 |
|
|
0707 00 05 |
TR |
116,3 |
|
ZZ |
116,3 |
|
|
0709 93 10 |
TR |
137,6 |
|
ZZ |
137,6 |
|
|
0805 10 20 |
EG |
45,4 |
|
IL |
88,6 |
|
|
MA |
55,4 |
|
|
TR |
31,5 |
|
|
ZA |
78,5 |
|
|
ZZ |
59,9 |
|
|
0805 50 10 |
ZA |
168,2 |
|
ZZ |
168,2 |
|
|
0808 10 80 |
AR |
111,7 |
|
BR |
98,2 |
|
|
CL |
123,9 |
|
|
CN |
61,7 |
|
|
NZ |
155,0 |
|
|
US |
162,5 |
|
|
ZA |
95,9 |
|
|
ZZ |
115,6 |
|
(1) Nomenclature des pays fixée par le règlement (UE) no 1106/2012 de la Commission du 27 novembre 2012 portant application du règlement (CE) no 471/2009 du Parlement européen et du Conseil concernant les statistiques communautaires relatives au commerce extérieur avec les pays tiers, en ce qui concerne la mise à jour de la nomenclature des pays et territoires (JO L 328 du 28.11.2012, p. 7). Le code «ZZ» représente «autres origines».
DÉCISIONS
|
14.5.2016 |
FR |
Journal officiel de l'Union européenne |
L 126/71 |
DÉCISION (UE) 2016/763 DU CONSEIL
du 13 mai 2016
établissant la position à prendre au nom de l'Union européenne au sein du comité des marchés publics en ce qui concerne le projet de décision sur les procédures d'arbitrage conformément à l'article XIX, paragraphe 8, de l'accord sur les marchés publics révisé
LE CONSEIL DE L'UNION EUROPÉENNE,
vu le traité sur le fonctionnement de l'Union européenne, et notamment son article 207, paragraphe 4, premier alinéa, en liaison avec l'article 218, paragraphe 9,
vu la proposition de la Commission européenne,
considérant ce qui suit:
|
(1) |
L'accord sur les marchés publics révisé (ci-après dénommé «AMP révisé»), entré en vigueur le 6 avril 2014, établit un cadre juridique rénové applicable aux marchés couverts par les parties à l'AMP révisé. L'accord révisé prévoit la possibilité pour ses parties de recourir à des procédures d'arbitrage dans les cas où des objections relatives à un projet de rectification, de transfert d'une entité d'une annexe à une autre, de retrait d'une entité ou autre modification des annexes de l'appendice I les concernant ont été soulevées mais que ces objections n'ont pas pu être levées dans le cadre de consultations. |
|
(2) |
Conformément à l'article XIX, paragraphe 8, de l'AMP révisé, le comité des marchés publics est tenu d'adopter des procédures d'arbitrage pour faciliter la levée de ces objections. |
|
(3) |
Les parties à l'AMP révisé ont longuement débattu des règles possibles de ces procédures d'arbitrage en ce qui concerne différentes options à appliquer en cas d'objection à une modification projetée du champ d'application d'un marché par une partie. Les parties à l'AMP révisé sont parvenues à un consensus sur cette question. |
|
(4) |
Les procédures d'arbitrage sont définies dans un projet de décision sur les procédures d'arbitrage conformément à l'article XIX, paragraphe 8, de l'AMP révisé. |
|
(5) |
Ce projet de décision sur les procédures d'arbitrage établit les conditions qui doivent être réunies pour pouvoir recourir aux procédures d'arbitrage et il définit les règles régissant la désignation des arbitres, la participation de tierces parties aux procédures d'arbitrage, la conduite de la procédure et la détermination par les arbitres. |
|
(6) |
L'adoption du projet de décision sur les procédures d'arbitrage devrait contribuer favorablement au cadre juridique de l'AMP révisé actuellement en vigueur car cette dernière vise à faciliter la levée des objections soulevées à l'égard d'un projet de rectification, de transfert d'une entité d'une annexe à une autre, de retrait d'une entité ou autre modification des annexes de l'appendice I de l'AMP révisé concernant une partie. |
|
(7) |
Il convient dès lors d'établir la position à prendre au nom de l'Union au sein du comité des marchés publics en ce qui concerne le projet de décision sur les procédures d'arbitrage, |
A ADOPTÉ LA PRÉSENTE DÉCISION:
Article premier
La position à prendre au nom de l'Union au sein du comité des marchés publics consiste à approuver l'adoption du projet de décision sur les procédures d'arbitrage conformément à l'article XIX, paragraphe 8, de l'accord sur les marchés publics révisé.
Le texte du projet de décision sur les procédures d'arbitrage est joint à la présente décision.
Article 2
La présente décision entre en vigueur le jour de son adoption.
Fait à Bruxelles, le 13 mai 2016.
Par le Conseil
Le président
E.M.J. PLOUMEN
PROJET DE DÉCISION SUR LES PROCÉDURES D'ARBITRAGE CONFORMÉMENT À L'ARTICLE XIX:8 DE L'AMP RÉVISÉ
Le comité des marchés publics («le comité»),
Notant que l'article XIX:8 de l'Accord révisé sur les marchés publics («l'Accord») dispose que le Comité doit élaborer des procédures d'arbitrage pour faciliter la levée des objections au titre de l'article XIX:2 de l'Accord, et
Confirmant l'importance de l'article XIX:8 b) et c) de l'Accord pour ces procédures d'arbitrage et réaffirmant l'engagement pris par les Parties d'adopter des décisions conformément à l'article XIX:8 b) et c) de l'Accord.
Adopte les procédures d'arbitrage ci-après pour faciliter la levée des objections au titre de l'article XIX:2 de l'Accord:
Invocation des procédures d'arbitrage
|
1. |
Conformément à l'article XIX:7 de l'Accord, dans les cas où la Partie apportant la modification et une Partie formulant une objection ne seront pas en mesure de lever une objection concernant une modification projetée au titre de l'article XIX:1 de l'Accord, la Partie apportant la modification ou toute Partie formulant une objection pourra soumettre la modification projetée à arbitrage, en indiquant les raisons de sa demande, au moyen d'une notification adressée au Comité au plus tôt 45 jours après la date de distribution de la notification de la modification projetée au titre de l'article XIX:1 de l'Accord. |
|
2. |
Dans les cas où deux Parties ou plus soumettront la même modification projetée à arbitrage avant la désignation de tous les arbitres, la Partie apportant la modification et toutes les Parties formulant une objection se mettront d'accord sur un seul arbitrage pour examiner toutes les objections à l'égard de la même modification projetée. Si des demandes d'arbitrage additionnelles concernant la même modification sont présentées après la désignation de tous les arbitres, la Partie apportant la modification et toutes les Parties formulant une objection se mettront d'accord sur un seul arbitrage chaque fois que possible. |
Désignation des arbitres
|
3. |
L'arbitrage sera assuré par des arbitres. À moins que les parties à l'arbitrage n'en décident autrement, il y aura trois arbitres. Les arbitres satisferont aux prescriptions relatives aux membres des groupes spéciaux énoncés à l'article 8:1, 8:2, et 8:9 du Mémorandum d'accord sur les règles et procédures régissant le règlement des différends. |
|
4. |
À la demande d'une partie à l'arbitrage, le secrétariat du Comité proposera des personnes désignées comme arbitres. Les parties à l'arbitrage ne s'opposeront pas à ces désignations, sauf pour des raisons contraignantes. Aucun ressortissant des parties à l'arbitrage ni fonctionnaire des tierces parties ne sera désigné comme arbitre, à moins que les parties à l'arbitrage n'en décident autrement. |
|
5. |
Dans les cas où les parties à l'arbitrage ne parviendront pas à s'entendre sur les personnes qui devraient être désignées comme arbitres dans un délai de 20 jours après que la modification projetée aura été soumise à arbitrage, à la demande d'une partie à l'arbitrage, le Directeur général désignera les arbitres dans les 10 jours, après avoir consulté les parties à l'arbitrage et le Président du Comité. |
Participation des tierces parties
|
6. |
Toute Partie à l'Accord qui aura un intérêt substantiel dans une modification projetée soumise à arbitrage et qui en aura informé le Comité (ci après dénommée «tierce partie») dans un délai de dix jours après que la modification projetée aura été soumise à arbitrage sera invitée à présenter une communication écrite, à assister aux réunions de fond des arbitres avec les parties à l'arbitrage et à faire des déclarations orales, et aura le droit de répondre aux questions posées par les arbitres. |
Procédures
|
7. |
Pour mener leurs travaux, les arbitres appliqueront les dispositions pertinentes de l'Accord et seront guidés par la décision adoptée par le Comité conformément à l'article XIX:8 b) de l'Accord, une fois adoptée. En outre, les procédures de travail ci-après seront d'application.
|
|
8. |
Les Règles de conduite relatives au Mémorandum d'accord sur les règles et procédures régissant le règlement des différends s'appliqueront à toute personne agissant en tant qu'arbitre au titre des présentes procédures et, ainsi qu'il est précisé dans les Règles de conduite et dans les dispositions pertinentes du Statut du personnel, aux membres du Secrétariat appelés à aider les arbitres. |
|
9. |
Dans les cas où les parties à l'arbitrage arriveront à un règlement mutuellement convenu des objections concernant la modification projetée, elles adresseront une notification aux arbitres dans les moindres délais. Dès réception de la notification, les arbitres cloront la procédure pour ces parties. Le détail de tout règlement mutuellement convenu sera notifié au Comité, dans le cadre duquel toute Partie à l'Accord pourra formuler des observations. |
Détermination par les arbitres
|
10. |
Le mandat des arbitres leur prescrira de déterminer:
|
|
11. |
Les arbitres remettront un rapport contenant leur détermination motivée aux parties à l'arbitrage dans un délai de 90 jours ou, si le calendrier est modifié par les arbitres, au plus tard 120 jours après:
Le délai indiqué au présent paragraphe pourra être prorogé par accord mutuel des parties à l'arbitrage. Le secrétariat du Comité distribuera le rapport aux Parties à l'Accord dans les moindres délais après la traduction. |
|
12. |
Dans les cas où les arbitres feront une détermination négative au titre du paragraphe 10.a et où ils n'auront fait aucune détermination sur les ajustements compensatoires au titre du paragraphe 10.b, toute partie à l'arbitrage pourra demander, après 30 jours et au plus tard 60 jours après la distribution du rapport des arbitres, que les mêmes arbitres, s'ils sont disponibles, déterminent le niveau des ajustements compensatoires qui permettrait d'obtenir un champ d'application d'un niveau comparable et préserverait l'équilibre des droits et des obligations au titre de l'Accord. Pour ce faire, les arbitres seront guidés par la décision adoptée par le Comité conformément à l'article XIX:8 c) de l'Accord, une fois adoptée. Dans les cas où l'un quelconque des arbitres initiaux ne sera pas disponible, un remplaçant sera désigné conformément aux paragraphes 3 à 5. |
Mise en œuvre
|
13. |
Les parties à l'arbitrage accepteront comme définitive la détermination des arbitres. |
|
14. |
Aux fins de l'article XIX:7 b) i) de l'Accord, les procédures d'arbitrage sont achevées:
|
ANNEXE
CALENDRIER PROPOSÉ POUR L'ARBITRAGE
Les arbitres établiront le calendrier adopté au titre du paragraphe 7.a sur la base des éléments suivants:
|
a. |
Réception des exposés écrits des parties à l'arbitrage: |
|
|
|
- - - - - - - - - - 2 semaines |
||
|
- - - - - - - - - - 2 semaines |
||
|
b. |
Réception des exposés des tierces parties: |
- - - - - - - - - - 1 semaine |
|
|
c. |
Réunion de fond avec les arbitres: |
- - - - - - - - - - 1 à 2 semaines |
|
|
d. |
Réponses aux questions posées aux parties et tierces parties à l'arbitrage: |
- - - - - - - - - - 1 à 2 semaines |
|
|
e. |
Remise et distribution du rapport des arbitres sur leur détermination: |
- - - - - - - - - - 4 semaines |
Conformément aux dispositions du paragraphe 11, les arbitres pourront modifier le calendrier ci-dessus et organiser des réunions additionnelles avec les parties à l'arbitrage après les avoir consultées.
|
14.5.2016 |
FR |
Journal officiel de l'Union européenne |
L 126/77 |
DÉCISION D'EXÉCUTION (UE) 2016/764 DE LA COMMISSION
du 12 mai 2016
modifiant la décision d'exécution (UE) 2015/789 relative à des mesures visant à éviter l'introduction et la propagation dans l'Union de Xylella fastidiosa (Wells et al.)
[notifiée sous le numéro C(2016) 2731]
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l'Union européenne,
vu la directive 2000/29/CE du Conseil du 8 mai 2000 concernant les mesures de protection contre l'introduction dans la Communauté d'organismes nuisibles aux végétaux ou aux produits végétaux et contre leur propagation à l'intérieur de la Communauté (1), et notamment son article 16, paragraphe 3, quatrième phrase,
considérant ce qui suit:
|
(1) |
Depuis l'adoption de la décision d'exécution (UE) 2015/789 de la Commission (2), et jusqu'en février 2016, plusieurs foyers de Xylella fastidiosa (Wells et al.) (ci-après «l'organisme spécifié») dans différentes parties de la zone située autour de la province de Lecce ont été notifiés à la Commission par l'Italie. Ces foyers se sont déclarés dans de nombreuses municipalités situées dans les provinces de Tarante et de Brindisi. En outre, le dernier audit effectué par la Commission en novembre 2015 a confirmé que les activités de surveillance requises par la décision d'exécution (UE) 2015/789 n'ont été menées que dans une mesure très limitée dans la zone située autour de la province de Lecce (région des Pouilles, en Italie). Cet audit a également confirmé que l'actuel programme d'enquêtes ne permettait toujours pas d'assurer la détection précoce de nouveaux foyers ou de déterminer de façon précise l'ampleur réelle de la propagation de l'organisme spécifié dans la zone. |
|
(2) |
Le dernier audit a confirmé le risque d'une propagation rapide de l'organisme spécifié dans le reste de la zone concernée. Pour cette raison, et compte tenu de la taille de cette zone, il est approprié d'étendre la zone infectée où des mesures d'enrayement peuvent s'appliquer au-delà des limites de la province de Lecce et de ne permettre le déplacement des végétaux spécifiés en dehors de cette zone que dans des conditions très strictes. Cette extension doit avoir lieu sans délai en tenant compte du fait que le risque de propagation de l'organisme spécifié dans le reste du territoire de l'Union augmente avec le début de la période de vol des insectes vecteurs au début du printemps. La zone infectée devrait par conséquent être étendue de façon à couvrir les municipalités ou parties de certaines municipalités des provinces de Brindisi et Tarante où des foyers de l'organisme spécifié se sont déclarés ou dans lesquelles il est probable que cet organisme est déjà répandu et établi. Cette zone infectée ne devrait toutefois pas inclure la superficie qui a été déclarée par l'Italie comme indemne de l'organisme spécifié avant l'adoption de la présente décision. |
|
(3) |
Pour des raisons de sécurité juridique, la formulation de l'article 7, paragraphe 2, point c), devrait être modifiée pour préciser clairement que les mesures qui seront prises conformément à cet article s'appliquent dans la zone infectée et non en dehors de celle-ci. |
|
(4) |
Pour assurer une protection efficace du reste du territoire de l'Union contre l'organisme spécifié, et dans la perspective de l'élargissement de la zone d'enrayement, il convient de remplacer la zone de surveillance par de nouvelles prescriptions concernant la surveillance dans cette zone d'enrayement. Ces prescriptions devraient s'appliquer à une zone d'une largeur de 20 km depuis les limites de la zone tampon et s'étendre à cette zone d'enrayement, et à la zone tampon avoisinante de 10 km. |
|
(5) |
Depuis l'adoption de la décision d'exécution (UE) 2015/789, l'expérience a montré qu'il serait disproportionné d'appliquer les mêmes prescriptions pour le déplacement des végétaux spécifiés dans les zones infectées que pour leur déplacement depuis les zones infectées vers les zones tampons, parce que l'organisme spécifié est déjà établi dans ces zones infectées. |
|
(6) |
Depuis l'adoption de la décision d'exécution (UE) 2015/789, l'expérience a confirmé que les végétaux spécifiés cultivés pendant tout leur cycle de production in vitro, en milieu stérile, ne présentent pas de risque de propagation de l'organisme spécifié, parce que ce mode de croissance élimine le risque d'infection en excluant la possibilité de contact avec les vecteurs de l'organisme spécifié. Il convient donc d'autoriser le déplacement à l'intérieur de l'Union et l'introduction dans l'Union de ces végétaux spécifiés sous certaines conditions. |
|
(7) |
Depuis l'adoption de la décision d'exécution (UE) 2015/789, l'expérience en matière de contrôles officiels a montré que les végétaux spécifiés originaires de zones indemnes de l'organisme spécifié devaient être soumis aux mêmes exigences que les végétaux spécifiés originaires de pays tiers où l'organisme spécifié n'est pas présent, pour ce qui est des contrôles officiels lors de l'introduction dans l'Union. |
|
(8) |
Il convient de modifier l'annexe I afin d'y inclure toutes les espèces végétales qui, depuis l'adoption de la décision d'exécution (UE) 2015/2417 (3), ont été identifiées par la Commission comme végétaux spécifiés. |
|
(9) |
Les mesures prévues dans la présente décision sont conformes à l'avis du comité permanent des végétaux, des animaux, des denrées alimentaires et des aliments pour animaux, |
A ADOPTÉ LA PRÉSENTE DÉCISION:
Article premier
Modifications de la décision d'exécution (UE) 2015/789
La décision d'exécution (UE) 2015/789 est modifiée comme suit:
|
1. |
À l'article 4, paragraphe 2, le troisième alinéa est remplacé par le texte suivant: «En ce qui concerne la présence de l'organisme spécifié dans la province de Lecce et dans les municipalités énumérées à l'annexe II, la zone infectée comprend au moins cette province et ces municipalités ou, selon le cas, des parcelles cadastrales («fogli») de ces municipalités.». |
|
2. |
L'article 7 est modifié comme suit:
|
|
3. |
L'article 8 est supprimé. |
|
4. |
À l'article 9, le paragraphe 1 est remplacé par le texte suivant: «1. Le présent article s'applique aux végétaux spécifiés autres que les végétaux qui ont été cultivés in vitro pendant toute la durée du cycle de production. Les déplacements en dehors des zones délimitées, ainsi que des zones infectées vers les zones tampons respectives, de végétaux spécifiés qui ont été cultivés pendant au moins une partie de leur existence dans une zone délimitée établie conformément à l'article 4, sont interdits.». |
|
5. |
L'article 9 bis suivant est inséré: «Article 9 bis Circulation sur le territoire de l'Union de végétaux spécifiés qui ont été cultivés in vitro 1. Les végétaux spécifiés qui ont été cultivés pendant toute la durée du cycle de production in vitro, et pendant au moins une partie de leur existence dans une zone délimitée établie conformément à l'article 4, ne peuvent être déplacés hors des zones délimitées, ainsi que des zones infectées vers les zones tampons respectives, que si les conditions énoncées aux paragraphes 2 à 5 sont remplies. 2. Les végétaux spécifiés visés au paragraphe 1 ont été cultivés sur un site où toutes les conditions suivantes sont remplies:
3. Les végétaux spécifiés visés au paragraphe 1 ont été cultivés dans un conteneur transparent en milieu stérile et remplissent l'une des conditions suivantes:
4. Les végétaux spécifiés visés au paragraphe 1 sont transportés dans des conditions stériles dans un conteneur transparent qui exclut la possibilité d'une infection par l'organisme spécifié via ses vecteurs. 5. Ils sont accompagnés d'un passeport phytosanitaire établi et délivré conformément aux dispositions de la directive 92/105/CEE.». |
|
6. |
L'article 17 est modifié comme suit:
|
|
7. |
À l'article 18, les paragraphes 2, 3 et 4 sont remplacés par le texte suivant: «2. Dans le cas de végétaux spécifiés originaires de pays tiers où l'organisme spécifié n'est pas présent ou d'une zone visée à l'article 17, paragraphe 2, l'organisme officiel responsable effectue les contrôles suivants:
3. Dans le cas de végétaux spécifiés originaires d'une région où la présence de l'organisme spécifié est connue, l'organisme officiel responsable effectue les contrôles suivants:
4. Les échantillons visés au paragraphe 2, point b), et au paragraphe 3, point b), sont d'une taille qui permet d'identifier, avec une fiabilité de 99 %, un taux de présence de végétaux infectés égal ou supérieur à 1 %, en tenant compte de la NIMP no 31. Le premier alinéa ne s'applique pas aux végétaux spécifiés qui ont été cultivés in vitro pendant toute la durée du cycle de production et sont transportés dans des conditions stériles dans des conteneurs transparents.» |
|
8. |
L'annexe I est modifiée conformément à l'annexe I de la présente décision. |
|
9. |
L'annexe qui figure en annexe II de la présente décision est ajoutée en tant qu'annexe II. |
Article 2
Destinataires
Les États membres sont destinataires de la présente décision.
Fait à Bruxelles, le 12 mai 2016.
Par la Commission
Vytenis ANDRIUKAITIS
Membre de la Commission
(1) JO L 169 du 10.7.2000, p. 1.
(2) Décision d'exécution (UE) 2015/789 de la Commission du 18 mai 2015 relative à des mesures visant à éviter l'introduction et la propagation dans l'Union de Xylella fastidiosa (Wells et al.) (JO L 125 du 21.5.2015, p. 36).
(3) Décision d'exécution (UE) 2015/2417 de la Commission du 17 décembre 2015 modifiant la décision d'exécution (UE) 2015/789 relative aux mesures visant à éviter l'introduction et la propagation dans l'Union de Xylella fastidiosa (Wells et al.) (JO L 333 du 19.12.2015, p. 143).
ANNEXE I
L'annexe I de la décision d'exécution (UE) 2015/789 est modifiée comme suit:
|
1. |
Les entrées suivantes sont insérées dans l'ordre alphabétique:
|
|
2. |
Les entrées suivantes sont supprimées:
|
|
3. |
L'entrée «Cytisus racemosus Broom» est remplacée par le texte suivant: «Genista x spachiana (syn. Cytisus racemosus Broom)». |
ANNEXE II
L'annexe II suivante est ajoutée à la décision d'exécution (UE) 2015/789:
«ANNEXE II
LISTE DES MUNICIPALITÉS VISÉES À L'ARTICLE 4, PARAGRAPHE 2
|
1. |
Municipalités situées dans la province de Brindisi:
|
|
2. |
Municipalités situées dans la province de Tarente:
|