ISSN 1977-0693
doi:10.3000/19770693.L_2013.289.fra
Journal officiel
de l'Union européenne
L 289

Édition de langue française
Législation
56e année
31 octobre 2013
|
ISSN 1977-0693 doi:10.3000/19770693.L_2013.289.fra |
||
|
Journal officiel de l'Union européenne |
L 289 |
|

|
||
|
Édition de langue française |
Législation |
56e année |
|
|
|
|
|
(1) Texte présentant de l'intérêt pour l'EEE |
|
FR |
Les actes dont les titres sont imprimés en caractères maigres sont des actes de gestion courante pris dans le cadre de la politique agricole et ayant généralement une durée de validité limitée. Les actes dont les titres sont imprimés en caractères gras et précédés d'un astérisque sont tous les autres actes. |
II Actes non législatifs
ACCORDS INTERNATIONAUX
|
31.10.2013 |
FR |
Journal officiel de l'Union européenne |
L 289/1 |
DÉCISION DU CONSEIL
du 22 octobre 2013
relative à la conclusion de l’accord entre l’Union européenne et la République d’Arménie visant à faciliter la délivrance de visas
(2013/628/UE)
LE CONSEIL DE L’UNION EUROPÉENNE,
vu le traité sur le fonctionnement de l’Union européenne, et notamment son article 77, paragraphe 2, point a), en liaison avec son article 218, paragraphe 6, deuxième alinéa, point a),
vu la proposition de la Commission européenne,
vu l’approbation du Parlement européen,
considérant ce qui suit:
|
(1) |
Conformément à la décision 2013/2/UE du Conseil (1), l’accord entre l’Union européenne et la République d’Arménie visant à faciliter la délivrance de visas (ci-après dénommé «accord») a été signé le 17 décembre 2012, sous réserve de sa conclusion à une date ultérieure. |
|
(2) |
Il convient d’approuver l’accord. |
|
(3) |
La présente décision constitue un développement des dispositions de l’acquis de Schengen auxquelles le Royaume-Uni ne participe pas, conformément à la décision 2000/365/CE du Conseil du 29 mai 2000 relative à la demande du Royaume-Uni de Grande-Bretagne et d’Irlande du Nord de participer à certaines dispositions de l’acquis de Schengen (2); le Royaume-Uni ne participe donc pas à l’adoption de la présente décision et n’est pas lié par celle-ci ni soumis à son application. |
|
(4) |
La présente décision constitue un développement des dispositions de l’acquis de Schengen auxquelles l’Irlande ne participe pas, conformément à la décision 2002/192/CE du Conseil du 28 février 2002 relative à la demande de l’Irlande de participer à certaines dispositions de l’acquis de Schengen (3); l’Irlande ne participe donc pas à l’adoption de la présente décision et n’est pas liée par celle-ci ni soumise à son application. |
|
(5) |
Conformément aux articles 1er et 2 du protocole no 22 sur la position du Danemark annexé au traité sur l’Union européenne et au traité sur le fonctionnement de l’Union européenne, le Danemark ne participe pas à l’adoption de la présente décision et n’est pas lié par celle-ci ni soumis à son application, |
A ADOPTÉ LA PRÉSENTE DÉCISION:
Article premier
L’accord entre l’Union européenne et la République d’Arménie visant à faciliter la délivrance de visas est approuvé au nom de l’Union.
Le texte de l’accord est joint à la présente décision.
Article 2
Le président du Conseil procède, au nom de l’Union européenne, à la notification prévue à l’article 14, paragraphe 1, de l’accord (4).
Article 3
La présente décision entre en vigueur le jour de son adoption.
Fait à Luxembourg, le 22 octobre 2013.
Par le Conseil
Le président
L. LINKEVIČIUS
(2) JO L 131 du 1.6.2000, p. 43.
(3) JO L 64 du 7.3.2002, p. 20.
(4) La date d’entrée en vigueur de l’accord sera publiée au Journal officiel de l’Union européenne par les soins du secrétariat général du Conseil.
|
31.10.2013 |
FR |
Journal officiel de l'Union européenne |
L 289/2 |
ACCORD
entre l’Union européenne et la République d’Arménie visant à faciliter la délivrance de visas
L’UNION EUROPÉENNE, ci-après dénommée l’«Union»,
et
LA RÉPUBLIQUE D’ARMÉNIE, ci-après dénommée l’«Arménie»,
ci-après dénommées les «parties»,
DÉSIREUSES de promouvoir les contacts entre les personnes comme condition importante d’un développement constant de leurs liens économiques, humanitaires, culturels, scientifiques et autres, en facilitant la délivrance de visas aux citoyens arméniens,
RAPPELANT l’accord de partenariat et de coopération entre l’Union et ses États membres, d’une part, et l’Arménie, d’autre part, ainsi que l’intention des parties de conclure un accord d’association UE Arménie,
TENANT COMPTE des déclarations communes adoptées à l’issue des sommets du partenariat oriental qui se sont tenus à Prague le 7 mai 2009 et à Varsovie le 30 septembre 2011, exprimant un soutien politique à l’égard d’une libéralisation, dans un environnement sûr, du régime des visas,
RÉAFFIRMANT leur intention de prendre des mesures progressives en vue d’instaurer, en temps opportun, un régime de déplacement sans obligation de visa pour leurs citoyens, sous réserve que les conditions d’une mobilité bien gérée et sûre soient réunies,
RAPPELANT que, à compter du 10 janvier 2013, tous les citoyens de l’Union seront dispensés de l’obligation de visa pour leurs voyages en Arménie d’une durée ne dépassant pas quatre-vingt-dix jours ou pour leur transit par le territoire arménien,
RECONNAISSANT que si l’Arménie réintroduisait l’obligation de visa pour les citoyens de l’Union ou certaines catégories de ces citoyens, les mesures visant à faciliter la délivrance de visas prévues dans le présent accord en faveur des citoyens arméniens s’appliqueraient automatiquement, sur la base de la réciprocité, aux citoyens de l’Union concernés,
RAPPELANT que ladite obligation de visa ne peut être réintroduite que pour l’ensemble des citoyens de l’Union ou pour certaines catégories de ces citoyens,
RECONNAISSANT que la facilitation de la délivrance de visas ne devrait pas favoriser l’immigration illégale et prêtant une attention particulière aux questions de sécurité et de réadmission,
TENANT COMPTE du protocole sur la position du Royaume-Uni et de l’Irlande à l’égard de l’espace de liberté, de sécurité et de justice ainsi que du protocole sur l’acquis de Schengen intégré dans le cadre de l’Union européenne, annexés au traité sur l’Union européenne et au traité sur le fonctionnement de l’Union européenne, et confirmant que les dispositions du présent accord ne s’appliquent pas au Royaume-Uni ni à l’Irlande,
TENANT COMPTE du protocole sur la position du Danemark annexé au traité sur l’Union européenne et au traité sur le fonctionnement de l’Union européenne, et confirmant que les dispositions du présent accord ne s’appliquent pas au Royaume de Danemark,
SONT CONVENUES DE CE QUI SUIT:
Article premier
Objet et champ d’application
1. Le présent accord vise à faciliter la délivrance de visas aux citoyens arméniens pour des séjours dont la durée prévue n’excède pas quatre-vingt-dix jours par période de cent quatre-vingts jours.
2. Si l’Arménie réintroduisait l’obligation de visa pour les citoyens de l’Union ou certaines catégories de ces citoyens, les mesures visant à faciliter la délivrance de visas prévues dans le présent accord en faveur des citoyens arméniens s’appliqueraient automatiquement, sur la base de la réciprocité, aux citoyens de l’Union concernés.
Article 2
Clause générale
1. Les mesures visant à faciliter la délivrance de visas prévues dans le présent accord s’appliquent aux citoyens arméniens dans la seule mesure où ceux-ci ne sont pas dispensés de l’obligation de visa par les dispositions législatives, réglementaires et administratives de l’Union ou de ses États membres, par le présent accord ou par d’autres accords internationaux.
2. Le droit national de l’Arménie ou des États membres, ou le droit de l’Union, s’applique aux questions qui ne relèvent pas des dispositions du présent accord, comme le refus de délivrer un visa, la reconnaissance des documents de voyage, la preuve de moyens de subsistance suffisants, le refus d’entrée et les mesures d’expulsion.
Article 3
Définitions
Aux fins du présent accord, on entend par:
|
a) |
«État membre», tout État membre de l’Union européenne, à l’exception du Royaume de Danemark, de la République d’Irlande et du Royaume-Uni de Grande-Bretagne et d’Irlande du Nord; |
|
b) |
«citoyen de l’Union», tout ressortissant d’un État membre au sens du point a); |
|
c) |
«citoyen arménien», toute personne qui possède la citoyenneté arménienne conformément à la législation de la République d’Arménie; |
|
d) |
«visa», une autorisation délivrée par un État membre, en vue d’un transit par le territoire des États membres ou d’un séjour prévu sur ce territoire pour une durée n’excédant pas quatre-vingt-dix jours sur une période de cent quatre-vingts jours; |
|
e) |
«personne en séjour régulier», tout citoyen arménien autorisé ou habilité, en vertu du droit national ou du droit de l’Union, à séjourner plus de quatre-vingt-dix jours sur le territoire d’un État membre. |
Article 4
Preuves documentaires de l’objet du voyage
1. Pour les catégories suivantes de citoyens arméniens, les documents énumérés ci-après suffisent à justifier l’objet du voyage sur le territoire de l’autre partie:
|
a) |
pour les parents proches – le conjoint, les enfants (y compris adoptifs), les parents (y compris les personnes ayant la garde légale), les grands-parents et les petits-enfants – rendant visite à des citoyens arméniens en séjour régulier dans les États membres ou à des citoyens de l’Union résidant sur le territoire de l’État membre dont ils sont ressortissants:
|
|
b) |
pour les membres de délégations officielles, y compris les membres permanents de ces délégations, qui, à la suite d’une invitation officielle adressée à l’Arménie, participent à des réunions, consultations, négociations ou programmes d’échange ainsi qu’à des événements ayant lieu sur le territoire de l’un des États membres à l’initiative d’organisations intergouvernementales:
|
|
c) |
pour les écoliers, les étudiants (y compris de troisième cycle) et les enseignants accompagnateurs qui entreprennent des voyages d’étude ou à but éducatif, y compris dans le cadre de programmes d’échange ou d’activités parascolaires:
|
|
d) |
pour les personnes qui voyagent pour des raisons médicales et les personnes qui doivent les accompagner:
|
|
e) |
pour les journalistes et le personnel technique les accompagnant à titre professionnel:
|
|
f) |
pour les participants à des manifestations sportives internationales et les personnes les accompagnant à titre professionnel:
|
|
g) |
pour les hommes et femmes d’affaires et les représentants d’entreprises:
|
|
h) |
pour les membres de professions libérales participant à des expositions et salons, conférences, symposiums et séminaires internationaux ou à d’autres événements analogues;
|
|
i) |
pour les représentants d’organisations de la société civile et les personnes invitées par des organisations à but non lucratif de la communauté arménienne enregistrées dans les États membres lorsque ces personnes entreprennent des voyages à but éducatif, se rendent à des séminaires ou à des conférences, y compris dans le cadre de programmes d’échange ou de programmes panarméniens ou de soutien à la communauté:
|
|
j) |
pour les personnes participant à des activités scientifiques, universitaires, culturelles ou artistiques, y compris des programmes d’échange universitaires ou autres:
|
|
k) |
pour les conducteurs fournissant des services de transport international de marchandises et de passagers vers le territoire des États membres dans des véhicules immatriculés en Arménie:
|
|
l) |
pour les participants à des programmes d’échange officiels organisés par des villes jumelées et d’autres entités municipales:
|
|
m) |
pour les personnes souhaitant se rendre dans un cimetière militaire ou civil:
|
2. Aux fins du présent article, la demande ou l’invitation écrite contient les informations suivantes:
|
a) |
pour la personne invitée: nom et prénom, date de naissance, sexe, nationalité, numéro du passeport, date et objet du voyage, nombre d’entrées et, s’il y a lieu, nom du conjoint et des enfants l’accompagnant; |
|
b) |
pour la personne invitante: nom, prénom et adresse; |
|
c) |
pour la personne morale, la société ou l’organisation invitante: nom complet et adresse, et:
|
3. Pour les catégories de personnes visées au paragraphe 1 du présent article, toutes les catégories de visas sont délivrées selon la procédure simplifiée, sans qu’il y ait lieu de produire une autre justification, invitation ou validation concernant l’objet du voyage prévue par le droit des parties.
Article 5
Délivrance de visas à entrées multiples
1. Les missions diplomatiques et les postes consulaires des États membres délivrent des visas à entrées multiples, d’une durée de validité de cinq ans, aux catégories de personnes suivantes:
|
a) |
les conjoints, les enfants (y compris adoptifs) n’ayant pas encore atteint l’âge de vingt-et-un ans ou étant à charge et les parents (y compris les personnes ayant la garde légale) qui rendent visite à des citoyens arméniens en séjour régulier dans les États membres ou à des citoyens de l’Union qui résident sur le territoire de l’État membre dont ils sont ressortissants; |
|
b) |
les membres des gouvernements nationaux et régionaux et les membres des cours constitutionnelles et suprêmes, dans l’exercice de leurs fonctions et lorsque ces personnes ne sont pas exemptées de l’obligation de visa par le présent accord; |
|
c) |
les membres permanents de délégations officielles qui, à la suite d’une invitation officielle adressée à l’Arménie, participent régulièrement à des réunions, consultations, négociations ou programmes d’échange ainsi qu’à des événements ayant lieu sur le territoire des États membres à l’initiative d’organisations intergouvernementales. |
Par dérogation, lorsque le besoin ou l’intention de voyager fréquemment ou régulièrement sont manifestement limités à une durée plus courte, la validité du visa à entrées multiples est limitée à cette durée, en particulier lorsque:
|
— |
dans le cas des personnes visées au point a), la durée de validité de l’autorisation de séjour des citoyens arméniens en séjour régulier dans l’Union, |
|
— |
dans le cas des personnes visées au point b), la durée de leur mandat, |
|
— |
dans le cas des personnes visées au point c), la durée de validité de leur statut de membre permanent d’une délégation officielle, |
est inférieure à cinq ans.
2. Les missions diplomatiques et les postes consulaires des États membres délivrent des visas à entrées multiples d’une durée de validité d’un an aux catégories de personnes suivantes, sous réserve que, durant l’année précédant la demande, ces personnes aient obtenu au moins un visa et qu’elles l’aient utilisé dans le respect de la législation régissant l’entrée et le séjour sur le territoire de l’État hôte:
|
a) |
les membres de délégations officielles qui, à la suite d’une invitation officielle adressée à l’Arménie, participent régulièrement à des réunions, consultations, négociations ou programmes d’échange ainsi qu’à des événements ayant lieu sur le territoire des États membres à l’initiative d’organisations intergouvernementales; |
|
b) |
les représentants d’organisations de la société civile et les personnes invitées par des organisations à but non lucratif de la communauté arménienne enregistrées dans les États membres lorsque ces personnes entreprennent des voyages à but éducatif, se rendent à des séminaires ou à des conférences, y compris dans le cadre de programmes d’échange ou de programmes de soutien à la communauté ou panarméniens; |
|
c) |
les membres des professions libérales participant à des expositions et salons, des conférences, des symposiums ou des séminaires internationaux ou à d’autres événements analogues, qui se rendent régulièrement dans les États membres; |
|
d) |
les personnes participant à des activités scientifiques, culturelles ou artistiques, y compris des programmes d’échange universitaires ou autres, qui se rendent régulièrement dans les États membres; |
|
e) |
les étudiants, y compris de troisième cycle, qui entreprennent régulièrement des voyages d’étude ou à but éducatif, y compris dans le cadre de programmes d’échange; |
|
f) |
les participants à des programmes d’échange officiels organisés par des villes jumelées et d’autres entités municipales; |
|
g) |
les personnes en visite régulière pour des raisons médicales et celles qui doivent les accompagner; |
|
h) |
les journalistes et le personnel technique les accompagnant à titre professionnel; |
|
i) |
les hommes et femmes d’affaires et les représentants d’entreprises se rendant régulièrement dans les États membres; |
|
j) |
les participants à des manifestations sportives internationales et les personnes les accompagnant à titre professionnel; |
|
k) |
les conducteurs fournissant des services de transport international de marchandises et de passagers vers le territoire des États membres dans des véhicules immatriculés en Arménie. |
Par dérogation à la première phrase, lorsque le besoin ou l’intention de voyager fréquemment ou régulièrement sont manifestement limités à une durée plus courte, la validité du visa à entrées multiples est limitée à cette durée.
3. Les missions diplomatiques et les postes consulaires des États membres délivrent des visas à entrées multiples d’une durée de validité minimale de deux ans et maximale de cinq ans aux catégories de personnes visées au paragraphe 2 du présent article, sous réserve que, durant les deux années précédant la demande, ces personnes aient utilisé leur visa à entrées multiples d’une durée d’un an dans le respect de la législation régissant l’entrée et le séjour sur le territoire de l’État hôte, sauf lorsque le besoin ou l’intention de voyager fréquemment ou régulièrement sont manifestement limités à une durée plus courte, auquel cas la validité du visa à entrées multiples est limitée à cette durée.
4. La durée totale du séjour des personnes visées aux paragraphes 1 à 3 du présent article sur le territoire des États membres ne peut excéder quatre-vingt-dix jours par période de cent quatre-vingts jours.
Article 6
Droits prélevés pour le traitement des demandes de visa
1. Le droit prélevé pour le traitement des demandes de visa est de 35 EUR.
Ce montant peut être revu en appliquant la procédure prévue à l’article 14, paragraphe 4.
2. Sans préjudice du paragraphe 3 du présent article, les catégories de personnes suivantes sont exonérées des droits de visa:
|
a) |
les retraités; |
|
b) |
les enfants de moins de douze ans; |
|
c) |
les membres des gouvernements nationaux et régionaux et les membres des cours constitutionnelle et suprême, lorsque ces personnes ne sont pas dispensées de l’obligation de visa par le présent accord; |
|
d) |
les personnes handicapées et les personnes les accompagnant, le cas échéant; |
|
e) |
les parents proches – le conjoint, les enfants (y compris adoptifs), les parents (y compris les personnes ayant la garde légale), les grands-parents et les petits-enfants – de citoyens arméniens en séjour régulier sur le territoire des États membres ou de citoyens de l’Union résidant sur le territoire de l’État membre dont ils sont ressortissants; |
|
f) |
les membres de délégations officielles, y compris les membres permanents de ces délégations, qui, à la suite d’une invitation officielle adressée à l’Arménie, participent à des réunions, consultations, négociations ou programmes d’échange ainsi qu’à des événements ayant lieu sur le territoire de l’un des États membres à l’initiative d’organisations intergouvernementales; |
|
g) |
les écoliers, les étudiants (y compris de troisième cycle) et les enseignants accompagnateurs qui participent à des voyages d’étude ou à but éducatif, y compris dans le cadre de programmes d’échange ou d’activités parascolaires; |
|
h) |
les journalistes et le personnel technique les accompagnant à titre professionnel; |
|
i) |
les participants à des manifestations sportives internationales et les personnes les accompagnant à titre professionnel; |
|
j) |
les représentants d’organisations de la société civile et les personnes invitées par des organisations à but non lucratif de la communauté arménienne enregistrées dans les États membres, lorsque ces personnes entreprennent des voyages à but éducatif, se rendent à des séminaires ou à des conférences, y compris dans le cadre de programmes d’échange ou de programmes de soutien à la communauté ou panarméniens; |
|
k) |
les personnes participant à des activités scientifiques, universitaires, culturelles ou artistiques, y compris des programmes d’échange universitaires ou autres: |
|
l) |
les personnes qui ont présenté des documents attestant la nécessité de leur voyage pour des raisons humanitaires, y compris pour recevoir un traitement médical urgent, ainsi que la personne les accompagnant, ou pour assister aux obsèques d’un parent proche, ou pour rendre visite à un parent proche gravement malade. |
3. Si un État membre coopère avec un prestataire de services extérieur en vue de la délivrance d’un visa, ce prestataire peut facturer des frais pour ses services. Ces frais sont proportionnels aux coûts engagés par le prestataire pour la réalisation de ses tâches et ne peuvent dépasser 30 EUR. Les États membres maintiennent la possibilité, pour tous les demandeurs, d’introduire directement leur demande auprès de leur consulat.
En ce qui concerne l’Union, le prestataire de services extérieur exerce ses activités conformément au code des visas et dans le respect de la législation arménienne.
Article 7
Durée des procédures de traitement des demandes de visa
1. Les missions diplomatiques et les postes consulaires des États membres prennent la décision de délivrer ou non un visa dans un délai de dix jours calendrier suivant la réception de la demande de visa et des documents requis aux fins de sa délivrance.
2. Le délai imparti pour prendre une décision sur une demande de visa peut être étendu à trente jours calendrier, notamment lorsqu’un examen complémentaire de la demande se révèle nécessaire.
3. En cas d’urgence, le délai imparti pour prendre une décision sur une demande de visa peut être ramené à deux jours ouvrables, voire moins.
4. Si les demandeurs sont tenus d’obtenir un rendez-vous pour l’introduction d’une demande, celui-ci a lieu, en règle générale, dans un délai de deux semaines à compter de la date à laquelle il a été demandé. Dans les cas d’urgence justifiés, le consulat peut autoriser les demandeurs à introduire leur demande sans rendez-vous ou leur accorder immédiatement un rendez-vous.
Article 8
Départ en cas de perte ou de vol de documents
Les citoyens de l’Union et de l’Arménie qui ont perdu leurs documents d’identité ou qui se les sont fait voler durant leur séjour sur le territoire de l’Arménie ou des États membres peuvent quitter le territoire de l’Arménie ou des États membres sur la base de documents d’identité valables délivrés par une mission diplomatique ou un poste consulaire des États membres ou de l’Arménie qui les habilitent à franchir la frontière, sans visa ni autre forme d’autorisation.
Article 9
Prorogation du visa dans des circonstances exceptionnelles
Les citoyens arméniens qui, pour des raisons de force majeure ou des raisons humanitaires, n’ont pas la possibilité de quitter le territoire des États membres à la date indiquée par leur visa voient celui-ci prorogé gratuitement, conformément à la législation appliquée par l’État hôte, pour toute la période nécessaire à leur retour dans leur État de résidence.
Article 10
Passeports diplomatiques
1. Les citoyens arméniens titulaires de passeports diplomatiques en cours de validité peuvent entrer sur le territoire des États membres, le quitter et le traverser sans visa.
2. Les personnes visées au paragraphe 1 du présent article peuvent séjourner sans visa sur le territoire des États membres pendant une durée n’excédant pas quatre-vingt-dix jours par période de cent quatre-vingts jours.
Article 11
Validité territoriale des visas
Sous réserve des règles et dispositions réglementaires nationales en matière de sécurité nationale appliquées par les États membres, et sous réserve des règles de l’Union relatives aux visas à validité territoriale limitée, les citoyens arméniens sont habilités à se déplacer sur le territoire des États membres dans les mêmes conditions que les citoyens de l’Union.
Article 12
Comité mixte de gestion de l’accord
1. Les parties instituent un comité mixte d’experts (ci-après dénommé le «comité»), composé de représentants de l’Union européenne et de l’Arménie. L’Union est représentée par la Commission, assistée d’experts des États membres.
2. Le comité est notamment chargé des tâches suivantes:
|
a) |
suivre la mise en œuvre du présent accord; |
|
b) |
proposer des modifications ou des ajouts au présent accord; |
|
c) |
résoudre les litiges liés à l’interprétation ou à l’application des dispositions du présent accord. |
3. Le comité se réunit chaque fois que nécessaire à la demande de l’une des parties et au moins une fois par an.
4. Le comité adopte son règlement intérieur.
Article 13
Relation entre le présent accord et les accords bilatéraux conclus entre les États membres et l’Arménie
À dater de son entrée en vigueur, le présent accord prime les dispositions de toute convention ou de tout accord bilatéral(e) ou multilatéral(e) conclu(e) entre un État membre et l’Arménie, dans la mesure où ces dispositions traitent de questions régies par le présent accord.
Article 14
Clauses finales
1. Le présent accord est ratifié ou approuvé par les parties conformément à leurs procédures respectives et entre en vigueur le premier jour du deuxième mois suivant la date à laquelle les parties se notifient mutuellement l’achèvement des procédures susmentionnées.
2. Par dérogation au paragraphe 1 du présent article, le présent accord n’entre en vigueur qu’à la date d’entrée en vigueur de l’accord de réadmission entre l’Union européenne et l’Arménie si cette seconde date est postérieure à la date visée audit paragraphe 1.
3. Le présent accord est conclu pour une durée indéterminée, sauf dénonciation effectuée conformément au paragraphe 6 du présent article.
4. Le présent accord peut être modifié d’un commun accord écrit entre les parties. Les modifications entrent en vigueur après que les parties se sont mutuellement notifiées le terme des procédures internes qu’elles doivent respectivement appliquer à cet effet.
5. Chaque partie peut suspendre l’application de tout ou partie du présent accord pour des raisons d’ordre public, de protection de sa sécurité nationale ou de protection de la santé publique. La décision de suspension est notifiée à l’autre partie au plus tard quarante-huit heures avant son entrée en vigueur. Dès que la suspension n’a plus lieu d’être, la partie qui en a pris la décision en informe immédiatement l’autre partie.
6. Chaque partie peut dénoncer le présent accord par notification écrite à l’autre partie. Le présent accord cesse d’être en vigueur quatre-vingt-dix jours après la date de cette notification.
Fait à Bruxelles, le dix-sept décembre deux mille douze, en double exemplaire en langues allemande, anglaise, bulgare, danoise, espagnole, estonienne, finnoise, française, grecque, hongroise, italienne, lettone, lituanienne, maltaise, néerlandaise, polonaise, portugaise, roumaine, slovène, slovaque, suédoise, tchèque et arménienne, chacun de ces textes faisant également foi.
За Европейския съюз
Por la Unión Europea
Za Evropskou unii
For Den Europæiske Union
Für die Europäische Union
Euroopa Liidu nimel
Για την Ευρωπαϊκή Ένωση
For the European Union
Pour l'Union européenne
Per l'Unione europea
Eiropas Savienības vārdā –
Europos Sąjungos vardu
Az Európai Unió részéről
Għall-Unjoni Ewropea
Voor de Europese Unie
W imieniu Unii Europejskiej
Pela União Europeia
Pentru Uniunea Europeană
Za Európsku úniu
Za Evropsko unijo
Euroopan unionin puolesta
För Europeiska unionen
![]()

За Pепублика Армения
Por la República de Armenia
Za Arménskou republiku
For Republikken Armenien
Für die Republik Armenien
Armeenia Vabariigi nimel
Για τη Δημοκρατία της Αρμενίας
For the Republic of Armenia
Pour la République d'Arménie
Per la Repubblica di Armenia
Armēnijas Republikas vārdā –
Armėnijos Respublikos vardu
Örmény Köztársaság részéről
Għar-Repubblika tal-Armenja
Voor de Republiek Armenië
W imieniu Republiki Armenii
Pela República da Arménia
Pentru Republica Armenia
Za Arménsku republiku
Za Republiko Armenijo
Armenian tasavallan puolesta
För Republiken Armenien


PROTOCOLE
à l’accord concernant les états membres qui n’appliquent pas l’intégralité de l’acquis de schengen
Les États membres qui sont liés par l’acquis de Schengen, mais qui ne délivrent pas encore de visas Schengen dans l’attente de la décision pertinente du Conseil à cet effet, délivrent des visas nationaux dont la validité est limitée à leur propre territoire.
Conformément à la décision no 582/2008/CE du Parlement européen et du Conseil du 17 juin 2008 établissant un régime simplifié pour le contrôle des personnes aux frontières extérieures, fondé sur la reconnaissance unilatérale par la Bulgarie, Chypre et la Roumanie de certains documents comme équivalents à leurs visas nationaux aux fins de transit par leur territoire (1), des mesures harmonisées ont été prises en vue de simplifier le transit des titulaires de visas Schengen et de titres de séjour Schengen via le territoire des États membres qui n’appliquent pas encore pleinement l’acquis de Schengen.
Déclaration commune relative à l’Article 10 de l’accord concernant les passeports diplomatiques
L’Union ou l’Arménie pourrait invoquer une suspension partielle de l’accord, et notamment de son article 10, conformément à la procédure prévue à son article 14, paragraphe 5, si l’application dudit article 10 donne lieu à des abus de la part de l’autre partie ou fait peser une menace sur la sécurité publique.
En cas de suspension de l’application de l’article 10, les deux parties engagent des consultations dans le cadre du comité mixte institué par l’accord, en vue de résoudre les problèmes qui ont conduit à la suspension.
Prioritairement, les deux parties s’engagent à garantir un haut niveau de sécurité des passeports diplomatiques, notamment en y intégrant des identifiants biométriques. En ce qui concerne l’Union, cette sécurité sera garantie conformément aux exigences énoncées dans le règlement (CE) no 2252/2004 du Conseil du 13 décembre 2004 établissant des normes pour les éléments de sécurité et les éléments biométriques intégrés dans les passeports et les documents de voyage délivrés par les États membres (1).
Déclaration de l’Union européenne concernant les documents à produire à l’appui d’une demande de visa de court séjour
L’Union européenne intensifiera les efforts pour établir, avant l’entrée en vigueur de l’accord entre l’Union européenne et la République d’Arménie visant à faciliter la délivrance de visas, une liste d’exigences minimales afin que les demandeurs arméniens reçoivent des informations de base cohérentes et uniformes, conformément à l’article 47, paragraphe 1, point a), du code des visas, et soient invités à fournir, en principe, les mêmes documents à l’appui de leur demande.
Les informations susmentionnées doivent être largement diffusées (sur le tableau d’affichage des consulats, sous la forme de dépliants, sur l’internet, etc.).
Déclaration commune concernant le Danemark
Les parties prennent acte de ce que le présent accord ne s’applique pas aux procédures de délivrance de visas appliquées par les missions diplomatiques et services consulaires du Danemark.
Dans ces circonstances, il convient que les autorités du Danemark et de l’Arménie concluent sans délai un accord bilatéral visant à faciliter la délivrance de visas de court séjour dans des conditions analogues à celles de l’accord entre l’Union et l’Arménie.
Déclaration commune concernant le Royaume-Uni et l’Irlande
Les parties prennent acte de ce que le présent accord ne s’applique pas aux territoires du Royaume-Uni et de l’Irlande.
Dans ces circonstances, il convient que les autorités du Royaume-Uni, de l’Irlande et de l’Arménie concluent des accords bilatéraux visant à faciliter la délivrance de visas.
Déclaration commune concernant l’Islande, la Norvège, la Suisse et le Liechtenstein
Les parties prennent acte des relations étroites qui existent entre l’Union et la Suisse, l’Islande, le Liechtenstein et la Norvège, particulièrement en vertu des accords du 18 mai 1999 et du 26 octobre 2004 concernant l’association de ces pays à la mise en œuvre, à l’application et au développement de l’acquis de Schengen.
Dans ces circonstances, il convient que les autorités de la Suisse, de l’Islande, du Liechtenstein, de la Norvège et de l’Arménie concluent sans délai des accords bilatéraux visant à faciliter la délivrance de visas de court séjour dans des conditions analogues à celles de l’accord entre l’Union et l’Arménie.
Déclaration commune relative à la coopération en matière de documents de voyage
Les parties conviennent que, lors du suivi de la mise en œuvre de l’accord, le comité mixte institué conformément à l’article 12 devrait évaluer l’incidence du niveau de sécurité des documents de voyage respectifs sur le fonctionnement de l’accord. À cette fin, les parties conviennent de s’informer régulièrement des mesures prises pour éviter la multiplication des documents de voyage et développer les aspects techniques de la sécurité de ces derniers, ainsi que des mesures concernant la procédure de personnalisation de la délivrance de ces documents.
|
31.10.2013 |
FR |
Journal officiel de l'Union européenne |
L 289/12 |
DÉCISION DU CONSEIL
du 22 octobre 2013
relative à la conclusion de l’accord entre l’Union européenne et la République d’Arménie concernant la réadmission des personnes en séjour irrégulier
(2013/629/UE)
LE CONSEIL DE L’UNION EUROPÉENNE,
vu le traité sur le fonctionnement de l’Union européenne, et notamment son article 79, paragraphe 3, en liaison avec l’article 218, paragraphe 6, deuxième alinéa, point a),
vu la proposition de la Commission européenne,
vu l’approbation du Parlement européen,
considérant ce qui suit:
|
(1) |
Conformément à la décision 2013/156/UE du Conseil (1), l’accord entre l’Union européenne et la République d’Arménie concernant la réadmission des personnes en séjour irrégulier (ci-après dénommé «l’accord») a été signé le 19 avril 2013, sous réserve de sa conclusion à une date ultérieure. |
|
(2) |
Il convient d’approuver l’accord. |
|
(3) |
L’accord institue un comité de réadmission mixte qui peut adopter son règlement intérieur. Il y a lieu de prévoir une procédure simplifiée pour la définition de la position de l’Union européenne à cet égard. |
|
(4) |
Conformément aux articles 1er et 2 du protocole no 21 sur la position du Royaume-Uni et de l’Irlande à l’égard de l’espace de liberté, de sécurité et de justice, annexé au traité sur l’Union européenne et au traité sur le fonctionnement de l’Union européenne, ces États membres ne participent pas à l’adoption de la présente décision et ne sont pas liés par celle-ci ni soumis à son application. |
|
(5) |
Conformément aux articles 1er et 2 du protocole no 22 sur la position du Danemark, annexé au traité sur l’Union européenne et au traité sur le fonctionnement de l’Union européenne, le Danemark ne participe pas à l’adoption de la présente décision et n’est pas lié par celle-ci ni soumis à son application, |
A ADOPTÉ LA PRÉSENTE DÉCISION:
Article premier
L’accord entre l’Union européenne et la République d’Arménie concernant la réadmission des personnes en séjour irrégulier est approuvé au nom de l’Union.
Le texte de l’accord est joint à la présente décision.
Article 2
Le président du Conseil procède, au nom de l’Union, à la notification prévue à l’article 23, paragraphe 2, de l’accord (2).
Article 3
La Commission, assistée d’experts des États membres, représente l’Union au sein du comité de réadmission mixte institué par l’article 19 de l’accord.
Article 4
La présente décision entre en vigueur le jour de son adoption.
Fait à Luxembourg, le 22 octobre 2013.
Par le Conseil
Le président
L. LINKEVIČIUS
(1) JO L 87 du 27.3.2013, p. 1.
(2) La date d’entrée en vigueur de l’accord sera publiée au Journal officiel de l’Union européenne par les soins du secrétariat général du Conseil.
|
31.10.2013 |
FR |
Journal officiel de l'Union européenne |
L 289/13 |
ACCORD
entre l’Union européenne et la République d’Arménie concernant la réadmission des personnes en séjour irrégulier
LES PARTIES CONTRACTANTES,
L’UNION EUROPÉENNE, ci-après dénommée «l’Union»,
et
LA RÉPUBLIQUE D’ARMÉNIE, ci-après dénommée «l’Arménie»,
DÉTERMINÉES à renforcer leur coopération afin de lutter plus efficacement contre l’immigration clandestine;
DÉSIREUSES d’établir, au moyen du présent accord et sur une base de réciprocité, des procédures rapides et efficaces d’identification et de rapatriement en toute sécurité et en bon ordre des personnes qui ne remplissent pas, ou ne remplissent plus, les conditions d’entrée, de présence et de séjour sur le territoire de l’Arménie ou de l’un des États membres de l’Union européenne, et de faciliter le transit de ces personnes dans un esprit de coopération;
SOULIGNANT que le présent accord n’affecte pas les droits, obligations et responsabilités de l’Union, de ses États membres et de l’Arménie découlant du droit international et, notamment, de la convention du 28 juillet 1951 relative au statut des réfugiés, modifiée par le protocole du 31 janvier 1967, ainsi que de la convention de sauvegarde des droits de l’homme et des libertés fondamentales du 4 novembre 1950;
CONSIDÉRANT que, en vertu du protocole no 21 sur la position du Royaume-Uni et de l’Irlande à l’égard de l’espace de liberté, de sécurité et de justice annexé au traité sur l’Union européenne et au traité sur le fonctionnement de l’Union européenne, le Royaume-Uni de Grande-Bretagne et d’Irlande du Nord et l’Irlande ne participeront pas au présent accord, à moins qu’ils ne notifient leur souhait d’y participer, conformément audit protocole;
CONSIDÉRANT que les dispositions du présent accord, qui relève du titre V de la troisième partie du traité sur le fonctionnement de l’Union européenne, ne s’appliquent pas au Royaume de Danemark, conformément au protocole no 22 sur la position du Danemark annexé au traité sur l’Union européenne et au traité sur le fonctionnement de l’Union européenne,
SONT CONVENUES DE CE QUI SUIT:
Article 1
Définitions
Aux fins du présent accord, on entend par:
|
a) |
«parties contractantes», l’Arménie et l’Union; |
|
b) |
«ressortissant arménien», toute personne possédant la nationalité arménienne conformément à la législation de la République d’Arménie; |
|
c) |
«ressortissant d’un État membre», toute personne possédant la nationalité d’un État membre, au sens de la définition de l’Union; |
|
d) |
«État membre», tout État membre de l’Union européenne, lié par le présent accord; |
|
e) |
«ressortissant de pays tiers», toute personne possédant une nationalité autre que la nationalité arménienne ou que celle de l’un des États membres; |
|
f) |
«apatride», toute personne dépourvue de nationalité; |
|
g) |
«titre de séjour», tout titre, de quelque type que ce soit, délivré par l’Arménie ou l’un des États membres, donnant droit à une personne de séjourner sur son territoire. Ne sont pas couvertes par cette définition les autorisations temporaires de rester sur le territoire qui sont accordées dans le cadre du traitement d’une demande d’asile ou d’une demande de titre de séjour; |
|
h) |
«visa», une autorisation délivrée ou une décision prise par l’Arménie ou l’un des États membres, nécessaire pour entrer sur leur territoire ou transiter par celui-ci. Cela n’inclut pas le visa de transit aéroportuaire; |
|
i) |
«État requérant», l’État (l’Arménie ou l’un des États membres) qui présente une demande de réadmission au titre de l’article 8 ou une demande de transit au titre de l’article 15 du présent accord; |
|
j) |
«État requis», l’État (l’Arménie ou l’un des États membres) qui est destinataire d’une demande de réadmission au titre de l’article 8 ou d’une demande de transit au titre de l’article 15 du présent accord; |
|
k) |
«autorité compétente», toute autorité nationale de l’Arménie ou de l’un des États membres chargée de la mise en œuvre du présent accord, conformément à son article 20, paragraphe 1, point a); |
|
l) |
«transit», le passage d’un ressortissant de pays tiers ou d’un apatride par le territoire de l’État requis au cours de son transfert entre l’État requérant et le pays de destination; |
|
m) |
«région frontalière», une zone s’étendant jusqu’à 15 kilomètres au-delà des territoires des ports maritimes, zones douanières comprises, et des aéroports internationaux des États membres et de l’Arménie. |
Article 2
Principes fondamentaux
Tout en renforçant leur coopération en matière de prévention et de lutte contre les migrations irrégulières, l’État requis et l’État requérant assurent, lors de l’application du présent accord aux personnes relevant de son champ d’application, le respect des droits de l’homme et des obligations et responsabilités découlant des instruments internationaux qui leur sont applicables, en particulier:
|
— |
la déclaration universelle des droits de l’homme du 10 décembre 1948, |
|
— |
la convention de sauvegarde des droits de l’homme et des libertés fondamentales du 4 novembre 1950, |
|
— |
le pacte international relatif aux droits civils et politiques du 16 décembre 1966, |
|
— |
la convention des Nations unies contre la torture et autres peines ou traitements cruels, inhumains ou dégradants du 10 décembre 1984, |
|
— |
la convention du 28 juillet 1951 relative au statut des réfugiés et le protocole du 31 janvier 1967 relatif au statut des réfugiés. |
L’État requis veille particulièrement, conformément à ses obligations au titre des instruments internationaux énumérés ci-dessus, à protéger les droits des personnes réadmises sur son territoire.
L’État requérant doit privilégier le retour volontaire par rapport au retour forcé lorsqu’il n’y a pas lieu de craindre que le retour d’une personne dans l’État requis s’en trouve compromis.
SECTION I
OBLIGATIONS DE RÉADMISSION PAR L’ARMÉNIE
Article 3
Réadmission des ressortissants nationaux
1. À la demande d’un État membre et sans autres formalités que celles précisées dans le présent accord, l’Arménie réadmet sur son territoire toute personne qui ne remplit pas, ou ne remplit plus, les conditions d’entrée, de présence ou de séjour applicables sur le territoire de l’État membre requérant, lorsqu’il est prouvé, ou peut être valablement présumé sur la base du commencement de preuve fourni, que cette personne est un ressortissant arménien.
2. L’Arménie réadmet également:
|
— |
les enfants mineurs célibataires des personnes mentionnées au paragraphe 1, quels que soient leur lieu de naissance ou leur nationalité, excepté lorsqu’ils disposent d’un droit de séjour autonome dans l’État membre requérant ou sont titulaires d’un titre de séjour en règle délivré par un autre État membre, |
|
— |
les conjoints des personnes mentionnées au paragraphe 1 qui ont une autre nationalité ou sont apatrides, pour autant qu’ils aient ou obtiennent le droit d’entrer et de séjourner sur le territoire de l’Arménie, excepté lorsqu’ils disposent d’un droit de séjour autonome dans l’État membre requérant ou sont titulaires d’un titre de séjour en règle délivré par un autre État membre. |
3. L’Arménie réadmet aussi toute personne ayant renoncé à la nationalité arménienne après son entrée sur le territoire d’un État membre, à moins que cette personne n’ait reçu au minimum l’assurance d’obtenir sa naturalisation par cet État membre.
4. Lorsque l’Arménie a fait droit à la demande de réadmission, la mission diplomatique ou le poste consulaire arménien compétent établit, immédiatement, gratuitement et au plus tard dans les trois jours ouvrables, indépendamment de la volonté de la personne à réadmettre, le document de voyage nécessaire au retour de l’intéressé, d’une durée de validité de 120 jours. Si, dans les trois jours ouvrables, l’Arménie n’a pas délivré le document de voyage, elle est réputée accepter l’utilisation du modèle type de document de voyage de l’Union établi à des fins d’éloignement (1).
5. Si, pour des raisons juridiques ou factuelles, l’intéressé ne peut pas être transféré au cours de la période de validité du document de voyage délivré initialement, la mission diplomatique ou le poste consulaire arménien compétent délivre, dans un délai de trois jours ouvrables et gratuitement, un nouveau document de voyage ayant la même durée de validité. Si, dans les trois jours ouvrables, l’Arménie n’a pas délivré le document de voyage, elle est réputée accepter l’utilisation du modèle type de document de voyage de l’Union établi à des fins d’éloignement (2).
Article 4
Réadmission des ressortissants de pays tiers et des apatrides
1. À la demande d’un État membre et sans autres formalités que celles précisées dans le présent accord, l’Arménie réadmet sur son territoire tout ressortissant de pays tiers ou apatride qui ne remplit pas, ou ne remplit plus, les conditions d’entrée, de présence ou de séjour applicables sur le territoire de l’État membre requérant, lorsqu’il est prouvé, ou peut être valablement présumé sur la base du commencement de preuve fourni, que cette personne:
|
a) |
détient, au moment du dépôt de la demande de réadmission, un visa en cours de validité ou un titre de séjour en règle délivré par l’Arménie; ou |
|
b) |
est entrée illégalement et directement sur le territoire des États membres après avoir séjourné sur, ou transité par, le territoire de l’Arménie. |
2. L’obligation de réadmission énoncée au paragraphe 1 ne s’applique pas lorsque le ressortissant de pays tiers ou l’apatride n’a effectué qu’un transit par un aéroport international de l’Arménie.
3. Sans préjudice de l’article 7, paragraphe 2, lorsque l’Arménie fait droit à la demande de réadmission, l’État membre requérant délivre à la personne qui en est l’objet le modèle type de document de voyage de l’Union européenne établi à des fins d’éloignement (3).
SECTION II
OBLIGATIONS DE RÉADMISSION PAR L’UNION
Article 5
Réadmission des ressortissants nationaux
1. À la demande de l’Arménie et sans autres formalités que celles précisées dans le présent accord, un État membre réadmet sur son territoire toute personne qui ne remplit pas ou ne remplit plus les conditions d’entrée, de présence ou de séjour applicables sur le territoire de l’Arménie, lorsqu’il est prouvé, ou peut être valablement présumé sur la base du commencement de preuve fourni, que la personne est un ressortissant de cet État membre.
2. Un État membre réadmet également:
|
— |
les enfants mineurs célibataires des personnes mentionnées au paragraphe 1, quels que soient leur lieu de naissance ou leur nationalité, excepté lorsqu’ils disposent d’un droit de séjour autonome en Arménie, |
|
— |
les conjoints des personnes mentionnées au paragraphe 1 qui ont une autre nationalité, pour autant qu’ils aient ou obtiennent le droit d’entrer et de séjourner sur le territoire de l’État membre requis, excepté lorsqu’ils disposent d’un droit de séjour autonome en Arménie. |
3. Un État membre réadmet aussi toute personne ayant renoncé à la nationalité d’un État membre après son entrée sur le territoire de l’Arménie, à moins que cette personne n’ait reçu au minimum l’assurance d’obtenir sa naturalisation par l’Arménie.
4. Lorsque l’État membre requis a fait droit à la demande de réadmission, la mission diplomatique ou le poste consulaire compétent de cet État membre établit, immédiatement, gratuitement et au plus tard dans les trois jours ouvrables, indépendamment de la volonté de la personne à réadmettre, le document de voyage nécessaire au retour de l’intéressé, d’une durée de validité de 120 jours.
5. Si, pour des raisons juridiques ou factuelles, l’intéressé ne peut pas être transféré au cours de la période de validité du document de voyage délivré initialement, la mission diplomatique ou le poste consulaire compétent de cet État membre délivre, dans un délai de trois jours ouvrables et gratuitement, un nouveau document de voyage ayant la même durée de validité.
Article 6
Réadmission des ressortissants de pays tiers et des apatrides
1. À la demande de l’Arménie et sans autres formalités que celles précisées dans le présent accord, un État membre réadmet sur son territoire tout ressortissant de pays tiers ou apatride qui ne remplit pas, ou ne remplit plus, les conditions d’entrée, de présence ou de séjour applicables sur le territoire de l’Arménie, lorsqu’il est prouvé, ou peut être valablement présumé sur la base du commencement de preuve fourni, que cette personne:
|
a) |
détient, au moment du dépôt de la demande de réadmission, un visa en cours de validité ou un titre de séjour en règle délivré par l’État membre requis; ou |
|
b) |
est entrée illégalement et directement sur le territoire de l’Arménie après avoir séjourné sur, ou transité par, le territoire de l’État membre requis. |
2. L’obligation de réadmission énoncée au paragraphe 1 ne s’applique pas lorsque le ressortissant de pays tiers ou l’apatride n’a effectué qu’un transit par un aéroport international de l’État membre requis.
3. L’obligation de réadmission mentionnée au paragraphe 1 incombe à l’État membre qui a délivré le visa ou le titre de séjour. Si plusieurs États membres ont délivré un visa ou un titre de séjour, l’obligation de réadmission mentionnée au paragraphe 1 incombe à l’État membre qui a délivré le document dont la période de validité est la plus longue ou, si l’un ou plusieurs d’entre eux ont déjà expiré, le document qui est toujours en cours de validité. Si tous les documents ont déjà expiré, l’obligation de réadmission mentionnée au paragraphe 1 incombe à l’État membre qui a délivré le document dont la date d’expiration est la plus récente. Si aucun document de cette nature ne peut être présenté, l’obligation de réadmission mentionnée au paragraphe 1 incombe à l’État membre dont le territoire a été quitté en dernier lieu.
4. Sans préjudice de l’article 7, paragraphe 2, lorsque l’État membre fait droit à la demande de réadmission, l’Arménie délivre à la personne qui en est l’objet le document de voyage nécessaire à son retour.
SECTION III
PROCÉDURE DE RÉADMISSION
Article 7
Principes
1. Sous réserve du paragraphe 2, tout transfert d’une personne devant être réadmise sur la base de l’une des obligations énoncées aux articles 3 à 6 requiert la présentation d’une demande de réadmission à l’autorité compétente de l’État requis.
2. Si la personne à réadmettre est en possession d’un document de voyage ou d’une carte d’identité en cours de validité et, s’il s’agit d’un ressortissant de pays tiers ou d’un apatride, d’un visa ou d’une autorisation de séjour en cours de validité délivré(e) par l’État requis, le transfert de la personne peut avoir lieu sans demande de réadmission ou communication écrite visée à l’article 12, paragraphe 1, de l’État requérant à l’autorité compétente de l’État requis.
3. Sans préjudice du paragraphe 2, si une personne a été appréhendée dans la région frontalière, y compris les aéroports, de l’État requérant après avoir franchi illégalement la frontière en provenance directe du territoire de l’État requis, l’État requérant peut présenter une demande de réadmission dans le délai de deux jours ouvrables à compter de l’arrestation de l’intéressé (procédure accélérée).
Article 8
Demande de réadmission
1. Dans la mesure du possible, la demande de réadmission doit comporter les informations suivantes:
|
a) |
les renseignements individuels concernant la personne à réadmettre (par exemple, les nom, prénoms, date de naissance, et – si possible – le lieu de naissance et le dernier lieu de résidence) et, le cas échéant, les renseignements individuels concernant les enfants mineurs célibataires et/ou le conjoint; |
|
b) |
pour les ressortissants nationaux, l’indication des moyens de preuve ou de commencement de preuve de la nationalité, conformément aux annexes 1 et 2 respectivement, sera fournie; |
|
c) |
pour les ressortissants de pays tiers et les apatrides, l’indication des moyens de preuve ou de commencement de preuve des conditions de la réadmission des ressortissants de pays tiers et des apatrides, conformément aux annexes 3 et 4 respectivement, sera fournie; |
|
d) |
une photographie de la personne à réadmettre. |
2. Dans la mesure du possible, la demande de réadmission doit également contenir les informations suivantes:
|
a) |
une déclaration indiquant que la personne à transférer peut avoir besoin d’assistance ou de soins, sous réserve que celle-ci ait donné son consentement exprès à cette déclaration; |
|
b) |
l’indication de toute autre mesure de protection ou de sécurité particulière, ou d’informations concernant la santé de l’intéressé, qui peuvent se révéler nécessaires pour son transfert. |
3. Un formulaire commun à utiliser pour les demandes de réadmission figure à l’annexe 5 du présent accord.
4. Les demandes de réadmission peuvent être transmises par tout moyen de communication, y compris électronique.
Article 9
Moyens de preuve de la nationalité
1. La preuve de la nationalité visée à l’article 3, paragraphe 1, et à l’article 5, paragraphe 1, peut être fournie, en particulier, au moyen des documents énumérés à l’annexe 1 du présent accord, même si leur période de validité a expiré depuis six mois au maximum. Si ces documents sont présentés, les États membres et l’Arménie reconnaissent mutuellement la nationalité sans qu’il soit nécessaire de procéder à une enquête complémentaire. La preuve de la nationalité ne peut être fournie au moyen de faux documents.
2. Le commencement de preuve de la nationalité visé à l’article 3, paragraphe 1, et à l’article 5, paragraphe 1, peut être fourni, en particulier, au moyen des documents énumérés à l’annexe 2 du présent accord, même si leur période de validité a expiré. Si ces documents sont présentés, les États membres et l’Arménie considèrent que la nationalité est établie, à moins qu’ils ne puissent prouver le contraire. Le commencement de preuve de la nationalité ne peut être fourni au moyen de faux documents.
3. Si aucun des documents énumérés à l’annexe 1 ou 2 ne peut être présenté, la mission diplomatique ou le poste consulaire compétent de l’État requis concerné, sur demande de l’État requérant à inclure dans la demande de réadmission, s’entretient avec la personne à réadmettre dans un délai raisonnable, et au plus tard dans les cinq jours ouvrables à compter de la date de la demande conformément à l’article 11, paragraphe 2, afin d’établir sa nationalité. La procédure applicable à ces auditions peut être établie dans les protocoles d’application prévus à l’article 20 du présent accord.
Article 10
Moyens de preuve concernant les ressortissants de pays tiers et les apatrides
1. La preuve des conditions de la réadmission des ressortissants de pays tiers et des apatrides visée à l’article 4, paragraphe 1, et à l’article 6, paragraphe 1, est fournie, en particulier, au moyen des éléments justificatifs énumérés à l’annexe 3 du présent accord. Elle ne peut être fournie au moyen de faux documents. Les États membres et l’Arménie reconnaissent mutuellement cette preuve sans qu’il soit nécessaire de procéder à une enquête complémentaire.
2. Le commencement de preuve des conditions de la réadmission des ressortissants de pays tiers et des apatrides visé à l’article 4, paragraphe 1, et à l’article 6, paragraphe 1, est fourni, en particulier, au moyen des éléments justificatifs énumérés à l’annexe 4 du présent accord. Il ne peut être fourni au moyen de faux documents. Lorsqu’un tel commencement de preuve est présenté, les États membres et l’Arménie considèrent que les conditions sont établies, à moins qu’ils ne puissent prouver le contraire.
3. L’irrégularité de l’entrée, de la présence ou du séjour est établie au moyen des documents de voyage de l’intéressé dans lesquels ne figure pas le visa ou autre titre de séjour exigé sur le territoire de l’État requérant. Une déclaration de l’État requérant selon laquelle l’intéressé a été intercepté sans avoir en sa possession les documents de voyage, le visa ou le titre de séjour exigés fournit de la même façon le commencement de preuve de l’irrégularité de l’entrée, de la présence ou du séjour.
Article 11
Délais
1. La demande de réadmission doit être présentée à l’autorité compétente de l’État requis dans un délai maximal de neuf mois après que l’autorité compétente de l’État requérant a eu connaissance du fait qu’un ressortissant de pays tiers ou qu’un apatride ne remplissait pas, ou ne remplissait plus, les conditions d’entrée, de présence ou de séjour en vigueur. Lorsque des obstacles factuels ou juridiques s’opposent à ce que la demande soit présentée en temps voulu, le délai est prolongé, à la demande de l’État requérant, mais seulement jusqu’à ce que ces obstacles cessent d’exister.
2. La réponse à la demande de réadmission est fournie par écrit:
|
— |
dans un délai de deux jours ouvrables si la demande a été introduite selon la procédure accélérée (article 7, paragraphe 3), |
|
— |
dans un délai de douze jours calendrier dans tous les autres cas. |
Le délai commence à courir à la date de réception de la demande de réadmission. En l’absence de réponse dans le délai fixé, le transfert est réputé approuvé.
Les réponses aux demandes de réadmission peuvent être transmises par tout moyen de communication, y compris électronique.
3. Le rejet d’une demande de réadmission doit être motivé par écrit.
4. Après approbation du transfert ou, le cas échéant, à l’expiration du délai mentionné au paragraphe 2, l’intéressé est transféré dans un délai de trois mois. À la demande de l’État requérant, ce délai peut être prolongé aussi longtemps que les obstacles d’ordre juridique ou pratique l’exigent.
Article 12
Modalités de transfert et modes de transport
1. Sans préjudice de l’article 7, paragraphe 2, avant le rapatriement d’une personne, les autorités compétentes de l’État requérant communiquent par écrit aux autorités compétentes de l’État requis, au moins deux jours ouvrables à l’avance, la date de transfert, le point de passage frontalier, les escortes éventuelles et d’autres informations concernant le transfert.
2. Le transport peut s’effectuer par tout moyen, y compris par voie aérienne. Le retour par voie aérienne ne se fait pas obligatoirement par l’intermédiaire des transporteurs nationaux de l’Arménie ou des États membres et peut s’effectuer dans le cadre de vols réguliers ou de vols charter. Dans le cas d’un retour sous escorte, cette dernière ne se limite pas aux personnes autorisées de l’État requérant, pour autant qu’il s’agisse de personnes autorisées par l’Arménie ou tout État membre.
3. Si le transfert s’effectue par voie aérienne, les éventuelles escortes sont dispensées de l’obligation d’obtenir les visas nécessaires.
Article 13
Réadmission par erreur
L’État requérant reprend en charge toute personne réadmise par l’État requis s’il est établi, dans un délai de six mois après le transfert de l’intéressé, que les conditions définies aux articles 3 à 6 du présent accord n’étaient pas remplies.
Dans de tels cas, les règles procédurales du présent accord s’appliquent mutatis mutandis et toutes les informations disponibles concernant l’identité et la nationalité réelles de la personne à reprendre en charge sont communiquées.
SECTION IV
OPÉRATIONS DE TRANSIT
Article 14
Principes
1. Les États membres et l’Arménie s’efforcent de limiter le transit des ressortissants des pays tiers et des apatrides aux cas dans lesquels ces personnes ne peuvent être directement rapatriées vers l’État de destination.
2. L’Arménie autorise le transit de ressortissants de pays tiers ou d’apatrides si un État membre en fait la demande, et un État membre autorise le transit de ressortissants de pays tiers ou d’apatrides si l’Arménie en fait la demande, à condition que la poursuite du voyage dans d’autres États de transit éventuels et la réadmission par l’État de destination soient garanties.
3. L’Arménie ou un État membre peut refuser le transit:
|
a) |
si le ressortissant de pays tiers ou l’apatride court un risque réel, dans l’État de destination ou dans un autre État de transit, d’être soumis à la torture ou à d’autres peines ou traitements inhumains ou dégradants ou encore à la peine de mort, ou d’être persécuté en raison de sa race, sa religion, sa nationalité, son appartenance à un groupe social particulier ou ses opinions politiques; ou |
|
b) |
si le ressortissant de pays tiers ou l’apatride doit faire l’objet de sanctions pénales dans l’État requis ou dans un autre État de transit; ou |
|
c) |
pour des raisons de santé publique, de sécurité nationale ou d’ordre public, ou en raison d’autres intérêts nationaux de l’État requis. |
4. L’Arménie ou un État membre peut retirer une autorisation délivrée si les circonstances évoquées au paragraphe 3, qui sont de nature à empêcher l’opération de transit, se produisent ou viennent à être connues ultérieurement, ou si la poursuite du voyage dans d’éventuels États de transit ou la réadmission par l’État de destination n’est plus garantie. Dans ce cas, si nécessaire et sans tarder, l’État requérant reprend en charge le ressortissant de pays tiers ou l’apatride.
Article 15
Procédure de transit
1. Toute demande de transit doit être adressée par écrit à l’autorité compétente de l’État requis et contenir les informations suivantes:
|
a) |
le type de transit (par voie aérienne, maritime ou terrestre), les autres États de transit éventuels et la destination finale prévue; |
|
b) |
les renseignements individuels concernant l’intéressé (par exemple, nom de famille, prénom, nom de jeune fille, autres noms utilisés/sous lesquels il est connu ou noms d’emprunt, date de naissance, sexe et – si possible – lieu de naissance, nationalité, langue, type et numéro du document de voyage); |
|
c) |
le point de passage frontalier envisagé, la date du transfert et le recours éventuel à des escortes; |
|
d) |
une déclaration précisant que, du point de vue de l’État requérant, les conditions visées à l’article 14, paragraphe 2, sont remplies et qu’aucune raison justifiant un refus en vertu de l’article 14, paragraphe 3, n’est connue. |
Le formulaire commun à utiliser pour les demandes de transit figure à l’annexe 6 du présent accord.
Les demandes de transit peuvent être transmises par tout moyen de communication, y compris électronique.
2. Dans un délai de trois jours ouvrables à compter de la réception de la demande, l’État requis informe par écrit l’État requérant de l’admission, en confirmant le point de passage frontalier et la date d’admission envisagée, ou l’informe du refus d’admission et des raisons de ce dernier. En l’absence de réponse dans un délai de trois jours ouvrables, le transit est réputé approuvé.
Les réponses aux demandes de transit peuvent être transmises par tout moyen de communication, y compris électronique.
3. Si l’opération de transit s’effectue par voie aérienne, la personne à réadmettre et les éventuelles escortes sont dispensées de l’obligation d’obtenir un visa de transit aéroportuaire.
4. Sous réserve de consultations mutuelles, les autorités compétentes de l’État requis apportent leur soutien aux opérations de transit, notamment par la surveillance des personnes concernées et la fourniture des équipements appropriés à cet effet.
5. Le transit des personnes a lieu dans les trente jours suivant la réception de l’acceptation de la demande.
SECTION V
COÛTS
Article 16
Coûts de transport et de transit
Sans préjudice du droit des autorités compétentes de récupérer le montant des coûts liés à la réadmission auprès de la personne à réadmettre ou de tiers, tous les frais de transport engagés jusqu’à la frontière de l’État de destination finale dans le cadre des opérations de réadmission et de transit effectuées en application du présent accord sont à la charge de l’État requérant.
SECTION VI
PROTECTION DES DONNÉES ET LIENS AVEC D’AUTRES OBLIGATIONS INTERNATIONALES
Article 17
Protection des données
La communication des données à caractère personnel n’a lieu que si cette communication est nécessaire à la mise en œuvre du présent accord par les autorités compétentes de l’Arménie ou d’un État membre, selon le cas. Le traitement des données à caractère personnel, dans les cas d’espèce, est régi par la législation nationale de l’Arménie et, lorsque le contrôleur est une autorité compétente d’un État membre, par les dispositions de la directive 95/46/CE et de la législation nationale adoptée par cet État membre en application de ladite directive. En outre, les principes suivants s’appliquent:
|
a) |
les données à caractère personnel doivent être traitées loyalement et licitement; |
|
b) |
les données à caractère personnel doivent être collectées dans le but spécifique, explicite et légitime de la mise en œuvre du présent accord et ne pas être traitées ultérieurement, par l’autorité qui les communique ou celle qui les reçoit, de manière incompatible avec cette finalité; |
|
c) |
les données à caractère personnel doivent être adéquates, pertinentes et non excessives au regard des finalités pour lesquelles elles sont collectées et/ou traitées ultérieurement; en particulier, les données à caractère personnel communiquées ne peuvent porter que sur les informations suivantes:
|
|
d) |
les données à caractère personnel doivent être exactes et, si nécessaire, mises à jour; |
|
e) |
les données à caractère personnel doivent être conservées sous une forme permettant l’identification des personnes concernées pendant une durée n’excédant pas celle nécessaire à la réalisation des finalités pour lesquelles elles ont été collectées ou pour lesquelles elles sont traitées ultérieurement; |
|
f) |
tant l’autorité qui communique les données que celle qui les reçoit prennent toute mesure utile pour garantir, selon le cas, la rectification, l’effacement ou le verrouillage des données à caractère personnel dont le traitement n’est pas conforme aux dispositions du présent article, notamment parce que les données ne sont pas adéquates, pertinentes et exactes ou qu’elles sont excessives au regard des finalités pour lesquelles elles sont traitées. Cela inclut la notification à l’autre partie de toute rectification, tout effacement ou tout verrouillage; |
|
g) |
sur demande, l’autorité destinataire informe l’autorité ayant communiqué les données de l’utilisation qui en a été faite et des résultats obtenus; |
|
h) |
les données à caractère personnel ne peuvent être communiquées qu’aux autorités compétentes. Leur transmission ultérieure à d’autres organismes nécessite le consentement préalable de l’autorité les ayant communiquées; |
|
i) |
l’autorité qui communique les données et celle qui les reçoit sont tenues de procéder à un enregistrement écrit de la communication et de la réception des données à caractère personnel. |
Article 18
Liens avec d’autres obligations internationales
1. Le présent accord n’affecte pas les droits, obligations et responsabilités de l’Union, de ses États membres et de l’Arménie, qui découlent du droit international, y compris de toute convention internationale auxquels ils sont parties, et notamment des instruments internationaux mentionnés à l’article 2, ainsi que:
|
— |
des conventions internationales relatives à la détermination de l’État responsable de l’examen d’une demande d’asile, |
|
— |
des conventions internationales relatives à l’extradition et au transit, |
|
— |
des conventions et accords internationaux multilatéraux concernant la réadmission des ressortissants étrangers. |
2. Aucun élément du présent accord n’empêche le retour d’une personne en vertu d’autres dispositions formelles ou informelles.
SECTION VII
MISE EN ŒUVRE ET APPLICATION
Article 19
Comité de réadmission mixte
1. Les parties contractantes se prêtent mutuellement assistance pour l’application et l’interprétation du présent accord. À cette fin, elles instituent un comité de réadmission mixte (ci-après dénommé «comité») chargé en particulier:
|
a) |
d’assurer le suivi et l’échange d’informations concernant l’application du présent accord, à l’exclusion des données à caractère personnel; |
|
b) |
de traiter les problèmes liés à l’interprétation ou à l’application des dispositions du présent accord; |
|
c) |
de décider des modalités de mise en œuvre nécessaires à son exécution uniforme; |
|
d) |
d’échanger régulièrement des informations sur les protocoles d’application établis par les différents États membres et l’Arménie en vertu de l’article 20; |
|
e) |
de recommander des modifications au présent accord et à ses annexes. |
2. Les décisions du comité sont contraignantes pour les parties contractantes.
3. Le comité se compose de représentants de l’Union et de l’Arménie.
4. Le comité se réunit si nécessaire, à la demande de l’une des parties contractantes.
5. Le comité établit son règlement intérieur.
Article 20
Protocoles d’application
1. Sans préjudice de l’applicabilité directe du présent accord, à la demande d’un État membre ou de l’Arménie, l’Arménie et cet État membre élaborent un protocole d’application portant notamment sur les éléments suivants:
|
a) |
la désignation des autorités compétentes, des points de passage frontaliers et l’échange des points de contact; |
|
b) |
les conditions applicables au retour sous escorte, y compris au transit sous escorte des ressortissants de pays tiers et des apatrides; |
|
c) |
les moyens et documents s’ajoutant à ceux énumérés aux annexes 1 à 4 du présent accord; |
|
d) |
les modalités de réadmission dans le cadre de la procédure accélérée; |
|
e) |
la procédure applicable aux auditions. |
2. Les protocoles d’application visés au paragraphe 1 n’entrent en vigueur qu’après leur notification au comité de réadmission visé à l’article 19.
3. L’Arménie accepte d’appliquer toute disposition d’un protocole d’application conclu avec un État membre également dans ses relations avec tout autre État membre, à la demande de ce dernier. Les États membres acceptent d’appliquer toute disposition d’un protocole d’application conclu par l’un d’entre eux également dans leurs relations avec l’Arménie, à la demande de cette dernière et sous réserve de son applicabilité pratique à d’autres États membres.
Article 21
Relation avec les accords ou arrangements bilatéraux de réadmission des États membres
Les dispositions du présent accord priment celles de tout accord ou arrangement bilatéral relatif à la réadmission des personnes en séjour irrégulier, conclu ou susceptible d’être conclu, en application de l’article 20, entre les États membres et l’Arménie, dans la mesure où les dispositions de ces accords ou arrangements sont incompatibles avec celles du présent accord.
SECTION VIII
DISPOSITIONS FINALES
Article 22
Application territoriale
1. Sous réserve du paragraphe 2, le présent accord s’applique au territoire de l’Arménie et au territoire sur lequel s’appliquent le traité sur l’Union européenne et le traité sur le fonctionnement de l’Union européenne.
2. Le présent accord ne s’applique au territoire du Royaume-Uni de Grande-Bretagne et d’Irlande du Nord et de l’Irlande qu’en vertu d’une notification adressée par l’Union européenne à l’Arménie à cet effet. Le présent accord ne s’applique pas au territoire du Royaume de Danemark.
Article 23
Entrée en vigueur, durée et dénonciation de l’accord
1. Le présent accord est ratifié ou approuvé par les parties contractantes conformément à leurs procédures respectives.
2. Le présent accord entre en vigueur le premier jour du deuxième mois suivant la date à laquelle la dernière partie contractante a notifié à l’autre l’accomplissement des procédures visées au paragraphe 1.
3. Le présent accord s’applique à l’Irlande et au Royaume-Uni de Grande-Bretagne et d’Irlande du Nord le premier jour du deuxième mois suivant la date de la notification visée à l’article 22, paragraphe 2.
4. L’accord est conclu pour une durée illimitée.
5. Le présent accord peut être modifié d’un commun accord des parties contractantes. Les modifications font l’objet de protocoles distincts, qui font partie intégrante du présent accord, et entrent en vigueur conformément à la procédure fixée au présent article.
6. Chacune des parties contractantes peut, par une notification officielle à l’autre partie contractante et après consultation du comité visé à l’article 18, suspendre temporairement, complètement ou en partie, la mise en œuvre du présent accord. La suspension entre en vigueur le deuxième jour suivant celui de sa notification.
7. Chacune des parties contractantes peut dénoncer le présent accord par une notification officielle à l’autre partie contractante. L’accord cesse d’être applicable six mois après cette notification.
Article 24
Annexes
Les annexes 1 à 6 font partie intégrante du présent accord.
Fait à Bruxelles, le dix-neuf avril deux mille treize, en deux exemplaires en langues allemande, anglaise, bulgare, danoise, espagnole, estonienne, finnoise, française, grecque, hongroise, italienne, lettone, lituanienne, maltaise, néerlandaise, polonaise, portugaise, roumaine, slovaque, slovène, suédoise, tchèque et arménienne, chacun de ces textes faisant également foi.
За Европейския съюз
Por la Unión Europea
Za Evropskou unii
For Den Europæiske Union
Für die Europäische Union
Euroopa Liidu nimel
Για την Ευρωπαϊκή Ένωση
For the European Union
Pour l'Union européenne
Per l'Unione europea
Eiropas Savienības vārdā –
Europos Sąjungos vardu
Az Európai Unió részéről
Għall-Unjoni Ewropea
Voor de Europese Unie
W imieniu Unii Europejskiej
Pela União Europeia
Pentru Uniunea Europeană
Za Európsku úniu
Za Evropsko unijo
Euroopan unionin puolesta
För Europeiska unionen
![]()


За Pепублика Армения
Por la República de Armenia
Za Arménskou republiku
For Republikken Armenien
Für die Republik Armenien
Armeenia Vabariigi nimel
Για της Δημοκρατίας της Αρμενίας
For the Republic of Armenia
Pour la République d'Arménie
Per la Repubblica di Armenia
Armēnijas Republikas vārdā –
Armėnijos Respublikos vardu
Örmény Köztársaság részéről
Għall-Repubblika tal-Armenja
Voor de Republiek Armenië
W imieniu Republiki Armenii
Pela República da Arménia
Pentru Republica Armenia
Za Arménsku republiku
Za Republiko Armenijo
Armenian tasavallan puolesta
För Republiken Armenien


(1) Conforme au formulaire prévu dans la recommandation du Conseil du 30 novembre 1994.
(2) Idem.
(3) Idem.
ANNEXE 1
LISTE COMMUNE DES DOCUMENTS DONT LA PRÉSENTATION EST CONSIDÉRÉE COMME UNE PREUVE DE LA NATIONALITÉ
(article 3, paragraphe 1, article 5, paragraphe 1, et article 9, paragraphe 1)
|
— |
passeport, quel qu’en soit le type (national, diplomatique, de service, collectif et de remplacement, y compris les passeports d’enfants mineurs), |
|
— |
carte d’identité, quel qu’en soit le type (y compris les cartes temporaires et provisoires), |
|
— |
certificat de nationalité et autres documents officiels mentionnant ou indiquant clairement la nationalité. |
ANNEXE 2
LISTE COMMUNE DES DOCUMENTS DONT LA PRÉSENTATION EST CONSIDÉRÉE COMME UN COMMENCEMENT DE PREUVE DE LA NATIONALITÉ
(article 3, paragraphe 1, article 5, paragraphe 1, et article 9, paragraphe 2)
|
— |
les documents énumérés à l’annexe 1, dont la période de validité a expiré depuis plus de six mois, |
|
— |
photocopie de tout document énuméré à l’annexe 1 du présent accord, |
|
— |
permis de conduire ou photocopie du permis, |
|
— |
extrait de naissance ou photocopie de ce document, |
|
— |
carte de service d’une entreprise ou photocopie de cette carte, |
|
— |
déclaration d’un témoin, |
|
— |
déclaration de l’intéressé et langue qu’il parle, attestée notamment par les résultats d’un test officiel, |
|
— |
tout autre document susceptible de permettre d’établir la nationalité de l’intéressé, |
|
— |
empreintes digitales, |
|
— |
laissez-passer délivré par l’État requis, |
|
— |
livret et carte d’identité militaires, |
|
— |
livret professionnel maritime et livret de batelier, |
|
— |
confirmation de l’identité à la suite d’une recherche effectuée dans le système d’information sur les visas (1), |
|
— |
pour les États membres n’utilisant pas le système d’information sur les visas, identification positive établie à partir des informations détenues par ces États membres concernant les demandes de visa. |
(1) Règlement (CE) no 767/2008 du Parlement européen et du Conseil du 9 juillet 2008 concernant le système d’information sur les visas (VIS) et l’échange de données entre les États membres sur les visas de court séjour (règlement VIS) (JO L 218 du 13.8.2008, p. 60).
ANNEXE 3
LISTE COMMUNE DES DOCUMENTS CONSIDÉRÉS COMME UNE PREUVE DES MOTIFS DE LA RÉADMISSION DES RESSORTISSANTS DE PAYS TIERS ET DES APATRIDES
(Article 4, paragraphe 1, article 6, paragraphe 1, et article 10, paragraphe 1)
|
— |
visa et/ou titre de séjour délivré par l’État requis, |
|
— |
cachet d’entrée/de sortie ou inscription similaire dans le document de voyage de l’intéressé ou autre preuve de l’entrée/de la sortie (photographique, par exemple). |
ANNEXE 4
LISTE COMMUNE DES DOCUMENTS CONSIDÉRÉS COMME UN COMMENCEMENT DE PREUVE DES MOTIFS DE RÉADMISSION DES RESSORTISSANTS DE PAYS TIERS ET DES APATRIDES
(article 4, paragraphe 1, article 6, paragraphe 1, et article 10, paragraphe 2)
|
— |
description du lieu et des circonstances dans lesquels l’intéressé a été intercepté après son entrée sur le territoire de l’État requérant, délivrée par les autorités compétentes de cet État, |
|
— |
informations relatives à l’identité et/ou au séjour d’une personne, qui ont été fournies par une organisation internationale (par exemple, le HCR), |
|
— |
communications/confirmation d’informations par des membres de la famille, des compagnons de voyage, etc., |
|
— |
déclaration de l’intéressé, |
|
— |
empreintes digitales, |
|
— |
documents, certificats et notes diverses (par exemple, notes d’hôtel, cartes de rappel de rendez-vous chez le médecin/dentiste, titres d’accès à des établissements publics/privés, contrats de location de voitures, reçus de cartes de crédit, etc.) montrant clairement que l’intéressé a séjourné sur le territoire de l’État requis, |
|
— |
billets nominatifs et/ou listes des passagers de compagnies aériennes, ferroviaires, maritimes ou d’autocars attestant la présence de l’intéressé sur le territoire de l’État requis ainsi que l’itinéraire qu’il a parcouru sur ce dernier, |
|
— |
informations montrant que l’intéressé a recouru aux services d’un guide ou d’un agent de voyage, |
|
— |
déclarations officielles faites notamment par les agents des postes-frontières et d’autres témoins qui peuvent attester que l’intéressé a franchi la frontière, |
|
— |
déclaration officielle faite par l’intéressé dans le cadre d’une procédure judiciaire ou administrative. |
ANNEXE 5



ANNEXE 6


Déclaration commune concernant l’article 3, paragraphe 3, et l’article 5, paragraphe 3
Les parties contractantes prennent acte de ce que, conformément aux codes de la nationalité de la République d’Arménie et des États membres, les citoyens de la République d’Arménie et ceux de l’Union européenne ne peuvent pas être déchus de leur nationalité.
Les parties conviennent de se consulter en temps utile en cas de modification de cette situation juridique.
Déclaration commune concernant la République d’Islande
Les parties contractantes prennent acte des relations étroites qui existent entre l’Union européenne et la République d’Islande, particulièrement en vertu de l’accord du 18 mai 1999 concernant l’association de ce pays à la mise en œuvre, à l’application et au développement de l’acquis de Schengen. Dans ces conditions, il convient que l’Arménie conclue un accord de réadmission avec la République d’Islande aux mêmes conditions que celles du présent accord.
RÈGLEMENTS
|
31.10.2013 |
FR |
Journal officiel de l'Union européenne |
L 289/30 |
RÈGLEMENT D’EXÉCUTION (UE) No 1059/2013 DE LA COMMISSION
du 29 octobre 2013
concernant l’autorisation d’une préparation de Saccharomyces cerevisiae MUCL 39885 en tant qu’additif destiné à l’alimentation des bovins d’engraissement et modifiant le règlement (CE) no 492/2006 (titulaire de l’autorisation: Prosol SpA)
(Texte présentant de l'intérêt pour l'EEE)
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l’Union européenne,
vu le règlement (CE) no 1831/2003 du Parlement européen et du Conseil du 22 septembre 2003 relatif aux additifs destinés à l’alimentation des animaux (1), et notamment son article 9, paragraphe 2,
considérant ce qui suit:
|
(1) |
Le règlement (CE) no 1831/2003 dispose que les additifs destinés à l’alimentation des animaux sont soumis à autorisation et définit les motifs et les procédures d’octroi de cette autorisation. Son article 10 prévoit la réévaluation des additifs autorisés conformément à la directive 70/524/CEE du Conseil (2). |
|
(2) |
Le règlement (CE) no 492/2006 de la Commission a autorisé sans limitation dans le temps, conformément à la directive 70/524/CEE, une préparation de Saccharomyces cerevisiae MUCL 39885 en tant qu’additif destiné à l’alimentation des bovins d’engraissement (3). Cette préparation a ensuite été inscrite au registre des additifs pour l’alimentation animale en tant que produit existant, conformément à l’article 10, paragraphe 1, point b), du règlement (CE) no 1831/2003. |
|
(3) |
L’utilisation de la préparation de Saccharomyces cerevisiae MUCL 39885 a également été autorisée pour une période de dix ans par le règlement (CE) no 896/2009 de la Commission (4) pour les truies, par le règlement (UE) no 1119/2010 de la Commission (5) pour les vaches laitières et les chevaux, et par le règlement (UE) no 170/2011 de la Commission (6) pour les porcelets sevrés. |
|
(4) |
Conformément aux dispositions conjointes de l’article 10, paragraphe 2, et de l’article 7 du règlement (CE) no 1831/2003, une demande de réévaluation de cette préparation en tant qu’additif dans l’alimentation des bovins d’engraissement a été introduite, sollicitant sa classification dans la catégorie des «additifs zootechniques». La demande était accompagnée des informations et des documents requis à l’article 7, paragraphe 3, du règlement précité. |
|
(5) |
Dans son avis du 13 mars 2013 (7), l’Autorité européenne de sécurité des aliments (ci-après l’«Autorité») a conclu que, dans les conditions d’utilisation proposées, la préparation de Saccharomyces cerevisiae MUCL 39885 n’avait pas d’effet néfaste sur la santé animale, la santé humaine ou l’environnement, et qu’elle pouvait améliorer le poids corporel final, l’indice de consommation et le gain moyen quotidien. Elle juge inutile de prévoir des exigences spécifiques en matière de surveillance consécutive à la mise sur le marché. L’Autorité a aussi vérifié le rapport sur la méthode d’analyse de l’additif dans l’alimentation animale soumis par le laboratoire de référence désigné par le règlement (CE) no 1831/2003. |
|
(6) |
Il ressort de l’évaluation de la préparation Saccharomyces cerevisiae MUCL 39885 que les conditions d’autorisation fixées à l’article 5 du règlement (CE) no 1831/2003 sont respectées. Il convient dès lors d’autoriser l’utilisation de cette préparation selon les modalités prévues à l’annexe du présent règlement. |
|
(7) |
Du fait de l’octroi d’une nouvelle autorisation au titre du règlement (CE) no 1831/2003, il y a lieu de supprimer les dispositions relatives à Saccharomyces cerevisiae MUCL 39885 dans le règlement (CE) no 492/2006. Il convient dès lors de modifier le règlement (CE) no 492/2006 en conséquence. |
|
(8) |
Étant donné qu’aucun motif de sécurité n’impose l’application immédiate des modifications des conditions d’autorisation, il convient de prévoir une période transitoire pour permettre aux parties intéressées de se préparer aux nouvelles exigences qui découleront de l’autorisation. |
|
(9) |
Les mesures prévues par le présent règlement sont conformes à l’avis du comité permanent de la chaîne alimentaire et de la santé animale, |
A ADOPTÉ LE PRÉSENT RÈGLEMENT:
Article premier
La préparation visée en annexe, qui appartient à la catégorie des «additifs zootechniques» et au groupe fonctionnel des «stabilisateurs de la flore intestinale», est autorisée en tant qu’additif dans l’alimentation des animaux, dans les conditions fixées à ladite annexe.
Article 2
L’entrée E 1710 correspondant à l’additif Saccharomyces cerevisiae MUCL 39885 est supprimée de l’annexe II du règlement (CE) no 492/2006.
Article 3
La préparation spécifiée en annexe et les aliments pour animaux contenant ladite préparation qui sont produits et étiquetés avant le 19 mai 2014, conformément aux règles applicables avant le 19 novembre 2013, peuvent continuer à être mis sur le marché et utilisés jusqu’à épuisement des stocks existants.
Article 4
Le présent règlement entre en vigueur le vingtième jour suivant celui de sa publication au Journal officiel de l’Union européenne.
Le présent règlement est obligatoire dans tous ses éléments et directement applicable dans tout État membre.
Fait à Bruxelles, le 29 octobre 2013.
Par la Commission
Le président
José Manuel BARROSO
(1) JO L 268 du 18.10.2003, p. 29.
(2) Directive 70/524/CEE du Conseil du 23 novembre 1970 concernant les additifs dans l’alimentation des animaux (JO L 270 du 14.12.1970, p. 1).
(3) Règlement (CE) no 492/2006 de la Commission du 27 mars 2006 portant autorisation provisoire ou permanente de certains additifs dans l’alimentation des animaux (JO L 89 du 28.3.2006, p. 6).
(4) Règlement (CE) no 896/2009 de la Commission du 25 septembre 2009 concernant l’autorisation d’une nouvelle utilisation de Saccharomyces cerevisiae MUCL 39885 comme additif dans l’alimentation des truies (titulaire de l’autorisation: Prosol SpA) (JO L 256 du 29.9.2009, p. 6).
(5) Règlement (UE) no 1119/2010 de la Commission du 2 décembre 2010 concernant l’autorisation de Saccharomyces cerevisiae MUCL 39885 en tant qu’additif pour l’alimentation des vaches laitières et des chevaux et modifiant le règlement (CE) no 1520/2007 (titulaire de l’autorisation: Prosol SpA) (JO L 317 du 3.12.2010, p. 9).
(6) Règlement (UE) no 170/2011 de la Commission du 23 février 2011 concernant l’autorisation de Saccharomyces cerevisiae MUCL 39885 en tant qu’additif pour l’alimentation des porcelets (sevrés) et modifiant le règlement (CE) no 1200/2005 (titulaire de l’autorisation: Prosol SpA) (JO L 49 du 24.2.2011, p. 8).
(7) EFSA Journal (2013); 11(4):3174.
ANNEXE
|
Numéro d’identification de l’additif |
Nom du titulaire de l’autorisation |
Additif |
Composition, formule chimique, description, méthode d’analyse |
Espèce ou catégorie d’animaux |
Âge maximal |
Teneur minimale |
Teneur maximale |
Autres dispositions |
Fin de la période d’autorisation |
||||||||||||
|
UFC/kg d’aliment complet ayant une teneur en humidité de 12 % |
|||||||||||||||||||||
|
Catégorie: additifs zootechniques. Groupe fonctionnel: stabilisateurs de la flore intestinale |
|||||||||||||||||||||
|
4b1710 |
Prosol S.p.A. |
Saccharomyces cerevisiae MUCL 39885 |
|
Bovins d’engraissement |
— |
4 × 109 |
— |
|
19 novembre 2023 |
||||||||||||
(1) La description détaillée des méthodes d’analyse est publiée sur le site du laboratoire de référence à l’adresse suivante (http://irmm.jrc.ec.europa.eu/EURLs/EURL_feed_additives/Pages/index.aspx)
|
31.10.2013 |
FR |
Journal officiel de l'Union européenne |
L 289/33 |
RÈGLEMENT D’EXÉCUTION (UE) No 1060/2013 DE LA COMMISSION
du 29 octobre 2013
concernant l’autorisation de la bentonite en tant qu’additif dans l’alimentation de toutes les espèces animales
(Texte présentant de l'intérêt pour l'EEE)
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l’Union européenne,
vu le règlement (CE) no 1831/2003 du Parlement européen et du Conseil du 22 septembre 2003 relatif aux additifs destinés à l’alimentation des animaux (1), et notamment son article 9, paragraphe 2,
considérant ce qui suit:
|
(1) |
Le règlement (CE) no 1831/2003 dispose que les additifs destinés à l’alimentation des animaux sont soumis à autorisation et définit les motifs et les procédures d’octroi de cette autorisation. Son article 10 prévoit la réévaluation des additifs autorisés conformément à la directive 70/524/CEE du Conseil (2). |
|
(2) |
Par la directive 82/822/CEE de la Commission (3), l’utilisation de la bentonite en tant qu’additif pour l’alimentation animale appartenant au groupe des agents liants, antimottants et coagulants a été autorisée pour l’alimentation de toutes les espèces animales, sans limitation dans le temps, conformément à la directive 70/524/CEE. Cet additif a ensuite été inscrit au registre des additifs pour l’alimentation animale en tant que produit existant, conformément à l’article 10, paragraphe 1, point b), du règlement (CE) no 1831/2003. |
|
(3) |
Conformément aux dispositions conjointes de l’article 10, paragraphe 2, et de l’article 7 du règlement (CE) no 1831/2003, une demande a été introduite en vue de la réévaluation de l’utilisation, pour toutes les espèces animales, de la bentonite en tant qu’additif alimentaire liant et antiagglomérant et, conformément à l’article 7 dudit règlement, en vue d’une nouvelle autorisation d’utilisation de la bentonite en tant que substance pour le contrôle de contamination de radionucléides, pour toutes les espèces animales. En outre, conformément à l’article 7 du règlement (CE) no 1831/2003, une demande a été introduite pour une nouvelle autorisation de l’utilisation de bentonite en tant que substance destinée à réduire la contamination des aliments pour animaux par les mycotoxines, pour toutes les espèces animales. Dans ces demandes, accompagnées des informations et documents requis au titre de l’article 7, paragraphe 3, du règlement (CE) no 1831/2003, il a été proposé que cet additif soit classé dans la catégorie des «additifs technologiques». |
|
(4) |
Dans ses avis rendus le 2 février 2011 (4), le 14 juin 2011 (5) et le 14 juin 2012 (6), l’Autorité européenne de sécurité des aliments (ci-après l’«Autorité») a conclu que, dans les conditions d’utilisation proposées, la bentonite n’avait pas d’effet néfaste sur la santé animale, la santé humaine ou l’environnement, et qu’elle pourrait être efficace en tant que liant, antiagglomérant et substance pour le contrôle de contamination de radionucléides, pour toutes les espèces animales. Elle a également constaté que la bentonite pourrait être efficace en tant que liant des aflatoxines pour les vaches laitières, cette conclusion pouvant en outre être étendue à tous les ruminants. L’Autorité ne juge pas utile de prévoir des exigences spécifiques en matière de surveillance consécutive à la mise sur le marché. Elle a aussi vérifié le rapport sur la méthode d’analyse de l’additif dans l’alimentation animale soumis par le laboratoire de référence désigné par le règlement (CE) no 1831/2003. |
|
(5) |
Comme les études in vitro qui ont été fournies satisfont aux conditions auxquelles doit satisfaire la démonstration de l’efficacité des additifs technologiques fixées dans le règlement (CE) no 429/2008 de la Commission (7), en particulier à son annexe II, point 4, et à son annexe III, point 1.4, qu’il a été reconnu que ces études permettaient de démontrer clairement la capacité de la bentonite à lier l’aflatoxine B1 (ci-après «AfB») et que cette capacité de liaison, limitée à l’AfB, a en outre été définie comme une caractéristique de la bentonite, la conclusion relative à l’efficacité de la bentonite en tant que substance destinée à réduire la contamination des aliments pour animaux par les mycotoxines peut être considérée comme suffisante pour permettre l’extension de l’autorisation à une utilisation pour la volaille et les porcs. |
|
(6) |
Il ressort de l’évaluation de la bentonite que les conditions d’autorisation prévues à l’article 5 du règlement (CE) no 1831/2003 sont remplies. Il convient dès lors d’autoriser l’utilisation de cet additif selon les modalités prévues à l’annexe du présent règlement. |
|
(7) |
Étant donné qu’aucun motif de sécurité n’impose l’application immédiate des modifications des conditions d’autorisation de l’utilisation de la bentonite en tant que liant et antiagglomérant, il convient de prévoir une période transitoire pour permettre aux parties intéressées de se préparer aux nouvelles exigences qui découleront de l’autorisation. |
|
(8) |
Les mesures prévues au présent règlement sont conformes à l’avis du comité permanent de la chaîne alimentaire et de la santé animale, |
A ADOPTÉ LE PRÉSENT RÈGLEMENT:
Article premier
L’utilisation, en tant qu’additif dans l’alimentation des animaux, de la bentonite spécifiée dans les annexes, qui appartient à la catégorie des «additifs technologiques» et aux groupes fonctionnels des «substances destinées à réduire la contamination des aliments pour animaux par les mycotoxines», des «liants», des «antiagglomérants» et des «substances pour le contrôle de contamination de radionucléides» est autorisée dans les conditions fixées dans ces annexes.
Article 2
L’additif spécifié dans l’annexe II, appartenant aux groupes fonctionnels des «liants» et des «antiagglomérants», ainsi que les aliments pour animaux contenant cet additif, qui sont produits et étiquetés avant le 19 novembre 2015, conformément aux règles applicables avant le 19 novembre 2013, peuvent continuer à être mis sur le marché et utilisés jusqu’à épuisement des stocks existants.
Article 3
Le présent règlement entre en vigueur le vingtième jour suivant celui de sa publication au Journal officiel de l’Union européenne.
Le présent règlement est obligatoire dans tous ses éléments et directement applicable dans tout État membre.
Fait à Bruxelles, le 29 octobre 2013.
Par la Commission
Le président
José Manuel BARROSO
(1) JO L 268 du 18.10.2003, p. 29.
(2) Directive 70/524/CEE du Conseil du 23 novembre 1970 concernant les additifs dans l’alimentation des animaux (JO L 270 du 14.12.1970, p. 1).
(3) Quarante et unième directive 82/822/CEE de la Commission du 19 novembre 1982 modifiant les annexes de la directive 70/524/CEE du Conseil concernant les additifs dans l’alimentation des animaux (JO L 347 du 7.12.1982, p. 16).
(4) EFSA Journal, 9(2):2007, 2011.
(5) EFSA Journal, 9(6):2276, 2011.
(6) EFSA Journal, 10(7):2787, 2012.
(7) Règlement (CE) no 429/2008 de la Commission du 25 avril 2008 relatif aux modalités d’application du règlement (CE) no 1831/2003 du Parlement européen et du Conseil en ce qui concerne l’établissement et la présentation des demandes ainsi que l’évaluation et l’autorisation des additifs pour l’alimentation animale (JO L 133 du 22.5.2008, p. 1).
ANNEXE I
|
Numéro d’identification de l’additif |
Additif |
Formule chimique, description, méthode d’analyse |
Espèce animale ou catégorie d’animaux |
Âge maximal |
Teneur minimale |
Teneur maximale |
Autres dispositions |
Fin de la période d’autorisation |
||||||||||||||||||||
|
mg de substance active par kg d’aliment complet ayant une teneur en humidité de 12 % |
||||||||||||||||||||||||||||
|
Catégorie: additifs technologiques. Groupe fonctionnel: substances destinées à réduire la contamination des aliments pour animaux par les mycotoxines: aflatoxine B1 |
||||||||||||||||||||||||||||
|
1m558 |
Bentonite |
|
Ruminants Volaille Porcs |
— |
|
20 000 |
|
19 novembre 2023 |
||||||||||||||||||||
(1) La description détaillée des méthodes d’analyse est publiée sur le site du laboratoire de référence de l’Union européenne chargé des additifs pour l’alimentation animale à l’adresse suivante (http://irmm.jrc.ec.europa.eu/EURLs/EURL_feed_additives/Pages/index.aspx).
ANNEXE II
|
Numéro d’identification de l’additif |
Additif |
Formule chimique, description, méthode d’analyse |
Espèce animale ou catégorie d’animaux |
Âge maximal |
Teneur minimale |
Teneur maximale |
Autres dispositions |
Fin de la période d’autorisation |
||||||||||||||||||||
|
mg de substance active par kg d’aliment complet ayant une teneur en humidité de 12 % |
||||||||||||||||||||||||||||
|
Catégorie: additifs technologiques. Groupe fonctionnel: liants |
||||||||||||||||||||||||||||
|
1m558i |
Bentonite |
|
Toutes les espèces animales |
— |
|
20 000 |
|
19 novembre 2023 |
||||||||||||||||||||
|
Catégorie: additifs technologiques. Groupe fonctionnel: antiagglomérants |
||||||||||||||||||||||||||||
|
1m558i |
Bentonite |
|
Toutes les espèces animales |
— |
|
20 000 |
|
19 novembre 2023 |
||||||||||||||||||||
|
Catégorie: additifs technologiques. Groupe fonctionnel: substances pour le contrôle de contamination de radionucléides (134/137Cs) |
||||||||||||||||||||||||||||
|
1m558i |
Bentonite |
|
Toutes les espèces animales |
— |
|
— |
|
19 novembre 2023 |
||||||||||||||||||||
(1) La description détaillée des méthodes d’analyse est publiée sur le site du laboratoire de référence de l’Union européenne chargé des additifs pour l’alimentation animale à l’adresse suivante http://irmm.jrc.ec.europa.eu/EURLs/EURL_feed_additives/Pages/index.aspx
|
31.10.2013 |
FR |
Journal officiel de l'Union européenne |
L 289/38 |
RÈGLEMENT D’EXÉCUTION (UE) No 1061/2013 DE LA COMMISSION
du 29 octobre 2013
concernant l’autorisation d’une préparation d’Enterococcus faecium NCIMB 10415 en tant qu’additif dans l’alimentation des veaux, des chevreaux, des chats et des chiens et modifiant le règlement (CE) no 1288/2004 (titulaire de l’autorisation: DSM Nutritional Products Ltd représenté par DSM Nutritional Products Sp. Z o.o.)
(Texte présentant de l'intérêt pour l'EEE)
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l’Union européenne,
vu le règlement (CE) no 1831/2003 du Parlement européen et du Conseil du 22 septembre 2003 relatif aux additifs destinés à l’alimentation des animaux (1), et notamment son article 9, paragraphe 2,
considérant ce qui suit:
|
(1) |
Le règlement (CE) no 1831/2003 dispose que les additifs destinés à l’alimentation des animaux sont soumis à autorisation et définit les motifs et les procédures d’octroi de cette autorisation. Son article 10 prévoit la réévaluation des additifs autorisés conformément à la directive 70/524/CEE du Conseil (2). |
|
(2) |
La préparation d’Enterococcus faecium NCIMB 10415 a été autorisée conformément à la directive 70/524/CEE en tant qu’additif dans l’alimentation des veaux par le règlement (CE) no 1288/2004 de la Commission (3), pour les truies par le règlement (CE) no 1200/2005 de la Commission (4), pour les porcelets par le règlement (CE) no 252/2006 de la Commission (5), pour les porcs d’engraissement par le règlement (CE) no 943/2005 de la Commission (6), et pour les chats et chiens par le règlement (CE) no 102/2009 de la Commission (7). Cette préparation a ensuite été inscrite au registre des additifs pour l’alimentation animale en tant que produit existant, conformément à l’article 10, paragraphe 1, point b), du règlement (CE) no 1831/2003. |
|
(3) |
Le règlement d’exécution (UE) no 361/2011 de la Commission (8) a autorisé cette préparation pour une durée de dix ans pour les poulets d’engraissement. |
|
(4) |
Une demande a été présentée conformément aux dispositions conjointes de l’article 10, paragraphe 2, et de l’article 7 du règlement (CE) no 1831/2003, en vue de la réévaluation de la préparation d’Enterococcus faecium NCIMB 10415 en tant qu’additif destiné à l’alimentation des veaux, des chats et des chiens et, conformément à l’article 7 dudit règlement, en vue de l’autorisation d’une nouvelle utilisation pour les chevreaux, sollicitant la classification de cet additif dans la catégorie des «additifs zootechniques». Cette demande était accompagnée des informations et des documents requis au titre de l’article 7, paragraphe 3, du règlement (CE) no 1831/2003. |
|
(5) |
L’Autorité européenne de sécurité des aliments («l’Autorité») a conclu dans son avis du 29 janvier 2013 (9) que, dans les conditions d’utilisation proposées, la préparation d’Enterococcus faecium NCIMB 10415 n’a pas d’effet néfaste sur la santé animale, la santé humaine ou l’environnement et que son utilisation augmente le poids corporel final et/ou le gain de poids journalier des veaux d’élevage et à l’engrais, ce qui peut être extrapolé aux chevreaux d’élevage et à l’engrais. Elle a aussi reconnu que cette préparation a un effet bénéfique chez les chiens en augmentant la concentration intestinale ou sérique d’IgA. L’Autorité juge inutile de prévoir des exigences spécifiques en matière de surveillance consécutive à la mise sur le marché. Elle a aussi vérifié le rapport sur la méthode d’analyse de l’additif pour l’alimentation animale soumis par le laboratoire de référence désigné par le règlement (CE) no 1831/2003. |
|
(6) |
Puisque des effets modestes mais significatifs sur la qualité fécale ont été observés chez les chats, ceux-ci ont été jugés suffisants pour confirmer l’efficacité chez cette espèce. |
|
(7) |
Il ressort de l’évaluation de la préparation d’Enterococcus faecium NCIMB 10415 que les conditions d’autorisation fixées à l’article 5 du règlement (CE) no 1831/2003 sont respectées. Il convient dès lors d’autoriser l’usage de cet additif selon les modalités prévues à l’annexe du présent règlement. |
|
(8) |
En conséquence de l’octroi d’une nouvelle autorisation au titre du règlement (CE) no 1831/2003, il convient d’abroger le règlement (CE) no 102/2009 et de modifier le règlement (CE) no 1288/2004 en conséquence. |
|
(9) |
Étant donné qu’aucun motif de sécurité n’impose l’application immédiate des modifications des conditions d’autorisation, il convient de prévoir une période transitoire pour permettre aux parties intéressées de se préparer aux nouvelles exigences qui découleront de l’autorisation. |
|
(10) |
Les mesures prévues au présent règlement sont conformes à l’avis du comité permanent de la chaîne alimentaire et de la santé animale, |
A ADOPTÉ LE PRÉSENT RÈGLEMENT:
Article premier
Autorisation
La préparation visée en annexe, qui appartient à la catégorie des «additifs zootechniques» et aux groupes fonctionnels des «stabilisateurs de la flore intestinale» et des «autres additifs zootechniques», est autorisée en tant qu’additif dans l’alimentation des animaux, dans les conditions fixées à ladite annexe.
Article 2
Abrogation du règlement (CE) no 102/2009
Le règlement (CE) no 102/2009 est abrogé.
Article 3
Modification du règlement (CE) no 1288/2004
À l’annexe I du règlement (CE) no 1288/2004, la ligne E 1705, Enterococcus faecium NCIMB 10415, est supprimée.
Article 4
Mesures transitoires
La préparation spécifiée en annexe en ce qui concerne son utilisation pour les veaux, et les aliments pour animaux contenant ladite préparation, qui sont produits et étiquetés avant le 19 mai 2014, conformément aux règles applicables avant le 19 novembre 2013, peuvent continuer à être mis sur le marché et utilisés jusqu’à épuisement des stocks existants.
La préparation spécifiée en annexe en ce qui concerne son utilisation pour les chats et les chiens, et les aliments pour animaux contenant ladite préparation, qui sont produits et étiquetés avant le 19 novembre 2015, conformément aux règles applicables avant le 19 novembre 2013, peuvent continuer à être mis sur le marché et utilisés jusqu’à épuisement des stocks existants.
Article 5
Entrée en vigueur
Le présent règlement entre en vigueur le vingtième jour suivant celui de sa publication au Journal officiel de l’Union européenne.
Le présent règlement est obligatoire dans tous ses éléments et directement applicable dans tout État membre.
Fait à Bruxelles, le 29 octobre 2013.
Par la Commission
Le président
José Manuel BARROSO
(1) JO L 268 du 18.10.2003, p. 29.
(2) Directive 70/524/CEE du Conseil du 23 novembre 1970 concernant les additifs dans l’alimentation des animaux (JO L 270 du 14.12.1970, p. 1).
(3) Règlement (CE) no 1288/2004 de la Commission du 14 juillet 2004 concernant l’autorisation permanente de certains additifs et l’autorisation provisoire d’un nouvel usage d’un additif déjà autorisé dans l’alimentation des animaux (JO L 243 du 15.7.2004, p. 10).
(4) Règlement (CE) no 1200/2005 de la Commission du 26 juillet 2005 concernant l’autorisation permanente de certains additifs dans l’alimentation des animaux et l’autorisation provisoire d’un nouvel usage d’un additif déjà autorisé dans l’alimentation des animaux (JO L 195 du 27.7.2005, p. 6).
(5) Règlement (CE) no 252/2006 de la Commission du 14 février 2006 portant autorisation permanente de certains additifs et autorisation provisoire de nouveaux usages de certains additifs déjà autorisés dans l’alimentation des animaux (JO L 44 du 15.2.2006, p. 3).
(6) Règlement (CE) no 943/2005 de la Commission du 21 juin 2005 concernant l’autorisation permanente de certains additifs dans l’alimentation des animaux (JO L 159 du 22.6.2005, p. 6).
(7) Règlement (CE) no 102/2009 de la Commission du 3 février 2009 concernant l’autorisation permanente d’un additif dans l’alimentation des animaux (JO L 34 du 4.2.2009, p. 8).
(8) Règlement d’exécution (UE) no 361/2011 de la Commission du 13 avril 2011 concernant l’autorisation d’Enterococcus faecium NCIMB 10415 en tant qu’additif dans l’alimentation des poulets d’engraissement (titulaire de l’autorisation: DSM Nutritional Products Ltd représenté par DSM Nutritional products Sp. z o.o) et modifiant le règlement (CE) no 943/2005 (JO L 100 du 14.4.2011, p. 22).
(9) EFSA Journal (2013); 11(2): 3097 et 3098.
ANNEXE
|
Numéro d’identification de l’additif |
Nom du titulaire de l’autorisation |
Additif |
Composition, formule chimique, description, méthode d’analyse |
Espèce animale ou catégorie d’animaux |
Âge maximal |
Teneur minimale |
Teneur maximale |
Autres dispositions |
Fin de la période d’autorisation |
||||||
|
UFC/kg d’aliment complet ayant une teneur en humidité de 12 % |
|||||||||||||||
|
Catégorie: additifs zootechniques. Groupe fonctionnel: stabilisateurs de la flore intestinale |
|||||||||||||||
|
4b1705 |
DSM Nutritional Products Ltd représenté par DSM Nutritional products Sp. Z o.o |
Enterococcus faecium NCIMB 10415 |
|
Veaux Chevreaux |
— |
1 × 109 |
— |
Dans le mode d’emploi de l’additif et du prémélange, indiquer les conditions de stockage et la stabilité à la granulation. |
19 novembre 2023 |
||||||
|
4b1705 |
DSM Nutritional Products Ltd représenté par DSM Nutritional products Sp. Z o.o |
Enterococcus faecium NCIMB 10415 |
|
Chats |
— |
7 × 109 |
— |
Dans le mode d’emploi de l’additif et du prémélange, indiquer les conditions de stockage et la stabilité à la granulation. |
19 novembre 2023 |
||||||
|
Catégorie: additifs zootechniques. Groupe fonctionnel: autres additifs zootechniques (amélioration des conditions intestinales) |
|||||||||||||||
|
4b1705 |
DSM Nutritional Products Ltd représenté par DSM Nutritional products Sp. Z o.o |
Enterococcus faecium NCIMB 10415 |
|
Chiens |
— |
2,5 × 109 |
|
Dans le mode d’emploi de l’additif et du prémélange, indiquer les conditions de stockage et la stabilité à la granulation. |
19 novembre 2023 |
||||||
(1) La description détaillée des méthodes d’analyse est publiée sur le site du laboratoire de référence de l’Union européenne chargé des additifs pour l’alimentation animale à l’adresse suivante: http://irmm.jrc.ec.europa.eu/EURLs/EURL_feed_additives/Pages/index.aspx
|
31.10.2013 |
FR |
Journal officiel de l'Union européenne |
L 289/42 |
RÈGLEMENT D’EXÉCUTION (UE) No 1062/2013 DE LA COMMISSION
du 30 octobre 2013
relatif au format de l’évaluation technique européenne pour les produits de construction
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l’Union européenne,
vu le règlement (UE) no 305/2011 du Parlement européen et du Conseil du 9 mars 2011 établissant des conditions harmonisées de commercialisation pour les produits de construction et abrogeant la directive 89/106/CEE du Conseil (1), et notamment son article 26, paragraphe 3,
après consultation du comité permanent de la construction,
considérant ce qui suit:
|
(1) |
L’évaluation technique européenne est nécessaire pour permettre à un fabricant d’un produit de construction d’élaborer une déclaration de performance pour un produit de construction qui n’est pas couvert ou pas entièrement couvert par une norme harmonisée. |
|
(2) |
L’article 26, paragraphe 2, du règlement (UE) no 305/2011 établit les exigences à respecter par l’évaluation technique européenne. Étant donné que les principes pour le contrôle de la production en usine applicable sont énoncés dans le document d’évaluation européen (DEE), l’évaluation technique européenne devrait uniquement contenir les détails techniques qui, selon les principes en question, devraient être définis à ce niveau pour la mise en œuvre du système d’évaluation de la performance et de vérification de sa constance. |
|
(3) |
La présentation de la description technique du produit en question devrait être définie de façon suffisamment souple dans le format de l’évaluation technique européenne, compte tenu de la grande variété de produits de construction concernés. |
|
(4) |
Une souplesse suffisante devrait également être autorisée pour la présentation de la performance du produit dans l’évaluation technique européenne, afin de permettre au fabricant de déclarer de façon fluide et exacte cette performance dans sa déclaration de performance qui repose sur cette évaluation. |
|
(5) |
Afin de protéger les informations techniques confidentielles relatives au produit, le fabricant devrait pouvoir indiquer à l’organisme d’évaluation technique compétent quelles parties de la description du produit sont confidentielles et ne doivent pas être divulguées dans l’évaluation technique européenne. Les informations confidentielles devraient figurer dans des annexes séparées à ces évaluations techniques européennes. |
|
(6) |
Afin d’améliorer l’efficacité du marché intérieur et la compétitivité du secteur européen de la construction dans son ensemble, les évaluations techniques européennes devraient pouvoir être délivrées le plus rapidement possible aux fabricants qui les demandent, |
A ADOPTÉ LE PRÉSENT RÈGLEMENT:
Article premier
Le format de l’évaluation technique européenne est fixé en annexe.
Article 2
Le présent règlement entre en vigueur le troisième jour suivant celui de sa publication au Journal officiel de l’Union européenne.
Le présent règlement est obligatoire dans tous ses éléments et directement applicable dans tout État membre.
Fait à Bruxelles, le 30 octobre 2013.
Par la Commission
Le président
José Manuel BARROSO
(1) JO L 88 du 4.4.2011, p. 5.
ANNEXE
ÉVALUATION TECHNIQUE EUROPÉENNE
No … du… [date]
Volet général
|
1. |
Organisme d’évaluation technique délivrant l’évaluation technique européenne: … |
|
2. |
Nom commercial du produit de construction: … |
|
3. |
Famille de produits à laquelle appartient le produit de construction: … |
|
4. |
Fabricant: … |
|
5. |
Atelier(s) de fabrication: … |
|
6. |
La présente évaluation technique européenne contient … pages, y compris … annexe(s) qui en font partie intégrante. L’annexe/Les annexes … contient/contiennent des informations confidentielles et n’est pas/ne sont pas incluse(s) dans l’évaluation technique européenne lorsque l’évaluation est diffusée publiquement. |
|
7. |
La présente évaluation technique européenne est délivrée conformément au règlement (UE) no 305/2011, sur la base de … |
Parties spécifiques
|
8. |
La description technique du projet: … |
|
9. |
Spécification de l’usage prévu/des usages prévus, conformément au document d’évaluation européen (ci-après «DEE»): … |
|
10. |
Performance du produit et références aux méthodes utilisées pour son évaluation: … |
|
11. |
Système d’évaluation de la performance et de vérification de sa constance appliqué, en référence à sa base juridique: … |
|
12. |
Détails techniques nécessaires pour l’application du système d’évaluation de la performance et de vérification de sa constance, tels que prévus dans le DEE applicable: … |
Délivrée à … le …/… 20…
par …
Annexe(s)
|
31.10.2013 |
FR |
Journal officiel de l'Union européenne |
L 289/44 |
RÈGLEMENT D’EXÉCUTION (UE) No 1063/2013 DE LA COMMISSION
du 30 octobre 2013
modifiant le règlement (CEE) no 2454/93 fixant certaines dispositions d'application du règlement (CEE) no 2913/92 du Conseil établissant le code des douanes communautaire, en ce qui concerne le recours à l'équivalence dans le secteur du sucre
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l'Union européenne,
vu le règlement (CEE) no 2913/92 du Conseil du 12 octobre 1992 établissant le code des douanes communautaire (1), et notamment son article 247,
considérant ce qui suit:
|
(1) |
L’annexe 74, point 3, du règlement (CEE) no 2454/93 de la Commission (2), autorise le recours à l'équivalence entre le sucre brut de canne (code NC 1701 11 90) et le sucre brut de betterave (code NC 1701 12 90) pour autant que le produit compensateur relève du code NC 1701 99 10 (sucre blanc). |
|
(2) |
Toutefois, le point 3 de l’annexe 74 du règlement (CEE) no 2454/93 ne peut être appliqué correctement car il n’existe pas de marché du sucre brut de betterave dans l’Union. |
|
(3) |
Il convient de trouver une solution qui garantisse la sécurité juridique dans le secteur du sucre dans le cadre du recours à des marchandises équivalentes. |
|
(4) |
Le sucre blanc est généralement obtenu à partir de betteraves à sucre selon un processus de production continu. Le sucre brut de betterave n’est pas produit en tant que produit séparé au cours de ce processus, et il ne peut donc pas être commercialisé. De ce fait, il convient d’autoriser l’utilisation des betteraves à sucre au lieu du sucre brut de betteraves en tant que marchandises équivalentes. |
|
(5) |
Le rendement du sucre brut de canne est à calculer comme indiqué à l’annexe IV, partie B, point III, paragraphe 3, du règlement (CE) no 1234/2007 du Conseil (3), étant donné qu’il s’agit d’une méthode de calcul spécifique dans le secteur du sucre. |
|
(6) |
Il convient d'actualiser les références aux codes NC (nomenclature combinée) à l'annexe 74, point 3, du règlement (CEE) no 2454/93 en raison des modifications intervenues dans la NC. |
|
(7) |
Il y a donc lieu de modifier le point 3 de l'annexe 74 du règlement (CEE) no 2454/93 en conséquence. |
|
(8) |
Les mesures prévues au présent règlement sont conformes à l’avis du comité du code des douanes, |
A ADOPTÉ LE PRÉSENT RÈGLEMENT:
Article premier
À l'annexe 74 du règlement (CEE) no 2454/93, le point 3 est remplacé par le texte suivant:
«3. Sucre
Le recours à des marchandises équivalentes est permis entre le sucre brut de canne non Union relevant des codes NC 1701 13 90 et/ou 1701 14 90 et la betterave à sucre relevant du code NC 1212 91 80 pour autant que le produit compensateur relève du code NC 1701 99 10 (sucre blanc).
La quantité équivalente de sucre brut de canne de qualité type telle qu’elle est définie à l'annexe IV, partie B, point III, du règlement (CE) no 1234/2007 du Conseil (4) est calculée en multipliant la quantité du sucre blanc par le coefficient 1,0869565.
La quantité équivalente de sucre brut de canne qui n'est pas de qualité type est calculée en multipliant la quantité du sucre blanc avec un coefficient obtenu en divisant le nombre 100 par le rendement du sucre brut de canne. Le rendement du sucre brut de canne est calculé conformément à l’annexe IV, partie B, point III, du règlement (CE) no 1234/2007.
Article 2
Le présent règlement entre en vigueur le vingtième jour suivant celui de sa publication au Journal officiel de l'Union européenne.
Le présent règlement est obligatoire dans tous ses éléments et directement applicable dans tout État membre.
Fait à Bruxelles, le 30 octobre 2013.
Par la Commission
Le président
José Manuel BARROSO
(1) JO L 302 du 19.10.1992, p. 1.
(2) Règlement (CEE) no 2454/93 de la Commission du 2 juillet 1993 fixant certaines dispositions d’application du règlement (CEE) no 2913/92 du Conseil établissant le code des douanes communautaire (JO L 253 du 11.10.1993, p. 1)
(3) Règlement (CE) no 1234/2007 du Conseil du 22 octobre 2007 portant organisation commune des marchés dans le secteur agricole et dispositions spécifiques en ce qui concerne certains produits de ce secteur (règlement «OCM unique») (JO L 299 du 16.11.2007, p. 1).
(4) Règlement (CE) no 1234/2007 du Conseil du 22 octobre 2007 portant organisation commune des marchés dans le secteur agricole et dispositions spécifiques en ce qui concerne certains produits de ce secteur (règlement «OCM unique») (JO L 299 du 16.11.2007, p. 1).»
|
31.10.2013 |
FR |
Journal officiel de l'Union européenne |
L 289/46 |
RÈGLEMENT D’EXÉCUTION (UE) No 1064/2013 DE LA COMMISSION
du 30 octobre 2013
fixant les coefficients applicables aux céréales exportées sous forme de Scotch whisky pour la période 2013/2014
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l’Union européenne,
vu le règlement (CE) no 1234/2007 du Conseil du 22 octobre 2007 portant organisation commune des marchés dans le secteur agricole et dispositions spécifiques en ce qui concerne certains produits de ce secteur (règlement «OCM unique») (1),
vu le règlement (CE) no 1670/2006 de la Commission du 10 novembre 2006 portant certaines modalités d’application du règlement (CE) no 1784/2003 du Conseil en ce qui concerne la fixation et l’octroi des restitutions adaptées pour les céréales exportées sous forme de certaines boissons spiritueuses (2), et notamment son article 5,
considérant ce qui suit:
|
(1) |
L’article 4, paragraphe 1, du règlement (CE) no 1670/2006 prévoit que les quantités de céréales pour lesquelles la restitution est octroyée sont les quantités de céréales mises sous contrôle et distillées, affectées d’un coefficient fixé annuellement pour chaque État membre concerné. Ce coefficient exprime le rapport existant entre les quantités totales exportées et les quantités totales commercialisées de la boisson spiritueuse concernée sur la base de la tendance constatée dans l’évolution de ces quantités pendant le nombre d’années qui correspond à la période moyenne de vieillissement de cette boisson spiritueuse. |
|
(2) |
Sur la base des informations fournies par le Royaume-Uni et relatives à la période du 1er janvier au 31 décembre 2012, cette période moyenne de vieillissement en 2012 était de sept ans pour le Scotch whisky. |
|
(3) |
Le règlement d’execution (UE) no 745/2012 de la Commission (3) a épuisé ses effets étant donné qu’il concerne les coefficients applicables pour l’année 2012/2013. Il y a lieu, en conséquence, de fixer les coefficients pour la période du 1er octobre 2013 au 30 septembre 2014. |
|
(4) |
L’article 10 du protocole 3 de l’accord sur l’Espace économique européen exclut l’octroi des restitutions à l’exportation vers le Liechtenstein, l’Islande et la Norvège. De surcroît, l’Union a conclu des accords avec certains pays tiers qui comportent la suppression des restitutions à l’exportation. En conséquence, il y a lieu, en application de l’article 7, paragraphe 2, du règlement (CE) no 1670/2006, d’en tenir compte dans le calcul du coefficient pour la période 2013/2014, |
A ARRÊTÉ LE PRÉSENT RÈGLEMENT:
Article premier
Pour la période du 1er octobre 2013 au 30 septembre 2014, les coefficients visés à l’article 4 du règlement (CE) no 1670/2006, applicables aux céréales utilisées au Royaume-Uni pour la fabrication du Scotch whisky, sont fixés à l’annexe du présent règlement.
Article 2
Le présent règlement entre en vigueur le jour de sa publication au Journal officiel de l’Union européenne.
Il est applicable à partir du 1er octobre 2013 jusqu’au 30 septembre 2014.
Le présent règlement est obligatoire dans tous ses éléments et directement applicable dans tout État membre.
Fait à Bruxelles, le 30 octobre 2013.
Par la Commission
Le président
José Manuel BARROSO
(1) JO L 299 du 16.11.2007, p. 1.
(2) JO L 312 du 11.11.2006, p. 33.
(3) Règlement d’execution (UE) no 745/2012 de la Commission du 16 août 2012 fixant les coefficients applicables aux céréales exportées sous forme de Scotch whisky pour la période 2012/2013 (JO L 219 du 17.8.2012, p. 13).
ANNEXE
|
Coefficients applicables au Royaume-Uni |
||
|
Période d’application |
Coefficient applicable |
|
|
à l’orge transformée en malt utilisée à la fabrication du malt whisky |
aux céréales utilisées à la fabrication du grain whisky |
|
|
Du 1er octobre 2013 au 30 septembre 2014 |
0,667 |
0,515 |
|
31.10.2013 |
FR |
Journal officiel de l'Union européenne |
L 289/48 |
RÈGLEMENT (UE) No 1065/2013 DE LA COMMISSION
du 30 octobre 2013
modifiant l’annexe III du règlement (CE) no 110/2008 du Parlement européen et du Conseil concernant la définition, la désignation, la présentation, l’étiquetage et la protection des indications géographiques des boissons spiritueuses
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l’Union européenne,
vu le règlement (CE) no 110/2008 du Parlement européen et du Conseil du 15 janvier 2008 concernant la définition, la désignation, la présentation, l’étiquetage et la protection des indications géographiques des boissons spiritueuses et abrogeant le règlement (CEE) no 1576/89 du Conseil (1), et notamment son article 17, paragraphe 8,
considérant ce qui suit:
|
(1) |
La République du Pérou a introduit pour la dénomination «Pisco» une demande d’enregistrement en tant qu’indication géographique à l’annexe III du règlement (CE) no 110/2008 conformément à la procédure prévue à l’article 17, paragraphe 1, dudit règlement. Le «Pisco» est une eau-de-vie de fruit traditionnellement produite au Pérou, obtenue par la fermentation et la distillation de raisins. |
|
(2) |
Les spécifications principales de la fiche technique relative au «Pisco» ont été publiées au Journal officiel de l’Union européenne (2) aux fins de la procédure d’opposition, en vertu de l’article 17, paragraphe 6, du règlement (CE) no 110/2008. Étant donné que la Commission n’a reçu aucune objection conformément à l’article 17, paragraphe 7, du règlement (CE) no 110/2008, il convient d’inscrire la dénomination à l’annexe III dudit règlement. |
|
(3) |
Conformément à l’accord établissant une association entre la Communauté européenne et ses États membres, d’une part, et la République du Chili, d’autre part, approuvé par la décision 2002/979/CE du Conseil (3), le «Pisco» est une appellation protégée de boissons spiritueuses originaires du Chili. Par conséquent, il y a lieu de clarifier que la protection de l’indication géographique «Pisco» pour les produits originaires du Pérou n’empêche pas d’utiliser cette appellation pour des produits originaires du Chili. |
|
(4) |
Il convient dès lors de modifier le règlement (CE) no 110/2008 en conséquence. |
|
(5) |
Les mesures prévues au présent règlement sont conformes à l’avis du comité des boissons spiritueuses, |
A ADOPTÉ LE PRÉSENT RÈGLEMENT:
Article premier
À l’annexe III du règlement (CE) no 110/2008, dans la catégorie de produit «9. Eau-de-vie de fruit», la ligne suivante est ajoutée:
|
|
«Pisco (4) |
Pérou |
Article 2
Le présent règlement entre en vigueur le jour suivant celui de sa publication au Journal officiel de l’Union européenne.
Le présent règlement est obligatoire dans tous ses éléments et directement applicable dans tout État membre.
Fait à Bruxelles, le 30 octobre 2013.
Par la Commission
Le président
José Manuel BARROSO
(1) JO L 39 du 13.2.2008, p. 16.
(2) JO C 141 du 12.5.2011, p. 16.
(3) JO L 352 du 30.12.2002, p. 1.
(4) La protection de l’indication géographique “Pisco” au titre du présent règlement est sans préjudice de l’utilisation de la dénomination “Pisco” pour des produits originaires du Chili protégés au titre de l’accord d’association conclu entre l’Union et le Chili en 2002.»
|
31.10.2013 |
FR |
Journal officiel de l'Union européenne |
L 289/49 |
RÈGLEMENT (UE) No 1066/2013 DE LA COMMISSION
du 30 octobre 2013
concernant le refus d’autoriser certaines allégations de santé portant sur les denrées alimentaires, autres que celles faisant référence à la réduction du risque de maladie ainsi qu’au développement et à la santé des enfants
(Texte présentant de l'intérêt pour l'EEE)
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l’Union européenne,
vu le règlement (CE) no 1924/2006 du Parlement européen et du Conseil du 20 décembre 2006 concernant les allégations nutritionnelles et de santé portant sur les denrées alimentaires (1), et notamment son article 18, paragraphe 5,
considérant ce qui suit:
|
(1) |
En application du règlement (CE) no 1924/2006, les allégations de santé portant sur les denrées alimentaires sont interdites, sauf si elles sont autorisées par la Commission conformément audit règlement et figurent sur une liste d’allégations autorisées. |
|
(2) |
Le règlement (CE) no 1924/2006 prévoit également que les exploitants du secteur alimentaire peuvent soumettre des demandes d’autorisation d’allégations de santé à l’autorité nationale compétente d’un État membre. Cette dernière est tenue de transmettre les demandes recevables à l’Autorité européenne de sécurité des aliments (EFSA), ci-après dénommée «Autorité», en vue d’une évaluation scientifique ainsi qu’à la Commission et aux États membres pour information. |
|
(3) |
L’Autorité rend un avis sur l’allégation de santé concernée. |
|
(4) |
La Commission statue sur l’autorisation de l’allégation de santé en tenant compte de l’avis de l’Autorité. |
|
(5) |
À la suite d’une demande de Béres Pharmaceuticals Ltd., introduite conformément à l’article 13, paragraphe 5, du règlement (CE) no 1924/2006, l’Autorité a été invitée à rendre un avis sur une allégation de santé concernant les effets de la glucosamine et la santé des articulations (question no EFSA-Q-2011-00907) (2). L’allégation proposée par le demandeur était libellée comme suit: «La glucosamine contribue à protéger le cartilage articulaire exposé à des mouvements trop importants ou à des charges excessives et aide à améliorer l’amplitude du mouvement articulaire». |
|
(6) |
Le 5 décembre 2011, la Commission et les États membres ont reçu l’avis scientifique de l’Autorité dans lequel cette dernière conclut, sur la base des données fournies, qu’un lien de cause à effet n’a pas été établi entre la consommation de glucosamine et l’effet allégué. Par conséquent, l’allégation ne satisfaisant pas aux exigences du règlement (CE) no 1924/2006, il convient de ne pas l’autoriser. |
|
(7) |
À la suite d’une demande de Merck Consumer Healthcare, introduite conformément à l’article 13, paragraphe 5, du règlement (CE) no 1924/2006, l’Autorité a été invitée à rendre un avis sur une allégation de santé concernant les effets de la glucosamine et la santé du cartilage articulaire normal (question no EFSA-Q-2011-01113) (3). L’allégation proposée par le demandeur était libellée, entre autres, comme suit: «La glucosamine contribue à la santé du cartilage articulaire normal». |
|
(8) |
Le 16 mai 2012, la Commission et les États membres ont reçu l’avis scientifique de l’Autorité dans lequel cette dernière conclut, sur la base des données fournies, qu’un lien de cause à effet n’a pas été établi entre la consommation de glucosamine et l’effet allégué. Par conséquent, l’allégation ne satisfaisant pas aux exigences du règlement (CE) no 1924/2006, il convient de ne pas l’autoriser. |
|
(9) |
À la suite d’une demande d’Extraction Purification Innovation France, introduite conformément à l’article 13, paragraphe 5, du règlement (CE) no 1924/2006, l’Autorité a été invitée à rendre un avis sur une allégation de santé concernant la consommation d’extrait de lipides polaires de blé et la protection de la peau contre la déshydratation (question no EFSA-Q-2011-01122) (4). L’allégation proposée par le demandeur était libellée, entre autres, comme suit: «Contribue à améliorer l’hydratation de la peau». |
|
(10) |
Le 5 juillet 2012, la Commission et les États membres ont reçu l’avis scientifique de l’Autorité dans lequel cette dernière conclut, sur la base des données fournies, qu’un lien de cause à effet n’a pas été établi entre la consommation d’extrait de lipides polaires de blé et l’effet allégué. Par conséquent, l’allégation ne satisfaisant pas aux exigences du règlement (CE) no 1924/2006, il convient de ne pas l’autoriser. |
|
(11) |
À la suite d’une demande de Lesaffre International/Lesaffre Human Care, introduite conformément à l’article 13, paragraphe 5, du règlement (CE) no 1924/2006, l’Autorité a été invitée à rendre un avis sur une allégation de santé concernant les effets de Saccharomyces cerevisiae var. boulardii CNCM I-3799 et la réduction des troubles gastro-intestinaux (question no EFSA-Q-2012-00271) (5). L’allégation proposée par le demandeur était libellée comme suit: «Saccharomyces cerevisiae var. boulardii CNCM I-3799 contribue à préserver le confort intestinal». |
|
(12) |
Le 17 juillet 2012, la Commission et les États membres ont reçu l’avis scientifique de l’Autorité dans lequel cette dernière conclut, sur la base des données fournies, qu’un lien de cause à effet n’a pas pu être établi entre la consommation de Saccharomyces cerevisiae var. boulardii CNCM I-3799 et l’effet allégué. Par conséquent, l’allégation ne satisfaisant pas aux exigences du règlement (CE) no 1924/2006, il convient de ne pas l’autoriser. |
|
(13) |
À la suite de deux demandes de Nutrilinks Sarl, introduites conformément à l’article 13, paragraphe 5, du règlement (CE) no 1924/2006, l’Autorité a été invitée à rendre un avis sur une allégation de santé concernant les effets d’une combinaison de thiamine, de riboflavine, de niacine, d’acide pantothénique, de pyridoxine, de D-biotine et d’huile de pépins de courge (Cucurbita pepo L.) et le maintien d’une chevelure normale (questions no EFSA-Q-2012-00334 et no EFSA-Q-2012-00335) (6). L’allégation proposée par le demandeur était libellée, entre autres, comme suit: «Contribue à accroître le nombre de cheveux». |
|
(14) |
Le 17 juillet 2012, la Commission et les États membres ont reçu l’avis scientifique de l’Autorité dans lequel cette dernière conclut, sur la base des données fournies, qu’un lien de cause à effet n’a pas été établi entre la consommation d’une combinaison de thiamine, de riboflavine, de niacine, d’acide pantothénique, de pyridoxine, de D-biotine et d’huile de pépins de courge (Cucurbita pepo L.) et l’effet allégué. Par conséquent, l’allégation ne satisfaisant pas aux exigences du règlement (CE) no 1924/2006, il convient de ne pas l’autoriser. |
|
(15) |
À la suite d’une demande de Nutrilinks Sarl, introduite conformément à l’article 13, paragraphe 5, du règlement (CE) no 1924/2006, l’Autorité a été invitée à rendre un avis sur une allégation de santé concernant les effets de l’extrait de Rhodiola rosea L. et la réduction de la fatigue intellectuelle (question no EFSA-Q-2012-00336) (7). L’allégation proposée par le demandeur était libellée, entre autres, comme suit: «Contribue à réduire la fatigue en cas de stress». |
|
(16) |
Le 17 juillet 2012, la Commission et les États membres ont reçu l’avis scientifique de l’Autorité dans lequel cette dernière conclut, sur la base des données fournies, qu’un lien de cause à effet n’a pas été établi entre la consommation d’extrait de Rhodiola rosea L. et l’effet allégué. Par conséquent, l’allégation ne satisfaisant pas aux exigences du règlement (CE) no 1924/2006, il convient de ne pas l’autoriser. |
|
(17) |
À la suite d’une demande de Nutrilinks Sarl, introduite conformément à l’article 13, paragraphe 5, du règlement (CE) no 1924/2006, l’Autorité a été invitée à rendre un avis sur une allégation de santé concernant les effets d’une combinaison d’huile de lin et de vitamine E et la protection de la fonction de barrière de perméabilité de la peau (question no EFSA-Q-2012-00337) (8). L’allégation proposée par le demandeur était libellée, entre autres, comme suit: «Contribue à protéger la fonction de barrière de perméabilité de la peau». |
|
(18) |
Le 17 juillet 2012, la Commission et les États membres ont reçu l’avis scientifique de l’Autorité dans lequel cette dernière conclut, sur la base des données fournies, qu’un lien de cause à effet n’a pas été établi entre la consommation d’une combinaison d’huile de lin et de vitamine E et l’effet allégué. Par conséquent, l’allégation ne satisfaisant pas aux exigences du règlement (CE) no 1924/2006, il convient de ne pas l’autoriser. |
|
(19) |
À la suite d’une demande de Nutrilinks Sarl, introduite conformément à l’article 13, paragraphe 5, du règlement (CE) no 1924/2006, l’Autorité a été invitée à rendre un avis sur une allégation de santé concernant les effets d’Opti EFAX™ et le maintien de concentrations sanguines normales de cholestérol LDL (question no EFSA-Q-2012-00339) (9). L’allégation proposée par le demandeur était libellée comme suit: «Opti EFAX™ contribue à maintenir des niveaux sanguins sains de cholestérol LDL». |
|
(20) |
Le 17 juillet 2012, la Commission et les États membres ont reçu l’avis scientifique de l’Autorité dans lequel cette dernière conclut, sur la base des données fournies, qu’un lien de cause à effet n’a pas été établi entre la consommation d’Opti EFAX™ et l’effet allégué. Par conséquent, l’allégation ne satisfaisant pas aux exigences du règlement (CE) no 1924/2006, il convient de ne pas l’autoriser. |
|
(21) |
À la suite d’une demande de Nutrilinks Sarl, introduite conformément à l’article 13, paragraphe 5, du règlement (CE) no 1924/2006, l’Autorité a été invitée à rendre un avis sur une allégation de santé concernant les effets d’Opti EFAX™ et le maintien de concentrations sanguines normales de cholestérol HDL (question no EFSA-Q-2012-00340) (10). L’allégation proposée par le demandeur était libellée comme suit: «Opti EFAX™ contribue à maintenir des niveaux sanguins sains de cholestérol HDL». |
|
(22) |
Le 17 juillet 2012, la Commission et les États membres ont reçu l’avis scientifique de l’Autorité dans lequel cette dernière conclut, sur la base des données fournies, qu’un lien de cause à effet n’a pas été établi entre la consommation d’Opti EFAX™ et l’effet allégué. Par conséquent, l’allégation ne satisfaisant pas aux exigences du règlement (CE) no 1924/2006, il convient de ne pas l’autoriser. |
|
(23) |
À la suite d’une demande de Nutrilinks Sarl, introduite conformément à l’article 13, paragraphe 5, du règlement (CE) no 1924/2006, l’Autorité a été invitée à rendre un avis sur une allégation de santé concernant les effets de KF2BL20, qui est une combinaison de kératine, de cuivre, de zinc, de niacine, d’acide pantothénique, de pyridoxine et de D-biotine, et le maintien d’une chevelure normale (question no EFSA-Q-2012-00381) (11). L’allégation proposée par le demandeur était libellée, entre autres, comme suit: «Aide à garder des cheveux vigoureux». |
|
(24) |
Le 17 juillet 2012, la Commission et les États membres ont reçu l’avis scientifique de l’Autorité dans lequel cette dernière conclut, sur la base des données fournies, qu’un lien de cause à effet n’a pas été établi entre la consommation de KF2BL20 et l’effet allégué. Par conséquent, l’allégation ne satisfaisant pas aux exigences du règlement (CE) no 1924/2006, il convient de ne pas l’autoriser. |
|
(25) |
À la suite d’une demande de Nutrilinks Sarl, introduite conformément à l’article 13, paragraphe 5, du règlement (CE) no 1924/2006, l’Autorité a été invitée à rendre un avis sur une allégation de santé concernant les effets de l’acide hyaluronique et la protection de la peau contre la déshydratation (question no EFSA-Q-2012-00382) (12). L’allégation proposée par le demandeur était libellée, entre autres, comme suit: «Contribue à maintenir une bonne hydratation de la peau». |
|
(26) |
Le 17 juillet 2012, la Commission et les États membres ont reçu l’avis scientifique de l’Autorité dans lequel cette dernière conclut, sur la base des données fournies, qu’un lien de cause à effet n’a pas été établi entre la consommation d’acide hyaluronique et l’effet allégué. Par conséquent, l’allégation ne satisfaisant pas aux exigences du règlement (CE) no 1924/2006, il convient de ne pas l’autoriser. |
|
(27) |
À la suite d’une demande de Nutrilinks Sarl, introduite conformément à l’article 13, paragraphe 5, du règlement (CE) no 1924/2006, l’Autorité a été invitée à rendre un avis sur une allégation de santé concernant les effets d’Opti EFAX™ et le maintien de concentrations sanguines normales de triglycérides (question no EFSA-Q-2012-00383) (13). L’allégation proposée par le demandeur était libellée comme suit: «Opti EFAX™ contribue à maintenir des niveaux sanguins sains de triglycérides.» |
|
(28) |
Le 17 juillet 2012, la Commission et les États membres ont reçu l’avis scientifique de l’Autorité dans lequel cette dernière conclut, sur la base des données fournies, qu’un lien de cause à effet n’a pas été établi entre la consommation d’Opti EFAX™ et l’effet allégué. Par conséquent, l’allégation ne satisfaisant pas aux exigences du règlement (CE) no 1924/2006, il convient de ne pas l’autoriser. |
|
(29) |
À la suite d’une demande de Vivatech, introduite conformément à l’article 13, paragraphe 5, du règlement (CE) no 1924/2006, l’Autorité a été invitée à rendre un avis sur une allégation de santé concernant Transitech® et «améliore le transit et le régule durablement» (question no EFSA-Q-2012-00296) (14). L’allégation proposée par le demandeur était libellée comme suit: «Améliore le transit et le régule durablement». |
|
(30) |
Le 26 septembre 2012, la Commission et les États membres ont reçu l’avis scientifique de l’Autorité dans lequel cette dernière conclut, sur la base des données fournies, qu’un lien de cause à effet n’a pas pu être établi entre la consommation de Transitech® et l’effet allégué. Par conséquent, l’allégation ne satisfaisant pas aux exigences du règlement (CE) no 1924/2006, il convient de ne pas l’autoriser. |
|
(31) |
À la suite d’une demande de Nutrilinks Sarl, introduite conformément à l’article 13, paragraphe 5, du règlement (CE) no 1924/2006, l’Autorité a été invitée à rendre un avis sur une allégation de santé concernant les effets de Femilub® et le maintien de l’humidification vaginale (question no EFSA-Q-2012-00571) (15). L’allégation proposée par le demandeur était libellée, entre autres, comme suit: «Contribue à réduire la sécheresse vaginale». |
|
(32) |
Le 26 septembre 2012, la Commission et les États membres ont reçu l’avis scientifique de l’Autorité dans lequel cette dernière conclut, sur la base des données fournies, qu’un lien de cause à effet n’a pas été établi entre la consommation de Femilub® et l’effet allégué. Par conséquent, l’allégation ne satisfaisant pas aux exigences du règlement (CE) no 1924/2006, il convient de ne pas l’autoriser. |
|
(33) |
À la suite d’une demande de Nutrilinks Sarl, introduite conformément à l’article 13, paragraphe 5, du règlement (CE) no 1924/2006, l’Autorité a été invitée à rendre un avis sur une allégation de santé concernant les effets d’une combinaison de lycopène, de vitamine E, de lutéine et de sélénium et la protection de la peau contre les dommages provoqués par les UV (question no EFSA-Q-2012-00592) (16). L’allégation proposée par le demandeur était libellée, entre autres, comme suit: «Contribue à préparer de l’intérieur les peaux sensibles pour améliorer leur tolérance au soleil». |
|
(34) |
Le 27 septembre 2012, la Commission et les États membres ont reçu l’avis scientifique de l’Autorité dans lequel cette dernière conclut, sur la base des données fournies, qu’un lien de cause à effet n’a pas été établi entre la consommation d’une combinaison de lycopène, de vitamine E, de lutéine et de sélénium et l’effet allégué. Par conséquent, l’allégation ne satisfaisant pas aux exigences du règlement (CE) no 1924/2006, il convient de ne pas l’autoriser. |
|
(35) |
À la suite d’une demande de Glanbia Nutritionals plc, introduite conformément à l’article 13, paragraphe 5, du règlement (CE) no 1924/2006, l’Autorité a été invitée à rendre un avis sur une allégation de santé concernant Prolibra® et «Contribue à réduire la graisse corporelle tout en préservant le muscle maigre» (question no EFSA-Q-2012-00001) (17). L’allégation proposée par le demandeur était libellée comme suit: «Contribue à réduire la graisse corporelle tout en préservant le muscle maigre». |
|
(36) |
Le 8 novembre 2012, la Commission et les États membres ont reçu l’avis scientifique de l’Autorité dans lequel cette dernière conclut, sur la base des données fournies, qu’un lien de cause à effet n’a pas pu être établi entre la consommation de Prolibra® et l’effet allégué. Par conséquent, l’allégation ne satisfaisant pas aux exigences du règlement (CE) no 1924/2006, il convient de ne pas l’autoriser. |
|
(37) |
À la suite d’une demande de Nutrilinks Sarl, introduite conformément à l’article 13, paragraphe 5, du règlement (CE) no 1924/2006, l’Autorité a été invitée à rendre un avis sur une allégation de santé concernant Eff EXT™ et «Contribue à soutenir la fonction articulaire par le maintien de faibles niveaux de protéine C-réactive dans le plasma» (question no EFSA-Q-2012-00386) (18). L’allégation proposée par le demandeur était libellée, entre autres, comme suit: «Contribue à soutenir la fonction articulaire par le maintien de faibles niveaux de protéine C-réactive dans le plasma». |
|
(38) |
Le 27 septembre 2012, la Commission et les États membres ont reçu l’avis scientifique de l’Autorité dans lequel cette dernière prend note du fait que l’allégation se réfère à une réduction de l’inflammation, indiquée par une concentration réduite de protéine C-réactive dans le plasma, et conclut sur la base des données fournies qu’une réduction de l’inflammation dans le contexte de maladies, telles que l’ostéoarthrose ou l’arthrite rhumatoïde, est une cible thérapeutique pour le traitement d’une maladie. |
|
(39) |
Le règlement (CE) no 1924/2006 complète les principes généraux de la directive du Parlement européen et du Conseil du 20 mars 2000 relative au rapprochement des législations des États membres concernant l’étiquetage et la présentation des denrées alimentaires ainsi que la publicité faite à leur égard (19). L’article 2, paragraphe 1, point b), de la directive 2000/13/CE dispose que l’étiquetage ne peut attribuer à une denrée alimentaire des propriétés de prévention, de traitement ou de guérison d’une maladie humaine, ni évoquer ces propriétés. Par conséquent, étant donné que l’attribution aux denrées alimentaires de vertus médicinales est interdite, il convient de ne pas autoriser l’allégation relative aux effets d’Eff EXT™. |
|
(40) |
L’allégation de santé concernant Eff EXT™ et «Contribue à soutenir la fonction articulaire par le maintien de faibles niveaux de protéine C-réactive dans le plasma» est une allégation de santé attribuant des vertus médicinales à la denrée alimentaire en question et est donc interdite pour les denrées alimentaires. |
|
(41) |
L’allégation de santé concernant Prolibra® et «Contribue à réduire la graisse corporelle tout en préservant le muscle maigre» est une allégation de santé telle que celles visées à l’article 13, paragraphe 1, point c), du règlement (CE) no 1924/2006, qui bénéficient de la période transitoire prévue à l’article 28, paragraphe 6, dudit règlement. La demande n’ayant toutefois pas été introduite avant le 19 janvier 2008, la condition prévue à l’article 28, paragraphe 6, point b), dudit règlement n’est pas remplie et cette allégation ne peut donc pas bénéficier de la période transitoire fixée par cet article. |
|
(42) |
Les autres allégations de santé relevant du présent règlement sont des allégations de santé au sens de l’article 13, paragraphe 1, point a), du règlement (CE) no 1924/2006 et bénéficient de la période transitoire prévue à l’article 28, paragraphe 5, dudit règlement jusqu’à l’adoption de la liste des allégations de santé autorisées, à condition qu’elles soient conformes audit règlement. |
|
(43) |
La liste des allégations de santé autorisées a été établie par le règlement (UE) no 432/2012 de la Commission (20) et est applicable depuis le 14 décembre 2012. Pour les allégations visées à l’article 13, paragraphe 5, du règlement (CE) no 1924/2006 qui, à la date du 14 décembre 2012, n’auraient pas été évaluées par l’Autorité ou examinées par la Commission et qui, en vertu du présent règlement, ne figurent pas sur la liste des allégations de santé autorisées, il convient de prévoir une période transitoire pendant laquelle elles pourront continuer à être utilisées de manière que les exploitants du secteur alimentaire et les autorités nationales compétentes puissent tenir compte de leur interdiction. |
|
(44) |
Les observations des demandeurs et de toute autre personne transmises à la Commission conformément à l’article 16, paragraphe 6, du règlement (CE) no 1924/2006 ont été prises en considération lors de la fixation des mesures prévues au présent règlement. |
|
(45) |
Les mesures prévues au présent règlement sont conformes à l’avis du comité permanent de la chaîne alimentaire et de la santé animale et n’ont soulevé l’opposition ni du Parlement européen, ni du Conseil, |
A ADOPTÉ LE PRÉSENT RÈGLEMENT:
Article premier
1. Les allégations de santé mentionnées à l’annexe du présent règlement ne sont pas inscrites sur la liste des allégations autorisées de l’Union visée à l’article 13, paragraphe 3, du règlement (CE) no 1924/2006.
2. Toutefois, les allégations de santé visées au paragraphe 1, qui étaient utilisées avant la date d’entrée en vigueur du présent règlement, peuvent continuer à être utilisées pendant une période maximale de six mois après cette date.
Article 2
Le présent règlement entre en vigueur le vingtième jour suivant celui de sa publication au Journal officiel de l’Union européenne.
Le présent règlement est obligatoire dans tous ses éléments et directement applicable dans tout État membre.
Fait à Bruxelles, le 30 octobre 2013.
Par la Commission
Le président
José Manuel BARROSO
(1) JO L 404 du 30.12.2006, p. 9.
(2) EFSA Journal (2011); 9(12):2476.
(3) EFSA Journal (2012); 10(5):2691.
(4) EFSA Journal (2012); 10(7):2773.
(5) EFSA Journal (2012); 10(7):2801.
(6) EFSA Journal (2012); 10(7):2807.
(7) EFSA Journal (2012); 10(7):2805.
(8) EFSA Journal (2012); 10(7):2819.
(9) EFSA Journal (2012); 10(7):2802.
(10) EFSA Journal (2012); 10(7):2803.
(11) EFSA Journal (2012); 10(7):2808.
(12) EFSA Journal (2012); 10(7):2806.
(13) EFSA Journal (2012); 10(7):2804.
(14) EFSA Journal (2012); 10(9):2887.
(15) EFSA Journal (2012); 10(9):2888.
(16) EFSA Journal (2012); 10(9):2890.
(17) EFSA Journal (2012); 10(11):2949.
(18) EFSA Journal (2012); 10(9):2889.
(19) JO L 109 du 6.5.2000, p. 29.
(20) JO L 136 du 25.5.2012, p. 1.
ANNEXE
Allégations de santé rejetées
|
Demande — dispositions applicables du règlement (CE) no 1924/2006 |
Nutriment, substance, denrée alimentaire ou catégorie de denrées alimentaires |
Allégation |
Référence de l’avis de l’EFSA |
|
Article 13, paragraphe 5 – allégation de santé fondée sur des preuves scientifiques nouvellement établies et/ou contenant une demande de protection des données relevant de la propriété exclusive du demandeur |
Glucosamine |
La glucosamine contribue à protéger le cartilage articulaire exposé à des mouvements trop importants ou à des charges excessives et aide à améliorer l’amplitude du mouvement articulaire |
Q-2011-00907 |
|
Article 13, paragraphe 5 – allégation de santé fondée sur des preuves scientifiques nouvellement établies et/ou contenant une demande de protection des données relevant de la propriété exclusive du demandeur |
Glucosamine |
La glucosamine contribue à la santé du cartilage articulaire normal |
Q-2011-01113 |
|
Article 13, paragraphe 5 – allégation de santé fondée sur des preuves scientifiques nouvellement établies et/ou contenant une demande de protection des données relevant de la propriété exclusive du demandeur |
Extrait de lipides polaires de blé |
Contribue à améliorer l’hydratation de la peau |
Q-2011-01122 |
|
Article 13, paragraphe 5 – allégation de santé fondée sur des preuves scientifiques nouvellement établies et/ou contenant une demande de protection des données relevant de la propriété exclusive du demandeur |
Saccharomyces cerevisiae var. boulardii CNCM I-3799 |
Saccharomyces cerevisiae var. boulardii CNCM I-3799 contribue à préserver le confort intestinal |
Q-2012-00271 |
|
Article 13, paragraphe 5 – allégation de santé fondée sur des preuves scientifiques nouvellement établies et/ou contenant une demande de protection des données relevant de la propriété exclusive du demandeur |
Une combinaison de thiamine, de riboflavine, de niacine, d’acide pantothénique, de pyridoxine, de D-biotine et d’huile de pépins de courge (Cucurbita pepo L.) |
Contribue à accroître le nombre de cheveux |
Q-2012-00334 et Q-2012-00335 |
|
Article 13, paragraphe 5 – allégation de santé fondée sur des preuves scientifiques nouvellement établies et/ou contenant une demande de protection des données relevant de la propriété exclusive du demandeur |
Extrait de Rhodiola rosea L. |
Contribue à réduire la fatigue en cas de stress |
Q-2012-00336 |
|
Article 13, paragraphe 5 – allégation de santé fondée sur des preuves scientifiques nouvellement établies et/ou contenant une demande de protection des données relevant de la propriété exclusive du demandeur |
Une combinaison d’huile de lin et de vitamine E |
Contribue à maintenir la fonction de barrière de perméabilité de la peau |
Q-2012-00337 |
|
Article 13, paragraphe 5 – allégation de santé fondée sur des preuves scientifiques nouvellement établies et/ou contenant une demande de protection des données relevant de la propriété exclusive du demandeur |
Opti EFAX™ |
Opti EFAX™ contribue à maintenir des niveaux sanguins sains de cholestérol LDL |
Q-2012-00339 |
|
Article 13, paragraphe 5 – allégation de santé fondée sur des preuves scientifiques nouvellement établies et/ou contenant une demande de protection des données relevant de la propriété exclusive du demandeur |
Opti EFAX™ |
Opti EFAX™ contribue à maintenir des niveaux sanguins sains de cholestérol HDL |
Q-2012-00340 |
|
Article 13, paragraphe 5 – allégation de santé fondée sur des preuves scientifiques nouvellement établies et/ou contenant une demande de protection des données relevant de la propriété exclusive du demandeur |
KF2BL20 |
Aide à garder des cheveux vigoureux |
Q-2012-00381 |
|
Article 13, paragraphe 5 – allégation de santé fondée sur des preuves scientifiques nouvellement établies et/ou contenant une demande de protection des données relevant de la propriété exclusive du demandeur |
Acide hyaluronique |
Contribue à maintenir une bonne hydratation de la peau |
Q-2012-00382 |
|
Article 13, paragraphe 5 – allégation de santé fondée sur des preuves scientifiques nouvellement établies et/ou contenant une demande de protection des données relevant de la propriété exclusive du demandeur |
Opti EFAX™ |
Opti EFAX™ contribue à maintenir des niveaux sanguins sains de triglycérides |
Q-2012-00383 |
|
Article 13, paragraphe 5 – allégation de santé fondée sur des preuves scientifiques nouvellement établies et/ou contenant une demande de protection des données relevant de la propriété exclusive du demandeur |
Transitech® |
Améliore le transit et le régule durablement |
Q-2012-00296 |
|
Article 13, paragraphe 5 – allégation de santé fondée sur des preuves scientifiques nouvellement établies et/ou contenant une demande de protection des données relevant de la propriété exclusive du demandeur |
Femilub® |
Contribue à réduire la sécheresse vaginale |
Q-2012-00571 |
|
Article 13, paragraphe 5 – allégation de santé fondée sur des preuves scientifiques nouvellement établies et/ou contenant une demande de protection des données relevant de la propriété exclusive du demandeur |
Une combinaison de lycopène, de vitamine E, de lutéine et de sélénium |
Contribue à préparer de l’intérieur les peaux sensibles pour améliorer leur tolérance au soleil |
Q-2012-00592 |
|
Article 13, paragraphe 5 – allégation de santé fondée sur des preuves scientifiques nouvellement établies et/ou contenant une demande de protection des données relevant de la propriété exclusive du demandeur |
Prolibra® |
Contribue à réduire la graisse corporelle tout en préservant le muscle maigre |
Q-2012-00001 |
|
Article 13, paragraphe 5 – allégation de santé fondée sur des preuves scientifiques nouvellement établies et/ou contenant une demande de protection des données relevant de la propriété exclusive du demandeur |
Eff EXT™ |
Contribue à soutenir la fonction articulaire par le maintien de faibles niveaux de protéine C-réactive dans le plasma |
Q-2012-00386 |
|
31.10.2013 |
FR |
Journal officiel de l'Union européenne |
L 289/56 |
RÈGLEMENT (UE) No 1067/2013 DE LA COMMISSION
du 30 octobre 2013
modifiant le règlement (CE) no 1881/2006 en ce qui concerne les teneurs maximales en dioxines, PCB de type dioxine et PCB autres que ceux de type dioxine dans le foie des animaux terrestres
(Texte présentant de l'intérêt pour l'EEE)
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l’Union européenne,
vu le règlement (CEE) no 315/93 du Conseil du 8 février 1993 portant établissement des procédures communautaires relatives aux contaminants dans les denrées alimentaires (1), et notamment son article 2, paragraphe 3,
considérant ce qui suit:
|
(1) |
Le règlement (CE) no 1881/2006 de la Commission du 19 décembre 2006 portant fixation de teneurs maximales pour certains contaminants dans les denrées alimentaires (2) fixe les teneurs maximales applicables aux dioxines et aux polychlorobiphényles (PCB) de type dioxine dans une série de denrées alimentaires, notamment le foie de certains animaux terrestres. |
|
(2) |
À la demande de la Commission, le groupe scientifique sur les contaminants de la chaîne alimentaire (ci-après le «groupe») de l’Autorité européenne de sécurité des aliments (EFSA) a adopté, le 5 juillet 2011, un avis sur les risques pour la santé publique liés à la présence de niveaux élevés de dioxines et de PCB de type dioxine dans le foie d’ovin et de cervidé (3). |
|
(3) |
La Commission a demandé que l’avis indique s’il existe une éventuelle aggravation des risques pour la santé du consommateur pour les sous-groupes de la population qui consomment ces produits (par exemple les gros consommateurs, les personnes suivant des régimes spécifiques, etc.). L’avis doit également étudier pourquoi des niveaux élevés de dioxines et de PCB ont été découverts dans le foie d’ovin et de cervidé et fournir des éléments scientifiques sur l’opportunité de fixer, à l’avenir, des niveaux réglementaires dans le foie par rapport au produit plutôt que par rapport aux graisses. |
|
(4) |
Le groupe a conclu que la consommation régulière de foie d’ovin augmenterait en moyenne d’à peu près 20 % l’exposition naturelle aux dioxines et aux PCB de type dioxine. Dans certains cas, la consommation de foie d’ovin pourrait entraîner l’absorption de fortes doses excédant la dose hebdomadaire tolérable (DHT) de ces contaminants. Le groupe a conclu que la consommation fréquente de foie d’ovin, en particulier par les femmes en âge de procréer et par les enfants, pourrait constituer un problème pour la santé. |
|
(5) |
Le groupe a également conclu que les sols et les sédiments étaient des réservoirs naturels de dioxines et de PCB. Le transfert de dioxines et de PCB du sol aux plantes par le système radiculaire est généralement négligeable. Ces dernières années, un certain nombre d’échantillons de foie d’ovin de divers pays européens ont révélé des concentrations élevées de dioxines et de PCB, non associées cependant à des sources de contamination spécifiques. Pour les ovins, la pâture est l’un des principaux facteurs d’exposition. En pâture, les animaux peuvent absorber de la terre sous forme de particules déposées sur les végétaux ou directement en ingérant des herbes proches de la surface du sol. L’absorption de terre est très variable et dépend fortement des saisons: la médiane déclarée s’établissait à hauteur de 8 % de l’ingestion de matière sèche. Dans l’ensemble, l’absorption de terre pourrait contribuer de manière substantielle à l’exposition des ovins aux dioxines et aux PCB. Peu de données sont disponibles concernant le transfert de dioxines et/ou de PCB des aliments des ovins à leur foie. En fonction des congénères des polychlorodibenzo-para-dioxines (PCDD), des polychlorodibenzofuranes (PCDF) ou des PCB considérés, les rapports de transfert enregistrés variaient de 5 à 175 et étaient environ quatre fois plus élevés pour le foie que pour la viande ou les rognons. |
|
(6) |
L’EFSA a également conclu que le foie d’ovin était un important organe de stockage de dioxines et de PCB. Les différences de métabolisme pourraient expliquer en partie que le stockage de dioxines et de composés analogues soit relativement plus élevé dans le foie des ovins que dans celui des bovins. |
|
(7) |
L’EFSA a conclu que, même s’il y avait une éventuelle rétention hépatique et que les dioxines et les PCB n’étaient pas totalement associés à la fraction lipidique du foie, cela n’aurait aucune influence sur le résultat, qu’il soit exprimé sur la base des graisses ou du poids de viande fraîche, puisque toutes les dioxines et les PCB sont extraits pendant la procédure analytique quelle que soit la partie du foie où ils sont présents. |
|
(8) |
Le laboratoire de référence de l’Union européenne (LRUE) pour les dioxines et les PCB dans les aliments pour animaux et les denrées alimentaires a été invité par la Commission à étudier l’influence des différentes méthodes d’extraction sur les niveaux de dioxines et de PCB dans le foie d’ovin en vue de l’expression du résultat analytique sur la base des graisses ou du poids à l’état frais. Le LRUE a conclu que les écarts de concentration en dioxines et PCB étaient nettement plus élevés sur la base des graisses que sur la base du poids à l’état frais. Les concentrations en dioxines et en PCB exprimées par rapport aux graisses dans le foie d’ovin dépendaient de la méthode d’extraction employée ou des solvants utilisés et donc de la teneur en graisses. Un examen des résultats sur la base du poids à l’état frais faisait apparaître des niveaux de dioxines et de PCB tout à fait comparables. |
|
(9) |
Par conséquent, afin d’assurer la comparabilité des résultats et une application uniforme de la législation dans l’ensemble de l’Union en ce qui concerne les dioxines et les PCB dans le foie des animaux terrestres, il convient de fixer les teneurs maximales sur la base du poids à l’état frais comme cela est déjà le cas pour le foie de poisson et ses produits dérivés. |
|
(10) |
Il convient d’établir que ces teneurs maximales ne s’appliquent pas aux denrées alimentaires légalement placées sur le marché avant la date d’application du présent règlement. |
|
(11) |
Les mesures prévues au présent règlement sont conformes à l’avis du comité permanent de la chaîne alimentaire et de la santé animale, |
A ADOPTÉ LE PRÉSENT RÈGLEMENT:
Article premier
Dispositions modificatrices
À l’annexe du règlement (CE) no 1881/2006, le point 5.2 est remplacé par le texte suivant:
|
«5.2 |
Foies des animaux terrestres visés au point 5.1, à l’exception des foies d’ovin et des produits dérivés de ces foies |
0,30 pg/g de poids à l’état frais |
0,50 pg/g de poids à l’état frais |
3,0 ng/g de poids à l’état frais |
|
|
Foies d’ovin et leurs produits dérivés |
1,25 pg/g de poids à l’état frais |
2,00 pg/g de poids à l’état frais |
3,0 ng/g de poids à l’état frais» |
Article 2
Dispositions transitoires
1. Le présent règlement ne s’applique pas aux produits mis sur le marché avant le 1er janvier 2014 conformément aux dispositions applicables à cette date.
2. Il incombe à l’exploitant du secteur alimentaire de prouver à quelle date les produits ont été mis sur le marché.
Article 3
Entrée en vigueur et application
Le présent règlement entre en vigueur le vingtième jour suivant celui de sa publication au Journal officiel de l’Union européenne.
Il s’applique à compter du 1er janvier 2014.
Le présent règlement est obligatoire dans tous ses éléments et directement applicable dans tout État membre.
Fait à Bruxelles, le 30 octobre 2013.
Par la Commission
Le président
José Manuel BARROSO
(1) JO L 37 du 13.2.1993, p. 1.
(2) JO L 364 du 20.12.2006, p. 5.
(3) Groupe de l’EFSA sur les contaminants de la chaîne alimentaire (Contam); avis scientifique sur les risques pour la santé publique liés à la présence de niveaux élevés de dioxines et de PCB de type dioxine dans le foie d’ovin et de cervidé. EFSA Journal 2011; 9(7):2297. [71 p.] doi:10.2903/j.efsa.2011.2297. Disponible en ligne à l’adresse suivante: www.efsa.europa.eu/efsajournal
|
31.10.2013 |
FR |
Journal officiel de l'Union européenne |
L 289/58 |
RÈGLEMENT (UE) No 1068/2013 DE LA COMMISSION
du 30 octobre 2013
modifiant l’annexe II du règlement (CE) no 1333/2008 du Parlement européen et du Conseil en ce qui concerne l’utilisation de diphosphates (E 450), de triphosphates (E 451) et de polyphosphates (E 452) dans le poisson salé en saumure
(Texte présentant de l'intérêt pour l'EEE)
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l’Union européenne,
vu le règlement (CE) no 1333/2008 du Parlement européen et du Conseil du 16 décembre 2008 sur les additifs alimentaires (1), et notamment son article 10, paragraphe 3, et son article 30, paragraphe 5,
considérant ce qui suit:
|
(1) |
L’annexe II du règlement (CE) no 1333/2008 établit une liste des additifs alimentaires dont l’Union autorise l’utilisation dans les denrées alimentaires et énonce leurs conditions d’utilisation. |
|
(2) |
Cette liste peut être modifiée conformément à la procédure prévue par le règlement (CE) no 1331/2008 du Parlement européen et du Conseil du 16 décembre 2008 établissant une procédure d’autorisation uniforme pour les additifs, enzymes et arômes alimentaires (2). |
|
(3) |
Conformément à l’article 3, paragraphe 1, du règlement (CE) no 1331/2008, la liste des additifs alimentaires autorisés par l’Union peut être mise à jour soit à l’initiative de la Commission, soit à la suite d’une demande. |
|
(4) |
Une demande d’autorisation concernant l’utilisation de diphosphates (E 450), de triphosphates (E 451) et de polyphosphates (E 452) dans le poisson salé en saumure a été introduite le 19 juin 2009 et communiquée aux États membres. |
|
(5) |
Le poisson peut être traité et conservé par l’ajout de grandes quantités de sel à la matière première. Composé initialement d’une seule étape, le processus de salage comporte maintenant plusieurs phases, dont un présalage permettant un temps de salaison plus court et une concentration de sel relativement homogène dans le muscle du poisson. À cet effet, le poisson est tout d’abord présalé par injection et/ou immersion dans une préparation de saumure dont la concentration de sel est contrôlée. Il est ensuite soumis à un salage à sec (salaison) pour une concentration de sel adéquate dans le produit fini. |
|
(6) |
Durant ce long processus de conservation, il peut encore se produire une oxydation, notamment des lipides présents dans le muscle du poisson, qui entraînera une altération de la couleur et du goût. L’oxydation est accélérée par la présence d’ions métalliques dans le muscle du poisson et dans le sel utilisé. Il a été prouvé que les diphosphates (E 450), les triphosphates (E 451) et les polyphosphates (E 452) constituent un moyen hautement efficace de protéger le poisson salé de l’oxydation, parce qu’ils forment des complexes chimiques avec les ions métalliques. L’essentiel des phosphates ajoutés et du sel est éliminé par trempage du poisson dans l’eau avant la consommation. L’utilisation de ces phosphates n’augmente pas la teneur en eau du produit salé en saumure final. Le poisson salé ayant conservé sa couleur et son goût d’origine est particulièrement demandé sur les marchés d’Espagne, d’Italie et de Grèce. |
|
(7) |
Conformément à l’article 3, en liaison avec l’article 6, paragraphe 4, de la directive 2000/13/CE du Parlement européen et du Conseil du 20 mars 2000 relative au rapprochement des législations des États membres concernant l’étiquetage et la présentation des denrées alimentaires ainsi que la publicité faite à leur égard (3), l’utilisation de phosphates dans le poisson salé en saumure doit être mentionnée sur l’étiquetage sur la liste des ingrédients. Les exploitants du secteur alimentaire peuvent également indiquer sur leurs produits qu’il n’a pas été fait usage de polyphosphates. |
|
(8) |
Étant donné que la plupart des phosphates ajoutés sont éliminés lors du trempage dans l’eau, l’exposition du consommateur aux phosphates sera minimale et n’est donc pas susceptible d’avoir un effet sur la santé humaine. Il convient donc d’autoriser l’utilisation de diphosphates (E 450), de triphosphates (E 451) et de polyphosphates (E 452) pour la conservation du poisson salé en saumure. |
|
(9) |
Conformément à l’article 3, paragraphe 2, du règlement (CE) no 1331/2008, la Commission est tenue de recueillir l’avis de l’Autorité européenne de sécurité des aliments (EFSA) pour mettre à jour la liste des additifs alimentaires de l’Union figurant à l’annexe II du règlement (CE) no 1333/2008, sauf si cette mise à jour n’est pas susceptible d’avoir un effet sur la santé humaine. L’autorisation de l’utilisation de diphosphates (E 450), de triphosphates (E 451) et de polyphosphates (E 452) pour la conservation du poisson salé en saumure constituant une mise à jour de cette liste qui n’est pas susceptible d’avoir un effet sur la santé humaine, il n’est pas nécessaire de recueillir l’avis de l’EFSA. |
|
(10) |
Le bacalao ou morue portugaise est produit par séchage supplémentaire du poisson salé en saumure. L’utilisation de polyphosphates pourrait avoir une influence sur ce processus de séchage et pourrait en outre entraver le développement de la couleur et de la saveur typiques du bacalao. Dans de telles conditions, les producteurs de bacalao traditionnel ne seraient pas demandeurs de poisson salé traité aux phosphates. Pour permettre à ces producteurs de s’adapter à une situation dans laquelle la mise sur le marché de poisson traité aux phosphates sera autorisée, il convient de proposer une période de transition au cours de laquelle ils pourront conclure des accords avec des fournisseurs et se familiariser avec les méthodes d’analyse pouvant être utilisées pour contrôler la présence de phosphates ajoutés dans le poisson. |
|
(11) |
Afin de mieux évaluer les conséquences sur la disponibilité de poisson salé en saumure pour la production de bacalao, la Commission surveillera pendant trois ans l’utilisation de polyphosphates dans les principaux pays producteurs de morue salée. |
|
(12) |
Au vu de ce qui précède, il convient de modifier l’annexe II du règlement (CE) no 1333/2008 en conséquence. |
|
(13) |
Les mesures prévues au présent règlement sont conformes à l’avis du comité permanent de la chaîne alimentaire et de la santé animale, |
A ADOPTÉ LE PRÉSENT RÈGLEMENT:
Article premier
L’annexe II du règlement (CE) no 1333/2008 est modifiée conformément à l’annexe du présent règlement.
Article 2
Le présent règlement entre en vigueur le vingtième jour suivant celui de sa publication au Journal officiel de l’Union européenne.
Il est obligatoire dans tous ses éléments et directement applicable dans tout État membre.
Fait à Bruxelles, le 30 octobre 2013.
Par la Commission
Le président
José Manuel BARROSO
(1) JO L 354 du 31.12.2008, p. 16.
(2) JO L 354 du 31.12.2008, p. 1.
(3) JO L 109 du 6.5.2000, p. 29.
ANNEXE
Dans la partie E de l’annexe II du règlement (CE) no 1333/2008, les lignes ci-après sont insérées dans la catégorie de denrées alimentaires 09.2 «Poisson et produits de la pêche transformés, y compris mollusques et crustacés», après la ligne concernant l’additif E 392:
|
|
«E 450 |
Diphosphates |
5 000 |
(4), (79) |
Uniquement poisson salé de la famille des gadidés ayant été présalé par injection et/ou immersion dans une solution saumurée contenant au moins 18 % de sel et souvent soumis par la suite à un salage à sec |
Période d’application: à partir du 31 décembre 2013 |
||
|
|
E 451 |
Triphosphates |
5 000 |
(4), (79) |
Uniquement poisson salé de la famille des gadidés ayant été présalé par injection et/ou immersion dans une solution saumurée contenant au moins 18 % de sel et souvent soumis par la suite à un salage à sec |
Période d’application: à partir du 31 décembre 2013 |
||
|
|
E 452 |
Polyphosphates |
5 000 |
(4), (79) |
Uniquement poisson salé de la famille des gadidés ayant été présalé par injection et/ou immersion dans une solution saumurée contenant au moins 18 % de sel et souvent soumis par la suite à un salage à sec |
Période d’application: à partir du 31 décembre 2013 |
||
|
|
|
|||||||
|
||||||||
|
31.10.2013 |
FR |
Journal officiel de l'Union européenne |
L 289/61 |
RÈGLEMENT (UE) No 1069/2013 DE LA COMMISSION
du 30 octobre 2013
modifiant l’annexe II du règlement (CE) no 1333/2008 du Parlement européen et du Conseil en ce qui concerne l’utilisation de phosphates de sodium (E 339) dans les boyaux naturels pour saucisses
(Texte présentant de l'intérêt pour l'EEE)
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l’Union européenne,
vu le règlement (CE) no 1333/2008 du Parlement européen et du Conseil du 16 décembre 2008 sur les additifs alimentaires (1), et notamment son article 10, paragraphe 3, et son article 30, paragraphe 5,
considérant ce qui suit:
|
(1) |
L’annexe II du règlement (CE) no 1333/2008 établit une liste des additifs alimentaires autorisés par l’Union dans les denrées alimentaires et énonce leurs conditions d’utilisation. |
|
(2) |
Cette liste peut être modifiée conformément à la procédure uniforme visée à l’article 3, paragraphe 1, du règlement (CE) no 1331/2008 du Parlement européen et du Conseil du 16 décembre 2008 établissant une procédure d’autorisation uniforme pour les additifs, enzymes et arômes alimentaires (2), soit à l’initiative de la Commission, soit à la suite d’une demande. |
|
(3) |
Une demande d’autorisation concernant l’utilisation de phosphates de sodium (E 339) comme régulateurs d’acidité dans les boyaux naturels pour saucisses a été introduite le 26 août 2010 et communiquée aux États membres. |
|
(4) |
Les phosphates de sodium (E 339) figurent sur la liste des additifs alimentaires de l’Union; leur utilisation est autorisée dans certains produits alimentaires dont ne font pas partie les boyaux naturels pour saucisses. |
|
(5) |
Parmi les caractéristiques mécaniques notables des boyaux naturels qui en réduisent l’efficacité et causent des problèmes dans l’industrie de la saucisse, il y a la propension à l’éclatement pendant le remplissage et à une réduction de la capacité de glisse (adhérence accrue) des boyaux sur la buse de remplissage à saucisse. |
|
(6) |
Il est prouvé que les phosphates de sodium (E 339) utilisés comme régulateurs d’acidité sont de nature à améliorer les propriétés de glissement des boyaux naturels, ce qui facilite le processus de remplissage et réduit la force maximale et la tension de rupture qui s’exercent sur les boyaux. |
|
(7) |
La dose journalière maximale tolérable (DJMT) de phosphates établie par le comité scientifique de l’alimentation humaine (3) est de 70 mg/kg de poids corporel. La concentration maximale proposée par le demandeur est de 12 600 mg/kg de boyaux, ce qui correspond à un transfert maximal de phosphates des boyaux vers la saucisse finale de 250 mg/kg. L’apport maximal de phosphates via les boyaux naturels traités sera de 2,1 % de la DJMT. Il convient par conséquent d’autoriser l’utilisation de phosphates de sodium comme régulateurs d’acidité destinés à améliorer les propriétés mécaniques des boyaux pour saucisses. |
|
(8) |
Conformément à l’article 3, paragraphe 2, du règlement (CE) no 1331/2008, la Commission est tenue de recueillir l’avis de l’Autorité européenne de sécurité des aliments (EFSA) pour mettre à jour la liste des additifs alimentaires de l’Union figurant à l’annexe II du règlement (CE) no 1333/2008, sauf si cette mise à jour n’est pas susceptible d’avoir un effet sur la santé humaine. L’autorisation de l’utilisation de phosphates de sodium (E 339) en vue de l’amélioration des propriétés mécaniques des boyaux naturels pour saucisses constituant une mise à jour de cette liste qui n’est pas susceptible d’avoir un effet sur la santé humaine pour les raisons exposées précédemment, il n’est pas nécessaire de recueillir l’avis de l’EFSA. |
|
(9) |
Dès lors, il convient de modifier l’annexe II du règlement (CE) no 1333/2008 en conséquence. |
|
(10) |
Les mesures prévues au présent règlement sont conformes à l’avis du comité permanent de la chaîne alimentaire et de la santé animale, |
A ADOPTÉ LE PRÉSENT RÈGLEMENT:
Article premier
L’annexe II du règlement (CE) no 1333/2008 est modifiée conformément à l’annexe du présent règlement.
Article 2
Le présent règlement entre en vigueur le vingtième jour suivant celui de sa publication au Journal officiel de l’Union européenne.
Il est obligatoire dans tous ses éléments et directement applicable dans tout État membre.
Fait à Bruxelles, le 30 octobre 2013.
Par la Commission
Le président
José Manuel BARROSO
(1) JO L 354 du 31.12.2008, p. 16.
(2) JO L 354 du 31.12.2008, p. 1.
(3) Reports of the Scientific Committee for Food, Twenty-fifth series (page 13), 1991, disponible à l’adresse http://ec.europa.eu/food/fs/sc/scf/reports/scf_reports_25.pdf
ANNEXE
Dans la partie E de l’annexe II du règlement (CE) no 1333/2008, la ligne suivante est insérée dans la catégorie de denrées alimentaires 08.2.3 «Boyaux, enrobages et décorations pour viande», après la ligne concernant les additifs E 338-452:
|
|
«E 339 |
Phosphates de sodium |
12 600 |
(4) (80) |
Uniquement dans les boyaux naturels pour saucisses |
||
|
|
|
|
|||||
|
|
|
|
|||||
|
31.10.2013 |
FR |
Journal officiel de l'Union européenne |
L 289/63 |
RÈGLEMENT D'EXÉCUTION (UE) No 1070/2013 DE LA COMMISSION
du 30 octobre 2013
établissant les valeurs forfaitaires à l'importation pour la détermination du prix d'entrée de certains fruits et légumes
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l'Union européenne,
vu le règlement (CE) no 1234/2007 du Conseil du 22 octobre 2007 portant organisation commune des marchés dans le secteur agricole et dispositions spécifiques en ce qui concerne certains produits de ce secteur (règlement «OCM unique») (1),
vu le règlement d'exécution (UE) no 543/2011 de la Commission du 7 juin 2011 portant modalités d’application du règlement (CE) no 1234/2007 du Conseil en ce qui concerne les secteurs des fruits et légumes et des fruits et légumes transformés (2), et notamment son article 136, paragraphe 1,
considérant ce qui suit:
|
(1) |
Le règlement d’exécution (UE) no 543/2011 prévoit, en application des résultats des négociations commerciales multilatérales du cycle d'Uruguay, les critères pour la fixation par la Commission des valeurs forfaitaires à l'importation des pays tiers, pour les produits et les périodes figurant à l'annexe XVI, partie A, dudit règlement. |
|
(2) |
La valeur forfaitaire à l'importation est calculée chaque jour ouvrable, conformément à l'article 136, paragraphe 1, du règlement d'exécution (UE) no 543/2011, en tenant compte des données journalières variables. Il importe, par conséquent, que le présent règlement entre en vigueur le jour de sa publication au Journal officiel de l’Union européenne, |
A ADOPTÉ LE PRÉSENT RÈGLEMENT:
Article premier
Les valeurs forfaitaires à l'importation visées à l'article 136 du règlement d’exécution (UE) no 543/2011 sont fixées à l'annexe du présent règlement.
Article 2
Le présent règlement entre en vigueur le jour de sa publication au Journal officiel de l'Union européenne.
Le présent règlement est obligatoire dans tous ses éléments et directement applicable dans tout État membre.
Fait à Bruxelles, le 30 octobre 2013.
Par la Commission, au nom du président,
Jerzy PLEWA
Directeur général de l'agriculture et du développement rural
(1) JO L 299 du 16.11.2007, p. 1.
(2) JO L 157 du 15.6.2011, p. 1.
ANNEXE
Valeurs forfaitaires à l'importation pour la détermination du prix d'entrée de certains fruits et légumes
|
(EUR/100 kg) |
||
|
Code NC |
Code des pays tiers (1) |
Valeur forfaitaire à l'importation |
|
0702 00 00 |
AL |
41,5 |
|
MA |
43,1 |
|
|
MK |
43,1 |
|
|
TR |
75,3 |
|
|
ZZ |
50,8 |
|
|
0707 00 05 |
EG |
207,6 |
|
MK |
69,6 |
|
|
TR |
139,0 |
|
|
ZZ |
138,7 |
|
|
0709 93 10 |
TR |
112,3 |
|
ZZ |
112,3 |
|
|
0805 50 10 |
AR |
12,9 |
|
CL |
81,7 |
|
|
TR |
76,3 |
|
|
ZA |
55,9 |
|
|
ZZ |
56,7 |
|
|
0806 10 10 |
BR |
220,8 |
|
TR |
170,3 |
|
|
ZZ |
195,6 |
|
|
0808 10 80 |
CL |
216,7 |
|
NZ |
142,8 |
|
|
US |
154,3 |
|
|
ZA |
141,7 |
|
|
ZZ |
163,9 |
|
|
0808 30 90 |
CN |
76,9 |
|
TR |
120,5 |
|
|
ZZ |
98,7 |
|
(1) Nomenclature des pays fixée par le règlement (CE) no 1833/2006 de la Commission (JO L 354 du 14.12.2006, p. 19). Le code «ZZ» représente «autres origines».
DÉCISIONS
|
31.10.2013 |
FR |
Journal officiel de l'Union européenne |
L 289/65 |
DÉCISION D’EXÉCUTION DE LA COMMISSION
du 29 octobre 2013
approuvant les restrictions concernant l’autorisation d’un produit biocide contenant du bromadiolone notifiées par l’Allemagne conformément aux dispositions de la directive 98/8/CE du Parlement européen et du Conseil
[notifiée sous le numéro C(2013) 7034]
(Le texte en langue allemande est le seul faisant foi.)
(2013/630/UE)
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l’Union européenne,
vu la directive 98/8/CE du Parlement européen et du Conseil du 16 février 1998 concernant la mise sur le marché des produits biocides (1), et notamment son article 4, paragraphe 4,
considérant ce qui suit:
|
(1) |
L’annexe I de la directive 98/8/CE contient la liste des substances actives dont l’Union a approuvé l’inclusion dans les produits biocides. La directive 2009/92/CE de la Commission (2) a ajouté la substance active bromadiolone en vue d’une utilisation dans des produits appartenant au type de produits 14, rodenticides, défini à l’annexe V de la directive 98/8/CE. |
|
(2) |
Le bromadiolone est un rodenticide anticoagulant qui présente des risques notoires d’accident pour les enfants, ainsi que des risques pour les animaux non cibles et l’environnement. Il a été répertorié en tant que substance potentiellement persistante, susceptible de bioaccumulation et toxique, ou très persistante et très bioaccumulable. |
|
(3) |
Pour des raisons de santé publique et d’hygiène, il a toutefois paru justifié d’inscrire le bromadiolone et d’autres rodenticides anticoagulants à l’annexe I de la directive 98/8/CE, ce qui permet dès lors aux États membres d’autoriser les produits à base de bromadiolone. Toutefois, la directive 2009/92/CE oblige les États membres à s’assurer, lorsqu’ils octroient une autorisation pour des produits qui contiennent du bromadiolone, que les risques d’exposition directe et indirecte des hommes et des animaux non cibles, ainsi que les risques pour l’environnement, sont limités dans toute la mesure du possible, grâce à l’adoption et à l’application de toutes les mesures d’atténuation des risques appropriées et disponibles. Les mesures d’atténuation des risques mentionnées dans la directive 2009/92/CE prévoient dès lors, notamment, une restriction au seul usage professionnel. |
|
(4) |
La société LiphaTech S.A.S. («le demandeur») a présenté aux Pays-Bas, conformément à l’article 8 de la directive 98/8/CE, une demande d’autorisation pour un rodenticide contenant du bromadiolone («le produit»). Le nom du produit et son numéro de référence dans le registre des produits biocides figurent à l’annexe de la présente décision. |
|
(5) |
Les Pays-Bas ont accordé l’autorisation le 2 novembre 2012. Le produit a été autorisé moyennant certaines restrictions afin de s’assurer du respect des conditions prévues à l’article 5 de la directive 98/8/CE aux Pays-Bas. Ces restrictions n’incluaient pas une restriction aux utilisateurs professionnels qualifiés ou titulaires d’une licence. |
|
(6) |
Le 20 décembre 2012, le demandeur a présenté un dossier complet à l’Allemagne en vue d’obtenir la reconnaissance mutuelle de la première autorisation relative au produit. |
|
(7) |
Le 10 avril 2013, l’Allemagne a notifié à la Commission, aux autres États membres et au demandeur sa proposition visant à restreindre la première autorisation conformément à l’article 4, paragraphe 4, de la directive 98/8/CE. L’Allemagne a proposé d’imposer une restriction limitant l’utilisation du produit aux professionnels qualifiés ou titulaires d’une licence. |
|
(8) |
La Commission a invité les autres États membres et le demandeur à présenter par écrit leurs observations sur la notification dans un délai de quatre-vingt-dix jours, conformément à l’article 27, paragraphe 1, de la directive 98/8/CE. Aucun commentaire n’a été présenté dans le délai prescrit. La notification a également fait l’objet d’une discussion entre la Commission et les autorités compétentes des États membres pour les produits biocides lors de la réunion du groupe d’autorisation des produits et de facilitation de la reconnaissance mutuelle qui s’est tenue le 14 mai 2013. |
|
(9) |
Conformément à la directive 2009/92/CE, les autorisations de produits biocides contenant du bromadiolone doivent être soumises à toutes les mesures d’atténuation des risques appropriées et disponibles, y compris la restriction à un usage exclusivement professionnel. L’évaluation scientifique qui a conduit à l’adoption de la directive 2009/92/CE a conclu que seuls les utilisateurs professionnels seraient en mesure de suivre les instructions visant à réduire au minimum le risque d’empoisonnement secondaire des animaux non cibles, et d’utiliser les produits d’une manière qui empêche la sélection et la propagation de la résistance. Une restriction aux utilisateurs professionnels devrait donc, en principe, être considérée comme une mesure d’atténuation des risques appropriée, notamment dans les États membres où la résistance au bromadiolone est confirmée. |
|
(10) |
En l’absence de toute indication contraire, la restriction aux utilisateurs professionnels est donc une mesure d’atténuation des risques appropriée et disponible pour que les produits contenant du bromadiolone puissent être autorisés en Allemagne. Les arguments avancés par l’Allemagne selon lesquels la résistance des rats au bromadiolone a été constatée et se développerait dans le pays viennent renforcer cette conclusion. Par ailleurs, l’Allemagne dispose d’une infrastructure performante de techniciens en dératisation qualifiés et de professionnels titulaires d’une licence, tels que les agriculteurs, les jardiniers et les sylviculteurs, qui ont suivi une formation professionnelle, ce qui signifie que la restriction proposée ne nuit pas à la prévention des infections. |
|
(11) |
Les mesures prévues à la présente décision sont conformes à l’avis du comité permanent des produits biocides, |
A ADOPTÉ LA PRÉSENTE DÉCISION:
Article premier
L’Allemagne peut restreindre l’autorisation octroyée conformément à l’article 4 de la directive 98/8/CE pour le produit mentionné à l’annexe de la présente décision à une utilisation par des professionnels qualifiés ou titulaires d’une licence.
Article 2
La République fédérale d’Allemagne est destinataire de la présente décision.
Fait à Bruxelles, le 29 octobre 2013.
Par la Commission
Janez POTOČNIK
Membre de la Commission
(1) JO L 123 du 24.4.1998, p. 1.
(2) Directive 2009/92/CE de la Commission du 31 juillet 2009 modifiant la directive 98/8/CE du Parlement européen et du Conseil aux fins de l’inscription du bromadiolone en tant que substance active à l’annexe I de ladite directive (JO L 201 du 1.8.2009, p. 43).
ANNEXE
Produit pour lequel l’Allemagne peut restreindre l’autorisation octroyée conformément à l’article 4 de la directive 98/8/CE à une utilisation par des professionnels qualifiés ou titulaires d’une licence:
|
Nom du produit aux Pays-Bas |
Numéro de référence de la demande des Pays-Bas figurant dans le registre des produits biocides |
Nom du produit en Allemagne |
Numéro de référence de la demande de l’Allemagne figurant dans le registre des produits biocides |
|
Maki Pat’ |
2011/4329/10506/NL/AA/20379 |
Maki Pat’ |
2011/4329/10506/DE/MA/20799 |
|
31.10.2013 |
FR |
Journal officiel de l'Union européenne |
L 289/68 |
DÉCISION DE LA COMMISSION
du 29 octobre 2013
relative à la conformité des taux unitaires de 2014 pour les zones tarifaires, en application de l’article 17 du règlement d’exécution (UE) no 391/2013
[notifiée sous le numéro C(2013) 7095]
(2013/631/UE)
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l’Union européenne,
vu le règlement (CE) no 550/2004 du Parlement européen et du Conseil du 10 mars 2004 relatif à la fourniture de services de navigation aérienne dans le ciel unique européen («règlement sur la fourniture de services») (1), et notamment son article 15,
considérant ce qui suit:
|
(1) |
Le règlement d’exécution (UE) no 391/2013 de la Commission (2) établit un système commun de tarification des services de navigation aérienne. Le système commun de tarification fait partie intégrante des moyens mis en œuvre pour atteindre les objectifs du système de performance instauré en vertu de l’article 11 du règlement (CE) no 549/2004 du Parlement européen et du Conseil (3) et du règlement d’exécution (UE) no 390/2013 de la Commission (4). |
|
(2) |
La décision 2011/121/UE de la Commission (5) fixe les objectifs de performance de l’Union européenne, y compris un objectif en matière d’efficacité économique, pour la fourniture de services de navigation aérienne pour les années 2012 à 2014. Par courriers du 19 juillet et du 17 décembre 2012, la Commission européenne a informé les États membres que leurs plans et objectifs de performance révisés étaient compatibles avec les objectifs de performance adoptés par l’Union européenne et y contribuaient dans une juste mesure. Les objectifs en matière d’efficacité économique sont exprimés en taux unitaires fixés. |
|
(3) |
L’article 17, paragraphe 1, point c), du règlement d’exécution (UE) no 391/2013 prévoit que la Commission évalue, au plus tard le 1er juin 2013, les taux unitaires de 2014 pour les zones tarifaires mis à sa disposition par les États membres, au regard des prescriptions de l’article 9, paragraphes 1 et 2, dudit règlement. Cette évaluation vise à vérifier la conformité des taux unitaires de 2014 avec les dispositions des règlements d’exécution (UE) no 390/2013 et (UE) no 391/2013. |
|
(4) |
La Commission a effectué son évaluation des taux unitaires de 2014 pour les zones tarifaires avec l’aide de l’organe d’évaluation des performances et du service central des redevances de route d’Eurocontrol, et sur la base des données et des informations complémentaires fournies par les États membres en juin 2013. Lors de son évaluation, la Commission a également pris en considération les explications fournies et les corrections apportées avant la réunion de consultation organisée le 26 juin 2013 en application de l’article 9, paragraphe 1, du règlement d’exécution (UE) no 391/2013, ainsi que la correspondance ultérieure entre la Commission et le Danemark, l’Estonie, l’Irlande, l’Espagne, la France, l’Italie, la Hongrie, Malte, les Pays-Bas, la Roumanie, la Suède et le Royaume-Uni. |
|
(5) |
Le Danemark, la France, l’Italie, les Pays-Bas et la Roumanie ont proposé de compenser, partiellement ou entièrement, les ajustements prévus au titre du règlement d’exécution (UE) no 391/2013 afin de diminuer ou de maintenir un certain niveau du taux unitaire, ce qui est dans l’intérêt des usagers de l’espace aérien. Ces montants ne devraient donc pas être recouvrés les années suivantes. |
|
(6) |
La Commission note que l’Espagne a l’intention d’appliquer une disposition transitoire, conformément à l’article 2 du règlement (UE) no 1191/2010 de la Commission (6). La Commission a vérifié les informations fournies à cet égard par l’Espagne et considère que cet État membre remplit les conditions énoncées à l’article 2 du règlement (UE) no 1191/2010 et peut décider d’exempter les coûts fixés des prestataires de services de navigation aérienne de l’application de l’article 11 bis, paragraphe 3, du règlement (CE) no 1794/2006 de la Commission (7). Ainsi, le mécanisme de partage des risques liés au trafic avec sa répartition 30/70, entre prestataires de services de navigation aérienne et usagers de l’espace aérien, du revenu ou de la perte résultant d’une différence entre le nombre réel d’unités de services et les prévisions en la matière devrait déjà s’appliquer dès 0 % de différence au lieu de 2 % de différence. Conformément à l’article 2 du règlement (UE) no 1191/2010 et compte tenu de la réduction du taux unitaire décidée par l’Espagne pour l’année 2012, cette exemption se limite au partage des risques liés au trafic pour les revenus de l’année en question. L’Espagne a l’intention de répartir le report qui en découle sur les années à venir, à compter de 2015. |
|
(7) |
Conformément à l’article 17, paragraphe 1, point d), du règlement d’exécution (UE) no 391/2013, lorsque les taux unitaires sont conformes aux dispositions des règlements d’exécution (UE) no 390/2013 et (UE) no 391/2013, celle-ci en informe les États membres concernés. |
|
(8) |
La notification de la conformité des taux unitaires pour les zones tarifaires aux dispositions des règlements d’exécution (UE) no 390/2013 et (UE) no 391/2013 devrait être sans préjudice des dispositions de l’article 16 du règlement (CE) no 550/2004, |
A ADOPTÉ LA PRÉSENTE DÉCISION:
Article premier
Les taux unitaires de 2014 pour les zones tarifaires qui figurent à l’annexe de la présente décision sont conformes aux dispositions des règlements d’exécution (UE) no 390/2013 et (UE) no 391/2013.
Article 2
La notification de la conformité des taux unitaires pour les zones tarifaires aux dispositions des règlements d’exécution (UE) no 390/2013 et (UE) no 391/2013 est sans préjudice des dispositions de l’article 16 du règlement (CE) no 550/2004.
Article 3
Les États membres sont destinataires de la présente décision.
Fait à Bruxelles, le 29 octobre 2013.
Par la Commission
Siim KALLAS
Vice-président
(1) JO L 96 du 31.3.2004, p. 10.
(2) Règlement d’exécution (UE) no 391/2013 de la Commission du 3 mai 2013 établissant un système commun de tarification des services de navigation aérienne (JO L 128 du 9.5.2013, p. 31).
(3) Règlement (CE) no 549/2004 du Parlement européen et du Conseil du 10 mars 2004 fixant le cadre pour la réalisation du ciel unique européen (JO L 96 du 31.3.2004, p. 1).
(4) Règlement d’exécution (UE) no 390/2013 de la Commission du 3 mai 2013 établissant un système de performance pour les services de navigation aérienne et les fonctions de réseau (JO L 128 du 9.5.2013, p. 1).
(5) Décision 2011/121/UE de la Commission du 21 février 2011 fixant les objectifs de performance de l'Union européenne et les seuils d’alerte pour la fourniture de services de navigation aérienne pour les années 2012 à 2014 (JO L 48 du 23.2.2011, p. 16).
(6) Règlement (UE) no 1191/2010 de la Commission du 16 décembre 2010 modifiant le règlement (CE) no 1794/2006 établissant un système commun de tarification des services de navigation aérienne (JO L 333 du 17.12.2010, p. 6).
(7) Règlement (CE) no 1794/2006 de la Commission du 6 décembre 2006 établissant un système commun de tarification des services de navigation aérienne (JO L 341 du 7.12.2006, p. 3).
ANNEXE
|
Zone tarifaire |
Taux unitaire en route de 2014 en monnaie nationale (1) (code ISO) |
|
Belgique et Luxembourg |
72,04 EUR |
|
Bulgarie |
73,50 BGN |
|
République tchèque |
1 198,16 CZK |
|
Danemark |
537,56 DKK |
|
Allemagne |
77,32 EUR |
|
Estonie |
23,97 EUR |
|
Irlande |
30,62 EUR |
|
Grèce |
34,53 EUR |
|
Espagne continentale |
71,69 EUR |
|
Espagne, îles Canaries |
58,36 EUR |
|
France |
65,77 EUR |
|
Italie |
78,83 EUR |
|
Chypre |
38,41 EUR |
|
Lettonie |
19,99 LVL |
|
Lituanie |
162,08 LTL |
|
Hongrie |
13 190,76 HUF |
|
Malte |
27,61 EUR |
|
Pays-Bas |
66,47 EUR |
|
Autriche |
73,39 EUR |
|
Pologne |
148,89 PLN |
|
Portugal ‒ Lisbonne |
38,74 EUR |
|
Roumanie |
168,83 RON |
|
Slovénie |
67,46 EUR |
|
Slovaquie |
60,04 EUR |
|
Finlande |
52,06 EUR |
|
Suède |
638,85 SEK |
|
Royaume-Uni |
70,46 GBP |
(1) Ces taux unitaires ne comprennent pas le taux unitaire administratif qui est visé à l’article 18 du règlement d’exécution (UE) no 391/2013 et qui s’applique aux États parties à l’accord multilatéral relatif aux redevances de route conclu par Eurocontrol.
|
31.10.2013 |
FR |
Journal officiel de l'Union européenne |
L 289/71 |
DÉCISION D’EXÉCUTION DE LA COMMISSION
du 30 octobre 2013
confirmant les émissions spécifiques moyennes de CO2 et les objectifs d’émissions spécifiques des constructeurs de voitures particulières pour l’année civile 2012, en application du règlement (CE) no 443/2009 du Parlement européen et du Conseil
(Texte présentant de l'intérêt pour l'EEE)
(2013/632/UE)
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l’Union européenne,
vu le règlement (CE) no 443/2009 du Parlement européen et du Conseil du 23 avril 2009 établissant des normes de performance en matière d’émissions pour les voitures particulières neuves dans le cadre de l’approche intégrée de la Communauté visant à réduire les émissions de CO2 des véhicules légers (1), et notamment son article 8, paragraphe 5, second alinéa, et son article 10, paragraphe 1,
considérant ce qui suit:
|
(1) |
La Commission est tenue, en application de l’article 8, paragraphe 5, du règlement (CE) no 443/2009, de confirmer chaque année les émissions spécifiques moyennes de CO2 et les objectifs d’émissions spécifiques pour chaque constructeur de voitures particulières de l’Union ainsi que pour chaque groupement de constructeurs constitué conformément à l’article 7, paragraphe 1, du même règlement. Sur la base de cette confirmation, il appartient à la Commission de déterminer si les constructeurs et les groupements satisfont aux exigences de l’article 4 dudit règlement. |
|
(2) |
En vertu de l’article 4 du règlement (CE) no 443/2009, les objectifs sont contraignants pour les constructeurs et les groupements de constructeurs, avec effet à partir de 2012. Les émissions spécifiques moyennes de chaque constructeur pour 2012 sont calculées conformément au deuxième paragraphe dudit article et prennent en compte 65 % des voitures neuves du constructeur immatriculées au cours de l’année en question. |
|
(3) |
Les données précises à utiliser pour le calcul des émissions spécifiques moyennes et des objectifs d’émissions spécifiques sont indiquées à l’annexe II, partie A, point 1, et à l’annexe II, partie C, du règlement (CE) no 443/2009 et sont fondées sur les immatriculations de voitures particulières neuves dans les États membres au cours de l’année civile précédente. Ces données proviennent des certificats de conformité émis par les constructeurs ou de documents fournissant des informations équivalentes conformément à l’article 3, paragraphe 1, du règlement (UE) no 1014/2010 de la Commission (2). |
|
(4) |
Tous les États membres ont transmis les données de 2012 à la Commission avant la date limite du 28 février 2013, conformément à l’article 8, paragraphe 2, du règlement (CE) no 443/2009. Dans les cas où, à la suite de la vérification des données par la Commission, il est apparu clairement que certaines données étaient manquantes ou manifestement incorrectes, la Commission a pris contact avec les États membres concernés et, avec leur assentiment, a rectifié ou complété les données en conséquence. Lorsqu’il n’a pas été possible de parvenir à un accord avec un État membre, les données provisoires de cet État membre n’ont pas été rectifiées. |
|
(5) |
Le 30 avril 2013, la Commission a publié les données provisoires et notifié à 85 constructeurs les calculs provisoires de leurs émissions spécifiques moyennes de CO2 pour 2012 et de leurs objectifs d’émissions spécifiques, conformément à l’article 8, paragraphe 4, du règlement (CE) no 443/2009. Les constructeurs ont été invités à vérifier ces données et à informer la Commission de toute erreur dans les trois mois suivant la réception de la notification, conformément à l’article 8, paragraphe 5, premier alinéa, de ce même règlement et à l’article 9, paragraphe 3, du règlement (UE) no 1014/2010. Huit constructeurs ont accepté les données préliminaires sans correction, tandis que 40 constructeurs ont signalé des erreurs dans les délais prévus. |
|
(6) |
Pour les 37 autres constructeurs qui n’ont pas signalé d’erreurs dans les ensembles de données ni communiqué d’autres informations, il y a lieu de confirmer sans les modifier les données provisoires et les calculs provisoires des émissions spécifiques moyennes et des objectifs d’émissions spécifiques. |
|
(7) |
La Commission a vérifié les corrections notifiées par les constructeurs, ainsi que les justifications correspondantes, telles qu’exprimées au moyen des codes d’erreurs prévus à l’article 9, paragraphe 3, du règlement (UE) no 1014/2010, et les ensembles de données ont été rectifiés en tant que de besoin. |
|
(8) |
En ce qui concerne les séries de données qui ont été signalées par les constructeurs au moyen du code d’erreur B, conformément à l’article 9, paragraphe 3, du règlement (UE) no 1014/2010, il convient de tenir compte du fait que les constructeurs ne peuvent ni vérifier ni corriger ces séries de données de manière appropriée, faute de paramètres d’identification ou en raison de paramètres d’identification incorrects. Il y a lieu, en conséquence, d’appliquer une marge d’erreur aux valeurs correspondant aux émissions de CO2 et à la masse qui figurent dans ces séries de données. |
|
(9) |
Aux fins du calcul de cette marge d’erreur, il y a lieu de définir qu’elle correspond à la différence entre l’écart par rapport à l’objectif d’émissions spécifiques (exprimé en tant qu’émissions moyennes déduites des objectifs d’émissions spécifiques) calculé en tenant compte des immatriculations qui ne peuvent pas être vérifiées par les constructeurs et l’écart par rapport à l’objectif d’émissions spécifiques calculé en n’en tenant pas compte. Que cette différence soit positive ou négative, la marge d’erreur devrait toujours améliorer l’écart par rapport à l’objectif du constructeur. |
|
(10) |
Conformément à l’article 10, paragraphe 2, du règlement (CE) no 443/2009, il y a lieu de considérer qu’un constructeur a respecté son objectif d’émissions spécifiques visé à l’article 4 dudit règlement lorsque les émissions moyennes indiquées dans la présente décision sont inférieures à l’objectif d’émissions spécifiques, ce qui s’exprime par un écart négatif par rapport à l’objectif. Lorsque les émissions moyennes dépassent l’objectif d’émissions spécifiques, il y a lieu d’imposer le paiement d’une prime sur les émissions excédentaires conformément à l’article 9 du règlement (CE) no 443/2009, à moins que le constructeur concerné ne bénéficie d’une dérogation relative à cet objectif ou qu’il soit membre d’un groupement conformément à l’article 7 dudit règlement, et que ce groupement ait respecté son objectif d’émissions spécifiques. |
|
(11) |
Il y a lieu de confirmer en conséquence les émissions spécifiques moyennes de CO2 des voitures particulières neuves immatriculées en 2012, les objectifs d’émissions spécifiques et la différence entre ces deux valeurs, |
A ADOPTÉ LA PRÉSENTE DÉCISION:
Article premier
Les valeurs suivantes, précisées en annexe, sont confirmées pour chaque constructeur de voitures particulières et pour chaque groupement de constructeurs en ce qui concerne l’année civile 2012:
|
a) |
l’objectif d’émissions spécifiques; |
|
b) |
les émissions spécifiques moyennes de CO2, le cas échéant corrigées de la marge d’erreur appropriée; |
|
c) |
la différence entre les valeurs visées aux points a) et b); |
|
d) |
les émissions spécifiques moyennes de CO2 pour toutes les voitures particulières neuves dans l’Union; |
|
e) |
la masse moyenne de toutes les voitures particulières neuves dans l’Union. |
Article 2
La présente décision entre en vigueur le troisième jour suivant celui de sa publication au Journal officiel de l’Union européenne.
Fait à Bruxelles, le 30 octobre 2013.
Par la Commission
Le président
José Manuel BARROSO
(1) JO L 140 du 5.6.2009, p. 1.
(2) Règlement (UE) no 1014/2010 de la Commission du 10 novembre 2010 concernant la surveillance et la communication des données relatives à l’immatriculation des voitures particulières neuves en application du règlement (CE) no 443/2009 du Parlement européen et du Conseil, JO L 293 du 11.11.2010, p. 15.
ANNEXE
Tableau 1
Valeurs relatives aux performances des constructeurs confirmées conformément à l’article 10 du règlement (CE) no 443/2009
|
A |
B |
C |
D |
E |
F |
G |
H |
I |
|
Nom du constructeur |
Groupements et dérogations |
Nombre d’immatriculations |
Moyenne CO2 (65 %) corrigée |
Objectif d’émissions spécifiques |
Écart par rapport à l’objectif |
Écart par rapport à l’objectif corrigé |
Masse moyenne |
Moyenne CO2 (100 %) |
|
ALPINA BURKARD BOVENSIEPEN GmbH E CO., KG |
|
459 |
156,768 |
152,125 |
4,643 |
4,643 |
1 856,13 |
183,037 |
|
ARTEGA AUTOMOBIL GmbH E CO., KG |
|
4 |
223,000 |
126,024 |
96,976 |
96,976 |
1 285,00 |
223,000 |
|
ASTON MARTIN LAGONDA LTD |
D |
1 549 |
296,355 |
320,000 |
–23,645 |
–23,645 |
1 774,48 |
321,944 |
|
AUDI AG |
P12 |
657 068 |
122,411 |
139,473 |
–17,062 |
–17,110 |
1 579,29 |
137,786 |
|
AUDI HUNGARIA MOTOR KFT |
P12 |
11 241 |
137,324 |
133,613 |
3,711 |
3,573 |
1 451,07 |
149,057 |
|
AUTOMOBILES CITROEN |
|
654 993 |
108,718 |
129,703 |
–20,985 |
–20,985 |
1 365,51 |
122,566 |
|
AUTOMOBILES PEUGEOT |
|
773 864 |
107,648 |
130,413 |
–22,765 |
–22,765 |
1 381,03 |
121,489 |
|
AVTOVAZ JSC |
P8 |
2 298 |
207,903 |
125,748 |
82,155 |
82,155 |
1 278,96 |
213,899 |
|
BENTLEY MOTORS LTD |
P12 |
1 992 |
310,230 |
181,440 |
128,790 |
128,790 |
2 497,60 |
338,040 |
|
BAYERISCHE MOTOREN WERKE AG |
P1 |
762 027 |
123,643 |
138,696 |
–15,053 |
–15,111 |
1 562,28 |
137,515 |
|
BMW M GmbH |
P1 |
6 375 |
231,079 |
151,103 |
79,976 |
78,034 |
1 833,77 |
247,941 |
|
BUGATTI AUTOMOBILES S.A.S |
P12 |
2 |
539,000 |
156,689 |
382,311 |
382,311 |
1 956,00 |
539,000 |
|
CATERHAM CARS LIMITED |
D |
139 |
174,178 |
210,000 |
–35,822 |
–35,822 |
704,32 |
188,921 |
|
CECOMP S.P.A. |
|
1 001 |
0,000 |
123,282 |
– 123,282 |
– 123,282 |
1 225,00 |
0,000 |
|
CHEVROLET ITALIA SPA |
P5 |
4 948 |
110,000 |
114,681 |
–4,681 |
–4,681 |
1 036,80 |
110,284 |
|
CHRYSLER GROUP LLC |
P3 |
57 034 |
177,442 |
159,650 |
17,792 |
17,295 |
2 020,79 |
192,882 |
|
CNG– TECHNIK GmbH |
P4 |
75 |
113,938 |
118,091 |
–4,153 |
–4,153 |
1 111,40 |
113,960 |
|
AUTOMOBILE DACIA SA |
P8 |
232 256 |
125,132 |
126,664 |
–1,532 |
–1,534 |
1 299,01 |
136,899 |
|
DAIHATSU MOTOR CO LTD |
P11 |
3 397 |
131,952 |
120,887 |
11,065 |
11,065 |
1 172,58 |
148,590 |
|
DAIMLER AG |
P2 |
631 475 |
123,873 |
139,576 |
–15,703 |
–15,716 |
1 581,53 |
142,842 |
|
DONGFENG MOTOR CORPORATION |
|
2 |
184,000 |
118,758 |
65,242 |
65,242 |
1 126,00 |
187,000 |
|
DR MOTOR COMPANY SRL |
|
645 |
126,489 |
122,520 |
3,969 |
3,969 |
1 208,33 |
141,574 |
|
FERRARI S.P.A |
D |
2 330 |
298,539 |
303,000 |
–4,461 |
–4,461 |
1 733,67 |
316,739 |
|
FIAT GROUP AUTOMOBILES S.P.A |
P3 |
686 449 |
109,841 |
118,886 |
–9,045 |
–9,171 |
1 128,80 |
117,233 |
|
FISKER AUTOMOTIVE INC |
|
166 |
53,000 |
181,778 |
– 128,778 |
– 128,778 |
2 505,00 |
53,000 |
|
FORD– WERKE GmbH |
P4 |
917 725 |
116,480 |
127,832 |
–11,352 |
–11,359 |
1 324,57 |
128,685 |
|
FUJI HEAVY INDUSTRIES LTD |
ND |
29 381 |
150,266 |
164,616 |
–14,350 |
–14,350 |
1 561,77 |
160,599 |
|
GENERAL MOTORS |
P5 |
2 673 |
130,061 |
154,444 |
–24,383 |
–24,383 |
1 906,87 |
253,869 |
|
GM ITALIA SRL |
P5 |
2 |
119,000 |
123,968 |
–4,968 |
–4,968 |
1 240,00 |
119,000 |
|
GM KOREA COMPANY |
P5 |
161 153 |
124,248 |
131,444 |
–7,196 |
–7,196 |
1 403,59 |
141,050 |
|
GREAT WALL MOTOR COMPANY LIMITED |
D |
309 |
168,000 |
195,000 |
–27,000 |
–27,000 |
1 184,23 |
169,049 |
|
HONDA AUTOMOBILE CHINA CO., LTD |
P6 |
17 668 |
123,408 |
119,912 |
3,496 |
3,496 |
1 151,26 |
124,855 |
|
HONDA MOTOR CO., LTD |
P6 |
71 717 |
121,571 |
130,995 |
–9,424 |
–9,424 |
1 393,77 |
138,965 |
|
HONDA TURKIYE AS |
P6 |
2 207 |
154,787 |
128,725 |
26,062 |
26,062 |
1 344,10 |
157,874 |
|
HONDA OF THE UK MANUFACTURING LTD |
P6 |
40 779 |
139,093 |
136,324 |
2,769 |
2,769 |
1 510,38 |
156,169 |
|
HYUNDAI MOTOR COMPANY |
|
416 987 |
118,808 |
128,266 |
–9,458 |
–9,458 |
1 334,05 |
132,203 |
|
IVECO S.P.A |
P3 |
6 |
143,333 |
224,310 |
–80,977 |
–80,977 |
3 435,67 |
146,667 |
|
JAGUAR |
ND; P10 |
22 621 |
150,844 |
178,025 |
–27,181 |
–27,409 |
1 910,74 |
168,970 |
|
JIANGLING MOTOR HOLDING CO., LTD |
|
39 |
144,480 |
130,348 |
14,132 |
14,132 |
1 379,62 |
147,897 |
|
KIA MOTORS CORPORATION |
|
329 474 |
114,489 |
127,175 |
–12,686 |
–12,686 |
1 310,18 |
129,464 |
|
KTM– SPORTMOTORCYCLE AG |
D |
18 |
180,000 |
200,000 |
–20,000 |
–20,000 |
875,00 |
183,000 |
|
AUTOMOBILI LAMBORGHINI S.P.A |
P12 |
413 |
343,683 |
144,315 |
199,368 |
199,021 |
1 685,23 |
364,295 |
|
LAND ROVER |
ND; P10 |
98 731 |
167,445 |
178,025 |
–10,580 |
–10,583 |
2 123,81 |
190,922 |
|
LOTUS CARS LIMITED |
D |
335 |
163,447 |
280,000 |
– 116,553 |
– 116,553 |
1 181,82 |
185,857 |
|
MAGYAR SUZUKI CORPORATION LTD |
P9 |
84 045 |
118,669 |
120,317 |
–1,648 |
–1,654 |
1 160,12 |
128,118 |
|
MAHINDRA & MAHINDRA LTD |
D |
64 |
179,000 |
205,000 |
–26,000 |
–26,000 |
1 915,08 |
182,234 |
|
MARUTI SUZUKI INDIA LTD |
P9 |
21 574 |
101,217 |
109,891 |
–8,674 |
–8,674 |
931,97 |
102,884 |
|
MASERATI S.P.A |
P3 |
883 |
343,492 |
158,286 |
185,206 |
184,578 |
1 990,95 |
351,072 |
|
MAZDA MOTOR CORPORATION |
|
113 565 |
128,793 |
129,494 |
–0,701 |
–0,701 |
1 360,93 |
141,779 |
|
MCLAREN AUTOMOTIVE LIMITED |
D |
335 |
279,000 |
285,000 |
–6,000 |
–6,000 |
1 511,50 |
279,475 |
|
MERCEDES– AMG GmbH |
P2 |
2 939 |
177,053 |
151,465 |
25,588 |
25,305 |
1 841,70 |
222,641 |
|
MG MOTOR UK LIMITED |
D |
755 |
176,147 |
184,000 |
–7,853 |
–7,853 |
1 585,69 |
178,914 |
|
MIA ELECTRIC S.A.S |
|
494 |
0,000 |
107,916 |
– 107,916 |
– 107,916 |
888,76 |
0,000 |
|
MICRO– VETT S.P.A |
|
5 |
0,000 |
130,091 |
– 130,091 |
– 130,091 |
1 374,00 |
0,000 |
|
MITSUBISHI MOTORS CORPORATION MMC |
P7 |
48 688 |
126,281 |
140,924 |
–14,643 |
–15,397 |
1 611,04 |
151,332 |
|
MITSUBISHI MOTORS EUROPE BV MME |
P7 |
18 604 |
117,601 |
118,511 |
–0,910 |
–0,981 |
1 120,59 |
126,014 |
|
MITSUBISHI MOTORS THAILAND CO LTD MMTH |
P7 |
15 |
97,778 |
123,575 |
–25,797 |
–26,331 |
1 231,40 |
125,667 |
|
MORGAN MOTOR CO LTD |
D |
398 |
156,050 |
180,000 |
–23,950 |
–23,950 |
1 120,11 |
184,078 |
|
NISSAN INTERNATIONAL SA |
|
423 818 |
122,253 |
131,177 |
–8,924 |
–8,924 |
1 397,75 |
137,341 |
|
OMCI SRL |
|
21 |
148,000 |
116,656 |
31,344 |
31,344 |
1 080,00 |
156,667 |
|
ADAM OPEL AG |
P5 |
814 229 |
119,708 |
133,821 |
–14,113 |
–14,114 |
1 455,62 |
133,002 |
|
PERODUA MANUFACTURING SDN BHD |
|
372 |
136,934 |
113,647 |
23,287 |
23,287 |
1 014,16 |
140,785 |
|
DR ING HCF PORSCHE AG |
P12 |
42 299 |
187,954 |
152,535 |
35,419 |
35,419 |
1 865,10 |
205,379 |
|
PERUSAHAAN OTOMOBIL NASIONAL SDN BHD |
D |
206 |
146,511 |
185,000 |
–38,489 |
–38,489 |
1 311,58 |
154,942 |
|
QUATTRO GmbH |
P12 |
3 904 |
219,136 |
147,404 |
71,732 |
70,977 |
1 752,84 |
243,966 |
|
RADICAL MOTORSPORT LTD |
|
6 |
229,000 |
106,145 |
122,855 |
122,855 |
850,00 |
229,000 |
|
RENAULT S.A.S |
P8 |
800 674 |
105,396 |
126,744 |
–21,348 |
–21,353 |
1 300,76 |
120,796 |
|
ROLLS– ROYCE MOTOR CARS LTD |
P1 |
417 |
317,376 |
181,976 |
135,400 |
135,377 |
2 509,34 |
329,930 |
|
SAAB AUTOMOBILE AB |
|
1 297 |
151,696 |
144,382 |
7,314 |
7,314 |
1 686,71 |
170,266 |
|
SEAT SA |
P12 |
252 173 |
114,757 |
127,124 |
–12,367 |
–12,521 |
1 309,07 |
127,191 |
|
SECMA S.A.S |
|
40 |
131,000 |
97,370 |
33,630 |
33,630 |
658,00 |
131,000 |
|
SHIJIAZHUANG SHUANGHUAN AUTOMOBILE COMPANY |
|
10 |
269,667 |
154,130 |
115,537 |
115,537 |
1 900,00 |
269,800 |
|
SKODA AUTO AS |
P12 |
460 603 |
120,028 |
126,655 |
–6,627 |
–7,026 |
1 298,81 |
132,247 |
|
SPYKER AUTOMOBIELEN BV |
D |
2 |
340,000 |
340,000 |
0,000 |
0,000 |
1 730,00 |
340,000 |
|
SSANGYONG MOTOR COMPANY |
D |
4 967 |
167,641 |
180,000 |
–12,359 |
–12,359 |
1 812,62 |
186,532 |
|
SUZUKI MOTOR CORPORATION |
P9 |
46 255 |
131,108 |
124,115 |
6,993 |
6,891 |
1 243,22 |
148,213 |
|
TATA MOTORS LIMITED |
ND; P10 |
592 |
134,367 |
178,025 |
–43,658 |
–43,658 |
1 336,03 |
141,978 |
|
TESLA MOTORS LTD |
|
159 |
0,000 |
128,309 |
– 128,309 |
– 128,309 |
1 335,00 |
0,000 |
|
THINK |
|
52 |
0,000 |
118,360 |
– 118,360 |
– 118,360 |
1 117,29 |
0,000 |
|
TOYOTA MOTOR EUROPE NV SA |
P11 |
515 028 |
103,613 |
127,912 |
–24,299 |
–24,371 |
1 326,30 |
121,862 |
|
VÉHICULES ÉLECTRIQUES PININFARINA– BOLLORE S.A.S. |
|
542 |
0,000 |
123,282 |
– 123,282 |
– 123,282 |
1 225,00 |
0,000 |
|
VOLKSWAGEN AG |
P12 |
1 535 755 |
119,343 |
131,203 |
–11,860 |
–11,952 |
1 398,32 |
132,965 |
|
VOLVO CAR CORPORATION |
|
204 539 |
121,944 |
144,736 |
–22,792 |
–22,792 |
1 694,44 |
142,116 |
|
WIESMANN GmbH |
D |
53 |
284,294 |
274,000 |
10,294 |
10,294 |
1 490,38 |
289,566 |
|
ZHEJIANG ZOTYE AUTOMOBILE MANUFACTURING CO., LTD |
|
2 |
0,000 |
128,172 |
– 128,172 |
– 128,172 |
1 332,00 |
75,000 |
Tableau 2
Valeurs relatives aux performances des groupements confirmées conformément à l’article 10 du règlement (CE) no 443/2009
|
A |
B |
C |
D |
E |
F |
G |
H |
I |
|
Nom du groupement |
Groupement |
Nombre d’immatriculations |
Moyenne CO2 (65 %) corrigée |
Objectif d’émissions spécifiques |
Écart par rapport à l’objectif |
Écart par rapport à l’objectif corrigé |
Masse moyenne |
Moyenne CO2 (100 %) |
|
BMW GROUP |
P1 |
768 819 |
123,824 |
138,822 |
–14,998 |
–15,052 |
1 565,05 |
138,535 |
|
DAIMLER AG |
P2 |
634 414 |
123,949 |
139,630 |
–15,681 |
–15,694 |
1 582,73 |
143,212 |
|
FIAT GROUP AUTOMOBILES SPA |
P3 |
744 372 |
110,597 |
122,056 |
–11,459 |
–11,468 |
1 198,18 |
123,307 |
|
FORD– WERKE GmbH |
P4 |
917 800 |
116,479 |
127,832 |
–11,353 |
–11,361 |
1 324,55 |
128,684 |
|
GENERAL MOTORS |
P5 |
983 005 |
119,853 |
133,391 |
–13,538 |
–13,539 |
1 446,21 |
134,536 |
|
HONDA MOTOR EUROPE LTD |
P6 |
132 371 |
125,014 |
131,120 |
–6,106 |
–6,106 |
1 396,5 |
142,697 |
|
MITSUBISHI MOTORS |
P7 |
67 307 |
122,126 |
134,725 |
–12,599 |
–13,121 |
1 475,39 |
144,328 |
|
POOL RENAULT |
P8 |
1 035 228 |
109,427 |
126,724 |
–17,297 |
–17,301 |
1 300,32 |
124,615 |
|
SUZUKI |
P9 |
151 874 |
115,511 |
119,993 |
–4,482 |
–4,498 |
1 153,02 |
130,654 |
|
TATA MOTORS LTD, JAGUAR CARS LTD, LAND ROVER |
P10 |
121 944 |
162,825 |
178,025 |
–15,200 |
–15,307 |
2 080,46 |
186,612 |
|
TOYOTA -DAIHATSU GROUP |
P11 |
518 425 |
103,694 |
127,865 |
–24,171 |
–24,239 |
1 325,29 |
122,037 |
|
VW GROUP PC |
P12 |
2 965 450 |
120,108 |
132,353 |
–12,245 |
–12,508 |
1 423,48 |
134,841 |
Notes explicatives relatives aux tableaux 1 et 2
Colonne A:
Tableau 1: on entend par «nom du constructeur» le nom du constructeur tel qu’il a été notifié à la Commission par l’intéressé ou, si cette notification n’a pas eu lieu, le nom enregistré par l’autorité de l’État membre chargée de l’immatriculation.
Tableau 2: on entend par «nom du groupement de constructeurs» le nom déclaré par l’administrateur du groupement.
Colonne B:
«D» indique qu’une dérogation relative à un petit constructeur a été accordée conformément à l’article 11, paragraphe 3, du règlement (CE) no 443/2009 avec effet à compter de 2012.
«ND» indique qu’une dérogation relative à un constructeur spécialisé a été accordée conformément à l’article 11, paragraphe 4, du règlement (CE) no 443/2009 avec effet à compter de 2012.
«P» indique que le constructeur est membre d’un groupement (mentionné dans le tableau 2) constitué conformément à l’article 7 du règlement (CE) no 443/2009 et que l’accord de regroupement est valable pour l’année civile 2012.
Colonne C:
On entend par «nombre d’immatriculations» le nombre total de voitures neuves immatriculées par les États membres au cours d’une année civile, compte non tenu des immatriculations auxquelles correspondent, d’une part, des séries de données dans lesquelles manquent les valeurs de masse et/ou les valeurs relatives au CO2 et, d’autre part, des séries de données non reconnues par le constructeur [signalées dans la notification par le code d’erreur «C», conformément à l’article 9, paragraphe 3, du règlement (UE) no 1014/2010]. Le nombre d’immatriculations communiqué par les États membres ne peut par ailleurs subir aucune modification.
Colonne D:
On entend par «moyenne CO2 (65 %) corrigée», les émissions spécifiques moyennes de CO2 qui ont été calculées sur la base des 65 % de véhicules de la flotte du constructeur qui présentent les plus faibles émissions, conformément à l’article 4, deuxième alinéa, premier tiret, du règlement (CE) no 443/2009, et au point 4 de la communication COM(2010) 657 final de la Commission. Le cas échéant, les émissions spécifiques moyennes ont été corrigées de manière à prendre en compte les corrections notifiées à la Commission par le constructeur concerné. Les séries de données utilisées pour le calcul comprennent celles qui contiennent des valeurs valables pour la masse et les émissions de CO2.
Colonne E:
On entend par «objectif d’émissions spécifiques» l’objectif d’émissions calculé sur la base de la masse moyenne de tous les véhicules attribués à un constructeur, à l’aide de la formule décrite à l’annexe I du règlement (CE) no 443/2009.
Colonne F:
On entend par «écart par rapport à l’objectif» l’écart entre les émissions spécifiques moyennes indiquées dans la colonne D et l’objectif d’émissions spécifiques indiqué dans la colonne E. Lorsque la valeur portée dans la colonne F est positive, les émissions spécifiques moyennes dépassent l’objectif d’émissions spécifiques.
Colonne G:
On entend par «écart par rapport à l’objectif corrigé» le fait que, lorsque les valeurs de cette colonne sont différentes de celles de la colonne F, les valeurs indiquées dans cette dernière ont été corrigées de manière à prendre en compte une marge d’erreur. La marge d’erreur ne s’applique que si le constructeur a notifié des séries de données à la Commission au moyen du code d’erreur B, comme le prévoit l’article 9, paragraphe 3, du règlement (UE) no 1014/2010. La marge d’erreur est calculée selon la formule suivante:
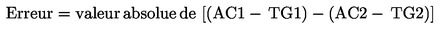
AC1= émissions spécifiques moyennes de CO2, y compris les véhicules non identifiables (telles qu’indiquées dans la colonne D).
TG1= objectif d’émissions spécifiques, y compris les véhicules non identifiables (tel que figurant dans la colonne E).
AC2= émissions spécifiques moyennes de CO2, à l’exclusion des véhicules non identifiables.
TG2= objectif d’émissions spécifiques, à l’exclusion des véhicules non identifiables.
Colonne I:
On entend par «moyenne CO2 (100 %)», les émissions spécifiques moyennes de CO2 qui ont été calculées sur la base de 100 % des véhicules attribués au constructeur. Le cas échéant, les émissions spécifiques moyennes ont été corrigées de manière à prendre en compte les corrections notifiées à la Commission par le constructeur concerné. Les séries de données utilisées pour le calcul comprennent celles qui contiennent des valeurs valables pour la masse et les émissions de CO2 mais qui ne prennent pas en compte les bonifications visées à l’article 5 du règlement (CE) no 443/2009.