ANNEXE III
PRÉPARATION DES ÉCHANTILLONS ET PRESCRIPTIONS APPLICABLES AUX MÉTHODES D'ANALYSE À UTILISER POUR LE CONTRÔLE DES TENEURS EN DIOXINES (PCDD/PCDF) ET EN PCB DE TYPE DIOXINE DE CERTAINES DENRÉES ALIMENTAIRES
1. CHAMP D'APPLICATION
Les prescriptions de la présente annexe s'appliquent aux analyses de denrées alimentaires effectuées aux fins du contrôle officiel des teneurs en dibenzo-p-dioxines polychlorées et dibenzofuranes polychlorés (PCDD/F) substitués en 2,3,7,8 et en polychlorobiphényles de type dioxine (PCB de type dioxine), ainsi qu'à d'autres fins réglementaires.
La présence de PCDD/F et de PCB de type dioxine dans les denrées alimentaires peut être contrôlée au moyen des deux types de méthodes d'analyse décrites ci-après.
|
a) |
Méthodes de dépistage Les méthodes de dépistage servent à sélectionner les échantillons dont les teneurs en PCDD/F et en PCB de type dioxine dépassent les teneurs maximales ou les seuils d'intervention. Elles devraient offrir une grande capacité de traitement d'échantillons à la fois efficace et économique et augmenter la probabilité de découvrir de nouveaux cas d'exposition élevée des consommateurs et de risques pour leur santé. Leur application doit permettre d'éviter les faux conformes. Elles peuvent comprendre des méthodes de bioanalyse et des méthodes de CG-SM. Elles permettent de comparer le résultat d'une analyse avec une valeur seuil et de confirmer ou d'infirmer (réponse positive ou négative) l'éventuel dépassement de la teneur maximale ou du seuil d'intervention. La concentration de PCDD/F et la somme des PCDD/F et des PCB de type dioxine dans les échantillons suspectés de non-conformité à la teneur maximale doivent être déterminées/confirmées au moyen d'une méthode de confirmation. En outre, les méthodes de dépistage peuvent donner une indication des teneurs en PCDD/F et en PCB de type dioxine des échantillons. En cas d'application de méthodes bioanalytiques de dépistage, le résultat est exprimé en équivalents de bioanalyse (BEQ), alors qu'en cas d'application de méthodes GC-SM physico-chimiques, il est exprimé en équivalents toxiques (TEQ). Les résultats numériques obtenus au moyen de méthodes de dépistage permettent de démontrer la conformité, la suspicion de non-conformité ou le dépassement des seuils d'intervention et donnent une indication sur la plage des teneurs en cas de suivi au moyen de méthodes de confirmation. Ils ne permettent pas, par exemple, d'évaluer les niveaux de bruit de fond, d'estimer l'ingestion, de suivre l'évolution chronologique ou de réévaluer les seuils d'intervention et les teneurs maximales. |
|
b) |
Méthodes de confirmation Les méthodes de confirmation permettent l'identification et la quantification univoques des PCDD/F et des PCB de type dioxine présents dans un échantillon et de fournir des informations complètes sur la base des congénères. Par conséquent, ces méthodes permettent de contrôler les teneurs maximales et les seuils d'intervention et de confirmer les résultats obtenus au moyen des méthodes de dépistage. En outre, les résultats peuvent servir à d'autres fins, telles que la détermination des faibles niveaux de bruit de fond dans le contrôle des denrées alimentaires, le suivi de l'évolution chronologique, l'évaluation de l'exposition de la population et la création d'une base de données en vue de la réévaluation éventuelle des seuils d'intervention et des teneurs maximales. Ils sont aussi importants pour établir les profils de congénères aux fins de la détermination de la source d'une contamination éventuelle. Ces méthodes reposent sur la chromatographie en phase gazeuse couplée à la spectrométrie de masse haute résolution (CG-SMHR). La chromatographie en phase gazeuse couplée à la spectrométrie de masse en tandem (CG-SM/SM) peut également être utilisée pour confirmer la conformité ou la non-conformité à la teneur maximale. |
2. CONTEXTE
Pour le calcul des concentrations d'équivalents toxiques (TEQ), les concentrations des différentes substances dans un échantillon donné sont multipliées par leurs facteurs d'équivalence toxique (TEF) respectifs, tels qu'ils sont fixés par l'Organisation mondiale de la santé et mentionnés dans l'appendice de la présente annexe, puis elles sont additionnées de façon à donner la concentration totale de composés de type dioxine, exprimée en TEQ.
Les méthodes de dépistage et de confirmation ne peuvent être appliquées aux fins du contrôle d'une matrice donnée que si les méthodes sont suffisamment sensibles pour déceler les teneurs de manière fiable au niveau de la teneur maximale ou du seuil d'intervention.
3. PRESCRIPTIONS D'ASSURANCE QUALITÉ
|
— |
Des mesures doivent être prises pour que soit évitée toute contamination croisée à chaque étape de la procédure d'échantillonnage et d'analyse. |
|
— |
Les échantillons doivent être conservés et transportés dans des récipients en verre, en aluminium, en polypropylène ou en polyéthylène adaptés à la conservation, préservant les teneurs en PCDD/F et en PCB de type dioxine dans les échantillons de la moindre influence. Toute trace de poussière de papier doit être enlevée du récipient contenant l'échantillon. |
|
— |
La conservation et le transport de l'échantillon doivent être effectués d'une façon telle que l'intégrité de l'échantillon de denrée alimentaire est préservée. |
|
— |
Si nécessaire, chaque échantillon pour laboratoire doit être broyé finement et mélangé soigneusement, selon une méthode garantissant une homogénéisation complète (par exemple de façon à pouvoir passer au travers d'un tamis à mailles de 1 mm); les échantillons doivent être séchés avant le broyage si leur teneur en humidité est trop élevée. |
|
— |
Il importe d'une manière générale de contrôler les réactifs, la verrerie et l'équipement en vue de déceler toute influence des résultats exprimés en TEQ ou en BEQ. |
|
— |
Un essai à blanc est réalisé, en suivant tout le procédé d'analyse, mais sans l'échantillon. |
|
— |
Pour les méthodes de bioanalyse, il est très important que l'ensemble de la verrerie et des solvants utilisés dans l'analyse fassent l'objet d'un dépistage de composés interférant avec la détection des composés cibles dans la plage de travail. La verrerie est rincée à l'aide de solvants ou/et chauffée à des températures permettant d'éliminer de sa surface les traces de PCDD/F, de composés de type dioxine et de composés interférents. |
|
— |
La quantité de l'extrait doit être suffisamment élevée, de façon à répondre aux prescriptions en ce qui concerne une plage de travail suffisamment basse comprenant les concentrations des teneurs maximales ou des seuils d'intervention. |
|
— |
Les procédures spécifiques de préparation des échantillons utilisées pour les produits considérés doivent être conformes aux lignes directrices internationalement acceptées. |
|
— |
Dans le cas des poissons, la peau doit être enlevée, car la teneur maximale s'applique à la chair musculaire dépouillée. Néanmoins, il est nécessaire que tous les restes de chair musculaire et de tissu adipeux se trouvant sur la face interne de la peau soient soigneusement et entièrement retirés de celle-ci et soient ajoutés à l'échantillon à analyser. |
4. PRESCRIPTIONS APPLICABLES AUX LABORATOIRES
|
— |
Conformément aux dispositions du règlement (CE) no 882/2004 du Parlement européen et du Conseil (1), les laboratoires doivent être accrédités par un organisme habilité qui se conforme au guide ISO 58, de manière à garantir qu'ils appliquent les procédures d'assurance qualité à leurs analyses. Les laboratoires doivent être accrédités selon la norme EN ISO/CEI 17025. |
|
— |
L'aptitude des laboratoires doit être prouvée par la participation continue et réussie à des études interlaboratoires sur le dosage des PCDD/F et des PCB de type dioxine dans les matrices de denrées alimentaires et les plages de concentration correspondantes. |
|
— |
Les laboratoires appliquant les méthodes de dépistage pour les contrôles de routine des échantillons coopèrent étroitement avec les laboratoires appliquant la méthode de confirmation, tant pour le contrôle qualité que pour la confirmation du résultat de l'analyse des échantillons suspects. |
5. PRESCRIPTIONS FONDAMENTALES APPLICABLES AUX PROCÉDÉS D'ANALYSE RELATIFS AUX DIOXINES (PCDD/F) ET AUX PCB DE TYPE DIOXINE
5.1. Sensibilité élevée et limite de quantification basse
|
— |
En ce qui concerne les PCDD/F, étant donné la toxicité extrêmement élevée de certains de ces composés, les seuils de détection doivent être de l'ordre de quelques femtogrammes (10– 15 g). Pour la plupart des congénères PCB, une limite de quantification de l'ordre du nanogramme (10– 9 g) est déjà suffisante. Cependant, pour la mesure des congénères PCB de type dioxine plus toxiques (en particulier les congénères non ortho substitués), la limite inférieure de la plage de travail doit être sous le picogramme (10– 12 g). |
5.2. Grande sélectivité (spécificité)
|
— |
Il est nécessaire de distinguer les PCDD/F et les PCB de type dioxine d'une multitude d'autres composés extraits simultanément de l'échantillon qui sont susceptibles d'interférer et peuvent être présents à des concentrations supérieures, jusqu'à plusieurs ordres de grandeur, à celles des analytes à doser. Pour les méthodes de chromatographie en phase gazeuse/spectrométrie de masse (CG-SM), il est nécessaire d'établir une distinction entre les congénères, notamment entre les congénères toxiques (par exemple, les dix-sept PCDD/F substitués en 2,3,7,8 et les douze PCB de type dioxine) et les autres congénères. |
|
— |
Les méthodes de bioanalyse doivent permettre la détection des composés cibles en tant que somme des PCDD/F et/ou des PCB de type dioxine. La purification des échantillons est destinée à éliminer les composés à l'origine de faux non conformes ou les composés susceptibles d'atténuer la réponse et de donner des faux conformes. |
5.3. Grande exactitude (justesse et fidélité, taux de récupération apparent du bioessai)
|
— |
Pour les méthodes de CG-SM, le dosage fournit une estimation juste de la concentration réelle dans un échantillon. Une grande exactitude (exactitude de la mesure: étroitesse de l'accord entre le résultat de la mesure et la valeur réelle ou attribuée de la grandeur à mesurer) est nécessaire pour empêcher que le résultat d'une analyse d'échantillon ne soit écarté en raison du manque de fiabilité de la valeur TEQ déterminée. L'exactitude est une expression de la justesse (la différence entre la valeur moyenne mesurée pour un analyte dans un matériau certifié et sa valeur certifiée, exprimée en pourcentage de cette valeur) et de la fidélité (RSDR est l'écart type relatif calculé à partir des résultats obtenus dans des conditions de reproductibilité). |
|
— |
Pour les méthodes de bioanalyse, le taux de récupération apparent du bioessai doit être déterminé. |
5.4. Validation dans la plage de la teneur maximale et mesures générales de contrôle de la qualité
|
— |
Les laboratoires doivent démontrer la validité de la méthode dans une certaine plage proche de la teneur maximale, par exemple à des niveaux égaux à 0,5 fois, 1 fois et 2 fois la teneur maximale, avec un coefficient de variation acceptable pour les analyses répétées, durant la procédure de validation et/ou l'analyse de routine. |
|
— |
Des essais à blanc et des expériences avec enrichissement ou des analyses sur des échantillons témoins (si possible des matériaux de référence certifiés) sont effectués régulièrement dans le cadre des mesures internes de contrôle de la qualité. Il est nécessaire de réaliser et de vérifier des cartes de contrôle de la qualité (CQ) pour les essais à blanc, les expériences avec enrichissement ou l'analyse des échantillons témoins afin de garantir que les performances analytiques sont conformes aux prescriptions. |
5.5. Limite de quantification.
|
— |
Pour une méthode bioanalytique de dépistage, l'établissement de la limite de quantification n'est pas indispensable, mais il doit être démontré que la méthode permet de distinguer la valeur de blanc de la valeur seuil. En cas de transmission d'une valeur BEQ, il est nécessaire d'établir un seuil d'inscription permettant de savoir que faire des échantillons produisant une réponse au-dessous de ce seuil. Le seuil d'inscription doit présenter une différence avérée d'un facteur de trois au moins par rapport aux échantillons du blanc de procédure produisant une réponse au-dessous de la plage de travail. Il est donc calculé à partir d'échantillons contenant les composés cibles proches de la teneur minimale requise et non à partir d'un rapport S/B ou d'un blanc d'essai. |
|
— |
La limite de quantification pour une méthode de confirmation est de l'ordre d'un cinquième de la teneur maximale. |
5.6. Critères d'analyse
|
— |
La fiabilité des résultats des méthodes de confirmation ou de dépistage impose le respect des critères ci-après dans la plage de la teneur maximale ou du seuil d'intervention pour la valeur TEQ ou la valeur BEQ, qu'elle soit exprimée en TEQ totaux (somme des PCDD/F et des PCB de type dioxine) ou séparément pour les PCDD/F et les PCB de type dioxine.
|
5.7. Prescriptions spécifiques applicables aux méthodes de dépistage
|
— |
Le dépistage peut être effectué au moyen de méthodes de CG-SM et de méthodes de bioanalyse. Pour les méthodes de CG-SM, les prescriptions établies au point 6 de la présente annexe doivent être appliquées. Pour les méthodes de bioanalyse cellulaire, des prescriptions spécifiques sont établies au point 7 de la présente annexe. |
|
— |
Les laboratoires appliquant les méthodes de dépistage pour les contrôles de routine d'échantillons coopèrent étroitement avec les laboratoires appliquant la méthode de confirmation. |
|
— |
Les performances de la méthode de dépistage doivent être vérifiées durant l'analyse de routine par un contrôle qualité des analyses et par la validation continue de la méthode. Il doit exister un programme continu de contrôle des résultats conformes. |
|
— |
Contrôle de l'atténuation éventuelle de la réponse cellulaire et cytotoxicité Vingt pour cent des extraits d'échantillons sont mesurés par dépistage de routine sans et avec ajout de la 2,3,7,8-TCDD à la teneur maximale ou au seuil d'intervention, pour vérifier si la réponse est éventuellement atténuée par des substances interférentes présentes dans l'extrait d'échantillon. La concentration mesurée de l'échantillon enrichi est comparée à la somme de la concentration de l'extrait non enrichi et de la concentration de l'enrichissement. Si cette concentration mesurée est inférieure de plus de 25 % à la concentration (somme) calculée, cela indique la possibilité d'atténuation du signal et l'échantillon en question doit faire l'objet d'une analyse de confirmation. Les résultats sont contrôlés à l'aide de cartes de contrôle de la qualité. |
|
— |
Contrôle de la qualité sur des échantillons conformes Environ 2 à 10 % des échantillons conformes, en fonction de la matrice et de l'expérience du laboratoire, doivent être confirmés. |
|
— |
Détermination des taux de faux conformes à partir des données du CQ Le taux de faux conformes résultant du dépistage des échantillons au-dessous et au-dessus de la teneur maximale ou du seuil d'intervention doit être déterminé. Les taux réels de faux conformes doivent être inférieurs à 5 %. Dès lors que le contrôle qualité des échantillons conformes fait apparaître au moins vingt résultats confirmés par matrice/groupe de matrices, des conclusions sur le taux de faux conformes doivent être tirées à partir de cette base de données. Les résultats des échantillons analysés au moyen d'essais circulaires ou durant des cas de contamination, jusqu'à concurrence d'une concentration de deux fois la teneur maximale, par exemple, peuvent figurer parmi les vingt résultats à atteindre pour déterminer le taux de faux conformes. Les échantillons couvrent les profils de congénères les plus fréquents, représentant différentes sources. Bien que les bioanalyses de dépistage servent avant tout à révéler les échantillons dépassant le seuil d'intervention, le critère appliqué pour la détermination des taux de faux conformes est la teneur maximale, compte tenu de l'incertitude de mesure de la méthode de confirmation. |
|
— |
Les résultats du dépistage potentiellement non conformes sont toujours vérifiés; à cette fin, l'échantillon initial est soumis à une nouvelle analyse complète, réalisée au moyen d'une méthode de confirmation. Ces échantillons peuvent également servir à l'évaluation du taux de «faux non conformes». Pour les méthodes de dépistage, le taux de «faux non conformes» est la fraction des résultats dont la conformité est confirmée par une analyse de confirmation, alors que lors du dépistage précédent, l'échantillon avait été déclaré suspecté d'être non conforme. Toutefois, l'évaluation du caractère avantageux de la méthode de dépistage se fonde sur la comparaison du nombre d'échantillons faussement non conformes et du nombre total d'échantillons contrôlés. Ce taux doit être suffisamment bas pour rendre l'utilisation de la méthode de dépistage avantageuse. |
|
— |
Les méthodes de bioanalyse doivent fournir une indication juste de la valeur TEQ, calculée et exprimée en BEQ, au moins dans des conditions de validation. |
|
— |
De plus, pour les méthodes de bioanalyse appliquées dans des conditions de répétabilité, la RSDr intralaboratoire sera généralement inférieure à la RSDR (reproductibilité). |
6. PRESCRIPTIONS SPÉCIFIQUES APPLICABLES AUX MÉTHODES DE CG-SM À RESPECTER À DES FINS DE DÉPISTAGE OU DE CONFIRMATION
6.1. Écarts acceptables entre l'estimation supérieure et l'estimation inférieure des OMS-TEQ
|
— |
L'écart entre l'estimation supérieure et l'estimation inférieure ne peut dépasser 20 % pour la confirmation du dépassement des teneurs maximales ou, en cas de besoin, des seuils d'intervention. |
6.2. Mesure des taux de récupération
|
— |
Des étalons internes de PCDD/F substitués en 2,3,7,8 marqués au 13C et des étalons internes de PCB de type dioxine marqués au 13C doivent être ajoutés au tout début de la méthode d'analyse, par exemple avant la phase d'extraction, afin de valider le procédé d'analyse. Il est nécessaire d'ajouter au moins un congénère pour chacun des groupes d'isomères tétrachlorés à octachlorés des PCDD/F et au moins un congénère pour chaque groupe d'isomères des PCB de type dioxine (une autre méthode consiste à ajouter au moins un congénère pour chaque fenêtre d'acquisition spectrométrique utilisée pour le contrôle des PCDD/F et des PCB de type dioxine). Pour les méthodes de confirmation, il y a lieu d'utiliser l'ensemble des dix-sept étalons internes de PCDD/F substitués en 2,3,7,8 marqués au 13C ainsi que la totalité des douze étalons internes de PCB de type dioxine marqués au 13C. |
|
— |
Des facteurs de réponse relatifs doivent également être déterminés dans le cas des congénères pour lesquels aucun analogue marqué au 13C n'est ajouté, en utilisant des solutions d'étalonnage appropriées. |
|
— |
Pour les denrées alimentaires d'origine végétale et les denrées alimentaires d'origine animale contenant moins de 10 % de graisses, il est obligatoire d'ajouter les étalons internes avant la phase d'extraction. Pour les denrées alimentaires d'origine animale contenant plus de 10 % de graisses, les étalons internes peuvent être ajoutés soit avant soit après l'extraction des graisses. Une validation adéquate de l'efficacité de l'extraction est effectuée, en fonction de la phase au cours de laquelle les étalons internes sont introduits et de la façon dont les résultats sont consignés (sur la base du produit ou des graisses). |
|
— |
Avant l'analyse CG-SM, un ou deux étalons de récupération (substitution) doivent être ajoutés. |
|
— |
Le taux de récupération doit être mesuré. Dans le cas des méthodes de confirmation, les taux de récupération des étalons internes se situent dans une plage comprise entre 60 et 120 %. Pour des congénères individuels, en particulier pour certains dibenzo-p-dioxines et dibenzofuranes heptachlorés et octachlorés, des taux de récupération inférieurs ou supérieurs sont acceptables, à condition que leur contribution à la valeur TEQ ne dépasse pas 10 % de la valeur TEQ totale (sur la base de la somme des PCDD/F et des PCB de type dioxine). Dans le cas des méthodes de dépistage par CG-SM, les taux de récupération doivent se situer dans une plage comprise entre 30 et 140 %. |
6.3. Élimination des substances interférentes
|
— |
Les PCDD/F sont séparés des composés chlorés interférents, tels que les PCB autres que ceux de type dioxine et les diphényléthers chlorés, au moyen de techniques chromatographiques appropriées (de préférence au moyen d'une colonne de florisil, d'alumine et/ou de charbon). |
|
— |
La séparation des isomères par chromatographie en phase gazeuse est suffisante (< 25 % de pic à pic entre 1,2,3,4,7,8-HxCDF et 1,2,3,6,7,8-HxCDF). |
6.4. Étalonnage avec courbe étalon
|
— |
La plage de la courbe d'étalonnage couvre la plage correspondante des teneurs maximales ou des seuils d'intervention. |
6.5. Critères spécifiques applicables aux méthodes de confirmation
|
— |
CG-SMHR:
|
|
— |
CG-SM/SM:
|
7. PRESCRIPTIONS SPÉCIFIQUES APPLICABLES AUX MÉTHODES DE BIOANALYSE
Les méthodes de bioanalyse sont des méthodes fondées sur le recours aux principes biologiques tels que les bioessais cellulaires, les tests d'interaction récepteurs ou les immuno-essais. Le présent point 7 énonce les prescriptions applicables aux méthodes de bioanalyse en général.
Dans une méthode de dépistage, l'échantillon est en principe déclaré conforme ou est déclaré suspecté d'être non conforme. À cette fin, la valeur BEQ calculée est comparée à la valeur seuil (voir point 7.3). Les échantillons au-dessous de la valeur seuil sont déclarés conformes, et ceux à la valeur seuil ou au-dessus de celle-ci sont déclarés suspectés d'être non conformes et nécessitent une analyse au moyen d'une méthode de confirmation. Dans la pratique, une valeur BEQ équivalant aux deux tiers de la teneur maximale peut servir de valeur seuil, à condition qu'un taux de faux conformes inférieur à 5 % et un taux acceptable de faux non conformes soient garantis. Avec des teneurs maximales distinctes pour les PCDD/F et pour la somme des PCDD/F et des PCB de type dioxine, le contrôle de la conformité des échantillons sans fractionnement requiert des valeurs seuil de bioessai appropriées pour les PCDD/F. Pour la vérification des échantillons dépassant les seuils d'intervention, la valeur seuil pourrait être un pourcentage approprié des seuils d'intervention respectifs.
En outre, dans le cas de certaines méthodes de bioanalyse, une valeur indicative exprimée en BEQ peut être donnée pour les échantillons situés dans la plage de travail et dépassant le seuil d'inscription (voir points 7.1.1 et 7.1.6).
7.1. Évaluation de la réponse à l'essai
7.1.1. Prescriptions générales
|
— |
Le calcul des concentrations à partir d'une courbe d'étalonnage de la TCDD fera apparaître une variation importante [coefficient de variation (CV) élevé] des valeurs aux extrémités inférieure et supérieure de la courbe. La plage de travail est la zone où ce CV est inférieur à 15 %. L'extrémité inférieure de la plage de travail (seuil d'inscription) doit par ailleurs être établie à un niveau significativement supérieur (d'un facteur de trois au moins) aux blancs de procédure. L'extrémité supérieure de la plage de travail est habituellement représentée par la valeur EC70 (70 % de la concentration effective maximale), mais elle se situe à un niveau inférieur si le CV est supérieur à 15 % dans cette plage. La plage de travail est établie pendant la validation. Les valeurs seuil (point 7.3) doivent se situer dans la plage de travail. |
|
— |
Les solutions étalon et les extraits d'échantillon sont analysés au moins en double. En cas d'utilisation de doubles, une solution étalon ou un extrait témoin analysé dans quatre à six puits répartis sur la plaque produisent une réponse ou une concentration (possible uniquement dans la plage de travail) sur la base d'un CV inférieur à 15 %. |
7.1.2. Étalonnage
7.1.2.1.
|
— |
Les teneurs dans les échantillons peuvent être estimées par comparaison de la réponse à l'essai avec une courbe d'étalonnage de la TCDD (ou du PCB 126 ou d'un mélange étalon de PCDD/F/PCB de type dioxine) aux fins du calcul de la valeur BEQ dans l'extrait et, ultérieurement, dans l'échantillon. |
|
— |
Les courbes d'étalonnage contiennent de huit à douze concentrations (au moins en double), la concentration dans la partie inférieure de la courbe (plage de travail) devant être suffisante. Une attention particulière est accordée à la qualité de l'ajustement de la courbe dans la plage de travail. La valeur R2 a peu ou n'a pas de valeur en tant que telle pour l'appréciation de la justesse de l'ajustement en régression non linéaire. La réduction de l'écart entre les valeurs calculées et les valeurs observées dans la plage de travail de la courbe améliorera l'ajustement (la réduction de la somme des résidus au carré, par exemple). |
|
— |
Le niveau estimatif dans l'extrait d'échantillon est ensuite corrigé de la valeur BEQ calculée pour un échantillon blanc de matrice/de solvant (pour tenir compte des impuretés provenant des solvants et substances chimiques utilisés) et du taux de récupération apparent (calculé à partir de la valeur BEQ d'échantillons de référence adéquats avec des profils de congénères représentatifs proches de la teneur maximale ou du seuil d'intervention). Pour la correction par le taux de récupération, le taux de récupération apparent doit toujours se situer dans les limites de la plage requise (voir point 7.1.4). Les échantillons de référence utilisés pour corriger du taux de récupération doivent respecter les prescriptions énoncées au point 7.2. |
7.1.2.2.
Une autre solution consiste à utiliser une courbe d'étalonnage élaborée à partir d'au moins quatre échantillons de référence (voir point 7.2): une matrice blanche et trois échantillons de référence à 0,5 fois, 1,0 fois et 2,0 fois la teneur maximale ou le seuil d'intervention, ce qui permet de se passer de la correction par le blanc et le taux de récupération. Dans ce cas, la réponse à l'essai correspondant aux deux tiers de la teneur maximale (voir point 7.3) peut être calculée directement à partir de ces échantillons et servir de valeur seuil. Pour la vérification des échantillons dépassant les seuils d'intervention, la valeur seuil pourrait être un pourcentage approprié de ces seuils d'intervention.
7.1.3. Dosage distinct des PCDD/F et des PCB de type dioxine
Les extraits peuvent être séparés en fractions contenant des PCDD/F et des PCB de type dioxine, permettant une indication distincte des teneurs en PCDD/F et en PCB de type dioxine (en BEQ). Il convient d'utiliser de préférence une courbe d'étalonnage du PCB 126 pour évaluer les résultats de la fraction contenant les PCB de type dioxine.
7.1.4. Taux de récupération apparents du bioessai
Le «taux de récupération apparent du bioessai» est calculé à partir d'échantillons de référence appropriés avec des profils de congénères représentatifs qui sont proches de la teneur maximale ou du seuil d'intervention et est exprimé en pourcentage de la valeur BEQ par rapport à la valeur TEQ. En fonction du type de bioessai et des TEF (3) utilisés, les écarts entre les facteurs TEF et REP pour les PCB de type dioxine peuvent entraîner des taux de récupération apparents faibles pour les PCB de type dioxine par rapport aux PCDD/F. Par conséquent, en cas de dosage distinct des PCDD/F et des PCB de type dioxine, les taux de récupération apparents du bioessai doivent être de 20 à 60 % pour les PCB de type dioxine et de 50 à 130 % pour les PCDD/F (les plages s'appliquent pour la courbe d'étalonnage de la TCDD). Comme la contribution des PCB de type dioxine à la somme des PCDD/F et des PCB de type dioxine peut varier en fonction des matrices et des échantillons, les taux de récupération apparents du bioessai pour le paramètre de la somme reflètent ces plages et doivent se situer entre 30 et 130 %.
7.1.5. Contrôle des taux de récupération de la purification
La perte de composés durant la purification est vérifiée pendant la validation. Un échantillon blanc enrichi d'un mélange des différents congénères fait l'objet d'une purification (n = 3 au moins) et la récupération et la variabilité doivent être vérifiées au moyen d'une méthode de confirmation. Le taux de récupération doit se situer entre 60 et 120 %, notamment pour les congénères contribuant à hauteur de plus de 10 % à la valeur TEQ dans différents mélanges.
7.1.6. Seuil d'inscription
S'agissant de l'inscription des valeurs BEQ dans un rapport, un seuil d'inscription est déterminé à partir des échantillons de matrice considérés associant des profils de congénères types, mais pas à partir de la courbe d'étalonnage des étalons, la fidélité de la plage inférieure de la courbe n'étant pas suffisante. Les effets de l'extraction et de la purification doivent être pris en compte. Le seuil d'inscription doit être établi à un niveau significativement supérieur aux blancs de procédure (d'un facteur de trois au moins).
7.2. Utilisation d'échantillons de référence
|
— |
Les échantillons de référence représentent la matrice de prélèvement, les profils de congénères et les plages de concentration des PCDD/F et des PCB de type dioxine proches de la teneur maximale ou du seuil d'intervention. |
|
— |
Chaque série d'essais doit comporter un blanc de procédure, ou de préférence une matrice blanche, et un échantillon de référence à la teneur maximale ou au seuil d'intervention. Ces échantillons doivent être extraits et analysés au même moment et dans les mêmes conditions. La réponse de l'échantillon de référence doit être nettement plus élevée que celle de l'échantillon blanc, garantissant ainsi la validité de l'essai. Ces échantillons peuvent être utilisés pour corriger du blanc et du taux de récupération. |
|
— |
Les échantillons de référence choisis pour corriger du taux de récupération sont représentatifs des échantillons de l'essai, ce qui signifie que les profils de congénères ne peuvent pas conduire à une surestimation des teneurs. |
|
— |
Des échantillons de référence supplémentaires, d'une concentration égale à 0,5 fois et 2 fois la teneur maximale ou le seuil d'intervention, par exemple, peuvent être inclus pour démontrer l'efficacité de l'essai dans la plage pertinente pour le contrôle de la teneur maximale ou du seuil d'intervention. Agrégés, ces échantillons peuvent servir au calcul des valeurs BEQ dans les échantillons d'essai (point 7.1.2.2). |
7.3. Détermination de valeurs seuil
Le lien entre les résultats de bioanalyse en BEQ et les résultats des méthodes de confirmation en TEQ doit être établi [par exemple par des expériences d'étalonnage avec adaptation matricielle, à l'aide d'échantillons de référence enrichis pour atteindre 0, 0,5 fois, 1 fois et 2 fois la teneur maximale, avec six répétitions sur chaque teneur (n = 24)]. Les facteurs de correction (blanc et taux de récupération) peuvent être estimés à partir de ce lien, mais doivent être contrôlés dans chaque série d'essais par l'inclusion de blancs de procédure/matrices blanches et d'échantillons de récupération (point 7.2).
Des valeurs seuil sont établies pour déterminer la conformité de l'échantillon avec les teneurs maximales ou pour vérifier que les seuils d'intervention, s'ils sont considérés, sont conformes aux teneurs maximales ou seuils d'intervention respectifs établis pour les PCDD/F et pour les PCB de type dioxine pris isolément, ou pour la somme des PCDD/F et des PCB de type dioxine. Elles sont représentées par l'extrémité inférieure de la répartition des résultats de bioanalyse (corrigés du blanc et du taux de récupération) correspondant à la limite de décision de la méthode de confirmation fondée sur un niveau de confiance de 95 %, soit un taux de faux conformes inférieur à 5 %, et sur un RSDR inférieur à 25 %. La limite de décision de la méthode de confirmation est la teneur maximale, compte tenu de l'incertitude de mesure.
Dans la pratique, la valeur seuil (en BEQ) peut être calculée à l'aide des formules ci-après (voir graphique 1).
7.3.1. Utilisation de la plage inférieure de l'intervalle de prédiction de 95 % à la limite de décision de la méthode de confirmation:

où
|
BEQDL |
BEQ correspondant à la limite de décision de la méthode de confirmation, soit la teneur maximale compte tenu de l'incertitude de mesure |
|
sy,x |
écart type résiduel |
|
t α,f=m – 2 |
facteur de Student (α = 5 %, f = degrés de liberté, unilatéral) |
|
m |
nombre total de points d'étalonnage (indice j) |
|
n |
nombre de répétitions à chaque niveau |
|
xi |
concentration dans l'échantillon (en TEQ) du point d'étalonnage i, déterminée par une méthode de confirmation |
|
|
concentration moyenne (en TEQ) de tous les échantillons d'étalonnage |
|
Qxx |
= |
|
|
i |
= |
indice pour le point d'étalonnage i |
7.3.2. Calcul à partir des résultats de bioanalyse (corrigés du blanc et du taux de récupération) de multiples analyses d'échantillons (n ≥ 6) contaminés à hauteur de la limite de décision de la méthode de confirmation, en tant qu'extrémité inférieure de la répartition des données à la valeur BEQ moyenne correspondante:

où
|
SDR |
écart type des résultats de bioanalyse à la BEQDL, mesuré dans des conditions de reproductibilité intralaboratoire |
7.3.3. Mesure en tant que valeur moyenne des résultats de bioanalyse (en BEQ, corrigée du blanc et du taux de récupération) à partir de l'analyse multiple d'échantillons (n ≥ 6) contaminés aux deux tiers de la teneur maximale ou du seuil d'intervention, sachant que ce niveau sera proche de la valeur seuil déterminée conformément au point 7.3.1 ou 7.3.2:
Graphique 1
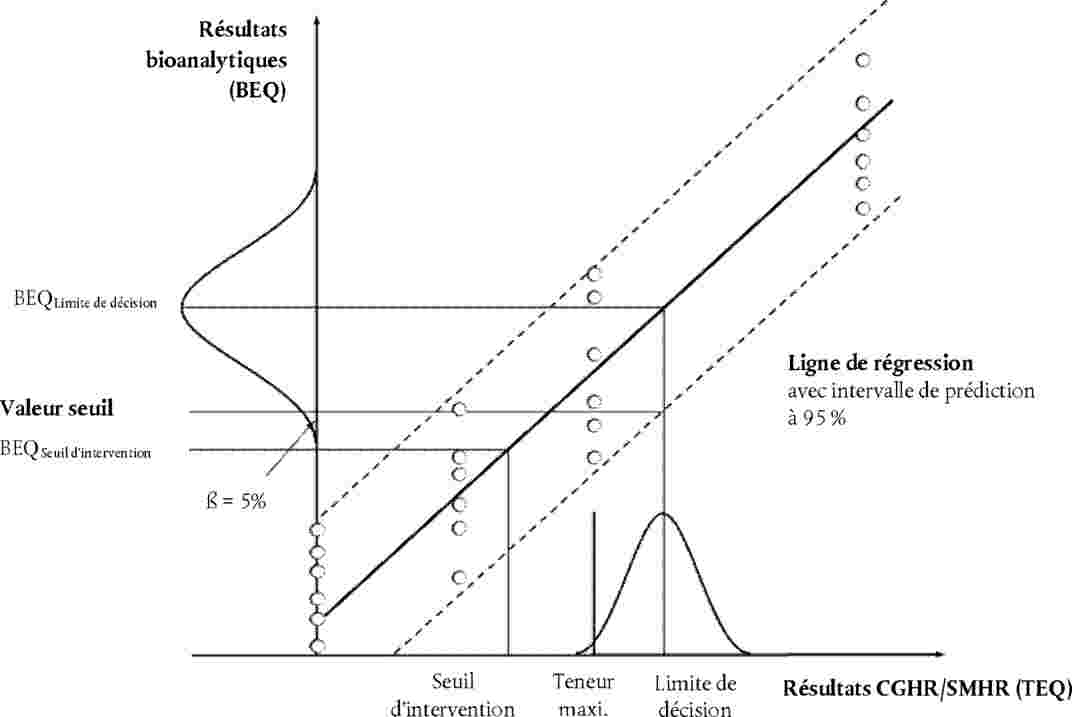
Calcul des valeurs seuil sur la base d'un niveau de confiance de 95 %, soit un taux de faux conformes inférieur à 5 %, et d'un RSDR inférieur à 25 %:
|
1) |
à partir de la plage inférieure de l'intervalle de prédiction de 95 % à la limite de décision de la méthode de confirmation; |
|
2) |
à partir de l'analyse multiple d'échantillons (n ≥ 6) contaminés à hauteur de la limite de décision de la méthode de confirmation en tant qu'extrémité inférieure de la répartition des données (représentée dans le graphique par une courbe en cloche) à la valeur BEQ moyenne correspondante. |
7.3.4. Restriction aux valeurs seuil
Les valeurs seuil fondées sur la valeur BEQ calculées à partir du RSDR atteint durant la validation à l'aide d'un nombre limité d'échantillons de matrices/profils de congénères différents peuvent être supérieures à la teneur maximale ou au seuil d'intervention fondés sur la valeur TEQ en raison d'une plus grande fiabilité que celle qu'il est possible d'atteindre dans les analyses de routine lorsqu'un spectre inconnu de profils de congénères possibles doit être contrôlé. Dans de tels cas, les valeurs seuil sont calculées à partir d'un RSDR égal à 25 % ou, de préférence, aux deux tiers de la teneur maximale ou du seuil d'intervention.
7.4. Caractéristiques de performances
|
— |
Étant donné qu'aucun étalon interne ne peut être utilisé dans les méthodes de bioanalyse, des tests de répétabilité doivent être effectués pour obtenir des données sur l'écart type au sein des séries d'essais et entre elles. La répétabilité doit être inférieure à 20 % et la reproductibilité intralaboratoire inférieure à 25 %. Ce calcul doit être fondé sur les valeurs calculées en BEQ après correction par le blanc et le taux de récupération. |
|
— |
Dans le cadre de la procédure de validation, l'essai doit permettre de distinguer un échantillon blanc d'une teneur à la valeur seuil, permettant ainsi l'identification des échantillons au-dessus de la valeur seuil correspondante (voir point 7.1.2). |
|
— |
Les composés cibles, les interférences potentielles et les valeurs maximales tolérées pour le blanc doivent être définis. |
|
— |
L'écart type relatif de la concentration calculée à partir des réponses (possible uniquement dans la plage de travail) d'un triple dosage d'un extrait d'échantillon ne peut être supérieur à 15 %. |
|
— |
Les résultats non corrigés du ou des échantillons de référence exprimés en BEQ (blanc et teneur maximale ou seuil d'intervention) sont utilisés pour évaluer les performances de la méthode de bioanalyse dans un intervalle de temps constant. |
|
— |
Il convient de réaliser et de vérifier des cartes de contrôle qualité (CQ) pour les blancs de procédure et chaque type d'échantillon de référence afin de s'assurer que la performance analytique est conforme aux prescriptions, notamment pour les blancs de procédure en ce qui concerne la différence minimale requise par rapport à l'extrémité inférieure de la plage de travail et pour les échantillons de référence en ce qui concerne la reproductibilité intralaboratoire. Les blancs de procédure doivent être bien contrôlés en vue d'éviter les faux conformes lorsqu'ils sont retranchés. |
|
— |
Les résultats, obtenus au moyen des méthodes de confirmation, des échantillons suspects et de 2 à 10 % des échantillons conformes (au minimum vingt échantillons par matrice) sont collectés et utilisés pour l'évaluation des performances de la méthode de dépistage et du lien entre les valeurs BEQ et TEQ. Cette base de données peut être utilisée aux fins de la réévaluation des valeurs seuil applicables aux échantillons de routine pour les matrices validées. |
|
— |
Les bonnes performances des méthodes peuvent également être démontrées à l'aide d'essais circulaires. Les résultats des échantillons analysés dans des essais circulaires, couvrant une concentration jusqu'à 2 fois la teneur maximale, par exemple, peuvent également faire partie de l'évaluation du taux de faux conformes, si un laboratoire est en mesure de démontrer ses bonnes performances. Les échantillons doivent couvrir les profils de congénères les plus fréquents, représentant différentes sources. |
|
— |
Durant les cas de crise, les valeurs seuil peuvent être réévaluées, reflétant mieux la matrice et les profils de congénères particuliers de ce cas précis. |
8. INSCRIPTION DES RÉSULTATS DANS UN RAPPORT
Méthodes de confirmation
|
— |
Dans la mesure où le procédé d'analyse utilisé le permet, les résultats d'analyse comprennent les teneurs en congénères individuels des PCDD/F et des PCB de type dioxine et sont indiqués en estimation inférieure, estimation supérieure et estimation intermédiaire, afin que soit consigné un maximum de données, ce qui permet une interprétation des résultats en fonction de prescriptions spécifiques. |
|
— |
Le rapport mentionne également la méthode utilisée pour extraire les PCDD/F, les PCB de type dioxine et les graisses. La teneur en graisses de l'échantillon est déterminée et est indiquée dans le rapport pour les échantillons de denrées alimentaires présentant des teneurs maximales exprimées par rapport à la matière grasse et ceux ayant une concentration de graisses attendue de l'ordre de 0 à 2 % (en accord avec la législation en vigueur); la détermination de la teneur en graisses est facultative pour les autres échantillons. |
|
— |
Les taux de récupération des étalons internes individuels doivent être fournis s'ils se situent en dehors de la plage mentionnée au point 6.2 ou si la teneur maximale est dépassée (dans ce cas, les taux de récupération doivent être fournis pour l'une des deux analyses faites en double). Dans tous les autres cas, ils doivent être fournis sur demande. |
|
— |
L'incertitude de mesure doit également être inscrite dans le rapport, car ce paramètre est pris en compte lorsqu'il s'agit de déterminer la conformité d'un échantillon. Par conséquent, les résultats de l'analyse sont consignés sous la forme x +/– U, où x est le résultat de l'analyse et U l'incertitude de mesure élargie calculée au moyen d'un facteur d'élargissement de 2 qui donne un niveau de confiance d'environ 95 %. En cas de dosage distinct des PCDD/F et des PCB de type dioxine, la somme des estimations de l'incertitude élargie des résultats d'analyse distincts concernant les PCDD/F et les PCB de type dioxine doit être utilisée pour la somme des PCDD/F et des PCB de type dioxine. |
|
— |
Si l'incertitude de mesure est prise en considération au moyen de la CCα (conformément à l'annexe II, point IV.2), ce paramètre est inscrit dans le rapport. |
|
— |
Les résultats sont exprimés dans les mêmes unités et par (au moins) le même nombre de chiffres significatifs que les teneurs maximales établies dans le règlement (CE) no 1881/2006. |
Méthodes bioanalytiques de dépistage
|
— |
Le dépistage livre un résultat exprimé en tant que conforme ou suspecté d'être non conforme («suspect»). |
|
— |
Il peut aussi livrer un résultat pour les PCDD/F et/ou les PCB de type dioxine exprimé en équivalents de bioanalyse (BEQ) (et non en TEQ) (voir annexe III, point 1). Les échantillons dont la réponse est au-dessous du seuil d'inscription sont indiqués comme étant sous le seuil d'inscription. |
|
— |
Pour chaque type de matrice de prélèvement, le rapport mentionne la teneur maximale ou le seuil d'intervention sur lequel repose l'évaluation. |
|
— |
Le rapport mentionne le type d'essai effectué, le principe de base de l'essai et le type d'étalonnage. |
|
— |
Le rapport mentionne également la méthode utilisée pour extraire les PCDD/F, les PCB de type dioxine et les graisses. La teneur en graisses de l'échantillon est déterminée et est indiquée dans le rapport pour les échantillons de denrées alimentaires présentant des teneurs maximales ou des seuils d'intervention exprimés par rapport à la matière grasse et ceux ayant une concentration de graisses attendue de l'ordre de 0 à 2 % (en accord avec la législation en vigueur); la détermination de la teneur en graisses est facultative pour les autres échantillons. |
|
— |
Dans le cas d'échantillons suspectés d'être non conformes, le rapport doit comprendre une note sur les mesures à prendre. La concentration de PCDD/F et la somme des PCDD/F et des PCB de type dioxine dans ces échantillons présentant des teneurs élevées doivent être déterminées/confirmées au moyen d'une méthode de confirmation. |
(1) Règlement (CE) no 882/2004 du Parlement européen et du Conseil du 29 avril 2004 relatif aux contrôles officiels effectués pour s'assurer de la conformité avec la législation sur les aliments pour animaux et les denrées alimentaires et avec les dispositions relatives à la santé animale et au bien-être des animaux (JO L 165 du 30.4.2004, p. 1).
(2) Au regard des teneurs maximales.
(3) Les prescriptions actuelles sont fondées sur les TEF publiés [Van den Berg, M., e.a., Toxicological Sciences 93(2), p. 223-241, 2006].
Appendice de l'ANNEXE III
TEF-OMS pour l'évaluation des risques pour l'homme, fondés sur les conclusions de la réunion des experts du Programme international sur la sécurité des substances chimiques (PISSC) de l'Organisation mondiale de la santé (OMS), qui s'est tenue à Genève en juin 2005 [van den Berg, M., e.a., «The 2005 World Health Organization Re-evaluation of Human and Mammalian Toxic Equivalency Factors for Dioxins and Dioxin-like Compounds», Toxicological Sciences 93(2), p. 223 à 241, 2006].
|
Congénère |
Valeur TEF |
Congénère |
Valeur TEF |
|
Dibenzo-p-dioxines (PCDD) |
PCB «de type dioxine» PCB non ortho + PCB mono ortho |
||
|
2,3,7,8-TCDD |
1 |
PCB non ortho |
|
|
1,2,3,7,8-PeCDD |
1 |
||
|
1,2,3,4,7,8-HxCDD |
0,1 |
PCB 77 |
0,0001 |
|
1,2,3,6,7,8-HxCDD |
0,1 |
PCB 81 |
0,0003 |
|
1,2,3,7,8,9-HxCDD |
0,1 |
PCB 126 |
0,1 |
|
1,2,3,4,6,7,8-HpCDD |
0,01 |
PCB 169 |
0,03 |
|
OCDD |
0,0003 |
|
|
|
Dibenzofuranes (PCDF) |
PCB mono ortho |
||
|
2,3,7,8-TCDF |
0,1 |
PCB 105 |
0,00003 |
|
1,2,3,7,8-PeCDF |
0,03 |
PCB 114 |
0,00003 |
|
2,3,4,7,8-PeCDF |
0,3 |
PCB 118 |
0,00003 |
|
1,2,3,4,7,8-HxCDF |
0,1 |
PCB 123 |
0,00003 |
|
1,2,3,6,7,8-HxCDF |
0,1 |
PCB 156 |
0,00003 |
|
1,2,3,7,8,9-HxCDF |
0,1 |
PCB 157 |
0,00003 |
|
2,3,4,6,7,8-HxCDF |
0,1 |
PCB 167 |
0,00003 |
|
1,2,3,4,6,7,8-HpCDF |
0,01 |
PCB 189 |
0,00003 |
|
1,2,3,4,7,8,9-HpCDF |
0,01 |
|
|
|
OCDF |
0,0003 |
|
|
|
Abréviations utilisées: «T» = tétra; «Pe» = penta; «Hx» = hexa; «Hp» = hepta; «O» = octa; «CDD» = chlorodibenzodioxine; «CDF» = chlorodibenzofurane; «CB» = chlorobiphényle. |
|||
