
02010R0206 — FR — 01.07.2017 — 023.001
Ce texte constitue seulement un outil de documentation et n’a aucun effet juridique. Les institutions de l'Union déclinent toute responsabilité quant à son contenu. Les versions faisant foi des actes concernés, y compris leurs préambules, sont celles qui ont été publiées au Journal officiel de l’Union européenne et sont disponibles sur EUR-Lex. Ces textes officiels peuvent être consultés directement en cliquant sur les liens qui figurent dans ce document
|
RÈGLEMENT (UE) No 206/2010 DE LA COMMISSION du 12 mars 2010 établissant des listes des pays tiers, territoires ou parties de pays tiers ou territoires en provenance desquels l’introduction dans l’Union européenne de certains animaux et viandes fraîches est autorisée, et définissant les exigences applicables en matière de certification vétérinaire (Texte présentant de l’intérêt pour l’EEE) (JO L 073 du 20.3.2010, p. 1) |
Modifié par:
Rectifié par:
RÈGLEMENT (UE) No 206/2010 DE LA COMMISSION
du 12 mars 2010
établissant des listes des pays tiers, territoires ou parties de pays tiers ou territoires en provenance desquels l’introduction dans l’Union européenne de certains animaux et viandes fraîches est autorisée, et définissant les exigences applicables en matière de certification vétérinaire
(Texte présentant de l’intérêt pour l’EEE)
CHAPITRE I
OBJET, CHAMP D’APPLICATION ET DÉFINITIONS
Article premier
Objet et champ d’application
1. Le présent règlement établit les exigences en matière de certification vétérinaire applicables à l’introduction dans l’Union de lots contenant les viandes fraîches ou les animaux vivants suivants:
a) les ongulés;
b) les animaux énumérés à l’annexe IV, partie 2;
c) les viandes fraîches d’ongulés et d’équidés destinées à la consommation humaine, à l’exclusion des préparations de viandes.
2. Le présent règlement établit les listes des pays tiers, territoires ou parties de pays tiers ou territoires en provenance desquels les lots visés au paragraphe 1 peuvent être introduits dans l’Union.
▼M18 —————
4. Le présent règlement s’applique sans préjudice des exigences spécifiques en matière de certification prévues dans d’autres actes de l’Union ou dans des accords conclus par l’Union avec des pays tiers.
Article 2
Définitions
Aux fins du présent règlement, on entend par:
a) «ongulés»: les ongulés définis à l’article 2, point d), de la directive 2004/68/CE;
b) «viandes fraîches»: les viandes fraîches définies au point 1.10 de l’annexe I du règlement (CE) no 853/2004;
c) «équidés»: les équidés définis à l’article 2, point b), de la directive 90/426/CEE du Conseil ( 1 );
d) «exploitation»: une exploitation agricole ou toute autre entreprise agricole, industrielle ou commerciale officiellement contrôlée, y compris les zoos, les parcs de loisirs, les réserves naturelles et les réserves de chasse, dans laquelle des animaux vivants sont détenus ou élevés de manière habituelle.
CHAPITRE II
CONDITIONS D’INTRODUCTION D’ANIMAUX VIVANTS DANS L’UNION
Article 3
Conditions générales d’introduction d’ongulés dans l’Union
Les lots d’ongulés ne sont introduits dans l’Union que s’ils satisfont aux conditions suivantes:
a) ils proviennent des pays tiers, territoires ou parties de pays tiers ou territoires énumérés dans les colonnes 1, 2 et 3 du tableau de l’annexe I, partie 1, pour lesquels la colonne 4 dudit tableau mentionne un modèle de certificat vétérinaire correspondant au lot concerné;
b) ils sont accompagnés du certificat vétérinaire approprié établi conformément au modèle de certificat vétérinaire applicable figurant à l’annexe I, partie 2, compte tenu des conditions spécifiques mentionnées dans la colonne 6 du tableau de l’annexe I, partie 1, rempli et signé par un vétérinaire officiel du pays tiers exportateur;
c) ils satisfont aux exigences énoncées dans le certificat vétérinaire visé au point b), y compris:
i) aux garanties supplémentaires énoncées dans ce certificat, lorsque la colonne 5 du tableau de l’annexe I, partie 1, le prévoit;
ii) à toute exigence additionnelle en matière de certification vétérinaire que l’État membre de destination peut imposer, conformément à la législation vétérinaire de l’Union, et qui est énoncée dans le certificat.
Article 3 bis
Conditions d’introduction d’ongulés destinés à un organisme, institut ou centre agréé
1. Par dérogation à l’article 3, l’autorité compétente d’un État membre peut autoriser l’introduction sur son territoire de lots d’ongulés des espèces énumérées à l’annexe VI, partie 1, tableaux 1, 2 et 3, lorsque ces lots sont destinés à un organisme, institut ou centre agréé, pour autant qu’il soit satisfait aux conditions suivantes:
a) une évaluation des risques zoosanitaires que chacun des lots peut présenter pour l’Union a été effectuée par l’autorité compétente de l’État membre de destination;
b) les lots concernés proviennent d’un pays tiers, d’un territoire ou d’une partie de pays tiers ou territoire énumérés dans l’une des listes figurant dans:
i) l’annexe I, partie 1, ou l’annexe II, partie 1, du présent règlement,
ii) la décision 2004/211/CE ( 2 ), la décision 2007/777/CE ( 3 ), le règlement (CE) no 798/2008 ( 4 ), le règlement (CE) no 119/2009 ( 5 ) ou le règlement (UE) no 605/2010 ( 6 );
c) les ongulés proviennent d’un organisme, institut ou centre situé dans un pays tiers, un territoire ou une partie de pays tiers ou territoire visés au point a) et figurant sur une liste établie conformément à l’article 3 quater;
d) les ongulés ont été mis en quarantaine dans une installation protégée contre les vecteurs dans les locaux de l’organisme, institut ou centre visé au point c) pendant la période prévue dans les certificats y afférents;
e) les ongulés sont amenés directement jusqu’à un organisme, institut ou centre agréé dans l’État membre de destination;
f) les ongulés sont accompagnés du certificat vétérinaire approprié rédigé conformément au modèle de certificat vétérinaire applicable visé à l’annexe VI, partie 1, tableaux 1, 2 et 3, et établi dans ladite annexe, partie 2;
g) les ongulés satisfont aux exigences énoncées dans le modèle de certificat vétérinaire visé au point f).
Avant l’introduction des ongulés sur son territoire, l’État membre de destination informe la Commission et les autres États membres, par l’intermédiaire du comité permanent de la chaîne alimentaire et de la santé animale, de l’autorisation accordée en vertu du premier alinéa.
2. Lorsque des circonstances exceptionnelles rendent le respect du paragraphe 1, points c) et d), impossible, l’autorité compétente de l’État membre de destination peut autoriser l’introduction sur son territoire d’ongulés des espèces énumérées dans l’annexe VI, partie 1, tableaux 1, 2 et 3, provenant d’autres exploitations non conformes aux exigences fixées aux points susvisés pour autant qu’il soit satisfait aux exigences fixées au paragraphe 1, points a), b) et e) à g), et que les conditions supplémentaires suivantes soient remplies:
a) une demande préalable de permis a été introduite par le propriétaire ou une personne physique le représentant et l’État membre de destination a accordé ce permis après avoir effectué une évaluation des risques dont il est ressorti que l’introduction des ongulés concernés sur son territoire ne constitue pas un risque zoosanitaire pour l’Union;
b) les ongulés ont été mis en quarantaine dans le pays tiers, le territoire ou la partie de pays tiers ou territoire d’origine sous contrôle officiel pendant la durée requise pour qu’ils satisfassent aux conditions de police sanitaire fixées dans le modèle de certificat vétérinaire visé au point f):
i) en un lieu agréé par l’autorité compétente du pays tiers, du territoire ou de la partie de pays tiers ou territoire d’origine des animaux;
ii) conformément aux modalités prescrites dans le permis, lesquelles fournissent des garanties au moins identiques à celles prévues au paragraphe 1, points a), b) et e) à g).
Lorsque des ongulés sont introduits dans l’Union en vertu du premier alinéa, ils sont mis en quarantaine dans l’organisme, institut ou centre agréé de destination pendant une durée d’au moins six mois à compter de la date d’introduction dans l’Union, au cours de laquelle les exigences prévues à l’article 8, paragraphe 1, point a), de la directive 90/425/CEE du Conseil peuvent être appliquées par les autorités compétentes.
Avant l’introduction des ongulés sur son territoire, l’État membre qui autorise cette introduction en vertu du premier alinéa informe la Commission et les autres États membres, par l’intermédiaire du comité permanent de la chaîne alimentaire et de la santé animale, de l’autorisation accordée.
Article 3 ter
Conditions d’entrée sur le territoire d’États membres autres que l’État membre de destination et conditions de transit par ce territoire d’ongulés destinés à un organisme, institut ou centre agréé
Le transit des ongulés visés à l’article 3 bis par un État membre autre que l’État membre de destination n’est autorisé que sous réserve de l’autorisation de l’autorité compétente de l’État membre de transit. Cette autorisation ne peut être accordée que sur la base d’une évaluation des risques effectuée par cette autorité compétente à la lumière des informations communiquées par l’État membre de destination.
Avant le transit, l’État membre de destination informe la Commission et les autres États membres, par l’intermédiaire du comité permanent de la chaîne alimentaire et de la santé animale, lorsqu’il autorise l’introduction d’animaux dans les conditions prévues à l’article 3 bis.
Article 3 quater
Liste des organismes, instituts ou centres agréés dans les pays tiers, territoires ou parties de pays tiers ou territoires
1. À la suite d’une évaluation du respect des conditions fixées au paragraphe 2, chaque État membre peut dresser une liste des organismes, instituts et centres à partir desquels l’introduction d’ongulés sur son territoire peut être autorisée en vertu de l’article 3 bis, paragraphe 1.
2. Un organisme, institut ou centre situé dans un pays tiers, un territoire ou une partie de pays tiers ou territoire n’est inscrit sur la liste visée au paragraphe 1 que lorsque les conditions suivantes sont remplies:
a) l’organisme, institut ou centre satisfait aux exigences énoncées à l’annexe VI, partie 3;
b) l’organisme, institut ou centre est agréé par l’autorité compétente du pays tiers, du territoire ou de la partie de pays tiers ou territoire dans lequel/laquelle il est situé;
c) l’autorité compétente du pays tiers, du territoire ou de la partie de pays tiers ou territoire fournit des garanties suffisantes quant au respect des conditions régissant l’agrément des organismes, instituts ou centres énoncées à l’annexe VI, partie 4.
3. Un État membre peut, sans avoir évalué le respect des conditions fixées au paragraphe 2, inscrire sur la liste visée au paragraphe 1 des organismes, instituts ou centres de pays tiers qui sont déjà mentionnés sur pareille liste établie par un autre État membre.
4. Les États membres tiennent à jour les listes visées au paragraphe 1, en tenant compte en particulier de toute suspension ou retrait de l’agrément accordé par l’autorité compétente d’un pays tiers, d’un territoire ou d’une partie de pays tiers ou territoire aux organismes, instituts ou centres qui y sont situés et qui figurent sur ces listes.
5. Les États membres mettent à la disposition du public, au moyen de pages d’information consultables sur l’internet, les listes visées au paragraphe 1 et assurent la mise à jour de ces pages.
6. Les États membres communiquent à la Commission l’adresse de leurs pages d’information consultables sur l’internet.
Article 4
Conditions applicables aux centres de rassemblement pour certains lots d’ongulés
1. Les lots d’ongulés contenant des animaux vivants provenant de plus d’une exploitation ne sont introduits dans l’Union que s’ils sont constitués dans des centres de rassemblement agréés par l’autorité compétente du pays tiers, du territoire ou de la partie de pays tiers ou territoire d’origine conformément aux conditions énoncées à l’annexe I, partie 5.
2. Les lots d’ongulés introduits dans l’Union conformément à l’article 3 bis ou à l’article 6 ne peuvent provenir de plus d’une exploitation et ne peuvent être constitués dans des centres de rassemblement.
Article 5
Protocoles de normalisation des matériels et procédures d’échantillonnage et de test applicables aux ongulés
Lorsque les certificats vétérinaires énumérés dans la colonne 4 du tableau de l’annexe I, partie 1, requièrent le prélèvement d’échantillons et la réalisation de tests de détection pour les maladies énumérées à l’annexe I, partie 6, en vue de l’introduction de lots d’ongulés dans l’Union, les échantillons sont prélevés et les tests réalisés par l’autorité compétente du pays tiers d’origine ou sous son contrôle conformément aux protocoles de normalisation des matériels et aux procédures de test figurant à l’annexe I, partie 6.
Article 6
Conditions spéciales applicables à certains lots d’ongulés importés à Saint-Pierre-et-Miquelon et introduits dans l’Union
Les lots d’ongulés des espèces énumérées dans le tableau de l’annexe I, partie 7, introduits à Saint-Pierre-et-Miquelon moins de six mois avant la date à laquelle ils sont expédiés de Saint-Pierre-et-Miquelon à destination de l’Union, sont introduits dans l’Union uniquement:
a) s’ils satisfont aux exigences en matière de séjour et de quarantaine énoncées à l’annexe I, partie 7, chapitre 1;
b) s’ils ont été testés conformément aux exigences en matière de tests de santé animale énoncées à l’annexe I, partie 7, chapitre 2.
Article 7
Conditions générales d’introduction de certaines espèces d’apidés dans l’Union
1. Les lots d’apidés des espèces énumérées dans le tableau 1 de l’annexe IV, partie 2, ne sont introduits dans l’Union qu’à partir des pays tiers ou territoires:
a) énumérés à l’annexe II, partie 1;
b) où la présence de la loque américaine, du petit coléoptère des ruches (Aethina tumida) et de l’acarien Tropilaelaps (Tropilaelaps spp.) fait l’objet d’une notification obligatoire sur l’intégralité du territoire du pays tiers ou territoire concerné.
2. Par dérogation au paragraphe 1, point a), les lots d’apidés peuvent être introduits dans l’Union à partir d’une partie d’un pays tiers ou territoire énumérée à l’annexe II, partie 1, qui:
a) est une partie géographiquement et épidémiologiquement isolée du pays tiers ou territoire;
b) est énumérée dans la troisième colonne du tableau de l’annexe IV, partie 1, section 1.
Lorsque cette dérogation est utilisée, l’introduction de lots d’apidés dans l’Union est interdite à partir de toute autre partie du pays tiers ou territoire concerné non énumérée dans la troisième colonne du tableau de l’annexe IV, partie 1, section 1.
3. Les lots d’apidés des espèces énumérées dans le tableau 1 de l’annexe IV, partie 2, sont composés:
a) soit de cages à reine (Apis mellifera et Bombus spp.) contenant chacune une seule reine et vingt accompagnatrices au maximum;
b) soit de conteneurs à bourdons (Bombus spp.) contenant chacun une colonie de deux cents bourdons adultes au maximum.
4. Les lots d’apidés des espèces énumérées dans le tableau 1 de l’annexe IV, partie 2:
a) sont accompagnés du certificat vétérinaire approprié établi conformément au modèle de certificat vétérinaire applicable figurant à l’annexe IV, partie 2, rempli et signé par un inspecteur officiel du pays tiers exportateur;
b) satisfont aux exigences vétérinaires énoncées dans le certificat vétérinaire visé au point a).
Article 8
Conditions générales applicables au transport d’animaux vivants à destination de l’Union
Au cours de la période suivant le chargement dans le pays tiers d’origine et précédant l’arrivée au poste d’inspection frontalier d’introduction dans l’Union, les lots d’animaux vivants ne sont pas:
a) transportés avec d’autres animaux vivants qui:
i) ne sont pas destinés à être introduits dans l’Union; ou
ii) ont un statut sanitaire inférieur;
b) déchargés ni, lorsqu’ils sont transportés par voie aérienne, déplacés vers un autre avion ou transportés par route ou par chemin de fer ou déplacés à pied dans un pays tiers, un territoire ou une partie de pays tiers ou territoire à partir desquels l’importation des animaux concernés dans l’Union n’est pas autorisée.
Article 9
Durée maximale du transport d’animaux vivants à destination de l’Union
Un lot d’animaux vivants n’est introduit dans l’Union que lorsqu’il arrive au poste d’inspection frontalier d’introduction dans l’Union dans les dix jours suivant la date de délivrance du certificat vétérinaire approprié.
En cas de transport maritime, ce délai de dix jours est prolongé de la durée du voyage maritime, telle qu’elle est attestée dans une déclaration signée par le capitaine du navire, établie conformément à l’annexe I, partie 3, et dont l’original est joint au certificat vétérinaire.
Article 10
Conditions particulières applicables à la vaporisation des lots d’animaux vivants transportés par voie aérienne à destination de l’Union
Lorsque des lots d’animaux vivants, à l’exception des lots d’apidés, sont transportés par voie aérienne, un insecticide approprié est vaporisé à l’intérieur et aux alentours de la caisse ou du conteneur servant à leur transport.
L’insecticide est vaporisé immédiatement avant la fermeture des portes de l’avion après le chargement et après toute ouverture ultérieure des portes dans un pays tiers jusqu’à l’arrivée de l’avion à sa destination finale.
Le commandant de bord certifie que la vaporisation a eu lieu en signant une déclaration établie conformément à l’annexe I, partie 4, et dont l’original est joint au certificat vétérinaire.
Article 11
Conditions à appliquer après l’introduction de certains lots d’ongulés dans l’Union
1. Après leur introduction dans l’Union, les lots d’ongulés autres que ceux visés à l’article 3 bis sont amenés sans délai à l’exploitation de destination dans un moyen de transport protégé contre les vecteurs.
Les ongulés séjournent dans cette exploitation durant une période d’au moins trente jours, sauf s’ils sont expédiés directement vers un abattoir.
2. Après leur introduction dans l’Union, les lots d’ongulés destinés à l’abattage immédiat sont amenés sans délai à l’abattoir de destination, où ils sont abattus dans un délai de cinq jours ouvrés à compter de la date de leur arrivée à l’abattoir.
Article 12
Conditions spécifiques concernant le transit de certains lots d’ongulés par des pays tiers
Lorsque la condition spécifique I prévue à l’annexe I, partie 1, est applicable, de manière à permettre que les lots d’ongulés visés dans ladite condition, provenant d’un État membre et destinés à un autre État membre, transitent par un pays tiers, un territoire ou une partie de l’un de ceux-ci qui est énuméré(e) dans le tableau de l’annexe I, partie 1, mais pour lequel/laquelle la colonne 4 dudit tableau ne mentionne pas de modèle de certificat vétérinaire correspondant aux lots d’ongulés concernés, les conditions énoncées ci-après sont applicables:
a) aux bovins destinés à l’engraissement:
i) les exploitations de destination finale doivent être désignées à l’avance par l’autorité compétente de la destination finale;
ii) les animaux vivants composant le lot ne peuvent quitter l’exploitation de destination finale que pour un abattage immédiat;
iii) tous les mouvements d’animaux vivants à destination et au départ de l’exploitation de destination finale doivent se dérouler sous le contrôle de l’autorité compétente aussi longtemps que les animaux composant le lot sont détenus dans l’exploitation.
b) aux ongulés destinés à l’abattage immédiat: l’article 11, paragraphe 2 est applicable.
Article 12 bis
Dérogation applicable au transit, par la Lituanie, de certains lots de bovins vivants destinés à l’élevage et à la rente
1. Le transit routier, par la Lituanie, de lots de bovins vivants destinés à l’élevage et à la rente en provenance de la région russe de Kaliningrad et expédiés vers une destination à l’extérieur de l’Union est autorisé sous réserve du respect des conditions suivantes:
a) les animaux entrent en Lituanie au poste d’inspection frontalier situé sur la route de Kybartai et quittent la Lituanie au poste d’inspection frontalier de Medininkai;
b) les animaux sont transportés par conteneurs dans des véhicules routiers scellés par les services vétérinaires de l’autorité compétente de Lituanie au poste d’inspection frontalier d’introduction dans l’Union situé sur la route de Kybartai, au moyen d’un cachet portant un numéro d’ordre;
c) les documents visés à l’article 7, paragraphe 1, troisième tiret, de la directive 91/496/CEE du Conseil, y compris le certificat vétérinaire dûment complété conformément au modèle de certificat vétérinaire «BOV-X-TRANSIT-RU» figurant dans la partie 2 de l’annexe I du présent règlement, qui accompagnent les animaux du poste d’inspection frontalier situé sur la route de Kybartai jusqu’au poste d’inspection frontalier de Medininkai sont marqués d’un cachet portant la mention «UNIQUEMENT POUR TRANSIT PAR LA LITUANIE DEPUIS LA RÉGION RUSSE DE KALININGRAD», sur chaque page, par le vétérinaire officiel de l’autorité compétente responsable du poste d’inspection frontalier situé sur la route de Kybartai;
d) les exigences prévues à l’article 9 de la directive 91/496/CEE du Conseil sont remplies;
e) le lot est certifié comme étant acceptable pour le transit via la Lituanie dans le document vétérinaire commun d’entrée visé à l’article 1er, paragraphe 1, du règlement (CE) no 282/2004 de la Commission ( 7 ), qui est signé par le vétérinaire officiel du poste d’inspection frontalier situé sur la route de Kybartai;
f) les animaux sont accompagnés d’un certificat sanitaire qui leur permet d’entrer librement en Biélorussie et d’un certificat vétérinaire délivré pour leur lieu de destination en Russie.
2. Le lot n’est pas déchargé dans l’Union et est transporté directement au poste d’inspection frontalier de sortie de Medininkai.
Le vétérinaire officiel du poste d’inspection frontalier de Medininkai remplit la partie 3 du document vétérinaire commun d’entrée après vérification, lors des contrôles de sortie, qu’il s’agit bien du lot qui est entré en Lituanie au poste d’inspection frontalier situé sur la route de Kybartai.
3. En cas d’irrégularité ou d’urgence pendant le transit, l’État membre de transit applique les mesures prévues à l’article 8, paragraphe 1, point b), deuxième tiret, de la directive 90/425/CEE ( 8 ) en tant que de besoin.
4. L’autorité compétente de Lituanie vérifie régulièrement la correspondance entre le nombre de lots à l’entrée et à la sortie du territoire de l’Union.
Article 13
Conditions à appliquer après l’introduction dans l’Union de lots d’apidés visés à l’article 7
1. Les lots de reines visés à l’article 7, paragraphe 3, point a), sont amenés sans délai au lieu désigné de destination finale, où les ruches sont placées sous le contrôle de l’autorité compétente et les reines transférées dans de nouvelles cages avant d’être introduites dans des colonies locales.
2. Les cages, les accompagnatrices et tout autre matériel accompagnant les reines en provenance du pays tiers d’origine sont envoyés dans un laboratoire désigné par l’autorité compétente en vue de la détection:
a) du petit coléoptère des ruches (Aethina tumida), de ses œufs ou de ses larves;
b) de traces de l’acarien Tropilaelaps (Tropilaelaps spp.).
Au terme de cet examen en laboratoire, les cages, les accompagnatrices et le matériel sont détruits.
3. Les lots de bourdons (Bombus spp.) visés à l’article 7, paragraphe 3, point b), sont amenés sans délai au lieu désigné de destination.
Ces bourdons peuvent rester dans le conteneur dans lequel ils ont été introduits dans l’Union jusqu’à la fin de la durée de vie de la colonie.
Ce conteneur et le matériel ayant accompagné les bourdons depuis le pays tiers d’origine sont détruits au plus tard au terme de la durée de vie de la colonie.
Article 13 bis
Conditions à appliquer après l’introduction de lots d’ongulés destinés à des organismes, instituts ou centres agréés
1. Après leur introduction dans l’Union, les lots d’ongulés destinés à des organismes, instituts ou centres agréés sont transportés sans délai jusqu’à l’organisme, institut ou centre agréé de destination dans un moyen de transport protégé contre les vecteurs et conçu de telle sorte que les animaux ne puissent s’en échapper et que les fèces, l’urine, la litière, le fourrage, les déchets ou toute autre matière ne puissent s’écouler ou tomber du véhicule ou du conteneur pendant le transport.
2. Les animaux sont maintenus en quarantaine dans des installations protégées contre les vecteurs dans les locaux de l’organisme, institut ou centre agréé de l’État membre de destination pendant au moins trente jours. Après la quarantaine de trente jours, les animaux peuvent être déplacés vers un autre organisme, institut ou centre agréé.
3. Les animaux introduits dans un organisme, institut ou centre agréé ne peuvent être déplacés vers une destination autre qu’un organisme, institut ou centre agréé que:
a) si au moins six mois se sont écoulés depuis le moment de l’introduction dans l’Union, et
b) si le déplacement est effectué conformément à l’annexe C, paragraphe 4, de la directive 92/65/CEE.
4. Par dérogation au paragraphe 3, les animaux ne peuvent quitter un organisme, institut ou centre agréé avant la fin de la période de six mois prévue audit paragraphe que si les conditions suivantes sont respectées:
a) les animaux sont exportés vers un pays tiers, un territoire ou une partie de pays tiers ou territoire;
b) aux fins de leur exportation au sens du point a), les animaux sont transportés dans des moyens de transport qui sont protégés contre les vecteurs et conçus de telle sorte que les animaux ne puissent s’en échapper et que les fèces, l’urine, la litière, le fourrage, les déchets ou toute autre matière ne puissent s’écouler ou tomber du véhicule ou du conteneur pendant le transport.
CHAPITRE III
CONDITIONS D’INTRODUCTION DE VIANDES FRAÎCHES DANS L’UNION
Article 14
Conditions générales d’importation de viandes fraîches
Les lots de viandes fraîches destinées à la consommation humaine ne sont importés dans l’Union que s’ils satisfont aux conditions suivantes:
a) ils proviennent des pays tiers, territoires ou parties de pays tiers ou territoires énumérés dans les colonnes 1, 2 et 3 du tableau de l’annexe II, partie 1, pour lesquels la colonne 4 dudit tableau mentionne un modèle de certificat vétérinaire correspondant au lot concerné;
b) ils sont présentés au poste d’inspection frontalier d’introduction dans l’Union accompagnés du certificat vétérinaire approprié établi conformément au modèle de certificat correspondant figurant à l’annexe II, partie 2, compte tenu des conditions spécifiques indiquées dans la colonne 6 du tableau de l’annexe II, partie 1, rempli et signé par un vétérinaire officiel du pays tiers exportateur;
c) ils satisfont aux exigences énoncées dans le certificat vétérinaire visé au point b), y compris:
i) aux garanties supplémentaires énoncées dans ce certificat, lorsque la colonne 5 du tableau de l’annexe II, partie 1, le prévoit;
ii) à toute exigence additionnelle en matière de certification vétérinaire que l’État membre de destination peut imposer, conformément à la législation vétérinaire de l’Union, et qui est énoncée dans le certificat.
Article 15
Conditions à appliquer après l’importation de carcasses non dépouillées de gibier biongulé sauvage
Conformément à l’article 8, paragraphe 2, de la directive 97/78/CE du Conseil ( 9 ), les lots de carcasses non dépouillées de gibier biongulé sauvage destinées à la consommation humaine après transformation sont amenés sans délai à l’établissement de transformation de destination.
Article 16
Transit et entreposage de viandes fraîches
L’introduction dans l’Union de lots de viandes fraîches non destinés à être importés dans l’Union, mais destinés à un pays tiers après un transit immédiat par l’Union ou après avoir été entreposés dans celle-ci conformément à l’article 12, paragraphe 4, et à l’article 13 de la directive 97/78/CE, n’est autorisée que si les lots satisfont aux conditions suivantes:
a) ils proviennent des pays tiers, territoires ou parties de pays tiers ou territoires énumérés dans les colonnes 1, 2 et 3 du tableau de l’annexe II, partie 1, pour lesquels la colonne 4 dudit tableau mentionne un modèle de certificat vétérinaire propre au type de lots concerné;
b) ils satisfont aux exigences de police sanitaire spécifiques qui leur sont applicables, et qui sont énoncées dans le modèle de certificat vétérinaire visé au point a);
c) ils sont accompagnés d’un certificat vétérinaire établi conformément au modèle de certificat vétérinaire figurant à l’annexe III, rempli et signé par un vétérinaire officiel du pays tiers exportateur;
d) ils sont certifiés acceptables pour le transit, y compris, le cas échéant, pour l’entreposage, dans le document vétérinaire commun d’entrée visé à l’article 2, paragraphe 1, du règlement (CE) no 136/2004 de la Commission ( 10 ), signé par le vétérinaire officiel du poste d’inspection frontalier d’introduction dans l’Union.
Article 17
Dérogation relative au transit par la Lettonie, la Lituanie et la Pologne
1. Par dérogation à l’article 16, le transit routier ou ferroviaire par l’Union, entre les postes d’inspection frontaliers lettons, lituaniens et polonais désignés, énumérés dans la décision 2009/821/CE de la Commission ( 11 ), de lots en provenance et à destination de Russie, directement ou via un autre pays tiers, est autorisé si les conditions suivantes sont remplies:
a) le lot est scellé au moyen d’un cachet portant un numéro d’ordre au poste d’inspection frontalier d’introduction dans l’Union par les services vétérinaires de l’autorité compétente;
b) les documents accompagnant le lot, visés à l’article 7 de la directive 97/78/CE, sont marqués sur chaque page, par le vétérinaire officiel de l’autorité compétente responsable du poste d’inspection frontalier d’introduction dans l'Union, d’un cachet portant la mention «UNIQUEMENT POUR TRANSIT PAR L’UE À DESTINATION DE LA RUSSIE»;
c) les exigences procédurales prévues à l’article 11 de la directive 97/78/CE sont remplies;
d) le lot est certifié acceptable pour le transit dans le document vétérinaire commun d’entrée signé par le vétérinaire officiel du poste d’inspection frontalier d’introduction dans l’Union.
2. Le déchargement et l’entreposage au sens de l’article 12, paragraphe 4, ou de l’article 13 de la directive 97/78/CE de ces lots sur le territoire de l’Union ne sont pas autorisés.
3. L’autorité compétente effectue régulièrement des contrôles afin de vérifier que le nombre de lots et les quantités de produits quittant le territoire de l’Union correspondent au nombre et aux quantités qui y ont été introduits.
Article 17 bis
Dérogation pour le transit par la Croatie de lots en provenance de Bosnie-Herzégovine destinés à des pays tiers
1. Par dérogation à l’article 16, le transit routier direct par l’Union, entre les postes d’inspection frontaliers de Nova Sela et de Ploče, de lots en provenance de Bosnie-Herzégovine à destination de pays tiers est autorisé si les conditions suivantes sont remplies:
a) le lot est scellé par le vétérinaire officiel au poste d’inspection frontalier d’entrée au moyen d’un sceau portant un numéro d’ordre;
b) les documents accompagnant le lot, visés à l’article 7 de la directive 97/78/CE, portent, sur chaque page, la mention «UNIQUEMENT POUR TRANSIT PAR L’Union européenne À DESTINATION DE PAYS TIERS», apposée au moyen d’un cachet par le vétérinaire officiel au poste d’inspection frontalier d’entrée;
c) les exigences procédurales prévues à l’article 11 de la directive 97/78/CE sont respectées;
d) le vétérinaire officiel du poste d’inspection frontalier d’entrée a certifié que le lot était acceptable pour le transit sur le document vétérinaire commun d’entrée prévu à l’article 2, paragraphe 1, du règlement (CE) no 136/2004.
2. Le déchargement et l’entreposage de ces lots, au sens de l’article 12, paragraphe 4, ou de l’article 13 de la directive 97/78/CE, ne sont pas autorisés sur le territoire de l’Union.
3. L’autorité compétente effectue régulièrement des contrôles afin de vérifier que le nombre de lots et les quantités de produits quittant le territoire de l’Union correspondent au nombre et aux quantités qui y ont été introduites.
CHAPITRE IV
DISPOSITIONS GÉNÉRALES, TRANSITOIRES ET FINALES
Article 18
Certification
Les certificats vétérinaires requis par le présent règlement sont remplis conformément aux notes explicatives de l’annexe V.
Néanmoins, cette disposition n’exclut pas la possibilité qu’il soit recouru à la certification électronique ou à d’autres systèmes agréés, harmonisés au niveau de l’Union.
Article 19
Dispositions transitoires
Pendant une période de transition expirant le 31 mai 2011, les lots d’animaux vivants, à l’exception des lots d’apidés en provenance de l’État d’Hawaii, et les lots de viandes fraîches destinés à la consommation humaine certifiés avant le 30 novembre 2010 conformément aux décisions 79/542/CEE et 2003/881/CE peuvent continuer d’être introduits dans l’Union.
Article 20
Abrogation
La décision 2003/881/CE est abrogée.
Article 21
Entrée en vigueur
Le présent règlement entre en vigueur le vingtième jour suivant celui de sa publication au Journal officiel de l’Union européenne.
Le présent règlement est obligatoire dans tous ses éléments et directement applicable dans tout État membre.
ANNEXE I
ONGULÉS
PARTIE 1
Liste des pays tiers, territoires ou parties de pays tiers ou territoires (1)
|
Code ISO et nom du pays tiers |
Code du territoire |
Description du pays tiers, du territoire ou de la partie de l’un de ceux-ci |
Certificat vétérinaire |
Conditions spécifiques |
|
|
Modèle(s) |
GS |
||||
|
1 |
2 |
3 |
4 |
5 |
6 |
|
▼M28 ————— |
|||||
|
CA — Canada |
CA-0 |
Ensemble du pays |
POR-X, BOV-X, OVI-X, OVI-Y, RUM (2) |
|
IVb IX V XIII (6) |
|
CH – Suisse |
CH-0 |
Ensemble du pays |
|
|
|
|
CL – Chili |
CL-0 |
Ensemble du pays |
BOV-X, OVI-X, RUM |
|
|
|
POR-X, SUI |
B |
||||
|
GL – Groenland |
GL-0 |
Ensemble du pays |
OVI-X, RUM |
|
V |
|
▼M16 ————— |
|||||
|
IS – Islande |
IS-0 |
Ensemble du pays |
BOV-X, BOV-Y RUM, OVI-X, OVI-Y |
|
|
|
POR-X, POR-Y |
B |
||||
|
ME – Monténégro |
ME-0 |
Ensemble du pays |
|
|
I |
|
MK – Ancienne République yougoslave de Macédoine (4) |
MK-0 |
Ensemble du pays |
|
|
I |
|
NZ – Nouvelle-Zélande |
NZ-0 |
Intégralité du pays |
BOV-X, BOV-Y, RUM, POR-X, POR-Y OVI-X, OVI-Y |
|
III V XII |
|
PM – Saint-Pierre-et-Miquelon |
PM-0 |
Ensemble du pays |
BOV-X, BOV-Y, RUM, OVI-X, OVI-Y CAM |
|
|
|
RS – Serbie (5) |
RS-0 |
Ensemble du pays |
|
|
I |
|
RU – Russie |
RU-0 |
Ensemble du pays |
|
|
|
|
RU-1 |
Ensemble du pays, à l’exception de la région de Kaliningrad |
|
|
|
|
|
RU-2 |
Région de Kaliningrad |
BOV-X-TRANSIT-RU |
|
X |
|
|
US – États-Unis |
US-0 |
Ensemble du pays |
POR-X |
D |
|
|
(*1) Sans préjudice des exigences spécifiques de certification prévues par tout accord conclu par l’Union avec des pays tiers. (*2) Uniquement pour les animaux vivants autres que les animaux appartenant à l’espèce des cervidés. (*3) Certificats prévus par l’accord entre la Communauté européenne et la Confédération suisse relatif aux échanges de produits agricoles (JO L 114 du 30.4.2002, p. 132). (*4) Ancienne République yougoslave de Macédoine: la nomenclature définitive pour ce pays sera adoptée à la suite de la conclusion des négociations en cours à cet égard aux Nations unies. (*5) Sans le Kosovo, conformément à la résolution 1244/1999 du Conseil de sécurité des Nations unies. (*6) ►M28 Canada: conformément au «Code sanitaire pour les animaux terrestres» de l'OIE, la période durant laquelle le pays est saisonnièrement indemne de fièvre catarrhale du mouton est comprise entre le 1er novembre et le 15 mai. ◄ |
|||||
Conditions spécifiques (voir les notes de bas de page de chaque certificat):
|
«I» |
: |
pour le transit par le territoire d’un pays tiers d’animaux vivants destinés à un abattage immédiat ou de bovins vivants destinés à l’engraissement, expédiés d’un État membre à destination d’un autre État membre dans des camions sous scellés numérotés. Le numéro des scellés doit être inscrit sur le certificat sanitaire établi conformément au modèle figurant à l’annexe F de la directive 64/432/CEE ( 12 ) pour ce qui concerne les animaux vivants de l’espèce bovine destinés à l’abattage et à l’engraissement, et conformément au modèle I figurant à l’annexe E de la directive 91/68/CEE ( 13 ) pour ce qui concerne les animaux des espèces ovine et caprine destinés à l’abattage. En outre, les scellés doivent être intacts à l’arrivée au poste d’inspection frontalier d’entrée dans l’Union désigné et le numéro des scellés doit être enregistré dans le système informatique vétérinaire intégré de l’Union (TRACES). Au point de sortie de l’Union et avant le transit par le territoire d’un ou de plusieurs pays tiers, l’autorité vétérinaire compétente doit apposer sur le certificat un cachet portant la mention: «UNIQUEMENT POUR TRANSIT ENTRE DES PARTIES DE L’UNION EUROPÉENNE PAR LE TERRITOIRE DE L’ANCIENNE RÉPUBLIQUE YOUGOSLAVE DE MACÉDOINE/DU MONTÉNÉGRO/DE LA SERBIE ( *1 ) ( *2 )». Les bovins destinés à l’engraissement doivent être transportés directement jusqu’à l’exploitation de destination désignée par l’autorité vétérinaire compétente du lieu de destination. Ils ne peuvent quitter ladite exploitation que pour un abattage immédiat. |
|
«II» |
: |
territoire reconnu officiellement indemne de tuberculose aux fins de l’exportation vers l’Union d’animaux vivants certifiés conformément au modèle de certificat BOV-X. |
|
«III» |
: |
territoire reconnu officiellement indemne de brucellose aux fins de l’exportation vers l’Union d’animaux vivants certifiés conformément au modèle de certificat BOV-X. |
|
«IVa» |
: |
territoire reconnu officiellement indemne de leucose bovine enzootique (LBE) aux fins de l’exportation vers l’Union d’animaux vivants certifiés conformément au modèle de certificat BOV-X. |
|
«IVb» |
: |
troupeaux reconnus officiellement indemnes de leucose bovine enzootique (LBE) selon des exigences équivalentes à celles établies à l’annexe D de la directive 64/432/CEE aux fins de l’exportation vers l’Union d’animaux vivants certifiés conformément au modèle de certificat BOV-X. |
|
«V» |
: |
territoire reconnu officiellement indemne de brucellose aux fins de l’exportation vers l’Union d’animaux vivants certifiés conformément au modèle de certificat OVI-X. |
|
«VI» |
: |
contraintes géographiques. |
|
«VII» |
: |
territoire reconnu officiellement indemne de tuberculose aux fins de l’exportation vers l’Union d’animaux vivants certifiés conformément au modèle de certificat RUM. |
|
«VIII» |
: |
territoire reconnu officiellement indemne de brucellose aux fins de l’exportation vers l’Union d’animaux vivants certifiés conformément au modèle de certificat RUM. |
|
«IX» |
: |
territoire reconnu officiellement indemne de maladie d’Aujeszky aux fins de l’exportation vers l’Union d’animaux vivants certifiés conformément au modèle de certificat POR-X. |
|
«X» |
: |
uniquement pour le transit, par la Lituanie, de bovins destinés à l’élevage et/ou à la rente de la région de Kaliningrad vers d’autres régions de la Russie. |
|
«XI» |
: |
exploitations ou compartiments dont il est reconnu qu'ils appliquent des conditions d'hébergement contrôlées conformément à l'article 8 du règlement (CE) no 2075/2005. |
|
«XII» |
: |
territoire reconnu comme ayant des troupeaux bovins officiellement déclarés indemnes de tuberculose, équivalents à ceux reconnus sur la base des conditions énoncées à l'annexe A, partie I, paragraphes 1 et 2, de la directive 64/432/CEE aux fins de l'exportation vers l'Union d'animaux vivants certifiés conformément aux modèles de certificats vétérinaires BOV–X ou BOV–Y. |
|
«XIII» |
: |
territoire reconnu comme bénéficiant du statut officiel de zone saisonnièrement indemne de fièvre catarrhale du mouton aux fins de l'exportation vers l'Union d'animaux vivants certifiés conformément au modèle de certificat BOV-X, OVI-X, OVI-Y ou RUM. |
PARTIE 2
Modèles de certificat vétérinaire
Modèles
|
«BOV-X» |
: |
modèle de certificat vétérinaire relatif aux bovins domestiques (comprenant les espèces des genres Bison et Bubalus ainsi que leurs hybrides) destinés à l’élevage et/ou à la rente après importation. |
|
«BOV-Y» |
: |
modèle de certificat vétérinaire relatif aux bovins domestiques (comprenant les espèces des genres Bison et Bubalus ainsi que leurs hybrides) destinés à l’abattage immédiat après importation. |
|
«BOV-X-TRANSIT-RU» |
: |
modèle de certificat vétérinaire relatif aux bovins domestiques (comprenant les espèces des genres Bison et Bubalus ainsi que leurs hybrides) pour le transit, par le territoire de la Lituanie, de la région de Kaliningrad vers d’autres régions de la Russie. |
|
«OVI-X» |
: |
modèle de certificat vétérinaire relatif aux ovins (Ovis aries) et aux caprins (Capra hircus) domestiques destinés à l’élevage et/ou à la rente après importation. |
|
«OVI-Y» |
: |
modèle de certificat vétérinaire relatif aux ovins (Ovis aries) et aux caprins (Capra hircus) domestiques destinés à l’abattage immédiat après importation. |
|
«POR-X» |
: |
modèle de certificat vétérinaire relatif aux porcins domestiques (Sus scrofa) destinés à l’élevage et/ou à la rente après importation, ou destinés à transiter par l’Union entre deux pays tiers. |
|
«POR-Y» |
: |
modèle de certificat vétérinaire relatif aux porcins (Sus scrofa) domestiques destinés à l’abattage immédiat après importation. |
|
«RUM» |
: |
modèle de certificat vétérinaire relatif aux animaux appartenant à l’ordre Artiodactyla [à l’exception des bovins (comprenant les espèces des genres Bison et Bubalus ainsi que leurs hybrides) Ovis aries, Capra hircus, Suidae et Tayassuidae] et aux familles Rhinocerotidae et Elephantidae. |
|
«SUI» |
: |
modèle de certificat vétérinaire relatif aux espèces non domestiques des familles Suidae, Tayassuidae et Tapiridae. |
|
«CAM» |
: |
modèle d’attestation spécifique pour les animaux importés de Saint-Pierre-et-Miquelon dans les conditions prévues à l’annexe I, partie 7. |
GS (garanties supplémentaires)
|
«A» |
: |
garanties relatives aux tests de dépistage de la fièvre catarrhale du mouton et de la maladie hémorragique épizootique effectués sur des animaux certifiés conformément aux modèles de certificats vétérinaires BOV-X [point II.2.1 d)], OVI-X [point II.2.1 d)] et RUM [point II.2.1 c)]. |
|
«B» |
: |
garanties relatives aux tests de dépistage de la maladie vésiculeuse du porc et de la peste porcine classique effectués sur des animaux certifiés conformément aux modèles de certificats vétérinaires POR-X (point II.2.4 B), et SUI (point II.2.4 B). |
|
«C» |
: |
garanties relatives au test de dépistage de la brucellose effectué sur des animaux certifiés conformément aux modèles de certificats vétérinaires POR-X (point II.2.4 C) et SUI (point II.2.4 C). |
|
«D» |
: |
garanties relatives au test de dépistage de la stomatite vésiculeuse effectué sur des animaux certifiés conformément au modèle de certificat vétérinaire POR-X [point II.2.1 b)]. |
Modèle BOV-X










Modèle BOV-X-TRANSIT-RU
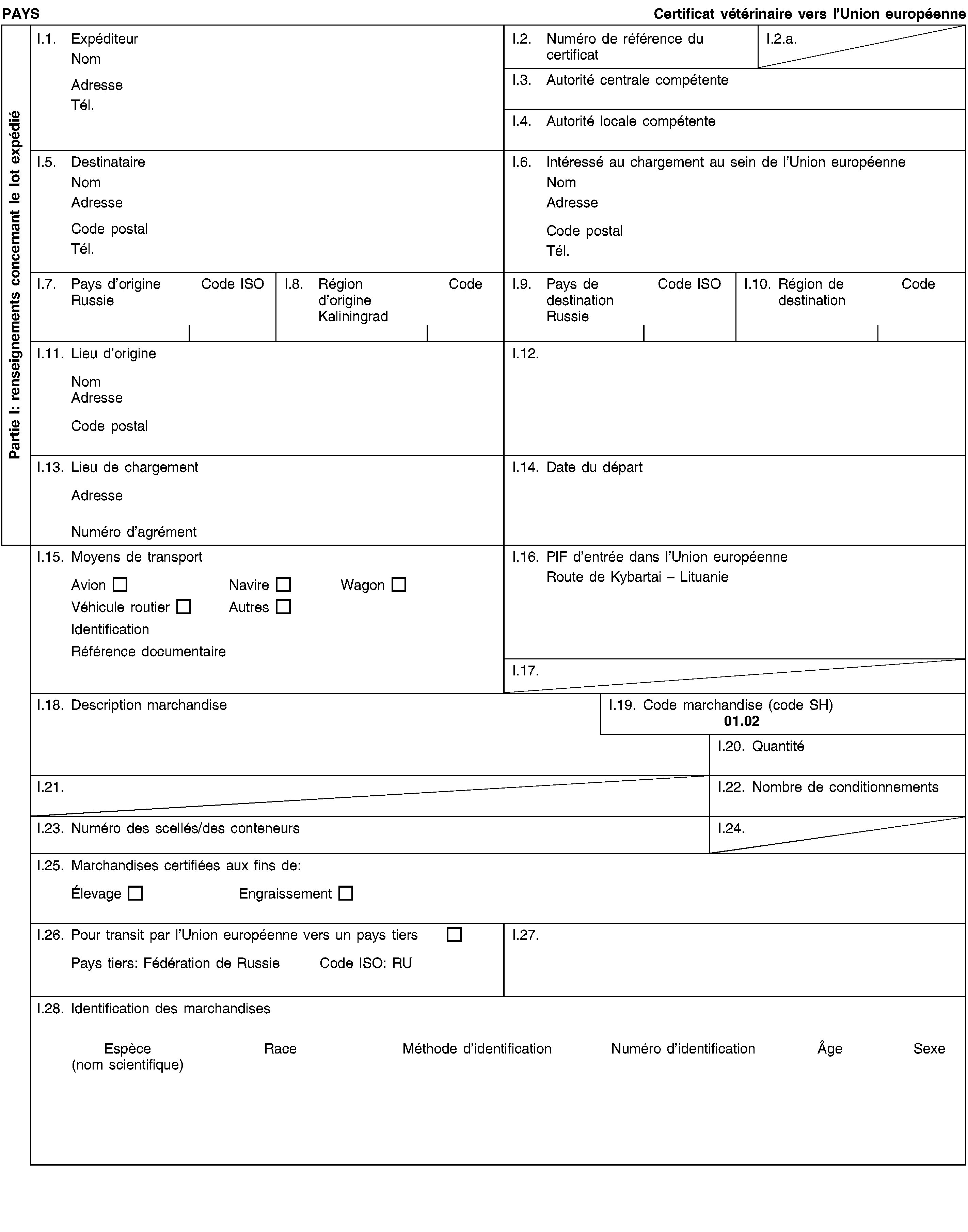


Modèle OVI-X







Modèle OVI-Y
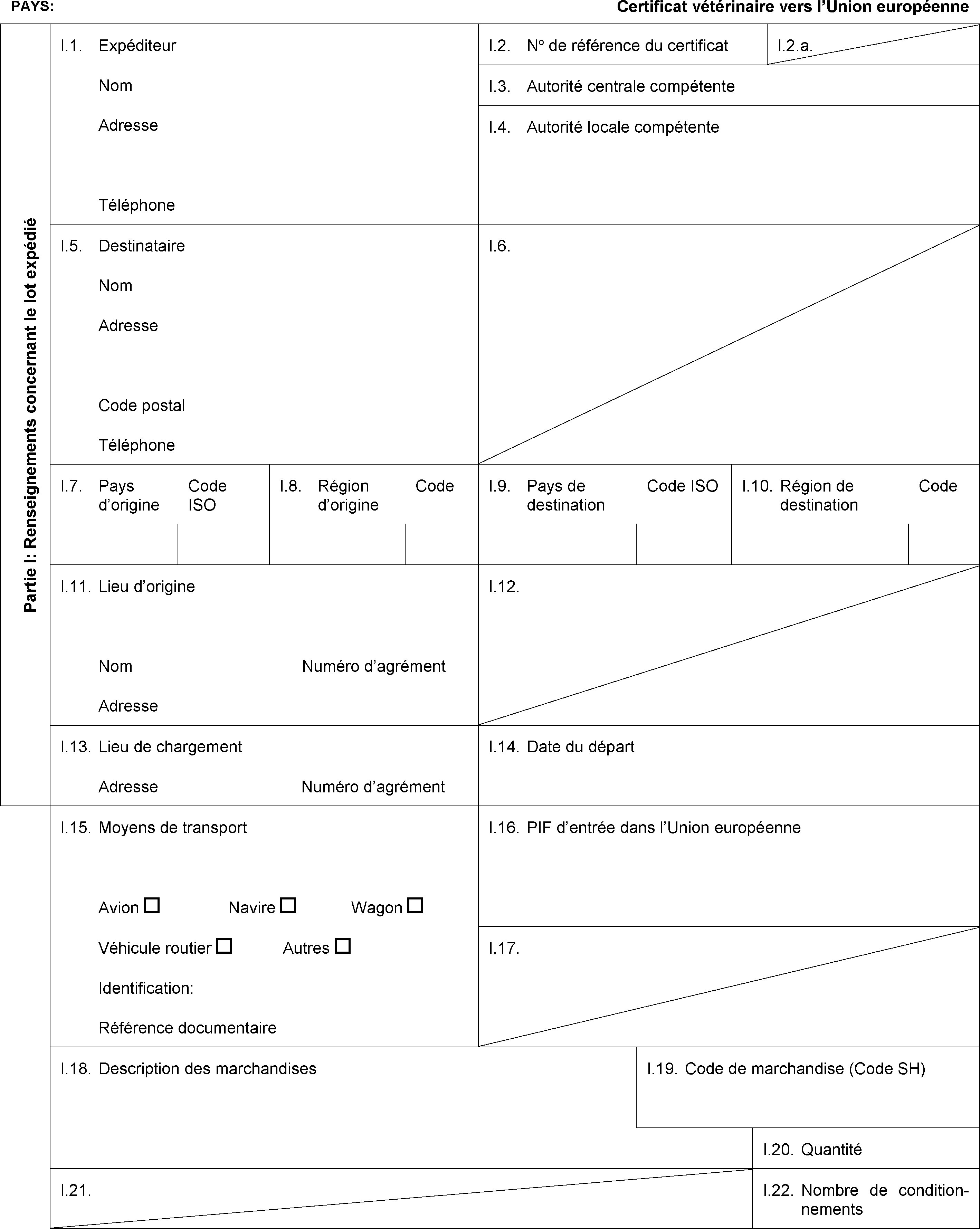




Modèle POR-X








Modèle RUM







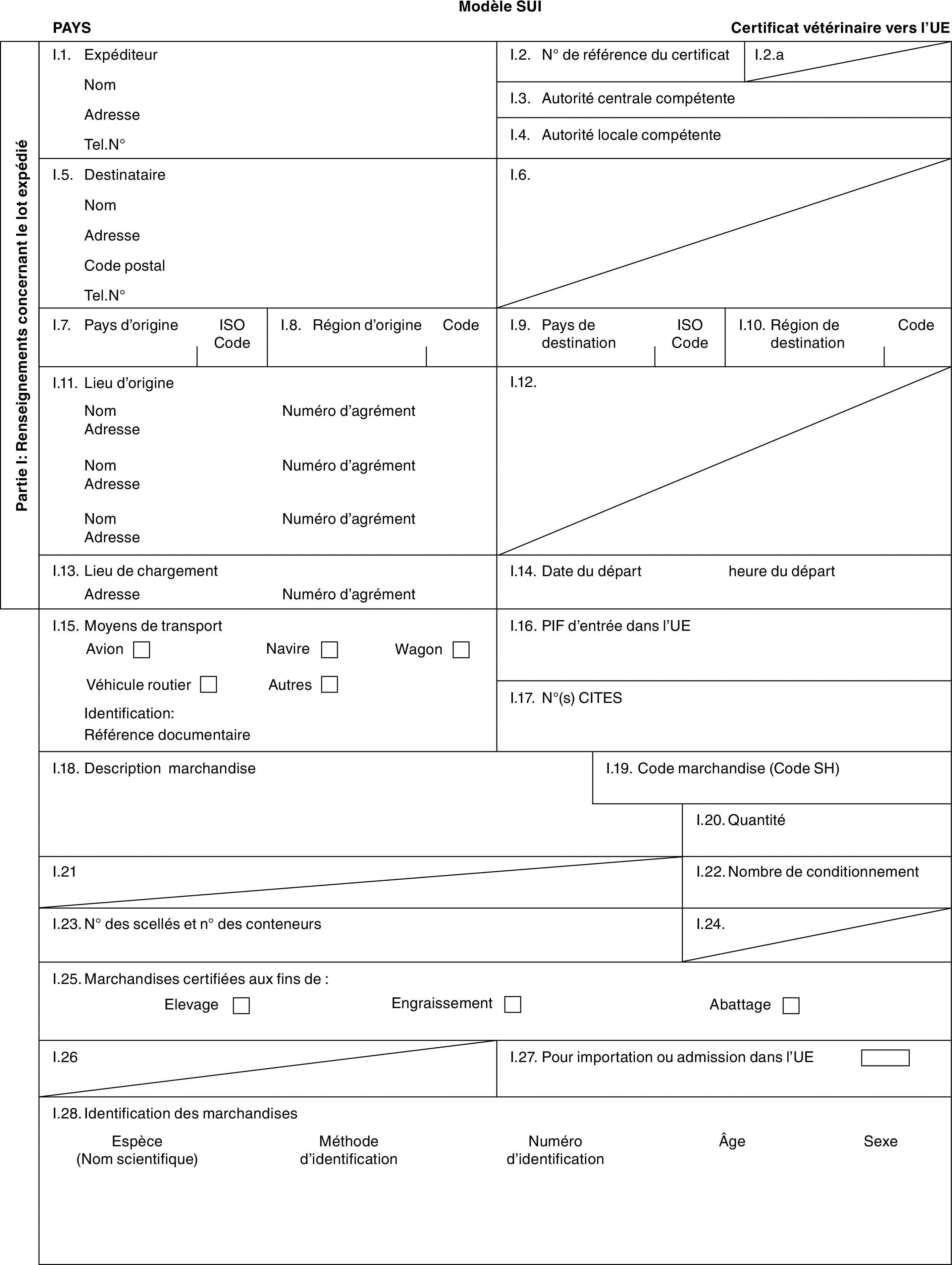







PARTIE 3
Addendum relatif au transport d’animaux par voie maritime
(À remplir et à annexer au certificat vétérinaire lorsque l’acheminement jusqu’à la frontière de l’Union s’effectue, même partiellement, par voie maritime)
|
Déclaration du capitaine du navire |
|
|
Je soussigné, capitaine du navire (nom: …), déclare que les animaux mentionnés dans le certificat vétérinaire no … ci-joint ont séjourné à bord du navire durant le trajet entre …, en/au(x)/à … (pays exportateur), et …, sur le territoire de l’Union, et que le navire, durant son voyage vers l’Union, n’a fait escale dans aucun lieu situé à l’extérieur de(s)/du … (pays exportateur), autre que: … (ports d’escale). Par ailleurs, ces animaux n’ont pas été en contact, durant le trajet, avec d’autres animaux relevant d’un statut sanitaire inférieur. Fait à …, le … |
|
|
(Port d’arrivée) |
(Date d’arrivée) |
|
(Cachet) |
(Signature du capitaine) |
|
(Nom en lettres capitales et titre) |
|
PARTIE 4
Addendum relatif au transport d’animaux par voie aérienne
(À remplir et à annexer au certificat vétérinaire lorsque l’acheminement jusqu’à la frontière de l’Union s’effectue, même partiellement, par voie aérienne)
|
Déclaration du commandant de bord |
|
|
Je soussigné, commandant de bord de l’avion (nom: …), déclare que la caisse ou le conteneur et les alentours de la caisse ou du conteneur contenant les animaux mentionnés dans le certificat vétérinaire no … ci-joint ont été vaporisés au moyen d’un insecticide avant le départ. Fait à …, le … |
|
|
(Aéroport de départ) |
(Date de départ) |
|
(Cachet) |
(Signature du commandant) |
|
(Nom en lettres capitales et titre) |
|
PARTIE 5
Conditions d’agrément des centres de rassemblement (visées à l’article 4)
Pour être agréés, les centres de rassemblement doivent répondre aux exigences énoncées ci-après.
I. Ils doivent être sous le contrôle d’un vétérinaire officiel.
II. Ils doivent tous être situés au centre d’une zone d’au moins 20 km de diamètre dans laquelle, selon des constatations officielles, aucun cas de fièvre aphteuse ne s’est déclaré au cours des trente jours au minimum qui ont précédé leur utilisation.
III. Ils doivent, avant chacune de leurs utilisations comme centres de rassemblement agréés, être nettoyés et désinfectés à l’aide d’un désinfectant officiellement autorisé dans le pays exportateur en tant que moyen de lutte efficace contre la fièvre aphteuse.
IV. Ils doivent disposer, compte tenu de leur capacité d’accueil:
a) d’une installation exclusivement affectée à la fonction de centre de rassemblement;
b) d’installations appropriées, faciles à nettoyer et à désinfecter, pour charger et décharger les animaux, les héberger convenablement, les abreuver, les nourrir et leur administrer tout traitement dont ils doivent faire l’objet;
c) d’installations appropriées pour les inspections et l’isolement;
d) d’un équipement approprié pour le nettoyage et la désinfection des locaux et des camions;
e) d’une surface de stockage suffisante pour le fourrage, la litière et le fumier;
f) d’un système adéquat pour la collecte et l’élimination des eaux usées;
g) d’un cabinet pour le vétérinaire officiel.
V. Lorsqu’ils exercent leurs activités, ils doivent disposer d’un nombre de vétérinaires leur permettant d’accomplir les tâches énoncées dans la partie 5.
VI. Ils ne peuvent accepter que des animaux identifiés individuellement afin de garantir la traçabilité. À cet effet, lorsque des animaux sont admis, le propriétaire ou la personne responsable du centre doit veiller à ce qu’ils soient identifiés de façon adéquate et accompagnés des documents sanitaires ou des certificats appropriés pour l’espèce et les catégories concernées.
En outre, le propriétaire ou la personne responsable du centre de rassemblement doit consigner dans un registre ou dans une base de données, et conserver pendant une période minimale de trois ans, le nom du propriétaire, l’origine, les dates d’entrée et de sortie, le numéro d’identification des animaux ou le numéro d’enregistrement du troupeau d’origine et l’exploitation de destination, ainsi que le numéro d’enregistrement du transporteur et le numéro d’enregistrement du camion qui décharge ou charge les animaux dans le centre de rassemblement.
VII. Tous les animaux passant par le centre de rassemblement doivent répondre aux conditions sanitaires prévues pour l’introduction dans l’Union de la catégorie d’animaux concernée.
VIII. Les animaux à introduire dans l’Union qui passent par un centre de rassemblement doivent, dans les six jours qui suivent leur arrivée au centre de rassemblement, être chargés et acheminés directement jusqu’à la frontière du pays exportateur:
a) sans entrer en contact avec des biongulés autres que ceux qui remplissent les conditions sanitaires fixées pour l’introduction de la catégorie concernée d’animaux dans l’Union;
b) répartis en lots de telle sorte qu’aucun lot ne contienne à la fois des animaux d’élevage ou de rente et des animaux destinés à l’abattage immédiat;
c) dans des véhicules de transport ou des conteneurs préalablement nettoyés et désinfectés à l’aide d’un désinfectant officiellement autorisé dans le pays exportateur en tant que moyen de lutte efficace contre la fièvre aphteuse, et construits de telle sorte que les fèces, l’urine, la litière ou le fourrage ne puissent s’écouler ou tomber pendant le transport.
IX. Lorsque les conditions prévues pour l’exportation d’animaux vers l’Union requièrent qu’un test soit effectué dans un délai précis avant le chargement, ce délai doit englober toute période de rassemblement, limitée à six jours, consécutive à l’arrivée des animaux dans le centre de rassemblement agréé.
X. Le pays tiers exportateur doit désigner les centres agréés pour les animaux d’élevage ou de rente et les centres agréés pour les animaux de boucherie et notifier à la Commission, ainsi qu’aux autorités centrales compétentes des États membres, les noms et adresses de ces installations. Ces informations doivent être mises à jour régulièrement.
XI. Le pays tiers exportateur règle les modalités du contrôle officiel des centres de rassemblement agréés et s’assure de l’exécution de ce contrôle.
XII. L’autorité compétente du pays tiers doit inspecter régulièrement les centres de rassemblement agréés afin de vérifier qu’ils continuent à remplir les conditions d’agrément énoncées aux points I à XI.
S’il ressort de ces inspections que ces conditions ne sont plus remplies, l’agrément du centre doit être suspendu. L’agrément ne peut être rétabli que lorsque l’autorité compétente du pays tiers s’est assurée que le centre satisfait entièrement aux conditions énoncées aux points I à XI.
PARTIE 6
Protocoles de normalisation des matériels et méthodes de test
(visés à l’article 5)
Tuberculose (TBL)
L’intradermotuberculination simple avec de la tuberculine bovine est effectuée conformément à l’annexe B de la directive 64/432/CEE. Dans le cas des suidés, la tuberculination intradermique simple utilisant la tuberculine aviaire doit être effectuée conformément à l’annexe B de la directive 64/432/CEE, si ce n’est que le point d’injection se situe sur la peau flasque à la base de l’oreille.
La séro-agglutination, la réaction de fixation du complément, l’épreuve à l’antigène brucellique tamponné, les essais d’immuno-absorption enzymatique (ELISA) et le test de polarisation de fluorescence (FPA) doivent être effectués conformément à l’annexe C de la directive 64/432/CEE.
Brucellose (Brucella melitensis) (BRL)
Les tests doivent être effectués conformément à l’annexe C de la directive 91/68/CEE.
Leucose bovine enzootique (LBE)
Le test d’immunodiffusion en gélose et l’épreuve d’immuno-absorption enzymatique (ELISA) doivent être effectués conformément à l’annexe D, chapitre II, points A et C, de la directive 64/432/CEE.
Fièvre catarrhale du mouton (FC)
|
A) |
L’épreuve ELISA bloquante ou de compétition est effectuée conformément au protocole suivant. L’épreuve ELISA de compétition, qui utilise l’anticorps monoclonal 3-17-A3, permet de détecter les anticorps de tous les sérotypes connus du virus de la fièvre catarrhale (VFC). Le principe de l’épreuve consiste dans l’interruption de la réaction entre l’antigène du VFC et un anticorps monoclonal spécifique au groupe (3-17-A3) par l’ajout de sérum d’épreuve. Les anticorps du VFC présents dans le sérum d’épreuve bloquent la réactivité de l’anticorps monoclonal (AcM) et entraînent une réduction du développement escompté de la couleur après ajout d’un anticorps antisouris marqué par un enzyme et de substrat/chromogène. Les sérums peuvent être testés à une seule dilution de 1/5 (méthode du test ponctuel - appendice 1) ou être titrés (méthode de titrage du sérum - appendice 2) afin de définir les points de dilution limite. Des valeurs d’inhibition supérieures à 50 % peuvent être considérées comme positives. Matériels et réactifs 1. Plaques de microtitrage ELISA appropriées. 2. Antigène: fourni sous forme de concentré cellulaire, préparé selon la procédure indiquée ci-dessous et conservé à une température de – 20 °C ou de – 70 °C. 3. Tampon bloquant: solution saline tamponnée au phosphate (PBS) contenant 0,3 % de sérum bovin adulte négatif du virus de la fièvre catarrhale, 0,1 % (v/v) de Tween 20 (fourni sous forme de sirop de polyoxyéthylène sorbiton monolaurate) dans du PBS. 4. Anticorps monoclonal: 3-17-A3 (fourni sous forme de surnageant de culture tissulaire hybridome) dirigé contre le polypeptide VP7 spécifique, stocké à – 20 °C ou lyophilisé et dilué à 1/100 avec un tampon bloquant avant utilisation. 5. Conjugué: globuline de lapin anti-souris (adsorbée et éluée), conjuguée à de la peroxydase de raifort et conservée à l’obscurité à 4 °C. 6. Chromogène et substrat: orthophényle-diamine (chromogène OPD) dont la concentration finale est de 0,4 mg/ml dans de l’eau distillée stérile. Peroxyde d’hydrogène (substrat 30 % p/v), 0,05 % v/v ajouté immédiatement avant utilisation (5 μl de H2O2/10 ml d’OPD). (Manipuler l’OPD avec précaution - Porter des gants en caoutchouc - Produit suspecté d’être mutagène). 7. Acide sulfurique à 1 mole: 26,6 ml d’acide ajouté à 473,4 ml d’eau distillée. (Attention: toujours ajouter l’acide à l’eau, jamais l’eau à l’acide.) 8. Agitateur orbital. 9. Lecteur de plaque ELISA (l’épreuve peut être lue visuellement). Schéma de l’épreuve Cc: Contrôle conjugué (pas de sérum/pas d’anticorps monoclonal); C++: Sérum témoin fortement positif; C+: Sérum témoin faiblement positif; C–: Sérum témoin négatif; Cm: Contrôle de l’anticorps monoclonal (sans sérum).
APPENDICE 1 Dilution unique (1/5) - Schéma (40 sérums/plaque)
APPENDICE 2 Schéma de titrage du sérum (10 sérums/plaque)
Protocole d’essai
Mode opératoire 1. Diluer l’antigène du VFC à la concentration prétitrée dans du PBS. Agiter brièvement (par agitateur à ultrasons) pour disperser les agrégats de virus (à défaut d’appareil, agiter vigoureusement à la pipette) et en ajouter 50 μl dans tous les puits de la plaque ELISA. Tapoter les bords de la plaque pour disperser l’antigène. 2. Incuber pendant une heure à 37 °C dans un agitateur orbital. Laver les plaques trois fois par rinçage, vider les loges avec du PBS non stérile et sécher à l’aide de papier buvard. 3. Puits de contrôle: ajouter 100 μl de tampon de blocage aux puits Cc. Ajouter 50 μl de sérums positif et négatif de contrôle, à une dilution de 1/5 (10 μl de sérum + 40 μl de tampon de blocage), aux puits C–, C+ et C++, respectivement. Ajouter 50 μl de tampon de blocage aux puits de contrôle AcM. Méthode de titrage ponctuelle: ajouter au tampon de blocage une dilution à 1/5 de chaque sérum d’épreuve afin de doubler les puits des colonnes 3 à 12 (10 μl de sérums + 40 μl de tampon de blocage), ou Méthode de titrage du sérum: préparer une série de dilutions de raison 2 de chaque échantillon d’épreuve (de 1/5 à 1/640) dans un tampon de blocage dans huit puits de chacune des colonnes 3 à 12. 4. Immédiatement après l’ajout des sérums d’épreuve, diluer l’AcM à 1/100 dans un tampon bloquant et ajouter 50 μl à tous les puits de la plaque, sauf le contrôle à blanc. 5. Incuber pendant une heure à 37 °C dans un agitateur orbital. Laver trois fois avec du PBS et sécher à l’aide de papier buvard. 6. Diluer le concentré de lapin antisouris à 1/5 000 dans un tampon bloquant et ajouter 50 μl dans tous les puits de la plaque. 7. Incuber pendant une heure à 37 °C dans un agitateur orbital. Laver trois fois avec du PBS et sécher à l’aide de papier buvard. 8. Décongeler le dichlorhydrate d’o-phénylènediamine (OPD) et, immédiatement avant utilisation, ajouter 5 μl de peroxyde d’hydrogène à 30 % à chaque quantité de 10 ml d’OPD. Ajouter 50 μl dans tous les puits de la plaque. Attendre le développement de la couleur pendant environ 10 minutes et arrêter la réaction à l’aide de l’acide sulfurique à 1 mole (50 μl par puits). La couleur devrait se développer dans les puits de contrôle AcM et dans les puits contenant des sérums sans anticorps du VFC. 9. Examiner et enregistrer les plaques soit visuellement, soit à l’aide d’un lecteur spectrophotométrique. Analyse des résultats À l’aide d’un logiciel, imprimer les valeurs de densité optique (DO) et le pourcentage d’inhibition (PI) des sérums à tester et des sérums témoins sur la base de la valeur moyenne enregistrée dans les puits témoins d’antigène. Les valeurs DO et PI sont utilisées pour déterminer si le test a été exécuté dans des limites acceptables. Les limites supérieure (UCL) et inférieure (LCL) de contrôle de l’AcM (antigène plus AcM en l’absence de sérum à tester) se situent entre les valeurs 0,4 et 1,4 de DO. Toute plaque non conforme aux critères précités doit être rejetée. En l’absence d’un logiciel informatique, imprimer les valeurs DO avec l’imprimante ELISA. Calculer la valeur moyenne de densité optique pour les puits témoins d’antigène, qui équivaut à la valeur à 100 %. Déterminer la valeur DO à 50 % et calculer manuellement la positivité ou la négativité de chaque échantillon. Pourcentage de la valeur d’inhibition (PI) = 100 – (DO de chaque témoin testé/DO moyenne de Cm) × 100. Les puits de sérum témoin négatif dédoublés et les puits de contrôle à blanc dédoublés doivent enregistrer des valeurs PI comprises entre + 25 % et – 25 % et entre + 95 % et + 105 % respectivement. Le non-respect de ces limites n’a pas pour effet d’invalider les résultats de la plaque, mais il laisse supposer la formation d’une couleur de fond. Les sérums témoins fortement et faiblement positifs doivent enregistrer des valeurs PI comprises entre + 81 % et + 100 % et entre + 51 % et + 80 % respectivement. Le seuil de diagnostic pour les sérums à tester est de 50 % (PI de 50 % ou DO de 50 %). Les échantillons donnant des valeurs PI supérieures à 50 % sont considérés comme négatifs. Les échantillons qui présentent des valeurs PI supérieures ou inférieures au seuil pour les puits dédoublés sont considérés comme suspects; ces échantillons peuvent être retestés par test ponctuel ou par titrage. Les échantillons positifs peuvent également être titrés afin de fournir une indication du degré de positivité. Lecture visuelle: les échantillons positifs et négatifs sont facilement repérables à l’œil nu; il peut toutefois être plus difficile d’interpréter à l’œil nu les échantillons faiblement positifs ou fortement négatifs. Préparation de l’antigène du virus de la fièvre catarrhale pour l’ELISA 1. Laver trois fois 40 à 60 roux de cellules BHK-21 confluentes à l’aide d’un milieu Eagle exempt de sérum, et infecter au moyen du sérotype 1 du virus de la fièvre catarrhale dans un milieu Eagle exempt de sérum. 2. Incuber à 37 °C et examiner l’effet cytopathogène (ECP) chaque jour. 3. Lorsque l’ECP est complet dans 90 à 100 % de la plaque de cellules de chaque roux, récolter le virus par agitation pour détacher les cellules adhérant à la paroi. 4. Centrifuger à une vitesse comprise entre 2 000 et 3 000 tours/minute pour réduire les cellules en fragments. 5. Jeter la fraction surnageante et remettre les cellules en suspension dans environ 30 ml de PBS contenant 1 % de «Sarkosyl» et 2 ml de fluorure de phényl méthyl sulfonyle (tampon de lyse). Cela peut provoquer une gélification des cellules; auquel cas, il convient d’ajouter davantage de tampon de lyse pour réduire cet effet. (NB: le fluorure de phényl méthyl sulfonyle est dangereux; le manipuler avec une extrême prudence.) 6. Dissocier les cellules pendant 60 secondes à l’aide d’une sonde ultrasonique fonctionnant à une amplitude de 30 microns. 7. Centrifuger à 10 000 tours/minute pendant dix minutes. 8. Stocker la fraction surnageante à + 4 °C et remettre en suspension le fragment de cellule restant dans 10 à 20 ml de tampon de lyse. 9. Soniquer et clarifier, trois fois au total, en stockant la fraction surnageante à chaque stade. 10. Réunir les fractions surnageantes et centrifuger à 24 000 tours/minute (100,000 g) pendant 120 minutes à une température de + 4 °C sur un coussin de 5 ml de sucrose à 40 % (p/v dans du PBS) en utilisant des tubes de centrifugation Beckmann de 30 ml et un rotor SW 28. 11. Jeter la fraction surnageante, laisser les tubes s’égoutter soigneusement et remettre en suspension le fragment dans du PBS par sonication. Stocker l’antigène en fractions aliquotes à – 20 °C. Titrage de l’antigène du virus de la fièvre catarrhale pour l’ELISA L’antigène de la fièvre catarrhale pour l’ELISA est titré par la technique ELISA indirecte. Des dilutions de raison 2 d’antigène sont titrées en fonction d’une dilution constante (1/100) d’anticorps monoclonal 3-17-A3. Le protocole est le suivant: 1. Titrer l’antigène du VFC dans du PBS à une dilution de 1/20 à travers une plaque de microtitrage dans une série de dilutions de raison 2 (50 μl/puits) en utilisant une pipette multiple. 2. Incuber pendant une heure à 37 °C dans un agitateur orbital. 3. Laver trois fois les plaques à l’aide de PBS. 4. Ajouter 50 μl d’anticorps monoclonal 3-17-A3 (dilution 1/100) dans chaque puits de la plaque de microtitrage. 5. Incuber pendant une heure à 37 °C dans un agitateur orbital. 6. Laver trois fois les plaques à l’aide de PBS. 7. Ajouter 50 μl de globuline de lapin antisouris conjuguée à de la peroxydase de raifort, à une concentration prétitrée optimale, dans chaque puits de la plaque de microtitrage. 8. Incuber pendant une heure à 37 °C dans un agitateur orbital. 9. Ajouter un substrat et un chromogène comme indiqué ci-dessus. Arrêter la réaction après dix minutes par addition d’acide sulfurique à 1 mole (50 μl/puits). Dans l’essai concurrent, l’anticorps monoclonal doit se trouver en excédent; c’est pourquoi il est choisi une dilution d’antigène qui se trouve sur la courbe de titrage (non dans la zone de plateau) qui donne approximativement une DO de 0,8 après dix minutes. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
B) |
Le test d’immunodiffusion en gélose est effectué selon le protocole suivant: Antigène Préparer l’antigène précipitant dans un quelconque système de culture cellulaire compatible avec la multiplication rapide d’un sérotype de référence du virus de la fièvre catarrhale. Les cellules BHK ou Vero sont recommandées. L’antigène est présent dans le fluide surnageant à la fin de la croissance virale mais doit être concentré de 50 à 100 fois pour être efficace. On y parvient à l’aide d’une quelconque méthode de concentration protéique type; le virus de l’antigène peut être inactivé par addition de 0,3 % (v/v) de béta-Propiolactone. Sérum témoin positif connu À l’aide du sérum de référence international et d’antigène, un sérum type national est produit, standardisé en vue d’obtenir une proportion optimale par rapport au sérum de référence international, lyophilisé et utilisé comme sérum témoin connu dans chaque test. Sérum à tester
|
Maladie hémorragique épizootique (MHE)
Le test d’immunodiffusion en gélose est effectué selon le protocole suivant:
Antigène
Préparer l’antigène précipitant dans un quelconque système de culture cellulaire compatible avec la multiplication rapide du/des sérotype(s) approprié(s) du virus de la maladie hémorragique épizootique. Les cellules BHK ou Vero sont recommandées. L’antigène est présent dans le fluide surnageant à la fin de la croissance virale mais doit être concentré de 50 à 100 fois pour être efficace. On y parvient à l’aide d’une quelconque méthode de concentration protéique type; le virus de l’antigène peut être inactivé par addition de 0,3 % (v/v) de béta-Propiolactone.
Sérum témoin positif connu
À l’aide du sérum de référence international et d’antigène, un sérum type national est produit, standardisé en vue d’obtenir une proportion optimale par rapport au sérum de référence international, lyophilisé et utilisé comme sérum témoin connu dans chaque test.
Sérum à tester
|
Mode opératoire |
: |
Verser de l’agarose à 1 % dans un tampon de borate ou de barbitol de sodium, pH 8,5 à 9,0, dans une boîte de Petri à une profondeur minimale de 3,0 mm. Une séquence à tester de sept puits exempts d’humidité, de 5,0 mm de diamètre chacun, est creusée dans l’agar. Le schéma comprend un puits central et six puits disposés en un cercle d’un rayon de 3 cm. Remplir le puits central avec de l’antigène standard. Remplir les puits périphériques 2, 4 et 6 avec du sérum positif connu, les puits 1, 3 et 5 avec des sérums à tester. Le système est incubé pendant 72 heures au maximum à température ambiante dans une étuve humide fermée. |
|
Interprétation |
: |
Un sérum à tester est positif s’il forme une ligne de précipitine spécifique avec l’antigène ainsi qu’une ligne complète d’identité avec le sérum de contrôle. Un sérum à tester est négatif s’il ne forme pas de ligne spécifique avec l’antigène et n’infléchit pas la courbe du sérum témoin. Les boîtes de Petri doivent être examinées sur fond sombre et en éclairage indirect. |
Rhinotrachéite infectieuse des bovins (RIB)/vulvovaginite infectieuse pustuleuse (VIP)
|
A) |
L’épreuve de séroneutralisation doit être effectuée conformément au protocole suivant:
|
|
B) |
Tout autre test reconnu dans le contexte de la décision 2004/558/CE ( 14 ). |
Fièvre aphteuse (FA)
|
A) |
Le prélèvement d’échantillons de l’œsophage/du pharynx et leur examen doivent être effectués conformément au protocole suivant:
Milieux de transport recommandés: 1. Tampon de phosphate à 0,08 M, pH 7,2, contenant de l’albumine de sérum bovin à 0,01 %, du rouge de phénol à 0,002 % et des antibiotiques. 2. Milieu de culture tissulaire (par exemple, Eagle MEM) contenant un tampon HEPES à 0,04 M, de l’albumine de sérum bovin à 0,01 % et des antibiotiques, pH 7,2. 3. Ajouter des antibiotiques dans les quantités suivantes par ml final de milieu de transport: par exemple, pénicilline 1 000 UI, sulfate de néomycine 100 UI, polymyxine B sulfate 50 UI, mycostatine 100 UI. |
|
B) |
L’épreuve de neutralisation virale doit être effectuée conformément au protocole suivant:
|
|
C) |
La détection et la quantification de l’anticorps par la technique ELISA s’effectuent conformément au protocole suivant:
Mode opératoire: 1. Saturer les plaques ELISA avec 50 μl de sérums antiviraux de lapin et les laisser pendant une nuit dans une chambre humide à la température ambiante. 2. Dans des plaques de microtitrage à puits multiples à fond rond (plaques porteuses), préparer des séries de 50 microlitres de dilutions de raison 2, en double, pour chaque sérum à éprouver à partir de la dilution 1/4. Ajouter à chaque puits 50 microlitres d’une dose constante d’antigène et placer les mélanges à 4 °C pendant une nuit. L’addition de l’antigène réduit la dilution de départ du sérum au 1/8. 3. Laver les plaques cinq fois à l’aide de PBST. 4. Transférer ensuite 50 microlitres de mélanges sérum/antigène des plaques porteuses vers les plaques ELISA enduites de sérum de lapin et les incuber à 37 °C pendant une heure sur un agitateur rotatif. 5. Après lavage, ajouter dans chaque puits 50 μl d’antisérum de cobaye vis-à-vis de l’antigène utilisé à l’étape 4. Incuber les plaques à 37 °C pendant une heure sur un agitateur rotatif. 6. Laver les plaques et ajouter dans chaque puits 50 μl d’immunoglobuline de lapin anticobaye conjuguée à de la peroxydase de raifort. Incuber les plaques à 37 °C pendant une heure sur un agitateur rotatif. 7. Laver les plaques et ajouter dans chaque puits 50 μl d’orthophényle-diamine contenant 0,05 % de H2O2 (30 %) p/v. 8. Arrêter la réaction après quinze minutes à l’aide de H2SO4 à 1,25 M. Effectuer une lecture spectrophotométrique des plaques à 492 nm à l’aide d’un lecteur ELISA connecté à un microordinateur.
|
Maladie d’Aujeszky
|
A) |
L’épreuve de séroneutralisation doit être effectuée conformément au protocole suivant:
|
|
B) |
Tout autre test reconnu dans le contexte de la décision 2008/185/CE ( 15 ). |
Gastro-entérite transmissible (GET)
L’épreuve de séroneutralisation doit être effectuée conformément au protocole suivant:
|
Sérum |
: |
Tous les sérums sont inactivés par chauffage pendant trente minutes à 56 °C avant utilisation. |
|
Mode opératoire |
: |
Le test de séroneutralisation constante sur différents types de virus sur plaques de microtitrage est effectué avec des cellules A72 (tumeur du chien) ou d’autres systèmes de cellules sensibles. Le virus GET est utilisé à 100 DICT50 pour 0,025 ml; mélanger des échantillons de sérum non dilués inactivés avec un volume égal (0,025 ml) de suspension virale. Incuber les mélanges virus/sérum pendant 30 à 60 minutes à 37 °C sur les plaques de microtitrage avant d’ajouter les cellules appropriées. Utiliser les cellules à une concentration qui forme une monocouche complète après vingt-quatre heures. Verser 0,1 ml de suspension cellulaire dans chaque puits. |
|
Témoins |
: |
i) contrôle de l’infectiosité du virus, ii) témoins de toxicité sérique, iii) culture de cellules témoins non inoculées, iv) antisérums de référence. |
|
Interprétation |
: |
Enregistrer les résultats de l’épreuve de neutralisation et le titre du virus utilisé après trois à cinq jours d’incubation à 37 °C. Les titres sériques inférieurs à 1/2 (dilution finale) sont considérés comme négatifs. Si des échantillons de sérum non dilués sont toxiques pour les culture tissulaires, ces sérums peuvent être dilués dans la proportion de 1/2 avant d’être utilisés pour l’épreuve. Cela correspond à une dilution finale du sérum de 1/4. Les titres sériques inférieurs à 1/4 (dilution finale) sont considérés comme négatifs en l’occurrence. |
Maladie vésiculeuse du porc (MVP)
Les tests relatifs à la maladie vésiculeuse du porc (MVP) doivent être effectués conformément à la décision 2000/428/CE ( 16 ).
Peste porcine classique (PPC)
Les tests relatifs à la peste porcine classique (PPC) doivent être effectués conformément à la décision 2002/106/CE ( 17 ).
La réalisation des tests relatifs à la PPC doit être conforme aux lignes directrices énoncées dans le chapitre y afférent du Manuel des tests de diagnostic et des vaccins pour les animaux terrestres de l’OIE.
L’évaluation de la sensibilité et de la spécificité du test sérologique pour la peste porcine classique doit être réalisée dans un laboratoire national disposant d’un système d’assurance qualité. Il doit être prouvé que les tests utilisés permettent de reconnaître une gamme de sérums de référence faiblement et fortement positifs, et de détecter des anticorps en phase aiguë et en phase de convalescence.
Le test de neutralisation virale (NV) est réalisé conformément aux protocoles de dépistage de la stomatite vésiculeuse prévus au chapitre 2.1.19 du manuel des tests de diagnostic et des vaccins pour les animaux terrestres de l’OIE.
Les sérums qui inhibent l’effet cytopathogène (ECP) à des dilutions supérieures ou égales à 1:32 sont considérés comme contenant des anticorps dirigés contre le virus de la stomatite vésiculeuse.
PARTIE 7
Conditions de police sanitaire relatives à l’importation et à la quarantaine applicables aux animaux importés à Saint-Pierre-et-Miquelon moins de six mois avant leur introduction dans l’Union
(visées à l’article 6)
Espèces animales concernées
|
Taxon |
||
|
ORDRE |
FAMILLE |
GENRE ET ESPÈCE |
|
Artiodactyla |
Camelidae |
Camelus spp., Lama spp., Vicugna spp. |
CHAPITRE 1
Séjour et quarantaine
|
1. |
Les animaux importés à Saint-Pierre-et-Miquelon doivent séjourner dans une station de quarantaine agréée pendant une période minimale de 60 jours avant d’être expédiés en vue d’être introduits dans l’Union. Cette période peut être prolongée en raison des conditions des tests relatifs aux différentes espèces. En outre, les animaux doivent remplir les conditions énoncées ci-après. a) Des lots séparés peuvent entrer dans la station de quarantaine. Cependant, après leur entrée dans la station de quarantaine, tous les animaux de la même espèce se trouvant dans l’installation de quarantaine doivent être considérés comme un seul groupe, et il y est fait référence en tant que tel. La période de quarantaine doit commencer, pour l’ensemble du groupe, au moment où le dernier animal est entré dans l’installation de quarantaine. b) Dans la station de quarantaine, chaque groupe spécifique d’animaux doit être maintenu dans l’isolement, sans contact direct ni indirect avec d’autres animaux, y compris ceux provenant des autres lots qui peuvent être présents. Chaque lot doit être maintenu dans la station de quarantaine agréée et protégé des insectes vecteurs. c) Si, au cours de la période de quarantaine, un groupe d’animaux n’est pas maintenu dans l’isolement et qu’un contact a lieu avec d’autres animaux, le groupe doit être soumis à une nouvelle période de quarantaine d’une durée égale à celle initialement prévue lors de l’entrée dans la station de quarantaine. d) Les animaux devant être introduits dans l’Union qui passent par la station de quarantaine doivent être embarqués et expédiés directement vers l’Union: i) sans entrer en contact avec des animaux autres que ceux qui remplissent les conditions sanitaires fixées pour l’introduction de la catégorie concernée d’animaux dans l’Union; ii) répartis en lots de telle sorte qu’aucun lot ne puisse entrer en contact avec des animaux dont l’importation n’est pas autorisée dans l’Union; iii) dans des véhicules de transport ou des conteneurs préalablement nettoyés et désinfectés à l’aide d’un désinfectant officiellement autorisé à Saint-Pierre-et-Miquelon en tant que moyen de lutte efficace contre les maladies visées au chapitre 2, et construits de telle sorte que les fèces, l’urine, la litière ou le fourrage ne puissent s’écouler ou tomber du véhicule ou du conteneur pendant le transport. |
|
2. |
Les locaux de quarantaine doivent au moins satisfaire aux normes minimales figurant à l’annexe B de la directive 91/496/CEE ( 18 ) et aux conditions suivantes: a) ils doivent être sous le contrôle d’un vétérinaire officiel; b) ils doivent être situés au centre d’une zone d’au moins 20 km de diamètre dans laquelle, selon des constatations officielles, aucun cas de fièvre aphteuse ne s’est déclaré au cours des trente jours au minimum qui ont précédé leur utilisation comme station de quarantaine; c) avant d’être utilisés comme station de quarantaine, ils doivent être nettoyés et désinfectés à l’aide d’un désinfectant officiellement autorisé à Saint-Pierre-et-Miquelon en tant que moyen de lutte efficace contre les maladies visées au chapitre 2; d) ils doivent disposer, compte tenu de leur capacité d’accueil: i) d’une installation consacrée exclusivement à la mise en quarantaine d’animaux, y compris un lieu d’hébergement convenable pour les animaux; ii) d’installations appropriées: — qui sont faciles à nettoyer et à désinfecter complètement, — qui comprennent des installations de chargement et de déchargement sûrs, — qui satisfont à toutes les conditions en matière d’abreuvement et d’alimentation des animaux, — qui permettent d’administrer facilement tout traitement vétérinaire nécessaire; iii) d’installations appropriées pour les inspections et l’isolement; iv) d’un équipement approprié pour le nettoyage et la désinfection des locaux et des véhicules de transport; v) d’une surface de stockage suffisante pour le fourrage, la litière et le fumier; vi) d’un système adéquat de collecte des eaux usées; vii) d’un cabinet pour le vétérinaire officiel; e) lorsque les locaux sont employés, le nombre de vétérinaires doit y être suffisant pour garantir l’accomplissement de toutes les tâches; f) ils ne peuvent accepter que des animaux identifiés individuellement afin de garantir la traçabilité. À cet effet, lorsque des animaux sont admis, le propriétaire ou la personne responsable de la station de quarantaine doit veiller à ce qu’ils soient identifiés de façon adéquate et accompagnés des certificats sanitaires applicables à l’espèce et aux catégories concernées. En outre, le propriétaire ou la personne responsable de la station de quarantaine doit consigner dans un registre ou dans une base de données, et conserver pendant une période minimale de trois ans, le nom du propriétaire, l’origine des animaux constituant le lot, les dates d’entrée et de sortie des animaux constituant le lot, le numéro d’identification des animaux constituant le lot et leur lieu de destination; g) l’autorité compétente doit régler les modalités du contrôle officiel de la station de quarantaine et s’assurer de l’exécution de ce contrôle; ce contrôle doit inclure des inspections régulières visant à garantir que les conditions d’agrément continuent d’être remplies. Dans le cas d’un retrait ou d’une suspension, l’agrément ne peut être rétabli que lorsque l’autorité compétente s’est assurée que les installations de quarantaine satisfont entièrement à l’ensemble des conditions énoncées aux points a) à g). |
CHAPITRE 2
Tests de santé animale
1. EXIGENCES GÉNÉRALES
Les animaux doivent être soumis aux tests énumérés ci-après, effectués à l’aide d’échantillons sanguins qui, sauf dispositions contraires, sont prélevés au plus tôt 21 jours après le début de la période d’isolement.
Les tests de laboratoire doivent être effectués dans un laboratoire agréé de l’Union et tous les tests de laboratoire et leurs résultats, vaccinations et traitements doivent être joints au certificat sanitaire.
Pour que les interventions sur les animaux soient réduites au minimum, l’échantillonnage, les tests et les vaccinations éventuelles doivent être regroupés autant que possible, tout en étant effectués dans le respect des délais minimaux requis par les protocoles de tests figurant dans la partie 2 du présent chapitre.
2. EXIGENCES PARTICULIÈRES
2.1 CAMÉLIDÉS
2.1.1 Tuberculose
a) Test à utiliser: test de réaction intradermique comparatif faisant appel à un dérivé protéique purifié (DPP) bovin et à un DPP aviaire conformes aux normes de production des tuberculines bovine et aviaire figurant à l’annexe B, point 2.1.2, de la directive 64/432/CEE.
Le test doit être exécuté dans la partie située derrière l’épaule (zone axillaire) suivant la technique décrite à l’annexe B, point 2.2.4, de la directive 64/432/CEE.
b) Planification: les animaux doivent être testés dans les deux jours qui suivent la date de leur arrivée dans la station de quarantaine et quarante-deux jours après la date du premier test.
c) Interprétation des tests:
la réaction est considérée comme:
— négative si l’accroissement de l’épaisseur de la peau est inférieur à 2 mm.
— positive si l’accroissement de l’épaisseur de la peau est supérieur à 4 mm.
— non concluante si l’accroissement de l’épaisseur de la peau au DPP bovin se situe entre 2 mm et 4 mm ou s’il est supérieur à 4 mm, mais inférieur à la réaction au DPP aviaire.
d) Mesures possibles en fonction des résultats des tests:
Si un animal présente un résultat positif au test de réaction intradermique au DPP bovin, cet animal est exclu du groupe et les autres animaux sont soumis à un nouveau test entrepris au moins quarante-deux jours après la réalisation du premier test positif: ce nouveau test est considéré comme le premier test visé au point b).
Si plus d’un animal du groupe présente un résultat positif, l’ensemble du groupe est interdit d’exportation vers l’Union.
Si un ou plusieurs animaux du même groupe présentent une réaction non concluante, l’ensemble du groupe est soumis à un nouveau test entrepris au moins quarante-deux jours après la réalisation du premier test: ce nouveau test est considéré comme le premier test visé au point b).
2.1.2 Brucellose
a) Test à utiliser:
i) Brucella abortus: le test au rose bengale (TRB) et l’épreuve de séro-agglutination (ESA), tels qu’ils sont décrits respectivement aux points 2.5 et 2.6 de l’annexe C de la directive 64/432/CEE. En cas de résultat positif, un test de fixation du complément est effectué pour confirmation, conformément à l’annexe I, partie 6, du règlement (UE) no 206/2010.
ii) Brucella melitensis: le TRB et l’ESA, tels qu’ils sont décrits respectivement aux points 2.5 et 2.6 de l’annexe C de la directive 64/432/CEE. En cas de résultat positif, un test de fixation du complément suivant la méthode décrite à l’annexe C de la directive 91/68/CEE doit être effectué pour confirmation.
iii) Brucella ovis: test de fixation du complément suivant la méthode décrite à l’annexe D de la directive 91/68/CEE.
b) Planification: les animaux doivent être testés dans les deux jours qui suivent la date de leur arrivée dans la station de quarantaine et quarante-deux jours après la date du premier test.
c) Interprétation des tests:
la positivité d’une réaction est définie conformément à l’annexe C de la directive 64/432/CEE.
d) Mesures possibles en fonction des résultats des tests:
Les animaux présentant un résultat positif à l’un des tests sont exclus du groupe et les autres animaux doivent subir un nouveau test entrepris au moins quarante-deux jours après la réalisation du premier test positif: ce nouveau test est considéré comme le premier test visé au point b).
Seuls les animaux présentant un résultat négatif à deux tests consécutifs réalisés conformément au point b) peuvent être introduits dans l’Union.
2.1.3 Fièvre catarrhale du mouton et maladie hémorragique épizootique (MHE)
a) Test à utiliser: l’épreuve d’immunodiffusion en gélose (IDG) décrite à l’annexe I, partie 6, du règlement (UE) no 206/2010.
En cas de réaction positive, les animaux doivent être soumis au test ELISA de compétition décrit à l’annexe I, partie 6, du règlement (UE) no 206/2010; ce test doit permettre de déterminer de quelle maladie il s’agit.
b) Planification:
les animaux doivent obtenir un résultat négatif à deux tests: le premier doit avoir lieu dans les deux jours qui suivent la date de leur arrivée dans la station de quarantaine et le second au moins vingt et un jours après la date du premier test.
c) Mesures possibles en fonction des résultats des tests:
i) Fièvre catarrhale du mouton
Si un ou plusieurs animaux présentent un résultat positif au test ELISA décrit à l’annexe I, partie 6, du règlement (UE) no 206/2010, l’animal ou les animaux positifs sont exclus du groupe et l’ensemble des animaux du groupe non exclus doit être mis en quarantaine pendant cent jours à compter de la date à laquelle les échantillons du test positif ont été collectés. Le groupe n’est considéré comme indemne de la fièvre catarrhale du mouton que si des contrôles réguliers effectués par des vétérinaires officiels pendant la période de quarantaine ne révèlent pas de symptômes cliniques de la maladie et si la station de quarantaine reste indemne de vecteurs de la fièvre catarrhale du mouton (Culicoides).
Si un autre animal présente des symptômes cliniques de la fièvre catarrhale du mouton pendant la période de quarantaine appliquée conformément au premier alinéa, tous les animaux du groupe sont interdits d’introduction dans l’Union.
ii) Maladie hémorragique épizootique (MHE)
Si le test ELISA de confirmation révèle la présence d’anticorps du virus de la MHE chez un ou plusieurs animaux ayant réagi positivement au premier test, cet animal ou ces animaux sont considérés comme positifs et sont exclus du groupe, et l’ensemble du groupe est soumis à deux tests supplémentaires entrepris respectivement au moins vingt et un jours après l’établissement du diagnostic positif initial et au moins vingt et un jours après la date de réalisation du premier test supplémentaire, les deux tests devant donner des résultats négatifs.
Si d’autres animaux réagissent positivement à l’un des deux ou aux deux tests supplémentaires, l’ensemble du groupe d’animaux est interdit d’introduction dans l’Union.
2.1.4 Fièvre aphteuse (FA)
a) Test à utiliser: tests de diagnostic (probang et sérologie) faisant appel aux techniques ELISA et de neutralisation du virus conformément aux protocoles décrits à l’annexe I, partie 6, du règlement (UE) no 206/2010.
b) Planification: les animaux doivent obtenir un résultat négatif à deux tests: le premier doit avoir lieu dans les deux jours qui suivent la date de leur arrivée dans la station de quarantaine et le second au moins quarante-deux jours après la date du premier test.
c) Mesures possibles en fonction des résultats des tests: si un animal réagit positivement pour le virus de la FA, aucun des animaux présents dans la station de quarantaine n’est jugé conforme aux conditions requises pour être introduit dans l’Union.
Remarque: toute détection d’anticorps de protéines structurelles ou non structurelles du virus de la FA est considérée comme le résultat d’une infection antérieure, quel que soit le statut en matière de vaccination.
2.1.5 Peste bovine
a) Test à utiliser: le test ELISA de compétition décrit dans le Manuel des tests de diagnostic et des vaccins pour les animaux terrestres de l’OIE, dernière édition, est le test prescrit pour les échanges internationaux et est le test retenu. Le test de séroneutralisation ou d’autres tests reconnus, réalisés conformément aux protocoles décrits dans les parties applicables du manuel de l’OIE, peuvent également être utilisés.
b) Planification: les animaux doivent subir deux tests: le premier doit avoir lieu dans les deux jours qui suivent la date de leur arrivée dans la station de quarantaine et le second au moins quarante-deux jours après la date du premier test.
c) Mesures possibles en fonction des résultats des tests: si un animal réagit positivement pour le virus de la peste bovine, aucun des animaux présents dans la station de quarantaine n’est jugé conforme aux conditions requises pour être introduit dans l’Union.
2.1.6 Stomatite vésiculeuse
a) Test à utiliser: le test ELISA, le test de neutralisation virale ou un autre test reconnu, réalisés conformément aux protocoles décrits dans les parties applicables du manuel de l’OIE.
b) Planification: les animaux doivent subir deux tests: le premier doit avoir lieu dans les deux jours qui suivent la date de leur arrivée dans la station de quarantaine et le second au moins quarante-deux jours après la date du premier test.
c) Mesures possibles en fonction des résultats des tests: si un animal réagit positivement pour le virus de la stomatite vésiculeuse, aucun des animaux présents dans la station de quarantaine n’est jugé conforme aux conditions requises pour être introduit dans l’Union.
2.1.7 Fièvre de la Vallée du Rift
a) Test à utiliser: le test ELISA, le test de neutralisation virale ou un autre test reconnu, réalisés conformément aux protocoles décrits dans les parties applicables du manuel de l’OIE.
b) Planification: les animaux doivent subir deux tests: le premier doit avoir lieu dans les deux jours qui suivent la date de leur arrivée dans la station de quarantaine et le second au moins quarante-deux jours après la date du premier test.
c) Mesures possibles en fonction des résultats des tests: si un animal présente des signes d’exposition à l’agent de la fièvre de la Vallée du Rift, aucun des animaux présents dans la station de quarantaine n’est jugé conforme aux conditions requises pour être introduit dans l’Union.
2.1.8 Dermatose nodulaire contagieuse
a) Test à utiliser: épreuve sérologique faisant appel au test ELISA, test de neutralisation virale ou un autre test reconnu, réalisés conformément aux protocoles décrits dans les parties applicables du manuel de l’OIE.
b) Planification: les animaux doivent subir deux tests: le premier doit avoir lieu dans les deux jours qui suivent la date de leur arrivée dans la station de quarantaine et le second au moins quarante-deux jours après la date du premier test.
c) Mesures possibles en fonction des résultats des tests: si un animal présente des signes d’exposition à la dermatose nodulaire contagieuse, aucun des animaux présents dans la station de quarantaine n’est jugé conforme aux conditions requises pour être introduit dans l’Union.
2.1.9 Fièvre hémorragique de Crimée-Congo
a) Test à utiliser: test ELISA, test de neutralisation virale, test d’immunofluorescence ou un autre test reconnu.
b) Planification: les animaux doivent subir deux tests: le premier doit avoir lieu dans les deux jours qui suivent la date de leur arrivée dans la station de quarantaine et le second au moins quarante-deux jours après la date du premier test.
c) Mesures possibles en fonction des résultats des tests: si un animal présente des signes d’exposition à l’agent de la fièvre hémorragique de Crimée-Congo, aucun des animaux présents dans la station de quarantaine n’est jugé conforme aux conditions requises pour être introduit dans l’Union.
2.1.10 Surra [Trypanosoma evansi (T. evansi)]
a) Test à utiliser: l’agent parasite peut être identifié dans des échantillons de sang concentré dans le respect des protocoles décrits dans les parties applicables du manuel de l’OIE.
b) Planification: les animaux doivent subir deux tests: le premier doit avoir lieu dans les deux jours qui suivent la date de leur arrivée dans la station de quarantaine et le second au moins quarante-deux jours après la date du premier test.
c) Mesures possibles en fonction des résultats des tests: si T. evansi est détecté dans un animal du lot, cet animal est jugé non conforme aux conditions requises pour être introduit dans l’Union. Les autres animaux du groupe subissent alors un traitement antiparasitaire interne et externe contenant des agents appropriés qui sont efficaces contre T. evansi.
2.1.11 Fièvre catarrhale maligne du mouton
a) Test à utiliser: détection de l’ADN viral sur la base de l’identification par immunofluorescence ou immunocytochimie suivant les protocoles décrits dans les parties applicables du manuel de l’OIE.
b) Planification: les animaux doivent subir deux tests: le premier doit avoir lieu dans les deux jours qui suivent la date de leur arrivée dans la station de quarantaine et le second au moins quarante-deux jours après la date du premier test.
c) Mesures possibles en fonction des résultats des tests: si un animal présente des signes d’exposition à la fièvre catarrhale maligne du mouton, aucun des animaux présents dans la station de quarantaine n’est jugé conforme aux conditions requises pour être introduit dans l’Union.
2.1.12 Rage
Vaccination: la vaccination antirabique peut être pratiquée lorsque l’État membre de destination le demande; du sang est prélevé sur l’animal et les anticorps font l’objet d’une séroneutralisation.
|
2.1.13 |
Leucose bovine enzootique (uniquement dans le cas où les animaux sont destinés à un État membre ou à une région officiellement indemne de leucose bovine enzootique, au sens de l’article 2, paragraphe 2, point k), de la directive 64/432/CEE) a) Test à utiliser: l’immunodiffusion en gélose (IDG) ou le test ELISA bloquant, conformément aux protocoles décrits dans le manuel de l’OIE, dernière version. b) Planification: les animaux doivent subir deux tests: le premier doit avoir lieu dans les deux jours qui suivent la date de leur arrivée dans la station de quarantaine et le second au moins quarante-deux jours après la date du premier test. c) Mesures possibles en fonction des résultats des tests: les animaux présentant un résultat positif à l’un des tests visés au point a) sont exclus du groupe des animaux séjournant dans l’installation de quarantaine et les autres animaux sont soumis à un nouveau test entrepris au moins vingt et un jours après la date de réalisation du premier test positif: ce nouveau test est considéré comme le premier test visé au point b). Seuls les animaux présentant un résultat négatif à deux tests consécutifs réalisés conformément au point b) sont jugés conformes aux conditions requises pour être introduits dans l’Union. |
ANNEXE II
VIANDES FRAÎCHES
PARTIE 1
Liste des pays tiers, territoires et parties de pays tiers ou territoires (1)
|
Code ISO et nom du pays tiers |
Code du territoire |
Description du pays tiers, du territoire ou de la partie de l’un de ceux-ci |
Certificat vétérinaire |
Conditions spécifiques |
Date de fin (2) |
Date de début (3) |
|
|
Modèle(s) |
GS |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
AL – Albanie |
AL-0 |
Ensemble du pays |
— |
|
|
|
|
|
AR — Argentine |
AR-0 |
Ensemble du pays |
EQU |
|
|
|
|
|
AR-1 |
Les provinces suivantes: Buenos Aires, Catamarca, Corrientes (9), Entre Ríos, La Rioja, Mendoza, Misiones, une partie de Neuquén (à l'exception du territoire inclus dans AR-2), une partie de Río Negro (à l'exception du territoire inclus dans AR-2), San Juan, San Luis, Santa Fe, Tucumán, Córdoba, La Pampa, Santiago del Estero, Chaco, Formosa, Jujuy, Salta (à l'exception du territoire inclus dans AR-3). |
BOV RUF RUW (9) |
A |
1 |
|
1er août 2010 |
|
|
AR-2 |
Les provinces suivantes: Chubut, Santa Cruz, Tierra del Fuego, une partie de Neuquén (exceptions: à Confluencia, la zone située à l'est de la route provinciale no 17 et, à Picún Leufú, la zone située à l'est de la route provinciale no 17), une partie de Río Negro (exceptions: à Avellaneda, la zone située au nord de la route provinciale no 7 et à l'est de la route provinciale no 250; à Conesa, la zone située à l'est de la route provinciale no 2; à El Cuy, la zone située au nord de la route provinciale no 7, depuis son intersection avec la route provinciale no 66 jusqu'à la frontière avec le département d'Avellaneda; et à San Antonio, la zone située à l'est des routes provinciales no 250 et 2). |
BOV OVI RUW RUF |
|
|
|
1er août 2008 |
|
|
AR-3 |
Une partie de Salta: la zone de 25 km à partir de la frontière avec la Bolivie et le Paraguay qui s'étend du district de Santa Catalina, dans la province de Jujuy, au district de Laishi, dans la province de Formosa (l'ancienne zone tampon de haute surveillance). |
BOV RUF RUW |
A |
1 |
|
1er juillet 2016 |
|
|
AU – Australie |
AU-0 |
Ensemble du pays |
BOV, OVI, POR, EQU, RUF, RUW, SUF, SUW |
|
|
|
|
|
BA – Bosnie-Herzégovine (10) |
BA-0 |
Ensemble du pays |
BOV |
|
|
|
|
|
BH – Bahreïn |
BH-0 |
Ensemble du pays |
— |
|
|
|
|
|
BR — Brésil |
BR-0 |
Ensemble du pays |
EQU |
|
|
|
|
|
BR-1 |
État du Minas Gerais, État de Espírito Santo, État de Goiás, État du Mato Grosso, État du Rio Grande do Sul, État du Mato Grosso do Sul (à l'exception du territoire inclus dans BR-4). |
BOV |
A et H |
1 |
|
1er décembre 2008 |
|
|
BR-2 |
État de Santa Catarina |
BOV |
A et H |
1 |
|
31 janvier 2008 |
|
|
BR-3 |
États de Paraná et de São Paulo |
BOV |
A et H |
1 |
|
1er août 2008 |
|
|
BR-4 |
Une partie de l'État du Mato Grosso do Sul: la zone de 15 km à partir des frontières extérieures dans les municipalités de Porto Murtinho, Caracol, Bela Vista, Antônio João, Ponta Porã, Aral Moreira, Coronel Sapucaia, Paranhos, Sete Quedas, Japorã et Mundo Novo, et la zone située dans les municipalités de Corumbá et Ladário (anciennement désignée comme la zone de haute surveillance). |
BOV |
A et H |
1 |
|
1er juillet 2016 |
|
|
BW — Botswana |
BW-0 |
Intégralité du pays |
EQU, EQW |
|
|
|
|
|
BW-1 |
Zones vétérinaires de contrôle des maladies 3c, 4b, 5, 8, 9 et 18 |
BOV, OVI, RUF, RUW |
F |
1 |
11 mai 2011 |
26 juin 2012 |
|
|
BW-2 |
Zones vétérinaires de contrôle des maladies 10, 11, 13 et 14 |
BOV, OVI, RUF, RUW |
F |
1 |
|
7 mars 2002 |
|
|
BW-3 |
Zone vétérinaire de contrôle des maladies 12 |
BOV, OVI, RUF, RUW |
F |
1 |
20 octobre 2008 |
20 janvier 2009 |
|
|
BW-4 |
La zone vétérinaire de contrôle des maladies 4a, à l'exception de la zone tampon de surveillance intensive de 10 km le long de la frontière avec la zone de vaccination contre la fièvre aphteuse et les zones de gestion de la faune sauvage |
BOV |
F |
1 |
28 mai 2013 |
18 février 2011 |
|
|
BW-5 |
Zones vétérinaires de contrôle des maladies 6a et 6b |
BOV, OVI, RUF, RUW |
F |
1 |
28 mai 2013 |
18 août 2016 |
|
|
BY – Biélorussie |
BY-0 |
Ensemble du pays |
— |
|
|
|
|
|
BZ – Belize |
BZ-0 |
Ensemble du pays |
BOV, EQU |
|
|
|
|
|
CA – Canada |
CA-0 |
Ensemble du pays |
BOV, OVI, POR, EQU, SUF, SUW RUF, RUW |
G |
|
|
|
|
CH – Suisse |
CH-0 |
Ensemble du pays |
* |
|
|
|
|
|
CL – Chili |
CL-0 |
Ensemble du pays |
BOV, OVI, POR, EQU, RUF, RUW, SUF |
|
|
|
|
|
CN – Chine |
CN-0 |
Ensemble du pays |
— |
|
|
|
|
|
CO – Colombie |
CO-0 |
Ensemble du pays |
EQU |
|
|
|
|
|
CR – Costa Rica |
CR-0 |
Ensemble du pays |
BOV, EQU |
|
|
|
|
|
CU – Cuba |
CU-0 |
Ensemble du pays |
BOV, EQU |
|
|
|
|
|
DZ – Algérie |
DZ-0 |
Ensemble du pays |
— |
|
|
|
|
|
ET – Éthiopie |
ET-0 |
Ensemble du pays |
— |
|
|
|
|
|
FK – Îles Falkland |
FK-0 |
Ensemble du pays |
BOV, OVI, EQU |
|
|
|
|
|
GL – Groenland |
GL-0 |
Ensemble du pays |
BOV, OVI, EQU, RUF, RUW |
|
|
|
|
|
GT – Guatemala |
GT-0 |
Ensemble du pays |
BOV, EQU |
|
|
|
|
|
HK – Hong Kong |
HK-0 |
Ensemble du pays |
— |
|
|
|
|
|
HN – Honduras |
HN-0 |
Ensemble du pays |
BOV, EQU |
|
|
|
|
|
▼M16 ————— |
|||||||
|
IL – Israël (6) |
IL-0 |
Intégralité du pays |
— |
|
|
|
|
|
IN – Inde |
IN-0 |
Ensemble du pays |
— |
|
|
|
|
|
IS – Islande |
IS-0 |
Ensemble du pays |
BOV, OVI, EQU, RUF, RUW |
|
|
|
|
|
JP – Japon |
JP |
Ensemble du pays |
BOV |
|
|
|
28 mars 2013 |
|
KE – Kenya |
KE-0 |
Ensemble du pays |
— |
|
|
|
|
|
MA – Maroc |
MA-0 |
Ensemble du pays |
EQU |
|
|
|
|
|
ME – Monténégro |
ME-0 |
Ensemble du pays |
BOV, OVI, EQU |
|
|
|
|
|
MG – Madagascar |
MG-0 |
Ensemble du pays |
— |
|
|
|
|
|
MK – Ancienne République yougoslave de Macédoine (4) |
MK-0 |
Ensemble du pays |
BOV, OVI, EQU |
|
|
|
|
|
MU – Maurice |
MU-0 |
Ensemble du pays |
— |
|
|
|
|
|
MX – Mexique |
MX-0 |
Ensemble du pays |
BOV, EQU |
|
|
|
|
|
NA – Namibie |
NA-0 |
Ensemble du pays |
EQU, EQW |
|
|
|
|
|
NA-1 |
Au sud de la ligne du cordon sanitaire qui s’étend de Palgrave Point, à l’ouest, à Gam, à l’est |
BOV, OVI, RUF, RUW |
F et J |
1 |
|
|
|
|
NC – Nouvelle-Calédonie |
NC-0 |
Ensemble du pays |
BOV, RUF, RUW |
|
|
|
|
|
NI – Nicaragua |
NI-0 |
Ensemble du pays |
— |
|
|
|
|
|
NZ – Nouvelle-Zélande |
NZ-0 |
Ensemble du pays |
BOV, OVI, POR, EQU, RUF, RUW, SUF, SUW |
|
|
|
|
|
PA – Panama |
PA-0 |
Ensemble du pays |
BOV, EQU |
|
|
|
|
|
PY – Paraguay |
PY-0 |
Intégralité du pays |
EQU |
|
|
|
|
|
PY-0 |
Intégralité du pays |
BOV |
A |
1 |
|
17 avril 2015 |
|
|
RS – Serbie (5) |
RS-0 |
Ensemble du pays |
BOV, OVI, EQU |
|
|
|
|
|
RU – Russie |
RU-0 |
Ensemble du pays |
— |
|
|
|
|
|
RU-1 |
Région de Mourmansk et région autonome de Yamalo-Nenets |
RUF |
|
|
|
|
|
|
SG — Singapour (7) |
SG-0 |
Ensemble du pays |
NZ-TRANSIT-SG (8) |
|
|
|
|
|
SV – El Salvador |
SV-0 |
Ensemble du pays |
— |
|
|
|
|
|
SZ – Swaziland |
SZ-0 |
Ensemble du pays |
EQU, EQW |
|
|
|
|
|
SZ-1 |
Zone située à l’ouest des clôtures de la «ligne rouge» qui s’étend vers le nord, de la rivière Usutu à la frontière sud-africaine, à l’ouest de Nkalashane |
BOV, RUF, RUW |
F |
1 |
|
|
|
|
SZ-2 |
Zones vétérinaires de surveillance et de vaccination contre la fièvre aphteuse, conformément à l’acte réglementaire publié dans l’annonce légale no 51 de l’année 2001 |
BOV, RUF, RUW |
F |
1 |
|
4 août 2003 |
|
|
TH – Thaïlande |
TH-0 |
Ensemble du pays |
— |
|
|
|
|
|
TN – Tunisie |
TN-0 |
Ensemble du pays |
— |
|
|
|
|
|
TR – Turquie |
TR-0 |
Ensemble du pays |
— |
|
|
|
|
|
TR-1 |
Provinces d’Amasya, d’Ankara, d’Aydin, de Balikesir, de Bursa, de Cankiri, de Corum, de Denizli, d’Izmir, de Kastamonu, de Kutahya, de Manisa, d’Usak, de Yozgat et de Kirikkale |
EQU |
|
|
|
|
|
|
UA – Ukraine |
UA-0 |
Ensemble du pays |
— |
|
|
|
|
|
US – États-Unis |
US-0 |
Ensemble du pays |
BOV, OVI, POR, EQU, SUF, SUW, RUF, RUW |
G |
|
|
|
|
UY – Uruguay |
UY-0 |
Ensemble du pays |
EQU |
|
|
|
|
|
BOV |
A et J |
1 |
|
1er novembre 2001 |
|||
|
OVI |
A |
1 |
|
|
|||
|
ZA – Afrique du Sud |
ZA-0 |
Ensemble du pays |
EQU, EQW |
|
|
|
|
|
ZA-1 |
Ensemble du pays excepté: — la partie de la zone de lutte contre la fièvre aphteuse située dans les régions vétérinaires des provinces de Mpumalanga et du Nord, dans le district d’Ingwavuma de la région vétérinaire du Natal et dans la zone de la frontière avec le Botswana située à l’Est de 28° de longitude, et — le district de Camperdown, dans la province du KwaZulu-Natal |
BOV, OVI, RUF, RUW |
F |
1 |
11 février 2011 |
|
|
|
ZW – Zimbabwe |
ZW-0 |
Ensemble du pays |
— |
|
|
|
|
|
(1) Sans préjudice des exigences spécifiques de certification prévues par les accords conclus par l’Union avec des pays tiers. (2) Les viandes issues d’animaux abattus au plus tard à la date mentionnée dans la colonne 7 peuvent être importées dans l’Union pendant quatre-vingt-dix jours à compter de cette date. Toutefois, les lots transportés par navires en haute mer qui sont certifiés avant la date mentionnée dans la colonne 7 peuvent être importés dans l’Union pendant quarante jours à compter de cette date (l’absence de date dans la colonne 7 signifie qu’aucune restriction dans le temps ne s’applique). (4) Ancienne République yougoslave de Macédoine; code provisoire qui ne préjuge en aucune manière de la nomenclature définitive qui sera adoptée pour ce pays à la suite de la conclusion des négociations en cours à cet égard aux Nations unies. (5) Sans le Kosovo, actuellement sous administration internationale en vertu de la résolution 1244 du Conseil de sécurité des Nations unies du 10 juin 1999. (6) Ci-après entendu comme l'État d'Israël, à l'exclusion des territoires sous administration israélienne depuis juin 1967, à savoir le plateau du Golan, la bande de Gaza, Jérusalem-Est et le reste de la Cisjordanie. (7) Uniquement pour les viandes fraîches originaires de Nouvelle-Zélande, dont l'introduction dans l'Union en provenance de Nouvelle-Zélande est autorisée, accompagnées du modèle de certificat vétérinaire approprié délivré par l'autorité compétente de la Nouvelle-Zélande, destinées au marché de l'Union, et déchargées, entreposées ou non, et rechargées dans un établissement agréé au cours de leur transit par Singapour. (8) À l'entrée sur le territoire de l'Union, les lots doivent être accompagnés du présent modèle de certificat vétérinaire délivré au moyen du système TRACES par l'autorité compétente de Singapour, ainsi que du modèle de certificat vétérinaire approprié pour l'importation de viandes fraîches délivré par l'autorité compétente de la Nouvelle-Zélande, éventuellement joint dans le système TRACES par l'autorité compétente de Singapour. (9) Pour le certificat «RUW»: à l'exception des départements suivants de la province de Corrientes: les départements de Berón de Astrada, Capital, Empedrado, General Paz, Itati, Mbucuruyá, San Cosme et San Luís del Palmar. (10) Uniquement pour le transit par la Bulgarie de lots de viandes fraîches de bovins domestiques à destination de la Turquie. * = Conformément à l’accord entre la Communauté européenne et la Confédération suisse relatif aux échanges de produits agricoles (JO L 114 du 30.4.2002, p. 132). — = Aucun certificat n’est établi et les importations de viandes fraîches sont interdites, sauf pour ces espèces lorsqu’elles sont indiquées sur la ligne correspondant à l’ensemble du pays. «1» Restrictions par catégorie: Les abats ne peuvent être introduits dans l’Union à l’exception, dans le cas de l’espèce bovine, des diaphragmes et des muscles masséters. |
|||||||
PARTIE 2
Modèles de certificats vétérinaires
Modèles
|
«BOV» |
: |
modèle de certificat vétérinaire relatif à des viandes fraîches, y compris les viandes hachées, de bovins domestiques (comprenant les espèces des genres Bison et Bubalus ainsi que leurs hybrides). |
|
«OVI» |
: |
modèle de certificat vétérinaire relatif à des viandes fraîches, y compris les viandes hachées, d’ovins (Ovis aries) et de caprins (Capra hircus) domestiques. |
|
«POR» |
: |
modèle de certificat vétérinaire relatif à des viandes fraîches, y compris les viandes hachées, de porcins (Sus scrofa) domestiques. |
|
«EQU» |
: |
modèle de certificat vétérinaire relatif à des viandes fraîches, à l’exception des viandes hachées, de solipèdes domestiques (Equus caballus, Equus asinus et leurs hybrides). |
|
«RUF» |
: |
modèle de certificat vétérinaire relatif à des viandes fraîches, à l’exception des abats et des viandes hachées, d’animaux d’élevage d’espèces non domestiques appartenant à l’ordre Artiodactyla [à l’exception des bovins (comprenant les espèces des genres Bison et Bubalus ainsi que leurs hybrides), Ovis aries, Capra hircus, Suidae et Tayassuidae] et aux familles Rhinocerotidae et Elephantidae. |
|
«RUW» |
: |
modèle de certificat vétérinaire relatif à des viandes fraîches, à l’exception des abats et des viandes hachées, d’animaux sauvages d’espèces non domestiques appartenant à l’ordre Artiodactyla [à l’exception des bovins (comprenant les espèces des genres Bison et Bubalus ainsi que leurs hybrides), Ovis aries, Capra hircus, Suidae et Tayassuidae] et aux familles Rhinocerotidae et Elephantidae. |
|
«SUF» |
: |
modèle de certificat vétérinaire relatif à des viandes fraîches, à l’exception des abats et des viandes hachées, d’animaux d’élevage d’espèces non domestiques appartenant aux familles Suidae, Tayassuidae et Tapiridae. |
|
«SUW» |
: |
modèle de certificat vétérinaire relatif à des viandes fraîches, à l’exception des abats et des viandes hachées, d’animaux sauvages d’espèces non domestiques appartenant aux familles Suidae, Tayassuidae ou Tapiridae. |
|
«EQW» |
: |
modèle de certificat vétérinaire relatif à des viandes fraîches, à l’exception des abats et des viandes hachées, de solipèdes sauvages appartenant au sous-genre Hippotigris (zèbre). |
|
«NZ-TRANSIT-SG» |
: |
Modèle de certificat vétérinaire uniquement réservé au transit par Singapour avec déchargement, entreposage éventuel et rechargement de viandes fraîches originaires de Nouvelle-Zélande, dont l'introduction dans l'Union en provenance de la Nouvelle-Zélande est autorisée, et conformes aux conditions requises pour être introduites dans l'Union et destinées au marché de l'Union. |
GS (garanties supplémentaires)
|
«A» |
: |
garanties concernant la maturation, le mesurage du pH et le désossage des viandes fraîches, à l’exception des abats, certifiées conformément aux modèles de certificats vétérinaires BOV (point II.2.6.), OVI (point II.2.6.), RUF (point II.2.7.) et RUW (point II.2.4.). |
|
«C» |
: |
garanties concernant les tests de laboratoire relatifs à la peste porcine classique dans les carcasses dont proviennent les viandes fraîches certifiées conformément au modèle de certificat vétérinaire SUW (point II.2.3 B). |
|
«D» |
: |
garanties concernant l’utilisation, dans l’exploitation/les exploitations, d’eaux grasses pour l’alimentation des animaux dont proviennent les viandes fraîches certifiées conformément au modèle de certificat vétérinaire POR [point II.2.3 d)]. |
|
«E» |
: |
garanties concernant les tests de tuberculose sur les animaux dont proviennent les viandes fraîches certifiées conformément au modèle de certificat vétérinaire BOV [point II.2.4 d)]. |
|
«F» |
: |
garanties concernant la maturation et le désossage des viandes fraîches, à l’exception des abats, certifiées conformément aux modèles de certificats vétérinaires BOV (point II.2.6.), OVI (point II.2.6.), RUF (point II.2.6.) et RUW (point II.2.7.). |
|
«G» |
: |
garanties concernant 1) l’exclusion des abats et de la moelle épinière; et 2) le dépistage et l’origine des cervidés au regard de la maladie du dépérissement chronique, conformément aux modèles de certificats vétérinaires RUF (point II.1.7.) et RUW (point II.1.8.). |
|
«H» |
: |
garanties supplémentaires exigées pour le Brésil. En ce qui concerne les programmes de vaccination, étant donné que l’État de Santa Catarina, au Brésil, ne vaccine pas contre la fièvre aphteuse, la référence à un programme de vaccination ne s’applique pas aux viandes obtenues à partir d’animaux provenant de cet État et abattus dans celui-ci. |
|
«J» |
: |
garanties concernant l’acheminement des bovins, ovins et caprins des exploitations à l’abattoir, qui leur permet de passer par un centre de rassemblement (y compris des marchés) avant leur transport direct vers l’abattoir. |
|
«K» |
: |
exploitations ou compartiments dont il est reconnu qu'ils appliquent des conditions d'hébergement contrôlées conformément à l'article 8 du règlement (CE) no 2075/2005. |
Modèle BOV
 ►(1) M29
►(1) M29

►(1) M29


►(1) M13

►(3) M13
►(3) M29
►(3) M29
Modèle OVI

 ►(1) M29
►(1) M29

►(1) M29

►(1) M13

►(2) M13
►(2) M29
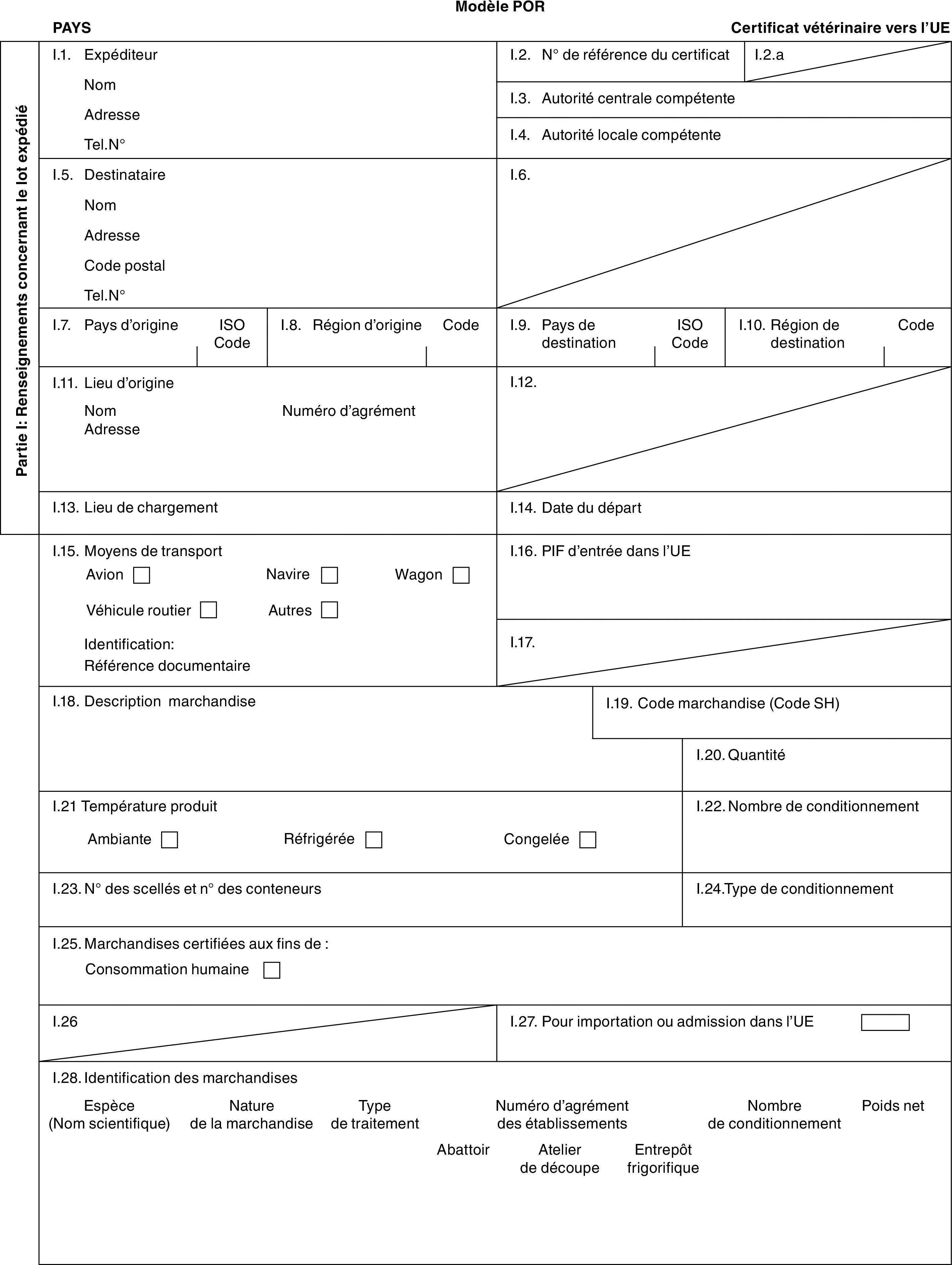












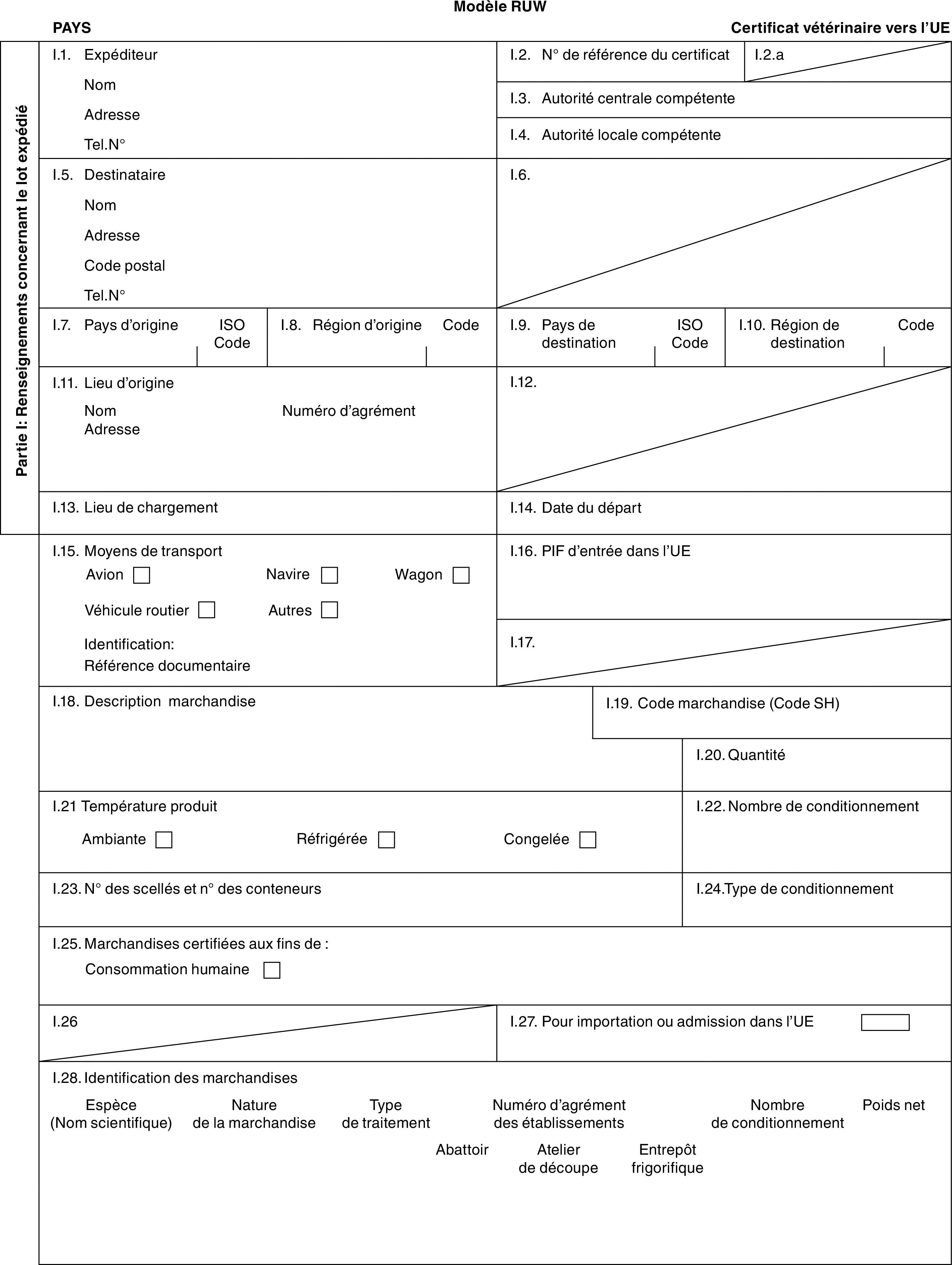

















ANNEXE III
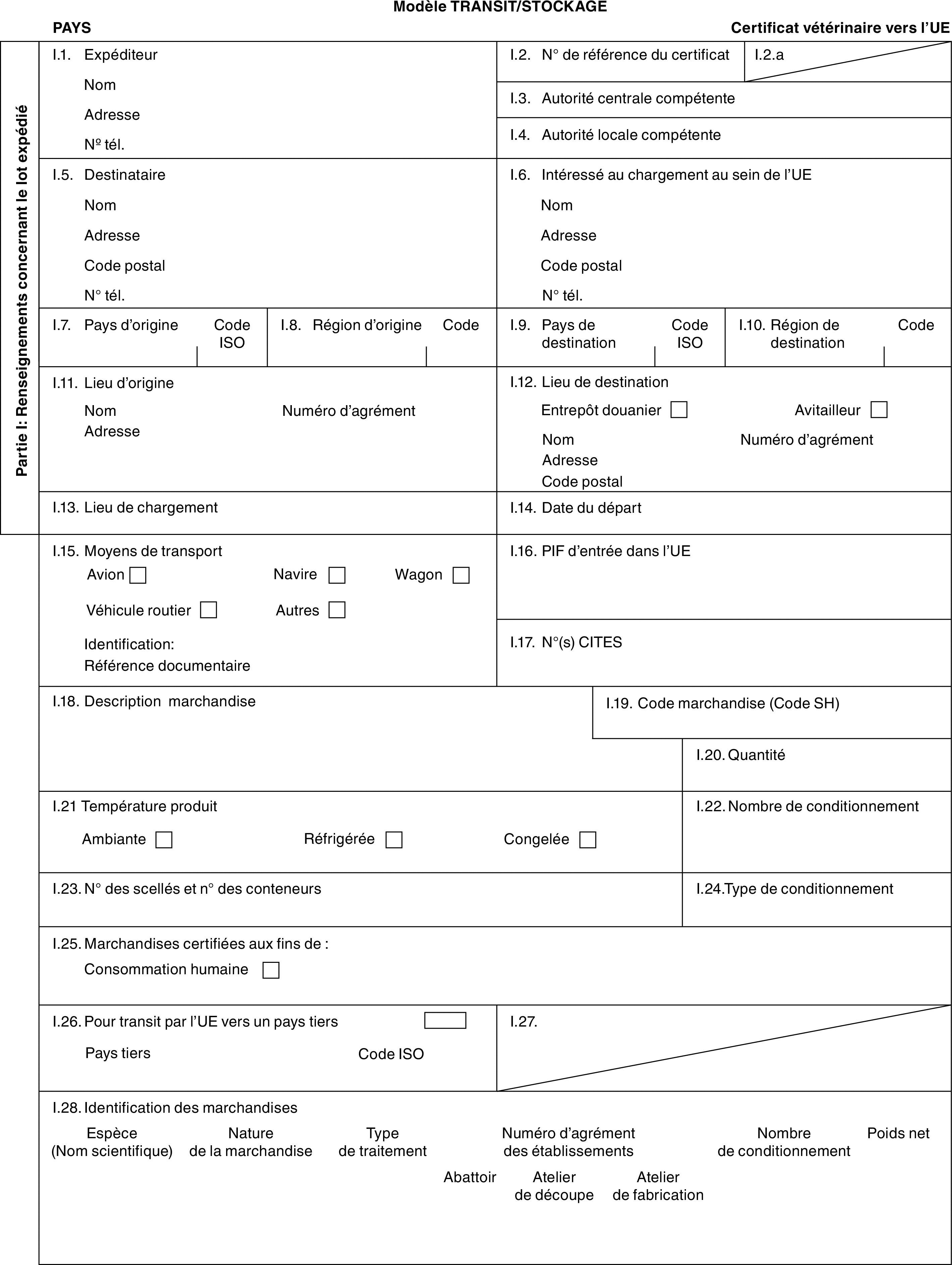


ANNEXE IV
ANIMAUX VISÉS À L’ARTICLE 1er, PARAGRAPHE 1, POINT b)
PARTIE 1
Listes des pays tiers, territoires ou parties de pays tiers ou territoires
SECTION 1
Parties de pays tiers ou territoires visées à l’article 7, paragraphe 2
|
Pays/Territoire |
Code de la partie de pays/territoire |
Description de la partie de pays/territoire |
|
US – États-Unis |
US-A |
État d’Hawaii (1) |
|
(1) Suspendu à compter du 5 mai 2010. |
||
PARTIE 2
Tableaux des animaux et des modèles de certificats vétérinaires y afférents
|
Tableau 1 |
|
|
| «QUE»: modèle de certificat vétérinaire à utiliser pour les lots de reines d’abeilles et de reines de bourdons (Apis mellifera et Bombus spp.) «BEE»:modèle de certificat vétérinaire à utiliser pour les lots de colonies de bourdons (Bombus spp.) |
||
|
Ordre |
Famille |
Genre/Espèce |
|
Hymenoptera |
Apidae |
Apis mellifera, Bombus spp. |
Modèle QUE




ANNEXE V
Notes expliquant comment compléter les certificats vétérinaires
(visées à l’article 18)
a) Les certificats vétérinaires sont délivrés par le pays tiers exportateur sur la base des modèles figurant à l’annexe I, partie 2, à l’annexe II, partie 2, à l’annexe III et à l’annexe IV, partie 2, et dans le respect de la mise en pages du modèle correspondant aux animaux vivants ou viandes fraîches concernés.
Ils contiennent, numérotées selon le modèle, les attestations exigées pour tout pays tiers et, le cas échéant, les garanties supplémentaires requises pour le pays tiers exportateur ou pour une partie de celui-ci.
Si l’État membre de destination impose, pour les viandes fraîches ou les animaux vivants concernés, des conditions de certification supplémentaires, il est également certifié sur le formulaire original du certificat vétérinaire que ces conditions sont remplies.
b) Lorsqu’il est précisé dans le modèle de certificat qu’il convient de choisir, parmi une série de mentions, celle qui convient, les mentions inutiles peuvent être biffées par le certificateur, qui y appose en outre son paraphe et son cachet, ou être entièrement supprimées du certificat.
c) Un certificat distinct et unique doit être fourni pour les viandes fraîches ou animaux vivants qui sont exportés à partir d’un ou de plusieurs territoires d’un même pays exportateur figurant à l’annexe I, partie 1, colonnes 2 et 3, à l’annexe II, partie 1, colonnes 2 et 3, ou à l’annexe IV, partie 1, colonnes 2 et 3, et qui ont la même destination et sont transportés dans le même wagon, camion, avion ou navire.
d) L’original de chaque certificat se compose d’une seule feuille de papier, ou, si cela ne suffit pas, il doit être présenté de façon à ce que toutes les feuilles de papier nécessaires fassent partie d’un tout intégré et indivisible.
e) Le certificat vétérinaire est établi dans au moins une des langues officielles de l’État membre dans lequel se trouve le poste d’inspection frontalier d’introduction du lot dans l’Union et de l’État membre de destination. Néanmoins, ces États membres peuvent autoriser qu’il soit établi dans la langue officielle d’un autre État membre et accompagné, si nécessaire, d’une traduction officielle.
f) Si des feuilles supplémentaires sont jointes au certificat pour des raisons liées à l’identification des différents éléments du lot (tableau au point I.28 du modèle de certificat vétérinaire), ces feuilles sont également considérées comme faisant partie de l’original du certificat à condition que la signature et le cachet du certificateur figurent au minimum sur chaque page.
g) Lorsque le certificat, y compris les tableaux supplémentaires visés au point f), comporte plus d’une page, chaque page doit être numérotée au bas de la page — (numéro de la page) de (nombre total de pages) —, et le numéro de référence du certificat attribué par l’autorité compétente doit figurer en haut des pages.
h) Le certificat original doit être rempli et signé par un vétérinaire officiel ou, lorsque le modèle de certificat vétérinaire le prévoit, par un autre inspecteur officiel désigné. Le certificat accompagnant des animaux vivants doit être rempli et signé dans les vingt-quatre heures qui précèdent le chargement du lot en vue de son introduction dans l’Union. Les autorités compétentes du pays tiers exportateur garantissent l’observation de règles de certification équivalentes à celles fixées dans la directive 96/93/CE ( 19 ).
La couleur de la signature est différente de celle du texte imprimé. Cette règle vaut également pour les cachets, à l’exception des reliefs et des filigranes.
i) Le numéro de référence du certificat, à mentionner dans les cases I.2 et II.a, doit être attribué par l’autorité compétente.
ANNEXE VI
PARTIE 1
|
Tableau 1 |
|
|
|
«RUM-A»: modèle de certificat vétérinaire applicable aux animaux des espèces énumérées ci-après en provenance et à destination d’un organisme, institut ou centre agréé |
||
|
Ordre |
Famille |
Genre/Espèce |
|
Artiodactyla |
Antilocapridae |
Antilocapra ssp. |
|
Bovidae |
Addax ssp., Aepyceros ssp., Alcelaphus ssp., Ammodorcas ssp., Ammotragus ssp., Antidorcas ssp., Antilope ssp., Bison ssp., Bos ssp. (y compris Bibos, Novibos, Poephagus), Boselaphus ssp., Bubalus ssp. (y compris l’anoa), Budorcas ssp., Capra ssp., Cephalophus ssp., Connochaetes ssp., Damaliscus ssp. (y compris Beatragus), Dorcatragus ssp., Gazella ssp., Hemitragus ssp., Hippotragus ssp., Kobus ssp., Litocranius ssp., Madoqua ssp., Naemorhedus ssp. (y compris Nemorhaedus et Capricornis), Neotragus ssp., Oreamnos ssp., Oreotragus ssp., Oryx ssp., Ourebia ssp., Ovibos ssp., Ovis ssp., Patholops ssp., Pelea ssp., Procapra ssp., Pseudois ssp., Pseudoryx ssp., Raphicerus ssp., Redunca ssp., Rupicapra ssp., Saiga ssp., Sigmoceros-Alcelaphus ssp., Sylvicapra ssp., Syncerus ssp., Taurotragus ssp., Tetracerus ssp., Tragelaphus ssp. (y compris Boocerus). |
|
|
Camelidae |
Camelus ssp., Lama ssp., Vicugna ssp. |
|
|
Cervidae |
Alces ssp., Axis-Hyelaphus ssp., Blastocerus ssp., Capreolus ssp., Cervus-Rucervus ssp., Dama ssp., Elaphurus ssp., Hippocamelus ssp., Hydropotes ssp., Mazama ssp., Megamuntiacus ssp., Muntiacus ssp., Odocoileus ssp., Ozotoceros ssp., Pudu ssp., Rangifer ssp. |
|
|
Giraffidae |
Giraffa ssp., Okapia ssp. |
|
|
Moschidae |
Moschus ssp. |
|
|
Tragulidae |
Hyemoschus ssp., Tragulus-Moschiola ssp. |
|
|
Tableau 2 |
|
|
|
«SUI-A»: modèle de certificat vétérinaire applicable aux animaux des espèces énumérées ci-après en provenance et à destination d’un organisme, institut ou centre agréé |
||
|
Ordre |
Famille |
Genre/Espèce |
|
Artiodactyla |
Suidae |
Babyrousa ssp., Hylochoerus ssp., Phacochoerus ssp., Potamochoerus ssp., Sus ssp. |
|
Tayassuidae |
Catagonus ssp., Pecari-Tayassu ssp. |
|
|
|
Hippopotamidae |
Hexaprotodon-Choeropsis ssp., Hippopotamus ssp. |
|
Tableau 3 |
|
|
|
«TRE-A»: modèle de certificat vétérinaire applicable aux animaux des espèces énumérées ci-après en provenance et à destination d’un organisme, institut ou centre agréé |
||
|
Ordre |
Famille |
Genre/Espèce |
|
Perissodactyla |
Tapiridae |
Tapirus ssp. |
|
|
Rhinocerotidae |
Ceratotherium ssp., Dicerorhinus ssp., Diceros ssp., Rhinoceros ssp. |
|
Proboscidea |
Elephantidae |
Elephas ssp., Loxodonta ssp. |
PARTIE 2





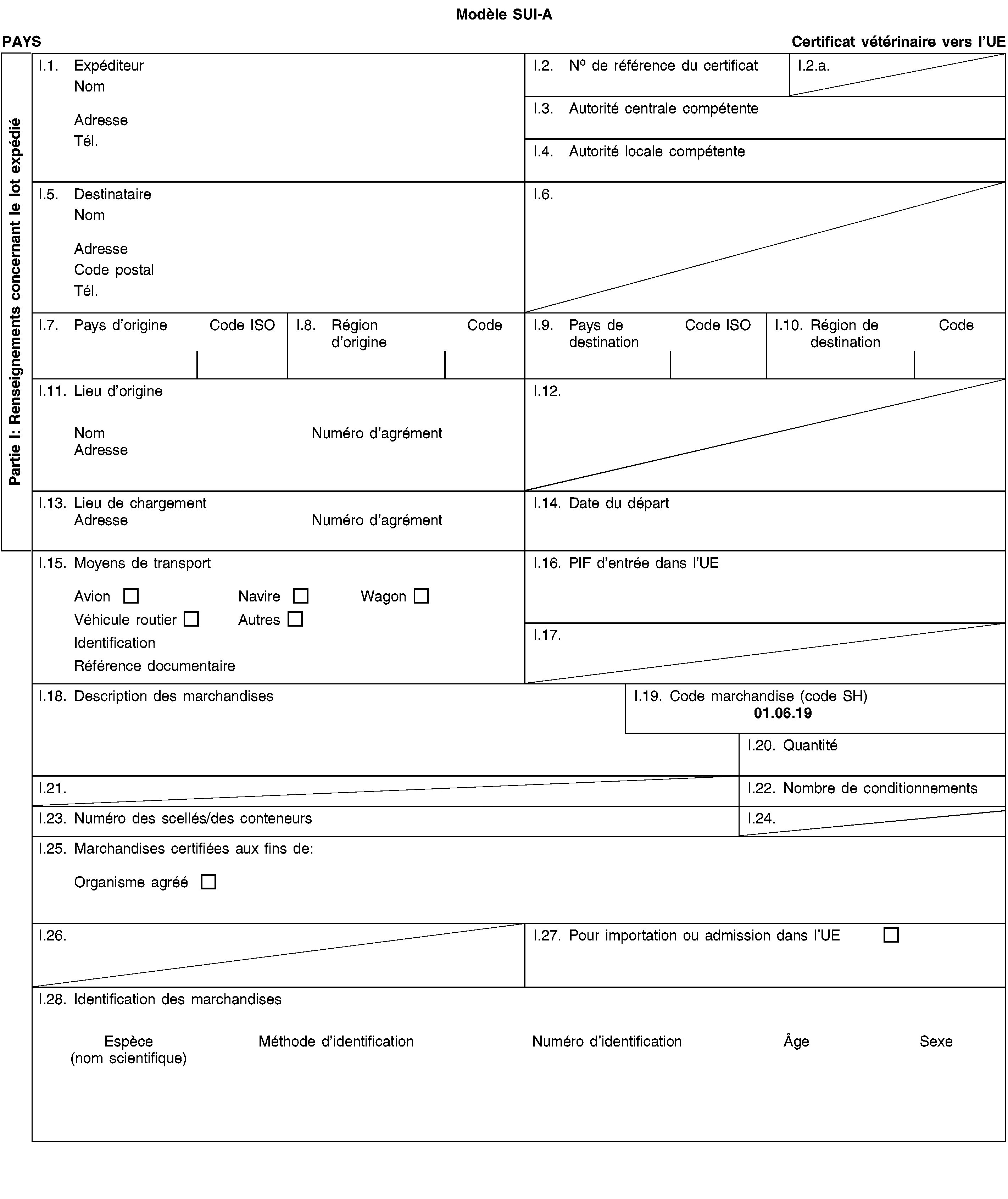







PARTIE 3
Exigences applicables aux organismes, instituts ou centres de pays tiers
L’organisme, institut ou centre d’un pays tiers doit:
a) être nettement délimité et séparé de son environnement;
b) disposer de moyens adéquats pour capturer, enfermer et isoler les animaux; posséder des installations de quarantaine appropriées et suivre des modes opératoires normalisés et agréés pour les animaux d’origine inconnue;
c) être doté d’une structure protégée contre les vecteurs satisfaisant aux exigences suivantes:
i) elle dispose de barrières physiques adéquates aux points d’entrée et de sortie;
ii) ses ouvertures sont protégées contre les vecteurs à l’aide de filets dont la largeur des mailles est appropriée et qui sont régulièrement imprégnés d’un insecticide agréé selon les instructions du fabricant;
iii) une surveillance des vecteurs et des actions de lutte contre ceux-ci sont menées dans l’enceinte de cette structure et autour de celle-ci;
iv) des mesures visant à limiter ou à éliminer les sites de prolifération des vecteurs aux abords de cette structure sont adoptées;
v) des modes opératoires normalisés, avec description, entre autres, des systèmes de secours et des systèmes d’alarme, sont appliqués au fonctionnement de la structure et au transport des animaux entre cette structure et le lieu de chargement;
d) tenir à jour, pendant une durée minimale de dix ans, des registres indiquant:
i) le nombre et l’identité (âge, sexe, espèce et identification individuelle, si nécessaire) des animaux de chaque espèce présente dans ses locaux;
ii) le nombre et l’identité (âge, sexe, espèce et identification individuelle, si nécessaire) des animaux à l’arrivée ou au départ de ses locaux, avec l’indication de leur origine ou de leur destination, des moyens de transport et de l’état de santé de ces animaux;
iii) les résultats des analyses de sang ou de toute autre procédure diagnostique pratiquées sur les animaux dans leurs locaux;
iv) les cas de maladie et, le cas échéant, les traitements administrés;
v) les résultats des examens post mortem de tous les animaux morts dans leurs locaux, y compris les animaux mort-nés;
vi) les constatations faites pendant toute période d’isolement ou de quarantaine;
e) être indemne des maladies énumérées à l’annexe A de la directive 92/65/CEE ou mentionnées dans les certificats vétérinaires pour l’espèce correspondante établis dans l’annexe VI, partie 2, du présent règlement, pendant les trois dernières années au moins, comme l’attestent les registres tenus conformément au point d) et les résultats des examens cliniques et épreuves de laboratoire effectués sur les animaux dans leurs locaux;
f) avoir chargé un laboratoire agréé par l’autorité compétente d’effectuer des examens post mortem ou disposer d’un ou de plusieurs locaux adaptés où ces examens peuvent être effectués sous l’autorité du vétérinaire agréé;
g) assurer l’élimination des carcasses des animaux morts à la suite d’une maladie ou euthanasiés;
h) s’assurer, par contrat ou instrument juridique, les services d’un vétérinaire agréé par l’autorité compétente et agissant sous le contrôle de celle-ci, qui doit s’acquitter au moins des tâches suivantes:
i) veiller à ce que des mesures appropriées de surveillance des maladies et de lutte contre celles-ci soient appliquées dans l’organisme, institut ou centre. Ces mesures doivent être approuvées par l’autorité compétente du pays tiers, du territoire ou de la partie de pays tiers ou territoire dans lequel/laquelle l’organisme, institut ou centre est situé, compte tenu de la situation de la maladie, et doivent comprendre au moins les éléments suivants:
— un plan de surveillance annuel des maladies, y compris des mesures appropriées de lutte contre les zoonoses applicables aux animaux présents sur place;
— des examens cliniques, épreuves de laboratoire et examens post mortem des animaux suspectés d’être affectés par des maladies transmissibles et des zoonoses;
— la vaccination des animaux sensibles contre les maladies infectieuses et les zoonoses;
ii) veiller à ce que toute mort suspecte ou la présence de tout autre symptôme laissant supposer que des animaux ont contracté une ou plusieurs des maladies énumérées à l’annexe A de la directive 92/65/CEE ou mentionnées dans les certificats vétérinaires pour l’espèce concernée établis à l’annexe VI, partie 2, du présent règlement soient notifiées sans délai à l’autorité compétente, si la ou les maladies concernées sont soumises à déclaration obligatoire dans le pays tiers, le territoire ou la partie de pays tiers ou territoire concerné;
iii) veiller à ce que les animaux entrants aient été mis en quarantaine, s’il y a lieu, conformément aux instructions de l’autorité compétente;
iv) veiller au respect des exigences de police sanitaire auxquelles les animaux doivent satisfaire pour pouvoir être introduits dans l’Union.
PARTIE 4
Conditions d’agrément des organismes, instituts ou centres de pays tiers
1. L’agrément ne peut être octroyé qu’aux organismes, instituts ou centres qui satisfont aux exigences énoncées dans la partie 3.
2. Lorsqu’une protection contre les vecteurs est requise, l’agrément d’une structure en tant que structure protégée contre les vecteurs ne peut être octroyé que si les critères énoncés à la partie 3, point c), sont respectés. En vue d’accorder l’agrément, l’autorité compétente doit vérifier, au moins trois fois pendant la période de protection requise (au début, au cours et à la fin de la période), l’efficacité des mesures de protection contre les vecteurs, au moyen d’un piège à vecteurs disposé à l’intérieur de la structure.
3. Chaque organisme, institut ou centre agréé doit se voir attribuer un numéro d’agrément.
4. L’agrément ne peut être maintenu qu’aussi longtemps qu’il est satisfait aux conditions énoncées ci-après.
Les locaux sont placés sous le contrôle d’un vétérinaire officiel qui doit s’acquitter au moins des tâches suivantes:
i) inspecter les locaux de l’organisme, institut ou centre au moins une fois par an;
ii) contrôler l’activité du vétérinaire visé à la partie 3, point h), et l’application du plan de surveillance annuel des maladies visé au point h) i), premier tiret;
iii) veiller au respect des dispositions des parties 3 et 4;
iv) vérifier que:
— les exigences de police sanitaire auxquelles les animaux doivent satisfaire pour pouvoir être introduits dans l’Union sont respectées;
— les résultats des examens cliniques et post mortem et des épreuves de laboratoire effectués sur les animaux n’ont révélé aucun cas des maladies énumérées à l’annexe A de la directive 92/65/CEE ou mentionnées dans les certificats vétérinaires pour l’espèce correspondante établis à l’annexe VI, partie 2, du présent règlement.
5. L’agrément doit être retiré lorsque l’autorité compétente constate qu’il n’est plus satisfait aux exigences de la partie 3.
6. Lorsque l’autorité compétente est informée que la présence de l’une des maladies énumérées à l’annexe A de la directive 92/65/CEE ou mentionnées dans les certificats vétérinaires pour les espèces correspondantes établis à l’annexe VI, partie 2, du présent règlement est soupçonnée, elle doit suspendre l’agrément de l’organisme, institut ou centre jusqu’à ce que tout soupçon ait été officiellement écarté. En fonction de la maladie suspectée et de son risque de transmission, la suspension peut s’appliquer à l’ensemble de l’organisme, institut ou centre ou uniquement à certaines catégories d’animaux sensibles à la maladie en question. L’autorité compétente doit veiller à ce que les mesures nécessaires pour confirmer ou écarter les soupçons et pour éviter toute propagation de la maladie soient prises.
7. Lorsque la présence de la maladie visée au point 6, qui était soupçonnée, est confirmée, l’agrément de l’organisme, institut ou centre doit être retiré.
8. Lorsque l’agrément d’un organisme, institut ou centre a été retiré, il ne peut être octroyé à nouveau que lorsque les conditions suivantes sont remplies:
a) la maladie et la source de l’infection ont été éradiquées dans les locaux de l’organisme, institut ou centre concerné;
b) les locaux de l’organisme, institut ou centre concerné ont fait l’objet d’un nettoyage et d’une désinfection adéquats;
c) l’organisme, institut ou centre concerné satisfait aux exigences énoncées dans la partie 3, points a) à d) et f) à h).
9. L’autorité compétente qui a agréé l’organisme, institut ou centre doit informer les États membres qui ont inscrit l’organisme, institut ou centre sur leurs listes d’organismes, instituts et centres agréés de la suspension, du retrait ou du nouvel octroi de l’agrément.
( 1 ) JO L 224 du 18.8.1990, p. 42.
( 2 ) JO L 73 du 11.3.2004, p. 1.
( 3 ) JO L 312 du 30.11.2007, p. 49.
( 4 ) JO L 226 du 23.8.2008, p. 1.
( 5 ) JO L 39 du 10.2.2009, p. 12.
( 6 ) JO L 175 du 10.7.2010, p. 1.
( 7 ) JO L 49 du 19.2.2004, p. 11.
( 8 ) JO L 224 du 18.8.1990, p. 29.
( 9 ) JO L 24 du 30.1.1998, p. 9.
( 10 ) JO L 21 du 28.1.2004, p. 11.
( 11 ) OJ L 296 du 12.11.2009, p. 1.
( 12 ) JO 121 du 29.7.1964, p. 1977.
( 13 ) JO L 46 du 19.2.1991, p. 19.
( *1 ) Supprimer la mention inutile.
( *2 ) Serbie, sans le Kosovo, conformément à la résolution 1244/1999 du Conseil de sécurité des Nations unies.
( 14 ) JO L 249 du 23.7.2004, p. 20.
( 15 ) JO L 59 du 4.3.2008, p. 19.
( 16 ) JO L 167 du 7.7.2000, p. 22.
( 17 ) JO L 39 du 9.2.2002, p. 71.
( 18 ) JO L 268 du 24.9.1991, p. 56.
( 19 ) JO L 13 du 16.1.1997, p. 28.