1992L0065 — FR — 29.12.2014 — 014.001
Ce document constitue un outil de documentation et n’engage pas la responsabilité des institutions
Modifié par:
Modifié par:
|
A1
|
Acte d’adhésion de l’Autriche, de la Finlande et de la Suède
|
C 241
|
21
|
29.8.1994
|
|
|
|
L 001
|
1
|
..
|
|
►A2
|
Acte relatif aux conditions d'adhésion à l'Union européenne de la République tchèque, de la République d'Estonie, de la République de Chypre, de la République de Lettonie, de la République de Lituanie, de la République de Hongrie, de la République de Malte, de la République de Pologne, de la République de Slovénie et de la République slovaque, et aux adaptations des traités sur lesquels est fondée l'Union européenne
|
L 236
|
33
|
23.9.2003
|
Rectifié par:
▼B
DIRECTIVE 92/65/CEE DU CONSEIL
du 13 juillet 1992
définissant les conditions de police sanitaire régissant les échanges et les importations dans la Communauté d'animaux, de spermes, d'ovules et d'embryons non soumis, en ce qui concerne les conditions de police sanitaire, aux réglementations communautaires spécifiques visées à l'annexe A section I de la directive 90/425/CEE
LE CONSEIL DES COMMUNAUTÉS EUROPÉENNES,
vu le traité instituant la Communauté économique européenne, et notamment son article 43,
vu les propositions de la Commission (
1
),
vu les avis du Parlement européen (
2
),
vu les avis du Comité économique et social (
3
),
considérant que les animaux vivants et les produits d'origine animale sont inclus dans la liste des produits énumérés à l'annexe II du traité; que la mise sur le marché de ces animaux et de ces produits constitue une source de revenus pour une partie de la population agricole;
considérant que, pour assurer un développement rationnel de ce secteur et en accroître la productivité, il y a lieu de fixer au niveau communautaire des règles de police sanitaire pour les animaux et les produits en question;
considérant que la Communauté doit arrêter les mesures destinées à établir progressivement le marché intérieur au cours d'une période expirant le 31 décembre 1992;
considérant que la poursuite des objectifs précités a conduit le Conseil à fixer des règles de police sanitaire relatives aux bovins, aux porcins, aux ovins et caprins, aux équidés, aux volailles et œufs à couver, aux poissons et produits de la pêche, aux mollusques bivalves, au sperme de bovins et de porcins, aux embryons de bovins, aux viandes fraîches, aux viandes de volaille, aux produits à base de viande et aux viandes de gibier et de lapins;
considérant qu'il importe de fixer des règles de police sanitaire régissant la mise sur le marché d'animaux et de produits d'origine animale non encore soumis aux règles citées ci-dessus;
considérant qu'il y a lieu de prévoir que la présente directive s'applique sans préjudice du règlement (CEE) no 3626/82 du Conseil, du 3 décembre 1982, relatif à l'application dans la Communauté de la convention sur le commerce international des espèces de faune et de flore sauvages menacées d'extinction (
4
);
considérant que, pour certains aspects techniques, il convient de se référer à la directive 64/432/CEE du Conseil, du 26 juin 1964, relative à des problèmes de police sanitaire en matière d'échanges intracommunautaires d'animaux des espèces bovine et porcine (
5
) et à la directive 85/511/CEE du Conseil, du 18 novembre 1985, établissant des mesures communautaires de lutte contre la fièvre aphteuse (
6
);
considérant que, pour ce qui concerne l'organisation des contrôles et les suites à donner à ceux-ci ainsi que les mesures de sauvegarde à mettre en œuvre, il convient de se référer aux règles générales fixées par la directive 90/425/CEE du Conseil, du 26 juin 1990, relative aux contrôles vétérinaires et zootechniques applicables dans les échanges intracommunautaires de certains animaux vivants et produits dans la perspective de la réalisation du marché intérieur (
7
);
considérant que, sauf dispositions contraires, les échanges des animaux et de produits d'origine animale doivent, sans préjudice du recours à d'éventuelles mesures de sauvegarde, être libéralisés;
considérant que, en raison des risques sensibles de propagation de maladies auxquelles les animaux sont exposés, il convient de spécifier, pour certains animaux et produits d'origine animale, les exigences particulières à imposer lors de leur mise sur le marché aux fins d'échanges, notamment à destination de régions disposant d'un statut sanitaire élevé;
considérant que la situation spécifique du Royaume-Uni de Grande-Bretagne et d'Irlande du Nord et de l'Irlande résultant de leur situation insulaire, du fait que ces États sont indemnes de la rage depuis une très longue période, justifie les dispositions particulières qui permettent de s'assurer que la mise sur le marché au Royaume-Uni et en Irlande de chiens et de chats non originaires de ces pays n'entraîne pas de risques d'introduction de la rage dans ces États sans pour autant affecter la suppression des contrôles vétérinaires aux frontières des États membres;
considérant que le certificat sanitaire constitue le moyen le plus approprié pour garantir et contrôler le respect de ces exigences;
considérant que, pour maintenir la situation sanitaire de la Communauté, il convient de soumettre, lors de leur mise sur le marché, les animaux et produits d'origine animale visés par la présente directive aux exigences minimales prévues pour les échanges et d'en contrôler le respect conformément aux principes et règles de la directive 90/675/CEE du Conseil, du 10 décembre 1990, fixant les principes relatifs à l'organisation des contrôles vétérinaires pour les produits en provenance des pays tiers introduits dans la Communauté (
8
);
considérant qu'il y a lieu de prévoir une procédure instaurant une coopération étroite entre les États membres et la Commission au sein du comité vétérinaire permanent;
considérant qu'il est opportun que le délai de transposition fixé au 1er janvier 1994 à l'article 29 n'ait pas d'incidence sur la suppression des contrôles vétérinaires aux frontières au 1er janvier 1993,
A ARRÊTÉ LA PRÉSENTE DIRECTIVE:
CHAPITRE PREMIER
Dispositions générales
Article premier
▼C1
La présente directive établit les exigences de police sanitaire régissant les échanges et les importations dans la Communauté d’animaux, de spermes, d’ovules et d’embryons non soumis, en ce qui concerne les conditions de police sanitaire, aux réglementations communautaires spécifiques visées à l’annexe F.
▼B
La présente directive s'applique sans préjudice des dispositions arrêtées dans le cadre du règlement (CEE) no 3626/82.
La présente directive n'affecte pas les règles nationales applicables aux animaux de compagnie sans que ce maintien ne puisse porter préjudice à la suppression des contrôles vétérinaires aux frontières entre États membres.
Article 2
1. Aux fins de la présente directive, on entend par:
|
a)
|
«échanges» : les échanges tels que définis à l'article 2 point 3 de la directive 90/425/CEE;
|
|
b)
|
«animaux» : les spécimens qui appartiennent aux espèces animales autres que celles visées par les directives 64/432/CEE, 90/426/CEE (
9
), 90/539/CEE (
10
), 91/67/CEE (
11
), 91/68/CEE (
12
), 91/492/CEE (
13
) et 91/493/CEE (
14
);
|
|
c)
|
«organisme, institut ou centre officiellement agréé» : toute installation permanente, géographiquement limitée, agréée conformément à l'article 13, où une ou plusieurs espèces d'animaux sont habituellement détenues ou élevées, à des fins commerciales ou non, et exclusivement dans un ou plusieurs des buts suivants:
— exposition de ces animaux et éducation du public,
— conservation des espèces,
— recherche scientifique fondamentale ou appliquée ou élevage d'animaux pour les besoins de cette recherche;
|
|
d)
|
«maladies à déclaration obligatoire» : les maladies visées à l'annexe A.
|
2. En outre, les définitions, autres que celles des centres et organismes agréés, prévues à l'article 2 des directives 64/432/CEE, 91/67/CEE et 90/539/CEE s'appliquent mutatis mutandis.
CHAPITRE II
Dispositions applicables aux échanges
Article 3
Les États membres veillent à ce que les échanges visés à l'article 1er premier alinéa ne soient pas interdits ou restreints pour des raisons de police sanitaire autres que celles qui résultent de l'application de la présente directive ou de la législation communautaire, et notamment des mesures de sauvegarde éventuellement prises.
▼
Dans l'attente de dispositions communautaires en la matière, la Suède peut maintenir ses règles nationales en ce qui concerne les serpents et autres reptiles qui lui sont destinés.
▼B
Article 4
Les États membres prennent les mesures nécessaires pour que, aux fins de l'application de l'article 4 paragraphe 1 point a) de la directive 90/425/CEE, les animaux visés aux articles 5 à 10 de la présente directive ne puissent, sans préjudice de l'article 13 et des dispositions particulières à arrêter en application de l'article 24, faire l'objet d'échanges que s'ils satisfont aux conditions prévues aux articles 5 à 10 et s'ils proviennent d'exploitations ou de commerces visés à l'article 12 paragraphes 1 et 3 de la présente directive qui font l'objet d'un enregistrement par l'autorité compétente et qui s'engagent:
— à faire examiner régulièrement les animaux détenus, conformément à l'article 3 paragraphe 3 de la directive 90/425/CEE,
— à déclarer à l'autorité compétente, outre l'apparition de maladies à déclaration obligatoire, l'apparition des maladies visées à l'annexe B pour laquelle l'État membre concerné a mis en place un programme de lutte ou de surveillance,
— à respecter les mesures nationales spécifiques de lutte contre une maladie qui présente pour un État membre donné une importance particulière et qui fait l'objet d'un programme établi conformément à l'article 14 ou d'une décision conformément à l'article 15 paragraphe 2,
— à ne mettre sur le marché aux fins d'échanges que des animaux ne présentant aucun signe de maladie et provenant d'exploitations ou de zones qui ne font l'objet d'aucune mesure d'interdiction pour des motifs de police sanitaire et, en ce qui concerne les animaux qui ne sont pas accompagnés d'un certificat sanitaire ou d'un document commercial prévu aux articles 5 à 11, que des animaux accompagnés par une autocertification de la part de l'exploitant attestant que les animaux en question ne présentent au moment de l'expédition aucun signe apparent de maladie et que son exploitation n'est pas soumise à des mesures de restriction de police sanitaire,
— à respecter les exigences permettant d'assurer le bien-être des animaux détenus.
Article 5
1. Les États membres veillent à ce que les singes (simiae et prosimiae) ne fassent l'objet d'échanges qu'en provenance et à destination d'organismes, d'instituts ou de centres officiellement agréés par les autorités compétentes des États membres, conformément à l'article 13, et à ce qu'ils soient accompagnés d'un certificat vétérinaire conforme au modèle figurant à l'annexe E, dont l'attestation devra être complétée par le vétérinaire officiel de l'organisme, de l'institut ou du centre d'origine pour garantir l'état sanitaire des animaux.
2. L'autorité compétente d'un État membre peut, par dérogation au paragraphe 1, autoriser l'acquisition par un organisme, un institut ou un centre agréé de singes appartenant à un particulier.
Article 6
A. Les États membres veillent à ce que, sans préjudice des articles 14 et 15, les ongulés des espèces autres que celles visées par les directives 64/432/CEE, 90/426/CEE et 91/68/CEE ne puissent faire l'objet d'échanges que s'ils satisfont aux exigences suivantes:
1) d'une manière générale:
a) être identifiés conformément à l'article 3 paragraphe 1 point c) de la directive 90/425/CEE;
b) ne pas devoir être éliminés dans le cadre d'un programme d'éradication d'une maladie contagieuse;
c) ne pas avoir été vaccinés contre la fièvre aphteuse et satisfaire aux exigences pertinentes de la directive 85/511/CEE et de l'article 4 bis de la directive 64/432/CEE;
d) provenir d'une exploitation visée à l'article 3 paragraphe 2 points b) et c) de la directive 64/432/CEE qui n'est pas soumise à des mesures de police sanitaire, notamment celles prises en application des directives 85/511/CEE, 80/217/CEE (
15
) et 91/68/CEE et dans laquelle ils ont été maintenus de façon permanente depuis leur naissance ou au cours des trente derniers jours avant l'expédition;
▼M7
e) être accompagnés d'un certificat conforme au modèle figurant à l'annexe E, partie I, complété par l'attestation suivante:

▼M7 —————
▼B
2) s'il s'agit de ruminants:
a) provenir d'un cheptel officiellement indemne de tuberculose et officiellement indemne ou indemne de brucellose conformément à la directive 64/432/CEE ou à la directive 91/68/CEE et satisfaire, en ce qui concerne les règles de police sanitaire, aux exigences pertinentes prévues pour l'espèce bovine à l'article 3 paragraphe 2 points c), d), f), g) et h) de la directive 64/432/CEE, ou à l'article 3 de la directive 91/68/CEE;
▼M7
b) s'ils ne proviennent pas d'un cheptel répondant aux conditions prévues au point a), provenir d'une exploitation dans laquelle aucun cas de brucellose et de tuberculose n'a été constaté au cours des quarante-deux jours précédant le chargement des animaux et dans laquelle les ruminants ont été soumis, dans les trente jours précédant l'expédition, avec un résultat négatif, à un test de dépistage de la brucellose et de la tuberculose;
▼
c) selon la procédure prévue à l'article 26, des dispositions relatives à la leucose peuvent être adoptées;
▼B
3) s'il s'agit de suidés:
a) ne pas provenir d'une zone soumise à des mesures d'interdiction liées à l'existence de la peste porcine africaine en application de l'article 9 bis de la directive 64/432/CEE;
b) provenir d'une exploitation qui n'est soumise à aucune restriction prévue par la directive 80/217/CEE du fait de la peste porcine classique;
c) provenir d'un cheptel indemne de brucellose conformément à la directive 64/432/CEE et satisfaire aux exigences de police sanitaire pertinentes prévues pour l'espèce porcine par la directive 64/432/CEE;
d) s'ils ne proviennent pas d'un cheptel répondant aux conditions prévues au point c), avoir, au cours des 30 jours précédant leur expédition, subi avec résultat négatif un test visant à démontrer l'absence d'anticorps contre la brucellose;
▼M7 —————
▼M7
4) Les exigences en matière de test visées au présent article et les critères correspondants peuvent être établis selon la procédure prévue à l’article 26. Ces décisions prennent en considération le cas des ruminants élevés dans les régions arctiques de la Communauté.
Dans l'attente des décisions prévues à l'alinéa précédent, les dispositions nationales continuent de s'appliquer.
▼B
B. La directive 64/432/CEE est modifiée comme suit.
1) À l'article 2 points b) et c), les mots «de l'espèce bovine» sont remplacés par les mots «des espèces bovines (y compris les espèces Bubalus bubalus)».
2) L'article suivant est inséré:
«Article 10 bis
Selon la procédure prévue à l'article 12, les certificats sanitaires dont le modèle figure à l'annexe F peuvent être modifiés ou complétés, notamment en vue de tenir compte des exigences de l'article 6 de la directive 92/65/CEE.»
Article 7
A. Les États membres veillent à ce que les oiseaux autres que ceux visés par la directive 90/539/CEE ne puissent faire l'objet d'échanges que s'ils satisfont aux exigences suivantes:
1) d'une manière générale:
a) provenir d'une exploitation dans laquelle l'influenza aviaire n'a pas été diagnostiquée au cours des 30 jours précédant l'expédition;
b) provenir d'une exploitation ou d'une zone qui ne soit pas soumise à des restrictions au titre des mesures de lutte contre la maladie de Newcastle.
Dans l'attente de la mise en œuvre des mesures communautaires visées à l'article 19 de la directive 90/539/CEE, les exigences nationales en matière de lutte contre la maladie de Newcastle restent applicables, dans le respect des dispositions générales du traité;
c) avoir, conformément à l'article 10 paragraphe 1 troisième tiret de la directive 91/496/CEE, subi, s'ils ont été importés en provenance d'un pays tiers, une quarantaine dans l'exploitation dans laquelle ils ont été introduits après l'admission sur le territoire de la Communauté;
2) en outre, s'il s'agit de psittacidés:
a) ne pas provenir d'une exploitation ou avoir été en contact avec des animaux d'une exploitation dans laquelle la psittacose (Chlamida psittaci) a été diagnostiquée.
La durée d'interdiction doit être d'au moins deux mois à compter du dernier cas diagnostiqué et d'un traitement effectué sous contrôle vétérinaire, reconnu selon la procédure prévue à l'article 26;
b) être identifiés conformément à l'article 3 paragraphe 1 point c) de la directive 90/425/CEE,
Les méthodes d'identification des psittacidés, et notamment des psittacidés malades, sont déterminées selon la procédure prévue à l'article 26;
c) être accompagnés d'un document commercial visé par un vétérinaire officiel ou par le vétérinaire qui a en charge l'exploitation ou le commerce d'origine et à qui l'autorité compétente aura délégué cette compétence.
B. À l'article 2 deuxième alinéa point 2 de la directive 91/495/CEE du Conseil, du 27 novembre 1990, concernant les problèmes sanitaires et de police sanitaire relatifs à la production et à la mise sur le marché de viandes de lapin et de viandes de gibier d'élevage (
16
), les mots «et les oiseaux coureurs (ratites)» sont insérés à la quatrième ligne après les mots «la directive 90/539/CEE».
À l'article 2 deuxième alinéa point 1 de la directive 90/539/CEE du Conseil, du 15 octobre 1990, relative aux conditions de police sanitaire régissant les échanges intracommunautaires et les importations en provenance des pays tiers de volailles et d'œufs à couver (
17
), les mots «ainsi que les oiseaux coureurs (ratites),» sont insérés après les mots «et perdrix».
Article 8
Les États membres veillent à ce que les abeilles (Apis melifera) ne puissent faire l'objet d'échanges que si elles satisfont aux exigences suivantes:
a) provenir d'une zone qui ne fait pas l'objet d'une interdiction liée à l'apparition de loque américaine.
La durée d'interdiction doit être d'au moins trente jours à compter du dernier cas constaté et de la date à laquelle toutes les ruches situées dans un rayon de trois kilomètres ont été contrôlées par l'autorité compétente et toutes les ruches infectées ont été brûlées ou traitées et contrôlées à la satisfaction de ladite autorité compétente.
Selon la procédure prévue à l'article 26, et après avis du comité scientifique vétérinaire, les exigences auxquelles sont soumises les abeilles (Apis melifera) ou des exigences équivalentes peuvent être appliquées aux bourdons;
b) être accompagnées d'un certificat sanitaire conforme au modèle figurant à l'annexe E, dont l'attestation devra être complétée par l'autorité compétente pour attester le respect des exigences prévues au point a).
Article 9
1. Les États membres veillent à ce que les lagomorphes ne puissent faire l'objet d'échanges que s'ils satisfont aux exigences suivantes:
a) ne pas provenir d'une exploitation dans laquelle la rage est apparue ou a été présumée au cours du dernier mois ne pas avoir été en contact avec des animaux d'une telle exploitation;
b) provenir d'une exploitation dans laquelle aucun animal ne présente des signes cliniques de myxomatose.
2. Les États membres qui exigent un certificat sanitaire pour les mouvements de lagomorphes sur leur territoire peuvent exiger que les animaux qui leur sont destinés soient accompagnés d'un certificat sanitaire conforme au modèle prévu à l'annexe E, complété par l'attestation suivante:
«Je soussigné, …, certifie que le lot indiqué ci-dessus respecte les exigences de l'article 9 de la directive 92/65/CEE et que les animaux n'ont présenté aucun signe clinique de maladie lors de l'examen.»
Cette attestation doit être délivrée par le vétérinaire officiel ou par le vétérinaire qui a en charge l'exploitation d'origine et à qui l'autorité compétente a délégué cette compétence et, pour les élevages industriels, par le vétérinaire officiel.
Les États membres qui veulent faire usage de cette faculté en informent la Commission qui doit s'assurer du respect de l'exigence prévue au premier alinéa.
3. L'Irlande et le Royaume-Uni peuvent exiger la présentation d'un certificat sanitaire attestant que l'exigence prévue au paragraphe 1 point a) est respectée.
Article 10
1. Les États membres veillent à ce que soient interdits les échanges des
►M5
————— ◄ visons et renards qui proviennent d'une exploitation dans laquelle la rage est apparue ou est présumée au cours des six derniers mois ou qui ont été en contact avec des animaux d'une telle exploitation, dans la mesure où ils ne sont pas soumis à une vaccination systématique.
▼M14
2. Pour faire l’objet d’échanges, les chiens, les chats et les furets:
a) répondent aux conditions prévues à l’article 6 et, le cas échéant, à l’article 7 du règlement (UE) no 576/2013 du Parlement européen et du Conseil du 12 juin 2013 relatif aux mouvements non commerciaux d’animaux de compagnie (
18
);
b) font l’objet d’un examen clinique réalisé dans les quarante-huit heures précédant l’heure d’expédition des animaux par un vétérinaire habilité par l’autorité compétente; et
c) sont accompagnés, durant le transport jusqu’au lieu de destination, d’un certificat sanitaire:
i) correspondant au modèle figurant à l’annexe E, première partie, et
ii) signé par un vétérinaire officiel qui atteste que le vétérinaire habilité par l’autorité compétente a consigné dans la section pertinente du document d’identification dans le format prévu à l’article 21, paragraphe 1, du règlement (UE) no 576/2013, l’examen clinique réalisé conformément au point b), lequel démontre qu’au moment dudit examen, les animaux étaient aptes à effectuer le voyage prévu conformément au règlement (CE) no 1/2005 du Conseil du 22 décembre 2004 relatif à la protection des animaux pendant le transport et les opérations annexes (
19
).
▼M14 —————
▼A2
4. L'Irlande, Chypre, Malte et le Royaume-Uni peuvent, sans préjudice des paragraphes 2 et 3, maintenir leur réglementation nationale relative à la quarantaine pour tous les carnivores,
►M5
à l'exception des espèces visées aux paragraphes 2 et 3, ◄ primates, chauves-souris et autres animaux réceptifs à la rage, qui sont visés par la présente directive et pour lesquels il ne peut être démontré qu'ils sont nés sur l'exploitation d'origine et maintenus depuis leur naissance en captivité, sans que le maintien de ces réglementations puisse porter préjudice à la suppression des contrôles vétérinaires aux frontières entre États membres.
▼B
5. La décision 90/638/CEE est modifiée comme suit.
1) À l'article 1er, le tiret suivant est ajouté:
— «en ce qui concerne les programmes de lutte contre la rage: les critères indiqués à l'annexe III.»
2) L'annexe suivante est ajoutée:
«ANNEXE III
Critères à retenir pour les programmes contre la rage.
Les programmes contre la rage doivent comprendre au moins:
a) Les critères visés aux points 1 à 7 de l'annexe I;
b) des informations détaillées sur la ou les régions dans laquelle ou lesquelles l'immunisation orale des renards aura lieu et ses limites naturelles. Cette ou ces région(s) couvre(nt) au moins 6 000 kilomètres carrés ou la totalité du territoire d'un État membre et elle(s) peut (peuvent) inclure des zones limitrophes de pays tiers;
c) des informations détaillées sur les vaccins proposés, le système de distribution, la densité et la fréquence de la pose des appâts;
d) le cas échéant, tous les détails, le coût et le but des actions de conservation ou de préservation de la flore et de la faune qui sont entreprises par des organisations bénévoles sur le territoire couvert par ces projets.»
6. Le Conseil, statuant à la majorité qualifiée sur proposition de la Commission, désigne un institut spécifique responsable pour l'établissement des critères nécessaires à la standardisation des tests sérologiques et décide de ses attributions.
7. Les États membres veillent à ce que les frais occasionnés par l'application du test sérologique soient à la charge des importateurs.
▼M5 —————
▼
Article 10 bis
En ce qui concerne la rage et selon la procédure prévue à l'article 26 après présentation des justifications appropriées, les articles 9 et 10 sont modifiés en vue de prendre en compte la situation de la Finlande et de la Suède, afin de leur appliquer les mêmes dispositions que celles applicables aux États membres ayant une situation équivalente.
▼M9
Article 11
1. Les États membres veillent à ce que, sans préjudice des décisions à prendre en application des articles 21 et 23, seuls fassent l'objet d'échanges les spermes, ovules et embryons répondant aux conditions visées aux paragraphes 2, 3, 4 et 5.
2. Les spermes des espèces ovine, caprine et équine doivent, sans préjudice d'éventuels critères à respecter pour l'inscription des équidés dans les livres généalogiques pour certaines races spécifiques:
— avoir été collectés, traités et stockés en vue de l'insémination artificielle dans une station ou un centre agréés, d'un point de vue sanitaire, conformément à l'annexe D, chapitre Ier, ou, s'agissant d'ovins et de caprins, par dérogation à ce qui précède, dans une exploitation satisfaisant aux exigences de la directive 91/68/CEE,
— avoir été collectés sur des animaux répondant aux conditions fixées à l'annexe D, chapitre II,
— avoir été collectés, traités, conservés, stockés et transportés conformément à l'annexe D, chapitre III,
— être accompagnés au cours de leur acheminement vers un autre État membre d'un certificat sanitaire conforme à un modèle à définir selon la procédure visée à l'article 26.
3. Les ovules et les embryons des espèces ovine, caprine, équine et porcine doivent:
— avoir été prélevés sur des femelles donneuses répondant aux conditions énoncées à l'annexe D, chapitre IV par une équipe de collecte ou avoir été produits par une équipe de production agréées par l'autorité compétente de l'État membre et satisfaisant aux conditions à fixer à l'annexe D, chapitre Ier, selon la procédure visée à l'article 26,
— avoir été collectés, traités et conservés dans un laboratoire adapté, et stockés et transportés conformément à l'annexe D, chapitre III,
— avoir été accompagnés au cours de leur acheminement vers un autre État membre d'un certificat sanitaire conforme à un modèle à définir selon la procédure visée à l'article 26.
Les spermes utilisés pour l'insémination des femelles donneuses doivent être conformes au paragraphe 2 en ce qui concerne les ovins, les caprins et les équidés et à la directive 90/429/CEE en ce qui concerne les porcins.
Des garanties supplémentaires peuvent être fixées conformément à la procédure visée à l'article 26.
4. Les stations ou centres visés au paragraphe 2, premier tiret, et les équipes agréées visées au paragraphe 3, premier tiret, sont enregistrés par l'autorité compétente de l'État membre concerné, chaque station ou centre et chaque équipe recevant un numéro d'enregistrement vétérinaire.
Chaque État membre dresse et tient à jour la liste de ces stations ou centres et de ces équipes agréés ainsi que de leur numéro d'enregistrement vétérinaire, et la communique aux autres États membres et au public.
Les modalités nécessaires à l'application uniforme du présent paragraphe peuvent être arrêtées selon la procédure visée à l'article 26.
5. Les conditions de police sanitaire ainsi que les modèles de certificats sanitaires applicables aux spermes, ovules et embryons des espèces non visées aux paragraphes 2 et 3 sont établis selon la procédure visée à l'article 26.
Dans l'attente de l'établissement des conditions de police sanitaire et des modèles de certificats sanitaires pour les échanges de ces spermes, de ces ovules et de ces embryons, la réglementation nationale continue de s'appliquer.
▼B
Article 12
1. Les règles de contrôle prévues par la directive 90/425/CEE sont applicables, notamment en ce qui concerne l'organisation des contrôles à effectuer et les suites à donner à ceux-ci, aux animaux et spermes, ovules et embryons visés par la présente directive qui sont accompagnés d'un certificat sanitaire. Les autres animaux doivent provenir d'exploitations soumises, en ce qui concerne les contrôles à effectuer à l'origine et à destination, aux principes de ladite directive.
2. L'article 10 de la directive 90/425/CEE s'applique aux animaux, spermes, ovules et embryons visés par la présente directive.
3. Aux fins des échanges, les dispositions de l'article 12 de la directive 90/425/CEE sont étendues aux commerces qui détiennent de manière permanente ou à titre occasionnel des animaux tels que visés aux articles 7, 9 et 10.
4. L'information du lieu de destination prévu à l'article 4 paragraphe 2 de la directive 90/425/CEE pour les animaux, spermes, ovules ou embryons qui, conformément à la présente directive, sont accompagnés d'un certificat sanitaire, doit intervenir par le système Animo.
5. Sans préjudice des dispositions spécifiques de la présente directive, l'autorité compétente procède, en cas de suspicion de non-observation de la présente directive ou en cas de doute quant à la santé des animaux ou la qualité des spermes, ovules et embryons visés à l'article 1er, à tous les contrôles qu'elle juge appropriés.
6. Les États membres prennent les mesures administratives ou pénales appropriées pour sanctionner toute infraction à la présente directive, en particulier lorsqu'il est constaté que les certificats ou documents établis ne correspondent pas à l'état réel des animaux visés à l'article 1er, que l'identification des animaux ou le marquage des spermes, ovules et embryons en question n'est pas conforme à la présente directive, ou que les animaux ou produits en question n'ont pas été soumis aux contrôles prévus par celle-ci.
Article 13
1. Les échanges d'animaux des espèces sensibles aux maladies visées à l'annexe A ou aux maladies visées à l'annexe B, dans le cas où l'État membre de destination bénéficie de garanties prévues aux articles 14 et 15, ainsi que les échanges de spermes, d'ovules ou d'embryons de ces animaux, à partir et à destination d'organismes, d'instituts ou de centres agréés conformément à l'annexe C, sont subordonnés à la présentation d'un document de transport reprenant les indications du modèle figurant à l'annexe E. Ce document, à compléter par le vétérinaire qui a en charge l'organisme, l'institut ou le centre d'origine, doit préciser que les animaux, spermes, ovules ou embryons proviennent d'un organisme, d'un institut ou d'un centre agréé conformément à l'annexe C et doit les accompagner au cours du transport.
2.
a) Pour être agréés, les organismes, instituts ou centres doivent, en ce qui concerne les maladies à déclaration obligatoire, présenter à l'autorité compétente de l'État membre toutes les pièces justificatives pertinentes se rapportant aux exigences de l'annexe C.
b) Après réception du dossier relatif à la demande d'agrément ou de renouvellement de l'agrément, l'autorité compétente l'examine à la lumière des renseignements qui y figurent et, le cas échéant, des résultats des contrôles effectués sur place.
c) L'autorité compétente retire l'agrément conformément à l'annexe C paragraphe 3.
▼M9
d) Tous les organismes, instituts et centres agréés sont enregistrés et dotés d'un numéro d'agrément par l'autorité compétente.
Chaque État membre dresse et tient à jour la liste des organismes, instituts et centres agréés et de leur numéro d'agrément, et la communique aux autres États membres et au public.
Les modalités nécessaires à l'application uniforme du présent point peuvent être arrêtées selon la procédure visée à l'article 26.
▼
e) La Suède dispose d'un délai de deux ans à compter de la date d'entrée en vigueur du traité d'adhésion pour mettre en œuvre les mesures prévues relatives aux organismes, instituts ou centres.
▼B
Article 14
1. Dans le cas où un État membre établit ou a établi, soit directement, soit par l'entremise des éleveurs, un programme facultatif ou obligatoire de lutte ou de surveillance contre une des maladies visées à l'annexe B, il peut soumettre ce programme à la Commission en indiquant notamment:
— la situation de la maladie sur son territoire,
— le caractère obligatoire de la notification de la maladie,
— la justification du programme, en prenant en compte l'importance de la maladie et ses avantages coût/bénéfice,
— la zone géographique dans laquelle le programme va être appliqué,
— les différents statuts applicables aux établissements, les exigences demandées pour chaque espèce au niveau de l'introduction dans l'élevage et les procédures de test,
— les procédures de contrôle du programme, y compris le degré d'association des éleveurs à la mise en œuvre du programme de lutte ou de surveillance,
— la conséquence à tirer en cas de perte de statut de l'exploitation pour quelque raison que ce soit,
— les mesures à prendre en cas de résultats positifs constatés lors de contrôles effectués conformément au programme,
— le caractère non discriminatoire entre les échanges sur le territoire de l'État membre concerné et les échanges intracommunautaires.
2. La Commission examine les programmes communiqués par les États membres. Les programmes peuvent être approuvés selon la procédure prévue à l'article 26 dans le respect des critères énoncés au paragraphe 1. Selon la même procédure, des garanties complémentaires générales ou limitées pouvant être exigées dans les échanges sont définies en même temps ou au plus tard trois mois après la présentation des programmes. Ces garanties doivent être au maximum équivalentes à celles que l'État membre met en œuvre dans le cadre national.
3. Les programmes soumis par les États membres peuvent être modifiés ou complétés selon la procédure prévue par l'article 26. Selon la même procédure, une modification peut être apportée aux garanties visées au paragraphe 2.
Article 15
1. Un État membre qui estime qu'il est totalement ou partiellement indemne de l'une des maladies visées à l'annexe B auxquelles les animaux visés par la présente directive sont sensibles soumet à la Commission les justifications appropriées. Il précise en particulier:
— la nature de la maladie et l'historique de son apparition sur son territoire,
— les résultats des tests de surveillance fondés sur une recherche sérologique, microbiologique, pathologique ou épidémiologique,
— depuis combien de temps cette maladie est à déclaration obligatoire auprès des autorités compétentes,
— la durée de la surveillance effectuée,
— éventuellement, la période durant laquelle la vaccination contre la maladie a été interdite et la zone géographique concernée par cette interdiction,
— les règles permettant le contrôle de l'absence de la maladie.
2. La Commission, après examen des justifications prévues au paragraphe 1, soumet au comité vétérinaire permanent une décision d'approbation ou de rejet du plan soumis par l'État membre. En cas d'acceptation du plan, les garanties complémentaires générales ou limitées pouvant être exigées dans les échanges sont définies selon la procédure prévue à l'article 26. Elles doivent être au maximum équivalentes à celles que l'État membre met en œuvre dans le cadre national.
Dans l'attente de cette décision, l'État membre concerné peut maintenir dans les échanges les exigences pertinentes nécessaires au maintien de son statut.
3. L'État membre concerné communique à la Commission toute modification des justifications mentionnées au paragraphe 1. À la lumière des informations communiquées, les garanties définies conformément au paragraphe 2 peuvent être modifiées ou supprimées selon la procédure prévue à l'article 26.
CHAPITRE III
Dispositions applicables aux importations dans la Communauté
Article 16
Les conditions applicables aux importations d'animaux, de spermes, d'ovules et d'embryons couverts par la présente directive doivent être au moins équivalentes à celles prévues au chapitre II.
▼M14
En ce qui concerne les chats, les chiens et les furets, les conditions d’importation doivent être au moins équivalentes à celles visées à l’article 10, paragraphe 1, points a) à d), et à l’article 12, point a), du règlement (UE) no 576/2013.
En plus des conditions visées au deuxième alinéa, les chiens, les chats et les furets sont, durant le transport jusqu’au lieu de destination, accompagnés d’un certificat sanitaire complété et signé par un vétérinaire officiel qui atteste qu’un examen clinique a été réalisé dans les quarante-huit heures précédant l’heure de l’expédition des animaux par un vétérinaire habilité par l’autorité compétente, lequel a vérifié qu’au moment de l’examen clinique, les animaux étaient aptes à effectuer le voyage prévu.
▼B
Article 17
1. Aux fins de l'application uniforme de l'article 16, les dispositions des paragraphes suivants s'appliquent.
▼M9
2. Ne peuvent faire l'objet d'importations dans la Communauté que les animaux et les spermes, ovules et embryons visés à l'article 1er qui satisfont aux exigences suivantes:
a) ils doivent provenir d'un pays tiers figurant sur une liste à établir conformément au paragraphe 3, point a);
b) être accompagnés du certificat sanitaire conforme à un modèle à définir selon la procédure visée à l'article 26, signé par l'autorité compétente du pays exportateur et attestant que:
i) les animaux:
— emplissent les conditions supplémentaires ou offrent les garanties équivalentes visées au paragraphe 4, et
— proviennent de centres, d'organismes ou d'instituts agréés offrant des garanties au moins équivalentes à celles qui sont prévues à l'annexe C;
ii) les spermes, les ovules et les embryons proviennent de stations de collecte et de stockage ou d'équipes de collecte et de production offrant des garanties au moins équivalentes à celles qui doivent être établies à l'annexe D, chapitre Ier, selon la procédure visée à l'article 26.
Dans l'attente de l'établissement des listes des pays tiers, des établissements agréés énumérés au point b), des exigences de police sanitaire et des modèles de certificats sanitaires visés aux points a) et b), la réglementation nationale continue de s'appliquer, pour autant qu'elle ne soit pas plus favorable que les règles fixées au chapitre II.
3. Sont établies:
a) selon la procédure visée à l'article 26, une liste de pays tiers ou de parties de pays tiers qui sont en mesure de fournir aux États membres et à la Commission des garanties équivalentes à celles prévues au chapitre II en ce qui concerne les animaux, les spermes, les ovules et les embryons,
b) conformément au présent point, une liste de stations ou centres ou d'équipes agréés, tels que visés à l'article 11, paragraphe 2, premier tiret, et paragraphe 3, premier tiret, situés dans l'un des pays tiers figurant sur la liste visée au point a) du présent paragraphe et pour lesquels l'autorité compétente est en mesure de fournir les garanties prévues à l'article 11, paragraphes 2 et 3.
La liste des stations ou centres et des équipes agréés visés au premier alinéa et leur numéro d'enregistrement vétérinaire sont communiqués à la Commission.
L'agrément d'un centre, d'une station ou des équipes doit être immédiatement suspendu ou retiré par l'autorité compétente du pays tiers lorsque ce centre, cette station ou cette équipe ne satisfont plus aux conditions prévues à l'article 11, paragraphes 2 et 3, et la Commission doit en être immédiatement informée.
La Commission transmet aux États membres toute nouvelle liste mise à jour qu'elle reçoit de l'autorité compétente du pays tiers concerné en vertu des deuxième et troisième alinéas, et la communique au public à titre d'information.
Les modalités nécessaires à l'application uniforme du présent paragraphe peuvent être arrêtées selon la procédure visée à l'article 26.
c) selon la procédure visée à l'article 26, les conditions spécifiques de police sanitaire, notamment celles visant à protéger la Communauté contre certaines maladies exotiques, ou des garanties équivalentes à celles prévues par la présente directive.
Les conditions spécifiques et les garanties équivalentes fixées pour les pays tiers ne peuvent être plus favorables que celles prévues au chapitre II.
▼B
4. Ne peuvent être inscrits sur la liste visée au paragraphe 3 que les pays tiers ou parties de pays tiers:
a) en provenance desquels les importations ne sont pas interdites:
— en raison de l'absence de maladies telles que visées à l'annexe A ou de toute autre maladie exotique à la Communauté,
— en application des articles 6, 7 et 14 de la directive 72/462/CEE et de l'article 17 des directives 91/495/CEE et 71/118/CEE (
20
) ou, dans le cas des autres animaux visés par la présente directive, sur une décision prise selon la procédure prévue à l'article 26 et tenant compte de leur état sanitaire;
b) qui, compte tenu de la législation et de l'organisation de son service vétérinaire et de ses services d'inspection, des pouvoirs de ces services et de la surveillance dont ils font l'objet, ont été reconnus aptes, conformément à l'article 3 paragraphe 2 de la directive 72/462/CEE, à garantir l'application de leur législation en vigueur;
c) dont le service vétérinaire est en mesure de garantir le respect d'exigences sanitaires au moins équivalentes à celles du chapitre II.
5. Des experts de la Commission et des États membres effectuent des contrôles sur place pour vérifier si les garanties offertes par le pays tiers quant aux conditions de production et de mise sur le marché peuvent être considérées comme équivalentes à celles qui sont appliquées dans la Communauté.
Les experts des États membres chargés de ces contrôles sont désignés par la Commission sur proposition des États membres.
Ces contrôles sont effectués pour le compte de la Communauté qui prend en charge les frais y afférents.
6. Dans l'attente des contrôles visés au paragraphe 5, les dispositions nationales applicables en matière d'inspection dans les pays tiers continuent à s'appliquer, sous réserve d'information, au sein du comité vétérinaire permanent, en ce qui concerne les manquements aux garanties offertes conformément au paragraphe 3, qui auront été constatés lors de ces inspections.
Article 18
1. Les États membres veillent à ce que les animaux, spermes, ovules et embryons visés par la présente directive ne soient importés dans la Communauté que:
— s'ils sont accompagnés d'un certificat délivré par le vétérinaire officiel.
— Le modèle de certificat est établi, en fonction des espèces, selon la procédure prévue à l'article 26,
— s'ils ont satisfait aux contrôles prévus par les directives 90/675/CEE et 91/496/CEE (
21
),
— s'ils ont été soumis, avant l'embarquement vers le territoire de la Communauté, à un contrôle par un vétérinaire officiel pour s'assurer que les conditions de transport prévues par la directive 91/628/CEE (
22
) sont respectées, notamment pour ce qui est de l'approvisionnement en eau et en nourriture,
— si, lorsqu'il s'agit d'animaux visés aux articles 5 à 10, ils font l'objet avant leur importation, d'une quarantaine dont les modalités sont à fixer selon la procédure prévue à l'article 26.
2. Dans l'attente de la fixation des modalités d'application du présent article, les règles nationales applicables aux importations en provenance de pays tiers pour lesquels ces exigences ne sont pas arrêtées au niveau communautaire continuent à s'appliquer, pour autant qu'elles ne soient pas plus favorables que celles prévues au chapitre II.
Article 19
Sont fixées selon la procédure prévue à l'article 26:
a) les conditions spécifiques de police sanitaire, à l'importation dans la Communauté, la nature et le contenu des documents d'accompagnement des animaux destinés à des zones, à des cirques, à des parcs d'attraction ou à des laboratoires d'expérimentation, selon les espèces;
b) des garanties additionnelles à celles prévues pour les différentes espèces d'animaux visés par la présente directive, pour protéger les espèces communautaires concernées.
Article 20
▼M9
Les règles prévues par la directive 97/78/CE s'appliquent, en particulier à l'organisation et au suivi des contrôles à effectuer par les États membres, ainsi qu'aux mesures de sauvegarde à mettre en œuvre selon la procédure visée à l'article 22 de ladite directive.
▼B
►C2
Dans l'attente de la mise en œuvre des décisions prévues à l'article 8, point B, et à l'article 30 de la directive 91/496/CEE ◄ , les modalités nationales pertinentes d'application de l'article 8 points 1 et 2 de ladite directive continuent à s'appliquer, sans préjudice du respect des principes et règles visés au premier alinéa du présent article.
CHAPITRE IV
Dispositions communes et finales
Article 21
Les éventuels modèles de certificats applicables aux échanges ainsi que les conditions de police sanitaire auxquelles doivent satisfaire les animaux, les spermes, les ovules et les embryons, autres que ceux visés aux articles 5 à 11 pour pouvoir faire l'objet d'échanges sont fixés, en tant que de besoin, selon la procédure prévue à l'article 26.
Article 22
Les annexes sont, en tant que de besoin, modifiées selon la procédure prévue à l'article 26.
▼
L'annexe B est réexaminée avant la date d'entrée en vigueur du traité d'adhésion en vue notamment de modifier la liste des maladies pour y inclure celles auxquelles les ruminants et les suidés sont susceptibles ainsi que celles transmissibles par les spermes, ovules et embryons des ovins.
▼B
Article 23
Selon la procédure prévue à l'article 26, peuvent, le cas échéant, par dérogation
►M7
————— ◄ au chapitre II, être fixées des conditions spécifiques pour la circulation des animaux accompagnant des cirques et des forains et les échanges d'animaux, de spermes, ovules et embryons destinés à des zoos.
Article 24
1. Les États membres sont autorisés à subordonner à la présentation d'un certificat sanitaire attestant que les exigences de la présente directive sont respectées l'introduction sur leur territoire des animaux (y compris les oiseaux de volières) et des spermes, ovules et embryons visés par celle-ci qui ont transité à travers le territoire d'un pays tiers.
2. Les États membres qui ont recours à la faculté prévue au paragraphe 1 en informent la Commission et les autres États membres au sein du comité vétérinaire permanent.
Article 25
À l'annexe A de la directive 90/425/CEE, la mention suivante est ajoutée:
«Directive 92/65/CEE du Conseil, du 13 juillet 1992, définissant les conditions de police sanitaire régissant les échanges et les importations dans la Communauté d'animaux, de spermes, d'ovules et d'embryons non soumis, en ce qui concerne les conditions de police sanitaire, aux réglementations communautaires spécifiques visées à l'annexe A section I de la directive 90/425/CEE (JO no L 268 du 14.9.1992, p. 54)»
.
▼M7
Article 26
1. La Commission est assistée par le comité permanent de la chaîne alimentaire et de la santé animale institué par l’article 58 du règlement (CE) no 178/2002 du Parlement européen et du Conseil (
23
).
2. Dans le cas où il est fait référence au présent paragraphe, les articles 5 et 7 de la décision 1999/468/CE s’appliquent.
La période prévue à l’article 5, paragraphe 6, de la décision 1999/468/CE (
24
) est fixée à trois mois.
3. Le comité adopte son règlement intérieur.
▼B
Article 27
Les États membres qui mettent en œuvre un régime alternatif de contrôle offrant des garanties équivalentes à celles prévues par la présente directive pour les mouvements, sur leur territoire, des animaux, spermes, ovules et embryons visés par celle-ci peuvent s'accorder, sur une base de réciprocité, une dérogation à l'article 6 paragraphe A point 1 f), à l'article 8 point b) et à l'article 11 paragraphe 1 point d).
Article 28
Selon la procédure prévue à l'article 26, des mesures transitoires peuvent être arrêtées, pour une période de trois ans, pour faciliter le passage au nouveau régime prévu par la présente directive.
Article 29
1. Les États membres mettent en vigueur les dispositions législatives, réglementaires et administratives nécessaires pour se conformer à la présente directive avant le 1er janvier 1994. Ils en informent immédiatement la Commission.
Lorsque les États membres adoptent ces dispositions, celles-ci contiennent une référence à la présente directive ou sont accompagnées d'une telle référence lors de leur publication officielle. Les modalités de cette référence sont arrêtées par les États membres.
2. Les États membres communiquent à la Commission le texte des dispositions essentielles de droit interne qu'ils adoptent dans le domaine régi par la présente directive.
3. La fixation de la date d'expiration du délai de transposition au 1er janvier 1994 ne porte pas préjudice à l'abolition des contrôles vétérinaires aux frontières prévue aux directives 89/662/CEE et 90/425/CEE.
Article 30
Les États membres sont destinataires de la présente directive.
▼M6
ANNEXE A
MALADIES À DÉCLARATION OBLIGATOIRE DANS LE CADRE DE LA PRÉSENTE DIRECTIVE
|
MALADIE
|
ORDRE/FAMILLE/ESPÈCE CONCERNÉ(E) À TITRE PRINCIPAL
|
|
Peste équine
|
Equidae
|
|
Peste porcine africaine
|
Suidae et Tayassuidae
|
|
Influenza aviaire
|
Oiseaux
|
|
Loque américaine
|
Abeilles
|
|
Charbon bactéridien
|
Bovidae, Camelidae, Cervicae, Elephantidae, Equidae et Hippopotamidae
|
|
Fièvre catarrhale
|
Antilocapridae, Bovidae, Cervidae, Giraffidae et Rhinocerotidae
|
|
Brucellosis abortus
|
Antilocapridae, Bovidae, Camelidae, Cervidae, Giraffidae, Hippopotamidae et Tragulidae
|
|
Brucellosis melitensis
|
Antilocapridae, Bovidae, Camelidae, Cervidae, Giraffidae, Hippopotamidae et Tragulidae
|
|
Brucellosis ovis
|
Camelidae, Tragulidae, Cervidae, Giraffidae, Bovidae et Antilocapridae
|
|
Brucellosis suis
|
Cervidae, Leporidae, Ovibos moschatus, Suidae et Tayassuidae
|
|
Peste porcine classique
|
Suidae et Tayassuidae
|
|
Péripneumonie contagieuse bovine
|
Bovins (y compris zébu, buffle, bison et yak)
|
|
Ebola
|
Primates non humains
|
|
Fièvre aphteuse
|
Artiodactyla et éléphants d'Asie
|
|
Nécrose hématopoïétique infectieuse
|
Salmonidae
|
|
Dermatose nodulaire contagieuse
|
Bovidae et Giraffidae
|
|
Variole du singe
|
Rodentia et primates non humains
|
|
Tuberculose bovine
|
Mammifères, en particulier Antilocapridae, Bovidae, Camelidae, Cervidae, Giraffidae et Tragulidae
|
|
Maladie de Newcastle
|
Oiseaux
|
|
Peste des petits ruminants
|
Bovidae et Suidae
|
|
Encéphalomyélite infectieuse du porc
|
Suidae
|
|
Psittacose
|
Psittacidés
|
|
Rage
|
Carnivores et chiroptères
|
|
Fièvre de la vallée du Rift
|
Bovidae, espèce Camelus et Rhinocerotidae
|
|
Peste bovine
|
Artiodactyla
|
|
Petit coléoptère des ruches (Aethina tumida)
|
Abeilles et bourdons
|
|
Clavelée et variole caprine
|
Bovidae
|
|
Maladie vésiculeuse du porc
|
Suidae et Tayassuidae
|
|
Coléoptère Tropilaelaps (Tropilaelaps spp.)
|
Abeilles
|
|
Stomatite vésiculeuse
|
Artiodactyla et Equidae
|
|
Encéphalopathie spongiforme transmissible
|
Bovidae, Cervidae, Felidae et Mustelidae
|
▼B
ANNEXE B
LISTE DES MALADIES POUR LESQUELLES DES PROGRAMMES NATIONAUX PEUVENT ÊTRE RECONNUS AU TITRE DE LA PRÉSENTE DIRECTIVE
|
Visons
|
Entérite virale
Maladie aléoutienne
|
|
Abeilles
|
Loque européenne
Varroase et acariose
|
|
Singes et félidés
|
Tuberculose
|
|
Ruminants
|
Tuberculose
|
|
Lagomorphes
|
Myxomatose
Maladies virales et hémorragiques
Tularémie
|
▼M3
ANNEXE C
CONDITIONS D'AGRÉMENT DES ORGANISMES, INSTITUTS OU CENTRES
1. Afin d'être officiellement agréé au titre de l'article 13, paragraphe 2, de la présente directive, un organisme, un institut ou un centre, au sens de l'article 2, paragraphe 1, point c), doit:
a) être nettement délimité et séparé de son environnement, ou les animaux qu'il détient doivent être enfermés ou installés de manière à ne présenter aucun risque sanitaire pour les exploitations agricoles dont le statut sanitaire pourrait être menacé;
b) disposer de moyens adéquats pour capturer, enfermer et isoler les animaux; posséder des installations de quarantaine appropriées et suivre des procédures agréées pour les animaux provenant de sources non agréées;
c) être indemne des maladies énumérées à l'annexe A et des maladies énumérées à l'annexe B lorsque le pays concerné dispose d'un programme conformément à l'article 14. Afin qu'un organisme, un institut ou un centre puisse être déclaré indemne de ces maladies, l'autorité compétente évalue les registres concernant l'état de santé des animaux, conservés pendant les trois dernières années au moins, et les résultats des examens cliniques et de laboratoire effectués sur les animaux dans l'organisme, l'institut ou le centre. Toutefois, par dérogation à cette exigence, de nouveaux établissements sont agréés si les animaux qui y sont détenus proviennent d'établissements agréés;
d) tenir à jour des registres indiquant:
i) le nombre et l'identité (âge, sexe, espèce et identification individuelle, si possible) des animaux de chaque espèce présente dans l'établissement;
ii) le nombre d'animaux arrivés dans l'établissement ou ayant quitté celui-ci et leur identité (âge, sexe, espèce et identification individuelle, si possible), avec indication de leur origine ou de leur destination, ainsi que des données relatives au transport en provenance de l'établissement ou vers celui-ci et à l'état de santé des animaux;
iii) les résultats des examens sanguins ou de toute autre procédure diagnostique;
iv) les cas de maladie et, le cas échéant, les traitements administrés;
v) les résultats des examens post mortem de tous les animaux morts dans l'établissement, y compris des animaux mort-nés;
vi) les constatations faites pendant toute période d'isolement ou de quarantaine;
e) soit avoir chargé un laboratoire compétent d'effectuer des examens post mortem, soit disposer d'un ou de plusieurs locaux où ces examens peuvent être effectués par une personne compétente sous l'autorité du vétérinaire agréé;
f) soit disposer d'un système adapté ou d'installations sur place permettant une élimination appropriée des animaux morts à la suite d'une maladie ou euthanasiés;
g) s'assurer, par contrat ou instrument juridique, les services d'un vétérinaire agréé par l'autorité compétente et soumis à son contrôle, qui:
i) respecte mutatis mutandis les conditions visées à l'article 14, paragraphe 3, point b), de la directive 64/432/CEE;
ii) veille à ce que des mesures appropriées de surveillance et de lutte contre la maladie, adaptées à la situation épidémiologique du pays concerné, soient agréées par l'autorité compétente et appliquées par l'organisme, l'institut ou le centre. Ces mesures incluent:
— un plan de surveillance annuel des maladies, y compris la lutte contre les zoonoses,
— des tests cliniques, de laboratoire et post mortem des animaux suspectés d'être affectés par des maladies transmissibles,
— la vaccination des animaux sensibles contre les maladies infectieuses, le cas échéant, uniquement en conformité avec la législation communautaire;
iii) veille à ce que toute mort suspecte ou la présence de tout symptôme laissant supposer que les animaux ont contracté une ou plusieurs des maladies visées aux annexes A et B soit déclarée immédiatement à l'autorité compétente, si cette maladie est soumise à déclaration dans l'État membre concerné;
iv) veille à ce que les animaux entrants aient été isolés s'il y a lieu, conformément aux exigences de la présente directive et, le cas échéant, conformément aux instructions de l'autorité compétente;
v) est responsable du respect quotidien des exigences de police sanitaire de la présente directive, et de la législation communautaire relative au bien-être des animaux au cours du transport et à l'élimination des déchets animaux;
h) s'il détient des animaux destinés à des expériences de laboratoire, conformément aux dispositions de l'article 5 de la directive 86/609/CEE du Conseil.
2. L'agrément est maintenu si les exigences suivantes sont satisfaites:
a) les locaux sont placés sous le contrôle d'un vétérinaire officiel agréé par l'autorité compétente, qui:
i) visite les locaux de l'organisme, de l'institut ou du centre au moins une fois par an;
ii) contrôle l'activité du vétérinaire agréé et la mise en œuvre du plan de surveillance annuel des maladies;
iii) veille au respect des dispositions de la présente directive;
b) seuls des animaux provenant d'autres organismes, instituts ou centres agréés, sont introduits dans l'établissement, conformément aux dispositions de la présente directive;
c) le vétérinaire officiel vérifie que:
— les dispositions de la présente directive sont respectées,
— les résultats des tests cliniques, post mortem et de laboratoire sur les animaux n'ont révélé aucun indice des maladies visées aux annexes A et B;
d) l'organisme, l'institut ou le centre conserve les registres visés au point 1 d) après l'agrément, pendant une période d'au moins dix ans.
3. Toutefois, par dérogation à l'article 5, paragraphe 1, de la présente directive, et au point 2 b), de la présente annexe, les animaux, y compris les singes (Simiae et Prosimiae), ne provenant pas d'un organisme, d'un institut ou d'un centre agréé peuvent être introduits dans un organisme, un institut ou un centre agréé, à condition d'être préalablement soumis à une quarantaine sous contrôle officiel, et conformément aux instructions données par l'autorité compétente.
En ce qui concerne les singes (Simiae et Prosimiae), les exigences de quarantaine fixées dans le code zoosanitaire international de l'OIE (chapitre 2.10.1 et annexe 3.5.1.) sont respectées.
Pour les autres animaux soumis à une quarantaine en application du point 2 b) de la présente annexe, la période de quarantaine doit être de trente jours au moins pour les maladies énumérées à l'annexe A.
4. Les animaux détenus dans un organisme, un institut ou un centre agréé ne peuvent quitter ces établissements que pour se rendre dans un organisme, un institut ou un centre agréé situé dans le même ou dans un autre État membre; cependant, si les animaux n'ont pas pour destination un organisme, un institut ou un centre agréé, ils ne peuvent quitter ces établissements que s'ils respectent les exigences établies par l'autorité compétente afin d'éviter tout risque de propagation éventuelle de la maladie.
5. Lorsqu'un État membre bénéficie de garanties additionnelles en vertu de la législation communautaire, il peut demander que des exigences et une certification supplémentaires appropriées pour les espèces sensibles soient imposées à l'organisme, à l'institut ou au centre agréé.
6. L'agrément est suspendu, retiré ou rétabli, en partie ou en totalité, dans les cas suivants:
a) lorsque l'autorité compétente estime que les exigences visées au point 2 ne sont pas respectées ou lorsqu'il s'agit d'un usage différent, non couvert par l'article 2 de la présente directive, l'agrément est suspendu ou retiré;
b) en cas de notification de soupçons quant à la présence d'une des maladies visées à l'annexe A ou à l'annexe B, l'autorité compétente suspend l'agrément de l'organisme, de l'institut ou du centre, jusqu'à ce que la suspicion ait été officiellement écartée. En fonction de la maladie suspectée et de son risque de transmission, la suspension peut s'appliquer à l'ensemble de l'établissement ou uniquement à certaines catégories d'animaux sensibles à la maladie en question. L'autorité compétente veille à ce que les mesures nécessaires pour confirmer ou écarter la suspicion, et pour éviter toute propagation de la maladie soient prises conformément à la législation communautaire relative aux mesures de lutte contre la maladie en question et aux échanges d'animaux;
c) lorsque la maladie suspectée est confirmée, l'organisme, l'institut ou le centre ne récupère son agrément que si, après l'éradication de la maladie et des foyers d'infection dans les installations, y compris une désinfection et un nettoyage adéquats, les conditions prévues au point 1 de la présente annexe, à l'exception de celles énoncées au point 1 c), sont à nouveau remplies;
d) l'autorité compétente informe la Commission de la suspension, du retrait ou du rétablissement de l'agrément d'un organisme, d'un institut ou d'un centre.
▼M10
ANNEXE D
CHAPITRE I
Conditions applicables aux centres et stations de collecte de sperme, aux centres de stockage de sperme, aux équipes de collecte d’embryons et aux équipes de production d’embryons
I.
Conditions d’agrément des centres et stations de collecte et de stockage de sperme
|
1.
|
Afin d’être officiellement agréé et de recevoir le numéro d’enregistrement vétérinaire visé à l’article 11, paragraphe 4, chaque centre ou station de collecte de sperme (ci-après «centre de collecte de sperme») doit:
▼M16
1.1. être placé sous la surveillance d'un vétérinaire de centre habilité par l'autorité compétente;
▼M10
1.2. disposer au moins:
a) d’installations fermant à clé pour le logement des animaux et, si nécessaire pour les équidés, d’une aire d’exercice matériellement séparée des installations de collecte, ainsi que des locaux de traitement et de stockage;,
b) d’installations d’isolement sans contact direct avec les locaux de logement normal des animaux;
c) d’installations de collecte de sperme qui peuvent être situées à l’extérieur si elles sont protégées des conditions climatiques défavorables et qui sont équipées d’un sol antidérapant, sur le lieu de collecte et autour du lieu de collecte, en prévention des blessures graves causées par les chutes, sans préjudice des dispositions du point 1.4;
d) d’un local séparé pour le nettoyage et la désinfection ou la stérilisation des équipements;
e) d’un local de traitement du sperme qui doit être séparé des installations de collecte et du local pour le nettoyage des équipements visé au point d) et qui ne doit pas nécessairement se trouver sur le même site;
f) d’un local de stockage du sperme qui ne doit pas nécessairement se trouver sur le même site;
1.3. être construit ou isolé de manière à empêcher tout contact avec des animaux se trouvant à l’extérieur;
1.4. être construit de manière à ce que l’ensemble du centre de collecte de sperme, à l’exception des bureaux et, dans le cas des équidés, de l’aire d’exercice, puisse être facilement nettoyé et désinfecté.
|
|
2.
|
Afin d’être officiellement agréé, chaque centre ou station de stockage de sperme (ci-après «le centre de stockage de sperme») doit:
a) recevoir un numéro d’enregistrement vétérinaire visé à l’article 11, paragraphe 4, distinct pour chacune des espèces dont il stocke le sperme lorsque le stockage concerne les spermes, collectés dans des centres de collecte de sperme agréés conformément à la présente directive, de plus d’une espèce, ou que le centre stocke des embryons conformément à la présente directive;
b) être placé en permanence sous la surveillance d’un vétérinaire de centre habilité par l’autorité compétente;
c) disposer d’un local de stockage du sperme équipé des installations nécessaires au stockage du sperme ou des embryons et construit de manière à protéger ces produits et ces installations contre les conditions climatiques et environnementales défavorables;
d) être construit de manière à empêcher tout contact avec des animaux se trouvant à l’extérieur;
e) être construit de manière à ce que le centre, dans son intégralité, à l’exception des bureaux et, dans le cas des équidés, de l’aire d’exercice, puisse être facilement nettoyé et désinfecté;
f) être construit de manière à empêcher effectivement l’entrée de toute personne non autorisée.
|
II.
Conditions de surveillance des centres et stations de collecte et de stockage de sperme
|
1.
|
Les centres de collecte de sperme doivent:
1.1. être surveillés de façon à ce que le respect des conditions suivantes soit garanti:
a) ils abritent exclusivement des animaux de l’espèce dont le sperme doit être collecté.
D’autres animaux domestiques peuvent tout de même être admis pour autant qu’ils ne fassent courir aucun risque d’infection aux espèces dont le sperme doit être collecté et satisfassent aux conditions fixées par le vétérinaire de centre.
Si, dans le cas des équidés, le centre de collecte de sperme partage un site avec un centre d’insémination artificielle ou de monte, les équidés femelles («les juments») et les équidés mâles entiers («les étalons») souffleurs ou destinés à la monte naturelle sont admis pourvu qu’ils satisfassent aux exigences du chapitre II, points I 1.1, I 1.2, I 1.3 et I 1.4;
b) l’entrée de toute personne non autorisée est empêchée, et les visiteurs autorisés sont tenus de respecter les conditions fixées par le vétérinaire de centre;
c) ils emploient un personnel compétent ayant reçu une formation adéquate en matière de techniques de désinfection et d’hygiène afin de prévenir la propagation des maladies;
1.2. être contrôlés de façon à ce que le respect des conditions suivantes soit garanti:
a) ils tiennent des registres permettant de connaître:
i) l’espèce, la race, la date de naissance et l’identité de chaque animal présent dans le centre;
ii) les mouvements éventuels des animaux pénétrant dans le centre ou le quittant;
iii) l’historique sanitaire et tous les tests diagnostiques ainsi que leurs résultats, les traitements et vaccinations effectués sur les animaux détenus;
iv) la date de collecte et de traitement du sperme;
v) la destination du sperme;
vi) le stockage du sperme;
b) aucun animal détenu dans le centre n’est utilisé à des fins de reproduction naturelle pendant au moins trente jours avant la première collecte de sperme et au cours de la période de collecte;
c) la collecte, le traitement et le stockage du sperme sont effectués exclusivement dans les locaux prévus à cet effet;
d) tous les instruments entrant en contact avec le sperme ou l’animal donneur pendant la collecte et le traitement sont convenablement désinfectés ou stérilisés avant chaque usage, sauf dans le cas d’instruments neufs, à usage unique et jetés après usage (ci-après «les instruments à usage unique»).
Si, dans le cas des équidés, le centre de collecte partage un site avec un centre d’insémination artificielle ou un centre de monte, le sperme doit être strictement séparé des instruments et équipements destinés à l’insémination artificielle ou à la monte et des instruments et équipements entrant en contact avec les animaux donneurs ou d’autres animaux détenus dans le centre de collecte;
e) les produits d’origine animale utilisés dans le traitement du sperme, tels que les diluants, additifs ou extendeurs, proviennent de sources ne présentant aucun risque zoosanitaire ou ont subi un traitement préalable de nature à écarter ce risque;
f) les agents cryogènes utilisés pour la conservation ou le stockage du sperme n’ont pas servi antérieurement pour d’autres produits d’origine animale;
g) les récipients utilisés pour le stockage et le transport sont convenablement désinfectés ou stérilisés avant le début de toute opération de remplissage, sauf dans le cas de récipients neufs, à usage unique et jetés après usage (ci-après «les récipients à usage unique»);
h) chaque dose individuelle de sperme ou chaque éjaculat de sperme frais destiné à être traité est muni d’une inscription apparente permettant de déterminer aisément la date de collecte du sperme, l’espèce, la race et l’identité de l’animal donneur, ainsi que le numéro d’agrément du centre de collecte;
1.3. être inspectés par un vétérinaire officiel au cours de la saison d’accouplement, au moins une fois par année civile dans le cas des animaux à reproduction saisonnière et deux fois par année civile dans le cas de la reproduction non saisonnière, afin que soient analysés et vérifiés tous les aspects relatifs aux conditions d’agrément, de surveillance et de contrôle, au moyen si nécessaire de registres, de modes opératoires normalisés et de contrôles internes.
|
|
2.
|
Les centres de stockage de sperme:
2.1. doivent être surveillés de façon à ce que le respect des conditions suivantes soit garanti:
a) le statut des animaux donneurs dont le sperme est stocké dans le centre est conforme aux exigences de la présente directive;
b) les conditions fixées aux points 1.1 b) et 1.1 c) sont remplies;
c) tous les mouvements de sperme sont enregistrés, que ce soit les entrées dans le centre de stockage de sperme ou les sorties;
2.2. doivent être contrôlés de façon à ce que le respect des conditions suivantes soit garanti:
a) n’est introduit dans un centre de stockage de sperme agréé que du sperme provenant d’un centre de collecte ou de stockage agréé et transporté dans des conditions offrant toute garantie sanitaire, sans être entré en contact avec du sperme ne répondant pas aux exigences de la présente directive;
b) le stockage du sperme s’effectue exclusivement dans les locaux réservés à cet effet et dans des conditions d’hygiène strictes;
c) tous les instruments entrant en contact avec le sperme sont convenablement désinfectés ou stérilisés avant chaque usage, sauf dans le cas d’instruments à usage unique;
d) les récipients utilisés pour le stockage et le transport sont convenablement désinfectés ou stérilisés avant le début de toute opération de remplissage, sauf dans le cas de récipients à usage unique;
e) les agents cryogènes utilisés pour la conservation ou le stockage du sperme n’ont pas servi antérieurement pour d’autres produits d’origine animale;
f) chaque dose individuelle de sperme est munie d’une inscription apparente permettant d’établir aisément la date de collecte du sperme, l’espèce, la race et l’identité de l’animal donneur, ainsi que le numéro d’agrément du centre de collecte de sperme; chaque État membre communique à la Commission et aux autres États membres les caractéristiques et la forme de l’inscription utilisée sur son territoire;
2.3. peuvent stocker des embryons, par dérogation au point 2.2 a), pourvu que les embryons satisfassent aux exigences de la présente directive et soient stockés dans des récipients séparés;
2.4. doivent être inspectés par un vétérinaire officiel au moins deux fois par année civile afin que soient analysés et vérifiés tous les aspects relatifs aux conditions d’agrément, de surveillance et de contrôle, au moyen, si nécessaire, de registres, de modes opératoires normalisés et de contrôles internes.
|
III.
Conditions d’agrément et de surveillance des équipes de collecte d’embryons et des équipes de production d’embryons
|
1.
|
Pour pouvoir être agréée, chaque équipe de collecte d’embryons doit satisfaire aux exigences suivantes:
1.1. La collecte, le traitement et le stockage d’embryons sont effectués soit par un vétérinaire d’équipe, soit, sous sa responsabilité, par un ou plusieurs techniciens compétents et formés aux méthodes et techniques d’hygiène et aux principes de la prophylaxie.
1.2. Le vétérinaire d’équipe est responsable de toutes les activités de l’équipe, et notamment des suivantes:
a) vérification de l’identité et de l’état sanitaire de l’animal donneur;
b) respect des conditions sanitaires lors des opérations de maniement des femelles donneuses et soins chirurgicaux;
c) procédures de désinfection et d’hygiène;
d) tenue de registres permettant de connaître:
i) l’espèce, la race, la date de naissance et l’identité de chaque animal donneur;
ii) l’historique sanitaire et tous les tests diagnostiques ainsi que leurs résultats, les traitements et vaccinations effectués sur les animaux donneurs;
iii) le lieu et la date de la collecte, du traitement et du stockage des ovocytes, ovules et embryons;
iv) l’identité des embryons et les renseignements concernant leur destination, si celle-ci est connue.
1.3. L’équipe est placée sous la surveillance générale du vétérinaire officiel. Celui-ci la contrôle au moins une fois par année civile pour s’assurer du respect des conditions sanitaires relatives à la collecte, au traitement et au stockage des embryons, au moyen si nécessaire de registres, de modes opératoires normalisés et de contrôles internes, et pour vérifier tous les aspects relatifs aux conditions d’agrément et de surveillance.
1.4. L’équipe dispose, pour examiner, traiter et emballer les embryons, d’installations fixes ou mobiles de laboratoire se composant d’au moins une surface de travail, un microscope optique ou stéréoscopique et un équipement cryogénique, si nécessaire.
1.5. Elle doit, lorsqu’il s’agit d’un laboratoire fixe:
a) disposer d’un local où les embryons peuvent être traités, matériellement séparé de la zone utilisée pour la manipulation des animaux donneurs pendant la collecte;
b) disposer d’un local ou d’une zone équipés pour le nettoyage et la stérilisation des instruments, sauf en cas d’utilisation d’instruments à usage unique;
c) disposer d’un local de stockage des embryons.
1.6. Elle doit, lorsqu’il s’agit d’un laboratoire mobile:
a) disposer d’une partie spécialement équipée du véhicule comprenant deux sections séparées:
i) l’une pour l’examen et le traitement des embryons, qui doit être une section propre;
ii) l’autre pour accueillir l’équipement et le matériel utilisés en contact avec les animaux donneurs;
b) n’utiliser que du matériel à usage unique, sauf si les contacts avec un laboratoire fixe lui permettent d’assurer la stérilisation du matériel et de s’approvisionner en fluides et autres produits nécessaires pour la collecte et le traitement des embryons.
1.7. Les bâtiments et les laboratoires doivent être conçus et aménagés et l’équipe doit exécuter ses opérations de manière à prévenir la contamination croisée des embryons.
1.8. L’équipe doit avoir à sa disposition des locaux de stockage:
a) comportant au moins un local fermant à clé destiné au stockage d’ovules et d’embryons;
b) faciles à nettoyer et à désinfecter;
c) disposant de registres dans lesquels sont consignées en permanence toutes les entrées et sorties d’ovules et d’embryons;
d) équipés de récipients de stockage d’ovules et d’embryons qui sont placés en un lieu demeurant sous le contrôle du vétérinaire d’équipe et régulièrement inspecté par un vétérinaire officiel.
1.9. L’autorité compétente peut autoriser le stockage de sperme dans les locaux de stockage visés au point 1.8 pour autant que le sperme:
a) réponde aux exigences de la présente directive, en ce qui concerne les espèces ovine, caprine et équine, ou de la directive 90/429/CEE du Conseil du 26 juin 1990 fixant les exigences de police sanitaire applicables aux échanges intracommunautaires et aux importations de sperme d’animaux de l’espèce porcine (
25
), en ce qui concerne l’espèce porcine;
b) soit stocké pour les besoins de l’équipe dans des récipients séparés et dans les locaux prévus pour le stockage des embryons agréés.
|
|
2.
|
En outre, pour être agréée, chaque équipe de production d’embryons doit satisfaire aux exigences complémentaires suivantes:
2.1. le personnel de l’équipe a reçu une formation appropriée sur les techniques de laboratoire et de prophylaxie, notamment les procédures relatives au travail en milieu stérile;
2.2. l’équipe doit disposer d’un laboratoire fixe:
a) muni d’installations et d’équipements appropriés, y compris de locaux séparés pour:
— l’extraction des ovocytes des ovaires,
— le traitement des ovocytes, des ovules et des embryons,
— le stockage des embryons;
b) équipé de dispositifs de flux laminaire ou de tout autre dispositif adapté pour mener l’ensemble des opérations requérant un milieu stérile spécifique (traitement des ovules, embryons et spermes).
Toutefois, la centrifugation du sperme peut avoir lieu en dehors du dispositif de flux laminaire ou du dispositif adapté, à condition que toutes les précautions d’hygiène soient prises;
2.3. lorsque des ovules et d’autres tissus doivent être collectés dans un abattoir, celui-ci doit avoir à sa disposition un équipement approprié garantissant la collecte et le transport des ovaires et autres tissus jusqu’au laboratoire de traitement dans des conditions d’hygiène et de sécurité.
|
CHAPITRE II
Conditions applicables aux animaux donneurs
I.
Conditions applicables aux étalons donneurs
|
1.
|
Pour être affecté à la collecte de sperme, un étalon doit, à la satisfaction du vétérinaire de centre, remplir les conditions suivantes:
1.1. il ne présente aucun signe clinique de maladie infectieuse ou contagieuse au moment de l’admission et le jour de la collecte de sperme;
1.2. il provient du territoire ou, en cas de régionalisation, de la partie du territoire d’un État membre ou d’un pays tiers et d’une exploitation sous contrôle vétérinaire satisfaisant aux exigences de la directive 90/426/CEE;
1.3. il a été détenu, pendant les trente jours précédant la collecte de sperme, dans des exploitations où aucun équidé n’a présenté de signes cliniques d’artérite virale ou de métrite contagieuse équine au cours de cette période;
1.4. il n’a pas été utilisé à des fins de reproduction naturelle au cours des trente jours précédant la première collecte de sperme et au cours de la période de collecte;
▼M16
1.5. il est soumis aux tests suivants, effectués et certifiés dans un laboratoire qui est reconnu par l'autorité compétente et qui dispose d'une accréditation délivrée en application de l'article 12 du règlement (CE) no 882/2004 du Parlement européen et du Conseil (
26
) dans laquelle sont inclus les tests visés ci-après, conformément aux programmes établis au point 1.6:
a) un test d'immunodiffusion en gélose (test de Coggins) ou un test ELISA pour la recherche de l'anémie infectieuse des équidés, avec un résultat négatif;
b) un test d'isolation du virus de l'artérite équine ou de détection de son génome par amplification en chaîne par polymérase (PCR) ou PCR en temps réel effectué sur une partie aliquote de sperme entier de l'étalon donneur, avec un résultat négatif, sauf si l'étalon donneur a réagi négativement à un test de dépistage de l'artérite virale équine par séroneutralisation à une dilution de 1/4;
c) un test d'identification de l'agent responsable de la métrite contagieuse équine, effectué, avec un résultat négatif dans chaque cas, sur trois échantillons (écouvillons) prélevés sur l'étalon donneur à deux reprises à un intervalle minimal de sept jours et en aucun cas moins de sept jours (traitement systémique) ou de vingt et un jours (traitement local) après un éventuel traitement antimicrobien administré à l'étalon donneur, au moins sur les sites suivants:
Les échantillons sont placés dans un milieu de transport avec du charbon actif, tel qu'un milieu Amies, avant d'être envoyés au laboratoire.
Les échantillons sont soumis à au moins l'un des tests suivants:
i) culture dans des conditions microaérophiles pendant au moins sept jours pour l'isolation de Taylorella equigenitalis, mise en place dans un délai de vingt-quatre heures suivant le prélèvement des échantillons sur l'animal donneur ou de quarante-huit heures si les échantillons sont conservés au froid pendant le transport; ou
ii) amplification en chaîne par polymérase (PCR) ou PCR en temps réel pour la détection du génome de Taylorella equigenitalis, effectuée dans un délai de quarante-huit heures suivant le prélèvement des échantillons sur l'animal donneur.
▼M10
1.6. il est soumis à l’un des programmes de tests suivants:
▼M16
a) si l'étalon donneur est détenu en permanence dans le centre de collecte de sperme au moins trente jours avant la première collecte de sperme et au cours de la période de collecte et si aucun équidé du centre de collecte de sperme n'entre en contact direct avec des équidés de statut sanitaire inférieur à celui de l'étalon donneur, les tests prescrits au point 1.5 sont effectués sur des échantillons prélevés sur l'étalon donneur au moins une fois par an au début de la saison d'accouplement ou avant la première collecte de sperme destiné aux échanges à l'état frais, réfrigéré ou congelé et au minimum quatorze jours après le commencement de la période de détention minimale de trente jours précédant la première collecte de sperme;
b) si l'étalon donneur est détenu dans le centre de collecte de sperme au moins trente jours avant la première collecte de sperme et au cours de la période de collecte, mais peut quitter occasionnellement le centre sous la responsabilité du vétérinaire de centre pour une période continue inférieure à quatorze jours et/ou si d'autres équidés du centre de collecte entrent en contact direct avec des équidés de statut sanitaire inférieur, les tests prescrits au point 1.5 sont effectués de la façon suivante:
i) au moins une fois par an sur des échantillons prélevés sur l'étalon donneur au début de la saison d'accouplement ou avant la première collecte de sperme destiné aux échanges à l'état frais, réfrigéré ou congelé et au minimum quatorze jours après le commencement de la période de détention minimale de trente jours précédant la première collecte de sperme; et
ii) au cours de la période de collecte de sperme destiné aux échanges à l'état frais, réfrigéré ou congelé, de la façon suivante:
— le test requis au point 1.5 a) sur des échantillons prélevés au maximum quatre-vingt-dix jours avant la collecte de sperme destiné aux échanges,
— le test requis au point 1.5 b) sur des échantillons prélevés au maximum trente jours avant la collecte de sperme destiné aux échanges, sauf si l'état de non-porteur actif d'un étalon donneur est confirmé par un test d'isolation du virus, une PCR ou une PCR en temps réel effectués sur des échantillons d'une partie aliquote de sperme entier prélevés au maximum six mois avant la collecte de sperme destiné aux échanges et si l'étalon donneur a réagi positivement à un test de dépistage de l'artérite virale équine par séroneutralisation à une dilution d'au moins 1/4,
— le test requis au point 1.5 c) sur des échantillons prélevés au maximum soixante jours avant la collecte de sperme destiné aux échanges, ce test pouvant être effectué, dans le cas d'une PCR ou d'une PCR en temps réel, sur trois échantillons (écouvillons) prélevés en une seule fois;
c) si l'étalon donneur ne satisfait pas aux conditions fixées aux points a) et b) et si le sperme est collecté en vue d'échanges de sperme congelé, les tests prescrits au point 1.5 sont effectués sur des échantillons prélevés sur l'étalon donneur de la façon suivante:
i) au moins une fois par an au début de la saison d'accouplement;
ii) au cours de la période de stockage prévue au chapitre III, point I 1.3 b) et avant que le sperme ne soit retiré du centre ou utilisé, sur des échantillons prélevés au plus tôt quatorze jours et au plus tard quatre-vingt-dix jours après la date de collecte du sperme.
Par dérogation au point ii) du premier alinéa, l'échantillonnage après la collecte et le test de dépistage de l'artérite virale équine prévus au point 1.5 b) ne sont pas requis si l'état de non-porteur actif d'un étalon donneur présentant une réaction séropositive est confirmé par un test d'isolation du virus, une PCR ou une PCR en temps réel, effectués, avec un résultat négatif, sur des échantillons d'une partie aliquote de sperme entier de l'étalon donneur prélevés deux fois par an à un intervalle minimal de quatre mois et si l'étalon donneur a réagi positivement à un test de dépistage de l'artérite virale équine par séroneutralisation à une dilution d'au moins 1/4;
▼M10
1.7. si l’un des tests prévus au point 1.5 se révèle positif, l’étalon donneur doit être isolé et son sperme, collecté depuis la date du dernier test négatif, ne peut faire l’objet d’échanges, à l’exception, pour l’artérite virale équine, du sperme de chaque éjaculat qui a réagi négativement au test d’isolation du virus de l’artérite virale équine.
Le sperme collecté chez tous les autres étalons du centre de collecte de sperme à partir de la date de prélèvement du dernier échantillon ayant réagi négativement à l’un des tests prévus au point 1.5 est stocké séparément et ne peut faire l’objet d’échanges tant que le statut sanitaire du centre de collecte de sperme n’a pas été rétabli et que le sperme stocké n’a pas fait l’objet des enquêtes officielles appropriées permettant d’écarter l’éventualité de la présence dans le sperme des agents pathogènes responsables des maladies mentionnées au point 1.5;
1.8. le sperme collecté chez les étalons d’un centre de collecte de sperme soumis à une interdiction conformément aux articles 4 et 5 de la directive 90/426/CEE est stocké séparément et ne peut faire l’objet d’échanges tant que le statut sanitaire du centre de collecte de sperme n’a pas été rétabli par le vétérinaire officiel conformément à la directive 90/426/CEE et que le sperme stocké n’a pas fait l’objet des enquêtes officielles appropriées permettant d’écarter l’éventualité de la présence, dans le sperme, des agents pathogènes responsables des maladies énumérées à l’annexe A de la directive 90/426/CEE.
|
II.
Conditions applicables aux mâles donneurs des espèces ovine et caprine
|
1.
|
Les conditions suivantes sont applicables à tous les animaux des espèces ovine et caprine admis dans un centre de collecte de sperme:
1.1. ils doivent avoir subi une quarantaine d’au moins vingt-huit jours dans une installation spécialement agréée à cette fin par l’autorité compétente (ci-après «la station de quarantaine») où n’étaient présents que des animaux ayant au moins le même statut sanitaire;
1.2. avant leur admission en station de quarantaine, ils doivent avoir appartenu à une exploitation ovine ou caprine officiellement indemne de brucellose au sens de l’article 2 de la directive 91/68/CEE et ils n’ont pas été détenus auparavant dans une exploitation de statut sanitaire inférieur en ce qui concerne la brucellose;
1.3. ils proviennent d’une exploitation où ils ont été soumis, durant les soixante jours précédant leur admission en station de quarantaine, à un test sérologique de dépistage de l’épididymite contagieuse ovine (B. ovis), conformément à l’annexe D de la directive 91/68/CEE, ou à tout autre test présentant une sensibilité et une spécificité équivalentes attestées;
1.4. ils ont été soumis aux tests mentionnés ci-après, effectués sur des échantillons de sang prélevés dans les vingt-huit jours précédant le début de la période de quarantaine visée au point 1.1, et dont les résultats se sont révélés négatifs pour chacun d’entre eux, à l’exclusion du test de dépistage de la maladie de la frontière (Border disease) visé au point c) ii):
a) pour la brucellose (B. melitensis), un test sérologique effectué conformément à l’annexe C de la directive 91/68/CEE;
b) pour l’épididymite contagieuse ovine (B. ovis), un test sérologique effectué conformément à l’annexe D de la directive 91/68/CEE, ou tout autre test présentant une sensibilité et une spécificité équivalentes attestées;
c) pour la maladie de la frontière:
i) un test d’isolation du virus ou un test de recherche d’antigènes du virus; et
ii) un test sérologique visant à déterminer la présence ou l’absence d’anticorps (test de dépistage d’anticorps).
L’autorité compétente peut autoriser que les tests visés au présent point soient effectués sur des échantillons prélevés dans la station de quarantaine. Si une telle autorisation est accordée, la période de quarantaine visée au point 1.1 ne peut pas commencer avant la date de l’échantillonnage. Toutefois, si l’un des tests énumérés au présent point se révèle positif, l’animal concerné est immédiatement retiré de la station de quarantaine. En cas d’isolement de groupe, la période de quarantaine visée au point 1.1 ne peut commencer pour les animaux restants qu’après le retrait de l’animal ayant réagi positivement;
1.5. ils ont été soumis aux tests mentionnés ci-après, effectués sur des échantillons prélevés pendant la période de quarantaine visée au point 1.1 et au moins vingt et un jours après leur admission en station de quarantaine, et dont les résultats se sont révélés négatifs:
a) pour la brucellose (B. melitensis), un test sérologique effectué conformément à l’annexe C de la directive 91/68/CEE;
b) pour l’épididymite contagieuse ovine (B. ovis), un test sérologique effectué conformément à l’annexe D de la directive 91/68/CEE ou tout autre test présentant une sensibilité et une spécificité équivalentes attestées;
1.6. ils ont été soumis aux tests de dépistage de la maladie de la frontière visés aux points 1.4 c) i) et 1.4 c) ii), effectués sur des échantillons de sang prélevés pendant la période de quarantaine visée au point 1.1 et au moins vingt et un jours après leur admission en station de quarantaine.
Un animal (séronégatif ou séropositif) ne peut être admis dans le centre de collecte de sperme que si aucune séroconversion ne se manifeste chez les animaux qui ont été testés séronégatifs avant leur admission dans la station de quarantaine.
En cas de séroconversion, tous les animaux qui sont restés séronégatifs doivent être maintenus en quarantaine au cours d’une période prolongée, jusqu’au moment où plus aucune séroconversion ne s’est manifestée dans le groupe pendant une période de trois semaines à compter de la date de la séroconversion.
Les animaux sérologiquement positifs peuvent être admis dans le centre de collecte de sperme sous réserve d’un résultat négatif au test visé au point 1.4 c) i).
|
|
2.
|
Les animaux ne sont admis dans le centre de collecte de sperme qu’avec l’autorisation expresse du vétérinaire de centre. Tous les mouvements dans le centre de collecte de sperme, qu’il s’agisse d’entrées ou de sorties, sont enregistrés.
|
|
3.
|
Les animaux admis dans le centre de collecte de sperme doivent être indemnes de tout signe clinique de maladie le jour de leur admission.
Sans préjudice du point 4, tous les animaux doivent provenir d’une station de quarantaine qui, le jour de l’expédition des animaux vers le centre de collecte de sperme, répond aux conditions suivantes:
a) elle est située dans une zone où aucun cas de fièvre aphteuse ne s’est manifesté au cours des trente derniers jours dans un rayon de dix kilomètres;
b) elle est indemne depuis trois mois de fièvre aphteuse et de brucellose;
c) elle est indemne depuis trente jours de maladies à déclaration obligatoire au sens de l’article 2, point b) 6), de la directive 91/68/CEE.
|
|
4.
|
Pour autant que les conditions prévues au point 3 soient remplies et que les examens de routine énumérés au point 5 aient été réalisés pendant les douze mois précédant le mouvement des animaux, les animaux peuvent être transférés d’un centre de collecte de sperme agréé à un autre de statut sanitaire équivalent sans période d’isolement et sans examen, à condition que le transfert s’effectue directement. L’animal concerné ne peut entrer directement ou indirectement en contact avec des animaux biongulés d’un statut sanitaire inférieur, et le moyen de transport utilisé doit être désinfecté au préalable. Si le transfert a lieu d’un centre de collecte de sperme vers un centre de collecte de sperme d’un autre État membre, il s’effectue conformément à la directive 91/68/CEE.
|
|
5.
|
Tous les ovins et caprins détenus dans un centre de collecte de sperme agréé doivent être soumis, au moins une fois par année civile, aux tests suivants et y réagir négativement:
a) pour la brucellose (B. melitensis), un test sérologique effectué conformément à l’annexe C de la directive 91/68/CEE;
b) pour l’épididymite contagieuse ovine (B. ovis), un test sérologique effectué conformément à l’annexe D de la directive 91/68/CEE, ou tout autre test présentant une sensibilité et une spécificité équivalentes attestées;
c) pour la maladie de la frontière, le test de dépistage d’anticorps visé au point 1.4 c) ii), auquel ne sont soumis que les animaux séronégatifs.
|
|
6.
|
Tous les tests visés au présent point II doivent être effectués par un laboratoire agréé.
|
|
7.
|
Si l’un des tests visés au point 5 se révèle positif, l’animal doit être isolé et son sperme collecté depuis le dernier test négatif ne peut fait l’objet d’échanges.
L’animal visé au premier alinéa doit être retiré du centre, sauf dans le cas de la maladie de la frontière; dans ce cas, il doit être soumis et réagir négativement au test visé au point 1.4 c) i).
Le sperme collecté chez tous les autres animaux du centre de collecte de sperme depuis la date de prélèvement du dernier échantillon ayant réagi négativement à l’un des tests prévus au point 5 est stocké séparément et ne peut faire l’objet d’échanges tant que le statut sanitaire du centre de collecte de sperme n’a pas été rétabli et que le sperme stocké n’a pas fait l’objet des enquêtes officielles appropriées permettant d’écarter l’éventualité de la présence dans le sperme des agents pathogènes responsables des maladies mentionnées au point 5.
|
|
8.
|
Le sperme doit provenir d’animaux qui:
a) ne présentent aucun signe clinique de maladie à la date de la collecte de sperme;
b) au cours des douze mois précédant la date de la collecte de sperme:
i) n’ont pas été vaccinés contre la fièvre aphteuse; ou
ii) ont été vaccinés contre la fièvre aphteuse trente jours au moins avant la collecte. Dans ce cas, 5 % des spermes de chaque collecte de sperme (avec un minimum de cinq paillettes) sont soumis à un test d’isolation du virus de la fièvre aphteuse dont les résultats doivent être négatifs;
c) ont été détenus dans un centre de collecte de sperme agréé pendant une période ininterrompue d’au moins trente jours avant la collecte du sperme, dans le cas de la collecte de sperme frais;
d) répondent aux exigences prévues aux articles 4, 5 et 6 de la directive 91/68/CEE;
e) s’ils sont détenus dans des exploitations visées à l’article 11, paragraphe 2, premier tiret, ont réagi négativement aux tests mentionnés ci-après, auxquels ils ont été soumis au cours des trente jours précédant la date de la collecte de sperme:
i) pour la brucellose (B. melitensis), un test sérologique effectué conformément à l’annexe C de la directive 91/68/CEE;
ii) pour l’épididymite contagieuse ovine (B. ovis), un test sérologique effectué conformément à l’annexe D de la directive 91/68/CEE, ou tout autre test présentant une sensibilité et une spécificité équivalentes attestées;
iii) pour la maladie de la frontière, un test d’isolation du virus;
f) n’ont été utilisés à des fins de reproduction naturelle ni au cours de la période d’au moins trente jours précédant la première collecte de sperme, ni entre la date du premier prélèvement d’échantillon visé aux points 1.5 et 1.6 ou au point e) et la fin de la période de collecte.
|
|
9.
|
Le sperme collecté sur des mâles donneurs des espèces ovine et caprine dans un centre de collecte de sperme ou une exploitation visés à l’article 11, paragraphe 2, premier tiret, et faisant l’objet d’une interdiction pour des motifs de police sanitaire, conformément à l’article 4 de la directive 91/68/CEE, doit être stocké séparément et ne peut faire l’objet d’échanges tant que le statut sanitaire du centre de collecte de sperme ou de l’exploitation n’a pas été rétabli par le vétérinaire officiel conformément à la directive 91/68/CEE et que le sperme stocké n’a pas fait l’objet des enquêtes officielles appropriées permettant d’écarter l’éventualité de la présence dans le sperme des agents pathogènes responsables des maladies énumérées à l’annexe B, section I, de la directive 91/68/CEE.
|
CHAPITRE III
Exigences relatives aux spermes, ovules et embryons
I.
Conditions applicables à la collecte, au traitement, à la conservation, au stockage et au transport des spermes
1.1. Le certificat sanitaire visé à l’article 11, paragraphe 2, quatrième tiret, doit mentionner le nom des antibiotiques ajoutés et leur concentration quand, sans préjudice de la directive 2001/82/CE du Parlement européen et du Conseil (
27
), il résulte de l’ajout des antibiotiques ou d’une combinaison d’antibiotiques une activité bactéricide au moins équivalente à celle des combinaisons suivantes, par ml de sperme: gentamicine (250 μg) — tylosine (50 μg) — lincomycine-spectinomycine (150/300 μg); pénicilline (500 UI) — streptomycine (500 μg) — lincomycine-spectinomycine (150/300 μg); amikacine (75μg) — divekacine (25μg).
1.2. Tout le matériel utilisé pour la collecte, le traitement, la conservation ou la congélation des spermes doit être convenablement désinfecté ou stérilisé avant usage, sauf dans le cas d’instruments à usage unique.
1.3. Les spermes congelés doivent:
a) être placés et stockés dans des récipients:
i) nettoyés et désinfectés ou stérilisés avant usage, sauf dans le cas de récipients à usage unique;
ii) comprenant un agent cryogène qui n’a pas servi antérieurement pour d’autres produits d’origine animale;
b) être stockés dans des conditions agréées pendant une période minimale de trente jours à compter de la date de collecte avant d’être transportés ou utilisés.
1.4. Les spermes faisant l’objet d’échanges doivent:
a) être transportés vers l’État membre destinataire dans des récipients de transport qui ont été nettoyés et désinfectés ou stérilisés avant usage, sauf dans le cas de récipients à usage unique, et qui ont été scellés et numérotés avant de quitter les centres de collecte ou de stockage de sperme agréés;
b) être marqués de sorte que le numéro des paillettes ou des autres emballages coïncide avec le numéro du certificat sanitaire visé à l’article 11, paragraphe 2, quatrième tiret, et avec le récipient dans lequel ils sont stockés et transportés.
II.
Conditions applicables aux ovules et embryons
1. Collecte et traitement des embryons collectés in vivo
Les embryons collectés in vivo doivent avoir été conçus par insémination artificielle à partir d’un sperme conforme aux exigences de la présente directive et avoir été collectés, traités et conservés conformément aux conditions suivantes:
1.1. les embryons doivent être collectés et traités par une équipe de collecte agréée, sans entrer en contact avec d’autres lots d’embryons ne répondant pas aux conditions de la présente directive;
1.2. les embryons doivent être collectés dans un site isolé des autres parties des locaux ou de l’exploitation où la collecte a lieu, en bon état et construit avec des matériaux le rendant facile à nettoyer et à désinfecter;
1.3. les embryons doivent être traités (examinés, lavés, manipulés et placés dans des paillettes, ampoules ou autres emballages marqués et stériles) dans un laboratoire, fixe ou mobile, situé, en ce qui concerne les espèces sensibles, dans une zone où aucun cas de fièvre aphteuse ne s’est manifesté au cours des trente derniers jours dans un rayon de dix kilomètres;
1.4. tout le matériel utilisé pour la collecte, la manipulation, le lavage, la congélation et la conservation des embryons doit être stérilisé ou convenablement nettoyé et désinfecté avant usage conformément aux recommandations du manuel de l’IETS (
28
), ou il doit s’agir de matériel à usage unique;
1.5. tout produit biologique d’origine animale entrant dans la composition des milieux et solutions utilisés pour la collecte, le traitement, le lavage ou la conservation des embryons doit être exempt de micro-organismes pathogènes. Les milieux et solutions utilisés pour la collecte, la congélation et la conservation des embryons doivent être stérilisés selon des méthodes agréées, comme indiqué dans le manuel de l’IETS, et manipulés de façon à rester stériles. Des antibiotiques peuvent, s’il y a lieu, être ajoutés aux milieux utilisés pour la collecte, le traitement, le lavage et la conservation, conformément aux recommandations du manuel de l’IETS;
1.6. les agents cryogènes utilisés pour la conservation ou le stockage des embryons ne peuvent servir antérieurement pour d’autres produits d’origine animale;
1.7. chaque paillette, ampoule ou autre emballage utilisé pour les embryons doit être clairement marqué au moyen d’étiquettes, conformément au système normalisé recommandé dans le manuel de l’IETS;
▼M16
1.8. les embryons doivent être lavés et conserver une zone pellucide — ou une capsule embryonnaire dans le cas d'embryons équins — intacte avant et immédiatement après le lavage. Conformément au manuel de l'IETS, la procédure de lavage normalisée doit être modifiée pour inclure de nouveaux lavages avec addition de trypsine, si ceux-ci sont recommandés pour l'inactivation ou l'élimination de certains agents pathogènes;
▼M10
1.9. les embryons provenant de femelles donneuses différentes ne peuvent être lavés ensemble;
▼M16
1.10. la zone pellucide de chaque embryon — ou la capsule embryonnaire dans le cas d'embryons équins — doit être examinée sur toute sa surface sous un grossissement d'au moins 50 × et être certifiée intacte et exempte de matière adhérente;
▼M10
1.11. les embryons d’un lot qui a satisfait aux exigences de l’examen prévu au point 1.10 doivent être placés dans une paillette, une ampoule ou un autre emballage stérile, marqué conformément au point 1.7 et immédiatement scellé;
1.12. les embryons doivent, le cas échéant, être congelés dès que possible et stockés en un lieu se trouvant sous le contrôle du vétérinaire d’équipe;
1.13. chaque équipe de collecte d’embryons doit soumettre à un examen officiel de dépistage de la contamination bactérienne et virale les prélèvements de routine d’embryons et d’ovules non viables et les liquides de rinçage et de lavage résultant de ses activités, comme indiqué dans le manuel de l’IETS;
1.14. chaque équipe de collecte d’embryons doit tenir un registre de ses activités relatives à la collecte d’embryons pendant les deux années qui suivent les échanges ou les importations de ces embryons; elle doit y consigner notamment les données suivantes:
a) la race, l’âge et l’identité individuelle des femelles donneuses concernées;
b) le lieu de collecte, de traitement et de stockage des embryons collectés par l’équipe;
c) l’identité des embryons et les coordonnées du destinataire de l’envoi.
2. Collecte et traitement d’ovules, d’ovaires et d’autres tissus concourant à la production d’embryons in vitro
Les conditions fixées aux points 1.1 à 1.14 s’appliquent mutatis mutandis à la collecte et au traitement d’ovules, d’ovaires et d’autres tissus utilisés pour la fertilisation ou la culture in vitro. En outre, les conditions suivantes sont applicables:
2.1. l’autorité compétente doit disposer d’informations et avoir autorité sur la ou les exploitations dont proviennent les femelles donneuses;
2.2. lorsque des ovaires et d’autres tissus sont collectés dans un abattoir, que ce soit dans le cas de donneuses individuelles ou de lots de donneuses (collecte par lot), l’abattoir doit être officiellement agréé conformément au règlement (CE) no 854/2004 du Parlement européen et du Conseil du 29 avril 2004 fixant les règles spécifiques d’organisation des contrôles officiels concernant les produits d’origine animale destinés à la consommation humaine (
29
) et placé sous la surveillance d’un vétérinaire chargé de veiller à l’exécution des inspections ante mortem et post mortem des éventuelles femelles donneuses et de certifier que ces animaux sont indemnes de tout indice des maladies contagieuses concernées, transmissibles aux animaux. En ce qui concerne les espèces sensibles, l’abattoir doit être situé dans une zone où aucun cas de fièvre aphteuse ne s’est manifesté au cours des trente derniers jours dans un rayon de dix kilomètres;
2.3. les lots d’ovaires ne peuvent être transportés au laboratoire de traitement avant la fin de l’inspection post mortem des femelles donneuses;
2.4. le matériel utilisé pour le prélèvement et le transport des ovaires et des autres tissus doit être nettoyé et désinfecté ou stérilisé avant usage et utilisé exclusivement à cette fin.
3. Traitement des embryons produits in vitro
Les conditions fixées aux points 1.1 à 1.14 s’appliquent mutatis mutandis au traitement des embryons produits in vitro. En outre, les conditions suivantes sont applicables:
3.1. les embryons produits in vitro doivent avoir été conçus par fertilisation in vitro à partir de sperme conforme aux exigences de la présente directive;
3.2. à l’issue de la période de culture in vitro, mais avant la congélation, le stockage et le transport des embryons, ceux-ci doivent être lavés et être soumis aux traitements visés aux points 1.8, 1.10 et 1.11;
3.3. les embryons provenant de femelles donneuses différentes (en cas de collectes individuelles) ou de lots différents (en cas de collectes par lots) ne peuvent pas être lavés ensemble;
3.4. les embryons provenant de femelles donneuses différentes (en cas de collectes individuelles) ou de lots différents (en cas de collectes par lots) ne sont pas conservés dans la même paillette, la même ampoule ou le même emballage.
4. Traitement des embryons micromanipulés
Avant toute micromanipulation portant atteinte à l’intégrité de la zone pellucide, les ovules ou embryons doivent être collectés et traités dans le respect des conditions sanitaires énoncées aux points 1, 2 et 3. En outre, les conditions suivantes sont applicables:
4.1. lorsque les embryons sont soumis à des opérations de micromanipulation qui impliquent la pénétration de la zone pellucide, ces opérations doivent être effectuées dans des installations de laboratoire appropriées, sous la surveillance d’un vétérinaire d’équipe agréé;
4.2. chaque équipe de collecte d’embryons doit tenir un registre de ses activités conformément au point 1.14 et y donner des précisions sur les techniques de micromanipulation appliquées aux embryons qui impliquent la pénétration de leur zone pellucide. Pour les embryons issus de la fertilisation in vitro, leur identification peut être faite sur la base d’un lot, mais elle doit indiquer la date et le lieu de la collecte des ovaires ou des ovules. Il faut également pouvoir identifier l’exploitation d’origine des femelles donneuses.
5. Conservation des embryons
5.1. Chaque équipe de collecte et de production d’embryons doit s’assurer que les embryons sont conservés à des températures appropriées dans les locaux de stockage visés au chapitre I, point III 1.8.
5.2. Avant expédition, les embryons congelés doivent être conservés dans les conditions agréées pendant une période minimale de trente jours à compter de la date de leur collecte ou de leur production.
6. Transport des embryons
6.1. Les embryons faisant l’objet d’échanges doivent être transportés vers l’État membre destinataire dans des récipients qui ont été nettoyés et désinfectés ou stérilisés avant usage, sauf dans le cas de récipients à usage unique, et qui ont été scellés et numérotés avant de quitter les locaux de stockage agréés.
6.2. Les paillettes, ampoules ou autres emballages doivent être marqués de sorte que leur numéro coïncide avec le numéro du certificat sanitaire visé à l’article 11, paragraphe 3, troisième tiret, et avec le récipient dans lequel ils sont stockés et transportés.
CHAPITRE IV
Exigences relatives aux femelles donneuses
|
1.
|
Les femelles donneuses affectées à la collecte d’embryons ou d’ovules, de même que les exploitations dont elles proviennent, doivent répondre, à la satisfaction du vétérinaire officiel, aux dispositions des directives régissant les échanges d’animaux vivants d’élevage et de rente au sein de l’Union européenne qui s’appliquent à l’espèce concernée.
|
|
2.
|
Outre les exigences établies à la directive 64/432/CEE, les femelles donneuses de l’espèce porcine doivent, sauf dans le cas des embryons collectés in vivo et soumis à un traitement à la trypsine, satisfaire aux exigences établies pour la maladie d’Aujeszky conformément à l’article 9 ou à l’article 10 de ladite directive.
|
|
3.
|
Les dispositions de la directive 91/68/CEE s’appliquent aux femelles donneuses des espèces ovine et caprine.
|
▼M16
|
4.
|
Outre les exigences établies par la directive 90/426/CEE, les juments donneuses doivent:
4.1. ne pas avoir été utilisées à des fins de reproduction naturelle pendant au moins trente jours avant la collecte d'ovules ou d'embryons, ni entre la date du premier échantillon visé aux points 4.2 et 4.3 et la date de la collecte d'ovules ou d'embryons;
4.2. avoir été soumises à un test d'immunodiffusion en gélose (test de Coggins) ou à un test ELISA pour la recherche de l'anémie infectieuse des équidés, effectué sur un échantillon de sang prélevé au minimum quatorze jours après le commencement de la période minimale de trente jours visée au point 4.1 et au maximum quatre-vingt-dix jours avant la collecte d'ovules ou d'embryons destinés aux échanges;
4.3. avoir été soumises à un test d'identification de l'agent responsable de la métrite contagieuse équine, effectué, avec un résultat négatif dans chaque cas, dans un laboratoire visé au chapitre II, point I. 1.5, sur au moins deux échantillons (écouvillons) prélevés sur la jument donneuse en aucun cas moins de sept jours (traitement systémique) ou de vingt et un jours (traitement local) après un éventuel traitement antimicrobien administré à la jument donneuse, au moins sur les sites suivants:
— les muqueuses de la fosse clitoridienne,
— les sinus clitoridiens.
Les échantillons sont prélevés durant la période visée au point 4.1 à deux occasions à un intervalle minimal de sept jours dans le cas du test visé au point i) ou en une seule fois dans le cas du test visé au point ii).
Les échantillons sont placés dans un milieu de transport avec du charbon actif, tel qu'un milieu Amies, avant d'être envoyés au laboratoire.
Les échantillons sont soumis à au moins l'un des tests suivants:
i) culture dans des conditions microaérophiles pendant au moins sept jours pour l'isolation de Taylorella equigenitalis, mise en place dans un délai de vingt-quatre heures suivant le prélèvement des échantillons sur l'animal donneur ou de quarante-huit heures si les échantillons sont conservés au froid pendant le transport; ou
ii) amplification en chaîne par polymérase (PCR) ou PCR en temps réel pour la détection du génome de Taylorella equigenitalis, effectuée dans un délai de quarante-huit heures suivant le prélèvement des échantillons sur l'animal donneur.
|
▼M8
ANNEXE E
▼M15
Première partie ‒ certificat sanitaire pour les échanges d’animaux provenant d’exploitations (ongulés, oiseaux vaccinés contre l'influenza aviaire, lagomorphes, chiens, chats et furets) 92/65 EI
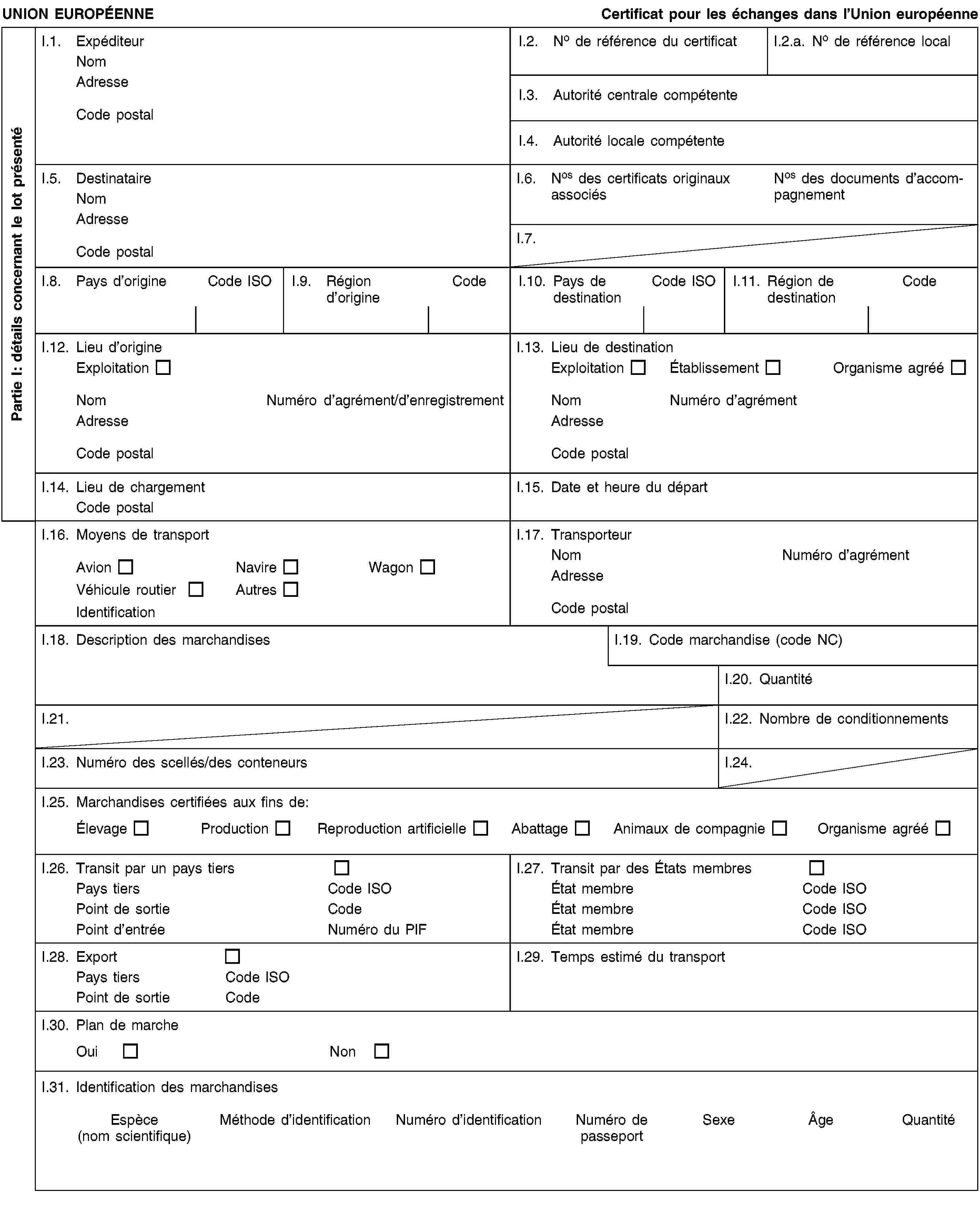



▼M11
Deuxième partie — certificat sanitaire pour les échanges d’abeilles et de bourdons
92/65 EII


▼M13
Troisième partie — certificat sanitaire pour les échanges d’animaux, de spermes, d’ovules et d’embryons provenant d’organismes, d’instituts ou de centres agréés 92/65 EIII


▼M7
ANNEXE F
Directive 64/432/CEE du Conseil du 26 juin 1964 relative à des problèmes de police sanitaire en matière d'échanges intracommunautaires d’animaux des espèces bovine et porcine.
Directive 88/407/CEE du Conseil du 14 juin 1988 fixant les exigences de police sanitaire applicables aux échanges intracommunautaires et aux importations de sperme surgelé d’animaux de l’espèce bovine.
Directive 89/556/CEE du Conseil du 25 septembre 1989 fixant les conditions de police sanitaire régissant les échanges intracommunautaires et les importations en provenance des pays tiers d’embryons d’animaux domestiques de l’espèce bovine.
Directive 90/426/CEE du Conseil du 26 juin 1990 relative aux conditions de police sanitaire régissant les mouvements d'équidés et les importations d'équidés en provenance des pays tiers.
Directive 90/429/CEE du Conseil du 26 juin 1990 fixant les exigences de police sanitaire applicables aux échanges intracommunautaires et aux importations de sperme d’animaux de l’espèce porcine.
Directive 90/539/CEE du Conseil du 15 octobre 1990 relative aux conditions de police sanitaire régissant les échanges intracommunautaires et les importations en provenance des pays tiers de volailles et d’œufs à couver.
Directive 91/67/CEE du Conseil du 28 janvier 1991 relative aux conditions de police sanitaire régissant la mise sur le marché d’animaux et de produits d’aquaculture.
Directive 91/68/CEE du Conseil du 28 janvier 1991 relative aux conditions de police sanitaire régissant les échanges intracommunautaires d’ovins et de caprins.
Directive 2004/68/CE du Conseil du 26 avril 2004 établissant les règles de police sanitaire relatives à l’importation et au transit, dans la Communauté, de certains ongulés vivants, modifiant les directives 90/426/CEE et 92/65/CEE et abrogeant la directive 72/462/CEE.








