EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 02009L0156-20161018
Council Directive 2009/156/EC of 30 November 2009 on animal health conditions governing the movement and importation from third countries of equidae (codified version) (Text with EEA relevance)
Consolidated text: Directive 2009/156/CE du Conseil du 30 novembre 2009 relative aux conditions de police sanitaire régissant les mouvements d’équidés et les importations d’équidés en provenance des pays tiers (version codifiée) (Texte présentant de l'intérêt pour l'EEE)
Directive 2009/156/CE du Conseil du 30 novembre 2009 relative aux conditions de police sanitaire régissant les mouvements d’équidés et les importations d’équidés en provenance des pays tiers (version codifiée) (Texte présentant de l'intérêt pour l'EEE)
 No longer in force
No longer in force
02009L0156 — FR — 18.10.2016 — 002.002
Ce texte constitue seulement un outil de documentation et n’a aucun effet juridique. Les institutions de l'Union déclinent toute responsabilité quant à son contenu. Les versions faisant foi des actes concernés, y compris leurs préambules, sont celles qui ont été publiées au Journal officiel de l’Union européenne et sont disponibles sur EUR-Lex. Ces textes officiels peuvent être consultés directement en cliquant sur les liens qui figurent dans ce document
|
DIRECTIVE 2009/156/CE DU CONSEIL du 30 novembre 2009 relative aux conditions de police sanitaire régissant les mouvements d’équidés et les importations d’équidés en provenance des pays tiers (version codifiée) (Texte présentant de l'intérêt pour l'EEE) (JO L 192 du 23.7.2010, p. 1) |
Modifié par:
|
|
|
Journal officiel |
||
|
n° |
page |
date |
||
|
L 158 |
234 |
10.6.2013 |
||
|
L 280 |
33 |
18.10.2016 |
||
Rectifié par:
DIRECTIVE 2009/156/CE DU CONSEIL
du 30 novembre 2009
relative aux conditions de police sanitaire régissant les mouvements d’équidés et les importations d’équidés en provenance des pays tiers
(version codifiée)
(Texte présentant de l'intérêt pour l'EEE)
CHAPITRE I
DISPOSITIONS GÉNÉRALES
Article premier
La présente directive définit les conditions de police sanitaire régissant les mouvements d’équidés entre les États membres et les importations d’équidés en provenance des pays tiers.
Article 2
Aux fins de la présente directive, on entend par:
|
a) |
«exploitation» : l’établissement agricole ou d’entraînement, l’écurie ou, d’une manière générale, tout local ou toute installation dans lesquels des équidés sont détenus ou élevés de façon habituelle, quelle que soit leur utilisation; |
|
b) |
«équidé» : les animaux domestiques ou sauvages des espèces équine – y compris les zèbres – ou asine ou les animaux issus de leurs croisements; |
|
c) |
«équidé enregistré» : tout équidé enregistré, tel que défini par la directive 90/427/CEE du Conseil du 26 juin 1990 relative aux conditions zootechniques et généalogiques régissant les échanges intracommunautaires d’équidés ( 1 ), identifié au moyen d’un document d’identification qui est délivré par: i) l’autorité d’élevage ou toute autre autorité compétente du pays d’origine de l’équidé qui gère le livre généalogique ou le registre de la race de cet équidé; ou ii) toute association ou organisation internationale gérant des chevaux en vue de la compétition ou des courses; |
|
d) |
«équidés de boucherie» : les équidés destinés à être menés à l’abattoir, soit directement, soit après passage dans un centre de rassemblement agréé, visé à l’article 7, pour y être abattus; |
|
e) |
«équidés d’élevage et de rente» : les équidés autres que ceux mentionnés aux points c) et d); |
|
f) |
«État membre ou pays tiers indemne de peste équine» : tout État membre ou pays tiers sur le territoire duquel aucune évidence clinique, sérologique (chez les équidés non vaccinés) ou épidémiologique n’a permis de constater la présence de peste équine au cours des deux dernières années et dans lequel la vaccination contre cette maladie n’a pas été pratiquée au cours des douze derniers mois; |
|
g) |
«maladies à déclaration obligatoire» : les maladies énumérées à l’annexe I; |
|
h) |
«vétérinaire officiel» : le vétérinaire désigné par l’autorité centrale compétente de l’État membre ou d’un pays tiers; |
|
i) |
«admission temporaire» : le statut d’un équidé enregistré provenant d’un pays tiers et admis sur le territoire de la Communauté pour une période inférieure à quatre-vingt-dix jours, à fixer selon la procédure visée à l’article 21, paragraphe 2, en fonction de la situation sanitaire du pays d’origine. |
CHAPITRE II
RÈGLES POUR LES MOUVEMENTS D’ÉQUIDÉS ENTRE LES ÉTATS MEMBRES
Article 3
Un État membre n’autorise le mouvement d’équidés enregistrés sur son territoire et n’expédie vers le territoire d’un autre État membre des équidés que s’ils remplissent les conditions prévues aux articles 4 et 5.
Toutefois, les autorités compétentes des États membres de destination peuvent accorder des dérogations générales ou limitées pour les mouvements d’équidés:
— qui sont montés ou menés à des fins sportives ou récréatives sur des routes se trouvant à proximité des frontières internes de la Communauté,
— qui participent à des manifestations culturelles ou similaires ou à des activités organisées par des organismes locaux habilités, situés à proximité des frontières internes de la Communauté,
— destinés exclusivement au pacage ou au travail, à titre temporaire, à proximité des frontières internes de la Communauté.
Les États membres faisant usage de cette autorisation informent la Commission du contenu des dérogations octroyées.
Article 4
1. Les équidés ne doivent présenter aucun signe clinique de maladie lors de l’inspection. L’inspection doit avoir lieu au cours des quarante-huit heures précédant l’embarquement ou le chargement pour les équidés. Toutefois, pour les équidés enregistrés, cette inspection est, sans préjudice de l’article 6, exigée seulement pour les échanges intracommunautaires.
2. Sans préjudice des exigences prévues au paragraphe 5 pour les maladies à déclaration obligatoire, le vétérinaire officiel doit, lors de l’inspection, s’assurer qu’aucun fait – y compris sur la base des déclarations du propriétaire ou de l’éleveur – ne permet de conclure que les équidés ont été en contact avec des équidés souffrant d’une infection ou d’une maladie contagieuse au cours des quinze derniers jours précédant l’inspection.
3. Les équidés ne doivent pas être à éliminer dans le cadre d’un programme d’éradication d’une maladie infectieuse ou contagieuse appliqué dans un État membre.
4. Les équidés doivent faire l’objet d’une identification qui devra intervenir:
a) pour les équidés enregistrés, au moyen d’un document d’identification prévu par la directive 90/427/CEE, ce document devant attester notamment le respect des paragraphes 5 et 6 du présent article et de l’article 5 de la présente directive.
La validité de ce document d’identification doit être suspendue par le vétérinaire officiel pendant la durée des interdictions prévues au paragraphe 5 du présent article ou à l’article 5 de la présente directive. Il doit être restitué après abattage du cheval enregistré à l’autorité qui l’a délivré. Les modalités d’application du présent point sont arrêtées selon la procédure visée à l’article 21, paragraphe 2;
b) pour les équidés d’élevage et de rente, selon la méthode d’identification déterminée selon la procédure visée à l’article 21, paragraphe 2.
5. Outre les exigences prévues à l’article 5, les équidés ne doivent pas provenir d’une exploitation faisant l’objet de l’une des mesures d’interdiction suivantes:
a) si tous les animaux des espèces sensibles à la maladie présents sur l’exploitation n’ont pas été abattus ou tués, la durée de l’interdiction frappant l’exploitation de provenance doit être au moins égale:
i) dans le cas d’équidés suspects d’être atteints de dourine, à six mois à compter de la date du dernier contact ou de la possibilité de contact avec un équidé malade. Toutefois, s’il s’agit d’un étalon, l’interdiction doit s’appliquer jusqu’à sa castration;
ii) en cas de morve et d’encéphalomyélite équine, à six mois à compter de la date à laquelle les équidés atteints ont été éliminés;
iii) dans le cas d’anémie infectieuse, à la période nécessaire pour que, à partir de la date à laquelle les équidés atteints ont été éliminés, les animaux restants aient réagi négativement à deux tests de Coggins effectués à un intervalle de trois mois;
iv) à six mois à compter du dernier cas de stomatite vésiculeuse constaté;
v) à un mois à compter du dernier cas de rage constaté;
vi) à quinze jours à compter du dernier cas de charbon bactéridien constaté;
b) si tous les animaux des espèces sensibles présents sur l’exploitation ont été abattus ou tués et les locaux désinfectés, la durée de l’interdiction est de trente jours à compter de la date à laquelle les animaux ont été éliminés et les locaux désinfectés, sauf dans le cas du charbon bactéridien pour lequel la durée d’interdiction est de quinze jours.
Les autorités compétentes peuvent déroger à ces mesures d’interdiction pour les hippodromes et les champs de courses et informent la Commission de la nature des dérogations accordées.
Dans le cas où un État membre établit ou a établi un programme facultatif ou obligatoire de lutte contre une maladie à laquelle les équidés sont sensibles, il peut soumettre ce programme à la Commission, dans un délai de six mois à compter du 4 juillet 1990 pour la Belgique, le Danemark, l'Allemagne, l'Irlande, la Grèce, l'Espagne, la France, l'Italie, le Luxembourg, les Pays-Bas, le Portugal et le Royaume-Uni, à compter du 1er janvier 1995 pour l'Autriche, la Finlande et la Suède, à compter du 1er mai 2004 pour la République tchèque, l'Estonie, Chypre, la Lettonie, la Lituanie, la Hongrie, Malte, la Pologne, la Slovénie et la Slovaquie, à compter du 1er janvier 2007 pour la Bulgarie et la Roumanie et à compter du 1er juillet 2013 pour la Croatie, en indiquant notamment:
◄
a) la situation de la maladie sur son territoire;
b) la justification du programme en prenant en compte l’importance de la maladie et ses avantages coût/bénéfice;
c) la zone géographique dans laquelle le programme va être appliqué;
d) les différents statuts applicables aux établissements, les normes qui doivent être atteintes pour chaque espèce et les procédures de test;
e) les procédures de contrôle du programme;
f) la conséquence à tirer lors de la perte du statut de l’exploitation pour quelque raison que ce soit;
g) le mesures à prendre en cas de résultats positifs constatés lors de contrôles effectués conformément au programme;
h) le caractère non discriminatoire entre les échanges sur le territoire de l’État membre concerné et les échanges intracommunautaires.
La Commission examine les programmes communiqués par les États membres. Le cas échéant, elle les approuve en respectant les critères énoncés au premier alinéa selon la procédure visée à l’article 21, paragraphe 2. Selon la même procédure, des garanties complémentaires générales ou limitées pouvant être exigées dans les échanges intracommunautaires peuvent être précisées. Ces garanties doivent être au maximum équivalentes à celles que l’État membre met en œuvre dans le cadre national.
Les programmes soumis par les États membres peuvent être modifiés ou complétés selon la procédure visée à l’article 21, paragraphe 3. Selon la même procédure, une modification ou un complément à un programme antérieurement approuvé et aux garanties définies conformément au deuxième alinéa du présent paragraphe peut être approuvé.
Article 5
1. Les États membres non indemnes de peste équine ne peuvent expédier d’équidés en provenance de la partie de territoire considérée comme infectée, au sens du paragraphe 2 du présent article, qu’aux conditions fixées au paragraphe 5.
2. Une partie du territoire d’un État membre est considérée comme infectée de peste équine si:
a) au cours des deux dernières années, une évidence clinique, sérologique (chez les animaux non vaccinés) et/ou épidémiologique a permis de constater la peste équine; ou
b) au cours des douze derniers mois, la vaccination contre la peste équine a été pratiquée.
La partie du territoire considérée comme infectée de peste équine se compose au minimum:
a) d’une zone de protection d’un rayon d’au moins 100 kilomètres autour de tout foyer;
b) d’une zone de surveillance d’une profondeur d’au moins 50 kilomètres qui s’étend au-delà des limites de la zone de protection et dans laquelle aucune vaccination n’a été pratiquée au cours des douze derniers mois.
3. Les règles de contrôle et les mesures de lutte contre la peste équine relatives aux territoires et zones visés au paragraphe 2 ainsi que les dérogations y afférentes sont précisées par la directive 92/35/CEE du Conseil du 29 avril 1992 établissant les règles de contrôle et les mesures de lutte contre la peste équine ( 2 ).
4. Tout équidé vacciné se trouvant dans la zone de protection doit être enregistré et marqué conformément à l’article 6, paragraphe 1, point d, de la directive 92/35/CEE.
La mention de cette vaccination doit être clairement portée dans le document d’identification et/ou sur le certificat sanitaire.
5. Un État membre ne peut expédier du territoire visé au paragraphe 2, deuxième alinéa, que des équidés satisfaisant aux exigences suivantes:
a) n’être expédiés que durant certaines périodes de l’année, en fonction de l’activité des insectes vecteurs, à fixer selon la procédure visée à l’article 21, paragraphe 3;
b) ne présenter aucun signe clinique de peste équine le jour de l’inspection visée à l’article 4, paragraphe 1;
c) avoir été soumis à un test pour la peste équine tel que décrit à l’annexe IV, à deux reprises, avec un intervalle compris entre vingt et un et trente jours, le second test devant être effectué dans les dix jours avant l’expédition:
i) avec des résultats négatifs, s’ils n’ont pas été vaccinés contre la peste équine, ou;
ii) sans qu’il ait été constaté d’accroissement des anticorps et sans avoir été vacciné au cours des deux derniers mois, s’ils ont été vaccinés contre la peste équine.
Conformément à la procédure visée à l’article 21, paragraphe 2, et après avis de l’Autorité européenne de sécurité des aliments, d’autres méthodes de contrôle peuvent être reconnues;
d) avoir été maintenus dans une station de quarantaine pendant une période minimale de quarante jours avant l’expédition;
e) avoir été protégés des insectes vecteurs pendant la période de quarantaine et au cours du transport de la station de quarantaine au lieu d’expédition.
Article 6
Les États membres qui mettent en œuvre un régime alternatif de contrôle offrant des garanties équivalentes à celles prévues à l’article 4, paragraphe 5, pour les mouvements, sur leur territoire, des équidés peuvent s’accorder, sur une base de réciprocité, une dérogation à l’article 4, paragraphe 1, deuxième phrase, et à l’article 8, paragraphe 1, point b).
Ils en informent la Commission.
Article 7
1. Les équidés doivent être acheminés, dans les délais les plus brefs, de l’exploitation de provenance, soit directement, soit après passage dans un centre de rassemblement agréé, tel que défini à l’article 2, paragraphe 2, point o), de la directive 64/432/CEE du Conseil du 26 juin 1964 relative à des problèmes de police sanitaire en matière d’échanges intracommunautaires d’animaux des espèces bovine et porcine ( 3 ), vers le lieu de destination, à l’aide de moyens de transport et de contention régulièrement nettoyés et désinfectés avec un désinfectant et selon une fréquence à fixer par l’État membre d’expédition. Les véhicules de transport doivent être aménagés de telle sorte que les fèces, la litière ou le fourrage des équidés ne puissent pas couler ou tomber hors du véhicule pendant le transport. Sans préjudice du règlement (CE) no 1/2005, le transport doit être effectué d’une manière permettant d’assurer une protection sanitaire efficace et le bien-être des équidés.
2. L’État membre de destination peut, de manière générale ou limitée, accorder une dérogation à certaines des exigences de l’article 4, paragraphe 5, pour autant que l’animal soit pourvu d’une marque particulière précisant qu’il est destiné à la boucherie et que mention de cette dérogation soit portée sur le certificat sanitaire conformément à l’annexe III.
En cas d’octroi d’une telle dérogation, les équidés de boucherie doivent être directement acheminés vers l’abattoir désigné pour y être abattus dans un délai n’excédant pas cinq jours après l’arrivée à l’abattoir.
3. Le vétérinaire officiel doit relever dans un registre le numéro d’identification ou le numéro du document d’identification de l’équidé abattu et transmettre à l’autorité compétente du lieu d’expédition, à sa demande, une attestation certifiant l’abattage des équidés.
Article 8
1. Les États membres veillent à ce que:
a) les équidés enregistrés soient accompagnés, s’ils quittent leur exploitation, du document d’identification prévu à l’article 4, paragraphe 4, point a), complété, s’ils sont destinés aux échanges intracommunautaires, par l’attestation sanitaire prévue à l’annexe II;
b) les équidés d’élevage, de rente et de boucherie soient accompagnés, au cours de leur transport, d’un certificat sanitaire conforme à l’annexe III.
2. Le certificat sanitaire ou, dans le cas des équidés enregistrés, l’attestation sanitaire doivent, sans préjudice de l’article 6, être établis au cours des quarante-huit heures, ou au plus tard le dernier jour ouvrable précédant l’embarquement, dans la ou les langues officielles de l’État membre d’expédition et de destination. La durée de validité du certificat sanitaire ou de l’attestation sanitaire est de dix jours. Le certificat sanitaire ou l’attestation sanitaire doivent comporter un seul feuillet.
3. Les mouvements entre États membres d’équidés, autres que les équidés enregistrés, peuvent se faire sous le couvert d’un seul certificat sanitaire par lot, au lieu du certificat sanitaire individuel visé au paragraphe 1, point b).
Article 9
Les règles prévues par la directive 90/425/CEE sont applicables, notamment en ce qui concerne les contrôles à l’origine, l’organisation et les suites à donner aux contrôles à effectuer par l’État membre de destination et les mesures de sauvegarde à mettre en œuvre.
Article 10
Des experts vétérinaires de la Commission peuvent, dans la mesure où cela est nécessaire à l’application uniforme de la présente directive et en collaboration avec les autorités nationales compétentes, effectuer des contrôles sur place. La Commission informe les États membres du résultat des contrôles effectués.
L’État membre sur le territoire duquel est effectué un tel contrôle apporte toute l’aide nécessaire aux experts pour l’accomplissement de leur mission.
Les modalités d’application du présent article sont fixées selon la procédure visée à l’article 21, paragraphe 2.
CHAPITRE III
RÈGLES POUR LES IMPORTATIONS D’ÉQUIDÉS EN PROVENANCE DES PAYS TIERS
Article 11
Les équidés importés dans la Communauté doivent remplir les conditions énoncées aux articles 12 à 16.
Article 12
1. L’importation d’équidés dans la Communauté n’est autorisée qu’en provenance des pays tiers figurant sur une liste à établir ou à modifier conformément à la procédure visée à l’article 21, paragraphe 2.
Au vu de la situation sanitaire du pays tiers et des garanties qu’il fournit en ce qui concerne les équidés, il peut être décidé, conformément à la procédure visée à l’article 21, paragraphe 2, que l’autorisation prévue au premier alinéa du présent paragraphe s’applique à l’ensemble du territoire du pays tiers ou à une partie de celui-ci uniquement.
À cet effet, il est tenu compte de la manière dont le pays tiers applique et met en œuvre, sur son propre territoire, les normes internationales correspondantes, notamment le principe de régionalisation, eu égard aux exigences sanitaires relatives aux importations en provenance d’autres pays tiers et de la Communauté.
2. Lors de l’établissement ou de la modification de la liste prévue au paragraphe 1, sont notamment pris en considération:
a) l’état sanitaire des équidés, des autres animaux domestiques et de la faune sauvage du pays tiers, une attention particulière étant accordée aux maladies animales exotiques et à tous les aspects de la situation sanitaire et environnementale générale du pays, dans la mesure où elle pourrait représenter un risque pour la situation sanitaire et environnementale de la Communauté;
b) la législation du pays tiers en matière de santé et de bien-être des animaux;
c) l’organisation de l’autorité vétérinaire compétente et de ses services d’inspection, les prérogatives de ces derniers, la supervision dont ils font l’objet, ainsi que les moyens dont ils disposent, y compris sur le plan des effectifs et des capacités de laboratoire, pour appliquer dûment la législation nationale;
d) les assurances que peut donner l’autorité vétérinaire compétente du pays tiers quant au respect des conditions de police sanitaire correspondantes en vigueur dans la Communauté ou à l’application de conditions équivalentes;
e) l’appartenance du pays tiers à l’Organisation mondiale de la santé animale (OIE) ainsi que la régularité et la rapidité avec lesquelles ce pays fournit des informations en ce qui concerne l’existence de maladies équines infectieuses ou contagieuses sur son territoire, notamment les maladies répertoriées par l’OIE et figurant à l’annexe I de la présente directive;
f) les garanties données par le pays tiers en ce qui concerne la fourniture directe d’informations à la Commission et aux États membres:
i) dans les vingt-quatre heures, sur la confirmation de la présence de maladies équines infectieuses énumérées à l’annexe I et sur tout changement dans la politique de vaccination relative à ces maladies;
ii) dans un délai approprié, sur toute modification proposée des règles sanitaires nationales concernant les équidés, notamment pour ce qui est des importations;
iii) à intervalles réguliers, sur le statut zoosanitaire de son territoire en ce qui concerne les équidés;
g) toute expérience acquise en matière d’importation d’équidés vivants en provenance du pays tiers et les résultats des contrôles éventuellement effectués à l’importation;
h) les résultats des inspections et/ou audits communautaires réalisés dans le pays tiers, notamment les résultats de l’évaluation des autorités compétentes ou, à la demande de la Commission, le rapport présenté par les autorités compétentes sur les inspections auxquelles elles ont procédé;
i) la teneur des règles en vigueur dans le pays tiers en ce qui concerne la lutte contre les maladies animales infectieuses ou contagieuses et leur prévention, y compris les règles relatives aux importations d’équidés en provenance d’autres pays tiers, ainsi que la mise en œuvre de ces règles.
3. La Commission prend les dispositions nécessaires pour que des versions actualisées de la liste établie ou modifiée conformément au paragraphe 1 soient accessibles au public.
Cette liste peut être combinée à d’autres listes dressées aux fins de la protection de la santé animale et de la santé publique et peut aussi inclure des modèles de certificats sanitaires.
4. Pour chaque pays tiers ou groupe de pays tiers, des conditions particulières d’importation sont établies conformément à la procédure visée à l’article 21, paragraphe 2, au vu de la situation zoosanitaire du ou des pays tiers considérés en ce qui concerne les équidés.
5. Les modalités d’application des paragraphes 1 à 4 ainsi que les critères d’inscription des pays tiers ou parties de pays tiers sur la liste prévue au paragraphe 1 peuvent être adoptés conformément à la procédure visée à l’article 21, paragraphe 2.
Article 13
1. Les équidés doivent provenir d’un pays tiers:
a) indemne de peste équine;
b) indemne depuis deux ans d’encéphalomyélite équine vénézuélienne (VEE);
c) indemne depuis six mois de dourine et de morve.
2. Selon la procédure visée à l’article 21, paragraphe 2, il peut être décidé:
a) que le paragraphe 1 du présent article ne s’applique qu’à une partie du territoire d’un pays tiers.
En cas de régionalisation des exigences pour la peste équine, les mesures prévues à l’article 5, paragraphes 2 et 5, doivent être au minimum respectées;
b) d’exiger des garanties additionnelles pour des maladies exotiques à la Communauté.
Article 14
Les équidés doivent, avant le jour de leur chargement en vue de leur expédition vers l’État membre de destination, avoir séjourné sans interruption sur le territoire ou sur une partie du territoire d’un pays tiers ou, en cas de régionalisation, sur la partie du territoire définie en application de l’article 13, paragraphe 2, point a), depuis une période à fixer lors de l’adoption des décisions à arrêter en application de l’article 15.
Ils doivent provenir d’une exploitation placée sous contrôle vétérinaire.
Article 15
L’importation d’équidés du territoire d’un pays tiers ou d’une partie du territoire d’un pays tiers définie en application de l’article 13, paragraphe 2, point a), figurant sur la liste établie conformément à l’article 12, paragraphe 1, n’est autorisée que si, outre les exigences prévues à l’article 13:
a) ils répondent aux conditions sanitaires arrêtées, selon la procédure visée à l’article 21, paragraphe 2, pour les importations d’équidés du pays considéré en fonction de l’espèce concernée et des catégories d’équidés.
Pour fixer ces exigences de police sanitaire, la base de référence à utiliser est celle des normes prévues aux articles 4 et 5; et
b) lorsqu’il s’agit des pays tiers non indemnes de vésiculeuse stomatite ou d’artérite virale pendant au moins six mois, les équidés satisfont aux exigences suivantes:
i) les équidés doivent provenir d’une exploitation indemne de vésiculeuse stomatite depuis au moins six mois et avoir réagi négativement à un test sérologique avant leur expédition;
ii) pour l'artérite virale, les équidés mâles doivent, sans préjudice de l'article 19, point b), avoir réagi négativement à un test sérologique ou à un test d'isolement du virus, ou à tout autre test reconnu selon la procédure visée à l'article 21, paragraphe 2, et garantissant que l'animal est indemne de cette maladie.
Selon la procédure visée à l’article 21, paragraphe 2, et après avis de l’Autorité européenne de sécurité des aliments, les catégories d’équidés mâles auxquels cette exigence est applicable peuvent être délimitées.
Article 16
1. Les équidés doivent être identifiés conformément à l’article 4, paragraphe 4, et être accompagnés d’un certificat sanitaire établi par un vétérinaire officiel du pays tiers exportateur. Le certificat sanitaire doit:
a) être délivré le jour du chargement des équidés en vue de l’expédition vers l’État membre de destination ou, lorsqu’il s’agit de chevaux enregistrés, le dernier jour ouvrable avant l’embarquement;
b) être rédigé au moins dans l’une des langues officielles de l’État membre de destination et dans l’une de celles de l’État membre où s’effectue le contrôle à l’importation;
c) accompagner les équidés dans son exemplaire original;
d) attester que les équidés répondent aux conditions prévues par la présente directive et à celles fixées en application de celle-ci pour l’importation en provenance du pays tiers;
e) comporter un seul feuillet;
f) être prévu pour un seul destinataire ou, dans le cas d’équidés de boucherie, pour un lot dûment marqué et identifié.
Les États membres informent la Commission s’ils recourent à cette possibilité.
2. Le certificat sanitaire doit être rédigé sur un formulaire conforme à un modèle établi selon la procédure visée à l’article 21, paragraphe 2.
Article 17
1. Dès leur arrivée dans l’État membre de destination, les équidés de boucherie doivent être conduits dans un abattoir soit directement, soit après passage dans un centre de rassemblement, visé à l’article 7, et, conformément aux exigences de police sanitaire, être abattus dans un délai à fixer lors de l’adoption des décisions à arrêter en application de l’article 15.
2. Sans préjudice des conditions particulières éventuellement fixées selon la procédure visée à l’article 21, paragraphe 2, l’autorité compétente de l’État membre de destination peut, en raison d’exigences de police sanitaire, désigner l’abattoir vers lequel ces équidés doivent être acheminés.
Article 18
Des contrôles sont effectués sur place par des experts vétérinaires des États membres et de la Commission pour vérifier si les dispositions de la présente directive, et notamment celles de l’article 12, paragraphe 2, sont effectivement appliquées.
Si, pendant le déroulement d’une inspection effectuée en application du présent article, des faits graves sont relevés à l’encontre d’une exploitation, la Commission en informe immédiatement les États membres et arrête aussitôt une décision comportant la suspension provisoire de l’agrément. Une décision finale est prise à cet égard conformément à la procédure visée à l’article 21, paragraphe 3.
Les experts des États membres chargés des contrôles sont désignés par la Commission sur proposition des États membres.
Ces contrôles sont effectués pour le compte de la Communauté, qui prend en charge les frais correspondants.
La périodicité et les modalités de ces contrôles sont déterminées selon la procédure visée à l’article 21, paragraphe 2.
Article 19
Selon la procédure visée à l’article 21, paragraphe 2:
a) il peut être décidé de limiter l’importation en provenance d’un pays tiers ou d’une partie d’un pays tiers à des espèces ou catégories particulières d’équidés;
b) par dérogation à l’article 15, les conditions particulières auxquelles peut s’effectuer l’admission temporaire sur le territoire de la Communauté ou la réintroduction sur ledit territoire après exportation temporaire d’équidés enregistrés ou d’équidés destinés à des utilisations particulières, sont établies;
c) les conditions permettant de convertir une admission temporaire en admission définitive sont déterminées;
d) un laboratoire communautaire de référence pour une ou plusieurs des maladies des équidés mentionnées à l’annexe I peut être désigné et les fonctions, tâches et procédures pour la collaboration avec les laboratoires en charge du diagnostic des maladies infectieuses des équidés dans les États membres sont définies.
CHAPITRE IV
DISPOSITIONS FINALES
Article 20
Les annexes I à IV sont modifiées selon la procédure visée à l’article 21, paragraphe 3.
Article 21
1. La Commission est assistée par le comité permanent de la chaîne alimentaire et de la santé animale institué par l’article 58 du règlement (CE) no 178/2002 du Parlement européen et du Conseil du 28 janvier 2002 établissant les principes généraux et les prescriptions générales de la législation alimentaire, instituant l’Autorité européenne de sécurité des aliments et fixant des procédures relatives à la sécurité des denrées alimentaires ( 4 ).
2. Dans le cas où il est fait référence au présent paragraphe, les articles 5 et 7 de la décision 1999/468/CE s’appliquent.
La période prévue à l’article 5, paragraphe 6, de la décision 1999/468/CE est fixée à trois mois.
3. Dans le cas où il est fait référence au présent paragraphe, les articles 5 et 7 de la décision 1999/468/CE s’appliquent.
La période prévue à l’article 5, paragraphe 6, de la décision 1999/468/CE est fixée à quinze jours.
Article 22
La directive 90/426/CEE, telle que modifiée par les actes visés à l’annexe V, partie A, est abrogée, sans préjudice des obligations des États membres en ce qui concerne les délais de transposition en droit national des directives indiqués à l’annexe V, partie B.
Les références faites à la directive abrogée s’entendent comme faites à la présente directive et sont à lire selon le tableau de correspondance figurant à l’annexe VI.
Article 23
La présente directive entre en vigueur le vingtième jour suivant celui de sa publication au Journal officiel de l’Union européenne.
Article 24
Les États membres sont destinataires de la présente directive.
ANNEXE I
MALADIES À DÉCLARATION OBLIGATOIRE
Sont soumises à déclaration obligatoire les maladies suivantes:
— dourine,
— morve,
— encéphalomyélite équine (sous toutes ses formes, y compris la VEE),
— anémie infectieuse,
— rage,
— charbon bactéridien,
— peste équine,
— stomatite vésiculeuse.
ANNEXE II
MODÈLE
ATTESTATION SANITAIRE ( 5 )
Passeport no…
Je soussigné, certifie ( 6 ) que l’équidé désigné ci-dessus répond aux conditions suivantes:
a) il a été examiné à ce jour et ne présente aucun signe clinique de maladie;
b) il n’est pas à éliminer dans le cadre d’un programme d’éradication d’une maladie contagieuse ou infectieuse appliqué dans l’État membre;
c)
— il ne provient pas du territoire ou d’une partie du territoire d’un État membre faisant l’objet de mesures de restriction en raison de la peste équine
— ou
— il provient du territoire ou d’une partie du territoire d’un État membre faisant l’objet de mesures de restriction pour des motifs de police sanitaire et a été soumis dans la station de quarantaine de … entre le … et le … aux tests avec résultats satisfaisants prévus à l’article 5, paragraphe 5, de la directive 2009/156/CE ( 7 ),
d) il ne provient pas d’une exploitation faisant l’objet de mesures d’interdiction pour des motifs de police sanitaire et n’a pas été en contact avec les équidés d’une exploitation faisant l’objet d’une interdiction pour des motifs de police sanitaire:
— dans le cas d’équidés suspects d’être atteints de dourine, durant six mois à compter de la date du dernier contact ou de la possibilité de contact avec un équidé malade. Toutefois, s’il s’agit d’un étalon, l’interdiction doit s’appliquer jusqu’à sa castration,
— en cas de morve et d’encéphalomyélite équine, durant six mois à compter de la date à laquelle les équidés atteints ont été éliminés,
— dans le cas d’anémie infectieuse, durant la période nécessaire pour que, à partir de la date à laquelle les équidés atteints ont été éliminés, les animaux restants aient réagi négativement à deux tests de Coggins effectués à un intervalle de trois mois,
— dans le cas de stomatite vésiculeuse, durant six mois à compter du dernier cas,
— dans le cas de rage, durant un mois à compter du dernier cas,
— dans le cas du charbon bactéridien, durant quinze jours à compter du dernier cas,
— dans le cas où tous les animaux des espèces sensibles présents sur l’exploitation ont été abattus ou tués et les locaux désinfectés, durant trente jours à compter de la date à laquelle les animaux ont été éliminés et les locaux désinfectés, sauf dans le cas du charbon bactéridien pour lequel la durée d’interdiction est de quinze jours;
e) il n’a pas été, à ma connaissance, en contact avec des équidés atteints d’infection ou de maladie contagieuse au cours des quinze derniers jours;
f) au moment de l’inspection, ils étaient aptes à être transportés sur le trajet prévu, conformément aux dispositions du règlement (CE) no 1/2005 ( 9 ).
ANNEXE III
MODÈLE
CERTIFICAT SANITAIRE
pour les échanges entre les États membres
ÉQUIDÉS



ANNEXE IV
PESTE ÉQUINE
DIAGNOSTIC
PARTIE A
Tests sérologiques
Les méthodes sérologiques décrites ci-après sont des tests d'immuno-absorption enzymatique (ELISA) fondés sur le chapitre 2.5.1 de la section B, paragraphe 2, du Manuel des tests de diagnostic et des vaccins pour les animaux terrestres, édition 2016, tel qu'adopté par l'Assemblée mondiale des délégués de l'OIE en mai 2012.
La protéine virale VP7 est un antigène majeur immunodominant du virus de la peste équine (VPE); elle est présente dans les neuf sérotypes du VPE. Il a été établi que la protéine recombinante VP7 du VPE était stable et inoffensive et qu'elle pouvait être utilisée en tant qu'antigène dans les procédés ELISA visant à détecter la présence d'anticorps dirigés contre le virus de la peste équine, dont le niveau de sensibilité et de spécificité est très élevé [Lavida et al. 1992b ( 10 ), Maree et Paweska, 2005]. Les tests ELISA indirect et bloquant utilisent la protéine VP7 du VPE et conviennent au diagnostic sérologique de la peste équine.
1. Test ELISA indirect visant à détecter la présence d'anticorps dirigés contre le virus de la peste équine (VPE)
Cette technique recourt à des anticorps anticheval conjugués à la peroxydase de raifort réagissant au sérum de cheval, de mule et d'âne. La méthode décrite par Maree et Paweska (2005) ( 11 ) utilise comme conjugué la protéine G qui réagit également au sérum de zèbre.
L'antigène peut être fourni par le Centro de Investigación en Sanidad Animal (CISA), en Espagne, dans un délai de quatre à six mois suivant la demande.
1.1. Description du test
1.1.1. Phase solide
1.1.1.1. Déposer sur des plaques ELISA de la protéine recombinante VP7 du VPE de sérotype 4, diluée dans du tampon carbonate/bicarbonate de pH 9,6. Incuber les plaques pendant une nuit à 4 °C.
1.1.1.2. Rincer les plaques cinq fois avec de l'eau distillée contenant 0,01 % (v/v) de Tween-20 (solution de lavage). Tapoter délicatement les plaques sur un matériau absorbant pour enlever toute trace de rinçage.
1.1.1.3. Saturer les plaques avec une solution saline tamponnée au phosphate (SSTP) de pH 7,2 + 5 % (m/v) de lait écrémé en poudre (lait NestléTM), à raison de 200 μl par puits pendant une heure à 37 °C.
1.1.1.4. Enlever la solution de saturation et tapoter délicatement les plaques sur un matériau absorbant.
1.1.2. Échantillons
1.1.2.1. Les sérums à tester et les sérums positif et négatif de contrôle sont dilués au 1/25 dans une SSTP + 5 % (m/v) de lait écrémé + 0,05 % (v/v) de Tween-20; ils sont ensuite déposés à raison de 100 μl par puits. Incuber pendant une heure à 37 °C.
Pour le titrage, réaliser des séries de dilution de 2 en 2 à partir du 1/25e (100 μl/puits), en utilisant une colonne de la plaque par sérum; réaliser la même opération avec les contrôles positif et négatif. Incuber pendant une heure à 37 °C.
1.1.2.2. Rincer les plaques cinq fois avec de l'eau distillée contenant 0,01 % (v/v) de Tween-20 (solution de lavage). Tapoter délicatement les plaques sur un matériau absorbant pour enlever toute trace de rinçage.
1.1.3. Conjugué
1.1.3.1. Déposer 100 μl/puits des anticorps anti-cheval conjugués à la peroxydase de raifort dilués dans une SSTP + 5 % de lait écrémé + 0,05 % de Tween-20 de pH 7,2. Incuber pendant une heure à 37 °C.
1.1.3.2. Rincer les plaques cinq fois avec de l'eau distillée contenant 0,01 % (v/v) de Tween-20 (solution de lavage). Tapoter délicatement les plaques sur un matériau absorbant pour enlever toute trace de rinçage.
1.1.4. Chromogène/substrat
1.1.4.1. Ajouter 200 μl/puits de la solution de chromogène/substrat [10 ml de 80,6 mM de DMAB (diméthylaminobenzaldéhyde) + 10 ml de 1,56 mM de MBTH (3-méthyl-2-benzothiazoline d'hydrochlorure d'hydrazone) + 5 μl de H2O2].
Bloquer après environ cinq à dix minutes (avant que le contrôle négatif ne commence à se colorer) la réaction colorimétrique en ajoutant 50 μl de H2SO4 3N.
D'autres chromogènes tels que le ABTS (2,2′-azino-bis-[3-éthylbenzothiazoline-6-acide sulphonique), le TMB (tétraméthyle de benzidine) ou l'OPD (ortho-phényldiamine) peuvent aussi être utilisés.
1.1.4.2. Lire les plaques à 600 nm (ou 620 nm).
1.2. Interprétation des résultats
1.2.1. Calculer la valeur du seuil en ajoutant 0,06 à la valeur du contrôle négatif (0,06 est l'écart type calculé à partir d'un groupe de 30 sérums négatifs).
1.2.2. Les échantillons testés donnant une valeur d'absorbance inférieure au seuil sont considérés comme négatifs.
1.2.3. Les échantillons testés donnant une valeur d'absorbance supérieure au seuil + 0,15 sont considérés comme positifs.
1.2.4. Les échantillons testés donnant une valeur d'absorbance intermédiaire sont considérés comme non probants et une deuxième technique doit être employée pour confirmer le résultat.
2. Test ELISA bloquant visant à détecter la présence d'anticorps dirigés contre le virus de la peste équine (VPE)
Le test ELISA bloquant de compétition est destiné à déceler la présence d'anticorps spécifiques contre le virus de la peste équine dans les sérums de l'ensemble des animaux de l'espèce équine, à savoir les chevaux, les ânes, les zèbres et tout animal issu de leurs croisements, ce qui permet d'éviter le problème de la spécificité occasionnellement rencontré dans l'utilisation du test ELISA indirect.
Le principe du test est le blocage de la réaction entre la protéine recombinante VP7 absorbée par la plaque ELISA et un anticorps monoclonal conjugué spécifique de la protéine VP7 du VPE. Les anticorps dans les sérums à tester bloqueront la réaction entre l'antigène et l'anticorps monoclonal, entraînant une réduction de la couleur. L'anticorps monoclonal étant dirigé contre la protéine VP7, le test présentera un niveau élevé de sensibilité et de spécificité.
Le test ELISA bloquant est disponible dans le commerce.
2.1. Description du test
2.1.1. Phase solide
2.1.1.1. Déposer sur des plaques ELISA 50 à 100 ng d'antigène du VPE de serotype 4 avec la protéine recombinante VP7, diluée dans un tampon carbonate/bicarbonate de pH 9,6. Incuber les plaques durant une nuit à 4 °C.
2.1.1.2. Laver les plaques trois fois avec une solution saline tamponnée au phosphate (SSTP) 0,1 × contenant 0,135 M de NaCl et 0,05 % (v/v) de Tween-20. Tapoter délicatement les plaques sur un matériau absorbant pour enlever toute trace de rinçage.
2.1.2. Échantillons et contrôles
2.1.2.1. Diluer les sérums à tester et les sérums positif et négatif de contrôle au 1/5 dans un diluant contenant 0,35 M de NaCl, 0,05 % (v/v) de Tween-20 et 0,1 % de Kathon, 100 μl par puits. Incuber pendant une heure à 37 °C.
Pour le titrage, réaliser une série de dilutions de 2 en 2 de sérums à tester de 1/10e à 1/280e à déposer dans huit puits (100 μl/puits), en utilisant une colonne de la plaque par sérum; réaliser la même opération avec les contrôles positif et négatif. Incuber pendant une heure à 37 °C.
2.1.2.2. Laver les plaques cinq fois avec une solution saline tamponnée au phosphate (SSTP) 0,1 × contenant 0,135 M de NaCl et 0,05 % (v/v) de Tween-20. Tapoter délicatement les plaques sur un matériau absorbant pour enlever toute trace de rinçage.
2.1.3. Conjugué
2.1.3.1. Déposer 100 μl/puits de l'anticorps monoclonal anti-VP7 conjugué à la peroxydase de raifort. Cet anticorps monoclonal a été préalablement dilué au 1/5 000 -1/15 000 dans une solution 1/1 de StabiliZyme Select® Stabilizer (SurModics, référence: SZ03) dans de l'eau distillée. Incuber pendant 30 minutes à 37 °C.
2.1.3.2. Laver les plaques cinq fois avec une solution saline tamponnée au phosphate (SSTP) 0,1× contenant 0,135 M de NaCl et 0,05 % (v/v) de Tween-20. Tapoter délicatement les plaques sur un matériau absorbant pour enlever toute trace de rinçage.
2.1.4. Chromogène/substrat
Ajouter 100 μl par puits de la solution suivante de chromogène/substrat: 1 ml de ABTS (2,2-azino-bis-[3-éthylbenzothiazoline-6-acide sulphonique]) à 5 mg/ml + 9 ml de tampon de substrat (0,1 M de tampon de phosphate-citrate de pH 4 contenant 0,03 % de H2O2), puis incuber pendant dix minutes à température ambiante. Le développement de la couleur est arrêté par l'addition de 100 μl par puits de SDS (sulfate de sodium dodécyl) à 2 % (m/v).
2.1.5. Lecture
Lire à 405 nm dans un lecteur ELISA.
2.2. Interprétation des résultats
2.2.1. Déterminer le pourcentage de blocage (PB) de chaque échantillon en appliquant la formule suivante, où «Acs» représente les anticorps:
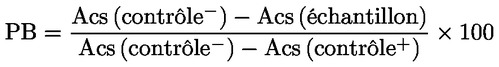
2.2.2. Dans la recherche d'anticorps contre le VPE, les échantillons présentant un PB d'une valeur supérieure à 50 % doivent être considérés comme positifs.
2.2.3. Dans la recherche d'anticorps contre le VPE, les échantillons présentant un PB d'une valeur inférieure à 45 % doivent être considérés comme négatifs.
2.2.4. Les échantillons présentant un PB d'une valeur comprise entre 45 et 50 % doivent être considérés comme non probants et faire l'objet d'un nouveau test. Si le résultat est à nouveau non probant, il convient de soumettre les animaux à un nouveau test sur la base d'échantillons prélevés au plus tôt deux semaines après le prélèvement de l'échantillon jugé non probant.
PARTIE B
Identification de l'agent pathogène
Réaction en chaîne par polymérase en temps réel après transcription inverse (rRT-PCR)
Les épreuves d'identification de l'agent pathogène fondées sur les méthodes de détection d'acide nucléique doivent déceler les souches de référence des neuf sérotypes du virus de la peste équine.
La méthode décrite au point 2.1 se fonde sur le chapitre 2.5.1 de la section B, paragraphe 1.2, du Manuel des tests de diagnostic et des vaccins pour les animaux terrestres, édition 2016, tel qu'adopté par l'Assemblée mondiale des délégués de l'OIE en mai 2012.
Toute méthode de détection RT-PCR utilisée pour tester des échantillons (de sang ou de rate), dans le cadre de la directive 2009/156/CE, doit obtenir des résultats d'une sensibilité égale ou supérieure à celle des méthodologies décrites au point 2.
Le virus inactivé des souches de référence des sérotypes 1 à 9 peut être obtenu auprès du laboratoire de référence de l'Union européenne ou du laboratoire de référence de l'OIE pour la peste équine à Algete, en Espagne.
1. Extraction de l'ARN viral
Pour assurer une bonne réaction, il est nécessaire d'extraire de l'échantillon un ARN du VPE d'excellente qualité. L'extraction des acides nucléiques à partir d'échantillons cliniques peut être réalisée au moyen de plusieurs méthodes internes et disponibles dans le commerce.
Les kits commerciaux utilisent des techniques différentes pour isoler l'ARN, la plupart reposant sur l'un des procédés suivants:
— extraction au phénol-chloroforme des acides nucléiques,
— adsorption des acides nucléiques sur la membrane filtrante,
— adsorption des acides nucléiques sur un système de billes magnétiques.
Exemple d'extraction de l'ARN en interne:
1.1. 1 g d'échantillon de tissus est homogénéisé dans 1 ml de solution de dénaturation (4 M de thiocyanate de guanidinium, 25 mM de citrate de sodium, 0,1 M de 2-mercaptoéthanol, 0,5 % de Sarcosyl).
1.2. Après centrifugation, 1 μg d'ARN de levure, 0,1 ml de 2 M d'acétate de sodium de pH 4, 1 ml de phénol et 0,2 ml d'un mélange de chloroforme et d'alcool isoamylique (au 49/1) sont ajoutés au surnageant.
1.3. La suspension est agitée vigoureusement puis refroidie sur de la glace pendant 15 minutes.
1.4. Après centrifugation, l'ARN présent dans la phase aqueuse est extrait au phénol, précipité à l'éthanol et remis en suspension dans de l'eau stérile.
2. Procédure RT-PCR en temps réel
2.1. RT-PCR en temps réel spécifique à un groupe, par Agüero et al., 2008 ( 12 )
Cette procédure RT-PCR en temps réel spécifique à un groupe cible la VP7 du VPE et peut déceler l'ensemble des sérotypes et souches connus du VPE qui circulent actuellement. Elle a été utilisée par les laboratoires de référence nationaux participants des États membres de l'Union européenne dans le cadre des contrôles de compétence organisés tous les ans par le laboratoire de référence de l'Union européenne pour la période 2009-2015 et a permis d'obtenir de très bons résultats. En outre, lors d'un essai circulaire international organisé en 2015 dans le cadre du réseau de laboratoires de référence de l'OIE, ce protocole a figuré parmi les mieux classés.
Séquences des amorces et de la sonde pour la détection des virus de la peste équine:
|
amorce sens |
5′-CCA-GTA-GGC-CAG-ATC-AAC-AG-3′ |
|
amorce antisens |
5′-CTA-ATG-AAA-GCG-GTG-ACC-GT-3′ |
|
Sonde TaqMan MGB |
5′-FAM-GCT-AGC-AGC-CTA-CCA-CTA-MGB-3′ |
2.1.1. La concentration des stocks d'amorces est diluée à une concentration de travail de 8 μM («stock de travail pour les amorces de 8 μM»), tandis que la sonde est diluée à une concentration de travail de 50 μM («stock de travail pour la sonde de 50 μM»). Un plan de plaque d'essai devrait être conçu et chargé dans le logiciel de l'appareil de PCR en temps réel. En se servant du plan comme guide, 2,5 μl de chaque stock de travail pour les amorces de 8 μM sont ajoutés à chaque puits qui contiendra des échantillons d'ARN ainsi que des contrôles positifs et/ou négatifs (la concentration finale de l'amorce sera de 1 μM dans le mélange de la RT-PCR de 20 μl). La plaque est maintenue sur de la glace.
2.1.2. 2 μl d'ARN isolé (échantillons de test et contrôle positif), ou 2 μl d'eau exempte de RNase dans des contrôles à réaction négative sont mélangés avec des amorces sens et des amorces antisens. Ce mélange est dénaturé par un chauffage à 95 °C pendant 5 minutes, suivi d'un refroidissement rapide sur de la glace pendant au moins 5 minutes.
2.1.3. Un volume du mélange réactionnel de la RT-PCR en temps réel en une étape adapté au nombre d'échantillons à tester est préparé en suivant les instructions du fabricant. 0,1 μl de stock de travail pour la sonde de 50 μM est ajouté à chaque puits contenant des échantillons d'ARN (la concentration finale de la sonde sera de 0,25 μM dans chaque puits contenant des échantillons d'ARN). 13 μl de mélange réactionnel de la RT-PCR en temps réel en une étape sont distribués dans chaque puits sur la plaque PCR contenant les amorces dénaturées et l'ARN.
2.1.4. La plaque est placée dans un thermocycleur en temps réel programmé pour la transcription inverse et la détection de l'amplification/la fluorescence de l'ADNc. Les conditions d'amplification consistent en une première étape de transcription inverse de 25 minutes à 48 ƒC, puis d'une autre de 10 minutes à 95 °C («démarrage à chaud»), et de 40 cycles de 15 secondes à 95 °C, 35 secondes à 55 °C et 30 secondes à 72 °C (ou 40 cycles à 97 °C pendant 2 secondes et 55 °C pendant 30 secondes si des réactifs et un thermocycleur permettant des réactions rapides sont utilisés). Les données de fluorescence sont acquises à la fin de l'étape à 55 °C.
2.1.5. Le test est jugé non valide si les courbes d'amplification obtenues sont atypiques; il doit alors être répété.
Les échantillons sont considérés comme positifs si la valeur Ct (nombre de cycles pour que la fluorescence générée dans une réaction franchisse le seuil de fluorescence) est inférieure ou égale au seuil Ct défini (35) dans les 40 cycles de la PCR (Ct ≤ 35).
Les échantillons sont considérés comme non probants si la valeur Ct est supérieure au seuil Ct défini (35) dans les 40 cycles de la PCR (Ct ≥ 35).
Les échantillons sont considérés comme négatifs en cas d'obtention d'une courbe d'amplification horizontale qui ne franchit pas la ligne de seuil dans les 40 cycles de la PCR.
2.2. RT-PCR en temps réel spécifique à un groupe par Guthrie et al., 2013 ( 13 )
La RT-PCR en temps réel réalisée à l'aide de sondes de transfert d'énergie par résonance en fluorescence (FRET) vise à déceler l'acide nucléique du VPE.
L'épreuve RT-PCR pour le virus de la peste équine décrite a été conçue à l'aide de séquences issues d'une grande variété de souches sauvages du VPE actuellement en circulation [Quan et al., 2010 ( 14 )]. Elle comporte également un test de contrôle externe synthétique propriétaire visant à vérifier le bon fonctionnement des composants de l'essai.
Des kits pour la PCR en temps réel en une étape sont disponibles dans le commerce. Ci-après figurent certaines étapes de base, telles que décrites par Guthrie et al. (2013), susceptibles d'être modifiées en fonction des exigences locales/spécifiques à chaque cas, des kits utilisés et du matériel disponible.
Séquences des amorces et de la sonde pour la détection des virus de la peste équine:
|
amorce sens |
5′-AGA-GCT-CTT-GTG-CTA-GCA-GCC-T-3′ |
|
amorce antisens |
5′-GAA-CCG-ACG-CGA-CAC-TAA-TGA-3′ |
|
Sonde TaqMan MGB |
5′-FAM-TGC-ACG-GTC-ACC-GCT-MGB-3′ |
2.2.1. Les solutions mères de mélange des amorces et de la sonde sont préparées dans une concentration 25 × à 5 μΜ pour les amorces sens et antisens et à 3 μΜ pour la sonde. Un plan de plaque d'essai devrait être conçu et chargé dans le logiciel de l'appareil PCR en temps réel. En se servant du plan comme guide, 5 μl d'échantillons d'ARN, comprenant des échantillons d'essai ainsi que les contrôles positif et négatif, sont ajoutés aux puits appropriés de la plaque suivant le plan.
2.2.2. L'ARN est dénaturé par chauffage à 95 °C pendant 5 minutes, suivi d'un refroidissement rapide sur de la glace pendant au moins 3 minutes.
2.2.3. Un volume du mélange réactionnel de la RT-PCR en temps réel en une étape adapté au nombre d'échantillons à tester est préparé en suivant les instructions du fabricant. 1 μl de solution mère de mélange des amorces et de la sonde 25 × (voir le point 2.2.1 ci-dessus) est incluse dans le mélange réactionnel afin d'obtenir une concentration finale dans chaque puits de 200 nM pour chaque amorce et de 120 nM pour la sonde. 20 μl du mélange réactionnel sont distribués dans chaque puits sur la plaque PCR contenant l'ARN dénaturé.
2.2.4. La plaque est placée dans un thermocycleur en temps réel programmé pour la transcription inverse et la détection de l'amplification/la fluorescence de l'ADNc, conformément aux recommandations des fabricants. Les conditions d'amplification peuvent être les suivantes: une première étape de transcription inverse de 10 minutes à 48 °C, puis une autre de 10 minutes à 95 °C, et 40 cycles de 15 secondes à 95 °C et de 45 secondes à 60 °C.
2.2.5. Les échantillons sont considérés comme positifs si la fluorescence normalisée pour l'épreuve RT-PCR pour le VPE dépasse un seuil de 0,1 dans les 36 cycles de la PCR dans tous les échantillons dupliqués.
Les échantillons sont considérés comme non concluants si la fluorescence normalisée pour l'épreuve RT-PCR pour le VPE dépasse un seuil de 0,1 entre 36 et 40 cycles de la PCR dans l'un des échantillons dupliqués.
Les échantillons sont considérés comme négatifs si la fluorescence normalisée pour l'épreuve RT-PCR pour le VPE ne dépasse pas un seuil de 0,1 dans les 40 cycles de la PCR dans tous les échantillons dupliqués et si la fluorescence normalisée pour le test de contrôle externe synthétique propriétaire dépasse un seuil de 0,1 dans les 33 cycles de la PCR.
ANNEXE V
PARTIE A
Directive abrogée avec liste de ses modifications successives
(visées à l’article 22)
|
Directive 90/426/CEE du Conseil (JO L 224 du 18.8.1990, p. 42) |
|
|
Directive 90/425/CEE du Conseil (JO L 224 du 18.8.1990, p. 29) |
Uniquement l’article 15, paragraphe 3 |
|
Directive 91/496/CEE du Conseil (JO L 268 du 24.9.1991, p. 56) |
Uniquement en ce qui concerne la référence à la directive 90/426/CEE, à l’article 26, paragraphe 2 |
|
Décision 92/130/CEE de la Commission (JO L 47 du 22.2.1992, p. 26) |
|
|
Directive 92/36/CEE du Conseil (JO L 157 du 10.6.1992, p. 28) |
Uniquement l’article 1er |
|
Acte d’adhésion de 1994, annexe I, point V.E.I.A.3 (JO C 241 du 29.8.1994, p. 132) |
|
|
Décision 2001/298/CE de la Commission (JO L 102 du 12.4.2001, p. 63) |
Uniquement en ce qui concerne la référence à la directive 90/426/CEE, à l’article 1er, paragraphe 1, et à l’annexe I, point 2 |
|
Décision 2002/160/CE de la Commission (JO L 53 du 23.2.2002, p. 37) |
|
|
Règlement (CE) no 806/2003 du Conseil (JO L 122 du 16.5.2003, p. 1) |
Uniquement l’annexe III, point 10 |
|
Acte d’adhésion de 2003, annexe II, point 6.B.I.16 (JO L 236 du 23.9.2003, p. 381) |
|
|
Directive 2004/68/CE du Conseil (JO L 139 du 30.4.2004, p. 320) |
Uniquement l’article 15 |
|
Directive 2006/104/CE du Conseil (JO L 363 du 20.12.2006, p. 352) |
Uniquement l’annexe, point I.2 |
|
Directive 2008/73/CE du Conseil (JO L 219 du 14.8.2008, p. 40) |
Uniquement l’article 7 |
PARTIE B
Délais de transposition en droit national
(visés à l’article 22)
|
Directive |
Date limite de transposition |
|
90/426/CEE |
1er janvier 1992 |
|
90/425/CEE |
1er juillet 1992 |
|
91/496/CEE |
1er juillet 1992 |
|
92/36/CEE |
31 décembre 1992 |
|
2004/68/CE |
19 novembre 2005 |
|
2006/104/CE |
1er janvier 2007 |
|
2008/73/CE |
1er janvier 2010 |
ANNEXE VI
Tableau de correspondance
|
Directive 90/426/CEE |
Présente directive |
|
Article 1er |
Article 1er |
|
Article 2, points a) et b) |
Article 2, points a) et b) |
|
Article 2, point c) |
Article 2, points c) i) et c) ii) |
|
Article 2, points d) à i) |
Article 2, points d) à i) |
|
Article 3 |
Article 3 |
|
Article 4, paragraphes 1, 2 et 3 |
Article 4, paragraphes 1, 2 et 3 |
|
Article 4, paragraphe 4, points i) et ii) |
Article 4, paragraphe 4, points a) et b) |
|
Article 4, paragraphe 5, point a), premier à sixième tirets |
Article 4, paragraphe 5, points a) i) à a) vi) |
|
Article 4, paragraphe 5, point b) |
Article 4, paragraphe 5, point b) |
|
Article 4, paragraphe 6, premier alinéa, premier à huitième tirets |
Article 4, paragraphe 6, premier alinéa, points a) à h) |
|
Article 4, paragraphe 6, deuxième et troisième alinéas |
Article 4, paragraphe 6, deuxième et troisième alinéas |
|
Article 5, paragraphe 1 |
Article 5, paragraphe 1 |
|
Article 5, paragraphe 2, point a) |
Article 5, paragraphe 2, premier alinéa, points a) et b) |
|
Article 5, paragraphe 2, point b) |
Article 5, paragraphe 2, deuxième alinéa, points a) et b) |
|
Article 5, paragraphe 2, point c) |
Article 5, paragraphe 3 |
|
Article 5, paragraphe 2, point d) |
Article 5, paragraphe 4 |
|
Article 5, paragraphe 3, points a) et b) |
Article 5, paragraphe 5, points a) et (b) |
|
Article 5, paragraphe 3, point c), premier et deuxième tirets |
Article 5, paragraphe 5, point c), premier alinéa, points i) et ii) |
|
Article 5, paragraphe 3, point c), deuxième tiret, dernière phrase |
Article 5, paragraphe 5, point c), deuxième alinéa |
|
Article 5, paragraphe 3, points d) et e) |
Article 5, paragraphe 5, points d) et (e) |
|
Article 6 |
Article 6 |
|
Article 7 |
Article 7 |
|
Article 8, paragraphe 1, premier alinéa, premier et deuxième tirets |
Article 8, paragraphe 1, points a) et (b) |
|
Article 8, paragraphe 1, deuxième alinéa |
Article 8, paragraphe 2 |
|
Article 8, paragraphe 2 |
Article 8, paragraphe 3 |
|
Article 9 |
Article 9 |
|
Article 10 |
Article 10 |
|
Article 11, paragraphe 1 |
Article 11 |
|
Article 11, paragraphe 2 |
— |
|
Article 12 |
Article 12 |
|
Article 13 |
Article 13 |
|
Article 14 |
Article 14 |
|
Article 15 |
Article 15 |
|
Article 16, paragraphe 1, points a) à f) |
Article 16, paragraphe 1, points a) à f) |
|
Article 16, paragraphe 1, dernière phrase |
— |
|
Article 16, paragraphe 2 |
Article 16, paragraphe 2 |
|
Article 17 |
Article 18 |
|
Article 18 |
Article 17 |
|
Article 19, points i) à iv) |
Article 19, points a) à d) |
|
Article 22 |
— |
|
Article 23 |
Article 20 |
|
Article 24, paragraphes 1 et 2 |
Article 21, paragraphes 1 et 2 |
|
Article 24, paragraphe 3 |
— |
|
Article 25, paragraphes 1 et 2 |
Article 21, paragraphes 1 et 3 |
|
Article 26 |
— |
|
Article 27 |
— |
|
— |
Article 22 |
|
— |
Article 23 |
|
Article 28 |
Article 24 |
|
Annexe A |
Annexe I |
|
Annexe B |
Annexe II |
|
Annexe C |
Annexe III |
|
Annexe D |
Annexe IV |
|
— |
Annexe V |
|
— |
Annexe VI |
( 1 ) JO L 224 du 18.8.1990, p. 55.
( 2 ) JO L 157 du 10.6.1992, p. 19.
( 3 ) JO 121 du 29.7.1964, p. 1977.
( 4 ) JO L 31 du 1.2.2002, p. 1.
( 5 ) Cette attestation n’est pas exigée en cas d’accord bilatéral conclu conformément à l’article 6 de la directive 2009/156/CE.
( 6 ) Valable dix jours.
( 7 ) Biffer la mention inutile.
( 8 ) Mention de la vaccination doit figurer dans le passeport.
( 9 ) Cette déclaration ne dispense pas les transporteurs des obligations qui leur incombent en vertu des dispositions communautaires en vigueur, notamment pour ce qui est de l’aptitude des animaux à être transportés.
( 10 ) Laviada, M.D., Roy, P., et Sanchez-Vizcaiono, J.M., «Adaptation and evaluation of an indirect ELISA and inmunoblotting test for African horse sickness antibody detection», dans Bluetongue, African Horse Sickness and Related Orbiviruses: Proceedings of the Second International Symposium, Walton T.E. & Osburn B.l., Eds. CRC Press, Boca Raton, États-Unis, 1992b, p. 646 à 650.
( 11 ) Maree, S., et Paweska, J.T., «Preparation of recombinant African horse sickness virus VP7 antigen via a simple method and validation of a VP7-based indirect ELISA for the detection of group-specific IgG antibodies in horse sera», dans Journal of Virological Methods, 2005, vol. 125, no 1, p. 55 à 65.
( 12 ) Agüero, M., Gomez-Tejedor, C., Angeles Cubillo, M., Rubio, C., Romero, E., et Jimenez-Clavero, A., «Real-time fluorogenic reverse transcription polymerase chain reaction assay for detection of African horse sickness virus», dans Journal of Veterinary Diagnostic Investigation, 2008, vol. 20, p. 325 à 328.
( 13 ) Guthrie, A.J., MacLachlan, N.J., Joone, C., Lourens, C.W., Weyer, C.T., Quan, M., Monyai, M.S., Gardner, I.A., «Diagnostic accuracy of a duplex real-time reverse transcription quantitative PCR assay for detection of African horse sickness virus», dans Journal of Virological Methods, 2013, vol. 189, no 1, p. 30 à 35.
( 14 ) Quan, M., Lourens, C.W., MacLachlan, N.J., Gardner, I.A., et Guthrie, A.J., «Development and optimisation of a duplex real-time reverse transcription quantitative PCR assay targeting the VP7 and NS2 genes of African horse sickness virus», dans Journal of Virological Methods, 2010, vol. 167, p. 45 à 52.

