ISSN 1977-0812
Euroopan unionin
virallinen lehti
L 426

Suomenkielinen laitos
Lainsäädäntö
64. vuosikerta
29. marraskuuta 2021
|
ISSN 1977-0812 |
||
|
Euroopan unionin virallinen lehti |
L 426 |
|

|
||
|
Suomenkielinen laitos |
Lainsäädäntö |
64. vuosikerta |
|
|
|
|
|
(1) ETA:n kannalta merkityksellinen teksti. |
|
FI |
Säädökset, joiden otsikot on painettu laihalla kirjasintyypillä, ovat maatalouspolitiikan alaan kuuluvia juoksevien asioiden hoitoon liityviä säädöksiä, joiden voimassaoloaika on yleensä rajoitettu. Kaikkien muiden säädösten otsikot on painettu lihavalla kirjasintyypillä ja merkitty tähdellä. |
II Muut kuin lainsäätämisjärjestyksessä hyväksyttävät säädökset
ASETUKSET
|
29.11.2021 |
FI |
Euroopan unionin virallinen lehti |
L 426/1 |
KOMISSION TÄYTÄNTÖÖNPANOASETUS (EU) 2021/2076,
annettu 26 päivänä marraskuuta 2021,
Escherichia coli KCCM 80210 -bakteerin tuottaman L-tryptofaanin hyväksymisestä kaikkien eläinlajien rehun lisäaineena
(ETA:n kannalta merkityksellinen teksti)
EUROOPAN KOMISSIO, joka
ottaa huomioon Euroopan unionin toiminnasta tehdyn sopimuksen,
ottaa huomioon eläinten ruokinnassa käytettävistä lisäaineista 22 päivänä syyskuuta 2003 annetun Euroopan parlamentin ja neuvoston asetuksen (EY) N:o 1831/2003 (1) ja erityisesti sen 9 artiklan 2 kohdan,
sekä katsoo seuraavaa:
|
(1) |
Asetuksessa (EY) N:o 1831/2003 säädetään eläinten ruokinnassa käytettävien lisäaineiden hyväksymisestä ja vahvistetaan perustelut ja menettelyt hyväksynnän myöntämiselle. |
|
(2) |
Asetuksen (EY) N:o 1831/2003 7 artiklan mukaisesti on jätetty Escherichia coli KCCM 80210 -bakteerin tuottaman L-tryptofaanin hyväksymistä koskeva hakemus. Hakemuksen mukana toimitettiin kyseisen asetuksen 7 artiklan 3 kohdan mukaisesti vaadittavat tiedot ja asiakirjat. |
|
(3) |
Hakemus koskee Escherichia coli KCCM 80210 -bakteerin tuottaman L-tryptofaanin hyväksymistä kaikkien eläinlajien rehun lisäaineena, joka luokitellaan lisäaineluokkaan ”ravitsemukselliset lisäaineet” ja funktionaaliseen ryhmään ”aminohapot, niiden suolat ja analogit”. |
|
(4) |
Euroopan elintarviketurvallisuusviranomainen, jäljempänä ’elintarviketurvallisuusviranomainen’, totesi 27 päivänä tammikuuta 2021 antamassaan lausunnossa (2), että ehdotetuissa käyttöolosuhteissa Escherichia coli KCCM 80210 -bakteerin tuottamalla L-tryptofaanilla ei ole haitallisia vaikutuksia muiden eläinten kuin märehtijöiden terveyteen, kuluttajien turvallisuuteen eikä ympäristöön. Jotta L-tryptofaani olisi turvallista märehtijöille, se olisi suojattava pötsihajotukselta. Elintarviketurvallisuusviranomainen totesi, että arvioitavana olevaa lisäainetta pidetään lievästi silmiä ärsyttävänä. Lisäaineen endotoksiiniaktiivisuuden ja sen mahdollisen pölyämisen vuoksi siihen liittyy hengitysteiden kautta aiheutuva riski. Sen vuoksi komissio katsoo, että ihmisten terveydelle aiheutuvien haittavaikutusten ehkäisemiseksi olisi toteutettava asianmukaisia suojatoimenpiteitä erityisesti lisäaineen käyttäjien osalta. |
|
(5) |
Elintarviketurvallisuusviranomainen katsoi, että Escherichia coli KCCM 80210 -bakteerin tuottama L-tryptofaani on tehokas välttämättömän aminohapon tryptofaanin lähde muille kuin märehtijöille; jotta Escherichia coli KCCM 80210 -bakteerin tuottama L-tryptofaani olisi täydennysravintona yhtä tehokasta märehtijöillä kuin muilla kuin märehtijöillä, se olisi suojattava pötsihajotukselta. Elintarviketurvallisuusviranomainen ei katso erityisten markkinoille saattamisen jälkeistä seurantaa koskevien vaatimusten olevan tarpeen. Lisäksi se vahvisti asetuksella (EY) N:o 1831/2003 perustetun vertailulaboratorion toimittaman raportin analyysimenetelmästä, jolla rehun lisäaine määritetään rehusta. |
|
(6) |
Escherichia coli KCCM 80210 -bakteerin tuottaman L-tryptofaanin arviointi osoittaa, että asetuksen (EY) N:o 1831/2003 5 artiklassa säädetyt hyväksymisen edellytykset täyttyvät. Sen vuoksi kyseisen aineen käyttö tämän asetuksen liitteessä esitetyllä tavalla olisi hyväksyttävä. |
|
(7) |
Tässä asetuksessa säädetyt toimenpiteet ovat pysyvän kasvi-, eläin-, elintarvike- ja rehukomitean lausunnon mukaiset, |
ON HYVÄKSYNYT TÄMÄN ASETUKSEN:
1 artikla
Hyväksytään lisäaineluokkaan ”ravitsemukselliset lisäaineet” ja funktionaaliseen ryhmään ”aminohapot, niiden suolat ja analogit” kuuluva liitteessä eritelty aine eläinten ruokinnassa käytettävänä lisäaineena kyseisessä liitteessä vahvistetuin edellytyksin.
2 artikla
Tämä asetus tulee voimaan kahdentenakymmenentenä päivänä sen jälkeen, kun se on julkaistu Euroopan unionin virallisessa lehdessä.
Tämä asetus on kaikilta osiltaan velvoittava, ja sitä sovelletaan sellaisenaan kaikissa jäsenvaltioissa.
Tehty Brysselissä 26 päivänä marraskuuta 2021.
Komission puolesta
Puheenjohtaja
Ursula VON DER LEYEN
(1) EUVL L 268, 18.10.2003, s. 29.
(2) EFSA Journal 2021;19(3):6425.
LIITE
|
Lisäaineen tunnistenumero |
Hyväksynnän haltijan nimi |
Lisäaine |
Koostumus, kemiallinen kaava, kuvaus, analyysimenetelmä |
Eläinlaji tai -ryhmä |
Enimmäisikä |
Vähimmäispitoisuus |
Enimmäispitoisuus |
Muut määräykset |
Hyväksynnän voimassaolo päättyy |
||||||||
|
mg / kg täysrehua, jonka kosteuspitoisuus on 12 % |
|||||||||||||||||
|
Luokka: ravitsemukselliset lisäaineet. Funktionaalinen ryhmä: aminohapot, niiden suolat ja analogit. |
|||||||||||||||||
|
3c440i |
- |
L-tryptofaani |
Lisäaineen koostumus: Jauhe, joka sisältää vähintään 98 % L-tryptofaania (kuiva-aineesta) ja jonka kosteuspitoisuus on enintään 1 %. Enintään 10 mg/kg 1,1′-etylideeni-bis-L-tryptofaania (EBT). |
Kaikki lajit |
- |
- |
- |
|
19. joulukuuta 2031 |
||||||||
|
Tehoaineen kuvaus: L-tryptofaani, jota tuotetaan fermentoimalla Escherichia coli KCCM 80210 -bakteerista. Kemiallinen kaava: C11H12N2O2 CAS-numero: 73-22-3 |
|||||||||||||||||
|
Analyysimenetelmät: (1) L-tryptofaanin tunnistaminen rehun lisäaineesta:
|
|||||||||||||||||
(1) Analyysimenetelmiä koskevia yksityiskohtaisia tietoja on saatavissa seuraavasta vertailulaboratorion osoitteesta: https://ec.europa.eu/jrc/en/eurl/feed-additives/evaluation-reports
(2) Altistuminen laskettuna lisäaineen endotoksiinipitoisuuden ja mahdollisen pölyämisen perusteella EFSAn käyttämän menetelmän mukaisesti (EFSA Journal 2015;13(2):4015); analyysimenetelmä: Euroopan farmakopea 2.6.14 (bakteeriendotoksiinit).
(3) Komission asetus (EY) N:o 152/2009, annettu 27 päivänä tammikuuta 2009 , näytteenotto- ja määritysmenetelmistä rehujen virallista valvontaa varten (EUVL L 54, 26.2.2009, s. 1).
|
29.11.2021 |
FI |
Euroopan unionin virallinen lehti |
L 426/5 |
KOMISSION TÄYTÄNTÖÖNPANOASETUS (EU) 2021/2077,
annettu 26 päivänä marraskuuta 2021,
Corynebacterium glutamicum CGMCC 7.366 -bakteerin tuottaman L-valiinin hyväksymisestä kaikkien eläinlajien rehun lisäaineena
(ETA:n kannalta merkityksellinen teksti)
EUROOPAN KOMISSIO, joka
ottaa huomioon Euroopan unionin toiminnasta tehdyn sopimuksen,
ottaa huomioon eläinten ruokinnassa käytettävistä lisäaineista 22 päivänä syyskuuta 2003 annetun Euroopan parlamentin ja neuvoston asetuksen (EY) N:o 1831/2003 (1) ja erityisesti sen 9 artiklan 2 kohdan,
sekä katsoo seuraavaa:
|
(1) |
Asetuksessa (EY) N:o 1831/2003 säädetään eläinten ruokinnassa käytettävien lisäaineiden hyväksymisestä ja vahvistetaan perustelut ja menettelyt hyväksynnän myöntämiselle. |
|
(2) |
L-valiinin hyväksymistä varten on toimitettu hakemus asetuksen (EY) N:o 1831/2003 7 artiklan mukaisesti. Hakemuksen mukana toimitettiin kyseisen asetuksen 7 artiklan 3 kohdan mukaisesti vaadittavat tiedot ja asiakirjat. |
|
(3) |
Hakemus koskee Corynebacterium glutamicum CGMCC 7.366 -bakteerin tuottaman L-valiinin hyväksymistä kaikkien eläinlajien rehun lisäaineena, joka luokitellaan lisäaineluokkaan ”ravitsemukselliset lisäaineet” ja funktionaaliseen ryhmään ”aminohapot, niiden suolat ja analogit”. |
|
(4) |
Euroopan elintarviketurvallisuusviranomainen, jäljempänä ’elintarviketurvallisuusviranomainen’, totesi 17 päivänä maaliskuuta 2021 (2) antamassaan lausunnossa, että Corynebacterium glutamicum CGMCC 7.366 -bakteerin tuottamalla L-valiinilla ei ole haitallisia vaikutuksia eläinten terveyteen, kuluttajien turvallisuuteen eikä ympäristöön, kun sillä täydennetään ravintoa asianmukaisina määrinä ja ehdotettujen käyttöedellytysten mukaisesti. Kyseisen lisäaineen käyttäjien turvallisuuden osalta elintarviketurvallisuusviranomainen ei voinut sulkea pois hengitysteitse aiheutuvaa riskiä eikä sitä, että L-valiini saattaa olla ihoa tai silmiä ärsyttävä tai ihoa herkistävä aine. Sen vuoksi komissio katsoo, että ihmisten terveydelle aiheutuvien haittavaikutusten ehkäisemiseksi olisi toteutettava asianmukaisia suojatoimenpiteitä erityisesti lisäaineen käyttäjien osalta. Elintarviketurvallisuusviranomainen totesi myös, että tämän lisäaineen katsotaan olevan eläinten ruokinnassa välttämättömän aminohapon L-valiinin tehokas lähde ja että se olisi suojattava pötsihajotukselta, jotta se olisi tehokas märehtijöillä. Elintarviketurvallisuusviranomainen ei katso erityisten markkinoille saattamisen jälkeistä seurantaa koskevien vaatimusten olevan tarpeen. Se myös vahvisti asetuksella (EY) N:o 1831/2003 perustetun vertailulaboratorion toimittamat raportit analyysimenetelmästä, jolla rehun lisäaine määritetään rehusta. |
|
(5) |
Corynebacterium glutamicum CGMCC 7.366 -bakteerin tuottaman L-valiinin arviointi osoittaa, että asetuksen (EY) N:o 1831/2003 5 artiklassa säädetyt hyväksyntäedellytykset täyttyvät. Sen vuoksi kyseisen aineen käyttö tämän asetuksen liitteessä kuvatulla tavalla olisi hyväksyttävä. |
|
(6) |
Tässä asetuksessa säädetyt toimenpiteet ovat pysyvän kasvi-, eläin-, elintarvike- ja rehukomitean lausunnon mukaiset, |
ON HYVÄKSYNYT TÄMÄN ASETUKSEN:
1 artikla
Hyväksytään lisäaineluokkaan ”ravitsemukselliset lisäaineet” ja funktionaaliseen ryhmään ”aminohapot, niiden suolat ja analogit” kuuluva, liitteessä kuvattu aine eläinten ruokinnassa käytettävänä rehun lisäaineena kyseisessä liitteessä vahvistetuin edellytyksin.
2 artikla
Tämä asetus tulee voimaan kahdentenakymmenentenä päivänä sen jälkeen, kun se on julkaistu Euroopan unionin virallisessa lehdessä.
Tämä asetus on kaikilta osiltaan velvoittava, ja sitä sovelletaan sellaisenaan kaikissa jäsenvaltioissa.
Tehty Brysselissä 26 päivänä marraskuuta 2021.
Komission puolesta
Puheenjohtaja
Ursula VON DER LEYEN
(1) EUVL L 268, 18.10.2003, s. 29.
(2) EFSA Journal 2021, 19(4):6521.
LIITE
|
Lisäaineen tunnistenumero |
Hyväksynnän haltijan nimi |
Lisäaine |
Koostumus, kemiallinen kaava, kuvaus, analyysimenetelmä |
Eläinlaji tai -ryhmä |
Enimmäisikä |
Vähimmäispitoisuus |
Enimmäispitoisuus |
Muut määräykset |
Hyväksynnän voimassaolo päättyy |
||||||||
|
mg / kg täysrehua, jonka kosteuspitoisuus on 12 % |
|||||||||||||||||
|
Luokka: ravitsemukselliset lisäaineet. Funktionaalinen ryhmä: aminohapot, niiden suolat ja analogit. |
|||||||||||||||||
|
3c371i |
- |
L-valiini |
Lisäaineen koostumus Jauhe, joka sisältää vähintään 98 % L-valiinia (kuiva-aineesta) ja jonka vesipitoisuus on enintään 1,5 %. |
Kaikki lajit |
- |
|
|
|
19. joulukuuta 2031 |
||||||||
|
Tehoaineen kuvaus L-valiini ((2S)-2-amino-3-metyylibutaanihappo), jota tuottaa Corynebacterium glutamicum CGMCC 7.366 Kemiallinen kaava: C5H11NO2 CAS-numero: 72-18-4 |
|||||||||||||||||
|
Analyysimenetelmä (1) L-valiinin tunnistaminen rehun lisäaineesta:
Valiinin määrän määrittäminen esiseoksista, rehuaineista ja rehuseoksista:
Valiinin määrän määrittäminen vedestä:
|
|||||||||||||||||
(1) Analyysimenetelmiä koskevia yksityiskohtaisia tietoja on saatavissa seuraavasta vertailulaboratorion osoitteesta: https://ec.europa.eu/jrc/en/eurl/feed-additives/evaluation-reports
|
29.11.2021 |
FI |
Euroopan unionin virallinen lehti |
L 426/9 |
KOMISSION TÄYTÄNTÖÖNPANOASETUS (EU) 2021/2078,
annettu 26 päivänä marraskuuta 2021,
Euroopan parlamentin ja neuvoston asetuksen (EU) 2017/745 soveltamista koskevien sääntöjen vahvistamisesta eurooppalaisen lääkinnällisten laitteiden tietokannan (Eudamed) osalta
EUROOPAN KOMISSIO, joka
ottaa huomioon Euroopan unionin toiminnasta tehdyn sopimuksen,
ottaa huomioon lääkinnällisistä laitteista, direktiivin 2001/83/EY, asetuksen (EY) N:o 178/2002 ja asetuksen (EY) N:o 1223/2009 muuttamisesta sekä neuvoston direktiivien 90/385/ETY ja 93/42/ETY kumoamisesta 5 päivänä huhtikuuta 2017 annetun Euroopan parlamentin ja neuvoston asetuksen (EU) 2017/745 (1) ja erityisesti sen 33 artiklan 8 kohdan,
sekä katsoo seuraavaa:
|
(1) |
Asetuksessa (EU) 2017/745 edellytetään, että komissio vahvistaa yksityiskohtaiset järjestelyt, jotka ovat tarpeen eurooppalaisen lääkinnällisten laitteiden tietokannan, jäljempänä ’Eudamed’, perustamiseksi ja ylläpitämiseksi. |
|
(2) |
Euroopan parlamentin ja neuvoston asetuksessa (EU) 2017/746 (2) edellytetään, että komissio perustaa Eudamed-tietokannan ja ylläpitää ja hallinnoi sitä asetuksessa (EU) 2017/745 vahvistettujen edellytysten ja yksityiskohtaisten järjestelyjen mukaisesti. |
|
(3) |
Kuten asetuksissa (EU) 2017/745 ja (EU) 2017/746 säädetään, komissiolla, toimivaltaisilla viranomaisilla, ilmoitetuista laitoksista vastaavilla viranomaisilla, ilmoitetuilla laitoksilla, valmistajilla, valtuutetuilla edustajilla, maahantuojilla, asetuksen (EU) 2017/745 22 artiklan 1 kohdassa tarkoitetuilla luonnollisilla henkilöillä tai oikeushenkilöillä (järjestelmien tai toimenpidepakkausten valmistajat) ja kliinisten tutkimusten ja suorituskykyä koskevien tutkimusten toimeksiantajilla olisi oltava oikeus ja mahdollisuus käyttää Eudamedia mainittujen asetusten mukaisten velvoitteidensa täyttämistä ja tehtäviensä suorittamista varten. Sen vuoksi on tarpeen säätää Eudamedin saavutettavuudesta suojatun verkkosivuston kautta. Lisäksi Eudamedin olisi tarjottava yleisölle asianmukaiset tiedot markkinoille saatetuista laitteista, niitä koskevista ilmoitettujen laitosten antamista todistuksista, asianomaisista talouden toimijoista ja kliinisistä tutkimuksista. Sen vuoksi on myös tarpeen asettaa Eudamed saataville julkisen verkkosivuston kautta. Eudamedin ja kansallisten tietokantojen välisen tietojenvaihdon mahdollistamiseksi on lisäksi tarpeen asettaa Eudamed saataville laitteiden väliseen tiedonvaihtoon tarkoitettujen palvelujen kautta. |
|
(4) |
Niiden luonnollisten henkilöiden ja oikeushenkilöiden osalta, joiden on voitava käyttää Eudamedia suojatun verkkosivuston kautta, on tarpeen täsmentää edellytykset ja menettely tällaisen käyttöoikeuden myöntämiseksi. |
|
(5) |
Komissio on perustanut eurooppalaisen lääkinnällisten laitteiden nimikkeistön (EMDN), josta säädetään asetuksissa (EU) 2017/745 ja (EU) 2017/746. Näin ollen EMDN olisi asetettava saataville Eudamedissa maksutta ja sitä olisi käytettävä lääkinnällisiä laitteita koskevien tietojen antamiseen Eudamedissa. |
|
(6) |
Sen varmistamiseksi, että Eudamedin käyttäjät saavat tarvittavaa tukea tietokannan käyttöä varten, komission olisi tarjottava heille Eudamedia koskevaa oikea-aikaista teknistä ja hallinnollista apua. |
|
(7) |
Jos Eudamed ei ole teknisistä syistä käytettävissä tai siinä on toimintahäiriö, valtuutetuilla käyttäjillä olisi silti oltava mahdollisuus täyttää velvoitteensa. Sen vuoksi on tarpeen määritellä vaihtoehtoisia menetelmiä, joita käytetään tiedonvaihtoon tällaisissa tilanteissa, ja vahvistaa tällaisia menetelmiä koskevat varautumissäännöt. |
|
(8) |
Eudamediin sovelletaan komission päätöksessä (EU, Euratom) 2017/46 (3) vahvistettuja tietotekniikan turvallisuutta koskevia sääntöjä. Jotta Eudamedin toiminta olisi turvallista ja suojassa sen toimintojen ja tietojen saatavuuteen, eheyteen ja luottamuksellisuuteen kohdistuvilta uhkilta, olisi säädettävä turvallisuutta koskevista lisäsäännöistä. |
|
(9) |
Riskien vähentämiseksi ja Eudamedin mahdollisen vilpillisen käytön torjumiseksi olisi vahvistettava erityissäännöksiä, jotka koskevat käyttäjien vilpillistä toimintaa Eudamedissa. |
|
(10) |
Euroopan tietosuojavaltuutettua on kuultu Euroopan parlamentin ja neuvoston asetuksen (EU) 2018/1725 (4) 42 artiklan 1 kohdan mukaisesti, ja hän on antanut lausunnon 9 päivänä heinäkuuta 2021. |
|
(11) |
Tässä asetuksessa säädetyt toimenpiteet ovat lääkinnällisiä laitteita käsittelevän komitean lausunnon mukaiset, |
ON HYVÄKSYNYT TÄMÄN ASETUKSEN:
1 artikla
Määritelmät
Tässä asetuksessa tarkoitetaan:
|
1) |
’toimijalla’ komissiota, toimivaltaista viranomaista, ilmoitetuista laitoksista vastaavaa viranomaista, ilmoitettua laitosta, valmistajaa, valtuutettua edustajaa, maahantuojaa, järjestelmän tai toimenpidepakkauksen tuottajaa tai toimeksiantajaa, joka on rekisteröity Eudamediin tämän asetuksen 3 artiklan mukaisesti asetuksissa (EU) 2017/745 ja (EU) 2017/746 säädettyjen velvoitteiden täyttämistä varten; |
|
2) |
’valtuutetulla käyttäjällä’ luonnollista henkilöä, jolle on myönnetty pääsy Eudamediin suojatun verkkosivuston kautta toimijan puolesta suoritettavaa toimintaa varten; |
|
3) |
’toimijan pääkäyttäjällä’ valtuutettua käyttäjää, jolla on oikeus hallinnoida tiettyjä toimijaa koskevia yksityiskohtaisia tietoja ja myöntää muille luonnollisille henkilöille pääsy Eudamediin suojatun verkkosivuston kautta kyseisen toimijan puolesta suoritettavaa toimintaa varten; |
|
4) |
’toimijan käyttöoikeusvastaavalla’ valtuutettua käyttäjää, jolla on oikeus myöntää muille luonnollisille henkilöille pääsy Eudamediin suojatun verkkosivuston kautta toimijan puolesta suoritettavaa toimintaa varten; |
|
5) |
’toimintahäiriöllä’ Eudamedin toiminnan merkittävää häiriötä, mukaan lukien ennalta arvaamattomista olosuhteista tai ylivoimaisesta esteestä johtuvat häiriöt, joka voisi vaikuttaa haitallisesti tietotekniikan turvallisuuteen tai estää asetuksen (EU) 2017/745 33 artiklan 2 kohdassa tarkoitettujen Eudamedin sähköisten järjestelmien jonkin toiminnon saatavuuden. |
2 artikla
Pääsytavat
1. Eudamedin on oltava valtuutettujen käyttäjien saatavilla suojatun verkkosivuston, jäljempänä ’suojattu verkkosivusto’, kautta ja tunnistautumattomien käyttäjien saatavilla julkisen verkkosivuston, jäljempänä ’julkinen verkkosivusto’, kautta.
2. Eudamedin on oltava asetuksen (EU) 2017/745 101 artiklassa ja asetuksen (EU) 2017/746 96 artiklassa tarkoitettujen toimivaltaisten viranomaisten, jäljempänä ’toimivaltaiset viranomaiset’, ja Eudamediin tämän asetuksen 3 artiklan mukaisesti rekisteröityjen ilmoitettujen laitosten saatavilla laitteiden väliseen tiedonvaihtoon tarkoitettujen palvelujen kautta. Komissio tarjoaa kullekin jäsenvaltiolle ja ilmoitetulle laitokselle tiedonvaihtoliittymät, joiden kautta ne voivat pyynnöstä käyttää tällaisia tiedonvaihtopalveluja.
Eudamedin on oltava muiden toimijoiden kuin toimivaltaisten viranomaisten ja ilmoitettujen laitosten saatavilla laitteiden väliseen tiedonvaihtoon tarkoitettujen palvelujen kautta edellyttäen, että asianomaisen toimijan pääkäyttäjä esittää käyttöoikeutta koskevan pyynnön 3 artiklan 8 kohdan ensimmäisessä alakohdassa tarkoitetulla tavalla. Komissio hyväksyy tällaisen pyynnön, jos 3 artiklan 8 kohdan toisessa alakohdassa säädetty edellytys täyttyy.
3 artikla
Rekisteröityminen Eudamediin ja pääsy Eudamediin suojatun verkkosivuston kautta
1. Jotta luonnolliselle henkilölle voidaan myöntää pääsy Eudamediin suojatun verkkosivuston kautta, hänen on luotava tili komission todentamispalvelun verkkosivustolla.
2. Komissio rekisteröi toimivaltaiset viranomaiset ja ilmoitetuista laitoksista vastaavat viranomaiset ja myöntää suojatulle verkkosivustolle pääsyn ensimmäiselle niiden puolesta toimivalle luonnolliselle henkilölle. Tätä varten jäsenvaltioiden on toimitettava komissiolle tiedot toimivaltaisista viranomaisistaan ja ilmoitetuista laitoksista vastaavista viranomaisistaan sekä luonnollisista henkilöistä, joista tulee kyseisten viranomaisten ensimmäisiä valtuutettuja käyttäjiä.
3. Komissio rekisteröi ilmoitetut laitokset Eudamediin komission kehittämässä ja hallinnoimassa ilmoitettujen laitosten tietokannassa (NANDO) olevien tietojen perusteella.
Jotta pääsy Eudamediin suojatun verkkosivuston kautta voidaan myöntää, ensimmäisen luonnollisen henkilön, joka toimii sellaisen toimijan puolesta, joka on ilmoitettu laitos, on esitettävä käyttöoikeuspyyntö suojatun verkkosivuston kautta. Ilmoitetusta laitoksesta vastaavan viranomaisen on hyväksyttävä pyyntö.
4. Jotta muut kuin 2 ja 3 kohdassa mainitut yhteisöt voidaan rekisteröidä Eudamediin, kyseisen tulevan toimijan puolesta toimivan luonnollisen henkilön on toimitettava toimijan rekisteröintipyyntö suojatun verkkosivuston kautta. Toimijan rekisteröintipyynnössä on oltava 10 artiklan 1 kohdassa tarkoitettu allekirjoitettu vakuutus tietoturvavelvoitteista. Kansallisen toimivaltaisen viranomaisen on hyväksyttävä toimijan rekisteröintipyyntö, paitsi jos pyyntö koskee kliinisen tutkimuksen tai suorituskykyä koskevan tutkimuksen toimeksiantajaa.
Toimijan rekisteröintipyynnön hyväksymisen jälkeen tai, jos kyseessä on toimeksiantaja, kun toimijan rekisteröintipyyntö on toimitettu, ensimmäisessä alakohdassa tarkoitetun pyynnön esittäneelle luonnolliselle henkilölle myönnetään automaattisesti pääsy suojatulle verkkosivustolle ja hänestä tulee ensimmäinen valtuutettu käyttäjä edellyttäen, että 6 kohdassa säädetyt edellytykset täyttyvät.
Tätä kohtaa sovellettaessa kansallisella toimivaltaisella viranomaisella tarkoitetaan tulevan toimijan sijoittautumispaikan viranomaista. Unionin ulkopuolelle sijoittautuneiden valmistajien osalta kansallinen toimivaltainen viranomainen on viranomainen, joka vastaa toimijan rekisteröintipyynnössä mainitusta valtuutetusta edustajasta. Kun on kyse unionin ulkopuolelle sijoittautuneista järjestelmien tai toimenpidepakkausten valmistajista, kansallinen toimivaltainen viranomainen on sen jäsenvaltion viranomainen, jossa kyseisen valmistajan ensimmäinen järjestelmä tai toimenpidepakkaus on määrä saattaa markkinoille.
5. Jotta luonnolliselle henkilölle voidaan myöntää pääsy suojatulle verkkosivustolle toimijan puolesta suoritettavaa toimintaa varten, hänen on esitettävä käyttöoikeuspyyntö suojatun verkkosivuston kautta. Kyseisen toimijan pääkäyttäjän tai toimijan käyttöoikeusvastaavan on hyväksyttävä käyttöoikeuspyyntö.
6. Tullakseen valtuutetuiksi käyttäjiksi luonnollisten henkilöiden on hyväksyttävä 10 artiklan 1 kohdan a alakohdassa tarkoitetussa asiakirjassa esitetyt käyttäjien oikeudet ja velvollisuudet ja tutustuttava kyseisen artiklan c alakohdassa tarkoitettuun tietosuojaselosteeseen.
7. Toimijan ensimmäinen valtuutettu käyttäjä on automaattisesti kyseisen toimijan ensimmäinen pääkäyttäjä.
8. Toimivaltainen viranomainen voi suojatun verkkosivuston kautta pyytää komissiolta laitteiden välistä yhteyttä tietojen vaihtamiseksi toimijan tietokannan ja Eudamedin välillä.
Komissio voi hyväksyä ensimmäisessä alakohdassa tarkoitetun pyynnön edellyttäen, että toimijan pääkäyttäjä on vahvistanut, että toimija täyttää 10 artiklan 1 kohdassa tarkoitetut tiedonvaihtoa koskevat tietoturvavaatimukset.
4 artikla
Nimikkeistö
Valtuutettujen käyttäjien on käytettävä eurooppalaisen lääkinnällisten laitteiden nimikkeistön (EMDN) avoimesti saatavilla olevia koodeja antaessaan tietoa lääkinnällisistä laitteista Eudamedissa.
Komissio asettaa EMDN:n saataville Eudamedissa maksutta.
5 artikla
Tekninen ja hallinnollinen tuki
1. Komissio perustaa Eudamedin käyttäjille oikea-aikaista apua antavan sovellustukiryhmän, johon saa yhteyden tarkoitukseen varatun sähköpostiosoitteen kautta.
2. Komissio asettaa Eudamedin käyttäjien saataville Eudamedia koskevat tekniset asiakirjat, usein kysytyt kysymykset ja laitteiden väliseen tiedonvaihtoon tarkoitettuihin palveluihin liittyvät asiakirjat.
6 artikla
Henkilötietojen omistus ja käsittely
1. Komissio on Eudamedin omistaja, ja sillä on täydet hallinnointioikeudet.
2. Henkilötietoja on käsiteltävä Eudamedissa asetuksissa (EU) 2017/745 ja (EU) 2017/746 säädettyjen velvoitteiden noudattamiseksi.
3. Seuraavia henkilötietojen luokkia on käsiteltävä:
|
a) |
toimijoiden ja valtuutettujen käyttäjien nimet; |
|
b) |
toimijoiden ja valtuutettujen käyttäjien yhteystiedot; |
|
c) |
muiden luonnollisten henkilöiden tai oikeushenkilöiden tunnistus- ja yhteystiedot ja ammattipätevyyttä koskevat tiedot, jotka on ilmoitettava Eudamedissa asetuksissa (EU) 2017/745 ja (EU) 2017/746 vahvistettujen velvoitteiden täyttämiseksi. |
7 artikla
Toimintasäännöt
1. Tietojen toimittaminen Eudamediin katsotaan suoritetuksi sinä päivänä ja sinä kellonaikana, jolloin tiedot rekisteröityvät Eudamediin. Toimittamispäivä ja -aika määritetään tapauksen mukaan Keski-Euroopan ajan (CET) tai Keski-Euroopan kesäajan (CEST) perusteella.
2. Eudamedin on oltava käytettävissä jatkuvasti, lukuun ottamatta huoltotoimista, mukaan lukien uudet järjestelmäversiot, johtuvia välttämättömiä ja ennalta ilmoitettuja käyttökatkoja. Komissio esittää etukäteen asiaa koskevan ilmoituksen tapauksen mukaan joko suojatulla verkkosivustolla tai julkisella verkkosivustolla.
8 artikla
Toimintahäiriö
1. Komissio toteuttaa kaikki tarvittavat toimenpiteet toimintahäiriöiden ehkäisemiseksi ja niiden tunnistamiseksi ilman aiheetonta viivytystä, jos niitä esiintyy.
2. Jos toimija tai valtuutettu käyttäjä epäilee toimintahäiriötä, sen on välittömästi ilmoitettava siitä komissiolle.
3. Jos komissio havaitsee toimintahäiriön, se toteuttaa seuraavat toimenpiteet:
|
a) |
se esittää asiaa koskevan ilmoituksen, jäljempänä ’häiriöilmoitus’, tapauksen mukaan joko suojatulla verkkosivustolla tai julkisella verkkosivustolla, paitsi jos toimintahäiriön luonne estää komissiota tekemästä niin, jolloin se mahdollisuuksien mukaan esittää ilmoituksen lääkinnällisiä laitteita koskevalla komission verkkosivustolla; |
|
b) |
se keskeyttää asetuksissa (EU) 2017/745 ja (EU) 2017/746 vahvistetut tietojen toimittamista Eudamediin koskevat määräajat, jos toimintahäiriö estää asiaankuuluvien tietojen tallentamisen. |
Jos komissio keskeyttää tietojen toimittamista Eudamediin koskevat määräajat, kuten ensimmäisen kohdan b alakohdassa säädetään, häiriöilmoituksessa täsmennetään kyseisen ilmoituksen esittämisajankohta ja keskeytyksen todennäköinen kesto.
4. Jos toimintahäiriö estää asetuksen (EU) 2017/745 80 artiklassa, 87 artiklan 1 kohdassa, 89 artiklan 5, 7, 8 ja 9 kohdassa, 95 artiklan 2, 4 ja 6 kohdassa tai 98 artiklan 2 kohdassa taikka asetuksen (EU) 2017/746 76 artiklassa, 82 artiklan 1 kohdassa, 84 artiklan 5, 7, 8 ja 9 kohdassa, 90 artiklan 2, 4 ja 6 kohdassa tai 93 artiklan 2 kohdassa tarkoitettujen velvoitteiden täyttämisen, sovelletaan tämän artiklan 3 kohdan ensimmäisen alakohdan b alakohdassa tarkoitetun määräaikojen keskeyttämisen lisäksi jompaa kumpaa seuraavista menettelyistä:
|
a) |
jos toimintahäiriö kestää yli 12 tuntia häiriöilmoituksen esittämisen jälkeen, toimijan on viipymättä annettava komissiolle, asianomaisille kansallisille toimivaltaisille viranomaisille ja tapauksen mukaan asetuksen (EU) 2017/745 56 artiklassa tai asetuksen (EU) 2017/746 51 artiklassa tarkoitetun vaatimustenmukaisuustodistuksen antaneelle ilmoitetulle laitokselle yleisiä tietoja asiaankuuluvasta tietokokonaisuudesta ja ilmoituksen siitä, että tietojen toimittaminen on kesken toimintahäiriön vuoksi; |
|
b) |
jos toimintahäiriö kestää yli 24 tuntia häiriöilmoituksen esittämisen jälkeen tai jos toimintahäiriö kestää alle 24 tuntia ja asianomaiset kansalliset toimivaltaiset viranomaiset sitä pyytävät saatuaan tämän kohdan a alakohdassa tarkoitetut tiedot, toimijan on viipymättä toimitettava asiaankuuluvat tiedot kyseisille viranomaisille niiden määräämällä tavalla. |
5. Jos toimintahäiriö estää jonkin asetuksessa (EU) 2017/745 tai asetuksessa (EU) 2017/746 säädetyn muun kuin tämän artiklan 4 kohdassa tarkoitetun velvoitteen noudattamisen, sovelletaan tämän artiklan 3 kohdan ensimmäisen alakohdan b alakohdassa tarkoitetun määräaikojen keskeyttämisen lisäksi seuraavaa menettelyä:
|
a) |
jos toimintahäiriö kestää yli 36 tuntia häiriöilmoituksen esittämisen jälkeen, toimijan on viipymättä annettava komissiolle, asianomaisille kansallisille toimivaltaisille viranomaisille ja tapauksen mukaan asetuksen (EU) 2017/745 56 artiklassa tai asetuksen (EU) 2017/746 51 artiklassa tarkoitetun vaatimustenmukaisuustodistuksen antaneelle ilmoitetulle laitokselle yleiset tiedot kyseisistä tiedoista ja ilmoituksen siitä, että tietojen toimittaminen on kesken toimintahäiriön vuoksi; |
|
b) |
jos toimintahäiriö kestää yli viisi päivää häiriöilmoituksen esittämisen jälkeen, toimijan on ilmoitettava siitä asianomaisille kansallisille toimivaltaisille viranomaisille ja niiden pyynnöstä toimitettava niille asiaankuuluvat tiedot niiden määräämällä tavalla. |
6. Kun komissio on todennut toimintahäiriön päättyneen, se tiedottaa asiasta toimivaltaisille viranomaisille. Lisäksi komissio esittää asiaa koskevan ilmoituksen suojatulla verkkosivustolla ja/tai julkisella verkkosivustolla, tapauksen mukaan. Sekä tiedotuksessa että ilmoituksessa ilmaistaan toimintahäiriön kesto ja 3 kohdan b alakohdassa tarkoitettu määräaikojen keskeytys.
7. Kun komissio on esittänyt 6 kohdassa tarkoitetun ilmoituksen, toimijoiden on viipymättä tallennettava tiedot, joita niiden ei ollut mahdollista toimittaa Eudamedin toimintahäiriön aikana.
9 artikla
Verkkosivustot testausta ja koulutusta varten
1. Komissio asettaa toimijoiden saataville verkkosivustoja Eudamedin käyttöä koskevaa testausta ja koulutusta varten, jäljempänä ’testaus- ja koulutussivustot’.
Testaus- ja koulutussivustoille tallennettuja tietoja on pidettävä kuvitteellisina eikä niitä saa asettaa yleisön saataville.
2. Ennen kuin toimija käyttää ensimmäistä kertaa laitteiden väliseen tiedonvaihtoon tarkoitettuja palveluja, sen on tehtävä ainakin yksi onnistunut tietojentoimitus laitteiden välillä käyttäen testaus- ja koulutussivustoja.
3. Muutokset, joita komissio aikoo tehdä Eudamedin laitteiden väliseen tiedonvaihtoon tarkoitettuihin palveluihin, tehdään ensin testaus- ja koulutussivustoilla, ja ne ovat saatavilla kyseisillä verkkosivustoilla ajanjakson, jonka komissio määrittää etukäteen yhteistyössä asetuksen (EU) 2017/745 103 artiklalla perustetun lääkinnällisten laitteiden koordinointiryhmän kanssa.
Komissio ilmoittaa etukäteen Eudamedin välityksellä asiaankuuluville toimijoille suunnitelluista muutoksista ja siitä, kuinka kauan ne ovat saatavilla testaus- ja koulutussivustoilla.
10 artikla
Tietotekniikan turvallisuus
1. Komissio asettaa seuraavat asiakirjat saataville suojatulla verkkosivustolla:
|
a) |
asiakirja käyttäjien oikeuksista ja velvoitteista; |
|
b) |
vakuutus tietoturvavelvoitteista; |
|
c) |
tietosuojaseloste; |
|
d) |
tiedonvaihtoon liittyvät tietoturvavaatimukset. |
2. Toimijoiden on noudatettava 1 kohdan b alakohdassa ja tapauksen mukaan d alakohdassa tarkoitetuissa asiakirjoissa vahvistettuja ehtoja ja edellytyksiä.
3. Jos komissio epäilee, että on tapahtunut tai esiintyy päätöksen (EU, Euratom) 2017/46 2 artiklan 15, 22 ja 25 alakohdassa määritelty tietotekniikan turvallisuushäiriö, tietotekniikan turvallisuutta koskeva riski tai tietotekniikan turvallisuutta koskeva uhka, jota se pitää mahdollisesti haitallisena Eudamedille, sen tiedoille tai niiden luottamuksellisuudelle, jäljempänä ’tietoturvahäiriö, tietoturvauhka tai tietoturvariski’, komissio voi keskeyttää kaiken pääsyn Eudamediin.
4. Komissio voi keskeyttää kokonaan tai osittain Eudamedin sähköisten järjestelmien toiminnot, jos se havaitsee tietoturvahäiriön, tietoturvauhkan tai tietoturvariskin.
Jos ensimmäisessä alakohdassa tarkoitettu keskeyttäminen estää tietojen tallentamisen Eudamediin, sovelletaan 8 artiklan 3, 4 ja 5 kohtaa soveltuvin osin.
5. Jos toimija tai valtuutettu käyttäjä saa tiedon tietoturvahäiriöstä, tietoturvauhkasta tai tietoturvariskistä tai epäilee sellaista, sen on välittömästi ilmoitettava siitä komissiolle ja asianomaisille jäsenvaltioille.
11 artikla
Käyttäjien vilpillinen toiminta Eudamedissa
1. Jos toimivaltainen viranomainen, toimijan pääkäyttäjä tai toimijan käyttöoikeusvastaava epäilee Eudamedin käyttöoikeuspyyntöä vilpilliseksi, niiden on hylättävä pyyntö ja ilmoitettava hylkäämisestä välittömästi komissiolle 5 artiklan 1 kohdassa tarkoitetun sovellustukiryhmän välityksellä ja täsmennettävä, että kyseessä on epäilty vilpillinen käyttöoikeuspyyntö.
2. Jos komissiolla on perusteltu syy epäillä valtuutetun käyttäjän syyllistyneen vilpilliseen toimintaan, joka vaikuttaa Eudamedin tietotekniikan turvallisuuteen, se keskeyttää tilapäisesti kyseisen valtuutetun käyttäjän pääsyn Eudamediin. Tällaisessa tapauksessa komissio ilmoittaa keskeytyksestä ja sen perusteluista viipymättä kaikille jäsenvaltioille ja asianomaisille toimijoille.
3. Jos toimija tai valtuutettu käyttäjä epäilee valtuutetun käyttäjän toimintaa vilpilliseksi, sen on viipymättä ilmoitettava epäillystä vilpillisestä toiminnasta komissiolle ja jäsenvaltioille 5 artiklan 1 kohdassa tarkoitetun sovellustukiryhmän välityksellä.
4. Jos komissio toteaa toiminnan Eudamedissa vilpilliseksi, se lopettaa välittömästi asianomaisten valtuutettujen käyttäjien pääsyn Eudamediin ja toteuttaa tarvittavat toimenpiteet, joihin kuuluu tarvittaessa pääsyn estäminen Eudamediin tulevaisuudessa myös kyseiseen tiliin liittyviltä komission todentamispalvelun verkkosivustolla luoduilta tileiltä. Komissio ilmoittaa viipymättä asianomaisille kansallisille toimivaltaisille viranomaisille ja asianomaisille toimijoille kaikista tämän kohdan nojalla toteutetuista toimenpiteistä.
12 artikla
Voimaantulo
Tämä asetus tulee voimaan kahdentenakymmenentenä päivänä sen jälkeen, kun se on julkaistu Euroopan unionin virallisessa lehdessä.
Tämä asetus on kaikilta osiltaan velvoittava, ja sitä sovelletaan sellaisenaan kaikissa jäsenvaltioissa.
Tehty Brysselissä 26 päivänä marraskuuta 2021.
Komission puolesta
Puheenjohtaja
Ursula VON DER LEYEN
(1) EUVL L 117, 5.5.2017, s. 1.
(2) Euroopan parlamentin ja neuvoston asetus (EU) 2017/746, annettu 5 päivänä huhtikuuta 2017, in vitro -diagnostiikkaan tarkoitetuista lääkinnällisistä laitteista sekä direktiivin 98/79/EY ja komission päätöksen 2010/227/EU kumoamisesta (EUVL L 117, 5.5.2017, s. 176).
(3) Komission päätös (EU, Euratom) 2017/46, annettu 10 päivänä tammikuuta 2017, viestintä- ja tietojärjestelmien turvallisuudesta Euroopan komissiossa (EUVL L 6, 11.1.2017, s. 40).
(4) Euroopan parlamentin ja neuvoston asetus (EU) 2018/1725, annettu 23 päivänä lokakuuta 2018, luonnollisten henkilöiden suojelusta unionin toimielinten, elinten ja laitosten suorittamassa henkilötietojen käsittelyssä ja näiden tietojen vapaasta liikkuvuudesta sekä asetuksen (EY) N:o 45/2001 ja päätöksen N:o 1247/2002/EY kumoamisesta (EUVL L 295, 21.11.2018, s. 39).
|
29.11.2021 |
FI |
Euroopan unionin virallinen lehti |
L 426/16 |
KOMISSION TÄYTÄNTÖÖNPANOASETUS (EU) 2021/2079,
annettu 26 päivänä marraskuuta 2021,
luvan antamisesta sienistä valmistetun D2-vitamiinijauheen saattamiseksi markkinoille uuselintarvikkeena Euroopan parlamentin ja neuvoston asetuksen (EU) 2015/2283 mukaisesti ja komission täytäntöönpanoasetuksen (EU) 2017/2470 muuttamisesta
(ETA:n kannalta merkityksellinen teksti)
EUROOPAN KOMISSIO, joka
ottaa huomioon Euroopan unionin toiminnasta tehdyn sopimuksen,
ottaa huomioon uuselintarvikkeista, Euroopan parlamentin ja neuvoston asetuksen (EU) N:o 1169/2011 muuttamisesta sekä Euroopan parlamentin ja neuvoston asetuksen (EY) N:o 258/97 ja komission asetuksen (EY) N:o 1852/2001 kumoamisesta 25 päivänä marraskuuta 2015 annetun Euroopan parlamentin ja neuvoston asetuksen (EU) 2015/2283 (1) ja erityisesti sen 12 artiklan,
sekä katsoo seuraavaa:
|
(1) |
Asetuksessa (EU) 2015/2283 säädetään, että unionin markkinoille voidaan saattaa vain sellaisia uuselintarvikkeita, jotka on hyväksytty ja jotka mainitaan unionin luettelossa. |
|
(2) |
Asetuksen (EU) 2015/2283 8 artiklan nojalla annettiin komission täytäntöönpanoasetus (EU) 2017/2470 (2), jossa vahvistetaan unionin luettelo hyväksytyistä uuselintarvikkeista. |
|
(3) |
Yritys MBio, Monaghan Mushrooms, jäljempänä ’hakija’, toimitti 29 päivänä heinäkuuta 2019 komissiolle asetuksen (EU) 2015/2283 10 artiklan 1 kohdan mukaisesti hakemuksen sienistä valmistetun D2-vitamiinijauheen saattamisesta unionin markkinoille uuselintarvikkeena. Hakija pyysi lupaa sienistä valmistetun D2-vitamiinijauheen käytölle useissa koko väestölle tarkoitetuissa elintarvikkeissa. Hakija pyysi lupaa myös uuselintarvikkeen käytölle Euroopan parlamentin ja neuvoston direktiivissä 2002/46/EY (3) määritellyissä ravintolisissä, lukuun ottamatta imeväisille tarkoitettuja ravintolisiä, sekä asetuksessa (EU) N:o 609/2013 (4) määritellyissä erityisiin lääkinnällisiin tarkoituksiin tarkoitetuissa elintarvikkeissa, lukuun ottamatta erityisiin lääkinnällisiin tarkoituksiin imeväisille tarkoitettuja elintarvikkeita. Hakumenettelyn aikana hakija suostui jättämään uuselintarvikkeen käytön hyväksymistä ravintolisissä koskevasta hakemuksesta pois maininnan alle kolmivuotiaista lapsista. |
|
(4) |
Hakija esitti komissiolle myös pyynnön, joka koski omistusoikeuden alaisten tietojen suojaamista useiden hakemuksen tueksi esitettyjen alkuperäisten tietojen osalta; näitä tietoja ovat tuotantomenetelmää koskevat tiedot (5), tiedot koostumuksesta eli raekoko (6), fysikaalis-kemialliset ominaisuudet (7), D-vitamiinianalyysi (8), ravitsemusanalyysi (9), D2-vitamiinianalyysi (10), D-vitamiinianalyysin todennus (11), stabiilisuustutkimukset (12), toksikologinen analyysi (13), takysterolia ja lumisterolia koskevat tiedot (14), ergosterolin suhteen määritys (15), D-vitamiinin suhteen määritys (16) ja ergosterolia koskevat tiedot (17), tuoreiden sienien eritelmät (18); allergeenisuutta koskevat tiedot (19). |
|
(5) |
Komissio kuuli Euroopan elintarviketurvallisuusviranomaista, jäljempänä ’elintarviketurvallisuusviranomainen’, 24 päivänä tammikuuta 2020 asetuksen (EU) 2015/2283 10 artiklan 3 kohdan mukaisesti ja pyysi sitä tekemään turvallisuusarvioinnin sienistä valmistetun D2-vitamiinijauheen käytöstä uuselintarvikkeena ja antamaan asiasta tieteellisen lausunnon. |
|
(6) |
Elintarviketurvallisuusviranomainen antoi 24 päivänä helmikuuta 2021 tieteellisen lausunnon ”Safety of Vitamin D2 mushroom powder (Agaricus bisporus) as a novel food pursuant to Regulation (EU) 2015/2283” (20). Lausunto on asetuksen (EU) 2015/2283 11 artiklan vaatimusten mukainen. |
|
(7) |
Elintarviketurvallisuusviranomainen totesi lausunnossaan, että sienistä valmistetun D2-vitamiinijauheen käyttö on ehdotetuissa käyttötarkoituksissa ja ehdotettuina käyttömäärinä turvallista. Elintarviketurvallisuusviranomaisen lausunto antaa riittävät perusteet sen vahvistamiselle, että sienistä valmistetun D2-vitamiinijauheen on erityisissä käyttöolosuhteissa asetuksen (EU) 2015/2283 12 artiklan 1 kohdan mukainen. |
|
(8) |
Olisi säädettävä merkintävaatimuksesta, jotta kuluttajille voidaan tiedottaa asianmukaisesti, että imeväisten ja alle 3-vuotiaiden lasten ei pitäisi käyttää sienistä valmistettua D2-vitamiinijauhetta sisältäviä ravintolisiä. |
|
(9) |
Elintarviketurvallisuusviranomainen totesi lausunnossaan, että uuselintarvikkeen turvallisuuden määrittämisen perusteena toimivat tuotantomenetelmää koskevat tiedot ja tiedot koostumuksesta. Tällä perusteella komissio katsoo, että sienistä valmistetun D2-vitamiinijauheen turvallisuutta koskevia päätelmiä ei olisi voitu tehdä ilman näitä tietoja. |
|
(10) |
Komissio pyysi hakijaa tarkentamaan antamiaan perusteluja, jotka koskivat omistusoikeutta näihin tietoihin, ja selventämään pyyntöään, joka koski asetuksen (EU) 2015/2283 26 artiklan 2 kohdan b alakohdassa tarkoitettua yksinomaista oikeutta käyttää viittauksia kyseisiin tietoihin. |
|
(11) |
Hakija ilmoitti, että sillä oli hakemuksen jättämishetkellä kansallisen lainsäädännön nojalla omistusoikeus ja yksinomainen oikeus käyttää viittauksia näihin tietoihin, eivätkä kolmannet osapuolet sen vuoksi voi laillisesti saada tai käyttää näitä tietoja eivätkä viitata niihin. |
|
(12) |
Komissio arvioi kaikki hakijan toimittamat tiedot ja katsoi, että hakija on riittävästi perustellut asetuksen (EU) 2015/2283 26 artiklan 2 kohdassa säädettyjen vaatimusten täyttymisen. Näin ollen elintarviketurvallisuusviranomaisen ei pitäisi käyttää minkään myöhemmän hakijan hyväksi viiden vuoden aikana tämän asetuksen voimaantulosta tietoja, joiden perusteella elintarviketurvallisuusviranomainen määritteli uuselintarvikkeen turvallisuuden ja joita ilman se ei olisi voinut arvioida uuselintarviketta, eli hakijan asiakirja-aineistoon sisältyviä tuotantomenetelmää koskevia tietoja sekä koostumustietoja eli raekokoa, fysikaalis-kemiallisia ominaisuuksia, D-vitamiinianalyysiä, ravitsemusanalyysiä, D2-vitamiinianalyysiä, D-vitamiinianalyysin todennusta, stabiilisuustutkimuksia, toksikologista analyysiä, takysterolia ja lumisterolia koskevia tietoja, ergosterolin suhteen määritystä, D-vitamiinin suhteen määritystä ja ergosterolia koskevia tietoja. Näin ollen ainoastaan hakijalla olisi oltava lupa saattaa sienistä valmistettua D2-vitamiinijauhetta unionin markkinoille kyseisenä ajanjaksona. |
|
(13) |
Se, että sienistä valmistetun D2-vitamiinijauheen hyväksyntä ja hakijan asiakirja-aineistossa oleviin tietoihin viittaaminen rajataan hakijan yksinomaiseen käyttöön, ei kuitenkaan estä muita hakijoita hakemasta lupaa saman uuselintarvikkeen markkinoille saattamiseksi edellyttäen, että hakemus perustuu laillisesti hankittuihin tietoihin, jotka tukevat asetuksen (EU) 2015/2283 mukaista lupaa. |
|
(14) |
Sen vuoksi täytäntöönpanoasetusta (EU) 2017/2470 olisi muutettava. |
|
(15) |
Tässä asetuksessa säädetyt toimenpiteet ovat pysyvän kasvi-, eläin-, elintarvike- ja rehukomitean lausunnon mukaiset, |
ON HYVÄKSYNYT TÄMÄN ASETUKSEN:
1 artikla
1. Sisällytetään liitteessä määritelty sienistä valmistettu D2-vitamiinijauhe täytäntöönpanoasetuksella (EU) 2017/2470 perustettuun unionin hyväksyttyjen uuselintarvikkeiden luetteloon.
2. Viiden vuoden ajan 19 päivästä joulukuuta 2021 lähtien ainoastaan seuraava alkuperäinen hakija:
|
|
Yritys: MBio, Monaghan Mushrooms, |
|
|
Osoite: Tullygony, Tyholland, Co. Monaghan, Irlanti, |
|
|
saa saattaa unionin markkinoille 1 kohdassa tarkoitettua uuselintarviketta, paitsi jos myöhempi hakija saa hyväksynnän uuselintarvikkeelle ilman viittausta 2 artiklan nojalla suojattuihin tietoihin tai yrityksen MBio, Monaghan Mushrooms suostumuksella. |
3. Edellä 1 kohdassa tarkoitettuun kohtaan unionin luettelossa lisätään liitteessä vahvistetut käyttöedellytykset ja merkintävaatimukset.
2 artikla
Tietoja, jotka sisältyvät hakemusasiakirja-aineistoon, jonka perusteella elintarviketurvallisuusviranomainen on arvioinut 1 artiklassa tarkoitetun uuselintarvikkeen, ja joihin nähden hakija on ilmoittanut sillä olevan omistusoikeus ja joiden puuttuessa uuselintarviketta ei olisi voitu hyväksyä, ei saa käyttää myöhemmän hakijan hyväksi viiden vuoden aikana 19 päivästä joulukuuta 2021 lähtien ilman yrityksen MBio, Monaghan Mushrooms suostumusta.
3 artikla
Muutetaan täytäntöönpanoasetuksen (EU) 2017/2470 liite tämän asetuksen liitteen mukaisesti.
4 artikla
Tämä asetus tulee voimaan kahdentenakymmenentenä päivänä sen jälkeen, kun se on julkaistu Euroopan unionin virallisessa lehdessä.
Tämä asetus on kaikilta osiltaan velvoittava, ja sitä sovelletaan sellaisenaan kaikissa jäsenvaltioissa.
Tehty Brysselissä 26 päivänä marraskuuta 2021.
Komission puolesta
Puheenjohtaja
Ursula VON DER LEYEN
(1) EUVL L 327, 11.12.2015, s. 1.
(2) Komission täytäntöönpanoasetus (EU) 2017/2470, annettu 20 päivänä joulukuuta 2017, unionin uuselintarvikeluettelon laatimisesta uuselintarvikkeista annetun Euroopan parlamentin ja neuvoston asetuksen (EU) 2015/2283 mukaisesti (EUVL L 351, 30.12.2017, s. 72).
(3) Euroopan parlamentin ja neuvoston direktiivi 2002/46/EY, annettu 10 päivänä kesäkuuta 2002, ravintolisiä koskevan jäsenvaltioiden lainsäädännön lähentämisestä (EYVL L 183, 12.7.2002, s. 51).
(4) Euroopan parlamentin ja neuvoston asetus (EU) N:o 609/2013, annettu 12 päivänä kesäkuuta 2013, imeväisille ja pikkulapsille tarkoitetuista ruoista, erityisiin lääkinnällisiin tarkoituksiin tarkoitetuista elintarvikkeista ja painonhallintaan tarkoitetuista ruokavalionkorvikkeista ja neuvoston direktiivin 92/52/ETY, komission direktiivien 96/8/EY, 1999/21/EY, 2006/125/EY ja 2006/141/EY, Euroopan parlamentin ja neuvoston direktiivin 2009/39/EY sekä komission asetusten (EY) N:o 41/2009 ja (EY) N:o 953/2009 kumoamisesta (EUVL L 181, 29.6.2013, s. 35).
(5) 2.3.1 Production Process Confidential_Final.
(6) Annex 1 Particle Size Report.
(7) Annex 3 NIZO Report physico-chemical properties.
(8) Annex 4 COA vitamin D analysis.
(9) Annex 5 COA nutritional analysis.
(10) Annex 7 MBio SOP Vitamin D2 analysis.
(11) Annex 8 MBio Vit D analysis validation report.
(12) Annex 9 Stability Study Report UCC; Annex 14 COA Vit D stability study; Annex 24 Stability study Report CampdenBRI; Annex 25 Stability study report meat free product; Annex 29 COAs Stability Meat free.
(13) Annex 16 COA Toxicological analysis.
(14) Annex 17 Report Tachysterol and lumisterol.
(15) Annex 20 COA Ergosterol ratio analysis.
(16) Annex 21 COA Vitamin D ratio analysis.
(17) Annex 22 MBio Ergosterol.
(18) Annex 13 COA fresh mushrooms analysis.
(19) Annex 12 MBio Allergen Policy.
(20) EFSA Journal 2021;19(4):6516.
LIITE
Muutetaan täytäntöönpanoasetuksen (EU) 2017/2470 liite seuraavasti:
|
1) |
Lisätään taulukkoon 1 (Hyväksytyt uuselintarvikkeet) seuraava kohta:
|
||||||||||||||||||||||||||||||||||||||||||
|
2) |
Lisätään taulukkoon 2 (Eritelmät) seuraava kohta:
|
(1) PMY: pesäkkeitä muodostavat yksiköt.
|
29.11.2021 |
FI |
Euroopan unionin virallinen lehti |
L 426/23 |
KOMISSION TÄYTÄNTÖÖNPANOASETUS (EU) 2021/2080,
annettu 26 päivänä marraskuuta 2021,
Escherichia coli NITE SD 00268 -bakteerista käymisreaktiolla valmistetun L-histidiinimonohydrokloridimonohydraatin hyväksymisestä rehun lisäaineena kaikille eläinlajeille eväkaloja lukuun ottamatta
(ETA:n kannalta merkityksellinen teksti)
EUROOPAN KOMISSIO, joka
ottaa huomioon Euroopan unionin toiminnasta tehdyn sopimuksen,
ottaa huomioon eläinten ruokinnassa käytettävistä lisäaineista 22 päivänä syyskuuta 2003 annetun Euroopan parlamentin ja neuvoston asetuksen (EY) N:o 1831/2003 (1) ja erityisesti sen 9 artiklan 2 kohdan,
sekä katsoo seuraavaa:
|
(1) |
Asetuksessa (EY) N:o 1831/2003 säädetään eläinten ruokinnassa käytettävien lisäaineiden hyväksymisestä ja vahvistetaan perustelut ja menettelyt hyväksynnän myöntämiselle. |
|
(2) |
Asetuksen (EY) N:o 1831/2003 7 artiklan mukaisesti on toimitettu hakemus, joka koskee Escherichia coli NITE SD 00268 -bakteerista käymisreaktiolla valmistetun L-histidiinimonohydrokloridimonohydraatin käytön laajentamisen hyväksymistä rehun lisäaineena eväkaloista kaikkiin eläinlajeihin. Hakemuksen mukana toimitettiin asetuksen (EY) N:o 1831/2003 7 artiklan 3 kohdan mukaisesti vaadittavat tiedot ja asiakirjat. |
|
(3) |
Hakemus koskee Escherichia coli NITE SD 00268 -bakteerista käymisreaktiolla valmistetun L-histidiinimonohydrokloridimonohydraatin käytön laajentamisen hyväksymistä rehun lisäaineena eväkaloista kaikkiin eläinlajeihin niin, että se luokitellaan lisäaineluokkaan ”ravitsemukselliset lisäaineet”, funktionaaliseen ryhmään ”aminohapot, niiden suolat ja analogit” ja lisäaineluokkaan ”sensoriset lisäaineet”, funktionaaliseen ryhmään ”aromiaineet”. |
|
(4) |
Euroopan elintarviketurvallisuusviranomainen, jäljempänä ’elintarviketurvallisuusviranomainen’, totesi 5 päivänä toukokuuta 2021 antamassaan lausunnossa (2), että Escherichia coli NITE SD 00268 -bakteerista käymisreaktiolla valmistetulla L-histidiinimonohydrokloridimonohydraatilla ei ehdotetuissa käyttöolosuhteissa ole haitallisia vaikutuksia eläinten terveyteen, kuluttajien turvallisuuteen eikä ympäristöön. Elintarviketurvallisuusviranomainen totesi kyseisen lisäaineen osalta myös, että ei ollut mahdollista päätellä, voiko lisäaine olla hengitettynä myrkyllinen, silmiä ärsyttävä tai ihoa herkistävä. Sen vuoksi komissio katsoo, että ihmisten terveydelle aiheutuvien haittavaikutusten ehkäisemiseksi olisi toteutettava asianmukaisia suojatoimenpiteitä erityisesti lisäaineen käyttäjien osalta. Elintarviketurvallisuusviranomainen totesi myös, että lisäaine on tehokas välttämättömän aminohapon histidiinin lähde ja tehokas aromiaineena. |
|
(5) |
Elintarviketurvallisuusviranomainen ei katso erityisten markkinoille saattamisen jälkeistä seurantaa koskevien vaatimusten olevan tarpeen. Se myös vahvisti asetuksella (EY) N:o 1831/2003 perustetun vertailulaboratorion toimittamat raportit analyysimenetelmästä, jolla rehun lisäaine määritetään rehusta. |
|
(6) |
Escherichia coli NITE SD 00268:n käymisreaktiolla tuottaman L-histidiinimonohydrokloridimonohydraatin arviointi osoittaa, että asetuksen (EY) N:o 1831/2003 5 artiklassa säädetyt hyväksyntäedellytykset täyttyvät. Kyseisen lisäaineen käyttö tämän asetuksen liitteessä esitetyllä tavalla olisi näin ollen hyväksyttävä. |
|
(7) |
Tässä asetuksessa säädetyt toimenpiteet ovat pysyvän kasvi-, eläin-, elintarvike- ja rehukomitean lausunnon mukaiset, |
ON HYVÄKSYNYT TÄMÄN ASETUKSEN:
1 artikla
1. Hyväksytään liitteessä tarkoitettu Escherichia coli NITE SD 00268 -bakteerista käymisreaktiolla valmistettu L-histidiinimonohydrokloridimonohydraatti, joka kuuluu lisäaineluokkaan ”ravitsemukselliset lisäaineet” ja funktionaaliseen ryhmään ”aminohapot, niiden suolat ja analogit”, eläinten ruokinnassa käytettävänä rehun lisäaineena kyseisessä liitteessä vahvistetuin edellytyksin.
2. Hyväksytään liitteessä tarkoitettu Escherichia coli NITE SD 00268 -bakteerista käymisreaktiolla valmistettu L-histidiinimonohydrokloridimonohydraatti, joka kuuluu lisäaineluokkaan ”sensoriset lisäaineet” ja funktionaaliseen ryhmään ”aromiaineet”, eläinten ruokinnassa käytettävänä rehun lisäaineena kyseisessä liitteessä vahvistetuin edellytyksin.
2 artikla
Tämä asetus tulee voimaan kahdentenakymmenentenä päivänä sen jälkeen, kun se on julkaistu Euroopan unionin virallisessa lehdessä.
Tämä asetus on kaikilta osiltaan velvoittava, ja sitä sovelletaan sellaisenaan kaikissa jäsenvaltioissa.
Tehty Brysselissä 26 päivänä marraskuuta 2021.
Komission puolesta
Puheenjohtaja
Ursula VON DER LEYEN
(1) EUVL L 268, 18.10.2003, s. 29.
(2) EFSA Journal 2021; 19(5):6622.
LIITE
|
Lisäaineen tunnistenumero |
Hyväksynnän haltijan nimi |
Lisäaine |
Koostumus, kemiallinen kaava, kuvaus, analyysimenetelmä |
Eläinlaji tai -ryhmä |
Enimmäisikä |
Vähimmäispitoisuus |
Enimmäispitoisuus |
Muut määräykset |
Hyväksynnän voimassaolo päättyy |
||||||||||
|
mg/kg täysrehua, jonka kosteuspitoisuus on 12 % |
|||||||||||||||||||
|
Luokka: ravitsemukselliset lisäaineet. Funktionaalinen ryhmä: aminohapot, niiden suolat ja analogit. |
|||||||||||||||||||
|
3c351i |
- |
L-histidiinimonohydrokloridimonohydraatti |
Lisäaineen koostumus: Jauhe, joka sisältää vähintään 98 % L-histidiinimonohydrokloridimonohydraattia ja 72 % histidiiniä ja jossa on enintään 100 ppm histamiinia |
Kaikki eläinlajit lukuun ottamatta eväkaloja |
- |
- |
- |
|
19. joulukuuta 2031 |
||||||||||
|
Tehoaineen kuvaus: L-histidiinimonohydrokloridimonohydraatti, joka tuotetaan käymisreaktiolla Escherichia coli NITE SD 00268:sta Kemiallinen kaava: C3H3N2-CH2-CH(NH2)-COΟΗ·ΗCl·Η2O CAS-numero: 5934-29-2 Einecs-numero: 211-438-9 |
|||||||||||||||||||
|
Analyysimenetelmä (1) : Histidiinin määrittäminen rehun lisäaineesta:
Histidiinin määrittäminen esiseoksista, rehuaineista ja rehuseoksista:
Histamiinin määrittäminen rehun lisäaineesta:
|
|||||||||||||||||||
|
Luokka: Sensoriset lisäaineet. Funktionaalinen ryhmä: Aromiaineet |
|||||||||||||||||||
|
3c351i |
- |
L-histidiinimonohydrokloridimonohydraatti |
Lisäaineen koostumus: Jauhe, joka sisältää vähintään 98 % L-histidiinimonohydrokloridimonohydraattia ja 72 % histidiiniä ja jossa on enintään 100 ppm histamiinia |
Kaikki eläinlajit |
- |
- |
- |
|
19. joulukuuta 2031 |
||||||||||
|
Tehoaineen kuvaus: L-histidiinimonohydrokloridimonohydraatti, joka tuotetaan käymisreaktiolla Escherichia coli NITE SD 00268:sta Kemiallinen kaava: C3H3N2-CH2-CH(NH2)-COΟΗ·ΗCl·Η2O CAS-numero: 5934-29-2 Einecs-numero: 211-438-9 |
|||||||||||||||||||
|
Analyysimenetelmä (1) Histidiinin määrittäminen rehun lisäaineesta:
Histidiinin määrittäminen esiseoksista:
Histamiinin määrittäminen rehun lisäaineesta:
|
|||||||||||||||||||
(1) Analyysimenetelmiä koskevia yksityiskohtaisia tietoja on saatavissa seuraavasta vertailulaboratorion osoitteesta: https://ec.europa.eu/jrc/en/eurl/feed-additives/evaluation-reports.
|
29.11.2021 |
FI |
Euroopan unionin virallinen lehti |
L 426/28 |
KOMISSION TÄYTÄNTÖÖNPANOASETUS (EU) 2021/2081,
annettu 26 päivänä marraskuuta 2021,
tehoaineen indoksakarbi hyväksynnän uusimatta jättämisestä kasvinsuojeluaineiden markkinoille saattamisesta annetun Euroopan parlamentin ja neuvoston asetuksen (EY) N:o 1107/2009 mukaisesti ja komission täytäntöönpanoasetuksen (EU) N:o 540/2011 muuttamisesta
(ETA:n kannalta merkityksellinen teksti)
EUROOPAN KOMISSIO, joka
ottaa huomioon Euroopan unionin toiminnasta tehdyn sopimuksen,
ottaa huomioon kasvinsuojeluaineiden markkinoille saattamisesta sekä neuvoston direktiivien 79/117/ETY ja 91/414/ETY kumoamisesta 21 päivänä lokakuuta 2009 annetun Euroopan parlamentin ja neuvoston asetuksen (EY) N:o 1107/2009 (1) ja erityisesti sen 20 artiklan 1 kohdan b alakohdan ja 78 artiklan 2 kohdan,
sekä katsoo seuraavaa:
|
(1) |
Komission direktiivillä 2006/10/EY (2) sisällytettiin indoksakarbi tehoaineena neuvoston direktiivin 91/414/ETY (3) liitteeseen I. |
|
(2) |
Direktiivin 91/414/ETY liitteessä I olevia tehoaineita pidetään asetuksen (EY) N:o 1107/2009 mukaisesti hyväksyttyinä, ja ne luetellaan komission täytäntöönpanoasetuksen (EU) N:o 540/2011 (4) liitteessä olevassa A osassa. |
|
(3) |
Tehoaineen indoksakarbi hyväksyntä, sellaisena kuin se on esitettynä täytäntöönpanoasetuksen (EU) N:o 540/2011 liitteessä olevassa A osassa, päättyy 31 päivänä lokakuuta 2022. |
|
(4) |
Hakemus, jossa pyydettiin uusimaan indoksakarbin hyväksyntä, jätettiin komission täytäntöönpanoasetuksen (EU) N:o 844/2012 (5) 1 artiklan mukaisesti kyseisessä artiklassa säädetyssä määräajassa. |
|
(5) |
Hakija on toimittanut täytäntöönpanoasetuksen (EU) N:o 844/2012 6 artiklan mukaisesti vaaditut täydentävät asiakirja-aineistot. Esittelevä jäsenvaltio totesi hakemuksen täydelliseksi. |
|
(6) |
Esittelevä jäsenvaltio laati rinnakkaisesittelijänä toimivaa jäsenvaltiota kuullen uusimista koskevan arviointikertomuksen luonnoksen ja toimitti sen Euroopan elintarviketurvallisuusviranomaiselle, jäljempänä ’elintarviketurvallisuusviranomainen’, ja komissiolle 28 päivänä marraskuuta 2016. |
|
(7) |
Elintarviketurvallisuusviranomainen asetti täydentävän asiakirja-aineiston tiivistelmän julkisesti saataville. Lisäksi elintarviketurvallisuusviranomainen toimitti uusimista koskevan arviointikertomuksen hakijalle ja jäsenvaltioille kommentoitavaksi ja käynnisti siitä julkisen kuulemisen. Elintarviketurvallisuusviranomainen toimitti saamansa huomautukset edelleen komissiolle. |
|
(8) |
Elintarviketurvallisuusviranomainen ilmoitti 15 päivänä joulukuuta 2017 komissiolle päätelmänsä (6) siitä, voidaanko indoksakarbin olettaa täyttävän asetuksen (EY) N:o 1107/2009 4 artiklassa säädetyt hyväksymiskriteerit. Päätelmän ekotoksikologiaa koskevaa jaksoa muutettiin vuonna 2018 mehiläisiä koskevan riskinarvioinnin selventämiseksi asiaa koskevien Euroopan komission ohjeiden (SANCO/10329/2002-rev.2) mukaisesti. Komissio pyysi 15 päivänä toukokuuta 2019 elintarviketurvallisuusviranomaiselta päivitetyn vertaisarvioinnin, joka koskee indoksakarbista nisäkkäille ja mehiläisille aiheutuvaa riskiä. Elintarviketurvallisuusviranomainen antoi 28 päivänä lokakuuta 2019 lausunnon (7) tehoaineesta indoksakarbi nisäkkäille ja mehiläisille aiheutuvaa riskiä koskevasta päivitetystä vertaisarvioinnista, ja se otettiin huomioon elintarviketurvallisuusviranomaisen toiseen kertaan ajantasaistetussa päätelmässä siitä, voidaanko indoksakarbin olettaa täyttävän asetuksen (EY) N:o 1107/2009 4 artiklassa säädetyt hyväksymiskriteerit. |
|
(9) |
Elintarviketurvallisuusviranomainen havaitsi erittäin merkittävän huolenaiheen, joka liittyy luonnonvaraisiin nisäkkäisiin kohdistuvaan suureen pitkän aikavälin riskiin ja erityisesti pieniin kasvissyöjänisäkkäisiin kohdistuvaan pitkän aikavälin riskiin. |
|
(10) |
Lisäksi havaittiin, että edustavasta käyttötarkoituksesta lehtisalaatissa aiheutuu suuri riski kuluttajille ja työntekijöille ja että edustavasta käyttötarkoituksesta maississa, sokerimaississa ja siementuotantoon käytettävässä lehtisalaatissa aiheutuu suuri riski mehiläisille. |
|
(11) |
Useita riskinarvioinnin osa-alueita ei myöskään voitu saattaa päätökseen, koska asiakirja-aineiston tiedot olivat riittämättömiä. Kuluttajille aiheutuvan riskin arviointia ei voitu saattaa päätökseen erityisesti siksi, että tiedot aineenvaihdunnasta vuoroviljelykasvustoissa, siipikarjan aineenvaihdunnasta, jäämien suuruusluokasta pääasiallisissa viljelmissä ja vuoroviljelykasveissa sekä tiedot vedenkäsittelyprosessien vaikutuksesta juomavedessä esiintyvien jäämien luonteeseen puuttuvat. Lisäksi pohjaveden altistumista maaperässä esiintyvälle metaboliitille IN-U8E24 koskevaa arviointia ei voitu saattaa päätökseen maaperän vaurioitumista ja adsorptiota koskevien tietojen puuttumisen vuoksi. Myöskään useiden aineenvaihduntatuotteiden ekotoksikologista riskinarviointia ei voitu saattaa päätökseen. |
|
(12) |
Hakija ilmoitti 14 päivänä marraskuuta 2018 komissiolle päätöksestään poistaa uusimishakemuksesta lehtisalaattia koskeva edustava käyttötarkoitus. |
|
(13) |
Komissio pyysi hakijaa toimittamaan elintarviketurvallisuusviranomaisen päätelmää, tarkistettua päätelmää ja lausuntoa koskevat huomautuksensa. Lisäksi komissio pyysi täytäntöönpanoasetuksen (EU) N:o 844/2012 14 artiklan 1 kohdan kolmannen alakohdan mukaisesti hakijaa toimittamaan huomatuksensa uusimista koskevan kertomuksen luonnoksesta. Hakija toimitti huomautuksensa, ja ne on tutkittu huolellisesti. |
|
(14) |
Hakijan esittämistä perusteluista huolimatta tehoainetta koskevia huolenaiheita ei voitu poistaa. |
|
(15) |
Näin ollen ei ole vahvistettu vähintään yhden kasvinsuojeluaineen yhden tai useamman edustavan käyttötarkoituksen osalta, että asetuksen (EY) N:o 1107/2009 4 artiklassa säädetyt hyväksymiskriteerit täyttyvät. Sen vuoksi on aiheellista olla uusimatta tehoaineen indoksakarbi hyväksyntää kyseisen asetuksen 20 artiklan 1 kohdan b alakohdan mukaisesti. |
|
(16) |
Sen vuoksi täytäntöönpanoasetusta (EU) N:o 540/2011 olisi muutettava. |
|
(17) |
Jäsenvaltioille olisi annettava riittävästi aikaa indoksakarbia sisältävien kasvinsuojeluaineiden lupien peruuttamiseen. |
|
(18) |
Jos jäsenvaltiot myöntävät indoksakarbia sisältävien kasvinsuojeluaineiden osalta siirtymäajan asetuksen (EY) N:o 1107/2009 46 artiklan mukaisesti, kyseisen siirtymäajan olisi oltava mahdollisimman lyhyt. |
|
(19) |
Indoksakarbin hyväksynnän voimassaoloaikaa pidennettiin 31 päivään lokakuuta 2022 komission täytäntöönpanoasetuksella (EU) 2021/1449 (8), jotta uusimisprosessi voitaisiin saattaa päätökseen ennen kyseisen aineen hyväksynnän voimassaolon päättymistä. Koska uusimista koskeva päätös on tehty ennen voimassaolon myöhennettyä päättymispäivää, tätä asetusta olisi sovellettava mahdollisimman pian. |
|
(20) |
Tämä asetus ei estä indoksakarbin hyväksyntää koskevan uuden hakemuksen toimittamista asetuksen (EY) N:o 1107/2009 7 artiklan mukaisesti. |
|
(21) |
Tässä asetuksessa säädetyt toimenpiteet ovat pysyvän kasvi-, eläin-, elintarvike- ja rehukomitean lausunnon mukaiset, |
ON HYVÄKSYNYT TÄMÄN ASETUKSEN:
1 artikla
Tehoaineen hyväksynnän uusimatta jättäminen
Tehoaineen indoksakarbi hyväksyntää ei uusita.
2 artikla
Täytäntöönpanoasetuksen (EU) N:o 540/2011 muuttaminen
Poistetaan täytäntöönpanoasetuksen (EU) N:o 540/2011 liitteessä olevasta A osasta indoksakarbia koskeva rivi 119.
3 artikla
Siirtymätoimenpiteet
Jäsenvaltioiden on peruutettava indoksakarbia tehoaineena sisältävien kasvinsuojeluaineiden hyväksynnät viimeistään 19 päivänä maaliskuuta 2022.
4 artikla
Siirtymäaika
Jäsenvaltioiden asetuksen (EY) N:o 1107/2009 46 artiklan mukaisesti mahdollisesti myöntämän siirtymäajan on päätyttävä viimeistään 19 päivänä syyskuuta 2022.
5 artikla
Voimaantulo
Tämä asetus tulee voimaan kahdentenakymmenentenä päivänä sen jälkeen, kun se on julkaistu Euroopan unionin virallisessa lehdessä.
Tämä asetus on kaikilta osiltaan velvoittava, ja sitä sovelletaan sellaisenaan kaikissa jäsenvaltioissa.
Tehty Brysselissä 26 päivänä marraskuuta 2021.
Komission puolesta
Puheenjohtaja
Ursula VON DER LEYEN
(1) EUVL L 309, 24.11.2009, s. 1.
(2) Komission direktiivi 2006/10/EY, annettu 27 päivänä tammikuuta 2006, neuvoston direktiivin 91/414/ETY muuttamisesta forklorfenuronin ja indoksakarbin sisällyttämiseksi siihen tehoaineina (EUVL L 25, 28.1.2006, s. 24).
(3) Neuvoston direktiivi 91/414/ETY, annettu 15 päivänä heinäkuuta 1991, kasvinsuojeluaineiden markkinoille saattamisesta (EYVL L 230, 19.8.1991, s. 1).
(4) Komission täytäntöönpanoasetus (EU) N:o 540/2011, annettu 25 päivänä toukokuuta 2011, Euroopan parlamentin ja neuvoston asetuksen (EY) N:o 1107/2009 täytäntöönpanosta hyväksyttyjen tehoaineiden luettelon osalta (EUVL L 153, 11.6.2011, s. 1).
(5) Komission täytäntöönpanoasetus (EU) N:o 844/2012, annettu 18 päivänä syyskuuta 2012, säännösten vahvistamisesta tehoaineiden uusimismenettelyn täytäntöönpanemiseksi kasvinsuojeluaineiden markkinoille saattamisesta annetun Euroopan parlamentin ja neuvoston asetuksen (EY) N:o 1107/2009 mukaisesti (EUVL L 252, 19.9.2012, s. 26).
(6) EFSA Journal 2018;16(1):5140, 36 s. doi: 10.2903/j.efsa.2018.5140. Saatavilla verkossa osoitteessa www.efsa.europa.eu.
(7) EFSA (Euroopan elintarviketurvallisuusviranomainen) 2019. Statement on the updated peer review concerning the risk to mammals and bees for the active substance indoxacarb. EFSA Journal 2019; 17(10):5866, s. 10.
(8) Komission täytäntöönpanoasetus (EU) 2021/1449, annettu 3 päivänä syyskuuta 2021, täytäntöönpanoasetuksen (EU) N:o 540/2011 muuttamisesta siltä osin kuin on kyse tehoaineiden 2-fenyylifenoli (mukaan luettuna sen suolat kuten natriumsuola), 8-hydroksikinoliini, amidosulfuroni, bifenoksi, klormekvatti, klorotoluroni, klofentetsiini, klomatsoni, sypermetriini, daminotsidi, deltametriini, dikamba, difenokonatsoli, diflufenikaani, dimetakloori, etofenproksi, fenoksaproppi-P, fenpropidiini, fludioksonili, flufenaset, fostiatsaatti, indoksakarbi, lenasiili, MCPA, MCPB, nikosulfuroni, parafiiniöljyt, parafiiniöljy, penkonatsoli, pikloraami, propakvitsafoppi, prosulfokarbi, kvitsalofoppi-P-etyyli, kvitsalofoppi-P-tefuryyli, rikki, tetrakonatsoli, triallaatti, triflusulfuroni ja tritosulfuroni hyväksynnän voimassaoloajan pidentämisestä (EUVL L 313, 6.9.2021, s. 20).
|
29.11.2021 |
FI |
Euroopan unionin virallinen lehti |
L 426/32 |
KOMISSION TÄYTÄNTÖÖNPANOASETUS (EU) 2021/2082,
annettu 26 päivänä marraskuuta 2021,
Euroopan parlamentin ja neuvoston asetuksen (EU) N:o 376/2014 täytäntöönpanoa koskevista järjestelyistä yhteisen eurooppalaisen riskiluokitusjärjestelmän osalta
(ETA:n kannalta merkityksellinen teksti)
EUROOPAN KOMISSIO, joka
ottaa huomioon Euroopan unionin toiminnasta tehdyn sopimuksen,
ottaa huomioon poikkeamien ilmoittamisesta, analysoinnista ja seurannasta siviili-ilmailun alalla, Euroopan parlamentin ja neuvoston asetuksen (EU) N:o 996/2010 muuttamisesta sekä Euroopan parlamentin ja neuvoston direktiivin 2003/42/EY, komission asetusten (EY) N:o 1321/2007 ja (EY) N:o 1330/2007 kumoamisesta 3 päivänä huhtikuuta 2014 annetun Euroopan parlamentin ja neuvoston asetuksen (EU) N:o 376/2014 (1) ja erityisesti sen 7 artiklan 7 kohdan,
sekä katsoo seuraavaa:
|
(1) |
Sekä jäsenvaltioiden että Euroopan unionin lentoturvallisuusviraston, jäljempänä ’virasto’, on asetuksen (EU) N:o 376/2014 mukaan perustettava mekanismi ilmailun turvallisuutta koskevien poikkeamatietojen keräämistä, arviointia, käsittelyä, analysointia ja tallentamista varten. Jäsenvaltioiden toimivaltaisten viranomaisten on laadittava poikkeamatietojen perusteella poikkeamailmoitukset ja tallennettava ne kansalliseen tietokantaan. Virastolla on sama velvoite laatia poikkeamatietojen perusteella poikkeamailmoitukset ja tallentaa ne tietokantaan. |
|
(2) |
Asetuksen (EU) N:o 376/2014 9 artiklan 1 kohdan mukaisesti jäsenvaltiot ja virasto osallistuvat tietojenvaihtoon asettamalla kaikki ilmoitustietokantoihinsa tallennetut turvallisuustiedot saataville eurooppalaisen keskusrekisterin välityksellä. |
|
(3) |
Asetuksen (EU) N:o 376/2014 mukaan poikkeamailmoituksissa on oltava jäsenvaltioiden toimivaltaisten viranomaisten tai viraston tarkistama turvallisuusriskiluokitus ja ne on siirrettävä eurooppalaiseen keskusrekisteriin. Sen varmistamiseksi, että kaikki eurooppalaisessa keskusrekisterissä olevat poikkeamailmoitukset on luokiteltu yhdenmukaisella tavalla, jäsenvaltioiden toimivaltaisten viranomaisten ja viraston olisi varmistettava, että luokitukset näissä ilmoituksissa on määritetty komission delegoidussa asetuksessa (EU) 2020/2034 (2) vahvistetun yhteisen eurooppalaisen riskiluokitusjärjestelmän (ERCS-järjestelmä) mukaisesti. |
|
(4) |
On tarpeen vahvistaa järjestelyt, joilla virasto ja jäsenvaltiot panevat ERCS-järjestelmän yhdenmukaisesti ja yhtenäisesti täytäntöön. |
|
(5) |
Jos poikkeamailmoituksessa oleva riskiluokitus on määritetty käyttäen jotakin muuta metodologiaa kuin ERCS-järjestelmää, jäsenvaltioiden toimivaltaisten viranomaisten tai viraston olisi luokiteltava kyseisen poikkeaman riski komission delegoidussa asetuksessa (EU) 2020/2034 määritellyn ERCS-järjestelmän mukaisesti. |
|
(6) |
Silloin kun jäsenvaltioiden toimivaltaiset viranomaiset tai virasto päättävät käyttää muuntamismenettelyä johdanto-osan 5 kappaleessa tarkoitettujen riskiluokitusten muuntamiseksi ERCS-luokitukseksi ja jos käytetyt metodologiat ovat ARMS-ERC 4x4 tai RAT ”ATM yleisesti”, jäsenvaltioiden toimivaltaisten viranomaisten tai viraston olisi käytettävä tässä asetuksessa vahvistettua suoraa muuntamismenettelyä. |
|
(7) |
Jos liitteessä esitettyä suoraa muuntamismenettelyä ei voida soveltaa, jäsenvaltioiden toimivaltaisten viranomaisten ja viraston olisi voitava käyttää muita muuntamismenettelyjä, kunhan niillä saadaan vastaava ERCS-luokitus. |
|
(8) |
ERCS-järjestelmän jatkuva seuranta ja kehittäminen on tarpeen sen tehokkaan soveltamisen varmistamiseksi. On tarpeen vahvistaa tällaista seurantaa ja kehittämistä koskevat yksityiskohtaiset säännöt, ja viraston olisi avustettava komissiota tässä tarkastelussa ja seurannassa. Sen vuoksi jäsenvaltioiden olisi säännöllisesti ja asetetuissa määräajoissa raportoitava virastolle ja komissiolle ERCS-järjestelmän käytöstä ja sen arvioinnista. |
|
(9) |
Jäsenvaltioiden toimivaltaisten viranomaisten ja viraston on valmistauduttava ERCS-järjestelmän täytäntöönpanoon erityisesti mukauttamalla sisäisiä menettelyjään ja mahdollisesti ottamalla käyttöön lisäresursseja. Asetuksen (EU) N:o 376/2014 24 artiklan 3 kohdassa säädetään kuitenkin, että mainitun asetuksen 7 artiklan 2 kohtaa, jossa jäsenvaltioille ja virastolle annetaan valtuudet käyttää ERCS-järjestelmää, sovelletaan vasta ERCS-järjestelmää määrittävien ja kehittävien delegoitujen ja täytäntöönpanosäädösten tultua voimaan. ERCS-järjestelmä määritellään komission delegoidussa asetuksessa (EU) 2020/2034, joka tuli jo voimaan 31 päivänä joulukuuta 2020. Sen vuoksi velvoitetta käyttää ERCS-järjestelmää olisi sovellettava viimeistään tämän asetuksen voimaantulopäivästä. Lisäksi vuotuista turvallisuuskatsausta varten, jonka virasto julkaisee Euroopan parlamentin ja neuvoston asetuksen (EU) 2018/1139 (3) 72 artiklan 7 kohdan mukaisesti, on olennaisen tärkeää, että luokitukset eurooppalaiseen keskusrekisteriin yhden vuoden ajanjaksolta ladatuissa poikkeamailmoituksissa on määritetty yhdenmukaisella tavalla. Velvoitetta luokitella poikkeamat ERCS-järjestelmän mukaisesti olisi sovellettava tämän asetuksen voimaantulopäivästä. Sen vuoksi tämän asetuksen olisi tultava voimaan 1 päivänä tammikuuta 2023. |
|
(10) |
Tässä asetuksessa säädetyt toimenpiteet ovat asetuksen (EU) 2018/1139 127 artiklalla perustetun komitean lausunnon mukaiset, |
ON HYVÄKSYNYT TÄMÄN ASETUKSEN:
1 artikla
Kohde
Tässä asetuksessa vahvistetaan järjestelyt delegoidussa asetuksessa (EU) 2020/2034 vahvistetun yhteisen eurooppalaisen riskiluokitusjärjestelmän, jäljempänä ’ERCS-järjestelmä’, täytäntöönpanoa varten.
2 artikla
Määritelmät
Tässä asetuksessa sovelletaan delegoidun asetuksen (EU) 2020/2034 2 artiklan määritelmiä.
Lisäksi tässä asetuksessa tarkoitetaan:
|
1) |
’ARMS-ERC-metodologialla’ metodologiaa, jonka ilmailualan työryhmä nimeltään Airline Risk Management Solutions (ARMS) on kehittänyt toiminnallisten riskien arviointia varten; |
|
2) |
’ATM:llä’ Euroopan parlamentin ja neuvoston asetuksen (EY) N:o 549/2004 (4) 2 artiklan 10 alakohdassa määriteltyä ilmaliikenteen hallintaa; |
|
3) |
’ATM ilmassa -vakavuustasolla’ sitä RAT-metodologian osaa, jolla arvioidaan poikkeaman lentotoimintavaikutusta; |
|
4) |
’ATM maassa -vakavuustasolla’ sitä RAT-metodologian osaa, jolla arvioidaan ilmaliikenteen hallintajärjestelmän suorituskykyä (menettelyt, laitteet ja henkilöstö); |
|
5) |
’ATM yleisesti -vakavuustasolla’ yhtä vakavuustasoa, joka muodostuu ATM ilmassa- ja ATM maassa -vakavuustasoista; |
|
6) |
’RAT-metodologialla’ Eurocontrolin kehittämää riskianalyysivälinemetodologiaa, jota käytetään turvallisuuteen liittyvien poikkeamien luokitteluun ilmaliikenteen hallinnan alalla; |
|
7) |
’Eurocontrolilla’ lennonvarmistusalan yhteistyöstä 13 päivänä joulukuuta 1960 tehdyllä kansainvälisellä yleissopimuksella (5) perustettua Euroopan lennonvarmistusjärjestöä. |
3 artikla
Turvallisuusriskiluokituksen tarkistaminen, muuttaminen ja hyväksyminen
1. Jäsenvaltion toimivaltaisen viranomaisen tai viraston on tarkistettava kunkin poikkeaman poikkeamailmoitukseen sisältyvä turvallisuusriskiluokitus sekä tarvittaessa muutettava sitä ja hyväksyttävä se komission delegoidussa asetuksessa (EU) 2020/2034 vahvistetun ERCS-järjestelmän mukaisesti.
2. Rajoittamatta 1 kohdan soveltamista jäsenvaltion toimivaltaisen viranomaisen tai viraston on käytettävä liitteessä esitettyä suoraa muuntamismenettelyä muuntaessaan ARMS-ERC 4x4- tai RAT ”ATM yleisesti” -metodologialla määritettyjä turvallisuusriskiluokituksia. Jäsenvaltion toimivaltainen viranomainen tai virasto voivat käyttää muiden metodologioiden avulla määritettyjen turvallisuusriskiluokitusten muuntamiseen liitteessä olevassa 2 kohdassa esitettyä manuaalista muuntamismenettelyä tai muita tarkoituksenmukaisiksi katsomiaan muuntamismenettelyjä, kunhan niillä saadaan vastaava ERCS-luokitus.
4 artikla
ERCS-järjestelmän seuranta ja kehittäminen
1. Kunkin jäsenvaltion on 31 päivänä maaliskuuta 2026 ja sen jälkeen viiden vuoden välein toimitettava komissiolle ja virastolle kertomus ERCS-järjestelmän käytöstä.
2. Virasto tarkistaa jäsenvaltioilta tämän artiklan 1 kohdan mukaisesti saadut tiedot sekä muut tiedot, jotka virasto mahdollisesti saa ERCS-järjestelmän täytäntöönpanosta. Virasto voi tarkistuksessaan ottaa huomioon asetuksen (EU) N:o 376/2014 14 artiklan 2 kohdassa tarkoitetun ilmailualan turvallisuusanalyytikkojen verkoston sekä viraston mahdollisesti perustamien asiaankuuluvien asiantuntijaryhmien asiantuntemuksen.
5 artikla
Yhteensopivuutta muiden riskiluokitusjärjestelmien kanssa koskeva seuranta
1. Virasto tarkastelee liitteessä esitettyjä muuntamismenettelyjä säännöllisesti uudelleen sen varmistamiseksi, että ne ovat edelleen tarkoituksenmukaisia. Uudelleentarkastelussa voidaan ottaa huomioon ilmailualan turvallisuusanalyytikkojen verkoston sekä viraston mahdollisesti perustamien asiaankuuluvien asiantuntijaryhmien asiantuntemus.
2. Jäsenvaltioiden on annettava komissiolle ja virastolle tiedoksi liitteessä olevassa 2 kohdassa esitetty manuaalinen muuntamismenettely ja muu tämän asetuksen 3 artiklan 2 kohdassa tarkoitettu muuntamismenettely, jos tällaista on käytetty.
6 artikla
Voimaantulo
Tämä asetus tulee voimaan 1 päivänä tammikuuta 2023.
Tämä asetus on kaikilta osiltaan velvoittava, ja sitä sovelletaan sellaisenaan kaikissa jäsenvaltioissa.
Tehty Brysselissä 26 päivänä marraskuuta 2021.
Komission puolesta
Puheenjohtaja
Ursula VON DER LEYEN
(1) EUVL L 122, 24.4.2014, s. 18.
(2) Komission delegoitu asetus (EU) 2020/2034, annettu 6 päivänä lokakuuta 2020, Euroopan parlamentin ja neuvoston asetuksen (EU) N:o 376/2014 täydentämisestä yhteisen eurooppalaisen riskiluokitusjärjestelmän osalta (EUVL L 416, 11.12.2020, s. 1).
(3) Euroopan parlamentin ja neuvoston asetus (EU) 2018/1139, annettu 4 päivänä heinäkuuta 2018, yhteisistä siviili-ilmailua koskevista säännöistä ja Euroopan unionin lentoturvallisuusviraston perustamisesta, Euroopan parlamentin ja neuvoston asetusten (EY) N:o 2111/2005, (EY) N:o 1008/2008, (EU) N:o 996/2010, (EU) N:o 376/2014 ja direktiivien 2014/30/EU ja 2014/53/EU muuttamisesta sekä Euroopan parlamentin ja neuvoston asetusten (EY) N:o 552/2004, (EY) N:o 216/2008 ja neuvoston asetuksen (ETY) N:o 3922/91 kumoamisesta (EUVL L 212, 22.8.2018, s. 1).
(4) Euroopan parlamentin ja neuvoston asetus (EY) N:o 549/2004, annettu 10 päivänä maaliskuuta 2004, yhtenäisen eurooppalaisen ilmatilan toteuttamisen puitteista (puiteasetus) (EUVL L 96, 31.3.2004, s. 1).
(5) Yleissopimus sellaisena kuin se on muutettuna 12 päivänä helmikuuta 1981 tehdyllä pöytäkirjalla ja tarkistettuna 27 päivänä kesäkuuta 1997 tehdyllä pöytäkirjalla.
LIITE
Muuntamismenettelyt riskianalyysivälineen (RAT) ja ilmailuriskien hallintaratkaisuja koskevan riskienluokittelumatriisin (ARMS-ERC) luokitusten muuntamiseksi yhteisen eurooppalaisen riskiluokitusjärjestelmän (ERCS) luokituksiksi
Tässä liitteessä vahvistetaan menettelyt, jolla RAT- ja ARMS-ERC-luokitukset muunnetaan komission delegoidun asetuksen (EU) 2020/2034 liitteessä olevassa vaiheessa 2 määritellyksi ERCS-luokitukseksi (1).
Seuraavilla menettelyillä RAT- ja/tai ARMS-ERC-luokitukset voidaan muuntaa joko suoraan tai manuaalisesti vastaavaksi ERCS-luokitukseksi tämän asetuksen 3 artiklan mukaisesti.
1. Suora muuntaminen
Pakollisessa muuntamismenettelyssä on seuraavat kaksi työvaihetta:
|
— |
Työvaihe 1 – suora muuntaminen ERCS-vakavuustason määrittämiseksi. |
|
— |
Työvaihe 2 – suora muuntaminen ERCS-todennäköisyystason määrittämiseksi. |
Menettelyjen kulku esitetään kuvassa 1. Menettely alkaa kohdasta ”Poikkeamailmoitus tehty” ja päättyy kohtaan ”Vastaava ERCS-luokitus”. Kuvan 1 katkoviivat osoittavat, että kunkin prosessin lopputulokseen riittää yksi lähde.
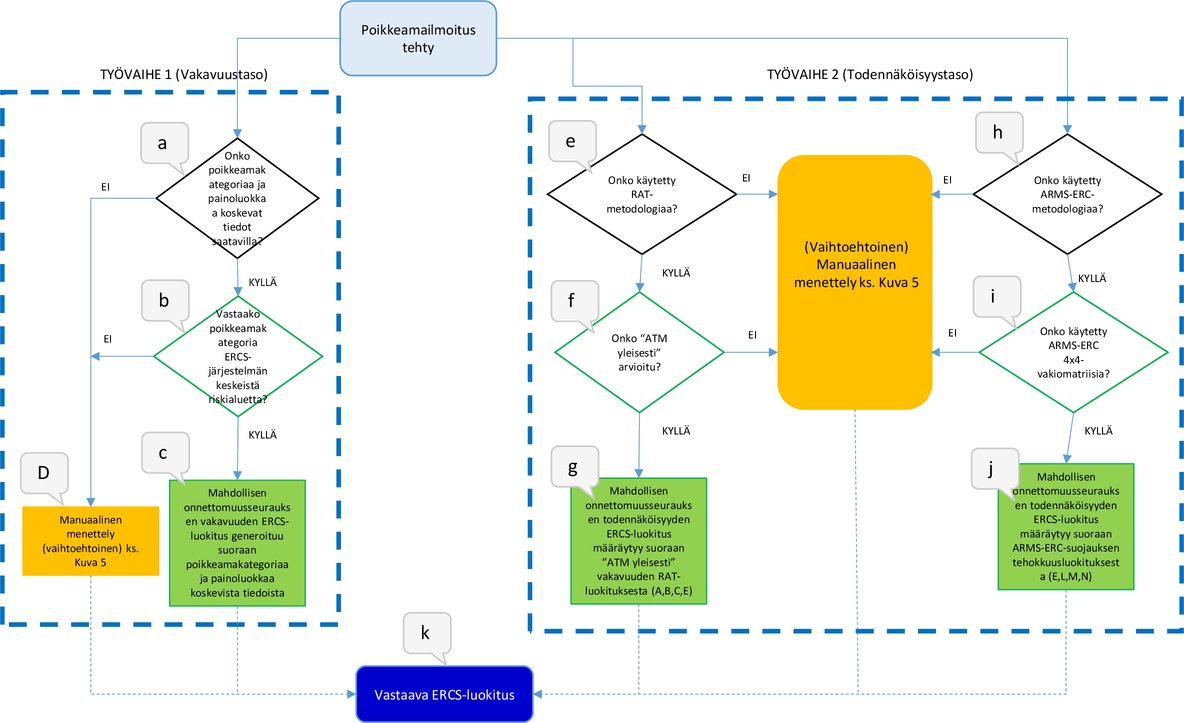
1.1 VAIHE 1 – ERCS-vakavuustaso
a. Poikkeamakategoriaa ja painoluokkaa koskevat tiedot
|
— |
Jos poikkeamailmoitus sisältää poikkeamakategoriaa ja painoluokkaa koskevat tiedot, ne voidaan muuntaa ERCS-luokitukseksi ”Mahdollisen onnettomuusseurauksen vakavuus”. Seuraava vaihe on kuvan 1 kohta b. |
|
— |
Jos poikkeamailmoituksessa ei ole poikkeamakategoriaa tai painoluokkaa taikka kumpaakaan koskevia tietoja, suora muuntaminen ei ole mahdollista. Jos käytetään tässä liitteessä olevassa 2 kohdassa kuvattua manuaalista muuntamista, seuraava vaihe on kuvien 1 ja 5 kohta D. |
b. Poikkeamakategorian muuntaminen ERCS-järjestelmän keskeiseksi riskialueeksi
|
— |
Jos poikkeamailmoituksen poikkeamakategoria vastaa suoraan jotakin delegoidun asetuksen (EU) 2020/2034 liitteessä olevassa 1.2 kohdassa määriteltyä ERCS-järjestelmän keskeistä riskialuetta, seuraava vaihe on kuvan 1 kohta c. |
|
— |
Jos poikkeamailmoituksen poikkeamakategoria ei vastaa ERCS-järjestelmän keskeisiä riskialueita, suora muuntaminen ei ole mahdollista. Jos käytetään tässä liitteessä olevassa 2 kohdassa kuvattua manuaalista muuntamista, seuraava vaihe on kuvien 1 ja 5 kohta D. |
c. ERCS-luokitus ”Mahdollisen onnettomuusseurauksen vakavuus” – suora muuntaminen
|
— |
Jos poikkeamailmoitus sisältää poikkeamakategoriaa ja painoluokkaa koskevat tiedot, vakavuustaso muunnetaan suoraan vastaavaksi ERCS-tasoksi ”Mahdollisen onnettomuusseurauksen vakavuus”. Tulos on kohta k, josta saadaan ensimmäinen merkki, joka vastaa poikkeaman vakavuuden laskemisen perusteella määritettyä kirjainta (vakavuustasot A–X). |
1.2 TYÖVAIHE 2 – ERCS-todennäköisyystaso
e. RAT-metodologialla luokitettu poikkeamailmoitus
Jos poikkeamailmoituksen luokituksessa on käytetty RAT-metodologiaa (2):
|
— |
Poikkeamailmoitukset, joilla on RAT-metodologian mukainen ”ATM yleisesti” -vakavuustaso, voidaan siirtää suoraan ERCS-järjestelmän todennäköisyyttä koskeviin sarakkeisiin kuvan 2 kohdan g mukaisesti. |
|
— |
Poikkeamailmoitukset, joilla on vain RAT-metodologian mukainen ”ATM maassa” -vakavuustaso (3), on muunnettava manuaalisesti ERCS-todennäköisyystason saamiseksi. Jos käytetään tässä liitteessä olevassa 2 kohdassa kuvattua manuaalista muuntamista, seuraava vaihe on kuvan 5 kohta L. |
|
— |
Jos poikkeamailmoitus on koodattu ”ATM-poikkeamana” (’ATM-specific occurence’), RAT-metodologian mukaisia luokituksia ei voida muuntaa ERCS-luokituksiksi. |
f. RAT-metodologian mukainen ”ATM yleisesti” -vakavuustaso
|
— |
Jos poikkeamailmoituksessa on ”ATM yleisesti” -vakavuustaso, seuraava vaihe on kuvan 1 kohta g. |
g. ERCS-järjestelmän sarake ”Mahdollisen onnettomuusseurauksen todennäköisyys” muunnetaan RAT-metodologian ”ATM yleisesti” -arvosta (koskee vain arvoja A, B, C ja E)
Poikkeamailmoitukset, joilla on ”ATM yleisesti” -vakavuustaso (A, B, C ja E), muunnetaan suoraan ERCS-järjestelmän todennäköisyysluokiksi seuraavasti:
h. ARMS-ERC-metodologialla luokitellut poikkeamailmoitukset
|
— |
ARMS-ERC-metodologialla luokitettujen poikkeamailmoitusten osalta seuraava vaihe on kuvan 1 kohta i. |
|
— |
Muuten kuin ARMS-ERC-metodologialla luokitettujen poikkeamailmoitusten osalta seuraava vaihe on kuvan 5 kohta M. |
i. ARMS-ERC 4x4-vakiomatriisi
Jos poikkeamailmoituksen luokitukseen on käytetty kuvassa 3 esitettyä ARMS-ERC 4x4-matriisia, seuraava vaihe on kuvan 1 kohta j.
j. ERCS-taso ”Mahdollisen onnettomuusseurauksen todennäköisyys” – suora muuntaminen
Jos poikkeamailmoituksessa on ARMS-metodologian ”Suojauksen tehokkuus” -taso, ERCS-tason ”Mahdollisen onnettomuusseurauksen todennäköisyys” määrittämisessä käytetään seuraavanlaista suoraa muuntamista ERCS-matriisiin.

k. Vastaava ERCS-luokitus
ERCS-tasot ”Mahdollisen onnettomuusseurauksen vakavuus” ja ”Mahdollisen onnettomuusseurauksen todennäköisyys” yhdistetään ERCS-matriisissa vastaavan ERCS-luokituksen saamiseksi delegoidun asetuksen (EU) 2020/2034 liitteessä olevan vaiheen 2 mukaisesti.
2. Manuaalinen muuntaminen
Manuaalisessa muuntamisessa on seuraavat kaksi työvaihetta:
|
— |
Työvaihe 1 – manuaalinen muuntaminen ERCS-vakavuustason määrittämiseksi; |
|
— |
Työvaihe 2 – manuaalinen muuntaminen ERCS-todennäköisyystason määrittämiseksi. |

2.1 TYÖVAIHE 1
D. ERCS-taso ”Mahdollisen onnettomuusseurauksen vakavuus” – manuaalinen muuntaminen
|
— |
Jos poikkeamailmoitus ei sisällä poikkeamakategoriaa tai painoluokkaa taikka kumpaakaan koskevia tietoja, ”Mahdollinen onnettomuusseuraus” ja keskeinen riskialue määritetään delegoidun asetuksen (EU) 2020/2034 liitteessä määritellyllä ERCS-metodologialla. Lopullinen tulos on kohta k, josta saadaan ensimmäinen merkki, joka vastaa poikkeaman vakavuuden laskemisen perusteella määritettyä kirjainta (vakavuustasot A–X). |
2.2 TYÖVAIHE 2
L. ERCS-järjestelmän sarake ”Mahdollisen onnettomuusseurauksen todennäköisyys” – manuaalinen muuntaminen
|
— |
Poikkeamailmoituksia, joihin ei sisälly ”ATM yleisesti” -vakavuuden arviointia, ei voida suoraan muuntaa ERCS-tasoksi ”Mahdollisen onnettomuusseurauksen todennäköisyys”. |
”ATM maassa” -vakavuus auttaa kuitenkin muuntamisessa sikäli, että se kartoittaa ”ATM maassa” -suojauksen arviointia ja delegoidun asetuksen (EU) 2020/2034 liitteessä olevassa 2.1.3 kohdassa määriteltyä ERCS-järjestelmän mukaista suojauksen arviointia.
M. ERCS-taso ”Mahdollisen onnettomuusseurauksen todennäköisyys” – manuaalinen muuntaminen
Jos poikkeamailmoituksissa ei käytetä poikkeaman luokitukseen ARMS-ERC 4x4-matriisia, ERCS-tason ”Mahdollisen onnettomuusseurauksen todennäköisyys” saamiseksi ARMS-ERC-metodologian suojauksen arvioinnin arvo muunnetaan delegoidun asetuksen (EU) 2020/2034 liitteessä olevassa 2.1.3 kohdassa vahvistetuksi ERCS:n suojauksen arvioinniksi.
k. Vastaava ERCS-luokitus
ERCS-tasot ”Mahdollisen onnettomuusseurauksen vakavuus” ja ”Mahdollisen onnettomuusseurauksen todennäköisyys” yhdistetään ERCS-matriisissa vastaavan ERCS-luokituksen saamiseksi delegoidun asetuksen (EU) 2020/2034 liitteessä olevan vaiheen 2 mukaisesti.
(1) ERCS-luokitus on kahdesta merkistä koostuva arvo, jossa ensimmäinen merkki on poikkeaman vakavuuden laskemisen perusteella määritetty kirjain (vakavuustasot A–X) ja toinen merkki on numeerinen arvo, joka ilmaisee laskelmien perusteella määritetyn poikkeamaa vastaavan pistemäärän (todennäköisyys).
(2) RAT-metodologialla luokitetaan ilmaliikenteen hallintaan liittyvät poikkeamat. RAT-metodologialla ei luokiteta onnettomuuksia, koska sillä mitataan vain sitä, kuinka lähellä ilmaliikenteen hallintaan liittyvä poikkeama oli muuttua onnettomuudeksi. RAT-metodologia on jaettu useisiin päätekijöihin (esim. ”ATM maassa”, ”ATM ilmassa”), joista kukin tuottaa osan RAT-metodologian mukaisesta lopullisesta ”ATM yleisesti” -vakavuustasosta. ”ATM yleisesti” -vakavuustason määrittämiseksi on oltava käytettävissä sekä ”ATM maassa”- että ”ATM ilmassa” -vakavuustasot.
(3) RAT-metodologiassa ’vakavuus’ osoittaa, kuinka paha poikkeama oli verrattuna muihin poikkeamiin. RAT-metodologiassa poikkeaman vakavuus määritellään arvioimalla suojaukset.
|
29.11.2021 |
FI |
Euroopan unionin virallinen lehti |
L 426/41 |
KOMISSION TÄYTÄNTÖÖNPANOASETUS (EU) 2021/2083,
annettu 26 päivänä marraskuuta 2021,
täytäntöönpanoasetuksilla (EU) 2018/886 ja (EU) 2020/502 käyttöön otettujen Amerikan yhdysvalloista peräisin olevia tiettyjä tuotteita koskevien kauppapoliittisten toimenpiteiden keskeyttämisestä
EUROOPAN KOMISSIO, joka
ottaa huomioon Euroopan unionin toiminnasta tehdyn sopimuksen,
ottaa huomioon unionin oikeuksien harjoittamisesta kansainvälisten kauppasääntöjen soveltamista ja täytäntöönpanoa varten ja yhteisön menettelyistä yhteisessä kauppapolitiikassa kansainvälisen kaupan säännöissä yhteisölle annettujen, erityisesti Maailman kauppajärjestössä (WTO) käyttöön otettujen oikeuksien käyttämisen varmistamiseksi annetun neuvoston asetuksen (EY) N:o 3286/94 muuttamisesta 15 päivänä toukokuuta 2014 annetun Euroopan parlamentin ja neuvoston asetuksen (EU) N:o 654/2014 (1), ja erityisesti sen 7 artiklan 3 kohdan,
sekä katsoo seuraavaa:
|
(1) |
Komissio antoi 20 päivänä kesäkuuta 2018 täytäntöönpanoasetuksen (EU) 2018/886 (2), joka koski Amerikan yhdysvalloista peräisin olevia tiettyjä tuotteita koskevia tiettyjä kauppapoliittisia toimenpiteitä ja jossa säädetään lisätullien soveltamisesta joidenkin Yhdysvalloista peräisin olevien tuotteiden tuonnissa unioniin seuraavasti:
|
|
(2) |
Komissio antoi 7 päivänä huhtikuuta 2020 täytäntöönpanoasetuksen (EU) 2020/502 (3), jossa säädetään lisätullien soveltamisesta tiettyjen Yhdysvalloista peräisin olevien tuotteiden tuonnissa unioniin seuraavasti:
|
|
(3) |
Unioni ja Yhdysvallat julkaisivat 17 päivänä toukokuuta 2021 yhteisen julkilausuman, minkä jälkeen komissio antoi 31 päivänä toukokuuta 2021 täytäntöönpanoasetuksen (EU) 2021/866 (4), joka koski Amerikan yhdysvalloista peräisin olevia tiettyjä tuotteita koskevia kauppapoliittisia toimenpiteitä ja jolla keskeytettiin täytäntöönpanoasetuksen (EU) 2018/886 liitteessä II lueteltujen tuotteiden tuontia koskevien arvoon perustuvien lisätullien soveltaminen 30 päivään marraskuuta 2021 asti. |
|
(4) |
Komissio voi muuttaa täytäntöönpanoasetuksia (EU) 2018/886 (5) ja (EU) 2020/502 (6) unionin puolesta, jos se katsoo sen tarpeelliseksi ottaakseen huomioon Yhdysvaltojen suojatoimenpiteisiin mahdollisesti tehtävät muutokset tai oikaisut. |
|
(5) |
Yhdysvallat ilmoitti 31 päivänä lokakuuta 2021 seuraavista 1 päivänä tammikuuta 2022 voimaan tulevista muutoksista suojatoimenpiteisiin:
|
|
(6) |
Näin ollen unionin olisi keskeytettävä täytäntöönpanoasetuksilla (EU) 2018/886 ja (EU) 2020/502 käyttöön otettujen arvoon perustuvien lisätullien soveltaminen 31 päivään joulukuuta 2023. Keskeytys olisi tehtävä seuraavasti:
|
|
(7) |
Tämän keskeyttämisen ansiosta unioni ja Yhdysvallat voisivat merkittävästi edistää käynnissä olevaa yhteistyötään, myös niiden soveltamien tullien poistamiseksi. On kuitenkin huomattava, että Yhdysvaltojen toimenpiteitä koskevia poikkeuksia sovellettaisiin ainoastaan 31 päivään joulukuuta 2023. Tällaiset tuojille, jotka tuovat unionin tuotteita Yhdysvaltoihin, myönnettävät poikkeukset vähentävät merkittävästi Yhdysvaltojen suojatoimenpiteiden kielteistä vaikutusta. Tämän vuoksi katsotaan, että soveltamisen keskeyttäminen 31 päivään joulukuuta 2023 on riittävä ja kohtuullinen jakso ja siinä otetaan asianmukaisesti huomioon Yhdysvaltojen 31 päivänä lokakuuta 2021 antamat ilmoitukset. |
|
(8) |
Asetuksen (EU) N:o 654/2014 4 artiklan 2 kohdan c alakohdassa edellytetään, että unionin toimien on olennaisilta osiltaan vastattava niiden myönnytysten tai muiden velvoitteiden tasoa, joihin kolmannen maan suojatoimenpide vaikuttaa. |
|
(9) |
Komission olisi tarkasteltava soveltamisen keskeyttämistä jatkuvasti tilanteen kehittymisen myötä, esimerkiksi sellaisten muutosten varalta, jotka voisivat heikentää tilannetta sellaisen unionin viennin osalta, johon sovelletaan edelleen Yhdysvaltojen suojatoimenpiteitä, mukaan lukien mahdolliset unionin vientiin vaikuttavat esteet. Komissio voi muuttaa tätä asetusta tällaisen kehityksen tai Yhdysvaltojen suojatoimenpiteiden muutosten tai oikaisun huomioon ottamiseksi. |
|
(10) |
Soveltamisen keskeyttäminen ei rajoita unionin kantaa, jonka mukaan Yhdysvaltojen toteuttamat suojatoimenpiteet ovat edelleen ristiriidassa WTO-sopimuksen kanssa. |
|
(11) |
Tässä asetuksessa säädetyt toimenpiteet ovat Euroopan parlamentin ja neuvoston asetuksen (EU) 2015/1843 (7) nojalla perustetun kaupan esteitä käsittelevän komitean lausunnon mukaiset, |
ON HYVÄKSYNYT TÄMÄN ASETUKSEN:
1 artikla
Keskeytetään täytäntöönpanoasetuksen (EU) 2018/886 liitteessä I lueteltujen tuotteiden tuontia koskevien arvoon perustuvien 10 ja 25 prosentin lisätullien soveltaminen 1 päivästä tammikuuta 202231 päivään joulukuuta 2023.
Keskeytetään täytäntöönpanoasetuksen (EU) 2018/886 liitteessä II lueteltujen tuotteiden tuontia koskevien arvoon perustuvien 10, 25, 35 ja 50 prosentin lisätullien soveltaminen 1 päivästä joulukuuta 202131 päivään joulukuuta 2023.
Rajoittamatta mahdollista keskeytyksen jatkamista tai muuttamista, mukaan lukien soveltamisen aloittaminen uudelleen aiemmin, täytäntöönpanoasetuksessa (EU) 2018/886 säädettyjä tulleja sovelletaan uudelleen 1 päivästä tammikuuta 2024.
2 artikla
Keskeytetään täytäntöönpanoasetuksen (EU) 2020/502 soveltaminen 31 päivään joulukuuta 2023 seuraavasti:
|
a) |
täytäntöönpanoasetuksen (EU) 2020/502 1 artiklan 2 kohdan a alakohdassa mainittujen tuotteiden tuontia koskevien arvoon perustuvien 20 ja 7 prosentin lisätullien soveltaminen 1 päivästä tammikuuta 2022; |
|
b) |
täytäntöönpanoasetuksen (EU) 2020/502 1 artiklan 2 kohdan b alakohdassa mainitun tuotteen tuontia koskevan arvoon perustuvan 4,4 prosentin lisätullin soveltaminen 8 päivästä helmikuuta 2023. |
Rajoittamatta mahdollista keskeytyksen jatkamista tai muuttamista, mukaan lukien soveltamisen aloittaminen uudelleen aiemmin, täytäntöönpanoasetuksessa (EU) 2020/502 säädettyjä tulleja sovelletaan uudelleen 1 päivästä tammikuuta 2024.
3 artikla
Tämä asetus tulee voimaan 30 päivänä marraskuuta 2021.
Tämä asetus on kaikilta osiltaan velvoittava, ja sitä sovelletaan sellaisenaan kaikissa jäsenvaltioissa.
Tehty Brysselissä 26 päivänä marraskuuta 2021.
Komission puolesta
Puheenjohtaja
Ursula VON DER LEYEN
(1) EUVL L 189, 27.6.2014, s. 50, muutettu 6 päivänä lokakuuta 2015 annetulla Euroopan parlamentin ja neuvoston asetuksella (EU) 2015/1843 (EUVL L 272, 16.10.2015, s. 1) ja 10 päivänä helmikuuta 2021 annetulla Euroopan parlamentin ja neuvoston asetuksella (EU) 2021/167 (EUVL L 49, 12.2.2021, s. 1).
(2) Komission täytäntöönpanoasetus (EU) 2018/886, annettu 20 päivänä kesäkuuta 2018, Amerikan yhdysvalloista peräisin olevia tiettyjä tuotteita koskevista tietyistä kauppapoliittisista toimenpiteistä ja täytäntöönpanoasetuksen (EU) 2018/724 muuttamisesta (EUVL L 158, 21.6.2018, s. 5).
(3) Komission täytäntöönpanoasetus (EU) 2020/502, annettu 6 päivänä huhtikuuta 2020, Yhdysvalloista peräisin olevia tuotteita koskevista tietyistä kauppapoliittisista toimenpiteistä (EUVL L 109, 7.4.2020, s. 10).
(4) Komission täytäntöönpanoasetus (EU) 2021/866, annettu 28 päivänä toukokuuta 2021, täytäntöönpanoasetuksella (EU) 2018/886 käyttöön otettujen Amerikan yhdysvalloista peräisin olevia tiettyjä tuotteita koskevien kauppapoliittisten toimenpiteiden keskeyttämisestä (EUVL L 190, 31.5.2021, s. 94).
(5) Täytäntöönpanoasetuksen (EU) 2018/886 johdanto-osan 7 kappale.
(6) Täytäntöönpanoasetuksen (EU) 2020/502 johdanto-osan 19 kappale.
(7) Euroopan parlamentin ja neuvoston asetus (EU) 2015/1843, annettu 6 päivänä lokakuuta 2015, unionin menettelyistä yhteisessä kauppapolitiikassa kansainvälisen kaupan säännöissä unionille annettujen, erityisesti Maailman kauppajärjestössä (WTO) käyttöön otettujen oikeuksien käyttämisen varmistamiseksi (EUVL L 272, 16.10.2015, s. 1).