LIITE II
YLEISET VAATIMUKSET 3 ARTIKLASSA SÄÄDETYLLE ASIAKIRJA-AINEISTOLLE
YLEISIÄ NÄKÖKOHTIA
Tässä liitteessä esitetään vaatimukset tutkimuksia koskevalle luettelolle ja kuvaukselle sekä aineita, mikro-organismeja ja valmisteita koskeville tiedoille, jotka on toimitettava asetuksen (EY) N:o 1831/2003 7 artiklassa säädettyjen asiakirjojen mukana haettaessa:
|
— |
hyväksyntää uutena rehun lisäaineena, |
|
— |
hyväksyntää rehun lisäaineen uudelle käytölle, |
|
— |
rehun lisäaineen olemassa olevan hyväksynnän muuttamista tai |
|
— |
rehun lisäaineen hyväksynnän uusimista. |
Toimitettavien asiakirjojen perusteella on voitava suorittaa senhetkiseen tietoon perustuva lisäaineiden arviointi ja varmistaa, että lisäaineet ovat asetuksen (EY) N:o 1831/2003 5 artiklassa hyväksymiselle säädettyjen perusperiaatteiden mukaisia.
Toimitettavat tutkimukset ja niiden laajuus määräytyvät lisäaineen luonteen, luokan ja funktionaalisen ryhmän, hyväksynnän tyypin (ei-haltijakohtainen vs. haltijakohtainen), itse aineen, kohde-eläinten ja käyttöolosuhteiden perusteella. Hakija tutustuu tähän liitteeseen ja liitteeseen III arvioidakseen, mitkä tutkimukset ja tiedot toimitetaan hakemuksen mukana.
Hakijan on perusteltava selkeästi tässä liitteessä, liitteessä III ja liitteessä IV edellytettyjen tietojen jättäminen pois asiakirja-aineistosta tai niistä poikkeaminen.
Asiakirja-aineiston on sisällettävä yksityiskohtaiset raportit kaikista tehdyistä tutkimuksista. Ne on esitettävä tässä liitteessä ehdotetun numerointijärjestelmän mukaisesti. Asiakirja-aineistossa on oltava viittaukset kaikkiin mainittuihin tieteellisiin julkaisuihin ja kopiot niistä sekä kopiot muista olennaisista lausunnoista, jotka tunnustettu tieteellinen laitos on antanut. Jos eurooppalainen tieteellinen laitos on jo arvioinut näitä tutkimuksia yhteisössä voimassa olevan lainsäädännön mukaisesti, riittää viittaus arvioinnin tuloksiin. Aiemmin tehtyihin ja julkaistuihin tutkimuksiin tai vertaisarviointiin perustuvien tietojen on viitattava selkeästi hyväksyntää koskevan hakemuksen kohteena olevaan lisäaineeseen.
Tutkimusten, myös aiemmin tehtyjen ja julkaistujen tai vertaisarviointiin perustuvien tutkimusten, ja tutkimusraporttien teossa tulee noudattaa asianmukaisia laatustandardeja (esim. hyvää laboratoriokäytäntöä eli GLP:tä) hyvän laboratoriokäytännön periaatteiden noudattamista kemiallisten aineiden kokeissa ja periaatteiden noudattamisen todentamista koskevien lakien, asetusten ja hallinnollisten määräysten lähentämisestä 11 päivänä helmikuuta 2004 annetun Euroopan parlamentin ja neuvoston direktiivin 2004/10/EY (1) tai Kansainvälisen standardointijärjestön (ISO) mukaisesti.
Jos in vivo- tai in vitro -tutkimuksia tehdään yhteisön ulkopuolella, hakijan on osoitettava, että kyseiset tutkimuslaitokset noudattavat Taloudellisen yhteistyön ja kehityksen järjestön (OECD) hyvän laboratoriokäytännön periaatteita tai ISO:n standardeja.
Lisäaineen fysikaalis-kemialliset, toksikologiset ja ympäristötoksikologiset ominaisuudet on määritettävä vaarallisten aineiden luokitusta, pakkaamista ja merkintöjä koskevien lakien, asetusten ja hallinnollisten määräysten lähentämisestä 27 päivänä kesäkuuta 1967 annetussa neuvoston direktiivissä 67/548/ETY (2), sellaisena kuin se on viimeksi muutettuna komission direktiivillä 2004/73/EY (3), vahvistettujen menetelmien mukaisesti tai kansainvälisten tieteellisten laitosten hyväksymillä ajantasaistetuilla menetelmillä. Muiden menetelmien käyttö on perusteltava.
On kannustettava in vitro -menetelmien tai sellaisten menetelmien käyttöä, joilla parannetaan tai korvataan tavanomaisia kokeita, joissa käytetään koe-eläimiä, tai vähennetään näissä kokeissa käytettävien eläinten määrää. Tällaisten menetelmien on oltava yhtä laadukkaita ja luotettavia kuin menetelmän, joka niillä on tarkoitus korvata.
Rehun tai veden analyysimenetelmien kuvauksen on vastattava hyvän laboratoriokäytännön sääntöjä, sellaisina kuin ne on vahvistettu direktiivissä 2004/10/EY ja/tai EN ISO/IEC 17025:ssä. Näiden menetelmien on vastattava rehu- ja elintarvikelainsäädännön sekä eläinten terveyttä ja hyvinvointia koskevien sääntöjen mukaisuuden varmistamiseksi suoritetusta virallisesta valvonnasta 29 päivänä huhtikuuta 2004 annetun Euroopan parlamentin ja neuvoston asetuksen (EY) N:o 882/2004 (4) 11 artiklassa asetettuja vaatimuksia.
Jokaiseen asiakirja-aineistoon on sisällyttävä julkinen tiivistelmä ja yksityiskohtainen tieteellinen tiivistelmä kyseisen lisäaineen tunnistamisen ja kuvaamisen mahdollistamiseksi.
Jokaiseen asiakirja-aineistoon on sisällyttävä markkinoille saattamisen jälkeen toteutettavaa seurantaa koskeva ehdotus, jos asetuksen (EY) N:o 1831/2003 7 artiklan 3 kohdan g alakohta sitä edellyttää, ja asetuksen (EY) N:o 1831/2003 7 artiklan 3 kohdan e alakohdassa tarkoitettu pakkausmerkintöjä koskeva ehdotus.
Turvallisuusarviointi
Arviointi perustuu tutkimuksiin, joiden tarkoituksena on osoittaa lisäaineen käytön turvallisuus seuraaville kohteille:
|
a) |
kohde-eläinlajeille suurimpina rehuun tai veteen ehdotettuina pitoisuuksina ja turvamarginaalin määrittämiseksi pitoisuuksina, jotka ylittävät suurimmat ehdotetut pitoisuudet moninkertaisesti; |
|
b) |
kuluttajille, jotka syövät elintarvikkeita, jotka ovat peräisin lisäainetta, sen jäämiä tai aineenvaihduntatuotteita saaneista eläimistä. Tässä tapauksessa turvallisuus varmistetaan asettamalla aineelle jäämien enimmäismäärä (MRL) ja varoaika hyväksyttävän päiväsaannin (ADI-arvo) tai korkeimman haitattoman saantitason (UL-taso) perusteella; |
|
c) |
lisäainetta sellaisenaan tai lisäainetta sisältäviä esiseoksia tai täysrehua tai vettä käsitteleville tai kyseistä lisäainetta sisältävää täysrehua tai vettä käyttäville henkilöille, jotka todennäköisesti altistuvat lisäaineelle, kun sitä joutuu heidän hengitysteihinsä tai limakalvoilleen, silmiinsä tai iholleen; |
|
d) |
eläimille ja ihmisille mikrobilääkeresistenssigeenien valikoitumisen ja leviämisen kautta; |
|
e) |
ympäristölle, kun tarkastellaan lisäaineen tai sen johdannaisen joutumista ympäristöön suoraan tai eläinten eritteiden kautta. |
Jos lisäaine koostuu useista ainesosista, jokaista ainesosaa voidaan arvioida erikseen kuluttajaturvallisuuden kannalta ja ottaa sitten huomioon ainesosien kumulatiivinen vaikutus (jos voidaan osoittaa, etteivät ainesosat ole vuorovaikutuksessa keskenään). Vaihtoehtoisesti on arvioitava koko seosta.
Tehokkuusarviointi
Arviointi perustuu tutkimuksiin, joiden tarkoituksena on osoittaa lisäaineen teho asetuksen (EY) N:o 1831/2003 6 artiklan 1 kohdassa ja liitteessä I määritellyn käyttötarkoituksen osalta.
1. I LUKU: TIIVISTELMÄ ASIAKIRJA-AINEISTOSTA
1.1 Asetuksen (EY) N:o 1831/2003 7 artiklan 3 kohdan h alakohdan mukainen julkinen tiivistelmä
Hakijan on toimitettava tiivistelmä, josta ilmenevät kyseisen lisäaineen tärkeimmät ominaisuudet. Tiivistelmään ei sisällytetä luottamuksellista tietoa, ja se on jäsenneltävä seuraavasti:
1.1.1 Sisältö
|
a) |
hakijan/hakijoiden nimi |
|
b) |
lisäaineen tunnistetiedot |
|
c) |
valmistusmenetelmä ja analyysimenetelmä |
|
d) |
lisäaineen turvallisuutta ja tehoa koskevat tutkimukset |
|
e) |
ehdotetut käyttöedellytykset |
|
f) |
ehdotus markkinoille saattamisen jälkeen toteutettavasta seurannasta. |
1.1.2 Kuvaus
|
a) |
hakijan/hakijoiden nimi ja osoite Nämä tiedot on annettava kaikissa tapauksissa rehun lisäaineen hyväksynnän tyypistä (hakijakohtainen tai ei-hakijakohtainen) riippumatta. Kun asiakirja-aineiston toimittaa ryhmä hakijoita, tähän kohtaan on merkittävä jokaisen hakijan nimi. |
|
b) |
lisäaineen tunnistetiedot Lisäaineen tunnistetietoihin on sisällytettävä tiivistelmä liitteessä II tai III vaadituista tiedoista rehun lisäaineen hyväksynnän tyypin mukaan. Erityisesti lisäaineen nimi, ehdotettu luokittelu luokan ja funktionaalisen ryhmän mukaan, kohde-eläimet/eläinluokat ja annokset. |
|
c) |
valmistusmenetelmä ja analyysimenetelmä Kuvaus valmistusprosessista. Kuvaus niiden menetelmien yleisistä käytännöistä, joita käytetään lisäainetta sellaisenaan ja lisäainetta sisältäviä esiseoksia ja rehuja koskevaa virallista valvontaa varten tehtävässä analyysissa tässä liitteessä ja liitteessä III esitettyjen vaatimusten mukaisesti. Tarvittaessa kuvaukseen on sisällytettävä tässä liitteessä ja liitteessä III annettujen tietojen pohjalta niiden menetelmien menettelytavat, joita käytetään eläinperäisten elintarvikkeiden sisältämiä lisäaineita tai niiden aineenvaihduntatuotteita koskevaa virallista valvontaa varten tehtävässä analyysissa. |
|
d) |
lisäaineen turvallisuutta ja tehoa koskevat tutkimukset On esitettävä tehtyihin eri tutkimuksiin perustuva päätelmä lisäaineen turvallisuudesta ja tehosta. Hakijan päätelmän tueksi voidaan sisällyttää taulukkomuotoiset tutkimustulokset. Tiivistelmässä on esitettävä vain liitteessä III vaaditut tutkimukset. |
|
e) |
ehdotetut käyttöedellytykset Hakijan on esitettävä ehdotus lisäaineen käyttöedellytyksiksi. Hakijan on kuvattava erityisesti lisäaineen pitoisuutta vedessä tai rehussa sekä yksityiskohtaisia edellytyksiä lisäaineen käytölle täydennysrehuissa. Muiden menetelmien mahdollisesta käytöstä lisäaineen käytössä tai lisäämisessä rehuun tai veteen on myös annettava tiedot. Kuvaukseen on sisällytettävä tiedot käyttöä koskevista erityisedellytyksistä (esim. yhteensopimattomuuksista), erityisistä pakkausmerkintöjä koskevista vaatimuksista ja eläinlajeista, joille lisäaine on tarkoitettu. |
|
f) |
ehdotus markkinoille saattamisen jälkeen toteutettavasta seurannasta Tämä osa koskee vain lisäaineita, jotka asetuksen (EY) N:o 1831/2003 7 artiklan 3 kohdan g alakohdan mukaisesti ehdotetaan sijoitettaviksi muuhun kuin saman asetuksen 6 artiklan 1 kohdassa tarkoitettuun a ja b luokkaan, ja tuotteiden markkinoille saattamista koskevan yhteisön lainsäädännön soveltamisalaan kuuluvia, muuntogeenisistä organismeista koostuvia, niitä sisältäviä tai niistä tuotettuja lisäaineita. |
1.2 Tieteellinen tiivistelmä asiakirja-aineistosta
Hakijan on toimitettava tieteellinen tiivistelmä, johon sisältyvät tiedot tämän liitteen ja liitteen III mukaisesti hakemuksen tueksi toimitettujen asiakirjojen kustakin osasta. Tähän tiivistelmään on sisällytettävä hakijan tekemät päätelmät.
Tiivistelmässä on noudatettava tämän liitteen järjestystä ja käsiteltävä kaikkia eri osia, joissa viitataan asiakirja-aineiston olennaisiin sivuihin.
1.3 Luettelo asiakirjoista ja muista tiedoista
Hakijan on ilmoitettava hakemuksensa tueksi toimittamiensa asiakirjaniteiden määrä ja nimet. Luetteloon on lisättävä yksityiskohtainen hakemisto niteistä ja sivuista.
1.4 Tarvittaessa luettelo asiakirja-aineiston osista, joita on pyydetty käsittelemään luottamuksellisina
Luettelossa on mainittava asiakirja-aineiston asianomaiset niteet ja sivut.
2. II LUKU: LISÄAINEEN TUNNISTETIEDOT, OMINAISUUDET JA KÄYTTÖEDELLYTYKSET; ANALYYSIMENETELMÄT
Lisäaineesta on annettava täydelliset tunnistetiedot ja ominaisuudet.
2.1 Lisäaineen tunnistetiedot
2.1.1 Lisäaineen nimi
Hyväksynnän haltijaan sidoksissa olevien lisäaineiden osalta on esitettävä tarvittaessa ehdotus lisäaineen kauppanimeksi.
2.1.2 Luokitteluehdotus
Ehdotus lisäaineen luokittelemisesta yhteen tai useampaan luokkaan ja funktionaaliseen ryhmään sen pääasiallisen käyttötarkoituksen perusteella asetuksen (EY) N:o 1831/2003 6 artiklan ja liitteen I nojalla.
Lisäksi on annettava tiedot muista identtisten vaikuttavien aineiden tunnetuista käyttötavoista (esim. elintarvikkeissa, lääketieteessä tai eläinlääketieteessä, maataloudessa ja teollisuudessa). Lisäaineen muu hyväksyntä rehun tai elintarvikkeiden lisäaineena tai eläinlääkkeenä tai vaikuttavan aineen muut hyväksynnät on eriteltävä.
2.1.3 Laadullinen ja määrällinen koostumus (vaikuttava aine, muut ainesosat, epäpuhtaudet, eräkohtainen vaihtelu)
Luettelo lisäaineen vaikuttavista aineista ja kaikista muista ainesosista paino-osuutena lopputuotteesta. Vaikuttavien aineiden laadullinen ja määrällinen eräkohtainen vaihtelu on määritettävä.
Mikro-organismien osalta on määritettävä elinkelpoisten solujen tai itiöiden määrä, joka ilmaistaan pesäkkeitä muodostavina yksikköinä (CFU) grammassa.
Entsyymien osalta on kuvattava jokainen (pääasiallinen) aktiivisuus ja annettava aktiivisuusyksikköjen määrä lopputuotteessa kunkin aktiivisuuden osalta. Muut entsyymin olennaiset aktiivisuudet on myös mainittava. Lisäksi on määritettävä aktiivisuusyksiköt mieluiten mikromooleina tuotetta, joka vapautuu minuutissa substraattigrammaa tai -litraa kohti, ja ilmoitettava myös pH ja lämpötila.
Jos lisäaineen vaikuttava ainesosa on vaikuttavien aineiden seos, joista kukin on tarkasti määriteltävissä (laadullisesti ja määrällisesti), vaikuttavien aineiden ainesosat on kuvattava erikseen ja ilmoitettava niiden osuudet seoksessa.
Muita seoksia, joissa ainesosia ei voida kuvata yhdellä kemiallisella kaavalla ja/tai joissa kaikkia ainesosia ei voida tunnistaa, on kuvattava seoksen aktiivisuuteen vaikuttavilla ainesosilla ja/tai tyypillisillä pääasiallisilla ainesosilla.
Ellei viranomaisen asetuksen (EY) N:o 1831/2003 8 artiklan 2 kohdan mukaisessa hakemukseen liitettyjen tietojen täydentämistä koskevassa pyynnössä muuta edellytetä, hakija voi jättää pois kuvauksen ainesosista, jotka eivät aiheuta turvallisuusriskejä, eivät ole eläintuotantoon vaikuttavien aineiden, kokkidiostaattien ja histomonostaattien luokkiin kuulumattomien lisäaineiden vaikuttavia aineita ja jotka eivät kuulu asetuksen (EY) N:o 1829/2003 soveltamisalaan. Kaikkien asiakirja-aineistossa mainittujen tutkimusten on joka tapauksessa perustuttava siihen nimenomaiseen lisäaineeseen, jolle haetaan hyväksyntää, ja niissä voidaan antaa tietoa muista mahdollisista valmisteista, joita lisäaineesta voitaisiin valmistaa. Kolmansien osapuolten laatimiin asiakirjoihin sisältyvien omien tunnistetietojen käyttö voidaan sallia. Lisäksi vaaditaan lausunto, jossa luetellaan tunnistetiedot ja vahvistetaan, että tunnistetiedot viittaavat koostumukseen, jolle hyväksyntää haetaan.
2.1.4 Puhtaus
Hakijan on määritettävä ja ilmoitettava lukuina kemialliset ja mikrobiperäiset epäpuhtaudet sekä myrkylliset tai muita ei-toivottuja vaikutuksia omaavat aineet, joita ei ole lisätty tarkoituksellisesti ja jotka eivät edistä lisäaineen toimintaa. Lisäksi käymistuotteiden osalta hakijan on vahvistettava, ettei lisäaine sisällä tuotantokantoina käytettäviä organismeja. Hakijan on kuvattava tuotantoeriin sovellettava saastuttavien aineiden ja epäpuhtauksien seulontakäytäntö.
Kaikkien annettujen tietojen on tuettava lisäaineen määrittelyehdotusta.
Seuraavassa luetellaan erityisvaatimukset, jotka määräytyvät yhteisön voimassa olevan lainsäädännön mukaisen tuotantoprosessin perusteella.
2.1.4.1 Lisäaineet, joiden hyväksyntä on sidoksissa hyväksynnän haltijaan
Niiden lisäaineiden osalta, joiden hyväksyntä on sidoksissa hyväksynnän haltijaan, on annettava olennaiset tiedot valmistajan käyttämästä prosessista muihin vastaaviin tarkoituksiin käytettävien standardien mukaisesti. Tähän tarkoitukseen voidaan käyttää FAO:n ja WHO:n yhteisen elintarvikelisäaineita käsittelevän asiantuntijakomitean (JECFA) eritelmiä tai Euroopan yhteisön elintarvikelisäaineiden hyväksyntiin sisältyviä eritelmiä.
2.1.4.2 Lisäaineet, joiden hyväksyntä ei ole sidoksissa hyväksynnän haltijaan
Niiden rehun lisäaineiden osalta, joiden hyväksyntä ei ole sidoksissa hyväksynnän haltijaan, voidaan käyttää muihin vastaaviin tarkoituksiin käytettäviä standardeja tai JECFA:n eritelmiä tai Euroopan yhteisön elintarvikelisäaineiden hyväksyntiin sisältyviä eritelmiä. Kun tällaisia standardeja ei ole käytettävissä, on annettava ainakin seuraavat tiedot ja määritettävä kyseisten aineiden pitoisuudet, jos nämä aineet ovat olennaisia valmistusprosessin kannalta:
|
— |
mikro-organismien osalta mikrobiologinen kontaminaatio, mykotoksiinit ja raskasmetallit, |
|
— |
käymistuotteiden (jotka eivät sisällä mikro-organismeja vaikuttavina aineina) osalta noudatetaan samoja vaatimuksia kuin mikro-organismituotteiden kohdalla (ks. yllä). Lisäksi on ilmoitettava, miten paljon lopputuote sisältää kasvatusainetta. |
|
— |
kasviperäisten aineiden osalta mikrobiologinen ja kasvitieteellinen kontaminaatio (esim. risiini, rikkaruohojen siemenet ja erityisesti rukiin torajyvä), mykotoksiinit, torjunta-aineista aiheutuva pilaantuminen, liuottimien enimmäisarvot ja tarvittaessa sellaiset toksikologisen riskin aiheuttavat aineet, joita tiedetään esiintyvän alkuperäkasvissa, |
|
— |
eläinperäisten aineiden osalta mikrobiologinen kontaminaatio, raskasmetallit ja tarvittaessa liuottimien enimmäisarvot, |
|
— |
kivennäisaineiden osalta raskasmetallit, dioksiinit ja polyklooribifenyylit (PCB:t), |
|
— |
kemiallisen synteesin ja kemiallisten prosessien avulla valmistettavien tuotteiden osalta on eriteltävä kaikki synteettisissä prosesseissa käytetyt kemikaalit ja lopputuotteen sisältämät välituotteet sekä ilmoitettava niiden pitoisuudet. |
Mykotoksiinien valinta analyysia varten on tehtävä tarvittaessa erilaisten matriisien perusteella.
2.1.5 Kunkin tuotemuodon fysikaalinen olomuoto
Kiinteiden valmisteiden osalta on annettava tiedot hiukkaskokojakaumasta, hiukkasten muodosta, tiheydestä, tilavuuspainosta, mahdollisesta pölyämisestä ja sellaisten prosessien käytöstä, jotka vaikuttavat valmisteen fysikaalisiin ominaisuuksiin. Nestemäisten valmisteiden osalta on annettava tiedot viskositeetistä ja pintajännityksestä. Jos lisäainetta on tarkoitus käyttää vedessä, on osoitettava sen liukoisuus tai levinneisyys.
2.2 Vaikuttavien aineiden ominaispiirteiden kuvaus
2.2.1 Kuvaus
Kuvaus vaikuttavan aineen laadusta. Kuvaukseen on sisällytettävä puhtaus ja aineen alkuperä sekä muut olennaiset ominaispiirteet.
2.2.1.1 Kemialliset aineet
Kemiallisesti tarkkaan määritellyistä aineista on annettava yleisnimi, kemiallinen nimi IUPACin (International Union of Pure and Applied Chemistry) nimistön mukaan, muut kansainvälisesti käytetyt yleisnimet ja lyhenteet ja/tai CAS-numero (Chemical Abstract Service Number). Kuvaukseen on sisällytettävä rakennekaava, molekyylikaava ja molekyylipaino.
Makuaineena käytettävän kemiallisesti määritetyn yhdisteen osalta kuvaukseen on sisällytettävä kemiallisen ryhmän yhteydessä FLAVIS-numero. Kasviuutteiden osalta kuvaukseen on sisällytettävä fytokemialliset markkerit.
Seoksia, joissa aineosia ei voida kuvata yhdellä kemiallisella kaavalla ja/tai kaikkia ainesosia ei voida tunnistaa, on kuvattava ilmoittamalla sen toimintaa edistävät ainesosat ja/tai tyypilliset pääasialliset ainesosat. Lisäksi määritetään merkkiyhdiste, jotta voidaan arvioida seoksen vakautta ja mahdollistaa jäljitettävyys.
Entsyymien ja entsyymivalmisteiden osalta kustakin aktiivisuudesta on annettava IUB:n (International Union of Biochemistry) Enzyme Nomenclature -julkaisun uusimmassa painoksessa ehdotettu numero ja systemaattinen nimi. Aktiivisuuksista, joita ei ole vielä sisällytetty nimikkeistöön, on käytettävä systemaattista nimeä, joka on IUB:n nimikkeistöä koskevien sääntöjen mukainen. Triviaalinimet ovat hyväksyttäviä, edellyttäen että ne ovat yksiselitteisiä, niitä käytetään johdonmukaisesti koko asiakirja-aineistossa ja ne voidaan selkeästi yhdistää systemaattiseen nimeen ja IUB-numeroon ensi kertaa mainittaessa. Kunkin entsyymiaktiivisuuden biologinen alkuperä on mainittava.
Lisäksi on mainittava käymisteitse valmistettujen kemiallisten aineiden tuotantokanta (ks. 2.2.1.2 kohta Mikro-organismit).
2.2.1.2 Mikro-organismit
Kaikista mikro-organismeista, käytetäänpä niitä tuotteena tai tuotantokantana, on ilmoitettava alkuperä.
Tuotteena tai tuotantokantana käytettävistä mikro-organismeista on ilmoitettava tiedot aiemmasta muuntamisesta. Kunkin mikro-organismin nimitys ja taksonominen luokittelu on annettava viimeisimpien kansainvälisessä nimikkeistössä ICN:ssä (International Codes of Nomenclature) julkaistujen tietojen mukaisesti. Mikrobikannat on tallennettava kansainvälisesti tunnustettuun kantakokoelmaan (mieluiten Euroopan unionissa sijaitsevaan), jossa niitä säilytetään lisäaineen hyväksynnän voimassaolon ajan. Hakijan on esitettävä kokoelman antama tallennustodistus, jossa ilmoitetaan tallennusnumero, jolla kantaa säilytetään kokoelmassa. Lisäksi on kuvattava kaikki olennaiset morfologiset, fysiologiset ja molekulaariset ominaisuudet, jotta kannalle voidaan antaa yksilöllinen tunniste ja jotta annetaan keinot sen geneettisen vakauden varmistamiseen. GMO:ien osalta on kuvattava geneettistä muuntelua. Kuvaukseen on sisällytettävä kunkin GMO:n yksilöllinen tunniste, sellaisena kuin siitä säädetään järjestelmän perustamisesta yksilöllisten tunnisteiden kehittämiseksi ja osoittamiseksi muuntogeenisille organismeille 14 päivänä tammikuuta 2004 annetussa komission asetuksessa (EY) N:o 65/2004.
2.2.2 Keskeiset ominaisuudet
2.2.2.1 Kemialliset aineet
Kuvaus aineen fysikaalisista ja kemiallisista ominaisuuksista, joista ilmoitetaan dissosiaatiovakio, pKa, elektrostaattiset ominaisuudet, sulamispiste, kiehumispiste, tiheys, höyrynpaine, liukoisuus veteen ja orgaanisiin liuottimiin, Kow- ja Kd/Koc-arvo, massa- ja absorptiospektri, NMR-spektri, mahdolliset isomeerit sekä tarvittaessa muut olennaiset fysikaaliset ominaisuudet.
Käymisteitse valmistetulla aineella ei saa olla antimikrobista vaikutusta, jolla on merkitystä ihmisille tai eläimille käytettävien antibioottien kannalta.
2.2.2.2 Mikro-organismit
|
— |
Toksiinit ja virulenssitekijät Mikro-organismien osalta on osoitettava, etteivät ne sisällä toksiineja tai virulenssitekijöitä tai ettei niihin liity tällaista riskiä. Sellaiseen taksonomiseen ryhmään, jonka jäsenten tiedetään pystyvän tuottamaan toksiineja tai muita virulenssitekijöitä, kuuluville bakteerikannoille on tehtävä asianmukaiset kokeet, joilla osoitetaan molekyylitasolla ja tarvittaessa solutasolla, ettei aihetta huoleen ole. Mikro-organismikannoille, joiden ilmeisen turvallisesta käytöstä ei ole aiempia kokemuksia ja joiden biologiaa tunnetaan edelleen heikosti, on tehtävä kaikki toksikologiset tutkimukset. |
|
— |
Antibioottien tuotanto ja antibioottiresistenssi Lisäaineina tai tuotantokantana käytettävillä mikro-organismeilla ei saa olla antibioottista aktiivisuutta tai kykyä tuottaa antibioottisia aineita, joilla on merkitystä ihmisille ja eläimille käytettävinä antibiootteina. Mikro-organismikannat, joita on tarkoitus käyttää lisäaineina, eivät saa lisätä eläinten suolistofloorassa ja ympäristössä jo olevien antibioottiresistenssigeenien määrää. Kaikki bakteerikannat on siten testattava lääketieteessä ja eläinlääketieteessä käytettäville antibiooteille kehittyvän resistenssin varalta. Jos resistenssiä havaitaan, määritetään resistenssin geneettinen tausta ja todennäköisyys, jolla resistenssi siirtyy muihin suolistossa oleviin organismeihin. Mikro-organismikantoja, joissa on kehittynyt resistenssi yhdelle tai useammalle mikrobilääkkeelle, ei saa käyttää rehun lisäaineina, ellei voida osoittaa, että resistenssi on kromosomimutaation tulos eikä voi siirtyä. |
2.3 Valmistusmenetelmä, myös mahdolliset erityiskäsittelyt
Kuvaus valmistusmenetelmästä, jotta voidaan määritellä menetelmän kriittiset vaiheet, jotka voivat vaikuttaa vaikuttavan aineen tai lisäaineen puhtauteen. Tuotantoprosessissa käytettävistä kemikaaleista on esitettävä käyttöturvallisuustiedote.
2.3.1 Vaikuttavat aineet
Kuvaus lisäaineen vaikuttavien aineiden valmistuksessa käytetystä tuotantoprosessista (esim. kemiallinen synteesi, käyminen, viljely, orgaanisesta aineesta uuttaminen tai tislaus) tarvittaessa vuokaavion avulla. Kuvaukseen on sisällytettävä käymis-/viljelynesteiden koostumus. Puhdistusmenetelmiä on kuvattava seikkaperäisesti.
Geneettisesti muunneltuihin mikro-organismeihin (GMM), joita käytetään lisäaineiden lähteinä ja kasvatetaan hallituissa olosuhteissa, sovelletaan neuvoston direktiiviä 90/219/EY (5). Kuvaus käymisprosesseista (viljelynesteestä, käymisolosuhteista ja käymistuotteiden jatkojalostuksesta) on sisällytettävä.
2.3.2 Lisäaine
Yksityiskohtainen kuvaus lisäaineen valmistusmenetelmästä. Kuvauksessa on esitettävä lisäaineen valmistuksen keskeiset vaiheet, mukaan luettuna vaikuttavien aineiden ja muiden ainesosien lisääminen, ja lisäainevalmisteeseen vaikuttavat mahdolliset myöhemmät käsittelyvaiheet tarvittaessa vuokaavion avulla.
2.4 Lisäaineen fysikaalis-kemialliset ja teknologiset ominaisuudet
2.4.1 Pysyvyys
Pysyvyyttä mitataan yleensä vaikuttavien aineiden tai niiden aktiivisuuden/elinkelpoisuuden analyyttisellä seurannalla. Entsyymien osalta pysyvyys voidaan määrittää suhteessa katalyyttisen aktiivisuuden menettämiseen, mikro-organismien osalta suhteessa elinkelpoisuuden menettämiseen ja aromiaineiden osalta suhteessa aromin häviämiseen. Muiden kemiallisten seosten/uutteiden pysyvyyttä voidaan arvioida seuraamalla yhden tai useamman sopivan merkkiaineen pitoisuutta.
Lisäaineen pysyvyys
On tutkittava eri ympäristötekijöiden (valon, lämpötilan, pH:n, kosteuden, hapen ja pakkausmateriaalin) vaikutusta lisäaineen eri muotojen pysyvyyteen. Markkinoitavan lisäaineen arvioidun säilyvyysajan on perustuttava ainakin kahteen koetilanteeseen, joissa käytetään lisäaineen todennäköisiä käyttöolosuhteita (esim. 25 oC, suhteellinen ilmankosteus 60 prosenttia ja 40 oC, suhteellinen ilmankosteus 75 prosenttia).
Esiseoksissa ja rehuissa käytettävän lisäaineen pysyvyys
Esiseoksissa ja rehuissa käytettävien lisäaineiden osalta, aromiaineita lukuun ottamatta, lisäaineen eri muotojen pysyvyyttä on tutkittava esiseosten ja rehujen yleisissä valmistus- ja varastointioloissa. Esiseoksilla tehtävien pysyvyystutkimusten on kestettävä vähintään kuusi kuukautta. Pysyvyyttä testataan mieluiten hivenaineita sisältävillä esiseoksilla; muussa tapauksessa lisäaine on varustettava merkinnällä ”ei saa sekoittaa hivenaineiden kanssa”.
Rehuilla tehtävät pysyvyystutkimukset kestävät tavallisesti vähintään kolme kuukautta. Pysyvyys tarkistetaan yleensä väittämässä mainitulle ensisijaiselle eläinlajille annettavasta mäskistä ja rakeistetusta rehusta (rakeistamisen tai muiden käsittelymuotojen vaikutus mukaan luettuna).
Vedessä käytettäviksi tarkoitettujen lisäaineiden osalta lisäaineen eri muotojen pysyvyyttä on tutkittava vedessä todellista käyttöä jäljittelevissä olosuhteissa.
Jos lisäaineen pysyvyys heikkenee, on tarvittaessa kuvattava mahdollisia hajoamistuotteita.
On esitettävä tiedot analyyseista, joissa on analysoitu ainakin yhtä varastointikauden alkaessa ja yhtä sen päättyessä tehtyä havaintoa.
Tutkimuksiin on tarvittaessa sisällytettävä kokeissa käytettyjen esiseosten tai rehujen yksityiskohtainen määrällinen ja laadullinen koostumus.
2.4.2 Homogeenisuus
Rehun lisäaineen (muiden kuin aromiaineiden) tasainen jakautuminen esiseoksissa, rehuissa tai vedessä on osoitettava.
2.4.3 Muut ominaisuudet
Kuvaus lisäaineen muista ominaisuuksista, kuten mahdollisesta pölyämisestä, sähköstaattisista ominaisuuksista tai nesteiden dispergoituvuudesta.
2.4.4 Fysikaalis-kemiallinen yhteensopimattomuus tai vuorovaikutus
Mahdollinen fysikaalis-kemiallinen yhteensopimattomuus tai vuorovaikutus rehujen, kantaja-aineiden, muiden hyväksyttyjen lisäaineiden tai lääkeaineiden kanssa on osoitettava.
2.5 Lisäaineen käyttöedellytykset
2.5.1 Ehdotettu käyttötapa eläinten ruokinnassa
Eläinlajit tai -ryhmät ja ikäryhmä tai tuotantovaihe on ilmoitettava tämän asetuksen liitteessä IV lueteltujen luokkien mukaisesti. Mahdolliset käytön esteet on mainittava. Ehdotettu käyttötapa, rehussa vai vedessä, on määritettävä.
On annettava tiedot ehdotetusta annostustavasta ja -tasosta esiseoksissa, rehuissa tai juomavedessä. Lisäksi on tarvittaessa ilmoitettava ehdotettu annos täysrehussa, aineen annostelun kesto ja varoaika. Ehdotus lisäaineen käytöstä täydennysrehuissa on perusteltava.
2.5.2 Käyttäjien tai työntekijöiden turvallisuuteen liittyvät tiedot
2.5.2.1 Kemialliset aineet
Yksityiskohtaisten järjestelyjen määrittelemisestä ja vahvistamisesta vaarallisia valmisteita koskevaa erityistietojärjestelmää varten direktiivin 88/379/ETY 10 artiklan täytäntöönpanemiseksi 5 päivänä maaliskuuta 1991 annetun komission direktiivin 91/155/ETY (6) vaatimusten mukaisesti laadittu käyttöturvallisuustiedote on esitettävä. Tarvittaessa on ehdotettava toimenpiteitä, jotka koskevat työperäisten riskien torjuntaa ja suojatoimia tuotteen valmistamisen, käsittelyn, jakelun eläimille ja hävittämisen yhteydessä.
2.5.2.2 Mikro-organismit
Työntekijöiden suojelemisesta vaaroilta, jotka liittyvät biologisille tekijöille altistumiseen työssä, 18 päivänä syyskuuta 2000 annetun Euroopan parlamentin ja neuvoston direktiivin 2000/54/EY (7) (seitsemäs direktiivin 89/391/ETY 16 artiklan 1 kohdassa tarkoitettu erityisdirektiivi) mukaisesti laadittu luokittelu on toimitettava. Mikro-organismeista, joita ei ole luokiteltu ryhmään 1 tässä direktiivissä, on annettava tiedot asiakkaille, jotta nämä voivat toteuttaa asianmukaiset työntekijöitään koskevat suojatoimenpiteet, sellaisina kuin ne määritellään mainitun direktiivin 3 artiklan 2 kohdassa.
2.5.2.3 Pakkausmerkintöjä koskevat vaatimukset
Jollei asetuksen (EY) N:o 1831/2003 16 artiklan pakkausmerkintöjä ja pakkauksia koskevista säännöksistä muuta johdu, on esitettävä mahdolliset pakkausmerkintöjä koskevat erityisvaatimukset ja tarpeen mukaan käyttöä ja käsittelyä koskevat erityisedellytykset (myös tunnetut yhteensopimattomuudet ja käytön esteet) sekä ohjeet oikeasta käytöstä.
2.6 Analyysimenetelmät ja vertailunäytteet
Analyysimenetelmät on esitettävä ISO:n suosittelemassa standardimuodossa (ISO 78-2).
Asetuksen (EY) N:o 1831/2003 ja asetuksen (EY) N:o 378/2005 nojalla yhteisön vertailulaboratorio arvioi tähän kohtaan sisällytetyt analyysimenetelmät. Yhteisön vertailulaboratorio toimittaa viranomaiselle arviointiraportin, josta ilmenee näiden menetelmien soveltuvuus hakemuksen kohteena olevan rehun lisäaineen virallisiin tarkastuksiin. Yhteisön vertailulaboratorion arvioinnissa keskitytään 2.6.1 ja 2.6.2 kohdassa eriteltyihin menetelmiin.
Jos hakemuksen kohteena olevalle aineelle on vahvistettu jäämien enimmäismäärä (MRL) yhteisön menettelystä eläinlääkejäämien enimmäismäärien vahvistamiseksi eläinperäisissä elintarvikkeissa 26 päivänä kesäkuuta 1990 annetussa neuvoston asetuksessa (ETY) N:o 2377/90 (8), 2.6.2 kohta ei kuulu yhteisön vertailulaboratorion arvioinnin piiriin. Hakijan on toimitettava 2.6.2 kohtaan sisältyvät samat menetelmät, tiedot ja tosiseikat (olennaiset päivitykset mukaan luettuina) Euroopan lääkevirastolle (EMEA) asetuksen (ETY) N:o 2377/90 liitteen V ja Lääkkeisiin sovellettavat säännöt Euroopan unionissa -julkaisun niteen 8, Notice to Applicants and Guidelines, mukaisesti.
Arviointiin voidaan sisällyttää myös 2.6.3 kohdassa kuvatut analyysimenetelmät, jos yhteisön vertailulaboratorio, viranomainen tai komissio katsoo sen tarpeelliseksi.
Asetuksen (EY) N:o 378/2005 mukaisesti hakijan on lähetettävä vertailunäytteet suoraan yhteisön vertailulaboratoriolle ennen teknisen asiakirja-aineiston arviointia ja korvaavat näytteet ennen viimeistä käyttöpäivää.
Hakijoita kehotetaan tutustumaan yhteisön vertailulaboratorion asetuksen (EY) N:o 378/2005 12 artiklan mukaisesti laatimiin yksityiskohtaisiin ohjeisiin.
2.6.1 Vaikuttavan aineen analyysimenetelmät
On laadittava yksityiskohtainen kuvaus kvalitatiivisista ja tarvittaessa kvantitatiivisista analyysimenetelmistä, joilla määritetään vaikuttavan aineen ehdotettujen enimmäis- tai vähimmäistasojen noudattaminen lisäaineessa, esiseoksissa, rehuissa ja tarvittaessa vedessä.
|
2.6.1.1 |
Näiden menetelmien on täytettävä samat vaatimukset kuin analyysimenetelmien, joita käytetään asetuksen (EY) N:o 882/2004 11 artiklassa säädetyssä virallisessa valvonnassa. Niiden on erityisesti täytettävä ainakin yksi seuraavista vaatimuksista:
|
|
2.6.1.2 |
Menetelmän tai menetelmien yksityiskohtaiseen kuvaukseen on sisällytettävä asianmukaiset asetuksen (EY) N:o 882/2004 liitteessä III määritetyt tunnusomaiset piirteet. |
|
2.6.1.3 |
Sisäisellä validoinnilla validoitujen menetelmien suorituskykyä kuvaavat ominaisuudet on todennettava testaamalla menetelmää toisessa, akkreditoidussa ja riippumattomassa laboratoriossa. Tällaisten testien tulokset toimitetaan yhdessä mahdollisten muiden menetelmän siirrettävyyttä tukevien tietojen kanssa viralliselle valvontalaboratoriolle. Jos toinen laboratorio, joka osallistuu hakijan esittämän dokumentaation arviointiin, osallistuu asetuksessa (EY) N:o 378/2005 säädettyyn yhteisön vertailulaboratoriota avustavaan kansallisten vertailulaboratorioiden muodostamaan yhteenliittymään, sen on lähetettävä heti, kun yhteisön vertailulaboratorio on vastaanottanut hakemuksen, yhteisön vertailulaboratoriolle etunäkökohdistaan ilmoitus, jossa kuvataan sen hakemusta koskevaa työtä, eikä se riippumattomuussyistä osallistu hakemuksen arviointiin. |
|
2.6.1.4 |
Yhteisön vertailulaboratorio voi valita viranomaiselle lähettämäänsä arviointiraporttiin tarkoituksenmukaiset asetuksen (EY) N:o 882/2004 liitteessä III mainitut tunnusomaiset piirteet. |
|
2.6.1.5 |
Erityisiin aineryhmiin (esim. entsyymeihin) sovellettavien menetelmien suorituskykyä koskevat kriteerit löytyvät yhteisön vertailulaboratorion asetuksen (EY) N:o 378/2005 12 artiklan nojalla antamista yksityiskohtaisista ohjeista. |
2.6.2 Analyysimenetelmät lisäaineen jäämien tai niiden aineenvaihduntatuotteiden määrittämiseksi elintarvikkeissa
Yksityiskohtainen kuvaus kvalitatiivisista ja kvantitatiivisista analyysimenetelmistä, joilla määritetään lisäaineen merkkijäämät ja/tai aineenvaihduntatuotteet kohdekudoksessa ja eläintuotteissa.
|
2.6.2.1 |
Näiden menetelmien on täytettävä samat vaatimukset kuin analyysimenetelmien, joita käytetään asetuksen (EY) N:o 882/2004 11 artiklassa säädetyssä virallisessa valvonnassa. Menetelmien on erityisesti täytettävä ainakin yksi 2.6.1.1 kohdassa mainituista vaatimuksista. |
|
2.6.2.2 |
Menetelmän tai menetelmien yksityiskohtaiseen kuvaukseen on sisällytettävä asianmukaiset asetuksen (EY) N:o 882/2004 liitteessä III määritetyt tunnusomaiset piirteet, ja siinä on otettava huomioon komission päätöksessä 2002/657/EY (10) asetetut vaatimukset. Tarvittaessa on otettava huomioon samat suorituskykyä koskevat kriteerit, jotka on vahvistettu neuvoston direktiivissä 96/23/EY säädettyjen elävissä eläimissä ja niistä saatavissa tuotteissa olevien tiettyjen aineiden ja niiden jäämien havaitsemiseen käytettävistä analyysimenetelmistä tehdyissä komission päätöksissä. Kunkin menetelmän määritysraja (LOQ) saa olla enintään puolet vastaavasta jäämien enimmäismäärästä ja on validoitava vähintään asteikolla 0,5–2 kertaa jäämien enimmäismäärä. |
|
2.6.2.3 |
Sisäisellä validoinnilla validoitujen menetelmien suorituskykyä kuvaavat ominaisuudet on todennettava testaamalla menetelmää toisessa, akkreditoidussa ja riippumattomassa laboratoriossa. Tällaisten testien tulokset on esitettävä. Jos toinen laboratorio, joka osallistuu hakijan esittämän dokumentaation arviointiin, osallistuu asetuksessa (EY) N:o 378/2005 säädettyyn yhteisön vertailulaboratoriota avustavaan kansallisten vertailulaboratorioiden muodostamaan yhteenliittymään, sen on lähetettävä heti, kun yhteisön vertailulaboratorio on vastaanottanut hakemuksen, yhteisön vertailulaboratoriolle etunäkökohdistaan ilmoitus, jossa kuvataan sen hakemusta koskevaa työtä, eikä se riippumattomuussyistä osallistu hakemuksen arviointiin. |
|
2.6.2.4 |
Yhteisön vertailulaboratorio voi valita viranomaiselle lähettämäänsä arviointiraporttiin tarkoituksenmukaiset tunnusomaiset piirteet 2.6.2.2 kohdassa mainituista tunnusomaisista piirteistä. |
|
2.6.2.5 |
Erityisiin aineryhmiin (esim. entsyymeihin) sovellettavien menetelmien suorituskykyä koskevat kriteerit löytyvät yhteisön vertailulaboratorion asetuksen (EY) N:o 378/2005 12 artiklan nojalla antamista yksityiskohtaisista ohjeista. |
2.6.3 Lisäaineen tunnistamista ja ominaisuuksia koskevat analyysimenetelmät
Hakijan on kuvattava 2.1.3, 2.1.4, 2.1.5, 2.2.2, 2.4.1, 2.4.2, 2.4.3 ja 2.4.4 kohdassa lueteltujen ominaisuuksien määrittämiseen käytettäviä menetelmiä.
Asetuksen (EY) N:o 1831/2003, sellaisena kuin se on muutettuna asetuksella (EY) N:o 378/2005, liitteen II nojalla tässä kohdassa esitettyjä menetelmiä voidaan myös arvioida, jos viranomainen tai komissio pitää niitä olennaisina hakemuksen arvioinnin kannalta.
On suositeltavaa, että tässä kohdassa kuvatut menetelmät ovat kansainvälisesti tunnustettuja. Menetelmät, joita ei ole tunnustettu kansainvälisesti, on kuvattava kokonaisuudessaan. Näissä tapauksissa tutkimukset on tehtävä akkreditoiduissa ja riippumattomissa laboratorioissa ja dokumentoitava asianmukaisten laatustandardien (esim. direktiivissä 2004/10/EY säädetyn hyvän laboratoriokäytännön tai ISO-standardien) mukaisesti.
Lisäaineen tunnistamiseen ja ominaisuuksien määrittämiseen käytettävien menetelmien on täytettävä samat vaatimukset kuin analyysimenetelmien, joita käytetään asetuksen (EY) N:o 882/2004 11 artiklassa säädetyssä virallisessa valvonnassa, erityisesti lainsäädännöllisten vaatimusten osalta (esim. epäpuhtaudet, ei-toivotut aineet).
3. III LUKU: LISÄAINEEN TURVALLISUUTTA KOSKEVAT TUTKIMUKSET
Tähän lukuun ja asianomaisiin liitteisiin sisällytettyjen tutkimusten tarkoituksena on mahdollistaa seuraavien seikkojen arviointi:
|
— |
lisäaineen turvallisuus kohde-eläinlajeille, |
|
— |
antimikrobiresistenssin valikoitumiseen ja/tai siirtymiseen sekä suolistopatogeenien itsepintaisuuden ja erittymisen lisääntymiseen liittyvät riskit, |
|
— |
kuluttajalle lisäaineita sisältävillä tai lisäaineella käsitellyillä rehuilla ruokituista eläimistä peräisin olevista elintarvikkeista tai lisäaineiden tai niiden aineenvaihduntatuotteiden jäämiä sisältävien elintarvikkeiden syömisestä aiheutuvat riskit, |
|
— |
lisäainetta tai sitä sisältäviä esiseoksia tai rehuja käsitteleville henkilöille aineen joutumisesta hengitysteihin tai muille limakalvoille, silmiin tai iholle aiheutuvat riskit, |
|
— |
lisäaineen tai sen johdannaisten joutumisesta ympäristöön joko suoraan tai eläinten eritteiden kautta syntyvät ympäristöriskit. |
3.1 Lisäaineen käytön turvallisuutta kohde-eläimille koskevat tutkimukset
Tähän lukuun sisällytettyjen tutkimusten tarkoituksena on arvioida seuraavia seikkoja:
|
— |
lisäaineen käytön turvallisuutta kohde-eläinlajeille sinänsä ja |
|
— |
antimikrobiresistenssin valikoitumiseen ja/tai siirtymiseen sekä suolistopatogeenien itsepintaisuuden ja erittymisen lisääntymiseen liittyviä riskejä. |
3.1.1 Sietokokeet kohde-eläinlajeilla
Sietokokeen tarkoituksena on antaa suppea arvio lisäaineen lyhytaikaisesta toksisuudesta kohde-eläimille. Sitä käytetään myös turvamarginaalin määrittämiseen, jos lisäainetta käytetään suositeltua suurempina annoksina. Tällaisia sietokokeita on tehtävä näytön esittämiseksi lisäaineen turvallisuudesta jokaiselle väittämässä mainitulle kohde-eläinlajille tai kohde-eläinryhmälle. Joissain tapauksissa on hyväksyttävää sisällyttää muutamia sietokokeen osatekijöitä yhteen tehokkuuskokeista, edellyttäen että näille kokeille jäljempänä asetetut vaatimukset täyttyvät. Kaikkien tässä luvussa raportoitavien tutkimusten on perustuttava II luvussa kuvattuun lisäaineeseen.
3.1.1.1 Sietokokeen rakenteessa on vähintään kolme ryhmää:
|
— |
ryhmä, jolle ei anneta lisäainetta, |
|
— |
ryhmä, jolle annetaan suurin suositeltu annos, |
|
— |
koeryhmä, jolle annetaan suurimpaan suositeltuun annokseen nähden moninkertainen annos. |
Koeryhmässä lisäainetta annetaan yleensä kymmenkertainen määrä suurimpaan suositeltuun annokseen nähden. Koe-eläinten rutiiniseurannassa on havainnoitava näkyviä merkkejä kliinisistä vaikutuksista, suorituskykyä kuvaavia ominaisuuksia, tuotelaatua silloin, kun sillä on merkitystä, hematologiaa ja veren kemiaa sekä muita muuttujia, jotka todennäköisesti liittyvät lisäaineen biologisiin ominaisuuksiin. Seurannassa on otettava huomioon koe-eläimillä tehdyistä toksikologisista tutkimuksista tunnetut kriittiset päätepisteet (critical end-points). Tässä luvussa on myös kerrottava tehokkuuskokeiden aikana mahdollisesti havaituista kielteisistä vaikutuksista. Sietokokeessa tapahtuneet selittämättömät kuolemat on tutkittava ruumiinavauksella ja tarvittaessa histologisin analyysein.
Jos koe-eläinten voidaan osoittaa sietävän tuotetta satakertaisena määränä suurimpaan suositeltuun annokseen nähden, hematologisia tutkimuksia tai veren kemian rutiinitutkimuksia ei tarvita. Jos tuotetta siedetään vain alle kymmenkertaisena määränä suurimpaan suositeltuun annokseen nähden, tutkimus on suunniteltava siten, että lisäaineelle voidaan laskea turvamarginaali, ja lisäksi on esitettävä muita päätepisteitä (ruumiinavauksella, histologisin analyysein silloin, kun niillä on merkitystä, ja muilla asianmukaisilla kriteereillä).
Joillekin lisäaineille ei niiden toksikologisuudesta ja aineenvaihdunnasta tai käytöstä riippuen ehkä ole tarpeen tehdä sietokokeita.
Käytetyllä koejärjestelyllä on oltava riittävä tilastollinen voima.
3.1.1.2 Sietokokeiden kesto
Taulukko 1
Sietokokeiden kesto: siat
|
Kohde-eläimet |
Tutkimusten kesto |
Kohde-eläinten kuvaus |
|
Imevät porsaat |
14 päivää |
Mieluiten 14 päivän ikäisestä alkaen ja ennen vieroituksen aloittamista |
|
Vieroitetut porsaat |
42 päivää |
42 päivän ajan vieroituksesta |
|
Lihasiat |
42 päivää |
Elopaino tutkimuksen alkaessa ≤ 35 kg |
|
Siitosemakot |
1 sykli |
Keinosiemennyksestä vieroituksen päättymiseen |
Jos hakemus koskee imeviä ja vieroitettuja porsaita, yhdistelmätutkimusta (14 päivää imeville porsaille ja 28 päivää vieroitetuille porsaille) pidetään riittävänä. Jos siedettävyys on osoitettu vieroitetuilla porsailla, erillistä tutkimusta lihasioilla ei tarvita.
Taulukko 2
Sietokokeiden kesto: siipikarja
|
Kohde-eläimet |
Tutkimusten kesto |
Kohde-eläinten kuvaus |
|
Broilerit/kananuorikot |
35 päivää |
Kuoriutumisesta alkaen |
|
Munivat kanat |
56 päivää |
Mieluiten munintakauden ensimmäisen kolmanneksen aikana |
|
Lihakalkkunat |
42 päivää |
Kuoriutumisesta alkaen |
Broilereista tai lihakalkkunoista saatuja siedettävyystietoja voidaan käyttää siedettävyyden osoittamiseen kana- tai kalkkunanuorikoilla tai kyseisten lajien siitoseläimillä.
Taulukko 3
Sietokokeiden kesto: naudat
|
Kohde-eläimet |
Tutkimusten kesto |
Kohde-eläinten kuvaus |
|
Lihavasikat |
28 päivää |
Alkupaino ≤ 70 kg |
|
Kasvatusvasikat; liha- tai siitoskarja |
42 päivää |
|
|
Lypsylehmät |
56 päivää |
|
Jos hakemus koskee kasvatusvasikoita ja lihakarjaa, yhdistelmätutkimusta (28 päivää kullakin kaudella) pidetään riittävänä.
Taulukko 4
Sietokokeiden kesto: lampaat
|
Kohde-eläimet |
Tutkimusten kesto |
Kohde-eläinten kuvaus |
|
Kasvatuslampaat ja lihalampaat |
28 päivää |
|
Taulukko 5
Sietokokeiden kesto: Salmonidae-heimoon kuuluvat kalat ja muut kalat
|
Kohde-eläimet |
Tutkimusten kesto |
Kohde-eläinten kuvaus |
|
Lohi ja taimen |
90 päivää |
|
Vaihtoehtona 90 päivää kestävälle tutkimukselle voitaisiin tehdä tutkimus, jossa kalat kasvattavat alkupainoaan kokeen alussa vähintään kaksinkertaiseksi.
Jos lisäainetta on tarkoitus käyttää vain siitoskantaan, sietokokeet on tehtävä mahdollisimman lähellä lisääntymisaikaa. Sietokokeiden on kestettävä 90 päivää, ja niissä on kiinnitettävä huomiota mädin laatuun ja eloonjääntiin.
Taulukko 6
Sietokokeiden kesto: lemmikkieläimet ja muut kuin elintarviketuotantoon käytettävät eläimet
|
Kohde-eläimet |
Tutkimusten kesto |
Kohde-eläinten kuvaus |
|
Koirat ja kissat |
28 päivää |
|
Taulukko 7
Sietokokeiden kesto: kaniinit
|
Kohde-eläimet |
Tutkimusten kesto |
Kohde-eläinten kuvaus |
|
Broilerikaniinit |
28 päivää |
|
|
Siitoskaniinit |
1 sykli |
Keinosiemennyksestä vieroituksen päättymiseen |
Jos hakemus koskee imeviä ja vieroitettuja kaniineja, 49 päivää kestävä tutkimus (alkaen viikko syntymän jälkeen) katsotaan riittäväksi, ja tutkimuksen on jatkuttava siitoskaniinien vieroitukseen asti.
Jos lisäainetta käytetään tietyn ajan, joka on lyhyempi kuin eläinluokan määritelmässä annettu aika, lisäaineen annostus määräytyy ehdotettujen käyttöolosuhteiden perusteella. Havainnointiajan on kuitenkin oltava vähintään 28 päivää käsittäen asianomaisen päätepisteen (esim. emakoiden osalta elävänä syntyneiden porsaiden määrä, kun tarkastellaan kantoaikaa, tai vieroitettujen porsaiden määrä ja paino, kun tarkastellaan imetysaikaa).
3.1.1.3 Koeolosuhteet
Tutkimuksista on laadittava erilliset raportit, joissa on yksityiskohtaiset tiedot kaikista koeryhmistä. Koeselostus on laadittava huolellisesti kuvausten osalta. Siihen kirjataan erityisesti seuraavat seikat:
|
1) |
Tuotantoyksikkö: sijainti ja koko, ruokinta- ja kasvatusolot sekä ruokintamenetelmä; vedessä elävien lajien osalta tilalla olevien tankkien ja kasvatuskassien koko ja määrä, valaistusolot ja veden laatu, myös veden lämpötila ja suolapitoisuus. |
|
2) |
Eläimet: lajit (ihmisravinnoksi tarkoitettujen vedessä elävien lajien osalta on annettava lajin yleisnimen jälkeen sulkeissa sen latinankielinen nimi), rotu, ikä (vedessä elävien lajien osalta koko), sukupuoli, tunnistaminen, fysiologinen kehitysvaihe ja yleinen terveydentila. |
|
3) |
Kokeiden päivämäärät ja tarkka kesto: suoritettujen tutkimusten päivämäärät ja luonne. |
|
4) |
Ruokinnat: kuvaus rehuannoksien valmistuksesta ja määrällisestä koostumuksesta ilmoittaen käytetyt valmistusaineet, olennaiset ravintoaineet (analyysiarvot) ja energiapitoisuus. Syöntitiedot. |
|
5) |
Vaikuttavien aineiden (ja mahdollisten vertailuaineiden) pitoisuus rehussa on määritettävä tarkastusanalyysillä, jossa käytetään sopivia tunnustettuja menetelmiä. Erien viitenumerot. |
|
6) |
Koe- ja vertailuryhmien määrä ja eläinten määrä kussakin ryhmässä. Eläinten määrän on oltava riittävä tilastollista analyysiä varten. Tilastollisessa arviossa käytetyt menetelmät on mainittava. Raporttiin on sisällytettävä maininnat kaikista kokeessa käytetyistä eläimistä ja/tai koeyksiköistä. Siinä on ilmoitettava tapauksista, joita ei voitu arvioida tietojen puuttumisen tai häviämisen vuoksi. Tällaisten tapausten jakauma eläinryhmittäin on ilmoitettava. |
|
7) |
Kaikista annostelun aiheuttamista haittavaikutuksista yksilöissä ja ryhmissä on ilmoitettava aika ja yleisyys (myös kuvaus tutkimuksessa käytetystä havainnointiohjelmasta). |
|
8) |
Hoidot ja tarvittaessa ennalta ehkäisevät hoidot eivät saa olla vuorovaikutuksessa lisäaineen ehdotetun vaikutustavan kanssa, ja niistä on laadittava erilliset raportit. |
3.1.2 Mikrobitutkimukset
Tutkimuksilla määritetään lisäaineen kyky lisätä ristiresistenssiä lääketieteessä tai eläinlääketieteessä käytettäville antibiooteille, valikoida resistenttejä bakteerikantoja kenttäolosuhteissa kohde-eläinlajeissa, vaikuttaa ruoansulatuskanavassa oleviin opportunistisiin patogeeneihin ja aiheuttaa zoonoottisten mikro-organismien levittämistä tai erittymistä.
Jos vaikuttavilla aineilla on antimikrobista vaikutusta rehussa käytettävänä pitoisuutena, tulee määrittää standardoiduilla menetelmillä niiden pienin mikrobien kasvua estävä pitoisuus (MIC) tärkeiden bakteerilajien osalta. Jos tutkimuksissa todetaan olennaista antimikrobista vaikutusta, määritetään lisäaineen kyky valikoida resistenttejä bakteerikantoja in vitro ja kohde-eläinlajeissa sekä lisätä ristiresistenssiä tärkeille antibiooteille (11).
Kokeet suositellulla käyttötasolla tehdään kaikille mikrobisille lisäaineille ja niille muille lisäaineille, joiden voidaan olettaa vaikuttavan suoliston mikroflooraan. Näillä tutkimuksilla osoitetaan, ettei lisäaineen käyttö luo liikakasvua ja mahdollisesti patogeenisten mikro-organismien leviämistä edistäviä olosuhteita.
Seurannan piiriin kuuluvien mikro-organismien valinta määräytyy kohde-eläinlajien perusteella, mutta seurantaan on sisällytettävä merkittävät zoonoottiset lajit riippumatta siitä, aiheuttavatko ne oireita kohde-eläimillä.
3.2 Lisäaineen käytön turvallisuutta kuluttajille koskevat tutkimukset
Tarkoituksena on arvioida lisäaineen turvallisuutta kuluttajalle ja selvittää lisäaineen tai sen aineenvaihduntatuotteiden mahdolliset jäämät lisäainetta sisältävällä tai lisäaineella käsitellyllä rehulla tai vedellä ruokituista eläimistä peräisin olevissa elintarvikkeissa.
3.2.1 Aineenvaihdunta- ja jäämätutkimukset
Lisäaineen aineenvaihdunnan selvittäminen kohde-eläinlajeissa on ratkaiseva vaihe jäämien tunnistamisessa ja niiden määrän määrittämisessä syötävissä kudoksissa tai lisäainetta sisältävällä rehulla tai vedellä ruokituista eläimistä peräisin olevissa tuotteissa. Hakijan on toimitettava aineen (ja sen aineenvaihduntatuotteiden) imeytymistä, jakautumista, aineenvaihduntaa ja erittymistä koskevat tutkimukset.
Tutkimukset on tehtävä noudattaen kansainvälisesti validoituja koemenetelmiä, EY:n voimassa olevaa lainsäädäntöä tai OECD:n menetelmäohjeita ja hyvää laboratoriokäytäntöä. Tutkimuksissa on noudatettava Euroopan yhteisön lainsäädännössä vahvistettuja eläinten hyvinvointia koskevia sääntöjä, eikä niitä pidä toistaa, ellei se ole välttämätöntä.
Aineenvaihdunta- ja jäämätutkimukset kohde-eläimillä on tehtävä sekoittamalla vaikuttava aihe rehuun (jota ei anneta letkuruokinnassa, ellei sitä ole perusteltu asianmukaisesti).
Aineenvaihduntatuotteiden, joita on yli 10 prosenttia kokonaisjäämästä syötävissä kudoksissa ja tuotteissa ja yli 20 prosenttia kokonaisjäämästä eritteissä, rakenne on tunnistettava. Jos vaikuttavan aineen aineenvaihduntatiellä on mahdollisesti toksikologista merkitystä, aineenvaihduntatuotteet, jotka eivät ylitä edellä mainittuja rajoja, on tunnistettava.
Jäämien kineettiset tutkimukset muodostavat perustan kuluttajien altistumisen laskemiselle sekä tarvittaessa varoajan ja jäämien enimmäismäärien määrittämiselle. Hakijan on esitettävä ehdotus merkkijäämäksi.
Joillekin lisäaineille ei niiden luonteesta tai käytöstä riippuen ehkä ole aina tarpeen tehdä aineenvaihdunta- ja jäämätutkimuksia.
3.2.1.1 Aineenvaihduntatutkimukset
Aineenvaihduntatutkimusten tarkoituksena on arvioida lisäaineen imeytymistä, jakautumista, biomuuntumista ja erittymistä kohde-eläinlajeissa.
Seuraavat tutkimukset vaaditaan:
|
1) |
aineen metabolinen tasapaino yhden vaikuttavan aineen annoksen, joka vastaa ehdotettuja käyttöannoksia (päivittäistä saantia vastaava kokonaismäärä), ja mahdollisesti moninkertaisen annoksen (jos perusteltua) jälkeen imeytymisen, jakautumisen (plasmassa/veressä) ja erityksen likimääräisen nopeuden ja määrän arvioimiseksi (virtsan, sapen, ulosteiden, maidon tai munien, uloshengitysilman, kidusten kautta) tarvittaessa koiras- ja naaraspuolisilla eläimillä; |
|
2) |
metaboliaprofiili, aineenvaihduntatuotteet tunnistetaan eritteistä ja kudoksista ja niiden jakaantuminen kudoksissa ja tuotteissa selvitetään leimatun aineen toistuvien annosten antamisen jälkeen eläimille (aineenvaihdunnan) tasapainotilan, jota plasmatasot osoittavat, saavuttamiseksi. Käytetyn annoksen on vastattava suurinta ehdotettua käyttöannosta, ja se on sekoitettava rehuun. |
3.2.1.2 Jäämätutkimukset
Tutkimuksissa on kiinnitettävä huomiota uuttamattomien jäämien määrään ja luonteeseen syötävissä kudoksissa tai tuotteissa.
Jäämätutkimukset vaaditaan kaikista aineista, joista tarvitaan aineenvaihduntatutkimukset.
Jos aine on kehon nesteiden tai kudosten luonnollinen ainesosa tai sitä esiintyy luontaisesti merkittävinä määrinä elintarvikkeissa tai rehuissa, jäämätutkimuksia koskeva vaatimus koskee pelkästään kudoksen/tuotetasojen vertailua käsittelemättömässä ryhmässä ja ryhmässä, jolle annetaan ainetta suurimpana väitteessä mainittuna annoksena.
Tärkeimpien lajien osalta tutkimuksissa on samanaikaisesti arvioitava toksikologisesti merkittäviä kokonaisjäämiä ja tunnistettava vaikuttavan aineen merkkijäämä syötävissä kudoksissa (maksa, munuaiset, lihas, iho, iho + rasva) ja tuotteissa (maito, munat ja hunaja). Merkkijäämä on kokeeseen valittu jäämä, jonka pitoisuudella tiedetään olevan yhteys toksikologisesti merkittävään kokonaisjäämään kudoksissa. Tutkimuksissa on myös osoitettava jäämien pysyvyys kudoksissa tai tuotteissa riittävän varoajan määrittämiseksi.
Varoajan määrittämistä varten ehdotetaan eläinten, joista otetaan näyte, ja/tai tuotteiden vähimmäismääräksi kunkin aikapisteen yhteydessä seuraavia:
|
— |
syötävät kudokset:
|
|
— |
tuotteet:
|
Näytteenotossa on otettava huomioon asianmukainen sukupuolijakauma.
Jäämien mittauksessa ei sovelleta varoaikaa (tasapainotila) ja käytetään vähintään kolmea muuta aikapistettä.
Hakijan on esitettävä ehdotus merkkijäämäksi.
Aineen imeytymistä, jakautumista ja erittymistä sekä pääasiallisten aineenvaihduntatuotteiden tunnistamista koskevat tutkimukset on tehtävä koe-eläinlajeilla, joilla on saatu alhaisin haitaton vaikutustaso (NOAEL), tai ellei niitä ole käytettävissä, rotilla (molemmilla sukupuolilla). Joistakin kohde-eläimessä muodostuvista aineenvaihduntatuotteista voidaan vaatia lisätutkimuksia, ellei niitä muodostu merkittävissä määrin koe-eläinlajissa.
3.2.1.3 Aineenvaihdunta- ja jakautumistutkimukset
On tehtävä aineenvaihduntatutkimus, jossa tarkastellaan aineen metaboliatasapainoa, metaboliaprofiilia ja tunnistetaan päämetaboliitit virtsassa ja ulosteissa. Lisätietoja vaaditaan, jos toisella koe-eläinlajilla havaitaan merkittävä ero herkkyydessä rottaan nähden.
3.2.1.4 Jäämien biosaatavuus
Arvioitaessa eläinperäisissä tuotteissa olevien sitoutuneiden jäämien riskiä kuluttajille voidaan ottaa huomioon myös turvallisuuskerroin, joka perustuu jäämien biosaatavuuden määrittämiseen sopivia koe-eläimiä ja yleisesti hyväksyttyjä menetelmiä käyttäen.
3.2.2 Toksikologiset tutkimukset
Lisäaineen turvallisuutta arvioidaan koe-eläimillä in vitro- ja in vivo -kokeilla tehtyjen toksikologisten tutkimusten perusteella. Niissä arvioidaan yleensä seuraavia seikkoja:
|
1) |
akuuttia toksisuutta; |
|
2) |
genotoksisuutta (mutageenisyyttä, klastogeenisyyttä); |
|
3) |
subkroonista oraalista toksisuutta; |
|
4) |
kroonista oraalista toksisuutta/karsinogeenisyyttä; |
|
5) |
lisääntymistoksisuutta, myös teratogeenisyyttä; |
|
6) |
muita tutkimuksia. |
Vaikuttavan aineen ja sen jäämien turvallisuuden arvioinnin kannalta tarpeellisia lisätietoja on hankittava tarvittaessa lisätutkimuksin.
Näiden tutkimusten tulosten perusteella on vahvistettava toksikologinen haitaton vaikutustaso.
Joistakin kohde-eläimessä muodostuvista aineenvaihduntatuotteista voidaan vaatia lisätutkimuksia, ellei niitä muodostu merkittävissä määrin koe-eläinlajissa. Jos ihmisillä tehtyjä aineenvaihduntatutkimuksia on käytettävissä, niiden tiedot on otettava huomioon päätettäessä mahdollisten lisätutkimusten luonteesta.
Toksikologiset tutkimukset on tehtävä vaikuttavalla aineella. Jos vaikuttavaa ainetta on käymistuotteessa, käymistuote on testattava. Testatun käymistuotteen on oltava sama kuin kaupallisessa tuotteessa käytetyn.
Tutkimukset on tehtävä noudattaen kansainvälisesti validoituja koemenetelmiä, EY:n voimassa olevaa lainsäädäntöä tai OECD:n menetelmäohjeita ja hyvää laboratoriokäytäntöä. Tutkimuksissa, joissa käytetään koe-eläimiä, on noudatettava Euroopan yhteisön lainsäädännössä vahvistettuja eläinten hyvinvointia koskevia sääntöjä, eikä niitä pidä toistaa, ellei se ole välttämätöntä.
3.2.2.1 Akuutti toksisuus
Ainesosan toksisuuden luokittelua ja suppeaa kuvausta varten on tehtävä akuutin toksisuuden tutkimuksia.
Akuutti toksisuus on tutkittava vähintään kahdella nisäkäslajilla. Yksi koe-eläinlaji voidaan korvata kohde-eläinlajilla, jos tämä on tarkoituksenmukaista.
Tarkkaa LD50-arvoa ei tarvitse määrittää; pienimmän tappavan annoksen likimääräinen määrittäminen riittää. Enimmäisannos ei saa ylittää 2 000 mg elopainokiloa kohti.
Akuutin toksisuuden annoskokeisiin kehitetään jatkuvasti uusia tutkimussuunnitelmia niissä käytettävien eläinten määrän ja kärsimysten vähentämiseksi. Näiden uusien menettelyjen mukaisesti suoritetut tutkimukset hyväksytään, jos ne on validoitu asianmukaisesti.
Tutkimuksissa on noudatettava OECD:n ohjeita nro 402 (akuutti myrkyllisyys ihon kautta), 420 (yhden annoksen menetelmä), 423 (akuutin toksisuusluokan menetelmä) ja 425 (ylös-alas-menetelmä).
3.2.2.2 Genotoksisuustutkimukset, mm. mutageenisyystutkimus
Vaikuttavien aineiden ja tarvittaessa niiden aineenvaihdunta- ja hajoamistuotteiden mutageenisten ja genotoksisten ominaisuuksien tunnistamiseksi on tehtävä erilaisten genotoksisuuskokeiden yhdistelmä. Kokeet on tarvittaessa tehtävä sekä ilman nisäkäsperäistä metaboliaa aktivoivaa valmistetta että sen kanssa, ja niissä on otettava huomioon näytteen yhteensopivuus testausjärjestelmän kanssa.
Kokeiden ydinjoukko käsittää seuraavat kokeet:
|
1) |
geenimutaatioiden aikaansaaminen bakteereissa ja/tai nisäkässoluissa (mieluiten hiiren lymfooma tk -koe); |
|
2) |
kromosomipoikkeavuuksien aikaansaaminen nisäkässoluissa; |
|
3) |
in vivo -koe nisäkkäillä. |
Edellä mainittujen kokeiden tulokset yhdessä aineen koko toksisuusprofiilin ja käyttötarkoituksen kanssa saattavat antaa aihetta lisäkokeisiin.
Tutkimussuunnitelmien on vastattava OECD:n ohjeita nro 471 (takaisinmutaatiotesti Salmonella typhimurium -bakteerilla), 472 (takaisinmutaatiotesti Escherichia coli -bakteerilla), 473 (in vitro -kromosomipoikkeavuustesti nisäkkäällä), 474 (mikrotumatesti nisäkkäällä), 475 (luuytimen kromosomipoikkeavuustesti nisäkkäällä), 476 (in vitro -geenimutaatiotesti nisäkässoluilla) tai 482 (ennakoimaton DNA-synteesi in vitro nisäkässoluilla) sekä muita merkityksellisiä OECD:n ohjeita in vitro- ja in vivo -kokeista.
3.2.2.3 Subkrooniset toistetun annoksen oraaliset toksisuuskokeet
Vaikuttavan aineen mahdollisen subkroonisen toksisuuden tutkimiseksi on tehtävä ainakin yksi, vähintään 90 päivää kestävä tutkimus jyrsijälajilla. Jos katsotaan tarpeelliseksi, on tehtävä toinen tutkimus eläinlajilla, joka ei ole jyrsijä. Annosvastesuhteen määrittämiseksi on testiainetta annettava suun kautta vähintään kolmena erisuuruisena annoksena kontrolliryhmän lisäksi. Käytetyn enimmäisannoksen on tavallisesti aiheutettava haittavaikutuksia. Alimmalla annostasolla toksisuudesta ei saisi olla mitään merkkejä.
Tutkimussuunnitelmien on vastattava OECD:n ohjetta nro 408 (jyrsijät) tai 409 (muut kuin jyrsijät).
3.2.2.4 Krooniset oraaliset toksisuuskokeet (myös karsinogeenisyystutkimukset)
Aineen mahdollisen kroonisen toksisuuden ja karsinogeenisyyden tutkimiseksi on tehtävä krooninen oraalinen toksisuuskoe vähintään yhdellä eläinlajilla, ja kokeen on kestettävä vähintään 12 kuukautta. Valittujen eläinlajien on oltava tarkoitukseen parhaiten sopivat kaikkien käytettävissä olevien tieteellisten tietojen perusteella, mukaan luettuina 90 päivän tutkimusten tulokset. Oletuseläinlaji on rotta. Jos pyydetään tekemään toinen tutkimus, siinä on käytettävä jyrsijää tai nisäkästä, joka ei ole jyrsijä. Annosvastesuhteen määrittämiseksi on testiainetta annettava suun kautta vähintään kolmena erisuuruisena annoksena kontrolliryhmän lisäksi.
Jos kroonisen toksisuuden tutkimukseen yhdistetään karsinogeenisyystutkimus, tutkimuksen kestoa pidennetään 18 kuukauteen hiirillä ja hamstereilla ja 24 kuukauteen rotilla.
Karsinogeenisyystutkimuksia ei välttämättä tarvita, jos vaikuttavalla aineella ja sen aineenvaihduntatuotteilla on seuraavat ominaisuudet:
|
1) |
ne antavat genotoksisuuskokeissa johdonmukaisesti negatiivisia tuloksia; |
|
2) |
ne eivät muistuta rakenteeltaan tunnettuja karsinogeeneja; |
|
3) |
kroonisissa toksisuuskokeissa ei ilmene vaikutuksia, jotka viittaisivat mahdolliseen (pre)neoplasiaan. |
Tutkimussuunnitelmien on vastattava OECD:n ohjetta nro 452 (krooninen toksisuustutkimus) tai 453 (yhdistetty krooninen toksisuus- ja karsinogeenisyystutkimus).
3.2.2.5 Lisääntymistoksisuustutkimukset (myös kehitystoksisuus)
Jotta tunnistetaan vaikuttavan aineen annostelusta aiheutuva uros- tai naaraspuolisten lisääntymistoimintojen mahdollinen huonontuminen tai haitalliset vaikutukset jälkeläisiin, on tehtävä seuraavat lisääntymistoimintoja koskevat tutkimukset:
|
1) |
kahden sukupolven lisääntymistoksisuustutkimus; |
|
2) |
kehitystoksisuustutkimus (teratogeenisyystutkimus). |
Uusissa kokeissa voidaan käyttää validoituja vaihtoehtoisia menetelmiä, joilla vähennetään koe-eläinten käyttöä.
3.2.2.5.1. Kahden sukupolven lisääntymistoksisuustutkimus
On tehtävä vähintään kaksi perättäistä sukupolvea (F1, F2) kattavia, lisääntymiskykyä koskevia tutkimuksia vähintään yhdellä eläinlajilla, joka on yleensä jyrsijä. Niiden yhteydessä voidaan tehdä teratogeenisyystutkimus. Tutkittavaa ainetta on annettava suun kautta uroksille ja naaraille sopivana ajankohtana ennen parittelua. Aineen antamista on jatkettava, kunnes F2-sukupolven yksilöt vieroitetaan.
Kaikki hedelmällisyyteen, tiineyteen, synnytykseen, emon käyttäytymiseen, imetykseen, F1-sukupolven poikasten kasvuun ja kehitykseen hedelmöityksestä sukukypsyyteen sekä F1-sukupolven jälkeläisten (F2) kehitykseen vieroitukseen asti liittyvät tekijät on huolellisesti tutkittava ja niistä on raportoitava. Lisääntymistoksisuustutkimuksen suunnitelmien on vastattava OECD:n ohjetta nro 416.
3.2.2.5.2. Kehitystoksisuustutkimus (teratogeenisyystutkimus)
Tavoitteena on havaita implantaatiosta seuraavan altistumisen mahdolliset kielteiset vaikutukset tiineenä olevaan naaraaseen sekä alkion ja sikiön kehitykseen koko tiineyden ajan. Tällaisia vaikutuksia ovat muun muassa lisääntynyt toksisuus tiineinä olevissa naaraissa, alkion tai sikiön tuhoutuminen, sikiön kasvuhäiriöt sekä sikiön rakenteelliset poikkeavuudet.
Ensimmäiseen tutkimukseen valittava eläinlaji on yleensä rotta. Jos tutkimuksen tulos on teratogeenisyyden osalta kielteinen tai epäselvä, on tehtävä toinen kehitystoksisuustutkimus toisella eläinlajilla, mieluiten kaniinilla. Jos rottatutkimus antaa myönteisen tuloksen teratogeenisyyden osalta, toisella eläinlajilla tehtävää tutkimusta ei tarvita, paitsi jos kaikkien keskeisten tutkimusten tarkastelu osoittaa, että aineen hyväksyttävä päiväsaanti perustuisi rotilla havaittuun teratogeenisyyteen. Tässä tapauksessa tarvitaan toisella eläinlajilla tehtävä tutkimus herkimmän eläinlajin määrittämiseksi tätä päätepistettä varten. Tutkimussuunnitelmien on vastattava OECD:n ohjetta nro 414.
3.2.2.6 Muut erityiset toksikologiset ja farmakologiset tutkimukset
Vaikuttavan aineen ja sen jäämien turvallisuuden arvioinnin kannalta hyödyllisiä lisätietoja on hankittava tarvittaessa lisätutkimuksin. Tällaisissa tutkimuksissa voidaan tarkastella muun muassa aineen farmakologisia vaikutuksia, vaikutuksia nuoriin (ei sukukypsiin) eläimiin, immunotoksisuutta tai neurotoksisuutta.
3.2.2.7 Haitattoman vaikutustason (NOAEL-arvon) määrittäminen
NOAEL-arvo perustuu yleensä aineen toksikologisiin vaikutuksiin, mutta farmakologiset vaikutukset voivat joissain tapauksissa soveltua tähän tarkoitukseen paremmin.
NOAEL-arvoksi on valittava alhaisin haitaton vaikutustaso. Kun aineelle määritetään alhaisinta NOAEL-arvoa, on otettava huomioon kaikki edellä kuvattujen kokeiden tulokset ja muut aiheeseen liittyvät julkaisut (myös tiedot vaikuttavan aineen vaikutuksista ihmiseen) sekä mahdollisesti tiedot kemialliselta rakenteeltaan samankaltaisista aineista. NOAEL-arvo ilmaistaan milligrammoina elopainokiloa ja päivää kohti.
3.2.3 Kuluttajaturvallisuuden arviointi
Kuluttajaturvallisuutta arvioidaan vertaamalla lisäaineen tai sen aineenvaihduntatuotteiden vahvistettua hyväksyttävää päiväsaantia (ADI-arvoa) ja laskettua teoreettista saantia elintarvikkeista. Vitamiinien ja hivenaineiden kohdalla ADI-arvon tilalla voidaan käyttää korkeinta haitatonta saantitasoa (UL-tasoa).
3.2.3.1 Ehdotus vaikuttavan aineen hyväksyttäväksi päiväsaanniksi (ADI-arvoksi)
ADI-arvo (lisäaineen tai siihen liittyvän aineen määrä milligrammoina henkeä kohti päivässä) määritetään jakamalla alhaisin NOAEL-arvo (milligrammaa elopainokiloa kohti) sopivalla turvallisuuskertoimella ja kertomalla osamäärä ihmisen keskipainolla 60 kg.
ADI-arvoa on ehdotettava, kun se on tarkoituksenmukaista. ADI-arvo voi myös olla ”määrittelemätön” eläinkokeissa todetun alhaisen toksisuuden vuoksi. ADI-arvoa ei ehdoteta, jos aineella on ihmisen kannalta merkityksellisiä genotoksisia tai karsinogeenisia ominaisuuksia.
ADI-arvon määrittäminen edellyttää yleensä vaikuttavan aineen metabolian samankaltaisuutta kohde-eläimissä ja koe-eläimissä (ks. 3.2.1.4 Jäämien biosaatavuus), millä varmistetaan, että kuluttajat altistuvat samoille jäämille kuin toksikologisissa tutkimuksissa käytetyt koe-eläimet. Ellei näin ole, ADI-arvo on kuitenkin mahdollista määrittää tekemällä lisätutkimuksia toisella koe-eläinlajilla tai kohde-eläinlajille ominaisilla aineenvaihduntatuotteilla.
Lisäaineen ADI-arvon määrittämisessä käytettävässä turvallisuuskertoimessa on otettava huomioon NOAEL-arvon määrittämiseen käytettyjen biologisten vaikutusten luonne ja tietojen laatu, näiden vaikutusten merkitys ihmisen kannalta ja niiden ohimenevyys sekä mahdolliset tiedot jäämien välittömistä vaikutuksista ihmisessä.
ADI-arvon laskemisessa on käytettävä turvallisuuskerrointa, jonka arvo on vähintään 100 (jos kaikki toksikologiset tiedot on toimitettu). Kun vaikuttavan aineen vaikutuksista ihmiseen on tietoja, saatetaan hyväksyä pienempi turvallisuuskerroin. Korkeampia turvallisuuskertoimia voidaan käyttää, kun tiedoissa on muita epävarmuustekijöitä tai kun NOAEL-arvo määritetään tietyn kriittisen päätepisteen, kuten teratogeenisyyden, perusteella.
3.2.3.2 Haitaton saantitaso (UL-taso)
Joidenkin lisäaineiden kohdalla saattaa olla tarkoituksenmukaisempaa perustaa turvallisuusarvio UL-tasoon, joka on ravintoaineen jatkuvan päivittäisen saannin enimmäistaso (kaikista lähteistä) ja joka ei (kansallisten tai kansainvälisten tieteellisten laitosten arvion mukaan) todennäköisesti aiheuta haitallisten terveysvaikutusten riskiä kuluttajille tai tietyille kuluttajaryhmille.
Asiakirja-aineistoon sisältyvillä tiedoilla on osoitettava, ettei lisäaineen käyttö johda tilanteeseen, jossa UL-taso voitaisiin ylittää ravintoaineen kaikki mahdolliset lähteet huomioon ottaen.
Jos ravitsemuksellisen lisäaineen tai sen aineenvaihduntatuotteiden jäämätasot eläinperäisissä tuotteissa ovat korkeammat kuin tasot, joita pidetään normaaleina tai joita odotetaan näiltä tuotteilta, tämä on ilmoitettava selkeästi.
3.2.3.3 Kuluttajien altistuminen
Kuluttajan lisäaineen ja/tai sen aineenvaihduntatuotteiden kokonaissaanti kaikista lähteistä ei saa ylittää ADI-arvoa tai UL-tasoa.
Eläinperäisten elintarvikkeiden sisältämän lisäaineen teoreettisen saannin laskemisessa on otettava huomioon pitoisuus (kokonaisjäämien aritmeettinen keskiarvo ja korkein yksittäinen arvo), joka on mitattu kudoksissa ja tuotteissa lisäaineen käytön päättyessä. Lisäksi on tarvittaessa määritettävä eri varoaikoja käyttäen ihmisen päivittäistä ravinnonsaantia koskevat arvot pahimman mahdollisen tapauksen perusteella.
Useille eläinlajeille tarkoitettujen lisäaineiden osalta kudoksista aiheutuva altistuminen on laskettava erikseen nisäkkäille, linnuille ja kaloille ja arvoksi otetaan korkein arvo. Tähän lukuun on tarvittaessa lisättävä maidon ja munien aiheuttama altistuminen. Esimerkiksi jos lisäainetta annetaan imettäville nisäkkäille ja muniville linnuille, kunkin lajin syötävää kudosta koskevat korkeimmat arvot lisätään maidon ja munien kulutusta koskevaan arvoon. Jos lisäainetta annetaan kaloille ja muniville linnuille ja imettäville nisäkkäille, kunkin lajin syötävää kudosta koskevat korkeimmat arvot lisätään munien ja maidon kulutusta koskevaan arvoon. Muita yhdistelmiä on muodostettava samalla tavalla.
Tietyissä tilanteissa (esim. joidenkin ravitsemuksellisten ja sensoristen lisäaineiden tai toissijaisille eläinlajeille tarkoitettujen lisäaineiden kohdalla) saattaa olla tarkoituksenmukaista tarkentaa myöhemmin ihmisten altistumista koskevaa arviota käyttäen realistisempia kulutuslukuja mutta noudattaen edelleen varovaisinta lähestymistapaa. Jos tämä on mahdollista, sen on perustuttava yhteisön tietoihin.
Taulukko 1
Ihmisen teoreettiset päivittäiset kulutusluvut (grammaa kudosta tai tuotetta)
|
|
Nisäkkäät |
Linnut |
Kalat |
Muut |
|
Lihas |
300 |
300 |
300 (12) |
|
|
Maksa |
100 |
100 |
— |
|
|
Munuainen |
50 |
10 |
— |
|
|
Rasva |
50 (13) |
90 (14) |
— |
|
|
+Maito |
1 500 |
— |
— |
|
|
+Munat |
— |
100 |
— |
|
|
+Hunaja |
|
|
|
20 |
3.2.3.4 Ehdotus jäämien enimmäismääriksi (MRL-arvoiksi)
Jäämien enimmäismäärä tarkoittaa jäämien enimmäispitoisuutta (merkkijäämän määrä mikrogrammoina kilogrammassa syötävän kudoksen tuorepainoa tai tuotetta), jonka yhteisö voi hyväksyä laillisesti sallittavaksi tai hyväksytyksi tunnustettavaksi elintarvikkeissa. Jäämien enimmäismäärä perustuu sellaiseen jäämätyyppiin ja jäämän määrään, josta ei katsota olevan toksikologista vaaraa ihmisten terveydelle, ADI-arvona ilmoitettuna. MRL-arvoa ei voida määrittää ilman ADI-arvoa.
Rehun lisäaineiden jäämien enimmäismääriä vahvistettaessa on otettava huomioon myös muista lähteistä (esim. kasviperäisistä elintarvikkeista) peräisin olevat jäämät. Lisäksi MRL-arvoa voidaan alentaa vastaamaan rehun lisäaineiden käyttöolosuhteita siinä määrin kuin käytännön analyyttisiä menetelmiä on käytettävissä.
Tarvittaessa on asetettava yksittäiset MRL-arvot (ilmaistuna merkkijäämän määrällä milligrammoina kilogrammassa syötävää käsittelemätöntä kudosta tai tuotetta) kohde-eläinlajin eri kudoksille tai tuotteille. Eri kudosten tai tuotteiden MRL-arvojen on kuvastettava jäämien poistumiskinetiikkaa ja jäämämäärien vaihtelevuutta eläinlajin käytettäviksi tarkoitetuissa kudoksissa tai tuotteissa. Vaihtelevuutta on yleensä kuvattava käyttämällä keskiarvon 95 prosentin luotettavuustasoa. Jos luotettavuustasoa ei voida laskea näytteiden vähäisen määrän vuoksi, vaihtelevuutta ilmaistaan käyttämällä sen sijaan korkeinta yksittäistä arvoa.
Kokkidiostaattien ja histomonostaattien jäämien enimmäismääriä koskevissa tutkimuksissa on noudatettava asianomaisia eläinlääkkeitä koskevia voimassa olevia sääntöjä (Lääkkeisiin sovellettavat säännöt Euroopan unionissa -julkaisun nide 8 Notice to applicants and guidelines. Veterinary medicinal products. Establishment of maximum residue limits (MRLs) for residues of veterinary medicinal products in foodstuffs of animal origin, lokakuu 2005).
Tutkimukset, joita mahdollisesti tarvitaan jäämien enimmäismäärien asettamiseksi muille lisäaineiden luokille kuin kokkidiostaateille ja histomonostaateille, on esitettävä tämän liitteen mukaisesti.
Kokonaisjäämiä (kuten laskettu 3.2.3.3 kohdassa) koskevan kuluttajien altistumisen määrittämiseksi eri kudoksille tai tuotteille ehdotetuissa MRL-arvoissa on otettava huomioon merkkijäämän ja kokonaisjäämän suhde (taulukko 2).
Taulukko 2:
MRL-arvon määrittämisessä käytetyt määritelmät
|
i-j |
Yksittäiset kudokset tai tuotteet (maksa, munuainen, lihas, nahka + rasva, maito, munat, hunaja) eri ajankohtina |
|
MRLi-j |
Jäämän enimmäismäärä kudoksissa tai tuotteissa (milligrammaa merkkiainetta kilogrammassa -1) |
|
Qti-j |
Taulukossa 1 määritetty yksittäisten kudosten tai tuotteiden päivittäinen kulutus ihmisillä (kg) tai tarkennettu kulutus |
|
TRCi-j |
Kokonaisjäämän pitoisuus yksittäisissä kudoksissa tai tuotteissa (milligrammaa kilogrammassa-1) |
|
MRCi-j |
Merkkijäämän pitoisuus yksittäisissä kudoksissa tai tuotteissa (milligrammaa kilogrammassa-1) |
|
RMTRi-j |
MRCi-j-arvon ja TRCi-j-arvon suhde yksittäisissä kudoksissa tai tuotteissa |
|
DITRi-j |
Kokonaisjäämistä (mg) laskettu yksittäisten kudosten tai tuotteiden saanti ravinnosta DITRi-j = Qti-j x TRCi-j |
|
DITRMRLi-j |
Yksittäisten kudosten tai tuotteiden MRL-arvoista (mg) laskettu saanti ravinnosta DITRMRLi-j = Qti-j x MRLi-j x RMTRi-j -1 |
Mitatut TRC- ja MRC-arvot on lisättävä asianmukaisesti taulukossa 3 esitettyyn malliin ja muut arvot on laskettava. Jos kaikkia tietoja ei ole käytettävissä, koska arvot eivät ylitä toteamisrajaa (LOD), saatetaan hyväksyä RMTR-arvon ekstrapolointi.
MRL-arvo voidaan määrittää vain, jos yksittäisten DITR-arvojen summa ei ylitä ADI-arvoa. Jos ADI-arvo ylittyy, voidaan vaihtoehtoisesti käyttää pidempää varoaikaa tai alhaisempia annoksia käyttäen saatuja tietoja. Ensimmäinen ehdotus MRL-arvoksi voidaan määrittää käyttäen ohjeena MRC-arvoa ja ottaen huomioon analyysimenetelmän määritysrajan (LOQ). Ehdotetuista MRL-arvoista saatujen DITRMRL-arvojen summan on oltava ADI-arvoa alhaisempi ja lähellä yksittäisten DITR-arvojen summaa. Jos ADI-arvo ylittyy, on ehdotettava alhaisempaa MRL-arvoa ja toistettava vertailu.
Joidenkin lisäaineiden tapauksessa saattavat MRL-arvoa alhaisemmat jäämät maidossa, munissa tai lihassa kuitenkin vaikuttaa elintarvikkeen laatuun, erityisesti elintarvikkeiden jatkojalostuksessa. Tällaisille lisäaineille voi olla aiheellista harkita MRL-arvojen lisäksi ”elintarvikkeen jatkojalostuksessa sallittua jäämien enimmäismäärää”.
Taulukko 3:
Malli MRL-arvon ehdottamiseen
|
|
Maksa |
Munuai-nen |
Lihas |
Nahka+ rasva |
Maito |
Munat |
Hunaja |
Summa |
|
TRC (15) (mg kg-1) |
|
|
|
|
|
|
|
— |
|
MRC (16) (mg kg-1) |
|
|
|
|
|
|
|
— |
|
RMTR (16) |
|
|
|
|
|
|
|
— |
|
DITR (17) (mg) |
|
|
|
|
|
|
|
|
|
ehdotettu MRL (mg kg-1) |
|
|
|
|
|
|
|
— |
|
DITRMRL(mg) |
|
|
|
|
|
|
|
|
3.2.3.5 Ehdotus varoajaksi
Varoaika on lisäaineen annon lopettamisesta alkava jakso, jonka aikana jäämätasot laskevat alle MRL-arvon.
3.3 Lisäaineen käytön turvallisuutta käyttäjille tai työntekijöille koskevat tutkimukset
Työntekijät voivat altistua lisäaineelle valmistaessaan, käsitellessään tai käyttäessään sitä lähinnä hengitysilman välityksellä tai ihoaltistuksen kautta. Esimerkiksi maatilan työntekijät voivat altistua lisäaineelle sitä käsitellessään ja sekoittaessaan. Aineiden käsittelystä on esitettävä lisätietoja.
Työturvallisuusriskit on arvioitava. Tuotantolaitoksessa saadut kokemukset, jos niitä on käytettävissä, ovat usein merkittävä tietolähde arvioitaessa ilman tai kosketuksen kautta tapahtuvan lisäainealtistuksen aiheuttamia työturvallisuusriskejä. Erityistä huomiota on kiinnitettävä sellaisiin lisäaineisiin, lisäaineella käsiteltyihin rehuihin tai eläinten eritteisiin, jotka ovat kuivassa jauhemaisessa muodossa tai pölyäviä, samoin mahdollisesti allergeenisiin lisäaineisiin.
3.3.1 Toksikologinen riskinarviointi käyttäjä- tai työturvallisuuden kannalta
Työntekijöihin kohdistuvia riskejä on arvioitava tutkimuksilla, joissa käytetään lisäainetta siinä muodossa, jolle hyväksyntää on haettu. Jos on todennäköistä, että tuote muodostaa hengitysteihin joutuvaa pölyä tai sumua, on tehtävä akuutti inhalaatiokoe. On tehtävä ihoärsytyskokeet, ja jos ne antavat kielteisen tuloksen, on arvioitava limakalvoärsytys (esim. silmästä). Allergiapotentiaali ja ihoherkistävyys on niin ikään arvioitava. Kuluttajaturvallisuuden varmistamiseksi kerättyjä toksisuustietoja (ks. 3.2.2) on käytettävä lisäaineen mahdollisen systeemisen toksisuuden arvioimiseksi. Kaikkia näitä on tarvittaessa arvioitava suorilla mittauksilla ja erityisillä tutkimuksilla.
3.3.1.1 Vaikutukset hengitysteihin
Hakijan on osoitettava, ettei lisäaineesta peräisin oleva ilman pöly- tai sumutaso aiheuta vaaraa käyttäjien tai työntekijöiden terveydelle. Todisteina on harkinnan mukaan käytettävä:
|
— |
inhalaatiokokeita koe-eläimillä, |
|
— |
julkaistuja epidemiologisia tietoja ja/tai hakijan omia tuotantolaitoksestaan keräämiä tietoja ja/tai ärsytyskokeita, |
|
— |
hengitysteiden herkistymiskokeita. |
Akuutti inhalaatiokoe on tehtävä, jos hiukkaset tai pisarat, joiden läpimitta on alle 50 μm, muodostavat yli prosentin tuotteen painosta.
Akuutin inhalaatiokokeen on vastattava OECD:n ohjetta nro 403. Jos subkrooniset toksisuuskokeet katsotaan tarpeellisiksi, niissä on noudatettava OECD:n ohjetta nro 412 (toistetun annoksen hengitysmyrkyllisyys: 28:n tai 14 päivän tutkimus) tai 413 (subkrooninen hengitysmyrkyllisyys: 90 päivän tutkimus).
3.3.1.2 Vaikutukset silmiin ja ihoon
Jos mahdollista, on esitettävä suorat, ihmisten altistumisesta saadut todisteet siitä, ettei aine aiheuta ärsytystä ja/tai herkistymistä. Niiden lisäksi on esitettävä tulokset validoiduista eläinkokeista, joissa on tutkittu lisäaineen aiheuttamaa iho- ja silmä-ärsytystä ja herkistävyyspotentiaalia. Allergiapotentiaali ja ihoherkistävyys on niin ikään arvioitava. Näissä tutkimuksissa käytettävien suunnitelmien on vastattava OECD:n ohjeita nro 404 (ihoärsyttävyys/-syövyttävyys), 405 (silmä-ärsyttävyys/-syövyttävyys), 406 (ihoherkistävyys) ja 429 (ihoherkistävyys — paikallinen imusolmuketesti).
Jos lisäaineella tiedetään joko julkaisujen tai erityisten in vitro -testien perusteella olevan syövyttäviä ominaisuuksia, in vivo -lisätestejä ei tehdä.
Ihotoksisuus on otettava huomioon, jos lisäaine on myrkyllinen hengitettynä. Tutkimusten on vastattava OECD:n ohjetta nro 402 (akuutti ihotoksisuus).
3.3.1.3 Systeeminen toksisuus
Esimerkiksi kuluttajaturvallisuutta koskevien vaatimusten täyttämiseksi kerättyjä toksisuustietoja (mm. toistuvan annostelun aiheuttama toksisuus, mutageenisyys, karsinogeenisyys, lisääntymistoksisuus ja metabolia) on käytettävä arvioitaessa systeemistä toksisuutta.
3.3.1.4 Altistuksen arviointi
Tietoja on annettava lisäaineen käytön todennäköisesti aiheuttamasta altistuksesta kaikkien reittien (hengityksen, ihon tai nielemisen) kautta. Tähän on mahdollisuuksien mukaan sisällyttävä arvio määristä, esimerkiksi tyypillisestä pitoisuudesta ilmassa, ihoaltistuksessa tai nielemisessä. Ellei tietoja määristä ole saatavilla, on esitettävä riittävät tiedot asianmukaista altistusarviota varten.
3.3.2 Toimenpiteet altistuksen rajoittamiseksi
Toksikologisista arvioista ja altistusarvioista saatujen tietojen perusteella on tehtävä johtopäätökset lisäaineen terveysriskeistä käyttäjälleen tai työntekijälle (hengittämiseen liittyvät riskit, ärsytys- ja herkistymisriskit ja systeemiseen toksisuuteen liittyvät riskit). Varotoimia voidaan ehdottaa altistuksen vähentämiseksi tai välttämiseksi. Henkilökohtaisia suojaimia pidetään kuitenkin äärimmäisenä varotoimenpiteenä henkilön suojaamiseksi riskeiltä, joita on jäljellä rajoittavista toimenpiteistä huolimatta. Suositeltavampaa on esimerkiksi harkita tuotteen uudelleenformulointia.
3.4 Lisäaineen käytön turvallisuutta ympäristölle koskevat tutkimukset
Lisäaineiden ympäristövaikutukset on otettava huomioon, koska lisäaineita annetaan tavallisesti pitkän aikaa ja usein suurille eläinryhmille. Vaikuttavaa ainetta saattaa erittyä huomattavassa määrin joko alkuperäisenä yhdisteenä tai sen aineenvaihduntatuotteina.
Lisäaineiden ympäristövaikutusten määrittämiseksi on noudatettava vaiheittaista menettelyä. Kaikki lisäaineet on arvioitava vaiheessa I niiden lisäaineiden tunnistamiseksi, joiden osalta ei tarvita lisäkokeita. Muiden lisäaineiden kohdalla tarvitaan toistakin arviointivaihetta (vaihe II), jonka perusteella voidaan katsoa tarpeelliseksi tehdä lisätutkimuksia. Nämä tutkimukset on tehtävä direktiivin 67/548/ETY mukaisesti.
3.4.1 Arviovaihe I
Vaiheen I arvion tarkoituksena on selvittää, onko lisäaineella tai sen aineenvaihduntatuotteilla todennäköisesti merkittäviä ympäristövaikutuksia ja tarvitaanko vaiheen II arviota (ks. päätöksentekokaavio).
Vaiheen II arvio voidaan jättää tekemättä, jos toinen seuraavista kriteereistä täyttyy, ellei lisäaineen huolestuttavista vaikutuksista ole tieteellisesti perusteltua näyttöä:
|
a) |
Lisäaineen kemiallisten ominaisuuksien, biologisten vaikutusten ja käyttöolosuhteiden perusteella vaikutukset ovat merkityksettömiä. Tällaisissa tapauksissa lisäaine on:
|
|
b) |
Pahimmalle mahdolliselle tapaukselle ennustettu pitoisuus ympäristössä (PEC) on niin pieni, ettei se anna aihetta huoleen. PEC on arvioitava kussakin keskeisessä ympäristölokerossa (ks. alla) sen oletuksen perusteella, että 100 prosenttia nautitusta annoksesta erittyy alkuperäisenä yhdisteenä. |
Ellei hakija pysty osoittamaan, että lisäaine kuuluu toiseen näistä poikkeusryhmistä, on suoritettava vaiheen II arvio.
3.4.1.1 Maaeläimille tarkoitetut lisäaineet
Kun karjan eritteitä käytetään maan lannoittamiseen, rehun lisäaineiden käyttö voi johtaa maaperän, pohjaveden ja pintaveden pilaantumiseen (valumisen ja huuhtoutumisen kautta).
Maaperässä pahimman mahdollisen tapauksen PEC:n (PECsoil) aiheuttaisi kaikkien eritteiden ja niiden sisältämien yhdisteiden levittäminen maahan. Jos PECsoil (oletus: 5 cm:n syvyydessä) on alle 10 μg /kg, lisäarviota ei tarvita.
Jos pohjaveden saastumisen PEC-arvo (PECgw) on alle 0,1 μg/l, lisäaineen ympäristövaikutuksista pohjaveteen ei tarvitse tehdä vaiheen II arviota.
3.4.1.2 Vesieläimille tarkoitetut lisäaineet
Vesiviljelyssä käytetyt rehun lisäaineet voivat johtaa sedimentin ja veden pilaantumiseen. Keskeinen ympäristölokero verkkoaltaissa viljeltyjä kaloja koskevan ympäristöriskien arvioinnin kannalta on oletettavasti sedimentti. Maapohjaisissa järjestelmissä viljeltyjen kalojen osalta pintaveteen virtaavan jäteveden katsotaan muodostavan suurimman ympäristöriskin.
Sedimentissä pahimman mahdollisen tapauksen PEC:n (PECsediment) aiheuttaisi kaikkien eritteiden ja niiden sisältämien yhdisteiden sijoittaminen sedimenttiin. Jos PECsediment (oletus: 20 cm:n syvyydessä) on alle 10 μg/kg tuorepainosta, lisäarviota ei tarvita.
Jos pintaveden PEC-arvo (PECsw) on alle 0,1 μg/l, lisäarviota ei tarvita.
Vaihe I Päätöksentekokaavio
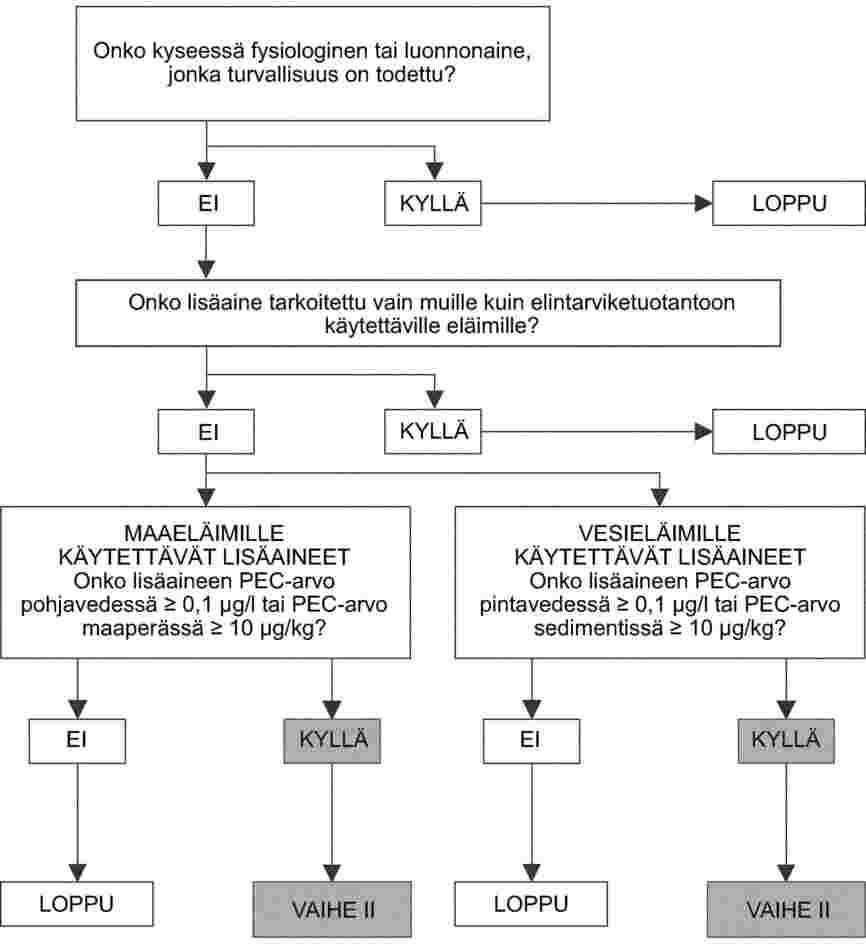
3.4.2 Arviovaihe II
Vaiheen II tarkoituksena on arvioida lisäaineiden mahdollisia vaikutuksia muihin kuin kohde-eläinlajeihin ympäristössä, sekä vesi- että maaeläinlajeihin, tai mahdollista päätymistä pohjaveteen liiallisina määrinä. Ei ole järkevää arvioida lisäaineiden vaikutuksia kaikkiin sellaisiin eläinlajeihin ympäristössä, jotka voivat altistua lisäaineelle sen jälkeen, kun sitä on annettu kohde-eläimille. Testattujen taksonomisten tasojen on tarkoitus toimia malleina tai indikaattoreina ympäristön eläinlajistolle.
Arviovaihe II perustuu riskisuhde-lähestymistapaan, jossa verrataan kullekin ympäristölokerolle laskettua PEC-arvoa ja ennustetun vaikutuksettoman pitoisuuden (PNEC) arvoa. PNEC-arvo määritetään jakamalla kokeellisesti määritellyt päätepisteet asianmukaisella turvakertoimella. PNEC-arvo on laskettava kullekin olennaiselle lokerolle.
Arviovaihe II alkaa, jos mahdollista, PEC-arvon tarkentamisella, ja siinä käytetään kaksivaiheista lähestymistapaa ympäristöriskien arviointiin.
Ensimmäisessä vaiheessa, vaiheessa II A, esitetään muutamien aineenvaihdunta- ja vaikutustutkimusten perusteella varovainen riskiarvio, joka perustuu lisäaineelle altistumiseen ja sen vaikutuksiin kyseisessä ympäristölokerossa. Jos PEC-arvon suhde PNEC-arvoon on alle 1, lisäarviota ei tarvita, ellei biokertyminen ole todennäköistä.
Jos PEC/PNEC-suhde enteilee kohtuutonta riskiä (suhde > 1), hakijan on siirryttävä vaiheeseen II B ympäristöriskejä koskevan arvion tarkentamiseksi.
3.4.2.1 Vaihe II A
Vaiheessa I tarkasteltujen lokeroiden lisäksi on laskettava pintaveden PEC-arvo valuminen ja huuhtoutuminen huomioon ottaen.
Kullekin kyseeseen tulevalle ympäristölokerolle voidaan laskea tarkempi PEC-arvo niiden tietojen perusteella, joita ei otettu huomioon vaiheessa I. Tarkempaa PEC-arvoa varmistettaessa on otettava huomioon seuraavat tekijät:
|
a) |
kyseisten vaikuttavien aineiden tai aineenvaihduntatuotteiden pitoisuus lannassa tai kalojen ulosteissa, kun eläimille on annettu lisäainetta ehdotetulla annostasolla; laskelmissa on otettava huomioon annostustasot ja eritemäärät; |
|
b) |
kyseisten eritettyjen vaikuttavien aineiden tai aineenvaihduntatuotteiden mahdollinen hajoaminen lannan tavanomaisen käsittelyn ja varastoinnin aikana ennen lannan levittämistä maahan; |
|
c) |
kyseisten vaikuttavien aineiden tai aineenvaihduntatuotteiden adsorptio/desorptio maaperään tai vesiviljelyn osalta pohjasedimenttiin, mikä määritetään mieluiten maaperä- tai sedimenttitutkimuksilla (OECD:n ohje nro 106); |
|
d) |
hajoaminen maaperässä ja vedessä tai vesien pohjasedimentissä (OECD:n ohjeet nro 307 ja 308); |
|
e) |
muut tekijät, kuten hydrolyysi, fotolyysi, haihtuminen ja laimeneminen aurauksen vaikutuksesta. |
Vaiheen II riskinarvioinnissa on käytettävä korkeinta näissä laskelmissa kullekin ympäristölokerolle saatua PEC-arvoa.
Jos on odotettavissa, että aine pysyy pitkään maaperässä tai pohjasedimentissä (aika siihen, että 90 prosenttia yhdisteen alkuperäisestä pitoisuudesta on hajonnut: DT90 > 1 vuosi), on otettava huomioon aineen mahdollinen kertyminen.
On määritettävä lisäaineiden (tai niiden aineenvaihduntatuotteiden) pitoisuudet, joilla syntyy vakavia haittavaikutuksia eri trofiatasoilla kyseeseen tulevissa ympäristölokeroissa. Nämä kokeet ovat enimmäkseen akuuttia toksisuutta mittaavia kokeita, ja niissä on noudatettava OECD:n ohjeita tai vastaavia vakiintuneita ohjeita. Maaympäristöä koskevissa tutkimuksissa on tutkittava toksisuutta lieroille, kolmelle maakasville ja maaperän mikro-organismeille (esim. vaikutuksia typen sitomiseen). Vesiympäristön osalta on tutkittava toksisuutta kaloille, vesikirpulle (Daphnia magna), leville ja yhdelle sedimentin organismille. Meressä käytettävien verkkoaltaiden tapauksessa on tutkittava kolmea eri taksonomisiin ryhmiin kuuluvaa sedimentin organismilajia.
Kullekin olennaiselle lokerolle on laskettava PNEC-arvo. Se saadaan tavallisesti jakamalla edellä kuvatuissa kokeissa havaittu pienin toksisuuden arvo turvakertoimella, jonka arvo on vähintään 100 päätepisteestä ja testattavien lajien määrästä riippuen.
Mahdollista biokertyvyyttä voidaan arvioida n-oktanoli/vesi-jakaantumiskertoimen eli logKow-arvon perusteella. Jos logKow-arvo on ≥ 3, aine voi olla biokertyvä. Sekundaarisen myrkytyksen riskin arvioimiseksi on harkittava biokertyvyystekijää (BCF) koskevan tutkimuksen tekemistä vaiheessa II B.
3.4.2.2 Vaihe II B (tarkempia ekotoksikologisia tutkimuksia)
Jos lisäaineen ympäristöriskiä ei voida sulkea pois arviovaiheen II A jälkeen, on hankittava lisätietoja sen vaikutuksista eri lajeihin niissä ympäristölokeroissa, joiden osalta vaiheen II A tutkimukset osoittivat aihetta huoleen. Tällöin on lisäkokein määritettävä krooniset ja täsmällisemmät vaikutukset sopiviin mikrobi-, kasvi- ja eläinlajeihin. Nämä lisätiedot mahdollistavat pienemmän turvakertoimen käytön.
Sopivia ekotoksisuustestejä on kuvattu monissa julkaisuissa, esimerkiksi OECD:n ohjeissa. Testit on valittava huolellisesti, jotta ne varmasti soveltuvat tilanteeseen, jossa lisäainetta ja/tai sen aineenvaihduntatuotteita voi päästä ja levitä ympäristöön. Maaperää koskevan vaikutustenarvioinnin (PNECsoil) tarkentaminen voisi perustua tutkimuksiin lisäaineen kroonisista vaikutuksista lieroihin, maaperän mikroflooraa ja useita tärkeitä kasvilajeja koskeviin lisätutkimuksiin sekä tutkimuksiin heinikkojen selkärangattomilla (mm. hyönteisillä) ja luonnonvaraisilla linnuilla.
Vettä tai pohjasedimenttiä koskevan vaikutustenarvioinnin tarkentaminen voisi perustua kroonisiin toksisuuskokeisiin vaiheen II A arviossa herkimmiksi osoittautuneilla vesi- tai pohjaeliöillä.
Jos biokertyvyystutkimuksia tarvitaan, niissä on noudatettava OECD:n ohjetta nro 305.
4. IV LUKU: LISÄAINEEN TEHOA KOSKEVAT TUTKIMUKSET
Tutkimuksilla on osoitettava lisäaineen teho kunkin ehdotetun käyttötavan osalta ja se, että lisäaineella on vähintään yksi asetuksen (EY) N:o 1831/2003 5 artiklan 3 kohdassa esitetyistä ominaisuuksista, mainitun asetuksen 6 artiklassa ja liitteessä I säädettyjen rehun lisäaineiden luokkien ja funktionaalisten ryhmien mukaisesti. Lisäksi tällaisten tutkimusten perusteella on voitava arvioida lisäaineen tehoa EU:n yhteisten maatalouskäytäntöjen mukaisesti.
Koejärjestelyn valinta on voitava perustella suhteessa lisäaineen käyttöön, eläinlajiin ja -ryhmään. Koe-eläimiä käytettäessä kokeet on tehtävä siten, etteivät eläinten terveys ja hoito-olosuhteet vaikuta kielteisesti tulosten tulkintaan. Kunkin kokeen osalta on esitettävä sekä teknologiset että biologiset positiiviset ja negatiiviset vaikutukset. Kokeilla on myös osoitettava, ettei lisäaineella ole eläintuotteiden tunnusomaisia piirteitä huonontavia vaikutuksia. Kokeet on mieluiten tehtävä tunnustetussa, ulkoisessa laadunvarmistusjärjestelmässä vahvistettujen kriteerien mukaisesti. Jos tällaista järjestelmää ei ole käytössä, on esitettävä todisteet siitä, että pätevä ja nimetylle tutkimuksen johtajalle vastuussa oleva henkilöstö on suorittanut kokeen käyttäen asianmukaisia laitteita ja välineitä.
Tutkimuksen johtajan on laadittava koeselostus huolellisesti, ja sen tulee sisältää kuvaukset esimerkiksi käytetyistä menetelmistä, laitteista ja materiaaleista, eläinten lajista, rodusta tai kannasta sekä niiden lukumäärästä ja majoitus- ja ruokintaolosuhteista. Kaikkien tutkimusten, joissa käytetään koe-eläimiä, koeolosuhteet on kuvattava 3.1.1.3 kohdan mukaisesti. Loppuraportit, käsittelemättömät tiedot, tutkimussuunnitelmat sekä tarkasti kuvatut ja tunnistetut testiaineet on arkistoitava myöhempää käyttöä varten.
Tutkimukset on suunniteltava siten, että niillä osoitetaan lisäaineen pienimmän suositellun annoksen teho käyttämällä herkkiä muuttujia negatiiviseen ja vaihtoehtoisesti positiiviseen kontrolliin verrattuna. Tällaisissa tutkimuksissa on myös tutkittava suositeltua enimmäisannosta, jos sellaista on ehdotettu. Mitään tiettyä koejärjestelyä ei suositella, vaan tutkimusten suunnittelussa ja toteuttamisessa jätetään varaa tieteelliselle harkinnalle.
Huomioon on myös otettava lisäaineen tunnettu tai mahdollinen biologinen tai kemiallinen vuorovaikutus muiden lisäaineiden ja/tai eläinlääkkeiden ja/tai rehun ainesosien kanssa, jos tällä on merkitystä kyseisen lisäaineen tehon kannalta (esim. mikrobisen lisäaineen yhteensopivuus kokkidiostaattien ja histomonostaattien tai orgaanisen hapon kanssa).
4.1 In vitro -tutkimukset
Kaikkien teknologisten ja joidenkin rehun ominaisuuksiin vaikuttavien sensoristen lisäaineiden teho on osoitettava laboratoriopohjaisella tutkimuksella. Tutkimus on suunniteltava siten, että se kattaa edustavan joukon aineistoa, johon lisäainetta käytetään. Tuloksia on arvioitava mieluiten parametrittömillä kokeilla, ja niiden on osoitettava odotetut muutokset todennäköisyydellä P ≤ 0,05.
In vitro -tutkimuksia, erityisesti ruoansulatusprosesseja simuloivia, voidaan soveltaa toisentyyppisiin lisäaineisiin niiden tehon varmistamiseksi. Näitä tutkimuksia on voitava arvioida tilastollisesti.
4.2 Lyhytaikaiset tehoa koskevat tutkimukset eläimillä
Biologista hyväksikäytettävyyttä koskevilla tutkimuksilla voidaan osoittaa, missä määrin ravintoaineen tai väriaineen uusi muoto tai lähde voi korvata vastaavan jo hyväksytyn tai vakiintuneen lisäaineen.
Ruoansulatusta tai tasapainotilaa koskevia tutkimuksia voidaan käyttää eläinten toimintakykyä koskevien tutkimusten tukena näytön esittämisessä lisäaineen vaikutustavasta. Joissakin tapauksissa, erityisesti ympäristöhyötyjen osalta, lisäaineen teho voidaan osoittaa paremmin tasapainotilaa koskevilla tutkimuksilla, joita voidaan käyttää pitkäaikaisten tehoa koskevien tutkimusten sijaan. Tällaisissa kokeissa käytettävien eläinten lukumäärän ja lajien tai -ryhmien on sovelluttava ehdotettuihin käyttöolosuhteisiin.
Muita lyhytaikaisia tehoa koskevia tutkimuksia eläimillä voidaan ehdottaa tarvittaessa, ja niillä voidaan korvata pitkäaikaiset tehoa koskevat tutkimukset eläimillä, edellyttäen että tämä on täysin perusteltua.
4.3 Pitkäaikaiset tehoa koskevat tutkimukset eläimillä
Tutkimukset on tehtävä ainakin kahdessa eri paikassa.
Koejärjestelyn valinnassa on otettava huomioon kokeen riittävä tilastollinen voima ja tyypin 1 ja 2 riskit. Koemenetelmän on oltava riittävän herkkä, jotta lisäaineen mahdolliset vaikutukset havaitaan pienimmällä suositellulla annoksella (tyypin 1-α riski, P ≤ 0,05 yleensä ja P ≤ 0,1 märehtijöillä, toissijaisilla eläinlajeilla, lemmikkieläimillä ja muilla kuin elintarviketuotantoon käytettävillä eläimillä), ja sillä on oltava riittävä tilastollinen voima sen takaamiseksi, että koesuunnitelmalla saavutetaan tutkimuksen tavoite. Tyypin 2-β riskin on oltava enintään 20 prosenttia yleensä ja 25 prosenttia märehtijöillä, toissijaisilla eläinlajeilla, lemmikkieläimillä ja muilla kuin elintarviketuotantoon käytettävillä eläimillä tehtävissä kokeissa. Kokeen tilastollisen voiman (1-β) on siten oltava vähintään 80 prosenttia (75 prosenttia märehtijöillä, toissijaisilla eläinlajeilla, lemmikkieläimillä ja muilla kuin elintarviketuotantoon käytettävillä eläimillä).
On tiedossa, että joidenkin lisäaineiden luonteen vuoksi on vaikea määrittää koeolosuhteet, joissa optimaaliset tulokset voidaan saavuttaa. Mahdollisuutta käyttää meta-analyysia on siten harkittava silloin, kun käytettävissä olevien kokeiden määrä ylittää kolme. Tästä syystä kaikissa tutkimuksissa on käytettävä samanlaista koesuunnitelmaa, jotta voidaan testata tietojen homogeenisuus ja koota ne yhteen (jos testit niin osoittavat) tilastollista tarkastelua varten tasolla P ≤ 0,05.
4.4 Kohde-eläimillä tehtävien pitkäaikaisten tehoa koskevien tutkimusten kesto
Tehoa koskevien kokeiden keston on yleensä vastattava lisäaineen väitteessä mainittua käyttöaikaa.
Tehoa koskevat kokeet on tehtävä Euroopan unionin maatalouskäytäntöjen mukaisesti, ja niiden vähimmäiskesto on esitetty liitteessä IV.
Jos lisäainetta käytetään tietyn ajan, joka on lyhyempi kuin eläinluokan määritelmässä annettu aika, lisäaineen annostus määräytyy ehdotettujen käyttöolosuhteiden perusteella. Havainnointiajan on kuitenkin oltava vähintään 28 päivää käsittäen asianomaisen päätepisteen (esim. emakoiden osalta elävänä syntyneiden porsaiden määrä, kun tarkastellaan kantoaikaa, tai vieroitettujen porsaiden määrä ja paino, kun tarkastellaan imetysaikaa).
Muiden eläinlajien tai -ryhmien osalta, joille ei ole määritetty tutkimusten vähimmäiskestoa liitteessä IV, on otettava huomioon ehdotettujen käyttöolosuhteiden mukainen annostusaika.
4.5 Lisäaineiden luokkia ja funktionaalisia ryhmiä koskevat tehokkuusvaatimukset
Kaikista lisäaineista, joiden on tarkoitus vaikuttaa eläimiin, on tehtävä in vivo -tutkimukset.
Eläintuotantoon vaikuttavien lisäaineiden sekä kokkidiostaattien ja histomonostaattien luokkien osalta lisäaineen teho on osoitettava vähintään kolmella pitkäaikaisella tehoa koskevalla tutkimuksella. Joidenkin eläintuotantoon vaikuttavien lisäaineiden ja muiden eläimiin vaikuttavien lisäaineiden luokkien kohdalla saatetaan kuitenkin hyväksyä lyhytaikaiset tehoa koskevat tutkimukset, jos teho voidaan osoittaa kiistattomasti.
Muista lisäaineiden luokista, joihin kuuluvat lisäaineet eivät vaikuta suoraan eläimiin, on esitettävä vähintään yksi in vitro -tutkimus.
4.6 Eläintuotteiden laatua koskevat tutkimukset, jos lisäaineen vaikutus ei vastaa väitettyä vaikutusta
Sen osoittamiseksi, ettei lisäaineella ole kielteistä tai muuta ei-toivottua vaikutusta lisäaineella ruokituista eläimistä peräisin olevien elintarvikkeiden aistinvaraisiin ja ravitsemuksellisiin (tarvittaessa hygieenisiin ja teknologisiin) ominaisuuksiin (kun tämä ei ole toivottu vaikutus), yhden tehokkuuskokeen aikana on otettava asianmukaiset näytteet. Tutkimuksessa on havainnoitava kahta ryhmää: ryhmää, jolle ei anneta lisäainetta, ja ryhmää, jolle annetaan suurin lisäaineelle ehdotettu annos. Tietoja on voitava arvioida tilastollisesti. Näiden tutkimusten poisjättämiselle on oltava riittävät perustelut.
5. V LUKU: SUUNNITELMA MARKKINOILLE SAATTAMISEN JÄLKEEN TOTEUTETTAVASTA SEURANNASTA
Asetuksen (EY) N:o 1831/2003 7 artiklan 3 kohdan g alakohdan nojalla tiettyjen lisäaineiden luokkien osalta on toimitettava ehdotus markkinoille saattamisen jälkeen toteutettavasta seurannasta, jotta on mahdollista jäljittää ja tunnistaa lisäaineiden käytön mahdolliset suorat tai epäsuorat, välittömät tai viivästyneet taikka ennakoimattomat vaikutukset ihmisten tai eläinten terveydelle tai ympäristölle kyseisten tuotteiden ominaisuuksien mukaisesti.
Seurantasuunnitelman on oltava yksityiskohtainen ja tapauskohtainen, ja siinä on nimettävä, kuka (esim. hakija, käyttäjät) toteuttaa seurantasuunnitelman edellyttämät tehtävät ja kuka vastaa siitä, että varmistetaan seurantasuunnitelman asianmukainen laatiminen ja noudattaminen. On myös varmistettava, että on olemassa väylä, jonka kautta toimivaltaisille viranomaisille ilmoitetaan lisäaineen käytön turvallisuutta koskevista uusista tiedoista. Ellei asetuksen (EY) N:o 1831/2003 12 artiklan valvontaa koskevista säännöksistä muuta johdu, komissiolle ja viranomaiselle ilmoitetaan havaituista haitallisista vaikutuksista.
Jos vaikuttava aine on myös tunnustettu antibiootti ja sen on osoitettu valikoivan resistenttejä bakteerikantoja rehussa käytettynä, markkinoille saattamisen jälkeen toteutettavassa seurannassa on tehtävä kenttäkokeita, joissa seurataan bakteerien resistenssiä lisäaineelle.
Kokkidiostaattien osalta on seurattava kenttäkokein Eimeria spp. -kokkidien ja histomonostaattien osalta Histomonas meleagridis -lajin resistenssiä mieluiten hyväksynnän voimassaoloajan jälkimmäisellä puoliskolla.
(1) EUVL L 50, 20.2.2004, s. 44.
(2) EYVL L 196, 16.8.1967, s. 1. Direktiivi sellaisena kuin se on viimeksi muutettuna Euroopan parlamentin ja neuvoston direktiivillä 2006/121/EY (EUVL L 396, 30.12.2006, s. 852. Oikaisu EUVL L 136, 29.5.2007, s. 281).
(3) EUVL L 152, 30.4.2004, s. 1. Oikaisu EUVL L 216, 16.6.2004, s. 3.
(4) EUVL L 165, 30.4.2004. Oikaisu EUVL L 191, 28.5.2004, s. 1.
(5) EYVL L 117, 8.5.1990, s. 1. Direktiivi sellaisena kuin se on viimeksi muutettuna komission päätöksellä 2005/174/EY (EUVL L 59, 5.3.2005, s. 20).
(6) EYVL L 76, 22.3.1991, s. 35. Direktiivi sellaisena kuin se on viimeksi muutettuna direktiivillä 2001/58/EY (EYVL L 212, 7.8.2001, s. 24).
(7) EYVL L 262, 17.10.2000, s. 21.
(8) EYVL L 224, 18.8.1990, s. 1. Asetus sellaisena kuin se on viimeksi muutettuna kommission asetuksella (EY) N:o 203/2008 (EUVL L 60, 5.3.2008, s. 18).
(9) Thompson, M. ym., Harmonized Guidelines For Single Laboratory Validation Of Methods Of Analysis (IUPAC Technical Report), Pure Appl. Chem., nide 74, nro 5, s. 835–855, 2002.
(10) EYVL L 221, 17.8.2002, s. 8. Päätös sellaisena kuin se on viimeksi muutettuna päätöksellä 2004/25/EY (EUVL L 6, 10.1.2004, s. 38).
(11) Luettelo, joka ei ole tyhjentävä, löytyy osoitteesta: www.efsa.europa.eu/en/science/feedap/feedap_opinion/993.html.
(12) Lihas ja nahka luonnollisessa suhteessa.
(13) Siat: 50 g rasvaa ja nahkaa luonnollisessa suhteessa.
(14) Rasva ja nahka luonnollisessa suhteessa.
(15) Otetaan huomioon ehdotettu varoaika.
(16) Määritetään ihannetapauksessa samalla kun TRC-arvo.
(17) Laskettu TRC-arvoista.