
2004R0136 — FI — 03.06.2014 — 003.001
Tämä asiakirja on ainoastaan dokumentointitarkoituksiin. Toimielimet eivät vastaa sen sisällöstä.
|
KOMISSION ASETUS (EY) N:o 136/2004, annettu 22 päivänä tammikuuta 2004, kolmansista maista tuotavien tuotteiden eläinlääkinnällisistä tarkastusmenettelyistä yhteisön rajatarkastusasemilla (ETA:n kannalta merkityksellinen teksti) (EYV L 021, 28.1.2004, p.11) |
Muutettu:
|
|
|
Virallinen lehti |
||
|
No |
page |
date |
||
|
Komission asetus (EY) N:o 1792/2006, annettu 23 päivänä lokakuuta 2006, |
L 362 |
1 |
20.12.2006 |
|
|
Komission asetus (EY) N:o 206/2009, annettu 5 päivänä maaliskuuta 2009, |
L 77 |
1 |
24.3.2009 |
|
|
Komission asetus (EU) N:o 519/2013, annettu 21 päivänä helmikuuta 2013, |
L 158 |
74 |
10.6.2013 |
|
|
Komission täytäntöönpanoasetus (EU) N:o 359/2014, annettu 9 päivänä huhtikuuta 2014, |
L 107 |
10 |
10.4.2014 |
|
|
Komission täytäntöönpanoasetus (EU) N:o 494/2014, annettu 13 päivänä toukokuuta 2014, |
L 139 |
11 |
14.5.2014 |
|
KOMISSION ASETUS (EY) N:o 136/2004,
annettu 22 päivänä tammikuuta 2004,
kolmansista maista tuotavien tuotteiden eläinlääkinnällisistä tarkastusmenettelyistä yhteisön rajatarkastusasemilla
(ETA:n kannalta merkityksellinen teksti)
EUROOPAN YHTEISÖJEN KOMISSIO, joka
ottaa huomioon Euroopan yhteisön perustamissopimuksen,
ottaa huomioon kolmansista maista yhteisöön tuotavien tuotteiden eläinlääkinnällisten tarkastusten järjestämistä koskevista periaatteista 18 päivänä joulukuuta 1997 annetun neuvoston direktiivin 97/78/EY ( 1 ) ja erityisesti sen 3 artiklan 5 kohdan, 4 artiklan 5 kohdan, 5 artiklan 4 kohdan, 8 artiklan 7 kohdan, 16 artiklan 3 kohdan ja 19 artiklan 1 kohdan,
sekä katsoo seuraavaa:|
(1) |
Kolmansista maista yhteisöön tuotavien tuotteiden eläinlääkinnällisiä tarkastuksia koskevista vaatimuksista säädettiin alun perin neuvoston direktiivissä 90/675/ETY ( 2 ), joka kumottiin ja korvattiin sittemmin direktiivillä 97/78/EY. |
|
(2) |
Direktiivin 97/78/EY myötä käyttöönotettuja menettelyitä muutettiin jonkin verran direktiivin 90/675/ETY hyväksymisen jälkeen saadun kokemuksen perusteella. Kolmansista maista tuotavien tuotteiden eläinlääkinnällisistä tarkastusmenettelyistä yhteisön rajatarkastusasemilla 22 päivänä joulukuuta 1992 tehty komission päätös 93/13/ETY ( 3 ), sellaisena kuin se on viimeksi muutettuna päätöksellä 2003/279/EY ( 4 ), hyväksyttiin alun perin annetun direktiivin pohjalta, mistä syystä sitä on ajantasaistettava. |
|
(3) |
Eläinlääkinnällisten tarkastusten jälkeen annettavaa todistusta, josta säädetään nykyään päätöksen 93/13/ETY liitteessä B, on mukautettava sekä yhteisön sääntöjen mukaisia että niiden vastaisia eriä koskevien menettelyiden muuttumisen huomioon ottamiseksi riippumatta siitä, onko erät määrä tuoda yhteisöön vai kuljettaa yhteisön kautta. |
|
(4) |
Yksityiskohtaiset säännöt kyseisen todistuksen käytöstä annetaan eläinperäisten tuotteiden passitusta kolmannesta maasta ainoastaan maanteitse Euroopan yhteisön kautta toiseen kolmanteen maahan koskevan neuvoston direktiivin 97/78/EY soveltamista koskevista yksityiskohtaisista säännöistä 24 päivänä helmikuuta 2000 tehdyssä komission päätöksessä 2000/208/EY ( 5 ) ja vapaa-alueille, vapaavarastoihin tai tullivarastoihin taikka rajat ylittäviin merikuljetusvälineisiin hankintoja toimittaville toimijoille tarkoitettujen kolmansien maiden tuotteiden eläinlääkärintarkastusta koskevista menetelmistä 8 päivänä syyskuuta 2000 tehdyssä komission päätöksessä 2000/571/EY ( 6 ). |
|
(5) |
On kuitenkin säädettävä todistuksen käytännön hallinnointiin liittyvistä yksityiskohtaisista säännöistä, jotta voidaan ottaa huomioon tilanteet, joissa erät saavat rajatarkastusasemalla eläinlääkinnällisen hyväksynnän mutta jäävät verotuksellisista syistä joksikin ajaksi tullivalvontaan. Tällaisissa tapauksissa on otettava käyttöön jäljitettävyysjärjestelmä ja selkiytettävä erää seuraavia asiakirjoja. |
|
(6) |
Jotta eläinlääkinnälliset tarkastukset toimisivat asianmukaisesti yhtenäismarkkinoilla, kaikki tarvittava tieto yhteisöön tuodusta tuotteesta olisi koottava yhteen yksinkertaistettuun asiakirjaan, joka on ulkomuodoltaan yhtenäistetty jäsenvaltioissa käytettäviin eri kieliversioihin mahdollisesti liittyvien ongelmien vähentämiseksi. |
|
(7) |
Erityyppisten tuotteiden yhdenmukaistetun näytteenoton ja laboratoriotestauksen yksityiskohtia käsitellään myöhemmissä täytäntöönpanoa koskevissa päätöksissä. Siihen saakka olisi sovellettava edelleen kansallisia sääntöjä, lukuun ottamatta tapauksia, joissa sovelletaan erityisiä suojatoimenpiteitä. |
|
(8) |
Kokemus on osoittanut, että tarkastusten kiertämisen ja petosten vähentämisen kannalta on ratkaisevan tärkeää, että kaikista yhteisöön saapuvista eristä on käytettävissä hyvät tietolähteet. Tavaraluetteloiden tarkastaminen on oleellinen osa tiedonkeruuta. Tarkastaminen on kuitenkin hyvin työläs ja aikaa vievä tehtävä, joten se pitäisi automatisoida sähköisten välineiden avulla mahdollisimman pitkälle. |
|
(9) |
Sen lisäksi, että keskeisiä tietoja kerätään tehokkaasti kaikilta asianomaisilta toimijoilta, toimivaltaisen viranomaisen olisi voitava tutustua tulliviranomaisten vastaaviin tietokantoihin. Kaikkien toimijoiden tiedot olisi syötettävä tähän tietokantajärjestelmään, jotta voidaan varmistaa ajantasaisen tiedon saatavuus kaikkia osapuolia varten. |
|
(10) |
Tietyille kasviperäisille tuotteille, jotka voivat tartuttaa eläimiin tarttuvia tauteja, olisi tehtävä eläinlääkinnällisiä tarkastuksia. Näistä tuotteista sekä kolmansista maista tai niiden osista, joista näiden tuotteiden vienti yhteisöön on sallittu, olisi laadittava luettelo. |
|
(11) |
Kolmannesta maasta saapuvien matkustajien tuomat pienet määrät eläinperäisiä tuotteita, jotka on tarkoitettu henkilökohtaiseen kulutukseen, voidaan vapauttaa eläinlääkinnällisiä tarkastuksia koskevista vaatimuksista. Muutamiin näistä tuotteista sovelletaan suojatoimenpiteitä henkilökohtaiseen kulutukseen tuotavia eläinperäisiä tuotteita koskevista väliaikaisista suojatoimenpiteistä 9 päivänä joulukuuta 2002 tehdyn komission päätöksen 2002/995/EY ( 7 ) mukaisesti. Näitä suojatoimenpiteitä koskevat viittaukset olisi säilytettävä, kunnes tällä alalla hyväksytään asiaa koskevat lopulliset säännöt. |
|
(12) |
Tässä asetuksessa säädetyt toimenpiteet korvaavat päätöksessä 93/13/ETY säädetyt toimenpiteet, mistä syystä kyseinen päätös olisi kumottava. |
|
(13) |
Tässä päätöksessä säädetyt toimenpiteet ovat elintarvikeketjua ja eläinten terveyttä käsittelevän pysyvän komitean lausunnon mukaiset, |
ON ANTANUT TÄMÄN ASETUKSEN:
1 artikla
Eläinlääkinnälliset tarkastukset
1. Direktiivin 97/78/EY 4 artiklan 3 kohdassa säädetyt asiakirjojen tarkastukset on suoritettava tämän asetuksen liitteen I mukaisesti.
2. Direktiivin 97/78/EY 4 artiklan 4 kohdan b alakohdassa säädetyt laboratoriotutkimukset ja virallisten näytteiden analyysit on suoritettava tämän asetuksen liitteen II mukaisesti.
2 artikla
Tuotteiden saapumisesta ilmoittaminen yhteisellä eläinlääkinnällisellä tuloasiakirjalla (CVED-todistuksella)
1. Jo ennen erän fyysistä saapumista yhteisön alueelle lastauksesta vastaavan henkilön on ilmoitettava liitteessä III olevalla yhteisellä eläinlääkinnällisellä tuloasiakirjalla (CVED-todistuksella) tuotteiden saapumisesta sen rajatarkastusaseman eläinlääkintähenkilöstölle, johon tuotteet on määrä toimittaa.
2. CVED-todistus on annettava yhdenmukaisesti niiden todistuksia koskevien yleisten sääntöjen kanssa, joista säädetään asiaa koskevissa säännöksissä muussa yhteisön lainsäädännössä.
3. CVED-todistus on laadittava yhtenä alkuperäiskappaleena ja jäljennöksinä, siten kuin toimivaltainen viranomainen on päättänyt tämän asetuksen vaatimusten täyttämiseksi. Lastauksesta vastaavan henkilön on täytettävä CVED-todistuksen osa 1 ja toimitettava se rajatarkastusaseman eläinlääkintähenkilöstölle.
4. CVED-todistuksessa olevat tiedot voidaan toimivaltaisen viranomaisen kanssa sovitulla tavalla ilmoittaa etukäteen teleliikenteen tai muun sähköisen tietojensiirtojärjestelmän välityksellä sanotun kuitenkaan rajoittamatta 1 ja 3 kohtaa. Sähköisesti toimitettujen tietojen on vastattava CVED-todistuksen mallin osassa 1 vaadittuja tietoja.
3 artikla
Eläinlääkinnällisten tarkastusten jälkeen noudatettava menettely
1. Kun direktiivin 97/78/EY 4 artiklassa säädetyt eläinlääkinnälliset tarkastukset on tehty, CVED-todistuksen osa 2 on täytettävä rajatarkastusasemasta vastaavan virkaeläinlääkärin vastuulla. Kyseinen virkaeläinlääkäri tai hänen valvonnassaan toimiva virkaeläinlääkäri antaa erälle eläinlääkinnällisen hyväksynnän allekirjoittamalla CVED-todistuksen.
Rajatarkastusasemalla komission päätöksen 93/352/ETY ( 8 ) mukaisesti tarkastettavien tuontikalaerien osalta nimetty virkamies voi vastata virkaeläinlääkärin tehtävistä, myös todistuksen täyttämisestä ja allekirjoittamisesta.
2. Eläinlääkinnällisen hyväksynnän saaneita eriä koskevan CVED-todistuksen alkuperäiskappale koostuu osista 1 ja 2, jotka on täytetty ja allekirjoitettu asianmukaisesti.
3. Virkaeläinlääkärin tai lastauksesta vastaavan henkilön on ilmoitettava rajatarkastusaseman tulliviranomaisille erän saamasta eläinlääkinnällisestä hyväksynnästä, kuten 1 kohdassa säädetään, toimittamalla CVED-todistuksen alkuperäiskappale paperiversiona tai sähköisesti.
— Kun tulliselvitys ( 9 ) on erän osalta tehty, CVED-todistuksen alkuperäiskappale seuraa erää ensimmäiseen määräpaikkalaitokseen.
— Rajatarkastusaseman virkaeläinlääkärille jää CVED-todistuksesta jäljennös.
— Virkaeläinlääkäri toimittaa lastauksesta vastaavalle henkilölle CVED-todistuksesta jäljennöksen.
4. Virkaeläinlääkärin on säilytettävä lähetyksen mukana seuraava kolmannen maan antama alkuperäinen eläinlääkärintodistus tai eläinlääkinnälliset asiakirjat ja CVED-todistuksesta jäljennös vähintään kolmen vuoden ajan. Kuitenkin eläinlääkinnällisten asiakirjojen alkuperäiskappaleet seuraavat yhteisön kautta kuljetettavia tai direktiivin 97/78/EY 12 artiklan 4 kohdan taikka 13 artiklan nojalla hyväksyttyihin varastoihin sijoitettavia eriä, joiden lopullinen määräpaikka on yhteisön ulkopuolella. Rajatarkastusasemille jäävät asiakirjoista ainoastaan jäljennökset.
4 artikla
Noudatettava menettely, kun eläinlääkinnällisen hyväksynnän saanut erä jää tullivalvontaan
1. Rajatarkastusasemalla 3 artiklan 1 kohdan mukaisesti eläinlääkinnällisen hyväksynnän saaneisiin tuote-eriin, jotka jäävät tullivalvontaan ja jotka lasketaan vapaaseen liikkeeseen myöhemmin, sovelletaan 2, 3 ja 4 kohdassa säädettyä menettelyä.
2. CVED-todistuksen alkuperäiskappale seuraa erää niin kauan kuin erää kuljetetaan yhden tai useamman laitoksen kautta tullivalvonnassa ja kunnes lastauksesta vastaava henkilö pyytää tulliselvitystä.
3. Ensimmäistä tulliselvitystä varten lastauksesta vastaavan henkilön on toimitettava CVED-todistuksen alkuperäiskappale tullitoimipaikkaan, joka vastaa laitoksesta, johon erä on sijoitettu. Alkuperäiskappale voidaan toimittaa myös sähköisesti, jos toimivaltainen viranomainen antaa siihen luvan.
4. Kun tulliselvitystä on pyydetty 3 kohdan mukaisesti, laitoksen toiminnanharjoittajan on
a) säilytettävä erää seuraavasta CVED-todistuksesta jäljennös;
b) kirjattava erän saapumispäivä;
c) kirjattava erän tulliselvityspäivä tai — mikäli erä jaetaan osiin 5 artiklan mukaisesti — tulliselvityspäivät.
5 artikla
Noudatettava menettely, kun tullivalvonnassa oleva erä on jaettu osiin
1. Jos 4 artiklan 1 kohdassa mainittu erä jaetaan osiin, CVED-todistuksen alkuperäiskappale esitetään toimivaltaisille tulliviranomaisille, jotka vastaavat laitoksesta, jossa erä jaetaan osiin. CVED-todistuksesta jää jäljennös laitokseen, jossa erä on jaettu osiin.
2. Edellä 1 kohdassa mainitusta laitoksesta vastaava toimivaltainen viranomainen voi myöntää erän kullekin osalle CVED-todistuksen alkuperäiskappaleesta oikeaksi todistetun valokopion, johon on merkitty tarkistettu määrä tai paino ja joka seuraa erää.
Toimivaltainen viranomainen voi vaatia sen laitoksen toiminnanharjoittajaa, jossa erä jaetaan osiin, säilyttämään tiedot erän osista niiden jäljitettävyyden varmistamiseksi.
Nämä tiedot ja CVED-todistuksen jäljennökset on säilytettävä kolmen vuoden ajan.
6 artikla
Koordinointi muiden täytäntöönpanosta vastaavien elinten kanssa
Sen varmistamiseksi, että yhteisöön ei pääse eläimistä saatavia tuotteita, joille ei ole tehty eläinlääkinnällisiä tarkastuksia, kunkin jäsenvaltion toimivaltaisen viranomaisen ja virkaeläinlääkärien on koordinoitava toimintansa muiden täytäntöönpanosta vastaavien elinten kanssa kattavien tietojen keräämiseksi eläinperäisten tuotteiden käyttöönotosta. Tämä koskee erityisesti
a) tulliviranomaisten saatavilla olevia tietoja;
b) alusten, laivojen, junien ja lentokoneiden rahtiluettelotietoja;
c) muita maantie-, rautatie-, satama- tai lentoliikenteen toimijoiden saatavilla olevia tietolähteitä.
7 artikla
Pääsy tietokantoihin ja tietojärjestelmien yhdenmukaistaminen
Edellä mainitun 6 artiklan soveltamiseksi toimivaltaisella viranomaisella on oltava pääsy tulliviranomaisten saatavilla oleviin tietokantoihin tai olennaisiin osiin niitä.
Toimivaltaisen viranomaisen käyttämät tietojärjestelmät on yhdenmukaistettava tietosuojavaatimusten edellyttämällä tavalla mahdollisimman pitkälle tulliviranomaisten ja yritysten käyttämien tietojärjestelmien kanssa tiedonsiirron nopeuttamiseksi.
8 artikla
Matkustajien matkatavaroissa tuotavia tai pikkupaketteina yksityishenkilöille lähetettäviä tuotteita koskevat erityissäännöt
Matkustajien matkatavaroissaan tuomien tai pikkupaketteina yksityishenkilöille lähetettävien eläinperäisten tuotteiden on täytettävä komission asetuksessa (EY) N:o 206/2009 ( 10 ) säädetyt vaatimukset.
9 artikla
Tietyille kasviperäisille tuotteille tehtävät eläinlääkinnälliset tarkastukset
1. Jäsenvaltioiden on tehtävä liitteessä IV luetelluille kasviperäisille tuotteille, jotka ovat peräisin liitteessä V luetelluista hyväksytyistä maista, tämän asetuksen 1 artiklan 1 kohdassa mainitut asiakirjatarkastukset ja tarvittaessa tämän asetuksen 1 artiklan 2 kohdassa mainitut laboratoriotestit sekä muut fyysiset tarkastukset, joista säädetään direktiivin 97/78/EY liitteessä III.
2. Direktiivin 97/78/EY ja tämän asetuksen vaatimuksia sovelletaan kaikkiin tämän asetuksen liitteessä IV lueteltuihin kasviperäisiin tuotteisiin erityisesti sen vuoksi, että niiden alkuperä ja myöhempi määräpaikka saattaa kasvattaa tarttuvien eläintautien leviämisen riskiä.
10 artikla
Sähköisen sertifioinnin käyttö
CVED-todistuksen laatiminen, käyttö, siirtäminen ja säilyttäminen tässä asetuksessa kuvatuissa eri tilanteissa voi tapahtua sähköisesti toimivaltaisen viranomaisen harkinnan mukaan.
11 artikla
Kumoaminen
Kumotaan päätös 93/13/ETY.
Viittauksia kumottuun päätökseen pidetään viittauksina tähän asetukseen.
12 artikla
Voimaantulo
Tämä asetus tulee voimaan 1 päivänä maaliskuuta 2004.
Tämä asetus on kaikilta osiltaan velvoittava, ja sitä sovelletaan sellaisenaan kaikissa jäsenvaltioissa.
LIITE I
TÄMÄN ASETUKSEN 1 ARTIKLAN 1 KOHDASSA MAINITUT ASIAKIRJOJEN TARKASTUKSET
Kolmansista maista tuotavia tuotteita koskevien asiakirjojen tarkastuksiin sovelletaan seuraavia sääntöjä:
1. Toimivaltaisen viranomaisen on osoitettava kullekin erälle tulliselvitysmuoto.
2. Jokainen kolmannesta maasta peräisin olevia tuotteita sisältävän ja rajatarkastusasemalle esitetyn erän mukana seuraava kansanterveyttä tai eläinten terveyttä koskeva todistus tai asiakirja on tarkastettava, jotta voidaan vahvistaa asianmukaisesti, että
a) kyseessä on alkuperäinen todistus tai asiakirja;
b) siinä viitataan sellaiseen kolmanteen maahan tai kolmannen maan osaan, jolla on lupa viedä yhteisöön, taikka yhdenmukaistamattomien tuotteiden osalta asianomaiseen jäsenvaltioon;
c) sen muoto ja sisältö vastaavat kyseiselle tuotteelle ja kolmannelle maalle laadittua mallia, taikka yhdenmukaistamattomien tuotteiden osalta asianomaiselle jäsenvaltiolle laadittua mallia;
d) se täyttää todistusten myöntämistä koskevat yleiset periaatteet, joista säädetään direktiivin 2002/99/EY ( 11 ) olevassa liitteessä IV;
e) se on täytetty kokonaisuudessaan;
f) se koskee hyväksyttyä tai rekisteröityä laitosta tai alusta, jolla on lupa viedä yhteisöön tai — niiden tuotteiden osalta, joita ei ole yhdenmukaistettu — kyseiseen jäsenvaltioon;
g) sen on allekirjoittanut virkaeläinlääkäri tai tarvittaessa viranomaisen edustaja, jonka nimi ja virka-asema käyvät siitä selvästi ilmi suuraakkosin, ja että kolmannen maan virallinen leima ja virallinen allekirjoitus on tehty eri värillä kuin todistuksen tai asiakirjan teksti, tai että sähköisten sertifikaattien allekirjoitus ja leima on tehty tietoturvallista järjestelmää käyttäen.
h) CVED-todistuksen 1 osa on täytetty asianmukaisesti ja että sen sisältämät tiedot ovat yhdenmukaisia muiden erää seuraavien keskeisten virallisten asiakirjojen kanssa.
LIITE II
TÄMÄN ASETUKSEN 1 ARTIKLAN 2 KOHDASSA MAINITUT LABORATORIOTUTKIMUKSET
Tuotteille tehtäviin laboratoriotutkimuksiin sovelletaan seuraavia sääntöjä:
1. Jäsenvaltioiden on saatettava tuontia varten esitettyjen tuotteiden erät valvontasuunnitelman alaiseksi yhteisön lainsäädännön tai sen puutteessa kansallisen lainsäädännön noudattamisen varmistamiseksi ja erityisesti jäämien, tautia aiheuttavien tekijöiden tai muiden ihmisille, eläimille tai ympäristölle vaarallisten aineiden havaitsemiseksi. Valvontasuunnitelmien on perustuttava tietoon tuotteiden ominaispiirteistä ja niihin liittyvistä vaaroista, ja niissä on otettava huomioon kaikki keskeiset valvontaparametrit, kuten tuotujen erien saapumistiheys ja lukumäärä sekä aikaisemman valvonnan tulokset.
2. Jos 1 kohdassa mainittujen valvontasuunnitelmien yhteydessä tehdään satunnaistestejä erälle, jonka ei epäillä aiheuttavan välitöntä vaaraa ihmisten tai eläinten terveydelle, erä voidaan laskea vapaaseen liikkeeseen ennen laboratoriokoetulosten saamista. Erää seuraava CVED-todistus on kaikissa tapauksissa varustettava asianomaisin merkinnöin, ja asiasta on ilmoitettava määräpaikan toimivaltaiselle viranomaiselle direktiivin 97/78/EY 8 artiklan mukaisesti.
3. Jos laboratoriokokeet tehdään sääntöjenvastaisuutta koskevan epäilyn, käytettävissä olevien tietojen, elintarvikkeita ja rehuja koskevan nopean hälytysjärjestelmän aiemman ilmoituksen tai suojatoimenpiteen vuoksi ja jos näytteenotto koskee tautia aiheuttavaa tekijää tai ainetta, joka aiheuttaa suoran tai välittömän vaaran ihmisten tai eläinten terveydelle, rajatarkastusaseman vastuullinen näytteenoton tehnyt virkaeläinlääkäri tai toimivaltainen viranomainen ei saa antaa erälle eläinlääkinnällistä hyväksyntää eikä laskea sitä liikkeeseen, ennen kuin laboratoriotutkimuksista saadaan tyydyttävät tulokset. Sillä välin erän on pysyttävä rajatarkastusaseman viranomaisten valvonnassa ja eläinlääkinnälliset tarkastukset tehneen virkaeläinlääkärin tai nimetyn virkamiehen vastuun alaisena.
4. Jäsenvaltioiden on ilmoitettava komissiolle kuukausittain niiden rajatarkastusasemilla tehtyjen laboratoriokokeiden positiivisista ja negatiivisista tuloksista.
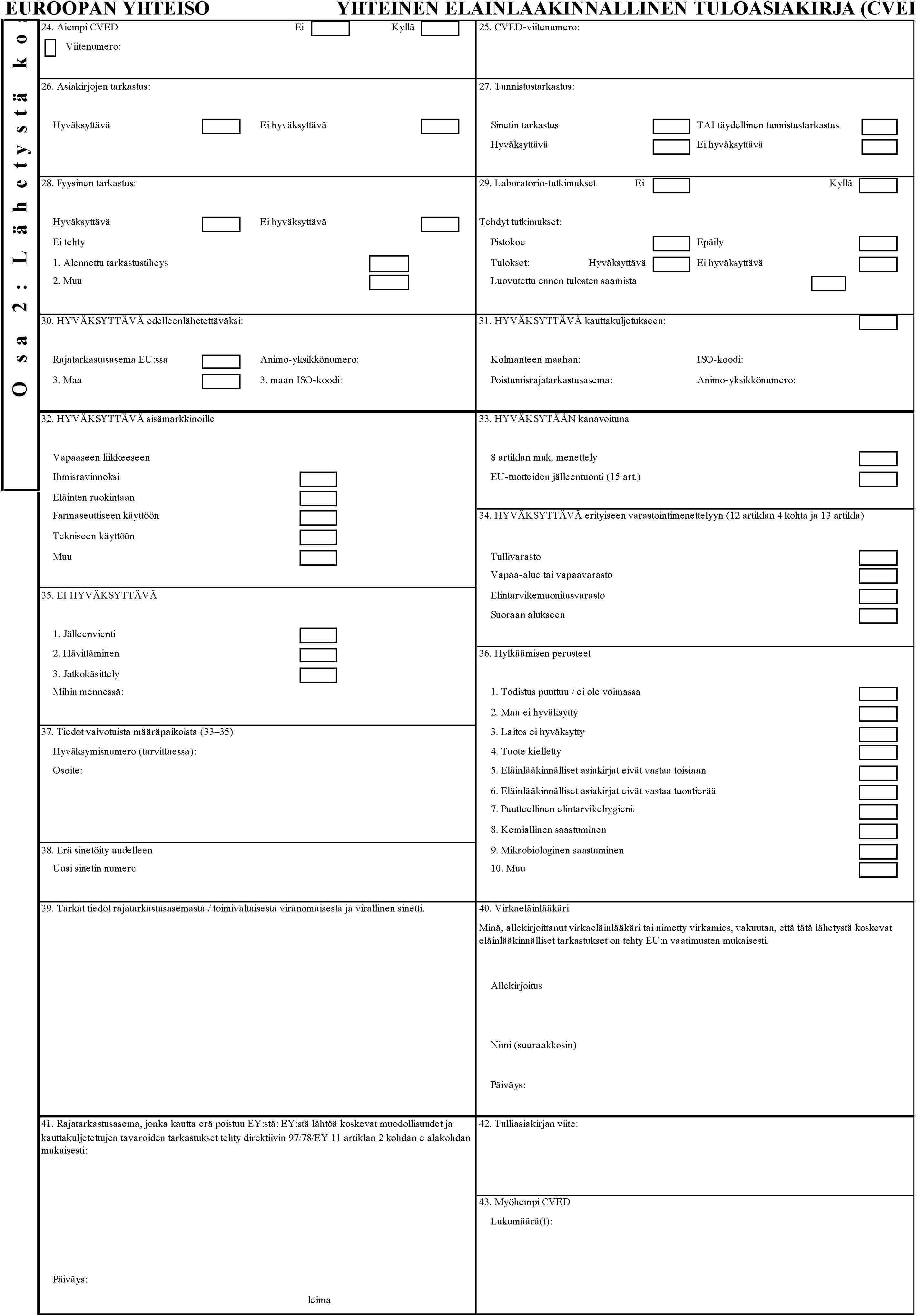
LIITE III
YHTEINEN ELÄINLÄÄKINNÄLLINEN TULOASIAKIRJA (CVED)


Ohjeet CVED-todistuksen täyttämistä varten ( 12 )
Yleistä:
Todistus täytetään suuraakkosin. Jos jokin laatikko voidaan poistaa tai se ei ole tarpeen, pyyhi se yli selkeästi tai vedä ruksi koko numeroidun laatikon yli. Myönteinen vastaus merkitään joko oikein-merkillä tai rastimalla ![]() -merkki.
-merkki.
Todistus täytetään kaikista rajatarkastusasemilla esitettävistä eristä, onpa kyseessä sitten EU:n vaatimukset täyttävänä vapaaseen liikkeeseen esitettävä erä taikka kanavoitava erä tai erät, jotka eivät täytä EU:n vaatimuksia ja jotka on tarkoitettu edelleenlähetettäviksi, kauttakuljetettaviksi, varastoitaviksi vapaa-alueilla, vapaavarastoissa tai tullivarastoissa taikka elintarvikemuonitusvarastoihin. Kanavoinnilla viitataan eriin, jotka ovat hyväksyttäviä direktiivin 97/78/EY 8 artiklan edellytysten mukaisesti mutta jotka pidetään eläinlääkärin valvonnassa määrättyyn lopulliseen määräpaikkaan asti, yleensä jatkokäsittelyä varten.
ISO-koodeilla tarkoitetaan kansainvälisiä kaksikirjaimisia maakoodeja.
Osa 1.
|
Tämän osan täyttää ilmoituksen tekijä tai direktiivin 97/78/EY 2 artiklan 2 kohdan e alakohdassa määritelty lastauksesta vastaava henkilö. Ohjeet noudattavat todistuksen laatikoiden numerointia. |
|
|
Laatikko 1. |
Lähettäjä/viejä: erän lähettävä kaupallinen yritys (kolmannessa maassa). |
|
Laatikko 2. |
Rajatarkastusasema. Täytetään, jos tietoja ei ole painettu lomakkeeseen valmiiksi. CVED-todistuksen viitenumero on CVED-todistuksen allekirjoittaneen rajatarkastusaseman antama viitenumero (myös laatikossa 25). Animo-yksikkönumero on kunkin rajatarkastusaseman oma numero, joka on mainittu aseman nimen edessä Euroopan unionin virallisessa lehdessä julkaistussa hyväksyttyjen rajatarkastusasemien luettelossa. |
|
Laatikko 3. |
Vastaanottaja: kolmannen maan antamassa terveystodistuksessa mainitun henkilön tai kaupallisen yrityksen osoite. Jos näitä tietoja ei ole todistuksessa, voidaan käyttää kaupallisissa asiakirjoissa mainitun vastaanottajan tietoja. |
|
Laatikko 4. |
Lastauksesta vastaavalla henkilöllä (myös edustaja tai ilmoituksen tekijä) tarkoitetaan direktiivin 97/78/EY 2 artiklan 2 kohdan e alakohdassa määriteltyä henkilöä, joka vastaa erästä, kun se esitetään rajatarkastusasemalle ja tekee tarvittavat ilmoitukset toimivaltaisille viranomaisille tuojan puolesta (ilmoitettava nimi ja osoite). |
|
Laatikko 5. |
Tuoja: tuojan ei tarvitse tulla itse rajatarkastusasemalle. Ilmoitetaan nimi ja osoite. Jos tuoja ja edustaja ovat sama, merkitään ”Ks. laatikko 4”. |
|
Laatikko 6. |
Alkuperämaalla tarkoitetaan maata, jossa tuote on tuotettu, valmistettu tai pakattu. |
|
Laatikko 7. |
Lähetysmaalla tarkoitetaan maata, jossa erä lastattiin lopulliseen kuljetusvälineeseen yhteisöön kuljetusta varten. |
|
Laatikko 8. |
Myös toimitusosoite EU:ssa. Tämä koskee sekä vaatimustenmukaisia (laatikko 19) että ei vaatimustenmukaisia (laatikko 22) tuotteita. |
|
Laatikko 9. |
Arvioitu päivämäärä, jona erän odotetaan saapuvan rajatarkastusasemalle. |
|
Laatikko 10. |
Eläinlääkinnällisen todistuksen/asiakirjan antopäivä on päivä, jona virkaeläinlääkäri tai toimivaltainen viranomainen allekirjoittaa todistuksen/asiakirjan. Numero: todistuksen virallinen numero. Jos tuotteet tulevat hyväksytystä tai rekisteröidystä laitoksesta tai aluksesta, merkitään tarvittaessa nimi ja hyväksymis- tai rekisteröintinumero. Alkioista, munasoluista tai siemennesteestä annetaan hyväksytyn siirtoryhmän tunnistusnumero. |
|
Laatikko 11. |
Tarkat tiedot tulokuljetusvälineestä: ilma-aluksesta lennon ja lentorahtikirjan numero, aluksesta aluksen nimi ja konossementin numero, maantieajoneuvoista rekisterinumero ja tarvittaessa perävaunun numero, rautatiekuljetuksista junan tunnistetiedot ja vaunun numero. |
|
Laatikko 12. |
Tavaroiden luonteesta on mainittava eläinlaji, tuotteille tehdyt käsittelyt sekä lastin muodostavien pakkausten lukumäärä ja pakkaustapa (esim. 50 kpl 25 kg:n laatikoita) tai konttien lukumäärä. Merkitään rasti asianmukaisesti kuljetusvälineen lämpötilan kohdalle. |
|
Laatikko 13. |
CN-koodi: vähintään neljä ensimmäistä numeroa kyseisestä neuvoston asetuksen (ETY) N:o 2658/87, sellaisena kuin se on viimeksi muutettuna, mukaisen yhdistetyn tullinimikkeistön CN-koodista. Koodit on lueteltu komission päätöksessä 2002/349/EY (ne vastaavat myös HS-järjestelmän koodeja). Jos ainoastaan kalastustuotteiden tapauksessa yhdelle erälle, jonka sisältö kuuluu useampaan kuin yhteen nimikenumeroon, on yksi todistus, lisäkoodeja voidaan tarvittaessa merkitä CVED-todistukseen. |
|
Laatikko 14. |
Bruttopaino: kokonaispaino kilogrammoina. Tämä määritellään tuotteiden yhteenlaskettuna massana tuotetta lähimpänä olevine astioineen ja pakkauksineen, lukuun ottamatta kuitenkin kuljetuskontteja ja muuta kuljetusvälineistöä. |
|
Laatikko 15. |
Nettopaino: varsinaisen tuotteen paino ilman pakkausta kilogrammoina. Tämä määritellään tuotteiden massana ilman tuotetta lähimpänä olevia astioita tai pakkauksia. Jos painon ilmaiseminen ei ole tarkoituksenmukaista, käytetään yksikköjä, esimerkiksi 100 X ml:n suuruista olkea siemennestettä tai 3 biologista kantaa/alkiota. |
|
Laatikko 16. |
Tarvittaessa annetaan kaikki sinetin ja kontin numerot. |
|
Laatikko 17. |
Edelleenlähetys: jos erää ei maahantuoda tämän rajatarkastusaseman kautta vaan se kuljetetaan edelleen toisella aluksella tai ilma-aluksella joko tuotavaksi yhteisöön toisen tai sitä seuraavien yhteisön/ETA:n rajatarkastusasemien kautta tai EU:n ulkopuoliseen määrämaahan. Animo-yksikkönumero — ks. laatikko 2. |
|
Laatikko 18. |
Kauttakuljetus: erät, jotka eivät ole EU:n vaatimusten mukaisia ja jotka on tarkoitettu lähetettäviksi kolmanteen maahan EU:n/tarkoituksenmukaisen ETA-maan kautta maitse, rauta- tai vesiteitse. Poistumisrajatarkastusasema: sen rajatarkastusaseman nimi, jonka kautta tuotteet lähtevät yhteisöstä. Animo-yksikkönumero — ks. laatikko 2. |
|
Laatikko 19. |
Vaatimustenmukaiset tuotteet: kaikki sisämarkkinoilla vapaaseen liikkeeseen laskettavat tuotteet, myös ne, jotka ovat hyväksyttäviä mutta jotka asetetaan ”kanavointimenettelyyn”, ja ne, jotka voidaan vapaaseen liikkeeseen laskemista koskevan eläinlääkinnällisen hyväksynnän jälkeen varastoida tullivalvonnassa ja luovuttaa tullivalvonnasta myöhemmin joko siinä tullitoimipaikassa, johon rajatarkastusasema on maantieteellisesti sidoksissa, ja/tai toisessa paikassa. Ei vaatimustenmukaiset tuotteet: tuotteet, jotka eivät ole EU:n vaatimusten mukaisia ja jotka on tarkoitettu vapaa-alueille, vapaavarastoihin, tullivarastoihin, elintarvikemuonitusvarastoihin tai aluksille taikka kauttakuljetettaviksi EU:n ulkopuoliseen maahan. |
|
Laatikko 20. |
Jälleenviennillä tarkoitetaan EU:n alkuperää olevia eriä, joita ei ole hyväksytty tai joilta on evätty pääsy kolmanteen maahan ja jotka palautetaan alkuperälaitokseen EU:ssa. |
|
Laatikko 21. |
Sisämarkkinat: tämä koskee eriä, jotka esitetään jakeluun yhtenäismarkkinoilla. Merkitään rasti sen kategorian kohdalle, johon erä esitetään. Tämä koskee myös eriä, jotka voidaan vapaaseen liikkeeseen laskemista koskevan eläinlääkinnällisen hyväksynnän jälkeen varastoida tullivalvonnassa ja luovuttaa tullivalvonnasta myöhemmin ja/tai toisessa paikassa eikä rajatarkastusaseman sijaintipaikkakunnalla. |
|
Laatikko 22. |
Tämä laatikko täytetään kaikista tuotteista, jotka eivät ole EU:n vaatimusten mukaisia, kun erä toimitetaan tai varastoidaan eläinlääkintäviranomaisten valvonnassa vapaa-alueelle, vapaavarastoon, tullivarastoon tai elintarvikemuonitusvarastoihin. Huom.Laatikoissa 18 ja 22 tarkoitetaan ainoastaan eläinlääkintämenettelyjä. |
|
Laatikko 23. |
Allekirjoitus. Tämä velvoittaa allekirjoittajan myös ottamaan vastaan kauttakuljetetut erät, joiden maahanpääsyn jokin kolmas maa hylkää. |
Osa 2. Tämän osan täyttää vain virkaeläinlääkäri tai nimetty virkamies (päätöksen 93/352/ETY mukaan)
Laatikot 38—41 on täytettävä muulla värillä kuin mustalla.
|
Laatikko 24. |
Aiempi CVED-todistus: ilmoitetaan aikaisemmin mahdollisesti annetun CVED-todistuksen sarjanumero. |
|
Laatikko 25. |
Tällä tarkoitetaan todistuksen antavan rajatarkastusaseman antamaa viitenumeroa, ja se on sama kuin laatikossa 2. |
|
Laatikko 26. |
Asiakirjojen tarkastus. Täytetään kaikista eristä. |
|
Laatikko 27. |
Rastitetaan ”sinetin tarkastus”, jos kontteja ei avata vaan tarkastetaan ainoastaan sinetti direktiivin 97/78/EY 4 artiklan 4 kohdan a alakohdan i alakohdan mukaisesti. |
|
Laatikko 28. |
Fyysiset tarkastukset: Alennetulla tarkastustiheydellä viitataan komission päätöksessä 94/360/ETY säädettyyn järjestelmään, jossa erää ei ole valittu fyysisesti tarkastettavaksi, mutta sitä pidetään hyväksyttävästi tarkastettuna ainoastaan asiakirja- ja tunnistustarkastuksen perusteella. ”Muu” tarkoittaa seuraavia: jälleentuontimenettely, kanavoitavat tavarat, edelleenlähetys, kauttakuljetus tai 12—13 artiklan mukaiset menettelyt. Nämä käyttötarkoitukset voidaan todeta muista laatikoista. |
|
Laatikko 29. |
Täydennä niiden tutkittavien aineiden tai patogeenien osalta, joista tehdään tutkimukset. ”Pistokoe” tarkoittaa, että näyte-erää ei pidätellä tulosten valmistumiseen asti, josta olisi ilmoitettava määräpaikan toimivaltaiselle viranomaiselle Animo-viestillä (ks. direktiivin 97/78/EY 8 artikla). ”Epäily” kattaa tapaukset, joissa erää on pidätelty suotuisan tuloksen saamiseen asti tai tutkimus on tehty elintarvikkeiden nopean hälytysjärjestelmän (RASFF) aiemman ilmoituksen taikka voimassa olevan suojatoimenpiteen vuoksi. |
|
Laatikko 30. |
Täytetään, jos tarpeen edelleenlähetyksen hyväksymistä varten. Jos erää ei maahantuoda tämän rajatarkastusaseman kautta vaan se kuljetetaan edelleen toisella aluksella tai ilma-aluksella joko tuotavaksi yhteisöön toisen tai sitä seuraavien yhteisön/ETA:n rajatarkastusasemien kautta tai EU:n ulkopuoliseen määrämaahan. Katso direktiivin 97/78/ETY 9 artikla ja komission päätös 2000/25/EY (1). Animo-yksikkönumero — ks. laatikko 2. |
|
Laatikko 31. |
Kauttakuljetus: täytetään, kun sellaisten erien lähetys EU:n/tarkoituksenmukaisen ETA-maan kautta maitse, rauta- tai vesiteitse kolmanteen maahan, jotka eivät ole EU:n vaatimusten mukaisia, on hyväksyttyä. Tämän on tapahduttava eläinlääkinnällisessä valvonnassa direktiivin 97/78/EY 11 artiklan ja päätöksen 2000/208/EY edellytysten mukaisesti. |
|
Laatikko 32. |
Tämä laatikko täytetään kaikista eristä, jotka on hyväksytty vapaaseen liikkeeseen yhtenäismarkkinoilla. (Se pitäisi täyttää myös eristä, jotka ovat EU:n vaatimusten mukaisia mutta joita ei taloudellisista syistä tullata välittömästi rajatarkastusasemalla vaan varastoidaan tullivalvonnassa tullivarastoon tai tullataan myöhemmin ja/tai maantieteellisesti erillisessä paikassa.) |
|
Laatikot 33 ja 34. |
Täytetään, jos eriä ei voida eläinlääkinnällisten sääntöjen perusteella hyväksyä laskettaviksi vapaaseen liikkeeseen vaan niitä pidetään suuririskisempinä ja ne lähetetään eläinlääkärin ja tullin valvonnassa johonkin direktiivissä 97/78/EY säädetyistä valvotuista määräpaikoista. Erät voidaan hyväksyä vapaa-alueille, vapaavarastoihin ja tullivarastoihin vain jos direktiivin 97/78/EY 12 artiklan 4 kohdassa säädetyt edellytykset täyttyvät. |
|
Laatikko 33. |
Täytetään, jos erät hyväksytään mutta ne on kanavoitava johonkin direktiivin 97/78/EY 8 tai 15 artiklassa säädetyistä erityisistä määräpaikoista. |
|
Laatikko 34. |
Täytetään kaikista eristä, jotka eivät täytä EU:n vaatimuksia ja jotka on tarkoitettu varastoitaviksi ja siirrettäviksi direktiivin 97/78/EY 12 artiklan 4 kohdan mukaisesti hyväksyttyihin varastoihin tai mainitun direktiivin 13 artiklan mukaisesti hyväksytyille toimijoille. |
|
Laatikko 35. |
Ilmoitetaan selkeästi, jos tuonti on hylätty, ja tästä seuraava menettelytapa. Ehdotetun toimen päättymispäivä on ilmoitettava. Mahdollisen jatkokäsittelylaitoksen osoite ilmoitetaan laatikossa 37. Hylkäämisen tai jatkokäsittelypäätöksen jälkeen myöhempien toimien toteutuspäivämäärä olisi merkittävä jatkotoimia koskevaan rekisteriin. |
|
Laatikko 36. |
Hylkäämisen syyt: täytetään tarvittaessa tarkoituksenmukaisten lisätietojen antamiseksi. Merkitään rasti asianmukaiseen laatikkoon. Kohta 7 koskee kohtiin 8 ja 9 kuulumattomia elintarvikehygieniapuutteita, kuten lämpötilan valvonnan epäsäännönmukaisuus, mädäntyminen tai likaiset tuotteet. |
|
Laatikko 37. |
Hyväksymisnumerot ja osoitteet (tai aluksen nimi ja satama) kaikkien määräpaikkojen osalta, joissa erälle on tehtävä eläinlääkinnällisiä lisätarkastuksia eli laatikko 33 (kanavointi), laatikko 34 (varastointimenettely) tai laatikko 35 (jatkokäsittely tai hävittäminen). |
|
Laatikko 38. |
Täytetään, jos erälle kirjattu alkuperäinen sinetti rikkoutuu konttia avattaessa. Kaikista tähän tarkoitukseen käytetyistä sineteistä on pidettävä konsolidoitua luetteloa. |
|
Laatikko 39. |
Rajatarkastusaseman tai toimivaltaisen viranomaisen virallinen leima. |
|
Laatikko 40. |
Eläinlääkärin tai, jos on kyse ainoastaan kalaa käsittelevistä satamista, päätöksen 93/325/ETY mukaisesti nimetyn virkamiehen allekirjoitus. |
|
Laatikko 41. |
Tämä laatikko täytetään rajatarkastusasemalla, jolta erät poistuvat EU:sta, kun ne kauttakuljetetaan EU:n kautta sen ulkopuolelle päätöksen 2000/208/EY mukaisesti. Jos kauttakuljetusta ei ole, tähän laatikkoon voidaan vaihtoehtoisesti merkitä lisäkommentteja esim. selkärangan poistamatta jättämisestä tai suoritetuista maksuista. |
|
Laatikko 42. |
Tulliviranomaisten käyttöön lisätietoja varten (esim. T1- tai T5-tullitodistusten numero) kun erät jäävät tullivalvontaan joksikin aikaa. Tiedot lisätään yleensä eläinlääkärin allekirjoituksen jälkeen. |
|
Laatikko 43. |
Täytetään, jos alkuperäinen CVED-todistus on jätettävä johonkin paikkaan, ja siitä on annettava kaksoiskappaleita. |
|
(1) EYVL L 9, 13.1.2000, s. 27. |
|
LIITE IV
TÄMÄN ASETUKSEN 9 ARTIKLASSA MAINITTU KASVIPERÄISTEN TUOTTEIDEN LUETTELO
Kasviperäiset tuotteet, joille tehdään eläinlääkinnälliset tarkastukset:
1. Olki
2. Heinä
LIITE V
TÄMÄN ASETUKSEN 9 ARTIKLASSA MAINITTU MAALUETTELO
|
ISO-koodi |
Maa |
|
AU |
Australia |
|
BY |
Valko-Venäjä (1) |
|
CA |
Kanada |
|
CH |
Sveitsi |
|
CL |
Chile |
|
GL |
Grönlanti |
|
IS |
Islanti |
|
NZ |
Uusi-Seelanti |
|
RS |
Serbia (2) |
|
UA |
Ukraina (1) |
|
US |
Yhdysvallat |
|
ZA |
Etelä-Afrikka (lukuun ottamatta suu- ja sorkkataudin torjunta-alueen sitä osaa, joka ulottuu Transvaalin pohjoiseen ja itäiseen eläinlääkintäalueeseen, Natalin eläinlääkintäalueen Ingwavuman piiriin ja Botswanan vastaiseen raja-alueeseen 28° pituuspiirin itäpuolella) |
|
(1) Ainoastaan poltettavaksi tarkoitetut olkipelletit, jotka toimitetaan asetuksen (ETY) N:o 2913/92 (EYVL L 302, 19.10.1992, s. 1) 4 artiklan 16 kohdan b alakohdan mukaisen passitusmenettelyn mukaisesti ja Traces-järjestelmässä suoritettavassa valvonnassa suoraan hyväksytyltä unioniin saapumispaikan rajatarkastusasemalta määräpaikkana olevaan laitokseen unionissa, jossa ne poltetaan. (2) Sellaisena kuin se on mainittuna Euroopan yhteisöjen ja niiden jäsenvaltioiden sekä Serbian tasavallan välisen vakautus- ja assosiaatiosopimuksen (EUVL L 278, 18.10.2013. s. 16) 135 artiklassa. |
|
( 1 ) EYVL L 24, 30.1.1998, s. 9.
( 2 ) EYVL L 373, 31.12.1990, s. 1.
( 3 ) EYVL L 9, 15.1.1993, s. 33.
( 4 ) EUVL L 101, 23.4.2003, s. 14.
( 5 ) EYVL L 64, 11.3.2000, s. 20.
( 6 ) EYVL L 240, 23.9.2000, s. 14.
( 7 ) EYVL L 353, 30.12.2002, s. 1.
( 8 ) EYVL L 144, 16.6.1993, s. 25.
( 9 ) Tässä asetuksessa termillä ’tulliselvitys’ tarkoitetaan luovutusta vapaaseen liikkeeseen, sellaisena kuin se määritellään yhteisön tullikoodeksista annetun asetuksen (ETY) N:o 2913/92 79 artiklassa (EYVL L 302, 19.10.1992, s. 1).
( 10 ) EUVL L 77, 24.3.2009, s. 1.
( 11 ) EYVL L 18, 23.1.2003, s. 11.
( 12 ) Täyttöohjeet voidaan tulostaa ja niitä voidaan jakaa erikseen ilman itse todistusta.