|
6)
|
Lisätään C.31–C.46 luvut seuraavasti: ”C.31. MAAKASVITESTI: ITÄVYYDEN JA ALKUKASVUN TESTAUS
JOHDANTO
|
1.
|
Tämä testimenetelmä vastaa OECD:n testiohjetta (TG) nro 208 (2006). Testimenetelmiä tarkastellaan säännöllisesti uudelleen tieteen kehityksen ja sääntelyyn sovellettavuuden perusteella. Tällä päivitetyllä testimenetelmällä arvioidaan kemikaalien mahdollisia vaikutuksia itävyyteen ja alkukasvuun. Tässä muodossa testi ei kata kroonisia vaikutuksia tai lisääntymiselle aiheutuvia vaikutuksia (eli vaikutuksia siementen ja kukkien muodostukselle tai hedelmien kypsymiselle). Altistusolosuhteet sekä testattavan kemikaalin ominaisuudet on otettava huomioon, jotta käytettävät testimenetelmät ovat asianmukaisia (esimerkiksi metalleja/metalliyhdisteitä testattaessa on otettava huomioon pH-arvon ja siihen liittyvien vastaioneiden vaikutukset) (1). Tämä testimenetelmä ei koske kasveja, jotka altistuvat kemikaalihöyryille. Testimenetelmää voidaan soveltaa yleisten kemikaalien, torjunta-aineiden ja kasvinsuojeluaineiden (eli biosidien) testaamiseen. Testimenetelmä on kehitetty olemassaolevien menetelmien pohjalta (2), (3), (4), (5), (6), (7). Huomioon on otettu myös muuta kasvien testaamisen kannalta olennaista lähdekirjallisuutta (8), (9), (10). Käytetyt määritelmät on esitetty lisäyksessä 1.
|
TESTIN PERIAATE
|
2.
|
Testillä arvioidaan maaperässä (tai muussa sopivassa kasvualustana toimivassa maa-aineksessa) olevan testikemikaalin aiheuttaman altistuksen vaikutuksia korkeampien kasvien itävyyteen ja varhaiseen kasvuun. Siemenet tuodaan kosketuksiin testikemikaalilla käsitellyn maa-aineksen kanssa ja vaikutuksia arvioidaan yleensä 14–21 vuorokauden kuluttua siitä, kun kontrolliryhmän siemenistä on itänyt 50 prosenttia. Mitatut loppupisteet ovat itävyyden silmämääräinen arviointi, versojen kuivapaino (vaihtoehtoisesti versojen tuorepaino) ja joissakin tapauksissa versojen korkeus sekä näkyvien haittavaikutusten arviointi kasvin eri osissa. Mittauksia ja havaintoja verrataan käsittelemättömistä kontrollikasveista tehtyihin.
|
|
3.
|
Odotetun altistusreitin mukaan testikemikaali joko viedään maaperän (tai mahdollisesti kasvualustana toimivan keinomaan) sisään tai sitä levitetään maan pinnalle sen mukaan, kumpi edustaa todenmukaisemmin mahdollista altistumisreittiä kemikaalille. Maaperän sisään vieminen tehdään käsittelemällä ritsosfääriin kuulumatonta maa-ainesta. Kemikaalin lisäämisen jälkeen maa-aines siirretään ruukkuihin, minkä jälkeen tutkittavan kasvilajin siemenet kylvetään maa-ainekseen. Pintalevitys tehdään ruukuissa olevalle maa-ainekselle, johon siemenet on jo kylvetty. Testiyksiköt (kontrollit ja käsitellyt maa-ainekset sekä siemenet) sijoitetaan tämän jälkeen sopiviin, kasvien itämistä/kasvua tukeviin olosuhteisiin.
|
|
4.
|
Testi voidaan tehdä halutun tarkoituksen mukaan annosvastekäyrän määrittämiseksi tai raja-annostestinä käyttämällä vain yhtä pitoisuutta/tasoa. Jos yhdellä pitoisuudella/tasolla tehdyn testin tulokset ylittävät tietyn myrkyllisyystason (esimerkiksi kun havaitaan yli x prosentin vaikutuksia), tehdään pitoisuusalueen määritystesti, jonka avulla määritellään myrkyllisyyden ylä- ja alarajat, minkä jälkeen laaditaan annosvastekäyrä toistamalla testi usealla pitoisuudella/tasolla. Sopivalla tilastollisella analyysilla saadaan vaikuttava pitoisuus (effective concentration) ECx tai vaikuttava käyttömäärä (effective application rate) ERx (esimerkiksi EC25, ER25, EC50, ER50) yhdelle tai useammalle herkimmälle tutkittavalle parametrille. Testissä voidaan lisäksi laskea pitoisuus, josta ei aiheudu vaikutuksia (NOEC) sekä pienin havaittavan vaikutuksen aiheuttava pitoisuus (LOEC).
|
TESTIKEMIKAALIA KOSKEVIA TIETOJA
|
5.
|
Seuraavien tietojen avulla voidaan tunnistaa kemikaalin odotettavissa oleva altistusreitti ja helpottaa koejärjestelyn suunnittelua: rakennekaava, puhtaus, vesiliukoisuus, liukoisuus orgaanisiin liuottimiin, 1-oktanoli/vesi-jakaantumiskerroin, maaperän sorptiokäyttäytyminen, höyrynpaine, kemiallinen stabiilisuus vedessä ja valossa sekä biohajoavuus.
|
TESTIN VALIDITEETTI
|
6.
|
Jotta testi olisi luotettava, kontrollin on täytettävä seuraavat kriteerit:
|
—
|
itävyys on vähintään 70 prosenttia;
|
|
—
|
taimissa ei ole näkyviä fytotoksisia vaikutuksia (esimerkiksi kloroosia, nekroosia, kuihtumista, lehtien ja versojen epämuodostumia) ja kasveissa ilmenee vain kyseiselle lajille tavanomaista kasvussa ja morfologiassa tapahtuvaa vaihtelua;
|
|
—
|
itäneiden kontrollitaimien keskimääräinen eloonjääneisyys on vähintään 90 prosenttia koko tutkimuksen ajan;
|
|
—
|
yksittäisen lajin ympäristöolosuhteet ovat identtiset ja kasvualustassa on yhtä paljon samasta lähteestä peräisin olevaa maa-ainesta, tukiainetta tai substraattia.
|
|
VERTAILUKEMIKAALI
|
7.
|
Vertailukemikaalin säännöllisin väliajoin tapahtuvalla testaamisella voidaan todeta, että testin toimivuus, tiettyjen testikasvien vaste tai testiolosuhteet eivät ole merkittävästi muuttuneet ajan myötä. Vaihtoehtoisesti testijärjestelmän toimivuutta tietyissä laboratoriossa voidaan arvioida mittaamalla kontrollien historiallista biomassaa tai kasvua, mikä toimii myös laboratorion sisäisenä laadunvalvontatoimenpiteenä.
|
MENETELMÄN KUVAUS
Luonnollinen maaperä – Keinotekoinen substraatti
|
8.
|
Kasveja voidaan kasvattaa ruukuissa, joissa käytetään hiekkapitoista hiesua, savista hiekkaa tai hiekkapitoista savimultaa, joka sisältää enintään 1,5 prosenttia orgaanista hiiltä (noin kolme prosenttia orgaanista ainesta). Kaupallisesti myytävää kukkamultaa tai synteettistä maaperäseosta voidaan myös käyttää, kunhan se sisältää enintään 1,5 prosenttia orgaanista hiiltä. Savimaata ei käytetä, jos tiedossa on, että testikemikaalin affiniteetti saveen on suuri. Peltomaa homogenisoidaan ja karkeat hiukkaset poistetaan seulomalla 2 mm:n raekokoon. Valmiista lopullisesta maaperästä ilmoitetaan tyyppi ja rakenne, orgaanisen hiilen pitoisuus prosentteina, pH-arvo sekä suolapitoisuus sähkönjohtavuutena. Maaperä luokitellaan tavanmukaisen luokittelujärjestelmän mukaan (11). Maaperä voidaan pastöroida tai lämpökäsitellä maaperän patogeenien vaikutuksen vähentämiseksi.
|
|
9.
|
Luonnollinen maaperä saattaa vaikeuttaa tulosten tulkintaa ja lisätä vaihtelua fysikaalisten ja kemiallisten ominaisuuksien sekä mikrobipopulaatioiden vaihtelevuuden vuoksi. Nämä muuttujat puolestaan muuttavat vedenpidätyskykyä, kemikaalien sitomiskykyä, tuulettumista sekä ravinne- ja hivenainepitoisuutta. Näiden fysikaalisten ominaisuuksien vaihtelun lisäksi vaihtelua on myös kemiallisissa ominaisuuksissa, kuten pH-arvossa ja hapetus-pelkistyspotentiaalissa, mikä saattaa vaikuttaa testikemikaalin biologiseen hyötyosuuteen (12), (13), (14).
|
|
10.
|
Keinotekoisia substraatteja ei yleensä käytetä kasvinsuojeluaineiden testaamisessa, mutta niitä voidaan käyttää yleisten kemikaalien testaamisessa tai silloin, kun halutaan pitää luonnollisen maaperän käytöstä aiheutuva vaihtelu mahdollisimman pienenä ja lisätä testitulosten vertailukelpoisuutta. Käytettyjen substraattien on oltava inerttiä materiaalia, joiden vuorovaikutus testikemikaalin, kantoaineena toimivan liuottimen tai molempien kanssa on mahdollisimman pieni. Happopesty kvartsihiekka, mineraalivilla ja lasihelmet (halkaisijaltaan esimerkiksi 0,35–0,85 mm) on todettu riittävän inerteiksi materiaaleiksi, jotka absorboivat testikemikaalia mahdollisimman vähän (15), millä varmistetaan, että kemikaalia on mahdollisimman paljon taimen saatavana juuriston kautta. Käyttötarkoitukseen soveltumattomia substraatteja ovat vermikuliitti, perliitti ja muut erittäin imukykyiset materiaalit. Kasvin kasvuaan varten tarvitsemia ravinteita on oltava saatavilla, jotta kasvit eivät kärsi ravinteiden puutostiloista. Ravinteiden saantia on mahdollisuuksien mukaan arvioitava kontrollikasvien kemiallisella analyysilla tai silmämääräisellä arvioinnilla.
|
Testilajien valintakriteerit
|
11.
|
Valittavien lajien olisi oltava keskenään riittävän erilaisia esimerkiksi levinneisyyden, yleisyyden, lajikohtaisten elinkaaren ominaisuuksien, luontaisen levinneisyysalueen sekä kasvikunnan taksonomisen monimuotoisuuden näkökulmasta, jotta vasteissa olisi vaihtelua (8), (10), (16), (17), (18), (19), (20). Valinnassa olisi otettava huomioon mahdollisten testilajien seuraavat ominaisuudet:
|
—
|
lajilla on yhdenmukaisia siemeniä, joita on helposti saatavilla tavanomaisista, luotettavista siemenlähteistä ja joiden itävyys on johdonmukaista, luotettavaa ja tasaista, ja alkukasvu on yhdenmukaista;
|
|
—
|
kasvi soveltuu laboratoriokokeisiin ja antaa luotettavia ja toistettavia tuloksia samassa testilaitoksessa sekä eri testilaitosten kesken;
|
|
—
|
testattavan lajin herkkyys vastaa johdonmukaisesti kemikaalille alttiina olevassa ympäristössä tavattujen lajien vastetta;
|
|
—
|
lajeja on käytetty aiemmissa myrkyllisyyskokeissa ja niiden käyttö esimerkiksi torjunta-aineiden biologisissa testeissä, raskasmetallien seulonnassa, suolapitoisuus- tai mineraalirasituskokeissa tai allelopatiatutkimuksissa osoittaa herkkyyttä monille erilaisille stressitekijöille;
|
|
—
|
lajit sopivat testimenetelmän edellyttämiin kasvuolosuhteisiin;
|
|
—
|
lajit täyttävät testin validiteettikriteerit.
|
Eräitä eniten käytettyjä testilajeja on lueteltu lisäyksessä 2 ja mahdollisia ravintokasveihin kuulumattomia lajeja lisäyksessä 3.
|
|
12.
|
Testattavien lajien määrä riippuu sovellettavista sääntelyvaatimuksista, minkä vuoksi määrään ei oteta kantaa tämän testimenetelmän yhteydessä.
|
Testikemikaalin lisääminen
|
13.
|
Kemikaalia lisätään sopivaan kantaja-aineeseen (esimerkiksi vesi, asetoni, etanoli, polyeteeniglykoli, arabikumi tai hiekka). Testattavaksi sopivat myös seokset (kaupallisesti saatavat tuotteet tai valmisteet), jotka sisältävät aktiivisia ainesosia ja erilaisia apuaineita.
|
Maa-aineksen / keinotekoisen substraatin sisään vieminen
|
14.
|
Vesiliukoiset tai veteen suspendoituneet kemikaalit voidaan lisätä veteen, minkä jälkeen liuos sekoitetaan maa-ainekseen sopivalla sekoituslaitteella. Tämäntyyppinen testaaminen voi olla tarpeen, jos altistuminen kemikaalille tapahtuu maaperän tai maaperän huokosveden kautta ja tutkittavana seikkana on imeytyminen juuriin. Testikemikaalia lisäämällä ei pidä ylittää maa-aineksen vedenpidätyskykyä. Lisätyn veden määrän on oltava sama kaikille testipitoisuuksille, mutta sitä on rajoitettava, jotta maaperän sidosaineet eivät paakkuunnu.
|
|
15.
|
Heikosti veteen liukenevat kemikaalit liuotetaan sopivaan haihtuvaan liuottimeen (esimerkiksi asetoniin tai etanoliin) ja sekoitetaan hiekkaan. Liuotin voidaan tämän jälkeen poistaa hiekasta ilmavirralla, kun hiekkaa samalla sekoitetaan jatkuvasti. Käsitelty hiekka sekoitetaan testissä käytettävään maa-ainekseen. Toiseen kontrolliin lisätään vain hiekkaa ja liuotinta. Kaikkiin käsittelytasoihin sekä toiseen kontrolliin lisätään yhtä paljon hiekkaa, johon liuotin on sekoitettu ja josta se on poistettu. Kiinteät, liukenemattomat testikemikaalit sekoitetaan kuivaan maa-ainekseen sopivalla sekoituslaitteella. Tämän jälkeen maa-aines lisätään ruukkuihin ja siemenet kylvetään välittömästi.
|
|
16.
|
Jos maa-aineksen sijasta käytetään keinotekoista substraattia, vesiliukoiset kemikaalit voidaan liuottaa ravinneliuokseen juuri ennen testin aloittamista. Kemikaalit, jotka eivät liukene veteen, mutta jotka voidaan suspendoida veteen kantoaineena toimivan liuottimen avulla, lisätään kantoaineen kanssa ravinneliuokseen. Veteen liukenemattomat kemikaalit, joille ei ole olemassa myrkytöntä vesiliukoista kantoainetta, liuotetaan sopivaan haihtuvaan liuottimeen. Liuos sekoitetaan hiekkaan tai lasihelmiin, sijoitetaan pyörivään tyhjiölaitteeseen ja haihdutetaan, jolloin hiekka tai helmet saavat tasaisen kemikaalipäällysteen. Punnittu määrä helmiä otetaan erilleen samaa orgaanista liuotinta käyttäen ja kemikaalin määrä analysoidaan ennen kylvöastioiden täyttämistä.
|
Pintalevitys
|
17.
|
Kasvinsuojeluaineille testikemikaalin lisäysmenetelmänä käytetään usein maa-aineksen pinnan ruiskuttamista testiliuoksella. Kaikkien testissä käytettävien välineiden, mukaan lukien testikemikaalin valmistus- ja annosteluvälineet, on oltava malliltaan ja kapasiteetiltaan sellaisia, että näitä välineitä hyödyntävät testit voidaan tehdä täsmällisesti ja peittävyys on toistettavissa. Peittävyyden on oltava sama kaikilla maa-ainespinnoilla. Kemikaalien mahdollista adsorboitumista välineisiin tai reagoimista niiden kanssa (esimerkiksi käytettäessä muoviputkia ja lipofiilisiä kemikaaleja tai teräsosia ja alkuaineita) olisi vältettävä huolellisesti. Testikemikaalia ruiskutetaan maa-aineksen pinnalle simuloiden tavanomaisia levitystapoja ruiskusäiliötä käyttämällä. Ruiskutettavan määrän on yleensä oltava tavanomaisen maatalouskäytännön tasolla, ja määrät (esimerkiksi veden määrä) kirjataan muistiin. Suutin valitaan siten, että peittävyys on sama kautta koko maa-aineksen pinnan. Liuottimia ja kantoaineita käytettäessä perustetaan toinen kontrollikasvien ryhmä, jolle annetaan vain liuotinta/kantoainetta. Tämä ei kuitenkaan ole tarpeen silloin, kun testataan kasvinsuojeluaineita valmisteina.
|
Testikemikaalin pitoisuuden/tason toteaminen
|
18.
|
Käytetyt pitoisuudet/tasot on vahvistettava tarkoitukseen sopivalla analyyttisella todentamismenetelmällä. Kun käytetään liukoisia kemikaaleja, kaikki testipitoisuudet/-tasot voidaan todentaa analysoimalla pitoisuudeltaan suurin testissä käytettävä liuos sekä dokumentoimalla sen laimentaminen ja käyttämällä kemikaalin lisäämisessä kalibroituja välineitä (esimerkiksi kalibroituja analyysilaseja sekä kalibroituja ruiskutusvälineitä). Liukenemattomia kemikaaleja käytettäessä seosmateriaalin todentaminen tehdään ilmoittamalla maa-ainekseen lisätyn testikemikaalin paino. Mahdollista homogeenisuuden osoittamista varten voidaan tarvita maa-aineksen analyysi.
|
MENETTELY
Testijärjestely
|
19.
|
Saman kasvilajin siemenet kylvetään ruukkuihin. Ruukkua kohti kylvettävien siementen lukumäärä riippuu lajista, ruukun koosta ja testin kestosta. Yhdessä ruukussa olevien kasvien määrän olisi tarjottava riittävät kasvuolosuhteet siten, ettei ruukku käy liian ahtaaksi testin kuluessa. Kasvien enimmäistiheys on noin 3–10 siementä 100 cm2:ä kohti siementen koon mukaan. Viidentoista senttimetrin ruukkuun suositellaan esimerkiksi yhtä tai kahta maissin, soijapavun, tomaatin, kurkun tai sokerijuurikkaan tainta, kolmea rapsin tai herneen tainta tai 5–10:tä pientä siementä, kuten sipulin tai vehnän siementä. Siementen ja rinnakkaisnäyteruukkujen lukumäärän (yksi rinnakkaisnäyte tarkoittaa yhtä ruukkua, eikä samassa ruukussa olevia kasveja siis lasketa rinnakkaisnäytteiksi) olisi oltava riittävä optimaalista tilastollista analyysia varten (21). On syytä huomata, että vaihtelu on suurempaa testilajeilla, joista kylvetään muutama suuri siemen ruukkua kohti (rinnakkaisnäyte), kuin lajeilla, joita voidaan kylvää suurempi määrä pieniä siemeniä ruukkua kohti. Vaihtelua saadaan vähennettyä kylvämällä jokaiseen ruukkuun yhtä monta siementä.
|
|
20.
|
Kontrolliryhmien avulla varmistetaan, että havaitut vaikutukset ovat yhteydessä vain testikemikaalille tapahtuvaan altistukseen tai johtuvat siitä. Asianmukainen kontrolliryhmä on joka suhteessa identtinen testiryhmän kanssa testikemikaalille altistusta lukuun ottamatta. Kaikkien samassa testissä käytettävien testikasvien, mukaan lukien kontrollit, on oltava peräisin samasta lähteestä. Tulosten vääristymisen välttämiseksi testi- ja kontrolliruukut on määriteltävä satunnaisesti.
|
|
21.
|
Hyönteismyrkyllä tai sienitautien torjunta-aineella käsiteltyjen siementen (eli peitattujen siementen) käyttöä on vältettävä. Eräiden maiden sääntelyviranomaiset kuitenkin sallivat tiettyjen muiden kuin systeemisten kosketusvaikutteisten sienitautien torjunta-aineiden (esimerkiksi kaptaanin ja tiraamin) käytön (22). Jos on syytä epäillä siementen välityksellä kulkeutuvia patogeenejä, siemenet voidaan upottaa lyhyeksi aikaa 5-prosenttiseen hypokloriittiliuokseen, minkä jälkeen ne huuhdellaan huolellisesti juoksevassa vedessä ja kuivataan. Jälkikäsittely muilla kasvinsuojeluaineilla on kielletty.
|
Testiolosuhteet
|
22.
|
Testiolosuhteiden on oltava mahdollisimman lähellä testattavien lajien ja lajikkeiden normaalisti edellyttämiä kasvuolosuhteita (esimerkkejä testiolosuhteista on lisäyksessä 4). Itäviä kasveja olisi hoidettava hyvän puutarhanhoidon käytäntöjen mukaisesti ympäristöolosuhteiltaan säädeltävissä kasvatuskammioissa, fytotroneissa tai kasvihuoneissa. Kasvatustiloja käytettäessä näihin käytäntöihin kuuluu yleensä ainakin seuraavien valvonta ja riittävän säännöllinen kirjaaminen (esimerkiksi päivittäin): lämpötila, kosteus, hiilidioksidipitoisuus, valo (voimakkuus, aallonpituus, fotosynteesille suotuisa aallonpituusalue), valoisa aika sekä kastelutapa. Näin varmistetaan kasvien hyvä kasvu, jota voidaan arvioida valittuja lajeja edustavien kontrollikasvien avulla. Kasvihuoneiden lämpötilaa säädellään tuuletus-, lämmitys- ja/tai jäähdytysjärjestelmän avulla. Kasvihuoneessa tapahtuvaa testaamista varten suositellaan yleisesti seuraavanlaisia olosuhteita:
|
—
|
lämpötila: 22 °C ± 10 °C;
|
|
—
|
valoisa aika: vähintään 16 tuntia valoa;
|
|
—
|
valovoima: 350 ± 50 μE/m2/s. Lisävalaistusta saatetaan tarvita, jos valovoima laskee alle 200 μE/m2/s:iin ja aallonpituus alle 400–700 nm:iin, paitsi eräillä lajeilla, jotka tarvitsevat vähemmän valoa.
|
Ympäristöolosuhteita valvotaan ja ne kirjataan muistiin tutkimuksen ajan. Kasvatusruukkujen on oltava lasitettuja tai muuta kuin huokoista muovia, ja ruukun alle tulee lautanen. Ruukkujen sijaintia voidaan muuttaa määräajoin, jotta kasvien kasvussa ilmenevä vaihtelu jää mahdollisimman pieneksi (sillä kasvatustiloissa vallitsevissa testiolosuhteissa on eroja). Ruukkujen on oltava niin suuria, että normaali kasvu on mahdollista.
|
|
23.
|
Kasvien elinvoiman ylläpitämiseksi maa-ainekseen voidaan tarvittaessa lisätä ravinteita. Lisäravinteiden tarpeesta ja ajoituksesta päätetään kontrollikasveja tarkkailemalla. Suositeltavaa on kastella testiruukut pohjan kautta (esimerkiksi lasikuituisen kastelulangan avulla). Aluksi ruukkuja voidaan kuitenkin kastella päältä, jotta siementen itäminen nopeutuu. Jos testikemikaalia on levitetty maa-aineksen pintaan, kasteluvesi helpottaa kemikaalin tunkeutumista maa-ainekseen.
|
|
24.
|
Valittujen kasvuolosuhteiden olisi oltava testattavalle lajille ja tutkittavalle testikemikaalille sopivat. Kontrollikasvit ja käsitellyt kasvit pidetään samoissa ympäristöolosuhteissa, mutta eri tavoin käsiteltyjen kasvien välinen ristialtistus sekä kontrollikasvien altistuminen testikemikaalille (esimerkiksi haihtuvia kemikaaleja käytettäessä) on estettävä riittävin toimenpitein.
|
Testaaminen yhdellä pitoisuudella/tasolla
|
25.
|
Yhdellä pitoisuudella tai tasolla testaamiseen (altistuskoe/raja-annostesti) sopivan kemikaalin pitoisuuden/tason määrittämisessä on otettava huomioon useita tekijöitä. Yleisiä kemikaaleja testattaessa näitä ovat esimerkiksi kemikaalin fysikaaliset ja kemialliset ominaisuudet. Kasvinsuojeluaineita testattaessa on otettava huomioon testikemikaalin fysikaaliset ja kemialliset ominaisuudet ja käyttötapa, suurin pitoisuus tai käyttötaso, käyttökertojen määrä kasvukautta kohti ja/tai testikemikaalin pysyvyys. Kun halutaan selvittää, onko yleisellä kemikaalilla fytotoksisia ominaisuuksia, saattaa olla tarpeen tehdä testi enimmäistasolla 1 000 mg yhdessä kilogrammassa kuivaa maa-ainesta.
|
Pitoisuusalueen määritystesti
|
26.
|
Tarvittaessa voidaan tehdä pitoisuusalueen määritystesti, joka auttaa selvittämään lopullisessa annosvastetutkimuksessa testattavat pitoisuudet/tasot. Pitoisuusalueen määritystestissä käytetään kaukana toisistaan olevia pitoisuuksia (esimerkiksi 0,1, 1,0, 10, 100 ja 1 000 mg yhdessä kilogrammassa kuivaa maa-ainesta). Kasvinsuojeluaineiden pitoisuudet/tasot voivat perustua suositeltuun tai suurimpaan pitoisuuteen tai käyttötasoon ja olla esimerkiksi 1/100, 1/10 ja 1/1 suositellusta tai suurimmasta pitoisuudesta tai käyttötasosta.
|
Testaaminen useammalla pitoisuudella/tasolla
|
27.
|
Testillä, jossa käytetään useita pitoisuuksia/tasoja, todetaan sääntelyviranomaisten edellyttämällä tavalla annosvastesuhde ja määritetään ECx- tai ERx-arvo itävyydelle, biomassalle ja/tai silmämääräisesti havaittaville vaikutuksille verrattuna kontrolleihin, joita ei ole altistettu testikemikaalille.
|
|
28.
|
Pitoisuuksien tai tasojen lukumäärän ja välimatkojen on oltava riittäviä luotettavan annosvastesuhteen määrittämiseen ja regressioyhtälön muodostamiseen sekä ECx- ja ERx-arvojen arviointiin. Valittujen pitoisuuksien/tasojen on katettava määritettävät ECx- tai ERx-arvot. Jos esimerkiksi halutaan saada selville EC50-arvo, on suotavaa tehdä testi tasoilla, jotka tuottavat 20–80 prosentin vaikutuksen. Tuloksen saamiseksi suositellaan käytettävän vähintään viittä geometrisessa sarjassa olevaa pitoisuutta/tasoa, joiden etäisyyden määrittävä kerroin on enintään kolme, sekä käsittelemätöntä kontrollia. Rinnakkaisnäytteiden määrän kaikissa käsittely- ja kontrolliryhmissä on oltava vähintään neljä, ja siemeniä on oltava ainakin 20 kappaletta. Tietyille kasveille, joiden itävyys on heikko tai kasvutavassa esiintyy paljon vaihtelua, voidaan tarvita enemmän rinnakkaisnäytteitä, jotta testin tilastollinen voima paranee. Rinnakkaisnäytteiden määrää voidaan vähentää, jos testipitoisuuksia/tasoja on enemmän. NOEC-arvon arvioinnissa riittävä tilastollinen voima saattaa edellyttää useampia rinnakkaisnäytteitä (23).
|
Havainnot
|
29.
|
Tarkkailujakson aikana eli 14–21 päivän kuluessa siitä, kun 50 prosenttia kontrollikasveista (tarvittaessa myös liuotinkontrolleista) on itänyt, kasveja tarkkaillaan säännöllisesti (vähintään viikoittain, mutta mieluiten päivittäin) itämisen, silmämääräisesti havaittavan fytotoksisuuden sekä kuolleisuuden havaitsemiseksi. Testin lopussa kirjataan muistiin mitattu itävyysprosentti, elossa olevien kasvien biomassa sekä kasvin eri osissa näkyvät haittavaikutukset, joita ovat esimerkiksi poikkeamat itäneiden taimien ulkonäössä, kloroosi, värimuutokset, kuolleisuus sekä vaikutukset kasvin kehitykseen. Lopullinen biomassa voidaan mitata elossa olevien kasvien versojen lopullisesta keskimääräisestä kuivapainosta keräämällä versot maan pintaa myöten ja kuivaamalla ne vakiopainoon 60 asteen lämpötilassa. Vaihtoehtoisesti lopullinen biomassa voidaan mitata versojen tuorepainosta. Toinen päätepiste on esimerkiksi versojen korkeus, jos sääntelyviranomaiset tätä edellyttävät. Havaittavien toksisten vasteiden arvioinnissa käytetään yhtenäistä silmämääräisten vaurioiden pisteytysjärjestelmää. Esimerkkejä kvalitatiivisten ja kvantitatiivisten silmämääräisten luokitusten tekemisestä on lähdeteoksissa (23), (24).
|
TIEDOT JA RAPORTOINTI
Tilastoanalyysi
Yhden pitoisuuden/tason testi
|
30.
|
Kutakin kasvilajia koskevat tiedot analysoidaan sopivalla tilastollisella menetelmällä (21). Kasvilajista ilmoitetaan vaikutuksen taso testipitoisuudella/-tasolla tai se, että tiettyä vaikutusta ei tapahtunut testipitoisuudella/-tasolla (esimerkiksi < x prosentin vaikutus havaittiin y-pitoisuudella tai tasolla).
|
Usean pitoisuuden/tason testi
|
31.
|
Annosvastesuhde määritetään regressioyhtälöllä. Tässä voidaan käyttää erilaisia malleja: esimerkiksi ECx:n tai ERx:n (esim. EC25, ER25, EC50, ER50) sekä ERx:n itävyyden luottamusvälien arviointiin dikotomisena tietona sopivat esimerkiksi logitti-, probitti- tai Weibull-menetelmät, Spearmanin ja Kärberin menetelmä tai viritetty Spearmanin ja Kärberin menetelmä. Taimien kasvun (painon ja pituuden) jatkuvina loppupisteinä ECx:ää tai ERx:ää ja sen luottamusvälejä voidaan arvioida sopivalla regressioanalyysilla (esimerkiksi Bruce-Versteegin epälineaarinen regressioanalyysi (25)). R2:n pitäisi herkimmille lajeille olla mahdollisuuksien mukaan 0,7 tai enemmän ja käytettyjen testipitoisuuksien/-tasojen käsittää 20 %:n ja 80 %:n vaikutukset. NOEC-arvoa arvioitaessa kiinnitetään huomiota ennen kaikkea testin voimaan, ja testien valintaperusteena on tiedon hajonta (21), (26).
|
Testiraportti
|
32.
|
Testiraportista käyvät ilmi tutkimusten tulokset, minkä lisäksi siinä kuvataan yksityiskohtaisesti testiolosuhteet, pohditaan tuloksia huolellisesti, analysoidaan tiedot ja tehdään johtopäätöksiä analyysin pohjalta. Tulokset esitetään myös taulukkomuotoisena yhteenvetona ja tiivistelmänä. Testiraportissa on esitettävä seuraavat tiedot:
|
|
Testikemikaali:
|
—
|
kemikaalin tunnistetiedot, testatun kemikaalin testin kannalta olennaiset ominaisuudet (esimerkiksi log Pow, vesiliukoisuus ja höyrynpaine sekä tietoa kulkeutumisesta ja käyttäytymisestä ympäristössä, jos näitä on saatavilla);
|
|
—
|
kuvaus testiliuoksen valmistuksesta sekä testipitoisuuksien vahvistamisesta 18 kohdassa mainitulla tavalla.
|
|
|
|
Testilajit:
|
—
|
testiorganismin tiedot: laji/lajike, kasvisuku, tieteellinen nimi ja yleisnimi, siementen lähde ja historia mahdollisimman tarkasti (siis esimerkiksi toimittajan nimi, prosentuaalinen itävyys, siementen kokoluokka, eränumero, siementen vuosiluku tai kasvukausi, jolloin ne on kerätty, itävyysluokituksen päiväys ja elinkelpoisuus);
|
|
—
|
testattujen yksi- ja kaksisirkkaisten lajien lukumäärä;
|
|
—
|
perustelut lajien valinnalle;
|
|
—
|
kuvaus siementen varastoinnista, käsittelystä ja hoidosta.
|
|
|
|
Testiolosuhteet:
|
—
|
testauslaitos (esimerkiksi kasvatuskaappi, fytotroni tai kasvihuone);
|
|
—
|
testijärjestelmän kuvaus (esimerkiksi ruukkujen mitat ja materiaali sekä maa-aineksen määrä);
|
|
—
|
maa-aineksen ominaisuudet (maa-aineksen rakenne tai tyyppi: maa-aineshiukkasten jakautuminen ja luokitus, fysikaaliset ja kemialliset ominaisuudet, mukaan lukien orgaanisen aineksen osuus, orgaanisen hiilen osuus ja pH-arvo);
|
|
—
|
maa-aineksen tai substraatin (esimerkiksi maa-aineksen, keinomaan, hiekan tai muun) valmistelutoimet ennen testiä;
|
|
—
|
ravinneliuoksen kuvaus, jos sellaista on käytetty;
|
|
—
|
testikemikaalin käyttö: applikointimenetelmän kuvaus, käytettyjen välineiden kuvaus, altistustasot ja -määrät, mukaan lukien kemikaalien todentaminen, kalibrointimenetelmän kuvaus sekä kuvaus ympäristöolosuhteista applikoinnin aikana;
|
|
—
|
kasvuolosuhteet: valon voimakkuus (esimerkiksi fotosynteesille suotuisa aallonpituusalue (PAR)), valoisa aika, enimmäis- ja vähimmäislämpötilat, kasteluaikataulu ja -menetelmä, lannoittaminen;
|
|
—
|
yhteen ruukkuun kylvettyjen siementen lukumäärä, kasvien lukumäärä annosta kohti, rinnakkaisnäytteiden (ruukkujen) määrä altistustasoa kohti;
|
|
—
|
kontrollien tyyppi ja lukumäärä (negatiiviset ja/tai positiiviset kontrollit, mahdollinen liuotinkontrolli);
|
|
|
|
Tulokset:
|
—
|
taulukko kaikista loppupisteistä kunkin rinnakkaisnäytteen osalta, testipitoisuus/-taso ja laji;
|
|
—
|
itäneiden siementen lukumäärä ja prosenttiosuus kontrolleihin verrattuna;
|
|
—
|
biomassaa koskevat mittaukset: kasvien versojen kuivapaino tai tuorepaino prosenttiosuutena kontrolleista;
|
|
—
|
kasvien versojen pituus prosenttiosuutena kontrolleista, jos mitattu;
|
|
—
|
silmämääräisten vaurioiden prosenttiosuus sekä kvalitatiivinen ja kvantitatiivinen kuvaus testikemikaalin aiheuttamista silmämääräisistä vaurioista (kloroosi, nekroosi, kuihtuminen, lehtien ja versojen epämuodostumat tai tieto siitä, että mitään vaikutuksia ei ollut) kontrollikasveihin verrattuna;
|
|
—
|
kuvaus silmämääräisten vaurioiden arvioinnissa käytetystä asteikosta, jos silmämääräistä arviointia käytetään;
|
|
—
|
yksittäisen tason tutkimuksista ilmoitetaan vaurioiden prosenttiosuus;
|
|
—
|
ECx- tai ERx-arvot (esimerkiksi EC50, ER50, EC25, ER25) sekä niiden luottamusvälit. Regressioanalyysia käytettäessä ilmoitetaan regressioyhtälön keskivirhe sekä yksittäisten parametrien (esimerkiksi kaltevuuden tai vakiotermin) estimoinnin keskivirhe;
|
|
—
|
NOEC- ja LOEC-arvot, jos ne on laskettu;
|
|
—
|
kuvaus tilastollisista menetelmistä ja käytetyistä olettamuksista;
|
|
—
|
edellä mainittujen tietojen sekä testattujen lajien annosvastesuhteen esitys graafisessa muodossa.
|
|
Lisäksi ilmoitetaan poikkeukset tässä testimenetelmässä kuvatuista menettelyistä ja kaikki testin aikana ilmenneet epätavallisuudet.
|
LÄHDEKIRJALLISUUS
|
(1)
|
Schrader G., Metge K., and Bahadir M. (1998). Importance of salt ions in ecotoxicological tests with soil arthropods. Applied Soil Ecology, 7, 189–193.
|
|
(2)
|
International Organisation of Standards (ISO). (1993). ISO 11269-1. Soil Quality -- Determination of the Effects of Pollutants on Soil Flora – Part 1: Method for the Measurement of Inhibition of Root Growth.
|
|
(3)
|
International Organisation of Standards (ISO). (1995). ISO 11269-2. Soil Quality -- Determination of the Effects of Pollutants on Soil Flora – Part 2: Effects of Chemicals on the Emergence and Growth of Higher Plants.
|
|
(4)
|
American Standard for Testing Material (ASTM). (2002). E 1963-98. Standard Guide for Conducting Terrestrial Plant Toxicity Tests.
|
|
(5)
|
U.S. EPA. (1982). FIFRA, 40CFR, Part 158.540. Subdivision J, Parts 122-1 and 123-1.
|
|
(6)
|
US EPA. (1996). OPPTS Harmonized Test Guidelines, Series 850. Ecological Effects Test Guidelines:
|
—
|
850.4000: Background – Non-target Plant Testing;
|
|
—
|
850.4025: Target Area Phytotoxicity;
|
|
—
|
850.4100: Terrestrial Plant Toxicity, Tier I (Seedling Emergence);
|
|
—
|
850.4200: Seed Germination/Root Elongation Toxicity Test;
|
|
—
|
850.4225: Seedling Emergence, Tier II;
|
|
—
|
850.4230: Early Seedling Growth Toxicity Test.
|
|
|
(7)
|
AFNOR, X31-201. (1982). Essai d'inhibition de la germination de semences par une substance. AFNOR X31-203/ISO 11269-1. (1993) Determination des effets des polluants sur la flore du sol: Méthode de mesurage de l'inhibition de la croissance des racines.
|
|
(8)
|
Boutin, C., Freemark, K.E. and Keddy, C.J. (1993). Proposed guidelines for registration of chemical pesticides: Non-target plant testing and evaluation. Technical Report Series No.145. Canadian Wildlife Service (Headquarters), Environment Canada, Hull, Québec, Canada.
|
|
(9)
|
Forster, R., Heimbach, U., Kula, C., and Zwerger, P. (1997). Effects of Plant Protection Products on Non-Target Organisms – A contribution to the Discussion of Risk Assessment and Risk Mitigation for Terrestrial Non-Target Organisms (Flora and Fauna). Nachrichtenbl. Deut. Pflanzenschutzd. No 48.
|
|
(10)
|
Hale, B., Hall, J.C., Solomon, K., and Stephenson, G. (1994). A Critical Review of the Proposed Guidelines for Registration of Chemical Pesticides; Non-Target Plant Testing and Evaluation, Centre for Toxicology, University of Guelph, Ontario Canada.
|
|
(11)
|
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sc. Soc. Amer. Proc. 26:305 (1962).
|
|
(12)
|
Audus, L.J. (1964). Herbicide behaviour in the soil. Teoksessa: Audus, L.J. ed. The Physiology and biochemistry of Herbicides, London, New York, Academic Press, NY, Chapter 5, s. 163–206.
|
|
(13)
|
Beall, M.L., Jr. and Nash, R.G. (1969). Crop seedling uptake of DDT, dieldrin, endrin, and heptachlor from soil, J. Agro. 61:571–575.
|
|
(14)
|
Beetsman, G.D., Kenney, D.R. and Chesters, G. (1969). Dieldrin uptake by corn as affected by soil properties, J. Agro. 61:247–250.
|
|
(15)
|
U.S. Food and Drug Administration (FDA). (1987). Environmental Assessment Technical Handbook. Environmental Assessment Technical Assistance Document 4.07, Seedling Growth, 14 pp., FDA, Washington, DC.
|
|
(16)
|
McKelvey, R.A., Wright, J.P., Honegger, J.L. and Warren, L.W. (2002). A Comparison of Crop and Non-crop Plants as Sensitive Indicator Species for Regulatory Testing. Pest Management Science vol. 58:1161–1174
|
|
(17)
|
Boutin, C.; Elmegaard, N. and Kjær, C. (2004). Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: Implications for risk assessment. Ecotoxicology vol. 13(4): 349–369.
|
|
(18)
|
Boutin, C., and Rogers, C.A. (2000). Patterns of sensitivity of plant species to various herbicides – An analysis with two databases. Ecotoxicology vol.9(4):255–271.
|
|
(19)
|
Boutin, C. and Harper, J.L. (1991). A comparative study of the population dynamics of five species of Veronica in natural habitats. J. Ecol. 9:155–271.
|
|
(20)
|
Boutin, C., Lee, H.-B., Peart, T.E., Batchelor, S.P. and Maguire, R.J. (2000). Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Envir. Toxicol. Chem. 19 (10): 2532–2541.
|
|
(21)
|
OECD (2006). Draft Guidance Document, Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Series on Testing and Assessment No 54, Organisation for Economic Co-operation and Development, Paris.
|
|
(22)
|
Hatzios, K.K. and Penner, D. (1985). Interactions of herbicides with other agrochemicals in higher plants. Rev. Weed Sci. 1:1–63.
|
|
(23)
|
Hamill, P.B., Marriage, P.B. and G. Friesen. (1977). A method for assessing herbicide performance in small plot experiments. Weed Science 25:386–389.
|
|
(24)
|
Frans, R.E. and Talbert, R.E. (1992). Design of field experiments and the measurement and analysis of plant response. Teoksessa: B. Truelove (Ed.) Research Methods in Weed Science, 2nd ed. Southern weed Science Society, Auburn, 15–23.
|
|
(25)
|
Bruce, R.D. and Versteeg, D. J.(1992). A Statistical Procedure for Modelling Continuous Toxicity Data. Environmental Toxicology and Chemistry 11, 1485–1492.
|
|
(26)
|
Tämän liitteen luku C.33. Lisääntymistesti lieroilla (Eisenia fetida/Eisenia andrei).
|
Lisäys 1
Määritelmät
Tehoaine tai aktiivinen ainesosa
: Aine, joka on suunniteltu tuottamaan tietyn biologisen vaikutuksen (esimerkiksi hyönteisten rajoitttaminen, kasvitautien hallinta, rikkakasvien hallinta käsittelyalueella). Kutsutaan myös teknistä laatua olevaksi tehoaineeksi tai aktiiviseksi aineeksi.
Kemikaali
: aine tai seos.
Kasvinsuojeluaine tai torjunta-aine
: aine, jonka tiettyä biologista aktiivisuutta käytetään tarkoituksellisesti suojelemaan kasveja tuholaisilta (esimerkiksi sienitaudeilta, hyönteisiltä ja kilpailijakasveilta).
ECx, x prosenttia vaikutuspitoisuudesta tai ERx, x prosenttia vaikutustasosta
: pitoisuus tai taso, joka saa aikaan x prosentin suuruisen epätoivottavan muutoksen testin loppupisteessä kontrolliin verrattuna (esimerkiksi 25 tai 50 prosentin vähenemä itävyydessä, versojen painossa tai jäljelle jääneiden kasvien määrässä taikka samansuuruinen silmämääräisten vaurioiden lisääntyminen on EC25/ER25 tai EC50/ER50).
Itäminen
: itutupen tai sirkkalehtien ilmestyminen maanpinnalle.
Valmiste
: Kaupallisesti valmistettu tuote, joka sisältää tehoainetta (vaikuttavaa ainesosaa). Kutsutaan myös lopulliseksi valmisteeksi (8) tai tyypilliseksi loppukäyttötuotteeksi.
LOEC (Lowest Observed Effect Concentration, pienin havaittavan vaikutuksen aiheuttava pitoisuus)
: Testikemikaalin pienin pitoisuus, jolla vaikutus havaitaan. Tässä testissä LOEC-arvoa vastaavalla pitoisuudella on tilastollisesti merkittävä vaikutus (p < 0,05) tietyn altistusajan kuluessa kontrolliin verrattuna ja se on suurempi kuin NOEC-arvo.
Muut kuin kohdekasvit
: Kasvit, jotka eivät ole kohteena olevalla alueella. Kasvinsuojeluaineiden yhteydessä tällä tarkoitetaan yleensä käsittelyalueen ulkopuolella olevia kasveja.
NOEC (No Observed Effect Concentration, pitoisuus, josta ei aiheudu vaikutuksia)
: Testikemikaalin suurin pitoisuus, josta ei ole havaittavaa vaikutusta. Tässä testissä NOEC-arvoa vastaavalla pitoisuudella ei ole tilastollisesti merkittävää vaikutusta (p < 0,05) tietyn altistusajan kuluessa kontrolliin verrattuna.
Fytotoksisuus
: haitalliset poikkeamat (mitatut ja silmämääräisesti arvioidut) kasvien normaalista ulkonäöstä ja kasvusta tietyn kemikaalin vuoksi.
Rinnakkaisnäyte
: Kokeellinen yksikkö, joka edustaa kontrolliryhmää ja/tai käsittelyryhmää. Tässä tutkimuksessa rinnakkaisnäyte on yksi ruukku.
Silmämääräinen arviointi
: silmämääräisten vaurioiden arviointi kasvin asennosta, elinvoimasta, epämuodostumista, kloroosista, nekroosista ja yleisestä ulkonäöstä tehtyjen havaintojen perusteella kontrolliin verrattuna.
Testikemikaali
: tätä testimenetelmää käyttäen testattu aine tai seos.
Lisäys 2
Luettelo kasvikokeissa historiallisesti käytetyistä lajeista
|
Heimo
|
Laji
|
Yleisnimet
|
|
KAKSISIRKKAISET
|
|
Sarjakukkaiskasvit
|
Daucus carota
|
Porkkana
|
|
Mykerökukkaiskasvit
|
Helianthus annuus
|
Auringonkukka
|
|
Mykerökukkaiskasvit
|
Lactuca sativa
|
Salaatti
|
|
Ristikukkaiskasvit
|
Sinapis alba
|
Keltasinappi
|
|
Ristikukkaiskasvit
|
Brassica campestris var. chinensis
|
Kiinankaali
|
|
Ristikukkaiskasvit
|
Brassica napus
|
Rapsi
|
|
Ristikukkaiskasvit
|
Brassica oleracea var. capitata
|
Keräkaali
|
|
Ristikukkaiskasvit
|
Brassica rapa
|
Nauris
|
|
Ristikukkaiskasvit
|
Lepidium sativum
|
Vihanneskrassi
|
|
Ristikukkaiskasvit
|
Raphanus sativus
|
Retiisi
|
|
Savikkakasvit
|
Beta vulgaris
|
Sokerijuurikas
|
|
Kurkkukasvit
|
Cucumis sativus
|
Kurkku
|
|
Hernekasvit
|
Glycine max (G. soja)
|
Soija
|
|
Hernekasvit
|
Phaseolus aureus
|
Mungopapu
|
|
Hernekasvit
|
Phaseolus vulgaris
|
Tarhapapu
|
|
Hernekasvit
|
Pisum sativum
|
Herne
|
|
Hernekasvit
|
Trigonella foenum-graecum
|
Sarviapila
|
|
Hernekasvit
|
Lotus corniculatus
|
Keltamaite
|
|
Hernekasvit
|
Trifolium pratense
|
Puna-apila
|
|
Hernekasvit
|
Trifolium incarnatum
|
Rehuvirna
|
|
Pellavakasvit
|
Linum usitatissimum
|
Pellava
|
|
Tatarkasvit
|
Fagopyrum esculentum
|
Tattari
|
|
Koisokasvit
|
Solanum lycopersicon
|
Tomaatti
|
|
YKSISIRKKAISET
|
|
Liljakasvit
|
Allium cepa
|
Sipuli
|
|
Heinäkasvit
|
Avena sativa
|
Kaura
|
|
Heinäkasvit
|
Hordeum vulgare
|
Ohra
|
|
Heinäkasvit
|
Lolium perenne
|
Englanninraiheinä
|
|
Heinäkasvit
|
Oryza sativa
|
Riisi
|
|
Heinäkasvit
|
Secale cereale
|
Ruis
|
|
Heinäkasvit
|
Sorghum bicolor
|
Jyvädurra
|
|
Heinäkasvit
|
Triticum aestivum
|
Vehnä
|
|
Heinäkasvit
|
Zea mays
|
Maissi
|
Lisäys 3
Luettelo mahdollisista ravintokasveihin kuulumattomista lajeista
OECD:n mahdolliset lajit kasvien myrkyllisyyskokeita varten
Huomautus: Seuraavassa taulukossa on tietoa 52:sta ravintokasveihin kuulumattomasta lajista (kutakin kohtaa koskevat kirjallisuusviitteet ilmoitetaan sulkeissa). Mainitut itävyysprosentit on saatu julkaistusta kirjallisuudesta, ja ne on tarkoitettu vain yleisohjeeksi. Yksittäiset kokemukset voivat vaihdella esimerkiksi siementen alkuperän ja muiden tekijöiden mukaan.
|
HEIMO Lajin tieteellinen nimi
(suomenkielinen yleisnimi)
|
Elinaika (9) ja kasvupaikka
|
Siemenpaino
(mg)
|
Itämistä tai kasvua varten tarvittava valoisa aika (10)
|
Kylvösyvyys
(mm) (11)
|
Itämiseen kuluva aika
(vuorokausina) (12)
|
Erikoiskäsittelyt (13)
|
Myrkyllisyyskoe (14)
|
Siementen toimittajat (15)
|
Muut kirjallisuusviitteet (16)
|
|
SARJAKUKKAISKASVIT
Torilis japónica
(Punakatko)
|
Y, K, kulutukselle alttiit alueet, pensasaidat, laidunmaat (16, 19)
|
1,7–1,9 (14, 19)
|
V = P (14)
|
0
(1, 19)
|
5 (50 %) (19)
|
kylmästratifiointi (7, 14, 18, 19), saattavat vaatia kypsymistä (19), pimeys estää itämisen (1, 19), ei erikoiskäsittelyitä (5)
|
JÄLKEEN (5)
|
|
|
|
MYKERÖKUKKAISKASVIT
Bellis perennis
(Tuhatkauno)
|
Ρ
niityt, nurmet, viljelysmaat
|
0,09–0,17 (4, 19)
|
V = P (14)
|
0
(4)
|
3 (50 %) (19)
11 (100 %) (18)
|
säteily ei vaikuta itävyyteen (18, 19), ei erikoiskäsittelyitä (4, 14)
|
JÄLKEEN (4)
|
A, D, F
|
7
|
|
Centaurea cyanus
(Ruiskaunokki)
|
Y
pellot, pientareet, avoimet kasvupaikat (16)
|
4,1–4,9 (4, 14)
|
V = P (14)
|
0–3 (2, 4, 14)
|
14–21 (100 %) (14)
|
ei erikoiskäsittelyitä (2, 4)
|
JÄLKEEN (2, 4)
|
A, D, E, F
|
7
|
|
Centaurea nigra
(Mustakaunokki)
|
Ρ
pellot, pientareet, avoimet kasvupaikat (16, 19)
|
2,4–2,6 (14, 19)
|
V = P (14)
|
0 (19)
|
3 (50 %) (19)
4 (97 %) (18)
|
saattavat vaatia kypsymistä (18, 19), pimeys estää itämisen (19), ei erikoiskäsittelyitä (5, 14, 26)
|
JÄLKEEN (5, 22, 26)
|
A
|
|
|
Inula helenium
(Isohirvenjuuri)
|
Ρ
kosteat, kulutukselle alttiit paikat
(16)
|
1–1,3 (4, 14, 29)
|
|
0
(4, 29)
|
|
ei erikoiskäsittelyitä (4)
|
JÄLKEEN (4)
|
A, F
|
|
|
Leontodon hispidus
(Kesämaitiainen)
|
Ρ
pellot, pientareet, kulutukselle alttiit alueet (16, 19)
|
0,85–1,2 (14, 19)
|
V = P (14)
|
0 (19)
|
4 (50 %) (19)
7 (80 %) (18)
|
pimeys estää itämisen (17, 18, 19), ei erikoiskäsittelyitä (5, 23)
|
JÄLKEEN (5, 22, 23)
|
|
|
|
Rudbeckia hirta
(Kesäpäivänhattu)
|
K, Ρ, kulutukselle alttiit alueet
(16)
|
0,3 (4, 14)
|
V = P (14)
|
0
(4, 33)
|
< 10 (100 %) (33)
|
ei erikoiskäsittelyitä
(4, 14, 33)
|
JÄLKEEN (4, 33)
|
C, D, E, F
|
|
|
Solidago canadensis
(Kanadanpiisku)
|
Ρ
laidunmaat, avoimet paikat (16)
|
0,06–0,08 (4, 14)
|
V = P (11)
|
0
(4)
|
14–21
(11)
|
sekoitetaan yhtä suureen määrään hiekkaa ja liotetaan gibberelliinihapossa (pitoisuus 500 ppm) 24 h ajan (11), ei erikoiskäsittelyitä (4)
|
JÄLKEEN (4)
|
E, F
|
|
|
Xanthium pensylvanicum
(Sappiruoho)
|
Y
pellot, avoimet kasvupaikat (16)
|
25–61 (14, 29)
|
|
0 (1)
5 (29)
|
|
pimeys saattaa estää itämisen (1), liotetaan lämpimässä vedessä 12 h ajan (29)
|
ENNEN JA JÄLKEEN (31)
|
A
|
|
|
Xanthium spinosum
(Piikkisappiruoho)
|
Y
avoimet kasvupaikat (16)
|
200 (14)
|
V = P (14)
V > P (6)
|
10
(6)
|
|
karheuttaminen (14), ei erikoiskäsittelyitä (6)
|
ENNEN JA JÄLKEEN (6)
|
A
|
|
|
Xanthium strumarium
(Karheasappiruoho)
|
Y
pellot, avoimet kasvupaikat (16)
|
67,4 (14)
|
V = P (14)
|
10–20 (6, 21)
|
|
ei erikoiskäsittelyitä
(6, 14, 21)
|
ENNEN JA JÄLKEEN (6, 21, 28, 31)
|
A
|
|
|
RISTIKUKKAISKASVIT
Cardamine pratensis
(Luhtalitukka)
|
Ρ
pellot, pientareet, nurmet (16, 19)
|
0,6 (14, 19)
|
V = P (14)
|
0 (19)
|
5 (50 %) (19)
15 (98 %) (18)
|
pimeys estää itämisen (18, 19), ei erikoiskäsittelyitä (5, 14, 22)
|
JÄLKEEN (5, 22)
|
F
|
|
|
KOHOKKIKASVIT
Lychnis flos-cuculi
(Käenkukka)
|
Ρ
(16)
|
0,21 (14)
|
V = P (14)
|
|
< 14 (100 %) (14, 25)
|
saattavat vaatia kypsymistä (18), ei erikoiskäsittelyitä (5, 14, 15, 22–26)
|
JÄLKEEN (5, 15, 22–26)
|
F
|
|
|
SAVIKKAKASVIT
Chenopodium album
(Jauhosavikka)
|
Y
pellonreunat, kulutukselle alttiit alueet (16, 19)
|
0,7–1,5 (14, 19, 34)
|
V = P (14)
|
0
(1, 19)
|
2 (50 %) (19)
|
käsittelyt eroavat siementen värin mukaan (19), lepotilassa kuivavarastoinnin aikana (19), pimeys estää itämisen (1, 18, 19), kylmästratifiointi (18), ei erikoiskäsittelyitä (14, 34)
|
ENNEN JA JÄLKEEN (28, 31, 34)
|
A
|
32
|
|
KLUSIAKASVIT
Hypericum perforatum
(Mäkikuisma)
|
Ρ
pellot, viljelysmaat, avoimet kasvupaikat (16, 19)
|
0,1–0,23
(14, 19)
|
V = P
(14)
|
0
(1, 19)
|
3 (19)
11 (90 %) (18)
|
pimeys estää itämisen (1, 18, 19)
ei erikoiskäsittelyitä (5, 14, 15, 25, 27)
|
JÄLKEEN
(5, 15, 25, 27)
|
A, E, F
|
|
|
KIERTOKASVIT
Ipomoea hederacea
(Liuskaelämänlanka)
|
Y
pientareet, avoimet kasvupaikat, viljapellot (16)
|
28,2
(14)
|
V > P
(6, 10)
|
10-20.
(6, 10, 21)
|
4 (100 %)
(10)
|
säteily ei vaikuta itävyyteen (1)
ei erikoiskäsittelyitä (6, 21)
|
ENNEN JA JÄLKEEN
(6, 12, 21, 28)
|
A
|
|
|
SARAKASVIT
Cyperus rotundus
(–)
|
Ρ
viljelysmaat, laidunmaat, pientareet (16, 30)
|
0,2
(14)
|
V = P
(14)
|
0 (1)
10–20 (6, 10)
|
12 (91 %)
(10)
|
pimeys estää itämisen (1)
ei erikoiskäsittelyitä (6, 10, 14)
|
ENNEN JA JÄLKEEN
(6, 28, 31)
|
K
|
7
|
|
HERNEKASVIT
Lotus corniculatus
Keltamaite
|
Ρ
niityt, pientareet, avoimet kasvupaikat (16, 19)
|
1–1,67
(14, 19)
|
V = P (14)
|
|
1 (50 %)
(19)
|
karheuttaminen (14, 19)
säteily ei vaikuta itävyyteen (18, 19), ei erikoiskäsittelyitä (23, 25)
|
JÄLKEEN
(5, 23, 25)
|
A, D, E, F
|
|
|
Senna obtusifolia
(Soijasenna)
|
Y
tuoreet metsät (16)
|
23–28
(9)
|
V = P (14)
V > P (9)
|
10–20
(6, 9)
|
|
siemeniä liotetaan vedessä 24 h (9)
karheuttaminen (14), siementen elinkelpoisuus riippuu väristä (1), ei erikoiskäsittelyitä (6)
|
JÄLKEEN
(6, 9)
|
A
|
|
|
Sesbania exaltata
(–)
|
Y
vesijättömaat (16)
|
11–13
(9, 14)
|
V > P (9)
|
10–20
(9, 21)
|
|
siemeniä liotetaan vedessä 24 h (9)
säteily ei vaikuta itävyyteen (1), ei erikoiskäsittelyitä (21)
|
ENNEN JA JÄLKEEN
(9, 21, 28, 31)
|
A
|
|
|
Trifolium pratense
(Puna-apila)
|
Ρ
pellot, pientareet, viljelysmaat (16, 19)
|
1,4–1,7
(14, 19)
|
V = P (14)
|
|
1 (50 %)
(19)
|
karheuttaminen (14, 18)
saattavat vaatia kypsymistä (19), säteily ei vaikuta itävyyteen (1, 19), ei erikoiskäsittelyitä (5)
|
JÄLKEEN
(5)
|
A, E, F
|
|
|
HUULIKUKKAISKASVIT
Leonurus cardiaca
(Nukula)
|
Ρ
avoimet paikat (16)
|
0,75–1,0
(4, 14)
|
V = P (14)
|
0
(4)
|
|
ei erikoiskäsittelyitä
(4, 14)
|
JÄLKEEN
(4)
|
F
|
|
|
Mentha spicata
(Viherminttu)
|
Ρ
kosteikot (16)
|
2,21
(4)
|
|
0
(4)
|
|
ei erikoiskäsittelyitä
(4)
|
JÄLKEEN
(4)
|
F
|
|
|
Nepeta cataria
(Aitokissanminttu)
|
Ρ
kulutukselle alttiit alueet (16)
|
0,54
(4, 14)
|
V = P (14)
|
0
(4)
|
|
ei erikoiskäsittelyitä
(2, 4, 14)
|
JÄLKEEN
(2, 4)
|
F
|
|
|
Prunella vulgaris
(Niittyhumala)
|
Ρ
peltomaat, niityt, kulutukselle alttiit paikat (16, 19)
|
0,58–1,2
(4, 14, 19)
|
V = P (14)
|
0
(4, 19)
|
5 (50 %) (19)
7 (91 %) (18)
|
pimeys estää itämisen (18, 19)
suuret siemenet itävät paremmin (1), ei erikoiskäsittelyitä (4, 14, 22)
|
JÄLKEEN
(4, 22)
|
A, F
|
|
|
Stachys officinalis
(Rohtopähkämö)
|
Ρ
niityt, pellonpientareet (19)
|
14–18
(14, 19)
|
V = P (14)
|
|
7 (50 %)
(19)
|
ei erikoiskäsittelyitä
(5, 14, 22)
|
JÄLKEEN
(5, 22)
|
F
|
|
|
MALVAKASVIT
Abutilón theophrasti
(–)
|
Y
pellot, avoimet kasvupaikat (16)
|
8,8
(14)
|
V = P (14)
|
10-20.
(6, 10, 21)
|
4 (84 %)
(10)
|
karheuttaminen (14)
ei erikoiskäsittelyitä (5, 10, 21)
|
ENNEN JA JÄLKEEN
(6, 22, 28, 31)
|
A, F
|
|
|
Sida spinosa
(Otasiida)
|
Y
pellot, pientareet (16, 19)
|
3,8
(14)
|
V = P (14)
|
10–20
(6, 21)
|
|
karheuttaminen (14)
säteily ei vaikuta itävyyteen (1), ei erikoiskäsittelyitä (6, 21)
|
ENNEN JA JÄLKEEN
(6, 21, 28, 31)
|
A, F
|
|
|
UNIKKOKASVIT
Papaver rhoeas
(Silkkiunikko)
|
Y
pellot, viljelysmaat, kulutukselle alttiit paikat (16, 19)
|
0,1–0,3
(4, 14, 19, 29)
|
V = P (14)
|
0
(4, 29)
|
4 (50 %)
(19)
|
kylmästratifiointi ja karheuttaminen (1, 19, 32)
ei erikoiskäsittelyitä (4, 14, 29)
|
JÄLKEEN
(4)
|
A, D, E, F, G
|
|
|
HEINÄKASVIT
Agrostis tenuis
(Nurmirölli)
|
nurmikot, laidunmaat (16)
|
0,07 (14)
|
V > P (Ю)
|
20 (10)
|
10 (62 %) (10)
|
pimeys estää itämisen (1, 17–19), ei erikoiskäsittelyitä (10)
|
JÄLKEEN (10)
|
A, E
|
|
|
Alopecurus myosuroides
(Rikkapuntarpää)
|
Y
pellot, avoimet kasvupaikat (16)
|
0,9–1,6
(29, 34)
|
V = P (14)
|
2
(29)
|
< 24 (30 %) (34)
|
karheuttaminen (14), KNO3-käsittely 101 mg/l (14), lämpöstratifiointi (1), pimeys estää itämisen (1), ei erikoiskäsittelyitä (34)
|
ENNEN JA JÄLKEEN
(28, 34)
|
A
|
32
|
|
Avena fatua
(Hukkakaura)
|
Y
viljelysmaat, avoimet kasvupaikat (16)
|
7–37,5 (14, 30)
|
V = P (14)
V > P (6)
|
10–20 (6, 10)
|
3 (70 %) (18)
|
karheuttaminen (7, 32), pimeys estää itämisen (1)
kylmästratifiointi (1, 18), ei erikoiskäsittelyitä (6, 10, 14)
|
ENNEN JA JÄLKEEN (6, 10, 28, 31)
|
A
|
|
|
Bromus tectorum
(Kattokattara)
|
Y
pellot, pientareet, viljelysmaat (16)
|
0,45–2,28 (14, 29)
|
V = P (14)
|
3 (29)
|
|
kypsymiskausi (1, 7, 32), valo estää itämisen (1), ei erikoiskäsittelyitä (14)
|
ENNEN JA JÄLKEEN (28, 31)
|
A
|
|
|
Cynosurus cristatus
(Otasukapää)
|
P
pellot, pientareet, avoimet kasvupaikat (16, 19)
|
0,5–0,7 (14, 19, 29)
|
V = P (14)
|
0 (29)
|
3 (50 %) (19)
|
säteily ei vaikuta itävyyteen (19), ei erikoiskäsittelyitä (14, 29)
|
JÄLKEEN (5)
|
A
|
|
|
Digitaria sanguinalis
(Rikkaverihirssi)
|
Y
pellot, nurmet, avoimet kasvupaikat (16)
|
0,52–0,6 (14, 30)
|
V = P (14)
|
10–20 (21)
|
7 (75 %)
14 (94 %) (7)
|
karheuttaminen, kylmästratifiointi ja kypsyminen (1, 7, 14, 32), KNO3-käsittely 101 mg/l (14), pimeys estää itämisen (1), ei erikoiskäsittelyitä (21)
|
ENNEN JA JÄLKEEN (18, 25, 31)
|
A
|
|
|
Echinochloa crusgalli
(Rikkakananhirssi)
|
Y
(16)
|
1,5 (14)
|
V = P (14)
V > P (3)
|
10–20 (7, 21)
|
|
karheuttaminen (7, 23), säteily ei vaikuta itävyyteen (1), ei erikoiskäsittelyitä (3, 14, 21)
|
ENNEN JA JÄLKEEN (3, 21, 28, 31)
|
A
|
|
|
Elymus canadensis
(Kanadanvehnä)
|
P
rannat, kulutukselle alttiit paikat (16)
|
4–5 (14, 30)
|
V = P (11)
|
1
(11)
|
14–28
(11)
|
ei erikoiskäsittelyitä
(2, 11)
|
JÄLKEEN (2)
|
C, D, E
|
|
|
Festuca pratensis
(Nurminata)
|
P
pellot, kosteikot (16, 19)
|
1,53–2,2 (16, 19)
|
V = P (14)
V > P (10)
|
20 (10)
|
9 (74 %) (10)
2 (50 %) (19)
|
ei erikoiskäsittelyitä
(10, 19)
|
JÄLKEEN (10)
|
A
|
7
|
|
Hordeum pusillum
(–)
|
Y
laidunmaat, pientareet, avoimet kasvupaikat (16)
|
3,28 (14)
|
|
|
|
lämpöstratifiointi (1), säteily ei vaikuta itävyyteen (1)
|
ENNEN (31)
|
|
7
|
|
Phieum pratense
(Timotei)
|
P
laidunmaat, viljelysmaat, kulutukselle alttiit paikat (16, 19)
|
0,45 (14, 19)
|
V > P (10, 14)
|
0–10 (10, 19)
|
2 (74 %) (10)
8 (50 %) (19)
|
pimeys estää itämisen (19), säteily ei vaikuta itävyyteen (17), ei erikoiskäsittelyitä (10, 14, 17, 19)
|
JÄLKEEN (10)
|
A, E
|
|
|
TATARKASVIT
Polygonum convolvulus
(Kiertotatar)
|
Y
avoimet kasvupaikat, pientareet (16)
|
5–8 (4, 14, 29)
|
V = P (20)
|
0–2 (4, 29)
|
|
kylmästratifiointi 4–8 viikon ajan (1, 2, 4, 20, 29), säteily ei vaikuta itävyyteen (1)
|
ENNEN JA JÄLKEEN (1, 2, 20, 28, 31)
|
A
|
32
|
|
Polygonum lapathifolium
(Ukontatar)
|
Y
tuore maaperä (16)
|
1,8–2,5 (14)
|
V > P (6)
|
|
5 (94 %) (18)
|
säteily ei vaikuta itävyyteen (1), pimeys estää itämisen (18), kylmästratifiointi (1), ei erikoiskäsittelyitä (5)
|
ENNEN JA JÄLKEEN (6)
|
A, E
|
|
|
Polygonum pennsylvanicum
(–)
|
Y
pellot, avoimet kasvupaikat (16)
|
3,6–7 (14, 29)
|
|
2 (29)
|
|
kylmästratifiointi 4 viikon ajan 0–5 °C:ssa (1, 29), pimeys estää itämisen (1)
|
ENNEN (31)
|
A, E
|
|
|
Polygonum periscaria
(Keiholehti)
|
Y
kulutukselle alttiit alueet, viljelysmaat (16, 19)
|
2,1–2,3 (14, 19)
|
V > P (13)
|
0 (19)
|
< 14 (13)
2 (50 %) (19)
|
karheuttaminen, kylmästratifiointi, GA-käsittely (14), kylmästratifiointi, kypsyminen (17–19), pimeys estää itämisen (19), ei erikoiskäsittelyitä (13)
|
JÄLKEEN (13)
|
A
|
32
|
|
Rumex crispus
(Poimuhierakka)
|
P
viljelysmaat, pientareet, avoimet alueet (16, 19)
|
1,3–1,5 (4, 14, 19)
|
V = P (14, 33)
|
0
(4, 19, 33)
|
3 (50 %) (19)
6 (100 %) (33)
|
pimeys estää itämisen (18, 19), saattavat vaatia kypsymistä (18), ei erikoiskäsittelyitä (4, 14, 33)
|
JÄLKEEN (4, 33)
|
A, E
|
32
|
|
ESIKKOKASVIT
Anagallis arvensis
(Peltopunka)
|
Y
peltomaat, avoimet alueet, kulutukselle alttiit paikat (16, 19)
|
0,4–0,5 (4, 14, 19)
|
V = P (14)
|
|
1 (50 %) (19)
|
kylmästratifiointi, GA-käsittely (1, 14, 18, 19, 32), itäminen edellyttää valoa (1), ei erikoiskäsittelyitä (2, 4)
|
JÄLKEEN (2, 4)
|
A, F
|
|
|
LEINIKKIKASVIT
Ranunculus acris
(Niittyleinikki)
|
Ρ
viljelysmaat, pientareet, avoimet alueet (16, 19)
|
1,5–2 (14, 19, 29)
|
V = P (14)
|
1
(29)
|
41–56 (19, 29)
|
ei erikoiskäsittelyitä
(5, 14, 22, 24–26)
|
JÄLKEEN (5, 22, 24–26)
|
|
32
|
|
RUUSUKASVIT
Geum urbanum
(Kyläkellukka)
|
Ρ
pensasaidat, kosteikot
(16, 19)
|
0,8–1,5 (14, 19)
|
V = P (14)
|
0 (19)
|
5 (50 %) (19)
16 (79 %) (18)
|
pimeys estää itämisen (18, 19), lämpöstratifiointi (1), ei erikoiskäsittelyitä (5, 14, 22, 25, 26)
|
JÄLKEEN (5, 22, 25, 26)
|
A
|
|
|
MATARAKASVIT
Galium aparine
(Kierumatara)
|
Y
peltomaat, kosteikot, kulutukselle alttiit paikat (16, 19)
|
7–9 (14, 19)
|
V = P (14)
|
|
5 (50 %) (19)
6 (100 %) (18)
|
kylmästratifiointi (1, 18, 19), säteily ei vaikuta itävyyteen (18, 19), valo estää itämisen (1), ei erikoiskäsittelyitä (6, 14)
|
ENNEN JA JÄLKEEN (6, 28)
|
A
|
32
|
|
Galium mollugo
(Saksanmatara)
|
Ρ
aidanvierustat, avoimet paikat (8)
|
7
(29)
|
V = P (14)
|
2
(29)
|
|
ei erikoiskäsittelyitä
(5, 14, 22, 24, 26, 29)
|
JÄLKEEN (5, 22, 24, 26)
|
A
|
|
|
NAAMAKUKKAISKASVIT
Digitalis purpurea
(Rohtosormustinkukka)
|
K, Ρ pensasaidat, avoimet paikat (16, 19)
|
0,1–0,6 (4, 14, 19)
|
V = P (14)
|
0
(4, 19)
|
6 (50 %) (19)
8 (99 %) (18)
|
pimeys estää itämisen (1, 17–19), ei erikoiskäsittelyitä (4, 22–26)
|
JÄLKEEN (4, 22–26)
|
D, G, F
|
|
|
Veronica persica
(Persiantädyke)
|
Y
peltomaat, avoimet alueet, kulutukselle alttiit paikat (16, 19)
|
0,5–0,6 (14, 19)
|
V = P (14)
|
0 (19)
|
3 (19)
5 (96 %) (18)
|
pimeys estää itämisen (18, 19), kylmästratifiointi (18), ei erikoiskäsittelyitä (14)
|
ENNEN JA JÄLKEEN (28)
|
A
|
32
|
Mainitut siementen toimittajat
|
Toimittajan tunniste
|
Toimittajan tiedot
|
|
A
|
|
Herbiseed
|
|
New Farm, Mire Lane, West End, Twyford RG10 0NJ ENGLAND +44 (0) 1189 349 464
|
|
www.herbiseed.com
|
|
|
B
|
|
Tropilab Inc.
|
|
8240 Ulmerton Road, Largo, FL 33771-3948 USA
|
|
+1 (727) 344-4050
|
|
www.tropilab.com
|
|
|
C
|
|
Pterophylla – Native Plants & Seeds
|
|
#316 Regional Road 60, RR#1, Walsingham, ON N0E 1X0 CANADA +1 (519) 586 – 3985
|
|
|
D
|
|
Applewood Seed Co.
|
|
5380 Vivian St., Arvada, CO 80002 USA +1 (303) 431-7333
|
|
www.applewoodseed.com
|
|
|
E
|
|
Ernst Conservation Seeds
|
|
9006 Mercer Pike, Meadville, PA 16335 USA
|
|
+1 (800) 873-3321
|
|
www.ernstseed.com
|
|
|
F
|
|
Chiltern Seeds
|
|
Bortree Stile, Ulverston, Cumbria LA12 7PB ENGLAND
|
|
+44 1229 581137
|
|
www.chiltemseeds.co.uk
|
|
|
G
|
|
Thompson & Morgan
|
|
P.O. Box 1051, Fort Erie, ON L2A 6C7 CANADA +1 (800) 274-7333
|
|
www.thompson-morgan.com
|
|
KIRJALLISUUSVIITTEET
|
(1)
|
Baskin, C.C. & Baskin, J.M. 1998. Seeds. Academic Press, Toronto
|
|
(2)
|
Blackburn, L.G. & Boutin, C. 2003. Subtle effects of herbicide use in the context of genetically modified crops: a case study with glyphosate (Round-Up®). Ecotoxicology, 12:271–285.
|
|
(3)
|
Boutin, C., Lee, H-B., Peart, T., Batchelor, P.S., & Maguire, R.J. 2000. Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Environmental Toxicology & Chemistry, 19(10):2532-2541.
|
|
(4)
|
Boutin, C., Elmegaard, N., & Kjaer, C. 2004. Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: implications for risk assessment. Ecotoxicology, 13:349–369.
|
|
(5)
|
Breeze, V., Thomas, G., & Butler, R. 1992. Use of a model and toxicity data to predict the risks to some wild plant species from drift of four herbicides. Annals of Applied Biology, 121:669–677.
|
|
(6)
|
Brown, R.A., & Farmer, D. 1991. Track-sprayer and glasshouse techniques for terrestrial plant bioassays with pesticides. Teoksessa: Plants for toxicity assessment: 2nd volume. ASTM STP 1115, J.W. Gorsuch, W.R. Lower, W.Wang, & M.A. Lewis, eds. American Society for Testing & Materials, Philadelphia. s. 197–208.
|
|
(7)
|
Buhler, D.D. & Hoffman, M.L. 1999. Anderson's guide to practical methods of propagating weeds and other plants. Weed Science Society of America, Lawrence, K.
|
|
(8)
|
Clapham, A.R., Tutin, T.G., & Warburg, E.F. 1981. Excursion flora of the British Isles, 3rd ed. Cambridge University Press, Cambridge
|
|
(9)
|
Clay, P.A. & Griffin, J.L. 2000. Weed seed production and seedling emergence response to late-season glyphosate applications. Weed Science, 48:481–486.
|
|
(10)
|
Cole, J.F.H. & Canning, L. 1993. Rationale for the choice of species in the regulatory testing of the effects of pesticides on terrestrial non-target plants. BCPC – Weeds. s. 151–156.
|
|
(11)
|
Fiely, M. (Ernst Conservation Seeds). 2004. Henkilökohtainen keskustelu. (www.ernstseed.com)
|
|
(12)
|
Fletcher, J.S., Johnson, F.L., & McFarlane, J.C. 1990. Influence of greenhouse versus field testing and taxonomic differences on plant sensitivity to chemical treatment. Environmental Toxicology & Chemistry, 9:769–776.
|
|
(13)
|
Fletcher, J.S., Pfleeger, T.G., Ratsch, H.C., & Hayes, R. 1996. Potential impact of low levels of chlorsulfuron and other herbicides on growth and yield of nontarget plants. Environmental Toxicology & Chemistry, 15(7):1189–1196.
|
|
(14)
|
Flynn, S., Turner, R.M., and Dickie, J.B. 2004. Seed Information Database (release 6.0, Oct 2004) Royal Botanic Gardens, Kew (www.rbgkew.org.uk/data/sid)
|
|
(15)
|
Franzaring, J., Kempenaar, C., & van der Eerden, L.J.M. 2001. Effects of vapours of chlorpropham and ethofumesate on wild plant species. Environmental Pollution, 114:21–28.
|
|
(16)
|
Gleason, H.A. & Cronquist, A. 1991. Manual of vascular plants of northeastern United States and adjacent Canada, 2nd ed. New York Botanical Garden, Bronx, NY
|
|
(17)
|
Grime, J.P. 1981. The role of seed dormancy in vegetation dynamics. Annals of Applied Biology, 98:555–558.
|
|
(18)
|
Grime, J.P., Mason, G., Curtis, A.V., Rodman, J., Band, S.R., Mowforth, M.A.G., Neal, A.M., & Shaw, S. 1981. A comparative study of germination characteristics in a local flora. Journal of Ecology, 69:1017–1059.
|
|
(19)
|
Grime, J.P., Hodgson, J.G., & Hunt, R. 1988. Comparative plant ecology: a functional approach to common British species. Unwin Hyman Ltd., London
|
|
(20)
|
Kjaer, C. 1994. Sublethal effects of chlorsulfuron on black bindweed (Polygonum convolvulus L.). Weed Research, 34:453–459.
|
|
(21)
|
Klingaman, T.E., King, C.A., & Oliver, L.R. 1992. Effect of application rate, weed species, and weed stage of growth on imazethapyr activity. Weed Science, 40:227–232.
|
|
(22)
|
Marrs, R.H., Williams, C.T., Frost, A.J., & Plant, R.A. 1989. Assessment of the effects of herbicide spray drift on a range of plant species of conservation interest. Environmental Pollution, 59:71–86.
|
|
(23)
|
Marrs, R.H., Frost, A.J., & Plant, R.A. 1991. Effects of herbicide spray drift on selected species of nature conservation interest: the effects of plant age and surrounding vegetation structure. Environmental Pollution, 69:223–235.
|
|
(24)
|
Marrs, R.H., Frost, A.J., & Plant, R.A. 1991. Effects of mecoprop drift on some plant species of conservation interest when grown in standardized mixtures in microcosms. Environmental Pollution, 73:25–42.
|
|
(25)
|
Marrs, R.H., Frost, A.J., Plant, R.A., & Lunnis, P. 1993. Determination of buffer zones to protect seedlings of non-target plants from the effects of glyphosate spray drift. Agriculture, Ecosystems, & Environment, 45:283–293.
|
|
(26)
|
Marrs, R.H. & Frost, A.J. 1997. A microcosm approach to detection of the effects of herbicide spray drift in plant communities. Journal of Environmental Management, 50:369–388.
|
|
(27)
|
Marshall, E.J.P. & Bernie, J.E. 1985. Herbicide effects on field margin flora. BCPC – Weeds. s. 1021–1028.
|
|
(28)
|
McKelvey, R.A., Wright, J.P., & Honegger, J.L. 2002. A comparison of crop and non-crop plants as sensitive species for regulatory testing. Pest Management Science, 58:1161–1174.
|
|
(29)
|
Morton, S. (Herbiseed). 2004. Personal communication. (http://www.herbiseed.com)
|
|
(30)
|
USDA, NRCS. 2004. The Plants Database, version 3.5. (http://plants.usda.gov). National Plant Data Centre, Baton Rouge, LA 70874-4490 USA
|
|
(31)
|
USEPA. 1999. One-Liner Database. [U.S. E.P.A./Office of Pesticide Programs/Environmental Fate and Effects Division/Environmental Epidemiology Branch].
|
|
(32)
|
Webster, R.H. 1979. Technical Report No. 56: Growing weeds from seeds and other propagules for experimental purposes. Agricultural Research Council Weed Research Organization, Oxford.
|
|
(33)
|
White, A. L. & Boutin, C. (National Wildlife Research Centre, Environment Canada). 2004. Henkilökohtainen keskustelu.
|
|
(34)
|
Zwerger, P. & Pestemer, W. 2000. Testing the phytotoxic effects of herbicides on higher terrestrial non-target plants using a plant life-cycle test. Z. PflKrankh. PflSchutz, Sonderh., 17:711–718.
|
Lisäys 4
Esimerkkejä eräille ravintokasvilajeille sopivista kasvuolosuhteista
Seuraavat olosuhteet on todettu sopiviksi kymmenelle ravintokasvilajille, ja niitä voidaan käyttää ohjeena myös eräille toisille lajeille kasvatuskaapeissa tehtävissä testeissä:
|
|
Hiilidioksidipitoisuus: 350 ± 50 ppm;
|
|
|
Suhteellinen kosteus: 70 ± 5 % valoisana aikana ja 90 ± 5 % pimeänä aikana;
|
|
|
Lämpötila: 25 ± 3 °C päivällä, 20 ± 3 °C yöllä;
|
|
|
Valojaksot: 16 h valoa / 8 h pimeyttä, kun oletetaan, että keskimääräinen aallonpituus on 400–700 nm;
|
|
|
Valo: luminanssi 350 ± 50 μE/m2/s kuvun huipulta mitattuna.
|
Ravintokasvilajit ovat:
|
—
|
tomaatti (Solanum lycopersicon);
|
|
—
|
kurkku (Cucumis sativus);
|
|
—
|
salaatti (Lactuca sativa);
|
|
—
|
soijapapu (Glycine max);
|
|
—
|
kaali (Brassica oleracea var. capitata);
|
|
—
|
porkkana (Daucus carota);
|
|
—
|
englanninraiheinä (Lolium perenne);
|
C.32. LISÄÄNTYMISTESTI ÄNKYRIMADOILLA
JOHDANTO
|
1.
|
Tämä testimenetelmä vastaa OECD:n testiohjetta (TG) nro 220 (2004). Menetelmä on tarkoitettu käytettäväksi arvioitaessa maaperässä olevien kemikaalien vaikutuksia änkyrimadon (Enchytraeus albidus Henle 1873) lisääntymiskykyyn. Menetelmä perustuu pääasiallisesti Saksan Umweltbundesamtin kehittämään (1), kansainvälisessä yhteistutkimuksessa käytettyyn menetelmään (2). Huomioon on otettu myös muita menetelmiä, joilla kemikaalien myrkyllisyyttä änkyrimadoille ja lieroille on testattu (3), (4), (5), (6), (7), (8).
|
ALUSTAVAT HUOMIOT
|
2.
|
Maaperässä elävät Enchytraeus-suvun änkyrimadot ovat ekologisesti merkittäviä lajeja ympäristömyrkyllisyyden testaukseen. Änkyrimatoja tavataan usein maa-aineksessa, jossa on myös lieroja, mutta silti niitä saattaa olla runsaasti sellaisessakin maaperässä, jossa lieroja ei ole. Änkyrimatoja voidaan käyttää laboratoriokokeissa, osittaisissa kenttätutkimuksissa ja kokonaan kentällä tehtävissä tutkimuksissa. Käytännön näkökulmasta monet Enchytraeus-suvun lajit ovat helppoja käsitellä ja kasvattaa, ja niiden generaatioaika on huomattavasti lyhyempi kuin lieroilla. Änkyrimadoilla tehtävän lisääntymistestin kesto onkin vain 4–6 viikkoa, kun lieroilla (Eisenia fetida) se on 8 viikkoa.
|
|
3.
|
Perustietoa änkyrimatojen ekologiasta ja ekotoksikologiasta maaympäristössä on lähteissä (9), (10), (11), (12).
|
TESTIN PERIAATE
|
4.
|
Täysikasvuiset änkyrimadot altistetaan keinomaahan sekoitetun testikemikaalin eri pitoisuuksille. Testin kulku voidaan jakaa kahteen vaiheeseen: (a) pitoisuusalueen määritystesti (jos tietoa ei ole saatavilla riittävästi), jossa pääasiallinen tutkittava ominaisuus on kuolleisuus kahden viikon altistuksen jälkeen, sekä (b) varsinainen lisääntymistesti, jossa arvioidaan emoeläinten tuottamien poikasten kokonaismäärä ja emoeläinten eloonjääminen. Varsinaisen testin kesto on kuusi viikkoa. Ensimmäisen kolmen viikon jälkeen täysikasvuiset madot otetaan talteen ja niiden morfologiset muutokset kirjataan ylös. Seuraavan kolmen viikon jälkeen lasketaan täysikasvuisten tuottamista munakoteloista kuoriutuneiden jälkeläisten lukumäärä. Testikemikaalille altistuneiden eläinten lisääntymiskykyä verrataan kontrollieläinten vastaavaan tulokseen, jotta voidaan määrittää i) pitoisuus, josta ei aiheudu vaikutuksia (no observed effect concentration, NOEC) ja/tai ii) ECx (esimerkiksi EC10 ja EC50) käyttämällä regressiomallia, jonka avulla arvioidaan pitoisuus, joka vähentää lisääntymiskykyä x prosenttia. Testipitoisuudet on valittava siten, että ECx-arvo on kyseisellä pitoisuusalueella (esimerkiksi EC10, EC50), jotta ECx saadaan interpoloimalla eikä ekstrapoloimalla.
|
TESTIKEMIKAALIA KOSKEVIA TIETOJA
|
5.
|
Testikemikaalista pitäisi olla käytettävissä seuraavat tiedot: vesiliukoisuus, log Kow, maa-vesi-jakaantumiskerroin (ks. esimerkiksi tämän liitteen luku C.18 tai C.19) sekä höyrynpaine. Lisätiedot testikemikaalin kulkeutumisesta maaperässä, kuten fotolyysi- ja hydrolyysinopeudet, ovat myös suotavia.
|
|
6.
|
Tätä testimenetelmää voidaan käyttää vesiliukoisten tai veteen liukenemattomien kemikaalien yhteydessä. Testikemikaalia käytetään kummassakin tapauksessa kuitenkin eri tavalla. Testimenetelmää ei voida soveltaa haihtuviin kemikaaleihin, eli sellaisiin, joiden osalta Henryn vakio tai ilma-vesi-jakaantumiskerroin on suurempi kuin yksi, tai sellaisiin kemikaaleihin, joiden höyrynpaine on suurempi kuin 0,0133 Pa 25 °C:ssa.
|
TESTIN VALIDITEETTI
|
7.
|
Jotta testi olisi luotettava, kontrollien on täytettävä seuraavat kriteerit:
|
—
|
täysikasvuisten kuolleisuus pitoisuusalueen määrityskokeen lopussa ja lisääntymistestin ensimmäisen kolmen viikon jälkeen saa olla enintään 20 prosenttia
|
|
—
|
jos testin alussa jokaisessa astiassa on esimerkiksi 10 täysikasvuista, testin lopussa on oltava tuotettuna vähintään 25 poikasta astiaa kohti
|
|
—
|
poikasten keskimäärän variaatiokerroin saa olla enintään 50 prosenttia lisääntymistestin lopussa.
|
Jos testi ei täytä näitä luotettavuuskriteerejä, se on keskeytettävä, ellei testin jatkamiselle ole perusteluita. Perustelut on kirjattava testiraporttiin.
|
VERTAILUKEMIKAALI
|
8.
|
Vertailukemikaali joko testataan säännöllisin väliajoin tai se otetaan mukaan jokaiseen testiin, jotta voidaan todeta, että testiorganismien vaste ei ole muuttunut merkittävästi ajan kuluessa. Sopiva vertailukemikaali on karbendatsiimi, jonka on osoitettu vaikuttavan änkyrimatojen eloonjäämiseen ja lisääntymiseen (13), (14). Myös muita kemikaaleja, joiden myrkyllisyystiedot tunnetaan hyvin, voidaan käyttää. Yhteistutkimuksessa käytettiin karbendatsiimivalmistetta, joka tunnetaan kauppanimellä Derosal™. Sen tuottaja on AgrEvo Company (Frankfurt, Saksa), ja se sisältää tehoainetta 360 g/l (32,18 %) (2). Yhteistutkimuksessa todettu lisääntymistä koskeva EC50-arvo oli välillä 1,2 ± 0,8 mg tehoainetta yhtä kuivamassakiloa kohti (2). Jos testisarjaan sisältyy positiivinen myrkyllinen standardi, käytetään yhtä pitoisuutta, jolloin rinnakkaisnäytteitä on oltava yhtä monta kuin kontrolleja. Karbendatsiimille suositeltava pitoisuus on 1,2 mg tehoainetta yhtä kuivamassakiloa kohti (testattuna nestemäisenä valmisteena).
|
TESTIN KUVAUS
Välineet
|
9.
|
Testiastioiden on oltava lasia tai muuta kemiallisesti inerttiä materiaalia. Sopivia ovat lasipurkit, joiden tilavuus on esimerkiksi 0,20–0,25 litraa ja halkaisija ≈ 6 cm. Astioissa on oltava läpinäkyvät kannet (esimerkiksi lasia tai polyetyleeniä), jotka on suunniteltu vähentämään veden haihtumista, mutta jotka päästävät kaasun vaihtumaan maaperän ja ympäröivän ilmakehän välillä. Kansien on oltava läpinäkyviä valonläpäisevyyden vuoksi.
|
|
10.
|
Testissä tarvitaan myös vakiolaboratoriolaitteisto, erityisesti seuraavat:
|
—
|
pH-mittari ja fotometri
|
|
—
|
sopivia tarkkoja vaakoja
|
|
—
|
asianmukaiset lämpötilan valvontalaitteet
|
|
—
|
asianmukaiset ilmankosteuden valvontalaitteet (eivät välttämättömiä, jos altistusastiat on peitetty kansilla)
|
|
—
|
inkubaattori tai pieni tila, jossa on ilmastointilaite
|
|
—
|
pinsettejä, koukkuja tai silmukoita
|
|
Keinomaan valmistus
|
11.
|
Tässä testissä käytetään keinomaata (5), (7), jonka lopullinen koostumus on seuraava (kuivapainojen perusteella, kun ainekset on kuivattu vakiopainoon 105 °C:ssa):
|
—
|
10 prosenttia rahkaturvetta, joka on ilmakuivattu ja jauhettu hienoksi (hiukkaskoko 2 ± 1 mm on hyväksyttävä); suositeltavaa on tarkistaa tuoreesta turve-erästä valmistetun maa-aineksen soveltuvuus matojen kasvatukseen ennen sen käyttämistä kokeessa
|
|
—
|
20 prosenttia kaoliinisavea (kaoliniitin osuus mieluiten yli 30 prosenttia)
|
|
—
|
noin 0,3–1,0 prosenttia kalsiumkarbonaattia (CaCO3, jauhemainen, analyyttinen laatu), jotta maan pH-arvoksi saadaan 6,0 ± 0,5; lisättävän kalsiumkarbonaatin määrään saattaa vaikuttaa etenkin turpeen laatu/tyyppi
|
|
—
|
noin 70 prosenttia ilmakuivattua teollisuushiekkaa (tarvittavan CaCO3-määrän mukaan), ensisijaisesti hienoa hiekkaa, jonka hiukkasista yli puolet on kooltaan 50–200 mikronia.
|
On suositeltavaa todeta keinomaan soveltuvuus matojen kasvatukseen ja testin hyväksyttävyyskriteerien täyttyminen ennen kuin maata käytetään varsinaisessa testissä. Erityisen suositeltavaa on tehdä tällainen tarkistus sen varmistamiseksi, että testin onnistuminen ei vaarannu, jos keinomaan orgaanisen hiilen pitoisuutta vähennetään. Tämä tehdään esimerkiksi vähentämällä turvepitoisuutta 4–5 prosenttiin ja lisäämällä vastaavasti hiekan määrää. Kun orgaanisen hiilen pitoisuus pienenee, testikemikaalin adsorboituminen maahan (orgaaniseen hiileen) saattaa heikentyä ja testikemikaalin saatavuus madoille nousta. On osoitettu, että Enchytraeus albidus täyttää lisääntymiskriteerit, kun luonnonmaan orgaanisen hiilen pitoisuus on edellä mainittua matalampi, esimerkiksi 2,7 prosenttia (15). Kokemuksen, joka tosin on rajallinen, mukaan sama saadaan aikaan keinomaassa käyttämällä 5 prosenttia turvetta.
Huomautus: Kun luonnollista maaperää käytetään myöhemmissä testeissä (esimerkiksi korkeamman tason testeissä), on maa-aineksen soveltuvuus ja testin hyväksyttävyyskriteerien täyttyminen osoitettava jälleen.
|
|
12.
|
Maan kuivat ainesosat sekoitetaan perusteellisesti (esimerkiksi suurella laboratoriosekoittimella). Tämä tehdään vähintään viikko ennen testin alkua. Sekoitettu maa-aines varastoidaan kahden vuorokauden ajaksi, jotta sen happamuus tasapainottuu/vakautuu. pH-arvon määrittämisessä käytetään seosta, jossa on yksi osa maa-ainesta ja viisi osaa 1 M:n kaliumkloridiliuosta (KCl) tai 0,01 M:n kalsiumkloridiliuosta (CaCl2) (ks. (16) ja lisäys 3). Jos maa-aines on vaadittua vaihteluväliä happamampaa (ks. 11 kohta), happamuutta voidaan säätää lisäämällä tarvittava määrä CaCO3:a. Jos maa-aines on liian emäksistä, happamuutta voidaan säätää lisäämällä 11 kohdassa mainittua seosta, mutta jättämällä pois CaCO3.
|
|
13.
|
Keinomaan enimmäisvedenpidätyskyky (WHC) määritetään lisäyksessä 2 kuvattujen menetelmien mukaisesti. Yhdestä kahteen vuorokautta ennen testin aloittamista kuiva keinomaa esikostutetaan lisäämällä deionisoitua vettä noin puoleen lopullisesta vesipitoisuudesta eli 40–60 prosenttiin enimmäisvedenpidätyskyvystä. Testin alussa esikostutettu maa-aines jaetaan osioihin, jotka vastaavat testissä käytettävien testipitoisuuksien (ja tarvittaessa vertailukemikaalien) sekä kontrollien lukumäärää. Kosteuspitoisuus säädetään 40–60 prosenttiin enimmäisvedenpidätyskyvystä lisäämällä testikemikaalia liuoksena ja/tai lisäämällä tislattua tai deionisoitua vettä (ks. 19–21 kohdat). Kosteuspitoisuus todetaan testin alussa ja lopussa (kuivaamalla vakiopainoon 105 asteen lämpötilassa), ja sen on oltava matojen eloonjäämisen kannalta ihanteellisella alueella. Maa-aineksen kosteuspitoisuus voidaan tarkistaa likimääräisesti puristamalla maa-ainesta varovasti kädessä. Sormien välistä pitäisi tihkua pieniä vesipisaroita, jos kosteuspitoisuus on oikea.
|
Koe-eläinten valinta ja valmistelu
|
14.
|
Suositeltava testilaji on Enchytraeus albidus Henle 1837 (änkyrimato), joka kuuluu heimoon Enchytraeidae (lahko Oligochaeta, pääjakso Annelida). E. albidus on eräs suurimpia änkyrimatolajeja, ja tavattujen yksilöiden pituus on ollut jopa 35 mm (17), (18). E. albidus on levinnyt kaikkialle maailmaan, ja sitä tavataan merellisistä, makean veden ja kuivan maan luontotyypeistä useimmiten lahoavasta orgaanisesta aineksesta (merilevästä, kompostimullasta) ja joskus harvoin myös niityiltä (9). Sen laaja ekologinen toleranssi sekä eräät morfologiset vaihtelut saattavat osoittaa, että lajista on olemassa eri alalajeja.
|
|
15.
|
E. albidus -lajin yksilöitä myydään kalanruoaksi. On tarkistettava, ettei viljelmä ole kontaminoitunut jollakin, yleensä pienemmällä lajilla (1), (19). Jos kontaminaatiota ilmenee, kaikki madot on pestävä vedellä petrimaljassa. Tämän jälkeen E. albidus -lajin suurikokoiset täysikasvuiset yksilöt erotetaan uuden viljelmän aloittamista varten, ja kaikki muut yksilöt heitetään pois. E. albidus -lajia voidaan kasvattaa helposti monenlaisissa orgaanisissa materiaaleissa (ks. lisäys 4). E. albidus -lajin elinkaari on lyhyt, sillä täysikasvuisuus saavutetaan 33 vuorokauden (lämpötilassa 18 °C) ja 74 vuorokauden (lämpötilassa 12 °C) välillä (1). Testissä käytetään ainoastaan viljelmiä, joita on pidetty laboratoriossa ongelmitta vähintään viiden viikon (yhden sukupolven) ajan.
|
|
16.
|
Sopivia ovat myös muut Enchytraeus-suvun lajit, esimerkiksi E. buchholzi Vejdovsky 1879 tai E. crypticus Westheide & Graefe 1992 (ks. lisäys 5). Jos käytetään muita Enchytraeus-lajeja, ne on tunnistettava selvästi ja lajin valintaperusteet on raportoitava.
|
|
17.
|
Testissä käytettävät eläimet ovat täysikasvuisia matoja. Niillä on oltava munia (valkoisia pisteitä) clitellumin alueella, ja niiden on oltava suunnilleen samankokoisia (noin 1 cm pitkiä). Kasvatusviljelmää ei tarvitse synkronisoida.
|
|
18.
|
Jos änkyrimatoja ei kasvateta samassa maa-ainestyypissä ja olosuhteissa (ruokinta mukaan luettuna), joissa varsinainen testi tehdään, matoja on totutettava uuteen ympäristöön vähintään 24 tunnin, mutta enintään kolmen vuorokauden ajan. Totutettavaksi otetaan ensin suurempi määrä täysikasvuisia kuin testin tekemiseen tarvitaan, jotta vahingoittuneet tai muuten soveltumattomat yksilöt voidaan tarvittaessa hylätä. Totutusjakson lopussa testiin valitaan vain munia sisältäviä matoja, joiden käytöksessä ei ilmene mitään epätavallista (ne eivät esimerkiksi pyri pois maa-aineksesta). Madot otetaan varovasti erilleen terävillä pinseteillä, koukuilla tai silmukoilla ja laitetaan petrimaljaan, jossa on vähän raikasta vettä. Tarkoitukseen sopivinta on tämän liitteen luvussa C.20 Lisääntymistesti vesikirpulla (Daphnia magna) esitetty synteettinen vesi, sillä deionisoitu tai demineralisoitu vesi tai hanavesi saattaa olla madoille haitallista. Madot tutkitaan stereomikroskoopin alla, ja munia sisältämättömät yksilöt hävitetään. Viljelmiin mahdollisesti joutuneet punkit tai hyppyhäntäiset on poistettava huolellisesti ja hävitettävä. Terveet madot, joita ei käytetä testiin, palautetaan kantaviljelmään.
|
Testipitoisuuksien valmistelu
Vesiliukoinen testikemikaali
|
19.
|
Testikemikaalista ja deionisoidusta vedestä valmistetaan sellainen määrä liuosta, joka riittää yhden testipitoisuuden kaikkiin neljään rinnakkaisnäytteeseen. Suositeltavaa on käyttää vettä riittävästi, jotta saavutetaan tarvittava kosteuspitoisuus, eli 40–60 prosenttia enimmäisvedenpidätyskyvystä (ks. 13 kohta). Kukin testikemikaaliliuos sekoitetaan perinpohjaisesti yhteen erään esikostutettua maata, ennen kuin se laitetaan testiastiaan.
|
Veteen liukenematon testikemikaali
|
20.
|
Jos käytettävä kemikaali ei ole vesiliukoista, mutta liukenee orgaaniseen liuottimeen, se voidaan liuottaa pienimpään mahdolliseen määrään sopivaa kantoainetta (esimerkiksi asetonia). Ainoastaan haihtuvia liuottimia saa käyttää. Kantoaine sekoitetaan pieneen määrään (esimerkiksi 2,5 g) hienoa kvartsihiekkaa tai ruiskutetaan sen päälle. Kantoaine poistetaan haihduttamalla hiekkaa vetokaapissa vähintään tunnin ajan. Kvartsihiekan ja testikemikaalin seos lisätään esikostutettuun maahan ja sekoitetaan huolellisesti sopivaan määrään deionisoitua vettä, jotta saadaan tarvittava kosteuspitoisuus. Lopullinen seos siirretään testiastioihin.
|
|
21.
|
Jos kemikaali liukenee heikosti veteen ja orgaanisiin liuottimiin, haluttu testipitoisuus saadaan sekoittamalla testikemikaaliin 2,5 grammaa vastaava määrä hienoksi jauhettua kvartsihiekkaa testiastiaa kohden. Kvartsihiekan ja testikemikaalin seos lisätään esikostutettuun maahan ja sekoitetaan huolellisesti sopivaan määrään deionisoitua vettä, jotta saadaan tarvittava kosteuspitoisuus. Lopullinen seos jaetaan testiastioihin. Menettely toistetaan jokaisen testipitoisuuden yhteydessä, ja myös asianmukainen kontrolli valmistellaan.
|
|
22.
|
Testattavan kemikaalin pitoisuus saa normaalisti olla enintään 1 000 mg/kg maa-aineksen kuivaan massaan nähden. Toisinaan testin tarkoitus voi kuitenkin edellyttää suuremmilla pitoisuuksilla testaamista.
|
TESTIEN SUORITTAMINEN
Testi- ja kontrolliryhmät
|
23.
|
Jokaisesta testipitoisuudesta laitetaan testiastiaan 20 gramman kuivapainoa vastaava määrä testattavaa maa-ainesta (ks. 19–21 kohdat). Lisäksi valmistellaan kontrollit, joihin ei lisätä testikemikaalia. Jokaiseen astiaan lisätään ruokaa 29 kohdassa kuvatulla tavalla. Kuhunkin testiastiaan sijoitetaan satunnaisesti kymmenen matoa. Madot siirretään varovasti testiastiaan ja asetetaan maa-aineksen pinnalle käyttäen esimerkiksi teräväkärkisiä pinsettejä, koukkuja tai silmukoita. Testipitoisuuksien rinnakkaisnäytteiden ja kontrollien lukumäärä määräytyy käytettävän testijärjestelyn mukaan (ks. 34 kohta). Testiastiat sijoitetaan testi-inkubaattoriin satunnaisesti, ja astioiden paikkoja muutetaan satunnaisesti viikoittain.
|
|
24.
|
Jos testikemikaalin applikoinnissa käytetään kantoainetta, koesarjojen lisäksi tulee tehdä yksi kontrollisarja, joka sisältää pelkästään kvartsihiekkaa, johon liuotinta on sekoitettu tai ruiskutettu. Liuottimen tai dispergointiaineen pitoisuuden olisi oltava sama kuin testikemikaalia sisältävissä testiastioissa. Lisäksi tehdään yksi ylimääräisen annoksen kvartsihiekkaa (2,5 g astiaa kohti) sisältävä kontrollisarja niille kemikaaleille, jotka on annosteltava 21 kohdassa kuvattujen menettelyjen mukaisesti.
|
Testiolosuhteet
|
25.
|
Testauslämpötila on 20 °C ± 2 °C. Matoja estetään poistumasta maa-aineksesta toteuttamalla testi valoisaa ja pimeää aikaa säätelemällä (mieluiten 16 tuntia valoisaa ja 8 tuntia pimeää). Testiastioiden alueella tulisi olla 400–800 luksin valaistus.
|
|
26.
|
Maa-aineksen kosteuden tarkistamiseksi astiat punnitaan testin alussa ja sen jälkeen kerran viikossa. Jos astian paino on pienentynyt, astiaan lisätään riittävästi deionisoitua vettä. Veden häviämistä voidaan vähentää säilyttämällä testi-inkubaattorin ilmankosteus korkeana (> 80 prosenttia).
|
|
27.
|
Kosteuspitoisuus ja pH-arvo on mitattava sekä pitoisuusalueen määritystestin että varsinaisen testin alussa ja lopussa. Mittaukset on tehtävä kontrolleista ja käsitellyistä maa-ainesnäytteistä (kaikki pitoisuudet), jotka on valmistettu samalla tavalla kuin koeviljelmät ja joita on ylläpidetty samoin, mutta joissa ei ole matoja. Näihin maa-ainesnäytteisiin lisätään ruokaa vain testin alussa mikrobien toiminnan helpottamiseksi. Ruokaa lisätään yhtä paljon kuin testiviljelmiin. Testin aikana näihin astioihin ei ole tarpeen enää lisätä ruokaa.
|
Ruokinta
|
28.
|
Käytettävä ruoka on sellaista, jota änkyrimatopopulaatio voi käyttää ravinnokseen. Ruokintaan sopivaksi on todettu kaurahiutaleet, jotka suositellaan käsiteltäväksi autoklaavissa ennen käyttöä mikrobikontaminaation estämiseksi; myös kuumentamista voidaan käyttää.
|
|
29.
|
Ensimmäinen ruokinta tapahtuu sekoittamalla 50 mg jauhettuja kaurahiutaleita kussakin astiassa olevaan maa-ainekseen ennen matojen lisäämistä. Tämän jälkeen ruokaa annetaan viikoittain päivään 21 saakka. Päivänä 28 ruokintaa ei tehdä, sillä täysikasvuiset yksilöt on tässä vaiheessa poistettu, ja poikaset tarvitsevat tämän ajankohdan jälkeen melko vähän lisäruokaa. Testin aikana ruokinta tapahtuu sijoittamalla 25 mg jauhettuja kaurahiutaleita maa-aineksen pinnalle niin varovasti, että madot eivät vahingoitu. Sienten kasvun estämiseksi kaurahiutaleet peitetään pienellä määrällä maa-ainesta. Jos kaikkea ruokaa ei syödä, annosta pienennetään.
|
Testijärjestely pitoisuusalueen määritystestiä varten
|
30.
|
Tarvittaessa pitoisuusalueen määritystesti toteutetaan esimerkiksi siten, että siinä on viisi testikemikaalipitoisuutta (0,1, 1,0, 10, 100 ja 1 000 mg/kg maa-aineksen kuivapainoon nähden). Jokaisesta käsittelystä riittää yksi rinnakkaisnäyte ja kontrolli.
|
|
31.
|
Pitoisuusalueen määritystestin kesto on kaksi viikkoa. Testin lopussa arvioidaan matojen kuolleisuus. Mato kirjataan kuolleeksi, jos se ei reagoi etupäähän annettuun mekaaniseen ärsytykseen. Kuolleisuuden lisäksi voidaan kerätä muita tietoja, joista saattaa olla apua varsinaisessa testissä käytettävien pitoisuusalueiden valinnassa. Siksi on syytä kirjata muistiin muutokset täysikasvuisten yksilöiden käyttäytymisessä (esimerkiksi kyvyttömyys kaivautua maa-ainekseen tai makaaminen liikkumatta testiastian lasiseinämää vasten) ja morfologiassa (esimerkiksi avohaavat) sekä mahdollisten poikasten esiintyminen. Viimeksi mainittu voidaan todeta lisäyksessä 6 kuvattua värjäysmenetelmää käyttämällä.
|
|
32.
|
LC50-arvo voidaan todeta likimääräisesti laskemalla kuolleisuusdatan geometrinen keskiarvo. Kun pitoisuuden vaihteluväliä valitaan varsinaista testiä varten, lisääntymiselle aiheutuvat vaikutukset arvioidaan enintään 10-kertaisesti LC50-arvoa pienemmiksi. Tämä suhde on kuitenkin empiirinen, eikä välttämättä päde yksittäistapauksissa. Muista pitoisuusalueen määritystestissä tehdyistä havainnoista, kuten poikasten esiintymisestä, voi olla apua varsinaisessa testissä käytettävän testikemikaalin pitoisuusalueen tarkemmassa määrittämisessä.
|
|
33.
|
LC50-arvon tarkkaa määrittämistä varten suositellaan, että testissä käytetään vähintään neljää rinnakkaisnäytettä jokaisesta testikemikaalin pitoisuudesta sekä riittävää määrää eri pitoisuuksia, jotta kyseisillä pitoisuuksilla saadaan aikaan vähintään neljä tilastollisesti merkittävää, toisistaan poikkeavaa keskimääräistä vastetta. Jos käytössä on kontrolleja, käytetään vastaavaa määrää pitoisuuksia ja rinnakkaisnäytteitä.
|
Testijärjestely varsinaista lisääntymistestiä varten
|
34.
|
Yhteistutkimuksen johdosta tehtyjen suositusten perusteella esitetään kolmea mahdollista testijärjestelyä (2):
|
—
|
NOEC-arvoa määritettäessä testataan vähintään viisi pitoisuutta geometrisessa sarjassa. Jokaista testipitoisuutta kohti suositellaan neljää rinnakkaisnäytettä ja kahdeksaa kontrollia. Pitoisuudet on porrastettava kertoimella, joka saa olla enintään 1,8.
|
|
—
|
ECx-arvoa määritettäessä (esimerkiksi EC10, EC50) testataan vähintään viisi pitoisuutta, ja pitoisuudet on valittava siten, että ECx-arvo on kyseisellä pitoisuusalueella, jotta ECx saadaan interpoloimalla eikä ekstrapoloimalla. Jokaista testipitoisuutta kohti suositellaan vähintään neljää rinnakkaisnäytettä ja neljää kontrollirinnakkaisnäytettä. Porrastuskerroin voi vaihdella ja olla enintään 1,8 odotetulla vaikutusalueella sekä yli 1,8 tätä suuremmilla ja pienemmillä pitoisuuksilla.
|
|
—
|
Yhdistetty lähestymistapa mahdollistaa sekä NOEC-arvon että ECx-arvon määrittämisen. Tällöin käytetään kahdeksaa käsittelypitoisuutta geometrisessa sarjassa. Jokaista käsittelyä kohti suositellaan neljää rinnakkaisnäytettä ja kahdeksaa kontrollia. Pitoisuudet on porrastettava kertoimella, joka saa olla enintään 1,8.
|
|
|
35.
|
Käytettävien täysikasvuisten matojen määrä astiaa kohti on 10 (ks. 23 kohta). Ruokaa lisätään testiastioihin testin alussa ja tämän jälkeen kerran viikossa (ks. 29 kohta). Viimeisen kerran ruokaa lisätään päivänä 21. Päivänä 21 maa-ainesnäytteet tutkitaan varovasti käsin ja elävät täysikasvuiset madot todetaan ja lasketaan. Samalla kirjataan muistiin muutokset niiden käyttäytymisessä (esimerkiksi kyvyttömyys kaivautua maa-ainekseen tai makaaminen liikkumatta testiastian lasiseinämää vasten) ja morfologiassa (esimerkiksi avohaavat). Tämän jälkeen kaikki täysikasvuiset poistetaan testiastioista ja testimaa-aineksesta. Jos testimaa-ainekseen on tuotettu munakoteloita, kotelot sisältävää maa-ainesta inkuboidaan vielä kolme viikkoa samoissa testiolosuhteissa, mutta ruokinta tehdään vain päivänä 35 (jolloin kuhunkin astiaan annostellaan 25 mg jauhettuja kaurahiutaleita).
|
|
36.
|
Kuuden viikon kuluttua vastakuoriutuneet madot lasketaan. Suositeltava menetelmä on rose bengal -värjäykseen (ks. lisäys 6) perustuva, mutta myös muut märkäerottamiseen (ei lämpöerottamiseen) perustuvat tekniikat ja kelluttaminen (ks. lisäys 6) on todettu sopiviksi (4), (10), (11), (20). Rose bengal -värjäystä suositellaan siksi, että suspendoituneiden savihiukkasten aikaansaama sameus voi haitata märkäerottamista maa-ainessubstraatista.
|
Raja-annostesti
|
37.
|
Jos pitoisuusalueen määritystestissä ei havaita vaikutuksia suurimmalla pitoisuudella (esimerkiksi 1 000 mg/kg), lisääntymistesti voidaan toteuttaa raja-annostestinä testipitoisuudella 1 000 mg/kg, millä voidaan osoittaa, että NOEC-arvo lisääntymiselle on tätä pitoisuutta suurempi.
|
Testin yhteenveto ja aikataulu
|
38.
|
Testin vaiheet voidaan tiivistää seuraavasti:
|
Aika
|
Pitoisuusalueen määritystesti
|
Varsinainen testi
|
|
Päivä –7 tai aiemmin
|
|
—
|
Keinomaan valmistus (kuivien ainesosien sekoitus)
|
|
|
—
|
Keinomaan valmistus (kuivien ainesosien sekoitus)
|
|
|
Päivä –5
|
|
—
|
Keinomaan pH-arvon tarkistaminen
|
|
—
|
Maan enimmäisvedenpidätyskyvyn mittaus
|
|
|
—
|
Keinomaan pH-arvon tarkistaminen
|
|
—
|
Maan enimmäisvedenpidätyskyvyn mittaus
|
|
|
Päivät –5… –3
|
|
—
|
Matojen lajittelu totuttelua varten
|
|
|
—
|
Matojen lajittelu totuttelua varten
|
|
|
Päivät –3… 0
|
|
—
|
Matojen annetaan tottua vähintään 24 tunnin ajan
|
|
|
—
|
Matojen annetaan tottua vähintään 24 tunnin ajan
|
|
|
Päivä –1
|
|
—
|
Keinomaan esikostuttaminen ja jakaminen eriin
|
|
|
—
|
Keinomaan esikostuttaminen ja jakaminen eriin
|
|
|
Päivä 0
|
|
—
|
Kantaliuosten valmistaminen
|
|
—
|
Testikemikaalin applikointi
|
|
—
|
Testisubstraatin punnitseminen testiastioihin
|
|
—
|
Matojen siirtäminen astiaan
|
|
—
|
Maa-aineksen pH-arvon ja kosteuspitoisuuden mittaaminen
|
|
|
—
|
Kantaliuosten valmistaminen
|
|
—
|
Testikemikaalin applikointi
|
|
—
|
Testisubstraatin punnitseminen testiastioihin
|
|
—
|
Matojen siirtäminen astiaan
|
|
—
|
Maa-aineksen pH-arvon ja kosteuspitoisuuden mittaaminen
|
|
|
Päivä 7
|
|
—
|
Maa-aineksen kosteuspitoisuuden tarkistaminen
|
|
|
—
|
Maa-aineksen kosteuspitoisuuden tarkistaminen
|
|
|
Päivä 14
|
|
—
|
Täysikasvuisten yksilöiden kuolleisuuden toteaminen
|
|
—
|
Poikasten lukumäärän arviointi
|
|
—
|
Maa-aineksen pH-arvon ja kosteuspitoisuuden mittaaminen
|
|
|
—
|
Maa-aineksen kosteuspitoisuuden tarkistaminen
|
|
|
Päivä 21
|
|
|
—
|
Täysikasvuisten käyttäytymisen tarkkaileminen
|
|
—
|
Täyskasvuisten poistaminen
|
|
—
|
Täysikasvuisten yksilöiden kuolleisuuden toteaminen
|
|
—
|
Maa-aineksen kosteuspitoisuuden tarkistaminen
|
|
|
Päivä 28
|
|
|
—
|
Maa-aineksen kosteuspitoisuuden tarkistaminen
|
|
|
Päivä 35
|
|
|
—
|
Maa-aineksen kosteuspitoisuuden tarkistaminen
|
|
|
Päivä 42
|
|
|
—
|
Maa-aineksen pH-arvon ja kosteuspitoisuuden mittaaminen
|
|
|
TIEDOT JA RAPORTOINTI
Tulosten käsittely
|
39.
|
Lisäyksessä 7 olevaa yhteenvetoa lukuun ottamatta tähän testimenetelmään ei kuulu tarkoin määriteltyä tilastollista menetelmää testitulosten analysointia varten.
|
|
40.
|
Pitoisuusalueen määritystestin keskeinen tutkittava ominaisuus on kuolleisuus. Muutokset käyttäytymisessä (esimerkiksi kyvyttömyys kaivautua maa-ainekseen tai makaaminen liikkumatta testiastian lasiseinämää vasten) ja morfologiassa (esimerkiksi avohaavat) sekä mahdollisten poikasten esiintyminen on kuitenkin myös syytä kirjata muistiin. LC50-arvo määritetään normaalisti tilastollista koestusta (21) tai logistista regressiota käyttämällä. Tapauksissa, joihin tämä analyysimenetelmä ei sovellu (esimerkiksi silloin, kun osittaista kuolleisuutta havaitaan alle kolmessa pitoisuudessa), voidaan kuitenkin käyttää muita menetelmiä. Näitä ovat esimerkiksi liukuva keskiarvo (22), viritetty Spearmanin ja Kärberin menetelmä (23) tai yksinkertainen interpolointi (esimerkiksi LC0:n ja LC100:n geometrinen keskiarvo laskettuna LC0:n neliöjuuresta kerrottuna LC100:lla).
|
|
41.
|
Varsinaisessa testissä tutkittava ominaisuus on hedelmällisyys eli tuotettujen poikasten lukumäärä. Pitoisuusalueen määritystestin tavoin kaikki muut merkit kemikaalin vaarallisuudesta on kuitenkin kirjattava loppuraporttiin. Tilastollinen analyysi edellyttää, että lisääntymisestä lasketaan aritmeettinen keskiarvo ja keskihajonta kutakin käsittelyä ja kontrollia kohti.
|
|
42.
|
Varianssianalyysiä tehtäessä keskihajonta s ja vapausaste df voidaan korvata yhdistetyllä varianssianalyysistä saadulla varianssiestimaatilla ja sen vapausasteilla sillä ehdolla, että varianssi ei ole riippuvainen pitoisuudesta. Tässä tapauksessa käytetään kontrollin ja käsittelyiden yksinkertaisia variansseja. Kaupalliset tilasto-ohjelmistot laskevat nämä arvot yleensä käyttämällä astiakohtaisia tuloksia rinnakkaisnäytteinä. Jos negatiivisista kontrolleista ja liuotinkontrolleista saadun datan yhdistäminen vaikuttaa järkevämmältä kuin testaaminen johonkin niistä verraten, ne on testattava, jotta voidaan todeta, etteivät ne eroa toisistaan merkittävästi (sopivista testeistä ks. 45 kohta ja lisäys 7).
|
|
43.
|
Muut tilastolliset testit ja interferenssi riippuvat siitä, ovatko rinnakkaisnäytteiden arvot normaalijakaumalla ja varianssiin nähden homogeenisia.
|
NOEC-estimointi
|
44.
|
Huomiota kiinnitetään ennen kaikkea testien voimaan. Kun halutaan arvioida, noudattaako data suurin piirtein normaalijakaumaa, hyödynnetään esimerkiksi aiemmista yhteistutkimuksista saatua tietoa tai muuta historiallista tietoa. Kriittisempi on varianssin homogeenisuus (homoskedastisuus). Kokemuksen perusteella varianssi usein kasvaa keskiarvon noustessa, ja tässä tilanteessa datan muuntaminen saattaa johtaa homoskedastisuuteen. Muunnosten täytyy kuitenkin perustua historiallisesta tiedosta saatuun kokemukseen tutkittavana olevan datan asemasta. Jos data on homogeenista, tehdään useita t-testejä, esimerkiksi Watsonin-Williamsin testi (α = 0,05, yksisuuntainen) (24), (25) tai joissakin tapauksissa Dunnettin testi (26), (27). On syytä huomata, että jos rinnakkaisnäytteitä ei ole yhtä paljon, taulukon t-arvoja on korjattava Dunnettin ja Williamsin esittämillä tavoilla. Suuren variaation vuoksi vasteet eivät aina kasva tai pienene säännönmukaisesti ja monotonisuudesta poiketaan voimakkaasti, jolloin Dunnettin testi sopii tarkoitukseen paremmin. Jos homoskedastisuudessa on poikkeamia, voi olla tarpeen tutkia tarkemmin mahdollisia vaikutuksia variansseihin, jotta saadaan selville, voiko t-testejä käyttää testien voimasta tinkimättä (28). Vaihtoehtoisesti voidaan käyttää moninkertaista U-testiä, esimerkiksi Bonferroni-U-testiä Holmin mukaan (29). Jos datassa ilmenee heteroskedastisuutta, mutta se vastaa muutoin taustalla olevaa monotonista annosvastetta, voidaan käyttää myös muuta parametritonta testiä, esimerkiksi Jonckheere-Terprstran testiä (30), (31) tai Shirleyn testiä (32), (33). Viimeksi mainitut ovat yleensä suositeltavampia kuin t-testit, joissa varianssit ovat heterogeenisiä. (Ks. myös lisäyksen 7 kaavio.)
|
|
45.
|
Jos raja-arvotesti on tehty ja parametritestimenetelmien edellytykset (yleensä homogeenisuus) täyttyvät, voidaan käyttää parittaista Studentin t-testiä tai muussa tapauksessa Mann-Whitneyn U-testimenetelmää (29).
|
ECx-pitoisuuden arviointi
|
46.
|
Kaikkia ECx-arvoja laskettaessa käsittelykohtaisia keskiarvoja käytetään regressioanalyysissa (lineaarisessa tai epälineaarisessa) sen jälkeen, kun on muodostettu sopiva annosvastefunktio. Kun matojen kasvu on jatkuva vaste, ECx-arvot voidaan estimoida sopivalla regressioanalyysillä (35). Sopivia funktioita dikotomisia tietoja varten (kuolleisuus/eloonjääminen ja tuotettujen jälkeläisten määrä) ovat tavanomaiset S-funktio, logistinen funktio tai Weibullin funktio, jotka sisältävät 2–4 parametria, joista osalla voidaan mallintaa myös hormeettisia vasteita. Jos annosvastefunktio on sovitettu lineaarisella regressioanalyysilla, merkitsevä r2 (determinaatiokerroin) ja/tai kaltevuus on etsittävä regressioanalyysilla, minkä jälkeen ECx arvioidaan käyttämällä kontrollikeskiarvon x prosenttia vastaavaa arvoa regressioanalyysilla muodostetussa yhtälössä. Seuraavaksi 95 prosentin luottamusvälit lasketaan Fiellerin mukaan (teoksessa Finney (21)) tai jollakin muulla sopivalla, nykyaikaisella menetelmällä.
|
|
47.
|
Vaihtoehtoisesti vaste voidaan mallintaa prosentti- tai muuna osuutena malliparametrista, joka tulkitaan kontrollin keskimääräiseksi vasteeksi. Tällöin normaali (logistinen, Weibullin) s-käyrä voidaan sovittaa helposti tuloksiin hyödyntämällä probitti-regressiomenetelmää (21). Painotusfunktiota on mukautettava metrisiin vasteisiin Christensenin esimerkin mukaan (36). Jos hormeesia on havaittu, probittianalyysin sijasta on käytettävä neliparametrista logistista tai Weibullin funktiota, joka sovitetaan epälineaarisella regressiomenetelmällä (36). Jos dataan ei saada sovitettua sopivaa annosvastefunktiota, voidaan ECx:n ja sen luottamusvälien estimoinnissa käyttää jotain muuta menetelmää, kuten Thompsonin liukuvaa keskiarvoa (22) tai viritettyä Spearman ja Kärberin menetelmää (23).
|
TESTIRAPORTTI
|
48.
|
Testiraportissa on esitettävä seuraavat tiedot:
|
|
Testikemikaali:
|
—
|
fysikaalinen olomuoto ja tarvittaessa fysikaalis-kemialliset ominaisuudet (esimerkiksi vesiliukoisuus, höyrynpaine)
|
|
—
|
testikemikaalin IUPAC-nimikkeistön mukaiset tunnistetiedot, CAS-numero, erä, rakennekaava ja puhtaus
|
|
—
|
näytteen viimeinen käyttöpäivä.
|
|
|
|
Testilajit:
|
—
|
käytetyt koe-eläimet: lajit, tieteellinen nimi, organismien lähde ja kasvatusolosuhteet.
|
|
|
|
Testiolosuhteet:
|
—
|
keinomaan ainesosat ja valmistustapa
|
|
—
|
testikemikaalin applikointitapa
|
|
—
|
kuvaus testiolosuhteista, mukaan lukien lämpötila, kosteuspitoisuus ja pH-arvo
|
|
—
|
täydellinen kuvaus testijärjestelystä ja käytetyistä menettelyistä.
|
|
|
|
Testitulokset:
|
—
|
täysikasvuisten matojen kuolleisuus kahden viikon kuluttua sekä poikasten määrä pitoisuusalueen määritystestin lopussa
|
|
—
|
täysikasvuisten matojen kuolleisuus kolmen viikon altistumisen jälkeen sekä täydelliset tiedot poikasista varsinaisen testin lopussa
|
|
—
|
kaikki testiorganismeissa havaitut fyysiset tai patologiset oireet sekä käyttäytymisen muutokset
|
|
—
|
LC50-arvo, NOEC-arvo ja/tai ECx (esimerkiksi EC50, EC10) lisääntymisen osalta, jos jotain näistä voidaan soveltaa luottamusvälien puitteissa, sekä käyrä sen laskennassa käytetystä sovitetusta mallista kaikki tiedot ja havainnot, jotka helpottavat tulosten tulkintaa.
|
|
Lisäksi ilmoitetaan poikkeukset tässä testimenetelmässä kuvatuista menettelyistä ja kaikki testin aikana ilmenneet epätavallisuudet.
|
LÄHDEKIRJALLISUUS
|
(1)
|
Römbke, J. (1989). Entwicklung eines Reproduktionstests an Bodenorganismen – Enchytraeen. Abschlußbericht des Battelle-Instituts e.V. Frankfurt für das Umweltbundesamt (Berlin), FE-Vorhaben 106 03 051/01.
|
|
(2)
|
Römbke, J. and Moser, T. (1999). Organisation and Performance of an International Ringtest for the Validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150 + 223 s.
|
|
(3)
|
Westheide, W. and Bethge-Beilfuss, D. (1991). The sublethal enchytraeid test system: guidelines and some results. Teoksessa: Modern Ecology: Basic and Applied Aspects. Ed. by Esser, G. and Overdieck, D. s. 497–508. Elsevier, Amsterdam.
|
|
(4)
|
Dirven-Van Breemen, E., Baerselmann, R. and Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. 46 s.
|
|
(5)
|
Tämän liitteen luku C.8: Myrkyllisyystutkimus madoilla.
|
|
(6)
|
International Organisation for Standardization (ISO) (1993). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 1: Determination of acute toxicity using Artificial Soil substrate, No. 11268-1. ISO, Geneve.
|
|
(7)
|
International Organisation for Standardization (ISO) (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
|
|
(8)
|
Rundgren, S. and A.K. Augustsson (1998). Test on the enchytraeid Cognettia sphagnetorum (Vejdovsky 1877). Teoksessa: Løkke, H. and C.A.M. Van Gestel, Handbook of soil invertebrate toxicity tests. John Wiley and Sons, Chichester, 73–94.
|
|
(9)
|
Kasprzak, K. (1982). Review of enchytraeid community structure and function in agricultural ecosystems. Pedobiologia 23, 217–232.
|
|
(10)
|
Römbke, J. (1995). Enchytraeen (Oligochaeta) als Bioindikator, UWSF – Z. Umweltchem. Ökotox. 7, 246–249.
|
|
(11)
|
Dunger, W. and Fiedler, H.J. (1997). Methoden der Bodenbiologie. G. Fischer Verlag, Stuttgart, New York.
|
|
(12)
|
Didden, W.A.M. (1993). Ecology of terrestrial Enchytraeidae. Pedobiologia 37, 2–29.
|
|
(13)
|
Becker, H. (1991). Bodenorganismen – Prüfungskategorien der Forschung. UWSF – Z. Umweltchem. Ökotox. 3, 19-24.
|
|
(14)
|
Römbke, J. and Federschmidt, A. (1995). Effects of the fungicide Carbendazim on Enchytraeidae in laboratory and field tests, Newsletter on Enchytraeidae 4, 79–96.
|
|
(15)
|
Römbke, J., Riepert, F. & Achazi R. (2000): Enchytraeen als Testorganismen. Teoksessa: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (eds.). Spektrum Verl., Heidelberg. 59–81.
|
|
(16)
|
International Organisation for Standardization (ISO) (1994). Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
|
|
(17)
|
Bell, A.W. (1958). The anatomy of Enchytraeus albidus, with a key to the species of the genus Enchytraeus. Ann. Mus. Novitat. 1902, 1–13.
|
|
(18)
|
Nielsen, C.O. and Christensen, B. (1959). The Enchytraeidae, critical revision and taxonomy of European species. Natura Jutlandica 8-9, 1–160.
|
|
(19)
|
Bouguenec, V. and Giani, N. (1987). Deux nouvelles especes d'Enchytraeus (Oligochaeta, Enchytraeidae) et rediscription d'E. bigeminus. Remarques sur le genre Enchytraeus. Ann. Limnol. 23, 9-22.
|
|
(20)
|
Korinkova, J. and Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300–305.
|
|
(21)
|
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19–76. Cambridge Univ. Press.
|
|
(22)
|
Finney, D.J. (1978). Statistical Method in Biological Assay. – Charles Griffin & Company Ltd, London.
|
|
(23)
|
Hamilton, M.A., R.C. Russo and R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714–719; Correction Environ. Sci. Technol. 12(1998), 417.
|
|
(24)
|
Williams, D.A., (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103–117.
|
|
(25)
|
Williams, D.A., (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
|
|
(26)
|
Dunnett, C.W., (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096–1121.
|
|
(27)
|
Dunnett, C.W., (1964) New tables for multiple comparisons with a control. Biometrics 20, 482–491.
|
|
(28)
|
Hoeven, N. van der, (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355–361.
|
|
(29)
|
Holm, S., (1979): A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65–70.
|
|
(30)
|
Jonckheere, A. R. (1954); A Distribution-free k-Sample Test Against Ordered Alternatives, Biometrika 41, 133-145.
|
|
(31)
|
Terpstra, T. J. (1952); The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327–333.
|
|
(32)
|
Shirley, E. A. (1979); The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144–151.
|
|
(33)
|
Williams, D.A. (1986); A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183–186.
|
|
(34)
|
Sokal, R.R. and F.J. Rohlf. (1981). Biometry. The Principle and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
|
|
(35)
|
Christensen, E.R., (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213–221.
|
|
(36)
|
Van Ewijk, P.H. and J.A. Hoekstra. (1993). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25–32.
|
Lisäys 1
Määritelmät
Tässä testimenetelmässä sovelletaan seuraavia määritelmiä:
|
|
Kemikaali: Aine tai seos.
|
|
|
ECx
(Effect concentration for x % effect = vaikuttava pitoisuus, joka aiheuttaa x prosenttia muutoksia): Pitoisuus, joka aiheuttaa x prosentin suuruisen vaikutuksen testiorganismeihin tietyn altistusjakson aikana kontrolliin verrattuna. Tässä testissä kaikki vaikuttavat pitoisuudet ilmaistaan testikemikaalin massana testimaa-aineksen kuivamassaa kohti.
|
|
|
LC0
(ei tappava pitoisuus) Testikemikaalin pitoisuus, joka ei aiheuta lainkaan altistuneiden testiorganismien kuolleisuutta tietyn ajanjakson aikana. Tässä testissä LC0 ilmaistaan testikemikaalin massana testimaa-aineksen kuivamassaa kohti.
|
|
|
LC50
(mediaani tappava pitoisuus): Testikemikaalin pitoisuus, joka aiheuttaa 50 prosentin kuolleisuuden altistuneissa testiorganismeissa tietyn ajanjakson aikana. Tässä testissä LC50 ilmaistaan testikemikaalin massana testimaa-aineksen kuivamassaa kohti.
|
|
|
LC100
(täysin tappava pitoisuus): Testikemikaalin pitoisuus, joka aiheuttaa 100 prosentin kuolleisuuden altistuneissa testiorganismeissa tietyn ajanjakson aikana. Tässä testissä LC100 ilmaistaan testikemikaalin massana testimaa-aineksen kuivamassaa kohti.
|
|
|
LOEC (Lowest Observed Effect Concentration, pienin havaittavan vaikutuksen aiheuttava pitoisuus): Testikemikaalin pienin pitoisuus, jolla on tilastollisesti merkittävä vaikutus (p < 0,05). Tässä testissä LOEC ilmaistaan testikemikaalin massana testimaa-aineksen kuivamassaa kohti. Kaikilla LOEC-pitoisuuden ylittävillä testipitoisuuksilla vaikutuksen olisi normaalisti oltava kontrollista tilastollisesti poikkeava. Kaikki poikkeamat edellä mainitusta LOEC-pitoisuuden määrittämisessä on perusteltava testiraportissa.
|
|
|
NOEC (pitoisuus, josta ei aiheudu vaikutuksia): LOEC-arvoa välittömästi seuraava testikemikaalin korkein pitoisuus, josta ei ole havaittavaa vaikutusta. Tässä testissä NOEC-arvoa vastaavalla pitoisuudella ei ole tilastollisesti merkittävää vaikutusta (p < 0,05) tietyn altistusajan kuluessa kontrolliin verrattuna.
|
|
|
Lisääntymiskyky: testijakson kuluessa tuotettujen poikasten keskimäärä täysikasvuisten matojen määrään verrattuna.
|
|
|
Testikemikaali on tätä testimenetelmää käyttäen testattu aine tai seos.
|
Lisäys 2
Enimmäisvedenpidätyskyvyn määrittäminen
Keinomaan vedenpidätyskyvyn määrittäminen
Seuraava standardin ISO DIS 11268-2 liitteessä C kuvattu menetelmä on todettu tarkoituksenmukaiseksi.
Kerää tietty määrä (esimerkiksi viisi grammaa) testimaa-ainessubstraattia sopivalla välineellä (kierrekairalla tms.). Aseta kierrekairaputken pohjalle pala suodatinpaperia, täytä vedellä ja laita putki sitten telineessä vesiastiaan. Putki upotetaan veteen vähitellen, kunnes vedenpinta on maanäytteen yläpuolella. Sen jälkeen näytettä pidetään vedessä noin kolme tuntia. Kaikkea maa-aineksen kapillaareihin imeytynyttä vettä ei pystytä pidättämään, minkä vuoksi maanäytettä valutetaan kahden tunnin ajan asettamalla putki hyvin märkään kerrokseen hienojakoista kvartsihiekkaa, joka on laitettu suljettuun astiaan (kuivumisen estämiseksi). Sen jälkeen näyte punnitaan ja kuivataan pysyvään massaan 105 °C:ssa. Vedenpidätyskyky (WHC) lasketaan seuraavasti:

jossa:
|
S
|
=
|
vesikyllästetty substraatti + putken massa + suodatinpaperin massa
|
|
T
|
=
|
taara (putken massa + suodatinpaperin massa)
|
|
D
|
=
|
substraatin kuivamassa.
|
VIITTEET:
International Organisation for Standardization (ISO) (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
Lisäys 3
Maan pH:n määrittäminen
Seuraava menetelmä, jolla määritetään maanäytteen pH-arvo, perustuu maan laatua koskevassa standardissa ISO 10390: Soil Quality – Determination of pH olevaan kuvaukseen.
Tietyn määrän maata annetaan kuivua huoneenlämmössä vähintään 12 tunnin ajan. Sen jälkeen maasta valmistetaan suspensio (joka sisältää vähintään viisi grammaa maata), jonka tilavuus on viisinkertainen joko analyyttista laatua olevaan 1 M:n kaliumkloridiliuoksen (KCl) tilavuuteen tai analyyttista laatua olevaan 0,01 M:n kalsiumkloridiliuokseen (CaCl2) nähden. Sen jälkeen suspensiota ravistetaan perinpohjaisesti viisi minuuttia. Ravistelun jälkeen sen annetaan asettua vähintään 2, mutta enintään 24 tuntia. Nestefaasin pH-arvo mitataan pH-mittarilla, joka kalibroidaan ennen jokaista mittausta käyttämällä asianmukaisia puskuriliuoksia (esimerkiksi pH 4,0 ja 7,0).
VIITTEET:
International Organisation for Standardization (ISO) (1994). Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
Lisäys 4
Enchytraeus-lajien kasvatusolosuhteet
Enchytraeus albidus -lajin änkyrimatoja (samoin kuin muita Enchytraeus-lajeja) voidaan kasvattaa suurissa muovilaatikoissa (koko esimerkiksi 30 × 60 × 10 cm), jotka on täytetty keinomaalla sekä luontaisella, kontaminoitumattomalla puutarhamullalla suhteessa 1:1. Kompostiainesta on vältettävä, sillä se voi sisältää myrkyllisiä kemikaaleja, kuten raskasmetalleja. Muut eläimet poistetaan maa-aineksesta ennen käyttöä esimerkiksi pakastamalla. Myös pelkkää keinomaata voi käyttää substraattina, mutta lisääntymiskyky saattaa tällöin jäädä pienemmäksi kuin maa-ainesseosta käytettäessä. Kasvatuksessa käytetyn substraatin pH-arvon on oltava 6,0 ± 0,5.
Viljelmää pidetään pimeässä 15–20 °C ± 2 °C:n lämpötilassa. Yli 23 °C:n lämpötiloja on syytä välttää. Maa-aines pidetään kosteana, muttei märkänä. Maa-aineksen kosteus on oikea, kun maata puristettaessa sormien välistä tihkuu pieniä vesipisaroita. Olosuhteiden muuttumista hapettomaksi on vältettävä huolehtimalla, että viljelmän peittämisestä huolimatta kaasut vaihtuvat riittävästi ympäröivän ilmakehän kanssa. Maata on muokattava varovasti viikoittain tuulettumisen edistämiseksi.
Madoille voidaan antaa ravinnoksi kaurahiutaleita. Kaurahiutaleita on säilytettävä suljetuissa astioissa ja ne on käsiteltävä autoklaavissa tai kuumennettava ennen käyttöä, jotta infektiot ja jauhopunkit (esim. Glyzyphagus sp., Astigmata, Acarina) tai petopunkit (esim. Hypoaspis (Cosmolaelaps) miles, Gamasida, Acarina) voidaan välttää. Kuumennuksen jälkeen ruoka jauhetaan siten, että sitä on helppo ripotella maa-aineksen pinnalle. Kaurahiutaleiden lisäksi voidaan toisinaan antaa vitamiineja, maitoa ja kalanmaksaöljyä. Muita sopivia ravinnonlähteitä ovat leivontahiiva sekä Tetramin-kalanruoka.
Ruokinta tapahtuu noin kahdesti viikossa. Riittävä määrä kaurahiutaleita ripotellaan maa-aineksen pinnalle tai sekoitetaan varovasti substraattiin samalla, kun maata muokataan tuulettumisen edistämiseksi. Annetun ruoan määrä riippuu substraatissa olevien matojen lukumäärästä. Ohjeeksi voidaan antaa, että jos kaikki ruoka syödään vuorokauden kuluessa ruokinnasta, ruoan määrää on tarpeen lisätä. Jos ruokaa toisaalta on edelleen jäljellä pinnalla seuraavalla ruokintakerralla viikkoa myöhemmin, ruoan määrää vähennetään. Jos ruokaan on tullut sienikasvustoa, se poistetaan ja tilalle annetaan uutta ruokaa. Kolmen kuukauden kuluttua madot siirretään vastavalmistettuun substraattiin.
Kasvatusolosuhteet ovat tyydyttävät, jos a) madot eivät pyri pois maa-ainessubstraatista, b) madot liikkuvat nopeasti maan sisällä c) matojen ulkopinta on kiiltävä, eikä siinä näy tarttuneita maa-aineshiukkasia, d) madot ovat väriltään suurin piirtein valkoisia, e) matoviljelmissä on eri-ikäisiä matoja ja f) madot lisääntyvät jatkuvasti.
Lisäys 5
Testin suorittaminen muita Enchytraeus-lajeja käyttämällä
Lajin valinta
Testissä voidaan käyttää myös muita lajeja kuin E. albidusta, mutta testimenettelyä ja hyväksyttävyyskriteerejä on mukautettava vastaavasti. Monia Enchytraeus-lajeja on helposti saatavilla ja ne sopivat kasvatettaviksi laboratoriossa, joten tärkein kriteeri jonkin muun kuin E. albidus -lajin valinnalle on ekologinen merkitys sekä lisäksi vertailukelpoinen herkkyys. Lajin vaihtamiselle saattaa olla myös muotosyitä. Esimerkiksi niissä maissa, joissa E. albidus -lajia ei tavata eikä sitä voi karanteenisäädösten vuoksi tai muista syistä tuoda maahan, on käytettävä muita Enchytraeus-lajeja.
Esimerkkejä sopivista vaihtoehtoisista lajeista
|
—
|
Enchytraeus crypticus (Westheide & Graefe 1992): Viime aikoina tätä lajia on käytetty runsaasti ympäristömyrkyllisyyden tutkimuksessa, koska sen kasvattaminen ja testaaminen on helppoa. Laji on kuitenkin pienikokoinen, mikä tekee käsittelystä vaikeampaa kuin E. albius -lajin (etenkin värjäysmenetelmän käyttöä edeltävissä vaiheissa). E. crypticus -lajia ei ole varmuudella tavattu kenttäolosuhteissa, sillä se on kuvattu vain lieroviljelmistä löytyneiden yksilöiden perusteella. Sen ekologisia vaatimuksia ei siis tunneta.
|
|
—
|
Enchytraeus buchholzi (Vejdovsky 1879): Nimi kattaa luultavasti ryhmän läheisesti toisilleen sukua olevia lajeja, joita on morfologisesti vaikea erottaa toisistaan. Sen käyttöä testeissä ei suositella, ellei testissä käytettyjä yksilöitä kyetä tunnistamaan samaan lajiin kuuluviksi. E. buchholzi -lajia tavataan yleensä niityiltä sekä kulutukselle alttiina olevilta alueilta, esimerkiksi pientareilta.
|
|
—
|
Enchytraeus luxuriosus: Laji tunnettiin aiemmin nimellä E.’minutus’, mutta se on hiljattain kuvattu. Lajin löysi ensimmäisenä hampurilainen U. Graefe Sankt Peter-Ordingin kaupungin läheiseltä niityltä Saksan Schleswig-Holsteinista. E. luxuriosus on kooltaan noin puolet E. albidus -lajista, mutta suurikokoisempi kuin muut tässä mainitut lajit, mikä saattaa tehdä siitä hyvän vaihtoehdon E. albidus -lajille.
|
|
—
|
Enchytraeus bulbosus (Nielsen & Christensen 1963): Tätä lajia on toistaiseksi tavattu Saksan ja Espanjan kivennäispitoisista maannoksista, joissa se on yleinen, muttei yleensä kovin runsaslukuinen. Heimon muihin pienikokoisiin lajeihin verrattuna sen tunnistaminen on yleensä suhteellisen helppoa. Sen käyttäytymistä laboratoriotesteissä tai herkkyyttä kemikaaleille ei tunneta lainkaan. Laji on kuitenkin todettu helpoksi kasvattaa (E. Belotti, henkilökohtainen keskustelu).
|
Kasvatusolosuhteet
Kaikkia edellä mainittuja Enchytraeus-lajeja voidaan kasvattaa samoissa substraateissa kuin E. albidus -lajia. Muiden lajien pienempi koko tarkoittaa, että kasvatusastiat voivat olla pienempiä, ja vaikka ruoka voi olla samaa, annoskokoa on syytä pienentää. Näiden lajien elinkaari on lyhyempi kuin E. albidus -lajilla, minkä vuoksi ruokaa on annettava useammin.
Testiolosuhteet
Testiolosuhteet ovat yleensä samat kuin E. albidus -lajilla lukuun ottamatta seuraavia seikkoja:
|
—
|
testiastia voi olla pienempi (mutta sen ei ole pakko olla)
|
|
—
|
lisääntymistestin kesto voi olla lyhyempi, esimerkiksi neljä viikkoa kuuden sijasta (mutta sen ei ole pakko olla); pitoisuusalueen määritystestin kestoa ei kuitenkaan pidä muuttaa
|
|
—
|
matojen jälkeläiset ovat pienikokoisia, minkä vuoksi laskennassa on erittäin suositeltavaa käyttää värjäysmenetelmää
|
|
—
|
hyväksyttävyyskriteeri, joka koskee poikasten määrää testiastiassa kontrollissa, muutetaan arvoksi 50.
|
VIITTEET
|
(1)
|
Schmelz, R.M. and Collado, R. (1999). Enchytraeus luxuriosus sp.nov., a new terrestrial oligochaete species (Enchytraeidae, Clitellata, Annelida). Carolinea 57, 93–100.
|
Lisäys 6
Talteenottomenetelmien tarkka kuvaus
Rose bengal -värjäys
Tämä menetelmä on alun perin kehitetty limnologiaa varten (1), ja sen käyttöä änkyrimadonpoikasten laskennassa änkyrimadoilla tehtävässä lisääntymistestissä esitti ensimmäisenä W. de Coen Ghentin yliopistosta Belgiasta. Modifioidun version, jossa rose bengal -väriaine sekoitetaan formaldehydiin etanolin sijasta, kehitti itsenäisesti RIVM Bilthoven (2), (3).
Varsinaisen testin lopussa eli noin kuuden viikon jälkeen testiastioissa oleva maa-aines siirretään matalaan säiliöön. Tarkoitukseen sopii hyvin laakea muovivati tai valokuvien kehittämiseen tarkoitettu vati, jossa on uritettu pohja, sillä urat estävät matojen liikkumista havaintoalueella. Poikaset kiinnitetään etanolilla (noin 5 ml rinnakkaisnäytettä kohti). Tämän jälkeen astiat täytetään vedellä niin, että pohjalla on 1–2 cm:n kerros. Veteen lisätään muutama tippa (200–300 μl) rose bengal -väriainetta (1-prosenttinen liuos etanolissa tai vaihtoehtoisesti 0,5-prosenttinen eosiini), minkä jälkeen komponentit sekoitetaan toisiinsa huolellisesti. Kun 12 tuntia on kulunut, madot ovat värjäytyneet punertaviksi ja makaavat substraatin pinnalla, josta ne on helppo laskea. Vaihtoehtoisesti substraatin ja alkoholin seos voidaan pestä seulassa (silmäkoko 0,250 mm) ennen matojen laskemista. Tällöin kaoliniitti, turve ja osa hiekasta huuhtoutuu pois, jolloin punertaviksi värjäytyneet madot on helpompi erottaa ja laskea. Laskemista helpottaa myös valaisimella varustettu suurennuslasi (linssin koko vähintään 100 × 75 mm ja suurennuskerroin 2–3).
Värjäysmenetelmää käytettäessä laskeminen vie vain muutaman minuutin astiaa kohti, ja ohjearvona voidaan todeta, että yhdeltä henkilöltä kaikkien yhdessä testissä käytettyjen astioiden arviointi vie yleensä enintään kaksi päivää.
Märkäerottaminen
Märkäerottaminen aloitetaan heti testin päätyttyä. Kaikkien testiastioiden maa-ainekset siirretään muovisiin siivilöihin, joiden silmäkoko on noin 1 mm. Tämän jälkeen siivilät asetetaan muovivateihin niin, että siivilät eivät kosketa vadin pohjaa. Vadit täytetään varovasti vedellä siten, että siivilöissä olevat näytteet jäävät kokonaan veden pinnan alapuolelle. Maa-aineksessa olevista madoista saadaan talteen yli 90 prosenttia, jos talteenotto kestää kolme vuorokautta 20 ± 2 °C:n lämpötilassa. Talteenottamisen lopuksi siivilät poistetaan ja vesi (pientä määrää lukuun ottamatta) dekantoidaan. Vatien pohjalla olevan sedimentin liikuttamista on varottava. Tämän jälkeen muovivateja ravistetaan kevyesti, jotta sedimentti suspendoituu vesikerrokseen. Vesi siirretään petrimaljaan ja maa-ainespartikkelien laskeuduttua änkyrimadot voidaan etsiä, poistaa ja laskea stereomikroskoopin ja pehmustettujen teräspihtien avulla.
Kelluttaminen
Kelluttamiseen perustuva menetelmä on kuvattu R. Kupermanin huomautuksessa (4). Kun testiastian sisältö on kiinnitetty etanolilla, maa-aineksen joukkoon kaadetaan runsaasti Ludox AM-30:tä (kolloidista silikaa, 30 painoprosentin suspensio vedessä) siten, että nesteen pinta on 10–15 mm maanpintaa ylempänä. Kun maa-ainesta ja kellutusainetta on sekoitettu perusteellisesti 2–3 minuuttia, pinnalla kelluvat madonpoikaset voidaan laskea helposti.
Viitteet
|
(1)
|
Korinkova, J. and Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300–305.
|
|
(2)
|
Dirven-Van Breemen, E., Baerselmann, R. and Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. 46 s.
|
|
(3)
|
Posthuma, L., Baerselmann, R., Van Veen, R.P.M. and Dirven-Van Breemen, E.M. (1997). Single and joint toxic effects of copper and zinc on reproduction of Enchytraeus crypticus in relation to sorption of metals in soils. Ecotox. Envir. Safety 38, 108–121.
|
|
(4)
|
Phillips, C.T., Checkai, R.T. and Kuperman, R.G. (1998). An alternative to the O'Connor Method for Extracting Enchytraeids from Soil. SETAC 19th Annual Meeting, Charlotte, USA. Abstract Book No. PMP069, s. 157.
|
Lisäys 7
Yhteenveto datan tilastollisesta arvioinnista (NOEC-arvon määrittäminen)
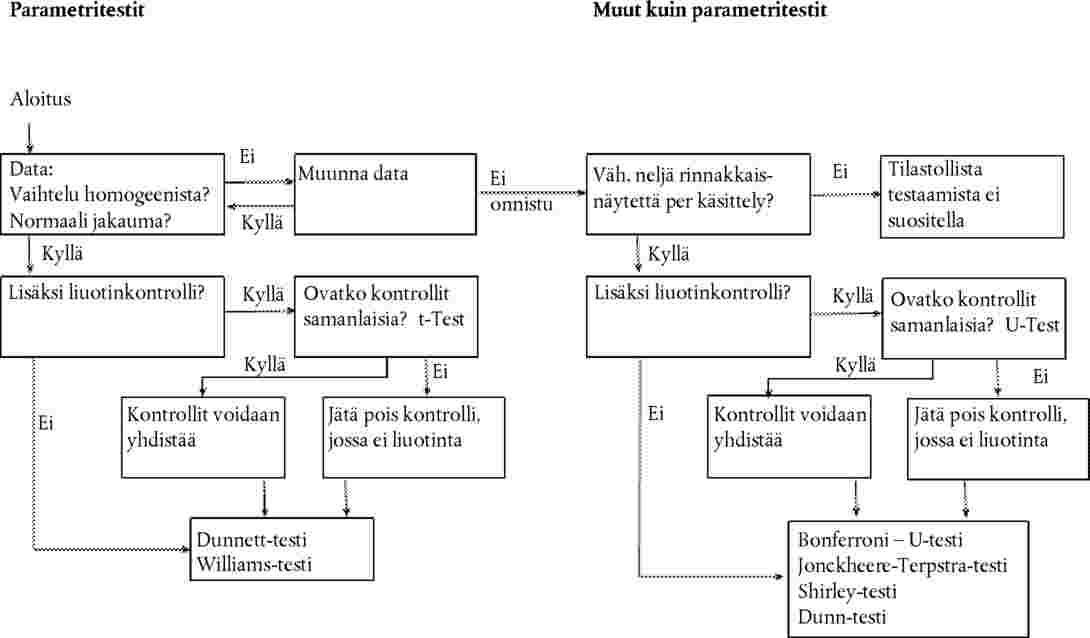
C.33. LISÄÄNTYMISTESTI LIEROILLA (EISENIA FETIDA/EISENIA ANDREI)
JOHDANTO
|
1.
|
Tämä testimenetelmä vastaa OECD:n testiohjetta (TG) nro 222 (2004). Menetelmä on tarkoitettu käytettäväksi arvioitaessa maaperässä olevien kemikaalien vaikutuksia lierolajien Eisenia fetida (Savigny 1826) tai Eisenia andrei (Andre 1963) lisääntymiskykyyn sekä muihin subletaaleihin seikkoihin. Testiä on käytetty kansainvälisessä yhteistutkimuksessa (3). Välitöntä myrkyllisyyttä lieroille testataan eri menetelmällä (4). Lieroilla tehtäviä välittömiä ja kroonisia vaikutuksia mittaavia testejä käsitellään useissa muissa kansainvälisissä ja kansallisissa ohjeissa (5), (6), (7), (8).
|
|
2.
|
Eisenia fetida / Eisenia andrei -lajit katsotaan edustaviksi maaperän eläimistön ja etenkin lierojen joukossa. Lierojen ekologiasta ja niiden käytöstä ympäristömyrkyllisyyden tutkimuksessa on saatavilla taustatietoa (7), (9), (10), (11), (12).
|
TESTIN PERIAATE
|
3.
|
Täysikasvuiset lierot altistetaan testikemikaalin eri pitoisuuksille joko sekoitettuna maa-ainekseen tai, jos kyseessä on torjunta-aine, lisättynä maahan tai maa-aineksen pinnalle menetelmällä, joka vastaa kemikaalin tavanomaista käyttöä. Applikointimentelmä määrittyy testin tarkoituksen mukaan. Testipitoisuuksien vaihteluväli valitaan siten, että se kattaa todennäköisesti sekä subletaaleja että tappavia vaikutuksia kahdeksan viikon aikana aiheuttavat pitoisuudet. Täysikasvuisten lierojen kuolleisuus ja niiden kasvulle aiheutuneet vaikutukset todetaan neljän viikon altistumisen jälkeen. Tämän jälkeen aikuiset poistetaan maa-aineksesta, ja vaikutukset lisääntymiselle arvioidaan neljä viikkoa myöhemmin laskemalla maa-aineksessa olevat poikaset. Testikemikaalille altistuneiden lierojen lisääntymiskykyä verrataan kontrollieläinten vastaavaan tulokseen, jotta voidaan määrittää i) pitoisuus, josta ei aiheudu vaikutuksia (no observed effect concentration, NOEC) ja/tai ii) ECx (esimerkiksi EC10 ja EC50) käyttämällä regressiomallia, jonka avulla arvioidaan pitoisuus, joka vähentää lisääntymiskykyä x prosenttia. Testipitoisuudet on valittava siten, että ECx-arvo on kyseisellä pitoisuusalueella (esimerkiksi EC10, EC50), jotta ECx saadaan interpoloimalla eikä ekstrapoloimalla (määritelmistä ks. lisäys 1).
|
TESTIKEMIKAALIA KOSKEVIA TIETOJA
|
4.
|
Sopivien testimenetelmien suunnittelun helpottamiseksi testikemikaalista pitäisi olla käytettävissä seuraavat tiedot:
|
—
|
sekä mahdollisuuksien mukaan tietoa kemikaalin kulkeutumisesta ja käyttäytymisestä ympäristössä (esimerkiksi fotolyysi- ja hydrolyysinopeus, jos ne ovat applikointitapojen kannalta merkityksellisiä).
|
|
|
5.
|
Testimenetelmää voidaan käyttää kaikille kemikaaleille niiden vesiliukoisuudesta riippumatta. Testimenetelmää ei voida soveltaa haihtuviin kemikaaleihin. Näiksi määritellään tässä kemikaalit, joiden osalta Henryn vakio tai ilma-vesi-jakaantumiskerroin on suurempi kuin yksi, tai kemikaalit, joiden höyrynpaine on suurempi kuin 0,0133 Pa 25 °C:ssa.
|
|
6.
|
Tässä testimenetelmässä ei oteta huomioon testikemikaalin mahdollista hajoamista testin kuluessa. Tästä syystä ei voida olettaa, että altistuspitoisuudet pysyvät alkuperäisellä tasolla koko testin ajan. Siksi suositeltavaa on tehdä testikemikaalille kemiallinen analyysi testin alussa ja lopussa.
|
VERTAILUKEMIKAALI
|
7.
|
Vertailukemikaalin NOEC-arvo ja/tai ECx-arvo on määritettävä, jotta voidaan osoittaa, että laboratorion testiolosuhteet ovat asianmukaiset, sekä todeta, että testiorganismien vasteessa ei tapahdu ajan kuluessa tilastollisesti merkittävää muutosta. Vertailukemikaali on suotavaa testata vähintään kerran vuodessa tai, jos testausta tehdään harvemmin, rinnakkain määritettäessä testikemikaalin myrkyllisyyttä. Sopivia vertailukemikaaleja, joiden on osoitettu vaikuttavan lisääntymiseen, ovat karbendatsiimi tai benomyyli. Merkittäviä vaikutuksia tulisi esiintyä seuraavilla pitoisuuksilla: a) 1–5 mg tehoainetta yhtä kuivamassakiloa kohti tai b) 250–500 g/ha tai 25–50 mg/m2. Jos testisarjaan sisältyy positiivinen myrkyllinen standardi, käytetään yhtä pitoisuutta, jolloin rinnakkaisnäytteitä on oltava yhtä monta kuin kontrolleja.
|
TESTIN VALIDITEETTI
|
8.
|
Jotta testitulosta voidaan pitää luotettavana, seuraavien kriteerien on täytyttävä kontrolleissa:
|
—
|
jokaisessa 10 täysikasvuista yksilöä sisältävässä rinnakkaisnäytteessä on tuotettu ≥ 30 jälkeläistä testin loppuun mennessä
|
|
—
|
lisääntymisen variaatiokerroin on ≤ 30 prosenttia
|
|
—
|
aikuisten kuolleisuus testin ensimmäisen neljän viikon aikana on ≤ 10 prosenttia.
|
Jos testi ei täytä näitä luotettavuuskriteerejä, se on keskeytettävä, ellei testin jatkamiselle ole perusteluita. Perustelut on kirjattava raporttiin.
|
TESTIN KUVAUS
Välineet
|
9.
|
Käytettävien testisäiliöiden on oltava lasia tai muuta kemiallisesti inerttiä materiaalia, ja niiden tilavuus on noin 1–2 litraa. Säiliöiden poikkipinta-alan on oltava noin 200 cm2, jotta kostean substraatin syvyydeksi tulee noin 5–6 cm, kun kuivaa substraattia lisätään 500–600 g. Säiliön kannen on päästettävä kaasut vaihtumaan substraatin ja ilmakehän välillä sekä päästettävä valoa lävitseen (tällainen on esimerkiksi rei'itetty läpinäkyvä kansi) samalla kun se estää lieroja pääsemästä ulos. Jos testisubstraattia käytetään huomattavasti enemmän kuin 500–600 g testisäiliötä kohti, lierojen määrää lisätään samassa suhteessa.
|
|
10.
|
Testissä tarvitaan myös vakiolaboratoriolaitteisto, erityisesti seuraavat:
|
—
|
pH-mittari ja fotometri
|
|
—
|
sopivia tarkkoja vaakoja
|
|
—
|
asianmukaiset lämpötilan valvontalaitteet
|
|
—
|
asianmukaiset ilmankosteuden valvontalaitteet (eivät välttämättömiä, jos altistusastiat on peitetty kansilla)
|
|
—
|
inkubaattori tai pieni tila, jossa on ilmastointilaite
|
|
—
|
pinsettejä, koukkuja tai silmukoita
|
|
Keinomaan valmistus
|
11.
|
Tässä testissä käytetään keinomaata (5), (7), jonka lopullinen koostumus on seuraava (kuivapainojen perusteella, kun ainekset on kuivattu vakiopainoon 105 °C:ssa):
|
—
|
10 prosenttia rahkaturvetta (pH-arvo mahdollisimman tarkasti välillä 5,5–6,0, ei kasvien jäänteitä näkyvissä, hienoksi jauhettuna ja kuivattuna mitattuun kosteuspitoisuuteen)
|
|
—
|
20 prosenttia (kuivapaino) kaoliinisavea (kaoliniitin osuus mieluiten yli 30 prosenttia)
|
|
—
|
0,3–1,0 prosenttia kalsiumkarbonaattia (CaCO3, hienoksia jauhettuna, analyysilaatuista), jotta pH-arvoksi testin alussa saadaan 6,0 ±0,5.
|
|
—
|
noin 70 prosenttia ilmakuivattua teollisuushiekkaa (tarvittavan CaCO3-määrän mukaan), ensisijaisesti hienoa hiekkaa, jonka hiukkasista yli puolet on kooltaan 50–200 mikronia.
|
Huomautus 1: Tarvittavaan CaCO3:n määrään vaikuttavat maa-ainessubstraatin ainesosat, ja se on määritettävä tekemällä mittauksia maa-aineksen osanäytteistä juuri ennen testiä. pH-arvo mitataan näytteestä, joka on sekoitettu joko 1 M:n kaliumkloridiliuokseen (KCl) tai 0,01 M:n kalsiumkloridiliuokseen (CaCl2) (13).
Huomautus 2: Keinomaan orgaanisen hiilen pitoisuutta voidaan pienentää esimerkiksi vähentämällä turvepitoisuus 4–5 prosenttiin ja lisäämällä hiekkapitoisuutta vastaavasti. Kun orgaanisen hiilen pitoisuus pienenee, testikemikaalin adsorboituminen maahan (orgaaniseen hiileen) saattaa heikentyä ja testikemikaalin saatavuus lieroille nousta. On osoitettu, että Eisenia fetida täyttää lisääntymiskriteerit, kun luonnonmaan orgaanisen hiilen pitoisuus on matala, esim. 2,7 prosenttia (14). Kokemuksen mukaan sama saadaan aikaan keinomaassa käyttämällä 5 prosenttia turvetta. Ennen kuin tällaista maa-ainesta käytetään varsinaisessa testissä, ei siis ole välttämätöntä osoittaa, että testi täyttää validiteettikriteerit keinomaata käytettäessä, ellei turpeen määrää vähennetä yllä mainittua enemmän.
Huomautus 3: Kun luonnollista maaperää käytetään myöhemmissä testeissä (esimerkiksi korkeamman tason testeissä), on maa-aineksen soveltuvuus ja testin hyväksyttävyyskriteerien täyttyminen osoitettava jälleen.
|
|
12.
|
Maan kuivat ainesosat sekoitetaan perusteellisesti (esimerkiksi suurella laboratoriosekoittimella) hyvin ilmastoidussa tilassa. Ennen testin aloittamista kuiva keinomaa esikostutetaan lisäämällä deionisoitua vettä noin puoleen lopullisesta vesipitoisuudesta eli 40–60 prosenttiin enimmäisvedenpidätyskyvystä (mikä vastaa 50 ± 10 prosenttia kuivan massan kosteudesta). Näin saadaan substraatti, jossa ei ole seisovaa vettä, eikä siitä kädessä puristettaessa tihku vettä. Keinomaan enimmäisvedenpidätyskyky (WHC) määritetään lisäyksessä 2, standardissa ISO 11274 (15) tai vastaavassa EU-standardissa kuvattujen menetelmien mukaisesti.
|
|
13.
|
Jos testikemikaalia levitetään maa-aineksen pinnalle tai sekoitetaan maa-ainekseen ilman vettä, veden lopullinen määrä voidaan sekoittaa keinomaahan sen valmistuksen aikana. Jos testikemikaali sekoitetaan maa-ainekseen veden joukossa, loppuvesi voidaan lisätä yhtä aikaa testikemikaalin kanssa (ks. 19 kohta).
|
|
14.
|
Maaperän kosteuspitoisuus määritetään testin alussa ja lopussa standardin ISO 11465 (16) tai vastaavan EU-standardin mukaisesti ja maa-aineksen pH-arvo lisäyksen 3, standardin ISO 10390 (13) tai vastaavan EU-standardin mukaisesti. Nämä määritykset tehdään kontrollimaa-ainesnäytteestä sekä jokaista testipitoisuutta sisältävistä maa-ainesnäytteistä. Maa-aineksen pH-arvoa ei saa säätää happamia tai emäksisiä kemikaaleja testattaessa. Kosteuspitoisuutta on seurattava koko testin ajan punnitsemalla säiliöt säännöllisesti (ks. 26 ja 30 kohta).
|
Koe-eläinten valinta ja valmistelu
|
15.
|
Testissä käytettävä laji on Eisenia fetida tai Eisenia andrei (1), (2). Testin aloittamiseen tarvitaan täysikasvuisia lieroja, jotka ovat iältään kahdesta kuukaudesta yhteen vuoteen ja joilla on clitellum. Lierot valitaan synkronoidusta viljelmästä, jonka ikärakenne on suhteellisen homogeeninen (lisäys 4). Testiryhmän yksilöiden ikäero saa olla enintään neljä viikkoa.
|
|
16.
|
Valittuja lieroja totutetaan testissä käytettävään keinomaasubstraattiin vähintään yhden päivän ajan. Tänä aikana lieroille annetaan samaa ruokaa, jota käytetään testissä (ks. 31–33 kohdat).
|
|
17.
|
Testin alussa kymmenen lieron ryhmät punnitaan yksitellen ja ryhmät sijoitetaan satunnaisesti testisäiliöihin. Lierot pestään ennen punnitusta (deionisoidulla vedellä) ja liika vesi poistetaan asettamalla madot hetkeksi aikaa suodatinpaperin päälle. Yksittäisten lierojen märkäpainon on oltava 250–600 mg.
|
Testipitoisuuksien valmistelu
|
18.
|
Testikemikaalin applikoinnissa voidaan käyttää kahta eri menetelmää: testikemikaalin sekoittaminen maa-ainekseen (ks. 19–21 kohdat) tai applikointi maa-aineksen pinnalle (ks. 22–24 kohdat). Soveltuvan menetelmän valinta määräytyy testin tarkoituksen mukaan. Yleensä testikemikaalin sekoittaminen maahan on suositeltavaa. Mahdollisesti on kuitenkin syytä käyttää tavanomaisen maatalouskäytännön mukaisia applikointimenetelmiä (esimerkiksi nestemäisen valmisteen suihkuttaminen tai tiettyjen torjunta-ainevalmisteiden, kuten rakeiden tai siementen peittausaineen käyttäminen). Liuottimien, joilla helpotetaan maa-aineksen käsittelyä testikemikaalilla, valintaperusteena on vähäinen myrkyllisyys lieroille. Testijärjestelyyn sisällytetään sopiva liuotinkontrolli (ks. 27 kohta).
|
Testikemikaalin sekoittaminen maa-ainekseen
Vesiliukoinen testikemikaali
|
19.
|
Testikemikaalista ja deionisoidusta vedestä valmistetaan välittömästi ennen testin aloittamista liuos, joka riittää yhden testipitoisuuden kaikkiin rinnakkaisnäytteisiin. Testiliuoksen valmistuksessa voidaan tarvita tukiliuotinta. Käytännöllisintä on valmistaa liuosta niin paljon, että sen avulla saadaan aikaan lopullinen kosteuspitoisuus (40–60 prosenttia enimmäisvedenpidätyskyvystä). Liuos sekoitetaan huolellisesti maa-ainessubstraattiin ennen sen siirtämistä testisäiliöön.
|
Veteen liukenematon testikemikaali
|
20.
|
Testikemikaali liuotetaan pieneen määrään sopivaa orgaanista liuotinta (esimerkiksi asetonia) ja liuos sekoitetaan pieneen määrään hienoa kvartsihiekkaa tai ruiskutetaan sen päälle. Liuotin poistetaan tämän jälkeen haihduttamalla hiekkaa vetokaapissa vähintään muutaman minuutin ajan. Seuraavaksi käsitelty hiekka sekoitetaan huolellisesti esikostutetun keinomaan joukkoon. Tämän jälkeen lisätään (tarvittava määrä) deionisoitua vettä ja sekoitetaan se keinomaan joukkoon siten, että lopulliseksi kosteuspitoisuudeksi saadaan 40–60 prosenttia enimmäisvedenpidätyskyvystä. Nyt maa-aines on valmis siirrettäväksi testisäiliöihin. On syytä pitää mielessä, että jotkin liuottimet voivat olla myrkyllisiä lieroille.
|
Veteen ja orgaanisiin liuottimiin liukenematon testikemikaali
|
21.
|
Aluksi valmistetaan seos, jossa on 10 g teollisuuskäyttöön tarkoitettua, hienoksi jauhettua kvartsihiekkaa sekä testipitoisuuden aikaansaamiseksi tarvittava määrä testikemikaalia. Seuraavaksi seos sekoitetaan huolellisesti esikostutetun keinomaan joukkoon. Tämän jälkeen lisätään tarvittava määrä deionisoitua vettä ja sekoitetaan se keinomaan joukkoon siten, että lopulliseksi kosteuspitoisuudeksi saadaan 40–60 prosenttia enimmäisvedenpidätyskyvystä. Nyt maa-aines on valmis siirrettäväksi testisäiliöihin.
|
Testikemikaalin applikointi maan pintakerrokseen
|
22.
|
Maa-aines käsitellään vasta sitten, kun lierot on lisätty. Testisäiliöt täytetään ensin kostutetulla maa-ainessubstraatilla, minkä jälkeen punnitut lierot asetetaan pinnalle. Terveet lierot kaivautuvat normaalisti välittömästi substraattiin, minkä vuoksi kaikki pinnalla vielä 15 minuutin kuluttua olevat lierot määritellään vahingoittuneiksi, jolloin ne on vaihdettava. Jos lieroja on vaihdettava, uudet ja pois vaihdettavat lierot punnitaan, jotta lierojen altistusryhmän yhteenlaskettu elävä paino sekä lieroja sisältävän säiliön kokonaispaino testin alussa on tiedossa.
|
|
23.
|
Tämän jälkeen lisätään testikemikaali. Testikemikaalia ei pidä lisätä maa-ainekseen ensimmäisen puolen tunnin kuluttua siitä, kun lieroja on lisätty (tai jos lieroja on vielä maa-aineksen pinnalla), jotta vältetään suora altistus testikemikaalille ihokontaktin kautta. Jos testikemikaali on torjunta-aine, voi olla tarpeen applikoida se maan pintakerrokseen suihkuttamalla. Testikemikaali tulee applikoida maan pinnalle mahdollisimman tasaisesti käyttämällä sopivaa laboratoriossa käytettävää suihkutuslaitetta. Näin simuloidaan torjunta-aineen suihkuttamista pellolla. Ennen applikointia testisäiliön kansi poistetaan ja sen tilalle asetetaan reunasuoja, joka suojaa suihkeelta astian sivuseiniä. Reunasuojana voi olla testisäiliö, josta pohja on poistettu. Applikointi tulisi tehdä olosuhteissa, joissa lämpötila vaihtelee 20 ± 2 °C. Vesiliuokset, emulsiot tai dispersiot tulee applikoida veden annostusnopeudella, joka on 600–800 μl/m2. Nopeus on varmistettava käyttämällä asianmukaista kalibrointitekniikkaa. Tietyt valmisteet, kuten rakeet tai siementen peittausaineet, applikoidaan samalla tavalla kuin maataloudessa.
|
|
24.
|
Testisäiliöt jätetään ilman kantta tunnin ajaksi, jotta applikoinnin yhteydessä vapautunut haihtuva liuotin ehtii haihtua. Tänä aikana on pidettävä huolta, ettei yksikään liero pääse poistumaan testiastioista.
|
MENETTELY
Testi- ja kontrolliryhmät
|
25.
|
Suositeltava määrä on 10 lieroa per 500–600 g keinomaan kuivamassaa (eli 50–60 maa-ainesta lieroa kohti). Jos maa-ainesta käytetään enemmän esimerkiksi testattaessa torjunta-aineita, jotka applikoidaan siementen peittausaineena tai muulla erityisellä tavalla, maa-aineksen määränä lieroa kohti pidetään edelleen 50–60 g lisäämällä lierojen määrää. Jokaista kontrolli- ja käsittelysäiliötä varten varataan kymmenen lieroa. Lierot pestään vedellä ja pyyhitään kuiviksi, minkä jälkeen ne sijoitetaan hetkeksi aikaa imupaperille, jotta ylimääräinen vesi poistuu.
|
|
26.
|
Lieroja testisäiliöihin jaettaessa on pyrittävä välttämään systemaattisia virheitä, minkä vuoksi testipopulaation tasalaatuisuus todetaan punnitsemalla yksitellen 20 lieroa, jotka on valittu satunnaisesti samasta populaatiosta, josta testilierot valitaan. Kun tasalaatuisuus on todettu, lieroerät valitaan, punnitaan ja siirretään testisäiliöihin satunnaistetulla menettelyllä. Testilierojen lisäämisen jälkeen kaikki testisäiliöt punnitaan, jotta saadaan määritettyä alkupaino, jota voidaan käyttää maa-aineksen kosteuspitoisuuden seuraamisessa koko testin ajan 30 kohdassa kuvatulla tavalla. Tämän jälkeen testisäiliöt peitetään, kuten 9 kohdassa on kuvattu, ja sijoitetaan testikammioon.
|
|
27.
|
Jokaista testikemikaalin 18–24 kohdassa kuvattua applikointimenetelmää varten valmistetaan sopiva kontrollinäyte. Kontrollien valmistuksessa noudatetaan sopivia kuvattuja menetelmiä, mutta testikemikaalia ei lisätä. Kontrolleihin lisätään siis tarvittaessa orgaanisia liuottimia, kvartsihiekkaa tai muuta kantoainetta samana pitoisuutena tai saman verran kuin käsittelyihin. Jos testikemikaalin lisäämisessä käytetään liuotinta tai muuta kantoainetta, on lisäksi valmistettava kontrolli, jossa ei käytetä kantoainetta tai testikemikaalia. Kontrollin testaamisella varmistetaan, että kantoaineella ei ole vaikutusta tulokseen.
|
Testiolosuhteet
|
28.
|
Testauslämpötila on 20 °C ± 2 °C. Testi toteutetaan valoisaa ja pimeää aikaa säätelemällä (mieluiten 16 tuntia valoisaa ja 8 tuntia pimeää). Testiastioiden alueella tulisi olla 400–800 luksin valaistus.
|
|
29.
|
Testisäiliöitä ei ilmasteta testin aikana, mutta testiastioiden kansien on päästettävä kaasut vaihtumaan samalla, kun ne estävät kosteuden haihtumista (ks. 9 kohta).
|
|
30.
|
Testisäiliöissä olevan maa-ainessubstraatin vesipitoisuutta pidetään yllä koko testin ajan punnitsemalla testisäiliöt säännöllisesti uudelleen (ilman kansia). Hävikki korvataan tarpeen mukaan deionisoidulla vedellä. Vesipitoisuus ei saa vaihdella enempää kuin 10 prosenttia testin alussa mitatusta.
|
Ruokinta
|
31.
|
Sopivaksi ruoaksi katsotaan kaikki sellainen, jolla lierojen painon on todettu pysyvän vähintään samana. Kokemus on osoittanut, että sopivaa ravintoa ovat kaurahiutaleet tai lehmän- tai hevosenlanta. On syytä tarkistaa, että naudat tai hevoset, joista lanta on peräisin, eivät saa lääkitystä tai niitä ei hoideta kemikaaleilla, kuten kasvunedistäjillä, nematisideilla tai muilla eläinlääkinnällisillä valmisteilla, jotka saattavat vaikuttaa lieroihin haitallisesti testin aikana. Suositeltavaa on itse kerätty lehmänlanta, sillä kokemus on osoittanut, että kaupallisesti saatavilla olevalla, puutarhalannoitteena käytettävällä lehmänlannalla voi olla lieroille haitallisia vaikutuksia. Lanta ilmakuivataan, jauhetaan hienoksi ja pastöroidaan ennen käyttöä.
|
|
32.
|
Uutta ruokaerää annetaan aina ensin testiin osallistumattomille lieroille ennen kuin sitä käytetään testissä, jotta erän laadun voidaan todeta olevan sopiva. Kasvun ja munakoteloiden tuotannon ei pidä vähentyä verrattuna lieroihin, joiden substraatissa ei ole uutta ruokaerää (olosuhteet vastaavat testimenetelmän C.8 kohdassa 4 kuvattuja olosuhteita).
|
|
33.
|
Ensimmäinen ruokintakerta on yksi vuorokausi sen jälkeen, kun madot on tuotu säiliöön ja testikemikaalia lisätty maa-ainekseen. Noin viisi grammaa ruokaa levitetään kussakin säiliössä olevan maa-aineksen pinnalle ja kostutetaan deionisoidulla vedellä (noin 5–6 ml säiliötä kohti). Tämän jälkeen ruokaa annetaan kerran viikossa neljä viikkoa kestävän testin aikana. Jos ruokaa jää syömättä, annosta pienennetään niin, että ruokaan ei tule sienikasvustoja tai hometta. Täysikasvuiset yksilöt poistetaan maa-aineksesta testin päivänä 28. Tämän jälkeen jokaiseen testisäiliöön lisätään vielä viisi grammaa ruokaa. Neljän jäljellä olevan testiviikon aikana ruokintaa ei enää jatketa.
|
Testipitoisuuksien valinta
|
34.
|
Sopivien testipitoisuuksien valinnassa auttaa testikemikaalin myrkyllisyydestä saatu aiempi tieto, joka on peräisin esimerkiksi välitöntä myrkyllisyyttä koskevasta testistä (4) ja/tai pitoisuusalueen määritystutkimuksista. Tarvittaessa pitoisuusalueen määritystesti toteutetaan esimerkiksi siten, että siinä on viisi testipitoisuutta (0,1, 1,0, 10, 100 ja 1 000 mg/kg maa-aineksen kuivamassaan nähden). Jokaisesta käsittelystä riittää yksi rinnakkaisnäyte ja kontrolli. Pitoisuusalueen määritystesti kestää kaksi viikkoa, ja kuolleisuus arvioidaan testin lopussa.
|
Testijärjestely
|
35.
|
Testille ei voi osoittaa yksittäistä yhteenvetotilastoa, joten testimenetelmä sallii sekä NOEC-arvon että ECx-arvon määrittämisen. NOEC-arvo on se, jota sääntelyviranomaiset todennäköisesti edellyttävät lähitulevaisuudessa. Tilastollisten ja ekologisten näkökohtien vuoksi ECx-arvoa saatetaan ryhtyä jatkossa käyttämään laajemmin. Tästä syystä ja änkyrimatojen lisääntymistestimenetelmää koskevan yhteistutkimuksen johdosta tehtyjen suositusten perusteella esitetään kolmea mahdollista testijärjestelyä (17).
|
|
36.
|
Pitoisuusalueen valinnassa on otettava huomioon seuraavat seikat:
|
—
|
NOEC-arvoa määritettäessä testataan vähintään viisi/kaksitoista pitoisuutta geometrisessa sarjassa. Jokaista testipitoisuutta kohti suositellaan neljää rinnakkaisnäytettä ja kahdeksaa kontrollia. Pitoisuudet on porrastettava kertoimella, joka saa olla enintään 2,0.
|
|
—
|
ECx-arvoa (esimerkiksi EC10, EC50) määritettäessä suositellaan käytettäväksi niin montaa pitoisuutta, että saadaan aikaan vähintään neljä tilastollisesti erittäin merkitsevästi poikkeavaa keskivastetta. Jokaista testipitoisuutta kohti suositellaan vähintään kahta rinnakkaisnäytettä ja kuutta kontrollirinnakkaisnäytettä. Porrastuskerroin voi vaihdella ja olla enintään 1,8 odotetulla vaikutusalueella sekä yli 1,8 tätä suuremmilla ja pienemmillä pitoisuuksilla.
|
|
—
|
Yhdistetty lähestymistapa mahdollistaa sekä NOEC- että ECx-arvon määrittämisen. Tällöin käytetään kahdeksaa käsittelypitoisuutta geometrisessa sarjassa. Jokaista käsittelyä kohti suositellaan neljää rinnakkaisnäytettä ja kahdeksaa kontrollia. Pitoisuudet on porrastettava kertoimella, joka saa olla enintään 1,8.
|
|
Testin kesto ja mittaukset
|
37.
|
Testin päivänä 28 elävät täysikasvuiset lierot tutkitaan ja lasketaan. Samalla kirjataan muistiin mahdollinen epätavallinen käyttäytyminen (esimerkiksi kyvyttömyys kaivautua maa-ainekseen tai makaaminen liikkumatta) sekä morfologiset poikkeavuudet (esimerkiksi avohaavat). Tämän jälkeen kaikki täysikasvuiset poistetaan testiastioista, ja ne lasketaan ja punnitaan. Täysikasvuisten yksilöiden löytämistä helpottaa, jos lierot sisältävä maa-aines siirretään puhtaalle tarjottimelle ennen arviointia. Maa-aineksesta talteenotetut lierot pestään ennen punnitusta (deionisoidulla vedellä) ja liika vesi poistetaan asettamalla lierot hetkeksi aikaa suodatinpaperin päälle. Lierot, joita ei tässä yhteydessä löydetä, on kirjattava kuolleiksi, sillä oletuksena on, että ne ovat kuolleet ja maatuneet ennen arviointia.
|
|
38.
|
Jos maa-aines on poistettu säiliöistä, se siirretään takaisin (ilman täysikasvuisia lieroja, mutta mahdollisesti tuotetut munakotelot ovat edelleen mukana). Tämän jälkeen maa-ainesta inkuboidaan vielä neljä viikkoa samoissa testiolosuhteissa, mutta ruokinta tapahtuu vain kerran tämän testivaiheen alussa (ks. 33 kohta).
|
|
39.
|
Toisen neljä viikkoa kestävän jakson lopulla munakoteloista testimaa-aineksessa kuoriutuneiden poikasten määrä sekä munakoteloiden määrä todetaan lisäyksessä 5 kuvattuja menettelyjä käyttämällä. Kaikki lieroille aiheutuneet vauriot on myös kirjattava koko testin keston ajan.
|
Raja-annostesti
|
40.
|
Jos pitoisuusalueen määritystestissä ei havaita vaikutuksia suurimmalla pitoisuudella (esimerkiksi 1 000 mg/kg), lisääntymistesti toteutetaan raja-annostestinä käyttäen testipitoisuutta 1 000 mg/kg. Raja-annostestin avulla voidaan osoittaa, että lisääntymisen NOEC-arvo on rajapitoisuutta korkeampi, mutta samalla testissä käytettyjen lierojen määrä voidaan pitää mahdollisimman pienenä. Sekä käsitellyn maa-aineksen että kontrollin osalta käytetään kahdeksaa rinnakkaisnäytettä.
|
TIEDOT JA RAPORTOINTI
Tulosten käsittely
|
41.
|
Lisäyksessä 6 olevaa yhteenvetoa lukuun ottamatta tähän testimenetelmään ei kuulu tarkoin määriteltyä tilastollista menetelmää testitulosten analysointia varten.
|
|
42.
|
Yksi tutkittavista ominaisuuksista on kuolleisuus. Muutokset käyttäytymisessä (esimerkiksi kyvyttömyys kaivautua maa-ainekseen tai makaaminen liikkumatta testiastian lasiseinämää vasten) ja morfologiassa (esimerkiksi avohaavat) sekä mahdollisten poikasten esiintyminen on kuitenkin myös syytä kirjata muistiin. LC50-arvo määritetään normaalisti tilastollista koestusta (18) tai logistista regressiota käyttämällä. Tapauksissa, joihin tämä analyysimenetelmä ei sovellu (esimerkiksi silloin, kun osittaista kuolleisuutta havaitaan alle kolmessa pitoisuudessa), voidaan kuitenkin käyttää muita menetelmiä. Näitä ovat esimerkiksi liukuva keskiarvo (19), viritetty Spearmanin ja Kärberin menetelmä (20) tai yksinkertainen interpolointi (esimerkiksi LC0:n ja LC100:n geometrinen keskiarvo laskettuna LC0:n neliöjuuresta kerrottuna LC100:lla).
|
|
43.
|
Toinen tutkittava ominaisuus on hedelmällisyys eli esimerkiksi tuotettujen poikasten lukumäärä. Pitoisuusalueen määritystestin tavoin kaikki muut merkit kemikaalin vaarallisuudesta on kuitenkin kirjattava loppuraporttiin. Tilastollinen analyysi edellyttää, että lisääntymisestä lasketaan aritmeettinen keskiarvo
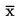
ja keskihajonta kutakin käsittelyä ja kontrollia kohti. |
|
44.
|
Varianssianalyysiä tehtäessä keskihajonta s ja vapausaste (df) voidaan korvata yhdistetyllä varianssianalyysistä saadulla varianssiestimaatilla ja sen vapausasteilla sillä ehdolla, että varianssi ei ole riippuvainen pitoisuudesta. Tässä tapauksessa käytetään kontrollin ja käsittelyiden yksinkertaisia variansseja. Kaupalliset tilasto-ohjelmistot laskevat nämä arvot yleensä käyttämällä astiakohtaisia tuloksia rinnakkaisnäytteinä. Jos negatiivisista kontrolleista ja liuotinkontrolleista saadun datan yhdistäminen vaikuttaa järkevämmältä kuin testaaminen johonkin niistä verraten, ne on testattava, jotta voidaan todeta, etteivät ne eroa toisistaan merkittävästi (sopivasta testistä ks. 47 kohta ja lisäys 6).
|
|
45.
|
Muut tilastolliset testit ja interferenssi riippuvat siitä, ovatko rinnakkaisnäytteiden arvot normaalijakaumalla ja varianssiin nähden homogeenisia.
|
NOEC-estimointi
|
46.
|
Huomiota kiinnitetään ennen kaikkea testien voimaan. Kun halutaan arvioida, noudattaako data suurin piirtein normaalijakaumaa, hyödynnetään esimerkiksi aiemmista yhteistutkimuksista saatua tietoa tai muuta historiallista tietoa. Kriittisempi on varianssin homogeenisuus (homoskedastisuus). Kokemuksen perusteella varianssi usein kasvaa keskiarvon noustessa, ja tässä tilanteessa datan muuntaminen saattaa johtaa homoskedastisuuteen. Muunnosten täytyy kuitenkin perustua historiallisesta tiedosta saatuun kokemukseen tutkittavana olevan datan asemasta. Jos data on homogeenista, tehdään useita t-testejä, esimerkiksi Watsonin-Williamsin testi (α = 0,05, yksisuuntainen) (21), (22) tai joissakin tapauksissa Dunnettin testi (23), (24). On syytä huomata, että jos rinnakkaisnäytteitä ei ole yhtä paljon, taulukon t-arvoja on korjattava Dunnettin ja Williamsin esittämillä tavoilla. Suuren variaation vuoksi vasteet eivät aina kasva tai pienene säännönmukaisesti ja monotonisuudesta poiketaan voimakkaasti, jolloin Dunnettin testi sopii tarkoitukseen paremmin. Jos homoskedastisuudessa on poikkeamia, voi olla tarpeen tutkia tarkemmin mahdollisia vaikutuksia variansseihin, jotta saadaan selville, voiko t-testejä käyttää testien voimasta tinkimättä (25). Vaihtoehtoisesti voidaan käyttää moninkertaista U-testiä, esimerkiksi Bonferroni-U-testiä Holmin mukaan (26). Jos datassa ilmenee heteroskedastisuutta, mutta se vastaa muutoin taustalla olevaa monotonista annosvastetta, voidaan käyttää myös muuta parametritonta testiä, esimerkiksi Jonckheere-Terprstran testiä (27), (28) tai Shirley-testiä (29), (30). Viimeksi mainitut ovat yleensä suositeltavampia kuin t-testit, joissa varianssit ovat heterogeenisiä. (Ks. myös lisäyksen 6 kaavio.)
|
|
47.
|
Jos raja-arvotesti on tehty ja parametritestimenetelmien edellytykset (yleensä homogeenisuus) täyttyvät, voidaan käyttää parittaista Studentin t-testiä tai muussa tapauksessa Mann-Whitneyn U-testimenetelmää (31).
|
ECx-pitoisuuden arviointi
|
48.
|
Kaikkia ECx-arvoja laskettaessa käsittelykohtaisia keskiarvoja käytetään regressioanalyysissa (lineaarisessa tai epälineaarisessa) sen jälkeen, kun on muodostettu sopiva annosvastefunktio. Kun lierojen kasvu on jatkuva vaste, ECx-arvot voidaan estimoida sopivalla regressioanalyysillä (32). Sopivia funktioita dikotomisia tietoja varten (kuolleisuus/eloonjääminen ja tuotettujen jälkeläisten määrä) ovat tavanomaiset S-funktio, logistinen funktio tai Weibullin funktio, jotka sisältävät 2–4 parametria, joista osalla voidaan mallintaa myös hormeettisia vasteita. Jos annosvastefunktio on sovitettu lineaarisella regressioanalyysilla, merkitsevä r2 (determinaatiokerroin) ja/tai kaltevuus on etsittävä regressioanalyysilla, minkä jälkeen ECx arvioidaan käyttämällä kontrollikeskiarvon x prosenttia vastaavaa arvoa regressioanalyysilla muodostetussa yhtälössä. Seuraavaksi 95 prosentin luottamusvälit lasketaan Fiellerin mukaan (teoksessa Finney (18)) tai jollakin muulla sopivalla, nykyaikaisella menetelmällä.
|
|
49.
|
Vaihtoehtoisesti vaste voidaan mallintaa prosentti- tai muuna osuutena malliparametrista, joka tulkitaan kontrollin keskimääräiseksi vasteeksi. Tällöin normaali (logistinen, Weibullin) s-käyrä voidaan sovittaa helposti tuloksiin hyödyntämällä probitti-regressiomenetelmää (18). Painotusfunktiota on mukautettava metrisiin vasteisiin Christensenin esimerkin mukaan (33). Jos hormeesia on havaittu, probittianalyysin sijasta on käytettävä neliparametrista logistista tai Weibullin funktiota, joka sovitetaan epälineaarisella regressiomenetelmällä (34). Jos dataan ei saada sovitettua sopivaa annosvastefunktiota, voidaan ECx:n ja sen luottamusvälien estimoinnissa käyttää jotain muuta menetelmää, kuten Thompsonin liukuvaa keskiarvoa (19) tai viritettyä Spearman ja Kärberin menetelmää (20).
|
TESTIRAPORTTI
|
50.
|
Testiraportissa on esitettävä seuraavat tiedot:
|
|
Testikemikaali:
|
—
|
testikemikaalin kattava kuvaus, erät ja CAS-numero sekä puhtaus
|
|
—
|
testikemikaalin ominaisuudet (esimerkiksi log Kow, vesiliukoisuus, höyrynpaine, Henryn vakio (H) sekä tiedot testikemikaalin kulkeutumisesta ja käyttäytymisestä.
|
|
|
|
Testiorganismit:
|
—
|
käytetyt koe-eläimet: lajit, tieteellinen nimi, organismien lähde ja kasvatusolosuhteet
|
|
—
|
testiorganismien ikä ja kokoluokka (massana)
|
|
|
|
Testiolosuhteet
|
—
|
tiedot testimaa-aineksen valmistuksesta
|
|
—
|
maa-aineksen enimmäisvedenpidätyskyky
|
|
—
|
kuvaus tekniikasta, jolla testikemikaali on applikoitu maa-ainekseen
|
|
—
|
tiedot kemikaalin annostelussa käytetyistä kemiallisista apuaineista
|
|
—
|
ruiskutuslaitteiden kalibrointitiedot (tarvittaessa)
|
|
—
|
kuvaus testijärjestelystä ja käytetyistä menettelyistä
|
|
—
|
testisäiliöiden koko ja testimaa-aineksen määrä
|
|
—
|
testiolosuhteet: valoteho, valoisien ja pimeiden jaksojen kesto, lämpötila
|
|
—
|
kuvaus eläinten ruokinnasta; testissä käytetyn ruoan tyyppi ja määrä, ruokintapäivämäärät
|
|
—
|
maa-aineksen pH ja vesipitoisuus testin alussa ja lopussa.
|
|
|
|
Testitulokset:
|
—
|
täysikasvuisten kuolleisuus (prosentteina) jokaisessa testisäiliössä testin ensimmäisen neljän viikon lopussa
|
|
—
|
täysikasvuisten yksilöiden kokonaismassa testin alussa jokaisessa testisäiliössä
|
|
—
|
elävien täysikasvuisten yksilöiden ruumiinpainossa tapahtunut muutos (prosentteina alkupainosta) jokaisessa testisäiliössä testin ensimmäisen neljän viikon jälkeen
|
|
—
|
jokaisessa testiastiassa tuotettujen poikasten määrä testin lopussa
|
|
—
|
kuvaus selvistä patologisista oireista tai selkeistä muutoksista käyttäytymisessä
|
|
—
|
vertailutestikemikaalista saadut tulokset
|
|
—
|
LC50-arvo, NOEC-arvo ja/tai ECx (esimerkiksi EC50, EC10) lisääntymisen osalta, jos jotain näistä voidaan soveltaa luottamusvälien puitteissa, sekä käyrä sen laskennassa käytetystä sovitetusta mallista kaikki tiedot ja havainnot, jotka helpottavat tulosten tulkintaa
|
|
—
|
annosvastesuhdetta esittävä käyrä
|
|
—
|
jokaiseen testisäiliöön sovellettavat tulokset.
|
|
Lisäksi ilmoitetaan poikkeukset tässä testimenetelmässä kuvatuista menettelyistä ja kaikki testin aikana ilmenneet epätavallisuudet.
|
LÄHDEKIRJALLISUUS
|
(1)
|
Jaenicke, J. (1982). ’Eisenia foetida’ is two biological species. Megadrilogica 4, 6–8.
|
|
(2)
|
Oien, N. and J. Stenerson (1984). Esterases of earthworm – III. Electrophoresis reveals that Eisenia foetida (Savigny) is two species. Comp. Biochem. Physiol. 78c (2), 277–282.
|
|
(3)
|
Kula, C. (1996). Development of a test method on sublethal effects of pesticides on the earthworm species Eisenia fetida/Eisenia andrei – comparison of two ringtests. Teoksessa: Riepert, F., Kula, C. (1996): Development of laboratory methods for testing effects of chemicals and pesticides on collembola and earthworms. Mitt. Biol. Bundesamst. f. Land- Forstwirtsch. Berlin-Dahlem, 320, s. 50–82.
|
|
(4)
|
Tämän liitteen luku C.8 Myrkyllisyystutkimus madoilla.
|
|
(5)
|
International Organisation for Standardization (ISO) (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No.11268-2. ISO, Geneve.
|
|
(6)
|
International Organisation for Standardization (ISO) (1993). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 1: Determination of acute toxicity using artificial soil substrate, No.11268-1. ISO, Geneve.
|
|
(7)
|
SETAC (1998). Advances in Earthworm Ecotoxicology. Sheppard, S.C., Bembridge, J.D., Holmstrup, M., and L. Posthuma, (eds). SETAC Press, 456 s.
|
|
(8)
|
EPA (1996). Ecological effects test guidelines. Earthworm Subchronic Toxicity Test (850.62.00). United States Environmental Protection Agency. Office of Prevention, Pesticides and Toxic Substances. EPA712-C-96-167, April 1996.
|
|
(9)
|
Bouché, M.B. (1972). Lombriciens de France, Ecologie et systématique. Publication de l'Institut National de la Recherche Agronomique.
|
|
(10)
|
Edwards, C.A. (1983). Development of a standardized laboratory method for assessing the toxicity of chemical substances to earthworms. Report EUR 8714 EN, Commission of European Communities.
|
|
(11)
|
Greig-Smith, P.W., H. Becker, P.J. Edwards and F. Heimbach (eds.) (1992). Ecotoxicology of Earthworms. Intercept.
|
|
(12)
|
Edwards, C.A. and J. P. Bohlen, (1996). Biology and ecology of Earthworms, 3rd Edition. Chapman and Hall, London.
|
|
(13)
|
International Organisation for Standardization (ISO) (1994). Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
|
|
(14)
|
Hund-Rinke, K, Römbke, J., Riepert, F. & Achazi R. (2000): Beurteilung der Lebensraumfunktion von Böden mit Hilfe von Regenwurmtests. Teoksessa: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (eds.). Spektrum Verl., Heidelberg. 59–81.
|
|
(15)
|
International Organisation for Standardization (ISO) (1992). Soil Quality –Determination of water retention characteristics –Laboratory methods, No. 11274. ISO, Geneve.
|
|
(16)
|
International Organisation for Standardization (ISO) (1993). Soil Quality –Determination of dry matter and water content on a mass basis – Gravimetric method, No. 11465. ISO, Geneve.
|
|
(17)
|
Römbke, J. and Th. Moser (1999). Organisation and Performance of an International Ringtest for the validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150 + 223 s.
|
|
(18)
|
Finney, D.J. (1971). Probit Analysis (3rd ed.), s. 19–76. Cambridge Univ. Press.
|
|
(19)
|
Finney, D.J. (1978). Statistical Method in Biological Assay. – Charles Griffin & Company Ltd, London.
|
|
(20)
|
Hamilton, M.A., R.C. Russo and R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714–719; korjaus Environ. Sci. Technol. 12(1998), 417.
|
|
(21)
|
Williams, D.A., (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103–117.
|
|
(22)
|
Williams, D.A., (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519–531.
|
|
(23)
|
Dunnett, C.W., (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096–1121.
|
|
(24)
|
Dunnett, C.W., (1964) New tables for multiple comparisons with a control. Biometrics 20, 482–491.
|
|
(25)
|
Hoeven, N. van der, (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355–361
|
|
(26)
|
Holm, S., (1979): A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65–70.
|
|
(27)
|
Jonckheere, A. R. (1954); A Distribution-free k-Sample Test Against Ordered Alternatives, Biometrika 41, 133-145.
|
|
(28)
|
Terpstra, T. J. (1952); The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327–333.
|
|
(29)
|
Shirley, E. A. (1979); The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144–151.
|
|
(30)
|
Williams, D.A. (1986); A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183–186.
|
|
(31)
|
Sokal, R.R. and F.J. Rohlf. (1981). Biometry. The Principle and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
|
|
(32)
|
Bruce R.D. and Versteeg D.J. (1992) A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry 11:1485–1494
|
|
(33)
|
Christensen, E.R., (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213–221.
|
|
(34)
|
Van Ewijk, P.H. and J.A. Hoekstra. (1993). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25–32.
|
Lisäys 1
Määritelmät
Tässä testimenetelmässä sovelletaan seuraavia määritelmiä:
Kemikaali
: aine tai seos.
ECx
(Effect concentration for x % effect = vaikuttava pitoisuus, joka aiheuttaa x prosenttia muutoksia): Pitoisuus, joka aiheuttaa x prosentin suuruisen vaikutuksen testiorganismeihin tietyn altistusjakson aikana kontrolliin verrattuna. Esimerkiksi EC50 on pitoisuus, jolla arvioidaan testin lopussa olevan 50 prosentin vaikutus altistuksen kohteeksi joutuneeseen populaatioon määritellyn altistusajan kuluessa. Tässä testissä kaikki vaikuttavat pitoisuudet ilmaistaan testikemikaalin massana testimaa-aineksen kuivamassaa kohti.
LC0
(ei tappava pitoisuus): Testikemikaalin pitoisuus, joka ei aiheuta lainkaan altistuneiden testiorganismien kuolleisuutta tietyn ajanjakson aikana. Tässä testissä LC0 ilmaistaan testikemikaalin massana testimaa-aineksen kuivamassaa kohti.
LC50
(mediaani tappava pitoisuus): Testikemikaalin pitoisuus, joka aiheuttaa 50 prosentin kuolleisuuden altistuneissa testiorganismeissa tietyn ajanjakson aikana. Tässä testissä LC50 ilmaistaan testikemikaalin massana testimaa-aineksen kuivamassaa kohti.
LC100
(täysin tappava pitoisuus): Testikemikaalin pitoisuus, joka aiheuttaa 100 prosentin kuolleisuuden altistuneissa testiorganismeissa tietyn ajanjakson aikana. Tässä testissä LC100 ilmaistaan testikemikaalin massana testimaa-aineksen kuivamassaa kohti.
LOEC (Lowest Observed Effect Concentration, pienin havaittavan vaikutuksen aiheuttava pitoisuus): Testikemikaalin pienin pitoisuus, jolla on tilastollisesti merkittävä vaikutus (p < 0,05). Tässä testissä LOEC ilmaistaan testikemikaalin massana testimaa-aineksen kuivamassaa kohti. Kaikilla LOEC-pitoisuuden ylittävillä testipitoisuuksilla vaikutuksen olisi normaalisti oltava kontrollista tilastollisesti poikkeava. Kaikki poikkeamat edellä mainitusta on perusteltava testiraportissa.
NOEC (pitoisuus, josta ei aiheudu vaikutuksia)
: LOEC-arvoa välittömästi seuraava testikemikaalin korkein pitoisuus, josta ei ole havaittavaa vaikutusta. Tässä testissä NOEC-arvoa vastaavalla pitoisuudella ei ole tilastollisesti merkittävää vaikutusta (p < 0,05) tietyn altistusajan kuluessa kontrolliin verrattuna.
Lisääntymiskyky
: testijakson kuluessa tuotettujen poikasten keskimäärä täysikasvuisten lierojen määrään verrattuna.
Testikemikaali
: tätä testimenetelmää käyttäen testattu aine tai seos.
Lisäys 2
Maan enimmäisvedenpidätyskyvyn määrittäminen
Seuraavan menetelmän on havaittu olevan tarkoituksenmukainen maan enimmäisvedenpidätyskyvyn määrittämisessä. Menetelmä on kuvattu standardin ISO DIS 11268-2 liitteessä C (1).
Kerää tietty määrä (esimerkiksi viisi grammaa) testimaasubstraattia sopivalla näytteenottovälineellä (kierrekairalla tms.). Aseta kierrekairaputken pohjalle pala märkää suodatinpaperia, ja laita se sitten telineessä vesiastiaan. Putki upotetaan veteen vähitellen, kunnes vedenpinta on maanäytteen yläpuolella. Sen jälkeen näytettä pidetään vedessä noin kolme tuntia. Kaikkea maa-aineksen kapillaareihin imeytynyttä vettä ei pystytä pidättämään, minkä vuoksi maanäytettä valutetaan kahden tunnin ajan asettamalla putki hyvin märkään kerrokseen hienojakoista kvartsihiekkaa, joka on laitettu suljettuun astiaan (kuivumisen estämiseksi). Tämän jälkeen näyte punnitaan, kun se on kuivattu vakiomassaan 105 oC:ssa. Nyt vedenpidätyskyky (WHC) voidaan laskea seuraavasti:

jossa:
|
S
|
=
|
vesikyllästetty substraatti + putken massa + suodatinpaperin massa
|
|
T
|
=
|
taara (putken massa + suodatinpaperin massa)
|
|
D
|
=
|
substraatin kuivamassa.
|
VIITTEET:
|
(1)
|
International Organisation for Standardization (ISO) (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No.11268-2. ISO, Geneve.
|
Lisäys 3
Maan pH:n määrittäminen
Seuraava menetelmä, jolla määritetään maan pH-arvo, perustuu maan laatua koskevassa standardissa ISO DIS 10390: Soil Quality – Determination of pH (1) olevaan kuvaukseen.
Tietyn määrän maata annetaan kuivua huoneenlämmössä vähintään 12 tunnin ajan. Sen jälkeen maasta valmistetaan suspensio (joka sisältää vähintään viisi grammaa maata), jonka tilavuus on viisinkertainen joko analyyttista laatua olevaan 1 M:n kaliumkloridiliuoksen (KCl) tilavuuteen tai analyyttista laatua olevaan 0,01 M:n kalsiumkloridiliuokseen (CaCl2) nähden. Sen jälkeen suspensiota ravistetaan perinpohjaisesti viisi minuuttia, ja sen annetaan asettua vähintään kaksi mutta enintään 24 tuntia. Nestefaasin pH-arvo mitataan pH-mittarilla, joka kalibroidaan ennen jokaista mittausta käyttämällä asianmukaisia puskuriliuoksia (esimerkiksi pH 4,0 ja 7,0).
VIITTEET:
|
(1)
|
International Organisation for Standardization (ISO) (1994). Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
|
Lisäys 4
Eisenia fetida / Eisenia andrei lajien kasvatus
Kasvatuspaikaksi suositellaan ilmasto-olosuhteiltaan säädettävää kaappia, jonka lämpötila on 20 °C ± 2 °C. Tässä lämpötilassa riittävästi ruokitut lierot tulevat sukukypsiksi noin 2–3 kuukaudessa.
Kumpaakin lajia voidaan kasvattaa hyvin erilaisissa eläinjätteissä. Suositeltava kasvatusalusta on hevosen- tai lehmälantaa ja turvetta suhteessa 50:50. On syytä tarkistaa, että naudat tai hevoset, joista lanta on peräisin, eivät saa lääkitystä tai niitä ei hoideta kemikaaleilla, kuten kasvunedistäjillä, nematisideilla tai muilla eläinlääkinnällisillä valmisteilla, jotka saattavat vaikuttaa lieroihin haitallisesti testin aikana. Suositeltavaa on luomuviljelmältä itse kerätty lanta, sillä kokemus on osoittanut, että kaupallisesti saatavilla olevalla, puutarhalannoitteena käytettävällä lannalla voi olla lieroille haitallisia vaikutuksia. Aineen pH-arvon on oltava noin 6–7 (sitä säädellään kalsiumkarbonaatilla). Ionisen johtavuuden on oltava matala (alle 6 mS/cm tai suolapitoisuus alle 0,5 %), eikä kasvatusalustassa saa olla liikaa ammoniakkia tai eläinten virtsaa. Alustan on oltava kostea mutta ei liian märkä. Kasvatuslaatikon sopiva koko on 10–50 litraa.
Jotta saadaan vakioikäisiä ja -painoisia lieroja, viljelmä on paras aloittaa munakoteloilla. Kun viljelmä on perustettu, sitä pidetään yllä sijoittamalla täysikasvuisia lieroja kasvatuslaatikkoon, jossa on tuoretta substraattia, 14–28 vuorokauden ajaksi, jolloin saadaan lisää munakoteloita. Tämän jälkeen täysikasvuiset yksilöt poistetaan, ja munakoteloista kuoriutuneita poikasia voidaan käyttää seuraavan viljelmän perustana. Lieroja ruokitaan jatkuvasti eläinjätteellä, ja ne siirretään säännöllisin väliajoin tuoreeseen substraattiin. Kokemus on osoittanut, että sopivaa ravintoa ovat hienoksi jauhettu lehmän- tai hevosenlanta tai jauhetut kaurahiutaleet. On syytä varmistaa, että naudat tai hevoset, joista lanta on peräisin, eivät saa lääkitystä tai niitä ei hoideta kemikaaleilla, kuten kasvunedistäjillä, jotka saattavat vaikuttaa lieroihin haitallisesti pitkäaikaisen viljelyn aikana. Munakoteloista kuoriutuneita lieroja käytetään testaamisessa, kun ne ovat iältään 2–12 kuukautta ja katsotaan täysikasvuisiksi.
Lieroja pidetään terveinä, jos ne liikkuvat substraatin läpi, eivät yritä poistua substraatista ja lisääntyvät jatkuvasti. Lierojen hyvin hidas liikkuminen tai keltainen peräpää viittaa substraatin ehtymiseen. Tällöin on suositeltavaa lisätä tuoretta substraattia ja/tai vähentää kasvattamistiheyttä.
Lisäys 5
Menetelmiä munakoteloista kuoriutuneiden lieronpoikasten laskemista varten
Lierojen poimiminen käsin maa-ainessubstraatista vie erittäin paljon aikaa. Tästä syystä suositellaan kahta vaihtoehtoista menetelmää.
|
a)
|
Testisäiliöt upotetaan vesihauteeseen, jonka lämpötila on aluksi 40 °C, mutta se nostetaan 60 °C:een. Noin 20 minuutin kuluttua lieronpoikasten pitäisi ilmestyä maa-aineksen pinnalle, josta ne voidaan helposti poimia talteen ja laskea.
|
|
b)
|
Testimaa-ainesta voidaan huuhdella siivilässä käyttämällä menetelmää, jonka ovat kehittäneet van Gestel ym. (1). Edellytyksenä on, että maa-ainekseen lisätty turve sekä lanta tai kaurahiutaleet oli jauhettu hienoksi jauheeksi. Kaksi siivilää, joiden silmäkoko on 0,5 mm ja halkaisija 30 cm, asetetaan päällekkäin. Testisäiliön sisältö huuhdellaan siivilöiden läpi voimakkaalla vesijohtovesisuihkulla, jolloin lieronpoikaset ja munakotelot jäävät pääasiassa ylempään siivilään. On tärkeää huomata, että ylemmän siivilän koko pinnan olisi pysyttävä märkänä koko toimenpiteen ajan, jotta lieronpoikaset kelluvat vesikerroksessa eivätkä pääse luikertelemaan siivilän reikien läpi. Paras tulos saadaan suihkupäätä käyttämällä.
|
Kun koko maa-ainessubstraatti on huuhdeltu siivilöiden läpi, poikaset ja munakotelot voidaan kaataa ylemmästä siivilästä astiaan. Tämän jälkeen astian sisällön annetaan seistä hetken, jolloin tyhjät munakotelot nousevat veden pintaan ja täydet munakotelot sekä poikaset laskeutuvat astian pohjalle. Sen jälkeen seisova vesi voidaan kaataa pois ja lieronpoikaset ja munakotelot siirtää petrimaljaan, jossa on pohjalla vähän vettä. Lierot voidaan poimia maljasta laskemista varten neulalla tai pinseteillä.
Kokemus on osoittanut, että menetelmä a sopii paremmin lieronpoikasten talteenottamiseen, sillä ne saattavat huuhtoutua läpi jopa siivilästä, jonka silmäkoko on vain 0,5 mm.
Lierojen (sekä tarvittaessa munakoteloiden) maa-ainessubstraatista erottamiseen käytetyn menetelmän toimivuus on aina todettava. Jos poikaset poimitaan käsin, on suositeltavaa toistaa toimenpide kahdesti kaikkien näytteiden osalta.
VIITTEET:
|
(1)
|
Van Gestel, C.A.M., W.A. van Dis, E.M. van Breemen, P.M. Sparenburg (1988). Comparison of two methods determining the viability of cocoons produced in earthworm toxicity experiments. Pedobiologia 32:367–371.
|
Lisäys 6
Yhteenveto datan tilastollisesta arvioinnista (NOEC-arvon määrittäminen)

C.34. ANAEROBISTEN BAKTEERIEN TOIMINNAN ESTYMISEN TOTEAMINEN – KAASUNMUODOSTUKSEN VÄHENTYMINEN ANAEROBISESSA MÄDÄTYSLIETTEESSÄ (JÄTEVEDESSÄ)
JOHDANTO
|
1.
|
Tämä testimenetelmä vastaa OECD:n testiohjetta (TG) nro 224 (2007). Vesiympäristöön joutuneet kemikaalit läpäisevät sekä aerobisen että anaerobisen vyöhykkeen, jossa ne saattavat alkaa hajota ja/tai estää bakteerien toimintaa; joissakin tapauksissa kemikaalit saattavat jäädä muuttumattomina anaerobiseen vyöhykkeeseen vuosikymmeniksi tai vieläkin pitemmäksi ajaksi. Jätevedenkäsittelyssä ensimmäinen vaihe eli esiselkiyttäminen on aerobinen supernatanttinesteeessä ja anaerobinen sedimenttilietteessä. Toisessa vaiheessa aktiivilietteen ilmastustankissa on aerobinen vyöhyke ja jälkiselkeyttimessä oleva sedimenttiliete on anaerobisella vyöhykkeellä. Molemmissa vaiheissa olevalle lietteelle tehdään tavallisesti anaerobinen käsittely, jolloin saadaan metaania ja hiilidioksidia, joita käytetään yleensä sähkön tuotantoon. Ympäristössä lahtien, jokisuistojen ja merenpohjan sedimentteihin päätyvät kemikaalit pysyvät todennäköisesti näissä anaerobisissa vyöhykkeissä määrittämättömän ajan, elleivät kyseiset kemikaalit ole biologisesti hajoavia. Joistakin kemikaaleista suhteellisen suuri määrä päätyy todennäköisesti anaerobisiin vyöhykkeisiin fysikaalisten ominaisuuksiensa vuoksi. Näitä ominaisuuksia ovat esimerkiksi alhainen vesiliukoisuus, voimakas adsorboituminen kiintoaineisiin sekä se, että olosuhteet eivät salli aerobista biohajoamista.
|
|
2.
|
Ympäristöön päästettävien kemikaalien pitäisi ihannetapauksissa olla biologisesti hajoavia sekä aerobisissa että anaerobisissa olosuhteissa, mutta ehdottoman tärkeää on, että kemikaalit eivät saa estää mikro-organismien toimintaa kummassakaan vyöhykkeessä. Yhdistyneessä kuningaskunnassa on havaittu tapauksia, joissa metaanin tuotanto on estynyt täydellisesti esimerkiksi teollisuuden päästöissä esiintyneen pentakloorifenolin vuoksi. Tämän seurauksena inhiboitunutta lietettä on jouduttu siirtämään kalliilla hinnalla mädätyslaitoksista turvallisille alueille ja tuomaan tilalle tervettä mädätyslietettä muista laitoksista. Samalla on kuitenkin ilmennyt monia vähemmän vakavia tapauksia, joissa mädätys on häiriintynyt muiden kemikaalien, esimerkiksi kuivapesussa käytettyjen alifaattisten halohiilivetyjen ja pesuaineiden vuoksi, mikä on aiheuttanut huomattavaa haittaa mädätyslaitoksen toiminnalle.
|
|
3.
|
Tiedossa on vain yksi testimenetelmä, jossa tutkimuksen kohteena on bakteerien toiminnan estyminen (C.11 Aktiivilietteen soluhengityksen inhibitiotesti (1)). Tällä testillä arvioidaan testikemikaalien vaikutusta hapenottoon substraatin läsnä ollessa. Menetelmä on laajassa käytössä, sillä se varoittaa jo varhaisessa vaiheessa kemikaalien mahdollisista haittavaikutuksista jäteveden aerobisessa käsittelyssä sekä osoittaa erilaisissa biologisen hajoavuuden testeissä testikemikaalien pitoisuudet, joilla ei ole inhibitiovaikutusta. Testimenetelmällä C.43 (2) voidaan joissakin tapauksissa määrittää testikemikaalin myrkyllisyys anaerobisen lietteen kaasunmuodostukselle, kun liete on laimennettu yhteen kymmenesosaan normaalista kiintoainepitoisuudestaan, jotta prosentuaalinen biohajoavuus voidaan arvioida riittävällä tarkkuudella. Laimennettu liete saattaa olla herkempää inhiboiville kemikaaleille, minkä vuoksi Kansainvälisen standardisoimisjärjestön ISOn työryhmä päätti kehittää menetelmän, jossa käytettäisiin laimentamatonta lietettä. Ainakin kolmen (Tanskassa, Saksassa ja Yhdistyneessä kuningaskunnassa tehdyn) testin tutkimisen jälkeen laadittiin kaksi ISO-standardia: standardissa ISO 13 641-1 (3) käytetään laimentamatonta lietettä ja standardissa ISO 13 641-2 (4) yhteen sadasosapitoisuuteen laimennettua lietettä, mikä edustaa bakteeripitoisuudeltaan alhaisia liejuja ja sedimenttejä. Molemmille menetelmille tehtiin yhteistutkimus (5), ja osa 1 hyväksyttiin standardiksi, mutta osasta 2 ei päästy yksimielisyyteen. Yhdistyneen kuningaskunnan näkemyksen mukaan menetelmä vaatii vielä lisätutkimuksia, sillä osanottajista merkittävä osuus ilmoitti kaasua muodostuneen vain vähän tai ei ollenkaan osittain siksi, että kaasutilan prosentuaalinen osuus (75 prosenttia) oli ihanteellisen herkkyyden kannalta liian suuri.
|
|
4.
|
Yhdistyneessä kuningaskunnassa aiemmin tehdyissä tutkimuksissa (6), (7) on käytetty manometrimenetelmää, jossa laimentamatonta mädätyslietettä sekä käsittelemätöntä jätevesilietettä laitettiin 500 ml:n pulloihin. Menetelmä oli kuitenkin kömpelö ja käsittelemättömän lietteen haju sietämättömän voimakas. Myöhemmin Wilson ym. (10) on käyttänyt hyvällä menestyksellä Sheltonin & Tiedjen (8) kehittämää ja Battersbyn & Wilsonin (9) muokkaamaa kooltaan pienempää ja helppokäyttöisempää laitteistoa. Kawahara ym. (11) on onnistunut valmistamaan laboratorio-olosuhteissa vakioidumpia lietteitä, joita voidaan käyttää anaerobisen biologisen hajoavuuden ja inhibitiovaikutuksen testauksessa useilla eri kemikaaleilla. Substraattina ei ole käytetty käsittelemätöntä lietettä, jolloin testiin kelpaavat myös yhteen sadasosapitoisuuteen laimennettu anaerobinen liete sekä esimerkiksi lieju ja sedimentit, joissa bakteeritoiminta on vähäistä.
|
|
5.
|
Menetelmällä saatavasta tiedosta voi olla hyötyä ennakoitaessa testikemikaalin todennäköisiä vaikutuksia kaasunmuodostukselle anaerobisissa mädätyslaitoksissa. Ainoastaan pitkäkestoinen, mädätyslaitoksen toimintaa tarkemmin simuloiva koe voi kuitenkin osoittaa, kykenevätkö mikro-organismit sopeutumaan testikemikaaliin vai voiko lietteeseen todennäköisesti absorboituvista ja adsorboituvista kemikaaleista muodostua myrkyllisiä pitoisuuksia, kun aikaa kuluu kauemmin kuin tämän testin puitteissa on mahdollista.
|
TESTIN PERIAATE
|
6.
|
Anaerobisen mädätyslietteen (kiintoainepitoisuus 20–40 g/l) ja hajoavan substraattiliuoksen seoksen alikvootteja inkuboidaan yksittäin ja samanaikaisesti testikemikaalin eri pitoisuuksissa suljetuissa astioissa enintään kolmen vuorokauden ajan. Tuotetun kaasun (metaani ja hiilidioksidi) määrä mitataan pulloissa vallitsevan paineen (Pa) kasvuna. Kaasunmuodostuksen prosentuaalinen inhibitio testikemikaalin eri pitoisuuksilla lasketaan testi- ja kontrollipulloissa tuotettujen määrien perusteella. EC50 ja muut vaikuttavat pitoisuudet lasketaan kuvaajista, jotka esittävät prosentuaalista inhibitiota testikemikaalien pitoisuuteen tai yleisemmin pitoisuuden logaritmiin nähden.
|
TESTIKEMIKAALIA KOSKEVIA TIETOJA
|
7.
|
Testikemikaaleja käytetään yleensä niiden puhtaimmassa helposti saatavilla olevassa muodossa, sillä eräiden kemikaalien, kuten kloorifenolien, epäpuhtaudet voivat olla paljon myrkyllisempiä kuin itse testikemikaali. On kuitenkin otettava huomioon, että kemikaaleja voi olla tarpeen testata siinä muodossa, jossa niitä valmistetaan tai jossa ne ovat kaupallisesti saatavilla. Valmisteiden käyttöä ei yleensä suositella, mutta jos kyseessä on huonosti liukeneva testikemikaali, valmisteen käyttö voi olla asianmukaista. Testikemikaalista on oltava tiedossa ainakin seuraavat ominaisuudet: liukoisuus veteen ja eräisiin orgaanisiin liuottimiin, höyrynpaine, adsorptiokerroin, hydrolyysi sekä anaerobinen biologinen hajoavuus.
|
MENETELMÄN SOVELTUVUUS
|
8.
|
Testiä voidaan käyttää vesiliukoisille tai veteen liukenemattomille kemikaaleille, myös haihtuville kemikaaleille. Heikosti veteen liukenevien (ks. kirjallisuusviite (12)), voimakkaasti haihtuvien materiaalien käsittelyssä on kuitenkin noudatettava erityistä varovaisuutta. Muista anaerobisista kohteista peräisin olevia siirrosteita, esimerkiksi liejua, kyllästettyä maa-ainesta tai sedimenttejä, voidaan myös käyttää. Anaerobisia bakteerijärjestelmiä, jotka ovat aiemmin altistuneet myrkyllisille kemikaaleille, voidaan sopeuttaa pysymään aktiivisina ksenobioottisten kemikaalien läheisyydessä. Sopeutetuista bakteerijärjestelmistä peräisin oleva siirroste saattaa sietää testikemikaaleja paremmin kuin sopeuttamattomista järjestelmistä peräisin oleva.
|
VERTAILUKEMIKAALIT
|
9.
|
Prosessin toimivuus tarkistetaan testaamalla vertailukemikaalia sopivissa astioissa samanaikaisesti tavanomaisen testin suorittamisen kanssa; 3,5-dikloorifenolin on osoitettu estävän johdonmukaisesti paitsi anaerobisen kaasunmuodostuksen, myös aktiivilietteen ja muiden kemiallisten reaktioiden hapenkulutuksen. Kahden muun kemikaalin eli metyleeni-bis-tiosyanaatin ja pentakloorifenolin on osoitettu estävän metaanintuotantoa 3,5-dikloorifenolia tehokkaammin, mutta näillä kemikaaleilla saatuja tuloksia ei ole validoitu. Pentakloorifenolia ei suositella, sillä sitä ei ole yleisesti saatavilla puhtaassa muodossa.
|
TULOSTEN VERRATTAVUUS
|
10.
|
Kansainvälisessä yhteistutkimuksessa (5) kymmenen osallistujalaboratorion 3,5-dikloorifenolilla ja 2-bromietaanisulfonihapolla saamat EC50-arvot olivat vain kohtuullisessa määrin verrattavissa keskenään. (Vaihteluväli 3,5-dikloorifenolilla oli 32–502 mg/l ja 2-bromietaanisulfonihapolla 220–2 190 mg/l.)
|
Laboratorioiden määrä
|
mg/l
|
mg/g lietettä
|
|
keskiarvo
|
keskihajonta
|
variaatiokerroin (%)
|
keskiarvo
|
keskihajonta
|
variaatiokerroin (%)
|
|
|
3,5-dikloorifenoli
|
|
10
|
153
|
158
|
103
|
5
|
4,6
|
92
|
|
|
2-bromietaanisulfonihappo
|
|
10
|
1 058
|
896
|
85
|
34
|
26
|
76
|
|
Yhteistutkimuksesta saadut EC50-tiedot – laimentamaton liete
|
11.
|
Laboratorioiden väliset suuret variaatiokertoimet kuvastavat suurelta osin eroja lietteen mikro-organismien herkkyydessä, mikä johtuu joko aiemmasta altistuksesta testikemikaalille tai muulle kemiallisesti läheistä sukua olevalle kemikaalille taikka altistuksen puuttumisesta. Tarkkuus, jolla lietteen pitoisuuteen perustuva EC50-arvo määriteltiin, oli vain lievästi parempi kuin volumetrinen arvo (mg/l). Niiden kolmen laboratorion, jotka ilmoittivat EC50-arvonsa tarkkuuden 3,5-dikloorifenolille, variaatiokerroin oli huomattavasti pienempi (järjestyksessä 22, 9 ja 18 prosenttia, kun EC50-arvo ilmoitetaan milligrammoina grammaa kohti) kuin kaikkien kymmenen laboratorion keskiarvojen. Kyseisten kolmen laboratorion omat keskiarvot olivat 3,1, 3,2 ja 2,8 mg/g. Hyväksyttävän matalat laboratorioiden sisäiset variaatiokertoimet (9–22 prosenttia) verrattuna laboratorioiden välisten arvojen huomattavasti suurempiin kertoimiin (92 prosenttia) viittaavat siihen, että yksittäisten lietteiden ominaisuudet poikkeavat merkittävästi toisistaan.
|
MENETELMÄN KUVAUS
Välineet
|
12.
|
Testissä tarvitaan tavallinen laboratoriolaitteisto ja seuraavat välineet:
|
a)
|
inkubaattori – kipinänkestävä, lämpötilaksi säädetty 35 °C ± 2 °C;
|
|
b)
|
paineenkestäviä lasisia testiastioita, joiden nimelliskoko on sopiva (17) ja joista jokaisessa on kaasutiivis, pinnoitettu tulppa, joka kestää noin kahden baarin tai 2 × 105 Pa:n paineen (pinnoitteena käytetään esimerkiksi PTFE:tä eli polytetrafluorieteeniä). Suositeltavia ovat lasiset seerumipullot, joiden nimellistilavuus on 125 ml ja kokonaistilavuus noin 160 ml ja jotka voidaan sulkea seerumitulpalla (18) ja reunatuilla alumiinirenkailla, mutta tarkoitukseen kelpaavat pullot, joiden kokonaistilavuus on 0,1–1 litraa;
|
|
c)
|
tarkkuuspainemittari
(19)
ja siihen liitetty neula
Muodostuneen kaasun kokonaismäärä (metaani ja hiilidioksidi) mitataan painemittarilla, jolla voi sekä mitata että ilmata tuotettua kaasua. Sopiva instrumentti on esimerkiksi kädessä pidettävä tarkkuuspainemittari, johon on liitetty sopiva injektioneula, ja kaasutiiviin kolmitieventtiilin avulla voidaan poistaa liiallista painetta (lisäys 1). Paineanturin putken ja venttiilin sisäisen tilavuuden on oltava mahdollisimman pieni, jotta virheet, jotka aiheutuvat laitteiston tilavuuden huomiotta jättämisestä, ovat merkityksettömiä.
|
|
d)
|
eristettyjä säiliöitä mädätyslietteen kuljettamiseen;
|
|
e)
|
kolmitiepaineventtiilejä;
|
|
f)
|
siivilä, jonka silmäkoko on 1 mm;
|
|
g)
|
säiliö mädätyslietteelle: lasista tai suuritiheyspolyetyleenistä valmistettu pullo, jonka tilavuus on noin viisi litraa ja johon kuuluu sekoitin sekä kaasutila, jonka läpi typpikaasu (ks. 13 kohta) pääsee virtaamaan;
|
|
h)
|
kalvosuodattimia (0,2 μm) substraatin sterilointia varten;
|
|
i)
|
mikroruiskuja, joilla toteutetaan paineanturin (ks. 12(c) kohta) ja pullojen kaasutilan (ks. 12(b) kohta) välinen kaasutiivis liitos ja joilla myös lisätään liukenemattomat nestemäiset testimateriaalit pulloihin;
|
|
j)
|
hansikaskaappi, jossa on lievästi paineistettua typpikaasua; kaappi ei ole välttämätön, mutta sen käyttöä suositellaan.
|
|
Reagenssit
|
13.
|
Käytä pelkästään analyysilaatuisia reagensseja. Koko testin ajan on käytettävä erittäin puhdasta typpikaasua, joka sisältää happea alle 5 μl/l.
|
Vesi
|
14.
|
Jos aineita on laimennettava, käytetään deionisoitua vettä, josta ilma on poistettu aiemmin. Veden analysoiminen ei ole tarpeen, mutta deionisointilaitteen säännöllisestä kunnossapidosta on huolehdittava. Deionisoitua vettä käytetään myös kantaliuosten valmistamisessa. Ennen kuin anaerobista siirrostetta lisätään mihinkään testimateriaaliliuokseen tai -laimennokseen, on tarkistettava, ettei missään ole happea. Hapettomuus tarkistetaan joko puhaltamalla typpikaasua laimennusveden (tai laimennosten) läpi yhden tunnin ajan ennen siirrosteen lisäämistä tai kuumentamalla laimennukseen käytettävä vesi kiehumispisteeseen ja jäähdyttämällä se huoneenlämpöiseksi hapettomassa ympäristössä.
|
Mädätysliete
|
15.
|
Aktiivinen mädätysliete kerätään jäteveden käsittelylaitoksessa olevasta mädätyslaitoksesta tai laboratoriossa olevasta mädätyslaitoksesta, jossa käsitellään pääasiassa kotitalousjätevedestä peräisin olevaa lietettä. Käytännön tietoa laboratoriossa olevasta mädätyslaitoksesta saatavasta lietteestä on muissa lähteissä (11). Jos testissä on määrä käyttää muokattua siirrosainetta, voidaan harkita myös teollisuusjätevedenkäsittelylaitoksesta peräisin olevaa mädätyslietettä. Lietteen keräämiseen käytetään leveäkaulaisia pulloja, jotka on valmistettu suurtiheyspolyeteenistä (HDPE:stä) tai vastaavasta, laajenevasta materiaalista. Pullot täytetään lietteellä noin 1 cm:n päähän pullonsuusta ja suljetaan tiiviisti mieluiten varoventtiilillä (12(e) kohta). Tämän jälkeen pullot sijoitetaan lämpösokin vähentämiseksi eristettyihin säiliöihin (12(d) kohta), kunnes pullot siirretään inkubaattoriin, jonka lämpötilana pidetään 35 °C ± 2 °C. Pulloja avatessa on muistettava vapauttaa ylimääräinen kaasunpaine joko löysäämällä suljinta varovasti tai käyttämällä kolmitiepaineventtiiliä (12(e) kohta). Liete on suositeltavaa käyttää muutaman tunnin sisällä keräämisestä. Muussa tapauksessa sitä voi säilyttää 35 °C ± 2 °C:ssa typpikaasussa enintään kolmen vuorokauden ajan, sillä tässä ajassa aktiivisuus normaalisti pysyy lähes samalla tasolla.
Varoitus – Mädätysliete sisältää syttyviä kaasuja, joista aiheutuu tulipalo- ja räjähdysvaara. Niissä voi olla myös patogeenisia organismeja, joten lietettä käsitellessä on noudatettava asianmukaisia varotoimia. Älä kerää lietettä lasiastioihin turvallisuussyistä.
|
Siirrosaine
|
16.
|
Liete sekoitetaan varovasti välittömästi ennen käyttöä ja kaadetaan siivilän (silmäkoko 1 mm2) läpi (12(f) kohta) sopivaan pulloon (12(g) kohta), jonka kaasutilan läpi johdetaan typpikaasua. Lietteestä otetaan erilleen näyte, josta kiintoaineen kokonaispitoisuus voidaan mitata (ks. esimerkiksi standardi ISO 11 923 (13) tai vastaava EU-standardi). Yleensä lietettä käytetään laimentamattomana. Kiintoainepitoisuus on yleensä 2–4 prosenttia (massaprosenttina tilavuutta kohti). Lietteen pH-arvo tarkistetaan ja se säädetään tarvittaessa arvoon 7 ±0,5.
|
Testissä käytettävä substraatti
|
17.
|
Deionisoituun veteen liuotetaan 10 g ravinneliuosta (esimerkiksi Oxoid), 10 g hiivauutetta ja 10 g D-glukoosia ja vettä lisätään niin paljon, että liuoksen tilavuudeksi saadaan 100 ml. Liuos steriloidaan suodattamalla se 0,2 μm kalvosuodattimen läpi (12(h) kohta) ja käytetään välittömästi tai säilytetään 4 °C:ssa enintään yhden vuorokauden ajan.
|
Testikemikaali
|
18.
|
Erillinen kantaliuos valmistetaan jokaista vesiliukoista testikemikaalia varten liuottamalla kemikaalia esimerkiksi 10 g litraan hapetonta laimennusvettä (14 kohta). Kantaliuoksia käytetään riittävä määrä porrastettuja pitoisuuksia sisältävien reaktioseosten valmistamiseen. Vaihtoehtoisesti jokaisesta kantaliuoksesta voidaan valmistaa laimennussarja, jolloin testipulloihin lisätään sama määrä jokaista tarvittavaa loppupitoisuutta kohti. Kantaliuosten pH:ksi säädetään tarvittaessa 7 ±0,2.
|
|
19.
|
Katso ISO 634 -standardista (12) tai vastaavasta EU-standardista veteen huonosti liukenevia testikemikaaleja koskevia lisäohjeita. Jos on tarpeen käyttää orgaanista liuotinta, vältä esimerkiksi kloroformia ja hiilitetrakloridia, joiden tiedetään estävän voimakkaasti metaanin tuotantoa. Pitoisuudeltaan sopiva liuos valmisteaan veteen liukenemattomasta kemikaalista ja sopivasta haihtuvasta liuottimesta, esimerkiksi asetonista tai dietyylieetteristä. Tarvittava määrä liuotinta sisältävää liuosta lisätään tyhjiin testipulloihin (12(b) kohta) ja liuotin haihdutetaan ennen lietteeseen lisäämistä. Muiden käsittelyiden osalta hyödynnetään standardia ISO 10 634 (12) tai vastaavaa EU-standardia, mutta muista, että emulsioiden tuottamiseen tarkoitetut pinta-aktiiviset aineet voivat estää anaerobista kaasunmuodostusta. Jos orgaanisten liuottimien ja emulgointiaineiden epäillään aiheuttavan artefakteja, testikemikaalia voidaan lisätä suoraan testiseokseen jauheena tai nesteenä. Haihtuvat kemikaalit ja veteen liukenemattomat testikemikaalit voidaan injektoida siirrosteella täytettyihin seerumipulloihin mikroruiskulla (12(i) kohta).
|
|
20.
|
Testikemikaaleja lisätään pulloihin siten, että pitoisuudet muodostavat geometrisen sarjan, esimerkiksi 500 mg/l, 250 mg/l, 125 mg/l, 62,5 mg/l, 31,2 mg/l ja 15,6 mg/l. Jos myrkyllisyyden voimakkuus ei ole tiedossa samankaltaisten kemikaalien perusteella, ensin tehdään pitoisuusalueen määritystesti pitoisuuksilla 1 000 mg/l, 100 mg/l ja 10 mg/l, jotta sopiva pitoisuusalue löytyy.
|
Vertailukemikaali
|
21.
|
Vesiliuos valmistetaan 3,5-dikloorifenolista (10 g/l) lisäämällä vähitellen vähimmäismäärä 5 mol/l natriumhydroksidiliuosta kiintoaineen joukkoon ja ravistamalla, kunnes se on liuennut. Tämän jälkeen lisätään laimennusvettä, josta happi on poistettu (14 kohta), kunnes liuosta on haluttu määrä. Ultraäänihajotus edistää liukenemista. Muita vertailukemikaaleja voidaan käyttää, kun EC50-arvon keskimääräinen vaihteluväli on muodostettu ainakin kolmen eri siirrosteilla tehdyn testin perusteella (siirrosteet kerätty eri lähteistä tai eri aikoina).
|
INTERFERENSSI/VIRHEET
|
22.
|
Lietteen jotkut ainesosat voivat mahdollisesti reagoida mahdollisten inhibiittoreiden kanssa, jolloin mikro-organismit eivät joudu niiden kanssa kosketuksiin ja tuloksena on heikko tai olematon inhibitiovaikutus. Jos lietteessä on toisaalta jo valmiiksi inhiboivaa kemikaalia, kyseistä kemikaalia testatessa tulokset ovat virheellisiä. Näiden mahdollisuuksien lisäksi joukko muitakin havaittuja tekijöitä voi vääristää tuloksia. Nämä tekijät on lueteltu lisäyksessä 3, jossa kerrotaan myös, miten vääristymät voidaan poistaa tai niitä voidaan vähentää.
|
TESTIMENETTELY
|
23.
|
Rinnakkaisnäytteiden määrä valitaan sen mukaan, kuinka tarkasti inhibitioindeksit on saatava määritettyä. Jos pullojen sulkimet ovat riittävän kaasutiiviitä koko testin ajan, tarvitaan vain yksi erä (jossa on vähintään kolme rinnakkaisnäytettä) testipulloja jokaista vaadittavaa pitoisuutta kohti. Lisäksi varataan yksi pulloerä, jossa on vertailukemikaalia, sekä yhdet kontrollit. Jos pullojen sulkimet sen sijaan säilyvät tiiviinä vain 1–2 läpäisykertaa, varataan yksi erä (esimerkiksi kolme rinnakkaisnäytettä) testipulloja jokaista väliaikaa (t) kohti, jonka ajalta tulokset tarvitaan, jotta kaikki testikemikaalin pitoisuudet saadaan testattua. Samalla varataan t määrä pulloeriä vertailukemikaalia ja kontrolleja varten.
|
|
24.
|
Suositeltavaa on käyttää hansikaskaappia (12(j) kohta). Viimeistään 30 minuuttia ennen testin alkua käynnistetään typpivirtaus kaikki tarvittavat välineet sisältävän hansikaskaapin läpi. Samalla varmistetaan, että lietteen lämpötila pysyy 35 °C ± 2 °C:ssa pullojen käsittelyn ja sulkemisen ajan.
|
Alustava testi
|
25.
|
Jos lietteen toimintaa ei tunneta, on suositeltavaa tehdä alustava testi. Testiä varten varataan kontrolleja, joissa on kiintoainetta esimerkiksi pitoisuutena 10 g/l, 20 g/l ja 40 g/l sekä substraattia, mutta ei testikemikaalia. Testissä käytetään myös erisuuruisia määriä reaktioseosta, jotta kaasutilan ja nesteen tilavuus muodostaa 3–4 eri suhdelukua. Eri aikaväleillä muodostuneen kaasun määrästä päätellään sopivimmat olosuhteet, joissa voidaan tehdä päivittäin kaksi mittausta ja saada merkittävä määrä kaasua sekä vapauttaa painetta päivittäin siten, että herkkyys pysyy ihanteellisena (20), mutta räjähdysvaaraa ei ole.
|
Testikemikaalien lisääminen
|
26.
|
Vesiliukoiset testikemikaalit lisätään tyhjiin testipulloihin (12(b) kohta) vesiliuoksena (18 kohta). Jokaisella pitoisuusalueella käytetään vähintään kolmen pullon erää (20 kohta). Jos testikemikaali on liukenematonta tai huonosti liukenevaa, kemikaalista tehtyä liuosta injektoidaan tyhjissä pulloissa oleviin orgaanisiin liuottimiin mikroruiskulla siten, että testikemikaalin jokaisesta viidestä pitoisuudesta saadaan rinnakkaisnäytteet. Liuotin haihdutetaan puhaltamalla typpikaasua testipulloissa olevien liuosten pinnan yli. Liukenemattomat kiinteät kemikaalit voidaan myös punnita suoraan testipulloihin.
|
|
27.
|
Jos liukenemattomien ja huonosti veteen liukenevien testikemikaalien lisäämisessä ei käytetä liuotinta, ne lisätään mikroruiskulla suoraan testipulloihin siirrosteen ja testisubstraatin lisäämisen jälkeen (ks. 30 kohta). Haihtuvat testikemikaalit voidaan lisätä samalla tavalla.
|
Siirrosteen ja substraatin lisääminen
|
28.
|
Sopivaa määrää siivilöityä mädätyslietettä (ks. 16 kohta) sekoitetaan viiden litran pullossa (12(g) kohta) samalla, kun kaasutilan läpi johdetaan typpikaasuvirta. Vesiliuosta tai testikemikaalien haihdutettua liuotinta sisältävää liuosta sisältäviä testipulloja huuhdellaan typpikaasuvirralla noin kahden minuutin ajan, jotta ilma poistuu. Tämän jälkeen hyvin sekoitetun lietteen alikvootteja, joiden tilavuus on esimerkiksi 100 ml, annostellaan testipulloihin suurikärkisellä pipetillä tai mittalasilla. Pipettiin on ehdottomasti otettava kerralla täsmälleen tarvittava lietemäärä, sillä lietteen kiintoaineet laskeutuvat helposti. Jos pipettiin tulee liikaa lietettä, tyhjennä se ja aloita alusta.
|
|
29.
|
Tämän jälkeen lisätään typpikaasuvirtaa katkaisematta substraattiliuosta (17 kohta), kunnes ravinneliuoksen, hiivauutteen ja D-glukoosin pitoisuus seoksessa on 2 g/l. Seuraavassa on esimerkki testieristä.
|
Testikemikaalin lopullinen massapitoisuus testipulloissa
(mg/l)
|
Testikemikaalin tilavuus
(ml)
|
Reagenssit ja väliaine
(ml)
|
|
Kantaliuos a)10 g/l18 kohta
|
Kantaliuos b)1 g/l18 kohta
|
Laimennusvesi
14 kohta
|
Siirrosaine
16 kohta
|
Substraatti
17 kohta
|
|
0
|
—
|
0
|
1,0
|
100
|
2
|
|
1
|
—
|
0,1
|
0,9
|
100
|
2
|
|
3,3
|
—
|
0,33
|
0,67
|
100
|
2
|
|
10
|
0,1
|
—
|
0,9
|
100
|
2
|
|
33
|
0,33
|
—
|
0,67
|
100
|
2
|
|
100
|
1,0
|
—
|
0
|
100
|
2
|
|
Pullon kokonaistilavuus = 160 ml. Nesteen tilavuus = 103 ml.
Kaasutilavuus = 57 ml eli 35,6 % kokonaistilavuudesta.
|
|
|
30.
|
Riittävä määrä tyhjiä testipulloja huuhdellaan samalla tavalla typpikaasulla, jotta haihtuvat ja liukenemattomat nestemäiset testikemikaalit poistuvat (ks. 27 kohta).
|
Kontrollit ja vertailukemikaali
|
31.
|
Kontrolleiksi varataan pelkästään lietettä ja substraattia sisältäviä pulloja vähintään kolmena kappaleena. Lisäksi varataan rinnakkaisnäytepulloja, joissa on lietettä ja substraattia sekä riittävästi vertailukemikaalin eli 3,5-dikloorifenolin kantaliuosta (21 kohta), jotta lopulliseksi pitoisuudeksi saadaan 150 mg/l. Tällä pitoisuudella kaasun muodostumisen pitäisi estyä noin 50 prosentilla. Vaihtoehtoisesti voidaan käyttää vertailukemikaalia eri pitoisuuksina. Lisäksi pH-arvon mittaamista varten varataan neljä ylimääräistä pulloa, jotka sisältävät lietettä, vettä, josta happi on poistettu, ja substraattia. Testikemikaalia lisätään kahteen pulloon suurimpana testattavana pitoisuutena ja kahteen muuhun pulloon lisätään vettä, josta happi on poistettu.
|
|
32.
|
Varmista, että kaikissa pulloissa – testi- ja vertailukemikaalia sisältävissä sekä kontrolleissa – on sama määrä nestettä (VR). Tarvittaessa pulloihin voidaan lisätä deionisoitua vettä, josta happi on poistettu (14 kohta), kunnes haluttu tilavuus on saavutettu. Kaasutilan on oltava 10–40 prosenttia pullon tilavuudesta; arvo valitaan alustavan testin perusteella saatuja tietoja käyttämällä. Kun kaikki ainesosat on lisätty pulloihin, poista kaasuneula ja sulje jokainen pullo kumitulpalla ja alumiinikorkilla (12(b) kohta). Tulpan saa helpommin paikalleen, kun se kostutetaan pisaralla deionisoitua vettä. Sekoita jokaisen pullon sisältö ravistamalla.
|
Pullojen inkubaatio
|
33.
|
Siirrä pullot mieluiten ravistimella varustettuun inkubaattoriin, jonka lämpötilan voi säätää 35 °C ± 2 °C:een. Pulloja inkuboidaan pimeässä. Noin yhden tunnin kuluttua tasaa pullojen ja ilmakehän välinen paine työntämällä sisään painemittariin kiinnitetty ruiskuneula (12(c) kohta) vuorollaan jokaisen pullon sulkimen läpi, avaa venttiili, kunnes painemittari näyttää nollaa, ja lopuksi sulje venttiili. Neula työnnetään sisään noin 45 asteen kulmassa, jotta kaasu ei pääse vuotamaan pulloista. Jos pulloja inkuboidaan laitteessa, johon ei kuulu ravistinta, ravistele pulloja käsin kahdesti päivässä koko inkubaatioajan, jotta järjestelmä tasaantuu. Pulloja inkuboidaan ja ne käännetään ylösalaisin, jotta kaasua ei pääse tulpan läpi. Pullojen ylösalaisin kääntäminen ei kuitenkaan sovi silloin, kun liukenemattomat testikemikaalit saattavat tarttua pullon pohjaan.
|
Paineen mittaaminen
|
34.
|
Kun pullojen lämpötila on 35 °C ± 2 °C, ota tarkoitukseen varatuista neljästä pullosta otetaan kaksi, niiden sisällön pH-arvo mitataan ja kirjataan muistiin ja sisältö hävitetään, minkä jälkeen pullojen inkubointia pimeässä jatketaan. Pulloissa oleva paine mitataan ja kirjataan muistiin kahdesti päivässä seuraavan 48–72 tunnin ajan työntämällä painemittarin neula vuorollaan jokaisen pullon sulkimen läpi ja kuivaamalla neula mittausten välillä. Kaikki pullon osat pidetään inkubointilämpötilassa mittauksen ajan, ja mittaus tehdään mahdollisimman nopeasti. Anna painelukeman tasaantua ennen muistiin kirjaamista. Avaa tämän jälkeen venttiili kaasun poistamista varten ja sulje se, kun paine näyttää nollaa. Testiä jatketaan yleensä 48 tunnin ajan ensimmäisestä paineentasauskerrasta eli nollahetkestä lukien. Haihtuvia kemikaaleja käytettäessä lukemat tarkistetaan ja kaasua poistetaan vain kerran (inkuboinnin lopuksi) tai kahdesti, jotta testikemikaalia joutuu hukkaan mahdollisimman vähän (10).
|
|
35.
|
Jos painelukema on negatiivinen, älä avaa venttiiliä. Toisinaan ruiskun neulaan ja letkuun kertyy kosteutta ja painelukema näyttää heikkoa alipainetta. Tässä tapauksessa irrota neula, ravista putkea, kuivaa se paperilla ja laita paikalleen uusi neula.
|
pH:n mittaaminen
|
36.
|
Mittaa ja kirjaa muistiin jokaisen pullon sisällön pH-arvo viimeisen painemittauksen jälkeen.
|
TIEDOT JA RAPORTOINTI
Tulosten ilmoittaminen
|
37.
|
Laske jokaisesta rinnakkaisnäytepullojen sarjasta kaikilta aikaväleiltä muistiin kirjattujen paineiden summa ja keskiarvo sekä laske keskimääräinen kumulatiivinen bruttokaasunpaine kaikilla aikaväleillä jokaisen rinnakkaisnäytesarjan osalta. Piirrä käyrät, jotka esittävät keskimääräistä kumulatiivista kaasunmuodostusta (Pa) ajan funktiona kontrolli-, testi- ja vertailukemikaalipulloissa. Valitse jokin ajankohta käyrän lineaariselta osalta, tavallisesti 48 tuntia, ja laske prosentuaalinen inhibitio (I) kunkin pitoisuuden osalta käyttämällä yhtälöä [1]:
|
I = (1 – Pt/PC) × 100
|
[1],
|
jossa
|
I
|
=
|
prosentuaalinen inhibitio (prosentteina);
|
|
Pt
|
=
|
testimateriaaleilla aikaan saatu kaasunpaine valittuna ajankohtana (pascaleina (Pa));
|
|
Pc
|
=
|
kontrollissa muodostunut kaasunpaine samana ajankohtana (pascaleina (Pa)).
|
Molemmat käyrät (käyrä I) on suositeltavaa piirtää paitsi pitoisuuden, myös pitoisuuden logaritmin funktiona, jotta näistä voidaan valita tarkemmin lineaarinen käyrä. EC50-arvo (mg/l) arvioidaan silmämääräisesti tai regressioanalyysilla siitä käyrästä, joka on tarkemmin lineaarinen. Vertailua varten voi olla käytännöllisempää ilmaista kemikaalin pitoisuus milligrammana kemikaalia yhtä kokonaiskiintoainegrammaa kohti. Tämä pitoisuus saadaan jakamalla tilavuuspitoisuus (mg/l) lietteen kuiva-aineen tilavuuspitoisuudella (g/l) (16 kohta).
|
|
38.
|
Laske joko käytetyn vertailukemikaalin yhdellä pitoisuudella aikaansaatu prosentuaalinen inhibitio tai EC50-arvo, jos pitoisuuksia on ollut tutkittavana riittävän monta.
|
|
39.
|
Muunna kontrollissa muodostuneen kaasun keskipaine Pc (Pa) tilavuudeksi painemittarin kalibrointikäyrän avulla (lisäys 2). Laske tämän perusteella kaasunmuodostus ilmaistuna tilavuutena, joka muodostui 48 tunnin aikana 100 ml:sta laimentamatonta lietettä, jonka kiintoainepitoisuus on 2–4 prosenttia (20–40 g/l).
|
Hyväksyttävyyskriteerit
|
40.
|
Kansainvälisen standardoimisjärjestön laboratorioiden välisen kokeen (5) tulokset osoittavat, että vertailukemikaali aiheutti kaasunmuodostuksessa 50 prosentin inhibition pitoisuuksilla 32–510 mg/l, keskiarvo 153 mg/l (10 kohta). Pitoisuusalue on niin laaja, että sen perusteella ei voi määrittää luotettavasti tarkkoja inhibitiorajoja; tämä tulee mahdolliseksi vasta sitten, kun on opittu tuottamaan yhdenmukaisempia siirrosteita. Kontrollipulloissa 48 tunnin aikana muodostuneen kaasun määrä yhtä lietteen kuiva-ainegrammaa kohti oli 21–149 ml (keskiarvo 72 ml). Muodostuneen kaasun määrän sekä vastaavan EC50-arvon välillä ei todettu selkeää suhdetta. Lopullinen pH-arvo oli välillä 6,1–7,5.
|
|
41.
|
Testi katsotaan hyväksyttäväksi, jos inhibitio 3,5-dikloorifenolia pitoisuutena 150 mg/l sisältävässä vertailukontrollissa on vähintään 20 prosenttia, nollanäytteessä muodostuu vähintään 50 ml kaasua yhtä kuiva-ainegrammaa kohti ja pH-arvo testin lopussa on välillä 6,2–7,5.
|
Testiraportti
|
42.
|
Testiraportissa on esitettävä seuraavat tiedot:
|
|
Testikemikaali
|
—
|
yleisnimi, kemiallinen nimi, CAS-numero, rakennekaava ja merkitykselliset fysikaalis-kemialliset ominaisuudet
|
|
—
|
testikemikaalin puhtaus (epäpuhtaudet),
|
|
|
|
Testiolosuhteet
|
—
|
nestemäisen sisällön ja kaasutilan määrä testiastioissa
|
|
—
|
kuvaus testiastioista sekä kaasunmittauksesta (esimerkiksi painemittarin tyyppi)
|
|
—
|
testikemikaalin ja vertailukemikaalin applikointi testijärjestelmään: käytetyt testipitoisuudet ja mahdollinen liuottimien käyttö
|
|
—
|
siirrosteen tiedot: esimerkiksi jätevesien käsittelylaitoksen nimi, kuvaus käsiteltävän jäteveden lähteestä (esimerkiksi toimintalämpötila, lietteen pidätysaika sekä tieto siitä, onko käsiteltävä jätevesi peräisin pääasiassa kotitalouksista vai teollisuudesta), kiintoainepitoisuus, kaasunmuodostus anaerobisessa mädätyslaitoksessa, aiempi altistuminen myrkyllisille kemikaaleille tai mahdollinen ennalta sopeutuminen niille taikka liejun, sedimentin tai vastaavan keruupaikka
|
|
—
|
inkubaatiolämpötila ja lämpötilan vaihteluväli
|
|
—
|
rinnakkaisnäytteiden määrä.
|
|
|
|
Tulokset
|
—
|
pH-arvot testin lopussa
|
|
—
|
kaikki testiastioista, nollanäytteistä ja vertailukemikaalin kontrolliastioista kerätyt mittaustiedot tarpeen mukaan (esimerkiksi paine pascaleina tai millibaareina) taulukkomuodossa esitettynä
|
|
—
|
prosentuaalinen inhibitio testi- ja vertailupulloissa sekä inhibitiota pitoisuuden funktiona esittävät käyrät
|
|
—
|
laskelma EC50-arvoista ilmaistuna yksikköinä mg/l ja mg/g
|
|
—
|
kaasunmuodostus yhtä lietegrammaa kohti 48 tunnin aikana
|
|
—
|
syyt mahdolliseen testitulosten hylkäämiseen
|
|
—
|
tulosten pohdinta, mukaan lukien mahdolliset poikkeukset tässä testimenetelmässä kuvatuista menettelyistä, sekä pohdintaa mahdollisen interferenssin ja virheiden vuoksi ilmenneistä poikkeamista odotettavissa olleista testituloksista
|
|
—
|
maininta siitä, oliko testin tarkoituksena mitata myrkyllisyyttä ennalta altistuneille vai ennalta altistumattomille mikro-organismeille.
|
|
|
LÄHDEKIRJALLISUUS
|
(1)
|
Tämän liitteen luku C.11. Aktiivilietteen soluhengityksen inhibitiotesti.
|
|
(2)
|
Tämän liitteen luku C.43. Orgaanisten aineiden anaerobinen biohajoavuus mädätyslietteessä: Mittauskohteena kaasuntuotanto.
|
|
(3)
|
International Organisation for Standardization (ISO) (2003) ISO 13 641-1 Water Quality – Determination of inhibition of gas production of anaerobic bacteria – Part 1: General Test.
|
|
(4)
|
International Organisation for Standardization (ISO) (2003) ISO 13 641-2 Water Quality – Determination of inhibition of gas production of anaerobic bacteria – Part 2: Test for low biomass concentrations.
|
|
(5)
|
International Organisation for Standardization (ISO) (2000) Ring test of ISO 13 641-1 and ISO 13 641-2. Determination of inhibition of activity of anaerobic bacteria. BL 6958/A. Evans MR, Painter HA. Brixham Environmental Laboratory, AstraZeneca UK Ltd., Brixham, TQ5 8BA UK.
|
|
(6)
|
Swanwick JD, Foulkes M (1971). Inhibition of anaerobic digestion of sewage sludge by chlorinated hydrocarbons. Wat. Pollut. Control, 70, 58–70.
|
|
(7)
|
HMSO (1986) Determination of the inhibitory effects of chemicals and waste waters on the anaerobic digestion of sewage sludge. ISBN 0 117519 43 X, teoksessa: Methods for the Examination of Waters and Associated Materials UK.
|
|
(8)
|
Shelton DR, Tiedje JM (1984). General method for determining anaerobic biodegradation potential. Appl. Env. Microbiol. 47 850–857.
|
|
(9)
|
Battersby NS and Wilson V (1988). Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic compounds under methanogenic conditions. Chemosphere 17, 2441–2460.
|
|
(10)
|
Wilson V, Painter HA and Battersby NS (1992). A screening method for assessing the inhibition of the anaerobic gas production from sewage sludge. Proc. Int. Symp. on Ecotoxicology. Ecotoxicological Relevance of Test Methods, GSF Forschungzentrum, Neuherberg, Germany (1990). Eds. Steinberg C and Kettrup A, s. 117–132 (1992).
|
|
(11)
|
Kawahara K, Yakabe Y, Chida T, and Kida K (1999). Evaluation of laboratory-made sludge for an anaerobic biodegradability test and its use for assessment of 13 chemicals. Chemosphere, 39 (12), 2007–2018.
|
|
(12)
|
International Organisation for Standardization (ISO) (1995) ISO 10 634 Water Quality – Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
|
|
(13)
|
International Organisation for Standardization (ISO) (1997) ISO 11 923 Water Quality – Determination of suspended solids by filtration through glass-fibre filters.
|
Lisäys 1
Esimerkki laitteistosta, jolla mitataan biokaasun tuotantoa kaasunpaineen perusteella

Selitykset:
|
1
|
–
|
painemittari
|
|
2
|
–
|
kaasutiivis kolmitieventtiili
|
|
3
|
–
|
injektioneula
|
|
4
|
–
|
kaasutiivis tulppa (kiristysholkki ja tulppa)
|
|
5
|
–
|
kaasutila
|
|
6
|
–
|
siirrosaine (mädätysliete)
|
Testiastioiden käyttölämpötila on 35 °C ± 2 °C.
Lisäys 2
Painemittarin lukemien muuntaminen
Painemittarin lukemat voidaan liittää kaasutilavuuksiin vakiokäyrällä, josta voidaan laskea 48 tunnin aikana muodostuneen kaasun tilavuus per yksi gramma kuivaa lietettä. Tämä toimivuusindeksi on eräs niistä kriteereistä, joiden perusteella testitulosten hyväksyttävyyttä arvioidaan. Kalibrointikäyrä saadaan injektoimalla tietty tilavuus ilmaa lämpötilassa 35 °C ± 2 °C seerumipulloihin, jotka sisältävät reaktioseoksen tilavuutta VR vastaavan tilavuuden vettä:
|
—
|
Laita viiteen seerumipulloon VR ml alikvootteja vedestä, jota on pidetty lämpötilassa 35 °C ± 2 °C. Sulje pullot ja laita ne vesihauteeseen (35 °C ± 2 °C) tasapainottumaan tunnin ajaksi.
|
|
—
|
Kytke painemittari päälle, anna sen tasapainottua ja säädä se nollaan.
|
|
—
|
Paina injektioneula yhden pullon tulpan läpi, avaa venttiiliä, kunnes painemittarin lukema on nolla, ja sulje venttiili.
|
|
—
|
Toista toimenpide muille pulloille.
|
|
—
|
Injektoi jokaiseen pulloon 1 ml ilmaa lämpötilassa 35 °C ± 2 °C. Paina (painemittarin) neula yhden pullon tulpan läpi ja anna painelukeman asettua. Merkitse painelukema muistiin. Avaa venttiiliä, kunnes painelukema on nolla, ja sulje venttiili.
|
|
—
|
Toista toimenpide muille pulloille.
|
|
—
|
Toista koko toimenpide käyttämällä 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml ja 50 ml ilmaa.
|
|
—
|
Piirrä paineen (Pa) muuntokäyrä injektoidun kaasutilavuuden (ml) funktiona. Instrumentin vaste on lineaarinen välillä 0–70 000 Pa ja kaasuntuotannon osalta välillä 0–50 ml.
|
Lisäys 3
Havaittuja tekijöitä, jotka voivat johtaa tulosten vääristymiseen
a) Pullonkorkkien laatu
Seerumipulloille on kaupallisesti saatavilla monenlaisia tulppia, mutta jotkut tulpat, esimerkiksi butyylikumista valmistetut, menettävät tiiviytensä, kun ne on lävistetty neulalla tämän testin olosuhteissa. Joskus paine lähtee laskemaan hyvin hitaasti sen jälkeen, kun tulppa on puhkaistu ruiskuneulalla. Vuotojen välttämiseksi on suositeltavaa käyttää kaasutiiviitä tulppia (12(b) kohta).
b) Ruiskuneulassa oleva kosteus
Toisinaan ruiskun neulaan ja letkuun kertyy kosteutta ja painelukema näyttää heikkoa alipainetta. Korjaa tilanne irrottamalla neula, ravistamalla putkea, kuivaamalla putki paperilla ja laittamalla paikalleen uusi neula (12(c) ja 35 kohdat).
c) Happikontaminaatio
Anaerobiset menetelmät ovat alttiita kaasunmuodostusta mahdollisesti vähentävästä happikontaminaatiosta johtuville virheille. Tässä menetelmässä happikontaminaation mahdollisuus on saatava mahdollisimman vähäiseksi käyttämällä ehdottomasti anaerobisia tekniikoita, esimerkiksi hansikaskaappia.
d) Ylimääräinen substraatti lietteen joukossa
Anaerobiseen kaasunmuodostukseen sekä lietteen herkkyyteen vaikuttavat substraatit, jotka siirtyvät siirrosteiden mukana testipulloihin. Kotitalouksien jätevettä käsittelevistä anaerobisista mädätyslaitoksista peräisin olevassa lietteessä on usein jäljellä tunnistettavia osasia, kuten hiuksia ja selluloosapitoisia kasvien jäänteitä, mikä voi tehdä edustavien näytteiden ottamisesta vaikeaa. Lietteen siivilöinnillä saadaan poistettua ylimääräiset, liukenemattomat osaset, jolloin näytteistä saadaan todennäköisemmin edustavia (16 kappale).
e) Haihtuvat testikemikaalit
Haihtuvat testikemikaalit vapautuvat testipullojen kaasutilaan. Tällöin osa testimateriaalista saatetaan menettää järjestelmästä painemittausten jälkeisessä ilmauksessa, jolloin EC50-arvoista tulee liian suuria. Virhe pienenee, kun kaasutilan ja nesteen tilavuuksien suhde on oikea eikä ilmausta tehdä paineenmittausten jälkeen (10).
f) Kaasunmuodostuksen epälineaarisuus
Jos kumulatiivisesta kaasunmuodostuksen keskiarvosta inkubaatioajan funktiona piirretty käyrä ei ole suunnilleen lineaarinen 48 tunnin aikana, testin tarkkuus saattaa kärsiä. Tämän välttämiseksi voi olla suositeltavaa käyttää toisesta lähteestä peräisin olevaa mädätyslietettä ja/tai lisätä suurempi pitoisuus testisubstraatin sekä ravinneliuoksen, hiivauutteen ja glukoosin seosta (29 kohta).
Lisäys 4
Soveltaminen ympäristöstä kerättyihin näytteisiin, joissa biomassan pitoisuus on pieni (esimerkiksi anaerobinen lieju ja sedimentit)
Johdanto
A.1 Luonnossa tavattavassa anaerobisessa liejussa, sedimenteissä, maa-aineksissa ja vastaavissa mikrobien toiminta (yhtä kiintoainegrammaa kohti tuotetun kaasun määrä) jää yleensä huomattavasti vähäisemmäksi kuin jätevedestä peräisin olevassa anaerobisessa lietteessä. Mitattaessa kemikaalien inhibitiovaikutusta tällaisissa vähemmän aktiivisissa näytteissä onkin syytä muuttaa osaa koeolosuhteista. Vähemmän aktiivisille näytteille voidaan valita kahdesta mahdollisesta toimintatavasta:
|
a)
|
Tehdään alustava testi (25 kohta) mukautetussa muodossa käyttämällä laimentamatonta lieju-, maa-aines- tai muuta näytettä lämpötilassa 35 °C ± 2 °C tai, jos halutaan tarkempaa simulointia, näytteen keruupaikan lämpötilassa (kuten standardin ISO 13 641 osassa 1 on kuvattu);
|
|
(b)
|
Tai tehdään testi käyttämällä laimennettua (1:100) mädätyslaitoksesta peräisin olevaa lietettä, jotta voidaan simuloida luonnosta peräisin olevan näytteen todennäköisesti vähäistä aktiivisuutta, mutta annetaan lämpötilan olla 35 °C ± 2 °C (kuten standardin ISO 13 641 osassa 2 on kuvattu).
|
A.2 Vaihtoehto a) voidaan toteuttaa noudattamalla tässä kuvattua menetelmää (joka vastaa standardin ISO 13 641 osaa 1), mutta alustava testi (25 kohta) on välttämätön ihanteellisten testiolosuhteiden varmistamiseksi, jolleivät nämä olosuhteet ole tiedossa jo aiempien testien perusteella. Lieju- tai sedimenttinäyte on sekoitettava perusteellisesti esimerkiksi tehosekoittimessa ja tarvittaessa laimennettava pienellä määrällä vettä, josta ilma on poistettu (14 kohta), jotta näyte on riittävän juoksevaa siirrettäväksi suurikärkisellä pipetillä tai mittalasilla. Jos näytteestä epäillään puuttuvan ravintoaineita, liejunäyte voidaan sentrifugoida (anaerobisissa olosuhteissa) ja suspendoida uudelleen hiivauutetta sisältävään epäorgaaniseen aineeseen (A.11).
A.3 Vaihtoehto b) jäljittelee kohtuullisen hyvin ympäristöstä kerättyjen näytteiden vähäistä aktiivisuutta, mutta siitä puuttuu näytteisiin yleensä kuuluva runsas suspendoitunut kiintoaine. Kiintoaineiden merkitystä inhibitiolle ei tunneta, mutta on mahdollista, että testikemikaalien ja liejun ainesosien väliset reaktiot sekä testikemikaalien adsorboituminen kiintoaineisiin saattavat vähentää testikemikaalin myrkyllisyyttä.
A.4 Toinen tärkeä tekijä on lämpötila. Kun halutaan simulaation olevan mahdollisimman tarkkaa, testit on tehtävä näytteenottopaikan lämpötilassa, sillä erilaisten metaania tuottavien bakteeriryhmien tiedetään toimivan eri lämpötiloissa (termofiilit noin 30–35 °C:ssa, mesofiilit 20–25 °C:ssa ja psykrofiilit alle 20 °C:ssa), jolloin inhibitiovaikutukset voivat olla erilaisia.
A.5 Testin kesto. Yhteistutkimuksessa havaittiin, että yleisen testin 1. osassa, jossa käytettiin laimentamatonta lietettä, kaasua muodostui 2–4 vuorokaudessa aina riittävä määrä, mutta 2. osassa, jossa käytettiin yhteen sadasosapitoisuuteen laimennettua lietettä, kaasua muodostui liian vähän tai ei ollenkaan. Jälkimmäistä testiä tutkineiden Madsenin ym. (1996) mukaan testin keston olisi oltava vähintään seitsemän vuorokautta.
Testaaminen matalalla biomassapitoisuudella (vaihtoehto b)
Testin kuvaukseen tehdään seuraavat muutokset, joilla korvataan varsinaisen tekstin kohtia ja alakohtia tai lisätään uusia:
A.6 Lisätään 6 kohtaan (Testin periaate) seuraava teksti:
’Tätä tekniikkaa voidaan käyttää anaerobiselle lietteelle, joka on laimennettu pitoisuuteen 1:100 osittain siksi, että näin voidaan simuloida liejun ja sedimenttien vähäistä aktiivisuutta. Inkubointilämpötila voi olla joko 35 °C tai se lämpötila, joka vallitsee näytteen keräyspaikassa. Bakteeritoiminta on huomattavasti laimentamatonta lietettä vähäisempää, joten inkubointiaikaa on pidennettävä vähintään seitsemään vuorokauteen.’
A.7 Lisätään 12(a) kohtaan seuraava maininta:
’Inkubaattorin on oltava sellainen, joka toimii alimmillaan 15 °C:n lämpötilassa.’
A.8 Lisätään ylimääräinen reagenssia 13 kohdan jälkeen:
’Fosforihappo (H3PO4), pitoisuus 85 prosenttia mitattuna massana vedessä.’
A.9 Lisätään 16 kohdan loppuun seuraava maininta:
’Testissä käytettävä lopullinen kiintoaineen kokonaispitoisuus on 0,20 ±0,05 g/l.’
A.10 17 kohta (Testissä käytettävä substraatti):
Tätä substraattia ei pidä käyttää, vaan se korvataan hiivauutteella (ks. 17 kohdan A.11, A.12 ja A.13 alakohdat).
A.11 Anaerobisen lietteen laimentamiseen tarvitaan hivenaineita sisältävää epäorgaanista ainetta, ja käytön helpottamiseksi aineeseen lisätään orgaanista substraattia eli hiivauutetta.
Lisätään 17 kohdan jälkeen seuraava maininta:
|
’a)
|
Epäorgaanista testiainetta, joka sisältää hiivauutetta.
|
Epäorgaaninen aine valmistetaan 10-kertaisesti tiivistetystä testiaineesta (17(b) kohta; A.12) hivenaineliuoksen avulla (17(c) kohta; A.13). Käytä vastahankittua natriumsulfidinonahydraattia (17(b) kohta; A.12) tai pese ja kuivaa aine ennen käyttöä, jotta sen pelkistyskapasiteetti on riittävä. Jos testissä ei käytetä hansikaskaappia (12(j) kohta), natriumsulfidin määrää kantaliuoksessa olisi nostettava pitoisuuteen 2 g/l (pitoisuudesta 1 g/l). Natriumsulfidi voidaan lisätä myös asianmukaisesta sopivasta kantaliuoksesta suljettujen testipullojen tulpan kautta. Näin pienennetään hapettumisen riskiä. Lopullisen pitoisuuden on oltava 0,2 g/l. Vaihtoehtoisesti voidaan käyttää myös titaani(III)sitraattia (17(b) kohta). Lisää ainetta suljettujen testipullojen tulpan kautta siten, että pitoisuudeksi tulee 0,8–1,0 mmol/l. Titaani(III)sitraatti on erittäin tehokas pelkistävä aine, jonka myrkyllisyys on pieni, ja sitä valmistetaan seuraavasti: Liuotetaan 2,94 g trinatriumsitraaattidihydraattia 50 ml:aan hapetonta laimennusvettä (14 kohta) (jolloin saadaan liuos, jonka pitoisuus on 200 mmol/l) ja lisätään 5 ml titaani(III)kloridiliuosta (15 g/100 ml laimennusvettä). Liuos neutraloidaan pH-arvoon 7 ± 0,5 natriumkarbonaatilla ja laitetaan se sopivaan seerumipulloon typpikaasuvirtauksen alla. Tässä kantaliuoksessa titaani(III)sitraatin pitoisuus on 164 mmol/l. Käytä testiaine välittömästi tai säilytä sitä 4 °C:ssa enintään yhden vuorokauden ajan.
|
A.12
|
b)
|
Kymmenkertaiseksi tiivistettyä testiainetta, joka valmistetaan seuraavista:
|
vedetöntä dikaliumvetyfosfaattia (KH2PO4)
|
2,7 g
|
|
dinatriumvetyfosfaattia (Na2HPO4)
|
4,4 g
|
|
(tai 11,2 g dodekahydraattia)
ammoniumkloridia (NH4Cl)
|
5,3 g
|
|
kalsiumkloridihydraattia (CaCl2 · 2H2O)
|
0,75 g
|
|
magnesiumkloridiheksahydraattia (MgCl2 · 6H2O)
|
1,0 g
|
|
rauta(II)kloriditetrahydraattia (FeCl2 · 4H2O)
|
0,2 g
|
|
resatsuriinia (hapetus-pelkistysreaktion indikaattoria)
|
0,01 g
|
|
natriumsulfidinonahydraattia (Na2S · 9H2O)
|
1,0 g
|
|
(tai titanium(III)sitraattia): lopullinen pitoisuus
|
0,8–1,0 mmol/l
|
|
hivenaineliuosta (ks. 17(c) kohta; A.13)
|
10,0 ml
|
|
hiivauutetta
|
100 g
|
|
Liuotetaan laimennusveteen (14 kohta) ja lisätään vettä niin paljon, että tilavuudeksi saadaan
|
1 000 ml
|
|
|
A.13
|
c)
|
Hivenaineliuosta, joka valmistetaan seuraavista:
|
mangaaneesi(II)kloriditetrahydraattia (MnCl2 · 4H2O)
|
0,5 g
|
|
ortoboorihappoa (H3BO3)
|
0,05 g
|
|
sinkkikloridia (ZnCl2)
|
0,05 g
|
|
kupari(II)kloridia (CuCl2)
|
0,03 g
|
|
natriummolybdaattidihydraattia (Na2MoO4 · 2H2O)
|
0,01 g
|
|
koboltti(II)kloridiheksahydraattia (CoCl2 · 6H2O)
|
1,0 g
|
|
nikkeli(II)kloridiheksahydraattia (NiCl2 · 6H2O)
|
0,1 g
|
|
dinatriumseleniittiä (Na2SeO3)
|
0,05 g
|
|
Liuotetaan laimennusveteen (14 kohta) ja lisätään vettä niin paljon, että tilavuudeksi saadaan
|
1 000 ml’
|
|
A.14 25 kohta (Alustava testi)
Kuvauksen 25 kohdan mukainen alustava testi on välttämätön, mutta sillä erotuksella, että lietteen kiintoainepitoisuuden on oltava yksi sadasosa mainituista arvoista eli 0,1 g/l, 0,2 g/l ja 0,4 g/l. Inkuboinnin keston on oltava vähintään seitsemän vuorokautta.
Huomaa: Yhteistutkimuksessa (5) kaasutilan tilavuus oli liian suuri, kun se oli 75 prosenttia kokonaistilavuudesta. Kaasutilan suositeltava tilavuus on 10–40 prosenttia. Merkityksellinen kriteeri on se, että inhibition ollessa noin 80 prosenttia muodostuneen kaasun tilavuus on voitava mitata hyväksyttävällä tarkkuudella (esimerkiksi ± 5…± 10 prosenttia).
A.15 26–30 kohta (Testikemikaalien lisääminen sekä siirrosteen ja substraatin lisääminen)
Lisääminen tehdään näissä kohdissa kuvatulla tavalla, mutta substraattiliuoksen (17 kohta) sijasta käytetään testiainetta sekä hiivauutesubstraattia (A.11).
Samalla kuivan kiintoaineen lopullista pitoisuutta vähennetään arvosta 2–4 g/l arvoon 0,2 ± 0,05 g/l (A.9). Kaksi esimerkkiä ainesosien lisäämisestä testiseokseen annetaan taulukossa A.1, joka korvaa 29 kohdassa olevan taulukon.
A.16 33 kohta (Pullojen inkubaatio)
Kaasun muodostumisen odotetaan olevan vähäisempää, minkä vuoksi inkubaatiota jatketaan vähintään seitsemän vuorokauden ajan.
A.17 34 kohta (Paineen mittaaminen)
Paine mitataan pullojen kaasutilasta samalla tavalla kuin 34 kohdassa on kuvattu, jos halutaan tietää määrät kaasufaasissa. Jos mitattava suure on CO2:n ja CH4:n yhteismäärä, nestefaasin pH-arvoa pienennetään noin arvoon 2 injektoimalla H3PO4:ää jokaiseen tarvittavaan pulloon ja mittaamalla paine sen jälkeen, kun pulloja on ravisteltu 30 minuutin ajan testilämpötilassa. Lisätietoa siirrosteen laadusta saadaan kuitenkin mittaamalla jokaisen pullon paine ennen ja jälkeen happamuuden lisäämistä. Esimerkiksi tilanteessa, jossa CO2:ta muodostuu huomattavasti enemmän kuin metaania, fermentatiivisten bakteerien herkkyys voi muuttua ja/tai testikemikaalin käyttäytyminen suosii metanogeenisia bakteereja.
A.18 36 kohta (pH:n mittaaminen)
H3PO4:ää käytettäessä on etenkin pH-arvon mittaamista varten varattava myös ylimääräisiä pulloja, jotka eivät sisällä H3PO4:ää.
Lähde:
Madsen, T, Rasmussen, HB; and Nilsson, L (1996), Methods for screening anaerobic biodegradability and toxicity of organic chemicals. Project No.336, Water Quality Institute, Danish Environment Protection Agency, Copenhagen.
Taulukko A.1
Esimerkkejä testierille käytettävästä koeasetelmasta
|
Reaktioseoksen ainesosat
|
Esimerkki 1
|
Esimerkki 2
|
Tavanomainen lisäämisjärjestys
|
|
Valmistetun siirrosteen pitoisuus (g/l)
|
0,42
|
2,1
|
—
|
|
Lisätyn siirrosteen määrä (ml)
|
45
|
9
|
4
|
|
Siirrosteen pitoisuus testipulloissa (g/l)
|
0,20
|
0,20
|
—
|
|
Lisätyn testiaineen määrä (ml)
|
9
|
9
|
2
|
|
Lisätyn laimennusveden määrä (ml)
|
36
|
72
|
3
|
|
Hiivauutteen pitoisuus testipulloissa (g/l)
|
9,7
|
9,7
|
—
|
|
Testikemikaalin kantaliuoksen määrä (ml)
|
3
|
3
|
1
|
|
Nesteen tilavuus yhteensä (ml)
|
93
|
93
|
—
|
Lisäys 5
Määritelmät
Tässä testimenetelmässä käytetään seuraavia määritelmiä:
Kemikaali
: aine tai seos.
Testikemikaali
: tätä testimenetelmää käyttäen testattu aine tai seos.
C.35 MYRKYLLISYYSTESTI LUMBRICULUS-ELIÖLLÄ VESI-SEDIMENTTISYSTEEMISSÄ KÄYTTÄEN KÄSITELTYÄ SEDIMENTTIÄ
JOHDANTO
|
1.
|
Tämä testimenetelmä vastaa OECD:n testiohjetta (TG) nro 225 (2007). Sedimenttiä ravinnokseen nielevät pohjaeläimet saattavat altistua suurille pitoisuuksille sedimenttiin sitoutuneita kemikaaleja, minkä vuoksi niihin olisi kiinnitettävä erityishuomiota (esimerkiksi (1), (2), (3)). Näistä sedimenttiä nielevistä eläimistä vedessä elävillä harvasukasmadoilla on tärkeä tehtävä vesijärjestelmien sedimenteissä. Koska nämä eläimet muokkaavat sedimenttiä ja koska ne ovat myös saaliseläimiä, ne voivat vaikuttaa voimakkaasti haitallisten kemikaalien biologiseen saatavuuteen muille organismeille, kuten pohjaeläimiä syöville kaloille. Toisin kuin pohjan päällä elävät organismit, vedenpohjassa elävät harvasukasmadot (esimerkiksi Lumbriculus variegatus) kaivautuvat sedimenttiin ja nielevät ravinnokseen sedimenttihiukkasia sedimentin pinnan alta. Näin testiorganismit altistuvat varmasti testikemikaalille kaikkia mahdollisia reittejä (esimerkiksi joutumalla suoraan kosketukseen kemikaalien kanssa ja kontaminoituneita sedimenttihiukkasia nielemällä, mutta myös huokosveden ja yläpuolisen veden kautta).
|
|
2.
|
Tällä testimenetelmällä arvioidaan vaikutuksia, joita pohjassa elävälle harvasukasmadolle Lumbriculus variegatus (Müller) koituu pitkäaikaiseta altistuksesta sedimentteihin kertyville kemikaaleille. Menetelmä perustuu nykyisiin sedimentin myrkyllisyyttä ja biokertyvyyttä koskeviin testisuunnitelmiin, esimerkiksi (3), (4), (5), (6), (7), (8), (9), (10). Menetelmä on kuvattu staattisia testiolosuhteita varten. Tässä testimenetelmässä altistus tapahtuu lisäämällä sedimenttiin testikemikaalia. Käsitellyn sedimentin käyttämisellä simuloidaan testikemikaalilla kontaminoitunutta sedimenttiä.
|
|
3.
|
Kemikaalit, joita sedimentissä elävillä eliöillä testataan, säilyvät yleensä sedimentissä pitkään. Sedimentissä elävät organismit voivat altistua useita reittejä pitkin. Jokaisen altistusreitin suhteellinen tärkeys sekä toksiseen kokonaisvaikutukseen vaadittava aika määräytyvät käytettävän kemikaalin fysikaalis-kemiallisten ominaisuuksien ja eläimen elimistössä kulkeutumisen mukaan. Jos kyseessä on voimakkaasti adsorboiva kemikaali (esim. log Kow > 5) tai kemikaali, joka sitoutuu kovalenttisesti sedimenttiin, kontaminoituneen ravinnon nauttiminen voi olla tärkeä altistusreitti. Jotta tällaisten kemikaalien myrkyllisyyttä ei aliarvioida, testiorganismien lisääntymiseen ja kasvuun tarvittavaa ruokaa on lisättävä sedimenttiin ennen testiaineen applikointia (11). Kuvattu testimenetelmä on riittävän yksityiskohtainen, jotta testi voidaan tehdä, vaikka testijärjestelyjä olisi mukautettava yksittäisten laboratorioiden olosuhteiden sekä testikemikaalien erilaisten ominaisuuksien mukaan.
|
|
4.
|
Testimenetelmällä on tarkoitus todeta testikemikaalin vaikutukset testiorganismien lisääntymiseen ja biomassaan. Mitattavia biologisia parametreja ovat eloonjääneiden matojen kokonaismäärä ja biomassa (kuivapaino) altistuksen lopussa. Data analysoidaan joko regressiomallilla, jolloin voidaan arvioida pitoisuus, joka aiheuttaa x prosentin suuruisen vaikutuksen (esimerkiksi EC50, EC25 ja EC10) tai tilastollisella hypoteesitestauksella, jolloin saadaan selville NOEC- (No Observed Effect Concentration eli pitoisuus, josta ei aiheudu vaikutuksia) ja LOEC-arvo (Lowest Observed Effect Concentration eli pienin havaittavan vaikutuksen aiheuttava pitoisuus).
|
|
5.
|
Tämän liitteen luvussa C.27 (Surviaissääskillä tehtävä myrkyllisyystesti, käyttäen vettä tai sedimenttiä, joihin on lisätty tutkittavaa ainetta (6)) on mainittu useita olennaisia ja hyödyllisiä seikkoja, joilla esitetyn sedimentin myrkyllisyystestimenetelmän toimivuutta voidaan parantaa. Tämä asiakirja toimiikin pohjadokumenttina, johon on kirjattu muutoksia, joita sedimentin myrkyllisyystestien suorittaminen Lumbriculus variegatus -eliöllä edellyttää. Muita tekstissä mainittuja asiakirjoja ovat esimerkiksi ASTM:n Standard Guide for Determination of the Bioaccumulation of Sediment-Associated Contaminants by Benthic Invertebrates (3), U.S. EPA:n Methods for Measuring the Toxicity and Bioaccumulation of Sediment-Associated Contaminants with Freshwater Invertebrates (7) sekä ASTM:n Standard Guide for Collection, Storage, Characterization, and Manipulation of Sediments for Toxicological Testing and for selection of samplers used to collect benthic invertebrates (12). Muita tärkeitä tietolähteitä asiakirjaa laadittaessa ovat olleet testimenetelmän yhteistutkimuksen kuluessa saatu käytännön kokemus ((13), yhteistutkimuksen testiraportti) sekä kirjallisuudesta peräisin olevat tiedot.
|
POHJATIEDOT JA OHJEET
|
6.
|
Tietoa testikemikaalista (turvallisuustoimenpiteet ja asianmukaiset säilytysolosuhteet) ja analyysimenetelmistä on hankittava ennen tutkimuksen aloittamista. Kirjallisuusviitteessä (14) annetaan ohjeita sellaisten kemikaalien testauksesta, joiden fysikaalis-kemialliset ominaisuudet vaikeuttavat niiden testaamista.
|
|
7.
|
Ennen testin tekemistä testiaineesta on oltava tiedossa seuraavat:
|
—
|
yleisnimi, kemiallinen nimi (mieluiten IUPAC-nimi), rakennekaava, CAS-numero, puhtaus
|
|
|
8.
|
Seuraavista tiedoista saattaa lisäksi olla hyötyä ennen testin aloittamista:
|
—
|
oktanoli/vesi-jakautumiskerroin Kow
|
|
—
|
orgaaninen hiili-vesi-jakautumiskerroin Koc
|
|
—
|
valokemiallinen muuntuminen vedessä
|
|
|
9.
|
Tiedot käytettävän sedimentin eräistä ominaisuuksista on hankittava ennen testin aloittamista (7). Ks. tarkemmin 22–25 kohta.
|
TESTIN PERIAATE
|
10.
|
Samankaltaisessa fysiologisessa tilassa olevat madot (jotka on synkronoitu lisäyksessä 5 kuvatulla tavalla) altistetaan sarjalle myrkyllisiä pitoisuuksia, joita on applikoitu sedimentti-vesijärjestelmän sedimenttifaasiin. Väliaineena käytetään keinosedimenttiä sekä synteettistä vettä. Kontrolleina toimivat testiastiat, joihin ei lisätä testikemikaalia. Testikemikaalin eri pitoisuudet lisätään sedimenttiin irtonaisena, jolloin vaihtelu kunkin pitoisuustason rinnakkaisnäytteiden välillä saadaan pidettyä mahdollisimman pienenä, minkä jälkeen testiorganismit siirretään testiastioihin, joissa sedimentti- ja vesipitoisuudet on tasapainotettu (ks. 29 kohta). Koe-eläimet altistetaan sedimentti-vesijärjestelmille 28 vuorokauden ajan. Keinosedimentin ravinnepitoisuus on alhainen, minkä vuoksi sedimentteihin on lisättävä ravintolähde (ks. 22 ja 23 kohta sekä lisäys 4), jotta voidaan varmistaa, että madot kasvavat ja lisääntyvät kontrolliolosuhteissa. Samalla varmistetaan, että koe-eläimet altistuvat paitsi veden ja sedimentin, myös ravinnon kautta.
|
|
11.
|
Suositeltavia tutkittavia ominaisuuksia tällaisessa tutkimuksessa ovat lisääntymisen ECx-arvo (esimerkiksi EC50, EC25 ja EC10 eli vaikuttava pitoisuus, joka vaikuttaa x prosenttiin testiorganismeista) sekä biomassa kontrolliin verrattuna. On kuitenkin syytä huomata, että kun huomioon otetaan pienen ECx-arvon (esimerkiksi EC10 tai EC25) erittäin suuri epätodennäköisyys, varsin korkeat 95 prosentin luottamusvälit (esimerkiksi (15)) sekä hypoteesitestauksen aikana laskettu tilastollinen voima, katsotaan EC50 kaikkein luotettavimmaksi tutkittavaksi ominaisuudeksi. Biomassalle ja lisääntymiselle voidaan lisäksi laskea NOEC-arvo (No Observed Effect Concentration eli pitoisuus, josta ei aiheudu vaikutuksia) ja LOEC-arvo (Lowest Observed Effect Concentration eli pienin havaittavan vaikutuksen aiheuttava pitoisuus), jos testijärjestely ja data tukevat näitä laskelmia (ks. 34–38 kohta). Testijärjestely valitaan sen mukaan, onko tutkimuksen tarkoituksena saada selville ECx- vai NOEC-arvo.
|
VERTAILEVAT TESTIT
|
12.
|
Oletuksena on, että kontrolliorganismien toiminta osoittaa riittävällä tavalla, että laboratorio pystyy suorittamaan testin, ja jos historiallista dataa on saatavilla, myös testin toistettavuuden. Testiorganismien herkkyyden arvioimiseksi voidaan lisäksi tehdä säännöllisin väliajoin vertailevia myrkyllisyystestejä, joissa käytetään vertailumyrkkyä. Koe-eläinten herkkyys ja tila voidaan tyydyttävästi osoittaa vain vedessä tehtävillä 96 tunnin vertailevilla myrkyllisyystesteillä (4), (7). Tietoa pentakloorifenolin (PCP) myrkyllisyydestä lyhentämättömissä testeissä (28 vuorokauden altistus käsitellylle sedimentille) on lisäyksessä 6 sekä testimenetelmän yhteistutkimuksesta laaditussa raportissa (13). PCP:n välitön myrkyllisyys vain vedessä kuvataan esimerkiksi kirjallisuusviitteessä (16). Tätä tietoa voidaan käyttää verrattaessa testiorganismin herkkyyttä vertailevissa testeissä, kun vertailumyrkkynä on PCP. Kaliumkloridia (KCl) tai kuparisulfaattia (CuSO4) on suositeltu vertailumyrkyiksi L. variegatus -lajille (4), (7). Toistaiseksi kaliumkloridin myrkyllisyystietoihin perustuvien laatukriteerien määrittäminen on vaikeaa, sillä vaikutuksista L. variegatus -lajiin on saatavilla niukasti kirjallisuustietoa. Tietoa kuparin myrkyllisyydestä L. variegatus -lajille on kirjallisuusviitteissä (17)–(21).
|
TESTIN VALIDITEETTI
|
13.
|
Testi on validi, jos seuraavat edellytykset täyttyvät:
|
—
|
Yhteistutkimuksella on osoitettu, että Lumbriculus variegatus -lajilla elävien matojen keskimäärän kontrollien rinnakkaisnäytettä kohti pitäisi kasvaa ainakin 1,8-kertaiseksi altistusjakson lopussa verrattuna matojen määrään rinnakkaisnäytettä kohti altistusjakson alussa.
|
|
—
|
Yläpuolisen veden pH:n on oltava 6–9 koko testin ajan.
|
|
—
|
Yläpuolisen veden happipitoisuus ei testin aikana saa laskea alle 30 prosenttiin ilman kyllästysarvosta (ASV) testilämpötilassa.
|
|
TESTIMENETELMÄN KUVAUS
Testijärjestelmä
|
14.
|
Testauksessa suositellaan käytettäväksi staattisia järjestelmiä, joissa yläpuolinen vesi ei vaihdu. Jos sedimentin ja veden välinen suhdeluku (ks. 15 kohta) on sopiva, varovainen ilmastaminen riittää yleensä pitämään veden laadun testiorganismien kannalta hyväksyttävällä tasolla (esimerkiksi maksimoimaan liuenneen hapen määrän ja pitämään ulosteiden kertymisen mahdollisimman vähäisenä). Semistaattisia tai läpivirtausjärjestelmiä, joissa yläpuolinen vesi vaihtuu säännöllisesti tai jatkuvasti, käytetään vain poikkeustapauksissa, sillä yläpuolisen veden säännöllisen vaihtumisen voidaan olettaa vaikuttavan kemialliseen tasapainoon (esimerkiksi testikemikaalin häviämiseen testijärjestelmästä).
|
Koeastiat ja -välineet
|
15.
|
Altistuminen tapahtuu dekantterilaseissa, joiden tilavuus on esimerkiksi 250 ml ja halkaisija 6 cm. Muitakin lasiastioita voidaan käyttää, kunhan sedimentin ja sen yläpuolisen veden syvyys on sopiva. Jokaiseen astiaan tulee noin 1,5–3 cm paksu kerros synteettistä sedimenttiä. Sedimenttikerroksen ja sen päällä olevan veden syvyyden suhteen on oltava 1:4. Astioiden tilavuuden on oltava täyttöasteen kannalta riittävä eli sedimentin painoyksikköä kohti lisättyjen testimatojen lukumäärälle sopiva (ks. myös 39 kohta).
|
|
16.
|
Astioiden ja muiden laitteiden, jotka joutuvat kosketuksiin testikemikaalin kanssa, on oltava kokonaan lasia tai muuta kemiallisesti inerttiä materiaalia. Missään laitteiston osissa ei saa käyttää materiaaleja, jotka voivat liuottaa tai adsorboida testikemikaalia, joista voi liueta muita kemikaaleja ja jotka voivat vaikuttaa haitallisesti koe-eläimiin. Kaikissa laitteissa, jotka ovat kosketuksissa testiväliaineeseen, on käytettävä polytetrafluoroetyleenistä (PTFE), ruostumattomasta teräksestä ja/tai lasista valmistettuja osia. Jos käytetään orgaanisia kemikaaleja, joiden tiedetään adsorboituvan lasiin, voi olla tarpeen käyttää silanoitua lasia. Tällöin välineet on heitettävä pois käytön jälkeen.
|
Testilajit
|
17.
|
Tässä tutkimuksessa käytettävä testilaji on makeassa vedessä elävä harvasukasmato Lumbriculus variegatus (Müller). Laji kykenee elämään monenlaisissa sedimenteissä ja sitä käytetään yleisesti sedimentin myrkyllisyyden ja biokertyvyyden testauksessa [esimerkiksi (3), (5), (7), (9), (13), (15), (16), (22), (23), (24), (25), (26), (27), (28), (29), (30), (31), (32), (33), (34), (35)]. Koe-eläinten alkuperä, lajin tunnistamistapa (esimerkiksi (6)) sekä viljelyolosuhteet on raportoitava. Lajin tunnistusta ei ole tarpeen tehdä ennen joka testiä, jos eliöt ovat peräisin laboratorion omasta viljelmästä.
|
Testiorganismien viljely
|
18.
|
Matoja kannattaa pitää pysyvässä laboratorioviljelmässä, jolloin niitä on aina riittävästi sedimentin myrkyllisyystestejä varten. Ohjeita Lumbriculus variegatus -lajin viljelymenetelmistä laboratoriossa sekä aloitusviljelmien lähteitä on mainittu lisäyksessä 5. Tarkempia tietoja lajin viljelystä on lähdeviitteissä (3), (7) ja (27).
|
|
19.
|
On erittäin suositeltavaa pitää yhdessä viljelmässä vain yhden lajin edustajia, jotta testien suorittamiseen käytetään varmasti aina saman lajin eläimiä. On syytä varmistaa, ettei viljelmissä eikä etenkään testeissä käytettävissä madoissa ole havaittavissa tauteja tai poikkeavuuksia.
|
Vesi
|
20.
|
Testissä käytettäväksi yläpuoliseksi vedeksi suositellaan tämän liitteen C.1 luvun (37) mukaista synteettistä vettä, jota voidaan käyttää myös matojen laboratorioviljelmissä (synteettisen veden valmistamisesta ks. lisäys 2). Tarvittaessa voidaan käyttää myös luonnonvettä. Valitun veden on oltava laadultaan sellaista, että koe-eläimet kasvavat ja lisääntyvät siinä totuttautumisvaiheen ja testin ajan ilman, että niiden ulkonäössä tai käyttäytymisessä havaitaan mitään poikkeavaa. On osoitettu, että Lumbriculus variegatus pysyy elossa, kasvaa ja lisääntyy tällaisessa vedessä (30), jossa testi- ja kasvatusolosuhteet on vakioitu mahdollisimman pitkälle. Synteettistä vettä käytettäessä on ilmoitettava sen koostumus ja mainittava ennen käyttöä ainakin veden pH-arvo, happipitoisuus ja kovuus (ilmaistuna milligrammoina CaCO3:ta litrassa). Hyödyllistä tietoa saatetaan saada, jos vedestä analysoidaan mikrosaasteet ennen käyttöä (ks. esimerkiksi lisäys 3).
|
|
21.
|
Yläpuolisen veden pH:n on oltava 6,0–9,0 (ks. 13 kohta). Jos ammoniakin muodostumisen odotetaan olevan runsasta, on hyvä pitää pH-arvo välillä 6,0–8,0. Esimerkiksi laimeiden orgaanisten happojen testaamista varten on suositeltavaa säätää pH-arvoa puskuroimalla testissä käytettävä vesi esimerkiksi kirjallisuusviitteessä (16) kuvatulla tavalla. Luonnonvettä käytettäessä testissä käytettävän veden kokonaiskovuuden on oltava 90–300 mg CaCO3:ta litrassa. Lisäyksessä 3 on yhteenveto hyväksyttävän laimennusveden muista kriteereistä OECD:n testiohjeen (TG) nro 210 (38) mukaisesti.
|
Sedimentti
|
22.
|
Kontaminoitumattomia luonnonsedimenttejä ei ole välttämättä saatavilla tietystä lähteestä kaikkina vuodenaikoina, minkä lisäksi paikalliset organismit ja mahdolliset mikrosaasteet saattavat vaikuttaa testiin. Tästä syystä on suositeltavinta käyttää synteettistä sedimenttiä (jota kutsutaan myös keinotekoiseksi sedimentiksi tai keinosedimentiksi). Synteettistä sedimenttiä käytettäessä testiolosuhteiden vaihtelu sekä paikallisten eläinten joutuminen testiin pysyy mahdollisimman vähäisenä. Seuraava synteettinen sedimentti perustuu kirjallisuusviitteissä (6), (39) ja (40) kuvattuun keinosedimenttiin. Tässä testissä suositellaan käytettäväksi seuraavanlaista synteettistä sedimenttiä ((6), (10), (30), (41), (42), (43)):
|
a)
|
4–5 prosenttia (kuivapaino) rahkaturvetta; on tärkeää käyttää vain hienoksi jauhettua (hiukkaskoko ≤ 0,5 mm), ilmakuivattua turvetta, jonka maatumisaste on medium.
|
|
b)
|
20 ± 1 prosenttia (kuivapaino) kaoliniittisavea (kaoliniitin osuus mieluiten yli 30 prosenttia).
|
|
c)
|
75–76 prosenttia (kuivapaino) hienoa kvartsihiekkaa (jyväskoko ≤ 2 mm, mutta > 50 prosenttia hiukkasista olisi oltava kooltaan 50–200 μm).
|
|
d)
|
Deionisoitua vettä 30–50 prosenttia sedimentin kuivapainosta sedimentin kuivien ainesosien lisäksi.
|
|
e)
|
Kemiallisesti puhdasta kalsiumkarbonaattia (CaCO3) lisätään, jotta lopullisen sedimenttiseoksen pH-arvoa voidaan säätää.
|
|
f)
|
Orgaanisen hiilen kokonaispitoisuuden lopullisessa seoksessa on oltava 2 prosenttia (±0,5 prosenttia) sedimentin kuivapainosta. Pitoisuutta voidaan säätää lisäämällä sopiva määrä turvetta ja hiekkaa kohtien a ja c mukaisesti.
|
|
g)
|
Ruokaa, esimerkiksi nokkosen (Urtica sp., lääkestandardien ja elintarvikkeita koskevien vaatimusten mukaisesti) hienoksi jauhettuja lehtiä tai seosta, jossa on Urtica sp. -lajin hienoksi jauhettuja lehtiä ja alfaselluloosaa suhteessa 1:1; määrä on noin 0,4–0,5 prosenttia sedimentin kuivapainosta sedimentin kuivien ainesosien lisäksi; lisätietoa on lisäyksessä 4.
|
|
|
23.
|
Turpeen, kaoliniittisaven, ravinnon ja hiekan alkuperän on oltava tiedossa. Kohdassa g) mainitun ruoan lisäksi tämän liitteen luvussa C.27 (6) on lueteltu muita kasvimateriaaleja, joita voidaan käyttää ruokinnassa: sopivia ovat valkomulperin (Morus alba), valkoapilan (Trifolium repens), pinaatin (Spinacia oleracea) tai viljakasvien itujen kuivatut lehdet.
|
|
24.
|
Valittu ravinnonlähde on lisättävä astioihin ennen kuin sedimenttiin lisätään testikemikaali tai kemikaalin lisäämisen aikana. Valitun ravinnonlähteen on oltava sellainen, jota käytettäessä lisääntyminen kontrolleissa on vähintään tyydyttävällä tasolla. Hyödyllistä tietoa voidaan saada, kun keinosedimentistä tai sen ainesosista analysoidaan mikrosaasteet ennen sen käyttöä. Esimerkki synteettisen sedimentin valmistuksesta on lisäyksessä 4. Myös kuivien ainesosien sekoittaminen on hyväksyttävää, jos voidaan osoittaa, että sedimentin ainesosat eivät erotu (esimerkiksi kelluvia turvehiukkasia) yläpuolisen veden lisäämisen jälkeen ja että turve tai sedimentti on vakioitunut riittävästi (ks. myös 25 kohta sekä lisäys 4). Keinosedimentistä on mainittava vähintään ainesosien alkuperä, raekokojakauma (hiekan, siltin ja saven prosenttiosuudet), orgaanisen hiilen kokonaispitoisuus (TOC), vesipitoisuus ja pH. Hapetus-pelkistyspotentiaalin mittaus on vapaaehtoista.
|
|
25.
|
Tarvittaessa (esimerkiksi tiettyihin testaustarkoituksiin) testi- ja/tai kasvatussedimenttinä (3) voidaan käyttää myös luonnonsedimenttiä, joka on peräisin saastumattomilta alueilta. Luonnonsedimenttiä käytettäessä siitä on mainittava vähintään ainesosien alkuperä (keruupaikka), huokosveden pH-arvo ja ammoniakkipitoisuus, orgaanisen hiilen kokonaispitoisuus (TOC) ja typpipitoisuus, hiukkaskokojakauma (hiekan, siltin ja saven prosenttiosuudet) sekä prosentuaalinen vesipitoisuus. Luonnonsedimentissä ei saa olla minkäänlaista kontaminaatiota eikä muita organismeja, jotka saattavat kilpailla testiorganismien kanssa tai käyttää niitä saaliseläiminään. Hapetus-pelkistyspotentiaalin sekä kationinvaihtokyvyn mittaaminen ei ole pakollista. Lisäksi on suositeltavaa, että ennen kuin luonnolliseen sedimenttiin lisätään testiainetta, sitä vakioidaan seitsemän päivän ajan samoissa olosuhteissa, jotka testissä vallitsevat. Tämän vakioimisvaiheen jälkeen yläpuolinen vesi on poistettava ja hävitettävä.
|
|
26.
|
Käytettävän sedimentin on oltava laadultaan sellaista, että kontrolliorganismit pysyvät siinä elossa ja lisääntyvät koko altistumisajan ilman, että niiden ulkonäössä tai käyttäytymisessä havaitaan mitään poikkeavaa. Kontrollimatojen kuuluu kaivautua sedimenttiin ja niellä sitä. Kontrolleissa tapahtuvan lisääntymisen on oltava vähintään 13 kohdassa mainitun hyväksyttävyyskriteerin mukaista. Tiedot sedimentin pinnalla olevista ulostepelleteistä, jotka ovat merkki siitä, että madot nielevät sedimenttiä, tai niiden puuttumisesta on kirjattava ylös, sillä ne saattavat helpottaa testitulosten tulkintaa altistumisreittien kannalta. Lisää tietoa sedimentin nielemisestä voidaan saada käyttämällä lähdeviitteissä (24), (25), (44) ja (45) kuvattuja menetelmiä, joissa selvitetään, miten testiorganismit nielevät sedimenttiä tai valitsevat hiukkasia.
|
|
27.
|
Luonnollisten sedimenttien käsittelyä ennen niiden käyttöä laboratoriossa kuvataan kirjallisuusviitteissä (3), (7) ja (12). Keinotekoisen sedimentin, jota suositellaan käytettäväksi Lumbriculus-eliöillä tehtävässä testissä, valmistamisesta ja säilytyksestä kerrotaan lisäyksessä 4.
|
Testikemikaalin lisääminen
|
28.
|
Testikemikaali lisätään sedimenttiin. Oletuksena on, että useimmat testikemikaalit liukenevat huonosti veteen, minkä vuoksi ne on liuotettava sopivaan orgaaniseen liuottimeen (esimerkiksi asetoni, n-heksaani tai sykloheksaani) mahdollisimman pienenä määränä kantaliuoksen valmistamista varten. Testiliuoksia valmistettaessa kantaliuosta laimennetaan samalla liuottimella. Liuottimen myrkyllisyys ja haihtuvuus sekä testikemikaalin liukenevuus valittuun liuottimeen ovat tärkeimmät kriteerit soveltuvan liuotusapuaineen valinnassa. Jokaista pitoisuustasoa varten käytetään saman verran vastaavaa liuosta. Testikemikaalin eri pitoisuustasot lisätään sedimenttiin irtonaisena, jolloin vaihtelu testikemikaalien pitoisuuksien rinnakkaisnäytteiden välillä saadaan pidettyä mahdollisimman pienenä. Tämän jälkeen testiliuokset sekoitetaan kvartsihiekkaan 22 kohdan mukaisesti (esimerkiksi 10 g kvartsihiekkaa testiastiaa kohti). Riittäväksi määräksi, jolla kvartsihiekka saadaan kasteltua kokonaan, on todettu 0,20–0,25 ml yhtä hiekkagrammaa kohti. Tämän jälkeen liuottimen annetaan haihtua, kunnes hiekka on kuivaa. Päällystetty hiekka on käytettävä välittömästi kuivaamisen jälkeen, jotta testikemikaalia haihtuu liuottimen mukana mahdollisimman vähän (esimerkiksi kemikaalin höyrynpaineen mukaan). Kuiva hiekka sekoitetaan sopivaan määrään vastaavan pitoisuustason synteettistä sedimenttiä. Testikemikaalin ja hiekkaseoksen mukana tuleva hiekka on otettava huomioon sedimentin valmistuksessa (eli sedimentin valmistukseen on käytettävä pienempi määrä hiekkaa). Menettelyn tärkeimpänä etuna on, että sedimenttiin ei joudu oikeastaan lainkaan liuotinta (7). Vaihtoehtoisesti esimerkiksi kentältä kerättyä sedimenttiä käytettäessä testikemikaali voidaan lisätä kuivattuun ja hienoksi jauhettuun sedimentin osaan samalla tavoin kuin edellä kuvattiin kvartsihiekan yhteydessä, tai sekoittamalla testikemikaali märkään sedimenttiin ja antamalla mahdollisen liuotusapuaineen höyrystyä. Varmista huolellisesti, että sedimenttiin lisättävä testikemikaali sekoittuu sedimenttiin hyvin ja tasaisesti. Tarvittaessa haluttujen pitoisuuksien muodostuminen sedimenttiin ja homogeenisuuden aste voidaan todeta osanäytteiden analyysilla. Myös testiliuosten osanäytteitä analysoimalla voidaan todeta, että sedimenttiin on saatu halutut pitoisuudet. Kvartsihiekka päällystetään testikemikaalilla liuottimen avulla, minkä vuoksi tarvitaan liuotinkontrolli, jota valmistettaessa käytetään yhtä paljon liuotinta kuin testisedimenteissä. Testikemikaalin lisäämisessä käytetty menetelmä sekä perustelut muun kuin edellä kuvatun lisäämismenetelmän valinnalle on ilmoitettava raportissa. Lisäämismenetelmää voidaan mukauttaa testikemikaalin fysikaalis-kemiallisten ominaisuuksien mukaan esimerkiksi siksi, että näin voidaan välttää kemikaalin menettäminen haihtumisen vuoksi lisäämisen tai järjestelmän tasapainottumisen aikana. Lisää ohjeita testiaineen lisäämismenettelyistä on julkaisussa Environment Canada (1995) (46).
|
|
29.
|
Kun sedimentti on valmistettu ja testikemikaali lisätty, sedimentti jaettu rinnakkaisiin testiastioihin ja testivettä lisätty, on suotavaa antaa testikemikaalin erottua sedimentistä vesifaasiin (esimerkiksi (3), (7), (9)). Tämä on suositeltavaa tehdä samoissa lämpötila- ja ilmastusolosuhteissa, joita testissä käytetään. Sopiva tasapainottumisaika määräytyy sedimentin ja kemikaalin mukaan, ja se voi vaihdella tunneista päiviin tai harvinaisissa tapauksissa jopa useampiin viikkoihin (4–5 viikkoa) (esimerkiksi (27), (47)). Tässä testissä tasapainottumista ei odoteta, vaan suositeltu tasapainottumisaika on 48 h – 7 päivää. Näin testikemikaalin hajoamisaika jää mahdollisimman lyhyeksi. Tutkimuksen tarkoituksen mukaan (esimerkiksi jos tarkoitus on jäljitellä ympäristöolosuhteita) käsiteltyä sedimenttiä voidaan tasapainottaa tai vanhentaa pidemmänkin aikaa.
|
|
30.
|
Tasapainottumisajan lopulla otetaan näytteitä testikemikaalin pitoisuuden analysointia varten vähintään yläpuolisesta vedestä sekä irtosedimentistä ainakin suurimmasta ja yhdestä pienemmästä pitoisuudesta. Näiden testikemikaalin analyyttisten määritysten perusteella voidaan laskea massatase, ja tulokset ilmoitetaan mitattujen pitoisuuksien pohjalta. Yleisesti ottaen näytteenotto häiritsee sedimentti-vesijärjestelmää tai tuhoaa sen. Siksi ei ole yleensä mahdollista käyttää samoja rinnakkaisnäytteitä sedimentistä ja madoista otettaviin näytteisiin. Tämän vuoksi on varattava riittävän kokoisia analyysiastioita, jotka käsitellään samalla tavalla (mukaan lukien testiorganismien käyttö), mutta joista ei tehdä biologisia havaintoja. Astioiden koko valitaan siten, että näytteitä saadaan analyysimenetelmässä tarvittava määrä. Näytteenottoa käsitellään tarkemmin 53 kohdassa.
|
TESTIN SUORITTAMINEN
Alustava testi
|
31.
|
Jos testikemikaalin myrkyllisyydestä Lumbriculus variegatus -lajille ei ole olemassa tietoa, voi olla hyödyllistä tehdä alustava koe, jonka avulla päätetään varsinaisessa testissä testattava pitoisuusalue sekä optimoidaan varsinaisen testin olosuhteet. Tähän tarkoitukseen käytetään testikemikaalin pitoisuuksia laajoin pitoisuusvälein. Madot altistetaan testikemikaalin jokaiselle pitoisuudelle tietyn aikaa (esimerkiksi 28 vuorokauden ajan, kuten varsinaisessa testissä), jolloin voidaan arvioida sopivat testipitoisuudet; tässä vaiheessa ei tarvita rinnakkaisnäytteitä. Alustavan testin aikana tulee tarkkailla matojen käyttäytymistä, esimerkiksi sedimentin välttelyä, mikä voi johtua testikemikaalista ja/tai sedimentistä, ja sitä koskevat havainnot on kirjattava muistiin. Alustavassa testissä testattavien pitoisuuksien on oltava alle 1 000 mg sedimentin kuivapainokiloa kohti.
|
Varsinainen testi
|
32.
|
Varsinaisessa testissä käytetään vähintään viittä pitoisuutta, joiden valintaperusteena on alustavan pitoisuusalueen määritystestin tulos (31 kohta); pitoisuuksien valinta kuvataan 35, 36, 37 ja 38 kohdassa.
|
|
33.
|
Testisarjan lisäksi käytetään yhtä kontrollia, jossa on mukana kaikki ainesosat testikemikaalia lukuun ottamatta (rinnakkaisnäytteistä katso 36, 37 ja 38 kohta). Jos testikemikaalin applikoinnissa käytetään liuotusapuainetta, pelkkää liuotinta sisältävän kontrollin avulla osoitetaan, että apuaineella ei ole merkittävää vaikutusta testiorganismeihin.
|
Testijärjestely
|
34.
|
Testijärjestely tarkoittaa testipitoisuuksien lukumäärän ja pitoisuusvälien valintaa, astioiden lukumäärää kutakin pitoisuutta kohti ja kuhunkin astiaan lisättyjen matojen lukumäärää. ECx- ja NOEC-arvon estimointia sekä raja-arvotestin tekemistä varten tarvittavat järjestelyt kuvataan 35, 36, 37 ja 38 kohdissa.
|
|
35.
|
Testissä käytettävien pitoisuuksien on katettava vaikutuspitoisuus (esim. EC50, EC25 tai EC10) ja se pitoisuusalue, joka on merkityksellinen kyseisen testikemikaalin kannalta. Huomattavasti pienimmän testiorganismeihin vaikuttavan pitoisuuden alapuolelle tai suurimman testatun pitoisuuden yläpuolelle menevää ekstrapolointia tulee välttää. Jos poikkeustapauksissa tehdään tällainen ekstrapolointi, toimenpide on perusteltava raportissa.
|
|
36.
|
Jos on tarkoitus estimoida ECx-arvoa, on testattava vähintään viisi pitoisuutta ja vähintään kolme rinnakkaisnäytettä jokaista pitoisuutta kohti; kontrollia tai tarvittaessa liuotinkontrollia varten suositellaan kuutta rinnakkaisnäytettä, jotta kontrollien vaihtelua saadaan arvioitua paremmin. On joka tapauksessa suositeltavaa käyttää riittäviä testipitoisuuksia, jotta mallin estimointi onnistuu hyvin. Pitoisuuksien välinen kerroin ei saa olla yli kaksi (poikkeus voidaan tehdä, jos pitoisuusvastekäyrä on loiva). Käsittelyssä käytettävien rinnakkaisnäytteiden määrää voidaan vähentää, jos 5–95 prosentin vasteita aiheuttavien testipitoisuuksien määrää nostetaan. Jos toistojen määrää lisätään tai testipitoisuuden välejä pienennetään, testin luottamusväli yleensä kapenee.
|
|
37.
|
LOEC-/NOEC-arvoja estimoidessa on käytettävä vähintään viittä testipitoisuutta ja vähintään neljää rinnakkaisnäytettä (kontrollia tai tarvittaessa liuotinkontrollia varten suositellaan kuutta rinnakkaisnäytettä, jotta kontrollien vaihtelua saadaan arvioitua paremmin), ja pitoisuuksien välinen kerroin saa olla enintään kaksi. Testimenetelmälle tehdyn yhteistutkimuksen hypoteesitestauksen yhteydessä havaitusta tilastollisesta voimasta on tietoa lisäyksessä 6.
|
|
38.
|
Raja-arvotesti (yhdellä testipitoisuudella ja kontrolleilla) voidaan tehdä, jos vaikutuksia ei odoteta pitoisuudella, joka on enintään 1 000 mg sedimentin kuivapainokiloa kohti (esimerkiksi alustavan pitoisuusalueen määritystestin perusteella), tai jos yhdellä pitoisuudella testaaminen riittää mielenkiinnon kohteena olevan NOEC-arvon toteamiseen. Jälkimmäisessä tapauksessa yksityiskohtaiset perustelut raja-arvopitoisuuden valinnalle on kirjattava testiraporttiin. Rajatestin tarkoituksena on tehdä testi riittävän suurella pitoisuudella, jotta päättäjät voivat sulkea pois testikemikaalin mahdolliset toksiset vaikutukset, ja raja asetetaan pitoisuuteen, jota ei odoteta esiintyvän missään tilanteessa. Suositeltava arvo on 1 000 mg/kg (kuivapaino). Yleensä vähintään kuusi rinnakkaisnäytettä sekä testi- että kontrollinäytteestä on tarpeen. Testimenetelmälle tehdyn yhteistutkimuksen hypoteesitestauksen yhteydessä havaitusta tilastollisesta voimasta on tietoa lisäyksessä 6.
|
Altistumisolosuhteet
Testiorganismit
|
39.
|
Testiä tehtäessä jokaisessa biologisten parametrien määrittämiseen käytettävässä rinnakkaisnäytteessä on oltava vähintään 10 matoa. Tämä määrä vastaa noin 50–100 mg:aa märkää biomassaa. Kun kuiva-ainepitoisuudeksi oletetaan 17,1 prosenttia (48), tulokseksi saadaan noin 9–17 mg kuivaa biomassaa astiaa kohti. U.S. EPA:n (2000 (7)) suosituksen mukaan täyttöasteessa kuivan biomassan ja orgaanisen hiilen kokonaispitoisuuden suhdeluku saa olla enintään 1:50. Kun käytetään 22 kohdassa kuvattua synteettistä sedimenttiä, tämä vastaa noin 43 g:aa sedimenttiä (kuivapaino) kymmentä matoa kohti, kun orgaanisen hiilen kokonaispitoisuus on 2,0 prosenttia kuivasta sedimentistä. Jos matoja käytetään astiaa kohti yli 10 kappaletta, sedimentin ja yläpuolisen veden määrää mukautetaan vastaavasti.
|
|
40.
|
Testissä käytettävien matojen on oltava peräisin samasta lähteestä, ja eläinten fysiologisen tilan on oltava samanlainen (ks. lisäys 5). Testiä varten valitaan samankokoisia matoja (ks. 39 kohta). Matoerästä tai -kannasta otettu osanäyte on suositeltavaa punnita ennen testiä keskipainon arvioimiseksi.
|
|
41.
|
Testissä käytettävät madot poistetaan kasvatussäiliöstä (lisätietoa on lisäyksessä 5). Suurikokoiset (täysikasvuiset) eläimet, joissa ei ole merkkejä viimeaikaisesta jakaantumisesta, siirretään puhdasta vettä sisältäviin lasiastioihin (esimerkiksi petrimaljoihin). Tämän jälkeen ne synkronisoidaan lisäyksessä 5 kuvatulla tavalla. Kun madot ovat regeneroituneet 10–14 vuorokauden ajan, testiä varten valitaan vahingoittumattomia kokonaisia matoja, jotka ovat samankokoisia ja jotka uivat tai matelevat aktiivisesti kevyen mekaanisen ärsytyksen seurauksena. Jos testiolosuhteet poikkeavat viljelyolosuhteista esimerkiksi lämpötilan, valon ja pimeyden vaihtelun tai yläpuolisen veden osalta, matojen mukautumiseen testiolosuhteisiin riittää yleensä esimerkiksi 24 tunnin totutusjakso, jonka aikana lämpötila, valon ja pimeyden vaihtelu ja yläpuolinen vesi ovat samoja kuin testissä. Olosuhteisiin mukautuneet harvasukasmadot siirretään satunnaistetusti testiastioihin.
|
Ruokinta
|
42.
|
Ruokaa lisätään sedimenttiin ennen testikemikaalin applikointia (tai sen aikana), minkä vuoksi madoille ei anneta muuta ruokaa testin aikana.
|
Valo ja lämpötila
|
43.
|
Valoisa jakso kasvatuksessa ja testissä on tavallisesti 16 tuntia (3), (7). Valo pidetään suhteellisen heikkona (esimerkiksi 100–500 luksissa), millä jäljitellään luonnonolosuhteita sedimentin pinnalla. Valon voimakkuus mitataan vähintään kerran altistumisjakson aikana. Lämpötilan on oltava 20 ± 2 °C koko testin ajan. Kaikkina mittausajankohtina testiastioiden välinen lämpötilaero saa olla enintään ± 1 °C. Testiastiat sijoitetaan testi-inkubaattoriin tai testialueelle satunnaisessa järjestyksessä esimerkiksi siksi, että näin vältetään lisääntymisen vääristyminen astian sijainnin takia.
|
Ilmastus
|
44.
|
Yläpuolista vettä testiastioissa on ilmastettava kevyesti (esimerkiksi 2–4 ilmakuplaa sekunnissa) Pasteur-pipetillä, joka sijaitsee noin kahden sentin päässä sedimentin pinnasta sedimentin sekoittumisen välttämiseksi. Samalla on varottava, että liuenneen hapen pitoisuus ei laske alle 30 prosenttiin ilman kyllästysarvosta (ASV). Tuloilman määrää on seurattava ja sitä on tarvittaessa säädettävä arkisin vähintään kerran päivässä.
|
Veden laadun mittaaminen
|
45.
|
Yläpuolisesta vedestä mitataan seuraavat laatua kuvaavat parametrit:
|
Lämpötila:
|
mitataan vähintään yhdestä kutakin pitoisuustasoa edustavasta testiastiasta sekä yhdestä kontrolleihin kuuluvasta testiastiasta kerran viikossa sekä altistusjakson alussa ja lopussa; lisäksi ympäröivän väliaineen (huoneilman tai vesihauteen) lämpötila mitataan esimerkiksi tunnin välein
|
|
Liuenneen hapen pitoisuus:
|
mitataan vähintään yhdestä kutakin pitoisuustasoa edustavasta testiastiasta sekä yhdestä kontrolleihin kuuluvasta testiastiasta kerran viikossa sekä altistusjakson alussa ja lopussa; ilmoitetaan yksikköinä mg/l ja prosenttiosuus ASV:stä (ilman kyllästysarvo)
|
|
Tuloilma:
|
seurataan vähintään kerran päivässä arkipäivisin ja säädetään tarvittaessa
|
|
pH:
|
mitataan vähintään yhdestä kutakin pitoisuustasoa edustavasta testiastiasta sekä yhdestä kontrolleihin kuuluvasta testiastiasta kerran viikossa sekä altistusjakson alussa ja lopussa
|
|
Veden kokonaiskovuus:
|
mitataan vähintään yhdestä kontrolleihin kuuluvasta rinnakkaisnäytteestä sekä yhdestä korkeinta pitoisuutta edustavasta testiastiasta altistusjakson alussa ja lopussa; ilmoitetaan yksikköinä mg/l CaCO3
|
|
Ammoniakin kokonaispitoisuus:
|
mitataan vähintään yhdestä kontrolleihin kuuluvasta rinnakkaisnäytteestä sekä yhdestä kutakin pitoisuustasoa edustavasta testiastiasta altistusjakson alussa ja sen jälkeen kolmesti viikossa; ilmoitetaan yksikköinä mg/l NH4
+ tai NH3 tai kokonaisammoniakki-N
|
Jos veden laatua kuvaavien parametrien mittaaminen edellyttää merkittävien vesinäytteiden keräämistä astioista, voi olla suositeltavaa varata erilliset astiat veden laadun mittaamista varten, jotta veden ja sedimentin tilavuuksien välistä suhdetta ei muutettaisi.
|
Biologiset havainnot
|
46.
|
Altistusaikana testiastioita on tarkkailtava, jotta voidaan arvioida silmämääräisesti mahdollisia eroja matojen käyttäytymisessä (esimerkiksi sedimentin välttely, sedimentin pinnalla näkyvät ulostepelletit) kontrolleihin verrattuna. Havainnot kirjataan muistiin.
|
|
47.
|
Testin lopussa kaikki rinnakkaisnäytteet tutkitaan (kemiallisia analyysejä varten varatut ylimääräiset astiat voidaan jättää huomiotta). Kaikki madot kerätään testiastioista sopivaa menetelmää käyttäen. Madot on kerättävä niin varovasti, että ne saadaan talteen vahingoittumattomina. Eräs mahdollinen tapa on siivilöidä madot sedimentin joukosta. Tähän tarkoitukseen voidaan käyttää silmäkooltaan sopivaa ruostumattomasta teräksestä valmistettua siivilää. Suurin osa yläpuolisesta vedestä dekantoidaan varovasti ja jäljelle jäävää sedimenttiä ja vettä sekoitetaan, jotta muodostuu lietettä, joka voidaan kaataa siivilän läpi. Kun siivilän silmäkoko on 500 μm, suurin osa sedimenttihiukkasista menee nopeasti siivilän läpi. Siivilöinti on kuitenkin syytä tehdä ripeästi, jotta madot eivät pääse luikertelemaan siivilän reikiin tai niiden läpi. Kun siivilän silmäkoko on 250 μm, madot eivät pääse luikertelemaan siivilän rei'istä, mutta tällöin on huolehdittava, että sedimenttihiukkasia jää siivilään mahdollisimman vähän. Kustakin rinnakkaisnäyteastiasta peräisin oleva siivilöity liete voidaan siivilöidä vielä uudelleen, jotta kaikki madot saadaan varmasti talteen. Vaihtoehtoinen menetelmä on sedimentin lämmittäminen asettamalla testiastiat vesihauteeseen, jonka lämpötila on 50–60 °C. Madot poistuvat sedimentistä, jolloin ne voidaan kerätä sedimentin pinnalta leveäsuisella, liekkikiillotetulla pipetillä. Toisessa vaihtoehtoisessa menetelmässä sedimentistä tehdään lietettä, joka kaadetaan sopivankokoiseen matalaan astiaan. Matalasta lietekerroksesta madot voidaan poimia teräsneulalla tai teräväkärkisillä pinseteillä (joita käytetään haarukan tapaan, ei pihteinä, jotta madot eivät vahingoitu) ja siirtää puhtaaseen veteen. Kun madot on erotettu sedimenttilietteestä, ne huuhdellaan testiväliaineessa ja lasketaan.
|
|
48.
|
Käytetystä menetelmästä riippumatta laboratorioiden on osoitettava, että niiden henkilökunta pystyy ottamaan talteen vähintään 90 prosenttia koko sedimentissä olevista organismeista. Tietty määrä testiorganismeja voidaan esimerkiksi lisätä kontrollisedimenttiin tai testisedimentteihin ja talteenoton onnistumista voidaan arvioida tunnin kuluttua (7).
|
|
49.
|
Elävien ja kuolleiden yksilöiden kokonaismäärä rinnakkaisnäytettä kohti kirjataan muistiin ja analysoidaan. Madot katsotaan kuolleiksi, jos ne täyttävät jonkin seuraavista tunnusmerkeistä:
|
a)
|
varovainen mekaaninen ärsyke ei aiheuta reaktiota
|
|
b)
|
madossa näkyy merkkejä maatumisesta (yhdessä a-kohdan kanssa)
|
Lisäksi elävät madot voidaan jakaa kolmeen ryhmään:
|
a)
|
suurikokoiset, vahingoittumat yksilöt (täysikasvuiset), joilla ei ole regeneroituneita vartalon osia
|
|
b)
|
vahingoittumat yksilöt, joilla on väriltään vaaleampia, regeneroituneita vartalon osia (uusi takapää, uusi etupää tai molemmat)
|
|
c)
|
vahingoittuneet yksilöt (äskettäin osia menettäneet yksilöt, joiden vartalon osat eivät ole regeneroituneet).
|
Nämä lisähuomiot eivät ole välttämättömiä, mutta niitä voidaan hyödyntää biologisten tulosten tarkemmassa tulkitsemisessa (esimerkiksi suuri määrä c-ryhmään kuuluvia matoja saattaa tarkoittaa, että tietyssä käsittelyssä lisääntyminen tai regeneroituminen on viivästynyt). Lisäksi on syytä todeta ja kirjata muistiin eroavaisuudet käsiteltyjen ja kontrollimatojen ulkonäössä (esimerkiksi integumentissa olevat leesiot tai pöhöttyneet vartalon osat).
|
|
50.
|
Välittömästi laskennan ja analysoinnin jälkeen jokaisesta rinnakkaisnäytteestä talteen otetut elävät madot siirretään kuivattuihin, etukäteen punnittuihin ja merkittyihin vaakakuppeihin (yksi jokaiselle rinnakkaisnäytteelle) ja lopetetaan tiputtamalla pisara etanolia jokaiseen vaakakuppiin. Vaakakuppeja kuivataan yön yli kuivausuunissa, jonka lämpötila on 100 ± 5 °C, minkä jälkeen vaakakupit jäähdytetään eksikkaattorissa ja punnitaan, ja matojen kuivapaino kirjataan muistiin (mieluiten grammoina ja vähintään neljän desimaalin tarkkuudella).
|
|
51.
|
Kokonaiskuivapainon lisäksi voidaan todeta tuhkaton kuivapaino kirjallisuusviitteessä (49) kuvatulla tavalla, jotta huomioon otetaan myös matojen ruoansulatuskanavassa olevasta sulamattomasta sedimentistä peräisin olevat epäorgaaniset yhdisteet.
|
|
52.
|
Biomassa määritetään kokonaisbiomassana rinnakkaisnäytettä kohti sisältäen täysikasvuiset madot ja poikaset. Kuolleita matoja ei huomioida rinnakkaisnäytekohtaista biomassaa määritettäessä.
|
Testikemikaalin pitoisuuksien toteaminen
Näytteenotto
|
53.
|
Testikemikaalin kemiallista analyysia varten tarvittavat näytteet otetaan ainakin kaikkein suurimmasta pitoisuudesta sekä yhdestä pienemmästä pitoisuudesta vähintään tasapainottumisvaiheen lopussa (ennen testiorganismien lisäämistä) sekä testin lopussa. Analyysia varten otetaan näytteet vähintään irtosedimentistä ja yläpuolisesta vedestä. Jokaista matriisia ja käsittelyä kohti otetaan kaikkina näytteenottopäivinä vähintään kaksi näytettä. Toinen kahdesta näytteestä voidaan säästää varalle (analysoitavaksi esimerkiksi siinä tapauksessa, että alkuperäinen analyysi ei ole nimellispitoisuuden ± 20 prosentin vaihteluvälin sisällä). Jos kemikaalilla on erityisominaisuuksia ja sen esimerkiksi odotetaan hajoavan nopeasti, analyysien aikataulua voidaan muuttaa (esimerkiksi näytteenottotiheyttä voidaan kasvattaa tai analysoitavien pitoisuustasojen määrää lisätä) asiantuntija-arvion perusteella. Näytteitä voidaan tällöin ottaa välinäytteenottopäivinä (esimerkiksi seitsemäntenä päivänä altistuksen alkamisesta lukien).
|
|
54.
|
Yläpuolisesta vedestä otetaan näytteitä varovasti dekantoimalla tai lapolla, jotta sedimentti sekoittuu mahdollisimman vähän. Näytteiden tilavuus kirjataan muistiin.
|
|
55.
|
Kun yläpuolinen vesi on poistettu, sedimentti homogenoidaan ja siirretään sopivaan säiliöön. Märän sedimentin paino kirjataan muistiin.
|
|
56.
|
Jos lisäksi tarvitaan huokosvedessä olevan kemikaalin analysointia, homogenoidut ja punnitut sedimenttinäytteet sentrifugoidaan, jolloin saadaan huokosvettä. Noin 200 ml märkää sedimenttiä voidaan esimerkiksi laittaa 250 ml:n sentrifugointiastioihin. Tämän jälkeen näytteitä sentrifugoidaan ilman suodatusta huokosveden erottamiseksi esimerkiksi kierrosnopeudella 10 000 ± 600 × g 30–60 minuutin ajan enintään testilämpötilassa. Sentrifugoinnin jälkeen supernatantti dekantoidaan tai pipetoidaan varovasti, jotta sedimenttipartikkeleita ei tule mukaan, ja tilavuus kirjataan muistiin. Jäljelle jääneen sedimenttikakun paino kirjataan muistiin. Massataseen arviointi tai testikemikaalin talteenotto vesi-sedimenttijärjestelmästä on helpompaa, jos sedimentin kuivapaino määritetään jokaisena näytteenottopäivänä. Joskus pitoisuuksien analysointi huokosvedestä ei ole mahdollista, koska näyte on liian pieni.
|
|
57.
|
Jos analyysia ei tehdä välittömästi, kaikki näytteet varastoidaan asianmukaisesti esimerkiksi olosuhteissa, joita suositellaan, jotta kyseinen testikemikaali hajoaisi mahdollisimman vähän (esimerkiksi ympäristöstä kerättyjä näytteitä säilytetään yleensä pimeässä ja – 18 °C:n lämpötilassa). Kerää tietoa kunkin testikemikaalin asianmukaisista säilytysolosuhteista – esimerkiksi säilytyslämpötilasta, säilytyksen kestosta ja talteenottomenetelmistä – ennen tutkimuksen aloittamista.
|
Analyysimenetelmä
|
58.
|
Koko menetelmään vaikuttaa olennaisesti testikemikaalin määritykseen käytettävän menetelmän tarkkuus, täsmällisyys ja herkkyys, minkä vuoksi on todettava kokeellisesti, että kyseisessä menetelmässä kemiallisen määrityksen täsmällisyys ja toistettavuus samoin kuin testikemikaalin saanto vesi- ja sedimenttinäytteistä ovat kyseisen menetelmän kannalta hyväksyttäviä ainakin pienimmän ja suurimman testipitoisuuden osalta. Lisäksi on tarkistettava, ettei testikemikaalia havaita kontrolliastioissa määritysrajaa suurempia pitoisuuksia. Tarvittaessa laadunvalvonnan huippuarvojen saannon nimellispitoisuuksia voidaan korjata (esimerkiksi silloin, kun saanto on alle 80 tai yli 120 prosenttia lisätystä määrästä). Käsittele kaikkia näytteitä testin aikana siten, että kontaminaatio ja häviö ovat mahdollisimman pieniä (niitä voi aiheuttaa esimerkiksi testikemikaalin adsorptoituminen näytteenottovälineisiin).
|
|
59.
|
Testikemikaalin saanto, määritysraja sekä havaitsemisraja sedimentissä ja vedessä kirjataan muistiin ja ilmoitetaan.
|
TIEDOT JA RAPORTOINTI
Tulosten käsittely
|
60.
|
Testin tärkeimmät pakolliset vastemuuttujat, joita arvioidaan tilastollisesti, ovat biomassa ja matojen kokonaismäärä rinnakkaisnäytettä kohti. Lisääntymistä (matojen määrän lisääntyminen) ja kasvua (kuivan biomassan määrän kasvu) voidaan niin haluttaessa myös arvioida. Tässä tapauksessa on tehtävä arvio matojen kuivapainosta altistumisen alussa esimerkiksi mittaamalla synkronoidusta, testiin käytettävästä matoerästä otetun edustavan osanäytteen kuivapaino.
|
|
61.
|
Kuolleisuus ei ole tutkittava ominaisuus tässä testissä, mutta kuolleisuutta olisi kuitenkin arvioitava mahdollisimman tarkasti. Kuolleisuutta arvioitaessa kuolleiksi katsotaan madot, joita ei löydy, jotka eivät reagoi varovaiseen mekaaniseen ärsykkeeseen tai joissa näkyy merkkejä maatumisesta. Kuolleiden matojen määrä on ainakin kirjattava muistiin ja otettava huomioon testituloksia tulkittaessa.
|
|
62.
|
Vaikuttavat pitoisuudet ilmaistaan milligrammoina sedimentin kuivapainokiloa kohti. Jos sedimentissä tai sedimentissä ja yläpuolisessa vedessä altistuksen alussa mitatun testikemikaalin saanto on 80–120 prosenttia nimellispitoisuudesta, vaikuttavat pitoisuudet (ECx-, NOEC- ja LOEC-arvo) voidaan ilmoittaa nimellispitoisuuksien perusteella. Jos saanto poikkeaa nimellispitoisuudesta yli ± 20 prosenttia, vaikuttavien pitoisuuksien (ECx-, NOEC- ja LOEC-arvon) on perustuttava altistuksen alussa mitattuihin pitoisuuksiin ottaen samalla huomioon esimerkiksi testikemikaalin massataseen testijärjestelmässä (ks. 30 kohta). Näissä tapauksissa lisätietoa saadaan analysoimalla kanta- ja/tai applikointiliuoksia, millä voidaan todentaa, että testisedimentit oli valmistettu oikein.
|
ECx
|
63.
|
Tämän testiohjeen 60 kohdasssa kuvattujen parametrien ECx-arvot lasketaan sopivien tilastollisten menetelmien avulla (esimerkiksi tilastollinen koestus, logistinen funktio tai Weibullin funktio, viritetty Spearmanin ja Kärberin menetelmä tai yksinkertainen interpolointi). Ohjeita tilastollisen arvioinnin tekemistä varten on kirjallisuusviitteissä (15) ja (50). ECx saadaan lisäämällä yhtälöön kontrollin keskiarvon x prosenttia vastaava arvo. Jos halutaan laskea EC50 tai jokin muu ECx-arvo, käsittelyä edeltävälle keskiarvolle (
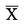
) olisi tehtävä regressioanalyysi. |
NOEC/LOEC
|
64.
|
Jos tilastollisella analyysilla on tarkoitus määrittää NOEC/LOEC-arvo, astiakohtaiset tilastot (yksittäisiä astioita pidetään rinnakkaisnäytteinä) ovat tarpeen. Laskennassa käytetään asianmukaisia tilastollisia menetelmiä. Yleensä testin kohteen haitallisia vaikutuksia verrattuna kontrolliin tutkitaan käyttämällä yksisuuntaista (pienempää) hypoteesitestausta, jossa p ≤ 0,05. Esimerkkejä annetaan seuraavissa kappaleissa. Ohjeita sopivan tilastollisen menetelmän valintaa varten on kirjallisuusviitteissä (15) ja (50).
|
|
65.
|
Datan normaalijakaumaa voidaan testata esimerkiksi Kolmogorov-Smirnovin sopivuustestillä, vaihteluvälin ja normaalijakauman suhdetta mittaavalla R/s-testillä tai Shapiro-Wilk-testillä (kaksisuuntainen, p ≤ 0,05). Cochranin testiä, Levenen testiä tai Bartlettin testiä (kaksisuuntainen, p ≤ 0,05) voidaan käyttää varianssin homogeenisuuden testaamiseen. Jos parametritestimenetelmien edellytykset (normaalius, varianssin homogeenisuus) täyttyvät, voidaan tehdä yksisuuntainen varianssianalyysi (ANOVA) sekä tämän jälkeen monivertailutestejä. Parivertailuja (esimerkiksi Dunnettin t-testiä) tai alaspäin askeltavia trenditestejä (esimerkiksi Williamsin testiä) voidaan käyttää sen laskemiseen, onko kontrollien ja eri testikohdepitoisuuksien välillä merkitseviä eroja (p ≤ 0,05). Muutoin NOEC- ja LOEC-arvojen määrittämisessä käytetään parametrittomia menetelmiä (esimerkiksi Bonferroni-U-testiä Holmin mukaan tai Jonckheere-Terpstran trenditestiä).
|
Raja-annostesti
|
66.
|
Jos raja-annostesti (kontrollin ja vain yhden käsittelyn vertailu) on tehty ja jos parametristen testimenetelmien vaatimukset (normaalius, homogeenisuus) täyttyvät, metrisiä vasteita (matojen kokonaismäärä sekä biomassa matojen kuivapainona) voidaan arvioida Studentin testillä (t-testillä). Jos vaatimukset eivät täyty, voidaan käyttää t-testiä, jossa varianssit ovat heterogeenisia (Welchin t-testi) tai parametritonta testiä, kuten Mann-Whitney-U-testiä. Menetelmälle tehdyn yhteistutkimuksen hypoteesitestauksen yhteydessä havaitusta tilastollisesta voimasta on tietoa lisäyksessä 6.
|
|
67.
|
Kontrollien välisten (kontrolli ja liuotinkontrolli) merkitsevien erojen määrittämiseksi jokaisen kontrollin rinnakkaisnäytteet voidaan testata raja-annoksen yhteydessä kuvatulla tavalla. Jos näissä testeissä ei havaita merkitseviä eroja, kaikki kontrolli- ja liuotinkontrollirinnakkaisnäytteet voidaan yhdistää. Muussa tapauksessa kaikkia käsittelyjä tulee vertailla liuotinkontrolliin.
|
Tulosten tulkinta
|
68.
|
Tulosten tulkinnassa on oltava varovainen, jos kuvatusta testimenetelmästä on poikettu ja jos testipitoisuuksista mitatut pitoisuudet ovat lähellä käytetyn analyysimenetelmän havaitsemisrajaa. Kaikki poikkeamat testimenetelmästä on kirjattava muistiin.
|
Testiraportti
|
69.
|
Testiraportissa on annettava ainakin seuraavat tiedot:
|
—
|
Testikemikaali:
|
—
|
kemialliset tunnistetiedot (yleisnimi, kemiallinen nimi, rakennekaava, CAS-numero jne.) sekä puhtaus ja testiaineen kvantifioinnissa käytetty analyysimenetelmä; testikemikaalin lähde, liuottimen tunnistetiedot ja pitoisuus
|
|
—
|
kaikki ennen testin alkua hankitut tiedot fysikaalisesta olomuodosta ja fysikaalis-kemiallisista ominaisuuksista (esimerkiksi vesiliukoisuus, höyrynpaine, jakaantumiskerroin maa-aineksessa (tai sedimentissä, jos saatavissa), log Kow ja stabiilisuus vedessä)
|
|
|
—
|
Testilajit:
|
—
|
tieteellinen nimi, lähde, mahdollinen esikäsittely, totuttamistiedot, viljelyolosuhteet jne.
|
|
|
—
|
Testiolosuhteet:
|
—
|
testauksessa käytetty menetelmä (staattinen, semistaattinen tai läpivirtausmenetelmä)
|
|
—
|
testijärjestely (testiastioiden lukumäärä, materiaali ja koko, veden tilavuus astiaa kohti, sedimentin massa ja tilavuus astiaa kohti, (läpivirtaus- tai semistaattisissa menetelmissä veden vaihtumisnopeus,) ennen testiä ja sen aikana käytetty ilmastus, rinnakkaisnäytteiden määrä, matojen lukumäärä rinnakkaisnäytettä kohti altistuksen alussa, testipitoisuuksien lukumäärä, vakioimis-, tasaantumis- ja altistusvaiheiden pituus, näytteenottotiheys)
|
|
—
|
sedimentin ja sen päällä olevan veden syvyys
|
|
—
|
testikemikaalin esikäsittelymenetelmä sekä lisäämis-/applikointimenetelmä
|
|
—
|
nimelliset testipitoisuudet, tiedot kemiallista analyysia varten otetuista näytteistä sekä analyysimenetelmät, joilla testikemikaalin pitoisuudet saatiin;
|
|
—
|
testimenetelmän 24–25 kohdassa kuvatut sedimentin ominaisuudet ja kaikki muut tehdyt mittaukset; synteettisen sedimentin valmistus
|
|
—
|
testiveden valmistus (jos käytetään synteettistä vettä) ja ominaisuudet (happipitoisuus, pH, johtavuus, kovuus ja kaikki muut tehdyt mittaukset) ennen testin alkua
|
|
—
|
yksityiskohtaiset tiedot ruokinnasta, kuten ravinnon tyyppi, valmistus, määrä ja ruokinta-aikataulu
|
|
—
|
valon voimakkuus ja valoisan ajan määrä
|
|
—
|
kaikkien biologisten parametrien määrityksessä käytetyt menetelmät (esimerkiksi näytteenotto ja testiorganismien tutkiminen ja punnitseminen) sekä abioottisten parametrien määrityksessä käytetyt menetelmät (esimerkiksi veden ja sedimentin laatua kuvaavat parametrit)
|
|
—
|
kaikkien kemiallista analyysia varten otettujen näytteiden tilavuudet ja/tai painot
|
|
—
|
tarkat tiedot kaikkien kemiallisesti analysoitavien näytteiden käsittelystä, mukaan luettuina tiedot testikemikaalin valmistuksesta, säilytyksestä, lisäämistavasta, talteenotosta ja analyysimenetelmistä (ja tarkkuudesta) sekä testikemikaalin saannista.
|
|
|
—
|
Tulokset:
|
—
|
veden laatu testiastioissa (pH-arvo, lämpötila, liuenneen hapen pitoisuus, kovuus, ammoniakkipitoisuudet ja kaikki muut tehdyt mittaukset)
|
|
—
|
orgaanisen hiilen kokonaispitoisuus (TOC), kuivapainon ja märkäpainon suhde, sedimentin pH-arvo ja kaikki muut tehdyt mittaukset
|
|
—
|
matojen kokonaismäärä sekä täydellisten ja epätäydellisten matojen määrä jokaisessa testikammiossa testin lopussa, jos tämä on määritetty
|
|
—
|
jokaisessa testikammiossa testin lopussa olleiden matojen kuivapaino sekä madoista otetun osanäytteen kuivapaino testin alussa, jos tämä on mitattu
|
|
—
|
havaittu epätavallinen käyttäytyminen kontrolleihin verrattuna (esimerkiksi sedimentin välttäminen, ulostepellettien mahdollinen esiintyminen)
|
|
—
|
myrkyllisten tutkittavien ominaisuuksien estimaatit (kuten ECx-, NOEC- ja/tai LOEC-arvo) ja niiden määrittämiseen käytetyt tilastolliset menetelmät
|
|
—
|
kaikki nimelliset testipitoisuudet, mitatut testipitoisuudet ja tulokset kaikista analyyseistä, joilla määritettiin testikemikaalin pitoisuus testiastiassa
|
|
—
|
poikkeamat hyväksyttävyyskriteereistä.
|
|
|
—
|
Tulosten arviointi
|
—
|
kohdassa 13 annettujen hyväksyttävyyskriteerien täyttyminen
|
|
—
|
tulosten pohdinta, mukaan luettuna mahdolliset vaikutukset, joita tästä testimenetelmästä poikkeamisella on ollut testin tuloksiin.
|
|
|
LÄHDEKIRJALLISUUS
|
(1)
|
Euroopan komissio (2003). Tekninen ohjeasiakirja, jolla tuetaan uusien ilmoitettujen aineiden vaarojen arviointiperiaatteiden vahvistamisesta annettua komission direktiiviä 93/67/ETY, olemassa olevien aineiden vaarojen arviointiperiaatteiden vahvistamisesta annettua komission asetusta (EY) N:o 1488/94 sekä biosidituotteiden markkinoille saattamisesta annettua Euroopan parlamentin ja neuvoston direktiiviä 98/8/EY, osa I–IV. Euroopan unionin julkaisutoimisto, Luxemburg.
|
|
(2)
|
OECD (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Organisation for Economic Co-operation and Development (OECD), Paris.
|
|
(3)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. Teoksessa ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(4)
|
ASTM International (2002). Standard Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, E1706-00. Teoksessa ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(5)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. and Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269–279.
|
|
(6)
|
Tämän liitteen luku C.27. Surviaissääskillä tehtävä myrkyllisyystesti, käyttäen vettä tai sedimenttiä, joihin on lisätty tutkittavaa ainetta.
|
|
(7)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(8)
|
Environment Canada (1997). Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius). Biological Test Method. Report SPE 1/RM/32. December 1997.
|
|
(9)
|
Hill, I.R., Matthiessen, P., Heimbach, F. (eds), 1993, Guidance document on Sediment Toxicity Tests and Bioassays for freshwater and Marine Environments, From the SETAC-Europe Workshop On Sediment Toxicity Assessment, 8-10 November 1993, Renesse (NL).
|
|
(10)
|
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Edited by M. Streloke and H.Köpp. Berlin 1995.
|
|
(11)
|
Riedhammer C. & B. Schwarz-Schulz (2001). The Newly Proposed EU Risk Assessment Concept for the Sediment Compartment. J. Soils Sediments 1(2), 105–110.
|
|
(12)
|
ASTM International (2004). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing and for selection of samplers used to collect benthic invertebrates. American Society for Testing and Materials, E 1391-03.
|
|
(13)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
(14)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
(15)
|
Environment Canada (2003). Guidance Document on Statistical Methods for Environmental Toxicity Tests; fifth draft, March 2003; Report EPS 1/RM/___
|
|
(16)
|
Nikkilä A., Halme A., Kukkonen J.V.K. (2003). Toxicokinetics, toxicity and lethal body residues of two chlorophenols in the oligochaete worm, Lumbriculus variegatus, in different sediments. Chemosphere 51: 35–46.
|
|
(17)
|
Baily H.C., & Liu D.H.W. (1980). Lumbriculus variegatus, a Benthic Oligochaete, as a Bioassay Organism. s. 205–215. Teoksessa J.C. Eaton, P.R. Parrish, and A.C. Hendricks (eds). Aquatic Toxicology, ASTM STP 707. American Society for Testing and Materials.
|
|
(18)
|
Chapman K. K., Benton M. J., Brinkhurst R. O. & Scheuerman P. R. (1999). Use of the aquatic oligochaetes Lumbriculus variegatus and Tubifex tubifex for assessing the toxicity of copper and cadmium in a spiked-artificial-sediment toxicity test. Environmental Toxicology. 14(2): 271–278.
|
|
(19)
|
Meyer J.S., Boese C.J. & Collyard S.A. (2002). Whole-body accumulation of copper predicts acute toxicity to an aquatic oligochaete (Lumbriculus variegatus) as pH and calcium are varied. Comp. Biochem. Physiol. Part C 133:99–109.
|
|
(20)
|
Schubauer-Berigan M.K., Dierkes J.R., Monson P.D. & Ankley G.T. (1993). pH-dependent toxicity of cadmium, copper, nickel, lead and zinc to Ceriodaphnia dubia, Pimephales promelas, Hyalella azteca and Lumbriculus variegatus. Environ. Toxciol. Chem. 12(7):1261–1266.
|
|
(21)
|
West, C.W., V.R. Mattson, E.N. Leonard, G.L. Phipps & G.T. Ankley (1993). Comparison of the relative sensitivity of three benthic invertebrates to copper-contaminated sediments from the Keweenaw Waterway. Hydrobiol. 262:57–63.
|
|
(22)
|
Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P. F., Norberg-King, T. J. and Winger, P.V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885–1894.
|
|
(23)
|
Kukkonen, J. and Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457–1468.
|
|
(24)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196–2202.
|
|
(25)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183–194.
|
|
(26)
|
Landrum, P.F., Gedeon, M.L., Burton, G.A., Greenberg. M.S., & Rowland, C.D. (2002). Biological Responses of Lumbriculus variegatus Exposed to Fluoranthene-Spiked Sediment. Arch. Environ. Contam. Toxicol. 42: 292–302.
|
|
(27)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191–201.
|
|
(28)
|
Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J. and Landrum, P. F. (2003). Uptake and depuration of non-ionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872–885.
|
|
(29)
|
Rodriguez, P. & Reynoldson, T.B. (1999). Laboratory methods and criteria for sediment bioassessment. Teoksessa: A. Mudroch, J.M. Azcue & P. Mudroch (eds.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
(30)
|
Liebig, M., Egeler, Ph. Oehlmann, J., & Knacker, Th. (2005). Bioaccumulation of 14C-17α-ethinylestradiol by the oligochaete Lumbriculus variegatus in artificial sediment. Chemosphere 59, 271–280.
|
|
(31)
|
Brust, K., O. Licht, V. Hultsch, D. Jungmann & R. Nagel (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, Vol. 20, s. 2000–2007.
|
|
(32)
|
Oetken, M., K.-U. Ludwichowski & R. Nagel (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. By order of the Federal Environmental Agency (Umweltbundesamt Berlin), FKZ 360 12 001, March 2000.
|
|
(33)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503–1508.
|
|
(34)
|
Dermott R. & Munawar M. (1992). A simple and sensitive assay for evaluation of sediment toxicity using Lumbriculus variegatus (Müller). Hydrobiologia 235/236: 407–414.
|
|
(35)
|
Drewes C.D. & Fourtner C.R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94–103.
|
|
(36)
|
Brinkhurst, R.O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
(37)
|
Tämän liitteen luku C.1 Akuutti myrkyllisyys kalalle.
|
|
(38)
|
OECD (1992c). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Paris.
|
|
(39)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. & Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835–852.
|
|
(40)
|
Meller, M., P. Egeler, J. Roembke, H. Schallnass, R. Nagel and B. Streit. (1998). Short-term Toxicity of Lindane, Hexachlorobenzene and Copper Sulphate on Tubificid Sludgeworms (Oligochaeta) in Artificial Media. Ecotox. and Environ. Safety, 39, 10–20.
|
|
(41)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C. & Studinger, G. (1999). Workshop on ’Bioaccumulation: Sediment test using benthic oligochaetes’, 26.-27.4.1999, Hochheim/Main, Germany. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlin.
|
|
(42)
|
Suedel, B.C. and Rodgers, J.H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163–1175.
|
|
(43)
|
Naylor, C. and C. Rodrigues. (1995). Development of a test method for Chironomus riparius using a formulated sediment. Chemosphere 31: 3291–3303.
|
|
(44)
|
Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J. & Smith, M.E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181–184.
|
|
(45)
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J.I. & Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111–124.
|
|
(46)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
(47)
|
Landrum, P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Technol. 23, 588–595.
|
|
(48)
|
Brooke, L.T., Ankley, G.T., Call, D.J. & Cook, P.M. (1996). Gut content and clearance for three species of freshwater invertebrates. Environ. Toxicol. Chem. 15, 223–228.
|
|
(49)
|
Mount, D.R., Dawson, T.D. & Burkhard, L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244–1249.
|
|
(50)
|
OECD 2006. Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. OECD Series on Testing and Assessment No. 54, OECD, Paris, France.
|
|
(51)
|
Liebig M., Meller M. & Egeler P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten – Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. March 24-25, 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Germany. s. 107–119.
|
Muuta kirjallisuutta tilastollisista menetelmistä:
Dunnett, C.W. (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096–1121.
Dunnett, C.W. (1964). New tables for multiple comparisons with a control. Biometrics 20, 482-491.
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19–76. Cambridge Univ. Press.
Finney, D.J. (1978). Statistical Method in Biological Assay. Charles Griffin & Company Ltd, London.
Hamilton, M.A., R.C. Russo and R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714–719; Correction: Environ. Sci. Technol. 12 (1998), 417.
Holm, S. (1979). A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65–70.
Sokal, R.R. and F.J. Rohlf. (1981) Biometry. The principles and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
Miller, R.G., Jr. (1986). Beyond ANOVA, basics of applied statistics. John Wiley & Sons. New York.
Shapiro S.S. & Wilk M.B (1965). An analysis of variance test for normality (complete samples). Biometrika 52: 591–611.
Williams, D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103–117.
Williams, D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519–531.
Lisäys 1
Määritelmät
Tässä testimenetelmässä käytetään seuraavia määritelmiä:
Kemikaali
: aine tai seos.
Vakioimisvaihe
: Käytetään sedimentin mikrobien vakauttamiseen ja esimerkiksi sedimentin ainesosissa olevan ammoniakin poistamiseen; sopeuttaminen tehdään ennen testikemikaalin lisäämistä sedimenttiin. Tavallisesti yläpuolinen vesi hävitetään vakioimisen jälkeen.
ECx
: testikemikaalin pitoisuus sedimentissä, jonka seurauksena johonkin biologiseen parametriin kohdistuu x prosentin (esimerkiksi 50 prosentin) suuruinen vaikutus mainitun altistusajan kuluessa.
Tasapainottumisaika
: käytetään testikemikaalin jakaantumiseen kiinteään faasiin, huokosveteen ja yläpuoliseen veteen. Sitä sovelletaan ennen testikemikaalin lisäämistä sedimenttiin ja ennen testiorganismien lisäämistä.
Altistumisvaihe
: aika, jona testiorganismit altistetaan testattavalle kemikaalille.
Synteettinen sedimentti
: luonnollisen sedimentin fyysisiä ainesosia jäljittelevistä materiaaleista valmistettu seos.
LOEC (Lowest Observed Effect Concentration)
: Pienin testikemikaalin testattu pitoisuus, jolla kemikaalin havaitaan aiheuttavan merkitsevän vaikutuksen (p < 0,05) verrattuna kontrolliin. Ehtona on myös, että kaikilla LOEC-pitoisuutta suuremmilla testipitoisuuksilla on oltava vähintään yhtä suuri vaikutus kuin LOEC-pitoisuudella. Jos nämä kaksi ehtoa eivät täyty, on annettava tyhjentävä selitys siitä, miten LOEC-pitoisuus (ja myös NOEC-pitoisuus) on valittu.
NOEC (No Observed Effect Concentration)
: LOEC:tä pienempi testipitoisuus, jolla ei ole kontrolliin verrattuna tietyllä altistusajanjaksolla tilastollisesti merkittävää vaikutusta (todennäköisyystasolla p < 0,05).
Oktanoli-vesi-jakaantumiskerroin (Kow, joskus myös Pow): Kemikaalin prosentuaalinen liukoisuus n-oktanoliin ja veteen tasapainotilassa. Edustaa kemikaalin lipofiilisyyttä (tämän liitteen A.24 luku). Kow-arvoa tai sen logaritmia (log Kow) käytetään ilmaisemaan kemikaalin biokertyvyyspotentiaalia vesieliöissä.
Orgaaninen hiili-vesi-jakaantumiskerroin (Koc): sedimentin orgaanisen hiilen fraktiossa tai sen pinnalla olevan kemikaalin pitoisuuden ja vedessä tasapainotilassa olevan pitoisuuden välinen suhde.
Yläpuolinen vesi
: testiastiassa sedimentin peittävä vesi.
Huokosvesi
: sedimentin tai maa-aineksen hiukkasten välissä olevaa vettä.
Käsitelty sedimentti
: sedimenttiä, johon on lisätty testiaine.
Testikemikaali
: tätä testimenetelmää käyttäen testattu aine tai seos.
Lisäys 2
Suositellun synteettisen veden koostumus
(muokattu tämän liitteen C.1 luvusta (1))
|
a)
|
Kalsiumkloridiliuos
Liuota 11,76 g CaCl2 · 2H2O:ta deionisoituun veteen ja lisää deionisoitua vettä yhteen litraan saakka.
|
|
b)
|
Magnesiumsulfaattiliuos
Liuota 4,93 g MgSO4 · 7 H2O:ta deionisoituun veteen ja lisää deionisoitua vettä yhteen litraan saakka.
|
|
c)
|
Natriumbikarbonaattiliuos
Liuota 2,59 g NaHCO3:a deionisoituun veteen ja lisää deionisoitua vettä yhteen litraan saakka.
|
|
d)
|
Kaliumkloridiliuos
Liuota 0,23 g KCl:a deionisoituun veteen ja lisää deionisoitua vettä yhteen litraan saakka.
|
Kaikkien kemikaalien on oltava analyyttistä laatua.
Tislatun tai deionisoidun veden johtavuus saa olla enintään 10 μScm– 1.
25 ml jokaisesta liuoksesta (a–d) sekoitetaan ja kokonaistilavuudeksi valmistetaan yksi litra deionisoidulla vedellä. Näiden liuosten kalsium- ja magnesiumionien summa on 2,5 mmol/l.
Ca:Mg-ionien suhde on 4:1 ja Na:K-ionien suhde on 10:1. Tämän liuoksen happokapasiteetti KS4.3 on 0,8 mmol/l.
Ilmasta laimennusvettä, kunnes happikyllästys saavutetaan, ja säilytä sitä sen jälkeen noin kaksi päivää ilmastamatta ennen käyttöä.
VIITE
|
(1)
|
Tämän liitteen luku C.1 Akuutti myrkyllisyys kalalle.
|
Lisäys 3
Hyväksyttävän laimennusveden fysikaalis-kemialliset ominaisuudet
|
Komponentti
|
Pitoisuudet
|
|
Hiukkaset
|
< 20 mg/l
|
|
Orgaanisen hiilen kokonaismäärä
|
< 2 μg/l
|
|
Ionisoitumaton ammoniakki
|
< 1 ug/l
|
|
Jäännöskloori
|
< 10 μg/l
|
|
Orgaanista fosforia sisältävien torjunta-aineiden kokonaismäärä
|
< 50 ng/l
|
|
Orgaanista klooria sisältävien torjunta-aineiden ja polykloorattujen bifenyylien kokonaismäärä
|
< 50 ng/l
|
|
Orgaanisen kloorin kokonaismäärä
|
< 25 ng/l
|
|
mukautettu kirjallisuuslähteestä OECD (1992) (1))
|
VIITE
|
(1)
|
OECD (1992). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Paris.
|
Lisäys 4
Suositeltu keinosedimentti – valmistus- ja varastointiohjeet
Sedimentin ainesosat
|
Ainesosa
|
Ominaisuudet
|
% sedimentin kuivapainosta
|
|
Turve
|
Rahkasammalturve, maatumisaste: ’medium’, ilmakuivattu, ei näkyviä kasvinjäänteitä, hienojakoinen (hiukkaskoko ≤ 0,5 mm)
|
5 ± 0,5
|
|
Kvartsihiekka
|
Raekoko: ≤ 2 mm, mutta > 50 prosenttia hiukkasista on oltava kokoa 50–200 μm
|
75–76
|
|
Kaoliniittisavi
|
Kaoliniittipitoisuus ≥ 30 %
|
20 ± 1
|
|
Ravinto
|
esimerkiksi jauhettua Folia urticae -kasvia, nokkosen (Urtica dioica) lehtiä hienoksi jauhettuna (hiukkaskoko ≤ 0,5 mm), lääkestandardien ja elintarvikkeita koskevien vaatimusten mukaisesti; kuivan sedimentin lisäksi
|
0,4–0,5 %
|
|
Orgaaninen hiili
|
Säädetään lisäämällä turvetta ja hiekkaa
|
2 ± 0,5
|
|
Kalsiumkarbonaatti
|
CaCO3, jauhemainen, kemiallisesti puhdas, kuivan sedimentin lisäksi
|
0,05–1
|
|
Deionisoitu vesi
|
Johtavuus ≤ 10 μS/cm, kuivan sedimentin lisäksi
|
30–50
|
Huomaa: Jos ammoniakkipitoisuuksien suurentuminen on odotettavissa (esimerkiksi jos testiaineen tiedetään estävän nitrifikaatiota), voi olla hyödyllistä korvata puolet typpipitoisesta nokkosjauheesta selluloosalla (esimerkiksi kemiallisesti puhdas α-selluloosajauhe, hiukkaskoko ≤ 0,5 mm) (1), (2).
Valmistaminen
Turve ilmakuivataan ja jauhetaan hienoksi. Tarvittava määrä turvejauhetta suspendoidaan deionisoituun veteen käyttämällä tehokasta homogenisointilaitetta. Tämän suspension pH säädetään välille 5,5 ± 0,5 CaCO3:lla. Suspension annetaan vakioitua vähintään kahden päivän ajan sekoittamalla sitä varovasti lämpötilassa 20 ± 2 °C, jotta pH stabiloituu ja saadaan stabiili mikrobikomponentti. pH-arvo mitataan uudelleen, ja sen täytyy olla 6,0 ± 0,5. Sen jälkeen turvesuspensioon sekoitetaan muut ainesosat (hiekka ja kaoliniittisavi) ja deionisoitu vesi, jotta saadaan homogeenista sedimenttiä, jonka vesipitoisuus on 30–50 prosenttia sedimentin kuivapainosta. Lopullisen seoksen pH mitataan vielä kerran, ja se säädetään tarvittaessa CaCO3:lla alueelle 6,5–7,5. Jos ammoniakin muodostumista on odotettavissa, sedimentin pH-arvo kannattaa pitää pienempänä kuin 7,0 (6,0–6,5). Sedimentistä otetaan näytteitä, joista määritetään kuivapaino ja orgaanisen hiilen pitoisuus. Jos ammoniakin muodostumista on odotettavissa, synteettistä sedimenttiä voidaan vakioida seitsemän päivän ajan samoissa olosuhteissa, jotka vallitsevat varsinaisessa testissä (ts. sedimentin ja veden suhde 1:4, sedimenttikerroksen korkeus sama kuin testiastioissa), ennen kuin siihen lisätään testiainetta. Siihen on siis lisättävä ilmastettua vettä. Tämän vakiointivaiheen jälkeen yläpuolinen vesi on poistettava ja hävitettävä. Sen jälkeen sedimenttiin sekoitetaan kvartsihiekkaa, johon on lisätty testiainetta jokaisen käsittelytason mukaisesti. Sedimentti jaetaan rinnakkaisnäytetestiastioihin, joihin lisätään testivettä. Tämän jälkeen astioita inkuboidaan samoissa olosuhteissa, jotka vallitsevat varsinaisessa testissä. Tästä alkaa tasapainotusvaihe. Yläpuolinen vesi tulee ilmastaa.
Valittu ravinnonlähde on lisättävä astioihin ennen kuin sedimenttiin lisätään testikemikaali tai kemikaalin lisäämisen aikana. Se voidaan sekoittaa myös turvesuspensioon (ks. edellä). Ravinnon liiallinen hajoaminen ennen testiorganismien lisäämistä – esimerkiksi kun tasapainottumisaika on pitkä – voidaan välttää pitämällä ravinnon lisäämisen ja altistumisen aloittamisen välinen aika mahdollisimman lyhyenä. Ravinnon on oltava kosketuksissa testikemikaalin kanssa, minkä varmistamiseksi ravinto tulisi sekoittaa sedimenttiin viimeistään samana päivänä, kun testikemikaali lisätään sedimenttiin.
Säilytys
Keinosedimentin kuivia ainesosia voi säilyttää kuivassa ja viileässä paikassa tai huoneenlämmössä. Valmis sedimentti, johon testikemikaalia on lisätty, on käytettävä välittömästi testissä. Näytteitä sedimentistä, johon testikemikaalia on lisätty, voidaan säilyttää kyseiselle testikemikaalille suositelluissa säilytysolosuhteissa analyysiin saakka.
VIITTEET
|
(1)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
(2)
|
Liebig M., Meller M. & Egeler P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten – Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. March 24-25, 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Germany. s. 107–119.
|
Lisäys 5
Lumbriculus variegatus -lajin kasvatusmenetelmät
Lumbriculus variegatus (Müller) (Lumbriculidae, Oligochaeta) elää makean veden sedimenteissä kaikkialla maailmassa, ja sitä käytetään laajalti ympäristömyrkyllisyyden testauksessa. Sitä on helppo kasvattaa laboratorio-olosuhteissa. Seuraavassa kerrotaan yleisluonteisesti kasvatusmenetelmistä.
Kasvatusmenetelmät
Lumbriculus variegatuksen kasvatusolosuhteet on kuvattu yksityiskohtaisesti julkaisuissa Phipps ym. (1993) (1), Brunson ym. (1998) (2), ASTM (2000) (3), U.S. EPA (2000) (4). Jäljempänä on lyhyt yhteenveto näistä olosuhteista. L. variegatuksen merkittävänä etuna on nopea lisääntyminen, jolloin laboratoriossa kasvatettujen populaatioiden biomassa kasvaa nopeasti (esimerkiksi (1), (3), (4), (5)).
Matoja voidaan kasvattaa suurissa akvaarioissa (57–80 l) 23 °C:ssa. Valojakson tulisi olla 16 h valoa ja 8 h pimeää (100–1 000 luksia), ja akvaarioissa tulisi käyttää päivittäin vaihtuvaa luonnollista vettä (45–50 l akvaariota kohti). Substraatti valmistetaan leikkaamalla valkaisemattomia ruskeita paperipyyhkeitä suikaleiksi, jotka laitetaan kasvatusveteen muutamaksi sekunniksi, jolloin muodostuu pieniä paloja paperisubstraattia. Sen jälkeen substraattia voi käyttää suoraan Lumbriculus-matojen kasvatusakvaariossa peittämällä niillä akvaarion pohja, tai niitä voidaan säilyttää jäädytettynä deionisoidussa vedessä myöhempää käyttöä varten. Uusi substraatti kestää säiliössä yleensä noin kaksi kuukautta.
Jokainen matoviljelmä aloitetaan 500–1 000 madolla, ja niitä ruokitaan kolmesti viikossa10 ml:n suspensiolla, joka sisältää 6 g lohien kasvatusravintoa, ajoittaisvaihtoisissa tai läpivirtausolosuhteissa. Staattisissa tai semistaattisissa viljelmissä eläimiä on ruokittava vähemmän bakteeri- ja sienikasvun estämiseksi.
Näissä olosuhteissa viljelmässä olevien yksilöiden määrä yleensä kaksinkertaistuu 10–14 vuorokaudessa.
Vaihtoehtoisesti Lumbriculus variegatus -lajia voidaan kasvattaa myös järjestelmässä, joka koostuu keinosedimentin sijasta 1–2 cm:n syvyisestä kerroksesta kvartsihiekkaa sekä synteettisestä vedestä. Kasvatusastioina voidaan käyttää lasista tai ruostumattomasta teräksestä valmistettuja säiliöitä, joiden korkeus on 12–20 cm. Vesikerrosta ilmastetaan kevyesti (noin kaksi kuplaa sekunnissa) Pasteur-pipetillä, joka sijaitsee noin kahden senttimetrin päässä sedimentin pinnasta. Esimerkiksi ammoniakin kertymisen välttämiseksi yläpuolinen vesi on vaihdettava läpivirtausjärjestelmää käyttäen tai manuaalisesti vähintään kerran viikossa. Harvasukasmatoja voidaan pitää huoneenlämmössä. Valoisan ajan pituus on 16 tuntia (valon voimakkuus 100–1 000 luksia) ja pimeän 8 tuntia. Semistaattisessa viljelmässä, jossa vesi vaihdetaan kerran viikossa, madoille annetaan kahdesti viikossa TetraMin-kalanruokaa (esimerkiksi 0,6–0,8 mg sedimentin pinta-alan cm2:ä kohti), joka voidaan applikoida suspensiona, jossa on 50 mg TetraMiniä yhdessä millilitrassa deionisoitua vettä.
Lumbriculus variegatus voidaan ottaa pois viljelmistä esimerkiksi siirtämällä substraatti tiheäsilmäisellä haavilla tai poimimalla yksilöt liekkikiillotetulla leveäsuisella (halkaisija noin 5 mm) lasipipetillä erilliseen laboratoriolasiin. Jos laboratoriolasiin siirretään myös substraattia, matoja ja substraattia sisältävää lasia pidetään yön yli läpivirtausolosuhteissa, jolloin substraatti poistuu lasista ja madot jäävät astian pohjalle. Ne voidaan siirtää sen jälkeen uusiin valmisteltuihin kasvatussäiliöihin tai käsitellä käytettäväksi testissä lähdeviitteissä (3) ja (4) tai seuraavassa esitetyn mukaisesti.
Seikka, johon on syytä suhtautua kriittisesti käytettäessä L. variegatusta sedimenttitesteissä, on sen lisääntymistapa eli jakaantuminen (esimerkiksi (6)). Tässä suvuttomassa lisääntymistavassa mato jakaantuu kahteen osaan, jotka eivät tarvitse ravintoa, ennen kuin pää- tai häntäosa on regeneroitunut (ks. (7), (8)). L. variegatuksen altistuminen kontaminoituja sedimenttihiukkasia nielemällä ei siis tapahdu jatkuvasti.
Sen vuoksi on huolehdittava synkronoinnista, jotta kontrolloimaton lisääntyminen ja regeneroituminen sekä testitulosten suuri vaihtelu voidaan minimoida. Vaihtelua voi nimittäin esiintyä, kun jotkin yksilöt, jotka ovat jakaantuneet eivätkä siksi tarvitse ravintoa tiettynä ajanjaksona, altistuvat testikemikaalille vähemmän kuin muut yksilöt, jotka eivät jakaannu testin aikana (9), (10), (11). Madot tulisi jakaa keinotekoisesti (synkronisointi) 10–14 päivää ennen altistumisen aloittamista. Synkronointia varten valitaan suurikokoisia (täysikasvuisia) matoja, joissa ei saisi näkyä merkkejä äskettäisestä jakautumisesta. Nämä madot asetetaan lasilevylle pisaraan kasvatusvettä ja leikataan skalpellilla kahtia ruumiin keskiosasta. Huomiota on kiinnitettävä siihen, että takapäät ovat samankokoisia. Sen jälkeen takaosat jätetään regeneroitumaan (jolloin niihin kehittyy uudet päät) kasvatusastiaan, joka sisältää samaa substraattia kuin alkuperäisessä kasvatusastiassa ja synteettistä vettä, altistuksen aloittamiseen saakka. Merkki siitä, että uudet päät ovat kehittyneet, on se, kun synkronisoidut madot alkavat kaivautua substraattiin (regeneroitujen päiden muodostuminen voidaan vahvistaa tutkimalla edustava alanäyte binokulaarimikroskoopilla). Tämän jälkeen testiorganismien oletetaan olevan samanlaisessa fysiologisessa tilassa. Kun synkronisoidut madot lisääntyvät morfallaksin kautta testin aikana, käytännössä kaikkien eläinten odotetaan altistuvan yhtä paljon sedimentille, johon on lisätty testiainetta. Synkronisoitujen matojen ruokkiminen tulee aloittaa heti, kun madot alkavat kaivautua substraattiin tai seitsemän päivän kuluttua leikkauksesta. Ruokintaohjelma tulisi olla samankaltainen kuin tavallisissa viljelmissä, mutta synkronisoituja matoja voi olla hyvä ruokkia samalla ravinnolla, jota käytetään myös testissä. Matoja pidetään testilämpötilassa 20 ± 2 °C. Kun madot ovat regeneroituneet, testiä varten valitaan vahingoittumattomia kokonaisia matoja, jotka uivat tai matelevat aktiivisesti kevyen mekaanisen ärsytyksen seurauksena. Matojen vaurioituminen tai autotomia on estettävä esimerkiksi käyttämällä niiden käsittelyssä pipettejä, joiden reunat on liekkikiillotettu, tai ruostumattomasta teräksestä valmistettuja hammastikkuja.
Lumbriculus variegatus -lajin aloitusviljelmien lähteitä (yhdysvaltalaiset osoitteet mukautettu kirjallisuusviitteestä (4))
|
Eurooppa
|
|
ECT Oekotoxikologie GmbH
|
|
Böttgerstr. 2-14
|
|
D-65439 Flörsheim/Main
|
|
Deutschland
|
|
|
Bayer Crop Science AG
|
|
Development – Ecotoxicology
|
|
Alfred-Nobel-Str. 50
|
|
D-40789 Monheim
|
|
Deutschland
|
|
|
|
|
|
Joensuun yliopisto
|
|
Vesistötoksikologian laboratorio
|
|
Biologian laitos
|
|
Yliopistokatu 7, PL 111
|
|
80101 Joensuu
|
|
Suomi
|
|
|
Dresden University of Technology
|
|
Institut für Hydrobiologie
|
|
Fakultät für Forst-, Geo- und Hydrowissenschaften
|
|
Mommsenstr. 13
|
|
D-01062 Dresden
|
|
Deutschland
|
|
|
|
|
|
C.N.R.- I.R.S.A.
|
|
Italian National Research Council
|
|
Water Research Institute
|
|
Via Mornera 25
|
|
I-20047 Brugherio MI
|
|
|
|
|
|
|
Yhdysvallat
|
|
U.S. Environmental Protection Agency
|
|
Mid-Continent Ecological Division
|
|
6201 Congdon Boulevard
|
|
Duluth, MN 55804
|
|
|
Michigan State University
|
|
Department of Fisheries and Wildlife
|
|
No. 13 Natural Resources Building
|
|
East Lansing, MI 48824-1222
|
|
|
|
|
|
U.S. Environmental Protection Agency
|
|
Environmental Monitoring System Laboratory
|
|
26 W. Martin Luther Dr.
|
|
Cincinnati, OH 45244
|
|
|
Wright State University
|
|
Institute for Environmental Quality
|
|
Dayton, OH 45435
|
|
|
|
|
|
Columbia Environmental Research Center
|
|
U.S. Geological Survey
|
|
4200 New Haven Road
|
|
Columbia, MO 65201
|
|
|
Great Lakes Environmental Research
|
|
Laboratory, NOAA
|
|
2205 Commonwealth Boulevard
|
|
Ann Arbor, MI 48105-1593
|
|
VIITTEET
|
(1)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. and Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269–279.
|
|
(2)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191–201.
|
|
(3)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. Teoksessa ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(4)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(5)
|
Kukkonen, J. and Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457–1468.
|
|
(6)
|
Drewes C.D. & Fourtner C.R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94–103.
|
|
(7)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196–2202.
|
|
(8)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183–194.
|
|
(9)
|
Brust, K., O. Licht, V. Hultsch, D. Jungmann & R. Nagel (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, Vol. 20, s. 2000–2007.
|
|
(10)
|
Oetken, M., K.-U. Ludwichowski & R. Nagel (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. By order of the Federal Environmental Agency (Umweltbundesamt Berlin), FKZ 360 12 001, March 2000.
|
|
(11)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503–1508.
|
Lisäys 6
Yhteenveto yhteistutkimuksen tuloksista
Sedimentin myrkyllisyystesti Lumbriculus variegatus -lajilla
Taulukko 1
Yhteistutkimuksen yksittäisten testien tulokset: Matojen keskimäärä kontrolleissa ja liuotinkontrolleissa testin lopussa; SD = standard deviation = keskihajonta; CV = coefficient of variation = variaatiokerroin.
|
|
matojen keskimäärä kontrolleissa
|
SD
|
CV (%)
|
n
|
matojen keskimäärä liuotinkontrolleissa
|
SD
|
CV (%)
|
n
|
|
|
32,3
|
7,37
|
22,80
|
3
|
39,0
|
3,61
|
9,25
|
3
|
|
|
40,8
|
6,55
|
16,05
|
6
|
36,0
|
5,29
|
14,70
|
3
|
|
|
41,5
|
3,54
|
8,52
|
2
|
38,5
|
7,05
|
18,31
|
4
|
|
|
16,3
|
5,99
|
36,67
|
6
|
30,8
|
6,70
|
21,80
|
4
|
|
|
24,3
|
10,69
|
43,94
|
3
|
26,3
|
3,06
|
11,60
|
3
|
|
|
28,5
|
8,29
|
29,08
|
4
|
30,7
|
1,15
|
3,77
|
3
|
|
|
28,3
|
3,72
|
13,14
|
6
|
28,8
|
2,56
|
8,89
|
6
|
|
|
25,3
|
5,51
|
21,74
|
3
|
27,7
|
1,53
|
5,52
|
3
|
|
|
23,8
|
2,99
|
12,57
|
4
|
21,3
|
1,71
|
8,04
|
4
|
|
|
36,8
|
8,80
|
23,88
|
6
|
35,0
|
4,20
|
11,99
|
6
|
|
|
33,0
|
3,58
|
10,84
|
6
|
33,5
|
1,73
|
5,17
|
4
|
|
|
20,7
|
2,73
|
13,22
|
6
|
15,0
|
6,68
|
44,56
|
4
|
|
|
42,0
|
7,07
|
16,84
|
6
|
43,7
|
0,58
|
1,32
|
3
|
|
|
18,2
|
3,60
|
19,82
|
6
|
21,7
|
4,04
|
18,65
|
3
|
|
|
32,0
|
3,95
|
12,34
|
6
|
31,3
|
4,79
|
15,32
|
4
|
|
laboratorioiden välinen keskiarvo
|
29,59
|
|
20,10
|
|
30,61
|
|
13,26
|
|
|
SD
|
8,32
|
|
10,03
|
|
7,57
|
|
10,48
|
|
|
N
|
15
|
|
|
|
15
|
|
|
|
|
min-arvo
|
16,3
|
|
|
|
15,0
|
|
|
|
|
max-arvo
|
42,0
|
|
|
|
43,7
|
|
|
|
|
CV (%)
|
28,1
|
|
|
|
24,7
|
|
|
|
Taulukko 2
Yhteistutkimuksen yksittäisten testien tulokset: Matojen keskimääräinen yhteenlaskettu kuivapaino rinnakkaisnäytettä kohti kontrolleissa ja liuotinkontrolleissa testin lopussa; SD = standard deviation = keskihajonta; CV = coefficient of variation = variaatiokerroin.
|
|
matojen yhteenlaskettu kuivapaino rinnakkais-näytettä kohti (kontrollit)
|
SD
|
CV (%)
|
n
|
matojen yhteenlaskettu kuivapaino rinnakkais-näytettä kohti (liuotinkontrollit)
|
SD
|
CV (%)
|
n
|
|
|
24,72
|
6,31
|
25,51
|
3
|
27,35
|
4,08
|
14,93
|
3
|
|
|
30,17
|
2,04
|
6,75
|
6
|
33,83
|
10,40
|
30,73
|
3
|
|
|
23,65
|
3,61
|
15,25
|
2
|
28,78
|
4,68
|
16,28
|
4
|
|
|
12,92
|
6,83
|
52,91
|
6
|
24,90
|
6,84
|
27,47
|
4
|
|
|
21,31
|
4,17
|
19,57
|
3
|
25,87
|
5,30
|
20,49
|
3
|
|
|
22,99
|
4,86
|
21,16
|
4
|
24,64
|
5,09
|
20,67
|
3
|
|
|
18,91
|
1,91
|
10,09
|
6
|
19,89
|
1,77
|
8,89
|
6
|
|
|
24,13
|
1,63
|
6,75
|
3
|
25,83
|
2,17
|
8,41
|
3
|
|
|
22,15
|
3,18
|
14,34
|
4
|
22,80
|
2,60
|
11,40
|
4
|
|
|
35,20
|
8,12
|
23,07
|
6
|
31,42
|
8,45
|
26,90
|
6
|
|
|
41,28
|
5,79
|
14,02
|
6
|
41,42
|
4,37
|
10,55
|
4
|
|
|
15,17
|
5,78
|
38,09
|
6
|
10,50
|
3,42
|
32,53
|
4
|
|
|
35,69
|
8,55
|
23,94
|
6
|
38,22
|
1,23
|
3,21
|
3
|
|
|
19,57
|
5,21
|
26,65
|
6
|
28,58
|
6,23
|
21,81
|
3
|
|
|
29,40
|
2,16
|
7,34
|
6
|
31,15
|
2,70
|
8,67
|
4
|
|
laboratorioiden välinen keskiarvo
|
25,15
|
|
20,36
|
|
27,68
|
|
17,53
|
|
|
SD
|
7,87
|
|
12,56
|
|
7,41
|
|
9,10
|
|
|
N
|
15
|
|
|
|
15
|
|
|
|
|
min-arvo
|
12,9
|
|
|
|
10,5
|
|
|
|
|
max-arvo
|
41,3
|
|
|
|
41,4
|
|
|
|
|
CV (%)
|
31,3
|
|
|
|
26,8
|
|
|
|
Taulukko 3
NOEC- ja LOEC-arvoille; SD = standard deviation = keskihajonta; CV = coefficient of variation = variaatiokerroin.
|
biologinen parametri
|
|
laboratorioiden välinen keskiarvo (mg/kg)
|
min-arvo
|
max-arvo
|
laboratorioiden välinen kerroin
|
SD
|
CV (%)
|
geometrinen ka. (mg/kg)
|
|
matojen kokonaismäärä
|
EC50
|
23,0
|
4,0
|
37,9
|
9,4
|
10,7
|
46,3
|
19,9
|
|
NOEC
|
9,9
|
2,1
|
22,7
|
10,7
|
7,2
|
72,3
|
7,6
|
|
LOEC
|
27,9
|
4,7
|
66,7
|
14,2
|
19,4
|
69,4
|
20,9
|
|
MDD (%)
|
22,5
|
7,1
|
39,1
|
|
|
|
|
|
matojen kuivapaino yhteensä
|
EC50
|
20,4
|
7,3
|
39,9
|
5,5
|
9,1
|
44,5
|
18,2
|
|
NOEC
|
9,3
|
2,1
|
20,0
|
9,4
|
6,6
|
70,4
|
7,4
|
|
LOEC
|
25,7
|
2,1
|
50,0
|
23,5
|
16,8
|
65,5
|
19,4
|
|
MDD (%)
|
24,8
|
10,9
|
44,7
|
|
|
|
|
|
kuolleisuus/eloonjääminen
|
LC50
|
25,3
|
6,5
|
37,2
|
5,7
|
9,4
|
37,4
|
23,1
|
|
NOEC
|
16,5
|
2,1
|
40,0
|
18,8
|
10,3
|
62,4
|
12,8
|
|
LOEC
|
39,1
|
4,7
|
66,7
|
14,2
|
18,1
|
46,2
|
32,6
|
|
lisääntyminen (matojen määrän kasvu rinnakkaisnäytettä kohti)
|
EC50
|
20,0
|
6,7
|
28,9
|
4,3
|
7,6
|
37,9
|
18,3
|
|
NOEC
|
7,9
|
2,1
|
20,0
|
9,4
|
5,2
|
66,0
|
6,4
|
|
LOEC
|
22,5
|
2,1
|
50,0
|
23,5
|
15,4
|
68,6
|
16,0
|
|
MDD (%)
|
29,7
|
13,9
|
47,9
|
|
|
|
|
|
kasvu (biomassan kasvu rinnakkaisnäytettä kohti)
|
EC50
|
15,3
|
5,7
|
29,9
|
5,2
|
7,1
|
46,5
|
13,7
|
|
NOEC
|
8,7
|
2,1
|
20,0
|
9,4
|
6,0
|
68,1
|
6,9
|
|
LOEC
|
24,0
|
2,1
|
50,0
|
23,5
|
15,7
|
65,5
|
17,3
|
|
MDD (%)
|
32,2
|
13,6
|
65,2
|
|
|
|
|
|
MDD: pienin havaittava ero kontrolliarvoista hypoteesitestauksen aikana; käytetään tilastollisen voiman mittaamiseen
|
VIITE
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
C.36 MAA-AINEKSESSA TEHTÄVÄ HARSOSÄÄSKENPETOPUNKIN (HYPOASPIS (GEOLAELAPS) ACULEIFER) LISÄÄNTYMISTESTI
JOHDANTO
|
1.
|
Tämä testimenetelmä vastaa OECD:n testiohjetta (TG) nro 226 (2008). Tämä testimenetelmä on tarkoitettu käytettäväksi arvioitaessa maaperässä olevien kemikaalien vaikutuksia maaperässä elävien punkkilajien Hypoaspis (Geolaelaps) aculeifer Canestrini (Acari: Laelapidae) lisääntymiskyvylle, jolloin voidaan arvioida populaation ominaiskasvunopeudelle koituvaa inhibitiovaikutusta (1), (2). Lisääntymiskyky tarkoittaa tässä testijakson lopussa havaittuja poikasia. H. aculeifer edustaa uutta ravintotasoa lajilla, jolle testimenetelmiä on jo olemassa. Tämän testimenetelmän tarkoitusta varten katsotaan riittäväksi lisääntymistesti, jossa lisääntymiskierron eri vaiheita ei eroteta toisistaan tai kvantifioida. Kemikaaleille, joiden altistusskenaario on jokin muu kuin maaperän kautta tapahtuva, jokin muu lähestymistapa voi sopia paremmin (3).
|
|
2.
|
Hypoaspis (Geolaelaps) aculeifer -lajin katsotaan olevan maaperän eläimistön ja etenkin petopunkkien merkityksellinen edustaja. Sitä tavataan kaikkialla maailmassa (5), ja sitä on helppo kerätä ja kasvattaa laboratoriossa. Yhteenveto H. aculeifer -lajin biologiasta on lisäyksessä 7. Punkkilajin ekologiasta ja sen käytöstä ympäristömyrkyllisyyden tutkimuksessa on saatavilla taustatietoa (4), (5), (6), (7), (8), (9), (10), (11), (12).
|
TESTIN PERIAATE
|
3.
|
Täysikasvuiset naaraat altistetaan maa-ainekseen sekoitetun testikemikaalin eri pitoisuuksille. Testin alussa jokaisessa rinnakkaisnäyteastiassa on 10 täysikasvuista naarasta. Koiraita ei oteta testiin, sillä kokemus on osoittanut, että jos koiraita on läsnä, naaraat pariutuvat välittömästi tai lähes välittömästi sen jälkeen, kun ne ovat kuoriutuneet deutonymfivaiheesta. Lisäksi koiraiden ottaminen testiin pidentäisi testiä niin, että eri ikävaiheita jouduttaisiin erottamaan toisistaan, mikä on varsin suuritöistä. Varsinainen pariutuminen ei siis kuulu tähän testiin. Naaraat otetaan testattaviksi 28–35 vuorokautta sen jälkeen, kun munintavaihe on alkanut synkronoinnissa (ks. lisäys 4), sillä naaraiden voidaan tällöin katsoa jo pariutuneen ja ohittaneen munintaa edeltävään vaiheen. Jos lämpötila on 20 °C, testi päättyy päivänä 14 sen jälkeen, kun naaraat on otettu testattaviksi (päivä 0), jolloin ensimmäiset kontrollijälkeläiset ehtivät jo siirtyä deutonymfivaiheeseen (ks. lisäys 4). Tärkeintä mittaussuuretta varten todetaan poikasten lukumäärä testiastiaa kohti sekä lisäksi elossa olevien naaraiden lukumäärä. Testikemikaalille altistettujen punkkien lisääntymiskykyä verrataan kontrolleihin, jolloin voidaan määrittää ECx-arvo (esimerkiksi EC10 ja EC50) tai NOEC-arvo (No Observed Effect Concentration eli pitoisuus, josta ei aiheudu vaikutuksia) testijärjestelyn mukaan (ks. 29 kohta). Yhteenveto testin aikataulusta on lisäyksessä 8.
|
TESTIKEMIKAALIA KOSKEVIA TIETOJA
|
4.
|
Testikemikaalista pitäisi olla käytettävissä seuraavat tiedot: vesiliukoisuus, log Kow, maa-vesi-jakaantumiskerroin sekä höyrynpaine. Lisätiedot testikemikaalin kulkeutumisesta maaperässä, kuten bioottinen ja abioottinen hajoamisnopeus, ovat myös suotavia.
|
|
5.
|
Tätä testimenetelmää voidaan käyttää vesiliukoisten tai veteen liukenemattomien kemikaalien yhteydessä. Testikemikaalia käytetään kummassakin tapauksessa kuitenkin eri tavalla. Testimenetelmää ei voida soveltaa haihtuviin kemikaaleihin, eli sellaisiin, joiden osalta Henryn vakio tai ilma-vesi-jakaantumiskerroin on suurempi kuin yksi, tai sellaisiin kemikaaleihin, joiden höyrynpaine on suurempi kuin 0,0133 Pa 25 °C:ssa.
|
TESTIN VALIDITEETTI
|
6.
|
Jotta testitulosta voidaan pitää luotettavana, seuraavien kriteerien on täytyttävä käsittelemättömissä kontrolleissa:
|
—
|
Aikuisten naaraiden keskimääräinen kuolleisuus testin lopussa saa olla enintään 20 prosenttia
|
|
—
|
Nuorten eläinten keskimäärän rinnakkaisnäytettä (johon siirrettiin 10 aikuista naarasta) kohti testin lopussa on oltava vähintään 50
|
|
—
|
Punkinpoikasten määrälle rinnakkaisnäytettä kohti lasketun variaatiokertoimen on oltava alle 30 prosenttia varsinaisen testin lopussa.
|
|
VERTAILUKEMIKAALI
|
7.
|
Vertailukemikaalin NOEC-arvo ja/tai ECx-arvo on määritettävä, jotta voidaan osoittaa, että laboratorion testiolosuhteet ovat asianmukaiset, sekä todeta, että testiorganismien vasteessa ei tapahdu ajan kuluessa muutosta. Sopiva vertailukemikaali, jonka on osoitettu vaikuttavan populaation kokoon, on dimetoaatti (CAS 60-51-5) (4). Vaihtoehtoisesti vertailukemikaalina voidaan käyttää boorihappoa (CAS 10043-35-3). Tästä kemikaalista on saatu vähemmän kokemusta. Testi voidaan järjestää kahdella tavalla:
|
—
|
Vertailukemikaalia voidaan testata samanaikaisesti kun jokaisen testikemikaalin myrkyllisyys todetaan yhdestä pitoisuudesta, jonka on osoitettava etukäteen annosvastetutkimuksessa vähentävän jälkeläisten määrää > 50 prosenttia. Tässä tapauksessa rinnakkaisnäytteitä on oltava sama määrä kuin kontrolleissa (ks. 29 kohta).
|
|
—
|
Vaihtoehtoisesti vertailukemikaali voidaan testata 1–2 kertaa vuodessa annosvastetestillä. Pitoisuuksien ja rinnakkaisnäytteiden määrä sekä porrastuskerroin ovat erilaiset eri järjestämistavoissa (ks. 29 kohta), mutta molemmissa vasteen olisi oltava 10–90 prosenttia (porrastuskerroin 1,8). Dimetoaatin jälkeläisten määrään perustuvan EC50:n on oltava välillä 3,0–7,0 mg tehoainetta maa-aineskiloa kohti (kuivapaino). Tähän mennessä boorihapolla saatujen tulosten perusteella jälkeläisten määrään perustuvan EC50:n on oltava välillä 100–500 mg maa-aineskiloa kohti (kuivapaino).
|
|
TESTIN KUVAUS
Testiastiat ja -laitteet
|
8.
|
Käytettävät testiastiat on valmistettu lasista tai muusta kemiallisesti inertistä materiaalista, niiden halkaisija on 3–5 cm (maa-aineksen korkeus ≥1,5 cm) ja niissä on tiiviisti sulkeutuva kansi. Suositeltavimpia ovat kierrekannet, jolloin astioita voi tuulettaa kahdesti viikossa. Vaihtoehtoisesti voidaan käyttää kantta, joiden läpi kaasut voivat vaihtua suoraan substraatin ja ilmakehän välillä, esimerkiksi harsoa. Kosteuspitoisuus on pidettävä korkeana koko testin ajan, minkä vuoksi on erittäin tärkeää valvoa jokaisen koeastian painoa koko testin ajan ja lisätä vettä tarvittaessa. Tämä on erityisen tärkeää silloin, jos käytössä ei ole kierrekansia. Jos käytetään läpinäkymätöntä testiastiaa, kannen on oltava materiaalia, josta valo pääsee läpi (esimerkiksi läpinäkyvä, rei'itetty kansi) mutta joka estää punkkeja poistumasta. Testiastian koko ja tyyppi määräytyvät talteenottomenetelmän mukaan (aiheesta tarkemmin lisäyksessä 5). Jos lämpöerottamista käytetään suoraan testiastiaan, pohjaan voidaan lisätä silmäkooltaan sopiva pohjaverkko (joka suljetaan erottamiseen saakka), ja maa-aineksen syvyys on oltava riittävä lämpötila- ja kosteusgradientin muodostumiseen.
|
|
9.
|
Testissä tarvitaan myös vakiolaboratoriolaitteisto, erityisesti seuraavat:
|
—
|
astioita, mieluiten lasisia, joissa on kierrekannet
|
|
—
|
harjoja punkkien siirtämistä varten
|
|
—
|
pH-mittari ja luksimittari
|
|
—
|
sopivia tarkkoja vaakoja
|
|
—
|
asianmukaiset lämpötilan valvontalaitteet
|
|
—
|
asianmukaiset ilmankosteuden valvontalaitteet (ei oleellinen, jos altistusastiat on peitetty kansilla)
|
|
—
|
lämpökaappi, jonka lämpötilaa voi säätää, tai muu pieni tila
|
|
—
|
talteenottovälineet (ks. lisäys 5) (13)
|
|
—
|
katkaisijalla varustettu ripustettava paneelivalaisin
|
|
—
|
keräilypurkkeja talteenotettuja punkkeja varten.
|
|
Keinomaan valmistus
|
10.
|
Tässä kokeessa käytetään keinomaata. Keinomaan ainesosat ovat seuraavat (kaikki arvot perustuvat kuivamassaan):
|
—
|
5 prosenttia rahkaturvetta, joka on ilmakuivattu ja jauhettu hienoksi (sopiva hiukkaskoko 2 ± 1 mm)
|
|
—
|
20 prosenttia kaoliinisavea (kaoliniitin osuus mieluiten yli 30 prosenttia)
|
|
—
|
noin 70 prosenttia ilmakuivattua teollisuushiekkaa (tarvittavan CaCO3-määrän mukaan), ensisijaisesti hienoa hiekkaa, jonka hiukkasista yli puolet on kooltaan 50–200 mikronia. Hiekan tarkkaan määrään vaikuttaa CaCO3-määrä (ks. jäljempänä); niiden yhteismäärän tulisi olla 75 prosenttia.
|
|
—
|
1,0 prosenttia kalsiumkarbonaattia (CaCO3, jauhemainen, analyyttinen laatu), jotta maan pH-arvoksi saadaan 6,0 ±0,5; lisättävän kalsiumkarbonaatin määrään saattaa vaikuttaa etenkin turpeen laatu/tyyppi (ks. huomautus 1).
|
Huomautus 1: CaCO3:n tarvittavaan määrään vaikuttavat maa-ainesalustan ainekset, ja se on määritettävä mittaamalla maa-aineksen osanäytteiden pH-arvo juuri ennen testiä (14).
Huomautus 2: Keinomaan turvepitoisuus poikkeaa muissa maaperän organismeja käyttävissä testimenetelmissä käytetystä pitoisuudesta, joka on useimmiten 10 prosenttia turvetta (esimerkiksi (15)). EPPOn mukaan tyypillisessä maatalousmaassa on orgaanista ainetta kuitenkin enintään 5 prosenttia, ja turvepitoisuuden vähentäminen kuvastaa siis luonnonmaan heikentynyttä kykyä sitouttaa testikemikaalia orgaaniseen hiileen.
Huomautus 3: Tarvittaessa (esimerkiksi tiettyihin testaustarkoituksiin) testi- ja/tai kasvatusalustana voidaan käyttää myös luonnonmaata, joka on peräisin saastumattomilta alueilta. Luonnonmaata käytettäessä siitä on kuitenkin mainittava vähintään seuraavat tiedot: alkuperä (keräyspaikka), pH, rakenne (hiukkaskokojakauma) ja orgaanisen aineksen pitoisuus. Maannoksen maaperäluokituksen mukainen tyyppi ja nimi mainitaan myös, jos nämä ovat tiedossa, eikä maa-aineksessa saa olla minkäänlaisia epäpuhtauksia. Jos testikemikaali on metalli tai organometalli, on luonnonmaalle määritettävä myös kationinvaihtokyky (CEC). Erityistä huomiota on kiinnitettävä hyväksyttävyyskriteerien täyttymiseen, sillä luonnonmaasta on tyypillisesti saatavan vähän taustatietoa.
|
|
11.
|
Maan kuivat ainesosat sekoitetaan perusteellisesti (esimerkiksi suurella laboratoriosekoittimella). pH-arvon määrittämisessä käytetään seosta, jossa on yksi osa maa-ainesta ja viisi osaa 1 M:n kaliumkloridiliuosta (KCl) tai 0,01 M:n kalsiumkloridiliuosta (CaCl2) (ks. (14) ja lisäys 3). Jos maa-aines on vaadittua vaihteluväliä happamampaa (ks. 10 kohta), happamuutta voidaan säätää lisäämällä tarvittava määrä CaCO3:a. Jos maa-aines on liian emäksistä, happamuutta voidaan säätää lisäämällä ensimmäistä kolmea ainesosaa sisältävää, 10 kohdassa mainittua seosta, mutta jättämällä pois CaCO3.
|
|
12.
|
Keinomaan enimmäisvedenpidätyskyky (WHC) määritetään lisäyksessä 2 kuvattujen menetelmien mukaisesti. Kahdesta seitsemään vuorokautta ennen testin aloittamista kuiva keinomaa esikostutetaan lisäämällä tislattua tai deionisoitua vettä noin puoleen lopullisesta vesipitoisuudesta eli 40–60 prosenttiin enimmäisvedenpidätyskyvystä. Kosteuspitoisuus säädetään 40–60 prosenttiin enimmäisvedenpidätyskyvystä lisäämällä testikemikaalia liuoksena ja/tai lisäämällä tislattua tai deionisoitua vettä (ks. 16-18 kohdat). Maa-aineksen kosteuspitoisuus on vielä tarkistettava likimääräisesti puristamalla maa-ainesta varovasti kädessä. Sormien välistä pitäisi tihkua pieniä vesipisaroita, jos kosteuspitoisuus on oikea.
|
|
13.
|
Maaperän kosteuspitoisuus määritetään testin alussa ja lopussa kuivaamalla maa-aines vakiopainoon 105 °C:ssa standardin ISO 11465 (17) ja määrittämällä maa-aineksen pH-arvo lisäyksen 3 tai standardin ISO 10390 (14) mukaisesti. Nämä mittaukset tehdään myös ylimääräisissä näytteissä, joissa ei ole punkkeja ja jotka on otettu kontrollimaa-aineksesta sekä jokaisesta maaperän testipitoisuudesta. Maa-aineksen pH-arvoa ei saa säätää happamia tai emäksisiä kemikaaleja testattaessa. Kosteuspitoisuutta on seurattava koko testin ajan punnitsemalla astiat säännöllisesti (ks. 20 ja 24 kohta).
|
Koe-eläinten valinta ja valmistelu
|
14.
|
Testissä käytettävä laji on Hypoaspis (Geolaelaps) aculeifer (Canestrini, 1883). Testin aloittamiseen tarvitaan synkronisoidusta kohortista peräisin olevia täysikasvuisia naaraspunkkeja. Punkit otetaan testiin noin 7–14 vuorokautta sen jälkeen, kun niistä on tullut täysikasvuisia ja 28–35 vuorokautta sen jälkeen, kun muninta on alkanut synkronoinnissa (ks. 3 kohta ja lisäys 4). Tiedot punkkien alkuperästä tai toimittajasta sekä laboratorioviljelmän ylläpidosta kirjataan muistiin. Jos punkkeja pidetään laboratorioviljelmässä, punkkien laji olisi syytä varmistaa vähintään kerran vuodessa. Tunnistuslomake on lisäyksessä 6.
|
Testipitoisuuksien valmistelu
|
15.
|
Testikemikaali lisätään maa-ainekseen. Orgaanisten liuottimien, joilla helpotetaan maa-aineksen käsittelyä testikemikaalilla, valintaperusteena on vähäinen myrkyllisyys punkeille. Testijärjestelyyn sisällytetään sopiva liuotinkontrolli (ks. 29 kohta).
|
Vesiliukoinen testikemikaali
|
16.
|
Testikemikaalista ja deionisoidusta vedestä valmistetaan sellainen määrä liuosta, joka riittää yhden testipitoisuuden kaikkiin neljään rinnakkaisnäytteeseen. Suositeltavaa on käyttää vettä riittävästi, jotta saavutetaan tarvittava kosteuspitoisuus, eli 40–60 prosenttia enimmäisvedenpidätyskyvystä (ks. 12 kohta). Kukin testikemikaaliliuos sekoitetaan perinpohjaisesti yhteen erään esikostutettua maata, ennen kuin se laitetaan testiastiaan.
|
Veteen liukenematon testikemikaali
|
17.
|
Jos käytettävä kemikaali ei ole vesiliukoista, mutta liukenee orgaaniseen liuottimeen, se voidaan liuottaa pienimpään mahdolliseen määrään sopivaa kantoainetta (esimerkiksi asetonia). Ainoastaan haihtuvia liuottimia saa käyttää. Tällaista kantoainetta käytettäessä kaikissa testipitoisuuksissa ja kontrollissa on oltava sama vähimmäismäärä kantoainetta. Kantoaine sekoitetaan pieneen määrään (esimerkiksi 10 g) hienoa kvartsihiekkaa tai ruiskutetaan sen päälle. Substraatin kokonaishiekkapitoisuutta säädetään tämän määrän mukaan. Kantoaine poistetaan haihduttamalla hiekkaa vetokaapissa vähintään tunnin ajan. Kvartsihiekan ja testikemikaalin seos lisätään esikostutettuun maahan ja sekoitetaan huolellisesti sopivaan määrään deionisoitua vettä, jotta saadaan tarvittava kosteuspitoisuus. Lopullinen seos siirretään testiastioihin. Huomaa, että jotkin liuottimet voivat olla myrkyllisiä punkeille. Tämän vuoksi on suositeltavaa käyttää ylimääräistä vesikontrollia, jossa ei käytetä kantoainetta, jos liuottimen myrkyllisyyttä punkeille ei tunneta. Vesikontrolli voidaan jättää pois, jos on riittävällä tavalla osoitettu, että liuottimella ei (testissä käytettyinä pitoisuuksina) ole vaikutuksia punkeille.
|
Huonosti veteen ja orgaanisiin liuottimiin liukeneva testikemikaali
|
18.
|
Jos kemikaali liukenee heikosti veteen ja orgaanisiin liuottimiin, haluttu testipitoisuus saadaan sekoittamalla testikemikaaliin 2,5 grammaa vastaava määrä hienoksi jauhettua kvartsihiekkaa testiastiaa kohden (esimerkiksi 10 grammaa hienoa kvartsihiekkaa neljää rinnakkaisnäytettä kohti). Substraatin kokonaishiekkapitoisuutta säädetään tämän määrän mukaan. Tämä kvartsihiekan ja testikemikaalin seos lisätään esikostutettuun maahan ja sekoitetaan hyvin sopivaan määrään deionisoitua vettä, jotta saadaan tarvittava kosteuspitoisuus. Lopullinen seos jaetaan testiastioihin. Menettely toistetaan jokaisen testipitoisuuden yhteydessä, ja myös asianmukainen kontrolli valmistellaan.
|
MENETTELY
Testi- ja kontrolliryhmät
|
19.
|
Suositeltavaa on sijoittaa jokaiseen kontrolli- ja käsittelyastiaan kymmenen täysikasvuista naarasta ja 20 grammaa keinomaata (kuivapaino). Testiorganismit on lisättävä kahden tunnin kuluttua lopullisen testisubstraatin valmistamisesta (eli testin kohteen lisäämisestä). Erityistapauksissa, esimerkiksi silloin, kun ikääntyminen katsotaan ratkaisevaksi tekijäksi, lopullisen testisubstraatin valmistamisen ja punkkien lisäämisen välistä aikaa voidaan pidentää (ikääntymisestä tarkemmin ks. (18)). Näissä tapauksissa on kuitenkin esitettävä tieteelliset perustelut sille, miksi näin toimittiin.
|
|
20.
|
Kun punkit on lisätty maa-ainekseen, niille annetaan ruokaa, ja jokaisen testiastian alkupaino mitataan, jotta sitä voidaan käyttää vertailuarvona maa-aineksen kosteuspitoisuuden seurannassa koko testin ajan 24 kohdassa kuvatulla tavalla. Tämän jälkeen testiastiat peitetään, kuten 8 kohdassa on kuvattu, ja sijoitetaan testikammioon.
|
|
21.
|
Jokaista testikemikaalin 15–18 kohdassa kuvattua applikointimenetelmää varten valmistetaan sopiva kontrollinäyte. Kontrollien valmistuksessa noudatetaan sopivia kuvattuja menetelmiä, mutta testikemikaalia ei lisätä. Kontrolleihin lisätään siis tarvittaessa orgaanisia liuottimia, kvartsihiekkaa tai muuta kantoainetta samana pitoisuutena tai saman verran kuin käsittelyihin. Jos testikemikaalin lisäämisessä käytetään liuotinta tai muuta kantoainetta ja liuottimen myrkyllisyyttä ei tunneta, on lisäksi valmistettava kontrolli, jossa ei käytetä kantoainetta tai testikemikaalia (ks. 17 kohta).
|
Testiolosuhteet
|
22.
|
Testauslämpötilan on oltava 20 °C ± 2 °C. Lämpötila kirjataan vähintään kerran päivässä ja sitä säädetään tarvittaessa. Testi toteutetaan valoisaa ja pimeää aikaa säätelemällä (mieluiten 16 tuntia valoisaa ja 8 tuntia pimeää). Testiastioiden lähellä on oltava 400–800 luksin valaistus. Testien vertailukelpoisuuden vuoksi olosuhteet ovat samanlaiset kuin muissa maaperän ympäristömyrkyllisyyttä koskevissa testeissä (esim. (15)).
|
|
23.
|
Kaasujen vaihtumisesta huolehditaan tuulettamalla testiastiat vähintään kahdesti viikossa, jos käytössä on kierrekannet. Harsokansia käytettäessä on kiinnitettävä erityistä huomiota maa-aineksen kosteuspitoisuuden ylläpitämiseen (ks. 8 ja 24 kohta).
|
|
24.
|
Testiastioissa olevan maa-ainessubstraatin vesipitoisuutta pidetään yllä koko testin ajan punnitsemalla testisäiliöt säännöllisesti (esimerkiksi kerran viikossa) ja lisäämällä vettä tarvittaessa. Hävikki korvataan tarpeen mukaan deionisoidulla vedellä. Kosteuspitoisuus testin aikana saa poiketa aloitusarvosta enintään 10 prosenttia.
|
Ruokinta
|
25.
|
Sopivaksi ravinnonlähteeksi on todettu Tyrophagus putrescentiae -laji (Schrank, 1781). Muita sopivia ravinnonlähteitä ovat esimerkiksi pienet hyppyhäntäiset (esimerkiksi Folsomia candida -lajin (Willem, 1902) tai Onychiurus fimatus -lajin poikaset (19), (20)), änkyrimadot (esimerkiksi Enchytraeus crypticus (Westheide & Graefe, 1992)) tai sukkulamadot (esimerkiksi Turbatrix silusiae (de Man, 1913)). On suositeltavaa tarkistaa ravinto ennen kuin sitä käytetään testissä. Ravinnon tyyppi ja määrä olisi oltava sellainen, jota käyttämällä tuotetaan riittävästi poikasia, jotta testin hyväksyttävyyskriteerit täyttyvät (6 kohta). Saaliseläimiä valitessa on otettava huomioon myös testin kohteen vaikutustapa (esimerkiksi punkkimyrkky saattaa olla myrkyllistä myös ruokana käytettäville punkeille; ks. 26 kohta).
|
|
26.
|
Ruokaa annetaan ad libitum (eli lastan kärjellä pieni määrä kerrallaan). Tässä voidaan käyttää myös hyppyhäntäisillä tehtävässä testissä esitettyä pienitehoista imuria tai hienoa sivellintä. Yleensä riittää, kun ruokaa annetaan testin alussa ja sen jälkeen 2–3 kertaa viikossa. Jos on syytä epäillä, että testin kohde on myrkyllinen saaliseläimille, on harkittava, pitääkö ruokaa antaa useammin tai ravinnonlähdettä vaihtaa.
|
Testipitoisuuksien valinta
|
27.
|
Sopivien testipitoisuuksien valinnassa auttaa testikemikaalin myrkyllisyydestä saatu aiempi tieto, joka on peräisin esimerkiksi pitoisuusalueen määritystutkimuksista. Tarvittaessa voidaan tehdä pitoisuusalueen määritystesti, jossa käytetään viittä testikemikaalin pitoisuutta vaihteluvälillä 0,1–1 000 mg yhdessä kilogrammassa kuivaa maa-ainesta, ja käsittelyille ja kontrollille käytetään ainakin yhtä rinnakkaisnäytettä. Pitoisuusalueen määritystesti kestää 14 vuorokautta, minkä jälkeen todetaan täysikasvuisten punkkien kuolleisuus ja poikasten määrä. Varsinaisessa testissä käytettävä pitoisuusalue valitaan mieluiten siten, että siihen sisältyvät myös pitoisuudet, joissa poikasiin kohdistuu jo vaikutuksia, mutta emosukupolveen ei. Tämä ei kuitenkaan ole välttämättä mahdollista kemikaaleille, joilla on tappavia ja subletaaleja vaikutuksia lähes samoina pitoisuuksina. Testissä käytettävien pitoisuuksien on katettava vaikutuspitoisuus (esim. EC50, EC25 tai EC10) ja se pitoisuusalue, joka on merkityksellinen kyseisen testikemikaalin kannalta. Ekstrapolointia huomattavasti alle pienimmän testiorganismeihin vaikuttavan pitoisuuden tai yli suurimman testattavan pitoisuuden kannattaa käyttää vain poikkeustapauksissa, ja näin toimiminen on perusteltava testiraportissa.
|
Testijärjestely
Annosvastetestit
|
28.
|
Änkyrimatojen lisääntymistestiä koskevan toisen yhteistutkimuksen johdosta tehtyjen suositusten perusteella esitetään kolmea mahdollista testijärjestelyä (22). Kaikkien järjestelyjen yleinen soveltuvuus on todettu H. aculeifer -lajilla tehdyn validoinnin tuloksista.
|
|
29.
|
Pitoisuusalueen valinnassa on otettava huomioon seuraavat seikat:
|
—
|
Jotta ECx-arvo voidaan määrittää (esimerkiksi EC10, EC50), tulee testata 12 pitoisuutta. Jokaista testipitoisuutta kohti suositellaan vähintään kahta rinnakkaisnäytettä ja kuutta kontrollirinnakkaisnäytettä. Porrastuskerroin voi vaihdella ja olla enintään 1,8 odotetulla vaikutusalueella sekä yli 1,8 tätä suuremmilla ja pienemmillä pitoisuuksilla.
|
|
—
|
NOEC-arvoa määritettäessä testataan vähintään viisi pitoisuutta geometrisessa sarjassa. Jokaista testipitoisuutta kohti suositellaan neljää rinnakkaisnäytettä ja kahdeksaa kontrollia. Pitoisuudet on porrastettava kertoimella, joka saa olla enintään 2,0.
|
|
—
|
Yhdistetty lähestymistapa mahdollistaa sekä NOEC- että ECx-arvon määrittämisen. Tällöin käytetään kahdeksaa käsittelypitoisuutta geometrisessa sarjassa. Jokaista käsittelyä kohti suositellaan neljää rinnakkaisnäytettä ja kahdeksaa kontrollia. Pitoisuudet on porrastettava kertoimella, joka saa olla enintään 1,8.
|
|
Raja-annostesti
|
30.
|
Jos pitoisuusalueen määritystestissä ei havaita vaikutuksia suurimmalla pitoisuudella (esimerkiksi 1 000 mg/kg kuivaa maa-ainesta), varsinainen lisääntymistesti voidaan toteuttaa raja-annostestinä käyttäen testipitoisuutta 1 000 mg/kg kuivaa maa-ainesta. Raja-annostestin avulla voidaan osoittaa, että lisääntymisen NOEC- tai EC10-arvo on rajapitoisuutta korkeampi, mutta samalla testissä käytettyjen punkkien määrä voidaan pitää mahdollisimman pienenä. Sekä käsitellyn maa-aineksen että kontrollin osalta tulee käyttää kahdeksaa rinnakkaisnäytettä.
|
Testin kesto ja mittaukset
|
31.
|
Muistiin on kirjattava kaikki havaitut erot kontrolli- ja käsittelyastioissa olevien punkkien käyttäytymisessä ja morfologiassa.
|
|
32.
|
Päivänä 14 loput elossa olevat punkit otetaan talteen maa-aineksesta lämpö- tai valoerotuksella tai jollakin muulla sopivalla menetelmällä (ks. lisäys 5). Poikaset (toukat, protonymfit ja deutonymfit) ja täysikasvuiset yksilöt lasketaan erikseen. Täysikasvuiset punkit, joita ei tässä yhteydessä löydetä, on kirjattava kuolleiksi, sillä oletuksena on, että ne ovat kuolleet ja maatuneet ennen arviointia. Talteenottamisen tehokkuus on todennettava 1–2 kertaa vuodessa kontrolleilla, joissa täysikasvuisten yksilöiden ja poikasten lukumäärä tunnetaan. Kaikkia kehitysvaiheita yhdessä koskevan keskimääräisen tehokkuuden on oltava vähintään 90 prosenttia (ks. lisäys 5). Täysikasvuisten ja poikasten lukumäärää ei oikaista tehokkuutta arvioitaessa.
|
TIEDOT JA RAPORTOINTI
Tulosten käsittely
|
33.
|
Tietoa tilastollisista menetelmistä, joita voidaan käyttää testitulosten analysoinnissa, on 36–41 kohdissa. Lisäksi on syytä tutustua OECD:n julkaisuun (Document 54) ’Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application’ (31).
|
|
34.
|
Testin pääasiallinen mitattava ominaisuus on lisääntymiskyky eli tässä rinnakkaisnäyteastiaa kohti tuotettujen poikasten lukumäärä, kun astiaan on sijoitettu alun perin 10 täysikasvuista naarasta. Tilastollinen analyysi edellyttää, että jokaiselle käisttelylle ja kontrollille lasketaan lisääntymiskyvyn aritmeettinen keskiarvo (X) sekä varianssi (s2). X:ää ja s2:a käytetään ANOVA-menettelyissä, esimerkiksi Studentin t-testissä, Dunnettin testissä tai Watsonin-Williamsin testissä sekä 95 prosentin luottamusvälien laskemisessa.
Huomautus: Testin pääasiallinen mitattava ominaisuus on sama kuin hedelmällisyys, jota mitataan testin aikana tuotettujen elävien poikasten määrällä jaettuna testin alussa astiaan sijoitettujen emoeläinten lukumäärällä.
|
|
35.
|
Käsittelemättömissä kontrolleissa eloonjääneiden naaraiden määrä on keskeinen hyväksyttävyyskriteeri, ja se on dokumentoitava. Pitoisuusalueen määrittämistestin tavoin kaikki muut merkit kemikaalin vaarallisuudesta on kirjattava loppuraporttiin.
|
ECx
|
36.
|
ECx-arvot, mukaan lukien niitä koskevat 34 kohdassa kuvatun parametrin 95 prosentin luottamusvälit, lasketaan sopivien tilastollisten menetelmien avulla (esimerkiksi tilastollinen koestus, logistinen funktio tai Weibullin funktio, viritetty Spearmanin ja Kärberin menetelmä tai yksinkertainen interpolointi). ECx saadaan lisäämällä yhtälöön kontrollin keskiarvon x prosenttia vastaava arvo. Jos halutaan laskea EC50 tai jokin muu ECx-arvo, käsittelyä edeltävälle keskiarvolle (X) olisi tehtävä regressioanalyysi.
|
NOEC/LOEC
|
37.
|
Jos tilastollisella analyysilla on tarkoitus määrittää NOEC/LOEC-arvo, astiakohtaiset tilastot (yksittäisiä astioita pidetään rinnakkaisnäytteinä) ovat tarpeen. Asianmukaisia tilastomenetelmiä tulee käyttää ekotoksisuustietojen tilastollisessa analyysissa sovellettavia nykyisiä lähestymistapoja koskevan OECD:n asiakirjan nro 54 mukaan (Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application). Yleensä testin kohteen haitallisia vaikutuksia verrattuna kontrolliin tutkitaan käyttämällä yksisuuntaista (pienempää) hypoteesitestausta, jossa p ≤ 0,05. Esimerkkejä annetaan seuraavissa kappaleissa.
|
|
38.
|
Datan normaalijakaumaa voidaan testata esimerkiksi Kolmogorov-Smirnovin sopivuustestillä, vaihteluvälin ja normaalijakauman suhdetta mittaavalla R/s-testillä tai Shapiro-Wilk-testillä (kaksisuuntainen, p ≤ 0,05). Cochranin testiä, Levenen testiä tai Bartlettin testiä (kaksisuuntainen, p ≤ 0,05) voidaan käyttää varianssin homogeenisuuden testaamiseen. Jos parametritestimenetelmien edellytykset (normaalius, varianssin homogeenisuus) täyttyvät, voidaan tehdä yksisuuntainen varianssianalyysi (ANOVA) sekä tämän jälkeen monivertailutestejä. Monivertailuja (esimerkiksi Dunnettin testiä) tai alaspäin askeltavia trenditestejä (esimerkiksi Williamsin testiä, jos annosvastesuhde on monotoninen) voidaan käyttää sen laskemiseen, onko kontrollien ja testin kohteen eri pitoisuuksien välillä merkitseviä eroja (p ≤ 0,05) (suositellun testin valinta OECD:n ohjeasiakirjan nro 54 mukaan (Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application)). Muutoin NOEC- ja LOEC-arvojen määrittämisessä käytetään parametrittomia menetelmiä (esimerkiksi Bonferroni-U-testiä Holmin mukaan tai Jonckheere-Terpstran trenditestiä).
|
Raja-annostesti
|
39.
|
Jos raja-annostesti (kontrollin ja vain yhden käsittelyn vertailu) on tehty ja jos parametristen testimenetelmien vaatimukset (normaalius, homogeenisuus) täyttyvät, metrisiä vasteita voidaan arvioida Studentin testillä (t-testillä). Jos vaatimukset eivät täyty, voidaan käyttää t-testiä, jossa varianssit ovat heterogeenisia (Welchin t-testi) tai parametritonta testiä, kuten Mann-Whitney-U-testiä.
|
|
40.
|
Kontrollien välisten (kontrolli ja liuotinkontrolli) merkitsevien erojen määrittämiseksi jokaisen kontrollin rinnakkaisnäytteet voidaan testata raja-annoksen yhteydessä kuvatulla tavalla. Jos näissä testeissä ei havaita merkitseviä eroja, kaikki kontrolli- ja liuotinkontrollirinnakkaisnäytteet voidaan yhdistää. Muussa tapauksessa kaikkia käsittelyjä tulee vertailla liuotinkontrolliin.
|
Testiraportti
|
41.
|
Testiraportin on sisällettävä vähintään seuraavat tiedot:
|
—
|
Testikemikaali
|
—
|
testikemikaalin tunnistetiedot, nimi, erät, CAS-numero, puhtaus
|
|
—
|
testikemikaalin fysikaalis-kemialliset ominaisuudet (esimerkiksi log Kow, vesiliukoisuus, höyrynpaine, Henryn vakio (H) sekä mielellään myös tiedot testikemikaalin kulkeutumisesta maaperässä).
|
|
|
—
|
Testiorganismit
|
—
|
testiorganismien tunnistetiedot ja toimittaja, kuvaus kasvatusolosuhteista
|
|
|
—
|
Testiolosuhteet
|
—
|
kuvaus kokeen rakenteesta ja menettelyistä
|
|
—
|
testimaa-aineksen valmistelutiedot; yksityiskohtainen erittely, jos käytetään luonnonmaata (alkuperä, historia, hiukkaskokojakauma, pH, orgaanisen aineksen pitoisuus sekä maalajiluokitus, jos sellainen on käytettävissä)
|
|
—
|
maa-aineksen enimmäisvedenpidätyskyky
|
|
—
|
kuvaus tekniikasta, jolla testikemikaali on applikoitu maa-ainekseen
|
|
—
|
tiedot kemikaalin annostelussa käytetyistä kemiallisista apuaineista
|
|
—
|
testiastioiden koko ja astiaa kohti annostellun testimaa-aineksen kuivamassa
|
|
—
|
testiolosuhteet: valoteho, valoisien ja pimeiden jaksojen kesto, lämpötila
|
|
—
|
kuvaus eläinten ruokinnasta; testissä käytetyn ruoan tyyppi ja määrä, ruokintapäivämäärät
|
|
—
|
maa-aineksen pH ja vesipitoisuus testin alussa ja testin aikana (kontrolli ja jokainen käsittely)
|
|
—
|
yksityiskohtainen kuvaus talteenottomenetelmästä ja talteenottamisen tehokkuudesta.
|
|
|
—
|
Testitulokset
|
—
|
jokaisesta testiastiasta tavattujen poikasten määrä testin lopussa
|
|
—
|
jokaisesta testiastiasta tavattujen täysikasvuisten naaraiden määrä sekä täysikasvuisten kuolleisuus ( %) testin lopussa
|
|
—
|
kuvaus selvistä oireista tai selkeistä muutoksista käyttäytymisessä
|
|
—
|
vertailutestikemikaalista saadut tulokset
|
|
—
|
yhteenvetotilastot (ECx- ja/tai NOEC-arvo), mukaan lukien 95 prosentin luottamusvälit sekä kuvaus laskentamenetelmästä
|
|
—
|
pitoisuusvastesuhdetta esittävä käyrä
|
|
—
|
poikkeukset tässä testimenetelmässä kuvatuista menettelyistä ja kaikki testin aikana ilmenneet epätavallisuudet.
|
|
|
LÄHDEKIRJALLISUUS
|
(1)
|
Casanueva, M.E. (1993). Phylogenetic studies of the free-living and arthropod associated Laelapidae (Acari: Mesostigmata). Gayana Zool. 57, 21–46.
|
|
(2)
|
Tenorio, J. M. (1982). Hypoaspidinae (Acari: Gamasida: Laelapidae) of the Hawaiian Islands. Pacific Insects 24, 259–274.
|
|
(3)
|
Bakker, F.M., Feije, R., Grove, A. J., Hoogendorn, G., Jacobs, G., Loose, E.D. and van Stratum, P. (2003). A laboratory test protocol to evaluate effects of plant protection products on mortality and reproduction of the predatory mite Hypoaspis aculeifer Canestrini (Acari: Laelapidae) in standard soil. JSS – Journal of Soils and Sediments 3, 73–77.
|
|
(4)
|
Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. 2nd edition. Teoksessa: Dahl, F. (Hrsg.): Die Tierwelt Deutschlands 59. Teil, G. Fischer, Jena, 523 s.
|
|
(5)
|
Ruf, A. (1991). Do females eat males?: Laboratory studies on the popualation development of Hypoaspis aculeifer (Acari: Parasitiformes). Teoksessa: F. Dusbabek & V. Bukva (eds.): Modern Acarology. Academia Prague & SPD Academic Publishing bv, The Hague, Vol. 2, 487–492
|
|
(6)
|
Ruf, A. (1995). Sex ratio and clutch size control in the soil inhabiting predatory mite Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Proc. 2nd Symp. EURAAC: s. 241–249.
|
|
(7)
|
Ruf, A. (1996). Life-history patterns in soil-inhabiting mesostigmatid mites. Proc. IXth Internat. Congr. Acarol. 1994, Columbus, Ohio: s. 621–628.
|
|
(8)
|
Krogh, P.H. and Axelsen, J.A. (1998). Test on the predatory mite Hypoaspis aculeifer preying on the collembolan Folsomia fimetaria. Teoksessa: Lokke, H. and van Gestel, C.A.M.: Handbook of soil invertebrate toxicity tests. John Wiley Sons, Chichester, s. 239–251.
|
|
(9)
|
Løkke, H., Janssen, C.R., Lanno, R.P., Römbke, J., Rundgren, S. and Van Straalen, N.M. (2002). Soil Toxicity Tests – Invertebrates. Teoksessa: Test Methods to Determine Hazards of Sparingly Soluble Metal Compounds in Soils. Fairbrother, A., Glazebrook, P.W., Van Straalen, N.M. and Tarazona, J.V. (eds.). SETAC Press, Pensacola, USA. 128 s.
|
|
(10)
|
Schlosser, H.-J. and Riepert, F. (1991/92). Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilben (Gamasina). Teil 1: Biologie der Bodenraubmilbe Hypoaspis aculeifer Canestrini, 1883 (Gamasina) unter Laborbedingungen. Zool. Beiträge, 34, 395–433.
|
|
(11)
|
Schlosser, H.-J. and Riepert, F. (1992). Entwicklung eines Prüfverfahrens für Chemikalien an Boden-raubmilben (Gamasina). Teil 2: Erste Ergebnisse mit Lindan und Kaliumdichromat in subletaler Dosierung. Zool. Beitr. N.F. 34, 413–433.
|
|
(12)
|
Heckmann, L.-H., Maraldo, K. and Krogh, P. H. (2005). Life stage specific impact of dimethoate on the predatory mite Hypoaspis aculeifer Canestrini (Gamasida: Laelapidae). Environmental Science & Technology 39, 7154–7157.
|
|
(13)
|
Petersen, H. (1978). Some properties of two high-gradient extractors for soil microarthropods, and an attempt to evaluate their extraction efficiency. Natura Jutlandica 20, 95–122.
|
|
(14)
|
International Organisation for Standardization (ISO) (1994). Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
|
|
(15)
|
Tämän liitteen luku C.8. Myrkyllisyystutkimus madoilla.
|
|
(16)
|
EPPO (2003): EPPO Standards. Environmental risk assessment scheme for plant protection products. Chapter 8. Soil Organisms and Functions. Bull. OEPP/EPPO Bull. 33, 195–209.
|
|
(17)
|
International Organisation for Standardization (ISO) (1993). Soil Quality –Determination of dry matter and water content on a mass basis – Gravimetric method, No. 11465. ISO, Geneve.
|
|
(18)
|
Fairbrother, A., Glazebrock, P.W., Van Straalen, N.M. and Tarazona, J.V. 2002. Test methods to determine hazards of sparingly soluble metal compounds in soils. SETAC Press, Pensacola, FL, USA.
|
|
(19)
|
Chi, H. 1981. Die Vermehrungsrate von Hypoaspis aculeifer Canestrini (Acarina, Laelapidae) bei Ernährung mit Onychiurus fimatus Gisin (Collenbola). Ges.allg..angew. Ent. 3:122–125.
|
|
(20)
|
Schlosser, H.J., und Riepert, F. 1992. Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilden (Gamasina). Zool.Beitr. N.F. 34(3):395–433.
|
|
(21)
|
Heckmann, L.-H., Ruf, A., Nienstedt, K. M. and Krogh, P. H. 2007. Reproductive performance of the generalist predator Hypoaspis aculeifer (Acari: Gamasida) when foraging on different invertebrate prey. Applied Soil Ecology 36, 130–135.
|
|
(22)
|
Tämän liitteen luku C.32 (Änkyrimatojen lisääntymistesti).
|
|
(23)
|
International Organisation for Standardization (ISO) (1994). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
|
|
(24)
|
Southwood, T.R.E. (1991). Ecological methods. With particular reference to the study of insect populations. (2nd ed.). Chapman & Hall, London, 524 s.
|
|
(25)
|
Dunger, W. and Fiedler, H.J. (1997). Methoden der Bodenbiologie (2nd ed.). G. Fischer, Jena, 539 s.
|
|
(26)
|
Lesna, I. and Sabelis, M.W. (1999). Diet-dependent female choice for males with ’good genes’ in a soil predatory mite. Nature 401, 581–583.
|
|
(27)
|
Ruf, A. (1989). Die Bedeutung von Arrhenotokie und Kannibalismus für die Populationsentwicklung von Hypoaspis aculeifer (Canestrini 1883) (Acari, Gamasina). Mitt. Deut. Ges. Allg. Angew. Ent. 7, 103–107.
|
|
(28)
|
Ruf, A. (1993). Die morphologische Variabilität und Fortpflanzungsbiologie der Raubmilbe Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Dissertation, Universität Bremen.
|
|
(29)
|
Ignatowicz, S. (1974). Observations on the biology and development of Hypoaspis aculeifer Canestrini, 1885 (Acarina, Gamasides). Zoologica Poloniae 24, 11–59.
|
|
(30)
|
Kevan, D.K. McE. and Sharma, G.D. (1964). Observations on the biology of Hypoaspis aculeifer (Canestrini, 1884), apparently new to North America (Acarina: Mesostigmata: Laelaptidae). Acarologia 6, 647–658.
|
|
(31)
|
OECD (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD environmental Health and Safety Publications Series on Testing and Assessment No.54. ENV/JM/MONO(2006)18
|
Lisäys 1
Määritelmät
Tässä testimenetelmässä sovelletaan seuraavia määritelmiä (tässä testissä kaikki vaikuttavat pitoisuudet ilmaistaan testikemikaalin massana testimaan kuivamassaa kohti):
Kemikaali
: aine tai seos.
NOEC (no observed effect concentration = pitoisuus, joka ei aiheuta havaittavaa vaikutusta)
: testikemikaalin pitoisuus, josta ei aiheudu vaikutuksia. Tässä testissä NOEC-arvoa vastaavalla pitoisuudella ei ole tilastollisesti merkittävää vaikutusta (p < 0,05) tietyn altistusajan kuluessa kontrolliin verrattuna.
LOEC (lowest observed effect concentration = pienin havaittavan vaikutuksen aiheuttava pitoisuus)
: testikemikaalin pienin pitoisuus, jolla on tilastollisesti merkitsevä vaikutus (p < 0,05) tietyn altistusjakson aikana kontrolliin verrattuna.
ECx (Effect concentration for x % effect = vaikuttava pitoisuus, joka aiheuttaa x prosenttia muutoksia)
: pitoisuus, joka aiheuttaa x prosentin suuruisen vaikutuksen testiorganismeihin tietyn altistusjakson aikana kontrolliin verrattuna. Esimerkiksi EC50 on pitoisuus, jolla arvioidaan testin lopussa olevan 50 prosentin vaikutus altistuksen kohteeksi joutuneeseen populaatioon määritellyn altistusajan kuluessa.
Testikemikaali
: tätä testimenetelmää käyttäen testattu aine tai seos.
Lisäys 2
Maan enimmäisvedenpidätyskyvyn määrittäminen
Seuraavan menetelmän, jolla määritetään maan enimmäisvedenpidätyskyky, on havaittu olevan tarkoituksenmukainen. Se on kuvattu saasteiden vaikutuksia lieroille koskevan ISO DIS 11268-2 (Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Method for determination of effects on reproduction (23)) -standardin liitteessä C.
Kerää tietty määrä (esimerkiksi viisi grammaa) testimaasubstraattia sopivalla näytteenottovälineellä (kierrekairalla tms.). Aseta kierrekairaputken pohjalle pala märkää suodatinpaperia, ja laita se sitten telineessä vesiastiaan. Putki upotetaan veteen vähitellen, kunnes vedenpinta on maanäytteen yläpuolella. Sen jälkeen näytettä pidetään vedessä noin kolme tuntia. Kaikkea maa-aineksen kapillaareihin imeytynyttä vettä ei pystytä pidättämään, minkä vuoksi maanäytettä valutetaan kahden tunnin ajan asettamalla putki hyvin märkään kerrokseen hienojakoista kvartsihiekkaa, joka on laitettu suljettuun astiaan (kuivumisen estämiseksi). Sen jälkeen näyte punnitaan ja kuivataan pysyvään massaan 105 °C:ssa. Vedenpidätyskyky (WHC) lasketaan seuraavasti:

jossa:
S= vesikyllästetty substraatti + putken massa + suodatinpaperin massa
T= taara (putken massa + suodatinpaperin massa)
D= substraatin kuivamassa.
Lisäys 3
Maan pH:n määrittäminen
Seuraava menetelmä, jolla määritetään maan pH-arvo, perustuu maan laatua koskevassa standardissa ISO DIS 10390: Soil Quality – Determination of pH (16) olevaan kuvaukseen.
Tietyn määrän maata annetaan kuivua huoneenlämmössä vähintään 12 tunnin ajan. Sen jälkeen maasta valmistetaan suspensio (joka sisältää vähintään viisi grammaa maata), jonka tilavuus on viisinkertainen joko analyyttista laatua olevaan 1 M:n kaliumkloridiliuoksen (KCl) tilavuuteen tai analyyttista laatua olevaan 0,01 M:n kalsiumkloridiliuokseen (CaCl2) nähden. Sen jälkeen suspensiota ravistetaan perinpohjaisesti viisi minuuttia, ja sen annetaan asettua vähintään kaksi mutta enintään 24 tuntia. Nestefaasin pH-arvo mitataan pH-mittarilla, joka kalibroidaan ennen jokaista mittausta käyttämällä asianmukaisia puskuriliuoksia (esimerkiksi pH 4,0 ja 7,0).
Lisäys 4
Hypoaspis (Geolaelaps) aculeifer -lajin (petopunkki) kasvatus ja viljelmän synkronointi
Hypoaspis (Geolaelaps) aculeifer -lajin kasvatus:
Viljelmiä voidaan pitää muoviastioissa tai lasipurkeissa, jotka on täytetty kipsi- ja hiilijauheen seoksella (sekoitussuhde 9:1). Kipsi saadaan pidettyä kosteana lisäämällä tarvittaessa muutama pisara tislattua tai deionisoitua vettä. Ihanteellinen kasvatuslämpötila on 20 ± 2 °C. Valoisan ja pimeän ajan vaihtelulla ei ole tälle lajille merkitystä. Saaliseläimenä voivat olla lajeihin Typrophagus putrescentiae tai Caloglyphus sp. kuuluvat punkit (ravintona käytettäviä punkkeja on käsiteltävä varoen, sillä ne saattavat aiheuttaa allergiaa ihmisillä), mutta sopivia saaliseläimiä ovat myös sukkulamadot, änkyrimadot ja hyppyhäntäiset. Saaliseläinten lähteen on oltava tiedossa. Populaation kasvattaminen voidaan aloittaa yhdestä naaraasta, sillä koiraat kehittyvät hedelmöittymättömistä munista. Sukupolvet ovat suurelta osin päällekkäisiä. Naaras voi elää vähintään 100 päivää ja tuottaa elinaikanaan noin 100 munaa. Muninta on kiivaimmillaan 10–40 päivän iässä (täysikasvuiseksi tulon jälkeen), jolloin tuotettujen munien määrä on 2,2 munaa naarasta kohti päivässä. Kehittymisaika munasta täysikasvuiseksi naaraaksi on noin 20 päivää 20 °C:ssa. Etukäteen kannattaa ylläpitää useampaa kuin yhtä viljelmää.
Typrophagus putrescentiae -lajin kasvatus:
Punkkeja pidetään lasiastiassa, joka on täytetty hienolla leivontahiivajauheella ja joka sijoitetaan KNO3-liuoksella täytettyyn muoviämpäriin, jotta punkit eivät pääse pois astiasta. Punkit asetetaan jauheen päälle. Myöhemmin ne sekoitetaan huolellisesti lastalla jauheeseen, joka on vaihdettava kahdesti viikossa.
Viljelmän synkronointi:
Testissä käytettävien yksilöiden on oltava suunnilleen samanikäisiä (seitsemän päivää aikuisvaiheen saavuttamisesta). Kasvatuslämpötilassa 20 °C tämä saavutetaan seuraavasti:
Naaraat siirretään puhtaaseen kasvatusastiaan ja lisätään riittävästi ruokaa
|
—
|
Muninta-aikaa annetaan 2–3 vuorokautta, minkä jälkeen naaraat poistetaan
|
|
—
|
Täysikasvuiset naaraat otetaan testiin päivinä 28–35 sen jälkeen, kun täysikasvuiset naaraat siirrettiin puhtaisiin kasvatusastioihin.
|
Täysikasvuiset naaraat on helppo erottaa koiraista ja muista kehitysvaiheista, sillä ne ovat kooltaan suurempia ja muodoltaan paisuneita ja niillä on ruskea selkäpanssari. Koiraat ovat hoikempia ja ohuita, ja nuoret yksilöt ovat valkoisia tai kermanvärisiä. Punkkien kehitys 20 °C:n lämpötilassa on suurin piirtein seuraavan kuvion mukainen (kuva): Muna 5 vrk, toukka 2 vrk, protonymfi 5 vrk, deutonymfi 7 vrk, naaraan munintaa edeltävä vaihe 2 vrk. Tämän jälkeen punkit ovat täysikasvuisia.
Kuva
Hypoaspis (Geolaelaps) aculeifer -lajin kehittyminen 20 °C:n lämpötilassa. (Poistaminen = naaraat käytetään testiin.)
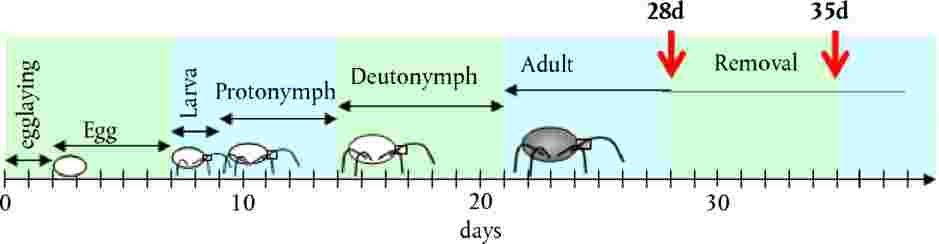
Täysikasvuiset koe-eläimet poistetaan synkronoidusta viljelmästä ja siirretään testiastioihin 28.–35. päivänä sen jälkeen, kun emoeläimet ovat aloitttaneet munimisen (7–14 vuorokautta sen jälkeen, kun niistä on tullut täysikasvuisia). Näin varmistetaan, että koe-eläimet eivät enää ole munintaa edeltävässä vaiheessa ja ne ovat pariutuneet kasvatusastiassa olevien koiraiden kanssa. Laboratorioviljelmistä tehtyjen havaintojen perusteella on syytä olettaa, että naaraat pariutuvat heti tai pian täysikasvuiseksi tulemisensa jälkeen, jos läsnä on koiraita (Ruf, Vanninen, henkilökohtaiset havainnot). Seitsemän vuorokauden jakso on valittu siksi, että se helpottaa integroimista laboratorion rutiineihin ja toimii puskurina punkkien yksilöllisille kehityseroille. Munintavaihe aloitetaan vähintään samalla määrällä naaraita, joka tarvitaan myöhemmin testiin. (Jos testiä varten tarvitaan esimerkiksi 400 naarasta, vähintään 400 naaraan annetaan munia 2–3 vuorokauden ajan.) Synkronoidun populaation alussa munia on oltava vähintään 1 200 (naaraiden ja koiraiden välinen suhde noin 0,5, kuolleisuus noin 0,2). Samassa astiassa on suositeltavaa pitää enintään 20–30 munivaa naarasta, jotta eläimet eivät ala syödä toisiaan.
Lisäys 5
Talteenottomenetelmät
Lämpöerottaminen on sopiva menetelmä mikroniveljalkaisten erottamiseen maa-aineksesta/substraatista (ks. oheinen kuva). Menetelmä perustuu organismien aktiivisuudelle, jolloin vain liikkuvat yksilöt tulevat kirjatuiksi. Lämpöerottamisen periaatteena on, että näytteessä olevien organismien olosuhteita heikennetään asteittain, jolloin ne poistuvat substraatista ja putoavat kiinnitysnesteeseen (esimerkiksi etanoliin). Ratkaisevia kohtia ovat talteenottoprosessin kesto sekä nopeus, jolla olosuhteet muuttuvat organismien kannalta hyvistä siedettävien kautta huonoiksi. Ympäristömyrkyllisyyttä testattaessa talteenottamisen täytyy tapahtua mahdollisimman nopeasti, sillä populaation kasvu talteenoton aikana vääristää tuloksia. Toisaalta näytteen lämpötila- ja kosteusolosuhteiden on aina oltava sellaisia, että punkit voivat liikkua. Maa-ainesnäytteen kuumentaminen saa substraatin kuivumaan. Jos kuivuminen tapahtuu liian nopeasti, osa punkeista saattaa myös kuivua ennen kuin ne ehtivät päästä pois.
Tämän vuoksi esitetään seuraavaa menettelyä (24), (25).
|
|
Laitteisto: Berlese-Tullgrenin suppilo tai vastaava menetelmä, esimerkiksi McFadyenin kehittämä (lämmitetään ylhäältäpäin, näyte laitetaan suppiloon)
|
|
|
Lämmityksen eteneminen: 25 °C 12 tunnin ajan, 35 °C 12 tunnin ajan, 45 °C 24 tunnin ajan (yhteensä 48 h). Lämpötila mitataan substraatista.
|
|
|
Kiinnitysneste: 70-prosenttinen etanoli
|
|
|
Ohjeet: Ota testissä käytetty lasipurkki. Poista kansi ja kääri suuaukon ympärille pala verkkoa tai kangasta. Kankaan silmäkoon on oltava 1,0–1,5 mm. Kiinnitä kangas paikalleen kumirenkaalla. Käännä lasipurkki varovasti ylösalaisin ja laita se talteenottolaitteeseen. Kangas estää substraattia valumasta kiinnitysnesteeseen, mutta päästää punkit pois näytteestä. Kun kaikki lasipurkit ovat erotuslaitteissa, aloita lämmittäminen. Lopeta talteenotto 48 tunnin kuluttua. Poista kiinnitysainetta sisältävät ampullit ja laske punkit preparointimikroskoopin avulla.
|
Valitun menetelmän tehokkuus talteenottamisessa on osoitettava 1–2 kertaa vuodessa käyttämällä astioita, joissa on tunnettu määrä poikasia ja täysikasvuisia punkkeja käsittelemättömässä testisubstraatissa. Kaikkia kehitysvaiheita yhdessä koskevan keskimääräisen tehokkuuden on oltava ≥ 90 prosenttia.
Berlese-Tullgrenin suppilon tyyppinen talteenottolaite

Testipurkin valmistelu testin päättymisen jälkeen ennen talteenoton aloittamista

Lisäys 6
Hypoaspis (Geolaelaps) aculeifer -lajin tunnistaminen
|
Alaryhmä/lahko/alalahko:
|
|
Heimo:
|
|
Suku/alasuku/laji:
|
|
Punkit/Loispunkit/Gamasida
|
|
Laelapidae
|
|
Hypoaspis (Geolaelaps) aculeifer
|
|
Laatija ja päivämäärä:
|
F. Faraji, Ph.D. (MITOX), 23.1.2007
|
|
Käytetty kirjallisuus:
|
Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. Tierwelt Deutschlands 59, 2nd revised edition: 1–523.
Hughes, A.M. (1976). The mites of stored food and houses. Ministry of Agriculture, Fisheries and Food, Technical Bulletin 9: 400 s.
Krantz, G.W. (1978). A manual of Acarology. Oregon State University Book Stores, Inc., 509 s.
|
|
Tunnusomaiset ominaisuudet:
|
Tectumissa pyöristynyt, hammastettu reuna; hypostomaalipainaumissa yli 6 pientä uloketta; Z4:n hännänpuoleiset selkäsuat eivät erityisen pitkät; setiformiset selkäsuat; genitaalipanssari normaali, ei kovin suurentunut eikä ulotu peräpanssariin saakka; selkäpanssarin taaemmaisessa osassa ei parittomia sukia; jaloissa II ja IV paksuja makrosukia; selkäsuka Z5 noin kaksi kertaa pitempi kuin J5; saksien kiinteässä haarassa 12–14 hammasta ja liikkuvassa haarassa 2 hammasta; idiosoman pituus 520–685 μm.
Hypoaspis miles -lajia käytetään myös biologisessa torjunnassa, ja se saatetaan sekoittaa H. aculeiferiin. Tärkein ero on seuraava:
H. miles kuuluu Cosmolaelaps-alasukuun ja sen selkäsuat ovat veitsimäiset, kun taas H. aculeifer kuuluu Geolaelaps-alasukuun ja sen selkäsuat ovat setiformiset.
|

Lisäys 7
Perustietoa Hypoaspis (Geolaelaps) aculeifer -lajin biologiasta
Hypoaspis aculeifer kuuluu sukuun Lealapidae, lahkoon Acari (punkit), luokkaan Arachnida, pääjaksoon niveljalkaiset. Ne elävät kaikentyyppisessä maa-aineksessa ja käyttävät ravinnokseen muita punkkeja, sukkulamatoja, änkyrimatoja ja hyppyhäntäisiä (26). Jos ravinnosta on pulaa, nämä punkit alkavat syödä toisiaan. Petopunkkien osat ovat idiosoma ja gnathosoma. Idiosoma ei jakaannu selvästi päähän (prosoma) ja muuhun vartaloon (opisthosoma). Gnathosomassa on syömiseen tarvittavat välineet, kuten tuntokarvat ja sakset. Sakset ovat kolmihaaraiset ja niissä on erikokoisia hampaita. Syömisen lisäksi koiraat käyttävät saksiaan pääasiassa spermapakettien siirtämiseen naaraisiin. Selkäpanssari peittää idiosoman lähes täysin. Suuren osa naaraan idiosomasta vievät lisääntymiselimet, jotka ovat erityisen helposti erotettavissa hieman ennen munien laskemista. Vatsapuolella erottuu kaksi panssaria, rintalasta sekä genitaalipanssari. Kaikissa raajoissa on harjaksia ja piikkejä. Harjaksia eläin käyttää ankkureina liikkuessaan maassa tai sen pinnalla. Ensimmäistä raajaparia käytetään lähinnä tuntosarvina. Toista raajaparia käytetään paitsi liikkumiseen, myös saaliiseen tarttumiseen. Neljännen raajaparin piikit ovat suojaamista varten, mutta, muodostavat myös eräänlaisen liikemoottorin. Koiraat ovat 0,55–0,65 mm pitkiä ja painavat 10–15 μg. Naaraat ovat 0,8–0,9 mm pitkiä ja painavat 50–60 μg (8) (kuva 1).
Kuva 1
H. aculeifer -lajin naaras, koiras, protonymfi ja toukkia.

Naaraspunkit tulevat sukukypsiksi 23 °C:ssä 16 vuorokaudessa ja koiraat 18 vuorokaudessa (6). Naaraat kantavat siittiösoluja solenostomissa, mistä ne siirretään kohtuun. Siittiösoluja säilytetään kohdussa, jossa ne kypsyvät. Hedelmöittyminen tapahtuu vasta, kun siittiösolut ovat kypsyneet kohdussa. Naaraat laskevat hedelmöityneet tai hedelmöittymättömät munat rykelminä tai erikseen mieluiten pieniin rakosiin. Paritelleet naaraat voivat tuottaa molempia sukupuolia olevia poikasia, mutta parittelemattomien naaraiden munista kuoriutuu vain koiraita. Täysikasvuiseksi kehittyessään punkki käy läpi neljä kehitysvaihetta: muna–toukka, toukka–protonymfi, protonymfi–deutonymfi, deutonymfi–täysikasvuinen.
Muna on maidonvalkoinen, soikea, läpinäkyvä, noin 0,37 mm pitkä ja siinä on kiinteä vaippa. Kirjallisuuslähteen (8) mukaan toukkien koko on 0,42–0,45 mm. Toukilla on vain kolme raajaparia. Pään alueelle kehittyvät tuntokarvat ja sakset. Saksissa on muutama pieni hammas, ja niitä käytetään apuna munasta kuoriutumisessa. Ensimmäisen nahanluonnin jälkeen 1–2 vuorokauden kuluttua kuoriutumisesta kehittyvät protonymfit. Nekin ovat valkoisia ja kooltaan 0,45–0,62 mm (8), ja niillä on neljä raajaparia. Saksissa on jo kaikki hampaat. Tästä vaiheesta lähtien punkit alkavat saalistaa. Saaliseläimen kutikula lävistetään saksilla ja saaliseläimeen eritetään ruoansulatusnestettä. Lopuksi punkki imee muhentuneen ruokansa. Saksia voidaan käyttää myös suuren ravinnon paloittelemiseen (28). Seuraavan nahanluonnin jälkeen kehittyvät deutonymfit. Ne ovat kooltaan 0,60–0,80 mm ja väriltään keltaisesta vaaleanruskeaan. Tästä vaiheesta lähtien naaras- ja koiraspunkit voi erottaa toisistaan. Nahka luodaan vielä kerran noin 14 vuorokauden iässä. Nahanluonnin aikana eläin on liikkumaton ja sille kehittyy ruskea panssari. Tämän jälkeen punkit ovat täysikasvuisia (28), (29), (30). Punkit elävät 48–100 vuorokautta 25 °C:n lämpötilassa (27).
Lisäys 8
Yhteenveto tärkeimmistä hypoaspis-testissä tehtävistä toimenpiteistä ja eri tehtävien aikataulu
|
Aika (vuorokausina)
testin aloittaminen = päivä 0
|
Tehtävä tai toimenpide
|
|
Päivät – 35
… – 28
|
Naaraat siirretään kantaviljelmästä puhtaisiin astioihin synkronoinnin aloittamista varten
2 päivää myöhemmin naaraat poistetaan
2–3 kertaa viikossa: annetaan riittävästi ruokaa
|
|
Päivä – 5 (± 2)
|
Keinomaa valmistetaan
|
|
Päivä – 4 (± 2)
|
Keinomaan vedenpidätyskyky todetaan
Kuivatus yön yli
Seuraavana päivänä: näytteet punnitaan ja vedenpidätyskyky lasketaan
|
|
Päivä – 4 (± 2)
|
Keinomaa esikostutetaan 20–30 prosenttiin vedenpidätyskyvystä
|
|
Päivä 0
|
Testi aloitetaan: testikemikaali lisätään keinomaahan
Jokaiseen rinnakkaisnäytteeseen siirretään 10 naarasta
Rinnakkaisnäytteet punnitaan
Perustetaan abioottiset kontrollit kosteuspitoisuuden ja pH-arvon mittaamista varten; 2 rinnakkaisnäytettä jokaiselle käsittelylle
Kosteuspitoisuuden kontrolleja kuivatetaan yön yli
Seuraavana päivänä: kosteuspitoisuuden kontrollit punnitaan
Seuraavana päivänä: kuivattujen abioottisten kontrollien pH-arvo mitataan
|
|
Päivä 3, 6, 9, 12 (noin)
|
Jokaiseen rinnakkaisnäytteeseen laitetaan riittävästi saalisorganismeja
Kaikki rinnakkaisnäytteet punnitaan ja tarvittaessa korvataan haihtunut vesi
|
|
Päivä 14
|
Testi lopetetaan ja punkit otetaan talteen kaikista rinnakkaisnäytteistä sekä talteenoton tehokkuuden kontrolleista
Vesipitoisuuden kontrolleja kuivatetaan yön yli
Seuraavana päivänä: vesipitoisuuden kontrollit punnitaan
Seuraavana päivänä: kuivattujen kontrollien pH-arvo mitataan
|
|
Päivä 16
|
Talteenotto lopetetaan
|
|
Päivä 16 +
|
Talteenotettujen täysikasvuisten yksilöiden ja poikasten lukumäärä kirjataan muistiin
Tulokset raportoidaan mallitaulukoita käyttämällä
Testauksessa käytetty menetelmä raportoidaan testipöytäkirjalomakkeita käyttämällä
|
C.37. 21PÄIVÄN MITTAINEN SEULONTATUTKIMUS KALOILLA: LYHYTAIKAINEN ESTROGEENI- JA ANDROGEENIAKTIIVISUUTEEN SEKÄ AROMATAASIN ESTOON KOHDISTUVA SEULONTA
JOHDANTO
|
1.
|
Tämä testimenetelmä vastaa OECD:n testiohjetta (TG) nro 230 (2009). Tarve kehittää ja validoida kalatutkimus, jolla pystytään havaitsemaan tiettyjä hormonitoimintaan vaikuttavia kemikaaleja, perustuu siihen, että kemikaalien ympäristöpitoisuuksista saattaa aiheutua haittavaikutuksia sekä ihmisille että eläimille kemikaalien ja hormonijärjestelmän välisen vuorovaikutuksen vuoksi. Vuonna 1998 OECD aloitti tärkeän toimenpiteen, nimittäin olemassa olevien ohjeiden uudistuksen ja uusien ohjeiden laatimisen mahdollisten hormonitoimintaa häiritsevien aineiden seulontaa ja testausta varten. Yksi toimenpiteen osa oli laatia testiohjeet kalojen hormonijärjestelmään vaikuttavien kemikaalien seulontaan. Kahdenkymmenenyhden päivän mittainen kalojen hormonijärjestelmään kohdistuva seulontatutkimus käsiteltiin laaja-alaisessa validointiohjelmassa. Siihen sisältyi laboratorioiden välisiä tutkimuksia tietyillä kemikaaleilla, ja tutkimusten tavoitteena oli osoittaa määritysmenetelmän tarkkuus ja luotettavuus estrogeenia ja aromataasia estävien kemikaalien havaitsemisessa (1, 2, 3, 4, 5) kolmella tutkitulla kalalajilla (rasvapäämutu, medaka ja seeprakala). Tutkimukset osoittivat, että androgeeninen aktiivisuus oli mahdollista osoittaa rasvapäämutussa ja medakassa, mutta ei seeprakalassa. Tällä testimenetelmällä ei voida havaita antiandrogeenisesti vaikuttavia kemikaaleja. Validoinnin vertaisarvioi asiantuntijaryhmä, jonka nimittivät testiohjeohjelman kansalliset koordinaattorit (6). Määritysmenetelmää ei ole tarkoitettu hormonitoimintaa häiritsevien tiettyjen mekanismien tunnistamiseen, sillä koe-eläimillä on ehjä hypotalamus-aivolisäke-sukurauhasakseli (HPG-akseli), joka saattaa reagoida kemikaaleihin, jotka vaikuttavat HPG-akseliin eri pitoisuuksilla. Kalojen lyhytaikaiseen lisääntymistutkimukseen (OECD TG 229) sisältyy rasvapäämutun hedelmällisyys ja tarvittaessa sukupuolirauhasten histopatologia sekä kaikki tähän testimenetelmään kuuluvat tutkittavat ominaisuudet. OECD TG 229 -testiohje koskee niiden kemikaalien seulontaa, jotka vaikuttavat lisääntymiseen eri mekanismeilla, mukaan luettuina hormonijärjestelmään kohdistuvat vaikutustavat. Tämä on otettava huomioon ennen sopivimman testimenetelmän valintaa.
|
|
2.
|
Tässä testimenetelmässä kuvataan in vivo -seulontamenetelmä, jossa sukukypsiä koiraskaloja ja kutevia naaraskaloja pidetään yhdessä ja altistetaan kemikaalille tietyn ajan niiden elinkaaresta (21 päivää). Kahdenkymmenenyhden päivän pituisen altistusjakson lopussa koirailta ja naarailta mitataan yksi tai kaksi biomarkkeriominaisuutta (käytetyn lajin mukaan), joita pidetään indikaattoreina testikemikaalin estrogeeni- ja androgeeniaktiivisuudesta sekä aromataasin estosta. Nämä ominaisuudet ovat vitellogeniini ja sekundaariset sukupuoliominaisuudet. Vitellogeniini mitataan rasvapäämutulta, medakalta ja seeprakalalta, kun taas sekundaariset sukupuoliominaisuudet mitataan vain rasvapäämutulta ja medakalta.
|
|
3.
|
Tämä biologinen testi toimii tiettyjen hormonijärjestelmään kohdistuvien vaikutustapojen in vivo -seulontamenetelmänä, ja sitä sovellettaessa on otettava huomioon asiakirjaan ’OECD Conceptual Framework for the Testing and Assessment of Endocrine Disrupting Chemicals’ (28) (hormonaalisten haitta-aineiden testausta ja arviointia koskeva toimintamalli) liittyvä konteksti.
|
JOHDANTO JA RAJOITUKSET
|
4.
|
Munimalla lisääntyvien selkärankaisten naaraiden maksa tuottaa yleensä vitellogeniinia verenkierrossa olevan endogeenisen estrogeenin avulla. Se on munankeltuaisen proteiinien esiaste, ja kun maksa on tuottanut sitä, se kulkeutuu verenkierrossa munasarjoihin, joissa kehittyvät munasolut ottavat sen sisäänsä ja muokkaavat sitä. Epäkypsien naaras- ja koiraskalojen plasmassa vitellogeniinia on lähes mahdoton havaita, koska niillä ei ole riittävästi estrogeenia verenkierrossaan. Maksa voi kuitenkin syntetisoida ja erittää vitellogeniinia eksogeenisen estrogeenistimulaation avulla.
|
|
5.
|
Vitellogeniinin mittauksella voidaan havaita kemikaaleja, joilla on erilaisia estrogeeniin liittyviä vaikutustapoja. Estrogeeniin vaikuttavien kemikaalien havaitseminen on mahdollista mittaamalla vitellogeniinin indusointia koiraskaloilla, ja sitä on dokumentoitu runsaasti tieteellisessä vertaisarvioidussa kirjallisuudessa (esimerkiksi (7)). Vitellogeniinin indusointi on osoitettu myös aromatisoituville androgeeneille altistumisen jälkeen (8, 9). Kun naaraskalojen verenkierron estrogeenipitoisuus pienentyy esimerkiksi estämällä aromataasia muuntamasta endogeenista androgeenia luonnolliseksi estrogeeniksi, 17β-estradioliksi, myös aromataasia estäviä ominaisuuksia sisältävien kemikaalien havaitsemisessa käytettävän vitellogeniinin pitoisuus pienenee (10, 11). Estrogeenin/aromataasin estämisen aiheuttaman vitellogeniinivasteen biologinen merkityksellisyys on osoitettu ja se on dokumentoitu laajalti. On kuitenkin mahdollista, että vitellogeniinin tuotantoon naarailla voivat vaikuttaa myös yleinen myrkyllisyys ja muuhun kuin hormonijärjestelmään kohdistuvat myrkylliset vaikutustavat (esimerkiksi hepatotoksisuus).
|
|
6.
|
Useita mittausmenetelmiä on kehitetty onnistuneesti, ja ne on myös vakioitu rutiinikäyttöön. Esimerkkinä tästä ovat lajikohtaiset entsyymivälitteiset immunosorbenttimääritysmenetelmät (ELISA), joissa käytetään immunokemiaa kvantifioitaessa vitellogeniinia yksittäisiltä kaloilta otetuista veri- tai maksanäytteistä (12, 13, 14, 15, 16, 17, 18). Rasvapäämutun verestä, seeprakalan verestä tai pään/pyrstön homogenaatista sekä medakan maksasta otetaan näytteitä vitellogeniinin mittausta varten. Medakalla verestä ja maksasta mitattujen vitellogeniiniarvojen välinen korrelaatio on hyvä (19). Lisäyksessä 6 on esitetty suositeltavat näytteenottomenetelmät vitellogeniinianalyysia varten. Vitellogeniinin mittaukseen tarkoitettuja testipaketteja on saatavilla laajalti, ja niiden on perustuttava validoituun lajikohtaiseen ELISA-menetelmään.
|
|
7.
|
Tiettyjen lajien koiraskaloilla sekundaariset sukupuoliominaisuudet ovat ulkoisesti näkyviä, ja ne ovat kvantifioitavissa ja vastaavat verenkierron endogeenisten androgeenien pitoisuutta rasvapäämutulla ja medakalla mutta eivät seeprakalalla, koska sillä ei ole kvantifioitavia sekundaarisia sukupuoliominaisuuksia. Naarailla on kyky kehittää koiraan sekundaarisia sukupuoliominaisuuksia, kun ne altistuvat androgeenisesti vaikuttaville kemikaaleille vedessä. Tieteellisessä kirjallisuudessa on useita tutkimuksia, joissa dokumentoidaan tämäntyyppisestä vasteesta rasvapäämutulla (20) ja medakalla (21). Koiraskalojen sekundaaristen sukupuoliominaisuuksien vähenemisen tulkinnassa on syytä olla varovainen heikon tilastollisen voiman takia, ja sen on perustuttava asiantuntijan arvioon ja näyttöön perustuvaan toimintatapaan. Seeprakalan käyttöön tässä määrityksessä liittyy rajoituksia, koska sillä ei ole kvantifioitavia sekundaarisia sukupuoliominaisuuksia, jotka reagoivat androgeenisesti vaikuttaviin kemikaaleihin.
|
|
8.
|
Rasvapäämutulla eksogeenisen androgeenialtistuksen pääindikaattori on naaraskalan kuonossa sijaitsevien kutukyhmyjen lukumäärä. Medakalla tärkein merkki eksogeenisesta altistumisesta androgeenisesti vaikuttaville kemikaaleille on naaraskalojen sukuelinpapillien lukumäärä. Lisäyksissä 5A ja 5B esitetään suositeltavat menetelmät rasvapäämutun ja medakan sukupuoliominaisuuksien arvioimiseksi.
|
|
9.
|
Tässä testimenetelmässä käytetyt määritelmät ovat lisäyksessä 1.
|
TESTIN PERIAATE
|
10.
|
Määrityksessä lisääntymistilassa olevat koiras- ja naaraskalat altistetaan yhdessä testiastiassa. Kumpikin sukupuoli voidaan erottaa selvästi aikuisuuden ja lisääntymistilan perusteella, joten kukin tutkittava ominaisuus voidaan analysoida sukupuolikohtaisesti, ja myös sukupuolikohtainen herkkyys eksogeenisille kemikaaleille voidaan selvittää varmasti. Testin päätteeksi sukupuoli vahvistetaan sukupuolirauhasten makroskooppisella tutkimuksella, joka tehdään avaamalla kalan maha saksilla ventraalisesti. Yhteenveto oleellisista biologisen testin olosuhteista on lisäyksessä 2. Yleensä testi aloitetaan kalalla, joka on otettu kutuikäisestä populaatiosta; vanhoja kaloja ei tule käyttää. Ohjeita kalan iän ja lisääntymistilan selvittämiseen on Kalan valinta -kohdassa. Testi tehdään käyttäen kolmea kemikaalialtistuksen pitoisuutta ja vesikontrollia sekä tarvittaessa liuotinkontrollia. Medakan ja seeprakalan kanssa käytetään kahta astiaa tai rinnakkaisnäytettä käsittelykertaa kohti (kukin astia sisältää viisi koirasta ja viisi naarasta), kun taas rasvapäämutun kanssa käytetään neljää astiaa tai rinnakkaisnäytettä käsittelykertaa kohti (kukin astia sisältää kaksi koirasta ja neljä naarasta). Tällä tavalla voidaan mukauttaa rasvapäämutukoiraan reviirikäyttäytyminen ja samalla säilyttää testin riittävä voima. Altistusta jatketaan 21 päivää, ja kaloista otetaan näytteet altistuksen päivänä 21.
|
|
11.
|
Päivänä 21 tehtävän näytteenoton yhteydessä kalat lopetetaan inhimillisellä tavalla. Sekundaariset sukupuoliominaisuudet mitataan rasvapäämutulta ja medakalta (ks. lisäykset 5A ja 5B). Verinäytteet vitellogeniinin määrittämiseksi otetaan seeprakalalta ja rasvapäämutulta; vaihtoehtoisesti seeprakalalta voidaan ottaa pää/pyrstö vitellogeniinin määrittämistä varten (lisäys 6). Medakalta otetaan maksa vitellogeniinianalyysia varten (lisäys 6).
|
TESTIN HYVÄKSYTTÄVYYSKRITEERIT
|
12.
|
Testitulokset ovat hyväksyttäviä, jos seuraavat ehdot täyttyvät:
|
—
|
kuolleisuus vesi- (tai liuotin)kontrolleissa on enintään 10 prosenttia altistusjakson lopussa.
|
|
—
|
liuenneen hapen pitoisuus on vähintään 60 prosenttia ilman kyllästysarvosta koko altistusjakson ajan.
|
|
—
|
veden lämpötila testiastioiden välillä vaihtelee enintään ± 1,5 °C milloin tahansa testin aikana ja poikkeaa enintään 2 °C siitä lämpötila-alueesta, joka on määritelty kyseiselle testilajille (lisäys 2).
|
|
—
|
saatavilla on oltava näyttöä, joka osoittaa, että testikemikaalin pitoisuudet liuoksessa ovat olleet ± 20 prosenttia keskimääräisistä mitatuista arvoista.
|
|
MENETELMÄN KUVAUS
Laitteisto
|
13.
|
Tavalliset laboratoriolaitteet ja erityisesti seuraavat:
|
b)
|
laitteet veden kovuuden ja emäksisyyden mittaamiseen
|
|
c)
|
asianmukaiset laitteet lämpötilan säätöön ja mieluiten sen jatkuvaan seurantaan
|
|
d)
|
säiliöitä, jotka ovat kemiallisesti inerttiä materiaalia ja riittävän suuria suhteessa suositeltuun lastaus- ja varastotiheyteen (ks. lisäys 2)
|
|
e)
|
kutualusta rasvapäämutulle ja seeprakalalle; tarkemmat tiedot ovat lisäyksessä 4
|
|
f)
|
riittävän tarkka vaaka (ts. tarkkuus ±0,5 mg).
|
|
Vesi
|
14.
|
Testissä voidaan käyttää mitä tahansa sellaista vettä, jossa testilaji selviytyy ja kasvaa riittävän pitkän ajan. Veden laadun pitäisi pysyä vakiona testin ajan. Veden pH:n on oltava välillä 6,5–8,5, mutta kunkin testin aikana se ei saa vaihdella minkään testin aikana enempää kuin 0,5 pH-yksikköä. Sen varmistamiseksi, ettei laimennusvesi vaikuta liikaa testituloksiin (esimerkiksi kompleksoimalla testattavaa ainetta), näytteitä on otettava säännöllisin väliajoin analyyseja varten. Raskasmetallit (esimerkiksi Cu, Pb, Zn, Hg, Cd, Ni), tärkeimmät anionit ja kationit (esimerkiksi Ca2+, Mg2+, Na+, K+, Cl– ja SO4
2–), torjunta-aineet (esimerkiksi orgaanista fosforia ja orgaanista klooria sisältävien torjunta-aineiden kokonaispitoisuudet), orgaanisiin yhdisteisiin sitoutuneen hiilen kokonaispitoisuus ja suspendoituneet kiinteät aineet on määritettävä esimerkiksi kolmen kuukauden välein, jos laimennusveden laatu tiedetään suhteellisen vakioksi. Jos veden laadun on osoitettu pysyvän vakiona ainakin vuoden ajan, määrityksiä voidaan tehdä harvemmin (esimerkiksi kuuden kuukauden välein). Lisäyksessä 3 luetellaan joitakin hyväksyttävän laimennusveden kemiallisia ominaisuuksia.
|
Testiliuokset
|
15.
|
Halutunpitoiset testiliuokset valmistetaan varastoliuoksista laimentamalla. Varastoliuos valmistetaan mieluiten yksinkertaisesti sekoittamalla testattava aine laimennusveteen käyttäen mekaanisia menetelmiä (kuten sekoittamista tai ultraääntä). Saturaatiopylväitä (liukoisuuspylväitä) voi käyttää riittävän väkevän varastoliuoksen valmistamiseksi. Liuottimen käyttöä kantoaineena ei suositella. Jos liuotin on kuitenkin tarpeen, rinnalla on käytettävä liuotinkontrollia, ja liuotinpitoisuuden on oltava sama kuin kemikaalilla käsittelyissä. Vaikeasti testattavien testikemikaalien yhteydessä liuotin voi olla teknisesti paras ratkaisu, mutta tällöin tulee noudattaa OECD:n ohjeasiakirjaa ’OECD Guidance Document on aquatic toxicity testing of difficult substances and mixtures’ (22) (vaikeasti testattavien aineiden ja seosten vesiympäristölle myrkyllisyyden testaus). Liuottimen valinta määräytyy kemikaalin kemiallisten ominaisuuksien perusteella. OECD:n ohjeasiakirjassa enimmäispitoisuudeksi suositellaan 100 μl/l, mikä tulee ottaa huomioon. Hiljattain julkaistussa katsauksessa (23) kuitenkin korostettiin lisähuolenaiheita, joita syntyy, kun hormonijärjestelmään kohdistuvia vaikutuksia testattaessa käytetään liuottimia. Sen vuoksi on suositeltavaa, että liuottimen pitoisuus pidetään tarvittaessa mahdollisimman pienenä, jos se on teknisesti toteutettavissa (testikemikaalin fysikaalis-kemiallisten ominaisuuksien mukaan).
|
|
16.
|
Testissä käytetään läpivirtaustestijärjestelmää. Tällainen järjestelmä annostelee ja laimentaa testiaineen varastoliuosta jatkuvasti (esimerkiksi annostelupumpulla, laimentimella, kyllästävällä järjestelmällä) testipitoisuuksien annostelemiseksi testiastioihin. Varastoliuosten ja laimennusveden virtausnopeudet on tarkistettava säännöllisin väliajoin, mieluiten kerran päivässä, ja virtausnopeus saa vaihdella enintään 10 prosenttia koko testin aikana. Heikkolaatuisten muoviletkujen tai muiden sellaisten materiaalien, jotka saattavat sisältää biologisesti aktiivisia kemikaaleja, käyttämistä on pyrittävä välttämään. Kun valitaan materiaalia läpivirtausjärjestelmään, testikemikaalin mahdollinen imeytyminen tähän materiaaliin on otettava huomioon.
|
Kalojen hoito
|
17.
|
Testikalat on valittava yhdestä laboratoriopopulaatiosta, mieluiten samasta poikueesta, jota on pidetty vähintään kaksi viikkoa ennen testiä samanlaatuisessa vedessä ja samanlaisissa valaistusolosuhteissa kuin ne, joita käytetään testissä. On tärkeää, että kalojen lastaustiheys ja varastotiheys (ks. määritelmät lisäyksestä 1) ovat asianmukaiset käytettyjen testilajien kannalta (ks. lisäys 2).
|
|
18.
|
Kuolleiden kalojen määrä kirjataan 48 tunnin alkutotuttelun jälkeen, jonka jälkeen noudatetaan seuraavia periaatteita:
|
—
|
Jos kuolleisuus on yli 10 prosenttia populaatiosta seitsemässä vuorokaudessa, koko erä hylätään.
|
|
—
|
Jos kuolleisuus on välillä 5–10 prosenttia populaatiosta, totuttautumista jatketaan seitsemän päivää lisää; jos kuolleisuus on yli 5 prosenttia näiden toisten seitsemän päivän aikana, koko erä hylätään.
|
|
—
|
Jos kuolleisuus on alle 5 prosenttia populaatiosta seitsemän vuorokauden aikana, koko erä hyväksytään.
|
|
|
19.
|
Kalat eivät saa saada hoitoa sairauteen totuttelujakson, esialtistusjakson tai altistusjakson aikana.
|
Esialtistus ja kalojen valinta
|
20.
|
Yhden viikon esialtistusjakso on suositeltavaa, ja siinä eläimet sijoitetaan samanlaisiin astioihin kuin varsinaisessa testissä. Kaloja on ruokittava ad libitum koko hoitojakson ja altistusjakson ajan. Altistusjakso aloitetaan lisääntymiskypsiin koe-eläimiin kuuluvalla dimorfisella aikuisella kalalla (ts. jonka sekundaariset sukupuoliominaisuudet ovat rasvapäämutulla ja medakalla selvästi näkyvillä), joka kutee aktiivisesti. Rasvapäämutujen osalta yleinen ohje (jonka lisäksi on tarkkailtava tietyn kalaerän varsinaista lisääntymistilaa) on se, että niiden iän on oltava 20 (± 2) viikkoa, kun oletetaan, että niitä on kasvatettu 25 ± 2 °C:n lämpötilassa niiden koko elinkaaren ajan. Medakojen iän on oltava 16 (± 2) viikkoa, kun oletetaan, että niitä on kasvatettu 25 ± 2 °C:n lämpötilassa niiden koko elinkaaren ajan. Seeprakalojen iän on oltava 16 (± 2) viikkoa, kun oletetaan, että niitä on kasvatettu 26 ± 2 °C:n lämpötilassa niiden koko elinkaaren ajan.
|
TESTISUUNNITELMA
|
21.
|
Testissä käytetään kolmea pitoisuutta testikemikaalista, yhtä kontrollia (vettä) ja tarvittaessa yhtä liuotinkontrollia. Tiedot voidaan analysoida käsittely- ja kontrollivasteiden välisten, tilastollisesti merkitsevien erojen määrittämiseksi. Näistä analyyseista saadaan tietoa siitä, onko kemikaalin pidempiaikainen lisätestaus haittavaikutusten osalta (eloonjääminen, kehitys, kasvu ja lisääntyminen) tarpeen sen sijaan, että näitä tietoja käytettäisiin riskinarvioinnissa (24).
|
|
22.
|
Kokeen päivänä 21 kummankin käsittelytason (viisi koirasta ja viisi naarasta kummassakin rinnakkaisnäytteessä) seeprakala- ja medakakoirailta ja -naarailta ja verrokkiryhmän (-ryhmien) kaloilta otetaan näytteet vitellogeniinin ja sekundaaristen sukupuoliominaisuuksien mittaamista varten, mikäli tarpeen. Kokeen päivänä 21 rasvapäämutukoirailta ja -naarailta (kaksi koirasta ja neljä naarasta kaikissa neljässä rinnakkaisnäytteessä) ja verrokkiryhmän (-ryhmien) kaloilta otetaan näytteet vitellogeniinin ja sekundaaristen sukupuoliominaisuuksien mittaamista varten.
|
Testipitoisuuksien valinta
|
23.
|
Tässä testissä suurimmaksi testipitoisuudeksi on valittava annostason määrittämistutkimuksista tai muista myrkyllisyystiedoista saatu suurin siedetty pitoisuus (MTC-arvo), tai 10 mg/l tai enimmäisliukoisuus vedessä sen mukaan, mikä arvo on pienin. MTC-arvo on kemikaalin suurin testauspitoisuus, jonka aiheuttama kuolleisuus on alle 10 prosenttia. Tässä lähestymistavassa oletetaan, että käytettävissä on empiiristä tietoa välittömästä myrkyllisyydestä tai muita myrkyllisyystietoja, joiden perusteella MTC-arvo voidaan arvioida. MTC-arvon arviointi voi olla epätarkkaa, ja siinä tarvitaan yleensä asiantuntijan näkemystä.
|
|
24.
|
Testissä tarvitaan siis kolme testipitoisuutta, pitoisuusvälin vakiokerroin, joka saa olla enintään 10, sekä laimennusvesikontrolli (ja tarvittaessa liuotinkontrolli). Pitoisuusvälin kertoimen vaihteluvälin suositellaan olevan 3,2–10.
|
MENETTELY
Kalojen valinta ja punnitus
|
25.
|
On tärkeää minimoida kalojen painon vaihtelu testin alussa. Lisäyksessä 2 mainitaan, minkälainen kokovaihtelu sopii tähän testiin suositelluille eri lajeille. Testissä käytetyssä koko kalaerässä koiras- ja naaraskalojen yksilöllisten painojen vaihteluväli testin alussa tulee mahdollisuuksien mukaan pitää ± 20 prosentissa saman sukupuolen painon aritmeettisesta keskiarvosta. Suositellaan, että osa erän kaloista punnitaan keskimääräisen painon arvioimiseksi.
|
Altistumisolosuhteet
Kesto
|
26.
|
Testi kestää 21 päivää esialtistusjakson jälkeen. Suositeltu esialtistusjakso on yksi viikko.
|
Ruokinta
|
27.
|
Kaloja on ruokittava ad libitum sopivalla ravinnolla (lisäys 2) riittävän usein, jotta ne pysyvät hyvässä kunnossa. On varottava, ettei vedessä kasva mikrobeja eikä se samennu. Yleisohjeena mainittakoon, että päivittäinen annos voidaan jakaa kahteen tai kolmeen yhtä suureen annokseen, kun ruokintakertoja on useampia päivässä, ja ruokintakertojen välillä on oltava vähintään kolme tuntia aikaa. Suurempi kerta-annos on hyväksyttävää antaa etenkin viikonloppuisin. Kalat on pidettävä ravinnotta 12 tuntia ennen näytteenottoa/ruumiinavausta.
|
|
28.
|
Kalanruoka on tarkastettava mahdollisten kontaminanttien, kuten orgaanista klooria sisältävien torjunta-aineiden, polysyklisten aromaattisten hiilivetyjen (PAH-yhdisteiden) ja polykloorattujen bifenyylien (PCB-yhdisteiden) varalta. Paljon fytoestrogeeneja sisältävää ruokaa on vältettävä, koska se heikentää testivastetta tunnetulle estrogeeniagonistille (ts. 17-beetaestradiolille).
|
|
29.
|
Syömättä jäänyt ruoka ja ulosteet on poistettava testiastioista vähintään kaksi kertaa viikossa; kunkin säiliön pohja on esimerkiksi puhdistettava huolellisesti käyttämällä lappoa.
|
Valo ja lämpötila
|
30.
|
Valoisan ajan ja testiveden lämpötilan pitää olla sopivia käytetylle testilajille (lisäys 2).
|
Analyyttisten määritysten ja mittausten taajuus
|
31.
|
Ennen altistusjakson aloittamista on varmistettava, että kemikaalin annostelujärjestelmä toimii asianmukaisesti. Kaikki analyysimenetelmät on määritettävä, ja kemiallisesta stabiiliudesta testijärjestelmässä on oltava riittävästi tietoa. Testin aikana testikemikaalin pitoisuudet määritetään säännöllisin väliajoin seuraavasti: laimentimen ja myrkyllisen aineen varastoliuoksen virtausnopeudet on tarkistettava mieluiten päivittäin mutta vähintään kahdesti viikossa, ja ne saavat vaihdella enintään 10 prosenttia koko testin aikana. Varsinaiset testikemikaalin pitoisuudet suositellaan mitattavan kaikista astioista testin alussa ja sen jälkeen viikon välein.
|
|
32.
|
Suositellaan, että tulosten perusteina käytetään mitattuja pitoisuuksia. Jos testiaineen pitoisuus pysyy kuitenkin tyydyttävästi 20 prosentin sisällä nimellispitoisuudesta koko testin ajan, tulosten perustana voidaan käyttää nimellispitoisuuksia tai mitattuja pitoisuuksia.
|
|
33.
|
Näytteet on mahdollisesti suodatettava (esim. 0,45 μm:n huokoskoon suotimella) tai sentrifugoitava. Mikäli se on tarpeen, sentrifugointi on suositeltava menetelmä. Jos testiaine ei adsorboidu suotimiin, voi myös suodatus olla hyväksyttävää.
|
|
34.
|
Testin aikana kaikista testiastioista on mitattava liuennut happi, lämpötila ja pH vähintään kerran viikossa. Kokonaiskovuus ja alkalisuus on mitattava kontrolleista ja suurimman pitoisuuden astiasta vähintään kerran viikossa. Lämpötilaa olisi mielellään seurattava jatkuvasti vähintään yhdessä testiastiassa.
|
Havainnot
|
35.
|
Monia yleisiä (esimerkiksi eloonjääneisyyttä) ja keskeisiä biologisia vasteita (kuten vitellogeniiniarvot) arvioidaan testin kuluessa tai sen päättyessä. Näiden ominaisuuksien mittaamista ja arviointia sekä tulosten käyttökelpoisuutta kuvataan jäljempänä.
|
Eloonjääneisyys
|
36.
|
Kalat on tutkittava päivittäin testijakson aikana. Kuolleisuus on kirjattava ja kuolleet kalat on poistettava testiastiasta mahdollisimman pian. Kuolleiden kalojen tilalle ei tule vaihtaa eläviä sen pikemmin kontrolli- kuin käsittelyastioihinkaan. Testin aikana kuolleiden kalojen sukupuoli on määritettävä sukupuolirauhasten makroskooppisella tutkimuksella.
|
Käyttäytyminen ja ulkonäkö
|
37.
|
Kaikenlainen poikkeava käyttäytyminen (kontrolleihin nähden) on kirjattava muistiin. Siitä osoituksena voivat olla yleisen myrkyllisyyden merkit, kuten hyperventilaatio, koordinoimaton uinti, tasapainon menetys sekä epätyypillinen liikkumattomuus tai syöminen. Myös muut ulkoiset poikkeavuudet (kuten verenvuoto tai värimuutokset) on merkittävä muistiin. Tällaisia myrkyllisyyden merkkejä on tulkittava varovasti tietoja analysoitaessa, koska ne voivat viitata pitoisuuksiin, joiden yhteydessä hormonijärjestelmään kohdistuviin vaikutuksiin liittyvät biomarkkerit eivät ole luotettavia. Näistä käyttäytymiseen liittyvistä havainnoista voidaan saada myös hyödyllistä laadullista tietoa mahdollisista tulevista kaloilla testausta koskevista vaatimuksista. Esimerkiksi rasvapäämutuilla on havaittu androgeenialtistuksen yhteydessä reviiriin liittyvää aggressiivisuutta normaaleilla koirailla tai maskulinisoituneilla naarailla, kun taas seeprakaloilla estrogeeni- tai antiandrogeenialtistuksen on havaittu vähentävän lajityypillistä parittelu- ja kutemiskäyttäytymistä tai estävän sen keinovalon syttyessä.
|
|
38.
|
Koska jotkin ulkonäköön liittyvät seikat (pääasiassa väri) voivat muuttua nopeasti käsittelyn yhteydessä, on tärkeää, että laadulliset havainnot tehdään ennen kuin eläimet poistetaan testijärjestelmästä. Rasvapäämutuista tähän saakka karttunut kokemus viittaa siihen, että jotkin hormonijärjestelmään vaikuttavat kemikaalit voivat aluksi aiheuttaa muutoksia seuraavissa ulkoisissa ominaisuuksissa: kalan väri (vaalea tai tumma), värityksen kuviot (pystysuorien raitojen ilmaantuminen) ja kalan muoto (pään ja rinnan alue). Sen vuoksi kalan fyysisestä ulkonäöstä on tehtävä havaintoja testin kuluessa ja tutkimuksen päättyessä.
|
Kalojen lopettaminen inhimillisesti
|
39.
|
Päivänä 21 eli altistuksen päättyessä kalat on lopetettava tarkoituksenmukaisella määrällä trikaiinia (trikaiinimetaanisulfonaatti, Metacain MS-222 (CAS 886-86-2), 100–500 mg/l, puskuroitu 300 mg/l:n vahvuisella NaHCO3:lla (natriumbikarbonaatti, CAS 144-55-8), limakalvoärsytyksen vähentämiseksi. Sen jälkeen kaloilta otetaan veri- tai kudosnäytteet vitellogeniinimääritystä varten, kuten vitellogeniinia koskevassa kohdassa on selitetty.
|
Sekundaaristen sukupuoliominaisuuksien havainnointi
|
40.
|
Jotkin hormonijärjestelmään vaikuttavat kemikaalit voivat aiheuttaa muutoksia tietyissä erikoistuneissa sekundaarisissa sukupuoliominaisuuksissa (kutukyhmyjen lukumäärä rasvapäämutukoirailla ja sukuelinpapillien lukumäärä medakakoirailla). Tämä johtuu siitä, että kemikaalit, joilla on tiettyjä vaikutustapoja, voivat aiheuttaa sen, että vastakkaisen sukupuolen eläimillä esiintyy sekundaarisia sukupuoliominaisuuksia. Esimerkiksi androgeenireseptorin agonistit, kuten trenboloni, metyylitestosteroni ja dihydrotestosteroni, voivat aiheuttaa korostuneiden kutukyhmyjen kehittymisen rasvapäämutunaaraille tai sukuelinpapillien kehittymisen medakanaaraille (11, 20, 21). On myös raportoitu, että estrogeenireseptorin antagonistit saattavat vähentää kutukyhmyjen määrää ja pienentää selänpuoleista niskakyhmyä aikuisilla koirailla (25, 26). Näistä morfologisista havainnoista voidaan saada myös hyödyllistä laadullista ja määrällistä tietoa mahdollisista tulevista kaloilla testausta koskevista vaatimuksista. Rasvapäämutun kutukyhmyjen ja medakan sukuelinpapillien lukumäärä ja koko voidaan määrittää suoraan tai käytännöllisemmin preparoiduilta yksilöiltä. Suositellut menetelmät rasvapäämutun ja medakan sekundaaristen sukupuoliominaisuuksien arvioimiseen on esitetty lisäyksessä 5A ja lisäyksessä 5B.
|
Vitellogeniini (VTG)
|
41.
|
Verinäyte otetaan pyrstösuonesta heparinisoituun mikrohematokriitti-kapillaariputkeen tai vaihtoehtoisesti sydänpunktiolla, joka tehdään ruiskulla. Kerättävän veren määrä vaihtelee kalan koon mukaan yleensä välillä 5–60 μl rasvapäämutuyksilöä kohti ja välillä 5–15 μl seeprakalayksilöä kohti. Plasma erotetaan verestä sentrifugoimalla, ja sitä säilytetään proteaasin estäjien kanssa – 80 °C:ssa vitellogeniinin analysointiin saakka. Toinen vaihtoehto on se, että vitellogeniinin määrityksen kudoslähteenä käytetään medakan maksaa ja seeprakalan pää-/pyrstöhomogenaattia (lisäys 6). Vitellogeniinin mittauksen on perustuttava validoituun yhdenmukaiseen ELISA-menetelmään, jossa käytetään yhdenmukaista vitellogeniinistandardia ja yhdenmukaisia vasta-aineita. On suositeltavaa käyttää sellaista menetelmää, jolla pystytään havaitsemaan jopa niin pieniä vitellogeniinipitoisuuksia kuin vain muutama ng/ml plasmassa (tai ng/mg kudoksessa), mitä pidetään altistumattomien koiraskalojen taustapitoisuutena.
|
|
42.
|
Vitellogeniinianalyysin laatu varmistetaan käyttämällä standardeja, nollakokeita ja vähintään kaksinkertaista analyysia. Jokaisen ELISA-menetelmän yhteydessä on tehtävä matriisivaikutustesti (vaikutus näytteen laimentumiseen), jotta voidaan määrittää näytteen vähimmäislaimennuskerroin. Kuhunkin vitellogeniinianalyysissa käytettävään ELISA-levyyn tulee sisältyä seuraavat kontrollinäytteet: vähintään kuusi kalibrointistandardia, jotka kattavat odotettujen vitellogeniinipitoisuuksien vaihteluvälin, ja vähintään yksi ei-spesifinen sitoutumismääritys -nollakoe (kaksinkertainen analyysi). Näissä nollakokeissa absorbanssin tulee olla alle viisi prosenttia kalibrointistandardin enimmäisabsorbanssista. Jokaisesta näytelaimennoksesta analysoidaan vähintään kaksi alikvoottia (kaksi rinnakkaiskuoppaa). Rinnakkaiskuopat, joiden arvot eroavat toisistaan yli 20 prosenttia, on analysoitava uudelleen.
|
|
43.
|
Kalibrointikäyrien korrelaatiokertoimen (R2) on oltava yli 0,99. Suuri korrelaatio ei kuitenkaan yksinään riitä takaamaan pitoisuuden asianmukaista ennustamista kaikissa vaihteluväleissä. Sen lisäksi, että korrelaatio kalibrointikäyrään on riittävän suuri, kunkin standardin pitoisuus – kalibrointikäyrästä laskettuna – on asetuttava välille 70–120 prosenttia sen nimellispitoisuudesta. Jos nimellispitoisuuksissa on havaittavissa kalibroinnin regressiolinjasta poispäin suuntautuva trendi (esimerkiksi pienemmillä pitoisuuksilla), voi olla tarpeen jakaa kalibrointikäyrä alempaan ja ylempään vaihteluväliin tai käyttää epälineaarista mallia, jotta absorbanssitiedot saadaan sovitettua asianmukaisesti. Jos käyrä jaetaan, kummankin linjan segmentin R2 on oltava > 0,99.
|
|
44.
|
Havaitsemisrajaksi (LOD) määritetään pienimmän määritysstandardin pitoisuus, ja määritysrajaksi (LOQ) määritetään pienimmän määritysstandardin pitoisuus kerrottuna pienimmällä laimennuskertoimella.
|
|
45.
|
Niinä päivinä, kun tehdään vitellogeniinimäärityksiä, analysoidaan myös rikastusnäyte käyttämällä määritysten välistä vertailuainetta (lisäys 7). Odotuksenmukaisen pitoisuuden ja mitatun pitoisuuden välinen suhde ilmoitetaan kyseisenä päivänä tehtyjen määritysten tulosten mukana.
|
TIEDOT JA RAPORTOINTI
Biomarkkerivasteiden arviointi varianssianalyysilla (ANOVA)
|
46.
|
Jotta voidaan tunnistaa kemikaalin mahdollinen hormonijärjestelmään kohdistuva vaikutus, käsittely- ja kontrolliryhmien vasteita verrataan käyttämällä varianssianalyysia (ANOVA). Jos käytetään liuotinkontrollia, on tehtävä asianmukainen tilastollinen testi laimennusvesi- ja liuotinkontrollien välillä kunkin tutkittavan ominaisuuden osalta. Ohjeita siitä, miten laimennusvesi- ja liuotinkontrolleja koskevia tietoja käsitellään tilastollisessa analyysissa, on OECD:n asiakirjassa 2006c (27). Kaikki tiedot biologisesta vasteesta on analysoitava ja raportoitava kummastakin sukupuolesta erikseen. Jos parametristen menetelmien edellyttämät vaatimukset eivät täyty – epänormaali jakauma (esimerkiksi Shapiro-Wilkin testi) tai heterogeeninen varianssi (Bartlettin testi tai Levenen testi) – on harkittava mittaustulosten muuntamista varianssien homogenisoimiseksi ennen ANOVA-analyysiä tai painotetun ANOVAn tekemistä. Monivertailuihin liittyvää Dunnettin testiä (parametrinen) tai Mann-Whitneyn testiä ja Bonferronin korjausta (ei-parametrinen) voidaan käyttää ei-monotonisten annosvasteiden yhteydessä. Muita tilastollisia testejä voidaan käyttää (esimerkiksi Jonckheere-Terpstran testi tai Williamsin testi), jos annosvaste on jotakuinkin monotoninen. Lisäyksessä 8 on tilastollinen vuokaavio, joka on tarkoitettu avuksi, kun päätetään, mikä on tarkoituksenmukaisin tilastollinen testi käytettäväksi. Lisätietoja on myös OECD:n asiakirjassa ’Current Approaches to Statistical Analysis of Ecotoxicity Data’ (27) (ekotoksisuustietojen tilastollisessa analyysissa sovellettavia nykyisiä lähestymistapoja koskeva asiakirja).
|
Testitulosten raportointi
|
47.
|
Tutkimustietojen tulee sisältää seuraavat seikat:
|
|
Testauslaitos:
|
—
|
Vastuuhenkilöt ja heidän tutkimukselliset vastuualueensa
|
|
—
|
Jokaisen laboratorion on täytynyt osoittaa pätevyytensä käyttää monenlaisia edustavia kemikaaleja
|
|
|
|
Testikemikaali:
|
—
|
Testikemikaalin luonnehdinta
|
|
—
|
Fysikaalinen olomuoto ja fysikaalis-kemialliset ominaisuudet, jos niillä on merkitystä
|
|
—
|
Testipitoisuuksien valmistuksen menetelmä ja yleisyys
|
|
—
|
Tiedot stabiiliudesta ja biohajoavuudesta
|
|
|
|
Liuotin:
|
—
|
Liuottimen luonnehdinta (tyyppi, käytetty pitoisuus)
|
|
—
|
Liuottimen valinnan perustelut (jos se on muu kuin vesi)
|
|
|
|
Koe-eläimet:
|
—
|
Toimittaja ja sen toimipaikka
|
|
—
|
Kalan ikä testin alussa ja sen lisääntymis-/kututila
|
|
—
|
Tarkat tiedot eläinten totuttelumenetelmästä
|
|
—
|
Kalan paino altistuksen alussa (kalaerän osan punnituksen perusteella)
|
|
|
|
Koeolosuhteet:
|
—
|
Käytettävä testimenetelmä (testin tyyppi, kalojen lastaustiheys, varastotiheys jne.)
|
|
—
|
Varastoliuosten valmistelumenetelmä ja virtausnopeus
|
|
—
|
Nimellistestipitoisuudet, testiliuosten viikoittain mitatut pitoisuudet ja käytetyt analyysimenetelmät, mitattujen arvojen keskiarvot ja keskihajonnat testiastioissa ja todisteet siitä, että mittaukset koskevat testikemikaalin pitoisuuksia todellisessa liuoksessa
|
|
—
|
Laimennusveden ominaisuudet (mukaan luettuina pH, kovuus, alkalisuus, lämpötila, liuennen hapen pitoisuus, jäännösklooripitoisuudet, orgaanisen hiilen kokonaismäärä, suspendoituneet kiinteät aineet ja muut tehdyt mittaukset)
|
|
—
|
Testiastioissa olevan veden laatu: pH, kovuus, lämpötila ja liuenneen hapen pitoisuus
|
|
—
|
Tarkat tiedot ruokinnasta (esimerkiksi ruoan (ruokien) tyyppi, lähde, annettu määrä ja antotiheys) sekä analyysit merkittävistä kontaminanteista, mikäli saatavilla (esimerkiksi PCB-yhdisteet, PAH-yhdisteet ja orgaanista klooria sisältävät torjunta-aineet)
|
|
|
|
Tulokset
|
—
|
Todisteet siitä, että kontrollit täyttävät testin hyväksyttävyyskriteerit
|
|
—
|
Tiedot testipitoisuuksiin ja kontrolleihin liittyvistä kuolemista
|
|
—
|
Käytetyt tilastolliset analyysitekniikat, aineiston käsittely ja käytettyjen tekniikoiden perustelut
|
|
—
|
Tiedot selvistä morfologiaa koskevista biologisista havainnoista, mukaan luettuina sekundaariset sukupuoliominaisuudet ja vitellogeniini
|
|
—
|
Tulokset aineiston analyyseista mieluiten taulukkoina ja graafisessa muodossa
|
|
—
|
Tiedot kalojen mahdollisista epätavallisista reaktioista ja testikemikaalin aiheuttamista mahdollisista näkyvistä vaikutuksista
|
|
|
TESTITULOSTEN TULKINTAA JA HYVÄKSYMISTÄ KOSKEVAT OHJEET
|
48.
|
Tämä kohta sisältää joitakin seikkoja, jotka on otettava huomioon eri mitattuja ominaisuuksia koskevia testituloksia tulkittaessa. Tuloksia on tulkittava varoen, jos testikemikaali vaikuttaa aiheuttavan liiallista myrkyllisyyttä tai vaikuttavan koe-eläimen yleiskuntoon.
|
|
49.
|
Testipitoisuuksien vaihteluvälin asettamisessa on varottava ylittämästä suurinta siedettyä pitoisuutta, jotta aineiston järkevä tulkinta on mahdollista. On tärkeää, että testissä on vähintään yksi käsittely, jossa ei ilmene merkkejä myrkyllisistä vaikutuksista. Sairauden ja myrkyllisten vaikutusten merkit on arvioitava ja raportoitava perinpohjaisesti. On kuitenkin mahdollista, että naarailla vitellogeniinin tuotantoon voivat vaikuttaa myös yleinen myrkyllisyys ja muuhun kuin hormonijärjestelmään kohdistuvat myrkylliset vaikutustavat (esimerkiksi hepatotoksisuus). Vaikutusten tulkintaa voidaan kuitenkin vahvistaa muilta käsittelytasoilta saaduilla tuloksilla, joita ei voida perustella systeemisellä myrkyllisyydellä.
|
|
50.
|
Testituloksen hyväksyttävyyden kannalta on niin ikään otettava huomioon muutamia seikkoja. Perusohje on se, että kontrolliryhmien koiraiden ja naaraiden vitellogeniinipitoisuudet on esitettävä selvästi. Rasvapäämutulta ja seeprakalalta ne on eriteltävä noin kolmeen suuruusluokkaan ja medakalta noin yhteen suuruusluokkaan. Esimerkkejä kontrolli- ja käsittelyryhmistä saatujen arvojen vaihteluvälistä on validaatioraporteissa (1, 2, 3, 4). Kontrolliryhmän koirailla tavatut suuret vitellogeniiniarvot voivat heikentää testin herkkyyttä ja sen kykyä havaita heikkoja estrogeeniagonisteja. Kontrolliryhmän naarailla tavatut pienet vitellogeniiniarvot voivat niin ikään heikentää testin herkkyyttä ja sen kykyä havaita aromataasin estäjiä ja estrogeeniantagonisteja. Nämä ohjeet laadittiin validointitutkimusten perusteella.
|
|
51.
|
Jos laboratorio ei ole tehnyt määritystä aikaisemmin tai jos on tehty huomattavia muutoksia (esimerkiksi kalakannan tai toimittajan vaihto), on syytä tehdä tekninen pätevyystutkimus. On suositeltavaa, että siinä käytetään kemikaaleja, joilla on monenlaisia vaikutustapoja tai jotka vaikuttavat lukuisiin testissä tutkittaviin ominaisuuksiin. Käytännössä jokaista laboratoriota kehotetaan keräämään omat historialliset kontrollitiedot koiraista ja naaraista sekä käyttämään positiivista kontrollikemikaalia estrogeeniaktiivisuuden osalta (esimerkiksi 17β-estradioli pitoisuudella 100 ng/l tai tunnettu heikko agonisti), jolloin koiraskalojen vitellogeniinipitoisuus kasvaa, positiivista kontrollikemikaalia aromataasin eston osalta (esimerkiksi fadrotsoli tai prokloratsi pitoisuudella 300 μg/l), jolloin naaraskalojen vitellogeniinipitoisuus pienenee, ja positiivista kontrollikemikaalia androgeeniaktiivisuuden osalta (esimerkiksi 17β-trenboloni pitoisuudella 5 μg/l), jolloin rasvapäämutu- ja medakanaaraille alkaa kehittyä sekundaarisia sukupuoliominaisuuksia. Kaikkia näitä tietoja voidaan verrata validointitutkimuksista (1, 2, 3) saatuihin tietoihin, jotta laboratorion pätevyys saadaan varmistettua.
|
|
52.
|
Yleensä vitellogeniinimittauksia tulee pitää positiivisina, jos koiraiden vitellogeniinipitoisuus lisääntyy tilastollisesti merkitsevästi (p <0,05), tai jos naaraiden vitellogeniinipitoisuus vähenee tilastollisesti merkitsevästi (p <0,05) ainakin suurimman testatun annoksen yhteydessä kontrolliryhmään verrattuna, ja jos merkkejä yleisestä myrkyllisyydestä ei ole. Positiivista tulosta tukee myös se, että annoksen ja vastekäyrän välillä voidaan osoittaa olevan biologisesti todennäköinen suhde. Kuten aiemmin on mainittu, vitellogeniinin vähentyminen ei välttämättä johdu pelkästään hormonijärjestelmästä, mutta positiivinen tulos on yleensä kuitenkin tulkittava todisteeksi hormonijärjestelmään kohdistuvasta vaikutuksesta in vivo, minkä perusteella tulisi ryhtyä toimiin lisäselvyyden saamiseksi.
|
LÄHDEKIRJALLISUUS
|
(1)
|
OECD (2006a). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1A). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.60, ENV/JM/MONO(2006)27.
|
|
(2)
|
OECD (2006b). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1B). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.61, ENV/JM/MONO(2006)29.
|
|
(3)
|
OECD (2007). Guidance Document on Acute Inhalation Toxicity Testing. Final report of the Validation of the 21-day Fish Screening Assay for the Detection of Endocrine Active Substances. Vaihe 2: Testing Negative Substances. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.78, ENV/JM/MONO(2007)25.
|
|
(4)
|
Owens JW (2007). Phase 3 report of the validation of the OECD Fish Screening Assay. CEFIC LRI Project, Endocrine. http://www.cefic-lri.org/index.php?page=projects (viitattu 18.9.2008).
|
|
(5)
|
US EPA 2007. Validation of the Fish Short-Term Reproduction Assay: Integrated Summary Report. Unpublished report dated 15 December 2007. US Environmental Protection Agency, Washington, DC. 104 pp.
|
|
(6)
|
OECD, 2008. Report of the Validation Peer Review for the 21-Day Fish Endocrine Screening Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.94, ENV/JM/MONO(2008)21.
|
|
(7)
|
Sumpter and Jobling (1995). Vitellogenesis as a biomarker for estrogenic contamination of the aquatic environment. Environmental Health Perspectives;103 Suppl 7:173–178 Review.
|
|
(8)
|
Pawlowski S, Sauer A, Shears JA, Tyler CR, Braunbeck T (2004). Androgenic and estrogenic effects of the synthetic androgen 17alpha-methyltestosterone on sexual development and reproductive performance in the fathead minnow (Pimephales promelas) determined using the gonadal recrudescence assay. Aquatic Toxicology; 68(3):277–91.
|
|
(9)
|
Andersen L, Goto-Kazato R, Trant JM, Nash JP, Korsgaard B, Bjerregaard P (2006). Short-term exposure to low concentrations of the synthetic androgen methyltestosterone affects vitellogenin and steroid levels in adult male zebrafish (Danio rerio). Aquatic Toxicology; 76(3–4):343–52.
|
|
(10)
|
Ankley GT, Kahl MD, Jensen KM, Hornung MW, Korte JJ, Makynen EA, Leino RL (2002). Evaluation of the aromatase inhibitor fadrozole in a short-term reproduction assay with the fathead minnow (Pimephales promelas). Toxicological Sciences;67(1):121–30.
|
|
(11)
|
Panter GH, Hutchinson TH, Hurd KS, Sherren A, Stanley RD, Tyler CR (2004). Successful detection of (anti-)androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development. Aquatic Toxicology; 70(1):11–21.
|
|
(12)
|
Parks LG, Cheek AO, Denslow ND, Heppell SA, McLachlan JA, LeBlanc GA, Sullivan CV (1999). Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds. Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 123(2):113–25.
|
|
(13)
|
Panter GH, Tyler CR, Maddix S, Campbell PM, Hutchinson TH, Länge R, Lye C, Sumpter JP, 1999. Application of an ELISA to quantify vitellogenin concentrations in fathead minnows (Pimephales promelas) exposed to endocrine disrupting chemicals. CEFIC-EMSG research report reference AQ001. CEFIC, Brussels, Belgium.
|
|
(14)
|
Fenske M., van Aerle, R.B., Brack, S.C., Tyler, C.R., Segner, H., (2001). Development and validation of a homologous zebrafish (Danio rerio Hamilton- Buchanan) vitellogenin enzyme-linked immunosorbent assay (ELISA) and its application for studies on estrogenic chemicals. Pakoll. Biochem. Phys. C 129 (3): 217–232.
|
|
(15)
|
Holbech H, Andersen L, Petersen GI, Korsgaard B, Pedersen KL, Bjerregaard P. (2001). Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio). Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 130: 119–131.
|
|
(16)
|
Rose J, Holbech H, Lindholst C, Noerum U, Povlsen A, Korsgaard B, Bjerregaard P. 2002. Vitellogenin induction by 17β-estradiol and 17β-ethinylestradiol in male zebrafish (Danio rerio). Pakoll. Biochem. Physiol. C. 131: 531–539.
|
|
(17)
|
Brion F, Nilsen BM, Eidem JK, Goksoyr A, Porcher JM, Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio). Environmental Toxicology and Chemistry; vol 21: 1699–1708.
|
|
(18)
|
Yokota H, Morita H, Nakano N, Kang IJ, Tadokoro H, Oshima Y, Honjo T, Kobayashi K. 2001. Development of an ELISA for determination of the hepatic vitellogenin in Medaka (Oryzias latipes). Jpn J Environ Toxicol 4:87–98.
|
|
(19)
|
Tatarazako N, Koshio M, Hori H, Morita M and Iguchi T., 2004. Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the Medaka. Journal of Health Science 50:301–308.
|
|
(20)
|
Ankley GT, Jensen KM, Makynen EA, Kahl MD, Korte JJ, Homung MW, Henry TR, Denny JS, Leino RL, Wilson VS, Cardon MC, Hartig PC, Gray LE (2003). Effects of the androgenic growth promoter 17-beta-trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environmental Toxicology and Chemistry; 22(6): 1350–60.
|
|
(21)
|
Seki M, Yokota H, Matsubara H, Maeda M, Tadokoro H, Kobayashi K (2004). Fish full life-cycle testing for androgen methyltestosterone on medaka (Oryzias latipes). Environmental Toxicology and Chemistry; 23(3):774–81.
|
|
(22)
|
OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Series on Testing and Assessment, no. Series on Testing and Assessment. No. 23. Paris.
|
|
(23)
|
Hutchinson TH, Shillabeer N, Winter MJ, Pickford DB, 2006a. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Tarkistus. Aquatic Toxicology, 76; pp. 69–92.
|
|
(24)
|
Hutchinson TH, Ankley GT, Segner H, Tyler CR, 2006b. Screening and testing for endocrine disruption in fish-biomarkers as ’signposts,’ not ’traffic lights,’ in risk assessment. Environmental Health Perspectives;114 Suppl 1:106–14.
|
|
(25)
|
Miles-Richardson, SR, Kramer VJ, Fitzgerald SD, Render JA, Yamini B, Barbee SJ, Giesy JP. 1999. Effects of waterborne exposure to 17β-estradiol on secondary sex characteristics and gonads of the fathead minnow (Pimephales promelas). Aquat. Meth. 47, 129–145.
|
|
(26)
|
Martinovic, D., L.S. Blake, E.J. Durhan, K.J. Greene, M.D. Kahl, K.M., Jensen, E.A. Makynen, D.L. Villeneuve and G.T. Ankley. 2008. Characterization of reproductive toxicity of vinclozolin in the fathead minnow and co-treatment with an androgen to confirm an anti-androgenic mode of action. Health Perspect. Meth. Toxicol. 27, 478–488.
|
|
(27)
|
OECD (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD environmental Health and Safety Publications Series on Testing and Assessment No.54. ENV/JM/MONO(2006)18.
|
|
(28)
|
OECD (2012) OECD Conceptual Framework for Testing and Assessment of Endocrine Disrupters (revised). Annex I to Draft Guidance Document on Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption. Series on Testing and Assessment No 150. ENV/JM/MONO(2012)22.
|
Lisäys 1
Lyhenteet ja määritelmät
Kemikaali
: aine tai seos.
CV
: variaatiokerroin.
ELISA
: entsyymivälitteinen immunosorbenttimääritys.
Täyttöaste
: kalojen märkäpaino tilavuusyksikköä kohti.
Varastotiheys
: kalojen lukumäärä tilavuusyksikköä kohti.
VTG (vitellogeniini)
: fosfolipoglykoproteiini, munankeltuaisen esiaste, jota tavataan yleensä kaikilla munimalla lisääntyvien lajien sukukypsillä naarailla.
HPG-akseli
: hypotalamus-aivolisäke-sukurauhasakseli.
MTC
: suurin siedetty pitoisuus, noin 10 prosenttia LC50-arvosta.
Testikemikaali
: tätä testimenetelmää käyttäen testattu aine tai seos.
Lisäys 2
Kalojen hormonijärjestelmään kohdistuvan seulontatutkimuksen koeolosuhteet
|
|
Rasvapäämutu
(Pimephales promelas)
|
Medaka
(Oryzias latipes)
|
Seeprakala
(Danio rerio)
|
|
|
Läpivirtaus
|
Läpivirtaus
|
Läpivirtaus
|
|
|
25 ± 2 °C
|
25 ± 2 °C
|
26 ± 2 °C
|
|
|
Loistelamppu (laajakirjoinen)
|
Loistelamppu (laajakirjoinen)
|
Loistelamppu (laajakirjoinen)
|
|
|
10–20 μE/m2/s, 540–1 000 luksia, tai 50–100 ft-c (laboratorion ympäristötasot)
|
10–20 μE/m2/s, 540–1 000 luksia, tai 50–100 ft-c (laboratorion ympäristötasot)
|
10–20 μE/m2/s, 540–1 000 luksia, tai 50–100 ft-c (laboratorion ympäristötasot)
|
|
6.
|
Valoisa aika (valoisan ja pimeän väliset siirtymät valinnaisia, niitä ei kuitenkaan pidetä tarpeellisina)
|
|
16 h valoisaa, 8 h pimeää
|
12–16 h valoisaa, 8 h pimeää
|
12–16 h valoisaa, 8 h pimeää
|
|
|
< 5 g litraa kohti
|
< 5 g litraa kohti
|
< 5 g litraa kohti
|
|
|
10 l (vähintään)
|
2 l (vähintään)
|
5 l (vähintään)
|
|
9.
|
Testiliuoksen tilavuus
|
|
8 l (vähintään)
|
1,5 l (vähintään)
|
4 l (vähintään)
|
|
10.
|
Testiliuosten tilavuuden muutokset
|
|
Vähintään kuusi päivässä
|
Vähintään viisi päivässä
|
Vähintään viisi päivässä
|
|
|
Katso edellä kohta 20.
|
Katso edellä kohta 20.
|
Katso edellä kohta 20.
|
|
12.
|
Täysikasvuisen kalan arvioitu märkäpaino (g)
|
|
Naaraat: 1,5 ± 20 %
Koiraat: 2,5 ± 20 %
|
Naaraat: 0,35 ± 20 %
Koiraat: 0,35 ± 20 %
|
Naaraat: 0,65 ± 20 %
Koiraat: 0,4 ± 20 %
|
|
13.
|
Kalojen lkm. testiastiaa kohti
|
|
6 (2 koirasta ja 4 naarasta)
|
10 (5 koirasta ja 5 naarasta)
|
10 (5 koirasta ja 5 naarasta)
|
|
|
= 3 (sekä asianmukaiset kontrollit)
|
= 3 (sekä asianmukaiset kontrollit)
|
= 3 (sekä asianmukaiset kontrollit)
|
|
15.
|
Astioiden lkm. käsittelyä kohti
|
|
Vähintään 4
|
Vähintään 2
|
Vähintään 2
|
|
16.
|
Kalojen lkm. testipitoisuutta kohti
|
|
16 täysikasvuista naarasta ja 8 koirasta (4 naarasta ja 2 koirasta jokaisessa rinnakkaisnäyteastiassa)
|
10 täysikasvuista naarasta ja 10 koirasta (5 naarasta ja 5 koirasta jokaisessa rinnakkaisnäyteastiassa)
|
10 täysikasvuista naarasta ja 10 koirasta (5 naarasta ja 5 koirasta jokaisessa rinnakkaisnäyte-astiassa)
|
|
|
Eläviä tai pakastettuja täysikasvuisia suolalehtijalkaisia tai niiden nauplius-toukkia 2–3 kertaa päivässä (ad libitum), kaupallisesti saatavaa ruokaa tai edellisten yhdistelmä
|
Suolalehtijalkaisia tai niiden nauplius-toukkia 2–3 kertaa päivässä (ad libitum), kaupallisesti saatavaa ruokaa tai edellisten yhdistelmä
|
Suolalehtijalkaisia tai niiden nauplius-toukkia 2–3 kertaa päivässä (ad libitum), kaupallisesti saatavaa ruokaa tai edellisten yhdistelmä
|
|
|
Ei tarpeen, ellei liuenneen hapen pitoisuus ole alle 60 % ilman kyllästysarvosta
|
Ei tarpeen, ellei liuenneen hapen pitoisuus ole alle 60 % ilman kyllästysarvosta
|
Ei tarpeen, ellei liuenneen hapen pitoisuus ole alle 60 % ilman kyllästysarvosta
|
|
|
Puhdas pinta-, kaivo- tai synteettinen vesi tai dekloorattu hanavesi
|
Puhdas pinta-, kaivo- tai synteettinen vesi tai dekloorattu hanavesi
|
Puhdas pinta-, kaivo- tai synteettinen vesi tai dekloorattu hanavesi
|
|
|
Suositus 7 päivää
|
Suositus 7 päivää
|
Suositus 7 päivää
|
|
21.
|
Kemikaalialtistuksen kesto
|
|
21 pv
|
21 pv
|
21 pv
|
|
22.
|
Biologiset ominaisuudet
|
|
eloonjääneisyys
käyttäytyminen
sekundaariset sukupuoliominaisuudet
VTG
|
eloonjääneisyys
käyttäytyminen
sekundaariset sukupuoliominaisuudet
VTG
|
eloonjääneisyys
käyttäytyminen
VTG
|
|
23.
|
Testin hyväksyttävyys
|
|
Liuennut happi >60 % kyllästysarvosta; keskilämpötila 25 ± 2 °C; kontrollikalojen eloonjääneisyys 90 %; mitatut testipitoisuudet 20 %:n sisällä keskimääräisistä mitatuista arvoista käsittelytasoa kohti.
|
Liuennut happi >60 % kyllästysarvosta; keskilämpötila 24 ± 2 °C; kontrollikalojen eloonjääneisyys 90 %; mitatut testipitoisuudet 20 %:n sisällä keskimääräisistä mitatuista arvoista käsittelytasoa kohti.
|
Liuennut happi >60 % kyllästysarvosta; keskilämpötila 26 ± 2 °C; kontrollikalojen eloonjääneisyys 90 %; mitatut testipitoisuudet 20 %:n sisällä keskimääräisistä mitatuista arvoista käsittelytasoa kohti.
|
Lisäys 3
Joitakin hyväksyttävän laimennusveden kemiallisia ominaisuuksia
|
Osatekijä
|
Pitoisuudet
|
|
Hiukkaset
|
< 20 mg/l
|
|
Orgaanisen hiilen kokonaismäärä
|
< 2 mg/l
|
|
Ionisoitumaton ammoniakki
|
< 1 μg/l
|
|
Jäännöskloori
|
< 10 μg/l
|
|
Orgaanista fosforia sisältävien torjunta-aineiden kokonaismäärä
|
< 50 ng/l
|
|
Orgaanista klooria sisältävien torjunta-aineiden ja polykloorattujen bifenyylien kokonaismäärä
|
< 50 ng/l
|
|
Orgaanisen kloorin kokonaismäärä
|
< 25 ng/1
|
Lisäys 4A
Seeprakalojen kutualusta
Kutulevy: Lasinen instrumenttitarjotin (koko esimerkiksi 22 × 15 × 15,5 cm (p × l × s)), jonka päällä irrotettava ruostumaton teräsristikko (silmäkoko 2 mm). Ristikon tulee peittää instrumenttitarjotin hieman reunojen alapuolelta.
Kutualusta on kiinnitettävä ristikkoon. Siitä on muodostuttava rakenne, johon kalat voivat siirtyä. Sopivia rakenteita ovat esimerkiksi vihreästä muovimateriaalista valmistetut keinotekoiset akvaariokasvit (huom. testikemikaalin adsorptoituminen muovimateriaaliin on muistettava ottaa huomioon). Muovimateriaalia on huuhdeltava runsaassa lämpimässä vedessä riittävän kauan, jotta varmistetaan, ettei testiveteen joudu kemikaaleja. Lasimateriaaleja käytettäessä on varmistettava, etteivät kalat vahingoitu ja että niillä on riittävästi tilaa rajuihinkin liikkeisiin.
Tarjottimen ja lasilevyjen välisen etäisyyden on oltava vähintään kolme senttimetriä sen varmistamiseksi, ettei kuteminen tapahdu tarjottimen ulkopuolella. Tarjottimelle lasketut mätimunat putoavat ristikon läpi, ja ne voidaan kerätä näytteenottoa varten 45–60 minuutin kuluttua valojen sytyttämisestä. Läpinäkyvät mätimunat eivät ole tahmeita, ja ne on helppo laskea poikittaisvalossa. Kun astiassa on viisi naarasta, kahtakymmentä munaa päivässä voidaan pitää pienenä määränä, sataa munaa kohtalaisena määränä ja yli sataa munaa suurena määränä. Kutualusta on poistettava astiasta ja munat on kerättävä joko mahdollisimman myöhään illalla tai varhain aamulla, ja alusta on laitettava sen jälkeen takaisin testiastiaan. Alusta on laitettava takaisin astiaan tunnin kuluessa sen poisottamisesta, sillä muutoin kutualusta saattaa houkutella kalat parittelemaan tai kutemaan yksilöllisesti epätavallisiin aikoihin. Jos tilanne vaatii kutualustan laittamista takaisin myöhemmin, se on tehtävä vähintään yhdeksän tunnin kuluttua valojen sytyttämisestä. Niin myöhäiseen vuorokaudenaikaan se ei aiheuta enää kutemista.
Lisäys 4B
Rasvapäämutun kutualusta
Jokaiseen testiastiaan asetetaan kaksi tai kolme muovista/keramiikasta/lasista tai ruostumattomasta teräksestä valmistettua kutulaattaa ja -levyä (esimerkiksi 80 mm pitkä harmaa puoliympyrän muotoinen katos 130 mm pitkän huulletun levyn päälle) (ks. kuva). Asianmukaisesti katetut PVC- tai keramiikkalaatat ovat osoittautuneet sopiviksi kutualustoiksi (Thorpe et al., 2007).
Laattoja kannattaa karhentaa hieman, jotta munat kiinnittyvät niihin paremmin. Tarjotin on suojattava siten, etteivät kalat pääse laskettujen mätimunien luokse, ellei ole osoitettu, että munat kiinnittyvät käytettyyn alustaan pitävästi.

Pohja on suunniteltu siten, että kaikki munat, jotka eivät kiinnity laatan pintaan, putoavat astian pohjalle (tai ne munat, jotka lasketaan suoraan sileälle muovipinnalle). Kaikkia kutualustoja on huuhdeltava vähintään 12 tuntia laimennusvedessä ennen käyttöä.
VIITTEET
Thorpe KL, Benstead R, Hutchinson TH, Tyler CR, 2007. An optimised experimental test procedure for measuring chemical effects on reproduction in the fathead minnow, Pimephales promelas. Aquatic Toxicology, 81, 90–98.
Lisäys 5A
Rasvapäämutun sekundaaristen sukupuoliominaisuuksien arviointi tiettyjen hormonijärjestelmään vaikuttavien kemikaalien havaitsemiseksi
Yleistä
Täysikasvuisilla rasvapäämutuilla mahdollisesti tärkeitä fyysiseen ulkonäköön liittyviä piirteitä hormonitoimintaa häiritseviä aineita testattaessa ovat väri (vaalea/tumma), värityskuviot (onko esimerkiksi pystysuoria raitoja vai ei), kalan muoto (pään ja rinnan alueen muoto, vatsan pullistuneisuus) sekä erikoistuneet sekundaariset sukupuoliominaisuudet (kutukyhmyjen lukumäärä ja koko, niskakyhmyn koko, munanasetin).
Kutukyhmyt sijaitsevat sukukypsien rasvapäämutukoiraiden päässä (niskakyhmy), ja ne ovat useimmiten järjestäytyneet molemmin puolin symmetriseksi kuvioksi (Jensen et al. 2001). Kontrollinaarailla sekä nuorilla koirailla ja naarailla kyhmyt eivät ole kehittyneet (Jensen et al. 2001). Koiraiden silmien ympärillä ja sierainten välissä voi olla jopa kahdeksan yksittäistä kyhmyä. Eniten kyhmyjä on kahdella samansuuntaisella viivalla heti sierainten alapuolella ja suun yläpuolella, ja ne ovat myös suurimpia kyhmyjä. Monilla kaloilla kyhmyryhmiä on alaleuan alapuolella. Suuta lähimpänä sijaitsee yleensä yksittäinen kyhmypari, kun taas lähempänä vatsapuolta voi olla jopa neljästä kyhmystä muodostuvia sarjoja. Kyhmyjen todellinen määrä on harvoin yli 30 (vaihteluväli 18–28; Jensen et al. 2001). Useimmat kyhmyt (määrän kannalta) ovat yksittäisiä, pyöreähköjä rakenteita, joiden korkeus vastaa suurin piirtein niiden sädettä. Useimmilla sukukypsillä koirailla on ainakin joitakin kyhmyjä, jotka ovat siinä määrin laajentuneita ja korostuneita, ettei niistä voi erottaa yksittäisiä rakenteita.
Tietyntyyppiset hormonitoimintaa häiritsevät kemikaalit voivat aiheuttaa sen, että tiettyjä sekundaarisia sukupuoliominaisuuksia alkaa esiintyä vastakkaisella sukupuolella. Esimerkiksi androgeenireseptorin agonistit, kuten 17β-metyylitestosteroni tai 17β-trenboloni, voivat aiheuttaa kutukyhmyjen kehittymisen rasvapäämutunaaraille (Smith 1974; Ankley et al. 2001; 2003), kun taas estrogeenireseptorin agonistit saattavat vähentää koiraiden kutukyhmyjen määrää tai pienentää niiden kokoa (Miles-Richardson et al. 1999; Harries et al. 2000).
Jäljempänä on kuvaus rasvapäämutujen kutukyhmyjen luonnehdinnasta. Kuvaus perustuu menetelmiin, joita käytetään Yhdysvaltojen ympäristönsuojelulaboratoriossa (Duluth, MN). Tietyt tuotteet ja/tai laitteet voidaan korvata saatavilla olevilla samantyyppisillä materiaaleilla.
Kalojen tutkimisessa on parhainta käyttää valollista suurennuslasia tai valollista disksektiomikroskooppia (3X). Tutki kalaa selkäpuolelta ja etuosa eteenpäin (pää tutkijaa kohti).
|
a)
|
Aseta kala pieneen petrimaljaan (halkaisija esimerkiksi 100 mm) etuosa eteenpäin ja vatsapuoli alaspäin. Tarkenna etsintä, jotta pystyt tunnistamaan kyhmyt. Käännä kalaa varovasti ja hitaasti puolelta toiselle kyhmyalueiden tunnistamiseksi. Laske ja pisteytä kyhmyt.
|
|
b)
|
Tutki myös pään pinta vatsapuolelta asettamalla kala petrimaljaan selkäpuoli alaspäin etuosa eteenpäin.
|
|
c)
|
Jokaisen kalan tutkimus tulisi saada tehtyä kahdessa minuutissa.
|
Kyhmyjen laskeminen ja arviointi
Täysikasvuisilta rasvapäämutuilta on tunnistettu kuusi aluetta, joilta kyhmyjen esiintymistä ja kehittymistä voidaan arvioida. On laadittu myös malli, johon kyhmyjen sijainti ja lukumäärä voidaan merkitä (ks. tämän lisäyksen loppu). Kyhmyjen lukumäärä merkitään muistiin, ja niiden kokoa voidaan arvioida määrällisesti seuraavasti: 0 – ei kyhmyjä, 1 – kyhmyjä, 2 – laajentuneita kyhmyjä ja 3 – korostuneita kyhmyjä kunkin organismin osalta (kuva 1).
Luokka 0 – kyhmyjä ei ole. Luokka 1 – kyhmyjä: Tähän luokkaan kuuluvat kaikki kyhmyt, joissa on yksi piste, jonka korkeus on miltei sama kuin sen säde (halkaisija). Luokka 2 – laajentuneita kyhmyjä: Tähän luokkaan kuuluu sellainen kudos, jonka ulkonäkö muistuttaa asteriskia. Tällaisessa kyhmyssä on yleensä laaja säteittäinen pohja, jossa on keskeltä reunoille päin suuntautuvia uria tai vakoja. Kyhmyn korkeus on usein muita epätasaisempi, mutta joskus se voi olla myös hieman pyöristynyt. Luokka 3 – korostunut: Tähän luokkaan kuuluvat kyhmyt ovat tavallisesti varsin suuria ja pyöreitä, ja niiden rakenne on muita epäselvempi. Toisinaan tällaiset kyhmyt yhtyvät muodostaen yhtenäisen massan yhdelle alueelle tai useammalle alueelle (B, C ja D, kuvattu jäljempänä). Kyhmyjen väri ja muoto vastaavat luokkaa 2, mutta joskus ne ovat melko epämääräisiä. Tätä arviointimenetelmää käyttämällä kyhmyjen kokonaispistemäärä on yleensä < 50 normaalilla kontrollikoiraalla, jolla on 18–20 kutukyhmyä (Jensen et al. 2001).
Kuva 1

Joidenkin kalojen kutukyhmyjen todellinen määrä voi olla suurempi kuin mallin ruuduissa (lisäys A) tietyllä pisteytysalueella. Jos näin on, pisteytysnumeroita voi lisätä laatikon oikealle tai vasemmalle puolelle. Mallin ei siis tarvitse näyttää symmetriseltä. Toinen tapa merkitä muistiin parilliset kyhmyt tai sellaiset kyhmyt, jotka ovat yhtyneet pystysuunnassa yhteen suun vaakasuuntaista tasoa pitkin, on merkitä yhteen ruutuun kahdet arviointipisteet.
Merkitsemisalueet:
A– Silmän ympärillä sijaitsevat kyhmyt. Merkitään selkäpuolelta vatsan puolelle silmän etureunan ympäriltä. Sukukypsillä kontrollikoirailla näitä on tavallisesti useita; kontrollinaarailla näitä ei ole; androgeeneille altistuneilla naarailla on yleensä yksi pari kyhmyjä (yksi kummankin silmän lähellä) tai yksittäinen kyhmy.
B– Sierainten (aistikanavahuokosten) välissä sijaitsevat kyhmyt. Kontrollikoirailla yleensä parilliset, kehitys ylemmän luokituksen (2 – laajentuneet kyhmyt tai 3 – korostuneet kyhmyt) mukaan. Kontrollinaarailla näitä kyhmyjä ei ole; androgeeneille altistuneilla naarailla niitä voi esiintyä ja kehittyä jonkin verran.
C– Sierainten edessä suun vieressä sijaitsevat kyhmyt. Sukukypsillä kontrollikoirailla yleensä laajentuneet tai korostuneet. Nuoremmilla koirailla tai androgeenikäsitellyillä naarailla näitä esiintyy, voivat olla laajentuneita.
D– Suulinjan suuntaisesti sijaitsevat kyhmyt. Arvioidaan yleensä kehittyneiksi kontrollikoirailla. Näitä kyhmyjä ei ole kontrollinaarailla, kun taas androgeeneille altistuneilla naarailla niitä on.
E– Alaleuassa suun lähellä sijaitsevat kyhmyt, yleensä pieniä ja tavallisesti pareittain. Esiintyvät vaihtelevasti kontrollikoirailla tai käsitellyillä koirailla sekä käsitellyillä naarailla.
F– Alaleuassa selkäpuolella sijaitsevat kyhmyt. Yleensä pieniä ja parillisia. Esiintyy kontrollikoirailla ja androgeeneille altistuneilla naarailla.
VIITTEET
|
(1)
|
Ankley GT, Jensen KM, Kahl MD, Korte JJ, Makynen ME. 2001. Description and evaluation of a short-term reproduction test with the fathead minnow (Pimephales promelas). Environ Toxicol Chem 20:1276–1290.
|
|
(2)
|
Ankley GT, Jensen KM, Makynen EA, Kahl MD, Korte JJ, Hornung MW, Henry TR, Denny JS, Leino RL, Wilson VS, Cardon MC, Hartig PC, Gray EL. 2003. Effects of the androgenic growth promoter 17-β trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environ Toxicol Chem 22:1350–1360.
|
|
(3)
|
Harries JE, Runnalls T, Hill E, Harris CA,Maddix S, Sumpter JP, Tyler CR. 2000. Development of a reproductive performance test for endocrine disrupting chemicals using pair-breeding fathead minnows (Pimephales promelas). Environ Sci Technol 34:3003–3011.
|
|
(4)
|
Jensen KM, Korte JJ, Kahl MD, Pasha MS, Ankley GT. 2001. Aspects of basic reproductive biology and endocrinology in the fathead minnow (Pimephales promelas). Comp Biochem Physiol C 128:127–141.
|
|
(5)
|
Kahl MD, Jensen KM, Korte JJ, Ankley GT. 2001. Effects of handling on endocrinology and reproductive performance of the fathead minnow. J Fish Biol 59:515–523.
|
|
(6)
|
Miles-Richardson SR, Kramer VJ, Fitzgerald SD, Render JA, Yamini B, Barbee SJ, Giesy JP. 1999. Effects of waterborne exposure of 17-estradiol on secondary sex characteristics and gonads of fathead minnows (Pimephales promelas). Aquat Toxicol 47:129–145.
|
|
(7)
|
Smith RJF. 1974. Effects of 17-methyltestosterone on the dorsal pad and tubercles of fathead minnows (Pimephales promelas). Can J Zool 52:1031–1038.
|
|
Kyhmyjen kirjaamismalli
|
Numeerinen pisteytys
|
|
ID
|
1 – kyhmyjä
|
|
Päivämäärä
|
2 – laajentuneita kyhmyjä
|
|
Kokonaispisteet
|
3 – korostuneita kyhmyjä
|
|
|
C
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
|
|
D
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
Lisäys 5B
Medakan sekundaaristen sukupuoliominaisuuksien arviointi tiettyjen hormonijärjestelmään vaikuttavien kemikaalien havaitsemiseksi
Jäljempänä on kuvaus sukuelinpapilleista (21), jotka ovat sekundaarisia sukupuoliominaisuuksia medakalla (Oryzias latipes).
|
1)
|
Maksan poistamisen (lisäys 6) jälkeen kalan ruumis asetetaan kartiomaiseen putkeen (pää ylöspäin, pyrstö alaspäin), joka sisältää noin 10 ml 10-prosenttista neutraalia puskuroitua formaliinia. Jos sukupuolirauhanen on kiinnitetty muulla kuin 10-prosenttisella neutraalilla puskuroidulla formaliinilla, leikkaa ruumis partaterällä poikittain peräevän etuosan ja peräaukon välistä varovasti, jotta gonopori ja sukupuolirauhanen eivät vaurioidu (kuva 3). Laita kalan ruumiin kallonpuoleinen osa kiinnitysliuokseen sukupuolirauhasen säilömiseksi ja pyrstönpuoleinen osa 10-prosenttiseen neutraaliin puskuroituun formaliiniin edellä kuvatun mukaisesti.
|
|
2)
|
Kun kalan ruumis on laitettu 10-prosenttiseen neutraaliin puskuroituun formaliiniin, tartu peräevän etuosaan pinseteillä ja pidä sitä taitettuna noin 30 sekunnin ajan, jotta peräevä pysyy auki. Kun tartut peräevään pinseteillä, käsittele etuosan tiettyjä eväpoimuja varovasti, jotta sukuelinpapillit eivät vaurioidu.
|
|
3)
|
Kun peräevä on ollut auki noin 30 sekunnin ajan, laita kalan ruumis 10-prosenttiseen neutraaliin puskuroituun formaliiniin ja säilytä sitä huoneenlämmössä sukuelinpapillien mittaukseen saakka (mittaus on tehtävä vasta sitten, kun kiinnityksestä on kulunut vähintään 24 tuntia).
|
Mittaus
|
1)
|
Kun kalan ruumis on ollut kiinnitettynä 10-prosenttiseen neutraaliin puskuroituun formaliiniin vähintään 24 tuntia, ota se pois kartiomaisesta putkesta ja pyyhi formaliini suodatinpaperiin (tai paperipyyhkeeseen).
|
|
2)
|
Aseta kala pöydälle vatsapuoli ylöspäin. Irrota peräevä varovasti pienillä dissekointisaksilla (peräevä kannattaa leikata siten, että sen mukana tulee myös hieman rintaevän tukiluuta).
|
|
3)
|
Tartu irrotetun peräevän etuosaan pinseteillä ja aseta muutamin vesitipoin kostutetulle lasilevylle. Peitä peräevä peitinlasilla. Kun tartut peräevään pinseteillä, ole varovainen, etteivät sukuelinpapillit vaurioidu.
|
|
4)
|
Laske niiden liitoslevyjen määrä, joissa on sukuelinpapilleja, käyttämällä biomikroskoopin näytetasoa (pystymikroskooppi tai käänteismikroskooppi). Sukuelinpapillit ovat tunnistettavissa liitoslevyn takaosassa näkyvästä pienestä papillimuodostelmasta. Merkitse kunkin eväpoimun liitoslevyssä olevien sukuelinpapillien määrä lomakkeeseen (ts. ensimmäinen eväpoimu: 0, toinen eväpoimu: 10, kolmas eväpoimu: 12 jne.) ja kirjoita kokonaislukumäärä Excel-työkirjaan kunkin yksittäisen kalan osalta. Ota peräevästä tarvittaessa valokuva ja laske siitä niiden liitoslevyjen lukumäärä, joissa on sukuelinpapilleja.
|
|
5)
|
Laita peräevä mittauksen jälkeen 1 kohdassa kuvattuun kartioputkeen ja varastoi se.
|
Kuva 1.
Piirros, josta näkee peräevän muotoon ja kokoon liittyvät sukupuolierot. A: koiras, B: naaras. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209–218.

Kuva 2.
A: Peräevän eväpoimun liitoslevyissä olevia sukuelinpapilleja. J.P., liitoslevy; A.S., aksiaalinen väli; P., papilli. B: Eväpoimun distaalinen pää. Actinotrichium-säikeet (Act.) ovat kärjessä. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209–218.

Kuva 3.
Kuva kalan ruumiista, jossa näkyy leikkauskohta, kun sukupuolirauhanen on kiinnitetty muulla kuin 10-prosenttisella neutraalilla puskuroidulla formaliinilla. Tässä tapauksessa jäljellä oleva ruumis leikataan kahtia peräevän etuosan ja peräaukon välistä partaterällä (punainen viiva). Kalan ruumiin päänpuoleinen osa laitetaan sukupuolirauhasen kiinnitysliuokseen ja pyrstöosa 10-prosenttiseen neutraaliin puskuroituun formaliiniin.
Lisäys 6
Suositellut näytteenottomenetelmät vitellogeniinianalyysia varten
Näytteenotossa on oltava huolellinen koiraiden ja naaraiden vitellogeniininäytteiden välisen ristikontaminaation välttämiseksi.
Menetelmä 1A; Rasvapäämutu, verinäytteen otto pyrstösuonesta
Nukutuksen jälkeen pyrstö leikataan osittain auki skalpellilla ja verinäyte otetaan pyrstösuonesta heparinisoituun mikrohematokriittikapillaariputkeen. Kun verinäyte on otettu, plasma eristetään nopeasti sentrifugoimalla näytettä kolme minuuttia 15 000g:ssä (tai 10 minuuttia 15 000g:ssä 4 °C:n lämpötilassa). Haluttaessa hematokriittien prosenttiosuus voidaan määrittää sentrifugoinnin jälkeen. Sen jälkeen plasma poistetaan mikrohematokriittiputkesta ja säilötään sentrifugiputkeen, jossa on 0,13 yksikköä aprotiniinia (proteaasin estäjää) – 80 °C:n lämpötilassa siihen saakka, kunnes vitellogeniinimääritys voidaan tehdä. Rasvapäämutun (sukupuolen mukaan määräytyvän) koon mukaan kerättävä plasmamäärä on yleensä 5–60 mikrolitraa kalaa kohti (Jensen et al. 2001).
Menetelmä 1B: Rasvapäämutu, verinäytteen otto sydämestä
Verinäyte voidaan ottaa vaihtoehtoisesti myös sydänpunktiolla, jossa käytetään heparinisoitua ruiskua (1 000 yksikköä hepariinia millilitrassa). Veri siirretään Eppendorf-putkiin (jotka pidetään jäissä) ja sentrifugoidaan (5 minuuttia, 7 000 g, huonelämpötila). Plasma on siirrettävä puhtaisiin Eppendorf-putkiin (alikvooteissa, jos se on plasman tilavuuden perusteella mahdollista) ja jäädytettävä nopeasti – 80 °C:ssä analysointiin saakka (Panter et al., 1998).
Menetelmä 2A: Medaka, maksan poisto
Kalan ottaminen pois testiastiasta
|
(1)
|
Kala otetaan pois testiastiasta pienen haavin avulla. Ole varovainen, jotta kala ei putoa muihin testiastioihin.
|
|
(2)
|
Periaatteessa kalat on otettava pois astioista seuraavassa järjestyksessä: kontrolli, liuotinkontrolli (tarvittaessa), pienin pitoisuus, keskisuuri pitoisuus, suuri pitoisuus ja positiivinen kontrolli. Lisäksi kaikki koiraat on otettava pois yhdestä testiastiasta ennen naaraiden ottamista.
|
|
(3)
|
Kunkin kalan sukupuoli on tunnistettavissa ulkoisten sekundaaristen sukupuoliominaisuuksien (kuten peräevän muodon) perusteella.
|
|
(4)
|
Laita kala kuljetussäiliöön ja vie se työpisteeseen, jossa maksan poisto tehdään. Tarkista testiastian ja kuljetussäiliön merkinnät, jotta voit vahvistaa, että testiastiasta otettujen kalojen lukumäärä ja siihen jääneiden kalojen lukumäärä ovat oikeat.
|
|
(5)
|
Jos kalan sukupuolta ei voi määrittää sen ulkonäön perusteella, ota kaikki kalat pois testiastiasta. Tässä tapauksessa sukupuoli on määritettävä tutkimalla sukupuolirauhasia tai sekundaarisia sukupuoliominaisuuksia stereomikroskoopilla.
|
Maksan poistaminen
|
(1)
|
Siirrä kala kuljetussäiliöstä nukutusliuokseen pienen haavin avulla.
|
|
(2)
|
Kun kala on nukutettu, siirrä se suodatinpaperin (tai paperipyyhkeen) päälle (tavallisilla) pinseteillä. Tartu pinseteillä kalaan sen pään molemmin puolin, jotta pyrstöosa ei rikkoonnu.
|
|
(3)
|
Kuivaa kalan pinta vedestä suodatinpaperiin (tai paperipyyhkeeseen).
|
|
(4)
|
Aseta kala pöydälle vatsapuoli ylöspäin. Tee sen jälkeen pieni poikittainen viilto vatsanpuoleisen niskan alueen ja vatsan keskiosan välistä dissektiosaksilla.
|
|
(5)
|
Laita dissektiosakset pienen viillon sisään ja avaa vatsa keskiviivaa pitkin kiduskannen pyrstönpuoleisesta päästä peräaukon kallonpuoleiseen päähän. Varo työntämästä saksia liian syvälle, jotta maksa ja sukupuolirauhanen eivät vaurioidu.
|
|
(6)
|
Tee seuraavat toimenpiteet stereomikroskoopin avulla.
|
|
(7)
|
Laita kala vatsapuoli ylöspäin paperipyyhkeen päälle (myös lasista petrimaljaa tai lasista näytelevyä voi käyttää).
|
|
(8)
|
Levitä vatsaontelon seinämiä tarkkuuspinseteillä, jotta saat sisäelimet esiin. Sisäelimet voi ottaa esiin myös poistamalla toisen puolen vatsaontelon seinämästä, jos tarpeen.
|
|
(9)
|
Ota maksan ja sappirakon yhtyneet osat esiin käyttämällä toista tarkkuuspinsettiparia. Tartu sappitiehen ja leikkaa sappirakko irti. Ole varovainen, jotta sappirakko ei mene rikki.
|
|
(10)
|
Tartu sen jälkeen ruokatorveen ja leikkaa ruoansulatuskanava irti maksasta samalla tavalla. Ole varovainen, jotta ruoansulatuskanavan sisältö ei vuoda ulos. Irrota ruoansulatuskanavan pyrstönpuoleinen osa peräaukosta ja ota kanava pois vatsaontelosta.
|
|
(11)
|
Poista rasva ja muut kudokset maksan reunoilta. Varo naarmuttamasta maksaa.
|
|
(12)
|
Tartu maksan porttialueeseen tarkkuuspinseteillä ja ota maksa pois vatsaontelosta.
|
|
(13)
|
Aseta maksa näytelevylle. Poista maksan pinnalta tarkkuuspinseteillä kaikki mahdollinen rasva ja ulkopuoliset kudokset (esimerkiksi vatsakalvo) tarvittaessa.
|
|
(14)
|
Punnitse maksa elektronisella analyysivaa'alla käyttäen 1,5 ml:n mikroputkea taarana. Merkitse paino lomakkeeseen (lukema: 0,1 mg). Varmista, että mikroputken etiketissä on oikeat tiedot.
|
|
(15)
|
Sulje maksan sisältävä mikroputki tulpalla. Aseta putki jäähdytystelineeseen (tai jäätelineeseen).
|
|
(16)
|
Kun yhdeltä kalalta on poistettu maksa, puhdista dissekointivälineet tai vaihda ne puhtaisiin.
|
|
(17)
|
Poista maksa kaikilta kuljetussäiliössä olevilta kaloilta edellä kuvatulla tavalla.
|
|
(18)
|
Kun kaikilta kuljetussäiliön kaloilta (ts. kaikilta testiastian koirailta tai naarailta) on poistettu maksa, laita kaikki maksanäytteet putkitelineeseen, varmista, että putkissa on tunniste-etiketit ja laita putkiteline sen jälkeen pakastimeen. Jos maksat toimitetaan esikäsittelyyn heti niiden irrottamisen jälkeen, näytteet on kuljetettava seuraavaan työpisteeseen jäähdytystelineessä (tai jäätelineessä).
|
Maksan irrottamisen jälkeen kalan ruumiista voi tutkia sekundaariset sukupuoliominaisuudet.
Näyte
Säilytä kaloilta otetut maksanäytteet ≤ – 70 °C:n lämpötilassa, jos niitä ei käytetä esikäsittelyyn pian irrottamisen jälkeen.
Kuva 1
Viilto tehdään saksilla aivan rintaevien edestä.

Kuva 2
Vatsan keskiviiva leikataan saksilla auki pisteeseen, joka sijaitsee noin kaksi millimetriä kallosta peräaukkoon päin.

Kuva 3
Vatsaontelon seinämät levitetään pihdeillä, jotta maksa ja muut sisäelimet saadaan esiin. (Vaihtoehtoisesti seinämät voidaan kiinnittää sivuille.)
Kuva 4
Maksa leikataan irti suoraan ja otetaan pois pihdeillä.

Kuva 5
Sisäelimet irrotetaan varovasti pihdeillä.

Kuva 6
Sisäelinten molemmat päät ja mahdolliset suoliliepeen kiinnikkeet leikataan irti saksilla.

Kuva 7 (naaras)
Menettely on naaraiden osalta samanlainen.
Kuva 8
Valmis toimenpide.

Menetelmä 2B: Medaka (Oryzias latipes), maksan esikäsittely vitellogeniinianalyysia varten
Ota homogenaattipuskuria sisältävä pullo ELISA-pakkauksesta ja jäähdytä se jäämurskalla (liuoksen lämpötila: ≤ 4 °C). Jos käytetään EnBio ELISA -järjestelmän homogenaattipuskuria, sulata liuos huoneenlämmössä ja jäähdytä pullo sen jälkeen jäämurskalla.
Laske tarvittavan homogenaattipuskurin määrä maksan painon perusteella (lisää 50 μl homogenaattipuskuria maksan painomilligrammaa kohti homogenaattia varten). Esimerkki: jos maksa painaa 4,5 mg, tarvittavan homogenaattipuskurin määrä on 225 μl. Tee luettelo kutakin maksaa varten tarvittavan homogenaattipuskurin määrästä.
Maksan valmistelu esikäsittelyä varten
|
(1)
|
Ota maksan sisältävä 1,5 ml:n putki pakastimesta vasta vähän ennen esikäsittelyä.
|
|
(2)
|
Koiraiden maksojen esikäsittely on tehtävä ennen naaraiden maksojen käsittelyä vitellogeniinikontaminaation välttämiseksi. Lisäksi testiryhmien esikäsittely on tehtävä seuraavassa järjestyksessä: kontrolli, liuotinkontrolli (tarvittaessa), pienin pitoisuus, keskisuuri pitoisuus, suuri pitoisuus ja positiivinen kontrolli.
|
|
(3)
|
Pakastimesta ei saa ottaa enempää maksanäytteitä sisältäviä 1,5 ml:n mikroputkia kuin yhdellä kerralla voidaan sentrifugoida.
|
|
(4)
|
Laita näytteet sisältävät 1,5 ml:n mikroputket jäätelineeseen näytenumeroiden mukaiseen järjestykseen (maksanäytteitä ei tarvitse sulattaa).
|
Esikäsittely
1. Homogenointipuskurin lisääminen
|
(1)
|
Tarkista luettelosta, kuinka paljon homogenaattipuskuria kutakin maksanäytettä kohti on käytettävä ja säädä mikropipetti (tilavuuden vaihteluväli: 100–1 000 μl) tarvittavan määrän mukaisesti. Kiinnitä mikropipettiin puhdas kärki.
|
|
(2)
|
Ota homogenaattipuskuri reagenssipullosta ja lisää puskuri maksanäytteen sisältävään 1,5 ml:n mikroputkeen.
|
|
(3)
|
Lisää homogenaattipuskuri kaikkiin 1,5 ml:n mikroputkiin, jotka sisältävät maksanäytteen, edellä kuvatun menettelyn mukaisesti. Mikropipettiin ei tarvitse vaihtaa välillä uutta kärkeä. Jos kärki kontaminoituu tai jos epäilet sen kontaminoituneen, se pitää kuitenkin vaihtaa.
|
2. Maksan homogenisointi
|
(1)
|
Kiinnitä mikroputkihomogenisaattoriin uusi homogenisointipää.
|
|
(2)
|
Työnnä pää 1,5 ml:n mikroputkeen. Pidä homogenisaattoria siten, että maksa puristuu pään pinnan ja 1,5 ml:n mikroputken seinän väliin.
|
|
(3)
|
Käytä homogenisaattoria 10–20 sekunnin ajan. Jäähdytä 1,5 ml:n mikroputki jäämurskalla toimenpiteen ajan.
|
|
(4)
|
Nosta homogenisointipää 1,5 ml:n mikroputkesta ja anna sen levätä noin 10 sekuntia. Tarkasta suspension tila sen jälkeen silmämääräisesti.
|
|
(5)
|
Jos suspensiossa näkyy maksan palasia, toista vaiheet 3 ja 4 hyväksyttävän maksahomogenaatin saamiseksi.
|
|
(6)
|
Jäähdytä suspendoitua maksahomogenaattia jäätelineessä sentrifugointiin saakka.
|
|
(7)
|
Vaihda homogenisaattoriin uusi pää jokaista homogenaattia varten.
|
|
(8)
|
Homogenisoi kaikki maksat homogenaattipuskurilla edellä kuvatun menetelmän mukaisesti.
|
3. Suspendoidun maksahomogenaatin sentrifugointi
|
(1)
|
Tarkista, että jäähdyttävän sentrifugikammion lämpötila on ≤ 5 °C.
|
|
(2)
|
Laita suspendoidun maksahomogenaatin sisältävät 1,5 ml:n mikroputket jäähdyttävään sentrifugiin (säädä tasapaino tarvittaessa).
|
|
(3)
|
Sentrifugoi suspendoituja maksahomogenaatteja 13 000g:ssa 10 minuuttia ≤ 5 °C:n lämpötilassa. Jos supernatanttien erottelu on kuitenkin riittävä, keskipakoisvoimaa ja sentrifugointiaikaa voi tarvittaessa säätää.
|
|
(4)
|
Tarkista sentrifugoinnin jälkeen, että supernatanttien erottelu on riittävä (pintakerros: lipidit, välikerros: supernatantti, pohjakerros: maksakudos). Jos erottelu ei ole riittävä, sentrifugoi suspensio uudestaan samoissa olosuhteissa.
|
|
(5)
|
Ota kaikki näytteet pois jäähdyttävästä sentrifugista ja aseta ne jäätelineeseen näytenumeron mukaiseen järjestykseen. Varo suspendoimasta eroteltuja kerroksia uudestaan sentrifugoinnin jälkeen.
|
4. Supernatantin kerääminen
|
(1)
|
Laita putkitelineeseen neljä 0,5 ml:n mikroputkea supernatantin säilyttämistä varten.
|
|
(2)
|
Ota mikropipetillä 30 μl jokaisesta supernatantista (joka on eroteltu välikerrokseen) ja tyhjennä määrä yhteen 0,5 ml:n mikroputkeen. Varo keräämästä pintakerroksessa olevia lipidejä tai pohjakerroksessa olevaa maksakudosta.
|
|
(3)
|
Kerää supernatantti ja tyhjennä se kahteen muuhun 0,5 ml:n mikroputkeen edellä kuvatulla tavalla.
|
|
(4)
|
Kerää loput supernatantista mikropipetillä (jos mahdollista: ≥ 100 μl). Tyhjennä tämä määrä neljänteen 0,5 ml:n mikroputkeen. Varo keräämästä pintakerroksessa olevia lipidejä tai pohjakerroksessa olevaa maksakudosta.
|
|
(5)
|
Sulje 0,5 ml:n mikroputkien päät tulpalla ja kirjoita supernatantin määrä etikettiin. Jäähdytä mikroputket välittömästi jäätelineessä.
|
|
(6)
|
Vaihda mikropipettiin uusi kärki jokaista supernatanttia varten. Jos kärkeen kiinnittyy suuri määrä lipidejä, vaihda se uuteen välittömästi, jotta rasva ei kontaminoi maksanäytettä.
|
|
(7)
|
Tyhjennä kaikki sentrifugoidut supernatantit neljään 0,5 ml:n mikroputkeen edellä kuvatulla tavalla.
|
|
(8)
|
Kun olet tyhjentänyt supernatantin 0,5 ml:n mikroputkiin, laita kaikki etiketöidyt putket putkitelineeseen ja pakasta ne välittömästi. Jos vitellogeniinipitoisuudet mitataan välittömästi esikäsittelyn jälkeen, pidä yksi 0,5 ml:n mikroputki (joka sisältää 30 μl supernatanttia) jäähdytettynä putkitelineessä ja vie se siihen työpisteeseen, jossa ELISA-määritys tehdään. Laita muut mikroputket putkitelineisiin ja pakasta ne.
|
|
(9)
|
Hävitä jäämät supernatantin keräämisen jälkeen asianmukaisesti.
|
Näytteiden säilytys
Säilytä maksahomogenaatin supernatanttia sisältävät 0,5 ml:n mikroputket ≤ – 70 °C:ssa siihen saakka, kun niitä käytetään ELISA-määrityksessä.
Menetelmä 3A: Seeprakala, verinäytteen otto pyrstösuonesta
Pyrstöön tehdään välittömästi nukutuksen jälkeen poikittainen viilto, ja verinäyte otetaan pyrstösuonesta heparinisoituun mikrohematokriittikapillaariputkeen. Verimäärä vaihtelee välillä 5–15 μl kalan koon mukaan. Mikrokapillaariputkeen lisätään sama määrä aprotiniinipuskuria (6 μgml fosfaattipuskuroidussa suolaliuoksessa), ja plasma erotellaan verestä sentrifugoimalla (5 minuuttia 600 g:ssä). Plasma kerätään koeputkiin ja varastoidaan – 20 °C:ssä siihen saakka, kunnes siitä analysoidaan vitellogeniini tai muut tarvittavat proteiinit.
Menetelmä 3B: Seeprakala, verinäytteen otto sydänpunktiolla
Veren koaguloitumisen ja proteiinin hajoamisen välttämiseksi näytteet otetaan fosfaattipuskuroituun suolaliuokseen, joka sisältää hepariinia (1 000 yksikköä/ml) ja proteaasin estäjää, aprotiniinia (2 TIU/ml). Hepariini-ammoniumsuola ja kylmäkuivattu aprotiniini ovat puskurin suositeltavia ainesosia. Näytteenotossa suositellaan käytettäväksi ruiskua (1 ml) ja kiinteää ohutneulaa (esimerkiksi Braun Omnikan-F). Ruisku on esitäytettävä puskurilla (noin 100 μl), jotta jokaisen kalan pieni verimäärä voidaan eluoida kunnolla. Verinäytteet otetaan sydänpunktiolla. Ensin kala on nukutettava MS-222:lla (100 mg/l). Kun anestesian taso on asianmukainen, näytteenottaja voi erottaa seeprakalan sydämensykkeen. Pidä ruiskun mäntä pienen paineen alaisena, kun punktoit sydäntä. Kerättävän veren määrä on 20–40 mikrolitraa. Sydänpunktion jälkeen veri-puskuriseos on laitettava koeputkeen. Plasma erotellaan verestä sentrifugoimalla (20 minuuttia; 5 000 g), ja sitä tulee säilyttää – 80 °C:ssa analysointiin saakka.
Menetelmä 3C: Menettelytapaohje: Seeprakala, pään ja pyrstön homogenisointi
|
(1)
|
Kalat nukutetaan ja lopetetaan testikuvauksen mukaisesti.
|
|
(2)
|
Kalan pää ja pyrstö leikataan kuvassa 1 näkyvällä tavalla.
|
Tärkeää: Kaikki dissekointivälineet ja leikkauspöytä on huuhdeltava ja puhdistettava kunnolla (esimerkiksi 96-prosenttisella etanolilla) jokaisen kalan käsittelyn jälkeen, jotta naaraiden tai niiden koiraiden, joille kemikaali on aiheuttanut vaikutuksia, vitellogeniini ei saastuta terveitä koiraita.
Kuva 1

|
(3)
|
Jokaisen kalan pään ja pyrstön yhteispaino punnitaan lähimpään milligrammaan.
|
|
(4)
|
Punnituksen jälkeen kalan osat laitetaan asianmukaisiin putkiin (esimerkiksi 1,5 ml:n Eppendorf-putkiin) ja jäädytetään – 80 °C:ssa homogenisointiin saakka. Ne voidaan myös homogenisoida suoraan jään päällä kahdella muovisurvimella. (Myös muita menetelmiä voi käyttää, jos ne tehdään jään päällä ja jos lopputuloksena on homogeeninen massa.) Tärkeää: Putket on numeroitava asianmukaisesti, jotta yhden kalan pää ja pyrstö voidaan yhdistää siihen ruumiinosaan, jota käytetään sukupuolirauhasen histologisessa tutkimuksessa.
|
|
(5)
|
Kun homogeeninen massa on valmis, siihen lisätään neljä kertaa kudoksen painon verran jääkylmää homogenisointipuskuria (22). Jatka työskentelyä survimilla, kunnes seos on homogeeninen. Tärkeä huomautus: Jokaiselle kalalle käytetään uusia survimia.
|
|
(6)
|
Näytteet laitetaan jäähän siihen saakka, kunnes ne sentrifugoidaan 4 °C:ssa (50 000 × g) 30 minuutin ajan.
|
|
(7)
|
Laita pipetillä 20 μl:n supernatanttiannoksia vähintään kahteen putkeen upottamalla pipetin kärki pinnan rasvakerroksen läpi ja vetämällä varovasti supernatanttia pipettiin ilman rasva- tai pellettifraktioita.
|
|
(8)
|
Putkia säilytetään – 80 °C:ssa siihen saakka, kunnes niitä käytetään.
|
Lisäys 7
Vitellogeniinin rikastusnäytteet ja määritysten välinen vertailuaine
Niinä päivinä, kun tehdään vitellogeniinimäärityksiä, analysoidaan myös rikastusnäyte käyttämällä määritysten välistä vertailuainetta. Määritysten välisen vertailuaineen valmistamisessa käytettävä vitellogeniini on peräisin eri erästä kuin se, jota käytettiin tehtävän määrityksen kalibrointistandardien tekemiseen.
Rikastusnäyte tehdään lisäämällä tunnettu määrä määritysten välistä vertailuainetta kontrolliryhmän koiraan plasmanäytteeseen. Näytettä rikastetaan, jotta saadaan sellainen vitellogeniinipitoisuus, joka on 10–100 kertaa suurempi kuin kontrolliryhmän koiraan odotuksenmukainen vitellogeniinipitoisuus. Rikastettava kontrolliryhmän plasmanäyte voi olla peräisin yksittäiseltä kalalta, tai se voidaan yhdistää useilta kaloilta.
Osanäyte rikastamattomasta kontrolliryhmän koiraan plasmasta analysoidaan vähintään kahdessa rinnakkaisessa kuopassa. Myös rikastettu näyte analysoidaan vähintään kahdessa rinnakkaisessa kuopassa. Vitellogeniinin keskimääräinen määrä kahdessa rikastamattomassa kontrolliryhmän koiraan plasmanäytteessä lisätään siihen vitellogeniinin laskettuun määrään, joka on lisätty näytteiden rikastamiseen, odotuksenmukaisen pitoisuuden määrittämiseksi. Tämän odotuksenmukaisen pitoisuuden ja mitatun pitoisuuden välinen suhde ilmoitetaan kyseisenä päivänä tehtyjen määritysten tulosten mukana.
Lisäys 8
Päätöksentekoa tukeva vuokaavio tilastollista analyysia varten
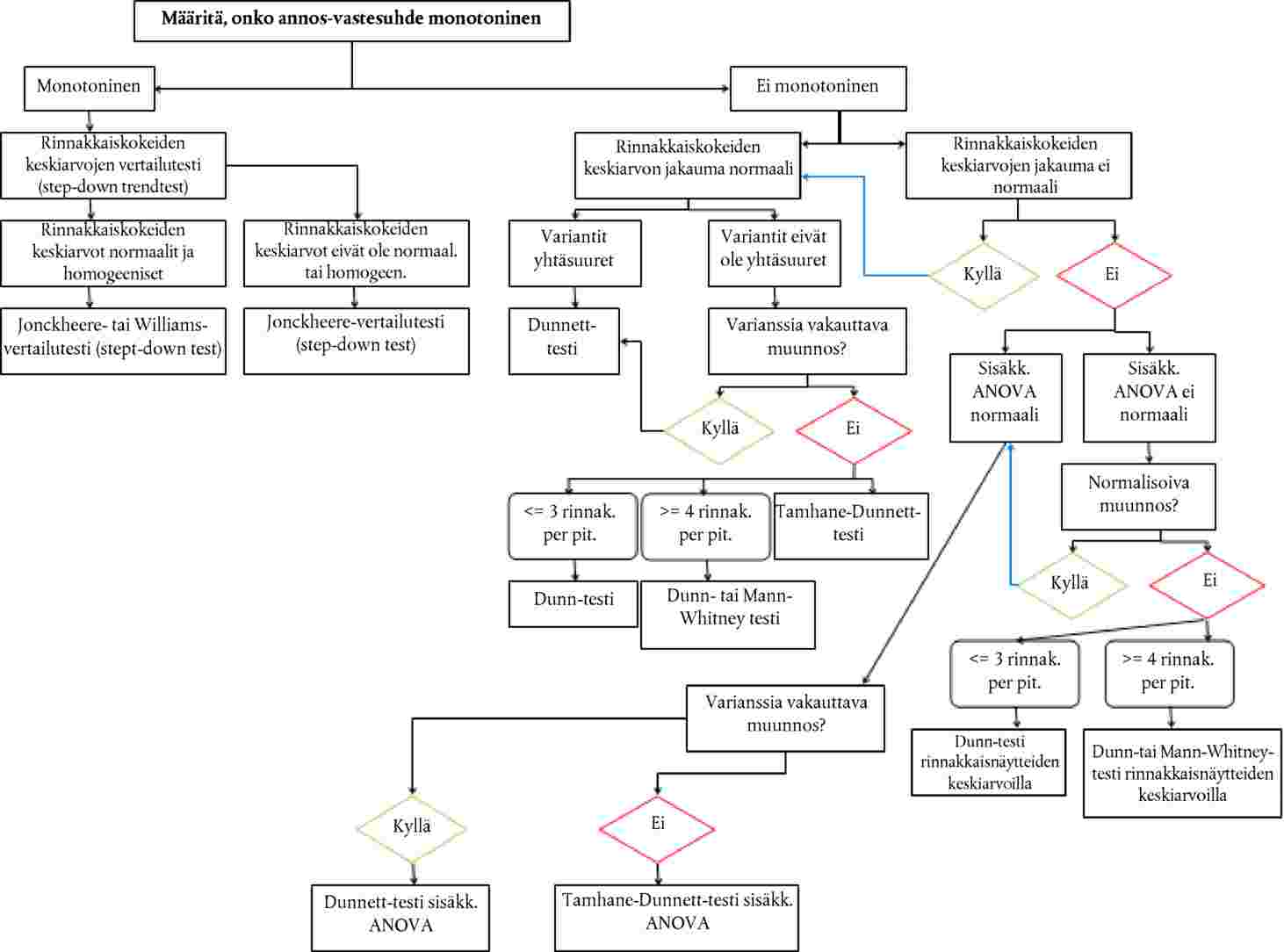
C.38. SAMMAKKOELÄINTEN MUODONVAIHDOSTUTKIMUS (AMA-TUTKIMUS)
JOHDANTO
|
1.
|
Tämä testimenetelmä vastaa OECD:n testiohjetta (TG) nro 231 (2009). Tarve kehittää ja validoida tutkimus, jolla pystytään havaitsemaan selkärankaisten lajien kilpirauhasjärjestelmään vaikuttavia kemikaaleja, perustuu huolenaiheisiin, joiden mukaan kemikaalien ympäristöpitoisuuksista saattaa aiheutua haittavaikutuksia sekä ihmisille että eläimille. Vuonna 1998 OECD aloitti tärkeän toimenpiteen, nimittäin olemassa olevien ohjeiden uudistuksen ja uusien ohjeiden laatimisen mahdollisten hormonitoimintaa häiritsevien aineiden seulontaa ja testausta varten. Yksi toimenpiteen osa oli laatia testiohjeet selkärankaisten lajien kilpirauhasjärjestelmään vaikuttavien kemikaalien seulontaan. Sekä jyrsijöillä tehtävän toistetun annoksen 28 päivän myrkyllisyystutkimusta (tämän liitteen luku B.7) että sammakkoeläinten muodonvaihdostutkimusta (Amphibian Metamorphosis Assay, AMA-tutkimus) ehdotettiin parannettavaksi. Parannettu testimenetelmä B.7 validoitiin, ja tarkistettu testimenetelmä on sittemmin julkaistu. AMA-tutkimus validoitiin kattavasti. Siihen sisältyi laboratorioiden sisäisiä ja välisiä tutkimuksia, joilla osoitettiin tutkimuksen merkityksellisyys ja luotettavuus (1, 2). Lopuksi riippumattomista asiantuntijoista koostuva ryhmä vertaisarvioi tutkimuksen validoinnin (3). Tämä testimenetelmä perustuu kilpirauhasjärjestelmään vaikuttavien kemikaalien havaitsemista koskevien validointitutkimusten aikana karttuneeseen kokemukseen sekä muualla OECD:n jäsenvaltioissa tehtyyn tutkimukseen.
|
TESTIN PERIAATE
|
2.
|
AMA-tutkimus on seulontatutkimus, jonka tavoitteena on tunnistaa empiirisesti sellaiset kemikaalit, jotka voivat häiritä hypotalamus-aivolisäke-kilpirauhasakselin (HPT-akselin) toimintaa. AMA on siinä mielessä yleispätevä selkärankaismalli, että se perustuu HPT-akselin säilöttyihin rakenteisiin ja toimintoihin. Se on tärkeä tutkimus, koska sammakon muodonvaihdos on hyvin tutkittu kilpirauhasesta riippuva prosessi, joka reagoi HPT-akseliin vaikuttaviin kemikaaleihin, ja se on ainoa olemassa oleva tutkimus, jolla voidaan havaita kilpirauhaseen kohdistuvia vaikutuksia morfologisessa kehitysvaiheessa olevalla eläimellä.
|
|
3.
|
Testissä vaiheessa 51 olevia Xenopus laevis -sammakonpoikasia altistetaan kolmelle eri pitoisuudelle testikemikaalia ja laimennusvesikontrollille 21 päivän ajan. Jokaisesta käsittelystä tehdään neljä rinnakkaistestiä. Testin alussa toukkien tiheys on 20 sammakonpoikasta testiastiaa kohti kaikissa käsittelyryhmissä. Tutkittavat ominaisuudet ovat takajalan pituus, kuonon ja peräaukon välinen pituus, kehitysvaihe, märkäpaino, kilpirauhasen histologia sekä päivittäiset havainnot kuolleisuudesta.
|
MENETELMÄN KUVAUS
Testilajit
|
4.
|
Xenopus laevis -lajia kasvatetaan yleisesti laboratorioissa kaikkialla maailmassa, ja sitä saa helposti kaupallisilta toimittajilta. Tässä lajissa lisääntyminen saadaan helposti aikaan kaikkina vuodenaikoina käyttämällä ihmisen koriongonadotropiini- eli hCG-injektioita, ja näin syntyvistä toukista voidaan kasvattaa suuri määrä tiettyihin kehitysvaiheisiin, jolloin voidaan käyttää kehitysvaihekohtaisia testisuunnitelmia. Tutkimuksessa on ensisijaisesti käytettävä laboratorion aikuisista sammakoista peräisin olevia toukkia. Vaihtoehtoisesti – joskaan tämä ei ole suositeltavaa – munat tai alkiot voidaan lähettää laboratorioon, jossa testi tehdään, jolloin on huolehdittava totutteluvaiheesta. Sen sijaan toukkavaiheessa olevien sammakonpoikasten lähettäminen testissä käytettäväksi ei ole hyväksyttävää.
|
Laitteet ja tarvikkeet
|
5.
|
Tässä tutkimuksessa tarvitaan seuraavat laitteet ja tarvikkeet:
|
a)
|
altistusjärjestelmä (ks. jäljempänä oleva kuvaus)
|
|
b)
|
lasisia tai ruostumattomasta teräksestä valmistettuja akvaarioita (ks. jäljempänä oleva kuvaus)
|
|
d)
|
lämpötilan valvontalaitteet (ts. lämmittimet tai jäähdyttimet (säädettävä lämpötila 22 ± 1 °C))
|
|
f)
|
kaksiokulaarinen dissektiomikroskooppi
|
|
g)
|
digitaalikamera, jonka tarkkuus on vähintään neljä megapikseliä ja jossa on mikrotoiminto
|
|
h)
|
kuvien digitointiohjelmisto
|
|
i)
|
petrimalja (esimerkiksi 100 × 15 mm) tai vastaavankokoinen läpinäkyvä muovimalja
|
|
j)
|
analyysivaaka, jonka tarkkuus on kolme desimaalia (mg)
|
|
k)
|
liuenneen hapen mittari
|
|
m)
|
valotehon mittari, jossa mittayksikkönä luksi
|
|
n)
|
erilaisia laboratoriolaseja ja -instrumentteja
|
|
o)
|
säädettäviä pipettejä (10–5 000 μl) tai valikoima vastaavankokoisia pipettejä
|
|
p)
|
tutkimuksen tekemiseen riittävä määrä testikemikaalia mieluiten yhdestä erästä
|
|
q)
|
testattavalle kemikaalille sopivat analyysilaitteet tai sopimusperusteiset analyysipalvelut.
|
|
Kemikaalin testattavuus
|
6.
|
AMA perustuu vesialtistukseen, jossa testikemikaalia johdetaan testiastioihin läpivirtausjärjestelmän kautta. Läpivirtausjärjestelmissä on kuitenkin kemikaalin fysikaalis-kemiallisiin ominaisuuksiin perustuvia rajoituksia sille, minkätyyppisiä kemikaaleja voidaan testata. Ennen tämän tutkimuksen tekemistä kemikaalista on hankittava perustiedot, joiden perusteella testattavuus voidaan määrittää. Lisäksi on tutustuttava vaikeasti testattavia kemikaaleja koskevaan OECD:n testiohjeeseen ’Aquatic Toxicity Testing of Difficult Substances and Mixtures’ (4). Sellaisia ominaisuuksia, jotka viittaavat siihen, että kemikaalia voi olla vaikea testata vesijärjestelmissä, ovat seuraavat: suuret oktanoli-vesi-jakaantumiskertoimen (log Kow), suuri haihtuvuus, hydrolyysiherkkyys ja fotolyysiherkkyys laboratorion valaistusolosuhteissa. Myös muilla tekijöillä voi olla merkitystä testattavuuden määrittämisessä, ja ne on otettava huomioon tapauskohtaisesti. Jos kemikaalia ei voida testata onnistuneesti läpivirtausjärjestelmää käyttäen, voidaan käyttää staattista järjestelmää, jossa testiliuos ei vaihdu. Jos testikemikaalia ei voida mukauttaa kumpaankaan järjestelmään, kemikaalia ei tule testata tämän suunnitelman mukaisesti.
|
Altistusjärjestelmä
|
7.
|
Mieluiten on käytettävä läpivirtauslaimenninjärjestelmää, jos mahdollista; toissijainen menetelmä on staattinen järjestelmä, jossa testiliuos ei vaihdu. Jos jonkin testikemikaalin fysikaaliset ja/tai kemialliset ominaisuudet eivät sovellu läpivirtauslaimenninjärjestelmään, voidaan käyttää vaihtoehtoista altistusjärjestelmää (ts. staattista järjestelmää). Järjestelmän veden kanssa kosketuksiin joutuvien osien tulee olla lasia, ruostumatonta terästä ja/tai polytetrafluoroetyleeniä. Muitakin sopivia muoveja voi käyttää, jos ne eivät vaaranna tutkimusta. Altistussäiliöinä tulee käyttää lasisia tai ruostumattomasta teräksestä valmistettuja akvaarioita. Niissä on oltava nousuputket, joilla säiliön vesimääräksi saadaan noin 4,0–10,0 litraa, ja veden vähimmäissyvyyden tulee olla 10–15 cm. Järjestelmässä on voitava käyttää kaikkia altistuspitoisuuksia ja kontrollia sekä neljää rinnakkaisnäytettä käsittelyä kohti. Jokaisen säiliön virtausnopeuden on oltava tasainen, kun otetaan huomioon sekä biologisten olosuhteiden ylläpitäminen että kemikaalialtistus (esimerkiksi 25 ml/min). Käsittelysäiliöt on laitettava altistusjärjestelmään sattumanvaraisiin paikkoihin, jotta mahdolliset sijainnista johtuvat vaikutukset voidaan minimoida. Tämä koskee myös lämpötilan, valotehon jne. vaihteluita. Tilassa on käytettävä loisteputkivalaistusta. Valoisan ajan kesto on 12 h ja pimeän ajan kesto 12 h, ja valoteho saa vaihdella 600–1 200 luksin (luumenia/m2) välillä veden pinnalla. Veden lämpötila on pidettävä arvossa 22 ± 1 °C; pH-arvo saa olla 6,5–8,5, ja liuenneen hapen (DO) pitoisuus saa olla > 3,5 mg/l (> 40 prosenttia ilman kyllästysarvosta) jokaisessa testisäiliössä. Viikoittain tulee mitata vähintään veden lämpötila, pH ja liuennut happi. Lämpötilaa on mitattava mieluiten jatkuvasti ainakin yhdestä testiastiasta. Lisäyksessä 1 on esitetty koeolosuhteet, joissa testi on toteutettava. Lisätietoja läpivirtausaltistusjärjestelmien ja/tai staattisten järjestelmien rakentamisesta on ASTM:n oppaassa ’Standard Guide for Conducting Acute Toxicity Tests on Test Materials with Fishes, Macroinvertebrates, and Amphibians’ (5) ja yleisissä myrkyllisyyttä vesieliöille koskevissa testeissä.
|
Veden laatu
|
8.
|
Tutkimuksessa voi käyttää mitä tahansa paikallisesti saatavaa vettä (esimerkiksi lähdevettä tai hiilisuodatettua vesijohtovettä), jossa X. laevis -sammakonpoikaset voivat kasvaa ja kehittyä normaalisti. Koska paikallisen veden laatu voi vaihdella huomattavasti alueelta toiselle, veden laatu on analysoitava etenkin silloin, jos saatavilla ei ole aiempia tietoja veden käyttökelpoisuudesta Xenopus-lajin kasvattamisessa. Erityisesti on varmistettava, ettei vedessä ole kuparia, klooria eikä kloramiineja, koska ne kaikki ovat myrkyllisiä sammakoille ja sammakonpoikasille. Lisäksi vedestä on suositeltavaa analysoida fluoridin, perkloraatin ja kloraatin (juomaveden desinfioinnista syntyvät sivutuotteet) taustapitoisuudet, koska kaikki nämä anionit ovat kilpirauhasen jodin kuljetusproteiinin substraatteja, ja kaikkien niiden kohonneet pitoisuudet voivat vaikuttaa tutkimustuloksiin. Analyysi on tehtävä ennen testauksen aloittamista. Yleensä testivedessä ei ole näitä anioneja.
|
Testiveden jodipitoisuus
|
9.
|
Jotta kilpirauhanen voi syntetisoida tyroksiinihormonia, toukkien on saatava vedestä ja ravinnosta riittävästi jodia. Tällä hetkellä empiirisesti johdettuja ohjeita vähimmäisjodipitoisuuksista ei ole. Jodin saatavuus voi kuitenkin vaikuttaa siihen, miten kilpirauhasjärjestelmä reagoi kilpirauhaseen vaikuttaviin aineisiin, ja sen tiedetään muokkaavan kilpirauhasen perustoimintaa. Tämä seikka on syytä ottaa huomioon kilpirauhasen histopatologisia tuloksia tulkittaessa. Tämän vuoksi testivedestä mitatut jodipitoisuudet on ilmoitettava. Validointitutkimuksista saatujen tutkimusten perusteella tutkimuksen on osoitettu toimivan hyvin, kun testiveden jodin (I–) pitoisuudet vaihtelivat välillä 0,5–10 μg/l. Ihannetapauksessa testiveden vähimmäisjodipitoisuuden tulisi olla 0,5 μg/l. Jos testivesi valmistetaan deionisoidusta vedestä, jodia on lisättävä sen verran, että vähimmäispitoisuudeksi tulee 0,5 μg/l. Jos testiveteen lisätään jodia tai muita suoloja, siitä on mainittava tutkimusraportissa.
|
Eläinten hoito
Aikuisten eläinten hoito ja lisääntyminen
|
10.
|
Aikuisten eläinten hoidossa ja lisääntymisessä sovelletaan vakio-ohjeita. Lukijaa kehotetaan lukemaan tarkempia tietoja sammakon alkion teratogeneettista tutkimusta (FETAX) (6) koskevista vakio-ohjeista. Nämä vakio-ohjeet ovat yksi esimerkki asianmukaisista hoito- ja lisääntymismenetelmistä, mutta niitä ei kuitenkaan tarvitse noudattaa tiukasti. Lisääntymistä varten aikuisista naaraista ja koiraista koostuviin pareihin injektoidaan ihmisen koriongonadotropiinia (hCG:tä). Naaraisiin injektoidaan noin 800–1 000 IU ja koiraisiin 600–800 IU 0,6–0,9-prosenttiseen suolaliuokseen liuotettua hCG:tä. Parit, joiden on määrä lisääntyä, pidetään suurissa säiliöissä häiriöittä ja staattisissa olosuhteissa, jotta eläimet hakeutuvat paritteluasentoon helpommin. Jokaisessa lisääntymissäiliössä tulee olla ruostumattomasta teräksestä tai muoviverkosta valmistettu valepohja, jotta munamassa laskeutuu säiliön pohjalle. Sammakot, joille injektio annetaan myöhään iltapäivällä, laskevat valtaosan munistaan yleensä seuraavan aamupäivän puolivälissä. Kun munia on laskettu riittävästi ja kun ne on hedelmöitetty, aikuiset eläimet on otettava pois lisääntymissäiliöstä.
|
Toukkien hoito ja valinta
|
11.
|
Kun eläimet on otettu pois lisääntymissäiliöistä, munat kerätään ja niiden kehityskelpoisuus arvioidaan käyttämällä edustavaa alaryhmää kaikista lisääntymissäiliöistä peräisin olevista alkioista. Parhaat yksittäiset mädit (mätien laadun arviointiin suositellaan kahta tai kolmea mätiä) tulee säilyttää alkioiden kehityskelpoisuuden ja riittävän alkiomäärän (vähintään 1 500) perusteella. Kaikkien tutkimuksessa käytettävien organismien on oltava peräisin yhdeltä kutukerralta (ts. mätejä ei saa sekoittaa keskenään). Alkiot siirretään suureen laakeaan astiaan, ja kaikki selvästi kuolleet tai poikkeavat munat (ks. määritelmä lähdeviitteestä (5)) poistetaan pipetillä tai vastaavalla instrumentilla. Jokaisen kolmen mädin hyväkuntoiset alkiot siirretään kolmeen erilliseen hautomisastiaan. Kun mäti on ollut neljä päivää hautomisastiassa, valitaan kehityskelpoisuuden ja hautomisen onnistumisen perusteella paras mäti, ja toukat siirretään niin moneen kasvatussäiliöön kuin on tarpeen (lämpötila 22 ± 1 °C). Lisäksi muutamia toukkia siirretään ylimääräisiin säiliöihin, ja niillä korvataan kasvatussäiliöissä ensimmäisen viikon aikana mahdollisesti kuolevat toukat. Tässä menetelmässä organismin tiheys pysyy vakiona, mikä vähentää yksittäisestä mädistä koostuvan kohortin sisäisiä kehityksellisiä eroavuuksia. Kaikki kasvatussäiliöt on puhdistettava lapolla päivittäin. Varotoimenpiteenä suositellaan käytettäväksi vinyyli- tai nitriilikäsineitä lateksikäsineiden sijasta. Kuolleet toukat on poistettava säiliöstä päivittäin, ja niiden tilalle on lisättävä korvaavia toukkia, jotta organismin tiheys pysyy samana ensimmäisen viikon ajan. Toukkia on ruokittava vähintään kahdesti päivässä.
|
|
12.
|
Esialtistusvaiheen aikana sammakonpoikaset totutetaan varsinaisen altistusvaiheen olosuhteisiin, mukaan luettuina tyypillinen ruoka, lämpötila, valoisan ja pimeän vaihteluväli sekä kasvatusalusta. Sen vuoksi on suositeltavaa, että esialtistusvaiheessa ja altistusvaiheessa käytetään samaa kasvatus-/laimennusvettä. Jos sammakonpoikasten ylläpitämisessä käytetään esialtistusvaiheessa staattista kasvatusjärjestelmää, kasvatusalusta on vaihdettava kokonaan vähintään kahdesti viikossa. Esialtistusvaiheen aikaisesta suuresta toukkatiheydestä johtuvaa tungosta on vältettävä, koska siihen liittyvät seikat saattavat vaikuttaa merkittävästi sammakonpoikasten kehitykseen myöhemmässä testausvaiheessa. Siksi kasvatustiheys ei saa olla enempää kuin noin neljä sammakonpoikasta litrassa kasvatusalustaa (staattinen altistusjärjestelmä) tai kymmenen sammakonpoikasta litrassa kasvatusalustaa (kun virtausnopeus esialtistus- tai kasvatusjärjestelmässä on esimerkiksi 50 ml/min). Tällaisissa olosuhteissa sammakonpoikasten tulisi kehittyä vaiheista 45/46 vaiheeseen 51 kahdentoista päivän kuluessa. Tätä varastopopulaatiota edustavien sammakonpoikasten kehitysvaihe on tutkittava päivittäin, jotta voidaan arvioida, milloin on sopiva ajankohta altistuksen aloittamiselle. Stressin ja traumojen aiheuttamista sammakonpoikasille on pyrittävä välttämään etenkin toukkien liikuttamisen ja käsittelyn sekä akvaarioiden puhdistamisen aikana. Stressaavia olosuhteita ja toimenpiteitä on vältettävä. Sellaisia ovat esimerkiksi kova ja/tai jatkuva melu, akvaarioihin koputtelu, akvaarioihin kohdistuva tärinä, liiallisen vilkas toiminta laboratoriossa sekä ympäristön muutokset (valaistus, lämpötila, pH, liuennut happi, veden virtausnopeudet jne.). Jos sammakonpoikaset eivät kehity vaiheeseen 51 seitsemäntoista päivän kuluessa hedelmöittymisestä, liiallinen stressi on otettava huomioon mahdollisena syynä.
|
Toukkien kasvatus ja ruokinta
|
13.
|
Sammakonpoikasia ruokitaan esimerkiksi kaupallisesti saatavalla, validointitutkimuksissa käytetyllä sammakonpoikasten ravinnolla koko esialtistusvaiheen ajan (Nieuwkoopin ja Faberin (NF) vaiheen 45/46 (8)) jälkeen) ja koko 21 päivän mittaisen testausvaiheen ajan. Myös muuta ravintoa voidaan käyttää, kunhan on osoitettu, että AMA-tutkimuksen suorituskyky pysyy sen avulla yhtä hyvänä. Ravinnon annostelua esialtistusvaiheen aikana on mukautettava huolellisesti, jotta se täyttää kehittyvien sammakonpoikasten tarpeet. Toisin sanoen hiljattain kehittyneille sammakonpoikasille on annettava pieniä annoksia ravintoa useita kertoja päivässä (ainakin kahdesti). On vältettävä antamasta ravintoa liikaa, jotta i) veden laatu pysyy hyvänä ja ii) jotta ruokahiukkaset ja jätökset eivät tuki suodattimia. Validointitutkimuksissa käytetyn sammakonpoikasten ravinnon osalta päivittäisiä ruoka-annoksia tulee suurentaa sammakonpoikasten kasvaessa siten, että annos on 30 mg/eläin/päivä hieman ennen tutkimuksen aloittamista. Validointitutkimuksissa tämän kaupallisesti saatavilla olevan ravinnon on osoitettu tukevan X. laevis -lajin sammakonpoikasten kasvua ja kehitystä asianmukaisesti. Kyseessä on hienojakoinen aines, joka pysyy suspendoituneena vesipatsaassa pitkän aikaa, ja se huuhtoutuu pois vedenvirtauksen mukana. Siksi ravinnon päivittäinen kokonaismäärä on jaettava pienempiin annoksiin, ja ne on annettava eläimille vähintään kahdesti päivässä. Tämän ravinnon annosteluohje on taulukossa 1. Ruokintakerrat on merkittävä muistiin. Ravinto voidaan antaa kuivana tai laimennusvedestä valmistettuna varastoliuoksena. Tuoretta varastoliuosta on valmistettava joka päivä, ja sitä on säilytettävä 4 °C:ssa, kun sitä ei käytetä.
Taulukko 1.
X. laevis -lajin sammakonpoikasia koskevissa validointitutkimuksissa käytetyn kaupallisesti saatavan sammakonpoikasten ruoan annosteluohje, AMA-tutkimuksen elossa-osuus, läpivirtausolosuhteet
|
Tutkimuspäivä
|
Ruoka-annos (mg ruokaa eläintä kohti päivässä)
|
|
0–4
|
30
|
|
5–7
|
40
|
|
8–10
|
50
|
|
11–14
|
70
|
|
15–21
|
80
|
|
Analyyttinen kemia
|
14.
|
Ennen tutkimuksen tekemistä testikemikaalin stabiilius on arvioitava sen liukoisuudesta, hajoavuudesta ja haihtuvuudesta saatavilla olevien tietojen perusteella. Jokaisesta rinnakkaistestisäiliön testausliuoksesta ja jokaisesta pitoisuudesta on otettava näyte analyyttisen kemian analyyseja varten testin alkaessa (päivänä 0), ja testin aikana on otettava vähintään neljä näytettä viikoittain. On myös suositeltavaa, että jokainen testipitoisuus analysoidaan järjestelmän valmistelun aikana ennen testin aloittamista järjestelmän tehokkuuden varmentamiseksi. Lisäksi varastoliuokset on suositeltavaa analysoida, kun ne vaihdetaan, etenkin jos varastoliuoksen tilavuudessa ei ole tavanomaisten näytteenottojaksojen ajaksi riittäviä määriä kemikaalia. Sellaisten kemikaalien yhteydessä, joita ei voida havaita joissakin tai kaikissa testissä käytetyissä pitoisuuksissa, varastoliuokset on mitattava ja järjestelmän virtausnopeudet kirjattava muistiin, jotta nimellispitoisuudet voidaan laskea.
|
Kemikaalin annostelujärjestelmä
|
15.
|
Menetelmä, jolla testikemikaali annostellaan järjestelmään, voi vaihdella kemikaalin fysikaalis-kemiallisten ominaisuuksien mukaan. Vesiliukoiset kemikaalit voidaan liuottaa testausveden alikvootteihin sellaisena pitoisuutena, jolla saadaan aikaiseksi testin tavoitepitoisuus läpivirtausjärjestelmässä. Kemikaalit, jotka ovat nestemäisiä huonelämpötilassa ja jotka liukenevat heikosti veteen, voidaan annostella käyttämällä neste-nestekyllästinmenetelmiä. Kemikaalit, jotka ovat kiinteitä huonelämpötilassa ja jotka liukenevat heikosti veteen, voidaan annostella käyttämällä lasivillaisia kyllästinkolonneja. Ensisijaisesti tulee käyttää kantoaineetonta testausjärjestelmää. Eri testikemikaaleilla on kuitenkin erilaisia fysikaalis-kemiallisia ominaisuuksia, jotka todennäköisesti edellyttävät eri toimintatapoja kemikaalialtistusveden valmistamiselle. Liuottimia ja kantoaineita on syytä välttää seuraavista syistä: i) tietyt liuokset voivat olla myrkyllisiä ja/tai aiheuttaa ei-toivottuja tai odottamattomia hormonijärjestelmän reaktioita, ii) kemikaalien testaaminen niiden vesiliukoisuuden yläpuolella (kuten voi usein käydä liuottimia käytettäessä) voi johtaa siihen, että vaikuttavat pitoisuudet määritetään epätarkasti ja iii) liuottimien käyttö pidempiaikaisissa testeissä voi aiheuttaa huomattavaa biokalvojen muodostumista, joka liittyy mikrobien toimintaan. Vaikeasti testattavien testikemikaalien yhteydessä liuotinta voidaan käyttää viimesijaisena keinona, ja tällöin paras menetelmä on määritettävä OECD:n ohjeasiakirjan ’OECD Guidance Document on aquatic toxicity testing of difficult substances and mixtures’ perusteella. Liuottimen valinta määräytyy kemikaalin kemiallisten ominaisuuksien perusteella. Sellaisia liuottimia, joiden on todettu olevan tehokkaita vesieliöihin kohdistuvaa myrkyllisyyttä testattaessa, ovat asetoni, etanoli, metanoli, dimetyyliformamidi ja trietyleeniglykoli. Jos kantoaineena käytetään liuotinta, liuotinpitoisuuksien on oltava pienempiä kuin pitoisuus, joka ei aiheuta havaittavaa vaikutusta (NOEC). OECD:n ohjeasiakirjassa suositeltu enimmäispitoisuus on 100 μl/l, ja hiljattain tehdyssä tarkistuksessa käytettäväksi suositellaan pitoisuutta, joka on 20 μl/l laimennusvedestä (12). Jos kantoaineina käytetään liuottimia, myös asianmukaiset liuotinkontrollit (puhdas vesi) on arvioitava muiden kuin liuotinkontrollien lisäksi. Jos kemikaalia ei voi annostella veden kautta joko fysikaalis-kemiallisten ominaisuuksien (heikon liukenevuuden) vuoksi tai siksi, että kemikaalin saatavuus on rajallista, sen annostelua ravinnon kautta voidaan harkita. Ravintoaltistusten parissa on tehty alustavia tutkimuksia, mutta tätä altistusreittiä ei yleensä käytetä. Menetelmän valinta on dokumentoitava ja vahvistettava analyyttisesti.
|
Testipitoisuuksien valinta
Suuren testipitoisuuden määrittäminen
|
16.
|
Tämän testin tarkoituksia varten suurimmaksi testipitoisuudeksi on asetettava testikemikaalin liukoisuusraja; suurin siedetty pitoisuus (MTC) välittömästi myrkyllisten kemikaalien osalta; tai 100 mg/l sen mukaan, mikä arvo on pienin.
|
|
17.
|
MTC-arvo on kemikaalin suurin testauspitoisuus, jonka aiheuttama välitön kuolleisuus on alle 10 prosenttia. Tässä lähestymistavassa oletetaan, että välittömästä myrkyllisyydestä on käytettävissä empiirisiä tietoja, joiden perusteella MTC-arvo voidaan arvioida. MTC-arvon arviointi voi olla epätarkkaa, ja siinä tarvitaan yleensä asiantuntijan näkemystä. Vaikka regressiomallien käyttö voi olla teknisesti paras tapa arvioida MTC-arvo, olemassa olevista välitöntä myrkyllisyyttä koskevista tiedoista voidaan johtaa siitä käyttökelpoinen arvio käyttämällä kolmasosaa (1/3) välittömästä LC50-arvosta. Välitöntä myrkyllisyyttä koskevia tietoja ei kuitenkaan välttämättä ole saatavilla testattavasta lajista. Jos lajikohtaisia tietoja välittömästä myrkyllisyydestä ei ole saatavilla, voidaan tehdä 96 tunnin LC50-testi niillä sammakonpoikasilla, jotka ovat AMA-tutkimuksessa testattaviin sammakonpoikasiin nähden edustavia (eli samassa kehitysvaiheessa). Jos saatavilla on tietoja muista vesieliölajeista (ts. LC50-tutkimuksia, jotka on tehty kaloilla tai muilla sammakkolajeilla), voidaan haluttaessa käyttää myös asiantuntijan näkemystä, kun arvioidaan todennäköinen MTC-arvo lajienvälisen ekstrapolaation perusteella.
|
|
18.
|
Jos kemikaali ei ole välittömästi myrkyllinen ja jos sen liukoisuus on yli 100 mg/l, suurimpana testipitoisuutena tulee vaihtoehtoisesti pitää arvoa 100 mg/l, koska tätä pitoisuutta pidetään yleensä ’käytännössä myrkyttömänä’.
|
|
19.
|
Myös staattisia menetelmiä, joissa testiliuos ei vaihdu, voidaan käyttää – vaikka niiden käyttöä ei suositella –, jos läpivirtausmenetelmät ovat epätarkoituksenmukaiset MTC-arvon määrittämisessä. Jos käytetään staattisia menetelmiä, testikemikaalin pitoisuuden stabiilius on dokumentoitava, ja sen on pysyttävä vaadituissa rajoissa. Vaihtoväliksi suositellaan kahtakymmentäneljää tuntia. Yli 72 tunnin vaihtovälit eivät ole hyväksyttäviä. Lisäksi jokaisen vaihtovälin lopussa on mitattava veden laatua koskevat parametrit (ts. liuennut happi, lämpötila, pH jne.) välittömästi ennen vaihtoa.
|
Testipitoisuuden vaihteluväli
|
20.
|
Vähimmäisvaatimus on kolme testipitoisuutta ja puhdas vesi -kontrolli (ja kantaja-ainekontrolli, jos tarpeen). Suurimman ja pienimmän testipitoisuuden vähimmäiseron on oltava noin yksi suuruusluokka. Annoksen erottelussa enimmäisarvo on 0,1 ja vähimmäisarvo 0,33.
|
MENETTELY
Testin aloittaminen ja tekeminen
Päivä 0
|
21.
|
Altistus tulee aloittaa, kun riittävä määrä esialtistuksen varastopopulaation sammakonpoikasista on saavuttanut kehitysvaiheen 51 (Nieuwkoopin ja Faberin (8) mukaan) ja kun niiden ikä hedelmöittymisen jälkeen on jotakuinkin tai täsmälleen 17 päivää. Koe-eläimiksi valitaan varastopopulaatiosta terveitä ja normaalin näköisiä sammakonpoikasia. Ne on laitettava yhteen astiaan, joka sisältää asianmukaisen määrän laimennusvettä. Jotta kehitysvaihe voidaan määrittää, sammakonpoikaset on otettava yksitellen pois yhteissäiliöstä käyttämällä pientä haavia tai siivilää, ja ne on siirrettävä läpinäkyvään mittausastiaan (esimerkiksi 100 mm:n petrimaljaan), joka sisältää laimennusvettä. Kehitysvaiheen määrittämisessä ei suositella käyttämään nukutusta, mutta sammakonpoikaset voi nukuttaa yksitellen trikaiinimetaanisulfonaatilla (esimerkiksi MS-222:lla) (100 mg/l), joka on puskuroitu asianmukaisesti natriumbikarbonaatilla (pH 7,0) ennen käsittelyä. Jos koe-eläimet nukutetaan, asianmukainen menetelmä, jolla esimerkiksi MS-222:ta käytetään nukuttamiseen, on pyydettävä laboratorioista, joissa siitä on kokemusta, ja menetelmä on ilmoitettava testitulosten yhteydessä. Eläimiä on käsiteltävä tämän siirtymän aikana varovasti, jotta käsittelystä aiheutuu mahdollisimman vähän stressiä ja jotta kaikki mahdolliset vammat vältetetään.
|
|
22.
|
Eläinten kehitysvaihe määritetään käyttämällä kaksiokulaarista dissektiomikroskooppia. Jotta kehitysvaiheen vaihtelu voidaan pitää mahdollisimman pienenä, on tärkeää, että tämä määritys tehdään niin tarkasti kuin mahdollista. Nieuwkoopin ja Faberin (8) mukaan ensisijainen kehityksellinen tunnusmerkki, jonka perusteella vaiheessa 51 olevat organismit valitaan, on takajalan morfologia. Takajalkojen morfologiset ominaisuudet on tutkittava mikroskoopilla. Vaikka Nieuwkoopin ja Faberin (8) oppaan täydellisestä versiosta saa tarkat tiedot sammakonpoikasten kehitysvaiheista, vaiheen voi kuitenkin määrittää luotettavasti selvien morfologisten tunnusmerkkien perusteella. Seuraavassa taulukossa kehitysvaiheet on esitetty yksinkertaisesti ja vakioidusti, ja sitä voi käyttää koko tutkimuksen ajan, kun tavoitteena on tunnistaa eri kehitysvaiheisiin liittyvät selvät morfologiset tunnusmerkit, olettaen, että kehitys on normaalia.
Taulukko 2.
Nieuwkoopin ja Faberin ohjeisiin perustuvat selvät morfologiset kehitysvaiheiden tunnusmerkit.
|
Selvät morfologiset tunnusmerkit
|
Kehitysvaihe
|
|
51
|
52
|
53
|
54
|
55
|
56
|
57
|
58
|
59
|
60
|
61
|
62
|
63
|
64
|
65
|
66
|
|
Takajalka
|
X
|
X
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
|
|
|
Etujalka
|
|
|
|
|
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
Kraniofasiaalinen rakenne
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
|
|
Hajuhermon morfologia
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
|
|
|
|
Pyrstön pituus
|
|
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
23.
|
Testin alussa kaikkien sammakonpoikasten tulee olla vaiheessa 51. Selvin morfologinen tunnusmerkki tässä kehitysvaiheessa on takajalan morfologia, joka on esitetty kuvassa 1
Kuva 1.
X. laevis -lajin poikasen takajalan morfologia vaiheessa 51.

|
|
24.
|
Kehitysvaiheen valinnan lisäksi myös koe-eläinten kokoon perustuvaa valintaa voidaan käyttää. Tällöin on mitattava koko ruumiin pituus (ei siis pelkästään kuonon ja peräaukon välistä pituutta) päivänä 0 alaryhmästä, joka koostuu noin kahdestakymmenestä (Nieuwkoopin ja Faberin) vaiheessa 51 olevasta sammakonpoikasesta. Kun tämän ryhmän eläinten koko ruumiin keskimääräinen pituus on laskettu, voidaan asettaa koe-eläinten koko ruumiin vähimmäis- ja enimmäisrajat siten, että keskiarvon vaihteluväli saa olla ± 3 mm (keskiarvot vaiheessa 51 olevien sammakonpoikasten koko ruumiin pituudesta, joka vaihtelee välillä 24,0–28,1 mm). Kunkin koe-eläimen kypsyyden määrittämisessä ensisijainen parametri on kuitenkin kehitysvaihe. Sammakonpoikaset, joilla on selvästi näkyviä epämuodostumia tai vammoja, on suljettava pois tutkimuksesta.
|
|
25.
|
Edellä kuvatut kehitysvaihekriteerit täyttävät sammakonpoikaset pidetään puhdasta kasvatusvettä sisältävässä säiliössä siihen saakka, kunnes kehitysvaiheen määritys on tehty. Määrityksen jälkeen toukat jaetaan satunnaisesti altistuskäsittelysäiliöihin, kunnes jokaisessa säiliössä on 20 toukkaa. Sen jälkeen jokaisesta säiliöstä tarkastetaan, onko siellä eläimiä, joiden ulkonäkö on poikkeava (niillä on esimerkiksi vammoja tai niiden uintikäyttäytyminen on poikkeavaa). Selvästi sairailta näyttävät sammakonpoikaset on poistettava käsittelysäiliöistä, ja niiden tilalle on laitettava keruusäiliöstä valitut uudet toukat.
|
Havainnot
|
26.
|
Tarkempia tietoja testin päättämiseen liittyvistä menettelyistä ja sammakonpoikasten käsittelystä on OECD:n ohjeasiakirjassa ’Amphibian Thyroid Histology’ (9).
|
Päivänä 7 tehtävät mittaukset
|
27.
|
Päivänä 7 jokaisesta testisäiliöstä otetaan viisi satunnaisesti valittua sammakonpoikasta kustakin rinnakkaisnäytteestä. Tässä tulee käyttää sellaista satunnaistamismenetelmää, että jokaisella testin organismilla on yhtäläinen todennäköisyys tulla valituksi. Tämä voidaan saavuttaa käyttämällä mitä tahansa satunnaistamismenetelmää, mutta se edellyttää, että jokainen sammakonpoikanen otetaan haaviin. Ne sammakonpoikaset, joita ei valita, laitetaan takaisin säiliöön. Valitut sammakonpoikaset lopetetaan inhimillisesti liuoksessa, joka sisältää 150–200 mg/l esimerkiksi MS-222:ta; liuos on puskuroitava asianmukaisesti natriumbikarbonaatilla pH-arvon 7,0 saavuttamiseksi. Lopetetut sammakonpoikaset huuhdellaan vedellä ja kuivataan imeyttämällä vesi paperiin. Tämän jälkeen ne punnitaan lähimmän milligramman tarkkuudella. Jokaiselta sammakonpoikaselta määritetään takajalan pituus, kuonon ja peräaukon välinen pituus sekä kehitysvaihe (kaksiokulaarista dissektiomikroskooppia käyttäen).
|
Päivänä 21 tehtävät mittaukset (testin päätös)
|
28.
|
Testin päättyessä (päivänä 21) loput sammakonpoikaset otetaan pois testisäiliöistä ja lopetetaan inhimillisesti liuoksessa, joka sisältää 150–200 mg/l esimerkiksi MS-222:ta; liuos on puskuroitava asianmukaisesti natriumbikarbonaatilla edellä kuvatun mukaisesti. Sammakonpoikaset huuhdellaan vedellä ja kuivataan imeyttämällä vesi paperiin. Tämän jälkeen ne punnitaan lähimmän milligramman tarkkuudella. Jokaiselta sammakonpoikaselta määritetään kehitysvaihe sekä mitataan kuonon ja peräaukon välinen pituus ja takajalan pituus.
|
|
29.
|
Kaikki toukat laitetaan Davidsonin kiinnitysaineeseen 48–72 tunnin ajaksi joko kokonaisina näytteinä tai leikattuina pääkudosnäytteinä, jotka sisältävät alaleuan histologisia arviointeja varten. Histopatologiaa varten jokaisesta rinnakkaisnäytesäiliöstä on kerättävä yhteensä viisi sammakonpoikasta näytteeksi. Koska follikkelisolun korkeus määräytyy kehitysvaiheen mukaan (10), tarkoituksenmukaisin tapa ottaa näytteet histologisia analyyseja varten on käyttää sellaisia yksilöitä, joiden kehitysvaihe on sopiva, jos mahdollista. Kehitysvaiheeltaan sopivien yksilöiden valitsemiseksi kaikkien toukkien kehitysvaihe on määritettävä ennen valintaa, ja sen jälkeen ne on käsiteltävä tiedonkeruuta ja säilöntää varten. Tämä on tarpeen, koska kehitykseen kuuluvan normaalien poikkeamien vuoksi kehitysvaiheet jakautuvat eri tavoin kussakin rinnakkaisnäytesäiliössä.
|
|
30.
|
Histopatologisiin analyyseihin valittujen eläinten (n = 5 kustakin rinnakkaisnäytteestä) tulee vastata kontrollien (yhdistetyt rinnakkaisnäytteet) kehitysvaiheiden mediaania, jos mahdollista. Jos rinnakkaisnäytesäiliöissä on enemmän kuin viisi sopivassa kehitysvaiheessa olevaa toukkaa, valitaan viisi toukkaa satunnaisotannalla.
|
|
31.
|
Jos rinnakkaisnäytesäiliöissä on vähemmän kuin viisi sopivassa kehitysvaiheessa olevaa toukkaa, näytteeksi otetaan satunnaisesti valittuja yksilöitä edellisestä tai seuraavasta kehitysvaiheesta, jotta näytteen koko olisi viisi toukkaa jokaisesta rinnakkaisnäytteestä. Päätös ottaa lisää toukkia joko edellisestä tai seuraavasta kehitysvaiheesta on tehtävä sen perusteella, miten kehitysvaiheiden arvioidaan kokonaisuudessaan jakautuvan kontrolliryhmissä ja kemikaalikäsittelyryhmissä. Toisin sanoen jos kemikaalikäsittely aiheuttaa kehityksen hidastumista, muut toukat on otettava edellisestä kehitysvaiheesta. Jos kemikaalikäsittely taas aiheuttaa kehityksen nopeutumista, muut toukat on otettava seuraavasta kehitysvaiheesta.
|
|
32.
|
Jos sammakonpoikasen kehityksessä on vakavia muutoksia, jotka johtuvat testikemikaalilla käsittelystä, vaiheen jakautuminen kemikaalikäsittelyryhmissä ei välttämättä limity kontrolliryhmien kehitysvaiheen laskettuun mediaaniin. Vain näissä tapauksissa valintamenettelyä on muutettava siten, että käytetään muuta vaihetta kuin kontrolliryhmän mediaanivaihetta, jotta kilpirauhasen histopatologiaa varten saadaan näytteeksi toukkia, joiden kehitysvaihe on sopiva. Lisäksi jos vaiheet ovat määrittämättömiä (esimerkiksi epäsynkronisia), jokaisesta rinnakkaisnäytteestä tulee valita satunnaisesti viisi sammakonpoikasta histologista analyysia varten. Jos näytteeksi valitaan toukkia, joiden kehitysvaihe ei vastaa kontrolliryhmän mediaanikehitysvaihetta, syy on ilmoitettava.
|
Biologisten ominaisuuksien määrittäminen
|
33.
|
Kahdenkymmenenyhden päivän mittaisen altistusvaiheen aikana ensisijaiset ominaisuudet mitataan päivinä 7 ja 21, mutta koe-eläimiä tulee silti havainnoida päivittäin. Taulukossa 3 on yhteenveto mitattavista ominaisuuksista ja vastaavista havainnointiajankohdista. Tarkempia tietoja apikaalisten ominaisuuksien mittaamisen ja histologisten arviointien teknisistä menetelmistä on OECD:n ohjeasiakirjoissa (9).
Taulukko 3.
AMA-tutkimuksen ensisijaisten ominaisuuksien havainnointiajankohdat
|
Apikaaliset ominaisuudet
|
Päivittäin
|
Päivä 7
|
Päivä 21
|
|
|
ߦ
|
|
|
|
|
|
ߦ
|
ߦ
|
|
|
|
ߦ
|
ߦ
|
|
—
|
kuonon ja peräaukon välinen pituus
|
|
|
ߦ
|
ߦ
|
|
|
|
ߦ
|
ߦ
|
|
—
|
kilpirauhasen histologia
|
|
|
|
ߦ
|
|
Apikaaliset ominaisuudet
|
34.
|
AMA-tutkimuksen apikaalisia ominaisuuksia ovat kehitysvaihe, takajalan pituus, kuonon ja peräaukon välinen pituus sekä märkäpaino, ja ne kuvataan lyhyesti jäljempänä. Lisää teknistä tietoa näiden tietojen keräämisestä on viiteohjeasiakirjoissa, mukaan luettuina käytettäväksi suositellut tietokoneavusteiset analyysimenetelmät.
|
Kehitysvaihe
|
35.
|
X. laevis -lajin sammakonpoikasten kehitysvaihe määritetään Nieuwkoopin ja Faberin (8) laatimien kriteerien perusteella. Kehitysvaihetietojen perusteella määritetään se, onko kehitys nopeutunutta, epäsynkronista, viivästynyttä vai normaalia. Kehityksen nopeutuminen tai viivästyminen määritetään vertailemalla kontrolli- ja käsittelyryhmissä saavutettua mediaanivaihetta. Kehitys määritetään epäsynkroniseksi, kun tutkitut kudokset eivät ole epämuodostuneita tai poikkeavia, vaan kun morfogeneesin suhteellinen ajoittuminen tai eri kudosten kehittyminen yksittäisellä sammakonpojalla on häiriintynyt.
|
Takajalan pituus
|
36.
|
Kilpirauhashormonit säätelevät takajalkojen eriytymistä ja kasvua, jotka ovat keskeisiä kehitysvaiheen määrittämisessä käytettyjä kehityksen tunnusmerkkejä. Kehitysvaiheen määrittämisessä takajalan kehittymistä arvioidaan laadullisesti, mutta tässä tutkimuksessa sitä tarkastellaan määrällisenä ominaisuutena. Siksi takajalan pituus mitataan ominaisuutena, jonka perusteella voidaan havaita kilpirauhasakseliin kohdistuvia vaikutuksia (kuva 2). Yhtenäisyyden vuoksi takajalan pituus mitataan vasemmasta takajalasta. Takajalan pituus arvioidaan testissä sekä päivänä 7 että päivänä 21. Päivänä 7 takajalan pituuden mittaaminen on helppoa, kuten kuvasta 2 näkyy. Päivänä 21 takajalan pituuden mittaaminen on kuitenkin hankalampaa jalassa olevien taipeiden vuoksi. Sen vuoksi takajalan pituuden mittaaminen päivänä 21 on aloitettava siitä kohdasta, jossa jalka yhtyy muuhun ruumiiseen, ja pituus on mitattava jalan keskiviivaa pitkin kaikkien kulmapoikkeamien läpi. Mahdollisen kilpirauhaseen kohdistuvan vaikutuksen kannalta takajalan pituudessa päivänä 7 havaittuja muutoksia pidetään merkittävinä, vaikka niitä ei ilmenisi enää päivänä 21. Pituuden mittaukset tehdään digitaalisista valokuvista käyttämällä kuvan analysointiohjelmaa, kuten OECD:n ohjeasiakirjassa ’Amphibian Thyroid Histology’ (9) on kuvattu.
|
Ruumiin pituus ja märkäpaino
|
37.
|
Kuonon ja peräaukon välisen pituuden (kuva 2) ja märkäpainon määrittämiset sisältyvät testiprotokollaan, jotta voidaan arvioida testikemikaalien mahdollisia vaikutuksia sammakonpoikasten kasvunopeuteen kontrolliryhmään verrattuna. Nämä tiedot ovat hyödyllisiä myös testikemikaalin yleisen myrkyllisyyden havaitsemisessa. Koska ylimääräisen veden poistaminen ennen painon määrittämistä voi aiheuttaa sammakonpoikasille stressiä ja ihovaurioita, nämä mittaukset tehdään päivänä 7 alaryhmään valituille sammakonpoikasille ja kaikille muille sammakonpoikasille testin päättyessä (päivänä 21). Käytä mittauksen pyrstönpuoleisena rajana peräaukon kallonpuoleista reunaa yhtenäisyyden vuoksi.
|
|
38.
|
Kuonon ja peräaukon välistä pituutta käytetään arvioitaessa sammakonpoikasen kasvua, kuten kuvassa 2 on näytetty.
Kuva 2.
A) Ruumiin pituuden mittausten tyypit ja B) X. laevis -lajin sammakonpoikasten takajalan pituuden mittaukset (1).

|
Kilpirauhasen histologia
|
39.
|
Vaikka kehitysvaihe ja takajalan pituus ovat tärkeitä ominaisuuksia, kun arvioidaan altistukseen liittyviä muutoksia muodonvaihdoksen kehittymisessä, kehityksen viivästymistä ei sinänsä voida pitää diagnostisena indikaattorina kilpirauhasen toimintaa hillitsevästä vaikutuksesta. Jotkin muutokset saattavat olla havaittavissa vain tavanomaisessa histopatologisessa analyysissa. Diagnostisia kriteerejä ovat kilpirauhasen hypertrofia/atrofia, follikkelisolun hypertrofia ja follikkelisolun hyperplasia. Muita laadullisia kriteerejä ovat lisäksi follikkelin ontelon alue, kolloidin laatu ja follikkelisolun korkeus/muoto. Vaikeusaste (neljä luokkaa) on ilmoitettava. Tietoja näytteiden ottamisesta ja käsittelemisestä histologista analyysia varten ja histologisten analyysien tekemisestä kudosnäytteistä on saatavana sammakkoeläinten muodonvaihdostutkimusta koskevassa julkaisussa ’Amphibian Metamorphosis Assay: Part 1 – Technical guidance for morphologic sampling and histological preparation’ ja ’Amphibian Metamorphosis Assay: Part 2 – Approach to reading studies, diagnostic criteria, severity grading and atlas’ (9). Niiden laboratorioiden, jotka tekevät tämän tutkimuksen ensimmäistä kertaa (ensimmäisiä kertoja), on kysyttävä koulutusmielessä neuvoa kokeneilta patologeilta ennen histologisen analyysin aloittamista ja kilpirauhasen arvioimista. Kehityksen nopeutumiseen tai epäsynkroniaan viittaavat selvät ja huomattavat muutokset apikaalisissa ominaisuuksissa saattavat tehdä kilpirauhasten histopatologisen analyysin tekemisestä tarpeetonta. Vaikka selviä morfologisia muutoksia tai näyttöä kehityksen viivästymisestä ei ole, histologiset analyysit on kuitenkin tehtävä.
|
Kuolleisuus
|
40.
|
Kaikki testisäiliöt on tarkastettava päivittäin kuolleiden sammakonpoikasten varalta, ja kuolleiden määrä on kirjattava muistiin jokaisesta säiliöstä. Kaikista kuolleisuuteen liittyvistä havainnoista on kirjattava päivämäärä, pitoisuus ja säiliön numero. Kuolleet eläimet on poistettava testisäiliöstä heti, kun ne havaitaan. Jos kuolleisuus on yli 10 prosenttia, se saattaa olla merkki epätarkoituksenmukaisista testiolosuhteista tai testikemikaalin myrkyllisistä vaikutuksista.
|
Muut havainnot
|
41.
|
Poikkeava käyttäytyminen sekä selvästi nähtävät epämuodostumat ja leesiot on merkittävä muistiin. Kaikista poikkeavaan käyttäytymiseen sekä selviin epämuodostumiin tai leesioihin liittyvistä havainnoista on kirjattava päivämäärä, pitoisuus ja säiliön numero. Vesikolonnissa olevien sammakonpoikasten käyttäytyminen on normaalia, kun i) niiden pyrstö on päätä korkeammalla, ii) niiden peräevän liike on säännöllisen rytmikästä, iii) ne tulevat ajoittain pintaan, iv) niiden kiduskannet toimivat ja v) ne reagoivat ärsykkeisiin. Epänormaalia käyttäytymistä on esimerkiksi pinnalla kelluminen, säiliön pohjassa makaaminen, käänteinen tai epäsäännöllinen uiminen, pintatoiminnan puuttuminen ja ärsykkeisiin reagoimattomuus. Lisäksi selvät eron ravinnon kulutuksessa käsittelyjen välillä on merkittävä muistiin. Selviä epämuodostumia ja leesioita voivat olla esimerkiksi morfologiset poikkeamat (esimerkiksi raajojen epämuodostumat), verta vuotavat leesiot sekä bakteeri- tai sieni-infektiot. Nämä määritykset ovat laadullisia, ja ne on rinnastettava sairaudesta/stressistä kertoviin kliinisiin merkkeihin kontrollieläimiin vertaamalla. Jos näitä merkkejä esiintyy altistussäiliöissä enemmän tai nopeammin kuin kontrollisäiliöissä, niitä on pidettävä osoituksena selvästä myrkyllisyydestä.
|
TIEDOT JA RAPORTOINTI
Tiedonkeruu
|
42.
|
Kaikki tiedot on kerättävä käyttäen elektronisia tai manuaalisia järjestelmiä, jotka ovat hyvää laboratoriokäytäntöä koskevien periaatteiden mukaisia. Tutkimustietojen tulee sisältää seuraavat seikat:
|
|
Testikemikaali:
|
—
|
Testikemikaalin luonnehdinta: fysikaalis-kemialliset ominaisuudet, tiedot stabiiliudesta ja biohajoavuudesta.
|
|
—
|
Kemialliset tiedot ja aineisto: laimennusten valmistelun menetelmä ja taajuus. Testikemikaalin tietoihin tulee sisältyä testikemikaalin varsinainen ja nimellinen pitoisuus ja joissakin tapauksissa tarvittaessa muu kuin lähtöaine. Testikemikaalimittaukset voi olla tarpeen tehdä niin varastoliuoksista kuin testiliuoksistakin.
|
|
—
|
Liuotin (jos se on muu kuin vesi): liuottimen valinnan perustelu ja liuottimen luonnehdinta (tyyppi, käytetty pitoisuus).
|
|
|
|
Testiolosuhteet:
|
—
|
Operatiiviset tiedot: havainnot, jotka liittyvät testijärjestelmän toimintaan sekä tukevaan ympäristöön ja infrastruktuuriin. Tyypillisiä tietoja ovat seuraavat: ympäristön lämpötila, testilämpötila, valoisa aika, altistusjärjestelmän kriittisten osien (kuten pumppujen, jaksolaskureiden, painemittareiden) tila, virtausnopeudet, vesimäärät, varastopullojen vaihdot ja ruokintatiedot. Yleisiä veden laadun parametreja ovat esimerkiksi pH, liuenneen hapen pitoisuus, johtavuus, kokonaisjodipitoisuus, emäksisyys ja kovuus.
|
|
—
|
Poikkeamiset testimenetelmästä: näiden tietojen tulee sisältää kaikki tiedot tai sanalliset kuvaukset testimenetelmästä poikkeamisista.
|
|
|
|
Tulokset:
|
—
|
Biologiset havainnot ja tiedot: näihin tietoihin tulee sisältyä havainnot kuolleisuudesta, ravinnon kulutuksesta, epänormaalista uintikäyttäytymisestä, letargiasta, tasapainon menetyksestä, epämuodostumista, leesioista jne. Ennalta määritetyin väliajoin tehtäviä havaintoja ja kerättäviä tietoja ovat kehitysvaihe, takajalan pituus, kuonon ja peräaukon välinen pituus sekä märkäpaino.
|
|
—
|
Tilastolliset analyysitekniikat ja käytettyjen tekniikoiden perustelut; tilastollisten analyysien tulokset mieluiten taulukkomuodossa.
|
|
—
|
Histologiset tiedot: näiden tietojen tulee sisältää sanalliset kuvaukset sekä tiettyjen havaintojen vakavuus ja ilmenevyys pisteytettynä, kuten histopatologiaa koskevassa ohjeasiakirjassa on eritelty.
|
|
—
|
Ad hoc -havainnot: näiden havaintojen tulee sisältää tutkimukseen liittyvät sanalliset kuvaukset, jotka eivät sovi edellä kuvattuihin kategorioihin.
|
|
|
Tietojen toimittaminen
|
43.
|
Lisäys 2 sisältää päivittäistä tietojenkeruuta varten tarkoitetut lomakkeet, joita voidaan käyttää raakatietojen syöttämiseen ja yhteenvetotilastojen laskemiseen. Lisäksi käytettävissä ovat raportointitaulukot, joiden avulla voi kätevästi ilmoittaa ominaisuuksia koskevien tietojen yhteenvedot. Histologisten arviointien raportointitaulukot ovat myös lisäyksessä 2.
|
Suorituskykyvaatimukset ja testin hyväksyttävyys/validiteetti
|
44.
|
Selvät poikkeamat testimenetelmästä johtavat yleensä siihen, että tutkimuksesta saatuja tietoja ei voida hyväksyä tulkittaviksi tai raportoitaviksi. Seuraavat, taulukossa 4 esitetyt kriteerit on sen vuoksi laadittu ohjeeksi toteutetun testin laadun ja kontrolliorganismien suorituskyvyn määrittämiseen.
Taulukko 4.
AMA-tutkimuksen suorituskykyvaatimukset
|
Arviointiperuste
|
Hyväksyttävät rajat
|
|
Testipitoisuudet
|
Pitoisuudet pysyneet ≤ 20 prosentin sisällä variaatiokertoimesta (mitatun testipitoisuuden vaihtelevuus) 21 päivän testin aikana
|
|
Kontrollien kuolleisuus
|
≤10 % – kuolleisuus missä tahansa kontrollien rinnakkaisnäytteessä saa olla enintään kaksi sammakonpoikasta
|
|
Kontrollien mediaani vähimmäiskehitysvaihe testin lopussa
|
57
|
|
Kehitysvaiheen jakauma kontrolliryhmässä
|
Kehitysvaiheen jakauman 10. ja 90. persentiilin välinen ero saa olla enintään neljä vaihetta
|
|
Liuennut happi
|
≥ 40 % ilman kyllästysarvosta (23)
|
|
pH
|
pH-arvon on pysyttävä välillä 6,5–8,5. Rinnakkaisnäytteiden/käsittelyjen välinen ero saa olla enintään 0,5.
|
|
Veden lämpötila
|
22° ± 1 °C – rinnakkaisnäytteiden/käsittelyjen välinen ero saa olla enintään 0,5 °C
|
|
Testipitoisuudet, joihin ei liity selvää myrkyllisyyttä
|
≥ 2
|
|
Rinnakkaisnäytteiden suorituskyky
|
≤ 2 rinnakkaisnäytettä testin aikana saa heikentyä
|
|
Liuottimen käytön edellytykset
|
Jos kantoaineena käytetään liuotinta, on käytettävä sekä liuotinkontrollia että puhdasvesikontrollia, ja tulokset on ilmoitettava.
|
|
Tilastollisesti merkitsevät erot liuotinkontrolli- ja vesikontrolliryhmien välillä käsitellään erikseen. Ks. lisätiedot jäljempänä.
|
|
Staattista menetelmää (jossa liuos ei vaihdu) koskevat edellytykset
|
Edustavat kemialliset analyysit ennen vaihtoa ja sen jälkeen on raportoitava.
|
|
Ammoniakkipitoisuudet tulee mitata juuri ennen vaihtoa.
|
|
Kaikki lisäyksessä 1 olevassa taulukossa 1 luetellut veden laatuparametrit on mitattava juuri ennen vaihtoa.
|
|
Vaihtoväli saa olla enintään 72 tuntia.
|
|
Asianmukainen ruokinta-aikataulu (50 prosenttia kaupallisen sammakonpoikasten ruoan päivittäisestä ruoka-annoksesta)
|
|
Testin pätevyys
|
45.
|
Jotta testi olisi hyväksyttävä/validi, seuraavien vaatimusten on täytyttävä:
|
|
Validi koe testissä, jonka on tarkoitus olla negatiivinen kilpirauhasen toiminnan osalta:
|
(1)
|
Kuolleisuus ei saa ylittää kymmentä prosenttia yhdessäkään käsittelyssä (mukaan luettuina kontrollit). Kuolleisuus ei saa olla enempää kuin kolme sammakonpoikasta yhdessäkään rinnakkaisnäytteessä. Muutoin rinnakkaisnäytettä on pidettävä vaarantuneena.
|
|
(2)
|
Analyysia varten saatavilla on oltava vähintään kaksi käsittelypitoisuutta ja kaikki neljä vaarantumatonta rinnakkaisnäytettä.
|
|
(3)
|
Analyysia varten saatavilla on oltava vähintään kaksi käsittelypitoisuutta, joissa ei ole merkkejä selvästä myrkyllisyydestä.
|
|
|
|
Validi koe testissä, jonka on tarkoitus olla positiivinen kilpirauhaseen kohdistuvan vaikutuksen osalta:
|
(1)
|
Kontrolliryhmässä kuolleisuus saa olla enintään kaksi sammakonpoikasta/rinnakkaisnäyte.
|
|
|
AMA-tutkimuksen päätöksentekologiikka
|
46.
|
AMA-tutkimusta varten laadittiin päätöksentekologiikka, jonka tarkoituksena on antaa loogista apua biologisen testin tekemisessä ja sen tulosten tulkinnassa (ks. kuvassa 3 oleva vuokaavio). Päätöksentekologiikassa painotetaan ominaisuuksia seuraavasti: edistynyttä kehitystä, epäsynkronista kehitystä ja kilpirauhasen histopatologiaa painotetaan voimakkaasti, kun taas viivästynyttä kehitystä, kuonon ja peräaukon välistä pituutta ja märkäpainoa (parametreja, joihin yleinen myrkyllisyys saattaa vaikuttaa) painotetaan vastaavasti vähemmän.
Kuva 3.
AMA-tutkimuksen päätöksentekologiikka
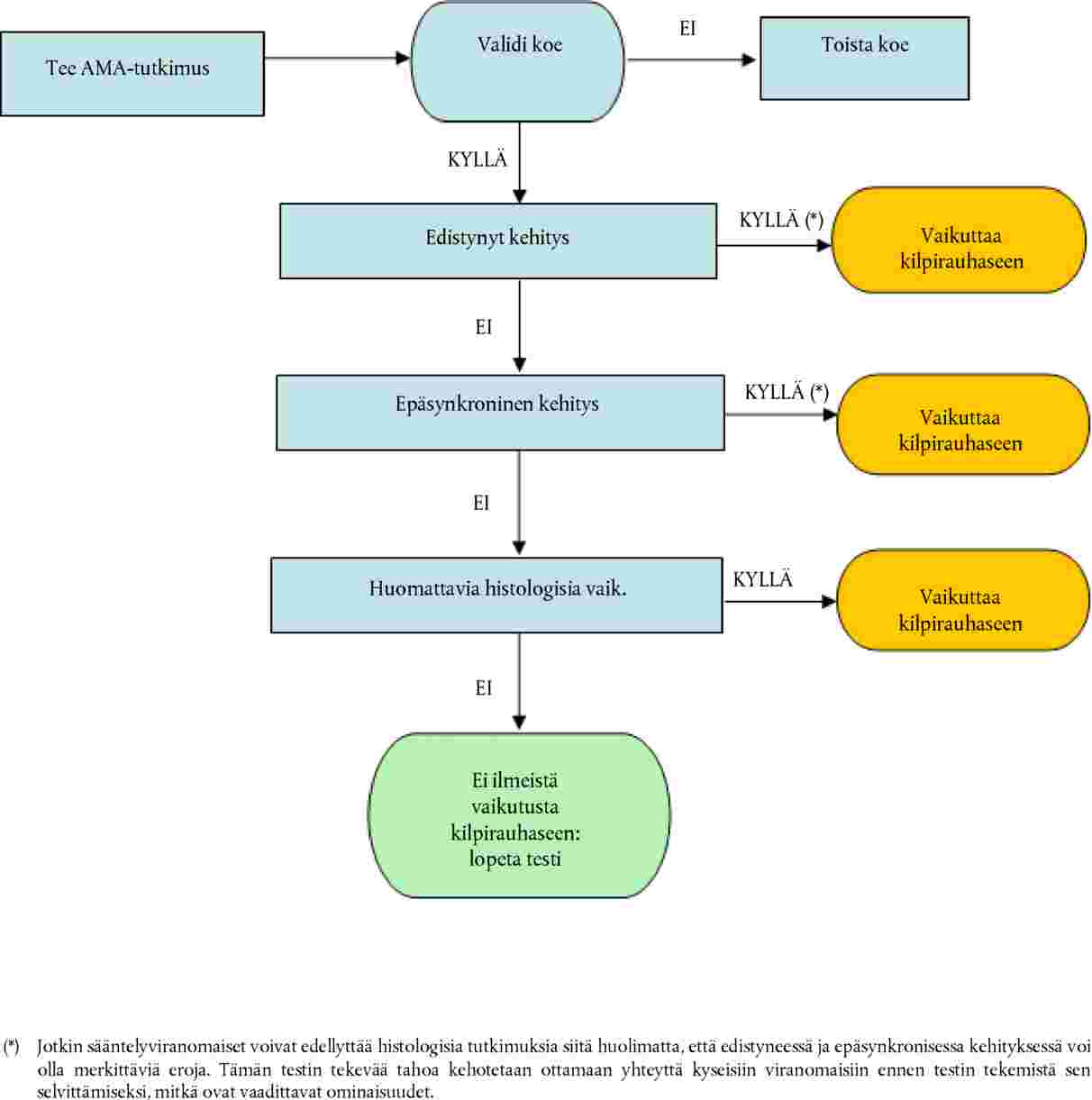
|
Edistynyt kehitys (määritetty kehitysvaiheen, kuonon ja peräaukon välisen pituuden sekä takajalan pituuden perusteella)
|
47.
|
Edistyneen kehityksen tiedetään ilmenevän vain kilpirauhashormoniin liittyvien vaikutusten kautta. Nämä voivat olla perifeerisiin kudoksiin kohdistuvia vaikutuksia, kuten suora vuorovaikutus kilpirauhashormonin reseptorin (kuten T4:n) kanssa, tai vaikutuksia, jotka muuttavat verenkierrossa olevia kilpirauhashormonipitoisuuksia. Kummassakin tapauksessa vaikutuksia pidetään riittävänä osoituksena siitä, että kemikaali vaikuttaa kilpirauhaseen. Edistynyttä kehitystä arvioidaan jommallakummalla seuraavasta kahdesta tavasta, Ensinnäkin yleistä kehitysvaihetta voidaan arvioida käyttämällä Nieuwkoopin ja Faberin (8) oppaassa tarkemmin kuvattua vakiolähestymistapaa. Toiseksi tiettyjä morfologisia piirteitä voidaan kvantifioida, kuten takajalan pituutta päivinä 7 ja 21, sillä se liittyy positiivisesti kilpirauhashormonireseptoriin kohdistuviin agonistisiin vaikutuksiin. Jos edistynyt kehitys tai takajalan pituus on tilastollisesti merkitsevää, testi osoittaa, että kemikaali vaikuttaa kilpirauhaseen.
|
|
48.
|
Koe-eläinten arviointi nopeutuneen kehityksen kannalta suhteessa kontrollipopulaatioon perustuu seuraavasta neljästä ominaisuudesta tehtävien tilastollisten analyysien tuloksiin:
|
—
|
takajalan pituus (kuonon ja peräaukon välisellä pituudella normalisoituna) tutkimuspäivänä 7
|
|
—
|
takajalan pituus (kuonon ja peräaukon välisellä pituudella normalisoituna) tutkimuspäivänä 21
|
|
—
|
kehitysvaihe tutkimuspäivänä 7
|
|
—
|
kehitysvaihe tutkimuspäivänä 21.
|
|
|
49.
|
Takajalan pituutta koskevat tilastolliset analyysit on tehtävä vasemman takajalan pituutta koskevien mittausten perusteella. Takajalan pituus normalisoidaan laskemalla kunkin yksilön takajalan pituuden sekä kuonon ja peräaukon välisen pituuden suhde. Sen jälkeen vertaillaan kunkin käsittelytason normalisoitujen arvojen keskiarvoa. Kehitystä pidetään nopeutuneena, jos keskimääräinen takajalan pituus (normalisoituna) jossakin kemikaalikäsittelyryhmässä on merkittävästi suurempi kontrolliryhmään verrattuna tutkimuspäivänä 7 ja/tai tutkimuspäivänä 21 (ks. lisäys 3).
|
|
50.
|
Kehitysvaiheen tilastolliset analyysit on tehtävä Nieuwkoopin ja Faberin (8) kuvaamien morfologisten kriteerien mukaisesti määritettyjen kehitysvaiheiden perusteella. Kehitystä pidetään nopeutuneena, jos monien dikotomisten tietojen analyysissa havaitaan, että kehitysvaihetta koskevat arvot jossakin kemikaalikäsittelyryhmässä ovat huomattavasti suuremmat kontrolliryhmään verrattuna tutkimuspäivänä 7 ja/tai tutkimuspäivänä 21.
|
|
51.
|
AMA-testimenetelmässä mihin tahansa edellä mainittuun neljään ominaisuuteen kohdistuvaa merkitsevää vaikutusta pidetään riittävänä, jotta kehitystä voidaan pitää nopeutuneena. Toisin sanoen merkitseviä vaikutuksia takajalan pituuteen tietyssä aikapisteessä ei tarvitse vahvistaa merkitsevillä vaikutuksilla takajalan pituuteen jossakin toisessa aikapisteessä eikä merkitsevillä vaikutuksilla kehitysvaiheeseen tässä nimenomaisessa aikapisteessä. Vastaavasti merkitseviä vaikutuksia kehitysvaiheeseen tietyssä aikapisteessä ei tarvitse vahvistaa merkitsevillä vaikutuksilla kehitysvaiheeseen jossakin toisessa aikapisteessä eikä merkitsevillä vaikutuksilla takajalan pituuteen tässä nimenomaisessa aikapisteessä. Nopeutunutta kehitystä koskevan näytön painoarvo kuitenkin lisääntyy, jos merkittäviä vaikutuksia havaitaan useamman kuin yhden ominaisuuden yhteydessä.
|
Epäsynkroninen kehitys (määritetty kehitysvaihekriteerien perusteella)
|
52.
|
Epäsynkronista kehitystä kuvaa morfogeneesin suhteellisen ajoittumisen tai yhden sammakonpoikasen eri kudosten kehittymisen häiriintyminen. Vaikeus määrittää organismin kehitysvaihetta selvästi käyttämällä morfologisia ominaisuuksia, joita pidetään tietylle kehitysvaiheelle tyypillisinä, osoittaa, että kudokset kehittyvät muodonvaihdoksen kautta epäsynkronisesti. Epäsynkroninen kehitys on merkki kilpirauhaseen kohdistuvasta vaikutuksesta. Ainoat tunnetut vaikutustavat, jotka aiheuttavat epäsynkronista kehitystä, johtuvat kemikaalien vaikutuksista, jotka kohdistuvat perifeeriseen kilpirauhashormonin toimintaan ja/tai kilpirauhashormonin metaboliaan kehittyvissä kudoksissa, mikä on havaittu esimerkiksi dejodinaasin estäjien yhteydessä.
|
|
53.
|
Koe-eläinten arviointi epäsynkronisen kehityksen kannalta suhteessa kontrollipopulaatioon perustuu koe-eläinten morfologiseen arviointiin tutkimuspäivänä 7 ja tutkimuspäivänä 21.
|
|
54.
|
Normaalin kudoksen muodostumisen kehitysjärjestyksen tunnistaminen perustuu Nieuwkoopin ja Faberin (8) laatimaan kuvaukseen Xenopus laeviksen normaalista kehityksestä. Käsite ’epäsynkroninen kehitys’ tarkoittaa nimenomaan niitä poikkeamia sammakonpoikasen morfologisessa kehityksessä, joiden perusteella kehitysvaihetta ei voida määrittää varmasti Nieuwkoopin ja Faberin (8) laatimien kriteerien mukaan, koska keskeisissä morfologisissa tunnusmerkeissä on piirteitä eri vaiheista.
|
|
55.
|
Kuten käsitteestä ’epäsynkroninen kehitys’ käy ilmi, huomioon tulee ottaa vain ne tapaukset, joissa esiintyy poikkeamia tiettyjen kudosten muodostumisen etenemisessä suhteessa muiden kudosten muodostumisen etenemiseen, Joissakin klassisissa fenotyypeissä etujalan kehitys on viivästynyt tai se puuttuu huolimatta siitä, että takajalat ja pyrstön kudokset ovat kehittyneet normaalisti tai tavallista nopeammin, tai kidukset ovat resorboituneet tavallista aikaisemmin suhteessa takajalan morfogeneesiin ja pyrstön resorboitumiseen. Eläin kirjataan epäsynkronisesti kehittyneeksi, jos sitä ei voida luokitella tiettyyn vaiheeseen, koska se ei täytä valtaosaa Nieuwkoopin ja Faberin (8) tietyn kehitysvaiheen tunnusmerkeistä, tai jos yhden tai useamman keskeisen ominaisuuden kehitys on viivästynyt tai nopeutunut tuntuvasti (esimerkiksi jos etujalat eivät ole kehittyneet, vaikka pyrstö on kokonaan resorboitunut). Tämä arviointi tehdään laadullisesti, ja siinä on tutkittava kaikki Nieuwkoopin ja Faberin (8) luettelemat tunnusmerkit. Havainnoitavien eläinten eri tunnusmerkkien kehitysvaihetta ei kuitenkaan tarvitse kirjata muistiin. Eläimiä, joiden kehitys näyttää epäsynkroniselta, ei luokitella mihinkään Nieuwkoopin ja Faberin (8) kehitysvaiheeseen.
|
|
56.
|
Kun sellaisia tapauksia, joiden morfologinen kehitys on poikkeavaa, määritellään luokkaan ’epäsynkroninen kehitys’, keskeinen kriteeri on se, että kudosten muodostumisen ja morfogeneesin suhteellinen ajoittuminen on häiriintynyt, kun taas niiden kudosten morfologia, joissa havaitaan kemikaalin vaikutuksia, ei ole erityisen poikkeava. Tällaista selvien morfologisten poikkeavuuksien tulkintaa voidaan havainnollistaa seuraavalla esimerkillä: hidastunut takajalan morfogeneesi suhteessa muiden kudosten kehittymiseen täyttää ’epäsynkronisen kehityksen’ kriteerin, kun taas niitä tapauksia, joissa takajalkoja ei ole tai joissa niiden lukumäärä on poikkeava (ektrodaktylia, polydaktylia) tai raajassa on muita selviä epämuodostumia, ei tule luokitella kohtaan ’epäsynkroninen kehitys’.
|
|
57.
|
Tässä yhteydessä tärkeimpiä morfologisia tunnusmerkkejä, jotka on arvioitava niiden yhteisen metamorfisen etenemisen kannalta, ovat takajalan morfogeneesi, etujalan morfogeneesi, etujalan kehittyminen, pyrstön resorboitumisen vaihe (etenkin pyrstöevän resorboituminen) ja pään morfologia (esimerkiksi kidusten koko ja niiden resorboitumisen vaihe, alaleuan morfologia, Meckelin ruston ulostyöntyminen).
|
|
58.
|
Kemikaalin vaikutustavan mukaan erilaisia selviä morfologisia fenotyyppejä saattaa ilmetä. Joissakin klassisissa fenotyypeissä etujalan kehitys on viivästynyt tai se puuttuu huolimatta siitä, että takajalat ja pyrstön kudokset ovat kehittyneet normaalisti tai tavallista nopeammin, tai että kidukset ovat resorboituneet tavallista aikaisemmin suhteessa takajalan ja pyrstön muodostumiseen.
|
Histopatologia
|
59.
|
Jos kemikaali ei aiheuta selvää myrkyllisyyttä eikä nopeuta kehitystä tai aiheuta epäsynkronista kehitystä, kilpirauhasen histopatologia arvioidaan käyttämällä asianmukaista ohjeasiakirjaa (9). Kehityksen viivästyminen silloin, kun myrkyllisyyttä ei ole todettu, on vahva osoitus siitä, ettei kemikaali vaikuta kilpirauhaseen, mutta kehitysvaiheen analyysi on vähemmän herkkä ja diagnostinen kuin kilpirauhasen histopatologinen analyysi. Siksi tässä tapauksessa on tehtävä kilpirauhasen histopatologiset analyysit. Kilpirauhasen histologiaan kohdistuvia vaikutuksia on todettu, vaikka kehitykseen kohdistuvia vaikutuksia ei olisikaan. Jos kilpirauhasen histopatologiassa ilmenee muutoksia, kemikaalin katsotaan vaikuttavan kilpirauhaseen, Jos kilpirauhasessa ei havaita kehitysviipeitä tai histologisia leesioita, kemikaalin ei katsota vaikuttavan kilpirauhaseen. Tämä päätös perustuu siihen, että THS-hormoni vaikuttaa kilpirauhaseen, ja mikä tahansa kemikaali, joka muuttaa verenkierrossa olevan kilpirauhashormonin määrää niin paljon, että THS:n eritys muuttuu, aiheuttaa myös histopatologisia muutoksia kilpirauhasessa. Erilaiset vaikutustavat ja -mekanismit voivat muuttaa verenkierrossa olevan kilpirauhashormonin määrää. Vaikka kilpirauhashormonipitoisuus viittaa kilpirauhaseen liittyvään vaikutukseen, sen perusteella ei kuitenkaan voida määrittää, mikä vaikutustapa tai -mekanismi saa tämän vasteen aikaan.
|
|
60.
|
Koska tämä ominaisuus ei sovellu analysoitavaksi tavanomaisilla tilastollisilla lähestymistavoilla, kemikaalille altistumiseen liittyvän vaikutuksen määrittää patologi, joka laatii siitä asiantuntijalausunnon.
|
Viivästynyt kehitys (määritetty kehitysvaiheen, takajalan pituuden, painon sekä kuonon ja peräaukon välisen pituuden perusteella)
|
61.
|
Kehitys saattaa viivästyä kilpirauhasesta johtumattomien mekanismien ja epäsuoran myrkyllisyyden vuoksi. Lievät kehitysviiveet, joihin liittyy selviä merkkejä myrkyllisyydestä, viittaavat todennäköisesti ei-spesifiseen myrkylliseen vaikutukseen. Kilpirauhaseen kohdistumattoman myrkyllisyyden arviointi on tärkeä osa testiä, jotta väärien positiivisten tulosten todennäköisyyttä voidaan vähentää. Liiallinen kuolleisuus on ilmiselvä merkki siitä, että on myös muita myrkyllisiä mekanismeja. Vastaavasti kasvun lievä väheneminen märkäpainon ja/tai kuonon ja peräaukon välisen pituuden perusteella määritettynä viittaa siihen, ettei myrkyllisyys kohdistu kilpirauhaseen. Kasvun selvää voimistumista on yleisesti havaittu sellaisten kemikaalien yhteydessä, jotka vaikuttavat normaaliin kehitykseen kielteisesti. Näin ollen se, että eläimet ovat mahdollisesti suuria, ei välttämättä tarkoita sitä, etteikö myrkyllisyys kohdistuisi kilpirauhaseen. Kilpirauhaseen kohdistuvaa myrkyllisyyttä ei kuitenkaan tule koskaan määrittää pelkästään kasvun perusteella. Kilpirauhaseen kohdistuva vaikutus on määritettävä kasvun, kehitysvaiheen ja kilpirauhasen histopatologian perusteella. Selvän myrkyllisyyden määrittämisessä on otettava huomioon myös muita ominaisuuksia, joita ovat esimerkiksi turvotus, verta vuotavat leesiot, letargia, vähentynyt ruoankulutus, epäsäännöllinen/muuttunut uintikäyttäytyminen jne. Jos kaikki testipitoisuudet aiheuttavat selvän myrkyllisyyden merkkejä, testikemikaali tulee arvioida uudelleen pienemmillä testipitoisuuksilla, ennen kuin päätetään, vaikuttaako kemikaali mahdollisesti kilpirauhaseen vai ei.
|
|
62.
|
Tilastollisesti merkitsevät kehitysviipeet silloin, kun muita selvän myrkyllisyyden merkkejä ei ole, viittaavat siihen, että kemikaali vaikuttaa kilpirauhaseen (antagonistisesti). Jos vahvoja tilastollisia vasteita ei ole, tämä tulos voidaan lisätä kilpirauhasen histopatologiaa koskeviin tuloksiin.
|
Tilastolliset analyysit
|
63.
|
Aineiston tilastollisissa analyyseissa on mieluiten noudatettava ympäristömyrkyllisyystietojen tilastollista analyysia koskevassa asiakirjassa ’Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application’ (11) kuvattuja menettelyjä. Kaikkien jatkuvien määrällisten ominaisuuksien (takajalan pituus, kuonon ja peräaukon välinen pituus, märkäpaino), jotka ovat yhdenmukaisia monotonisen annosvasteen kanssa, yhteydessä on sovellettava Jonckheere-Terpstran testiä alaspäin askeltavasti merkitsevän käsittelyvaikutuksen toteamiseksi.
|
|
64.
|
Niitä jatkuvia ominaisuuksia, jotka eivät ole yhdenmukaisia monotonisen annosvasteen kanssa, koskevista tiedoista on arvioitava normaalius (mieluiten käyttämällä Shapiro-Wilkin tai Anderson-Darlingin testiä) ja varianssin homogeenisuus (mieluiten käyttämällä Levenen testiä). Molemmat testit tehdään ANOVA-menetelmästä saaduilla jäännöksillä. Näiden virallisten normaaliutta ja varianssin homogeenisuutta koskevien testien sijasta voidaan käyttää myös asiantuntijan arvioita, joskin ensisijaisesti tulee käyttää virallisia testejä. Jos havaitaan ei-normaaliutta tai varianssin heterogeenisuutta, on käytettävä normalisoivaa, varianssia stabiloivaa muunnosta. Jos tiedot (kenties muunnoksen jälkeen) jakautuvat normaalisti homogeenisen varianssin yhteydessä, merkittävä käsittelyvaikutus määritetään Dunnettin testin avulla. Jos tiedot (kenties muunnoksen jälkeen) jakautuvat normaalisti heterogeenisen varianssin yhteydessä, merkittävä käsittelyvaikutus määritetään Tamhane-Dunnettin testin tai T3-testin tai Mann-Whitney-Wilcoxonin U-testin avulla. Jos normalisoivaa muunnosta ei löydy, merkittävä käsittelyvaikutus määritetään Mann-Whitney-Wilcoxonin U-testillä käyttäen Bonferroni-Holm-korjausta p-arvoihin. Dunnettin testiä sovelletaan riippumatta ANOVA F-testeistä, ja Mann-Whitneyn testiä sovelletaan riippumatta yleisistä Kruskall-Wallisin testeistä.
|
|
65.
|
Merkittävää kuolleisuutta ei odoteta, mutta se on arvioitava alaspäin askeltavalla Cochran-Armitage-testillä, kun tiedot ovat yhdenmukaiset annosvasteen monotonisuuden kanssa. Muussa tapauksessa on käytettävä Fisherin tarkkaa testiä ja Bonferroni-Holm-korjausta.
|
|
66.
|
Kehitysvaiheeseen kohdistuva merkitsevä käsittelyvaikutus määritetään soveltamalla rinnakkaisnäytteiden mediaaneihin käytettyä Jonckheere-Terpstran testiä alaspäin askeltavasti. Vaihtoehtoisesti – ja mieluiten – vaikutuksen määrittämisessä tulee käyttää monidikotomista Jonckheeren testiä 20. ja 80. persentiilin välillä, koska siinä otetaan huomioon jakautumisprofiilin muutokset.
|
|
67.
|
Tarkoituksenmukainen analyysiyksikkö on rinnakkaisnäyte, joten tiedot koostuvat rinnakkaisnäytteiden mediaaneista, jos käytetään Jonckheere-Terpstran testiä tai Mann-Whitneyn U-testiä, tai rinnakkaisnäytteiden keskiarvoja, jos käytetään Dunnettin testiä. Annosvasteen monotonisuus voidaan arvioida silmämääräisesti rinnakkaisnäytteestä sekä käsittelyjen keskiarvoista tai mediaaneista tai virallisista testeistä, kuten edellä on kuvattu (11). Jos käsittelyä tai kontrollia kohti on vähemmän kuin viisi rinnakkaisnäytettä, on käytettävä Jonckheere-Terpstran ja Mann-Whitneyn testien permutaatioversioita, jos ne ovat saatavilla. Kaikkien testien tilastollista merkitsevyyttä arvioidaan merkitsevyystasolla 0,05.
|
|
68.
|
Kuvassa 4 on vuokaavio, joka koskee tilastollisten testien tekemistä jatkuvista tiedoista.
Kuva 4.
Vuokaavio jatkuviin vastetietoihin sovellettavista tilastollisista lähestymistavoista.
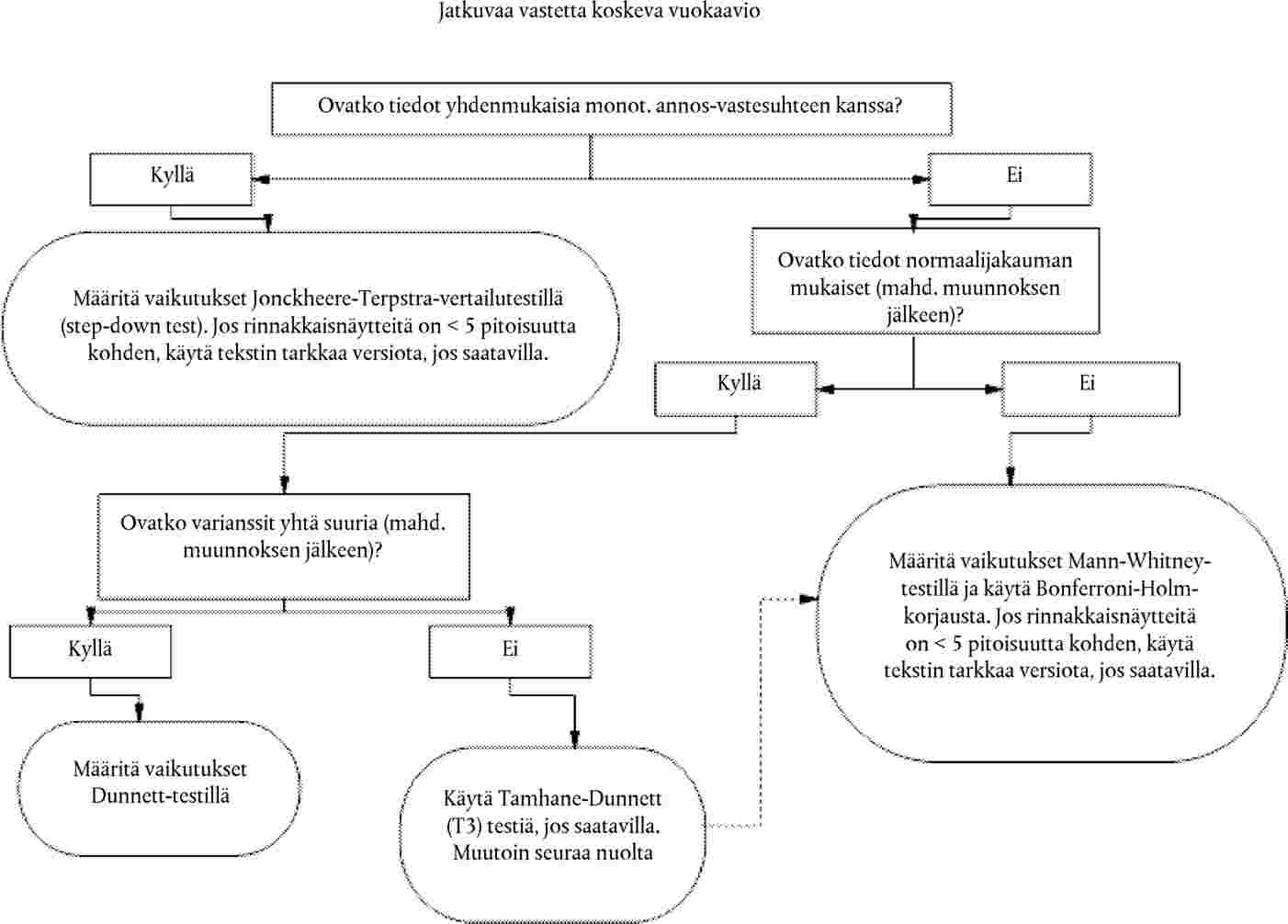
|
Tietojen analysointia koskevia erityishuomioita
Vaarantuneiden käsittelytasojen käyttö
|
69.
|
Useita tekijöitä otetaan huomioon, kun määritetään, esiintyykö rinnakkaisnäytteessä tai koko käsittelyssä selvää myrkyllisyyttä, jolloin näytteet tulisi poistaa analyysista. Selväksi myrkyllisyydeksi määritellään se, että missä tahansa rinnakkaisnäytteessä on enemmän kuin kaksi kuollutta koe-eläintä ja kun kuolema voidaan selittää ainoastaan myrkyllisyydellä teknisen virheen sijasta. Muita selvän myrkyllisyyden merkkejä ovat verenvuoto, epänormaali käyttäytyminen, epänormaalit uintikuviot, ruokahaluttomuus ja muut sairaudesta kertovat kliiniset merkit. Muiden subletaalien myrkyllisyyden merkkien osalta laadulliset arvioinnit voivat olla tarpeen, ja niissä on otettava aina huomioon puhtaan veden kontrolliryhmä.
|
Liuotinkontrollit
|
70.
|
Liuottimen käyttöä on harkittava vasta viimesijaisena keinona, kun kaikki muut kemikaalin annosteluvaihtoehdot on kokeiltu. Jos liuotinta käytetään, sen kanssa on käytettävä puhtaan veden kontrollia. Testin lopuksi on arvioitava liuottimen mahdolliset vaikutukset. Tämä tehdään vertailemalla liuotinkontrolliryhmää ja puhtaan veden kontrolliryhmää tilastollisesti. Oleellisimmat ominaisuudet, jotka tässä analyysissa tulee ottaa huomioon, ovat kehitysvaihe, kuonon ja peräaukon välinen pituus sekä märkäpaino, koska muuhun kuin kilpirauhaseen kohdistuva myrkyllisyys saattaa vaikuttaa niihin. Jos näissä ominaisuuksissa havaitaan tilastollisesti merkitseviä eroja puhtaan veden kontrolliryhmän ja liuotinkontrolliryhmän välillä, tutkimuksen päätepisteet vastemittausten osalta on määritettävä käyttämällä puhtaan veden kontrollia. Jos kontrolliryhmien välillä ei ole tilastollisesti merkitsevää eroa kaikkien mitattujen vastemuuttujien osalta, tutkimuksen päätepisteet vastemittausten osalta on määritettävä käyttäen yhdistettyjä laimennusvesi- ja liuotinkontrolleja.
|
Käsittelyryhmät, jotka saavuttavat vähintään kehitysvaiheen 60
|
71.
|
Vaiheen 60 jälkeen sammakonpoikasten koko ja paino pienenevät kudosten resorboitumisen ja absoluuttisen vesipitoisuuden vähenemisen vuoksi. Märkäpainon sekä kuonon ja peräaukon välisen pituuden mittausta ei siis voida käyttää asianmukaisesti kasvunopeuden erojen tilastollisissa analyyseissa. Siksi niiden organismien, joiden kehitysvaihe on >NF60, märkäpaino- ja pituustiedot on sensuroitava, eikä niitä voida käyttää rinnakkaisnäytteiden keskiarvojen tai mediaanien analyyseissa. Näiden kasvuun liittyvien parametrien analysoimisessa voidaan käyttää kahta eri toimintatapaa.
|
|
72.
|
Ensimmäinen toimintatapa on ottaa märkäpainon ja/tai kuonon ja peräaukon välisen pituuden tilastollisissa analyyseissa huomioon vain ne sammakonpoikaset, joiden kehitysvaihe on aiempi tai vastaava kuin vaihe 60. Tästä toimintatavasta ajatellaan saatavan riittävän vankkoja tietoja mahdollisten kasvuun kohdistuvien vaikutusten vakavuudesta, kunhan vain pieni osuus koe-eläimistä poistetaan analyyseista (≤20 prosenttia). Jos suurempi määrä sammakonpoikasista on ylittänyt kehitysvaiheen 60 (≤20 prosenttia) yhdessä tai useammassa nimellispitoisuudessa, on tehtävä kaikilla sammakonpoikasilla, kaksisuuntainen ANOVA, joka perustuu hierarkkiseen varianssirakenteeseen, jotta voidaan arvioida kemikaalikäsittelyjen kasvuun kohdistuvat vaikutukset samalla kun otetaan huomioon myöhäisvaiheen kehityksen vaikutus kasvuun. Lisäyksessä 3 on ohjeet painon ja pituuden kaksisuuntaisesta ANOVA-analyysista.
|
LÄHDEKIRJALLISUUS
|
(1)
|
OECD (2004) Report of the Validation of the Amphibian Metamorphosis Assay for the detection of thyroid active substances: Phase 1 – Optimisation of the Test Protocol. Series on Testing and Assessment, no. Series on Testing and Assessment. No. 77, Paris.
|
|
(2)
|
OECD (2007) Final Report of the Validation of the Amphibian Metamorphosis Assay: Phase 2 – Multi-chemical Interlaboratory Study. Series on Testing and Assessment, no. Series on Testing and Assessment. No. 76. Paris.
|
|
(3)
|
OECD (2008) Report of the Validation Peer Review for the Amphibian Metamorphosis Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. Series on Testing and Assessment, no. Series on Testing and Assessment. No. 92. Paris.
|
|
(4)
|
OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Series on Testing and Assessment, no. Series on Testing and Assessment. No. 23. Paris.
|
|
(5)
|
ASTM (2002) Standard Guide for Conducting Acute Toxicity Tests on Test Materials with Fishes, Macroinvertebrates, and Amphibians. American Society for Testing and Materials, ASTM E729–96(2002), Philadelpia, PA.
|
|
(6)
|
ASTM (2004) Standard Guide for Conducting the Frog Embryo Teratogenesis Assay – Xenopus (FETAX). E 1439–98.
|
|
(7)
|
Kahl, M.D., Russom, C.L., DeFoe, D.L. & Hammermeister, D.E. (1999) Saturation units for use in aquatic bioassays. Chemosphere 39, pp. 539–551.
|
|
(8)
|
Nieuwkoop, P.D. & Faber, J. (1994) Normal Table of Xenopus laevis. Garland Publishing, New York.
|
|
(9)
|
OECD (2007) Guidance Document on Amphibian Thyroid Histology. Series on Testing and Assessment, no. Series on Testing and Assessment. No. 82. Paris.
|
|
(10)
|
Dodd, M.H.I. & Dodd, J.M. (1976) Physiology of Amphibia. Lofts, B. (ed.), Academic Press, New York, pp. 467–599.
|
|
(11)
|
OECD (2006) Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Series on Testing and Assessment, no. Series on Testing and Assessment, No. 54. Paris.
|
|
(12)
|
Hutchinson TH, Shillabeer N, Winter MJ, Pickford DB, 2006. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Tarkistus. Aquatic Toxicology, 76; pp. 69–92.
|
Lisäys 1
Taulukko 1
21 päivän mittaisen AMA-tutkimuksen koeolosuhteet
|
Koe-eläin
|
Xenopus laevis -toukat
|
|
Toukkavaihe testin alussa
|
Nieuwkoopin ja Faberin vaihe 51
|
|
Altistusaika
|
21 päivää
|
|
Toukkien valintaperusteet
|
Kehitysvaihe ja kokonaispituus (valinnainen)
|
|
Testipitoisuudet
|
Vähintään kolme pitoisuutta, joiden väli on suurin piirtein yksi suuruusluokka
|
|
Altistusmenetelmä
|
Läpivirtaus (ensisijainen) ja/tai staattinen menetelmä, jossa liuos ei vaihdu
|
|
Testausjärjestelmän virtausnopeus
|
25 ml/min (koko tilavuus vaihtuu noin 2,7 h:n välein)
|
|
Ensisijaiset ominaisuudet / määrityspäivät
|
Kuolleisuus
|
Päivittäin
|
|
Kehitysvaihe
|
Päivät 7 ja 21
|
|
Takajalan pituus
|
Päivät 7 ja 21
|
|
Kuonon ja peräaukon välinen pituus
|
Päivät 7 ja 21
|
|
Ruumiin märkäpaino
|
Päivät 7 ja 21
|
|
Kilpirauhasen histologia
|
Päivä 21
|
|
Laimennusvesi-/laboratoriokontrolli
|
Dekloorattu vesijohtovesi (hiilisuodatettu) tai vastaava laboratoriolähde
|
|
Toukkien tiheys
|
20 toukkaa / testiastia (5/l)
|
|
Testiliuos/testiastia
|
4–10 l (vettä vähintään 10–15 cm) / lasinen tai ruostumattomasta teräksestä valmistettu testiastia (esim. 22,5 cm × 14 cm × 16,5 cm)
|
|
Rinnakkaisnäyte
|
4 rinnakkaistestiastiaa / testipitoisuus ja kontrolli
|
|
Hyväksyttävä kuolleisuus kontrolleissa
|
≤ 10 % rinnakkaisnäytetestiastiaa kohti
|
|
Kilpirauhasen kiinnitys
|
Kiinnitettyjen lkm
|
Kaikki sammakonpoikaset (5 / rinnakkaisnäyte arvioidaan alustavasti)
|
|
Alue
|
Pää tai koko ruumis
|
|
Kiinnitysneste
|
Davidsonin kiinnitysneste
|
|
Ruokinta
|
Ravinto
|
Sera Micron® tai vastaava
|
|
Määrä/antotiheys
|
Ks. taulukosta 1 ohjeet ruokinnasta Sera Micron® -ravinnolla
|
|
Valaistus
|
Valojaksot
|
12 h valoisaa / 12 h pimeää
|
|
Intensiteetti
|
600–2 000 luksia (veden pinnalta mitattuna)
|
|
Veden lämpötila
|
22 ± 1 °C
|
|
pH
|
6,5–8,5
|
|
Liuenneen hapen pitoisuus
|
> 3,5 mg/l (> 40 % ilman kyllästysarvosta)
|
|
Analyyttisen kemian näytteenottoaikataulu
|
Kerran viikossa (neljä näytteenottokertaa / testi)
|
Lisäys 2
Raakatietojen ja yhteenvetotietojen raportointitaulukot
Taulukko 1
Yleiset tiedot testikemikaalista
|
Kemialliset tiedot
|
|
|
Syötä testikemikaali, pitoisuusyksiköt ja käsittelyt
|
|
|
Testikemikaali:
|
|
|
|
|
Pitoisuusyksiköt:
|
|
|
|
|
Käsittely 1
|
|
|
|
|
Käsittely 2
|
|
|
|
|
Käsittely 3
|
|
|
|
|
Käsittely 4
|
|
|
|
|
|
|
|
|
|
Päivämäärä (päivä 0):
|
|
Syötä päivämäärä (kk/pp/vv)
|
|
|
Päivämäärä (päivä 7):
|
|
Syötä päivämäärä (kk/pp/vv)
|
|
|
Päivämäärä (päivä 21):
|
|
Syötä päivämäärä (kk/pp/vv)
|
Taulukko 2
Raakatietojen keruulomakkeet päiville 7 ja 21
|
PÄIVÄ X
PVM 00.00.00
|
|
|
Pitoisuus
|
Käsittelyn numero
|
Rinnakkaisnäytteen numero
|
Yksilön numero
|
Yksilön tunniste
|
Kehitysvaihe
|
Kuono-peräaukko-pituus (mm)
|
Takajalan pituus (mm)
|
Koko organismin märkäpaino (mg)
|
|
RIVI
|
KÄS.
|
KÄS.#
|
RINN.
|
YKS.
|
YKS.#
|
VAIHE
|
PIT.
|
TAKAJ.PIT.
|
PAINO
|
|
1
|
0,00
|
1
|
|
|
|
|
|
|
|
|
2
|
0,00
|
1
|
|
|
|
|
|
|
|
|
3
|
0,00
|
1
|
|
|
|
|
|
|
|
|
4
|
0,00
|
1
|
|
|
|
|
|
|
|
|
5
|
0,00
|
1
|
|
|
|
|
|
|
|
|
6
|
0,00
|
1
|
|
|
|
|
|
|
|
|
7
|
0,00
|
1
|
|
|
|
|
|
|
|
|
8
|
0,00
|
1
|
|
|
|
|
|
|
|
|
9
|
0,00
|
1
|
|
|
|
|
|
|
|
|
10
|
0,00
|
1
|
|
|
|
|
|
|
|
|
11
|
0,00
|
1
|
|
|
|
|
|
|
|
|
12
|
0,00
|
1
|
|
|
|
|
|
|
|
|
13
|
0,00
|
1
|
|
|
|
|
|
|
|
|
14
|
0,00
|
1
|
|
|
|
|
|
|
|
|
15
|
0,00
|
1
|
|
|
|
|
|
|
|
|
16
|
0,00
|
1
|
|
|
|
|
|
|
|
|
17
|
0,00
|
1
|
|
|
|
|
|
|
|
|
18
|
0,00
|
1
|
|
|
|
|
|
|
|
|
19
|
0,00
|
1
|
|
|
|
|
|
|
|
|
20
|
0,00
|
1
|
|
|
|
|
|
|
|
|
21
|
0,00
|
2
|
|
|
|
|
|
|
|
|
22
|
0,00
|
2
|
|
|
|
|
|
|
|
|
23
|
0,00
|
2
|
|
|
|
|
|
|
|
|
24
|
0,00
|
2
|
|
|
|
|
|
|
|
|
25
|
0,00
|
2
|
|
|
|
|
|
|
|
|
26
|
0,00
|
2
|
|
|
|
|
|
|
|
|
27
|
0,00
|
2
|
|
|
|
|
|
|
|
|
28
|
0,00
|
2
|
|
|
|
|
|
|
|
|
29
|
0,00
|
2
|
|
|
|
|
|
|
|
|
30
|
0,00
|
2
|
|
|
|
|
|
|
|
|
31
|
0,00
|
2
|
|
|
|
|
|
|
|
|
32
|
0,00
|
2
|
|
|
|
|
|
|
|
|
33
|
0,00
|
2
|
|
|
|
|
|
|
|
|
34
|
0,00
|
2
|
|
|
|
|
|
|
|
|
35
|
0,00
|
2
|
|
|
|
|
|
|
|
|
36
|
0,00
|
2
|
|
|
|
|
|
|
|
|
37
|
0,00
|
2
|
|
|
|
|
|
|
|
|
38
|
0,00
|
2
|
|
|
|
|
|
|
|
|
39
|
0,00
|
2
|
|
|
|
|
|
|
|
|
40
|
0,00
|
2
|
|
|
|
|
|
|
|
|
41
|
0,00
|
3
|
|
|
|
|
|
|
|
|
42
|
0,00
|
3
|
|
|
|
|
|
|
|
|
43
|
0,00
|
3
|
|
|
|
|
|
|
|
|
44
|
0,00
|
3
|
|
|
|
|
|
|
|
|
45
|
0,00
|
3
|
|
|
|
|
|
|
|
|
46
|
0,00
|
3
|
|
|
|
|
|
|
|
|
47
|
0,00
|
3
|
|
|
|
|
|
|
|
|
48
|
0,00
|
3
|
|
|
|
|
|
|
|
|
49
|
0,00
|
3
|
|
|
|
|
|
|
|
|
50
|
0,00
|
3
|
|
|
|
|
|
|
|
|
51
|
0,00
|
3
|
|
|
|
|
|
|
|
|
52
|
0,00
|
3
|
|
|
|
|
|
|
|
|
53
|
0,00
|
3
|
|
|
|
|
|
|
|
|
54
|
0,00
|
3
|
|
|
|
|
|
|
|
|
55
|
0,00
|
3
|
|
|
|
|
|
|
|
|
56
|
0,00
|
3
|
|
|
|
|
|
|
|
|
57
|
0,00
|
3
|
|
|
|
|
|
|
|
|
58
|
0,00
|
3
|
|
|
|
|
|
|
|
|
59
|
0,00
|
3
|
|
|
|
|
|
|
|
|
60
|
0,00
|
3
|
|
|
|
|
|
|
|
|
61
|
0,00
|
4
|
|
|
|
|
|
|
|
|
62
|
0,00
|
4
|
|
|
|
|
|
|
|
|
63
|
0,00
|
4
|
|
|
|
|
|
|
|
|
64
|
0,00
|
4
|
|
|
|
|
|
|
|
|
65
|
0,00
|
4
|
|
|
|
|
|
|
|
|
66
|
0,00
|
4
|
|
|
|
|
|
|
|
|
67
|
0,00
|
4
|
|
|
|
|
|
|
|
|
68
|
0,00
|
4
|
|
|
|
|
|
|
|
|
69
|
0,00
|
4
|
|
|
|
|
|
|
|
|
70
|
0,00
|
4
|
|
|
|
|
|
|
|
|
71
|
0,00
|
4
|
|
|
|
|
|
|
|
|
72
|
0,00
|
4
|
|
|
|
|
|
|
|
|
73
|
0,00
|
4
|
|
|
|
|
|
|
|
|
74
|
0,00
|
4
|
|
|
|
|
|
|
|
|
75
|
0,00
|
4
|
|
|
|
|
|
|
|
|
76
|
0,00
|
4
|
|
|
|
|
|
|
|
|
77
|
0,00
|
4
|
|
|
|
|
|
|
|
|
78
|
0,00
|
4
|
|
|
|
|
|
|
|
|
79
|
0,00
|
4
|
|
|
|
|
|
|
|
|
80
|
0,00
|
4
|
|
|
|
|
|
|
|
Taulukko 3
Päivien 7 ja 21 ominaisuustietojen lasketut yhteenvedot
|
|
|
Kehitysvaihe
|
Kuono-peräaukko-pituus (mm)
|
Takajalan pituus (mm)
|
Paino (mg)
|
|
KÄS
|
RINN
|
MIN
|
MEDIAANI
|
MAX
|
KESKIARVO
|
KESK.HAJ.
|
KESKIARVO
|
KESK.HAJ.
|
KESKIARVO
|
KESK.HAJ.
|
|
1
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
Huomautus: Solun laskelmat liittyvät taulukkoon 2 syötettyihin tietoihin.
|
Taulukko 4
Päivittäiset kuolleisuustiedot
|
Testipäivä
|
Päivämäärä
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00.00.00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Rinnakkaisnäytteiden luku
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Käsittelyn luku
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
|
Huomautus: Solun laskelmat liittyvät taulukkoon 1 syötettyihin tietoihin.
|
Taulukko 5
Veden laatukriteerit
Altistusjärjestelmä (läpivirtaus/staattinen)
Lämpötila:
Valovoima:
Valoisa-pimeä-sykli
Elintarvikkeet:
Ruokintatiheys:
Veden pH:
Testiveden jodipitoisuus:
Taulukko 6
Yhteenveto kemiallisista tiedoista
|
Kemiallinen nimi:
|
|
Cas #:
|
|
Testipäivä
|
Päivämäärä
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00.00.00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Arvo!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Huomautus: Solun laskelmat liittyvät taulukkoon 1 syötettyihin tietoihin.
|
Taulukko 7
Keskeisten kriteerien histopatologiset raportointitaulukot
|
Päiväys:
|
Kemikaali:
|
|
|
Patologi:
|
|
|
Kilpirauhasen hypertrofia
|
Kilpirauhasen atrofia
|
Follikkelisolun hypertrofia
|
Follikkelisolun hyperplasia
|
|
Kilpirauhasen hypertrofia
|
Kilpirauhasen atrofia
|
Follikkelisolun hypertrofia
|
Follikkelisolun hyperplasia
|
|
Kontrollieläimen tunniste – rinnakkaisnäyte 1
|
|
|
|
|
|
Annoseläimen tunniste – rinnakkaisnäyte 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kontrollieläimen tunniste – rinnakkaisnäyte 2
|
|
|
|
|
|
Annoseläimen tunniste – rinnakkaisnäyte 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Yhteensä:
|
|
|
|
|
Yhteensä:
|
|
|
|
|
|
|
Kilpirauhasen hypertrofia
|
Kilpirauhasen atrofia
|
Follikkelisolun hypertrofia
|
Follikkelisolun hyperplasia
|
|
|
Kilpirauhasen hypertrofia
|
Kilpirauhasen atrofia
|
Follikkelisolun hypertrofia
|
Follikkelisolun hyperplasia
|
|
Annoseläimen tunniste – rinnakkaisnäyte 1
|
|
|
|
|
|
Annoseläimen tunniste – rinnakkaisnäyte 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Annoseläimen tunniste – rinnakkaisnäyte 2
|
|
|
|
|
|
Annoseläimen tunniste – rinnakkaisnäyte 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Yhteensä:
|
|
|
|
|
Yhteensä:
|
|
|
|
|
Taulukko 8
Muut histopatologiset kriteerit
|
Päiväys:
|
Kemikaali:
|
|
|
Patologi:
|
|
|
|
|
|
|
|
|
Follikkelin ontelon alue suurentunut
|
Follikkelin ontelon alue pienentynyt
|
Follikkelin ontelon alue suurentunut
|
Follikkelin ontelon alue pienentynyt
|
|
Kontrollieläimen tunniste – rinnakkaisnäyte 1
|
|
|
|
Annoseläimen tunniste – rinnakkaisnäyte 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kontrollieläimen tunniste – rinnakkaisnäyte 2
|
|
|
|
Annoseläimen tunniste – rinnakkaisnäyte 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Yhteensä:
|
|
|
Yhteensä:
|
|
|
|
|
Follikkelin ontelon alue suurentunut
|
Follikkelin ontelon alue pienentynyt
|
|
|
Follikkelin ontelon alue suurentunut
|
Follikkelin ontelon alue pienentynyt
|
|
Annoseläimen tunniste – rinnakkaisnäyte 1
|
|
|
|
Annoseläimen tunniste – rinnakkaisnäyte 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Annoseläimen tunniste – rinnakkaisnäyte 2
|
|
|
|
Annoseläimen tunniste – rinnakkaisnäyte 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Yhteensä:
|
|
|
Yhteensä:
|
|
|
Taulukko 9
Histopatologisten löydösten kuvaukset
|
Päiväys:
|
|
Kemikaali:
|
|
Patologi:
|
|
|
Kuvaus:
|
|
Kontrollieläimen tunniste – rinnakkaisnäyte 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kontrollieläimen tunniste – rinnakkaisnäyte 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Annoseläimen tunniste – rinnakkaisnäyte 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Annoseläimen tunniste – rinnakkaisnäyte 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Annoseläimen tunniste – rinnakkaisnäyte 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Annoseläimen tunniste – rinnakkaisnäyte 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Annoseläimen tunniste – rinnakkaisnäyte 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Annoseläimen tunniste – rinnakkaisnäyte 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Taulukko 10
Yhteenvetoraportointitaulukon malli AMA-tutkimuksen päivälle x (7 tai 21)
|
|
|
Valvonta
|
Annos 1
|
Annos 2
|
Annos 3
|
|
Ominaisuus
|
Rinnakkaisnäyte
|
Keskiarvo
|
SD
|
CV
|
N
|
Keskiarvo
|
SD
|
CV
|
N
|
p-arvo
|
Keskiarvo
|
SD
|
CV
|
N
|
p-arvo
|
Keskiarvo
|
SD
|
CV
|
N
|
p-arvo
|
|
Takajalan Pituus
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Keskiarvo:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kuono-peräaukko-pit.
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Keskiarvo:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Märkäpaino:
(mg)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Keskiarvo:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Taulukko 11
Kehitysvaihetietojen yhteenvetoraportointitaulukon malli AMA-tutkimuksen päivälle × (7 tai 21)
|
|
|
Valvonta
|
Annos 1
|
Annos 2
|
Annos 3
|
|
|
Rinnakkaisnäyte
|
Mediaani
|
Minimi
|
Maksimi
|
N
|
Mediaani
|
Minimi
|
Maksimi
|
N
|
p-arvo
|
Mediaani
|
Minimi
|
Maksimi
|
N
|
p-arvo
|
Mediaani
|
Minimi
|
Maksimi
|
Mediaani
|
p-arvo
|
|
Kehitysaste (vaihe)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Keskiarvo:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Lisäys 3
Pituuden ja painon vaihtoehtoinen analyysi, jos myöhäisvaiheen kehitystä esiintyy yli 20 prosentilla sammakonpoikasista yhdessä tai useammassa pitoisuudessa
Jos suurempi määrä sammakonpoikasista on ylittänyt kehitysvaiheen 60 (≤ 20 prosenttia) yhdessä tai useammassa nimellispitoisuudessa, on tehtävä kaikilla sammakonpoikasilla kaksisuuntainen ANOVA, joka perustuu hierarkkiseen varianssirakenteeseen, jotta voidaan arvioida kemikaalikäsittelyjen kasvuun kohdistuvat vaikutukset samalla kun otetaan huomioon myöhäisvaiheen kehityksen vaikutus kasvuun.
Kaikkia tietoja suositellaan käytettäväksi, mutta huomioon tulee ottaa myöhäisvaiheen kehityksen vaikutus. Tämä voidaan tehdä kaksisuuntaisella ANOVAlla, joka perustuu hierarkkiseen varianssirakenteeseen. Määritä LateStage=’Yes’, jos eläimen kehitysvaihe on vähintään 61. Määritä muussa tapauksessa LateStage=’No’ +. Sen jälkeen voidaan tehdä kaksisuuntainen ANOVA muuttujilla pitoisuus, LateStage ja niiden yhteisvaikutus. Satunnaiskertoimena on Rep(Conc) ja toisena satunnaisvaikutuksena on Tadpole(Rep). Tällöin ’rep’ on edelleen analyysiyksikkö, ja se antaa pitkälti samat tulokset kuin painotettu analyysi ’rep*latestage means’, painotettuna eläinten lukumäärällä keskiarvoa kohti. Jos tiedot rikkovat ANOVAn normaaliuden tai varianssin homogeenisuuden vaatimuksia, se voidaan korjata käyttämällä normalisoitua arvojärjestysmuunnosta.
Tavanomaisten ANOVA F-testien (Conc, LateStage ja niiden yhteisvaikutus) lisäksi yhteisvaikutuksen F-testi voidaan jakaa kahteen muuhun ANOVA F-testiin, joista toinen käsittelee keskimääräisiä vasteita kaikissa pitoisuuksissa määrityksellä LateStage=’No’ ja toinen keskimääräisiä vasteita kaikissa pitoisuudessa määrityksellä LateStage=’Yes’. Muut käsittelykeskiarvojen vertailut kontrolleihin tehdään kullakin LateStage-tasolla. Trendityyppinen analyysi voidaan tehdä käyttämällä asianmukaisia kontrasteja. Myös yksinkertaisia parillisia vertailuja voidaan tehdä, jos LateStage-muuttujan tasolla on näyttöä ei-monotonisesta annosvasteesta. Bonferroni-Holm-korjaus p-arvoihin tehdään vain, jos vastaava F-osa ei ole merkitsevä. Tämä voidaan tehdä SAS-ohjelmassa ja luultavasti myös muissa tilasto-ohjelmapaketeissa. Komplikaatioita voi ilmetä, jos jossakin pitoisuudessa ei ole myöhäisessä kehitysvaiheessa olevia eläimiä, mutta nämä tilanteet voidaan selvittää helposti.
Lisäys 4
Määritelmät
Kemikaali
: aine tai seos.
Testikemikaali
: tätä testimenetelmää käyttäen testattu aine tai seos.
C.39. MAA-AINEKSESSA TEHTÄVÄ HYPPYHÄNTÄISTEN LISÄÄNTYMISTESTI
JOHDANTO
|
1.
|
Tämä testimenetelmä vastaa OECD:n testiohjetta (TG) nro 232 (2009). Tämä testimenetelmä on kehitetty siksi, että voidaan arvioida kemikaalien vaikutuksia maaperässä elävien hyppyhäntäisten lisääntymiseen. Se perustuu nykyisiin menetelmiin (1) (2). Partenogeneettisesti lisääntyvä Folsomia candida ja suvullisesti lisääntyvä Folsomia fimetaria ovat kaksi helpoiten saatavilla olevaa hyppyhäntäisten lajia. Niitä voi kasvattaa ja niitä on myös kaupallisesti saatavilla. Kun arvioitavana on tiettyjä elinympäristöjä, joissa näitä kahta lajia ei esiinny, menetelmä on laajennettavissa myös muihin hyppyhäntäislajeihin, jos ne täyttävät testin validiteettikriteerit.
|
|
2.
|
Maaperässä hyppyhäntäiset ovat ekologisesti merkittäviä lajeja ympäristömyrkyllisyyden testaukseen. Hyppyhäntäiset ovat kuusijalkaisia, ja niiden ohut ulkoinen tukiranka läpäisee ilmaa ja vettä erittäin hyvin. Ne kuuluvat niveljalkaisiin, mutta niiden altistumisreitti ja -nopeus on eri kuin kastemadoilla ja änkyrimadoilla.
|
|
3.
|
Hyppyhäntäispopulaation tiheys on yleensä 105 m– 2 maaperässä ja lehtikarikekerroksissa monissa maanpäällisissä ekosysteemeissä (3) (4). Aikuisten koko on yleensä 0,5–5 mm, ja niiden osuus maaperäeläinten kokonaisbiomassasta ja maahengityksestä on pieni, arviolta 1–5 prosenttia (5). Niiden tärkein tehtävä onkin toimia mahdollisina prosessien säätelijöinä saalistamalla mikrobeja ja pieneliöitä. Hyppyhäntäiset ovat hyvin monentyyppisten endogeeisten ja epigeeisten selkärankaisten, kuten punkkien, tuhatjalkaisten, hämähäkkien, maakiitäjäisten ja lyhytsiipisten saaliseläimiä. Hyppyhäntäiset osallistuvat hajotusprosesseihin hapokkaassa maassa, jossa ne voivat olla tärkeimpiä maan selkärangattomia änkyrimatojen ohella, sillä kastematoja ja kaksoisjalkaisia ei tällaisessa maaperässä yleensä ole.
|
|
4.
|
F. fimetaria on levinnyt koko maailmaan, ja sitä tavataan yleensä monentyyppisessä maaperässä, niin hiekka- ja hiesupitoisessa maassa kuin mullas- ja kangashumusmaassa. Se on silmätön ja pigmentitön hyppyhäntäinen. Sitä on löydetty myös viljelysmailta kaikkialla Euroopassa (6). Ruokailutavoiltaan se on kaikkiruokainen; se syö sienirihmastoja, bakteereita, alkueläimiä ja jätöksiä. Laidunmaalla se on vuorovaikutuksessa kasvitauteja aiheuttavien sienten kanssa (7), ja se saattaa vaikuttaa myös sienijuuriin, minkä tiedetään pitävän paikkansa ainakin F. candidan osalta. Useimpien hyppyhäntäisten tavoin se lisääntyy sukupuolisesti, mikä edellyttää koiraiden jatkuvaa läsnäoloa munien hedelmöittämistä varten.
|
|
5.
|
Myös F. candidaa tavataan kaikkialla maailmassa. Vaikka se ei ole yleinen useimmissa luonnollisissa maaperissä, sitä tavataan usein suuria määriä paikoissa, joissa on paljon humusta. Se on silmätön ja pigmentitön hyppyhäntäinen. Sillä on hyvin kehittynyt hyppyhanko (hyppyelin) ja aktiivinen juoksuliike, ja se hyppää nopeasti, jos sitä häiritään. F. candidan ekologinen rooli on samankaltainen kuin F. fimetarian, mutta sen elinympäristönä ovat orgaanisesti monimuotoisemmat maaperät. Se lisääntyy partenogeneettisesti. Koiraita voi olla vähemmän kuin yksi tuhannesta.
|
TESTIN PERIAATE
|
6.
|
Synkronisesti kehittyneet aikuiset (F. fimetaria) tai nuoret (F. candida) hyppyhäntäiset altistetaan testikemikaalin eri pitoisuuksille siten, että kemikaali sekoitetaan muokattuun keinotekoiseen maahan (8), jonka orgaanisen aineksen pitoisuus on viisi prosenttia (tai vaihtoehtoiseen maaperään). Testin kulku voidaan jakaa kahteen vaiheeseen:
|
—
|
Pitoisuusalueen määritystesti (jos myrkyllisyydestä ei ole riittävästi tietoa saatavana), jossa pääasiallisia tutkittavia ominaisuuksia ovat kuolleisuus ja lisääntyminen. F. fimetarialta ne arvioidaan kahden viikon altistuksen jälkeen ja F. candidalta kolmen viikon jälkeen.
|
|
—
|
Varsinainen lisääntymistesti, jossa arvioidaan emoeläinten tuottamien poikasten kokonaismäärää ja emoeläinten eloonjäämistä. Tämän varsinaisen testin kesto on F. fimetarian osalta kolme viikkoa ja F. candidan osalta neljä viikkoa.
|
Testikemikaalin myrkyllinen vaikutus aikuisten eläinten kuolleisuuteen ja lisääntymistuloksiin ilmaistaan arvoilla LCx ja ECx. Tiedot sovitetaan epälineaarisen regression avulla tarkoituksenmukaiseen malliin, jotta voidaan arvioida se pitoisuus, joka aiheuttaa x prosentin kuolleisuuden tai vähenemän lisääntymistuloksissa. Vaihtoehtoisesti voidaan käyttää myös NOEC/LOEC-arvoja (9).
|
TESTIKEMIKAALIA KOSKEVIA TIETOJA
|
7.
|
Testikemikaalista pitäisi olla käytettävissä seuraavat tiedot: fysikaaliset ominaisuudet, vesiliukoisuus, log Kow, maa-vesi-jakaantumiskerroin sekä höyrynpaine. Lisätiedot testikemikaalin käyttäytymisestä maaperässä, kuten fotolyysi- ja hydrolyysinopeudet sekä bioottinen hajoaminen, ovat myös suotavia. Testikemikaalin IUPAC-nimikkeistön mukaiset tunnistetiedot, CAS-numero, erä, rakennekaava ja puhtaus on dokumentoitava, jos nämä tiedot ovat saatavilla.
|
|
8.
|
Tätä testimenetelmää voidaan käyttää vesiliukoisten tai veteen liukenemattomien kemikaalien yhteydessä. Testikemikaalia käytetään kummassakin tapauksessa kuitenkin eri tavalla. Testimenetelmää ei voida soveltaa haihtuviin kemikaaleihin, eli sellaisiin, joiden osalta Henryn vakio tai ilma-vesi-jakaantumiskerroin on suurempi kuin yksi, tai sellaisiin kemikaaleihin, joiden höyrynpaine on suurempi kuin 0,0133 Pa 25 °C:ssa.
|
TESTIN VALIDITEETTI
|
9.
|
Jotta testitulosta voidaan pitää luotettavana, seuraavien kriteerien on täytyttävä käsittelemättömissä kontrolleissa:
|
—
|
Aikuisten eläinten keskimääräinen kuolleisuus testin lopussa saa olla enintään 20 prosenttia.
|
|
—
|
Nuorten eläinten keskimäärän testiastiaa kohti testin lopussa tulee olla vähintään 100.
|
|
—
|
Nuorten eläinten määrälle lasketun variaatiokertoimen tulee olla alle 30 prosenttia varsinaisen testin lopussa.
|
|
VERTAILUKEMIKAALI
|
10.
|
Vertailukemikaali on testattava sen EC50-pitoisuudella valitussa testimaaperätyypissä joko säännöllisin väliajoin tai mahdollisesti osana jokaista testikertaa, jotta voidaan varmentaa, että testijärjestelmän testiorganismien vaste on normaalilla tasolla. Sopiva vertailukemikaali on boorihappo, jonka tulisi vähentää kummankin lajin lisääntymistä 50 prosentilla (10) (11), kun sen pitoisuus on 100 mg/kg maa-aineksen kuivapainosta.
|
TESTIN KUVAUS
Testiastiat ja -laitteet
|
11.
|
Sopivia testiastioita ovat säiliöt, joihin mahtuu 30 g kosteaa maa-ainesta. Materiaalin tulee olla joko lasia tai inerttiä muovia (myrkytöntä). Muovisäiliöiden käyttöä on kuitenkin vältettävä, jos testikemikaalille altistuminen vähenee sorption takia. Testiastioiden on oltava poikkileikkaukseltaan sellaisia, että maa-aineksen varsinainen syvyys testiastiassa on 2–4 cm. Astioissa tulee olla kannet (esimerkiksi lasia tai polyetyleeniä), jotka on suunniteltu vähentämään veden haihtumista samalla kun maa-aineksen ja testi-ilmakehän välinen kaasujenvaihto on mahdollista. Säiliön tulee olla ainakin osittain läpinäkyvä valonläpäisevyyden vuoksi.
|
|
12.
|
Testissä tarvitaan myös vakiolaboratoriolaitteisto, erityisesti seuraavat:
|
—
|
pH-mittari ja luksimittari
|
|
—
|
sopivia tarkkoja vaakoja
|
|
—
|
asianmukaiset lämpötilan valvontalaitteet
|
|
—
|
asianmukaiset ilmankosteuden valvontalaitteet (ei oleellinen, jos altistusastiat on peitetty kansilla)
|
|
—
|
lämpökaappi, jonka lämpötilaa voi säätää, tai pieni huone
|
|
—
|
pinsettejä tai imulaite, jonka imuteho on pieni.
|
|
Testattavan maa-aineksen esikäsittely
|
13.
|
Testissä käytetään muokattua keinotekoista maata, jonka orgaanisen aineksen pitoisuus on viisi prosenttia. Myös luonnollista maata voidaan käyttää, koska keinotekoinen maa ei muistuta luonnollista maata. Keinotekoisen maan suositeltu koostumus on seuraavanlainen (kuivapainojen perusteella, kun ainekset on kuivattu vakiopainoon 105 °C:ssa):
|
—
|
5 % rahkaturvetta, joka on ilmakuivattu ja jauhettu hienoksi (hiukkaskoko 2 ± 1 on hyväksyttävä)
|
|
—
|
20 % kaoliinisavea (kaoliniitin osuus mieluiten yli 30 %)
|
|
—
|
noin 74 % ilmakuivattua teollisuushiekkaa (tarvittavan CaCO3-määrän mukaan), ensisijaisesti hienoa hiekkaa, jonka hiukkasista yli puolet on kooltaan 50–200 mikronia. Hiekan tarkkaan määrään vaikuttaa CaCO3-määrä (ks. jäljempänä); niiden yhteismäärän tulisi olla 75 prosenttia.
|
|
—
|
1,0 % kalsiumkarbonaattia (CaCO3, jauhemainen, analyyttinen laatu), jotta maan pH-arvoksi saadaan 6,0 ± 0,5; lisättävän kalsiumkarbonaatin määrään saattaa vaikuttaa etenkin turpeen laatu/tyyppi (ks. huomautus 1).
|
Huomautus 1: CaCO3:n tarvittavaan määrään vaikuttavat maa-ainesalustan ainekset, ja se on määritettävä mittaamalla esi-inkuboidun kostean maa-aineksen osanäytteiden pH-arvo juuri ennen testiä.
Huomautus 2: On suositeltavaa mitata maa-aineksen pH-arvo, valinnaisesti myös C/N-suhde, kationinvaihtokyky (CEC) ja orgaanisen aineksen pitoisuus, jotta normalisointi myöhemmässä vaiheessa on mahdollista ja jotta tuloksia voidaan tulkita paremmin.
Huomautus 3: Tarvittaessa (esimerkiksi tiettyihin testaustarkoituksiin) testi- ja/tai kasvatusalustana voidaan käyttää myös luonnonmaata, joka on peräisin saastumattomilta alueilta. Luonnonmaata käytettäessä sitä on kuitenkin luonnehdittava vähintään seuraavin tiedoin: alkuperä (keräyspaikka), pH, rakenne (hiukkaskokojakauma), CEC ja orgaanisen aineksen pitoisuus, eikä siinä saa olla minkäänlaisia epäpuhtauksia. Luonnonmaan soveltuvuus testiin ja testin validiteettikriteerien täyttämiseen on syytä osoittaa ennen sen käyttämistä varsinaisessa testissä.
|
|
14.
|
Maan kuivat ainesosat sekoitetaan perusteellisesti (esim. suurella laboratoriosekoittimella). Keinomaan enimmäisvedenpidätyskyky (WHC) määritetään lisäyksessä 5 kuvattujen menetelmien mukaisesti. Testimaan kosteuspitoisuus on optimoitava; sen rakenteen tulee olla irtonainen ja huokoinen, jotta hyppyhäntäiset voivat kaivautua huokosiin. Ihanteellinen kosteus on tavallisesti 40–60 prosenttia enimmäisvedenpidätyskyvystä.
|
|
15.
|
Kuiva keinomaa esikostutetaan lisäämällä siihen riittävästi deionisoitua vettä, jotta noin puolet lopullisesta vesipitoisuudesta saavutetaan 2–7 päivää ennen testin aloittamista happamuuden tasapainottamiseksi/vakauttamiseksi. Maan ja 1 M:n kaliumkloridin (KCl) tai 0,01 M:n kalsiumkloridin (CaCl2) pH-arvon määrittämisessä käytetään liuosta suhteessa 1:5 (lisäyksen 6 mukaisesti). Jos maa on vaadittua vaihteluväliä happamampaa, sitä voidaan muokata lisäämällä tarvittava määrä CaCO3:a. Jos maa on liian emäksistä, sitä voidaan muokata lisäämällä epäorgaanista happoa, joka on hyppyhäntäisille vaaratonta.
|
|
16.
|
Esikostutettu maa jaetaan osioihin, jotka vastaavat testissä käytettävien testipitoisuuksien (ja tarvittaessa vertailukemikaalien) ja kontrollien lukumäärää. Lopuksi maa-ainekseen lisätään testikemikaalit ja vesipitoisuus säädetään 24 kohdan mukaisesti.
|
Koe-eläinten valinta ja valmistelu
|
17.
|
Suositeltu laji on partenogeneettinen F. candida, koska testimenetelmän rengastestauksessa (11) tämä laji täytti eloonjäämistä koskevat validiteettikriteerit useammin kuin F. fimetaria. Jos vaihtoehtoista lajia käytetään, sen on täytettävä 9 kohdassa esitetyt validiteettikriteerit. Testin alussa eläinten tulee olla hyvin ruokittuja, ja iältään niiden tulee olla 23–26 päivää (F. fimetaria) ja 9–12 päivää (F. candida). Jokaisessa rinnakkaisnäytteessä F. fimetaria -lajista tulee olla 10 koirasta ja 10 naarasta. F. candida -lajista tulee käyttää 10:tä naarasta (ks. lisäys 2 ja lisäys 3). Synkroniset eläimet valitaan niiden säilytysastioista satunnaisotannalla, ja niiden terveys ja fyysinen kunto tarkastetaan jokaisesta rinnakkaisnäytteeseen lisättävästä erästä. Kukin 10–20 yksilöstä koostuva ryhmä laitetaan satunnaisesti valittuun testisäiliöön. F. fimetaria -lajista valitaan isoja naaraita, jotta ne erotetaan kunnolla F. fimetaria -koiraista.
|
Testipitoisuuksien valmistelu
|
18.
|
Testikemikaalin lisäämisessä voi käyttää neljää menetelmää: 1) testikemikaali sekoitetaan maahan käyttämällä vettä kantoaineena, 2) testikemikaali sekoitetaan maahan käyttämällä orgaanista liuotinta kantoaineena, 3) testikemikaali sekoitetaan maahan käyttämällä hiekkaa kantoaineena ja 4) testikemikaali applikoidaan maan pintakerrokseen. Sopiva menetelmä valitaan kemikaalin ominaisuuksien ja testin tarkoituksen mukaan. Yleensä testikemikaalin sekoittaminen maahan on suositeltavaa. Sellaiset applikointimenetelmät, jotka vastaavat sitä, miten testikemikaalia käytetään käytännössä, saattavat kuitenkin olla tarpeen (esimerkiksi nestemäisen valmisteen suihkuttaminen tai tiettyjen torjunta-ainevalmisteiden, kuten rakeiden tai siementen peittausaineen käyttäminen). Maa käsitellään ennen hyppyhäntäisten lisäämistä paitsi silloin, kun testikemikaali lisätään maan pintakerrokseen; tällöin hyppyhäntäisten on annettava kaivautua maahan ennen kemikaalin lisäämistä.
|
Vesiliukoinen testikemikaali
|
19.
|
Testikemikaalista ja deionisoidusta vedestä valmistetaan sellainen määrä liuosta, joka riittää yhden testipitoisuuden kaikkiin neljään rinnakkaisnäytteeseen. Kukin testikemikaaliliuos sekoitetaan perinpohjaisesti yhteen erään esikostutettua maata, ennen kuin se laitetaan testiastiaan.
|
Veteen liukenematon testikemikaali
|
20.
|
Jos kemikaali ei liukene veteen, vaan orgaanisiin liuottimiin, testikemikaali voidaan liuottaa pienimpään mahdolliseen määrään sopivaa liuotinta (esimerkiksi asetonia). Sen jälkeen kemikaali on sekoitettava maahan perusteellisesti. Tarvittaessa se on sekoitettava pieneen määrään kvartsihiekkaa. Ainoastaan haihtuvia liuottimia saa käyttää. Kun käytetään orgaanista liuotinta, kaikissa testipitoisuuksissa ja negatiivisessa liuotinkontrollissa on oltava sama vähimmäismäärä liuotinta. Applikaatiosäiliöt on pidettävä jonkin aikaa peittämättöminä, jotta testikemikaalin applikointiin liittyvä liuotin haihtuu. Näin varmistetaan, että myrkyllistä kemikaalia ei tässä vaiheessa häviä.
|
Huonosti veteen ja orgaanisiin liuottimiin liukeneva testikemikaali
|
21.
|
Kun kemikaalit liukenevat huonosti veteen ja orgaanisiin liuottimiin, kvartsihiekkaa – jonka tulee olla osa maahan sekoitettavan hiekan kokonaismäärää – sekoitetaan testikemikaaliin, jotta saadaan haluttu testipitoisuus. Tämä kvartsihiekan ja testikemikaalin seos lisätään esikostutettuun maahan ja sekoitetaan hyvin sopivaan määrään deionisoitua vettä, jotta saadaan tarvittava kosteuspitoisuus. Lopullinen seos jaetaan testiastioihin. Menettely toistetaan jokaisen testipitoisuuden yhteydessä, ja myös asianmukainen kontrolli valmistellaan.
|
Testikemikaalin applikointi maan pintakerrokseen
|
22.
|
Kun testikemikaali on torjunta-aine, voi olla asianmukaista applikoida se maan pintakerrokseen suihkuttamalla. Maa käsitellään vasta sitten, kun hyppyhäntäiset on lisätty. Testisäiliöihin täytetään ensin kostutettua maasubstraattia, sen jälkeen lisätään eläimet ja lopuksi testisäiliöt punnitaan. Jotta vältetään eläinten suora altistuminen testikemikaalille suoran kosketuksen vuoksi, testikemikaali applikoidaan vähintään puoli tuntia sen jälkeen, kun hyppyhäntäiset on laitettu säiliöön. Testikemikaali tulee applikoida maan pinnalle mahdollisimman tasaisesti käyttämällä sopivaa laboratoriossa käytettävää suihkutuslaitetta. Näin simuloidaan torjunta-aineen suihkuttamista pellolla. Applikointi tulisi tehdä olosuhteissa, joissa lämpötila vaihtelee ± 2 °C, ja vesiliuokset, emulsiot tai dispersiot tulee applikoida veden annostusnopeudella riskinarviointiin perustuvien suositusten mukaisesti. Nopeus on varmistettava käyttämällä asianmukaista kalibrointitekniikkaa. Tietyt valmisteet, kuten rakeet tai siementen peittausaineet, voidaan applikoida samalla tavalla kuin maataloudessa. Eläinten ruoka lisätään suihkutuksen jälkeen.
|
MENETTELY
Testiolosuhteet
|
23.
|
Testin keskilämpötilan tulee olla 20 ± 1 °C, ja lämpötilan vaihteluväli saa olla 20 ± 2 °C. Testi toteutetaan valoisaa ja pimeää aikaa säätelemällä (mieluiten 12 tuntia valoisaa ja 12 tuntia pimeää). Testiastioiden alueella tulisi olla 400–800 luksin valaistus.
|
|
24.
|
Maan kosteuden tarkistamiseksi astiat punnitaan testin alussa, keskivaiheilla ja lopussa. Jos astian paino on pienentynyt yli kaksi prosenttia, astiaan lisätään deionisoitua vettä. Veden häviämistä voidaan vähentää pitämällä testi-inkubaattorissa suuri ilmankosteus (> 80 prosenttia).
|
|
25.
|
pH-arvo on mitattava sekä pitoisuusalueen määritystestin että varsinaisen testin alussa ja lopussa. Mittaukset on tehtävä yhdestä ylimääräisestä kontrollinäytteestä ja yhdestä ylimääräisestä näytteestä, joka on otettu käsiteltyjen maa-ainesten näytteistä (kaikki pitoisuudet) ja joka on valmisteltu ja ylläpidetty samalla tavalla kuin koeviljelmät mutta johon ei ole lisätty hyppyhäntäisiä.
|
Testimenettely ja mittaukset
|
26.
|
Jokaisesta testipitoisuudesta laitetaan testiastiaan sellainen määrä testimaata, joka vastaa 30 gramman tuorepainoa. Lisäksi valmistellaan vesikontrollit, joihin ei lisätä testikemikaalia. Jos testikemikaalin applikoinnissa käytetään kantoainetta, koesarjojen lisäksi tulee tehdä yksi kontrollisarja, joka sisältää pelkästään kantoainetta. Liuottimen tai dispergointiaineen pitoisuuden olisi oltava sama kuin testikemikaalia sisältävissä testiastioissa.
|
|
27.
|
Yksittäiset hyppyhäntäiset siirretään kuhunkin testiastiaan varovasti (jaotellen ne testiastioihin satunnaisesti) asettamalla ne maa-aineksen pinnalle. Jotta eläinten siirto olisi tehokasta, voidaan käyttää imulaitetta, jonka imuteho on pieni. Testipitoisuuksien rinnakkaisnäytteiden ja kontrollien lukumäärä määräytyy käytettävän testisuunnitelman mukaan. Testiastiat sijoitetaan testi-inkubaattoriin satunnaisesti, ja astioiden paikkoja muutetaan satunnaisesti viikoittain.
|
|
28.
|
F. fimetaria -testissä yhdessä testiastiassa tulee olla 20 aikuista eläintä, joista 10 on koirasta ja 10 naarasta ja joiden ikä on 23–26 päivää. Päivänä 21 hyppyhäntäiset otetaan pois maa-aineksesta ja lasketaan. F. fimetarian osalta sukupuolet erotellaan koon perusteella testissä käytetystä synkronisoidusta eläinerästä. Naaraat ovat selvästi suurempia kuin koiraat (ks. lisäys 3).
|
|
29.
|
F. candida -testissä yhdessä testiastiassa tulee olla kymmenen eläintä, joiden ikä on 9–12 päivää. Päivänä 28 hyppyhäntäiset poistetaan maa-aineksesta ja lasketaan.
|
|
30.
|
Sopiva ravinnonlähde on jauhemainen leivontakuivahiiva, jota on saatavilla tavallisista ruokakaupoista. Sitä lisätään jokaiseen säiliöön riittävä määrä, esimerkiksi 2–10 grammaa, testin alussa ja noin kahden viikon kuluttua.
|
|
31.
|
Testin lopussa arvioidaan kuolleisuutta ja lisääntymistä. Kolmen viikon (F. fimetaria) tai neljän viikon (F. candida) kuluttua hyppyhäntäiset uutetaan maa-aineksesta (ks. lisäys 4) ja lasketaan (12). Hyppyhäntäinen merkitään kuolleeksi, jos sitä ei löydetä maa-aineksen seasta. Uutto- ja laskemismenetelmä on validoitava. Yksi validiteettikriteeri on se, että nuorten eläinten uuttotehokkuus on yli 95 prosenttia, mikä saadaan aikaan esimerkiksi lisäämällä maa-ainekseen tietty määrä eläimiä.
|
|
32.
|
Testimenetelmän yhteenveto ja aikataulu on kuvattu lisäyksessä 2.
|
Testisuunnitelma
Pitoisuusalueen määritystesti
|
33.
|
Tarvittaessa pitoisuusalueen määritystesti toteutetaan esimerkiksi siten, että siinä on viisi testikemikaalipitoisuutta (0,1, 1,0, 10, 100 ja 1 000 mg/kg maa-aineksen kuivapainoon nähden), kaksi rinnakkaisnäytettä jokaisesta käsittelystä ja kontrolli. Samankaltaisilla kemikaaleilla tehdyistä testeistä tai kirjallisuudesta saadut lisätiedot hyppyhäntäisten kuolleisuudesta tai lisääntymisestä voivat olla hyödyllisiä, kun päätetään pitoisuusalueen määritystestissä käytettävien pitoisuuksien vaihteluvälistä.
|
|
34.
|
Pitoisuusalueen määritystestin kesto on kaksi viikkoa F. fimetarian osalta ja kolme viikkoa F. candidan osalta. Näin varmistetaan, että ne tuottavat yhden poikueen jälkeläisiä. Testin lopussa arvioidaan hyppyhäntäisten kuolleisuus ja lisääntyminen. Aikuisten lukumäärä ja jälkeläisten olemassaolo on kirjattava.
|
Varsinainen testi
|
35.
|
Jotta ECx-arvo voidaan määrittää (esimerkiksi EC10, EC50), tulee testata 12 pitoisuutta. Jokaista testipitoisuuskäsittelyä kohti suositellaan vähintään kahta rinnakkaisnäytettä ja kuutta kontrollirinnakkaisnäytettä. Porrastuskerroin voi vaihdella annos-vastemallin mukaisesti.
|
|
36.
|
NOEC/LOEC-arvojen määrittämisessä tulee testata vähintään viisi pitoisuutta geometrisessa sarjassa. Jokaista testipitoisuuskäsittelyä kohti suositellaan neljää rinnakkaisnäytettä ja kahdeksaa kontrollia. Pitoisuudet on porrastettava kertoimella, joka saa olla enintään 1,8.
|
|
37.
|
Yhdistetty lähestymistapa mahdollistaa sekä NOEC/LOEC-arvojen että ECx-arvon määrittämisen. Yhdistettyä lähestymistapaa sovellettaessa on käytettävä kahdeksaa käsittelypitoisuutta geometrisessa sarjassa. Jokaista käsittelyä kohti suositellaan neljää rinnakkaisnäytettä ja kahdeksaa kontrollia. Pitoisuudet on porrastettava kertoimella, joka saa olla enintään 1,8.
|
|
38.
|
Jos pitoisuusalueen määritystestissä ei havaita vaikutuksia suurimmalla pitoisuudella (esimerkiksi 1 000 mg/kg), lisääntymistesti voidaan toteuttaa raja-annostestinä käyttäen testipitoisuutta 1 000 mg/kg ja kontrollia. Raja-annostestin avulla on mahdollista osoittaa, ettei rajapitoisuus aiheuta tilastollisesti merkitsevää vaikutusta. Sekä käsitellyn maa-aineksen että kontrollin osalta tulee käyttää kahdeksaa rinnakkaisnäytettä.
|
TIEDOT JA RAPORTOINTI
Tulosten käsittely
|
39.
|
Pääasiallinen päätetapahtuma on lisääntymistulos (ts. testiastiaa kohti tuotettujen jälkeläisten määrä). Tilastollisessa analyysissa eli ANOVA-menettelyissä käsittelyjä verrataan Studentin t-testillä, Dunnettin testillä tai Williamsin testillä. Jokaisen käsittelyn keskiarvoille lasketaan 95 prosentin luottamusvälit.
|
|
40.
|
Käsittelemättömissä kontrolleissa elossapysyneiden aikuisten määrä on keskeinen validiteettikriteeri, ja se on dokumentoitava. Pitoisuusalueen määrittämistestin tavoin kaikki muut merkit kemikaalin vaarallisuudesta on raportoitava loppuraportissa.
|
LCx ja ECx
|
41.
|
ECx-arvot sekä niihin liittyvät parametrin 95 prosentin luottamusvälin ylä- ja alarajat lasketaan asianmukaisilla tilastomenetelmillä (ts. logistisella tai Weibullin funktiolla, trimmatulla Spearman-Kärberin menetelmällä tai yksinkertaisella interpoloinnilla). ECx-arvo saadaan lisäämällä yhtälöön arvo, joka vastaa x:ää prosenttia kontrollin keskiarvosta. EC50 -arvon tai minkä tahansa muun ECx-arvon laskemiseksi koko aineistolle on tehtävä regressioanalyysi. LC50-arvo arvioidaan yleensä Probit-analyysilla tai muulla vastaavalla analyysilla, jossa otetaan huomioon binomiaalisesti jakautuneet kuolleisuustiedot.
|
NOEC/LOEC
|
42.
|
Jos tilastollisella analyysilla on tarkoitus määrittää NOEC/LOEC-arvo, astiakohtaiset tilastot (yksittäisiä astioita pidetään rinnakkaisnäytteinä) ovat tarpeen. Asianmukaisia tilastomenetelmiä tulee käyttää ekotoksisuustietojen tilastollisessa analyysissa sovellettavia nykyisiä lähestymistapoja koskevan OECD:n asiakirjan nro 54 mukaan (Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application) (9). Yleensä kontrolliin verrattavan testikemikaalin aiheuttamia haittavaikutuksia tutkitaan käyttämällä yksisuuntausta hypoteesitestausta, jossa p ≤ 0,05.
|
|
43.
|
Normaalijakaumaa ja varianssin homogeenisuutta voidaan testata käyttämällä asianmukaista tilastollista testiä, kuten Shapiro-Wilkin testiä ja Levenen testiä (p ≤ 0,05). Myös yksisuuntainen varianssianalyysi (ANOVA) ja sen jälkeiset monivertailutestit voidaan toteuttaa. Monivertailuja (esimerkiksi Dunnettin testiä) tai alaspäin askeltavia trenditestejä (esimerkiksi Williamsin testiä) voidaan käyttää sen laskemiseen, onko kontrollien ja eri testikemikaalipitoisuuksien välillä merkitseviä eroja (p ≤ 0,05) (suositellun testin valinta OECD:n ohjeasiakirjan (TG) nro 54 mukaan (9)). Muutoin NOEC- ja LOEC-arvojen määrittämisessä voidaan käyttää parametrittomia menetelmiä (esimerkiksi Bonferroni-U-testiä Holmin mukaan tai Jonckheere-Terpstran trenditestiä).
|
Raja-annostesti
|
44.
|
Jos raja-annostesti (kontrollin ja vain yhden käsittelyn vertailu) on tehty ja jos parametristen testimenetelmien vaatimukset (normaalius, homogeenisuus) täyttyvät, metrisiä vasteita voidaan arvioida Studentin testillä (t-testillä). Jos vaatimukset eivät täyty, voidaan käyttää t-testiä, jossa varianssit ovat heterogeenisia (Welchin t-testi) tai parametritonta testiä, kuten Mann-Whitneyn U-testiä.
|
|
45.
|
Kontrollien välisten (kontrolli ja liuotinkontrolli) merkitsevien erojen määrittämiseksi jokaisen kontrollin rinnakkaisnäytteet voidaan testata raja-annostestin yhteydessä kuvatulla tavalla. Jos näissä testeissä ei havaita merkitseviä eroja, kaikki kontrolli- ja liuotinkontrollirinnakkaisnäytteet voidaan yhdistää. Muussa tapauksessa kaikkia käsittelyjä tulee vertailla liuotinkontrolliin.
|
Testiraportti
|
46.
|
Testiraportin on sisällettävä vähintään seuraavat tiedot:
|
|
Testikemikaali
|
—
|
testikemikaalin tunnistetiedot, erät ja CAS-numero sekä puhtaus
|
|
—
|
testikemikaalin fysikaalis-kemialliset ominaisuudet (esimerkiksi log Kow, vesiliukoisuus, höyrynpaine, Henryn vakio (H) sekä mielellään myös tiedot testikemikaalin käyttäytymisestä maaperässä), mikäli saatavilla
|
|
—
|
testikemikaalin ja lisäaineiden koostumus on eriteltävä, jos testataan muu kuin puhdas kemikaali.
|
|
|
|
Testiorganismit
|
—
|
lajien ja testiorganismien toimittajan tiedot, kuvaus kasvatusolosuhteista ja testiorganismien ikärakenne
|
|
|
|
Testiolosuhteet
|
—
|
kuvaus kokeen rakenteesta ja menettelyistä
|
|
—
|
testimaa-aineksen valmistelutiedot; yksityiskohtainen erittely, jos käytetään luonnonmaata (alkuperä, historia, hiukkaskokojakauma, pH, orgaanisen aineksen pitoisuus)
|
|
—
|
maaperän vedenpidätyskyky
|
|
—
|
kuvaus tekniikasta, jolla testikemikaali on applikoitu maa-ainekseen
|
|
—
|
testiolosuhteet: valoteho, valoisien ja pimeiden jaksojen kesto, lämpötila
|
|
—
|
kuvaus eläinten ruokinnasta; testissä käytetyn ruoan tyyppi ja määrä, ruokintapäivämäärät
|
|
—
|
maa-aineksen pH ja vesipitoisuus testin alussa ja lopussa (kontrolli ja jokainen käsittely)
|
|
—
|
yksityiskohtainen kuvaus uuttomenetelmästä ja uuton tehokkuudesta.
|
|
|
|
Testitulokset
|
—
|
jokaisesta testiastiasta määritettyjen nuorten eläinten määrä testin lopussa
|
|
—
|
jokaisesta testiastiasta määritettyjen aikuisten eläinten määrä ja niiden kuolleisuus ( %) testin lopussa
|
|
—
|
kuvaus selvistä fysiologisista tai patologisista oireista tai selkeistä muutoksista käyttäytymisessä
|
|
—
|
vertailutestikemikaalista saadut tulokset
|
|
—
|
NOEC/LOEC-arvot, LCx-arvo kuolleisuusta ja ECx lisääntymisestä (useimmiten LC50, LC10, EC50ja EC10) sekä 95 prosentin luottamusvälit ja kaavio laskennassa käytetystä sovitetusta mallista sekä sen funktion yhtälö ja parametrit (ks. (9))
|
|
—
|
kaikki tulosten tulkinnan kannalta hyödylliset tiedot ja havainnot
|
|
—
|
varsinaisen testin todistusvoima, jos hypoteesin testaus on tehty (9)
|
|
—
|
poikkeukset tässä testimenetelmässä kuvatuista menettelyistä ja kaikki testin aikana ilmenneet epätavallisuudet
|
|
—
|
NOEC-arvon osalta (kun se on arvioitu) pienin havaittava ero.
|
|
|
LÄHDEKIRJALLISUUS
|
(1)
|
Wiles JA and Krogh PH (1998) Testing with the collembolans I. viridis, F. candida and F. fimetaria. In Handbook of soil invertebrate toxicity tests (ed. H Løkke and CAM Van Gestel), pp. 131–156. John Wiley & Sons, Ltd., Chichester.
|
|
(2)
|
ISO (1999) Soil Quality – Effects of soil pollutants on Collembola (Folsomia candida): Method for determination of effects on reproduction. No. 11267. International Organisation for Standardisation, Geneve.
|
|
(3)
|
Burges A and Raw F (Eds) (1967) Soil Biology. Academic Press. London.
|
|
(4)
|
Petersen H and Luxton M (1982) A comparative analysis of soil fauna populations and their role in decomposition processes. Oikos 39: 287–388.
|
|
(5)
|
Petersen H (1994) A review of collembolan ecology in ecosystem context. Acta Zoologica Fennica 195: 111–118.
|
|
(6)
|
Hopkin SP (1997). Biology of the Springtails (Insecta Collembola). Oxford University Press. 330pp (ISBN 0-19-854084-1).
|
|
(7)
|
Ulber B (1983) Einfluss von Onychirurus fimatus Gisin (Collembola, Onychiuridae) und Folsomia fimetaria L. (Collembola, Isotomidae) auf Pythium ultimum Trow. einen Erreger des Wurzelbrandes der Zuckerrübe. In New trends in soil Biology (Lebrun Ph, André HM, De Medts A, Grégoire-Wibo, Wauthy G (Eds), Proceedings of the VI. international colloquium on soil zoology, Louvain-la-neuve (Belgium), 30 August-2 September 1982, I Dieu-Brichart, Ottignies-Louvain-la-Neuve, pp. 261-268.
|
|
(8)
|
Tämän lisäyksen C.36 luku, Predatory mite (Hypoaspis (Geolaelaps) aculeifer) reproduction test in soil.
|
|
(9)
|
OECD (2006), Current approaches in the statistical analysis of ecotoxicity data: a guidance to application. OECD series on testing and assessment Number 54, ENV/JM/MONO(2006)18, OECD Paris.
|
|
(10)
|
Scott-Fordsmand JJ and Krogh PH (2005) Background report on prevalidation of an OECD springtail test guideline. Environmental Project Nr. 986. Miljøstyrelsen 61 pp. Danish Ministry for the Environment.
|
|
(11)
|
Krogh, P.H., 2009. Toxicity testing with the collembolans Folsomia fimetaria and Folsomia candida and the results of a ringtest. Danish Environmental Protection Agency, Environmental Project No. 1256, pp. 66.
|
|
(12)
|
Krogh PH, Johansen K and Holmstrup M (1998) Automatic counting of collembolans for laboratory experiments. Appl. Soil Ecol. 7, 201–205.
|
|
(13)
|
Fjellberg A (1980) Identification keys to Norwegian collembolans. Norsk Entomologisk Forening.
|
|
(14)
|
Edwards C.A. (1955) Simple techniques for rearing Collembola, Symphyla and other small soil inhabiting arthropods. In Soil Zoology (Kevan D.K. McE., Ed). Butterworths, London, pp. 412–416.
|
|
(15)
|
Goto HE (1960) Simple techniques for the rearing of Collembola and a not on the use of a fungistatic substance in the cultures. Entomologists' Monthly Magazine 96:138–140.
|
Lisäys 1
Määritelmät
Tässä testimenetelmässä sovelletaan seuraavia määritelmiä (tässä testissä kaikki vaikuttavat pitoisuudet ilmaistaan testikemikaalin massana testimaan kuivamassaa kohti):
|
|
Kemikaali on aine tai seos.
|
|
|
NOEC (no observed effect concentration = pitoisuus, joka ei aiheuta havaittavaa vaikutusta) on se testikemikaalin pitoisuus, josta ei aiheudu vaikutuksia. Tässä testissä NOEC-arvoa vastaavalla pitoisuudella ei ole tilastollisesti merkitsevää vaikutusta (p < 0,05) tietyn altistusjakson aikana kontrolliin verrattuna.
|
|
|
LOEC (lowest observed effect concentration = pienin havaittavan vaikutuksen aiheuttava pitoisuus) on testikemikaalin pienin pitoisuus, jolla on tilastollisesti merkitsevä vaikutus (p < 0,05) tietyn altistusjakson aikana kontrolliin verrattuna.
|
|
|
ECx (Effect concentration for x % effect = vaikuttava pitoisuus, joka aiheuttaa x prosenttia muutoksia) on pitoisuus, joka aiheuttaa x prosentin suuruisen vaikutuksen testiorganismeihin tietyn altistusjakson aikana kontrolliin verrattuna. Esimerkiksi EC50-arvo on pitoisuus, jonka on arvioitu aiheuttavan vaikutuksen testiominaisuuteen 50 prosentilla altistuneesta populaatiosta tietyn altistusjakson aikana.
|
|
|
Testikemikaali on tätä testimenetelmää käyttäen testattu aine tai seos.
|
Lisäys 2
Tärkeimmät toimenpiteet ja hyppyhäntäistestin toteuttamisen aikataulu
Testin vaiheet voidaan tiivistää seuraavasti:
|
Aika (päivä)
|
Toiminta
|
|
-23 – -26
|
Synkronisen F. fimetaria -viljelmän valmistelu
|
|
-14
|
Keinomaan valmistus (kuivien ainesosien sekoitus)
Keinomaan pH:n tarkistus ja sen säätäminen tarvittaessa
Maan enimmäisvedenpidätyskyvyn mittaus
|
|
-9 – -12
|
Synkronisen F. candida -viljelmän valmistelu
|
|
-2 – -7
|
Maan esikostutus
|
|
–1
|
Nuorten eläinten jakaminen eriin
Varastoliuosten valmistus ja testikemikaalin lisääminen, jos liuotin on tarpeen
|
|
0
|
Varastoliuosten valmistus ja testikemikaalin lisääminen, jos tarvitaan kiinteä tai vesiliukoinen kemikaali tai jos kemikaali pitää applikoida maan pintaan.
Maan pH:n mittaus ja säiliöiden punnitus
Ruoan lisäys, hyppyhäntäisten laittaminen testiastioihin
|
|
14
|
Pitoisuusalueen määritystesti F. fimetaria: testin päättäminen, eläinten uuttaminen, maan pH:n ja vesihävikin mittaus (paino)
Varsinaiset testit: mittaa kosteuspitoisuus ja lisää vettä sekä 2–10 mg hiivaa
|
|
21
|
Varsinainen F. fimetaria -testi: testin päättäminen, eläinten uuttaminen, maan pH:n ja vesihävikin mittaus (paino)
Pitoisuusalueen määritystesti F. candida: testin päättäminen, eläinten uuttaminen, maan pH:n ja vesihävikin mittaus (paino)
|
|
28
|
Varsinainen F. candida -testi: testin päättäminen, eläinten uuttaminen, maan pH:n ja vesihävikin mittaus (paino)
|
Lisäys 3
Ohjeet F. fimetaria- ja F. candida -lajien kasvattamista ja synkronointia varten
Näissä ohjeissa annetut ajat ja kestot on tarkistettava jokaisen hyppyhäntäiskannan osalta, jotta voidaan varmistaa, että ajoitus mahdollistaa nuorten eläinten riittävän synkronisoinnin. Sen jälkeen, kun aikuiset eläimet on siirretty tuoreeseen substraattiin, muninta ja munien kuoriutuminen määräävät sen päivän, jolloin munat ja synkronisesti kehittyvät nuoret eläimet kerätään.
On suositeltavaa pitää pysyvää varastoviljelmää, joka sisältää esimerkiksi 50 säiliötä/petrimaljaa. Varastoviljelmää on ruokittava hyvin; ruokaa on annettava ja viljelmä on kasteltava viikoittain, ja myös vanha ruoka ja jäännökset on poistettava. Jos substraatissa on liian vähän hyppyhäntäisiä, sienien kasvun lisääntyminen saattaa aiheuttaa inhibitiota. Jos varastoviljelmää käytetään munien tuotantoon liian usein, viljelmä voi väsyä. Sen merkkejä ovat kuolleet aikuiset ja home substraatissa. Synkronisten eläinten tuotannosta jäljelle jääneitä munia voidaan käyttää viljelmän uudistamiseen.
Synkronisessa F. fimetaria -viljelmässä koiraat erotetaan naaraista pääasiassa koon perusteella. Koiraat ovat selvästi pienempiä kuin naaraat, ja koiraat liikkuvat nopeammin kuin naaraat. Oikean sukupuolen valinta vaatii hieman harjoitusta. Sukupuoli voidaan vahvistaa sukupuolielinten alueen mikroskooppisella tutkimuksella (13).
1. Kasvatus
1.a. Kasvatusalustan valmistelu
Kasvatusalusta on kipsiä (kalsiumsulfaattia), joka sisältää myös aktiivihiiltä. Näin saadaan aikaan kostea alusta. Hiilen tehtävänä on imeä jätekaasuja ja eritteitä (14) (15). Hiilestä saa käyttää erilaisia tyyppejä, jotta hyppyhäntäisten havainnointi on mahdollista. F. candida- ja F. fimetaria -lajien kanssa käytetään esimerkiksi jauhemaista hiiltä (lopputuloksena on mustaa tai harmaata kipsiä):
Alustan ainesosat:
tai
|
—
|
50 g jauhemaista aktiivihiiltä
|
|
—
|
260–300 ml tislattua vettä
|
Alustaseoksen on annettava asettua ennen käyttöä.
1.b. Kasvatus
Hyppyhäntäisiä pidetään sopivissa säiliöissä, esimerkiksi petrimaljoissa (90 mm × 13 mm), joiden pohjalla on 0,5 cm:n kerros kipsistä ja hiilestä valmistettua substraattia. Niiden kasvatuslämpötila on 20 ± 1 °C ja valoisan ja pimeän vaihteluväli on 12/12 tuntia (400–800 luksia). Säiliöt pidetään kosteina, ja on varmistettava, että säiliöiden suhteellinen ilmankosteus on jatkuvasti 100 prosenttia. Tämä voidaan taata siten, että huokoisessa kipsissä on aina vapaata vettä, mutta vesikalvon muodostumista kipsipinnan päälle on kuitenkin vältettävä. Veden häviämistä voidaan ehkäistä pitämällä ympäröivä ilma kosteana. Säiliöistä pitää poistaa kaikki kuolleet yksilöt ja homeinen ruoka. Munantuotannon edistämiseksi aikuiset eläimet tulee siirtää petrimaljoihin, joissa on tuoretta kipsi-hiilisubstraattia.
1.c. Ravinto
Sekä F. candidaa että F fimetariaa ruokitaan ainoastaan kuivahiivajauheella. Tuoretta ruokaa annetaan kerran tai kahdesti viikossa homehtumisen välttämiseksi. Ruoka laitetaan suoraan kipsin päälle pieneen kasaan. Leivontahiivan määrä tulee mukauttaa hyppyhäntäispopulaation koon mukaan, mutta yleensä 2–15 g riittää.
2. Synkronisointi
Testi on tehtävä synkronisilla eläimillä, jotta käytettävissä on samassa kehitysvaiheessa olevia ja samankokoisia homogeenisia koe-eläimiä. Lisäksi synkronisointi mahdollistaa F. fimetaria -koiraiden ja naaraiden erottelun kolmen viikon iästä alkaen naaraiden ja koiraiden erilaisuuden, ts. kokoerojen perusteella. Jäljempänä esitetty menettely on esimerkki siitä, miten saadaan synkronisoituja elimiä (käytännön vaiheet ovat valinnaisia).
2.a. Synkronisointi
|
—
|
Laita säiliöihin 0,5 cm:n kerros kipsi-hiilisubstraattia.
|
|
—
|
Siirrä 150–200 aikuista F. fimetaria- ja 50–100 F. candida -lajin hyppyhäntäistä munintaa varten 15–20 parhaasta varastoviljelmäsäiliöstä, joiden kasvatusalusta on 4–8 viikkoa vanhaa, säiliöihin ja ruoki niitä 15 mg:lla leivontahiivaa. Vältä laittamasta nuoria eläimiä aikuisten sekaan, koska niiden läsnäolo saattaa estää munantuotannon.
|
|
—
|
Pidä viljelmä 20 ± 1 °C:n lämpötilassa (keskilämpötilan tulisi olla 20 °C) ja huolehdi siitä, että valoisan ja pimeän vaihteluväli on 12/12 tuntia (400–800 luksia). Varmista, että saatavilla on tuoretta ruokaa ja että ilma on tarpeeksi kosteaa. Jos ruokaa ei ole, eläimet saattavat ulostaa munien päälle, jolloin niissä alkaa kasvaa sientä. F. candida -lajin eläimet voivat myös syödä omia muniaan. Kymmenen päivän kuluttua munat kerätään varovasti neulalla ja lastalla. Ne siirretään ’munapaperille’ (pienille suodatinpaperipaloille, jotka on kastettu kipsi-hiilimassaan), joka asetetaan tuoretta kipsi-hiilisubstraattia sisältävään säiliöön. Substraattiin lisätään muutama murunen hiivaa, joka houkuttelee nuoret eläimet pois munapaperilta. On tärkeää, että munapaperi ja substraatti ovat kosteita, sillä muuten munat kuivuvat. Vaihtoehtoisesti aikuiset eläimet voidaan poistaa synkronisointikasvatuslaatikoista muninnan jälkeen kahdeksi tai kolmeksi päiväksi.
|
|
—
|
Kolmen päivän kuluttua useimmat munapaperilla olevat munat ovat kuoriutuneet; myös munapaperin alla saattaa olla nuoria eläimiä.
|
|
—
|
Jotta testissä olisi samanikäisiä nuoria eläimiä, munapaperi ja kuoriutumattomat munat poistetaan petrimaljasta pinseteillä. Nuoret eläimet, joiden ikä on 0–3 päivää, jäävät maljaan ja syövät ravinnokseen leivontahiivaa. Kuoriutumattomat munat hävitetään.
|
|
—
|
Munia ja kuoriutuneita nuoria eläimiä kasvatetaan samalla tavalla kuin aikuisia. Etenkin F. fimetarian kohdalla on varmistettava, että tuoretta ruokaa on riittävästi ja että vanha homehtuva ruoka poistetaan. Lisäksi nuoret eläimet siirretään uusiin petrimaljoihin viikon kuluttua, jos niiden tiheys on yli 200.
|
2.b. Hyppyhäntäisten käsittely testin alussa
|
—
|
F. candida -yksilöt, joiden ikä on 9–12 päivää, tai F. fimetaria -yksilöt, joiden ikä on 23–26 päivää, kerätään esimerkiksi imulla ja siirretään pieneen säiliöön, jossa on kosteaa kipsi-hiilisubstraattia. Sen jälkeen niiden fyysinen kunto tarkastetaan kaksiokulaarisella mikroskoopilla (loukkaantuneet ja vaurioituneet eläimet hävitetään). Kaikki vaiheet tulee tehdä pitämällä hyppyhäntäiset kosteassa ympäristössä kuivuudesta aiheutuvan stressin välttämiseksi käyttämällä esimerkiksi märkiä pintoja jne.
|
|
—
|
Käännä säiliö ylösalaisin ja koputa sen pohjaan, jotta hyppyhäntäiset kulkeutuvat maa-ainekseen. Staattinen sähkövaraus tulee neutraloida, muuten eläimet saattavat vain lentää ilmaan tai liimautua testisäiliön seinämään ja kuivua. Neutralointiin voi käyttää ionisaattoria tai kosteaa liinaa säiliön alla.
|
|
—
|
Ruoka tulisi levittää maa-aineksen koko pinnan laajuudelle, ei siis vain yhteen kasaan.
|
|
—
|
Siirto- ja testausvaiheen aikana tulee välttää kopauttamasta testisäiliöihin tai häiritsemästä eläimiä muulla tavoin, koska se saattaa lisätä maa-aineksen tiivistymistä ja häiritä hyppyhäntäisten välistä vuorovaikutusta.
|
3. Vaihtoehtoiset hyppyhäntäislajit
Tämän testimenetelmän mukaiseen testaukseen voi valita myös muita hyppyhäntäislajeja, esimerkiksi seuraavia: Proisotoma minuta, Isotoma viridis, Isotoma anglicana, Orchesella cincta, Sinella curviseta, Paronychiurus kimi, Orthonychiurus folsomi ja Mesaphorura macrochaeta. Tiettyjen vaatimusten on kuitenkin täytyttävä ennen vaihtoehtoisten lajien käyttämistä:
|
—
|
Ne on täytynyt tunnistaa yksiselitteisesti.
|
|
—
|
Lajien valinnan perustelut on ilmoitettava.
|
|
—
|
On varmistettava, että testausvaiheeseen sisältyy lisääntymisbiologia, jotta se olisi mahdollinen vaikutusten kohde altistuksen aikana.
|
|
—
|
Eläinten elinhistoria on tunnettava: ikä täysikasvuiseksi kehittymisen hetkellä, munien kehittymisen kesto sekä altistuksen aikainen kehitysvaihe.
|
|
—
|
Kasvuun ja lisääntymiseen on oltava ihanteelliset olosuhteet, jotka saadaan aikaan testisubstraatin ja ravinnon avulla.
|
|
—
|
Vaihtelun tulee olla riittävän vähäistä, jotta myrkyllisyys voidaan arvioida tarkasti ja täsmällisesti.
|
Lisäys 4
Eläinten uuttaminen ja laskeminen
1. Uuttaminen voidaan tehdä kahdella menetelmällä.
|
1.a.
|
Ensimmäinen menetelmä: Tässä menetelmässä voidaan käyttää säädettävää lämpötilagradienttia uuttolaitetta, joka perustuu MacFadyenin periaatteisiin (1). Lämpö tulee uuttolaatikon päällä olevasta lämmityselementistä (ja sitä säädellään termistorilla, joka asetetaan maanäytteen pinnalle). Keruuastiaa ympäröivän jäähdytysnesteen lämpötilaa säädellään termistorilla, joka sijaitsee keruulaatikon pinnalla (se asetetaan maa-aineksen ytimen alle). Termistorit liitetään ohjelmoitavaan ohjauslaitteeseen, joka nostaa lämpötilaa ohjelmoidun aikataulun mukaisesti. Eläimet kerätään jäähdytettyyn keruuastiaan (2 °C), jonka pohjalla on kipsi-hiilikerros. Uutto aloitetaan 25 °C:ssa, ja lämpötilaa nostetaan automaattisesti 12 tunnin välein 5 °C:lla. Uuton kokonaiskesto on 48 tuntia. Uutto päättyy, kun lämpötila on ollut 12 tunnin ajan 40 °C.
|
|
1.b.
|
Toinen menetelmä: Kokeellisen inkubaatiovaiheen nuorten hyppyhäntäisten lukumäärä arvioidaan flotaatiotutkimuksessa. Testi tehdään astioissa, joiden tilavuus on noin 250 ml. Testin lopuksi astioihin lisätään noin 200 ml tislattua vettä. Maa-ainesta sekoitetaan hienoharjaksisella siveltimellä, jotta hyppyhäntäiset nousevat kellumaan vedenpinnalle. Veteen voi lisätä pienen määrän, noin 0,5 ml, Kentmere Photographicin mustaa väriainetta. Se auttaa eläinten laskemista lisäämällä veden ja valkoisten hyppyhäntäisten välistä kontrastia. Väriaine ei ole hyppyhäntäisille myrkyllistä.
|
2. Laskeminen:
Eläinten lukumäärät voidaan laskea paljain silmin tai valomikroskoopilla, jolloin kellunta-astian päälle tulee laittaa ristikko, tai valokuvaamalla jokaisen astian pinta ja laskemalla hyppyhäntäiset myöhemmin suurennetuista kuvista tai valkokankaalle heijastetuista diakuvista. Laskenta voidaan tehdä myös käyttämällä digitaalisia kuvankäsittelytekniikoita (12). Kaikki tekniikat on validoitava.
Lisäys 5
Maan enimmäisvedenpidätyskyvyn määrittäminen
Seuraavan menetelmän, jolla määritetään maan enimmäisvedenpidätyskyky, on havaittu olevan tarkoituksenmukainen. Se on kuvattu saasteiden vaikutuksia maan laatuun koskevan ISO DIS 11268-2 (Soil Quality – Effects of pollutants on earthworms (Eisenia fetida) Osa 2: Method for determination of effects on reproduction) -standardin liitteessä C.
Kerää tietty määrä (esimerkiksi viisi grammaa) testimaasubstraattia sopivalla näytteenottovälineellä (kierrekairalla tms.). Aseta kierrekairaputken pohjalle pala märkää suodatinpaperia, ja laita se sitten telineessä vesiastiaan. Putki tulee upottaa veteen vähitellen, kunnes vedenpinta on maanäytteen yläpuolella. Sen jälkeen näyte tulee pitää vedessä kolme tuntia. Koska kaikkea maa-aineksen kapillaareihin imeytynyttä vettä ei pystytä pidättämään, maanäytteen on annettava valua kahden tunnin ajan asettamalla putki hyvin märkään kerrokseen hienojakoista kvartsihiekkaa, joka on laitettu peitettävään astiaan (kuivumisen estämiseksi). Sen jälkeen näyte on punnittava ja kuivattava pysyvään massaan 105 °C:ssa. Vedenpidätyskyky (WHC) lasketaan seuraavasti:

jossa:
|
S
|
:
|
vesikyllästetty substraatti + putken massa + suodatinpaperin massa
|
|
T
|
:
|
taara (putken massa + suodatinpaperin massa)
|
|
D
|
:
|
substraatin kuivamassa.
|
Lisäys 6
Maan pH:n määrittäminen
Seuraava menetelmä, jolla määritetään maan pH-arvo, perustuu maan laatua koskevassa standardissa ISO DIS 10390: Soil Quality – Determination of pH olevaan kuvaukseen.
Tietyn määrän maata annetaan kuivua huoneenlämmössä vähintään 12 tunnin ajan. Sen jälkeen maasta valmistetaan suspensio (joka sisältää vähintään viisi grammaa maata), jonka tilavuus on viisinkertainen joko analyyttista laatua olevan 1 M kaliumkloridiliuoksen (KCl) tilavuuteen tai analyyttista laatua olevan 0,01 M kalsiumkloridiliuoksen (CaCl2) tilavuuteen nähden. Sen jälkeen suspensiota ravistetaan perinpohjaisesti viisi minuuttia, ja sen annetaan asettua vähintään kaksi mutta enintään 24 tuntia. Nestefaasin pH-arvo mitataan pH-mittarilla, joka kalibroidaan ennen jokaista mittausta käyttämällä asianmukaisia puskuriliuoksia (esimerkiksi pH 4,0 ja 7,0).
C.40. SURVIAISSÄÄSKEN KOKO SUKUPOLVEN KIERRON KÄSITTÄVÄ MYRKYLLISYYSTESTI, KÄYTTÄEN VETTÄ TAI SEDIMENTTIÄ, JOIHIN ON LISÄTTY TUTKITTAVAA AINETTA
JOHDANTO
|
1.
|
Tämä testimenetelmä vastaa OECD:n testiohjetta (TG) nro 233 (2010). Sen tarkoituksena on arvioida koko elinkaaren aikaisen kemikaaleille altistumisen vaikutuksia makeanveden kaksisiipisiin, jotka kuuluvat Chironomous sp. -lajiin. Tutkimus kattaa kokonaan ensimmäisen sukupolven (P-sukupolvi) ja toisen sukupolven varhaisvaiheen (F1-sukupolvi). Kyseessä on laajennus nykyiseen testimenetelmään C.28 (1) tai C.27 (15), joissa käytettävässä altistumisskenaariossa veteen tai sedimenttiin on lisätty tutkittavaa ainetta. Menetelmässä otetaan huomioon lajeja Chironomus riparius ja Chironomus dilutus (aiemmin nimeltään C. tentans (2)) koskevat myrkyllisyystestiprotokollat, jotka on laadittu Euroopassa ja Pohjois-Amerikassa (3) (4) (5) (6) (7) (8) (9) ja jotka on myöhemmin rengastestattu (1) (7) (10) (11) (12). Myös muita hyvin dokumentoituja surviaissääskilajeja, kuten Chironomus yoshimatsui -lajia (13)(14), voidaan käyttää. C. ripariuksen ja C. yoshimatsuin altistuksen kokonaiskesto on noin 44 päivää, ja C. dilutuksen osalta se on noin 100 päivää.
|
|
2.
|
Sekä vesi- että sedimenttialtistumisskenaariot kuvataan tässä testimenetelmässä. Soveltuvan altistusskenaarion valinta määräytyy testin sovellustarkoituksen mukaan. Vesialtistuksessa, jossa testiainetta lisätään vesipatsaaseen, tarkoituksena on simuloida torjunta-aineiden lentosumutusta. Se kattaa alkuhuippupitoisuudet pintavedessä. Testiaineen lisäämistä veteen voidaan käyttää myös muuntyyppisessä altistuksessa (myös kemikaalivuodoissa), mutta ei sellaisissa tutkimuksissa, joissa tarkastellaan sedimenttiin kertymisen prosesseja testausjaksoa pitemmän aikaa. Tässä tapauksessa ja myös silloin, kun valuma on torjunta-aineiden pääasiallinen kulkeutumisreitti vesistöihin, tutkimus, jossa sedimenttiin on lisätty testiainetta, voi olla sopivampi. Jos muut altistumisskenaariot ovat tarpeen, testin rakennetta voi muuttaa helposti. Esimerkiksi jos tietoa testikemikaalin jakaantumisesta vesifaasiin ja sedimenttikerrokseen ei tarvita ja jos sedimenttiin adsorptoituminen on minimoitava, keinotekoisen sedimenttikorvikkeen (kuten kvartsihiekan) käyttöä voidaan harkita.
|
|
3.
|
Kemikaalit, jotka edellyttävät sedimentissä elävien organismien testaamista, saattavat pysyä sedimentissä pitkiä aikoja. Sedimentissä elävät organismit voivat altistua useita reittejä pitkin. Jokaisen altistusreitin suhteellinen tärkeys sekä myrkylliseen kokonaisvaikutukseen vaadittava aika määräytyvät käytettävän kemikaalin fysikaalis-kemiallisten ominaisuuksien mukaan. Jos kyseessä on voimakkaasti adsorboiva kemikaali tai kemikaali, joka sitoutuu kovalenttisesti sedimenttiin, kontaminoituneen ravinnon nauttiminen voi olla tärkeä altistusreitti. Jotta hyvin rasvahakuisten aineiden myrkyllisyyttä ei aliarvioida, voidaan harkita ravinnon lisäämistä sedimenttiin ennen testiaineen lisäämistä (ks. 31 kohta). Näin ollen tutkimukseen on mahdollista ottaa mukaan kaikki altistumisreitit ja kaikki elinkaaren vaiheet.
|
|
4.
|
Mitattavat ominaisuudet ovat kehittyneiden aikuisten kokonaismäärä (sekä 1. että 2. sukupolvi), kehittymisnopeus (sekä 1. että 2. sukupolvi), täysin kehittyneiden ja elävien sääskien sukupuolten välinen suhde (sekä 1. että 2. sukupolvi), munaryppäiden lukumäärä naarasta kohti (vain 1. sukupolvi) sekä munaryppäiden hedelmällisyys (vain 1. sukupolvi).
|
|
5.
|
Synteettisen sedimentin käyttö on erittäin suositeltavaa. Synteettisellä sedimentillä on useita etuja luonnolliseen sedimenttiin verrattuna:
|
—
|
kokeellinen vaihtelu vähenee, koska sedimentti on toistettava ’vakiomatriisi’, eikä kontaminoitumattomia ja puhtaita sedimenttilähteitä tarvitse etsiä
|
|
—
|
testit voidaan aloittaa milloin tahansa ilman, että testisedimentissä ilmenee kausivaihtelua, eikä sedimenttiä tarvitse esikäsitellä poistamalla siitä kotoperäiset eläimet
|
|
—
|
kustannukset pienenevät verrattuna siihen, että rutiinitestaukseen tarvittavat määrät sedimenttiä kerättäisiin pellolta
|
|
—
|
synteettisen sedimentin avulla voidaan vertailla myrkyllisyyttä eri tutkimusten välillä ja luokitella kemikaalit sen mukaisesti (3).
|
|
|
6.
|
Käytetyt määritelmät on esitetty lisäyksessä 1.
|
TESTIN PERIAATE
|
7.
|
Surviaissääsken ensimmäisen kehitysvaiheen munatoukat altistetaan testikemikaalin pitoisuusalueelle sedimentti-vesisysteemissä. Testi aloitetaan laittamalla (ensimmäisen sukupolven) munatoukat laboratoriolaseihin, jotka sisältävät sedimenttiä, johon on lisätty testattavaa kemikaalia. Vaihtoehtoisesti testikemikaali voidaan lisätä veteen toukkien laittamisen jälkeen. Arvioitavia seikkoja ovat surviaissääskien kuoriutuminen, siihen kuluva aika sekä täysin kehittyneiden ja elävien sääskien sukupuolten välinen suhde. Kehittyneet aikuiset siirretään kasvatushäkkeihin, jotta ne voivat parveilla, paritella ja munia. Tuotettujen munaryppäiden lukumäärä ja niiden hedelmällisyys arvioidaan. Näistä munaryppäistä saadaan toisen sukupolven ensimmäisen kehitysvaiheen munatoukat. Nämä toukat laitetaan uusiin valmisteltuihin laboratoriolaseihin (kemikaalin lisäämismenettely kuten 1. sukupolven yhteydessä), ja toisen sukupolven elinkelpoisuutta määritetään arvioimalla niiden kuoriutumista, siihen kuluvaa aikaa sekä täysin kehittyneiden sääskien sukupuolten välistä suhdetta (kaavakuva sukupolven kierron kattavasta testistä on lisäyksessä 5). Kaikki tiedot analysoidaan joko regressiomallilla sen pitoisuuden arvioimiseksi, joka aiheuttaa x prosentin vähennyksen kyseisessä ominaisuudessa, tai käyttämällä hypoteesitestausta, jotta saadaan määritettyä pitoisuus, josta ei aiheudu vaikutuksia (NOEC). Jälkimmäinen testi edellyttää käsittelyvasteiden vertailua asianmukaisiin kontrollivasteisiin tilastollisia testejä käyttämällä. Skenaariossa, jossa testattavaa kemikaalia lisätään veteen, ja jos kemikaalit ovat nopeasti hajoavia, kunkin sukupolven myöhemmissä vaiheissa (esimerkiksi kotelovaiheessa) olevat eläimet saattavat altistua huomattavasti pienemmälle pitoisuudelle yläpuolisessa vedessä kuin ensimmäisen sukupolven munatoukat. Jos tämä aiheuttaa huolta ja jos jokaisessa vaiheessa tarvitaan samankaltainen altistustaso, seuraavia muutoksia testimenetelmään voidaan harkita:
|
—
|
rinnakkaistestit, joissa kemikaali lisätään eri kehitysvaiheissa
|
|
—
|
kemikaalin lisääminen (tai sedimentin yläpuolisen veden vaihtaminen) testijärjestelmään toistuvasti kummankin testivaiheen aikana (1. sukupolvi ja 2. sukupolvi), jolloin kemikaalin lisäämisen (veden vaihtamisen) välit on mukautettava testikemikaalin käyttäytymisominaisuuksien perusteella.
|
Tällaiset muutokset ovat mahdollisia skenaariossa, jossa kemikaalia lisätään veteen, mutta eivät skenaariossa, jossa kemikaalia lisätään sedimenttiin.
|
TESTIKEMIKAALI KOSKEVIA TIETOJA
|
8.
|
Seuraavien seikkojen on oltava tiedossa: testikemikaalin vesiliukoisuus, höyrynpaine, log Kow-arvo, mitattu tai laskettu erottuminen sedimenttiin sekä stabiilius vedessä ja sedimentissä. Käytössä on oltava luotettava analyysimenetelmä, jolla testikemikaali voidaan kvantifioida sedimentin yläpuolisessa vedessä, huokosvedessä ja sedimentissä. Menetelmän tarkkuus ja havaitsemisraja on tiedettävä, ja ne täytyy raportoida. Hyödyllisiä tietoja ovat esimerkiksi rakennekaava ja testikemikaalin puhtaus. Tiedot testikemikaalin kemiallisesta käyttäytymisestä (esimerkiksi häviäminen, abioottinen ja bioottinen hajoaminen jne.) ovat myös hyödyllisiä. Kirjallisuusviitteessä (16) annetaan lisäohjeita sellaisten kemikaalien testauksesta, joiden fysikaalis-kemialliset ominaisuudet vaikeuttavat niiden testaamista.
|
VERTAILUKEMIKAALIT
|
9.
|
Vertailuaineita voidaan testata silloin tällöin sen varmistamiseksi, ettei laboratoriopopulaation herkkyys ole muuttunut. Kuten vesikirppujen yhteydessä, 48 tunnin välitöntä myrkyllisyyttä koskevan testin tekeminen riittää (kirjallisuusviitteen 17 mukaan). Kuitenkin siihen saakka, kunnes validoidut ohjeet välittömän myrkyllisyyden testistä ovat saatavilla, tämän lisäyksen C.28 kohdan mukaista kroonista myrkyllisyyttä koskevaa testiä on syytä harkita. Esimerkkejä myrkyllisistä vertailuaineista, joita on käytetty onnistuneesti rengastesteissä ja validointitutkimuksissa, ovat lindaani, trifluraliini, pentakloorifenoli, kadmiumkloridi ja kaliumkloridi. (1) (3) (6) (7) (18).
|
KOKEEN VALIDITEETTI
|
10.
|
Testi on luotettava, jos
|
—
|
Kontrollikäsittelyssä keskimääräisen kuoriutumisen on oltava kummassakin sukupolvessa vähintään 70 prosenttia altistusjakson päättyessä (1) (7).
|
|
—
|
C. riparius- ja C. yoshimatsui -lajien osalta kontrollikäsittelyn kummankin sukupolven kaikista kehittyneistä aikuisista sääskistä 85 prosentin tulee kehittyä 12–23 päivän kuluessa siitä, kun ensimmäisen kehitysvaiheen munatoukat laitettiin testiastioihin. C. dilutuksen osalta 20–65 päivän mittainen ajanjakso on hyväksyttävä.
|
|
—
|
Kummankin sukupolven kontrollikäsittelyssä täysin kehittyneiden ja elävien aikuisten sääskien (naaras- ja koirasfraktiona) keskimääräisen sukupuolten välisen suhteen tulee olla vähintään 0,4 ja enintään 0,6.
|
|
—
|
Jokaisessa kasvatushäkissä ensimmäisen sukupolven kontrollien munaryppäiden määrän tulee olla vähintään 0,6 kutakin häkkiin laitettua naarasta kohti.
|
|
—
|
Jokaisessa kasvatushäkissä ensimmäisen sukupolven kontrollien hedelmällisten munaryppäiden fraktion tulee olla vähintään 0,6.
|
|
—
|
Kummankin sukupolven altistusjakson päätyttyä jokaisesta astiasta on mitattava pH-arvo sekä liuenneen hapen pitoisuus. Happipitoisuuden on oltava vähintään 60 prosenttia ilman kyllästysarvosta (ASV (24)), ja sedimentin yläpuolisen veden pH-arvon tulee olla 6–9 kaikissa testiastioissa.
|
|
—
|
Veden lämpötila vaihtelee enintään ± 1,0 °C.
|
|
MENETELMÄN KUVAUS
Testiastiat ja kasvatushäkit
|
11.
|
Toukat altistetaan 600 ml:n laboratoriolaseissa, joiden halkaisija on noin 8,5 mm (ks. lisäys 5). Muitakin astioita voidaan käyttää, kunhan sedimentin ja sen päällä olevan veden syvyys on sopiva. Sedimentin pinta-alan on oltava riittävä, jotta tilaa on 2–3 cm2 toukkaa kohden. Sedimenttikerroksen ja sen yläpuolisen veden syvyyden suhteen on oltava 1:4. Kasvatushäkkien (joiden korkeuden, leveyden ja pituuden on oltava vähintään 30 cm) päällä ja vähintään yhdellä sivulla on oltava verkko (silmäkoko n. 1 mm) (ks. lisäys 5). Munintaa varten jokaiseen häkkiin asetetaan kahden litran kiteytysmalja, joka sisältää testivettä ja -sedimenttiä. Myös kiteytysmaljan osalta sedimenttikerroksen ja sen yläpuolisen veden syvyyden suhteen on oltava jotakuinkin 1:4. Kun munaryppäät on kerätty kiteytysmaljasta, ne laitetaan 12-kuoppaiseen mikrotitterilevyyn (yksi rypäs yhteen kuoppaan, jossa on vähintään 2,5 ml vettä testikemikaalia sisältävästä kiteytysmaljasta). Sen jälkeen levyt peitetään kannella huomattavan haihtumisen estämiseksi. Myös muita sopivia astioita munaryppäiden säilyttämiseen voi käyttää. Mikrotitterilevyjä lukuun ottamatta kaikkien testiastioiden ja muiden laitteiden, jotka joutuvat kosketuksiin testijärjestelmän kanssa, on oltava kokonaan lasia tai muuta kemiallisesti inerttiä materiaalia (esimerkiksi polytetrafluorietyleeniä).
|
Lajin valinta
|
12.
|
Paras laji tähän testiin on Chironomus riparius. Myös C. yoshimatsui -lajia voi käyttää. C. dilutus on myös sopiva, mutta sitä on hankalampi käsitellä ja se edellyttää pidempää testijaksoa. Viljelymenetelmien yksityiskohtia käsitellään C. ripariuksen osalta tarkemmin lisäyksessä 2. Tietoa on saatavilla myös C. dilutuksen (5) ja C. yoshimatsuin viljelyolosuhteista (14). Lajin tunnistus on varmistettava ennen testiä, mutta sitä ei ole tarpeen tehdä ennen jokaista testiä, jos eliöt ovat peräisin laboratorion omasta viljelmästä.
|
Sedimentti
|
13.
|
Synteettisen sedimentin (keinosedimentin) käyttö on suositeltavaa. Jos kuitenkin käytetään luonnollista sedimenttiä, se on kuvailtava (vähintään pH, orgaaninen kokonaishiilipitoisuus, mutta myös muut parametrit, kuten C/N-suhde ja rakeisuus ovat suositeltavia), eikä siinä saa olla kontaminaatiota tai muita organismeja, jotka saattavat kilpailla surviaissääsken toukkien kanssa tai syödä ne. Lisäksi on suositeltavaa, että sedimentit saavat sopeutua testiolosuhteisiin seitsemän päivän ajan. Suositeltava (1) (20) (21) synteettinen sedimentti, jota on kuvattu kirjallisuusviitteessä (1), valmistetaan seuraavasti:
|
a.
|
4–5 % (kuivapaino) turvetta: pH mahdollisimman tarkasti 5,5–6,0; on tärkeää käyttää jauhemaista turvetta, joka on jauhettu hienoksi (hiukkaskoko ≤ 1 mm), ja ainoastaan ilmakuivattua versiota.
|
|
b.
|
20 % (kuivapaino) kaoliniittisavea (kaoliniitin osuus mieluiten yli 30 %).
|
|
c.
|
75–76 % (kuivapaino) kvartsihiekkaa (pääosin hienoa hiekkaa, jossa yli puolet 50–200 μm:n hiukkasia).
|
|
d.
|
Deionisoitua vettä lisätään, kunnes lopullisen seoksen kosteus on 30––50 %.
|
|
e.
|
Kemiallisesti puhdasta kalsiumkarbonaattia (CaCO3) lisätään, jotta lopullisen sedimenttiseoksen pH-arvoksi tulee 7,0 ± 0,5.
|
|
f.
|
Orgaanisen hiilen pitoisuuden on oltava lopullisessa seoksessa 2 % (± 0,5 %). Sitä voidaan säätää lisäämällä sopiva määrä turvetta ja hiekkaa kohtien a ja c mukaisesti.
|
|
|
14.
|
Turpeen, kaoliniittisaven ja hiekan alkuperän on oltava tiedossa. Tarkista, ettei sedimentin ainesosissa ole kemikaalista kontaminaatiota (esimerkiksi raskasmetalleja, orgaanisia klooriyhdisteitä ja orgaanisia fosforiyhdisteitä). Esimerkki synteettisen sedimentin valmistuksesta on lisäyksessä 3. Myös kuivien ainesosien sekoittaminen on hyväksyttävää, jos voidaan osoittaa, että sedimentin ainesosat eivät erotu (esim. kelluvia turvehiukkasia) veden lisäämisen jälkeen ja että turve tai sedimentti on sopeutunut tarpeeksi.
|
Vesi
|
15.
|
Testivedeksi soveltuu vesi, joka täyttää lisäyksissä 2 ja 4 luetellut laimennusveden kemialliset ominaisuudet. Kasvatus- ja testivedeksi soveltuu mikä tahansa vesi, luonnonvesi (pinta- tai pohjavesi), synteettinen vesi (katso lisäys 2) tai talousvesi, josta on poistettu kloori, jos surviaissääsket voivat elää siinä viljelyn ja testauksen ajan osoittamatta stressaantumisen merkkejä. Testiveden pH-arvon on oltava testin alussa 6–9, eikä kokonaiskovuus CaCO3:na saa olla yli 400 mg/l. Jos kovuusionien ja testikemikaalin välillä epäillään yhteisvaikutusta, on kuitenkin käytettävä pehmeämpää vettä (tässä tapauksessa ei saa käyttää Elendt M4 -viljelynestettä). Samantyyppistä vettä on käytettävä koko tutkimuksen ajan. Lisäyksessä 4 luetellut vedenlaadun ominaisuudet on mitattava vähintään kahdesti vuodessa tai aina kun on epäilystä siitä, että nämä ominaisuudet ovat voineet muuttua merkittävästi.
|
Varastoliuokset – vesi, johon on lisätty testikemikaalia
|
16. a.
|
Testipitoisuudet lasketaan vesipatsaan eli sedimentin yläpuolisen veden pitoisuuksien perusteella. Halutunpitoiset testiliuokset valmistetaan tavallisesti varastoliuoksista laimentamalla. Varastoliuokset valmistetaan mieluiten liuottamalla testikemikaalia testiveteen. Liuottimien tai dispergointiaineiden käyttö voi olla tarpeen joissakin tapauksissa riittävän väkevän varastoliuoksen valmistamiseksi. Esimerkkejä sallituista liuottimista ovat asetoni, etyleeniglykolimonoetyylieetteri, etyleeniglykolidimetyylieetteri, dimetyyliformamidi ja trietyleeniglykoli. Sallittuja dispergointiaineita ovat Cremophor RH40, Tween 80, 0,01-prosenttinen metyyliselluloosa ja HCO-40. Liuotusapuaineen pitoisuuden on oltava mahdollisimman pieni lopullisessa testiviljelyaineessa (≤ 0,1 ml/l), ja sen on oltava sama kaikissa käsittelyissä. Kun käytetään liuotusapuainetta, sillä ei saa olla merkittäviä vaikutuksia eloonjäämiseen, mikä käy ilmi liuotinkontrollista, kun sitä verrataan negatiiviseen (vesi)kontrolliin. Näiden aineiden käyttöä on kuitenkin vältettävä mahdollisimman pitkälle.
|
Varastoliuokset – sedimentti, johon on lisätty testikemikaalia
|
16.b.
|
Sedimentit, joiden pitoisuus on haluttu, valmistetaan yleensä lisäämällä testikemikaaliliuosta suoraan sedimenttiin. Testikemikaalin varastoliuos, joka on liuotettu deionisoituun veteen, sekoitetaan synteettiseen sedimenttiin valssauskoneella, sekoittimella tai käsin. Jos testikemikaali liukenee huonosti veteen, se voidaan liuottaa käyttämällä pienintä mahdollista määrää soveltuvaa orgaanista liuotinta (esimerkiksi heksaania, asetonia tai kloroformia). Seuraavaksi liuokseen sekoitetaan 10 g hienoa kvartsihiekkaa yhtä testiastiaa kohden. Sen jälkeen liuottimen annetaan haihtua; sen pitäisi hävitä hiekasta kokonaan, minkä jälkeen hiekkaan sekoitetaan sopiva määrä sedimenttiä. Testikemikaalin liuottamiseen, dispergoimiseen tai emulgointiin saa käyttää vain helposti haihtuvia aineita. On pidettävä mielessä, että testikemikaalin ja hiekkaseoksen mukana tuleva hiekka on otettava huomioon sedimentin valmistuksessa (eli sedimentin valmistukseen on käytettävä pienempi määrä hiekkaa). Varmista huolellisesti, että sedimenttiin lisättävä testikemikaali sekoittuu sedimenttiin hyvin ja tasaisesti. Homogeenisuusasteen voi määrittää tarvittaessa analysoimalla osanäytteitä.
|
TESTISUUNNITELMA
|
17.
|
Testin suunnittelu tarkoittaa testipitoisuuksien lukumäärän ja pitoisuusvälien valintaa, testiastioiden lukumäärää kutakin pitoisuutta kohti, toukkien lukumäärää kutakin astiaa kohti sekä kiteytysmaljojen ja kasvatushäkkien lukumäärää. ECx,- ja NOEC-arvoja sekä raja-annostestiä koskevat suunnitelmat kuvataan jäljempänä.
|
Regressioanalyysille suositeltava testisuunnitelma
|
18.
|
Testin on katettava vaikuttava pitoisuus (ECx,) ja se pitoisuusalueväli, jossa testikemikaalin vaikutuksella on merkitystä, siten, että ominaisuutta ei ekstrapoloida saatujen tietojen rajojen ulkopuolelle. Paljon pienimmän pitoisuuden alapuolelle tai suurimman pitoisuuden yläpuolelle menevää ekstrapolointia tulee välttää. Testimenetelmien C.27 tai C.28 mukaisesta alustavasta pitoisuusalueen määritystestistä saattaa olla apua, kun valitaan testipitoisuuksien sopivaa vaihteluväliä.
|
|
19.
|
ECx-lähestymistavassa tarvitaan vähintään viisi pitoisuutta ja kahdeksan rinnakkaisnäytettä kutakin pitoisuutta kohti. Jokaisen pitoisuuden yhteydessä on käytettävä kahta kasvatushäkkiä (A) ja (B). Kahdeksan rinnakkaisnäytettä jaetaan kahteen ryhmään, joissa kummassakin on neljä rinnakkaisnäytettä, ja nämä kaksi ryhmää vastaavat kumpaakin kasvatushäkkiä. Rinnakkaisnäytteet on tarpeen yhdistää tällä tavalla siksi, että häkissä tarvitaan tietty määrä sääskiä vankkojen lisääntymisarviointien tekemiseksi. Toisessa sukupolvessa on kuitenkin taas kahdeksan rinnakkaisnäytettä, jotka ovat saaneet alkunsa kasvatushäkkien altistuneista populaatioista. Pitoisuuksien välinen kerroin ei saa olla yli kaksi (poikkeus voidaan tehdä, jos annosvastekäyrä on loiva). Käsittelyssä käytettävien rinnakkaisnäytteiden määrää voidaan vähentää kuuteen (kolme kumpaakin kasvatushäkkiä kohti), jos eri vasteita aiheuttavien testipitoisuuksien määrää lisätään. Jos rinnakkaisnäytteiden määrää lisätään tai testipitoisuuden välejä pienennetään, ECX-testin luottamusväli yleensä kapenee.
|
NOEC-arvon estimointiin suositeltava testisuunnitelma
|
20.
|
NOEC-lähestymistavassa on käytettävä viittä testipitoisuutta ja vähintään kahdeksaa rinnakkaisnäytettä (neljä kumpaakin kasvatushäkkiä, A:ta ja B:tä, kohti), ja pitoisuuksien välinen kerroin saa olla enintään kaksi. Rinnakkaisnäytteiden määrän on oltava riittävän suuri, jotta tilastollinen voima on riittävä ja kontrollista havaitaan 20 prosentin ero viiden prosentin merkitsevyystasolla (α = 0,05). Kehittymisnopeuden, hedelmällisyyden ja lisääntymiskyvyn osalta varianssianalyysi on yleensä tarkoituksenmukainen, ja sen jälkeen voi tehdä Dunnettin testin tai Williamsin testin (22–25). Kuoriutumisasteen ja sukupuolten välisen suhteen osalta Cochran-Armitagen testi, Fisherin tarkka testi (Bonferroni-korjauksella) tai Mantel-Haentzalin testi voivat olla sopivia.
|
Raja-annostesti
|
21.
|
Raja-annostestin voi tehdä (yksi testipitoisuus ja kontrolli(t)), jos valinnaisessa pitoisuusalueen määritystestissä ei havaita vaikutuksia edes enimmäispitoisuudella. Raja-annostestin tarkoituksena on osoittaa, että testikemikaalin myrkyllisiä vaikutuksia havaitaan pitoisuuksilla, jotka ovat suurempia kuin testattu rajapitoisuus. Veden osalta pitoisuudeksi ehdotetaan 100 mg/l ja sedimentin osalta 1 000 mg/kg (kuivapaino). Yleensä vähintään kahdeksan rinnakkaisnäytettä sekä käsittelystä että kontrollista on tarpeen. On osoitettava, että tilastollinen voima on riittävä, jotta kontrollista havaitaan 20 prosentin ero viiden prosentin merkitsevyystasolla (α = 0,05). Jos vaste on metrinen (kehittymisnopeus), t-testi on soveltuva tilastollinen menetelmä, jos aineisto täyttää tämän testin vaatimukset (normaalisuus, homogeeniset vaihtelut). Jos nämä vaatimukset eivät täyty, voidaan käyttää t-testiä, jossa varianssit ovat heterogeenisia, tai parametritonta testiä, kuten Wilcoxon-Mann-Whitneyn testiä. Fisherin tarkka testi soveltuu kuoriutumisasteeseen.
|
MENETTELY
Altistumisolosuhteet
Vesi-sedimenttijärjestelmän valmistelu (testikemikaalin lisääminen veteen)
|
22. a.
|
Jokaiseen testiastiaan ja kiteytysmaljaan laitetaan vähintään 1,5 cm:n (kiteytysmaljaan voi laittaa hieman vähemmänkin) ja enintään 3 cm:n kerros synteettistä sedimenttiä (ks. 13–14 kohta ja lisäys 3). Vettä (ks. 15 kohta) lisätään siten, että sedimenttikerroksen syvyyden ja veden syvyyden suhde on enintään 1:4. Testiastioiden valmistelun jälkeen sedimentti-vesijärjestelmän tulee antaa asettua kevyesti ilmastettuna noin seitsemän päivän ajan ennen ensimmäisen tai toisen sukupolven ensimmäisen kehitysvaiheen munatoukkien lisäämistä (ks. 14 kohta ja lisäys 3). Kiteytysmaljojen sedimentti-vesijärjestelmää ei ilmasteta testin aikana, koska niiden ei tarvitse tukea toukkien elossapysymistä (munat on jo kerätty ennen niiden kuoriutumista). Sedimentin voi peittää muovikiekolla, kun testivettä lisätään vesipatsaaseen, jotta sedimentin ainesosien erottuminen ja hienon materiaalin resuspensio voidaan välttää, mutta kiekko on poistettava heti tämän jälkeen. Myös muut välineet voivat olla sopivia.
|
Vesi-sedimenttijärjestelmän valmistelu (testikemikaalin lisääminen sedimenttiin)
|
22. b
|
Sedimentit, jotka on valmisteltu 16.b kohdan mukaisesti ja joihin on lisätty testikemikaalia, laitetaan astioihin ja kiteytysmaljaan, ja niiden päälle lisätään vettä siten, että sedimentin ja veden tilavuuden suhde on 1:4. Sedimenttikerroksen syvyyden tulisi olla 1,5–3 cm (kiteytysmaljassa se voi olla vähän matalampi). Sedimentin voi peittää muovikiekolla, kun testivettä lisätään vesipatsaaseen, jotta sedimentin ainesosien erottuminen ja hienon materiaalin resuspensio voidaan välttää, mutta kiekko on poistettava heti tämän jälkeen. Myös muut välineet voivat olla sopivia. Kun sedimenttiin on lisätty testikemikaali ja sedimentin päälle on lisätty vesi, testikemikaalin on hyvä antaa erottua sedimentistä vesifaasiin (4) (5)(7) (18). Tämä on suositeltavaa tehdä samassa lämpötilassa ja ilmastuksessa, joita testissä käytetään. Sopiva tasapainottumisaika on sedimentti- ja kemikaalikohtaista, ja se voi vaihdella tunneista päiviin; harvinaisissa tapauksissa se voi olla jopa viisi viikkoa. Koska monet kemikaalit voisivat hajota tässä ajassa, tasapainotilaa ei jäädä odottamaan, vaan tasapainottumisajaksi suositellaan 48:aa tuntia. Jos kuitenkin tiedetään, että sedimentissä olevan kemikaalin hajoamisen puoliintumisaika on pitkä, tasapainottumisaikaa voi pidentää. Tämän tasapainottumisajan jälkeen testikemikaalin pitoisuus on mitattava sedimentin yläpuolisessa vedessä, huokosvedessä ja sedimentissä vähintään suurimman pitoisuuden ja yhden pienemmän pitoisuuden osalta (ks. 38 kohta). Näiden testikemikaalin analyyttisten määritysten perusteella voidaan laskea massatase, ja tulokset voidaan ilmoittaa mitattujen pitoisuuksien pohjalta.
|
|
23.
|
Testiastiat on peitettävä (esimerkiksi lasilevyillä). Tutkimuksen aikana vettä voidaan tarvittaessa lisätä alkuperäiseen tilavuuteen saakka haihtumisen kompensoimiseksi. Käytä tähän tarkoitukseen tislattua tai deionisoitua vettä, jotta suoloja ei keräydy. Kasvatushäkeissä olevia kiteytysmaljoja ei peitetä, ja testijakson aikaista veden haihtumista saa kompensoida lisäämällä vettä, mutta se ei ole välttämätöntä, koska munaryppäät ovat kosketuksissa veden kanssa vain noin yhden päivän ajan ja koska maljoja käytetään testissä vain lyhyen aikaa.
|
Testiorganismien lisääminen
|
24.
|
Neljä tai viisi päivää ennen ensimmäisen sukupolven ensimmäisen kehitysvaiheen munatoukkien lisäämistä viljelmästä on poistettava munamassat, ja ne tulee laittaa pieniin astioihin kasvatusalustalle. Alustana voidaan käyttää varastoliuoksesta saatua kypsynyttä alustaa tai vasta valmistettua alustaa. Kasvatusalustalle on lisättävä pieni määrä ruokaa, esimerkiksi muutama pisara filtraattia, joka on tehty hiutalemaisen kalanruoan hienoksi jauhetusta suspensiosta (ks. lisäys 2). Käytä ainoastaan vastamunittuja munamassoja. Tavallisesti toukat alkavat kuoriutua muutaman päivän kuluttua muninnasta (C. riparius kuoriutuu 2–3 päivässä, kun lämpötila on 20 °C, ja C. dilutus 1–4 päivässä, kun lämpötila on 23 °C; C. yoshimatsui tarvitsee 25 °C:n lämpötilan). Toukat kasvavat neljässä vaiheessa, joista jokainen kestää 4–8 päivää. Testissä käytetään ensimmäisen kehitysvaiheen munatoukkia (enintään kaksi vrk kuoriutumisen jälkeen). Ensimmäisen kehitysvaiheen munatoukat voidaan tarkastaa käyttämällä pääkotelon leveyttä (7).
|
|
25.
|
Kaksikymmentä ensimmäisen kehitysvaiheen munatoukkaa ensimmäisestä sukupolvesta jaetaan satunnaisesti kuhunkin testiastiaan, joka sisältää sedimentti-vesijärjestelmän, käyttämällä tylppäkärkistä pipettiä. Veden ilmastus keskeytetään siksi aikaa, kun toukkia lisätään testiastioihin, ja se tulee pitää keskeytettynä 24 tunnin ajan toukkien lisäämisen jälkeen (ks. 32 kohta). Käytettävän testisuunnitelman (ks. 19 ja 20 kohta) mukaan kutakin pitoisuutta kohti käytettävien toukkien määrä on ECX-tutkimuksessa vähintään 120 (kuusi rinnakkaisnäytettä pitoisuutta kohti) ja NOEC-tutkimuksessa 160 (kahdeksan rinnakkaisnäytettä pitoisuutta kohti). Tutkimuksessa, jossa sedimenttiin on lisätty testikemikaalia, altistus alkaa toukkien lisäämisellä.
|
Testikemikaalin lisääminen sedimentin yläpuoliseen veteen
|
26.
|
Vuorokauden (24 h) kuluttua ensimmäisen sukupolven ensimmäisessä kehitysvaiheessa olevien munatoukkien lisäämisestä testikemikaali lisätään sedimentin yläpuoliseen vesipatsaaseen, ja kevyt ilmastus aloitetaan uudestaan (ks. testisuunnitelman mahdolliset muutokset 7 kohdasta). Pieni määrä testikemikaalia sisältävää varastoliuosta lisätään pipetillä vedenpinnan alle. Sen jälkeen sedimentin päällä oleva vesi sekoitetaan varoen häiritsemästä sedimenttiä. Tutkimuksessa, jossa kemikaali lisätään veteen, altistus aloitetaan, kun kemikaali on lisätty veteen (ts. yhden päivän kuluttua toukkien lisäämisestä).
|
Kuoriutuneiden aikuisten kerääminen
|
27.
|
Ensimmäisen sukupolven kuoriutuneet sääsket kerätään testiastioista vähintään kerran mutta mieluiten kahdesti päivässä (ks. kohta 36) käyttämällä imulaitetta, imuria tai vastaavaa laitetta (ks. lisäys 5). Keräämisessä on oltava varovainen, etteivät aikuiset sääsket vaurioidu. Yhden käsittelyn neljästä testiastiasta kerätyt sääsket laitetaan siihen kasvatushäkkiin, jossa ne olivat aiemmin olleet. Kun ensimmäinen sääski (koiras) kuoriutuu, kiteytysmaljoihin laitetaan pipetillä pieni määrä testikemikaalin varastoliuosta veden pinnan alle (tutkimus, jossa testikemikaalia lisätään veteen). Sen jälkeen sedimentin päällä oleva vesi sekoitetaan varoen häiritsemästä sedimenttiä. Kiteytysmaljan testikemikaalipitoisuus on nimellisesti sama kuin käsittelyastioissa, jotka kuuluvat kyseiseen kasvatushäkkiin. Tutkimuksessa, jossa testikemikaalia lisätään sedimenttiin, kiteytysmaljat valmistellaan suurin piirtein 11. päivänä altistuksen alkamisesta (ts. ensimmäisen sukupolven toukkien lisäämisestä), jotta ne voivat tasapainottua noin 48 tuntia ennen ensimmäisten munaryppäiden tuottamista.
|
|
28.
|
Munaryppäät kerätään kiteytysmaljasta kasvatushäkkiin pinseteillä tai tylppäkärkisellä pipetillä. Jokainen munarypäs asetetaan astiaan, joka sisältää siitä kiteytysmaljasta otettua kasvatusalustaa, josta rypäs kerättiin (esimerkiksi 12-kuoppaisen mikrolevyn kuoppaan, jossa on vähintään 2,5 ml alustaa). Munaryppäät sisältävät astiat peitetään kannella merkittävän haihtumisen estämiseksi. Munaryppäitä tarkkaillaan vähintään kuusi päivää niiden tuottamisen jälkeen, jotta ne voidaan luokitella joko hedelmöittyneiksi tai hedelmöittymättömiksi.
Toisen sukupolven osalta valitaan vähintään kolme mutta mieluiten kuusi hedelmöittynyttä munarypästä jokaisesta kasvatushäkistä ja myös hieman ruokaa, jotta munat pystyvät kuoriutumaan. Nämä munaryppäät olisi täytynyt tuottaa muninnan ollessa huipussaan, mikä tapahtuu kontrollieläimillä yleensä testipäivänä 19. Ihannetapauksessa kaikkien käsittelyjen toisen sukupolven altistus aloitetaan samana päivänä, mutta koska kemikaali vaikuttaa toukkien kehitykseen, se ei ehkä ole aina mahdollista. Tällöin altistus suuremmilla pitoisuuksilla voidaan aloittaa myöhemmin kuin käsittely pienemmillä pitoisuuksilla ja (liuotin)kontrollin tarkkailu.
|
|
29. a.
|
Tutkimuksessa, jossa testikemikaali lisätään veteen, toisen sukupolven sedimentti-vesijärjestelmä valmistetaan lisäämällä testikemikaalia sedimentin yläpuoliseen vesipatsaaseen noin tuntia ennen ensimmäisen kehitysvaiheen munatoukkien laittamista testiastioihin. Pieniä määriä testikemikaaliliuoksia lisätään pipetillä vedenpinnan alle. Sen jälkeen sedimentin päällä oleva vesi sekoitetaan varoen häiritsemästä sedimenttiä. Kemikaalin lisäämisen jälkeen järjestelmää ilmastetaan kevyesti.
|
|
29. b.
|
Tutkimuksessa, jossa testikemikaali lisätään sedimenttiin, altistusastiat, jotka sisältävät sedimentti-vesijärjestelmän toista sukupolvea varten, valmistellaan samalla tavalla kuin ensimmäisen sukupolven yhteydessä.
|
|
30.
|
Kaksikymmentä ensimmäisen kehitysvaiheen munatoukkaa (viimeistään 48 tunnin kuluttua kuoriutumisesta) toisesta sukupolvesta jaetaan satunnaisesti kuhunkin testiastiaan, joka sisältää sedimentti-vesijärjestelmän, käyttämällä tylppäkärkistä pipettiä. Veden ilmastus tulee keskeyttää siksi aikaa, kun ensimmäisen kehitysvaiheen munatoukkia lisätään testiastioihin, ja se tulee pitää keskeytettynä 24 tunnin ajan toukkien lisäämisen jälkeen. Käytettävän testisuunnitelman (ks. 19 ja 20 kohta) mukaan kutakin pitoisuutta kohti käytettävien toukkien määrä on ECX-tutkimuksessa vähintään 120 (kuusi rinnakkaisnäytettä pitoisuutta kohti) ja NOEC-tutkimuksessa 160 (kahdeksan rinnakkaisnäytettä pitoisuutta kohti).
|
Ravinto
|
31.
|
Testiastioissa olevia toukkia on ruokittava mieluiten päivittäin tai vähintään kolme kertaa viikossa. Sopiva määrä ruokaa nuorille toukille niiden kehityksen 10 ensimmäisen päivän aikana on 0,25–0,5 mg (C. yoshimatsuille 0,35–0,5 mg) kalanruokaa (suspensiona vedessä tai hienoksi jauhettua ruokaa, esimerkiksi Tetra-Miniä tai Tetra-Phylliä, katso tarkemmat tiedot lisäyksestä 2) toukkaa kohti päivässä. Vanhemmat toukat saattavat tarvita hieman enemmän ruokaa: 0,5–1,0 mg toukkaa kohti päivässä pitäisi riittää testin loppuun saakka. Ruoan määrää pitää pienentää kaikissa käsittelyissä ja säädellä, jos sienikasvua ilmenee tai kontrolleissa esiintyy kuolleisuutta. Jos sienikasvua ei saada loppumaan, testi on toistettava.
Ravinnon kautta altistumisen toksikologinen merkitys on yleensä suurempi sellaisilla kemikaaleilla, joiden affiniteetti orgaaniseen hiileen on suuri, tai kemikaaleilla, jotka sitoutuvat sedimenttiin kovalenttisesti. Kun testataan tällaisia kemikaaleja, se määrä ruokaa, jota toukkien elossapysyminen ja luonnollinen kasvu edellyttää, voidaan lisätä synteettiseen sedimenttiin ennen stabilisointijaksoa sääntelytarpeen mukaan. Veden laadun heikkenemisen ehkäisemiseksi on käytettävä kalanruoan sijasta kasviainesta, kuten 0,5 prosenttia (kuivapaino) nokkosen (Urtica dioica), valkomulperin (Morus alba), valkoapilan (Trifolium repens), pinaatin (Spinacia oleracea) tai muun kasviaineksen (Cerophyl tai alfaselluloosan) hienoksi jauhettuja lehtiä. Se, että sedimenttiin lisätään koko annos orgaanista ruokaa ennen kemikaalin lisäämistä, ei ole yhdentekevää veden laadun ja biologisen prosessin tehon kannalta (21), eikä se ole vakiintunut menetelmä, mutta viimeaikaisten tutkimusten mukaan on viitteitä siitä, että tämä menetelmä toimii (19) (26). Kasvatushäkissä olevia aikuisia sääskiä ei yleensä tarvitse ruokkia, mutta hedelmällisyys ja hedelmöittyminen paranevat, jos kuoriutuneille aikuisille annetaan ruoaksi saturoitua sukroosiliuosta puuvillavanulappuun imeytettynä.
|
Inkubaatio-olosuhteet
|
32.
|
Testiastioiden sedimentin yläpuolista vettä aletaan ilmastaa varovasti 24 tuntia molempien sukupolvien ensimmäisen kehitysvaiheen munatoukkien lisäämisen jälkeen, ja ilmastusta jatketaan testin loppuun saakka (on pidettävä huoli, ettei liuenneen hapen pitoisuus laske alle 60 prosenttiin ilman kyllästysarvosta). Ilmastuksessa käytetään lasista Pasteur-pipettiä, jonka suu kiinnitetään 2–3 cm:n korkeudelle sedimenttikerroksen yläpuolelle, ja siitä pitäisi tulla muutama ilmakupla sekunnissa. Haihtuvia kemikaaleja testattaessa on pidettävä huoli siitä, ettei sedimentti-vesijärjestelmää ilmasteta, mutta samalla validiteettikriteerin (ts. vähintään 60 prosenttia ilman kyllästysarvosta) tulisi täyttyä. Tästä annetaan tarkempia ohjeita kirjallisuusviitteessä (16).
|
|
33.
|
C. riparius -lajilla tehtävässä testissä käytetään vakiolämpötilaa 20 °C (± 2 °C). C. dilutus- ja C. yoshimatsui -lajeille suositellut lämpötilat ovat 23 °C ja 25 °C (± 2 °C). Valoisa aika on 16 tuntia, ja valon voimakkuuden pitää olla 500–1 000 luksia. Kasvatushäkkien osalta voidaan lisätä yhden tunnin sarastus- ja hämäräjakso.
|
Altistuksen kesto
|
34.
|
Tutkimus, jossa testikemikaali lisätään veteen: Ensimmäisen sukupolven altistusjakso alkaa, kun testikemikaali lisätään testiastioissa olevaan veteen (yhden päivän kuluttua toukkien lisäämisestä – katso mahdolliset muutokset altistustapaan 7 kohdasta). Toisen sukupolven toukkien altistus alkaa heti, koska ne lisätään sedimentti-vesijärjestelmään, johon testikemikaali on jo lisätty. C. riparius- ja C. yoshimatui -lajien ensimmäisen sukupolven altistuksen enimmäiskesto on 27 päivää ja toisen sukupolven 28 päivää (ensimmäisen sukupolven toukat ovat astioissa yhden päivän ilman altistusta). Kun otetaan huomioon altistusjaksojen päällekkäisyys, testin kokonaiskesto on noin 44 päivää. C. dilutuksen osalta altistuksen enimmäiskesto on ensimmäisellä sukupolvella 64 päivää ja toisella sukupolvella 65 päivää. Kokonaiskesto on noin 100 päivää.
Tutkimus, jossa testikemikaali lisätään sedimenttiin: altistus alkaa toukkien lisäämisestä, ja C. ripariuksen ja C. yoshimatsuin molemmilla sukupolvilla se kestää enintään 28 päivää ja C. dilutuksen molemmilla sukupolvilla enintään 65 päivää.
|
Havainnot
Kuoriutuminen
|
35.
|
Molemmista sukupolvista määritetään täysin kehittyneiden ja elävien koiras- ja naarassääskien kehitysaika ja kokonaismäärä. Koiraat tunnistaa helposti niiden viuhkamaisista tuntosarvista ja kapeasta ruumiinrakenteesta.
|
|
36.
|
Kummankin sukupolven testiastioita tulee tarkkailla vähintään kolme kertaa viikossa, ja silloin on tehtävä silmämääräinen arviointi toukkien mahdollisesta poikkeavasta käyttäytymisestä (esimerkiksi sedimentistä poistuminen, epätavallinen uinti) kontrolleihin verrattuna. Kuoriutumisvaiheen aikana – C. riparius- ja C. yoshimatsui -toukilla se alkaa yleensä noin 12 päivän kuluttua toukkien lisäämisestä (C. dilutus -toukilla 20 päivän kuluttua) – kuoriutuneet sääsket lasketaan ja niiden sukupuoli määritetään vähintään kerran mutta mieluiten kahdesti päivässä (varhain aamulla ja myöhään iltapäivällä). Tunnistamisen jälkeen ensimmäisen sukupolven sääsket otetaan varovasti pois astioista ja siirretään kasvatushäkkiin. Toisen sukupolven sääsket otetaan pois ja lopetetaan tunnistamisen jälkeen. Kaikki ensimmäisen sukupolven testiastioihin munitut munaryppäät on kerättävä yksitellen, ja ne tulee siirtää 12-kuoppaisille mikrotitterilevyille (tai muihin sopiviin astioihin) siten, että mukana on vähintään 2,5 ml testiastiasta peräisin olevaa vettä. Mikrotitterilevyt peitetään kannella merkittävän haihtumisen estämiseksi. Kuolleiden toukkien ja näkyvillä olevien koteloiden, joiden kuoriutuminen ei ole onnistunut, lukumäärä on kirjattava muistiin. Esimerkkejä kasvatushäkistä, testiastiasta ja imurista on lisäyksessä 5.
|
Lisääntyminen
|
37.
|
Lisääntymiseen kohdistuneita vaikutuksia arvioidaan ensimmäisen sukupolven sääskien tuottamien munaryppäiden lukumäärän ja niiden hedelmöittymisen perusteella. Munaryppäät kerätään kerran päivässä jokaisessa kasvatushäkissä olevasta kiteytysmaljasta. Munaryppäät on kerättävä ja siirrettävä 12-kuoppaiselle mikrotitterilevylle (yksi munarypäs jokaiseen kuoppaan) tai muihin sopiviin astioihin siten, että mukana on vähintään 2,5 ml kiteytysmaljan vettä, ja astiat on peitettävä kannella merkittävän haihtumisen estämiseksi. Jokaisesta munaryppäästä dokumentoidaan seuraavat ominaisuudet: munintapäivä, koko (normaali = 1,0 ± 0,3 cm vai pieni = yleensä ≤ 0,5 cm) ja rakenne (normaali = banaaninmuotoinen, jossa munat sijaitsevat spiraalimaisesti, vai epänormaali = munat sijaitsevat muuten kuin spiraalimaisesti) ja hedelmällisyys (hedelmöittynyt vai hedelmöittymätön). Munaryppään hedelmöittymistä arvioidaan kuuden päivän ajan sen muninnan jälkeen. Munarypästä pidetään hedelmällisenä, kun vähintään kolmannes munista kuoriutuu. Kasvatushäkkiin laitettujen naaraiden lukumäärää käytetään laskettaessa kunkin naaraan munimien munaryppäiden lukumäärää ja hedelmällisten munaryppäiden lukumäärää kutakin naarasta kohti. Tarvittaessa munaryppään sisältämien munien lukumäärä voidaan arvioida rypästä rikkomatta käyttämällä kasvurenkaiden laskentamenetelmää (tarkempia tietoja on kirjallisuusviitteissä 32 ja 33).
|
Mittaukset
Testikemikaalin lisääminen
|
38.
|
Vähintään sedimentin yläpuolisen veden, huokosveden ja sedimentin näytteet on analysoitava testin alussa (mieluiten yksi tunti testiaineen lisäämisen jälkeen) ja lopussa suurimmassa testipitoisuudessa ja yhdessä pienemmässä pitoisuudessa. Tämä koskee kummankin sukupolven testiastioita. Kasvatushäkeissä olevista kiteytysmaljoista analysoidaan vain yläpuolinen vesi, koska sen kanssa munaryppäät joutuvat kosketuksiin (tutkimuksessa, jossa kemikaali on lisätty sedimenttiin, voidaan harkita sedimentin pitoisuuden vahvistamista analyyttisesti). Muita sedimentin, huokosveden tai yläpuolisen veden mittauksia voidaan tarvittaessa tehdä testin aikana. Näistä testikemikaalin pitoisuuden määrityksistä saadaan tietoa testikemikaalin käyttäytymisestä ja jakautumisesta vesi-sedimenttijärjestelmässä. Jos sedimentistä ja huokosvedestä otetaan näytteet testin alussa ja sen aikana (ks. 39 kohta), tarvitaan ylimääräisiä testiastioita analyyttisten määritysten tekemiseksi. Tutkimuksessa, jossa testikemikaali on lisätty veteen, sedimentin mittaukset eivät välttämättä ole tarpeen, jos testikemikaalin jakaantuminen veteen ja sedimenttiin on määritetty selvästi vesi/sedimenttitutkimuksessa vastaavissa olosuhteissa (sedimentin ja veden välinen suhde, applikointityyppi, orgaanisen hiilen pitoisuus sedimentissä), tai jos mitatut pitoisuudet yläpuolisessa vedessä ovat osoittautuneet pysyvän 80–120 prosentissa nimellisistä tai mitatuista alkupitoisuuksista.
|
|
39.
|
Jos välimittauksia tehdään (esimerkiksi päivänä 7) ja analyysiin tarvitaan suuria näytteitä, joiden ottaminen testiastioista vaikuttaisi testijärjestelmään, analyyttisiin määrityksiin on käytettävä ylimääräisistä testiastioista otettuja näytteitä. Näitä astioita käsitellään samalla tavoin kuin testiastioita (mukaan lukien testiorganismien lisääminen), mutta niitä ei käytetä biologiseen havainnointiin.
|
|
40.
|
Huokosveden suositeltava eristystapa on sentrifugointi (esimerkiksi 10 000 g ja 4 °C 30 minuutin ajan). Jos on kuitenkin osoitettu, että testikemikaali ei adsorboidu suotimiin, myös suodatus voi olla hyväksyttävää. Joskus pitoisuuksien analysointi huokosvedestä ei ole mahdollista, koska näytteen tilavuus on liian pieni.
|
Fysikaalis-kemialliset parametrit
|
41.
|
Testiastioissa ja kiteytysmaljoissa olevasta vedestä tulee mitata pH, testiveteen liuennut happi ja veden lämpötila asianmukaisella tavalla (ks. 10 kohta). Kovuus ja ammoniakkipitoisuus on mitattava kontrolleista ja suurimman pitoisuuden testiastiasta ja kiteytysmaljasta testin alussa ja lopussa.
|
TIEDOT JA RAPORTOINTI
Tulosten käsittely
|
42.
|
Tämän koko sukupolven kierron kattavan testin tarkoitus on määrittää testikemikaalin vaikutus lisääntymiseen ja kahden sukupolven osalta täysin kehittyneiden ja elävien koiras- ja naarassääskien kehitysnopeuteen ja lukumäärään. Kuoriutumisasteen osalta koiraiden ja naaraiden tiedot on yhdistettävä. Jos sukupuolten kehitysnopeutta koskevissa herkkyyksissä ei ole tilastollisesti merkitseviä eroja, koiraiden ja naaraiden tulokset voidaan yhdistää tilastollista analyysia varten.
|
|
43.
|
Vaikuttavat pitoisuudet, jotka ilmaistaan päällä olevan veden (jos testikemikaali on lisätty veteen) tai sedimentin (jos testikemikaali on lisätty sedimenttiin) pitoisuuksina, lasketaan yleensä altistuksen alussa mitattujen pitoisuuksien perusteella (ks. 38 kohta). Kun testikemikaali on lisätty veteen, pitoisuuksista, jotka yleensä mitataan altistuksen alussa testiastioiden ja kiteytysmaljojen yläpuolisesta vedestä kummankin sukupolven osalta, lasketaan jokaisen käsittelyn keskiarvo. Kun testikemikaali on lisätty sedimenttiin, pitoisuuksista, jotka yleensä mitataan altistuksen alussa testiastioista (ja valinnaisesti myös kiteytysmaljoista) kummankin sukupolven osalta, lasketaan jokaisen käsittelyn keskiarvo.
|
|
44.
|
Jotta voidaan laskea piste-estimaatti, kuten ECx, astia- ja kasvatushäkkikohtaisia tilastotietoja voidaan käyttää todellisina rinnakkaisnäytteinä. Laskettaessa minkä tahansa ECx-arvon luottamusväliä astioiden välinen vaihtelu on otettava huomioon tai vaihtoehtoisesti osoitettava vaihtelu niin pieneksi, että se voidaan jättää huomiotta. Jos malliin sovelletaan pienimmän neliösumman menetelmää, astiakohtaisiin tilastotietoihin on sovellettava muunnosta, jotta varianssin homogeenisuus paranee. ECx-arvot on kuitenkin laskettava sen jälkeen, kun vaste on muunnettu takaisin alkuperäisarvoon (31).
|
|
45.
|
Kun tilastollisen analyysin tavoitteena on määrittää NOEC hypoteesitestauksella, astioiden välinen vaihtelu on otettava huomioon. Tämä voidaan varmistaa käyttämällä ANOVA-menetelmiä (kuten Williamsin ja Dunnettin testimenetelmiä). Williamsin testi on sopiva silloin, kun odotettavissa on monotoninen annosvaste, ja Dunnettin testi taas silloin, kun monotonisuushypoteesi ei toteudu. Vaihtoehtoisesti yksityiskohtaisemmat testit (27) voivat olla soveltuvia tilanteissa, joissa tavalliset ANOVAn oletukset eivät täyty (31).
|
Kuoriutumisaste
|
46.
|
Kuoriutumisasteet ovat dikotomisia tietoja, ja ne voidaan analysoida Cochran-Armitagen testillä, jota sovelletaan alaspäin askeltavasti, kun monotoninen annosvaste on odotettavissa ja kun näitä tietoja pidetään tämän odotuksen mukaisina. Jos näin ei ole, voidaan käyttää Fisherin tarkkaa testiä tai Mantel-Haentzalin testiä, jossa p-arvot on korjattu Bonferroni-Holmin menetelmällä. Jos on näyttöä siitä, että saman pitoisuuden rinnakkaisnäytteiden välinen varianssi on suurempi kuin binomijakauma antaa edellyttää (ylihajonta), tulee käyttää yksityiskohtaista Cochran-Armitagen testiä tai Fisherin tarkkaa testiä (27).
Elävien ja kuoriutuneiden sääskien (koiraat ja naaraat) yhteismäärä astiaa kohti, ne
, määritetään ja jaetaan astiaan laitettujen toukkien määrällä, na
:

jossa
|
ER
|
=
|
kuoriutumisaste
|
|
ne
|
=
|
elävien, kuoriutuneiden sääskien lukumäärä astiaa kohti
|
|
na
|
=
|
astiaan laitettujen toukkien lukumäärä (yleensä 20)
|
Jos ne
on suurempi kuin na
(esimerkiksi jos toukkia laitettiin vahingossa aiottua enemmän), na
pitää muuttaa yhtä suureksi kuin ne
.
|
|
47.
|
Vaihtoehtoinen tapa, joka on sopivin suurten näytekokojen yhteydessä, kun binomiaalista vaihtelua on paljon, on pitää kuoriutumisastetta jatkuvana vasteena ja käyttää menetelmiä, jotka ovat yhdenmukaisia näiden ER-tietojen kanssa. Näytekoko määritetään tässä suureksi, jos sekä kuoriutuneiden että kuoriutumattomien toukkien määrä on toistossa (astiassa) yli viisi.
|
|
48.
|
Jos halutaan soveltaa ANOVA-menetelmiä, ER-arvot on ensin muunnettava arcsin-neliöjuuri-muunnoksella tai Tukey-Freemanin muunnoksella, jotta saadaan likimääräinen normaalijakauma ja jotta varianssi tasoittuu. Cochran-Armitagen testiä, Fisherin tarkkaa testiä (Bonferroni) tai Mantel-Haentzalin testiä voidaan soveltaa, kun käytetään absoluuttisia frekvenssejä. Arcsin-neliöjuuri-muunnosta sovelletaan ottamalla kuoriutumisasteen neliöjuuren käänteinen sini (sin– 1).
|
|
49.
|
Kuoriutumisasteiden osalta ECx-arvot lasketaan käyttämällä regressioanalyysia (esimerkiksi Probit-, logit- tai Weibull-mallit (28)). Jos regressioanalyysi epäonnistuu (esimerkiksi kun osittaisia vasteita on alle kaksi), käytetään muita parametrittomia menetelmiä, kuten liukuvaa keskiarvoa tai yksinkertaista interpolaatiota.
|
Kehittymisnopeus
|
50.
|
Keskimääräinen kehittymisnopeus tarkoittaa keskimääräistä aikaväliä, joka kuluu toukkien laittamisesta testiastiaan (testin päivä 0) siihen, kun sääskien tutkimuskohortti kuoriutuu (varsinaisen kehittymisajan laskemisessa on huomioitava toukkien ikä astiaan laitettaessa). Kehittymisnopeus (yksikkö: 1/vrk) on kehittymisajan käänteisluku, ja se edustaa yhdessä vuorokaudessa tapahtuvaa toukkien kehittymistä. Kehittymisnopeuden käyttö on suositeltavaa näiden sedimentin myrkyllisyyskokeiden arvioinnissa, sillä sen varianssi on pienempi ja se on homogeenisempi ja lähempänä normaalijakaumaa kuin kehittymisaika. Siksi tehokkaita parametritestimenetelmiä käytetään mieluummin kehittymisnopeuden kuin kehittymisajan kanssa. Kun kehittymisnopeus on jatkuva vaste, ECx-arvot voidaan estimoida regressioanalyysillä (esimerkiksi (29), (30)). Keskimääräisen kehittymisnopeuteen liittyvä NOEC-arvo voidaan määrittää ANOVA-menetelmillä, esimerkiksi Williamsin tai Dunnettin testillä. Koska koiraat kuoriutuvat aiemmin kuin naaraat (eli niiden kehittymisnopeus on suurempi), on mielekästä laskea kummankin sukupuolen kehittymisnopeus erikseen sen lisäksi, että lasketaan myös kaikkien sääskien kokonaiskehittymisnopeus.
|
|
51.
|
Tilastollisissa testeissä oletetaan, että tarkastuspäivänä x havaittu sääskimäärä kuoriutuu päivän x ja päivän x – l välissä (l = tarkastusvälin pituus, yleensä 1 päivä). Keskimääräinen kehittymisnopeus astiassa (
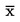
) lasketaan seuraavasti:
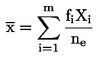
jossa
|
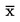
|
:
|
keskimääräinen kehittymisnopeus astiassa
|
|
i
|
:
|
tarkastusvälin indeksi
|
|
m
|
:
|
tarkastusvälien enimmäismäärä
|
|
fi
|
:
|
tarkastusvälissä i kuoriutuneiden sääskien määrä
|
|
ne
|
:
|
testin lopussa kuoriutuneiden sääskien kokonaismäärä (Σfi
)
|
|
xi
|
:
|
tarkastusvälissä i kuoriutuneiden sääskien kehittymisnopeus
|

jossa
|
dayi
|
:
|
tarkastuspäivä (monesko päivä toukkien lisäämisen jälkeen)
|
|
li
|
:
|
tarkastusvälin i pituus (päivissä, yleensä 1 päivä)
|
|
Sukupuolijakauma
|
52.
|
Sukupuolten väliset suhteet ovat dikotomisia tietoja, ja ne tulee siksi arvioida Fisherin tarkalla testillä tai muilla asianmukaisilla menetelmillä. C. ripariuksen osalta sukupuolten välinen luonnollinen suhde on yksi, eli koiraita ja naaraita on yhtä paljon. Molempien sukupolvien osalta sukupuolten välistä suhdetta koskevia tietoja tulee käsitellä samalla tavoin. Koska sääskien astiakohtainen enimmäismäärä (20) on liian pieni, jotta siitä voitaisiin tehdä järkevä tilastollinen analyysi, yhden käsittelyn kaikkien astioiden täysin kehittyneiden ja elävien sääskien kokonaismäärä kummankin sukupuolen osalta lasketaan yhteen. Nämä muuntamattomat tiedot testataan (liuotin)kontrollia tai yhdistettyjä kontrollitietoja vastaan 2 × 2 -kontingenssitaulukossa.
|
Lisääntyminen
|
53.
|
Lisääntyminen (hedelmällisyys) lasketaan kunkin naaraan tuottamien munaryppäiden lukumäärän perusteella. Toisin sanoen kasvatushäkissä tuotettujen munaryppäiden kokonaismäärä jaetaan häkkiin lisättyjen, elossa olevien ja terveiden naaraiden kokonaismäärällä. Hedelmällisyyteen liittyvä NOEC-arvo voidaan määrittää ANOVA-menetelmillä, esimerkiksi Williamsin tai Dunnettin testillä.
|
|
54.
|
Munaryppäiden hedelmällisyyden avulla kvantifioidaan hedelmällisten munaryppäiden määrä naarasta kohti. Kasvatushäkissä tuotettujen hedelmällisten munaryppäiden kokonaismäärä jaetaan häkkiin lisättyjen, elossa olevien ja terveiden naaraiden kokonaismäärällä. Munien hedelmällisyyteen liittyvä NOEC-arvo voidaan määrittää ANOVA-menetelmillä, esimerkiksi Williamsin tai Dunnettin testillä.
|
Testiraportti
|
55.
|
Testiraportissa on esitettävä seuraavat tiedot:
|
|
Testikemikaali:
|
—
|
fysikaalinen olomuoto ja fysikaalis-kemialliset ominaisuudet (vesiliukoisuus, höyrynpaine, log Kow, jakaantumiskerroin maa-aineksessa (tai sedimentissä, jos saatavissa), stabiilisuus vedessä ja sedimentissä jne.)
|
|
—
|
kemialliset tunnistetiedot (yleisnimi, kemiallinen nimi, rakennekaava, CAS-numero jne.) sekä puhtaus ja testiaineen kvantifioinnissa käytetty analyysimenetelmä.
|
|
|
|
Testilajit:
|
—
|
käytetyt testiorganismit: lajit, tieteellinen nimi, organismien lähde ja kasvatusolosuhteet
|
|
—
|
tiedot siitä, miten munamassoja ja toukkia käsiteltiin
|
|
—
|
tiedot ensimmäisen sukupolven kuoriutuneiden aikuisten käsittelystä imurilla jne. (ks. lisäys 5)
|
|
—
|
testiorganismien ikä sillä hetkellä, kun na laitettiin 1. ja 2. sukupolven testiastioihin.
|
|
|
|
Testiolosuhteet:
|
—
|
käytetty sedimentti, eli luonnollinen vai synteettinen (keinotekoinen) sedimentti
|
|
—
|
luonnollinen sedimentti: sedimentin keräyspaikan sijainti ja kuvaus sekä mahdollisuuksien mukaan tiedot kontaminaatiohistoriasta; sedimentin ominaisuudet: pH, orgaanisen hiilen pitoisuus, C/N-suhde ja granulometria (jos tarpeen)
|
|
—
|
synteettinen sedimentti: valmistus, ainesosat ja ominaisuudet (orgaanisen hiilen pitoisuus, pH, kosteus jne. testin alussa mitattuna)
|
|
—
|
testiveden valmistus (jos käytetään synteettistä vettä) ja ominaisuudet (happipitoisuus, pH, kovuus jne. testin alussa mitattuna)
|
|
—
|
sedimentin ja sen yläpuolisen veden syvyys testiastioissa ja kiteytysmaljoissa
|
|
—
|
sedimentin yläpuolisen veden ja huokosveden tilavuus, sedimentin märkäpaino huokosveden kanssa ja ilman sitä testiastioissa ja kiteytysmaljoissa
|
|
—
|
testiastiat (materiaali ja koko)
|
|
—
|
kiteytysmaljat (materiaali ja koko)
|
|
—
|
kasvatushäkit (materiaali ja koko)
|
|
—
|
varastoliuosten ja testipitoisuuksien valmistusmenetelmät testiastioiden ja kiteytysmaljojen osalta
|
|
—
|
testikemikaalin lisääminen testiastioihin ja kiteytysmaljoihin: testipitoisuudet, rinnakkaisnäytteiden määrä ja liuottimet tarvittaessa
|
|
—
|
testiastioiden inkubaatio-olosuhteet: lämpötila, valoisa jakso ja valoteho, ilmastus (montako kuplaa sekunnissa)
|
|
—
|
kasvatushäkkien ja kiteytysmaljojen inkubaatio-olosuhteet: lämpötila, valoisa jakso ja valoteho
|
|
—
|
mikrotitterilevyillä (tai muissa astioissa) olevien munaryppäiden inkubaatio-olosuhteet: lämpötila, valoisa jakso ja valoteho
|
|
—
|
yksityiskohtaiset tiedot syöttämisestä, kuten ravinnon tyyppi, valmistus, määrä ja syöttöaikataulu.
|
|
|
|
Tulokset:
|
—
|
nimelliset testipitoisuudet, mitatut testipitoisuudet ja tulokset kaikista analyyseistä, joilla määritettiin testiaineen pitoisuus testiastioissa ja kiteytysmaljoissa
|
|
—
|
veden laatu testiastioissa ja kiteytysmaljoissa: pH, lämpötila, liuenneen hapen pitoisuus, kovuus ja ammoniakki
|
|
—
|
tiedot testiastioista haihtuneen veden korvaamisesta tarvittaessa
|
|
—
|
kuoriutuneiden koiras- ja naarassääskien määrä astiaa ja päivää kohti, 1. ja 2. sukupolvi
|
|
—
|
täysin kehittyneiden ja elävien sääskien sukupuolten välinen suhde käsittelyä kohti, 1. ja 2. sukupolvi
|
|
—
|
niiden toukkien astiakohtainen lukumäärä, joista ei kehittynyt sääskiä, 1. ja 2. sukupolvi
|
|
—
|
kuoriutumisen prosenttiosuus/fraktio rinnakkaisnäytettä ja testipitoisuutta kohti (koiras- ja naarassääsket yhdistettynä, 1. ja 2. sukupolvi
|
|
—
|
täysin kehittyneiden ja elävien sääskien keskimääräinen kehittymisnopeus rinnakkaisnäytettä ja käsittelyastetta kohti (koiras- ja naarassääsket erikseen ja yhteensä), 1. ja 2. sukupolvi
|
|
—
|
kiteytysmaljoihin munittujen munaryppäiden lukumäärä kasvatushäkkiä ja päivää kohti
|
|
—
|
jokaisen munaryppään ominaisuudet (koko, muoto ja hedelmöittyminen)
|
|
—
|
hedelmällisyys – munaryppäiden kokonaismäärä kasvatushäkkiin laitettujen naaraiden kokonaismäärää kohti
|
|
—
|
hedelmöittyminen – hedelmöittyneiden munaryppäiden kokonaismäärä kasvatushäkkiin laitettujen naaraiden kokonaismäärää kohti
|
|
—
|
myrkyllisten tutkittavien ominaisuuksien estimaatit, kuten ECx (ja siihen liittyvät luottamusvälit), NOEC ja sen määrittämiseen käytetyt tilastolliset menetelmät
|
|
—
|
tulosten pohdinta, mukaan luettuna mahdolliset vaikutukset, joita tästä testimenetelmästä poikkeamisella on ollut testin tuloksiin.
|
|
|
LÄHDEKIRJALLISUUS
|
(1)
|
Tämän liitteen luku C.28 Surviaissääskillä tehtävä myrkyllisyystesti, käyttäen vettä tai sedimenttiä, joihin on lisätty tutkittavaa ainetta.
|
|
(2)
|
Shobanov, N.A., Kiknadze, I.I. and M.G. Butler (1999), Palearctic and Nearctic Chironomus (Camptochironomus) tentans Fabricius are different species (Diptera: Chironomidae). Entomologica Scandinavica, 30: 311–322.
|
|
(3)
|
Fleming, R. et al. (1994), Sediment Toxicity Tests for Poorly Water-Soluble Substances, Final Report to the European Commission, Report No: EC 3738. August 1994. WRc, UK.
|
|
(4)
|
SETAC (1993), Guidance Document on Sediment toxicity Tests and Bioassays for Freshwater and Marine Environments, From the WOSTA Workshop held in the Netherlands.
|
|
(5)
|
ASTM International (2009), E1706-05E01: Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, In: Annual Book of ASTM Standards, Volume 11.06, Biological Effects and Environmental Fate; Biotechnology. ASTM International, West Conshohocken, PA.
|
|
(6)
|
Environment Canada (1997), Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius), Biological Test Method, Report SPE 1/RM/32, December 1997.
|
|
(7)
|
US-EPA (2000), Methods for Measuring the Toxicity and Bioaccumulation of Sediment-associated Contaminants with Freshwater Invertebrates, Second edition, EPA 600/R-99/064, March 2000, Revision to the first edition dated June 1994.
|
|
(8)
|
US-EPA/OPPTS 850.1735 (1996), Whole Sediment Acute Toxicity Invertebrates.
|
|
(9)
|
US-EPA/OPPTS 850.1790 (1996), Chironomid Sediment toxicity Test.
|
|
(10)
|
Milani, D., Day, K.E., McLeay, D.J. and R.S. Kirby (1996), Recent intra- and inter-laboratory studies related to the development and standardisation of Environment Canada's biological test methods for measuring sediment toxicity using freshwater amphipods (Hyalella azteca) and midge larvae (Chironomus riparius), Technical Report, Environment Canada, National Water Research Institute, Burlington, Ontario, Canada.
|
|
(11)
|
Norberg-King, T.J., Sibley, P.K., Burton, G.A., Ingersoll, C.G., Kemble, N.E., Ireland, S., Mount, D.R. and C.D. Rowland (2006), Interlaboratory evaluation of Hyalella azteca and Chironomus tentans short-term and long-term sediment toxicity tests, Environ. Toxicol. Chem., 25: 2662–2674.
|
|
(12)
|
Taenzler, V., Bruns, E., Dorgerloh, M., Pfeifle, V. and L. Weltje (2007), Chironomids: suitable test organisms for risk assessment investigations on the potential endocrine-disrupting properties of pesticides, Ecotoxicology, 16: 221–230.
|
|
(13)
|
Sugaya, Y. (1997), Intra-specific variations of the susceptibility of insecticides in Chironomus yoshimatsui, Jp. J. Sanit. Zool., 48: 345–350.
|
|
(14)
|
Kawai, K. (1986), Fundamental studies on chironomid allergy, I. Culture methods of some Japanese chironomids (Chironomidae, Diptera), Jp. J. Sanit. Zool., 37: 47–57.
|
|
(15)
|
Chapter C.27 of this Annex, Sediment-water chironomid toxicity test using spiked sediment.
|
|
(16)
|
OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Environment, Health and Safety Publications, Series on Testing and Assessment No. 23, ENV/JM/MONO(2000)6, OECD, Paris.
|
|
(17)
|
Weltje, L., Rufli, H., Heimbach, F., Wheeler, J., Vervliet-Scheebaum, M. and M. Hamer (2010), The chironomid acute toxicity test: development of a new test system, Integr. Environ. Assess. Management.
|
|
(18)
|
Environment Canada. (1995), Guidance Document on Measurement of Toxicity Test Precision Using Control Sediments Spiked with a Reference Toxicant, Report EPS 1/RM/30, September 1995.
|
|
(19)
|
Oetken, M, Nentwig, G., Löffler, D, Ternes, T. and J. Oehlmann (2005), Effects of pharmaceuticals on aquatic invertebrates, Part I, The antiepileptic drug carbamazepine, Arch. Environ. Contam. Toxicol., 49: 353–361.
|
|
(20)
|
Suedel, B.C. and J.H. Rodgers (1994), Development of formulated reference sediments for freshwater and estuarine sediment testing, Environ. Toxicol. Chem., 13: 1163–1175.
|
|
(21)
|
Naylor, C. and C. Rodrigues (1995), Development of a test method for Chironomus riparius using a formulated sediment, Chemosphere, 31: 3291–3303.
|
|
(22)
|
Dunnett, C.W. (1964), A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statis. Assoc., 50: 1096–1121.
|
|
(23)
|
Dunnett, C.W. (1964), New tables for multiple comparisons with a control, Biometrics, 20: 482–491.
|
|
(24)
|
Williams, D.A. (1971), A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103–117.
|
|
(25)
|
Williams, D.A. (1972), The comparison of several dose levels with a zero dose control. Biometrics, 28: 510–531.
|
|
(26)
|
Jungmann, D., Bandow, C., Gildemeister, T., Nagel, R., Preuss, T.G., Ratte, H.T., Shinn, C., Weltje, L. and H.M. Maes (2009), Chronic toxicity of fenoxycarb to the midge Chironomus riparius after exposure in sediments of different composition. J Soils Sediments, 9: 94–102.
|
|
(27)
|
Rao, J.N.K. and A.J. Scott (1992), A simple method for the analysis of clustered binary data. Biometrics, 48: 577–585.
|
|
(28)
|
Christensen, E.R. (1984), Dose-response functions in aquatic toxicity testing and the Weibull model, Water Res., 18: 213–221.
|
|
(29)
|
Bruce, R.D. and D.J. Versteeg (1992), A statistical procedure for modelling continuous toxicity data, Environ. Toxicol. Chem., 11: 1485–1494.
|
|
(30)
|
Slob, W. (2002), Dose-response modelling of continuous endpoints. Toxicol. Sci., 66: 298–312.
|
|
(31)
|
OECD (2006), Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application, OECD Series on Testing and Assessment No. 54, 146 pp., ENV/JM/MONO(2006)18, OECD, Paris.
|
|
(32)
|
Benoit, D.A., Sibley, P.K., Juenemann, J.L. and G.T. Ankley (1997), Chironomus tentans life-cycle test: design and evaluation for use in assessing toxicity of contaminated sediments, Environ. Toxicol. Chem., 16: 1165–1176.
|
|
(33)
|
Vogt, C., Belz, D., Galluba, S., Nowak, C., Oetken, M. and J. Oehlmann (2007), Effects of cadmium and tributyltin on development and reproduction of the non-biting midge Chironomus riparius (Diptera) – baseline experiments for future multi-generation studies, J. Environ. Sci. Health Part A, 42: 1–9.
|
|
(34)
|
OECD (2010), Validation report of the Chironomid full life-cycle toxicity test, Forthcoming publication in the Series on Testing and Assessment, OECD, Paris.
|
Lisäys 1
Määritelmät
Tässä testimenetelmässä käytetään seuraavia määritelmiä:
|
|
Kemikaali on aine tai seos.
|
|
|
Synteettinen sedimentti tai rekonstituoitu tai keinotekoinen sedimentti on luonnollisen sedimentin fyysisiä ainesosia jäljittelevistä materiaaleista valmistettu seos.
|
|
|
Yläpuolinen vesi on testiastiassa sedimentin päällä oleva vesi.
|
|
|
Huokosvesi on sedimenttirakeiden välissä olevaa vettä.
|
|
|
Testivesi on vettä, johon on lisätty testikemikaalia.
|
|
|
Testikemikaali on tätä testimenetelmää käyttäen testattu aine tai seos.
|
Lisäys 2
Chironomus riparius -lajin kasvatussuosituksia
|
1.
|
Chironomus-toukkia voi kasvattaa kiteytysmaljoissa tai suurissa astioissa. Astian pohjalle levitetään noin 5–10 mm:n paksuinen kerros hienoa kvartsihiekkaa. Myös piimaa (esimerkiksi Merck, tuotenro 8117) on osoitettu soveltuvaksi substraatiksi (ohuempi, enintään muutaman millimetrin paksuinen kerros riittää). Astiaan lisätään sopivaa vettä useita senttimetrejä. Haihtunut vesi on tarvittaessa korvattava lisäämällä uutta vettä. Tämä on tarpeen myös kuivumisen estämiseksi. Vesi voidaan vaihtaa tarvittaessa. Varovainen ilmastus on tarpeen. Toukkien kasvatusastioita on säilytettävä soveltuvassa häkissä, jotta kuoriutuvat aikuiset eivät pääse pakenemaan. Häkin on oltava tarpeeksi tilava, jotta kuoriutuneet aikuiset mahtuvat parveilemaan. Häkin on oltava tarpeeksi tilava, jotta kuoriutuneet aikuiset mahtuvat parveilemaan. Muutoin parittelua ei välttämättä tapahdu (vähimmäiskoko on n. 30 × 30 × 30 cm).
|
|
2.
|
Häkkejä säilytetään huoneenlämmössä tai huoneessa, jonka lämpötila on vakioitu (20 ± 2 °C). Valoisa jakso on 16 tuntia (voimakkuus n. 1 000 luksia), pimeys 8 tuntia. On ilmoitettu, että lisääntyminen voi estyä, jos ilman suhteellinen kosteus on alle 60 prosenttia.
|
Laimennusvesi
|
3.
|
Mitä tahansa soveltuvaa luonnollista tai synteettistä vettä voidaan käyttää. Kaivovesi, talousvesi, josta on poistettu kloori, ja keinotekoinen neste (esimerkiksi Elendtin ’M4’- tai ’M7’-liuos, ks. jäljempänä) ovat yleisesti käytettyjä. Vesi on ilmastettava ennen käyttöä. Kasvatusvesi voidaan tarvittaessa uusia kaatamalla tai lappamalla käytetty vesi kasvatusastioista varoen tuhoamasta toukkaputkia.
|
Toukkien ruokinta
|
4.
|
Chironomus-toukkia ruokitaan kalojen hiutaleruoalla (Tetra Min®, Tetra Phyll® tai muu vastaava kaupallinen kalanruoka), jota annetaan noin 250 mg astiaa kohden päivässä. Ruoka voidaan antaa kuivana hienoksi jauhettuna jauheena tai veteen sekoitettuna suspensiona: 1,0 g hiutaleruokaa lisätään 20 millilitraan laimennusvettä ja sekoitetaan tasaiseksi. Tätä valmistetta voidaan antaa noin 5 ml testiastiaa kohti päivässä. (Ravista ruoka ennen käyttöä.) Vanhemmille toukille voi antaa enemmän ruokaa.
|
|
5.
|
Ruokkimista säädellään vedenlaadun mukaan. Jos kasvatusalusta muuttuu sameaksi, ravinnon määrää on vähennettävä. Ravinnon määrän lisäämistä on seurattava tarkasti. Jos ravintoa on liian vähän, toukat siirtyvät kohti vesipatsasta, ja jos ravintoa on liian paljon, mikrobien toiminta voi lisääntyä ja happipitoisuudet voivat laskea. Kumpikin vaihtoehto voi laskea kasvunopeutta.
|
|
6.
|
Vähän viherlevän (esimerkiksi Scenedesmus subspicatus, Chlorella vulgaris) soluja voidaan lisätä, kun uusia kasvatusastioita perustetaan.
|
Kuoriutuneiden aikuisten ruokinta
|
7.
|
Eräät kokeen suorittajat ovat ehdottaneet, että kylläisessä sakkaroosiliuoksessa liotettu vanutuppo saattaa riittää kuoriutuneiden aikuisten ravinnoksi.
|
Kuoriutuminen
|
8.
|
Kun lämpötila on 20 ± 2 °C, toukkien kasvatusastioista alkaa kuoriutua aikuisia noin 13–15 päivän kuluttua. Koiraat tunnistaa helposti niiden viuhkamaisista tuntosarvista ja hoikasta ruumiinrakenteesta.
|
Munamassat
|
9.
|
Kun kasvatushäkissä on aikuisia, kaikista toukkien kasvatusastioista on tarkistettava kolme kertaa viikossa, onko niissä hyytelömäisiä munamassoja. Jos munamassoja on, ne on poistettava varovasti. Ne siirretään pieneen astiaan, jossa on pieni määrä kasvatusvettä. Munamassoja voi käyttää uuden viljelyastian perustamiseen (esimerkiksi 2–4 munamassaa astiaa kohden) tai myrkyllisyystesteihin.
|
|
10.
|
Ensimmäisen kehitysvaiheen munatoukkien pitäisi kuoriutua 2–3 päivän kuluttua.
|
Uusien viljelyastioiden perustaminen
|
11.
|
Kun viljelmät on perustettu, uuden toukkaviljelyastian voi aloittaa testivaatimusten mukaan kerran viikossa tai harvemmin. Vanhat astiat poistetaan, kun aikuiset sääsket ovat kuoriutuneet. Näin saadaan säännöllisesti aikuisia mahdollisimman vähäisellä vaivalla.
|
Testiliuosten M4 ja M7 valmistaminen
|
12.
|
Elendt (1990) on kuvannut M4-testiliuosta. M7-testiliuos valmistetaan kuten M4-liuos lukuun ottamatta taulukossa 1 mainittuja aineita, joiden osalta pitoisuudet ovat neljä kertaa pienemmät M7-liuoksessa kuin M4-liuoksessa. Testiliuosta ei tule valmistaa Elendtin ja Biasin (1990) mukaan, jos varastoliuoksissa käytetyt NaSiO3 ·- 5H2O-, NaNO3-, KH2PO4- ja K2HPO4-pitoisuudet eivät ole asianmukaisia.
|
M7-liuoksen valmistaminen
|
13.
|
Jokainen varastoliuos (I) valmistetaan erikseen, ja näistä varastoliuoksista (I) valmistetaan yhdistetty varastoliuos (II) (katso taulukko 1). M7-liuos valmistetaan näin: yhdistetystä varastoliuoksesta (II) otetaan 50 ml ja jokaisesta makroravinteiden varastoliuoksesta otetaan taulukossa 2 esitetty määrä, ja nämä määrät täytetään yhdeksi litraksi deionisoitua vettä. Vitamiinivarastoliuos valmistetaan lisäämällä deionisoituun veteen kolme vitamiinia taulukon 3 mukaan, ja 0,1 ml yhdistettyä vitamiinivarastoliuosta lisätään lopulliseen M7-liuokseen hieman ennen käyttöä. Yhdistetty vitamiinien varastoliuos säilytetään jäädytettynä pienissä alikvooteissa. Liuos ilmastetaan ja stabiloidaan.
|
Taulukko 1
Hivenaineiden varastoliuokset M4- ja M7-liuosta varten
|
Varastoliuokset (I)
|
Määrä (mg), joka täytetään 1 litraksi deionisoitua vettä
|
Yhdistetyn varastoliuoksen (II) valmistaminen: sekoita seuraavat määrät (ml) varastoliuoksia (I) ja täytä ne yhdeksi litraksi deionisoitua vettä
|
Lopulliset pitoisuudet testiliuoksissa (mg/l)
|
|
M4
|
M7
|
M4
|
M7
|
|
H3BO3
(25)
|
57 190
|
1,0
|
0,25
|
2,86
|
0,715
|
|
MnCl2 · 4H2O (25)
|
7 210
|
1,0
|
0,25
|
0,361
|
0,090
|
|
LiCl (25)
|
6 120
|
1,0
|
0,25
|
0,306
|
0,077
|
|
RbCl (25)
|
1 420
|
1,0
|
0,25
|
0,071
|
0,018
|
|
SrCl2 · 6H2O (25)
|
3 040
|
1,0
|
0,25
|
0,152
|
0,038
|
|
NaBr (25)
|
320
|
1,0
|
0,25
|
0,016
|
0,004
|
|
Na2MoO4 · 2H2O (25)
|
1 260
|
1,0
|
0,25
|
0,063
|
0,016
|
|
CuCl2 · 2H2O (25)
|
335
|
1,0
|
0,25
|
0,017
|
0,004
|
|
ZnCl2
|
260
|
1,0
|
1,0
|
0,013
|
0,013
|
|
CaCl2 · 6H2O
|
200
|
1,0
|
1,0
|
0,010
|
0,010
|
|
KI
|
65
|
1,0
|
1,0
|
0,0033
|
0,0033
|
|
Na2SeO3
|
43,8
|
1,0
|
1,0
|
0,0022
|
0,0022
|
|
NH4VO3
|
11,5
|
1,0
|
1,0
|
0,00058
|
0,00058
|
|
Na2EDTA · 2H2O (25)
(26)
|
5 000
|
20,0
|
5,0
|
2,5
|
0,625
|
|
FeSO4 · 7H2O (25)
(26)
|
1 991
|
20,0
|
5,0
|
1,0
|
0,249
|
Taulukko 2:
Makroravinteiden varastoliuokset M4- ja M7-liuosta varten
|
|
Määrä, joka täytetään 1 litraksi deionisoitua vettä
(mg)
|
Lisätyn makroravinteiden varastoliuoksen määrä M4- ja M7-liuosten valmistuksessa
(ml/l)
|
Lopulliset pitoisuudet testiliuoksissa M4 ja M7
(mg/l)
|
|
CaCl2 · 2H2O
|
293 800
|
1,0
|
293,8
|
|
MgSO4 · 7H2O
|
246 600
|
0,5
|
123,3
|
|
KCl
|
58 000
|
0,1
|
5,8
|
|
NaHCO3
|
64 800
|
1,0
|
64,8
|
|
NaSiO3 · 9H2O
|
50 000
|
0,2
|
10,0
|
|
NaNO3
|
2 740
|
0,1
|
0,274
|
|
KH2PO4
|
1 430
|
0,1
|
0,143
|
|
K2HPO4
|
1 840
|
0,1
|
0,184
|
Taulukko 3:
Vitamiinien varastoliuos M4- ja M7-liuosta varten
Kaikki kolme vitamiiniliuosta yhdistetään yhdeksi vitamiinien varastoliuokseksi.
|
|
Määrä, joka täytetään 1 litraksi deionisoitua vettä
(mg)
|
Lisätyn vitamiinien varastoliuoksen määrä M4- ja M7-liuosten valmistuksessa
(ml/l)
|
Lopulliset pitoisuudet testiliuoksissa M4 ja M7
(mg/l)
|
|
Tiamiinihydrokloridi
|
750
|
0,1
|
0,075
|
|
Syaanikobalamiini (B12)
|
10
|
0,1
|
0,0010
|
|
Biotiini
|
7,5
|
0,1
|
0,00075
|
VIITTEET
BBA (1995), Long-term toxicity test with Chironomus riparius: Development and validation of a new test system, Edited by M. Streloke and H. Köpp. Berlin.
Elendt, B.P. (1990), Selenium deficiency in Crustacea, Protoplasma, 154: 25–33.
Elendt, B.P. and W.-R. Bias (1990), Trace nutrient deficiency in Daphnia magna cultured in standard medium for toxicity testing, Effects on the optimisation of culture conditions on life history parameters of D. magna, Water Research, 24: 1157–1167.
Lisäys 3
Synteettisen sedimentin valmistus
SEDIMENTIN KOOSTUMUS
Synteettisen sedimentin koostumuksen on oltava seuraavanlainen:
|
Ainesosa
|
Ominaisuudet
|
% sedimentin kuivapainosta
|
|
Turve
|
Rahkasuoturvetta, pH mahdollisimman tarkoin 5,5–6,0, ei näkyviä kasvijäänteitä, hienoksi jauhettuna (hiukkaskoko ≤ 1 mm) ja ilmakuivattuna
|
4–5
|
|
Kvartsihiekka
|
Raekoko: > 50 prosenttia hiukkasista on oltava kokoa 50–200 μm
|
75–76
|
|
Kaoliniittisavi
|
Kaoliniittipitoisuus≥ 30 %
|
20
|
|
Orgaaninen hiili
|
Säädetään lisäämällä turvetta ja hiekkaa
|
2 (± 0,5)
|
|
Kalsiumkarbonaatti
|
CaCO3, jauhemainen, kemiallisesti puhdas
|
0,05–0,1
|
|
Vesi
|
Johtavuus ≤ 10 μS/cm
|
30–50
|
VALMISTELUVAIHE
Turve ilmakuivataan ja jauhetaan hienoksi. Tarvittava määrä turvejauhetta suspendoidaan deionisoituun veteen käyttämällä tehokasta homogenisointilaitetta. Tämän suspension pH säädetään välille 5,5 ± 0,5 CaCO3:lla. Suspension annetaan vakioitua vähintään kahden päivän ajan sekoittamalla sitä varovasti lämpötilassa 20 ± 2 °C, jotta pH stabiloituu ja saadaan stabiili mikrobikomponentti. Sen jälkeen pH mitataan uudelleen. Arvon pitäisi olla 6,0 ± 0,5. Sen jälkeen turvesuspensioon sekoitetaan muut ainesosat (hiekka ja kaoliniittisavi) ja deionisoitu vesi, jotta saadaan homogeenista sedimenttiä, jonka vesipitoisuus on 30–50 prosenttia sedimentin kuivapainosta. Lopullisen seoksen pH mitataan vielä kerran, ja se säädetään tarvittaessa CaCO3:lla alueelle 6,5–7,5. Sedimentistä otetaan näytteitä, joista määritetään kuivapaino ja orgaanisen hiilen pitoisuus. On suositeltavaa, että synteettistä sedimenttiä sopeutetaan ennen surviaissääskillä tehtävää myrkyllisyystestiä seitsemän päivää samoille olosuhteille, jotka testissä vallitsevat.
VARASTOINTI
Synteettisen sedimentin kuivia ainesosia voi säilyttää kuivassa ja viileässä paikassa huoneenlämmössä. Valmistettua (märkää) sedimenttiä ei saa säilyttää ennen käyttöä tässä testissä. Se on käytettävä heti valmistuksen lopussa olevan 7 päivän sopeutusajan jälkeen.
VIITTEET
OECD (1984), Earthworm, Acute Toxicity Test, Test Guideline No. 207, Guidelines for the Testing of Chemicals, OECD, Paris.
Meller, M., Egeler, P., Roembke, J., Schallnass, H., Nagel, R. and B. Streit (1998), Short-term toxicity of lindane, hexachlorobenzene and copper sulfate on tubificid sludgeworms (Oligochaeta) in artificial media, Ecotox. Environ. Safety, 39: 10–20.
Lisäys 4
Hyväksyttävän laimennusveden kemialliset ominaisuudet
|
AINESOSA
|
PITOISUUDET
|
|
Hiukkaset
|
< 20 mg/1
|
|
Orgaanisen hiilen kokonaismäärä
|
< 2 mg/1
|
|
Ionisoitumaton ammoniakki
|
< 1 μg/l
|
|
Kovuus CaCO3:na
|
< 400 mg/l (27)
|
|
Jäännöskloori
|
< 10 μg/l
|
|
Orgaanista fosforia sisältävien torjunta-aineiden kokonaismäärä
|
< 50 ng/1
|
|
Orgaanista klooria sisältävien torjunta-aineiden ja polykloorattujen bifenyylien kokonaismäärä
|
< 50 ng/1
|
|
Orgaanisen kloorin kokonaismäärä
|
< 25 ng/1
|
Lisäys 5
Testin toteuttamisohjeet
Esimerkki kasvatushäkistä:

|
A
|
:
|
Suojaverkko häkin päällä ja vähintään yhdellä sivulla (silmäkoko noin 1 mm)
|
|
B
|
:
|
Aukko, josta kehittyneet aikuiset laitetaan kasvatushäkkiin ja poistetaan munitut munaryppäät kiteytysmaljoista (eivät näy tässä kuvassa)
|
|
C
|
:
|
Kasvatushäkki, vähimmäismitat: pituus 30 cm, korkeus 30 cm ja leveys 30 cm
|
Esimerkki testiastiasta:

|
A
|
:
|
Pasteur-pipetti ilmansyöttöön yläpuolisen veden päältä
|
|
B
|
:
|
Lasikansi, jolla estetään sääskien karkaaminen
|
|
C
|
:
|
Veden pintakerros
|
|
D
|
:
|
Testiastia (laboratoriolasi, vähintään 600 ml)
|
|
E
|
:
|
Sedimenttikerros
|
Esimerkki imurista, jolla kerätään aikuiset sääsket (nuolet tarkoittavat ilman virtaussuuntaa)

|
A
|
:
|
Lasiputki (sisähalkaisija noin 5 mm), joka on liitetty itsesyöttävään pumppuun
|
|
B
|
:
|
Vulkanoidusta kumista valmistettu korkki, jonka lasiputki lävistää (A). Lasiputken (A) aukko tulee päällystää sisäpuolelta pumpulilla ja verkolla (silmäkoko noin 1 mm), jotta sääsket eivät vaurioidu, kun niitä imetään imuriin.
|
|
C
|
:
|
Läpinäkyvä säiliö (muovia tai lasia, pituus noin 15 cm) kerättyjä sääskiä varten.
|
|
D
|
:
|
Vulkanoidusta kumista valmistettu korkki, jonka putki lävistää (E). Sääsket vapautetaan kasvatushäkistä avaamalla säiliön C korkki D.
|
|
E
|
:
|
Putki (muovia tai lasia, sisähalkaisija noin 8 mm), johon aikuiset sääsket kerätään astiasta.
|
Kaavakuva sukupolven kierron kattavasta testistä:

|
A
|
:
|
1. sukupolvi – testiastiat, jotka sisältävät sedimentti-vesijärjestelmän, kahdeksan rinnakkaisnäytettä ja 20 ensimmäisen kehitysvaiheen munatoukkaa astiaa kohti
|
|
B
|
:
|
Neljä testiastiaa kumpaakin kasvatushäkkiä (A ja B) kohti
|
|
C
|
:
|
Kasvatushäkit (A ja B) parveilua, parittelua ja munintaa varten
|
|
D
|
:
|
Kiteytysmaljat munaryppäiden säilytystä varten
|
|
E
|
:
|
Mikrotitterilevyt, yksi kuoppa kutakin munarypästä kohti
|
|
F
|
:
|
2. sukupolvi – testiastiat, jotka sisältävät sedimentti-vesijärjestelmän, kahdeksan rinnakkaisnäytettä ja 20 ensimmäisen kehitysvaiheen munatoukkaa astiaa kohti
|
C.41. KALOJEN SUKUPUOLIKEHITYSTÄ TUTKIVA TESTI
JOHDANTO
|
1.
|
Tämä testimenetelmä vastaa OECD:n testiohjetta (TG) nro 234 (2011). Se perustuu vuonna 1998 tehtyyn päätökseen uudistaa ohjeita ja laatia uusia ohjeita mahdollisten hormonitoimintaa häiritsevien aineiden seulontaa ja testausta varten. Kalojen sukupuolikehitystä tutkivaa testiä (Fish Sexual Development Test, FSDT) pidettiin lupaavana testimenetelmänä, sillä se kattaa kalan elinkaaren herkän vaiheen, jossa kala reagoi sekä estrogeenin että androgeenin kaltaisiin kemikaaleihin. Testimenetelmälle tehtiin vuosina 2006–2010 laboratorioiden välinen validointi, jossa validoitiin medaka (Oryzias latipes), seeprakala (Danio rerio) ja kolmipiikki (Gasterosteus aculeatus). Rasvapäämutu (Pimephales promelas) validoitiin osittain (41) (42) (43). Tähän tutkimussuunnitelmaan kuuluvat medaka, kolmipiikki ja seeprakala. Suunnitelma on periaatteessa OECD:n testiohjeen nro 210 (kalan elinkaaren varhaisvaiheen myrkyllisyystesti) (1) parannettu versio, jossa altistus jatkuu siihen saakka, kunnes kalojen sukupuoli on eriytynyt, mikä tapahtuu medakalla, kolmipiikillä ja seeprakalalla noin 60 päivän kuluttua mätimunien kuoriutumisesta (altistusjakso voi olla lyhyempi tai pidempi muilla lajeilla, jotka validoidaan tulevaisuudessa), ja johon lisätään hormonitoiminnan kannalta herkkiä tutkittavia ominaisuuksia. FSDT-testissä arvioidaan elinkaaren varhaisvaiheen vaikutuksia ja mahdollisia haitallisia seurauksia, joita oletetuilla hormonitoimintaa häiritsevillä kemikaaleilla (kuten estrogeeneilla, androgeeneilla ja steroidogeneesin estäjillä) voi olla sukupuolikehitykseen. Yhdistämällä kaksi keskeistä hormonitoimintaan liittyvää ominaisuutta, vitellogeniinin (VTG:n) pitoisuus ja fenotyyppinen sukupuolijakauma, testistä voidaan saada tietoa testikemikaalin vaikutustavasta. Koska fenotyyppinen sukupuolijakauma muuttuu populaatiokohtaisesti, FSDT:tä voidaan käyttää vaarojen ja riskien arviointiin. Jos testiä käytetään vaarojen tai riskien arvioinnissa, kolmipiikkiä ei tule kuitenkaan käyttää, koska tällä hetkellä käytettävissä olevat validointitiedot ovat osoittaneet, että tässä lajissa kemikaalien aiheuttamat muutokset fenotyyppisessä sukupuolijakaumassa olivat harvinaisia.
|
|
2.
|
Suunnitelma perustuu siihen, että kaloja altistetaan veden kautta kemikaaleille sukupuolikehityksen kannalta labiilin vaiheen aikana, jolloin kalan oletetaan olevan herkimmillään hormonitoimintaa häiritsevien ja sukupuolikehitystä haittaavien kemikaalien vaikutuksille. Merkkeinä hormonitoimintaan liittyvistä kehityksellisistä poikkeamista mitataan kahta keskeistä ominaisuutta, vitellogeniinipitoisuutta ja sukupuolijakaumaa (sukupuolten välistä suhdetta), jotka määritetään sukupuolirauhasten histologian perusteella. Sukupuolirauhasten histopatologia (oosyyttien ja spermatogeneettisten solujen arviointi ja määritys) on valinnaista. Lisäksi geneettinen sukupuoli määritetään aina kun mahdollista (esimerkiksi medakassa ja kolmipiikissä). Geneettisten sukupuolitunnusmerkkien olemassaolosta on paljon hyötyä, koska se lisää sukupuolijakaumatilastojen selitysvoimaa ja mahdollistaa yksilöllisen fenotyyppisen sukupuolen vaihtumisen havaitsemisen. Muita apikaalisia ominaisuuksia, jotka tulee mitata, ovat kuoriutumisaste, eloonjääminen, pituus ja paino. Testimenetelmän voi muokata myös muille lajeille kuin edellä mainituille edellyttäen, että i) muut lajit validoidaan samalla tavalla kuin medaka, kolmipiikki ja seeprakala, ii) kontrollikalojen sukupuoli on eriytynyt testin lopuksi, iii) vitellogeniinipitoisuudet ovat tarpeeksi suuria, jotta merkitsevät kemikaaleihin liittyvät vaihtelut havaitaan, ja iv) testijärjestelmän herkkyys määritetään käyttämällä hormonitoimintaan vaikuttavia vertailukemikaaleja ((anti-)estrogeeneja, (anti-)androgeeneja, aromataasin estäjiä jne.). Lisäksi kaikki validointiraportit, jotka liittyvät FSDT-tietoihin ja joissa on käytetty muita lajeja, olisi toimitettava OECD:n tarkastettaviksi, ja validoinnin tulos tulee olla hyväksyttävä.
|
JOHDANTO JA RAJOITUKSET
|
3.
|
Munimalla lisääntyvien selkärankaisten naaraiden maksa tuottaa yleensä vitellogeenia verenkierrossa olevan endogeenisen estrogeenin avulla (2). Se on munankeltuaisen proteiinien esiaste, ja kun maksa on tuottanut sitä, se kulkeutuu verenkierrossa munasarjoihin, joissa kehittyvät munasolut ottavat sen sisäänsä ja muokkaavat sitä. Vitellogeniinin synteesi on hyvin vähäistä mutta havaittavissa nuorilla kaloilla ja aikuisilla koiraskaloilla, koska niiden verenkierrossa ei ole tarpeeksi estrogeenia. Maksa voi kuitenkin syntetisoida ja erittää vitellogeniinia eksogeenisen estrogeenistimulaation vuoksi (3) (4) (5).
|
|
4.
|
Vitellogeniinipitoisuutta mittaamalla pystytään havaitsemaan kemikaaleja, joilla on estrogeenisia, antiestrogeenisia ja androgeenisia vaikutustapoja, ja kemikaaleja, jotka häiritsevät steroidogeneesia, kuten aromataasin estäjät. Estrogeeniin vaikuttavien kemikaalien havaitseminen on mahdollista mittaamalla vitellogeniinin indusointia koiraskaloilla, ja sitä on dokumentoitu runsaasti tieteellisessä vertaisarvioidussa kirjallisuudessa. Vitellogeniinin indusointi on osoitettu myös aromatisoituville androgeeneille altistumisen jälkeen (6) (7). Kun naaraskalojen verenkierron estrogeenipitoisuus pienentyy esimerkiksi estämällä aromataasia muuntamasta endogeenista androgeenia luonnolliseksi estrogeeniksi, 17β-estradioliksi, myös aromataasia estäviä ominaisuuksia sisältävien kemikaalien tai laajemmin steroidogeneesin estäjien havaitsemisessa käytettävän vitellogeniinin pitoisuus pienenee (33). Estrogeenin/aromataasin estämisen aiheuttaman vitellogeniinivasteen biologinen merkityksellisyys on osoitettu ja se on dokumentoitu laajalti (8) (9). On kuitenkin mahdollista, että vitellogeniinin tuotantoon naarailla voivat vaikuttaa myös yleinen myrkyllisyys ja muuhun kuin hormonijärjestelmään kohdistuvat myrkylliset vaikutustavat.
|
|
5.
|
Useita mittausmenetelmiä on kehitetty onnistuneesti, ja ne on standardoitu vakiokäyttöön vitellogeniinin kvantifioimiseksi yksittäiseltä kalalta otetusta verestä, maksasta, koko ruumiista tai pään/pyrstön homogenaattinäytteistä. Tämä koskee esimerkiksi seeprakalaa, kolmipiikkiä ja medakaa sekä myös rasvapäämutua, joka on osittain validoitu laji. Saatavilla on lajikohtaisia entsyymivälitteisiä immunosorbenttimääritysmenetelmiä (ELISA), joissa käytetään immunokemiaa vitellogeniinin kvantifioimisessa (5) (10) (11) (12) (13) (14) (15) (16). Medakalla ja seeprakalalla veren plasmasta, maksasta ja homogenaattinäytteistä mitattujen vitellogeniinipitoisuuksien välinen korrelaatio on hyvä, vaikka homogenaateista saatavat arvot ovat yleensä hieman pienempiä kuin plasman arvot (17) (18) (19). Liitteessä 5 on esitetty suositeltavat näytteenottomenetelmät vitellogeniinianalyysia varten.
|
|
6.
|
Fenotyyppisen sukupuolijakauman (sukupuolten välisen suhteen) muutos on ominaisuus, joka kuvastaa sukupuolen vaihtumista. Periaatteessa estrogeenit, antiestrogeenit, androgeenit, antiandrogeenit ja steroidogeneesia estävät kemikaalit voivat vaikuttaa kehittyvien kalojen sukupuolijakaumaan (20). On osoitettu, että sukupuolen vaihtuminen estrogeenin kaltaiselle kemikaalille altistumisen jälkeen on osittain palautuvaa seeprakalalla (21), kun taas androgeenin kaltaiselle kemikaalille altistumisen jälkeen se on pysyvää (30). Sukupuolet määritellään seuraavasti: naaras, koiras, sekasukupuolinen (sekä oosyyttejä että spermatogeneettisia soluja yhdessä sukupuolirauhasessa) tai eriytymätön, ja yksittäisen kalan sukupuoli määritetään sukupuolirauhasten histologisella tutkimuksella. Ohjeita on lisäyksessä 7 ja OECD:n ohjeasiakirjassa, joka koskee hormonitoimintaan liittyvän histopatologian diagnosointia kalojen sukupuolirauhasissa (Guidance Document on the Diagnosis of Endocrine-Related Histopathology of Fish Gonads) (22).
|
|
7.
|
Geneettinen sukupuoli tutkitaan geneettisten merkkien avulla, jos niitä on tietyssä kalalajissa. Medakalla naaraan XX-geenit tai koiraan XY-geenit voidaan havaita polymeraasiketjureaktiolla (PCR:llä), tai Y-kromosomiin liittyvä DM-domeenin geeni (DMY) voidaan analysoida (DMY negatiivinen tai positiivinen), kuten kirjallisuusviitteissä (23) ja (24) on kuvattu. Kolmipiikin osalta vastaava PCR-menetelmä geneettisen sukupuolen määrittämiseen on kuvattu lisäyksessä 10. Kun geneettinen sukupuoli voidaan yksilöllisesti liittää fenotyyppiseen sukupuoleen, testin selitysvoima paranee, joten geneettinen sukupuoli pitää määrittää lajeilta, joilla on dokumentoitu olevan geneettisen sukupuolen merkkejä.
|
|
8.
|
Kaksi keskeistä hormonitoimintaan kohdistuvaa ominaisuutta, vitellogeniini ja sukupuolijakauma, voivat yhdessä osoittaa, millainen hormonitoimintaan kohdistuva vaikutustapa kemikaalilla on (taulukko 1). Sukupuolijakauma on populaation kannalta oleellinen biomarkkeri (25) (26), ja joidenkin tarkasti määriteltyjen vaikutustapojen osalta FSDT-tuloksia voidaan käyttää vaarojen ja riskien arvioinnissa, mikäli sääntelyviranomainen pitää sitä tarkoituksenmukaisena. Tällaisia vaikutustapoja on estrogeeneilla, androgeeneilla ja steroidogeneesin estäjillä.
Taulukko 1
Hormonitoimintaan liittyvien ominaisuuksien reaktio kemikaalien erilaisille vaikutustavoille:
↑= lisääntyy, ↓= vähenee, — = ei tutkittu
|
Vaik.tapa
|
VTG ♂
|
VTG ♀
|
Sukupuolijakauma
|
Viitteet
|
|
Heikko estrogeeniagonisti
|
↑
|
↑
|
↑♀ tai ↑Eriyt.
|
(27) (40)
|
|
Vahva estrogeeniagonisti
|
↑
|
↑
|
↑♀ tai ↑Eriyt, ei ♂
|
(28) (40)
|
|
Estrogeeniantagonisti
|
—
|
—
|
↓♀, ↑Eriyt.
|
(29)
|
|
Androgeeniagonisti
|
↓ tai —
|
↓ tai —
|
↑ ♂, ei ♀
|
(28) (30)
|
|
Androgeeniantagonisti
|
—
|
—
|
↑♀
↑Sekasukup.
|
(31)
|
|
Aromataasin estäjä
|
↓
|
↓
|
↓♀
|
(33)
|
|
|
9.
|
FSDT ei kata kalan elinkaaren lisääntymisvaihetta, joten kemikaalit, joiden epäillään vaikuttavan pieninä pitoisuuksina ennemminkin lisääntymiseen kuin sukupuolikehitykseen, on tutkittava testillä, joka kattaa lisääntymisen.
|
|
10.
|
Tässä testimenetelmässä käytetyt määritelmät on esitetty lisäyksessä 1.
|
|
11.
|
FSDT in vivo -testi on tarkoitettu havaitsemaan kemikaalit, joilla on androgeenisia ja estrogeenisia ominaisuuksia sekä antiandrogeenisia, antiestrogeenisia ja steroidogeneesia estäviä ominaisuuksia. FSDT:n validointivaiheet (1 ja 2) kattoivat estrogeeniset, androgeeniset ja steroidogeneesia estävät kemikaalit. Estrogeeni- ja androgeeniantagonistien vaikutukset FSDT:ssä on esitetty taulukossa 1, mutta näistä vaikutustavoista ei ole tällä hetkellä kovin paljon dokumentaatiota.
|
TESTIN PERIAATE
|
12.
|
Tässä testissä kalat – alkaen hiljattain hedelmöittyneistä munista sukupuolisen eriytymisen päättymiseen saakka – altistetaan kolmelle pitoisuudelle kemikaalia, joka on liuotettu veteen. Testiolosuhteissa on käytettävä läpivirtausjärjestelmää, ellei se ole mahdotonta testikemikaalin saatavuuden tai luonteen (esimerkiksi vähäisen liukoisuuden) vuoksi. Testi aloitetaan asettamalla kaksi hiljattain hedelmöitynyttä munaa (ennen emosolun jakautumista) testiastioihin. Astioiden täyttäminen on kuvattu kunkin lajin osalta 27 kohdassa. Validoitujen kalalajien (medaka, kolmipiikki ja seeprakala) testi päättyy 60 päivän kuluttua kuoriutumisesta. Testin päättyessä kaikki kalat lopetetaan inhimillisesti. Jokaisesta kalasta otetaan biologinen näyte (veren plasma, maksa tai pää-/pyrstöhomogenaatti) vitellogeniinianalyysia varten, ja ruumis kiinnitetään kiinnitysaineella sukupuolirauhasten histologista arviointia varten. Siinä määritetään fenotyyppinen sukupuoli, ja sukupuolirauhasten histopatologinen tutkimus (rauhasten kehitysvaiheen määritys, sekasukupuolisuuden aste) voidaan toteuttaa valinnaisesti. Lajeilla, joilla on asianmukaiset merkit sukupuolesta, otetaan biologinen näyte (perä- tai selkäevästä) geneettisen sukupuolen määritystä varten (lisäykset 9 ja 10).
|
|
13.
|
Yhteenveto validoituja lajeja (medaka, kolmipiikki ja seeprakala) koskevista oleellisista testiolosuhteista on lisäyksessä 2.
|
TESTIKEMIKAALIA KOSKEVIA TIETOJA
|
14.
|
Tuloksia välittömän myrkyllisyyden testistä tai muusta lyhytaikaista myrkyllisyyttä koskevasta testistä [esimerkiksi testimenetelmä C.14 (34) ja OECD:n testiohje (TG) 210 (1)], tulisi olla saatavilla. Tämä tarkoittaa sitä, että testiaineen vesiliukoisuus ja höyrynpaine tunnetaan, että käytettävissä on luotettava analyyttinen menetelmä aineen kvantifioimiseksi testiliuoksissa ja että menetelmän tarkkuus ja havaitsemisraja tunnetaan ja ne on raportoitu.
|
|
15.
|
Tarpeellisia tietoja ovat mm. rakennekaava, kemikaalin puhtaus, stabiilisuus vedessä tai valossa, pKa, Pow ja nopean biohajoavuuden testin (ks. testimenetelmä C.4) tulokset (35).
|
Testin hyväksyttävyyskriteerit
|
16.
|
Testitulokset ovat hyväksyttäviä, jos seuraavat ehdot täyttyvät:
|
—
|
Liuenneen hapen pitoisuus on vähintään 60 prosenttia ilman kyllästysarvosta koko altistusjakson ajan.
|
|
—
|
Veden lämpötila testiastioiden välillä vaihtelee enintään ± 1,5 °C milloin tahansa altistusjakson aikana ja pysyy sillä lämpötila-alueella, joka on määritelty kyseiselle testilajille (lisäys 2).
|
|
—
|
Käytettävissä tulee olla altistuksessa käytettävälle kemikaalille validoitu analyysimenetelmä, jonka havaitsemisraja on selvästi alle pienimmän nimellispitoisuuden. Lisäksi on kerättävä näyttöä, jolla osoitetaan, että testikemikaalin pitoisuudet liuoksessa ovat pysyneet hyväksyttävästi ± 20 prosentissa keskimääräisistä mitatuista arvoista.
|
|
—
|
Hedelmöityneiden munien eloonjäämisaste kontrolleissa ja – mikäli tarpeen – liuotinkontrolleissa on vähintään yhtä suuri kuin lisäyksessä 2 määritellyt rajat.
|
|
—
|
Kasvuun ja sukupuolijakaumaan testin päättyessä liittyvät hyväksymiskriteerit perustuvat kontrolliryhmistä saatuihin tietoihin (yhdistetty liuotin- ja vesikontrolli; jos ne ovat merkittävästi erilaisia, vain liuotinkontrolli).
|
|
Medaka
|
Seeprakala
|
Kolmipiikki
|
|
Kasvu
|
Kalan märkäpaino, kuivattu imeyttämällä vesi paperiin
|
> 150 mg
|
>75 mg
|
> 120 mg
|
|
Pituus (vakiopituus)
|
> 20 mm
|
> 14 mm
|
> 20 mm
|
|
Sukupuolijakauma (koiraiden/naaraiden prosenttiosuus)
|
30–70 %
|
30–70 %
|
30–70 %
|
|
|
—
|
Kun käytetään liuotinta, sillä ei tulisi olla tilastollisesti merkitsevää vaikutusta eloonjäämiseen, eikä sen pitäisi aiheuttaa hormonitoimintaa häiritseviä vaikutuksia tai muita haittavaikutuksia elinkaaren varhaisvaiheisiin, kuten liuotinkontrollista käy ilmi.
|
Jos havaitaan poikkeama testin hyväksymiskriteereistä, sen vaikutukset testin luotettavuuteen on otettava huomioon, ja nämä seikat on sisällytettävä tutkimusraporttiin.
|
TESTIMENETELMÄN KUVAUS
Testiastiat
|
17.
|
Kaikkia lasista, ruostumattomasta teräksestä tai muusta kemiallisesti inertistä materiaalista valmistettuja astioita voi käyttää. Astioiden tulee olla riittävän suuria, jotta jäljempänä esitetyt täyttötiheyteen liittyvät kriteerit täyttyvät. Suositellaan, että testiastiat sijoitetaan koealueelle satunnaistetusti. Satunnaistettu lohkoittainen järjestys, jossa jokaista pitoisuutta on jokaisessa lohkossa, on ensisijainen täydelliseen satunnaistamiseen nähden. Testiastiat olisi suojattava ei-toivotuilta häiriöiltä.
|
Lajin valinta
|
18.
|
Suositeltavat kalalajit luetellaan lisäyksessä 2. Menettelyt uusien lajien lisäämiseksi on esitetty 2 kohdassa.
|
Kutevan kalan hoito
|
19.
|
Tarkempia tietoja kutevan kalan hoitamisesta hyväksyttävissä olosuhteissa on OECD:n testiohjeessa (TG) nro 210(1). Kuteva kala on ruokittava kerran tai kahdesti päivässä sopivalla ruoalla.
|
Alkioiden ja toukkien käsittely
|
20.
|
Aluksi alkioita ja toukkia voidaan altistaa pienemmissä lasista tai ruostumattomasta teräksestä valmistetuissa astioissa, jotka laitetaan varsinaiseen testiastiaan. Astioiden sivujen tai päiden on oltava verkkoa, jotta testikemikaali pääsee virtaamaan astian läpi. Pienten astioiden läpi johdetaan pyörteetön virtaus ripustamalla astiat varteen, jota voidaan nostaa ja laskea astiassa siten, että organismit ovat nestepinnan alla koko ajan.
|
|
21.
|
Jos munien säilytysastioita pidetään isossa testiastiassa telineissä, ritilöissä tai verkoissa, ne on poistettava toukkien kuoriutumisen jälkeen, mutta verkkopäädyt tai -sivut tulee kuitenkin pitää paikallaan kalojen karkaamisen estämiseksi. Jos toukkia täytyy siirtää, ne eivät saisi altistua ilmalle, eikä kalojen vapauttamiseen munien säilytysastioista tule käyttää haaveja. Siirtoajankohta vaihtelee lajeittain, eikä siirto ehkä ole aina välttämätöntä.
|
Vesi
|
22.
|
Testivedeksi sopii mikä tahansa vesi, jossa testilajin kontrollieläimet pysyvät elossa vähintään yhtä hyvin kuin lisäyksessä 3 kuvatussa vedessä. Veden laadun pitäisi pysyä vakiona testin ajan. Sen varmistamiseksi, ettei laimennusvesi vaikuta liikaa testituloksiin (esimerkiksi reagoimalla testikemikaalin kanssa) tai haitallisesti siitoskalakannan vointiin, näytteitä on otettava säännöllisin väliajoin analysoitavaksi. Orgaanisen hiilen kokonaispitoisuus, johtavuus, pH ja suspendoituneet kiinteät aineet on mitattava esimerkiksi kolmen kuukauden välein, jos laimennusveden laadun tiedetään pysyvän melko vakiona. Raskasmetallien (esimerkiksi Cu, Pb, Zn, Hg, Cd, Ni), pääasiallisten anionien ja kationien (esimerkiksi Ca2+, Mg2+, Na+, K+, Cl–, SO4
2–) ja torjunta-aineiden pitoisuudet tulee mitata, jos veden laatu on kyseenalainen. Tarkempia tietoja kemiallisesta analyysista ja veden keräämisestä on 34 kohdassa.
|
Testiliuokset
|
23.
|
Testissä tulisi käyttää läpivirtausjärjestelmää, jos se on käytännössä mahdollinen. Läpivirtaustesteissä on käytettävä testiaineen varastoliuosta jatkuvasti annostelevaa ja laimentavaa järjestelmää (esimerkiksi annostelupumppua, laimenninta ja kyllästävää järjestelmää) testipitoisuuksien annostelemiseksi testiastioihin. Varastoliuosten ja laimennusveden virtausnopeudet on tarkistettava säännöllisin väliajoin, mieluiten kerran päivässä, ja virtausnopeus saa vaihdella enintään 10 prosenttia koko testin aikana. Virtausnopeus, joka on vähintään viisi kertaa testiastian tilavuus 24 tunnissa, on havaittu sopivaksi (1). Muoviletkujen tai muiden sellaisten materiaalien, jotka saattavat sisältää biologisesti aktiivisia kemikaaleja tai joihin testikemikaali saattaa adsorboitua, käyttämistä on pyrittävä välttämään.
|
|
24.
|
Varastoliuos valmistetaan mieluiten liuottimia käyttämättä yksinkertaisesti sekoittamalla testikemikaali laimennusveteen käyttäen mekaanisia menetelmiä (kuten sekoittamista tai ultraääntä). Jos testikemikaali liukenee veteen huonosti, on noudatettava OECD:n toimintaohjetta, joka koskee vaikeasti testattavien aineiden ja seosten vesieliöille myrkyllisyyden testaamista (OECD Guidance Document on aquatic toxicity testing of difficult substances and mixtures) (36). Liuottimien käyttöä tulee välttää, mutta se voi olla tarpeen joissakin tapauksissa riittävän väkevän varastoliuoksen valmistamiseksi. Esimerkkejä sopivista liuottimista on kirjallisuusviitteessä (36).
|
|
25.
|
Puolistaattisia testiolosuhteita tulee välttää, ellei niiden käyttö ole perusteltua testikemikaaliin liittyvistä pakottavista syistä (esimerkiksi stabiilius, rajallinen saatavuus, kalleus tai vaarallisuus). Puolistaattisessa testissä voidaan käyttää kahta eri liuoksenvaihtomenetelmää: Joko uudet testiliuokset valmistetaan puhtaissa astioissa ja elossa olevat munat ja toukat siirretään varovasti niihin, tai testiorganismit pidetään testiastioissa sen aikaa, kun osa (vähintään kaksi kolmasosaa) testivedestä vaihdetaan päivittäin.
|
MENETTELY
Altistumisolosuhteet
Munien kerääminen ja altistuksen kesto
|
26.
|
Geneettisten poikkeamien välttämiseksi munia kerätään vähintään kolmelta kalaparilta tai -ryhmältä, jotka sekoitetaan ja valitaan satunnaisesti testin aloitukseen. Katso kuvaus kolmipiikin keinohedelmöityksestä lisäyksestä 11. Testi tulee aloittaa mahdollisimman pian munien hedelmöittymisen jälkeen. Alkiot on upotettava testiliuoksiin mieluiten ennen kuin emosolun jakautuminen alkaa tai mahdollisimman pian tämän vaiheen jälkeen, viimeistään kuitenkin 12 tunnin kuluttua hedelmöittymisestä. Testiä tulee jatkaa siihen saakka, kunnes sukupuolten eriytyminen kontrolliryhmässä on päättynyt (60 päivää kuoriutumisen jälkeen medakalla, kolmipiikillä ja seeprakalalla).
|
Täyttö
|
27.
|
Testin alussa hedelmöityneitä munia on oltava vähintään 120 pitoisuutta kohti jaettuna vähintään neljään rinnakkaisnäytteeseen (kontrolliryhmiin jakaminen neliöjuuren perusteella on hyväksyttävää). Munat tulee jakaa käsittelyihin satunnaistetusti (käyttämällä satunnaistamiseen tilastollisia taulukoita). Astioiden täyttöaste (ks. määritelmä lisäyksestä 1) tulee olla riittävän pieni, jotta liuenneen hapen pitoisuus (vähintään 60 prosenttia ilman kyllästysarvosta) voidaan säilyttää ilman astioiden suoraa ilmastusta. Läpivirtaustesteissä täyttöaste saisi olla enintään 0,5 g/l per 24 tuntia ja enintään 5 g/l liuosta minä tahansa ajankohtana. Viimeistään 28 päivän kuluttua hedelmöittymisestä rinnakkaisnäytekohtainen kalojen määrä tulee jakaa uudelleen, jotta jokaisessa rinnakkaisnäytteessä mahdollisimman tarkasti sama määrä kaloja. Jos altistumiseen liittyvää kuolleisuutta ilmenee, rinnakkaisnäytteiden määrää tulee vähentää vastaavasti, jotta käsittelytasojen välinen kalatiheys säilyy mahdollisimman samankaltaisena.
|
Valo ja lämpötila
|
28.
|
Valoisan ajan ja testiveden lämpötilan pitää olla sopivia käytetylle testilajille (ks. lisätietoja FSDT-testin koeolosuhteista lisäyksestä 2).
|
Ruokinta
|
29.
|
Ruoka ja ruokinta ovat hyvin tärkeitä, ja on olennaista, että kussakin vaiheessa annetaan asianmukaista ruokaa sopivin väliajoin sellainen määrä, joka tukee normaalia kasvua. Ruokinnassa tulee noudattaa ad libitum -periaatetta ylimäärä minimoiden. Jotta kasvunopeus olisi riittävä, kalat on ruokittava vähintään kahdesti päivässä (viikonloppuisin riittää yksi kerta), ja ruokintakertojen välillä tulee olla vähintään kolme tuntia. Ylimääräinen ruoka ja ulosteet on tarvittaessa poistettava astiasta jätteen kertymisen välttämiseksi. Kokemuksen karttuessa ruoan tyyppiä ja ruokinta-aikataulua voi mukauttaa jatkuvasti eloonjäämisen edistämiseksi ja kasvun optimoimiseksi. Ehdotetulle aikataululle on pyrittävä saamaan asiantuntijoiden vahvistus. Ruokinta on lopetettava 24 h ennen testin päättymistä. Esimerkkejä sopivista ruoista on lisäyksessä 2 (katso myös OECD:n kaloilla testausta koskeva asiakirja ’Fish Testing Framework’ (39).
|
Testipitoisuudet
|
30.
|
Testikemikaalien pitoisuudet on porrastettava lisäyksessä 4 kuvatun mukaisesti. Testissä on käytettävä vähintään kolmea testipitoisuutta vähintään neljässä rinnakkaisnäytteessä. Käyrää, jossa esitetään LC50 saatavilla olevien välittömien myrkyllisyystestien altistusajan funktiona, olisi käytettävä apuna valittaessa testipitoisuusaluetta. Jos tietoja on määrä käyttää riskinarviointiin, testissä suositellaan käytettäväksi viittä testipitoisuutta.
|
|
31.
|
Kemikaalipitoisuuksia, jotka ovat suurempia kuin 10 prosenttia aikuisen eläimen välittömän myrkyllisyyden LC50-arvosta tai 10 mg/l (näistä pienempi arvo), ei tarvitse testata. Enimmäistestipitoisuus on 10 prosenttia toukan tai nuoren eläimen LC50-arvosta.
|
Kontrollit
|
32.
|
Testipitoisuuksien lisäksi testissä on käytettävä laimennusvesikontrollia (≥ 4 rinnakkaisnäytettä) ja tarvittaessa liuotinkontrollia (≥ 4 rinnakkaisnäytettä). Testissä saa käyttää vain sellaisia liuottimia, joilla ei tutkitusti ole tilastollisesti merkitsevää vaikutusta testissä tutkittaviin ominaisuuksiin.
|
|
33.
|
Liuotinta käytettäessä sen lopullinen pitoisuus saa olla enintään 0,1 ml/l (36), ja kaikissa testiastioissa pitää olla sama pitoisuus laimennusvesikontrollia lukuun ottamatta. Liuottimen käyttöä tulee kuitenkin pyrkiä välttämään kaikin keinoin tai niiden pitoisuudet tulee pitää mahdollisimman pieninä.
|
Analyyttisten määritysten ja mittausten taajuus
|
34.
|
Ennen testin aloittamista testikemikaalipitoisuus on analysoitava kemiallisesti sen tarkistamiseksi, että hyväksymiskriteerit täyttyvät. Kaikki rinnakkaisnäytteet on analysoitava yksittäin testin alussa ja lopussa. Testin aikana on analysoitava yksi rinnakkaisnäyte testipitoisuutta kohti vähintään kerran viikossa, ja rinnakkaisnäytteitä on vaihdettava järjestelmällisesti (1, 2, 3, 4, 1, 2…). Jos näytteet varastoidaan analysoitavaksi myöhemmin, niiden varastointimenetelmä on validoitava etukäteen. Näytteet on suodatettava (esimerkiksi käyttämällä huokoskokoa 0,45 μm) tai sentrifugoitava, jotta varmistetaan, että määritykset tehdään todellisessa liuoksessa olevasta kemikaalista.
|
|
35.
|
Testin aikana kaikista testiastioista on mitattava liuennut happi, pH, kokonaiskovuus, johtavuus, suolapitoisuus (jos tarpeen) ja lämpötila. Vähintään liuennut happi, suolapitoisuus (jos tarpeen) ja lämpötila on mitattava viikoittain, ja pH, johtavuus ja kovuus testin alussa ja lopussa. Lämpötilaa on mielellään seurattava jatkuvasti vähintään yhdessä testiastiassa.
|
|
36.
|
Tulosten perustana tulee käyttää mitattuja pitoisuuksia. Jos testikemikaalin pitoisuus pysyy kuitenkin tyydyttävästi ± 20 prosentin sisällä nimellispitoisuudesta koko testin ajan, tulosten perustana voidaan käyttää joko nimellispitoisuuksia tai mitattuja pitoisuuksia.
|
Havainnot ja mittaukset
Alkiokehityksen vaiheet
|
37.
|
Altistus pitää aloittaa mahdollisimman pian hedelmöittymisen jälkeen ja ennen kuin emosolun jakautuminen alkaa, kuitenkin viimeistään 12 tunnin kuluttua hedelmöittymisestä. Näin varmistetaan varhaisen alkiokehityksen aikainen altistus.
|
Kuoriutuminen ja eloonjääminen
|
38.
|
Kuoriutumisesta ja eloonjäämisestä olisi tehtävä havaintoja vähintään kerran päivässä, ja yksilöiden lukumäärät on kirjattava. Kuolleet alkiot, toukat ja nuoret kalat on poistettava heti kun ne on havaittu, koska ne saattavat hajota nopeasti tai muiden kalojen toiminta saattaa rikkoa ne. Kuolleita yksilöitä poistettaessa on oltava erittäin varovainen, ettei vieressä olevia munia tai toukkia kosketa tai vahingoiteta fyysisesti, sillä ne ovat hyvin herkkiä ja hauraita. Kuolemantapaukset todetaan eri kehitysvaiheessa eri tavoin:
|
—
|
Munat: Erityisesti varhaisvaiheissa läpikuultavuus vähenee ja väri muuttuu, mikä johtuu valkuaisaineiden hyytymisestä ja/tai saostumisesta, josta on seurauksena valkoinen väri ja läpinäkymättömyys.
|
|
—
|
Toukat ja nuoret kalat: Toukat eivät liiku ja/tai niiden hengitysliikkeet puuttuvat ja/tai sydän ei lyö ja/tai keskushermosto on valkoinen ja läpinäkymätön ja/tai ne eivät reagoi mekaanisiin ärsykkeisiin.
|
|
Epänormaali ulkonäkö
|
39.
|
Niiden toukkien tai kalojen lukumäärä, joiden muoto on poikkeava, on kirjattava muistiin, ja poikkeavuuden ulkonäkö ja luonne on kuvattava. Huomattakoon, että epänormaaleja alkioita ja toukkia esiintyy luonnollisesti, ja niiden määrä voi olla useita prosentteja kontroll(e)issa joissakin lajeissa. Epänormaalit eläimet tulee vain poistaa testiastioista, kun ne kuolevat. Jos poikkeavuudet aiheuttavat kuitenkin kipua, tuskaa, kärsimystä tai pysyvää haittaa ja jos kuolema voidaan ennustaa luotettavasti, Euroopan parlamentin ja neuvoston 22 päivänä syyskuuta 2010 tieteellisiin tarkoituksiin käytettävien eläinten suojelusta antaman direktiivin 2010/63/EU mukaan eläimet on nukutettava ja lopetettava 44 kohdassa kuvatulla tavalla.
|
Epänormaali käyttäytyminen
|
40.
|
Poikkeavuudet, kuten hyperventilaatio, koordinoimaton uinti, epätyypilliset äänet ja epätyypillinen syömiskäyttäytyminen on kirjattava muistiin niitä havaittaessa.
|
Paino
|
41.
|
Testin lopussa kaikki eloonjääneet kalat on lopetettava (nukutettava, jos on määrä ottaa verikokeita), ja niiden yksilöllinen märkäpaino (kun ne on kuivattu imeyttämällä vesi paperiin) on punnittava.
|
Pituus
|
42.
|
Testin lopussa kalojen yksilölliset pituudet (vakiopituus) on mitattava.
|
|
43.
|
Näiden havaintojen avulla voidaan raportoida seuraavat tiedot:
|
—
|
terveiden kalojen lukumäärät testin lopussa
|
|
—
|
kuoriutumisen alkamis- ja päättymisajankohdat
|
|
—
|
eloon jääneiden eläinten pituus ja paino
|
|
—
|
epämuodostuneiden toukkien lukumäärät
|
|
—
|
epätavallisesti käyttäytyvien kalojen lukumäärä.
|
|
Näytteenotto kaloilta
|
44.
|
Kaloilta otetaan tarvittavat näytteet testin päättyessä. Kalat, joilta otetaan näytteitä, on lopetettava esimerkiksi MS-222:lla (100–500 mg litrassa liuosta, joka on puskuroitu 200 mg:lla NaHCO3:a litrassa) tai FA-100:lla (4-allyyli-2-metoksofenoli: eugenoli), ja jokaisen kalan pituus on mitattava ja märkäpaino punnittava (kun kala on kuivattu imeyttämällä vesi paperiin), tai nukutettava, jos niiltä on määrä ottaa verinäyte (ks. 49 kohta).
|
Näytteenotto vitellogeniinianalyysia varten ja sukupuolen määritys histologisen arvioinnin avulla
|
45.
|
Kaikilta kaloilta tulee ottaa näytteet ja ne pitää valmistella sukupuolen määritystä ja vitellogeniinianalyysia varten. Kaikki kalat on analysoitava histologisesti sukupuolen määrittämiseksi. Vitellogeniinimittauksissa vähintään 16 kalaa käsittävä osanäyte jokaisesta rinnakkaisnäytteestä on hyväksyttävä. Vitellogeniini on analysoitava useammista kaloista, jos osanäytteen tulokset osoittautuvat epäselviksi.
|
|
46.
|
Näytteenottomenetelmä vitellogeniinipitoisuuden ja sukupuolen määritystä varten määräytyy vitellogeniinin analyysimenetelmän mukaan:
|
Pää-/pyrstöhomogenaattimenetelmä vitellogeniinianalyysia varten
|
47.
|
Kala lopetetaan. Jokaisen kalan pää ja pyrstö irrotetaan muusta ruumiista heti rintaevien ja selkäevän takaa tehtävillä viilloilla skalpellia käyttäen (ks. kuva 1). Jokaisen kalan pää- ja pyrstöosa yhdistetään, punnitaan ja numeroidaan yksitellen. Sen jälkeen ne jäädytetään nestemäisessä typessä, ja niitä säilytetään vähintään – 70 °C:ssa vitellogeniinianalyysia varten. Kalan ruumis numeroidaan ja kiinnitetään asianmukaisella kiinnitysaineella histologista arviointia varten (22). Tätä menetelmää käyttämällä vitellogeniini ja histopatologia arvioidaan jokaiselta kalalta yksitellen, ja mahdollinen vitellogeniinipitoisuuden muutos voidaan näin liittää kalan fenotyyppiseen tai geneettiseen sukupuoleen (medaka ja kolmipiikki). Katso lisätietoja homogenisointia koskevista ohjeista (lisäys 5) ja vitellogeniinin kvantifiointia koskevista ohjeista (lisäys 6).
|
Maksahomogenaattimenetelmä vitellogeniinianalyysia varten
|
48.
|
Kala lopetetaan. Maksa irrotetaan ja säilytetään vähintään – 70 °C:ssa. Suositellut menetelmät maksan irrottamiseen ja esikäsittelyyn ovat saatavilla OECD:n testiohjeessa (TG) nro 229 (37) tai tämän liitteen luvussa C.37 (38). Sen jälkeen maksat homogenisoidaan yksittäin OECD:n testiohjeessa (TG) nro 229 tai tämän liitteen luvussa C.37 kuvatun mukaisesti. Kerättyä supernatanttia käytetään vitellogeniinin mittaamiseen homologisella ELISA-tekniikalla (ks. esimerkki kvantifioinnista seeprakalan yhteydessä lisäyksestä 6 tai medakan yhteydessä OECD:n testiohjeesta (TG) nro 229 (37)). Tällä tavalla on myös mahdollista saada kalakohtaista tietoa sekä vitellogeniinista että sukurauhasten histologiasta.
|
Veriplasmamenetelmä vitellogeniinianalyysia varten
|
49.
|
Verinäyte otetaan nukutetuilta kaloilta sydänpunktiolla, pyrstösuonesta tai leikkaamalla pyrstö, ja se sentrifugoidaan 4 °C:ssa plasman keräämistä varten. Plasma säilytetään vähintään – 70 °C:ssa käyttämiseen saakka. Kaikki kalat lopetetaan ja kiinnitetään kiinnitysaineella histologista tutkimusta varten. Sekä plasmanäytteet että kalat numeroidaan yksilöllisesti, jotta vitellogeniinipitoisuudet voidaan yhdistää kalan sukupuoleen.
Kuvio 1
Kalan leikkaaminen pää-/pyrstöhomogenaattiosiin vitellogeniinin mittausta varten ja keskiruumiin histologista arviointia varten

|
Geneettisen sukupuolen määrittäminen
|
50.
|
Biologinen näyte geneettisen sukupuolen määrittämistä varten otetaan jokaiselta niiden lajien kalalta, joilla on asianomaiset merkit sukupuolesta. Medakalta näytteeksi otetaan peräevä tai selkäevä. Tarkat ohjeet ovat lisäyksessä 9, mukaan luettuina kudosnäytteiden ottaminen ja sukupuolen määrittäminen PCR-menetelmällä. Kolmipiikkiä koskevat ohjeet kudosnäytteiden ottamisesta ja sukupuolen määrittämisestä PCR-menetelmällä ovat lisäyksessä 10.
|
Vitellogeniinipitoisuuden mittaaminen
|
51.
|
Vitellogeniinipitoisuus on mitattava määrällisesti ja analyyttisesti validoidulla menetelmällä. Tietyssä laboratoriossa käytetyn menetelmän testin sisäisestä ja testien välisestä vaihtelusta tulisi olla saatavilla tietoa. Laboratorioiden välisen ja laboratorion sisäisen vaihtelun lähde perustuu (todennäköisimmin) kalapopulaation eri kehitysvaiheisiin. Kun otetaan huomioon vitellogeniinimittauksiin liittyvä vaihtelu, pelkästään tähän ominaisuuteen perustuvaan NOEC-arvoon tulee suhtautua hyvin varauksellisesti. Käytettävissä on eri menetelmiä, joilla voidaan arvioida vitellogeniinin tuotantoa tässä testissä käytetyillä lajeilla. Mittaustekniikka, joka on sekä varsin herkkä että spesifi on proteiinipitoisuuksien määrittäminen entsyymivälitteisellä immunosorbenttimääritysmenetelmällä (ELISA-menetelmällä). Tällöin on käytettävä homologisia vasta-aineita (joita on muodostunut saman lajin vitellogeniinia vastaan) ja tärkeimpiä homologisia standardeja.
|
Sukupuolen määrittäminen
|
52.
|
Sen mukaan, mitä vitellogeniinin näytteenottomenetelmää käytetään, koko kala tai jokaisesta kalasta jäljelle jäävä keskiruumis asetetaan kudoskasettiin (johon on laitettu tarvittavat merkinnät etukäteen) ja kiinnitetään asianmukaisella kiinnitysaineella sukupuolen histologista määritystä varten (valinnaisesti myös sukupuolirauhasten kehitysvaiheen arviointia varten). Ohjeita kiinnittämistavoista on lisäyksessä 7 sekä OECD:n ohjeasiakirjassa, joka koskee hormonitoimintaan liittyvän histopatologian diagnosointia kalojen sukupuolirauhasissa (Guidance Document on the Diagnosis of Endocrine-Related Histopathology of Fish Gonads) (22). Käsittelyn jälkeen kalat valetaan parafiiniblokiksi. Kalat on asetettava parafiiniblokkiin pitkittäin. Jokaiselta yksilöltä otetaan vähintään kuusi pitkittäisleikettä (paksuus 3–5 μm) frontaalitasossa, mukaan luettuina sukupuolirauhaskudosta molemmista rauhasista. Näiden leikkeiden välinen etäisyys tulisi olla koirailla noin 50 μm ja naarailla 250. Koska jokaisessa blokissa on kuitenkin usein sekä koiraita että naaraita (jos yhteen blokkiin on valettu useampi kuin yksi yksilö), näistä blokeista otettujen leikkeiden väli tulisi olla noin 50 μm siihen saakka, kunnes jokaisen koiraan sukupuolirauhasista on saatu vähintään kuusi leikettä. Sen jälkeen leikkeiden välistä etäisyyttä voidaan suurentaa naarailla noin 250 μm:iin. Leikkeet värjätään hematosykliinillä ja eosiinilla, ja ne tutkitaan valomikroskoopilla sukupuoleen keskittyen (koiras, naaras, sekasukupuolinen vai eriytymätön). Sekasukupuolisuus määritellään siten, että kuutta analysoitua leikettä kohti kiveksissä on useampi kuin yksi oosyytti tai että munasarjoissa on spermatogeenisia soluja (kyllä/ei). Munasarjojen ja kivesten histopatologia ja kehitysvaiheen määritys ei ole pakollista, mutta jos ne tutkitaan, tulokset on analysoitava tilastollisesti ja raportoitava. On muistettava, että joillakin kalalajeilla täysin kehittyneiden sukupuolirauhasten puuttuminen on luonnollista, ja niillä voi olla vain yksi sukupuolirauhanen (esimerkiksi medaka ja toisinaan myös seeprakala). Kaikki tällaiset havainnot on kirjattava muistiin.
|
|
53.
|
Medaka-yksilön geneettisen sukupuolen määritys perustuu siihen, onko niillä medakan koirassukupuolen määrittävä geeni DMY vai ei. Tämä geeni sijaitsee Y-kromosomissa. Medakan genotyyppinen sukupuoli voidaan tunnistaa sekvensoimalla DMY-geeni DNA:sta, joka on otettu esimerkiksi peräevän tai selkäevän palasesta. Jos kalalla on DMY-geeni, kyseessä on XY-yksilö (koiras) fenotyypistä riippumatta, ja jos DMY-geeniä ei ole, kyseessä on XX-yksilö (naaras) fenotyypistä riippumatta (23). Kudosten valmistelua ja PCR-menetelmää koskevia ohjeita on lisäyksessä 9. Kolmipiikkiyksilön geneettinen sukupuoli määritetään myös PCR-menetelmällä, jota kuvataan lisäyksessä 10.
|
|
54.
|
Sekasukupuolisuuden esiintyminen (katso määritelmä lisäyksestä 1) on raportoitava.
|
Sekundaariset sukupuoliominaisuudet
|
55.
|
Medakan kaltaisilla lajeilla sekundaarisia sukupuoliominaisuuksia ohjaa hormonijärjestelmä, joten havainnot kalan fyysisestä ulkonäöstä tulisi tehdä altistuksen lopussa, mikäli mahdollista. Medakalla naaraiden peräevän takaosassa oleva papillimuodostelma on androgeenille herkkä. Tämän liitteen (38) luvussa C.37 on asiaankuuluvia valokuvia koiraan ja koiraaksi muuttuneen naaraan sekundaarisista sukupuoliominaisuuksista.
|
TIEDOT JA RAPORTOINTI
Tulosten käsittely
|
56.
|
On tärkeää, että ominaisuus määritetään vahvimmalla validilla tilastollisella testillä. Kokeellinen yksikkö on rinnakkaisnäyte, mutta rinnakkaisnäytteiden sisäinen vaihtelu on sisällytettävä tilastolliseen testaukseen. Lisäyksessä 8 on päätöksentekoa tukeva vuokaavio, joka on tarkoitettu avuksi, kun valitaan käytettävää sopivinta tilastollista testiä altistustestistä saatujen tietojen piirteiden perusteella. Tilastollinen merkitsevyystaso on 0,05 kaikkien asiaankuuluvien ominaisuuksien yhteydessä.
|
Sukupuolten ja geneettisten sukupuolten jakaumat
|
57.
|
Sukupuolijakaumista on analysoitava altistuksen merkitsevä vaikutus (NOEC/LOEC-lähestymistapa) Jonckheere-Terpstran testillä (trenditestillä), jos monotoninen annos-vastesuhde on todettu. Jos annos-vastesuhde on ei-monotoninen, on sovellettava kahta testiä: Dunnettin testiä käytetään, jos normaalisuus ja homogeeninen varianssi on havaittu. Sen sijaan jos on havaittu heterogeeninen varianssi, käytetään Tamhane-Dunnettin testiä. Muussa tapauksessa käytetään Mann-Whitneyn tarkkaa testiä ja Bonferroni-Holm-korjausta. Vuokaavio, jossa kuvataan sukupuolijakaumaan liittyviä tilastoja, on lisäyksessä 8. Sukupuolijakaumat on esitettävä taulukoissa pitoisuuden mukaisina jakaumina ± keskihajonta koiraiden, naaraiden, sekasukupuolisuuden ja eriytymättömyyden osalta. Tilastollinen merkitsevyys tulisi korostaa. Esimerkkejä on FSDT-testin vaiheen 2 validointiraportissa (42). Geneettinen sukupuoli on ilmoitettava prosenttiosuutena koiraiden ja naaraiden fenotyyppisen sukupuolen vaihtumisesta, sekasukupuolisuudesta ja eriytymättömyydestä.
|
Vitellogeniinipitoisuudet
|
58.
|
Vitellogeniinipitoisuuksista on analysoitava altistumisen merkitsevä vaikutus (NOEC/LOEC-lähestymistapa). Dunnettin testiä tulisi käyttää mieluummin kuin t-testiä ja Bonferronin korjausta. Jos käytetään Bonferronin korjausta, Bonferroni-Holmin korjaus on suositeltavampi. Vitellogeniinin log-muunnokset on otettava huomioon normaalisuuden ja varianssin homogeenisuuden saavuttamiseksi. Jos pitoisuus-vaste on yhdenmukainen monotonisuuden kanssa, Jonckheere-Terpstran testi on kaikkiin edellä mainittuihin testeihin nähden ensisijainen. Jos käytetään t-testejä tai Dunnettin testiä, merkitsevä ANOVA F -testi ei ole etenemisen kannalta tarpeen. Katso tarkempia tietoja lisäyksessä 8 olevasta vuokaaviosta. Tulokset on ilmoitettava taulukoissa pitoisuuksien keskiarvona ± keskihajonta koiraiden, naaraiden, sekasukupuolisuuden ja eriytymättömyyden osalta erikseen. Fenotyyppisten naaraiden ja fenotyyppisten koiraiden tilastollinen merkitsevyys on korostettava. Esimerkkejä on FSDT-testin vaiheen 2 validointiraportissa (42).
|
Testikemikaalin varsinaiset pitoisuudet
|
59.
|
Testikemikaalin todelliset pitoisuudet testiastioissa on analysoitava 34 kohdassa kuvattujen taajuuksien mukaisesti. Tulokset on ilmoitettava taulukoissa keskimääräisenä pitoisuutena ± keskihajontana rinnakkaisnäytekohtaisesti ja myös pitoisuuskohtaisesti. Tällöin on annettava tiedot näytteiden lukumäärästä ja korostettava niitä vieraita havaintoja, jotka olivat ± 20 prosentin sisällä keskimääräisestä käsittelypitoisuudesta. Esimerkkejä on FSDT-testin vaiheen 2 validointiraportissa (42).
|
Tulosten tulkinta
|
60.
|
Tulosten tulkinnassa on oltava varovainen, jos testiliuoksista mitatut testikemikaalipitoisuudet ovat lähellä analyysimenetelmän havaitsemisrajaa.
|
Testiraportti
|
61.
|
Testiraporttiin on sisällytettävä seuraavat tiedot:
|
|
Testikemikaali
|
—
|
Olennaiset fysikaalis-kemialliset ominaisuudet; kemialliset tunnistetiedot; tiedot esimerkiksi puhtaudesta ja testikemikaalin kvantifioinnin analyysimenetelmä.
|
|
|
|
Testiolosuhteet
|
—
|
Käytetty testimenettely (esimerkiksi läpivirtaus, puolistaattinen/ajoittaisvaihtoinen); testisuunnitelma ja testipitoisuudet, varastoliuosten valmistusmenetelmä (liitteessä), liuoksen vaihtotiheys (liuotusapuaine ja sen pitoisuus tulee ilmoittaa, jos sitä on käytetty).
|
|
—
|
Testikemikaalin nimellispitoisuudet, mitattujen arvojen keskiarvot ja niiden keskihajonnat testiastioissa sekä menetelmä, jolla arvot laskettiin (käytetty analyysimenetelmä tulee esittää liitteessä); todisteet siitä, että mittaukset koskevat testikemikaalin pitoisuuksia todellisessa liuoksessa.
|
|
—
|
Veden laatu testiastioissa: pH, kovuus, lämpötila ja liuenneen hapen pitoisuus.
|
|
—
|
Tarkat tiedot ruokinnasta (esimerkiksi ruoan (ruokien) tyyppi, lähde, annettu määrä ja antotiheys sekä analyysit merkittävistä kontaminanteista (esimerkiksi PCB-yhdisteet, PAH-yhdisteet ja orgaanista klooria sisältävät torjunta-aineet), mikäli tarpeen.
|
|
|
|
Tulokset
|
—
|
Todisteet siitä, että kontrollit täyttävät validiteettikriteerit: tiedot kuoriutumisasteesta on esitettävä taulukoissa rinnakkaisnäyte- ja pitoisuuskohtaisena prosenttiosuutena. Hyväksymiskriteereitä (kontrollit) koskevat vieraat havainnot tulee korostaa. Eloonjääminen on esitettävä rinnakkaisnäyte- ja pitoisuuskohtaisena prosenttiosuutena. Validiteettikriteereitä koskevat vieraat havainnot tulee korostaa.
|
|
—
|
Havainnoituja eri ominaisuuksia koskevat tulokset on esitettävä selvästi: alkion eloonjääminen ja kuoriutumisen onnistuminen; ulkoiset poikkeamat; pituus ja paino; vitellogeniinimittaukset (ng/g homogenaatissa, ng/ml plasmassa tai ng/mg maksassa); sukupuolirauhasten histologia, sukupuolijakauma, tiedot geneettisestä sukupuolesta; kaloilla ilmenneet epätavalliset reaktiot ja kaikki testikemikaalin aiheuttamat näkyvät vaikutukset.
|
|
|
|
62.
|
Tulokset on esitettävä keskiarvoina ± keskihajonta (SD) tai keskivirhe (SE). Tilastoista on ilmoitettava vähintään NOEC- ja LOEC-arvot ja luottamusvälit. Tilastollista vuokaaviota (lisäys 8) on noudatettava.
|
LÄHDEKIRJALLISUUS
|
(1)
|
OECD (1992), Fish, Early Life Stage Toxicity Test, Test Guideline No. 210, Guidelines for the Testing of Chemicals, OECD, Paris.
|
|
(2)
|
Jobling, S., D. Sheahan, J.A. Osborne, P. Matthiessen, and J.P. Sumpter, 1996, ’Inhibition of testicular growth in rainbow trout (Oncorhynchus mykiss) exposed to estrogenic alkylphenolic chemicals’, Environmental Toxicology and Chemistry 15, pp. 194–202.
|
|
(3)
|
Sumpter, J.P. and S. Jobling, 1995, ’Vitellogenesis As A Biomarker for Estrogenic Contamination of the Aquatic Environment’, Environmental Health Perspectives 103, pp. 173–178.
|
|
(4)
|
Tyler, C.R., R.van Aerle, T.H. Hutchinson, S. Maddix, and H. Trip (1999), ’An in vivo testing system for endocrine disruptors in fish early life stages using induction of vitellogenin’, Environmental Toxicology and Chemistry 18, pp. 337–347.
|
|
(5)
|
Holbech, H., L. Andersen, G.I. Petersen, B. Korsgaard, K.L. Pedersen, and P. Bjerregaard (2001a), ’Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio)’, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 130, pp. 119–131.
|
|
(6)
|
Andersen, L., P. Bjerregaard, and B. Korsgaard ( 2003), ’Vitellogenin induction and brain aromatase activity in adult male and female zebrafish exposed to endocrine disrupters’, Fish Physiology and Biochemistry 28, pp. 319–321.
|
|
(7)
|
Orn, S., H. Holbech, T.H. Madsen, L. Norrgren, and G.I. Petersen (2003), ’Gonad development and vitellogenin production in zebrafish (Danio rerio) exposed to ethinylestradiol and methyltestosterone’, Aquatic Toxicology 65, pp. 397–411.
|
|
(8)
|
Panter, G.H., T.H. Hutchinson, R. Lange, C.M. Lye, J.P. Sumpter, M. Zerulla, and C.R. Tyler (2002), ’Utility of a juvenile fathead minnow screening assay for detecting (anti-)estrogenic substances’, Environmental Toxicology and Chemistry 21, pp. 319–326.
|
|
(9)
|
Sun, L.W., J.M. Zha, P.A. Spear, and Z.J. Wang (2007), ’Toxicity of the aromatase inhibitor letrozole to Japanese medaka (Oryzias latipes) eggs, larvae and breeding adults’, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, pp. 533–541.
|
|
(10)
|
Parks, L.G., A.O. Cheek, N.D. Denslow, S.A. Heppell, J.A. McLachlan, G.A. LeBlanc, and C.V.Sullivan (1999), ’Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds’, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 123, pp. 113–125.
|
|
(11)
|
Brion, F., B.M. Nilsen, J.K. Eidem, A. Goksoyr, and J.M. Porcher (2002), ’Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio)’, Environmental Toxicology and Chemistry 21, pp. 1699–1708.
|
|
(12)
|
Nishi, K., M. Chikae, Y. Hatano, H. Mizukami, M. Yamashita, R. Sakakibara, and E. Tamiya (2002), ’Development and application of a monoclonal antibody-based sandwich ELISA for quantification of Japanese medaka (Oryzias latipes) vitellogenin’, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 132, pp. 161–169.
|
|
(13)
|
Hahlbeck, E., I. Katsiadaki, I. Mayer, M. Adolfsson-Erici, J. James, and B.E. Bengtsson (2004), ’The juvenile three-spined stickleback (Gasterosteus aculeatus L.) as a model organism for endocrine disruption – II – kidney hypertrophy, vitellogenin and spiggin induction’, Aquatic Toxicology 70, pp. 311–326.
|
|
(14)
|
Tatarazako, N., M. Koshio, H. Hori, M. Morita, and T. Iguchi (2004), ’Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the medaka’, Journal of Health Science 50, pp. 301–308.
|
|
(15)
|
Eidem, J.K., H. Kleivdal, K. Kroll, N. Denslow, R. van Aerle, C. Tyler, G. Panter, T. Hutchinson, and A. Goksoyr (2006), Development and validation of a direct homologous quantitative sandwich ELISA for fathead minnow (Pimephales promelas) vitellogenin. Aquatic Toxicology, 78, pp. 202–206.
|
|
(16)
|
Jensen, K.M. and G.T. Ankley (2006), ’Evaluation of a commercial kit for measuring vitellogenin in the fathead minnow (Pimephales promelas)’, Ecotoxicology and Environmental Safety 64, pp. 101–105.
|
|
(17)
|
Holbech, H., Petersen, G. I., Norman, A., Örn, S, Norrgren, L., and Bjerregaard, P (2001b), ’Suitability of zebrafish as test organism for detection of endocrine disrupting chemicals. Comparison of vitellogenin in plasma and whole body homogenate from zebrafish (Danio rerio) and rainbow trout (Oncorhynchus mykiss)’, Nordic Council of Ministers, TemaNord 2001:597, pp. 48–51.
|
|
(18)
|
Nilsen, B.M., K. Berg, J.K. Eidem, S.I. Kristiansen, F. Brion, J.M. Porcher, and A. Goksoyr (2004), ’Development of quantitative vitellogenin-ELISAs for fish test species used in endocrine disruptor screening’, Analytical and Bioanalytical Chemistry 378, pp. 621–633.
|
|
(19)
|
Orn, S., S. Yamani, and L. Norrgren (2006), ’Comparison of vitellogenin induction, sex ratio, and gonad morphology between zebrafish and Japanese medaka after exposure to 17 alpha-ethinylestradiol and 17 beta-trenbolone’, Archives of Environmental Contamination and Toxicology 51, pp. 237–243.
|
|
(20)
|
Scholz, S. and N. Kluver (2009), Effects of Endocrine Disrupters on Sexual, Gonadal Development in Fish, Sexual Development 3, pp. 136–151.
|
|
(21)
|
Fenske, M., G. Maack, C. Schafers, and H. Segner (2005), ’An environmentally relevant concentration of estrogen induces arrest of male gonad development in zebrafish, Danio rerio’, Environmental Toxicology and Chemistry 24, pp. 1088–1098.
|
|
(22)
|
OECD (2010), Guidance Document on the Diagnosis of Endocrine-related Histopathology in Fish Gonads, Series on Testing and Assessment No. 123, ENV/JM/MONO(2010)14, OECD, Paris.
|
|
(23)
|
Kobayashi, T., M. Matsuda, H. Kajiura-Kobayashi, A. Suzuki, N. Saito, M. Nakamoto, N. Shibata, and Y. Nagahama (2004), ’Two DM domain genes, DMY and DMRT1, involved in testicular differentiation and development in the medaka, Oryzias latipes’, Developmental Dynamics 231, pp. 518–526.
|
|
(24)
|
Shinomiya, A., H. Otake, K. Togashi, S. Hamaguchi, and M. Sakaizumi (2004), ’Field survey of sex-reversals in the medaka, Oryzias latipes: genotypic sexing of wild populations’, Zoological Science 21, pp. 613–619.
|
|
(25)
|
Kidd, K.A., P.J. Blanchfield, K.H. Mills, V.P. Palace, R.E. Evans, J.M. Lazorchak, and R.W. Flick (2007), ’Collapse of a fish population after exposure to a synthetic estrogen’, Proceedings of the National Academy of Sciences of the United States of America 104, pp. 8897–8901.
|
|
(26)
|
Palace,V.P., R.E. Evans, K.G. Wautier, K.H. Mills, P.J. Blanchfield, B.J. Park, C.L. Baron, and K.A. Kidd (2009), ’Interspecies differences in biochemical, histopathological, and population responses in four wild fish species exposed to ethynylestradiol added to a whole lake’, Canadian Journal of Fisheries and Aquatic Sciences 66, pp. 1920–1935.
|
|
(27)
|
Panter, G.H., T.H. Hutchinson, K.S. Hurd, J. Bamforth, R.D. Stanley, S. Duffell, A. Hargreaves, S. Gimeno, and C.R. Tyler (2006), ’Development of chronic tests for endocrine active chemicals – Part 1. An extended fish early-life stage test for oestrogenic active chemicals in the fathead minnow (Pimephales promelas)’, Aquatic Toxicology 77, pp. 279–290.
|
|
(28)
|
Holbech, H., K. Kinnberg, G.I. Petersen, P. Jackson, K. Hylland, L. Norrgren, and P. Bjerregaard (2006), ’Detection of endocrine disrupters: Evaluation of a Fish Sexual Development Test (FSDT)’, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 144, pp. 57–66.
|
|
(29)
|
Andersen, L., K. Kinnberg, H. Holbech, B. Korsgaard, and P. Bjerregaard (2004), ’Evaluation of a 40 day assay for testing endocrine disrupters: Effects of an anti-estrogen and an aromatase inhibitor on sex ratio and vitellogenin concentrations in juvenile zebrafish (Danio rerio)’, Fish Physiology and Biochemistry 30, pp. 257–266.
|
|
(30)
|
Morthorst, J.E., H. Holbech, and P. Bjerregaard (2010), ’Trenbolone causes irreversible masculinization of zebrafish at environmentally relevant concentrations’, Aquatic Toxicology 98, pp. 336–343.
|
|
(31)
|
Kiparissis,Y., T.L. Metcalfe, G.C. Balch, and C.D. Metcalf (2003), ’Effects of the antiandrogens, vinclozolin and cyproterone acetate on gonadal development in the Japanese medaka (Oryzias latipes)’, Aquatic Toxicology 63, pp. 391–403.
|
|
(32)
|
Panter, G.H., T.H. Hutchinson, K.S. Hurd, A. Sherren, R.D. Stanley, and C.R. Tyler (2004), ’Successful detection of (anti-) androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development’, Aquatic Toxicology 70, pp. 11–21.
|
|
(33)
|
Kinnberg, K., H. Holbech, G.I. Petersen, and P. Bjerregaard (2007), ’Effects of the fungicide prochloraz on the sexual development of zebrafish (Danio rerio)’, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, pp. 165–170.
|
|
(34)
|
Tämän liitteen luku C.14 Nuorten kalojen kasvutesti.
|
|
(35)
|
Tämän liitteen luku C.4 Nopea biohajoavuus.
|
|
(36)
|
OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Series on Testing and Assessment No. 23, OECD, Paris.
|
|
(37)
|
OECD (1992), Fish, Early Life Stage Toxicity Test, Test Guideline No. 210, Guidelines for the Testing of Chemicals, OECD, Paris.
|
|
(38)
|
Tämän liitteen luku C.37 21 päivän mittainen seulontatutkimus kaloilla: Lyhytaikainen estrogeeni- ja androgeeniaktiivisuuteen sekä aromataasin estoon kohdistuva seulonta.
|
|
(39)
|
OECD (2012), Fish Toxicity Framework, Series on Testing and Assessment No. 171, OECD, Paris.
|
|
(40)
|
Schäfers, C., Teigeler, M., Wenzel, A., Maack, G., Fenske, M., Segner, H (2007), ’Concentration- and time-dependent effects of the synthetic estrogen, 17 alpha-ethinylestradiol, on reproductive capabilities of the zebrafish, Danio rerio’ Journal of Toxicology and Environmental Health-Part A, 70, 9–10 pp 768–779.
|
|
(41)
|
OECD (2011), Validation Report (Phase 1) for the Fish Sexual Development Test, Series on Testing and Assessment No 141, ENV/JM/MONO(2011)22, OECD, Paris.
|
|
(42)
|
OECD (2011), Validation Report ( Phase 2) for the Fish Sexual Development Test, Series on Testing and Assessment No 142, ENV/JM/MONO(2011)23, OECD, Paris.
|
|
(43)
|
OECD (2011), Peer Review Report of the validation of the Fish Sexual Development Test, Series on Testing and Assessment No 143, ENV/JM/MONO(2011)24, OECD, Paris.
|
|
(44)
|
Euroopan parlamentin ja neuvoston direktiivi 2010/63/EU, annettu 22 päivänä syyskuuta 2010, tieteellisiin tarkoituksiin käytettävien eläinten suojelusta. EYVL L 276, 20.10.2010, s. 33.
|
Lisäys 1
Lyhenteet ja määritelmät
Apikaalinen päätepiste
: aiheuttaa vaikutuksen populaation tasolla
ASV
: air saturation value, ilman kyllästysarvo
Biomarkkeri
: aiheuttaa vaikutuksen yksilön tasolla
Kemikaali
: aine tai seos
Dph
: days post hatch, (xx) päivää kuoriutumisen jälkeen
DMY
: Y-kromosomispesifi DM-domeenin geeni, jota medakakalojen kehittyminen koiraiksi edellyttää.
ELISA
: entsyymivälitteinen immunosorbenttimääritys
Kalan paino
: kalan märkäpaino (kuivattu imeyttämällä vesi paperiin)
FSDT
: Fish Sexual Development Test, kalojen sukupuolikehitystä tutkiva testi
HPG-akseli
: hypotalamus-aivolisäke-sukurauhasakseli
Sekasukupuolinen kala
: kala, jolla on kuutta analysoitua leikettä kohti useampi kuin yksi oosyytti kiveksissä tai spermatogeneettisiä soluja munasarjoissa (kyllä/ei)
Täyttöaste
: kalojen märkäpaino tilavuusyksikköä kohti
MOA
: mode of action, vaikutustapa
RT-PCR
: Reverse Transcriptase Polymerase Chain-Reaction, käänteiskopioijaentsyymi-polymeraasiketjureaktio
Testikemikaali
: tätä testimenetelmää käyttäen testattu aine tai seos
Eriytymätön kala
: kala, jonka sukupuolirauhasissa ei ole selvästi näkyviä itusoluja
VTG
: vitellogeniini
Lisäys 2
FSDT-testin (makean veden lajit) koeolosuhteet
|
|
Medaka (Oryzias latipes)
|
Seeprakala (Danio rerio)
|
Kolmipiikki (Gasterostreus aculeatus)
|
|
|
Läpivirtaus tai puolistaattinen
|
Läpivirtaus tai puolistaattinen
|
Läpivirtaus tai puolistaattinen
|
|
|
25 ± 2 °C
|
27 ± 2 °C
|
20 ± 2 °C
|
|
|
Loistelamppu (laajakirjoinen)
|
Loistelamppu (laajakirjoinen)
|
Loistelamppu (laajakirjoinen)
|
|
|
10–20 μE/m2/s, 540–1 080 luksia tai 50–100 ft-c:tä (ympäröivän laboratorion tasot)
|
10–20 μE/m2/s, 540–1 080 luksia tai 50–100 ft-c:tä (ympäröivän laboratorion tasot)
|
10–20 μE/m2/s, 540–1 080 luksia tai 50–100 ft-c:tä (ympäröivän laboratorion tasot)
|
|
|
12–16 h valoisaa, 8–12 h pimeää
|
12–16 h valoisaa, 8–12 h pimeää
|
16 h valoisaa, 8 h pimeää
|
|
|
Yksittäisiin astioihin on mahduttava vähintään seitsemän litraa vettä
|
Yksittäisiin astioihin on mahduttava vähintään seitsemän litraa vettä
|
Yksittäisiin astioihin on mahduttava vähintään seitsemän litraa vettä
|
|
8.
|
Testiliuosten tilavuuden muutokset
|
|
Vähintään viisi päivässä
|
Vähintään viisi päivässä
|
Vähintään viisi päivässä
|
|
9.
|
Testiorganismien ikä altistuksen alussa
|
|
Hiljattain hedelmöityneet munat (varhainen rakkula-aste)
|
Hiljattain hedelmöityneet munat (varhainen rakkula-aste)
|
Hiljattain hedelmöityneet munat
|
|
10.
|
Munien lukumäärä käsittelyä kohti
|
|
Vähintään 120
|
Vähintään 120
|
Vähintään 120
|
|
|
Vähintään 3 (sekä asianmukaiset kontrollit)
|
Vähintään 3 (sekä asianmukaiset kontrollit)
|
Vähintään 3 (sekä asianmukaiset kontrollit)
|
|
12.
|
Rinnakkaisnäytteiden lkm käsittelyä kohti
|
|
Vähintään 4 (ellei käytetty neliöjuureen perustuvaa jakamista kontrolliryhmiin)
|
Vähintään 4 (ellei käytetty neliöjuureen perustuvaa jakamista kontrolliryhmiin)
|
Vähintään 4 (ellei käytetty neliöjuureen perustuvaa jakamista kontrolliryhmiin)
|
|
|
Elävä ravinto (Artemia), pakastetut täysikasvuiset suolalehtijalkaiset, hiutaleruoka jne. Kalat suositellaan ruokittavan kahdesti päivässä.
|
Kalanpoikasten erikoisruoka, elävä ravinto (Artemia), pakastetut täysikasvuiset suolalehtijalkaiset, hiutaleruoka jne. Kalat suositellaan ruokittavan kahdesti päivässä.
|
Elävä ravinto (Artemia), pakastetut täysikasvuiset suolalehtijalkaiset, hiutaleruoka jne. Kalat suositellaan ruokittavan kahdesti päivässä.
|
|
|
Ei tarpeen, ellei liuenneen hapen pitoisuus ole alle 60 % ilman kyllästysarvosta
|
Ei tarpeen, ellei liuenneen hapen pitoisuus ole alle 60 % ilman kyllästysarvosta
|
Ei tarpeen, ellei liuenneen hapen pitoisuus ole alle 70 % ilman kyllästysarvosta
|
|
|
Puhdas pinta- tai kaivovesi tai synteettinen vesi
|
Puhdas pinta- tai kaivovesi tai synteettinen vesi
|
Puhdas pinta- tai kaivovesi tai synteettinen vesi
|
|
16.
|
Testikemikaalialtistuksen kesto
|
|
60 pv kuoriutumisen jälkeen
|
60 pv kuoriutumisen jälkeen
|
60 pv kuoriutumisen jälkeen
|
|
17.
|
Biologiset ominaisuudet
|
|
Kuoriutumisen onnistuminen, eloonjäämisen morfologia, VTG sukup.rauhasten histologia, geneettinen sukupuoli sukup.jakauma
|
Kuoriutumisen onnistuminen, eloonjäämisen morfologia, VTG sukup.rauhasten histologia, sukup.jakauma
|
Kuoriutumisen onnistuminen, eloonjäämisen morfologia, VTG sukup.rauhasten histologia, sukup.jakauma
|
|
18.
|
Testin hyväksymiskriteerit (kontrollien yhdistetyt rinnakkaisnäytteet)
|
|
Kuoriutumisen onnistuminen > 80 %
|
Kuoriutumisen onnistuminen > 80 %
|
Kuoriutumisen onnistuminen > 80 %
|
|
Kuoriutumisen jälkeinen eloonjääminen ≥ 70 %,
|
Kuoriutumisen jälkeinen eloonjääminen ≥ 70 %,
|
Kuoriutumisen jälkeinen eloonjääminen ≥ 70 %,
|
|
kasvu (kalan märkäpaino, kuivattu imeyttämällä vesi paperiin) > 150 mg
|
kasvu (kalan märkäpaino, kuivattu imeyttämällä vesi paperiin) > 75 mg
|
kasvu (kalan märkäpaino, kuivattu imeyttämällä vesi paperiin) > 120 mg
|
|
Pituus (vakiopituus) > 20 mm
|
Pituus (vakiopituus) > 14 mm
|
Pituus (vakiopituus) > 20 mm
|
|
Sukup.jakauma (% koiraita tai naaraita)
30–70 %
|
Sukup.jakauma (% koiraita tai naaraita) 30–70 %
|
Sukup.jakauma (% koiraita tai naaraita) 30–70 %
|
Lisäys 3
Hyväksyttävän laimennusveden kemialliset ominaisuudet
|
AINESOSA
|
KESKITTYMÄ
|
|
Hiukkaset
|
< 20 mg/1
|
|
Orgaanisen hiilen kokonaismäärä
|
< 2 mg/1
|
|
Ionisoitumaton ammoniakki
|
< 1 ug/l
|
|
Jäännöskloori
|
< 10 ug/l
|
|
Orgaanista fosforia sisältävien torjunta-aineiden kokonaismäärä
|
< 50 ng/1
|
|
Orgaanista klooria sisältävien torjunta-aineiden ja polykloorattujen bifenyylien kokonaismäärä
|
< 50 ng/1
|
|
Orgaanisen kloorin kokonaismäärä
|
< 25 ng/1
|
Lisäys 4
Testimenetelmästä C.14 / Ohjeita testipitoisuuksista
|
Sarake (välillä 100–10 tai välillä 10–1 olevien pitoisuuksien lukumäärä) (28)
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
32
|
46
|
56
|
63
|
68
|
72
|
75
|
|
10
|
22
|
32
|
40
|
46
|
52
|
56
|
|
3,2
|
10
|
18
|
25
|
32
|
37
|
42
|
|
1,0
|
4,6
|
10
|
16
|
22
|
27
|
32
|
|
|
2,2
|
5,6
|
10
|
15
|
19
|
24
|
|
|
1,0
|
3,2
|
6,3
|
10
|
14
|
18
|
|
|
|
1,8
|
4,0
|
6,8
|
10
|
13
|
|
|
|
1,0
|
2,5
|
4,6
|
7,2
|
10
|
|
|
|
|
1,6
|
3,2
|
5,2
|
7,5
|
|
|
|
|
1,0
|
2,2
|
3,7
|
5,6
|
|
|
|
|
|
1,5
|
2,7
|
4,2
|
|
|
|
|
|
1,0
|
1,9
|
3,2
|
|
|
|
|
|
|
1,4
|
2,4
|
|
|
|
|
|
|
1,0
|
1,8
|
|
|
|
|
|
|
|
1,3
|
|
|
|
|
|
|
|
1,0
|
Lisäys 5
Ohjeet pään ja pyrstön homogenisointiin (nuoret seeprakalat, rasvapäämutut, kolmipiikit ja medakat)
Tässä kohdassa kuvataan menettelyt, jotka edeltävät vitellogeniinipitoisuuden kvantifiointia. Myös muita menettelyjä, joiden tuloksena on samankaltainen vitellogeniinin kvantifiointi, voidaan käyttää. Testissä voidaan valita, määritetäänkö vitellogeniinipitoisuus veren plasmasta tai maksasta pää-/pyrstöhomogenaatin sijasta.
Menettely
|
1.
|
Kalat nukutetaan ja lopetetaan testikuvauksen mukaisesti.
|
|
2.
|
Kalan pää ja pyrstö leikataan irti testikuvauksessa esitetyllä tavalla. Tärkeää: Kaikki dissekointivälineet ja leikkauspöytä on huuhdeltava ja puhdistettava kunnolla (esimerkiksi 96-prosenttisella etanolilla) jokaisen kalan käsittelyn jälkeen, jottei naaraiden tai niiden koiraiden, joille kemikaali on aiheuttanut vaikutuksia, vitellogeniini saastuta terveitä koiraita.
|
|
3.
|
Jokaisen kalan pään ja pyrstön yhteispaino punnitaan lähimpään milligrammaan.
|
|
4.
|
Punnituksen jälkeen kalan osat laitetaan asianmukaisiin putkiin (esimerkiksi 1,5 ml:n Eppendorf-putkiin) ja jäädytetään – 80 °C:ssa homogenisointiin saakka. Ne voidaan myös homogenisoida suoraan jään päällä kahdella muovisurvimella. (Myös muita menetelmiä voi käyttää, jos ne tehdään jään päällä ja jos lopputuloksena on homogeeninen massa). Tärkeää: Putket on numeroitava asianmukaisesti, jotta yhden kalan pää ja pyrstö voidaan yhdistää siihen ruumiinosaan, jota käytetään sukupuolirauhasen histologisessa tutkimuksessa.
|
|
5.
|
Kun homogeeninen massa on valmis, siihen lisätään 4–10 kertaa kudoksen painon verran jääkylmää homogenisointipuskuria
(29) (muista laimennus). Jatka työskentelyä survimilla, kunnes seos on homogeeninen. Tärkeä huomautus: Jokaiselle kalalle käytetään uusia survimia.
|
|
6.
|
Näytteet laitetaan jäähän siihen saakka, kunnes ne sentrifugoidaan 4 °C:ssa 50 000 g:ssa 30 minuutin ajan.
|
|
7.
|
Laita pipetillä 20–50 μl:n supernatanttiannoksia (huomaa määrä) vähintään kahteen putkeen upottamalla pipetin kärki pinnan rasvakerroksen läpi ja vetämällä varovasti supernatanttia pipettiin ilman rasva- tai pellettifraktioita.
|
|
8.
|
Putkia säilytetään – 80 °C:ssa niiden käyttöön saakka.
|
Huomautus: Homogenisointipuskuri on käytettävä samana päivänä kuin se valmistetaan. Pidä puskuri jään päällä käytön aikana.
Lisäys 6
Ohjeet seeprakalojen (Danio rerio) pää- ja pyrstöhomogenaatin vitellogeniinipitoisuuden kvantifiointiin (muokattu Holbechin ja muiden (2001) laatimista ohjeista) myös muita menetelmiä, joissa käytetään homologisia vasta-aineita ja standardeja, voidaan käyttää.
|
1.
|
Mikrotitterilevyt (sertifioitu Maxisorp F96, Nunc, Roskilde, Tanska), jotka on aiemmin päällystetty 5 μg/ml:lla anti-seeprakala-lipovitelliini-IgG:tä, sulatetaan ja pestään kolme kertaa pesupuskuriliuoksella (*).
|
|
2.
|
Puhdistettu seeprakalan vitellogeniinistandardi (30) laimennetaan asteittain pitoisuuteen 0,2, 0,5, 1, 2, 5, 10 ja 20 ng/ml laimennuspuskurissa (**), ja näytteet laimennetaan vähintään 200 kertaa (matriisivaikutuksen estämiseksi) laimennuspuskurissa, jonka jälkeen ne laitetaan mikrotitterilevyihin. Testikontrollia laitetaan kaksinkertainen määrä. Jokaiseen kuoppaan laitetaan 150 μl. Standardit laitetaan kaksinkertaisesti ja näytteet kolminkertaisesti. Anna inkuboitua ravistimessa yön yli 4 °C:n lämpötilassa.
|
|
3.
|
Levyt pestään viisi kertaa pesupuskurilla.
|
|
4.
|
Dekstraaniketjuun liittynyt HRP (esimerkiksi AMDEX A/S, Tanska) ja konjugoituneet vasta-aineet laimennetaan pesupuskurissa; varsinainen laimennus vaihtelee erän ja iän mukaan. Jokaiseen kuoppaan laitetaan 150 μl, ja levyjä inkuboidaan ravistimessa tunnin ajan huoneenlämmössä.
|
|
5.
|
Levyt pestään viisi kertaa pesupuskurilla, ja niiden pohja puhdistetaan huolellisesti etanolilla.
|
|
6.
|
Jokaiseen kuoppaan laitetaan 150 μl TMB plus -substraattia (***). Suojaa levy valolta foliolla ja tarkkaile värin kehittymistä ravistimessa.
|
|
7.
|
Kun vakiokäyrä on täysin kehittynyt, entsyymitoiminta pysäytetään lisäämällä jokaiseen kuoppaan 150 μl 0,2 M:n H2SO4:ää.
|
|
8.
|
Absorbanssi mitataan aallonpituusalueella 450 nm (esimerkiksi Molecular Devices Thermomax -mikrolevynlukijalla). Tiedot analysoidaan laitteistoon kuuluvalla ohjelmistolla (esimerkiksi Softmaxilla).
|
|
(*)
|
Pesupuskuri
|
PBS-varastoliuos (****)
|
500,0
|
ml
|
|
BSA
|
5,0
|
g
|
|
Tween 20
|
5,0
|
ml
|
|
Säädä pH:ksi 7,3 ja täytä 5 litraksi Milliporen H2O:lla Säilytä 4 °C:ssa.
|
|
|
(**)
|
Laimennuspuskuri:
|
PBS-varastoliuos (****)
|
100,0
|
ml
|
|
BSA
|
3,0
|
g
|
|
Tween 20
|
1,0
|
ml
|
|
Säädä pH:ksi 7,3 ja täytä 1 litraksi Milliporen H2O:lla. Säilytä 4 °C:ssa.
|
|
|
(***)
|
TMB plus on käyttövalmis substraatti, jonka valmistaja on KemEnTec (Tanska). Tuote on herkkä valolle. Säilytä 4 °C:ssa.
|
|
(****)
|
PBS-varastoliuos
|
NaCl
|
160,0
|
g
|
|
KH2PO4
|
4,0
|
g
|
|
Na2HPO4
.2H2O
|
26,6
|
g
|
|
KCl
|
4,0
|
g
|
|
Säädä pH:ksi 6,8 ja täytä 2 litraksi Milliporen H2O:lla. Säilytä huoneenlämmössä.
|
|
Lisäys 7
Ohjeet kudosleikkeiden valmisteluun sukupuolen ja sukupuolirauhasten kehitysasteen määritystä varten
Tässä kohdassa kuvataan menettelyt, jotka edeltävät histologisten leikkeiden arviointia. Myös muita menetelmiä, joiden tuloksena on samankaltainen sukupuolen ja sukupuolirauhasten kehitysasteen määritys, voidaan käyttää.
Muutamia poikkeuksia lukuun ottamatta nämä menettelyt ovat samanlaisia medakalle (JMD) ja seeprakalalle (SK).
Lopettaminen, ruumiinavaus ja kudosten kiinnittäminen
Tavoitteet:
|
1.
|
Kalan inhimillinen lopettaminen.
|
|
2.
|
Tarvittavien paino- ja pituustietojen hankkiminen.
|
|
3.
|
Sekundaaristen sukupuoliominaisuuksien arvioiminen.
|
|
4.
|
Kudosten dissekointi vitellogeniinianalyysia varten.
|
|
5.
|
Sukupuolirauhasten kiinnittäminen.
|
Menettelyt:
|
1.
|
Kala on lopetettava juuri ennen ruumiinavausta. Ellei ruumiinavauksiin ole käytettävissä useampia henkilöitä, samanaikaisesti ei saa lopettaa useampia kaloja.
|
|
2.
|
Kala otetaan pois testiastiasta tiheällä haavilla ja siirretään ruumiinavausalueelle kuljetussäiliössä.
|
|
3.
|
Sen jälkeen kala laitetaan lopetusliuokseen. Kala otetaan pois liuoksesta, kun hengitys on lakannut ja kun kala ei reagoi ulkoisiin ärsykkeisiin.
|
|
4.
|
Kala punnitaan märkänä.
|
|
5.
|
Vitellogeniinianalyysissa tarvittavien kudosten valmistelua varten kalan voi asettaa korkkialustalle dissekointimikroskoopin tasolevylle.
|
a.
|
Seeprakalan pää leikataan heti rintaevän takaa ja pyrstö leikataan heti selkäevän takaa.
|
|
b.
|
Medakan maha aukaistaan huolellisesti tehdyllä viillolla, joka ulottuu vatsanpuoleista keskiviivaa pitkin hartiaosasta peräaukon kallonpuoleiseen päähän. Maksa irrotetaan varovasti pieniä pinsettejä ja pieniä saksia käyttäen.
|
|
|
6.
|
Vitellogeniinianalyysissa tarvittavat näytteet laitetaan Eppendorf-putkiin ja jäädytetään heti nestemäisellä typellä.
|
|
7.
|
Sukupuolirauhaset sisältävä muu ruumis laitetaan muoviseen kudoskasettiin (johon on tehty tarvittavat merkinnät etukäteen), joka siirretään Davidsonin tai Bouinin kiinnitysaineeseen. Kiinnitysainetta tulee olla vähintään kymmenkertainen määrä kudosten arvioituun määrään nähden. Kiinnitysainetta sisältävää astiaa ravistetaan varovasti viisi sekuntia, jotta ilmakuplat häviävät kasetista.
|
|
8.
|
|
a.
|
Kaikkia kudoksia pidetään Davidsonin kiinnitysaineessa yön yli, ja seuraavana päivänä ne siirretään yksittäisiin astioihin, jotka sisältävät 10-prosenttista neutraalia puskuroitua formaliinia. Kudoskasetit sisältäviä säiliöitä ravistetaan varovasti viisi sekuntia, jotta formaliini tunkeutuu kasetteihin kunnolla.
|
|
b.
|
Kudoksia pidetään Bouinin kiinnitysaineessa 24 h, jonka jälkeen ne siirretään 70-prosenttiseen etanoliin.
|
|
Kudosten käsittely
Tavoitteet:
|
1.
|
Kudosten kuivaaminen parafiinin riittävän tunkeutumisen varmistamiseksi.
|
|
2.
|
Kudosten kyllästäminen parafiinilla kudosten eheyden säilyttämiseksi ja kiinteän pinnan luomiseksi mikrotomiaa varten.
|
Menettelyt:
|
3.
|
Etiketein varustetut kudoskasetit otetaan pois formaliini-/etanolisäilytyksestä ja laitetaan käsittelykoreihin. Käsittelykori asetetaan kudosprosessoriin.
|
|
4.
|
Sen jälkeen valitaan prosessointiohjelma.
|
|
5.
|
Kun prosessointivaihe kudosprosessorissa on päättynyt, kori(t) voidaan siirtää valuasemalle.
|
Valaminen
Tavoite:
Aseta näyte kiinteään parafiiniin oikeaan asentoon mikrotomiaa varten.
Menettelyt:
|
1.
|
Kasettikori(t) otetaan pois prosessorista ja upotetaan valuaseman lämpökonsolin parafiinia sisältävään etummaiseen kammioon. Kasetit voidaan myös siirtää erilliseen parafiinilämmittimeen.
|
|
2.
|
Ensimmäinen valettava kasetti otetaan pois lämpökonsolin etummaisesta kammiosta tai parafiinilämmittimestä. Kasetin kansi poistetaan ja hävitetään, ja kasetin etiketistä tarkastetaan, että se vastaa eläimen tietoja, jotta mahdolliset poikkeavuudet voidaan selvittää ennen valamista.
|
|
3.
|
Seuraavaksi valitaan sopivankokoinen valumuotti.
|
|
4.
|
Muotti laitetaan annostelukonsolin nokan alle ja täytetään sulalla parafiinilla.
|
|
5.
|
Näyte otetaan pois kasetista ja laitetaan muotissa olevaan sulaan parafiiniin. Tämä toistetaan 4–8 näytteen kanssa jokaisen parafiinimuotin osalta. Yksittäisen kalan paikka merkitään siten, että ensimmäinen kala asetetaan 180 asteen kulmaan kaloihin 2–4/8 nähden.
|
|
6.
|
Muottiin lisätään parafiinia, jotta näytteet peittyvät.
|
|
7.
|
Muotti ja kasetin alaosa laitetaan kylmäkonsolin jäähdytyslevylle.
|
|
8.
|
Kun parafiini on jähmettynyt, blokki (ts. kudokset ja kasetin alaosan sisältävä kovettunut parafiini) otetaan pois muotista.
|
Mikrotomia
Tavoite:
Histologisten leikkeiden leikkaaminen ja kiinnittäminen värjäystä varten.
Menettelyt:
|
1.
|
Mikrotomian aloitusvaihe toteutetaan seuraavasti:
|
a.
|
Parafiiniblokki asetetaan mikrotomin istukkaan.
|
|
b.
|
Kun mikrotomin pyörää pyöritetään, istukka liikkuu eteenpäin, ja blokin parafiinipinnan paksut kohdat leikkautuvat pois siihen asti, kunnes leikkuuterä koskettaa valettuja kudoksia.
|
|
c.
|
Mikrotomin leikepaksuudeksi tulee asettaa 3–5 mikronia. Istukka liikkuu eteenpäin ja blokista leikataan useita leikkeitä, jotta kaikki kudoksen leikatulle pinnalle karkean trimmauksen aikana muodostuneet artefaktit saadaan pois.
|
|
d.
|
Blokin voi ottaa pois istukasta ja laittaa leikattu pinta alaspäin jäähän kudoksen pehmentämiseksi.
|
|
|
2.
|
Seuraava mikrotomian vaihe on lopullisten leikkeiden tekeminen ja kudosleikkeiden kiinnittäminen näytelaseille. Nämä toimenpiteet tehdään seuraavasti:
|
a.
|
Jos blokki on laitettu jäähän, se otetaan siitä pois ja asetetaan mikrotomin tasolle.
|
|
b.
|
Leikepaksuudeksi asetetaan 3–5 mikronia, ja istukkaa liikutetaan eteenpäin pyörittämällä mikrotomin pyörää. Blokista leikataan leikkeitä siihen saakka, kunnes saadaan ’kaistale’, joka sisältää vähintään yhden hyväksyttävän leikkeen, sukupuolirauhaset mukaan luettuina. (Tarvittaessa blokin voi ottaa leikkaamisen aikana pois istukasta ja laittaa jäähän kudoksen pehmentämiseksi ja sitten takaisin istukkaan).
|
|
c.
|
Tämän jälkeen leikkeet laitetaan kellumaan tasaisesti vesiastiaan veden pinnalle. Tavoitteena on saada vähintään yksi leike, joka on suora ja jonka alapuolella ei ole ilmakuplia.
|
|
d.
|
Parhaan leikkeen alle laitetaan näytelasi, ja se nostetaan lasin avulla pois vedestä. Tätä prosessia kutsutaan leikkeen kiinnittämiseksi näytelasille.
|
|
e.
|
Yhdestä kalaryhmästä valmistellaan kolme leikettä. Toinen ja kolmas leike otetaan 50 mikronin välein ensimmäisestä leikkeestä. Jos kalojen sukupuolirauhasia ei ole valettu samaan leikkaustasoon, on tehtävä useampia leikkeitä sen varmistamiseksi, että jokaiselta kalalta saadaan vähintään kuusi leikettä sukupuolirauhaset mukaan luettuina.
|
|
f.
|
Näytelasiin merkitään merkkauskynällä sen blokin numero, josta leikkeet otettiin lasille.
|
|
g.
|
Lasi laitetaan värjäystelineeseen.
|
|
h.
|
Blokki otetaan pois istukasta ja laitetaan leikattu pinta alaspäin säilytykseen.
|
|
Värjääminen, näytelasien päällystäminen ja merkitseminen
Tavoitteet:
|
—
|
Leikkeiden värjääminen histopatologista tutkimusta varten
|
|
—
|
Pysyvästi kiinnitetyt ja värjätyt kudokset.
|
|
—
|
Värjättyjen leikkeiden merkitseminen pysyvästi siten, että niiden täydellinen jäljittäminen on mahdollista.
|
Menettelyt:
|
1.
|
Värjäys
|
a.
|
Lasien annetaan kuivua ilmassa yön yli ennen värjäystä.
|
|
b.
|
Leikkeet värjätään hematoksyliini-eosiinivärjäyksellä.
|
|
|
2.
|
Näytelasien päällystäminen
|
a.
|
Näytelasit voidaan päällystää käsin tai automaattisesti.
|
|
b.
|
Lasi upotetaan ksyleeniin tai TissueCleariin, ja ylimääräinen liuos ravistetaan varovasti pois lasilta.
|
|
c.
|
Noin 0,1 ml kiinnitysainetta laitetaan lähelle lasin toista päätä (mattapään vastakkaista päätä) tai päällysteeseen.
|
|
d.
|
Päällyste laitetaan lasille matalassa kulmassa.
|
|
|
3.
|
Merkinnät
|
a.
|
Jokaisen lasin etiketissä on oltava seuraavat tiedot:
|
iii.
|
Näytteen numero / lasin numero
|
|
iv.
|
Kemikaali/käsittelyryhmä
|
|
|
Lisäys 8
Tilastollinen vuokaavio vitellogeniinianalyysia varten

Tilastollinen vuokaavio sukupuolijakauman analyysia varten

Lisäys 9
Ohjeet kudosnäytteiden ottamiseen geneettisen sukupuolen määrittämistä varten ja pcr-menetelmällä toteutettavaa geneettisen sukupuolen määrittämistä varten
Kudosnäytteiden ottaminen, valmistelu ja säilytys ennen medakan geneettisen sukupuolen määrittämistä PCR-menetelmällä (ohjeet on laatinut Bayer CropScience AG:n vesieliöitä käsittelevä laboratorio)
|
1.
|
Jokaiselta kalalta leikataan pienillä saksilla perä- tai selkäevä, ja se laitetaan putkeen, joka sisältää 100 μl uuttopuskuria 1 (katso tarkemmat tiedot puskurin valmistamisesta jäljempää). Sakset puhdistetaan jokaisen kalan käsittelyn jälkeen laboratoriolasissa, jossa on tislattua vettä, ja kuivataan paperipyyhkeellä.
|
|
2.
|
Seuraavaksi eväkudokset homogenisoidaan mikroputkessa teflonsurvimella, jotta solut hajoavat. Jokaisessa putkessa käytetään uutta survinta mahdollisen kontaminoitumisen välttämiseksi. Survimet laitetaan 0,5 M:n NaOH-liuokseen yöksi, huuhdellaan viisi minuuttia tislatulla vedellä ja säilytetään etanolissa tai steriilisti autoklaavauksen jälkeen seuraavaan käyttökertaan saakka.
|
|
3.
|
Eväkudos voidaan säilöä myös ilman uuttopuskuria 1 kuivajäällä ja sen jälkeen – 80 °C:ssa jääkaapissa DNA:n hajoamisen ehkäisemiseksi. Uutto kuitenkin sujuu paremmin, jos uutat DNA:n samaan aikaan (katso tiedot käsittelystä edeltä; näytteet on sulatettava jään päällä sen jälkeen, kun niitä on säilytetty – 80 °C:ssa, ennen kuin puskuri lisätään putkiin).
|
|
4.
|
Homogenisoinnin jälkeen kaikki putket laitetaan vesiastiaan ja niitä keitetään 15 minuutin ajan 100 °C:ssa.
|
|
5.
|
Tämän jälkeen jokaiseen putkeen pipetoidaan 100 μl uuttopuskuriliuosta 2 (katso tarkemmat tiedot puskurin valmistuksesta jäljempää). Näytteitä säilytetään huoneenlämmössä 15 minuutin ajan, ja silloin tällöin niitä ravistetaan varovasti käsin.
|
|
6.
|
Tämän jälkeen kaikki putket laitetaan takaisin vesiastiaan ja niitä keitetään toiset 15 minuuttia 100 °C:ssa.
|
|
7.
|
Putket pidetään jäädytettyinä – 20 °C:ssa analysointiin saakka.
|
Puskurin valmistus
PCR-puskuri 1:n ainesosat
|
|
500 mg N-lauryylisarkosiinia (valmistaja esimerkiksi Merck KGaA, Darmstadt, Saksa)
|
PCR-puskuri 2:n aineosat:
|
|
20 g Chelex (valmistaja esimerkiksi Biorad, München, Saksa)
|
|
|
Anna turvota 100 ml:ssä tislattua vettä
|
Medakan geneettisen sukupuolen määrittäminen (PCR-menetelmällä) (menetelmä on laadittu Bayer CropScience AG:n vesieliöitä käsittelevässä laboratoriossa ja Würzburgin yliopiston biokeskuksessa)
Valmistellut ja jäädytetyt putket (kuvattu edellisessä kohdassa) sulatetaan. Sen jälkeen ne sentrifugoidaan Eppendorfin sentrifugissa (30 sekuntia enimmäisnopeudella huoneenlämmössä). PCR-menetelmässä käytetään sakasta erotettua kirkasta supernatanttia. Chelexin jäämien (joita on sakassa) siirtymistä PCR-reaktioon on ehdottomasti vältettävä, koska se häiritsee Taq-polymeraasin toimintaa. Supernatantti käytetään heti, mutta sitä voidaan myös säilyttää jäädytettynä (– 20 °C:ssa) ja sulattaa uudelleen useita kertoja ilman, että se vaikuttaisi kielteisesti DNA:han myöhemmissä analyyseissa.
1. Reaktioseoksen valmistus (25 μl näytettä kohti):
|
|
Tilavuus
|
Lopullinen pitoisuus
|
|
Templaatti-DNA
|
0,5–2 μl
|
|
|
10 × PCR-puskuri + MgCl2
|
2,5 μl
|
1x
|
|
Nukleotidit (dATP, dCTP, dGTP, dTTP)
|
4 μl (5 mM)
|
200 μM
|
|
Etualuke (10 μM) (ks. kohdat 3–5)
|
0,5 μl
|
200 nM
|
|
Taka-aluke (10 μM) (ks. kohdat 3–5)
|
0,5 μl
|
200 nM
|
|
DMSO
|
1,25 μl
|
5 %
|
|
Vesi (PCR-laatu)
|
enintään 25 μl
|
|
|
Taq E -polymeraasi
|
0,3 μl
|
1,5 U
|
|
10 × PCR-puskuri + MgCl2: 670 mM Tris/HCl (pH 8,8 lämpötilassa 25 °C), 160 mM (NH4)2SO4, 25 mM MgCl2, 0,1 % Tween 20
|
Jokaisessa PCR:ssä (katso kohdat 3–5 jäljempänä) tarvitaan erikoisaluke uutena yhdistelmänä reaktioseoksesta ja tarvittavasta määrästä templaatti-DNA:ta jokaista näytettä (ks. edellä) varten. Nämä määrät siirretään uusiin putkiin pipeteillä. Sen jälkeen kaikki putket suljetaan ja niitä sekoitetaan (n. 10 sekuntia) ja sentrifugoidaan (10 sekuntia huoneenlämmössä). Tämän jälkeen voidaan käynnistää PCR-ohjelmat. Jokaisessa PCR-ohjelmassa käytetään lisäksi positiivista kontrollia (esimerkinomaista DNA-näytettä, jonka aktiivisuus tiedetään ja jota koskevat tulokset ovat selvät) ja negatiivista kontrollia (1 μl tislattua vettä).
2. Agaroosigeelin (1 %) valmistaminen käynnissä olevien PCR-ohjelmien aikana:
|
—
|
Liuota 3 g agaroosia 300 ml:aan 1 × TAE-puskuria (1 %:n agaroosigeeli).
|
|
—
|
Kuumenna liuos mikroaaltouunissa (n. 2–3 min).
|
|
—
|
Siirrä kuuma liuos jään päällä olevaan erikoisvalulaatikkoon.
|
|
—
|
Agaroosigeeli on valmista käytettäväksi noin 20 minuutin kuluttua.
|
|
—
|
Säilytä agaroosigeeli 1 × TAE-puskurissa PCR-ohjelmien päättymiseen saakka.
|
3. Aktiini-PCR-ohjelma:
Tämän PCR-reaktion tarkoituksena on osoittaa, ettei näytteessä oleva DNA ole vaurioitunut.
|
—
|
Erikoisaluke:
|
—
|
’Mact1(upper/forward)’ → TTC AAC AGC CCT GCC ATG TA
|
|
—
|
’Mact2(lower/reverse)’ → GCA GCT CAT AGC TCT TCT CCA GGG AG
|
|
|
—
|
Ohjelma:
|
—
|
Sykli (35-kertainen):
|
Denaturaatio
|
→ 45 sek., 95 °C
|
|
Jäähdytys
|
→ 45 sek., 56 °C
|
|
Pidentäminen
|
→ 1 min, 68 °C
|
|
|
4. X- ja Y-geeni-PCR-ohjelma:
Näytteitä, joissa DNA on ehjä, käytetään tässä PCR-ohjelmassa X- ja Y-geenien löytämiseen. Koiraan DNA:ssa tulee näkyä yksi kaksoisnauha ja naaraan DNA:ssa yksi yksinkertainen nauha (värjäyksen ja geelielektroforeesin jälkeen). Tässä ohjelmassa on käytettävä yhtä positiivista kontrollia koiraille (XY-näyte) ja yhtä naaraille (XX-näyte).
|
—
|
Erikoisaluke:
|
—
|
’PG 17.5’ (upper/forward) → CCG GGT GCC CAA GTG CTC CCG CTG
|
|
—
|
’PG 17.6’ (lower/reverse) → GAT CGT CCC TCC ACA GAG AAG AGA
|
|
|
—
|
Ohjelma:
|
—
|
Sykli (40-kertainen):
|
Denaturaatio
|
→ 45 sek., 95 °C
|
|
Jäähdytys
|
→ 45 sek., 55 °C
|
|
Pidentäminen
|
→ 1 min 30 sek., 68 °C
|
|
|
5. Y-geeni-PCR-ohjelma X- ja Y-geeni-PCR-ohjelman kontrollina:
Tällä PCR-ohjelmalla vahvistetaan X- ja Y-geeni-PCR-ohjelman tulokset. Koirasnäytteissä tulee näkyä yksi nauha, ja naarasnäytteissä ei tule näkyä yhtään nauhaa (värjäyksen ja geelielektroforeesin jälkeen).
|
—
|
Erikoisaluke:
|
—
|
’DMTYa (upper/forward)’ → GGC CGG GTC CCC GGG TG
|
|
—
|
’DMTYd (lower/reverse)’ → TTT GGG TGA ACT CAC ATG G
|
|
|
—
|
Ohjelma:
|
—
|
Sykli (40-kertainen):
|
Denaturaatio
|
→ 45 sek., 95 °C
|
|
Jäähdytys
|
→ 45 sek., 56 °C
|
|
Pidentäminen
|
→ 1 min, 68 °C
|
|
|
6. PCR-näytteiden värjääminen:
Värjäysliuos:
Pipetoi 1 μl värjäysliuosta jokaiseen yksittäiseen putkeen.
7. Geelielektroforeesin aloittaminen:
|
—
|
Valmistettu 1-prosenttinen agaroosigeeli siirretään geelielektroforeesikammioon, joka on täytetty 1 × TAE-puskurilla.
|
|
—
|
Jokaisesta värjätystä PCR-näytteestä pipetoidaan 10–15 μl agaroosigeelikuoppaan.
|
|
—
|
Erilliseen kuoppaan pipetoidaan myös 5–15 μl 1kb-Ladder-valmistetta (Invitrogen).
|
|
—
|
Aloita elektroforeesi 200 V:lla.
|
|
—
|
Lopeta se 30–45 minuutin kuluttua.
|
8. Nauhojen määrittäminen
|
—
|
Puhdista agaroosigeeli tislatulla vedellä.
|
|
—
|
Laita agaroosigeeli etidiumbromidiin 15–30 minuutin ajaksi.
|
|
—
|
Ota agaroosigeelistä sen jälkeen kuva UV-valolaatikossa.
|
|
—
|
Lopuksi näytteet analysoidaan vertaamalla niitä positiivisen kontrollin nauhaan (tai nauhoihin) ja kokostandardiin.
|
Lisäys 10
Ohjeet kudosnäytteiden ottamiseen kolmipiikiltä (geneettisen sukupuolen määrittäminen PCR-menetelmällä)
Kudosnäytteiden ottaminen ja DNA:n uuttaminen
DNA voidaan uuttaa monilla kaupallisesti saatavilla reagensseilla ja sekä manuaalisilla että automaattisilla uuttojärjestelmillä. Cefasin laboratoriossa Weymouthissa käytettävä menetelmä kuvataan jäljempänä, ja myös vaihtoehtoisia toimintatapoja on esitetty tarpeen mukaan.
|
1.
|
Jokaiselta kalalta leikataan terävillä saksilla pieni pala kudosta (10–20 mg) dorsolateraaliselta alueelta (sen jälkeen, kun pää ja pyrstö on irrotettu vitellogeniinianalyysia varten). Kudospala laitetaan putkeen, joka joko asetetaan suoraan nestemäiseen typpeen (säilytettäväksi – 80 °C:ssa) tai siihen lisätään 70-prosenttista etanolia (kuljetusta ja myöhempää säilytystä -4 °C:ssa varten). Sakset puhdistetaan jokaisen kalan käsittelyn jälkeen 70-prosenttisella etanolilla ja tislatulla vedellä ja kuivataan paperipyyhkeellä.
|
|
2.
|
Mahdolliset etanolijäämät poistetaan imulla, ja kudos hajotetaan yön yli kestävällä proteinaasi K -käsittelyllä 400 μl:ssa ATL-puskuria (Qiagen). Alikvootti (200 μl) kudosjätteestä siirretään 96-kuoppaiseen S-blokkiin (Qiagen), ja DNA uutetaan 96-kuoppaiseen formaattiin käyttämällä Qiagen Universal BioRobotia ja QIamp Investigator BioRobot -menetelmää. DNA eluoidaan 50 μl:ssä vettä, jossa ei ole deoksiribonukleaasia eikä ribonukleaasia. Jos DNA:n uuttamisessa käytetään kovaa kudosta (kuten selkärankaa tai rintaevää), näyte voi olla tarpeen homogenisoida lyysipuskurissa käyttämällä FastPrep®-laitetta tai muuta vastaavaa kudoksen hajottamismenetelmää.
Vaihtoehtoisesti voidaan toimia myös seuraavilla tavoilla:
|
a)
|
Kudos hajotetaan yön yli kestävällä proteinaasi K -käsittelyllä 400 μl:ssä G2-lyysipuskuria (Qiagen), ja DNA uutetaan 200 μl:sta kudosjätettä käyttämällä joko EZ 1 DNA Easy Tissue Kit -pakettia ja EZ 1 -biorobottia tai DNA Easy Tissue Mini Kit -pakettia. DNA eluoidaan 50 μl:n tilavuuteen.
|
|
b)
|
Kudokset käsitellään DNAzol-reagenssilla. Kudosnäytteet hajotetaan pitämällä niitä 1 ml:ssa DNAzolia 10 minuutin ajan 1,5 ml:n mikrosentrifugiputkessa, minkä jälkeen niitä sentrifugoidaan (13 000 kierrosta minuutissa) viiden minuutin ajan hiukkasaineksen poistamiseksi. Näin hajotettu näyte laitetaan sen jälkeen uuteen 1,5 ml:n mikrosentrifugiputkeen, joka sisältää 500 μl molekyylibiologisesti puhdasta 100-prosenttista etanolia. Putkea sentrifugoidaan 13 000 kierroksen nopeudella 10 minuutin ajan DNA:n saostamiseksi. Etanoli poistetaan ja sen tilalle laitetaan 400 μl molekyylibiologisesti puhdasta 70-prosenttista etanolia. Tämän jälkeen putkea sentrifugoidaan taas 13 000 kierroksen nopeudella viiden minuutin ajan, ja DNA-pelletti liuotetaan 50 μl:aan puhdasta vettä, jossa ei ole deoksiribonukleaasia eikä ribonukleaasia. Jos käytetään kovia kudoksia (rintaevää), näyte voi tässäkin olla tarpeen homogenisoida lyysipuskurissa käyttämällä FastPrep®-laitetta tai muuta vastaavaa kudoksen hajottamismenetelmää ennen DNA:n uuttamista.
|
|
|
3.
|
DNA:ta säilytetään -20 °C:ssa käyttöön saakka.
|
Tärkeä huomautus: Näiden käsittelyjen aikana on käytettävä suojakäsineitä.
Polymeraasiketjureaktion (PCR:n) analyysi
Monistukset tehtiin käyttämällä 2,5 μl DNA-uutetta 50 μl:ssa reaktiotilavuutta Idh-paikka-alukkeiden avulla (ks. tarkempi kuvaus julkaisusta Peichel et al., 2004. Current Biology 1:1416–1424):
|
Etualuke
|
5′ GGG ACG AGC AAG ATT TAT TGG 3′
|
|
Taka-aluke
|
5′ TAT AGT TAG CCA GGA GAT GG 3′
|
Sopivien PCR-reagenssien toimittajia on useita. Jäljempänä kuvattua menetelmää käytetään tällä hetkellä Cefasin laboratoriossa Weymouthissa.
1. Reaktioseoksen valmistus (50 μl näytettä kohti):
Master mix -reaktioseos valmistetaan jäljempänä kuvatulla tavalla. Seos voidaan valmistaa etukäteen ja säilyttää käyttöön saakka jäädytettynä – 20 °C:ssa. Valmista master mix -seosta tarpeeksi myös negatiivista kontrollia varten (vain molekyylibiologisesti puhdas vesi).
|
|
Tilavuus (varastopit.) / näyte
|
Lopullinen pitoisuus
|
|
5 × GoTaq®-reaktiopuskuri
|
10 μl
|
1x
|
|
MgCl2
|
5 μl (25 mM)
|
2,5 mM
|
|
Nukleotidit (dATP, dCTP, dGTP, dTTP)
|
0,5 μl (25 mM kutakin)
|
250 μM kutakin
|
|
Etualuke
|
0,5 μl (0,1 nmol/μl)
|
2,0 μM
|
|
Taka-aluke
|
0,5 μl (0,1 nmol/μl)
|
2,0 μM
|
|
Molekyylibiologisesti puhdas vesi
|
30,75 μl
|
|
|
GoTaq-polymeraasi
|
0,25 μl
|
1,25 U
|
|
—
|
Laita 47,5 μl liuosta ohutseinäiseen 0,5 ml:n PCR-putkeen, jossa on etiketti.
|
|
—
|
Lisää 2,5 μl puhdistettua DNA:ta asianmukaisesti merkittyyn putkeen. Toista menettely kaikkien näytteiden ja negatiivisen kontrollin osalta.
|
|
—
|
Lisää putkiin kaksi tippaa mineraaliöljyä. Vaihtoehtoisesti voit käyttää PCR-laitetta, jossa on lämpökansi.
|
|
—
|
Näytteitä denaturoitiin Peltier PTC-225 -laitteessa 94 ± 2 °C:n lämpötilassa viisi minuuttia, sen jälkeen 39 sykliä 94 ± 2 °C:ssa 1 minuutti, 55 ± 2 °C:ssa 1 minuutti, 72 ± 2 °C:ssa 1 minuutti ja lopullinen pidentäminen 72 ± 2 °C:ssa 10 minuutin ajan.
|
2. Agaroosigeelin (2 %) valmistaminen:
Tavallisesti PCR-tuotteet analysoidaan 20-prosenttisessa agaroosigeelissä, joka sisältää etidiumbromidia.
Myös kapillaaripohjaista elektroforeesijärjestelmää voi käyttää.
|
—
|
Mittaa 2 g agaroosia 100 ml:aan 1 × TAE-puskuria.
|
|
—
|
Kuumenna liuos mikroaaltouunissa (n. 2–3 min), jotta agaroosi liukenee.
|
|
—
|
Lisää kaksi tippaa etidiumbromidia (lopullinen pitoisuus 0,5 μg/ml).
|
|
—
|
Siirrä kuuma liuos geelivalulaitteeseen.
|
3. Geelielektroforeesi
|
—
|
Laita agaroosigeeli elektroforeesilaitteeseen ja upota se 1 × TAE-puskuriin.
|
|
—
|
Laita 20 μl jokaisesta näytteestä erilliseen kuoppaan ja lisää molekyylipainomarkkeria (100 emäsparin DNA-kokostandardi, Promega) tyhjään kuoppaan.
|
|
—
|
Elektroforeesi tehdään 120 V:lla ja se kestää 30–45 minuuttia.
|
4. Monistustuotteiden visualisointi
Jos agaroosigeeliin lisättiin etidiumbromidia edellä kuvatun mukaisesti, DNA-tuotteet näkyvät UV-valon avulla. Toinen tapa värjätä agaroosigeeli on peittää geeli laimennetulla etidiumbromidiliuoksella (0,5 μg/ml vedessä) 30 minuutin ajaksi ennen visualisointia.
Lisäys 11
Ohjeet kolmipiikin keinohedelmöitysmenettelyä varten
Tässä kohdassa kuvataan menetelmät, joiden avulla kolmipiikiltä saadaan hedelmöityneitä munasoluja, jotta niitä voidaan käyttää FSDT-tutkimuksessa.
Menettelyt
Maidin ottaminen koirailta
|
1.
|
Hyvänvärinen koiras toivotusta populaatiosta lopetetaan.
|
|
2.
|
Kivekset irrotetaan kalan kummaltakin puolelta. Kivekset ovat yleensä voimakkaasti pigmentoituneita sauvan muotoisia rakenteita, jotka näkyvät selvästi ruumiin sivuittaisella keskiviivalla. Käytä jompaakumpaa seuraavista menetelmistä:
|
|
3.
|
Käytä teräviä saksia. Aloita yhteissuolen kohdalta ja tee 1–1,5 cm:n pituinen viilto yhdellä leikkauksella noin 45 asteen kulmassa.
|
|
4.
|
Tee skalpellilla pieni viilto kalan kylkeen hieman lantion takapuolelta ja juuri ennen kylkipanssareita.
|
|
5.
|
Irrota kivekset pienillä pinseteillä ja laita ne petrimaljaan.
|
|
6.
|
Jokainen kives peitetään 100 μl:lla tuoretta lopullista HBSS-liuosta
(31).
|
|
7.
|
Kivekset leikataan pieniksi paloiksi käyttämällä partaterää tai skalpellia. Näin maiti pääsee kiveksistä ulos, ja HBSS-liuos muuttuu maitomaiseksi.
|
|
8.
|
Maitia sisältävä neste laitetaan putkeen, ja pipetoitaessa on yritettävä välttää kiveskudoksen joutumista mukaan.
|
|
9.
|
Putkeen lisätään 800 μl lopullista HBSS-liuosta, joka sekoitetaan hyvin.
|
|
10.
|
Tarvittaessa koiraskalan voi säilöä kiinnittämällä se 100-prosenttisella etanolilla tai muulla halutulla kiinnitysaineella. Tämä on tärkeää etenkin silloin, jos tutkimuksessa tarkastellaan jälkeläisten alkuperää.
|
Tärkeä huomautus: vaikka useimmat tarvittavat varastoliuokset voidaan tehdä etukäteen, varastoliuos 5 ja lopullinen liuos on valmistettava tuoreena sinä päivänä, kun ne käytetään.
|
Varastoliuos 1
|
|
NaCl
|
8,00 g
|
|
KCl
|
0,40 g
|
|
Tislattu vesi (TV)
|
100 ml
|
|
Varastoliuos 2
|
|
Na2HPO4 (vedetön)
|
0,358 g
|
|
KH2PO4
|
0,60 g
|
|
TV
|
100 ml
|
|
Varastoliuos 3
|
|
CaCl2
|
0,72 g
|
|
TV
|
50 ml
|
|
Varastoliuos 4
|
|
MgSO4
.7H2O
|
1,23 g
|
|
TV
|
50 ml
|
|
Varastoliuos 5 (tuore)
|
|
NaHCO3
|
0,35 g
|
|
TV
|
10 ml
|
Huomautus: Jos sinulla on jo joitakin edellä mainituista suoloista mutta jos niiden vesipitoisuus on eri (esimerkiksi 2H2O vedettömän sijasta), voit käyttää niitä, kunhan mukautat ensin painon molekyylipainon perusteella.
Noudata Hankin lopullisen liuoksen osalta seuraavaa järjestystä:
|
Varastoliuos 1
|
1,0 ml
|
|
Varastoliuos 2
|
0,1 ml
|
|
Varastoliuos 3
|
0,1 ml
|
|
TV
|
8,6 ml
|
|
Varastoliuos 4
|
0,1 ml
|
|
Varastoliuos 5
|
0,1 ml
|
Sekoita hyvin ennen käyttöä.
Hedelmöitys
|
1.
|
Halutusta populaatiosta valitaan suuria, kutevia naaraita. Niistä voi ottaa mätiä vasta, kun näet, että yhteissuolesta työntyy ulos mätimunia. Valmiit naaraat tunnistaa siitä, että ne uivat pää ylöspäin.
|
|
2.
|
Painele kalaa varovasti sormella tai peukalolla kyljestä pyrstöä kohti, jotta se laskee munapussin puhtaaseen petrimaljaan. Toista menettely kalan toiselle kyljelle ja laita kala takaisin omaan säiliöönsä.
|
|
3.
|
Munat voidaan levittää (yhteen kerrokseen) käyttämällä hienoharjaksista sivellintä. On tärkeää, että mahdollisimman paljon munia altistuu maidille. Tässä auttaa munien levittäminen mahdollisimman suurelle alalle. Tärkeä huomautus: Pidä munat kosteina peittämällä ne kauttaaltaan kostealla liinalla (on tärkeää, etteivät munat kosketa suoraan veteen, koska se voi kovettaa suonikalvon ennenaikaisesti, jolloin hedelmöityminen estyy). Se, miten paljon munia kukin naaras voi tuottaa, vaihtelee suuresti, mutta yhdeltä kutevalta naaraalta pitäisi saada helposti keskimäärin 150 munaa.
|
|
4.
|
Munien pinnalle levitetään siveltimellä tasaisesti 25μl Hankin seoksessa olevaa maitia. Kun hedelmöittyminen on alkanut, munat kovettuvat nopeasti ja muuttavat väriään (minuutin kuluessa). Jos munien arvioitu määrä on yli 150, toista menettely. Jos munat eivät kovetu minuutissa, lisää maitia hieman. Tärkeä huomautus: jos maitia lisätään paljon, se ei välttämättä paranna hedelmöittymisastetta.
|
|
5.
|
Munien ja maitinesteen on annettava olla ’vuorovaikutuksessa’ vähintään 15 minuuttia, ja hedelmöityneet munat on asetettava altistusakvaarioihin 1,5 tunnin kuluessa hedelmöittymisen jälkeen.
|
|
6.
|
Menettely toistetaan käyttämällä toista naarasta, kunnes haluttu määrä munia on saatu.
|
|
7.
|
Säästä muutama muna viimeisestä erästä ja kiinnitä ne 10-prosenttiseen etikkahappoon.
|
Munien laskeminen ja jakaminen testausakvaarioihin
|
1.
|
Munat tulee jakaa tasaisesti jokaiseen käsittelytasoon geneettisten poikkeamien välttämiseksi. Jokainen erä hedelmöityneitä munia on eroteltava yhtä suuriin ryhmiin (joita on yhtä monta kuin käsittelytasoja) käyttämällä tylppäkärkistä instrumenttia (esimerkiksi leveäteräisiä hyönteispinsettejä tai rengaspäistä inokulointi-instrumenttia). Jos tarvitset neljä rinnakkaisnäytettä käsittelyä kohti ja jos jokaisessa käsittelyssä on 20 munaa, yhteen altistusakvaarioon on siis jaettava 80 munaa. Tärkeä huomautus: munia kannattaa lisätä 20 prosenttia enemmän (ts. 96 munaa käsittelytasoa kohti), kunnes olet varma, että hedelmöitysaste on 100 prosenttia.
|
|
2.
|
Kolmipiikin munat ovat hyvin herkkiä sieni-infektioille koiraskalan vartioiman pesän ulkopuolella. Tämän vuoksi on erittäin tärkeää, että kaikki munat käsitellään metyleenisinellä testin viiden ensimmäisen päivän aikana. Metyleenisinestä valmistetaan varastoliuos, jonka vahvuus on 1 mg/ml, ja se lisätään altistusakvaarioihin, jolloin lopullinen enimmäispitoisuus on 2,125 mg/l. Tärkeä huomautus: kolmipiikit eivät saa altistua metyleenisinelle kuoriutumisen jälkeen, eikä järjestelmässä saa olla metyleenisineä päivästä 6 alkaen.
|
|
3.
|
Munat tutkitaan päivittäin, ja kaikki kuolleet tai hedelmöittymättömät munat kirjataan muistiin. Tärkeä huomautus: ennen kuoriutumista munia ei saa ottaa pois vedestä edes lyhyeksi aikaa.
|
C.42 BIOHAJOAVUUS MERIVEDESSÄ
YLEISJOHDANTO
|
1.
|
Tämä testimenetelmä vastaa OECD:n testiohjetta (TG) nro 306 (1992). Kun alkuperäisiä testimenetelmiä laadittiin, ei tiedetty, miten nopeaa biohajoavuutta koskevien seulontatutkimusten, joissa siirrosaineen lähteinä käytettiin makeaa vettä sekä jätevettä tai aktiivilietettä, tuloksia voitaisiin soveltaa meriympäristöön. Vaihtelevia tuloksia on raportoitu (esimerkiksi (1)).
|
|
2.
|
Monet teollisuuden jätevedet, jotka sisältävät erilaisia kemikaaleja, päätyvät mereen joko suorina päästöinä tai suistoalueilta tai joista, joissa viipymisajat ovat lyhyitä verrattuna siihen aikaan, jota monien kemikaalien täydellinen biohajoaminen edellyttää. Koska tietoisuus tarpeesta suojella meriympäristöä alati kasvavalta kemikaalikuormitukselta ja tarpeesta arvioida merien todennäköinen kemikaalipitoisuus lisääntyy, on kehitetty testimenetelmiä, joilla tutkitaan biohajoavuutta merivedessä.
|
|
3.
|
Tässä luvussa kuvatuissa menetelmissä käytetään luonnollista merivettä sekä vesifaasina että mikro-organismien lähteenä. Koska tavoitteena oli, että menetelmät olisivat yhdenmukaisia nopeaa biohajoavuutta makeassa vedessä koskevien menetelmien kanssa, tutkittiin ultrasuodatetun ja sentrifugoidun meriveden sekä merisedimenttien käyttöä siirrosaineen lähteenä. Nämä tutkimukset eivät kuitenkaan onnistuneet. Sen vuoksi testiaineena käytetään luonnollista merivettä, joka on esikäsitelty suurhiukkasten poistamiseksi.
|
|
4.
|
Jotta lopullista biohajoavuutta voidaan arvioida ravistuspullomenetelmällä, testiainetta on käytettävä melko suurina pitoisuuksina, koska liuennutta orgaanista hiiltä (DOC) koskevan analyysimenetelmän herkkyys on vähäinen. Tämän vuoksi meriveteen on lisättävä mineraaliravinteita (N ja P), joiden pienet pitoisuudet rajoittaisivat muutoin liuenneen orgaanisen hiilen poistumista. Myös suljetun pullon menetelmässä veteen on lisättävä ravinteita lisätyn testiaineen pitoisuuden vuoksi.
|
|
5.
|
Näin ollen menetelmillä ei voida testata nopeaa biohajoavuutta, koska meriveteen ei lisätä siirrosainetta siinä jo olevien mikro-organismien lisäksi. Testeillä ei myöskään simuloida meriympäristöä, koska veteen lisätään ravinteita ja koska testiaineen pitoisuus on hyvin paljon suurempi kuin se olisi meressä. Näistä syistä menetelmien kuvaamiseksi ehdotetaan uutta alakohtaa ’Biohajoavuus merivedessä’.
|
SOVELTAMINEN
|
6.
|
Niiden testien, joita sovelletaan, kun tutkittavan aineen käyttötavat ja hävittäminen osoittavat sitä joutuvan mereen, tuloksista saadaan alustavaa tietoa aineen biohajoavuudesta merivedessä. Jos tulos on positiivinen (liuenneen orgaanisen hiilen poistuminen >70 %; teoreettinen hapenkulutus ThOD >60 %), voidaan päätellä, että biohajoaminen meriympäristössä on mahdollista. Negatiivinen tulos ei kuitenkaan tarkoita, että tämä mahdollisuus olisi poissuljettu, vaan se osoittaa, että tarvitaan lisätutkimuksia, joissa esimerkiksi käytetään testiaineesta mahdollisimman pientä pitoisuutta.
|
|
7.
|
Jos biohajoavuusasteesta merivedessä tietyssä paikassa tarvitaan jommassakummassa tapauksessa kuitenkin tarkempi arvo, on sovellettava monimutkaisempia ja kehittyneempiä ja siksi myös kalliimpia menetelmiä. Esimerkiksi voidaan soveltaa simulaatiotestiä, jossa testiaineesta käytetään todennäköistä ympäristöpitoisuutta lähempänä olevaa pitoisuutta. Myös tietystä paikasta otettua rikastamatonta esikäsittelemätöntä merivettä voidaan käyttää, ja primaarinen biohajoavuus voidaan määrittää tietyllä kemiallisella analyysilla. Lopullisen biohajoavuuden määrittämisessä 14C--leimatut aineet ovat tarpeen, jotta voidaan mitata liukenevan orgaanisen 14C:n häviämisnopeus ja 14CO2:n tuotanto ympäristön kannalta realistisina pitoisuuksina.
|
MENETELMIEN VALINTA
|
8.
|
Käytettävän menetelmän valinta määräytyy useiden tekijöiden perusteella. Seuraava taulukko on tarkoitettu avuksi menetelmän valintaan. Koska aineita, joiden vesiliukoisuus on vähemmän kuin noin 5 mg C/l, ei voida testata ravistuspullomenetelmällä, ainakin huonosti liukenevia aineita voidaan periaatteessa testata suljetun pullon menetelmällä.
Taulukko
Ravistuspullo- ja suljettu pullo -testin edut ja haitat
|
III MENETELMÄ
|
EDUKSI KATSOTTAVAT OMINAISUUDET
|
HAITAT
|
|
RAVISTUS-PULLO
|
|
—
|
yksinkertainen laitteisto hiilianalysaattoria lukuun ottamatta
|
|
—
|
60 päivän kesto ei ongelmallinen
|
|
—
|
ei häiriötä nitrifikaatiosta
|
|
—
|
voidaan mukauttaa haihtuville aineille
|
|
|
—
|
tarvitaan hiilianalysaattori
|
|
—
|
käyttää 5–40 mg liuennutta orgaanista hiiltä litrassa, mahdollinen inhibitiovaikutus
|
|
—
|
liuenneen orgaanisen hiilen määrittäminen vaikeaa, kun pitoisuudet merivedessä ovat pienet (kloridivaikutus)
|
|
—
|
liuenneen orgaanisen hiilen pitoisuus joskus suurempi merivedessä.
|
|
|
SULJETTU PULLO
|
|
—
|
yksinkertainen laitteisto
|
|
—
|
yksinkertainen loppumääritys
|
|
—
|
käyttää testiaineesta pieniä pitoisuuksia (2 mg/l), jolloin inhibition mahdollisuus on pienempi
|
|
—
|
helposti mukautettavissa haihtuville aineille
|
|
|
—
|
pullojen ilmatiiviyden säilyttäminen voi olla hankalaa
|
|
—
|
seinämien bakteerikasvu voi johtaa vääriin arvoihin
|
|
—
|
puhtaan O2:n kertymäarvot voivat olla suuret etenkin 28 päivän kuluttua; mahdollisesti ratkaistavissa merivettä vanhentamalla
|
|
—
|
mahdollinen häiriö nitrifikaation aiheuttamasta O2-kertymästä.
|
|
|
RAVISTUSPULLOMENETELMÄ
JOHDANTO
|
1.
|
Tämä menetelmä on merivedelle tarkoitettu muunnos OECD:n muokatusta seulontatestistä, joka on kuvattu tämän liitteen luvussa C.4B (2). Se viimeisteltiin rengastestissä, jonka tanskalainen vedenlaatua tutkiva laitos järjesti Euroopan komission puolesta (3).
|
|
2.
|
Kuten merivedellä tehtävässä suljettu pullo -menetelmässä, myöskään tämän testin tuloksia ei tule pitää merkkeinä nopeasta biohajoavuudesta, vaan niitä on käytettävä pikemminkin keinona hankkia tietoa aineiden biohajoavuudesta meriympäristössä.
|
MENETELMÄN PERIAATE
|
3.
|
Ennalta määritetty määrä testiainetta liuotetaan testiväliaineeseen siten, että liuenneen orgaanisen hiilen pitoisuudeksi saadaan 540 mg. Jos orgaanisen hiilen analyysien herkkyysrajat paranevat, testiaineen käyttämisestä pienempinä pitoisuuksina voi olla hyötyä etenkin sellaisten aineiden kannalta, joilla on inhiboivia ominaisuuksia. Testiväliaineessa olevaa testiaineliuosta inkuboidaan hämmentämällä pimeässä tai hajavalossa aerobisissa olosuhteissa kiinteässä lämpötilassa (vaihteluväli ± 2 °C), joka on yleensä 15–20 °C. Kun tutkimuksen tavoitteena on simuloida ympäristötilanteita, testit voidaan tehdä tämän normaalin lämpötila-alueen ulkopuolellakin. Testin suositeltu enimmäiskesto on noin 60 päivää. Hajoamista arvioidaan mittaamalla liuenneen orgaanisen hiilen pitoisuus (lopullinen hajoaminen) ja joissakin tapauksissa tekemällä ominaisanalyysi (primaarinen hajoaminen).
|
TESTIAINETTA KOSKEVIA TIETOJA
|
4.
|
Jotta tiedetään, voidaanko testiä soveltaa tiettyyn aineeseen, sen joidenkin ominaisuuksien on oltava tiedossa. Aineen orgaanisen hiilen pitoisuus on määritettävä, ja sen haihtuvuuden on oltava sellainen, ettei merkittävää häviötä tapahdu testin aikana. Lisäksi sen vesiliukoisuuden on oltava suurempi kuin 2 540 mg C/l. Testiaine ei saa myöskään imeytyä lasipintoihin merkittävästi. Tiedot testiaineen tärkeimpien ainesosien puhtaudesta tai niiden suhteellisista osuuksista ovat tarpeen, jotta saatuja tuloksia voidaan tulkita, etenkin jos tulos on lähellä hyväksyttävää raja-arvoa.
|
|
5.
|
Tieto testiaineen myrkyllisyydestä bakteereille, esimerkiksi mitattuna lyhytaikaisissa soluhengitystesteissä (4), voi olla hyödyllinen asianmukaisia testipitoisuuksia valittaessa, ja se voi olla olennainen pienten biohajoavuusarvojen oikean tulkinnan kannalta. Nämä tiedot eivät kuitenkaan aina riitä biohajoavuustesteistä saatujen tulosten tulkintaan, ja 18 kohdassa kuvattu menettely voi olla sopivampi.
|
VERTAILUAINEET
|
6.
|
Sopivia vertailuaineita on käytettävä, jotta merivesinäytteen mikrobien toiminta voidaan tarkistaa. Esimerkkejä tähän tarkoitukseen sopivista aineista ovat natriumbentsoaatti, natriumasetaatti ja aniliini. Vertailuaineiden tulee hajota suhteellisen lyhyen ajan kuluessa; muutoin on suositeltavaa toistaa testi käyttämällä toista merivesinäytettä.
|
|
7.
|
Euroopan komission rengastestissä, jossa merivesinäytteitä otettiin eri paikoista ja eri aikoina vuodesta (3), natriumbentsoaatin osalta lag-vaihe (tL) oli 1–4 päivää ja 50 prosentin biohajoamisen saavuttamiseen tarvittu aika (t50), lag-vaihe pois lukien, oli 1–7 päivää. Aniliinin osalta tL vaihteli välillä 0–10 päivää, kun taas t50 vaihteli välillä 1–10 päivää.
|
MENETELMÄN TOISTETTAVUUS JA HERKKYYS
|
8.
|
Menetelmän toistettavuus todettiin rengastestissä (3). Testiaineen pienin pitoisuus, jota varten tätä menetelmää voidaan käyttää DOC-analyysin kanssa, määräytyy pitkälti orgaanisen hiilen analyysissa mahdollisen havaitsemisrajan (tällä hetkellä noin 0,5 mg C/l) sekä käytetyssä merivedessä olevan liuenneen orgaanisen hiilen pitoisuuden (avomereltä otetussa vedessä yleensä suunnilleen 35 mg/l) perusteella. Liuenneen orgaanisen hiilen taustapitoisuus saisi olla enintään 20 prosenttia liuenneen orgaanisen hiilen kokonaispitoisuudesta testiaineen lisäämisen jälkeen. Jos tämä ei ole mahdollista, liuenneen orgaanisen hiilen taustapitoisuutta voi joskus pienentää vanhentamalla merivettä ennen testausta. Jos menetelmää käytetään ainoastaan tietyn kemiallisen analyysin kanssa (jolla mitataan primaarinen hajoaminen), tutkijan on dokumentoitava (lisätietoja antamalla), onko lopullinen hajoaminen odotettavissa. Nämä lisätiedot voivat koostua muista nopeaa tai luontaista biohajoavuutta koskevista testeistä saaduista tuloksista.
|
MENETELMÄN KUVAUS
Laitteisto
|
9.
|
Tavallinen laboratoriolaite ja lisäksi:
|
a.
|
ravistuskone, johon mahtuu 0,52 litran Erlenmeyer-pulloja ja jossa on joko automaattinen lämpötilansäätö tai jota käytetään huoneessa, jonka vakiolämpötila on 15–20 °C (vaihteluväli ± 2 °C)
|
|
b.
|
kapeakaulaisia 0,52 litran Erlenmeyer-pulloja
|
|
c.
|
kalvosuodatin tai sentrifugi
|
|
d.
|
kalvosuodattimia (0,2-0–0,45 μm)
|
|
f.
|
ominaisanalyysia varten tarvittava laitteisto (valinnainen).
|
|
Merivesi
|
10.
|
Kerää merivesinäyte huolellisesti puhdistettuun säiliöön ja kuljeta se laboratorioon mieluiten yhden tai kahden päivän kuluessa keräämisestä. Kuljetuksen aikana näytteen lämpötila ei saa ylittää testissä käytettävää lämpötilaa kovin paljoa. Määritä näytteenottopaikka tarkasti ja kuvaa myös sen saastumis- ja ravinnetilaa. Sisällytä luonnehdintaan etenkin rannikkovesien osalta heterotrofinen pesäkeluku sekä liuenneen nitraatin, ammoniumin ja fosfaatin pitoisuusmääritykset.
|
|
11.
|
Ilmoita merivesinäytteestä myös seuraavat tiedot:
|
—
|
näytteen ulkonäkö – sameus jne.
|
|
—
|
lämpötila näytteenottoaikana
|
|
—
|
liuenneen orgaanisen hiilen pitoisuus
|
|
—
|
näytteenoton ja testissä käyttämisen välinen aika.
|
|
|
12.
|
Jos merivesinäytteen liuenneen orgaanisen hiilen pitoisuus todetaan liian suureksi (8 kohta), on suositeltavaa, että meriveden annetaan vanheta noin viikon ajan ennen käyttöä. Näytettä vanhennetaan säilyttämällä sitä aerobisissa olosuhteissa testilämpötilassa joko pimeässä tai hajavalossa. Ylläpidä aerobisia olosuhteita tarvittaessa varovaisella ilmastuksella. Vanhentamisen aikana helposti hajoavan orgaanisen aineksen pitoisuus pienenee. Rengastestissä (3) vanhennettujen ja tuoreena kerättyjen merivesinäytteiden hajoavuuspotentiaalissa ei havaittu eroa. Esikäsittele merivesi ennen käyttöä suurhiukkasten poistamiseksi esimerkiksi suodattamalla se nailonsuodattimen tai karkean paperisuodattimen läpi (ei kalvo- tai lasikuitusuodattimien läpi) tai sedimentoimalla ja dekantoimalla. Käytetty menetelmä on raportoitava. Jos merivettä on vanhennettu, esikäsittele vesi sen jälkeen.
|
Mineraaliravinteiden varastoliuokset
|
13.
|
Valmista seuraavat varastoliuokset analyyttisen puhtaita reagensseja käyttäen:
|
a)
|
Kaliumdivetyortofosfaatti, KH2PO4
|
8,50 g
|
|
Dikaliumvetyortofosfaatti, K2HPO4
|
21,75 g
|
|
Dinatriumvetyortofosfaattidihydraatti, Na2HPO4 · 2H2O
|
33,30 g
|
|
Ammoniumkloridi, NH4Cl
|
0,50 g
|
|
Liuota ja valmista yhdeksi litraksi tislatulla vedellä.
|
|
|
b)
|
Kalsiumkloridi, CaCl2
|
27,50 g
|
|
Liuota ja valmista yhdeksi litraksi tislatulla vedellä.
|
|
|
c)
|
Magnesiumsulfaattiheptahydraatti, MgSO4 · 7H2O
|
22,50 g
|
|
Liuota ja valmista yhdeksi litraksi tislatulla vedellä.
|
|
|
d)
|
Rauta(III)kloridiheksahydraatti, FeCl3 · 6H2O
|
0,25 g
|
|
Liuota ja valmista yhdeksi litraksi tislatulla vedellä.
|
|
Liuoksen saostuminen (d) on estettävissä lisäämällä yksi tippa konsentroitua HCl:ää tai 0,4 g etyleenidiamiinitetraetikkahappoa (EDTA:ta, dinatriumsuolaa) yhteen litraan. Jos varastoliuokseen muodostuu sakkaa, vaihda se tuoreeseen liuokseen.
|
Testiväliaineen valmistelu
|
14.
|
Lisää 1 ml jokaista edellä mainittua varastoliuosta yhteen litraan esikäsiteltyä merivettä.
|
Siirrosaine
|
15.
|
Älä lisää tiettyä siirrosainetta merivedessä jo olevien mikro-organismien lisäksi. Määritä (valinnaisesti) pesäkkeitä muodostavien heterotrofien määrä merivesitestiväliaineessa (ja mielellään myös alkuperäisissä merivesinäytteissä) esimerkiksi laskemalla pesäkeluku Marine Agaria käyttäen. Tämä on paikallaan erityisesti tutkittaessa rannikkoalueilta tai saastuneilta paikoilta otettuja näytteitä. Tarkista heterotrofisten mikrobien toiminta merivedessä tekemällä testi vertailuaineella.
|
Pullojen valmistelu
|
16.
|
Varmista, että kaikki lasiastiat ovat hyvin puhtaita, eivät kuitenkaan välttämättä steriilejä (esimerkiksi käyttäen alkoholipitoista hydrokloridihappoa), huuhdeltuja ja kuivia ennen käyttöä. Näin vältetään aiemmista testeistä jääneiden jäämien aiheuttama kontaminoituminen. Pullot on pestävä myös ennen ensimmäistä käyttökertaa.
|
|
17.
|
Arvioi testiaineet rinnakkaisnäytepulloissa samanaikaisesti yhdessä vertailuainetta sisältävän yhden pullon kanssa. Tee nollakoe rinnakkaisnäyttein (ilman testi- ja vertailuainetta) analyyttisten nollanäytteiden määrittämiseksi. Liuota testiaineet testiväliaineeseen – ne voidaan lisätä kätevästi konsentroidun varastoliuoksen kautta, jolloin saavutetaan halutut aloituspitoisuudet (liuenneen orgaanisen hiilen pitoisuus yleensä 540 mg/l). Vertailuaine testataan yleensä aloituspitoisuudella, joka vastaa liuenneen orgaanisen hiilen pitoisuutta 20 mg/l. Jos testi- ja/tai vertailuaineista käytetään varastoliuoksia, varmista, ettei merivesiväliaineen suolaisuus ole muuttunut kovin paljoa.
|
|
18.
|
Jos myrkyllisiä vaikutuksia on odotettavissa tai jos niitä ei voida sulkea pois, testisuunnitelmaan on syytä sisällyttää rinnakkaisnäyttein toteutettava inhibitiokoe. Lisää testi- ja vertailuaineet samaan astiaan. Vertailuaineen pitoisuus on yleensä sama kuin kontrollitestissä (esimerkiksi liuenneen orgaanisen hiilen pitoisuus 20 mg/l), jotta vertailu on mahdollista.
|
|
19.
|
Laita asianmukaiset määrät testiliuoksia Erlenmeyer-pulloihin (sopiva määrä on noin puolet pullon tilavuudesta) ja peitä pullot löysällä kannella (esimerkiksi alumiinifoliolla), joka ei estä kaasunvaihtoa pullon ja ympäröivän ilman välillä. (Puuvillakorkit eivät käy, jos käytetään liuenneen orgaanisen hiilen analyysia.) Aseta astiat ravistimeen ja ravista niitä jatkuvasti kohtuullisella nopeudella (esimerkiksi 100 kierrosta minuutissa) koko testin ajan. Valvo lämpötilaa (15–20 °C, vaihteluväli ± 2 °C), ja suojaa astiat valolta, jotta niissä ei ala kasvaa levää. Varmista, ettei ilmassa ole myrkyllisiä aineita.
|
Fysikaalis-kemiallinen kontrollitesti (valinnainen)
|
20.
|
Jos on syytä epäillä abioottisen hajoamisen tai häviämisen mekanismeja, joita ovat esimerkiksi hydrolyysi (ongelma vain ominaisanalyysin yhteydessä), haihtuminen tai adsorptio, kannattaa tehdä fysikaalis-kemiallinen kontrollikoe. Se voidaan tehdä lisäämällä elohopea(II)kloridia (HgCl2) (32) (50–100 mg/l) testiainetta sisältäviin astioihin mikrobitoiminnan pysäyttämiseksi. Jos liuenneen orgaanisen hiilen pitoisuus tai aineen ominaispitoisuus pienenevät merkittävästi fysikaalis-kemiallisessa kontrollitestissä, se viittaa abioottisiin poistomekanismeihin. (Elohopeakloridia käytettäessä on kiinnitettävä huomiota häiriöihin tai katalyytteihin kohdistuvaan myrkyllisyyteen liuenneen orgaanisen hiilen pitoisuutta koskevissa analyyseissa.)
|
Pullojen määrä
|
21.
|
Tyypillisessä ajossa käytetään seuraavia pulloja:
|
Pullot 1 & 2
|
sisältävät testiainetta (testisuspensio)
|
|
Pullot 3 & 4
|
sisältävät vain merivettä (nollanäyte)
|
|
Pullo 5
|
sisältää vertailuainetta (menettelyn kontrolli)
|
|
Pullo 6
|
sisältää testi- ja vertailuaineita (myrkyllisyyskontrolli) – valinnainen
|
|
Pullo 7
|
sisältää testiainetta ja sterilisoivaa ainetta (abioottinen steriili kontrolli) – valinnainen.
|
|
DOC-analyysi
|
22.
|
Ota testin aikana sopivin väliajoin näytteitä DOC-analyysia varten (lisäys 1). Ota näytteet aina testin alkaessa (päivänä 0) ja päivänä 60. Näytteitä tarvitaan yhteensä vähintään viisi, jotta hajoamista voidaan kuvata ajallisesti. Näytteenottoa varten ei voida asettaa kiinteää aikaväliä, koska biohajoamisen nopeus vaihtelee. Tee DOC-määritys rinnakkaisnäyttein jokaisesta näytteestä.
|
Otanta
|
23.
|
Tarvittavaan näytemäärään vaikuttavat analyysimenetelmä (ominaisanalyysi), käytettävä hiilianalysaattori sekä näytteiden käsittelyyn ennen hiilimääritystä valittu menetelmä (kalvosuodatus vai sentrifugointi) (25 ja 26 kohta). Varmista ennen näytteenottoa, että testiväliaine on sekoitettu hyvin ja että kaikki pullon seinämiin mahdollisesti kiinnittynyt aines on liuennut tai suspendoitunut.
|
|
24.
|
Tee kalvosuodatus tai sentrifugointi heti näytteenoton jälkeen. Jos tarpeen, suodatettuja tai sentrifugoituja näytteitä voi säilyttää 2–4 °C:ssä enintään 48 tuntia tai alle – 18 °C:ssa pidemmän aikaa (jos tiedetään, ettei aine muutu; säädä pH-arvoksi 2 ennen säilytystä).
|
|
25.
|
Kalvosuodattimet (0,2-0–0,45 μm) ovat sopivia, jos on varmaa, ettei niistä vapaudu hiiltä ja etteivät ne adsorboi ainetta suodatusvaiheessa (esimerkiksi polykarbonaatista valmistetut kalvosuodattimet sopivat). Jotkin kalvosuodattimet on kyllästetty pinta-aktiivisilla aineilla hydrofiilisyyden parantamiseksi, ja niistä voi vapautua huomattavia määriä liuennutta hiiltä. Valmistele tällaiset suodattimet keittämällä ne deionisoidussa vedessä tunnin ajan, ja toista käsittely kolme kertaa. Säilytä suodattimet keittämisen jälkeen deionisoidussa vedessä. Ensimmäiset 20 ml suodosta heitetään pois.
|
|
26.
|
Näytteiden sentrifugointi voidaan valita vaihtoehdoksi kalvosuodatukselle. Sentrifugoi näytteet nopeudella 40 000 m.s– 2 (~ 4 000 g) 15 minuutin ajan mieluiten jäähdytetyssä sentrifugissa.
Huomautus: TOC:n (orgaanisen hiilen kokonaismäärän) ja DOC:n (TOC/DOC) osuuksia hyvin pieniä pitoisuuksia sentrifugoitaessa ei voida määrittää luotettavasti, koska kaikki bakteerit eivät välttämättä poistu tai bakteeriplasman orgaaninen hiili liukenee uudelleen. Suurempien testipitoisuuksien (> 10 mg hiiltä litrassa) sentrifugointivirhe vaikuttaa olevan verrattain pieni.
|
Näytteenottotiheys
|
27.
|
Jos analyysit tehdään heti näytteenoton jälkeen, määritä seuraava näytteenottoajankohta analyyttisen määrityksen tuloksen perusteella.
|
|
28.
|
Jos näytteet säilötään (24 kohta) myöhemmin tehtävää analyysia varten, ota vaadittua vähimmäismäärää (viisi) enemmän näytteitä. Analysoi viimeiset näytteet ensiksi. Kun näytteet valitaan analyysiin näytteenottojärjestykseen nähden päinvastaisessa järjestyksessä asteittain (’takaperin’), on mahdollista saada hyvä kuva biohajoamiskäyrästä, ja samalla tarvitaan melko vähän analyyttisia määrityksiä. Jos hajoamista ei ole tapahtunut testin loppuun mennessä, lisänäytteitä ei tarvitse analysoida, ja tällaisessa tilanteessa analyysikustannuksissa saatetaan säästää huomattavasti päinvastaisen järjestyksen noudattamisen ansiosta.
|
|
29.
|
Jos hajoamiskäyrässä havaitaan tasannevaihe ennen päivää 60, lopeta testi. Jos hajoaminen on selvästi alkanut päivään 60 mennessä mutta jos tasannevaihetta ei ole saavutettu, jatka koetta.
|
TIEDOT JA RAPORTOINTI
Tulosten käsittely
|
30.
|
Merkitse analyysin tulokset liitteenä olevaan tietolomakkeeseen (lisäys 2), ja laske sekä testi- että vertailuaineen biohajoavuusarvot seuraavalla yhtälöllä:
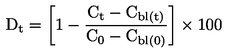
Jossa
|
Dt
|
=
|
hajoaminen DOC-poistumaprosenttina tai tietyn aineen poistumaprosenttina ajassa t
|
|
Co
|
=
|
DOC:n tai tietyn aineen aloituspitoisuus testiväliaineessa
|
|
Ct
|
=
|
DOC:n tai tietyn aineen pitoisuus testiväliaineessa ajassa t
|
|
Cbl(0)
|
=
|
DOC:n tai tietyn aineen aloituspitoisuus nollanäytteessä
|
|
Cbl(t)
|
=
|
DOC:n tai tietyn aineen pitoisuus nollanäytteessä ajassa t.
|
|
|
31.
|
Ilmoita hajoaminen DOC-poistumaprosenttina (lopullinen hajoaminen) tai tietyn aineen poistumaprosenttina ajassa t. Laske DOC-pitoisuudet lähimpään 0,1 mg:aan litraa kohti, ja pyöristä Dt-arvojen keskiarvot lähimpään kokonaiseen prosenttilukuun.
|
|
32.
|
Kuvaa hajoamisen etenemistä graafisesti kaavakuvassa kohdassa ’Validiteetti ja tulosten tulkinta’ olevan kuvan mukaisesti. Jos tietoja on riittävästi, laske käyrästä lag-vaihe (tL) ja aika, joka kului 50 prosentin poistuman saavuttamiseen lag-vaiheen lopusta alkaen (t50).
|
Testiraportti
|
33.
|
Testiraportissa on esitettävä seuraavat tiedot:
|
|
Testiaine:
|
—
|
fysikaalinen olomuoto ja fysikokemialliset ominaisuudet, jos niillä on merkitystä
|
|
|
|
Testiolosuhteet:
|
—
|
näytteenottopaikan sijainti ja kuvaus; saaste- ja ravinnetila (pesäkeluku, nitraatti, ammonium, fosfaatti, jos tarpeen)
|
|
—
|
näytteen ominaisuudet (näytteenottopäivä ja -syvyys, ulkonäkö, lämpötila, suolaisuus, DOC (valinnainen), näytteenoton ja testissä käyttämisen välinen viive
|
|
—
|
meriveden (mahdollisessa) vanhentamisessa käytetty menetelmä
|
|
—
|
meriveden esikäsittelyssä (suodatus/sedimentointi) käytetty menetelmä
|
|
—
|
DOC-määrityksessä käytetty menetelmä
|
|
—
|
ominaisanalyysissa käytetty menetelmä (valinnainen)
|
|
—
|
meriveden heterotrofien lukumäärän määrittämisessä käytetty menetelmä (pesäkeluvun laskeminen tai jokin muu menetelmä) (valinnainen)
|
|
—
|
muut meriveden luonnehtimisessa käytetyt menetelmät (valinnainen) (ATP-mittaukset jne.).
|
|
|
|
Tulokset:
|
—
|
tietolomakkeella (lisäys 2) raportoidut analyysitiedot
|
|
—
|
hajoamistestin eteneminen esitetään graafisesti kaavakuvassa, jossa näkyy lag-vaihe (tL), kulmakerroin ja aika (lag-vaiheen lopusta alkaen), joka kului 50 prosentin poistuman (t50) saavuttamiseen. Lag-vaihe voidaan arvioida graafisesti kohdassa ’Validiteetti ja tulosten tulkinta’ olevan kuvan mukaisesti, tai se voidaan ilmoittaa helpommin aikana, joka kului 10 prosentin hajoamisen saavuttamiseen.
|
|
—
|
hajoamisen prosenttiosuus mitattuna 60 päivän kuluttua tai testin lopussa.
|
|
|
Validiteetti ja tulosten tulkinta
|
34.
|
Vertailuaineista (esimerkiksi natriumbentsoaatti, natriumasetaatti tai aniliini) saatujen tulosten tulisi olla verrattavissa rengastestissä (3) saatuihin tuloksiin (ks. kohta ’Vertailuaineet’, 7 kohta). Jos vertailuaineista saadut tulokset ovat epätyypillisiä, testi on toistettava käyttämällä toista merivesinäytettä. Vaikka inhibitiotestien tuloksia ei aina voida tulkita suoraviivaisesti, koska testiaine vaikuttaa liuenneen orgaanisen hiilen pitoisuuteen, sen kokonaispitoisuuden poistumanopeuden merkittävä pieneneminen kontrolliin verrattuna on positiivinen merkki myrkyllisistä vaikutuksista.
|
|
35.
|
Koska käytetyt testipitoisuudet ovat varsin suuria verrattuna useimpiin luonnollisiin järjestelmiin (ja koska testiaineiden ja muiden hiililähteiden pitoisuuksien välinen suhde on siksi epäsuotuisa), menetelmää on pidettävä alustavana testinä, jota voidaan käyttää sen osoittamiseksi, onko aine nopeasti biohajoava vai ei. Toisaalta jos testin tulokseksi saadaan pieniä arvoja, se ei välttämättä tarkoita, etteikö testiaine olisi biohajoava meriympäristössä. Sen sijaan tällainen tulos viittaa siihen, että asian selvittämiseksi tarvitaan lisää tutkimuksia.
Jäljempänä olevassa kuvassa on esimerkki teoreettisesta hajoamiskokeesta, joka edustaa mahdollista tapaa arvioida arvot tL (’lag-vaiheen’ pituus) ja t50 (aikaväli, alkaa ajasta tL), joka tarvitaan 50 prosentin poistuman saavuttamiseen.
|
SULJETTU PULLO -MENETELMÄ
JOHDANTO
|
1.
|
Tämä menetelmä on meriveteen sovellettava muunnos suljetun pullon testistä (5), ja sen viimeisteli tanskalainen vedenlaatua tutkiva laitos, joka järjesti rengastestin Euroopan komission puolesta (3).
|
|
2.
|
Kuten merivedellä tehtävässä ravistuspullomenetelmässä, myöskään tämän testin tuloksia ei tule pitää merkkeinä nopeasta biohajoavuudesta, vaan niitä on käytettävä pikemminkin keinona hankkia tietoa aineiden biohajoavuudesta meriympäristössä.
|
MENETELMÄN PERIAATE
|
3.
|
Ennalta määritetty määrä testiainetta liuotetaan testiväliaineeseen pitoisuutena, joka on yleensä 210 mg testiainetta litrassa (yhtä tai useampaa pitoisuutta voidaan käyttää). Liuosta pidetään täytetyssä suljetussa pullossa pimeässä ja hauteessa, jonka lämpötila on vakio, tai kotelossa, jonka lämpötilaksi on säädetty 15–20 °C (vaihteluväli ± 1 °C). Kun tutkimuksen tavoitteena on simuloida ympäristötilanteita, testit voidaan tehdä tämän normaalin lämpötila-alueen ulkopuolellakin, kunhan lämpötilansäätöön tehdään tarvittavat mukautukset. Hajoamista seurataan happianalyyseilla 28 päivän ajanjaksolla.
|
|
4.
|
Rengastesti osoitti, että kun testiä jatkettiin yli 28 päivää, useimmissa tapauksissa ei saatu hyödyllistä tietoa vakavien häiriöiden takia. Nollanäytteen biokemiallisen hapenkulutuksen (BOD) arvot olivat erittäin suuret luultavasti pullon seinämien bakteerikasvuston, sekoituksen puuttumisen ja nitrifikaation takia. Näin ollen testin suositeltu kesto on 28 päivää, mutta jos nollanäytteen BOD-arvo on edelleen 30 prosentin rajan sisällä (15 ja 40 kohta), testiä voidaan pidentää.
|
TESTIAINETTA KOSKEVIA TIETOJA
|
5.
|
Jotta tiedetään, voidaanko testiä soveltaa tiettyyn aineeseen, sen joidenkin ominaisuuksien on oltava tiedossa. Jotta teoreettinen hapenkulutus (ThOD) voidaan laskea (ks. lisäys 3), on tiedettävä aineen empiirinen kaava. Muussa tapauksessa on määritettävä aineen kemiallinen hapenkulutus (COD) vertailuarvoksi. COD-arvon käyttämistä ei suositella, koska jotkin aineet eivät hapetu täysin COD-testissä.
|
|
6.
|
Aineen liukoisuuden tulisi olla vähintään 2 mg/l, joskin periaatteessa myös huonommin liukenevia aineita voidaan testata (esimerkiksi käyttämällä ultraäänikäsittelyä), kuten myös haihtuvia aineita. Tiedot testiaineen tärkeimpien ainesosien puhtaudesta tai niiden suhteellisista osuuksista ovat tarpeen, jotta saatuja tuloksia voidaan tulkita, etenkin jos tulos on lähellä hyväksyttävää raja-arvoa.
|
|
7.
|
Tieto testiaineen myrkyllisyydestä bakteereille, esimerkiksi mitattuna lyhytaikaisissa soluhengitystesteissä (4), voi olla hyödyllinen asianmukaisia testipitoisuuksia valittaessa, ja se voi olla olennainen pienten biohajoavuusarvojen oikean tulkinnan kannalta. Nämä tiedot eivät kuitenkaan aina riitä biohajoavuustesteistä saatujen tulosten tulkintaan, ja 27 kohdassa kuvattu menettely voi olla sopivampi.
|
VERTAILUAINEET
|
8.
|
Sopivia vertailuaineita on käytettävä, jotta merivesinäytteen mikrobien toiminta voidaan tarkistaa. Tähän tarkoitukseen voidaan käyttää (esimerkiksi) aniliinia, natriumasetaattia tai natriumbentsoaattia. Näiden aineiden on hajottava vähintään 60-prosenttisesti (niiden ThOD-arvosta) melko lyhyessä ajassa. Muussa tapauksessa suositellaan, että testi toistetaan käyttämällä toista merivesinäytettä.
|
|
9.
|
Euroopan komission rengastestissä, joissa merivesinäytteitä otettiin eri paikoista ja eri aikoina vuodesta, natriumbentsoaatin osalta lag-vaihe (tL) oli 0–2 päivää ja 50 prosentin biohajoamisen saavuttamiseen tarvittu aika (t50), lag-vaihe pois lukien, oli 1–4 päivää. Aniliinin osalta tL-arvo oli 0–7 päivää ja t50-arvo 2–12 päivää.
|
TOISTETTAVUUS
|
10.
|
Menetelmien toistettavuus todettiin Euroopan komission rengastestissä (3).
|
MENETELMÄN KUVAUS
Laitteisto
|
11.
|
Tavallinen laboratoriolaitteisto ja lisäksi:
|
a)
|
250–300 ml:n BOD-pulloja, joissa on lasikorkit, tai kapeakaulaisia 250 ml:n pulloja, joissa on lasikorkit
|
|
b)
|
useita 2, 3 ja 4 litran pulloja, joissa on litran merkit, kokeen valmisteluun ja BOD-pullojen täyttämiseen
|
|
c)
|
vesihaude tai tila, jonka lämpötila on vakio, jotta pulloja voidaan pitää vakiolämpötilassa (± 1 °C) ja pimeässä
|
|
d)
|
laitteisto liuenneen hapen analysointiin
|
|
e)
|
kalvosuodattimia, 0,2–0,45 μm (valinnainen)
|
|
f)
|
ominaisanalyysia varten tarvittava laitteisto (valinnainen).
|
|
Merivesi
|
12.
|
Kerää merivesinäyte huolellisesti puhdistettuun säiliöön ja kuljeta se laboratorioon mieluiten yhden tai kahden päivän kuluessa keräämisestä. Kuljetuksen aikana näytteen lämpötila ei saa ylittää testissä käytettävää lämpötilaa kovin paljoa.
|
|
13.
|
Määritä näytteenottopaikka tarkasti ja kuvaa myös sen saastumis- ja ravinnetilaa. Sisällytä luonnehdintaan etenkin rannikkovesien tai saastuneiden vesien osalta heterotrofinen pesäkeluku sekä liuenneen nitraatin, ammoniumin ja fosfaatin pitoisuusmääritykset.
|
|
14.
|
Ilmoita merivesinäytteestä myös seuraavat tiedot:
|
—
|
näytteen ulkonäkö – sameus jne.
|
|
—
|
lämpötila näytteenottoaikana
|
|
—
|
liuennut orgaaninen hiili (DOC)
|
|
—
|
näytteenoton ja testissä käyttämisen välinen aika.
|
|
|
15.
|
Jos näytteen DOC-pitoisuuden havaitaan olevan suuri tai jos oletetaan, että nollanäytteen BOD-arvo olisi 28 päivän kuluttua enemmän kuin 30 prosenttia vertailuaineiden arvosta, on suositeltavaa, että meriveden annetaan vanhentua noin viikon ajan ennen käyttöä.
|
|
16.
|
Näytettä vanhennetaan säilyttämällä sitä aerobisissa olosuhteissa testilämpötilassa joko pimeässä tai hajavalossa. Ylläpidä aerobisia olosuhteita tarvittaessa varovaisella ilmastuksella. Vanhentamisen aikana helposti hajoavan orgaanisen aineksen pitoisuus pienenee. Rengastestissä (3) vanhennettujen ja tuoreena kerättyjen merivesinäytteiden hajoavuuspotentiaalissa ei havaittu eroa.
|
|
17.
|
Esikäsittele merivesi ennen käyttöä suurhiukkasten poistamiseksi esimerkiksi suodattamalla se nailonsuodattimen tai karkean paperisuodattimen läpi (ei kalvo- tai lasikuitusuodattimien läpi) tai sedimentoimalla ja dekantoimalla. Ilmoita käytetty menetelmä. Esikäsittele vesi vanhentamisen jälkeen, jos sitä on käytetty.
|
Mineraaliravinteiden varastoliuokset
|
18.
|
Valmista seuraavat varastoliuokset analyyttisen puhtaita reagensseja käyttäen:
|
a)
|
Kaliumdivetyortofosfaatti, KH2PO4
|
8,50 g
|
|
Dikaliumvetyortofosfaatti, K2HPO4
|
21,75 g
|
|
Dinatriumvetyortofosfaattidihydraatti, Na2HPO4 · 2H2O
|
33,30 g
|
|
Ammoniumkloridi, NH4Cl
|
0,50 g
|
|
Liuota ja valmista yhdeksi litraksi tislatulla vedellä.
|
|
|
b)
|
Kalsiumkloridi, CaCl2
|
27,50 g
|
|
Liuota ja valmista yhdeksi litraksi tislatulla vedellä.
|
|
|
c)
|
Magnesiumsulfaattiheptahydraatti, MgSO4 · 7H2O
|
22,50 g
|
|
Liuota ja valmista yhdeksi litraksi tislatulla vedellä.
|
|
|
d)
|
Rauta(III)kloridiheksahydraatti, FeCl3 · 6H2O
|
0,25 g
|
|
Liuota ja valmista yhdeksi litraksi tislatulla vedellä.
|
|
Liuoksen saostuminen (d) on estettävissä lisäämällä yksi tippa konsentroitua HCl:ää tai 0,4 g etyleenidiamiinitetraetikkahappoa (EDTA:ta, dinatriumsuolaa) yhteen litraan. Jos varastoliuokseen muodostuu sakkaa, vaihda se tuoreeseen liuokseen.
|
Testiväliaineen valmistelu
|
19.
|
Lisää yhteen litraan esikäsiteltyä merivettä 1 ml jokaista edellä mainittua varastoliuosta. Kyllästä testiväliaine ilmalla testilämpötilassa ilmastamalla sitä puhtaalla paineilmalla noin 20 minuutin ajan. Määritä liuenneen hapen pitoisuus vertailua varten. Liuenneen hapen kyllästetty pitoisuus suolaisuuden ja lämpötilan funktiona voidaan lukea nomogrammista, joka on tämän testimenetelmän liitteenä (lisäys 4).
|
Siirrosaine
|
20.
|
Älä lisää tiettyä siirrosainetta merivedessä jo olevien mikro-organismien lisäksi. Määritä (valinnaisesti) pesäkkeitä muodostavien heterotrofien määrä merivesitestiväliaineessa (ja mielellään myös alkuperäisissä merivesinäytteissä) esimerkiksi laskemalla pesäkeluku Marine Agaria käyttäen. Tämä on paikallaan erityisesti tutkittaessa rannikkoalueilta tai saastuneilta paikoilta otettuja näytteitä. Tarkista heterotrofisten mikrobien toiminta merivedessä tekemällä testi vertailuaineella.
|
Testipullojen valmistelu
|
21.
|
Tee kaikki tarvittavat käsittelyt, mukaan luettuina meriveden vanhentaminen ja esikäsittely, valitussa testilämpötilassa (välillä 15–20 °C), ja varmista, että kaikki lasiastiat ovat puhtaita mutta eivät steriilejä.
|
|
22.
|
Valmistele rinnakkaiset ryhmät BOD-pulloja, joiden avulla voidaan toteuttaa rinnakkaisia koesarjoja testi- ja vertailuaineen BOD-arvojen määritystä varten. Tee kaikki analyysit rinnakkaisnäytepulloilla (nollanäytteet, vertailu- ja testiaineet), ts. valmista jokaista määritystä varten kaksi pulloa. Tee analyysit vähintään päivinä 0, 5, 15 ja 28 (neljä määritystä). Happianalyyseissa neljään määritykseen tarvitaan yhteensä 3 × 2 × 4 = 24 pulloa (nollanäyte, vertailuaine ja testiaine) ja siis noin kahdeksan litraa testiväliainetta (yhtä testiainepitoisuutta varten).
|
|
23.
|
Valmista testi- ja vertailuaineista erilliset liuokset riittävän suuriin pulloihin (11 kohta). Lisää osittain täytettyihin suuriin pulloihin ensin testi- ja vertailuaineet joko suoraan tai käyttämällä konsentroitua varastoliuosta. Lisää sen jälkeen testiväliainetta halutun lopullisen pitoisuuden saavuttamiseksi. Jos testi- ja/tai vertailuaineista käytetään varastoliuoksia, varmista, ettei merivesiväliaineen suolaisuus ole muuttunut kovin paljoa.
|
|
24.
|
Valitse testi- ja vertailuaineiden pitoisuudet ottamalla huomioon seuraavat seikat:
|
a)
|
liuenneen hapen liukoisuus merivedessä testissä vallitsevan lämpötilan ja suolaisuuden yhteydessä (ks. liitteenä oleva nomogrammi, lisäys 4)
|
|
b)
|
meriveden nollanäytteen BOD-arvo
|
|
c)
|
testiaineen odotettu biohajoavuus.
|
|
|
25.
|
Kun lämpötila on 15–20 °C ja kun suolaisuus on 32 tuhannesosaa (valtamerivesi), liuennen hapen liukoisuus on noin 8,1 ja 7,4 mg/l. Meriveden hapenkulutus (nollanäytteen soluhengitys) on 2 mg O2/l tai enemmän, jos merivesi ei ole vanhentunut. Jotta voidaan varmistaa, että jäljelle jäävä happipitoisuus on merkittävä testiaineen hapettumisen jälkeen, käytä testiaineen aloituspitoisuutena suurin piirtein arvoa 2–3 mg/l (ThOD-arvon mukaan) sellaisille aineille, joiden odotetaan hajoavan kokonaan testiolosuhteissa (kuten vertailuaineet). Testaa huonommin hajoavat aineet suurempina pitoisuuksina (noin 10 mg/l) edellyttäen, ettei myrkyllisiä vaikutuksia ilmene. Voi olla hyödyllistä tehdä rinnakkaiset testit testiaineen pienellä pitoisuudella (noin 2 mg/l) ja suurella pitoisuudella (noin 10 mg/l).
|
|
26.
|
Hapen nollanäyte on määritettävä rinnakkain pulloista, jotka eivät sisällä testiainetta eivätkä vertailuainetta.
|
|
27.
|
Jos on tarkoitus määrittää inhiboivia vaikutuksia, valmistele seuraavat liuokset erillisiin suuriin pulloihin (13 kohta):
|
a)
|
nopeasti hajoavaa ainetta, esimerkiksi mitä tahansa mainittua vertailuainetta, 2 mg/l
|
|
b)
|
testiainetta × mg/l (x on yleensä 2)
|
|
c)
|
nopeasti hajoavaa ainetta 2 mg/l sekä testiainetta × mg/l.
|
|
Fysikaalis-kemiallinen kontrollitesti (valinnainen)
|
28.
|
Jos hyödynnetään mahdollisuutta käyttää ominaisanalyyseja, voidaan tehdä fysikaalis-kemiallinen koe sen tarkistamiseksi, poistuuko testiainetta abioottisten mekanismien, kuten hydrolyysin tai adsorption, kautta. Fysikaalis-kemiallinen kontrollitesti voidaan tehdä lisäämällä elohopea(II)kloridia (HgCl2) (33) (50–-100 mg/l) testiainetta sisältäviin rinnakkaisnäytepulloihin mikrobitoiminnan pysäyttämiseksi. Jos aineen ominaispitoisuus pienenee merkittävästi testin aikana, se viittaa abioottisiin poistomekanismeihin.
|
BOD-pullojen lukumäärä tyypillisessä ajossa
|
29.
|
Tyypillisessä ajossa käytetään seuraavia pulloja:
|
—
|
vähintään 8 pulloa, jotka sisältävät testiainetta
|
|
—
|
vähintään 8 pulloa, jotka sisältävät vain ravinteilla rikastettua merivettä
|
|
—
|
vähintään 8 pulloa, jotka sisältävät vertailuainetta, ja tarvittaessa
|
|
—
|
6 pulloa, jotka sisältävät testi- ja vertailuaineita (myrkyllisyyskontrolli).
|
|
MENETTELY
|
30.
|
Täytä kukin BOD-pulloryhmä lappamalla kutakin liuosta heti valmistuksen jälkeen jokaisen suuren pullon alemmasta neljänneksestä (ei pohjalta) BOD-pulloihin. Analysoi heti liuenneen hapen nollakontrollit (aika nolla) (33 kohta) tai säilö ne myöhemmin tehtävää kemiallista analyysia varten saostamalla ne MnCl2:lla (manganeesi(II)kloridilla) ja NaOH:lla (natriumhydroksidilla).
|
|
31.
|
Inkuboi loput rinnakkaiset BOD-pullot testilämpötilassa (15–20 °C), pidä ne pimeässä, poista ne inkubointialueelta sopivin väliajoin (esimerkiksi vähintään 5, 15 ja 28 päivän kuluttua) ja analysoi niistä liuennut happi (33 kohta).
|
|
32.
|
Kalvosuodata (0,2-0–0,45 μm) tai sentrifugoi (15 minuuttia) näytteet ominaisanalyysia varten (valinnainen). Säilytä näytteitä enintään 48 tuntia 2-4 °C:ssa tai pitempiä aikoja – 18 °C:ssa, jos niitä ei analysoida välittömästi (jos tiedetään, ettei testiaine muutu; säädä pH-arvoksi 2 ennen säilytystä).
|
Liuenneen hapen määritys
|
33.
|
Määritä liuenneen hapen pitoisuus käyttämällä kemiallista tai sähkökemiallista menetelmää, joka on hyväksytty kansallisesti tai kansainvälisesti.
|
TIEDOT JA RAPORTOINTI
Tulosten käsittely
|
34.
|
Merkitse analyysitulokset liitteenä oleviin tietolomakkeisiin (lisäys 5).
|
|
35.
|
Laske BOD nollanäytteen ja testiaineliuoksen välisenä hapen häviämisen erotuksena testiolosuhteissa. Jaa hapen nettohäviäminen aineen pitoisuudella (massaprosenttina tilavuutta kohden, w/v), jotta voit ilmoittaa BOD-arvon kaavalla ’BOD x mg yhdessä mg:ssa testiainetta’. Hajoaminen määritellään biokemiallisen hapenkulutuksen suhteena joko teoreettiseen hapenkulutukseen (ThOD) tai kemialliseen hapenkulutukseen (COD), ja se ilmoitetaan prosenttiosuutena (ks. 36 kohta).
|
|
36.
|
Laske biohajoavuusarvot jokaista näytteenottokertaa kohti sekä testi- että vertailuaineille käyttämällä jompaakumpaa seuraavista yhtälöistä:

jossa
|
ThOD
|
=
|
teoreettinen hapenkulutus (laskenta, ks. lisäys 3)
|
|
COD
|
=
|
kemiallinen hapenkulutus.
|
Huomautus: Joskus näillä kahdella laskentatavalla (prosenttiosuus ThOD:sta tai COD:sta) ei saada samoja tuloksia. Siksi on parempi kyttää ThOD:ta, koska jotkin aineet eivät hapetu kokonaan COD-testissä.
|
|
37.
|
Kuvaa hajoamisen etenemistä graafisesti kaavakuvassa (katso esimerkki kohdasta ’Validiteetti ja tulosten tulkinta’). Jos tietoja on riittävästi, laske biohajoamiskäyrästä lag-vaihe (tL) ja aika, joka kului 50 prosentin poistuman saavuttamiseen lag-vaiheen lopusta alkaen (t50).
|
|
38.
|
Jos käytetään ominaisanalyysia (valinnainen), ilmoita primaarisen hajoamisen prosenttiosuus prosenttiosuutena aineen ominaispoistumasta testin aikana (korjattu analyyttisten nollakokeiden osalta).
|
Testiraportti
|
39.
|
Testiraportissa on esitettävä seuraavat tiedot:
|
|
Testiaine:
|
—
|
fysikaalinen olomuoto ja fysikaalis-kemialliset ominaisuudet, jos niillä on merkitystä
|
|
|
|
Testiolosuhteet:
|
—
|
näytteenottopaikan sijainti ja kuvaus: saaste- ja ravinnetila (pesäkeluku sekä nitraatti, ammonium ja fosfaatti, jos tarpeen)
|
|
—
|
näytteen ominaisuudet (näytteenottopäivä ja -syvyys, ulkonäkö, lämpötila, suolaisuus, DOC (valinnainen), näytteenoton ja testissä käyttämisen välinen viive
|
|
—
|
meriveden (mahdollisessa) vanhentamisessa käytetty menetelmä
|
|
—
|
meriveden esikäsittelyssä (suodatus/sedimentointi) käytetty menetelmä
|
|
—
|
COD-määrityksessä (jos tehty) käytetty menetelmä
|
|
—
|
happimittauksissa käytetty menetelmä
|
|
—
|
dispersiomenetelmä aineille, jotka liukenevat huonosti testiolosuhteissa
|
|
—
|
meriveden heterotrofien lukumäärän määrittämisessä käytetty menetelmä (pesäkeluvun laskeminen tai jokin muu menetelmä)
|
|
—
|
meriveden DOC-arvon määrittämisessä käytetty menetelmä (valinnainen)
|
|
—
|
ominaisanalyysissa käytetty menetelmä (valinnainen)
|
|
—
|
muut meriveden luonnehtimisessa käytetyt valinnaiset menetelmät (ATP-mittaukset jne.).
|
|
|
|
Tulokset:
|
—
|
tietolomakkeella (liitteenä, lisäys 5) raportoidut analyysitiedot
|
|
—
|
hajoamistestin eteneminen esitetään graafisesti kaavakuvassa, jossa näkyy lag-vaihe (tL), kulmakerroin ja aika (lag-vaiheen lopusta alkaen), joka kului siihen, että testiaineen hapettumisen aiheuttamasta lopullisesta hapenkulutuksesta oli saavutettu 50 prosenttia (t50). Lag-vaihe voidaan arvioida graafisesti liitteenä olevassa kuvassa esitetyn mukaisesti, tai se voidaan ilmoittaa helpommin aikana, joka kului 10 prosentin hajoamisen saavuttamiseen.
|
|
—
|
hajoamisen prosenttiosuus 28 päivän jälkeen mitattuna.
|
|
|
Validiteetti ja tulosten tulkinta
|
40.
|
Nollanäytteen respiraatio saa olla enintään 30 prosenttia testipullossa olevasta hapesta. Jos tätä kriteeriä ei voida täyttää käyttämällä tuoretta kerättyä merivettä, merivesi on vanhennettava (stabiloitava) ennen käyttöä.
|
|
41.
|
On otettava huomioon myös se mahdollisuus, että typpeä sisältävät aineet saattavat vaikuttaa tuloksiin.
|
|
42.
|
Vertailuaineista natriumbentsoaatti ja aniliini saatujen tulosten tulisi olla verrattavissa rengastestissä (3) saatuihin tuloksiin (9 kohta). Jos vertailuaineista saadut tulokset ovat epätyypillisiä, testi on toistettava käyttämällä toista merivesinäytettä.
|
|
43.
|
Testiaineen voidaan katsoa olevan bakteereita inhiboiva (käytetyllä pitoisuudella), jos vertailu- ja testiaineiden seoksen BOD-arvo on pienempi kuin näiden kahden aineen erillisten liuosten BOD-arvojen summa.
|
|
44.
|
Koska käytetyt testipitoisuudet ovat varsin suuria verrattuna useimpiin luonnollisiin järjestelmiin (ja koska testiaineiden ja muiden hiililähteiden pitoisuuksien välinen suhde on siksi epäsuotuisa), menetelmää on pidettävä alustavana testinä, jota voidaan käyttää sen osoittamiseksi, onko aine nopeasti biohajoava vai ei. Toisaalta jos testin tulokseksi saadaan pieniä arvoja, se ei välttämättä tarkoita, etteikö testiaine olisi biohajoava meriympäristössä. Sen sijaan tällainen tulos viittaa siihen, että asian selvittämiseksi tarvitaan lisää tutkimuksia.
Jäljempänä olevassa kuvassa on esimerkki teoreettisesta hajoamiskokeesta, joka edustaa mahdollista tapaa arvioida arvot tL (’lag-vaiheen’ pituus) ja t50 eli aikaväli (alkaa ajasta tL), joka tarvitaan siihen, että testiaineen hapettumisen aiheuttamasta lopullisesta hapenkulutuksesta saavutetaan 50 prosenttia.

|
LÄHDEKIRJALLISUUS
|
(1)
|
de Kreuk J.F. and Hanstveit A.O. (1981). Determination of the biodegradability of the organic fraction of chemical wastes. Chemosphere, 10 (6); 561–573.
|
|
(2)
|
Tämän liitteen luku C.4-B: Biohajoavuuden määritys, OECD:n muunnellun seulontakokeen osa III.
|
|
(3)
|
Nyholm N. and Kristensen P. (1987). Screening Test Methods for Assessment of Biodegradability of Chemical Substances in Seawater. Final Report of the ring test programme 1984–1985, March 1987, Commission of the European Communities.
|
|
(4)
|
Tämän liitteen luku C.11. Biologinen hajoaminen – aktiivilietteen soluhengityksen inhibitiotesti.
|
|
(5)
|
Tämän liitteen luku C.4-E: Biohajoavuuden määritys, osa VI, suljetun pullon menetelmä.
|
Lisäys 1
Orgaanisen hiilen määritys merivedestä
RAVISTUSPULLOMENETELMÄ
Jotta vesinäytteestä voidaan määrittää orgaanisen hiilen pitoisuus, näytteen orgaaniset yhdisteet hapetetaan hiilidioksidiksi käyttämällä yleensä jotakin kolmesta seuraavasta tekniikasta:
|
—
|
märkähapetus persulfaatilla/UV-säteilytyksellä
|
|
—
|
märkähapetus persulfaatilla / suuremmassa lämpötilassa (116–130 °C)
|
Muodostunut CO2 kvantifioidaan infrapunaspektrometrialla tai titrimetrialla. Vaihtoehtoisesti CO2 pelkistetään metaaniksi, joka kvantifioidaan liekki-ionisaatioilmaisimella.
Persulfaatti/UV-menetelmää käytetään tavallisesti analysoitaessa ’puhdasta’ vettä, jonka hiukkasainepitoisuus on pieni. Kahta jälkimmäistä menetelmää voidaan soveltaa useimpiin vesinäytetyyppeihin. Persulfaatti / suurempi lämpötila -menetelmä on sopivin menetelmä näytteisiin, joiden pitoisuudet ovat pienet, ja polttamistekniikkaa voidaan soveltaa näytteisiin, joiden haihtumattoman orgaanisen hiilen (NVOC) -pitoisuus on selvästi alle 1 mg hiiltä litrassa.
Häiriöt
Kaikkiin kolmeen menetelmään vaikuttaa näytteessä olevan epäorgaanisen hiilen eliminoituminen tai kompensoituminen. CO2:n puhdistaminen happamoitetusta näytteestä on yleisimmin käytetty menetelmä epäorgaanisen hiilen eliminoimiseksi, joskin se aiheuttaa haihtuvien orgaanisten yhdisteiden häviämistä (1). Epäorgaanisen hiilen täydellinen eliminoituminen tai kompensoituminen on varmistettava jokaisesta näytematriisista, ja haihtuva orgaaninen hiili on määritettävä haihtumattoman orgaanisen hiilen lisäksi näytetyypin mukaisesti.
Suuret kloridipitoisuudet vähentävät hapetustehoa, kun käytetään persulfaatti/UV-menetelmää (2). Tämä häiriö voidaan kuitenkin poistaa käyttämällä hapetusreagenssia, jota on muunneltu lisäämällä elohopea(II)nitraattia. Kunkin klorideja sisältävän näytetyypin arvioinnissa on suositeltavaa käyttää suurinta mahdollista (siedettyä) näytetilavuutta. Polttomenetelmällä analysoidun näytteen suuret suolapitoisuudet voivat aiheuttaa sen, että katalyyttiin muodostuu suolapinnoite ja että polttoputki syöpyy liiallisesti. Varotoimia on noudatettava valmistajan käsikirjan mukaisesti.
Hyvin sameat näytteet ja hiukkasainesta sisältävät näytteet saattavat hapettua epätäydellisesti persulfaatti/UV-menetelmää käytettäessä.
Esimerkki sopivasta menetelmästä
Haihtumaton orgaaninen hiili määritetään hapettamalla näyte persulfaatti/UV-säteilytysmenetelmällä, ja tästä muodostunut CO2 kvantifioidaan ei-dispersiivisellä infrapunaspektrometrialla.
Hapetusreagenssi muunnetaan kirjallisuusviitteessä (2) esitetyn mukaisesti, kuten valmistajan käsikirjassa on kuvattu:
|
a)
|
8,2 g HgCl2:ta ja 9,6 g Hg(NO3)2. H2O:ta liuotetaan muutamaan sataan millilitraan reagenssivettä, jonka hiilipitoisuus on pieni.
|
|
b)
|
20 g K2S2O8:aa liuotetaan elohopeasuolaliuokseen.
|
|
c)
|
Seokseen lisätään 5 ml HNO3:a (kons.).
|
|
d)
|
Reagenssi laimennetaan 1 000 ml:ksi.
|
Kloridin aiheuttama häiriö poistetaan käyttämällä 40 μl:n näytetilavuutta 10-prosenttiselle kloridille ja 200 μl:n näytetilavuutta 1,9-prosenttiselle kloridille. Näytteet, joiden kloridipitoisuudet ovat suuria, ja/tai suuremmat näytemäärät voidaan analysoida tällä menetelmällä, kunhan kloridin kertyminen hapetusastiaan on estetty. Myös haihtuvan orgaanisen hiilen määritys voidaan tehdä, jos sillä on merkitystä kyseisen näytetyypin kannalta.
LÄHDELUETTELO
|
(1)
|
ISO, Water quality determination of total organic carbon. Draft International Standard ISO/DIS 8245, January 16, 1986.
|
|
(2)
|
American Public Health Association, Standard Methods for the Estimation of Water and Wastewater. American Water Works Association & Water Pollution Control Federation, 16th edition, 1985.
Myös hyödyllinen lähde (kuvaus autoanalyysijärjestelmästä):
|
|
(3)
|
Schreurs W. (1978). An automated colorimetric method for the determination of dissolved organic carbon in seawater by UV destruction. Hydrobiological Bulletin 12, 137–142.
|
Lisäys 2
Biohajoavuus merivedessä
RAVISTUSPULLOMENETELMÄ
TIETOLOMAKE
|
2.
|
TESTIN ALOITUSPÄIVÄMÄÄRÄ:
|
|
3.
|
TESTIAINE:
Nimi:
|
Varastoliuoksen pitoisuus:
|
mg/l aineena
|
|
Alkupitoisuus väliaineessa, to:
|
mg/l aineena
|
|
:
|
mg DOC/l
|
|
|
4.
|
MERIVESI:
Lähteet:
Keräyspäivä:
Näytteenottosyvyys:
Ulkonäkö keruuhetkellä (sameus jne.):
|
Suolaisuus keruuhetkellä:
|
‰
|
|
Lämpötila keruuhetkellä:
|
°C
|
|
DOC ’x’ tuntia keruun jälkeen:
|
mg/l
|
Esikäsittely ennen testausta (esimerkiksi suodatus, sedimentointi, vanhentaminen jne.):
|
Pesäkeluku
|
|
pesäkettä/ml
|
|
|
|
pesäkettä/ml
|
|
Muut ominaisuudet:
|
|
|
|
|
5.
|
HIILIMÄÄRITYKSET:
Hiilianalysaattori:
|
|
Pullon nro:
|
|
DOC n päivän kuluttua (mg/l)
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
Testi: ravinnerikastettu merivesi, jossa testiainetta
|
1
|
a1
|
|
|
|
|
|
|
a2
|
|
|
|
|
|
|
keskiarvo, Ca(t)
|
|
|
|
|
|
|
2
|
b1
|
|
|
|
|
|
|
b2
|
|
|
|
|
|
|
keskiarvo, Cb(t)
|
|
|
|
|
|
|
Nollanäyte: ravinnerikastettu merivesi, ilman testiainetta
|
1
|
c1
|
|
|
|
|
|
|
c2
|
|
|
|
|
|
|
keskiarvo, Cc(t)
|
|
|
|
|
|
|
2
|
d1
|
|
|
|
|
|
|
d2
|
|
|
|
|
|
|
keskiarvo, Cd(t)
|
|
|
|
|
|
| keskiarvo,

|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.
|
RAAKATIETOJEN ARVIOINTI:
|
Pullon nro:
|
Tulosten laskeminen
|
Prosentuaalinen hajoaminen n päivän jälkeen
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
1
|

|
0
|
|
|
|
|
|
2
|
|
0
|
|
|
|
|
|
Keskiarvo (34)
|

|
0
|
|
|
|
|
|
Huomautus:
|
Arvioitaessa hajoamista ominaisanalyysilla sekä vertailuaineiden ja myrkyllisyyskontrollien osalta tiedot voidaan esittää samalla tavoin kuin tässä.
|
|
|
7.
|
ABIOOTTINEN HAJOAVUUS (valinnainen)
|
|
loppupiste
|
|
0
|
t
|
|
Steriilin vertailunäytteen DOC-pitoisuus (mg/l)
|
Cs(o)
|
Cs(t)
|
|
Lisäys 3
Teoreettisen biokemiallisen hapenkulutuksen laskeminen
SULJETTU PULLO -MENETELMÄ
Aineen CcHhClclNnNanaOoPpSs, jonka molekyylipaino (MW) on x, ThOD-arvo lasketaan seuraavasti:
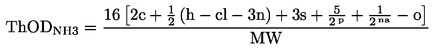
Tässä laskelmassa oletetaan, että C mineralisoituu CO2:ksi, H mineralisoituu H2O:ksi, P P2O5:ksi ja Na Na2O:ksi. Halogeeni eliminoituu vetyhalidina ja typpi ammoniakkina.
Esimerkki:
Glukoosi C6H12O6, MW = 180

Muiden kuin alkalimetallien suolojen molekyylipainot lasketaan olettaen, että suolat ovat hydrolysoituneet.
Rikin oletetaan hapettuvan siten, että sen hapetusluvuksi tulee + 6.
Esimerkki:
Natrium-n-dodekyylibentseenisulfonaatti C18H29SO3Na, MW = 348

Typpeä sisältävien aineiden yhteydessä typpi voi eliminoitua ammoniakiksi, nitriitiksi tai nitraatiksi erilaisen teoreettisen biokemiallisen hapenkulutuksen mukaan.


Oletetaan, että sekundäärisen amiinin tapauksessa analyysissa on havaittu täydellinen nitrifikaatio:
(C12H25)2 NH, MW = 353

Lisäys 4

Lisäys 5
Biohajoavuus merivedessä
SULJETTU PULLO -MENETELMÄ
TIETOLOMAKE
|
2.
|
TESTIN ALOITUSPÄIVÄMÄÄRÄ:
|
|
3.
|
TESTIAINE:
Nimi:
|
Varastoliuoksen pitoisuus:
|
mg/l
|
|
Alkuperäinen pit. merivesiväliaineessa:
|
mg/l
|
|
ThOD tai COD:
|
mg O2/mg testiainetta
|
|
|
4.
|
MERIVESI:
Lähteet:
Keräyspäivä:
Näytteenottosyvyys:
Ulkonäkö keruuhetkellä (sameus jne.):
|
Suolaisuus keruuhetkellä:
|
‰
|
|
Lämpötila keruuhetkellä:
|
°C
|
|
DOC ’x’ tuntia keruun jälkeen:
|
mg/l
|
Esikäsittely ennen testausta (esimerkiksi suodatus, sedimentointi, vanhentaminen jne.)
|
Pesäkeluku
|
|
pesäkettä/ml
|
|
|
|
pesäkettä/ml
|
|
Muut ominaisuudet:
|
|
|
|
|
5.
|
TESTIVÄLIAINE:
|
Lämpötila ilmastuksen jälkeen:
|
°C
|
|
O2-pitoisuus ilmastuksen ja seisottamisen jälkeen ennen testin alkamista:
|
mg O2/l
|
|
|
6.
|
DO-MÄÄRITYS:
Menetelmä: Winkler/elektrodi
|
|
Pullon nro:
|
|
mg O2/l n päivän kuluttua
|
|
0
|
5
|
15
|
28
|
|
Testi: Ravinnerikastettu merivesi, jossa on testiainetta
|
1
|
a1
|
|
|
|
|
|
2
|
a2
|
|
|
|
|
|
Testin keskiarvo
|

|
|
|
|
|
|
Nollanäyte: Ravinne-rikastettu merivesi ilman testiainetta
|
1
|
c1
|
|
|
|
|
|
2
|
c2
|
|
|
|
|
|
Nollanäytteen keskiarvo
|

|
|
|
|
|
Huomautus: Vertailuaineiden ja myrkyllisyyskontrollien osalta tiedot voidaan esittää samalla tavoin kuin tässä.
|
|
7.
|
DO-VÄHENNYS: PROSENTUAALINEN HAJOAMINEN ( % D):
|
|
DO-vähennys n päivän kuluttua
|
|
5
|
15
|
28
|
|
(mb
– mt
) (35)
|
|
|
|
|

|
|
|
|
|
C.43. ORGAANISTEN AINEIDEN ANAEROBINEN BIOHAJOAVUUS MÄDÄTYSLIETTEESSÄ: MITTAUSKOHTEENA KAASUNTUOTANTO
JOHDANTO
|
1.
|
Tämä testimenetelmä vastaa OECD:n testiohjetta (TG) nro 311 (2006). On olemassa koko joukko seulontatestejä, joilla arvioidaan orgaanisten aineiden aerobista biohajoavuutta (testimenetelmät C.4, C.9, C.10 ja C.11 (1) ja OECD:n testiohje (TG) nro 302C (2)). Näiden menetelmien soveltamisesta saatuja tuloksia on käytetty menestyksekkäästi ennustettaessa aineiden käyttäytymistä aerobisessa ympäristössä ja etenkin jätevedenkäsittelyn aerobisissa vaiheissa. Myös erisuuruisia määriä veteen liukenemattomia aineita sekä sellaisia aineita, jotka adsorboituvat jäteveden kiinteään ainekseen, käsitellään aerobisesti, koska niitä on selkeytetyssä jätevedessä. Suurempia fraktioita näistä aineista sitoutuu kuitenkin selkeytettyyn lietteeseen, joka erotetaan raakajätevedestä selkeytysaltaissa, ennen kuin selkeytetty tai supernatantti jätevesi käsitellään aerobisesti. Liete, joka sisältää joitakin liukenevia aineita huokosnesteessä, ohjataan sen jälkeen lämmitettyyn mädätyslaitokseen anaerobista käsittelyä varten. Tällä hetkellä ei ole testejä, joilla arvioidaan anaerobista biohajoavuutta anaerobisissa mädätyslaitoksissa, ja tämän testin tarkoituksena on täyttää tämä aukko. Se ei ole välttämättä sovellettavissa ympäristön muihin anaerobisiin osa-alueisiin.
|
|
2.
|
Respirometrisia tekniikoita, joilla mitataan tuotetun kaasun, pääasiassa metaanin (CH4) ja hiilidioksidin (CO2), määriä anaerobisissa olosuhteissa, on käytetty menestyksekkäästi anaerobisen biohajoavuuden arvioinnissa. Birch ja muut (3) arvioivat nämä menetelmät ja totesivat, että Sheltonin ja Tiedjen (4) työ, joka perustui aiempiin tutkimuksiin (5)(6)(7), oli kattavin. Tällä menetelmällä (4), jonka kehittämistä muut jatkoivat (8) ja josta on tullut amerikkalainen standardi (9)(10), ei kuitenkaan ratkaistu ongelmia, jotka liittyivät CO2:n ja CH4:n erilaisiin liukoisuuksiin testiväliaineessa ja testiaineen teoreettisen kaasuntuotannon laskemiseen. ECETOCin raportissa (3) suositeltiin, että lisäksi mitataan supernatanttinesteen liuenneen epäorgaanisen hiilen pitoisuus. Tämän ansiosta tekniikkaa voitiin alkaa soveltaa laajemmin. ECETOCin menetelmä kalibroitiin kansainvälisesti (tai sille tehtiin rengastesti), ja siitä tuli ISO-standardi, ISO 11734 (11).
|
|
3.
|
Tässä ISO 11734 -standardiin (11) perustuvassa testimenetelmässä kuvataan seulontamenetelmä, jolla voidaan arvioida orgaanisten aineiden mahdollista anaerobista biohajoavuutta tietyissä olosuhteissa (ts. anaerobisessa mädätyslaitteistossa tiettynä aikana, kun mikro-organismien pitoisuus vaihtelee). Koska testissä käytetään laimennettua lietettä, jossa on melko suuri pitoisuus testiainetta, ja koska testi kestää yleensä pidempään kuin mikä on lietteen retentioaika anaerobisissa mädätyslaitteissa, testin olosuhteet eivät välttämättä vastaa anaerobisten mädätyslaitteiden olosuhteita, eikä sitä voida soveltaa orgaanisten aineiden anaerobisen biohajoavuuden arviointiin, kun ympäristöolosuhteet ovat erilaiset. Liete altistetaan testiaineelle jopa 60 päivän ajaksi, mikä on pitempi aika kuin lietteen normaali retentioaika (25–30 päivää) anaerobisissa mädätyslaitteistoissa, joskin teollisuudessa retentioajat voivat olla paljon pidemmät. Tämän testin tulosten perusteella ei voida tehdä yhtä vakuuttavia ennusteita kuin aerobisen biohajoavuuden yhteydessä: testiaineiden käyttäytymisestä ’nopeissa’ aerobisissa testeissä sekä simulaatiotesteissä ja aerobisessa ympäristössä kertyneitä todisteita on riittävästi, jotta voidaan luotettavasti todeta, että yhteys on olemassa. Samankaltaisia todisteita anaerobisesta ympäristöstä on sen sijaan vähän. Anaerobisen biohajoavuuden voidaan olettaa olevan täydellistä, jos teoreettisesta kaasuntuotannosta saavutetaan 75–80 prosenttia. Näissä testeissä käytetyt suuret aineen ja biomassan väliset suhteet tarkoittavat, että aine, joka läpäisee testin, todennäköisesti hajoaa anaerobisessa mädätyslaitteistossa. Lisäksi aineet, joita ei onnistuta muuttamaan kaasuksi testissä, eivät välttämättä kestä, kun aineen ja biomassan suhteet ovat ympäristön kannalta realistisemmat. Myös muita sellaisia anaerobisia reaktioita tapahtuu, joissa aineet hajoavat ainakin osittain (esimerkiksi deklorinaatiossa), mutta tällä testillä näitä reaktioita ei havaita. Aineen häviämistä voidaan kuitenkin seurata soveltamalla tiettyjä analyysimenetelmiä testiaineen määrittämiseen (ks. 6, 30, 44 ja 53 kohta).
|
TESTIN PERIAATE
|
4.
|
Pesty mädätetty liete (36), joka sisältää pieniä (< 10 mg/l) pitoisuuksia epäorgaanista hiiltä, laimennetaan noin kymmenkertaisesti, kunnes kokonaiskiintoainepitoisuus on 1–3 g/l. Sen jälkeen lietettä inkuboidaan sinetöidyissä astioissa, joissa testiainetta on 20–100 mg C/l, 35 °C:ssa (± 2 °C) enintään 60 päivän ajan. Lietteen aktiivisuuden mittaamisessa on käytettävä rinnakkaisia nollakontrolleja, joiden väliaineessa on lietesiirrosainetta mutta ei testiainetta.
|
|
5.
|
Astioista mitataan kaasutilan paineen lisääntyminen, joka johtuu hiilidioksidin ja metaanin tuotannosta. Tuotetusta CO2:sta liukenee hyvin paljon nestefaasiin, tai se muuttuu karbonaatiksi tai vetykarbonaatiksi testin olosuhteissa. Tämä epäorgaaninen hiili mitataan testin lopussa.
|
|
6.
|
Testiaineen biohajoavuudesta syntyvän hiilen (epäorgaaninen ja metaani) määrä lasketaan nestefaasin nettokaasuntuotannon ja epäorgaanisen hiilen nettomuodostumisen perusteella nollakontrolliarvojen lisäksi. Biohajoavuuden laajuus lasketaan tuotetun epäorgaanisen hiilen ja metaanihiilen kokonaispitoisuuden perusteella prosenttiosuutena testiaineena lisätyn hiilen mitatusta tai lasketusta määrästä. Biohajoavuuden etenemistä voidaan seurata tekemällä välimittauksia vain kaasuntuotannosta. Lisäksi primaarinen biohajoavuus voidaan määrittää ominaisanalyyseilla testin alussa ja lopussa.
|
TESTIAINETTA KOSKEVIA TIETOJA
|
7.
|
Testiaineen puhtauden, vesiliukoisuuden sekä haihtuvuus- ja adsorptio-ominaisuuksien on oltava tiedossa, jotta tulokset voidaan tulkita oikein. Testiaineen orgaanisen hiilen pitoisuus (painoprosenttina) on tiedettävä joko sen kemiallisen rakenteen tai mittauksen perusteella. Haihtuvien testiaineiden osalta mitatusta tai lasketusta Henryn lain vakiosta on apua päätettäessä, voidaanko testiä soveltaa tietyssä tapauksessa. Tiedot testiaineen myrkyllisyydestä anaerobisille bakteereille ovat hyödyllisiä, kun valitaan sopivaa testipitoisuutta ja kun tulkitaan tuloksia, joiden mukaan biohajoavuus on heikko. On suositeltavaa käyttää myös inhibitiokontrollia, ellei tiedetä, ettei testiaine inhiboi anaerobisten mikrobien toimintaa (ks. 21 kohta ja ISO 13641-1 (12)).
|
TESTIMENETELMÄN SOVELLETTAVUUS
|
8.
|
Testimenetelmää voidaan soveltaa vesiliukoisiin aineisiin. Sitä voidaan soveltaa myös heikosti liukeneviin ja liukenemattomiin aineisiin, kunhan käytetään tarkan annostelun takaavaa menetelmää (ks. esimerkiksi ISO 10634 (13)). Haihtuvien aineiden osalta päätös on tehtävä yleensä tapauskohtaisesti. Tiettyihin toimiin on kenties ryhdyttävä esimerkiksi siksi, ettei kaasua vapaudu testin aikana.
|
VERTAILUAINEET
|
9.
|
Menetelmän tarkistamiseksi vertailuainetta testataan valmistamalla asianmukaiset astiat normaalien testiajojen rinnalle. Vertailuaineina voidaan käyttää esimerkiksi fenolia, natriumbentsoaattia ja polyetyleeniglykoli 400:aa, ja niiden hajoavuuden oletetaan olevan yli 60 prosenttia teoreettisesta kaasuntuotannosta (ts. metaani ja epäorgaaninen hiili) 60 päivän aikana (3) (14)).
|
TESTITULOSTEN TOISTETTAVUUS
|
10.
|
Kansainvälisessä rengastestissä (14) kaasunpaineen mittausten (kolmet astiat) toistettavuus oli hyvä. Suhteellinen keskihajonta (variaatiokerroin, COV) oli valtaosin alle 20 prosenttia, joskin tämä arvo suureni usein yli 20 prosenttiin myrkyllisten aineiden yhteydessä tai 60 päivän inkubaatiojakson loppua kohti. Suurempaa hajontaa tavattiin myös tilavuudeltaan alle 150 ml:n astioiden yhteydessä. Testiväliaineiden lopulliset pH-arvot olivat välillä 6,5–7,0.
|
|
11.
|
Rengastestissä saatiin seuraavassa taulukossa esitetyt tulokset.
|
Testiaine
|
Koko aineisto
n1
|
Keskim. hajoavuus
(koko aineistosta)
(%)
|
Suhteellinen keskihajonta
(koko aineistosta)
(%)
|
Validi aineisto
n2
|
Keskim. hajoavuus
(validista aineistosta)
(%)
|
Suhteell. keskihajonta
(validista aineistos-ta)
(%)
|
Aineisto > 60 % hajoavuus valideissa testeissä
n3
|
|
Palmitiinihappo
|
36
|
68,7 ± 30,7
|
45
|
27
|
72,2 ± 18,8
|
26
|
19 = 70 % (37)
|
|
Polyeteeniglykoli 400
|
38
|
79,8 ± 28,0
|
35
|
29
|
77,7 ± 17,8
|
23
|
24 = 83 % (37)
|
|
|
12.
|
Kaikkien palmitiinihaposta ja polyeteeniglykoli 400:sta saatujen arvojen keskiarvon variaatiokertoimet olivat jopa 45 prosenttia (n = 36) ja 3 prosenttia (n = 38). Kun laskelmista poistettiin arvot, jotka olivat < 40 prosenttia ja > 100 prosenttia (edellisen arveltiin johtuvan suboptimaalisista olosuhteista, jälkimmäisen tuntemattomista syistä), variaatiokertoimet pienenivät 26 prosenttiin ja 23 prosenttiin. ’Validien’ arvojen (jolloin hajoavuus oli vähintään 60 prosenttia) osuus oli palmitiinihapon osalta 70 prosenttia ja polyeteeniglykoli 400:n osalta 83 prosenttia. DIC-mittauksista johdetut biohajoavuuden prosenttiosuudet olivat melko pienet mutta vaihtelevat. Palmitiinihapon osalta vaihteluväli oli 0–35 prosenttia, keskiarvo 12 prosenttia ja variaatiokerroin 92 prosenttia. Polyeteeniglykoli 400:n osalta vaihteluväli oli 0–40 prosenttia, keskiarvo 24 prosenttia ja variaatiokerroin 54 prosenttia.
|
TESTIMENETELMÄN KUVAUS
Laitteisto
|
13.
|
Testissä tarvitaan tavallinen laboratoriolaitteisto ja seuraavat välineet:
|
a.
|
Inkubaattori – kipinänkestävä, lämpötilaksi säädetty 35 °C ± 2 °C.
|
|
b.
|
Paineenkestäviä lasisia testiastioita, joiden nimelliskoko on sopiva (38) ja joista jokaisessa on kaasutiivis tulppa, joka kestää noin kahden baarin paineen. Kaasutilan tilavuuden tulisi olla noin 10–30 prosenttia kokonaistilavuudesta. Jos biokaasua vapautetaan säännöllisesti, noin 10 prosentin kaasutilan tilavuus on sopiva, mutta jos kaasua vapautetaan vasta testin lopussa, 30 prosentin tilavuus on sopiva. Jos painetta lasketaan ulos jokaisella näytteenottokerralla, testissä suositellaan käytettäväksi lasisia seerumipulloja, joiden nimellistilavuus on 125 ml ja kokonaistilavuus noin 160 ml ja jotka voidaan sulkea seerumitulpalla (39) ja reunatuilla alumiinirenkailla.
|
|
c.
|
Paineenmittauslaite (40), jolla voi sekä mitata että ilmata tuotettua kaasua; esimerkiksi kädessä pidettävä tarkkuuspainemittari, johon on liitetty sopiva injektioneula. Kaasutiiviin kolmitieventtiilin avulla voidaan poistaa liiallista painetta (lisäys 1). Paineanturin putken ja venttiilin sisäisen tilavuuden tulee olla mahdollisimman pieni, jotta virheet, jotka aiheutuvat laitteiston tilavuuden huomiotta jättämisestä, ovat merkityksettömiä.
Huomio – Painelukemia käytetään suoraan kaasutilassa tuotetun hiilen määrän laskemiseksi (42–44 kohta). Vaihtoehtoisesti painelukemat voidaan muuntaa tuotetun kaasun tilavuuksiksi (35 °C:ssa, ilmanpaine) käyttämällä muuntokaavaa. Kaava muodostuu tiedoista, jotka saadaan injektoimalla tietty tilavuus typpikaasua testiastioihin (esimerkiksi seerumipulloihin) lämpötilassa 35 ° +/– 2 °C ja kirjaamalla muistiin tulokseksi saadut tasapainottuneet painelukemat (ks. lisäys 2). Laskentatapa kuvataan 44 kohdassa olevassa huomautuksessa.
Varoitus – Ole varovainen, jos käytät mikroruiskuja, jotta et saa neulanpistovammoja.
|
|
d.
|
Hiilianalysaattori, jolla voidaan määrittää epäorgaaninen hiili suoraan vaihteluvälillä 1–200 mg/l.
|
|
e.
|
Ruiskuja, joiden tarkkuus on suuri, kaasu- ja nestenäytteitä varten
|
|
f.
|
Magneettisekoittimia ja -sauvoja (valinnainen).
|
|
g.
|
Hansikaskaappi (suositeltava).
|
|
Reagenssit
|
14.
|
Käytä pelkästään analyysilaatuisia reagensseja.
|
Vesi
|
15.
|
Tislattu tai deionisoitu vesi (josta on poistettu happi syöttämällä siihen typpikaasua ja joka sisältää vähemmän kuin 5 μl/l happea), joka sisältää liuennutta orgaanista hiiltä vähemmän kuin 2 mg/l.
|
Testiviljelyaine
|
16.
|
Valmista laimennusväliaine, joka sisältää ilmoitetut määrät seuraavia ainesosia:
|
Vedetön kaliumdivetyfosfaatti (KH2PO4)
|
0,27 g
|
|
Dinatriumvetyfosfaattidodekahydraatti (Na2HPO4 · 12H2O))
|
1,12 g
|
|
Ammoniumkloridi (NH4Cl)
|
0,53 g
|
|
Kalsiumklorididihydraatti (CaCl2 · 2H2O)
|
0,075 g
|
|
Magnesiumkloridiheksahydraatti (MgCl2 · 6H2O)
|
0,10 g
|
|
Rauta(II)kloriditetrahydraatti (FeCl2 · 4H2O)
|
0,02 g
|
|
Resatsuriini (happi-indikaattori)
|
0,001g
|
|
Natriumsulfidinonahydraatti (Na2S · 9H2O)
|
0,10 g
|
|
Hivenaineiden varastoliuokset (valinnainen, 18 kohta)
|
10 ml
|
|
Lisää hapetonta vettä (15 kohta)
|
yhteen litraan saakka
|
Huomautus: Testissä tulisi käyttää tuoretta natriumsulfidia, tai se on pestävä ja kuivattava ennen käyttöä riittävän pelkistyskyvyn varmistamiseksi. Testi voidaan tehdä käyttämättä hansikaskaappia (ks. 26 kohta). Tässä tapauksessa natriumsulfidin lopullinen pitoisuus väliaineessa tulee suurentaa 0,20 grammaan Na2S · 9H2O:ta litrassa. Natriumsulfidi voidaan lisätä myös asianmukaisesta anaerobisesta varastoliuoksesta suljettujen testiastioiden tulpan kautta. Näin pienennetään hapettumisen riskiä. Natriumsulfidin tilalla voidaan käyttää titaani(III)sitraattia, joka lisätään suljettujen testiastioiden tulpan kautta lopullisena pitoisuutena, joka on 0,8–1,0 mmol/l. Titaani(III)sitraatti on erittäin tehokas pelkistävä aine, jonka myrkyllisyys on pieni, ja sitä valmistetaan seuraavasti: Liuota 2,94 g trinatriumsitraattidihydraattia 50 ml:aan hapetonta vettä (jotta saat liuoksen, jonka pitoisuus on 200 mmol/l) ja lisää 5 ml 15-prosenttista (p/p) titaani(III)kloridiliuosta. Neutraloi liuos pH-arvoon 7 ± 0,2 mineraaliemäksellä ja laita se sopivaan astiaan typpivirtauksen alla. Tässä varastoliuoksessa titaani(III)sitraatin pitoisuus on 164 mmol/l.
|
|
17.
|
Sekoita testiväliaineen muut ainesosat paitsi pelkistävä aine (natriumsulfidititaanisitraatti) ja syötä liuokseen typpikaasua noin 20 minuutin ajan hieman ennen käyttöä hapen poistamiseksi. Lisää sen jälkeen tuoreeseen liuokseen tarkoituksenmukainen määrä pelkistävää ainetta (valmistettu hapettomassa vedessä) hieman ennen väliaineen käyttöä. Säädä väliaineen pH tarvittaessa laimennetulla mineraalihapolla tai emäksellä arvoon 7 ± 0,2.
|
Hivenaineiden varastoliuos (valinnainen)
|
18.
|
On suositeltavaa, että testiväliaine sisältäisi seuraavia hivenaineita anaerobisen hajoamisprosessin edistämiseksi etenkin, jos siirrosainetta käytetään pieninä pitoisuuksina (esimerkiksi 1 g/l) (11).
|
Manganeesikloriditetrahydraatti (MnCl2 · 4H2O)
|
50 mg
|
|
Boorihappo (H3BO3)
|
5 mg
|
|
Sinkkikloridi (ZnCl2)
|
5 mg
|
|
Kupari(II)kloridi (CuCl2)
|
3 mg
|
|
Dinatriummolybdaattidihydraatti (Na2MoO4 · 2H2O)
|
1 mg
|
|
Kobolttikloridiheksahydraatti (CoCl2 · 6H2O)
|
100 mg
|
|
Nikkelikloridiheksahydraatti (NiCl2 · 6H2O)
|
10 mg
|
|
Dinatriumseleniitti (Na2SeO3)
|
5 mg
|
|
Lisää hapetonta vettä (15 kohta)
|
yhteen litraan saakka
|
|
Testiaine
|
19.
|
Lisää testiaine varastoliuoksena, suspensiona, emulsiona tai suoraan kiinteänä aineena tai nesteenä taikka lasikuitusuodattimeen absorboituna, jotta saat pitoisuuden, joka sisältää enintään 100 mg/l orgaanista hiiltä. Jos käytät varastoliuoksia, valmista siitä veden kanssa sopiva liuos (15 kohta) (josta on poistettu happi aiemmin typpikaasua syöttämällä), jonka vahvuus on sellainen, että lisätty tilavuus on vähemmän kuin viisi prosenttia reaktioseoksen kokonaistilavuudesta. Säädä varastoliuoksen pH:ksi tarvittaessa 7 ± 0,2. Katso ISO 10634 -standardista (13) veteen huonosti liukenevia testiaineita koskevia lisäohjeita. Jos käytät liuotinta, valmista lisäkontrolli, jossa liuotinta lisätään ainoastaan siirrosainetta sisältävään väliaineeseen. Sellaisten orgaanisten liuottimien, joiden tiedetään estävän metaanin tuotantoa, kuten kloroformin ja hiilitetrakloridin, käyttöä tulee välttää.
Varoitus – Käsittele varovasti myrkyllisiä testiaineita ja sellaisia aineita, joiden ominaisuudet eivät ole tiedossa.
|
Vertailuaineet
|
20.
|
Esimerkiksi natriumbentsoaatin, fenolin ja polyetyleeniglykoli 400:n kaltaisia vertailuaineita on käytetty menetelmän tarkistamisessa menestyksekkäästi, ja ne hajoavat yli 60-prosenttisesti 60 päivän aikana. Valmista valitusta vertailuaineesta varastoliuos (hapettomassa vedessä) samaan tapaan kuin testiaineesta ja säädä pH:ksi tarvittaessa 7 ± 0,2.
|
Inhibitiokontrolli (valinnainen)
|
21.
|
Jotta saadaan tietoa testiaineen myrkyllisyydestä anaerobisille mikro-organismeille ja jotta myös sopivin testipitoisuus voidaan valita, lisää testiainetta ja vertailuainetta astiaan, joka sisältää testiväliainetta (ks. 16 kohta), kumpaakin samoina pitoisuuksina kuin niitä on lisätty (ks. 19 ja 20 kohta sekä ISO 13641-1 -standardi (12)).
|
Mädätetty liete
|
22.
|
Kerää mädätettyä lietettä sellaisen jätteenkäsittelylaitoksen mädätyslaitteistosta, jossa käsitellään pääasiassa talousjätevettä. Lietettä tulee luonnehtia kattavasti, ja sen taustatiedot on raportoitava (ks. 54 kohta). Jos testissä on määrä käyttää muokattua siirrosainetta, voidaan harkita myös teollisuusjätevedenkäsittelylaitoksesta peräisin olevaa mädätettyä lietettä. Käytä mädätetyn lietteen keräämiseen leveäkaulaisia pulloja, jotka on valmistettu suurtiheyspolyeteenistä (HDPE:stä) tai vastaavasta, laajenevasta materiaalista. Täytä pullot lietteellä noin yhden cm:n päähän pullonsuusta ja sulje ne tiiviisti mieluiten varoventtiilillä. Laboratorioon kuljettamisen jälkeen kerätty liete voidaan käyttää välittömästi tai laittaa laboratoriotason mädättimeen. Vapauta liiallinen biokaasu avaamalla lietepullot varovasti. Vaihtoehtoisesti siirrosaineen lähteenä voidaan käyttää laboratoriossa kasvatettua anaerobista lietettä, mutta sen toimintakirjo on voinut heikentyä.
Varoitus – Mädätetty liete sisältää syttyviä kaasuja, joista aiheutuu tulipalo- ja räjähdysriskejä. Niissä voi olla myös patogeenisia organismeja, joten noudata asianmukaisia varotoimia lietettä käsitellessäsi. Älä kerää lietettä lasiastioihin turvallisuussyistä.
|
|
23.
|
Taustakaasun tuotannon vähentämiseksi ja nollakontrollien vaikutuksen pienentämiseksi lietteen esimädätystä on syytä harkita. Jos esimädätys on tarpeen, lietteen on annettava mädätä lisäämättä ravinteita tai substraatteja 35 °C:ssa (± 2 °C) enintään seitsemän päivän ajan. On todettu, että noin viiden päivän mittainen esimädätys vähentää kaasuntuotantoa nollanäytteessä ihanteellisesti ilman, että joko lag-vaihe tai inkubointivaihe pidentyisivät liikaa testivaiheen aikana tai että aktiivisuus vähenisi ainakaan muutaman testatun aineen osalta.
|
|
24.
|
Lietteen esialtistusta testiaineelle kannattaa harkita sellaisten aineiden yhteydessä, jotka ovat tai joiden oletetaan olevan heikosti biohajoavia, jotta saadaan paremmin mukautettu siirrosaine. Tässä tapauksessa lisää testiainetta (kun orgaanisen hiilen pitoisuus on 5–20 mg/l) mädätettyyn lietteeseen ja inkuboi sitä enintään kaksi viikkoa. Pese esialtistettu liete huolellisesti ennen käyttöä (ks. 25 kohta) ja ilmoita testiraportissa esialtistuksen olosuhteet.
|
Siirrosaine
|
25.
|
Pese liete (ks. 22–24 kohta) juuri ennen käyttöä, jotta lopullisen testisuspension epäorgaanisen hiilen pitoisuus on pienempi kuin 10 mg/l. Sentrifugoi liete suljetuissa putkissa (esimerkiksi 3 000 g, 5 min) ja poista supernatantti. Suspendoi pelletti hapettomaan väliaineeseen (16 ja 17 kohta), sentrifugoi suspensio uudelleen ja poista supernatanttineste. Jos epäorgaanisen hiilen pitoisuus ei ole pienentynyt tarpeeksi, lietteen pesumenettelyn voi toistaa enintään kaksi kertaa. Tämä ei näytä vaikuttavan mikro-organismeihin haitallisesti. Suspendoi pelletti lopuksi testiväliaineen tarvittavaan tilavuuteen ja määritä kiintoaineiden kokonaispitoisuus [esimerkiksi ISO 11923 (15)]. Testiastioiden kiintoaineiden lopullisen kokonaispitoisuuden tulisi olla 1–3 g/l (tai noin 10 prosenttia laimentamattoman mädätetyn lietteen pitoisuudesta). Tee edellä mainitut toimenpiteet siten, että liete on mahdollisimman vähän kosketuksissa happeen (käytä esimerkiksi typpi-ilmakehää).
|
TESTAUSMENETTELY
|
26.
|
Tee seuraavat alustavat toimenpiteet käyttämällä tekniikoita, joilla mädätetty liete on niin vähän kosketuksissa hapen kanssa kuin käytännöllisesti on mahdollista. Voi olla tarpeen työskennellä esimerkiksi hansikaskaapissa käyttämällä typpi-ilmakehää ja/tai puhdistaa pullot typellä (4).
|
Testin ja kontrollitestien valmistelu
|
27.
|
Valmistele ainakin kolmet testiastiat (ks. 13b kohta) testiaineelle, nollakontrolleille, vertailuaineelle, inhibitiokontrolleille (ehdollinen) ja paineensäätökammioille (valinnainen menettely) (ks. 7 ja 19–21 kohta). Voit valmistella myös ylimääräiset astiat primaarisen biohajoavuuden arviointiin, jossa käytetään testiaineen ominaisanalyyseja. Samaa nollakontrollisarjaa voidaan käyttää useille testiaineille samassa testissä, kunhan kaasutilan tilavuudet ovat yhdenmukaiset.
|
|
28.
|
Valmistele laimennettu siirrosaine ja lisää se sen jälkeen astioihin esimerkiksi leveäsuisella pipetillä. Lisää alikvootit hyvin sekoitetusta siirrosaineesta (25 kohta), jotta kiintoaineiden kokonaispitoisuus on sama kaikissa astioissa (1–3 g/l). Lisää testi- ja vertailuaineen varastoliuokset sen jälkeen, kun pH:ksi on säädetty 7 ± 0,2, jos tarpeen. Testiaine ja vertailuaine on lisättävä käyttämällä sopivinta annostelutapaa (19 kohta).
|
|
29.
|
Orgaanisen hiilen testipitoisuuden tulisi yleensä olla 20–100 mg/l (4 kohta). Jos testiaine on myrkyllinen, testipitoisuutta tulee pienentää arvoon 20 mg C/l tai vielä pienemmäksi, jos tarkoituksena on mitata vain primaarinen biohajoavuus ominaisanalyyseilla. Todettakoon, että testitulosten vaihtelu lisääntyy pienemmillä testipitoisuuksilla.
|
|
30.
|
Lisää nollanäyteastioihin se määrä kantoainetta, jonka verran testiainetta annosteltiin varastoliuoksen, suspension tai emulsion sijasta. Jos testiainetta annosteltiin lasikuitusuodattimia tai orgaanisia liuottimia käyttäen, lisää nollanäytteisiin suodatin tai se määrä liuotinta, joka on haihtunut. Valmistele testiaineesta ylimääräinen rinnakkaisnäyte pH-arvon mittaamista varten. Säädä pH:ksi 7 ± 0,2, jos tarpeen, pienellä määrällä laimennettua mineraalihappoa tai -emästä. Kaikkiin testiastioihin tulee lisätä samat määrät neutraloivia aineita. Näitä aineita ei yleensä tarvitse lisätä, koska testi- ja vertailuaineiden varastoliuosten pH on jo säädetty (ks. 19 ja 20 kohta). Jos tarkoitus on mitata primaarinen hajoavuus, pH-kontrolliastiasta tai ylimääräisestä testiastiasta on otettava asianmukainen näyte, ja testiaineen pitoisuus on mitattava ominaisanalyyseja käyttäen. Kaikkiin testiastioihin voi lisätä päällystetyn magneetin, jos reaktioseoksia täytyy sekoittaa (valinnainen).
|
|
31.
|
Varmista, että nesteen kokonaistilavuus V1 ja kaasutilan tilavuus Vh ovat samat kaikissa astioissa. Tarkista V1- ja Vh-arvot ja merkitse ne muistiin. Kukin astia on suljettava kaasutulpalla ja siirrettävä hansikaskaapista (ks. 26 kohta) inkubaattoriin (ks. 13a kohta).
|
Liukenemattomat testiaineet
|
32.
|
Lisää punnitut määrät aineita, jotka liukenevat huonosti veteen, suoraan valmisteltuihin astioihin. Kun liuottimen käyttö on tarpeen (ks. 19 kohta), siirrä testiaineliuos tai -suspensio tyhjiin astioihin. Mikäli mahdollista, haihduta liuotin syöttämällä astioihin typpikaasua ja lisää sen jälkeen muut ainesosat eli laimennettu liete (25 kohta) ja hapeton vesi tarpeen mukaan. Myös ylimääräinen liuotinkontrolli on valmisteltava (ks. 19 kohta). Lisätietoja muista menetelmistä, joilla liukenemattomia aineita voidaan lisätä, on ISO 10634 -standardissa (13). Nestemäisiä testiaineita voidaan annostella ruiskulla valmiisiin suljettuihin astioihin, jos oletetaan, että alkuperäinen pH-arvo on enintään 7 ± 1. Muussa tapauksessa aine annostellaan edellä kuvatulla tavalla (ks. 19 kohta).
|
Inkubointi ja kaasunpaineen mittaukset
|
33.
|
Inkuboi valmisteltuja astioita lämpötilassa 35 °C ± 2 °C noin tunnin ajan, jotta liete tasapainottuu ja liiallinen kaasu purkautuu ilmakehään. Ravistele jokaista astiaa vuorotellen, paina painemittarin neula (13c kohta) tulpan läpi ja avaa venttiiliä, kunnes painemittarin lukema on nolla. Jos kaasutilan paine on tässä vaiheessa tai välimittauksia tehtäessä pienempi kuin ilmakehän paine, astiaan on syötettävä typpikaasua, jotta paine on taas sama kuin ilmakehän paine. Sulje venttiili (ks. 13c kohta) ja jatka inkubointia pimeässä. Varmista, että mädätyslämpötila säilyy kaikissa astioiden osissa. Tarkkaile astioita inkuboinnin jälkeen 24–48 tuntia. Poista astiat testistä, jos astioiden sisältämä supernatanttineste värjäytyy pinkiksi, eli jos resatsuriini (ks. 16 kohta) on muuttanut väriään merkiksi siitä, että astiassa on happea (ks. 50 kohta). Järjestelmä saattaa sietää pieniä määriä happea, mutta isommat pitoisuudet voivat estää anaerobisen biohajoamisen etenemistä voimakkaasti. Satunnaisen yksittäisen astian poistaminen kolmen rinnakkaisnäytteen sarjasta voidaan hyväksyä, mutta jos tällaisia tapauksia ilmenee useammin, koemenettelyt on syytä tutkia, ja testi on toistettava.
|
|
34.
|
Sekoita jokaisen astian sisältö huolellisesti sekoittamalla tai ravistamalla astiaa muutamia minuutteja vähintään 2–3 kertaa viikossa ja hieman ennen jokaista paineenmittauskertaa. Ravistaminen suspendoi siirrosaineen uudelleen ja varmistaa kaasutasapainon. Kaikki paineenmittaukset on tehtävä nopeasti, koska testiastioiden lämpötila voi laskea, mikä johtaa vääriin lukemiin. Painetta mitattaessa koko testiastian, kaasutila mukaan luettuna, on pysyttävä mädätyslämpötilassa. Mittaa kaasunpaine esimerkiksi painamalla tulpan läpi injektioneula (13c kohta), joka on liitetty paineenvalvontamittariin. Mittauksessa on oltava huolellinen, jotta injektioneulaan ei pääse vettä. Jos näin käy, märät osat on kuivattava ja laitteistoon on vaihdettava uusi neula. Paine tulee mitata millibaareina (ks. 42 kohta). Astioiden kaasunpaine voidaan mitata säännöllisesti, esimerkiksi viikoittain, ja liiallinen kaasu voidaan valinnaisesti päästää ilmakehään. Vaihtoehtoisesti paine mitataan vain testin päättyessä tuotetun biokaasun määrän määrittämiseksi.
|
|
35.
|
Kaasunpaineen välimittaukset ovat suositeltavia, koska paineen suurenemisen avulla saadaan merkkejä siitä, milloin testi olisi lopetettava, ja sen perusteella voidaan seurata myös kinetiikkaa (ks. 6 kohta).
|
|
36.
|
Yleensä testi lopetetaan 60 päivän inkubaatioajan kuluttua, ellei paineenmittauksista saatu biohajoavuuskäyrä ole saavuttanut tasannevaihetta ennen sitä. Tasannevaihe tarkoittaa, että enimmäishajoavuus on saavutettu ja biohajoavuuskäyrä on tasoittunut. Jos tasannearvo on vähemmän kuin 60 prosenttia, tulkinta on ongelmallista, koska tämä viittaa siihen, että vain osa molekyylistä on mineralisoitunut tai että on tapahtunut virhe. Jos normaalin inkubaatioajan lopussa kaasuntuotanto jatkuu edelleen mutta tasannevaihetta ei selvästi ole saavutettu, on harkittava testin jatkamista, jotta voidaan tarkistaa, saavutetaanko tasanne (>60 prosenttia).
|
Epäorgaanisen hiilen mittaaminen
|
37.
|
Anna lietteen asettua testin lopussa viimeisen kaasunpaineen mittauksen jälkeen. Avaa jokainen astia vuorotellen ja ota välittömästi näyte supernatanttinesteen epäorgaanisen hiilen pitoisuuden (mg/l) määrittämistä varten. Supernatanttinestettä ei pidä sentrifugoida eikä suodattaa, koska siinä häviäisi liuennutta hiilidioksidia liikaa, mitä ei voida hyväksyä. Jos nestettä ei voida analysoida heti näytteenoton jälkeen, sitä voidaan säilyttää suljetussa ampullissa (ilman kaasutilaa) jäähdytettynä 4 °C:een enintään kahden päivän ajan. Mittaa pH-arvo ja kirjaa se muistiin epäorgaanisen hiilen mittauksen jälkeen.
|
|
38.
|
Vaihtoehtoisesti supernatantin epäorgaanisen hiilen pitoisuus voidaan määrittää epäsuorasti vapauttamalla liuennutta epäorgaanista hiiltä hiilidioksidina, joka voidaan mitata kaasutilasta. Säädä kaasunpaineen viimeisen mittauksen jälkeen jokaisen astian paine ilmakehän paineeseen. Happamoita kunkin astian sisällöt suurin piirtein pH-arvoon 1 lisäämällä suljettujen astioiden tulpan läpi konsentroitua mineraalihappoa (esimerkiksi H2SO4:ää). Inkuboi ravistettuja astioita 35 °C:ssa (± 2 °C) noin 24 tuntia ja mittaa muodostuneesta hiilidioksidista syntynyt kaasunpaine painemittarilla.
|
|
39.
|
Ota samat lukemat myös nollanäyte- ja vertailuaineastioista sekä tarvittaessa inhibitiokontrolliastioista (ks. 21 kohta).
|
|
40.
|
Joissakin tapauksissa – eritoten jos samoja kontrolliastioita käytetään useiden testiaineiden kanssa – testi- ja kontrolliastioiden epäorgaanisen hiilen pitoisuuden välimittauksia on syytä harkita tarpeen mukaan. Tässä tapauksessa kaikkia välimittauksia varten on valmisteltava riittävän monta astiaa. Tämä toimenpide on parempi kuin kaikkien näytteiden ottaminen vain yhdestä astiasta. Jälkimmäinen toimenpide voidaan tehdä vain silloin, jos liuenneen epäorgaanisen hiilen analyysissa tarvittavan tilavuuden ei katsota olevan liian suuri. Liuenneen epäorgaanisen hiilen mittaus tulee tehdä sen jälkeen, kun kaasunpaine on mitattu vapauttamatta liiallista kaasua seuraavassa kuvatulla tavalla:
|
—
|
Ota mahdollisimman pieni määrä näytteitä supernatantista injektioneulalla tulpan läpi astioita avaamatta ja määritä näytteestä epäorgaanisen hiilen pitoisuus.
|
|
—
|
Kun olet ottanut näytteen, voit joko vapauttaa liiallisen kaasun tai olla tekemättä sitä.
|
|
—
|
On otettava huomioon, että vaikka supernatantin tilavuus pienenisi vain vähän (esimerkiksi noin yhden prosentin), kaasutilan kaasun tilavuus (Vh) saattaa lisääntyä huomattavasti.
|
|
—
|
Yhtälöt (ks. 44 kohta) korjataan suurentamalla arvoa Vh yhtälössä 3 tarvittaessa.
|
|
Ominaisanalyysit
|
41.
|
Jos primaarinen anaerobinen hajoaminen (ks. 30 kohta) on tarkoitus määrittää, ota testiainetta sisältävistä astioista tarkoituksenmukainen määrä näytettä ominaisanalyyseja varten testin alussa ja lopussa. Jos analyysit tehdään, huomaa, että kaasutilan (Vh) ja nesteen (Vl) tilavuudet muuttuvat. Ota tämä huomioon kaasuntuotannon tuloksia laskettaessa. Vaihtoehtoisesti näytteet ominaisanalyyseja varten voidaan ottaa ylimääräisistä seoksista, jotka on tehty aiemmin tätä tarkoitusta varten (30 kohta).
|
TIEDOT JA RAPORTOINTI
Tulosten käsittely
|
42.
|
Käytännöllisistä syistä kaasunpaine mitataan millibaareina (1 mbar = 1h Pa = 102 Pa; 1 Pa = 1 N/m2), tilavuus litroina ja lämpötila Celsius-asteina.
|
Kaasutilassa oleva hiili
|
43.
|
Koska yksi mooli metaania ja yksi mooli hiilidioksidia sisältää kumpikin 12 g hiiltä, hiilen massa tietyssä tilavuudessa muodostunutta kaasua voidaan ilmaista seuraavasti:
jossa
|
m
|
=
|
hiilen massa (mg) tietyssä tilavuudessa muodostunutta kaasua
|
|
12
|
=
|
hiilen suhteellinen atomimassa
|
|
n
|
=
|
kaasun moolien lukumäärä tietyssä tilavuudessa.
|
Jos muita kaasuja kuin metaania tai hiilidioksidia (esimerkiksi N2O:ta) muodostuu huomattavia määriä, kaavaa [1] on muutettava, jotta voidaan kuvata muodostuneiden kaasujen vaikutusten mahdollisuutta.
|
|
44.
|
Kaasulakien perusteella n voidaan ilmaista seuraavasti:
|
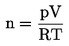
|
Yhtälö [2]
|
jossa
|
p
|
=
|
kaasun paine (Pascalia)
|
|
V
|
=
|
kaasun tilavuus (m3)
|
|
R
|
=
|
moolinen kaasuvakio [8,314J/(mol K)]
|
|
T
|
=
|
inkubaatiolämpötila (Kelviniä).
|
Yhtälöt [1] ja [2] yhdistämällä ja yksinkertaistamalla voidaan määrittää kaasuntuotanto nollanäytteessä:
|

|
Yhtälö [3]
|
jossa
|
mh
|
=
|
kaasuna kaasutilassa tuotetun nettohiilen massa (mg)
|
|
Dp
|
=
|
testiastioiden alku- ja loppupaineiden keskimääräinen ero, josta on vähennetty nollanäyteastioiden vastaava keskiarvo (millibaareina)
|
|
Vh
|
=
|
astian kaasutilan tilavuus (l)
|
|
0,1
|
=
|
muuntokerroin muunnettaessa newtonit/m2 millibaareiksi ja m3 litroiksi.
|
Yhtälöä [4] tulee käyttää normaalia inkubaatiolämpötilaa 35 °C (308 K) varten:
|
mh
= 0,468(Δp·Vh
)
|
Yhtälö [4]
|
Huomautus: Vaihtoehtoinen tilavuudenlaskentatapa. Painemittarin lukemat muunnetaan millilitroiksi tuotettua kaasua käyttämällä vakiokäyrää, joka saadaan piirtämällä käyrä injektoidusta tilavuudesta (ml) mittarilukemaan nähden (lisäys 2). Kaasun moolien lukumäärä jokaisen astian kaasutilassa lasketaan jakamalla kumulatiivinen kaasuntuotanto (ml) arvolla 25 286 ml/mooli, joka on yhtä kuin yhden kaasumoolin viemä tilavuus 35 °C:ssa ja ilmakehän paineessa. Koska yksi mooli CH4:ää ja yksi mooli CO2:ta sisältää kumpikin 12 g hiiltä, hiilen määrä (mg) kaasutilassa (mh
) saadaan yhtälöstä [5]:
|
mh
= 12 × 103×n
|
Yhtälö [5]
|
Yksinkertaistus nollanäytteen kaasuntuotannon laskemiseksi:
|

|
Yhtälö [6]
|
jossa
|
mh
|
=
|
kaasuna kaasutilassa tuotetun nettohiilen massa (mg)
|
|
DV
|
=
|
testiastioiden ja nollanäyteastioiden kaasutilassa tuotetun kaasun tilavuuden eron keskiarvo
|
|
25 286
|
=
|
yhden kaasumoolin viemä tila 35 °C:ssa, yksi ilmakehä.
|
|
|
45.
|
Biohajoavuuden etenemistä voidaan seurata piirtämällä käyrä kumulatiivisesta paineennoususta Dp (millibaareina) suhteessa aikaan, jos tarpeen. Määritä tästä käyrästä lag-vaihe (päiviä) ja kirjaa se muistiin. Lag-vaihe on aika, joka kuluu testin alkamisesta siihen saakka, kunnes huomattava hajoaminen alkaa (ks. esimerkki lisäyksestä 3). Jos supernatantista otettiin ja analysoitiin välinäytteet (ks. 40, 46 ja 47 kohta), vain kumulatiivisen paineen sijasta voidaan piirtää käyrä tuotetun hiilen (kaasussa ja nesteessä) kokonaismäärästä.
|
Nesteessä oleva hiili
|
46.
|
Metaanin määrä nesteessä jätetään huomiotta, koska sen vesiliukoisuuden tiedetään olevan hyvin huono. Laske testiastioiden nesteessä olevan epäorgaanisen hiilen massa käyttämällä yhtälöä [7]:
jossa
|
ml
|
=
|
nesteessä olevan epäorgaanisen hiilen massa (mg)
|
|
Cnet
|
=
|
testiastioissa olevan epäorgaanisen hiilen pitoisuus vähennettynä kontrolliastioiden pitoisuudella testin lopussa (mg/l)
|
|
Vh
|
=
|
astiassa olevan nesteen tilavuus (l).
|
|
Kaasuksi muuttuneen hiilen kokonaismäärä
|
47.
|
Laske kaasuksi muuttuneen hiilen kokonaismassa astiassa käyttämällä yhtälöä [8]:
jossa
|
|
mt = kaasuksi muuttuneen hiilen kokonaismassa (mg)
|
|
|
mh
ja ml
edellä olevien määritelmien mukaisesti.
|
|
Testiaineessa oleva hiili
|
48.
|
Laske testiastioissa olevan hiilen massa johdettuna lisätystä testiaineesta käyttämällä yhtälöä [9]:
jossa
|
mv
|
=
|
testiaineessa olevan hiilen massa (mg)
|
|
Cc
|
=
|
testiaineessa olevan hiilen pitoisuus testiastiassa (mg/l)
|
|
Vl
|
=
|
testiastiassa olevan nesteen tilavuus (l).
|
|
Biohajoavuuden määrä
|
49.
|
Laske biohajoavuuden prosenttiosuus kaasutilan kaasusta käyttämällä yhtälöä [10] ja biohajoavuuden kokonaisprosenttiosuus käyttämällä yhtälöä [11]:
|
Dh
= (mh
/mv
) × 100
|
Yhtälö [10]
|
|
Dt
= (mt
/mv
) × 100
|
Yhtälö [11]
|
jossa
|
|
Dh
= biohajoavuus kaasutilan kaasun perusteella ( %)
|
|
|
Dt
= kokonaisbiohajoavuus ( %)
|
|
|
mh
, mv
ja mt
edellä olevien määritelmien mukaisesti.
|
Primaarisen biohajoavuuden aste lasketaan (valinnaisista) testiaineen pitoisuuden mittauksista inkuboinnin alussa ja lopussa käyttämällä yhtälöä [12]:
|
Dp
= (1 –Se
/Si
) × 100
|
Yhtälö [12]
|
jossa
|
Dp
|
=
|
testiaineen primaarinen hajoavuus ( %)
|
|
Si
|
=
|
testiaineen alkupitoisuus (mg/l)
|
|
Se
|
=
|
testiaineen pitoisuus testin lopussa (mg/l).
|
Jos analyysimenetelmä viittaa siihen, että testiaineen pitoisuus muuttamattomassa anaerobisen lietteen siirrosaineessa on huomattava, käytä yhtälöä [13]:
|
Dp
1
= [1 – (Se
–Seb
)/(Si
–Sib
)] × 100
|
Yhtälö [13]
|
jossa
|
Dp
1
|
=
|
testiaineen korjattu primaarinen hajoavuus ( %)
|
|
Sib
|
=
|
testiaineen alkuperäinen ’ilmeinen’ pitoisuus nollakontrolleissa (mg/l)
|
|
Seb
|
=
|
testiaineen ’ilmeinen’ pitoisuus nollakontrolleissa testin lopussa (mg/l).
|
|
Tulosten luotettavuus
|
50.
|
Painelukemia tulee käyttää vain niistä astioista, joiden väri ei ole muuttunut pinkiksi (ks. 33 kohta). Happikontaminaatio minimoidaan käyttämällä asianmukaisia anaerobisia käsittelytekniikoita.
|
|
51.
|
On otettava huomioon, että testi on validi, jos vertailuaine saavuttaa tasanteen, joka edustaa yli 60 prosentin biohajoavuutta. (41)
|
|
52.
|
Jos pH-arvo testin lopussa on yli 7 ± 1 ja jos biohajoavuus on ollut epätäydellistä, toista testi lisäämällä väliaineen puskurikapasiteettia.
|
Hajoamisen estyminen
|
53.
|
Kaasuntuotannon astioissa, jotka sisältävät sekä testiainetta että vertailuainetta, tulisi olla vähintään yhtä suurta kuin astioissa, jotka sisältävät vain vertailuainetta. Muussa tapauksessa merkit viittaavat kaasuntuotannon estymiseen. Joissakin tapauksissa kaasuntuotanto astioissa, jotka sisältävät testiainetta mutta eivät vertailuainetta, on vähäisempää kuin nollakontrolleissa, mikä viittaa siihen, että testiaine on inhiboiva.
|
Testiraportti
|
54.
|
Testiraportin on sisällettävä seuraavat tiedot:
|
|
Testiaine:
|
—
|
yleisnimi, kemiallinen nimi, CAS-numero, rakennekaava ja merkitykselliset fysikaalis-kemialliset ominaisuudet
|
|
—
|
testiaineen puhtaus (epäpuhtaudet).
|
|
|
|
Testiolosuhteet:
|
—
|
laimennetun mädätysnesteen (Vl
) ja kaasutilan (Vh
) tilavuus astiassa
|
|
—
|
testiastioiden kuvaus, biokaasumittauksen ja epäorgaanisen hiilen analysaattorin pääpiirteet (esimerkiksi painemittarin tyyppi)
|
|
—
|
testiaineen ja vertailuaineen applikointi testijärjestelmään: käytetty testipitoisuus ja mahdollinen liuottimien käyttö
|
|
—
|
tarkat tiedot käytetystä siirrosaineesta: jätevedenkäsittelylaitoksen nimi, kuvaus käsitellyn jäteveden lähteestä (esimerkiksi käyttölämpötila, lietteen retentioaika, tieto siitä, onko kyseessä pääasiassa talousjätevesi jne.), pitoisuus, sen perustelemiseen tarvittavat tiedot sekä tiedot siirrosaineen mahdollisesta esikäsittelystä (esimerkiksi esimädätys, esialtistus)
|
|
—
|
rinnakkaisnäytteiden määrä.
|
|
|
|
Tulokset:
|
—
|
pH-arvo ja epäorgaanisen hiilen määrä testin lopussa
|
|
—
|
testiaineen pitoisuus testin alussa ja lopussa, jos ominaismittaus on tehty
|
|
—
|
kaikki kerätyt mittaustiedot testi-, nolla- ja vertailuaineista sekä inhibitiokontrolliastioista, tarvittaessa (esimerkiksi paine millibaareina, epäorgaanisen hiilen pitoisuus (mg/l)), taulukkomuodossa (kaasutilan ja nesteen mittaustiedot tulee ilmoittaa erikseen)
|
|
—
|
tietojen tilastollinen käsittely, testin kesto ja kaavakuva testiaineen, vertailuaineen ja inhibitiokontrollin biohajoavuudesta
|
|
—
|
testiaineen ja vertailuaineen prosentuaalinen biohajoavuus
|
|
—
|
syyt mahdolliseen testitulosten hylkäämiseen
|
|
|
LÄHDEKIRJALLISUUS
|
(1)
|
Tämän liitteen seuraavat luvut:
|
|
C.4, Biohajoavuuden määritys
|
|
|
C.9 Biologinen hajoaminen – Zahn-Wellens-testi;
|
|
|
C.10 Simulaatiotestit – Aerobinen jätevedenkäsittely:
A: Aktiivilieteyksiköt, B: Biofilmit
|
|
|
C.11 Biologinen hajoaminen – Aktiivilietteen soluhengityksen inhibitiotesti.
|
|
|
(2)
|
OECD (2009) Inherent Biodegradability: Modified MITI Test (II), OECD Guideline for Testing of Chemicals, No. 302C, OECD, Paris.
|
|
(3)
|
Birch, R. R., Biver, C., Campagna, R., Gledhill, W.E., Pagga,U., Steber, J., Reust, H. and Bontinck, W.J. (1989) Screening of chemicals for anaerobic biodegradation. Chemosphere 19, 1527–1550. (Julkaistu myös ECETOCin teknisenä raporttina nro 28, kesäkuu 1988).
|
|
(4)
|
Shelton D.R. and Tiedje, J.M. (1984) General method for determining anaerobic biodegradation potential. Appl. Environ. Microbiology, 47, 850–857.
|
|
(5)
|
Owen, W.F., Stuckey, DC., Healy J.B., Jr, Young L.Y. and McCarty, P.L. (1979) Bioassay for monitoring biochemical methane potential and anaerobic toxicity. Water Res. 13, 485–492.
|
|
(6)
|
Healy, J.B.Jr. and Young, L.Y. (1979) Anaerobic biodegradation of eleven aromatic compounds to methane. Appl. Environ. Microbiol. 38, 84–89.
|
|
(7)
|
Gledhill, W.E. (1979) Proposed standard practice for the determination of the anaerobic biodegradation of organic chemicals. Working document. Draft 2 no.35.24. American Society for Testing Materials, Philadelphia.
|
|
(8)
|
Battersby, N.S. and Wilson, V. (1988) Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic chemicals under methanogenic conditions. Chemosphere, 17, 2441–2460.
|
|
(9)
|
E1192-92. Standard Test Method for Determining the Anaerobic Biodegradation Potential of Organic Chemicals. ASTM, Philadelphia.
|
|
(10)
|
US-EPA (1998) Fate, Transport and Transformation Test Guidelines OPPTS 835.3400 Anaerobic Biodegradability of Organic Chemicals.
|
|
(11)
|
International Organization for Standardization (1995) ISO 11 734 Water Quality – Evaluation of the ultimate anaerobic biodegradation of organic compounds in digested sludge – Method by measurement of the biogas production.
|
|
(12)
|
International Organization for Standardization (2003) ISO 13 641-1 Water Quality – Determination of inhibition of gas production of anaerobic bacteria – Part 1 General Test.
|
|
(13)
|
International Organization for Standardization (1995) ISO 10 634 Water Quality – Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
|
|
(14)
|
Pagga, U. and Beimborn, D.B., (1993) Anaerobic biodegradation test for organic compounds. Chemosphere, 27, 1499–1509.
|
|
(15)
|
International Organization for Standardization (1997) ISO 11 923 Water Quality – Determination of suspended solids by filtration through glass-fibre filters.
|
Lisäys 1
Esimerkki laitteistosta, jolla mitataan biokaasun tuotantoa kaasunpaineen perusteella

Selitykset:
|
1
|
–
|
painemittari
|
|
2
|
–
|
kaasutiivis kolmitieventtiili
|
|
3
|
–
|
injektioneula
|
|
4
|
–
|
kaasutiivis tulppa (kiristysholkki ja tulppa)
|
|
5
|
–
|
kaasutila (Vh
)
|
|
6
|
–
|
siirrosaine (mädätetty liete) (Vl
)
|
Testiastioiden käyttölämpötila on 35 °C ± 2 °C.
Lisäys 2
Painemittarin muuntaminen
Painemittarin lukemat voidaan liittää kaasutilavuuksiin vakiokäyrällä, joka saadaan injektoimalla tietty tilavuus ilmaa lämpötilassa 35 °C ± 2 °C seerumipulloihin, jotka sisältävät reaktioseoksen tilavuutta V
R vastaavan tilavuuden vettä:
|
—
|
Laita viiteen seerumipulloon V
R ml alikvootteja vedestä, jota on pidetty lämpötilassa 35 °C ± 2 °C. Sulje pullot ja laita ne vesihauteeseen (35 °C) tasapainottumana tunnin ajaksi.
|
|
—
|
Kytke painemittari päälle, anna sen tasapainottua ja säädä se nollaan.
|
|
—
|
Paina injektioneula yhden pullon tulpan läpi, avaa venttiiliä, kunnes painemittarin lukema on nolla, ja sulje venttiili.
|
|
—
|
Toista toimenpide muille pulloille.
|
|
—
|
Injektoi jokaiseen pulloon 1 ml ilmaa lämpötilassa 35 °C ± 2 °C. Paina (painemittarin) neula yhden pullon tulpan läpi ja anna painelukeman asettua. Merkitse painelukema muistiin. Avaa venttiiliä, kunnes painelukema on nolla, ja sulje venttiili.
|
|
—
|
Toista toimenpide muille pulloille.
|
|
—
|
Toista koko toimenpide käyttämällä 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml ja 50 ml ilmaa.
|
|
—
|
Piirrä paineen (Pa) muuntokäyrä injektoituun kaasutilavuuteen Vb (ml) nähden. Instrumentin vaste on lineaarinen välillä 0–70 000 Pa ja kaasuntuotannon osalta välillä 0–50 ml.
|
Lisäys 3
Esimerkki hajoamiskäyrästä (paineen kumulatiivinen nettolisäys)

Lisäys 4
Esimerkkejä anaerobisen biohajoavuustestin tietolomakkeista – Testiainetta koskeva tietolomake
|
Laboratorio: …
|
Testiaine: …
|
Testin nro: …
|
|
Testilämpötila:(°C): …
|
Kaasutilan tilavuus (V
h): …(l)
|
Nesteen tilavuus (V
l ): …(l)
|
|
Testiaineen hiilipitoisuus C
c,v: …(mg/l)
|
mv
(42): …(mg)
|
|
|
Päivä
|
p
1 (testi)
(mbar)
|
p
2 (testi)
(mbar)
|
p
3 (testi)
(mbar)
|
p (testi)
keskiarvo
(mbar)
|
p
4 (nolla)
(mbar)
|
p
5 (nolla)
(mbar)
|
p
6 (nolla)
(mbar)
|
p (nolla)
Keskiarvo
(mbar)
|
p (netto)
testi – nollakeskiarvo
(mbar)
|
D
p (netto)
Kertymä
(mbar)
|
m
h
kaasutilan C
(43)
(mg)
|
D
h
Biohajoavuus (44)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
1.3.2NRTC-testi:
(mg)
|
C
IC, 2
1.3.2NRTC-testi:
(mg)
|
C
IC, 3
1.3.2NRTC-testi:
(mg)
|
C
IC
testin keski-arvo
(mg)
|
C
IC, 4
tyhjä
(mg)
|
C
IC, 5
tyhjä
(mg)
|
C
IC, 6
tyhjä
(mg)
|
C
IC
nollan keski-arvo
(mg)
|
C
IC, net
testi – nolla
Keskiarvo
(mg)
|
m
l
nesteen C (45)
(mg)
|
m
t
C yhteensä (46)
(mg)
|
D
t
Biohajoavuus (47)
(%)
|
|
IC (lopussa)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (lopussa)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Laboratorio: …
|
Vertailuaine: …
|
Testin nro: …
|
|
Testilämpötila:(°C): …
|
Kaasutilan tilavuus (V
h): …(l)
|
Nesteen tilavuus (V
l ) (litraa): …
|
|
Vertailuaineen hiilipitoisuus C
c,v (mg/l): …
|
mv
(48) (mg):
|
|
|
Päivä
|
p
1 (vert.)
(mbar)
|
p
2 (vert.)
(mbar)
|
p
3 (vert.)
(mbar)
|
p (vert.)
Keskiarvo
(mbar)
|
p
4 (inhib.)
(mbar)
|
p
5 (inhib.)
(mbar)
|
p
6 (inhib.)
(mbar)
|
p (inhib.)
Keskiarvo
(mbar)
|
p (vert.)
vert. – nolla
(mbar)
|
D
p (vert.)
kertymä
(mbar)
|
m
h
kaasutilan C
(49)
(mg)
|
D
h
Biohajoavuus (50)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
vert.
(mg)
|
C
IC, 2
vert.
(mg)
|
C
IC, 3
vert.
(mg)
|
C
IC
vert. keskiarvo
(mg)
|
C
IC, 4
inhib.
(mg)
|
C
IC, 5
inhib.
(mg)
|
C
IC, 6
inhib.
(mg)
|
C
IC
inhib. keski-arvo
(mg)
|
C
IC, net
vert. – inhib.
(mg)
|
m
l
nesteen C (51)
(mg)
|
m
t
C yhteensä (52)
(mg)
|
D
t
Biohajoavuus (53)
(%)
|
|
IC (lopussa)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (lopussa)
|
|
|
|
|
|
|
|
|
|
|
|
|
C.44. UUTTUMINEN MAAKOLONNEISSA
JOHDANTO
|
1.
|
Tämä testimenetelmä vastaa OECD:n testiohjetta (TG) nro 312 (2004). Keinotekoiset kemikaalit voivat kulkeutua maaperään tarkoituksellisesti (kuten maatalouskemikaalit) tai epäsuoria reittejä pitkin (esimerkiksi jäteveden → lietteen → maaperän tai ilman → kautta märkä- tai kuivalaskeumaksi). Näihin kemikaaleihin liittyvien riskien arvioinnissa on tärkeää selvittää, missä määrin ne voivat muuttua maaperässä ja kulkeutua (uuttua) syvempiin maakerroksiin ja mahdollisesti pohjaveteen.
|
|
2.
|
Käytettävissä on useita menetelmiä, joilla kemikaalien uuttumisen potentiaalia maaperässä voidaan mitata valvotuissa laboratorio-olosuhteissa, esimerkiksi seuraavat: maaperän ohutkerroskromatografia, maaperän paksukerroskromatografia, maakolonnikromatografia sekä adsorptio-desorptiomittaukset (1) (2). Ionisoitumattomien kemikaalien yhteydessä n-oktanoli-vesi-jakaantumiskertoimen (Pow) avulla voidaan tehdä alustava arviointi niiden adsorptio- ja uuttumispotentiaalista (3)(4)(5).
|
|
3.
|
Tässä testimenetelmässä kuvattava menetelmä perustuu häiriintyneen maaperän maakolonnikromatografiaan (ks. määritelmä lisäyksestä 1). Testimenetelmässä tehdään kahdentyyppisiä kokeita, joilla määritetään i) testikemikaalin uuttumispotentiaali ja ii) hajoamistuotteiden uuttumispotentiaali (tutkitaan vanhentuneilla jäämillä) maanäytteissä kontrolloiduissa laboratorio-olosuhteissa (54). Testimenetelmä perustuu olemassa oleviin menetelmiin (6) (7) (8) (9) (10)(11).
|
|
4.
|
Tässä testimenetelmässä käytettävien maanäytteiden määrästä ja tyypistä on sovittu maalajin ja sedimentin valintaa käsitelleessä OECD:n työryhmässä, joka kokoontui Belgiratessa Italiassa vuonna 1995 (12). Työryhmä antoi myös suosituksia uuttumiskokeiden maanäytteiden keräämisestä, käsittelystä ja varastoinnista.
|
TESTIMENETELMÄN PERIAATE
|
5.
|
Sopivasta inertistä materiaalista (kuten lasista, ruostumattomasta teräksestä, alumiinista, teflonista, PVC:stä jne.) valmistettuihin kolonneihin laitetaan maa-ainesta, ja ne kyllästetään ja tasapainotetaan keinosadeliuoksella (ks. määritelmä lisäyksestä 1), minkä jälkeen niiden annetaan kuivua. Sen jälkeen jokaisen maakolonnin pinta käsitellään testikemikaalilla ja/tai sen vanhentuneilla jäämillä. Sitten maakolonneihin applikoidaan keinosadetta ja suotovesi kerätään. Uuttomenettelyn jälkeen maa-aines poistetaan kolonneista ja jaotellaan asianmukaiseen määrään segmenttejä sen mukaan, mitä tietoja tutkimuksesta on tarkoitus saada. Tämän jälkeen jokaisesta maasegmentistä ja suotovedestä analysoidaan testikemikaalin ja tarvittaessa hajoamistuotteiden tai muiden asiaankuuluvien kemikaalien pitoisuus.
|
TESTIMENETELMÄN SOVELLETTAVUUS
|
6.
|
Testimenetelmää voidaan soveltaa testikemikaaleihin (joita ei ole tai jotka on radioleimattu esimerkiksi 14C:lla), joiden analysointiin on olemassa riittävän tarkka ja herkkä menetelmä. Testimenetelmää ei tule soveltaa kemikaaleihin, jotka haihtuvat maasta tai vedestä ja jotka eivät näin ollen pysy maassa ja/tai suotovedessä tämän testimenetelmän mukaisissa koeolosuhteissa.
|
TESTIKEMIKAALIA KOSKEVIA TIETOJA
|
7.
|
Radioleimaamattomia tai -leimattuja testikemikaaleja voidaan käyttää, kun mitataan uuttumiskäyttäytymistä maakolonneissa. Hajoamistuotteiden (testikemikaalin vanhentuneiden jäämien) uuttumista tutkittaessa ja massatasemäärityksiä tehtäessä tarvitaan radioleimattuja materiaaleja. 14C-leimaus on suositeltava, mutta muutkin isotoopit, kuten 13C, 15N,3H, 32P, voivat olla hyödyllisiä. Leiman pitäisi mahdollisuuksien mukaan sijaita molekyylin stabiileimmassa osassa tai osissa. Testikemikaalin puhtausasteen tulisi olla vähintään 95 prosenttia.
|
|
8.
|
Useimmat kemikaalit tulisi applikoida yksittäisenä aineena. Kasvinsuojelutuotteiden tehoaineiden yhteydessä voidaan kuitenkin käyttää kaupallisia tuotteita, kun tutkitaan alkuperäisen testiaineen uuttumista, mutta niiden testaus on tarpeen etenkin silloin, kun seos todennäköisesti vaikuttaa vapautumisen määrään (ts. raemaiset valmisteet tai valmisteet, joista tehoaine vapautuu kontrolloidusti). Testiasetelman seoskohtaiset vaatimukset kannattaa selvittää sääntelyviranomaiselta ennen testin tekemistä. Vanhentuneiden jäämien uuttumista koskevissa tutkimuksissa tulisi käyttää puhdasta alkuperäistä testiainetta.
|
|
9.
|
Ennen maakolonnien uuttumistestien tekemistä testikemikaalista on mielellään oltava saatavilla seuraavat tiedot:
|
(1)
|
liukoisuus veteen [testimenetelmä A.6] (13)
|
|
(2)
|
liukoisuus orgaanisiin liuottimiin;
|
|
(3)
|
höyrynpaine [testimenetelmä A.4] (13) ja Henryn lain vakio
|
|
(4)
|
n-oktanoli/vesi-jakaantumiskerroin [testimenetelmät A.8 ja A.24 ] (13)
|
|
(5)
|
adsorptiokerroin (Kd, Kf tai KOC) [testimenetelmät C.18 ja/tai C.19 ] (13)
|
|
(6)
|
hydrolyysi [testimenetelmä C.7] (13)
|
|
(7)
|
dissosiaatiovakio (pKa) [OECD:n testiohje (TG) nro 112] (25)
|
|
(8)
|
aerobinen ja anaerobinen hajoaminen maaperässä [testimenetelmä C.23] (13).
|
Huomautus: Lämpötila, jossa nämä mittaukset tehtiin, on raportoitava testiraporteissa.
|
|
10.
|
Maakolonneihin on applikoitava riittävästi testikemikaalia, jotta vähintään 0,5 prosenttia applikoidusta annoksesta voidaan havaita mistä tahansa yksittäisestä segmentistä. Kasvinsuojelutuotteiden tehoaineiden osalta applikoitavan testikemikaalin määrä voi vastata suositeltua enimmäiskäyttömäärää (kerta-applikaatio).
|
|
11.
|
Testikemikaalin ja tarvittaessa sen hajoamistuotteiden kvantifioimiseksi maaperässä ja suotovedessä on oltava käytettävissä asianmukainen analyysimenetelmä, jonka tarkkuus, täsmällisyys ja herkkyys tunnetaan. Myös testikemikaalin ja sen merkittävien hajoamistuotteiden (yleensä vähintään kaikki hajoamistuotteet, joita on havaittu vähintään 10 prosenttia käytetyssä annoksessa hajoamisreittitutkimuksissa, mutta mieluiten kaikki merkittävät ja huolta aiheuttavat hajoamistuotteet) analyyttinen havaitsemisraja on tunnettava (ks. 17 kohta).
|
VERTAILUKEMIKAALIT
|
12.
|
Testikemikaalin suhteellista kulkeutumista maaperässä arvioitaessa tulee käyttää vertailukemikaaleja, joiden uuttumiskäyttäytyminen tunnetaan, kuten atratsiinia tai mononuronia, joiden voidaan katsoa uuttuvan maaperään kohtalaisesti (1) (8) (11). Myös ei-sorboivat ja hajoamattomat polaariset vertailukemikaalit (kuten tritium, bromidi, fluoreseiini ja eosiini), joilla voidaan jäljittää veden liikkumista kolonnissa, voivat olla hyödyllisiä, kun vahvistetaan maakolonnin hydrodynaamisia ominaisuuksia.
|
|
13.
|
Analyyttisistä standardikemikaaleista voi niin ikään olla hyötyä, kun luonnehditaan ja/tai määritetään hajoamistuotteita, joita on löydetty maasegmenteistä ja suotovesistä kromatografisilla, spektroskooppisilla tai muilla sopivilla menetelmillä.
|
MÄÄRITELMÄT JA YKSIKÖT
LAATUKRITEERIT
Talteenotto
|
15.
|
Uuttumiskokeen saanto on yhtä kuin maasegmenteistä ja kolonnin suotovedestä uuttumisen jälkeen löytyneen testikemikaalin prosenttiosuuksien summa. Saantojen tulisi olla 90–110 prosenttia, kun käytetään radioleimattuja kemikaaleja (11), ja 70–110 prosenttia, kun käytetään leimaamattomia kemikaaleja (8).
|
Analyysimenetelmän toistettavuus ja herkkyys
|
16.
|
Analyysimenetelmän toistettavuus testikemikaalin ja hajoamistuotteiden kvantifioimiseksi voidaan tarkistaa tekemällä rinnakkaisanalyysi samasta maasegmentin tai suotoveden uutoksesta (ks. 11 kohta).
|
|
17.
|
Analyysimenetelmän havaitsemisraja (LOD) testikemikaalille ja hajoamistuotteille on oltava vähintään 0,01 mg · kg– 1 jokaisessa maasegmentissä tai suotovedessä (testikemikaalina) tai 0,5 prosenttia applikoidusta annoksesta missä tahansa yksittäisessä segmentissä sen mukaan, kumpi on pienempi. Määritysraja (LOQ) on myös määritettävä.
|
TESTIMENETELMÄN KUVAUS
Testijärjestelmä
|
18.
|
Tässä testissä käytetään sopivasta inertistä materiaalista (lasista, ruostumattomasta teräksestä, alumiinista, teflonista, PVC:stä jne.) valmistettuja uuttokolonneja, joiden sisähalkaisija on vähintään 4 cm ja korkeus vähintään 35 cm. Kolonnin materiaalit on testattava mahdollisten yhteisvaikutusten varalta testikemikaalin ja/tai sen hajoamistuotteiden kanssa. Esimerkkejä sopivista kolonneista, jotka ovat tai eivät ole jaettavissa osiin, on lisäyksessä 2.
|
|
19.
|
Maakolonnien täyttämisessä ja tiivistämisessä käytetään lusikkaa, survinta ja tärinälaitetta.
|
|
20.
|
Keinosade voidaan applikoida maakolonneihin mäntä- tai peristalttipumpuilla, suihkupäillä, Mariotte-pulloilla tai yksinkertaisilla tiputussuppiloilla.
|
Laboratoriolaitteisto ja kemikaalit
|
21.
|
Kokeeseen tarvitaan vakiolaboratoriolaitteisto, erityisesti seuraavat:
|
(1)
|
analyyttiset laitteet, kuten GLC-, HPLC- ja TLC-laitteet, mukaan luettuina radioleimattujen tai -leimaamattomien kemikaalien osoittamiseen soveltuvat järjestelmät tai käänteinen isotooppilaimennusmenetelmä
|
|
(2)
|
tunnistukseen käytettävät laitteet (esimerkiksi MS-, GC-MS-, HPLC-MS-spektrometri tai NMR-laite)
|
|
(3)
|
nestetuikelaskin radioleimattua testikemikaalia varten
|
|
(4)
|
hapetin leimatun materiaalin polttamista varten
|
|
(5)
|
uuttovälineet (esimerkiksi sentrifugiputkia kylmäuuttoa varten ja Soxhlet-uuttolaite jatkuvaa takaisinvirtausuuttoa varten)
|
|
(6)
|
liuosten ja uutteiden konsentrointivälineet (esimerkiksi pyöröhaihdutin).
|
|
|
22.
|
Käytettäviin kemikaaleihin kuuluvat analyyttisen puhtaat orgaaniset liuottimet, kuten asetoni, metanoli jne., tuikeneste, 0,01 M CaCl2-liuos tislatussa tai deionisoidussa vedessä (= keinosade).
|
Testikemikaali
|
23.
|
Testikemikaali on liotettava (deionisoituun tai tislattuun) veteen, jotta sen voi applikoida maakolonniin. Jos testikemikaali liukenee veteen huonosti, sen voi applikoida joko kaupallisesti saatavana valmisteena (tarvittaessa sen jälkeen, kun se on suspendoitu tai emulgoitu veteen) tai johonkin orgaaniseen liuottimeen. Jos käytetään orgaanista liuotinta, sitä on käytettävä mahdollisimman vähän, ja sen on annettava haihtua maakolonnin pinnalta ennen uuttomenettelyn aloittamista. Kiinteät valmisteet, kuten rakeet, tulee applikoida kiinteässä muodossa ilman vettä. Jotta tällainen valmiste jakautuu tasaisemmin maakolonnin pinnalle, kaupallisesti saatavaan tuotteeseen voi sekoittaa hieman kvartsihiekkaa (noin yhden gramman) ennen applikointia.
|
|
24.
|
Maakolonneihin on applikoitava riittävästi testikemikaalia, jotta vähintään 0,5 prosenttia applikoidusta annoksesta voidaan havaita mistä tahansa yksittäisestä segmentistä. Kasvinsuojelutuotteiden tehoaineiden osalta tämä voi perustua suositeltuun enimmäiskäyttömäärään (kerta-applikointimäärä), ja sekä alkuperäisen aineen että vanhentuneiden jäämien uuttumisen tulee liittyä käytetyn maakolonnin pinta-alaan (55).
|
Vertailukemikaali
|
25.
|
Uuttumiskokeissa on käytettävä vertailukemikaalia (ks. 12 kohta). Sitä on applikoitava maakolonnin pinnalle samalla tavoin kuin testikemikaalia ja riittävä määrä, jotta se voidaan havaita asianmukaisesti joko sisäisenä standardina yhdessä testikemikaalin kanssa samasta maakolonnista tai yksinään erillisessä maakolonnissa. Kumpikin kemikaali suositellaan laitettavaksi samaan kolonniin, paitsi jos ne on leimattu samalla tavalla.
|
Maa-ainekset
Muunnoksen valinta
|
26.
|
Uuttumistutkimuksissa, joissa käytetään alkuperäistä testikemikaalia, tulisi käyttää kolmea tai neljää maa-ainesnäytettä, joiden pH, orgaanisen hiilen pitoisuus ja rakenne vaihtelevat (12). Jäljempänä olevassa taulukossa 1 on ohjeita uuttumistestien maa-ainesten valintaan. Ionisoituvia testikemikaaleja varten tulisi valita maa-aineksia, joiden pH vaihtelee suuresti, jotta voidaan arvioida kemikaalin kulkeutuvuutta sen ionisoituneessa ja ionisoitumattomassa muodossa. Vähintään kolmen maa-aineksen pH:n tulisi olla sellainen, jossa testikemikaali on kulkeutuvassa muodossaan.
Taulukko 1
Ohjeet uuttumistutkimusten maa-ainesten valintaan
|
Maa-aineksen nro
|
pH-luku
|
Orgaaninen hiili
%
|
Savipitoisuus
%
|
Rakenne (56)
|
|
1
|
> 7,5
|
3,5–5,0
|
20–40
|
hiuesavi
|
|
2
|
5,5–7,0
|
1,5–3,0
|
15–25
|
hiesusavi
|
|
3
|
4,0–5,5
|
3,0–4,0
|
15–30
|
savikko
|
|
4
|
< 4,0–6,0 (57)
|
< 0,5–1,5 (57)
(58)
|
< 10–15 (57)
|
savinen hiekka
|
|
5
|
< 4,5
|
> 10 (59)
|
< 10
|
savinen hiekka / hiekka
|
|
|
27.
|
Toisinaan myös muuntyyppiset maa-ainekset voivat olla tarpeen, jotta viileämmät, lauhkeammat ja trooppiset alueet olisivat edustettuina. Jos muuntyyppisiä maa-aineksia käytetään, niitä on luonnehdittava samoilla parametreilla ja niiden ominaisuuksien tulee vaihdella samalla tavalla kuin uuttumistutkimusten maa-ainesten valintaa koskevissa ohjeissa on kuvattu (ks. taulukko 1 edellä), vaikka ne eivät varsinaisesti täytäkään kriteerejä.
|
|
28.
|
Uuttumistutkimuksissa, joissa hyödynnetään vanhentuneita jäämiä, on käytettävä yhtä maa-ainesnäytettä (12). Sen hiekkapitoisuuden olisi oltava >70 prosenttia ja orgaanisen hiilen pitoisuuden välillä 0,5–1,5 prosenttia (esimerkiksi taulukon 1 maa-aines nro 4). Useampien maa-ainestyyppien käyttö voi olla tarpeen, jos tiedot hajoamistuotteista ovat tärkeitä.
|
|
29.
|
Kaikista maa-aineksista on luonnehdittava vähintään seuraavat ominaisuudet: rakenne [hiekan, hiesun ja saven prosenttiosuudet FAO:n ja USDA:n luokitusjärjestelmien mukaan (14)], pH, kationinvaihtokyky, orgaanisen hiilen pitoisuus, maamassan tiheys (häiriintynyt maa-aines) ja vedenpidätyskyky. Mikrobibiomassan mittaaminen on tarpeen vain sellaisesta maa-aineksesta, jota käytetään ennen vanhentuneiden jäämien uuttumiskoetta edeltävän vanhentamis- tai inkubointivaiheen aikana. Tiedot maa-aineksen muista ominaisuuksista (esimerkiksi maa-aineksen luokittelu, saven mineraloginen koostumus, ominaispinta-ala) voivat olla hyödyllisiä tämän tutkimuksen tuloksia tulkittaessa. Maa-aineksen ominaisuuksia voidaan määrittää lähteissä (15), (16), (17), (18) ja (19) suositeltujen menetelmien avulla.
|
Maanäytteiden kerääminen ja varastointi
|
30.
|
Maanäytteet tulisi ottaa pintakerroksesta (A-tasolta) enintään 20 cm:n syvyydestä. Näytteistä on poistettava kasvijätteet, makrofauna ja kivet. Maa-ainekset (paitsi ne, joita käytetään testikemikaalin vanhentamiseen) ilmakuivataan huoneenlämmössä (lämpötila mielellään 20–25 C). Kokonaisuuden pilkkominen on suoritettava mahdollisimman varovasti, jotta maaperän alkuperäinen rakenne muuttuisi mahdollisimman vähän. Maa-ainekset siivilöidään siivilässä, jonka tiheys on ≤ 2 mm. Huolellista homogenointia suositellaan sen vuoksi, että se parantaa tulosten uusittavuutta. Ennen käyttöä maa-aineksia voidaan säilyttää huoneenlämmössä ja pitää ilmakuivattuina (12). Säilytykselle ei suositella varsinaista takarajaa, mutta maa-ainekset, joita on säilytetty yli kolme vuotta, on analysoitava uudelleen ennen käyttöä niiden orgaanisen hiilen pitoisuuden, pH:n ja kationinvaihtokyvyn (CEC) osalta.
|
|
31.
|
Yksityiskohtaiset taustatiedot maanäytteiden keruupaikoista on oltava saatavilla. Näihin tietoihin kuuluvat tarkka sijainti [määritettynä tarkasti UTM-projektiolla (Universal Transversal Mercator-Projection / European Horizontal Datum) tai maantieteellisillä koordinaateilla], kasvipeite, käsittelyt kasvinsuojelukemikaaleilla, käsittelyt orgaanisilla ja epäorgaanisilla lannoitteilla, biologisten materiaalien lisäykset tai tahaton kontaminaatio (12). Uuttumistutkimuksissa ei pitäisi käyttää maannoksia, joita on käsitelty testikemikaalilla tai sen kanssa rakenteellisesti analogisella aineella neljän edeltävän vuoden aikana (10) (15).
|
Testiolosuhteet
|
32.
|
Testijakson aikana maa-ainesta sisältävät uuttokolonnit on pidettävä pimeässä ja huoneenlämmössä, kunhan lämpötila pysyy ± 2 °C:n vaihteluvälin rajoissa. Suositeltava lämpötila on 18–25 °C.
|
|
33.
|
Maakolonnien pinnalle on applikoitava jatkuvasti keinosadetta (0,01 M CaCl2) 200 mm:n nopeudella 48 tunnin ajan (60). Tämä nopeus vastaa 251 ml:n applikointia kolonniin, jonka sisähalkaisija on 4 cm. Myös muita keinosademääriä tai pidempää kestoa voidaan soveltaa, jos se on testin tarkoituksen kannalta tarpeen.
|
Testin suorittaminen
Uuttuminen alkuperäisellä testikemikaalilla
|
34.
|
Vähintään kahteen uuttokolonniin laitetaan käsittelemätöntä, ilmakuivattua ja siivilöityä maa-ainesta (< 2 mm) noin 30 cm:n korkeudelta. Yhtenäisen täytön aikaansaamiseksi maa-ainesta laitetaan kolonneihin lusikalla pieniä määriä, ja ainesta painetaan survimella samalla, kun kolonnia tärisytetään kevyesti, kunnes maakolonnin pinta ei enää laske. Yhtenäinen täyttö on tarpeen siksi, että uuttokolonneista saatavat tulokset olisivat toistettavissa. Tarkempia tietoja kolonnien täyttötekniikoista on lähdeviitteissä (20), (21) ja (22). Jotta täyttömenetelmän toistettavuutta voidaan valvoa, kolonneihin täytetyn maa-aineksen kokonaispaino on määritettävä (61); rinnakkaisnäytekolonnien on oltava samanpainoisia.
|
|
35.
|
Täyttämisen jälkeen maakolonnit esikostutetaan keinosateella (0,01 M CaCl2) alhaalta ylöspäin, jotta vesi syrjäyttää maa-aineksen huokosissa olevan ilman. Sen jälkeen maakolonnien annetaan tasoittua ja ylimääräinen vesi poistetaan painovoiman avulla. Kolonnin kyllästämismenetelmiä on käsitelty lähdeviitteessä (23).
|
|
36.
|
Seuraavaksi maakolonneihin applikoidaan testikemikaalia ja/tai vertailukemikaalia (ks. myös 23–25 kohta). Testi- ja/tai vertailukemikaaliliuokset, -suspensiot tai -emulsiot on applikoitava maakolonnien pinnalle tasaisesti, jotta ne jakautuvat homogeenisesti. Jos jokin testikemikaali suositellaan applikoitavaksi maa-aineksen sisään, se on sekoitettava pieneen määrään (n. 20 g) maa-ainesta ja lisättävä sen jälkeen maakolonnin pinnalle.
|
|
37.
|
Tämän jälkeen maakolonnien pinnat peitetään lasisintterilevyllä, lasihelmillä, lasikuitusuodattimella tai pyöreällä suodatinpaperilla, jotta keinosade voidaan jakaa tasaisesti koko pinnalle ja jotta sadepisarat eivät häiritse maa-aineksen pintaa. Mitä suurempi kolonnin halkaisija on, sitä huolellisemmin keinosade on applikoitava maakolonneihin, jotta se jakautuu tasaisesti maa-aineksen pinnalle. Keinosade lisätään maakolonneihin pisaroittain mäntä- tai peristalttipumpulla tai tiputussuppilolla. Suotovedet on kerättävä mieluiten fraktioina, ja niiden tilavuudet on kirjattava muistiin (62).
|
|
38.
|
Uuttumisen ja kolonnien kuivumisen jälkeen maakolonnit jaotellaan segmentteihin, joiden määrään vaikuttaa se, millaisia tietoja tutkimuksesta on määrä saada. Segmentit uutetaan asianmukaisilla liuottimilla tai liuotinseoksilla, ja niistä analysoidaan testikemikaalin pitoisuus, tarvittaessa hajoamistuotteiden osalta myös kokonaisradioaktiivisuus sekä vertailukemikaali. Suotovedet tai niiden fraktiot analysoidaan suoraan tai samoilla tuotteilla uuttamisen jälkeen. Kun käytetään radioleimattua testikemikaalia, kaikki fraktiot, jotka sisältävät ≥ 10 prosenttia applikoidusta radioaktiivisuudesta, on määritettävä.
|
Uuttuminen vanhentuneilla jäämillä
|
39.
|
Tuore maa-aines (jota ei ole ilmakuivattu aiemmin) käsitellään sellaisella määrällä radioleimattua testikemikaalia, joka vastaa maakolonnien pinta-alaa (ks. 24 kohta), ja inkuboidaan aerobisissa olosuhteissa testimenetelmän C.23 (13) mukaisesti. Inkubointiajan (vanhentamisajan) tulisi olla riittävän pitkä, jotta hajoamistuotteita muodostuu huomattavia määriä. Vanhentamisajaksi suositellaan testikemikaalin yhtä puoliintumisaikaa (63), mutta se ei saa olla pidempi kuin 120 päivää. Ennen uuttumista vanhennetusta maa-aineksesta analysoidaan testikemikaali ja sen hajoamistuotteet.
|
|
40.
|
Uuttumiskolonneihin täytetään 28 cm:n korkeudelta samaa maa-ainesta (joka on kuitenkin ilmakuivattu), jota käytettiin 34 kohdassa kuvatussa vanhentamiskokeessa, ja myös täytettyjen maakolonnien kokonaispaino määritetään. Sen jälkeen maakolonnit esikostutetaan 35 kohdassa kuvatulla tavalla.
|
|
41.
|
Seuraavaksi maakolonnien pinnalle applikoidaan testikemikaalia ja sen hajoamistuotteita vanhentuneina maa-ainesjääminä (ks. 39 kohta) kahden senttimetrin paksuiseksi maasegmentiksi. Maakolonnien kokonaiskorkeus (käsittelemätön maa-aines ja vanhennettu maa-aines) saisi olla korkeintaan 30 cm (ks. 34 kohta).
|
|
42.
|
Uuttuminen toteutetaan 37 kohdassa kuvatun mukaisesti.
|
|
43.
|
Uuttumisen jälkeen maasegmenteistä ja suotovesistä analysoidaan 38 kohdan mukaisesti testikemikaali, sen hajoamistuotteet ja uuttumaton radioaktiivisuus. Sen määrittämiseksi, kuinka paljon vanhentunutta jäämää on pysynyt kahden senttimetrin korkuisessa ylimmässä kerroksessa, kyseinen segmentti on analysoitava erikseen.
|
TIEDOT JA RAPORTOINTI
Tulosten käsittely
|
44.
|
Testikemikaalin, hajoamistuotteiden, uuttumattomien aineiden ja vertailukemikaalin (jos sitä on käytetty) määrät on esitettävä prosenttiosuutena applikoidusta alkuperäisestä annoksesta jokaisen maasegmentin ja suotovesifraktion osalta. Jokaisesta kolonnista on laadittava graafinen esitys, jossa näytetään todetut prosenttiosuudet maa-aineksen syvyyksien funktiona.
|
|
45.
|
Kun näihin kolonniuuttumistutkimuksiin sisältyy vertailukemikaali, kemikaalin uuttumista voidaan arvioida suhteellisella asteikolla käyttäen suhteellisen kulkeutumisen kertoimia (RMF, ks. määritelmä lisäyksestä 3) (1) (11), joiden avulla voidaan vertailla eri maa-ainestyypeistä saatuja eri kemikaalien uuttumistietoja. Esimerkkejä monien kasvinsuojelukemikaalien RMF-kertoimista on lisäyksessä (3).
|
|
46.
|
Myös estimaatit Koc-kertoimesta (orgaanisen hiilen normalisoitu adsorptiokerroin) ja Kom-kertoimesta (orgaanisen aineksen normalisoitu jakaantumiskerroin) voidaan saada kolonnin uuttumistuloksista käyttämällä keskimääräistä uuttumisetäisyyttä tai määrittämällä RMF-kertoimen ja Kom- tai Koc-kertoimen väliset korrelaatiot (4) taikka soveltamalla yksinkertaista kromatografista teoriaa (24). Jälkimmäisen menetelmän käytössä on kuitenkin oltava varovainen etenkin kun otetaan huomioon, ettei uuttumisprosessi koostu pelkästään kyllästetyistä virtausolosuhteista vaan pikemminkin kyllästymättömistä järjestelmistä.
|
Tulosten tulkinta
|
47.
|
Tässä menetelmässä kuvatuilla kolonniuuttumistutkimuksilla voidaan määrittää testikemikaalin (alkuperäisen kemikaalin uuttumistutkimus) ja/tai sen hajoamistuotteiden (vanhentuneiden jäämien uuttumistutkimus) uuttumista tai kulkeutumispotentiaalia maaperässä. Näillä testeillä ei voida määrällisesti ennustaa uuttumiskäyttäytymistä kenttäolosuhteissa, mutta niiden avulla voidaan vertailla yhden kemikaalin ’uuttuvuutta’ toisiin kemikaaleihin, joiden uuttumiskäyttäytyminen saattaa olla tiedossa (24). Näillä testeillä ei voida myöskään määrällisesti mitata, kuinka monta prosenttia applikoidusta kemikaalista päätyy pohjaveteen (11). Kolonniuuttumistutkimusten tuloksista voi kuitenkin olla apua päätettäessä, ovatko osittaiset tai kokonaiset kenttätestit tarpeen sellaisille kemikaaleille, joiden kulkeutuvuuspotentiaali on ollut laboratoriotesteissä suuri.
|
Testiraportti
|
48.
|
Testiraportin tulee sisältää seuraavat tiedot:
|
|
Testikemikaali ja vertailukemikaali (jos käytetty):
|
—
|
yleisnimi, kemiallinen nimi (IUPAC- ja CAS-nimikkeistö), CAS-numero, kemiallinen rakenne (sekä leiman sijainti, jos radioleimattua materiaalia on käytetty) sekä oleelliset fysikaalis-kemialliset ominaisuudet
|
|
—
|
testikemikaalin puhtaus (epäpuhtaudet)
|
|
—
|
merkkiaineella leimatun kemikaalin radiokemiallinen puhtaus ja spesifinen aktiivisuus (tapauksen mukaan).
|
|
|
|
Testimaannokset:
|
—
|
keruupaikkaa koskevat tiedot
|
|
—
|
maa-ainesten ominaisuudet, kuten pH, orgaanisen hiilen ja saven pitoisuus, rakenne ja massatiheys (häiriintyneen maan osalta)
|
|
—
|
maa-aineksen mikrobitoiminta (vain testikemikaalin vanhentamisessa käytetystä aineksesta)
|
|
—
|
maa-aineksen säilytyksen pituus ja säilytysolosuhteet.
|
|
|
|
Testiolosuhteet:
|
—
|
testien suorituspäivämäärät;
|
|
—
|
uuttumiskolonnien pituus ja halkaisija
|
|
—
|
maakolonnien maa-aineksen kokonaispaino
|
|
—
|
testikemikaalin määrä ja applikoidun vertailukemikaalin määrä tarvittaessa
|
|
—
|
keinosateen määrä sekä applikointitiheys ja -kesto
|
|
—
|
koejärjestelmän lämpötila
|
|
—
|
rinnakkaisnäytteiden määrä (vähintään kaksi)
|
|
—
|
testikemikaalin, hajoamistuotteiden ja tarvittaessa vertailukemikaalin analyysimenetelmät (pitoisuudet eri maasegmenteissä ja suotovesissä)
|
|
—
|
maasegmenteissä ja suotovesissä olevien hajoamistuotteiden luonnehdinta- ja määritysmenetelmät.
|
|
|
|
Testitulokset:
|
—
|
tulostaulukko, jossa tulokset on ilmoitettu pitoisuuksina ja prosenttiosuutena maasegmentteihin ja suotovesiin applikoidusta annoksesta
|
|
—
|
uuttumisetäisyydet ja tarvittaessa suhteellisen kulkeutumisen kertoimet
|
|
—
|
kaavakuva maasegmenteissä havaittujen pitoisuuksien prosenttiosuuksista maasegmentin syvyyteen nähden
|
|
—
|
tulosten tarkastelu ja tulkinta.
|
|
|
LÄHDEKIRJALLISUUS
|
(1)
|
Guth, J.A., Burkhard, N. and Eberle, D.O. (1976). Experimental Models for Studying the Persistence of Pesticides in Soil. Ind. BCPC Symposium: Persistence of Insecticides and Herbicides.
|
|
(2)
|
Russel, M.H. (1995). Recommended approaches to assess pesticide mobility in soil. In progress in Pesticide Biochemistry and Toxicology, Vol. 9 (Environmental Behaviour of Agrochemicals – T.R. Roberts and P.C. Kearney, Eds.). J. Wiley & Sons.
|
|
(3)
|
Briggs, G.G. (1981). Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficient, water solubilities, bioconcentration factors, and the parachor. J. Agric. Food Chem. 29, 1050–1059.
|
|
(4)
|
Chiou, C.T., Porter, P.E. and Schmedding, D.W. (1983). Partition equilibria of non-ionic organic compounds between soil organic matter and water. Environ. Sci. Technol. 17, 227–231.
|
|
(5)
|
Guth, J.A. (1983). Untersuchungen zum Verhalten von Pflanzenschutzmitteln im Boden. Bull. Bodenkundliche Gesellschaft Schweiz 7, 26–33.
|
|
(6)
|
US-Environmental Protection Agency (1982). Pesticide Assessment Guidelines, Subdivision N, Chemistry: Environmental Fate.
|
|
(7)
|
Agriculture Canada (1987). Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada.
|
|
(8)
|
Komission direktiivin 95/36/EY, annettu 14 päivänä heinäkuuta 1995, kasvinsuojeluaineiden markkinoille saattamisesta annetun neuvoston direktiivin 91/414/ETY muuttamisesta (ETA:n kannalta merkityksellinen teksti), liite I, EYVL L 172, 22.7.1995, s. 8.
|
|
(9)
|
Dutch Commission for Registration of Pesticides (1991). Application for registration of a pesticide. G jakso: Behaviour of the product and its metabolites in soil, water and air.
|
|
(10)
|
BBA (1986). Richtlinie für die amtliche Prüfung von Pflanzenschutzmitteln, Teil IV, 4-2. Versickerungsverhalten von Pflanzenschutzmitteln.
|
|
(11)
|
SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed.
|
|
(12)
|
OECD (1995). Guidance Document on Acute Inhalation Toxicity Testing. Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italy, 18–20 January 1995.
|
|
(13)
|
Tämän liitteen seuraavat luvut:
|
|
Luku A.8 Jakaantumiskerroin (ravistuspullomenetelmä)
|
|
|
Luku A.25 Jakaantumiskerroin (HPLC-menetelmä)
|
|
|
Luku C.7 Hajoaminen – abioottinen hajoaminen: hydrolyysi pH:n funktiona
|
|
|
Luku C.18 Adsorptio/desorptio erätasapainomenetelmää käyttäen
|
|
|
Luku C.23 Kemikaalien aerobinen ja anaerobinen hajoaminen maaperässä.
|
|
|
(14)
|
Soil Texture Classification (US and FAO systems). Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Ind. 26, 305 (1962).
|
|
(15)
|
Methods of Soil Analysis (1986). Part 1, Physical and Mineralogical Methods (A. Klute, Ed.). Agronomy Series No. 9, 2nd Edition.
|
|
(16)
|
Methods of Soil Analysis (1982). Part 2, Chemical and Microbiological Methods (A.L. Page, R.H. Miller and D.R. Kelney, Eds.). Agronomy Series No. 9, 2nd Edition.
|
|
(17)
|
ISO Standard Compendium Environment (1994). Soil Quality – General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition.
|
|
(18)
|
Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt/Main.
|
|
(19)
|
Scheffer, F. and Schachtschabel, P. (1998). Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart.
|
|
(20)
|
Weber, J.B. and Peeper, T.F. (1977). In Research Methods in Weed Science, 2nd Edition (B. Truelove, Ed.). Soc. Weed Sci., Auburn, Alabama, 73–78.
|
|
(21)
|
Weber, J.B., Swain, L.R., Strek, H.J. and Sartori, J.L. (1986). In Research Methods in Weed Science, 3rd Edition (N.D. Camper, Ed.). Soc. Weed Sci., Champaign, IL, 190–200.
|
|
(22)
|
Oliveira, et al. (1996). Packing of sands for the production of homogeneous porous media. Soil Sci. Soc. Soc. Amer. J. 60(1): 49–53.
|
|
(23)
|
Shackelford, C. D. (1991). Laboratory diffusion testing for waste disposal. – A review. J. Contam. Hydrol. 7, 177–217.
|
|
(24)
|
(Hamaker, J.W. (1975). Interpretation of soil leaching experiments. In Environmental Dynamics of Pesticides (R. Haque, V.H. Freed, Eds), 115–133. Plenum Press, New York.
|
|
(25)
|
OECD (1981). Guidance Document on Acute Inhalation Toxicity Testing. Dissociation constants in water. OECD Guideline for Testing of Chemicals, No. 4112, OECD, Paris.
|
Lisäys 1
Määritelmät ja yksiköt
Vanhentuneessa maa-aineksessa oleva jäämä
: maa-aineksessa oleva testikemikaali ja sen hajoamistuotteet applikoinnin jälkeen ja kun kulkeutumis-, adsorptio-, metabolia- ja häviämisprosessien kannalta riittävän pitkä aika applikoidun kemikaalin jakaantumisen ja kemiallisten ominaisuuksien muuttumiseksi ainakin osittain (1).
Keinosade
: 0,01 M CaCl2-liuos tislatussa tai deionisoidussa vedessä.
Keskimääräinen uuttumisetäisyys
: sen maa-ainesosan pohja, jossa kemikaalin kumulatiivinen saanto = 50 prosenttia testikemikaalin kokonaissaannosta [normaali uuttumiskoe] tai (sen maa-ainesosan pohja, jossa kemikaalin kumulatiivinen saanto = 50 prosenttia testikemikaalin kokonaissaannosta) – ((vanhentuneiden jäämien kerroksen paksuus)/2) [vanhentuneiden jäämien uuttumistutkimus].
Kemikaali
: aine tai seos.
Suotovesi
: vesifaasi, joka on suodattunut maalajien tai maakolonnin läpi (1).
Uuttuminen
: prosessi, jossa kemikaali kulkeutuu maalajien tai maakolonnin läpi alaspäin (1).
Uuttumisetäisyys
: syvin maasegmentti, josta löytyi ≥ 0,5 prosenttia applikoidusta testikemikaalista tai vanhentuneesta jäämästä uuttumisprosessin jälkeen (sama kuin tunkeutumissyvyys).
Havaitsemisraja (LOD) ja määritysraja (LOQ)
: havaitsemisraja (limit of detection, LOD) on se kemikaalin pitoisuus, jonka alapuolella ainetta ei voida erottaa määritysartefakteista. Määritysraja (limit of quantification, LOQ) on se kemikaalin pitoisuus, jonka alapuolella pitoisuutta ei voida määrittää hyväksyttävällä tarkkuudella.
RMF Relative Mobility Factor, suhteellisen kulkeutumisen kerroin
: (testikemikaalin uuttumisetäisyys (cm)) / (vertailukemikaalin uuttumisetäisyys (cm))
Testikemikaali
: tätä testimenetelmää käyttäen testattu aine tai seos.
Hajoamistuote
: kaikki kemikaalit, jotka syntyvät testiaineen bioottisista tai abioottisista hajoamisreaktioista, mukaan luettuina CO2 ja tuotteet, jotka ovat sitoutuneet jäämiin.
Maaperä
: pienten organismien (pääasiassa mikro-organismien) eloperäiseksi tekemä sekoitus mineraalisia ja orgaanisia kemiallisia ainesosia, joista jälkimmäisiin sisältyy suuren hiili- ja typpipitoisuuden sisältäviä yhdisteitä sekä molekyylipainoltaan suuria yhdisteitä. Maaperää voidaan käsitellä kahdessa eri tilassa:
|
—
|
luonnontilaisena eli siinä muodossa, johon se on ajan kuluessa kehittynyt maannostyypilleen luonteenomaisiksi kerrostumiksi;
|
|
—
|
häiriintyneenä eli siinä muodossa, jossa se yleensä esiintyy viljellyissä peltomaissa tai tätä testimenetelmää varten kaivetuissa näytteissä (2).
|
|
(1)
|
Holland, P.T. (1996). Glossary of Terms Relating to Pesticides. IUPAC Reports on Pesticide (36). Pure & Appl. Chem. 68, 1167–1193.
|
|
(2)
|
OECD Test Guideline 304 A: Inherent Biodegradability in Soil (adopted 12 May 1981).
|
Lisäys 2
Kuvio 1
Esimerkki lasisista uuttokolonneista, joita ei voida purkaa osiin
Pituus 35 cm ja sisähalkaisija 5 cm (1)

|
(1)
|
Drescher, N. (1985). Moderner Acker- und Pflanzenbau aus Sicht der Pflanzenschutzmittelindustrie. In Unser Boden – 70 Jahre Agrarforschung der BASF AG, 225–236. Verlag Wissenschaft und Politik, Köln.
|
Kuvio 2
Esimerkki metallikolonnista, jonka voi purkaa osiin (sisähalkaisija 4 cm) (1)

|
(1)
|
Burkhard, N., Eberle D.O. and Guth, J.A. (1975). Model systems for studying the environmental behaviour of pesticides. Environmental Quality and Safety, Suppl. Vol. III, 203–213.
|
Lisäys 3
Esimerkkejä useiden kasvinsuojelukemikaalien suhteellisen kulkeutumisen kertoimista
(64)
(RMF) (1)(2) ja vastaavista kulkeutumisluokista
(66)
|
RMF-vaihteluväli
|
Kemikaali (RMF)
|
Kulkeutuvuusluokka
|
|
≤ 0,15
|
Parationi (< 0,15), fluorodifeeni (0,15)
|
I
Kulkeutumaton
|
|
0,15–0,8
|
Profenofossi (0,18), propikonatsoli (0,23), diatsinoni (0,28), diuroni (0,38), terbutylatsiini (0,52), metidationi (0,56), prometryyni (0,59), propatsiini (0,64), alakloori (0,66), metolakloori (0,68)
|
II
Vähän kulkeutuva
|
|
0,8–1,3
|
Monuroni (65) (1,00), atratsiini (1,03), simatsiini (1,04), fluometuroni (1,18)
|
III
Jonkin verran kulkeutuva
|
|
1,3–2,5
|
Prometoni (1,67), syanatsiini (1,85), bromasiili (1,91), karbutilaatti (1,98)
|
IV
Melko kulkeutuva
|
|
2,5–5,0
|
Karbofuraani (3,00), dioksakarbi (4,33)
|
V
Liikkuvat lähteet
|
|
> 5,0
|
Monokrotofossi (> 5,0), dikrotofossi (> 5,0)
|
VI
Erittäin kulkeutuva
|
|
(1)
|
Guth, J.A. (1985). Adsorption/desorption. In Joint International Symposium ’Physicochemical Properties and their Role in Environmental Hazard Assessment’. Canterbury, UK, 1–3 July 1985.
|
|
(2)
|
Guth, J.A. and Hörmann, W.D. (1987). Problematik und Relevanz von Pflanzenschutzmittel-Spuren im Grund (Trink-) Wasser. Schr.Reihe Verein WaBoLu, 68, 91–106.
|
|
(3)
|
Harris, C.I. (1967). Movement of herbicides in soil. Weeds 15, 214–216.
|
|
(4)
|
Helling, C.S. (1971). Pesticide mobility in soils. Soil Sci. Soc. Soc. Am. Proc. 35, 743–748.
|
|
(5)
|
McCall, P.J., Laskowski, D.A., Swann, R.L. and Dishburger, H.J. (1981). Measurements of sorption coefficients of organic chemicals and their use in environmental fate analysis. In Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington D.C.
|
|
(6)
|
Hollis, J.M. (1991). Mapping the vulnerability of aquifers and surface waters to pesticide contamination at the national/regional scale. BCPC Monograph No. 47 Pesticides in Soil and Water, 165–174.
|
C.45. PUUNSUOJA-AINEILLA KÄSITELLYSTÄ PUUSTA AIHEUTUVIEN YMPÄRISTÖPÄÄSTÖJEN ARVIOINTI: LABORATORIOMENETELMÄ PUUTUOTTEILLE, JOTKA EIVÄT OLE PEITETTYJÄ JA JOTKA OVAT KOSKETUKSISSA MAKEAN VEDEN TAI MERIVEDEN KANSSA
JOHDANTO
|
1.
|
Tämä testimenetelmä vastaa OECD:n testiohjetta (TG) nro 313 (2007). Puunsuoja-aineilla käsitellyn puun ympäristöpäästöt on kvantifioitava, jotta käsitellyn puun ympäristöriskit voidaan arvioida. Tässä testimenetelmässä kuvataan laboratoriomenetelmä puunsuoja-aineilla käsitellyn puun päästöjen arvioimiseksi kahdessa tilanteessa, joissa päästöt voivat kulkeutua ympäristöön:
|
—
|
Päästöt makean veden kanssa kosketuksissa olevasta käsitellystä puusta: käsitellyn puun pinnalla muodostuvat päästöt voivat kulkeutua veteen.
|
|
—
|
Päästöt meriveden kanssa kosketuksissa olevasta käsitellystä puusta: käsitellyn puun pinnalla muodostuvat päästöt voivat kulkeutua meriveteen.
|
|
|
2.
|
Tämä testimenetelmä on tarkoitettu puusta ja puutuotteista, jotka eivät ole peitettyjä ja jotka ovat kosketuksissa makean veden tai meriveden kanssa, aiheutuvien päästöjen testaamiseen. Käyttöluokat ovat käytössä kansainvälisesti, ja niiden avulla luokitellaan käsitellyn tuotteen aiheuttama biologinen vaara. Käyttöluokissa määritellään myös tilanteet, joissa käsiteltyä tuotetta käytetään, sekä ympäristön osa-alueet (ilma, vesi, maaperä), joihin puunsuoja-aineilla käsitellystä puusta aiheutuva riski kohdistuu.
|
|
3.
|
Tämä testimenetelmä on laboratoriotoimenpide, jolla otetaan näytteitä käsitellyn puun kyllästämiseen käytetystä vedestä pitenevin aikavälein altistuksen jälkeen. Päästönäytteessä olevien päästöjen määrä liittyy puun pinta-alaan ja altistumisen kestoon, ja virtausta arvioidaan yksikössä mg/m2/päivä. Näin voidaan arvioida virtaus (uuttumisnopeus) pitenevien altistusjaksojen jälkeen.
|
|
4.
|
Päästöjen määrää voidaan käyttää käsitellyn puun ympäristöriskien arvioinnissa.
|
ALUSTAVAT HUOMIOT
|
5.
|
Mekanismin, jolla makea vesi saa aikaan uuttumisen puun pinnalla, ei oleteta olevan luonteeltaan ja vakavuudeltaan samanlainen kuin meriveden aikaansaaman uuttumismekanismi. Puunsuoja-aineiden tai merivesiympäristöissä käytettävän puun käsittelyyn käytettävien seosten osalta onkin siksi tutkittava meriveden aiheuttamaa uuttumista puun pinnalta.
|
|
6.
|
Siltä osin kuin kyseessä on puunsuoja-aineella käsitelty puu, tutkimuksessa tulisi käyttää kaupallisesti käytettävää puuta. Se on käsiteltävä puunsuoja-aineen valmistajan ohjeiden sekä asianmukaisten standardien ja määritysten mukaisesti. Parametrit, joiden mukaan puu viimeistellään varsinaisen käsittelyn jälkeen ennen testin aloittamista, on ilmoitettava.
|
|
7.
|
Puunäytteiden tulisi edustaa käytettäviä tuotteita (esimerkiksi lajien, tiheyden ja muiden ominaisuuksien kannalta).
|
|
8.
|
Testiä voidaan soveltaa puuhun, jonka käsittelyssä käytetään tunkeutumisprosessia tai pinta-applikointia, tai käsiteltyyn puuhun, jossa on ylimääräinen pakollinen pintakäsittely (esimerkiksi maali, jonka käyttö on kaupallisen käytön edellytys).
|
|
9.
|
Veden koostumus, määrä, pH ja fysikaalinen olomuoto ovat tärkeitä tietoja, kun määritetään puusta aiheutuvien päästöjen määrää, pitoisuutta ja luonnetta.
|
TESTIMENETELMÄN PERIAATE
|
10.
|
Testissä käytettävät, puunsuoja-aineella käsitellyt puulajit upotetaan veteen. Vesi (päästönäyte) kerätään ja analysoidaan kemiallisesti tilastollisten laskelmien kannalta riittävän monta kertaa altistusjakson aikana. Päästönopeudet, jotka ilmoitetaan yksikössä mg/m2/päivä, lasketaan analyysituloksista. Näytteenottoajankohdat on kirjattava muistiin. Testit käsittelemättömillä näytteillä voidaan lopettaa, jos kolmessa ensimmäisessä datapisteessä ei havaita lisääntymistä taustaan verrattuna.
|
|
11.
|
Kun tutkimukseen lisätään käsittelemättömiä puunäytteitä, voidaan määrittää taustatasot muusta kuin käytetystä puunsuoja-aineesta aiheutuneille puun päästöille.
|
LAATUKRITEERIT
Tarkkuus
|
12.
|
Testimenetelmän tarkkuus päästöjen arvioimisessa määräytyy sen mukaan, miten hyvin testissä käytetyt puulajit vastaavat kaupallisesti käsiteltyä puuta, miten hyvin testivesi edustaa todellista käsittelyvettä ja miten hyvin altistustapa vastaa luonnollisia olosuhteita.
|
|
13.
|
Analyysimenetelmän tarkkuus, täsmällisyys ja toistettavuus tulisi määrittää ennen testin tekemistä.
|
Uusittavuus
|
14.
|
Testissä kerätään kolme vesinäytettä, jotka analysoidaan, ja päästöarvoksi otetaan keskiarvo. Tulosten toistettavuus yhdessä laboratoriossa ja eri laboratorioiden välillä määräytyy käytetyn upotusmenetelmän ja testipuulajina käytetyn puun mukaan.
|
Tulosten hyväksyttävyyden vaihteluväli
|
15.
|
Tässä testissä tulosten vaihteluväliksi hyväksytään se, jos ylemmät ja alemmat arvot eroavat toisistaan vähemmän kuin yhden suuruusluokan.
|
TESTAUSOLOSUHTEET
Vesi
|
16.
|
Makean veden uuttumismallit: Kun on määrä arvioida makealle vedelle altistuvaa puuta, uuttumistestissä suositellaan käytettäväksi deionisoitua vettä (esimerkiksi ASTM D 1193, tyyppi II). Veden lämpötilan tulee olla 20 °C +/– 2 °C, ja mitattu pH ja veden lämpötila on ilmoitettava testiraportissa. Ennen käsiteltyjen puunäytteiden upottamista käytetystä vedestä otettujen näytteiden avulla on mahdollista estimoida vedessä olevat analysoitavat kemikaalit. Tämä on kontrolli, jonka avulla voidaan määrittää taustatasot kemikaaleille, jotka analysoidaan sen jälkeen kemiallisesti.
|
|
17.
|
Meriveden uuttumismallit: Kun on määrä arvioida merivedelle altistuvaa puuta, uuttumistestissä suositellaan käytettäväksi synteettistä merivettä (esimerkiksi ASTM D 1141, substituoitu valtamerivesi, ilman raskasmetalleja). Veden lämpötilan tulee olla 20 °C +/-2 °C, ja mitattu pH ja veden lämpötila on ilmoitettava testiraportissa. Ennen käsiteltyjen puunäytteiden upottamista käytetystä vedestä otettujen näytteiden avulla on mahdollista estimoida vedessä olevat analysoitavat kemikaalit. Tämä on kontrolli, jonka avulla voidaan analysoida tärkeiden kemikaalien taustatasot.
|
Testissä käytettävät puulajit
|
18.
|
Puulajien tulisi olla sellaisia puulajeja, joita yleensä käytetään puunsuoja-aineiden tehokkuuden testaamisessa. Suositeltavat lajit ovat Pinus sylvestris L. (metsämänty), Pinus resinosa Ait. (amerikanpunamänty) tai Pinus spp (pitkäneulasmänty). Muilla lajeilla voidaan tehdä lisätestejä.
|
|
19.
|
Testissä tulee käyttää suorasyistä puuta, jossa ei ole pahkoja. Pihkaisen materiaalin käyttöä on vältettävä. Puun tulisi olla sellaista puuta, jota yleensä on saatavana kaupallisesti. Puun lähde, tiheys ja vuosirenkaiden määrä 10:tä millimetriä kohti on kirjattava muistiin.
|
|
20.
|
Puulajinäytteinä suositellaan käytettäväksi sarjaa, joka koostuu viidestä EN 113 -standardissa määritellyn kokoisista paloista (mitat 25 mm × 50 mm × 15 mm), joiden pitkittäispinnat ovat puun syiden suuntaisia, joskin myös muunkokoisia paloja (esimerkiksi 50 mm × 150 mm x10 mm) voidaan käyttää. Testinäytteet tulee upottaa veteen kokonaan. Testinäytteiden on oltava 100-prosenttisesti pintapuuta. Jokainen näyte on merkittävä ainutkertaisesti siten, että se voidaan tunnistaa koko testin ajan.
|
|
21.
|
Kaikkien testinäytteiden on oltava höylättyjä tai höylättyä puutavaraa, eivätkä pinnat saa olla hiekkapaperilla hiottuja.
|
|
22.
|
Testissä on analysoitava vähintään viisi puunäytesarjaa: kolme näytesarjaa käsitellään puunsuoja-aineella, yksi näytesarja jätetään kokonaan käsittelemättä ja yhtä sarjaa käytetään testinäytteiden absoluuttisen kosteuspitoisuuden arviointiin ennen käsittelyä. Testinäytteitä valmistellaan riittävä määrä, jotta niistä voidaan valita kolme sarjaa näytteitä, joissa puunsuoja-aineen jäämä on 5 % testinäytepoolin keskiarvosta.
|
|
23.
|
Kaikki testinäytteet tiivistetään kemikaalilla, joka estää suoja-aineen tunkeutumisen näytteiden katkaisupintoihin tai estää aineen uuttumisen näytteestä katkaisupinnan kautta. Tiivisteen applikointia varten on erotettava näytteet, joita käytetään pinta-applikointiin, ja ne, joihin suoja-aine imeytetään. Tiivisteaine on applikoitava ennen käsittelyä ainoastaan niihin näytteisiin, joita käytetään pinta-applikoinnissa.
|
|
24.
|
Katkaisupinnan on oltava avoin upotusprosesseihin liittyville käsittelyille. Siksi näytteet on tiivistettävä vasta viimeistelyvaiheen lopussa. Päästöt tulee arvioida vain pitkittäispinta-alalta. Tiivisteaineet on tarkistettava ja applikoitava tarvittaessa uudelleen ennen uuttumisen aloittamista. Niitä ei saa applikoida uudelleen sen jälkeen, kun uuttuminen on aloitettu.
|
Upotusastia
|
25.
|
Astian on oltava inerttiä materiaalia ja tarpeeksi suuri, jotta siihen voi laittaa viisi EN 113 -standardin mukaista puunäytettä ja 500 ml vettä, jolloin pinta-ala suhteessa veden tilavuuteen on 0,4 cm2/ml.
|
Näytteiden testausrakennelma
|
26.
|
Testinäytteitä käsitellään rakennelmassa, jossa näytteiden kaikki altistuneet pinnat voivat olla kosketuksissa veden kanssa.
|
SUOJA-AINEKÄSITTELY
Käsiteltyjen testinäytteiden valmistelu
|
27.
|
Puunäytteet, jotka on tarkoitus käsitellä testissä suoja-aineella, käsitellään suoja-aineelle määritetyllä menetelmällä, joka voi olla joko upotuskäsittely tai kastamalla, ruiskuttamalla tai sivelemällä tehtävä pinta-applikointi.
|
Upotuskäsittelyssä käytettävät suoja-aineet
|
28.
|
Suoja-aineesta valmistetaan liuos, jolla saavutetaan määritetty tunkeuma tai jäämä upotuskäsittelyssä. Puutestinäyte punnitaan ja mitataan. Testissä on käytettävä sellaista upotuskäsittelyä, joka on määritetty luokassa 4 tai 5 käytettävän puun suoja-aineelle. Käsittelyn jälkeen näyte punnitaan uudestaan, ja suoja-aineen jäämä (kg/m3) lasketaan seuraavalla yhtälöllä:

|
|
29.
|
Tässä testissä voidaan käyttää teollisessa käsittelylaitoksessa käsiteltyä (esimerkiksi tyhjöpainekyllästys) puutavaraa. Käytetyt menettelyt on kirjattava muistiin, ja tällä tavalla käsitellyn materiaalin jäämä on analysoitava ja kirjattava muistiin.
|
Pinta-applikoinnissa käytettävät suoja-aineet
|
30.
|
Pinta-applikointikäsittelyssä puutestinäytteet käsitellään suoja-aineella kastamalla, ruiskuttamalla tai sivelemällä. Testissä tulee noudattaa sitä menettelyä ja applikointimäärää (esimerkiksi litraa/m2), joka kyseisen suoja-aineen pinta-applikointiin on määritetty.
|
|
31.
|
Myös tässä tapauksessa testissä voidaan käyttää teollisessa käsittelylaitoksessa käsiteltyä puutavaraa. Käytetyt menettelyt on kirjattava muistiin, ja tällä tavalla käsitellyn materiaalin jäämä on analysoitava ja kirjattava muistiin.
|
Testinäytteiden viimeistely suoja-ainekäsittelyn jälkeen
|
32.
|
Käsittelyn jälkeen käsitellyt testinäytteet on viimeisteltävä joko testattavan suoja-aineen valmistajan suositusten mukaan suoja-aineen etiketissä olevien ohjeiden perusteella, alalla noudatettavien käsittelykäytäntöjen mukaisesti tai EN 252 -standardin mukaisesti.
|
Testinäytteiden valmistelu ja valinta
|
33.
|
Käsittelyä seuraavan viimeistelyn jälkeen lasketaan testinäyteryhmän keskimääräinen jäämä, ja uuttumismittauksiin valitaan satunnaisesti kolme edustavaa näytesarjaa, joissa jäämä on viiden prosentin sisällä ryhmän keskiarvosta.
|
SUOJA-AINEPÄÄSTÖJEN MITTAUSMENETELMÄ
Upotusmenetelmä
|
34.
|
Testinäytteet punnitaan ja upotetaan sen jälkeen kokonaan veteen. Päivämäärä ja kellonaika kirjataan muistiin. Astia peitetään haihtumisen estämiseksi.
|
|
35.
|
Vesi vaihdetaan seuraavin väliajoin: 6 tuntia, 1 päivä, 2 päivää, 4 päivää, 8 päivää, 15 päivää, 22 päivää, 29 päivää (huomaa: nämä ovat kokonaisaikoja, eivät väliaikoja). Vedenvaihdon kellonaika ja päivämäärä sekä astiasta talteenotetun veden massa kirjataan muistiin.
|
|
36.
|
Jokaisen vedenvaihdon jälkeen otetaan näyte siitä vedestä, johon testinäytesarja on upotettu, kemiallista analyysia varten.
|
|
37.
|
Näytteenottomenettelyn avulla voidaan laskea päästöjen määrän profiili suhteessa aikaan. Näytteitä tulee säilyttää sellaisissa olosuhteissa, joissa analyytti säilyy, kuten jääkaapissa valolta suojattuna (pimeässä) näytteen mikrobikasvun vähentämiseksi ennen analyysia.
|
PÄÄSTÖMITTAUKSET
Käsitellyt näytteet
|
38.
|
Kerätystä vedestä analysoidaan kemiallisesti tehoaine ja/tai oleelliset hajoamistuotteet tarvittaessa.
|
Käsittelemättömät näytteet
|
39.
|
Keräämällä vettä (päästönäytettä) tästä järjestelmästä ja analysoimalla siitä käsittelemättömistä puunäytteistä uuttuneet kemikaalit on mahdollista arvioida suoja-aineen mahdollinen päästönopeus käsittelemättömästä puusta. Kun päästönäytteitä kerätään ja analysoidaan sitä mukaa kuin altistusaika pitenee, voidaan arvioida päästönopeuden muutosnopeus suhteessa aikaan. Tämä analyysi on kontrollitoimenpide, jolla määritetään testikemikaalin taustapitoisuudet käsittelemättömässä puussa sen vahvistamiseksi, ettei näytteiden lähteenä käytettyä puuta ollut käsitelty aikaisemmin suoja-aineella.
|
TIEDOT JA RAPORTOINTI
Kemialliset analyysit
|
40.
|
Kerätty vesi analysoidaan kemiallisesti, ja vesianalyysin tulos ilmaistaan asianmukaisina yksikköinä (esimerkiksi μg/l).
|
Tulosten raportointi
|
41.
|
Kaikki tulokset kirjataan muistiin. Lisäyksessä on esimerkki raportointilomakkeesta yhdelle käsiteltyjen puunäytteiden sarjalle ja yhteenvetotaulukko, jolla lasketaan keskimääräiset päästöarvot jokaiselta näytteenottokerralta.
|
|
42.
|
Vuorokausipäästövirtaus (mg/m2/päivä) lasketaan ottamalla ensin keskiarvo kolmen rinnakkaisnäytteen kolmesta mittauksesta ja jakamalla se upotuspäivien lukumäärällä.
|
Testiraportti
|
43.
|
Testiraportissa on esitettävä vähintään seuraavat tiedot:
|
—
|
testattavan suoja-aineen toimittajan nimi
|
|
—
|
testattavan suoja-aineen tarkka ja ainutkertainen nimi tai koodi
|
|
—
|
tehoaineen (-aineiden) kauppa- tai yleisnimi sekä apuaineiden (esimerkiksi apuliuotin, hartsi) geneerinen kuvaus ja ainesosien koostumus yksikössä % m/m
|
|
—
|
oleellinen jäämä tai määrä (yksikössä kg/m3 tai l/m2), joka on määritelty veden kanssa kosketuksissa olevalle puulle
|
|
—
|
käytetty puulaji, sen tiheys ja kasvunopeus renkaina jokaista 10 mm:ä kohti
|
|
—
|
testatun suoja-aineen määrä tai jäämä sekä jäämän laskemisessa käytetty yhtälö, ilmaistuna yksikössä l/m2 tai kg/m3
|
|
—
|
suoja-aineen applikointimenetelmä, jossa kuvataan myös upotusmenettelyn käsittelyaikataulu, ja mahdollisen pintakäsittelyn applikointimenetelmä
|
|
—
|
suoja-aineen applikoinnin päivämäärä sekä estimaatti testinäytteiden kosteuspitoisuudesta (ilmoitetaan prosenttiosuutena)
|
|
—
|
käytetyt viimeistelymenettelyt (niiden tyyppi, olosuhteet ja kesto)
|
|
—
|
käytetyn tiivisteaineen spesifikaatio ja applikointikertojen lukumäärä
|
|
—
|
spesifikaatio puun mahdollisesta jälkikäsittelystä (esimerkiksi tiedot maalin valmistajasta, tyypistä, ominaisuuksista ja määrästä)
|
|
—
|
jokaisen upotuskerran kellonaika ja päivämäärä, jokaisella kerralla testinäytteiden upottamisessa käytetty vesimäärä ja puuhun upotuksessa imeytyneen veden määrä
|
|
—
|
kaikki poikkeukset kuvatusta menetelmästä ja kaikki tekijät, jotka ovat voineet vaikuttaa tuloksiin.
|
|
LÄHDEKIRJALLISUUS
|
(1)
|
European Standard, EN 84 – 1997. Wood preservatives. Accelerated ageing of treated wood prior to biological testing. Leaching procedure.
|
|
(2)
|
European Standard, EN 113/A1 – 2004. Wood preservatives. Test method for determining the protective effectiveness against wood destroying basidiomycetes. Determination of the toxic values.
|
|
(3)
|
European Standard, EN 252 – 1989. Field test method for testing the relative protective effectiveness of a wood preservative in ground contact.
|
|
(4)
|
European Standard, EN 335 – Part 1: 2006. Durability of wood and wood-based products – Definition of use classes – Part 1: kenraali.
|
|
(5)
|
American Society for Testing and Materials Standards, ASTM D 1141 – 1998. Standard Practice for the Preparation of Substitute Ocean Water, Without Heavy Metals. Annual Book of ASTM Standards, Volume 11.02.
|
|
(6)
|
American Society for Testing and Materials Standards, ASTM D 1193-77 Type II – 1983. Specifications for Reagent Water. Annual Book of ASTM Standards, Volume 11.01.
|
Lisäys 1
Testimenetelmän raportointilomake
Puunsuoja-aineilla käsitellystä puusta aiheutuvien ympäristöpäästöjen arviointi: Laboratoriomenetelmä puutuotteille, jotka eivät ole peitettyjä ja jotka ovat kosketuksissa makean veden tai meriveden kanssa
|
Testauslaitos
|
|
|
Puunsuoja-aine
|
|
Suoja-aineen valmistaja
|
|
|
Suoja-aineen tarkka ja ainutkertainen nimi tai koodi
|
|
|
Suoja-aineen kauppa- tai yleisnimi
|
|
|
Apuaineet
|
|
|
Veden kanssa kosketuksissa olevan puun jäämäarvo
|
|
|
Hakemukset
|
|
Applikointimenetelmä
|
|
|
Soveltamispäivä
|
|
|
Jäämän laskemisessa käytetty yhtälö:
|
|
|
Vakauttamismenettely
|
|
|
Viimeistelyn kesto
|
|
|
Tiivisteaine / applikointikertojen lukumäärä
|
|
|
Jälkikäsittely
|
tarvittaessa
|
|
Testikappaleet
|
|
Puulaji
|
|
|
Puun tiheys
|
(vähimmäisarvo … keskiarvo … enimmäisarvo)
|
|
Kasvunopeus (renkaita jokaista 10 mm:ä kohti)
|
(vähimmäisarvo … keskiarvo … enimmäisarvo)
|
|
Kosteuspitoisuus
|
|
|
Testirakennelmat
(67)
|
Jäämä (esimerkiksi kg/m3)
|
|
Käsitelty ’x’
|
Viiden näytteen keskiarvo, keskihajonta tai vaihteluväli
|
|
Käsitelty ’y’
|
Viiden näytteen keskiarvo, keskihajonta tai vaihteluväli
|
|
Käsitelty ’z’
|
Viiden näytteen keskiarvo, keskihajonta tai vaihteluväli
|
|
Käsittelemätön
|
|
|
Testimenetelmän parametrien vaihtelu
|
Esimerkiksi veden laatu, testinäytteiden koko jne.
|
|
Aika
|
Veden vaihto
|
Näytteen massa
|
Veden imeytymä
|
Vesinäyte
|
|
Käsitelty (keskiarvo)
|
Käsittelemätön
|
Käsitelty (keskiarvo)
|
Käsittelemätön
|
|
Testivesi
|
x
|
y
|
z
|
|
|
Pvm.
|
g
|
g
|
g
|
g
|
nro
|
pH
|
pH
|
pH
|
pH
|
|
alku
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 h
|
|
|
|
|
|
1
|
|
|
|
|
|
24 h
|
|
|
|
|
|
2
|
|
|
|
|
|
2 d
|
|
|
|
|
|
3
|
|
|
|
|
|
4 d
|
|
|
|
|
|
4
|
|
|
|
|
|
8 d
|
|
|
|
|
|
5
|
|
|
|
|
|
15 d
|
|
|
|
|
|
6
|
|
|
|
|
|
22 d
|
|
|
|
|
|
7
|
|
|
|
|
|
29 d
|
|
|
|
|
|
8
|
|
|
|
|
|
|
|
Laadi erilliset taulukot jokaiselle tehoaineelle
|
Aika
|
Veden vaihto
|
Analyysitulokset
|
|
Käsittelemättömät näytteet
|
Käsitellyt näytteet
|
|
Tehoaineen pitoisuus vedessä
mg/l
|
Päästömäärä
mg/m2
|
Päästönopeus
mg/m2/d
|
Tehoaineen pitoisuus vedessä
|
Päästömäärä
|
Päästönopeus
|
|
x
|
y
|
z
|
Keskiarvo
|
x
|
y
|
z
|
Keskiarvo
|
x
|
y
|
z
|
Keskiarvo
|
|
|
Pvm.
|
mg/l
|
mg/l
|
mg/l
|
mg/l
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2/d
|
mg/m2/d
|
mg/m2/d
|
mg/m2/d
|
|
6 h
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
24 h
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 d
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 d
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 d
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15 d
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
22 d
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
29 d
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Huomautus: Koska käsittelemättömiä näytteitä koskevia tuloksia on mahdollisesti käytettävä käsiteltyjen näytteiden päästönopeuksien korjaamiseen, käsittelemättömien näytteiden tulokset on määritettävä ensin, ja kaikki käsiteltyjä näytteitä koskevat tulokset ovat ’korjattuja arvoja’. Korjaus voi olla tarpeen myös alkuperäisen vesianalyysin osalta.
Lisäys 2
Määritelmät
Kemikaali
: aine tai seos
Testikemikaali
: tätä testimenetelmää käyttäen testattu aine tai seos.
C.46. BIOKERTYVYYS SEDIMENTIN POHJA-AINEKSESSA ELÄVISSÄ HARVASUKASMADOISSA
JOHDANTO
|
1.
|
Tämä testimenetelmä vastaa OECD:n testiohjetta (TG) nro 315 (2008). Sedimenttiä ravinnokseen nielevät pohjaeläimet saattavat altistua sedimenttiin sitoutuneille aineille (1). Näistä sedimenttiä nielevistä eläimistä vedessä elävillä harvasukasmadoilla on tärkeä tehtävä vesijärjestelmien pohjalla. Ne elävät sedimentissä ja ovat usein runsaslukuisimpia lajeja etenkin sellaisissa elinympäristöissä, joiden ympäristöolosuhteet ovat muille eläimille haitallisia. Koska nämä eläimet muokkaavat sedimenttiä ja koska ne ovat myös saaliseläimiä, ne voivat vaikuttaa voimakkaasti haitallisten aineiden biologiseen saatavuuteen muille organismeille, kuten pohjaeläimiä syöville kaloille. Toisin kuin pohjan päällä elävät organismit, vedenpohjassa elävät harvasukaismadot kaivautuvat sedimenttiin ja nielevät ravinnokseen sedimenttihiukkasia sedimentin pinnan alta. Tämän vuoksi nämä organismit altistuvat haitallisille aineille monia reittejä pitkin, kuten suorassa kosketuksessa niihin, kontaminoituneita sedimenttihiukkasia nielemällä sekä huokosveden ja yläpuolisen veden kautta. Joitakin vedenpohjassa elävien harvasukasmatojen lajeja, joita käytetään nykyään ekotoksikologisissa testeissä, on kuvattu liitteessä 6.
|
|
2.
|
Aineen biokertyvyyttä kuvaavia parametreja ovat ennen kaikkea biokertyvyystekijä (BAF), sedimentin kertymävakio (ks) ja eliminaatiovakio (ke). Näiden määritelmien tarkat kuvaukset ovat lisäyksessä 1.
|
|
3.
|
Jotta voidaan arvioida aineiden yleistä biokertyvyyspotentiaalia ja tutkia sellaisten aineiden biokertyvyyttä, jotka voivat jakaantua sedimenttien sisään tai niiden päälle, tarvitaan osa-aluekohtainen testimenetelmä (1) (2) (3) (4).
|
|
4.
|
Tämä testimenetelmä on suunniteltu sedimentteihin liittyvien aineiden biokertyvyyden arvioimiseen pohjan sisällä elävissä harvasukaismadoissa. Testiaine lisätään sedimenttiin. Tällaisen sedimentin käyttämisen on määrä simuloida kontaminoitunutta sedimenttiä.
|
|
5.
|
Tämä menetelmä perustuu nykyisin sedimentin myrkyllisyyttä ja biokertyvyyttä koskeviin testimenetelmiin (1) (4) (5) (6) (7) (8) (9). Muita hyödyllisiä asiakirjoja ovat kansainvälisen työpajan (11) keskustelut ja tulokset sekä kansainvälisen rengastestin (12) tulokset.
|
|
6.
|
Tämä testi soveltuu vakaille neutraaleille orgaanisille aineille, joita voi kertyä sedimentteihin. Tällä menetelmällä voidaan mitata myös sedimentteihin kertyviä vakaita metallo-orgaanisia yhdisteitä (12). Sen sijaan menetelmää ei voi soveltaa metalleihin ja muihin hivenaineisiin (11) muuttamatta testin rakennetta substraattien ja veden tilavuuksien ja mahdollisesti myös kudosnäyteotoksen koon osalta.
|
TESTIAINETTA KOSKEVAT VAATIMUKSET JA TIEDOT
|
7.
|
Tällä hetkellä käytettävissä on vain muutamia hyvin vakiintuneita kvantitatiivisia rakenne-aktiivisuussuhde (QSAR) -malleja, jotka koskevat biokertyvyysprosesseja. Yleisimmin käytetty suhde on vakaiden orgaanisten aineiden ja niiden lipofiilisyyden välinen korrelaatio (ilmaistuna oktanoli-vesi-jakaantumiskertoimen logaritmina (log Kow); ks. määritelmä lisäyksestä 1). Tämä malli on laadittu kuvaamaan aineen jakaantumista veden ja kalan välillä. Tätä suhdetta käyttämällä on määritetty myös sedimenttikerrosta koskevia korrelaatioita (15) (16) (17) (18). Korrelaatiosta ’log Kow-log BCF’ pääasiallisena QSAR-mallina voi olla apua tehtäessä ensimmäisiä alustavia arvioita sedimenttiin kertyvien aineiden biokertyvyyspotentiaalista. BAF-arvoon voivat kuitenkin vaikuttaa testiorganismin lipidipitoisuus ja sedimentin orgaanisen hiilen pitoisuus. Sen vuoksi myös orgaaninen hiili-vesi -jakaantumiskerrointa (Koc) voi käyttää sedimenttiin kertyvien orgaanisten aineiden biokertyvyyden pääasiallisena määrittimenä.
|
|
8.
|
Tämä testi soveltuu seuraaviin aineisiin:
|
—
|
vakaat orgaaniset aineet, joiden log Kow -arvot ovat 3,0–6,0 (5)(19), ja superlipofiiliset aineet, joiden log Kow on suurempi kuin 6,0 (5)
|
|
—
|
aineet, jotka kuuluvat sellaisten orgaanistenaineiden luokkaan, joiden biokertyvyyspotentiaali eläviin organismeihin on tiedossa, kuten pinta-aktiiviset aineet tai erittäin adsorptiiviset aineet (ts. joiden Koc-arvo on suuri).
|
|
|
9.
|
Tietoa testiaineesta (turvallisuustoimenpiteet, asianmukaiset säilytysolosuhteet ja stabiilisuus) ja analyysimenetelmistä on hankittava ennen tutkimuksen aloittamista. Lähdeviitteessä (20) ja (21) annetaan lisäohjeita sellaisten aineiden testauksesta, joiden fysikaalis-kemialliset ominaisuudet vaikeuttavat niiden testaamista. Ennen biokertyvyyttä koskevan testin tekemistä vedessä elävillä harvasukasmadoilla testiaineesta on oltava saatavilla seuraavat tiedot:
|
—
|
yleisnimi, kemiallinen nimi (mieluiten IUPAC-nimi), rakennekaava, CAS-numero, puhtaus
|
|
—
|
vesiliukoisuus [testimenetelmä A.6 (22) ]
|
|
—
|
oktanoli-vesi-jakaantumiskerroin, Kow [testimenetelmät A.8, A.24 (22)]
|
|
—
|
sedimentti-vesi-jakaantumiskerroin, ilmaistuna arvoina Kd tai Koc [testimenetelmä C.19 (22)]
|
|
—
|
hydrolyysi [testimenetelmä C.7 (22)]
|
|
—
|
valokemiallinen muuntuminen vedessä (23)
|
|
—
|
höyrynpaine [testiohje A.4 (22)]
|
|
—
|
nopea biohajoavuus [testimenetelmät C.4 ja C.29 (22)]
|
|
—
|
pintajännitys [testimenetelmä A.5 (22)]
|
|
—
|
kriittinen misellipitoisuus (24).
|
Lisäksi seuraavat tiedot – jos saatavilla – olisivat oleellisia:
|
—
|
biohajoavuus vesiympäristössä [testimenetelmät C.24 ja C.25 (22)]
|
|
|
10.
|
Radioleimatut testiaineet saattavat helpottaa veden, sedimentin ja biologisten näytteiden analysointia, ja niitä voidaan käyttää sen määrittämiseen, onko hajoamistuotteiden tunnistaminen ja kvantifioiminen tarpeen. Tässä kuvattu menetelmä validoitiin kansainvälisessä rengastestissä (12), jossa tarkasteltiin 14C-leimattuja aineita. Jos radioaktiiviset kokonaisjäämät mitataan, biokertyvyyskerroin (BAF) perustuu alkuperäiseen aineeseen kaikki jäljellä olevat hajoamistuotteet mukaan luettuina. Biokertyvyystutkimukseen on mahdollista yhdistää myös metaboliatutkimus, kun analysoidaan ja kvantifioidaan alkuperäisen aineen ja sen hajoamistuotteiden prosenttiosuudet näytteistä, jotka otetaan kertymävaiheen lopussa tai biokertyvyyden huipputasolla. Joka tapauksessa on suositeltavaa, että BAF lasketaan organismeissa olevan alkuperäisen aineen pitoisuuden eikä pelkästään radioaktiivisten kokonaisjäämien perusteella.
|
|
11.
|
Testiaineen ominaisuuksien lisäksi tarvitaan tietoa myös aineen myrkyllisyydestä testissä käytettäville harvasukasmadoille, kuten tieto mediaanista tappavasta pitoisuudesta (LC50) kertymävaiheeseen kuluvan ajan määrittämiseksi, jotta voidaan varmistaa, että valitut altistuspitoisuudet ovat paljon pienemmät kuin myrkylliset pitoisuudet. Ensisijaista olisi käytettävä subletaalien tutkittavien ominaisuuksien pitkäaikaisista tutkimuksista johdettuja myrkyllisyysarvoja (EC50), jos sellaisia on saatavilla. Jos näitä tietoja ei ole saatavilla, hyödyllisiä tietoja voidaan saada välittömän myrkyllisyyden testistä, jotka on tehty samanlaisissa olosuhteissa kuin biokertyvyystestit, tai muita surrogaattilajeja koskevista myrkyllisyystiedoista.
|
|
12.
|
Testiliuoksissa, sedimentissä ja biologisessa aineksessa olevan aineen kvantifioimiseksi täytyy olla käytettävissä sopiva määritysmenetelmä, jonka tarkkuus, täsmällisyys ja herkkyys tunnetaan. Käytettävissä on oltava myös näytteen valmistusta ja säilyttämistä koskevat tiedot sekä materiaalin käyttöturvallisuustiedotteet. Tiedossa on oltava myös testiaineen analyyttiset havaintorajat vedessä, sedimentissä ja madon kudoksissa. Jos testissä käytetään radioleimattua testiainetta, myös ominaisradioaktiivisuus (ts. Bq mol– 1), radioleimatun atomin sijainti ja sen radioaktiivisuuden prosenttiosuus, johon liittyy epäpuhtauksia, on tiedettävä. Testiaineen ominaisradioaktiivisuuden tulisi olla mahdollisimman suuri, jotta testissä havaitaan mahdollisimman pieniä testipitoisuuksia (11).
|
|
13.
|
Lisäksi saatavilla olisi oltava tiedot käytettävän sedimentin ominaisuuksista (ts. sedimentin tai sen ainesosien alkuperä, pH ja huokosveden ammoniakkipitoisuus (kenttäsedimentit), orgaanisen hiilen pitoisuus (TOC), hiukkaskokojakauma (hiekan, siltin ja saven prosenttiosuudet) sekä prosentuaalinen kuivapaino) (6).
|
TESTIN PERIAATE
|
14.
|
Testi koostuu kahdesta vaiheesta: kertymävaiheesta (altistus) ja eliminaatiovaiheesta (altistuksen jälkeen). Kertymävaiheessa madot altistetaan sedimentille, johon on lisätty testiainetta ja jonka päälle on lisätty synteettistä vettä ja joka on tasapainotettu tarpeen mukaan (11). Kontrollimatoryhmiä pidetään samanlaisissa olosuhteissa ilman testiainetta.
|
|
15.
|
Eliminaatiovaiheessa madot siirretään sedimentti-vesi-järjestelmään, jossa ei ole testiainetta. Eliminaatiovaihe tarvitaan siksi, että saataisiin tietoa nopeudesta, jolla testiaine erittyy pois testiorganismeista (19) (25). Eliminaatiovaihe vaaditaan aina, ellei testiaineen kertymä altistusvaiheen aikana ole ollut merkityksetöntä (ts. kun testiaineen pitoisuudessa testi- ja kontrollimadoilla ei ole tilastollista eroa). Jos kertymävaiheen aikana ei saavuteta vakaata tilaa, kinetiikkamääritykset – BAFk, kertymä- ja eliminaationopeusvakio(t) – voidaan tehdä käyttämällä eliminaatiovaiheen tuloksia. Testikemikaalin pitoisuuden muutosta madoissa ja matojen pinnalla seurataan testin kummassakin vaiheessa.
|
|
16.
|
Kertymävaiheen aikana mittauksia tehdään siihen saakka, kunnes BAF saavuttaa tasannevaiheen tai vakaan tilan. Oletusarvoisesti kertymävaiheen tulisi kestää 28 päivää. Käytännön kokemus on osoittanut, että 12–14 päivän mittainen kertymävaihe riittää monille vakaille neutraaleille orgaanisille aineille vakaan tilan saavuttamiseen (6) (8) (9).
|
|
17.
|
Jos vakaata tilaa ei kuitenkaan saavuteta 28 päivän kuluessa, eliminaatiovaihe aloitetaan siirtämällä altistuneet harvasukasmadot astioihin, jotka sisältävät samaa väliainetta ilman testiainetta. Eliminaatiovaihe päättyy, kun saavutetaan joko 10 prosentin pitoisuustaso madoilla kertymävaiheen päivänä 28 mitattuna, tai 10 päivän enimmäiskesto. Matojen jäämäpitoisuus eliminaatiovaiheen lopussa kirjataan ylimääräisenä tutkittavana ominaisuutena eli eliminoitumattomina jääminä (Non-Eliminated Residues, NER). Biokertyvyyskerroin (BAFss) lasketaan mielellään sekä madoissa (Ca) ja sedimentissä (Cs) olevan pitoisuuden suhteena, kun vakaa tila näyttää olevan saavutettu, että kineettisenä biokertyvyyskertoimena BAFK, joka tarkoittaa sedimentin kertymävakion (ks) ja eliminaatiovakion (ke) välistä suhdetta, kun oletetaan, että reaktio noudattaa ensimmäisen asteen kinetiikkaa. Jos vakaata tilaa ei saavuteta 28 päivän kuluessa, BAFK lasketaan kertymä- ja eliminaatiovakioiden perusteella. Lisätietoja laskemisesta on lisäyksessä 2. Jos reaktio ei noudata ensimmäisen asteen kinetiikkaa, on käytettävä monimutkaisempia malleja (lisäys 2 ja lähdeviite (25)).
|
|
18.
|
Jos vakaata tilaa ei saavuteta 28 päivän kuluessa, kertymävaihetta voidaan valinnaisesti pidentää, jolloin altistuneiden matojen ryhmille – mikäli saatavilla – tehdään lisää mittauksia, kunnes vakaa tila saavutetaan. Eliminaatiovaihetta ei saa kuitenkaan aloittaa kertymävaiheen päivänä 28.
|
|
19.
|
Kertymävakio, eliminaatiovakio (tai vakiot, jos käytetään monimutkaisempia malleja), kineettinen biokertyvyystekijä (BAFK) ja mahdollisuuksien mukaan näiden parametrien luottamusvälit lasketaan tietokonemalleilla (mallit ovat lisäyksessä 2). Mallin soveltuvuuden voi määrittää esimerkiksi korrelaatiokertoimella tai determinaatiokertoimella (soveltuvuus on hyvä, jos kerroin on lähellä yhtä).
|
|
20.
|
Sellaisia orgaanisia aineita, joiden lipofiilisyys on suuri, koskevien testitulosten vaihtelun vähentämiseksi biokertyvyyskertoimet on ilmaistava myös suhteessa testiorganismien lipidipitoisuuteen ja sedimentin orgaanisen hiilen pitoisuuteen (TOC) (biota-sedimentti-kertyvyyskerroin tai BSAF kilossa sedimentin TOC-pitoisuutta / kilossa madon lipidipitoisuutta). Tämä lähestymistapa perustuu sellaista vesiympäristöä koskeviin kokemuksiin ja teoreettisiin korrelaatioihin, joissa – tiettyjen kemikaaliluokkien osalta – aineen biokertyvyyspotentiaalin ja sen lipofiilisyyden välillä on selvä suhde, joka on osoitettu varmasti käytettäessä kalaa malliorganismina (14) (25) (27). Myös testikalan lipidipitoisuuden ja tällaisten aineiden havaitun biokertyvyyden välillä on suhde. Samanlaisia korrelaatioita on löydetty pohjaeläinten yhteydessä (15) (16) (17) (18). Jos matojen kudosta on saatavilla riittävästi, testieläinten lipidipitoisuus voidaan määrittää käyttämällä samaa biologista ainesta, jota käytettiin testikemikaalin pitoisuuden määrittämiseen. On kuitenkin hyvä käyttää totutettuja kontrollieläimiä ainakin kertymävaiheen alussa tai – mieluiten – lopussa lipidipitoisuuden mittaamiseen, ja tätä arvoa voidaan käyttää myöhemmin BAF-arvojen normaalistamisessa.
|
TESTIN VALIDITEETTI
|
21.
|
Testi on validi, jos seuraavat edellytykset täyttyvät:
|
—
|
Matojen kumulatiivinen kuolleisuus (kontrollit ja käsitellyt eläimet) testin loppuun mennessä saisi olla enintään 20 prosenttia matojen alkuperäisestä määrästä.
|
|
—
|
Lisäksi olisi osoitettava, että madot kaivautuvat sedimenttiin mahdollisimman suuren altistuksen varmistamiseksi. Ks. tarkemmin 28 kohta.
|
|
MENETELMÄN KUVAUS
Testilajit
|
22.
|
Testissä voidaan käyttää useita vedessä eläviä harvasukasmatolajeja. Yleisimmin käytetyt lajit on lueteltu liitteessä 6.
|
|
23.
|
Myrkyllisyystestit (96 tuntia, vain vedessä) on tehtävä säännöllisin väliajoin (esimerkiksi joka kuukausi) myrkyllisellä vertailuaineella, kuten kaliumkloridilla (KCl) tai kuparisulfaatilla (CuSO4), testieläinten terveydentilan määrittämiseksi (1) (6). Jos vertailevia myrkyllisyystestejä ei tehdä säännöllisin väliajoin, sedimentin biokertyvyystestissä käytettyjen organismien erä on tarkastettava käyttämällä myrkyllistä vertailuainetta. Myös lipidipitoisuuden mittaamisesta voidaan saada hyödyllistä tietoa eläinten voinnista.
|
Testiorganismien kasvattaminen
|
24.
|
Jotta matoja olisi riittävästi biokertyvyystestejä varten, matoja voidaan joutua pitämään pysyvässä yhden lajin laboratorioviljelmässä. Yhteenveto valittujen testilajien kasvattamismenetelmistä laboratoriossa on lisäyksessä 6. Katso tarkempia tietoja lähdeviitteistä (8) (9) (10) (18) (28) (29) (30) (31) (32).
|
Laitteisto
|
25.
|
Missään laitteiston osissa ei saa käyttää materiaaleja, jotka voivat liuottaa tai adsorboida testiainetta, joista voi liueta muita aineita ja jotka voivat vaikuttaa haitallisesti testieläimiin. Testissä voidaan käyttää normaaleja suorakulmaisia tai lieriömäisiä astioita, jotka on valmistettu kemiallisesti inertistä materiaalista ja jotka ovat riittävän tilavia testimatojen täyttöasteeseen nähden. Pehmeiden muoviputkien käyttämistä veden tai ilman annostelemiseen tulee välttää. Kaikissa laitteissa, jotka ovat kosketuksissa testiväliaineeseen, on käytettävä polytetrafluoroetyleenistä, ruostumattomasta teräksestä ja/tai lasista valmistettuja osia. Jos aineiden adsorptiokerroin on suuri, kuten synteettisillä pyretroideilla, voi olla tarpeen käyttää silanoitua lasia. Tällöin välineet on heitettävä pois käytön jälkeen (5). Radioleimattujen ja haihtuvien testiaineiden yhteydessä on vältettävä aineiden haihtumista ja haihtuneen testiaineen poistumista. Testiastioista mahdollisesti höyrystyvien jäämien keräämiseen on käytettävä loukkuja (esimerkiksi lasisia kaasunpesupulloja), jotka sisältävät sopivia absorbentteja.
|
Vesi
|
26.
|
Yläpuolisen veden on oltava laadultaan sellaista, että koe-eläimet pysyvät siinä totuttautumisvaiheen ja testin ajan elossa ilman, että niiden ulkonäössä tai käyttäytymisessä havaitaan mitään poikkeavaa. Testeissä ja matojen laboratorioviljelmien yläpuolisena vetenä suositellaan käytettäväksi testimenetelmän C.1 (25) mukaista synteettistä vettä. On osoitettu, että useat koe-eläimet pysyvät elossa, kasvavat ja lisääntyvät tällaisessa vedessä (8), minkä ansiosta testi- ja kasvatusolosuhteet ovat erittäin vakiot. Vedestä on luonnehdittava vähintään sen pH, johtavuus ja kovuus. Hyödyllistä tietoa saatetaan saada, jos vedestä analysoidaan mikrosaasteet ennen käyttöä (lisäys 4).
|
|
27.
|
Veden laadun on oltava tasainen testin ajan. Yläpuolisen veden pH:n on oltava 6–9. Testin alussa veden kokonaiskovuuden tulee olla 90–400 mg CaCO3:a litrassa (7). Edellä mainitun synteettisen veden pH:n ja kovuuden vaihteluväli on ilmoitettu testimenetelmässä C.1 (25). Jos on aihetta epäillä kovuusionien ja testiaineen välistä yhteisvaikutusta, on käytettävä pehmeämpää vettä. Lisäyksessä 4 on yhteenveto hyväksyttävän laimennusveden muista kriteereistä OECD:n testiohjeen (TG) nro 210 (34) mukaisesti.
|
Sedimentti
|
28.
|
Testissä käytettävän sedimentin on oltava laadultaan sellaista, että testiorganismit pysyvät siinä elossa ja mielellään myös lisääntyvät totuttautumisvaiheen ja testin aikana ilman, että niiden ulkonäössä tai käyttäytymisessä havaitaan mitään poikkeavaa. Matojen tulisi kaivautua sedimenttiin. Kaivautuminen voi vaikuttaa altistukseen ja myös BAF-kertoimeen. Jos testiorganismit välttelevät sedimenttiä tai kaivautumista, se on kirjattava muistiin, mikäli tällaisten havaintojen tekeminen on yläpuolisen veden sameuden vuoksi mahdollista. Matojen (kontrollien ja käsiteltyjen matojen) tulisi kaivautua sedimenttiin 24 tunnin kuluessa niiden laittamisesta testiastioihin. Jos havaitaan jatkuvaa kaivautumisen epäonnistumista tai sedimentin välttelyä (esimerkiksi yli 20 prosentilla yli puolet kertymävaiheen kestosta), se on merkki siitä, että joko testiolosuhteet eivät ole asianmukaiset tai että testiorganismit eivät ole terveitä tai että testiaineen pitoisuus aiheuttaa tällaista käyttäytymistä. Tässä tapauksessa testi on lopetettava ja toistettava parannetuissa olosuhteissa. Lisää tietoa sedimentin nielemisestä voidaan saada käyttämällä lähdeviitteissä (35) ja (36) kuvattuja menetelmiä, joissa selvitetään, miten testiorganismit nielevät sedimenttiä tai valitsevat hiukkasia. Jos havainnointi on mahdollista, ainakin tiedot sedimentin pinnalla olevista ulostepelleteistä, jotka ovat merkki siitä, että madot nielevät sedimenttiä, tai niiden puuttumisesta on kirjattava muistiin ja otettava huomioon testitulosten tulkinnassa altistumisreittien kannalta.
|
|
29.
|
Sekä testeissä että matojen laboratorioviljelmissä suositellaan käytettäväksi keinomaahan perustuvaa keinosedimenttiä, jota on kuvattu testimenetelmässä C.8 (40), koska riittävän laadukasta luonnonsedimenttiä ei välttämättä ole saatavilla ympäri vuoden. Lisäksi luonnonsedimenteissä olevat paikalliset organismit ja mahdolliset mikrosaasteet saattavat vaikuttaa testiin. Useat testilajit voivat pysyä elossa, kasvaa ja lisääntyä keinosedimentissä (8).
|
|
30.
|
Keinosedimentistä on luonnehdittava vähintään ainesosien alkuperä, raekokojakauma (hiekan, siltin ja saven prosenttiosuudet), orgaanisen hiilen pitoisuus (TOC), vesipitoisuus ja pH. Hapetus-pelkistyspotentiaalin mittaus on vapaaehtoista. Testi- ja/tai kasvatussedimenttinä voidaan kuitenkin käyttää saastumattomilta alueilta otettua luonnollista sedimenttiä. Luonnollisesta sedimentistä on luonnehdittava vähintään ainesosien alkuperä (keräyspaikka), pH ja huokosveden ammoniakkipitoisuus, orgaanisen hiilen pitoisuus (TOC), hiukkaskokojakauma (hiekan, siltin ja saven prosenttiosuudet) ja prosentuaalinen vesipitoisuus (6). Lisäksi on suositeltavaa, että ennen kuin luonnolliseen sedimenttiin lisätään testiainetta, sitä sopeutetaan seitsemän päivän ajan samoille olosuhteille, jotka testissä vallitsevat, jos ammoniakin muodostumista on odotettavissa. Tämän sopeuttamisvaiheen jälkeen yläpuolinen vesi on poistettava ja hävitettävä. Hyödyllistä tietoa voidaan saada, kun sedimentistä tai sen ainesosista analysoidaan mikrosaasteet ennen sen käyttöä.
|
Valmisteluvaihe
|
31.
|
Luonnollisten sedimenttien käsittelyä ennen niiden käyttöä laboratoriossa kuvataan lähdeviitteissä (1), (6) ja (44). Keinosedimentin valmistusta kuvataan lisäyksessä 5.
|
Varastointi
|
32.
|
Luonnollisia sedimenttejä tulisi säilyttää laboratoriossa mahdollisimman lyhyen aikaa. Yhdysvaltain ympäristönsuojeluvirasto suosittelee enimmäissäilytysajaksi kahdeksaa viikkoa 4 ± 2 °C:n lämpötilassa valolta suojattuna (pimeässä). Säilytysastioissa sedimentin yläpuolella ei saa olla kaasutilaa. Suosituksia keinosedimentin säilytyksestä on lisäyksessä 5.
|
Testiaineen annostelu
|
33.
|
Sedimenttiin lisätään testiainetta. Lisäämismenettelyssä yksi tai useampi sedimentin ainesosa pinnoitetaan testiaineella. Esimerkiksi kvartsihiekkaa tai pientä määrää sitä (noin 10 g kvartsihiekkaa testiastiaa kohti) voidaan liuottaa testiaineliuokseen sopivalla liuottimella, jonka annetaan höyrystyä hitaasti kuivaksi. Sen jälkeen pinnoitettu fraktio sekoitetaan märkään sedimenttiin. Testiaineen ja hiekkaseoksen mukana tuleva hiekka on otettava huomioon sedimentin valmistuksessa (eli sedimentin valmistukseen on käytettävä pienempi määrä hiekkaa) (6).
|
|
34.
|
Luonnollista sedimenttiä käytettäessä testiaine voidaan lisätä kuivattuun osioon sedimenttiä samalla tavoin kuin edellä kuvattiin keinosedimentin yhteydessä, tai sekoittamalla testiaine märkään sedimenttiin ja antamalla mahdollisen liuotusapuaineen höyrystyä. Sopivia liuottimia testiaineen lisäämiseen märkään sedimenttiin ovat etanoli, metanoli, etyleeniglykolimonometyylieetteri, etyleeniglykolidimetyylieetteri, dimetyyliformamidi ja trietyleeniglykoli (5) (34). Liuottimen myrkyllisyys ja haihtuvuus sekä testiaineen liukenevuus valittuun liuottimeen ovat tärkeimmät kriteerit soveltuvan liuotusapuaineen valinnassa. Lisää ohjeita testiaineen lisäämismenettelyistä on julkaisussa Environment Canada (1995) (41). Varmista huolellisesti, että sedimenttiin lisättävä testiaine sekoittuu sedimenttiin hyvin ja tasaisesti. Kun testiaine on lisätty sedimenttiin, siitä on analysoitava kaksi alanäytettä, jotta testiaineen pitoisuus sedimentissä voidaan tarkistaa ja jotta testiaineen jakaantumisen tasaisuus voidaan määrittää.
|
|
35.
|
Kun sedimenttiin on lisätty testiaine ja sedimentin päälle on lisätty vesi, testiaineen on hyvä antaa erottua sedimentistä vesifaasiin. Tämä on suositeltavaa tehdä samassa lämpötilassa ja ilmastuksessa, joita testissä käytetään. Sopiva tasapainottumisaika määräytyy sedimentin ja aineen mukaan, ja se voi vaihdella tunneista päiviin tai harvinaisissa tapauksissa jopa useampiin viikkoihin (4–5 viikkoa) (28) (42). Tässä testissä tasapainottumista ei odoteta, vaan suositeltu tasapainottumisaika on 48 tuntia – 7 päivää. Tutkimuksen tarkoituksen mukaan (esimerkiksi jos tarkoitus on jäljitellä ympäristöolosuhteita) testiaineen sisältävää sedimenttiä voidaan tasapainottaa tai vanhentaa pidemmänkin aikaa (11).
|
TESTIN SUORITTAMINEN
Alustava testi
|
36.
|
Voi olla hyvä tehdä esitesti lopullisen kokeen olosuhteiden optimoimiseksi (esimerkiksi testiaineen pitoisuuden (pitoisuuksien) valitseminen ja kertymä- ja eliminaatiovaiheen kesto). Esitestin aikana tulee tarkkailla matojen käyttäytymistä, esimerkiksi sedimentin välttelyä, jolloin madot poistuvat sedimentistä, mikä voi olla testiaineen ja/tai sedimentin itsensä aiheuttamaa, ja sitä koskevat havainnot on kirjattava muistiin. Sedimentin välttelyä voidaan käyttää myös subletaalina parametrina esitestissä, kun arvioidaan biokertyvyystestissä käytettävää testiaineen pitoisuutta (tai käytettäviä pitoisuuksia).
|
Altistumisolosuhteet
Kertymävaiheen kesto
|
37.
|
Testiorganismit altistetaan testiaineelle kertymävaiheessa. Ensimmäinen näyte tulisi ottaa 4–24 tunnin kuluttua kertymävaiheen alkamisesta. Kertymävaiheen on kestettävä 28 vuorokautta (1) (6) (11), ellei voida osoittaa, että tasapainotila on saavutettu aikaisemmin. Vakaa tila on saavutettu, kun i) biokertyvyyskertoimien käyrä suhteessa aikaan on jokaisella näytteenottokerralla aika-akselin suuntainen; ii) kolme peräkkäistä BAF-analyysia, jotka on otettu vähintään kahden päivän välein, eroavat toisistaan enintään ± 20 prosenttia, ja iii) kolmen näytteenottokerran välillä ei ole merkitseviä eroja (tilastollisten vertailujen, kuten varianssianalyysin ja regressioanalyysin, perusteella). Jos vakaata tilaa ei ole saavutettu 28 päivän kuluessa, kertymävaihe voidaan lopettaa aloittamalla eliminaatiovaihe, ja BAFK voidaan laskea kertymä- ja eliminaatiovakioista (ks. myös 16–18 kohta).
|
Eliminaatiovaiheen kesto
|
38.
|
Ensimmäinen näyte tulisi ottaa 4–24 tunnin kuluttua eliminaatiovaiheen alkamisesta, koska alkuvaiheessa kudosjäämissä saattaa esiintyä nopeita muutoksia. Eliminaatiovaihe on suositeltavaa lopettaa joko silloin, kun testiaineen pitoisuus on alle 10 prosenttia vakaan tilan pitoisuudesta, tai kun se on kestänyt enintään 10 päivää. Jäämäpitoisuus madoissa eliminaatiovaiheen lopussa raportoidaan toissijaisena tutkittavana ominaisuutena. Tämä aika voidaan kuitenkin määrätä esimerkiksi sen perusteella, kuinka kauan testiaineen pitoisuus madoissa pysyy analyyttisen havaitsemisrajan yläpuolella.
|
Testiorganismit
Testimatojen lukumäärä
|
39.
|
Näytekohtaisen matolukumäärän on muodostettava sellainen massa matokudosta, että näytekohtainen testiaineen massa kertymävaiheen alussa ja eliminaatiovaiheen lopussa on huomattavasti suurempi kuin testiaineen havaitsemisraja biologisessa materiaalissa. Mainituissa kertymä- ja eliminaatiovaiheissa pitoisuus koe-eläimissä on yleensä varsin pieni (6)(8)(18). Koska monien vedessä elävien harvasukasmatolajien yksilöllinen paino on hyvin pieni (Lumbriculus variegatus- ja Tubifex tubifex -lajien yksilökohtainen märkäpaino 5–10 g), tietyn rinnakkaisnäytteen testiastioissa olevat madot voidaan yhdistää punnitusta ja kemiallista analyysia varten. Testilajeissa, joissa yksilöllinen paino on suurempi (esimerkiksi Branchiura sowerbyi), voidaan käyttää vain yhdestä yksilöstä koostuvia rinnakkaisnäytteitä, mutta tällöin rinnakkaisnäytteiden määrää on lisättävä vähintään viiteen näytteenottokertaa kohti (11). Lisäksi on muistettava, ettei B. sowerbyi sisältynyt rengastestiin (12), joten se ei ole suositeltava laji tässä testimenetelmässä.
|
|
40.
|
Testissä tulee käyttää samankokoisia matoja (L. variegatus -lajin osalta ks. lisäys 6). Niiden tulisi olla peräisin samasta lähteestä ja saman ikäluokan täysikasvuisia tai isoja eläimiä (ks. lisäys 6). Eläimen paino ja ikä saattavat vaikuttaa BAF-arvoihin huomattavasti (esimerkiksi erilaisen lipidipitoisuuden ja/tai munien kehittymisen vuoksi), joten nämä parametrit on kirjattava muistiin tarkasti. Jotta keskimääräiset märkä- ja kuivapainot voidaan mitata, madoista tulee punnita alanäyte ennen testin aloittamista.
|
|
41.
|
Tubifex tubifex- ja Lumbriculus variegatus -lajeilla lisääntyminen on odotettavissa testin aikana. Lisääntymisen puuttuminen biokertyvyystestissä on kirjattava muistiin ja otettava huomioon testituloksia tulkittaessa.
|
Täyttöaste
|
42.
|
Testissä tulee käyttää suuria sedimentistä matoon- ja vedestä matoon -suhdelukuja, jotta voidaan minimoida testiaineen pitoisuuden pieneneminen sedimentissä kertymävaiheen aikana ja välttää liuenneen hapen pitoisuuden pienenemiset. Valitun täyttöasteen tulisi myös vastata valittujen lajien luonnollista populaatiotiheyttä (43). Esimerkiksi Tubifex tubifexin osalta suositeltu täyttöaste on 1–4 mg matokudosta (märkäpaino) yhtä grammaa märkää sedimenttiä kohti (8)(11). L. variegatuksen osalta lähdeviitteissä (1) ja (6) suositeltu täyttöaste on ≤1 g matokudosta (kuivapaino) 50 grammassa sedimentin orgaanista hiiltä.
|
|
43.
|
Testissä käytettävät madot poistetaan kasvatussäiliöstä siivilöimällä säiliön sedimentti. Eläimet (täysikasvuiset tai isot madot, joissa ei ole merkkejä viimeaikaisesta jakaantumisesta) siirretään puhdasta vettä sisältäviin lasiastioihin (esimerkiksi petrimaljoihin). Jos testiolosuhteet poikkeavat kasvatusolosuhteista, 24 tunnin totutteluvaiheen pitäisi olla riittävä. Ennen punnitsemista madoista tulee poistaa liiallinen vesi. Se voidaan tehdä asettamalla madot varovasti esikostutetun paperipyyhkeen päälle. Imupaperin käyttäminen matojen kuivaamiseen ei ole suositeltavaa, koska se voi aiheuttaa stressiä madoille tai vahingoittaa niitä. Brunson ja muut (1998) suosittelevat, että testissä käytettävä matomäärä olisi noin 1,33 kertaa kohdebiomassa (kun matoja ei ole kuivattu imupaperilla). Tässä ylimääräiset 33 prosenttia vastaavat kuivattujen ja kuivaamattomien matojen välistä eroa (28).
|
|
44.
|
Kertymävaiheen alussa (testin päivä 0) testiorganismit otetaan pois totutteluastiasta ja jaetaan satunnaisesti synteettistä vettä sisältäviin astioihin (esimerkiksi petrimaljoihin) siten, että jokaiseen astiaan laitetaan aina kaksi matoa, kunnes jokaisessa astiassa on kymmenen matoa. Sen jälkeen nämä matoryhmät siirretään satunnaisessa järjestyksessä eri testiastioihin käyttämällä esimerkiksi pehmytkärkisiä teräspinsettejä. Sen jälkeen testiastioita inkuboidaan testiolosuhteissa.
|
Ruokinta
|
45.
|
Koska keinosedimentti sisältää vain vähän ravinteita, sedimenttiä tulee muokata lisäämällä siihen ravinnon lähteitä. Jotta testiorganismien altistumista ei aliarvioida esimerkiksi ruokkimalla niitä valikoidusti kontaminoitumattomalla ruoalla, testiorganismien lisääntymiseen ja kasvuun tarvittavaa ruokaa on lisättävä sedimenttiin kerran ennen testiaineen applikointia tai sen aikana (ks. lisäys 5).
|
Sedimentin ja veden suhde
|
46.
|
Sedimentin ja veden suositeltu suhde on 1:4 (45). Tätä suhdetta pidetään sopivana, jotta happipitoisuus säilyy asianmukaisena ja jotta vältetään ammoniakin kertyminen yläpuoliseen veteen. Yläpuolisen veden happipitoisuus tulisi pitää sellaisena, että kyllästys olisi ≥ 40 prosenttia. Yläpuolista vettä testiastioissa on ilmastettava kevyesti (esimerkiksi 2–4 ilmakuplaa sekunnissa) Pasteur-pipetillä, joka sijaitsee noin kahden sentin päässä sedimentin pinnasta sedimentin sekoittumisen välttämiseksi.
|
Valo ja lämpötila
|
47.
|
Valoisa jakso kasvatuksessa ja testissä on 16 tuntia (1) (6). Testitilassa olisi oltava 500–1 000 luksin valoteho. Lämpötilan on oltava 20 ± 2 °C koko testin ajan.
|
Testipitoisuudet
|
48.
|
Kertymiskinetiikan määrittämisessä käytetään yhtä testipitoisuutta (mahdollisimman pientä), mutta myös toista (suurempaa) pitoisuutta voidaan käyttää (ks. lähdeviite (46)). Tällöin näytteet otetaan ja analysoidaan, kun vakaa tila on saavutettu, tai 28 päivän kuluttua, jotta pienemmästä pitoisuudesta mitattu BAF voidaan vahvistaa (11). Suurempi pitoisuus tulisi valita niin, että haittavaikutukset ovat suljettavissa pois (esimerkiksi valitsemalla noin 1 prosentti pienimmästä tunnetusta pitkäaikaisen vaikutuksen pitoisuudesta ECx, joka on johdettu asiaankuuluvista pitkäaikaisen myrkyllisyyden tutkimuksista). Pienemmän testipitoisuuden on oltava huomattavasti suurempi kuin käytettävän analyysimenetelmän havaitsemisraja sedimentissä ja biologisissa näytteissä. Jos testiaineen vaikuttava pitoisuus on lähellä analyyttista havaitsemisrajaa, on suositeltavaa käyttää radioleimattua testiainetta, jonka ominaisradioaktiivisuus on suuri.
|
Rinnakkaisnäytteet (käsitellyt ja kontrollit)
|
49.
|
Kinetiikkamittauksissa käsiteltyjen rinnakkaisnäytteiden vähimmäismäärä on kolme näytteenottokertaa (11) kohti kertymä- ja eliminaatiovaiheissa. Enemmän rinnakkaisnäytteitä voidaan käyttää esimerkiksi valinnaisten ylimääräisten näytteenottoajankohtien yhteydessä. Eliminaatiovaiheessa valmistellaan sopiva määrä rinnakkaisnäytteitä, jotka sisältävät testiaineetonta sedimenttiä ja yläpuolista vettä, jotta käsitellyt madot voidaan siirtää kertymävaiheen lopussa käsittelyastioista niihin astioihin, jotka eivät sisällä testiainetta. Käsiteltyjen rinnakkaisnäytteiden yhteismäärän tulisi olla riittävä sekä kertymä- että eliminaatiovaiheeseen.
|
|
50.
|
Vaihtoehtoisesti madot, joista otetaan näytteitä eliminaatiovaiheessa, voidaan altistaa yhdessä isossa astiassa; siinä on oltava testiaineella käsiteltyä sedimenttiä, joka on peräisin samasta erästä kuin kertymäkinetiikkaa varten tarkoitettu sedimentti. On myös osoitettava, että testiolosuhteet (kuten sedimentin syvyys, sedimentin ja veden suhde, täyttöaste, lämpötila, veden laatu) ovat verrattavissa kertymävaiheeseen tarkoitettuihin rinnakkaisnäytteisiin. Kertymävaiheen lopussa tästä astiasta on otettava vesi-, sedimentti- ja matonäytteet analysoitavaksi, ja riittävän monta isoa matoa, joissa ei ole merkkejä viimeaikaisesta jakaantumisesta, on otettava varovasti pois astiasta ja siirrettävä eliminaatiovaiheeseen tarkoitettuihin rinnakkaisnäyteastioihin (esimerkiksi 10 organismia rinnakkaisnäyteastiaa kohti).
|
|
51.
|
Jos testissä ei käytetä muuta liuotinta kuin vettä, biologiseen ja tausta-analyysiin on valmistettava vähintään yhdeksän rinnakkaisnäytettä negatiivista kontrollia varten (vähintään kolme näytettä otetaan testin alussa, kolme kertymävaiheen lopussa ja kolme eliminaatiovaiheen lopussa). Jos testiaineen applikoinnissa käytetään jotakin liuotusapuainetta, on tehtävä liuotinkontrolli (vähintään kolmesta rinnakkaisnäytteestä on otettava näyte testin alussa, kolmesta kertymävaiheen lopussa ja kolmesta eliminaatiovaiheen lopussa). Tässä tapauksessa on valmistettava vähintään neljä rinnakkaisnäytettä negatiivista kontrollia (ei liuotinta) varten, ja näytteet otetaan kertymävaiheen lopussa. Rinnakkaisnäytteitä verrataan biologisesti liuotinkontrolliin, jotta saadaan tietoa liuottimen mahdollisesta vaikutuksesta testiorganismeihin. Yksityiskohtaiset tiedot annetaan lisäyksessä 3.
|
Veden laatua koskevien mittausten taajuus
|
52.
|
Yläpuolisesta vedestä on mitattava vähintään seuraavat veden laatua koskevat parametrit kertymä- ja eliminaatiovaiheen aikana:
|
Lämpötila
|
Yhdestä astiasta jokaisella käsittelytasolla näytteenottokertaa kohti ja yhdestä kontrolliastiasta kerran viikossa sekä kertymä- ja eliminaatiovaiheiden alussa ja lopussa; ympäristön lämpötila (huoneilma tai vesihaude), tai tiedot yhdestä edustavasta testiastiasta voidaan kirjata joko jatkuvasti tai tunnin välein.
|
|
Liuenneen hapen pitoisuus
|
Yhdestä astiasta jokaisella käsittelytasolla ja yhdestä kontrolliastiasta näytteenottokertaa kohti; arvot ilmoitetaan yksiköissä mg/l ja % ASV (ilman kyllästysarvo).
|
|
Tuloilma
|
Tarkistetaan vähintään kerran päivässä (arkipäivisin) ja säädetään tarvittaessa.
|
|
pH
|
Yhdestä käsitellystä astiasta jokaisella käsittelytasolla näytteenottokertaa kohti ja yhdestä kontrolliastiasta kerran viikossa sekä kertymä- ja eliminaatiovaiheiden alussa ja lopussa.
|
|
Veden kokonaiskovuus
|
Vähintään yhdestä käsitellystä astiasta ja yhdestä kontrolliastiasta kertymä- ja eliminaatiovaiheiden alussa ja lopussa, ilmaistaan yksikössä mg/l CaCO3.
|
|
Ammoniakin kokonaispitoisuus
|
Vähintään yhdestä käsitellystä astiasta ja yhdestä testiastiasta kertymä- ja eliminaatiovaiheiden alussa ja lopussa, ilmaistaan yksikössä mg/l NH4
+ tai NH3 tai kokonais-ammoniakki-N.
|
|
Näytteenotto madoista, sedimentistä ja vedestä sekä näytteiden analysointi
Näytteenottoaikataulu
|
53.
|
Esimerkkejä 28-päiväisen kertymävaiheen ja 10-päiväisen eliminaatiovaiheen näytteenottoaikatauluista on lisäyksessä 3.
|
|
54.
|
Testiastioista otetaan vesi- ja sedimenttinäytteet, joista määritetään testiaineen pitoisuus ennen matojen lisäämistä sekä kertymä- ja eliminaatiovaiheen aikana. Testin aikana testiaineen pitoisuudet määritetään madoista, sedimentistä ja vedestä, jotta voidaan seurata testiaineen jakaantumista testijärjestelmän eri osa-alueisiin.
|
|
55.
|
Ota madoista, sedimentistä ja vedestä näytteet vähintään kuusi kertaa sekä kertymä- että eliminaatiovaiheen aikana.
|
|
56.
|
Jatka näytteenottoa, kunnes tasannevaihe (vakaa tila) on saavutettu (ks. lisäys 1) tai 28 päivän ajan. Jos tasannevaihetta ei ole saavutettu 28 päivän kuluessa, aloita eliminaatiovaihe. Kun eliminaatiovaihe alkaa, siirrä madot rinnakkaisnäyteastioihin, jotka sisältävät käsittelemätöntä sedimenttiä ja vettä (ks. myös 17 ja 18 kohta).
|
Näytteenotto ja näytteiden valmistus
|
57.
|
Ota vesinäytteitä varten dekantoimalla, lapolla tai pipetillä sellainen määrä vettä, joka riittää testiaineen määrän mittaamiseen näytteestä.
|
|
58.
|
Ota loput yläpuolisesta vedestä pois testiastioista dekantoimalla tai lapolla. Sedimenttinäytteet on otettava varovasti siten, että madoille aiheutuu siitä mahdollisimman vähän häiriötä.
|
|
59.
|
Ota kaikki madot pois rinnakkaisnäytteestä näytteenottohetkellä esimerkiksi suspendoimalla sedimentti yläpuolisen veden kanssa ja levittämällä kunkin rinnakkaisnäytteen sisältö matalalle tarjottimelle ja poimimalla madot pehmeäkärkisillä teräspinseteillä. Huuhtele ne nopeasti vedellä matalassa lasi- tai terästarjottimessa. Poista liiallinen vesi. Siirrä madot varovasti esipunnittuun astiaan ja punnitse ne. Lopeta madot jäädyttämällä ne (esimerkiksi ≤ – 18 °C:ssa). Munakoteloiden ja/tai nuorten matojen esiintyminen ja lukumäärä on kirjattava muistiin.
|
|
60.
|
Yleensä madot tulee punnita ja lopettaa heti näytteenoton jälkeen ilman suolen tyhjentämistä, jotta saadaan varovainen BAF-arvo, joka sisältää kontaminoituneen suolensisällön, ja jotta vältetään se, ettei ruumiin jäämiä häviä, kun suoli tyhjennetään vain veteen (8). Aineiden, joiden log Kow on yli 5, ei odoteta eliminoituvan suuremmin, kun suoli tyhjennetään vain veteen, kun taas aineet, joiden log Kow on alle 4, voivat eliminoitua huomattavina määrinä (47).
|
|
61.
|
Eliminaatiovaiheen aikana madot tyhjentävät suolensa puhtaaseen sedimenttiin. Tämä tarkoittaa sitä, että suolensisällöllä kontaminoituneesta sedimentistä tehdään mittaukset välittömästi ennen eliminaatiovaihetta, koska eliminaatiovaiheen ensimmäisten 4–24 tunnin jälkeen suurimman osan suolensisältöä oletetaan korvautuvan puhtaalla sedimentillä (11) (47). Testiaineen pitoisuutta madoissa tässä näytteessä voidaan siis pitää kudospitoisuutena suolen tyhjentämisen jälkeen. Jotta kontaminoitumattoman sedimentin laimentava vaikutus testiaineen pitoisuuteen eliminaatiovaiheessa voidaan huomioida, suolen sisällön paino voidaan arvioida madon märkäpainon ja tuhkapainon tai madon kuivapainon ja tuhkapainon suhteesta.
|
|
62.
|
Jos tietyn tutkimuksen tarkoituksena on mitata biologista saatavuutta ja todellisia kudosjäämiä testiorganismeissa, vähintään yksi alanäyte käsitellyistä eläimistä (esimerkiksi kolmesta ylimääräisestä rinnakkaisnäyteastiasta), joka otetaan mieluiten vakaan tilan aikana, tulee punnita, puhdistaa puhtaassa vedessä kuuden tunnin ajan (47) ja punnita sen jälkeen uudelleen ennen analyysia. Tästä alanäytteestä saatuja tietoja matojen painosta ja ruumiin pitoisuudesta voidaan verrata niistä madoista saatuihin arvoihin, joiden suoli ei ole tyhjentynyt. Eliminaation mittaamiseen matojen suolta ei tule tyhjentää ennen siirtoa puhtaaseen sedimenttiin, jotta eläimille aiheutetaan mahdollisimman vähän ylimääräistä stressiä.
|
|
63.
|
Vesi-, sedimentti- ja matonäytteet on analysoitava mieluiten välittömästi (ts. 1–2 tunnin kuluessa) siirtämisen jälkeen hajoamisen tai muiden häviöiden estämiseksi ja arvioitujen kertymä- ja eliminaatioarvojen laskemiseksi testin edetessä. Kun näytteet määritetään heti, voidaan myös nähdä nopeasti, milloin tasapainotila on saavutettu.
|
|
64.
|
Jos välitön analyysi ei ole mahdollinen, näytteitä on säilytettävä asianmukaisissa olosuhteissa. Ota selvää tietyn testiaineen stabiiliudesta ja asianmukaisista säilytysolosuhteista ennen tutkimuksen aloittamista (esimerkiksi säilytyksen kesto ja lämpötila, uuttomenettelyt jne.). Jos näitä tietoja ei ole saatavilla ja jos sitä pidetään tarpeellisena, säilytyksen stabiiliutta voidaan seurata käyttämällä myös testiaineella käsiteltyjä kontrollikudoksia.
|
Määritysmenetelmän laatu
|
65.
|
Koska koko menetelmään vaikuttaa olennaisesti testiaineen määritykseen käytettävän menetelmän tarkkuus, täsmällisyys ja herkkyys, on todettava kokeellisesti, että kyseisessä menetelmässä kemiallisen määrityksen täsmällisyys ja toistettavuus samoin kuin testiaineen saanto vesi-, sedimentti- ja matonäytteistä ovat hyväksyttäviä. Lisäksi on tarkistettava, ettei testiainetta havaita kontrolliastioissa taustapitoisuuksia suurempia pitoisuuksia. Jos tarpeen, korjaa saantojen Cw-, Cs- ja Ca-arvot sekä kontrollien tausta-arvot. Käsittele kaikkia näytteitä testin aikana siten, että kontaminaatio ja häviö ovat mahdollisimman pieniä (niitä voi aiheuttaa esimerkiksi testiaineen adsorptoituminen näytteenottovälineisiin).
|
|
66.
|
Kokonaissaanto ja testiaineen saanto madoista, sedimentistä, vedestä ja tarvittaessa loukuista, jotka sisältävät adsorbentteja höyrystyneen testiaineen taltioimiseksi, on kirjattava muistiin ja raportoitava.
|
|
67.
|
Koska radioleimattujen aineiden käyttö on suositeltavaa, myös kokonaisradioaktiivisuus on mahdollista analysoida (ts. alkuperäisestä aineesta ja hajoamistuotteista). Alkuperäisen aineen ja hajoamistuotteiden kvantifioinnista vakaassa tilassa tai kertymävaiheen lopussa voidaan saada tärkeää tietoa, jos kvantifiointi on analyyttisesti toteutettavissa. Jos tällaisia mittauksia on määrä tehdä, näytteille on tehtävä asianmukaiset uuttotoimenpiteet, jotta alkuperäinen aine on mahdollista kvantifioida erikseen. Jos havaitun hajoamistuotteen prosentuaalinen osuus testiorganismeissa vakaassa tilassa tai kertymävaiheen lopussa mitatusta radioaktiivisuudesta on huomattava (esimerkiksi > 10 prosenttia), tällaiset hajoamistuotteet on suositeltavaa määrittää (5).
|
|
68.
|
Pienen yksilöllisen biomassan vuoksi testiaineen pitoisuutta jokaisessa yksittäisessä madossa ei usein ole mahdollista määrittää, ellei käytettävä testilaji ole Branchiura sowerbyi (madon yksilöllinen märkäpaino 40–50 mg) (11). Siksi tietystä testiastiasta näytteeksi otettujen yksilöiden yhdistäminen on hyväksyttävää, mutta se rajoittaa kuitenkin niitä tilastomenettelyjä, joita tietoihin voidaan soveltaa. Jos tietty tilastollinen menettely ja testin voima ovat tärkeitä, testissä on oltava riittävä määrä koe-eläimiä ja/tai rinnakkaisnäytetestiastioita, jotta haluttu yhdistäminen, menettely ja voima voidaan mukauttaa.
|
|
69.
|
On suositeltavaa, että BAF ilmoitetaan sekä kokonaismärkäpainon ja kokonaiskuivapainon funktiona ja tarvittaessa (esimerkiksi erittäin lipofiilisten aineiden yhteydessä) lipidipitoisuuden ja sedimentin TOC-arvon funktiona. Lipidipitoisuuden määrittämiseen tulee käyttää sopivia menetelmiä (48) (49). Kloroformi-metanoliuuttoa (50) voi suositella standardimenetelmänä (48). Klooripitoisten liuottimien käytön välttämiseksi voidaan kuitenkin käyttää kohdassa (51) kuvattua Blighin ja Dyerin menetelmän rengastestissä sovellettua muunnosta (50). Koska eri menetelmillä ei välttämättä saada samoja arvoja (48), on tärkeää kuvata käytetty menetelmä. Jos mahdollista (jos esimerkiksi matokudosta on riittävästi), lipidipitoisuus mitataan samasta näytteestä tai uutteesta, josta testiaine määritetään, koska rasvat täytyy usein poistaa uutteesta ennen kuin sitä voi käyttää kromatografisessa analyysissa (5). Lipidipitoisuuden mittaamiseen on kuitenkin hyvä käyttää totutettuja kontrollieläimiä ainakin kertymävaiheen alussa tai – mieluiten – lopussa esimerkiksi kolmessa näytteessä.
|
TIEDOT JA RAPORTOINTI
Tulosten käsittely
|
70.
|
Testiaineen kertymäkäyrä saadaan tekemällä aritmeettinen asteikko testiaineen pitoisuudesta madoissa tai niiden pinnalla kertymävaiheessa suhteessa aikaan. Jos käyrä on saavuttanut tasannevaiheen, laske vakaan tilan BAFss:

|
|
71.
|
Määritä kineettinen biokertyvyyskerroin (BAFK) kertymävakion (ks) ja eliminaatiovakion (ke) suhteena. Eliminaatiovakio (ke) määritetään yleensä eliminaatiokäyrästä (joka toisin sanoen kuvaa testiaineen pitoisuutta madoissa eliminaatiovaiheessa). Kertymävakio (ks) lasketaan kertymäkäyrän kinetiikasta. Paras menetelmä BAFK:n ja nopeusvakioiden ks ja ke laskemiseksi on estimoida epälineaariset parametrit tietokoneella (ks. lisäys 2). Jos on ilmeistä, ettei eliminaatio noudata ensimmäisen asteen kinetiikkaa, on käytettävä monimutkaisempia malleja (25) (27) (52).
|
|
72.
|
Biota-sedimentti-kertyvyyskertoin (BSAF) määritetään normalisoimalla BAFK matojen lipidipitoisuuden ja sedimentin orgaanisen hiilen kokonaispitoisuuden osalta.
|
Tulosten tulkinta
|
73.
|
Tulosten tulkinnassa on oltava varovainen, jos testipitoisuuksista mitatut pitoisuudet ovat lähellä käytetyn analyysimenetelmän havaitsemisrajaa.
|
|
74.
|
Selvät kertymä- ja eliminaatiokäyrät ovat merkki laadukkaista biokertyvyystiedoista. Yleensä hyvin suunnitelluista tutkimuksista saatujen BAF-arvojen luottamusvälit eivät saisi ylittää 25:tä prosenttia (5).
|
Testiraportti
|
75.
|
Tutkimusselostuksen on sisällettävä seuraavat tiedot:
|
|
Testiaine
|
—
|
puhtaus, fysikaalinen olomuoto ja fysikaalis-kemialliset ominaisuudet, esim. log Kow, vesiliukoisuus
|
|
—
|
kemialliset tunnistetiedot, testiaineen lähde, mahdollisesti käytetyn liuottimen tunnistetiedot ja pitoisuus
|
|
—
|
jos testiaine on radioleimattu, leimattujen atomien tarkka sijainti, ominaisradioaktiivisuus ja epäpuhtauksiin liittyvän radioaktiivisuuden prosenttiosuus.
|
|
|
|
Testilajit
|
—
|
tieteellinen nimi, kanta, lähde, mahdollinen esikäsittely, totuttamistiedot, ikä, koko jne.
|
|
|
|
Testiolosuhteet
|
—
|
testauksessa käytetty menetelmä (staattinen, semistaattinen tai läpivirtausmenetelmä)
|
|
—
|
käytetty valaistustyyppi ja valon ominaisuudet sekä valojakso(t)
|
|
—
|
testisuunnitelma (testiastioiden lukumäärä, materiaali ja koko, veden tilavuus, sedimentin massa ja tilavuus, veden vaihtumisonopeus (läpivirtaus- tai semistaattisissa menetelmissä), ennen testiä ja sen aikana käytetty ilmastus, rinnakkaisnäytteiden määrä, matojen lukumäärä rinnakkaisnäytettä kohti, testipitoisuuksien lukumäärä, kertymä- ja eliminaatiovaiheiden pituus, näytteenottotiheys)
|
|
—
|
testiaineen valmistelu ja lisäys sekä tietyn menetelmän valintaperusteet
|
|
—
|
nimellistestipitoisuudet
|
|
—
|
keinotekoisen veden ja sedimentin ainesosien lähde tai – luonnollisia väliaineita käytettäessä – veden ja sedimentin alkuperä; kuvaus mahdollisista esikäsittelyistä; todisteet siitä, että koe-eläimet voivat elää ja/tai lisääntyä käytetyssä väliaineessa; sedimentin ominaisuudet (pH ja huokosveden ammoniakkipitoisuus (luonnolliset sedimentit), orgaanisen hiilen pitoisuus (TOC), hiukkaskokojakauma (hiekan, siltin ja saven prosenttiosuudet), vesipitoisuus prosentteina ja kaikki muut mittaukset)) sekä veden ominaisuudet (pH, kovuus, johtavuus, lämpötila, liuenneen hapen pitoisuus, jäännösklooripitoisuudet (jos mitattu) ja kaikki muut tehdyt mittaukset))
|
|
—
|
keinosedimentin nimellinen ja mitattu kuivapaino prosenttiosuutena märkäpainosta (tai kuivapainon ja märkäpainon suhde); mitattu kuivapaino prosenttiosuutena märkäpainosta (tai kuivapainon ja märkäpainon suhde) kenttäsedimenttien osalta
|
|
—
|
veden laatu testiastioissa luonnehdittuna seuraavilla tekijöillä: lämpötila, pH, ammonium, kokonaiskovuus ja liuennen hapen pitoisuus
|
|
—
|
yksityiskohtaiset tiedot vesi-, sedimentti- ja matonäytteiden käsittelystä, mukaan luettuina tiedot testiaineen säilytyksestä, lisäämistavasta, uutosta ja analyysimenetelmistä (ja tarkkuudesta) sekä lipidipitoisuudesta (jos mitattu) ja testiaineen saannista.
|
|
|
|
Tulokset
|
—
|
kontrollimatojen ja jokaisessa testiastiassa olevien matojen kuolleisuus sekä mahdollisesti havaitut subletaalit vaikutukset, mukaan luettuna epänormaali käyttäytyminen (kuten sedimentin välttely, ulostepellettien esiintyminen tai niiden puute, lisääntymättömyys)
|
|
—
|
sedimentin ja testiorganismien mitattu kuivapaino prosenttiosuutena märkäpainosta (tai kuivapainon ja märkäpainon suhde) (hyödyllinen normalisoinnissa)
|
|
—
|
matojen lipidipitoisuus
|
|
—
|
käyrät, jotka osoittavat testiaineen kertymä- ja eliminaatiokinetiikan madoissa, ja vakaan tilan saavuttamiseen kuluneen ajan
|
|
—
|
Ca, Cs ja Cw (sekä keskihajonta ja vaihteluväli tarvittaessa) kaikilta näytteenottokerroilta (Ca ilmaistuna muodossa grammaa kilossa koko ruumiin märkä- ja kuivapainoa, Cs ilmaistuna muodossa grammaa kilossa sedimentin märkä- ja kuivapainoa ja Cw muodossa milligrammaa litrassa). Jos biota-sedimentti-kertyvyyskerroin (BSAF, ks. määritelmä lisäyksestä 1) tarvitaan (esimerkiksi jotta voidaan verrata tuloksia kahdesta tai useammasta testistä, jotka on tehty eläimillä, joiden lipidipitoisuus on eri), Ca tulisi ilmaista lisäksi muodossa grammaa kilossa organismin lipidipitoisuutta, ja Cs tulisi ilmaista muodossa grammaa kilossa sedimentin orgaanista hiiltä
|
|
—
|
BAF (ilmaistuna muodossa kiloa märkää sedimenttiä kilossa märkää matoa), sedimentin kertymävakio ks (ilmaistuna muodossa grammaa märkää sedimenttiä kilossa märkää matoa, d– 1), ja eliminaatiovakio ke (ilmaistuna muodossa d– 1); lisäksi voidaan raportoida BSAF (ilmaistuna muodossa kiloa sedimentin liuennutta happea kilossa matojen lipidipitoisuutta)
|
|
—
|
eliminoitumattomat jäämät (NER) eliminaatiovaiheen lopussa
|
|
—
|
jos mitattu: koe-eläimissä havaitut prosenttiosuudet alkuperäisestä aineesta, hajoamistuotteista ja sitoutuneista jäämistä (ts. se osuus testiainetta, jota ei voida uuttaa tavallisilla uuttomenetelmillä)
|
|
—
|
tietojen tilastollisissa analyyseissa käytetyt menetelmät.
|
|
|
|
Tulosten arviointi
|
—
|
kohdassa 21 annettujen luotettavuusehtojen täyttyminen
|
|
—
|
odottamattomat tai epätavalliset tulokset, esimerkiksi testiaineen täydellinen eliminoituminen koe-eläimistä; tällöin mahdollisen esitutkimuksen tuloksista voidaan saada hyödyllistä tietoa.
|
|
|
Lisäys 1
Määritelmät ja yksiköt
|
|
Keinotekoinen sedimentti (tai synteettinen sedimentti) on luonnollisen sedimentin fyysisiä ainesosia jäljittelevistä materiaaleista valmistettu seos.
|
|
|
Biokertyvyys on organismissa tai sen pinnalla olevan testiaineen pitoisuuden lisääntyminen verrattuna testikemikaalin pitoisuuteen väliaineessa. Biokertymistä aiheuttaa biokonsentraatio ja biomagnifikaatio (katso seuraavat kohdat).
|
|
|
Biokertyvyyskerroin (BAF) minä tahansa aikana tämän biokertyvyystestin kertymävaihetta on testiaineen pitoisuus organismissa tai sen pinnalla (Ca = grammaa kilossa märkä- tai kuivapainoa) jaettuna aineen pitoisuudella ympäröivässä väliaineessa (Cs = grammaa kilossa sedimentin märkä- tai kuivapainoa). Ca- ja Cs-yksiköihin viittaamiseksi BAF: yksikkö on muotoa ’kg sedimenttiä kilossa matoa’ (15).
|
|
|
Biokertyvyyskertoimia, jotka on laskettu suoraan sedimentin kertymävakion ja eliminaatiovakion suhteesta jaettuna nopeusvakioilla (ks ja ke, ks. jäljempää), kutsutaan kineettisiksi biokertyvyyskertoimiksi (BAFK).
|
|
|
Biokonsentroituminen on organismissa tai sen pinnalla olevan testiaineen pitoisuuden lisääntyminen, jossa kertyminen tapahtuu pelkästään aineen saannista ruumiin pinnan kautta, verrattuna testiaineen pitoisuuteen väliaineessa.
|
|
|
Biomagnifikaatio on organismissa tai sen pinnalla olevan testiaineen pitoisuuden lisääntyminen, joka johtuu pääasiassa kontaminoituneen ravinnon tai saaliin nauttimisesta, verrattuna testiaineen pitoisuuteen ravinnossa tai saaliissa. Biomagnifikaatio voi aiheuttaa testiaineen siirtymistä tai kertymistä ravintoverkoissa.
|
|
|
Biota-sedimentti-kertyvyyskerroin (BSAF) on testiaineen lipidien suhteen normalisoitu vakaan tilan pitoisuus testiorganismissa tai sen pinnalla jaettuna orgaanisen hiilen suhteen normalisoidulla aineen pitoisuudella sedimentissä vakaassa tilassa. Ca ilmoitetaan muodossa ’grammaa kilossa organismin lipidipitoisuutta’ ja Cs muodossa ’grammaa kilossa sedimentin orgaanisen aineen pitoisuutta’.
|
|
|
Sopeuttamisvaihetta käytetään sedimentin mikrobien vakauttamiseen ja esimerkiksi sedimentin ainesosissa olevan ammoniakin poistamiseen; sopeuttaminen tehdään ennen testiaineen lisäämistä sedimenttiin. Tavallisesti yläpuolinen vesi hävitetään sopeuttamisen jälkeen.
|
|
|
Eliminaatio on testiaineen poistumista testiorganismikudoksesta aktiivisilla tai passiivisilla prosesseilla riippumatta siitä, onko ympäröivässä väliaineessa testiainetta vai ei.
|
|
|
Eliminaatiovaihe alkaa, kun testiorganismit on siirretty kontaminoituneesta väliaineesta sellaiseen väliaineeseen, jossa ei ole testiainetta. Eliminaatiovaiheen aikana tutkitaan kyseisen testiaineen (netto)poistumaa testiorganismeista.
|
|
|
Eliminaatiovakio (ke) on numeerinen arvo, joka kuvaa testiaineen pitoisuuden alenemisen nopeutta testiorganismissa tai sen pinnalla, kun testiorganismit on siirretty testiainetta sisältävästä väliaineesta sellaiseen väliaineeseen, jossa ei ole kyseistä ainetta; ke ilmoitetaan muodossa d– 1.
|
|
|
Tasapainottumisaikaa käytetään testiaineen jakaantumiseen kiinteään faasiin, huokosveteen ja yläpuoliseen veteen. Sitä sovelletaan ennen testiaineen lisäämistä sedimenttiin ja ennen testiorganismien lisäämistä.
|
|
|
Oktanoli-vesi-jakaantumiskerroin (Kow) on aineen n-oktanoliliukoisuuden ja vesiliukoisuuden suhde tasapainotilassa, josta käytetään myös merkintää Pow. Logaritmia Kow (log Kow) käytetään ilmaisemaan kemikaalin biokertyvyyspotentiaalia vesieliöissä.
|
|
|
Orgaaninen hiili-vesi-jakaantumiskerroin (Koc) on aineen sedimentin orgaanisen hiilen fraktiossa tai sen pinnalla olevan pitoisuuden ja vedessä tasapainotilassa olevan pitoisuuden välinen suhde.
|
|
|
Yläpuolinen vesi on testiastiassa sedimentin päällä oleva vesi.
|
|
|
Tasannevaihe tai vakaa tila on altistusvaiheessa samanaikaisesti tapahtuvien kertymä- ja eliminaatioprosessien välinen tasapainotila. Vakaa tila saavutetaan BAF:ää jokaisen näytteenottokerran ajan funktiona esittävässä käyrässä silloin, kun käyrä on aika-akselin suuntainen, kolme peräkkäistä vähintään kahden vuorokauden välein otetuista näytteistä tehtyä BAF-määritystä poikkeavat enintään ± 20 prosenttia ja kun näiden kolmen näytteenottoajanjakson välillä ei ole tilastollisesti merkitseviä eroja. Kun testataan aineita, jotka kertyvät hitaasti, välit voivat olla pikemminkin seitsemän vuorokautta (5).
|
|
|
Huokosvesi on sedimentin tai maa-aineksen hiukkasten välissä olevaa vettä.
|
|
|
Sedimentin kertymävakio (ks) on numeerinen arvo, joka määrittää, kuinka nopeasti testiaineen pitoisuus lisääntyy testiorganismissa tai sen pinnalla, koska testiainetta kertyy sedimenttifaasista. ks ilmaistaan muodossa grammaa sedimenttiä kilossa matoa, d– 1.
|
|
|
Käsitelty sedimentti on sedimenttiä, johon on lisätty testiaine.
|
|
|
Vakaan tilan biokertyvyyskerroin (BAFss) on biokertyvyyskerroin vakaassa tilassa, eikä se muutu merkittävästi pitkän ajanjakson aikana, kun testiaineen pitoisuus väliaineessa on vakio tänä aikana (Cs = grammaa kilossa sedimentin kuivapainoa).
|
|
|
Kertymä- eli altistumisvaihe on aika, jona testiorganismit altistetaan testiaineelle.
|
Lisäys 2
Kertymä- ja poistumaparametrien laskeminen
Biokertymistestin tärkein tutkittava ominaisuus on biokertyvyystekijä BAF. Mitattu BAF voidaan laskea jakamalla testiaineen pitoisuus testiorganismissa, Ca, testiaineen pitoisuudella sedimentissä, Cs, vakaassa tilassa. Jos vakaata tilaa ei saavuteta 28 päivän aikana, BAF lasketaan samalla tavalla päivän 28 osalta. On kuitenkin ilmoitettava, perustuuko BAF vakaan tilan pitoisuuksiin vai ei.
Ensisijainen keino määrittää kineettinen biokertyvyyskerroin (BAFK), sedimentin kertymävakio (ks) ja eliminaatiovakio (ke) on käyttää epälineaarisen mallin parametrien estimointiin tarkoitettuja tietokoneohjelmia. Kun ohjelmaan syötetään kertymävaiheen keskimääräisten kertymäkerrointen aikasarjat (Ca, keskiarvot jokaiselta näytteenottokerralta / Cs, keskiarvot jokaiselta näytteenottokerralta = AF) matojen ja sedimentin märkäpainon perusteella sekä malliyhtälö
|
AF(t) = BAF × (1 – eke × t)
|
[yhtälö 1]
|
jossa AF(t) on matojen ja sedimentin testiainepitoisuuden suhde minä tahansa kertymävaiheen ajankohtana (t), nämä tietokoneohjelmat laskevat BAFK:n, ks:n ja ke:n arvot.
Kun vakaa tila saavutetaan kertymävaiheen aikana (i.e. t = ∞), yhtälö 1 voidaan yksinkertaistaa seuraavasti:
|

|
[yhtälö 2]
|
jossa
|
ks
|
=
|
kertymävakio kudoksessa [grammaa sedimenttiä kilossa matoa, d– 1]
|
|
ke
|
=
|
eliminaatiovakio [d– 1]
|
Sen jälkeen kaavalla ks/ke × Cs voidaan laskea testiaineen pitoisuus matokudoksessa vakaassa tilassa (Ca,ss).
Biota-sedimentti-kertyvyyskerroin (BSAF) tulee laskea seuraavasti:

jossa foc on sedimentin orgaanisen hiilen fraktio ja flip on matojen lipidipitoisuuden fraktio joko kuivapainon tai märkäpainon perusteella.
Kun pitoisuusarvojen aikasarjat on annettu, eliminaatiokinetiikka voidaan mallintaa käyttämällä seuraavia malliyhtälöitä ja tietokonelaskentaa, joka perustuu epälineaarisen mallin parametrien estimointimenetelmään.
Oletusaloituspisteenä suositellaan käytettäväksi kertymävaiheen lopussa mitattua keskimääräistä ruumiin jäämäarvoa, Kertymävaiheen perusteella mallinnettua/estimoitua arvoa tulisi käyttää vain, jos esimerkiksi mitattu arvo poikkeaa merkittävästi mallinnetusta ruumiin jäämäarvosta. Katso myös 50 kohta, jossa käsitellään eliminaatiovaiheeseen otettavien matojen esialtistusta; tässä lähestymistavassa näistä esialtistetuista madoista, joista otetaan näytteet eliminaatiovaiheen päivänä 0, oletetaan saatavan realistiset ruumiin jäämäarvot, joista eliminaatiokinetiikan selvittäminen voi alkaa.
Jos ajan suhteen esitetyt datapisteet viittaavat testiaineen pitoisuuden jatkuvaan eksponentiaaliseen pienenemiseen eläimissä, eliminaation ajallista esiintymistä voidaan kuvata yhden lohkon mallilla (yhtälö 4).
|

|
[yhtälö 3]
|
Toisinaan eliminaatioprosessit vaikuttavat kaksivaiheisilta: Ca pienenee nopeasti alkuvaiheissa, mutta eliminaation myöhemmissä vaiheissa testiaineet häviävät hitaammin (8) (19) (25). Nämä kaksi vaihetta voidaan tulkita olettamalla, että organismissa on kaksi eri lohkoa, joista testiaine poistuu eri nopeuksilla. Tällöin on tutustuttava asiaa käsittelevään kirjallisuuteen (15) (16) (17) (25).
Kahden lohkon eliminaatiota kuvataan esimerkiksi seuraavalla yhtälöllä (25):
|
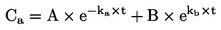
|
[yhtälö 4]
|
A ja B edustavat lohkojen kokoa (prosenttiosuutena kokonaiskudosjäämästä), ja A on se lohko, joista aine poistuu nopeasti ja B se lohko, joista aine poistuu hitaasti. A:n ja B:n summa on yhtä kuin 100 prosenttia eläimen koko lohkotilavuudesta vakaassa tilassa. ka ja kb edustavat vastaavia eliminaatiovakioita [d– 1]. Jos kahden lohkon malli sovitetaan eliminaatiotietoihin, kertymävakio ks voidaan määrittää seuraavasti (53) (54):
|

|
[yhtälö 5]
|
Näitä malliyhtälöitä on kuitenkin syytä käyttää varoen etenkin jos testiaineen biosaatavuudessa tapahtuu muutoksia testin aikana (42).
Vaihtoehtona edellä kuvatuille malliyhtälöille kinetiikka (ks ja ke) voidaan laskea myös yhdellä kertaa soveltamalla ensimmäisen asteen kineettistä mallia samanaikaisesti kaikkiin kertymä- ja eliminaatiovaiheen tietoihin. Tällaisen kertymä- ja eliminaatiovakioiden yhdistetyn laskentamenetelmän kuvaus on lähdeviitteissä (55), (56) ja (57).
Eliminoitumattomat jäämät (NER) tulee laskea toissijaisena tutkittavana ominaisuutena kertomalla matojen keskimääräisen pitoisuuden (Ca) eliminaatiovaiheen päivänä 10 ja matojen keskimääräisen pitoisuuden (Ca) vakaassa tilassa (kertymävaiheen päivä 28) välinen suhde sadalla:

Lisäys 3
Esimerkki 28 päivän mittaisen biokertyvyystestin näytteenottoaikataulusta
a) Kertymävaihe (sisältään neljän päivän tasapainottumisvaiheen)
|
Päivä
|
Toiminnot
|
|
– 6
|
Turvesuspension valmistaminen sedimenttiä varten; suspension sopeuttamisvaihe 48 tuntia
|
|
– 4
|
Testiaineen lisääminen sedimenttiin tai sedimenttifraktioon; kaikkien sedimentin ainesosien sekoittaminen; näytteiden ottaminen käsitellystä ja liuotinkontrollisedimentistä testiaineen pitoisuuden määritystä varten; yläpuolisen veden lisääminen; inkubointi testiolosuhteissa (tasapainottumisvaihe)
|
|
– 3/– 2
|
Testiorganismien valitseminen kasvatusalustalta totutteluvaihetta varten
|
|
0
|
Veden laadun mittaus (ks. 52 kohta); rinnakkaisnäytteiden ottaminen esille vesi- ja sedimenttinäytteiden ottamista varten testiainepitoisuuden määrittämiseksi; matojen jakaminen satunnaistetusti testiastioihin; riittävien alanäytteiden säilyttäminen madoista analyyttisten tausta-arvojen määrittämistä varten; tuloilman kontrollointi, jos käytetään suljettua testijärjestelmää
|
|
1
|
Ota rinnakkaisnäytteet esille näytteenottoa varten; kontrolloi tuloilma, matojen käyttäytyminen, veden laatu (ks. 56 kohta); ota vesi-, sedimentti- ja matonäytteet testiaineen pitoisuuden määrittämiseksi
|
|
2
|
Tuloilman kontrollointi, matojen käyttäytyminen ja lämpötila
|
|
3
|
Sama kuin päivänä 1
|
|
4–6
|
Sama kuin päivänä 2
|
|
7
|
Sama kuin päivänä 1; kompensoi haihtunut vesi tarvittaessa
|
|
8–13
|
Sama kuin päivänä 2
|
|
14
|
Sama kuin päivänä 1; kompensoi haihtunut vesi tarvittaessa
|
|
15–20
|
Sama kuin päivänä 2
|
|
21
|
Sama kuin päivänä 1; kompensoi haihtunut vesi tarvittaessa
|
|
22–27
|
Sama kuin päivänä 2
|
|
28
|
Sama kuin päivänä 1; veden laadun mittaus (ks. 52 kohta); kertymävaiheen päättäminen; riittävien alanäytteiden säilyttäminen madoista analyyttisten tausta-arvojen, märkä- ja kuivapainon sekä lipidipitoisuuden määrittämistä varten; matojen siirtäminen lopuista altistetuista rinnakkaisnäyteastioista puhdasta sedimenttiä sisältäviin astioihin eliminaatiovaihetta varten (ei suolen tyhjennystä); vesi-, sedimentti- ja matonäytteiden ottaminen liuotinkontrolleista; näytteenotto imeytysliuoksista, jos käytössä.
|
|
|
Esialtistustoimet (tasapainottumisvaihe) on ajoitettava testiaineen ominaisuuksien mukaan. Tarvittaessa valmistetun sedimentin on annettava sopeutua yläpuolisen veden alla 20 ± 2 °C:n lämpötilassa seitsemän päivän ajan; tässä tapauksessa sedimentti on valmistettava aikaisemmin!
|
|
|
Päivänä 2 kuvatut toimet tehdään päivittäin (vähintään kaikkina arkipäivinä).
|
b) Eliminaatiovaihe
|
Päivä
|
Toiminnot
|
|
– 6
|
Turvesuspension valmistaminen sedimenttiä varten; suspension sopeuttamisvaihe 48 h
|
|
– 4
|
Kaikkien sedimentin ainesosien sekoittaminen; näytteiden ottaminen käsitellystä ja liuotinkontrollisedimentistä testiaineen pitoisuuden määritystä varten; yläpuolisen veden lisääminen; inkubointi testiolosuhteissa
|
|
0 (kertymävaiheen päivä 28)
|
Veden laadun mittaus (ks. 52 kohta); siirrä madot lopuista altistetuista rinnakkaisnäytteistä puhdasta sedimenttiä sisältäviin astioihin; ota rinnakkaisnäytteistä 4–6 tunnin kuluttua vesi-, sedimentti- ja matonäytteet testiaineen pitoisuuden määrittämiseksi; jaa madot satunnaistetusti testiastioihin
|
|
1
|
Ota rinnakkaisnäytteet esille näytteenottoa varten; kontrolloi tuloilma, matojen käyttäytyminen, veden laatu (ks. 52 kohta); ota vesi-, sedimentti- ja matonäytteet testiaineen pitoisuuden määrittämiseksi
|
|
2
|
Tuloilman kontrollointi, matojen käyttäytyminen ja lämpötila
|
|
3
|
Sama kuin päivänä 1
|
|
4
|
Sama kuin päivänä 2
|
|
5
|
Sama kuin päivänä 1
|
|
6
|
Sama kuin päivänä 2
|
|
7
|
Sama kuin päivänä 1; kompensoi haihtunut vesi tarvittaessa
|
|
8–9
|
Sama kuin päivänä 2
|
|
10
|
Sama kuin päivänä 1; eliminaatiovaiheen päättäminen; veden laadun mittaus (ks. 52 kohta); vesi-, sedimentti- ja matonäytteiden ottaminen liuotinkontrolleista; näytteenotto imeytysliuoksista, jos käytössä.
|
|
|
Sedimentti valmistellaan ennen eliminaatiovaiheen alkamista samoin kuin ennen kertymävaihetta.
|
|
|
Päivänä 2 kuvatut toimet tehdään päivittäin (vähintään kaikkina arkipäivinä).
|
Lisäys 4
Joitakin hyväksyttävän laimennusveden fysikaalis-kemiallisia ominaisuuksia
|
AINESOSA
|
PITOISUUDET
|
|
Hiukkaset
|
< 20 mg/1
|
|
Orgaanisen hiilen kokonaismäärä
|
< 2 μg/l
|
|
Ionisoitumaton ammoniakki
|
< 1 ug/l
|
|
Jäännöskloori
|
< 10 μg/l
|
|
Orgaanista fosforia sisältävien torjunta-aineiden kokonaismäärä
|
< 50 ng/1
|
|
Orgaanista klooria sisältävien torjunta-aineiden ja polykloorattujen bifenyylien kokonaismäärä
|
< 50 ng/l
|
|
Orgaanisen kloorin kokonaismäärä
|
< 25 ng/1
|
SUOSITELLUN SYNTEETTISEN VEDEN KOOSTUMUS
|
a)
|
Kalsiumkloridiliuos
Liuota 11,76 g CaCl2·2 H2O:ta deionisoituun veteen ja lisää deionisoitua vettä yhteen litraan saakka.
|
|
b)
|
Magnesiumsulfaattiliuos
Liuota 4,93 g MgSO4.7 H2O:ta deionisoituun veteen ja lisää deionisoitua vettä yhteen litraan saakka.
|
|
c)
|
Natriumbikarbonaattiliuos
Liuota 2,59 g NaHCO3:a deionisoituun veteen ja lisää deionisoitua vettä yhteen litraan saakka.
|
|
d)
|
Kaliumkloridiliuos
Liuota 0,23 g KCl:a deionisoituun veteen ja lisää deionisoitua vettä yhteen litraan saakka.
|
Kaikkien kemikaalien on oltava analyyttistä laatua.
Tislatun tai deionisoidun veden johtavuus saa olla enintään 10 μScm– 1.
25 ml jokaisesta liuoksesta (a–d) sekoitetaan ja kokonaistilavuudeksi valmistetaan yksi litra deionisoidulla vedellä. Tämän liuoksen kalsium- ja magnesiumionien summa on 2,5 mmol/l.
Ca:Mg-ionien suhde on 4:1 ja Na:K-ionien suhde on 10:1. Tämän liuoksen happokapasiteetti KS4.3 on 0,8 mmol/l.
Ilmasta laimennusvettä, kunnes happikyllästys saavutetaan, ja säilytä sitä sen jälkeen noin kaksi päivää ilmastamatta ennen käyttöä.
Hyväksyttävän laimennusveden pH:n tulisi olla 6–9.
Lisäys 5
Keinosedimentti – valmistus- ja säilytyssuosituksia
Toisin kuin testimenetelmän C.8 (40) vaatimuksissa, keinosedimentin turvepitoisuudeksi suositellaan 10 prosentin sijasta kahta prosenttia kuivapainosta, jotta se vastaisi luonnollisten sedimenttien orgaanisen aineksen pitoisuutta, joka on pieni tai kohtalainen (58).
Keinosedimentin kuivien ainesosien prosenttiosuudet:
|
Ainesosa
|
Ominaisuudet
|
Prosenttia kuivasta sedimentistä
|
|
Turve
|
Rahkasammalturve, hajoamisaste: ’medium’, ilmakuivattu, ei näkyviä kasvinjäänteitä, hienojakoinen (hiukkaskoko ≤ 0,5 mm)
|
2 ± 0,5
|
|
Kvartsi-hiekka
|
Raekoko: ≤ 2 mm, mutta > 50 prosentin hiukkasista on oltava kokoa 50–200 μm
|
76
|
|
Kaoliniitti-savi
|
Kaoliniittipitoisuus ≥ 30 %
|
22 ± 1
|
|
Ravinto
|
Folia urticae, Urtica sp.:n (nokkosen) hienoksi jauhetut lehdet (hiukkaskoko ≤ 0,5 mm) tai seos, joka koostuu Urtica sp.:n jauhetuista lehdistä ja alfaselluloosasta (1: 1); lääkestandardien ja elintarvikkeita koskevien vaatimusten mukaisesti; kuivan sedimentin lisäksi
|
0,4–0,5 %
|
|
Kalsium-karbonaatti
|
CaCO3, jauhemainen, kemiallisesti puhdas, kuivan sedimentin lisäksi
|
0,05–1
|
|
Deionisoitu vesi
|
Johtavuus ≤ 10 μS/cm, kuivan sedimentin lisäksi
|
30–50
|
Jos ammoniakkipitoisuuden suurentuminen on odotettavissa (esimerkiksi jos testiaineen tiedetään estävän nitrifikaatiota), voi olla hyödyllistä korvata puolet typpipitoisesta nokkosjauheesta selluloosalla (ts. α-selluloosajauhe, hiukkaskoko ≤ 0,5 mm).
Valmisteluvaihe
Turve ilmakuivataan ja jauhetaan hienoksi jauheeksi (raekoko ≤ 0,5 mm, ei näkyviä kasvijäämiä). Tarvittavasta määrästä turvejauhetta valmistetaan suspensio käyttämällä sitä määrää deionisoitua vettä, joka on lisättävä kuivaan sedimenttiin (on havaittu, että kun veden tilavuus on 11,5 kertaa turpeen kuivapaino, muodostuu sekoitettava turveliete (8)) tehokasta homogenisointilaitetta käyttäen.
Tämän suspension pH säädetään CaCO3:lla välille 5,5 ± 0,5. Suspension annetaan vakioitua vähintään kahden päivän ajan sekoittamalla sitä varovasti lämpötilassa 20 ± 2 °C, jotta pH stabiloituu ja saadaan stabiili mikrobikomponentti. Sen jälkeen pH mitataan uudelleen ja säädetään tarvittaessa CaCO3:lla välille 6,0 ± 0,5. Sen jälkeen suspensioon sekoitetaan kaikki muut kuivat ainesosat; tässä on otettava huomioon testiaineen lisäämiseen käytetty osuus. Seokseen lisätään loput deionisoidusta vedestä, jotta saadaan aikaan homogeeninen sedimentti. Sen jälkeen pH mitataan uudelleen ja säädetään tarvittaessa CaCO3:lla välille 6,5 ± 7,5. Jos ammoniakin muodostumista on odotettavissa, sedimentin pH-arvo kannattaa pitää pienempänä kuin 7,0 (6,0–6,5). Sedimentistä otetaan näytteitä, joista määritetään kuivapaino ja orgaanisen hiilen pitoisuus. Jos ammoniakin muodostuminen on odotettavissa, keinosedimenttiä voidaan sopeuttaa seitsemän päivän ajan samoissa olosuhteissa, jotka vallitsevat varsinaisessa testissä (ts. sedimentin ja veden suhde 1:4, sedimenttikerroksen korkeus sama kuin testiastioissa), ennen kuin siihen lisätään testiainetta. Siihen on siis lisättävä ilmastettua vettä. Tämän sopeuttamisvaiheen jälkeen yläpuolinen vesi on poistettava ja hävitettävä. Sedimentistä otetaan näytteitä, joista määritetään kuivapaino ja orgaanisen hiilen kokonaispitoisuus (ts. kolme näytettä).
Sen jälkeen sedimenttiin sekoitetaan kvartsihiekkaa, johon on lisätty testiainetta jokaisen käsittelytason mukaisesti. Sedimentti jaetaan rinnakkaisnäytetestiastioihin, joihin lisätään testivesi (ts. sedimentin ja veden suhde 1:4, sedimenttikerroksen korkeus sama kuin testiastioissa). Tämän jälkeen astioita inkuboidaan samoissa olosuhteissa, jotka vallitsevat varsinaisessa testissä. Tästä alkaa tasapainotusvaihe. Yläpuolinen vesi tulee ilmastaa.
Valittu ravinnonlähde on lisättävä astioihin ennen kuin sedimenttiin lisätään testiaine tai sen aikana. Se voidaan sekoittaa myös turvesuspensioon (ks. edellä). Ravinnon liiallinen hajoaminen ennen testiorganismien lisäämistä – esimerkiksi kun tasapainottumisaika on pitkä – voidaan välttää pitämällä ravinnon lisäämisen ja altistumisen aloittamisen välinen aika mahdollisimman lyhyenä. Sen varmistamiseksi, että ravinto on riittävästi kosketuksissa testiaineeseen, ravinto tulisi sekoittaa sedimenttiin viimeistään sinä päivänä, kun testiaine lisätään sedimenttiin. Poikkeuksia voidaan tehdä, jos tasapainottumisajan pituus johtaa ravinnon liialliseen mikrobiaaliseen hajoamiseen ennen testiorganismien lisäämistä. Sedimentistä otetaan näytteitä, joista määritetään kuivapaino ja orgaanisen hiilen kokonaispitoisuus (ts. kolme näytettä testiainetta sisältävästä sedimentistä tai kontrollisedimentistä).
Ainesosien (turve, hiekka, kaoliini) kuivapaino on ilmoitettava grammoina ja prosentteina kokonaiskuivapainosta.
Sedimentin valmistamisen aikana kuiviin ainesosiin lisättävän veden tilavuus on myös ilmoitettava prosentteina kokonaiskuivapainosta (esimerkiksi kun kuivapaino on 100 prosenttia ja veden tilavuus 46 prosenttia, 1 000 gramman kuivapainosta yhteensä 460 ml vettä, mistä tulokseksi saadaan 1 460 grammaa märkää sedimenttiä).
Varastointi
Keinosedimentin kuivia ainesosia voi säilyttää kuivassa ja viileässä paikassa huoneenlämmössä. Valmistettu märkä sedimentti voidaan säilyttää (käytettäväksi myöhemmin vain laboratorioviljelyssä) 4 ± 2 °C:n lämpötilassa pimeässä 2–4 viikon ajan valmistuspäivästä alkaen (8).
Sedimentti, johon on lisätty testiaine, on käytettävä heti, ellei ole tiedossa, että tiettyä sedimenttiä voidaan säilyttää ilman, että se vaikuttaa testiaineen myrkyllisyyteen ja biologiseen saatavuuteen. Näytteitä sedimentistä, johon testiainetta on lisätty, voidaan säilyttää kyseisen testiaineen suositelluissa säilytysolosuhteissa analyysiin saakka.
Lisäys 6
Biokertyvyystestaukseen suositeltavat harvasukasmatolajit
Tubifex tubifex (MÜLLER), Tubificidae, Oligochaeta
Harvasukasmatoihin kuuluva torvimato (Tubificidae, Oligochaeta) Tubifex tubifex (Müller) elää makean veden sedimenteissä rakentamissaan putkissa, jotka on pinnoitettu limalla. Madot elävät näissä putkissa pää alaspäin ja nielevät sedimenttihiukkasia hyödyntäen niissä olevia mikro-organismeja ja orgaanista jätettä. Madon takapää heilahtelee yleensä yläpuolisessa vedessä hengittämistä varten. Vaikka tämä laji elää monenlaisissa sedimenttityypeissä kaikkialla pohjoisella pallonpuoliskolla, Tubifex tubifex suosii melko hienojakoista ravintoa (59). Tämän lajin soveltuvuutta ympäristömyrkyllisyyden testaukseen kuvataan esimerkiksi lähdeviitteissä (8) (29) (31) (39) (60) (62) (63).
Viljelymenetelmät
Jotta Tubifex tubifex -yksilöitä olisi riittävästi biokertyvyystestien tekemistä varten, matoja on kasvatettava laboratoriossa jatkuvasti. Testimenetelmässä C.1 T. tubifexin kasvattamiseen suositellaan järjestelmää, joka koostuu keinomaahan perustuvasta keinosedimentistä ja synteettisestä vedestä (8).
Kasvatusastioina voidaan käyttää lasista tai ruostumattomasta teräksestä valmistettuja säiliöitä, joiden korkeus on 12–20 cm. Jokaiseen kasvatussäiliöön laitetaan kerros lisäyksessä 5 kuvatun mukaisesti valmistettua märkää keinosedimenttiä. Sedimenttikerroksen pitäisi olla niin syvä, että matojen luonnollinen kaivautumiskäyttäytyminen on mahdollista (vähimmäissyvyys T. tubifexille 2 cm). Järjestelmään lisätään synteettistä vettä varovasti, jotta sedimentti ei häiriinny. Vesikerrosta ilmastetaan kevyesti (noin kaksi kuplaa sekunnissa 0,45 μm:n suodattimella suodatetulla ilmalla) Pasteur-pipetillä, joka sijaitsee noin kahden senttimetrin päässä sedimentin pinnasta. Suositeltu kasvatuslämpötila on 20 ± 2 °C.
Kasvatusjärjestelmään lisätään matoja siten, että enimmäistäyttöaste on 20 000 yksilöä neliömetrillä sedimentin pintaa. Suurempi täyttöaste saattaa hidastaa kasvua ja lisääntymistä (43).
Keinosedimenttiin perustuvissa kasvatusjärjestelmissä matoja on ruokittava. Ravintona voidaan käyttää hienojakoista kalanruokaa, esimerkiksi TetraMin®-valmistetta voidaan käyttää lisäravinteena (8); Klerks 1994, henkilökohtainen tiedonanto. Ruokintatiheyden tulee olla sellainen, että madot kasvavat ja lisääntyvät riittävästi ja että ammoniakin muodostuminen ja sienten kasvaminen kasvatusjärjestelmässä pysyy mahdollisimman pienenä. Ruokaa voidaan annostella kahdesti viikossa (esimerkiksi 0,6–0,8 mg sedimentin pinnan neliösenttimetriä kohti). Käytännön kokemus on osoittanut, että deionisoituun veteen suspendoidun ja homogenisoidun ruoan antaminen saattaa edistää ruoan jakautumista tasaisesti sedimentin pinnalle kasvatussäiliöissä.
Ammoniakin kertymisen välttämiseksi yläpuolinen vesi on vaihdettava läpivirtausjärjestelmää käyttäen tai manuaalisesti vähintään kerran viikossa. Varastokasvatusjärjestelmissä sedimentti on vaihdettava kolmen kuukauden välein.
Kasvatusjärjestelmästä voidaan ottaa näytteitä madoista siivilöimällä kasvatussedimentti 1 mm:n siivilällä, jos vain täysikasvuisia matoja tarvitaan. Munakoteloiden säilyttämiseksi 0,5 mm:n siivilä on sopiva ja nuorten matojen säilyttämiseksi 0,25 mm:n siivilä. Siivilät voidaan laittaa synteettiseen veteen, kun sedimentti on valunut siivilän läpi. Madot lähtevät siivilästä, ja ne voidaan poimia vedestä käyttämällä pehmeäkärkisiä pinsettejä tai pipettiä, jonka reunat on liekkikiillotettu.
Testin aloittamisessa tai uusien matojen kasvattamisessa käytetään vain vahingoittumattomia ja selvästi tunnistettuja Tubifex tubifex -yksilöitä (esimerkiksi lähdeviite (64)). Sairaat tai vaurioituneet madot sekä munakotelot, joissa kasvaa sienirihmastoja, on hävitettävä.
Synkronisoidusta kasvatusjärjestelmästä voidaan saada tietyn ikäisiä matoja sopivin väliajoin tarvittaessa. Uusia kasvatusastioita perustetaan tietyin väliajoin (esimerkiksi kahden viikon välein), ja niissä käytetään tietyn ikäisiä eläimiä (kuten kotelovaiheessa olevia matoja). Edellä kuvatuissa kasvatusolosuhteissa madot ovat täysikasvuisia 8–10 viikon kuluttua. Kasvatussäiliöistä voidaan kerätä matoja, kun ne ovat muodostaneet uusia munakoteloita, eli 10 viikon kuluttua. Kerättyjä täysikasvuisia matoja voidaan käyttää testeihin ja munakoteloita voidaan käyttää uusien matojen kasvattamiseen.
Lumbriculus variegatus (MÜLLER), Lumbriculidae, Oligochaeta
Lumbriculus variegatus (Lumbriculidae, Oligochaeta) elää myös makean veden sedimenteissä kaikkialla maailmassa, ja sitä käytetään laajalti ympäristömyrkyllisyyden testauksessa. Tietoa tämän lajin biologiasta, kasvatusolosuhteista ja herkkyydestä on lähdeviitteissä (1) (6) (9) (36). Lumbriculus variegatus -matoja voidaan kasvattaa myös T. tubifex -madoille suositellussa keinosedimentissä lähdeviitteen (8) mukaisesti tietyin rajoituksin. Koska L. variegatus suosii luonnossa karkeampia sedimenttejä kuin T. tubifex (59), T. tubifexin kasvattamisessa käytetyt laboratorioviljelmät, joissa on käytetty keinosedimenttiä, voidaan lakkauttaa 4–6 kuukauden kuluttua. Käytännön kokemus on osoittanut, että L. variegatusta voidaan pitää hiekkaisella alustalla (esimerkiksi kvartsihiekassa tai hienossa sorassa) läpivirtausjärjestelmässä, jossa käytetään kalanruokaa ravinnonlähteenä, useita vuosia alustaa uudistamatta. Muihin vedessä eläviin harvasukasmatolajeihin verrattuna L. variegatuksella on se etu, että se lisääntyy nopeasti, jolloin laboratoriossa kasvatettujen populaatioiden biomassa kasvaa nopeasti (1) (6) (9) (10).
Viljelymenetelmät
Lumbriculus variegatuksen kasvatusolosuhteet on kuvattu yksityiskohtaisesti julkaisussa Phipps ym. (1993) (10), Brunson ym. (1998) (28), ASTM (2000) (1), U.S. EPA (2000) (6). Jäljempänä on lyhyt yhteenveto näistä olosuhteista.
Matoja voidaan kasvattaa suurissa akvaarioissa (57–80 l) 23 °C:ssa. Valojakson tulisi olla 16 tuntia valoa ja 8 tuntia pimeää (100–1 000 luksia), ja akvaarioissa tulisi käyttää päivittäin vaihtuvaa luonnollista vettä (45–50 l akvaariota kohti). Substraatti valmistetaan leikkaamalla valkaisemattomia ruskeita paperipyyhkeitä suikaleiksi, jotka laitetaan kasvatusveteen muutamaksi sekunniksi, jolloin muodostuu pieniä paloja paperisubstraattia. Sen jälkeen substraattia voi käyttää suoraan Lumbriculus-matojen kasvatusakvaariossa peittämällä niillä akvaarion pohja, tai niitä voidaan säilyttää jäädytettynä deionisoidussa vedessä myöhempää käyttöä varten. Uusi substraatti kestää säiliössä yleensä noin kaksi kuukautta.
Jokainen matoviljelmä aloitetaan 500–1 000 madolla, ja niitä ruokitaan kolmesti viikossa10 ml:n suspensiolla, joka sisältää 6 g lohien kasvatusravintoa, ajoittaisvaihtoisissa tai läpivirtausolosuhteissa. Staattisissa tai semistaattisissa viljelmissä eläimiä on ruokittava vähemmän bakteeri- ja sienikasvun estämiseksi. Ruoka ja paperisubstraatti on analysoitava biokertyvyystesteissä käytettävien aineiden suhteen.
Näissä olosuhteissa viljelmässä olevien yksilöiden määrä yleensä kaksinkertaistuu 10–14 päivässä.
Lumbriculus variegatus voidaan ottaa pois viljelmistä esimerkiksi siirtämällä substraatti tiheäsilmäisellä haavilla tai poimimalla yksilöt liekkikiillotetulla leveäsuisella (halkaisija noin 5 mm) lasipipetillä erilliseen laboratoriolasiin. Jos laboratoriolasiin siirretään myös substraattia, matoja ja substraattia sisältävää lasia pidetään yön yli läpivirtausolosuhteissa, jolloin substraatti poistuu lasista ja madot jäävät astian pohjalle. Ne voidaan siirtää sen jälkeen uusiin valmisteltuihin kasvatussäiliöihin tai käsitellä käytettäväksi testissä lähdeviitteissä (1) ja (6) esitetyn mukaisesti. Matojen vaurioituminen tai autotomia on estettävä esimerkiksi käyttämällä niiden käsittelyssä pipettejä, joiden reunat on liekkikiillotettu, tai ruostumattomasta teräksestä valmistettuja puikkoja.
Seikka, johon on syytä suhtautua kriittisesti käytettäessä L. variegatusta sedimentin biokertyvyystesteissä, on sen lisääntymistapa (jakaantuminen, jota seuraa regeneraatio). Tässä suvuttomassa lisääntymistavassa mato jakaantuu kahteen osaan, jotka eivät tarvitse ravintoa, ennen kuin pää- tai häntäosa on regeneroitunut (ks. (36) (37)). Näin ollen nielemisen kautta tapahtuvaa sedimentti- ja kontaminanttikertymistä ei tapahdu L. variegatuksella välttämättä jatkuvasti, kuten torvimadoilla, jotka eivät lisäänny jakaantumalla.
Sen vuoksi on huolehdittava synkronoinnista, jotta kontrolloimaton lisääntyminen ja regeneroituminen sekä testitulosten suuri vaihtelu voidaan minimoida. Vaihtelua voi nimittäin esiintyä, kun jotkin yksilöt, jotka ovat jakaantuneet eivätkä siksi tarvitse ravintoa tiettynä ajanjaksona, altistuvat testiaineelle vähemmän kuin muut yksilöt, jotka eivät jakaannu testin aikana (ks. (38)). Madot tulisi jakaa keinotekoisesti (synkronisointi) 10–14 päivää ennen altistumisen aloittamista (65). Tässä on käytettävä isoja matoja, joissa mieluiten ei ole merkkejä viimeaikaisesta jakaantumisesta. Nämä madot asetetaan lasilevylle pisaraan kasvatusvettä ja leikataan skalpellilla kahtia ruumiin keskiosasta. Huomiota on kiinnitettävä siihen, että takapäät ovat samankokoisia. Sen jälkeen takaosat jätetään regeneroitumaan (jolloin niihin kehittyy uudet päät) kasvatusastiaan, joka sisältää samaa substraattia kuin alkuperäisessä kasvatusastiassa ja synteettistä vettä, altistuksen aloittamiseen saakka. Merkki siitä, että uudet päät ovat kehittyneet, on se, kun synkronisoidut madot alkavat kaivautua substraattiin (regeneroitujen päiden muodostuminen voidaan vahvistaa tutkimalla edustava alanäyte binokulaarimikroskoopilla). Tämän jälkeen testiorganismien oletetaan olevan samanlaisessa fysiologisessa tilassa. Kun synkronisoiduissa madoissa esiintyy morfallaksin aiheuttamaa regeneraatiota testin aikana, käytännössä kaikkien eläinten odotetaan altistuvan yhtä paljon sedimentille, johon on lisätty testiainetta. Synkronisoitujen matojen ruokkiminen tulee aloittaa heti, kun madot alkavat kaivautua substraattiin tai seitsemän päivän kuluttua leikkauksesta. Ruokintaohjelma tulisi olla samankaltainen kuin tavallisissa viljelmissä, mutta synkronisoituja matoja voi olla hyvä ruokkia samalla ravinnolla, jota käytetään myös testissä. Madot tulisi pitää testilämpötilassa (20 ± 2 °C). Regeneroitumisen jälkeen testissä tulee käyttää vahingoittumattomia kokonaisia matoja, jotka ovat samankokoisia ja jotka uivat tai matelevat aktiivisesti kevyen mekaanisen ärsytyksen seurauksena. Matojen vaurioituminen tai autotomia on estettävä esimerkiksi käyttämällä niiden käsittelyssä pipettejä, joiden reunat on liekkikiillotettu, tai ruostumattomasta teräksestä valmistettuja puikkoja.
Kun testissä käytetään Lumbriculus variegatusta, matojen määrän tulisi lisääntyä testissä, jos olosuhteet ovat asianmukaiset, tämän lajin erityisen lisääntymistavan takia (6). Lisääntymisen puuttuminen L. variegatuksella tehtävässä biokertyvyystestissä on kirjattava muistiin ja otettava huomioon testituloksia tulkittaessa.
Branchiura sowerbyi (BEDDARD), Tubificidae, Oligochaeta (ei validoitu rengastestissä)
Branchiura sowerbyi elää monenlaisissa patoaltaiden, järvien, lampien ja jokien sedimenttityypeissä, ja se on peräisin trooppisilta alueilta. Tämän lajin matoja tavataan myös pohjoisen pallonpuoliskon lämpimissä vesistöissä. Niitä esiintyy kuitenkin enemmän mutaisissa ja savisissa sedimenteissä, joiden orgaanisen aineksen pitoisuus on suuri. Madot elävät myös sedimenttikerroksessa. Myös matojen takapäät yleensä kaivautuvat sedimenttiin. Tämä laji on helposti tunnistettavissa niiden takaosassa olevista helttamaisista filamenteista. Täysikasvuisten matojen pituus saattaa olla 9–11 cm ja märkäpaino 40–50 mg. Madot lisääntyvät vilkkaasti; niiden populaatio kaksinkertaistuu alle kahdessa viikossa, kun olosuhteet ovat jäljempänä kuvatun mukaiset (Aston ym., 1982 (65)). B. sowerbyitä on käytetty sekä myrkyllisyys- että biokertyvyystutkimuksissa (Marchese & Brinkhurst 1996, (31) Roghair ym. 1996 (67)).
Viljelymenetelmät
Yhteenveto Branchiura sowerbyin kasvatusmenetelmistä on esitetty jäljempänä (laatineet Mercedes R. Marchese, INALI, Argentiina, ja Carla J. Roghair, RIVM, Alankomaat).
Testiorganismien kasvattamisessa ei edellytetä mitään tiettyä kasvatustekniikkaa. Ne voidaan kasvattaa käyttämällä kontaminoitumatonta luonnollista sedimenttiä (31). Käytännön kokemus on osoittanut, että väliaine, joka sisältää luonnollista sedimenttiä ja hiekkaa, parantaa matojen terveyttä verrattuna puhtaaseen luonnolliseen sedimenttiin (32) (67). Kasvattamiseen voidaan käyttää kolmen litran laboratoriolaseja, jotka sisältävät 1 500 ml sedimentti-vesiväliainetta, joka puolestaan koostuu 375 ml:sta luonnollista kontaminoitumatonta sedimenttiä (orgaanisen hiilen kokonaispitoisuus noin 10 prosenttia; noin 17 prosenttia hiukkasista kokoa ≤ 63 μm), 375 ml:sta puhdasta hiekkaa (M32) ja 750 ml:sta synteettistä tai dekloorattua vesijohtovettä (31) (32) (67). Myös paperipyyhkeitä voidaan käyttää kasvatuksessa substraattina, mutta silloin populaatio kasvaa vähemmän kuin luonnollisessa sedimentissä. Semistaattisissa järjestelmissä laboratoriolasin vesikerrosta ilmastetaan hitaasti, ja yläpuolinen vesi tulee vaihtaa viikoittain.
Jokainen lasi sisältää aluksi 25 nuorta matoa. Kahden kuukauden kuluttua isot madot poimitaan sedimentistä pinseteillä ja laitetaan uuteen lasiin, joka sisältää tuoretta sedimentti-vesiväliainetta. Vanhassa lasissa on myös munakoteloita ja nuoria matoja. Tällä tavalla on mahdollista kerätä jopa 400 nuorta matoa yhdestä lasista. Täysikasvuisia matoja käytetään lisääntymiseen vähintään kerran vuodessa.
Viljelmät on pidettävä 21–25 °C:n lämpötilassa, ja lämpötilan vaihtelu saa olla enintään ± 2 °C. Alkion kehittymiseen kuluva aika (munimisesta siihen saakka, kunnes nuori mato kuoriutuu munakotelosta) on noin kolme viikkoa, kun lämpötila on 25 °C. B. sowerbyin osalta on havaittu, että elossa pysyvän madon munantuotanto mudassa 25 °C:n lämpötilassa vaihtelee välillä 6,36 (31) – 11,2 (30). Munien määrä munakotelokohtaisesti vaihtelee välillä 1,8–2,8 (66) (69) tai enintään 8 (68).
Liuenneen hapen pitoisuus, veden kovuus, lämpötila ja pH on mitattava viikoittain. Kalanruokaa (esimerkiksiTetraMin®-valmistetta) voidaan lisätä suspensiona kaksi tai kolme kertaa viikossa ad libitum. Lisäksi matoja voidaan ruokkia sulatetulla lehtisalaatilla ad libitum.
Suurin etu tämän lajin käyttämisestä on suuri yksilöllinen biomassa (yksilön märkäpaino jopa 40–50 mg). Sen vuoksi tätä lajia voi käyttää radioleimaamattomien testiaineiden biokertyvyystesteissä. Se voidaan altistaa T. tubifexille tai L. variegatukselle käytetyissä järjestelmissä siten, että yhdessä näytteessä on yksi yksilö (11). Rinnakkaisnäytteiden määrää on kuitenkin lisättävä, ellei käytetä isompia testiastioita (11). Myös kaivautumiskäyttäytymiseen liittyvää validiteettikriteeriä on mukautettava tätä lajia varten.
LÄHDEKIRJALLISUUS
|
(1)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(2)
|
Euroopan komissio (2003). Riskinarviointia koskeva tekninen ohjeasiakirja, jolla tuetaan uusien ilmoitettujen aineiden vaarojen arviointiperiaatteiden vahvistamisesta annettua komission direktiiviä 93/67/ETY, olemassa olevien aineiden vaarojen arviointiperiaatteiden vahvistamisesta annettua komission asetusta (EY) N:o 1488/94 sekä biosidituotteiden markkinoille saattamisesta annettua Euroopan parlamentin ja neuvoston direktiiviä 98/8/EY, osa 1–IV. Euroopan unionin julkaisutoimisto, Luxemburg.
|
|
(3)
|
OECD (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Organisation for Economic Co-operation and Development (OECD), Paris.
|
|
(4)
|
Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P. F., Norberg-King, T. J. and Winger, P.V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885–1894.
|
|
(5)
|
Tämän liitteen luku C.13. Biokertyvyys: testi kaloilla läpivirtausolosuhteissa.
|
|
(6)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(7)
|
Tämän liitteen luku C.27 – Surviaissääskillä tehtävä myrkyllisyystesti, käyttäen vettä tai sedimenttiä, joihin on lisätty tutkittavaa ainetta.
|
|
(8)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. & Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835–852.
|
|
(9)
|
Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J. and Landrum, P. F. (2003). Uptake and depuration of nonionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872–885.
|
|
(10)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. and Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269–279.
|
|
(11)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C. & Studinger, G. (1999). Workshop on ’Bioaccumulation: Sediment test using benthic oligochaetes’, 26.-27.04.1999, Hochheim/Main, Germany. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlin.
|
|
(12)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2006). Validation of a sediment bioaccumulation test with endobenthic aquatic oligochaetes by an international ring test. Report to the Federal Environmental Agency (Umweltbundesamt Dessau), R&D No.: 202 67 437.
|
|
(13)
|
Kelly, J.R., Levine, S.N., Buttel, L.A., Kelly, A.C., Rudnick, D.T. & Morton, R.D. (1990). Effects of tributyltin within a Thalassia seagrass ecosystem. Estuaries 13, 301–310.
|
|
(14)
|
Nendza, M. (1991). QSARs of bioaccumulation: Validity assessment of log Kow/log BCF correlations. In: R. Nagel and R. Loskill (eds.): Bioaccumulation in aquatic systems. Contributions to the assessment. Proceedings of an international workshop, Berlin 1990. VCH, Weinheim.
|
|
(15)
|
Landrum, P.F., Lee II, H., & Lydy, M.J. (1992). Toxicokinetics in aquatic systems: Model comparisons and use in hazard assessment. Environ. Toxicol. Chem. 11, 1709–1725.
|
|
(16)
|
Markwell, R.D., Connell, D.W. & Gabric, A.J. (1989). Bioaccumulation of lipophilic compounds from sediments by oligochaetes. Wat. Res. 23, 1443–1450.
|
|
(17)
|
Gabric, A.J., Connell, D.W. & Bell, P.R.F. (1990). A kinetic model for bioconcentration of lipophilic compounds by oligochaetes. Wat. Wat. Res. 24, 1225–1231.
|
|
(18)
|
Kukkonen, J. and Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457–468.
|
|
(19)
|
Franke, C., Studinger, G., Berger, G., Böhling, S., Bruckmann, U., Cohors-Fresenborg, D. and Jöhncke, U. (1994). The assessment of bioaccumulation. Chemosphere 29, 1501–514.
|
|
(20)
|
OECD (2000). Guidance Document on Acute Inhalation Toxicity Testing. Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
(21)
|
U.S. EPA (1996). Special Considerations for Conducting Aquatic Laboratory Studies. Ecological Effects Test Guidelines. OPPTS 850.1000. Public Draft. EPA 712-C-96-113. U.S. Environmental Protection Agency.
|
|
(22)
|
Tämän liitteen seuraavat luvut:
|
|
Luku A.8 Jakaantumiskerroin (ravistuspullomenetelmä)
|
|
|
Luku A.25 Jakaantumiskerroin (HPLC-menetelmä)
|
|
|
Luku C.7 Hajoaminen – abioottinen hajoaminen: hydrolyysi pH:n funktiona
|
|
|
Luku C.4 A–F Biohajoavuuden määritys
|
|
|
Luku C.19 Maa-aineksiin ja viemärilietteeseen sovellettavan adsorptiokertoimen (KOC) määritys korkean suorituskyvyn nestekromatografialla
|
|
|
Luku C.29 Biohajoavuus – CO2 suljetuissa astioissa.
|
|
|
(23)
|
OECD (1996). Guidance Document on Acute Inhalation Toxicity Testing. Direct Phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals No. 3. OECD, Paris.
|
|
(24)
|
Antoine, M.D., Dewanathan, S. & Patonay, G. (1991). Determination of critical micelles concentration of surfactants using a near-infrared hydrophobicity probe. Microchem. J. 43, 165–172.
|
|
(25)
|
Beek, B., S. Boehling, U. Bruckmann, C. Franke, U. Joehncke & G. Studinger (2000). The assessment of bioaccumulation. In Hutzinger, O. (editor), The Handbook of Environmental Chemistry, Vol. 2 Part J (Vol. editor: B. Beek): Bioaccumulation – New Aspects and Developments. Springer-Verlag Berlin Heidelberg: 235–276.
|
|
(26)
|
Spacie, A. & Hamelink, J.L. (1982). (1982), Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. Chem. 1, 309–320.
|
|
(27)
|
Hawker, D.W. & Connell, D.W. (1988). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Wat. Res. 22, 701–707.
|
|
(28)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191–201.
|
|
(29)
|
Reynoldson, T.B., Thompson, S.P. and Bamsey, J.L. (1991). A sediment bioassay using the tubificid oligochaete worm Tubifex tubifex. Environ. Toxicol. Chem. 10, 1061–1072.
|
|
(30)
|
Aston, R.J. & Milner, A.G.P. (1981). Conditions for the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) in activated sludge. Aquaculture 26, 155–160.
|
|
(31)
|
Marchese, M.R. & Brinkhurst, R.O. (1996). A comparison of two tubificid species as candidates for sublethal bioassay tests relevant to subtropical and tropical regions. Hydrobiologia 334, 163–168.
|
|
(32)
|
Roghair, C.J. & Buijze, A. (1994). Development of sediment toxicity tests. IV. A bioassay to determine the toxicity of field sediments to the oligochaete worm Branchiura sowerbyi. RIVM Report 719102027.
|
|
(33)
|
Tämän liitteen luku C.1 Akuutti myrkyllisyys kalalle.
|
|
(34)
|
OECD (1992c). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Paris.
|
|
(35)
|
Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J. & Smith, M.E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181–184.
|
|
(36)
|
Leppänen, M.T. & Kukkonen, J.V.K. 1998: Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183–194.
|
|
(37)
|
Leppänen, M.T. & Kukkonen, J.V.K. 1998: Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196–2202.
|
|
(38)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503–1508.
|
|
(39)
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J.I. & Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111–124.
|
|
(40)
|
Tämän liitteen luku C.8 Myrkyllisyystutkimus madoilla.
|
|
(41)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
(42)
|
Landrum, P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Toxicol. 23, 588–595.
|
|
(43)
|
Poddubnaya, T.L. (1980). Life cycles of mass species of Tubificidae (Oligochaeta). In: R.O. Brinkhurst and D.G. Cook (eds.): Aquatic Oligochaeta Biology, 175–184. Plenum Press, New York.
|
|
(44)
|
ASTM (1998). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing. American Society for Testing and Materials, E 1391–94.
|
|
(45)
|
Hooftman, R.N., van de Guchte, K. & Roghair, C.J. (1993). Development of ecotoxicological test systems to assess contaminated sediments. Joint report no. 1: Acute and (sub)chronic tests with the model compound chlorpyrifos. RIVM-719102022.
|
|
(46)
|
Franke, C. (1996). How meaningful is the bioconcentration factor for risk assessment?. Chemosphere 32: 1897–1905.
|
|
(47)
|
Mount, D.R., Dawson, T.D. & Burkhard, L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244–1249.
|
|
(48)
|
Randall, R.C., Lee II, H., Ozretich, R.J., Lake, J.L. & Pruell, R.J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Environ.Toxicol. Chem. 10, 1431–1436.
|
|
(49)
|
Gardner, W.S., Frez, W.A., Cichocki, E.A. & Parrish, C.C. (1985). Micromethods for lipids in aquatic invertebrates. Limnology and Oceanography, 30, 1099–1105.
|
|
(50)
|
Bligh, E.G. & Dyer, W.J. (1959). A rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol. 37, 911–917.
|
|
(51)
|
De Boer, J., Smedes, F., Wells, D. & Allan, A. (1999). Report on the QUASH interlaboratory study on the determination of total-lipid in fish and shellfish. Round 1 SBT-2. Exercise 1000. EU, Standards, Measurement and Testing Programme.
|
|
(52)
|
Kristensen, P. (1991). Bioconcentration in fish: comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Water Quality Institute, Denmark.
|
|
(53)
|
Zok, S., Görge, G., Kalsch, W. & Nagel, R. (1991). Bioconcentration, metabolism and toxicity of substituted anilines in the zebrafish (Brachydanio rerio). Sci. Total Environment 109/110, 411–421
|
|
(54)
|
Nagel, R. (1988). Umweltchemikalien und Fische – Beiträge zu einer Bewertung. Habilitationsschrift, Johannes Gutenberg-Universität Mainz, Germany.
|
|
(55)
|
Janssen, M.P.M., A Bruins, T.H. De Vries & Van Straalen, N.M. (1991). Comparison of cadmium kinetics in four soil arthropod species. Arch. Environ. Contam. Toxicol. 20: 305–312.
|
|
(56)
|
Van Brummelen, T.C. & Van Straalen, N.M. (1996). Uptake and elimination of benzo(a)pyrene in the terrestrial isopod Porcellio scaber. Arch. Environ. Contam. Toxicol. 31: 277–285.
|
|
(57)
|
Sterenborg, I., Vork, N.A., Verkade, S.K., Van Gestel, C.A.M. & Van Straalen, N.M. (2003). Dietary zinc reduces uptake but not metallothionein binding and elimination of cadmium in the springtail Orchesella cincta. Environ. Toxicol. Chemistry 22: 1167–1171.
|
|
(58)
|
Suedel, B.C. and Rodgers, J.H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163–1175.
|
|
(59)
|
Wachs, B. (1967). Die Oligochaeten-Fauna der Fließgewässer unter besonderer Berücksichtigung der Beziehung zwischen der Tubificiden-Besiedlung und dem Substrat. Arch. Hydr. 63, 310–386.
|
|
(60)
|
Oliver, B. G. (1987). Biouptake of chlorinated hydrocarbons from laboratory-spiked and field sediments by oligochaete worms. Environ. Sci. Technol. 21, 785–790.
|
|
(61)
|
Chapman, P.M., Farrell, M.A. & Brinkhurst, R.O. (1982a). Relative tolerances of selected aquatic oligochaetes to individual pollutants and environmental factors. Aquatic Toxicology 2, 47–67.
|
|
(62)
|
Chapman, P.M., Farrell, M.A. & Brinkhurst, R.O. (1982b). Relative tolerances of selected aquatic oligochaetes to combinations of pollutants and environmental factors. Aquatic Toxicology 2, 69–78.
|
|
(63)
|
Rodriguez, P. & Reynoldson, T.B. (1999). Laboratory methods and criteria for sediment bioassessment. In: A. Mudroch, J.M. Azcue & P. Mudroch (eds.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
(64)
|
Brinkhurst, R.O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
(65)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
(66)
|
Aston, R.J., Sadler, K. & Milner, A.G.P. (1982). The effect of temperature on the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) on activated sludge. Aquaculture 29, 137–145.
|
|
(67)
|
Roghair, C.J., Buijze, A., Huys, M.P.A., Wolters-Balk, M.A.H., Yedema, E.S.E. & Hermens, J.L.M. (1996). Toxicity and toxicokinetics for benthic organisms; II: QSAR for base-line toxicity to the midge Chironomus riparius and the tubificid oligochaete worm Branchiura sowerbyi. RIVM Report 719101026.
|
|
(68)
|
Aston, R.J. (1984). The culture of Branchiura sowerbyi (Tubificidae, Oligochaeta) using cellulose substrate. Aquaculture 40, pp. 89–94.
|
|
(69)
|
Bonacina, C., Pasteris, A., Bonomi, G. & Marzuoli, D. (1994). Quantitative observations on the population ecology of Branchiura sowerbyi (Oligochaeta, Tubificidae). Hydrobiologia, 278, 267–274.
|
” |

 In force
In force